Author: Самсонов Г.В. Серебрякова Т.И. Неронов В.А.
Tags: самородные элементы и сплавы карбиды нитриды силициды фосфиды химия металлургия
Year: 1975
Г. В. САМСОНОВ Л. И. СЕРЕБРЯКОВА.
В. А. НЕРОНОВ
БОРВДЫ
МОСКВА АТОМИЗДАТ 1975
УДК 549.2
Самсонов Г. В., Серебрякова Т. И., Неронов В. А. Бориды. М.( Атомиздат, 1975. 376 с.
В книге обобщены и систематизированы сведения об одном из важнейших классов неорганических соединений — боридах— перспективных материалах для новой техники.
Проведен подробный анализ имеющихся данных о химическом строении и кристаллической структуре боридов металлов и неметаллов, рассмотрены вопросы химической связи и электронного строения боридов и природа их физических, физико-химических и химических свойств. Рассмотрены диаграммы состояния систем всех элементов периодической системы с бором, дана характеристика условий существования, образования и свойств двойных боридных фаз.
Описаны методы получения боридов, важнейшие области использования боридов в промышленности и технике, а также в научных исследованиях.
Книга рассчитана на широкий круг научных, инженерно-технических работников и студентов, интересующихся химией и металлургией тугоплавких соединений. (Рисунков 69, таблиц 98, список литературы — 1028 иазв.)
С
30107—062
62—75
© Атомиздат, 1975
034(01)—75
ОТ АВТОРОВ
Соединения и сплавы бора находят все более широкое применение в новой технике как высокотемпературные материалы, обладающие часто уникальным комплексом физических, физико-технических и химических свойств. Это способствует развитию соответствующих исследований экспериментального и теоретического характера, которые ведутся специалистами самых различных отраслей науки и техники.
Для дальнейшего развития исследований боридов и тугоплавких неметаллических соединений бора, более всестороннего использования результатов этих исследований необходимо обобщение информации о боридах и выделение тех главных направлений, которые определяют расширение их использования и производства.
Частные сообщения по отдельным вопросам, связанным с боридами, сделаны в книгах Киффера и Шварцкопфа («Твердые сплавы». М., Металлургиздат, 1957), Г,В. Самсонова, Л. Я. Марковского, А. Ф. Жигача, М. Г. Валяшко («Бор, его соединения и сплавы». Киев, «Наукова думка», 1960), X. Дж. Гольдшмидта («Сплавы внедрения». Пер. с англ. М., «Мир», 1971). Однако стала насущной необходимость более широкого, цельного и современного обобщения в форме единой монографии,. которая могла бы использоваться широкими кругами научных работников, инженеров, конструкторов.
Такая задача и стояла перед авторами настоящей книги, содержащей основные сведения о структуре, свойствах, методах получения, областях применения боридов металлов, а также некоторых неметаллических тугоплавких соединений бора.
При написании монографии авторами использовались как собственные результаты, так и работы многих советских и зарубежных исследователей, большая часть которых была пере
3
дана авторам й виде оттисков, за что мйг выражаем этим ученым глубокую благодарность.
Авторы надеются, что их книга послужит дальнейшему ознакомлению с боридами как важным и обширным классом неорганических соединений, а также будет содействовать расширению их использования в промышленности и технике, и примут с благодарностью все замечания и рекомендации читателей книги.
Посвящается светлой памяти ЛЬВА ЯКОВЛЕВИЧА МАРКОВСКОГО
ВВЕДЕНИЕ
Соединения металлов с бором — бориды— представляют важный и обширный класс неорганических соединений, отлича-ющихся тугоплавкостью, высокой химической стойкостью в раз-личных агрессивных средах, а также металлоподобностью, выражающейся в их высоких электро- и теплопроводности, магнитных свойствах, в специфической электронной структуре.
Изолированный атом бора имеет конфигурацию валентных электронов 2s22p; эта энергетически неустойчивая конфигурация стремится при образовании как элементарного бора, так и его соединений преобразоваться в энергетически более устойчивую 2s2p2 за счет одноэлектронного з->-р-перехода; последняя склонна к достройке до наиболее устойчивой, возможной для бора конфигурации 2s2p3. Таким образом, бор в соединениях с металлами, обычно обладающими донорными свойствами, является сильно выраженным акцептором электронов, что определяет как кристаллическую и электронную структуру боридов, так и их свойства. Высокие акцепторные свойства бора в первую очередь вызывают образование ковалентных связей между его атомами не только в элементарном боре, но и в боридах, где в их формировании участвуют не одни валентные электроны бора, но и металлов — партнеров по соединениям. Это приводит к образованию структурных элементов из атомов' бора, тем более сложных, чем меньшее число электронов атомов металла-партнера может принимать участие в образовании связей В—В, т. е. чем более выражены непосредственные обмены валентными электронами между атомами собственно бора. Поэтому образование боридных фаз с каркасными структурными элементами из атомов бора (гексаборидов МеВ6, додекаборидов MeBi2) характерно для щелочных, щелочноземельных, редкоземельных металлов; в то же время переходные d-метал-лы — сильные доноры электронов — склонны__к__образованшо_ боридных фаз с более простыми структурными элементами из атомов бора — линейными и плоскими.* Способность переходных металлов с недостроенной d-оболочкой к поливалентности и образованию ковалентных связей Me—Me определяет многообразие боридных фаз, кристаллических структур и свойств, что вызвало их интенсивное исследование в последние десятилетия.
5
Стремление к образованию атомами бора в боридах «^-гибридных конфигураций, являющихся носителями твердости и хрупкости, в значительной степени определяет твердость и хрупкость большинства боридов. Однако их твердость и хрупкость меньше, чем у соответствующих карбидов, так как в структурных элементах из атомов бора обычно комбинируются sp3- и менее прочные sp2 (а иногда и еще менее прочные s2p-, sp-) -конфигурации, в то время как для атомов углерода в карбидах наиболее характерна «р3-гибридизация.
Образование ковалентно связанных структурных элементов из атомов бора в боридах при наличии электронов проводимости атомов металлов вызывает уменьшение решеточного рассеяния носителей тока и высокую электропроводность боридов, иногда болей высокую, чем у соответствующих металлов.
В то же время наличие структурных элементов из атомов бора, упрочняющих решетку, приводит К относительно умеренным значениям коэффициента термического расширения, высокой тугоплавкости, химической инертности.
Наряду с боридами — соединениями бора с более электроположительными элементами периодической системы — большой научный и практический интерес представляют его соединения с более электроотрицательными элементами— неметаллами, а также в целом с «-, p-элементами. В Этом случае образуются преимущественно ковалентные соединения, химическая связь в которых определяется сложными типами гибридизации, в конечном счете направленными на формирование максимальной локализации валентных электронов в sp3- и «2р6-конфигурации. К Числу таких соединений относятся, в частности, карбиды, нитриды, фосфиды, халькогениды бора, соединения бора с кремнием, алюминием. Эти соединения формально не могут быть названы боридами, однако элементы общности построения химической связи, определяющее значение в ней бора, а также их высокая тугоплавкость позволяют рассматривать Их вместе с собственно боридами.
Все соединения ,бора, кроме характерных особенностей Элект; ронного строения и кристаллических структур, объединяются также тем замечательным свойством, что бор обладает способностью сильно поглощать нейтроны (изотоп 10В и в меньшей степени природная смесь изотопов). Это обусловливает использование соединений бора для изготовления регулирующих стержней реакторов, а также биологической защиты от нейтронного излучения. Особое значение в этом отношении имеют карбид и нитрид бора, а также некоторые бориды металлов.
Бориды и другие тугоплавкие соединения бора находят все более широкое использование в промышленности и технике. Высокая твердость позволяет применять их как абразивы, обеспечивающие при обработке пластичных металлов и сплавов более высокую чистоту поверхности, чем шлифование синтетиче
6
ским алмазом; давно известен и применяется как абразив кар* бид бора, а в последние годы — кубическая модификация нитрида бора (боразон или кубонит) и особенно гексагональная вюрцитная модификация нитрида бора — гексанит, обладающий наряду с высокой твердостью также известной пластичностью. Последнее свойство позволяет изготовлять из гексанита также 'высокоэффективные режущие и другие металлообрабатывающие ^инструменты.
Высокая жаропрочность некоторых боридов делает их перспективными компонентами жаропрочных сплавов, особенно .композиционных материалов, армированных боридными волокнами или, дисперсноупрочненных боридами.
Широко известны огнеупорные свойства некоторых боридов, особенно диборида циркония и керметов на его основе, отличающихся высокой стойкостью против действия расплавленных сталей, чугунов и других металлов и сплавов, что позволяет изготовлять из боридов защитные чехлы термопар и собственно термопары, а также различные футеровочные, электродные и иные подобные материалы и детали металлургических печей.
Еще более .широко распространено„лспользование боридов-лантаноидов в электронике (особенно гексаборида лантана) в связи с их низкой работой выхода, высокими плотностями снимаемых токов и стойкостью против ионной бомбардировки.
Бориды никеля и некоторые другие бориды успешно используются в качестве катализаторов в процессах гидрирования и иных реакциях органического синтеза.
Важную роль играют бориды при создании поверхностных покрытий на железе, сталях, тугоплавких металлах; такие покрытия отличаются высокой износостойкостью, коррозионной стойкостью и прочностью удержания на основном металле.
Диэлектрические свойства неметаллических тугоплавких соединений бора используются в технике высоких температур, плазменных устройствах, в электротехнике и электронике.
Бориды и другие подобные соединения бора представляют удобные и довольно простые объекты для изучения электронного строения и химической связи, необходимого для постепенного приближения к решению задач создания тугоплавких материалов с заранее заданными свойствами.
Все это вызвало широкие исследования боридов и неметаллических соединений бора как в СССР, так и за рубежом. Исследования были начаты у нас в стране в Московском институте цветных металлов и золота им. М. И. Калинина (Г. А. Меер-сон, Г. В. Самсонов, Р. Б. Котельников), ГИПХ (Л. Я. Марковский, В. С. Нешпор), ФХИ им. Л. Я- Карпова (Б. Ф. Ор-монт, В. А. Эпельбаум) в послевоенные годы и затем получили значительное развитие в Институте проблем материаловедения АН УССР, ВИАМ (К. И. Портной), Институте новых химических проблем АН СССР (М. И. Айвазов), ИМЕТ им. А. А. Бай
7
кова АН СССР (Ф. И. Шамрай), ФТИ АН СССР (В. Н. Гурин), Московском институте стали и сплавов (С. С. Кипарисов), ИАЭ им. И. В. Курчатова, ИФХИМС СО АН СССР, Львовском университете. Они позволили существенно расширить представления о структуре и свойствах боридов, найти новые области их промышленного и технического использования, а также разработать методы их получения, реализованные в промышленном масштабе. В результате работ Института высоких давлений АН СССР и Института сверхтвердых синтетических материалов АН УССР организовано промышленное производство кубического нитрида бора. В Институте общей и неорганической химии АН ЛатвССР и других организациях развиты плазменные методы получения дисперсных порошков боридов и тугоплавких неметаллических соединений бора, в ИПМ АН УССР и ФТИ АН СССР начаты исследования по получению монокристаллов боридов. В ИПМ АН УССР, Одесском, Белорусском, Киевском политехнических институтах, Уманском пединституте и многих других организациях развиваются работы по нанесению боридных покрытий на детали машин и механизмов.
Большой вклад в исследование электрофизических свойств боридов внесен Херсонским пединститутом, а также Институтом новых химических проблем АН СССР. Термодинамические свойства боридов успешно и систематически исследуются в Московском университете (Г. Л. Гальченко).
В ряде институтов разрабатываются новые эффективные катодные материалы на основе боридов, особенно боридов лантаноидов, или с их участием.
Значительное развитие получили исследования боридов за рубежом. Фундаментальные работы по получению и строению боридов, а также по изучению систем тугоплавких металлов с бором выполнены Кисслингом (Швеция), Киффером, Бенезов-ским, Новотным (Австрия), Глезером, Шварцкопфом, Биндером, Дж. Нортоном, Блюменталем, Московичем, Постом, Бру-эром, Матковичем (США), Гренобльской школой (Пастор и др.) и школой в Бордо (Хагенмюллер, Налэ, Этурно и др.) во Франции, в ГДР Мерцем и др., в ПНР под руководством Не-мысского.
В настоящее время изучение боридов приобретает принципиально новые направления, связанные с получением этих соединений высокой степени чистоты, в монокристаллическом виде, заданной дисперсности, а также с приготовлением из боридов крупногабаритных изделий. Важной научной задачей является разработка методов повышения пластичности боридов, решение которой позволит существенно расширить области их использования и сделать бориды эффективными конструкционными материалами.
Глава I
СТРОЕНИЕ И ФИЗИКО-ХИМИЧЕСКИЕ
СВОЙСТВА БОРИДОВ
КРИСТАЛЛОХИМИЯ И СТРУКТУРНЫЕ ОСОБЕННОСТИ
Вопросы соотношения между составом, структурой и типом химической связи в боридах сложны. Известно, что тип кристаллической структуры соединения определяется его составом и типом химической связи. Состав же соединения обусловливается валентностью, электронной концентрацией, размерами атомов, а также структурными особенностями.
Из 70 исследованных двойных систем простых веществ с бором соединения образуются только в 55 системах; это соединения, содержащие элементы 1а—Villa подгрупп и цинк. Элементы 16—IV6 подгрупп периодической системы элементов соединений с бором не образуют.
Максимальное число боридных фаз с различным содержанием в них бора (атомное отношение В/Me изменяется от 1/4' в соединениях типа Ме4В до 12/1 в МеВ^)- образуют редкоземельные и тугоплавкие переходные металлы III—VIII групп, для которых возможны различные валентные состояния, связанные с перекрытием d-, f-, р- и 5-орбиталей.
Двойные системы с бором различаются также интервалами составов, в которых образуются соединения. Для большинства систем соединения содержат бор в пределах 25—66,7%, что отвечает формульному составу Ме4В—МеВг.
Важными факторами, от которых зависит состав всех остальных соединений бора, являются: размерный фактор, учитывающий в первую очередь соотношение размеров взаимодействующих атомов (гц/гме); электрохимический фактор, связанный с электронными переходами, и электронная концентрация, определяемая степенью локализации и делокализации электронов.
Все отмеченные факторы связаны между собой и зависят определенным образом от расположения элементов в периодической системе.
Образование различных структурных комплексов из атомов бора в боридах объясняется спецификой электронного строения бора, энергетической неустойчивостью внешних электронных состояний: 2s22p’. При образовании борида происходит перераспределение внешних электронов с образованием sp2- и sp3-
9
Кристаллохимические характеристики
Металл Борид Сингония Содержа ние-бора, масс. % Структурный тип Пространственная группа Число формуль-иых единиц
Li LiB6 —— 90,33 Близок к а-А1В12 — —
Na NaBe Кубическая 73,84 СаВ4 О\ — Рт Зт 4
NaB15 Ромбическая 86,7 NaB16 Р^или 4
К KB6 Кубическая 62,39 СаВв — Рт Зт 4
Be Be5B Тетрагональная 19,36 ВеБВ Р4/птт —
Be2B Кубическая 37,16 Антитип CaF2 — Рт Зт 4 ’
BeB2 Гексагональная 70,61 А1В2 Dl6fl — Рб/ттт. 1
BeB4 Тетрагональная 82,76 ив4 D^h — P4/mbm 4
BeBe » 87,81 Близкая к А1В1а — —
BeBg Гексагональная 91,53 —
Mg MgB2 » 47,0 А1В2 — P&jmmm I
MgB4 Ромбическая 64,03 MgB4 Рпат —
MgB„ Тетрагональная 72,8 ||~ —•
MgBia Не опр. 84,5 — —
Са CaBe Кубическая 61,9 СаВв — Рт Зт 4
Sr SrB6 » 4?,56 СаВв 0^—РтЗт 4
Ba BaBe 31,96 СаВв 0^ — Рт Зт 4
Al A1B2 Гексагональная 44,49 А1В2 DgA Р<з[ттт 1
A1B1O Ромбическая 80,03 —- 5,2
a-AlB12 Тетрагональная 82,78 — Р42242 14,4
₽-aib12 Ромбическая 82,78 — 12/m2/m2/a 15,8
y-AlB12 » 82,78 <— Р212121 29
Sc ScB2 Гексагональная 32,42 А1В2 Dgft — Р&)ттт 1
ScB12 Кубическая 74,28 ив12 0® — Frn Зт 4
Y YB2 19,5 А1В2 Dgh — Р&/ттт 1
yb4 Тетрагональная 32,7 ив4 — Р4)тЬт 4
YB6 Кубическая 42,2 СаВв 01 — Рт Зт п 4
yb12 » 59,4 ив12 0^ — Рт Зт 4
YBee 88,9 YB6e Рт Зс —
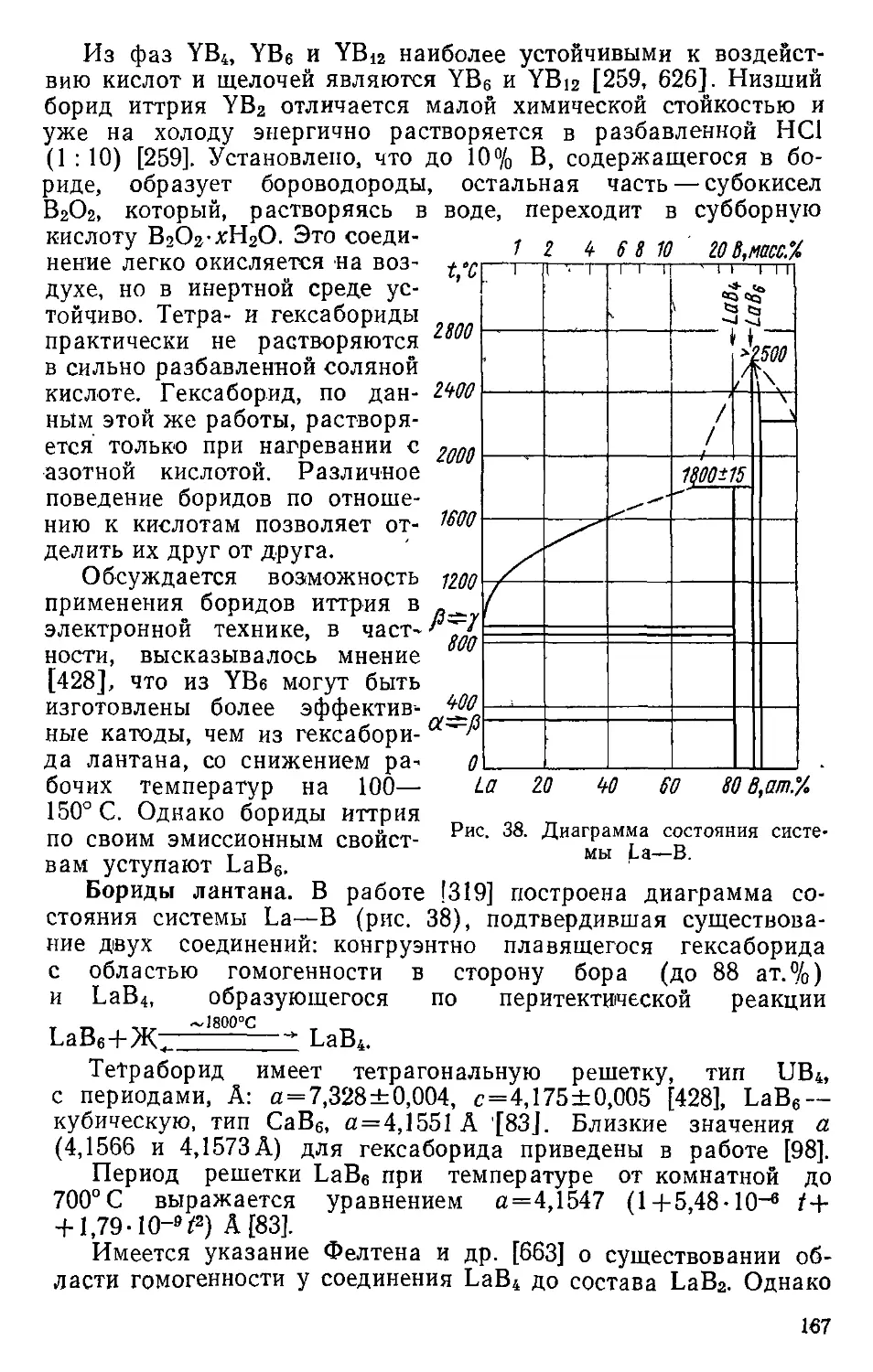
La LaB4 Тетрагональная 23,7 ив4 D^h — Р4{тЬт 4
LaBe Кубическая 31,7 СаВ6 О}, — Рт Зт 4
Si SiB4 Ромбоэдрическая 60,61 SiB4 R Зт 9
12
Таблица 1
двойных соединений бора
О Период решетки., А Среднее межатомное о расстояние, А Плотность, г/см* Литература
а ь с/а Me—Me Me—В в-в рентгеновская пикно- метрическая'
— — — — — — — — — [860]
г— — — — — —- 2,12 [717, 860]
5,847 8,415 10,229 — — — 1,776 — 2,44 [861]
4,232 —. — г 4,232 3,119 1,747 — 2,99 [859]
3,38 — 7,06 2,088 — — — — 2,01 [575]
4,668 — •ч — — 2,33 2,01 3,30 1.9 2,18 [2Н]
9,79 — 9,55 0,975 — — —- 2,35 2,42 [946]
— — .— — — — —- —• [412]
10,16 — 14,28 1,405 — — — 2,33 2,35 [731,946]
5,08 — 8,80 1,732 <— — — — — [946]
3,083 — 3,521 1,142 3,03 2,50 1,78 2,63 2,48— 2,67 [218]
5,464 7,472 4,428 — 3,075 2,392 1,787 2,47 2,49 [218, 702|
7,07 — 6,45 0,912 — — — — 2,45 [218, 380]
— — — г — — —- 2,44 [218]
4,148 — — — 4,144 3,053 1,717 2,45 2,49 [428]
4,190 — — — 4,175 3,093 1,739 3,42 3,28 [428]
4,280 ——* — — 4,261 3,139 1,766 4,25 4,26 [428]
3,009 — 3,262 1,08 3,12 2., 37 1,73 3,18 2,84 [662]
8,881 9,100 5,690 .— — f — — 2,537 [776]
10,161 — 14,283 1,405 — — — —4 2,557-2,660 [777, 779]
12,34 12,631 10,161 — — — — — 2,60 [777, 779]
16,56 17,53 10,16 — — — —- 2,56 [778, 779]
3,148 3,516 1,116 — — — 3,665 3,642 [658, 900]
7,422 — — — — — — 2,890 2,883 [658, 900]
3,303 — 3,842 1,632 — -J- — 2,91 — [240, 809]
7,086 — 4,012 0,565 — — —— 4,36 — [927]
4,102 — — — 4,101 3,040 1,710 3,70 3,72 [211, 428]
7,506 — — — 2,783 1,809 1,684 3,43 — [211,827]
23,44 — — — — — .— —• — [951,964]
7,324 — 4,181 0,57 — — — 5,44 — [428,667]
4,156 — * — 4,153 3,061 1,722 4,71 4,69 [428,841]
6,319 — 12,713 2,01 —’ •— 2,43 2,43— 2,55 [601]
13
Металл Борид Сиигоиия Содержание бора, масс, % • Структурный тиа Пространственная группа аЧнсло формуль-пых единиц
SiBe Ромбическая 69,78 SiBe Pnnr, Pnntn 40
Tf TiB 18,45 FeB DU — Pbntn 4
Ti3B4 Орторомбическая 23,13 Та3В4 ImrrLm 2
TiB2 Гексагбнальная 31,10 А1В8 D\hb~P&lmmm 1
Ti2B6. » 36,10 w2b5 Dt,h P^lmnK 2
Zr ZrB2. 19,81 ajb2 D1^ — P&jmmm 1
ZrB18 Кубическая 58,75 UB12 1 0^ — Fm3m 4
Hf HfB2 Гексагональная 10,81 А1В2 Dgh ~~ P&lmtnm I
Th ThB4 Тетрагональная 16,7 ив4 Dlh — P4/mbm. 4
ThBe Кубическая 21,82 СаВв Olh -r- Pm3m 4
ThB7e 7,79 YB66 ртЗб —
V V3B2 Тетрагональная 12,4 U3Si2 P4/mbm
VB Орторомбическая 17,5б CrB — Cmcm 4
V6Be 20,29 V6Be Ammrn —.
VsBt 22,05 Ta3B4 — Immm 2
V2B3 24,14 V2B3 Cmcm
VB2 Гексагональная 29,8 aib2 Dgh РЪ/ттт. 1
Nb Nb3B3 Тетрагональная 7,21 U3Si2 D^h — Pb/mbm
NbB Ромбическая 10,44 CrB ^2h Сжт 4
Nb3B4 13,32 ^a3B4 ©2/j— Immrri 2
NbBa' Гексагональная 18,89 A1B? Dgh — P6/mmm 1
Ta Ta2B Тетрагональная 2,90 CuA12 tymcrn 4
Ta3B2 » 3,84 U3Si2 D^h—P4/mbm
TaB Ромбическая 5,64 CrB P2I — Cmcm 4
Ta3B4 , » 7,38' Ta3B4 — !mmm. r 2
TaB2 Гексагональная 10,68 aib2 — P§[mmm 1
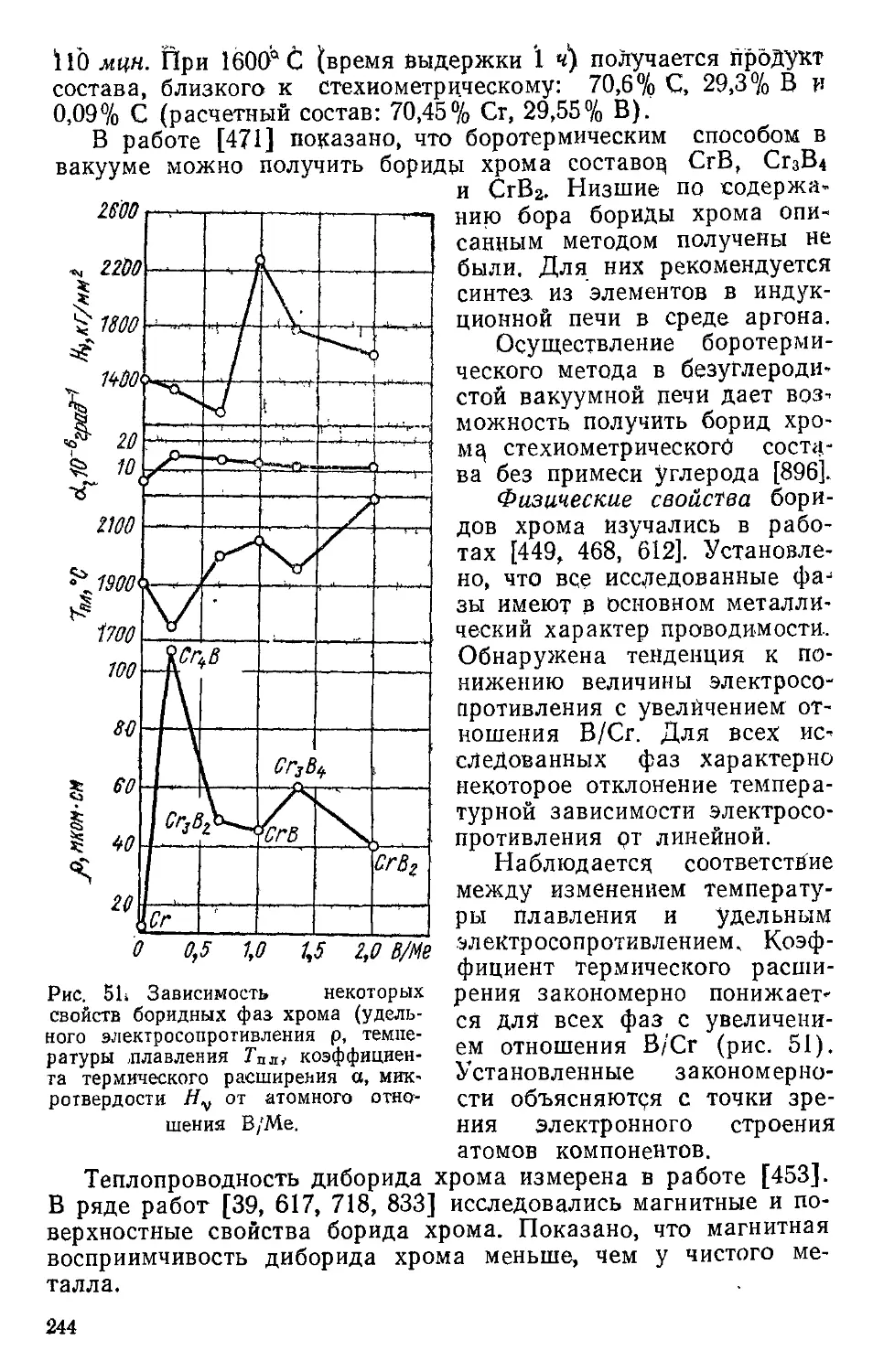
tr Сг2Й Ромбическая 9,45 Mn4B D^-Fddd ’в
Cr&B3 Тетрагональная 11,1 CrsB3 O4h — P4[mbm
CrB Ромбическая 21,72 CrB ©2h ~~ Cmcm 4
Cr3B4 S’ 29,55 Ta3B4 ^2h — fmmm 2
14
Продолжение табл. 1
О Период решетки, А Среднее межатомное о расстояние, А Плотность, Литература
d Ъ С с[а Ме-Ме Me—В в-в рентгеновская пикнометрическая
14]392 18,267 9,885 2,39 2,43 [530]
6,112 3,054 4,560 — 1 >— 5,26 5,09 [643, 814,902]
3,259 13,73 3,042 — — *" — Д- Ч—• [665]
3,028 •Ui 3,228 1,066 2,35 1,75 4,52 4,45 [121, 655, 814]
2,98 13,98 4,06 с •<— г—* —. [530]
3,165 — 3,547 1,12 -г-т 2,50 1,83 6,09 6,17 [359, 906]
4,408 1 2,75 1,73 3,63 3,75 [697, 827]
3,14 ——• 3,47 1,105 —— 2,47 1,81 11,28 10,5 [814, 930]
7,257 >— 4,097 0,564 3,9 2,92 1,77 8,45 — [1027]
4,110 .— —- —ч 4,11 3,028 >,703 7.Ю 6,99 [428, 657]
25,518 — ч—- -г* •— — [951]
5,739 .— 3,029 0,528 —- 2,29 1,79 6,56 5,83 [687, 967]
3,060 8,048 2,972 — ——— 5,44 г—» [869, 967]
3,058 21,25 2,974 —Л *—f •*— [967]
3,058 13,22 2,981 4-^ <r—г —- 5,44 О' ।« [814,967]
3,061 18,40 2,984 —— —— uU. [814, 967]
2,998 3,057 1,019 2,28 1,73 (5,10 4,61 [121, 869]
6,185 3,281 0,53 >— ч, 7,99 8,00 [561, 871]
, 3,298 8,724 3,166 -Ч- 7,6 11 1 [561,871]
3,305 14,08 3,137 —*> — — — 7,33 [561]
3,086 •Д- 3,306 1,07 2,38 1,78 7,00 6,60 (121]
5,780 Г— 4,865 0,841 2,73 2,47 2,43 15,18 r-*J [766, 769, 800]
6,175 —• 3,284 0,531 — -Ч-» V— 15,00 15,01 [800, 871]
3,276 8,669 3,157 —• ч— 4- * 14,29 14,0 [561, 7661
3,284 13,98 3,129 — 1— — ч 13,60 13,50 (561, 766, 931]
3,097 —‘ 3,225 1,041 —i- 2,38 1,78 12,62 11,70 [121, 561, 931]
14,71 7,41 4,25 — 2,45 2,18 — 6,24 6,07 [579]
5,44 — 10,07 1,851 — — —— 6,12 6,03 [579, 814]
2,969 7,858 2,932 — •— — 6,12 6,13 [561, 579, 814]
2,986 13,020 2,952 — ’— 5,76 5,22. [539, 654, 770]
15
бора
0) S tf
§ Борид Сингония £ Я Структурный тип Пространственная группа о 5 •&s g 5
л 1) и i *
о S о я О 2
СгВ2 Гексагональная 34,2 А1В2 Dgh — PS Immm 1
СгВ4 Орторомбическая 45,42 СгВ4 Immm 2
Мо Мо2В Тетрагональная 5,3 СиА12 D\sh — 14/mcm 4
а-МоВ » 10,1 a-MoB £>4® — A-Jamd 8
р-МоВ Ромбическая Ю,1 CrB Dl^h — Cmcm 4
MogBg Ромбоэдрическая 22,0 MogBg D3d — ^m —
МоВ4 Гексагональная 31,15 МоВ4 D6h — P63/mmc 4
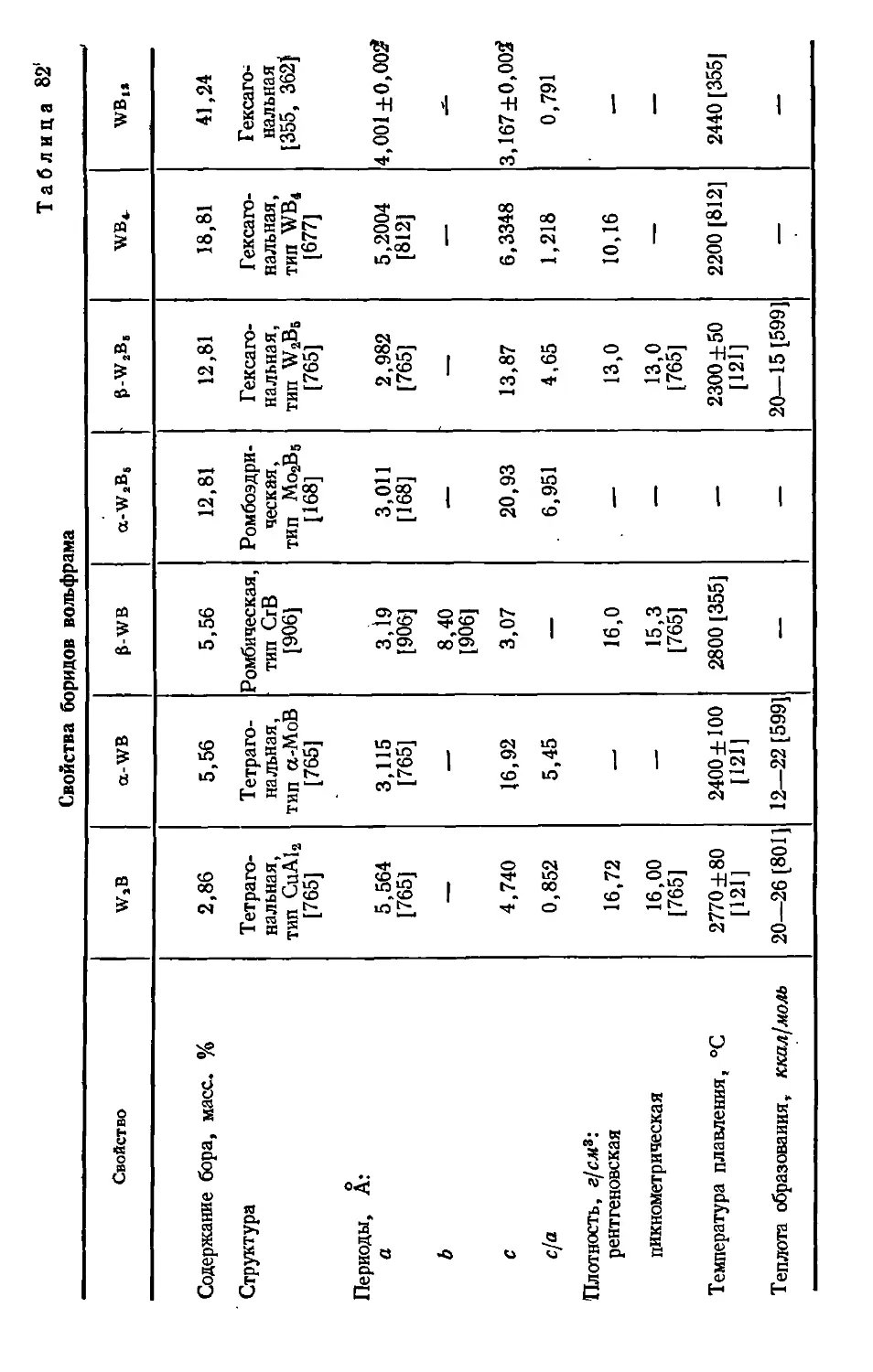
W W2B Тетрагональная 2,86 CuA12 — Щтст 4
a-WB » 5,56 a-MoB —
p-WB Ромбическая 5,56 CrB — Cmcm —
p-W2B6 Гексагональная 12,81 W2B5 Dlh~ Р^з/ттс 2
a-W2B6 Ромбоэдрическая 12,81 Mo2B5 D3d — Ют
WB4 Гексагональная 18,81 MoB4 D6h — Р^з/ттс 2
и UB2 7,03 aib2 Dgh— PS/ттт 1
UB2 7,03 aib2 Dgh — PS Immm 1
UB4 Тетрагональная 15,36 ub4 D\h — P^lmbm 4
UB42 Кубическая 35,00 UB12 Од — Fm3m 4
Мп Mn4B Ромбическая 4,68 Mn4B D™ — Fddd 8
Mn2B Тетрагональная 8,95 CuA12 D\sh — li/mcm 4
MnB Ромбическая 16,44 FeB I>2h — Pnma 4
Mn3B4 20,78 Ta3B4 Z>2h — Immm 2
MnB2 Гексагональная 28,23 A1B2 Dgh — P6/mmm 1
MnB4 Моноклинная 44,04 MnB4 C2/m
Тс Tc,B Ромбическая 26,68 Re3B — Cmcm 4
TC,B3 Гексагональная 31,87 Th7Fe3 C6o — P^fnc 2
TcB2 17,92 ReB2 D6h ~~ P^l/nmc 2
Re Re3B Ромбическая 1,89 Re3B — Cmcm 4
Re7B3 Гексагональная 2,42 Th7Fe3 Сы—Р&зпк 2
ReB2 10,49 ReBa D46h — PS3/mmc 2
16
Пр'одо'л'жение табл. 1
Среднее межатомное Плотность,
Период решетки, А расстояние А г/см* Литература
рент- пикно-
а Ь с с/а Me—Ме Ме—В В-В генов-ская метрическая
2,969 — 3,066 1,066 — 2,26 1,73 5,22 5,6 [121, 528, 579]
4,744 5,477 2,866 2,866 2,20 1,75 — — [540]
5,543 4,735 0,854 2,67 2,37 2,37 9,31 9,10 [765, 769, 814, 977]
3,110 16,95 5,45 — — — 8,77 8,3 [765, 814]
3,16 8,61 3,08 — — — — — — [561, 765]
3,011 - - 20,936 6,703 3,01 2,4 1,81 7,48 7,01 (765, 814]
5,203 6,345 1,219 3,004 2,351 1,734 — . — [814, 816]
5,567 4,745 0,852 2,68 2,38 2,37 16,72 16,00 [765, 880]
3,115 16,22 5,45 — — — — — [765, 812]
3,19 8,40 3,07 — — — — 16,0 15,3 [765, 906]
2,982 13,87 4,65 2,983 2,31 1,76 13,0 - 13,0 [765, 814]
3,011 20,93 6,951 — — — — - [168]
5,200 6,334 1,218 ——• — — — — [677]
3,1293 3,9893 1,274 3,66 2,69 1,81 12,71 — [24, 736]
(при избытке В) 1,272
3,1314 (при из- —» 3,9857
бытке U) 7,075 3,979 0,562 37,6 1,72 9,38 9,32 — [24, 1027]
7,477 —— — 5,28 2,771 1,76 5,825 5,65 [736, 827]
14,53 7,293 4,209 — 2,64 2,19 2,И — 6,62 [12, 770]
5,148 4,208 0,817 2,37 2,20 2,11 — 7,21 [12, 770]
5,560 2,977 4,145 U—-» — , 1 т— — 6,35 [12,561; 770]
3,032 12,86 2,960 — 2,86 2,19 — — 5,95 [561, 758, 770]
3,007 3,037 1,009 3,02 2,31 1,74 — 5,20 [588]
5,5029 3,3669 2,9487 ₽= 2,949 2,15 1,80; — — [541, 543]
=122,71ч 2,81
2,891 9,161 7,246 — —> — — [561,998]
7,417 4,777 0,644 — — — — — [561, 998]
2,892 7,453 2,578 — — — — [561, 998]
2,890 9,313 7,258 — 2,79 2,23 — — — [561, 356, 362]
7,469 .— 4,713 0,636 — — — — — [356, 362, 561]
2,900 — 7,478 '^2,578 2,900 2,24 1,82 — — [561, 791]
2 Зак. 1305
F Металл Борид Сингония Содержание бора J масс. % Структурный тип Простран ственная группа Число формуль-ных единиц
Fe Fe2B Тетрагональная 8,84 СцА1а —14/ nian 4
FeB Ромбическая 16,25 FeB Г>2® — Pnma. 4
Ru Ru7Bs Гексагональная 4,38 Th,Fe3 Ctv—p&amc 2
RUuBg Ромбическая 7,22 RuhBs Pbam 2
RUBJJ Гексагональная 9,66 wq Dgh — P6m2 1
RU2B3 16,05 W2B6 Dth — Р^з/ттс 2
RuB2 Ромбическая 17,62 RuB2 — 2
Os OsBj (2 Гексагональная 5,38 WC D^h — P&m2 1
OsBj 6 7,86 w2B8 D6h — Р^з/ттс 2
OsB2 Ромбическая 10,21 RuB2 1- 2
Pu PuB Кубическая 4,24 NaCl — Fm3m 4
PuB2 Гексагональная 8,19 AlBa t)\h — Pb/mtnm 1
PuB4 Тетрагональная 15,05 UB4 Dfh — P4/mbm 4
PuBe Кубическая 20,99 CaBe Olh — РтЗ.п 4
Co Co3B Ромбическая 5,77 Fe3C D}^ — Pnma 4
Co2B Тетрагональная 8,4 CuA12 D\6h — 14/man 4
CoB Ромбическая 15,51 FeB — Pnma 4
Rh RhvBg Гексагональная 4,31 Th,Fe3 c&v ~ P^ 2
RhB^t। 10,35 Ahth-NIAs He onp. 2
Ir IrBl,15 Тетрагональная 5,83 a-ThSi2 —
IrBl ,35 Моноклинная 7,59 IrBi ,35
Ni NisB Ромбическая 5,78 Fe3C p\h — Pnma 4
Ni3B Тетрагональная 8,43 CuA12 D\&h — 14/mcm 4
Ni4B3«>) Ромбическая 12,13 N14B3(o) Pnma 4
Ni4Bs(m) Моноклинная 12,13 Ni4B3(m) C2/C 4
NIB Ромбическая 15,55 CrB ©2Л — Cmcm 4
Pd PdsB 3,27 Fe3C Pnma 4
Pd6B2 Моноклинная 3,90 MnjCj C 2/C 4
Pt PtsB Тетрагональная 1,90 — —
PtBM Гексагональная 5,24 Ahth-NIAs —’ —
18
Продолжение табл. 1
О Период решетки, А Среднее межатомное Плотность, г/сл<* Литература
расстояние О А
а b с с/а Ме—Ме Me—В в—в рентгеновская пикнометрическая
5.Ю9 — 4,249 0,831 2,12 -г- 6,93— 7,30 (357, 561]
5,506 2,952 4,061 -Т- — —* 1,8 6,47— 6,8 [35/, 561]
7,469 —, 4,714 0,633 2,77 2,16 3,22 10,78 [553,761]
11,609 11,342 2,836 — 2,79 2,18 — — •—— [562]
2,852 -— 2,855 1,001 — • — — [561,568]
2,89 — 12,81 4,432 3,228 2,18 1,82 «— —т [812, 814]
4,645 2,865 4,045 и. 3,26 2,20 1,82 7,56 J— [539, 560, ! 761]
2,876 . *— 2,871 0,998 — — —X —• [568]
2,91 — 12,91 4,436 —* [761]
4,684 4,076 2,872 2,51 2,21 1,84 12,82 —— [560, 926]
4,92 — — 2,46 — — [835]
3,18 1 3,90 1,226 —— 2,57 1,83 —-• [835]
7,10 !< 4,014 0,565 1—ь 2,69 — — — [835]
4,115 —Г- — 2,69 1,75 -ь- [835]
5,225 6,629 4,408 —• 2,46 2,01 — 8,8 -h — 1935, 936]
5,016 4,220 0,841 2,57 2,15 2,11 — — [561, 935, 936, 957]
5,253 3,043 3,956 —— 2,60 2,12 1,86 — — [561, 936, 957]
7,471 — 4,777 0,642 -— — —— 10,82 —• [561]
3,309 —>4 4,224 1,276 3,08 2,18 2,11 9,51 — [553, 562]
2,810 10,263 3,652 —- «— 16,73 > [554]
10,525 2,910 6,099 ₽= =91,07° 2,94 2,18 2,06 14,70 — . [561, 814]
5,2105 6,6174 4,3904 — 2,57 2,18 3,04 “• — [937, 938]
4,990 4,245 0,851 2,36 2,14 2,12 —1 4— [539, 561, 769]
11,954 2,9815 6,5684 —у- 2,70 2,16 2,66 [832, 938]
6,4282 4,8795 7,8190 р=. =103,315° 2,68 2,17 2,38 —L [832, 938]
2,925 7,396 2,966 — — — —- 7,13 — [561, 539]
5,463 7,567 4,852 — —, 2,17 10,9 — [561,980]
12,786 4,995 5,472 =97,2° 2,83 2,18 — 10,68 •—' [362, 561]
2,63 — 3,83 1,456 2,845 2,17 — — — [554,
3,358 — 4,058 1,208 2,81 2,19 2,03 17,25 i— 1UV4J [554, 814]
2* 19
Комбинации изолированных атомов бора и зигзагообразных цепей наблюдаются в структуре NiiB3(o), изолированных атомов бора и разветвленных цепей — в структуре RunB8.
В монобориде рутения RuB~i,i со структурой типа WC или деформированного А1В2 атомы бора изолированы друг от друга, как и в ItB~i,i, которому приписывается структурный тип a-ThSi2 с некоторой деформацией.
В структуре IrB-jj (тип ThSi2) атомы бора наряду с изолированным состоянием образуют зигзагообразные цепи, параллельные осям а и b [814].
В боридах со структурой типа Та3В4 (ромбическая ячейка с двумя формульными единицами) атомы бора образуют двойные цепи, пронизывающие металлические призмы двух типов, отличающихся друг от друга размерами и направлением боковых граней (в меньших призмах они параллельны оси х, в больших — оси у). Расстояния В—В в цепях и между цепями различны. К этому структурному типу относятся бориды Ti3B4, V3B4, Nb3B4, Та3В4, Сг3В4 и Мп3В4.
В структуре V3B6, недавно описанной Спиром [967], параллельно двойным цепям располагаются зигзагообразные борные цепи. В этой же работе описана новая конфигурация из атомов бора, не встречавшаяся ранее, показанная на рис. 1,ж и представляющая тройные цепи.
Следует заметить, что упомянутые выше двойные и тройные цепи из атомов бора, наблюдаемые в боридах типа Та3В4 и V2B3, уже можно рассматривать как элементы гексагональных ячеек, характерных для структур диборидов металлов (структурный тип А1В2).
Бориды с сетками из атомов бора. Для диборидов переходных металлов характерна структура типа А1В2 (гексагональная ячейка с двумя формульными единицами). Структура А1В2 построена из трехгранных призм, в вершинах которых находятся атомы металла, а в центрах призм располагаются атомы бора, образующие графитоподобные плоские сетки. Слои, из атомов бора атомодмшадда^в последоватёль-
ЛР.М..порядке. Атом бора окружен шестью атомами металла и тремя атомами бора, атом металла — шестью атомами металла и 12 атомами бора.
На рис. 3, 4 показаны элементарная ячейка МеВ2 и структура металлических и борных слоев в боридах типа А1В2.
К описанию этой структуры можно подойти иначе, полагая, что атомы металла располагаются слоями (см. рис. 4), параллельными базисной плоскости, причем в каждом слое они имеют плотную упаковку; у каждого атома металла есть шесть ближайших соседей в плоскости и два соседа (один выше, другой ниже) на несколько большем расстоянии. Атомы бора располагаются слоями, лежащими между металлическими слоями, и каждый атом бора имеет три ближайших соседа на обычном 20
расстоянии (около 1,73А). Такое расположение дает более сильные связи. В—В. С учетом плотной упаковки слоев в структурах внедрения интересно проследить, как изменяются параметры решетки с изменением размеров атомов металла /табл. 2).
Все параметры уменьшаются с понижением размеров атомов металла. В ZrB2 расстояние Ме—Ме в металлических слоях та
кое же, как в чистом металле. Дырка, в которой располагается атом бора в структуре плотной упаковки, имеет размеры больше нормального радиуса бора (0,87 А), но атом бора должен ее заполнять, так как, во-первых, это характерно для фаз внедрения и, во-вторых, удаление металлических
Рис. 3. Элементарная ячейка Рис. 4. Слои металлических атомов
МеВ2. (а) и атомов бора (б) в кристалле
AlBj.
Таблица 2
/ °
Рассчитанные параметры решетки, А [121]
Боридная фаза Me—Me в слоях В—В в слоях Me—В Расстояние между слоями' Me—Ме в _чнстом металле
tib2 3,026 1,750 2,380 3,213 2,920
ZrB2 3,169 1,830 2,540 3,530 3,170
HfB2 3,141 1,815 2,510 3,470 3,203 .
vb2 2,998 1,730 2,310 3,057 2,630
NbB2 3,086 1,780 2,430 3,306 2.&50
TaB2 3,078 1,780 2,410 3,265 2,850
СгВ2 2,969 1,720 2,30 3,066 2,555
21
слоев друг от друга в структуре МеВ2 значительно больше, чем у отдельных атомов.
К структурному типу А1Вг близки структуры типа М02В5, М.0В4, W2B5 и ReB2 [916J. Общая черта этих структур — наличие правильных или деформированных двумерных борных ячеек.
Структура W2B5 отличается от А1В2 видом сеток из атомов бора и является дефектной. Этот тип решетки имеет борид
Рис. 5. Кристаллическая структура IrBi,35: а '—борные слои; б —сдвоенные слои металлических атомов, пронизан-ные зигзагообразными цепями из атомов бора.
вольфрама идеального состава W2B5. Обнаружена низкотемпературная модификация W2B5 (a-W2B5) [168] со структурой типа Mo2Bs, отличающейся от W2B5 характером чередования слоев из атомов металла.
Ru2B3 и RuB2 с псевдогексагональными гофрированными слоями из атомов бора, а также IrBi,3s (рис. 5) тесно примыкают к семейству структур типа А1В2, хотя экспериментальные данные для IrBi.as [561] не исключают возможности наличия трехмерных борных сеток.
В табл. 3 и 4 приведены некоторые характеристики структур типа А1В2 и близких к нему. Группа родственных типу А1В2 структур подробно обсуждена в работе [814] с использованием различной укладки металлических и борных слоев. Характерным для этой группы структур является наличие плотно-упакованных гексагональных слоев из атомов металла (А, В, С) и трех типов слоев из атомов бора (К, К', Н и Н'), показанных на рис. 6. На рис. 7 представлены экспериментально обнаруженные дефектные слои металлических атомов (А', В') в структуре Мо1_жВ3 (МоВ4) [816].
Все слои располагаются вдоль оси с. Борные слои типа К и К' слегка деформированы, слои Н плоские. Связей В—В в плоских слоях типа Н' нет.
22
Таблица 3
Положение атомов металла в некоторых структурах боридов, относящихся к типу Л1В2 [814, 916]
Фаза О Расстояние Me—Me, А 2 гМе» A О расстояние Me—X, A 'Me+O.Se.A
внутри слоя между слоями
МоА* [765] Мо—6Мо 3,01 .AA: Mo—IMo AB: Mo—3Mo 3,14 4,21 2,80 Mo—3B(1) B(l) 6B(2) 3B(3) 2,3 2,3 2,3 2,6 2,28
Мо!_хВ3 [816] Мо(1)—ЗМо(2) Мо(2)—ЗМо(1) 3,004 3,004 A'B' Mo(l)—2Mo(l) Mo (2)—3Mo(l) 3,17 4,37 2,80 Mo (1)—12B Mo (2)—12B 2,35 2,35 2,28
W2B6 [812] W—6W 2,983 AA: W—1W AB: W—3W 3,121 4,190 2,82 W—B(l) 3B (2) 3B (3) 3B(1) 2,25 2,32 2,32 2,33 2,29
ReB, [791] Re—6Re 2,900 AB: Re—3Re 4,097 2,74 Re—-2B 6B 2,23 2,26 2,25
RuaBs [812] Ru—6Ru 2,905 AA: Ru—IRu AB: Ru—3Ru 2,822 3,957 2,64 Ru—IB (1) 3B (2) 3B(1) 2,15 2,19 2,21 2,20
RuBs** [560, 926] Ru—2Ru 2,866 Ru—4Ru 3,924 2,64 Ru—2B 2,14 2,20
Фаза О Расстояние Me—Me, А
внутри слоя между слоями
RuB**{560, 926] 4Ru 2,992
1гВ;>35 [560] 1г(1)-21г(1) 11г (2) 2,910 2,851 Между половинами сдвоенных слоев
21г-(2) 3,085 1г (1)—1г (1) 2,607
21г (2) 3,026
Ir(2)- Пг(1) 2,85 1г (2)—21г (1) 3,026
Sir (1) 3,085
21г (2) 2,910 Между сдвоенными
слоями: 3,755
♦ Положения бора не определены.
♦♦ Средние расстояния по работам [560, 926].
Продолжение Табл. 3
2 А О Расстояние Me—X, А О гМе+0«88.А
2.70 4В . 2,21 2В 2,27 1г(1)—1В(6) 2,07 2,23
2В(3) 2,16 2В (6) 2,17 1В(4) 2,18 1г (2)—2В(4) 2,13 2В (3) 2,16 2В(6) 2,17 1В(4) 2,18 1г (2)—2В(4) 2,13 В(3) 2,16 В (4) 2,16 В (3) 2,16 2В(6) 2,31 В(6) 2,38
Таблица 4
Положение атомов бора* в некоторых структурах боридов, относящихся к типу А1В2 [814, 916]
Фаза Расстояние В—Ме, 'O A 0 A Расстояние В—В, к
Мо2В6* В (2)—6Мо 2,3 2,28 В (2)—ЗВ (2) 1,74
[765] В(1)— Шо 2,3 В(1)-ЗВ(1) 1,92
—ЗМо 2,3 ЗВ (3) 1,79
В (3)—6Мо 2,6 В(3)—6В (1) 1,79
МО] _XB3 [816] В — 2Мо(1) 2,35 2,28 в—зв 1,73
2Мо (2) 2,35 В(1)—ЗВ (1) 1,85
W2B6 В (1)—W 2,25 2,29
[812] 3W 2,33 В (2)—ЗВ(З) 1,72
В (2)—6W 2,32 В (3)—ЗВ (2) 1,72
В (3)—6W 2,32
ReBa В—Re 2,23 2,25 В—ЗВ 1,82
[791] 3Re 2,26 В(1)-ЗВ(1) 1,82
RU2B3 B(l)-Ru 2,15 2,20
[812] 3Ru 2,21
В (2)—6Ru 2,19 1,76
RuB2** В—Ru 2,14 2,20 В—1В
[560, 926] 2Ru 2,21 2В 1,89
2,27
TrR? <» г B(3)—2Ir(l) 2,16 2,23 В(3)-В(3) 1,81
, 35 [560] Ir(2) Ir(2) 2,16 2,16 В(4) 2,04
В (4)—2Ir (2) 2,13 В (4)-2В (3) 2,04
Ir(2) 2,16 2В (4) 2,06
Ir(l) 2,18
B(6)-Ir(l) 2,07 В (6)—2В (6) 1,65
2Ir(1) 2,17
2Ir (2) 2,31
Ir (2) 2,38
* Положения бора не определены.
** Средние расстояния по работам [560, 926].
Используя эту систему обозначения слоев, Лунд стрем представляет следующее их чередование в структурах семейства типа А1В2 [814]:.
А1В2
Мо2В5 Мох—хВз (МоВ4)
W2Bt
ReB2
Ru2Bg
АНАНАН .... АНАКВНВКСНСК А'НВ'Н .... АНАК'ВНВК' . АК'ВК'АК'ВК' . АН'АК'ВН'ВК' .
Хорд и Хьюз в работе [730] подчеркивают, что наиболее важным структурным элементом в типе А1В2 являются прочные борные сетки.
25
Слоев типа Н в структурах Ru2B3 и ReB2 нет. Ru2B3 содержит подобно WC пакеты {АН'А...) и гофрированные К'-слои, в которых бор имеет тетраэдрическое окружение из атомов металла [812]. В структуре ReB2 наблюдаются борные слои К'-типа [791]. Таким образом, гексагональную структуру Ru2B3
-0,025 • Z-+0,025' е z~ О о
О 5 А.
Li 1.1 .< 1 i.i.ij.i
Рис. 6. Слои из атомов металла {А, В, С) и атомов бора (Н, Н', К, К') в структурах, родственных типу А1Вг.
Рис, 7. Дефектные слои из атомов металла (А', В') (а) и слои типа Н из атомов бора в кристаллической структуре Moi-jcBj (М0В4) (б) (последовательность чередования: АН'В'Н.,.)
можно рассматривать как промежуточную между структурами W2B5 и ReB2.
В структуре борида W2B3 при исследовании монокристаллов обнаружены дефектные слои типа К' [812]. Пустые положения 2 (а) могут быть, вероятно, частично заполнены в кристаллах W2Bs, содержащих больше бора.
26
Для высшего борида вольфрама WB4 были высказаны два независимых структурных предположения [880, 925], согласующиеся в структуре металлических слоев (см. рис. 7) и имеющие расхождения в числе и положении атомов бора. Недавние исследования изоструктурного соединения молибдена МоВ4 [816] показали, что предположения Романса и Круга [925] относительно расположения атомов бора в структуре высшего борида вольфрама почти правильны, хотя и имеется одно незаполненное положение атомов бора.
Рис. 8. Кристаллическая структура RuB2!
а — слой из атомов бора; б — слой металлических атомов; в — упаковка борных и металлических слоев.
Борид молибдена МоВ4 содержит плотноупакованные слои из атомов металла, в которых 1/3 атомов удалена и одно из двух оставшихся положений только частично заполнено. Структура МоВ4 базируется на борных слоях типа Н, но в положении 4 (/) атомов бора нет. Обозначенные как А'В' дефектные металлические слои полностью упакованы в структурной последовательности А'НВ'Н... Таким образом, окончательная формула высшего борида молибдена будет Мо]_хВз, где х~ 1/6 [816].
Структура примыкающего к типу Д1В2 борида RuB2 доказана на рис. 8. Гофрированные почти гексагональные слои металлических атомов, как и атомов бора, различаются проекцией вдоль оси с, как это показано на рисунке. Атомы металла имеют шесть ближайших металлических соседей внутри слоя и дополнительно восемь атомов бора, шесть из которых расположены в одном борном слое, а два—в другом. Каждый атом бора окружен, в свою очередь, тремя атомами бора внутри деформированного слоя и четырьмя атомами металла, расположенными в углах деформированного тетраэдра. Упаковка слоев имеет последовательность АК'АК'... Такая структура приводит к незаполненному 2 (6)-положению с z=0,75.
В моноклинной структуре IrBi,35 (см. рис. 5) имеются гофрированные сдвоенные слои атомов металла, располагающиеся параллельно плоскости ab.
27
На основании подробного рассмотрения кристаллической структуры 1гВ1,з5 в работе [560] делается предположение, что гофрированные борные слои и гофрированные сдвоенные слои металлических атомов содержат более или менее непрерывные борные цепочки.
Из данных, приведенных в табл. 2—4, следует, что межатомные расстояния Me—Me внутри плотноупакованных металлических слоев в структурах, близких к типу А1В2, не превышают сумму радиусов более чем на 0,2—0,3 А в RU2B3, ReB2, W2B5 и Mo2Bs. Расстояние между слоями, упакованными в последовательности АА, также не превышает сумму радиусов более чем на 0,3 А, в то время как в диборидах переходных металлов, содержащих большие атомы, расстояния Me—Me внутри металлического слоя меньше, а между слоями больше суммы радиусов [730]. В диборидах, содержащих малые атомы металла, оба типа расстояний Me—Me превышают сумму радиусов примерно на 0,3 А. Расстояния Me—Me между слоями в последовательности АВ (см. табл. 3) превосходят сумму радиусов более чем на 1 А, расстояния Me—В близки к сумме радиусов. Отсюда можно сделать вывод о том, что в рассмотренных структурах связи Me—В играют более важную роль. Эта особенность наиболее ярко выражена в ReB2. Поэтому в дибориде рения связь между слоями в направлении с преимущественно определяется связями Me—В.
Расстояния между гофрированными металлическими слоями в структурах RuB2 и IrBi,35 превышают 3,7 А, в связи с чем следует предположить наличие сильных связей Me—В между слоями.
Бориды с каркасом из атомов бора. Среди боридов, имеющих трехмерные образования из атомов бора, следует отметит особо четыре структурных типа: UB4, СгВ4, СаВ6 и UBi2.
При описании этих структурных типов необходимо в первую очередь остановиться на структуре СаВ6, так как структура UB4 — своеобразная комбинация элементов структур двух типов: А1В2 и СаВ6.
В работах [428, 970] при исследовании гексаборидов Y, La, Се, Pr, Nd, Gd и Er установлено, что все они имеют однотипную структуру. Наличие систематических погасаний показало, что решетка кубическая типа хлористого цезия, центрированная комплексом из шести атомов бора. Атомы металла расположены в узлах простого куба в положениях (000), атомы бора образуют октаэдр и находятся в положениях (1/г1/2±«; 72±«’/2).
Структуру типа СаВ6 (рис. 9) интересно рассматривать как кубическую, в узлах которой располагаются октаэдры.из атомов бора, а в пустотах — атомы металла, поскольку определяющее влияние на общий вид структуры и размеры элементарной ячейки оказывают атомы бора. Атомы металла занимают пу
28
стоты, достаточные по размерам, чтобы не оказывать на них дефор'мирующего влияния [428]. Г. С Жданов и др. [42.81. по-казали, что гексабориды типа СаВ^~образуют элементы, распо--^ГС>жеттгБГе~В?Г7Т^1У'группах периодической системы, кроме бериллия й магния; структура гексаборидо'в'бериллия и магния '-даГИчна “от-типа" СаВ6. Учитывая валентность атома металла, Г. С. Жданов выделяет среди гексаборидов редкоземельных металлов несколько подгрупп.
Рис. 9. Кристаллическая структура гексаборидов типа СаВ6.
Рис. 10. Зависимость атомных радиусов редкоземельных металлов (а) и периодов решеток их гексаборидов (б) от порядкового номера элементов.
К такому же выводу приходят Пост и др. [910] на основании соответствия кривых эффективных атомных радиусов по Клемму* [775] и периодов решеток гексаборидов редкоземельных металлов (рис. 10).
Как показали прецизионные измерения периодов решетки гексаборидов, картина изменения их величин (см. рис. 10) находится в соответствии с общими представлениями о лантаноидном сжатии в ряду редкоземельных элементов.
Для европия и иттербия наблюдается резкое повышение на обеих кривых, что связывается (для атомных радиусов) с двухположительной эффективной валентностью этих элементов. Близкий ход кривых показывает, что эффективная валентность металлов р гексаборидах близка к валентности металлов в чистых кристаллах. Повышение периодов решетки у гексаборидов самария, европия и тулия объясняется не только внешними валентными состояниями, но также изменением состояния /-электронов.
П ряду гексабопилдв-БгВб и.ВаВб .обдадают металлическими £2Ж£сал^ —превосходящими средние. Полинг
29
(891J показал, что йри йерёхоДе ot каЛьция, стронция и барий к скандию, иттрию и лантану наблюдается не только увеличение валентности от п=2/12 к п==3/12, но и дальнейшее ее снижение, приводящее к изменению природы валентности. Щелочноземельные металлы обладают гибридными sp-связями; в Sc, Y и La начинает заполняться 3 d-оболочка и в связи принимают участие s-, р- и d-электроны. С появлением 3 d-электронов начинается большее или меньшее сжатие решетки. Так как стронций и барий не имеют d-электронов, то для них невозможно сжатие в скелете из атомов бора, связанное с уменьшением радиусов металлов и способствующее, образованию гексаборидов, Однакб^^ёзультате"взаимодействия стронция и бария с бором них начинается заполнение d-оболочки, и становится возможным образование гексаборидов SrB6 и ВаВв со структурой типа СаВ«. Расчет показывает, что проявление d-характера значи-2^*^меньша^адиусы^ 1891].
Недавние теоретические исследования электронного строения гексаборидов щелочно- и редкоземельных элементов показали существенную роль d-состояний в формировании фаз со структурой СаВб. Рассмотрение в первую очередь p-состояний металлических атомов более или менее оправдывается только для щелочных металлов, в меньшей мере для щелочноземельных и европия и совершенно не обосновано для трехвалентныд редкоземельных металлов [51]. На основании расчета энергетического электронного спектра гексаборида кальция в работе делается вывод о том, что одно из необходимых условий образования соединений со структурой тиП4~СэВ6~>«»превышение энергии d-Состояния над энергией s-состояния не более чем на 2,76 эд (величина этой энергии для -Кальция).
Отсюда следует, что отсутствие гексаборидов Li, Na, К, Be и Mg со структурой СаВв можно объяснить относительно высоким положением d-уровня у атомов этих металлов.
Тетраборйды, как и гексабориды МеВб1, содержат трехмерные каркасы из атомов бора, между которыми находятся атомы металла, расположенные по узлам тетрагональной или кубической решетки.
Структуру тетраборида (тип UB4) можно представить как комбинацию структур А1Вг и СаВ6; в ней есть трехгранные призмы типа AIB2 и четырехгранные призмы, аналогичные слегка искаженным кубам СаВ6 (рис. 11). В центрах трехгранных призм располагаются атомы бора, а в каналах, пронизывающих четырехгранные призмы, размещаются октаэдры из атомов бора. Эти октаэдры не имеют общих вершин и связаны друг с другом только вдоль тетрагональной оси через пары атомов бора.
Таким образом, атомы бора из квадратных сечений октаэдров и атомы бора в трехгранных призмах образуют плоские сетки из 4- и 7-членных колец*
30
Обращает внимание сходство й расположении атомов металла в структурах YB4 (структурный тип UB4) и V3B2 (рис. 12), хотя по содержанию бора эти фазы сильно различаются. Средние расстояния Me—Me в обеих структурах невелики и превы-
шают сумму радиусов на 5% в YB4 (табл. 5) и на 2% в V3B2 [871]. Подробно структура типа UB4 была исследована в работах [987» 1026, 1027] и недавно на примере YB4 [687].
Рассмотрение периодов решетки тетраборидов редкоземельных металлов, измеренных на монокристаллах- в работе [688], показало, что с увеличением порядкового номера элемента размеры элементарной ячейки тетраборида уменьшаются. Из общей закономерности выпадают периоды решеток тетраборидов церия и иттербия, что объясняется изменением валентности данных
Q)M(Z’O) Ob(z*1/2) ®B(z*iO,Zl)
M;Y,n,l/,Pu,Ln
Рис. 11. Кристаллическая структура тетраборидов типа UB4 (проекция на плоскость хоу).
элементов в этих соединениях. Предварительные результаты магнитных измерений церия и
Рис. 12. Кристаллическая структура боридов: СгВ4 (а), YB* (б) и V3B2 (а).
иттербия подтвердили наличие в них двух- и трехвалентного состояний соответственно.
К структуре YB4 близка структура СгВ4 (см. рис. 12, а), описанная недавно в работе [540]. Тетраборид хрома представляет собственный структурный тип, хотя между CrB4, YB4 и МпВ4 имеется сходство. В структуре СгВ4 атомы бора образуют трех-
31
Таблица 5
Межатомные расстояния в YB4 [688] и СгВ4 [540], А*
yb4
Y-4Y3,69)
Y 3,69> 2Y 4,02]
СгВ4
Сг— 2Сг 2,866
О г
сч
2,866 2,56
Y—4B (1)2,73 4В(2)2,85 2В (2)3,08 4В (3)2,75 4В (3)2,83
Сг-4В
8В
2,07]
2,27/
2,82
2,69
2,16
В (1)—В(1) 1,61
4В (3) 1,75
В (2)—В (2) 1,74 2В (3) 1,75
В(3)—2В(1)1,75 В(2)1,75 2В (3)1,78
В-В 1,66
В 1,69
2В 1,91
* Погрешность измерения
(a): Me—Me—0,015; Me—В-0,02; В-В-0,04.
мерные сетки, пронизанные вдоль оси с каналами, в которых располагаются атомы хрома. Элементарная ячейка содержит два атома хрома в положении 2 (а) и восемь атомов бора в положении 8 (п).
Как показано на рис. 12, а, квадраты из атомов бора, параллельные плоскости [001] вдоль оси с, связываются в зигзагообразные цепи связями В—В, равными 1,91 А. Если элементарную ячейку СгВ4 слегка деформировать в направлении с, то можно перейти к ячейке МпВ4 [543].
В структуре СгВ4 средние межатомные расстояния Сг—В равны 2,20А (см. табл. 5), в то время как сумма радиусов составляет 2,16 А. Средние расстояния Мп—В в структуре МпВ4 короче, чем Сг—В в структуре СгВ4 [543].
Если сравнить структуру СгВ4 с УВ4 (см. рис. 12, а, б, табл. 5), то можно заметить некоторое сходство в сочленении борных комплексов вдоль оси с. Обращает внимание близость значений длин связей В—В в обеих структурах. Средние расстояния В—В и Me—В приближаются к сумме радиусов (см. табл. 5). Средние межатомные расстояния Me—Me в СгВ4 и YB4 сильно различаются, превышая сумму радиусов в СгВ4 на 12% (вдоль оси с) ив YB4 на 5'°/0.
Структурный тип UB12 объединяет большую группу додекаборидов переходных металлов, включая лантаноиды и актинои-32
Ды (см. табл. 1). Эта структура в отличие от СаВб построена из правильных кубооктаэдров, в пустотах между которыми размещаются атомы металла (рис. 13). Атомы бора образуют пространственную координацию вокруг металлических атомов; каждый атом бора имеет пять ближайших борных и два металлических атома.
Структуру UB12 можно вывести из структуры NaCl, если поместить вместо атомов натрия атомы урана, а вместо атомов хлора —комплексы В12, образованные квадратами [100] и треугольниками [111].
Недавно было показано [730], что расстояния В —В внутри кубооктаэдра значительно короче внутриоктаэдри-ческих расстояний в структурах СаВ& и LaB6. Аналогичные результаты отмечены при исследовании структуры YB12 [827].
В структурах YB12, ZrBu и UB,2 наблюдаются два типа расстояний В — В, из которых В — В внутри кубооктаэдров
длиннее, чем экстремальные расстояния В — В [827] (табл. 6).
Структуры боридов с большим содержанием бора, чем в боридах состава MeBi2, изучены мало [820, 825, 829].
Кристаллохимический обзор [651] известных кристаллических структур боридов с большим содержанием бора, чем в MeBj2, позволил выявить, что в основе всех структур лежат икосаэдры В12, характер упаковки которых определяет тот или иной структурный тип. При этом атомы одной природы могут как замещать бор в вершинах икосаэдра, так и занимать пустоты трехмерного борного каркаса.
Рис. ' 13. Кристаллическая структура додекаборидов типа UB12 (проекция на плоскость хоу) (Me=U, Zr, Y, Tb, Dy, Ho, Er, Tm, Yb, Lu, Pu).
Таблица 6 О Длины связей в структурах додекаборидов иттрия, циркония и урана, А [827]
Борид Me—Me rMe Me—В В—В ( тип I) В—В (тип II)
YB12 7,500 1,797 2,783+0,012 1,809 + 0,024 1,684+0,024
7,408 1,597 2,750+0,013 1,780 + 0,026 1,678+0,026
ив12 7,473 1,516 2,771+0,013 1,803± 0,026 1,675 ±0,026
3 Зак. 1305
33
Известно, что в высокобористых Твёрдых растворах, которым приписываются составы СгВ4Ь МпВ23, FeB76, YB66, ThB66, атомы бора, группирующиеся в икосаэдры В12, образуют гигантские цепи Bi2(Bi2)i2, которые характеризуют уже структуру чистого кристаллического бора [542, 815, 951, 1009].
При рассмотрении различных структурных типов боридов и анализа формы координационных многогранников бора в них можно заметить, что с повышением содержания бора в бориде увеличивается число атомов бора, расположенных против центров боковых граней тригональных призм [170]. Вследствие этого увеличивается число атомов бора, связанных друг с другом, что соответствует увеличению доли ковалентной связи в структурах боридов.
Из различного способа расположения координационных многогранников бора в структурах боридов вытекают разные формы образований из атомов бора: изолированные атомы бора, пары, цепи, простые и сложные, плоские или гофрированные сетки, каркасы.
Увеличение содержания бора в двойных соединениях сопровождается уменьшением среднего координационного числа атомов бора: в низших боридах состава Ме4В и Ме2В оно колеблется от 12 до 6 + 3, в боридах МеВ —только 6 или 6 + п (п = = 3), в боридах состава МеВ2 и МеВ4 — 6+п (п = 3) и 4,4 или 3.
В некоторых случаях у боридов наблюдается отклонение количественного состава от идеальной формулы, что в значительной мере связано с дефектностью структуры по металлу, по бору или той и другой вместе. В структурах W2B5, ReB2, Мо2В5 имеются октаэдрические пустоты, которые могут заполняться частично (у борида вольфрама) или полностью (у боридов молибдена и рения) атомами бора. Возможностью разных схем связи в семействе структур типа А1В2 объясняется кристаллизация большего числа боридных фаз в этом структурном типе.
По табл. 1 можно проследить, что периоды решетки у диборидов переходных металлов уменьшаются в последовательности ZrB2->NbB2->TaB2-*TiB2-*VB2, т. е. с уменьшением размеров атомов металла. Следует отметить, что при этом отношение с/а изменяется незначительно.
Аналогичные закономерности в изменении периодов решетки с увеличением порядкового номера элемента, как уже отмечалось выше, наблюдаются в случае гексаборидов редкоземельных металлов.
Однако было бы неправильно считать, что размерный фактор, а не валентное состояние атомов бора и металла играет основную роль в боридах, как это предлагается в работе [54], где при рассмотрении структур боридов часто исходят из простых геометрических соображений.
Бориды занимают среди соединений внедрения особое положение в связи с тем, что в силу специфических свойств самого 34
атома бора, относящихся к его размеру и электронному строению, в боридах, в отличие от соединений элементов с С, N, Н, О, могут образовываться непосредственные связи В—В. Их наличие свидетельствует о том, что бориды лежат у границы применимости правила Хэгга [719, 720]. Хэгговское критическое отношение (гв/лме) =С0,59 справедливо в основном для низших боридов, в решетках которых атомы бора изолированы друг от друга (например, в Ме2В).
Структура низших (по содержанию бора) боридов близка к структуре фаз, образованных атомами неметалла меньшего размера (гидридам, карбидам, нитридам), т. е. к фазам хэггов-ского типа. Начиная с моноборидов МеВ, в которых возникают прочные ковалентные связи В—В между атомами бора, образующими зигзагообразные цепочки, критерий отношения радиусов [(/'в//'ме);^0,59] становится менее важным фактором. С увеличением содержания бора в боридах и усложнением структурных образований из атомов бора эволюции все упрочняющихся борных связей начинает играть основную роль.
Способностью атомов бора образовывать прочные ковалентные связи можно объяснить наличием стабильных боридных фаз у железа и металлов платиновой группы, в то время как карбиды и нитриды этих металлов неустойчивы или их вовсе нет.
Устойчивость боридных фаз металлов длинных периодов с увеличением номера металла уменьшается, бориды меди, серебра и золота не существуют, а системы Си—В, Ag—В и Au—В — простые эвтектические.
Многообразие структурных типов боридов определяется способностью атомов бора образовывать связи В—В, упрочняющиеся с усложнением структурных комплексов из атомов бора в боридах.
Природа металла в боридах не играет превалирующей роли, хотя и определяет многие свойства боридов. В пользу этого говорит возможность изоморфных замещений одних металлов другими с сильно различающимися атомными размерами, например в W2B, Fe2B и Ni2B, кристаллизующихся в структурном типе С 16.
Как показывают квантовомеханические расчеты [670, 806], атом бора может образовывать s-, р- и d-функции связи. Кажется вероятным, что s- и p-функции, образуя гибридные орбиты, используются в связях между самими атомами бора в структурных комплексах, тогда как d-функции вместе с оставшимися свободными р-функциями — для организации связей Ме—В. В этом случае связь Ме—В имеет металлический характер и приводит к образованию общей полосы проводимости, составленной из перекрывающихся уровней металла и бора, как для карбидов и нитридов переходных металлов с достраивающимися (/-уровнями [394].
3* 35
В боридах состава МеВ^<2 для образований ДвуМерйЫХ структурных комплексов из атомов бора достаточно трех валентных электронов бора (2s22p1). Связь Me—В осуществляется ns-электронами металла, перешедшими на гибридные spd-орбиты атомов бора, перекрывающиеся С системой связывающих орбит металла, которые построены с привлечением электронов незаполненной d-оболочки.
В боридах МеВх>2 для образования трехмерных структурных комплексов из атомов бора требуется большее число валентных электронов, чем то, которое имеется у бора, в связи с чем связь В—В в боридах этого состава осуществляется за счет валентных sd-электронов металла. Этот вывод согласуется с результатами исследования ядерного магнитного резонанса, показавшими наличие в подрешетке бора не только о-, но и я-связей [959, 960], для формирования которых требуется частичный переход электронов от металла к бору.
Особенности кристаллического строения боридов, характер и энергия межатомных связей, электронное строение атомов бора и металла, образующих борид, существенным образом определяют физические и химические свойства боридных фаз.
Усложнение структурных элементов из атомов бора, наблюдающееся при переходе от низших боридов к высшим, приводит к возрастанию жесткости кристаллической решетки в ряду Ме4В — Ме3В2—МеВ— Ме3В4—МеВ2, в этом же направлении уменьшаются теплоты образования [393], увеличивается температура плавления, возрастает твердость [400, 448, 499], стойкость против окисления, механическая прочность, снижается способность гидролизоваться [227].
ТЕРМОДИНАМИЧЕСКИЕ, ТЕРМИЧЕСКИЕ И ТЕПЛОФИЗИЧЕСКИЕ СВОЙСТВА
Исследованию теплот образования, теплоемкости, термодинамической устойчивости, температур плавления, термического расширения и теплопроводности боридов уделяется большое внимание не только в связи с тем, что этими свойствами определяется использование их при высоких температурах, но и потому, что комплекс упомянутых свойств дает информацию о природе и силе связей в кристаллических решетках боридных фаз.
Теплоты образования. Развитие работ по экспериментальному определению теплот образования соединений бора является до настоящего времени этапом накопления данных и разработки методов термохимического анализа.
Анализ имеющихся сведений по теплотам образования боридов проведен в работе [49]. Показано, что основным препятствием в развитии термохимии борсодержащих веществ явилось то, что на протяжении почти 90 лет не удавалось установить хотя бы ориентировочное значение теплоты образования 36
окиси бора (борного ангидрида) —основной исходной константы для нахождения теплот образования многих соединений бора. Кроме того, высокая химическая инертность боридов затрудняла применение калориметрических методов для определения теплот их образования.
Имеются немногочисленные сведения о теплотах образования тетра- и гексаборидов иттрия, лантана и церия [56, 159, 599]. Некоторые данные по термодинамическим свойствам неорганических веществ, в том числе боридов, обобщены в справочниках [493, 494].
Необходимо отметить, что среди боридов переходных металлов более или менее надежные данные по величинам теплот образования имеют менее десяти соединений.
В работе [599] теплоты образования боридов Ti, Zr, Nb, Та, Сг, Mo, W, Се и Th были получены на основании анализа сведений по устойчивости боридов против действия азота и углерода, а также по так называемой относительной устойчивости боридов, установленной при исследовании реакций вытеснения одних металлов, входящих В состав борида, другими.
В работах [315, 385, 400, 417] оценивали теплоты образования боридов стронция, титана, гафния и хрома на основании манометрического анализа соответствующих реакций их получения.
В. А. Эпельбаум и М. И. Старостина [529] определили теплоты образования диборидов титана и циркония калориметрически при сжигании образцов в кислороде. Позже, в работах [737, 738, 754, 1021], были уточнены величины теплот образования боридов титана, циркония и гафния.
Надежных данных по теплоте образования диборида ниобия нет. По данным работ [760, 947], значение ДН298 Для NbB2 изменяется в пределах от —20 до —40 ккал/моль.
В табл. 7 приведены имеющиеся данные по теплотам образования боридов переходных металлов на 1 моль фазы и на 1 г • атом бора.
Рассмотрение приведенных в табл. 7 данных показывает, что среди диборидов переходных металлов IV—VI групп наибольшими значениями теплот образования обладают дибориды металлов IV группы. Наблюдается тенденция уменьшения значений теплот образования в каждом периоде при переходе от боридов металлов IV группы к V и VI группам. Кроме того, с увеличением внутри группы порядкового номера элемента, образующего борид, теплоты образования возрастают.
Как было показано в работах [383, 394], термодинамическая устойчивость соединений переходных металлов с бором, углеродом и азотом вообще и с бором в частности, помимо внутренней энергии образующихся соединений, определяется степенью заполнения rf-состояния металла и ионизационным потенциалом атома неметалла.
37
Таблица 7
Теплоты образования боридов переходных металлов
Металл
Теплота образования —ДЛ7, ккал
на 1 моль фазы атом В
g
о св
РЭ
Теплота образования —ДН, ккал
св ес S на 1 моль фазы 1 г-атом В
£ о РЭ СВ S
Теплота образования —ДЯ, ккал
ч к на 1 моль фазы г‘атом В
S
Q £ о И св
Ti Т1Ва 63,6 [760]* 31,8 Zr ZrBa 72,0 [754]* 31,5 Hf HfB2 79,7*[947] 39,8
V Ti2B5 VBa 66,85 [529] 70,07[385] ~ 72 [599], 73 [156]** 77,4 [738] >100 [599] 62[156]** 38,7 20 31 Nb ZrB12 NbB2 >78 [599], 65 [156]** 63,1 [385] 75,02 [529] 77,0± 1,6 [737] >120 [599] >36 [599] 39 60 18 Ta TaB2 74,2 [315] 46,3+1,8 [48]* 37,1 21,3
Сг СгВа 30 [149], >30 [599]* 9,5 Mo Mo2B5 49,7[951] 41,7(947] 50,0 [599] 29,5 10,0 W W2B6 45,5 [801], 52 [599] 25—45 [599] 31,5 5—9
47[156]** 19[400] 23,5 MoaB MoB 25,5[599] 16,3[599] 25,5 16,3 W2B WB 20—28 [599, 801] - 12—22 [599] 20—28 12—22
* Наиболее достоверные данные.
*♦ Рассчитано по формулам О. Кубашевского [156].
При переходе от титана к ванадию и далее к хрому увеличивается степень заполненности (/-состояния, уменьшаются электронный дефект металла' и доля нелокализованных элект-.ронов, которые могут быть переданы атомам бора [450], что ’приводит к ослаблению связей Me—В и уменьшению теплотоб-;разования.
Как уже отмечалось выше, с увеличением содержания бора в бориде усложняются структурные образования из атомов бора, что приводит к возрастанию жесткости решетки за счет усиления ковалентных связей В—В [125, 447, 467, 468].
Характер изменения теплового эффекта на 1 г • атом бора, т. е. его уменьшение при переходе от TiB2 к Т12В5, от ZrB2 к ZrBi2, от Мо2В к Мо2Вб (см. табл. 7), свидетельствует о том, что теплота образования связи Me—В уменьшается вследствие передачи части электронов, ответственных за связь Me—В, на усиление ковалентных связей В—В.
Теплоемкость. Обсуждение данных по теплоемкости боридов затруднено в связи с их малочисленностью. Первые работы в этом направлении проведены для боридов магния [52, 989]. Исследование термохимических характеристик боридов магния было вызвано тем, что бориды магния (в частности, MgBj2) — важные промежуточные продукты магнийтермического способа производства бора. Данные по теплоемкости, энтальпии, энтропии и давлению диссоциации MgBj2 необходимы для проведения термодинамического анализа технологической стадии рафинирования «сырого» бора, которая сводится к его диссоциации и отгонке .магния [218, 220]: MgBi2, TB=Mg(r) +12 В(ТВ).
В работе [52] измерена средняя теплоемкость, практически совпадающая с истинной, и проведено высокотемпературное определение изменения энтальпии. На основании полученных данных рассчитаны интерполяционные значения истинных молярных теплоемкости, энтропий и изменений энтальпий в интервале температур 300—1800° К (табл. 8). В изученных условиях термодинамические характеристики MgBi2 монотонно изменяются с температурой, что указывает на отсутствие в MgBi2 превращений.
Давление диссоциации MgBj2 при 1700° К по этим данным составляет около 10~5 атм. В работе [52] рассчитана теплота образования MgBi2, равная АЯ = —34,4 ккал[моль.
Свифт [989] исследовал низкотемпературную теплоемкость Двух боридов магния — MgB2 и MgB4 при 18—305° К. По данным этой работы, теплоемкость MgB2 и MgB4 при низких температурах не подчиняется закону Дебая (Р), что характерно для соединений, имеющих слоистую структуру [565, 884].
Энтропця MgB2 при 298,16°К равна 8,60±0,04 калЦградХ Хмоль), для MgB4—12,41±0,06 кал!(град моль} [989].
В ряде работ [36, 117, 148, 150, 1014] проводилось экспериментальное определение теплоемкости диборидов титана, цир-
39
Таблица 8
Результаты измерений изменения энтальпии и теплоемкости MgBis в интервале температур 300—1800 °К [52J
т, °к т Энтальпия Д|Л /^298 15 Теплоемкость, дж/(моль-град)
эксп- расч. эксп. расч.
300 fc 152,6 158,9
400 18 500 18 900 219 211,5
500 42 200 42 500 215 240,9
600 69 200 68 600 270 261,3
700 97 500 96 600 285 277,4
800 12 550 125 400 297 291,3
900 154 500 155 600 307 303,7
1000 183 500 186800
1100 214 000 218 600
1200 248 000 251 700
1300 281 000 285 400
1400 318 000 319 900
1500 3 500 355 100
1600 394 000 391 000
1700 432 000 427 700
1800 471 000 465 100
копия и хрома в ограниченном интервале температур (30— 800°С). Образцы боридов, на которых проводились измерения, были загрязнены различными примесями: так, в бориде титана имелся свободный бор (около 0,2%) и железо [1006], борид хрома содержал углерод [147]. Данные, полученные в этих работах, значительно расходятся между собой.
На рис. 14 показан характер изменения средней теплоемкости диборида титана при 273,15—2600°К [117]. Для сравнения приведены данные работ [36, 150, 1006].
Результаты исследования средней теплоемкости диборида титана в широкой температурной области, полученные В. А. Кириллиным и др. [117], хорошо согласуются с результатами исследований при средних температурах [1006]. Значения истинной удельной и мольной теплоемкостей диборида титана, рассчитанные по эмпирическим уравнениям [117]
= 0,3005 — + И1^°* ехр ( кшЦкг г/хО)
с, = 20,90 _^+ И,п111- ехр Г-^3] хшЦт-град),
приведены в табл. 9. 40
Рис. 14. Зависимость средней теплоемкости Диборида титана от температуры:
7 —данные работы {117]; 5 — данные работы [1006J; Jr данные работ [36, 150]. т
Таблица 9
Результаты расчета теплоемкости диборида титана
Г, °к u Теплоемкость
средняя | истинная удельная мольная, 1 кал/(моль-град}
ккал/(к г-град}
273,15 0,1404 0,1404 9,766
298,15 0,1474 0,1539 10,70
300 0,1478 0,1548 10,76
400 0,1690 0,1912 13,80
500 0,1840 0,2131 14,82
600 0,1952 0,2276 15,83
700 0,2041 0,2381 16,66
800 0,2114 0,2460 17,11
900 0,2174 0,2523 17,55
1000 0,2226 0,2614 , 18,18
1100 0,2271 0,2641 18,37
1200 0,2312 0,2667 18,55
1300 0,2348 0,2673 18,59
1400 0,2382 0,2746 19,10
1500 0,2413 0,2783 19,35
1600 0,2442 0,2819 19,60
1700 0,2470 0,2853 19,84
1800 0,2496 0,2885 20,06
1900 0,2521 0,2916 20,28
2000 0,2545 0,2945 20,48
2100 0,2567 0,2973 20,67
2200 0,2589 0,2999 20,85
2300 0,2610 0,3023 21,02
2400 0,2630 0,3045 21,17
2500 0,2649 0,3066 21,35
2600 0,2667 0,3084 21,45
41
В работах [608, 616, 618, 623, 1014] результаты измерений удельной теплоемкости и магнитных свойств впервые обсуждаются с позиций электронной структуры боридов. Анализ зависимости электронной составляющей удельной теплоемкости от числа электронов на атом металла для чистого металла в полуборидах и моноборидах позволил предположить наличие перехода около 1,5—1,7 электрона бора в d-полосу металла [785].
Термодинамические свойства гексаборидов редкоземельных металлов изучены слабо. В настоящее время определены температуры плавления некоторых гексаборидов, изучены энтропия, энтальпия и теплоемкость боридов La, Eu, Sm и Nd [57]. Теплоемкость гексаборида лантана при температурах выше 3000° К определена в работе [57].
С. П. Гордиенко и др. [57] установили, что испарение гексаборидов редкоземельных металлов сопровождается их диссоциацией. *
С ростом температуры относительная концентрация атомов бора увеличивается, на основании чего в предельном случае предполагается протекание реакции
МеВб(тв) = Ме(г) -}- 6В(Г).
В работе приводятся теплоты образования гексаборидов La, Се, Pr, Nd, Sm, Gd и Tb.
Имеющиеся в литературе сведения по термодинамическим свойствам гексаборидов редкоземельных металлов, а также результаты исследований [415] приведены в табл. 58.
Температура плавления. Температура плавления боридов как одна из важнейших физико-технических характеристик веществ измерялась во многих работах [130, 185, 383, 690, 762, 763, 977].
Пост и Глезер [908] впервые провели сравнение температур плавления различных боридов и заметили, что дибориды металлов с большими_размерамй атомов имеют наиболее высокие температуры плавления,„Поскольку в этих соединениях расстоя-ния В—В превосходят те же расстояния в боридах металлов с малыми размерами атомов (см. табл. 1), был сделан вывод, что за температуры плавления в боридах ответственны главным образом связи Me—В.
У атома бора в изолированном состоянии конфигурация валентных электронов имеет вид s2p; $->р-переход приводит к образованию ^-конфигурации, которая стремится к достройке до наиболее стабильной в первом полупериоде ^-конфигурации [450].
В диборидах переходных металлов образуются в основном зр2-конфигурации атомов бора, что определяет свойственный им тип кристаллической решетки, сходный с решеткой графита, характеризующейся наличием плоских сеток. Связь между плос-42
кими сетками из атомов бора в диборидах осуществляется коллективизированными электронами. С повышением устойчивости ^-состояний металла вследствие роста локализации число He-
локализованных электронов уменьшается, что приводит к смещению динамического равновесия sp2+±sp+p вправо. Это вызывает ослабление связей внутри сеток и между отдельными сетками в диборидах. С этой точки зрения становится понятным наблюдаемое снижение температур плавления боридов в рядах Т1В2—СгВг, ZrB2—М02В5, HfBa—W2B5.
Увеличение содержания бора в боридах при переходе от низших (по содержанию бора) к высшим приводит к формированию более жестких ковалентных связей В—В, сопровождающемуся все большим отвлечением нелокализованных электронов на образование стабильных sp2- и «реконфигураций бора; вследствие чего наблюдается последовательное увеличение температур плавления и уменьшение коэффициента термического
расширения.
Подтверждением этого являются результаты исследования свойств боридных фаз в системах Nb—В и Сг—В [125, 468]. Температура плавления фаз в рядах Nb3B2—NbB—Nb3B4— —NbB2 и СггВ—СГ5В3—СгВ—Сг3В4—СгВг возрастает.
Межатомные расстояния в какой-то мере отражают силы
связи, но не являются при этом их единственным критерием, поэтому вывод об ослаблении связей В—В в диборидах с ростом порядкового номера металла требует подтверждения характером изменения других физических свойств боридов, характеризующих упруго-динамическое состояние решетки: коэффициентов термического расширения, сжимаемости, фононной составляю-
щей теплопроводности.
В работах [37, 698, 764] при исследовании термического расширения боридов обнаружена линейная зависимость коэффициентов термического расширения (КТР) от температуры, причем значения КТР для диборидов металлов IV—V групп лежат в пределах (6-4-8) -10-6 град-1 и не выявляют четко выраженной закономерности внутри групп. Для борида хрома приводится высокое значение КТР (11 -10—6 град-1) [37, 296, 418]. Биндер и Москович [589] приводят для КТР СгВ2 значение, близкое по величине к КТР боридов металлов IV и V групп.
Данные по КТР боридов W2B5 и М02В5 получены недавно (соответственно 7,8 • 10-6 и 8,6-Ю"6 град-1) [126]. Для диборидов металлов IV и V групп обнаружена анизотропия КТР [17, 764]; для диборидов металлов IV группы —- «1,1, для диборидов ме-da,
Vdc _ _
группы — ~1,7.
ЯСС
Исследование теплового расширения диборидов переходных металлов IV—VI групп в интервале температур 300—2500° К [448] показало, что коэффициент термического расширения зна-
43
Таблица 10 Термическое расширение и некоторые упруго-динамические параметры боридов переходных металлов
Борид Коэффициент термического расширения, 10~* ерад~1 е, °к Е, 1оМ кГ/ся* X, кГ/ля’ ХФ* вт/(л-ераЗ)
г по а поГпл
TiBa •M 1100 970 5,5 135J 20,6
ZrBj 6,2 765 730 4,3 158 18,9
HfB, 6,6 550 580 16,6
VB2 8,0 880 880 3,5 13,1
NbBa 8,2 701 720 *— 6,9
TaBa 8,Б Б4Б 570 2,9 6,0
CrBg 10,5 726 780 2.2 128 ! 31,8
Рис. 16. Температурная зависимость коэффициента термического расширения:
Z —TiB2; 2—ZrB2; 3 —HfB2; 4 — VB2; 6 - NbB2: 6 —TaB2.
чительно увеличивается с ростом температуры в интервале 300-Я30(УК и практически йе изменяется при более высоких температура^ (рис.15, табл. 10), В табл.10 для сравнения приведены значения характеристических температур! 0, рассчитанные nd формуле
где Z— число формульных единиц в ячейке; С^молъ-i ная теплоемкость; у — плотность; М —* молекулярная масса; В —г эмпирический коэффициент, равный 15,44; 0 значения, рассчитанные в работе [314] по температурам плавления. Там же приведены данные по моду-, лю Юнга Е и коэффициенту сжимаемости х, а также значения фононной составляющей теплопроводности
М [453].
Как следует из табл. 10, значения а коррелируют с другими физическими параметрами, характеризующими жесткость решетки. Так, в рассмотренном ряду диборидов дебаевская темпера-
тура, вычисленная из данных по а и температуре плавления, меняется одинаковым образом. То же относится и к соотношению между изменением величин а, с одной стороны, и модулем
44
КЭйГа, коэффициентом сжимаемостй и фононной составляющей теплопроводности — с другой (£~1/а, хАф~1/а) [180, 508,516]. 1
Сравнение приведенных в таблице значений а, £ и Лф дозволяет сделать вывод об ослаблении прочности межатомной связи при переходе от диборидов переходных металлов. IV группы к диборидам V группы.,
Расчеты [60] показали, что атомы металла в диборидах передают часть своих нелокализованных валентных электронов ра упрочнение связей В.—В, Поскольку металлы JV группы обладают более высокой по сравнению с металлами V и VI групп донорной способностью [436, 450], в их диборидах реализуется большая степень локализации электронных состояний атомов бора. Следовательно, и жесткость решетки этих диборидов выше, что проявляется в меньших значениях а и х и более высоких, Е и Аф по сравнению с теми же параметрами для Диборидов металлов V и VI группы.
Исследование свойств боридных фаз в система^ Nb-^B и Сг-*-В [125, 447, 468] показало, что увеличение содержания бора в боридах приводит к росту параметров, характеризующих прочность решетки (табл. 11).
Таблица И
Некоторые свойства боридов ниобия и хрома
ЬорндТ? 'Температура плавления, °C Коэффициент термического расширения, 10’“* град-1, в интервале Характеристическая температура е, ° к Среднеквадра* тичиые смещен иия атомов» о А
300-1300 «К 1300—2200 °к
Nb3Ba 1860 13,8 15,9 500 0,108
NbB 2000 12,9 13,4 582 0,106
NbsB4 2290 9,9 10,3 624 0,100
NbBa 3000 8,0 8,5 701 0,088
Сг2В 1750 14,2 15,0 487 0,117
СгБВ3 2000 13,7 14,2 555 0,106
CrB 2050 12,3 12,6 627 0,103
Сг3В4 2100 11,8 12,1 496 0,100
СгВа 2200 10,5 11,0 726 0,088
Как следует из данных табл. 11, с ростом отношения В/Ме увеличиваются температуры плавления боридных фаз ниобия и) хрома, растут характеристические температуры; коэффициент термического расширения и среднеквадратичные смещения ато-1 мов уменьшаются. Такое изменение свойств свидетельствует об] увеличении жесткости решетки с увеличением содержания бора в бориде. Увеличение содержания бора в фазах ведет к повышеД нию степени локализации электронных состояний его атомов, обусловливающему упрочнение связей В—В.
45
Теплопроводность. До недавнего времени теплопроводность диборидов была измерена только при комнатной температуре [185, 189]. В работах [193, 453] на образцах боридов переходных металлов IV—VI групп проведено измерение коэффициента теплопроводности при комнатной температуре и высокотемпературные измерения в интервале температур 300—2500° К.
Как известно, теплопроводность токопроводящих веществ состоит из электронной Хе и фононной /.ф составляющих. При температурах выше характеристической Т$ фононная составляющая теплопроводности изменяется обратно пропорционально
Рис. 16. Температурная зависимость теплопроводности боридов в интервале температур 300—1200° К:
1 — Т1В2; 2 — ZrB2; 3— VB2; 4 — CrB2; 5 — Мо.2в5;
6 — W2Bj [1931.
температуре, а электронная в первом приближении не зависит от температуры [101]. В связи с этим наблюдаемая теплопроводность с повышением температуры должна убывать и приближаться при высоких температурах к некоторому постоянному значению, определяемому Хе.
Теплопроводность боридов ванадия, молибдена и вольфрама качественно следует этому закону в интервале температур 300— 1200° К, для боридов титана и циркония теплопроводность практически не меняется с ростом температуры, а для СгВ2 наблюдается резкое возрастание теплопроводности (рис. 16).
Постоянство и рост теплопроводности могут быть обусловлены возрастанием доли электронной составляющей. Подобное поведение наблюдалось у собственно переходных металлов ц их германидов [192, 793].
Фононная составляющая теплопроводности в значительной мере зависит от рассеяния упругих волн на дефектах решетки, примесях и других центрах рассеяния. Это затрудняет сравнительный анализ данных по теплопроводности боридов.
Результаты измерений теплопроводности диборидов металлов IV—VI групп при 300° К приведены в табл. к12, а при температурах 1300—2500° К —на рис, 17 [453].
46
Таблица 12
Результаты измерения теплопроводности диборидов металлов IV—VI групп [453]
Дорид Т!В2 ZrBa HfBj VB„ NbB, TaB, CrBa
X, вт/(м-град) 64,5’ 58,0 51,0 42,2 24,0 16,0 31,8
Р 0,52 0,62 0,50 0,99 1,44 1,94 0,64
/е, вт^м-град) 43,9 39,1 32,4 29,1 z 17,8 11,8 21,4
Хф, втЦм-град) 20,6 18,9 18,6 13,1 6,2 4,2 10,4
Как показали результаты этой работы, для всех боридов наблюдается возрастание теплопроводности с температурой.
С помощью закона Видемана — Франца (Xe/a)=LT (о — электропроводность; L — число Лоренца) сделана попытка разделить электронный и фононный вклады в теплопроводность:
А, — + ^ф •
Число Лоренца в общем случае имеет непостоянное значение, зависящее'от механизма рассеяния и степени вырождения электронов проводимости [487]:
L = A (kle'f,
где k — постоянная Больцмана; А — коэффициент, зависящий от механизма рассеяния:
Л= (г + 2)(г + 3)
Л+г (и*)
Fr (И
-(г+2)2
fr2+i+*) F2r (р*)
Коэффициент А рассчитывали с использованием значений параметров рассеяния г и уровня Ферми р,*, оцененных по методике, описанной в работе [172]. В расчетах использовали экспериментальные данные по температурной зависимости удельного элек< тросОпротивления и термо-э. д. с., значения г, р* и т*, приведенные в работе [449].
и Хф для температур ниже 1600° К оценивали с помощью соотношения [151]
(Хе/Хф) = (Ь/Р)(Т/0),
где Р — параметр, свойственный данному соединению и определенный для боридов при Т~^-1600° К-
47
Как показали результаты (см„ табл. 12 и рис. 17, бив), возрастание теплопроводности с температурой боридов обусловлено вкладом ее электронной составляющей. Возрастание с
ю. ^0. 6
।—q—<
1 > /// : / 1-3 / / 1 *F—Cl—1 1 т 1 Р ► х Ji । . 1 о ь к UJ о I хН* —X А. ,s
Г-ГТ*-1 г—.V Л —х ' ,6
/ Ek о —a~sr, ; /1 ; Л
—J
1200 1400 1600 1800 2000 Т,‘К
6т/(м-граЗ) Л г Огп/(м-граа)
Рис. 17. Температурная зависимость теплопроводности % (а),' лг (б) и Хф (в) диборидов в интервале тем» ператур 1300—2500° К.‘
/ — TiB2; i — ZrB2: 3 — HfB2f 4 — VB2s 5 — NbB2; 6 — TaB2;- 7 —CrB2.
температурой объясняется уменьшением значений эффективной массы носителей ~V) ° Росто№ температуры.
Заметен значительный вклад фононной составляющей в общую теплопроводность, что объясняете^ наличием в решетке боридов большой доли локализованных гибридных sp-состояний 48
атомов бора, обусловливающих преимущественно ковалентный характер связи между атомами бора [60].
В работах [693, 959, 960] предполагается большая степень локализации электронных состояний атомов бора в диборидах металлов IV группы по сравнению с ббридами металлов V и VI групп. Наличие более жестких связей в диборидаХ металлов IV группы^ в свою очередь, обусловливает меньшее фонон-фо-ионное И электрон-фононное рассеяния [81, 180], вследствие чего фононная и электронная составляющие теплопроводности имеют более высокие значения.
Уменьшение теплопроводности при переходе от диборидов металлов IV группы К диборидам металлов V и VI групп может быть объяснено снижением ее электронной составляющей, поскольку в этом направлении отмечается спад удельной электропроводности, а структурный тип решетки сохраняется. Наблюдаемое снижение значений решеточной составляющей С увеличением средней атомной массы находится в согласии с теорией [180].
' Таким образом, в теплопроводности боридов переходных металлов существенная роль принадлежит решеточной составляющей благодаря наличию структурных элементов из атомов бора. При усложнении структурных образований из атомов бора теплопроводность возрастает в связи с усилением связей В^В [189].
Измерения’теплопроводности боридов ниобия и хрома, выполненные при комнатной температуре [126], подтвердили сделанный в работе [189] вывод о возрастании Теплопроводности боридных фаз при увеличении содержания в них бора (табл. 13).
В изоморфных боридах характер изменения теплопроводности аналогичен изменению их удельного электросопротивления. К какому выводу пришли С. Н. Львов и др. [189] при исследовании теплопроводности боридов переходных металлов iy^ VI групп.
К диборидам переходных металлов IV—VI групп структурно близки бориды W2B5 и Мо2В5, характер изменения теплопроводности боридов молибдена и вольфрама тот же, что у диборидов. Замечено [126], что теплопроводность Мо2В5 и W2B5 воз-
1
Таблица 13
Теплопроводность боридных фаз ниобия и хрома при комнатной температуре [126]
Борид NbaB, NbB Nb,B, NbB, Cr,B CreBs CrB Cr,B4 CrB,
Коэффициент теплопроводности, втЦм'град) 12,0 15,6 20,5 24,0 10,9 15,8 20,1 20,5 31,8
4 Зак. 1305
49
.рйстает с температурой, хотя и менее интенсивно, чем это наблюдается для диборидов (табл. 14) [453].
В случае боридов железа наблюдаются некоторые аномалии в изменении теплопроводности. Результаты исследования температурной зависимости теплопроводности боридов железа [139, 140] показали, что теплопроводность борида FeB растет, а FeaB убывает с ростом температуры. Рост теплопроводности моноборида железа в области температур выше точки Кюри согласуется с характером изменения электросопротивления, для Fe2B, наоборот, убывание теплопроводности в интервале тем-
Таблица 14
Теплопроводность Мо2В8 и W2B5, втпЦм град)
Т, °к Мо2В5 W2B„ Т, °к MosBs W2BS т, °к Мо2В5 W,B5
300 26,8 28,4 1600 31,1 36,7 2000 37,0 51,6
1300 28,1 30,3 1700 32,2 39,8 2100 39,2 55,9 ’
1400 29,2 31,8 1800 33,7 43,4 2200 42,2 60,0
1500 30,0 33,9 1900 35,0 47,6 2300 — —*
ператур до точки Кюри согласуется с ростом электросопротивления. В области температур до точки Кюри для FeB и выше точки Кюри для Fe2B ход теплопроводности не отвечает ходу изменения электросопротивления.
Теплопроводность боридов С03В и Со2В вблизи точки Кюри имеет 'Минимум, что характерно для ферромагнетиков. Ход температурной зависимости удельного электросопротивления и теплопроводности боридов Со3В и Со2В указывает на преобладающую роль электронной составляющей теплопроводности (см. рис. 58 [141]). Теплопроводность в ряду Ni2B—Ni3B—NiB (см. рис. 60 [141]) уменьшается, а удельное электросопротивление увеличивается, что также свидетельствует о металлическом характере проводимости и о преобладающей роли электронов в процессе переноса тепла.
В работах [190, 428] проведено систематическое исследование теплопроводности гексаборидов щелочно- и редкоземельных металлов. ДТоказано, что теплопроводность гексаборидов,_значи-тельно выше, чём~у'А1еталлов. Отмечается высокая фононная составляющая теплопроводности, превышающая в случае гексаборидов Са, Sr, Ba, Sm, Ей и Yb электронную составляющую.
Большая доля фононной составляющей в гексаборидах обусловливается высокой жесткостью решетки МеВб, которая,^ свою очередь, определяется наличием октаэдра из атомов бора с сильными ковалентными связями В—В, центрирующего элементарную ячейку типа СаВ6.
50
ЭЛЕКТРОФИЗИЧЕСКИЕ И МАГНИТНЫЕ СВОЙСТВА
Особенности физических свойств боридов переходных металлов обусловлены двумя существенными факторами: надичиец незаполненных внутренних оболочек переходных металлов и спецификой электронного строения бора.
У переходных металлов 4-гсптериода — от скандия до иттрия—происходит заполнение Sd-уровня при наличии валентных 4х-электронов; у элементов 5-го периода — от иттрия до палладия — заполняется 4й-ур,овень при наличии Ss-электронов, у лантаноидов идет заполнение более глубокого 4[-уровня при наличии 5s-, 5р-, 5d- и ба-электронов, у. .металлов от гафния до платины заполняетсяГ5й!-уровень прюталичии бз-электронов 'и у актиноидов при уже заполненных 6s-, (эр-, 6d- и 7з-уровнях заполняется 5[-уровень [523].
Исследованием физических свойств боридов занимались Киффер и Бенезовский [121], Шварцкопф и Глезер [950], С. Н. Львов, В. Ф. Немченко и др. [24,139—141, 185], Юречке и Штейниц [755], Б. А. Ковенская и др, [126, 447—449, 453], Ю. Б. Падерно [416, 428].
Уже в работе [24] делалась попытка систематизировать накопленные данные по физическим свойствам боридов и интерпретировать наблюдаемые закономерности их изменений в зависимости от различных факторов. Было замечено, что удельное электросопротивление боридов с возрастанием степени заполненности d-полосы металла (при неизменном главном квантовом числе.) увеличивается.
За основной фактор, определяющий электропроводность боридов переходных металлов, в упомянутых работах принимаются степень незаполненности и энергетический уровень d-полосы в кристалле соответствующего металла, а также способность атомов бора отдавать электроны. Доля участия d-электронов в связи характеризуется коэффициентом \/nN (п — число d-электронов; N — главное квантовое число незаполненного уровня).
Увеличение значения 1/пУ приводит к дополнительному рассеянию электронов проводимости на узлах решетки, занятых атомами переходного металла, и, следовательно, к росту электрического сопротивления. Такой характер изменения электросопротивления боридов объясняется уменьшением степени перекрытия d-полос металлов и s-полос бора с ростом числа электронов на недостроенном d-уровне металла [394].
Температурная зависимость удельного электросопротивления в интервале температур 300—1500°К показала наличие в боридах металлической проводимости [130]. Сопротивление боридов по этим данным линейно увеличивается с температурой, что указывает не независимость количества носителей тока от
4* 51
^температуры и на достаточно полное перекрытие Полосы валентных электронов с полосой проводимости.
Металлический характер проводимости диборида титана, обнаруженный ра монокристаллах TiB2, объясняется в работе [1001] только частичным переходом ЗбЛэлектронов титана в «-полосу. Как показали исследования Тальваномагнитных свойств Диборидов металлов IV группы {130, 599], число носителей в этом случае Невелико (0,06—0,1 электрона на элементарную ячейку), В связи с. этим увеличение электропроводности объясняется не столько дополнительным вкладом й полосу прово* Димости, Сколько большой подвижностыд носителей, характерной для полуметаллов, имеющих меньше 1/4 Электрона проводимости на ячейку [755]. (
Для гексаборидов /^-переходных металлов со структурой *гипа СаВ6 обнаружен рост удельного электросопротивления с увеличением атомного номера металла в ряду LaBg— —CeB6...SmB6, что связывается в работах [407, 416] с уменьшением эффективной концентрации носителей; тока (нелокаЛизо-ванных электронов) вследствие повышения устойчивости в этом ряду 4/-оболочки и затрудненности /^-d-перехода.
Анализ данных по физическим характеристикам боридов усложнен тем» -что не др всех работах учитывалась пористость образцов, не проводилась экстраполяция на нулевую пористость, По этой причине, а также из-за отклонений химического состава иссЛедуемьц фаз от стехиометрического наблюдается разноречивость в полученных величинах.
В работе [755] на оснований анализа кривой зависимости удельного электросопротивления диборида титана от пористости образцов предложена формула для экстраполяции значений Удельного электросопротивления на нулевую пористость:
р = (1 r_n)“3’sp0>
В ряде работ [130, 188, 390, 440, 699] исследовалась температурная зависимость электросопротивления боридов в интервале температур от комнатной до 1200° С-
Глезер и Московии [699] обнаружили уменьшение значения термического коэффициента сопротивления'£ ростом- тем nep's туры у TiB2 и Мо2В5. Для боридов Ti, Zr, V, Nb, Та и W наблюдалась линейная зависимости удельного электросопротивления от температуры [699]. Характер изменения электросопротивления Мо2В5 в зависимости от температуры не подчинялся линейному закону. Отмечаются большие значения dp/dT для боридов вольфрама и молибдена по сравнению с другими боридами, Последнее объясняется меньшей жесткостью связей в этих боридах, имеющих дефектную структуру.
Исследованию термо-э. д. с. боридов посвящен ряд работ [130, 185, 191, 405], результаты которых обсуждены в моногра-,52
-фии 124]. Обнаружена закономерность в изменении значения термо-э. д.С, боридов в зависимости от степени дефектности d-уровней металла. Объяснение этой закономерности проводится на основе донорно-акцепторного взаимодействий переходных металлов и бора [405].
Измерение коэффициента Холла диборидов переходных металлов IV—VI групп при комнатной температуре проводилось $ работах [185, 755, 901], где показано, что коэффициент Холла для всех диборидоввеличина отрицательная^!' этО"~С'в~йДетелв^ савуСхдг1^лектронн01^арактереиг_^^проводимбст1?Т*Замечено, что значение коэффйциента~”Холла резко снижается при переходе от боридов металлов IV группы Й боридам металлов V группы и незначительно от боридов металлов V группы к бо-,’ридам металлов VI группы. Это связано со значительно боль-1 щей концентрацией' электронов проводимости в диборидах металлов V и VI групп по сравнению с диборидами Металлов Пу группы. t
Большие значения коэффициента Холла /?н для дибориДой 'металлов IV Труппы объясняются [185] расширением зоны npo-i видимости со снижением в ней плотности состояний при запоЛн Кении d-полосы металла валентными электронами бора. В работе [755] предлагается аналогичный механизм перехода валентных электронов бора в d-полосу металла. Ответственной за Проводимость считается s-полоса, которая С d-полосой почти не перекрывается. Резкое уменьшение значения 7?н для диборидов металлов V—-VI групп объясняется увеличением Электронной плотности в полосе проводимости (около Одного электрона На ячейку) за счет электронов металла, Пайпер [901] считает Такое объяснение неверным, так кай ему противоречит вы-сокая стабильность диборидов IV Группы, “что свидетельствует О довольно прочной связи В—-В и о наличии большой доли йо-валентной связи Ме-т-В, аналогичной такой же связи в карби-' дах и нитридах.
В работе [4] приводится Температурная и концентрационная зависимости коэффициента ХоллЯ диборида титана в области гомогенности.
Bi И. Малинский и др. [201] На основании данных по измерению коэффициента Холла диборидов переходных металлов IV группы при комнатной температуре й температуре жидкого азота, а также расчета концентраций и подвижности носителей Тока по двухзонной модели делают вывод о том, что, как и в случае монокарбидов [186, 202], двухзонное приближение точнее Отражает свойства, чем однозонная модель.*
В работах [124, 125, 447, 449, 468] проведенд систематическое исследование электрофизических и гальваномагнитных Свойств боридов переходных металлов IV—VI групп на образцах боридов, полученных методом горячего прессования (их пористость Не превышала 12%)< Металлографический И рентгеновский ана
53
лизы подтвердили бднофазность образцов, а химический анализ установил близость их состава к стехиометрическому.
Измерены электросопротивление в области температур 300— 2300° К, коэффициент термо-э. д. с. в интервале 300-*-1400° К, коэффициент Холла при комнатной температуре для диборидов Ti, Zr, Hf, V, Nb, Та и Cr, боридных фаз ниобия и хрома и боридов М02В5 И W2B5.
Совокупность этих данных дала возможность в приближении однозонной модели оценить основные параметры электропереноса: концентрацию, подвижность носителей тока (по данным коэффициентов Холла и величин электросопротивления), эффективную массу носителей заряда т*, уровень Ферми ц* и показатель рассеяния г.'Последний рассчитывался путем графического решения системы уравнений
(1) и
(2)
Интеграл Ферми — Дирака Л/гСц*), с помощью которого число носителей тока связано с уровнем Ферми
п = 4,831 • 1016 (—Х/г (р*), (3)
\ та J
для случаев р*>10 рассчитывался по формуле [20]
da dT
Расчеты выполнены в рамках однозонного приближения. Критерием применимости такого приближения явилось совпадение знаков термо-э. д. с, и коэффициентов Холла для диборидов переходных металлов IV—VI групп, а также то, что система уравнений (1) и (2) имела разумные решения во всем интервале температур, а рассчитанные величины параметров электропереноса находились в полном соответствии с результатами эксперимента. Результаты исследований и выполненных расчетов приведены в табл. 15.
Для диборидов Ti, Zr, Hf, V, Nb, Та и Cr наблюдается линейная зависимость удельного электросопротивления от температуры и нелинейная для коэффициентов термо-э. д. с.
Ход зависимости электросопротивления свидетельствует о металлическом характере проводимости диборидов переходных металлов. В пользу этого говорит и характер изменения термо-э. д. сл абсолютные значения коэффициентов термо-э. д. с. увеличиваются с ростом температуры. Удельное электросопротивле-54
Таблица 15
Электрофизические свойства и основные параметры электропереноса боридов переходных металлов IV—VI групп
Борид Температура, CK Удельное электросопротивление, Коэффициент термо-э. д. с., л<кв/град Термический коэффициент сопротивления, 10 3 град 1 Коэффициент Холла, 10-4 сж’/к Концентрация носителей п, 10~23 см3 Подвижность и, см2 (сек. Отношение эффективной массы к массе свободного т* электрона — Уровень Ферми ц*, эв Показатель рассеяния
Т1В2 293 9,0 —2,9 —19,6 217 —
500 12,8 —7,8 2,0 0,32 152 1,47 0,54 1,2
750 16,9 —11,4 2,0 116 1,0 0,77 1,0
1000 21,8 —12,0 2,0 89 0,99 0,95 1,0
1250 26,0 —12,0 2,0 — —г — —•
ZrBa 293 9,7 —1,2 -—. —19,0 195 . — •
500 13,5 —3,3 2,3 0,33 140 1,55 0,52 1,2
750 19,2 —6,4 2,3 98 1,07 0,74 1,1
1000 24,6 —8,4 2,3 77 0,88 0,90 1,0
1250 29,7 —9,8 2,3 63,7 0,68 1,18 1,0
HfB2 293 10,6 —1,0 -— —18,0 169 — —
500 17,0 —4,4 3,3 0,35 105 1,76 0,47 1,0
750 .25,8 —8,5 3,3 69,2 1,22 0,68 1,0
1000 34,5 —11,3 3,3 51,8 0,92 0,90 1,0
1250 43,2 —13,2 3,3 41,2 0,74 1,12 1,0
VB2 293 22,7 —5,8. —- —0,82 3,62 — —
500 33,0 —7,9 2,1 7,6 2,49 13,45 0,47 1,25
750 44,8 —13,5 2,1 1,83, 9,0 0,71 1,2
1000 57,8 —15,9 2,1 1,42 7,0 0,90 1,16
1250 68,8 —16,9 2,1 1,19 5,52 1,14 1,1
Борид Температура, °K Удельное электросопротивление, мком -см Коэффициент термо-э. д. с,, мкв/ерад Термический коэффициент электросопротивления» 10~• град—1
NbgB» * 300 45,0 —8,0
500 64,0 —11,7 2,4
800 96,1 —16,6 2,4
1000 117,6 —18,8 2Л
1200 123,2 —19,9 . 2,4
NbB 300 40,0 —5,2
500 57,2 —9,2 2,2
800 86,5 —14,6 2,2
1000 106,6 —17,6 2,2
1200 118,5 —19,2 2,2
Nb8B« 300 33,5 —2,3
500 43,2 —7,1 1,6
800 60,0 —9,4 1,6
1000 70,8 —10,5 1,6
1200 80,1 —11,4 1.&
NbBa 293 25,7 —3,4
500 31,3 —5,4 1,0
750 37,5 —8,5 1,0
1000 44,2 —11,0 1,0
1250 50,8 12,0 м
TaBa 293 32,5 —2,8
500 . 41,5 —4,8 1,2
750 52,5 —4Л 1,2
1000 63,2 — 11,2 1,2
1250 75,5 —13,4 ' 1,2
Продолжение табл. 15
Коэффициент Холла, Концентрация носителей at 10~2» см» Подвижность Un смг]еек Отношение эффективной массы к массе свободного /72* электрона —— лц Уровень Ферми И*» эв Показатель рассеяния г
i-0,4 1,03
13,6 0,68 16,9 0,56 1,2
0,49 11,9 0,60 1,2
0,38 8,9 0,65 1,1
— —’ г—•> —-
—0,6 1,50 . ММ»
10,4 1,00 13,5 0,58 1,3
0,72 10,8 0,63 1,4
0,55 8,4 0,68 1,1
f* ——
—U1 3,22
5,8 ~ 2,40 8,4 0,64 1,5
1,83 5,9 J 0,72 1,5
' 1,50 4,6 0,76 1,3
е-е*- •
—1,50 •—f
.4,2 4,75 1 5,92 0,72 1,5
3,97 ' 4,48 0,95 1,4
3,37 3,61 1J9 1,4
—• — —-
«—2,10
3,0 5,02 5,07 0,67 1.5
3,97 3,65 0,64 1,4
3,29 2,85 1,95 1,35
—- —— ——
П-р одолжение табл. 15
Борнд Температура, °К Удельное электросопротивление, мком-см Коэффициент термо-э. д. с,, мкв/град Термический коэффициент электросопротивления 10 8
Сг2В 300 102,5 —6,9 - -
500 116,4 —11,0 . 0,6
800 135,8 —13,7 ' 0,6
1000 144,3 - —15,1 0,6
1200 150,1 —16,3 0,6
СгБВз 300 49,0 —6,2 —
500 69,9 —8,0 1,9
800 93,2 —10,2 1,9
1000 99,5 —11,4 - 4,9
1200 101,4 12,6 1,9
СгВ 'зоо 45,5 —4,7
500 60,8 —6,9 1,1
800 73,7 —8,9 ’ 1,1
1000 77,8 —9,9 UI
1200 79, 1 —10,7 1,1
Сг3в4 300 60,0 —6,7
500 105,0 <- —8,4 3,7
800 143,2 —11,5 3,7
1000 146,2 —13,6 3,7
1200 146,8 —15,8 3,7
СгВ2 300 30,0 —3,0 нН»
500 38,2 —5,6 1,2
800 46,5 - —7,1 1,2
1000 51,0 —7,6 1,2
1200 54,2 —7,9 L 1,2
Коэффициент Холла, 1 0—* 4M*jK Концентрация носителей rt, 10—23 см* Подвижность и, 4М*1сек Отношение эффективной массы к массе свободного т* электрона — Уровень Ферми Показатель рассеяная г
—0,8 0,75 — -
7,8 0,68 17,4 0,79 4,7
0,60 • 15,7 0,86 1,5
0,55- 14,3 0,91 1,4
-— —— —
—0,9 : 4,85
6,9 1,33 18,6 0,59 1,4
1,03 16,6 0,65 1,4
0,92 13,8 0,69 1,3
— -— —
—1,0 2,2
6,2 1,7 13,8 0,65 1,3
1,4 12,5 0,71 1,2
- 3,3 10,5 0,77 1.1
й—Г —- —
—1,0 1,7 —
6,2 0,95 .
- ' 0,71 7,9 1,16 1,7
0,69 " 3,3 1,32 1,8
——
ь. —1.2 4,0 е—а
6,2 -3,25 15,24 0,41 1,4
2,64 7,0 0,44 1,4
- 2,6 4,9 0,48 1,1
- — — —.
пие растет в рядах TiB2—ZrB2—HfB2, VB2—NbB2—TaB2 (c увеличением главного квантового числа d-электронов металла). Для всех боридов наблюдается увеличение значений энергий Ферми и уменьшение эффективных масс с ростом температуры. Для диборидов металлов IV группы получены большие значения подвижностей при незначительной (для соединений металлического типа) концентрации носителей (1/4 электрона на ячейку), для диборидов металлов V группы характерны достаточная заполненность зоны проводимости (один электрон на ячейку) и существенно меньшая подвижность носителей. Дибориды металлов IV группы отличаются от диборидов металлов V группы меньшими значениями электросопротивления, коэффициентов термического расширения и среднеквадратичных смещений атомов и большими величинами термического коэффициента сопротивления (табл. 15, см. табл. 10).
Отмеченные закономерности рассмотрены с позиций зонной теории и модели конфигурационной локализации валентных электронов [450].
В процессе образования кристалла организуются состояния, которые могут быть описаны локализованными р- и d-функциями (или гибридными sp2, sp3 и Др.). Степень локализации электронных состояний в твердом теле определяется электронным строением исходных изолированных атомов. Концентрация осуществляющих проводимость свободных (коллективизированных) электронов, характеризующихся плотностью состояний вблизи поверхности Ферми, определяется степенью локализации. Электропроводность осуществляется в полосе, образованной за счет перекрытия s- и d-функций валентных электронов металла.
Переходные металлы IV группы, обладая высокой донорной способностью, передают часть своих нелокализованных валентных электронов для образования жестких ковалентных связей В—В. Это приводит к весьма незначительной концентрации носителей, обладающих высокой подвижностью. В зоне с малой плотностью состояний носители тока имеют малую эффективную массу и большую подвижность [1023]. С повышением температуры возрастает степень перекрытия внешних электронных сб-стояний, размытие полосы проводимости, связанное с этим, и обусловливает, очевидно, уменьшение эффективной массы носителей. Последнее, в свою очередь, приводит к уменьшению величины термо-э. д. с. с возрастанием температуры.
При переходе от диборидов переходных металлов IV группы к диборидам металлов V группы в результате увеличения степени устойчивости d-состбяний атомов металлов происходит нарушение sp-гибридов атомов бора, обладающих акцепторными свойствами. Это приводит к дополнительному рассеянию носителей тока и, следовательно, к снижению их подвижности. Термический коэффициент сопротивления зависит от двух факторов: рассеяния носителей на тепловых колебаниях решетки ^ 58
d-полосе, причем последнее, естественно, тем меньше,'чем больше заполнение этой полосы. С повышением температуры происходит перераспределение электронов в зоне проводимости: увеличивается степень перекрытия энергетических полос, что приводит к снижению плотности состояний у поверхности Ферми, и рассеяние носителей в Ме—Ме-полосе становится меньшим. Полученные значения температурного коэффициента сопротивления (ТКС) указывают на то, что определяющим фактором для температурной зависимости электросопротивления является изменение плотности электронных состояний на поверх-. ности Ферми, а не рассеяние носителей на тепловых колебаниях. Действительно, при переходе от диборидов металлов IV группы к диборидам металлов V группы ТКС снижается, а значения параметров рассеяния увеличиваются, что легко объясняется ростом плотности состояний на поверхности Ферми. К аналогичному выводу пришли при исследовании коэффициента Холла диборида ванадия при температурах 300 и 77° К в магнитных -полях от 5 до 25 кэ [203].
Обнаруженное расчетом уменьшение эффективной массы носителей с ростом температуры обусловлено увеличением степени перекрытия внешних электронных состояний и связанным с этим размытием полосы проводимости. Сравнительно большие значения среднеквадратичных смещений атомов диборидов V группы приводят к большей степени размытия полосы проводимости с температурой, поэтому эффект снижения величины эффективной массы с ростом температуры у диборидов V группы выражен значительно ярче.
Рассмотрение свойств боридных фаз ниобия и хрома в зависимости от количественного соотношения В/Me (см. табл. 15) [125, 447, 468] показывает, что увеличение отношения В/Me приводит к уменьшению удельного электросопротивления, концентрации носителей и увеличению их подвижности. Следовательно, переход от низших (по содержанию бора) боридов, где атомы бора изолированы друг от друга, к диборидам, в которых атомы бора жестко связаны в плоские сетки, приводит к изменению состояния как коллективизированных электронов, так и электронов, ответственных за ковалентную связь. Отсюда вытекает и изменение свойств соединений.
к Увеличение содержания бора в боридных фазах приводит к формированию более жестких связей В—В, что, в свою очередь, вызывает Переход электронов из полосы проводимости, следствием чего является наблюдаемое уменьшение концентрации носителей (см. табл. 15).
В работе [447] делается предположение о том, что в боридах, богатых металлом (Ме4В, Ме2В, Ме3Вг), передача электронов направлена к металлу, что согласуется с результатами работ [99, 608], а в боридах с большим содержанием бора (М.еВ2 и выше) она направлена от металла к бору.
59
а,мкв/град Л,6т/(см-град) />,мкомч;м
РиС. 18. Температурная зависимость удельного сопротивления р, коэффициента термо-э. д. с. а и теплопроводности X боридов МоВ4 и WB4,
Для диборидов переходных металлов может быть предложена следующая схеме межатомной связи. Связь В-*-В имеет крвалентный характер и осуществляется за счет валентных sp-электронов бора и части нелокализованных валентных sd-электронов металла. Это согласуется с результатами исследования ядерного магнитного резонанса, показавшими наличие в подрешетке бора не только о-, но И л-связей [959, 960], формирование которых требует частичного перехода электронов от металла к бору. Ясно, что доля л-связей тем больше и тем выше Степень локал иза-ч ции жестких связей В — В, чем выше донорная способность атомов металла; С другой стороны, чем выше энергетическая устойчивость ^-состояний металла, тем существеннее связи Me---Me, носящие преимущественно ковалентный характер и осуществляющиеся за счет локализованной части валентных электронов.
Наличие в рассматриваемых диборидах ряда Металлических свойств указывает на существование в их решетке связей металлического харак-к тер а;, последние реализуются" преимущественно между атомами металла И бора и в мень-<
шей степени -r-т между атбмами металла, йоскольку, как сказано выше, связи Me-—Me и В —В носят рреимущественно ковалентный характер.
Ход температурной зависимости электросопротивления боридов МогВ5 и W2B5 и коэффициентов теплопроводности типичен для металлоподобных соединений [454], а изменение коэффициента термо-э. д. с. с температурой существенно отличается. Для обоих боридов получены отрицательные значения коэффициентов термо-э. д. с, до 1300° С, выше которой знак термо-э, Д. С. меняется на положительный. Абсолютные значения коэффициентов термо-э. д. с, боридов М02В5 и W2B5, уменьшаются с ростом температуры, что отличает их от соединений с металлическим типом проводимости. Аналогичные зависимости температурного изменения удельного электросопротивления, коэффициентов теплопроводности и термо-э. д. с. наблюдаются для тетраборидов МоВ< и WB4 (рис. 18) [123].
60
Учитывая особенности изменения электрофизических свойств боридов молибдена и вольфрама, можно предположить, что перенос в них осуществляется носителями двух знаков с различной степенью вырождения. Для боридов МогВд и W2B5 предложена модель электронного строения, в которой ответственными за электропроводность являются Электроны со значительной степенью вырождения (1-я полоса)» Уменьшение абсолютной величины коэффициента тер,мо-э. д. с. обусловлено влиянием носителей, рочти полностью заполняющих сильно локализованные
состояния при практическом отсутствии вырождения (2-я полоса).
Для принятой модели разработана методика и проведены расчеты параметров переноса в' двухзонном приближении [454]. Результаты расчетов параметров электропереносй боридов Мо2В5 и W2B5 приведены в табл. 16, где использованы следую
щие обозначения: — коэффициент Холла; оэлектропро-
водность; а — коэффициент термо-э^ д. С., сц коэффициент термо-э. д. р, в 1-й полосе Д энергией Ферми
а2 — коэффициент термо-э. д, с. во 2-й Полосе с энергией Ферми р2 и параметром рассеяния" г2 [аг=—(2 + r2+ ]"L mi и
L е \ кТ ) \ т2 -«эффективная масса носителей в 1-й и 2-й полосах; и нг* Мо —отношение эффективной массы носителей в 1-й и 2-й полосах к массе свободного электрона; ni и п2т~ концентрации носителей в обеих полосах; щ и и2 —- подвижности носителей. Данные, приведенные в табл. 16, получены в предположении, что концентрация носителей в 1-й полосе постоянна.
На основании результатов расчета температурные зависимости электропроводности и коэффициента термо-э. д. с, боридов молибдена и вольфрама можно объяснить следующим образом. Ход температурной зависимости а(Т) определяется В основном концентрацией и подвижностью носителей 1-й полосы («1 и щ), поскольку вклад в электропроводность носителей 2-й полосы незначителен. Аномальная зависимость коэффициента Термо-H. д. с. от температуры обусловливается совместным влиянием «1 и аг; знак коэффициента термо-э. д. с. определяется влиянием сц, характер зависимости а (Т) — влиянием а2. Обращает внимание, что «1<н2; Wi*<wz*2. Большие значения эф-
фективной массы и концентрации носителей заряда во 2-й полосе свидетельствуют о большей степени локализации электронных состояний в ней по сравнению с 1-й полосой. Высказывается предположение, что 2-я полоса заполнена d-состояниями переходного металла. Более высокая степень локализации электронных состояний в W2Bg (большие значения пг2* у W2B5, чем у М02В5) свидетельствует об усилении ковалентной связи ’ при переходе от борида молибдена к бориду вольфрама и хорошо
61
Таблица 1$
Электрофизические свойства и параметры электропереноса боридов Мо2В5 и W2B&
Свойство Мо2Вб W2B6
Температура, °К
300 500 750 1000 1250 300 500 750 1000 1250
7?н. Ю~4 см3/к —6,6 •— *— — — —6,9 —> —— —
а, ом~1-см~1 37 740 26 670 19 420 15 270 12 660 44 444 28 170 19 230 14 490 11 700
а, мкв/град —9,4 —9,0 —8,1 —6,0 —1,5 —6,6 —5,6 —4,1 —2,3 +1,5
а1( ож~1-см^1 37 377 26 411 19 235 15 127 12 542 44 206 28 021 19 129 14414 11 639
а2, ом~1-см~1 373 259 185 143 118 237 149 J01 76 61
alt мкв/град —11,6 —12,2 —14,8 —17,6 —18,6 —7,8 —8,3 —9,0 —9,8 —10,7
а2, мкв/град +211 +317 +689 + 1222 + 1811 +217 +502 +922 +145 +1926-
2,50 1,60 1,30 1,15 0,96 1,66 1,07 0,88 0,65 0,55
mflm^ 27,9 15,2 10,9 8,1 6,5 29,4 18,3 11,8 8,7 6,8
пъ10-ai см-з 9,2 9,2 9,2 9,2 9,2 8,9 8,9 8,9 8,9 8,9
п2,10~21 см~~8 18,4 17,8 17,8 17,5 17,5 21,2 21,2 21,2 20,7 20,1
и1г см2/(в-сек) 25,4 18,0 13,1 10,3 8,6 31,1 19,7 13,5 10,1 8,2
и2, см2/(в-сек) 0,130 0,091 0,065 0,051 0,042 0,070 0,044 0,030 0,023 0,019
согласуется с моделью конфигурационной локализации Электронных состояний [433].
Температурная зависимость удельного электросопротивления боридов железа и кобальта [139—141] имеет вид, типичный для ферромагнетиков: наблюдаются две области на кривой зависи
мости (рис. 19) с характерным уменьшением угла наклона при переходе через точку Кюри. С увеличением содержания бора в боридах железа и кобальта удельное электросопротивление увеличивается. Для боридов никеля удельное электросопротивление р практически линейно увеличивается с температурой, хотя и в этом случае наблюдается возрастание р с температурой с увеличением отношения В/Ме [141, 455].
Для атомов металлов семейства железа при образовании кристаллов характерно заполнение ЗбЛполосы, причем вероятность такого заполнения увеличивается от железа к кобальту и никелю. Данное положение согласуется с уменьшением магнитных моментов
Рис. 19. Температурная зависимость удельного сопротивления р, коэффициента термо-э. д. с. а и теплопроводности X боридов железа.
кристаллов железа, кобальта и
никеля по сравнению с магнит
ными моментами изолированных атомов этих металлов, а также с уменьшением значений энергии возбуждения 45-электрона на ЗбЛуровень по сравнению с энергией перехода на 4р-уровень [455].
При взаимодействии железй, кобальта и никеля с бором характер спектра валентных электронов атомов металла и бора изменяется так, что атом металла стремится к захвату валентных электронов бора. Такое перераспределение электронной плотности сказывается на изменении электросопротивления.
Увеличение удельного электросопротивления боридов железа, кобальта и никеля с возрастанием атомного отношения В/Me в работе [139] объясняется влиянием магнитного порядка на энергетический спектр s-электронов. Наличие магнитного порядка у ферромагнитных переходных металлов приводит к изменению фононной части сопротивления. Для ферромагнитных материалов
Р = (Рл« + Psa) U + С (md mJ2] 4- рм,
63
•-ГД0 ftid и itis — средняя намагниченность d- и s-электронов; С'— некоторая константа; pss И рз<г—доли, вносимые в электросопротивление рассеянием s-электронов в s- и d-зоны; рм — сопротивление, вызванное рассеянием носителей тока на магнитных неоднородностях, Более высокое сопротивление FeB по сравнению с Fe2B в работе [139] объясняется нормальным фононным сопротивлением pss+psa- В связи с повышенной плотностью состояний в d-зоне преобладающим в этой сумме является вто-рой член, которому электросопротивление обязано увеличением в ряду Fe2B—FeB, i
Так как члец pS(j пропорционален плотности состояний В d-полосе на уровне Ферми [101], для оценки влияния степени заполнения d-полосы на величину pS(j в работе проведен расчет числа свободных состояний в Sd-полосе для Fe2B и FeB. Обнаружено, что ртносительная незаполненность Sd-полосы для Fe2B и FeB соответственно равна 15 й 8%,
Электросопротивление боридов кобальта ниже, чем боридов железа, а перегибы на кривой p~f(T) выражены менее четко И больше сдвинуты в сторону меньших температур (см. рис. 58), Такое отличие в температурной зависимости электросопротивления боридов кобальта от боридов железа можно связать в увеличением плотности состояний в d-полосе и с уменьшением перекрытия d- и s-полос. Первое обстоятельство связано с менее выраженным ферромагнетизмом боридов кобальта (у боридов кобальта меньше величина магнитного момента, см, табл. 89). Разупорядочение спиновой системы У боридод кобальта происходит при более низких температурах, чем у боридов железа. Уменьшение перекрытия d- и s-полос приводит к уменьшению электросопротивления вследствие того, что 45-электроны, ответственные за проводимость, испытывают меньшее рассеяние в Sd-зону. Отсутствие аномалий на кривых p=f(T) для боридов никеля (см. рис, 60) связано с еще большей заполненностью 3d-лолосы. Предполагается, что атомы никеля в боридах стремятся к достройке Sd-уровня не только за счет s-^-d-обмена, но и потому, что происходит передача электронов от атомов бора к атомам металла. Это предположение подтверждается отсутствием ферромагнетизма у боридов никеля, а также согласуется с мо--делью полос, предложенной в работе [81,0].
Магнитные свойства боридов. Магнитные свойства боридов переходных металлов изучены слабо, Дибориды, по данным работ [608, 615, 619], проявляют парамагнетизм со слабым отрицательным Температурным коэффициентом магнитной восприимчивости.
Кадвилль [608] исследовал диборид хрома при 100—1200° К и диборид марганца в интервале 4—1050° К. Обнаружено, что МпВ2 является ферромагнетиком С точкой Кюри 157° К и моментом насыщения 0,25цв на атом марганца, выше точки Кюри вплоть до 650° К диборид марганца проявляет парамагнетизм 64
Кюри — Вейсса с цР=2,30цв. По данным этой работы, ди борид хрома является парамагнетиком, причем до 600° К его магнитная восприимчивость изменяется с температурой в соответствии с законом Кюри — Вейсса с цР=2,07цв. Эти результаты связываются с переходом примерно 1,7 электрона от атомов бора на 3<2-уровни металлов, что маловероятно, так как переход должен иметь обратное направление — от металла к бору< Полученные результаты находятся в противоречии с данными работ [615, 617, 619], где показано, что диборид хрома до Т^= =85° К антиферромагнитен, а в парамагнитной области его восприимчивость не подчиняется закону Кюри — Вейсса. Дибориды ScB2, TiB2 и VB2 — парамагнетики, также не подчиняющиеся закону Кюри — Вейсса [615, 617, 900].
По данным работы [609], диборид хрома — антиферромагнетик с температурой. Нееля 7\=88,0±2,0° К, а диборид МпВ2 упорядочен ферромагнитно сточкой Кюри Гк=140± ±2° К; последнее удовлетворительно согласуется с результатами Кадвилля [608].
Следует отметить, что появление сильного магнетизма <в .диборидах металлов первого переходного ряда и самих металлах совпадает. Скандий, титан, ванадий и соответствующие им дибориды не обнаруживают магнитного упорядочения, а дибориды СгВ2 и МпВ2, как и исходные металлы, сильномагнитны.
При исследовании магнитных свойств слабомагнитных кристаллов интересны измерения удельной электронной теплоемкости, которая пропорциональна плотности состояний на уровне Ферми и непосредственно коррелирует с паулиевской составляющей магнитной восприимчивости. Однако исследования низкотемпературной теплоемкости диборидов переходных металлов малочисленны [615,617]. Слабую изученность магнитных свойств диборидов‘ переходных металлов можно до некоторой степени объяснить отсутствием у них сверхпроводимости [377, 437]. Действительно, температура перехода в сверхпроводящее состояние непосредственно связана с плотностью состояний на уровне Ферми, поэтому часто исследованию магнитной восприимчивости и низкотемпературной теплоемкости способствует наличие сверхпроводимости.
В работе [39] исследованы магнитные свойства диборидов металлов IV—VI групп и близких к структуре А1В2 боридов Мо2В5 и W2B5. Измерена магнитная восприимчивость этих боридов в интервале температур 100—300° К. Обнаружено, что увеличение температуры приводит к уменьшению восприимчивости (рис. 20). Температурные зависимости очень слабы и не подчиняются закону Кюри — Вейсса, что свидетельствует об отсутствии в боридах локализованных магнитных моментов. Сопоставление величин магнитной восприимчивости диборидов с величинами восприимчивости переходных металлов (табл. 17) подтверждает этот вывод. Данные, приведенные в табл. 17, показы-
5 Зак. 1305 65
ваюФ, чГо магнитная восприимчивость боридов металлов IV— VI групп, за исключением W2B5, меньше восприимчивости соответствующих металлов. Это согласуется с тем, что атомы металлов в диборидах являются донорами и передают часть своих электронов атомам бора с образованием связей Me—В и стабилизацией связей В—В. Таким образом, при образовании диборидов наблюдается смещение части электронных состояний атомов металла в область меньших значений энергии, что, в свою
очередь, должно приводить к уменьшению плотности состояний на уровне Ферми в диборидах по сравнению с чистыми металлами, а это вызывает уменьшение паулиевской парамагнитной составляющей восприимчивости.
В работе делается предположение, что магнитную восприимчивость диборидов переходных металлов в основном j определяет величина паулиевской составляющей, которая, как уже указывалось, меньше по сравнению с чистыми металлами, а в диборидах ZrB2 и ТаВ2 даже уступает по значению Диамагнетизму
Рис. 20. Температурная зависимость маг» нитной восприимчивости боридов переход-ных металлов IV—VI групп.
атомных остовов. Большое значение магнитной восприимчивости борида W2B5 объясняется с точки зрения конфигурационной модели вещества высокой стабильностью полузаполненных электронных конфигураций [436, 450].
Сравнение значений магнитной восприимчивости со значе-' ниями плотности состояний на уровне Ферми, оцененными по экспериментальным данным измерений низкотемпературной теплоемкости [617], а также теоретически [60] (см. табл. 17), показывает, что при переход^ от боридов металлов IV—VI групп магнитная восприимчивость и плотность состояний возрастают. Исключение составляет только диборид тантала. Это сравнение согласуется с предположением о том, что паулиевский парамагнетизм в значительной степени определяет магнитную восприимчивость диборидов.
Магнитная восприимчивость диборида титана в области гомогенности [4] с увеличением содержания "бора от TiBli94 до Ti2>28 уменьшается. Рассчитанные с учетом влияния обменных сил эффективные массы носителей заряда для составов
66
Таблица 17
Магнитная восприимчивость у переходных металлов IV—VI групп, их диборидов и плотность состояний N(Ep) на уровне Ферми боридов
Металл Магнитная восприимчивость , 10“’ см3Цг-атом) Борид Магнитная восприимчивость, 10“’ ли’/г Магнитная восприимчивость, 10“’ см’/(г-атом Ме) cocm/G 1617] 10“al в-моль} [60]
Ti 4-153 Т1В2 4-0,45 +31,2 70,4 121,5
Zr 4-122 ZrB$ —0,60 —67,7 89,5
Hf 4-75 шв2 +0,06 +12 105 —
V 4-254,5 VB2 +0,47 +34,1 419 479
Nb 4-204 NbB2 +0,07 +8,0 743
Та 4-153,6 ТаВ2 —0,32 —64,8 564
Cr Антиферро магнетик СгВ2 +6,3 +390 715 1170
Mo 4-89,2 Мо2В6 +0,25 +30,8 970 4—
W 4-58,8 W2B6 rj-1,20 +253 1013 •—
TiBi,94 (m*/mo=O,65) и ПВг.гв (m*/mo=O>85) меныце т0. С увеличением температуры влияние обменных сил резко уменьшается, а при температурах выше 1000° С магнитная восприимчивость диборида титана выходит в диамагнитную об-ласть, где она рассматривается как обусловленная нооитолями двух типов электронами и «дырками», причем вклад в восприимчивость «дырками» ничтожно мал по сравнению с элект-г ронами и им можно пренебречь.
Поведение диборида ванадия в магнитном поле подобно поведению диборидов титана (203], циркония и других металлопо-i добных соединений [901], Расчет параметров электропереноса для VB2 по двухзонной модели показал относительно высокую подвижность обоих типов носителей. При переходе от TiBa к VB2 подвижность электронов и «дырок» уменьшается, что связывается с увеличением плотности состояний у границы Ферми для VB2 по сравнению с плотностью для TiB2.
Подробное обсуждение'сведений о магнитных свойства^ боридов Мп, Fe, Со и Ni проведено в работе [142]. Исследование температурной зависимости магнитной восприимчивости боридов никеля при 100—1100° К и обсуждение полученных результатов с учетом степени заполнения Зй-зоны и влияния различ-! ных пара- и диамагнитных вкладов на суммарную восприимчивость проведено в работе [142]. Показано, что при высоких .температурах восприимчивость Ni3B и Ni2B содержит значительный вклад паулиевского парамагнетизма. При низших температурах на восприимчивость NisB существенное влияние оказывает наличие локализованных магнитных моментов. NiB проявляет диамагнетизм, слабо убывающий с повышением
б* 67
температуры. Такой характер магнитных свойств боридов никеля при переходе от Ni3B к NiB дает основание считать, что в намагничивании боридов никеля важную роль играют электроны металла, и, следовательно, Зй-состояния никеля у боридов Ni3B и N12B не полностью заняты, а у NiB Sd-зона занята полностью.
Магнитные свойства гексаборидов редкоземельных металлов подробно обсуждены в работах [307, 428].
Сверхпроводимость. Бориды переходных металлов переходят в сверхпроводящее состояние [24, 406, 723, 739]. Для большинства боридов точки перехода в сверхпроводящее состояние низкие и лежат ниже 1,9° К. У боридов NbB, М02В и Ta3B сверхпроводимость появляется при более высоких температурах: соответственно 8,25; 4,74 и 3,12° К-
Сравнительный анализ данных по сверхпроводимости боридов, карбидов и нитридов [24, 391, 406] дает основание сделать вывод, что точка Кюри 7к этих соединений связана непосредственно с распределением электронной плотности, т. е. зависит от степени заполненности d-полосы металла.
Относительно низкие температуры перехода в сверхпроводящее состояние наблюдаются у карбидов и более высокие — у боридов и нитридов. При увеличении содержания бора в бориде критическая температура понижается [432, 450].
Термоэмиссионные свойства боридов. Бориды находят широкое использование в качестве тугоплавких и высокоустойчивых в вакууме эмиттеров при разработке электронных приборов повышенной мощности [24, 163]. В связи с этим к настоящему времени накоплен обширный экспериментальный материал, позволяющий получить более четкую картину природы эмиссионных свойств боридов [428, 441, 451, 462, 505].
Термоэмиссионные свойства гексаборидов редкоземельных металлов изучались в ряде исследований, которые рассмотрены в монографии [428]. Все гексабориды отличаются умеренной работой выхода электронов, а некоторые из них — одновременно высокими токами эмиссии.
В работах [441, 451, 462] проведено изучение термоэмиссионных свойств боридов металлов IV—VI групп и исследование функциональной взаимосвязи между работой выхода, некоторыми физическими свойствами боридов и особенностями их кристаллического и электронного строения.
Измерения проводились в экспериментальных приборах с плоской геометрией электродов в вакууме порядка 10-8 мм рт.ст. по методике [451] в интервале температур 1300—2100° К. Все бориды не обнаружили сколько-нибудь заметного активирования или дезактивирования при этих температурах и после тщательного обезгаживания давали хорошо воспроизводимые результаты (табл. 18).
68
Таблица 18
Термоэмиссионные и поверхностные свойства боридов переходных металлов IV—VI групп
Борид Работа выхода <₽ = <₽„+ ^-T, dT эе Температура, Коэффициент рекомбинации • Средняя энергия адсорбции, ккал/моль
V102 vN.io« £н en
TiB2 4.08-J-8-10- 1300—2100 2,4 5,0 7 2
ZrB2 3,69+1,8.10-1 Т 1300—2100 4,0 6,2 12 3
ZrBJ2 4,16+1,3.10-4Т 1300—2100 3,5 4,2 10 2
HfB2 3,54+2,1 • 10-*? 1300—2100 7,4 15,5 17 7
VB2 3,98+1,8-10-4? 1300—2100 2,5 5,3 7 2
Nb3B2 3,35+1,0-10-4? 1300—1850 6,3 12,4 19 6
NbB 3,58+1,0-10-4? 1300—2000 5,0 8,1 18 4-
Nb8B4 3,88+8-10—» Г 1300—2000 3,0 6,6 9 3
NbB2 4,03+1,6-10-4? 1300—2100 2,4 5,1 7 . 2
TaB2 4,06+1,4-10-4? 1300—2100 1,9 4,5 5 2
Cr2B 2,46+4,0-10-4? 1300—1460 7,5 13,0 23 7
^1*5^3 2,72+8,0-10-4 ? 1300—1540 6,6 8,9 20 4
CrB 3,02+4,6-10“5 ? 1300-1680 5,8 8,7 17 4
Cr3B4 3,12+8,0-10“6 ? 1300—1800 5,4 8,3 16 4
CrB2 3,18+1,0-10-4? . 1300—2000 5,0 8,0 16 4
Mo2B6 3,70+1,0-10-4? 1300—2100 3,9 7,3 12 3
W2B5 3,79+1,2-10-4? 1300—2100 2,7 5,7 8 3
Линейный характер зависимости работы выхода боридов позволяет характеризовать эмиссионные свойства аналитическим выражением
<Р = Фо + Г-
Обнаружены определенные закономерности в изменении работы выхода от атомного номера металла (рис. 21) и от содержания бора в бориде (рис. 22). Работа выхода диборидов металлов IV группы уменьшается с возрастанием главного квантового числа; для боридов металлов VI группы наблюдается обратная зависимость, в ряду VB2—NbB2—ТаВ2 работа выхода меняется незначительно (см. рис. 21). Если рассматривать изменение работы выхода вдоль периодов, то можно заметить, что для диборидов 3^-металлов работа выхода уменьшается от TiB.2 к VB2 и СгВ2, для боридов 4d- и бй-металлов работа выхода носит сложный характер: от ИгВг к NbB2 и от Н1В2 к ТаВг растет, а от NbB2 к Мо2В5 и от ТаВ2 к W2BS уменьшается. В боридных фазах ниобия и хрома работа выхода электронов увеличивается с возрастанием атомного отношения В/Me в фазе.
Закономерности в изменении работы выхода вытекают из электронного строения боридов переходных металлов, которое
69
характеризует особенности строения поверхностных слоев атомов, осуществляющих эмиссию. Поверхностные атомы сохраняют до некоторой степени «индивидуальный характер», т. е. волновые функции, описывающие состояние электронов на поверхности, аппроксимируются в непосредственной близости поверхностного атома волновой функцией изолированного атома того же элемента [976]. Следовательно, на поверхности твердого" тела имеются комбинации атомных орбиталей, учитывающие асимметрию окружения поверхностных атомов и влияние участвующих в связи электронов решетки. .'Поэтому каждый вы
Рис. 22. Зависимость работы выхода боридов ниобия и хрома от атомного отношения В/Me (Г =300° К).
Рис. 21. Зависимость работы выхода боридов переходных металлов IV— VI групп от порядкового номера элемента (Г=300°К).
летевший электрон находится на валентной орбитали атома поверхности, и эмиссия рассматривается как переход электрона из локализованной электронной конфигурации атома твердого тела в свободное состояние.
Для боридов переходных металлов характерны s->-p-nepe-ходы с преобразованием «^-конфигурации атомов бора в энергетически более стабильную «реконфигурацию. Устойчивость «реконфигураций определяется числом коллективизированных электронов: ,чем больше это число, тем выше стабильность «реконфигураций, тем прочнее связь между сетками в структуре диборидов. В связи с более высокой донорной способностью переходных металлов IVa подгруппы по сравнению с такой же для металлов Va и Via подгрупп [19, 436] вероятность стабилизации атомов бора в диборидах металлов IVa подгруппы больше. Вследствие этого определяющую роль в формировании свойств диборидов металлов IV групры играют связи Me—В,
70
причем степень локализации электронов на этих связях уменьшается с ростом главного квантового числа валент-. ных электронов атомов металла. Это приводит к ослаблению связей Ме—В при переходе от борида TiBa к ZrBz и далее к HfB2 и соответственно к уменьшению работы выхода. В VI группе положение меняется, так как в этом случае превалирует локализация электронов в (^-конфигурациях 1450], что приводит, в свою очередь, к нарушению стабилизации зр2-конфигурации атомов бора и ослаблению связей Ме—В и В—В. Определяющими изменение работы выхода в данном случае являются связи Ме—Ме, усиливающиеся с ростом энергетической устойчивости (15-состояний металла. В связи с этим закономерно увеличение работы выхода у диборидов металлов VI группы в ряду СгВ2—М02В5—W2B5.
Увеличение работы выхода с ростом содержания бора, наблюдаемое для боридов ниобия и хрома (см. рис. 22), является следствием возрастающей роли ковалентной составляющей связи В—В. Интересно взаимосвязь работы выхода, адсорбционных и каталитических свойств боридов переходных металлов [174] (см. табл. 18),
-Для боридов металлов IV группы коэффициент рекомбинации у при возрастании порядкового номера элемента увеличивается, а работа выхода <р уменьшается. Для боридов металлов VI группы с увеличением главного квантового числа валентных электронов коэффициент рекомбинации у уменьшается как для водорода, так и для азота, .а работа выхода <р увеличивается, Незначительное уменьшение значения у и небольшое увеличение ср отмечаются у боридов металлов у группы.
В боридных фазах систем Nb—В и Сг—В с увеличением, содержания бора в бориде работа выхода увеличивается, а коэффициент рекомбинации азота и водорода уменьшается.
Соответствие вероятности поверхностной реакции и работы выхода объясняется определяющей ролью энергии адсорбции при взаимодействии налетающих атомов газа с адсорбционным слоем на поверхности [174]. Известно [89], что при хемосорбции между газом и адсорбентом образуется химическая связь, т. е. происходит передача электронов. Электронный характер адсорбционного взаимодействия между атомом и поверхностью имеет преимущественное влияние на энергию связи и продолжающийся процесс рекомбинации атомов.
С учетом электронного строения атомов переходных металлов и наличия в них свободных (/-состояний возможно образование между атомом металла и адсорбированной частицей ковалентной связи при локальном орбитальном перекрытии волновых функций.
Корреляция между каталитической активностью боридов переходных металлов в реакции рекомбинации атомов водоро-
71
Дй и азота и работой выхода свидетельствует о тесной связи между физическими свойствами и каталитической активностью боридов.
ОПТИЧЕСКИЕ СВОЙСТВА
Оптические методы исследования боридов могут внести существенный вклад в решение вопросов электронного строения боридов л природы химической связи в них.
Как уже отмечалось выше, бориды переходных металлов по концентрации свободных (нелокализоваппых) электронов близки к металлам, поэтому представляется необходимым проведение исследований оптических свойств боридов с использованием экспериментальных и теоретических методов, хорошо разработанных для металлов.
Учитывая довольно заметную электропроводность боридов, можно использовать для исследования боридов соотношения между оптическими свойствами металлов п и а (коэффициентами преломления и поглощения) и их электропроводностью:
а па = —, v
где v — частота света, падающего на металл. Это. соотношение оправдывается для далекого инфракрасного излучения. Для видимого излучения отмечается значительное расхождение, указывающее на то, что при падении на металл видимого света заметную роль играю!1 не только свободные (нелокализованные) электроны, но и связанные (локализованные). Таким образом, степень отклонения экспериментальных данных от приведенного соотношения дает некоторую возможность судить' о распределении доли локализованных и нелокализованных электронов.
Данные по. оптическим свойствам боридов малочисленны [24, 161, 465, 504, 597, 851]. При исследовании закономерностей инфракрасного поглощения боридов ЛВг, ZrBz и МогВ обнаружено, что полосу поглощения, довольно слабую, имеет только полуборид молибдена МогВ, что связано со значительной размытостью энергетических состояний s- и d-полос в боридах [24].
Для некоторых боридов редкоземельных и переходных металлов измерен коэффициент излучения, знание которого необходимо при использовании боридов в технике высоких температур [161, 465, 504, 851]. Разработанная в работе методика измерения коэффициента излучения боридов позволила приблизиться к модели абсолютно черного тела и получить весьма надежные данные.
Результаты измерений приведены в табл. 19, где для сравнения даны коэффициенты излучения карбидов и нитридов. Рассмотрение этих коэффициентов позволяет отметить, что соединения металлов, имеющих незаполненные d-оболочки, характе-
72
т аблица 19
Коэффициенты излучения порошков некоторых боридов
Температура, °C
Борид 800 900 1000 1100 1200 1300 1400 1600 1600
Ве6В 0,77 0,77 0,77 0,77 0,77 0,77 0,77 0,77 0,77
СаВв 0,75 0,75 0,75 0,75 0,75 0,75 0,75 0,75 0,75
SrBg 0,79 0,79 0,79 0,79 0,79 0,79 0,79 0,79 0,79
ВаВ, 0,84 0,84 0,84 0,84 0,84 0,84 0,84 0,84 —.
ScB2 0,89 0,89 0,89 0,89 0,89 0,89 0,89 0,89 0,89
YB, 0,66 0,66 0,66 0,67 0,67 0,68 0,68 0,69 0,70
LaBg 0,82 0,82 0,82 0,82 0,82 0,82 0,82 0,82 0,82
CeBe 0,72 0,73 0,73 0,74 0,74 0,75 0,75 0,76 0,76
РгВв 0,76 0,76 0,76 0,77 0,77 0,77 0,78 0,78 0,78
NdBg 0,51 0,51 0,50 0,50 0,49 0,48 0,48 0,47 0,47
SmBe 0,77 0,77 0,77 0,77 0,77 0,77 0,77 0,77 0,77
EuBg 0,83 0,83 0,83 0,83 0,83 0,83 0,83 0,83 0,83
GdBg 0,66 0,66 0,65 0,65 0,64 0,62 0,62 0,62 0,61
ТЬВд 0,74 0,74 0,74 0,74 0,74 0,74 0,74 0,74 0,74
TmBg 0,57 0,60 0,62 0,64 0,65 0,67 0,69 0,71 0,73
YbBg 0,73 0,73 0,73 0,74 0,74 0,74 0,74 0,75 0,75
AlBla 0,76 0,76 0,76 0,76 0,76 0,76 0,76 0,76 0,76
TiBa 0,71 0,71 0,71 0,71 0,71 0,71 0,71 0,71 0,71
ZrBa 0,89 0,89 0,90 0,90 0,90 0,91 0,91 0,91 0,91
HfB2 0,89 0,89 0,90 0,90 0,91 0,91 0,92 0,92 0,92
VB2 0,72 0,72 0,73 0,73 0,74 0,74 0,75 0,75 0,76
NbB2 0,77 0,77 0/77 0,77 0,77 0,77 0,77 0,77 0,77
CrB2 0,72 0,72 0,72 0,72 0,72 0,72 0,72 0,72 0,72
MogBg 0,80 0,79 0,79 0,78 0,78 0,78 0,78 0,77 0,77
w2B6 0,83 0,83 0,83 0,83 0,83 0,83 0,83 0,83 0,83
ризуются близкими значениями коэффициентов излучения, намного превышающими коэффициенты для редкоземельных металлов, у которых не заполнена глубоко лежащая и сильно экранированная 4/-оболочка ('за исключением иттрия, относящегося к d-переходным металлам). Это может быть связано с большей легкостью электронных переходов в первом случае. Кроме того, бориды редкоземельных металлов имеют своеобразную кристаллическую структуру, характеризующуюся наличием жесткого каркаса из атомов бора, в построении которого участвуют валентные электроны атома металла, что также затрудняет возможные электронные переходы.
Более высокий коэффициент излучения карбида бора по сравнению с нитридом бора при общности характера химической связи объясняется относительно легкой возбудимостью электронов карбида бора, ответственных за связь между атомами углерода [403]. Необходимо отметить, что именно по этой причине удельное электросопротивление карбида бора значительно ниже сопротивления нитрида.
73
ФИЗИКО-МЕХАНИЧЕСКИЕ СВОЙСТВА
Основные закономерности физико-механических свойств металлоподобных соединений были сформулированы в работе [404]. Механические свойства боридов определяются наличием структурных дефектов, примесей, пористости. Наиболее характерное свойство боридов — их значительная твердость, связанная с направленным характером й высокой энергетической прочностью межатомных связей.
Несмотря на большой разброс данных По микротвердости боридов, опубликованных в различных работах [106, 404, 632, 765], можно заметить, что микротвердость боридов уменьшается с увеличением порядкового номера металла в группах и по диагонали участка периодической системы, где располагаются переходные металлы.
Характер изменения микротвердости боридов в зависимости от порядковдго номера элемента показай на рис. 23. Рассмотрение этих данных показывает, что микротвердость диборидов переходных металлов IV—VI групп при переходе от боридов металлов IV группы к V уменьшается, микротвердость боридов металлов VI группы несколько выше микротвердости боридов металлов V группы, хотя для борида хрома наблюдается дальнейшее снижение микротвердости по сравнению с диборидом ванадия. Такой характер Изменения микротвердости боридных фаз определяется энергией межатомного взаимодействия, которая, в свою очередь, является функцией электронного строения боридов. При образовании диборидов происходит трансформация электронного спектра [450]. Атомы бора, как уже указывалось выше, в диборидах обладают преимущественно зр3-конфигура-циями, устойчивость которых снижается при переходе от металлов IV группы к металлам V группы. Снижение устойчивости ?тих состояний по сравнению с «/^-конфигурациями в карбидах переходных металлов и отвлечение электронов со связей Me—В частично компенсируется ковалентным взаимодействием «реконфигураций с образованием в диборидах Плоских гексагональных сеток из атомов бора. Наличие прочных ковалентных связей В—В обусловливает наличие высокой микротвердости боридов.
Связь Мё—В в диборидах зависит от степени локализации электронов металла и включает ковалентную составляющую в результате частичного возбуждения d-электронов металла с образованием гибридных spd-конфигураций и ионную составляющую— за счет донорно-акцепторного взаимодействия. Снижение обеих составляющих при переходе от диборидов металлов IV группы к диборидам металлов V группы приводит к уменьшению микротвердости в этом направлении (см. рис. 23). В направлении NbB2-+-Mo2B5 и TaBz-HV^Bs резко возрастает степень устойчивости ^-состояний металла и снижается устой-74
чивость sp-конфигураций атомов бора, т. е. уменьшается ковалентная составляющая связи Me—В. Резкое ослабление связи Me—В в бориде вольфрама W2Bs подтверждается еще и тем, что период решетки с у этой фазы почти в пять раз превосходит тот же период у борида тантала (см. табл. 1). На микротвердость оказывает основное влияние связь Me—Me, которая усиливается из-за роста степени устойчивости <25-состояпий металла и отвлечения на нее дополнительных электронов со связи Me—В. Это приводит к некоторому увеличению микротвердости у боридов
Рис. 23, Микротвердость боридов переходных металлов IV—VI групп вдоль периода (а) и внутри групп (б).
молибдена и вольфрама по сравнению с боридами ниобия и тантала.
Проведенные в работе [1001J измерения микротвердости по осям диборида титана не обнаружили существенной ее анизотропии. Величина микротвердости по оси а оказалась незначительно большей, чем по оси с. Исследование температурной зависимости твердости некоторых боридов (TiB2, ZrB2, HfB2, W2B5) в интервале температур от комнатной до 1900° С показало уменьшение твердости с ростом температуры [780].
Бориды переходных металлов, как и все металлоподобные соединения, отличаются высокой хрупкостью, связанной с направленным характером и очень большой жесткостью межатомных связей, что затрудняет релаксацию упругих напряжений в решетках боридов.
Оценка напряжений в решетках диборидов титана, циркония и ниобия, проведенная по уширению рентгеновских линий й работе [693], показала, что в направлении [00/] величина напряжений намного выше, чем по другим направлениям. Такое явление характерно для материалов со слоистой структурой, где связь между плоскостями [00/] слабее, чем по другим направлениям в кристалле. Отмечается, что дибориды металлов IV группы достаточно изотропны, причем напряжения в решетке диборида титана меньше, чем в дибориде циркония.
75
Для оценки хрупкости в работах [24, 404] предлагается использовать представления о колебаниях атомных комплексов, допустимых без разрыва связей, т. е. без разрушения элементарной ячейки. Сведения о возможных перемещениях структурных элементов дают характеристические температуры и значения среднеквадратичных смещений атомов в решетке.
От TiB2 к СгВ2 уменьшается хрупкость, увеличиваются среднеквадратичные смещения атомов в решетке, что указывает на уменьшение жесткости связи при переходе от диборидов металлов IV труппы ц диборидам металлов V группы.
Упругие и прочностные характеристики диборидов изучались в работах [37, 200, 694, 1001]. Данные измерений, приреденные в табл. 10, обнаружили: высокие показатели упругости и прочности для диборидов IV группы, а также для диборида хрома.
Джилмен и Робертс [694] на основании определения упругих постоянных для диборида титана предполагают частичную ковалентность связей Ti—В со значительной долей связей металлоподобного характера.
Бориды TiB2, ZrB2, NbB2 и W2B5 обладают высокой абразивной способностью, значительно превышающей электрокорунд различных марок [433, 483]. Перечисленные бориды мбгут быть рекомендованы для создания на их основе абразивного инструмента. Высокие абразивные характеристики боридов сочетаются с их устойчивостью к взаимодействию по цтношению к обрабатываемым материалам. Например, шлифование деталей из титановых сплавов существующими абразивными материалами, в том числе и алмазом, приводит к значительному снижению циклической прочности деталей из-за физико-химического взаимодействия, сопровождающегося налипанием титана на абразивные зерна. Применение шлифовальных кругов из борида вольфрама на бакелитовой связке для шлифования титановых сплавов показало, что максимальные остаточные напряжения на глубине до 10 мкм на 20—25% ниже, чем после шлифования кругами из карбида кремния [484]. Можно предположить, что циклическая прочность деталей из титановых сплавов, шлифованных новыми абразивами из боридов и материалов па их основе, будет значительно выше.
Исследование электроискрового легирования переходных металлов IV—VI групп тугоплавкими боридами [488—490] показало, что эрозия боридов уменьшается при переходе от боридов металлов IV группы к боридам металлов V и VI групп. Минимальные значения эрозии отмечаются для боридов молибдена и вольфрама (рис. 24), характеризующихся минимальными среднеквадратичными смещениями атомов в решетке, что свидетельствует об определяющей роли жесткости решетки и прочности связей в эрозии боридов.
Испытание легированных различными боридами образцов на абразивную износостойкость показало, что при упрочнении ти-76
Тановых. образцов лёгйрующймй элёк'фоДйми из боридов титана,-циркония и вольфрама получаются наиболее износостойкие слои. Данные по механическим и термическим свойствам боридов дают основание предположить сравнительно высокую их термостойкость.
Рие. 24. Зависимость эрозий анодов уа из боридов переходных металлов от среднеквадратичных смещений их атомов V и2 при электроискровом Легировании.
РАДИАЦИОННАЯ СТОЙКОСТЬ
Одной из характеристик механической прочности боридов является их радиационная стойкость, определяющаяся способностью материала выдерживать высокие упругие напряжения.
Бориды и сплавы на их основе благодаря высоким поперечным сечениям захвата тепловых нейтронов применяются в регулирующих устройствах и защитных блоках ядерных реакторов [348]. Медленные нейтроны, вступая в ядерную реакцию с атомами бора
'sB 4- оИ —> 3L1 4- аНе 4-7 4- 2,78 Мэв, вызывают деление ядер бора на два легких осколка-ядра лития и гелия с энергией 0,59 и 1,77 Мэв соответственно. Объем пары атомов лития и гелия почти в 10 раз больше объема атома бора, в связи с чем каждый такой акт деления сопровождается сильным распуханием решетки. Вследствие большого поперечного сечения реакции деления ядер 10В (4010 барн) и высокой концентрации этих ядер в естественной смеси изотопов (19%) облучение боридов нейтронами приводит к быстрому накоплению лития и гелия в решетке борида, что, в свою очередь, вызывает серьезное повреждение борсодержащих материалов.
Возможности снятия напряжений посредством пластической деформации в случае хрупких боридов весьма ограничены, поэтому можно предположить наличие определенной взаимосвязи между радиационной стойкостью и модулем нормальной упругости Е или, в случае неодинакового размера зерен d, отношением Ej^d, определяющим напряжение, необходимое для распространения трещины из одного зерна в другое.
Сравнение полученных в работе [439] данных, приведенных в табл. 20, показывает, что такая корреляция действительно наблюдается.
77
Таблица 20
Связь радиационной стойкости боридов с модулем нормальной упругости
Борид Модуль нормальной упругости, кн/мм* Размер зерна, мкм Отношение E/VT Средний размер осколков, мм Радиационная СТОЙКОСТЬ, усл. ед.
TiBa 530 25 106 Не разрушился 5
(Ti, Сг)Ва 566 30 103 Tq же 4
ZrB2 343 38 55 2 1
СгВ2 211 9 70 3 2
LaBe 398 15 102 5 3
Исследование образцов боридов титана, циркония, хрома и дантана в вертикальном водоохлаждаемом канале ядерного реактора ВВР-М, расположенном в зоне отражателя, показало, что в боридах TiB2 и (Ti, Сг) В2 появляются трещины, а образцы боридов циркония, хрома и лантана разрушались на оскодки размером от одного до нескольких миллиметров [439].
Причина появления трещин и разрушения образцов боридов— накопление гелия в области несовершенств кристаллической решетки. В работах [122,423] показано, что радиационная .стойкость зависит от условий, контролирующих диффузию гелия в решетке боридов, т. е. от характера связи и типа кристаллической структуры. В связи с тем, что в кристаллической структуре диборидов отмечается последовательное чередование слоев металла и бора, диффузия атомов гелия между слоями определяется в основном прочностью химической связи Ме—В.
Согласно конфигурационной модели локализации валентных электронов (433, 436], как это уже отмечалось выше, при образовании боридов переходными металлами IV группы, атомы которых преимущественно доноры электронов, происходит переход нелокализованной части валентных электронов от атомов металла к атомам бора. Это сопровождается стабилизацией «реконфигураций атомов бора и локализацией у их остовов ранее нелока-лизованных электронов металла, что вызывает общую энергетическую стабилизацию борида. У атомов переходных металлов V и VI групп наблюдается тенденция к повышению стабильности с!5-состояний в связи с увеличением степени заполненности d-полосы. Поэтому прочность химической связи Ме—В убывает в ряду TiB2—(Ti, Cr)B2—ZrB2—CrB2. Действительно, как показали результаты работы [439], максимальное расширение решетки наблюдается в случае диборида титана, обладающего наибольшей прочностью химической связи между слоями атомов металла и бора, что препятствует диффузии гелия между слоями (табл. 21). Наблюдаемая анизотропия искажения элементарной 78
Таблица 21
Изменение решетки боридов под воздействием излучения, %
Борид Относительное изменение объема элементарной ячейки Относительное изменение периодов решетки, %
Д а]а Д е/с
TiB2 3,1 1,5 0,1
(Ti, Сг)В2 1,4 0,4 0,6
ZrBjj 0,9 0,3 0,3
ячейки диборидов свидетельствует о преимущественном расположении атомов лития и гелия внутри слоев, что Подтверждает наличие сильных связей между слоями И менее прочных внутри сдоев. Переход от TiB2 К (Ti, Сг)В2 и далее к ZrB2 сопровождается ослаблением связи Me—В, что облегчает выход гелия из решетки и уменьшает ее «распухание», Одновременно наблю-" дается уменьшение степени анизотропии расширения решетки. Следовательно, йоявляется возможность размещения Примесных атомов между слоями. Увеличение выхода гелия из решетки при переходе от TiB2 к ZrB2 наблюдали экспериментально [734].
Радиационная стойкость боридов зависит также от условий облучения [76, 439]. Увеличение температуры облучения способствует релаксации внутренних напряжений и препятствует растрескиванию и разрушению образцов. Следует полагать, что для каждого борида существует критическая температура, выше которой облучение не вызывает разрушения изделий, подобно тому, как-то наблюдается для ВеО [915].
ХИМИЧЕСКИЕ СВОЙСТВА
Исследование химических свойств боридов, изучение связи химической стойкости, боридов с их структурой имеет большое научное Значение.
Многочисленные работы, выполненные различными исследователями и посвященные изучению поведения боридных фаз в разных химических реагентах: кислотах, щелочах, растворах кислот и щелочей, воде, — а также стойкости боридов по отношению к углероду, кислороду, азоту, обсуждаются подробно при рассмотрении свойств бинарных соединений в системах Me—В.
Анализ этих данных приводит к следующим основным выводам. Наблюдается корреляция между химической стойкостью боридов и их составом. Стойкость боридов одного и того же металла повышается по мере перехода к индивидуальным соединениям, содержащим большую долю бора. Эта зависимость
79
определяется упрочнением связей В—В с усложнением структурных образований из атомов бора в боридах. Исследование реакции гидролитического разложения боридов при обработке кислотами, сопровождающейся нарушением связей В—В с образованием бороводородов, дает наиболее полную информацию о зависимости химической стойкости от строения боридов.
Работы, проведенные в этом направлении Л. Я. Марковским и др. [217, 218, 222, 225, 227], показали, что выделение борово-дорода при гидролитическом разложении боридов — характерная особенность большей части боридов.
В ряду TiB2—ZrB2—СгВг гидролитическаястойкость убывает.
При разложении СгВ2 в соляной кислоте образуется до 1— 2% бороводородов, TiB2 разлагается с образованием диборана и тетраборана. Л. Я. Марковский своими исследованиями показал, что при гидролитическом разложении боридов й раствор переходят ионы соответствующих металлов, а бор — в виде субборной кислоты, соответствующей субокислу бора В2О2.
Предполагается [227], что первичным продуктом гидролиза боридов является первичный бороводородный 'радикал ВНз. В зависимости от темпов его образования, гидролитического разложения и полимеризации, степень которой может также зависеть и от каталитических факторов, количество бороводородов, которое может быть выделено, оказывается различным у разных боридов и зависит от условий гидролиза. Наряду с В2Н6 и В4Н10 при гидролизе боридов образуются также жидкие и твердые бороводороды в столь незначительных количествах, что они с трудом обнаруживаются при разложении очень больших количеств боридов.
Необходимо отметить, что на процесс гидролиза влияет скорость разложения борида, его количество и происхождение (метод получения), природа кислоты.
Бороводороды, выделяющиеся при реакции разложения, возможно, сразу же реагируют с водой, что приводит к образованию борной кислоты. В этих случаях при исследовании гидролитической стойкости не наблюдали появления бороводородов.
При реакции с серной кислотой установлено, что количество сероводорода и сернистого газа зависит от скорости разложения. Образование сероводорода и сернистого газа объясняется также наличием в продуктах разложения боридов некоторого количества бороводородов, восстанавливающих серную кислоту.
Разложение диборидов металлов IV—VI групп в соляной и серной кислотах идет по реакциям [157, 158]:
TiBa + ЗНС1 + 4Н2О -ч- TiCl3 + 2НВО2 4- 4,5Н2;
ZrB2 4- 2НС1 4- 5Н2О -ч- ZrOCl2 4- 2НВО2 4- 5Н2;
HfB2 4- 2НС1 4- 5Н2О м. НЮС12 4- 2НВОа 4- 5Н2;
VB2 4- ЗНС1 4- 4Н2О -> VC18 4- 2НВОа 4- 4,5Н2;
80
TiB2 + H2SO4 + H20 -+ Ti2 (SO4)3 + HBO2 + SO2 + H2S + H2;
ZrB2 + H2SO4 + H2O -> ZrOSO4 + HBO2 + SO2 + H2S + H2;
HfB2 + H2SO4 + H2O^HfOSO4 + HBO2 + SO2 + H2S + Ha;
VB2 + H.2so4 + H2O -> V2 (SO4)3 + HBO2 +
SO2 4" H2S H2;
NbB2 + H2SO4 + H2O -> Nb2O3 (SO4)3 + HBO2 + SO2 + H2S + H2.
Дибориды переходных металлов IV, группы, особенно ZrB2 и HfB2, в кислых растворах менее стойкие соединения, чем дибориды металлов V группы. При этом химическая устойчивость диборидов металлов IV группы уменьшается от TiB2 к HfB2. Для диборидов металлов V группы наблюдается увеличение химической устойчивости с возрастанием порядкового номера элемента.
Бориды металлов, особенно дибориды переходных металлов IV—VI групп, характеризуются высокой устойчивостью в среде кислорода. При окислении боридов кроме окпслов Металлов образуется борный ангидрид В20з и низшие окислы типа ВО, В2О2, которые, взаимодействуя при высоких температурах С окислами соответствующих металлов, образуют пленки сложных соединений — пироборатов, усиливающих защитные свойства окисной пленки. Этим и обусловливается окалиностойкость боридов, превосходящая в большинстве случаев окалиностойкость многих карбидов.
Бориды переходных металлов—’Огнеупорные материалы, которые все шире используются при высоких температурах в агрессивных средах.
Имеющиеся сведения по устойчивости боридов в контакте С расплавленными металлами и сплавами весьма противоречивы, что в значительной степени объясняется различиями в методиках исследований, условиях проведения эксперимента, чистоте, плотности и структуре материалов, а также разными целями, вызывавшими постановку исследований, а следовательно, разными подходами к оценке результатов опытов.
Недавно проведено систематическое исследование смачивания боридов металлов IV—VI групп переходными металлами группы железа и непереходными металлами 16—V6 подгрупп; изучена кинетика взаимодействия в этих системах, рассчитаны работы адгезии и межфазная поверхностная энергия, исследованы температурные и временные зависимости краевого угла смачивания [459, 460].
Обзор полученных результатов, приведенных в табл. 22, обнаруживает различный характер смачивания боридов металлов IVa—Via подгрупп расплавленными металлами. Эти различия определяются электронным строением, структурой и прочностью химических связей контактирующих фаз.
6 Зак. 1305
81
Таблица 22
краевое углы и энергетические характеристики смачивания боридов расплавленными элементами 16—V6 подгрупп и переходными металлами триады железа
Борид Смачивающий элемент Температура, °C Краевой угол смачивания а град Работа адгезии, эрг/см* Молярная работа адгезии, ккал/моль
1 в вакууме в аргоне
TiBs Си 1100—1300 143—124 596 7,55
ZrB2 Си 1100—1300 135—132 452 5,85
NbBj СгВ2 Си Си 1100—1300 1100—1300 109—95 26—15 910—1914 2646 11,7—24,8 31,5
Мо2В8 Си 1000 Г— 0 —ч—
W2B8 Си 1000—1200 — 104—93 1280 22,0
TiB2" Ga 800 115 ——I» 407 5,18
ZrB2 Ga 800 117 386 5,08
NbB2 Ga 200—500 109—101 575 7,53
CrB2 Ga 200—500 128—123 - ж 322 3,8
TiB2 In 300—500 —4 124 246 3,14
ZrB, In 300—500 114 330 4,34
HfB2 In 300—500 114 330 4,75
NbBj In 300—500 133 177 2,32
TaB2 In 300—500 117 305 4,37
CrB2 In 300—500 100—97 462—670 3,36—7,9
W2B6 In 300—500 130 199 3,4
TiB2" Si(xp) 1500 15 1690 21,2
W2B8 Si(Kp) 1500 п— 22 1650 28,2
ZrB2 Ge 1000 102 476 6,2
HfB2 Ge 1000—1100 141—140 140 2,0
NbB2 Ge 1000 60 900 11,8
NbB2 CrB2 Ge Ge 1000 1000—1200 - • 66 126—23 860 1150 11,2 13,7
Mo2B6 Ge 1000 28 ИЗО 15,0
Mo2B8 .Ge 1000 4-4- 28 ИЗО 15,0
W2B5" Ge 1000—1200 128 318 5,42
TiB2 Sn 250 ч—— 114 328 4,1
ZrBa Sn 250—600 101 364 5,2
NbB2 Sn 250—600 102 438 5,7
CrB2 Sn 250—600 100 458 5,4
Mo8B8 W2B8 TiBa NbBa Sn Sn Pb Pb ’ 250—500 250—800 350—800 350—800 — 100—92 100—92 106 125 458 581 348 204 6,1 6,21 4,35 2,67
CrB2 Pb ’ 350—800 124 210 2,5
TiB2 Bi 320 л— 141 107 3,3
NbB2 Bi 320 110 316 4,3
w.bZ Bi 320 —— 128 254 2,7
TiB2 Al 900—1250 140—38 402—1700 3,38—13,8
ZrBa Al 900—1250 106—60 709—1645 10,1
HfB2 Al 900—1250 134—60 —- 279—1645 3,9—23,2
NbBa Al 900—1250 125—0 — 388—1828 5,16
TaB2 Al 900—1250 138—0 235—1828 3,36
Al 900—1250 107—0 — 646—1828 7,7—22,4
MojB8 Al 900—1250 134—0 — 279—1828 3,71—24
82
Продолжение табл. 22
Борид Смачивающий элемент Температура, °C Краевой угол смачивания» град Работа адгезии, эрг/см2 Молярная работа адгезии» ккал/моль
в вакууме в аргоне
TiB2 Fe 1550—1670 62 92 2620 33,0
ZrB2 Fe 1550 72 102 2350 30,9
ШВ2 Fe 1550 100 98 1461 20,5
VB2 Fe 1400 17 — 3480 43,1
NbB2 Fe 1450 0 31—0 3500 45,0
TaBs Fe 1500 0 0 3500 45,0
CrB2 Fe 1540 30 1 3300 38,4
Mo2B6 Fe 1540 0 3500 74,1
W2B6 Fe 1550 0 0 3500 60, ь
TiB2 Ni 1480—1600 20 72 3200 40,8
ZrB2 Ni 1480—1600 65 78 2430 31,8
HfBa. Ni 1480—1600 99 99 1430 20,0
VB2 Ni 1450 0 0 3500 43,4
NbB2 Ni 1450 24 2450 31,7
CrB2 Ni 1450 20 21 3310 38,4
Mo2Bs Ni 1450 0 0
W2B6 Ni 1450 4 3400 58,1
TiB2 Co 1500—1600 20 64 3500 40,0
ZrB2 Co 1500—1600 63 81 2640 34,7
CrB2 Co 1500 15 28 3550 41,0
Mo2B6 Co 1500 > — 22 — — 74,2
W2B8 Co 1600 19 94 60,0
VB2 Co 1500 0 0 II « 1»
NbBa Co 1500 0 0 3460 ЛА—
TaB2 Co 1500 0 0 3500
BKp Fe 1550 45 3060 16,9
BKp Ni 1450 15 3560 19,5
ЭЛЕКТРОННОЕ СТРОЕНИЕ БОРИДОВ ПЕРЕХОДНЫХ МЕТАЛЛОВ
Бор при образовании боридов проявляет все многообразие структур: в низших боридах (по содержанию бора) атомы бора изолированы друг от друга, в высших — атомы бора образуют прочные ковалентные связи. Такое поведение бора объясняется специфическим электронным строением самого атома бора. Атомы бора в изолированном состоянии имеют структуру внешних валентных электронов 2s22pl [668, 670]. Наличие одного неспаренного электрона, обладающего тремя p-функциями связи [182], приводит к образованию электронных конфигураций различной степени устойчивости.
Имеется много теорий, по-разному объясняющих вклад ковалентной и металлической составляющих в энергию связи и физические свойства боридов.
6*
83
Ёсть 1йоделй, в которых основйую роль jirpaiat ат'омы борд как доноры электронов [645, 755, 769], и такие, в которых электроны атомов бора принимают активное участие в организации жестких ковалентных связей [130, 185, 616,- 618^ 762, 977].
В работе [755] предполагают, что электроны бора заполняют d-полосу металла, приводя к стабилизации гексагональной структуры МеВ2 без резко выраженных связей между атомами бора. В d-полосу металла, перекрывающуюся с s-полосой, атом бора передает три свободных электрона.
В работе [383] для оценки способности и организации электронного коллектива вводится понятие донорно-акцепторного взаимодействия, характеризующегося отношением 1/nN (акцепторная способность). Используя критерий 1/nN и исходя из заполнения d-полосы металла электронами бора, авторы [185] предлагают объяснение экспериментальных данных по эффекту Холла, электросопротивлению и термо-э. д. с/ боридов [185]. Робинс [923] ц Кисслинг [771] также считают, что донорная способность атомов бора играет существенную роль в организации электронного коллектива при образовании борида.
Демпси [645] предложил металлическую модель зонной структуры диборидов металлов IV группы. Он предполагает, что величина удельного электросопротивления определяется в боридах плотностью состояний полосы проводимости вблизи уровня Ферми. Анализ- физических свойств диборидов IV группы показывает, что концентрация носителей у диборидов IV группы мала. В связи с этим предложенная Демпси модель, по которой каждый атом бора передает в d-полосу металла один электрон, правомочна только при условии расщепления или глубокого минимума d-полосы.
Характеристики d-полос переходных металлов весьма разноречивы [282, 611, 636]. По данным Бильца [585]. и Эрна [656], для карбида и нитрида титана при наличии сильного взаимодействия Me—X кривая плотности состояний имеет глубокий минимум.
Дибориды переходных металлов обладают структурой с довольно высоким заполнением объема, причем атомы $ора можно рассматривать как внедренные в междоузлия гексагональной решетки из более крупных атомов металла. Это делает дибориды похожими на типичные фазы внедрения — карбиды, что проявляется в одинаково высоких температурах плавления боридов и карбидов, в металлическом типе йроводимости. Дибориды, кай и карбиды,-—твердые и хрупкие материалы, поэтому логично предположение Пайпера [901] о том, что электронная структура диборидов аналогична электронной структуре карбидов. В соответствии с этим связь Me—В также может обусловить обнаруженный в работах [585, 656] минимум и низкую плотность состояний на уровне Ферми. Однако атомы бора превосходят по размерам атомы углерода, что затрудняет их размещение в 84
октаэдрических междоузлиях металлических решеток с плотнейшей упаковкой и приводит к появлению фаз, в которых существенную роль Должны играть взаимодействия между атомами бора. В дибэридах расстояния В—В близки к ковалентному расстоянию В—В, равному 1,78 А (см. табл. 1), и, следовательно, помимо взаимодействий Me—X и Me—iMe, которые рассматриваются в монокарбидах, в диборидах следует учитывать связи X—X, играющие существенную роль.
Кадвилль [608] считает, что при образовании боридов атомы бора склонны отдавать часть своих электронов в d-полосу металла. Он измерил электрические и магнитные свойства полу- и моноборидов переходных металлов от хрома до никеля. При рассмотрении результатов измерений Кадвилль опирается на главенствующую роль d-полосы металла в электронной структуре боридов и делает вывод о том, что число электронов в d-полосе металла увеличивается в среднем на 1,7—1,8 на атом растворенного бора. Энергетическую d-полосу Кадвилль подразделяет на две подполоеы, одна из которых целиком заполнена, вторая— d-подполоса противоположного спина—Частично. Частично заполненная d-подполоса перекрывается на уровне Ферми с полосой проводимости. Таким образом, он принимает наличие в боридах прочной ковалентной связи Me—Me, металлической связи Me—В и менее существенной связи В—В. Такая схема, по его мнению, применима" к боридным фазам МегВ и МеВ переходных металлов конца периода. Для таких же металлов, как титан, ванадий, переход электронов бора в d-полосу металла не обязателен. Однако свою модель Кадвилль переносит на СгВг [608]. На основании измерения магнитного момента СдВг он делает предположение, что атом бора при образовании диборида хрома отдает в d-полосу металла около 1,7 электрона. Это предположение справедливо, если допустить, что электроны, передаваемые бором металлу, равномерно распределяются между-двумя d-подполосами противоположных спинов, создавая в подполосе проводимости определенную концентрацию. Такая схема маловероятна, как и выводы рентгеноспектральных исследований [99], потому что она не принимает во внимание изменение характера химической связи при возрастании атомного отношения В/Ме.
К аналогичным выводам приходят в работе [999], в которой результаты исследования низкотемпературной теплоемкости боридов переходных металлов с различным содержанием бора обсуждаются в рамках единой модели, согласно которой бориды сохраняют зонную структуру образующих их чистых металлов, а каждый атом бора,.являясь донором, передает в d-зону металла 1—1,5 электрона.
В связи с различием кристаллических структур металлов и их боридов такой подход к объяснению результатов исследования низкотемпературной удельной теплоемкости в работе [999]
85
считают чересчур упрощенным,, несмотря на то, что удалось найти? корреляцию между полученными значениями теплоемкости и формой обобщенной d-полосы. Есть и другое мнение, основывающееся на том, что атомы бора используют свои валентные электроны для организации собственных жестких связей [749, 781, 805, 959].
Кристаллохимическое рассмотрение диборидов переходных металлов [908] привело к следующему выводу: длина оси а в. дибориДах определяется равновесием между двумя противопо-ложными силами —отталкиванием между атомами металла и сцеплением между атомами бора. Расстояние Me—В при изменении отношения с/а в области гомогенности диборидов остается Постоянным. Эти особенности структуры свидетельствуют о том, что за прочность диборидов ответственны, в первую очередь, Связи В—В внутри графитоподобных слоев из атомов бора и связи Мё-Л-В между слоями.
В согласии с выводами Поста ц Др( [908] Находится модель электронного Строения диборидов переходных металлов, предложенная Липскомбом [805], по которой 'металл является донором, а боракцептором электронов, По этим данным бор акцептирует у металла два электрона,
Предложенная модель находится В согласии с моделью для графита; каждый атом в плоской сетке имеет четыре электрона для организации связи В—В. ПрЦ таком допущений дибориды Металлов IV группы имеют два свободных электрона на каждый атом металла.
Результаты рентгеновской и электронной спектроскопии [199, -268, 283, 669, 862, 939, 940], а также исследования ядерного магнитного резонанса [208, 209, 959, 960] свидетельствуют о том, что атомы бора в диборидах — акцепторы электронов. Так как валентная оболочка атомов бора имеет четыре орбитали, да которых в изолированных атомах располагаются три электрона, такой переход электронов, приближая конфигурацию атомов бора к полузаполненной (р3), усиливает их способность К образованию связей,
Джонсон и Даай [749] в предположении жесткой связи В— В, а также того, что ответственным за металлическую связь являются электроны металла, провели работу с целью получения экспериментальных сведений для оценки двух моделей электронной структуры боридов. Целью работы было установить, достаточно ли у бора электронов, чтобы обеспечить связь В—В, и все ли валентные электроны металла (оставшиеся в случае передачи необходимого количества на связь В—В) связаны, а если нет, то с помощью эффекта ХоЛла определить концентрацию свободных носителей. В качестве объекта исследования был выбран диборид иттрия. В работе сделано предположение, что атом металла передает бору все свои валентные электроны. Известно, что металлы с различной валентностью могут образовывать бо-
Г86
рйдные фазы одного состава. В связи с этим предположение о передаче атомом металла всех валентных электронов бору было применено к дибориду иттрия, поскольку у иттрия наблюдается минимальная валентность. Однако предположение, что атом иттрия отдает на организацию В—В связи три валентных электрона, требует дополнительного подтверждения в связи с тем, что может существовать не открытый еще изоморфный бориду иттрия борид металла с еще более низкой валентностью. Температурная зависимость удельного электросопротивления, йолучен-ная в работе [749] для УВ2, показала, что он обладает металлическим типом проводимости. Отсюда следует, что определенная доля электронов иттрия переходит в .полосу проводимости, а значит, число электронов, переданных бору, меньше трех. Были проанализированы в связи с этим две модели:
L Атом металла передает бору для организации связей В—-В два электрона. Теоретически рассчитанная величина коэффициента Холла с учетом предположения хорошо совпала с экспериментальными данными.
2, Атомы бора обеспечивают ковалентные связи В~-В собственными электронами. В этом случае в полосу проводимости добавляются два электрона. Сравнение с данными по эффекту Холла привело к неудовлетворительным' результатам, в связи с чем вторая модель была отвергнута.
На основании анализа полученных результатов делается вывод о Том, что в диборидах на организацию связей В—В уходит четыре электрона на каждый атом бора. Аналогичного мнения придерживается Кребс [781], Таким образом, существуют две противоположные точки Зрения па электронную структуру боридов, !
Одна из них базируется на предположении, что бор передает свои валентные электроны в d-полосу металла. Эта гипотеза вытекает из металлических свойств боридов и сравнительно низкого ионизационного потенциала бора.
Юречке и Штейниц [755] считают, что электроны бора, заполняя d-полосу металла, сдвигают уровень Ферми к границе d-полосы. Отсюда следует, что электроны бора занимают высокие энергетические уровни. Это маловероятно и находится в противоречии с высокой стабильностью диборидов IV и V групп. Связи В—В играют существенную роль в стабильности диборидов. Результаты исследования магнитных и электромагнитных свойств диборидов [749, 901, 959] указывают на то, что жесткая связь атомов бора образуется за счет валентных электронов бора с привлечением некоторой части электронов металла. Этот вывод подтверждается результатами исследования других свойств [199, 283, 669, 862, 959].
На основании анализа данных по тепловому расширению диборидов следует, что бориды металлов IV группы обладают незначительной анизотропией [17, 764]. Полученные Вальдиеком
87
[1001] дайные по электросопротивлению монокристаллов TiB2 также не показывают анизотропии. Измерение напряжений кристаллической решетки диборидов титана, циркония и ниобия [693] обнаружило минимальные и одинаковые по всем направлениям напряжения в решетке TiB2. У диборида циркония напряжения несколько выше, у диборида ниобия напряжения между слоями намного больше, чем в других направлениях, что характерно для материалов со слоистой структурой. На основании работы [693] можно сделать вывод о наличии сильных связей по всем направлениям у TiB2; у ZrB2 связь между слоями слабее.
Данные по измерению электромагнитных свойств диборидов металлов IV группы подтвердили высокую электропроводность при чрезвычайно низкой концентрации носителей (менее 0,1 электрона на ячейку) для диборидов металлов IV группы.
В работах [60, 61, 452] описаны результаты расчета электронного спектра диборидов переходных металлов и тетраборида церия, проведенного с использованием метода сильной связи (МО—ЛКАО), который дает возможность получить перераспределение электронов с оболочек изолированных атомов на орбитали твердых соединений. Как показали работы [538, 817], использованный для расчета метод при условии учета влияния трех ближайших соседей вполне удовлетворителен.
При расчете, проведенном для диборидов титана, ванадия и хрома (М-переходных металлов) [60, 452], ставилась цель — получить информацию об относительном вкладе электронных состояний металла и бора в энергию связи и физические свойства диборидов и об их перераспределении при изменении числа электронов в d-полосе металла.
Для проведения расчета был выбран фрагмент кристаллической решетки диборидов переходных металлов, в котором учитывались соседи 4-го и 5-го порядков. Линейные комбинации составлялись из s-, p-состояний атомов бора и S-, р-, d-состояний атомов металла.
Результаты расчета матриц шести секулярных уравнений 2—11-го порядков, полученных в результате разложения исходного набора атомных волновых функций Па молекулярные по неприводимым представлениям группы симметрии рассматриваемого фрагмента D3hf представлены в табл. 23. На основании анализа этих данных в работе оценены важные параметры электронной структуры диборидов (см. табл. 22).
Сравнение данных табл. 24 и 25, в которой приведены некоторые свойства диборидов титана, ванадия и хрома, определенные экспериментально, и свойства А1В2, оцененные расчетным путем [452], дает возможность установить корреляцию этих значений. Для определения данной взаимосвязи вся совокупность характеристик делится на три группы (каждая группа определенным образом зависит от электронной структуры бори-
88
Таблица 23
Энергетический спектр диборидов титана, ванадия и хрома
Фаза Индекс уровня Энергия, эё Число электронов Вклад атомных орбиталей в молекулярные орбитали
Me в
S р d sp
TiB2 1а2 24,0879 2 — 0,2760 0,1574 1,5612
1е' 23,2835 4 0,0372 0,4800 0,0224 2,4654
laj 21,2772 2 0,0186 0,0414 0,0522 1,8874
2а] 21,0032 2 0,4140 0,0172 0,0042 1,5832
1е 15,6764 4 — 0,1018 0,8860 3,6304
2е' 13,7412 4 0,0232 0,1012 0,2376 3,6404
Зе' 13,6290 4 0,8880 0,0944 1,0060 ' 2,0168
2е’ 13,0332 4 0,1868 0,2800 3,5368
2а2 11,6874 2 — 0,1580 0,0332 1,8066
3aJ 11,6134 2 0,1480 0,0436 0,2424 1,5676
4/ 10,6360 4 0,6800 0,0924 0,0760 3,1504
Зе’ 10,5313 2 0,8200 0,0034 0,8102 0,3664
VBS 1а{ 22,6925 2 0,3704 0,0760 0,4992 1,5384
2а[ 21,1334 2 0,0274 0,0356 0,0158 1,9502
1а2 18,9084 2 — 0,0902 0,0530 1,8566
1е’ 16,4991 4 0,7652 0,2836 0,4640 2,5556
1е” 16,0383 4 0,0340 3,9664
За[ 14,1439 2 0,4426 0,0090 0,9128 0,6352
2е’ 13,8067 4 — 0,0950 0,4040 3,5016
2е 13,2522 4 0,2052 0,0012 0,1176 3,6608
89
Продолжение табл. 23
Фаза Индекс уровня Энергия» эв Число электронов Вклад атомных орбиталей в молекулярные орбитали
Ме .. ч.|— в
S р d sp
VB3 2aj 12,7416 2 0,0894 0,4680 1,4434
Зе' 11,8720 4 0,6904 0,0424 1,1158 2,1538
4е'1 11,0058 4 0,0988 0,1436 0,8832 2,8744
4ai 10,7920 2 0,0208 0,0034 1,5536 0,4210
1а2 10,4285 2 6,0250 1,1984 0,7768
За’ 10,3029 1 -X. 0,0035 0,7629 0,2334
СгВа ц 22,2018 2 0,2892 0,1000 0,0020 1,6092
2aJ 21,1269 2 0,0592 0,002 0,3688 1,5716
1«2 18,8932 2 — 0,1130. 0,0238 1,8632
1е* 16,0031 4 0,5212 0,0104 0,4670 3,0776
1е’ 14,1491 4 — 0,0844 0,1352 3,7740
2а” 12,0339 2 — 0,1006 0,1914 1,7090
3aj 1 Г,9909 2 0,5022 0,0356 0,4752 0,9876
2е” 11,6852 4 т 0,0456 1,8076 2,1708
2е' 11,2943 4 0,0296 0,1208 0,2728 3,5764
За” 10,2612 2 — 0,0026 0,0122 1,9846
Зе' 9,7398 4 1,4888 0,2668 1,6584 0,5894
4е' 9,0640 4 1,1660 0,0320 2,3682 1,3584
Зе' 8,8243 4 ГГ“ 0,0072 2,6480 1,3364
4е* 8,0262 2 -U— 0,0002 1,5060 1,4940
90
Таблица 24
Расчетные параметры электронной структуры диборидов
Расчетная характеристика А1В* TiB, VB, CrB,
Зарядность атомов А1+0.33в-0,165 9g—9,95 V+>B^°’5 Cr+°’7B~°-35
Вклад в полосу проводимости, % — Ti—82, 6В—17,4 V—81 В—19 Сг—75,3 В-24,7
Схема заполнения полосы проводи- — (Зе")1 (4^'102 ХЗ^)',64Х (Зе'4е’)2-44Х.
МОСТИ X (Ц)]®’135 X(laX)3-36 X (4а;5а1' 5е')3,56
Заполнение d-состояний 0,80 1,06 2,80 3,60
Степень заполненности состояний, % 16 21,2 56,5 79,5
Степень заполненности состояний чистого Me**, % — 43 81 84
Заполнение sp-состояний атомов бора 3,165 3,95 3,5 3,35
Дополнительный к sp2 вклад р-состояний sp2 + р0-165 sp2 + р°’95 spa + p°-5 sp’+p0-35
Активность верхнего уровня, эв —11,3943 —10,5309 —10,3029 —8,0262
Энергия диссоциации в плазменное состояние, эв 846,19 561,78 561,76 487,80
Энергия диссоциации в атомарное состояние, эв 591,86 318,86 179,70 118,19
Энергия диссоциации по отношению к компонентам, эв 534,17 256,28 115,80 75,95
* Данные для А1В- получены в работе [60]. Использованы данные работы [438].
Таблица 25
Некоторые физические свойства диборидов Al, Ti, V и Cr
Физические свойства А1В2 TiB, VB3 СгВя
Температура плавления, °C . . . ........ 1655 2980 2400 2200
Коэффициент термического расширения, 10_6 град~1 14,5* 4,6 7,6 10,5
Фононная составляющая теплопроводности, вт.Цм'Х. Хград) . 7,5* 20,6 13,1 10,4
Мнкротвердость, кГ]мм* 1400* 3370 2590 1600
Теплота образования, ккал! моль 126* 71,4 31
Работа выхода, эв ... 5,4* 4,19 4,03 3,31
Краевой угол смачивания расплавленной медью, град . . . 158—154 150—114 50
Плотность электронных СОСТОЯНИИ, 10—21 (gey Хс-н3)-"1 • 7,79 30,6 - 88,8
Подвижность носителей, см* Це-сек) — 252 5,73 4,0
* Теоретические значения.
дов): 1) решеточные свойства; 2) термодинамические характеристики; 3) электронные свойства. Решеточные свойства определяются ковалентной составляющей межатомного взаимодействия, термодинамические характеристики — набором занятых электронных состояний; определяющими электронные свойства являются верхние занятые электронные уровни.
Как видно из табл. 25, в ряду TiB,2—VB2—СгВ2—А1В2 монотонно уменьшаются температура плавления [424], фононная составляющая теплопроводности, микротвердость, увеличивается коэффициент термического расширения [449]. Такая последовательность изменения свойств согласуется с уменьшением степени заполненности электронами s~, p-состояний атомов бора. Исходя из кристаллохимических соображений, основными s-, р-состояниями, обеспечивающими связь между атомами бора в плоских сетках, следует считать зрг-гибридные состояния.
Данные расчета свидетельствуют о наличии дополнительных рх-состояний, вклад которых можно рассматривать как усиливающий межатомную связь как в плоскости сетки (л-связи), так и между слоями (о-связи). Уменьшение вклада /^-состояний в указанном ряду боридов (см. табл. 24) находится в соответствии с результатами исследования напряжений в решетках
92
диборидов переходных металлов, пблучепныМй в работе [693], где сделан вывод о сильной связи по всем направлениям в TiB2 и об ослаблении межатомных связей (особенно междуслойных) при переходе от диборидов металлов IV группы к диборидам металлов V группы.
Термодинамические характеристики изменяются в другой последовательности: А1В2—TiB2—VB2—СгВ2, поскольку в этом направлении уменьшаются расчетные энергии разложения диборидов в плазменное и атомарное состояние, а также на конденсированные компоненты (Ме+В). В этом же направлении уменьшаются энтальпии образования диборидов (см. табл. 7), определенные экспериментально.
В группе электронных свойств наблюдается более сложная зависимость расчетных параметров и экспериментально изученных свойств. Проявляется закономерность в поведении поверхностных свойств: увеличение кинетической скорости взаимодействия боридов с кислотами [424], уменьшение работы выхода [462], увеличение коэффициента рекомбинации атомов водорода и азота [174]. Уменьшение краевого угла смачивания согласуется с увеличением расчетной активности верхнего заполненного уровня в ряду А1В2—TiB2—VB2—CrB2.
В этом направлении увеличивается степень заполнения d-состояпий металла, полученная расчетом, что согласуется с увеличением плотности электронных состояний, рассчитанной из измерений низкотемпературной удельной теплоемкости [615].
В ряду TiB2—VB2—СгВ2—А1В2 уменьшается зарядность атомов (см. табл. 24). В этой же последовательности надо ожидать изменение диэлектрической проницаемости, низкотемпературной подвижности носителей, сведений о которых нет.
Таким образом, с позиций электронного строения все многообразие структурных типов боридов можно разделить на две группы. К первой относятся низшие (по содержанию бора) бориды составов от Ме3В до МеВ2, структуры которых носят основные элементы решетки металла, вторую представляют высшие бориды состава МеВ2, МеВ4, МеВ6, МеВ]2 и МеВж (где >12), в которых основную роль играют атомы бора, образующие сложные структурные комплексы (цепи, сетки, каркасы и др.).
В боридах первой группы передача электронов направлена к металлу и металлическим состояниям принадлежит главная роль в электронной структуре соединений. В боридах состава МеВ2 и выше передача электронов направлена от атомов металла к подрешетке бора [60, 61, 452]. Основная роль в электронной структуре высших боридов принадлежит p-состояниям бора. В связи с этим более устойчивые бориды первой группы образуются металлами — акцепторами электронов, а более устойчивые бориды второй группы — металлами — донорами электронов [199, 283].
93
Глава!!
Методы получения боридов
Для приготовления боридов металлов "й-некоторых Соединений бора с неметаллами применяются следующие методы:
1) синтез из металлов и бора (спеканием или сплавлением)
хМе 4- г/В МелВу;
2) карботермическое восстановление (восстановление смесей окислов металла и бора углем)
МеО -р В2О3 -f~ С —> МеВ 4~ СО",
3) борокарботермическое восстановление (восстановление окислов металлов одновременно бором и углем)
МеО В 4- С -> МеВ 4- ВхОу 4- СО;
4) карбидоборное восстановление окислов металлов
МеО + В4С -> МеВ 4- СО;
5) боротермическое восстановление окислов металлов
МеО В -> МеВ 4- B^Oy;
6) металлотермическое восстановление смесей окислов металла и бора
МеО 4- В2О3 4- Mg (Na, К) -> МеВ 4- MgO (Na2O, К2О);
7) осаждение из газовой фазы
МеСД + ВС13 4- Н2 -> МеВ 4- НС1;
8) электролиз расплавленных сред из ванн следующих составов:
МеО 4- В2О3 4- MeFa;
МеО2 4- ВА 4- MgO (СаО) 4- MgF2 (CaF2);
1/5Ме2О5 4- 2В3О3 4- Li2O 4- LiF;
ЗВ2О3-2СаО 4-CaFa 4-1/Ю (1/5; 1/4; 2/3) Cr2O3;
1/4МеО3 4- 2B2O3 4- NaF;
1/9WO3 4- 2B2O3-Na2O + NaF.
94
Синтез йз металла и бора заключается в проведении реакции xMe+ г/В->МехВу, осуществляемой либо сплавлением металла и бора (обычно в дуговой или ВЧ-печи), либо спеканием смесей соответствующих металлов с бором.
В первых работах этого направления [24] бориды Ti, Zr, V* Cr, Мо и W получались дуговой плавкой, они были недостаточно чистыми и не всегда однофазными в связи с тем, что исполь-зуемые для плавки металлы и особенно бор были невысокой чистоты (65—80%). Это, в свою очередь, требовало дополнитель-. ной очистки полученных боридов.
Упомянутым способом были получены бориды Zr, Nb, Та, Сг, Мо и W В работах Кисслинга [539, 767, 770]. Синтез бывает низкотемпературный и высокотемпературный, В первом варианте смесь металла и бора помещали в вакуумированную кварцевую трубку и нагревали в течение 48 ч при 1200° С, во втором—s смесь металла й бора нагревали в вакуумной печи при 1500— 1600°С в течение нескольких минут. При использовании бора с содержанием основного компонента 88% бориды не отличались высокой чистотой. Применение бора,, полученного термической диссоциацией в вакууме бромида ВВгз в присутствии водорода (чистота бора 98—99%), дало возможность получить чистые однофазные бориды вольфрама и молибдена [770].
Борид циркония ZrBa был получен Кисслинтом [767] сплавлением циркония и бора в индукционной вакуумной ВЧ-печи с графитовой трубой. Исходными материалами служили цирконий и бор чистотой 99%. В этом случае диборид загрязнялся углеродом (содержание углерода в бориде составляло 1,09%).
Бруэр и Темплетон [598] осуществляли синтез боридов из компонентов в молибденовом тигле в среде аргона в условиях, исключающих загрязнение боридов углеродом. Нагрев производился индукционным методом. Процесс синтеза Проходил в две стадии: сначала смесь нагревалась в вакууме при 1250° С, затем температура повышалась до 2050°С, при этом через систему пропускался аргон для уменьшения испарения бора. Тем не менее вследствие улетучивания бора его содержание в бориде отклонялось от стехиометрического. В связи с этим в работе в исходные смеси вводили 10%-ный избыток бора. Таким способом были получены относительно чистые бориды Ti, Zr, Nb, Та, Мо, W, Се, Th и U.
Использование исходных материалов высокой степени чистоты дает возможность получать синтезом из элементов высокочистые бориды. Примером может служить борид хрома, приготовленный сплавлением в работах [540, 770]. Электролитический хром чистотой 99,97% и кристаллический бор с содержанием основного вещества 99,8% сплавлялись в дуговой печи в среде аргона с последующим длительным отжигом в вакууме при 1400°С в течение одной —трех недель и при 1600° С в течение
95
трёх дней [540]. Таким образом был получен тетраборид хрома СгВ4 высокой чистоты и стехиометрического состава.
Одной из разновидностей метода синтеза боридов из элементов является взаимодействие бора не с собственно металлом, а с его гидридом, нитридом или сульфидом [567, 641]. Использование, в частности, гидридов дает при их диссоциации особо активные атомы металла, а выделяющийся при этом водород защищает смесь от окисления. Образование боридов сопровождается выделением бороводородов.
В работе [641] были синтезированы бориды титана, ванадия и хрома при взаимодействии сульфидов титана, ванадия и Хрома с элементарным бором при 700—1000°С по реакции
Me2S3 хВ —> МеВ^ -ф BgSg.
Как показывают результаты химического анализа продуктов реакции (табл. 26), варьируя соотношение сульфида и бора в исходной смеси, можно получать бориды переходных металлов различного состава. Этот метод может быть использован для получения чистых от примесей боридов в области гомогенности]
Таблица 26
Некоторые характеристики процесса взаимодействия сульфидов переходных металлов с бором [641]
Исходный сульфид Соотношение в смеси сульфид/В Температура процесса, °C Время реакции, ч Фазовый состав по данным
радиокристалло-графического анализа химического анализа
Ti2S3 1/6 750 10 TiB24-Ti2S3
1/6 950 12 TiB2 TiB2
V2S3 1/6 700 8 vb2+ * 2sa
1/6 800 8 VB2+V2s3
1/6 1000 8 VB2 VB2
Cr2S3 1/6 700 6 CrB2 CfBi,g
1/14 750 6 CrB2 CrBi,7
1/6 800 12 CrB2 CrB2,0
1/14 800 10 CrB2 СгВ1,в
1/6 900 8 CrB2 CrBpg
1/14 900 8 CrB2 CrB2ll
Метод горячего прессования смесей порошков металла и бора [696] приводит к получению относительно чистых боридов с одновременным формованием изделий из них, однако при этом способе синтеза трудно избежать загрязнения боридов углеродом.
96
'В работе [251 осуществлен самораспространяюшийся ВЫС.О-. котемпературный синтез (СВСЛдиборидов Ti, Zr, ЙГ, Nb, Та, Ст, моноборидов V, Nb, Та, Ст, Мо и додекаборида циркония ZrBi2. Этот вариант синтеза боридов основан на использовании только тепла экзотермического взаимодействия исходных реагентов; образование соединений происходит в режиме горения и характеризуется наличием узкой, ярко светящейся зоны, перемещающейся по смеси от места локального инициирования реакции путем передачи тепла от нагретых слоев к холодным. Объектами горения являются прессованные цилиндрические образцы из смесей металла и бора диаметром 0,5—2 см и высотой до 2 см, с размером частиц металла меньше 50 мкм и бора около 0,1 мкм, чистота исходных металла и бора соответственно 99 и 98%; «горючим» в этом процессе является металл, а «окислителем»— бор в твердом или газообразном состояний}.
Горение большинства смесей проходит быстро. При скоростях перемещения фронта горения по прессовке от 0,4 до 12 см!сек время синтеза борида не превышает нескольких секунд.
[Плотность смеси, соотношение исходных компонентов, размеры частиц металла и бора влияют на протекание процессов горения и на состав получаемых продуктов. Температуры горения в ряде случаев повышаются настолько, что необходимо введение в исходные смеси «разбавителя» для снижения температуры. В качестве разбавителя используют готовые бориды.
В табл. 27 приведены результаты исследования влияния плотности прессованных смесей металла и бора, диаметра прес-
Таблица 27
Влияние некоторых параметров метода СВС на получение диборидов циркония и ниобия
Борид Относительная плотность Диаметр, см Содержание разбавителя, масс. % Содержание свободного бора, масс. %
ZrB2 0,25 — 0,13
0,45 — 0,07
0,5 — 0,09
0,58 — — 0,11
— 10 0,1
— 20 0,09
— — 40 0,11
NbB2 0,21 — 0,24
0,4 — — 0,145
0,46 — 0,14
0,5 — 0,1
— 0,5 — 0,12
— 0,7 0,2
— 1,0 — 0,15
7 Зак. 1305
97
Совок, содержания разбавителя йа присутствие в йойёчйых боридах свободного бора. Из этих данных следует, что влияние отмечейных факторов несущественно. Увеличение диаметра прессовок не вызывает ухудшения химического состава борида, что является весьма важным фактором при разработке промышленной технологии получения боридов методом СВС.
Полученные методом СВС бориды обладают хорошо сформированными структурами, периоды решеток удовлетворительно согласуются с табличными данными. В табл, 28 приведены ре-
Таблица 28
Режимы горения и химический состав некоторых боридов, полученных методом СВС
Состав исходной смеси Адиабатическая температура горения, °K Химический состав борида, масс. % О Период решетки, А
ЧИСТОЙ смеси смеси с разбавителем Ме вобщ Всвоб а Ъ С
Ti+2B 3193 69,2 31,3 '•н— 3,023 - 3,230
Ti-f-B .1 HR 82,0 18,2 6,095 3,064 4,57
Zr+2B 3313 2940—2350 79,8 19,05 0,1 3,169 — 3,518
Hf+2B 3523 л 89,15 10,7 0,12 3,158 Vr—> 3,485
Nb-j-2B 2330 2190—1990 81,8 18,45 0,17 3,119 — 3,288
Nb+B — —— 90,1 9,87 — 3,284 8,63 3,15
зультаты исследования метода СВС для получения некоторых боридов.
(Большим преимуществом осуществления синтеза боридов из исходных компонентов в режиме горения по методу СВС является высокая скорость протекания процесса, бестигельность метода^ проведение его в вакууме, что в принципе обеспечивает высокую чистоту конечных продуктов.
Особенно важна в этом методе его экономичность: реакция боридообразойания не требует внешнего притока энергии (только на поджог смеси) и есть возможность получения больших количеств борида]
Метод СВС боридов требует дальнейшего развития в направлении разработки промышленных режимов непрерывного цикла.
В последние годы начинает успешно развиваться техника кристаллизации боридов из жидкого металла. В работах [74, 304] исследовалась возможность выращивания монокристаллов тугоплавких соединений синтезом из элементов в расплаве цинка.
Бориды переходных металлов IV—VI групп периодической системы получены спонтанной кристаллизацией При медленном охлаждении их растворов в расплаве, содержащем стехиометри-
98
веские соотношения переходный металлов и бора. Расплав цинка с исходными компонентами нагревают в кварцевых ампулах до 907°С ('температура кипения цинка), выдерживают при этой температуре 2 ч, затем охлаждают со скоростью 0,3—3 град/мин. Соотношение количества цинка и стехиометрической смеси (Ме+хВ) варьировалось от 35:1 до 20:1. Порошок готового борида отмывался от цинка в соляной (1 : 1) или азотной кислоте.
• Бориды, полученные описанным методом, не имёют четкой морфологической огранки это либо чешуйчатые гранулы, либо мелкозернистые выделения в форме извилистых лену
Кристаллы диборида титана имели размер около.200 мкм, кристаллы других боридов -г- еще более мелкие.-Замечено, что с уменьшением скорости охлаждения цинкового расплава увеличивается размер кристаллов. Показано, что реакция синтеза, боридов в расплаве цинка характеризуется более низкой энергией активации, чем непосредственная реакция между элемен-тами. Это весьма важная характеристика процесса, свидетельствующая о том, что можно использовать в данном случае низкие температуры и короткие времена реакции. Недостатками описанного метода являются одновременно протекающие процессы образования интерметаллидов и загрязнение боридов примесями, вносимыми из жидкого металла. ' i.
Трудность осуществления метода выращивания монокристаллов боридов из металлического расплава связана, еще и с необходимостью Подбора инертных к расплаву кристаллизаторов. Тем не менее возможность выращивать описанным методом крупные монокристаллы делает его перспективным и заслуживающим внимания.
При Спекании порошков металлов и бора борид образуется в результате реакционной диффузии бора в металл. Время и температура реакции образования борида связаны экспоненциальной зависимостью
1/т^Ле^, где т—время диффузии, необходимое для образования гомогенной фазы при температуре Т‘ А-~ константа; Q—-энергия активации диффузии; постоянная Больцмана.
Изучению реакционной диффузии бора в некоторые переходные металлы посвящен ряд работ [10, 91, 114, 135, 270, 383, 396, 461, 576], при этом рассматривались вопросы кинетики насыщения, фазового состава продуктов реакции, механизм переноса активных атомов бора к реакционной поверхности. На основании проведенных исследований установлено, что определяющую роль играет в описанных процессах реакционная диффузия, а химическая реакция, протекающая на фазовых границах, имеет в кинетическом отношении второстепенное значение. Образование боридов при непосредственном взаимодействии элементов идет через стадии образования низших фаз [93, 445].
7* 99
Анализ работ, посвященных этому вопросу,- позволяет предложить следующую схему образования боридов: I) доставка бора на поверхность металла; 2) диффузия бора в металл и, впоследствии, через слой химических соединений; 3) образование низших фаз на границе раздела борид — металл.
Каждая из выделенных стадий сама по себе — сложный процесс. Так, в работе [445] при исследовании борирования переходных металлов IV—VI групп показано, что доставка атомов бора к насыщаемой поверхности осуществляется в процессе твердофазного взаимодействия в местах контактирования частиц бора с поверхностью металла, через паро-газовую составляющую смеси, а также путем испарения низших окислов бора и реакции их диспропорционирования на поверхности металла с образованием активных атомов бора (идущих на образование борида). Какой из этих механизмов превалирует, зависит от температуры, времени, давления в реакционном пространстве, наличия низ'ших окислов в смеси и других параметров и факторов.
Установлено, что при борировании переходных металлов IV группы в вакууме образующиеся слои состоят из высших боридов МеВг; боридные слои на металлах V группы являются двухфазными— МежВ и МеВ2. На металлах VI группы образуются более сложные диффузионные зоны, состав которых зависит в основном от температуры насыщения.
Скорость диффузии при получении боридов непосредственным спеканием исходных порошков бора и металла определяется в значительной степени кинетическими факторами: крупностью частиц, качеством смеси, ее однородностью, наличием и толщиной окисных пленок, адсорбированных газов, газовой средой печи.
Для получения синтезом из элементов боридов заданного состава и надежной чистоты необходимо использовать исходные материалы высокой чистоты, правильно подобрать материал тигля и рабочую среду.
В настоящее время высокая чистота исходных металла и бора уже не является неразрешимой проблемой. Остается еще не до. конца решенной проблема тигля, в котором осуществляется синтез. Имеются примеры, когда неправильный выбор материала тигля приводил к открытию «новых» фаз. Так, в 1961 г. был описан додекаборид галлия [622], полученный синтезом из элементов в кварцевых ампулах при 1200—1300° С. Позже [928] доказали, что за GaBi2 приняли продукт взаимодействия субо-киси бора с кремнием. Попытка получить богатый бором борид палладия из элементов при 900° С с использованием алюминиевой трубки, вставленной в кварцевую ампулу, привела к тому, что за новый борид приняли силицид PdjSi. Эти примеры свидетельствуют о том, что за неправильные результаты могут быть ответственны побочные реакции, протекающие в газовой фазе.
100
Немаловажную роль играют в процессе синтеза различные примеси в газовой среде: кислород, азот, углерод. Длительная дискуссия о существовании моноборидов циркония и гафния [24]__хороший пример влияния на состав конечных продуктов
малейших примесей в инертной газовой среде.
При учете всех описанных особенностей и условий синтезом из элементов можно получить высокочистые и однофазные бориды. В качестве материала тигля при получении боридов можно рекомендовать тот же борид. В этом уже имеется некоторый опыт [814], давший хорошие результаты. Чтобы снизить вероятность взаимодействия с материалом тигля, надо понижать температуру процесса и увеличивать скорость реакции. Последнее осуществляется в новом плазмохимическом методе синтеза боридов [577, 995].
Химический синтез с применением плазмы представляет сложный процесс в квазинейтральной системе, приводящий в определенных условиях к образованию продуктов заданного состава.
Работ, посвященных исследованию плазмохимического метода получения боридов, пока очень мало [577, 995]. Но уже теперь видны преимущества этого метода синтеза перед другими и его перспективность.
Высокая температура и концентрация энергии в плазменной струе, высокие скорости тепло- и массопереноса приводят практически к мгновенному протеканию химической реакции, что ведет к резкому повышению производительности процесса. Осуществление реакций в газовой среде и в безэлектронных разрядах позволяет получать продукты высокой степени чистоты.
Метод плазмохимического синтеза отличается простотой технологических схем вследствие одностадийности процесса, миниатюризацией оборудования, возможностью разработки замкнутых технологических циклов и автоматизации процесса. Одно из преимуществ плазмохимического метода синтеза боридов — высокая экономическая эффективность, обеспечиваемая использованием дешевого природного сырья, например природного газа, воздуха, металлосодержащих руд и минералов, возможностью организации многотоннажного производства. Кроме того, применение плазмохимического метода позволяет синтезировать соединения, которые нельзя или трудно получить другими методами.
Плазмохимические процессы можно использовать для выращивания монокристаллов, получения особо чистых порошков, их сфероидизации, для наплавки и получения различных по составу и свойствам покрытий [461].
[Карботермическое восстановление смесей окислов металла и бора углем впервые упоминается в работе Мак-Кенна [836], который получал дибориды титана, циркония и хрома по реакции
МеО В2О2 4С -> МеВ2 4- 4СО.
Ю/
Бориды были сильно загрязнены углеродом, что связано с высокой летучестью борного ангидрида при температурах восстановления. Чтобы компенсировать потери борного ангидрида за счет испарения, Блюменталь [594] вводил в шихту тройной Избыток борного ангидрида при получении боридов переходных, металлов, что привело к снижению содержания углерода в продуктах восстановления до 1,7—2,1%, а в отдельных случаях — до 0,5—0,6%.СJ
Л. я. Марковский [223] .получал этим способом бориды щелочноземельных металлов. Помимо основной реакции образования борида в данном случае одновременно идет образование соответствующих карбидов. Высокая химическая активность карбидов металлов II группы и известная инертность боридов позволили предположить возможность полного выделения боридных фаз путем обработки продуктов восстановления кислотами. рднако оказалось, что при кислотной обработке образуются органические соединения, которые лишь частично удаляются при последующем прокаливании продуктов реакции с добавками борного ангидрида. Кроме того, при восстановлении смесей МеО + В2О3 углем наряду с боридами образуются тройные соединения систем Me—В—С, так называемые карбобориды, особенно при проведении восстановления при высоких температурах [32]. Образование карбоборидов и органических продуктов при их гидролизе препятствует широкому распространению этого метода для получения боридов щелочноземельных и редкоземельных металлов.
Г. А. Кудинцева и др. [160] исследовали описанную реакцию для получения боридов La, Се, Рг и Nd. Полученные бориды содержали до 1,5—2,0% С, а также остаточный кислород (табл. 29). После термической обработки в вакууме при 1700— 1800° С, приводящей к образованию окиси углерода, содержание углерода было доведено до 0,8%,
Г. А. Меерсон [263] подробно исследовал реакцию восстановления окислов металла и бора углем для получения боридов циркония, хрома и молибдена. Он предлагает проводить процесс получения боридов в две стадии, чтобы не вводить в исходную шихту избыток дорогостоящего борного ангидрида (борный ангидрид получается сложной, связанной с большими потерями дегидратацией борной кислоты). В первой стадии осуществляется процесс восстановления смеси окислов металла и бора (или борной кислоты) углем, а во второй — борид рафинируется от примеси углерода и кислорода нагревом в вакууме с небольшими добавками (около 2%) соответствующего металла и бора. Для снижения содержания углерода в бориде до нескольких сотых процента рекомендуется температура прокаливания смеси борида с добавками соответствующего окисла и бора, обеспечивающая высокую скорость протекания диффузионных процессов. После прокаливания борида хрома при 1600° С в течение 3 ч 102
Таблица 29
Результаты опытов по получению боридов бария и стронция при использовании карботермического способа [223]
Реакционная шихта Температура опыта, °C Химический состав исходного продукта, масс. %. Содержание С после кислотной обработки, % Химический состав продукта, очищенного методом прокаливания, масс. % Данные рентгеновского фазового анализа
Ме в с Всего Ме в с Всего
ВаО+ЗВ2О3+10С 1700 44,2 27,9 21,4 93,5 - — 15,1 — Линин ВаВв нет. Неизвестная фаза
2250 — — 17,9 — 19,0 40,6 50,7 9,8 101,1 Линии ВаВв, есть дополнительные линии
2BaO+3B2Os4-10C 1900 — — 20 — — — — 8,3 — Линин ВаВв нет
2050 56,4 16,6 17,2 90,2 21,13 —* 18,7 — Линин ВаВв и Сг есть дополнительные линии
2200 59,7 20,5 15,1 95,3 19,4 —— — 8,1 — —
2300 — — 18,5 — 18,0 66,7 30,8 3,2 100,7 Линии ВаВв
2250 — *— 18,1 —’ 22,0 58,6 27,8 12,5 98,9 —
2300 59,6 19,5 19 98 Д 20,0 59 28 7,9 94,9 —•
2SrO+3B2O8+10C 1700 — — 14,5 t— 15,2 59,7 34,6 2,7 97,0
1900 — —— 17,6 . — 18,7 54,7 39,1 4,0 97,8 Линии SrBa
2000 — 10,8 — 11,0 54,7 40,9 3,0 98,6
содержание углерода снижается до 0,05%, а при 1800° С аналогичный эффект достигается за 2 ч. ZrB2 очищается от углерода при прокаливании его при 1900° С в течение 2 ч (содержание углерода снижается до 0,06%). Добавка в шихту около 2% В сверх расчетного количества позволяет получать при использовании описанного метода продукт стехиометрического состава. Результаты последних работ [263] значительно повысили экономичность метода и его эффективность в отношении качества и чистоты получаемых боридов.
Тем не менее двухстадийность процесса трудоемка при промышленном производстве боридов. Необходимо найти такие оптимальные температурные режимы, при которых скорость восстановления смесей окислов и борного ангидрида с образованием борида подавляет испарение борного ангидрида, что дает возможность использовать для получения боридов карботерми-ческий метод из шихт, близких по составу к стехиометрическим. В работах [111—113] исследовалось влияние температуры, времени выдержки, скорости подъема температуры до оптимальной, состава шихты и газовой среды на процесс получения диборидов Ti, Zr, Hf, V, Nb и Сг карботермическим методом в графитотрубчатых печах в условиях, близких к производственным. Результаты исследования приведены в табл. 30. Было установлено, что оптимальным режимом получения упомянутых выше диборидов является проведение процесса при 1900°С в среде водорода или конверсированного газа из шихт с 30%-ным избытком В2О3 по сравнению с расчетным. Содержание углерода при этом во всех упомянутых боридах не превышает 0,5%, содержание металла и бора близко к стехиометрическому.
В работе [НО] описан карботермический способ получения борида вольфрама W2B5. Результаты исследований приведены в табл. 31. Установлено, что борид вольфрама карботермическим восстановлением смеси окислов вольфрама и бора можно получить при 1500—1600°С из шихты с 40%-ным избытком борного ангидрида. Рекомендуется проведение процесса в две стадии: нагревание смеси в течение 60 мин при 850—900° С, затем повышение температуры за 5—7 мин до 1500—1600° С (без выгрузки продукта) и выдержка при ней 60 мин.
В работах [ПО—113] избытки борного ангидрида, превышающие 40—50%, считаются критическими в связи с тем, что борный ангидрид, будучи кислотным окислом, проявляет себя при высоких температурах как хороший растворитель и активно взаимодействует с большинством окислов металлов или их карбонатами с образованием соответствующих боратов. При оптимальных температурах процесса и с увеличением времени выдержки образующаяся стеклообразная масса кипит, интенсивно испаряется, подавляя процесс боридообразования.
В качестве металлосодержащего компонента шихты при кар-ботермическом методе получения боридов в работах [326, 327] 104
Таблица 30
Химический состав боридов, полученных карботермическим методом, в зависимости от содержания борного ангидрида в шихте (температура 1900 °C, время иагрева 30 мин)
Борид Состав шихты (Me0:B2O8:C) Избыток В2О3, масс. % Химический состав, масс. % Ме+В+С, % S + V Е
а> Е Л о° РЭ
TiB2 Расчетный состав 68,9 31,1 - -
1:1,1:5 10 70,1 1,7 27,8 99,6 28,3
1:1,2:5 20 69,6 0,5 28,6 98,7 28,8
1:1,3:5 30 69,2 0,5 29,6 99,3 30,0
1:1,4:5 40 69,8 0,6 28,0 98,4 29,5
1:1,5:5 80 71,4 0,9 26,2 98,5 26,8
ZrB2 Расчетный состав 80,82 __ 19,18 - -
1:1:5 81,5 1,7 16,1 99,3 16,5
1:1,1:5 10 80,0 1,6 17,6 99,2 18,0
1:1,2:5 20 80,3 0,8 18,3 99,4 18,6
1:1,3:5 30 79,6 0,7 18,0 98,3 18,4
1:1,4:5 40 78,1 0,7 17,2 96,0 18,0
1:1,5:5 50 82,0 0,8 16,9 99,7 17,1
1:1,8:5 80 81,5 1,8 14,4 97,7 15,0
HfB2 Расчетный состав 89,19 - -- 10,81 . .
1:1:5 89,00 1,63 9,00 99,63 9,40
1:1,1:5 10 89,00 1,31 9,50 99,61 9,60
1:1,2:5 20 89,10 0,74 10,00 99,84 10,05
1:1,3:5 , 30 89,00 0,32 10,50 99,82 10,57
1:1,5:5 50 90,17 0,67 9,10 99,94 9,15
VB2 Расчетный состав 70,1 29,9 — .
1:2:9 — 71,70 2,00 26,00 99,70 26,70
1:2,2:9 10 71,30 1,00 27,50 99,80 27,80
1:2,4:9 20 69,70 0,70 28,90 99,30 29,30
1:2,6:9 30 69,90 0,43 29,40 99,73 29,50
1:3:9 50 69,90 0,80 28,20 99,90 28,40
1:3,6:9 80 71,00 0,95 28,00 98,95 28,50
1:4:9 100 70,60 ,1,80 27,50 99,90 28,00
NbB2 Расчетный состав '81,11 __ 18,89
1:2:11 82,15 1,73 16,00 99,88 16,30
1:2,2:11 10 81,91 1,22 16,70 99,83 16,90
1:2,4:11 20 81,03 0,82 18,00 99,85 18,20
1:2,6:11 30 80,60 0,45 18,90 99,95 19,00
1:3:11 50 81,50 0,95 17,50 99,95 17,60
1:3,6:11 80 82,00 1,10 16,70 99,80 16,90
1:4:11 100 82,00 1,75 16,20 99,95 16,50
CrB2 Расчетный состав 70,62 __ 29,38
1:2:9 — 68,0 4,7 26,6 99,3 28,2
1:2,2:9 10 69,0 2,2 27,7 98,9 28,7
105
Продолжение табл. 30
Борид Состав шихты (MeOiBjO,:C) Избыток масс. % Химический состав, масс. % Ме+в+С, % + ф g ю
Л и° «
СгВа Расчетный состав 70,62 29,38
1:2,4:9 20 69,6 1,3 28,4 99,3 28,9
1:2,6:9 30 69,9 0,7 28,8 99,4 29,2
1:2,8:9 40 70,1 0,4 29,1 99,6 29,3
1:3:9 50 70,0 1,2 28,2 99,4 28,7
1:3,6:9 80 71,2 1,5 27,4 100,1 27,7
1:4:9 - 100 71,0 2,3 26,5 99,8 27,2
рекомендуется использовать фосфаты и соли. Так, диборид циркония был получен по реакции ZrSiO3+B2O34-C->-ZrB24-SiO + + СО в дуговой печи из смеси состава 40—70% ZrSiO3, 15—35% В2О3 и 15—35% С.
Диборид титана [327] был получен из смеси, содержащей фосфат титана, борный ангидрид и уголь, в среде аргона при 1100—1600° С.
Интересен способ получения гексаборида кальция карботер-мическим восстановлением ди- и гексабората кальция [463], исключающий использование чистого борного ангидрида в качестве борсодержащего элемента. Шихта составляется из безводного бората, содержащего 45—53% В2О3 (СаО • В2О3) и каменного угля марки К2(Сяа80%). Брикеты, приготовленные с
Таблица 31
Химический состав W2B5) полученного карботермическим методом, в зависимости от содержания борного ангидрида (процесс ведется в Две стадии) [110]
Состав шихты (WOS;BSO,:C) Избыток масс. % Химический состав» масс. % W+B+Co6iu, масс. % B/(W+B)
W В Собщ
4:5:27 87,5 9,6 2,5 99,6 9,9
4:5,5:27 10 87,1 10,2 1,7 99,0 10,4
4:6:27 20 . 86,6 10,8 1,1 98,5. 11,0
4:6,5:27 30 87,0 11,7 0,7 99,4 11,9
4:7:27 40 87,0 12,3 0,4 99,7 12,5
4:7,5:27 50 88,7 11,6 0,8 101,1 11,8
4:9:27 80 89,0 9,3 1,5 99,8 10,5
4:10:27 100 89,2 8,7 2,5 99,4 8,9
4:15:27 200 89,5 8,0 2,2 99,7 8,4
использованием сульфитцеллюлозного щелока в качестве связки, просушивались при 90—100° С, затем погружались, в графитовый тигель вакуумной ВЧ-электропечи и выдерживались при 1600 ° С в течение 2—3 я. Продукты реакции подвергались водному или кислотному выщелачиванию, промывались водой декантацией или на фильтре и просушивались при 100—110° С. По данным Химического и рентгеновского анализов получен гекса-борид кальция состава, близкого к стехиометрическому, загрязненный углеродом, магнием и окисью кальция (табл. 32).
Таблица 32
Результаты восстановления дибората кальция углеродом в вакууме при 1600° С [3 (СаО В2О3) 4-10 С]
Способ выщелачивания Химический состав, масс. %
в Са ^общ Ссв
Водный 39,30 36,9 1,56 1,3
» 32,73 35,9 1,53 4,6
Кислотный 51,75 35,46 4,23 1,9
» 52,98 33,42 1,03 1,57-
48,89 37,7 4,30 2,61
Если заменить диборат, представляющий по Существу механическую смесь окиси кальция и борного ангидрида, Гексаборатом (СаО-ЗВ2Оз), можно достичь лучших результатов. В гексаборате кальция борный ангидрид связац и менее летуч. Шихта готовится в расчете на проведение реакции СаО-ЗВ2Оз+ +10 С=СаВ6+10 СО, прессуется в брикеты под давлением 250—270 кГ/см\ помещается в реакционную зону печи и вы-“ держивается 10—20 мин при 1400—1550° С в токе аргона, затем температура повышается до 1900—1950° С, нагрев продолжается 10—30 мин (табл. 33).
Установлено, что процесс образования гексаборида кальция при карботермическом восстановлении боратов идет через стадию образования карбида бора. Для снижения содержания углерода в бориде кальция предлагается вводить в шихту 90% восстановителя, необходимого по стехиометрии.
Использование гексабората кальция в качестве исходного сырья для получения борида кальция экономично с точки эре-, ния стоимости конечного продукта (2—3 руб. за 1 кг), что весьма перспективно для промышленного производства боридов.
Борокарботермическое восстановление (восстановление окис-лов металлов одновременно бором и углем) было использовано Постом [363, 910] для получения боридов щелочноземельных и редкоземельных металлов.
107
Таблица 33
Результаты восстановления гексабората кальция в токе аргона (СаО-ЗВ2О8 + 10 С = СаВв + 10 СО)
Температура, °C Выдержка» мин Содержание углерода в шихте, масс. % Масса образца» а Химический состав» ыасс. %
до опыта после опыта в Са с
1600 10 90 5,008 0,734 18,88 71,9
1600 30 90 6,720 1,302 58,03 42,87
1700 10 110 4,050 0,752 41,04 41,42
1700 30 110 5,077 0,952 30,18 39,56
1750 10 100 5,212 0,997 45,39 13,28 12,03
1750 10 110 4,905 1,039 25,46 5,83 46,53
1750 20 110 4,928 0,846 42,76 25,92 25,17
1900 30 ПО 5,790 1,178 43,91 25,51 14,70
1900 47 110 7,471 1,268 50,92 35,24 9,28
1900 60 110 7,562 1,133 44,69 35,18 11,21
1900 30 90 6,528 1,142 54,07 29,36 1,28
1900 15 90 5,249 0,969 52,73 24,82 2,99
1900 10 120 9,423 2,295 35,42 25,86 18,22
Процесс заключается в проведении реакции МеО+В + С-*-—>-МеВ + СО в интервале температур 1500—1800° С в среде водо-рода или в вакууме.
Бориды, полученные этим способом, содержат значительные количества углерода (примерно до 6 масс. %). Это можно объяснить тем, что бор, являясь более сильным восстановителем, чем углерод, играет основную роль в протекании процесса восстановления и образования борида. Такой же точки зрения придерживаются Пост и др. [909].
В табл. 34 приведены режимы получения и состав гексаборидов лантана и самария при восстановлении окислов металлов смесью бора и угля.
Как видно из данных химического анализа гексаборидо» лантана и самария, их состав неудовлетворителен и сам метод требует дальнейшего усовершенствования и доработки, с варьированием состава шихты и технологических параметров реакции.
ГКарбидоборное восстановление окислов металла основано на взаимодействии металлов, гидридов или карбидов переходных металлов с карбидом бора с добавками борного ангидрида в количествах, необходимых для удаления углерода. Карбидо-борный метод осуществляется в электропечи сопротивления с графитовой трубкой накала в интервале температур 1750— 2000° С. Процесс ведется в расчете на прохождение реакции
Me (МеН, МеС) + В4С + В2О3 МеВ + СО.
108
Таблица 34
Результаты получения гексаборидов лантана и самария восстановлением окислов металлов смесью бора и угля
Состав шихты Температура, Выдерж-ка, ч Химический состав, масс. %
Me В(общ) с(общ)
2La2O8+24B+3C 1500 2 65,9 20,9 5,4
1800 1 70,0 27,5 1,35
2Sm2O84-24B-|-3C 1500 2 62,4 23,0 6,0
1800 1 67,0 30,2 2,01
Широкое распространение этот метод получил при восстановлении окисла металла в вакууме углеродом карбида и дополнительно вводимой в шихту, в случае необходимости, сажи в соответствии со схемой реакции
МеО + В4С + С МеВ + СО.
Проведение процесса в вакууме способствует полноте прохождения реакции, а также предотвращению азотирования и окисления образующихся продуктов. Этот способ, предложенный в 1952 г. {24], обстоятельно описан в работах [384, 397] для боридов как тугоплавких, так и редкоземельных металлов.
В реакции может использоваться карбид бора как стехиометрического состава (78, 3% В, 21,7% С), так и в широких пределах содержаний бора и углерода, но при условии, что В + С=100%. 'При использовании такого карбида, в котором, как правило, содержание углерода больше теоретически положенного, делается соответствующий пересчет количества сажи, добавляемой в шихту.
При исходном составе окислов Ме20з, типичном для редкоземельных металлов, составление шихт требует использования карбида бора точного состава В4С, что достигается отмывкой технического карбида бора от примеси свободного углерода по методике, описанной в сообщении [402].
На основании результатов манометрического исследования [385] установлено, что реакция
ТЮа + В4С + С TiBa + СО
проходит через несколько стадий, отвечающих образованию промежуточных окислов, и стадии непосредственной боридиза-
109
Цйй (рис. 25):
2TiO3 + В4С + С = Т12О3 + СО + В4С;
Ti2O3 + В4С 4- С = 2ТЮ + СО + В4С;
2ТЮ + В4С -J- С = 2TiB<j -J- 2СО.
Двуокись титана восстанавливается до низших окислов TiaOa и TiQ исключительно за счет углерода сажи, карбид бора принимает участие лишь в восстановлении низшего окисла TiO до образования борида, что связано с большей термодинамической устойчивостью TiO по сравнению с TiO2 и TiaOj.
Рис. 25. Манометрическая кривая получения борида титана по реакции TiO2+B4C4-C->TiB2+CO:
7 — кривая температуры; 2—кривая давления»
По' этим данным, с привлечением температурных зависимостей теплоемкости боридов титана и хрома, полученных А. Н. Крестовниковым и М. С. Вендрих [147, 148], в работе [385] были рассчитаны значения свободных энергий, констант равновесия и равновесных давлений для реакций образования диборидов титана и хройа (табл. 35).
Видно, что при давлении в реакционном пространстве печи до опыта около 10-1—10~2 мм рт. ст. равновесные температуры соответственно составляют 1400-5-1500 и 1300—1400° С, что близко к экспериментальным температурам (табл. 35).
В работе [510] исследован карбидоборный способ получения борида молибдена и подтверждено представление о процессе получения боридов как многостадийном: на начальной стадии МоО3 восстанавливается до МоО2 углеродом, затем идет собственно процесс боридообразования (боридизации).
Форма введения молибдена в реакционную смесь существенно влияет на основную примесь в бориде т- углерод. Замена Мо03 на МоО2 при карбидоборном методе приводит к уменьшению содержания углерода в бориде молибдена.
Процесс получения боридов карбидоборным методом протекает в вакууме (около 10~2 мм рт. ст.) в печи с графитовыми или металлическим нагревателями в интервале 1500—1800° С.
ПО
Та 8 л й ti а 35
Термодинамические условия прохождения реакций образования боридов титана и хрома карбидоборным методом в вакууме [385]
Реакция 1, °C Д2Г « kpt мм рт. ст. ♦ ♦ РСО» 1мм Спг-
2ТЮ + В4С + С = 25 177728 3,473-10-8* 1,6-10—*2
=2TiB2 +2СО 227 101044 5,258-Ю-й 2,3-10-21
727 63717 9,095-10-12 3,016Л0-в
1027 42924 4,601-10—5 7,230-Ю-з
1127 36117 1,745-Ю-з 4,200-10-2
1227 29369 3,979-10-2 1,99-10-1
1327 22667 6,077-10-1 7,90-10
1427 16020 6,62 2,58
1527 9281 56,71 7,53
1627 2630 387,5 1,968-102
1727 —4031 2096,6 4,578
СГ2О3 “I- В^С -4-2С= 25 156980 , 4,795-10-118 3,634-10—38
=2СгВ2+ЗСО 227 131067 3,722-10-м 7,193-10-1’
727 71190 2,092-10-13 5,936-10-6
927 47986 1,390-10-® 1,116-10-2
1027 36380 5,805-10-* 8,343-10-2 ,
1127 24750 1,365- 10Т* 4,699-10-1
1227 13071 9,477 ’ 2,115
1327 1420 4,862-102 7,861
1427 —10318 1,614-10* 2,527-10
1527 —22045 3,613-106 7,124-10
1627 —34012 6,205-Юв 1,838-Юз
1727 —46019 8,147-10’ 4,335-102
* kp (Т(Вг) = Pqq', kp(CrB2) = Pqo-_ 3 _
pco (TiB2)=Kfep; Pco (CrbJ^Vkp.
Реакция образования борида этим методом сопровождается выделением тепла, в связи с чем
din АН
dT ~ RT2 > °'
Константа равновесия реакции kp и давление паров рсо с ростом температуры увеличиваются, что приводит к смещению равновесия в сторону образования борида. Таким образом, увеличение степени разрежения снижает температуру процесса. Если в печи Таммана при нормальном давлении водорода процесс образования Диборида циркония протекает при температуре юкол о 2000° С, то в вакуумной печи эта реакция завершается при 1600° С в течение 1—1,5 ч в зависимости от веса загрузки. Необходимо отметить, что увеличение массы загрузки
111
несколько увеличивает продолжительность протекания прЬ-цесса.
Карбидоборный метод успешно используется для получения боридов тугоплавких, щелочно- и редкоземельных металлов в лабораторных и промышленных условиях в печах различных типов [24, 428],
Таблица 36
Режимы получения боридов металлов карбидоборным методом и их примерный химический состав [24, 472, 925]
Борид Температура процесса, °C Время выдержки, ч Химический состав, масс. % Собщ Ме + +В+С, %
Me в
расч. 9КСП. расч. эксп.
СаВв SrBe ВаВ6 YBe LaBe CeBe PrBe NdBe GdB6 TiB2 ZrB2 VB2 NbB3 TaB2 CrB2 Mo2B8 W2B6 1500 1500 1600 1600 1600 1500 1600 1600 2000 1400 1500—1600 1400—1500 1500—1600 1400—1500 1400—1500 1200 1200—1300 1 1 1 1 1 1 1 1 0,16 1 0,2—0,5 0,5—1,0 1 1 1 1 1 38,17 57,44 67,9 57,81 68,20 68,30 68,50 69,1 70,8 68,90 80,79 70,10 81,04 89,30 70,59 78,00 87,20 31,6 54,81 66,7 57,65 68,90 67,50 70,70 69,30 69,4 68,20 80,72 70,00 81,36 89,17 70,58 77,15 87,00 61,83 42,56 32,1 42,19 31,80 31,70 31,50 30,9 29,2 31,10 19,21 29,90 18,96 10,70 29,41 22,00 12,80 61,7 42,5 31,64 42,11 30,70 32,19 30,0 29,30 30,47 31,02 19,20 29,96 18,90 10,23 29,39 22,63 12,90 0,4 0,5 0,2 0,01 0,08 0,02 0,02 0,01 0,06 0,09 0,14 0,02 0,09 0,15 93,7 ' 97,81 98,54 99,77 99,68 99,71 100,70 98,60 99,87 99,24 99,93 100,02 99,35 99,54 99,99 99,87 100,05
В табл. 36 приведены режимы получения боридов тугоплавких и некоторых редкоземельных металлов и их типичные химические составы. Как видно из этих данных, содержание углерода В боридах редкоземельных и тугоплавких металлов не превышает 0,15%.
Бориды, полученные карбидоборным методом, близкие по составу к стехиометрическим, содержат незначительные количества углерода, сам метод прост в исполнении, пригоден для получения боридов в больших количествах, не требует специального оборудования и дополнительной очистки продуктов, поэтому высокопроизводителен и экономичен и положен в основу промышленного выпуска боридов тугоплавких металлов.
Боротермическое восстановление окислов металлов с целью получения борида впервые было использовано Бине дю Жассо-112
не (746], который восстанавливал бором двуокись тория на воздухе в электрической печи. Таким способом удалось получить два борида тория ThB4 и ThB6, но продукты восстановления были загрязнены примесями двуокиси тория, свободных бора и углерода.
Пост, Москович и Глезер [363, 909] пробовали проводить восстановление окислов металлов бором в водороде с использованием избыточного количества бора, так как расчетное количество по реакции недостаточно для восстановления окиси. Полученные бориды были, загрязнены (до 1—2%) углеродом графитового тигля, в который помещалась реакционная смесь. Кроме того, фазовый состав продуктов восстановления оказался неудовлетворительным.
Такие результаты в значительной степени объясняются условиями проведения процесса восстановления (недостаточно высокие температуры, осуществление реакции взаимодействия на воздухе), а также неточным соотношением исходных компонентов в шихте в связи с неправильным расчетом реакции боротермического восстановления.
^Реакция восстановления окислов металлов бором протекает по схеме
МеО + В ->,МеВ 4- В2О2.
Бор играет роль и восстановителя и борирующего реагента; продуктами твердофазного взаимодействия являются соответствующий борид и субокись бора В2О2, для удаления которой процесс целесообразно проводить в вакууме (около 10~1— 10-2 мм рт. ст.)-, одновременно удаляется значительная часть примесей, содержащихся в исходных окислах металлов и боре. Это дает возможность использовать в реакции магниетермический бор с содержанием основного компонента не более 90 — 92%. При развиваемых в реакционных смесях температурах борид магния MgB12 подвергается термическому разложению с выделением элементарного бора и магния, который практически полностью удаляется в процессе восстановления (его содержание в продуктах реакции не превышает 0,001%).
Скорость описанной реакции, выход и чистота продуктов, принципиальная возможность протекания процесса зависят от кинетических факторов, которые в ранних работах не оценивались.
Предполагалось выделение борного ангидрида В2О3 [663] и моноокиси бора ВО [428, 591].
Бор образует с кислородом ряд соединений различной степени окислен-ности. Особое положение среди них занимают борный ангидрид, его производные и соответствующие им кислоты.
Низшие окислы бора В?О, В4О£, В2О, В4О3, В2О2, ВО, В4О5, ВО2 до настоящего времени изучены недостаточно, и многие из них- еще требуют доказательств существования. Работы, посвященные этому вопросу и опубликованные до 1960 г., подробно рассмотрены в монографии [24].
8 Зак. 1305 ИЗ
Кислорбдные соединения бора, существующие в парах при высоких температурах, играют большую роль в современной технике. Изучение их спектров позволяет получать сведения как о составе газовой фазы, так и о строении таких молекул, как ВО, ВО2, В2О2, В20з, НВО2, что имеет значение для теории химического строения, а также для правильного понимания химизма восстановительных реакций с участием бора, которые все шире используются в технологии получения боридов и боросодержащих соединении.
В последние годы большое внимание уделялось изучению инфракрасного и электронного спектра молекулы В2О2 (205, 206, 301, 303, 1016]. Следует отметить большие трудности исследования молекулы В2О2 в связи с тем, что В2О2 всегда находится в равновесии с бориым ангидридом, при этом концентрация последнего велика и мешает наблюдению спектра В2О2. В работах [205, 301, 303] исходными продуктами для получения паров В2О2 служили смеси В + В20з, B+ZrO2, В-|-Сг20з, а также тетрагидроокись бора В2(ОН)4, Испарение велось в среде сухого аргона в молибденовой или графитовой трубе. Установлено, что при 1600° С в спектре наблюдается единственная полоса 1890 см~\ относящаяся к молекуле В2О2. Сравнение результатов исследований ИК-опектров поглощения паров В2О2 при испарении смеси бора и борного ангидрида в молибденовой и графитовой трубках показало, что в последнем случае полоса В2О2 проявляется отчетливее полосы B2OS. Это объясняется тем, что до температур 1400° С реакция согласно Рентце-пису [917] следует уравнению
ВгОз(ж) Н" ЗСррафит * 2В(тв) "Ь
а при более высоких температурах .образуются молекулы В2О2 по уравнению В2°3(ж) + Сграфит С0(г) + В2°2(г).
Бор, образующийся в процессе протекания первой реакции, может реагировать с В20з, образуя В2О2 [743]:
2В(тв) + 2В2°з(ж) •* ЗВ2О2(г).
В подобных условиях может идти образование карбида бора, который реагирует с избытком борного ангидрида, добавляя в газовую фазу субокись бора. Взаимодействие борного ангидрида с углеродом при 1550° С также приводит к образованию карбида бора, который, в свою очередь, реагирует с избытком борного ангидрида с образованием субокиси бора В2О2.
Иоследование состава газовой фазы над системой В4С—В20з [79] показало, что основными компонентами пара в этом случае являются В2О3+, В2О2+, ВО+ и В+. Потенциалы составляющих, по данным работы [79]: В2О3+ и В2О2+—14 эв, ВО+—24 эв, В+—18 эв. Отсюда следует, вывод, что основным компонентом пара смеси В4С+3% В2О3 является молекула В2О2, а в случае испарения борного ангидрида — В2О3; Ионы ВО+ и В+ образуются предпочтительно в результате диссоциации основных компонентов пара. По аналогии с данными Ингрема [743], испарение В2О3 в присутствии В4С происходит так же, как в восстановительной среде (В + В2О3—>.В2О2). Окисли углерода при этом обнаружены не были.
Анализ рассмотренных работ дает основание предположить, что можно повысить концентрацию паров В2О2 над системами окисел — бор, если перейти к более восстановительным условиям образования В2О2: от системы В—В2О3 к В—В2О3—С и далее к системе В—В2О3—С—Н2.
При рассмотрении термодинамических свойств молекулы В2О2 отмечается большая величина энергии связи В—В (120 ккал/моль), значительно превышающая энергию диссоциации молекулы В2 (около 80 ккал/моль), что свидетельствует о высокой стабильности и прочности молекулы В2О2.
В работах [206, 302] описаны результаты исследования в широком диапазоне длин волн Электронно-колебательно-вращательного спектра молекулы ВО, образующейся в электрическом разряде при испарении В20з.
114
Получены новые данные по теплоте образования радикала ’ВО2. Па данным А. А. Мальцева и др. [204, 379], — ДЯ<вО). =68±7 ккал/моль.
В монографии [24] подробно обсуждены методы получения и физико-химические свойства борного ангидрида. Следует отметить, что самой важной проблемой в экспериментальной термохимии является получение точного значения теплоты образования борного ангидрида. Многочисленные попытки определения этой характеристики дали результаты, рассеянные в интервале, равном почти 100 ккал/моль (от 270 до 368 ккал/моль). Детальное рассмотрение работ, посвященных этому вопросу, проведено Г. Л. Гальченко [49]. Выявлены основные источники ошибок, сказывающиеся на величине теплоты образования В2О3, среди которых можно отметить следующие: использование препаратов аморфного бора низкой чистоты с примесями водорода; отсутствие учета влияния примесей на ДЯр отсутствие надежных методик определения теплот образования, проявляющееся в неполноте сгорания бора; неполнота сгорания вспомогательных горючих веществ при отсутствии коли-чественногб контроля полноты их сгорания; частичная гидратация окиси бора, не поддающаяся оценке; влияние различных побочных реакций между бором и некоторыми дополнительно вводимыми в реакцию веществами.
В работе [49] теплота образования борного ангидрида определялась четырьмя независимыми путям'и: при окислении аморфного бора в кислороде (ДН^298 is ° к В2О3=-299,5 ±2,5 ккал/моль); прямым определением теплоты образования нитрида бора с последующим расчетом ДЯ^ В2О3 с использованием теплоты Сгорания нитрида бора (ДЯ^ов.ы'К В20з=—302,6± ±1,4 ккал/моль); расчет ДЯ^ В20з с использованием определенной теплоты образования ВС13(ДЯ^ 29s,is°k В20з=—-301,78±0,76 ккал/моль); путем проведения реакции термического разложения дибораиа В2Нв(Г) на В(аМ) и Над при 600° С и гидролиза В2Нв(ДЯ^298,15°к' В2О3=—302,38 ±0,72 ккал/моль). На основании определения теплоты образования борного ангидрида впервые получено надежное значение этой величины, равное ДЯ^ 298,15° к В20з(етекл)= ——302,10± 0,48 ккал/моль.
В последние годы появились новые данные по термодинамике двойных систем РЬО—В20з, МпО—В2О3 [183, 703, 969], по -поведению никелевых сплавов с расплавленной окисью бора, по поверхностным свойствам расплавленных борагов [503, 509], по изучению диссоциации и парциальному давлС4 нию окислов бора [1], по энтальпии расплавленной окиси бора [525] и другим свойствам [502].
В работе [952] была сделана попытка оценить масс-спектрометрически продукты взаимодействия в системах В20з—В и MgO—В. Результаты исследования показали, что главной составляющей газовой фазы в этих системах при температурах выше 1400° К является субокись бора В2О2. Выход субокиси бора [759] по реакции восстановления окиси бора бором при 1350° С составляет 60—70%. Субокись бора В2О2 собирается на холодных частях приборов в виде Желтого или красного сублимата.
Реакция
в + Ва03(ж) ЗВО(Г) - 1,5В2О2(Г)
является равновесным процессом. При высоких температурах образуется субокись бора, а при низких — наблюдается диспропорционирование ее на ВО, В20з и бор.
8* 115
В работах [205, 302, 303] на оснований Масс-спектрометрй-ческих исследований показано, что основной составляющей пара над системами В—В20з, В—ZrO2, В—Сг20з при 1500—1700° С является субокись бора В2О2. С введением в систему углерода (смесь помещалась в графитовый тигель) состав пара усложняется и наряду с субокисью бора В2О2 появляется борный ангидрид. В процессе восстановления окислов металлов бором в вакууме в присутствии углерода в газовой фазе наличие борного ангидрида можно объяснить протеканием побочной реакции
вд со вд 4- с.
Первичным в результате твердофазного взаимодействия окислов металлов и бора в вакууме является выделение суб-окисла бора В2О2.
Бан и Сикирика [573], получая дибориды титана и циркония
Рис. 26. Зависимость убыли свободной энергии от температуры для реакций боротермического образования диборидов металлов IV—VI групп периодической системы.
Рис. 27. Зависимость равновесных температур реакций боротермического образования диборидов переходных металлов IV—VI групп периодической системы от давления.
В работе [470] проведен термодинамический расчет убыли свободной энергии и равновесных температур реакций образования боридов щелочноземельных и тугоплавких металлов. Результаты расчета (рис. 26 и 27) показали, что при давлении в печи около 10"1—5-10~2 мм рт. ст. равновесные температуры
116
реакции образования боридов лежат в интервале 800—1700° С, что близко к экспериментально установленным температурам (табл. 37). Реакции образования боридных фаз боротермическим способом сопровождаются поглощением тепла, поэтому повышение температуры восстановления создает возможность проведения процесса при меньшем разрежении (рис. 27).
На манометрической кривой, полученной при исследовании реакции
Сг2О8 4- В -> СгВ2 + В2О2,
наблюдается один скачок давления при 1350° С (рис. 28), косвенно характеризующий моностадийность прохождения этой реакции в отличие от многостадийности, наблюдаемой при карбидоборном способе получения диборида титана (см. рис. 25).
Рис. 28. Манометрическая кривая получения борида хрома по реакции СггОз+В-^СгВг+ВгОг:
1 — кривая давления; 5 —кривая температуры.
Длительность газоотделения в процессе восстановления составляет около ПО мин. Химический и рентгеновский фазовый анализы подтвердили однофазность полученного диборида хрома. Замечено, что с повышением температуры скорость образования борида увеличивается, состав борида приближается к стехиометрическому [471].
В работах [660, 661] проведено масс-спектрометрическое исследование состава пара над системами окисел переходного металла — бор. Подтверждено выделение субокиси бора В2О2. Фавр [660] провел термодинамический расчет реакции восстановления окислов переходных металлов IV группы бором с уче-
117
Таблица 37
Режимы получения боридов металлов боротермическим методом в вакууме
Борид Температура, °C Химический состав, масс, %
расч. эксп.
Me В Me В
СаВ6 (с 10% СаО) 1600 61,83 38,17 61,7 38,0
1550 57,5 42,5 56,6 42,7
ВаВв (с 40% ВаО) 1400 67,9 32,1 67,5 31,5
YBe 1750 57,9 42,1 57,9 42,05
LaBe 1600 68,2 31,8 68,1 31,9
GdBe 1800 70,7 29,3 70,55 29,3
TiB2 1500 68,9 31,1 69,0 31,2
ZrB2 1600 80,82 19,18 80,3 19,1
HfB2 1700 89,19 10,81 89,0 10,9
VB2 1500—1550 70,1 29,9 80,2 19,8
TaB2 1600 89,32 10,68 88,6 10,9
TaB2 1700 89,32 10,68 88,8 10,5
NbB2 1600 81,11 18,89 80,2 19,0
CrB2 1600 70,62 29,38 70,6 29,3
YBj2 1700 40,60 59,40 . 38,60 61,00
TbB12 1600 55,06 44,94 54,00 45,30
DyB12 1450 55,60 44,40 54,00 45,50
HoBla 1450 56,00 44,00 54,80 45,10
ErB12 1450 56,32 43,68 55,50 43,90
TmB12 1450 56,56 43,44 55,60 44,00
YbBu 1600 57,15 42,85 56,00 43,30
LuBja 1450 57,40 42,60 -56,10 42,80
ZrBja 1550 41,30 58,70 42,80 57,00
UB12 1500 64,72 35,28 67,70 32,50
том выделения моноокиси и субокиси бора и установил, что для одной и той же температуры Рвл^Лво. Отсюда следует,, что в данном процессе термодинамически преобладает В2О2, Масс-спектрометрический анализ состава пара над системой ТЮг —В при температурах, начиная от 1450° С, констатирует появление молекул В2О2 и бора, другие окисли бора не наблюдаются.
Боротермический способ при осуществлении его в безугле-родистой вакуумной печи дает возможность получать бориды стехиометрического состава, не загрязненные углеродом (см. табл. 37), что очень важно при использовании боридов в катодной электронике и других областях новой техники.
Особого внимания заслуживает использование нагрева реакционной смеси электронной бомбардировкой при получении боридов боротермическим способом [572, 661] в вакууме. Обра« щает внимание, что боротермическим методом в вакууме хорошо получаются высшие бориды переходных металлов IV-*-VI групп периодической системы элементов состава МеВ2 и
118
МеВ6, в то же время описанный метод неприменим для получения боридных фаз, богатых, металлом [470, 471].
Бориды YB12 и TbBi2 хорошо получаются синтезом из эде^ ментов, но боротермическим методом в вакууме однофазные бориды выделить трудно [792]. В работах [792, 814] высказывается мнение, что ответственным за это является большое количество кислорода в реакционной смеси.
Разработанные режимы получения боридов щелочноземельных, редкоземельных и тугоплавких металлов боротермическим способом в вакууме [466, 472, 473] легли в основу промышленного производства боридов металлов,
Металлотермическое восстановление смесей окислов метал* ла и бора. Основы металлотермического метода получения боридов восстановлением окислов смесей металлов и бора алюминием, магнием, кальцием и кремнием уже разработаны [278, 397].
В общем виде реакция получения боридов металлотермиче-» ским методом может быть записана таким образом:
МеО + ВгО3 + Al (Mg, Са, Si) МеВ + Al (Mg, Са, Si) А-
Впервые этот метод был применен Штоком и Холле [982], а также в работе [649] для получения борида кальция. Продукты реакции былй многокомпонентными соединениями, в них присутствовали и бориды, и шлаки, а также окислы металла-восстановителя (алюминия, магния).
Процесс боридообразования при металлотермическом методе получения боридов проходит через ряд окислительно-восстановительных реакций, в которых исходные вещества всегда участвуют в твердой фазе. Конечные продукты часто представ-< ляют оплавленные спеки. Это особенно характерно для алюминотермии в связи с высокими температурами процесс^ восстановления.
Наиболее перспективным в производстве боридов следует считать магниетермический способ, исследованию которого посвящен ряд работ [24, 239, 962]. Известно, что магниетермическим методом могут быть получены гексабориды редко- и щелочноземельных металлов [237], а также Диборидй титана, ванадия, ниобия, тантала, хрома, молибдена и вольфрама [239].
Магниетермический метод синтеза боридов основан на следующих реакциях:
Ме„От 4- ЗпВ2О3 + (т + 9n) Mg -*• пМеВ6 -j- (m-f- 9п) MgO;
Me„Om + nB2O3 + (m + 3n) Mg -> nMeBa 4- (m -f- 3n) MgO,
Борный ангидрид — трудновосстановимый окисел. Теплота образования его из элементов в стандартных условиях — A#298=345000 кал/моль. При высоких температурах В2О3 обладает очень малой вязкостью и весьма активно взаимодействует С большинством других окислов.
lljl
Восстановление борного ангидрида магнием по реакции
2/ЗВаОз + 2Mg = 4/ЗВ + 2MgO, для которого
Л£(17оо—2000) = — 139 118 + 69,047’,
протекает достаточно легко при температурах до 1850—1900° К [197].
Поставщиком бора при использовании магниетермического метода в работе [239] служила борная кислота, в связи с чем технологический процесс получения боридов предусматривал стадию обезвоживания смеси окислов металла и борной кислоты при медленном нагреве до 800° С с образованием так называемой губки, которая растирается, просеивается и перемешивается с расчетным количеством магния, затем смесь подвергается восстановлению при температурах, определяемых для каждого борида и находящихся обычно в пределах 1100— 1400° С [237].
Как правило, бориды составов, близких к стехиометрическим, образуются при введении в шихту двойного избытка борной кислоты и некоторого избытка магния. Полученные таким образом продукты восстановления содержат кроме основного борида соединения магния, очистка от которых возможна прокаливанием в вакууме при 1600—1700° С спеков, предварительно обработанных кислотами для удаления растворимых суббо-ратов магния.
В работе [239] приводятся результаты исследования магниетермического метода получения гексаборидов щелочноземельных и диборидов тугоплавких металлов. Бориды составов, близких к стехиометрическим, получаются при введении в шихту двойного избытка борного ангидрида и некоторого избытка магния. В работе предложены оптимальные составы шихт для получения моно- и диборидов магниетермическим методом (табл. 38). Добавка в шихту окиси магния обеспечивает при обезвоживании борной кислоты получение" рыхлого спека — бората магния, который затем взаимодействует с окислами молибдена, вольфрама и бора с образованием боридов.
С точки зрения химизма магниетермических процессов реакция проходит таким образом, что бор, образующийся при восстановлении магнием борного ангидрида, восстанавливает, в свою очередь, окислы металлов с образованием борида.
В табл. 39 приведены сравнительные данные приближенного расчета изобарных термодинамических потенциалов при 1500° К для реакций восстановления магнием окислов с выделением свободных металлов и для восстановления окислов бором с образованием боридов. Данные рассчитаны на 1 моль образовавшегося борида.
120
Таблица 38
Синтез боридов переходных металлов магниетермическим способом
Молярный состав смеси Температура, °C Химический состав борида, масс. % Атомное соотношение Me: В Фазовый состав по данным рентгеновского анализа
Me в Ме+В
Mg 1150 68,9 30,5 99,4 1:2,08 VBa
УгОз+^з^зЧ" 12Mg 1100 82,8 17,5 99,8 1:1 VB
V аОзЧ^ВгОзЧ-15М g 1150 70,8 29,0 99,8 1:2 VB2
МЪгОз-р^ВаОзЧг! lMg 1200 87,0 12,8 99,8 1:1,1 NbB4-NbB2
Nb2O54-BaO84-8Mg 1200 80,3 7,0 87,3 1:1 NbB4-NB2Os
Nb2O5+4BaO84-17Mg 1200 80,9 19,0 99,9 1:2 NbBa
Т agOg-p^BaOg-l" 17М g 1200 89,9 10,7 99,9 1:2 TaB2
Т agOg-p ЗВаОдЧ-12М g 1200 94,2 5,6 99,8 1:2 TaB
СгаО84-2ВаО8-}- 9М g 1200 76,6 23,1 99,7 1:1,1 CrB-}-CrBa
Сг2О8Ч-4В2О8Ч-12 Mg 1200 67,7 30,0 97,7 1:2,16 CrB2
Сг 2О3Ч- ЗВаОзЦ-12М g 1200 71,0 28,9 99,9 1:1,95 CrBa
2Мо084-5Ва08+2 IM g+15MgO 1200 72,3 23,8 96,1 2:5,8 Mo2Bs
2МоО8-}-5В2О3-}-13,5 Mg+5MgO 1200 80,7 19,1 99,8 2:4,2 Mo2B5
2МоО84-4,5ВаО34-13,5Mg-}-5M gO 1200 79,6 20,3 99,9 2:4,5 Mo2B5
2WO84-5BaO8+21Mg4-5MgO 1200 88,3 14,8 94,3 2:4,6 WaB6
2WO8+ 4,5BaO3+13,5Mg4-5MgO 1200 88,0 11,8 99,8 2:6,0 W2B6
2WO84- 5B2O84-13,5Mg4-5MgO 1200 89,1 11,3 100,4 / 2:4,5 WaBs
Таблица 39
Значения изобарных термодинамических потенциалов AZ° в килокалориях на 1 г-атом металла для реакций магниетермического А и боротермического Б восстановления окислов при атмосферном давлении и 1500°К
Борид А Б Борид А Б
SrBe 4-6 —68 ТаВ3 —170 —94
LaBe —10 —100 СгВ2 —122 —65
TiB2 —42 (для 1200°К) —29 МоВг.б —206 —155
Приведенные данные показывают, что магниетермическое восстановление окислов переходных металлов V и VI групп до металла возможно и более вероятно, чем боротермическое вое-* становление окислов. Важно, что й боротермическое восстановление с энергетической точки зрения возможно?. Вероятность его протекания возрастает с увеличением атомного номера металла, образующего борид.
н При получении боридов щелочно- и редкоземельных металлов восстановление магнием идет иначе. Предполагается, что выделяющийся при восстановлении В2О3 свободный бор во вторичной реакции с окислами металлов восстанавливает их с образованием гексаборидов. Образующийся в результате реакций субокисел бора В2О2 остается в основном в конечном продукте, образуя cMgO суббораты магния [237].
Предложен следующий механизм протекания реакции магч Ииетермического восстановления окислов щелочно- и редкоземельного металлов и бора:
З.БВаОд + 10,5Mg 7В + 10,5MgO + МеО 4- 7В -> МеВв 4- 0,бВ2О2
МеО 4- 3,5В2О8 -h 10,5Mg -> MeBe 4- 0,5ВаОа 4- 10,5MgO,
т. е. процесс является магниеборотермическим [239].
Сопоставление Экспериментально установленных соотношений компонентов шихты в исходной смеси с вычисленными в расчете на чисто магниетермический и магниеборотермический Процессы, приведенных в табл, 40, показывает, что магниеборо-термическая схема металлотермического процесса играеу существенную роль в химизме восстановительных реакций.
Если составлять шихту с учетом предложенной в работе [239] схемы протекания процесса, то можно получить бориды высокой чистоты. Так, содержание магния в боридах не Превосходит десятых и даже сотых долей процента, причем от этой примеси бориды легко очищаются при прокаливании их в вакууме при 1600° С.
122
Таблица 40
Оптимальные соотношения компонентов шихт (МеО:ВгО3) и их сравнение с расчетными для магннетермического процесса получения боридов [239]
Бориды Исходный окисел Эксперимент аль • ные данные Рассчитано для реакций
магниетермических магниеборо-термических
СаВ6, SrBe, ВаВв МеО 1:3:10 1:3:10 1:3,5:10,5
LaBe> EuB8, GdB, Me2Os 1:6:21 1:6:21 1:7,5:22,5
TiB2 TiO2 1:1:5 1:1:5 1:2:6
VB, TaB Me2O6 1:3:12 1:1:8 1:3,5:10,5
NbB Nb2Oe 1:2:11 1:1:8 1:3,5:10,5
VB2, NbB2, TaB2 • Me2O6 1:4:17 1:2:11 1:4,5:13,5
CrB 1:2:9 1:1:6 1:2,5:7,5
CrB2 Cr2O3 1:3:12 1:2:9 1:3,5:10,5
Mo2B6 MoO. 2:5:13,5 2:5:13,5 2:5,5:16,5
W2B6 wos 2:4,5-5:13,5 2:2,5:13,5 2:5,5:16,5
Магниетермический метод получения боридов сравнительно прост в технологическом отношении; экономичен, так как допускает использование борной кислоты вместо ангидрида.
[Осаждение из газовой фазы, аналогичное получению карби-дов и нитридов при разложении галоидных соединений металлов на накаленной вольфрамовой нити в присутствии углеводородов или азота, впервые было использовано Бине дю Жассоне [746] для получения борида хрома; смесь хлорида бора с водо* родом пропускалась над тонкоизмельченным хромом.
В общем случае суммарная реакция восстановления водоро*" дом борсодержащих компонентов может быть представлена следующей ёхемой:
МеС14 + 2ВС13 + 5Н2 м- МеВа -f- 10НС1,
Сущность этой реакции заключается в разложении химических соединений 0 последующим взаимодействием их составных частей, находящихся в газообразном (парообразном) состоянии, и образованием борида.
Метод осаждения из газовой фазы представляет совокупность ионных и атомарных, (молекулярных) реакций, протекающих в газовой фазе в восстановительной среде, присутствие которой необходимо для восстановления продуктов пиролиза и их отвода.
Моерс [854] восстанавливал хлориды Ti, Zr, Hf, V, Та и W на накаленной вольфрамовой нити при 900—2500е С. Продукты восстановления были в значительной степени загрязнены металлом нити, имели неопределенный фазовый состав, требовали дополнительных операций гомогенизации и очистки [24, 854]. Наряду с боридами часто соосаждается бор [24]. Боридные осадки получаются в виде мелкокристаллических выделений,
123
I I
ВС1г нг
монокристаллы боридов в первых работах получить не удавалось. Ганнон [679] получал диборид титана, осуществляя описанную реакцию в реакторе-трубе под давлением. Этот диборид был стехиометрического состава и проявлял заметную преимущественную кристаллическую ориентацию.
Исследования процесса осаждения пирографита показали [981], что условия осаждения — наиболее важный фактор, влия-7 ющий на микроструктуру осад-
8акиимноми'^°ъ' слеД°вательно> почти на все 9 свойства осажденного материала.
К этому же заключению пришли в работе [681] при исследовании процесса получения диборидов титана, циркония и гафния. Осаждение проводилось при 1400° С в системе, схематически показанной на рис. 29. Основу системы составляет печь с графитовой трубой сопротивления (горячая зона имеет диаметр 100 и длину 250 мм), вакуумный насос с ловушками. В середине трубы по диаметру укрепляется плоская пластина из пиролитического графита, которая служит поверхностью осаждения. Через входные отверстия подаются хлорид бора и водород соответственно, бойлер заполняется хлоридом металла. Подача трихлорида бора, хлорида металла и водорода строго контролируется.
В работе установлено влияние параметров процесса на структуру и свойства получаемых боридных слоев. В таких боридах на-. блюдалась незначительная сте-
пень преимущественной ориентации, указывающая на то, что кристаллиты осаждались осью с параллельно подложке.
Осадки диборида титана получаются беспористые и стехиометрического состава, осадки диборидов циркония и гафния содержали в качестве примеси небольшие количества (5-ромбоэдр ического бора.
Установлено, что на состав осадков, их пористость и ориентацию граней влияют различные условия осуществления процесса. Например, увеличивая или уменьшая расход водорода, мойно получать то пористые, то кристаллические осадки с различной степенью преимущественной ориентации; при высоких
Рис. 29. Схема системы осаждения из газовой фазы боридов титана, циркония и гафния [631]:
1 — смотровые окна: 2 — графитовая труба; 3 — манометр; 4 —печь; 5—пластина из пиролитического графита — поверхность осаждения; 6 — бойлер с
МеС1«4
общйй. дайЛенйях расходуемый Материалов . получаются более мелкозернистые осадки. При очень высоких температурах уменьшается содержание металла. Эффект соосаждения бора на периоды решетки влияет слабо (табл. 41).
Таблица 41
Некоторые характеристики боридов, полученных осаждением из Тазовой фазы [347]
Осадок Плотность осадка, е/ои* вносимая в плотность бором, а/слс3 Плотность боридной фазы (рентгеновская), г/слс8 о Период решетки, А
а С с/а
TiB2 3,104 0,48 4,472 3,038 3,232 1,064
3,410 0,34 4,463 3,040 3,233 1,064
3,980 0,13 4,469 3,038 3,234 1,065
4,007 0,13 4,481 3,035 3,231 1,065
4,500 °1 4,483 3,034 3,233 1,066
— — 3,028 3,228 1,066
ZrB2 2,816 0,72 6,088 3,171 3,535 1,115
— —— 1 1 • 3,169 3,531 1,111
HfB2 3,453 0,86 5,871 3,211 3,482 1,085
—• — 3,142 3,475 1,106
В работе [347] методом осаждения из газовой фазы получены монокристаллические осадки диборида титана (рис. 30). Показано, что на формирование кристаллов диборида титана при протекании реакции..,
TiCl4 + 2ВС13 + 5На = TiBa + 10НС1
существенное влияние оказывают температура, скорость прохождения реагентов через реакционное пространство, а также соотношение Н2 и TiCl4+BCl3.
Оптимальными условиями получения кристаллических осадков TiB2 являются: температура 1400° С, небольшие скорости
подачи реагентов и мольное соотношение —:——---------<30. Уже
TiCL -|- BClg
Н2
при отношении ——------— =45 кристалличность осадков умень-
T1C14 -|- BClg
шается, в них появляется аморфный диборид.
Метод осаждения из газовой фазы в настоящее время развивается очень интенсивно и наряду с методом восстановления окислов металлов весьма перспективен.
Возможность получения монокристаллов, покрытий, а также изделий сложной формы из монокристалльных осадков боридов открывает методу осаждения из газовой фазы широкие перспективы для использования в промышленности [735]. Уже сейчас
125
Рис. 30. Дендритовидные кристаллы диборида титана, полученные осаждением из- газовой фазы [347J.
описанный метод нашел использование при производстве 6opj ных волокон [677, 678], для защиты сопел, камер сгорания, тиглей, лопаток турбин, микротермопар, трубопроводов и насосов в химической промышленности, деталей реакторов [569], упрочнения твердосплавных резцов.
Основные направления развития исследований метода осажч, дения из газовой фазы заключаются в разработке оптимальных режимов осаждения индивидуальных боридных фаз, их различных модификаций, твердых растворов, смесей для решения вопросов, связанных с созданием материалов с заданной структурой, которые работают прй повышенных температурах в окислительных средах.
Разновидностью метода осаждения из газовой фазы являются химические^ транспортные реакции. Этот метод интересен, главным образом, для получения монокристаллов боридов. В работе [867] методом транспортных реакций получены монокристаллы диборидов титана, ванадия, хрома и моноборида хрома. Реактором служили кварцевые ампулы. В качестве реакционного и транспортного газа использовались хлор, бром или иод под давлением от 5 До 120 мм рт. ст.
Перед наполнением галогенами ампулы с исходными веществами нагревались под давлением. Температура реакции 1050—и-1100° С, время транспортировки от 5 до 22 дней, В табл. 42 приведены основные характеристики результатов использования метода транспортных реакций.
[Электролиз расплавленных сред заключается в пропускании электрического тока через расплавы солей, являющиеся силь^
Т аблица 42
Режимы получения монокристаллов боридов методом химических транспортных реакций
Исходный материал Температура, °C, продолжительность транспортировки (дни) Состав и вид кристаллов Структура, пространственная группа о Период решетки, А
О' С . с,'а
TiB2 1100 (5-22) Иглы TiB2 Гексагональная Dgh—P6[mmm 3,03 3,23 1,006
ZrBa 1100 Кристаллы То же . 3,17 3,53 1,11
VB2 ,я (В-Т) ZrB2 Призмы VB2 3,00 3,06 1,02
CrB2 1050 Кристаллы СгВ2 » 2,97 3,07 1,03
CrB 1100 (15) Кристаллы СгВ Опторомбическая 2,97 2,83 0,952
127
ними электролитами, и образовании борида в результате электродных реакций как на катоде, так и на аноде. Плотность тока, напряжение и температуру электролизной ванны варьируют
в широких пределах.
Этот метод впервые был применен Муассаном и Вильямсом [24] для получения боридов щелочноземельных металлов. Поз-
, же Андрие [545] электро-
Рис. 31. Схематическое представление электролизной ваины по данным работы [914]:
/ — пластина из стеатита, поддерживающая электроды; 2— электроды; 3 — трубка для ввода аргона; 4 — печь сопротивления; 5 — крышка с отверстиями для электродов и подачн аргона; 6 — графитовый тигель; 7 — электролит; 8 — графитовый экран; 9 — зазор для ввода термопары-. Внизу — схема питания.
лизом расплавленных фторидов провела синтез этих боридов и изоморфных им гексаборидов редкоземельных металлов. Электролиз расплавленных сред был использован для получения боридов также в работе Барбетти [546]л
Электролиз осуществляется в графитовых тиглях, служащих одновременно анодом, с использованием катодов из графита или полых железных, охлаждаемых водой (рис. 31). В со
ставе ванны для электролиза используются окислы металлов и борный ангидрид с добавками фторидов щелочных и щелочноземельных металлов для снижения температуры плавления и вязкости ванны. Температура электролиза таких смесей составляет 950—1000° С, напряжение 3—10 в, плотность анодного тока 0,3—1 а/см2^
Есть две точки зрения на механизм получения боридов металлов этим методом. По мнению Андрие [545], восстановление окислов металла и бора в расплаве осуществляется магнием, кальцием или литием, пер-
вично выделяющимися па катоде. Г. А. Меерсон [256] на основании анализа кривых ток — напряжение при электролитическом разложении TiOj и В2О3 показал, что первичен процесс непосредственного выделения борида из расплавленных боратно-фторидных ванн. По
128
ёгб мнению, образование диборида сопровождается выделением дополнительно свободной энергии, что значительно снижает потенциал выделения кристаллов диборида.
Если принять, что разряжающиеся ионы сразу становятся в узлы формирующейся кристаллической решетки борида, а не взаимодействуют с поверхностью электрода и не диффундируют в глубь электрода, то образование борида на катоде — первичный электродный процесс [75].
В работе [914] сделана попытка разобраться в химизме процессов, происходящих на аноде при образовании диборида тантала. При диссоциации TaF7Cl3~ образуется пятивалентный тантал
TaFjCl3- Та6+ + 7F“ + Cl“
с последующей реакцией
Та6+ 5е” Та.
Параллельно идет процесс образования бора по реакции
ВЕГ + Зе~ -> В + 4F-.
При одновременном протекании этих реакций образуется моноборид тантала:
Та6+ + BF? + 8е“ -> ТаВ + 4F~, который служит зародышем для получения непосредственно ди* борида по реакции
ТаВ + ВЕГ + Зе- ТаВ2 + 4F“.
Варьируя молярный состав ванны, анодный ток и напряжение, можно получить либо смесь моно- и диборида, либо один из этих боридов (табл. 43).
Таблица 43
Некоторые параметры процесса электролиза боратов при получении боридов тантала [914]
Молярный состав электролита Напряжение , в Ток, a Время •лектро-лнза, ч Состав продукта по данным рентгеновского анализа
KCl:K2TaF7 =10:1 1,5 1,5 1 Та
KC1:KBF4=5:1 1,4 1,7 3 В(ам)
KCl:KaTaF7:KBF4=10:l:2 1,5 1,75 1 ТаВ
KCl:KaTaF7:KBF4=10:l:2 3,6 10,0 3 ТаВ+ТаВа
KCl:KaTaF7:KBF4=10:l:2 3,3 6,0 1 ТаВ
KC1:KBF4=5:1 2,4 4,8 2 ТаВа
9 Зак. 1305
129
Таблица 44
Режимы получения боридов электролизом расплавов [24]
Молярный состав ванны Температура, °C Химический состав борида, масс. % Формула соединения
Me В
CaO4-2B2O34-CaF2 1000 37,87 Не прив. ‘ СаВ$,
SrO-f-2B2O3-)-SrF2 1000 56,53- ’ э SrBb
BaO+2B2O3-|~BaF2 1000 67,47 > ВаВв.
V2TiO2+2B2O3-}-MgO-}-MgF2 1000 1 68,5—69,1 30,8—31,2 TiB2
1/ aZrO2-J- 2B CaO-J- CaF2 990—1050 81,0—86,3 13,8—19,4 ZrB2
1/3V2O8+2B2O3+MgO (CaO)+MgF2(CaF2) 910—1050 69,6—70,0 29,4—30,2 VB2.
’/10Nb2O8-}-2B2O3-}-MgO(CaO)-}-MgF2(CaF2, LiF) 980—1000 80,9—81,7 18,0—18,2 NbB2
VioTa206+2Ba03+{MgO(CaO, Li2O)-|"MgF2) 980—990 89,1—89,4 10,3—10,7 TaB2
3B20g • 2CaO+ 2CaP 2-f- */щСг 2O3 1000 Не прив. 82,1 Сг3В4+СгВ;
3B2Og* 2СаО4-2СаР2+1/бСг2О3 1000 ъ 82,5 CrB
ЗВ2О3 • 2CaO+2CaFa+ V4Cr2O3 1000 > 85,1 CrB+Cr2B
2B2O3- ^CaO-pCaFj-^VaoCibO» 1000 > 78,8 СгэВ^СгВ
3B2O3 • 2CaO+2CaF2+2/3CraO3 1000 > 92,4 Cr2B 4- «Cr4B»<
i/4MoO3-}-2B2O3+NaF 1000 93,3—94,0 5,32—5,66 Mo2B8,
V»WO3+2BaOs • Na2O+ NaF 960 93,9—94,5 5,1—5,4 WB.
Аналогичный вывод делается в работах [74, 304], где подчеркивается, что состав ванны, особенно содержание окислов металлов, существенно сказывается на составе получаемых боридов. В зависимости от концентрации окислов могут быть получены бориды с различным химическим составом. В табл. 44 приведены некоторые режимы и составы ванн для получения боридов электролизом.
Необходимо отметить, что электролиз расплавленных сред дает при тщательно отработанных режимах бориды в форме хорошо кристаллизованных дисперсных осадков, отличается про-
Методы получения боридов
Синтез из элементов
Электролиз расшибленных солей
ЁзаимооеистВие металлсодержащ их и борсодержащих соединений
Взаимодеистдие летучих соединений металла и бора б присутствии Водорода
Восстановлеше
окиств метал-
Восстановление металлсодер*» ..»»»...______
лов снесет до- Та^Ш- №№ди-пп у „а [шиТ/глем --------------------
ра и угля
-----..--- [Восстановлений [Восстановление Взаимодействие ^ne'^nnlSn11' окислов метал- металлсодер- метаплсодер-
-. ла и бора не- жащих соеви- Sff/iti нении бором и рп.) с босом
нениями
таллом
нений (МрН-МеВ и др.) с юром
Восстановление сме- Восстановление си окислов металла боратов металлов
' и <>°Ра Умем У^ем
Восстановление окислов металлов Вором
Восстановление кар-дон a mod ми боратов металлов сором
Рис. 32, Классификация методов получения боридов.
стотой установок, не требующих сложных технологических оформлений, доступностью исходных веществ, низкими температурами синтеза.
Однако чистота таких боридов еще недостаточно высокая и трудно получить продукты синтеза строго определенного заданного состава. Кроме того, не исключена возможность загрязнения готовый продуктов углеродом при распылении графитового анода, что, в свою очередь, требует дополнительной очистки боридов, Метод отличается малой экономичностью.
При разработке непрерывных процессов электролиза, подборе легкоплавких, Технически чистых и дешевых электролитов и исходных компонентов перспективы описанного метода могут быть значительно расширены. В настоящее время ‘этот метод синтеза используется для нанесения покрытий [461],
Рассмотрение методов получения боридов дает основание предложить следующую их классификацию, исходя из характера веществ, принимающих участие в реакциях боридообразова-ния (рис. 32). Основными являются синтез из элементов (метод, основанный на взаимодействии ^металлсодержащих И борсодержащих соединений); взаимодействие летучих соединений
9* 131
металла и бора в присутствии водорода Досаждение из газовой фазы) и электролиз расплавленных сред.
Каждый из описанных методов синтеза боридов имеет различные способы осуществления, характеризующиеся индивидуальным аппаратурным оформлением, технологическими условиями, средой, в которой процесс протекает, видом получаемых боридов (порошки, осадки, монокристаллы), их количеством.
Восстановление окислов металлов (природных руд) и бора различными восстановителями, в том числе бором и борсодержащими материалами, наиболее перспективно при получении больших количеств боридов.
Синтез из элементов, электролиз расплавленных сред, метод осаждения из газовой фазы могут быть использованы для получения равномерных покрытий на изделиях из различных материалов и изготовления самих изделий сложной формы, обладающих специфическими свойствами. Кроме того, метод осаждения из газовой фазы весьма перспективен для выращивания монокристаллов, которые могут найти использование в приборостроении и технике.
Вероятнее всего, монокристаллы боридов, полученные методом осаждения из газовой фазы, будут существенно отличаться по своим физико-химическим свойствам от монокристаллов, выращенных методом вытягивания из расплава.
Большой интерес представляет разработка принципиально новых методов синтеза боридов (СВС, плазмохимические процессы, метод псевдоожижения).
При разработке' новых и совершенствовании прежних методов синтеза боридов предстоит решить очень важную проблему получения боридов высокой чистоты во всем интервале содержаний бора, а также выращивание особо чистых и легированных монокристаллов, обладающих специфическими, заранее заданными свойствами.
Глава III
БОРИДЫ МЕТАЛЛОВ I ГРУППЫ
ПЕРИОДИЧЕСКОЙ СИСТЕМЫ ЭЛЕМЕНТОВ
БОРИДЫ ЩЕЛОЧНЫХ МЕТАЛЛОВ
Бориды лития. Первые сведения о продуктах взаимодействия бора с литием относятся к 1929 г., когда Андрие [546] получила электролизом расплавленного бората лития с добавкой LjiF 82,9 %-ный бор, содержащий 9,4% Li и представляющий смесь бора и борида лития.
Л. Я. Марковский и Ю. Д. Кондрашев [221] исследовали возможность получения борида лития рядом методов: электролизом Ы2О-СаО-2В2Оз, синтезом из элементов, взаимодействием между бором и гидридом лития, магниетермическим восстановлением смеси окислов. Во всех случаях получались смеси бора с 2—6% Li. Наибольшее содержание лития (6,1%) было получено при электролизе. На порошкограммах образцов продуктов взаимодействия лития и бора не были обнаружены отражения, которые можно отнести к индивидуальной фазе; во всех случаях наблюдались системы линий, характерные для мелкокристаллического бора. При анализе продуктов электролиза были получены порошкограммы, характерные для СаВ6, а высокое содержание кальция в этих продуктах (15,2%) дает основание полагать, что при электролизе получался гексаборид кальция.
В работе [275] при восстановлении борного ангидрида металлическим литием был получен продукт, содержащий 90% В, что приближается к составу LiB6 (90,43% В); кристаллическое строение продукта не было установлено. В этих работах предполагается, что происходит образование твердого раствора лития в боре.
Следует отметить, что давление паров лития при высоких температурах мало и составляет р°ы=121 мм рт, ст. при 1100° С [860], что в 70 раз ниже давления паров калия при той же температуре; в связи с этим метод синтеза под давлением из элементов неприменим к получению боридов лития. Кроме того, исключительная химическая агрессивность лития уже при 200° С по отношению к кварцу -и силикатам исключает проведение экспериментов в аппаратуре из этих материалов.
Портье [905] использовал для получения борида лития метод синтеза в металлической бомбе с последующим удалением
133
свободного лития раствором аммиака. Этот метод был положен в основу работы I860], но осуществлялся при низкой температуре в безводной среде., Метод трудоемкий, так как требует Многократной обработки продуктов реакции кислотами. Взаимодействие литий с бором начинается при 680° С и ускоряется при 750° С с образованием новой фазы, дающей индивидуальную рентгеновскую картину, которая достаточно хорошо совпадает с данными работы [953], где бориду лития приписана формула LiBi2, хотя, по данным химического анализа, формула борида LiB6. Все попытки проиндицировать порошкограмму борида лития не привели к успеху. Формулу нужно считать условной, поскольку в бориде лития, по данным химического анализа, имеется 2,8% примесей в форме кислородных соединений. Если считать, что в бориде лития присутствует в каче->. стве примеси В7О, то B'(Li = 7, если примесь в виде Li2O, то В ; Li=13.
При исследовании реакции взаимодействия лития с карбидом бора получен борид состава LiBiO,85±o,35 [954]. Периоды решетки LiBWj85 (<я=10,16 А, с = 14,28 А) близки к периодам для тетрагонального бора. Предполагают*, что борид лития представляет твердый раствор лития в тетрагональном боре. Формульный Состав борида лития остается неустановленным и требует дальнейшего уточнения.
Свойства борида лития изучены недостаточно. Нала [860] отмечает исключительно высокое сродство лития к кислороду. В связи с этим существенное влияние на свойства борида лития оказывает присутствующий в нем всегда кислород в форме окислов. Рекомендуется отмывка борида лития соляной кислотой, что значительно повышает содержание лития в бориде. Борйд лития устойчив Bi среде кислорода до 400° С. Галогены на него не действуют до 45Q° С. В водороде борид лития устойчив вплоть до 850° С.
При проведении спектрального анализа установлено [860], что интенсивности линий в спектрах, полученных при разных температурах и выдержках, различаются. Эти данные дают основание полагать, что борид лития имеет значительную область гомогенности^
Бориды натрия. В рабрте [828] бор, полученный восстановлением В2О3 или фтороборатов калия металлическим натрием или калием, после обработки кислотами содержал от 3 до 6% щелочных металлов, что объяснялось образованием боридов натрия или калия. По данным Муассана [845, 846], при нагревании смеси В2О3 с кусочками натрия с последующей обработкой продукта водой получается тонкий зеленовато-синий порошок, легко проходящий через фильтр. Называя продукт восстановления боридом натрия, Муассан в то же время утверждал, что щелочные металлы могут возгоняться над аморфным .бором без взаимодействия.
134
Кроль [782] и Андрие [545], изучая восстановление В2О3 щелочными металлами, а также проводя электролиз натрия и калия с целью получения аморфного бора, подтвердили результаты Муассана. Относительно состава боридов щелочных металлов в ранних работах никаких сведений нет.
Андрие [546] при электролизе сложных расплавленных боратов щелочноземельных (кальция, Стронция, бария) или редкоземельных (церия, лантана, неодима) металлов и актиноидов (тория) с добавкой боратов щелочных металлов удалось получить продукт, содержащий 23,6% Са, 10% Na и 65,5% В, а весовое соотношение в нем Na/B=0,35-j-0,36, что отвечает примерной формуле NaBe. •
Исследования Берто и Блюма [580] показали, что натрий — единственный металл, способный замещать в рексаборидах другие металлы, образуя сплавы составов ТЬо,2зИао,7тВв; Bao,57Nao,4sBe, причем количество растворенного натрия возрастает* с увеличением валентности металла-растворителя.
Позже, в работах Налэ [717, 860], при взаимодействии бора и натрия, взятых в соотношении Na/B = l, при 1000°С в течение 12 ч был получен продукт, который после обработки соляной кислотой соответствовал, по данным Химического анализа, гексабориду NaB6. Реакция образования гексаборида натрия сопровождается возгонкой 'металла в вакууме при 350° С. Структура NaBe кубическая, типа СаВ6, пространственная группа Oh1—РтЗт.
Позже [861] были выделены монокристаллы <р-фазы, проведен их химический анализ и рентгенографическое исследование. По данным химического анализа, <р-фаза содержит 12,6±0,2% Na и 86,7±0,8% В, рентгеновская плотность 2,426 г/см?, пикнометрическая — 2,44 г/см3, формула ИаодазВ [NaB~15], Структура NaB~u орторомбическая, пространственная группа 1таг(С$), число формульных единиц четыре. Периоды решетки NaB~15, А: а = 5,847±0,005, Ь=8,415±0,005, с=10,229±0,005. <р-Фаза характеризуется наличием борного скелета, состоящего из икосаэдров В12 с дополнительными атомами бора, ось пятого порядка каждого икосаэдра наклонена под углом 13° к оси с в плоскости, параллельной плоскости OOZ. Длина связей В—В внутри икосаэдров равна 1,807 А, а связей В—В, образующих икосаэдры, —1,776А. На каждый икосаэдр В12 в структуре NaB~15 приходится дополнительно три атома бора и один атом натрия. Поэтому формулу борида натрия можно записать в виде NaB3B12. Структура NaB_15 подобна структуре двойных боридов (Mg, Al) В7 и MgAlBu [769]. В табл. 45 приведены координаты атомов бора и натрия в структуре NaB~15.
Свойства боридов натрия изучены недостаточно. NaB6 — порошок черного цвета, плотность его 2,12±0,01 г/см?. При высокой температуре Диссоциирует с образованием <р-фазы
135
Таблица 45
Координаты атомов в структуре NaB~]5
Атом Положение X У Z Атом Положение X У
Bi 16(7) 0,2475 0,0364 0,0820 в6 8 (ft) 0 0,3941 0,1450
в, 16 (!) 0,1609 0,8343 0,0484 в. 4(e) 0 0,2541 1/4
В3 8 (ft) 0 0,1529 0,1011
В4 8 (ft) 0 —0,0472 0,1641 Na 4(e) 0 0,3386 3/4
(NaB~15). NaB~15 — порошок коричневого цвета, тонкий, напоминающий тальк. В кристаллическом состоянии он похож на p-бор. Плотность NaB~i5 равна 2,44+0,01, что очень близко к плотности p-бора (</в=2,35+2,46).
Удельное электросопротивление NaB6 при комнатной температуре 4-Ю6 ом-см, при 100—300°К NaB6 — изолятор, рыаь~15= = 104 ом-см. NaB6 не гидролизуется. По данным Муассана [845, 846], бориды натрия после обработки соляной кислотой разлагаются на натрий и В2О3. Окисление NaB6 в кислороде начинается при 500° С и проходит довольно интенсивно [860].
Бориды калия. Синтезом из калия и бора при атомном соотношении в шихте К/В = 1+2 при 1130° С и давлении паров калия =10,7 ат в течение 14—16 ч Налэ [860] получил гексаборид калия. Образование КВ6 сопровождается кристаллизацией в качестве побочных продуктов а- и ₽-бора.
Кристаллическая структура КВ6 кубическая (изотип СаВ6), пространственная группа Он1—РтЗпг. Период решетки, определенный по методу Брэдли экстраполяцией на 90° по кривой зависимости ,a=f(cos20), составляет а = 4,2325±0,0005 А. Координационное число атомов калия 24, атомов бора 5. Кратчайшие расстояния, рассчитанные для периода решетки КВ6 а = =4,232 А, составляют, А: В—В = 1,747, К—К=4,232, В—В = = 3,119.
В работе [860] отмечается, что гексаборид калия в зависимости от условий получения может иметь различное содержание калия, на что указывает период, решетки: а изменяется от 4,230 до 4,232 А.
Плотность гексаборида калия, определенная на образцах методом гидростатического взвешивания, d—2,99+0,01 г/см3. На образцах КВ6, полученных спеканием при 750° С предварительно спрессованных штабиков, измерено удельное электросопротивление, которое при 300°К составляет 10-4 ом-см. С повышением температуры проводимость КВ8 возрастает. КВ6 проявляет слабый парамагнетизм в интервале температур 100— 600°К, не зависящий от температуры (%=150-10-6 ед. СГС). Гексаборид калия устойчив в среде аргона до 800° С, выше этой температуры наблюдается диссоциация КВ6 с удалением метал-
136
лического калия и образованием р-бора: 1050° с
квв-------бве + ю.
Отмечается (860], что в связи со значительным испарением калия гексаборид КВв может перейти в борид калия с дефектной структурой К1-хП«В6 (где □ —пустоты) с плотностью 1,7.6 г/слг3, затем при дальнейшем испарении калия и возникновении в связи с этим дефицита электронов связь между октаэдрами из атомов бора ослабляется и происходит разрушение борного скелета с образованием аморфного бора. Отмечается, что при диссоциации КВ6 при высоких температурах (1050°С) гё,ксаборид калия может перейти в связи со значительным испарением калия в новую разновидность бора а-В с кубической структурой, стабилизированной небольшими примесями калия (860]. КВ6 не гидролизуется, что свойственно всем боридам со структурой СаВ6. Окисление КВ6 в среде кислорода начинается при 500° С и проходит более интенсивно, чем у NaB6. КВв подобно бору дает бурные реакции с окислителями при температуре окружающей среды.
Бориды рубидия, цезия, франция. О взаимодействии рубидия, цезия и франция с бором сведений нет.
БОРИДЫ МЕТАЛЛОВ ПОДГРУППЫ МЕДИ
Бориды меди. Сведения о взаимодействии между бором и медью весьма противоречивы (см. [24]). До настоящего времени нет однозначных данных о существовании боридов меди. В одниД работах [683, 732] отрицается взаимодействие между бором и медью как в твердом, так и в жидком состояниях. В работах Муассана (845, 846] описан борид меди состава B2CU3. Кроме того, имеются сведения о существование бори-стых бронз и бористого серебра [740, 1010]. Хансен [512], критически рассмотрев данные по системе Си—В, пришел к твердому убеждению, что бор в меди растворяется. Действительно, в работе [803] при исследовании реакций в системах Си—Mg и Си—Ga с добавками буры при 1500° С обнаружили серовато-синие кристаллы, которые были выделены и проанализированы. На основании результатов этого анализа делается вывод о том, что выделенные кристаллы представляют борид меди состава СиВэг. В работе приводят значение микротвердости борида (1115 кГ/мм2 при нагрузке 120 г) и указывают на высокую температуру его плавления. При 2 масс. % В в системе обнаружена эвтектика с температурой плавления 10б0±2°С.
Лиль и Файшль [803] обнаружили увеличение с повышением температуры растворимости бора в жидкой меди от 0,06 до 0,09 масс.%.
Позже [929] методами микроскопического, рентгенографического, термического и химического анализов было проведено
137
Рис. 33. Диаграмма состояния системы Си—В.
исследование системы Си—В bq всем концентрационном интервале содержаний бора. Установлено, что система Си—-В занимает особое положение среди систем Ме—В (Ме — металл подгруппы меди), в которых наблюдается полное отсутствие взаимной растворимости. При 13,3 ат.% В и 1013°С в системе Си—В образуется эвтектика. При 950° С медь растворяется в боре до 2,8 ат.%. Таким образом, температура эвтектики, по данным [1003], лежит -где-то около ДО 10°Q. Диаграмма состояния системы Си—В, предложенная в работе [929], наиболее вероятна. Существование борида СиВ22 не было подтверждено в последующих работах [103, 1005].
Учитывая большие трудности взаимодействия бора с медью, Уолд и Стэпмонт [1003] разработали методику, позволившую им вводить жидкую медь в расплавленный бор под избыточным давлением очищенного гелия в тйглях из нитрида бора. Такие сплавы затем отжигались один-два месяца при 900—1000° С, после
чего проводилось их исследование методами рентгеновского, металлографического и термического анализов.
В системе Си—В подтверждена эвтектика, но температура плавления эвтектики 1008, а не 1060° С, как это сообщалось ранее; содержание бора в эвтектике выше 2 масс.%. В сплаве с 90 ат.% В рентгенографически обнаружен тетрагональный Р-бор и ромбоэдрические а- и p-бор. Наблюдается довольно заметное изменение периода решетки тетрагонального бора: а= 11,26 А (по данным [1003], для чистого термического бора 10,14 А, с=14,14 А). Период решетки меди остается практически неизменным (а = 3,614+0,002 А). Выше температуры эвтектики (при 1022° С) на термограмме обнаружен «всплеск», который объясняется а->р-превращением бора. Термический эффект превращения бора регистрируется, даже если одновременно происходит растворимость бора в меди. Существование борида меди в работе не подтверждено. Длительный отжиг сплавов системы Au—Си—В (отжиг длился в течение нескольких месяцев) [1005] при температуре выше температуры эвтектики и ниже температуры превращения a->-₽-6opa также подтвердил отсутствие взаимодействия в упомянутой системе.
138
Искривление линии ликвидуса иа диаграмме Си—В (рис. 33), наблюдающееся выше температуры эвтектики, вероятнее всего, характеризует изменение растворимости бора в меди в связи с а-^р-превращением бора.
Интересно отметить, что медь сама не образует боридов,, но оказывает влияние на процессы кристаллизации боридов при борировании стали [103], Известно, что одним из перспективных методов повышения поверхностной твердости деталей является борирование, как метод защиты изделий от изнашивания.
Рис. 34. Микроструктура борированной (а) и боромедненной (б) стали 45 (Х200).
Один из существенных недостатков данного метода упрочнения— высокая хрупкость боридных слоев. Этот недостаток тормозит эффективное использование борирования для деталей, подвергающихся в процессе эксплуатации высоким ударным нагрузкам. В работе [103] исследовано влияние боромеднения на некоторые характеристики прочности, пластичности и трения среднеуглеродистой стали. При борировании стали использовали смесь карбида бора (84%), буры (16%) и меди (2,4 и 8%). Процесс проводили при 950°С в течение 6 ч. Исследование показало, что введение в реакционную смесь 2—8% меди в 1,5—2 раза уменьшает толщину боридного слоя (рис. 34), снижает несколько микротвердость зоны реакционной диффузии, на 5—7 кг/мм2 уменьшает предел текучести, но на 60% повышает относительное удлинение, а также увеличивает ударную вязкость с 4,5 до 5,5 кГ/см2. Заметной зависимости между
139
изменением концентрации меди в исследованной области и толщиной диффузионного слоя не обнаружено. Микроскопические исследования, а также изучение влияния содержания меди в насыщающей смеси на эпюру сжимающих напряжений, проведенные в работе [103], показали, что в присутствии меди боридный слой более равномерен, т. е. менее ярко выражена его иглообразная структура (см. рис. 34).
Бориды серебра. Обзор имеющихся работ [24] по исследованию системы Ag--B дает основание заключить, что взаимодействия между бором и серебром нет. Сколько-нибудь надежных данных о существовании соединений в системе Ag—В не имеется.
В работах [683, 747] отрицается возможность взаимодействия между бором и серебром в твердом и жидком состояниях. Тем не менее имеются сведения о существовании бористого серебра [740, 1010]. Хансен [512] на основании критического пересмотра данных по системам Си—В, Ag—В и Au—В утверждает, что бор не растворяется ни в одном из этих металлов, кроме меди. Обровски [881] описывает диборид серебра AgB2, но не приводит экспериментальных данных о структуре и химическом составе этого соединения.
Учитывая трудность проведения реакции между бором и серебром, Уолд [1003] разработал методику, позволившую ему вводить в тигель с расплавленным металлом бор при избыточном давлении очищенного гелия. Металл и бор имели высокую чистоту (бор полупроводниковый, полученный зонной плавкой, серебро содержало 0,05% примесей). Готовились сплавы с содержанием 10; 66,6 и 75 ат. % В. Микроскопическое исследование сплавов показало отсутствие взаимодействия в жидкой фазе. В сплавах с содержанием 66,6 ат. % В (что соответствует приблизительному составу AgB2)} отожженных в течение одного месяца при 900° С, борид AgB^ не был обнаружен, а бор, появляющийся в виде эвтектики, в поляризованном свете принимает окраску ромбоэдрического а-бора. На рентгенограммах сплавов имелись отражения, не относящиеся ни к p-бору, ни к серебру, ни к а-бору, ни к AgB2. Некоторые из них были отнесены к другим формам бора, но и после этого оставались еще нерасшифрованные линии, что позволило сделать вывод о существований неизвестных ранее метастабильных или даже стабильных форм бора.
Повторными исследованиями системы Ag—В Уолд [1005] еще раз подтвердил отсутствие в ней каких-либо соединений. Ни рентгенографически, ни металлографически при использовании высокочистого бора соединение состава AgB2 обнаружено не было. Рентгеновский фазовый анализ показал наличие в образцах чистого металла и низкотемпературной стабильной формы бора — а-ромбоэдрического бора.
140
Бориды золота. Диаграмма сОс4оянйя СйстеМы Ай—Й нё построена. Сведения о наличии соединений в этой системе весьма малочисленны и противоречивы [24, 527].
В ранних работах [683, 747] при исследовании системы Au—В было обнаружено полное отсутствие взаимодействия между золотом и бором.
Обровски [881] упоминает о существовании диборида золота со структурой, близкой к АиВ2, но не приводит никаких данных о структуре и химическом составе борида. Муилер и Мел [855] показали, что в системе Au—В наблюдается незначительная растворимость бора в жидком золоте. Температура плавления золота поднимается при этом выше 1100° С. Химических соединений в системе Au—В по этим данным нет.
Уолд в своих работах [1003, 1005] описывает результаты исследования взаимного поведения золота и бора при введении расплавленного металла в тигель с расплавленным бором. Готовили восемь сплавов, содержащих 5, 10, 20, 50, 60, 66,6 (АиВ2), 75 и 80 ат. % бора. По данным термического анализа, температура плавления золота понижалась при этом до 1050± ±30°С. На микрофотографии сплава с содержанием 20 ат.% В наблюдаются равномерные включения кристаллов бора в матрицу из чистого золота. В поляризованном свете эти кристаллы окрашиваются в красный цвет, что свидетельствует о наличии ₽->а-превращения бора. В сплавах, содержащих 50 ат.% В и выше, включения бора становятся неоднородными, наблюдаются большие участки бора, не имеющие определенной кристаллической огранки. Сплав состава, близкого к АиВ2 (66,6 ат.% В), подвергался длительному отжигу при 1000° С в течение двух месяцев. Микроструктура сплава не изменилась. Образцы представляли смесь двух фаз: бора и золота. Отмечается, что период решетки золота практически не изменился (ади=4,080 ±0,005 А, период решетки чистого золота а—4,0786А). Некоторое изменение периода решетки золота свидетельствует о наличии незначительной растворимости бора в золоте. Для решения вопроса о количественном соотношении а- и p-бора сплавы золота ц 5 и 10 ат.% В растворяли в ртути. Нерастворившийся бор отделяли от амальгамы флотацией с изопропиловым спиртом и подвергали рентгеновскому анализу, который показал преимущественное содержание p-бора. Концентрация а-бора в сплавах мала. Линии, относящиеся к описанному ранее бориду АиВ2, не обнаружены.
Глава IV
БОРИДЫ МЕТАЛЛОВ И ГРУППЫ ПЕРИОДИЧЕСКОЙ СИСТЕМЫ ЭЛЕМЕНТОВ
БОРИДЫ БЕРИЛЛИЯ, МАГНИЯ И ЩЕЛОЧНОЗЕМЕЛЬНЫХ МЕТАЛЛОВ
Бориды бериллия. Лебо {795] и Шток [983] получали соединения бериллия с бором при взаимодействии окиси бериллия с бором и борного ангидрида с бериллием, В обоих случаях не было уверенности в образовании боридов бериллия, поскольку в продуктах реакции имелся углерод, а данных о фазовом составе боридов бериллия не было. Шток провел аналогию с системой Mg—В и предположил формулу соединения Ве3В2. Для сплавов с содержанием бора 10—20 ат.% обнаружена эвтектика, плавящаяся при 1125° С [971].
В 1955 г. опубликована работа Л. Я. Марковского,' Ю, Д. Кондрашева и Г. В. Капутовской [219], в которой установлено существование четырех боридных фаз бериллия:' а-фазы состава Ве2В (растворимой в кислотах), р-, у- и б-фаз составов ВеВ2, ВеВ6. и Ве5В соответственно (нерастворимых в кислотах). а-Фаза была получена синтезом из элементов при температуре выше 1100° С, а также при восстановлении борного ангидрида бериллием. Борид Ве2В представляет кристаллы цвета красной меди, кристаллизующиеся в кубической решетке типа CaF2, пространственная группа ОД период решетки а = 4,668±0,001 А, число формульных единиц в ячейке четыре, рентгеновская плотность 1,9 г/см?. Атомы бора располагаются в вершинах правильного куба, атомы бериллия —в тетраэдрических пустотах. Межатомные расстояния, А: 2,33 (Be—Be), 3,30 (В—В), 2,01 (Be—В),
Существование Ве2В подтверждено в работе [946]. Структуры остальных боридов бериллия описаны в работах [216, 217, 581].
Г. С. Маркевич [216] удалось синтезировать путем спекания порошков бора и бериллия при 800—г!900°С (образцы боридов синтезировались во всем интервале концентрацией от 0 до 100% В через каждые 5 ат.%) шесть индивидуальных химических соединений, в том числе а-, р- и у-фазы, описанные, но не изученные ранее.
Наиболее богатая бериллием фаза Ве5В наблюдается при атомных соотношениях Ве/В от 20; 1 до 2 : 1 (от 4 до 33 ат.%). Структура Ве5В тетрагональная, пространственная группа 142
D[h —Pblnmm, периоды решетки, A: a=3,368 ± 0,002, c=7,650±i ±0,005, c/a=2,093. Сравнение размеров ячеек б- и a-фаз дает основание заключить, что период а б-фазы приближается к 1/2 диагонали ячейки а-фазы (3,35 А), а с — около 3/2 периода а a-фазы. Из сравнения структур этих фаз следует, что введение одного дополнительного атома в ячейку Ве2В (в центр куба из восьми атомов бериллия), имеющую диаметр около 4 А (т. е. при замене двух слоев бора слоем из атомов бериллия), преобразует ячейку Ве2В в Ве4В. Предельное заполнение пустот атомами бериллия приводит к формуле Ве5В с 12 атомами в ячейке.
Таким образом, состав б-фазы может изменяться при заполнении пустот ячейки атомами бериллия от Ве4В до BesB, Такое же мнение высказывается в работе [575], в которой синтезировали борид бериллия состава Ве4В; рассчитанные и наблюдаемые структурные факторы дали хорошее соответствие с тетрагональной решеткой/ Пространственная группа Pbjnmtn и периоды решетки а=3,38±0,01 и с=7,06±0,02 А Ве4В совпадали с данными работы [216] для фазы BesB. Борид Ве5В наиболее химически активен: под действием горячей воды и разбавленных кислот легко Гидролизуется с выделением боро-водородов в значительно большем количестве, чем в случае гидролиза Ве2В. 0-Фаза (ВеВ2) образуется ь виде темно-серых спеков, структура этой фазы не расшифрована. Выше 1600° С 0-фаза разлагается, с кислотами она не реагирует.
По данным работы [946], фаза ВеВ2,о1±о,оз кристаллизуется в гексагональной сингонии, пространственная группа ТАд—-Р^/ттт, периоды решетки А: а=9,79±0,02, с=9,55±0,02, плотность 2,42 г/слА Сравнение плотности описанной фазы С плотностью, приводимой для ВеВ2 в работе [216], дает основание полагать, что в обеих работах речь идет об одном и том же соединении бериллия с бором. е-Фаза получена при температурах выше 1500° С, по составу она близка к ВеВ4.
В работе [412] при синтезе гексаборида ВеВ6 получен в смеси с a-фазой борид ВеВж, не растворимый в соляной кислоте. После обработки продуктов синтеза 6%-ным раствором НС1 нерастворимый остаток анализировался методом рентгенофазового анализа. Обнаружено, что рентгенограммы остатка сильно затемнены, но наблюдаемые линии хорошо индицируются в тетрагональной решетке типа UB4. В работе же [134] структура ВеВ4 описывается как аналог В12С3.
При дальнейшем увеличении содержания бора в сплавах с бериллием (80—90 ат.%) при 1400—1600°С обнаруживается фаза состава ВеВ6. Структура ВеВ« сложная, отличающаяся от структуры гексаборида кальция, так же как у диборида бериллия ВеВ2, структура отличается от гексагональной структуры типа А1В2. По данным работы [946], фаза BeBg представляет соединение состава BeB5t88±o,25 (по данным химического анали-
143
$а, 12,8±0,2% бе и 8б,3±0,5% 6). Ячейка тетрагональна^, близкая к ячейке структуры А1В12, плотность 2,33 г/см3.
£-Фаза получена при 1700—1900° С. Рентгенограмма этой фазы отличается от рентгенограмм описанных выше боридных фаз бериллия. Предполагают [946J, что состав £-фазы соответствует ВеВ9 или ВеВ12. £-Фаза обнаруживается в сплавах, содержащих до 95 ат.% В. Как и все соединения с высоким содержанием бора, эта фаза химически инертна. В работе [34] проведено исследование системы Be—В в зависимости от содержания шести и более атомов бора на один атом бериллия. Обнаружена значительная растворимость бериллия в решетке Р-бора (до 13 масс.%). Введение бериллия в бор способствует различным модификационным превращениям в боре. При 800° С сохраняется p-ромбоэдрический бор; от 1100 до 1300° С, в зависимости от количества растворенного бериллия, происходит превращение бора в одну из тетрагональных форм; при 1600° С образуется только тетрагональная модификация бора типа А1В12; при 2000° С образуется ромбоэдрический а-бор. Таким образом, нельзя сказать однозначно, является ли £-фаза индивидуальным соединением бериллия с бором или представляет стабилизированную высокотемпературную модификацию бора, не описанную ранее.
Штехер [984] методами микроскопического, рентгеноструктурного и химического анализов исследовал строение сплавов Be—В, полученных дуговой плавкой и методами порошковой металлургии, в жидком и твердом состоянии до содержаний 70 ат.% В. Определены линии границ фаз до 1150°С, построена диаграмма состояния Be—В (рис. 35). В области 60 ат.% В обнаружено новое соединение с тетрагональной симметрией и периодами решетки, А: а = 7,25, с = 8,46. Высказывается сомнение относительно существования таких боридов, как ВеВ4 И ВеВв. Фазовые отношения в области содержаний бора 70 ат.% требуют дальнейшего уточнения. Некоторые физические и химические свойства боридов бериллия приведены в табл. 46. Сравнение свойств боридных фаз бериллия дает основание разделить их на две группы: к одной отнести BesB, Ве2В, обладающие низкой температурой плавления, к другой — ВеВ4, ВеВ6 и ВеВ9 с температурами плавления, близкими к температурам плавления для тугоплавких соединений. Первая группа боридов обладает металлической проводимостью, вторая — полупроводниковой, подобно собственно бору [300]. Различаются и химические свойства: скорости окисления, азотирования, способность к гидролитическому разложению.
Бориды бериллия ВеВ2 и ВеВв взаимодействуют с углеродом при 900—1300° С с образованием борокарбидов составов ВеС2В2 и ВеС2В12 [234]. В работе [299] исследованы некоторые свойства борокарбидов бериллия. Установлено, что высший борокарбид бериллия ВеС2В12 по своим свойствам (структура, твердость и 144
электрические свойства) близок карбиду бора, низший боро-карбид бериллия ВеС2В2 имеет свойства полуметалла, приближающиеся к свойствам низших боридов бериллия (см. гл. VII).
Бориды бериллия Ве5В и Ве2В, а также эвтектические спла-
Рис. 35. Диаграмма состояния системы Be—В [984].
[227]. Выход бороводородов с увеличением содержания бора в бориде уменьшается. Разложение борида бериллия состава Ве2В схематически может быть представлено следующими уравнениями:
2Ве2В + 8Н2О = 2ВН3 + 4Ве (ОН)а -> Н2 +
2ВН3 4- 2 (I + х) Н2О = 2 (ВО• хН2О) + 5Н2
2ВеаВ + (Ю + 2х) Н2О = 2 (ВО-хН2О) + 4Ве (ОН)2 + 6Н2.
Борид бериллия состава Ве5В дает при гидролитическом разложении максимальный выход бороводородов (8—10%). Бориды бериллия ВеВ2, ВеВ6 практически не окисляются на воздухе и в азоте при 900° С. Устойчивость боридов бериллия на воздухе при высоких температурах понижается с уменьшением содержания в них бора (рис. 36).
Бориды магния. 'Диаграмма состояния системы Mg—В не построена. По данным различных работ [218, 648, 753, 845], в этой системе имеются четыре боридные фазы: MgB2, MgB4, MgB6 и MgB12. Кристаллическая структура высших боридов магния; MgBe и MgBi2 точно не установлена до настоящего времени.
10 Зак. 1305
145
Таблица 46
Некоторые физико-химические свойства боридов бериллия
Свойство б(Ве8В) а(Ве2В) Р(ВеВ2) «(ВеВ4) ?(ВеВв) ^[ВеВв(ВеВ12) J
Содержание бора» % Структура 19,36 Тетрагональная [57 5] "37,16 Кубическая, тип CaF2 [219] 70,61 Гексагональ- “ ная [946J — 82,76 Тетрагональная, тип UB. 1412] 87,81 Тетрагональная, близкая К А1Вц [731] 91,53 Тетрагональная [575, 946].
О Период решетки", А: а с с/а 3,38±0,01 [575] 7,0 64-0,0 2 2,088 4,6684-0,001 [219] 9.79+0,02 [946] 9.5540,0У 0,975 t 1 Г 10,16[731] 14,28[731] 1 ,405 8,80 [575, 946] 5,08 0,577
расстояние между атомами: А; Be—В а Be—В В—В Плотность, г/см*'. рентгеновская пикнометрическая Температура плавления, °C Область температурной устойчивости, °C- 2,01—2,14 [575] 1160 [216, 217] >1500 распад 2,33 3,30 3,01 1.9 2,18—2,211575] 1529 [216, 217] >1600 распад 1 п я ч 2,42* [946] — 1700 [216, 217] >1600 не сущест. 2,57 >2000 [216, 217] 2,33 2,35 >2000 [216, 217] >2000 [216, 217J
Удельное электросопротивление (при 20 °C), ом-см Термо-э. д. с., мкв-град Теплота образования, ккал/град Взаимодействие с кислотами Скорость окисления при 1200 °C, г/(см*‘Ч) Температура начала взаимодействия с углеродом, °C ЗО-Ю-6 [3001 -f-1,6 18,8±0,7 [380] Реагирует с выделением бороводородов [227], 9% бора в виде бороводородов 0,2676 [227] 900 [227] 12-10~4 [300] +8,8 16,7±0,7 [ 380] Реагирует с выделением бороводородов [227], 3% бора в виде бороводородов 0,1666[227] 900 [227] 2-10~2 [300] 15,5±0?7 [380] 0,0166 [227] 1000 [227] 11-10“[300] 20,8* [380] Не реагирует [227] 0,0237 [227] 1200[227] 1110“[300] 26,0±0,7 [380] 0,0581 [227] 1300 [227] 60-10“ [3001 38,6±0,7 [380J
* Расчетное значение..
При исследовании системы JAg—В использовались следующие методы получения сплавов: восстановление натрийборфто-рида Na2BF6 магнием; восстановление магнием борного ангидрида; непосредственное взаимодействие элементов; реакция между магнием и ВС13 [218, 229]; восстановление окиси магния
бором; взаимодействие окиси магния с карбидом бора в вакууме [412].
Еще в 1895 г. Муассан [24] отметил, что среди соединений бора с магнием есть бориды, легко разлагающиеся в воде и кислотах с выделением газообразных бороводородов, и бориды, не разлагаемые даже при длительной обработке в кислотах. Одной из наиболее трудно удаляемых примесей в аморфном боре является борид магния. Он может быть разложен путем сплавления с избытком борного ангидрида. Наиболее приемлемый способ получения боридов магния — синтез из
Рис. 36. Кривые окалинообразова-ния для боридов бериллия [227].
элементов. Л. Я, Марковский
и др. [218] синтез боридов магния осуществляли в графитовых пробирках в среде водорода в железных и кварцевых герметически закрытых реакторах в интервале температур 800—1200 °C.
Диборид магния MgB2 — порошок темно-коричневого Цвета,
кристаллизуется в гексагональной сингонии, изоструктурен А1В2, пространственная группа Dl6h —Р6/тттг одна формуль-
ная единица в ячейке, рентгеновская плотность 2,63 г/с.и3. Структура MgB2 — трехгранные призмы из атомов магния, содержащие в центре атом бора. Базис ячейки: Mg (ООО), В (1/3 2/3 1/2, 2/1 1/3 1/2). Расстояние между соседними атомами магния одного слоя 3,08 А, Между атомами магния соседних слоев — 3,52 А, кратчайшие расстояния Mg—В и В—В соответственно равны 2,50 и 1,78 А [218]. Периоды кристаллической решеткц MgB2, А: а = 3,0834 ±0,0003, с=3,5213±0,0006.
Диборид магния может быть отнесен к группе диборидов переходных металлов, таких, как Ti, Zr, Hf, V, Nb, Та и Cr, имеющих близкие с магнием значения атомного радиуса металла; отличается от них своей высокой химической активностью [218]. Образуется диборид магния уже при 720±20°С синтезом из элементов, при температурах выше 800—900° С образуются бориды магния с большим содержанием бора; их образование, по-видимому, связано с термическим распадом MgB2 (табл.47), [218], сопровождающимся удалением части магния.
10* 147
Таблица 47
Фазовый состав продуктов распада MgB2
Температура прокаливания, °C Длительность прокаливания, ч Содержание нерастворимого остатка, масс. % Фазовый состав продукта по данным рентгеновского анализа
800 2 6,2 MgB2
900 4 24,5 М§В2Н-следы фазы А
1000 2 81,3 Фаза Я-|-следы MgB2
1100 2 86,1 Смесь фаз
1200 2 92,6 Фаза 5
1300 2 1 . > В
1400 2 — » В
1500 4 — » в
Фаза А образуется как при термическом распаде MgB2 при 1000° С после прокаливания в течение 3 ч, так и при синтезе из элементов при соотношении Mg:B = l:n, где п = 4~6 при 1000—1100° С либо в чистом виде, либо в смеси с фазой Б. Л. Я. Марковский и др. [218] приписывают фазе А состав MgBe, причем указывают на ее довольно широкую область гомогенности. По этим данным содержание магния в бориде MgBe колеблется от 19 до 32,5%. MgB6 термически нестоек, теряет магний вследствие летучести, что ведет к выделению избыточного бора в элементарном виде и пониженному содержанию магния по сравнению с расчетным (27,2% Mg по расчету в MgBe) •
В работе [412] борид магния состава MgB6 был получен при взаимодействии окиси магния с бором в вакууме при 1400° С, содержание магния в бориде было также несколько ниже расчетного.
Фаза Б дает индивидуальную рентгенограмму, довольно сложную для расшифровки, плотность этой фазы 2,47 г/см3. Получается она (см. табл. 47) при 1100—12Q0°C, выше этой температуры фаза Б распадается с выделением фазы В. По-видимому, фаза Б соответствует составу MgB4.
В работах [412, 941] получен борид магния, близкий по составу к MgB4. Борид MgB4, полученный боротермическим методом в вакууме [412] и синтезом из элементов при 1300° С, содержал 67,5% В (расчетное содержание бора в MgB4 64,03%). В работе [380] предполагается, что MgB4 кристаллизуется в тетрагональной сингонии. Были выделены [702] монокристаллы MgB4 и исследована их структура. Тетоаборид магния кристаллизуется в ромбической сингонии, пространственная группа Рпат, периоды решетки, А: а = 5,464 ±0,003, в = 7,472 ±0,003, с=4,428±0,003.
Фаза В (см. табл. 47) — самая высокотемпературная из всех боридов магния [218]. Она устойчива даже при 1500° С при длительном нагревании в вакууме. Порошки этой фазы имеют 148
темно-коричневый цвет и плотность 2,44. При температуре выше 1700° С этот борид разлагается с выделением элементарного бора и отгоном металлического магния. Состав фазы очень близок к MgB12 (табл. 48). Рентгенограмма MgB12 идентична рентгенограммам неочищенного «муассановского» бора и частично рентгенограммам бора, полученного в разряде восстановлением ВС1з водородом. Это служит основанием утверждать,
Таблица 48
Результаты опытов по получению MgB12 [218]
Условия получения Состав, масс. % Фазовый состав, по данным рентгеновского анализа Примечание '
Mg в
Расчетный состав MgB12 15,5 84,5 MgB12
Синтез Mg:B=l;6 при 15,4 82,0 MgBi2+B Опыт на брикети-
1200 °C, 2,5 ч рованной шихте
Термическое разложение / 12,7 82,0 1
MgBe при 1230 °C, 1 ч 1 14,8 83,5 f MgD12
То же, при 1380 °C, 1 ч 15,0 81,3 MgB12+B (?) —
То же, при 1300 °C, 1 ч 13,6 81,6 MgB12+B (?) —
Термическое разложение в
течение 1 ч при, °C:
1200 15,0 80,9 MgB12+B (?) —
1300 15,0 82,2 MgB12+B (?) —
1400 14,8 81,4 MgB12+B (?) —.
1470 13,8 83,3 MgB12+B (?) —
1700 0,9 9.6,6 Чистый В ] Опыты в вакуумной
1900 0,4 97,8 » В / печи
что фаза В — трудно растворимая боридная примесь, на которую в свое время указывал Муассан [845]. MgB12— важный промежуточный продукт магниетермического способа производства бора [229].
Система Mg—В представляет нелегкий объект для исследования в связи с высокой летучестью магния и сложностью выделения монокристаллов образующихся в ней бинарных соединений, а также из-за трудности химического определения свободного и связанного бора. Все это не дает возможности внести достаточную ясность в вопрос о составе и структуре высших боридов магния.
Однако на основании рентгеновских данных (все бориды магния дают индивидуальные порошкограммы), а также поведения боридов магния в химических реагентах существование боридов магния MgB2, MgB4, MgBe и MgB12 не вызывает сомнений. Ранее описанный [24] борид магния состава Mg3Ba в работах Л. Я- Марковского и др. [211, 218, 224] не подтвержден; этот продукт представляет смесь MgB2 и магния.
149
электронных конфигураций, которые характерны для жестких ковалентных связей. Роль электронных sp2- и $р3-состояний изменяется в зависимости от донорных способностей атомов, взаимодействующих с атомами бора с образованием твердого тела. Различные комбинации sp2- и хр3-электронных конфигураций и обусловливают все многообразие структурных типов, в которых кристаллизуются бориды.
Кисслинг [769] при обсуждении кристаллических структур боридов принимает за основу образование структурных элемен-
Рис. 1. Структурные элементы из атомов бора в боридах:
а — изолированные атомы бора; б—1 пары из атомов бора; в —• зигзагообразные цепи; г — прямолинейные цепи; д — разветвленные цепи; е —сдвоенные цепи; ок -г-страеиные> цепи; з — гофрированные плоские сетки; а-’Плоские упакованные сетки.
тов из атомов бора.^н^бнаружил^ . чтр^томыцборд^ боридах занимают либо изолированные положения, либо образуют пары 1ШГТ5брныё~цепотаи различнб^ГТложности (прямые, зигзагообразные, зигзагообразные с боковыми ветвями, ленты, плоские' или гофрированные сетки..двух- и трехмерныё ячейки),
В ряде боридов, содержащих выше 50 ат. % В, атомы бора связаны в каркас, состоящий из гофрированных сеток (структурные типы a-ThSi2, СгВ4, МпВ4) или октаэдров В6 (ThB4 и СаВ6). В структурах боридов, содержащих свыше 85 ат. % В, каркас образован кубооктаэдрами (UBi2) или икосаэдрами (В4С, NaBis, YB66, AlBio).
Предложенная Кисслингом классификация структурных типов боридов (рис. 1) удобна и лежит в основе многих работ [561, 814]. В табл. 1 приведены кристаллохимические характеристики боридов.
10
Бориды с изолированными атомами бора. К этой Группе относятся бориды со структурой типа CuA!2 (С-16), как и тесно примыкающая к этому типу б-фаза в системе Мп—В. Оба типа состоят из слоев тетраэдров металлических атомов с атомами бора в порах между этими слоями (рис. 2), Сюда же относится большое число боридных фаз: Та2В, Мо2В, W2B, Мп2В, Со2В, Ni2B. Фазы Мп4В и Сг2В имеют ячейки, близкие по типу
к ромбическим. Расстояние В —В в них больше, чем ’в’ других соединениях бора (например', в бориде жеЛезИ оно равно 2,12 А). Изолированные атомы бора с расстояниями В—гВ больше 2,8 А обнаружены в Re3B, Ni3B, Pd5B2 и Ru7Ba.
В структурах, изоморфных U3Si2 (V3B2, Nb3B2), атомы бора также изолированы, а атомы металла образуют тригональные и тетрагональные призмы. В центрах первых находятся пары из атомов бора,
- Рис. 2. Структурный тип CuAla-
в центрах вторых — атомы ме-
талла.
Бориды с цепями из атомов бора. Установлено несколько типов структур с атомами бора, образующими цепи.
В боридах состава МеВ, кристаллизующихся в структурных типах CrB (VB, NbB, ТаВ, CrB, ₽-МоВ, p-WB, NiB), FeB (TiB, 6-МпВ, FeB, CoB) и a-MoB (a-MoB, a-WB), ^томы бора образуют зигзагообразные цепи. Все три типа различаются взаимным расположением призм, образованных металлическими атомами. ’ L
В структуре типа СгВ (ромбическая ячейка б четырьмя формульными единицами) атомы металла образуют трехгранные призмы, в центрах половины которых находятся атомы металла, сквозь остальные призмы параллельно оси z проходят зигзагообразные цепи из атомов бора.
Структура боридов типа FeB отличается от структуры СгВ размерами призм и их размещением [24].
Структура МоВ (тетрагональная ячейка с восьмью формульными единицами) отличается от структуры СгВ и FeB тем, что призмы из атомов металла расположены слоями с чередующимся направлением их боковых граней (одни параллельны оси х, Другие — оси у).
Бориды со смешанными элементами из атомов бора. Среди боридов встречаются структуры, в которых наблюдается одновременное присутствие различных комбинаций структурных элементов из атомов бора. Например, в структурах V3B2 и Сг5В3 имеются изолированные атомы и пары из атомов бора.
11
В работе Рея (цит. па [24]) при изучении продуктов гидролиза боридов магния делается заключение о существовании борида магния состава Mg2B4, но рентгеновских данных о структуре фазы этого состава не приводите#, поэтому остается предположить, что и в данной работе был получен диборид магния MgB2.
Сведения о физико-механических свойствах боридов магния весьма ограничены. В работах [52, 380] проводилось исследование некоторых термохимических и теплофизических свойств боридов магния (теплоемкости, энтальпии, энтропии и давления Диссоциации, теплот образования). Эти характеристики, изученные для борида магния состава MgB12,' необходимы для термодинамического анализа стадии рафинирования «сырого» бора, сводящейся к Нго диссоциации и отгонке магния [218]:
MgB|2(TB) == Mg^ -f- 12В(тв)?
Теплоемкость MgBi2 исследовалась с помощью адиабатического калориметра. Погрешность не превышала 0,5%. Высокотемпературные (до 1800° К) определения изменения энтальпии осуществлялись в адиабатических калориметрах смешения, Погрешность измерений до 1200°К не превышала 1%, а между 1200 и 1800°К—1,2—1,5%. На основании полученных данных рассчитаны интерполяционные значения истинных молярных теплоемкости, энтропии и изменений энтальпии MgB12 в интервале Температур 0—.1800° К (табл. 49), Монотонное изменение с температурой термодинамических характеристик свидетельствует об отсутствии H MgB12 превращений. Давление диссоциации MgBi2 при 1700° К составляет примерно 10~s атм. По этим данным, а также по величинам термических характеристик рассчитана теплота образования MgB12 из компонентов и температурные зависимости АЯ°т(а), А5°Г(а), AZ°T(a) и lg/<P(a) реакции Диссоциации MgB^ [52].
В работе [989] при измерении низкотемпературой теплоемкости боридов MgBJ2 и MgB4 замечено, что их теплоемкость при низких температурах не подчиняется закону Дебая (~ Т3). Это характерно для кристаллических веществ, имеющих слоистую структуру [884]. Таким образом, на основании Исследова-» ния низкотемпературной теплоемкости предполагается наличие у тетраборида магния слоистой структуры [989]. Кроме того, делается вывод о присутствии более слабых связей между слоями, чем внутри слоев. Это вытекает как обязательное следствие из подчинения низкотемпературной теплоемкости MgB4 закону Т2 [989].
Исследователями, занимавшимися изучением боридных фаз в системе Mg—В [218, 224, 227, 229, 412], замечено большое различие их поведения в химических реагентах. Диборид магния медленно гидролизуется по реакции
MgB2 + ЗНаО = Mg (ОН)а + ВгО + 2Н2.
150
Таблица 49
Некоторые свойства боридов магния
Свойство MgBa MgB4 MgBs MgBla
Содержание бора, % 47 64,03 72,8 84,5
Структура О Периоды решетки, А: Гексагональная, тип А1В2 [218] Ромбическая [702] Тетрагональная [380] Не расшифрована
а 3,0834 ±0,0003 [218] 5,464 ±0,003 [702] 7,07 [380] -з—
в 7,472 ±0,003 — —
с 3,5213±0,0006 4,428 ±0,003 6,45
с]а Плотность, z)cms'. 1,142 — 0,912
рентгеновская 2,63 2,495+0,005 [702] — —•
пикнометрическая 2,48—2,67 [218] 2,47 [218] 2,45—2,47 [218] 2,44 [218]
Область гомогенности, масс. % 44—47 [218] — 69—77 [218] 82—83,5 [218]
Теплота образования, ккал/моль 13,3±0,8 [380] 17,6±0,6 [380] 22,4 ±0,5 [380] 34,4 [52]
Энтропия, кал/(моль-град) 8,60±0,04 [989] 12,41 ±0,06 [989] — 21,32 [52]
Теплоемкость, кал/(моль • град) 11,43 16,81 —— 3,905 [52]
Химические свойства Разлагается водой и кислотами с выделением бороводородов Водой и кислотами не гидролизуется
С кислотами MgB2 бурно реагирует с выделением бороводородов [218, 994]. При обработке горячей соляной кислотой M.gB2 полностью растворяется, причем до 1,1% общего количества бора выделяется в виде газообразных бороводородов. Одновременно выделяется около 2 моль водорода на 1 моль MgB2. При гидролизе диборида магния в сильно щелочной среде образуются борогидриды металлов [773].
Гидролиз диборида магния исследовался в работах [24, 983], однако наиболее подробно химизм процесса гидролиза боридов магния был изучен Л. Я. Марковским и др. [225]. Гидролитическая стойкость боридов магния определялась при разложении боридов в разбавленной соляной кислоте при нагревании и характеризовалась суммарным выходом бороводородов (B2Hg+B4Hio), определенным по поглощению в воде и в концентрированном растворе Щелочи. Полученные результаты показали, что бороводороды образуют только продукты, содержащие диборид магния MgB2, а при гидролизе MgB6 и MgB12 бороводороды не выделяются. Сплавы MgB2 с магнием дают больший выход бороводородов, чем чистый диборид (табл. 50).
Таблица 50
Зависимость выхода тетраборана от состава спеков магния с бором
Соотношение Mgs В в исходной шихте Состав спека, масс. % Бор в виде тетраборана, % Фазовый состав по данным рентгеновского анализа
®общ нерастворимый остаток
1:4 57,5 40,5 0,56 MgBa
1:3 53,8 44,8 0,46 MgB2
2:5 48,8 26,7 1,39 MgB2
1:2 45,0 10,5 1,31 Хорошо сформированный MgB2
1:1 31,8 5,45 2,87 MgB2-|-Mg
3:2 23,3 2,92 3,53 MgB2+Mg
2:1 18,8 2,84 3,84 MgB2-|-Mg
3:1 13,5 1,46 4,00 MgB2-j-Mg
10:1 4,69 1,69 4,30 MgB2 (слабые отражения) + Mg
Это объясняется гидрирующим действием водорода, образующегося при растворении магния в разбавленной кислоте. Показано методом инфракрасной спектроскопии [225], что при гидролизе MgB2 в качестве конечного продукта образуется тетраборан.
Диборид магния по своей химической активности и растворимости в кислотах с образованием бороводородов существенно отличается от большинства диборидов переходных металлов, для которых характерна высокая химическая стойкость [225, 227, 229].
Высшие бориды магния MgB4, MgB6 и MgB12 весьма стойки по отношению к разбавленной соляной кислоте [218, 702]. Так, 152
при 80-часовом кипячении в НС1 (1:1) MgB6 в раствор перешло только 0,019% В; при кипячений MgB12 в течение 100 ч в НС1 (1:1) в раствор не перешло требуемого для проведения химического анализа количества магния и бора. Перекись водорода и азотная кислота разлагают MgB6 и MgB12 очень медленно, даже при кипячении, в'расплавленных карбонатах и щелочах они растворяются медленно.
Реакция гидролитического разложения боридов магния при обработке кислотами — одна из основных, при получении бороводородов [227]. Имеется сообщение об использовании боридов магния в качестве инициатора в реакциях превращения a-BN^p-BN [337].
Бориды щелочноземельных металлов. В системах Са—В, Sr—В и Ва—В получены и идентифицированы бориды состава МеВ6, кристаллизующиеся в кубической решетке типа СаВ6 (см. рис. 9). Имеется указание на существование тетраборидов СаВ4 и ВаВ2, но убедительных доказательств этому нет.
Структура борида СаВ6 и изоморфных ему боридов была изучена в работах [891, 970]. Структура СаВ6 кубическая, пространственная группа О*—РтЗт с одной формульной единицей в элементарной ячейке. Атомы металла находятся в положениях (1/2, 1/2, 1/2) и образуют простую кубическую решетку. Шесть атомов бора занимают положения (±«00), (0±и0) и (00±м) (см. рис. 9). По данным работы [970], п = 0,3±0.02. Каждый атом бора находится приблизительно на равном расстоянии от пяти соседних атомов бора, с которыми он связан прочной связью. Наличие этих связей создает трехмерную сетку, в пустотах которой размещаются ионы кальция.
Паулинг [891] провел глубокий кристаллохимический анализ структуры СаВ6, уточнил значение и. По этим данным, н=0,293±0,001. Расстояние В—В составляет 1,716А, что несколько меньше длины одинарной ковалентной связи (1,78А).
Устойчивость борного каркаса из шести атомов бора в СаВ6 обеспечивается осциллирующими ковалентными связями В—В, усиливающимися валентными электронами атомов металла [668, 670].
Квантово-механические расчеты энергетических полос МеВв с учетом только s- и p-функций показали, что гексабориды двухвалентных щелочноземельных металлов должны быть полупроводниками [806], расчеты с учетом S-, р- и d-функций показали наличие в них полосы проводимости [671].
Берто и Блюм [580] экспериментально установили, что в гексабориде бария часть атомов металла может быть замещена атомами одновалентного натрия. Содержание натрия в бориде бария соответствует составу Вао,57Као,4зВб, т. е. предельная электронная концентрация составляет 1,6 электрона на атом металла. Очевидно, на образование связей В—В в гексаборидах атом металла передает не 2э-электрона, а несколько меньше
153
(около 1,6), Оставшиеся примерно 0,4 электрона на атом металла могут переходить в коллективизированное состояние и обеспечивать высокую электропроводность.
Физические свойства гекса боридов щелочноземельных металлов изучались во многих работах. Ю. Б. Падерно и др. [3I7J измерили удельное Электросопротивление, эффект Холла, термо-э^ Д. с. и термический коэффициент электросопротивления на образцах гексаборидов кальция, стронция и бария стехиометрического состава. С целью оценки возможности применения однозонной модели к рассматриваемым соединениям по методике [185] было рассчитано значение 6= — =п+и^—п_и^.
ер2 "Г
Для сравнения рассчитана б для гексаборидов редкоземельных металлов, которые кристаллизуются в структурном типе СаВ6. Во всех случаях, за исключением SmB6, абсолютное значение б достаточно велико, что свидетельствует о существенной роли электронной проводимости в гексаборидах (табл. 51).
Расчет параметров электропереноса, проведенный в однозонной модели, показал, что гексабориды кальция, стронция и бария имеют малую концентрацию носителей. Таким образом, весь электронный коллектив участвует в организации связей, т. е. происходит заполнение валентных уровней.
Сравнительно небольшие величины удельного электросопротивления гексаборидов щелочноземельных металлов объяс-
Таблица 51
Некоторые электрические свойства и параметры электропереиоса гексаборидов щелочно- и редкоземельных металлов [317]
Борид Удельное электросопротивление, мксм-см Коэффициент Холла, 10”4 см*/к Термо-э. д. с., мкв/град Термический коэффициент электросопротивления, 10“ ® град~1 Концентра• ция носителей тока п*, электрон на 1 атом металла Подвижность носителей и*, см*/(в- сек) в, 10м сиДв’Х Хсек»)
СаВ6 222 —91,0 —32,8 -1,16 0,05 41,0 —11,5
SrBe 111 —76,3 —30,3 -0,83 0,06 68,7 —38,7
ВаВ6 77 —57,5 —26,2 1-1,08 0,08 74,7 —60,5
YBe 40 —4,56 —0,5 И,24 0,96 11,4 —17,8
LaBe 15,0 —4,96 +0,1 1-2,68 0,90 33,1 —137,8
CeBe 29,4 —4,18 +2,8 - J г1,00 1,06 14,2 —30,2
РгВ6 19,5 —4,33 —0,6 1-1,92 1,02 22,2 —71,1
NdB6 20,0 —4,39 +0,4 1-1,93 1,00 22,0 —68,5
SmBe 207,0 +1,54 +7,6 -0,42 2,86 0,74 +0,2
EuBe 84,7 —50,2 —17,7 +0,90 0,09 59,3 —43,7
CdB6 44,7 —4,39 +0,1 +1,40 0,94 9,8 —13,7
TbBe .37,4 —4,57 —1,1 + 1,31 0,94 12,2 —20,4
YbB6 46,6 —83,6 —25,5 +2,34 0,05 179,4 —240,3
ThB6 14,8 —2,18 —0,6 +2,31 1,99 14,7 —62,1
154
няются высокой подвижностью носителей, связанной с малым рассеянием в заполненной полосе.
Значения термо-э. д. с. боридов кальция, стронция и бария значительно выше по абсолютной величине, чем термо-э. д. с. боридов трехвалентных металлов (см. табл. 51), причем при переходе от СаВ6 к SrB6 и далее к ВаВ6 она несколько снижается.
В работе (417] было проведено исследование некоторых свойств гексаборида стронция, уточнено удельное электросопротивление, измерена микротвердость, оценена теплота образования SrB6 из элементов, определены теплота сублимации ц коэф'1 фициент излучения. Полученные величины измеренных свойств приведены в табл. 52.
Таблица 52
Физические свойства гекса боридов щелочноземельных металлов
Свойство СаВв SrBe ВаВ,
Содержание бора, масс. % 61,82 42,53 32,07
Структура Кубическая, Кубическая, Кубическая,
тип СаВ6 тип СаВв тип СаВ6
Период решетки а, А 4,148 4,190 4,280
Плотность, г!см?'. 4,25
рентгеновская 2,45 3,44
пикном етрическая 2,49(297] 3,28(297] 4,26[297]
Теплота образования, ккал!моль —~ 50,4(417]
Теплота сублимации, ккал]моль —- 97,2(417] » 1
Температура плавления, °C 2235(788] 2235[788] 2270[788]
Теплопроводность, 10—а кал/(см-сек'Х. 55±4 (190] 63±5 [190] 87±4 [190]
Хград)
Коэффициент термического расширения, 10-« град-1 5,64(82] 6,7 6,8(485]
Удельное электросопротивление, 123,5(297] 191,8[297] 306 [297]
МКОМ* СМ
Магнитная восприимчивость, 10—6 813(190] 0[190] 1520[190]
ед. СГСМ/люль 1 ,41 [190]
Магнитный' момент^ 0(190] 1,92[190]
Работа выхода, эв Микротвердость, кГ1мм3 2,86(788] 2,67(788] 3,15(297]
2740 [297] 2900 [417] 3000[297]
Коэффициент излучения (л=0,655 мкм) — 0,79 [417] ——*•
Исследование электрических свойств гексаборидов щелочноземельных металлов в интервале температур 77—300 и 1,3—300° К, проведенное Ю. Б. Падерно и др. [318] на спеченных и полученных дуговой плавкой образцах, показало, что свойства плавленых и спеченных образцов существенно различны. Абсолютные значения удельного электросопротивления при комнатной температуре для плавленых СаВ6 и ВаВ6 на три порядка выше, чем для спеченных [51]. Вырожденное со-
155
стояние плавленых образцов типично для полуметаллов. Эти данные находятся в хорошем согласии с результатами исследования свойств монокристаллического SrB6 [428, 749].
Результаты этих работ дают основание считать, что свойства гексаборидов щелочноземельных металлов зависят от метода их получения и наличия в них примесей.
Расчет электронного спектра гексаборидов щелочноземельных металлов по методу сильной связи (МО—ЛКАО) [51] показал, что их полуметалличность следует связать с компенсированным незаполнением уровня (3Ajg) и частичным заполнением вышележащих состояний. Тепловые свойства гексаборида кальция изучены Я. И. Дутчаком и др. [82]. Теплопроводность и магнитная восприимчивость гексаборидов щелочноземельных металлов исследованы в работе [190].
Бориды щелочноземельных металлов имеют относительно низкие работы выхода и большие плотности тока эмиссии [161, 297, 788], в связи с чем они могут найти применение в термоэлектронных приборах в качестве термоэмиттеров. В табл. 52 приведены физические свойства гексаборидов кальция, стронция и бария.
Химические свойства боридов щелочноземельных металлов были систематически исследованы и обобщены в работах Л. Я. Марковского и др. [31, 215, 226, 232].
Бориды кальция, стронция и бария устойчивы против действия кислот (кроме азотной) и щелочей. Разложение боридов щелочноземельных металлов разбавленной соляной кислотой при кипячении с последующим поглощением газообразных продуктов реакции водой и раствором щелочи показало, что они не гидролизуются и не выделяют бороводородов. Кроме того, эти бориды химически более устойчивы, чем дибориды титана, циркония и хрома. Азот до 1400° С не действует на СаВ6, SrB6 и ВаВ6. С углеродом образуют борокарбиды [215, 241]. В кислороде они начинают окисляться при температурах .выше 600° С. Однако образование защитной окисной пленки препятствует полному сгоранию боридов CaBe, SrBe и ВаВ6 и в этом случае.
Методы получения. В работах [32, 33, 659] исследован химизм карботермического способа получения боридов щелочноземельных металлов. Показано, что в этом случае параллельно с образованием гексаборидов образуются борокарбиды, бораты и карбид бора. Введение дополнительной операции очистки продуктов реакции приводит к получению борида кальция практически стехиометрического состава с незначительной загрязненностью углеродом (до 0,5%). Трудоемкость этого метода, связанная с введением дополнительных операций, тормозит его широкое использование.
В настоящее время при производстве боридов кальция, стронция и бария используются карбидоборный и боротермический методы получения, основы которых уже разработаны 156
[32, 33, 210, 412, 417, 472, 591, 659]. Оба способа основаны на протекании следующих реакций:
МеО + В4С + 2В (или С в случае перекиси бария) МеВв 4- СО;
(1)
МеО + В -> МеВ, + В2О2; (2)
МеСО8 4- В МеВв 4~ В2О24~СО2. (3)
Последняя реакция протекает через стадию восстановления карбоната до окиси по реакции МеСОз~>МеО + СО2.
При получении гексаборида кальция карбидоборным и боротермическими методами по реакциям (1) и (2) в шихту вводится дополнительно 10 масс. % СаО для компенсации потерь кальция при испарении. При 1600° С и выдержке 1 ч состав борида кальция близок к стехиометрическому (37,6 масс.% Са; 61,7 масс. % В) [472].
Гексаборид бария лучшего качества получается при использовании как исходных продуктов карбоната бария и бора [по реакции (3)]. В этом случае из смеси расчетного состава получается стехиометрический ВаВ6, не загрязненный углеродом (68,3 масс.% Ва; 31,3 масс.% В при 1500° С и выдержке 1 ч). Гекса борид стронция, близкий по составу к расчетному, получается по реакциям (1) и (2) при 1600—1800° С [417, 591].
В работе [472] проведен анализ методов получения боридов щелочноземельных металлов. Показано, что скорость образования гексаборидов при получении их восстановлением окислов бором в вакууме выше, чем при карбидоборном взаимодействии. При образовании гексаборидов существенную роль играет упругость паров окислов металлов, самих металлов, а также высокие скорости испарения щелочноземельных металлов и их окислов в вакууме.
Ф.1 Г- Мамедов и др. [210] изучили влияние органической среды, используемой при мокром замешивании исходной смеси, и установили, что бензол приводит к загрязнению углеродом до 0,1%, ацетон меньше загрязняет смесь (до 0,02%), спирт — лучшая среда для приготовления шихт.
В работе [210] рекомендуют при получении боридов кальция, стронция и бария использовать мокрое смешивание на спирту, перетирание смеси для разрушения конгломератов через капроновое сито и проведение опытов в печи с вольфрамовым нагревателем.
Бориды щелочноземельных металлов, как уже отмечалось, могут найти использование в качестве материала катодов электронных приборов. Есть указание на использование борида кальция в составе сплавов с карбидом бора и бором, обладающих высокой прочностью (сплав с содержанием 35% СаВ6, 5% В и 60% В4С характеризуется прочностью при поперечном изгибе 33 kFImm2 [807]).
157
БОРИДЫ МЕТАЛЛОВ ПОДГРУППЫ ЦИНКА
Бориды цинка. Взаимодействие цинка с бором изучалось в работе [683], в которой не обнаружено образование химических соединений и отмечается, что кипящий цинк не растворяет аморфный бор. Л. Я. Марковский и Ю. Д. Кондрашев [221] исследовали методами рентгеновского и химического анализов реакцию между бором и металлическим цинком и установили, что бор внедряется в решетку цинка, о чем свидетельствует довольно заметное перераспределение интенсивности линий цинка на рентгенограмме продуктов реакции. В. Н. Гурин и др. [74] установили, что аморфный бор после пребывания в кипящем цинке и последующей Кислотной обработки содержит 18—20 масс. % цинка.
.Индивидуальные соединения в системе. Zn—В не обнаружены. Тем не менее вопрос о взаимодействии бора с цинком представляется интересным В связи с возможностью получения монокристаллов диборидов переходных металлов IV—VI групп периодической системы из растворов в расплаве цинка [74]. Было проведено [136] исследование характера взаимодействия аморфного и зонноплавленого бора с гранулированным цинком ((99,99%). Навески выдерживали в эвакуированных кварцевых ампулах и кварцевых трубках с экранирующим током аргона при 500, 800° С и температуре кипения цинка (906® С) [478] от 1 мил до 96 ч с последующей закалкой в воду либо с медленным охлаждением. При этом установлено, что цинк адсорбируется бором из водного раствора НС1. Кроме того, прутки компактного зонноплавленого бора диспергировали при обра-
Таблица 53
Результаты рентгеновского анализа зонноплавленого бора и ZnB~22
Вис;х Висх ZnB^22
I d/n 1 d/n I d/п. I din
10 5,15 5 5,6 5 2,05 5 1,775
5 4,70 3 4,05 5 1,77 1 1,73
1 4,00 5 3,62 1 1,72 3 1,69
2 3,78 2 3,27 1 1,68 4 1,555
1 3,59 2 2,80 5 1,556 2 1,437
1 3,46 4 2,50 1 1,455 2 1,390
3 2,89 4 2,35 8 1,430 1 1,355
2 2,64 1 2,22 5 1,388 2 1,300
3 2,49 2 2,14 8 1,350 2 1,097
2 2,40 10 2,06 L_ 1,322
2 2,33 1 2,00 2 1,307
1 2,23 2 1,84 2 1,286
158
Таблица 54
Растворимость ZnB~22 в различных реагентах при кипячении в течение 2 ч и при комнатной температуре в течение суток [136]
Реагент Нерастворимый остаток» % Фильтрат, масс. % Примечания
В Zn В + Zn
НС1 ( кип. 99,35 99,3 -au г * Фильтрат не анали-
( хол. 99,75 — знровался
HaS64(K0Ifll) ( КИП. 99,75 »
1 хол. 99,50 ♦—г —.
H2SO4 (1:3) f кип. L ХОЛ. 99,25 99,25 *— . Ч1.Г
NaOH г кип. L хол. 98,28 97,33 т —ч
NaOH (13,7%) f кип. ! ХОЛ. 99,35 99,80 -5—
KOH (12,1%) ’ кип. . хол. 99,50 99,50 М — —•
HN°8(k0HU> кип. 0,80 78,57 20,13 98,70
хол. 1,63 78,49 20,22 98,71
НР(конц) i кип. [ хол. 96,30 0,25 0,38 Потери бора нз-за
98; 18 0,38 —' летучести в присутствии галоидо-
1,47 8,05 20,11 20,50 водородных кислот
HF(kohu) + HNO3 ' кнп. хол. 4,78
1 1СЙП. 0,98 47,68 19,75 97,50
Нь1(конц) + НЛиЗ(К0НЦ) хол. 2,87 76,17 19,38 95,50
(3 . 1) H2O2(~30%) КИП. хол. 49,75 80,23 — — Для фильтрата результаты неудов-
30% НД + кип. 5,87 летворительны
4-NHO3( +Н2О 98; 95 - — . - из-за присутствия
(1:1:3) перекиси, мешающей определению
5,87 бора
30 % Н2О2 + NaOH + кип. — —-
-рН2О (1:1:3) хол. 98,95 -г- —- —-
Na.COo (сплавление) — 78,89 20,70 99,59
кю4 + НС1 79,89 20,70 99,59
ботке йх кипящим цинком в течение 10 мин и 2 ч на гранулоаморфные частицы размером от 2 до 2000 мкм, при этом степень дисперсности возрастала с увеличением времени контакта. По данным, химического анализа, в таких частицах, предварительно обработанных НС1 (1:1), содержание цинка лежит в пределах 20—68 масс.%. Явление диспергирования компактного бора в цинковом расплаве объясняется значительным сни
159
жением свободной поверхностной энергии на границе жидкий цинк—твердый бор в результате абсорбции.
При контакте аморфного бора, обладающего большой удельной поверхностью (7—40 .ад2/г), с цинковым расплавом в результате абсорбции цинка бором и внедрения атомов цинка в решетку бора образуется сплав с содержанием цинка 19—20 масс.%, что соответствует примерному составу ZnBao-24. В работе предполагается, что получено индивидуальное соединение ZnB~22, образование которого можно объяснить абсорбцией цинковых паров либо абсорбцией цинка из жидкой фазы, а зависимость содержания цинка в боре от температуры расплава связана с изменением константы скорости химической реакции с температурой.
Сравнение межплоскостных расстояний (табл. 53) рентгеновских отражений зонноплавленого бора и ZnB~22, а также значений микротвердости (микротвердость ZnB~22 равна 3511 ±211 кГ/мм2 при нагрузке на индентор 30 Г; это значение очень близко к микротвердости зонноплавленого бора 3428±61 К.Г1ММ1} вызывает сомнение относительно существования индивидуального химического соединения бора с цинком.
Исследование химических свойств ZnB~22 показало отсутствие избирательной растворимости сплава в различных химических реагентах (табл. 54), на основании чего все же делается вывод [136] о получении индивидуального химического соединения бора с цинком.
Имеющиеся в сообщении [136] противоречивые данные о свойствах сплава условного состава ZnB»^ требуют дальнейшего уточнения для доказательства возможной индивидуальности полученного соединения.
Глава V
БОРИДЫ ПЕРЕХОДНЫХ МЕТАЛЛОВ
БОРИДЫ МЕТАЛЛОВ Ша ПОДГРУППЫ
Бориды скандия. Диаграмма, состояния системы Sc—В не построена. Первые сведения о существовании боридов скандия относятся к 1958 г. [94]. В различных работах [195, 411, 427] показано' существование двух боридных фаз скандия: ScB2 и ScBi2. В работе [658] определены структура боридов скандия и их некоторые электрофизические и химические свойства.
Диборид скандия ScB2 кристаллизуется в гексагональной сингонии, имеет структуру типа А1Вг, пространственная группа Dl6h —PQ/mmm, периоды решетки, А: а = 3,148, с = 3,516 (с/а= 1,116), рентгеновская плотность 3,665 г/см3, плотность, определенная пикнометрически, 3,642 г/см3 [96, 658]. ScBi2 изо-структурен UBia с кубической решеткой и периодом а = 7,422 А, рентгеновская плотность 2,890 г/см3, пикнометрическая — 2,883 г!см3 [658].
Имеются указания на существование тетра- и гексаборидов скандия ScB4 и ScB6 {411, 427]. Однако позже [900] бориды скандия этого состава подтверждены не были.
В области высоких содержаний бора, соответствующих составу борида МеВ2о, наблюдается образование высокобористого твердого раствора скандия в p-ромбоэдрическом боре [614]. Следует отметить, что растворение скандия в p-боре приводит к резкому возрастанию твердости бора. Микротвердость такого высокобористого твердого раствора составляет 4210 кГ/мм?. Эффект возрастания микротвердости p-бора при растворении в нем скандия аналогичен такому же эффекту при введении в p-ромбоэдрический бор марганца [614].
Физические свойства боридов скандия изучались на компактных образцах, полученных методом горячего прессования в графитовых прессформах при 2000—2050° С и давлении 100 кГ/см?-, образцы, приготовленные таким образом, были однофазными.
Бориды скандия ScB2 и ScBi2, по данным работ [411, 427, 571], типичные металлические проводники. Удельное электросопротивление ScBa равно 7—15 мком-см, термо-э. д. с.— 7,7 мкв/град, коэффициент термического расширения в интервале температур 20—800°С — 9,48-10-8 град~1, коэффициент из-
11 Зак. 1305 ' 161
Лучения при Х=0,650 мкм— 0,89. Температура плавЛения ScB2, определенная по методике [387], равна 2250° С. Микротвердость диборида скандия 1780±80 кГ)мм2. Свойства диборида скандия дают основание расположить его в ряду ScB2—TiB2—VB2—CrB2 и считать крайним членом этого ряда.
Температура плавления, микротвердость и коэффициент термического расширения диборидов скандия и хрома весьма близки, что при высокой электропроводности и, следовательно, теплопроводности ScB2, а также его плотности, приблизительно
Таблица 55
Результаты взаимодействия боридов скандия с концентрированными кислотами
Борид Реагент Время взаимодействия, ч Температура» °C Нерастворимая часть борида, % Скорость разложения, г/ч Содержание Sc в растворе, масс. %
ScBg HC1 (d= 1,19) 1 80 25,0 0,75 0,67 49,6 44,9
ScB2 H2SO4 1 300 32,8
(d = 1,84)
Sc В 2 HNOS (d = l,4) 1 120 22,5 0,88 51,6
ScB^a HC1 (d = 1,19) 5 80 99,2 0,002 0,2
SctJjg H2SO4 (d = 1,84) 4 300 86,4 0,03 3,5
ScB12 HNOS (d = l,4) 1 120 19,2 0,81 20,4
на 35% меньшей, чем у СгВ2, делает перспективным использование диборида скандия в составе легких жаропрочных сплавов, в которых в настоящее время используется диборид хрома СгВ2 [352]. Компактные образцы диборида скандия не окисляются на воздухе до 700° С [427]. Химическая и термическая устойчивость боридов скандия изучалась на порошках крупностью 40 мкм.
В воде бориды скандия не разлагаются. При взаимодействии боридов скандия с концентрированными кислотами (табл. 55) диборид скандия ScB2 сравнительно хорошо разлагается; относительная скорость разложения диборида в соляной, серной и азотной кислотах практически одинакова; ScBi2 устойчив к воздействию соляной и серной кислот, но хорошо разлагается в концентрированной азотной кислоте. Действие разбавленных кислот на ScB2 и ScBi2 практически не отличается от действия на них концентрированных кислот.
Химическая стойкость боридов скандия вытекает из их кристаллического строения; с усложнением структурных элементов 162
йз атомов бора химическая стойкость повышается. В структуре ScB12 атомы бора имеют пространственную координацию вокруг атомов скандия, расположенных в центрах трехмерных борных сеток. Атомы скандия надежно экранированы атомами бора, в связи с чем повышается устойчивость ScBi2 к воздействию различных реагентов, особенно таких, по отношению к которым атомы бора инертны. Это наблюдение хорошо согласуется с основным выводом Л. Я. Марковского и др. [225, 228] о химической стойкости боридов переходных металлов, возрастающей с увеличением содержания в них бора.
Анализ нерастворимых остатков после разложения боридов скандия в кислотах и самих растворов показал, что формульный состав соединений сохраняется. Порошки боридов ScB2 и ScB12 устойчивы на воздухе до 600° С.
Химический анализ окисленных порошков показал, что окисление боридов скандия на воздухе идет через образование оксиборидов скандия с последующим их разложением на борный ангидрид и окись скандия [195].
Бориды скандия неустойчивы в контакте с графитом, при высоких температурах наблюдается образование карбоборида скандия ScB2C2 с ромбической структурой (пространственная группа РЬат, периоды решетки, А: а = 5,175±0,005, 6 = 10,075± ±0,007, с — 3,440±0,005).
Методы получения. При исследовании возможности получения боридов скандия были использованы следующие методы: взаимодействие окиси скандия с карбидом бора и боротермическое восстановление окиси скандия в вакууме по реакциям
ScA 4- В4С + С ScBx + СО; (1>
ScA + B-> ScBx+ВА. (2)
В работах [427, 614, 900] проведено детальное изучение системы Sc—В в широком интервале температур (1200—2200° С) и составов 2^B/ScC100. Диборид скандия. ScB2 образуется при 1850° С, додекаборид ScB12 — при 1750° С при проведении реакций (1) и (2) в вакууме.
Бориды иттрия. Обзор исследований по системе Y—В сделан ранее [428]. Диаграмма состояния, подробно изученная в работе [809] (см. также [77]), показана на рис. 37. Максимальная растворимость бора в иттрии 0,1 масс.%. В системе обнаружены пять фаз: YB2, YB4, YB6, YB8 и YB7o. Состав последнего соединения точно не установлен и находится между YB50 и YB7o [428]. Диборид и тетраборид плавятся конгруэнтно. Температура перитектического превращения X+YB4^YB6 найдена равной 2600° С, что на 300° С выше, чем по данным работы [159]. Сведения относительно температур плавления (разложения) фаз неоднозначны (табл. 56), однако конгруэнтный характер плавления YB2 [214] и YB4 [259] установлен надежно.
11* 163
Таблица 56
Свойства боридов иттрия
1" " *
Свойство та, YB, YBo YB,„
Содержание бора» % Структура Пространственная группа 19,56 Гексагональная ^[98] 32,72 Тетрагональная Д5Й[2 59] 42,18 ♦ Кубическая Од [259] 59,34 Кубическая Од [2591 89,49 Тетрагональная Fm3c[951J
Периоды решетки, А: 6 С с/а Плотность, г/см*: рентгеновская пикнометрическая Теплота образования, ккал/моль-Температура плавления, °С£1&9] < 3,3036 ,3,8427 1.1632[240] 5,07 [240] 4,86[240] 2100 7,107 4,018 0,565 [240] 4,36 [927i 2800 4,1001 [83]; 4,1017 [240] 3,76(809] 3,72[80] 24[159] 2600 (разл.) 2300 [159] 70 30 40 7,589 [83]; 7,501 [320]; 7,500[827] 3,43 [258] 2200 (разл.) 11.75 12,62 4,07[240] 2000 (разл.)
Теплопроводность, кал/(см-сек-град) [187]: 'Чбщ 10»Ле Ю’Ьф 1 1 1 1 1 1 1 4 1 1 1 t
Коэффициент термического расширения, 10*-9 ера#—1* по а (I) [98] по с (all) [98] Удельное электросопротивление, мком-см Термический коэффициент сопротивления, 10 2 град * Коэффициент термо-э. д. с., мкв/град Коэффициент Холла, 10“"4 см* [к, Работа выхода, эв Постоянная Ричардсона, а/(см*-град*) [259] Микротвердость*, кГ/мм* Предел прочности на изгиб*, кГ/см* Коэффициент излучения при 1500 °C (Х=0,655 мкм) Характеристическая температура, °К 9,4±Г,0 8,5±0,9 39 [749] —3,05(428] 3,23—3,46 [2.14] 7,6±0,5 6,4±0,6 28,5(749] —21,3 [428] 3,2[259] 1,58-10» 2850±100 290 6,02±0,6 40,0[416] 0,124(416] 4,6(159] —4,56(416] 5,31 [259] 2,24-10» 2575±100 270 0,7 [428] 570[501] 6,6±0,6 94,8[749] 5,36[259] 3,16-10» 2500+150 165 Н 1 i 1 111 н । г
* Пористость образцов 22—26%.
YB2 имеет гексагональную структуру типа А1В2 с периодами решетки, А: «=3,3036, < = 3,8427, (с/а= 1,632) [240]. Структура УВ4 тетрагональная (тип .UB4), а=7,107А, с=4,018А [240]. Близкие значения периодов получены Гизе и др. [688], подробно
2 4 S' 8 10 15 20 30 В,маос.%
-т^' II ЧГ Г lUllg
_____________S?
• —за zW * , *
^9,5
!
22Ш5
рассмотревшими структуру этого соединения. Гексаборид иттрия кристаллизуется р кубической «сингонии (тип СаВв, а= = 4,1001 А [83]), додекаборид имеет кубическую решетку ти-звов' па UB12 («=7,501 [320],
7,498 А при 78° К [320]),£W.
YB70—тетрагональную (а=
= 11,75 А, с = 12,62 А, </«= = 1,07) [809]. 220в-
В работе [82] приведена температурная зависимость пе-^ риода кристаллической решет-кй YBe. Я. И, Дутчак и др. [83] '
в дальнейшем показали, что/W-эта зависимость д диапазоне I от комнатной температуры ДО;^[_
700° С может быть представ лё- у Ю М S0
на аналитически: а=4,0097Х
гт ^70,5
Ж
"7
2000
1230
25,5
J.
80В,ат.°/^
X (1+5,82-10~6/+2,36-10-9/2) А. Рис» 37, Диаграмма состояния систе-
Шветц и др. [951] описали мы Y—B-
гектаборид иттрия (состав подобных фаз лежит в области MeB8O_ioo), имеющий кубическую ячейку с периодом а—23,446 А (пространственная группа f/n3c).
Бориды иттрия получались взаимодействием иттрия и бора, восстановлением окислов металла и бора углем, вакуумнотермическим борокарбидным восстановлением, боротермическим восстановлением Y2O3, электролизом расплавленной смеси Y2O3, В2О3 с добавкой окислов лития и магния или их фторидов [78, 159, 212, 240, 259, 320, 428].
Свойства соединений системы Y—В приведены в табл. 57. По данным работы [321], электросопротивление YB12 при повышении температуры с 2Q0 до 950° С Нозрастг(ет от 30' до 90 мком-см. Более низкие значения электросопротивления по сравнению с сообщавшимися ранее (см. табл. 56) объясняются
отсутствием экстраполяции на нулевую пористость в прежних работах. Коэффициент термо-э. д. с. в интервале температур 0—800° С изменяется в пределах от —4 до -—11 мкв/град [321].
Меерсон и др. [259] изучили термоэлектронную эмиссию YB4, YB6 и YB 12. Наибольшее значение плотности тока ЗмисСии установлено у тетраборида (/=0,284 а/см? при 1890°К). С YBe и YBia на танталовой подложке можно снимать токи 9,68-10-4—2,01 • IO-5 а/С}Аг при максимальной рабочей температуре 1790 и 1730° К соответственно. Исследованные бориды по
165
своим эмиссионным свойствам значительно уступают гексабориду лантана.
Данные работы [214] подтверждают предположение [213] о том, что в ряду соединений системы РЗМ — бор термоэмиссия будет тем больше, а работа выхода тем меньше, чем больше отношение Me/В. В ряду YB4->-YBe->YBi2 эффективная работа выхода в зависимости от температуры испытаний изменяется соответственно как 3,55—3,63->4,2—4,3->-4,6 эв [259]. Значения ср, полученные для YB6 Г. А. Меерсоном и др. [259], резко расхо-Дятсй с данными работы [428] (2,22 эв), что связано, по-видимому, с изменением фазового состава образцов, вызванным высокотемпературной обработкой катодов [428].
Коэффициент термического расширения в интервале 78—300°К для YB12 составляет 2-Ю-® град~1 при 300°К — 3,6-10-6, а в интервале 300—1300°К — 5,2-10-® град”1 [320]. В работе [82] приводится температурная зависимость истинного коэффициента термического расширения а и его вкладов «о и щ для фазы YBe (табл. 58).
В работе [258] приводится предел прочности YB6 при изгибе, равный 380—400 кГ/см? (при пористости около 30%), что существенно выше значений, полученных в исследовании [259] (см. Табл. 57),
Микротвердость гектаборида равна 2620 + 50 кТ/мм? [951].
В. В. Одинцовым и др. [306] показано расположение энергетических полос и их заселение электронами в некоторых кубических додекаборидах металлов. Полученный энергетический спектр позволяет объяснить металлические свойства YBI2, определяющиеся частичным заполнением уровня (2/2?)2.
Исследование температурной зависимости магнитной восприимчивости х в интервале 70—570°К показало, что YB2— типичный диамагнетик; значение х не превышает 10-7 ас-1 см? [214].
Таблица 57
Температурная зависимость коэффициента термического расширения a и его вкладов а0 и ai* для YBe [82]
т, °к а, 10 8 град~1 «о/а, % т, °к а. 10“* граЭ-1 а»/а, % «i/af, %
273 5,82 100 0 523 6,99 , 83,15 16,85
293 5,91 98,40 1,60 573 7,22 80,43 19,57
323 6,05 96,09 3,91 673 7,69 75,51 24,49
373 6,29 92,49 7,51 773 8,15 71,15 28,85
423 6,52 89,15 10,85 873 8,62 67,27 32,73
473 6,76 86,04 13,96 973 9,08 63,79 36,21
• а0 и а, —коэффициенты в уравнении os=ao-|-a1f-f-a1fJ4-.... рассчитанные в работе [82].
166
Из фаз YB4, УВб и YB12 наиболее устойчивыми к воздействию кислот и щелочей являются YB6 и YBj2 [259, 626]. Низший
борид иттрия YB2 отличается малой химической стойкостью и уже на холоду энергично растворяется в разбавленной НС1
(1 : 10) [259]. Установлено, что до 10% В, содержащегося в бориде, образует бороводороды, остальная часть — субокисел В2О2, который, растворяясь в воде, переходит в субборную
кислоту В2Ог-хН2О. Это соединение легко окисляется на воздухе, но в инертной среде устойчиво. Тетра- и гексабориды практически не растворяются в сильно разбавленной соляной кислоте. Гексаборид, по данным этой же работы, растворяется только при нагревании с азотной кислотой. Различное поведение боридов по отношению к кислотам позволяет отделить их друг от друга.
Обсуждается возможность применения боридов иттрия в электронной технике, в частности, высказывалось мнение [428], что из УВб могут быть изготовлены более эффективные катоды, чем из гексаборида лантана, со снижением рабочих температур на 100— 150° С. Однако бориды иттрия по своим эмиссионным свойствам уступают LaB6.
Рис. 38. Диаграмма состояния системы La—В.
Бориды лантана. В работе 1319] построена диаграмма состояния системы La—В (рис. 38), подтвердившая существова-
ние двух соединений: конгруэнтно плавящегося гексаборида с областью гомогенности в сторону бора (до 88 ат.%) и LaB4, образующегося по перитектической реакции
, „ ~1800°С , _
LaBfi+Ж. ' —* LaB4.
ТеТраборид имеет тетрагональную решетку, тип UB4, с периодами, А: « = 7,328±0,004, с=4,175±0,005 [428], LaB6 — кубическую, тип СаВ6, « = 4,1551 А [83]. Близкие значения « (4,1566 и 4.1573А) для гексаборида приведены в работе [98].
Период решетки LaB6 при температуре от комнатной до 700°С выражается уравнением «=4,1547 (1+5,48-Ю-6 /+ ±1,79-10-9^) А [83].
Имеется указание Фелтена и др. [663] о существовании области гомогенности у соединения LaB4 до состава ЬаВ2. Однако
167
практическое постоянство/ параметров элементарной ячейки, отмеченное этймй же исследователями, ставит под сомнение наличие широкой области гомогенности тетраборида лан^ тана.
Относительно существования области гомогенности у LaB& опубликовано значительное число работ, данные которых весьма противоречивы [97, 210]. В связи с этим Н, Н. Журавлевым И Др. [97] в "1967 г. было предприняло рентгенографическое исследование сплавов от LaB6 до LaBia и показано, что область гомогенности гексаборида лантана незначительна и находится в пределах LaBe—ЕаВб,5.
JB том же году на основании прецизионных измерений периода решетки образцов с различным содержанием лантана и бора вблизи состава LaBg- Ф. Г, МамеДов и др/ [210] отвергли предположение о существовании области гомогенности у этой фазы. Изменение фиолетового цвета на голубой для образцов с небольшим избытком бора Приписано дисперсным включениям бора, не обнаруживающимся микроскопически и рентгенографически.
При исследовании LaBe, подвергнутого высокотемпературному прессованию при высокий давлениях (до 2300° С и 85 кбар), установлено, что гексаборид лантана может существовать в широком интервале составов за счет образования дефектной структуры с дефицитом атомов лантана в решетке типа СаВе. Образование дефектной структуры сопровождается изменением плотности и цвета кристаллов борида при сохранении размеров элементарной ячейки. При значительном дефиците йтомов лантана (в интервале LaB8—LaBg), когда число атомов металла становится недостаточным для сохранения неизменности размеров каркаса из атомов бора, наблюдается увеличение объема элементарной ячейки. Эти результаты подтверждают высказанное Постом, Лафферти и др. [428] положение об образовании фазы вычитания на основе гексаборида лантана, С учетом электронного строения гексаборидов редкоземельных металлов образование твердого раствора вычитания на основе LaBe с Сохранением каркаса из атомов бора возможно до состава, соответствующего наличию достаточного числа валентных электронов металла для организации ковалентных связей В—В в каркасе, т. е. 1,6 электрона на атом металла. Такая электронная концентрация Достигается при составе LaBn,2. Г. В. Самсонову и др. [428] удалось получить фазу примерного состава LaBu, окрашенную в лазурно-Эеленый цвет и имеющую кубическую решетку с периодом, несколько меньшим периода гексаборйда. Работа выхода электронов одного из этих препаратов найдена равной 2,16 эв, что значительно ниже работы выхода LaBe [416].
В системе La—B отмечалась [428] фаза LaBx (х=3-=-4), кристаллизующаяся в тетрагональной сингонии с периодами, А-168
ц = 3,82, с == 3,96. ’ Предполагается, что это соединение стабилизируется незначительными примесями углерода. Другие попытки синтезировать LaBi2 оказались Тщетными [97, 98, 428].
Бориды рантана получались синтезом из элементов, восстановлением смесей борногр ангидрида и окиси лантана углем, при взаимодействии Ьаг'Оз со смесью углерода и бора, карбидоборным или боротермическим восстановлением La2Os, электролизом расплавленных, сред [97,. 98, 254, 415, 428]. Наибольшим распространением, <в частности для получения LaBg, пользуютсй методы, основанные на восстановлении окиси лантана бором или карбидом бора. Однако примесь связанного углерода может привести к разрушению изделий из гексаборида вследствие разложения карбида (карбоборида) лантана влагой [243]. По этой причине боротермическое восстановление
2La2O3 ЗОВ = 4LaBe -4- ЗВ2О2
следует считать более надежным методом получения LaBe. R А. Меёрсон и Др. [264] показали, что оптимальная температура восстановления при одночасовой выдержке в вакууме 10-Б мм рт. ст\ составляет 1900 ±20° С (по данным работы [260] 1800°С). Шихта должна содержать 5%-ный избыток^бора, пористость брикетов 53—55% (давление прессования 0,4— 0,5 Т/см2), скорость подъема температуры в интервале 1300—1900° С около 18—20 град!мин, содержание влаги в Ба20з не более 5%.
Свойства гексаборида лантана изучены довольно хорошо (табл. 58—61). Приведены многочисленные сведения по эмиссионным характеристикам LaB6, в частности по работе выхода: от 2,66 До 2,90 эв [260]. Одной из причин таких значительных отличий могут явиться разный химический состав образцов, их недостаточная чистота, возможно различная зернистость и др.
С, В. Ермаков и др. [85] показали, что в д^иапазон^ температур 1000—1400° К и составов LaB3,8—LaBe,4 работа выхода борида линейно зависит от температуры и состава. По их данч ным, при одинаковой чистоте препаратов увеличение содержания бора не понижает, как указывалось в некоторых исследовау ниях, а повышает работу выхода. При 1400° К различные порошки LaBg (5—6 нм) на вольфрамовой подложке имеют следующие значения работы выхода: чистый с избытком бора (66,77% La, 33,2% В) <^2,75 эв; чистый стехиометрического состава (68,2% La, 31,78% В) —2,64 эв; чистый с избытком лантана (68,9% La, 31,1 % В)—2,59 эв; особо чистый стехиометрического состава (68,15% La, 31,83% В)—2,55 эв. Технический борид имеет наибольший разброс значений работы выхода: при 1400° К среднее —2,69 эв, максимальное — 2,74 эв. Температурный коэффициент работы выхода у особо чистого гексаборида наименьший (0,8- 10-4 эв/град).
169
Физические свойства
Металл Борид Молекулярная масса Содержание бора, % Структура Кристаллохим ическ ие
Пространственная группа о Периоды решетки, Л
а С с/а
La LaB3 171,34 18,93 Тетрагональная — 3,82 3,96 1,04
LaB4 182,15 23,74 То же °45Л 7,324 [98] 7,324 [667] 7,30 4,175 4jll [667] 4,17 0,570 0,571 0,57
LaBe 203,78 31,83 Кубическая «а [98] 4,1573 [98] 4,1566 4,1551 4Д^4
Се СеВ4 183,36 23,58 Тетрагональная 7,205 7,208 [667] 4,090 4,091 [667] 0,568 0,568
СеВв 204,99 31,64 Кубическая 4,137 4,141 1"
Рг РгВ3 173,34 18,71 Псевдокуби-ческая — [512] 3,81 — —
РгВ4 184,15 23,48 Тетрагональная D4b 7,20 7,241 [667] 4,11 4,119 [667] 0,57 0,5^9
РгВв 205,77 31,52 Кубическая O/J 4,130 4,1307 —
Nd NdB4 187,48 23,06 Тетрагональная oh [83] 7,219 7,220 [667] 4,102 4,102 [667] 0,568 0,568
NdB„ 209,11 31,02 Кубическая Oi 4,125 4,1237 [83]
170
[353,495]
свойства
1 1 рентгеновская Плотность, s/см9
1 1 пикнометрическая
1 1 Теплота образования, ккал/моль Термохимические свойства
1 I Скрытая теплота испарения, ккал/моль
' I, 1 Теплоемкость, ккал/(г-град)
1 1 Температура плавления,
| | 1 Теплопровод-। иость, кал/(ему. X сек- град) L Термические свойства
1 ~ По а (а_1_) ! 7,17±1J6 По с(а ||) 8,36±1,03 [98] П Коэффициент термического расширения, 10 6 град“~^
О Sa X X
Металл Борид Молекулярная масса Содержание бора, % Структура Кристаллохимическне
Пространственная группа Периоды решетки, А
а с/а
Pm PmB4 209,87 30,91 Кубическая tf-* т-
Sm SmB4 193,59 22,34 Тетрагональная 7,174 7,178 [667] 4,0696 4,071 [667] 0,567 0,567
SmBe SmBjLoo 216,82 29,92 *4'4' Кубическая $ O/J 4,131 4,115 [6] 23,487
Eu EuBe 216,83 29,92 4,178 4,155 [6] -U—
Gd GdB3 189,68 17,10 Тетрагональная —S- 3,79 3,63 0,96
GdB4 200,49 21,57 То же П5 , u4h Р ifmbtn [212] 7,120 [212] 7,145 [667] 4,048 [212] 4,048 [667] 0,569 0,567 г
GdBe GdB^oo 222,12 29,20 Кубическая * olh 4,1144 23,474 [951] . Я— ‘ I 1
Tb TbB4 202,17 21,39 Тетрагональная 7.И8 7,119 [667] 4,0286 4,029 [667] 0,566 0,566
TbB„ 223,79 28,99 Кубическая °; 4,1020 —* —
TbBia TbBjoo 288,66 44,94 «*♦ » > ^5 t О > 7,504 [792] 7,507 [320] 23,457 [951] — —
172
свойства
I F 5,385 6,579 4 ** 5,33 [212] 6,52 ' [212] 6,03 4,938 4 5,076 6,14 1 рентгенов’ екая Плотность,
I 1 F I I 5^288 [78] I J I 4,79 F пикнометрическая t
1 1 ' 117,8 [353,495] 1 1 114,7 [353,495] 1 j 112,2 [353,495] J 108,6 [353,495] I 105,7 [353,495] Теплота образования-, ккал /моль Термо
1 I 1 1 1 1’1 4 1 1 4 1 J 1 Скрытая теплота испарения, ккал/моль химичек
1 1 1 1 I 1 F t f I 1 1 1 к Теплоемкость, ккалЦг-град) о S в»
1 1 1 1 1 ~2500 1212] I >2500 [212] 1 2150 1 „ю*— to (JJ 4b 00 СЛ <—> О о о © 4 r Температура плавления, •С а и
1 1 О о йь 00 H-о 8 00 1 1 0,049±0,003 1 F 0,055±0,002 4 0,033±0,004 1 I Теплопроводность, калЦ.см'Х. Хсек-град) о 3 г £3 -о о г» о я
1 w ьэ W to о 1 ь 1 J 4 1 1 98*9 1 6,5 J 1 Коэффициент , термического расширения, 10”в град”1 скне свойства Л я я о н р OL St g
00
Металл Борид Молекулярная масса Содержание бора, % Структура Пространственная группа Кристаллохимнческие
о Периоды решетки, А
а С с/а
Dy Но DyBa DyB4 DyBe DyBia DyB100 HoBa [604a] HoB4 HoBe 184,12 205,74 227,37 292,23 186,55 208,17 229,80 11,74 21,02 28,53 4,39 *** 11,58 20,77 28,23 Гексагональная Тетрагональная Кубическая » » Гексагональная Тетрагональная Кубическая 1 1 1 Q5 СГ Ъ* 3,83 [77] 7,101 7,102 [667] 4,0976 4,148 [6] 7,464 7,501 [527] 7,499 [320] 23,441 [Э 7,064 7,086 [527] 7,087 [667] 4,096 4,45 [77] 4,0174 4,017 [667] 3,811 4,000 4,0079 [527] 4,008 [667] 1,16 0,566 0,566 1,162 0,566 0,566 0,566
HoB12 294,66 44,03 °h п 7,492 — —
HoBjoo » — 7,491 23,441 [951] — —
Er ErB4 ErBe 210,50 232,13 20,54 27,94 ТетрагО' нальная Кубическая о 7,071 7,071 [667] 4,110 3,9972 3,997 [667] 0,565 0,565
ErB12 ЕгВюо 296,99 43,68 » 7,484 7,482 [320] 23,428 [951] — —
174
СП
5,49 — 120,0 — — 2200
[353,495] [6]
свойства I
рентгеновская ! Плотность, г/см9
пикнометрическая
Теплота образования, ккал/моль Термохимические свойства
Скрытая теплота нспа-. рения, ккал/моль
Теплоемкость, ккал/(г-град)
Температура плавления, °C
Теплопроводность, кал/(ему. X сек • град) Термические свойства
Коэффициент термического расширения, 10”в град~г
2а
и* оо>
х
ct>
*
Металл Борид Молекулярная масса Содержание, бора, % Структура Кристаллохимические
Пространственная группа О Периоды решетки, Л
а С cfa
Tm TmBa 190,55 If,34 Гекса го- D'to 3,250 3,739 i ,15
[604a] , нальная 7,06 0,57
TmB4 212,18 20,38 Тетраго- Dlh 3,99
нальная 7,057 3,987 0,565
[667] [667]
TmBe 233,80 27,74 Кубическая ol п 4,110 т* —’
TmBia 298,67 43,44 °h 7,476 — *—ч
7,474
[320]
TmBloO 23,433 м
Yb [951]
YbB3 205,47 15,78 Тетраго- 3,77 3,562 0,94
нальная
YbB4 216,28 19,99 То же n5 U4h 7,01 4,00 0,57
7,064 3,989 0,565
[667] [667]
YbBe 237,91 27,27 Кубическая 0^ 4,144 — ь—*
4,1478 •—>
[841] 4,1482 <5
[83]
YbBia 302,77 . 42,85 » 7,468 Um
[320]
YbBl№ *** А — 23,722 «—••
Lu [951]
LuBa 196,59 11,00 Гексаго- D^h 3,246 3,704 1,141
нальная
LuB4 218,21 19,82 Тетраго? Din 6,997 3,938 0,563
нальная 7,036 3,974 0,565
[667] [667]
. LuB8 239,81 27,05 Кубическая °h 4,11 — -» UM
LuB12 304,70 42,58 о 7,464 —
LuB100 > — 23,412 —
[951]
476
Продолжение табл. 58
свойства Термохимические свойства Термические свойства
Плотность а о В £ н к S со пикнометричес- 7? кая js Теплота образования, ккал/моль Скрытая теплота испарения, ккал/моль Теплоемкость, ккал/(г-град) Температура плавления, СС Теплопроводность, *алЦсмК ХсеК'град) Коэффициент термического расширения, 10~8 град~1
7,09 5,59 4,756 6,74 7,31 5,556 5,53 1841] 9,76 7,52 5,74 4,868 5,55 4,37 5,45 [841] 129,0 [353,495] 131,5 [353,495] 134,0 [353,495] III II II 1 1 Г 1 II III Ф , III II 1 1 1 II II III Л— 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 0,060±0,004 3,85 [320] 5,85** 3,75 [320] 3,4[320]
12 Зак. 1305
177
Физические свойства
Металл Борид Электрические и магнитные
Удельное электросопротивление, мком*см Термический коэффициент сопротивления, 10—8 град-1 Коэффициент термо-s. Д. с., мкв/град Коэффициент Холла, 10“* сл’/к Эффективный магнитный момент, НВ Магнитная восприимчивость, 10~•
La LaBs LaB4 LaBe 17+ 9,1* [319] г— +0,268 7?0 • 10,8 —+96 —4,68* [319] 9,0 Диамагнитен
Се CeB4 CeBe 60,5; 43,3 +0,100 1,1 —4,18 2,49 [888] т~ 2260
Рг PrBs PrB4 PrBe 31,7 19,5 24*[319] +0,192 г7б —4,33 —5,08* [319] 3,59[888] 4800
Nd NdB4 NdBe 28,0 19,6* [319] +0,193 8,7 —+39 —4,98* [319] 3,54 [888] 2420
Pm PmBe — —*• — — —
Sm SmB4 SmB8 SmBjQQ 200 249* [3119] сч 1 ч 1 3,4 8,4* [319] ,1* +1,54* +2,68* [888] 2,52 г 1810
Eu EuBe 84,7 2-10е* [319] +0,090 —17,7 —38,5* [319] —50,2 8,1 [888] а—
178
"Таблица 55
боридов лантаноидов
Термоэмиссиониые Оптические Прочностные
Работа выхода» эв Постоянная Ричардсона, а/(ои«Х Херад’) Коэффициент вторичной эмиссии Коэффициент излучения при Х= «0,655 мкм Цвет Микротвердость , кГ/мм* Предел прочности при изгибе, кПсм*
• 2,55[85] 29 0,95 0,7 Пурпурно-фиолетовый 2770 3250 [258] 1290 [6]
2,07— 2,42 2,59— 2,93 - -т* 3,6 0,68 0,68 f Серовато-коричневый Сине-фиолетовый —Н-» 3140 Г 1
3,12 т—• 300 Г И ••Л 0,67 Серовато-коричневый Синий
3,97 420 0,64 Синий 2530
— —• — — — [951]
4,4 1 1 1 1 I 1 0,68 Серовато-коричневый Синий Черный 2500 2510 ±50 1951] 1510[6]
4,9 — *—1 0,83 Темно-серый — I1 11 1870 [6]
12 ♦
179
Металл Борид Электрические и магнитные
Удельное электросопротивление, мком-см Термический коэффициент сопротивления , 10—2 град""1 Коэффициент термо-э. д. с.» мкв/ерад Коэффициент Холла, 10~4 см»/к Эффективный магнитный момент »в Магнитная восприимчивость, 10-в
Gd GdB3 .
GdB4 — — — — 8,07 [889] —
GdBe 94,3 4-0,140 +0,1 —4,39 8,01[888] 21 000
GdB10# — — — — — .—
Tb TbB4 — — — — —
TbBe TbB12 TbB100 88,0 4-0,131 —1,1 —4,57 9,43[888] —
— — — — —
Dy DyB2 — __._
DyB4 — — — — 10,4[889]
DyBe — — 10,63 «' —
[888]
DyB12 — — — — — —
UyBioo — — '— — — —-
Ho HoB4 — — •— 10,8[889] —
HoBe —— — — — — —•
HoBi2 — —. — — 1 '
Hob100 — —
Er ErB4 — — — 9,52[889] —
ErBe ErB100 — — — — —
Tm TmB4 — — — — 7,68[889] —
TmBe — ____ —
TmBls —— — —
TmB100 — • • — —
180
Продолжение табл. 59
Термоэмиссионные Оптические Прочностные
Работа выхода, эв Постоянная Ричардсона , а/(см3х У. град2) Коэффициент вторичной эмиссии Коэффициент излучения прн А,=0,б55мкм Цвет Мнкро-твердость, кГ/мм* Предел прочности при изгибе, кГ/см.*
3,13(213] 2,05 3,41 [213] 1,78(213] 0,84 7,08 10-4 [213] 0,8 0,65 —Т" Серовато-коричневый Синий Черный 1900 ±50 [212] 1850 ±50 [212] 2460 ±50 [951] 675(212] 320(212]
2,99 120 — 0,74 Серовато-коричневый Синий Черный 3500 2340 ±50 [951] —
3,53 25,2 1 1 о- 1 1 0,7 Серовато-коричневый Синий Черный 2540 ±50 [951], II 1 II
3,42 13,9 0,7 0,7 .— \ Серовато-коричневый Синий Черный 2340 ±50 [951] 11 1
3,37 0,9 1 1 1 1 0,7 Серовато-коричневый Синий Черный 2 440 ±50 [951] —
3,34 III 1 — III 1 Серовато-коричневый Синий Черный 2300 ±50 [951] 1 J11
181
Металл БориД Электрические и магнитные
Удельное электро^ сопротивление, МКОМ-см Термический коэффициент сопротивления, 10“* град~1 Коэффициент термо-s. д. с., мкв/град Коэффициент Холла, 10“4 см*}к Эффективный маг 4 нитный момент Магнитная восприимчивость , 10“’
Yb YbB3 YbB. YbB, YbB12 YbB100 36?5 4-10з« [3191 +0,234 — —25,5 +18,4* [319] —i-83,6 4,58[888] 8740
Lu LuB2 LuB4 LuB, LuB12 LuBloa л ИИ ТИН J 1 Г 1 1 И И I ] И И И И 1
* Для плавленых образцов. См. табл. 63.
»♦« Состав гектаборидов лежит в области MeBjQ_]qq. Гектабориды La, Се, Рг,
По данным работы {213], при 1600° К LaB6 имеет плотность тока / = 1,34 а/сл2, эффективную работу выхода <р=2,71 эв, а при 1800° К/^=7,15 а/см2, ф=2,85 эв,
Удельная электронная эмиссия а и скорость испарения b при различных; температурах составляют [428]:
т, °к 1600 1700 1800 1900 2000 2100 2200
a, а!см? 0,4 1,0 3,0 8,5 25 100 400
Ь, г/(см?-сек) 1-10—и l-10-w 1-10-» 9-10-» + 10-8 6-10-’ 4-10-^
По другим данным, скорости испарения различаются на два порядка и составляют при 2000° К, например, 1,536-IO-8 г/(см2-сек) [258].
Г. А. Кудинцева и др. [162, 164] исследовали работу выхода катода.из LaBe с присадками W, Ti, Re, Ir (около 10 масс.%). Наиболее высокие эмиссионные свойства получены для систем LaBe+Ti, LaBe+W (табл. 62).
182
Продолжение табл. 159
Термоэмиссионные Оптические Прочностные
Работа выхода, эв Постоянная Ричардсона , аДсмах Хград») Коэффициент вторичной эмиссии Коэффициент излучения, при Л=0,655 мзде Цвет Микротвердость, кГ/мм8 Предел прочности при изгибе, кГ/см'
3J3*' 2,5 1 1 I 0,7 Черный 3080 [ill
1J ] *—г > . ,! 1 1 Черный t t 2410 ±50 [951] И
——* •л** Т-* »
IX-I f 0,36 1 1"! 0,7 Синий Черный ,, 2460 ±50 <951] HJ 1
Nd. Ей синтезировать не удалось [951].
Катоды с добавками вольфрама и титана обладают в два раза большей эмиссией, чем катоды из чистого LaBfi, и сохраняют долговечность и устойчивость К отравлению, характерные для катодов из гексаборида лантана. В этой же работе показано, что пленка лантана на LaBe при внешнем напылении реально существует до температур порядка 1600° К и снижает работу выхода катода из LaB6.
91 Таблица 60
Температура перехода боридов РЗМ в парамагнитное состояние [888, 889]
Борид T. °K Борид г, °k
СеВ, —76 YbB, —2
РгВ6 —68 GdB, —50
NdBe —42 DyB, —21
EuBe +9 HoB, —21
GdB6 TbBe —55 —35 ErB, TmB, —11 —23
DyBe —21
Таблица 61
Значения характеристической температуры 60 для некоторых боридов [501]
Борид e0. °K Борид 0O. °K
СаВ» 700 TbB12 810
YB6 570 DyBj2 920
LaBe 710 HoB13 870
CeB6 520 ErB12 1000
PrBe 780 TmB12 790
NdBe 650 LuB12 830
YbB, 450 UB12 740
ThBe - 530
183
Таблица 62
Работа выхода катодов фт на основе гексаборида лантана с присадками
Материал катода т, °к Фу1 , эв Материал катода т, °к фу t Эв
LaB6-|-W 1530 2,42 LaB6+Ti 1450 2,2
1700 2,57 1650 2,44
1840 2,67 1840 2,64
LaBe+Ir 1450 2,77 LaB6 1600 2,56
1650 2,98 1700 2,64
1770 3,06 1780 2,74
1860 2,80
Автоэлектронная эмиссия гексаборида лантана, т. е. так называемая холодная эмиссия с острия (диаметр закругления около 3—5 мкм) из эмиттера при наложении электрического поля, показывает большую эмиссионную устойчивость борида. С такого острия получают автоэмиссионный ток плотностью до 106 а/см2- (плотность автоэмиссионного тока для острия и& вольфрама составляет 105 а/см?- [428]). В дальнейшем необходимо изучить возможность улучшения эмиссионных свойств LaB6 при уменьшении в нем примесей редкоземельных элементов [85]. 1
Теплоемкость LaBe, определенная калориметрическим методом до 1200° С [428], составляет:
Интервал температур, °с 245—20 430—20 620—20 830—20 1020—20 1210-20
Теплоемкость, ккалЦг-град) 0,1465 0,155 0,165 0,175 0,186 0,195
С учетом этих данных уравнение теплоемкости имеет вид Ср — 21,73 + 20,4- 10~3Т кал/(моль-град).
В работе [109] для интервала температур 1100—2200° К найдено:
Н — tf298, 15 = 0,4902?+ 16,150-10—в7’2— 1997,2?-1 — — 152,11 кдж!кг\
Ср = 0,4902 + 32,3-10-6 Т + 1997,2Т“а кдж/(кг-град).
Экспериментальные и расчетные данные по энтальпии приведены в табл. 63. В работе [82] показана температурная зави-184
Таблица 63
Экспериментальные и расчетные данные по энтальпии LaBe [109]
Г, °к Ну—Н298 уз, кдж/кг г, °к Hj— Я298 15, кдж/кг
эксп. расч. эксп. расч.
1100 569 581 1681 1135 1127
1125 600 602 1725 1174 1173
1178 646 648 1750 1195 1199
1243 706 705 1810 1260 1263
1284 742 742 1875 1336 1333
1321 777 775 1937 1401 1402
1371 821 822 1983 1453 1454
1434 879 881 2012 1486 1487
1454 899 900 2025 1503 1501
1514 954 959 2076 1559 1560
1553 996 997 2151 1659 1648
1589 1030 1033 2190 1659 1695
1634 1075 1078 2223 1737 1734
симость истинных коэффициентов термического расширения a = ao + aj/ и вкладов а0 и ои для ряда гексаборидов (табл. 64). При магнитных исследованиях обнаружены диамагнитность борида лантана и трехположительная эффективная валентность [428].
Компактные изделия из гексаборида лантана изготовляют обычно горячим прессованием или методом холодного прессования с последующим спеканием в вакууме или защитной газовой среде при 2073—2423° К [258].
По данным работы [6], наиболее благоприятные температуры, обеспечивающие относительную плотность изделий до 0,97, составляют 2223—2323° К при давлении прессования 5 Т/см2. Прочность этих образцов при изгибе составляет 1290 кГ/см2. При пористости 18—20% оиаг=850-Ь960 кГ/см2 [258]. Так как в процессе спекания в вакууме борид испаряется, образцы целесообразно засыпать порошком того же борида [258]. Испарение LaBe стехиометрического состава происходит молекулярными комплексами. Недостатки упомянутых методов-—невозможность получения изделий с отношением высоты к диаметру свыше 4—5 и неравномерное распределение плотности по объему.
О. Г. Медведев и др. [251] показали, что для изготовления изделий из LaB6 может быть использован метод горячего литья термопластичных шликеров. Шликер готовится постепенным добавлением порошка LaBe в жидкую ванну из парафина и пчелиного воска (85: 15) при 80—90° С и перемешивании. Оптимальное содержание связки 10,5 масс. %. Изделия отливались под
185
Таблица 64
Температурные изменения а для гексаборидов металлов [82]
Борид Коэффициент термического расширения и его вклады а0* и at* Температура, °К,
273 293 323 373 423 473 523 573 673 773 873 973
LaBe а,-10—8 град~х 5,48 5,55 5,66 5,83 6,01 6,19 6,37 . 6,54 6,89 7,25 7,60 7,95
а0/«1, % 100 98,71 96,83 93,87 91,08 88,44 85,96 83,61 79,28 75,38 71,84 68,62
(аДа 0 1,29 3,17 6,13 8,92 11,56 14,04 16,39 20,72 24,62 28,16 31,38
PrBe а,-10-8 град~1 £,93 6,97 7,03 7,13 7,23 7,33 7,42 7,52 7,72 >7,92 8,11 §,31
a0/ai, % 100 99,42 98,56 97,15 95,81 94,49 93,21 91,96 89,56 87,28 85,11 83,06
% 0 0,58 1,44 2,83 4 „19 5,51 6,79 8,04 10,44 12,72 14,89 16,94
NdBe а,-10~8 град~~1 6,37 6,41 6,54 6,72 6,89 7,06 7,24 7,41 7,75 8,10 8,44 8,78
«о/а1, % 100 98,90 97,31 94,76 92,35 90,05 87,86 85,78 81,90 78,35 75,10 72,11
(aj/aji, % 0 1,10 2,69 5,24 7,65 9,95 12,14 14,22 18,10 21,65 24,90 27,89
YBe а,-10-8 град~г 5,78 5,85 5,95 6,12 6,28 6,45 6,62 6,79 7,12 7,46 7,79 8,12
а0/«х. % 100 98,83 97,14 94,45 91,89 89,47 87,18 85,00 80,95 77,27 73,92 70,83
(ai/a)£, % 0 1,17 2,86 5,55 8Д1 10,53 - 12,82 15,00 19,05 22,73 26,08 29,17
• а» и а,-—коэффициенты в уравнении а=а04-а,^-|-®1^2+-> » .
Давлением 5—8 атм, после чего подвергались сушке и спеканию, Предложенный способ обеспечивает получение плотных изделий (пористость 3—5%) законченной конфигурации независимо от их скорости.
Немысски и др. [284] исследовали процесс кристаллизации гексаборида лантана. LaB6 формировался в стержни методом зонной плавки. Из поликристаллических стержней путем бести-гельНой кристаллизации вытягивались кристаллы цз расплав,-ленной капли LaB6, удерживающейся на одном конце стержня. Процесс происходил в смеси аргрна и водорода. В расплавленную каплю вводилась затравка, которая поднималась вверх, и на ней нарастал кристалл. Показано, что чистота исходных материа-лов очень сильно влияет на процесс кристаллизации^ Из чистого ЬдВ6 почти всегда получаются монокристаллы. Загрязнения являются источником дефектов и причиной нарастания йоликри7 сталлического стержня^ В этой же работе методом катодного распыления на изоляционные подложки (кварцевое стекло, неориентированный сапфир) получены пленки LaBg, В зависимости от температуры и типа подложки скорости наращивания слоев составляют 15—40А/жмн. На сапфировых подложках достигалось наращивание пленок до 1250° С, на кварце пленки не получались уже при 1100° С. Наблюдалось интенсивное травление кварца. Толщина полученных пленок составляет 0,01—1 мкм. При температурах наращивания до 200° С пленки имеют аморфную структуру, а выше этой температуры образуются поликри-сталлические пленки С улучшающейся структурой по мере возрастания температуры подложки.
Проведенные измерения оптического пропускания полученных пленок в пределах длин волн 0,3—4 мкм показали существование максимума пропускания Для волны длиной 0,5 мкм. Постоянная Холла аморфных пленок (толщина 0,3 мкм) составила, 14-10”4 см?[к, а поликристаллической текстурированной пленки —5,4 1 О*4 (толщина 0,18 мкм) и 5 ‘ 10~4 (0,10 мкм)см?1к. Показан металлический характер проводимости пленок LaBs.
Назини и Редаэлли [858] предложили способ изготовления катодов из LaB6, заключающийся в нанесении слоя гексаборида На предварительно карбидизированную поверхность танталовой ленты. Для нанесения LaBe используется катафоретический метод, позволяющий получать плотные и однородные слои. Осаждение ведется при непрерывном магнитном перемешивании при комнатной температуре в течение около 2 мин из раствора со-втава 10 мл деионизированной воды, 100 мл абсолютного этилового спирта, 10 мг ЬаОз-УНгО и 10 а порошкообразного LaBe. На танталовую ленту подается отрицательное напряжение смещения по отношению к золотой сетке, погруженной в тот же раствор. Плотность тока поддерживается на уровне около 10 aJcM2. Осажденный слой LaB6 спекают* при 1700° С в среде
187
аргона. Такие катоды хорошо зарекомендовали себя при работе в разрядных трубках с довольно большой плотностью газа (например, в ионных лазерах). При рабочей температуре 1400°С ток насыщения катода составлял около 2,5 afcM2. Срок службы катода в этих условиях — около 500 ч.
Гексаборид лантана, как отмечено, нашел применение в качестве материала для изготовления катодов мощных электронных приборов, а также ускорителей заряженных частиц—циклотронов, синхрофазотронов, электронных пушек, в установках для сварки тугоплавких металлов электронным лучом в вакууме, в печах с электронным подогревом [415]. Использование LaBg по сравнению с обычно применяемой вольфрамовой шпилькой нити накала улучшает характеристику электронной пушки [533].
Бориды церия. Диаграмма состояния системы Се—В еще не построена. Достоверно установлено существование двух соединений— тетра- и гексаборида.
Согласно Бруэру и др. [598]:
а) тетраборид образует с церием эвтектику, расположенную вблизи металла;
б) как и в системе La—В, наблюдается аналогичное перитектическое превращение Ж+СеВ65=ьСеВ4, происходящее при температурах намного выше 2000° С.
СеВ4 кристаллизуется в тетрагональной сингонии. Периоды решетки, А: а —7,208, с=4,091 [667]. Высший борид имеет кубическую структуру с периодом 4,1410 А [512] ‘ (4,130+0,002 А [527]). Отмечалась фаза состава МеВх (3<х<4), которая не была идентифицирована [428].
Способы получения боридов церия и боридов лантана принципиально не различаются. Разные технологические варианты обобщены в монографиях [416, 428]. В более поздних исследованиях [21] рассмотрена одна из этих реакций — получение СеВ6 по схеме СеОг + 8 В->СеВ6 + 2 ВО. При использовании в качестве исходных компонентов порошков СеОг чистотой 99,9%, бора чистотой 95—97% и при 1800° С получен продукт с содержанием 68,41% Се и 30,04% В (2=98,45%).
Свойства боридов церия обсуждались в монографиях [416, 428], в работе Ли и Белла'[797] и приведены в табл. 59—61. Из высоких значений температур плавления, микротвердости, относительно малого коэффициента термического расширения и других свойств следует, что СеВ6 — химически прочное соединение. Теплоты образования СеВ6 и СеВ4 составляют соответственно 81 ±16 и 84 ккал!моль.
Препарат светло-синего цвета, пригоТовлецный В. С. Нешпо-ром [297] и содержащий бора больше, чем в СеВ6, имел работу выхода 2,22 эв, что значительно ниже работы выхода гексаборида, равной, по различным данным, 2,59—2,93 эв. Работа выхода тетраборида, измеренная Г. А. Кудинцевой, составляет 188
2,07—2,42 эв. ГексаббрЙД Церия имеет точку Кюри, очень удаленную от абсолютного нуля (344° К) [428]. Согласно работе [888], температура перехода СеВ6 в парамагнитное состояние равна —76° К.
Рентгеновские спектры (Ащ-полосы) и спектры испускания
-полосы) СеВб в сравнении с типичным ионным , соединением— двуокисью церия показывают, что в образовании химических связей главную роль играют 5d- и бх-элект-ронные состояния [428]. На основе исследования смещений линий, соответствующих переходам в 4[-состояние, сделан вывод о наличии у церия в СеВ6 «валентности» меньше четырех, что соответствует металлической связи коллектива электронов между атомами церия и бора в решетке гексаборида. 4/-Состояния принимают очень малое участие в образовании химических связей.
Сведения о химических свойствах боридов церия, как и бо-риДов других редкоземельных металлов, ограничены. ГекСабо-риды Y, La, Се, Pr, Nd, Sm, Gd легко разлагаются в окислительных средах [428]. Рекомендуют [428] применять некоторые бориды, в том числе гексаборид церия, для изготовления огнеупорных изделий для работы в нейтральной или Восстановительной среде, а также в Вакууме при 7’^2000° С.
Бориды празеодима. Сведения по системе Рг—В, как и по следующим системам бора с РЗМ, за исключением Gd—В, весьма ограничены. Надежно установлено существование двух соединений — РгВ4 и РгВб.
Тетраборид кристаллизуется в тетрагональной сингонии с периодами, А: а~7,241, с=4,119 [667]. Структура кубическая с периодом 4,1307 А [83]. В пределах от комнатной температуры до 700° С период а может быть вычислен из следующего уравнения:
а = 4,1301 (1 +6,93-10-4-1-10,1-10-’ /2)А[83].
Пост и др. [428] получили еще одно соединение — РгВж (х= = 34-4), стабилизируемое, по-видимому, очень малыми примесями углерода. В отличие от других подобных фаз (LaBx, GdBx, YBX) для РгВх отношение с]а —1,000; следовательно, фаза празеодима должна быть псевдокубической. Это может проявляться в расщеплении линий иа рентгенограммах при повышенных температурах, что, в свою очередь, должно быть следствием различия коэффициентов расширения в направлениях а и с, если РгВх в действительности тетрагональный.
Бориды празеодима могут быть получены различными методами, предпочтение среди которых следует отдать восстановлению окислов металла карбидом бора или бором при температурах порядка 1650—1800° С [21, 428, 590]. Основные физические свойства боридов празеодима приведены в табл. 59—61.
189
бориды неодима. В этой системе известны два соединения: NdBt с тетрагональной структурой (а=?7,220А, с=4,102А [667]) и NdB&, имеющий кубическую решетку и период а, изменяющийся в интервале 20—700° С согласно уравнению а=4,1232 X X (1+6,37•lO-’f-b 1,76- 10~9i2) А [83]. При комнатной температуре, по данным этой работы, а = 4,1237 А.
Впервые NdBe был получен электролизом расплавленных сред [428]. Обычно Для синтеза соединений неодима с бором восстанавливают окислы металла карбидом бора или бором в вакууме при температурзх от 1600 до 1800° С [21, 428].
Свойства боридов неодима приведены в табл. 59—61 и 65. NdBe, как И СеВ6, имеет точку Кюри, сильно удаленную от абсолютного нуля (455°К)- При приближении к 760° К кривая температурного коэффициента магнитной восприимчивости проходит ниже прямой Кюри — Вейсса [428].
В интервале температур 298,15^-1300° К энтальпия и теплоемкость гексаборида неодима (см, табл. 65) выражаются зависимостями [367]
Нт~Я298,15 = 0.4812Г-f- 0,2178-10“3 Т2 +
+ 0,1135-ЮТ-1 —200,9;
Ср = 0,4812 + 0,4356 • 10"8 Т — 0,1135 • 1057\
Бориды прометия. Бориды прометия еще не получены. На основании данных зависимости периодов кристаллической решетки гексаборидов РЗМ от атомного номера элемента постоянная решетки PmBe, по предположению, составляет около 4,128 А [428]. Соединение должно обладать посредственными термоэмиссионными характеристиками. Теплота образования РтВб оценена равной 105,7 ккал]моль [353, 495].
Бориды самария. Известны три соединения этой системы: SmBi с тетрагональной решеткой (а = 7,178 А, с = 4,071 А [667], SmB6 и гектаборид, имеющие кубическую структуру с периодами 4,115 [6] и 23,487 А [951] соответственно.
Бориды самария получали синтезом из элементов [866, 951], карбидоборным и боротермическим восстановлением S1TI2O3 [866]. Свойства соединений приведены в табл. 59. Сопоставление свойств гексаборида самария do свойствами гексаборидов РЗМ, расположенных до него, позволяет отметить увеличение электросопротивления и работы выхода при термоэмиссии, что находится в прямой связи с повышением степени 'заполненности 4^-уровня и соответственным ростом его устойчивости, а также снижением акцептирующей способности 5</-уровня.
Ю. Б. Падерно и др. [888] в соответствии с данными по измерению магнитных свойств в интервале 80—300° К изученные ими гексабориды разделили на три группы. Первая включает фазы LaB6 и УЬВб, показавшие слабый парамагнетизм и незначительную зависимость магнитной восприимчивости от темпе-
190
Таблица 65
Экспериментальные й расчетные данные по энтальпии NdBe, SmB«, EuBs [367J
г, °к Нг~#298,16 ► кдж/кг Т, ’К яг—#298,15 1
9КСП. расч. ЭКСП^ расч.
NdB,
473 98,66 98,84 • 1336 845,7 839,2
518 129,4 128,7 1388 887,3 894,8
613 193,8 194,4 1446 956,5 958,2
725 278,2 278,1 1529 1046 1052
771 315,5 314,3 1568 1094 1096
832 363,2 364,9 1663 1215 1209
882 408,2 405,8 1746 1315 1310
925 440,9 442,8 1785 1350 1358
974 484,3 486,1 1808 1398 1389
1077 582,6 580,5 1887 1495 1489
1171 666,8 670,9 1928 1540 1542
1221 724,6 720,6 1941 1544 1560
1282 785,2 782,8
Sir Be
373 37,10 36,87 882 407,2 406,8
417 62,01 61,99 930 448,3 448,1
480 100,9 101,1 998 507,9 508,3
528 134,8 133,0 1022 526,7 530,0
580 168,9 169,3 1089 591,7 591,6
623 201,2 200,4 1141 637,4 640,7
674 240,2 238,6 1161 660,3 659,8
713 267,8 268,9 1205 701,1 702,3
757 303,4 303,4 1252 747,8 748,6
800 337,9 338,3 1273 773,4 769,5
851 379,4 380,5
Ей в.
376 35,75 36,13 829 345,7 348,5
409 53,81 53,73 883 395,6 393,8
422 60,29 60,95 923 431,5 428,4
479 95,06 94,47 980 481,8 479,0
535 130,9 129,9 1024 516,2 519,2
573 154,7 155,2 1073 568,4 565,2
629 195,1 194,2 1126 616,3 616,2
681 231,3 232,2 1187 673,5 676,5
720 261,8 261,6 1213 709,1 702,8
774 302,4 303,8 1291 779,6 783,6
191
ратуры. Ко второй отнесены гексабориды Pr, Nd, Eu, Gd, ТЬ, 1)у — соединения с сильным парамагнетизмом и магнитной восприимчивостью, резко возрастающей с температурой. Третья группа содержит только SmB6. Магнитная восприимчивость этого парамагнитного материала показала нормальную температурную зависимость в сравнении с той же зависимостью для других гексаборидов.
Как следует из табл. 59, в отличие от других гексаборидов SmB6 имеет положительное значение постоянной Холла и отрицательный температурный коэффициент электросопротивления (в интервале до. 300°С). Аномалии физических свойств этого соединения определяются, по-видимому, особенностями его электронного строения.
В работе [680] утверждается, что SmB6 — сверхпроводник при -низких температурах (около 0,1° К). В интервале 298,15— 1300° К получены следующие уравнения теплоемкости и энтальпии (см. табл. 65) для 5тВб[367]:
Нт — Н29&, 15 = 0,58147’-f-0,1689.10-®7’2 +
+ 0,2283-Ю8?-1 —265,7;
Cf = 0,5841 + 0,3378 10~3 Т — 0,62283 • 10~5 Т~* .
Изделия из SmB6 с относительной плотностью до 0,97 могут быть получены горячим прессованием при 2273—2373° К под давлением 5000 кГ/см2. Предел прочности этих образцов при изгибе составил около 1510 кГ]см? [6]. Электронная структура и некоторые свойства гексаборида обсуждаются Нцккерсоном и др. [866].
Бориды европия. В системе Ей—В описано только одно соединение— ЕиВ6. Оно было впервые получено Г. В. Самсоновым и др. [428] вакуумно-термическим методом по реакции Еи2О3 + + 3 В4С = 2 ЕиВ6 + 3 СО в течение 2 ч при 1650° С, Фелтеном и др. [428] при восстановлении окиси металла бором. Фаза имеет кубическую решетку с периодом идентичности (а = = 4,155 А [6]), что свидетельствует о двухположительной эффективной валентности европия в его гексабориде.
ЕиВ6 характеризуется высоким значением работы выхода при термоэмиссии (4,9 эв), объясняющимся максимальной мультиплетностью и, следовательно, наибольшей степенью связанности электронов европия, имеющих в нормальном состоянии семь электронов на 4f-o6ono4Ke без наличия электронов на Sd-оболочке.
Энтальпия (см. табл. 65) и теплоемкость ЕиВ6 в интервале 298,15—4300° К имеют температурные зависимости [367]
Нт — Я298, is = 0,46861 + 0,2312• Ю-3 Г2 -f-
+ 0,17799- Ю6?-1 — 220,6;
Ср = 0,4686 + 0,4624 • 10-3 Т — 0,1799 • 1О6?-2.
192
Изделия с относительной плотностью до 0,96 могут быть получены горячим прессованием гексаборида при 2223—2243° К под нагрузкой 5000 кГ[см2. Прочность такого материала при изгибе составляет около 1870 кГ!см2 [6].
Физические свойства ЕиВ6 приведены в табл. 59,60. Синтезировать ЕиВ^ и Е11В12 не удалось [6].
Бориды гадолиния. В работе [212] -на основании исследования температурных условий получения боридов и фазового
Рис. 39. Диаграмма состояния системы Gd—В.
состава различных бинарных композиций предложена гипотетическая диаграмма состояния Gd—В (рис. 39). Подтверждено существование упомянутых ранее [364] соединений GdB$ и GdB6, Диборид гадолиния, устойчивый, по данным работы [77], ниже 1300° С, синтезирован не был. Тетраборид не претерпевал разложения или плавления до 2500° С, в то время как GdBe при высокотемпературной обработке в вакууме оказался неустойчивым и распадался с образованием GdB4, по-видимому, по перитектической реакции GdBe—^GdBi+X- Высшего борида GdBia обнаружить не удалось.
GdB4 кристаллизуется в тетрагональной сингонии (а--=7,120 ± 0,005 А, с=4,048 ±
Д=0,005 А [212]; а = 7,145 А, с=
= 4,048 А [667]), гекс а бор ид — в кубической (а=4,1144 А [667]). Шветцем и др. [951] получен гектаборид GdBloo с кубической структурой и периодом а = 23,474 А. Обнаруженная Постом и др. [428] фаза GdB^ (х = 34-4) имеет тетрагональную решетку (а = 3,79 А, с = 3,63 А).
Бориды1 гадолиния получались синтезом из элементов, восстановлением окиси гадолиния смесью бора и угля, карбидом бора, вакуумно-термическим восстановлением окиси бора и электролизом расплавленных сред [78, 212, 416, 951]. Отмечено [212], что для получения GdB6 реакцию МеО + 2В->МеВ + ВО проводят при 1700° С, а для получения GdB< — при 1900° К.
Важно, что гексаборид, полученный М. В. Дереновским и ДР- [78] боротермическим восстановлением окисла при электронно-лучевом нагреве (1850° С, I ч), вдвое мельче, чем при получении GdBe в вакуумной печи с графитовым нагревателем.
13 Зак. 1305
193
‘Высокая дисперсность порошков оказываем 'положительное влияние при последующем изготовлении из них катодов прессованием и спеканием. Кроме того, гексаборид не содержит углерода. Аналогичным способом в этой работе были получены LaB6 и УЬВб.
Свойства боридных фаз гадолиния сведены в табл. 58, 59. Отмечалось [428], что GdB6 по сравнению со всеми остальными гексаборидами имеет наиболее низкую работу выхода электронов (<р=2,05 эв), однако при сравнительно невысоком токе эмиссии. Манелис и др. [213] нашли, что <р составляет гораздо большее значение (3,41 эв при 1600°К)- Максимальный ток эмиссии /, который можно снимать с гексаборида на танталовой подложке при этой тёмпературе, равен 1,4-КН а! см1. Тетраборид имеет лучшие эмиссионные свойства: j = 0,68 а) см1, <р = 3,13 эв при 1750° С. Таким образом, бориды гадолиния по своим эмиссионным свойствам значительно уступают ЬаВб.
В этой же работе подтверждено, что GdB4 более устойчив, чем GdB6. При отжиге катодов GdB4 в интервале 1510—1600° К работа выхода существенно не изменялась, однако увеличение температуры с 1600 до 1870° К приводило к уменьшению работы выхода (до 3,06 эв). Одновременно наблюдалось частичное изменение цвета борида с синего на серый, свидетельствующее, по-видимому, о распаде GdB6. Примеси Gd2O3 в GdB4 и в GdB6 снижают эмиссию на единицу поверхности композиции. Данные, полученные Манелисом и др. [213] о термоэлектронной эмиссии тетра- и гексаборидов гадолиния, наиболее достоверны, так как в этой работе химический и фазовый составы композиций контролировались очень тщательно. В других исследованиях измерения эмиссионных свойств борида GdB6, считавшегося наиболее устойчивым соединением, проводились после длительной высокотемпературной обработки его в вакууме, причем данных химического и рентгеноструктурного анализов материалов до и после испытания нет.
Коулсон и др., исследовавшие магнитные свойства GdB6 в температурном интервале 4,2—300° К, ниже 13,5° К обнаружили антиферромагнетизм соединения; точка Кюри ©к = = 60° К [428].
При изучении гексаборидов гадолиния и европия в интервале 77—300° К использовали электронный парамагнитный резонанс (ЭПР) [40]. Были сняты кривые парамагнитного поглощения для этих гексаборидов при упомянутых температурах. Полученные данные по ЭПР находятся в согласии с результатами Коулсона. При 300° К ширины линий составляли 460 э для GdB6 и 940 э для ЕиВе. Экспериментальные данные дают значения фактора спектроскопического расщепления g'=2,01 для GdB6 и £'=1,98 для ЕиВе, что согласуется со значениями g, рассчитанными из конфигурации 8s?/2 для Gd3+ и Еи2+. При 77° К ши-
194
рийы линий составляют 520 э для GdBe и 1080 э для EuBg, а значения g равны 2,03 и 2,15 соответственно.
Таким образом, с понижением температуры уширяются резонансные кривые парамагнитного Поглощения. Такое уширение резонансной линии относят за счет магнитного упорядочения, лежащего ниже 77° К. Точка магнитного упорядочения для ЕпВ6 лежит, вероятно, при более высокой температуре, чем для GdB6.
Величина сопротивления GdB6 в пересчете на нулевую пористость составляет 45 мком • см 1428]. По данным Биндера и Штейница [428], в интервале температур 80—203° С теплопроводность GdBg изменяется от 0,0466 до 0,0536 ккал!{см - граду. Усек). Отношение величины теплопроводности к электропроводности по этим данным составляет 10-10-6, что близко к значению, характерному для металлов (7-Ю-6), и подтверждает металлическую природу этого соединения.
Бориды Gd, а также Sm, Eu, Dy, имеющие высокую поглощающую способность тепловых нейтронов, могут использоваться для изготовления регулирующих стержней ядерных реакторов [267, 428].
Бориды тербия. Из лантаноидов тербий является первым металлом, для которого, кроме боридов ТЬВ4 и ТЬВ6, бесспорно установлено существование ТЬВ12. Этот борид имеет тетрагональную решетку с периодами, А: а=7,118±0,001, с— = 4,0286 ±0,0005, ТЬВб — кубическую с периодом 4,1020 ±0,0003 или 4,094±0,0002 А [527]. Структура додекаборида также куби--ческая с периодом 7,507 А. При 78° К п = 7,498 А [320]. Недавно обнаружен [951] гектабор.ид тербия ТЬВ1Оо (кубическая структура, а = 23,457 А).
Боридные фазы тербия были получены синтезом из элементов, при взаимодействии окиси тербия со смесью бора и угля, восстановлением окисла металла карбидом бора или бором [320, 428, 951]. Свойства боридов тербия приведены в табл. 58— 60. Коэффициент термического расширения TbBi2 в интервале 78—300° К составляет 2,3-10-6 град~\ в интервале 300— 1300° К —5,0 • 10-6, при 300° К—3,2-10-е град~1 [320].
Бориды диспрозия. Диаграмма состояния Dy—В построена в работе [951]. В системе Dy—В известны пять соединений: ди-тетра-, гекса-, додека- и гектабориды. Структура DyB2 гексагональная типа А1В2, а=3,83 А, с=4,45 А [77]. DyB4 имеет тетрагональную решетку типа UB4 с периодами, А:а=7,101± ±0,001, с=4,017±0,0005 [527] (а=7,102 А, с=4,017 А [667]). Решетка гексаборида однотипна с решеткой СаВб, а=4,0976± ±0,0005 А [527] (4,148 А [6]). DyBi2 имеет ГЦК-решетку типа UB12, а=7,501 ±0,001 [527] или 7,499 А (при 78° К 7,495 А) [320].
Период кубической решетки гектаборида DyBioo а=23,441 А [951]. Судя по постоянству параметров решеток, при изменении
13* 195
‘-состава бориды диспрозия должны иметь очень узкие области гомогенности [951].
Бориды диспрозия могут быть приготовлены синтезом Из элементов, взаимодействием полуторной окиси металла с карбидом: бора или бором.
Свойства соединений приведены в табл. 59, 60. При 300° К коэффициент- термического расширения DyBi2 равен 4,2X Х1О-45 град-"1, в интервалах 78-—300 й 300—1300° К соответственно 2,670-IO8 и 5,5-10^8 град-1 [320]. Относительная плотность изделий, полуЛенйых горячим прессованием додекаборида при 2273—2373° К под давлением 5000 кГ[см\ не превышает 0,95 [6].
Бориды гольмия. Бор е гольмием образует соединения Н0В4, НоВ6, НоВ12, НоВюо, имеющие соответственно тетрагональную (а=7,086±0,001 А, с=4,0079±0,0005 А) и Кубические решетки С периодами 4,096±0,0005 А у НоВб [527], 7,491 А у HoBi2 (7,488 А при 78° К) [320] и 23,441 А-у НоВ100 [951].
Бориды гольмия готовились синтезом из элементов, восстановлением НО2О3 смесью бора и В4С, а также карбидом бора или бором [320, 428, 951]. 4
Свойства боридов гольмия изучены мало ^см. табл.. 58, "59). Коэффициент термического расширения Н0В12. в интервале температур 78—300° К равен 2,003-Ю-6 град~х, при 300° К — 3,6х ХЮ-6, в интервале 300—1300°К —-5,211Q~8 град~1 [320].
Бориды эрбия. В настоящее время известны ErB4, ErBg, ЕгВ12 и ЕгВюо- Структуры этих фаз однотипны со структурами описанных выше подобных соединений. Периоды решеток (см. табл. 56) а и с тетраборида равны 7,071 и 3,9972 А, фа$ ЕгВ6 и Е;В12 4,110 и 7,482 А соответственно. При 78° К период решетки а додекаборида составляет 7,479 А [320]. Для богатой бором фазы а = 23,428 А [951].
Бориды эрбий получены синтезом ив элементов, при досста-новлении окиси металла карбидом бора и бором, электролизом расплавленных сред [320, 428, 951] и др. [610]. .
Некоторые физические свойства фаз приведены в табл*. 58— 60. Коэффициент1 термического расширения при 78—300° К составляет 2,0004-> 10—6 град~\ при 300° К — 3,7-10-6, в интервале 300—1300° к — 5,2'1 о-6 град-1- [320].
Бориды тулия. Получены четыре фазы тулия; TmB4, ТтВ6> TmBi2 и ТтВюо. ТтВ4 имеет структуру типа UB4 с параметрами, А: а=7,057, с=рЗ,987 [667], периоды кристаллических решеток ТтВ6 и ТтВ12 равны'4,110 [428] и 7,474 А (при 78° К 7,471 А) [320] соответственно. У гектаборида ТтВюо а = 23,433А 1951]. ' •
Соединения бора с тулием получают обычно боротермическим восстановлением окиси металла в вакууме [320, 428]. Свойства боридов тулид изучены слабо (см. табл. 59).
1Q6
Работа выхода гексаборида тулия в интервале 1100—1800° К выражается уравнением фэфф=2,75+3,3 * 10~4. Т эв. При 1800° ТшВ6 сильно испаряется [428]. Коэффициент термического расширения додекаборида в интервале температур 78—300° К равен 2,008-10-* град-1, 300—1300°К —5,2-10-6 град-\ при 300°К — 3,85-10-6 эра сМ [320].
Бориды иттербия. Известно пять соединений в системе иттербий— бор; YbBx (х=3+4), УЬВ4, YbB6, YbBj2 и УЬВюо. Фаза УЬВЖ, обладающая тетрагональной структурой (а = 3,77А, с — fe-3,562 А), по-видимому, стабилизируется малыми примесями ^углерода [428]. YbB4 имеет также тетрагональную решетку с периодом, А:а = 7,064, с = 3,989 [667]. Период кубической решетки [*УЬВ6 а = 4,1478 [841] или 4,1482 А [83], в интервале 20—700° С .-аналитически выражается следующим образом: й = 4,1477(1 + 45,78-10-® 41,70,10-9/2) А [83].
Додека- и гектаборид кристаллизуются в кубической синго-s нии с параметрами .7,468 (при 78°*- 7,465) [320] и 23,422 А [951] соответственно!.
Бориды иттербия получены синтезом из компонентов, восстановлением Окиси иттербия смесью бора и (угля, а также карбидом бора или бором [320, 4^8,, 792]. Свойства фаз приведены в табл, 59, Зависимость параметров кристаллической решетки гексаборидов от Положения металлов в системе (см. табл. 58 и рис. 10) показывает, что иттербий в этом соединений находится в двукратно ионизированном Состоянии, что объясняется достаточной устойчивостью Заполненной 4/-оболочки [428]. Дебаевская температура 193° К, Термические свойства этого соединения сходны со свойствами полупроводников [841].
Коэффициент термического расширения YbBi? равен 2,009Х ХКН (в интервале 78—300°К), 3,75-10~6 (при 300° К), 5.7Х ХЮ-6 град-1 (в интервале 300—1300° К) [320], Полуметаллические свойства додекаборида объясняются заполнением электронами (Зе#)4-уровня и частичным перекрыванием его с близлежащими уровнями lazu и 2tzg [306].
Бориды лютеция. В системе Lu—В синтезировано пять соединений: LuB2, LuB4, Lub6, LuB]5> и LuBIOq. Диборид характеризуется структурой Типа А1В2 (а=3,24б А, с=3,704 А [428]). LuB4 имеет тетрагональную решетку с периодами, А:а= =6,997 + 0,005, с=3,938+0,003 [527] (й = 7,036 А, с=3,974 А [667]). Кристаллическая решетка гексаборида однотипна с решёткой СаВв, а=4,11 А [428]. LuBj2 и гектаборид ЬиВюо имеют кубическую структуру с периодами п=7,464 (7,461 А при 78° К) [320] и 23,412 А [951] соответственно.
Сплавы лютеция с бором-получали синтезом из элементов, восстановлением окисла металла карбидом бора или бором [320, 428]. Свойства боридов лютеция приведены в табл. 59. В интервале 78—300° К коэффициент термического расширения
197
LuB]2 равен 2,010-IO-6, при 300° К — 3,4 МО-6, в интервале 300— 1300° К — 5,0 • 10-6 град-1 [320].
Металлические свойства додекаборида определяются частичным' заполнением электронами уровня (l^ig)4 [306].
Бориды актиноидов. Бориды тория. Диаграмма состояния системы Th—В не построена. Изучением возможности получения боридов тория с использованием различных методов синтеза занимались многие исследователи [545, 746, 970, 1026].
Наиболее полно система Th—В описана Бруэром и др. [598]. По данным этой работы, в образцах, содержащих от 25 до 75 ат. % В, присутствует чистый торий. Начиная с 80 ат. % В в образцах появляется ’борид состава ThB4, обладающий очень узкой областью гомогенности. Между торием и ThB4 обнаружена эвтектика с температурой плавления выше 1550° С. В образцах с 'Содержанием бора выше 80 ат. % не наблюдали борида ThB6. В работе делается предположение, что ТЬВб неустойчив и при 1600—1700° С разлагается.
Анализ работ [392, 657, 746, 951, 970, 1026] дает основание считать установленным ’существование в системе Th—В трех боридных фаз: ThB4, ThB6 и ThB76. ThB4 кристаллизуется в тетрагональной сингонии, пространственная группа Z)54ft— P^/mbm, периоды решетки, А: а=7,256, с=4,113 (с/а= =0,567) [1027].
ThB6 имеет кубическую структуру типа СаВ6, пространственная группа О1к — Pm3m, период решетки а=4,11 А [598]. У ThB76 решетка кубическая, гранецентрированная, пространственная группа О6ь—Fm3c, период решетки а = 23,518А [657,951].
Свойства боридов тория 'исследованы недостаточно. Наиболее изучен геисаборид тория.
Ю. Б. Падерно и др. [317] провели измерение удельного электросопротивления, термо-э. д. с. и коэффициента Холла ThB6. Работа выхода термоэмиссии и коэффициент излучения определены в работе [392]. В табл. 66 приведены электрофизические свойства борида ThBe и результаты расчета параметров электропереноса, полученные при применении однозонной модели и предположении зарядов двух знаков.
Относительно невысокому значению удельного электросопротивления и коэффициента термо-э. д. с. гексаборида тория
Таблица 66 Некоторые электрофизические свойства и параметры электропереноса гексаборида тория [317]
Удельное электросопротивление, мком-см 14,8
Термический коэффициент сопротивления, 10“8 град—1 (0—100 °C) —|—2,31
Коэффициент Холла, I0~4 cms/k —2,18
Термо-э. д. с., мке/град —0,6
Концентрация носителей тока п*, электронов на 1 атом М© 1,99
Подвижность носителей и*. см2/(в-сек) 14,7
6 , 10-«» сж/(в».еек«) -62,1
198
«соответствует высокая концентрация нелокализованных электронов, ответственных за проводимость (около двух электронов на один атом металла). '
В работе [657] исследовалась низкотемпературная теплоемкость гексаборида тория в интервале 2—12° К, определены коэффициенты в уравнении с=у7’+р7’3, у=4,8 и р = = 0,3 мдж/(моль-град). Остальные свойства боридов тория приведены в табл. 67.
Таблица 67 Некоторые свойства боридов тория
Свойство тьв4 ThB. гтьв„
Содержание бора, масс. % 16,7 21,82 77,98
Структура Тетра го» Кубическая Кубичес-
о Периоды решетки, А: нальная [1027] [598] кая [951]
а 7,256 4,11 [841] 23,518
с 4,113 —
с]а Плотность, г/см3'. 0,567 — —
рентгеновская 8,45 7,10 —
пикнометрическая — 6,99 —-
Теплота образования, ккал/моль 52 66
Температура плавления, °C 2500 [598] 2195[598] —
Коэффициент термического расширения, 10~8 град-"1 5,9—7,9 1717] — —
Удельное электоосопротивление, мком-см Коэффициент термо-э. д. с., мкв/град 14,8[317] —.
—— 0,6 [317] —2,18(317]
Коэффициент Холла, 10—1 см3!к —— —
Работа выхода, эв — 2,86 [392] ——
Микротвердость, кГ/мм? 2043[830] 1740±123 [392] 2310(951]
Предел прочности при изгибе, кГ/см3 1406(830]
Коэффициент излучения (Х=0,685 мкм) 0,69—0,70 [392] —-
Химические свойства боридов тория изучены слабо. По данным Андрие [545], гексаборид тория не разлагается концентрированными соляной, плавиковой и серной кислотами, растворами щелочей, легко разлагается под действием подогретых концентрированных азотной и серной кислот, а также расплавленных карбонатов и бисульфатов щелочных металлов, бурно реагирует с перекисями PhO2 и Na2O2.
При взаимодействии с углеродом тетраборид тория образует карбоборид ThJByCz, состав которого не установлен, плотность его ниже плотности тетраборида и составляет 7,552 г/см3 [794].
Имеются сведения о том, что ТЬВ4 в среде О2 и СО2 при 800° С в течение 50 ч не корродирует, при температуре 1000° С привес составлял около 6—7 мг/см2 при тех же условиях. Зна-
199
чительная коррозия Наблюдается в среде осушенного водорода при 100(^0, потери массы составили 10—11 msIcm1 после 50-часовой выдержки [830].
Методы получения боридов тория описаны в работах [409, 545, 598, 657, 746, 951, 970, 1026]. Штаккельберг и Нойман [970] получали бориды тория синтезом из элементов, нагреванием смеси порошков тория и бора при I50Q°С в вакууме. Этим же методом Бруэр и др, [598] получали тетраборид тория. Синтез осуществлялся при 1600—1700° С.
Пост и др, [910] для получения боридов тория рекомендуют использовать восстановление двуокиси тория смесью бора И угля. Предварительно спрессованные из подготовленной смеси ддастинки загружались в Графитовые ^гирли и нагревались ВЧ-токами. Процесс осуществлялся в водороде при 1500 и 1800° С с выдержками 2 и 1 ч соответственно. Образцы, полученные пр описанной методике, были загрязнены углеродом.
В работе [392] бориды тория получены карбидоборным методом в вакууме цо реакции 2ThO2 + 3B4C-t-C=2ThB6 + 4CO в интервале Температур 1200-^-1900° С.
Образовакие гексаборида тория начинается при 1300°С И заканчивается полностью при 1800° С в течение 35—45 мин. Содержание бора в продуктах реакции при оптимальном режиме (1800—4900° С) приближается к расчетному и Ьоставляет 21,31—*-21,76 масс. %, содержание углерода при этом в образцах малое (0,09—0,18 маср. %).
Тетраборид тория ThB4 карбидоборным методом в вакууме получить труднее в связи с протеканием побочной реакции образования карбоборида тория, что объясняется в работе [392] относительно невысокой устойчивостью ThB4 к углероду.
Боротермический ‘метод получения боридов был использован в работе [746]. Бине дю Жассоне осуществлял процесс на воздухе при пропускании токов около 500 а при напряжении 100 в через прессовки из смеси окиси тория с бором. В результате получена смесь боридов ThB4 и ThBg, которую надо было дополнительно разделять.
Борид тория ThBs лучше всего получать по методике, описанной в работе [409]. В основё этого метода лежит восстановление окислов металлов бором в вакууме по реакции ТЬО2+ + В->-ТЬВж+В2О2. Процесс ведется при 1600—1700° С (время выдержки 1ч).
Низкая работа выхода электронов для гексаборида тория ThBe (см. табл. 67) делает возможным использование его в качестве материала для изготовления катодов электронных приборов.
Бориды урана. Диаграмма состояния системы U—В, построенная в работе [736], показана На рис. 40. При исследовании диаграммы состояния использовались микроскопический, 200
рентгеновский и дилатометрический анализы сплавов, полученных дуговой плавкой.
При растворении бора в а-уране период решетки урана не изменяется, что свидетельствует о незначительной растворимости бора в а-уране в твердом состоянии. Температура ат^р-превра-
щения в уране при введении в него бора понижается нН 6° и составляет 661° С [527]. Да диаграмме состояния, по данным работы [736], температура этого превращения ошибочно принята равной 561° С. Температура Р^а-превращеция не зависит От содержания бора [736]. При содержании Около 2 ат.% В наблюдаете^ эвтектика с температурой плавления 1107° С, В области содержаний бора до 92 ат % установлено существование трех боридов *- UB2, UB4 и t>Bt2, которые плавятся без разложения при 2385, 2495
и 2235° С.
Диборид и тетраборид урана образуют эвтектику, температура плавления которой, равная 2300° С, значительно выше, чем сообщалось ранее в работе [598].
Структура боридов урана исследовалась в работах [578, 1026, 1027]. Диборид урана имеет узкую область гомогенности, в которой периоды решетки изменяются: а—-от 3,1293 до 3,1314 и с —от 3,9893 до 3,9857 А.
Рис. 40. Диаграмма состояния си-стемы U—В [736].
UB2 кристаллизуется в гексагональной сингонии, структурный тип А1В2, пространственная группа О'ел—P&lmmm, периоды решетки, А : а=3,14, с=4,00 [835].
UB4 имеет тетрагональную структуру, пространственная группа Dfh '—P^/mbtn с периодами, А: а=7,075, с = 3,979 (с/а= s=0,562) [1026, 1027]; у UBJ2 структура кубическая, пространственная группа Oft—Fm3m, период решетки а=7,473 А.
> Физические свойства боридов урана. В работе [305] измерены удельное электросопротивление, термический коэффициент со-
201
Таблица 63
Некоторые физические свойства боридов урана
Свойство ив. ив. ив„
Содержание бора, масс.,% 8,36 15,4 35,3
Структура Гексагональ- Тетрагональ- Кубическая
ная, тип А1Ва ная
Периоды решетки А:
а 3,14[835) 7,075 [1026, 1027] 7,473
с 4,00 3,979
с/а Плотность, г/см3: 1,274 0,562
рентгеновская 12,71 9,38 5,825 [578]
пикнометрическая —- 9,32 5,65
Температура плавления, °C 2385[736) 2495[736] 2235[736]
Коэффициент термического расширения, 10~9 град-1 (20 °C) Удельное электросопротивление, 9 по оси а 8 по оси с — 4,6[305]
— 98 [997] 23 [305]
МКОМ* СМ
Термический коэффициент сопротивления, 10~3 град-1 — -г— 4-2,3[305]
Коэффициент Холла 10~4 см3/к — — —0,24
Магнитный момент •— 3,4[997] —
Магнитная восприимчивость, Ю-4 (300 °C) Работа выхода, эв 550 [997] 1390[997] 70 [997]
(9,3-|-0,2)Х (3,4+0,8)Х (2,89+2,38) х
х10—4Т[713] Х10-4 Т[713] Х10-4Т[713]
Предел прочности при изгибе, кГ/см3 — 4218 [830] —-
Коэффициент излучения (900—1700 °C) — 0,75
противления, коэффициент Холла, термическое расширение, коэффициент излучения додекаборида урана. По методике [295]
оценены характеристическая температура и среднеквадратичные смещения атомов. Полученные в работе [305] сведения по элек-
трофизическим свойствам UB12 и свойствам других боридных фаз урана приведены в табл. 68.
Расчет критерия 6= =п+и2, — п_и2_, характеризующего
ера '
тип проводимости [997], показал, что для додекаборида урана
неприменима однозонная модель.
Анализ полученных в работе [305] результатов измерения электрофизических свойств UB^ и характер температурной зависимости р тетраборида урана (рис. 41) [997] позволяют сделать вывод о том, что бориды урана являются металлоподобными соединениями с металлическим типом проводимости. Малые величины коэффициента теплового расширения и среднеквадратичных смещений атомов в решетке UB12 свидетельству
202
ют об определяющей роли борного каркаса в его структуре. По аналогии с боридами трехвалентных металлов можно предположить, что проводимость осуществляется в полосах, образо
ванных атомами металла.
Исследование магнитных свойств боридов урана [664, 805] показало независимость магнитной восприимчивости от магнитного поля при температурах от 4,2—80 до 1000° К- При гелиевой температуре магнитная восприимчивость UB2 и UB12
возрастала, вероятно, вследст-
вие присутствия в них парамагнитных примесей.
Магнитная восприимчивость диборида урана в пределах экспериментальных погрешностей оказалась темпе-•ратурно-независимой, что находится в хорошем согласии с данными, приведенными в работе [664] (рис. 42) „
Магнитная восприимчивость додекаборида урана незначительно уменьшается с ростом температуры, а кривая X=f(T) тетраборида урана имеет максимум при 150° К. При температурах выше 450° К
Рис. 41. Удельное электросопротивление UB4 в зависимости от температуры (пунктирная линия —- кривая, приведенная к нулевой пористости [664]).
она изменяется по закону
Кюри—Вейсса с более высоким отрицательным значением константы Вейсса (—680° К).
Полученные результаты трактуются в работе [997] с позиции модели молекулярных орбиталей [805], при этом указывается, что большой вклад в магнитную восприимчивость боридов урана вносят орбитальный парамагнетизм и спин-орбиталь-ное взаимодействие, кроме обменного.
Температурную независимость магнитной восприимчивости UB2 можно объяснить, если предположить, что уровень Ферми находится под минимумом на кривой плотности состояний, как это предполагали для у-урана. Аналогичное объяснение дано и для UB12. Небольшие значения d'/JdT для UB!2 могут быть объяснены незначительным смещением энергии Ферми от положения минимума по сравнению с UBi2. Сложный характер температурной зависимости магнитной восприимчивости тетраборида урана объясняют в работе [997] по аналогии с палладием [852, 958], исходя из предположения наличия острого максимума на кривой плотности состояний вблизи уровня Ферми.
Химические свойства боридов урана исследовались Андрие [545] и обсуждены в работе [121]. Бориды UB4 и UBi2 легко растворяются в смеси HNO3 + H2O, бурно реагируют с пере-
203
кисями, UB4 растворяется в соляной и плавиковой кислотах,, UB12 устойчив в кипящих НС1 к HF, медленно реагирует с серной кислотой, тетраборид урана бурно реагирует с ней. Такое различное поведение боридов UB4 и UBii в соляной, плавико-
вой и серной кислотах можно использовать для разделения этих двух боридов.
В работе [996] отмечается способность диборида урана образовывать твердые 'растворы с изоморфными боридами и ниоби-
ем, что Делает его перспективным для использования в реакторной технике.
Методы получения. Бориды урана в работе (1012] получены спеканием рмеси порошков урана И бора в вакууме. Бруэр и др. [598] использовали этот же метод, но спекание осуществляли при 1550—1750° С в вакуумной ВЧ-печи.
Борид UB12 состава, близкого к стехиометрическому, получается [316] при восстановлении двуокиси урана бором в вакууме при 1500° С (время выдержки 1 ч).
Андрие [545] получала тетраборид урана электролизом расплавленных ванн составов: 1/20 и3О8-1-2В2Оз+
Рис. 42. Магнитная восприимчивость боридов урана и UB13 в зависимости от температуры [664].
+ MgO+MgF2 (1000°С, 9 в, 24 а)* 1/20 U3O8-l_2B2O34-CaO + + CaF2 (980°С, 5,2 в, 23 а); 1/20 U3O8+2B2O3+Li2Q + LiF (980° С, 3,8 в, 22 а). 1 '
Бориды плутония. Диаграмма состояния Системы Pu—В не построена. Сведения о боридах плутония малочисленны. Макдональд [835], спекая смеси порошков плутония и бора в широком концентрационном интервале содержаний бора, получил четыре борида: РиВ, РиВа, РиВ4 и РиВ6.
Моноборид плутония образуется при 1200° С. в области составов 40—70 ат. % В. РиВ2 наблюдали в узкой концентрационной области 60—65 ат.1% В в образцах, полученных при 800° С.
В области составов 70—85 ат. % В был выделен тетраборид плутония РиВ4 из образцов, спеченных при 1200° С. В образцах с таким же содержанием бора получен гексаборид плутония. Состав гексаборида не соответствовал стехиометрическому, в образцах присутствовал свободный бор. В работе отмечается, что на рентгенограммах образцов изученных составов имелись
204
нерасшифрованный линий. Предполагается существование В системе Ри—В других фаз»
Эйк [653] сообщает о существовании гектаборида плутония примерного состава PuB6e-76. изоморфного ректаборидам РЗМ и тория (951]. РиВ имеет кубическую структуру типа NaCl, период решетки 4,92 А, расстояние В—В равно 2,46 А [835]. РиВ2 кристаллизуется в гексагональной сингонии, структурный тип А1Вг, периоды решетки, А;а = 3,18, с=3,90, атомы плутония находятся в положении (О, О, Q), атомы бора—-в положениях (1/3, 2/3, 1/2) и (2/3, 1/3, 1/2),
Диборид плутония изоморфен дибориду урана [835]. У Р11В4. структура тетрагональная, структурный тип UB4 [835], периоды решетки, А:а=7,10, с=4,014. Расстояния Ме—В ц РиВ4 равны, A: Pu—Bi=2,77, РиВп=2,84 и Ри—Вш=2,47. -
РиВ6 кубический, структурный тип СаВв, период решетки изменяется от 4,115 до 4,140 А в зависимости от содержания В нем бора [835]. РиВ66_76 кубический, пространственная группа Fm3c, период решетки а—23,43 А [653]. Свойства боридов плутония не изучены.
БОРИДЫ МЕТАЛЛОВ IVa ПОДГРУППЫ
Бориды титана. Результаты многочисленных исследований боридов титана, их свойств, структуры и методов получения отражены подробно в монографиях [24, 121]. Тем не менее до
настоящего времени нет надежной диаграммы состояния системы Ti—В.
Диаграмма состояния системы Ti—В, приведенная в справочной литературе [121] (рис, 43), претерпела ряд существенных изменений И требует дальнейшего уточнения, До Настоящего времени неясны вопросы растворимости бора в титане. Есть мнение о незначительной растворимости бора в титане. Установлено, что растворимость бора в сплаве состава TiB менее 0,1% [24, 121]. Эрлих [655] предполагал, что в пределах составов TiBoj—TiB0i75-o,a из металлической решетки без заметных фазовых превращений образуется сверхст-
2
2600^-
2200 -n-t—
1800
1000
1000
600
10,15 18,0!з В, масс. %
\ Ti2B TiB \1ВгПгВ5Щ
Ti2B /
TtBz+S
„at ft
fi*TiB
a+TiB
2 VJ_ ___ I
I НВ г
tibois.
Ti 20 00 60 В,ат.°/,
Рис. 43. Диаграмма состояния системы Ti—В.
205
руктура, аналогичная титану; состав ее Не был выяснен.
Участок диаграммы состояния системы Ti—В в области больших содержаний металла (Ti—TiB) требует подробного изучения [637]. Вопрос о существовании Ti2B долгое время обсуждался в литература (см. работу [24]); Аронссон и Лундстрем [558, 561, 814] однозначно утверждают, что борида титана Ti2B не существует.
Данные Полти [902] о наличии Ti2B появились в связи с неправильным толкованием рентгенограмму моноборида титана. Действительно, сравнение периодов решетки моноборида титана и борида Ti2B, которому приписывалась в работе [902] тетрагональная структура с периодами, А: <2 = 6,11, с=4,53, свидетельствует в пользу выводов Аронссона [558] и Лундстрема [814].
В работе [902] предполагается, что моноборид титана TiB (см. рис. 43) образуется при перитектоидном превращении Ti2B-|-TiB2^3TiB при 2060° С, а при 2200±50°С по перитектической реакции из расплава, содержащего 9,9% В и TiB2, образуется Ti2B, распадающийся при 1800° С на жидкую фазу и TiB.
Структура моноборида титана обсуждалась длительное время. Эрлих [655] считает, что TiB кристаллизуется в гексагональной сингонии и имеет структуру типа WC; Полти [902] и Глезер [696] приписывают монобориду титана кубическую гранецентрированную структуру. Наконец, по данным Деккера [643], TiB имеет ромбическую структуру типа FeB [643]. Эта структура моноборида была подтверждена в более поздних работах [561, 814] и, видимо, может считаться наиболее правильной. Однако разноречивость данных о структуре моноборида титана, а также результаты исследования систем Ti—В и Zr—В дают основание заключить, что существование борида TiB в системе Ti—В требует уточнения [362].
Недавно в работе [665] было получено новое промежуточное соединение в системе Ti—В: Ti3B4. Существование борида титана состава Ti3B4 подтверждено в работе [814]. Диборид титана TiB2 получен Эрлихом [655], его существование подтверждено в работах Лундстрема [561, 814].
Ранее [655] предполагалось наличие у диборида титана широкой области гомогенности, простирающейся вплоть до состава TiB3, и указывалось на незначительное изменение периодов решетки между составами TiB2—TiB3. По-видимому, Эрлих получил соединение, близкое к Ti2Bs, ошибочно приняв его за TiB2 в области гомогенности.
Ti2B5, изоморфный W2B5, с гексагональной структурой описали в своей работе Глезер и Пост [696]; позже этот борид был подтвержден в работе [950], где указывается на его устойчивость при высоких температурах (1700—2100°С).
В. А. Эпельбаум и М. А. Гуревич определили структуру борида Ti2Bg и измерили периоды решетки, А:а=2,98, с= 13,98. 206
Существование борида титана Ti2Bs оспаривалось в работе [1024] при исследовании системы Ti—Мо — В. Вопрос о существовании додекаборида титана TiBia также остается не выясненным окончательно.
Сейболт [955] при получении сплавов системы Ti—В с содержанием 1 и 6 ат. % титана дуговой плавкой установил, что сплав бора с 1 ат. % титана представляет твердый раствор титана в боре, а с 6 ат. % титана — TiB2 в форме игольчатых кристаллов. Таким образом, установлено существование четырех боридных фаз титана: TiB, Ti3B4, TiB2 и Ti2Bs [643, 665, 696, 814, 950J.
TiB кристаллизуется в ромбической сингонии, структурный тип FeB, пространственная группа —Рпта с четырьмя моле-
кулами в элементарной ячейке с периодами решетки, А: а= =6,112, 5 = 3,06, с=4,56 [643].
Ti3B4 изоморфен Та3В4. Структура этого борида орторомбическая, пространственная группа —Immm, периоды решет-
ки, А: а=3,259, 5 = 13,73, с=3,042.
TiB2 кристаллизуется в гексагональной сингонии, структур-ный~ тип" А1В2, пространственная группа (D^—Pblmmm, с одной молекулой в элементарной ячейке, периоды решетки, А: а= = 3,028, с=3,228 [814].
Ti2Bg, изоморфный W2Bs, кристаллизуется в гексагональной сингонии, пространственная группа D|h—Pfalmmc, периоды решетки, А: а=2,98, с= 13,98.
Физические свойства диборида титана изучены достаточно полно. Исследованы удельное электросопротивление, коэффициент термо-э. д. с., теплопроводность, коэффициент термического расширения, температурные зависимости этих величин; измерены энтальпия и теплоемкость в интервале температур 273,15—2600° К, проведен теоретический расчет электронного спектра с использованием метода МО—ЛКАО (сильной связи), на основании которого оценен вклад атомов титана и бора в полосу проводимости, а также сделана попытка объяснить основные закономерности формирования физико-химических свойств диборида титана и их изменение в ряду TiB2—VB2— CrB2 [117, 124, 193, 448, 452, 453, 462, 1017].
Для диборида титана характерна линейная зависимость удельного электросопротивления от температуры и нелинейная — для коэффициента термо-э. д. с. (табл. 69). С повышением температуры крутизна спада коэффициента термо-э. д. с. уменьшается. Расчет параметров электропереноса в дибориде титана [124] дает основание заключить, что рассеяние на колебаниях решетки и на заряженных примесях носит смешанный характер. Кроме того, с повышением температуры увеличивается энергия Ферми и уменьшается подвижность носителей и их эффективная масса.
207
Таблица 69
Температурная Зависимость некоторых электрофизических свойств и основные параметры электропереноса* диборида титана
293
500
750
1000
1200
9,0 12,8 16,9 21,8 26,0
0,020
0,020
0,020
0,020
—2,9
—7,8
—11,4
—12,0
—12,0
0,028
0,010
0,002
0,002
152
89
1,47 0,54
1,00 0,77
0,99 0,95
1,2
1,1
1,0
* Расчеты параметров электропереноса проведены Б. А. Ковенской (ИПМ АН УССР),
Диборид титана среди диборидов других переходных металлов IV—VI групп периодической системы элементов обладает максимальной жесткостью решетки. Показано [452], что степень жесткости определяется степенью заполненности sp-состояний бора. У диборида титана по сравнению с диборидами ванадия и хрома степень заполненности sp-состояний бора наибольшая (3,95) [452]. О высокой жесткости решетки диборида титана свидетельствуют полученные экспериментально небольшие значения коэффициентов термического расширения и сжимаемости, а также высокие значения модуля Юнга и фононной составляющей теплопроводности [448, 453, 963].
Химические свойства диборйда титана описаны в работах [157, 222, 276, 704]. По данным этих работ, TiB2 относительно устойчив в соляной и плавиковой кислотах, легко растворяется в серной, азотной кислотах, в перекиси водорода, в смесях Н2О2+Н2С2О4, H2SO4+H2C2O4, разлагается расплавленными щелочами, карбонатами и бисульфатами щелочных металлов, перекисями свинца и натрия. Диборид титана не взаимодействует у расплавленными Zn, Cd, Sn, Pb, Bi, слабо взаимодействует с медью при температурах выше 1400° С, в жидком алюминии стоек до 1000° С [460].
Диборид титана устойчив при нагревании на воздухе. До 800° С TiB2 не окисляется, при 900° С наблюдается незначительное окисление с образованием стекловидной пленки, создающей диффузионный карьер для компонентов реакции окисления. Скорость окисления существенно возрастает при 208
1000°С [41]. В работах [35, 41] отмечается, что пористость образцов практически не влияет на характер окисления,, что объясняется «самозалечиванием» пор и трещин расплавленным борным ангидридом, образующимся в процессе окисления.
Методы получения. При изучении системы Ti—В для получения боридных фаз титана использовались различные методы: синтез из элементов (спекание или сплавление), карботермиче-ский метод, карбидоборный, боротермический, осаждение из газовой фазы, электролиз расплавленных сред.
В работах [643, 655, 846, 870, 902, 1012] бориды титана получались спеканием или сплавлением спрессованных смесей порошков титана и бора. Бруэр и др. [598] проводили синтез боридов титана из элементов в молибденовом тигле в вакуумной ВЧ-печи. Для уменьшения отклонения состава борида от заданного вследствие испарения бора в смесь вводился 10%-ный избыток бора.
Андерсон [539] получал бориды титана спеканием спрессованных смесей порошков титана и бора в запаянной кварцевой ампуле при 1100—1200° С или вакуумной печи при высоких температурах (1200°С).
Блюменталь [594] получал диборид титана углетермическим методом по реакции
TiOa + BA + 5С = Т1Вг + 5СО.
Состав диборида титана отклонялся от стехиометрического, сумма содержания металла и бора не превышала 96%.
Одним из наиболее экономичных и технологически удобных методов, дающих возможность получать бориды титана состава, близкого к стехиометрическому, является карбидоборный [24], основанный на реакции
2TiOa + В4С 4- ЗС = 2Т1В, -ф 4СО, проводимой в вакууме (около 5-10~2 мм рт. ст.) при 1400— 1450° С. С ростом массы исходной загрузки время процесса увеличивается до 60—180 мин при 1650—1750° С. Описанный способ позволяет получить TiB2 стехиометрического состава с содержанием до 0,02—0,03% С.
Диборид титана, не загрязненный углеродом, можно получить боротермическим способом [466, 898], заключающимся в восстановлении окиси титана бором в вакууме, по реакции
ТЮа + В -> TiBa + В/Д.
. Процесс осуществляется при 1500—1600° С, время выдержки в зависимости от загрузки (от 5—6 до 30—50 г) изменяется от 60 до 180 мин.
При использовании осаждения из газовой фазы диборид титана может быть получен либо в форме плотных поликристал-лических беспористых осадков [681], либо в форме монокри-
14 Зак. 1305 209
сталЛов [347, $95]. Суммарная реакция образования диборйДй титана при осаждении из газовой фазы при 1400° С может быть представлена схемой
TiCl4 + 2ВС1з + 5На -> TiBa + 10HCR
В работе [347] изучено влияние различных факторов на ориентацию, пористость и химический состав осадков. Диборид титана был получен в форме беспористых осадков стехиометрического состава с незначительной степенью преимущественной ориентации кристаллов. Прецизионное измерение периодов решетки диборида титана дало следующие их значения, А:а=3,034, с = 3,233; пикнометрическая плотность образцов лежала в пределах 3,104—4,5 г/см* (рентгеновская плотность 4,483 г/сл3).
В работах [347, 895] также тщатёльно исследована возможность получения монокристаллов TiB2 методом осаждения из газовой фазы. Установлено существенное влияние температуры, скорости прохождения реагентов через реакционное пространство, а также отношения Hg/XTiCh+BCla) На форму, размеры и чистоту кристаллов. При 1400° С, скорости подачи реагентов около 32 г/ч и соотношении Н2/(Т1С14-ЬВС1з)!С30 получаются дендритообразные кристаллы (см. рис. 30).
Методом транспортных реакций [867] с использованием в качестве реакционного и транспортного газа галогенов в течение 22 дней при 1100° С были получены монокристаллы диборида титана TiB2 в виде Мельчайших игл, Рентгеноструктурный анализ монокристаллов подтвердил принадлежность их к гексагональной сингонии. Периоды решетки, измеренные на монокристаллах, составляли, А : а = 3,03, с=3,23.
Электролизом расплавленных смесей: 1/2 ТЮ2+3 В20з + +MgO+MgF2 (при 1000° С), l/2TiO2+2B2O3 + CaO + CaF2 (при 990°С) и 1/2 TiO2+2B2O3+Na2O-|-NaF (при 950° С) —диборид титана был получен в форме пластинчатых гексагональных мелких кристаллов с металлическим блеском [545].
TiB2 —перспективный огнеупор. Он Используется при изготовлении сопл установок для распыления жидких металлов, лодочек, тиглей для испарения перегретых металлов В вакууме, трубопроводов для транспорта расплавленных металлов, защитных чехлов термопар [422]. Сплавы на основе борида титана используются в качестве материалов для изготовления управляющих стержней в термоядерных установках [903].
В табл. 70 приведены имеющиеся данные по физическим свойствам боридов титана.
Бориды циркония. В работе [24] подробно описаны результаты ранних исследований, в которых впервые были получены бориды циркония неопределенного состава.
Диаграмма состояния системы Zr—В, построенная в работах [598, 906], показывает наличие трех боридных фаз: ZrB, 210 -
"t а 5 л И ц а 16
Некоторые свойства боридов титана
Свойства TIB Ti,B4 Т1В, Ti,Bs
Содержание бора, мае?. 18,45 23,13 31,10 36,10 Гексаго-
Структура Ромбичес- Ромбичес* Гексаго-
кая, тип кая, тип нальная, нальная,
FeB Та3В4 тип А1В2 тип W2BS
[643] [665]
Периоды решетки, А: 6,1121814] 3,028 [814]
а 3,259 [665] 2,98 [696]
ь 3,054 (814] 13,73[665] » »
с 4,560 [814] 3,042(665] 3,228 [814] 13,98
Плотность, г/см9:
рентгеновская 5,26 «»>>« 4,52
пикнометрическая 5,09(902] 4,45[655] —л
Теплота образования. •Ч "Ч ч— 70,04 [24]; 105 [599]
ккал/моль ' 66,85 [24]
Теплоемкость, ккал/моль W-ч —4, 10,35±1,147х
Температура плавления, Х10—а [24]; 0,0064 [348]
2600 [24] •йм 2,980 —«
°C (разлагается) [24,646]
Теплопроводность, —ч» 64,5 [453];
вт/(м-град) 62,4 [869];
Коэффициент термичес- 4,5 [448]
кого расширения, 10~® град~1
Удельное электросопро- 40 [696] 9,0(447]; «чм»
тивление, мком-см 9,0 [755]
Термо-э.д.с., мкв/град Коэффициент Холла, — 2,9 [447]
ч— —г* —19,6 [447]; ХМ
Ю~4 см3/к —17,8(185]]
Магнитная восприимчивость, 10~в см3/г •— -}-0,45 [39] Г
Работа выхода, эв — 4,08(462] -м
Микротвердость, кГ/мм3 2800 [24] «ч — 3480 [24] 4-»
Модуль упругости, 10—6 1» 3,8—5,4 Г4-»
кГ /см3 [308]
Предел прочности при сжатии, кГ/мм3 Предел прочности на 158,0 [37]
» 14,4—18,5
изгиб, кГ/мм3 Ударная вязкость, ка-м [348]
—“! 0,003(308] •ххм
Коэффициент излучения (л=0,655 мкм) — — 0,69 [24]
Коэффициент рекомби- ч— — 1,13±0,23 « X
нации атомов водорода, (Т±ДТ)-1(Р [173]
14* ац
подработы
ZrB2 и ZrBi2. Данные 6 растворимости dopa в циркойий разноречивы. По работе (768] предел растворимости бора в цирконии составляет около 1 ат. %. Растворение бора ведет к увеличению периодов решетки циркония от а=3,235 А и с = 5,149 А до а = = 3,255 А и с=5,213 А.
По данным [398], предел растворимости бора в р-цирконии составляет 2,87 ат. %; при этом твердость циркония возрастает до 1120 кГ/мм2. Проведенное недавно исследование [359] показало, что предельная растворимость бора в p-цирконии не превышает 3 ат.%, что тверждает данные [398]. В а-цирконии растворяется около 2 ат. % В [878]. В работах [120, 878] указывается, что растворимость бора в p-цирконии не превышает 5 ат.%, что несколько выше результатов работ [398, 359].
Ранее в работе Сейболта [955] впервые указывалось на то, что цирконий растворяется в боре. Эта растворимость более 1 ат. %, но менее 6 ат. %. Сплав бора с 1 ат.% Zr в литом состоянии имеет одно-Рис. 44. Диаграмма состояния систе- фазную структуру, в сплав с мы Zr—В [362]. 6 ат. % Zr входит ZrB12.
К. И. Портной и др. [3591 показали, что предельная растворимость циркония в боре лишь несколько’выше 1 ат.%. Борид ZrBi2 и твердый раствор циркония в ^-ромбоэдрическом боре образуют эвтектику, плавящуюся при температуре около 1975° С (рис. 44). Относительно существования моноборида циркония ZrB мнения расходились.
Пост и Глезер [906] считали, что существует моноборид циркония ZrB с кубической гранецентрированной решеткой (а = = 4,65 А), устойчивый в интервале температур 800—1250°С.
Аналогичные результаты были получены Ю. В. Ворошиловым [43, 44] и П. С. Кислым [120]. Кроме того1, сообщалось, что ZrB плавится с разложением , по перитектической реакции и устойчив при температуре выше 1500° С [878]. В работах [879, 930] впервые ставится под сомнение существование моноборида ZrB.
Предполагается, что на стабилизацию моноборида циркония влияют такие примеси, как углерод и азот, о чем свидетельствует сходство 'структур ZrB и ZrC, а также близость периодов решетки этих соединений.
212
Эпельбаум и др. [530] получали сплавы с содержанием бора. от 0 до 73 ат. % при 1900—2300° С и обнаружили только диборид циркония ZrB2.
В обзорах [561, 814] отмечается, что образование моноборида циркония маловероятно из-за неблагоприятного размерного фактора. Таким образом, для доказательства существования моноборида циркония необходимо тщательное исследование, исключающее влияние каких бы то ни было примесей, что было осуществлено1 К. И. Портным и др. [359, 362].
В этой работе исследована система Zr—В методами термического, металлографического и локального рентгеноспектрального анализов в широком интервале содержаний бора, в условиях, исключающих загрязнение и контакты с посторонними материалами, проводилось измерение микротвердости фаз.
В сплавах, близких по составу к ZrB, ускоренное охлаждение от различных температур в интервале 1500—2500° С не зафиксировало присутствия моноборида циркония. ZrB не обнаружен ни микроструктурным, ни локальным рентгеноспектральным анализами. В изученных сплавах наблюдаются лишь крупные выделения диборида циркония ZrB2. Сплавы, содержащие от 5 До 58 ат. % бора, имели температуру плавления около 1680° С (температура плавления эвтектики из В-циркония и ZrB2).
Таким образом, исследования сплавов бора с Цирконием, проведённые К. И. Портным и др. [359, 362], дают основание полагать, что моноборид циркония не существует. За приведенные ранее сведения о ZrB [120, 878] ответственны примеси углерода, азота или кислорода, вызывавшие образование карбоборида или другого соединения циркония сложного состава, которому ошибочно была приписана формула ZrB, На рис. 44 приведена диаграмма состояния системы Zr — В, построенная по данным работы [362] и являющаяся наиболее вероятной в настоящее время. Здесь же подтверждено существование диборида и додекаборида циркония. Таким образом, в системе Zr —В Достоверно’ установлено существование двух боридных фаз — ZrB2 и ZrB12.
ZrB2 кристаллизуется в гексагональной сингонии, структурный тип А1В2, пространственная группа DJe/t—Р6/ттт, формульных единиц в элементарной ячейке одна, периоды решетки, А:я=3,165, с=3,547, что хорошо согласуется с прежними данными других исследований [530, 561, 878].
ZrBj2, по данным работы [696], имеет кубическую гранецентрированную решетку с четырьмя формульными единицами в элементарной ячейке, пространственная группа 0^—Fm3m, плавится конгруэнтно, обладает металлическими тепло- и электропроводностью и высокой твердостью.
213
В работах [359, 932] указывается на перитектический характер плавления борида ZrBI2. Температура плавления ZrBi2 — около 2030° С [359].
Физические свойства ZrB2 исследованы относительно хорошо. В ряде работ [62, 124, 173, 193, 447, 453, 1008] изучались электрофизические, термические и термоэмиосионные характеристики диборида циркония. Температурная зависимость удель-кого электросопротивления, коэффициента термо-э. д. с., основные параметры электропереноса приведены в табл. 71.
Таблица 71
Температурная зависимость некоторых свойствен основные параметры электропереноса* диборида циркония
Для диборида циркония наблюдается линейная зависимость удельного электросопротивления от температуры. Температурная зависимость термо-э. д. с. (см. табл. 71) незначительно отклоняется от линейной. Параметр рассеяния г уменьшается с повышением температуры. Получены большие значения подвижностей при незначительной концентрации носителей. Расчеты показали, что с повышением температуры возрастает энергия Ферми, уменьшаются подвижность и эффективная Масса носителей. Замеченные закономерности вытекают из электронного строения диборида циркония. Атомам металлов IV группы, к которым относится цирконий, свойственна высокая донорная способность, проявляющаяся в передаче атомам бора (при образовании борида) части валентных ^-электронов [436]. Это приводит к уменьшению плотности состояний на поверхности Ферт ми по сравнению с чистым цирконием и уменьшению рассеяния носителей.
214
Характер изменения теплового расширения диборида циркония, изученный на кварцевом дилатометре в высокотемпературной вакуумной камере в интервале температур 300—2500° К, находится в хорошем согласий с- изменением модуля Юнга, коэффициента сжимаемости и фононной составляющей теплопроводности, характеризующими жесткость кристаллической решетки,
Для диборида циркония обнаружено возрастание теплопроводности с температурой [453], что, по-видимому, обусловлено вкладом ее электронной составляющей.
В работе [462] изучены термоэмиссионные свойства диборида циркония^ измерена работа выхода электронов в интервале температур 1300—2100° К.
Свойства додекаборида циркония изучены мало. Имеется Лишь указание, что ZrB)2 при Температуре ниже 5,7ЬК становится сверхпроводником [831].
Химические свойства диборида циркония изучались в работах [157, 181, 276]. Исследована химическая стойкость диборида циркония в кислотах, щелочах, их смесях, а также в растворах щелочей при комнатной температуре и кипячении. Установлено, что ZrB2 в кислых растворах менее устойчив, чем дибориды металлов V группы.
Разложение диборида циркония в соляной и серной кислотах идет по реакциям
ZrB2 -f 2НС1 + 5Н2О «= ZrOCl2 4- 2НВО2 4- 5Н2;
ZrB2 + H2SO4 + НаО ZrOSO4 + НВО2 + H2S + На
с выделением водорода, количество которого составляет 4—« 5 моль на 1 моль разложившегося борида. Введение окислителей (перекиси водорода) увеличивает скорость разложения борида, Введение комплексообразователей (щавелевой и лимонной кислот) не влияет на разложение диборида циркония. В растворе щелочи борид циркония ведет себя инертно. При разложении ZrBa в соляной и серной кислотах наблюдается образование бороводородов, которые обнаруживались по присутствию в продуктах разложения борной кислоты (результат взаимодействия бороводородов с водой), сероводорода и сернистого газа (продукты восстановления серной кислоты бороводородаМи).
В условиях электродной поляризации в насыщенном растворе хлорида натрия (около 300 е/л, рН = 4ч-5) при 20° С и в неводных средах: спиртах, дихлорэтане, нитробензоле, содержащих как простые галоидные соли (NaBr, КВт, Nal и KI), так и комплексные соединения типа CH3CONH2Br2, борид циркония разрушается анодно даже при малых скоростях тока (5* 10-4— 1 • 10—3 а! см?). При катодной поляризации в растворе хлористого натрия ZrB2 разрушается с образованием рыхлого слоя на поверхности образца [Ю4], 1
215
Диборид циркония отличается относительно высокой стойко, стью против окисления. При 600—800° С он практически не окисляется, едва заметное окисление начинается при 900— 1000° С. Пленка, образующаяся при окислении ZrB2, обладает высокими защитными свойствами [796]. Предполагается, что продуктами окисления диборида циркония являются бораты [35, 41].
Исследование высокотемпературной коррозии в среде кислорода и поведения в вакууме борида циркония при температурах от комнатной до 1500° К [62] показало, что выдержка в течение 5 ч при 1473° К в чистом кислороде приводит к увеличению массы образца диборида циркония на 13,56 кГ/см2. Диборид циркония проявляет повышенную жаростойкость в кислороде по сравнению с СгВ2 и W2B5. Такое поведение ZrB2 в кислороде объясняется образованием на поверхности образца цельной пленки, состоящей из двуокиси циркония со стекловидными включениями борного ангидрида, переходящего ни воздухе в гидрат В2О3 • пН2О.
Диборид циркония устойчив против действия углерода вплоть до высоких температур [24, 27]. Диборид циркония стоек против многих расплавленных металлов; не взаимодействует с Mg, Си, Zn, Cd, Sn, Pb, pi, Fe; слабо взаимодействуете жидким алюминием при температуре выше 1000° С; жидкий кремний смачивает поверхность диборида циркония, образуя краевой угол около 20—0°, наблюдается образование твердого раствора кремния в ZrB2 [460, 890].
В среде азота и безводного аммиака диборид циркония стоек до 1200° С. При 1300° С начинается взаимодействие ZrB2 с азотом с образованием ZrBxNi^x [613].
Некоторые электрофизические и физико-химические свойства боридов циркония приведены в табл. 72.
Методы получения боридов циркония, применяемые в различных работах, разнообразны. Бориды циркония получали дуговой плавкой смеси алюминотермического циркония и бора, спеканием смеси порошков циркония и бора прямым пропусканием тока через спрессованные брикеты, спеканием методом горячего прессования и т. д. [545, 746, 970].
Восстановление смеси ZrO2 и В20з углеродом по реакции ггО2 + В2Оз + 5 C = ZrB2 + 5 СО [24] связано с высокой летучестью борного ангидрида, что требует больших (тройных и четверных) избытков его в шихте. Недавно предложен новый вариант карботермического метода получения чистых боридов, свободных от примесей [261, 263], не связанный С введением в шихту избытков борного ангидрида. Процесс Проводится в две стадии. В первой стадии осуществляется восстановление смеси окислов металлов и бора углеродом (МеО + В2Оз + С->МехВу + + СО), во второй — борид рафинируется от примесей углерода и остатков кислорода нагревом в вакууме с небольшими до-216
Таблица 72
Некоторые свойства боридов циркония
Свойство
Содержание бора, масс. % Структура 19,8 Гексагональная тип А1Ва [906] 58, Кубическая гранецентрированная, тип UBl2 [696]
Периоды решетки, А: а с с/а Плотность, г/см3: рентгеновская пикнометрическая Теплота образования, ккал/моль Теплоемкость, ккал! (моль-град) (0—800°-С) Энтропия, кал'/моль град) (298° К) Температура плавления, °C Теплопроводность, кал/(см сек град): 3,17(867] 3,165(359] 3,547[359] 3,53{768] 1,11—1,12 6,09—6,13 6,17 >78 [599]; 75 [24]; 77,2±1,2 [737] 14.20+7.787Х Х10-3?+4,028х Х10—в/2 [24] 10,7[24] 3040 ±100[24] 3200[359] 7,408 (696] 3,63[696] 3,70[696] >120 [599] 2030[359]
при 23° С » 200° С » 300° К, втЦм’град) Коэффициент термического расширения, 10—8 град ~ при 20—1000° С » 1600—2200° С Удельное электросопротивление, мком-см: при —80° С » 25° С Термический коэффициент электросопротивления, 10~3 град~г Коэффициент термо-э.д.с., мкв/град Коэффициент Холла, 10~4 см3/к Магнитная восприимчивость, 10~3 см3/г Работа выхода, эв Плотность Тока эмиссии в парах цезия, а/см2 Микротвердость, кГ/мм2 Модуль упругости, кГ/мм2 Предел прочности при разрыве, кГ/мм* (20° С) Ударная вязкость, кГ-м/м2 0,055(869] 0,060[962] 58,0 [453] 5,9—6,2 (448,449] 28-10-» [166] 9,7 [449] 2,3 [124] —3,3(449, 124] —19,0 [449, 124] —0,60 [308] 3,69[462] 1—3; 5 [464] 2190[359] 35000[24] 183 0,006(308] 0,029(696] 60—100(24] 60 [696] +0,00162 [696] 2750—2850 [359]; 45000 ±150 [166] 2680[24]
217
Продолжение табл. 72
Свойство ZrB, ZrBia
Среднеквадратичное смещение атомов ]/^иг, А 0,081 [447] —Ji
Коэффициент рекомбинации атомов водорода, (у ± А у) • 102 1,12±0,22[173] —»
Коэффициент излучения при 850— 1650° (Х.=0,650 0,86—0,95 [465]
банками окисла данного металла и бора. При прокаливании борида циркония с небольшими добавками окисла и бора (примерно до 2% сверх расчетного) при 1900° С в течение 2 ч содержание углерода снижается до 0,06%,
Двухстадийность карботермического способа получения диборида циркония достаточно трудоемка и неэкономична для получения диборида циркония в промышленных масштабах.
В работе А. И. Карасева [111] на основании тщательного Исследования параметров карботермического метода получения борида циркония (изучалось влияние температуры, времени выдержки, скорости подъема температуры до оптимальной, состава шихты и состава газовой среды на процесс получения борида) предложено Получать диборид циркония при 1900° С в среде водорода или конверсированного газа из шихты е 30 % -ным избытком борного ангидрида против расчетного; Содержание углерода при этом не превышает 0,5%, содержание циркония —- 76,9—81 %* бора-ч-больше 18%, что близко к стехиомет^ рическому составу. Необходимо отметить, что карботермиче-ский метод пригоден в основном для получения технического диборида циркония.
Технологическим методом получения диборида циркония считается борокарбидный [257, 372, 384], заключающийся во взаимодействии окислов металлов с карбидом бора по реакции
Me -f- В^С -f- С —н МеВ2 СО
и осуществляющийся в вакууме при 1500—1600° С или в водороде при 1900° С. Борид циркония, полученный этим методом, близок к стехиометрическому составу и не требует никаких до-“ полнительных операций очистки.
Функе и Юдковский [511] показали, что состав диборида циркония в значительной степени зависит от содержания связанного углерода в карбиде бора (табл. 73)’, а .также От его крупности. Чем мельче карбид бора и чем больше в нем связанного 'Углерода, тем ближе состав получаемого диборида циркония к стехиометрическому, 218
Таблица 73
Влияние химического состава исходного карбида бора на состав борида циркония
Ns партии] Химический состав карбида бора, масс» %
Р «Девиз) Fe 81 CtB
1 76,23 23,25 0,33 0,7 6,305
п 78,20 21,00 0115 ' 0,54 0,268.
ш 78,3* Г— г-*? 0,276
Продолжение табл. 73
№ партии Химический состав борида, % ,
в . Zr С(связ) Ге 81 X Zr:B
I 19,01 80,48 0,30 0,01 Следы 99,80 4,234
II 16,56 77,85 1,40 0,09 0,002 95,81 4,70
III 19,18* 80,82 ъ— 100,0 4,21
* Стехиометрический состав.
Вакуумный процесс приводит к тому,, чтр такие примеси, как Fe, Si, Al, Mg, Na, Са, удаляются в процессе реакции поч-' ти полностью,
В работе [470] предложен боротермический способ получения диборида циркония, заключающийся в восстановлении двуокиси циркония бором в вакууме по реакции
ZrO<j -f- В -> ZrB2 -J- В2О2-
Продукт, полученный при 1600° С в течение 1 ч, представляет собой, по данным химического и рентгеновского анализов, диборид циркония с содержанием 80,3% Zr и 19,1 % В. При боротермическом способе получения диборид Циркония не загрязнен углеродом, что очень важно при использовании его в катодной электронике [464].
Борокарбидный и боротермический способы получения бори1-да циркония в настоящее время приняты для промышленного производства,
В работах [854, 879] соединения циркония с бором неопределенного фазового состава получены осаждением из газовой. фазы. Методом осаждения из газовой фазы при тщательном проведении эксперимента можно получать очень чистые, однофазные бориды стехиометрического состава. Так, в работе [681] получен диборид циркония есаждением из Газовой фаза по сум-
219
маркой реакции
ZrCl, + 2BC1S + 5Н2 = ZrBa + 10НС1
при 1400° С лишь с незначительной примесью 0-ромбоэдриче-ского бора. На ориентацию граней, пористость осадков и их стехиометрию влияют различные факторы процесса (см. с. 123).
Метод осаждения из газовой фазы перспективен при создании материалов с, оптимальной структурой для использования их в качестве высокотемпературных тяжело нагруженных конструкций, работающих в: окислительных условиях.
Для получения борида циркония может быть применен метод электролиза расплавленных сред, описанный Андрие [545] и Нортоном [869], с использованием расплавленных ванн составов '/^гОгЧ^ВгОз+М^О+М^Бг или V4ZrO2 + 2 ВгОз + СаОЧ-+ СаРг. Андрие получала смесь боридов, в работе Нортона получен ZrB2 состава 80,0 и 18,9% В, что близко к стехиометрическому. Плотность такого диборида ZrB2 составляла 6,17 г!см? (6,09 — рентгеновская плотность).
Диборид циркония находит широкое использование в различных областях техники [24, 119, 430, 431, 697].
Стабильные термоэлектрические характеристики диборида циркония при работе в агрессивных средах и высоких температурах обусловливают использование его в качестве термоэлектродов в термопарах с графитом (ТГБЦ) [144], применяемых для измерения температур расплавленных чугуна, стали, нейтральных и науглероживающих газовых сред, вакуума. Пределы температурных измерений 800—2000° С, время стабильной работы 400—500 ч.
Диборид циркония по сравнению с чистым бором обладает высокой радиационной стойкостью. По данным работы [348], из порошка ZrB2, облученного нейтронами до выгорания 67,8 ат. % по 10В (8,9% полного числа атомов), выделилось 0,41% теоретического количества гелия, образовавшегося в процессе облучения в течение 2800 ч при 54,5° С, и при последующем нагреве до 400° С в течение 140 ч выделилось 0,9% теоретического количества. Указывается на возможность использования диборида циркония в качестве поглощающего материала для ядерных реакторов.
Бориды гафния. Диаграмма состояния системы Hf—В, приведенная в справочной литературе [527] по данным работ Руди, Новотного [877] и Глезера [698, 950], показывает существование в этой системе двух боридных фаз — HfB и HfB2. Указывается также на большое сходство диаграмм состояния Hf—В и Zr—В в области больших содержаний металла.
Руди и Бенезовский [930] установили, что при растворении бора в гафнии периоды решетки а-гафния возрастают, А: а — от 3,194 до 3,204, с — от 5,052 до 5,090. Указывается на существование двух боридных фаз гафния—HfB и HfB2. В этой 220
2070 98
Ц-Hf + HfBz
I
-h1—-1—
же работе монобориду гафния приписываемся то ромбическая структура типа FeB, то кубическая типа NaCl, Отмечается, что ромбическая структура переходит в кубическую при загрязнении моноборида гафния углеродом или кислород.
На основании результатов этого исследования можно предположить, что либо при взаимодействии моноборида гафния с углеродом образуется карбид гафния HfC, кристаллизующийся в кубической гранецентрированной решетке типа NaCl, либо за моноборид гафния принято какое-то другое сложное соеди- t,’C нение.
К. И. Портной и др. [361, 362] провели тщательное исследование системы Hf—В, на 3000 основании которого построена диаграмма состояния Hf—В (рис. 45).
Для приготовления сплавов использовали порошок 99,6% Hi и 99,5% В(ам). Методика приготовления сплавов, исключающая взаимодействие сме-сей с другими элементами, парение и ликвацию компонентов шихты, давала возможность наблюдать сплавы в виде капель, которые удержива-^^1 лись в поле наблюдения поверхностным натяжением. Для уменьшения попадания в сплавы азота и кислорода использовался титановый геттер. Для фиксирования фазовых превращений проводились изотермический отжиг и ускоренное охлаждение со скоростями более 700° С/сек.
На основании проведенных исследований показано существенное влияние азота и кислорода на фазовое равновесие в системе Hf—В. Отмечено появление двух уровней начала плавления сплавов в области существования предполагаемого моноборида HfB, которые зависят от содержания примесей. Такое же наблюдение было сделано и Руди [932]. Температура около 1820° С (первый уровень) соответствует эвтектике р-гафний и HfB2, температура около 2070° С связана с плавлением эвтектики, состоящей из а-гафния, стабилизированного примесями, и HfB2.
Результаты работ К. И. Портного и др. [361, 362] дают основание полагать, что моноборид гафния, описанный ранее [877], представляет сложную фазу Hf (В, N, О), возникающую
Hf 20 40 60 80 B,am.7,
Рис. 45. Диаграмма состояния системы Hf—В [362J.
221
в результате ВЛйяния гйзоВЫх (азот, КйСЛорбд] прймесей йа взаимодействие гафния С бором, Таким образом, можно считать установленным существование только одного соединения гафния с бором — диборида HfB2. V
Структура HfB2 гексагональная, тип А1В2, 'пространственная группа PQjmmm, периоды решетки А; а?=3,137, с=3,469 [315],.
Относительно существования области гомогенности диборида гафния нет единого мнения, В работе [744] приводятся на ос-новации термодинамических данных следующие пределы состав ва диборида! HfBii90~2,10. В то же время, по данным Руди [930], HfB2 не имеет заметной области гомогенности. Рассмотрение этих Данных и сравнение их с результатами исследования областей гомогенности диборидов титана и циркония [655, 878] дают основание считать, Ито диборид гафния не имеет заметной Области гомогенности. Сведений о существовании до-декаборида гафния нет, рее попытки получить HfBi2 не дали результатов [121, 932].
В работе [362] показано, что в p-ромбоэдрическом боре растворяется около 2 ат. % Hf> причем отмечается, что это растворение приводит к некоторому упорядочению структуры, чтй выражается в изменении интенсивности отдельных линий p-ромбоэдрического бора на рентгенограмме.
Образование таких высокобористых твердых растворов на основе решетки p-ромбоэдрического бора наблюдалось в систе-мах Сг—В, Мп—В, Fe—В, Ni—В, Si—В [542, 614, 687, 1009].
Свойства диборида гафния —» теплофизические, термодина-мические, электрофизические и химические *— изучены относительно Хорошо и описаны в ряде работ* [189, 315, 447, 451, 453; 945]. Основные, наиболее достоверные физико-химические характеристики диборида гафния приведены В табл, 74,
В работах [447, 451] исследованы электрофизические свойства и коэффициент Холла при комнатной температуре, а также рассчитаны основные характеристики электропереноса В Однозонном приближений для диборида гафния. Температурная зависимость полученных значений приведена в табл. 75*
Как показывают полученные результаты, для диборида гафния характерна линейная температурная зависимость удельногб электросопротивления и нелинейная для коэффициента термо-э. д, с. На основании рассчитанных величин параметра рассеяния г можно заключить, что рассеяние на колебаниях решетки и на заряженных примесях носит смешанный характер.
Расчеты параметров электропереноса Показали, что с повышением температуры увеличивается энергия Ферми и уменьшаются подвижность и эффективная масса носителей.
На основании результатов измерений и расчета можно сказать, что атомы гафния при взаимодействии с атомами бора передают последним На формирование прочных ковалентных связей В—В часть валентных sd-электронов. Это приводит к
222
Таблица 74
Некоторые свойства диборида гафиия
Свойство. рорид HfB,
Содержание бора, масс. % Структура О Периоды решетки, А: а b в Плотность, г!см3'. рентгеновская пикнометрическая Теплота Образования , ккал!моль Мольная теплоемкость при 700° С, кал/([моль-град) Энтропия AS29g, кал!(моль-град) Температура плавления, *С Теплопроводность, 10—3 калКсм-сек-град) Коэффициент термического расширения, 10—♦ град^1 Удельное электросопротивление, мком-см Коэффициент термо-э.д.с,, мне!град Термический коэффициент электросопротивления, 10—3 град~1 Коэффициент Холла, 10~4 см?)к Магнитная восприимчивость, 10~® см3/г Работа выхода электронов, эв Микротвердость, кГ}ммг Среднеквадратичное смещение атомов иг, А Температура перехода к сверхпроводимости, °К Коэффициент излучения при 1600° С =0,655 мкм) 10,81 Гексагональная, тцп А1В2 3,137 [315]; 3,142(930]; 3,14(814] 3,469(315]; 3,477(930]; 3,470(814] 11,28 10,5(698] 79,65[947] 29,98 11,02(947] 3250±100[542] 3054(124] 104,0(189]; 51,0(453] 6,3(854]; 6,3(447] 10,2(854]; 10,6(447] —1,0(4471 3,6(854]; 3,3(447] —18,0(447] 4-0,06(39] 3,54[451 ] 2900 [315]Г 2250±200 [945] 0,083[447] 1,26(723] 0,9(315]
223
Таблица 75
Температурная зависимость некоторых свойств и основные параметры электропереноса в HfB2
Температура, °К Удельное электросопротивление, МКОМ-см rfp dT Коэффициент термо -э.д.с., мкв!град da . dT Коэффициент Холла, 10“4 см*/к Концентрация носителей п, 10“ 21с.«~3 Подвижность и, см*!сек Отношение эффективной массы к массе свободного электрона Уровень Фёрмн, эв Параметр рассеяния
293 10,6 —1.0 —18,0
500 17,6 0,033 —4,4 0,020 .— 3,5 105 1,76 0,47 1.0
750 25,8 0,033 —8,5 0,015 1 —— 69,2 1,22 0,68 1,0
1000 34,5 0,033 —11,3 0,010 — 61,8 0,92 0,90 1,0
1250 43,2 0,033 —13,2 0,006 — •— 41,2 0,74 1,12 1,0
уменьшению плотности состояний на поверхности Ферми по сравнению с чистым металлом. С повышением температуры степень перекрытия внешних электронных состояний возрастает, связанное с этим размытие полосы проводимости обусловливает уменьшение эффективной массы носителей, а это, в свою очередь, приводит к уменьшению величины термо-э. д. с. с повышением температуры.
Химические свойства. Е. М. Савицкий и J4. И. Тимофеева [382] исследовали химическую стойкость диборида гафния по отношению к различным кислотам, воде и кислороду. По данным этой работы, HfB2 частично растворяется в концентрированной соляной, серной и хлорной кислотах. Менее стоек HfB2 в HNO3 (нерастворимый остаток составляет 30 масс. %). При кипячении в концентрированной азотной кислоте и царской водке HfB2 растворяется полностью в течение 30 мин, а в НСЮ4 (плотность 1,20), HF и HNO3 (1:1)—за 1 ч. Практически полное растворение борида гафния происходит в концентрированных НС1, H2SO4, Н3РО4, НСЮ4 (1 : 1), H2SO4 (1 :1), Н3РО4 (1:1); за 2 ч нерастворимый остаток составлял 1—3 масс. %.
По отношению к уксусной кислоте и растворам перекиси водорода и аммиака HfB2 устойчив как йри комнатной температуре, так и при нагревании. В воде при комнатной температуре HfB2 весьма устойчив, не взаимодействует и с кипящей водой (по истечении 100 ч в растворе обнаружено 0,0045 масс. % В).
Разложение диборида гафния кислотами, не обладающими окислительными свойствами, сопровождается значительным выделением водорода, количество которого составляет 4—5 моль на 1 моль борида [157].
224
Диборид гафния обладает высокой стойкостью против окисления на воздухе [41, 315] благодаря образованию при 900° С защитной пленки, состоящей из бората Hf, В2О3, HfB, а при температурах выше 1100° С—только из бората гафния. Из боридов переходных металлов IVa подгруппы диборид гафния самый стойкий [41].
Скорость окисления диборида гафния в кислороде изменяется по параболическому закону до 1100° С. Энергия активации процесса окисления диборида гафния в интервале температур 700—1200° С составляет 20,4 ккал, а в интервале 1200—1400° К— 34,9 ккал. Уравнения окисления HfB2 до 1200° К и при более высоких температурах имеют вид
Ат =4,2-10-6 ]/т ехр (— 20 400/jRT) мг!см2 и
Am = 2,2 • 10-3 [А; ехр (— 34 900//?Т) мг/см2.
Методы получения боридов гафния. Бориды гафния в работах Глезера [698, 950] получали синтезом из элементов. Этим же способом, но с использованием высокочистых порошков исходного гафния и бора получались сплавы гафния с бором в работе К. И. Портного и др. [361, 362].
Моерс [854] получал соединения гафния с бором неопределенного фазового состава при разложении смеси ШС14 и ВВгз на нагретой металлической нити при 1927—2727° С. Кэмпбелл [24] получал сплавы гафния с бором также неопределенного состава осаждением из газовой фазы HfCl4—ВСЦ в присутствии водорода при 1900—2700° С.
В работе [681] проведено тщательное исследование метода осаждения из газовой фазы применительно к получению диборидов титана, циркония и гафния. В работе получены беспористые осадки диборида гафния HfB2 с незначительной примесью P-ромбоэдрического бора.
Монокристаллы HfB2 получены в работе [714].
Диборид гафния лучше всего получать борокарбидным и боротермическим способами по реакциям
НЮ2 4- В4С -> HfB2 + СО; (1)
HfO2 + B->HfB2 + B2O2, (2)
осуществляемым в вакууме при 1600—1700° С [315].
С целью предварительного определения интервала температур образования диборида гафния были проведены манометрический анализ реакций (1) и (2) по методике [401] в интервале температур 800—1800° С и термодинамический расчет изменения свободной энергии от температуры. Зависимость изменения сво-
15 Зак. 1305
225
бодной энергии от температуры для реакций (1) и (2) определяется соответственно выражениями
Д7 = 358,2-103—175,057
и
Д7 = 91,9- 10s — 39,17.
Анализ полученных результатов показал, что взаимодействие окиси гафния с карбидом бора происходит при несколько более низких температурах, чем с бором.
В результате обработки манометрических кривых изменения давления в реакционном пространстве печи в процессе прохождения реакций взаимодействия двуокиси гафния с карбидом бора и бором рассчитана теплота образования диборида гафния, равная —74,2 ккал/моль, что согласуется с общим ходом увеличения теплот образования в ряду боридов TiB2—ZrBa— HfB2 [393] и калориметрическими данными работы [947] (—79,65 ккал/моль). Остальные свойства боридов гафния приведены в табл. 74.
Есть упоминание о возможности использования HfB2 в качестве присадки к материалам управляющих стержней в реакторах благодаря большому сечению захвата нейтронов [903].
БОРИДЫ МЕТАЛЛОВ Va ПОДГРУППЫ
Бориды ванадия. Диаграмма состояния системы V—В предложена в работе [527]. Основанием для построения этой ориентировочной диаграммы послужили данные, полученные при исследовании сплавов, спеченных и литых, методами металлографического, рентгеновского анализов, а также измерением температур плавления фаз.
На диаграмме состояния отражены следующие бориды ванадия: V3B2, VB, V3B4 и VB2, из которых VB, V3B4 и VB2 были известны ранее [545, 871, 869, 1012] (рис. 46). По этим данным все бориды ванадия, кроме V3B4, плавятся конгруэнтно, без разложения. V3B4 образуется по перитектической реакции. Температура плавления эвтектики УзВ2+твердый раствор бора в ванадии установлена не точно и равна примерно 1550° С. Предполагается, что температура плавления эвтектики УВ2 + В должна быть ниже 1550° С. Температуры эвтектик определены не совсем точно из-за присутствия в образцах легкоплавкой окиси бора [121].
В работе [967] описаны две новые боридные фазы ванадия VsBs и У2Вз, полученные дуговой плавкой смесей ванадия и бора на медном поддоне с вольфрамовым электродом, образцы содержали 57—64 ат. % В. Области температурной устойчи-226
вости V5B6 и V2B3 не установлены. Предполагается, что VsB6
неустойчива при температурах ниже температуры плавления или даже метастабильна. На диаграмме состояния (см. рис. 46) эти фазы отмечены схематически. Определены кристаллографические характеристики всех боридных фаз ванадия.
На основании проведенного исследования [967] подтверждено существование четырех боридных фаз: V3B2, VB, V3B4,
VB2 — и две фазы получены впервые: V5B6 и V2B3.
Структура боридов ванадия изучалась в ряде работ [561, 593, 853, 869, 871].
V3B2 кристаллизуется в тетрагональной сингонии, структурный тип UsSiz; периоды решетки, А: а =5,739, с = 3,029 [871, 967]. VB— орторомбический, структурный тип. СгВ, периоды решетки, А: а=3,060, 6 = 8,048, с = 2,972 [593, 869, 967].
У V5B6 структура орторомбическая, пространственная, группа Amtntn, периоды решетки, А: а = =3,058, 6 = 21,28, с = 2,974 [967].
V3B4 кристаллизуется в ромбической сингонии, структурный тип Та3В4, пространственная группа - D 2 л — Immm, формульных единиц две, периоды решетки, А: а = 3,058, 6 = 13,22, с = 2,981 [967].
V2B3 имеет орторомбическую группа Cmcm, периоды решетки, [967].
Рис. 46. Диаграмма состояния системы V—В.
структуру, пространственная
А: а = 3,061, 6=18,40, с = 2,984
VB2 — гексагональный, структурный тип А1В2, пространственная группа/)^—PQjmmm, в элементарной ячейке одна фор-
мульная единица, периоды решетки, Ас а = 2,996, с = 3,050.
В работе [967] подтверждено наличие у VB2 заметной области гомогенности, периоды решетки изменяются в пределах этой области: а —от 2,994 до 2,998 А и с —от 3,048 до 3,056 А.
Физические свойства боридов ванадия практически не изучены. Относительно хорошо исследованы свойства диборида ванадия. В работах [203, 449, 452] измерены удельное электросопротивление, термо-э. д. с., относительное удлинение в интервале температур 295—1300° К, коэффициент Холла при комнатной температуре, рассчитаны параметры электропереноса. Методом сильной связи [452] проведен теоретический расчет электронного спектра диборида ванадия.
15* 227
Б. И, Малинский и др< [203] и И. М. Винницкий [39] исследовали магнетосопротивление и магнитную восприимчивость VB2.
Анализ полученных данных по физическим свойствам бо-, рида ванадия VB2 (табл. 76) показывает, что они хорошо кор-релируют со свойствами диборидов металлов IV—VI групп и объясняются с позиций электронного строения боридов [451, 570].
Химические свойства боридов ванадия изучались только для VB2 [157, 276, 545]. В основном, данные упомянутых работ совпадают. Небольшие различия в скоростях разложения диборида ванадия объясняются, по-видимому, чистотой разлагаемого борида, его количеством и природой кислоты.
Диборид ванадия относительно медленно разлагается плавиковой, соляной и серной кислотами, при нагреваний в разбавленной соляной кислоте НС1 (1 :1), в смеси НС1-ЬН2С2О4 разлагается медленно (нерастворимый остаток составляет 80%). В расплавленной перекиси и щелочи VB2 растворяется полностью, в смеси Н2О2+Н2С2О4 разложение диборида ванадия заканчивается в течение 5—10 мин-
Взаимодействие диборида ванадия с соляной и серной кислотами проходит по реакциям [157]
VB2 + ЗНС1 + 4Н2О == VC18 + 2НВОа + 4,5Н2;
VB2 4- H2SO4 + Н2О V2 (SO4)s + НВО2 + SO2 + H2S + H2.
Качественными реакциями с азотнокислым серебром было доказано наличие бороводородов в газообразных продуктах разложения VBa соляной кислотой. При реакции с серной кислотой образуются сероводород и сернистый газ, что объясняется в работе [157] наличием в продуктах разложения небольшого количества бороводородов, которые восстанавливают серную кислоту.
Диборид ванадия начинает окисляться довольно интенсивно уже при 700° С. При его окислении образуется многофазная окисная пленка, состоящая из V2O3, V2O5, В2О3. В глубоких слоях окисных пленок обнаружены низшие окислы ванадия, низшие бориды ванадия, а также следы бора [35, 41].
Методы получения. Бориды ванадия были получены синтезом из элементов, осуществляемым спеканием и дуговой плавкой смесей порошков ванадия и бора [871, 899, 967, 1012]. Восстановление смеси окислов бора и ванадия углем в графитовом тигле в вакуумной ВЧ-печи [160, 869] приводит к получению диборида ванадия, по составу близкого к стехиометрическому, но с содержанием около 0,8% углерода.
228
Таблица 76
Свойства боридов ванадия
Свойство V,B, VB У,в, V,Bt У,Й, VB,
Содержание бора, масс. % Структура Периоды решетки, О А: а Ь с Плотность} г/см3'. рентгеновская п икнометрическая Теплота образования, ккал/моль Энтропия ДХгов. калКмоль-град) Температура плавления, °C Теплопроводность, виг/(м-град) Коэффициент термического расширения, 10—• град~1 Удельное электросопротивление, мком-см Термический коэффициент сопротивления, 10—3 град-"1 Коэффициент термо-э. д.с., мкв/град Коэффициент Холла, 10~4 см3/к Магнитная восприимчивость, 10“6 см3/г Работа выхода, эв Микротвердость, кГ/мм3 12,4 Тетрагональная, тнп UsSi2 [8711 5,739 [967] 3,029 5,83 П21} “T 2070 [950] > 2300 [873] 17,56 Ромбическая, тип СгВ [593] 3,060 [967] 8,048 2,972 Т— 1900 [950] 35 [121] 2300 [873] 20,29 Орторомбическая, тип V6Be [967] 3,058 [967] 21,25 2,974 L_ 1600, разлагается [967] 22,05 Ромбическая, тип Та3В4 . [967] 5,058 [967] 13,220 2,981 2350 [873] 24,14 Ромбическая, тип V2B3 [967] 3,061 1® 2,984 29,8 Гексагональная, тип А1В2 [869] 2,994— 2,998 3,048т 3,056 5,28 [545] 62* [545] 7,9 . [24] 2400 [950] 42,2 [453] 7,9 [449] 22,7 [449] 2,1 [449] 5,8 [449] 0,82 [449 4-0,47* [39 3,98 [462] 2800 [873]
229
Продолжение табл. 76
Свойство V3Ba VB v,Be v.B4 v,Ba VB,
Коэффициент излучения (Z=0,655 мкм.) — — — — 0,7 [504]
Коэффициент рекомбинации атомов водорода (у±Ду).1О2 1,97± ±0,17 [173]
* Теплота образования рассчитана по эмпирическим формулам О. Кубашевского [156].
Блюменталь [593] получил карботермическим методом в водороде при 1650° С моноборид ванадия удовлетворительного состава. Андрие [545] электролизом расплавленных смесей Vs V2O5 + 2 B2O3 + MgO(CaO, Li2O)+MgF2(CaF2, LiF) получила диборид ванадия в форме игольчатых кристаллов серого цвета.
Наиболее удобными и экономичными способами получения диборида ванадия являются борокарбидный [384] и боротермический [470], основанные на реакциях
V2O6 + В4С 4- С -> VB2 4- СО;
V2O3 + B->VB2 + B2O2, проводимых в вакууме при 1500—1600° С.
Бориды ниобия. Диаграмма состояния системы Nb—В, приведенная в справочной литературе [527] и построенная Новотным и Бенезовски1М [876], уточнялась в ряде работ [370, 967].
На /рис. 47 приведена диаграмма состояния системы Nb—В, построенная по данным работ [370, 876, 955], на ней четыре борида: Nb3B2, NbB, Nb3B4 и NbB2.
В работе [876] методами рентгенографического и металлографического анализов подтверждено существование боридов ниобия составов NbB, Nb3B4 и NbB2, полученных Андрие [545], Нортоном [869] и Андерссоном [539].
Кроме того, показано, что в области составов Nb—NbB имеется только одно индивидуальное соединение ниобия с бором — борид Nb3B2. Предполагавшиеся ранее [539, 598] бориды Nb3B и Nb2B не подтверждены.
Сплавы с большим содержанием металла, в частности ниобия, исключительно чувствительны к таким примесям, как кислород, азот и углерод. Подтверждением этому может Служить то, что Nb2B при тщательном исследовании в работе [876] оказался окислом ниобия NbO. В работе [871] при исследовании сплавов ниобия с бором также не были получены бориды
230
Nb3B и Nb2B. Nb3B2 и Nb3B4 образуются по перитектическим реакциям, NbB и NbB2 плавятся без разложения [876].
I Данных о растворимости ниобия в боре в литературе нет. Максимальная растворимость бора в ниобии, равная 0,11— 0,18%, приведена в работе [121].
В работе [370] тщательно исследована растворимость бора в ниобии в твердом состоянии в области до 5,4 масс. % В ме
тодами определения температур начала плавления, микроскопического и рентгеновского анализов литых и деформированных сплавов, закаленных с различных температур после длительного отжига. Сплавы готовились дуговой плавкой высокочистых ниобия и бора в печи с нерасходуемым W-электродом в среде гелия. Для получения равновесного состояния плавка велась пятикратно. Суммарная длительность отжига составила: при 1600° С—125 ч, при 1200° С— 275 ч.
Обнаружено, что при введении в ниобий околр 0,35% В температура солидуса понижается до 2170° С. С увеличением содержания бора до 5,39% она остается постоянной, являясь температурой плавления эвтектики a+Nb3B2. Это значительно выше темпе-
Рис. 47. Диаграмма состояния системы Nb-^B.
ратуры плавления, приводимой в работе [876] (1600°С). О том, что температура плавления эвтектик^ a + Nb3B2 лежит значительно выше 1600° С, свидетельствуют' и температуры отжига сплавов с содержанием от 2,8 до 10,4% В, используемые в работе [598].
При отжиге сплавов этого состава при 1980° С оплавление образцов не наблюдалось. По-видимому, в работе [876] образцы были несколько загрязнены углеродом и кислородом, что привело к образованию побочных продуктов (Nb2C, NbO), присутствие которых сказалось на результатах работы.
На диаграмме состояния (см. рис. 47) эвтектика соответствует содержанию 1,6 масс. % В. До этого состава в сплавах наблюдаются первичные кристаллы твердого раствора на основе ниобия, выше—Nb3B2. Максимальная растворимость бора в ниобии составляет 0,35 масс. %,
231
Данные по растворимости бора в ниобии при 1200—2170°£ хорошо укладываются на прямую, описываемую уравненифи Шредера -+• Ле Шателье
1пС=4,15 — Т где С содержание В, ат. -%; 7 —температура, °К<
Моноборид ниобия имеет узкую область гомогенности, плавится с открытым максимумом при температуре около 2280° С [876]. Борид Nb3B4 образуется по перитектической реакции при температуре около 2700° С, Указывается на широкую область гомогенности диборида ниобия в работе [876]. Ширина области гомогенности предполагалась, примерно 10 ат. % В. Перибды решетки диборида ниобия в области гомогенности изменяются в следующих пределах, А: а~3,095-4-3,105, с—3,284-?' -4-3,259 ;[876]. Позже, в работе этих же исследователей, уточня-лись границы области гомогенности NbB2 и высказано предположение, что она более широкая. Период решетки а изменяется в пределах 3,086—-3,305 А. Ю. Б. Кузьма и др. [167] на основании измерений периодов решетки дибориДа Ниобия также предполагают наличие более широкой области гомогенности, чем 10 ат. % В. По их данным а изменяется of 3,097 до 3,315 А. Верхняя граница области гомогенности диборида ниобия требует дальнейшего уточнения.
Участок диаграммы состояния в области, богатой бором, построен по данным работы Сейболта, Который Исследовал микроструктуру литых сплавов с содержанием 1 и 6 ат. % Nb и установил, что эвтектика, богатая бором, содержит 1,42 ат, % Nb [955].
Обзор работ дает основание считать, что в системе Nb—В твердо установлено существование четырех боридных фаз: Nb3B2, NbB, Nb3B4 и NbB2.
Nb3B2 кристаллизуется в тетрагональной сингонии, структурный тип U3Si2, периоды решетки, А ; а = 6,179, с=3,285 [167, 871].
NbB кристаллизуется в ромбической сингонии, Структурный тип СгВ, элементарная ячейка содержит четыре формульные единицы, пространственная Группа iD27h— 14/гпстп, периоды решетки, А: а —3,298, 6 = 8,724, с=3,166 [814, 871].
У Nb3B4 структура ромбическая типа Та3В4 с двумя формульными единицами в элементарной ячейке, периоды решетки, А: а=3,305, 6 = 14,081, с=3,137 [539, 814].
NbB2 кристаллизуется в гексагональной сингонии, структурный тип А1В2, пространственная группа D\h—P&lmtntnr формульных единиц одна, периоды решетки, А: а=3,086, с = 3,306 [121].
Физические свойства боридных фаз ниобия изучены в работах [125, 449]. Результаты и другие свойства боридов приведены в табл, 77.
232
Таблима 77
Некоторые свойства боридных фаз в системе Nb—В
Свойства NbsBi NbB Nb,Bt NbB,
Содержание бора, масс. % 7,21 10,44 13,32 18,89
Структура Тетраго- Ромбичес- Ромбичес- Гексаго-
нальная, кая, тип. СгВ кая, нальная,’
тип U3Si2 тип Та3В« тип А1Ва
Периоды решетки, А:
а 6,185 [871] 3,298 [871] 3,305 [561] 3,097—3,315 [167]
ь 8,724 [871] 14,08 [561]
с 3,281 [871] 3,166 [871] 3,137.[561] 3,284—3,105
Плотность, г]см?-. * [876]
рентгеновская 7,99 [871] 7,6 7,33 7,00
пикнометрическая 8,00 [871] « 6,60 [869]
Теплота образования, «—<* ч - 41,7 [947]
ккал/моль 19,7± 5 [373]
Энтропия, кал](мольХ -г1-» — V 14,2 [947]
Хград) 8,9 [1015]
Теплоемкость, 11,42 [1015]
кал/(моль • град), для NbB 1,9 63
Температура плавления, 1850 [876], 2300 [876] 2750 [876], 3000 ±50 [24]
°C разлагается 20—2300 разлагается 3050 [908] 30—3000
Область температурной —ч
устойчивости, °C [876] [950]
Т еплопроводность, кал](см-сек-град) 24,0 [449]
Коэффициент термичес- 13,8 [125] 12,9 [125] 9,9 [125] 7,7 [125]
кого расширения, 10~в град-1
Удельное электросопротивление, мком-см [125] ’ Термический коэффи- 45 40 33,5 25,7
2,4 2,2 1,6 1,0
циент электросопротивле-* ния, 10“5 град-1 [125] Коэффициент термо-
г-9,7 —8,0 —5,4 —3,4
э.д.с., мкв]град [125]
Коэффициент Холла, 10-* ои3/к [1251 —0,46 —0,60 —1,1 —1,5
Концентрация носителей, IO-32 см-3 [125] 13,6 10,4 5,8 4,2
Подвижность носителей, см?/(в-сек) [125] 1,022 1,50 3,22 5,83
Температура перехода к сверхпроводимости, °К —* 8,25 [432] 1,27 [723] 1,27 [723]
Работа выхода, эв 3,35 [462] 3,58 [462] 3,88 [462] 4,03 [462]
Микротвердость, кГ]мм3 1720 [308] 2200 [308] 2290 [308] 3000 [945] 2600 [308]
.233
Продолжение табл. 77
Свойство Nb,B, NbB NbjB, NbB,
Коэффициент рекомбинации атомов водорода, (у±Ду)-102 Коэффициент излучения (Х=0,655 мкм) — — '— 2,50±0,3 [173] 0,77 [504]
Все бориды ниобия обладают характерной для металлических соединений температурной зависимостью электросопротивления. В области температур 700—1100° С наблюдается некоторое снижение величины термического коэффициента сопротив
ления, так что оно практически перестает зависеть от темпера-
Рис. 48. Зависимость удельного электросопротивления р, термического коэффициента электросопротивления 0, температуры плавления 7ПЛ и коэффициента термического расширения а от атомного отношения В/Me в боридах ниобия.
туры. Такая «стабилизация» электросопротивления резко проявляется и начинается при более низкой температуре (700° С) для низшего борида Nb3B2 и слабее — для диборида NbB2.
Повышение содержания бора при переходе от низших боридов к высшим (по содержанию бора)' приводит к уменьшению величины удельного электросопротивления, .термического коэффициента электросопротивления и коэффициента термического расширения (рис. 48). В этом направлении увеличиваются температуры плавления боридов ниобия. Такой характер изменения свойств в зависимости от атомного отношения В/Ме обсуждается с позиций особенностей структурного и электронного строения рассмотренных соединений.
Увеличение содержания бора приводит к формированию более жестких связей. Для Nb3B2, в кртором атомы бора располагаются изолированными парами, характерно наличие «рыхлых» связей со значительной делокализацией электронов бора. Упрочнение связи В—В в NbB, Nb3B4 и NbB2 приводит к отвлечению электронов на образование стабильных конфигураций металла, вследствие чего закономерным оказывается уменьшение концентрации носителей и увеличение их
234
подвижности <в ряду Nb3B2—NbB—ЫЬзВ4—NbB2 (см. табл. 77). Снижение коэффициента термического расширения и возрастание температур плавления в этом ряду свидетельствуют об упрочнении межатомных связей. Есть указание на то, что бориды ниобия Nb3B4 и NbB2 — сверхпроводники [723].
Химические свойства изучены только для NbB2. Диборид ниобия не растворяется в азотной кислоте, соляной кислоте, в смеси соляной кислоты с Н2С2О4. NbB2 практически также не растворяется (нерастворимый остаток составляет 96%), незначительно растворяется в серной кислоте и в смеси H2SO4 + + Н2С2О4. Добавление в серную кислоту перекиси водорода ведет к полному разложению NbB2. В перекиси водорода и смеси Н2О2+Н2С2О4 диборид ниобия разлагается полностью [157].
При нагреве до 700° С на воздухе NbB2 практически не окисляется. Заметное окисление начинается при температурах выше 700° С и скорость' окисления растет до 1000° С. На образцах появляется окисная пленка значительной толщины, состоящая в основном из p-Nb2O5, В2О3, Nb3B4. Обнаружены следы бора [41]. Бориды ниобия устойчивы по отношению к углероду.
Методы получения. Бориды ниобия в работах [871, 876] получались синтезом из элементов, из Смеси гидрида ниобия и бора спеканием, горячим прессованием и дуговой плавкой. Андрие и Нортон [545, 869] получили хорошо кристаллизованные осадки NbB2 электролизом смеси солей.
Для получения диборида ниобия лучше использовать карбидоборный и боротермический способы получения, заключающиеся в проведении реакции в вакууме:
NbaOs + В4С + С -> NbB2 + СО (1500 — 1600° С); (1)
Nb2O5 + В NbB2 + В2О2 (1600° С). (2)
По реакции (1) получается борид ниобия состава, близкого к расчетному, с содержанием примеси углерода около 0,1%' [24]. При осуществлении реакции (2) в печи с безуглероди-стым нагревателем можно получить диборид NbB2 стехиометрического состава, не содержащий углерода [470, 899].
Бориды ниобия могут найти применение в качестве защитных покрытий, в которых сохраняются их высокие технические качества: твердость, износоустойчивость, коррозионная стойкость, окалиностойкость [461].
Такие покрытия (слои) можно получить при абсорбировании ниобием паров ВО—Н2 в интервале температур 700— 1200° С. В этом случае покрытие состоит из смеси фаз Nb3B4 и NbB2 [10]. В результате борирования ниобия карбидом бора и бором при 1200—1400° С образуются слои из NbB2 [270, 461]-.
Бориды тантала. Диаграмма состояния системы Та—В, приведенная в справочной литературе [527], претерпела ряд существенных изменений. Киффер и Бенезовский [121] при исследовании системы Та—В применяли тигли из двуокиси тория, что
235
могло привести к загрязнению сплавов торием и кислородом й сильно сказаться на температурах фазовых превращений.
Результаты работ [767, 800, 931, 932, 955] не согласуются с диаграммой состояния, предложенной Новотным и др. [876].
Лейтнакер [800] в своих исследованиях получил более высокие температуры превращений в твердом состоянии. В работе указывается на то, что получение рплавов спеканием порошков тантала и бора сопровождается сильными экзотер-мическими эффектами, что вносит погрешность в определение Температур превращений и образования фаз в системе Та—В.
Отмечаются большие трудности при получении Та3В2. Эту фазу, образующуюся по перитектоидной реакции, Лейтнакер получил в результате отжига сплава при 2000° С в течение 9 ч при условии предварительного измельчения соединения в порошок.
Та2В, которому приписывается в работе [800] формула Таг,4±о,2В, по данным этой же работы, существует при температурах выше 2040° С, но Новотный [876] и Руди [931] наблюдали появление Та2В при более низких температурах (около 1700° С). Температуры плавления боридов тантала^ а также эвтектики Та+Та2В уточнялись в работе [932].
К. И. Портной и др. [360, 362], используя методику термического анализа и порошки тантала и бора высокой чистоты (Та«99,5%, Вам>99,5%), исследовали диаграмму состояния системы Та—В. Примененная ими методика исключала влияние посторонних примесей, сплавы получались в виде капель диаметром от 2,5 до 4 мм, удерживаемых поверхностным натяжением на концах стержней из спеченных композиций. Для фиксации фазовых превращений использовались изотермические отжиги и ускоренное охлаждение. Некоторые сплавы были получены электронно-лучевой плавкой.
Исследуемые сплавы изучались методами рентгено- и микроструктурного, а также локального рентгеноспектрйльного анализов и измерением микротвердости фаз. На основании проведённой работы предложена уточненная диаграмма состояния системы Та—В (рис. 49), которая в настоящее время наиболее правильна.
В работе подтверждено существование пяти боридных фаз: Та2В, Та3В2, ТаВ, Ta3Bt и ТаВа. Температуры плавления и образования боридных фаз тантала близки к полученным в работах [800, 932]. Области существования боридов, имеющих температуры плавления выше 3000° С, показаны на диаграмме с использованием результатов другого исследования [932]. Та2В плавится по перитектической реакции при температуре около 2380° С; примерно при 2040е С происходит эвтектоидный распад этого соединения на твердый раствор бора в тантале и моно-борид ТаВ.
236
Длительный отжиг Сплавов при 200б® С не привел к обрй* зованию Та3В2. Появление, кристаллов этого Соединения наблюдалось После отжига образцов соответствующего состава в контейнере из тантала при 1950° С в течение 10 « в вакууме 2Х X Ю-5 мм рт. ст.
Электронно-лучевой плав- ’ кой цолучен сплав, содержащий смесь фаз ТазВ4+ТаВ и имеющий перитектический ха-рактер кристаллизации. В связи с этим фазовое равновесие тантала и бора в области составов с содержанием от 50 до 66 ат.% В существенно ^т-^000 дичается от предложенного в работе [876].
Максимальная растворимость тантала в p-ромбоэдри- Z200 ческом боре, по данным К. И. Портного [360], составляет около 1,7 ат. %.
Структура боридов тантала ... . изучалась в ряде работ (767, 800, 869, 931].
Та2В кристаллизуется в тетрагональной сингонии, структурный тип СиА12 с четырьмя формульными единицами в элементарной ячейке, пространственная группа iD — lOfmcm,
= 5,780, с ==4,865 (360, 766, 767, 800, 931].
ТазВ? имеет тетрагональную структуру типа UsSia, пространственная группа D\h—PAlmbm, периоды решетки, А: а = 6,175, с=3,284 [360, 800, 871].
У ТаВ структура ромбическая, пространственная группа Cmcm, с четырьмя формульными единицами в элементарной ячейке, периоды решетки, А: а=3,276, 5 = 8,669, с — = 3,157 [561,767].
Та3В4 кристаллизуется в ромбической сингонии, структурный тип Та3В4, пространственная группа —Immm, с двумя формульными единицами, периоды решетки, А: а = 3,284,, 5 = 13,98, с=3,129 [561,767, 931].
Диборид тантала ТаВ2 —гексагональный, структурный тип А1В2, пространственная группа D'6h—PQ/tnmm, периоды решетки; А: а=3,097, с=3,225. ТаВ2 обладает довольно широкой областью гомогенности (от 64 до 72 ат. % В). В пределах этой области Гомогенности периоды решетки изменяются: а — от
•2360
*5
-2070
963
&
<50 Лз
-2000 ~Т^Тав
-1970
Та-^та}вг
7аг0
-Та+Та^ Н
та
Рис.
20 00 60 80в,атЗ/.
49. Диаграмма состояния систе-мы Та—В 1362].
периоды решетки, А: а —
TqBfty-
&
237
3,099 до 3,065 А, с — от 3,224 до 3,283 А, что соответствует составам ТаВ1,97—ТаВг.то- Диборид тантала устойчив вплоть до температуры плавления (около 3100° С) [360, 598].
Физические, свойства боридов тантала изучены слабо. В работах [360, 932] измерены микротвердость и температуры плавления фаз.
Для диборида тантала исследовались электрофизические свойства, на основании которых оценены параметры электропереноса. Кроме того, определены коэффициент термического расширения [449], теплота образования [48], теплопроводность и ее температурная зависимость [453].
Полученные результаты хорошо коррелируют со свойствами диборидов переходных металлов IV—VI групп и обсуждены выше (см. гл. 1). В табл. 78 даны сведения по физическим свойствам боридов тантала.
Химические свойства изучены только для ТаВ2. Диборид тантала среди боридов переходных металлов наиболее стойкий против действия кислот [157, 276]. ТаВ2 не растворяется ни на холоде, ни при кипячении ни в одной из минеральных кислот. Он не разлагается в соляной, серной, азотной кислотах, в смеси щавелевой и серной кислот. В кипящей смеси плавиковой и азотной кислот не разлагается за 2 ч. В соляной и серной кислотах с добавками Н2С2О4, K2SO4, Кг520в диборид тантала не разлагается. Незначительное растворение ТаВ2 наблюдается в серной кислоте с добавкой перекиси водорода (нерастворимый остаток составляет 61 масс. %). В 30%-ном растворе NaOH разлагается полностью и на холоде и при кипячении. Значительно разлагается в перекиси водорода и смеси Н2О2 + Н2С2О4 (нерастворимый остаток соответственно составляет 25 и 8 масс. %).
Диборид тантала начинает окисляться при 900°С [876]. Окисная пленка состоит в основном из боратов тантала [41].
Методы, получения. Бориды тантала в работах [360, 800, 876] готовились синтезом из элементов. Кисслинг [767] спекал смеси порошков тантала и бора в вакуумной ВЧ-печи при 1800—1900° С. Бруэр [598] синтезировал бориды тантала в молибденовых тиглях в среде аргона в интервале температур 1565—2050° С. Новотный и др. [876] при исследовании диаграммы состояния системы Та—В получали сплавы из гидрида тантала и 96%-ного бора путем спекания, сплавления и горячего прессования.
В работе [24] описан карбидоборный метод получения борида тантала ТаВ2, заключающийся в восстановлении пятиоки-си тантала карбидом бора с добавками угля по реакции Та2О5 + В4С + 4С = 2ТаВ2 + 5СО, протекающей интенсивно в вакууме около 5- 10-2 мм рт. ст. при 1200—1300° С. Наблюдается незначительное загрязнение продукта реакции углеродом (до 0,03%).
238
Таблица 78
Некоторые свойства боридов тантала
Свойство Та,в TaaBs ТаВ Та,В, ТаВ,
Содержание бора, % 2,90 3,84 5,64 7,38 10,68
Структура Тетраго- Тетраго- Ромби- Ромби- Гексаго-
нальная, нальная, ческая, ческая, нальная,
тип тип тип СгВ тип тип А1В2
О Периоды решетки, А: CuA12 [767] ЫзЫг [871] [767] Та3В4 [767J [767,869]
а 5,780 6,175 3,276 3,284 3,097
[360] [800] [767] [931] [767,360]
ь — — 8,669 [767] 3,157 [767] 13,98 •—
с 4,865 [360] 3,284 [800] 3,129 3,285
Плотность, г/см3'.
рентгеновская 15,18 15,00 14,29 [767] 13,60 [767] 12,62 [767]
пикнометрическая — 15,01 14,0 13,50 11,70 [767] 46,3±1,8 [48]
Теплота образования —ДЯ298> ккал/моль — — —
Энтропия ASggg, кал/моль — — — — 13,9 [24]
Температура плавления, °C 2040 2180 3090 3030 3037
[932]
Теплопроводность, в/л/(л«Х Хград) — — — — 16,0 [453]
Коэффициент термического расширения, 10—8 град-1 — — — — 7,9 [449]
Электросопротивление, МКОМ • см — . — 100 [696] — 32,5 [449]
Термический коэффициент электросопротивления, 10—3 — •— •— — 1,2 [449]
град~г
Коэффициент термо-э. д. с., мкв /град — — — —2,8 [449]
Коэффициент Холла, 10—*см3/к -— — — — —2,10 [449]
Концентрация носителей, IO-33 См~3 — — — — 3,0 [449]
Температура перехода к сверхпроводимости, °К [723] а, 12 •— 1,32 <1,32 ' >2,2 4,06
Микротвердость, кГ/мм3 2200 2700 2040 2450 [462] 2600
[876] [876] [360] [360] [360]
Коэффициент излучения (к=0,655 мкм) 0,70 [360]
239
Диборид тантала состава, близкого к стехиометрическому, не загрязненный углеродом, можно получить боротермическим методом в вакууме по реакции
2ТаА + 18В = 4ТаВ2 + 5В2Оа.
Процесс ведется при 1550—1700° С в течение 1 ч [470, 899].
В работах [160, 594, 836] диборид тантала был Получен восстановлением углеродом смеси окислов тантала и бора в вакууме. Этот метод уступает по чистоте полученного продукта карбидоборному и боротермическому. Осаждением из газовой фазы [854] получить чистые однофазные осадки трудно из-за совместного осаждения и борида, и тантала.
Бориды тантала впервые получены Андрие [545] электролизом расплавленных сред. Позже Нортон [869] по методике Андрие выделил в относительна чистом состоянии борид тантала, которому на основании данных химического анализа была приписана формула ТаВ2.
Недавно [914] методом электролиза солей из ванны состав ва KCJ j КгТаРз: KBF4== 10 : 1 ; 2 при 930° С был получен моноборид тантала ТаВ. При дальнейшем борировании моноборида по схеме TaB + BF^-|-3e_->TaB2-f-4F_ может быть получен диборид тантала ТаВ2.
При разложении пентабромида тантала в присутствии трибромида бора при 1300 и 1600° С на поверхности ниобия образуются плотные поликристаллические осадки ТаВ2 с высокой микротвердостью (2600 кГ!мм2) [548]. Такие осадки могут служить надежной защитой ниобия от науглероживания в связи 'С тем, что борид тантала ТаВ2 обладает высокой устойчивостью по отношению к углероду.
В работах [92, 750] рекомендуется использование диборидов тантала и ниобия в качестве «барьеров» против науглероживания и материала для изготовления тиглей.
БОРИДЫ МЕТАЛЛОВ Via ПОДГРУППЫ
Бориды хрома. Диаграмма состояния. Система Сг—В характеризуется большим числом фаз и разнообразием их структур. Много работ посвящено исследованию боридных фаз хрома, их структур и методов их выделения. Большинство этих работ обсуждено в монографии [24].
Диаграмма состояния системы Сг—В изучалась во многих работах [528, 561, 768, 875]. Кисслинг [768] получил пять боридных фаз: Сг2В, СгзВ2, СгВ, СгзВ4, СгВ2—и исследовал их рентгенографически. В работе отмечается, что фаза с наименьшим содержанием бора соответствует составу Сг2В (примерно 33 ат. % В), фаза, образующаяся при 40 ат. % В, соответствует формуле СгзВ2, СгВ обладает узкой областью гомогенности в области составов 50 аг. % В. СгзВ4 образуется при 66,7 ат. % В, 240
1850
Сг+СггВ
2200
0830
1600
20 00 60 60 0,am’/,
50. Диаграмма состояния систем мы Cr—В £362].
Ofia изоморфна ТазВ2. Диборид Хрома СгВг, по данным Кисслий-га, обладает узкой областью гомогенности.
Диаграмма состояния системы Ст—В, построенная в работах [518, 542, 875], уточнялась другими исследователями! [358, 362, 528, 561]. В настоящее дремя наиболее достоверной можно считать диаграмму состояния системы Сг—В (рис. 50), построенную по данным К- Порт-i ного и др. [362].
Относительно состава низшего борида хрома продолжалась . длительная дискуссия. Существовало мнение [518,2200 875], что его формула Сг4В.
Берто и Блюм [579], затем Эпельбаум [528] и Аронссон [561] в своих исследованиях 1800 показали, что в области 20—-30 ат.% В образуется борид состава Сг2В с областью гомогенности СгВо,35^СгВО>58, кристаллизующейся в структурном типе Мп4В.
Наличие термографических j эффектов у сплавов с содер-
жанием 25-i-33 ат.% В [518] Сг-не подтверждено в работах К. И. Портного и др, [358,362]. ис'
Относительно структуры низшего борида Хрома мнения исследователей также расходились [551, 561, 579, 768, 814]. Лундстрем [561, 814] считает, что структура Сг2В — типа СпА12. Кисслинг [768] приписывает соединению Сг2В структурный тин Мп2В, Аронссон [561] описывает борид хрома Сг2В, кристаллизующийся в ромбической сингонии, структурный тип Мп4В. Возможность существования фаз состава (М^Мег^В со структурой типа Мп4В подтверждена в работе [603].
К. И. Портной и др. [358, 362] на основании данных термического, локального рентгеноспектрального анализов, измерений микротвердости и температур фазовых составляющих однозначно подтвердили существование низшего борида Сг2В, имеющего структуру Мп4В. В этих работах подтверждены результаты Берто и Блюма [579] по исследованию фазы состава СГ5В3. Показано, что борид хрома, описанный Кисслингом [768] как СгзВ2, на самом деле является боридом СГ5В3.
Диборид хрома СгВ2 образует эвтектику с твердым раствором хрома в p-ромбоэдрическом боре (см. рис. 50). При кратковременных отжигах в случаях снижения вакуума при синтезе сплавов наблюдалось соединение «СгВ6», на существование ко-
16 Зак. 1305 241
дорого указывалось в работё [528]. Предполагается [358], что «СгВб» является оксиборидом хрома (это согласуется с данными работы [471]).
Область высоких содержаний бора исследовалась Андерсоном и др. [540, 542]. Сплавы составов СгВ4, СгВ5>8, СгВ 12, СгВ30 и СгВюо готовились дуговой плавкой электролитического хрома (99,97%) и кристаллического бора (99,8%) с последующим отжигом в течение одной — трех недель в высоковакуумной печи сопротивления в тиглях из диборида хрома при 1350— 1400 и 1600° С в течение трех дней. Монокристаллы боридных фаз хрома не были выделены. Рентгеновскому исследованию подвергались порошки сплавов. Как показали данные рентгеновского анализа, образец первоначального состава СгВ4,о содержал СгВа и СгВ4, сплавы состава CrBs.e представляли смесь СгВ4 и высокобористого твердого раствора на основе решетки p-ромбоэдрического бора. СгВ4 устойчив в интервале температур 1400—1600° С и образуется в равновесии с СгВ2 и бором при низких температурах.
Высокобористый твердый раствор соответствует составу СгВ4] и представляет твердый раствор хрома в р-ромбоэдри-ческом боре [542].
В работе К. И. Портного и др. [362] подтверждено существование в системе Сг—В борида состава СгВ4. Тетраборид хро-’ ма в этой работе был получен после 100-часового отжига сплавов при 1400° С в вакууме около 2 • 10-5 мм рт. ст. Таким образом, в системе Сг—В достоверно установлено существование шести боридных фаз: Сг2В, СГ5В3, СгВ, Сг3В4, СгВ2, СгВ4 — и высокобористого твердого раствора на основе решетки р-ром-боэдрического бора.
Структура боридов хрома исследована в работах [358, 492, 561, 579, 670, 718, 768].
Сг2В кристаллизуется в ромбической сингонии, структурный, тип Мп4В, периоды решетки, А: а= 14,71, 6 = 7,41, с = 4,25 [579, 768].
СГ5В3 — тетрагональный, собственный структурный тип, пространственная группа D\h—РЩтЬш, периоды решетки, А: а— = 5,44, с= 10,07 [768, 814].
СгВ — ромбический, пространственная группа D^—Cmcm, с четырьмя формульными единицами в элементарной ячейке, периоды решетки, А: а = 2,969, 6 = 7,858, с=2,932 [561, 768, 814].
СгзВ4 кристаллизуется в ромбической сингонии, структурный тип Та3В4, пространственная группа .Dfh—Immm, формульных единиц две, периоды решетки, А: а = 2,986, 6 = 13,02, с=2,952 [654, 768, 907].
242
У СгВ2 структура гексагональная типа А1В2, пространственная группа D'6ft —Реттиг, периоды решетки, А: а=2,969, с= =3,066 [121, 528, 579].
Структура борида хрома СгВ4 орторомбическая, пространственная группа Immm, формульных единиц две, периоды решетки, А: а = 4,7441, 6 = 5,4773, с=2,8659. Борные сетки в структуре СгВ4 имеют своеобразное строение (см. описание структур). В работе [814] указывается на некоторое сходство структур СгВ4 и МпВ4. Атомы бора в структуре СгВ4 группами из четырех атомов в каждой образуют зигзагообразные цепи вдоль оси с. Кроме того, у каждого из четырех атомов бора располагаются соседями три атома хрома: два — на расстоянии 2,27 А и один — на расстоянии 2,07 А.
В работе [543] после тщательного исследования структуры МпВ4 и рассмотрения сходства ее со структурой СгВ4 высказывается мнение о том, что., структура борида хрома СгВ4 не орторомбическая, а моноклинная и что СгВ4 изоструктурен МпВ4.
CrB~4i — высокобористый твердый раствор со структурой p-ромбоэдрического бора и периодами решетки, А: а= 10,964, с=23,848 [542].
Методы получения. Описано много способов получения боридов хрома. Один из наиболее распространенных — метод синтеза из элементов, осуществляемый при разных температурах в среде аргона или в вакууме [528, 598, 768].
Алюминотермическое восстановление окиси хрома алюминием, силикотермическое восстановление кремнием, а также восстановление смеси окислов хрома и бора не дают чистых боридов определенного фазового состава. Перечисленные методы получения боридов хрома, по данным различных работ, подробно обсуждены в монографии [24].
Электролиз расплавленных смесей состава 1/2 Сг20з + +2 B2O3-|-MgO+MgF2 (или 1/2 Сг2О3+3 В20з • 2 СаО + 2 F2Ca), использованный в работе [536], также приводит в основном к получению смеси боридных фаз.
Наиболее эффективно приготовление боридов хрома карбидоборным и боротермическим методами [372, 466, 471] по реакциям
Cr2O3 + В4С + 2С = 2СгВа + ЗСО; (1)
2Сг2О3 + 14В == 4СгВ2 + ЗВА- (2)
Диборид хрома, полученный по реакции (1) при 1400— 1500°С, содержал 70,5% Сг, 29,39% В и 0,02% С, что почти точно соответствует расчетному составу (70,59% Сг, 29,41% В).
Реакция (2), по данным манометрического анализа [471], проходит одностадийно (см. рис. 28) при 1350° С в течение
16* 243
110 мин. При 1600® С (время выдержки 1 ч) получается продукт состава, близкого к стехиометрическому: 70,6% С, 29,3% В и 0,09% С (расчетный состав: 70,45% Ст, 29,55% В).
В работе [471] показано, что боротермическим способом в вакууме можно получить бориды хрома составов СгВ, СгзВ< и СгВг. Низшие по содержанию бора бориды хрома описанным методом получены не были. Для них рекомендуется синтез из элементов в индукционной печи в среде аргона.
Осуществление боротермического метода в безуглероди-стой вакуумной печи дает возможность получить борид хро-мц стехиометрического состава без примеси углерода [896].
Физические свойства боридов хрома Изучались в работах [449, 468, 612]. Установлено, что все исследованные фа-1 зы имеют В основном металлический характер проводимости. Обнаружена тенденция к понижению величины электросопротивления с увеличением отношения B/Сг. Для всех исследованных фаз характерно некоторое отклонение температурной зависимости электросопротивления рт линейной.
Наблюдается соответствие между изменением температуры плавления и удельным электросопротивлением. Коэффициент термического расширения закономерно понижается для всех фаз с увеличением отношения B/Сг (рис. 51). Установленные закономерности объясняются с точки зрения электронного строения атомов компонентов.
Теплопроводность диборида хрома измерена в работе [453]. В ряде работ [39, 617, 718, 833] исследовались магнитные и поверхностные свойства борида хрома. Показано, что магнитная восприимчивость диборида хрома меньше, чем у чистого металла.
2500
1400
“fe
20
10
2W0
5 i
2200 I $ 1800
< 1900
SO
SO
40
1700
100
Рис.
свойств боридных фаз хрома (удельного электросопротивления р, температуры .плавления ТПл< коэффициента термического расширения а, микротвердости Hv от атомного отношения В/Ме.
20
0 ij 2,0 В/Ме
5L Зависимость некоторых
244
Таблица 70
Некоторые физические свойства боридных фаз хрома
Свойство Сг2В СгьВ* СгВ СгзВ* CrB2 СгВ,
Содержание бора, масс. % 9,45 11,1 21,72 29,55 ’ 34,2 45,42
Структура Ромбическая [579] Тетрагональная [579] Ромбическая [768] Ромбическая [579,654] Гексагональная [579] Орторомбическая [540]
О Периоды решетки, А:
а 14,71 [579] 5,44 [768] 2,969 [768] 2,986 [654] 2,969 [579] 4,744 [540]
ь 7,41 — 7,858 13,02 — 5,477
с 4,25 10,07 2,932 2,952 3,066 2,866
Плотность, г/см3-.
рентгеновская 6,24 6,12 6,12 5,76 5,22 —
пикнометрическая 6,07 6,03 6,13 [579] 5,22 [186] 5,6 [528] —
Теплота образования —ЛЯ, ккал/моль — — — 30 [599] —
Теплоемкость (20—800°С), калЦмоль • град) — — 4-1,517.10-* [147] —
Энтропия (295°К), калЦмольХ Хград) '— 5,8 [24] — 9,4 [24]
Продолжение табл. 79
Свойство Сг3В Сг5В, СгВ Сг3В4 СгВ3 СгВ4
Температура плавления, °C 1870 [358] 1890 [358] 2100 [358] 2070 [358] 2200 [358], [767] Выше 1600° разлагается [540]
Теплопроводность, втЦмХ. Хград) {126] , Коэффициент термического расширения, 10_’вряд-1 [468] Удельное электросопротивление, мком-см [447] Термический коэффициент сопротивления, 10~3 град~1 [447] Коэффициент термо-э. д. с., мкв/град [447] Коэффициент Холла, 10— 4 см3! к [447] Магнитная восприимчивость, 10—6 см.3/г Работа выхода, эв [462] Микротвердость, кГ/мм2 Среднеквадратичные смещения атомов [447] Коэффициент излучения (Х= =0,655 мкм) Коэффициент рекомбинации атомов водорода 10,9 14,2 107 0,6 —6,9 —0,8 2,46 1350 [468] 0,11? 15,8 13,7 49 1,9 —6,2 —0,9 2,72 1420—1520 [358] 0,106 20,1 12,3 45,5 1,1 —4,7 —1,0 3,02 2100—2200 [358] 0,103 20,5 10,8 60 3,7 —6,7 —1,0 3,12 1800—1850 [358] 0,100 31,8 ' 10,5 30 1,2 —3,0 —1,2 +5,3 [39] 3,18 2130—2240 [358] 0,088 0,77 [504] 0,80±0,17 [173]
Экспериментальные данные по свойствам боридных фаз хрома (табл. 79), а также результаты расчета электронного спектра диборида хрома, выполненные по методу сильной связи (МО—ЛКАО) [452], хорошо коррелируют со свойствами диборидов металлов IV—VI групп (см. гл. I).
Химические свойства. В работе [179] установлено, что моно-и диборид хрома отличаются высокой стабильностью п<2 отношению к углероду, а низшие бориды хрома в присутствии углерода при высокой температуре переходят в борокарбиды с содержанием до 10 ат.% В и борид хрома СгВ. Продукты взаимодействия низших боридов хрома С углеродом представляют борокарбид хрома состава СГ7ВС4. Эти данные согласуются «с приведенными в работе [696].
Бориды хрома, главным образом СгВ2, относясь к наиболее «стойким к окислению материалам, сравнительно устойчивы к воздействию химических реагентов [24].
В работах [194, 196] исследована химическая и термическая стойкость боридов хрома на порошках крупностью 40—50 мкм. Наиболее устойчивы бориды хрома в разбавленной серной кислоте, резко повышается устойчивость боридов в разбавленной азотной кислоте. Относительная скорость разложения боридов хрома в разбавленных (1:1) серной и соляной кислотах с увеличением атомного содержания бора в соединении практически не меняется, однако в азотной кислоте (1:1) устойчивость боридов хрома повышается в ряду СгВ2<Сг3В4<:СгВ<СгзВ2<; <Сг2В. Концентрированной соляной кислотой бориды хрома разлагаются.
Относительная скорость разложения боридов практически не зависит от состава борида. Скорость разложения боридов в концентрированной азотной кислоте резко снижается, по убывающей устойчивости бориды различного состава можно расположить в ряд СгВ>СгзВ2>СгВ>СгзВ4>СгВ2.
Высокая устойчивость боридов хрома в концентрированной азотной кислоте объясняется в работе образованием пассивной пленки окиси хрома; чем выше содержание хрома в бориде, тем устойчивее он к воздействию азотной кислоты.
Бориды хрома в зависимости от состава начинают окисляться при 500—800°С [194]. Методом химического фазового анализа показано, что продуктами окисления низших фаз являются окись хрома и фаза, близкая по составу к оксиборидам. Высшие бориды хрома при взаимодействии с кислородом воздуха разлагаются на окись хрома Сг20з и борный ангидрид В20з.
Устойчивость диборида хрома при 1000° С обеспечивается образованием при разложении СгВ2 окиси бора, которая обладает в расплавленном состоянии высокими защитными свойствами.
По данным работы [24], высокая стойкость против окисления диборида хрома объясняется образованием при его окислении
247
на поверхности образцов довольно легкоплавкого борохроми-Стогр «стекла», надежно защищающего поверхность против окисления при температурах до 1200—1300° С,
Окисление диборида хрома в кислороде начинается при температурах выше 1100°С [175]. Незначительная скорость роста окалины при 1000° С объясняется высокими защитными свойствами образующихся при окислении В20з и СгВОз.
Высокая термическая стойкость борида хрома СгВ2 и значительная «эластичность» кристаллической решетки диборида хрома, характеризуемая величиной среднеквадратичного смещения структурных элементов йри распространении упругих волн равной для СгВ2 0,088 [447], определяющие относительно низкую хрупкость борида хрома д довольно высокую стойкость против теплового удара, позволяют использовать борид хрома в составе жаропрочных сплавов, работающих при значительных нагрузках и высоких температурах. Известно использование боридов хрома в составе жаропрочных керметов. Особенно эффективно использование борида хрома и сплавов на его основе в качестве высокоизносостойких покрытий и наплавок на сталях и чугунах [107, 309, 461].
Бориды молибдена. Диаграмма состояния системы Мо —В изучалась многими исследователями [121, 544, 690, 977]* В работах [690, 977] на основании многочисленных определений точек плавления были установлены эвтектики Мо — Мо2В, МоВ —«МоВ2^, что дало возможность построить схематическую диаграмму состояния системы Мо —В, которая проводится в справочной литературе [527]. На этой диаграмме имеются, кроме Мо2В, МоВ и Мо2В5, существование которых доказано [512, 765, 931, 955], бориды состава МозВ2 и «МоВ2».
По данным разных работ [955, 978], температура плавления эвтектики а-Мо2В изменяется от 1960 до 2200° С. Разноречивы данные по максимальной растворимости бора в молибдене: of 0,02 до 0,2 масс.% [513]. Такое расхождение в данных объясняется, по-видимому, различной чистотой сплавов, полученных разными методами. К. И. Портной И др. [351, 362] исследовали систему Мо — В методами термического, рентгеноструктурного И металлографического анализов. Учитывая влияние углерода на устойчивость боридов МоВ и МоВ2 [179], Термическую обработку и Определение температур плавления в этой работе проводили в печи с вольфрамовым нагревателем в условиях, исключающих загрязнение образцов углеродом. Методика приготовления сплавов [362] не допускала взаимодействия композиций с другими элементами, испарения и ликвации компонентов.
Сравнение температур плавления, полученных в работе [351], с даннымиЛругих работ [121, 690, 977] показывает (табл, 80), что температуры плавления боридов молибдена в ранних работах существенно ниже и для боридов МоВ и «МоВ2» согла-i суются с температурами эвтектик борид —углерод, 248
Таблица 80
Температура плавления боридных фаз молибдена, °C
Борид Работа Эвтектика с углеродом [544]
[121] [977] [690] [351]
Мо2В 1850±50 2000 2097—2142 « 2270
«Мо3В2» — 2070 2221—2266 _д_
МоВ . 1 2180 2325—2374 2550 2300
«МоВ2» 2250 ±50 2100 -г- 2350 2180
MojBj 1 —9— 2200 * ,1»
МоВ1а — —- 2110
На основании полученных Данных в работе предложена диаграмма состояния системы Мо—В (рис, 52). Молибден образует е Мо2В эвтектику При 2200° С и содержании бора более 20 ат.%, Борид Мо2В плавится по перитектической реакции с образованием р-МоВ. Температуру плавления эвтектики а+Мо2В, близкую к приведенной выше (2190±20° С), получили при исследовании молибденового угла диаграммы состояния системы Мо—В (до 4,05 масс.) % В) в работе [102]. Содержание бора в Зв-' тектике, по этим данным, находится в пределах 2,4—г 4,05 масс, %. Максимальная
растворимость бора в молиб- Рис дене .при температуре эвтекти-j ки составляет около 0,11% и уменьшается до 0,08—0,09;
0,06—0,07 и менее 0,05 масс.% '
52. Диаграмма состояния Мо—В [362].
соответственно при 1950,
1600 и 1200° С. Растворимость бора в твердом состоянии при 1200—2200° С удовлетворительно описывается уравнением 1пС— =>=4,60—12,6-103/Т, где С — содержание бора, ат, %, и Т — температура, °К [102].
На рентгенограммах литых и закаленных сплавов эвтектического состава отмечены только линии борида Мо2В [102].
Мо2В имеет узкую область гомогенности [351]. р-МоВ плавится без разложения при температуре около 2550° С. Тем? цература перехода а-МоВ в р-МоВ,. принятая по данным рабо-
249
ты [769, 931], составляет 2000° С. «МрВ2» плавится по перитектической реакции р образованием, по-видимому, р-МоВ при 2360° С. В области содержаний бора от 65 до 68 ат. % присутствуют и МоВ2 и Мо2В5. Это объясняется в работе как тем, что указанные составы относятся к двухфазной области, так и тем, что «МоВ2» при охлаждении частично распадается на Мо2В5 и а-МоВ. Борид молибдена Мо2В5 плавится при 2200±30° С по перитектической реакции с образованием «МоВ2». По данным рентгеновского анализа, Мо2В5 при температуре около 2000° С растворяет в себе заметное количество избыточного бора.
По данным работы [351], структуры сплавов с содержанием от 82 до 90 ат. % В представляют эвтектику (Mo2B5 + MoB~i2) с первичными кристаллами Мо2В5 и эвтектику с первичными кристаллами MoB~i2. С бором MoB~i2 образует эвтектику при температуре около 2040° С.
Разноречивость в результатах исследования боридов «МоВ2» и Мо2В5 объясняется в работе [351] влиянием на их стабильность углерода. Действительно, по данным К. И. Портного и др. [179, 351], Мо2В5 в присутствии углерода при нагревании переходит в «МоВ2». Вероятно, диборид молибдена стабилизируется примесями углерода.
В работе [492] показано, что стабилизирующее влияние на соединение «МоВ2» оказывает не только углерод, но и примесь марганца; обнаружена фаза (Мо, Мп)В2 со структурой типа А1В2, Кроме того, показано [492], что на формирование структуры типа U3Si2 влияют добавки Ti, Fe, Сг и Мп. В двойных соединениях металлов VI группы с брром структур типа U3Si2 нет. В работе [351] также не подтверждено существование борида Мо3В2 со структурой U3Si2. В присутствии марганца стабилизируется борид (Мо, Мп)зВ2 [492]. Таким образом, можно предположить, что обнаруженный в работах [977, 1024] борид молибдена Мо3В2 на самом деле представляет тройную фазу. «МоВ2» скорее всего высокотемпературная модификация Мо2В5, стабилизируемая различными примесями [351, 492].
Относительно состава высших боридов молибдена мнения расходятся. Руди и др. [931], К. И. Портной и др. [351] предполагают существование борида состава МоВ12, приписывают ему гексагональную структуру. В работах [621, 678] получен тетраборид молибдена, на существование которого указывали Теле-гус [492] и Уитмен [1024].
Тетраборид молибдена, полученный при исследовании борных водокон [678], изоморфен WB4, описанному в работе [677], и кристаллизуется в гексагональной сингонии.
Лундстрем и др. [816] провели тщательное рентгеноструктурное исследование образцов МоВ4, выделенных дуговой плавкой смеси бора (99,8%) и молибдена (98,7%), в среде аргона с последующим отжигом в вакууме при 1400 и 1800° С. Установлено существование борида молибдена Moi-XB3 с узкой областью 250
гомогенности (л'ж 0,20). Полученный в работе [816] борид молибдена соответствует составу МоВ3175, что хорошо согласуется с данными другой работы [123]. Структура тетраборида молибдена, по данным Лундстрема [816], высокодефектная. Расстояния Мо — В превосходят сумму радиусов на 3%, Мо — Мо — на 7 и 13%. В решетке МО1_ЖВ3 есть достаточно большие пустоты, которые могли быть заполнены атомами бора до стехиометрического состава МоВ4, но незаполнены.
Резюмируя вышеизложенное, в системе Мо —В можно считать установленными следующие фазы: Мо2В, а- и p-МоВ, М02В5 и МоВ4. Есть мнение, что в системе Мо —В должен существовать борид Мо2В5 со структурой W2B5 [492, 1024] по аналогии с системой W — В (см. подразд. «Бориды вольфрама»), но сведений о нем в литературе нет.
Структура боридов молибдена МоВ2, а- и p-МоВ и Мо2В5 определена в работе Кисслинга [765].
Мо2В кристаллизуется в тетрагональной сингонии, структурный тип CuAU, пространственная группа D\8h—I4/mcm с четырьмя формульными единицами в элементарной ячейке, периоды решетки, А: а = 5,543, с=4,735 [765, 814].
а-МоВ—тетрагональный, собственный структурный тип, пространственная группа D™h —14t/amd, формульных единиц восемь, периоды решетки, А: а = 3,110, с= 16,95 [765, 814].
P-МоВ имеет ромбическую структуру типа СгВ, пространственная групппа Dl27h—Cmcm, периоды решетки, А: я = 3,16, & = 8,61, с=3,08 [765, 814].
М02В5 — ромбоэдрический, собственный структурный тип, пространственная групппа 7)'м—R3m, периоды решетки, А: а = 3,011, с = 20,936 [765, 814].
У М0В4 структура гексагональная, пространственная группа Dgh—Р§з[ттс, формульных единиц в элементарной ячейке четыре, периоды решетки, А: а = 5,203, с = 6,345 [678, 816].
Физические свойства относительно хорошо изучены только у М02В5 и МоВ4.
В работах [123, 454] исследовались некоторые электрофизические и термические свойства боридов Мо2В5 и МоВ4: удельное электросопротивление, коэффициент термо-э. д. с., их температурные зависимости, коэффициент Холла и теплопроводность.
• Установлено, что бориды — типичные металлоподобные соединения с металлическим типом проводимости. Об этом свидетельствует изменение с температурой удельного сопротивления и теплопроводности,.
Температурный ход изменения коэффициента термо-э. д. с. обоих боридов существенно отличается от обычного для соединений сцметаллическим типом проводимости (см. рис. 17). На основании анализа наблюдаемых закономерностей в изменении электрофизических свойств боридов молибдена в работах [123,
251
454] делается вывод, что перенос зарядов осуществляется носителями двух знаков р существенно различной степенью вырождения. По абразивной способности М0В4 превосходит М02В5 [123].
Химические свойства борида молибдена М02В5 исследовались в работах [41,. 158, 276]. М02В5 устойчив против действия раз* бавленных соляной, серной и щавелевой кислот. В азотной кислоте, а также в смесях соляной и серной кислот с азотной кислотой борид молибдена легко разлагается [158].
Введение' в серную и соляную кислоты перекиси водорода или бромной воды увеличивает скорость разложения Мо2В5. В частности, добавление 30%-ной перекиси водорода к соляной Кислоте приводит к полному разложению борида.
Перекись водорода, добавленная к серной кислоте, также способствует разложению МогВ5. На этом основана методика определения содержания двуокиси циркония в системе М02В5 — ZrO2.
Исследование химической устойчивости М02В5 в щелочных растворах показало, что в 5%- и 20%-ном растворах едкого натра борид молибдена устойчив, добавление в щелочной раствор окислителей (перекиси водорода или бромной воды) значи* Тельно ускоряет разложение борида.
В работе [179] исследовано взаимодействие боридов молиб* деца МоВ и М02В5 с углеродом. Подтверждено образование борокарбида Мо2ВС [931]. Поведение борида молибдена в ере* де кислорода и азота подробно обсуждено в работе [41].
М02В5 устойчив против окисления при температурах; 500— 700° С, при более высоких температурах скорость окисления возрастает, окалина состоит из МО2О3, МО4О, МоОг, МоОз.
Методы получения. Бориды молибдена в ранних работах!, которые подробно обсуждены в монографиях [24, 121], были полученье синтезом Из элементов нагреванием смесй бора и Мблибдена в дуговой печи с угольными электродами, в результате чего бориды были загрязнены углеродом, который оказывал существенное влияние на состав образующихся фаз.
Кисслинг [765] получил три борида Молибдена (М02В, МоВ и МогВ5) нагреванием смесей порошков молибдена и бора в эвакуированных кварцевых ампулах при 1200° С в течение 48 ч и в магнезитовом тигле в вакууме при 1500—1600°С(в течение нескольких минут), Аналогичным методом, но при осуществлении его в графитовой лодочке в водороде при 1500—1700° С борид молибдена приготойляли Штейниц и др. [977].
В работах Андрие [544, 545] борид молибдена состава МоВ получался электролизом расплавленных смесей составов
2ВА • Na2O 4- NaF + V4 МоО3 и
2BaOs • Na Д-hNaF + Vg MoO8.
252
Ё завйсймости от содержания в ванне Моб3 мойсно получить или Мо2В, или МоВ [121].
В работах [24, 510] рекомендуется карбидоборный способ, заключающийся в восстановлений молибденового ангидрида или двуокиси МоО2 углеродом карбида бора по реакциям
8МоО3 4- 5В4С + 19С = 4Мо2В5 + 24СО и
8МоО2 4- 5B4t 4-11С = 4Мо2В6 4- 16СО.
Процесс осуществляется в вакууме 10~*—10-2 мм рт, ст. при ]200-г1500° Q Исследовано влияние температуры, Давления и длительности процесса на химический и фазовый состав борида молибдена. Установлено, что высокая летучесть молибденовогр ангидрида подавляется высокой- скоростью образования термодинамически прочного борида. Повышение температуры получения борида молибдена ведет к увеличению содержания углерода в продуктах реакций. |
Карботермический способ получения боридов, более трудо* емкий, чем карбидоборный, заключающийся в восстановлении углеродом смеси окислов МоО3 и В2О3, также используется для получения борида молибдена [263].
Этот метод требует больших избытков борного ангидрида, примесь углерода составляет до 1%. Дополнительным прокаливанием борида молибдена при 1900° С с добавками соответствующих окислов и бора достигается рафинирование борида практически До расчетного состава с содержанием углерода менее 0,05%.
При осаждении боридов молибдена при термическом разложении галогенидов на нагретой металлической нити [547] получаются высокотвердые слои из борида МоВ (/7V — 2200 кГ/мм2}.
Борирование поверхности молибдена карбидом бора или бором при 1200—1400° С приводит к образованию твердых диффузионных слоев, которые состоят из боридов молибдена Мо2В и Мо2Вэ [93, 270]. По данным работы [24], энергия активации при реактивной диффузии бора в ; молибден составляет 12 200- кал1г-атом по сравнению е 17 200 кал/г-атом для диффузии бора в вольфрам.
Бориды молибдена в составе металлокерамических сплавов с никелем, железом и кобальтом предложены в качестве режущих материалов, поскольку отличаются высокой твердостью [499, 586, 838, 978]; борид состава Мо2В нашел использование в качестве материала нагревателя электронных трубок [979].
Небольшие присадки бора в молибден (до 0,1 масс,%) оказывают сильное модифицирующее действие на макро-, микро- и субструктуру металла, повышая его пластичность и прочность [515], Свойства боридов молибдена приведены в табл. 81.
253
Таблица 81
Физические свойства боридов молибдена
Свойство М.овВ a-MoB Р-МоВ МогВ5 МоВ,
Содержание бора, масс. % 5,3 10,1 10,1 22,0 31,15
Структура Тетраго- Тетраго- Ромби- Ромбоэд- Гексаго-
нальная, нальная, ческая, тип СгВ рическая, нальная,
тип СиА12 тип a-МоВ тип МогВь тип МоВ4
Периоды решетки, А: 5,543 3,16
а 3,110 3,011 5,203
ь .— — 8,61 -
с 4,735 16,95 3,08 20,936 6,345
с/а Плотность, г/см3: 0,845 8,77 —’ 7,48 1,219
рентгеновская 9,31 8,77 — 7,48 6,21
пикнометрическая 9,10 [977] 8,2—8,3 [977] — 7,01 —
Теплота образования, ккал/моль 25,5 [599] 16,3 [599] — 50,0. [599] —
Температура плавления, °C 2270 [351] — 2550 [351] 2200 [351] —
Теплопроводность, вт/(м X У'град) — — 26,8 [126] —
Коэффициент термического расширения, 10“ 6 гроб-1 Удельное электросопротив- *— — —> 8,6 [126] 6,5 [123]
40 45,7 25 26,0 —
ление, мком-см Коэффициент термо-э. д. с., мкв/град [599] [977] [977] [126]
—• — — —9,4 [126] —
Коэффициент Холла, 10-4 смДк •— — —- —6,6 [454] —
Температура перехода в сверхпроводящее состояние, °к 4,74 [723] 4,40 [723] —’ <1,32 [121] —
Работа выхода, эв — — — 3,70 [462] 2300— 2800 [351] —
Микротвердость, кГ/мм3 1700— 1900 [351] 2100— 2500 [351] 2500 [977] —
Бориды вольфрама. Диаграмма состояния системы W — В наиболее изученная среди диаграмм переходных металлов с бором. По данным различных работ, установлено существование по крайней мере шести боридных фаз вольфрама: W2B, a-WB, ₽-WB, (X-W2B5, P-W2B5 и WB4, однако до настоящего времени нет четких и надежных данных относительно состава высокобо-ристых соединений вольфрама.
В работе [400] методами рентгеновского, металлографического анализов и микротвердостщбыла уточнена диаграмма со-254
стояния сйстемы W —В. Для этой целй готовились сплавы WB», где х=0,01; 0,02; 0,05; 0,1; 0,2; 0,4; 0,8; 1,0; 1,5; 2,0; 2,5; 3,0. В работе подтверждено существование в системе W — В боридов W^B, WB, WzB5 и были намечены следующие фазовые области системы W —В (от 1 до 70—80 ат.% В):
1) а-областъ ограниченного твердого раствора бора в a-W. Период решетки a-W уменьшаетсяпри этом от 3,1495 до 3,133 А и остается неизменным вплоть до 28,6 ат. % В. Изменению периода решетки соответствует понижение твердости от 340 до 77 кГ(мм2',
2) двухфазная область a+у; у-фаза (W2B) обладает узкой областью гомогенности и твердостью 2420 кГ/лш2;
3) двухфазная область у + б (W2B + WB);
4) область гомогенности WB (б-фазы), простирающаяся почти до 50—55 ат.°/о В с твердостью, изменяющейся от 2080 до 3752 кГ/мм2-,
" 5) двухфазная область б + е (WB + W2B5);
6) область гомогенности W2B5.
В отличие от данных Кисслинга [765] указывается на-довольно широкую область гомогенности борида W2B5 (от 68 до 75 ат.% В).
На рентгенограмме образца с содержанием 75,0 ат.% В обнаруживаются наряду с W2B5 линии, принадлежащие бору. В ряде работ [355, 362, 514] установлено, что борид вольфрама W2B5 образуется не в результате конгруэнтного плавления [932], а по перитектической реакции при 2375° С.
Кисслинг получал сплавы вольфрама с бором в широком концентрационном интервале содержаний (до 71,4 ат.%) бора [765]. В работе также получены и идентифицированы три индивидуальных соединения вольфрама с бором состава W2B (a-фаза), WB (б-фаза) и W2B5 (е-фаза).
Моноборид вольфрама существует в двух модификациях: низкотемпературный a-WB, кристаллизующийся в структурном типе a-МоВ, переходит при высоких температурах в структурный тип СгВ—0-WB. По данным различных работ, температура перехода a-WB—>-|3-WB лежит в интервале 1850—2400° С [400, 595, 813, 906]. По данным К. И. Портного и др. [355, 362], при исследовании диаграммы состояния системы W — В с привлечением комплексных методов анализа (рентгеноструктурного, микроструктурного, локального, рентгеноспектрального, химического и гравиметрического) и с использованием высокочистых бора и вольфрама установлено, что переходы a-WB4=t₽-WB наблюдаются при разных температурах. Фаза a-WB, находящаяся в равновесии с W2B, переходит в 0-WB при температуре более 2300° С, а находящаяся в образцах в равновесии с W2B5 — при 2400° С.
В работа [765] подтверждено существование боридов W2B, WB и W2Bs с гексагональной структурой. Ю. Б. Кузьма и др.
255
1168J в продуктах восстановления двуокиси вольфрама бором в вакууме получили при 900—1300° С новое соединение, близкое по составу к W2Bs. В работе сделан вывод о том, что существуют две модификации борида W2B5: низкотемпературная фаза a-W2B5, структурный тип Мо2В5 и высокотемпературная фаза p-W2B5, собственный структурный тип. Кроме того,, показано, что образование a-W2B5 идет через стадию образования низкотемпературной модификации WB при ее последующем взаимодействии с избытком бора.
Новотный и др. [880] подтвердили существование бориДа вольфрама- со структурой Мо2В5. В работе получали полуторный борцц вольфрама, стабилизированный малыми добавками палладия. Оказалось, что незначительное замещение атомов вольфрама палладием (около 10 ат.%) при 950° С стабилизирует структурный тип Мо2Вз (объем элементарной ячейки W2B5> ста-, билизированного палладием, 160,1 А, а для собственного W2B5 — 160,4 А). Периоды решетки (W„ Pd)2B5, А: a = 2,981, с=°20,Й1 (с/я=6,982) близки к приведенным в работе [383]. Позже Новотный и Др. [924] еще раз подтвердили существование борида вольфрама W2B3 со структурой Мо2Вз.
О существовании диборида вольфрама со структурой А1В2 сообщалось в работе [1025]. Однако в чистом виде дибориД вольфрама не выделен, нет данных о его термической устойчивости. В работах [355, 362, 492] также не подтверждено существование диборида вольфрама со структурой А1В2.
Известно, что стойкость фаз МеВ2 в системах металлов VI группы с бором уменьшается по мере увеличения атомного номера металла [24, 950]. Наиболее стоек диборид хрома СгВ2, диборид молибдена [492, 931] существует только при высоких температурах, разлагаясь при температуре около 1500°С на a-МоВ и Мо2В5, а существование диборида вольфрама вообще сомнительно. Лундстрем [812] описывает борид вольфрама состава WB2WB2,27 с довольно широкой областью гомогенности, кристаллизующийся в гексагональной сингонии, пространственная группа Ptymmc, периоды решетки WB2, А: я = 2,9831, с— = 13,8790.
Структура описанного борида отличается от структуры W2Bs наличием двух типов борных слоев (гофрированные и плоские гексагональные), характеризующихся различными расстояниями В—В. В гофрированных слоях Это расстояние равно 1,85 А, в плоских—>1,72 А. Кроме того, указывается, что структура борида WB2_227 еще более дефектна пр бору, чем структура борида W2B5.
В работе [400] борид W2B5 с содержанием бора выше 71,4 ат.% описывается формулой WB3jQ. Романс и Круг [925] уточнили состав этой фазы и приписывают ей формулу WB2,2z, что близко к составу WB2,13, описанному Кисслингом [765]. По-видимому, в обоих случаях речь идет о бориде вольфрама
256
W2B5 в области гомогенности со стороны высоких содержаний бора.
В работе Чретина и Хельгорски [621] впервые указывается на существование борида состава WB4. Борид получен спеканием W2B5 с избытком бора при 1400° С или спеканием порошков вольфрама и бора при 1000° С. Соединение неустойчиво и при 1600°С разлагается с выделением свободного бора и W2Bs по реакции
W2B6 + 3B^2WB4.
Гольдшмидт [701] подтвердил в своей работе существование тетраборида вольфрама. Структура борида WB4 в упомянутых работах определена как тетрагональная по сходству порошко-грамм борида вольфрама с тетраборидами тория и урана.
Позже, в работе Романса и Круга [925] дуговой плавкой сплавов с содержанием 41,4 масс.% В были получены монокристаллы борида вольфрама состава WB*, где 4<+С5, и определена его кристаллическая структура. Рассчитанные структурные факторы с учетом положения атомов в пространственной группе Z?6/i—Ptymmc дали хорошее совпадение с полученными по порошкограмме. Структура тетраборида вольфрама близка к А1В2. Если в структуре А1В2 заменить [/з атомов металла парами из атомов бора так, что оставшиеся атомы металла образуют слои открытых гексагонов, чередующиеся со слоями с замещенными атомами, то получится структура WB4. Периоды решетки этого борида, А: п=5,200, с = 6,340.
При исследовании тройной системы W — Ni — В [880] были выделены и детально изучены монокристаллы богатого бором борида вольфрама примерного состава W2-XB9 (л^’/б). Полученные в работе сведения о кристаллической структуре W2-xB9 подтвердили существование тетраборида вольфрама с гексагональной структурой, описанной Романсом и Кругом.
При исследовании боридов вольфрама и молибдена в борных волокнах [677, 678] также подтверждено существование тетраборида WB4 с гексагональной структурой.
По данным работ [812, 814] тетраборид вольфрама обладает узкой областью гомогенности, в пределах которой периоды решетки изменяются следующим образом, А; а = 5,20044-5,2005, £=6,33484-6,3356. WB4 устойчив до температуры плавления (2200°С), что согласуется с данными работы [925]. Микротвердость WB4 с примесью W2B5 составляет 3800+15 кГ]мм2, а с незначительным содержанием свободного бора — 3940±200 кГ]'мм2.
В работе [123] определяли температурную и концентрационную области существования борида вольфрама состава WB4. Исходными материалами служили порошок вольфрама чистотой 99,98% и кристаллического бора — 99,8%. Смеси готовились в расчете на составы WBX, где х = 4+14. Синтез осуществлялся при 1100—2100° С в печи с молибденовым нагревателем при
17 Зак. 1305
257
избыточном давЛёПИи ."Очищенного аргона в -течение 2—3 Ч1 Во всех случаях, ло жданным химического анализа, быЛ получен бориД,-состав которого лежит в пределах WBsj—WB4,b Рентгеновский фазовый анализ подтвердил образование тетраборида, вольфрама, кристаллизующегося в гексагональной сингонии, пространственная группа — Рбз/mmc, с периодами решет-» ки, А: й=5,202, с = 6,333, что хорошо согласуется с данными Лундстрема [816], где приводится кристаллографическая формула теТраборида вольфрама WB3,75.
РудИ и др. [931] при исследовании трехкомпонентной системы W—В—С обнаружили богатЬш бором борид вольфрама, которому приписывают формулу WB12- Структура WB12 описывается как гексагональная с периодами решетки, А; а = 3,994, с=3,174. К. И. Портной и др. [355, 362] подтвердили существование борида WB12. По этим дайныМ WBj2 плавится без разложения при температуре около 2440° С, имеет очень узкую область гомогенности, структура
его гексагональная с периодами решетки, близкими к указанным в работе [931], А: а = 4,001 ±0,002, с=3,167±0,002.
*,ГГ V
$000
2600
2200
1800
WO
1000
WB
щгв
м W>B\ 1—г
I 1,1---d---1-,.
w 20 00 SO I 80 B, am,7.
Рис. 53. Диаграмма состояния системы W—В 1812]. '
Таким образом, можно считать, что в области больших содержаний бора (более 76 ат.%) существуют два индивидуальных соединения вольфрама с бором, кристаллизующиеся в гексагональной сингонии: WBs, где 40^5, близкий по структуре к А1В2, пространственная группа D^k— РЬ-Jmmc, и WBi2,'пространственная группа которого не определена и индивидуальность которого требует подтверждения. По-видимому, оба борида отличаются друг от друга структурой борных слоев и их упаковкой.
Диаграммы состояния системы W-В, описанные в работах [362, 812] в области, богатой бором, несколько различаются в связи с отсутствием единого мнения о структуре высших по содержанию бора боридов вольфрама. На рис, 53 показана наиболее достоверная диаграмма состояния системы W — В по данным работы [812].
Можно считать установленным существование шести боридных! фаз вольфрама: W2B, a-WB, p-WB, a-W2B5, 0-W2B5 и WB4.
258
W2B имеет тетрагональную структуру с изолированным!! атомами бора, структурный тип CuAI2, пространственная группа Dxfh—I^lmctn с периодами ячейки, А: а=5,564, с = 4,740. Этот борид изоморфен боридам Мо2В, СогВ и Ni2B, устойчив вплоть до 2040° С [908], обладает узкой областью гомогенности.
a-W'B кристаллизуется в тетрагональной сингонии, структурный тиа a-МоВ, пространственная группа —Mj/amd, периоды решетки, А: а=3,115, с— 16,92, с/а = 5,45.
0-WB ромбический, структурный тип СгВ, пространственная рруппа iD 2h — Стет, периоды решетки, A: a =^=3,19, b = 8,40, с= = 3,07 [906].
W2B5 (p-W2B5) имеет, по данным Кисслинга [765], гексагональную решетку с двумя формульными единицами в элементарной ячейке, пространственная группа к Р6$]ттс. Атомы металла в решетке W2B5 образуют плотноупаковаИныё слои, а атомы бора — плоские гексагональные сетки и частично двумерные слои. Борид W2B5 является структурой вычитания и характеризуется дефицитом бора. Он по твердости почти не отличается от W2B и WB, устойчив вплоть до температуры плавления.
a-W2B5 кристаллизуется в ромбоэдрической сингонии, структурный тип Мо2В5, пространственная группа R3m, периоды решетки, A: a=3,011, с=20,93, с/а=6,951.
WB4 имеет гексагональную структуру типа МоВ4, пространственная группа Ptymmc, периоды решетки, А: а=5,2004, с = 6,3348 (cfa = 1,218).
Физические свойства боридных фаз в системе W — В изучены недостаточно (табл. 82).
Сравнение значений микротвердости боридов вольфрама приводит к следующему выводу: наиболее твердой фазой является моноборид WB, что объясняется образованием атомами бора зигзагообразных цепочек; микротвердость W2B сравнительно низкая, что связано с изолированным положением атомов бора в ячейке из атомов металла; микротвердость W2Bs несколько ниже твердости моноборида WB, что объясняется образованием атомами бора плоских сеток, обусловливающих пониженную прочность к сдвигу. КР0Ме того, W2B5 не является упорядоченной фазой [908], что подтверждается ее способностью образовывать широкие, области твердых растворов с другими боридами.
В работах [123, 454] проведено исследование температурной зависимости электропроводности и коэффициента термо-э. д. с. боридов W2B5 и WB4, коэффициента Холла при комнатной температуре борида W2Bs, температурной зависимости теплопроводности, коэффициента теплопроводности, коэффициента термического расширения и абразивной способности WB4. Образцы готовились методом горячего прессования и спеканием соответствующих смесей в аргоне.
17* 259
Таблица 82‘
Свойства боридов вольфрама
Свойство W2B a-WB P-WB a-W2B5 P-w2B, WBt WB„
Содержание бора, масс. % 2,86 5,56 5,56 12,81 12,81 18,81 41,24
Структура Тетрагональная, тип СпА12 [765] Тетрагональная, тип a-MoB [765] Ромбическая, тип СгВ [906] Ромбоэдрическая, ТИП Мо2В5 [168] Гексагональная, тип W2BB [765] Гексагональная, тип WB4 [677] Гексагональная [355, 362]
О Периоды, А: а 5,564 [765] 3,115 [765] 3,19 [906] 3,011 [168] 2,982 [765] 5,2004 [812] 4,001 ±0,00?
ь — — 8,40 [906] — — — —
с 4,740 16,92 3,07 20,93 13,87 6,3348 3,167±0,00?
с/а 0,852 5,45 — . 6,951 4,65 1,218 0,791
Плотность, г/см3: рентгеновская 16,72 — 16,0 — 13,0 10,16 —
пикнометрическая 16,00 [765] — 15,3 [765] — 13,0 [765] — —
Температура плавления, °C 2770 ±80 [121] 2400 ±100 [121] 2800 [355] — 2300 ±50 [121] 2200[812] 2440[355]
Теплота образования, ккал/моль 20—26 [801] 12—22 [599] — — 20—15 [599] — —
Теплопроводность, втЦм-град) —
Энтропия (298° К), калКмольУ. Хград) — —
Удельное электросопротивление,
мком-см
Коэффициент Холла, 10_4 см3/к —
Магнитная восприимчивость, 10~’ см3/г — —
Коэффициент термо-э. д. с., мкв)град — —
Коэффициент термического расширения, 10-’ град~1 6,7 [312] —
Работа выхода, эв — —
Микротвердость, кГ/мм3 2440 ±120 3700 [24]
[24]
Макроскопическое сечение захвата тепловых нейтронов, ел-1 37,7 [312]
28,4
— 28,3 [24] — —
— 22,0 [454] — —
— —6,9 [454] — —
— +0,25 [39] — —
— —6,6 [454] — —
— 7,8 [454] 5,8 [123] —
— 3,79[451] — —
— 2580 ±100 [355] 3800—4000 [123, 814] 2950j100
- - __
Как показали результаты исследования, ход изменения электропроводности обоих боридов типичен для металлоподобных соединений, а изменение коэффициента термо-э. д. с, с температурой существенно отличается от обычного для соединений с металлическим типом проводимости (вблизи температуры 400° С коэффициент, термо-э. д. с. меняет знак с « + » на «—» и увеличивается по абсолютному значению). Данная особенность изменения коэффициента термо-э. д. с. исключает возможность анализа свойств высших боридов вольфрама в приближении однозонной модели, как это было сделано для диборидов переходных металлов [449]. Предполагают, что в боридах W2B5 и WB4 проводимость осуществляется носителями двух знаков с различной степенью вырождения; электронами со значительной степенью вырождения и «дырками», почти полностью заполняющими сильно локализованные состояния при практическом отсутствии вырождения. Исходя из этой модели, провели расчет параметров электропереноса (концентрации носителей, их подвижности, эффективной массы носителей, показателя рассеяния) для борида W2B5 [454]. Результаты расчетов подтвердили необходимость учета в явлениях переноса различных степеней локализации электронных состояний для соединений переходных металлов.
По абразивной способности WB4 превосходит борид состава W2B5 [123], что делает перспективным использование его в составе абразивных и износостойких материалов. Кроме того, полагают [123], что тетраборид вольфрама может быть использован как поглотитель у- и нейтронного излучения в ядерной энергетике.
О химических свойствах боридов вольфрама сведений в Литературе мало. W2B5 устойчив в обычных условиях [276], слабо растворяется в соляной, серной, фосфорной и щавелевой кислотах, разлагаясь почти полностью за 2 ч кипящими азотной, концентрированной серной и хлорной кислотами. Кипящей плавиковой кислотой разлагается лишь на 25% за 2 ч, что делает его по сравнению с боридами TiB2 и СгВ2 более стойким. W2BS устойчив в 5%- и 20%-ных растворах едкого натра [342], добавка перекиси водорода или бромной воды приводит к полиному растворению. Окисляться W2B5 начинает уже при 800° С, продуктами окисления являются В20з, моноклинная и тетрагональная модификации WO3.
Технически чистый борид вольфрама при длительном хранении на воздухе окисляется, суммарное содержание в нем металла и бора составляет при этом 92—95%. После обработки такого борида 1%-Ной щавелевой кислотой химическая стойкость его на воздухе повышается [158].
При нагревании в аргоне наиболее устойчив борид W2B, не теряющий бор даже при нагревании до 2040° С [908]. В присутствии углерода W2B распадается с образованием WC и WB; в отличие от Мо2В борид W2B борокарбида не образует; W2B 262
с углеродом не взаимодействует [931]. Некоторые свойства (боридов вольфрама приведены в табл. 82.
Методы получения. При исследовании системы W — В использовались следующие методы получения боридных фаз: сплавление бора и вольфрама в электрической дуге [971], восстановление хлоридов или бромидов вольфрама и бора [854], взаимодействие вольфрама с BCI3 + H2 [544], алюминотермическое восстановление смеси вольфрамового и борного ангидридов, электролиз из ванны состава 2Na2O-B?.O3+NaF+,/9WO3. Во всех перечисленных случаях рентгеновский фазовый анализ не давал однозначных результатов. Конечные продукты были загрязнены соосажденным металлом, легкоплавкими шлаками, окисью алюминия. Кисслинг [24] готовил бориды спеканием смеси порошков вольфрама и бора в эвакуированных кварцевых трубках при 1200° С и в магнезитовом тигле в вакууме при 1500— 360(ГС.
В работе [123] борид вольфрама WB4 получали спеканием смеси порошков вольфрама бора в аргоне при 1800'° С и методом горячего прессования. Ю. Б. Кузьма и др. [168] получали бориды вольфрама боротермическим методом в вакууме по реакции
2WO2 + 9В = W2B8 + 2ВЛ
при 900—1300° С.
Для получения боридов вольфрама кроме описанных способов можно рекомендовать карбидоборный метод [372, 398], восстановление смеси окислов вольфрама и борного ангидрида углем, а также взаимодействие между W, В4С, В2О3 и С. При проведении этих реакций в печи Таммана в токе водорода борид вольфрама содержит до 2—3% С. '
Лучше использовать для получения борида вольфрама W5B5 вакуумно-термическое восстановление WO3 по реакции [372, 398]
WO3 + В4С + С -> W2BB 4- СО.
Для снижения содержания углерода в бориде вольфрама рекомендуется брать в состав шихты 80% Сажи расчетного состава, учитывая восстановительное действие окиси углерода в вакуумной печи с графитовым нагревателем. Карбидоборный способ получения борида вольфрама технической чистоты в условиях, близких к производственным, уже разработан [НО]. Исследовано влияние на процесс боридообразования таких факторов, как температура, время подъема температуры, выдержка, состав газовой среды. Рекомендуется йосстановлепие шихты в электропечи сопротивления с графитовым нагревателем при 1800° С в среде водорода; показана возможность производства борида вольфрама в среде конверсированного газа. Состав борида близок к стехиометрическому, содержание углерода не превышает 0,6%.
263
В работах [168, 897] для получения боридов вольфрама, не содержащих углерода, рекомендуется боротермическое восстановление двуокиси вольфрама бором в печи с металлическим нагревателем. Этот метод дает возможность получать борид W2Bj состава, близкого к стехиометрическому и не загрязненного углеродом, но не находит широкого использования из-за высокой стоимости бора.
Технически наиболее изученным и нашедшим применение в составе керметов [342], а также в качестве износостойкого и высокоэффективного наплавочного материала [280, 309] является борид вольфрама W2B5.
Борид вольфрама W2Bj в составе наплавочных композиций [309] придает- рабочим поверхностям деталей машин и механизмов • повышенную износо-, окалино- и красностойкость. Интенсивность износа образцов, наплавленных композицией с 50% W2B5, в 10—15 раз меньше, чем образцов из эталонной стали У8А.
Производственные испытания зубьев ковшей экскаваторов, наплавленных композицией состава 50% W2B5 + 50% (Ti, Cr)B2, показали, что при переработке 30000 м3 абразивного грунта не обнаружено заметного износа.
Борид вольфрама может найти использование при разработке новых материалов для режущих инструментов [13, 499].
При диффузионном насыщении бором поверхности вольфрама [114, 383] образуются высокопрочные боридные покрытия, которые перспективны в новой технике в связи с тем, что у борида вольфрама высокое сечение захвата тепловых нейтров сочетается с высокой температурой плавления, химической стойкостью и твердостью. Это сочетание свойств открывает пути к использованию таких покрытий в ядерной энергетике [1000].
БОРИДЫ МЕТАЛЛОВ Vila ПОДГРУППЫ
Бориды марганца. Диаграмма состояния системы Мп — В не изучена. По данным различных авторов [24, 588, 769], в этой системе имеются по крайней мере шесть боридных фаз: Мп4В, Мп2В, МпВ, МП3В4, МпВ2 и МпВ4 [543, 674, 814].
Л. Я. Марковский и др. [230] на основании измерения температур плавления боридных фаз марганца построили диа^ грамму плавкости системы' Мп — В. Полученная кривая (рис. 54) подтвердила существование четырех боридов: Мп2В, МпВ, Мп3В4 и МпВ2. Ход кривой в области выше 66,7 масс. % В указывает на вероятность существования борида марганца с большим содержанием бора, чем в МпВ2. Борид состава Mn4B в чистом виде получить не удалось [230]; этот борид был выделен позже [272, 273].
Л. Я. Марковский и ftp. [235] подчеркивают трудность получения Мп4В в чистом виде, Ьбъясняя это сильным влиянием 264
Рис. 54. Диаграмма плавкости системы Мп—В [230].
углерода на состав борида. Уже примесь 0,2—0,5% С приводит к образованию борокарбида марганца и ‘отклонению состава МщВ от стехиометрического, что требует при синтезе низших боридов марганца избегать использования печей с графитовым нагревателем или графитовых тиглей. _
Первое детальное рентгенографическое исследование фаз, образующихся в системе Мп — В, было проведено Кисслингом [769], который получил и идентифицировал четыре борида составов МщВ, Мп2В, МпВ и Мп3В4. а ‘
МщВ (6-4>аза) кристаллизуется в ромбической сингонии, пространственная группа —Fddd, формульных единиц в ячейке — восемь, периоды решетки, А: а—14,53, Ь = = 7,293, с = 4,209. Позже в работах М. 3. Мирясова [272, 273] была подтверждена описанная Кисслингом структура низшего борида марганца МщВ.
МщВ (е-фаза) имеет тетрагональную структуру,
пространственная группа
—Щтст, формульных единиц в ячейке четыре. Борид МщВ изоморфен боридам Та2В, W2B, Мо2В, Fe2B, Со2В и Ni2B. Периоды решетки МщВ, по данным Кисслинга [769], А: а=5,148, с=4,208 (с/а = 0,817).
МпВ (у-фаза) кристаллизуется в ромбической сингонии, пространственная группа Dx£h— Рпта, формульных единиц в решетке четыре, периоды решетки, А: а = 5,560, Ь = 2,977, с = 4,145. МпВ относится к структурному типу FeB(B27).
МП3В4 (щфаза) изоструктурен ТазВ4, сингония ромбическая, пространственная группа D225h—Immm, формульных единиц в решетке четыре, периоды решетки, А: а = 3,032, 6 = 12,86, с = 2,960.
МпВ2 кристаллизуется в гексагональной сингонии, структурный тип А1В2, пространственная группа D1^— Рб/ттт, формульных единиц в решетке одна, периоды решетки, А: а = 3,007+ +0,002, с=3,037+0,002.
Фрюшар [674] и Аронссон [557] подтвердили существование диборида марганца со структурой типа А1В2. В работе [674] с применением более точных методов, чем в исследовании [588], были измерены периоды решетки МпВ2, А: а = 3,0081 ±0,0005, с=3,034б±0,0008. В этой же работе описан борид марганца
265
МпВ4, образующийся или по эвтектоидной реакции 4MnBa -* Мп3В4 4- МпВ4,
или по реакции
МпВ4 МпВ2 + 2В.
МпВ4, по Данным работ [541, 814], кристаллизуется в моноклинной сингонии (собственный структурный тип) с параметрами решетки, А: о = 5,503, 5=5,367у с = 2,949; 3—122,71°. Недавно проведено тщательное исследование структуры борида марганца МпВ4 [543]. Подтверждено наличие у МпВ4 моно-* клиннрй симметрии, собственного структурного типа., пространственной группы С2/т с периодами, А: а=5,5029, 5 — 5,3669, с — =2,9487, р= 122,710°. Структура МпВ4 очень близка к описанной ранее (см. с. 243) структуре борида хрома СгВ4, Атомы бора находятся в положении 8 (/) и образуют трехмерные ячейки, пронизанные вдоль направления о атомами марганца, объем элементарной ячейки МпВ4 равен 73,28 А. В этой работе обнаружено, что образцы составов МпВб,4 и МпВ917 после длительного отжига при 1350° С содержали МпВ4 и MnBxi Структура МпВх подобна структуре СгВ~4], представляющего твердый раствор хрома в 0-ромбоэдрическом боре [542],
По данным Лундстрема [815], высокобористый твердый раствор марганца соответствует примерному составу МпВ~2з и построен на основе решетки ₽-ромбоэдрического бора. Растворение марганца в боре повышает твердость 0-бора на 25%.
В соединениях марганца с бором наблюдается все многообразие образований из атомов бора: от изолированных атомов и одинарных цепей в низших боридах. Мп4В, Мп2В и МпВ, сдвоенных цепей в структуре МпзВ4, плоских двумерных сеток в МпВ2, трехмерных образований из атомов бора в Тетрабориде МпВ^ к трехмерным сложным сеткам, являющимся результатом соединения ячеек из комплексов В12 и характерным для 0-ром-боэдрического бора, в MnBx [542].
Физико-химические свойства боридов марганца изучены недостаточно. В работах Л. Я. Марковского [12, 233, 235, 236, 238] исследовались некоторые пять боридных фаз марганца: Mn4B, Мп2В, МпВ, МпзВ4, МпВ2. Свойства тетраборида марганца вообще не изучены. Результаты работы Л. Я. 1Марков-ского, а также другие свойства боридов марганца приведены в табл. 83.
Анализ Свойств боридов марганца показывает, что они относятся к классу металлоподобных соединений, обладающих более высокой электропроводностью, чем собственно марганец. Наблюдается некоторое понижение электропроводности при переходе от Мп2В к МпВ2. Это, по-видимому, обусловливается тем, что при переходе от структуры с изолированными атомами бора (Мп2В) к структуре, в которой лтомы бора образуют плоские
266
Таблица 83
Некоторые физические свойства боридов марганца [7, 12, 758]
Свойство Мп,В Мп,В МпВ Мп, в. МпВ, МпВ,
Содержание бора, масс. % 4,68 8,95 16,44 20,78 28,23 44.04
Структура Ромбическая Тетрагональня Ромбическая Ромбическая Гексагональ- Моноклинная
Периоды решетки, А: [769] [561, 769] [561] [561, 769] ная [588] [543]
а 14,53 5,148 5,560 3,032 3,007 5,5029
ь 7,293 — 2,977 12,86 — 3,3669
с 4,209 4,208 4,145 2,960 3,037 2,948?
с[а Плотность, г/см3'. —’ 0,817 — — 1,009 р=122,710°
рентгеновскея —”Т —
пикнометрическая 6,62 7,21 6,35 5,95 5,20
Температура плавления, °C [12] ~1200 ~1600 ~2200 >2200 ~2250
Теплопроводность, 10~8 калием-сек-град) [12] 12,0±1,0 15,7±1,0 18,5±0,5 20,5±0,8 24,4±0,5
Удельное электросопротивление, мком-см [12] 85 ±5 40±5 57,8 62,S’ 71 ±5 —
Термический коэффициент сопротивления, 10~8 град~* 1,1 ±0,1 1,8±0,1 2,2±0,2 2,3±0,3 2,4±0,2 —
Коэффициент термо-э. д. с., мкв[град [12] -±10,0±0,5 4-8,2±0,3 +6.7±0,1 4-4,8±О,3 +3,9±0,1 —
Магнитный момент, ра —— — Ферромагнетик Антиферромагнетик 2,6
Микротвердость, кГ[мм2 [12] 1050 ±50 1800 ±50 2050 ±50 2000 ±50 1700 ±50
гексагональные сетки, для усиления связей В—В уходит часть электронов проводимости. Полученные результаты хорошо согласуются с выводами рентгеноспектральных исследований [956]. МщВ характеризуется высоким значением электросопротивления, что объясняется незначительной ролью эффекта экранирования атомов марганца валентными электронами бора, вытекающей из структурных особенностей борида упомянутого состава,-Электропроводность: боридов марганца носит дырочный характер. Теплопроводность при переходе от МщВ к МпВ2 растет, что связано с увеличением доли решеточной составляющей теплопроводности из-за усложнения структурных образований из атомов бора. Аналогичный ход изменения теплопроводности наблюдался в бориднкх фазах хрома при переходе от низших боридов к высшим [189, 453]. Наличие в структуре МпВ2 плоских сеток из атомов бора обусловливает пониженную прочность к сдвигу, что проявляется в меньшей микротвердости борида МпВ2 по сравнению с микротвердостью для МпВ и МП3В4.
В работах Мирясова [272, 273] 'и Фрюшара [674] есть упоминание о том, что МпВ обладает высокой способностью к намагничиванию; диборид МпВ2 — парамагнетик [757], а при низкой температуре у МпВ2 появляется незначительный ферромагнетизм. В работе [798] при исследовании диборида марганца методом нейтронной дифракции установлено, что диборид марганца антиферромагнитен. Магнитные моменты ферромагнитно спарены в базисной Плоскости и перпендикулярны оси с. Величина магнитных моментов на атом марганца составляет 2,6 цв.
По своему строению к дибориду марганца близок борид МпзВ4. В обоих боридах каждый атом бора располагается в центрах тригональных призм, образованных шестью атомами марганца, которые находятся друг от друга на расстоянии 2,0— 2,3 А. В связи с этим интересно сравнить их магнитные свойства. В работе [758] исследована магнитная восприимчивость монокристаллов МпзВ4, снималась температурная зависимость восприимчивости в трех направлениях орторомбической решетки МщВ4: ха, х&, Хс. На основании проведенного исследования предполагается, что Мп3В4 имеет антиферромагнитную структуру слоистого типа с легким наклоном вдоль оси с выше 226? К и спирального типа ниже этой температуры. Магнитные моменты лежат в плоскости ас и обеспечиваются, главным образом, атомами марганца, занимающими положение 2 (с), аналогичное тому, которое занимают атомы марганца в дибориде МпВ2.
В работе [500] исследовано влияние сильного импульсного Магнитного поля на магнитные превращения в бориде марганца МщВ4, приводится магнитная фазовая диаграмма. Показано, что для борида характерны два антиферромагнитных состояния АФх и АФц. При слабых магнитных полях ЯС 100 кэ положе-268
ййё точек Л и Т2 на фазовой диаграмме не меняется. Порядок чередования магнитных превращений:
АФ; —► АФц П.
При магнитных полях 100С// < 250 кэ происходит переход из антиферромагнитного состояния в ферромагнитное:
АФ1 -* АФц -* Ф.
При дальнейшем увеличении напряженности магнитного поля (Я>250кэ) на диаграмме наблюдается только одно превращение:
АФ1 -> Ф.
Бориды марганца легко растворяются в соляной кислоте [230], гидролизуются в воде с выделением бороводородов. Гидролитическое разложение боридов марганца протекает по схеме nMnxBy + mH2O = cMn(OH)2 + ^B2O2 + bH2. Гидролитическая стойкость боридов марганца (табл. 84) зависит от состава
Таблица 84
Некоторые характеристики химической стойкости боридов марганца [230]
Борид Содержание В, масс. % Количество На на 1 моль борида, моль Скорость разложения, г/ч на 1 а порошка
в HSO в щелочи 2
Мп2В 0,21 0,53 0,74 2,9 4,0
0,20 0,47 0,67 2,8
МпВ 0,09 0,22 0,31 2,2 3,9
0,05 0,26 0,31 1,9 —
Мп3В4 0,08 0,19 0,27 7,2 3,8
0,05 0,19 0,24 7,2 —
МпВа 0,03 0,12 0,15 2,9 3,2
0,03 0,13 0,16 3,0 —
борида. Эта же зависимость сохраняется при взаимодействии боридов с кислородом воздуха, азотом, аммиаком и углеродом.
При взаимодействии с кислородом наиболее устойчив против окисления диборид марганца. Скорость окалинообразования при переходе от Мп2В к МпВ2 уменьшается.
При прокаливании боридов марганца в азоте наибольшая реакционная способность также наблюдается у низшего борида Мп2В: уже при 700° С образуется нитрид марганца. Бориды марганца с содержанием бора выше 8,97 масс. % не подвергаются азотированию до 1300° С.
В аммиаке при 500—1300° С бориды Мп2В и МпВ разрушаются с образованием нитрида марганца МпзМ2 и нитрида бора, ’а бориды МП3В4 и МпВ2 устойчивы против действия аммиака в упомянутом интервале температур.
269
При взаимодействии низших боридов марганца Мп4В и Мп2В с углеродом образуются борокарбиды составов Мп8ВС и Мп7ВС (см. гл. VII). Остальные бориды марганца до 1800° С с углеродом не взаимодействуют [233, 235].
Химическая стойкость боридов марганца существенно зависит от состава борида: с увеличением содержания бора она повышается, что находится в соответствии с данными, полученными для боридов других переходных металлов [227].
Методы получения боридов марганца: сплавление или спекание смесей бора и марганца [12, 541, 543, 674, 769], восстановление окислов марганца и бора алюминием, взаимодействие карбида марганца с борным ангидридом [24], электролиз расплавленных смесей l/2Mn0+2B2O3+Na2O-bNAF [545] и КВР4+МпзО4 [988]. Наиболее эффективен метод получения боридов марганца различного состава — синтез из элементов, осуществляемый либо спеканием исходных смесей, либо дуговой плавкой.
МпВ2 был получен Биндером и Постом [588] при нагревании смеси порошков марганца и бора при 1400—1500° С в смеси с бором. Свободный бор удалялся из продукта реакции флотацией.
Борид марганца МпВ4 был получен электролизом расплавленных смесей фторида KBF4 и окиси марганца Мп3О4 [988].
Бориды технеция. Сплавы техйеция с бором приготавливались спеканием смесей порошков технеция и кристаллического бора (99%) в вакууме при 1100—1200°С в течение 120—200 ч с последующим отжигом при 800° С [998]. Содержание бора в сплавах варьировалось от 0,5 до 72,8 масс.%. Результаты рентгеновского анализа показали, что при незначительном растворении бора в технеции периоды решетки последнего возрастали, А: а = 2,740, с=4,398 (для чистого технеция) и а=2,749, с=4,406 (для твердого раствора бора в технеции). В работе получены и проидецтифицированы бориды технеция составов ТсзВ, Тс7Вз и ТсВ2.
ТсзВ кристаллизуется в ромбической сингонии, элементарная ячейка содержит четыре молекулы ТсзВ и принадлежит к пространственной группе Cmcm. ТсзВ изоморфен Re3B [556], периоды решетки, А: а=2,891, 6 = 9,161, £’ = 7,246.
Структура Тс7Вз гексагональная, тип Th7Fe3, как и у боридов рутения, родия и рения [553], с двумя формульными единицами в элементарной ячейке, пространственная группа С|у—Р63/ис, периоды решетки, А: а = 7,417, с = 4,777, с/а=0,644.
ТсВ2 имеет гексагональную структуру, подобную ReB2 [791], с двумя молекулами в элементарной ячейке, пространственная группа D^h—Рб^/ттс, периоды решетки, А: а = 2,892, с = 7,453г с/а — 2,578. В работе [561] подтверждено существование описанных боридов. Сведений о свойствах боридов технеция нет.
270
Бориды фения. Диаграмма состояния системы Re — В построена в работах Л. Я. Марковского- [356, 362]. Исследование сплавов рения с бором во всем концентрационном интервале содержаний бора проведено с привлечением термического, рентгеноструктурного и металлографического анализов, измерены температуры плавления и м икротверд ость боридных фаз.
При изготовлении сплавов исключалась возможность загрязнения сплавов углеродом и другими примесями И соблюдались
условия, препятствующие испарению бора. Результаты исследования сплавов 'системы Re—В приведены в табл! 85 и на рис. 55- В работе подтверждено существование трех боридов: Re3B, Re7B3 и ReB2.
Re3B образуется по перитектической реакции при температуре около 2150° С, область его гомогенности очень узкая, судя по отсутствию изменения периодов решетки при изменении содержания бора в сплавах от Ц до 30 ат.% В.
Re7B3 плавится также с разложением по перитектической реакции с образованием Re3B и жидкой фазы, обогащенной бором, при 2000° С. ReB2 имеет широкую область гомогенности, простирающую^
Рис. 55. Диаграмма система Re-1362],
В
ся от 67 до 75 ат.% В. Перио-
ды решетки ReB2, находящегося в равновесии с Re7B3, составляют, А: ц=2,902, с —7,479, и находящегося в равновесии с бором: а = 2,905, с = 7,485. Максимальная температура плавления
этого соединения при содержании 75 ат. % В составляет около 2400° С. Бориды Re7B3 и ReB2 образуют эвтектику с точкой плавления примерно 1830° С, которой соответствует состав около 42 ат.% В. С бором ReB2 также образует эвтектику, плавящуюся примерно при 2050° С.
В сплавах с 75—80 ат. % В наблюдался распад твердого раствора состава «ReB3», дающий основание считать, что растворимость бора в этой фазе существенно уменьшается при температурах ниже начала плавления. На рентгенограммах сплавов, содержащих 90 ат. % В и более, появляются наряду с линиями ReB2 линии исходного бора.
Тщательное рентгеноструктурное изучение борида ReB2, проведенное Ла Плаком и Постом [791], показало, что «ReB3» и
271
Таблица 85 Результаты термического, рентгёноструктурного и Металлографического анализов сплавов системы Re—В [356]
№ сплава Содержание бора Температура плавления, °C Фазовый состав Микростр укт ура и микротвердость,
ат. % масс. % начало конец
1 15 1,0 2130 2250 ResB; Re Неравновесное состояние, недоплавленные сферические зерна
2 20 1Л 2120 2150 Re3B Недоплавленный Re3B, сферические зерна Re (Я=410±50)
3 25 1,9 2150 2310 Re3B Крупные зерна Re3B (77=1690 ±150)
4 27 2,1 2170 Re3B , То же
5 28 2,1 2000 2170 Re3B »
6 30 2,4 2020 2160 Re?B3; Re3B Ликвация, характер кристаллизации перитектический
7 8 33 2,5 2000 2070 KC7B3 (ReBa) В основном одна фаза (77=1650 ±150)
40 f 3,8 1820 1840 Re7B3 (Re3B) Эвтектика + избы точные выделения
9 ' 45*’ 4,6 ’ Гйо 1900 To же Re,B3
10 50 5,5 1800 1900 Re7B3> ReB2 Эвтектика избыточные выделения
11 55* 6,6 1860 2000 ReB2
12 60 8,0 1820 2210 ReB2 (Re7B3) Первичные выделения ReB2 -ф эвтектика
13 63* 9,0 1900 2270 —
14 67 10,4 1880 2280 ' ReB2 Фаза ReBa, эвтектики очень мало
15 70 Н,2 1900 2280 » В основном
16 72 14,4 2200 2340 одна фаза То же
17 75 . 14,8 2340 2400 Крупные зерна «ReB3»
18 75* 14,8 2150 2400 (77=3100±200)
19 78 16,8 2140 2340 ReB2 В основном «ReBs» распадается в твердом состоянии
20 80* 18,0 2050 2250 То же
272
Продолжение табл. 85
№ сплава Содержание бора Температура плавления, °C Фазовый состав Микроструктура и микротвердость, кГ1м.м*
ат. % масс. % начало конец
21 86 25,8 2150 . * . ReBa Избыточные выделения «ReB3» ± эвтектика
22 90* 34,5 2060 2130 ReBa(В) Эвтектика ± избыточные выделения «ReB3»
23 92 41,0 2050 • г • Эвтектика, избыточных выделений мало
24 97 63,5 2050 2200 Избыточные выделения бора (//=3400 ±200) ± ± эвтектика
* Использован бор чистотой 99,8%, в остальных случаях — 99,4%.
ReBa — это одно и то же соединение; ReBa с областью гомогенности, простирающейся вплоть до состава «ReB3».
Наличие широкой области гомогенности у диборида рения объясняет разноречивость данных о формульном составе выевшего борида рения в ранних работах [554, 587]. В работе [814] подтверждено существование в системе трех боридов: Re3B, Re7B3 и ReB2, приводятся периоды решеток, измеренные с точностью 0,01%.
Re3B кристаллизуется в ромбической сингонии с четырьмя формульными единицами в элементарной ячейке, пространственная группа Стет, периоды решетки, А: « = 2,890, 6 = 9,313, «= = 7,258 [556].
Re7B3 имеет гексагональную структуру типа Th7Fe3, пространственная группа Рбзтс, периоды решетки, А: « = 7,469, с = = 4,713 [561].
ReB2 («ReB3») кристаллизуется в гексагональной сингонии с двумя формульными единицами в элементарной ячейке, пространственная группа PSzImmc, периоды решетки, А: а=2,900, с = 7,475. Атомы рения находятся в положении ±(1/3, 2/3, 1/4), атомы бора — в положениях ±(1/3, 2/3, г), ±(1/3, 2/3, 1/2, —г): кратчайшие расстояния, А: В — В = 1,82, Re — В = 2,23±2,26 [561].
Физические свойства боридных фаз рения изучены мало. В работе [294] измерен коэффициент термо-э. д. с. сплавов рения с бором неопределенного фазового состава с содержанием 30—40 и 60—66 ат.% В. Коэффициент термо-э. д. с. этих сплавов 18 Зак. 1305 273
соответственно равен 6—7 к 3—4 мкв/град. Делается прёдйолсн жение, что такое изменение термо-э. д. с. может быть связано С переходом к более упорядоченной структуре.
К. И. Портной и др. [356] измерили микротвердость боридных фаз рения. Re3B и ReyB3 имеют близкие значения микротвердости; у ReB2 микротвердость высокая (3100 кГ/мм?-) (см. табл. 85),
Известно, что рений наряду с европием, танталом и ’мате-! риалами на основе бора, обогащенного изотопом 10В, являются наиболее эффективными поглотителями в быстрых реакторах. В связи с этим В. Г. Арабеем и др. [7] проведено исследование эффективности поглощения нейтронов его некоторыми сплавами с бором, изучена коррозионная стойкость таких материалов в натрии и их совместимость при нагревании с нержавеющей сталью Х15Н15МЗБ.
Образцы готовились с использованием рения чистотой 99,9%, аморфного бора чистотой 99,5% и бора 80%-ного обогащения по 10В методом синтеза из элементов при 1800° С в вакууме 1(К3 мм рт. ст. Компактные образцы псевдосплавов спекались методом горячего прессования под давлением до 250 кГ/см2 при 1600—1700° С. По данным химического и рентгеновского анализов, образцы псевдосплавов соответствовали составу «ReB3»4-B. -Микротвердость сплавов, измеренная при нагрузке 50 г, составила 2850—3100 кГ[мм2, предел прочности на сжатие 99—• 112 кГ/мм2, модуль нормальной упругости в зависимости от состава изменялся в пределах (35-5-41) • 103 кГ/мм2, коэффициент теплопроводности в интервале температур 20—650°£ равнялся (0,05-f-0,06) 10-'3 кал/(см-сек-град), коэффициент термического расширения 6,5-Ю-6 град~1 при 20—1000° С, теплоемкость при 20° С 0,045—0,055 кал/(г • град).
Результаты измерения эффективности рения и его сплавов в отношении влияния их на реактивность, проведенного на быстрой критической сборке, моделирующей реактор БН-350, представлены в табл. 86. Для сравнения приведены данные по эффективности карбидй бора, боридов тантала и хрома, а также результаты испытания рения и его сплавов с бором на коррозионную стойкость в натрии.
Эффективность рения И его псевдосплавов примерно в 1,5 раза выше эффективности карбида бора естественного обогащения и раза в три ниже эффективности высокообогащенного карбида бора, но стоимость единицы реактивности композиций Re — В (бор естественный) в несколько раз ниже стоимости высокообогащенного карбида бора.
Коэффициент перехода Кп, равный отношению количества бора, перешедшего в натрий, к содержанию бора в образцах, для сплавов рения с бором несколько выше (см. табл. 86), чем у В4С и ТаВ2, СгВ2, что свидетельствует о меньшей коррозионной стойкости сплавов рения в натрии.
274
Поглотитель Плотность» е/см*
физи- ческая по —7—,10 • К »
ЭКСП.
В4С 1.8 0,264 —8,75±0,012
Re 21,0 — —14,0±0,69
ReB8-{-B (естественный) 10,0 0,296 —13,8±0,6
ТаВа 11,5 0,23 •—
СгВ2 5,4 0,28 —
ReB3+B 10,0 1,128 —
В4С 2,1 1,264 —42,5±0,38
Эффективность Испытания в натрин при 800° С в течение 500 ч
CM-8 'Относительная B*CecTr=l Изменение массы Содержание бора в натрии, масс. %
расч. эксп, раеч. образца, кг! см* вблизи образца среднее в объеме kn
—7,55 1>о 0,863 Разрушился 0,19 0,17 0,0274
—14,9 1,6 1,7 •— —• —
—14,7 .1,58 1,68 '—0,0523 0,35' 0,25 0,0352
— — —0,0028 0,064 0,058 0,0105
— — —’ —0,0321 0,053 0,043 0,0064
—39,8 — 4,55 — —
—40,2 4,85 ' 4,58 — — — —
Результаты микроскопического и микрорентгеноспектрального анализов Стальных трубок (из стали Х15Н15МЗБ), находящихся под влиянием псевдосплавов Re — В при 700 и 800° С в течение 500, 5000 и 10000 ч, показали, что происходит перераспределение компонентов стали в поверхностном слое с обра-» зованием соединений состава (Cr, Мо, Ni)4B3 и (Cr, Ni, Мо)5В4, что, в свою очередь, приводит к изменению механических свойств стальных стержней.
По данным работ [356, 362], плавленые образцы боридов рения слабо корродируют во влажном воздухе, а спеченные, нерасплавившиеся образцы гигроскопичны и разрушаются при длительном хранении на воздухе.
Методы получения боридов рения описаны в ряде работ [587, 727]. В работе [294] сплавы рения с бором приготавливались спеканием смесей рения с бором при 1900° С в расчете на образование химических соединений составов Re4B, Re2B, ReB, Re3B4, Re2B3, ReB2 и Re2B5.
Показано, что происходит образование двух соединений (у и у') в областях 20—35 и более 40 ат.% В, идентичных описанным позже [559, 561] боридам составов Re7B3 и ReB2. В работах Аронссона [553, 554] бориды рения Re3B, Re7B3 и «ReB3» получены дуговой плавкой. Биндер [587] синтезировал диборид per ния ReB2 спеканием смеси металла и бора в вакууме при температуре выше 1400° С в алупдовом тигле.
В работе [567] диборид рения получен при взаимодействии рения с нитридом бора в интервале температур 1300—1800° С по реакции
Re + 2BN = ReB2 N2.
Показано, что реакция образования Диборида рения в данном случае проходит через стадии образования низших боридов:
3Re + BN = Re3B + J/2 N2;
7Re3B + 2BN = 3Re7B3 + N2;
Re7B3 + 11BN = 7ReB2 + 3/2 N2.
Moepc [727] сплавы рения e бором получал по реакции между рением и ВВг3. Продукты реакции имели неопределенный фазовый состав.
Бориды рения привлекают внимание исследователей в связи с тем, что являются перспективными материалами для различных отраслей современной техники, в том числе для ядерной энергетики, как поглотители нейтронов [7, 381].
БОРИДЫ МЕТАЛЛОВ VIII ГРУППЫ
Бориды железа. Диаграмма состояния системы Fe — Вс содержанием до 16,23 масс.% В (50 ат.%), приведенная в справочной литературе [24, 512], подвергалась дальнейшему изуче
276
нию и уточнению. Участок диаграммы состояния системы Fe—Fe2B подробно исследован в работе [24]. Показано, что растворимость бора во всех трех модификациях железа незначительна и составляет: в б-Fe — около 0,15% при 1381° С, в y-Fe — до 0,15% при 1174°С, в a-Fe — более 0,15% при 915°С.
По данным работы [834], растворимость бора в а- и y-Fe еще меньше и составляет соответственно от 0,0004% В при 710° С до 0,08% при. 906° С и от 0,0021%'при 906° С до 0,021% прй 1149°С.« Такую заметную разницу в растворимости бора в а- и y-Fe, по данным работ [24, 834], можно объяснить наличием примесей в образцах железа, использованных в работе [24], что подтверждено данными работы [864], где показано, что в чистейшем a-Fe при 850° С растворяется всего 0,0028% В. '
Существовало ошибочное мнение [24, 834, 864], что бор образует с a-Fe твердые растворы замещения. В работах [152, 153, 269, 365] методом внутреннего трения на низкобористых сплавах системы Fe — В показано, что бор образует с железом только твердые растворы внедрения. Максимум внутреннего трения при 40°С обусловливается миграцией внедренных атомов бора в поле напряжений. С увеличением содержания бора в железе этот максимум повышается. Однако при появлении в структуре боридов железа максимум внутреннего трения резко понижается. По-видимому, бориды ускоряют выделение атомов бора из твердого раствора. Замещение части атомов металла бором ведет к образованию боридов [424]. Тдким образом бор, как и углерод, образует с a-Fe твердые растворы внедрения.
Диаграмма состояния системы Fe — В с содержанием до 18 масс.% В (55 ат.%) уточнялась в основном в области малых концентраций бора. В этой области (до 40 ат.% В) обнаружен борид Fe2B, структура которого описана в ряде работ [512, 561, 724].
На диаграмме состояния системы Fe — В присутствуют две модификации FeB [512] с температурой перехода a-FeB-H3-FeB 1135° С. Наблюдается необратимый переход низкотемпературной модификации a-FeB в высокотемпературную р-FeB, который сопровождается изменением магнитного 'момента от 1,252 до 1,205 цв [675].
Данные о существовании двух модификаций борида FeB вызывают сомнение в связи с тем, что на формирование фаз в системе Fe — В, как это подчеркивалось еще в ранних работах [512] и позже [559], существенное влияние оказывают примеси углерода, кремния, алюминия, особенно при синтезе боридов при высоких температурах. Позже К. И. Портной и др. [357, 362, 729] показали, что существует лишь одна модификация FeB со структурой В27,
277
В литературе описаны попытки получить фазу, аналогичную цементиту «РезВ» [127* 152, 559, 935]. Показано [559, 935], что «Fe3B» образуется только в присутствии углерода и представляет бороцементит, состав которого можно описать формулами Fe3Bo,8Co,2 или РезВо.эСод. По данным работы [127], бор может замещать в РезС 2/3 атомов углерода, не изменяя его структуры.
Аронссон и Ранквист [552, 559] показали, что фаза Рез(В, Si), богатая бором, также имеет структурный тип Fe3C и бороцемен-
тита, периоды решетки этой фазы, -А: * а=ё,363, < 5 = 6,660, с=4,458.
Таким образом, описанный в Литературе борид железа «РезВ» представляет тройную фазу, К, И. Портной и др< [357] на основании исследования методом микротвердости сплава о 6 ат.% железа предполагают существование в системе Fe—В соединения с большим (чем в РеВ) содержанием бора.
Действительно, у соседей Fe, именно Сг, Мп, известны дибориды состава МеВ2. Естественно было предположить существование и диборида же-
FeBny
1800
1W0
1500
-WO
FezB - t
FeB
1200 j-Fe +FezB
4850
1800
a-Fe tFezB
FeB+FeBn-
20 00 SO 80В,ат.°/.
Рис. 56. Диаграмма состояния си- В работе [357] методами стемы Fe—В [362]. термического, металлографиче-
ского, Локального рентгеноспектрального и рентгеноструктурного анализов с измерением микротвердости и температур плавления составляющих фаз была исследована диаграмма состояния системы Fe—В во всем интервале концентраций. Подтверждено существование боридов ре2В и FeB в плавленых образцах и при спекании из элементов соответственно при 900 и 1000° С в течение 2 Ч.
Результаты исследований приведены в табл. 87 и на рис. 56, Особых отличий в характере плавления сплавов, содержащих до 50 ат.% В, в работе не наблюдали. Для моноборида железа FeB получена более высокая температура плавления (1650°С).
Между составами FeB и высокобористой фазой FeBn наблюдается образование эвтектики с температурой плавления около 1500°С (64 ат.% В), диборид железа в данной работе не получен (см. табл. 87). Соединение FeBn (п~19) с 5 ат.% Fe по кристаллической структуре близко к структуре 0-ромбоэдриче-ского бора.
278
Таблица 87
Составы композиций Fe—В и результаты их исследования по данным работы [357]
Содержание бора Температура плавления, °C Фазовый состав по данным рентгеновского-анализа Микроструктура
ат. % масс. начало конед
21,65 25,00 30,00 33,40 36,40 39,80 45,00 47,9 50,00 53,00 56,40 60,00 63,50 65,00 68,50 73,50 75,00 77,00 80,70 83,70-86,30 88,60 '90,80 92,40 93,90 95,30 96,70 97,90 98,90 5,00 5,80 7,60 8,83 10,00 11,40 13,70 15,00 16,20 17,90 20,00 22,50 25,00 26,50 30,00 35,00 37,20 40,00 45,00 50 55 60 65 70 75 80 85 90 95 1200 . 1200 1200 1400 1420 1420 1410 1530 1520 ' 1510 1500 1480 1510 1510 1500 1540 1500 1520 1520 1540 1950 * 1980 1980 1980 2130 1240 1240 1300 1420 1540 < 1480 1610 1600 1650 1620 1600 [600 1510 1580 1700 1820 1750 1840 . 1900 2050 2000 2080 2030 2050 2100 2140 2180 2150 2150 Fe2B-f-a-Fe Fe2B-f-a-Fe Fe2B Fe2B Fe2B-f-FeB Fe2B-j-FeB FeB FeB FeB FeB FeB FeB FeB FeB FeB FeB FeB FeB FeB, (FeB„) FeB, (FeB„) FeB„, (FeB) FeB„, (FeB) FeB„ FeB„ FeBn FeB„ p-в Эвт.-рРе2В Эвт.4-Ре2В Ре2В4-эвт. Fe2B Fe2B-]-FeB Fe2B-j-FeB Fe2B-j-FeB FeB FeB-f-эвт. FeB+эвт. FeB-f-эвт. (~2%) Эвт. Эвт.-1-FeB FeB^-f-эвт. FeB„- -эвт. FeB4-f-3BT. РеВп+эвт. FeB„- -эвт. РеВл+эвт. РеВ^-{-эвт. РеВп4-эвт. FeB„+3BT. (1%) FeB„ FeB„ FeB„-|-B В В
За диборид железа «FeB2», Появляющийся в сплавах с содержанием более 16 масс.°/о В сначала в виде эвтектики с FeB, а затем первичных выделений серо-голубого цвета, был принят высокобористый твердый раствор железа в боре. Микротвердость этой фазы 2740—2800 кГ/лл2, что близко к микротвердости FeB~ls (2830±100 кГ/мм2) [357]. По данным работ [46, 362], диборид железа «FeB2» и высокобористая фаза FeB ^19 образуют с FeB эвтектику. Температуры плавления эвтектик, по данным упомянутых работ, соответственно равны 1428 и 1500° С. Сравнение этих данных свидетельствует о том, что, по-видимому, речь идет об одном и том же соединении — высоко-бористом твердом растворе на основе решетки 0-ромбоэдриче-ского бора. Таким образом, в системе Fe—В в области содер-
279
жаний бора до 50 ат. % существуют два борида — Fe2B и FeB; в области больших содержаний бора (52—95 ат. %) наблюдается образование ряда высокобористых твердых растворов на основе решетки 0-ромбоэдрического бора.
Структура боридов железа изучалась и описана во многих работах [512, 561, 724, 1009]. Борид Fe2B относится к структурному Типу СиА12, кристаллизуется в тетрагональной сингонии с четырьмя формульными единицами в элементарной ячейке, пространственная группа D\^—M/fncm, периоды решетки, А: а= = 5,109, с=4,249 (а/с = 0,831), температура плавления 1389° С.
FeB имеет ромбическую структуру с четырьмя молекулами в элементарной ячейке, пространственная группа —Рпта, периоды решетки, А: а = 5,506, Ь = 2,952 и с = 4,061, температура плавления FeB 1540° С.
Возможность образования высокобористых твердых растворов показана при исследовании систем Сг — В [540], Мп —В [543] и систем других За!-переходных металлов с бором [614]. На основании тщательного кристаллохимического изучения твердых растворов металлов в боре показано, что в структуре ^-ромбоэдрического бора имеются по крайней мере восемь кристаллографических положений, представляющих пустоты, достаточные по размерам, чтобы в них могли разместиться атомы металла.
В работе [1009] исследовались образцы составов FeBye, FeB 76,6 и FeBuo методом мёссбауэровской спектроскопии. На спектрах наблюдались шесть абсорбционных линий, группирующихся попарно, что указывает на три неэквивалентных положения атомов железа в структуре борида. Кроме того, полученные значения изомерных сдвигов отличаются от сдвигов для чистого железа и боридов железа, богатых металлом [634]. В работе делается предположение,, что атомы железа в высокобористых твердых растворах занимают два кристаллографических положения А (1) и D, аналогичные тем, которые занимают атомы хрома в СгВ~41 [542], и еще одно, обозначенное в структуре 0-В как Е (см. работу [542]). Этот вывод может быть уточнен после получения результатов рентгеновских исследований структуры соединений FeB76 и FeBuo.
Возрастание изомерных сдвигов, наблюдаемое в работе для FeB 76, FeBuo по сравнению с полученными данными [634], свидетельствует о правильности теории, по которой электроны от атомов бора передаются атомам металла в богатых металлом боридах.
Свойства боридов железа: физико-механические, электрофизические и химические — исследованы довольно широко. В работах [455, 1011] изучены удельное электросопротивление, коэффициент термо-э. д. с., теплопроводность, температурная зависимость электросопротивления, термо-э. д. с., теплопроводно-280
сти, определены работа выхода, теплота сублимации и микротвердость боридов железа Fe2B и FeB. Измерения проводились на образцах боридов, полученных синтезом из металла чистотой 99,95% и бора — 99,75%- Образцы спекались в среде очищенного аргона. Результаты измерения свойств боридов железа, полученные в работах Э. В. Марек, С. Н. Львова, И. И. Костец-кого [139, 140] и других исследователей [171, 507, 512], приведены в табл. 88.
Как видно, с увеличением содержания бора в боридах железа, при переходе от Fe2B к FeB, изменяются свойства; увеличиваются удельное электросопротивление и температура плавления, уменьшаются атомный магнитный момент и величина намагниченности насыщения, увеличивается удельная электронная теплоемкость и работа выхода электронов, возрастают
Таблица 88
Некоторые свойства боридных фаз железа
Свойство Fe2B FeB FeBR(n~19)
Содержание бора, масс. % 8,84 16,25 >35
Структура Периоды решетки, А: Тетрагональная Ромбическая Псевдо-кубическая
а 5,Ю9[561] 5,506(561] •—-
ь .— 2,952(561] .—
с 4,249(561] 4,062(561] —
с/а Плотность, е/см3'. 0,831 — —
рентгеновская — — —
пикнометрическая 6,93—7,30 [357] 6,47—6,8 [357] —
Теплота образования, ккал/моль — 9,2(912] —
Теплота сублимации, кдж/моль 86,9 214 —
Удельная электронная теплоемкость, мдж/(г-атом-град) 5,32 (609] 10,35 [609] —•
Температура плавления, °C 1389(512] 1540(512] 1650 [357] * 12(171] —•
Теплопроводность, втЦм град) (Т=20° С) 3,0(171] —
Удельное электросопротивление, МКОМ* см 38[455] 80 [455] —
Коэффициент термо-э. д. с., мкв/град (7'=20° С) —28 [171] —14,2 [171] —
Магнитный момент, 1,91 [609] 1,11 609] —
Намагниченность насыщения, ед. СГСМ 154 [139] 79,5 139] —
Работа выхода, эв 3,3(171] 3,6(171] —
Микротвердость, кГ/мм2 1340 ±50 1650 ±50 2830 ±100 [357]
Модуль упругости, 10е кГ/см? Цвет 2,9(507] 3,5 (507] Се] )ЫЙ
281
кикротвердость и модуль упругости. Наблюдаемые закономерности можно проанализировать с точки зрения особенностей структурного и электронного строения боридов железа. Для атомов железа при образовании кристаллов характерно заполнение Зс?-полосы [455], изменяется спектр валентных электронов атомов железа и бора таким образом, что атом металла стремится к захвату валентных электронов бора. Такое перераспределение электронной плотности проявляется в различных физических характеристиках, в частности на электросопротивлении.
Уменьшение величины магнитного момента и увеличение «удельной» электронной теплоемкости [607], результаты исследования эффекта Мёссбауэра [596, 686, 1009] свидетельствуют о заполнении ЗгЛполосы железа электронами бора, в связи с чем плотность состояний в d-полосе с возрастанием содержания бора й бориде увеличивается. Это приводит к перераспределению валентно-активных электронов между связями различных типов таким образом, что общая прочность межатомного взаимодействия увеличивается в результате усиления ковалентной связи В—В (см. гл. I).
В термодинамическом отношении бориды железа нестойки, при 1650° С начинают разлагаться. Масс-спектроскопические исследования состава пара над Fe2B и FeB [140] показали, что теплоты сублимации Fe2B и FeB соответственно равны 86,9 и 214 кдж/моль. Низший борид железа Fe2B разлагается на же-1 лезо и FeB:
Fe1B->Fe(r) -|- FeB,
высший борид FeB—г на составляющие элементы:
FeB -* Fe(r) -f- В(Кр),
Химические свойства боридов железа очень близки друг другу, Бориды железа хорошо растворяются в соляной, азотной, серной кислотах, взаимодействуют с перекисью водорода с образованием гидроокиси Fe(OH)3 [357, 496], почти не разлагаются водой при кипячении [496].
Способы получения боридов железа. При углеродном восстановлении смесей окислов железа и бора бориды железа загрязняются карбидом бора и железом, при силикотермическом способе в продуктах реакции наряду с боридами присутствует кремний. Несколько лучшие по чистоте бориды получаются при углеродном восстановлении смеси борида кальция с железом и алюминотермическом восстановлении борного ангидрида [24]. Технология получения ферробора внепечным алюминотермическим восстановлением боратовых руд и в дуговой печи описана в работе [197]. Осаждением из газовой фазы были получены кристаллы Fe2B (300 мкм), ориентированные плоскостью [001] перпендикулярно поверхности осаждения [566].
28.2
Наиболее чистые бориды железа могут быть получены спеканием смеси порошков железа и бора в среде аргона при 1200—1300° G в течение 2 ч [357].
Большая практическая важность исследования фаз, образующихся в системе Fe—‘В, возникает в связи с борированием стали, являющимся наиболее дешевым и доступным для промышленного производства методом создания на поверхности деталей высокотвердого и износостойкого слоя, который состоит в Основном из боридов железа. Образование боридов железа ведет д повышению сопротивления поверхностных слоев абразивному износу и коррозии в агрессивных средах, в том числе и при высоких температурах [184, 198, 271, 369, 461].
Борирование чугуна и стали осуществляется различными методами, из которых можно выделить борирование в тазовой, твердой и жидкой фазах.
Газовое борирование в среде Треххлористого бора [369] приводит к образованию слоев, состоящих из бориДов FeB и Fe2B, повышающих твердость и Сопротивление абразивному износу и коррозии в агрессивных средах.
Высокое качество боридных слоев получается при борировании стали карбидом бора. Карбид бора наносится на сталь методом газопорошковой наплавки [45, 524]. В процессе наплав-ди происходит химическое взаимодействие карбида бора с железом по предполагаемой реакции
В4С 4-Fe-> FeB.
Продукты реакции взаимодействуют, в свою очередь; с желе-зом с образованием борокарбида железа Рез (СВ)«
Используется комплексное насыщение стали бором из паст, состоящих из аморфного бора с различными легирующими добавками [103, 368]. В процессе насыщения поверхности стали бором при любом методе борирования атомы бора, преодолев поверхностный энергетический барьер и внедрившись в кристаллическую решетку Дустенита, избирательно диффундируют по границам блоков и зерен, способствуя внутриблочной диффузии бора и повышению его объемной концентрации. Фронт предельного насыщения аустенита бором с течением времени удаляется от поверхности, а в зоне между поверхностью образца и этим фронтом развиваются кристаллизационные боридообразующие процессы. Сначала идет образование богатого металлом борида РегВ. По мере поступления бора эта фаза растет, создаются условия для образования FeB, которое идет через Fe2B, С появлением сплошной зоны из боридов поступление бора в глубину замедляется, появляется зона боридного аустенита с твердостью около 220 кГ!мм2 [368]. При борировании чугуна [103] перед слоем боридов образуется бороцементит Fe3 (СВ).
Таким образом, поверхностное борирование железа, чугуна и стали приводит к повышению поверхностной твердости, из-
283
йосостойкости, жаростойкости, коррозионной стойкости благодаря образованию боридов железа Fe2B и FeB [53].
Бориды кобальта. Бориды кобальта составов Со2В и СоВ впервые получены в работах Муассана и Бине дю Жассоне [24]. Диаграмма состояния системы Со — В, построенная впервые Бьюрштремом [24], отражала существование только упомянутых боридов
На рис. 57 показана наиболее вероятная диаграмма состояния системы Со — В, построенная по результатам термического, микроскопического и рентгеновского методов анализа сплавов во всем интервале содержаний бора. До содержания 33,3 ат. % В присутствует одно соединение Со3В, плавящееся инконгруэнт-но, и другое, плавящееся конгруэнтно — Со2В с температурой плавления 1280° С. Кобальт и Со2В образуют эвтектику. В сплавах с содержанием от 33,3 до 100 ат. % В обнаружено только одно соединение — моноборид СоВ, плавящееся при 1460° С [949].
Ранквист [935, 936] установил существование борида кобальта состава С03В и описал его как соединение, изоморфное Fe3C и Ni3B.
В работах П. Т. Коломыцева [131, 132] методами термического и микроскопического анализов исследована богатая кобальтом часть диаграммы состояния системы Со—В, установлено образование Со3В по перитектической реакции. Со2В плавится с открытым максимумом при 1265° С. Кроме того, обнару-
284
жён бориД кобальта с большим, чем в СоЁ, содёржаннел! бора —так называемая q-фаза. Предполагается, что по составу т]-фаза является диборидом СоВ2 со структурой А1В2 аналогично описанному ранее бориду железа FeB2 [46]. По аналогии с системой Fe—В можно предположить, что в области высоких содержаний бора возможно существование высокобористой фазы СоВп, образованной на основе твердого раствора кобальта в решетке ^-ромбоэдрического бора.
В системе Со — В достоверно установлено существование трех боридных фаз: Со3В, Со2В и СоВ.
С03В — ромбический с четырьмя формульными единицами в элементарной ячейке, пространственная группа —Рпта, периоды решетки, А: а = 5,2234-5,235, Ь — 6,6294-6,634, с = = 4,4084-4,411. Значения периодов решетки свидетельствуют о наличии небольшой области гомогенности у борида Со3В.
. Со2В кристаллизуется в структурном типе СиА12, решетка тетрагональная с четырьмя формульными единицами в элементарной ячейке, пространственная группа —14/тст, периоды решетки, А: ег=5,016, с=4,220 [517, 561].
СоВ — ромбический, структурный тип FeB, пространственная группа D^—Pnma, периоды решетки, А: а = 5,253, 6 = 3,043, с= 3,956.
Свойства боридов кобальта. К настоящему времени накоплен довольно большой объем экспериментальных данных по изучению свойств боридов кобальта.
Исследованы магнитные свойства, ЯМР, низкотемпературная удельная теплоемкость, упругие константы, электрофизические свойства, температуры плавления, микротвердость, химическая устойчивость [228, 455, 507, 756, 808, 949, 957]. На основании полученных данных и анализа результатов рентгеносПект-ральных исследований боридов кобальта [100, 863] сделана попытка описать электронную структуру этих фаз [141].
_ По данным работ [673, 808], Со3В — ферромагнетик, температура, соответствующая точке Кюри 474° С. Температура плавления боридов кобальта Со3В, Со2В и СоВ соответственно составляет 1125, 1288 и 1460° С [949], микротвердость всех трех боридных фаз практически одинакова и равна 1145 кГ1мм2, микротвердость т}-Фазы высокая — 2575 кГ/мм2 [131].
В работе [141] на образцах боридов кобальта, полученных синтезом из элементов при спекании смеси кобальта чистотой 99,7% и кристаллического бора — 99,5%, исследована температурная зависимость удельного электросопротивления р, коэффициентов теплопроводности X и термо-э. д. с. и. Результаты измерения свойств при комнатной температуре приведены в табл. 89, температурные зависимости р, А и а — на рис. 58.
285
Анализ полуденных Данных свидетельствует о то1й, что Со3В, Со2В обладают металлическим, характером проводимости, а СоВ — полупроводниковым. Зависимость удельного электросопротивления от температуры (см. рис. 58) типична для ферромагнитных металлов: с ростом температуры электросопротивление повышается и при переходе Через точку Кюри (747° С для С03В и 429° С для Со3В) [675] ^наклон кривой р(Г) уменьшается. Коэффициент теплопроводности Со3В И Со2В вблизи
Рис. 58. Температурная зависимость коэффициента термо-э. д.с. « , удельного электросопротивления р и теплопроводности X ферромагнитных боридов: кобальта (О-—нагрев; ® — охлаждение, 6 и 61 —точки Кюри для С03В и С02В) £141).
точки Кюри имеет минимум, что также характерно для ферромагнетиков [105]. В ферромагнитной области, где Наблюдается быстрый рост электросопротивления с повышением температуры, теплопроводность уменьшается, а после перехода через точку Кюри растет. Подобный ход температурной зависимости удельного электросопротивления и теплопроводности находится В качественном соответствии с требованиями закона Видемана — Франца, что, в свою очередь, указывает на преобладающую роль электронной составляющей в процессе переноса тепла для боридов Со3В и Со2В.
Как следует из табл, 89, изменение некоторых физических характеристик боридов кобальта носит довольно монотонный концентрационный характер: систематически уменьшается магнитный момент на атом кобальта и значение внутреннего поля на ядре Б9Со в ферромагнитных боридах Со3В и Со2В, увеличивается температура плавления, повышается химическая устойчивость.
Наблюдаемые закономерности вытекают из особенностей кристаллического строения боридов кобальта и его изменения при переходе от низшего борида С03В к высшему i-*-СоВ. Борид Со3В — одно из немногих соединений со структурой цементита, 286
Таблица 89
Некоторые физические свойства боридов кобальта
Свойство Со,в СовВ СоВ
Содержание бора, масс. % 6,77 8,4 15,51
Структура Ромбическая, Тетрагональная, Ромбическая,
тип FesC тип СцА1а тип FeB
Периоды решетки, А: К 525 3,956
а "" 5,016
Ь [935, 936] 6,629 [561] [949] 5,253
е 4,408 4,220 3,043
с/а 0,841 ь---
Плотность, г/см* 8,8
рентгеновская —•
пикнометрическая —- 0,66
Коэффициент электронной тепло- 7,05 6,70
емкости [785] Температура плавления, “С [949] 1125 1288 1460
Теплопроводность, етКсм • град) 0,17 0,14 0,17
[141] Удельное электросопротивление, 28 33 76
мком-см [455] Коэффициент термо-э. д. С., —40 —27 —51
10_в в/град [141] Коэффициент Холла, 10—* см*/к —104 [141]
Магнитный момент, [957] Cd 1,06; Coil 1,25 0,806 Диам.
Точка Кюри, °К 747[957] 433 [957] 477[455]
Внутреннее магнитное поле кэ [957] Col 116,3; Coil 137,9 54,5 Ьч »'
Микротвердость, кГ/мм* 1145[949] —
Выход бороводородов при гидро- 0,925 0,7 0,205
литическом разложении [228]
состоящей из деформированных рядов треугольных и прямоугольных призм с металлическими атомами в узлах и атомами бора в центрах треугольных призм. Расстояния Со — В в такой структуре очень малы (см. табл. 89), а атомы металла, находящиеся в основании (Со1) и на верхнем ребре (Со11) призм, не-s эквивалентны, вследствие чего различаются атомные магнитные моменты и внутренние поля, измеренные методом ЯМР. С02В и СоВ характеризуются более тесными контактами между атомами бора и соответствующим возникновением ковалентной связи В — В. Содержание бора при переходе от С03В к СоВ увеличивается, что, в свою очередь, приводит к росту электросопротивления, температуры плавления и уменьшению величины магнитного момента.
Полученные данные по свойствам непосредственно связаны с плотностью состояний на уровне Ферми (785] и являются
287
Одним из доказательств донорного поведения бора, электроны которого компенсируют дефект d-полосы исходного кобальта.
Химические свойства боридов кобальта изучались Л. Я. Марковским и др. [242], которые показали, что Со2В и СоВ инертны по отношению к углероду в интервале температур 900—2000° С. С03В взаимодействует с углеродом выше 1100° С с образованием Со2В и СозС. При прокаливании смеси Со2В, СозС и металлического кобальта, а также синтезом из элементов при 2000° С получен борокарбид кобальта состава СоцВ2С.
В работах [673, 949] исследовано поведение боридов кобальта в кислотах и установлено, что бориды кобальта разлагаются соляной кислотой с выделением бороводородов: выход бороводородов при гидролитическом разложении НС1 боридов состава С03В, Со2В и СоВ соответственно составляет 0,9; 0,7; 0,2. Полученные результаты свидетельствуют о повышении прочности связи в боридах кобальта с увеличением содержания бора.
Действительно, по мере увеличения содержания бора в боридах в связи с перераспределением валентно-активных электронов между связями трех типов (Ме — Me, Ме — В, В—В) общая прочность связи возрастает главным образом за счет усиления связей В — В [100, 228].
Исследование свойств фаз, образующихся в системе Со — В. становится одной из важных задач в связи с высокой окалино-стойкостью боридных слоев, образующихся при термодиффузионном насыщении поверхности деталей бором из газовых, твердых или жидких сред, [55, 270, 455].
Методы получения. В работах [131, 132, 935, 936] боридные фазы кобальта, как правило, получались синтезом из элементов. Карбидоборный метод получения боридов кобальта различного состава исследован в работе [469]. Установлено, что при взаимодействии окислов кобальта с карбидом бора в вакууме при 1100—-1300° С из шихт расчетного состава можно получить бориды СозВ, Со2В и СоВ. Использование в качестве исходных продуктов окиси кобальта и карбида бора дает бориды, содержащие 1,5—2% С, в связи с чем этот метод неудовлетворителен. Синтез из элементов, осуществляемый в среде аргона в электропечи сопротивления при 1050—1100° С и выдержке 1,5— 2 ч, дает возможность получать бориды кобальта стехиометрического состава.
Бориды никеля. Диаграмма состояния системы Ni — В изучалась многими исследователями [133, 354, 378, 937]. Приведенные в справочной литературе [512, 527] варианты диаграммы Ni — В не отражают существующих боридных фаз никеля.
По данным работы [683], в системе Ni — В присутствуют Ni2B, Ni3B2, NiB и Ni2B3. Ранее был описан борид никеля NiB2 [24]. Бориды никеля состава МзВ2, Ni2B3 и «№В2» не подтверждены в последующих работах [22, 270, 675, 936, 937]. А. П. Сми-рягин и О. С. Квурт [481] предполагали, что в области высоких
288
содержаний никеля существует борид NigB. Позже эта фаза также не была подтверждена [354, 362, 378].
Ранквист [937, 938] и Марион [832] уточнили часть диаграммы состояния системы Ni — В в области между Ni2B и NiB и показали, что борида состава Ni3B2 нет; в этой области составов располагается фаза Ni4B3, существующая в двух кристаллических модификациях.
В работе [948] диаграмма состояния системы Ni — В построена на основании данных прецизионного термографического анализа по кривым нагрева и охлаждения, а также данных металлографического и рентгенографического анализов до 60 ат. % В. Образцы плавились в среде аргона в тиглях из спеченного глинозема, что могло привести к загрязнению кремнием. Потеря веса сплавов при плавлении происходила при иопарении бора в процессе окисления, и состав их пересчитывался с учетом потерь. Установлено, что NiB образуется из расплава и бора по перитектической реакции при 1035 ° С.
Ni4B3(o) (41,4 ат.% В) плавится конгруэнтно при 1025°С и Ni4B3(m) (43,6 ат.% В) при 1031° С. В работе обнаружена в системе Ni — В метастабильная эвтектика Ni—Ni2B при 986° С.
В работе [482] в области содержаний бора выше 60 ат. % описан «NiB2», установлен перитектический характер образования Ni4B3 и «NiB2», что в отношении Ni4B3 хорошо согласуется с данными работы [948]. На микроструктуре сплавов с 58 и 65 ат. % В присутствуют крупные кристаллы, приписываемые фазе «NiB2».
В работе [482] отмечается, что характерной чертой системы Ni — В является наблюдаемый по мере увеличения содержания бора переход от стойких химических соединений к инкон-груэнтно плавящимся соединениям, образующимся по перитектическим реакциям. В работе приводятся значения микротвеэ-дости боридных фаз никеля Ni3B, Ni2B, Ni4Bs, NiB и «NiB2», которые соответственно равны 1190, 1430, 1486, 1546 и 3360 кГ[мм2.
На существование борида «NiB2» указывалось еще в работе [24]. П. Т. Коломыцев и Бест в своих работах [133, 582] делают вывод о возможности существования фазы NiBx, где х>1. В сплавах с 16 масс. % Ni обнаружена фаза с твердостью около 2500 кГ/мм2.
Результаты термического исследования, проведенные и описанные К. И. Портным и В. М. Ромашовым в работе [362], дают основание считать построенную ими диаграмму состояния Ni — В наиболее достоверной (рис. 59). Уточненная диаграмма состояния Ni — В (см. рис. 59) отличается от диаграмм, приведенных в других работах, более высокими температурами плавления соединений Ni4B3(o), Ni4B3(m) и NiB, что, по-видимому, связано с использованием высокочистых исходных материалов
19 Зак. 1305
289
(Ni — 99,7%, В — 99,4%) й Проведением ’гермичёёйЬГО анализа на установке, позволяющей наблюдать сплавы в виде капель, удерживающихся поверхностный натяжением. Методика приготовления сплавов исключала взаимодействие с другими элементами, испарение и ликвацию компонентов [362].
К. И. Портной и В. М. Ромашов [354, 362] подтвердили существование боридных фаз Ni3B, Ni2B, Ni4B3(o), Ni4B3(/n), NiB в интервале концентраций до 50 ат,% В.
На основании анализа имеющихся в литературе сведений
Ni Z0 40
[24( 527, 832, 936] и результатов работы [362] можно считать доказанным существование пяти боридных фаз нике^ ля! Ni3B, Ni2B, Ni4B3(o), Ni4B3 (/и) и NiB. Структурное исследование образующихся в системе фаз первым провел Андерссон [539], определив структуру боридов Ni2B и NiB. Кристаллическая структура боридов Ni3B, Ni4B3 (o),*Ni4B(m) установлена в работах Ранквиста [936—938].
Ni3B кристаллизуется в ромбической сингонии с че-формульными едини-ячейке,
тырьмя
80 В,ат°/. цами в элементарной
пространственная группа
Рис. 59. Диаграмма состояния систе- рпта периОды решетки, А: мы Ni—В [362]. й=3=5(2ю, Ъ =6,6174 и с=4,3904
[938].
Ni2B, по данным Кисслинга [539], имеет тетрагональную структуру с периодами решетки, А: а = 4,993, 6 = 4,249, cja = = 0,851, плавится при 1230° С [683].
Ni4B3(o) имеет орторомбическую структуру, пространственная группа Рпта с четырьмя формульными единицами в элементарной ячейке, периоды решетки, А: а= 11,9540, 6 = 2,9815 и с= 6,5684.
У Ni4B3(m) структура моноклинная, пространственная труп-, па С2)С с четырьмя формульными единицами в элементарной ячейке, периоды решетки, А: а=6,4282, 6 = 4,8795, с=7,8190, £ = 103,315°.
Моноборид никеля NiB, по данным Кисслинга [539], кристаллизуется в ромбической сингонии, пространственная группа —Cmcm, периоды решетки, А: а—2,925, 6=7,396, с=2,966, расчетная плотность 7,13 г)см&.
290
NiB изоморфен боридам СгВ и ТаВ. В сплавах с содержанием более 50 ат. % В в работах (362, 378] обнаружено еще одно высокобористое соединение никеля с микротвердостью 2900 кГ/мм?. Предполагается, что это высокобористое соединение никеля содержит! не менее 94 ат. % В и представляет твердый раствор никеля в решетке 0-ромбоэдрического бора по типу высокобористых твердых растворов железа в ^-ромбоэдрическом боре [1009]..
Результаты проведения реакции между никелем и бором (с 4 ат.%) при 1600°С и давлении около 80 атм [644] свидетельствуют о том, что малые добавки никеля в бор при различных условиях эксперимента могут приводить к стабилизации той или иной модификации бора. В частности, в работе [644] получено соединение со структурой «-тетрагонального бора. На элементарную ячейку Приходится 50 атомов бора и менее двух атомов никеля. Пространственная группа P^lnnm, периоды решетки, А: а=8,986±0,006, с = 5,078±0,003. Атомы никеля занимают положение 2 (а), вокруг них восемь атомов бора на расстоянии 2,20 и шесть — на расстоянии 2,53А, что близко'к сумме радиусов никеля и бора.
Таким образом, а-тетрагональный бор можно рассматривать как борид (высокобористое соединение никеля NiBn, где п~24) или «-тетрагональный бор, стабилизированный малыми примесями никеля. Растворение никеля в боре приводит к резкому возрастанию микротвердости бора [614]’
Физические свойства боридов никеля широко исследуются в настоящее время в связи с высокой окалиностойкостью боридных слоев, получаемых при термодиффузионном насыщении поверхности различных деталей из чугуна и стали бором [53, 270].
Показано, Что бор повышает силы связи атомов в решетке никеля, уменьшает диффузионную подвижность атомов и вакансий, увеличивает сопротивление пластической деформации и особенно ползучести, влияет на структуру никеля, уменьшая размеры кристаллитов при первичной кристаллизации, уменьшает скорость роста зерен при собирательной рекристаллизации, оказывает рафинирующее действие, упрочняет никель.
Данные по удельному электросопротивлению, термо-э. д. с., коэффициенту Холла и магнитной восприимчивости йри комнат ной температуре, температурная зависимость удельного электросопротивления, коэффициентов теплопроводности, термо-э. д. с. и магнитной восприимчивости боридов никеля приведены в работах [141, 455]. Исследования вели на образцах, полученных синтезом из электролитического никеля чистотой 99,8% и кристаллического бора чистотой 99,5% при 1200—1250° С. Образцы подвергались длительному гомогенизирующему отжигу (50 ч), по данным рентгеновского и химического анализов все бориды были стехиометрического состава. Результаты исследований приведены в табл. 90 и на рис. 60.
19* 291
Видно, что бориды никеля обладают металлическим характером проводимости. Удельное электросопротивление при переходе от Ni3B к NiB несколько возрастает, что вызывается снижением концентрации носителей тока в связи с усилением связи Me — В и В — Вис возрастанием содержания бора в бориде. Судя по знаку и относительно небольшому значению коэффициента Холла, в проводимости: боридов никеля, кроме электронов, принимают участие и Дырки. В работе делается предполо-
жение о том, что бориды никеля характеризуются наличием двух перекрывающихся зон, обеспечивающих вклад в проводимость.
Коэффициент термо-э. д. с. боридов никеля (см. рис. 60) с повышением содержания бора увеличивается, и у NiB его знак меняется с отрицательного • на положительный. Для Ni3B и Ni2B зависимость а(Т) имеет сложный вид, для NiB она близка к линейной. Такой характер зависимости а(Т) качественно объясняется предположением о своеобразном расположении уровня Ферми относительно Зй-зоны.
Теплопроводность в ряду Ni2B, Ni3B и NiB уменьшает-
Рис. 60. Температурная зависимость удельного электросопротивления р, коэффициентов термо-э. д. с. а и теплопроводности А. боридов никеля.
ся, удельное сопротивление увеличивается. Такое изменение упомянутых характеристик показывает, что для боридов никеля выполняется закон Видемана—Франца, что свидетельству-
ет также о металлическом характере проводимости и о преобладающей роли электронов в процессе переноса тепла.
Исследование магнитных свойств боридов никеля [142] показало, что Ni3B и Ni2B — парамагнетики, a NiB — диамагнетик [607, 608, 675].
Относительно большие значения магнитной восприимчивости для Ni2B и Ni3B и сложный характер зависимости % (Г) для NiB дают основание считать, что в намагничивании боридов никеля весьма существенную роль играют 3(/-электропы никеля. Такой вывод согласуется с результатами рентгеноспектральных исследований [863] и изучением магнитных свойств никеля в сильных магнитных полях [725].
Диамагнетизм NiB, слабо убывающий с повышением температуры, свидетельствует прежде всего о том, что у этого борида ЗбЛзона заполнена.
292
Некоторые свойства боридов никеля
Таблица 90
Свойство Ni,B Ni2B Ni.B, (О) Ni,B3 (т) NIB
Содержание бора, масс. % 5,78 8,43 12,13 12,13 15,55
Структура О Ромбическая [937, 938], тип Fe3C Тетрагональная [539], тип СиА12 Орторомбическая [832, 938] тип Ni4B3 (о) Моноклинная [832, 938], тип Ni4B3 (т); пространственная группа С2/С Ромбическая [539], тип СгВ
Периоды решетки, А:
а 5,2Ю0±0,0005 4,990[561] 11,9540±0,0008 6,4282 ±0,0005 2,925
ь 6,6174±0,0006 —— 2,9815± 0,0003 4,8795±0,0004 7,396
с 4,3904±0,0004 4,245 6,5684 ±0,0005 7,8190±0,0006 2,966
с/а Плотность, г)см3: — 0,851 — Р = (103,315± ±0,008)° —
рентгеновская -— -— — 7,13
пикнометрическая — — —-- — —
Удельная электронная теплоем- —— 1,95[784] — —
кость, мджЦг-атом. Ме-град) Температура плавления, °C
1478 1513 1600 1600 1863
[243, 354, 378] 0,55
Теп лопрово дность, втЦсм • град) [1411 0,42 -У- — 0,22
L J Удельное электросопротивление, 21 [141] 14 [141] — .— 50 [454]
МКОМ •СМ
Коэффициент термо-э. д. с., 10“6 в/град [141] —10,8 —1,6 г — 4-2,3
Коэффициент Холла, 10~4 см3 [к [141] 0 4-0,53 — — 4-0,63
Магнитная восприимчивость, 4-88 [141] 4-47[141] — — —5,5
10_в ед. СГСМ/г-атом Me
Микротвердость, кГ/мм3 [482] 1190 ИЗО 1486 1486 1546
Химические свойства боридов никеля и их устойчивость по отношению к углероду изучались в работах [22, 242, 496]. Бориды никеля с углеродом не взаимодействуют [242]. Ni3B не растворяется в разбавленной H2SO4 (1:2), малорастворим в концентрированной и разбавленной НС1. При длительном нагрева-нии в концентрированной H2SO4 Ni3B растворяется, легкорастч ворйм в HNO3 и царской водке, а также в H2SQ4 и НС1 в присутствии окислителей, например Н2О2[22].
Ni2B не разлагается водой При кипячении, содержание его в растворе составляет 1—4%, частичнд разлагается в концентрированной соляной кислоте, в серной кислоте разлагается значительно, в азотной кислоте разлагается полностью. Ni2B более стоек к действию минеральных кислот, чем борид железа Fe2B^ что, по-видимому, связано с большей прочностью связей МеВ и В — В в этом бориде никеля.
Бориды никелд Ni3B и Ni2B устойчивы в уксусной и' щавелевой кислотах, в растворах перекиси водорода, щелочи и аммиака, в 25%-Ном растворе НСЮ4 эти бориды никеля раство* ряются полностью в течение часа. ЬЩВ3 и №В весьма устойчивы в раствора^ хлорной кислоты. В соляной кислоте наиболее стоек борид никеля состава Ni4B3 [496].
При взаимодействии водных или спиртовых растворов бор-Гидрида натрия и соли никеля (хлорид, ацетат, сульфат) образуется черный мелкодисперсный осадок, являющийся активным катализатором гидрирования многих органических соединений [277т 604, 993], гидролиза боргидрида натрия [695], разложения муравьиной кислоты, восстановления нитрат-ибна дй аммиака и других процессов [695].
Осадки, высушенные обработкой спиртом и эфиром, рентгеноаморфны, но после нагревания их в инертной среде на дебае-грамме осадков появляются линий боридов никеля Ni3B, Ni2B и металлического Никеля [486], В работе [911] полагают, что катализатором упомянутых выше реакций является борид никеля»
В работах [207, 486, 506] подробно изучены реакция борогид-рида натрия с хлористым никелем в воде при различных соотношениях исходных компонентов и взаимодействие «никельбо-ридногр» катализатора с кислородом' воздуха и разбавленными растворами кислот, цигграт-ионом и стиролом.
Проведенные исследования показали, что «никельборидный» катализатор окисляется кислородом воздуха, взаимодействует с водой, восстанавливает KNO3 до аммиака, т. е. ведет себя в этих реакциях как скелетный никель. Переход бора в раствор, а также образование борной кислоты при нагревании указывают на присутствие бора в элементарном виде.
Использование в качестве восстановителя NaBH4 приводит к осаждению никеля с развитой поверхностью, поглощающей водород.
294
Вопрос о механизме образования боридной фазы при полу-< чении катализатора при комнатной Температуре пока неясен.
Исследование влияния малых добавок никеля на температуру спекания, пористость, эмиссионные свойства, отравление в кислородной среде и долговечность катодов из гексаборида Лантана [498] показало, что пористость катодов уменьшается, плотность тока эмиссии никельсодержащих катодов в 1,5 раза выше плотности тока эмиссии чистого LaBg. Рентгеновский фаговый анализ показал, что никельсодержащий катод состоит из трех фаз: LaBg, LaB4 и Ni2B. Увеличение эмиссионной способности катодов, по-видимому, вызвано образованием борида никеля, что ведет, в свою очередь, к появлению и диффузии свободного лантана на поверхность катода,
Методы получения. При получении боридов никеля использовали прямой синтез из элементов [936—938]. Спекание соответствующих смесей порошков аморфного бора и никеля проводили в дуговой печи в среде аргона или в эвакуированных запаянных кварцевых ампулах[786]. В работе [948] образцы боридов никеля плавились в тиглях из спеченного глинозема в среде аргона. j
Н. И. Блок [22] выделил борид никеля Ni3B растворением в разбавленной серной кислоте H2SO4 двухфазных эвтектических сплавов с содержанием бора от 0,01 до 25%.
П, Пешев [346] получал борид никеля N12B при взаимодействии раствора уксуснокислого^ никеля с раствором боргидрида натрия по реакции
2Ni (СН3СОО)2 + 6NaBH4 + 17НаО Ni2B 4- 5Н3ВО3 4-
4- 4CH3COONa 4- 2NaOH 4- 20,5Н2.
Реакция ведется при 40° С.
Бориды платиноидов. Бориды рутения. Диаграмма состояния системы изучена недостаточно. В работе [882] предложена диаграмма состояния, построенная на основании термических, рентгенофазовых и металлографических исследований. Она подтвердила существование в системе Ru— В четырех боридных фаз: Ru7B3 [553], RuB [761], Ru2B3 [761, 811] и RuB2 [560]. В работе [562] была получена фаза состава RuuBe- Таким образом, в си-i стеме Ru — В получены и однозначно определены пять боридных фаз.
Ru7B3 и RuB2 образуются по перитектической реакции при 1660 и 1600° С, a RuB и Ru2B3 плавятся конгруэнтно при 1520 и 1560° С соответственно.
В работах [553, 922] проведено рентгеноструктурное исследование борида рутения, описанного ранее [512] как Ru3B. Установлено, что это не что иное, как фаза Ru7B3. Исследование проводилось на монокристаллах. Структура Ru7B3 гексагональная, структурный тип Th7Fe3, пространственная группа Р63тс, перио
' 4
295
ды решетки, А: а=7,469, с=4,714. Позже эти данные были подтверждены в работах Аселиса [562], Кемптера [761] и Аронссо-на [561].
В структуре RU7B3 у атома бора имеются шесть ближайших соседей на расстояниях около 2,16 А. Это значение очень близко к расстоянию Ме — В, обнаруженному в МоВ (В—6Мо = 2,23А) и №зВ (В — 6Ni = 2,04A). Интересной особенностью структуры R117B3 является ее близкое сходство со структурой тригонального карбида хрома СГ7С3. Структуру карбида хрома можно описать дак слегка искаженную структуру RU7B3. Кроме того, борид рутения RU7B3 очень близок к хорошо известным боридам молибдена и железа [553]; у N13B и у бороцементита изолированные атомы бора имеют тригонально-призматическое окружение, как и у RU7B3. В виде монокристаллов был выделен RunB8 [562]. Структура его ромбическая, пространственная группа РЬат с двумя формульными единицами в элементарной ячейке, периоды решетки, А: а= 11,609, Ь—11,342, с = 2,836. Предполагается наличие незначительной области гомогенности у борида RuhB8 [562]. Среднее межатомное расстояние Ru — Ru равно 2,79А, что близко к сумме радиусов рутения и бора (2,21 А).
Структура RutiB8 очень близка к структуре борида никеля N14B3 [937]. Особенностью структуры RuhB8 является наличие в ней двух видов структурных образований из атомов бора: одна часть атомов бора изолирована, а другая образует зигзагообразные цепочки, причем последние представляют переходный тип между одинарными и двойными цепочками (см. рис. 1).
RuB~bl, вероятнее всего, имеет гексагональную решетку типа WC [568], а не гексагональную типа А1Вг, описанную Кемптером [761], поскольку атомы бора в решетке RuB~i,i занимают изолированное положение и их явно недостаточно для образования плоских гексагональных сеток. RU2B3 подобно W2B5 имеет дефектную решетку, кристаллизуется в гексагональной сингонии с периодами решетки, А: а = 2,89, с= 12,81 [812].
По данным работ [560, 926], у RuB2 структура ромбическая с периодами, А: а=4,645, 6 = 2,865, с=4,045. Данные о наличии у диборида R11B2 ромбической структуры подтверждены в работах [561, 814], что полностью ставит под сомнение правильность ранних работ Кемптера и Фриза [761], которые утверждали, что структура RuB2 гексагональная. Атомы рутения в структуре RuB2 занимают тетраэдрическую координацию, а не тригонально-призматическую, как у А1В2, при наличии одинаковых структурных образований из атомов бора (плоских плотноупакован-ных гексагональных сеток) [814]. Данные о существовании борида рутения состава Ru2Bs [761] со структурой W2B5 не подтвердились Аронссоном [560].
Физико-химические свойства боридов рутения изучены слабо. Имеются сведения о способности борида Ru7B8 к переходу в сверхпроводящее состояние (табл. 91) при 2,58° К.
296
Таблица 91
Некоторые свойства боридов металлов платиновой труп пы
Металл Борид Содержание бора, масс. % Структура, тип Число формульных единиц Атомный объем О Периоды решетки, А Температура плавления, °C Удельное электросопротивление, МКОМ’СМ Коэффициент термо-э. д. с, мкв!град Температура хода в сверхпроводящее состояние, °К Микротвердость, кГ/мм* Литература
а b с
Ru Ru?Bj 4,38 Гексагональная, тип Th7Fe3 . 2 16,26 7,469 — 4,714 1660 — 2,58 — 1131 [137, 553]
RUuBg 7,22 Ромбическая, RultBe 2 21,6 1 1,609 1 1 ,342 ' 2,836 1370 — — — 1307 [137, 562]
RuBtl 9,66 Гексагональная, WC 1 20,1 2,852 2,855 1 520 — — — 1409 [137, -568]
16,05 Гексагональная, W2B5 2 — 2,89 — 12,81 1580 — —* — 1523 [137, 812]
RuB2 17,62 Ромбическая, RuB2 29,9 4,645 2,865 4,045 1600 — — — 2263 [137, 560, 926] [138, 561]
Rh Rh,B, 4,31 Гексагональная, ThyFe., 2 16,49 7 ,471 — 4,777 1140 88 0,3 +0,30 777
RhB-1,1 10,35 Гексагональная, анти-Ni As 2 20,03 3,309 —* 4,224 1260 88,0 +0,6 1,28 1213 [138, 561]
Pd Pd,B 3,27 Ромбическая, Fe3C 4 16,71 5,463 7,567 4,8 52 ЛЮ 10 —7,2 — 470 [457, 980]
PdtB2 3,90 Моноклинная, Мп 4 17,20 12,786 4,995 5,472 (1=97,2^ 1200 26 +2,0 — 595 [457, 787]
Os OsBj 12 5,38 Гексагональная, WC 1 20,56 2,876 — 2,871 1760 — — — 1642 [137, 568]
OsBl,6 7,86 Гексагональная, W2B6 2 — 2,91 — 12,91 1820 — — — 1878 [137, 761]
OsB 2 10,21 Ромбическая, RuB2 2 27,41 4,684 4,076 2,872 1920 — — — 2899 (137, 560, 926]
lr IrB 1,15 ^,83 Тетрагональная, a-ThSi2 4 20,26 2,810 — 10,263 1190 — —* — 1652 [456, 554]
И1,35 7,59 Моноклинная, 1гВ1,35 8 23,34 10,525 2,910 6,099 (Р = 91,07 = ) — — — [456, 560]
Pt Pt,B 1,81 Тетрагональная — — 2,63 — 3,83 — — — — — [137, 1004] (137, 554]
5,24 Гексагональная, анти-NiAs 2 19,81 3,3 58 — 4,058 — — — 1,28 , 940
В работе [446] исследованы условия синтеза и некоторые свойства боридов рутения. Методами термографического, металлографического, рентгеновского анализов подтверждено наличие в системе пяти боридных фаз; RU7B3, RunB8, RuBi.i, RU2B3 и RuB2. На основании данных термического анализа образца состава Ru+2B показано, что образование диборида ру-тения RuB2 при реакционном спекании протекает через стадии образования всех низших (по содержанию бора) боридных фаз: Ru7B3-»-RuiiB8->RuBiii->Ru2B3-*RuB2. Процесс завершается после 70 ч при 1300° С.
В работе [137] исследованы некоторые электрофизические свойства боридов рутения: удельное электросопротивление и коэффициент термо-э. д. с. в области температур 20—800° С, микротвердость, Удельное электросопротивление боридных фаз рутения с увеличением содержания бора при 20° С понижается; с ростом температуры электросопротивление возрастает [137]. Бориды рутения составов RuBi.j и Ru2Bs проявляют металлический характер проводимости, a RunB8 и RU7B3-— полуметаллический, коэффициент абсолютной термо-э. д. С, с ростом содержания бора в боридах рутения при 40° С увеличивается, а с ростом температуры для каждого борида—уменьшается. В работе измерена микротвердость боридов, рутения. Результаты исследований приведень! й табл. 91.
Бориды рутения с кислотами при 20° С не взаимодействуют, а при кипячении растворяются незначительно [137]. Аналогично поведение боридов рутения в щелочах. При окислительно-щелочном сплавлении бориды рутения разлагаются полностью. Эта особенность в поведении боридов рутения при щелочно-окислительном сплавлении может быть использована при проведении химического анализа для разделения смесей боридов, а также боридов и бора, Предполагается, что разложение боридов рутения при окислительно-щелочном сплавлении идет по схеме [137]
RuxB? -ф Na2O2 ->• Na2RuO4 4- NaBO3.
С ростом содержания бора в боридах рутения химическая устойчивость вплоть до состава RU2B3 (13,8% В) уменьшается, а для борида рутения RuB2 несколько увеличивается:
Ru7B3 > RuuBs > RuBi, 1 > Ru2B3 < RuB,.
При нагревании на воздухе бориды рутения начинают заметно окисляться при 900° С.
Предполагается [11], что бориды рутения могут быть использованы в Качестве катализаторов в реакциях гидрирования.
Бориды родия. В системе Rh — В установлено существование двух боридов — RI17B3 и RhB~>i,i [561]. RI17B3 имеет гексагональную структуру, тип Th7Fe3, С периодами решетки, А: а=7,471, с=4,777. У RhB.,1,1 структура гексагональная типа анти-NiAs 298
С периодами, А: 0=3,309, с=4,224, с/а= 1,277. Предполагается [554], что формула RhB~ij условная; пока Дет данных о более полном исследовании этой системы. Есть отрывочные сведения о наличии в области, богатой родием, эвтектики с температурой
плавления 1131° С [933].
Исследованный ранее подробно борид родия RhaB [850] не
Рис. 61. Температурные зависимости удельного электросопротивления р (а) и коэффициента термо-э. д. с( а (б) боридов родия RhB~i,i (/) и RhjBs (2).
сплавления в кварцевой ампуле, где не исключалось загрязнение продуктов кремнием.
В работе [446] методами термического, металлографического и рентгеновского анализов подтверждено существование в системе Rh —В двух боридных фаз — Rh7B3 и RhB~i,i. Борид RhB~i,i получается при реакционном спекании порошков родия и бора в течение 40 ч при 1000° С. Образование борида родия RhB^u идет через стадию образования Низшего борида Rh7B3.
Физико-химические свойства боридов родия исследованы недавно и описаны в работах [137, 138]. Исследование температурной зависимости удельного электросопротивления и абсолютной термо-э. д. с. [138] боридов родия показало, что удельное электросопротивление Rh7B3 с температурой возрастает; при 510— 530° С наблюдается перегиб в сторону уменьшения этой величины (рис. 61,а). Борид проявляет полупроводниковый характер проводимости в области температур от комнатной до 800° С. Значение абсолютной термо-э. д. с. для боридов родия также проявляет сложный характер температурной зависимости (рис. 61,6).
Исследование поведения боридов родия в различных химических реагентах (Н2О, H2SO4, НС1, Н3РО4, HNO3, СН3СООН,
299
NaOH, NaOH + H2O2) показало их высокую устойчивость по отношению к упомянутым кислотам и щелочам при комнатной температуре [137]. Бориды родия растворяются в концентрированной серной кислоте и царской водке при кипячении. Исследование кинетики разложения боридов родия в серной кислоте при кипячении привело к следующему выводу: с увеличением содержания бора в боридах родия скорость разложения борида уменьшается, что, по-видимому, связано с увеличением жесткости кристаллической решетки вследствие усиления В — В-взаимодействия.
Изучение состава газовой фазы, выделяющейся при разложении боридов родия горячей серной кислотой, методом, масс-спектрометрии показало наличие следующих составляющих: 502>50з>В2Н6»Н2? При переходе от Rh7B3 к RhB~i,t наблюдается уменьшение выхода бороводородов, что хорошо согласуется с данными работы [228] и объясняется увеличением доли ковалентной связи вследствие усиления В — В-взаимодействия в боридах с увеличением содержания в них бора.
Процесс растворения боридов родия в концентрированной серной кислоте протекает по схеме 2Rh7B3-|-33H2SO4= = 7Rh2(SO4)s+ 125О24-ЗВ2Нб+24Н2О. Далее происходит гидролиз бороводородов и образование ортоборной кислоты. Первичным продуктом гидролиза бороводородов является боран ВН3, который, полимеризуясь, дает B2H3. Схема такой полимеризации на примере гидролиза борида магния описана Вибер-гом [24].
Бориды палладия. Диаграмма состояния системы Pd—В, приведенная в справочной литературе [527], вызывает серьезные сомнения из-за того, что сплавы выплавлялись в тиглях из SiO2, и не исключена возможность загрязнения образцов продуктами восстановления SiO2 бором, а также продуктами взаимодействия палладия с кремнием типа Pd2Si.
В системе Pd — В твердо установлено существование двух боридов —Pd3B и Pd5B2 [980]. Данные ранних работ [568] относительно существования борида Pd3B2 не подтвердились [799]. Структура боридов Pd3B и Pd3B2 исследована на монокристаллах.
Pd3B кристаллизуется в ромбической сингонии, Кристаллическая структура типа Fe3C с периодами, А: а=5,463, 6 = 7,567, с=4,852, пространственная группа —Ptwia с четырьмя формульными единицами в элементарной ячейке.
У PdgB2 структура моноклинная, пространственная группа С2/С с периодами, А: а= 12,786, 6=4,995, с= 5,472, £ = 97°2'. Элементарная ячейка содержит четыре формульные единицы. PdsB2 изоморфен карбиду Мп3С2 [787].
Атомы бора в структурах Pd3B и Pd3B2 изолированы друг от друга и располагаются в пустотах тригонально-призматических образований из атомов металла. Кратчайшие расстояния 300
Pd— В в решетке Pd3B составляют 2,17 А, в Pd3B2— 2,18 А, что хорошо согласуется с расстоянием Ме — В для других боридов с такой же координацией атомов бора в решетке, в частности для Ru7B3 расстояние В — 6Ru равно 2,16 А.
В работе [446] методами термического, металлографического
и рентгеновского анализов подтверждено существование в си-
стеме Pd—В двух боридных фаз состава Pd3B и Pd3B2. Термический анализ показал, что борид палладия Pd3B может быть получен при реакционном спекании порошков палладия и бора в те
Рис. 63. Температурная зависимость коэффициента термо-э. д. с. а боридов палладия РсЕВг (/) и
Pd3B (2).
Рис. 62. Удельное электросопротивление р боридов палладия РсЬВа (/) и Pd3B (2) в интервале температур 20—800° С.
чение 3—5 ч при 850° С, борид палладия Pd5B2 требует более длительной выдержки (60 ч при 900° С).
Физико-химические свойства. Недавно проведено исследование некоторых электрофизических свойств боридов палладия [457]. Установлено, что оба борида палладия характеризуются металлическим характером проводимости (рис. 62). Удельное электросопротивление борида Pd3B 10 мком-см, борида Pd5B2 — 26 мком-см. Значения коэффициентов абсолютной термо-э.д.с. в боридах палладия с увеличением содержания бора уменьшаются (рис. 63). Отмечается [457], что значение коэффициента термо-э. д. с. Pd5B2 ( + 2,0 мкв!град) близко к коэффициенту серебра ( + 1,42 мкв!град). Микротвердость боридов палладия 480 (Pd3B) и 595 (Pd5B2) кГ1мм2. Температура плавления боридов палладия: 1110 (Pd3B) и 1200° С (Pd3B2).
Бориды палладия нерастворимы в воде [137]. В концентрированной серной кислоте бориды палладия даже при кипячении устойчивы при длительной (до 12 ч) обработке. В горячей концентрированной серной кислоте бориды палладия более устойчивы, чем чистый палладий, что в значительной степейи объясняется образованием на поверхности частиц борида защитной окисной пленки из В2О3. Это предположение находится в хорошем согласии с данными по исследованию реакционной спо
301
Собности и восстановительных свойств Порошка бора в присут-’ствии различных окислителей (647]. Борид PdgB2 более устойчив в агрессивных средах, чем РбзВ.
В концентрированной азотной кислоте и царской водке бориды палладия растворяются, что может быть использовано для перевода в раствор компонентов этих соединений При проведении химического анализа. Разложение боридов палладия В царской водке протекает по схеме РджВу+ЗНСЦ-НЫОз-* ^ЩРбСЦ+ЪЮ + НзОзВ + ВгН/(ВгНе, В^о...) +Н2О. В органических растворителях, в частности в СНзСООН, бориды палладия' не разлагаются, незначительно растворяются в щелочах при нагревании, причем степень разложения с уменьшением концентрации растворов несколько увеличивается, что связано, по-видимому, с растворением на поверхности борида пленки из лалладада или палладита натрия.
Исследование поведения боридов палладия на воздухе показало, что они более устойчивы к окислению, чем бориды рутения и родия. Процесс окисления боридов палладия на воздухе начинается при температуре выше 900° С.
В работе [11] отмечается высокая каталитическая активность боридов палладия в реакций гидрирования.
Бориды осмия. Диаграмма состояния системы Os-—В не разработана. На основании рентгеноструктурных исследований Установлено существование трех боридных фаз осмия: OsBi,2, OsBi.e и OsB2.
Относительно структуры борида OsBi>2 мнения расходятся. Так, 'По данным 1 Кемптера и Фриза [761], OsBi,2 имееД гексагональную структуру типа А1В2, а по Данным работы [568]-—гексагональную типа WC. По аналогии с боридом RuB^i.i Правильнее считать, что у борида OsBi,2 структура гексагональная типа WC (см. выше).
OsBi>6, как и Нн2Вз, имеет структуру, сходную с W2B5 [761], d периодами, А: а=2,91, с—12,91.
Борид OsB2, изоморфный RuB2, Имеет ромбическую структуру с периодами, А: а=4,684, 6 = 4,076, с=2,872 [560, 926], кратчайшие межатомные расстояния В — Os равны 2,15 А.
Данные [761] о существовании OsB3 и OsB2 со структурой типа А1В2 весьма сомнительны и вызваны, вероятно, присутствием примесей в исходных материалах.
В бориде OsBi>2 атомы бора образуют двумерные сетки. В OsB2 наблюдается образование трехмерных каркасов из атомов бора, расстояния между которыми составляют около 1,84 А, что значительно меньше, чем в низших боридах (2,11—2,18А); это свидетельствует об увеличении жесткости кристаллической решетки у OsB2.
В работе [446] методами термического, рентгенографического и металлографического анализов исследована система Os — В. Подтверждено существование трех боридных фаз: OsBi;2, OsB16, 302
OsB2. Бориды получены реакцйбйным спеййнйем комйойенТой. На основании термического анализа установлено, что борид осмия состава OsBi,2 получается при 1400° С и выдержке 1 ч. Плавление OsBi,2 начинается при 1760° С. Образование борида OsBi.e идет через стадию образования низшего борида OsBi,3 и завершается при 1400° С после 10—15 ч выдержки. Образование диборида осмия OsB2 проходит через стадии образования двух низших боридов по схеме
OsBi >2 -► OsB! ,6 -*• OsB2.
Оптимальными условиями для получения диборида осмия при реакционном спекании компонентов в работе считают выдержку в течение 70 ч при Ц00° С;
Физико-химические свойства боридов осмия. По характеру проводимости бориды осмия близки к металлам [137J. Температурный коэффициент электросопротивления для OsB2 и OsBi>2 примерно одинаков, для OsBi.e он несколько меньше. Коэффициенты термо-э. д. с. в интервале температур от комнатной до 800° С для фаз OsB2 и OsBi,2 лежат в области положительных значений, а для OsBi)6 при 300° С наблюдается изменение знака термо-э. д. с. на отрицательный. Бориды осмия характеризуются большими значениями микротвердости: 1642 (OsBi,2), 1878 (OsBi>6) и 2899 (OsB2) кГ/ммК
В химическом отношении бориды осмия менее устойчивы, чем остальные бориды платиноидов. Они нерастворимы в концентрированных серной и соляной кислотах при комнатной температуре и незначительно разлагаются при нагревании, в концентрированной азотной кислоте бориды осмия при комнатной температуре растворяются на 8—16%, при нагревании полностью разлагаются за 30—35 мин. Бориды осмия устойчивы к действию фосфорной и уксусной кислот, но хорошо растворяются в царской водке и концентрированной азотной кислоте; Необходимо отметить, что металлический осмий в царской водке не растворяется. Эту особенность в поведении боридов осмия и осмия можно использовать для их разделения при проведении химического и фазового анализов боридов осмия.
При разложении боридов осмия в сильно окислительных реагентах (30%-ный раствор перекиси водорода) при нагревании осмий окисляется до летучей четырехокиси OSO4:
ОзхВу + НА -> OsO4 4- Н3ВО3 + ВгН/(В2Нв, В4Н10 . . .)+НаО.
На воздухе бориды осмия начинают незначительно окисляться при 500° С. С ростом содержания бора в боридах осмия их устойчивость к окислению уменьшается. При 700 и 900° С наблюдается обратная зависимость, т. е. с увеличением содержания бора в бориде устойчивость к окислению повышается. Это, по-видимому, объясняется тем, что при высоких температурах уп
303
ругость паров окисла OsCU возрастает настолько, что приводит к разрыхлению и разрушению защитной окисной пленки бора. В связи с этим устойчивость боридов осмия к окислению при нагревании па воздухе увеличивается в ряду OsBi,2-*OsBi,6 -+ —> ОэВг.
Бориды иридия. Диаграмма состояния системы 1г — В не изучена. По данным работ [13, 554, 560, 568], существуют два
Рис. 64. Температурная зависимость удельного электросопротивления р и коэффициента термо-э. д. с, а борида ИРИДИЯ IrB!,15.
борида иридия состава 1гВ1,15 и 1гВ1,зв. По данным работы [933], в системе 1г—В в области, богатой иридием, как и в системе Rh—В, имеется эвтектика с температурок плавления 1046° С.
Недавно [446, 456] исследована система 1г—В методами термического, рентгенофазового и металлографического анализов. Подтверждено существование двух боридных фаз —1гВ1,15 и 1гВ1,з5-IrB],i5 кристаллизуется в тетрагональной сингонии, структурный тип a-ThSi2, периоды решетки, А: а -= 2,810, с =10,263, с/а = 3,652 [554].
Борид IrBi,35 [560] имеет моноклинную ячейку, собственный структурный тип, периоды решетки, А: а= 10,525, £> = 2,910, с = = 6,099, 0 = 91,070°. Точных сведений о расположении атомов бора в структуре IrBj.ss нет. Предполагается, что атомы металла образуют тригональные призмы, а атомы бора изолированы друг от Друга. Расстояние В —В равно 2,06 А [561, 814]. Моно-борид иридия IrBi.is получается при реакционном спекании смеси исходных компонентов при 900° С в течение 5 ч, при температуре выше 900° С идет образование борида иридия состава 1гВ1,35.
Физические свойства боридов иридия изучены недостаточно
[137, 456]. Температурное изменение удельного электросопротивления и термо-э. д. с. борида иридия IrBijs (рис. 64) проявляют сложный ход, что характерно для полуметаллов. В боридах иридия аналогично боридам металлов триады железа, по-видимому, происходит перераспределение электронной плотности от атомов бора к атомам металла [99, 100, 686]. Это предположение согласуется с характером изменения электрических свойств и моделью строения энергетических зон, предложенных для моно
304
боридов железа, кобальта и никеля (810]. В боридах металлов триады железа металлы являются акцепторами и принимают в d-полосу один электрон от атомов бора. То же сохраняете^ и в случае IrBi,i5, о чем свидетельствуют величина и знак термо-э.д. с. борида иридия. Температура плавления 1гВ1д5 равна 1190°, микротвердость 1652 + 80 кГ]мм2 [456J.
Химические свойства борида иридия и его поведение при
Рис. 65. Диаграмма состояния системы Pt—В [1004J.
иридия в воде не растворяется, с растворами кислот слабо взаимодействует только при нагревании. После 20-часовой обработки концентрированной серной кислотой литой образец 1гВ1,15 не растворяется, порошок борида иридия в этих же условиях заметно разлагается, особенно в царской водке. Борид иридия менее устойчив по отношению к химическим реагентам, нежели металлический иридий.
При нагревании на воздухе моноборид иридия начинает заметно окисляться при температурах выше 50—700° С.
Бориды платины. Диаграмма состояния системы Pt—В построена в работе Уолда [1004] (рис. 65). По данным этой работы, в системе Pt — В существуют три борида: Pt3B, Pt2B и Pt3B2. Кристаллическая структура определена пока только для Pt3B. Структура этого борида тетрагональная с периодами, А: а— = 2,63, с = 3,83, г/а = 1,45. Борид платины состава PtBi.i, описанный Аронссоном в 1960 г. [554], в работе Уолда не подтвержден. Существование PtBi;i требует дальнейшего уточнения. Структура его, по данным [554], типа анти-NiAs с периодами, А: а— =3,358, с=4,058, с/а= 1,208. Объем элементарной ячейки
20 Зак. I30S
305
39,63А. Межатомные 'расстояния изменяются от £,93 (В—2В) до 2,81 A (Pt — 12Pt). В работе [446] подтверждено существование в системе Pt — В 'трех боридных фаз: Pt3B, Pt2B и Pt3B2. Установлено, что оптимальной температурой реакционного спекания компонентов с образованием боридов платины различных составов является температура 700—760° С. С увеличением содержания бора в бориде платины отмечается увеличение времени выдержки при данной температуре: для Pt3B —5 ч, для Pt2B —10 ч, для Pt3B2—15 ч. Аналогичное увеличение времени выдержки для образования боридов, более богатых бором, наблюдается для всех боридов платиноидов, что связано скорее всего с тем, что в начальный период реакционного спекания скорость реакции лимитируется скоростью химического взаимодействия на границе фаз, а по мере образования борида происходит перемещение реакции в диффузионную область. С увеличением слоя продуктов взаимодействия бора С металлом на границе фаз уменьшается скорость диффузии бора в платиноид, что приводит к увеличению времени выдержки для получения однофазного продукта.
Физические свойства боридов платины изучены недостаточно. В работе [137] измерены величины удельного электросопротивления в термо-э. д. с. боридов платины, установлен металлический тип их проводимости.
Бориды Платины [137] при 20° С с водой и растворами кислот не взаимодействуют, при кипячении в кислотах незначительно разлагаются (6—8%) в течение 1—6 ч, что связано с пассивирующим действием продуктов реакции, образующихся на поверхности растворяемых частиц. Еще менее эффективно бориды платины взаимодействуют с серной кислотой. В работе делается предположение, что при растворении боридов платины на поверхности частиц образуется не только пленка из окиси бора, но и малорастворимые комплексные сульфаты платины, а также продукты их взаимодействия, лимитирующие процесс растворения. Фосфорная и уксусная кислоты с боридами платины не взаимодействуют. Бориды платины хорошо реагируют с царской водкой. В растворах щелочей при комнатной температуре бориды платины не разлагаются, при нагревании разлагаются незначительно, причем с ростом содержания бора в бориде скорость разложения увеличивается. При нагревании боридов платины на воздухе заметное окисление начинается при 500° С. По увеличению устойчивости к окислению на воздухе бориды платины располагаются в ряд Pt3B -> Pt2B Pt3B2.
В работе [И] сообщается о возможности использования боридов платины в качестве катализатора в реакции гидрирования. В табл. 91 приведены кристаллохимические характеристики и некоторые свойства боридов металлов платиновой группы.
306
Глава Vi
СОЕДИНЕНИЯ БОРА С ЭЛЕМЕНТАМИ НЕЧЕТНЫХ ПОДГРУПП
СОЕДИНЕНИЯ БОРА С АЛЮМИНИЕМ
Бориды алюминия. Диаграмма состояния системы А1 — В до сих пор окончательно не разработана. Исследованию фазовых равновесий посвящены работы [676, 849, 715, 728], но наиболее полный вариант диаграммы, представленный В. Т. Се-ребрянским и др?(474], как показано в работе [292], на ряде участков противоречит правилу фаз. Эллиот [527], проанализировав литературные данные, предложил диаграмму, показанную на рис. 66.
В системе А1 —В описаны следующие соединения: А1В2) А1В4, AIBio, А1В12.[ Кроме того, предполагалось существование А1В13 [721]. А1В2 имеет гексагональную структуру [733]. Кристаллы диборида построены таким образом, что атомы алюминия образуют простую гексагональную решетку. Атомы бора образуют сетки, аналогичные сеткам атомов углерода в графите и располагающиеся между двумя перпендикулярными оси с плоскостями атомов алюминия так, что атомы алюминия находятся в центре шестигранных призм, составленных из атомов бора. Напротив, атомы бора размещены в центре трехгранных призм из атомов алюминия. Периоды элементарной ячейки имеют следующие значения, А: а — 3,009±0,001, с = 3,262± ±0,001 [662]. В элементарной ячейке одна формульная единица.
Кристаллическая структура А1Вю ромбическая, периоды, А: а = 8,881, b = 9,100, с = 5,690, ’формульных единиц 5,2 [776].
Описаны несколько модификаций А1В ]2: «алмазоподобный бор» (р-А1В12), две разновидности «графитоподобного бора» и у-А1В12. Подробно все эти модификации рассмотрены в работе [289]. Р-А1В12 имеет ромбическую решетку с периодами, А: а = 12,34, 6 = 12,631, с= 10,161, формульных единиц 15,8 [777]. Одна из разновидностей «графитоподобного бора» оказалась идентичной ромбоэдрическому бору, другая (обозначена как а-А1В[2) имеет тетрагональную решетку с периодами, А: а = = 10,161, с= 14,283, формульных единиц 14,4 [776]. Элементарная ячейка у-А1В]2 ромбическая с периодами, А: а= 16,56, 6 = 17,53, с = 10,16, формульных единиц 29 [779].
Данные Лиля и Еничека [802] о распаде А1В2 при комнатной температуре с образованием А1В4 и алюминия не подтвер
20* 307
дились ни в одной из работ. Необходимо отметить, что йз рассмотренных фаз бесспорно установлены только А1В2> а- и у-А1В12. Относительно соединений А1В10 и р-А1В13 данные про
тиворечивы.
Маткович и др. (689, 824] считают, что фаза, определяемая как А1Вю, образуется только в присутствии углерода и описы-
Рис. 66. Диаграмма состояния системы
Al-т-В (527].
вается формулой С4А1В24-Такой же вывод сделан в работе [285], где бор-алюминиевые композиции были приготовлены как синтезом из элементов при различных температурах, так и алюминотермическим восстановлением борного ангидрида. Фаза с рентгенограммой AlBio получена только при введении углерода и соответствовала составу C4AIB24. Вилл [1019J, изучавший структуры
C4AIB24 и А1Вю, пришел к заключению о существовании обеих фаз.
Хампе [722] и Бильтц [584] показали, что «алмазоподобный бор» (P-AIB12) представляет фазу системы алюминий — углерод — бор C2AI3B48 [722] или C2AI3B44 [584]. Нарай-Сабо [987], который обнаружил в соединении всего 0,7% С, выразил его формулой А1В12. К тому же выводу пришли и другие исследователи [474, 776]. Формулу Бильтца Нарай-Сабо интерпретирует
как результат сращивания последовательных слоев А1В12 и В4С. Однако такая трактовка неправомерна, поскольку на рентгенограммах «алмазоподобного бора» не были обнаружены линии карбида бора [824, 826].
В недавних исследованиях Матковича и др. [824, 826] с достаточным основанием утверждается, что р-А1В12 на самом деле является тройным соединением С2АГ3В48. Им не удалось синтезировать р-А1В12 только из алюминия и бора. В присутствии же углерода этот борид всегда образовывался легко и содержал около 3% С.
308
Эти выводы были подтверждены в работе [285]. Сплавы получались различными методами: алюминотермическим восстановлением борсодержащих минералов, спеканием и сплавлением аморфного бора с алюминием в печах с молибденовым, вольфрамовым и графитовым нагревателями, плавкой во взвешенном состоянии. Во всех экспериментах кристаллы с рентгенограммой р-А1В12 возникали только при введении сажи. Они представляли коричневые, иногда прозрачные янтарного цвета иглы. Фаза содержала (масс. %): 12,05 А1:, 84,08 В, 3,5 С, что близко к формуле C2AI3B48. В этом соединении было обнаружено переменное количество углерода. При использовании аморфного бора, который не содержал углерода, р-А1В]2-рент-генограмма ни разу получена не была.
Таким образом, в большинстве работ сделан вывод о том, что рассматриваемое соединение тройное и образуется в присутствии углерода. Следует также подчеркнуть, что в исследованиях, где фаза трактуется как бинарная [474, 776], эксперименты были осуществлены либо в присутствии углерода, либо анализ на его содержание не проводился. Л. К. Ла-миховым и др. [177] показано, что при замене углерода кремнием также образуется тройное соединение S1AI3B48 с рентгенограммой р-бора.
Из изложенного следует, что фазовые равновесия в системе требуют дополнительных исследований. В частности, необходимо проведение работ по синтезу соединений из чистых алюминия и бора различных модификаций, а также по выяснению роли элементов, вводимых в качестве добавок. Необходимость дополнительных исследований 'подчеркивается еще и тем, что на предложенной диаграмме не нашли отражения полиморфизм бора и надежно установленная фаза у-А1В]2. Данные о температурных областях существования А1В,о неоднозначны: от плавления при 2000—2100 [776], 2423° С [684] до ограниченного перитектическими превращениями интервала [660—1850° С [474].
Методы получения. Разработаны различные методы получения боридов алюминия. Борид А1В2 может быть выделен растворением алюминиевой основы'бедных бором (менее 1%) сплавов, полученных синтезом из элементов (или алюминия и А1В|2) при 1450°С [733, 289]. При большем содержании бора в продуктах борида наряду с А1В2 появляются кристаллы борида А1В|2. Удобный метод получения А1В2, заключающийся в прокаливании стехиометрической смеси компонентов в течение 12—15 ч при 800°С, предложен Фелтеном [662]. В. Т. Сереб-рянский и В. А. Эпельбаум [475] подтвердили его данные относительно наиболее выгодных условий образования А1В2: при 800° С штабик соответствующего состава дает однофазный продукт. Из образцов, спеченных при 800° С и содержащих избыток алюминия, при растворении алюминиевой основы А1В2
309
выделяется в виде «бронзовых» правильных гексагональных пластинок.
Монокристаллы А1В2 получены в работе [961]. Синтезом из элементов при закалке с соответствующих температур были получены фазы А1Вю, а-и fl-A!Bi2 .[474].
Для получения додекаборида алюминия Наиболее эффективны методы, Основанные на проведении, алюминотермических реакций восстановления борсодержащего сырья (В2О3, борные минералы, KBF4).
Различный варианты Этого процесса, обобщенные в работах [24, 286, 289, 892], в дальнейшем были оптимизированы [266, 279, 290, 291, 332, 531, 592]. В частности при алюминотермическом восстановлении борного ангидрида рассмотрены процессы как с предварительным подогревом шихтовых материалов [287—289], так и без него [944], При использовании шихты состава 40 г В2О3, 40,5 г CaSO4, 74—78 2 Al и температуре предварительного подогрева 540—580°С извлечение бора составило более 70%. Для получения кристаллов A1B42 алюминиевая основа слитка растворялась в соляной кислоте. Использование вместо CaSO4 сернокислого алюминия или Са$О4+А12(5О4)з способствует более полному протеканию процесса восстановления. Результаты опытов по получению А1В!2 из борных минералов [293, 944] приведены в табл. 92.
Содержание борида в слитке составляет в среднем около 30%, в то время как при восстановлении борного ангидрида — около 50%. Максимальное извлечение бора из минералов равно 45%.
Следует отметить, .что избыток восстановителя (15—20% стехиометрического) приводит к появлению в продукте второй фазы—А1В2. Однако относительное содержание ее невелико.
Таблица 92
Составы шихт и результаты опытов по получению AlBu из борных минералов
Минерал Состав шихты, г Технологическое извлечение бора, %
минерал CaSO, A13(SO(), А1
Иниоит 25 зб 32,6 46,1
25 40 — 34,9 44,3
Колеманит 25 30 32,6 40,5
25 40 34,9 33,6
Улексит f 25 50 45,6 46,2
25 50 —— 40,5 39,6
Гидроборацит 25 — 50 46,0 42,1
25 50 40,9 32,8
Ашарит 25 40 37,8 44,4
25 50 — 39,2 34,6
ЗЮ
Бориды алюминия были получены также при взаимодействии газообразных соединений бора (ВС1з, BF3) с алюминием [289]. Наряду со сложностью этот метод малопроизводителен. При электролизе расплавленных бинарных систем А12Оз—1 с добавкой фтористых солей не удалось получить на катоде ни одного из боридов алюминия [24].
Физико-химические свойства боридов алюминия до настоящего времени мало изучены (табл. 93). Некоторые свойства (X-AIB12 приведены в работах [14—16, 819]. Показано, что предел прочности на сжатие зерен додекаборида размером 160—200 мкм составляет 268 кИмм2, на растяжение — 33,5 кГ/мм2. По отношению к электрокорунду микротвердость составляет 1,62 кГ/мм2, абразивная способность 1,74, разрушающая нагрузка 1,3 Г.
Таким образом, свойства А1В12 довольно близки к свойствам элементарного бора. Однако удельное электрическое сопротивление А1В12 на несколько порядков меньше, чем у бора, что связано [24] с декомпенсацией ковалентных связей между атомами бора из-за наличия атомов алюминия и появления дополнительных зон проводимости.
В токе хлора диборид алюминия сгорает до А1С1з и ВС1з, в -графитовой трубке уже при не очень высоких температурах он чернеет. О поведении этого соединения в кислых и щелочных средах данные весьма различны. Одни исследователи отмечают умеренную стойкость фазы, другие, наоборот, подчеркивают, что А1В2 легко растворяется в НС1.
При нагревании на воздухе А1Вю сохраняется примерно до 700° С, выше —окисляется [289]. А1В]2 характеризуется высокой химической стойкостью в кислотах и щелочах. С азотом и углеродом бориды алюминия взаимодействуют, образуя сложные соединения.
В связи с малым удельным весом, высокими температурами плавления, химической стойкостью, большим поперечным сечением захвата тепловых нейтронов, соединения системы А1—В являются перспективными материалами в ядерной технике [476]. Додекаборид A1Bi2 в Смеси с SiBs перспективен также при изготовлении абразивных кругов. Эти материалы выгодно отличаются от многих других меньшим удельным весом, что более безопасно в работе при больших скоростях. Круги, изготовленные из А1В12 и SiB6, имеют хорошее сопротивление скалыванию,
СОЕДИНЕНИЯ БОРА С УГЛЕРОДОМ
Хотя соединение бора с углеродом (~В6С) было получено еще Муассаном [847], пробная диаграмма системы В—С построена только в 1934 г. [918], а интенсивные исследования фа-
зи
co (О
Свойство А1В2
Содержание бора, масс. % 44,49
Структура Гексагональная
О Периоды решетки, А: а 3,009
ь 1—
с 3,262[662]
Плотность, г 1см3'.
рентгеновская 3,18[245]
пикнометрическая 2,84 [733]
Температура плавления, °C 980 [574] (разлагается)
Твердость по Кнупу для различных плоскостей, кГ)мм2 [684] 960[001]
* Полисинтетическое двойникование.
Таблица 93
Свойства боридов алюминия
А1В10 А1В12
а 3 V
80,03 82,78 82,78 82,78
Ромбическая Тетрагональная Ромбическая Ромбическая
8,881 10,161 12,34 16,56
9,100 —. 12,631 17,53
5,690[776] 14,283[777] 10,161[777] 10,16 [778]
— — - —
2,537[776] 2,557—2,660 [289] 2,600[777] 2,56(778]
2000—2100 [776] 2423[684] Существует в области 1660—1850 [474] 2163[684] 2070 [474] (разлаг.) 2214 [684] —
2610 [010] 2445 [110] 2450 [100]—[010]* 2 355(100]
2785 [101] 2380 [101] 2525 [101]—[ОН]*
2550[111] 2210 [221] 2870 [201]—[021]*
зовых равновесий начались примерно с 1950 г. [88, 165, 253, 310, 399, 700]. Критические обзоры этой системы приведены в работах [24, 116, 143, 527].
Диаграмма состояния В — С на рис. 67 является обобщением многочисленных данных. Она подтверждает наличие трех карбидов: В12Сз(В4С), образующегося по перитектической реакции, конгруэнтно плавящегося В13С2, фазы предположительного состава ВС2 и двух эвтектик: В4С +богатоуглеродистый карбид,
Рис. 67. Диаграмма состояния системы В—С:
а — на основании обобщения многочисленных данных; б — по данным работы [527].
В^Сг+твердый раствор углерода в боре. В работе [95] установлено существование карбида с предполагаемым составом В12С.
К 1960—1961 гг. относятся сообщения Доллофа и Эллиота [527] по исследованию системы В—С методами дифференциально-термического, рентгеновского и микроскопического анализов. Диаграммы, построенные ими, хорошо согласуются (см. рис. 67). Основное различие между работами заключается в ширине области твердых растворов на основе В4С. Богатой углеродом фазы не обнаружено. Предложенные Доллофом и Эллиотом фазовые равновесия можно отнести к другой группе представлений, согласно которым со стороны бора имеется только один, плавящийся конгруэнтно, борид В4С с широкой областью гомогенности. Однако на этих диаграммах игнорируется экспериментально установленный и многократно подтвержденный перитектический распад В4С при плавлении. Кроме того, вызывает сомнение непрерывность перехода от фазы В1зС2 к фазе В12Сз, так как физические процессы при образовании этих двух фаз неодинаковы: фаза В13С2 образуется замещением вакантных мест (дырок) атомами углерода, а фаза В]2Сз — замещением атомов бора атомами углерода [24, 86, 87, 536].
313
В4С кристаллизуется в ромбоэдрической решетке: а=5,19А; а = 66°18' [825] (или агеко=5,598А, с=12,12А [88]). На элементарную ячейку приходятся три формульные единицы. В13С2 также обладает ромбоэдрической структурой с периодами, А: а = 5,630, £-= 12,19 [88].
Карбид бора может быть получен следующими основными методами [24, 143, 265, 842]:
1) синтезом из элементов 4В + С = В4С;
2) углеродным восстановлением борного ангидрида, которое может быть выражено схематическим уравнением
2ВаО8 + 7С = В4С + 6СО;
3) восстановлением В2О3 магнием в присутствии углерода: 2B2Os + 6Mg + С = В4С 4- 6MgO;
4) восстановлением хлорида бора водородом в присутствии углерода:
4ВС13 + 6Н2 + С = В4С + 12НС1;
5) осаждением из газовой фазы:
4ВС13 + СС14 + 8Н2 = В4С 4- 16НС1.
Получение карбида из элементов не имеет практического значения вследствие экономической нерентабельности, однако часто используется в исследовательских целях.
Восстановление В20з избытком угля, по данным работы [24], складывается из двух последовательных процессов: восстановления борного ангидрида окисью углерода до бора В2Оз+ЗСО = 2В+ЗСО2 и последующей реакции 4В + С = В4С. Температура начала восстановления В2О3 окисью углерода составляет около 1400° С. Для увеличения скорости процесса температуру восстановления повышают — иногда до 2300—2500° С. Однако при высоких температурах (выше 2200—-2250° С) В4С разлагается с улетучиванием бора и обогащением продукта углеродом, а также активируются побочные процессы (улетучивание борного ангидрида,, восстановление Компонентов футеровки печи). Все это ухудшает качество получаемого продукта: снижается абразивная способность карбида, ухудшается спекае-мость при изготовлении из него изделий.
В качестве исходных материалов предложено [2] использовать борную кислоту и сажу, которые предварительно брикетируются и выдерживаются при 800° С. В результате образуется так называемая губка, состоящая из пористого борного ангидрида, перемешанного с сажей. Большая реакционная способность сажи позволяет проводить процесс при относительно низких температурах (1900—2000° С) и достаточно высокой скорости.
314
Практические способы производства 'карбида углеродным восстановлением различаются в основном по типу печей, в которых осуществляется процесс [24].
Очистка ВаС от свободного графита — довольно трудоемкая операция [24, 329]. Она может быть осуществлена обработкой порошка карбида бора раствором хромового ангидрида или двухромовокислого калия в серной кислоте.
Магниетермический способ приготовления В4С [255, 408, 642, 706], осуществляемый по упомянутой выше реакции, обеспечивает получение карбида бора уже при 1000—1200° С, Продукт реакции отмывается от окиси магния соляной кислотой. Практического значения для производства этот способ пока не имеет, однако он важен для лабораторной практики получения карбида точного стехиометрического состава [24]. Другие отмеченные способы —восстановление хлорида бора водородом в присутствии углерода и осаждение из газовой фазы—г также не имеют практического значения.
Физико-химические свойства. Значительный интерес представляет зависимость термо-э, д. с. и удельного электросопротивления сплавов бора с углеродом от состава. Наиболее высокие значения термо-э. д. с. (250—300 мкв/град) соответствуют фазам В13С2 и BiC. -Этим карбидам и соединению В13С (В12С) отвечают максимальные значения сопротивления. В!3С име'ет p-тип проводимости и относительно высокую термо-э. д. с. Фаза В13С2, структура которой характеризуется линейной цепочкой С —В — С, обнаруживает электронную проводимость, а фаза В4С с цепочкой С — С — С является дырочным полупроводником [24].
Электрические свойства B4G изучены во многих работах [24, 298, 414, 420, 772, 789]. Электросопротивление технического карбида бора почти на порядок ниже сопротивления чистого карбида. При повышении температуры до 500° С удельное электросопротивление технического карбида снижается вследствие возбуждения электронов примесей линейно до 0,04 ом-см, при 1000°С составляет около 0,03 ом-см, после чего несколько повышается из-за рассеяния на тепловых колебаниях решетки и снова снижается при переходе к собственной проводимости карбида [420]. Ширина запрещенной зоны В4С в области собственной проводимости (выше 1600° С) около 1,64 эв,
В работах [298, 497] при исследовании электрофизических свойств карбида В4С, полученного методом химического газофазного осаждения (плотность теоретическая, структура компактная слоисто-столбчатая), показано, что в исследованном интервале температур (20—1000° С) соединение 78,5 ат. % В и 21,3 ат. % С представляет примесный полупроводник p-типа с концентрацией носителей 3,4 - 1020 см~3 и подвижностью 0,13 см2/(в-сек). Энергия активации примесных носителей тока составляет 0,22 эв. Теплопроводность образцов после двухчасо
315
вого отжига при 1000°С составила около 18 вт](м• град), абсолютная дифференциальная термо-э. д. с. 216 мкв!град.
Основные свойства карбидов бора сведены в табл. 94. В4С — относительно химически устойчивое соединение, что объясняется сильными ковалентными связями между атомами углерода и бора и низкой концентрацией делокализованных электронов [24, 143, 435]. Этот карбид практически не разлагается минеральными кислотами и их смесями, включая смесь азотной и фтористрводородной кислот. Однако при обработке кипящими растворами щелочей ЕкС легко разлагается. Окисление карбида на воздухе начинается при температуре около 500° С и становится заметным при 800—1000° С. Сера, фосфор и азот не реагируют с ним при 1200° С. Хлор взаимодействует при 1000° С, бром и иод не действуют.
Таблица 94
Свойства соединений бора с углеродом
Свойство в,С В6,5С
Содержание бора, % 78,26 85,40
Структура Ромбоэдр ическая
Периоды решетки, А [89]:
а 5,598 5,630
с 12,12 12,19
с/а 2,165 2,16
Плотность, г/см? [89] 2,52 2,44
Температура, °C:
плавления 2440 [520] 2450 [24]
разложения 2250 [24] ——
Теплота образования*, ккал]моль [49] 13,7±4,0
Теплоемкость [24], ккал] (моль-граду.
250 °C 12,5
1380 °C 30,3 - -
Коэффициент термического расширения, 10~« град~* 4,5 [527] 5,5 [24]
Удельное электросопротивление (при 20 °C), 0,90** ~12**
ом-см [24]
Термо-э. д. с., мкв]град [24] 80** ~180**
Предел прочности, кГ/мм? [8]:
при сжатии 180 ——
при поперечном изгибе 31
Микротвердость, кГ/мм? 4950 [253] 5600—5800 [88]
Коэффициент излучения (1 = 0,655 мкм)'.
1800 °C 0,91**[24]
1500 °C 0,85[443] —
* Для В4_233 ± 0,043 Скрн(.т.
Для очень чистых сплавов стехиометрического состава.
316
Некоторые свойства BiC приводятся в сообщениях [265, 563, 564, 705, 919]. В работах [24, 128, 444] изучена смачиваемость карбида многими жидкими металлами и лигатурами.
Компактные изделия из карбида бора получают обычно горячим прессованием при 2000—2100°С и давлениях 200— 350 кГ/см2 [24, 537, 818]. В патенте [344] предложен способ спекания порошков металлов и соединений, в том числе В4С, импульсным методом за счет создания электрических разрядов между частицами при одновременном сжатии порошка под давлением. Разработаны методики получения покрытий [630] и нитей из В4С [666].
Карбид бора нашел широкое применение в машиностроении как в форме порошков, так и в форме спеченных или литых деталей. Благодаря высокой абразивной способности он используется при шлифовании и полировании твердых материалов (стекол, керамики, кварца, минералов, технических камней), заточке и доводке резцовых пластин из твердых сплавов [9, 24, 442, 497, 839]. В форме спеченных изделий, сцементированных разными связками, этот материал применяется для изготовления шлифовальных и разрезных кругов, режущих элементов буровых колонок и инструментов для обработки твердых материалов, высокоомных сопротивлений, полупроводниковых термопар, наконечников мундштуков для сварки в защитных газах [24, 341, 345]. Износостойкость стальной поверхности (сталь 45), легированной карбидом бора, возрастает более чем в пять раз [115]. Карбид бора—составная часть многих наплавочных смесей, имеющих высокую стойкость против абразивного изнашивания [497, 524, 526, 700, 752].
В4С используется для изготовления пескоструйных сопл, инструментов для правки шлифовальных кругов, матриц для протяжки абразивных стержней, фильер, химической посуды [24], инденторов для измерения твердости карбидов до 2170°С [497], электродов для электролитического метода получения порошков [343]. Карбиды бора используются в качестве поглотителей нейтронов [24, 143, 635, 742, 972].
СОЕДИНЕНИЯ БОРА С КРЕМНИЕМ
Изучению взаимодействия кремния с бором посвящено большое число работ, выводы которых часто не согласуются между собой. По системе имеется несколько критических обзоров [18, 24, 176, 410, 479, 527, 742].
Предварительные варианты диаграммы [527, 421] использовались в последующих работах [176, 429] й до настоящего времени не претерпели изменений (рис. 68).
В системе описаны соединения составов Si2B (0), SiB3, SiB4, SiB6, SiBn (n= 10-?-14). Надежно установленными фазами, по данным работы [176], следует считать SiB4 и SiB6, однако
317
К. И. Портному и В. М. Ромашову [362] не удалось синтезировать SiB6.
Кристаллическая структура Silk ромбоэдрическая (оге1(С = = 6,35А, сгекс = 12,69А), пространственные группы 7?32, Л’Зт, R3m [629].
SiB6 имеет ромбическую решетку с периодами, А: о= 14,392, 6=18,267, с = 9,885, пространственные группы Рпп2, Рпппг, формульных единиц 40 [532].
Рис. 68. Диаграмма состояния системы Si—В:
а-*-По данным работы [4281; б по дап-Яым работы [527].
В работах [429, 601, 629, 821, 921] показано, что соединение, которому раньше приписывали формулу SiB3 [388, 848], в действительности является фазой Silk.
Неоднозначные данные химических анализов объясняются наличием у борида SiBi широкой области гомогенности в сторону кремния. Например, по данным работы [601], содержание кремния в различных образцах фазы SiB4 может изменяться в широких пределах — от 39,3 до 48,0 масс. % (SiB2,82-4,o)-Химический анализ соединения всегда почти точно соответствует формульному составу [532, 627, 629, 848].
Богатое бором соединение SiBn (более 95 ат. % В), полученное в работах [873—875], изоструктурно с [1-бором (а = = 11;13А, с = 23,83А) [687].
318
Сообщалось [804j & фазе йёйзвестного состава с гексагональной решеткой (тип С32, изоструктурного А1Вг) и параметрами, А: «=3,17, с=3,54. Существование этой фазы и фазы предполагаемого состава SizB (Р) весьма сомнительно. Это подтверждают данные работ |Д78, 429], в которых на участке Si — SiB4 обнаружена только одна боридная фаза. В связи с этим вариант диаграммы состояния, предложенный Эллиотом [527], который анализировал результаты исследований [480, 601, 627, 628], представляется более достоверным.
Однако фазовые равновесия, особенно со стороны бора, требуют дополнительных исследований. Данные работ [873, 874] дают основание считать, что в системе имеется богатое бором соединение SiBn. Отмечен [362] перитектический характер его плавления при температуре около 1970° С. Принимая во внимание изоструктурность этой фазы с одной из модификаций бора [687], а также факт равномерного травления сплавов с содержанием более 90 ат. % В, можно сделать заключение о существовании по крайней мере в области 0—• 5 ат. % Si твердого раствора кремния в боре.
В работе [425] установлено, что растворимость бора в кремнии составляет (ат. %): при 25°С—0,81, при 1000°-—0,92, при 1100° С —1,2, при 1200°—1,28, при 1300° С —2,88, при температуре эвтектики. (1375°С)—3,6. По данным работы [726], В интервале температур 900—1200°С область твердого раствора расширяется примерно от 0,2 до 0,85 ат. % В. Эвтектика расположена при указанной температуре в интервале 17—18 ат. % В [429].
Впервые сплавить кремний и бор и выделить фазы «SiB3» и SiB6 удалось Муассану и Штоку в 1900 г, [848]. Более полно бориды кремния начали изучаться лишь с 1955 г.,‘ когда Г. В. Самсонову и В. П. Латышевой [388] удалось синтезировать борид состава SiB3. Большинство работ посвящено синтезу из элементов [421, 429, 601, 627, 628, 631, 633, 659, 921]. При этом были рассмотрены различные технологические варианты: спекание, сплавление, горячее прессование. Оптимальные температуры синтеза SiB4 составляют 1200—1370° С, поскольку выше 1380° С происходит разложение соединения на SiBe и кремний Si [335, 601, 821]. SiB3 рентгенографически обнаруживается в продуктах реакции, полученных при выдержке 120 мин, брикетов из порошков кремния и бора при 1100° С, а при той же выдержке и 1200° С образование этой фа-зы полностью заканчивается. Практически беспористые образцы этого соединения получены горячим прессованием смесей порошков бора и кремния при температурах порядка 1600— 1800° С [24].
Для синтеза другого соединения — SiB6 — также удобен способ горячего прессования, проводимого в течение короткого времени при 2150° С и давлении около 100 кГ/мм2. В шихте
319
используется некоторый избыток бора. При этик условиях получаются образцы с остаточной пористостью около 2% [24].
Липп и Родер [804] пропусканием тока через шихту, состоящую из J>iO2, Н3ВО3 и угля, получили наряду с карбидными фазами соединение SiBg. Г. В. Самсоновым и В. М. Слепцовым [24] для получения SiBe предложен способ восстановления кремнезема бором в вакууме по реакции SiO2 + 8B = SiB6 + 2BO при 1300—1400° С. Однако это соединение образуется далеко не всегда [429]. Как правило, в результате процесса возникает фаза SiB4. Аналогичная картина наблюдается при магниетермическом восстановлении смесей борного ангидрида и кварцевого песка [24, 388]. Даже при шихтовке на SiB6 получалось соединение, отвечающее формуле SiB3. По-видПмому, в ходе процесса происходит «расшихтовка» на состав SiB3, который, охлаждаясь, попадает в температурную область, благоприятную для формирования структуры SiB4. При силикотермическом восстановлении борного ангидрида Риззо и Бидвел [921] также получили фазу SiB4.
В работе [178] изучен процесс внепечного силикотермичес-кого восстановления В2О3 с использованием подогревающей добавки 6Si+Al2(SO4)3.
Поскольку термичность реакции 6Si + A12(SO4)3->Al2S3+ + 6SiO2 невелика,, шихтовые материалы [10 г В2О3, 41,6 г Si, 68,4 г A12(SO4)3] предварительно нагревались до 600° С, после чего смесь инициировалась электрической дугой. Реакция проходит и без предварительного подогрева, но в этом случае образуется много мелких корольков сплава, которые практически невозможно отделить от шлака.
Кремниевая основа сплава растворялась в смеси кислот HF + HNO3. Нерастворимый остаток представлял фазу SiB2;87-3,1 ь Коларовым [129] разработан метод получения боридов кремния восстановлением смеси газообразных SiCl4 и ВС13 водородом, а в работе [534] сплавы Si—В получали при электролизе расплава смесей солей KBF4, ^SiBe и KF.
Характерной особенностью методов, основанных на восстановлении бора и кремния из различных соединений, является то, что почти все они обеспечивают получение богатого кремнием борида SiB4.
Свойства боридов кремния изучены мало (табл. 95). Одним из наиболее ценных в практическом отошении свойств сплавов системы Si — В является их высокая окалиностойкость, сочетающаяся с высоким сопротивлением тепловому удару [176]. Так, при выдержке образцов SiB4 и SiB6 на воздухе в течение 60 ч при 1375° С привес составил для SiB4 около 62 мГ)см2, для SiBe — примерно 55 мГ/см2 [633].
Сплавы Si — В имеют высокую прочность как при комнатной, так и при повышенных температурах. SiBs обладает при-320
Таблица 95
Свойства боридов кремния
Свойство Si в. SIB«
Содержание бора, масс. % 60,62 69,78
Кристаллическая решетка Ромбоэдрическая Ромбическая
Периоды решетки, А: 6,35 14,392
а
ь 18,267
с 12,69(629] 9,885 [629]
Температура плавления, °C 1269(527] 1864 [527]
(разлагается) 1900(421] (разлагается) -2000(421]
Плотность, г/см3; (разлагается) (разлагается)
рентгеновская 2,41 [362] 2,39(532]
пикнометрическая 2,41—2,49 (24] . 2,43
Микротвердость, кГ[мм* 3200 [129] 2520—2870 [921]
1870—2290 [921]
мерно такими же абразивными свойствами, как карбид кремния [176].
Термо-э. Д. с. сплавов кремния с бором имеет сложную зависимость от состава. При добавке небольших количеств бора она резко падает. Так, при 0,5 ат. °/о В термо-э. д. с. снижается с +182 до +106 мкв!град и имеет минимум при содержании 15—25 ат. % В [429]. Сплав кремния с 5 ат. % В характеризуется следующими значениями электросопротивления при различных температурах (мком-см): 6,653 (1100°С), 6,663 (1200°С), 4,76 (1300°С). По мере увеличения содержания бора в кремнии от 0,1 до 10 ат. % электросопротивление при 1300° С уменьшается с 22,9 до 4,8 мком • см [429].
Химически бориды кремния весьма устойчивы [848]. Окисление кислородом воздуха, как отмечено выше, происходит с трудом. При нагревании бориды кремния взаимодействуют с фтором. Хлор реагирует с ними только при температуре красного каления (около 700°С). Бром не взаимодействует с этими соединениями. Азот не реагирует с ними до 1000° С. С концентрированной серной кислотой бориды кремния взаимодействуют только при кипячении. Кипящая HNO3 воздействует преимущественно на SiBe и в меньшей степени на SiB4. Расплавы щелочных карбонатов или их смеси с нитратами при температурах красного каления быстро разлагают оба соединения.
Разработан устойчивый на воздухе и хорошо сопротивляющийся тепловому удару (до 1550° С) огнеупорный материал на боросиликатной основе с включениями кремния и SiB4 [865, 920]. Изделия из SiB4 и SiB6, приготовленные обычными методами порошковой металлургии, хорошо служат в окислитель-
21 Зак. 1305 321
ной среде при высоких температурах [176]. Нагревательные стержни, в состав которых наряду с другими соединениями входит SiB4, стойки в окислительной среде при 1600°С [340].
Полупроводниковые свойства твердого раствора бора в кремнии нашли применение при создании солнечных батарей, фотоэлементов, Служащих для преобразования солнечной энергии в электрическую [24].
Бориды кремния могут использоваться для изготовления регулирующих стержней и защитных устройств ядерных реакторов [176].
ДРУГИЕ СОЕДИНЕНИЯ БОРА
Взаимодействие бора с элементами подгруппы алюминия —• галлием, индием и таллием — изучалось в работах [244,413,478, 955]. При этом использовались различные методы; синтез из элементов, углеродное восстановление смесей металла и бора, карбидоборное восстановление окислов металлов, боротермический метод, восстановление водородом смеси, состоящей из окисла металла и бора. В упомянутых работах не обнаружены борцды Галлия, индия и таллия.
! Было сообщение [622, 1003] о существовании борида GaBi2. Позже [928] показано, что GaBis представляет смесь галлия с кремнием и субокисью бора, образовавшуюся в результате проведения синтеза в кварцевых ампулах.
t Бинарных соединений в системах Ga — В,.In-—В, Т1 — В нет; обнаруженное в работах [244, 413] активное восстановление окисла галлия бором с возгонкой металлического галлия в вакууме может быть использовано для получения чистого галлия1 из его окисла.
Элементы подгруппы углерода — германий, олово, свинец — с бором не взаимодействуют [24, 145, 413, 965, 1003], В работе [583] предложена схематическая диаграмма состояния системы Ge—-В. Отмечается незначительная растворимость германия в твердом боре и бора в жидком германии. Решетка германия при растворении в нем бора изменяется .на 0,01—0,02 об. %.
Соединения бора с элементами подгруппы азота. Соединения бора с азотом. В системе В—N обнаружено одно соединение—нитрид бора, существующий в Трех модификациях: а, р и у. Кристаллическая структура, ее особенности, способы приготовления различных форм нитрида бора, их физико-химические свойства, формирование изделий из нитрида бора, использование нитрида бора в различных областях техники и в промышленности подробно описаны и обсуждены в монографиях [24, 462а, 4626] и работах [349, 350, 366].
Наиболее полно изучены свойства графитоподобного гексагонального нитрида бора a-BN. a-Нитрид бора обладает высокими электроизоляционными свойствами, устойчивостью по отношению к тепловым ударам, прочностью при высоких темпе-322
рйтурйх, хорошей теплопроводностый, высокими огнеупорными свойствами, устойчивостью в вакууме, большим сечением захвата нейтронов. Важное свойство нитрида бора — способность к люминесценции.
Кубический fJ-BN обладает высокой твердостью, близкой к алмазу, и некоторой пластичностью, что позволяет использовать его для обработки многих материалов; еще более пластичен при относительно высокой твердости y-BN, который успешно
Таблица 96
Основные свойства модификаций нитрида бора BN
Свойство 05 V
Содержание бора, масс. % 43,6 43,6 43,6
Кристаллическая структура Гексагональная, Кубическая, Гексагональная,
О Периоды решетки, А: тип графита тип алмаза > тип вюрцита
а 2,504 3,615 2,504
с 6,661 10,01
с/а Плотность, г/см2-. 2,662 4,0
рентгеновская 2,29±0,3 3,45 1,80
пикнометрическая 2,20—2,355 —
насыпная 0,1—0,7 —
Удельная поверхность, см1/г 20 000—40000 —
Теплота образования, ккал/моль 60,7 'i— F ।
Теплота сгорания, ккал/моль 90,2 —
Температура плавления, °C (под давлением азота) 3000 — Р~*•
Энтропия, кал/(моль-град) 20,77 ь— —
Удельная теплоемкость, кал/(моль-град) 4,65 — -и
Теплопроводность, кал/(см-секХ X град) 0,036—0,069 |»| —
Удельное электросопротивление, ОМ'СМ 1Q13 103—104 —
Ширина запрещенной зоны, эв 3,6—3,8 — —fe'
Твердость по Моосу 1-2 10 —t-
Предел упругости при сжатии, кГ/мм? 24—32 —
Предел упругости при растяжении, кГ/мм? 5,11—11,12 —
Модуль упругости, кГ/мм1 3440—8650 — —
Коэффициент термического расширения, 10—в град-1 0,5—1,7 — —Л
Показатель преломления 1,74 2,22 ——
Двойное лучепреломление 0,3 — —
Коэффициент излучения при 0,64—0,62 —-с ——
800—1700° (А = 0,665 мкм) Характеристическая температура, °К 598
21*
323
используется для обработки углеродистых и легированных сталей. В табл. 96 приведены некоторые свойства модификаций нитрида бора.
Соединения бора с фосфором. Первые исследования системы В—Р относятся к попытке получить монофосфид бора [844, 894, 904, 934, 1002]. В последующих работах, посвященных изучению вопроса взаимодействия бора с фосфором, подробно описаны и обсуждены методы приготовления фосфидов, их структуры, свойства, различные области их использования. Среди способов получения фосфидов бора можно отметить следующие: синтез Из элементов [66, 893, 904, 934], кристаллизацию из расплавов металлов, насыщенных бором и фосфором [29, 331, 333, 334, 338, 605, 973, 975, 1022], кристаллизацию из расплавов состава ВР — СизР [59], Ni — Р—В [745], взаимодействие бора с фосфином [426], разложение галоидных соединений [1002], взаимодействие хлоридов или бромидов с парами фосфора в токе водорода [328, 638, 1020].
В последние годы для выращивания монокристаллов широко используются химические транспортные реакции [63—65, 67, 68, 70, 72, 73, 521, 837], а также осаждение фосфида ВР из газовой фазы [624].
В работе [324] описан метод получения монокристаллических эпитаксиальных пленок из ВР на подложке из SiC. При легировании таких пленок определенными элементами можно создать слои р- и п-типа.
Реакции получения низшего фосфида В1зР2(В6Р) детально обсуждены в работах [550, 650, 856, 893, 968, 1020]. Различные варианты описанных методов получения фосфидов использовались многими исследователями [30, 323, 330, 339, 376, 774, 872, 885, 992]. Работ, в которых исследовалась кристаллическая структура фосфидов бора, сравнительно мало [419, 823, 904, 968, 1007].
Физико-химические, каталитические и некоторые другие свойства соединений бора с фосфором изучаются довольно широко [47, 108, 155, 419, 672, 710, 711, 844, 868, 942, 1002, 1018].
Монокристаллические эпитаксиальные пленки ВР, полученные на подложках из SiC [324], могут использоваться в производстве электронных приборов. Выпрямители на основе ВР устойчиво работают в окислительной среде до 1000°С [726]. Отмечается возможность применения монофосфида бора в преобразователях тепловой энергии в электрическую [30], в качестве электролюминесцентного устройства, основанного на полупроводниковом переходе типа р— п [682], для футеровки сопел реактивных двигателей [328], в качестве абразивного материала для обработки кварца, агата и сапфира [328, 904, 1020]. Фосфид бора перспективен как материал для квантовых
324
генераторов [66]. Кроме того, ВР оказывает модифицирующее и легирующее действие на силумины [58]. В табл. 97 приведены некоторые свойства фосфидов бора.
Соединения бора с мышьяком. Детальное рентгенографическое исследование системы В—As проведено в работах [84, 252, 790, 822], предложена диаграмма состояния этой системы,
подтвердившая существование двух химических соединений — BAs и BgAs (рис. 69).
Для получения арсенидов бора применялись: синтез из элементов [247, 248, 886, 894, 1020], осаждение из газовой фазы [146, 325, 639]. Гройсон [707]
и др. [313, 887] осуществляли синтез из элементов при 800 и 1200° С и давлениях до 33 кбар. В ряде работ проведено обсуждение различных методов получения соединений бора с мышьяком [549, 650, 783].
Физико-химические свойства арсенидов бора изучены слабо (табл. 98). В работе [371] проведено тщательное исследование термической устойчивости моноарсенида бора гравиметрическим методом. Показано, что разложение BAs в вакууме около Ю-5 мм
Рис. 69. Диаграмма состояния системы В—As [84].
рт. ст. начинается с 580° С и сопровождается выделением мышьяка с образованием субарсенида бора. Оценена энергия активации этого процесса в интервале 800—1000°С (22,9 ккал/моль).
В работах [42, 155, 519, 550, 625, 975, 986, 1007, 1013] ис-
следованы удельное электросопротивление, температурная за-
висимость сопротивления, рассчитаны концентрации носителей и ширина запрещенной зоны, изучены спектры отражения в области 1—6 эв в спектры пропускания в области 0,8—2 эв кристаллов BAs. Эти исследования показали, что арсениды бора являются перспективными полупроводниками, нашедшими применение в различных областях техники [38, 325, 522, 783, 913]. В частности, B6As благодаря высокой светопропускающей способности, повышенной термической и эрозионной устойчивости может быть использован для изготовления смотровых окошек на искусственных спутниках и в ядерных реакторах [325].
Соединения бора с сурьмой и висмутом. Попытки синтезировать BSb при 800—2400° С и давлении 75—100 атм привели к отрицательным результатам [707]. Предполагается [974],
325
Таблица 97
Свойства фосфидов бора
Свойство ВР В„Р, (В0Р)
Содержание бора, масс. % Структура Периоды решетки, А: а •е Плотность, а/сл3: рентгеновская пикнометрическая Температура плавления, °C Теплота образования, ккал)моль Ширина запрещенной зоны, эв Твердость по Моосу Микротвердость, кГ[мм? Показатель преломления Термо-э. д. с. (20—150°C), мкв/град 25,87 Кубическая 4,538 [331] 2,97 [47] 2,98—3,01 (638] 2,91 [47] >3000 [745] 22,27 [50] 2,1 [974] 2,4 [477] 4,5 [311] 5,9 [1020] 8,9[328, 638] 3400—3600(63]; 4000 [65] 3,0—3,5 [985] 150 [63], 260 (легированный) [65] 69,41(67,68) Ромбоэдрическая 5,984 [823] 11,850 2,76(968, 893] 2,72[968] >2000 [893] 118 [494]
Свойства арсенидов бора Таблица 98
Свойство BAs BltAs2 (B„As)
Содержание бора, масс. % Структура Периоды решетки. А: а с Плотность, г]см?‘. • рентгеновская пикнометрическая Ширина запрещенной зоны, эв 12,61 Кубическая 4,777 [894] 5,223 [246] 4,0—5,0(325] 2,1 [974] 48,40(46,40] Ромбоэдрическая 6,1390(84] 11,8921 [84] 3,58(3,73) [84] 3,53
что ширина запрещенной зоны BSb не должна превышать 2,1 эв. При создании различных структур’ в полупроводниковых материалах предлагается использование присадок В —Р, В — As, В —Sb [336].
Соединения бора с элементами подгруппы кислорода. Соединения бора с серой. Взаимодействие бора <?, серой изучалось еще в прошлом веке многими известными химиками, работы которых обобщены в монографиях [24, 250].
326
Методами масС-спектроскопии, электронографии и спект-роскопии в ИК- и видимой Областях спектра [5, 491, 620, 652, 691, 1028] был изучен состав пара в системе В — S при высоких температурах, В этих работах установлено, что твердые продукты, содержащие бор и серу в различных отношениях, образуют в газовой фазе сульфиды BS2, B2S3 и BS, а также полимерные молекулы (BS2)m, (BS)n с различной степенью полимеризации.
Диаграмма состояния системы В—S в интервале концентраций от 65 до 100 ат, % серы построена и описана 3. С. Медведевой 1249]. Структура сульфидов бора не определена; есть данные по интенсивности отражений и межплоскостным расстояниям для B2S3, но тип кристаллической решетки и сингония не установлены [90, 716].
В работах [322, 822] определена структура B]2S. Показано, что Bi2S является структурным аналогом а-бора, кристаллизуется в ромбической сингонии с параметрами а = 5,19А, р = = 67°56'.
Существование B4S и BS окончательно не доказано [250, 943, 1028].'
Полуторный сульфид бора B2S3 получался различными методами; непосредственным соединением нагретого до красного каления аморфного бора с сероводородом или парами серы в проточной системе, при взаимодействии A12S3 с В2О3 при 1200° С в токе азота, по реакции между аморфным бором и сульфидами некоторых металлов [24, 250, 458].
Дисульфид бора BS2 сначала обнаружили в газовой фазе [69, 154, 709, 966, 991], затем было показано, что BS2 существует и в твердом состоянии [71]. В этой работе проведено исследование термодинамики испарения BS2. Установлено,' что основными компонентами насыщенного пара BS2 выше 550° С являются молекулы BS2, (BS2)2 и (BS2)4.
Физико-химические свойства сульфида бора B2S3 изучены слабо. Известно, что это белое вещество, гидролизующееся на воздухе и энергично взаимодействующее с водой с выделением сероводорода, температура плавления B2S3 417° С, теплота плавления и энтропия соответственно равны 8,9 ккал!моль и 12,9 кал/(моль • град) [249, 709, 822].
На основании данных по исследованию спектров газообразного B2S3 сделано предположение, что молекула B2S3 в газовой фазе зигзагообразна [708, 709].
Соединения бора с селеном и теллуром. О селенидах бора сведений в литературе мало [26, 741, 840, 943]. Диаграмма состояния систем В — Se в интервале содержаний селена от 60 до 100 ат. % описана в работе [26]. Показано, что в этой системе существует единственное соединение B2Se3, плавящееся с открытым максимумом при 480° С.
327
B2Se3 получается при взаимодействии парообразного селена или селенистого водорода с ферробором или марганобором, при температуре красного каления одновременно образуются селениды металлов. Кроме того, ВгЗез может быть получен синтезом из элементов в запаянных кварцевых ампулах при 550— 800°С [640].
B2Se3— чрезвычайно гигроскопичное соединение, гидролизующееся на воздухе, более легкоплавкое и менее летучее, чем сульфид бора. При взаимодействии с водой выделяет селеноводород H2Se. При 550° С реагирует с кварцем, образуя В2О3 и SiSe3 [250, 640]. С теллуром бор не взаимодействует [250].
ЗАКЛЮЧЕНИЕ
Бориды представляют исключительно перспективный класс тугоплавких соединений, так как широкие возможности и многовариантность комбинирования связей Me—Me, Me—В и В—В обеспечивают многообразие боридных фаз и варьирования их физических, химических и прочностных свойств. Это существенно отличает бориды от карбидов и нитридов, где число устойчивых фаз значительно более ограничено, и хотя последние рмеют бесконечное число фаз в широких областях гомогенности, однако сохранить их в технологических композициях и строить на их основе промышленные материалы затруднительно.
Замечательным овойством многих боридных фаз является сочетание их высокой прочности, твердости с некоторой пластичностью, основанной на недостройке состояний атомор бора до «р3-гибридов. Даже многоборные бориды, имеющие ^отивы структуры элементарного бора, могут рассматриваться как фазы, пластифицированные металлами, особенно если эти металлы — акцепторы электронов.
Не менее характерным свойством боридных фаз является окисление с образованием боратов, существенно предохраняющих от дальнейшего разрушения.
Высокие акцепторные свойства бора приводят к образованию в боридных фазах весьма устойчивых состояний, трудно нарушаемых при химических и электрохимических процессах, в условиях действия воднорастворимых реагентов, расплавленных металлов, шлаковг солей. Эти возможности боридов, замеченные, например, для диборида циркония, далеко еще не использованы и не исследованы достаточно фундаментально.
Комбинированием донорно-акцепторных свойств атомов переходных металлов и бора могут быть получены как неустойчивые электронные состояния, реализуемые, например, в термоэмиссионных свойствах некоторых гексаборидов редкоземельных металлов и их сплавов с металлами, так и весьма устойчивые состояния с высокозаполненной полосой проводимости, па которых основаны высокоэффективные резистивные композиции, обладающие в широких областях температур низким и практи
329
чески постоянным термическим коэффициентом электросопротивления.
Упомянутое выше сочетание высокой твердости с пластическими свойствами, а также с высокой химической инертностью создает многообещающие перспективы использования боридных фаз в качестве материалов абразивных инструментов, обеспечивающих высокую чистоту обработки, материалов режущих инструментов типа спеченных твердых сплавов, а также высоколегированных боридами спеченных инструментальных сталей.
Ещё, по существу, только начато использование боридных фаз в составе покрытий на деталях машин и механизмов, имеющих высокую устойчивость против износа, коррозии, эрозии в условиях не только статических, но и ударных нагружений.
Не менее широкие перспективы имеют неметаллические соединения бора типа карбидов, нитридов, силицидов, фосфидов, обладающие нестандартными полупроводниковыми свойствами, экстремально низкими и экстремально высокими значениями твердости; многие из них представляют атомные и космические материалы, в том числе материалы дальних планет Солнечной системы.
Развитие методов и научных основ создания материалов с заданными свойствами в сочетании с использованием многообразия свойств боридных фаз позволит существенно расширить арсенал современного материаловедения и обеспечить разработки в различных областях современной техники.
СПИСОК ЛИТЕРАТУРЫ
1. Абрикосов Н. X., Лан Цзунь-у, Шашков Ю. М. О летучести окиси бора в гелии и водороде при наличии водяного пара. «Изв. АН СССР. Отд. техн. наук. Металлургия и топливо», 1960, № 4, С. 156—159.
2. Авт. свид. СССР № 48255, 1936; № 50966, 1937.
3. Айвазов М. И., Домашнее И. А. Электрофизические свойства диборида титана и сплавов в системе Ti—В—N.—«Изв. АН СССР, Неорганические материалы», 1971, т. 7, с. 1735.
4. Айвазов М. И. и др. Исследование магнитных свойств фаз переменного состава нитрида титана, диборида, титана и сплавов в системе Ti—В— N. — «Изв. АН СССР, Неорганические материалы», 1971, т. 7, № 7, с. 1176—1179.
5; Акинин П. А., Спиридонов В. П. Электроинографическое иследование строения молекулы сульфида бора. — «Докл. АН СССР», 1959, т. 129, № 6, с. 1317—1320.
6. Арабей Б. Г., Штром Е. Н., Ларицкий Ю. А. Особенности технологии изготовления плотных изделий и механические свойства некоторых гек-саборидов редкоземельных металлов. — «Порошковая металлургия», 1964, № 5, с. 65—70.
7, Арабей В. Г. и др. Рений и его сплавы с бором — эффективные поглотители нейтронов. — «Атомная энергия», 1970, т. 29, № 4, с. 295.
8. Артамонов А. Я., Безыкорнов А. И., Иванов А. Н. Исследование абразивной способности тугоплавких соединений. — «Порошковая металлург гия», 1966, № 9, с. 55—60.
9. Артамонов А, Я., Тутаков О. В., Дайч А. П. Исследование полирующей способности тугоплавких соединений.-т-Там же, 1967, № 2,
с. 29—35.
10. Асанова М. П., Герасимов А. Ф., Конев В. Н. Исследование реакционной диффузии в системах «металл — сложный газ». III. Система Nb—(B+N).—'«Физ. металлов и металловедение», 1960, т. 9, вып. 5, с. 689—694.
1L Баландин А. А., Полковников Б. Д., Табер А. И. О каталитических свойствах боридов металлов платиновой группы. — «Докл. АН СССР. Отд. хим. иаук», 1962, т. 145, с. 809.
12, Безрук Е. Г., Марковский Л. Я. Некоторые физические свойства боридов. — «Изв. АН СССР. Неорганические материалы», 1968, т. 4, с. 447.
13. Безыкориов А. И., Богомолов Н. И., Ковальченко М. С. Исследование геометрии и прочности зерен порошков тугоплавких соединений. — «Порошковая металлургия», 1969, № 6, с. 65—70.
14. Безыкорнов А. И. Автореф. канд. дис. Исследование режущих свойств тугоплавких соединений применительно к шлифованию титана. Киев, ИПМ АН УССР, 1971.
15. Безыкорнов А. И. и др. Исследование формы, прочности и абразивной способности зерен порошков тугоплавких соединений. — «Порошковая металлургия», 1971, № 5, с. 65—69.
16. Безыкорнов А. И., Богомолов Н. И., Ковальченко М. С. Влияние физи-
331
ко-химического взаимодействия титана на износостойкость тугоплавких соединений при прерывистом микрорезании. — В кн.: Электронное строение и физические свойства твердого тела. Ч. 2. Киев, «Наукова думка», 1972, с. 128—136.
17. Беликов А. М., Уманский Я. С. Изучение анизотропии тепловых колебаний атомов в некоторых карбидах и диборидах металлов переходных групп с гексагональной решеткой. — «Кристаллография», 1959, т. 4,с. 684.
18. Бережной А. С. Кремний и его бинарные системы. Киев, Изд-во АН УССР, 1958.
19. Бете Г. Квантовая механика. Пер. с англ. ЭД., «Мир», 1965. с. 83.
20. Блейкмор Дж. Статистика электронов в полупроводниках. Пер. с англ. М., «Мир», 1964.
21. Близнаков Г., Пешев П. Върху получаването на хексаборидите на церия, празеодима и неодима. — «Изв. на Института по обща и неорганична химия на Бълг. АН», 1965, т. 3, с. 5—13.
22. Блок Н. И. и др. О соединении NisB в сплавах никель—бор.—«Докл. АН СССР», 1951, т. 113, с. 811.
23. Болгар А. С,, Верхоглядова Т. С., Самсонов Г. В. Давление пара и скорость испарения некоторых тугоплавких соединений в вакууме при высоких температурах. — «Изв. АН СССР. Отд. техн. наук. Металлургия и топливо», 1961, № 1, с. 142—145.
24. Бор, его соединения и сплавы. Киев, Изд-во АН УССР, 1960. Авт.: Г. В. Самсонов, Л. Я. Марковский, А. Ф. Жигач, М. Г. Валяшко и др.
25. Боровинская И. П., Мержанов А. Г. Самораспространяющийся высокотемпературный синтез тугоплавких неорганических соединений. — В кн.: Металлотермические процессы в химии и металлургии. Новосибирск, «Наука», 1971, с. 58.
26. Бояркова В. А. и др. Диаграмма состояния системы B2Se3—Se. — «Изв. АН СССР. Неорганические материалы», 1969, т. 5, № 3, с. 477—480.
27. Бурыкина А. Л., Евтушок Т. М. Исследование контактного взаимодействия металлоподобных боридов с графитом при высоких температурах в вакууме.—«Порошковая металлургия», 1965, №6, с. 75—78.
28. Бурылев Б. П. Влияние разных элементов на растворимость углерода в жидком марганце и его сплавах. —« Изв. вузов. Черная металлургия», 1964, № 10, с. 5—12.
29. Валов Ю. А. Тезисы докладов на конференции по бору, его соединениям и сплавам. Киев, ИПМ АН УССР, 1962, с. 25.
30. Валов Ю. А., Лубенская Э. Ю. О фосфиде бора ВР. — В кн.: Физика. Л., 1962, с. 31—34. (Инж.-строит. ин-т).
31. Векшина Н. В., Марковский Л. Я. О некоторых химических свойствах гексаборидов щелочноземельных металлов. — «Жури, прикл. химии», 1961, т. 34, ®ып. 10, с. 2171—2173.
32. Векшина Н. В., Марковский Л. Я. Исследование реакций, протекающих при получении гексаборидов щелочноземельных металлов методом восстановления углеродом. — Там же, 1962, т. 35, вып. 1, с. 30—37.
33. Векшина Н. В., Марковский Л. Я., Пронь Г. Ф. О химизме процессов при углетермическом синтезе боридов щелочноземельных и некоторых редкоземельных металлов. — В кн.: Высокотемпературные неорганические соединения. Киев, «Наукова думка», 1965, с. 404—414.
34. Векшииа Н. В. ‘и др. О модификационных превращениях бора при растворении в нем бериллия. — «Журн. прикл. химии», 1969, № 42, с. 1229—1232.
35. Войтович Р. Ф., Пугач Э. А. Окисление тугоплавких соединений. III. Бориды металлов VI группы. — «Порошковая металлургия», 1974, № 3 (135), С. 86—92.
36. Вендрих М. С. Автореф. канд. дисс. Влияние разбора данных по теплоемкости на константу равновесия и определение теплоемкости боридов некоторых металлов. ЭД., 1958. (Моск, ин-т цвет. мет. и золота).
37. Верейкина Л. Л., Руденко В. Н., Самсонов Г. В. Методика определения
332
Прочности на сжатие образцов из’ тугоплавких соединений при высокйх температурах. — «Заводск. лаборатория», 1960, № 5, с. 17.
38. Вильямс Ф., Руэрвейн Р. Приготовление и свойства фосфида и арсенида бора. — В кн.: Новые полупроводниковые материалы. М., «Металлургия», 1964, с. 256—259.
39. Винницкий И. М. Автореф. канд. дисс. Гальваномагнитные свойства монокарбидов и диборидов переходных металлов. Киев, ИПМ АН УССР, 1972.
40. Власова М. В., Сорин Л. А., Щербина В. И. Об исследовании гексаборидов РЗМ методом ЭПР.—«Порошковая металлургия», 1967, № 1, с. 70—72.
41. Войтович Р. Ф. Тугоплавкие соединения. Термодинамические характеристики. Справочник. Киев, «Наукова думка», 1971, с. 10—20.
42. Воробьев В. Г., Медведева 3. С., Соболев В. В. Спектры отражения арсенида бора BAs. — «Изв. АН СССР. Неорганические материалы», 1967, т. 3, № 6, с. 1079.
43. Ворошилов Ю. В., Кузьма Ю. Б. Исследование тройных систем Zr— Мо—В и Zr—Та—В. — «Изв. вузов. Цветная металлургия», 1967, №4, с. 146.
44. Ворошилов Ю. В. и др. Тройные системы цирконий — хром — бор и цирконий— вольфрам — бор. — «Изв. АН СССР. Неорганические материалы», 1967, т. 3, № 9, с. 1597—1600.
45. Ворошнин Л. Г., Ляхович Л. С., Фунштейн Я. Н. Борирование порошкообразными смесями. — «Металловедение и терм, обработка металлов», 1966, № 12, с. 67—69.
46. Ворошнин Л. Г. и др. Структура сплавов системы Fe—В. — «Металловедение и терм, обработка металлов», 1970, № 9, с. 14.
47. Гальченко Г. Л. и др. Теплота реакции фосфида бора с хлором. — «Изв. АН СССР. Неорганические материалы», 1966, т. 2, № 8, с. 1410—1415.
48. Гальченко Г. Л. и др. Стандартные теплоты образования ТаВ2 и ТаС15. — «Докл. АН СССР», 1966, т. 170, с. 132.
49. Гальченко Г. Л. Автореф. докт. дис.. Теплоты образования соединений бора. М., МГУ, 1972.
50. Гальченко Г. Л., Тимофеев Б. И., Гринберг Я. X. Теплота образования монофосфида бора. — «Изв. АН СССР. Неорганические материалы», 1972, т. 8, № 4, с. 634—637.
51. Гарф Е. С., Падерно Ю. Б., Горячев Ю. М. Экспериментально-теоретические исследования электронного строения гексаборидов РЗМ и других элементов. — В кп.: Редкоземельные '.металлы и их соединения. Киев, «Наукова думка», 1970, с. 101—108.
52. Гермаидзе М. С., Гельд П. В., Летун С. М. Теплоемкость, энтальпия, энтропия и давление диссоциации додекаборида магния. — «Журн.прикл. химии», 1966, т. 39, с. 1941.
53. Глухов В. П. Боридные покрытия иа железе и сталях. Киев, «Наукова думка», 1970.
54: Гольдшмидт X. Дж. Сплавы внедрения. Вып. 1. Пер. с англ. М., «Мир», 1971, с. 364—378.
55. Горбунков Н. С. Диффузионные покрытия на железе и стали. М., Изд-во АН СССР, 1958.
56. Гордиенко С. П., Гусева Е. А., Фесенко В. В. Исследование термодинамических свойств гексаборида лантана. — «Теплофизика высоких температур», 1968, т. 6, № 5, с. 821.
57. Гордиенко С. П., Феночка Б. В., Фесенко В. В. Редкоземельные металлы и их тугоплавкие соединения. Киев, «Наукова думка», 1971, с. 121.
58. Горшков А. А. и др. Влияние фосфидов- AlnBv на структуру и некоторые свойства заэвтектических силуминов. — В кн.: Модифицирование силуминов. Киев, ИПМ АН УССР, 1970, с. 77—82.
59. Горюнова Н. А., Баранов Б. В., Прочухан В. Д. Способ выращивания монокристаллов фосфида бора. Авт. овид. СССР № 185087, 1966.
333
60. Горячев Ю. М., Ковенская Б. А., Тельников Ё. Я. Расчет энергетического спектра диборида титана. — «Жури, эксперим. и теор. химии*, 1971, т. 7, № 3, с. 387—390.
61. Горячев Ю. М., Ковенская Б. А., Арабей Б. Г. Об электронном строении тетраборидов РЗМ иттриевой группы. — «Изв. вузов. Физика», 1974, № 10, с. 157.
62. Глебов Л. О., Лавренко В. О., Кир’якова I. Е. Дослщження окалииоут-ворення в кисш та повед!нка у вакуум! деяких високотемпературиих тугоплавких борид!в.— «Доповйи АН УРСР, сер. Б», 1972, № 11, с. 1014.
63. Гринберг Я. X., Медведева 3. С., Клинкова Л. А. Получение монокристаллов фосфида бора. — «Изв, АН СССР. Неорганические материалы», 1965, т. 1, М 4, с. 478, 479.
64. Гринберг Я. X., Медведева 3. Жуков Э. Г. Исследование переноса фосфида бора ВР в процессе транспортной реакции. — «Изв. АН СССР. Неорганические материалы», 1965, т. 1, № 1, с. 88—90.
65. Гринберг Я. X. и Др. Получение монокристаллов фосфида бора ВР из газовой фазЬ1. — «Докл. АН СССР», 1965, т. 160, № 2, с. 337—338.
66. Гринберг Я. X. и др. Кинетика взаимодействия аморфного бора с фосфором.-г-«Изв. АН СССР. Неорганические материалы», 1965, т. 1, №9, с. 1484—1492.
67. Гринберг Я. X., Лужная Н. П., Медведева 3. С. Исследование равновесия в системе фосфид бора—иод,— Там же, 1966, т. 2, № 12, с. 2130—2133.
68. Гринберг Я. X. Кинетика транспортной реакции фосфида бора с иодом.—'Там же, 1967, т. 3, '№ 5, с. 797—801.
69. Гринберг Я. X., Жуков Э. Г., Коряжкин В. А. Термическая диссоциация B2S3. — «Докл, АН СССР», 1969, т. 184, № 4, с. 847—849,
70. Гринберг Я. X. и др. Гетерогенное равновесие в системе фосфид бора — сера. — «Журн. неорган. химии», 1969, т. 14, № 9, с. 2583'—2586.
71. Гринберг Я. X., Жуков Э. Г., Коряжкин В. А. Термодинамика испарения ,BS2. —«Докл. АН СССР», 1970, т. 190, № 3, с. 589—592.
72. Гринберг Я. X., Жуков Э. Г., Медведева 3. С. Термодинамика химических транспортных реакцг'й фосфида бора с серой. — В кн.: Процессы роста кристаллов и пленок полупроводников. Новосибирск, «Наука», 1970, с. 316—329.
73. Гринберг Я. X., Лужная Н. П., Медведева 3. С. Химическая транспортная реакция фосфида бора с йодом. — В кн.: Химия фосфидов |с полупроводниковыми свойствами. Новосибирск, «Наука», 1970, .с 11—15.
74. Гурни В. Н., Обухов А. П., Корсукова М. Г. Получение монокристаллов тугоплавких соединений из раствора в расплаве цинка. — «Изв. АН СССР. Неорганические материалы», 1969, т. 5, № II, с. 1995.
75. Гурии В. Н. Методы синтеза тугоплавких соединений переходных металлов и перспективы их развития. — «Успехи химии», 1972, т. 41, № 4, с. 616—647.
76. Гусева Т. М., Гольцев В. П., Ольховиков В. А. Радиационное распухание некоторых боридов переходных металлов.!—«Атомная энергия», 1972, т. 33, вып. 3, с. 747.
77. Гшнейднер К. А. Сплавы редкоземельных металлов. Пер. с нем. М., «Мир», 1965.
78. Дереновский М. В., Шлюко В. Я-, Черняк Л. В. Разработка технологии получения гексаборидов La, Gd и Y с использованием электронно-лучевого нагрева. — «Порошковая металлургия», 1967, №2, с. 8—12.
79, Деркач В. Д. и др. Исследование состава газовой фазы над системой В4С—В2О3. — Там же, 1971, № 4, с. 58.
80. Добрецов Л. Н. Электронная и иоииая эмиссия. М,—Л., Гостехиздат, 1950.
81. Драбл Дж., Голдсмит Г. Теплопроводность полупроводников. Пер. с англ. М., Изд-во иностр, лит., 1963.
82. Дутчак Я. И., Федышин Я. И., Падерно Ю. Б. Тепловые свойства гек-
334
Саборидов металлов. —*• «Изв. АН СССР. Неорганические материалы», 1972, т. 8, № 12, с. 2134—2137.
S3. Дутчак Я. И. и др. Тепловые колебания атомов некоторых гексаборидов металлов. — «Изв. вузов. Физика», 1973, № 1, с. 154—156.
84. Елисеев А. А., Бабйцина А. А., Медведева 3. С. Рентгенографическое исследование системы бор — мышьяк. — «Журя, иеорган. химии», 1964, т. 9, вып. 5, с. 1158—1162.
85. Ермаков С. В. и др. Исследование эмиссионных свойств порошкообразного гексаборида лантаиа в зависимости от состава и чистоты. — «Изв. АН СССР. Неорганические материалы», 1967, т. 3, № 5, с. 808—812.
86. Жданов Г. С., Севастьянов Н. Рентгенографическое исследование структуры карбида бора.— «Жури. физ. химии», 1943, т, 17, вып. 5—6, с. 326—335.
87. Жданов Г. С., Журавлев Н. Н., Зевин Л. С. Рентгеиопрафическое установление образования1 твердых растворов в 'карбиде бора. — «Докл. АН СССР», 1953, т. 92, № 4, с. 767, 768.
88. Жданов Г. С. и др. К вопросу о растворимости бора и углерода в карбиде бора. — «Журн. физ, химии», 1954, т. 28, вып. (6, с. 1076—1082.
89. Жермен Ж. Гетерогенный катализ. Пер. с фраиц. М., Изд-во иностр, лит., 1961.
90. Жуков Э. Г., Гринберг Я- X. Получение монокристаллов B2S3. — «Изв. । АН СССР. Неорганические материалы», 1969, т. 5, № 9, с. 1646—1647.
91. Жунковский Г. Л., Самсонов Г. В. Вакуумное борирование переходных металлов IV—VI групп периодической системы элементов. — «Физика и химия обработки материалов», 1968, № 4, стр. 132.
92. Жунковский Г. Л., Евтушок Т. М. Защита ниобия и тантала от науглероживания.— «Защитные покрытия на металлах», 1971, вып. 5, с. 169.
93. Жунковский Г. Л., Браун С. М. Исследование взаимодействия сплавов Nb—Мо с бором. — «Изв. АН СССР. Металлы», 1972, т. 1, с. 188—192.
94. Журавлев Н. Н., Степанова А. А. Рентгенографическое определение структуры ScBz. — «Кристаллография», 1958, т. 3, с. 83.
95. Журавлев Н. Н. и др. К вопросу о свойствах и фазовом составе сплавов бора с углеродом. — «Изв. АН СССР. Отд. техн. наук. Металлургия и топливо», 1961, № 1, с. 133—141.
96. Журавлев Н. Н., Степанова А. А. Рентгенографическое определение коэффициента термического расширения ScBj. — «Порошковая металлургия», 1964, № 6, с. 83.
97. Журавлев Н. Н. и др. Рентгенографическое исследование боридов лантана.— «Порошковая металлургия», 1967, № 2, с. 95—101.
98. Журавлев Н. Н. и др. Рентгенографическое определение коэффициентов термического расширения боридов лантана и иттрия. — «Кристаллография», 1970, г. 15, вып. 4, с. 836—838.
99. Жураковский Е. А., Котляр В. I., Шашкша Т. Б. Об электронном строении боридов железа. — «Доп. АН УРСР. Сер1я А», 1969, т. 12, №7, с. 654.
100. Жураковский Е. А., Шашкина Т. Б., Котляр В. И. Рентгеновские спектры поглощения кобальта в ферромагнитных боридах. — «Изв. вузов. Физика», 1970, № 1, с. 24.
101. Займам Дж. Электроны и фоноиы. Пер. с англ. М., Изд-во иностр, лит., 1962.
102. Захаров А. М., Новиков И. И., Полькин В. С. Система Мо—В со стороны молибдена. — «Изв. вузов. Цветная металлургия», 1971, №6, с. 126.
103. «Защитные покрытия на металлах», 1971, вып. 5, с. 172. (Влияние боро-меднения на прочность и износостойкость среднеуглеродистой стали. Авт.: Похмурский В. М., Вамга Р. Г., Грибовский Я. С. и др.).
104. «Защитные покрытия иа металлах», 1971, вып. 5, с. 171. (Исследование некоторых тугоплавких соединений в качестве электродных материалов. Дат.: Горенбейн А. Е., Скрыпник В. А., Федоровская А. Ф. и др.)
335
105. Зиновьев В. Е. и др. Температуропроводность и теплопроводность кобальта при высоких температурах. — «Физ. металлов и металловедение», 1968, т. 26, с. 60.
106. Иванько Г. А. Твердость. Справочник. Киев, «Наукова думка», с. 76—79.
107. Искольдский И. И., Богородская Л. П. О возможности получения металлокерамических твердых сплавов на основе боридов хрома, титана и вольфрама. — «Журн. прикл. химии», 1957, т. 30, выл. 2, с. 177—184.
108. Кавабэ Кадзуо. — «Термостойкие полупроводники», 1971, т. 23, № 3, й.А—9 (япон.).
109. Капырина В. Я. и др. Энтальпия и теплоемкость гексаборида лантана при температурах 1100—2200° К. — «Теплофизика высоких температур», 1968, № 1, с. 193—194.
ПО. Карасев А. И. Получение порошков технических боридов титана, циркония, хрома и вольфрама борокарбидным методом. — «Порошковая металлургия», 1973, J4s 10, с. 1—5,
111. Карасев А. И. Исследование условий получения технического диборида циркония углегермическим восстановлением смесей окислов циркония и бора. — «Порошковая металлургия», 1973, № 11, с. 80.
112. Карасев А. И. Автореф. канд. дис. «Разработка полупромышленных технологий получения боридов переходных металлов». Киев, ИПМ АН УССР, 1973.
ИЗ. Карасев А. И. Исследование условий получения технических диборидов гафния, ванадия и ниобия углетермическим методом 'восстановления окислов. — «Порошковая металлургия», 1974, № 11, с. 12.
114. Карев В. Н. и др. Получение и исследование боридных покрытий на молибдене. — «Изв. АН СССР, Неорганические материалы», 1967, т. 3, № 9, с. 1676.
115. Келоглу Ю. П. и др. Влияние режимов электроискрового легирования на твердость и износостойкость металлической поверхности. — «Порошковая металлургия», 1967, № 5, с. 40—45.
116. Кипарисов С. С., Гуревич Б. Д. Современное состояние карбида бора н его применение. М., 1965 (Ин-т «Цветметинформация»),
117. Кириллин В. А. и др. Энтальпия и теплоемкость TiB2 |в интервале температур 273,15—2600° К. — «Теплофизика высоких температур», 1964, № 5, с. 710.
118. Кислый П. С., Кузенкова М. А. Газонепроницаемые защитные чехлы термопар из борида циркония. — «Порошковая металлургия», 1965, № 1, с. 32—36.
119. Кислый П. С., Кузенкова М. А. Исследование процесса намораживания 'наконечников термопар из борида циркония. — «Порошковая металлургия», 1965, № 8, с. 45.
120. Кислый П. С., Кузенкова М. А. Исследование превращения ZrBu в ZrB2. — «Изв. АН СССР. Неорганические материалы», 11966, т. 2, № 4, с. 617.
121. Киффер Р., Бенезовский Ф. Твердые материалы. Пер. с нем. М., «Металлургия», 1968.
122. Ковальченко М. С., Самсонов Г. В. Исследование поведения неметаллических реакторных материалов под действием нейтронного излучения.— В кн.: Высокотемпературные неорганичексие соединения. (Киев, «Наукова думка», 1965, с. 456. /
123. Ковальченко М. С., Серебрякова Yy И., Бодрова Л. Г. Высшие бориды молибдена и вольфрама. — В кн.: Бор, получение, структура и свойства. Т 4 М., «Наука», 1974; те же — «Порошковая металлургия», 1974, №1 (133), с. 1—4.
124. Ковенская Б. А. Некоторые электрофизические свойства диборвдов титана, циркония и гафния. — «Доповгдд АН УРСР. Сер. А», 1970,. № 7, с. 661—664.
125. Ковенская Б. А., Серебрякова Т. И. Физические свойства боридных фаз ниобия. — «Порошковая металлургия», 1970, № 5, с. 79—82.
126. Ковенская Б. ‘А. Автореф. канд. дис. Исследование некоторых физиче-336
екйх свойств й элёк^роннбгб строения борйдов йерёходных Металлон ( IV—VI групп периодической системы. Киев, ИПМ АН УССР, 1971.
127, Койфман И. С., Егоршина Т. В., Ласкова Г. В. Рентгеновский анализ бороцементита, — «Металловедение и терм, обработка металлов», 1969, № 2, с. 59, 60.
1-28 . Козина Г. К- и др. Взаимодействие неметаллических тугоплавких соединений с переходными металлами и ферросплавами. — «Изв. вузов. Цветная металлургия», 1972, т. 2, с. Ill—114.
1'29 . Коларов Д. Получаване иа сплави от снстемата бор — силиций чрез реакция в газова фаза.—«Тр. филиал «Металлокерамика, спец, сплави и контактни материали», НИПКИЕП, 1968/69, т. 2, с. 51—59.
130. Коломоец Н. В. и др. Термоэлектрические свойства некоторых металлоподобных соединений. — «Жури. техн, физ.», 1958, т. 28, № 11, с. 2382—2389.
131, Коломыцев П. Т. О фазовом составе сплавов системы кобальт—'бор. — «Докл. АН СССР», 1959, т„ 124, № 6, с. 1247.
132. Коломыцев П. Т. Диаграмма состояния системы Со—Со2В.—«Докл. АН СССР», 1960, т. 30, № 4, с. 767.
133. Коломыцев П. Т. Диаграмма состояния системы Ni—Ni2B.—«Изв. АН СССР. Отд. техн, наук. Металлургия й топливо», 4960, № 3, с. 83—85.
134. Кондрашев Ю. Д., Марковский Л. Я.,- Маркевич Г. С. Структура е-фаэы в системе Be—В.—«Журн. неорг. химии», 1966, т. 11, 1№ 6, с. 1461.
135. Конев В. Н., Нестеров А. Ф., Глазкова И. П. Исследование реакционной диффузии в системах металл—-сложный газ. Сообщение VII. Молибден — кремний — бор. — «Физ. металлов и металловедение», 1963, т. 16, № 1, с. 86—90.
136. Корсукова М. М. и др. Получение и некоторые свойства соединений бора с цинком.—«Изв. АН СССР. Неорганические материалы», 1971,-т. 7, с. 1518—1522.
J37. Косенко В. А. Исследование условий получения некоторых фиэико-хйми-ческих свойств боридов платиноидов. Канд. дис. Киев, ИПМ АН УССР, 1971.
138. Косенко В. А., Рудь Б. М., Сидорова В. Г. Свойства боридов родия,— «Изв. АН СССР. Неорганические материалы», 1971, т. 7, с. 1455, 1456.
139. Костецкий И. И., Львов С. Н. Температурная зависимость электросо-противления, термо-э.д.с. и теплопроводности боридов железа и возможная структура их 3<Кзоны.—«Физ. металлов и металловедение», 1971, т. 31, с. 491.
140. Костецкий И. И., Львов С. Н., Куницкий Ю. А. Некоторые физические свойства боридов железа. — «Изв. АН СССР. Неорганические материалы», 1971, т. 7, с. 951—955.
141. Костецкий И. И., Львов С. Н. Некоторые физические свойства боридов кобальта и никеля. — «Физ, металлов и металловедение», 1972, т. 33, вып. 4, с. 773—779.
142. Костецкий И. И., Львов С. И. Магнитная восприимчивость борйдов никеля при 100—1100° К. — «Физ. металлов и металловедение», 1972, т. 34, вып. 3, с. 473—475.
143. Косолапова Т. Я- Карбиды. М., «Металлургия», 1968.
144. Кошкии И. А., Островерхое В. И. Производство чехлов на основе диборида циркония для термопар. — «Огнеупоры», 1968, № 1, с. 12—15.
145. Красик Б. А., Грибор А. П. Полупроводники. Германий и кремний. М., Металлургиздат, 1961.
146. Кренев В. А., Евдокимов В. И. О равновесиях реакций совместного восстановления хлоридов бора, мышьяка, кремния и сурьмы водородом,— «Жури, неорган. химии», 1968, т. 13, № 5, с. 1279—1282.
147. Крестовников А. Н., Вендрих М. С. Теплоемкость борида хрома. — «Физика и физико-химический анализ. Сб. науч, трудов Моск, ин-та цвета, мет. и золота», 1957, вып. 1, № 30, с. 135.
148. Крестовников А, Н., Вендрих М. С. Термодинамика диборида титана. — «Изв. вузов. Цветная металургия», 1959, № 2, с. 54—57.
22 Зак. 1305 337
<49. крестовников Л. ti., Вендрих М. С., ТёрМодйнамйка диборйда Хрома,— «Изв. вузов. Черная металлургия», 1960, т. 3, с. 13—17.
150. Крестовников Л. Н., Вендрих М. С.—«Сб. науч. тр. Моск, ин-та цветН. мет. и золота и ВНИТО металлургов», 1960, № 32, с. 36.
151. Кржижановский Р. Е. О связи между электронной и фононной прово'-димостями в металлах. — «Теплофизика высоких температур», 1968, т. 6, с. 261—264.
152. Криштал М. А. Внутреннее трение в .металлах и сплавах. М., «Металлургия», 1964.
153. Криштал М. А. Туркельтауб Г. М. Микроструктура сплавов железо — бор. — «Металловедение и терм, обработка металлов», 1967, !№ 8, с. 63.
154. Коряжкин В. А., Мальцев А. А. Электронный спектр поглощения BS2.— «Вести. Моск, ун-та. Химия», 1966, № 1, с. 6—12.
155. Крылов О. В., Фокина Е. А. Изучение связи между каталитической активностью некоторых полупроводников и шириной запрещенной зоны. — «Кинетика и катализ», 1964, т. 5, К» 2, с. 284—292.
156. Кубашевский О., Эванс Э. Термохимия в металлургий. Пер. с англ. М., Изд-во иностр, лит., 1954.
157. Кугай Л. Н., Назарчук Т. Н. Химическая устойчивость боридов переходных металлов. — «Порошковая металлургия», 1971, № 3, с. 51.
158. Кугай Л. Н. О химической устойчивости боридов Мо и W. — «Порошковая металлургия», 1971, № 12, с. 54.
159. Кудинцева Г. А. и др. Приготовление и некоторые свойства гексаборида иттрия. — «Физ металлов и металловедение», 1958, т. 6, вып. 2, с. 272—275.
160. Кудинцева Г. А., Царев Б. М., Эпельбаум В. А. Бориды переходных металлов и их электронно-эмиссионные свойства. — В кн.: Бор (труды конференции по химии бора и его соединений). М., Госхимиздат, 1958, с. 106; Синтез гексаборидов некоторых редкоземельных металлов и их электронно-эмиссионные свойства. — Там'же, с. 112.
161. Кудинцева Г. А., Царев Б. М. Эмиссионные свойства гексаборидов некоторых редкоземельных металлов. — «Радиотехника и электроника», 1958, т. 3, с. 428, 429.
162. Кудинцева Г. А. и др. Получение спеченных катодов из чистого гекса-борида лантана и изучение их эмиссионных свойств. — «Изв. АН СССР. Неорганические материалы», 1968, т. 4, № 1, с. 49.
163. Кудинцева Г. А. и др. Термокатоды. М.—Л., «Энергия», 1966.
164, Кудинцева Г. А., Кузнецова Г. М., Никулов В. В. Исследование эмиссионных свойств эмиттеров на основе гексаборида лантана. — «Радиотехника и электроника», 1967, т. 12, вып. 5, с. 857—861.
165. Кудрявцев В. И., Сафронов Г. В. Прецизиолное определение периодов решетки карбида бора состава Вг.тзС—B6,7sC по рентгенограммам, полученным в области больших углов рассеяния (0—>.90°). — В кн.: Труды семинара по жаростойким материалам. Вып. 5. Киев, Изд-во АН УССР, 1960, с. 52—54.
166. Кузенкова М. А., Кислый П. С. О получении диборида циркония. — «Порошковая металлургия», 1965, № 12, с. 8.
167. Кузьма Ю. Б. и др. Рентгеноструктурное исследование системы ниобий— вольфрам — бор. — «Порошковая металлургия», 1966, № 6, с. 73—76.
168. Кузьма Ю. Б., Серебрякова Т. И., Плахина А. М. О полиморфном превращении W2B5. — «Журн. неорган. химии», 1967, т. 12, йып. 2, с. 559—560.
169. Кузьма Ю. Б. Кристаллическая структура соединения YCrB4 и его аналогов. — «Кристаллография», 1970, т. 15, вып. 2, с. 372—374.
. 170. Кузьма Ю, Б. Автореф. докт. дне. Исследования по кристаллохимии боридов. Львов, 1973.
171. Куницкий Ю. А., Марек Э. В. Некоторые физические свойства боридов железа. — «Порошковая металлургия», 1971, № 3, с. 56.
172. Куценок Т. Г. Автореф. канд. дис. Физические свойства высокотемпе-
338
натурного термоэлектрического материала на основе сульфида церия. Киев, ИПМ АН УССР, 1969.
173. Лавренко В. А. и др. Каталитическая активность боридов и силицидов переходных металлов. — «Порошковая металлургия», 1968, № 12, с. 65.
374. Лавренко В. А. та шип. Взаёмозв’язок робота внходу, адсорбщйних та каталггичних властивостей борид!в перех!дних метал!в в реакцп атом!в водню i азоту. — «ДоповцД АН УРСР. Сер. Б», 1972, № 6, с. 539.
175. Лавренко В. А., Глебов Л. А., Луговская Е. С. Высокотемпературное окисление борида Хрома в кислороде. — «Защита металлов», 1973. т. 9, № 3, с. 29=1.
176. Ламихов Л. К. Методы получения, свойства и применение тугоплавких сплавов Системы кремний — бор. — «Изв. АН СССР. Неорганические материалы», 1968, т. 4, № 7, с. 1076^-1080.
177. Ламихов Л. К. и др. О фазе 0-А1В12 в системе кремний — алюминий — бор. — «Изв. АН СССР. Неорганические материалы», 1969, т. 5, № 7, С. 1214—1217.
178. Ламихов Л. К., Неронов В. А., Самсонова Т. И. Внепечной силикотерми-ческий способ получения 'борида кремния SiB4. — В кн.: Металлотермические методы полученя соединений и сплавов. Новосибирск, «Наука», 1972, с. 11—13.
179. Левинский Ю. В., Салибеков С. Е., Левинская М. X. Исследование взаимодействия боридов хрома, молибдена и вольфрама с углеродом. — «Порошковая ’металлургия», 1965, Ns 12, с. 56—62.
180. Лейбфрид Г. Микроскопическая теория механических и тепловых свойств кристаллов. М., Физматгиз, 1963.
181. Левинский Ю. В., Салибеков С. Е. Взаимодействие диборидов титана, циркония и гафния с углеродом. — «Журн. неортан. химии», 1965, т. 10, вып. 3, с. 588—591; Взаимодействие диборидов ванадия, ниобия и тантала с углеродом. — «Порошковая металлургия», 1965, № 11, с. 66—69.
182. Лесник А. Г. К вопросу о природе фаз внедрения. — В кнд Вопросы физики металлов и металловедения. № 1. Киев, Изд. Лаборатории металлофизики АН УССР, 1950, с. 184—192.
183. Ленинских Б. М., Есии О. А. Термодинамические свойства систем РЬО—В2О3, МпО—В2О3. — «Журн. неорган. химии», 1961, т. 6, № 5, с. 1223.
184. Лифшиц Л. С„ Щербакова В. С., Грииберг Н. А. Влияние бора на структуру и свойства наплавленного металла. — «Металловедение и терм, обработка металлов», 1967, № 6, с. 67.
185. Львов С. Н., Немченко В. Ф., Самсонов Г. В. Некоторые закономерности электрических свойств боридов, карбидов и нитридов переходных металлов IV—VI групп периодической системы. — «Докл. АН СССР», 1960, т. 135, с. 577. ’ ’
186. Львов С. Н., Немченко В. Ф., Самсонов Г. В. Влияние атомов неметаллов на электрические свойства тугоплавких соединений переходных металлов.— «Порошковая металлургия», 1962, № 4, с. 3—10.
187. Львов С. Н., Немченко В. Ф., Падерно Ю. Б. Теплопроводность текса-боридов щелочно- и редкоземельных металлов. — «Докл. АН СССР», 1963, т. 149, № 6, с. 1371, 1372.
188. Львов С. Н., Немченко В. Ф. Температурная зависимость ,термо-э.д.с. и удельного электросопротивления титана, ванадия, хрома и их боридов, карбидов и нитридов. — В кн.: Высокотемпературные неорганические соединения. Киев, «Наукова думка», 1965, с. 100.
189. Львов С. Н., Немченко В. Ф., Мальков П. И. Теплопроводность боридов переходных металлов IV—VI групп периодической системы. — Там же, с. 451.
190. Львов С. Н., Немченко В. Ф., Падерно Ю. Б. Теплопроводность и магнитная восприимчивость гексаборидов щелочно- и редкоземельных металлов.— Там же, с 445.
191. Львов С. Н., Немченко В. Ф. О возможности применения одиозонных
% 22* 339
представлений к диборидам переходных металлов IV труппы. — «Изв. вузов. Физика», 1968, № 1, с. 59—62.
192. Львов С. Н., Гречко О. Г. Теплопроводность германидов переходных металлов IV—VI групп. -j- «Изв. АН СССР. Неорганические материалы», 1971, т. 7, № II, С. 1978—1982.
193. Львов С. Н. и др. Теплопроводность некоторых тугоплавких карбидов и боридов.— «Теплофизика высоких температур», 1972, т. 10, с. 1327.
194. Лютая М. Д., Серебрякова Т. И. О термической стойкости боридов хрома. — «Изв. АН СССР. Неорганические материалы», 1965, т. 1 № 7, с. 1044.
195. Лютая М. Д., Акинина 3. С. Химическая и термическая устойчивость боридов скандия. — «Изв. АН СССР. Неорганические материалы», 1965, т. 1, № 7, с. 1039.
196. Лютая М. Д., Акниина 3. С., Серебрякова Т. И. О химической стойкости боридов хрома, —«Укр. хим. жури.», 1966, т. 32, № 7, с. 686.
197. Ляхин Б. П. Исследование выплавки ферробора и никельбора из боратовых руд.— «Сталь», № 12, с. 1104—1112. 1
198. Ляхович Л. С., Пучков Э. П., Ворошнин Л. Г. и др. Распределение легирующих элементов бора и углерода по глубине борированного слоя среднеуглеродистых сталей. — «Металловедение и терм, обработка металлов», 1969, № 1, с. 37.
199. Ляховская И. И., Зинкина Т. М., Фомичев В. А. /(-спектры бора в диборидах переходных металлов и в соединениях LaB6, ВаВе и AsB.— «Физ, твердого тела», 1970} т. 12, с. 174.
20Q. Лященко А. Б. Автореф. канд. дис. Некоторые физические свойства тугоплавких металлов, их соединений с бором, углеродом, азотом и кремнием. Киев, 1965.
201. Малинский Б. И., Немченко В. Ф., Львов С. Н. Магнетосопротивление и эффект Холла диборидов металлов IVA подгруппы. — «Изв. вузов. Физика», 1969, № 12, с. 69.
202, Малинский Б. И., Немченко В. Ф., Львов С. Н. Эффект Холла и магнетосопротивление нитридов Ti и Zr. Гальваномагнитные свойства некоторых твердых тугоплавких соединений металлов IVa подгруппы в двухзонном представлении. — «Изв. вузов. Физика», 1971, №3, с. 84, 134—138. •
203. Малинский Б. И., Немчеико В. Ф., Львов С. Н. Магнетосопротивление и эффект Холла диборида .ванадия в двухзонном представлении. — «Изв. вузов. Физика», 1972, № 8, с. 55—59.
204. Мальцев А. А. Спектроскопическое определение радикала ВОг.
В кн.: Тезисы докладов 14-го совещания по спектроскопии. М., Изд-во-МГУ, 1961, с. 60.
205. Мальцев А. А., Матвеев В. К., Татевский В. М. Исследование спектров испускания и поглощения окиси бора при высоких температурах в различных атмосферах. — В кн.: Физические проблемы спектроскопии. М., Изд-вэ АН СССР, 1962, с. 201—203.
206. Мальцев А. А. Спектры и строение кислородных соединений бора и некоторых элементов III группы в газовой фазе. Докт. дне. М., МГУ, 1965.
207. Мальцева М. Н., Стерлядкина 3. К., Михеева В. И. Реакция борогидри-да натрия с хлористым Ni в водных растворах. — «Жури, неорган. химии», 1966, т. 11, вып. 4, с. 720—725.
208. Малючков О. Т., Повицкий В. А. Исследование боридов переходных металлов и чистого бора методом ядерного магнитного резонанса. — «Порошковая металлургия», 1962, № 4, с. 26—34.
209. Малючков О. Т.,' Повицкий В. А. Исследование боридов переходных металлов методом ядерного магнитного резонанса. — «Физ. металлов и металловедение», 1962, т. 13, вып. 5, с. 76.
210. Мамедов Ф. Г. и др. Получение чистых гексаборидов редкоземельных и щелочноземельных металлов и их рентгенографическое исследование. —
340
«Изв. АН СССР. Неорганические материалы», 1967, т. 3, № 6, с. 950—956.
211. Манелис Р. М. и др. Некоторые свойства боридов иттрия. — «Изв. АН СССР. Неорганические материалы», 1966, т. 2, с. 608.
212. Манелис Р. М. и др. Особенности .вакуумно-термического метода получения и некоторые свойства боридов иттрия и гадолиния. — «Порошковая металлургия», 1966, № 11, с. 77—84.
213. Манелис Р. М., Меерсои Г. А., Гришина Л. П. О термоэлектронной эмиссии некоторых боридов гадолиния. — «Изв. АН СССР. Неорганические материалы», 1967, т. 3, № 1, с. 54—60.
214. Манелис Р. М., Телюкова Т. М., Гришина Л. П. Структура и некоторые свойства диборида иттрия. — «Изв. АН СССР. Неорганические материалы», 1970, т. 6, № 6, с. 1184, 1185.
215. Марковский Л. Я.. Векшина Н. В. О борокарбидах щелочноземельных металлов.—«Журн. прикл. химии», 1964, т. 37, вып. 10, е. 2126—2133; Некоторые химические свойства борокарбидов щелочноземельных металлов и продуктов их гидролитического разложения.—Там же, с. 2120—2126.
216. Маркевич Г. С., Кондрашев Ю. Д., Марковский Л. Я. О новой боридной фазе в системе бериллий — бор. — «Журн. неорган. химии», 1960, т. 5, с. 1783—1789.
217. Маркевич Г. С., Марковский Л. Я. О химической стойкости боридов бериллия по отношению к кислороду, азоту и углероду (при высоких температурах.— «Журн. прикл. химии», 1960, т. 33, вып. 5, с. 1008—1012.
218. Марковский Л. Я., Кондрашев Ю. Д., Капутовская Г. В. О составе и химических свойствах боридов магния. — «Журн. орган, химии», 1955, т. 25, с. 433.
219. Марковский Л. Я-, Кондрашев Ю. Д., Капутовская Г. В. О составе и свойствах боридов бериллия. — Там же, с. 1045.
220. Марковский Л. Я*, Кондрашев Ю. Д., Капутовская Г. В. К вопросу о составе и структуое боридов магния. — «Докл. АН СССР», 1965, т. 100, № 6, с. 1095—1098.
221. Марковский Л. Я-, Кондрашев Ю. Д. О составе и свойствах боридов элементов первой и второй групп. — «Журн. неорган. химии», 1957, т. 2, с. 34.
222. Марковский Л. Я-, Капутовская Г. В. О взаимодействии элементарного бора и некоторых боридов с перйодатом и йодатом калия..— «Там же, 1958, т. 3, с. 328.
223. Марковский Л. Я-, Векшина Н. В. Получение боридов щелочноземельных металлов методом восстановления окислов углеродом. — «Журн. прикл. химии», 1958, т. 31, вып. 9, с. 1293—1299.
224. Марковский Л. Я-, Капутовская Г. В., Кондрашев Ю. Д. К вопросу о существовании борида магния состава Mg3B2. — «Журн. неорган. химии», 1959, т. 4, вып. 8, с. 1710.
225. Марковский Л. Я-, Капутовская Г. В. О химической стойкости и гидролитическом разложении диборидов некоторых переходных металлов при взаимодействии с кислотами. — «Журн. прикл. химии», 1960, т. 33, № 3, с. 569.
226. Марковский Л. Я., Векшина Н. В. О тройных соединениях в системе щелочноземельный металл — бор — углерод. — Там же, 1961, т. 34, вып. 2, с. 242—248.
227. Марковский Л. Я. Химическая стойкость и структура боридов. — «Порошковая металлургия», 1962, № 4, с. 39—44.
228. Марковский Л. Я-, Безрук Е. Г. О химической стойкости боридов некоторых переходных металлов. — «Журн. прикл. химии», 1962, т. 35, вып. 3, с. 491.
229. Марковский Л. Я-, Капутовская Г. В. О некоторых химических свойствах боридов Mg и об их роли при получении элементарного бора маг-ний-термическим методом. — Там же, вып. 4, с. 723.
22 Зак. 1305
341
230. Марковский Л. Я., Безрук Е. Т. Изучение системы Мп—Й.—<-В кн.: Высокотемпературные неорганические соединения, Киев, Изд-во АН УССР, 1965, с. 433.
231. Марковский Л. Я.* Векшина Н. В., Пронь Г .Ф. О борокарбвдах лан-, тана.— «Жури, прикл. химии», 1965, т. 38, вып. 9, с. 245—251.
232. Марковский Л. Я., Векшина Н. В., Проиь Г. Ф. О борокарбидах щелочноземельных и редкоземельных металлов. — В кн.: Высокотемпературные неорганические соединения. Киев, «Наукова думка», 1965, с. 415—420.
233. Марковский Л. Я., Безрук Е. Т< Диаграмма плавкости и некоторые химические свойства боридов В системе марганец — бор. —«Журн. прикл. химии», 1965, т: 38, вып. 8, с, 1677—1682.
234. Марковский Л. Я., Векшина Н. В., Кондрашев Ю. Д. О тройных сое-динеииях в системе бериллий —бор — углерод. — Там же, 1966, т. 39, вып. 2, с. 13—19.
235. Марковский Л. Я.; Безрук Е. Т. О борокарбидах марганца, —Там же, вып. 2, с. 258—265.
236. Марковский Л. Я., Безрук Е. Т. Диаграмма состояния системы Мп—В. —«Изв. АН СССР.. Неорганические материалы», 1967, т. 3, с. 2165; 1968, т. 4, с. 447.
237. Марковский Л. Я., Векшина Н. В. Магний-термический способ получения боридов, — «Журн. прикл. химии», 1967, т. 40, вып. 8, с. 1824—1826.
238. Марковский Л. Я-, Безрук Е. Т. Исследование фазового состава соединений, образующихся в системе Мп—В в области, богатой бором, -е-Там же, с. 1199—1204. !
239. Марковский Л. Я. и др. Магний-термический метод получения борцдов металлов. — «Порошковая металлургия», 1969, № 5, с. 13—18.
240. Марковский Л. Я. и др. Об условиях получения диборида иттрия, о его структуре и некоторых свойствах. — «Жури, прикл. химии», 1969, т. 42, As 12, с, 2690. !
241. Марковский Л. Я., Векшина Н. В., Безрук Е. Т. О взаимодействии боридов. С углеродом и карбидами. — В ки.: Химические свойства и методы анализа тугоплавких соединений. Киев, «Наукова думка», 1969, С. 143—148,
242, Марковский Л, Я., Безрук Е. Т., Берлова Г. Е. О стабильности боридов N1 и Со по отношению к углероду. — «Изв. АН СССР. Неорганические материалы», 1971, т, 7, № 1, с. 56—58.
243. Марковский Л. Я., Векшина Н. В., Кондрашев Ю. Д. Исследование бо-рокарбидов редкоземельных металлов.—«Жури, прикл. химии», 1972, т. 45, вып. 6, с. 1183—1187.
244. Материалы Совещания па вопросам производства и применения индия, галлия и таллия. М., Гиредмет, 1960, с. 138. (О взаимодействии галлия, индия и таллия с бором. Авт.: р В. Самсонов, Ю. Б. Падерно, О. И. Шулишова, Т. И. Серебрякова.)
245. Матюшенко Н. Н. Кристаллографические данные по соединениям бинарных систем (соединения с элементами второго и третьего периодов). Отчет № 034/ВМ-003. ФТИ АН УССР, Харьков, 1964.
246. Матюшенко Н. Н. Кристаллические структуры двойных- соединений. М., «Металлургия», 1969.
247. Медведева 3. С., Миткнна Г. Д. Тезисы Всесоюзного совещания по полупроводниковым соединениям. Л., 1961,
248. Медведева 3. С., Миткииа Г. Д, Способ получения арсенида бо,ра. Двт. свид. СССР № 176265 (5.01.66). /
249. Медведева 3. С. и др. Диаграмма состояния системы BS2—S. — «Журн. неорган. химии», 1968, т. 13, вып. 5, с. 1440—1443.
250. Медведева 3. С. Халькогениды элементов Шб подгруппы периодической системы. М., «Наука», 1968.
251. Медведев О. Г. и др. Изготовление изделий сложной формы из гексаборида щантана. — «Порошковая металлургия», 1971, № 3, с. 101—102.
342
252. Медведева 3. С., Радченко А. Ф. Синтез и некоторые; свойства субарсс-нида бора. —гВ кн.: Международный симпозиум по бору. Тезисы докл. Тбилиси, октябрь, 1972, с. 38.
253. Меерсон Г. А., Самсонов Г, В. Исследование диаграммы Плавкости системы бор — углерод и природы фаз в этой системе. — «Изв.- сектора физ.-хим. анализа ИОНХ АН СССР», 1953, т. 22, с. 92—103.
254. Меерсон Г. А., Нурмухамедов В. X., Манелис Р. М. Термодинамика боротермической реакции получения LaB6. — «Изв. АН СССР, Неорганические материалы», 1973, т. 9, № 12, с. 2133—2135.
255. Меерсон А., Самсонов Г. В. (ред.), Бор. Труды конференции по химии бора и его соединений. М., Госхимиздат, 1958, с. 52.
256. Меерсон Г. А.-^«Химия редких элементов» 1955, № 2 с. 130
,257. Меерсон Г. А. и др. Вакуумно-термическое получение боридой тугоплавких металлов и исследование некоторых боридных систем. — «Научн. Труды Моск, ин-та цвет. мет. И золота», 1955, т. 25, С. 209—225.
258. Меерсон Г. А., Манелис Р. М., Телюкова Т. М. Особенности получения изделий из гексаборида лантана и иттрия спеканием в вакууме, — «Изв. АН СССР. Неорганические материалы», 1966, т. 2, № 2, с. 291—298.
259. Меерсон Г. А. и др. Некоторые свойства боридов иттрия.— Там же, № 4, с. 608—616.
260. Меерсон Г. А., Мамедов Ф. Г. Исследо1вание условий получения гекса-боридов редкоземельных и щелочноземельных .металлов повышенной чистоты, г—Там же, 1967, т. 3, № 5, с. 802—807.
261. Меерсон Г. А., Горбунов А. Е. Активированное впекание борида циркония.—Там же, 1968, т. 4, Ns 3, с. 320.
262. Меерсои Г. А., Кипарисов С. С., Гуревич Б. Д. О получении карбида бора в графитовотрубчатых печах. — «Тугоплавкие металлы», 1968, вып. 5, с. 115—120 (Моск, ин-т стали и сплавов).
263. Меерсон Г. А., Горбунов А. Е. Получение чистых боридов, свободных от-углерода, углетермическим способом. — «Изв, АН СССР» Неорганические материалы», 1969, т. 5, № 12, с. 2075.
264. Меерсон Г. А., Манелис Р. М., Нурмухамедов В. X. Исследование условий получения гексаборида лантана повышенной чистоты и стехиометрического состава. — Там же, 1970, т. 6, № 7, с- 1219—1223.
265. Микадзе 3. М, и др. Исследования структуры и некоторых свойств высокочистого карбида бора. — В кн.: Международный симпозиум по бору. Тбилиси, 1972, с. 12, 20, 32, 42.
266. Металлотермические методы получения соединений и сплавов. Под ред. А. А. Корнилова. Новосибирск, «Наука», 1972.
267. Металловедение реакторных материалов. Кн. 3. Под ред. Д. М. Скорова. М., Госатомиздат, 1962, с. 105.
268. Меньшиков А. 3., Немнонов С. А., Самсонов Г. В. Электронная структура тугоплавких соединений хрома. — В кн.: Высокотемпературные неорганические соединения. Киев, «Наукова думка», 1965, с. 88,
269. Метревели В. Ш. и др. Внутреннее трение сплавов системы Fe—В.—( «Металловедение и терм, обработка металлов», 1970, Ns 1, с 21—25.
270. Минкевич А. Н. Диффузионные боридные слои на металлах, -е- Там же, 1961, № 8, с. 9—15.
271+ Минкевич А. М., Расторгуев Л. Н., Ютфина Л. И. Исследование структуры и ориентировки боридных слоев на железе.—Там же, 1967, JV» 3, с. 36—38.
272. Мирясов М. 3., Парсаиов А. П. Магнитные свойства и структура сплавов 'марганец — бор. — «Вести. Моск, ун-та. Серия матем., мех., астр., физ. и химии», 1959, т. 1, с. 43—50.
273. Мирясов М. 3., Парсанов А. П. Ферромагнетизм сплавов Мп—В—«Изв. АН СССР. Сер. физ.», 1959, т. 23, с. 285. '
274. Михеева В. И., Маркина Ю. Ю. Получение тетраборана гидролизом боридов.— «Жури, неорган. химии», 1956, т. 1, вып. 4 а 619—627.
22* 343
275. Михеева В. И., Шамрай Ф. И., Крылова К. Й. Получение аморфного бора выской чистоты,—«Жури, неорган. химии», 1957, т. 2. вып 6, с. 1223—1253.
276. Модылевская К. Д., Самсонов Г. В. Стойкость боридов переходных металлов против действия кислот и щелочей.— «Укр. хим. журн.», 1959, т. 25, с. 55.
277. Мочалов К. Н., Поликарпов С. И. Исследование каталитических свойств боридно-никелевого катализатора в реакции гидрирования растительных масел.— «Труды Казанского хим,- техи. ин-та», 1962, т. 30, с. 283.
278. Мурач Н. Н., Верятин У. Д. Внепечиая металлотермия. М., Металлург-издат, 1956.
279. Напалков В. П., Ходаков П. Е., Митволь Л. С. Приготовление лигатур алюминий — бор и алюминий — титан — бор.— «Технология легких сплавов» (науч.-техн. бюл. ВИЛСа), 1970, № 3, с. 95—97.
280. Наплавочные сплавы на основе тугоплавких соединений. Волгоград, 1972, с. 116, 121. (Волгоградский пединститут им. А. С. Серафимовича).
281. Некрасов М. М. Неоднородные диэлектрики. Т. 1. Киев, Изд. Киевского политехи, ин-та, 1964.
282. Немнонов С. А. Электронная структура и некоторые свойства переходных металлов и сплавов I, И и III больших периодов.— «Физ. металлов и металловедение», 1965, т. 19, вып. 4, с. 550—568.
283. Немнонов С. А., Колобова К. М. Рентгеновские спектры, электронная структура и свойства металлических соединений Ti.— Там же, 1966, т. 22, с. 680—692.
284. НемЫсски Т., Працка И., Юн Я- Исследование процесса кристаллизации гексаборида лантана.— В кн.: Бор, получение, структура и свойства. Т. 4. М„ «Наука», 1974.
285. Неронов В. А. Автореф. каид. дис. Исследование процесса алюмино-термического восстановления борсодержащего сырья и условий образования боридных фаз алюминия. Киев, ИПМ АН УССР, 1969.
286. Нероиов В. А., Самсонов Г. В. О методах получения и свойствах боридов алюминия.— «Порошковая металлургия», 1965, № 7, с. 67—73.
287. Неронов В. А., Ламихов Л. К., Самсонов Г. В. Оптимизация процесса получения А1В12 по способу внепечной- металлотермии.— В ки.: Исследования в области химии и технологии минеральных солей и окислов. Под ред. проф. М. Е. Позина. М.-Л., «Наука», 1965, с. 308—311.
288. Неронов В. А., Ламихов Л. К. Влияние некоторых факторов на процесс алюминотермического получения соединения А1В12.— «Изв. АН СССР. Неорганические материалы», 1966, т. 2, № 7, с. 1213—1217.
289. Неронов В. А. Бориды алюминия. Новосибирск, «Наука», 1966.
290. Неронов В. А. Влияние некоторых факторов на процесс- алюминотермического восстановления буры. — «Изв. СО АН СССР. Сер. хим. наук», 1968, № 14, вып. 6, с. 52—56.
291. Нероиов В. А., Ламихов Л. К. Получение додекаборида алюминия в крупнолабораторном масштабе.— «Журн. прикл. химии», 1969, № 6, с. 1396—1398.
292. Неронов В. А. К вопросу о диаграмме состояния системы А1-—В.— «Жури, неорган. химии», 1969, т. 14, Xs 6, с. 1704, 1705.
293. Неронов В. А., Ламихов Л. К. Алюминотермичесвое получение додекаборида алюминия А1В12 из борных минералов.—'«Изв. СО АН СССР. Сер. хим. наук», 1969, № 9, с. 122—126.
294. Нешпор В. С., Падерио Ю. Б., Самсонов Г. В. О боридах рения.— «Докл. АН СССР», 1958, т. 118, Xs 3, с. 515.
295. Нешпор В. С. О связи между некоторыми термическими характеристиками твердых тел.— «Физ. металлов и металловедение», 1959, тл 7, вып. 4, с. 559—564.
296. Нешпор В. С., Кислый П. С. Горячее прессование порошка борида хрома и некоторые свойства спеченного материала.— «Огнеупоры», 1959, № 5, с. 231.
344
297. Нешпор В, С., Самсонов Г. В. Свойства и технология приготовления гексаборидов в связи с их использованием в качестве термоэмиттеров.— «Электроника», 1959, № 3, с. 149.
298. Нешпор В. С., Никитин В. П., Работнов В. В. Исследование некоторых электрофизических свойств пиролитического карбида бора.— «Порошковая металлургия», 1968, № 11, с. 63—68.
299. Нешпор В. С. и др. Некоторые физические свойства борокарбидов бериллия, хрома и лантана.—«Изв. АН СССР. Неорганические материалы», 1971, т. 7, № 12, с. 2170—2174.
300. Нешпор В. С., Самсонов Г. В. Электрофизические свойства и характер химической связи в соединениях бериллия с бором и углеродом.— «Изв. АН СССР. Неорганические материалы», 1971, № 1, с. 50.
301, Никитин В. С., Мальцев А. А. Инфракрасный спектр поглощения паров системы В—В2О2—Н2(Н2О).—«Вести. Моск, ун-та. Химия», 1966, № 6. с. 12.
302. Никитин В. С., Мальцев А. А. Инфракрасный спектр поглощения молекулы В2О2.— Там же, 1966, № 3, с. 40.
303. Никитин В. С. Автореф. канд, дис. Спектроскопические исследования некоторых окислов бора и борных кислот в газовой фазе, М., МГУ, 1967.
304. Обухов А. П. и др. Синтез тугоплавких соединений переходных металлов IV—VI групп в расплаве цинка.— «Изв. АН СССР. Неорганические материалы», 1968, т. 4, № 4, е. 527—531.
305. Одинцов В. В., Падерно Ю. Б. Физические свойства додекаборида урана.— «Атомная энергия», 1971, т. 30, вып. 5, с. 453.
306. Одинцов В, В., Падерно Ю. Б., Горячев Ю. М. Структура энергетических полос в кубических додекаборидах металлов.— «Жури, структ. химии», 1971, т. 12, № 2, с. 344—346.
307» Одинцов В. В., Костецкий М. И., Львов С. Н. Магнитная восприимчивость додекаборидов металлов со структурой типа UB12.— «Изв. АН СССР. Неорганические материалы», 1973, № 6, с. 944.
308. Огнеупоры для космоса. М., «Металлургия». 1967, с. 21—31.
309. Орешкин В. Д., Светлополянский В. И., Серебрякова Т. И. Исследование износостойкости поверхностей, наплавленных боридами.— «Порошковая металлургия», 1971, № 3, с. 78.
310. Ормонт Б. Ф. Структуры неорганических веществ. М., Гостехиздат, 1950.
311. Ормонт Б. Ф. О ширине запрещенной зоны ряда соединений AnlBv.— «Журн. неоргаи. химии», 1959, т. 4, вып. 9, с. 2176, 2177.
312. Особо тугоплавкие элементы и соединения. М., «Металлургия». 1969, с. 26, 74. (Авт.: Р. Б. Котельников, С. Н. Башлыков, 3. Г. Галибаев и др.)
313. Осуги Дзиро, Симидзу Киеси, Танака Иосикжа. Взаимодействие бора и мышьяка при высоких давлениях и высокой температуре.—«J.Chem. Japan», 1966, т. 87, № 5, с. 401—405 (японск.).
314. Ощерии Б. Н. Новая формула для расчета характеристической температуры по температуре плавления.— «Порошковая металлургия», 1962, № 1, с. 11—16.
315. Падерно Ю. Б., Серебрякова Т. И., Самсонов Г. В. Получение и некоторые свойства борида гафния.— «Цветные металлы», 1959, № 11, с. 48—51.
316. Падерно Ю. Б. Получение додекаборида урана.—«Атомная энергия», 1961, т. 10, № 4, с. 396.
317. Падерио Ю. Б., Самсонов Г. В. Электрические свойства гексаборидов щелочно-редкоземельных металлов и тория.— «Докл. АН СССР», 1961, т. 137, № 3, с. 646, 647.
318. Падерио Ю. Б., Новиков В. И., Гарф Е. С. Электрические свойства гексаборидов щелочно- и редкоземельных металлов при низких температурах.— «Порошковая металлургия», 1969, № 11, с. 70.
319. Падерно Ю. Б. и др. Электрофизические свойства плавленых гексабо-
345
рядов щелочно- и редкоземельных металлов.-^-Там же, 1969, № 10, •с. бб-г-58.
320. Падерно Ю. Б. и др. Термическое расширение додекаборидов метал*-лов.— «Теплофизика высоких температур», 1971, т. 9, вып. 1, с. 200—202.
32). Падерно Ю. Б., Одинцов В. В. Исследование условий получения и электрофизические свойства додекаборидов металлов.—В кн.: Электронное строение и физические свойства твердого тела. Ч. 2. Киев, «Наукова думка». 1972, с. 112—119.
322. Пат, ПНР № 54502 (20.01.68) «Способ приготовления кристаллического фосфида бора», (Авт. Г. Немысски, С. Аппенгеймер, Ю. Маевский.)
323. Пат. США № 3073679 (15.01.63) «Производство монокристаллов фосфида бора». (Авт. Стоун Б.).
324. Пат. США № 3210624 (5.10.65) «Изделия; имеющие прослойки карбида кремния с эпитаксиальными слоями фосфида* бора». (Авт. Ф. Вильямс.)
325. Пат. США № 3413092 (26.11.68) «Процесс приготовления кристаллического арсенида бора», (Авт. Ф. Вильямс.) < '
326, Пат. США № 3069238 (1960) «Метод получения ХгВ2».
327. Пат. США № 2929685 (1960) «Метод получения борида титана из фосфата».
328. Патенты США № 2966426 (27.12.60), № 2974064 (7.03.61), № 2984577 (16^05.61) «Способ приготовления фосфида бора», (Авт. Ф. Вильямс.) 329, Пат. США № 3106455 (8.10.63) «Очистка металлических карбидов и боридов.» (Авт. Р. Райпли.)
330 Пат, США № 3363984 (16.01.68) «Приготовление соединений элементов III—V групп». (Авт. Р. Рурвейн.)
331. Пат. США № 3009780 (21.11.61) «Процесс производства крупных кристаллов фосфида бора». (Авт. Б. Стоун.)
332. Пат. США № 3503738 (31.03.70) «Металлургический способ получения бор-алюминиевых сплавов». (Авт. X. Купер.)
333. Патенты США № 3395986 (6.08.68), № 3423218 (21.01.69). «Процесс получения фосфида бора», «Композиции фосфида бора» (Авт. Б. Грубе.)
334. Пат. США № 320571 (12.07.66) «Фосфиды бора». (Авт. Б. Грубе.)
335. Пат. США № 3138468 (1964) «Бориды кремния». (Авт. В. Маткович, Е. Колтон.)
336, Пат. США № 2977256 (28.03.61) «Полупроводниковые приборы и методы их изготовления». (Авт. Д. Эйрил.)
337, Пат. Франции № 2098009 (7.02.72) «Способ получения кубического нитрида бора и абразивный материал на его основе».
338. Пат. ФРГ № 1280819 (26.06.69) «Способ Осаждения кристаллов из SIC, BN, BP, A1N или A1P на металлической подложке», (Авт. В. Либман.)
339. Пат. ФРГ № 1107652 (31.05.61) «Способ получения монокристаллов фосфида бора». (Авт. Б. Стоун, Р. Рурвейн.)
340. Пат. ФРГ № 1142307 (10.1.63) «Спеченный высокотемпературный материал». (Авт. А. Кенсел.)
341, Пат. ФРГ № 977030 (19.11.64) «Способ приготовления формуемых изделий из карбида бора с добавками кремния или алюминия». (Авт. В. Якоби.)
342. Пат. Швейцарии № 163064 (16.09.33) «Твердый сплав». (Авт. Ф. Круп.)
343. Пат. Японии № 26347 (31.08.70) «Электроды для электролитического метода получения порошков». (Авт. Иноуэ Киеси.)
344. Пат. Японии № 14573 (20.06.68) «Метод спекания». (Авт. Иноуэ Киеси.)
345. Пат. Японии № 1533 (19.01.70) «Сверхтвердый сплав на основе карбида бора». (Авт. Мута Акинори, Тода Гедзо.)
346. Пешев П., Близиаков Г., Гюров Г. Исследования по получению борида никеля из растворов.— В кн.: Международный симпозиум по бору. Тезисы докл. Тбилиси, октябрь 1972, с. 37.
347. Пешев П. Вверху получаването на кристален титанов диборид из га-зова фаза.— «Изв. ИОНХ Бълг. АН», 1966, т. 4, с. 53.
346
348. Поглощающие материалы для регулирования ядерных реакторов. Справочник. Пер. с англ. Под ред. Б. Г. Арабея, В. В. Чекунова. М., Атом-издат, 1965.
349. Полубояринов Д. И. и др. О влиянии разупорядоченности кристаллической структуры BN на его спекание.— «Огнеупоры», 1971, № 2, с. 27.
350. Полубояринов Д, И., Садковский Е. П., Кузнецова И, Г. «Труды Мос-> ковского хим.-техн. ин-та. Силикаты», 1973, вып. 22, с. 79.
351. Портной К. И., Левинский Ю. В., Ромашов В. М. Диаграмма состояния Мо—В. — «Изв. АН СССР. Металлы», 1967, № 4, с. 171.
352. Портной К. И., Самсонов Г. В. Боридные сплавы. М., ВИНИТИ, 1959.
353. Портной К. И., Тимофеев В. А., Тимофеева В. Н. Термодинамика реакций получения гексаборидов редкоземельных элементов.-— «Изв. АН СССР. Неорганические материалы», 1965, т. 1, № 9, с. 1513—1520.
354. Портной К. И. и др. Диаграмма состояния системы никель — бор. — «Порошковая металлургия», 1967, № 2, с. 15.
355. Портной К. И. и др. Диаграмма состояния системы W—В,—г Там же, 1967, № 5, с. 75.
356. Портной К. И. Ромашов В. М. Диаграмма состояния Re—-fe.—Там же,/ 1968, № 2, с. 41.
357. Портной К. И., Левинская М. X., Ромашов В. М. Диаграмма состояния Fe—В.— Там же, 1969, № 8, с. 66.
358. Портной К. И., Ромашов В. М., Романович И. В. Диаграмма состояния системы Сг—В.— Там же, 1969, № 4, с. 51.
359. Портной К. И., Ромашов В. М., Буробина Л. Н. Диаграмма состояния системы цирконий — бор.— Там же, 1970, № 7, с. 68—71.
360. Портной К. И., Ромашов В. М., Салибеков С. Е. Диаграмма состояния системы Та—В.— Там же, 1971, № 11, с. 89.
361. Портной К. И. и др. Диаграмма состояния системы Hf—В.— «Изв. АН СССР. Неорганические материалы», 1971, т. 7, № 11, с. 1987—1991.
362. Портной К. И., Ромашов В. М. Бинарные диаграммы состояния ряда элементов с бором.—«Порошковая металлургия», 1972, № 5, с. 48—56.
363. Пост Б., Московия Д., Глезер Ф. В ки.: Жаропрочные и коррозионно-стойкие металлокерамические материалы. М., Оборонгиз, 1959, с. 183.
364. Пост Б., Москович Д., Глезер Ф. Бориды редкоземельных элементов,— В кнл Металлургия редкоземельных металлов. Пер. с англ, М., Изд-во иностр, лит., 1962, с. 182.
365. Приданцев М. В., Мещеринова О. Н., Пигузов Ю. В. Изучение механизма влияния бора методом внутреннего трения. — «Докл. АН СССР», 1956, т. Ill, Хе 1, с. 98.
366. Приходько Л. И. Перспективы создания материалов со специальными физическими свойствами в системе алюминий — бор — азот. — «Вести. Киевского политехи, ин-та, сер. мех.-технологическая», 1965, № 2, стр. 59.
367. Прилепский В. Н. н др. Энтальпия и теплоемкость гексаборидов европия, неодима, самария при 300—1300° К. — «Изв. АН СССР. Неорганические материалы», 1970, т. 6, № 11, с. 2069—2070.
368. Просвирин В. И., Герасимов Л. В. Бороалитирование пастами, содержащими малое количество алюминия. — В кн.: Защитные покрытия на металлах. Киев, «Наукова думка», 1971, вып. 5, с. 132.
369. Пчелкина М. А., Лахтин Ю. М. Газовое борирование в среде треххлористого бора. — «Металловедение и терм, обработка металлов», 1960, № 7, с. 40.
370. Пшокин В. П., Захаров А. М., Новиков И. И. Растворимость бора и ниобия в твердом состоянии. — «Изв. вузов. Цветные металлы», 1971, № 1, с. 112.
371. Радченко А. Ф. и др. Термическое разложение арсенида бора. — «Изв. АН СССР. Неорганические материалы», 1972, т. 8, № 4, с. 767, 768.
372. Раковский В. С./ Самсонов Г. В., Ольхов И. И. Основы производства твердых сплавов. М., Металлургиздат, 1960.
347
373. Резницкий Л. А. Приближенная оценка теплот образования некоторых соединений переходных металлов IV и V групп.—«Журн. физ-химии»; 1966, т. 40, № 1, с. 134—139.
374. Рещикова А. А. Анализ гексаборида мышьяка. — «Заводск. лаборатория», 1965, т. 31, № 2, с. 164.
375. Рещикова А. А., Медведева 3. С., Дмитриева Г. Ф. Определение основных компонентов в полупроводниковых соединениях бора с мышьяком и фосфором. — «Труды комис. по аналит, химии АН СССР», 1968, т. 16, с. 216—222.
376. Роберт Виллардсон, Харвет Геринг. Полупроводниковые соединения AT1IBV. М., «Металлургия», 1967. 1
377. Робертс Б. Сверхпроводящие материалы и их свойства. — В кн.: Новые материалы и методы 'исследования металлов и сплавов. Пер. с англ. М., «Металлургия», 1966, с. 9—15.
378. Ромашов В. М. Взаимодействие никеля с гексаборидом самария и бором.—«Порошковая металлургия», 1970, № 9, с. 80—86.
379. Русин А. Д., Татевский В. М. Состав продуктов сгорания бора при 3000—3200° К и теплота образования ВОг. — «Журн. прикл. хщмн», 1965, т. 38, № 8.
380. Рыбакова Г. А. Автореф. канд. дис. Термохимическое изучение боридов бериллия и магния. Л., ГИПХ, 1972.
381. Савицкий Е. М., Тылкина М. А., Поварова К. Б. Сплавы рения. М., «Наука», 1965.
382. Савицкий Е. М., Тимофеева И. И., Бакаринова В. И. Исследование химической стойкости диборида гафния. — «Изв. АН СССР. Неорганические материалы», 1970, т. 6, № 1, с. 120.
383. Самсонов Г. В. Физические свойства некоторых фаз внедрения. — «Докл. АН СССР», 1953, т. 93, с. 689.
384. Самсонов Г. В., Меерсон Г. А. Вакуумно-термическое получение боридов тугоплавких металлов.—«Журн. прикл. химии», 1954, т. 27, № 10, с. 1115—1120.
385, Самсонов Г. В. К вопросу о прохождении реакций восстановления двуокиси титана углеродом через стадви низших окислов; — Там же, 1955, т. 28, с. 919.
386. Самсонов Г. В., Нешпор В. С. Исследование некоторых закономерностей образования сплавов изоморфных боридов. — Там же, 1955, т. 29, с. 846.
387. Самсонов Г. В., Петраш Е. В. Некоторые физико-химические свойства сплавов борида и нитрида титана. — «Металловедение и терм, обработка металлов», 1955, № 4, с. 19—24.
388. Самсоиов Г. В., Латышева В. П. К «опросу о химических соединениях бора с кремнием. — «Докл. АН СССР», 1955, т. 105, № 3, с. 499.
389. Самсоиов Г. В., Журавлев Н. Н. О бориде алюминия AIB12.—’«Физ. металлов и металловедение», 1955, т. 1, вып. 3, с. 564—566.
390. Самсонов Г. В. Электропроводность некоторых соединений переходных металлов с бором, углеродом, азотом и их сплавов. — «Журн. теор. физ.» 1956, т. 26, с. 716.
391. Самсонов Г. В., Нешпор В. С. О сверхпроводимости боридов, карбидов, нитридов н силицидов переходных .металлов. — «Журн. экоперим. и теор. физ.», 1956, т. 30, № 6, с. 1143.
392. Самсонов Г. В., Зорина О. Н. Приготовление и некоторые свойства борида тория. — «Журн. неорган. химии», 1956, т. 1, с. 2260.
393. Самсонов Г. В. Теплоты образования боридов некоторых переходных металлов. — «Журн. физ. химии», 1956, т. 30,' с. 2057.
394. Самсонов Г. В. Физико-химические свойства соединений тугоплавких металлов с бором, углеродом, азотом и особенности двойных сплавов.— «Изв. Сектора физ.-хим. анализа. ИОНХ АН СССР», 1956, т. 27, с. 97.
395. Самсонов Г, В., Гродштейн А. Е. Некоторые свойства гексаборидов щелочно- и редкоземельных металлов. — «Жури. физ. химии», 1956, т. 30, с. 379.
348
396. Самсонов Г. В., Латышева В. П. Реактивная диффузия бора и углерода в переходные металлы IV—VI групп. — «Физ. металлов и металловедение», 1956, т. 2, № 2, с. 309.
397. Самсонов Г. В., Марковский Л. Я. Химия боридов. — «Успехи химии», 1956, т. 25, № 2, с. 190—241.
398. Самсонов Г, В. Докт. дис. Некоторые физико-химические особенности соединений переходных металлов с бором, углеродом, азотом и кремнием. М., Моск, ин-т цвета, мет. и золота, 1956.
399. Самсонов Г. В., Журавлев Н. Н., Амнуэль И. Г. К вопросу о физико-химических свойствах сплавов -бора с углеродом.—«Физ. металлов и металловедение», 1956, т. 3, вып. 2, с. 309—313.
400. Самсонов Г. В. Фазовая диаграмма системы W—В.— «Докл. АН СССР», 1957, т. 113, с. 1299.
401. Самсонов Г. В. Промежуточные стадии реакции образования карбидов титана, циркония, ванадия, ниобия и тантала. — «Укр. хим. жури.», 1957, т. 23, № 3, с 287.
402. Самсонов Г. В. Очистка карбида бора от примеси свободного углерода. Информ, письмо № 33 ИПМ АН УССР. Киев, 1957.
403. Самсонов Г. В. Современное состояние исследования диаграммы системы бор — углерод. — «Журн. физ. химии», 1958, т. 32, вып. 10, с. 2424—2429.
404. Самсонов Г, В., Нешпор В. С. Некоторые физические характеристики металлоподобных соединений. — В кн.: Вопросы порошковой металлургии и прочности материалов. Вып. 1, Киев, Изд-во АН УССР, 1958, с. 3.
405. Самсонов Г. В., Стрельшкова Н. С. Про термоелектрорушшну силу дея-ких металлопод!бних борид!в i карб!д!в у napi з мщдк>. — «Укр. ф!з. журн.», 1958, т. 3, № 1, с. 135—138.
406. Самсонов Г. В., Нешпор В. С. О сверхпроводимости металлоподобных соединений. — «Научные труды Московского ин-та цвет. мет. и золота». М. ,1958, т. 29, с. 361—366.
407. Самсонов Г. В., Нешпор В. С. О связи работы выхода электронов из гексаборидов с их электронным строением. — «Докл. АН СССР», 1958, т. 122, с. 1021—1023.
408. Самсонов Г. В. Магниетермическое получение карбида бора. — «Укр. хим. журн.», 1958, т. 25, с. 674—679.
409. Самсонов Г. В., Падерно Ю. Б. Способ получения боридов редкоземельных металлов и их окислов. — «Бюл. изобрет.» 1959, № 15, с. 48.
410. Самсонов Г. В. Силициды и их использование в технике. Киев, Изд-во АН УССР, 1959.
411. Самсонов Г. В. Получение н свойства диборида скандия. — «Докл. АН СССР», 1960, т. 133, с. 1340—1344.
412. Самсонов Г. В., Серебрякова Т. И. Получение боридов металлов П-а подгруппы периодической системы. — «Журн. прикл. химии», 1960, т. 33, с. 563.
413. Самсоиов Г, В. и др. О взаимодействии галлия, индия, талия, германия, олова и свинца с бором. — «Жури, струит, химии», 1960, № 4, с. 458—463.
414. Самсонов Г. В. Термофизические свойства спланон в системах бор — азот, бор — углерод, кремний — азот и бор — кремний — углерод, — «Порошковая металлургия», 1961, № 3, с. 53—62.
415. Самсоиов Г. В., Падерио Ю. Б,, Крейнгольд С. У. Получение гексаборида лантана. — «Журн. прикл. химии», 1961, т. 34, № 1, с. 10—15.
416. Самсонов Г. В., Падерно Ю. Б. Бориды редкоземельных металлов, Киев, Изд-ъо АН УССР, 1961.
417. Самсонов Г. В., Серебрякова Т. И., Болгар А. С. Получение и некоторые физико-химические свойства гексаборида стронция. — «Журн. неорг. химии», 1961, т. 6, с. 2243—2248.
418. Самсонов Г. В., Портной К. И. Сплавы на основе тугоплавких соединений. М., Обороигиз, 1961.
419. Самсонов Г. В., Верейкииа Л. Л. Фосфиды. Киев, Изд-во АН УССР, 1961.
349
420. Самсонов Г. В., Синельникова В. С. До питания про ширину заборюне-но! ?оин карбщу бору.—«Укр. ф!з. журя.», 1961, т. 6, № 5, с. 687—690.
421. Самсонов Г. В., Слепцов В. М. Попередшй вар1ант д!аграми система бор — кремшй. — «Доповш АН УРСР», 1962, № 8, с. 1066—1068.
422. Самсонов Г- В., Решетник Ю. Г., Власов К. Р. Автоматизация производственных процессов в машиностроении. Киев, Гостехиздат, 1963, с. 47.
423. Самсонов Г. В. К вопросу о связи поведения борсодержащих фаз при действии нейтронного облучения с особенностями их кристаллического строения. — «Атомная энергия», 1963, т. 14, вып. 6, с. 588—590.
424. Самсонов Г. В. Тугоплавкие соединения. М., Металлургиздат, 1963.
425. Самсонов Г. В., Слепцов В. М. Исследование растворимости бора в кремнии^— «Журн. неоргаи. химии», 1963, т. 8, вып. 8, с. 2009—2011.
426. Самсоиов Г. В., Титков Ю. Б. Получение монофосфида бора. —• «Жури, прикл. химии», 1963, т. 36, вып. 3, с. 669, 670.
427. Самсонов Г. В.( Верхоглядова Т. С., Вдовенко С. А. Химические соединения системы скандий — бор и их свойства.'—В кн.: Вопросы теории и применения редкоземельных металлов. М., «Наука», 1964, с. 163.
428. Самсонов Г. В. Тугоплавкие соединения редкоземельных металлов с неметаллами. М., «Металлургия», 1964.
429. Самсонов Г. В., Слепцов В. М. Приготовление сплавов бора с кремнием. — «Порошковая металлургия», 1964, Ns б, С. 58—67.
430. Самсонов Г. В., Кислый П. С. Защитные чехлы термопар для непрерывного контроля температуры расплавленных металлов и сплавов. — «Огнеупоры», 1965, № 4, с. 28—32.
431. Самсонов Г. В. и др. Непрерывный контроль температуры жидкой стали в период доводки мартеновской плавки. Киев, Гостехиздат, 1965.
432. Самсонов Г. В. Сверхпроводимость тугоплавких соединений. — В кн.: Металловедение и металлофизика сверхпроводников. М., «Наука», 1965.
433. Самсонов Г. В. Роль образования стабильных электронных конфигураций в формировании свойств химических элементов.—«Укр. хим. журн.», 1965, т. 31, № 12, с. 1233—1247.
434. Самсоиов Г. В., Стасовская В. В. Абразивная способность некоторых тугоплавких соединений. — «Абразивы и алмазы», 1965, №5(50), с. 15—17.
435. Самсоиов Г. В. К вопросу о классификации карбидов. — «Порошковая металлургия», 1965, Ns 1, с. 98—106.
436. Самсонов Г. В. Роль образования стабильных электронных конфигураций в формировании свойств химических элементов и соединений. — Там же, 1966, № 12, с. 49—61.
437. Самсонов Г. В., Денбновецкая Е. Н. Некоторые закономерности сверхпроводимости металлидов. — В кн.: Металловедение, физико-химия И металлофизика сверхпроводников. М., «Наука», 1967, с. 137.
438. Самсонов Г. В., Падерио Ю. Б., Рудь Б. М. К вопросу о проводимости переходных металлов. — «Изв. вузов СССР. Физика», 1967, Ns 9, с. 129—131.
439. Самсонов Г. В. Исследование радиационной стойкости боридов.— «Атомная энергия», 1968, т. 24, вып. 2, с. 191, 192.
440. Самсонов Г. В., Гребенкина В. Т. Температурный коэффициент электросопротивления некоторых тугоплавких соединений. — «Порошковая металлургия», 1968, № 2, с. 35—40.
441. Самсонов Г. В., Кондратов И. Я- О связи работы выхода с физическими характеристиками некоторых переходных металлов. — «Изв. вузов. Физика», 1968, № 6, с. 103—105.
442. Самсонов Г. В., Стасовская В. В., Казаков В. К. Абразивная способность некоторых неметаллических тугоплавких соединений. — «Порошковая металлургия», 1968, Ns 3, с. 37—41.
443. Самсонов Г. В., Подчерняева И. А., Фоменко В. С. Коэффициент излучения тугоплавких соединений. — «Порошковая металлургия», 1969, Ns 5, с. 43—50.
350
444. Самсоиов Г. В., Панасюк А. Д., Козина Г. К. Контактна взабмод1я кар-б1д!в кремнию I бору та ix сполук з рщкими металами. — «Доповцп АН VPCP. Сер. А», 1969, № 5, с. 468—471.
445. Самсонов Г. В., Жунковский Г. Л. Исследование механизма взаимодействия тугоплавких металлов с бором при борировании в вакууме. — «Порошковая металлургия», 1970, № 6, с. 44—52.
446. Самсоиов Г. В., Косенко В. А. Исследование условий получения боридов платиноидов. — Там же, 1971, № 8, с. 25—29.
447. Самсонов Г. В., Ковенська Б. А., Серебрякова Т. I. Про х!м!чний зв’язок у боридах перех!дних метал!в. — «Доповщ! АН УРСР. Сер. А», 1971, № 12, с. 1127—1129.
448. Самсонов Г. В. и др. Термическое расширение диборидов переходных металлов IV и V групп.—’«Теплофизика высоких температур», 1971, т. 9, № 1, с. 195—197.
449. Самсонов Г. В., Ковенская Б. А., Серебрякова Т. И. Некоторые физические характеристики диборидов переходных металлов IV и V групп,— «Изв. вузов. СССР. Физика», 1971, № 1, с. 19—23.
450. Самсонов Г. В., Прядко И. Ф., Прядко Л. Ф. Конфигурационная модель вещества. Киев, «Наукова думка», 1971.
451. Самсонов Г. В., Фоменко В. С., Куницкий Ю. А. Термоэмиссиоиные свойства боридов переходных металлов IV группы.— «Радиотехника и электроника», 1971, т. 16, № 7, с. 1302—1304.
452. Самсонов Г. В. и др. Электронный спектр и физические свойства диборидов титана, ванадия и хрома, — «Изв. вузов СССР. Физика» 1972, № 6, с. 37—42.
453. Самсонов Г. В. и др. Теплопроводность диборидов переходных металлов IV—VI групп. — «Теплофизика высоких температур», 1972, т. 10, №6, с. 1324—1326.
454. Самсонов Г. В., Горячев, Ю. М., Ковенська Б. А. Про деяк! особливост! температурно! залежиост! електроф!зичних властивостей М02В5 I W2B5.— «Допов!д1 АН УРСР. Сер. А», 1972, № 10, с. 943—946.
455. Самсонов Г. В., Куницкий Ю. А., Косенко В. А. Электросопротивление боридов железа, кобальта и никеля. — «Физ. металлов и металловедение», 1972, Т. 33, № 4, с. 884—887.
456. Самсонов Г. В. и др. Исследование условий получения и свойств соединения IrBi.i. — «Изв. АН СССР. Неорганические материалы», 1972, ь 8, № 4, с. 771, 772.
457. Самсоиов Г. В. и др. Некоторые свойства боридов палладия.—«Изв. вузов СССР. Физика», 1972, № 6, с. 146—148.
458. Самсонов Г. В., Дроздова ' С. В. Сульфиды. М., «Металлургия», 1972.
459. Самсонов Г. В., Панасюк А. Д., Боровикова М. С. Контактное взаимодействие тугоплавких соединений с жидкими металлами. •— «Порошковая металлургия», 1973, № 6, с. 51.
460. Самсонов Г. В., Панасюк А. Д., Боровикова М. С. Контактное взаимодействие тугоплавких соединений с жидкими металлами.— Там же, 1973, № 5, с. 61.
461. Самсонов Г. В., Эпик А. П. Тугоплавкие покрытия. М., «Металлургия», 1973.
462. Самсонов Г. В., Фоменко В. С., Куницкий Ю. А. Термоэмиссионные свойства боридов переходных металлов. — «Изв. вузов. Физика», 1972, № 4, с. 41; «Rev. Intern. Hites Temp. Refract.», 1973, v. 10, p. 11—14. 462a. Самсонов Г. В. Нитриды. Киев, «Наукова думка», 1969.
4626. Самсонов Г. В. Неметаллические нитриды. М., «Металлургия», 1969.
463. Сачко А. П. Авт. свид. № 276271. «Способ получения борида кальция».— «Бюл. изобрет.», 1965, № 22.
464. Семенченков А. Т. и др. Выходные характеристики цериевого диода с катодами из диборида циркония. — «Теплофизика высоких температур», 1968, № 5, с. 826.
465. Серебрякова Т. И., Падерно Ю. Б., Самсонов Г. В. Коэффициенты излу
351
чения порошков некоторых тугоплавких соединений. — «Оптика и спектроскопия», 1960, т. 8, с. 410—412.
466. Серебрякова Т. И., Самсонов Г. В. Боротермический способ получения боридов. — «Укр. хим. журн.», 1963, т. 29, № 8, с. 876—887.
467. Серебрякова Т. И. Природа химической связи в соединениях переходных металлов с бором. — «Изв. АН СССР. Неорганические материалы», 1965, т. 1, № 10, с. 1811—1815.
468. Серебрякова Т. И., Ковеиская Б. А. Физические свойства боридных фаз хрома. — Там же, 1966, т. 2,. № 12, с. 2134—2138.
469. Серебрякова Т. И. Исследование условий получения боридов кобальта.— «Укр. хим. журн.», 1966, т. 32, № 10, с. 1067—1070.
470. Серебрякова Т. И. Автореф. канд. дис. Исследование условий получения и некоторых свойств боридов щелочноземельных и переходных металлов. Киев, ИПМ АН УССР, 1967.
471. Серебрякова Т. И., Самсоиов Г. В. Исследование условий получения боридов хрома. — «Журн. прикл. химии», 1967, т. 60, № 1, с. 3.
472. Серебрякова Т. И.. Марек Э. В. Исследование условий получения порошков гексаборидов кальция и бария. — «Порошковая металлургия», 1969, № 8, с. 3—9.
473. Серебрякова Т. И., Марек Э. В. Получение боридов боротермическим восстановлением окислов металлов в вакууме. — В кн.: Металлотермические процессы в химии и металлургии. Новосибирск, «Наука», 1971, с. 78.
474. Серебрянский В. Т., Эпельбаум В. А., Жданов Г. С. К диаграмме состояния системы алюминий — бор. — «Докл. АН СССР», 1961, т. 141, № 4, с. 884—886; Диаграмма состояния системы алюминий — бор. — «Журн. неорган. химии», 1967, т. 12, вып. 9, с. 2486—2493.
475. Серебрянский В. Т.,. Эпельбаум В. А. О фазовой диаграмме системы алюминий — бор. — «Журн. структурн. химии», 1961, т. 2, №6,
с. 748—756.
476. Синельникова В. С., Подергин В. А., Речкин В. Н. Алюминиды. Киев, «Наукова думка», 1965.
477. Сирота Н. Н., Боднар И. В., Виткина И. 3. Ширина запрещенной зоны и магнитная восприимчивость фосфида бора. — В кн.: Химическая связь в кристаллах. Минск, «Наука и техника», 1969, с. 492—494.
478. Славинский М. П. Физико-химические свойства элементов. М., Гостех-издат, 1952, с. 171, с. 226.
479. Слепцов В. М, Автореф. канд. дис. Исследование условий получения и свойств некоторых тугоплавких соединений бора с азотом и кремнием. Киев, ИМП АН СССР, 1962.
480. Слепцов В. М., Самсонов Г. В. До питания про розчиншсть бору в кремнн. — «Допов1д1 АН У'РСР», 1959, вил. 9, с. 982—985.
481. Смирягин А. П., Квурт О. С. Диаграмма состояния никель — бор.— В кн.: Металловедение и обработка цветных металлов и сплавов. М., Метгиз, 1965, с. 12—17.
482. Соболев А. С., Федоров Т. Ф. Диаграмма состояния системы никель — бор. — «Изв. АН СССР. Неорганические материалы», 1967, т. 3, № 4, с. 723.
483. Стасовская В. В. Измерение абразивной способности порошков карбидов и боридов тугоплавких металлов. — «Порошковая металлургия», 1965, № 11 (35), с. 52—54.
484. Стасовская В. В. Автореф. канд. дис. Исследование твердости, хрупкости и абразивной способности порошков тугоплавких соединений. Киев, ИПМ АН УССР, 1967,
485. Степанова А. Л., Уманский М. М. Параметры элементарных ячеек гексаборидов.— В кн.: Бор (Труды конференции по химии бора и его соединений). М., Госхимиздат, 1958, с. ЮЗ.
486. Стерлядкина 3. К. н др. О катализаторах, получаемых восстановлением солей металлов VIII группы боргидридом натрия. — «Изв. АН СССР. Сер. Химия», 1972, № 6, с. 1240.
352
48?. Стнльбанс Л. С. Физика полупроводников. М., «Советское радио», 1967.
488. Сычев В. С. Некоторые закономерности легирования боридами переходных металлов IV—VI групп. — «Электронная обработка материалов», 1972, № 5, с. 20.
489. Сычев В. С. Закономерности эрозии боридов переходных металлов IV—VI групп при электроискровом легировании. — Там же, 1973, № 1, с. 31.
490. Сычев В. С. Автореф. канд. дис. Исследование электроискрового легирования переходных металлов- IV—VI групп тугоплавкими боридами. Киев, ИПМ АН УССР, 1973.
491. Татевский В. М., Коптев Г. С., Мальцев А. А. Колебательные спектры молекул ВгО3 и ВгЗз. — «Оптика и спектроскопия», 1961, т. 11, вып. 6, с. 724—729.
492. Телегус В. С. Автореф. докт. дис. Исследование тройных систем переходных металлов VI группы с бором или углеродом и некоторых родственных систем. Львовский Госуниверситет. Львов, 1970.
493. Термодинамические свойства индивидуальных веществ. М., Изд-во АН СССР, 1962.
494. Термодинамические свойства неорганических веществ. М., Атомиздат, 1965, с. 172.
495. Тимофеев В. А., Тимофеева Е. Н. Стандартные теплоты образования окислов и гексаборидов редкоземельных элементов. — «Журн. неорган. химии», 1966, т. 11, вып. 6, с. 1233—1235.
496. Тимофеева Н. И., Левинская М. X., Крайнова 3. И. Исследование химической стойкости боридов Ni и Fe. — «Изв. АН СССР. Неорганические материалы», 1970, т. 6, № 9, с. 1613.
497. Тугоплавкие карбиды. Под ред, чл.-кор. АН УССР Г. В. Самсонова, Киев, «Наукова думка», 1970, с. 132.
498. Трофимов Е. А. и др. Спекание гексаборида лантана, активированного никелем.—«Электронная техника. Сер. 6. Материалы», 1972, вып. 1, с. 130.
499. Туманов А. Г., Портной К. И. Тугоплавкие материалы в машиностроении. Справочник. М., «Машиностроение», 1967.
500. Факидов И. Г., Тимощук В. И. Влияние сильного импульсного магнитного поля на магнитные превращения в Мп3В4. — «Физика твердого тела», 1970, т. 12, № 1, с. 273.
501. Федышин Я. И. Автореф. канд. дис. Рентгенографическое исследование тепловых колебаний атомов . некоторых кубических структур. Львов, Львовский ун-т, 1972.
502. Физико-химические свойства окислов. Справочник. Под ред. чл.-кор. АН УССР Г. В. Самсонова. М., «Металлургия», 1969.
503. Фирсова Л. П., Несмеянов А. Н. Степень диссоциации и парциалыые давления пара окислов лития, бериллия, бора, кремния и свинца. — «Журн. физ. химии», 1960, т. 34, № 11, с. 2615.
504. Фоменко В. С., Самсонов Г. В. Коэффициенты излучения тугоплавких соединений. — «Огнеупоры», 1962, № 1, с. 40.
505. Фоменко В. С., Подчерняева И. А. Эмиссионные и адсорбционные свойства веществ и материалов. Справочник. Под ред. чл.-кор. АН УССР Г. В. Самсонова. М., Атомиздат, .1975.
506. Фраигулян Г. Д. и др. О природе никельборидного катализатора. — «Изв. АН СССР. Сер. химия», 1972, № 10, с. 2162.
507. Францевич I. М., Лященко А. Б. Характеристична температура, модуль Юнга i середнэквадратичне эмпцення атом!в у гратш борид1в титану, ванадпо, хрому, зал1за, кобальту i циркошю.—«Доп. АН УРСР. Сер. А», 1969, т. 1, с. 64.
508. Френкель Я. И. Введение в теорию металлов. М., Физматгиз, 1958.
509. Фрумин Е. П., Якобашвили С. Б., Семкин Ю. Р. Поверхностное натяжение, плотность н вязкость расплавленных боратов. — В кн.: Поверхностные явления в расплавах и возникающих из них твердых фазах. Нальчик, Кабардино-балкарское книжное изд-во, 1968, с. 72, 73.
353
510. Функе В. Ф., Юдковский С. М. Исследование условий получения, структуры и свойств боридов молибдена и сплавов на его основе. —«Изв. АН СССР. Отд. техн. иауц. Металлы», 1962, № 4, с. 126—132.
511. Функе В. Ф., Юдковский С. М. Получение борида циркония. — «Порошковая металлургия»» 1963, № 4, с. 49.
512. Хансен М., Андерко К. Структуры двойных сплавов, М., Металлургиз-дат, 1962.
513. Харитонов В. И., Макуиин М. С., Шамрай Ф. И. О совместной растворимости вольфрама и бора в молибдене. — «Изв, АН СССР, Отд. техн, наук. Металлы», 1968» № 6, с. 227—231.
514. Харитонов В. И., Шамрай Ф. И. Диаграмма состояния системы молибден —- вольфрам — бор. — В кн.: Диаграммы состояния металлических систем. М., «Наука», 1971, с. 109—112.
515. Харитонов В. И. и др. Механические свойства сплавов системы Мо—В.— «Изв. АН СССР. Отд. техн, наук» Металлы», 1972, Ms 5, с. 133.
516. Цянь Сюэ-сеиь. Физическая механика. Пер. с китайского. М., «Мир», 1965.
517, Чабан Н. Ф., Кузьма Ю. Б. Изотермические разрезы система {Со, Ni}— {Al, Si}—В. — «Изв. АН СССР, Неорганические материалы», 1973, т. 9, № 12, с. 2136—2140.
518. Шамрай Ф. И., Федоров Т. Ф. К вопросу о диаграмме состояния Сг—В. — В кн.: Исследование металлов в жидком и твердом состоянии. М., «Наука», 1964.
519. Шафиров К. А. О расчете энтропии твердых веществ. — «Журн. физ. химии», 1966, т. 40, № 1, с. 218—220.
520, Шейндлин А. Е.„ Белевич И. С., Кожевников И. Г. Энтальпия и теплоемкость карбида бора .в интервале температур от 273 до 2600° К. —» «Теплофизика высоких температур», 1972, т. 10, № 2, с. 421—423.
521. Шефер Г. Химические транспортные реакции. М., «Мир», 1964.
522. Шмарцев Ю. В., Валов Ю. А., Борщевский А. С.—В кн.: Тугоплавкие алмазоподобные полупроводники. М., «Металлургия», 1964.
523. Шпольскнй Э, В. Атомная физика. Т. 2. М., Гостехиздат, 1952.
524, Шутов И. Д., Добровольский Л. Г. Газопорошковая наплавка карбидом бора. — «Порошковая металлургия», 1971, Ms 9, с. 30—34.
525. Шпильрайн Э. Э., Колешнлова Д. Н. Измерение энтальпии расплавлен^ ной окиси бора при высоких температурах. — «Теплофизика высоких температур», 1972, т. 10, № 1, с. 193.
526. Электронное строение и физические свойства твердого тела. Ч. 2. Киев, «Наукова думка», 1972.
527. Эллиот Р. П. Стрктуры двойных -сплавов, Пер. с англ. М., «Металлург гия», 1970.
528, Эпельбаум В. А. и др. О фазах, образующихся в системе Сг—В. — «Журн. неоргаи. химии», 1958, т. 3, вып. 11, с. 2545—2552.
529, Эпельбаум В. А., Старостина М. И. Термохимические исследования бора и некоторых боридов. — В кн.: Бор (Труды конференции по химии бора И его соединений). М., Госхимкздат, 1958, с. 97,
530. Эпельбаум В. А., Гуревич М. А. К исследованию фазовой диаграммы системы цирконий — бор. Об образовании твердого раствора бора в цирконии. К исследованию фазы, отвечающей составу ZrBs-—«Журн. физ. химии», 1957, т. 31, вып. 3, с. 708—712; 1958, т. 32, вып. 10, с. 2274—2282.
531. Яио Момосабуро, Комацу Якитоси. Способ производства боралюминиевых сплавов. Японск. пат. № 23455 (4.11.63)..
532. Adamsky R. F. Unit Cell Space Group of Orthorombic SiBe. — «Acta crystallogr.», 1958, v. II, N 10, p. 744, 745.
533. Armed H. Proc. Fifth European Congress on Electron Microscopy, Universities of engineering Office. Cambridge, 1972.
534. Aleonard S. Preparation de composes bore —silicium par Electrolyse ig‘ nee. —• «Bull. Soc. Chirn. France», 1961, N I, p. 34—36.
535. Allen В. C. Corrosion of Refractory Metals in Aqueous and Gaseous Media.—> «React. Mater.», 1970, v. 13, N 1, p. 47, 48.
354
536. Allert Й. D. The Solid Solution Series, Ёогоп — Boron darbide. «J. Amer. Chem. Soc.», 1953, v. 75, N 14, p. 3582, 3583.
537. Alliegro Richard A. Method of Preparation Plates of Boron Carbide Powder. USA Patent N 3440312 (22.04.69).
538. Alstrup I., Johnson K. Empirical Third Neighbour LCAO Energy Bonds of Silicon. — «Phys. Stat. Sol.», 1968, v< 28, N 2, p. 555—564.
539. Andersson S., Kiessling R. Investigations on the Binary Systems of Boron with Chromium, Columbium, Nickel and Thorium, Including a Discussion of the Phase «TjB» in the Ti—В System. — «Acta chem. scand.», 1950, v. 4, p. 160—164.
540. Andersson S., Lundstrom T. The Crystal Structure of CrB4.— «Ibid., 1968, v. 22, p. 3103—3110.
54Ц Andersson S. The Notes of the Crystal Structure of MnB4. — Ibid., 1969, v. 23, p. 687.
542. Andersson S., Lundstrom T. The Solubility of Cromium in P-Rhombohed-ral Boron as Determined in CrB4t by Single-Crystal Diffractometry.— «J. Solid Stat. Chem.», 1970, v. 2, p. 603—611.
543. Andersson S., Karlsson J. The Crystal Structure of MnB4.— «Acta chem. scand.», 1970, v. 24,.N 5, p. 1791—1794.
544. Andrieux J. L., Weiss G. Preparation des composes du molybdene et du tungstene par electrolyse ignee. — «Bui. SoC. Chim. France», 1948, v. 15, N 5—6, p. 598—601.
545. Andrieux L. Recherches sur le’lectrolyse des oxides metalliques Dissous dans 1'anhydride borique ou les borates foudas. — «Ann. Chimie», 1929, v. 12, p. 422.
546. Andrieux L., Barbetty D. Sur les borures a lealies. — «Compt. rend. Acad, sci. colon.», 1932, v. 194, p. 1573. j
547. Armas B., Trombe F. Depots en phase vapeur, sur «front chaud solaire, de borures de molybdene et de tungstene par decomposition thermique de melages d'halogenures. — Ibid., 1971, v. 272, p. 286, serie C.
548. Armas B., Trombe L. Depots chimiques eu phase gaseuse de borures de niobium et de tantal. — Ibid., 1972, v. 274, N 12, p. 1134.
549. Armington Alton F. Vapor transport of Boron, Boron Phosphide and Boron Arsenide. — «Cryst. Growth», 1967, v. I, N I, p. 47, 48.
550. Armington A. F., Bufford, I., Rising I. Preparation and Properties of B13P2 and B13As2 (Intern. Symposium of Boron. Abstracts of papers, October 1972, Tbilisi, USSR).
551. Aronsson B., Aselius J. The Effect of Boron on the Formation of O-FeCr at 700° C. — «Acta chem. scand.», 1958, V. 12, N 7, p. 1476—1480.
552. Aronsson B., Lundgren G. X-Ray Investigation on Me—Si—В Systems (Me—Mn, Fe, Co). I. Some Features of the Co—Si—В and Fe—Si—В Systems. — «Acta chem. scand.», 1959, v. 13, N 3, p. 433—441.
553. Aronsson B. The Crystal Structure of RU7B3. — «Acta chem. scand.», 1959, v. 13, N I, p. 109—114.
554, Aronsson B., Stenberg E-> Aselius J. Borides of Rhenium and the Platinum Metals. —Ibid., 1960, v. 14, p. 733.
555. Aronsson B., Engstrom I. X-Ray Investigations on Me—Si—В Systems (Me Mn, Fe, Co). II. Some Features of the Fe—Si—В and Mn—Sr—В Systems. — «Acta chem. scand.», 1960, v. 14, p. 1403—1413.
556. Aronsson B., Backman M., Rundqvist S. The Crystal Structure of Re3B.— t.Acta chem. scand.», 1960, v. 14, N 5, p. 1001.
557. Aronsson В A Note on the Compositions and Crystal Structures of MnB>, MnsSi, MnsSis and FeSi2. — Ibid., 1960, v. 14, N 6, p. 1414—1423.
558. Aronsson B. Borides and Silicides of the Transition Metals. — «Arkiv kemi», 1961, Bd 16, N 36, S. 379. '
559. Aronsson B., Rundqvist S. Structural Features of some Phases Related to Cementite. — «Acta cryst.», 1962, v. 15, N 9, p. 878—887.
560. Aronsson B. The Crystal Structure of RuB2, OsB2 and IrBi.ss and some General Comments on the Crystal Chemistry of Borides in the Composition Range MeB—MeB3. — «Acta chem. scand.», 1963, v. 17, N 7, p. 2036.
355
5(j1. Aronsson B„ Lundstrom T., Rundqvist S. Borides, Silicides and Phosphides. Methuen. London, 1965.
562. Aselius J. The Crystal Structure of RunBs. —«Acta chem. scand.», 1960, v. 14, N 10, p. 2169—2196.
563. Ashbee К. H. G., DuBose. С. К- H. Dislocation Models in Boron Carbide with Spesial Reference to Non-stoichiometry.—«Acta metallurgies», 1972, v. 20, N 2, p. 241—245.
564. Atkins A. G., Tabor D. Hardness and Deformation Properties of Solids at Very High Temperatures. — «Proc. Roy. Soc.», 1966, v. A292, N 1431, p. 441—459.
565. Austin A. E. X-Ray Diffraction Data for Compounds in Systems LiaO— SiOa and Bad—SiO2.— «J. Amer. Ceram. Soc.», 1947, v. 30, N 7, p. 218, 219.
566. Ayel M. et Etienne Racotomaria. Sur la morphologie des couches de diffusion des surface metallique phase gazeuse. — «Compt. rend.», 1971, v. 273, p. 1332.
567. Buenren F. D., Thiimrnler F., Vollath D. Die kinetik der Bilding von Bo-riden der Molybdan, Wolfram und Rhenium aus Bornitrid Me-tallpulvergemischen. — «J. Less-Common Met.», 1969, v. 18, N 3, p. 295—304.
568. Baddery J. H., Welch A. J. Borides and Silicides of the Platinum Metals.— «Nature», 1951, v. 167, N 4244, p. 362.
569. Bakish R., Gellas C. A. Vapor Phase Metallurgy and Ceramices.—«Metals», 1962, v. 14, N 10, p. 770.
570. Barnes R. G., Creel R. B., Torgeson D. R. Evidence for Localised Character of Electronic Structure in Vanadium Borides from V51 Nuclear Magnetic Resonance. — «Solid State Comm.», 1970, v. 8, p.1411—1414; «Phys. Letters», 1969, v. A29, N 4, p. 203.
571. Barnes R. G. Nuclear Magnetic Resonance in the Diborides of Scandium and Yttrium. —«J. Chem. Phys.», 1971, v. 53, N 9, p. 3762.
572. Barton L., Nicholls D. The hydrogenation of boron monoxide to diborane and the reactions of Boron and boron carbide with titanium and zirco-niurrr dioxides. — «J. Inorg. and Nucl. Chem.», 1966, v. 28, N 6/7, p. 1367—1372.
573. Ban Z., Sicirica M. New Nucl. Mater. Including Non-Metal Fuels. Proc. Conf. Praque, 1963, v. 2, p. 175.
574. Becher H. I. Uber die Darstellung und Bestandigkeit von Aluminium-diborid. — «Z. Anorg. und allgem. Chem.», 1961, Bd 308, N 1—6, S. 13—22.
575. Becher H. L, Schafer A. Darstellung und des Berillium boride Be4B.— «Z. anorgem. und allgem. Chem.», 1962, Bd 318, N 5, 6, S. 304—312; 1963, Bd 321, S. 217—223.'
576. Beck W. Coatings on Molibdenum. — «Metal Ind.», 1955, v. 86, p. 43—46.
577. Bentz G,, Provost G., Urban C. Etude de la projection, des borures et des nitrures au chalumean a plasma. — «Bull. Soc. Franc. Ceram.», 1968, N 78, p. 5—17.
578. Bertaut F., Bilim P La structure des borures d’uranium. — «Compt. rend. Acad. sci. colon.», 1949, v. 229, N 14, p. 666, 667.
579. Bertaut F., Blume P. Etude des borures de chrome. — Ibid., 19o3, v. 236, p. 1055.
580. Bertaut F., Blume P. To the Investigation of Borides with Augmented Contents of Boron. — «Acta cryst.», 1954, v. 7, p. 81—86; «Compt. rend. Acad. sci. colon.», 1952, v. 234, p. 2621.
581. Becher H. I. Uber die kristallisation borreiher Berilliumboride und Aluminium — Berilliumboride aus Aluminiumschmelzen. — «Acta crystallogr.», 1964, v. 17, N 5, p. 617,
582. Best P., B. Sc., Twigg S. R., Ceram A. I. The Fabrication of Boron by Powder Metallurgical Techniques. — «Metallurgia», 1960, v. 62, N 372, p. 146—152.
356
583. Bidwell L. R. The Germanium — Boron System. — «J. Less-Common Met.», 1970, v. 20, N 1, p. 19.
584. Biltz H. Uber «Kristallitsiertes Вог». II. Berlin, 1910, Bd 43, S. 297—306; Uber «Kristallisiertes Вог». I. Ber., 1908, Bd 41, S. 2634—'2645.
585. Biltz H. Uber Electronenzustanden von Hartstoffen mit Natriumchlorid — Structur. — «Z. Physic.», 1958, Bd 153, S. 338—358.
586. Binder I., Roth A. An Evolution of Molibdenum Borides as Cutting Tools. — «Powder Metal. Bull.», 1953, v. 6, N 5, p. 154—162.
587. Binder I., La Placa S., Post B. Boron Synthesis, Structure and Properties, ed. I. A. Kohn. Plenum Press. N.Y., 1960.
588. Binder L, Post B. }J-Ray Study of Structure MnB2.—«Acta crystallogr.?, 1960, v. 13, p. 356.
589. Binder I., Moskowitz D. Cemented Borides. — «Summary progress Report», 1964, v. 60, p. 719—736.
590. Bliznakov G., Peshev P. The Preparation of cerium, prasodymium and neodymium he.xaborides. — «J. Less-Common Metals», 1964, v. 7, N 6.
591. Bliznakov G., Peshev P., Levarovska. On the Preparation of Calcium, Stroncium and Barium Hexaborides.—'«Compt. rend. Acad. Bulgare Sci.», 1966, v. 19, N 5. p. 381.
592. Bliznakov G., Peshev P.t Niemyski T. On the Preparation of Cristalline Aluminium Borides by a Vapour Deposition Process. — «J. Less-Common Metals», 1967, v. 12, N 5, p. 405—410.
593. Blumenthal H. Vanadium Monoboride.—«J. Amer. Chem. Soc.», 1952, v. 74, N 11, p. 2942.
594. Blumenthal H. Production of transition metal diborides and their solid solutions from metal oxides and boron oxide. — «Powder Metallurgy i Bull.», 1956, v. 7, N 3—6, p. 79—81.
595. Boiler H., Rieger W., Nowotny H. Systematische Stapelfehler in der б-WB-Phase bei Bor-Unterschub. —«Monatsh», 1964, Bd 95,. N 6, S. 1497—1501.
596, Brown P. J.r Cox J. I.. Charge and Spin Density Distribution in the Ferromagnetic Alloy Fe2B.— «Phil. Mag.», 1971, v. 23, N 183, p. 705—725.
597. Brame E., Margrave J., Meloche V. Infera-Red Spectra of Inorganic, — «.I. Inorg. and Nuct. Chem.», 1957, v. 5, N I, p. 48—52.
598. Brewer L., Sawyer D., Templeton D. A Study of the Refractory Borides.-r «J. Amer. Ceram. Soc.», 1951, v. 34, N 6, p. 173.
599. Brewer L., Haraldsen H. The Thermodynamic Stability of Refractory Borides.— «J. Electrochem. Soc.», 1955, V. 102, p. 399—406.
600. Brewer L., Krikorian O. Reactions of Refractory Silicide with Carbon and Nitrogen.'—Ibid., 1956, v. 103, N 1, p. 38—50.
601. Brosset C., Magnusson B. The Silicon—Boron System.—«Nature», 1960, v. 187, p. 54, 55.
602. Brown A. R. G. e. a. High-Modulus Titanium Alloys Containing Boron and Aluminium.— «J. Inst. Metals», 1962,/63, v. 91, N 5, p. 161—166.
603. Brown В. E., Beerutsen D, I. Refinement of an Iron Chromium Boride with the МщВ Structure. —«Acta cryst.», 1964, v. 17, N 4, p. 448—450.
604. Brown C. A. Catalitic Hydrogenation. The Reaction pf Sodium Borohyd-ride with Agueous Nickel Salts. P—I Nickel Boride, a Convenient, Hignly Active. Nickel Hvdrogenation Catalyst. —«J. Organ. Chem.», 1970, v. 35, p. 1900—1904.
604a. Bauer J., Debuigne J. Sur la synthese et la durete des diborures de holmium et de thulium. — «Compt. rend. Acad. Sci. Colon.», 1973, v. 277, Serie C. o. 851—853.
605. Burmeister R. A., Greene P. E. Synthesis and Crystal Growth of BeP.— «Trans. Metallurg. Soc. А1МЕ», 1967, v. 239, N 3, p. 408—413.
606. Buschow К. H. J., Creyghton J. H. N. Magnetic Properties of Rare Earth Tetraborides. — «J. Chem. Phys.», 1972, v. 57, N 9, p. 3910—3915.
607. Cadeville M. C., Andre M., Meyer G. P. Points de Curie et moments des borures ferromagnetiques du groupe du fer de type M2B, MB, (Mi, M2) В et (Mi, M2)B.— «Compt. rend. Acad. sci. colon.», 1962, v. 255, N 25,
357
608. Cadeville M. C., Daniel Е. Sur la structure electronique des certaines borures des metaux de transition. — «J. de Phys.», 1966, v. 27, N 7/8, p. 449—456.
609. Cadeville M. C. Proprietes Magnetiques des diborures de Manganese et de Chrome MnB2 et CrB2. — «J. Phys. Chem. Solids», 1966, v. 27, N 3, p. 667—670.
610. Castellano R. N. Crystal Growth of TmB2 and ErB2. — «Mat. Res. Bull.», 1972, v. 7, N 4, p. 26'1—266.
611. Callaway J. A Bands in Cubic Lattices. III.—«Phys. Rev.», 1961, v. 121, N 5, p. 1351.
612. Castaing J., Caplin R., Costa P. Chaleur specifique a basse temperature et susceptibilite magnetique des- borures mites de molybdene et de chrome.— «Solid. Stat Commun.», 1971, v. 9, p. 297—300.
613. Cantoral I.-J., Montel G. Sur la nitruration diborure de zirconium.— «Compt. rend. Acad. sci. colon.», 1972, v. 274, p. 164.
614. Carlsson J.-O., Lundstrom T. The Solution Hardening of P-Rhombohedral Boron. — «J. Less-Common Met.», 1970, v. 22, p. 317—320.
615. Castaing J., Caudron R., Toupance G. Electronic structure of transition metal diborides. — «Solid State Com.», 1969, v. 7, p. 1453.
616. Castaing J. «Structure electronique et proprietes magnetiques des diborures des metaux de transition». Office national d’etudes et de recherches aero-spatiales publ N 140, 1971, Paris.
617. Castaing J., Caudron R., Costa P. Renforcement du terme de Chaleur specifique electronique a 1’apparition de 1’ordre antiferromagnetique dans les diborures des metaux de transition.—«J. phys.», 1971, v. 32, N 2, 3, p. 638, 639.
618. Castaing J., Danan J., Rieux M. Calorimetric and Resistive Investigations of the Magnetic Properties of CrB2. — «Solid State Comm.», 1972, v. 10. N 6, p. 563—565.
619. Castaing J. e. a. Spin Fluctuation effects in nearly antiferromagnetic vanadium and chromium diborides. — «J. Phys. Chem. Solids», 1972, v. 33, N 2, p. 533—547.
620. Chen Horn-yih, Gilles P. W. High Molekular Weight Boron Sulfides. Behaviour of the Boron — Sulfer Sistem. — «J. Amer, ceram. Soc.», 1970, v. 92, N 8, p. 2309—2312.
621. Chretien A.. Helgorsky J. Sur les borures de molybdene et de tungstene MoB4 et WB4 composes nouveaux. — «Compt. rend. Acad, sci., colon.». 1961, v. 252, N 5, p. 742—744.
622. Chretien A., Laveant P. Sur les borures de gallium; le borure GaBi2. — Ibid.. 1961, v. 252, N 1, p. 134, 135.
623. Creel R. B., Barnes R. G. Nuclear Magnetic Resonance Study of Transition Metal Monoborides. I. nB Nuclear Electric Quadrupole Interaction Parameters. — «J. Chem. Phys.», 1972, v. 56, N 4, p. 1549—62.
624. Chu T. L. e. a. Crystals and Epitaxial Layer of Boron Phosphide. — «J. Appl. Phys.», 1971, v. 42. N I, p. 420—424.
625 Chu T. L., Hyslop A. E. Crystal Growth and Properties of Boron Monoarsenide. — Ibid., 1972, v. 43, N 2, p. 276—279.
626. Curtis В. I. The Precipitation of Graphite from the Hexaborides of some Rare Earth Elements and Yttrium. — «Carbon», 1966, v. 4, N 4, p. 483—488.
627. Cline C. F. Preliminary Investigations of the Silicon SiB6. — «Nature», 1958, v. 181, p. 476, 477.
628. Cline C. F. An Investigation of the Compound Silicon Boride SiB6. — «J. Electrochem. Soc», 1959, v. 106, N 4, p. 322—325.
629. Cline C. F., Sands D. E. A New-Silicon Boride SiB4.— «Nature», 1960, v. 185, p. 456.
630. Cochran A. A., Stephenson J. B. Boron and Boron Carbide Coatings by Vapor Deposition. — «Met. Trans.», 1970, v. I, N 10, p. 2875—2880.
631. Colton E. Preparation of Tetraboron Silicides B4Si.—«J. Amer. Chem. Soc.», 1960, v. 82, p. 1002.
358
632. Clougherfy Ё. V., Pober R. L Physical and 'Mechanical Properties of Transition Metal Diborides.—«Nuclear Metallurgy. А1МЕ», 1964, v. 10, N 13, p. 423—444.
633. Colton E. On the Boron — Silicon Reaction.— «J. Inorg. Nucl. Chem.», 1961, v. 17, N 1, 2, p. 108—111.
634. Cooper J. D. Cibb T. C. Chemical Application of the Mossbauer Effect.— $:Trans. Faraday Soc.», 1964, v. 60, p. 2097.
635. Copeland G> L. DuBose С. К. H., Donnely R. G. Transmission Electron Microscopy of Irradiated Boron Carbide.—«J. Nucl. Mat.», 1972, v. 43, N 2, p. 126—132.
636. Costa P., Conte R. Properties of the Carbides of the Transition Metals.— «J. Nucl. Metal. А1МЕ», 1964, v. 10, N 13, p. 3—28.
637. Crossman F. W., Gue A. S. Unidirectionally Solidified Ti—TiB and Ti— Ti5Si3 Eutectic Compositions.—«Metallurg. Trans.», 1971, v. 2, N 6, p. 1545—1555.
638. Cueilleron J., Thevenot F. Etude sur le phosphure de bore cristallise.— «Bull. Soc. Chim. France», 1965, N 2, p. 402—404.
639. Cueilleron J., Thevenot F. Contribution a letude des arseniures de bore.— Ibid., 1965, N 10, p. 2739—2742.
640. Cueilleron J., Hillel R. Preparation du seleniure de bore: B2Ses.—«Bull. Soc. Chim. France», 1967, N 8, p. 2973—2976.
641. Cueilleron J. e. a. Nouvelle methode d’obtention de borures metalques.— «Less-Common Metals», 1971, v. 24, N 3, p. 317—322.
642. Dawihl W. Uber die Gleitscwindung bei Metall—Metalloxyd—Gemischen und bei Borkarbid, — «Z. Metallkunde», 1952, Bd 43, N 4, S. 138—142.
643. Decker E., Kasper J. The crystal structure fo TiB2.—«Acta crystallogr.», 1954, v. 7,, p. 77—80.
644. Decker E., Kasper J. The crystal structure of a nickel boride related to tetragonal boron.—Ibid., 1960, v. 13, N 12, p.1030, 1031.
645. Dempsy E. Bonding in the Refractory Hard Metals.—«Phil. Mag.», 1963, v. 8, p. 285—291.
646 Dolloff R. T., Meers J. T. Present Status and Future Prospects ol Graphite and Refractory Compounds.-—«J. Metals», 1964, v. 14, p. 147.
647. Donnel I. B., Kobel L.,’ Messiet I. «Compt. rend. Journcss Etud. Solid finement divises». Gaclay. Paris, 1968, p. 241.
648. Duhart P. Recherchis sur les borures' de magnesium et les boruses d’aluminium.—«Ann. chim.», 1962, v. 7, p. 339—366.
649. Durr L. Uber die Reduction von Silicatcn und Boraten mit metallischem Calcium. — «Chemisch Ztg», 1912, Bd 36, S. 657.
650. Economy B. J., Matcovich V. I., Giese R. F. Crystal Chemistry ot Alpha—Boron Derivatives.—«Z. Krist.», 1965, Bd 122, N 3, 4, S. 248—258.
651. Economy B. J., Matcovich V. I. Crystal Chemistry of Higher Borides.— «Electron. Technology», 1970, v. 3, p. 159.
652. Edwards J. G., Widemier H., Gilles P. W. High Molecular Weight Boron Sulfides. III. A. Mass Spectrometric Study of the Vaporisation and Decomposition of Metathioboric Acid.—«J. Amer. Chem. Soc.», 1966, v. 88, N 3, p. 2935—2938.
653. Eick H. A. The Plutonium Borides.—«Inorg. Chem.», 1965, v. 4, p. 1237. 654. Elfstron M. Crystal Structure of СгзВ4. — «Acta chem. scand.», 1961, v. 15. 655. Erlich P. Uber die binaren Systeme des Titans mit den Elementen Stickstoff, Kohlenstoff, Bor und Berillium.—«Z. anorgan und allgem. Chem.», 1949, Bd 259, N 1, S. 1—42.
656. Ern V., Switendick A. C. Electronic Band Structure of TiC, TiN and TiO—’V.—«Phys. Rev.», 1965, v. 137, p. AI927.
657. Etourneau J., Naslain R., Morreu N. Sur quelques nouvelles phases riches en bore dans system bore—thorium.—«Compt. rend. Acad. Sci. Colon.», 1968, v. 266, p. 1452.
658. Etourneau J. e. a. Les Haxaborures de terres rares. Le Systeme bore scandium, Colloques internationaux, C. N. R. S., N 205, Etude des Transformations cristallines a haute temperatures, 1973.
359
659. Eubank W. R., Pruitt t, E., Tfiurhauer Й. Observations on Йогой and1 some Borides. Boron Synthesis, Structure, Properties, Proc. Conf. Asbury Park, N. Y., 1959, p. 116-127 (pab. 1960).
660. Favre R. Mise an point d un foir a bombardement electronique etude des diborures de diborures de titane de, zirconium et de hafnium. These, Lyon, 1971.
661. Favre R., Thevenot F. Mise an point d’un loir a bombardement electronique etude des diborures de titane, de zirconium et de hafnium. — «Bull. Soc. Chim. France», 1971, N 11, p. 3911.
66^. Felten E. J. The Preparation of Aluminium Diboride, A1B2.— «J. Amer. Chem. Soc.», 1956, v. 78, N 23, p. 5977, 5978.
663. Felten E. J., Binder I., Post B. Europium Hexaboride and Lanthanum Tetraboride.—«J. Amer. Chem. Soc.», 1958, v. 80, p. 3479.
664. Felton H. E., Osborne D. W., O’hara G. Uranium Diboride: Preparati— on, Enthalpy of Formation at 298.15° K. Heat Capacity from Г to 350° K, and some Derived thermodynamic Properties.—«J. Chem. Phys.» 1969, v. 51, N 2, p. 583—592.
665. Fenish R. G. A new intermediate compound" in the Titanium—Boron System, Ti3B4.—«Trans. Met. Soc. Д1МЕ», 1966, v. 236, p. 804.
666. Forretty M. e. a. Des fibres hautes performances.!—«Usine Nouvelle», 1970, v. 26, N 46, p. 150—153.
667. , Fisk Z. e. a. Preparation and Lattice Parameters of the Rare Earth Tetraborides.—«Mat. Res. Bull.», 1972, v. 7, p. 285—291.
668. Fischer J., Fiodmark S. Covalent В—В Bonds in Certain Metal Borides Crystals.—«J. Chem, Phys.», 1954, v. 22, p. 11—16.
669. Fischer D. W., Baun W. L. Band Structure and the Titanium. HI. X-Ray Emission, and Absorption Spectra from pure Metal. Oxides, Nitrides, Carbides and Borides. — «J, Appl. Phys.», 1968, v. 39, N 10, p. 4757—4776.
670. Fiodmark S. Quantum-Mechanical Theory of Chemical Bonding between Boron Atoms in the Structure of some Metal Borides.—«Arkiv Fys.», 1955, Bd 4, S. 357—376.
671. Fiodmark S. Electrons Distribution and Energy Bonds in the Metal Borides.—Ibid., 1959, Bd 14, S. 513—516.
672. Fomichev V. A., Zhukova I. I., Polushina I. K. Investigation of the energy bond structure of boron phosphide by ultrasoft X-Ray spectroscopy.—«J. Phys, and Chem. Solids»., 1968, v. 29, N 6, p. 1025—1032.
673. Fruchart R., Auel M. Sur les borures de nickel de cobalt et de fer osomorphes de la cementite.—«Bull. Soc. Cliim. France», 1959, v, 25, N 2, p. 422, 423.
674. Fruchart R., Auel M. Un nouveau borure de manganese MnB4.—«Compt. rend. Acad. sci. colon.». 1960, v. 251, N 25, p. 2953, 2954.
675. Fruchart R. Moments magnetiques des borures ferromagnetiques de cobalt Co3B, C02B et du borure de fer FeB. — «Compt. rend. Acad, sci. colon.», 1963, v. 256, N 15, p. 3304.
676. Fuss V. Metallographie des Aluminiums und seiner Legierungen. Berlin, Verlag von J. Springer, 1934.
677. Galasso F., Paton A. The Tungsten Borides in Boron Fibre Cores.— «Trans. Metallurg. Soc. А1МЕ», 1966, v. 236, p. 1750.
678. Galasso F., Pinto J., Paton A. The Metal Borides in Boron Fibre Cores; Identification of M0B4.—Ibid., 1968, v. 242, p. 754.
679. Gannon R. E., Felweiler R. C., Vasilos T. Pyrolitic Synthesis of Titanium Diborides.—«J. Amer. Ceram. Soc.», 1963, v. 46, p. 496.
680. Geballe T. H. e. a. Properties of SmBe doped with Eu and Gd.—«J, Appl. Phys.», 1970, v. 41, N 3, p. 904, 905.
681. Gebhardt J. J., Cree R. F. Vapor-Deposited Borides of Group IVa.— «J. Amer. Ceram. Soc.», 1965, v. 48, N 5, p. 262—267.
682. Gershenzon M., Thomas D., Trumbore F. Electroluminescent junction device including a bismuth doper group 111(a)—V(a) composition.—USA Patent N 3414441 (3.12.68).
360
685. tiiebelshausen H. Ober das Verhalten des Vanadins zu Silicium, Nickel Kupfer und Silber und das Verhalten des Bors zu Nickel, Nickel—Bor.— «Z. Anorg. Chem.», 1915, Bd 91, S. 251.
684. Giardini A. A. e. a. Vector Hardness Properties of Boron and Aluminium Borides. — In: Boron. Syntheses, Structure and Properties. N.Y. t’lenum Press, Inc., 1960, p. 140—158.
685. Gibb T. R., Knischwitz H. W. The Titanium-Hydrogen System and Titanium Hudride.—«J. Amer. Chem. Soc.», 1950, v. 72, N 12, p. 5365—5369.
686. Gibb T. C., Greenwood N. N. Mossbauer Spectra of Some Iron Compounds.—«Techn. Reports, Ser. Internt. Atom. Energy», 1966, N 50, p. 143—155.
687. Giese R. F., Economy J., Matkovich V. I. Interstitial Derivatives of fi-Boron. — «Z. Krist.», 1965, Bd 122, N 1,2, S. 144—147.
688. Giese R. F., Economy J., Matkovich V. I. The Crystal Structure of YBi.— Ibid., 1965, Bd 122, N 5—6, S. 432—435.
689. Gyese R. F., Economy J., Matkovich V. I. Topotactic transition in C4AIB24.—«Acta cryst.», 1966, v. 20, N 5, p. 697, 698.
690. Gilles P. W., Pollock B. D. The System of Mo—B.—«J. Metals Trans А1МЕ», v. 197, N 5, p. 1537—1539; «Ref. Met. Powd. Reports, VI», 1954, v. 8, N 10, p. 192.
691. Gilles P. W. e. a. Abstracts XX Congress IUPAC, Mosckow, 1965.
692. Gilles D. C., Lewis D. Strength in Metal Carbides.—«J. Less-Common Metals», 1967, v. 13, N 2, p. 179—185.
693. Gilles D. C., Lewis D. Bond Strength in certain group IV and Group V Metals Diborides. — «J. Less-Common Metals», 1968, v. 16, p. 162—171.
694. Gilman I. L, Roberts B. W. Elastic Constants of TiC and TiB2. — «J. Appl. Phys.», 1961, v. 32, N 7, p. 1405.
695. Giner J., Rissman E. The Catalytic Activity ot Nickel and Nickel Boride for Formic Acid Decomposition. — «J. Cattlysis», 1967, v. 9, N 2, p. 115—124.
696. Glaser F. W. Contribution to the Metal—Carbon—Boron Systems.— «J. Metals», 1952, v. 4, p. 391—632.
69*7 . Glaser F. Cemented Zirconium Boride Meterial having a protective Chromium Containing Coating.—«J. Amer. Cer. Soc.», 1960, v. 43, N 9, p. 212.
698. Glaser F. W., Moskovitz D., Post B. Some binary compounds of Hafnium HfB, HfB2, HfC, HfN.—«J. Metals», 1953, v. 5, p. 1119, 1120.
699. Glaser F. W., Moskowitz D. Electrical Measurements at High Temperatures as an Efficient Tool for Thermal Analysis.—«Powder Met. Bull.», 1953, v. 6, N 6, p. 178—185.
700. Glaser F. W., Moskovitz D., Post B. An Investigation of Boron Carbide.—«J. Appl. Phys.», 1953, v. 24, N 6, p. 731—733.
701. Goldshmidt H. J. e. a. Wright Patterson AEB Report N ASD-TDR-62-25, p. 11, 1963.
702. Guette A., Naslain R., Gaily J. Structure cristalline du tetraborure de magnesium. — «Comp. rend. Acad. sci. colon.», 1972, v. 275, Ser. C-41.
703. Graham I. P., Meyers J. R., Saxer R. K. Corrosion of Unstresseh Superalloys by Molten Boron Oxide.—«Corrosion», 1965, v. 21, N 6, p. 196— 206.
704. Greenwood N. N., Parish ft. V., Thornton P. Some Reactions of Metal Borides. — «J. Chem. Soc.», 1955, v. 66, p. 545—549.
705. Graper E. B. Evaporation characteristics of materials from an electronbeam gun.—«J. Vacuum. Sci. and Technol.», 1971, v. 8, p. 333—337,
706. Gray E. Brit. Patent N 687946 (1950).
707. Grayson P. E., Buford J. T., Armington A. F. Pressure Synthesis of Boron Phosphide and Boron Arsenide.—«Electrochem. Technol.», 1965 v. 3, N 11—12, p. 338, 339,
708. Greene F. T., Margrave J. L. Infrared and Visible Spectra of Gaseus B2S3 at High Temperatures.—«J. Amer. Chem. Soc.», 1959, v. 81, N 21, p. 5555, 5556.
£3 Зак. 1305 361
709. Greene F. T., Gilles P. W. New classes' of high Molecular Wieght Boron* Sulfides.—Ibid., 1962, v. 84, N 18,-p. 3598, 3599; 1964, v. 86, p. 3964.
710. Greiner E. S., Gutowski I. A. Electrical Resistivity of Boron—Phosphorus' Alloys. — «J. Appl. Phys.», 1959, v. 30, N 14, p. 1842, 1843.
711. Greiner E. S. The Floating-Zone Melting of Boron and the Properties-of Boron and its Alloys.—In; Boron Synthesis, Structure and Properties,
• N. V., Plenum Press, Inc., 1960, p. 105—109.
712. Guy V., Luque A. Les proprietes thermoelectriques du carbure aux-hautes temperatures.—«Compt. rend. Acad. sci. colon.», 1965, v. 260,-N 20, p. 5282—5285.
713. Haas G., Jensen J.. Thermoionic Studies of Various Uranium Compounds. — «J. Appl. Phys.», 1'963, v. 34, N 12, p. 3451—3457.
714. Haggerty J. S. e. a. Preparation and Characterization of High Quality' Single Crystal Refractory Metal Borides and Carbides. Technical Report-AFML-TR-68-228, 1968.
715. Haenni P. Le bore dans L’aluminium et be alliages d’aluminium.—«Rev.-Metallurgie», 1926, v. 23, p. 342; «Compt. rend. Acad. sci. colon.», 1925,-v. 181, p. 864.
716. Hagenmuller P., Chopin F. Sur le systeme bore—soufre.—«Compt. rendJ-Acad. sci. colon.», 1962, v. 255, N 18, p. 2259, 2260.
717. Hagenmuller P., Naslain R. L’hexaboruce NaB6. — Ibid., 1963, v. 257,,-p. 1294.
718. Hagenlocker A. Halbleit ereigenschaft.en von Bor,, Techn; Hochsdiuf. Stuttgart, 1958.
719. Hagg G. Gesetzmassigkeiten, im. Kristallbau. bei Hydriden, Borideh,. Carbiden und Nitriden der Ubergangselemente; Uberganggelementen in* binaren Sistem mit Bor, Kohlenstoff und Stickstoff.—«Z. phys. Chem,», 1930, Bd 6; 1931, Bd 12, S, 33.
720. Hagg G., Kiessling R. Distribution Equilibria in some ternary Systems; Mei—Mea—В and the Relative Strength of the Transition Metal—Borons Bonds.—«J. Metals», 1952, p. 57—60.
721. Halla F., Weil R. Das Raumgitter des Aluminiumbori des AlBij.—«Natur-wissenschaften», 1939, Bd 27, S. 96.
722. Hampe W. Veber das Bor.—«.Liebigs Ann.», 1876, Bd 183, S. 75.
723. Hardy G. Hulm J. K- The Superconductivity of some transition Metals Compounds.—«Phys. Rev.», 1954, v. 93, N, 5, p. 1004—1016.
724. Haughton J. The Constitutional Diagrams at Alloys, a Bibliography,. London, 1956.
725. Herring C. e. a. High-Field Susceptibilities of Iron and Nickel.—«J. Appl, Phys.», 1966, v. 37, N 3, p. 1340, 1341.
726. Hesse I. Loslichkeit und Ausscheidungskinetik von Bor in polikristallinem1 Silizium.—«Z. Metallkunde», 1968, Bd 59, S. 499—502.
727. Heyne G., Moers K. Der analytische Nachweis des Rheniums sowie ei-' nige Chemische Reaktionen des Metalls. Physikalische und Chemische’ Eigenschaften des Rhenium.—«Z. anorgan. und allgem. Chem.», 1931,-Bd 196, S. 129—152.
728. Hancock J. Improvements in or Relating to Alloys containing Boron ands Aluminium. British Patent N 1268812 (29.03.72).
729. Hayashi Y., Sugeno T. Nature of Boron in L-iron.—«Acta metallurgy,'. 1970, v. 18, N 6, p. 693—697.
730. Hoard J. L., Hughes R. E. In: The Chemistry of Boron and its Compounds (ed. E. L. Muetterties). Wiley. N. Y., London Sydney, 1967..
731. Hoenig C. L., Cline C. F. Investigation of the System Beryllium—Bo--ron.—«J. Amer. Ceram. Soc.», 1961, v. 44, N 8, p. 385—390.
732. Hofmann J. Solid Solution of Iron and Alanganese Borides.—«J. Chem.'-Soc.», 1911, v. 99, N 1, p. 116.
733. Hofmann W., Janiche W. Die Struktur von Aluminium — borid A1B2.— «Z. Phys. Chem.», 1936, Bd 31, N 3, S. 214—222; Beitrag zur Kenntnis-des Systems Aluminium—Bor.—«Z. Metallkunde», 1936, Bd 28, N 1,-
362
S. 1—5; Der Strukturtyp von Alumlniumborid (A1B2).—«Naturwissens-shaften», 1935, Bd 23, N 50, S. 851.
734. Holden A. Properties of Reactor Materials and the Effects of Rediation Damage. London, Butterworths, p. 457, 1962.
735. Huggins R. A. Thermodinamic Considerations Relating to the Rise of Electrochemical Techniques for the Growth of Single Crystals of Borides.—«Mat. Res. Bull.», 1970, v. 5, N 6, p. 391.
736. Howlett B. W. A Note on the Uranium—Boron Alloy System.—«J. Inst. Metals», 1959, v. 88, N 2, p. 91, 92.
737. Huber Elmer J., Head S. L., Holley C. Specific Heats of ZrBa and ZrOa.—«J. Phys. Chem.», 1964, v. 68, N 10, p. 3010.
738. Huber Elmer J. The Heat of Formation of Titanium Diboride — «J. Chem. Engng Data», 1966, v. 11, N 3, p. 430,431.
739. Hulm J. K-, Matthias В. T. New Superconducting Borides and Nitrides.— «Phys. Rev.», 1951, v. 82, p. 273, 274.
740. Hunt T. Electrical furnace for reducing refractory ores.—«Chem. News», 1886, v. 53, p. 64.
741. Hutchinson W. H., Eick H. A. Preparation and Properties of Boron Sesquiselenide.—«Inorg. Chem.», 1962, v. 1, N 2, p. 434—436.
742. Hesse J. Loslichkeit und Ausschidungs—kinetik von Bor in Polikris-tallinem Silicium. — «Z. Metallkunde», 1968, Bd 59, N 6, S. 499.
743. Inghram M. G., Portier R. F., Chupka W. A. Mass Spectrometric Study of Gaseous Species in the В—B2O3 System. — «J. Chem. Phys.», 1956, v. 25, p. 498—501.
744. International Symposium on Compound of interest in Nuclear Reactor Technology. Univ. Colorado, 1964, p. 3—5.
74'5. Iwami Motohiro, Fujita Nobuhiko, Kawabe Kazno. Preparation of BP single crystals from В—Ni—P solution.—«J. Appl. Phys.», 1971, v. 10, N 12, p. 1746, 1747.
746. Jasscneux B. Sur la reduction par le bore amorphe de e’oxyde. — «Compt. rend. Acad. csi. colon.», 1905, v. 141, p. 191.
747. Jassoneux B. Untersuchungen fiber die Verbindungen des Bors mit eini-gen Metallen. — «Chemisches Zentralblatt», 1909 (11).
748. Jeitschko W., Nowotny H., Benesovsky F. Die Kristallstruktur von Mo2BC.—«Monatsh. Chem.», 1963, Bd 94, N 3, S. 565—568.
749. Johnson R. W., Daane A. K. Electron Requirements of Bonds in Metal Diborides.—«J. Chem. Phys.», 1963, v. 38, N 2, p. 425—432; «J. Phys. Chem.», 1961, v. 65, p. 909—915.
750. Jenkins I., Keln N. Production of Tantalum Boride for Containers for Liquid Uranium and Calcium — «J. Less-Common Met.», 1962, v. 4, N 4, p. 387.
751. Jillson D. C. Production and Examination of Zinc Single Crystals. — «J. Metals», 1950, v. 188, p. 1005—1009.
752. Janes S., Nixdorf H. Herstellung von Sinterkorpern aus Borkarbid und Bornitrid. — «Вег. Dtsch Keram. Ces.», 1966, Bd 43, S. 136—145.
753. Jones M. E., Marsch R. E. The Preparation and Structure of Magnesium Boride, MgB2.—«J. Amer. Chem. Soc.», 1954, v. 76, N 5, p. 1434—1436.
754. Johnson G. e. a. Fruorine bomb Calorimetry. Enthalpies of Formation of the Diborides of Zirconium and Hafnium.—«J. Chem. and Engng Data», 1967, v. 12, p. 137.
755. Juretscke H. I., Steinitz R. Hall Effect and Electrical Conductivity of Transition Metal Diborides.—«J. Phys. Chem. Sol.». 1958, v. 4, p. 118— 124.
756. Kasaya M., Hihara T. Maclear Magnetic Resonance Study of Co2B.— «J. Phys. Soc. Japan», 1973, v. 34, N 1, p. 63—67.
757. Kasaya M., Hihara T., Koi J. NMR Study in MnB2. — «J. Phys. Soc. Japan», 1969, v. 26, p. 1549, 1550; Magnetic Structure of MnB2. — Ibid., 1970, v. 29, p. 336—342.
758. Kasaya M., Hihara T., Koi J. Magnetic Susceptibility of Singl Crystal МП3В4. — Ibid., 1971, v. 30, p. 296.
23* 363
V59. Kotlensky W., Schaeffer R. Decomposition ot biborane in a Silent Discharge, Isolation of B6Hio and B9H15. — «J. Amer. Chem. Soc.», 1958, v. 80, N 17, p. 4517—1519.
760. Kaufman L. Compounds of Interest in Nuclear Reactor Technology. J. T. Waber, P. Chiotti and W. N. Miner, Eds. AIME, N.Y., N 4, 1964, p. 193.
761. Kempter С. P., Fries R. J. Crystallography of the Ru—В and Os—В Systems.—«J. Chem. Phys.», 1961, v. 34, p. 1994, 1995.
762. Kieffer R., Schwarzkopf P. Harstoffe und Hartmetalle. Wien, 1953.
763. Kieffer R., Benesovsky F. Recent Developments in the Field of Silicides and Borides of the High—Melting—Point Transition Metals. — «Powder Metallurgy Bull.», 1958, N 1/2, p. 145—171.
764. Keihn F. G., Keplin E. J. High-Temperature Thermal Expension of Certain Group IV and Group V Diborides.—«J. Amer. Ceram. Soc.», 1967, v. 50, p. 81—86.
765. Kiessling R. The Crystal Structure of Molubdenum and Tungsten Borides.— «Acta Chem. Scand.», 1947, v. I, p. 893.
766. Kiessling R. A Method for Preparing Boron of High Purity. — Ibid., 1948, v. 2, N 8, p. 707—712.
767. Kiessling R. The Borides of Tantalum. — Ibid., 1949, v. 3, p. 603—615.
768. Kiessling R. The binary System Zirconium — Boron. — Ibid., 1949, v. 3, N 1, p. 90, 91, 595.
769. Kiessling R. The Borides of Manganese. — Ibid., 1950, v. 4, p. 146— 159.
770. Kiessling R. The Borides some Transition Elements (Ti, Zr, Nb) — «J. Electrochem. Soc.», 1954, v. 98, N 12, p. 518, 519.
771. Kiessling R. — «Powder Metallurgy Bull.», 1959, N 3, p. 177—184.
772. Kimpel R. F., Moss R. G. Melting Point of 98,9, to 99,6% Pure Boron.— «J. Chem. Engng Data», 1968, v. 13, N 2, p. 231—234.
773. King A., Kanda F., Russell V. A New Method for the Preparation of Bo-rohydrides. — «J. Amer. Chem. Soc.», 1956, v. 78, N 16, p. 4176.
774. Kischio Werner. Verfahren Zum Herstellen Oder Umkristallisieren von Bor-phosphid. Pat. FRG N 1242580 (21.12.67).
775. Klemm W., Bommer H. — «Z. anorg. Chem.», 1937, Bd 231, S. 138.
776. Kohn I. A., Katz G., Giardini A. A. AlBio, a New Phase and a Critique on the Aluminium Borides.—«Z. Krist.», 1958, Bd III, N 1, S. 53—62.
777. Kohn 1. A., Eckart D. W. Aluminum Boride AIB12. — «Analitic Chem.», 1960, v. 32, N 2, p. 296—298.
778. Kohn I. A., Eckart D. W. y-AlBij. A new Structure and its Relation to a-AlBi2 as Shoun by Twinned space Groups. — «Z. Krist.», 1961, Bd 116, N 1, 2, S. 134—142.
779. Kohn I. A. Boron Synthesis, Structure and Properties. I. A. Kohn e. a; eds. Plenum Press., Inc., N. Y., 1960, p. 75—82.
780. Koester R. D., Noak D. P. Hot Hardness of Selected Borides, Oxides and Carbides to 1900° C. — «J. Amer. Ceram. Soc.», 1967, v. 50, N 6, p. 290—296.
781. Krebs H. Der Einfluss homodpolarer Bindungsanteile auf die Struktur anorganischer Salze. II. Halbleiter und Legierungsartige Phasen. — «Acta cryst.», 1956, v. 9, p. 95—108.
782. Kroll W. Ober die darstellung des amorphen Bors. — «Z. anorg. Chem.», 1918, Bd 102, S. I.
783. Ku S. M. Preparation and Properties of Boron Arsenides and Boron Arsenide— Gallium Arsenide mixed Crystals. — «J. Electrochem. Soc.», 1966, v. 113, N 8, p. 813—816.
784. Kuentzler R. Specific Heat of Nearly Ferromagnetic Borides (Co, Ni)zB and (Fe, Co)B.—«J. Appl. Phys.», 1970, v. 41, N 3, p. 908, 909.
785. Kuentzler R. Structure electronique de borures des metaux de transition par mesures de chaleur specifique. — «J. Physique», 1971, v. 32, p. 634—672.
786. Kuhnast F.-A., Flechon J. Conductivite electrique des lames minces de
364
nickel—bore obtenues par oxydo—reduction en phase liquide. — «J. Chim. Phys. Physicochim. Biol.», 1972, v. 69, p. 1136—1142.
7787. Kuo K., Persson L. E. A Contribution to the Constitution of the Ternary System Fe—Mn—C. — «J. Iron Steel Inst., London», 1954, v. 178, p. 39—44.
7788. Lafferty J. Boride Cathodes. — «J. Appl. Phys.», 1951, v. 22, No. 3, p. 299—309.
'789. Lagrenaudie J. Composes semi — conducteurs du bore avec le carbone et L’aluminium. — «J. chim. phys. et phys. chim biol.», 1953, v. 50 No. 5, p. 352—355.
790. La Placa S., Post B. The Boron Carbide Structure Type. — «Planseeber.— Pulvermet», 1961, v. 9, No. 1—2, p. 109—112.
791. La Placa S., Post B. The Crystal Structure of Rhenium Diboride ReBa.— «Acta cryst.», 1962, v. 15, p. 97.
792. La Placa S., Noonan D. Ytterbium and Terbium Dodecaborides. — «Acta cryst.», 1963, v. 16, pt. 11, p. 1182.
793. Laubitz M. L, Van der Meer. The Thermal Conductivity of Platilu between 300 and 1000°K.— «Canad. J. Phys.», 1966, v. 44, No. 12, p. 3173—3185.
794. Laves F. Theory of Alloy Phases. — «Amer. Soc. Metals», Cleveland. Ohio, 1956.
795. Lebeau P. Sur qtielques proprietes de la glucine pure. — «Compt. rend. Acad. sci. colon.», 1896, v. 123, p. 818.
796. Lebugle A., Montel G. Sur les differents prdcessus d’oxydation du dibo-rure de Zirconium — «Compt. rend. Acad. sci. colon.», 1972, v. 274, No. 17, p. 1519.
797, Lee K. N., Bell B. Exchange Interactions and Fluctuations in CeB«. — «Phys. Rev. Solid. State», 1972, v. 6, No. 3, p. 1032—1040.
798. Legrand E. Neutron Diffraction Study of MnB2. — «Solid State Com.», 1972, v. 10, No. 9, p. 883—885.
791 Lehrer W. H. — «Trans, of Metallurg. А1МЕ», 1959, v. 215, p. 168.
800. Leitnaker J. M., Bowman M. G„ Gilles P. W. High—Temperature Phase Studies in the Tantalum — Boron System between Ta and TaB. — «J. Electrochem. Soc.», 1961, v. 108, No. 6, p. 568—572.
801. Leitnaker J. M., Bowman M. G. Thermodynamic Properties of the Tantalum and Tungsten Borides. — «J. Electrochem. Soc.», 1962, v. 109, No. 5, p. 441—444.
802. Lihl F., Jenitschek P. Uber den Zerfall des hexagonalen Aluminiumborids A1B2. —«Z. Metallkunde», 1953, Bd 44, No. 9, S. 414—417.
803. Lihl F., Feichl O. Hersfellung und Konstitution von Kupfer—Bor—Legie-rungen. — «Metall», 1954, Bd 8, No. 1/2, S. 11—19.
804. Lipp A., Roder M. Verbindrugen im System В—C—Si und В—Si.—«Z. anorgan. und allgem. Chem.», 1966, Bd 344, No. 5—6, S. 225—229.
805. Lipscomb W. N., Britton D. Valence Structure of the Higher Borides. —< «J. Chem. Phys.», 1960, v. 33, p. 275.
806. Longuet — Higgins H. C., Roberts M. The Electronic Structure of the Borides MeB3.— «Proc. Roy. Soc.», 1954, v. A. 224, p. 336—341.
807. Lowe. Pat. USA N2647061 (28.7.53).
808. Lemius B. Resonance ferromagnetique nucleare pulse dans CoaB et C02B. — «Compt. rend. Acad. sci. colon.», v. 277, Serie В—111—113, 1973.
809. Lundin C. Rare Earth Metal Phase Diagrams «Rare Earth Symposium». Annal. Meeting Amer. Soc. Metals, Chicago, 1959.
810. Lundqvist N., Meyer H., Westin R. The Paramagnetic Properties of the Monoborides of V, Cr, Mn, Fe, Co and Ni. — «Phil. Mag.», 1962, v. 7, No. 79, p. 1187—1189.
811. Lundstrom T. Properties Thermodinamiques et structurales des derives semi — metalliques. — «Compt. rend. Acad. sci. colon.», 1967, v. 157, p.91.
812. Lundstrom T. The Structure of Ru2B3 and WB2 as determined by Single— Crystal Diffractometry and some Notes on the W—В System. — «Arkiv. Kemi», 1968, v. 30, p. 115.
365
813. Lundstrom T. The Crystal Structure of Hf3P2. — «Acta chem. scand.», 1968, v. 22, No. 7, p. 2191—2199.
814. Lundstrom T. Preparation and Crystal Chemistry of some refractory Borides and Phosphides.—«Arkiv. К emi», 1969, V. 31, p. 227—266.
816. Lundstrom T. Structural Studies of the Solid Solubility of Transition Metals in ₽-Rhombohedral Boron. UUJC—B18—17. Uppsala University Institute of Chemistry, 1972; «J. Less-Common. Met.», 1970, v. 22, p. 317.
816. Lundstrom T., Rosenberg I. The Crystal Structure of the Molybdenum Boride Moi-xBj. —- «J. Solid State Chem.», 1973, v. 6, No. 2, p. 299—305.
Щ7. Lye R. G. Electronic Energy Bond Structure of Titanium Carbide.— «Colloq. Intemat. Centre Nat. Rech. Scient», 1967, v, 157, p. 207—214.
818, Maire J., Slonina J.-P., Scherer A. Agglommer^ de carbure de bore. Pat. France N 1568883 (21.04.69).
819. Marcantonio I. A., Mondotfo L. F. The Nucleation, of Aluminium by Several Intermetallic Compounds, -r* «J. Inst. Metals», 1970, v. 98, p. 23—27.
820. Matkovich V. I., Economy I. Structure of MgAlB14 and a Brief Criticjue of Structural Belation-ships in Higher Borides. — «Acta cryst.», 1970, v. B26, No. 5, p. 616—621.
821, Matkovich V. I. A new form of Boron Silicide, B4Si.— «Acta cryst.», 1960, v. 13, No. 8, p, 679—680.
822. Matkovich V. I. Interstitial Compounds of Boron.—«J. Amer. Chem. Soc.», 1961, v. 83, No. 8, p. 1804—1806.
823. Matkovich V. I. Unit Cell, Space Group and Composition of a Lower Boron Phosphide. — «Acta cryst.», 1961, v. 14, No. 1, p. 93.
824. Matkovich V. I., Economy I., Giese R. F. In Presence of Carbon in Aluminum Borides. — «J. Amer. Chem. Soc.», 1964, v. 86, No. 12, p. 2337—2340.
825. Matkovich V. I. e. a. Packing of Bi2 Groups in Boron and Boride Structures.—«Z. Kristallogr.», 1965, Bd 122, No 1—2, S. 116—130.
826. Matkovich V. I., Giese R. E, Economy I. Phases and Twinning in C2A13B48 (beta A1B12). —Ibid., 1965, Bd 122, No. 1, 2, S. 108—115.
827. Matkovich V. I. e. a. The Structure of Metallic Dodecaborides, r- «Acta cryst.», 1965, v. 19, pt 6, p. 1056—1058.
828. Matkovich V. L, Economy I. Abstract E12. Am. Cryst. Assoc. Winter Meeting, 1967 and Abstract Ell. Am. Cryst. Assoc. Summer Meeting, 1968.
829. Matkovich V. L, Economy I. On Predictive Nature of B12 Polyhedral Borides.—«Electron Technology», 1970, v. 3, p. 167.
830. Matterson K. J., Jones H. A study of the Tetraborides of Uranium and Thorium.—«British Ceramic Society, Transactions», 1961, v. 60, p. 475—491.
831. Mattias В. T., Andres К.» Geballe T. H. Superconductivity and Antiferromagnetism in Boron Rich Lattices. — «Science», 1968, v. 159, No. 3822.
832. Marion S. M. Preparation des Borures de Nickel par Electrolyse Ignee.— «Bull. Soc. Chim. France», 1957, v. 23, No. 4, p. 522—525.
833. Mavel G. e. a. Esca Surface Study of Metal Borides. — «Surface science», 1973, v. 35, p. 109—116.
834. Me Bride С. C., Sprefnak J. W., Speiser R.—«Trans. Amer. Soc. Met.», 1954, V. 46, p. 499.
835. Me Donald B. J., Stuart W. I. The Crystal Structures of Some Plutonium Borides. — «Acta cryst.», 1960, v. 13, p. 447, 448.
836. Me Кеппа P. M. — «Industr. and Engng Chem.», 1936, v. 28, p. 767.
837. Medvedeva Z. S. e. a. Die anwendung der Methode der Chemischen Tran-sportreaktion zur Zuchtung von Borphosphid — Einkristallen. — «Kristall und Techn.», 1967, Bd 2, No.-4, S. 523—534.
838. Mitteilung K. Die Kristallstruktur von Mo2Fe2B. — «Z. Monatshefte fur Chem.», 1964, Bd 95, No. 6, S. 1501—1503.
839. Meerson G. A. In: Mod. Developm. Powder Metallurgy. V. 3. Plenum Press, N. Y., 1966, p. 95—104.
840. Meluccl R. C., Wahlbeck P. G. Mass spectrometric observations of ga* seous boron selenides. — «Inorg. Chem.», 1970, v. 9, No. 5, p. 1065—1068.
841. Mercurio J. P. e. a. Specific Heats of some Hexaborides of tipe CaBe.— «Compt. rend. Acad. sci. colon.», 1969, v. 268, p. 1766.
366
842. Mierzejewska S., NKniyski T. Preparation of Crystalline Boron Carbide by vapour Phage Reaction. — «J. Less-Сопцпод..- Metals», 1965, v. 8, No. 6, p. 368--'374; Otrymyw*aiiie krystalicznego wedlika bory z fazy ga-zowey. — «Pi^egL Electron.»,1966,v. 7, No. 4, p. 187—190.
843. ’Mercurio 5. P. e. a Etude comparee des. proprietes electriques des hexah.o-ryres ’d’eflrbpiutn "et ''‘d’ytterbi'um.— «Mat. Res. Bull.», 1973, v. 8, p. 83M&4. , у
844, 'MbYssah. H.. Etude des phosphoi’dures de bore. — «Compt. rend. Acad. sci. Colon>, 1891, V. 113, p. 624; Preparation et propridtes des phosphures de ‘bore.-*-Ibid.,;p. 726. . . >
845. Moissan’H. Preparation du bore amorphe. — Ibid., 1892, v. 114, p.. 392.
846. Moissan‘H. Preparation et proprietes du borure de fer. — ibid., 1895, V/120, p.'173. , ,
847. Moissan H. Preparation et proprietes du borure de carbone. — Ibid., 1894, v. 118, p. 556.
848. Moissan H., Stock A. Preparation et proprietes des deux borures de sili-cium, SiBj et SiBe.— «Ibid., 1900, v. f131, p. 139.
849. Mondslfo L. F., Metallography of Aluminium Alloys. Tohn Willey and Sorts. N. Y., 1943.
850. ’Mbtmey R., Welch A. The 'Crystal Structure of Rh2B. «Acta cryst.», 1954, V. p. 49.
5851. Morgan F. H. Spectral Emissivity of Coatings of Thoria and other Refractories as a Function of Temperature. — «3. Appl. Phys.», 1951, v. 22, p. 108; Goldwater P., Haddad R.— Ibid., p. 70—74.
'852. Mori N. Calculation of Paramagnetic Susceptibilities for Ni, Pd and Pt Metals.— «J. Phys. Soc. Japan», 1968, v. 25, No. 1, p. 72-Г-76. , ,,
853. Moskowitz D. New Vanadium boride of the Composition V3B4— «J. Metals», 1956, v. 8, No. 10, p. 1325.
854. Moers K., Agte C. Reindarstellung hochschmelzender Carbide, Nitride und Boride und Beschreibung Einiger ihrer Eigenschaften. — «2. anorg. allgem. Chem.», 1931, Bd 198, S, 233.
855, Mueller K-, Mer L. W. Untersuchungen an einigtn in der Halbieitertechnik verwendeten Edelmetall — Legierungen.—«Electrotechn. Zeitschrift», 1959, Bd 80, No. 15, S. 515—518.
856. Myers С. E. Heat of Dissociation of Boron Phosphide, BP.— «J. Phys. Chem», 1961, v. 65, No. 11, p. 2111, 2112.
857, Narita Kenji, Sasaki Tadoshi, Seteguchy Yoshinori, Composition ranges with similar constricted hysteresis loops in Mn—Al—В alloys. — «J. Appl. Phys. Japan», 1970, v 9, No. 12, p. 1536.
858. Nasini M., Redaelly G. A Method of Preparation of LaBe Cathodes, i— «Apparatus for the Scientific Investigation», 1971, No 12, p. 13—15.
859, Naslain R., Etoumeau I. L’hexaborure de Potassium, — «Compt. rend. Acad, sci.», 1966, v. 263, p. 484.
860. Naslain R. Preparation de bore pur sous les formes rhomoedriques a et 0 Les borures alcalins. Theses No 188, Docteures Sciences Physiques, Paris. 1967.
861. Naslain R., Kasper J. The Crystal Structure of, Ф-phase in В — Na System.— «J. Solid Stat. Chem.», 1970, v. 1, p. 150.
862. Nemnonov S. A. Study of the Electronic Structure and Interatomic Bonds in Some Compounds and Binary Alloys by the Method of X-Ray Spectroscopy.— «Trans. Met. Soc. AIME», 1969, v. 245, No. 6, p. 1191.
863. Nemoshkalenko V. V., Mindlina M. A., Matko В. P. X-Ray Spectra and Electronic Structure of Elements at the End of the First Lond Period from 29Cu to 34Se.— «Phys. Stat. Solid!.», 1968, v. 30, No. 12, p. 703; «Phys. Letters», 1969, v. 30A, p. 44.
864. Nicholson M. E. Solid Solubility of Boron in Iron.— «J. Metals», 1952, v. 4, No. 2. p. 148.
865. Niemysky T. e. a. Vapor a phase crystallization of B—Si—C phase.— «J. Cryst. Giowth», 1969, v. 5, No. 5, p. 401—404.
367
866. Nickerson J. C., White R. M. e. a. Physical Properties of SmBe. — «Phys. Stat. Solidi», 1971, v. 9, No. 6, p. 2030—2040.
867. Nickl D., Duck M., Pieritz J. Transportreactionen von Siliciden und Bo-riden der Ubergangsmetalle. — «Angevandte Chemie», 1966, Bd 78 No. 17, S._ 882—887.
868. Nishinaga Tatau, Ogawa Hiroshi, Watanabe Hisatsune. Vapor Growth of Boron Monophosphide using open and closed Tube Processes. — «J. Cryst, Growth», 1972, v. 13, 14, p. 346—349.
869. Norton J., Blumenthal H., Sindeband J. Structure of Diborides of Titanium, Zirconium, Columbium, Tantalum and Vanadium. — «Metals Trans.», 1949, v. I, No. 10, p. 19, 749—751.
870. Nowotny H. e. a. Die Dreistoffe: Titan — Bor-—Kohlenstoff und Titan — Bor — Stickstoff. — «Monatsh. Chem.», 1961, Bd 92, No. 2, S. 403—414.
871. Nowotny H., Wittmann A. Zur Struktur der metallreichen Borid-Phase bei V, Nb und Ta. — «Monatsh. Chem.», 1958, Bd 89, No. 2, S. 220—224.
872. Noth Heinrich, Schragle Wolfgang. Uber eine neue Methode zur Dorstel-lung von Bor — Phosphor — Verbindungen. — «Z. Naturforsch.», 1961, Bd 166, No. 7, S. 473, 474.
873. Nowotny H„ Kieffer R., Benesovsky F. Silicoboride der Ubergangsmetalle Vanadium, Niob, Tantal, Molybdan und Wolfram. — «Planseeber. Pulver-met», 1957, Bd 5, No. 3, S. 86—93.
874. Nowotny H., Dimakopoulou E., Kudielka H. Untersuchungen in den Drei-stoffsystemen: Molybden — Silizium — Bor, Wolfram — Silizium — Bor und in den System: VSi2—TaSi2. — «Monatsh. Chem.», 1957, Bd 88, No. 2, S. 180—192.
875. Nowotny H. e. a. Das Dreistoffsystem Chrom — Silizium — Bor. — Ibid., 1958, Bd 89, No. 4—5, S. 611—617.
876. Nowotny H., Benesovsky F„ Kieffer R. Beitrag zum Aufbau der Systeme Niob — Bor und Tantal — Bor. — «Z. Metallkunde», 1959, Bd 50, No. 7. S. 417—424.
877. Nowotny H., Braun H., Benesovsky F. Uber einige Zweistoffsysteme des Hafniums. — «Radex Rundschau», 1960, No. 6, S. 367—372.
878. Nowotny H., Rudy E., Benesovsky F. Untersuchungen in der Systemen: Zirkonium — Bor — Kohlenstoff und Zirkonium — Bor — Stickstoff.— «Monatsh. Chem.», 1960, Bd 91, No. 5, S. 963—974.
879. Nowotny H„ Rudy E., Benesovsky F. Untersuchungen in der Systemen Hafnium — Bor — Kohlenstoff und Zirconium—Bor — Kohlenstoff.— «Monatsh. Chem.», 1961, Bd 91, No. 2, S. 393—402.
880. Nowotny H., Haschke H., Benesovsky F. Borreiche Wolframboride. — Ibid., 1967, Bd 98, S. 547.
881. Obrowsky W. Die Struktur der Diboride von Gold und Silber. — «Natur-wissenschaften», 1961, Bd 48, No. 11, S. 428.
882. Obrowsky W. Uber Legirungen des Ruteniums mit Bor, Berilium und Aluminium.— «Metall», 1963, Bd 17, S. 108—112.
883. Ogden H. R., Jaffee R. I. Titanium — Boron Alloys. — «J. Metals», 1951, v. 3, No. 4, p. 335, 336.
884. O'Daniel H., Tscheischwieli L. Zur Struktur von K2BeF4 Sr2SiO4 und Ba2SiO4. — «Z. Kristallogr.», 1942, Bd 104, No. 4/5, S. 348—357.
885. Osugi Jiro Shimizu Kiyoshi, Tanaka Yoshiyuki. Chemical Reaction at High Temperature and High Pressure. I. Reaction of Boron and Phosphorus at High Temperature and High Pressure. — «Proc. Japan Acad.», 1964, v. 40, No. 2, p. 105—110.
886. Osuga Jiro, Shimizu Kiyoshi, Tanaka Yashiyuki. Preparation and Chemical Properties of Cubic Boron Arsenide, BAs. — «Rev. Phys. Chem. Japan», 1966, v. 36, No. 1, p. 54—57.
887. Osugi Jiro, Shimizu Kiyoshi, Tanaka Yishiyuki. Chemical Reaction at High Temperature and Boron and Arsenic at High Temperature and High Pressure. — «Proc. Japan Acad.», 1966, v. 42, No. I, p. 48—53.
888. Paderno Yu. B., Pokrzywnicki S., Stalinski B. Magnetic Properties of some Rare Earth Hexaborides. — «Phys. Stat. Solidi», 1967, v. 24, p. K73.
368
889. . Paderno Yu. В., Pokrzywnicki S. Magnetic Properties of some Heavy Rare Earth Tetraborides.— Ibid., 1967, v. 24, p. 11.
890. Parthe E. P., Nortoh I. T. Das Dreistoffsystem Zirkonium — Silizium — Bor. — «Monatsh. Chem.», 1960, Bd 91, No 6, S. 1127—1133.
891. Pouling L„ Weinbaum S. Structure of the Boride CaBe.—«Z. Kristallogr.», 1934, Bd 87, S. 181.
892. Peflen R. Contribution a la proparation du «bore amorphe», des borures metalliques et des alliages au bore le procede aluminothermique. Grenoble, 1966.
893. Peret James L. Preparation and Properties of the Boron Phosphides.— «J. Amer. Ceram. Soc.», 1964, v. 47, No. 1, p. 44—46.
894. Perry I., La Placa S., Post B. New Group III — Group V Compounds: BP and BAs. — «Acta cryst.», 1958, v. 11, No. 4, p. 310.
895. Peshev P., Niemyski T. Preparation de Diborure de titane cristallin au moyen d’une reaction eu phase gaseuse. — «J. Less — Common Metals», 1966, v. 10, p. 1.33.
896. Peshev P. Etude Thermodynamique de certains Reactions de Borures de metaux des Groupes II—VI de la classification Periodique. — «Rev. Internal. Hautes temper, et Refract.», 1967, v. 4, p. 289—296.
897. Peshev P., Bliznakov G., Leyarovska L. On the Preparation of some Chromium, Molibdenum and Tungsten Borides. — «J. Less. — Common. Met.», 1967, v. 13, p. 241.
898. Peshev P., Bliznakov G. On the Borothermic preparation of Titanium Zirconium and Hafnium Diborides. — Ibid., 1968, v. 14, p. 23.
899. Peshev P., Leyarovska L., Bliznakov G. On the Borothermic Preparation of some Vanadium. Niobium and Tantalum Borides. — Ibid., 1968, v. 15, p. 259.
900. Peshev P., Etourneau J., Naslain R. Sur de systeme bore scandium. — «Mat. Res. Bull.», 1970. v. 5, p. 319.
901. Piper J. Galvanomagnetic Effects in Single Crystal ZrB2. — «J. Phys. Chem. Solid.», 1966, v. 27, No. 11/12, p. 1907—1910.
902. Polty A. E., Margolin R., Nilsen T. — «Trans. Amer. Soc. Metals», 1954, v. 46, p. 312.
903. Ploetz G. L. Ceramic Materials for Nuclear Reactor Controls and Poison.— «Bull. Amer. Ceram. Soc.», 1960, v. 39, No. 7, p. 362—365.
904. Popper P., Ingles A. Boron Phosphide a III—V Compound of Zinc — Blende Structure. — «Nature», 1957, v. 179, No. 3569, p. 1075.
905. Portier J.—«Rev. Chim. Minerale», 1966, v. 3, p. 483.
906. Post B., Glaser F. Borides of some Transition Metals.—«J. Chem. Phys.», 1952, v. 20, p. 1050—1051.
907. Post B., Pipitz E., Herz W. H. A new Ternary Boride: Cr2NiB4. — «Powder Metallurgy Bull.», 1956, v. 7, No. 3—6, p. 149—152.
908. Post B. e. a. Transition Metal Diborides. — «Acta metallurgy, 1954, v. 2, No. 1, p. 20—25.
909. Post B., Moskovitz D., Glaser F. Borides of Rare Earth and Related Metals. Warmfeste und Korrosionstandige Sinterwekstoffe.— «Z. Plansee Siminar «de re metallica», Springer — Verlag, Wien, 1956.
910. Post B., Moskovitz D., Glaser F. Borides of Rare Earth Metals. — «J. Chem. Soc.», 1956, v. 78, p. 1800.
911. Pratt J. M., Swinden G. Cobalt Boride as a Heterogeneous Catalyst.— «Chem. Commun.», 1969, No. 22, p. 1321, 1322.
912. Preceeding of a Symposium held at Built Unit and the National Physical Laboratory on the 14—16 July, 1971, Metallurgical Chemistry, London, 1972, p. 577.
913. Rabenau A. Chemical Problems in Semiconductor Research. — «Enden-veur», 1966, v. 25, No. 96, p. 158—165.
914. Rameau J. — «J. Conribution a letude de la formation du tantale et des borures de tantale par electrolyse ingee.— «Rev. Intern. Hautes Temper et Refract», 1971, v. 8, No. 1, p. 59.
915. Raw C. — «J. Nucl. Materials», 1964, v. II, p. 320.
369
916. Raman A. On the A1B2 Type Phases.— «Z. Metallkunde», 1967, v. 58 No. 3, p. 179.
917. Rentzepis P., White D., Walsh P. N. The Reaction Between B2O3(I) and C(s): heat of formation of B2O2 (g). — «J. Phys, Chem.», 1960. v. 64, p. 1784-1787.
918. Ridgway R. — «Trans. Electrochem. Soc.», 1934, v. 66, p. 117.
919. Ritzau Gunter. Neue Erfahrungen auf dem Gebit der Sinterwerkstoffe. VDI. — «Zeitschrift», 1965, Bd 107, No. 25, S. 1203—1212.
920. Rizzo H. F., Weber В. C., Schwartz M. A. Refractory Compositions Based on Silicon — Boron — Oxygen Reactions. — «J. Amer. Ceram. Soc.», 1960, v. 43, p. 497—504.
921. Rizzo H. F., Bidwell L. R. Formation and Structure of SiB4. — Ibid., p. 550—552.
922. Rogl P., Benesovsky F., Nowotny H. Uber einige Komplexboride mit Pla-tinmetallen. — «Monatsht. Chem.», 1972, Bd 103, No. 4, S. 965—989.
923. Robins D. A. Bonding in Carbides, Silicides and Borides. — «Powder Metallurg. Bull.», 1958, No. 1—2, p. 172.
924. Rogl P., Nowotny H., Benesovsky F. Komplexboride mit ReB2 Struktur.— «Monatsh. Chem.», 1970, Bd 101, No. 1, S. 27—31.
925. Romans P. A., Krug M. P. Composition and Crystallographic Data for the Highest Boride of Tungsten. — «Acta cryst.», 1966, v. 20, p. 313.
926. Roof R .B., Kempter С. P. New Orthornombic Phase in the Ru—В and Os—В Systems. —«J. Chem. Phys.», 1962, v. 37, No. 7, p. 1473—1476.
927. Rudman R., La Placa S., Post B. The Crystal Structure of Yttrium Tetraboride.— «Acta cryst.», 1963, v. 16, No. 13, p. A29.
928. Rudman R. Notes for Syntheses of Gallium Dodecaboride. — «Inorgan. Chem.», 1966, v. 5, p. 1823.
929. Rexer J., Petzow G. Uber den Aufbau und einige Eigenschaften von Kup-fer — Bor — Legirungen. — «Metall», 1970, Bd 10, S. 1083—1086.
930. Rudy E., Benesovsky F. Untersuchungen in den Systemen: Hafnium — Bor — Stickstoff. — «Monatsh. Chem.», 1961, Bd 92, No. 2, S. 415—441.
931. Rudy E., Benesovsky F., Toth L. Dreistoff Systeme der Va und Vla-Me-talle mit Bund C. — «Z. Metallkunde», 1963, Bd 54, S. 345—353.
932. Rudy E., Progulski 1. APirani Furnace for the Precision Determination of the Melting Temperature of Refractory Metallic Substances. — «Planseeber. Pulvermetallurgie», 1967, Bd 15, S. 13—46.
933. Ruinacher G. Determination des joints de fusion minima des systemes des platinoides au microscope a dispositif chauf fant. — «Rev. met. (Paris)», 1957, v. 54, No. 5, p. 321—336.
934. Rundqvist Stig. XVI Congrees International de Chimie Pure et appliquee, Paris, 1957. Memoire presente & la Section de Chimie Minerale, p. 539.
935. Rundqvist Stig. Two Borides with the Cementite Structure. — «Nature», 1958, v. 181, No. 4604, p. 259, 260.
936. Rundqvist S. Crystal Structure of Ni3B and Co3B.— «Acta chem. scand.», 1958, v. 12, No. 4, p. 658—662.
937. Rundqvist S. X-Ray Study of System Ni—B. Crystal Structure of Orthorhombic and Monoclinic Ni«B3. — Ibid., 1959, v. 13, p. 1193.
938. Rundqvist S., Pramatus S. Crystal Structure Refinements of Ni3B, o-NiiB3 and m-Ni4B3. — Ibid., 1967, v. 21, No. 1, p. 191—194.
939. Rumqvist L., Manne R. X-Ray. Study of Inner Level Shifts and bond Structure of TiC and related Compounds. — «J. Phys. Chem. Solids», 1969, v. 30, No. 7, p. 1849—1860.
940. Rumqvist L., Hamrin K., Johansson G. Charge transfer in transition Metal Carbides and related Compounds Stadied by Esca. — Ibid., 1969, v. 30, No. 7, p. 1835—1849.
941. Russell V. e. a. An X-Ray Study of the Magnesium Borides. — «Acta cryst.», 1953, v. 6, No. 11, p. 870.
942. Ryan F. M., Miller R. C. Photoluminescence and Pair Spectrum in Boron Phosphide. — «Phys, Rev.», 1966, v. 148, No. 2, p. 858—862.
370
943. Sabatier P. Sur le seleniure de bore; Sur les sulfures de bore.—«Compt. rend. Acad. sci. colon.», 1891, v. 112, p. 1000; «Bull. Soc. Chim. France», 1891, v. 6, p. 216.
944. Samsonov G. V., Neronov V. A. Aluminothermal Preperation of Aluminium Dodecaboride. — Electron Technology, v. 3, 1/2, p. 67—72. Institute of Electron Technology P. A. Sci., Warsaw, 1970.
945. Sanders W. A., Probst H. B. — «J. Amer. Ceram. Soc.», 1966, v. 49, No. 4, p. 231.
946. Sands D. e. a. The Berillium — Boron System. — «Acta cryst.», 1961, v. 14, No. 3, p. 309, 310.
947. Scrick H. L. e. a. Thermodinamics of Certain Refractory Compounds. Academic Press, N. Y., 1966.
948. Schobel J., Stadelmaier H. H. Das Zweistoffsystem Ni—B. — «Z. Metall-kunde», 1965, Bd 56, No. 12, S. 856.
949. Schobel J. Das Zweistoffsystem Co—B.—Ibid., 1966, Bd 57, No. 4, S. 323.
950. Schwarzkopf P. und Glaser F. W. Strustur und chemische Eigenschaften der Boride der Ubergangsmetalle der vierten, funften und sechsten Grup-pe. — Ibid., 1953, Bd 44, S. 353—358.
951. Schwetz K. e. a. Uber die Hektoboridphasen der Lanthaniden und Aktini-den. — «J. Less—Common. Met.», 1972, v. 26, p. 99—104.
952. Searcy W., Moyers С. E. The Heat of Sublimation of Boron and the Gaseous Species of the Boron—Boric Oxide System.—«J. Phys. Chem.», 1957, v. 61, No. 7, p. 957—960.
953. Secrist D. R„ Childs W. J. —U.S. At. Energy Comm. TID, 17149, 1962.
954. Secrist D. R. Compounds Formation in the Systems Lithium — Carbon and Lithium — Boron. — «J. Amer. Ceram. Soc.», 1967, v. 50, No. 10, p. 520—523.
955. Seybolt A. U. An Exploration of High Boron Alloys. — «Trans. ASM», 1960, v. 52, No. 2, p. 971—989.
956. Shashkina T. X-Ray. Emission Spectra of Manganese Borides. — «Phys. Stat. Solid! (b)», 1971, v. 44, No. 2, p. 571.
957. Shinohara T., Watanabe N. Nuclear Magnetic Resonance of Co5’ in Ferromagnetic Cobalt Compounds C03B and C02B. — «J. Phys. .Soc, Japan», 1965, v. 20, No. 11, p. 2020—2027.
958. Shimizu M., Takahashi T., Katsuki A. Magnetic Susceptibility and Electronic Specific Heat of Transition Metals and Alloys. II. Pa Metal and Pd—Ag and Pd—Rh Alloys. — Ibid., 1965, v. 18, No. 2, p. 240—249.
959. Silver A. H., Bray P. J. NMR Study of Bonding in Some Solid Boron Compounds. — «J. Chem. Phys.», 1960, v. 32, No. 1, p. 288—292.
960. Silver A. H., Kush!da T. Nuclear Magnetic Resonance in Transition Metal Diborides. — Ibid., 1963, v. 38, No. 4, p. 865—872.
961. Sirtl E., Woerner L. M. Preparation and properties of aluminum diboride Single. — «J. Cryst. Growth», 1972, v. 16, No. 3, p. 215—218.
962. Sindeband S., Schwarzkopf P. The Metallic Nature of Metal Borides. — «Powder Metallurgy Bull.», 1950, v. 5, No. 3, p. 42.
963. Scaar E. C., Croft W. J. Thermal Expansion of T1B2. — «J. Amer. Ceram. Soc.», 1973, v. 56, No. 1, p. 45—47.
964. Smith P. K., Gilles P. W. Die Hektoboridphasen der RZ Metals. — <rj. Inorg. and Nucl. Chem.», 1964, v. 26, No. 8, p. 1465—1467.
965. Snide J. A., Lynch С. T., Whipple L. D. Air Force Mater. Laborat. Techn. Rept., February, 1968, p. 67—359.
966. Sommer A., Walsh P. N., White D. Mass-spectrometric and Infared Emission Investigation of the Vapor Species in the В—S System at Elevated Temperatures. — «J. Chem. Phys.», 1960, v. 33, No. 1, p. 296, 297.
967. Spear К. E., Gilles P. W. Phase and Structure Relationships in the Vanadium Boron System. — «High Temperat. Sci.», 1969, v. 1, p. 86.
968. Spinar L. H., Wang С. C. The Crystal Structure of Tridecaboron Diphosphide.— «Acta cryst.», 1962, v. 15, No. 10, p. 1048, 1049.
969. Sridhar R., Jeffes J. H. E. Thermodinamics of Metals. PbO—В20з and
371
PbO—-P20s. — «Trans. Instit. Mining and Metallurgy», 1969, v. 78, p. 14—20.
970. Stackelberg M., Neumann F. — «J. Phys. Chem.», 1932 v. B19, p. 314.
971. Stacy J. The Reactor Handbook. USA, AECD—364, 1955, v. 3, No. l,p.55.
972. Stansfield О. M. Irradiationiduced Dimensional Change in Boron Carbide. — «J. Nucl. Mater.», 1969, v. 31, No. 3, p. 351—355.
973. Steams R., Greene P. E. Phase Stability Regions of Boron Phosphides in the Ni—В—P System. — «J. Electrochem. Soc.», 1965, v. 112, No. 12, p. 1239, 1240.
974. Stearns R. Bond Cap of Boron Phosphide. — «J. Appl. Phys,», 1965, v. 36, No. 1, p. 330, 331.
975. Steigmeier E. F. The Debye Temperatures of III—V Compounds. — «Appl. Phys. Letters», 1963, v. 3, No. I, p. 6—8.
976. Steiner D., Gyfftopoulos E. P. 27th Annual Conf. Physical Electronics, 1967, p. 160.
977. Steinitz R., Binder I., Moskovitz D. System Molybdenum — Boron and Some Properties of the Molybdenum — Borides; The System Mo—B. — «J. Metals», 1952, v. 4, No. 9, p. 983—987.
978. Steinitz R. Investigation of Boride Phases. Preliminary Results. — «Powder Metallurgie Bull.», 1951, v. 6, p. 54—56.
979. Steinitz R. Modern Materials, Academic Press, N. Y., i960, v 2, p. 191.
980. Stenberg E. The Crystal Structures of Pd5C2 (МП5С2) and PdsB.—«Acta chem. scand.», 1961, v. 15, p. 861—870.
981. Stern D. R., Lahmer Lynds. Pure Crystalline Boron. — «J. Electrochem. Soc.», 1958, v. 105, p. 676.
982. Stock A. Hydrides of Boron and Silicon, Cornell University Press, Ithaca, N.Y., 1933.
983. Stock A., Wiberg E., Martini H. Uber die Borwasserstoff Darstellung.— «Z. anorgan. und allgem. Chem.», 1930, Bd 188, S. 32—36.
984. Stecher J. und Aldinger F. Uber den Aufbau des Systems Berillium — Bor. — «Z. Metallkunde», 1973, Bd 64, No. 10, S. 684—689.
985. Stone B., Hill D. Semiconducting Properties of Cubic Boron Phosphide.— «Phys. Rev. Letters», 1960, v. 4, No. 6, p. 282—284.
986. Stukel D. I. Electronic Structure and Optical Spectrum of Boron Arsenide.— «Phys. Rev. B: Solid State», 1970, v. I, No. 8, p. 3458—3463.
987. St. von Naray — Szabo. Uber das «kristallisierte Bor». — «Naturwissen-schaften», 1936, Bd 24, Nr. 5. S. 77; Rontgenographische Untersuchung des Aluminium—12 — Borids AlBiz. — «Z. Krist.», 1936, Bd 94, Nr. 5, S. 367—374.
988. Suranne A. Deux nouyeaux borures de manganese obtenus par electrolyse ignee. — «Compt. rend. Acad, sci.», 1961, v. 253, No. II, p. 1213—1218.
989. Swift R. M., White D. Low Temperature Heat Capacities of Magnesium Diboride (MgBa) and Magnesium Tetraboride (MgB4). — «J. Amer. Chem. Soc.», 1957, v. 79, No. 14, p. 3641—3664.
990. Templeton D., Dauben C. Lattice Parameters of Some Rare Earth Compounds and a Set of Crystal Radii. — «J. Amer. Chem. Soc.», 1954, v. 76, No. 20, p. 5237, 5238.
991. Thomas D., Tridot G. Preparation proprietes et etude cristallographique d’un sulfure double de bore et de plomb. — «Compt. rend. Acad. sci. colon.», 1964, v. 259, No. 17, p. 2854—2856.
992. Tiller W. A. Theoretical Analysis of Requirements for Crystal Growth from Solution. — «.J. Cryst. Growth», 1968, v. 2, No. 2, p. 69—79.
993. Thonnart P., Lenfant P., Claude L. Sur la structure des catalyseurs appe-les «borure de Nickel». — «Compt. rend. Acad. sci. colon.», 1964, v. 258, No. 21, p. 5207—5209.
994. Trawers W., Ray R. — «Proc. Roy. Soc. London», 1973, v. Л87, p. 153.
995. Tridre H., Talayrach B., Besomber — Vaiehe Z. — «Methodeu Physique D’Analyse», 1969, v. 5, p. 343.
372
996. Tripier А. В, BNY, 1959, No. 1313; Materials in Nuclear Application, ASME. — «Techn. Publ.», 1960, No. 276, p. 293.
997. Troc R., Trzebiatowski W., Piprek K. Magnetic Properties of the Uranium Borides and UBeis. Preprint, No. 7, Wroclaw, Institute for low temperature and Structure Research Polish Academy of Science, 1971.
998. Trzebiatowski W., Rudzinski I. The Composition and Structure of Nitrides and Boride Technecium. — «J. Less — Common Met.», 1964, v. 6, No. 3, p. 244.
999. Tyan J. S., Toth L. E., Chang Y. A. A Study of Electrons Transition Theory Borides by the Investigation of the Low — Temperature Heat Capacity.— «J. Phys. Chem. Sol.», 1969, v. 30, p. 785—792.
1000. Udy M. The Reactor Handbuk. USA, v. 3, Sect. I, AECD—3647, March, 1955, p. 505.
1001. Vehldiek E. W. Electrical Resistivity, Elastic Modulus and Debye Temperature of Titanium Diboride. — «J. Less — Common Met.», 1967, v. 12, No. 3, p. 209—212.
1002. Vickery R. C. Synthesis oi Boron Phosphide and Nitride. — «Nature», 1959, v. 184, No. 4682, p. 268.
1003. Wald F., Stormont R. Investigation on the Constitution of Certain Binary Boron—Metal Systems — «J. Less — Common Met.», 1965, v. 9, No. 6, p. 423—434.
1004. Wald F., Rosenberg A. J., Constitutional Investigations in the Boron — Rlatinum System. — «Trans. Metallurg. Soc. А1МЕ», 1965, v. 233, p. 796—799.
1005. Wald F. On the Stability of the Red a-Rhombohedral Boron Modification.— «Electron Technology», 1970, v. 3, p. 103.
1006. Walker В. E., Ewing С. T., Miller R. R. Heat Capacity of Titanium Diboride from 30 to 700°. — «J. Phys. Chem.», 1957, v. 61, N 11, p. 1682.
1007. Wang С. C., Spiner Leo H. Electron Transfer in Zinc — Blende III—V Compounds. — «J. Phys, and Chem. Solids», 1963, v. 24, No. 7, p. 953—955.
1008. Wachtell R. A Method of the Metallographic Preparation of Zirconium Boride. — «Powder Metall. Bull.», 1951, v. 6, No. 1, p. 62—66.
1009. Wappling R., Haggstrom L., Devanarayanan S. Mdssbauer Investigation of Iron in Boron. Institute of Physics, Uppsala University, Box 530, S. 751 21 Uppsala I, Sweden, UUIP—733, February 1971.
1010. Warren H. N. Boronised Silver. — «Chem. News», 1890, v. 61, p. 231.
1011. Watanabe H., Shinohara T. Magnetism of Borides, Carbides, Nitridesand Silicides. — «Bull. Japan Inst. Metals», 1968, v. 7, No. 8, p. 433—447.
1012. Wedekind E., Horst G. Synthese von Boriden im elektrischen Vakuumofen. Vanadium — Borid—VB. —«Вег. Atsch. Chem. ges.», 1913, Bd 46, S. 1198.
1013. Wenzel F., Merkel H. Verfahren Zum Herstellen von AU1BV — Verbin-dungen in Kristalliner Form. Pat. FGR No 1255716 (14.11.68).
1014. Westrum E. E., Fleick G. ZrB2: the Heat Capacity and Thermodinamic Properties from 5 to 350° K. — «J. Chem. Engng Data», 1963, v. 8(2), p. 193.
1015. Westrum E. F., Clay G. A. NzB1|9es: the Heat Capacity and Thermodynamic Properties from 5 to 350° K-—«J- Phys. Chem.», 1963, v. 67, No. 11, p. 2385—2387.
1016. White D. E., Mann P; N., Welsh P. N. Infrared Emission Spectra of Gaseous B2O3 and B2O2. — «J. Chem. Phys.», I960, v. 32, No. 2, p. 481—487.
1017. Wendell S. W. The Heat of Formation of Titanium Diboride: Experemen-tal and Analitical Resolution of Literature Conflict. — «J. Phys. Chem.», 1961, v. 65, p. 2213. ............ , r J
1018. Wiech G. Rontgenemissionsbanden und Struktur des Waienzbandes von elementaren Phosphor, III—V—Phosphiden und Phosphaten. «Z. Phys.», 1968, Bd 216, N £ S. 472—487.
1019 Will G. Crystal Structure of Higher Aluminium Borides. — «Nature», 1966, v. 212, No. 5058, p. 175, 176; Crystal Structure Analysis of AIB10 by the
373
Convolution Molecule Method. — «Acta cryst.», 1967, v. 23, No. 6, p. 1071—1079.
1020. Williams F. V., Ruehrwein R. A. The Preparation and Properties of Boron Phosphydes and Arsenides. — «J. Amer. Chem. Soc.», 1960, v. 82, No. 6, p. 1330—1332.
1021. Williams R. J. P., Williams R. L. Boron Hydride Derivatives. Part VII. The Characterisation of some Decaborane Derivatives of the Type, ВюНл, 2M. — «J. Phys. Chem.», 1961, v. 65, No. 5, p. 2196—2204.
1022. Williams F. V. Preparation of Boron Phosphide.— In: Compound Semiconductor. V. I. N. Y., Reinhold Publ. Corp., London, Chapman and Hall, Ltd., 1962, p. 171—173.
1023. Wilson A. M. The Theory of Metals. University Press, Cambridge, 1953.
1024. Wittman A. Ein Beitrag zum Dreistoff Titan — Molybdan — Bor. — «Mo-natschefte Chem.», 1960, Bd 91, No 3, 4, S. 608—615.
1025. Woods H. P., Wawner F. E., Fox B. G. Tungsten Diboride: Preparation and Structure. — «Science», 1966, v. 151, p. 75.
1026. Zalkin A., Templeton D. H. The Crystal Structures of CeB4, ThBt and UB4. — «J. Chem. Phys.», 1950, v. 18, No. 3, p. 391, 392.
1027. Zalkin A., Templeton D. H. The Crystal Structure of CeB<, ThB4 and UB4. — «ACta cryst.», 1953, v. 6, p. 269.
1028. Zeeman P. B. Spectrum of the Boron Monosulfide (BS) Molecule.— «Phys. Rev.», 1950, v. 80, No. 5, p. 902.
ОГЛАВЛЕНИЕ
От авторов....................................................3
Введение......................................................<5
Глава I. Строение и физико-химические свойства боридов .... 9
Кристаллохимия и структурные особенности..................9
’ Термодинамические, термические и теплофизические свойства ... 36
Электрофизические и магнитные свойства....................51
Оптические свойства............................................ 72
Физико-механические свойства..............................74
Радиационная стойкость....................................77
Химические свойства....................................... ... 79
Электронное строение боридов переходных металлов ............... 83
Глава II. Методы получения боридов............................94
Глава III. Бориды металлов I группы периодической системы элементов 133
Бориды щелочных металлов.................................133
Бориды металлов Подгруппы меди...........................137
Глава IV. Бориды металлов II группы периодической системы элементов .............................................................142
Бориды бериллия, магния и щелочноземельных металлов .... 142
Бориды металлов подгруппы цинка..........................158
Глава V. Бориды переходных металлов..........................161
Бориды металлов Ша подгруппы..................................161
Бориды металлов IVa подгруппы.................................205
Бориды металлов Va подгруппы..................................226
Бориды металлов Via подгруппы.................................240
Бориды металлов Vila подгруппы................................264
Бориды металлов VIII группы...................................276
Глава VI. Соединения бора с элементами нечетных подгрупп . . . 307
Соединения бора с алюминием.....................................307
Соединения бора с углеродом.....................................311
Соединения бора с кремнием......................................317
Другие соединения бора..........................................322
Заключение......................................................329
Список литературы .............................................331
БОРИДЫ
Григорий Валентинович Самсонов, Тамара Ивановна Серебрякова, Владимир Александрович Неронов
Редактор А. Ф. Алябьев
Художественный редактор А. Т. Кирьянов Технический редактор Н. А. Власова Корректоры О. Р. Харламова, Л. А. Курылева
Сдано в набор 25/IX 1974 г. Подписано к печати 19/IV 1975 г. Т-06937. Формат бОхЭО’/ю. Бумага типографская № 2. Усл. печ. л. 23,5. Уч.-изд. л. 27,26. Тираж 1640 экз. Цена 2 р. 93 к. Зак. изд. 71340. Зак. тип. 1305.
Атомиздат, 103031, Москва, К-31, ул. Жданова, 5
Московская типография № 6 Союзполиграфпрома при Государственном комитете Совета Министров СССР по делам издательств, полиграфии и книжной торговли.
109088, Москва, Ж-88, Южнопортовая ул., 24.