Author: Сойфер В.Н.
Tags: общая генетика общая цитогенетика иммуногенетика эволюционное учение видообразование филогенез медицина днк рнк молекулярная генетика
Year: 1970
В.Н. Саифер
ОЧЕРКИ
ИСТОРИИ
МОЛЕКУЛЯРНОЙ
ГЕНЕТИКИ
В. Н. СОЙФЕР
Очерки истории
молекулярной генетики
в
ИЗДАТЕЛЬСТВО «II А У К А»
М <1 С I. Н А 19 7 И
УДК 575(091)
В. Н. Сойфер. Очерки истории молекулярной
М., «Наука»,
1970, стр. 1—260.
В книге излагаются в историческом аспекте достижения молекулярной
генетики в изучении структуры и синтеза ДНК и РНК, строения генети-
ческого аппарата высших организмов и микробов, включая вирусы жи-
вотных и бактерий, тонкого строения гена, модификаций первичной, вто-
ричной и третичной структур ДНК и РНК. Рассматривается история уста-
новления общей природы и строения генетического кода.
Книга предназначена для широкого круга читателей — научных сотруд-
ников, специалистов в области генетики, биохимии, биофизики, микро-
биологии и вирусологии, медиков, преподавателей высшей и средней
школы, аспирантов и студентов биологических, медицинских и сельско-
хозяйственных вузов и всех, кто интересуется биологией и генетикой.
Табл. 21. Илл. 71. Библ. 23 стр.
Ответственный редактор
академик Н. П. ДУБИНИН
2-10-2
490-69(11)
Моей жене Нине Яковлевой
посвящаю
ПРЕДИСЛОВИЕ
История молекулярной генетики — это, по сути дела, история сегодняшнего
дня. Те, кто закладывал первые камни в фундамент этой науки, в боль-
шинстве своем еще полны сил, энергии и творческих замыслов. Поэтому
ставшая крылатой фраза «История пишется па наших глазах» к молеку-
лярной генетике приложима в полной мере.
Но несмотря на молодость этой науки, стремление понять преемствен-
ность ее идей и достижений ощущается повсюду в мире. Для подтвержде-
ния этого можно сослаться на статьи Г. Стента «Оперон: его третья годов-
щина» (1964), Ф. Крика «Генетический код — вчера, сегодня, завтра» (1966),
книгу Дж. Уотсона «Двойная спираль» (1967). Такие экскурсы в историю
вполне закономерны, ибо, проследив развитие тех пли иных отраслей мо-
лекулярной генетики, можно гораздо четче увидеть перспективу дальней-
ших исследований, дать научные прогнозы будущего.
Не менее важно и то, что, задумываясь над историей науки, летоис-
числение которой охватывает два — три десятилетия, мы обнаруживаем ее
связь с более ранними исследованиями. Такая связь молекулярной генети-
ки и умозрительных рассуждений Г. Менделя о природе наследственных
факторов, Н. К. Кольцова о структуре и свойствах наследственных моле-
кул, С. С. Четверикова о точечности мутаций становится для нас очевид-
ной.
Цель, которую ставил перед собой автор настоящей монографии, зак-
лючалась в анализе исторического развития некоторых областей молеку-
лярной генетики. Дать полный обзор всех ее направлений — вряд ли по-
сильная задача для одного автора. Естественно, что определяющим для вы-
бора основных тем книги были личные интересы автора. Это нашло отра-
жение в названии книги, озаглавленной «Очерками истории», а не просто
«Историей молекулярной генетики».
Наибольшая трудность при написании книги была сопряжена с отбо-
ром основного материала и установления связи и преемственности между
исследованиями, порой прямо противоречащими друг другу. Подавляющее
ольшипство отраслей молекулярной генетики развивается столь бурно,
что книжный и журнальный рынок буквально захлестывает новая инфор-
мация. Выбрать из этого моря старых и новых работ все действительно
ПРЕДИСЛОВИЕ
6
важные исследования чаще всего невозможно, и такой выбор неизбежно
субъективен. Но автор все-таки надеется, что основные вехи на пути раз-
вития тех областей науки, о которых идет речь в книге, ему удалось рас-
ставить правильно.
Другая трудность была связана с выбором стиля и манеры написания.
Представить своего будущего читателя, особенно книги с названием
«Очерки истории молекулярной генетики», по-видимому, невозможно. Если
бы за ее чтение взялись одни неспециалисты, то наверное надо было бы
написать чисто литературное произведение. Но, вероятно, и специалисты в
узких областях биологии, биофизики и биохимии иногда ощущают потреб-
ность в ознакомлении с историей такой действительно краеугольной нау-
ки, каковой является генетика. Не рискуя быть разорванным между этими
полярными запросами, автор репгил предпослать книге вводную главу, в
которой насколько возможно проще рассказать об основных этапах и на-
правлениях молекулярной генетики. Многое о том, что лишь названо в этой
главе, затем подробно расшифровывается в последующих главах, где дает-
ся более полный анализ исследований структуры, функции и репликации
нуклеиновых кислот, размножения вирусов, генетического кода, структуры
и функции гена. В книге есть небольшая глава «Исследование модифика-
ций структуры нуклеиновых кислот». Вводя этот материал в книгу, автор
хотел показать, как развивается исследование структуры нуклеиновых кис-
лот «вглубь» и как обнаружение странных на первый взгляд усложнений
ДНК и РНК помогает укрепить «каноны» молекулярной генетики.
Можно спорить о том, имеет ли прямое отношение к молекулярной ге-
нетике изучение гистонов, но мнение о том, что без их участия нельзя по-
нять регуляцию генной активности хромосом высших организмов, широко
распространено.
Книга заканчивается главой, в которой автор пытается осмыслить ос-
новные факторы мутационного процесса. В написании этой главы и заклю-
чения к книге принял участие академик Н. П. Дубинин. В главах 3—5 и 8
частично использован материал моей книги «Молекулярные механизмы
мутагенеза» (М., «Наука», 1969).
Рукопись в целом или ее отдельные главы были прочитаны профессо-
рами Л. Я. Бляхером, Ю. 3. Гендоном, 10. К. Фомичевым, докторами наук
Э. И. Будовским, В. Н. Гершановичем, Г. А. Дворкиным, Ф. И. Ершовым и
кандидатами наук И. Г. Атабековым, В. А. Гвоздевым и Г. А. Паносяном.
Автор выражает им признательность за критику и ценные предложения.
Особенно признателен автор Институту истории естествознания и техники
АН СССР, представившему к печати эту книгу, и члену-корреспонденту
АН СССР С. Р. Микулинскому за помощь во время подготовки ее к печати.
Замечания и критические предложения просьба направлять автору в Ин-
ститут общей генетики АН СССР, Москва, В-133, Профсоюзная, 7,
1
Ретроспективный обзор истории
молекулярной генетики
Молекулярная генетика стала ведущей биологической дисципли-
ной. Добытые ею результаты оказались существенными для боль-
шинства биологических и многих медицинских паук (в частно-
сти, вирусологии, эндокринологии, иммунологии и т. д.). Для
многих биологов исключительно интенсивное развитие молекуляр-
ной биологии, наблюдающееся с 1953 г. (года установления
Дж. Уотсоном и Ф. Криком принципиальной структуры дезокси-
рибонуклеиновой кислоты) по сей день, оказалось неожиданным и
невероятным. Не менее странным для многих явилось то, что в
создании молекулярной генетики важную роль сыграли физики и
математики, пришедшие в нее со своими методами исследований и
принципами мышления. Этому вторжению физиков в биологиче-
ские лаборатории в немалой степени способствовало то, что клас-
сическая генетика, па базе которой развивалась ее новая отрасль,
трактующая вопросы наследственности с позиций взаимодействия
молекул, сама была наиболее строгой и, главное, количественной
биологической дисциплиной. О том, насколько бурным был расцвет
молекулярной генетики, можно судить по такому примеру.
В 1955 г., через два года после обнародования гипотезы Уотсона
и Крика, редколлегия журнала «Технике! — молодежи» собрала
за круглым столом наиболее выдающихся ученых, интересующих-
ся биологическими проблемами,—биохимика В. А. Энгельгардта,
генетика Н. П. Дубинина, физика-теоретика И. Е. Тамма, химика
И. Л. Кнунянца, кибернетика А. А. Ляпунова и попросила их
высказаться о том, что следует ждать от повой науки. Мнения
всех собравшихся были единодушны — они отводили молекуляр-
ной генетике первое место среди естественных наук. Но наиболее
интересным для пас сегодня является выступление В. А. Энгель-
гардта: он предположил, что на решение центральной проблемы —
установление точной структуры генетического кода — потребуется
не менее 50 лет. На деле эта проблема была решена за 10 лет!
В истории всех наук такой бурный всплеск результативных
исследований претерпевала еще лишь одна наука — ядерная фи-
зика. Многие сейчас вспоминают, что в тридцатые — сороковые
годы наблюдался такой же «бум» в ядерных исследованиях, даже
в мелких деталях напоминавший то, свидетелями чего мы явля-
ОВЗОР ИСТОРИИ МОЛЕКУЛЯРНОЙ ГЕНЕТИКИ
8
емся сегодня. Так же увлеченно работали ученые, так же важней-
шие результаты становились доступными научной общественности
не из научных публикаций, а обгоняя их — из газет или личных
писем. Как и сейчас, в разных странах коллективы ученых па-
раллельно работали над одними и теми же проблемами, и дух
соперничества придавал особую романтичность научным поискам.
Как же шло развитие молекулярной генетики? В чем секрет
удивительного расцвета этой пауки? Насколько правомерно сейчас,
когда молекулярная генетика, едва достигшая 15-летнего возраста,
находится в расцвете, обращаться к ее истории? Что касается послед-
него вопроса, то следует отметить, что сейчас как нельзя более бла-
гоприятное время для такого экскурса в историю молодой науки.
Мы стоим перед важным этаном в развитии молекулярной гене-
тики: переходом к молекулярно-генетическому изучению высших
организмов. Добыты основные сведения о структуре и функциях
нуклеиновых кислот, установлена общая природа генетического
кода, найдены состав и строение всех 64 кодонов, описан путь от
гена к белку и расшифрованы основные закономерности белкового
синтеза, получены основные сведения о первичных механизмах
взаимодействия мутагенов химической и лучевой природы с на-
следственными молекулами. Все это позволяет нарисовать единую
картину устройства и функционирования наследственного мате-
риала.
Большинство этих данных получено на микроорганизмах. На-
сколько справедливы выводы, полученные при изучении прими-
тивных организмов (бактерий, фагов, микроскопических грибов),
в отношении высших животных и растений, сказать трудно, на
этот вопрос призвана ответить интенсивно разрабатываемая моле-
кулярная генетика высших форм. Кроме того, важнейшей пробле-
мой, встающей перед молекулярной генетикой, становится проблема
участия наследственных структур в таких процессах, как мышле-
ние, поведение, способность к обучению и т. д., к изучению кото-
рых обратились сейчас многие выдающиеся специалисты молеку-
лярной генетики.
Роль ДНК в живых клетках
Решающим обстоятельством, обеспечившим быстрый прогресс мо-
лекулярной генетики, было мощное развитие классической генети-
ки, биохимии и биофизики, представивших научную базу для ис-
следования молекулярных основ наследственности. Хранитель на-
следственной информации — ДНК была открыта Фридрихом Ми-
шером более 100 лет назад, и первое время некоторые биологи
(например, братья Гертвпги) высказывали надежду, что изучение
9
РОЛЬ ДНК В ЖИВЫХ КЛЕТКАХ
R = H, урацил
R=CH3, тимин
R=H, цитозин Гуанин
R = CH2OH, 5-окси-
метилцитозин
Аденин
ОН R
-неорганический
фосфат
R=OII, рибоза
R = 11, 2-дезоксирибоза
Рис. 1. Структурные формулы составных частей дезокси-
рибонуклеиновой и рибонуклеиновой кислот
ДНК даст ключ к познанию наследственных процессов. Но этим
пророчествам не суждено было сбыться в то время, поскольку не
хватало не только знаний по биохимии (по сути дела, сама эта
наука еще не успела зародиться), но и не существовало еще на-
дежных методов изучения наследственности. Открытие Мишера
опередило современную ему науку. По той же причине, почему
опыты Г. Менделя получили признание лишь через 35 лет после
их завершения, и ДНК, открытая Мпшером, привлекла серьезное
внимание только через 85 лет.
К концу 90-х годов прошлого столетия Пикар изолировал пз
нуклеиновой кислоты спермы лосося пуриновые основания — гуа-
нин и гипоксантин (продукт разрушения аденина), Коссель нашел
аденин и ксантин и впервые выделил из нуклеиновых кислот пи-
римидиновые основания — тимин и цитозин, Асколи изолировал
урацил, а в 1909 г. Левин, наряду с азотистыми основаниями,
оонаружил в нуклеиновой кислоте фосфорную кислоту и пен-
тозный сахар — рибозу. Лишь в 1930 г. было закончено исследо-
вание основных (канонических) составных частей ДНК, когда
1евин обнаружил другой пятичленпый сахар, входящий в состав
нуклеиновых кислот — дезоксирибозу (рис. 1). Однако до настоя-
щего времени в ДНК и РНК обнаруживают новые типы основа-
нии и сахаров, так называемые неканонические, или минорные,
компоненты.
Пожалуй, наиболее значительным моментом в исследовании
ишера было то, что он установил внутриядерную локализацию
нуклеина — открытого им соединения нуклеиновой кислоты с
ОБЗОР ИСТОРИИ МОЛЕКУЛЯРНОЙ ГЕНЕТИКИ
10
Рис. 2. Двойная спираль ДНК
с указанием расстояний, отде-
ляющих основания друг от
друга и одну нить спирали от
другой
основными белками — гистонами. Нахож-
дение нуклеина в ядрах и только в ядрах
клеток навело ученых па мысль, что, по-
скольку с ядром связана передача наслед-
ственных свойств, то, видимо, и разгадку
их следует искать в единственном соедине-
нии, отличающем ядра от других компо-
нентов клетки,— нуклеине (братья Герт-
виги). Но, к сожалению, в последующем
эта идея не развивалась и многие годы
свойство наследственности связывалось с
поведением белков.
Неимоверно сложные по своей струк-
туре, ускользающие от обычного химического анализа, нуклеино-
вые кислоты стали объектом детальных исследований лишь в кон-
це 40-х — начале 50-х годов. Широко известные опыты, начатые
открытием феномена трансформации бактерий Гриффитом (1928 г.),
привели Эйвери, Мак Леода и Мак Карти к установлению в
1944 г. важнейшего факта, что наследуемая передача признаков
у бактерий осуществляется дезоксирибонуклеиновой кислотой.
В 1952 г. Альфред Херши и Марта Чейз обнаружили, что при
заражении фагами бактериальной клетки (далее эти клетки будут
называться клетками-хозяевами), в них проникает только фаговая
Днк, а белок остается на поверхности оболочки бактерии.
В сороковые годы накапливались химические данные (Буа-
вен, Вандрелли, Чаргафф), радиобиологические данные (Холлен-
дер), свидетельствовавшие о генетической роли ДНК, но тем не
менее эти результаты никем не были осмыслены и восприняты
именно как доказательство генетической роли ДНК. Вспоминая
об отношении к ДНК подавляющего большинства биологов тех
дней, Джеймс Уотсон писал недавно:
«После опытов Эйвери было похоже, что именно ДНК основ-
ной генетический материал. Таким образом, выяснение химиче-
ского строения ДНК могло оказаться важным шагом к понима-
нию того, как воспроизводятся гены. Но в отличие от белков,
относительно ДНК имелось очень мало точно установленных хи-
мических сведений. Ею занимались считанные химики, и за
исключением того факта, что нуклеиновые кислоты представля-
ют собой очень большие молекулы, построенные из более мелких
11
ГЕНЕТИЧЕСКИЙ КОД
строительных блоков — нуклеотидов, об их химии не было изве-
стно ничего такого, за что мог бы ухватиться генетик. Более того,
химики-органики, работавшие с ДНК, почти никогда не интере-
совались генетикой» \
Переворот в воззрениях генетиков на роль ДНК как хранителя
и переносчика генетической информации произошел в 1953 г.
Дж. Уотсон и Ф. Крик подвергли анализу данные рентгеноструктур-
ного анализа ДНК, сопоставили их с результатами химических ис-
следований соотношения нуклеотидов в ДНК (правила Чаргаффа)
и применили к ДНК идею Л. Полинга о возможности существова-
ния спиральных полимеров, высказанную им в отношении белков.
В результате они смогли предложить гипотезу о структуре ДНК,
согласно которой ДНК представлялась составленной из двух поли-
нуклеотидных нитей, соединенных водородными связями и взаим-
но закрученных друг относительно друга (рис. 2). Гипотеза Уотсо-
на и Крика так просто объясняла большинство загадок о функцио-
нировании ДНК как генетической матрицы, что она буквально сра-
зу была принята генетиками и в короткий срок экспериментально
доказана.
Генетический код
Важнейшим преимуществом гипотезы Уотсона и Крика было то,
что она давала возможность сформулировать четкие предположе-
ния о природе генетического кода. В основу механизма записи ге-
нетической информации Уотсон и Крик положили идею о том, что
вдоль молекулы ДНК располагаются азотистые основания. Чере-
дование этих оснований могло составлять материальную запись на-
следственности, а каждое основание — являться элементарной
смысловой единицей кода. В таком случае можно было предложить
схему устройства генетического кода, что и было сделано в 1954 г.
Георгием Гамовым.
Гамов прежде всего строго поставил задачу о структуре гене-
тического кода. Так как основной функцией генов должно быть
управление синтезом специфических белков, следовало указать
способ перевода информации, записанной в ДНК, в первичную
структуру белков. Иными словами, нужно было найти способ пе-
ревода четырехбуквенной записи ДНК, осуществленной с помощью
четырех оснований, в двадцатибуквепную запись белковых моле-
кул, содержащих 20 различных аминокислот (см. стр. 14—16).
nnKM0B предположил, что каждая аминокислота кодируется в
ДНК не одним, а комбинацией нескольких нуклеотидов. Если ком-
Дж. Уотсон. Двойная спираль. Химия и жизнь, 1968, № 7, стр. 83—84.
ОБЗОР ИСТОРИИ МОЛЕКУЛЯРНОЙ ГЕНЕТИКИ
12
ДНК I I I г-1 I I I I I I .......I I I I |- | I ।
1 2 3 4 5 6 7 8 9 10 1 1 12 13 14 15 16 17 18 19 20 2122 23 24 25
1 ак 2 ак з ак i ак 2 ак
2 АК
Так
L-g_______1 I_____________I I_________________I
Перекрываю- Сплошной непере- Код с запятыми”
щйися код крывающийся код
Рис. 3. Типы кодов, предложенные разными авторами
АК — аминокислота
бинировать нуклеотиды по два, то можно получить 42 = 16 комби-
наций, чего недостаточно для кодирования 20 аминокислот. Поэто-
му Гамов предположил, что каждая аминокислота кодируется в
ДНК сочетанием из трех нуклеотидов. Таких сочетаний уже могло
иметься 64, чего с избытком хватало для всех аминокислот. Впо-
следствии тройку нуклеотидов стали именовать триплетом, или
кодоном.
Чтобы узнать, каким образом кодоны располагаются в ДНК,
нужно было решить довольно трудную задачу.
Априорно можно предположить три типа кодов: перекрываю-
щийся код, сплошной код без промежутков и неперекрывающий-
ся код с запятыми (рис. 3). Доказательство того, что в природе
существует неперекрывающийся код без запятых (сплошной код
без промежутков) было получено в конце 1961 г. Криком, Барне-
том, Бреннером и Ваттс-Тобпным. Авторы смогли доказать на си-
стеме так называемых г! 1-мутаций бактериофага Т4, что при счи-
тывании генетической информации три последовательно располо-
женных основания (триплеты) читаются как единый элемент, что
в пределах гена чтение начинается со строго фиксированной точ-
ки (О-точка, начальная точка, пли инициатор) и что это считы-
вание идет в одном направлении, причем каждые три последова-
тельно расположенные в гене основания дают информацию об од-
ной аминокислоте (непрерывность считывания).
Выяснение общей природы генетического кода было большим
шагом вперед, но оставался нерешенным не менее важный воп-
рос о точном строении каждого из 64 кодонов. Исторически реше-
ние этой проблемы оказалось разделенным на два этапа.
В 1961 г. два молодых американских исследователя М. Нирен-
берг и Г. Маттеи доложили на V Международном биохимическом
конгрессе в Москве данные об изучении состава кодона, отвечаю-
щего за синтез аминокислоты фенилаланина. Им удалось разрабо-
тать остроумный прием для получения информации о составе ко-
донов. В систему для синтеза белка вводились в качестве матри-
цы синтетические олигонуклеотиды, состав которых был известен.
13
ГЕНЕТИЧЕСКИЙ КОД
В первом опыте, давшем положительные результаты, такой матри-
цей служила синтетическая РНК, содержавшая только один сорт
оснований — урациловые основания (эта молекула называется по-
лиуридиловой кислотой). В ответ на введение такой матрицы на-
чинался синтез белка, состоявшего также из одинаковых амино-
кислот — фенилаланиновых. Так стал известен первый кодон. Ами-
нокислота фенилаланин кодировалась триплетом ААА (пли УУУ
для РНК)
Работа Ниренберга и Маттеи открыла принципиально новый
подход к изучению состава кодонов. Поскольку к 1961 г. биохимики
научились синтезировать искусственные полприбонуклеотиды за-
данного состава, работа по получению полимеров, в которых име-
лось бы нужное сочетание оснований, не представляла значитель-
ной трудности. Для изучения состава всех кодонов требовалось
приготовить сополимеры, в которых имелось бы различное сочета-
ние четырех рибонуклеотидов. Например, при сочетании в полиме-
ре урацила и гуанина в пропорции 1 : 1 наиболее вероятным было
получить такой полимер: УГУГУГУГУГ. Частота встречаемости
пар УУ и ГГ в таком полимере ниже, чем пар УГ. Поэтому, изу-
чая включение аминокислот в белок в бесклеточной системе, следо-
вало ожидать, что будут преимущественно включаться две амино-
кислоты, кодируемые триплетами УГУ и ГУГ.
ДНК РНК
Основания
Пуриновые
Рибоза
он н
2-Дезоксирибоза
Урацил Цитозин
Тимин Цитозин
В книге приняты
новации в ДНК н
и урацил — У.
следующие сокращения для обозначения азотистых ос-
РНК: аденин — А, тпмип — Т, гуанин — Г, цитозин — Ц
ОБЗОР ИСТОРИИ МОЛЕКУЛЯРНОЙ ГЕНЕТИКИ
14
ОСНОВНЫЕ АМИНОКИСЛОТЫ, ВСТРЕЧАЕМЫЕ В БЕЛКАХ
I. МОНОАМИНОМОНОКАРБОНОВЫЕ
Чисто углеводородные (содержащие алкильные радикалы)
н н О
I I II
Н-N—С—C-OII
I
н
Глицин
(г ли)
Н Н О
I I II
II—N-C-C—ОН
I
СНз
Ъ-Алании
(ала)
н н О
I I II
П-N—G-C-OII
I
сн
Сщ'сНз
Ъ-Валин
(вал)
н н О
I I II
Н—N—С—С—ОН
I
сн2
I
сн
/\
СНз СНз
Ъ-Лейции
(лей)
Н Н О
I I II
Н—N—С—С-ОН
I
СН
сщ\нз
I
СНз
Ъ-Изолейции
(илей)
Содержащие оксигруппу
Н Н О 1 1 II H-N-C-C-OH Н Н О 1 1 II Н—N—С—С—ОН
сн2 1 Н—С—СНз 1
1 он Серин (сер) он Треонин (тре)
II МОНОАМИНОДИКАРБОНОВЫЕ
(КИСЛЫЕ)
Н Н О
I I II
H-N-С—С-ОН
I
сн2
СООН
н н о
I I II
Н—N—С—С-ОН
I
сн2
I
СН2
I
соон
L-A( парагиновая
кислота- (асп)
L-Гл ута mui < о ва я
кислота (глу)
15
ГЕНЕТИЧЕСКИЙ КОД
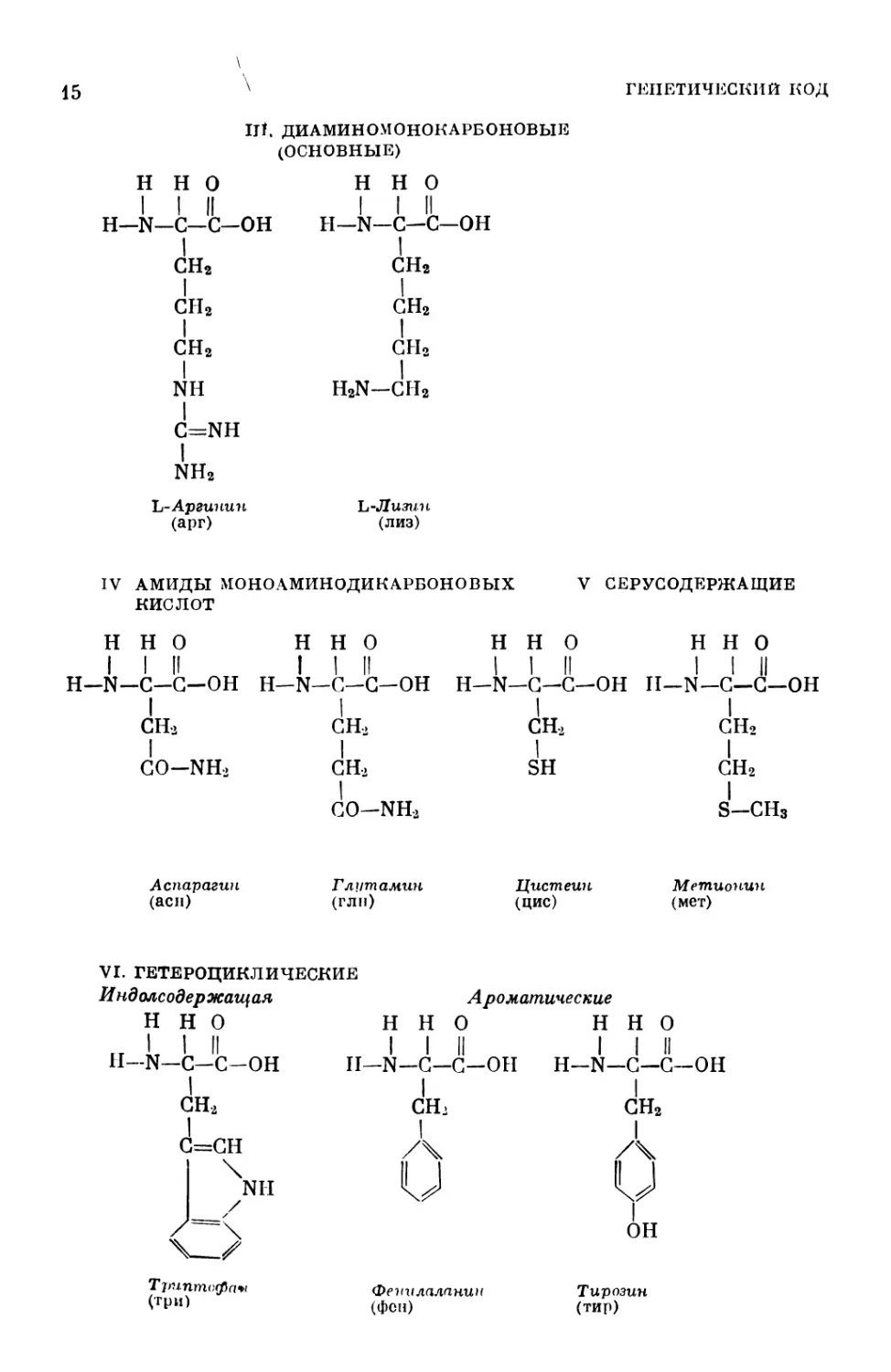
ITt ДИАМИНОМОНОКАРБОНОВЫЕ
(ОСНОВНЫЕ)
н н О
I I II
Н—N—С—С-ОН
I
сн2
I
сн2
I
сн2
I
NH
I
C=NH
I
nh2
L-Аргинин
(арг)
н н О
I I II
Н—N—С—С—ОН
I
СН2
СН2
I
сн2
I
h2n-ch2
L-Лизин
(лиз)
IV АМИДЫ МОНОАМИНОДИКАРБОНОВЫХ V СЕРУСОДЕРЖАЩИЕ
КИСЛОТ
Н Н О н 1 Н О 1 II н 1 Н О 1 II Н Н О 1 1 II
1 1 II
H-N- -С-С-ОН 1 H-N- -С-С-ОН 1 Н—N- -с—с—он 1 II—N— С—С—ОН
1 сн2 1 сн> 1 1 сн2 1 1 сн2
1 СО—NH> 1 сн2 1 SH 1 сн2
I I
GO-NH2 S-CHs
Аспарагин
(асн)
Глутамин
(глн)
Цистеин
(ЦИС)
Метионин
(мет)
VI. ГЕТЕРОЦИКЛИЧЕСКИЕ
Индолсодержащая
н н о
Н-N—С—С-ОН
А роматические
Н Н О Н Н О
I I II I I II
II—N—С—С—ОН Н—N—С—С—ОН
Т риптсфаы
(три)
СН>
СН2
ОН
Фенилаланин
(Фон)
Тирозин
(тир)
ОБЗОР ИСТОРИЙ МОЛЕКУЛЯРНОЙ ГЕНЕТИКИ
16
Имидазолеодержанная (основная)
Н Н О
I I II
Н—N-C-C-OH
I
сн2
I
C-N
HC-N7
(гис)
VII. ЦИКЛИЧЕСКИЕ
(имино-или пиролсодер н< a iue)
н н О
I I II
N-C-C-OII
ЩеГ СН2
Н2
Пролин
(про)
н н о
I I II
N-C-G-OH
щсГ 'сщ
но7 \
Окс.гтролин
(опро)
ДИМЕР ЦИСТЕИНА
н н о
I I II
Н—N-G-C-OH
I
сн2
I
S
I
S
I
gh2
I
Н—N-G-G—ОН
Цистин
Если же ввести сополимер урацила и гуанина в сочетании 1 : 5,
то в таком полимере следовало ожидать с большой частотой встре-
чаемости последовательности ...УГГГГГУГГГГГУ... и тогда мож-
но было ожидать большого включения аминокислот, кодируемых
такими тройками: УГГ, ГГГ, ГУГ и ГГУ.
Этот принцип был широко использован в лабораториях М. Ни-
ренберга и С. Очоа. В результате интенсивной работы этих лабора-
торий к концу 1962 г. были установлены составы кодонов для
большинства аминокислот. Однако в этих данных не содержалось
информации о том, в каком порядке следуют основания в любом
конкретном случае. Был момент, когда казалось, что задача отыс-
кания точной последовательности оснований в кодонах является
гораздо более трудной, чем все до сих пор сделанное. Тем не ме-
нее и эта задача была решена в кратчайший срок.
Второй этап в изучении структуры генетического кода оказал-
ся связанным также с именем Маршалла Ниренберга. В 1964 г,
17
ГЕНЕТИЧЕСКИЙ КОНТРОЛЬ СИНТЕЗА БЕЛКА
М. Ниренберг и Ф. Ледер задались целью определить, какой мини-
мальной длины олигонуклеотид может быть присоединен к рибо-
соме, с тем чтобы вызвать специфическое связывание с ней амино-
ацил-т-РНК 1. Им удалось показать, что такой минимальной инфор-
мационной РНК может быть олигонуклеотид, содержащий всего
три основания. Поскольку химическими методами можно синтези-
ровать трппуклеотиды точно известного строения, Ниренберг и Ле-
дер получили возможность следить за присоединением ампноацпл-
т-РНК, несущих любую из аминокислот, к любым кодонам.
В короткий срок в лаборатории Ниренберга была выполнена
работа по определению большинства кодонов. Параллельно с этим
Гобинд Корана, Чарлз Яновский, Герман Виттман и др. смогли
проверить правильность кодонов, найденных в лаборатории Ни-
ренберга. Эта проверка заключалась в определении состава белков,
синтезируемых па искусственных матрицах, и в определении за-
мен аминокислот в ряде мутантов бактерий, вирусов животных и
растений. Совпадение данных проверки с таблицей кода, предло-
женного Ниренбергом, явилось достаточно убедительным доказа-
тельством универсальности кода.
Генетический контроль синтеза белка
Основной вопрос, касавшийся проблемы функционирования генов,
заключался в определении того пути, каким информация, запи-
санная в гене, переводилась в структуру белка. После опубликова-
ния гипотезы Крика и Уотсона тезис о связи синтеза белка с
функционированием ДНК и РНК стал исключительно популярным,
хотя первые работы, показавшие эту связь, были выполнены еще
в 40-х годах Ж. Браше и Б. В. Кедровским.
Г. Гамов, одним из первых попытавшийся выяснить путь от
гена к белку, постулировал, что аминокислоты могут сорбировать-
ся непосредственно на ДНК, присоединяясь к специфическим три-
плетам. Однако такое простое решение проблемы было неверным,
поскольку точного стерического соответствия между участками
ДНК и молекулами белков найти не удалось. Кроме того, широкий
ряд экспериментов школы Ж. Браше, Б. В. Кедровского и др. го-
ворил о том, что синтез белка связан прежде всего с рибонуклеи-
новыми кислотами.
Большим шагом вперед было установление локализации синте-
за белков внутри клетки. Разработка методов электронного микро-
скопирования ультратонких срезов клеток, определения молекуляр-
1 Амипоацил-т-РНК — молекула транспортной РНК с присоединенной к
Вей молекулой аминокислоты. Только т-РНК может поставить на нужное
место аминокислоту при синтезе белка.
ОБЗОР ИСТОРИИ МОЛЕКУЛЯРНОЙ ГЕНЕТИКИ
18
пых весов с помощью ультрацентрифугпрования, биохимического
анализа белка, РНК и ДНК с использованием изотопных методов
позволили в начале пятидесятых годов приступить к интенсивному
изучению биосинтетической активности живых клеток и прежде
всего синтеза белка.
Было установлено, что наряду с крупными органеллами клеток,
такими как митохондрии и пластиды, в пих обнаруживаются го-
раздо более мелкие по размерам структуры. Эти структуры, рас-
полагавшиеся в местах, где наблюдается синтез белков, стали объ-
ектом пристального изучения. В их составе было найдено пример-
но равное содержание белка и РНК, и они получили название
рибосом. Было обнаружено, что в цитоплазме животной клетки
существует сеть канальцев, соединенных с отверстиями в ядерпой
мембране (рис. 4). Канальцы, отходя от этих отверстий и развет-
вляясь, занимают большой объем цитоплазмы, причем в месте ло-
кализации сети (она получила название эндоплазматический рети-
кулум) как раз и наблюдается интенсивный синтез белка. Далее
оказалось, что рибосомы находятся внутри ретикулума, п внутрен-
ние стенки канальцев его усеяны рибосомами.
Химический анализ РНК давно привлек внимание биохимиков
к проблеме связи между ДНК, расположенной в ядре клеток выс-
ших организмов, и РНК, локализующейся в цитоплазме. Эту связь
теперь можно было объяснить, предположив, что РНК синтезиру-
ется па ДНК в ядре, затем освобождается от матрицы ДНК, через
отверстие в ядерной мембране выходит из ядра и попадает в ка-
нальцы эндоплазматического ретикулума, где соединяется с рибо-
сомами. Переход РНК из ядра в цитоплазму был даже зарегистри-
рован экспериментально, и теперь можно было думать, что пере-
мещаясь из ядра в цитоплазму и затем соединяясь с рибосомами,
РНК определяет, какие белки будут синтезироваться.
Такая картина могла просто объяснить многие загадки биохи-
мической генетики, и несколько лет казалось, что именно так и
обстоит дело в живых клетках. Вместе с тем, важным преимуще-
ством этой схемы было то, что она позволяла предпринимать экс-
периментальное изучение ее правильности.
В числе таких экспериментов важное место заняли опыты по
изучению так называемого нуклеотидного состава ДНК и РНК.
В лабораториях Э. Чаргаффа и А. Н. Белозерского был установлен
факт фундаментальной важности. Изучение соотношения пар АТ и
ГЦ в ДНК разных организмов выявило серьезные отличия в ка-
чественном составе ДНК. Одни организмы характеризовались
большим содержание пар АТ, чем ГЦ, другие, напротив, несли
больше пар ГЦ. Более того, нуклеотидный состав оказался падеж-
ным видовым признаком.
Однако предположение о том, что РНК рибосом представляет
собой продукт, синтезированный на ДНК и перешедший в цпто
19
ГЕНЕТИЧЕСКИЙ КОНТРОЛЬ СИНТЕЗА БЕЛКА
^ис. 4, Электронная микрофотография участка эндоплазматического
Ретикулума
Видны рибосомы, прикрепившиеся к канальцам ретикулума
плазму, требовало, чтобы нуклеотидный состав РНК отражал тако-
вой состав ДНК. Исходя из этого, А. Н. Белозерский и А. С. Спи-
Рин начали изучение нуклеотидного состава клеточной РНК и ДНК
У разных организмов. Так как на долю РНК рибосом приходится
основная доля клеточной РНК, то следовало ожидать получения
ОВЗОР ИСТОРИИ МОЛЕКУЛЯРНОЙ ГЕНЕТИКИ
20
совпадающих цифр. Однако эксперимент показал, что никакого со-
ответствия между нуклеотидным составом суммарной клеточной
РНК и ДНК на деле не существует. Этот вывод А. Н. Белозерско-
го и А. С. Спирина был истолкован некоторыми исследователями
как принципиальное опровержение схемы «ДНК — РНК — белок»,
хотя сами авторы полагали, что возможно такая связь существу-
ет, но только процентное соотношение тех молекул РНК, которые
синтезировались на ДНК, и каких-то других молекул РНК невели-
ко, и первые составляют небольшую долю от вторых.
Пропасть, разделявшая ДНК и клеточные РНК, оказалась за-
полненной в 1961 г., когда Волкин и Астрахан, исследовавшие
вновь синтезируемую РНК в бактериальных клетках, зараженных
фагом Т2, обнаружили новый класс РНК, названной впоследст-
вии информационной РНК. Эти авторы использовали метод так
называемого импульсного мечения. В клетку па короткий отрезок
времени вводил и предшественники РНК, после чего вновь синте-
зированную РНК выделяли из клетки и анализировали. Выясни-
лось, что эта РНК полностью совпадает по составу с ДНК фагов.
Затем структурное соответствие ДНК и информационной РНК,
пли и-РНК (синонимы — РНК-посредник, мессенджерная РНК)
было установлено в опытах по молекулярной гибридизации. Этот
метод, разработанный П. Доти, С. Шпигельманом и др., заключа-
ется в том, что молекула ДНК денатурируется, иначе говоря, нити
ДНК разделяются в растворе. Они могут при создании подходя-
щих условий снова соединиться и закрепиться водородными свя-
зями. Такое соединение, очевидно, возможно только в том случае,
когда нити взаимно комплементарны:
Этот метод назвали гибридизацией, причем выяснилось, что
можно соединить не только две нити ДНК друг с другом, но и
нить ДНК с синтезированной на ней нитью РНК (рис. 5). Исполь-
зование метода гибридизации позволило доказать, что быстро син-
тезируемая РНК комплементарна к ДНК. Затем было показано,
что и-РНК перед началом синтеза белка соединяется с рибосома-
24
ГЕНЕТИЧЕСКИЙ КОНТРОЛЬ СИНТЕЗА БЕЛКА
Рис. 5. Гибридизация молекул РНК и ДНК
Гибридизация возможна только при наличии однонитевых структур и осуществля-
ется при комплементарности нитей РНК и ДНК. Показаны две нити ДНК; видно,
что гибридизация может произойти только между молекулами ДНК-1 и РНК-1
ми, «заряжает» их, после чего может определять порядок присо-
единения ампноацил-т-РНК. Рибосомзная РНК (р-РНК), как ока-
залось, не принимает непосредственного участия в синтезе белка,
а потому не несет специфической информации, и нет ничего удиви-
тельного в том, что Белозерский и Спирин не смогли обнаружить
совпадение нуклеотидного состава суммарного препарата РНК
(являющегося в значительной мере рибосомной РЦК) и нуклео-
тидного состава ДНК.
Примерно в это же время был обнаружен третий вид РНК —
так называемая транспортная РНК (т-РНК). Низкомолекулярная
по сравнению с информационной и рибосомной РНК, транспорт-
ная РНК находилась в клетке в растворенном состоянии и поэто-
му вначале ее называли растворимой РНК (рис. 6).
Открытие транспортной РНК позволило разрешить еще одну
загадку, связанную с белковым синтезом. Так как прямого стери-
ческого соответствия между нуклеиновыми кислотами и белками
обнаружено не было, следовало выяснить, каким образом амино-
кислоты определяют нужное место при сборке полипептидной
Цепи.
Ф. Крик предложил адапторную гипотезу, согласно которой в
клетке должно существовать, по крайней мере, 20 сортов особых
адапторных РНК, роль которых сводится к тому, чтобы соеди-
няться с аминокислотами (отсюда двадцать сортов адапторных
РНК — по одному сорту на каждую аминокислоту) и уметь узна-
вать соответствующий данной аминокислоте кодон. Поскольку
соединение РНК с аминокислотой не могло совершаться без
Участия ферментов, Крик постулировал существование не менее
I
о
Рис. 6. Структуры тирозиновой (а), аланиновой (6), фенилаланиновой (в)
и сериновой (г) транспортных РНК
Полагают, что вторичная структура транспортных РНК образует характерную
тырехлистную конфигурацию (^клеверный лист»)
23
ГЕНЕТИЧЕСКИЙ КОНТРОЛЬ СИНТЕЗА БЕЛКУ
Рис. 7. Схема, поясняющая синтез белка под контролем генов
С генов считывается молекула информационной РНК, которая соединяется с рибо-
сомами. К последним подходят молекулы транспортных РНК, соединенные с ами-
нокислотами
20 специфических активирующих ферментов, катализирующих
реакцию присоединения каждой аминокислоты к соответствующей
адапторной РНК.
Адапторная гипотеза Крика получила блестящее подтвержде-
ние после обнаружения транспортных РЦК. Эти РНК действи-
тельно соединялись одним концом с аминокислотой и несли в оп-
ределенном месте триплет, комплементарный к кодону для данной
аминокислоты. Этим триплетом (или антикодоном, как принято
его называть) транспортная РНК, соединенная с аминокислотой
(аминоацил-т-РНК), присоединялась к информационной РНК.
Такое присоединение осуществлялось только в рибосоме, что
объяснило роль последних в синтезе белка.
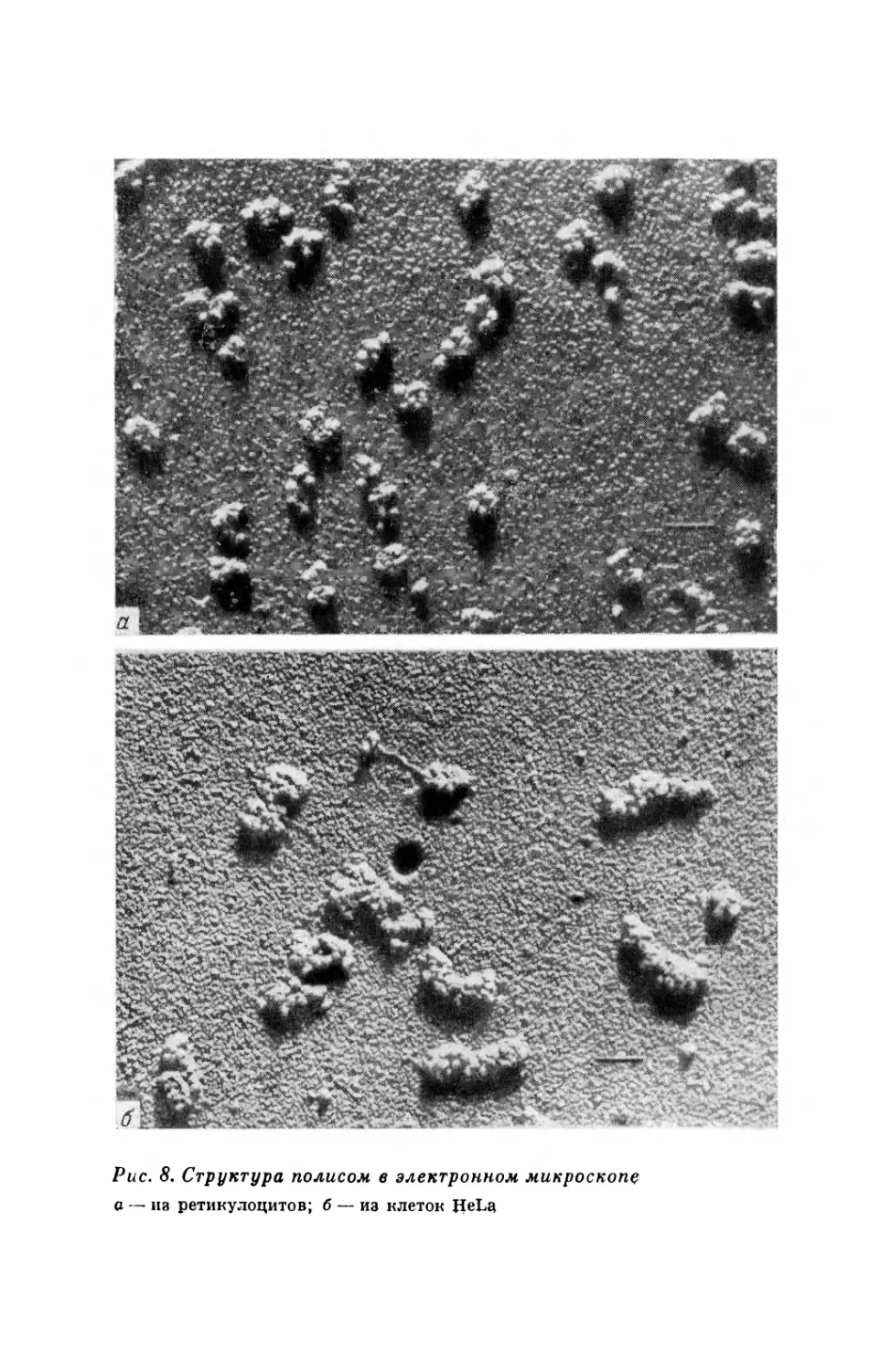
Таким образом, путь от гена к белку был установлен, и найде-
но, что белковый синтез состоит из многих реакций (рис. 7). Кро-
ме того, было обнаружено, что к одной молекуле информационной
РНК присоединяется несколько рибосом, образующих так назы-
ваемую полирибосому, пли полисому. Полисомы удалось рассмот-
реть в электронном микроскопе (рис. 8).
Следует также упомянуть, что в последнее время удалось рас-
крыть механизмы начала и прекращения синтеза белка у бакте-
рий. Начало синтеза осуществляется с помощью специального
класса транспортных РНК — формилметиоппповой т-РНК. Снача-
ла предполагали, что только эти т-РНК могут узнать начальную
точку'чтения в информационной РНК, и все белки должны были
Рис. 8. Структура полисом в электронном микроскопе
а — из ретикулоцитов; б — из клеток HeLa
25
ГЕНЕТИЧЕСКИЙ КОНТРОЛЬ СИНТЕЗА БЕЛКА
Участок, списанный с Pro гена
полицистронной и-РНК
____________А______________
Направление движения рибосом
Естественная
конечная и
начальная точки
Нонсенс-
кодон
Место
присоединения
рибосом
Участок на котором Участок на котором остается
рибосома освобож- меньше активных рибосом
дается от и - РНК
Рис. 9. Продвижение рибосом по полицистронной информационной РНК
Обрыв синтеза полипептидной цепи происходит на нонсенс-кодоне, имеющемся в
правой части и-РНК, списанной с первого гена, и на концевой точке этого гена.
Большая часть рибосом отсоединяется на этик точках, и движение вдоль полици-
стронной и-РНК продолжают лишь немногие «проскользнувшие» рибосомы (Yanof
sky el al., 1966)
бы начинаться с этой аминокислоты. Однако этого на деле не ока-
залось. Последующие работы доказали, что после окончания син-
теза белка, с помощью специальных ферментов, от него отщепля-
лась либо формильная группа, либо формилированный метионин.
Прекращение считывания происходит на одном из трех особых
триплетов, так называемых бессмысленных кодонах (УГА, УАГ
и УАА), которые не соответствуют никакой аминокислоте и по-
тому обрывают синтез белка. Кстати, обнаружение этих кодонов
позволило понять, почему после некоторых мутаций (вызываю-
щих возникновение именно этих кодонов У ГА, УАГ и УАА) по-
лучаются короткие отрезки полппептидных цепей (рис. 9).
Наконец, упомянем о том, что благодаря работам лабораторий
Холли, А. А. Баева и других удалось установить точное строение
почти 15 транспортных РНК.
Молекулярные механизмы мутагенеза
Важнейшей характеристикой наследственного материала являет-
ся способность давать стойкие изменения — мутации. Без этого
свойства невозможна эволюция живого мира.
С момента переоткрытия законов Менделя (1900 г.) и знаме-
нитых работ Гуго де Фриза (1900—1904 гг.), привлекших внима-
ние исследователей к изучению мутаций, в первые два десятиле-
тия XX века был накоплен обширный экспериментальный мате-
риал относительно мутаций различных организмов, преимущест-
ОБЗОР ИСТОРИИ МОЛЕКУЛЯРНОЙ ГЕНЕТИКИ
26
Выдающиеся советские генетики — С. С. Четвериков, А. С. Серебровский,
Г. Д. Карпеченко и Н. И. Вавилов на Между народном Генетическом Кон-
грессе в Берлине в 1927 г.
венно растительных. С введением в обиход генетических
экспериментов плодовой мушки-дрозофилы (школа Т. Г. Морга-
на) началось исключительно интенсивное изучение мутаций у
этого насекомого. В течение примерно десяти лет работы с дрозо-
филой ученые описали у нее большое число мутаций, затрагивав-
ших практически все морфологические структуры тела мухи.
Принципиальной отличительной чертой этих наблюдений было
то, что частота мутаций, обнаруженная в условиях лаборатории,
была такой же, как у свободно обитающих в природе мух. Особен-
но показательной в этом наира вл опии была работа лаборатории
Сергея Сергеевича Четверикова в Кольцовском институте экспе-
риментальной биологии. С. С. Четвериков и его ученики выловили
в предгорьях Кавказа большую популяцию дрозофил и изучили
мутации, встречающиеся в этих популяциях. Анализ показал, что
в природных условиях дрозофилы несут практически такое же ко-
личество и примерно те же типы мутаций, что и лабораторные
мухи. В то время казалось, что вызвать искусственно мутации не-
возможно, хотя генетики понимали, насколько важно и для изу-
чения генетических закономерностей, и для целей селекции на-
учиться повышать частоту мутаций.
Возможность искусственного вызывания мутаций была доказа-
на в 1925 г. Г. А. Надсоном и Г. С. Филипповым и в 1927 г.
Г. Меллером. Использовав рентгеновые лучи, эти авторы смогли
зарегистрировать повышение частоты мутаций у дрожжей и у
дрозофилы. Еще через год Л. Стадлер обнаружил мутагенный эф-
фект рентгенового облучения на кукурузе.
27
МОЛЕКУЛЯРНЫЕ МЕХАНИЗМЫ МУТАГЕНЕЗА
В короткий срок исследование ин-
дуцированного мутационного процес-
са у различных организмов под влия-
нием облучения приобрело широкий
размах. В начале 30-х годов осо-
бенно сильная группа исследовате-
лей сконцентрировалась вокруг со-
ветского генетика Николая Влади-
мировича Тимофеева-Ресовского, ко-
мандированного в Германию для
постановки генетических экспери-
ментов. В эту группу входили тогда
еще молодые физики Макс Дельбрюк
и Карл Циммер. Задавшись целью
сформулировать основные законо-
мерности взаимодействия излучения
и наследственного вещества, эти ав-
торы и параллельно с ними англий-
ские исследователи Дж. Кроутер и
Д. Ли создали широко известную
теорию мишени.
Следует особо подчеркнуть ту
Гуго де Фриз, основавший
вместе с русским ученым
С. И. Коржинским мутацион-
ную теорию в 1900—1901 гг.
роль, которую сыграли в развитии
молекулярной биологии и в особен-
ности молекулярной генетики Тимо-
феев-Ресовский и Дельбрюк. Их ис-
ключительные организаторские спо-
собности и редкий дар популяриза-
ции генетических задач особенно
проявились при создании так назы-
ваемого Боровского биологического
семинара. Макс Дельбрюк впослед-
ствии вспоминал, что любовь к био-
логии была традиционной в семье
Нильса Бора (его отец был доволь-
но известным биологом). Не удиви-
гельно, что ряд блестящих физи-
ков — друзей Нильса Бора приняли
участие в этом семинаре.
Чрезвычайно большое влияние
Основоположник хромосомной
теории наследственности
Томас Гент Морган
на последующее развитие молеку-
лярной генетики и на привлечение в
нее молодых физиков и математиков
указала книга Зрвпна Шредингера
к Что такое жизнь с точки зрения
ризики», написанная под влиянием
ОБЗОР ИСТОРИИ МОЛЕКУЛЯРНОЙ ГЕНЕТИКИ
28
Основатель эволюционной генетики Сергей Сергеевич Четвериков в своем
кабинете в Горьковском университете в 1946 г.
идей, обсуждавшихся на Боровском семинаре. Эта книга была пе-
реведена на русский язык А. А. Малиновским и, снабженная при-
мечаниями и послесловием А. А. Малиновского, вышла в конце
1947 г.
\ Следующим важным шагом в развитии мутационной теории
послужило открытие Владимиром Владимировичем Сахаровым в
1933—1934 гг. химического мутагенеза. Вместе с тем должного
внимания работа В. В. Сахарова не привлекла, и хотя в 1937 г.
М. Е. Лобашов повторил вывод Сахарова о возможности индуци-
рования мутаций химическими агентами, пора широкого развития
химического мутагенеза наступила только после окончания Вто-
рой мировой войны, когда Иосиф Абрамович Рапопорт в СССР и
Шарлотта Ауэрбах в Англии опубликовали свои работы по вызы-
ванию мутаций алкилирующими агентами. В лаборатории И. А. Ра-
попорта развернулись весьма интересные исследования химиче-
ского мутагенеза, прерванные в 1948 г. после августовской сессии
ВАСХНИЛ.
Молекулярная природа химического мутагенеза оставалась не-
ясной до появления гипотезы Крика и Уотсона относительно
структуры ДНК. Уже в этой гипотезе содержалось зерно будущих
представлений о том, что обусловливает возникновение мутаций.
29
МОЛЕКУЛЯРНЫЕ МЕХАНИЗМЫ МУТАГЕНЕЗА
По мысли авторов, замена одного из
нуклеотидов в паре ГЦ пли АТ на
иекомнЛемеитарного партнера должна
привести к изменению генетической
записи. Однако конкретная модель му-
тационных изменений была предло-
ложена только в 1959 г. Эрнстом
Фризом и развита им в последующие
3—4 года. Фриз предполагал, что все
случаи точечных мутаций с точки
зрения их молекулярной природы
можно разделить на два основных ти-
па: простые и сложные. При простых
заменах происходит замена пурино-
вого основания пуриновым, а пирими-
динового пиримидиновым. При слож-
ной замене пуриновое основание за-
меняется пиримидиновым и наоборот.
В настоящее время более распростра-
ненными являются термины транзи-
ция (для простых замен) и трансвер-
зия (для сложных замен) (рис. 10).
Переход к генетическим исследо-
ваниям микроорганизмов (конец 40-х
годов) дал возможность настолько
увеличить разрешающую способность
генетических методов, что практиче-
ски генетики приблизились к работе
с отдельными основаниями в огром-
ных молекулах ДНК. Это удобство
работы с микробами, когда в руках
исследователя в одном опыте может
оказаться до миллиарда легко учиты-
ваемых особей, сказалось прежде все-
го на исследовании молекулярных ме-
ханизмов мутагенеза. Э. Фриз и его
коллеги сумели быстро доказать, что
подавляющее большинство мутаций
является точечными. Этим па моле-
кулярном уровне было подтверждено
правило, впервые высказанное
С. С. Четвериковым в 1926 г., глася-
щее, что большинство встречающих-
ся в природе мутаций суть точечные
Мутации,
Георгий Адамович Надсон, от-
крывший явление радиацион-
ного мутагенеза в 1925 г.
Герман Мёллер, открывши»,
одновременно с Над с о ном и
Филипповым возможность ис-
кусственного вызывания му-
таций рентгеновыми лучами
ОБЗОР ИСТОРИИ МОЛЕКУЛЯРНОЙ ГЕНЕТИКИ
30
Трансверзии
а
— Транзиции
Внеядерные
(иди внехромосомные)
=Цитоплазматические
Наследственные
вариации
Ядерные
(или хромосомные)
Изменение числа
хромосом
Изменение
генетической
информации
Анеуплоиды Полиплоиды /
Рекомбинация Мутация
Точечные
мутации
Крупные
перестройки
Выпадение Замена Вставка
оснований оснований основания
в
Рис. 10. Типы мутаций
а — точечные мутации; б — транзиции и трансверзии;
Делении ТрансЛ'окации
Инверсии
в — классификация мутаций
Наряду с этим в классификации Э. Фриза сохранились типы
мутаций, ранее описанные в классической генетике, такие как де-
лении, дупликации, инверсии, транслокации. Развитие работ по
генетике бактериофагов, п в особенности работ с rl 1-мутантами
фага Т4 (Сеймур Бензер), позволило доказать наличие ряда таких
мутаций и прежде всего делений.
Однако в своей трактовке молекулярной природы точечных му-
таций Фриз не учел того, что наряду с трапзицпями и трансверзия-
ми могут быть мутации, изменяющие количество оснований в
31
ТЕОРИЯ ГЕНА
гене. Этот промах был исправлен Кембриджской школой молеку-
лярных генетиков, которые в 1961 г. сначала предсказали (Брсш-
нер, Барнет, Крик и Оргель), а затем экспериментально доказали,
что наряду с заменами существуют такие точечные мутации, ког-
да один или несколько нуклеотидов внедряются в структуру
ДНК или, наоборот, выпадают из нее. Такие мутации изменяют
чтение всего последующего участка гена от точки изменения,
и они получили название «мутации сдвига чтения». Исключитель-
но важными для молекулярной теории мутагенеза оказались ра-
боты по изучению аминокислотных замен в мутаптиых белках,
выполненные на бактериальных и растительных вирусах и белках
кишечной палочки.
Наконец, в самое последнее время появилась надежда с моле-
кулярных позиций объяснить загадку, касавшуюся возникновения
полных и мозаичных мутаций. Долгое время генетики не могли
представить убедительных объяснений, почему в некоторых слу-
чаях поврежденными оказываются сразу обе нити ДНК (полная
мутация), в то время как в других случаях изменению подверга-
ется только одна из нитей (мозаичная мутация). Открытие фер-
ментных систем, исправляющих повреждения ДНК, нанесенные
физическими и химическими агентами, и выяснение молекулярно-
го механизма их действия позволило обосновать тезис о том, что
именно репарирующие системы переносят повреждения с одной
нити ДНК па другую, вызывая появление полной мутации. Этот
же принцип был использован для объяснения причин появления
хромосомных, а не хроматидных мутаций в стадии £i, когда
Днк хромосом остается неренлицирующейся, при воздействии
на клетки агентами, вызывающими ренарируемые повреждения1
(Н. Н. Дубинин, В. Н. Сойфер, 1969).
Теория гена
Первоначальные данные о гене, базировавшиеся в основном па
представлениях и экспериментах Грегора Менделя и описывав-
шие ген как стабильную генетическую структуру, передающуюся
1 gi-Стадия митотического цикла, предшествующая фазе синтеза ДНК
(5-фаза). На этой стадии хромосомы, как это недавно было показано, со-
держат одну двунитевую молекулу ДНК. Основной принцип модели Н. П.
Дубинина и В. Н. Сойфера заключается в том, что при повреждении одной
нити ДНК, приводящем к нарушению вторичной конфигурации ДНК, ре-
парирующие ферменты могут узнать поврежденное место в молекуле
ДНК и вырезать участок одной из нитей дуплекса в поврежденном райо-
не. При вырезании нити, противоположной поврежденной, само повреж-
дение, искажающее конфигурацию ДНК, будет сохраняться, и при пов-
торном прохождении по ДНК репарпрующих ферментов этот участок
Может быть разрезан, что обусловит возникновение хромосомного
разрыва.
ОБЗОР ИСТОРИИ МОЛЕКУЛЯРНОЙ генетики
32
Основатель генетики
Грегор Мендель
как целое при скрещиваниях и определяющую один морфологи-
ческий признак, приобрели законченный вид к середине 20-х го-
дов. К этому времени стала известна локализация многих генов
в хромосомах дрозофилы, началось построение генетических карт
некоторых растений, и заключение о том, что ген — есть единица
функции, мутации и кроссинговера, казалось надежно доказан-
ным. В пользу этого говорил ряд фактов. Прежде всего в боль-
шинстве исследований генетической структуры хромосом количе-
ственные оценки расстояний между генами свидетельствовали о
том, что ген неделим при кроссииговере. Цитологические данные,
в особенности данные по перестройкам хромосом, также совпада-
ли с генетическими. Изучение как прямых, так и обратных мута-
ций (Г. Меллер, Н. В. Тимофеев-Ресовский, Ф. Г. Добржанский)
говорило о том, что во время мутации ген переходит из одного
аллельного состояния в другое, не дробясь. Все эти данные хоро-
шо укладывались в концепцию о неделимости гена.
Однако эта концепция не выдержала проверки временем.
В 1928—1929 гг. Н. П. Дубинин опубликовал первые работы по
изучению так называемого ступенчатого аллеломорфизма (термин
предложен А. С. Серебровскпм). В течение 1929—1934 гг. было
опубликовано большое число сообщений об обнаружении мутан-
тов, имеющих разную локализацию в пределах одного гена scute
у дрозофил (Дубинин, Серебровский, Агол, Гайсинович, Сидоров
и др.). Эти работы опровергали представление о неделимости
гена.
Исключительно важной особенностью работ по ступенчатому
аллеломорфизму оказалось то, что впервые в этих опытах уда-
33
ТЕОРИЯ ГЕНА
лось обнаружить внутригепную комплементацию генов — восста-
новление функции гена после объединения в одной особи хромо-
сом, несущих повреждения одного и того же гена, но в непере-
крывающихся сайтах. Впоследствии явление комплементации
было широко изучено на микроорганизмах *.
В 1938 г. Н. П. Дубинин, Н. Н. Соколов и Г. Г. Тиняков опуб-
ликовали работу, доказавшую, что и при кроссинговере ген можно
разделить.
К такому же выводу впоследствии пришли американские ис-
следователи .Льюис и Понтекорво.
Г11 Г1 гШ
----
Рис. 11. Расположение r-мутаций на генетиче-
ской карте бактериофага Т4
Указанные работы, проведенные в основном на дрозофиле,
хотя и представили убедительное доказательство дробимости гена,
но не могли стать базой для дальнейшего анализа внутригенной
структуры хотя бы потому, что они требовали для получения не-
обходимого количества информации огромного времени и средств.
Для получения всего лишь одной особи с перекрестом внутри
гена Дубинину и его сотрудникам потребовалось просмотреть
75 000 мух, а в аналогичный эксперимент Льюиса было вовлечено
100 тысяч мух. Поэтому естественно, что после открытия мутаци-
онной и рекомбинационной дробимости гена прошло более 20 лет,
прежде чем интерес к этой проблеме возродился.
Основой для такого возрождения послужил переход к изуче-
нию генетики микроорганизмов. В начале 50-х годов за изучение
мутационной изменчивости и рекомбинационной способности взял-
ся физик Сеймур Бензер. Он намеренно ограничил себя объектом
исследований. Основное внимание он сосредоточил на изучении
так называемых г-мутантов фага Т4. Прежде всего он сумел диф-
ференцировать мутанты, отличающиеся г-признаком (быстрый
рост, прозрачная крупная бляшка с четко очерченными краями),
на три группы. Оказалось, что г-мутапты занимают па генетиче-
ской карте, по крайцей мере, три локуса в разных точках хромосо-
мы (г!~, и rll- и гШ-мутанты) (рис. 11). После этого Бензер еще
более сузил свое исследование и обратился к изучению только rll-
Мутаптов. Оказалось, что и эти г! 1-мутанты не представляют
собой единой группы. С помощью разработанного им метода опре-
1 См. Дж. Финчем. Генетическая комплементация. М., «Мир», 1968.
2 В. Н. Сойфер
ОБЗОР ИСТОРИИ МОЛЕКУЛЯРНОЙ ГЕНЕТИКИ
34
деления функционального различия мутантов (цис-транс-тсст)
Бензеру удалось разделить все полученные ИI-мутанты (несколь-
ко сотен) на две группы. Этим самым Бензер показал, что в пре-
делах ril-области существует два гена — цпстроны А и В.
Не менее важным было н то, что Беизер в пределах каждого
из этих генов смог локализовать несколько сот мутирующих
точек *.
Таким образом, па молекулярном уровне было подтверждено
и окончательно доказано положенно о дроби мости гена, впервые
установленное на дрозофиле И. II. Дубининым.
Регуляция генной активности
Любая клетка живого организма принципиально равнозначна
другим клеткам этого же организма в отношении количества ге-
нетической информации и характеристик генов. Но тем пе менее
в любом дифференцированном организме клетки совершенно раз-
личны по своему фенотипу (понимая под фенотипом не только
внешнюю форму клеток, по и совокупность биохимических реак-
ций, совершающихся в этой клетке). Отсюда следует признать,
что при реализации генетической программы происходит неоди-
наковое выключение тех или иных генов в различных клетках.
Эта функциональная неравнозначность клеток и связанная с
ней репрессия и активация генов давно вызывали удивление ге-
нетиков, но до недавнего времени никто не мог предложить реаль-
ного механизма контроля генной активности.
Первые попытки объяснить проблему регуляторной активно-
сти были связаны с изучением гистонных белков. Еще супруги
Стэдман в своих пионерских работах по изучению гистонов вы-
сказывали мысль, что именно гистоны могут выполнять роль
контролеров активности генов. Эта догадка получила некоторое
косвенное подтверждение в более поздпих работах Давида Поппе-
ра, Ру-Чи-Хуапга, Тсьо и других;
Комплекс данных, говорящих в пользу этой гипотезы, в на-
стоящее время довольно обширен, п вряд ли предположение
о регуляторной роли гистонов окажется только предположе-
нием.
В то же время все больше данных говорит о том, что регуляция
генной активности гораздо более сложный процесс, нежели про-
1 Полная карта ril-области, полученная С. Призером, приведена в кни-
ге В. Н. Сойфера «Молекулярные механизмы мутагенеза». М., «Наука»,
1969.
35
РЕГУЛЯЦИЯ ГЕННОЙ АКТИВНОСТИ
стое взаимодействие участков генов с молекулами белков. Об этом
в первую очередь свидетельствуют эксперименты по регуляции
генов у микроорганизмов.
Прежде всего следует указать, что в 1960—1962 гг. в лабора-
тории Романа Бениаминовича Хесипа-Лурье удалось доказать
неравнозначность генов фаговой хромосомы. Было показано,
что можно разделить гены фага Т2 па ранние, работа которых
происходила в первые минуты заражения бактериальной клетки,
и поздние гены, начавшие синтезировать и-РНК после заверше-
ния работы ранних генов.
Четкая координированность действия генов и их своеобразная
иерархия была доказана Франсуа Жакобом и Жаком Моно в
1961 г. Они показали, что гены бактерий можно условно разде-
лить па два различных типа: структурные гены, дающие инфор-
мацию о синтезе определенных ферментных белков, и регулятор-
ные гены, следящие за включением и выключением отдельных
генов пли их блоков в зависимости от метаболических потребно-
стей клетки.
По мысли Жакоба и Моно регуляторные гены должны были
детерминировать особые молекулы репрессоров, которые, соеди-
няясь с другими генами регуляторной системы — генами-опе-
раторами, управляли бы работой последних. Тем самым Жа-
коб и Моно разделили гены регуляторной системы в свою очередь
на два типа: гепы-регуляторы и гены-операторы. В эксперимен-
тах с кишечной палочкой Жакоб и Моно смогли дать принци-
пиальное доказательство существованию этих генов. По их дан-
ным геп-регулятор находится па некотором отдалении от струк-
турных генов, управляемых им, а ген-оператор непосредственно
примыкает к блоку структурных генов.
Авторы ввели новое понятие в генетике, определив блок струк-
турных гепов и управляющий ими оператор как единую структу-
ру — оперон.
Таким образом, схема взаимодействия гена-регулятора, опе-
ратора и структурных гепов (рис. 12) может быть представлена
следующим образом: геп-регулятор синтезирует особое вещест-
во — репрессор. Последний может воздействовать на операторный
участок — выключать (или в некоторых случаях включать) его.
Активность репрессора зависит от того, находятся ли в клетке в
Достаточном количестве регуляторные метаболиты (рис. 13). При
включении оператора последние дают команду структурным ге-
нам, и те, в свою очередь, начинают синтезировать молекулы ин-
формационных РНК, которые затем подвергаются считыванию в
Рибосомах. Процесс заканчивается синтезом специфических фер-
ментных белков.
2*
Рис. 12. Схема регуляции белкового синтеза по Жакобу и Моно
Рис. 13. Две системы обратной связи контроля биосинтеза клеточных
продуктов на примере синтеза изолейцина в бактерии Е. coll
Конечный продукт синтеза действует как регуляторный сигнал, который ингибирует
активность первого фермента L-треониндезаминазы (А), а также подавляет синтез
всех пяти {1—5) ферментов цепи (Б)
37
РЕПАРАЦИЯ ГЕНЕТИЧЕСКИХ ПОВРЕЖДЕНИЙ
В последнее время ла фаге лямбда Марком Пташне и на клет-
ках кишечной палочки Бенно Мюллер-Хиллом было показано,
что репрессор является белковой молекулой.
Наконец, было установлено (Беквит), что помимо оператора
и гена-регулятора имеются гепы-промотеры, также участвующие
в регуляции работы структурных генов. По-видимому, к промо-
терам присоединяется молекула РНК-полимеразы.
Репарация генетических повреждений
Новой главой в развитии молекулярной генетики стало учение
о системе репарирующих ферментов, исправляющих повреждения
генетических структур, вызванные облучением или обработкой
химическими агентами. Первоначально репарирующие системы
были найдены только у бактерий и фагов, ио в настоящее время
получены доказательства, что репарация активно осуществляет-
ся и в грибах, и в водорослях, и в клетках высших растений и
животных.
Наиболее хорошо изучены два вида репараций — фотореакти-
вация и темповая репарация. Под фотореактивацией понимают
восстановление нормальной жизнедеятельности клеток, предвари-
тельно облученных ультрафиолетовым светом, а затем освещенных
видимым светом. Обязательным условием реакции фотореакти-
вации, заканчивающейся восстановлением жизнедеятельности, яв-
ляется наличие фотореактивирующего фермента. Этот фермент
был выделен (по нр очищен) в лаборатории Клода Руперта и изу-
чен в реакциях in vitro и in vivo L Фотореактивации могут под-
вергаться разные реакции организмов: синтез отдельных фер-
ментов, способность к делению, размножению, синтез различных
метаболитов клетки и т. д.
Однако было найдено, что в некоторых случаях наблюдается
реактивация не только при освещении облученных УФ-лучами
клеток видимым светом, по и в темноте. Этот вид реактивации,
не связанный с квантами видимого света, был назван темновой
репарацией. Оказалось, что темновая репарация так же широко
распространена в живом мире, как и фотореактивация, по ее мо-
лекулярный механизм в корне отличен от фотореактивацпи.
Если при фотореактивации репарирующий фермент (или фермеп-
ты) восстанавливают нативную структуру ДНК путем разъедине-
ния связей, возникших после ультрафиолетового облучения, то
процесс темповой репарации протекает гораздо сложнее (рис. 14).
В 1966 г. Мухаммед сумел получить препарат чпетого фотореактивирую-
Щего фермента (Muhammed, 1966).
ОБЗОР ИСТОРИИ МОЛЕКУЛЯРНОЙ ГЕНЕТИКИ
38
Прежде всего с помощью сначала эндонуклеаз, а затем экзонук-
леаз происходит вырезание из ДНК поврежденного участка из
одной нити, далее с помощью полимеразы ДНК происходит за-
стройка вырезанного участка в соответствии с правилами комп-
лементарности. Тем самым восстанавливается нативная структу-
ра ДНК. Процесс заканчивается соединением вновь синтезиро-
ванного участка с концом старой нити ДНК. Последняя реакция
происходит с участием вновь открытого фермента — полинук-
леотидлигазы (рис. 15).
По-видимому, реакция темновой репарации имеет гораздо
более широкое распространение в живом мире хотя бы потому,
что при темновой репарации могут восстанавливаться поврежде-
ния, нанесенные различными агентами как лучевой, так и хими-
ческой природы. Репарирующие ферменты системы темновой ре-
парации узнают любые изменения ДНК, нарушающие правиль-
ность двойной спирали Уотсона — Крика (нарушения вторичной
конфигурации ДНК), вырезают их и после этого восстанавливают
нативную структуру. Высказываются довольно обоснованные
предположения о том, что ферменты темновой репарации могут
принимать участие в таком важнейшем генетическом акте, как
рекомбинация. Выделено большое количество мутантов бакте-
риальных клеток, дефектных в системе темновой репарации,
и показано, что в бактериальной хромосоме имеется, по крайней
мере, четыре гена темновой репарации.
Важным достижением последних лет стало доказательство
существования ферментной системы темповой репарации у мле-
копитающих, в том числе у человека. В Оак Риджской Нацио-
нальной лаборатории в США в 1968 г. (Regan et. al., 1968) было
обнаружено, что димеры пиримидиновых оснований, возникаю-
щие после облучения ультрафиолетовым светом, устраняются в
клетках HeLa в результате темповой репарации. В. Н. Сойфер,
Л. Л. Матусевич и Г. И. Горошкина (Сойфер и др., 1970) более
подробно изучили этот феномен.
Выше уже упоминалось о том, что ряд авторов (Э. Виткин,
Ш. Ауэрбах, Н. П. Дубинин, В. Н. Сойфер) развивают идеи о
роли репарирующих систем в возникновении полных мутаций и
в хромосомных перестройках. Однако роль репарирующих систем,
как это показано в последней главе этой книги, может оказаться
еще более важной в мутационном процессе.
Кроме того, не исключено, что репарирующие системы осу-
ществляют контроль и за ходом репликации ДНК. Два независи-
мо полученных факта свидетельствуют об этом. Оказаки и сото.
(Okazaki et al., 1968) обнаружили, что синтез ДНК осуществля-
ется фрагментами, после чего куски соединяются полинуклео-
тидлигазой. В. Н. Сойфер и Ю. Л. Дорохов (1970а; Soyfer, Do
rohoy, 1969. 1970; Сойфер, 1969, 1970) отметили более высокую
Рис. 14. Схема работы фермен-
тов, участвующих в темновой
репараци и
1 поражение структуры ДНК
после воздействии на нее му-
тагеном (показано стрелкой);
2 — надрез с помощью эндонукле-
азы одной нити ДНК вблизи
пораженпя;
в выщенлепие повре; щепного
участка эндо- ли экзонукле-
азой;
— расширение бреши
щыо экзонуклеазы;
J— репаративная репликация в
участке бреши (репарпрую-
щая ДНК-полимераза);
5 — соединение отрепарированных
участков с помощью полину-
клеотидлигазы (из Сойфера,
1969)
5'||||||НШШ 111 1 ш
Исходная ДНК
...... । и 11 rm-
Пораженная ДНК
— Эндонуклеаза
IHIIIH I |У| I 11 □ j пт
—Эндо-или
у экзонуклеаза
1111 I П'ТТТ. . . I I I II П~Т'
Экзонуклеаза -----
IIIIIIIII.............тттг
Полимераза -
и 11 m-п тттттттттт
6 *^ига’а
IIIIIIIIIIIII IIIIHTI'
Репарированная ДНК
Рис. 15. Схема работы
нуклеотидлигазы
ОБЗОР ИСТОРИИ МОЛЕКУЛЯРНОЙ ГЕНЕТИКИ
40
скорость размножения фага, дефектного но одному из генов тем-
новой репарации, в клетках, также мутантных но ряду генов
темновой репарации. Все это в сумме говорит об исключительно
важной роли ферментов темповой репарации в жизнедеятельности
клеток.
Описано большое число других систем репарации, возможно,
близких по своим механизмам фотореактпвацип и темновой репа-
рации. В их числе следует упомянуть ультрафиолетовую реакти-
вацию, осуществляющуюся при слабом облучении бактериаль-
ных клеток ультрафиолетовыми лучами, и затем инфицированных
фагами, подвергнувшимися облучению высокими дозами ультра-
фиолетовых лучей, пострепликативную репарацию, осуществляю-
щуюся по окончании репликации поврежденной ДНК. Описаны
тепловая реактивация, реактивация при выдерживании в жидкой
среде и т. д.
Репликация ДНК и проблема искусственного синтеза
ДНК и генов
С начала 60-х годов были проведены широкие исследования фер-
ментов, участвующих в синтезе нуклеиновых кислот. Были опи-
саны ДНК- н РНК-полимеразы, изучены характеры репликации
ДНК в хромосомах высших организмов, ДНК и РНК в клетках
бактерий п у вирусов. Исследованы различные типы модифика-
ций синтезов ДНК и РНК у ДНК- и РНК-содержащих вирусов.
Те нарушения в структурах ДНК, которые, как первоначально
многим казалось, опрокидывают привычные представления моде-
ли Уотсона — Крика, были описаны в терминах этой модели.
Важнейшие исследования были связаны с изучением искус-
ственного синтеза ДНК. Первые успехи в этой области, когда с
участием бесклеточных экстрактов бактериальных клеток была
синтезирована ДНК, достигнуты в лаборатории Артура Корнбер-
га в Стэпдфордском университете. Затем была синтезирована
РНК (Севере Очоа и Марианн Грюпберг-Манаго). Однако в этих
работах хотя и были получены доказательства возможности син-
теза нуклеиновых кислот, вновь синтезированные молекулы не
обладали биологической активностью. Артур Корнберг и его
ученики на протяжении нескольких лет пытались получить био-
логически активную ДНК, по лишь в конце 1967 г. им удалось со-
общить о достигнутом успехе. В качестве матрицы для синтеза
ДНК использовалась нуклеиновая кислота бактериофага ФХ174.
Для того чтобы синтезированная ДНК не имела нарушений в
структуре, в систему для синтеза была введена фракция репари-
рующих ферментов. Синтезированная в искусственных условиях
41
РЕПЛИКАЦИЯ ДПК
ДНК была испытана на биологическую активность путем зара-
жения бактерий. После заражения был зарегистрирован синтез
новых дочерних корпускул фага.
В 1968 г. группе американского исследователя Гобипд Кора-
на удалось синтезировать отдельный ген. Поскольку нет етце
способов расшифровки последовательности оснований в участках
ДНК, соответствующих отдельным генам, Г. Корана воспользо-
вался данными расшифровки последовательности оснований в мо-
лекулах транспортной РНК (расшифровка была сделана группой
Холли в США). Затем чисто химическими способами Г. Корана
и его сотрудники синтезировали отдельные участки этого гена и
соединили полученные отрезки с помощью полинуклеотидлпгазы
в единую структуру. Искусственный ген был присоединен к ин-
фекционной ДНК фага ФХ174 и введен в клетку бактерии, после
чего был зарегистрирован синтез соответствующей транспортной
РНК. Тем самым была принципиально решена проблема искус-
ственного синтеза ДНК в целом и ее отдельных участков-генов.
2
История установления
генетической роли ДНК
Открытие ДНК
Осенью 1868 г. молодой швейцарский химик Фридрих Мишер,
исследуя химический состав клеток, натолкнулся па интересный
факт. Применив открытый Шваииом фермент, расщепляющий
белки — пепсин — для разрушения клеток, Мишер обнаружил,
что ядра клеток при такой обработке не разрушаются. В то же
время оставшийся после обработки пепсином материал почти
полностью растворялся в щелочах и тем самым резко отличался
по своим свойствам от белков.
Тщательная отработка методики выделения ядер и дальней-
шей их очистки позволили Мишеру в 1869 г. уверенно заявить,
что клетки содержат иной, чем белки, класс соединений, который
он назвал нуклеинами (нуклеус — ядро). Следующим этапом
работы Мишера было определение примерного химического со-
става нуклеина. В августе 1869 года оп сообщил в письме к
отцу1: «Я еще работаю над количественным анализом ядерпого
материала. Оказывается, что оп весьма богат фосфором, но не
входящим в состав лецитина» 2.
Первые анализы Мишера, собранные нм в статье «О химиче-
ском составе клеток гноя», говорили, что вещество ядер содер-
жит'около 3% фосфора и 14% азота. Несовершенство методов
очистки ядер явилось причиной того, что в их составе было найде-
но также около 2% серы. Мишер так формулировал вывод иссле-
дования: «Мне представляется вероятным, что обнаружено це-
лое семейство фосфор-содержащих веществ, которые могут быть
отнесены к группе нуклеинов, занимающих равное положение с
белками» 3.
Цпт. по Cohen D. Biological role of the nucleic acids, Arnold Ltd., (publ).
London, 1965, p. 6.
2 Сведения по химии биоорганических соединений в те годы были крайне
скудны. В частности, считалось, что весь фосфор в организме входит в со-
став особого белка — лецитина.
3 Цпт. nx^Cohen D. Biological role of the nucleic acids. Arnold Ltd., (publ).
London0965, p. 4,
to
ОТКРЫТИЕ ДНК
В следующем году Мишер сумел осуществить еще один шаг
в очистке нуклеина. Он выделил основную и кислотную часть
нуклеина, назвав основную часть протамином, и дал химическое
описание кислотной части («бесцветное, аморфное, слабо раство-
римое в воде, но легко растворимое в соде, растворе аммониевого
или натриевого фосфата, вещество, имеющее 28% азота.
44% углерода, 8,5% водорода и 8,5% фосфора»). Соединение
имело большой молекулярный вес.
Статья Мишера, подготовленная к печати в том же 1869 г.,
увидела свет лишь в 1871 г., после того как Гоппе-Зейлер, кото-
рому Мишер передал ее для опубликования в Zeitschrift fur phy-
siologische Chemie, перепроверил все данные и убедился в спра-
ведливости сделанных Мишером анализов.
Последующие работы Мишера (продолжавшиеся до августа
1895 г.) касались установления молекулярного веса нуклеина.
Сначала он считал, что формула нуклеина — C29H49N9P3O22, а за-
тем пришел к выводу, что нуклеин имеет состав: C40H54N14O17P2O5.
Сегодня мы знаем, что казавшиеся огромными цифры на самом
деле были невероятно занижены.
Число объектов, изученных Мишером, было невелико: он в
основном экспериментировал на ядрах клеток гноя и спермы ло-
сося. Поэтому не удивительно, что его первые выводы об уни-
кальности химического состава ядер можно было признать ча
стичным, не заслуживающим особого внимания явлением. Однако
с расширением исследований становилось все более очевидным,
что это не так.
Лилиепфельд (Lilienfeld, 1894), изучая вилочковую железу
(тимус) теленка, обнаружил в ней богатый гистонами нуклеин.
Мэттьюс (Mathews, 1897) исследовал сперму сельди и сперму мор-
ского ежа и нашел в последней арбацин — вещество, родственное
протаминам и гистонам.
В 1889 г. Альтман сумел расщепить нуклеин Мишера на бел-
ковую (протамин или гистон) часть и нуклеиновую кислоту
(фермии предложен Альтманом). Ему удалось вновь реконструи-
ровать нуклеин из этих компонентов.
Пикар изолировал из нуклеиновой кислоты спермы лосося пу-
риновые основания — гуанин и гипоксантин (последний был эн-
зиматически разрушенным продуктом аденина).
Алыман (1886 г.) выделил нуклеиновую кислоту из расти-
тельного объекта (дрожжей), Коссель (Kossel, 1891, 1893, 1896,
1912) и Нойман в эти же годы изолировали нуклеиновую кислоту
из тимуса. Коссель также впервые идентифицировал аденин и
ксантин и выделил из нуклеиновых кислот пиримидиновые осно-
вания — тимин и цитозин. Асколи изолировал урацил, так что в
начале века все канонические основания нуклеиновых кислот
стали известны.
ГЕНЕТИЧЕСКАЯ РОЛЬ ДНК
44
В 1909 г. Левин при гидролизе ядер, изолированных из дрож-
жей и из зародышей пшеницы, обнаружил наряду с четырьмя
азотистыми основаниями (аденином, гуанином, цитозином и
урацилом) еще два компонента — фосфорную кислоту и пентоз-
ный сахар, который он идентифицировал как рибозу.
Наличие в нуклеиновых кислотах, выделенных из раститель-
ных объектов (дрожжи) и из животных (тимус), разных основа-
ний (урацила в первом случае и тимина во втором) навело уче-
ных на мысль, что растительные объекты несут урацил-содержа-
щие, а животные — тимин-содержащие нуклеиновые кислоты.
Окончательный вид мнение о наличии этих двух соединений при-
обрело в высказывании Джонса (Jones, 1920), заявившего без
обиняков: «В природе имеется два типа нуклеиновых кислот.
Одни, полученный из ядер животных клеток, и другой — из ядер
растительных клеток».
Различие в растительных и животных нуклеиновых кислотах
было еще раз подчеркнуто Левином, обнаружившим в 1930 г.,
что животные несут в составе нуклеиновых кислот (их стали
именовать тимонуклеиповымп кислотами) не рибозу, а другой
пятичленный сахар — дезоксирибозу.
Для растительной и животной нуклеиновых кислот было пред-
ложено много названий — соответственно дрожжевая, фитонук-
леиновая, пентозная нуклеиновая кислота и тимусная, тимонук-
леиновая, дезоксипентозная кислота. Некоторые из этих назва-
ний удержались до начала 50-х годов нашего века (см. Char-
gaff, 1951), и заблуждение относительно локализации пентозной
кислоты в растениях, а дезоксипентозной в животных организ-
мах разделялось большинством авторов вплоть до 30-х годов.
Лишь в 30-х годах удалось установить, что пептозонуклеино-
вая кислота (ныне называемая рибонуклеиновой — РНК — по
имени сахара рибозы) и дезоксипентозная (дезоксирибонуклеино-
вая — ДНК) встречаются во всех клетках как растительного, так
и животного происхождения. Положение о том, что все ядра не-
сут в своем составе ДНК, было особенно убедительно доказано
после открытия рибонуклеазы — фермента, расщепляющего РНК
(Kunits, 1940). Браше (Brachet, 1941) разработал метод гистохи-
мического определения РНК в срезах тканей после обработки их
РНК-азой и показал, что РНК сосредоточена в цитоплазме кле-
ток, а ДНК непосредственно связана с хромосомами. Подтвердив
эти данные, Мирский предложил считать ДНК — хромонуклеино-
вой и РНК — плазмонуклеиновой кислотой ([Mirsky, Pollister,
1943). Однако уже в 1945 г. удалось показать (см. Stedman,
Stedman, 1947), что такое заключение ошибочно. Шнайдер
(Schneider, 1945) развил количественный метод определения
нуклеиновых кислот с помощью дифениламина, карбазола и
орципола, реагирующих с фосфором сахаро-фосфатпого остова
45
ОТКРЫТИЕ ДНК
Таблица 1
Содержание ДНК в гаплоидных (сперма) и диплоидных ядрах различных
организмов, мг X 10 ° (Mirsky, Ris, 1949)
Живота Ядра эритро- цитов Ядра клеток печени Сперма Число в пре- дыдущей колонке х2
Курица 2,34 2,39 1,26 2,52
Сельдь 1,97 2,01 0,91 1,82
Карп 3,49 3,33 1,64 з,з
Лосось-таймень 5,79 — 2,67 5,34
Лягушка 15,0 15,7 — —
Жаба 7,33 — 3,70 7,40
Зеленая черепаха 5,27 5,12 — —
нуклеиновых кислот. Немалую роль в стандартизации метода
количественного определения нуклеиновых кислот сыграло при-
менение Шнайдером экстракции их из животных тканей трихлор-
уксуспой кислотой ‘. Разработка точного метода не замедлила
сказаться. Шнайдеру (Schneider, 1945; Schneider, Klug, 1946)
удалось показать, что в ядрах нормальных и малигнизированных
тканей крыс и мышей содержится как ДНК, так и РНК (см. так-
же табл. 1), в то время как в цитоплазме была обнаружена лишь
Гнк.
К 1945 г. утверждение о том, что все без исключения клетки
(как растительные, так и животные) содержат оба типа нуклеи-
новых кислот, приобрело законченный вид (см. Davidson, 1947)
и было получено первое доказательство связи ДНК с ядром и
РНК с цитоплазмой. Однако точная локализация нуклеиновых
кислот в клетке, и в особенности, их биохимическая роль оста-
вались невыясненными.
Касперсон с сотр. (Caspersson, 1939; Caspersson, Brandt,
1940; Caspersson et al., 1941) и независимо от них Браше (Вга-
chet, 1941) обнаружили в цитоплазме делящихся клеток и кле-
ток, осуществляющих активный синтез белка, достаточно боль-
шое количество нуклеиновых кислот. Недостатки метода разделе-
ния РНК и ДНК не позволили указанным авторам определить
точно, какая из нуклеиновых кислот играет решающую роль в
1 Независимо от Шнайдера метод выделения нуклеиновых кислот с по-
мощью трихлоруксусной кислоты был развит Шраммом и Данненбергом
применительно к РНК-содержащему вирусу табачной мозаики (Schramm,
Dannenberg, 1944). Для количественного определения РНК они использо
вали измерение поглощения препаратами в ультрафиолетовом свете.
ГЕНЕТИЧЕСКАЯ РОЛЬ ДНК 46
синтезе белка. Однако наличие сильного поглощения ультрафио
лета с длиной волны 257 ммк и отрицательная фельгеновскал
реакция навели Каснерсона на мысль, что цитоплазматической
нуклеиновой кислотой является рибонуклеиновая кислота.
Год спустя Кедровский (1942) показал, что количество РНК
в клетке находится в прямой зависимости от синтеза белка. Позд-
нее Шпигельман и Камеи (Spiegolman, Kamen, 1946), используя
меченые нуклеопротеиды, установили, что нуклеиновые кислоты
принимают непосредственное участие в синтезе белка.
Таким образом, начали накапливаться данные о том, что пук-
леиновые кислоты играют существенную роль в самых важных
процессах, совершающихся в живых клетках. Наличие убедитель-
ных доказательств в пользу ключевой роли нуклеиновых кислот
в управлении белковыми синтезами клетки видно хотя бы из док-
ладов ежегодной конференции в Колд Спринг Харбор лаборато-
рии, состоявшейся в июне — июле 1947 г. (Nucleic acids and
nucleoproteins, 1947), и тем не менее эти доказательства не по-
служили толчком к пересмотру представлений о нуклеиновых
кислотах как второстепенных веществах клетки.
Развитие представлений
о биологической роли ДНК
Со времен первых анализов ядерпого содержимого, выполненных
Мишером, стало ясно, что в ядрах клеток находятся комплексы
нуклеиновых кислот с белками. Последующая проверка этого по-
ложения настолько укрепила его, что уже к концу 90-х годов
прошлого века всеми признавалось наличие в ядрах особых струк-
тур, получивших название нуклеопротеидов.
В это же время громадное развитие получили исследования по
цитологии наследственности [история цитологии наследственно-
сти описана Э. Вильсоном (1936, 1940) в его фундаментальном
труде «Клетка»]. Обилие доказательств в пользу исключительной
роли ядра в хранении и передаче генетических признаков, с од-
ной стороны, и определенные успехи химии ядра, с другой, по-
ставили перед учеными четкую задачу определения того, какие
же молекулярные структуры несут генетическую запись. Так как
белки были обнаружены во многих структурах в органеллах кле-
ток, а нуклеиновые кислоты лишь в ядре, первое предположение,
наиболее четко сформулированное Рихардом Гертвигом \ отда-
1 В 1876 г. Рихард Гертвиг писал: «Приступая к изложению моих сообра-
жений, я тотчас же должен указать на важнейший пункт для общего су-
ждения о различных формах ядер, па то обстоятельство, что во всех яд
47
РАЗВИТИЕ ПРЕДСТАВЛЕНИЙ О РОЛЙ. ДНВ
вало предпочтение именно пуклеиновым кислотам как храните-
лям наследственной информации.
Для того чтобы доказать справедливость этой точки зрения,
требовалось установить с помощью тонкого анализа локализацию
нуклеиновых кислот в ядре, определить их химическое строение
и биологическую активность.
Как мы уже знаем, наука тех лет не смогла справиться с эти-
ми задачами. Лишь для обнаружения основных компонентов нук-
леиновых кислот потребовалось почти 65 лет. В 1930 г. Левин
открыл последний основной компонент ДНК — сахар — дезокси-
рибозу. К этому времени, кроме того, было установлено, что пук-
лепповые кислоты характеризуются очень большим молекуляр-
ным весом.
Казалось бы, полимерный характер этих молекул должен был
служить прямым указанием па важность таких структур в хра-
нении генетической информации, поскольку для записи такой ин-
формации требуются огромные информационные молекулы. Но
примерно в это же время были найдены белки почти такого (а в
некоторых анализах даже еще большего) молекулярного веса. К
тому же наличие в белках не шести, а более двадцати составных
частей1, казалось, давало больше возможностей для составления
различных комбинаций. Не удивительно, что некоторое время
ученые предположительно говорили о равновероятном участии и
белков и нуклеиновых кислот в передаче наследственной инфор-
мации, а затем мнение о возможном претенденте на такую роль
склонилось в пользу белков.
Следует отметить, что четкая, почти современная поста-
новка задачи о том, каким условиям должна отвечать молекула,
несущая генетическую запись, была сделана еще в 1928 г.
Н. К. Кольцовым. К этому времени, благодаря трудам Т. Г. Мор-
гана, была прочно утверждена идея, что наследственные задат-
ки — гены расположены строго определенным образом в линей-
ных структурах — хромосомах. Однако молекулярная организа-
ция хромосом оставалась совершенно невыясненной.
Из чисто логических соображений Кольцов (1928) пришел к
выводу, что каждая хромосома представлена двумя совершен-
но одинаковыми гигантскими молекулами, порядок радикалов
рах можно заметить известное соответствие веществ. Будем ли мьт иссле-
довать ядра клеток животных, растений или иротистов, мы всегда най-
дем, что они более пли мепее состоят из вещества, которое мы, следуя
прежним авторам, назовем ядериым веществом (нуклеином^. Мы должны
начать с характеристики этого вещества, как тот, кто хочет изобразить
существенную часть клетки, должен начать с протоплазмы».
Белки составлены из аминокислот. В составе белков удалось обнаружить
более 20 аминокислот.
ГЕНЕТИЧЕСКАЯ РОЛЬ ДНК
48
Николай Константинович Коль-
цов. Широко известен своими
работами в области физиологии,
динамики развития и генетики.
Обосновал принцип редуплика-
ции генетических систем
в которых строго определен (он назвал эти молекулы «наследст-
венными»). При делении клеток, по мнению Кольцова, должен
происходить процесс постройки на уже имеющейся молекуле вто-
рой точно такой же ее копии. «Я формулировал эту мысль,— писал
Н. К. Кольцов,— в тезисе: Omnis molecula ex molecula, т. e. вся-
кая (конечно сложная органическая молекула) возникает из ок-
ружающего раствора только при наличии уже готовой молекулы,
причем соответствующие радикалы помещаются путем аппозиции
(ван-дер-ваальсовыми силами притяжения или силами кристал-
лизации) на те пункты имеющейся налицо и служащей затрав-
кой молекулы, где лежат такие же радикалы»1 (рис. 16).
Высказав такую гипотезу (в основных чертах подтвержден-
ную лишь четверть века спустя), Кольцов сделал и следующий
шаг. Он предположил, что такой молекулой является молекула
белка. В противовес его мнению Мплислав Демерец в своей статье
«Что такое ген» (Demerec, 1935) предложил считать наследствен-
ной молекулой тимоиуклеиновую кислоту (ДНК).
1 Цит. по Кольцову, 1965. Наследственные молекулы. Бюлл. МОИП, сер.
биол., 70, № 4, стр. 100.
49
РАЗВИТИЕ ПРЕДСТАВЛЕНИЙ О РОЛИ ДНК
Рис. 16. Схема, поясняющая меха-
низм репликации наследственных
структур, предложенная Н. К. Коль-
цовым
По его гипотезе, наследственные струк-
туры состояли из двух субструктур
(субхроматиды), каждая из которых со-
держала двойные наследственные моле-
кулы. Вдоль молекул располагались «ра-
дикалы», помеченные буквами греческо-
го алфавита. Парность радикалов обес-
печивала сохранение неизменности гене-
тической записи при расхождении мо-
лекул перед делением. Вокруг хромосом
плавают отдельные радикалы (предше-
ственники синтезирующихся молекул),
которые используются при синтезе но-
вых копий наследственных молекул.
Спор между Демерецем и
Кольцовым должна была решить
аналитическая химия. Именно в
это время химик Левин, осно-
вываясь на результатах элек-
трометрического титрования
нуклеиновых кислот, предложил
гипотезу тетрануклеотидного
строения этих соединений (Le
vene, Simms, 1926; Levene, Lon-
don, 1929; Levene, Bass, 1931;
Levene, Tipson, 1935); Левин
считал, что и ДНК и РНК со-
стоят из непрерывно повто-
ряющихся агрегатов, состав-
ленных из четырех нуклео-
тидов1: аденилового (А), гуа-
нилового (Г), цитидилового (Ц)
и тимидилового (Т) для ДНК и
аденилового (А), гуанилового
(Г), цитидилового (Ц) и ури-
дилового (У) для РНК. Таким
образом, структуру ДНК и РНК
Нуклеотидом называют молекулу, состоящую из остатка фосфорной кис-
лоты, сахара и азотистого основания. Название нуклеотиду дабтся по име-
ни основания, входящего в его состав. Основание, соединенное с сахаром,
называют нуклеозидом.
ГЕНЕТИЧЕСКАЯ РОЛЬ ДНК
50
можно было представить соответственно формулами (АТГЦ)П и
(АУГЦ)п, где и — достаточно большое число. Гипотеза Левина
сразу же сняла с обсуждения вопрос о биологической специфич-
ности нуклеиновых кислот. Молекула, составленная из регулярно
повторяющихся одинаковых кирпичиков — тетрамеров, не могла
нести много информации.
Многочисленные последующие исследования состава и струк-
туры ДНК, как казалось в те годы, подкрепляли тетрапуклоотид-
ную гипотезу Левина (см. обзор Гуллапда, Gullaud, 1947).
Особенно убедительной точка зрения Левина предстала после
изучения в 1938 г. Астбюри и Беллом (Asllniry, Bell, 1938) нат-
риевой соли ДНК методами реитгепоструктурпого анализа. Эти
авторы впервые установили наличие периодпчпости мономеров,
слагавших структуру. Астбюри удалось измерить расстояние
между повторяющимися единицами структуры. Но самое главное*
заключалось в том, что, по данным Астбюри, повторен не* наблю-
далось через 8—16 мономеров, т. е. число, кратное четырем.
В заключении своей работы «Рентгено-структурное исследование
нуклеиновых кислот» Астбюри (Aslhiiry, 1917) писал, что моле*
кула натриевой соли тимонуклеиповой кислоты несет «участки,
повторяющиеся вдоль оси молекулы па расстоянии, соответствую-
щем толщине 8 нуклеотидов пли кратном 8 нуклеотидам — наибо-
лее вероятно 8 или 16 нуклеотидам». Так как «этот вывод не пре)'
тпворечил гипотезе Левина, сторонники ее стали рассматривать
полученные данные как крупное подтверждение* ее* правильности.
Однако, как ни убедительно укладывались новые* данные в ложе
тетрануклеотидной теории, сведения, для которых это ложе* оказа-
лось прокрустовым, накапливались.
ДНК — носитель наследственной информации
Началом переворота в воззрениях на ДНК как па второстепенную
молекулу клетки явилось открытие Гриффитом в 1928 г. (Griffith,
1928) феномена трансформации и анализ его природы Эйвери,
Мак Леодом и Мак Карти в 1944 г. (Avery et al., 1944).
Среди пневмококков имеются формы с полисахаридной капсу-
лой и без нее. Именно наличие этой капсулы обеспечивает свой-
ство вирулентности пневмококка для животных. Изучая характер
вирулентности тех и других форм бактерий, Гриффит на-
толкнулся на любопытный факт. Мышам вводилась смесь микро-
бов, состоящая из убитых нагреванием (и, следовательно, потеряв-
ших вирулентность) капсульных пневмококков и из живых бес
капсульных (невирулентных) форм. В контрольных опытах, где
51
ДНК - НОСИТЕЛЬ НАСЛЕДСТВЕННОЙ ИНФОРМАЦИИ
Фредерик Гриффит, открыв-
ший в 1928 г. явление транс-
формации
оба тина бактерий вносились порознь,
никакого поражения мышей не наб-
людалось. Следовало ожидать такого
же результата и в случае совместно-
го их введения.
Однако на деле, при совместном
введении этих микробов мыши в под-
опытной партии погибли. Из крови
животных Гриффит выделил чистые
культуры второго тина, но приобрет-
шие капсулу. Оставалось предполо-
жит!», что убитые капсульные бакте-
рии содержали некое вещество, спо-
собное передать признак капсульно-
сти живы аг бактериям второго типа
и тем самым трансформировать их в
капсульные формы. Гриффит считал,
что этим трансформирующим факто-
ром может быть сам полисахарид.
Спустя три года Даусоиу и Сиа уда-
лось повторить опыт Гриффита в про-
бирке и наблюдать трансформацию
in vitro (Dawson, Sia, 1931). Еще че-
рез два года Аллоуэй выделила трансформирующий фактор из бес-
клеточного экстракта капсульных бактерий (Alloway, 1933).
Истинная химическая природа трансформирующего фактора
оставалась невыясненной до 1944 г., когда Эйвери, Мак Леод и
Мак Карти пришли к выводу, что трансформирующим фактором
является дезоксирибонуклеиновая кислота капсульных бактерий.
Последующие многочисленные проверки этого вывода целиком и
полностью подтвердили его (см. обзоры: Хесин, 1958; Ravin, 1961;
Thomas, 1962; Ephrussi-Taylor, 1955, 1960; Hotchkiss, 1955).
В результате работ Хочкиса (Hotchkiss, 1948, 1952) и Заменгофа
с сотр. (Zamenhof et al., 1953) стало ясно, что в акте трансфор-
мации принимает участие молекула ДНК с молекулярным весом
не менее 10”, что само но себе снимало вопрос о белковой приро-
де трансформирующего агента. Заменгофу и сотрудникам уда-
лось получить высоко очищенный препарат трансформирующей
ДНК, проявившей активность в чрезвычайно низкой концентра-
ции (0,0004 мкг!мл ДНК).
Наряду с чисто химическими данными, противоречащими
мнению о генетической инертности ДНК, накапливались много-
численные биохимические данные, недвусмысленно указывавшие
на важную генетическую роль ДНК. Супруги Вандрелли в лабо-
ратории Буавена в 1948—1949 гг. провели обширные эксперимен-
ты по количественному определению содержания ДНК в ядрах
ГЕНЕТИЧЕСКАЯ РОЛЬ ДНК
52
диплоидных и гаплоидных клеток (Boivin, Vendroly, Vendroly,
1948; Vondrely, Vendroly, 1948, 1949 a, b). Ядра спермы содержали
примерно вдвое меньше ДНК, чем ядра соматических клеток. Этот
вывод был подтвержден результатами других исследователей
(Mirsky, Ris, 1949; Leuchtenberger et al., 1951). Содержание ДНК
в ядрах клеток теленка и взрослых животных (Mirsky, Ris, 1949)
приведено ниже:
Объект Содержание ДНК на 1 ядрохК)-», мг
Сперма быка 2,82
Тимус теленка 7,15
Лимфоузлы теленка 7,09
Почка теленка 6,25
Объект Содержание ДНК на 1 ядрохЮ", Л(3
Почка быка 6,81
Печень теленка 6,22
Печень быка 8,4
К выводу о несомненной генетической роли ДНК приводили
результаты радиационно-генетических экспериментов. Из них
следует особо отметить работы лаборатории А. Холлепдера (Em-
mons, Hollaender, 1939; Hollaender, Emmons, 1941; Hollaender et
al., 1945), Стадлера и Убера (Studler, Uber, 1942), Кнаппа и Шрай-
дера (Knapp, Schreider, 1939), изучавших мутагенное действие
излучений на различных объектах (растения, микроорганизмы)
и нашедших, что максимальное мутагенное действие оказывают
ультрафиолетовые лучи с длиной волны 2537 А, т. е. как раз те
лучи, которые преимущественно поглощаются нуклеиновыми
кислотами.
Исключительной важности работа по выяснению биологиче-
ской роли ДНК была выполнена Э. Чаргаффом (Chargaff, 1950,
1951).
Чаргафф применил к исследованию нуклеотидного состава
ДНК и РНК новый метод с исключительно высокой степенью
разрешения, а именно: метод хроматографического разделения
компонентов нуклеиновых кислот.
Подвергнув анализу ДНК самого различного происхождения,
он сразу же обнаружил ряд фундаментальных фактов, пришедших
в противоречие с общепринятыми. Прежде всего оп показал, что
нуклеотидный состав ДНК, выделенной из организмов разных ви-
дов, сильно различается. В то же время никаких различий в соста-
ве ДНК из разных тканей представителей одного и того же вида
найдено не было. Это позволило автору сделать вывод, что состав
ДНК является характерным для вида, из которого она выделена.
Тщательная проверка тетрануклеотидной гипотезы обнаружи-
ла ее полную несостоятельность. Никакого равенства в количест-
вах А, Т, Г иЦ в ДНК и А, У, Г, Цв РНК на самом деле несуще-
53
ДНК — НОСИТЕЛЬ НАСЛЕДСТВЕННОЙ ИНФОРМАЦИИ
ствовало. Наконец, что самое главное, Чаргаффу удалось уста-
новить количественные закономерности содержания различных
нуклеотидов в ДНК, закономерности, получившие впоследствии
название «правил Чаргаффа» и оказавшие огромное влияние па
последующее развитие молекулярной биологии.
Правила эти таковы.
1. Отношение суммарного количества пуриновых оснований
к суммарному количеству пиримидиновых оснований в одной мо-
лекуле ДНК равно единице.
2. Молярное отношение аденина к тимину и гуанина к цито-
зину равно единице.
Состав ДНК спермы лосося (в молях азота па моль фосфора)
(Chargaff, 1951) приведен ниже:
Аденин 0,280 ±0,005
Гуанин 0,196 ±0,004
Цитозин 0,192 ±0,006
Тимин 0,274 ±0,274
Достаточно широкий набор видов, у которых был исследован
состав ДНК, привел Чаргаффа к выводу, что все ДНК можно
разделить на два типа— «АТ-тип» с преобладанием аденина +
+ тимина над цитозином + гуанином и «ГЦ-тип», где в большом
количестве содержался гуанин + цитозин (к этому тину относи-
лись многие микроорганизмы) (табл. 2).
Изучение РНК не выявило таких четких закономерностей.
Доказав неверность гипотезы Левина, Чаргафф столкнулся с
важной проблемой. Поскольку попытки представить ДНК в виде
бесконечно повторяющихся одинаковых бусин из АГЦТ не оправ-
дались, и поскольку можно было предположить нерегулярное че-
редование оснований вдоль молекулы ДНК, встал вопрос о том,
какое значение имеет подобное разнообразие в составе ДНК.
После многочисленных поисков вещества наследственности было
наконец обнаружено соединение, сочетавшее в себе два удиви-
тельных качества: строгую зависимость в сочетании различных
его компонентов и одновременно нерегулярность чередования
этих компонентов.
Вопрос, который был поставлен Чаргаффом (Chargaff, 1951)
в его статье «Структура и функция нуклеиновых кислот как со-
ставных частей клетки», гласил: «Не может ли Днк удовлетво-
рить генетическим требованиям... не означает ли это, что клетка
содержит столько различных индивидуальных ДНК, сколько в
ней генов? Или может быть одна и та же видоспецифичная ДНК
формирует так много трехмерных структур, связанных с белка-
ми, что генетические требования удовлетворяются?»
ГЕНЕТИЧЕСКАЯ РОЛЬ ДНК
54
Т а (5 .1 11 ц а
М олярные соотношения азотистых оснований в препаратах ДНК
различного происхождения (Chargaff, 1951)
Источник Аденин Гуанин Тимин Цитоз ин Аденин Тим И I Гуанин Циго ЗИН Пурины Пирими- дины Амино- группы Кето- грунны
Бык 1,29 1,43 ' 1,04 1 1 1,00 1 1,1 1,4
Человек 1,56 1,75 1,00 1,00 1,0 1,3
Курица 1,45 1,29 1,06 0,91 0,99 1,5
Лосось 1,43 1,43 1,02 1,02 1,02 1,4
Пшеница 1,22 1,18 1,00 0,97 0,99 1,4
Дрожжи Hemophilus influenzae 1,67 1,92 1,03 1,20 1,00 1,3
тип С 1,74 1,54 1,07 0,91 1,0 1,5
Е. coli К-12 Бациллы тубер- 1,05 0,95 1,09 0,99 1,0 1,6
кулеза птиц Serratia 0,4 0,4 1,09 1,08 1,1 1,7
marcescens Bacillus schatz (анаэробный орга- 0,7 0,7 0,95 0,86 0,9 1,6
низм) 0,7 0,6 1,12 0,89 1,0 1,7
Для ответа на эти вопросы потребовалось два года.
В 1952 г. Альфред Херши и Марта Чейз (Hershey, Chase,
1952), применив самые современные способы анализа радиоактив-
ных изотопов, предприняли следующее исследование. Пометив
ДНК фага Т2 радиоактивным изотопом фосфора Р32, а белок это-
го фага изотопом серы S13, они заразили таким дважды меченным
фагом бактериальные клетки.
Бактериофаги представляют собой пеметаболирующие (в от-
сутствие клетки-хозяина) организмы, имеющие различную фор-
му и строение. Можно отметить два основных компонента бак-
териофагов: их белковую оболочку и нуклеиновую кислоту. До
работы Херши и Чейз считалось, что при заражении клеток фа-
гами последние целиком попадают внутрь бактерии, после чего
происходит их размножение.
Однако вопреки этой точке зрения, результаты эксперимен-
тов Херши и Чейз свидетельствовали, что белок оболочки фагов
внутрь бактерий не проникает и в размножении фага не участву-
ет. Почти вся радиоактивность, связанная с S13, была обнаруже-
СТРУКТУРА ДИК
па вне клеток. Что касалось Р32, то он полностью находился вну-
три клеток. Клетки, не получившие фагового белка, по прошествии
времени, достаточного для образования фагового потомства, рас-
падались (лизировались) и высвобождали нормальное количество
вполне зрелых фаговых частиц.
Оставалось признать, что для передачи наследственных при-
знаков бактериофагов достаточно лишь их нуклеиновой кислоты.
Решающие эксперименты по трансформации и фаговой ин-
фекции с полной очевидностью показали, что наследственные
свойства связаны не с белком, а с нуклеиновыми кислотами.
Структура ДНК
Следующим важным этаном в становлении представлений о ну-
клеиновых кислотах как детерминантах наследственности яви-
лись физико-химические исследования строения ДНК и прежде
всего рептгепоструктурные исследования.
Первый рентгеноструктурный анализ натриевой соли ДНК
был осуществлен Астбюри и Бэллом в 1938 г. (Astbury, Hell,
1938). Авторы установили, что нуклеотиды в ДНК расположены
на расстоянии 3,4 А в направлении оси молекулы и уложены стоп-
ками вдоль молекулы. Фарбер (Fnrberg, 1950, 1952) в рентгено-
структурном исследовании полидезоксирибонуклеозидов и поли-
рибонуклеозидов подтвердил перпендикулярность нуклеотидов к
оси молекул Днк и однонитчатость структуры. Хотя еще Астбю-
ри предполагал, что ДНК может иметь спиральную структуру,
первое четкое доказательство этого было дано Полингом, Кори и
Бренсоном (Pauling el al., 1951) в 1951 г., а затем подтверждено
широкими исследованиями Уилкипса и соавторов (Wilkins et al.,
1951; Wilkins, Randell, 1953; Wilkins et al., 1953) и Франклин и
Гослипга (Franklin, Gosling, 1953).
Из работ двух последних групп исследователей стало ясно,
что ДНК может существовать в двух формах: кристаллической
(структура А) и паракристаллической (структура В). Первая по-
лучается в том случае, когда ДНК содержит 30 процентов воды,
вторая — при увеличении содержания воды (рис. 17), что приво-
дит к вытягиванию молекулы: у нее длина витка равна 34 А. Пе-
реход к структуре А сопровождается укорочением волокна ДНК
па 30%, и периодичность наблюдается уже через 28 А.
Рассчитав плотность структур А и В и размеры их элементар-
ных ячеек, Франклин и Гослинг и независимо от них Уотсон и
Крик (Watson, Crick, 1953а) пришли к исключительно важному
выводу о двунитевом строении ДПК. Действительно, число нук-
леотидов в элементарной ячейке оказалось примерно равным 20,
а так как па виток одной нити длиной 34 А (для структуры В)
Рис. 17. Шариковые модели А-конфигурации (слева) и В-конфигурации
(справа) молекул ДНК
57
СТРУКТУРА ДНК
приходилось по 10 нуклеотидов, оставалось признать, что число
нитей должно равняться двум.
Расстояние между узлами псевдогексагопалыюй решетки ока-
залось равным примерно 20 А, что совпадало с диаметром нитей
ДНК, видимых в электронном микроскопе (Williams, 1952; Kah-
ler, Lloyd, 1953). К этой же величине диаметра молекулы ДНК
привели физико-химические исследования (седиментация, диф-
фузия, светорассеяние и измерение вязкости).
Хотя многие основные параметры структуры ДНК были выяс-
нены (степень ориентации, период вдоль оси волокна, макси-
мальный экваториальный период, число нуклеотидов в элемен-
тарной ячейке), этих данных было недостаточно для построения
точной структуры ДНК.
Первая попытка выяснения этой структуры принадлежала
Полингу и Кори (Pauling, Corey, 1953). Они предложили считать
молекулу ДНК составленной из трех взаимно закрученных нитей.
Остов структуры, по их мнению, составляли плотно упакованные
фосфатные группы и сахарные остатки, а азотистые основания
торчали наружу.
Хотя эта модель была шагом вперед по сравнению с представ-
лениями Астбюри и Фарбера (Полинги Кори ввели спиральность
и многонитевость ДНК), предложенная ими структура противоре-
чила многим известным данным и прежде всего разультатам
электрометрического титрования ДНК.
Гулланд, Иордан и Тэйлор (Gulland et al., 1947, цит. по Gul-
land, 1947) показали, что кривые прямого и обратного титрова-
ния нативной ДНК кислотами и щелочами в диапазоне pH от 2,5
до 12 не совпадают. Их данные свидетельствовали, что амино- и
кетогруппы пуриновых и пиримидиновых оснований связаны
друг с другом в структуры типа NH—СО. Такая связь обеспечи-
вала стабильность этих групп в широком диапазоне pH (пример-
но от 4 до 11), а при переходе к более кислым или более щелоч-
ным условиям связь разрушалась, основная аминогруппа и кислая
кетогруппа высвобождались, после чего при обратном титрова-
нии получались иные кривые. Наличие связи между основания-
ми противоречило схеме Полинга и Кори, которые полагали, что
основания располагаются свободно.
В то же время фосфатные группы ДИК легко титровались,
могли реагировать с различными ионами и взаимодействовали с
красителями. Этот экспериментальный факт так же противоре-
чил гипотезе Полинга и Кори.
Параллельно с Полингом и Кори над этой же проблемой вы-
яснения строения ДНК работали еще два исследователя — аме-
риканец Джеймс Уотсон и англичанин Фрэнсис Крик.
В том же 1953 году они закончили формулировку своей гипо-
тезы строения ДНК, азатем обсудили применимость ее дляобъяс-
ГЕНЕТИЧЕСКАЯ РОЛЬ ДНК
58
нения генетических свойств ДНК (Watson, Crick, 1953 а, ])). Глав-
ным преимуществом гипотезы Уотсона и Крика явилось то, что
эти авторы постарались свести воедино все имевшиеся до сих пор
сведения о ДНК (как физико-химические, так и биологические).
При этом им пришлось ввести два поначалу ниоткуда не следо-
вавших предположения: двупитевость ДНК 1 и симметричность
любой пары оснований вдоль молекулы ДНК.
Модель Уотсона — Крика
Наличие строго определенных рефлексов па рентгенограммах
ДНК свидетельствовало в пользу правильности структуры моле-
кул ДНК и возможности их кристаллизации. Из этого следовало
вполне определенное взаимное расположение двух цепочек, сла-
гающих двунитевую молекулу ДНК.
Исходя из этого, Уотсон и Крик предложили следующую мо-
дель ДНК.
1. Две цепочки в структуре ДНК обвиты одна вокруг другой
и образуют правозакрученную спираль.
2. Каждая цепь составлена регулярно повторяющимися остат-
ками фосфорной кислоты и сахара дезоксирибозы. К остаткам
сахара присоединены азотистые основания (по одному на каждый
сахарный остаток).
3. Цепочки фиксированы друг относительно друга водородны-
ми связями, соединяющими попарно азотистые основания. В ре-
зультате оказывается, что фосфорные и углеводные остатки рас-
положены па наружной стороне спирали, а основания заключе-
ны внутри ее. Основания перпендикулярны к оси цепочек2.
4. Имеется правило отбора для соединения оснований в пары.
Пуриновое основание может сочетаться с пиримидиновым и, бо-
лее того, тимин может соединяться только с аденином, а гуанин
с цитозином:
Тимин Аденин
Г уанин
1 Следует напомнить, что данные Розалинды Франклин и Мориса Уилкин-
са, свидетельствовавшие в пользу двунптевой ДНК, были получены одно-
временно с формулировкой Криком и Уотсоном их гипотезы и не были нм
известны (см. Уотсон, Крик, 1957).
1 Астбюри и Фарбер высказывали противоположную точку зрения.
59
ГЕНЕТИЧЕСКИЙ СМЫСЛ МОДЕЛИ УОТСОНА II КРИКА
Благодаря этому удалось рассчитать модель, целиком удовлет-
воряющую экспериментальным данным. Расстояние атома фос-
фора от оси молекулы оказалось равным 10 А, а, следовательно,
толщина двунитевоп структуры — 20 А; периодичность наблюда-
лась через 34 А, и расстояние, отделявшее нуклеотиды друг от
друга, получалось равным 3,4 А. Кроме того, «все расстояния свя-
зен п углы, в том числе вап-дер-ваальсовские расстояния, со сте-
реохимической точки зрения были вполне приемлемы» (Уотсон.
Крик, 1957, стр. 61).
5. Можно поменять местами:
а) участников данной пары;
б) любую пару на другую пару,
и это не приведет к нарушению структуры, хотя решающим об-
разом скажется на ее биологической активности.
Последние два пункта можно развить дальше, указав, что
замена одной пары па другую никак не сказывается на соседних
нарах в молекуле, и, кроме того, зная истинный порядок основа-
ний одной цепочки, мы тем самым автоматически узнаем их пос-
ледовательность в другой цепочке. «Наша структура, — писали
Уотсон и Крик. — состоит, таким образом, из двух цепочек, каж-
дая из которых является комплементарной по отношению к
другой» (Уотсон, Крик, 1957, стр. 63).
Генетический смысл модели
Уотсона и Крика
Структура ДНК, предложенная Уотсоном и Криком, отлично
удовлетворяла главному критерию, выполнение которого было
необходимо для молекулы, претендующей на роль хранилища
наследственной информации: генетический материал должен
сохранить свою информацию при делении клеток (быть способным
удваиваться). При этом очевидно, что наследственная молекула
должна позволять «запомнить» информацию, и запас такой
информации должен быть весьма большим. Правда, нужно,
чтобы генетический материал выполнял вторую, не менее важную
функцию, а именно управлял синтезами в клетке (функция реали-
зации наследственной программы), но способ, позволявший осу-
ществлять эту функцию, в момент формулировки структуры
ДНК авторам известен не был.
Первое важное предположение Крика и Уотсона относительно
способа записи генетического кода заключалось в том, что смы-
словую нагрузку в ДНК песет последовательность азотистых
оснований. «Остов пашей модели в высокой степени упорядочен,
И последовательность пар оснований является единственным
ГЕНЕТИЧЕСКАЯ РОЛЬ ДНК
60
свойством, которое может обеспечить передачу генетической
информации», — писали они (Уотсон, Крик, 1957, стр. 65). По-
скольку по длине одной молекулы ДНК, по их подсчетам, должно
было укладываться несколько сот тысяч, а, возможно, и несколько
миллионов пар оснований, очевидно, что такой запас памяти был
достаточен для запоминания генетической программы.
Легко объяснить и то, каким образом происходит размножение
молекул ДНК. Энергия, приходящаяся па водородные связи,
Рис. 18. Расхождение нитей ДНК
перед удвоением молекул
Рис. 19. Синтез дочерней нити ДНК
при репликации
меньше энергии остальных связей, принимавших участие в пост-
роении молекулы ДНК. Исходя из этого можно представить, что
перед удвоением происходит разрыв водородных связей вдоль
всей нити ДНК и разъединение молекулы на две отдельных цепоч-
ки (рис. 18). Во время такого разъединения или после заверше-
ния его па половинках молекулы могло произойти достраивание
целой структуры (рис. 19). Так как правило отбора позволяло
объединиться аденину только с тимином, а гуанину только с
цитозином, па имеющихся половинках молекулы могли достроить-
ся лишь их комплементарные нити. В результате такого процес-
са образовывались две новые молекулы ДНК, абсолютно идентич-
ные исходной молекуле.
Наконец, Крик и Уотсон рассмотрели другой не менее важный
аспект генетической природы ДНК: возможность давать измене-
ния в наследственной записи (мутации). Поскольку их предполо-
жение заключалось в том, что запись ведется непрерывно следую-
щими друг за другом основаниями, легко было себе представить,
что замена одной пары другой, так же как и поворот пары на
180°, изменит эту запись.
Уотсоп и Крик предложили механизм, объясняющий возмож-
ность замены одной пары (например, А-Т) другой парой (Г-Ц).
Как уже отмечалось (см. стр. 58), соединение А с Т и Г с Ц осу-
ществляется за счет водородных связей. Единственность такого
соединения обеспечивалась, по предложению Уотсона и Крика,
тем, что все четыре основания преимущественно находятся лишь
61 ГЕНЕТИЧЕСКИЙ СМЫСЛ МОДЕЛИ УОТСОНА И КРИКА
в одной таутомерной форме, обеспечивающей именно это соедине-
ние в пары.
Однако изменение физиологических условий могло, по мнению
авторов, привести к некоторым таутомерным переходам. В част-
ности, таутомерный переход одного из водородных атомов адени-
на, возможно осуществляющийся, по очень редко, позволит аде-
нину спариться не с тимином, а с цитозином. Авторы полагали,
что «при следующем соединении в пары аденин, вновь перешед-
ший в свою обычную таутомерную форму, соединится с тимином,
но цитозин соединится уже с гуанином и, таким образом, про-
изойдет изменение в последовательности оснований» (Уотсон, Крик,
1957, стр. 69).
Репликация и синтез ДНК
Репликация ДНК
Принципиальное доказательство верности предположения Крика
и Уотсона относительно полуконсервативного способа репликации
Днк было получено в опытах Месельсона и Сталя (Meselson,
Stahl, 1958).
Многочисленные биохимические данные показали, что при
делении клеток происходит точное распределение ДПК поровну
между дочерними клетками. Однако мыслимы три различных
пути разделения ДНК но дочерним клеткам, названные Дельб-
рюком и Стентом (1960) консервативным, пол у консервативным и
дисперсным способами репликации ДНК (рис. 20).
При консервативной репликации ДНК па целой двупитевой
молекуле Днк, как на матрице, заново строится идентичная
молекула днк, а исходная остается неизменной. При полукон-
сервативном способе исходная молекула распадается па две зер-
кально подобные комплементарные нити и на каждой из них
достраивается по целой молекуле ДНК. Дисперсный способ пред-
полагает, что материал исходной ДНК среднестатистически рас-
пределяется по клеткам потомков, а остальные участки ДНК до-
страиваются заново.
В момент формулировки Криком и Уотсоном гипотезы деления
ДНК (разрыв водородных связей, приводящий к расхождению
двух полинуклеотидных нитей с последующей достройкой па них
вторых комплементарных нитей,— процесс, соответствующий
нолуконсервативному механизму) метода, позволившего бы сде-
лать выбор между этими тремя способами, не существовало.
Однако вскоре Месельсоп и сотр. разработали метод так на-
зываемого равновесного центрифугирования (Meselson et al.,
1957), с помощью которого и удалось решить эту проблему в
целом.
Суть метода сводилась к следующему. Если при обычном уль-
трацентрифугироваппи полимерные молекулы разделяются по мо-
лекулярному весу, то в методе Месельсона разделялись макромо-
лекулы с различной удельной плотностью. Для этого центрифуги-
рование велось в растворах ряда солей (хлористого цезия,
63
РЕПЛИКАЦИЯ ДНК
хлористого рубидия, гидротартрата калия и т. д.) большой плотно-
сти. В поле ускорения силы тяжести, создаваемом в кювете ультра-
центрифуги, эти соли по закону Больцмана дают непрерывное рас-
пределение плотностей, так что концентрация соли в зависимости
от уровня в кювете будет описываться выражением
— е !<т
со
где р — плотность растворителя, pz — плотность соли, М — моле-
кулярный вес соли, со — угловая скорость ультрацентрифуги.
г — радиус ротора, X — координата, 7? — газовая постоянная,
Т — абсолютная температура. Разложив эту функцию в ряд и ог-
раничившись первым членом разложения, можно представить эту
функцию в виде
иначе говоря, градиент концентрации соли будет постоянным. Для
установления градиента плотности при достаточно высоких уско-
рениях (несколько сот тысяч g) требуется несколько часов. Так
как можно почти всегда подобрать такую концентрацию соли, что-
бы в середине кюветы плотность раствора примерно соответство-
вала плотности изучаемого полимера (в случае ДНК р'«
— 1,7 г/см3), то после установления градиента молекулы изучае-
мого вещества сконцентрируются в том узком участке пробирки,
где плотность вещества равна плотности среды. Достигнув этого
места, полимер перестанет двигаться. Если исследуемые молеку-
лы гомогенны, то они все соберутся в данном узком слое среды,
ибо сверху пробирки они будут спускаться до уровня равновес-
ного распределения под действием центробежного поля, а снизу
Рис. 20. Схематическое изо-
бражение консервативного
(I), полуконсервативного (If)
и дисперсного (Ш) способов
передачи наследственного ма-
териала
Не заштрихован вновь синтезиро-
ванный материал
РЕПЛИКАЦИЯ И СИНТЕЗ ДНК
64
/
Рис. 21. Силы, действующие на полимерные молекулы при ультрацентри-
фугировании
Рис. 22. Опыт Месельсона — Сталя
I — исходная ДНК с тяжелыми атомами N*5; 11 — первая репликация на среде
с легкими атомами N14; 111 — распределение N15 и N14 после второй репликации
выталкиваться более плотной средой (рис. 21). Если же изучае-
мый препарат содержит несколько типов молекул разной плотно-
сти, то они соберутся в разных участках пробирки.
Таким образом, метод равновесного центрифугирования исклю-
чительно изящно позволяет решить сразу две задачи.
1. Разделить изучаемый препарат полимеров па его компонен-
ты, отличающиеся плотностью.
2. Получить значение плавучей плотности отдельных компо-
нентов смеси ’. Высокая разрешающая способность метода,
равная примерно 0,001 г) см1 * 3, послужила причиной быстрого его
распространения при различных исследованиях полимеров.
Коль скоро метод равновесного центрифугирования позволяет
разделить молекулы различной плотности, Месельсон и Сталь ре-
шили использовать его для доказательства полуконсервативного
механизма репликации ДНК. Объектом исследований служили бак-
терии Escherichia coli В. Кишечные палочки в течение 14 поколе-
ний выращивали в глюкозо-солевой среде, единственным источни-
ком азота в которой служил NH4CI (100 мкг/мл). 96,5% азота сре-
ды было представлено его тяжелым изотопом N15. При этом прак-
1 «Плавучая плотность молекулы есть плотность раствора в том месте цен-
трифужной кюветы, где сумма сил, действующих на молекулу, равна ну-
лю» (Meselson, Stahl. Proc. Nat. Acad. Sci. U. S. A. 44, 682, 1958).
65
РЕПЛИКАЦИЯ ДНК
тически весь азот в клетках был заменен изотопом N15. После то-
го как была получена суспензия клеток, содержащая 2Х108 бак-
терий/лм, клетки были осаждены, высушены и перенесены в сре-
ду, где весь азот был представлен его легким изотопом N14. Так как
в подобных условиях бактерии начинают делиться одновременно
(синхронно), то авторы могли точно определить время, когда все
клетки осуществят первое деление. Поскольку в деление вступали
клетки с ДНК, содержащей только тяжелый изотон, а при редуп-
ликации ДНК в качестве строительного материала клетка исполь-
зовала лишь легкий тгзотоп, то после деления с помощью метода
равновесного центрифугирования можно было точно определить,
по какой же схеме осуществляется репликация ДНК. Если бы реп-
ликация шла по консервативному механизму, после деления кле-
ток половина их содержала бы целиком тяжелые молекулы ДНК,
а у половины клеток Днк была бы легкой. Если бы выполнялся
полу консервативный механизм, все молекулы ДНК имели бы од-
ну нить с тяжелыми атомами N15, а вторую с легкими N14. После
центрифугирования препаратов ДНК исходных клеток и клеток,
претерпевших первое деление, авторы установили, что ДНК дочер-
них клеток различаются но удельной плотности, причем, согласно
расчетам, получилось, что 50% азота в них замещено па легкий
изотоп N14. Таким образом, па основании этого эксперимента кон-
сервативная модель должна была быть отброшена.
Оставалось сделать выбор между полуконсервативным и дис-
персным механизмами.
Дисперсный механизм предполагает, что в любом делении осу-
ществляется статистически равномерное распределение материала
родительской хромосомы по дочерним клеткам. Если так, то ре-
зультат, полученный после первого деления, а именно — разделе-
ние N15 поровну между дочерними клетками с равным успехом мог
получиться как при полуконсервативном, так и при дисперсном
способах репликации. Ио в последующих делениях следовало ожи-
дать резкого отличия в распределении изотопной метки. В случае
дисперсного механизма после второго деления дочерние хромосомы
должны были содержать примерно половину материала родитель-
ских структур, т. е. 25% азота должно быть представлено N15 и
остальной азот должен быть легким. При полуконсервативном ме-
ханизме половина хромосомы, несущая тяжелый изотоп, достроила
бы себе легкую половину (и снова имела бы 50% тяжелых ато-
мов), а вторая половина походной хромосомы, ставшая после пер-
вого деления легкой, достроила бы себе легкую половину,
и теперь уже 100% ее атомов было бы представлено легкими ато-
мами (рис. 22).
Позволив пройти второму делению клеток, авторы выделили
ДНК и испытали ее в градиентном центрифугировании. После
установления градиентного равновесия и просматривания кювет
3 В. И. Сойфер
РЕПЛИКАЦИЯ И СИНТЕЗ ДНК
66
в ультрафиолетовом свете в них был обнаружен ряд полос и среди
них две полосы — одна, совпадающая с плотностью исходных ДНК
(50% N15 и 50% N14), а вторая полоса, соответствовавшая плот-
ности ДНК, в которой все атомы азота замещены N14. Тем самым
был доказан полуконсервативпый механизм репликации ДНК
Месельсоп и Сталь так резюмировали свои результаты.
1. Азот молекулы ДНК резделяется поровну между двумя
субъединицами, остающимися интактными па протяжении многих
поколений.
2. После репликации каждая дочерняя молекула получает одну
родительскую единицу.
3. Репликативный процесс завершается удвоением молекул.
Для подтверждения этих выводов Месельсоп и Сталь провели
второй эксперимент. Клеткам Е. coli, в которых азот был замещен
на N15, давали возможность пройти одну репликацию в среде с
N14. Затем клетки разрушали, и полученную ДНК прогревали при
температуре, близкой к 100° С в течение 30 мин. Прогрев приводил
к денатурации ДНК (Rice, Doty, 1957) за счет разрыва водородных
связей и образованию двух одиночных нитей ДНК. Последующее
центрифугирование прогретых образцов привело к разделению их
на две фракции — одну с плотностью, соответствующей N15, и вто-
рую с плотностью, соответствующей N14.
Чтобы окончательно устранить возражение, что во время деле-
ния происходит не продольное расщепление ДНК по водородным
связям, допускаемое схемой Уотсона и Крика, а поперечный раз-
рыв ДНК пополам и достройка второй двупитчатой половины ДНК,
Ральф (RoHe, 1962) повторил опыт Месельсона, но ввел одну мо-
дификацию в схему экспериментов. Е. coll также выращивалась
на среде с N15, а затем переносилась па среду с N14. После первого
акта деления из клеток выделялась ДНК и разрушалась ультра-
звуком, вызывающим поперечную фрагментацию молекулы ДНК.
В случае справедливости полукоисервативного механизма все об-
ломки ДНК должны были иметь одинаковую плотность и занять
в кювете ультрацентрифуги одно положение. Если же при делении
ДНК действует дисперсный механизм, то половина молекулы ДНК
во время репликации останется целиком меченной N15, а вторая по-
ловина будет целиком нести N14; образовавшиеся после озвучива-
ния куски будут иметь разную плотность и дадут две полосы
(рис. 23). Убедившись в том, что после озвучивания все куски
ДНК имеют одинаковую плотность, Ральф подтвердил правиль-
ность полуконсервативиого механизма репликации ДНК.
Наконец, следует упомянуть о возражении Кавальери и сотр.
(Cavaliery, Rosenberg, 1961; Cavaliery et al., 1962) против двуни-
тевого строения ДНК. Изучая кинетику деградации полимерной
ДНК под влиянием ультразвука и иуклеДз (ферментов, разрушаю-
щих ДНК), они пришли к выводу, что нативная ДНК состоит не
67
РЕПЛИКАЦИЯ ДНК В ХРОМОСОМАХ
//
IV
Рис. 23. Опыт Ральфа
I — при полуконсервативной репликации одна нить ДНК будет содержать тяжелый
изотоп (заштриховано), вторая — легкий (не заштриховано); II- при дисперсном
способе репликации часть молекулы оказывается легкой, часть тяжелой. Ральф
сумел сделать выбор между этими двумя возможностями, подвергнув деградации
ультразвуком молекулы ДНК, содержащие легкие и тяжелые изотопы. После дегра-
дации структур I должны образоваться одинаковые по весу фрагменты (III), а при
деградации структур II — разные по весу (IV). Получение в опыте фрагментов
одинакового веса подтвердило полуконсервативный механизм
из двух, а из 4 нитей, и, следовательно, разделение молекулы сво-
дится к расхождению четырехнитевых структур на две двуните-
вые. Позднее (Steffensen, 1959) удалось показать, что результаты
Кавальери и сотр. были ошибочны, так как в этих опытах не были
учтены многие условия эксперимента, в том числе ионная сила и
концентрация ДНК в растворе. В условиях высокой ионной силы
и больших концентраций ДНК происходит межмолекулярная аг-
регация двунитевых молекул ДНК. Образование квази-тетраните-
вой структуры приводит к изменению кинетики деградации, на-
блюдавшейся в опытах Кавальери.
Полуконсервативный характер репликации был доказан не
только для ДНК микроорганизмов, но и для высших организмов.
Репликация ДНК
в хромосомах высших организмов
Как уже указывалось, в составе хромосом любых организмов была
обнаружена ДНК примерно такого же состава, как и у микроорга-
низмов (отличие заключается в так называемых минорных нук-
леотидах — см. след, главу — ив нуклеотидном составе — Бело-
зерский, Спирин, 1962). Однако вопрос о том, совпадает ли струк-
турная организация и репликация ДНК у высших и низших жи-
вых существ, оставался до самого последнего времени невыяснен-
ным. Нельзя сказать, что и сейчас все выяснено, но во всяком слу-
чае наши представления об устройстве и репликации ДНК высших
организмов приобретают до некоторой степени законченный вид.
В частности, последние данные свидетельствуют о том, что в
Шггерфазных хромосомах высших, так же как и в хромосомах мик-
3*
РЕПЛИКАЦИЯ И СИНТЕЗ ДНК
68
роорганизмов имеется лишь одна двунитевая структура ДНК. Так
как литература, касающаяся организации и репликации хромосом
высших, очень обширна, — мы постараемся осветить лишь вопрос
о репликации ДНК. Интересующиеся более подробными деталями
могут почерпнуть их из обзоров (Peacock, 1965; Прокофьева-
Бельговская, 1960, 1962; Тейлор, 1964).
Первый подход к изучению репликации хромосомного материа-
ла заключался в установлении корреляции между синтезом ДНК
в хромосомах и делением последних. Вполне естественно было ис-
пользовать при этом радиоактивные изотопы. В 1954 г. Тейлор и
Мак Мастер (Taylor, McMaster, 1954) изучили включение Р32 в
ДНК хромосом клеток Lilium в различные периоды времени. Ока-
залось, что такое включение действительно наблюдается перед уд-
воением как митотических, так и мейотических хромосом. Эти
данные подтвердились при использовании других методов (индук-
ция аберраций хромосом рентгеновыми лучами и последующая
авторадиография препаратов) (Mitra, 1954; Wolff, Luippold,
1964).
Следующим шагом вперед явилась попытка определения того,
как осуществляется постройка новых молекул Днк в составе реп-
лицирующихся хромосом, иначе говоря, попытка установления ме-
ханизма репликации хромосом. Первая работа в этом плане при-
надлежит Плауту и Мэзия, которые, использовав С14, попытались
получить препараты делящихся хромосом, пригодные для автора-
диографического исследования (Plant, Mazia, 1956). Хотя четкого
ответа получить не удалось, авторы сочли возможным присоеди-
ниться к полуконсервативпой схеме репликации.
Значительное улучшение метода авторадиографии было достиг-
нуто Тейлором (Taylor, 1957; Taylor, Woods, Huges, 1957).
Во-первых, он вводил метку с тимидином, т. е. с непосредственным
предшественником днк, включающимся в нее без дополнительных
изменений и не включающимся в другие компоненты клетки. Во-
вторых, в качестве изотопов использовался тритий, обладающий
преимущественно излучением низкой энергии; за счет этого треки
электронов получались короткими, что наилучшим образом сказы-
валось на четкости радиоавтографов. Кроме того, Н3 позволяет по-
лучать препараты тимпдина-Н3 с высокой удельной активностью.
Н3-тимидин добавлялся к культуральной среде на период, при-
мерно равный периоду одной репликации хромосом, а затем уда-
лялся отмыванием. Так как внутриклеточный запас тимидина в
клетках достаточно мал, отмывание приводило практически к пол-
ному удалению несвязанной метки.
Полученный Тейлором и сотр. (Taylor et al., 1957) результат
оказался весьма знаменательным. После первого деления метка
обнаруживалась только в одной из сестринских хроматид, причем
в некоторых случаях метка распределялась неравномерно вдоль
69
РЕПЛИКАЦИЯ ДНК В ХРОМОСОМАХ
Рис. 24. Схема, поясняющая результаты авторадиографического изучения
репликации кольцевой хромосомы бактерий (Кернс, 1966)
1 — немеченые нити; 2 — меченые нити; 3 — шарнир
хроматиды, но всякий раз меченой оказывалась лишь одна хрома-
тида.
Стоило удалить метку, как удваивающаяся хромосома, полу-
чившая меченую хроматиду, достраивала вторую хроматиду из
немеченых продуктов. Кроме того, авторам удалось наблюдать
процесс обмена участками меченых и немеченых хромосом.
Тем самым Тейлор и сотр. получили результаты, подтверждаю-
щие полуконсервативный механизм репликации. В пользу полу-
консервативной репликации хромосом говорят многочисленные
опыты, проведенные на самых различных объектах как раститель-
ного, так и животного происхождения, в частности на Bellevalia
и Crepis (Taylor, 1958а, b), Tradescantia (Peacock, 1965), Allium
(Lima-De-Faria, 1962), клетках культуры тканей хомячка (Tay-
lor, 1960а, Ь), человека (Prescott, Bender, 1963), сумчатого Poto-
rus (Walen, 1963). Так ка Кернсу (рис. 24) удалось авторадио-
графически доказать полуконсервативный характер репликации у
бактерий, стало возможным говорить о едином механизме реп-
ликации ДНК в живом мире.
В течение ряда лет данные о характере репликации ДНК в
хромосомах высших организмов, так же как выводы о наличии од-
ной нити ДНК в хромосомах высших, полученные из генетических
и радиационно-генетических исследований, вступали в противоре-
РЕПЛИКАЦИЯ И СИНТЕЗ ДНК
70
чие с мнением о многонитчатости хромосом, выведенным на осно-
вании цитологических экспериментов, включая многочисленные ис-
следования с помощью электронного микроскопа. Это противоре-
чие рассматривалось рядом крупных исследователей как одно из
самых веских возражений против справедливости нарисованной
генетиками картины устройства и функционирования генетическо-
го аппарата живых организмов.
Лишь в последние четыре года стали накапливаться сведения
о том, что заключения о многонитчатости хромосом (наличие не-
скольких параллельно расположенных нитей ДНК в хроматидах)
вряд ли обоснованны, а наблюдавшиеся в экспериментах цитологов
многонитчатые хромосомы либо являются артефактами, либо мо-
гут быть интерпретированы как однонитчатые структуры.
Биосинтез ДНК
Прежде чем может наступить полимеризация ДНК из предшествен-
ников, в клетке должна произойти большая предварительная ра-
бота по подготовке мономерных блоков. Наиболее общими предва-
рительными стадиями в биосинтезе ДНК являются: 1) биосинтез
нуклеозидмонофосфатов из простых молекул; 2) превращение
нуклеозидмонофосфатов в дифосфаты; 3) превращение последних
в дезоксирибопроизводные; 4) фосфорилирование дезоксирибонук-
леотидов до трифосфатов.
Образовавшиеся трифосфаты, как было установлено А. Корн-
бергом и сотр. (Kornberg et al., 1956), могут полимеризоваться в
ДНК. Ими был выделен фермент ДНК-полимераза, осуществляю-
щий эту реакцию. Для действия фермента необходимо наличие
всех четырех дезоксинуклеозидтрпфосфатов, ионов магния и так
называемой ДНК-затравки (Bessman et al., 1958).
Реакция обратима и может быть представлена следующим
образом:
пдАТФ 4- пдПТФ _д_ + ДНК ДНК + гдАФп 1 дЦФ 4- 4пФФ2
пдГТФ (затрав- (затрав- ка) ка) । дГФ
4- пдТТФ 1 ьдТФ-1 п
Синтезированная
ДНК
Условием, обеспечивающим смещение реакции вправо, являет-
ся удаление образующегося пирофосфата.
1 ФФ — Неорганический пирофосфат; Ф — неорганический фосфат.
fl
Биосинтез днк
Синтезированную молекулу ДНК, представленную в уравнении
~дАФ~1
в виде
Мулой:
ДЦФ
дГФ
, можно изобразить следующей структурной фор-
дТФ _|п
Природа ДНК-затравки была выяснена в опытах как самого
Корнберга, так и в обширной серии последующих экспериментов.
Прежде всего следует указать, что термин ДНК-затравка недоста-
точно точен, так как он указывает на роль инициатора реакции,
а на самом деле это лишь частично отражает существо дела. То
небольшое количество исходной ДНК, которое вносится в систему
Корнберга для синтеза ДНК, оказывает решающее влияние на
состав синтезированной ДНК. Установлено (табл. 3), что внесен-
ная ДНК играет роль матрицы, на которой фермент ДНК-полиме-
раза строит из имеющихся дезоксинуклеозидтрифосфатов поли-
мерную ДНК, полностью повторяющую нуклеотидный состав
РЕПЛИКАЦИЯ И СИНТЕЗ ДНК
72
Таблица 3
Сравнение состава оснований в ДН К-затравке и в синтезированной
в ее присутствии ДНК (Lehman et al. 1958)
Объект иссле- дования Число ана- лизов А т г ц А 4- Т Г + Ц А + Г T-f-Ц
1
Тимус теленка
Затравка 2 1,14 1,05 0,90 0,85 1,25 (1,24-1,26) 1,05 (1,03—0,18)
Продукт 6 1,19 1,19 0,81 0,83 1,46 (1,22—1,67) 0,99(0,82-1,04)
Бактериофаг Т2
Затравка 2 1,31 1,32 0,67 0,70 1,92(1,86-1,97) 0,98(0,95—1,01)
Продукт Синтетиче- ский АТ-со- 2 1,33 1,29 0,69 0,70 1,90(1,82—1,98) 1,02 (1,01—1,03)
полимер 1 1,99 1,93 0,05 0,05 40 1,05
затравки. При синтезе ДНК, по-видцмому, полностью выполняют-
ся правила Чаргаффа, и синтезируемая структура удовлетворяет
закону Уотсона и Крика.
С помощью радиоактивных изотопов Корнбергу удалось уста-
новить, что с самого начала реакции синтеза ДНК на матрице зат-
равочной ДНК вновь образующийся продукт имеет то же самое
соотношение оснований, что и в ДНК-затравке. Это соотношение
не менялось ни в тот момент, когда содержание ДНК в реакцион-
ной смеси увеличивалось на 2%, пи когда оно достигало 163%. По-
пытки изменить состав синтезируемой ДНК резким изменением
количества внесенных дезоксинуклеозпдтрифосфатов не привели
к успеху. Определяющая роль в поддержании нуклеотидного
состава синтезированного продукта, очевидно, принадлежит ДНК-
затравке.
Молекулярный вес ДНК
Мягкие щадящие методы выделения ДНК из клеток, разработан-
ные Ф. Мишером, были затем заменены грубыми методами, приво-
дящими к разрыву молекул ДНК на более или менее длинные
фрагменты. Разрыв длинной ломкой молекулы ДНК могут вызвать
разные причины: действие ферментов, разрывающих фосфоэфир-
ную связь, или механический разлом молекулы при поперечном
сдвиге и т. д.
73
МОЛЕКУЛЯРНЫЙ ВЕС ДНК
Вполне попятно, что определение молекулярного веса ДНК,
полученной из разных источников, может нередко отражать не ис-
тинные различия в весе ДНК клеток разного происхождения,
а быть следствием разной степени деградации молекул.
Не менее важным обстоятельством в установлении истинного
молекулярного веса является определение размера ДНК. Приме-
няемые для этого методы изучения светорассеяния, скорости се-
диментации, характеристической вязкости и градиентного центри-
фугирования не равноценны, и наиболее точные цифры могут быть
получены при использовании сразу нескольких методов. Первые
более или менее точные определения молекулярного веса ДНК при-
вели к цифрам порядка 6—14 10б. Затем оказалось, что многие
препараты содержат гораздо более длинные молекулы, разрушаю-
щиеся в процессе выделения и очистки (Davison, 1960; Hershey,
Burgi, 1960; Burgi, Hershey, 1961, 1962). Удалось получить образ-
цы ДНК с молекулярным весом до 300-106 (Thomas, Berns, 1961).
В усовершенствовании метода определения молекулярных весов
ДНК большую роль сыграло введение хроматографического (Her-
shey, Burgi, 1960; Burgi, Hershey, 1961), авторадиографического
(Cairns, 1961, 1962; Davison et al., 1961; Rubenstein et al., 1961)
и электронномпкроскоппческого (Beer, 1961; Kleinschmidt et al.,
1961) способов исследования полимеров. С их помощью удалось ус-
пешно изучить ДНК с молекулярным весом, значительно превы-
шающим 107. Бендет и др. (Bendet et al., 1962) изучили ДНК, вы-
деленную с помощью слабой щелочи из бактериофага ТЗ, и вычис-
лили ее длину, оказавшуюся равной 14 мк. ДНК фага X имела
длину 23 мк (Cairns, 1962). Для ДНК фагов Т2 и Т4 было получено
значение от 35 до 52 мк, что соответствует молекулярному весу
около 130 106 (Levinthal, Davidson, 1961; Beer, 1961: Cairns,
1961). Исследование ДНК бактерий показало, что их длина в де-
сятки или сотни раз превосходит длину фагов. Кэйрнс (Cairns,
1962) нашел, что длина ДНК Escherichia coli равна 400 мк и ее вес
превышает 109 дальтон. Опыты Дэвисона с ДНК спермы рыб
(Davison, 1960) и ряд последующих экспериментов показали,
что у высших организмов ДНК может иметь еще большие раз-
меры.
Если характеризовать ДНК не по величине молекулярного ве-
са, а по числу мономерных звеньев — нуклеотидов, то тогда можно
привести следующие цифры: в мелком бактериофаге ФХ174 со-
держится около 5000 нуклеотидов в ДНК, в бактериофаге Т2 —
около 4-105, в клетках Е. coli — 1 • 107 мономерных звеньев.
При обсуждении данных о размерах ДНК высших организмов
и содержании ДНК в ядрах этих клеток необходимо помнить, что
если у большинства микроорганизмов хромосомы представляют
собой одиночные молекулы ДНК (Levinthal, Davidson, 1961; Levin-
thal, 1956; Levinthal, Thomas, 1957; Thomas, Knight, 195U;
РЕПЛИКАЦИЯ И СИНТЕЗ ДНК
74
Thomas, 1961), то у высших в одной клетке содержится несколько
хромосом и, следовательно, по крайней мере, такое же количество
молекул ДНК. Поэтому при наличии в ядре клеток высших организ-
мов набора из многих хромосом значения количества мономерных
звеньев достигают огромных величин (5 109—1010 звеньев). Так
как средний вес одного звена примерно равен 330. то вес ДНК, со-
держащейся в одном ядре клеток высших, достигает фантастиче-
ских размеров — 1013 дальтон. В то же время содержание ДНК в
ядрах клеток различных органов одного и того же организма до-
вольно постоянно. Данные по количеству ДНК в различных клет-
ках крысы (Бреслер, 1966) приведены ниже:
Орган
Количество ДНК
в клеткехЮ-11 а
Орган
Поджелудочная железа 0,712 Сердце
Тонкий кишечник 0,738 Зобная железа
Легкие 0,651 Селезенка
Почки 0,652 Костный мозг
Количество ДНК
в клеткехЮ-11 а
0,627
0,718
0,633
0,670
цуклеотидный состав ДНК
Согласно гипотезе Уотсона — Крика генетический смысл в моле-
куле Днк задается чередованием оснований вдоль цепи полиме-
ра. Это одно из основных требований модели Уотсона — Крика, оно
приводит с несомненностью к выводу, что последовательность
нуклеотидов вдоль цепи не может быть монотонной, что, в свою
очередь, с достаточно высокой степенью вероятности требует
различий в нуклеотидном составе молекул разного происхож-
дения.
Такое различие было действительно обнаружено при исследо-
вании видов, являющихся представителями всех крупных систе-
матических групп живого мира. Достаточно сказать, что к октяб-
рю 1962 г. было исследовано среднее молярное содержание нуклео-
тидов у ДНК 73 видов бактерий, 14 видов высших растении,
10 видов водорослей, 4 видов грибов, 18 видов простейших, 28 ви-
дов беспозвоночных, 31 вида позвоночных, 14 видов бактериальных
вирусов, 13 видов вирусов и риккеттсий высших животных, 2 ви-
дов вирусов насекомых и в эписомах бактерий (Schildkraut et al.,
1962; Белозерский, Спирин, 1962; Аптонов, Белозерский, 1961;
Marmur, Doty, 1962; Fredericq, Fontaine, 1961; Sneoka, 1961; Kit,
1962, 1963; Shapiro, Chargaff, 1960; Rolfe, Meselson, 1959; Doty
et al., 1959).
Мы ограничимся лишь основными данными по нуклеотидному
составу всех изученных организмов. Ниже представлено относи-
75
НУКЛЕОТИДНЫЙ СОСТАВ ДНК
тельное процентное содержание
источников:
Объект Содержание пар Г—Ц в молекулах ДНК, мол %
Бактерии 25-75
Водоросли
диатомовые 37-40
зеленые 54-64
бурые 59
молей Г — Ц пар в ДНК разных
Объект Содержание парх Г—Ц в молекула ДНК, мол %
Простейшие
жгутиковые 46—61
цилиаты 22—35
миксомицеты 22
Растения 35-48 *
Животные
беспозвоночные 35-45
позвоночные 10—44
* С учетом 5-оксимегилцитозина.
Из этого перечня следует, что если у микроогранизмов наблюда-
ется чрезвычайно широкая изменчивость нуклеотидного состава,
то у различных видов высших организмов и позвоночных, иссле-
дованных также достаточно подробно (изучались отдельные пред-
ставители губок, кишечнополостных, иглокожих, моллюсков, чле-
нистоногих, кольчатых червей, позвоночных),— эта вариация не-
велика. Кроме того, установлено, что нуклеотидный состав ДНК из
различных тканей взрослого животного и из эмбриональных и опу-
холевых тканей заметно не отличается (Никитин, Шерешевская,
1961; Kit, 1960, 1961, 1962). Отсутствие возрастной разницы в
отношении нуклеотидного состава установлено и для растений (Ва<
нюшин, Белозерский, 1959) и микроорганизмов (стафилококки)
(Губерниев, Уголева, 1960). Единственным исключением из пра-
вила гомогенного состава ДНК у одного организма является ДНК
высокогалофильного организма Holobacterium solinarium, растуще-
го в среде с необычайно высоким содержанием солей (оптималь-
ные условия для роста — наличие в ростовой среде 25% NaCl).
У этой бактерии с помощью градиентного центрифугирования уда-
лось разделить ДНК на два сорта (Jochi el al., 1963): около 80%
всей ДНК имеет 67% пар Г — Ц, а 20% ДНК содержат лишь
58% Г —Ц.
4
Структура, синтез и функции РНК
Структура РНК
Когда мы говорили о структуре и свойствах ДНК, мы упоминали
лишь о двунитевой нуклеиновой кислоте, описываемой теорией
Уотсона — Крика. Однако, наряду с такой канонической формой
ДНК, существует однонитевая дезоксирибонуклеиновая кислота,
присутствующая главным образом в вирусах. Рассмотрение проб-
лем, связанных с функционированием таких однонитевых молекул
ДНК, будет дано в следующей главе. Точно так же при описании
структуры рибонуклеиновой кислоты мы вначале опишем канони-
ческую форму РНК, а все усложнения приведем позже.
РНК в отличие от ДНК несет не дезоксирибозный остаток,
а также пятичленный сахар — рибозу, у которого во втором по-
ложении имеется гидроксильная группа, и, кроме того, пиримиди-
новое основание — тимин в РНК заменен другим пиримидиновым
основанием — урацилом:
.А / HOV-n-n-V-n-n Ъ-fi n-Vz 4J-HZ рГ-Г-Г-Ц-Г Г-У ц-г \/ \Меу \ N ' Ц — Г Г-Г HOV^“H*V-n-n-A n-A-Tl-V-J-J-'n-n д ^.Г-Г-Г- а- Г-А-Г y-U-Ц-Г-Г У-и и_ k Л J Ч'Ь рГ’г-г'Л<’и'г'ц^> у1 лА v-j-п ,\-п j j-v-j-j-j У-А-Г А—Г ,,-?п Ц-У-Ц-и-Ц > ' ч' । ;Че/ ^r_v-s ц-г г ./-4> V Т HO-V-n-n-V-n-n-A-J-n-A-n *'1’"-Ay-J-V-J-J* JZ^ ^l' рГ-Г-1 -U-Г-У-Гхр у_ц_ц_ц у- Ч 4' J-y-s ? Г 7 р 1 X V 'v = / ЕЗХОь
Рис. 25. Три возможных типа структур, образуемых одной молекулой РНК
СТРУКТУРА, СИНТЕЗ И ФУНКЦИИ РНК
78
Рис. 26. Третичная структура
рибонуклеиновой кислоты
(из Бреслера, 1966)
Наконец, в отличие от ДНК, РНК, как
правило, представлена однонитевыми моле-
кулами.
РНК в растворе обладает спиральностью,
по выраженной не так отчетливо, как у ДНК,
и спиральные участки молекул перемежа-
ются с беспорядочными, аморфными участ-
ками. Те участки одной нити РНК, где нахо-
дятся комплементарные основания, могут
спариваться за счет замыкания водородных
связей. Так как вдоль молекулы может иметь-
ся много комплементарных зон, естественно,
что и число различных структур, даваемых одной и той же нитью
РНК, оказывается достаточно большим. На рис. 25 представлены
три возможных типа структур, образуемых одной последователь-
ностью нуклеотидов в цепи короткой РНК, состоящей всего из
75 нуклеотидов. Если же попытаться представить себе структуру
более длинной молекулы РНК в растворе, то с учетом спиральных
и аморфных участков ее нужно будет изобразить в виде своеоб-
разного клубка (рис. 26). Очевидно, что такое строение РНК от-
крывает большие возможности для различных преобразований
этой структуры в растворе. Этим и объясняется исключительная
лабильность РНК, весьма чутко реагирующей на малейшие изме-
нения в физико-химических характеристиках растворителя (Be-
lozersky, Spirin, 1958; Kisselev et al., 1961).
Биосинтез РНК
В отличие от синтеза дезоксиполинуклеотидов, требующего нали-
чия дезоксирибопуклеозидтрифосфатов, синтез рибополинуклеоти-
дов может осуществляться из пуклеозиддифосфатов. В 1955 году
Грюнберг-Мапаго и Очоа обнаружили в бактериальных экстрактах
фермент, осуществляющий синтез РНК из рибонуклеозиддифосфа-
тов в присутствии ионов магния. Фермент был назван полирибонук-
леотидфосфорилазой (Grunberg-Manago, Ochoa, 1955). Подобные
ферменты были найдены в объектах различного происхождения:
животных, растительных тканях, в ряде микроорганизмов. Другим
отличием полирибонуклеотидфосфорилазы от ДНК-полимеразы яв-
ляется то, что для синтеза РНК необязательно наличие всех че-
79
ФОРМИРОВАНИЕ ВЗГЛЯДОВ О РОЛИ РНК В КЛЕТКЕ
тырех сортов нуклеотидов (напомним, что в состав РНК входят
четыре типа оснований — урацил, гуанин, аденин и цитозин).
Фермент ведет полимеризацию любой смеси рибопуклеозиддифос-
фатов (НДФ), в том числе он может работать и при наличии все-
го лишь одного типа нуклеотидов. В последнем случае синтезиру-
ется гомополимер.
При полимеризации нуклеозиддифосфатов происходит отщеп-
ление неорганических фосфатов от каждой молекулы нуклеозид-
дифосфата, так что уравнение реакции может быть представлено
следующим образом:
пНДФ —> [НФ]п + пФ
Синтезиро-
ванная РНК
Максимальная скорость реакции наблюдается в том случае,
когда в реакционную среду вносится затравочная ДНК, на кото-
рой синтезируется РНК как на матрице, и когда в среде имеются
все четыре сорта рибонуклеозиддифосфатов. Последняя реакция
может быть представлена следующим образом:
пАДФ + пЦДФ + 4- ДПК ДПК- ’ АФ " ЦФ +4 пФ
пГДФ затрав- затрав- ГФ
+ ка ка
пУДФ УФ Синтез ГНК п и ров а
Формирование взглядов о роли РНК в клетке
История установления многообразной роли рибонуклеиновых кис-
лот пестрит многочисленными ошибками и заблуждениями. Дол-
гое время биохимики вообще не умели разделять нуклеиновые
кислоты на два класса: ДНК и РНК, а когда это стало возможным,
возникло другое заблуждение, что ДНК является нуклеиновой
кислотой животных клеток, а РНК — растительных.
Затем много времени потребовалось, чтобы доказать локали-
зацию ДНК преимущественно в ядре, а РНК — в цитоплазме. Но и
после этого трудности на пути установления роли РНК в жизни
клетки не кончились.
Кедровский (1951) и одновременно Касперсон (Caspersson,
1950) и Браше высказали мысль о связи РНК с синтезом белков
в клетках. Оказалось, что всевозможные изменения в условиях
питания, содержания или размножения клеток, влияющие на син-
тез белков, непременно сказываются на количестве РНК. Разрабц-
СТРУКТУРА, СИНТЕЗ И ФУНКЦИИ РНК
80
Рис. 27. Строение рибосом (Спирин, 1968)
тав метод ультрафиолетовой микроспектрофотометрии и сочетая его
с традиционными гистохимическими методами, Касперсон и его сот-
рудники собрали много фактов, свидетельствовавших в пользу
роли РНК в синтезе белка (Caspersson, 1950). Этот вывод был под-
креплен многочисленными доказательствами, полученными при
изучении микроорганизмов, насекомых, растений и животных (см.
Браше, 1960).
Одновременно проводившиеся исследования локализации мест
синтеза белка и распространения РНК в клетке показали, что и
первое и второе по преимуществу связано с цитоплазмой, хотя
отрицать наличия РНК в ядре было нельзя (привести убедитель-
ных данных против наличия синтеза белка в ядрах клеток также
не удавалось). Успехи электронной микроскопии в 40—50-е годы
позволили с очевидностью установить, что наряду с крупными ор-
ганеллами клетки (митохондриями, пластидами растений и др.)
в пей имеются мелкие гранулы (диаметром 100—150 А), которые
были названы «мелкими гранулами Палада» (Palade, 1955) или
микросомами. Биохимический анализ состава микросом показал,
что они содержат много РНК. В дальнейшем из них была выделе-
на фракция, состоящая из еще более мелких структур, названных
рибосомами (рис. 27). В лаборатории Олфри и Мирского (Allfrey
et al., 1953, 1955), Замечника (Zamechnik, Keller, 1954) и др. было
доказано, что имеется корреляция между синтезом белка и актив-
ностью рибосом. Синтез белка in vitro сильно угнетался добавлени-
ем рибонуклеазы.
Все эти факты затрудняли понимание роли ДНК в синтезе
специфических белков, определяющих всю жизнь клетки, и ка-
81
ДОКАЗАТЕЛЬСТВО УЧАСТИЯ РНК В СИНТЕЗЕ БЕЛКОВ
кие бы подтверждения в пользу наличия синтеза белка непосредст-
венно ;в ядре ни приводились, все-таки никто не мог отрицать, что
синтез белка преимущественно осуществляется в цитоплазме, в ри-
босомах.
Следовательно, прежде чем пытаться отыскать основные чер-
ты механизма сборки белков из аминокислот, надлежало свести в
единую причинную связь деятельность ДНК, находящейся в ядре,
и синтез белка, осуществляемый в цитоплазме.
Доказательство участия РНК
в синтезе белков
Были высказаны две диаметрально противоположные гипоте-
зы, объяснявшие роль ДНК как шаблона для синтеза белка.
Первая, сформулированная Гамовым (Gamow, 1954 а, Ь; Гамов
и др., 1957), трактовала этот вопрос весьма своеобразно. Предпо-
лагалось, что свободные аминокислоты выстраиваются чередой
непосредственно на поверхности структуры ДНК и затем соеди-
няются, давая полипептидную цепь. Порядок постановки данной
аминокислоты на нужное место строго задается, по мнению ав-
торов этой гипотезы, чередованием нуклеотидов вдоль ДНК. Но
так как различных сортов оснований имелось лишь четыре,
а число аминокислот превышало 20, Гамов допустил, что одну
аминокислоту кодирует определенное сочетание трех нуклеоти-
дов, иначе говоря триплет.
Сформировавшись, полипептпдпая цепь должна была освобож-
даться от ДНК и переходить из ядра в цитоплазму.
Эта гипотеза носила чисто спекулятивный характер и пол-
ностью игнорировала все данные о роли РНК в синтезе белка
и о разграниченности места синтеза белка (цитоплазма) и лока-
лизации ДНК (ядро).
Гораздо правдоподобнее была вторая гипотеза, отводившая
также ДНК роль шаблона для синтезируемых белков, по через
посредство синтезируемых на ДНК молекул РНК. По этой ги-
потезе (Gale, 1955; Gale, Folkes, 1954) па ДНК происходила
сборка не белка, а рибонуклеиновой кислоты. Почти точное
соответствие между составными частями ДНК и РНК легко
объясняло преемственность между этими разновидностями ну-
клеиновой кислоты, и синтез РНК мог проистекать как в соот-
ветствии с гипотезой Уотсона—Крика (т. е. комплементариости
оснований одной нити ДНК основаниям в нити РНК), так и пу-
тем непосредственного подчинения последовательности основа-
ний в РНК их последовательности в одной из нитей ДНК.
РНК, синтезированная на ДНК, должна была следовать из
ядра в цитоплазму и там служить шаблоном для синтеза белка.
СТРУКТУРА, СИНТЕЗ И ФУНКЦИИ РНК
82
При этом можно было сохранить без изменения все те расчеты,
которые провел Гамов для соотношения нуклеотидов и амино-
кислот. На базе этой гипотезы получило объяснение и хорошо
известное наблюдение (Marshak, Harting, 1948; Marshak, Calvet,
1949; Caspersson, 1941, 1950), что цитоплазматическая РНК
синтезируется под контролем ядра.
К середине 50-х годов, особенно после формулирования ги-
потезы Уотсона—Крика, мнение о том, что синтез белка в
клетке осуществляется с участием РНК (Кедровский, 1951; Cas-
persson, 1950; Bracket, 1942) по схеме ДНК—РНК—белок, при-
обрело широкую популярность. Однако безупречных данных,
доказывающих правильность каждого из этапов этой схемы,
по было. Поэтому естественно, что первое же затруднение, об-
наруженное при проверке одного из этапов схемы, поставило
всю ее под сомнение.
Это затруднение было связано с изучением нуклеотидного
состава Днк и РНК у разных организмов, в особенности у мик-
робов. Нуклеотидный состав ДНК является важной системати-
ческой характеристикой вида. Если РНК действительно синте-
зируется на ДНК, прежде чем перейти в цитоплазму, соеди-
ниться с рибосомами и там стать шаблоном (матрицей) для
синтеза белка, то следовало ожидать, что нуклеотидный состав
РНК будет одинаковым с нуклеотидным составом ДНК.
Многочисленные исследования (Thomas, 1952; Lombard,
Chargaff, 1956, 1957; Pardee, Prestidgo, 1956) показали, что из-
менения в условиях культивирования организмов не сказываются
на специфичности нуклеотидного состава.
Следующим этапом должно было стать подтверждение сход-
ства в суммарном составе ДНК и РНК у одних и тех же видов.
Так как максимальное разнообразие в видовом составе ДНК
наблюдалось у микробов, то наиболее удобной моделью для про-
верки этого положения стали именно микроорганизмы.
При проведении этих исследовании применялся метод выде-
ления всей клеточной РНК после разрушения клеток (Thomas,
1952). Поскольку никакого фракционирования РНК не делалось,
полученный суммарный препарат РНК (пул РНК) содержал все
виды молекул РНК, но в основном в препарате присутствовала
рибосомная РНК, так как па ее долю приходилось до 85% всей
клеточной РНК.
В лабораториях Э. Чаргаффа (Elson et al., 1954; Elson, Char-
gaff, 1954, 1955) it A. H. Белозерского (см. обзор Белозерского
и Спирина, 1962) были выполнены исследования нуклеотидного
состава суммарных препаратов РНК из разных источников. Вы-
вод, полученный этими группами исследователей, оказался обе-
скураживающим. Совпадения в нуклеотидном составе РНК
и ДНК, как правило, не наблюдалось, а состав РНК почти все.у
83
ОТКРЫТИЕ ИНФОРМАЦИОННОЙ РЙН
изученных видов был очень сходным. «Сравнение аналитических
данных но составу ДНК н составу РНК у микроорганизмов по-
казывает, что состав РНК не изменяется столь значительно, как
состав ДНК, в зависимости от положения вида в системе,—
писали Белозерский и Спирин.— Из этих данных можно сделать
вывод об отсутствии выраженного соответствия РНК с составом
ДНК»Х (курсив наш.—В. С.).
Не отрицая роли РНК в синтезе белка, но показав отсутствие
корреляции между составом ДНК и РНК, эти опыты поставили
под сомнение участие генетической матрицы (каковой по всем по-
казателям должна была быть ДНК) в управлении синтезом белка.
Однако этот вывод оказался поспешным п неверным.
Открытие информационной РНК
Выход из создавшегося затруднительного положения был намечен
уже в работах А. Н. Белозерского и А. С. Спирина. Обсуждая воз-
можные причины неудачи в доказательстве преемственности со-
става ДНК и РНК, они указали па то, что суммарный препарат
РНК, возможно, состоит из нескольких типов молекул, различаю-
щихся как по своим физико-химическим показателям, так и по
биологической роли. Отрицать наличие в клетках нескольких ти-
пов РНК и в том числе небольшой фракции, состав которой был
бы идентичен составу ДНК, было вряд ли возможно, и Белозер-
ский и Спирин не раз подчеркивали это обстоятельство (Belozers-
ky, Spirin, 1958; Спирин и др., 1957).
Это предположение впоследствии было доказано. При прове-
дении седиментационного анализа РНК бактерий удалось выявить
три основных типа РНК с константами седиментации 23S, 16S и
4S. Молекулярный вес этих РНК оказался равным 1,1 • 106, 6-105
и 25000 соответственно. Первые два типа молекул входили в сос-
тав рибсГсом и потому были названы рибосомными РНК. Третий
тип — с очень низким молекулярным весом был назван раствори-
мой РНК (в настоящее время принят термин транспортная РНК).
Анализ нуклеотидного состава этих двух видов РНК выявил,
что они не могут претендовать па роль переносчика генетической
информации от ДНК к белку. Оказалось, что рибосомная РНК
(р-РНК), выделенная из разных источников, имеет весьма сход-
ный нуклеотидный состав. Состав растворимой РНК оказался су-
щественно отличным от состава р-РНК, но и эта РНК нс могла
служить переносчиком информации от ДНК к белку из-за малого
молекулярного веса. Действительно, коль скоро молекулярный вес
1 Белозерский, Спирин. 1962, стр. 148.
СТРУКТУРА, СИНТЕЗ И ФУНКЦИИ РИК
84
среднего белка соответствовал 105, то, принимая во внимание необ-
ходимость трех нуклеотидов для кодирования одной аминокисло-
ты, следовало признать, что молекулы РНК — переносчики инфор-
мации должны были иметь молекулярный вес не менее 106 или
даже больше. Но мы видели, что этому условию вряд ли могли удов-
летворить даже рибосомные РНК, вес которых не превышал
1,1 10б.
Учитывая требования, которые предъявлялись к такой молеку-
ле-переносчику информации, Жакоб и Моно сформулировали
представление об особом классе рибонуклеиновых кислот — так
называемой информационной РНК (Жакоб, Моно, 1962).
Жакоб и Моно учли три главных требования, которым должна
была отвечать комплементарная к гену информационная РНК
(сокращенно и-РНК). Так как линейные размеры всех генов мог-
ли быть разными, то это должно было найти отражение в молеку-
лярном весе и-РНК. Поскольку роль и-РНК заключается в про-
граммировании синтеза белков в рибосомах, следовало ожидать, что
такой комплекс рибосом с и-РНК будет найден в клетках. Нако-
нец, Жакоб и Моно предположили, что скорость обновления моле-
кул и-РНК в клетке должна была быть достаточно высокой, так
как быстрая реакция клеток в ответ на изменения условий су-
ществования требовала быстрого изменения внутриклеточных син-
тезов. Когда Жакоб и Моно формулировали свою гипотезу об ин-
формационной РНК уже имелось исследование, практически дока-
завшее существование этого класса молекул. Волкин и Астрахан
(1961), изучавшие синтез РНК в бактериях Е. coli, зараженных
бактериофагом Т2, практически обнаружили и-РНК. Они метили
вновь синтезирующиеся молекулы РНК очень непродолжительное
время (С14-урацил добавлялся па 5 сек.), затем клетки отмывали
от метки и разрушали. Для того чтобы удалить ДНК, на разру-
шенные клетки воздействовали ДНК-азой, после чего полученный
препарат центрифугировали в градиенте сахарозы. Было обнару-
жено, что после центрифугирования примерно 2% всей РНК име-
ло высокий молекулярный вес (константа седиментации превыша-
ла 13S), и именно эта высокомолекулярная РНК содержала прак-
тически всю метку.
Нуклеотидный состав выделенной РНК оказался сходным с
нуклеотидным составом ДНК фага Т2, но не имел ничего общего
с нуклеотидным составом ДНК бактерии.
Другое предположение Жакоба и Моно о быстром распаде ин-
формационной РНК, образуемой в бактериях, было доказано Гро
и сотр. (Gros et al., 1961). Правда, впоследствии удалось проде-
монстрировать, что в клетках различного происхождения скорость
распада и-РНК разная; так, в клетках животных тканей и-РНК
сохраняется значительно дольше, чем бактериальная информацион-
ная РНК.
85
ОТКРЫТИЕ ИНФОРМАЦИОННОЙ РНК
Но самое веское доказательство синтеза и-РНК на ДНК было
получено в опытах по гибридизации и-РНК и ДНК (работы лабо-
ратории Шпигельмана). Ранее было показано, что если «распла-
вить» двуспиральную молекулу ДНК (денатурировать ее), т. е.
разорвать но водородным связям (этого можно достичь либо на-
греванием раствора ДНК до температуры, близкой 100° С, либо
щелочной обработкой), и предотвратить обратную ренатурацию,
получатся индивидуальные однопитевые ДНК.
После этого можно использовать отдельные нити как шаблоны
для проверки на комплемептарпость к пим любых других моле-
кул нуклеиновых кислот. В частности, можно попытаться объ-
единить одну нить ДНК с одпонитевой молекулой РНК. Была по-
казана исключительная специфичность гибридизации, ибо даже
использование неродственных молекул, хотя бы имеющих одина-
ковый нуклеотидный состав, не приводило к гибридизации. Если
комплекс образуется, то это будет свидетельствовать о совпадении
(правильнее сказать, комнлементарности) последовательности ос-
нований в одной и другой нити.
Применив метод гибридизации, Холл и Шиигельман (Hall,
Spiegelman, 1961) смогли получить гибриды между одной из ни-
тей расплавленной ДНК фага Т2 и молекулой информационной
РНК, выделенной из клеток, зараженных ДНК этого фага. Гиб-
риды удалось получить только с молекулами гомологичной РНК;
чужеродные молекулы комплекса не образовывали.
Удалось подтвердить и предположение Жакоба и Моно о ге-
терогенности информационной РНК в отношении молекулярного
веса. Препараты РНК, полученные из бактерий, клеток HeLa,
лейкоцитов, ядер печени и др., распределяются по молекулярно-
му весу в широком диапазоне (константы седиментации лежат
в пределах от 4 до 45 ед. Сведберга). Гетерогенность информаци-
онных РНК была доказана также и другими методами. Хесин и
Шемякин (1962) обнаружили разницу в информационных РНК,
синтезированных в начале и конце развития бактериофага Т2 в
клетках Е. coli. РНК, синтезированные в начале развития фагов
(ранние РНК), управляют синтезом ферментов, необходимых для
образования фаговой ДНК, в то время как РНК, синтезированные
в конце развития (поздние РНК), необходимы для синтеза фаго-
вых белков и белков, управляющих сборкой частиц. Чтобы разде-
лить два сорта РНК, Хесин и Шемякин объединили метод им-
пульсного мечения и гибридизации РНК с ДНК и показали, что
ранняя и поздняя РНК занимают разные участки на молекуле
фаговой ДНК. Удалось также определить, что температура плав-
ления гибридов «ранняя РНК — ДНК» и «поздняя РНК — ДНК»
различаются, что свидетельствовало о различном нуклеотидном
составе этих РНК.
Открытие нового класса нуклеиновых кислот — информацион-
Структура, синтез и функции рнк
ЙС
ной РНК — сняло возражения, высказывавшиеся по поводу вер-
ности схемы ДНК — РНК — белок. Гипотеза Жакоба и Моно,
предсказавших существование и поведение неизвестного до того
класса нуклеиновых кислот, была полностью подтверждена.
Транспортная РНК
Не менее ярким примером научного прогнозирования была «адап-
торная гипотеза» Ф. Крика, предположившего существование
другого класса рибонуклеиновых кислот — адапторных РНК.
Предпосылкой для создания адапторной гипотезы явились за-
труднения в объяснении стерического взаимодействия нуклеино-
вокислотпой матрицы для синтеза белка и аминокислот, слагаю-
щих полипептидную цепь. Длина трех нуклеотидов, кодирующих
одну аминокислоту (триплет), равна примерно 10 А, в то время
как средняя длина аминокислотного остатка белковой цепи не
превышает 3 А. Не менее трудно представить себе, каким образом
происходит взаимодействие, «узнавание» аминокислотой своего
места при синтезе белка.
Чтобы обойти эти трудности, Крик предположил наличие в
клетке особых адапторных РНК, роль которых должна сводиться,
во-первых, к специфическому соединению с аминокислотой, а,
во-вторых, к «узнаванию» места на информационной молекуле,
соответствующего данной аминокислоте. Так как в клетке имеется
не менее двадцати типов аминокислот, то следовало предполо-
жить наличие не менее двадцати типов адапторных РНК. Кроме
того, Крик допустил наличие не менее двадцати сортов особых
ферментов, каждый из которых управлял бы присоединением дан-
ной аминокислоты к РНК соответствующего типа.
Такая гипотеза отлично объясняла все моменты взаимодейст-
вия нуклеиновой кислоты и аминокислот. Однако прежде чем
она была экспериментально подтверждена, прошло более 3 лет.
Хогланд, Стефенсон и др. из лаборатории Замечника (США) и
Агата, Нахара и Морито (Япония) обнаружили низкомолекуляр-
ные растворимые рибонуклеиновые кислоты, соединенные кова-
лентной связью с аминокислотами (Hoagland et al., 1957; Ogata
et al. 1957). Дальнейшие исследования показали, что это и есть
адапторные молекулы РНК, предсказанные Криком. Сейчас вмес-
то терминов адапторные (или растворимые) кислоты используют
термин транспортные РНК (сокращенно т-РНК).
Блестящее доказательство адапторной гипотезы было достиг-
нуто в опыте Чэпевилла, Липмана, Эренстейна, Вейнсблюма, Рэя
и Бензера (Chapeville et al., 1962). Чтобы узнать, что является оп-
ределяющим в постановке аминокислоты на нужное место сама
аминокислота или соответствующая ей адапторная РНК, авторы
87
ТРАНСПОРТНАЯ РНК
Цистеин-
активирующий
фермент
--------------ОН
Цистеиновая т-РНК
АТФ
NH2 Н
Цистеин
-SH
sh
Н
они
----------------о ~ с—с-
Цистеиновая т-РНК , |
NH;
Цистеин
н
2
о
Цистеиновая т-РНК
Аланин
Рис. 28. Доказательство роли транспортной РНК
в переносе аминокислот
поступили следующим образом. Из исследований Ниренберга и
Очоа было известно, что синтетический полирибонуклеотид, со-
ставленный из уридиловых и гуаниловых кислот (поли-УГ), яв-
ляется матрицей для включения в белок аминокислоты цистеина.
Собрав систему для бесклеточного синтеза белка, состоявшую из
рибосом, надосадочной жидкости после центрифугирования гомо-
гената клеток Е. coli при 105 000 g и матрицы в виде поли-УГ,
авторы ввели в эту систему т-РНК, уже соединенную с цистеи-
ном. Естественно, что такой т-РНК могла быть только (согласно
адапторпой гипотезе) цистеиновая РНК. Было обнаружено, что
при этих условиях происходит синтез белка, состоящего из ци-
стеиновых остатков. Введение в такую систему аланиновой
т-РНК, соединенной с аланином, не привело к заметному синте-
зу белка: матрица поли-УГ пе кодировала аминокислоту аланин
и поэтому синтез белка пе шел. Проверив, что цис-т-РНКЦИ0
активна \ а ала-т-РНКала неактивна в отношении синтеза белка
авторы предприняли следующий шаг. С помощью особого ката-
лизатора — никеля Ренея от молекулы цистеина, уже присоеди-
1 В обозначении цис-т-РНКцис стоящая впереди приставка «цис» указыва-
ет на аминокислоту цистеип, присоединенную к адапторной РНК. При-
ставка «цис» над символом т-РНК указывает на то, что эта т-РНК явля-
ется специфичной для цистеина,
СТРУКТУРА, СИНТЕЗ И ФУНКЦИИ РНК
88
ненной к РНК, была оторвана группа SH, после чего цистеин
превратился в аланин (рис. 28). Теперь в руках исследователей
была адапторная РНК, специфичная для цистеина, но несущая
па себе не цистеин, а аланин. С точки зрения адапторной гипоте-
зы Крика такая ненормальная амииоацпл-т-РНК должна вести
себя как цистеиновая, так как главным началом в определении
специфичности подстановки аминокислоты в строящуюся белко-
вую цепь является не сама аминокислота, а тот кодирующий
триплет, который имеется у т-РНК, несущей эту аминокислоту.
Так как десульфированием т-РНК не была нарушена, и ее
цистеиновый триплет остался неизменным, следовало предполо-
жить, что присоединенная к этой т-РНК аминокислота (в данном
случае аланин) и будет введена в строящийся белок. В случае,
если бы главным в комплексе амипоацил-т-РНК был не нуклеи-
новокислотный компонент, а аминокислота, то никакого вклю-
чения в белок не произошло бы, так как аланин не кодируется
поли-УГ.
В полном согласии с адапторной гипотезой Крика было заре-
гистрировано включение аланиновой аминокислоты в белковую
фракцию. Чтобы доказать, что никель Ренея не влияет на амино-
ацил-т-РНК, не имеющую групп SH у аминокислоты, этим ката-
лизатором была обработана феиилаланин-т-РНКфен. Как и следо-
вало ожидать, никакого изменения в активности этой адапторной
кислоты не произошло.
Другие положения гипотезы Крика (наличие не менее двадца-
ти различных т-РНК и такого же количества специфических фер-
ментов) были также доказаны. Следует еще раз упомянуть, что
транспортная РНК имеет малый молекулярный вес (около 25 000)
и осаждается в ультрацентрифуге с константой примерно 4S.
Рибосомная РНК
Роль третьего типа рибонуклеиновых кислот — рибосомной до сих
пор неизвестна. Рибосомные РНК составляют 80—90% всей РНК
клетки, их молекулярный вес достаточно высок и составляет 0,6—
1,1-106. Имеются данные о самосборке рибосом из рибосомного
белка и РНК. Среди гипотез, выдвигавшихся по поводу роли
р-РНК, можно упомянуть две. Первая, сформулированная
А. С. Спириным, отводит рибосомной РНК роль шаблона, на кото-
ром выстраиваются молекулы белка рибосом, с тем чтобы потом
этот нуклеопротеидный тяж свернулся в субъединицы рибосом.
Таким образом, РНК отводится чисто структурная роль, правда
с учетом специфичности макромолекулярной структуры нуклеи-
новой кислоты, определяющей порядок выстраивания белка.
89
РИБОСОМНАЯ РНК
Вторая гипотеза принадлежит Крику, и согласно этой гипотезе,
рибосомная РНК играет роль пассивного наполнителя, внедряю-
щегося внутрь белков рибосом и тем самым создающего нужный
для активности рибосом объем и конфигурацию.
Заканчивая этот раздел, еще раз подчеркнем, что изучение ри-
бонуклеиновых кислот выявило их гетерогенность как по разме-
рам и структуре, так и по функциям. Информационная РНК ока-
залась самой большой по своим линейным размерам, и после ее
соединения с рибосомой на ней строились специфические белко-
вые молекулы. Транспортная РНК (самая малая по размерам)
осуществляет перенос аминокислот к строящимся белкам и помо-
гает им встать на нужное место, задаваемое последовательностью
оснований в информационной РНК. После окончания постройки
белковой цепи последняя освобождается от рибосомы. В состав
рибосом входят белки рибосом и рибосомные РНК, достаточно
большие по своему молекулярному весу. Роль последних не опре-
делена.
5
Исследования модификаций структуры
нуклеиновых кислот
Понятие о первичной, вторичной и третичной
структурах белков и нуклеиновых кислот
Под первичной структурой полимерных молекул, следуя Линдер-
штрему-Лангу, предложившему этот термин для белков, понима-
ется цепь главных валентностей, удерживаемая ковалентными
(химическими) связями. В случае белков первичную структуру
слагает последовательность аминокислот, объединенных в поли-
пептидную цепь, в случае нуклеиновых кислот первичная структу-
ра задается чередованием нуклеотидов вдоль нити полимера.
Между звеньями полипептидной цепи и между основаниями
нитей ДНК происходит взаимодействие (по-видимому, за счет об-
разования водородных связей). Возникающие при этом спираль-
Структура Первичная Вторичная Третичная
Бе; Api - Лсй-«Ме г-Цис Пос ледова тел ь ность аминокислот <зшииишишь Спираль Полин! а - Кори Нативный фермент
ДНК А-Т-Ц-Г-Ц-А Пос; Двойная спираль Уотсона -Крика % \
Закрытый 1 Закрытый неактивный неактивн й участок | участок г Открытый нкцнонируютнй участок
Рис. 29. Сравнение первичной, вторичной и третичной структур белков и
ДНК
91
МОДИФИКАЦИЯ ПЕРВИЧНОЙ СТРУКТУРЫ ДНК
ные структуры (спираль Полинга — Кори в случае белков и двой-
ная спираль ДНК Уотсона — Крика) представляют собой вторич-
ную структуру.
Нарушения регулярной вторичной структуры приводят к изги-
бу спиральных молекул, образованию аморфных участков. Такие
нарушения вторичной структуры вызываются рядом причин, еще
не до конца понятых — возникновением дисульфидных мостиков;
наличием мономерных звеньев, нарушающих регулярность, как
это имеет место, например с пролином и оксипролином, резко из-
меняющих углы поворота полипептидной цепи; наличием ван-дер-
ваальсовых сил между радикалами молекул и т. д.
Укладка изогнутых цепей в компактные глобулярные струк-
туры приводит к образованию третичной структуры. Следует ука-
зать, что такая укладка в клубок резко уменьшает свободную энер-
гию полимера и позволяет достаточно длинным структурам занять
компактный объем (ДНК бактерии имеет 700—900 мк длины, но
укладывается в структуру, диаметр которой всего 1 мк (Cairns,
1963). На рис. 29 приведено схематичное изображение первичной,
вторичной и третичной структур белка и ДНК.
Модификация первичной структуры ДНК
Выяснение химического строения мономерных блоков (нуклеоти-
дов), слагающих первичную структуру ДНК, выявило наличие
шести компонентов ДНК — сахара дезоксирибозы, остатка фосфор-
ной кислоты и четырех канонических оснований: аденина, тимина,
гуанина и цитозина. Долгое время в составе ДНК находили толь-
ко эти 6 составных частей. Однако в дальнейшем были найдены
другие компоненты, получившие название минорных. Прежде все-
го, в составе Т-четных фагов был обнаружен вместо цитозина
5-оксиметилцитозин (Wyatt, 1951а,b; Wyatt, Cohen, 1953),а у выс-
ших растений и животных часть цитозина оказалась замещенной
на 5-метилцитозин.
nh2
I
с
'с—СН2ОН
NH2
I
С
II
5-Оксиметилцитозин
5-М етилцитозип
Кайе и Винокур (Kaye, Winocour, 1968) доказали наличие
5-метилпитозина в ДНК вируса полиомьк Метилированные осно-
МОДИФИКАЦИЯ СТРУКТУРЫ НУКЛЕИНОВЫХ кислот
92
вапия (6-метиламинопурин и 5-метилцитозин) были найдены в
ДНК синезеленых водорослей (Kaye et al., 1967).
Дэнн и Смит (Dunn, Smith, 1958) нашли в составе ДНК фага
Т2 6-метиламинопурин. На каждые 200 молей аденина приходится
1 моль 6-метиламипопурина, что в пересчете на одну фаговую час-
тицу дает цифру 500—600 необычных оснований на молекулу
ДНК.
Дальнейшее усложнение картина получила после обнаружения
в составе ДНК Т-четных фагов глюкозы, присоединенной глюко-
зидной связью к метильной группе 5-оксиметилцитозина (Jesai-
tis, 1956):
HOCH
с
ОН2С-С N
II I
С с=о
Процент глюкозилирования варьирует: у Т2 на моль оксиме-
тилцитозипа приходится 0,82 моля глюкозы, у Т4 эта величина
равна 1, у Тб—1,45 (Lehman, Pratt, 1960). Как было показано
рентгепоструктурными методами (Мокульская и др., 1966), внед-
рение глюкозы внутрь двойной спирали препятствует переходу
A-конфигурации в В-конфигурацпю. Помимо этого, было найдено
различие в количестве глюкозных остатков, приходящихся на ок-
симетилцитидиловый нуклеотид у разных фагов. Если фаг Т4 со-
держит только моноглюкозилированные основания, то у фагов Т2
и Тб наряду с неглюкозилированными встречаются моно- и ди-
глюкозилированные основания (табл. 4).
Различия, кроме того, касаются характера связи между глюко-
зой и оксигруппой метилцитозина. У фага Т4 68% глюкозы присо-
Таблица 4
Степень глюкозилирования 5-оксиметилцитидиловых
остатков в ДНК Т-четных бактериофагов
Бактериофаг
Степень глюкозилирования 5-оксиме-
тилцитозина, %
без глюкозы одна молеку- ла глюкозы две молеку- лы глюкозы
25
25
70
72
100
5
3
Т2
Тб
Т4
93
МОДИФИКАЦИЯ ПЕРВИЧНОЙ СТРУКТУРЫ ДНК
единены а-глюкозидной связью, а 32 % — (3-глюкозидной связью
Н
Глюкозилирование ДНК может осуществляться не только по
метильной группе 5-оксиметилцитозина. Такахаши и Мармур
(Takahashi, Marmur, 1963а, b) нашли глюкозу в ДНК трансдуци-
рующего фага PBS-2, присоединенную к азоту кольца гуанина и к
цитозину.
Кроме глюкозы, в составе ДНК фагов были найдены также мо-
лекулы гентпбиозы (Кино, Lehman, 1962). У фага PBS-2 Bacillus
subtilis, способного осуществлять трансдукцию, был обнаружен
урацил, соединенный с дезоксирибозой, а в фаге, лизирующем
Bacillus subtilis,— 5-оксиметилурацил (Kallen et al., 1962).
Разнообразные модифицированные основания были найдены в
составе транспортных РНК. В настоящее время детально изучена
структура ряда т-РНК. В них обнаружено не менее 10 необыч-
ных оснований (в основном метилированных) и, кроме того, псев-
доуридиловая кислота, рибоза которой присоединена не к азоту,
а к 5-му углеродному атому урацила, инозиновая и 3-метилино-
зиновая кислоты:
Псевдоуридиловая кислота З-Метплгуанозин №~Диметилгуанозин
Инозиновая кислота 3-Метилинозиновая
кислота
МОДИФИКАЦИЯ СТРУКТУРЫ НУКЛЕИНОВЫХ кислот
94
Кроме того, в составе т-РЦК встречается 5, 6-дигидроурацил
и другие минорные компоненты.
Внедрение необычных оснований пе сказывается коренным
образом на матричных свойствах наследственных молекул, так как
организмы с измененными основаниями продолжают развиваться.
Однако многие их характеристики (радиочувствительность, му-
табильность) резко меняются.
Генетическая роль модификаций первичной структуры пока
еще не достаточно выяснена. Предположения о роли метилирова-
ния будут рассмотрены в следующем разделе. Что касается глю-
козилированпя, то, как установили Саймондс и сотр. (Symonds
et al., 1963) и Хаттман и Фукасава (Hattmann, Fukasawa, 1963),
оно играет важную роль в явлении модификации за счет клетки-
хозяина (host — cell modification, см. также Никифоров, 1966).
Так, фаг Т2, выращенный на клетках Е. coli В/3, В/4 пли В/7, не
содержащих фермента, осуществляющего глюкозилированне фаго-
вой ДНК, не способен к последующему размножению в клетках
Е. coli В. Анализ причин этого явления выявил, что после выращи-
вания на клетках Е. coli В/3 и В/7 фаг Т2 содержал пе более
5—10% глюкозы. Однако такой безглюкозный фаг мог размно-
жаться в клетках Shigella, причем после размножения у него вос-
станавливалось исходное количество глюкозы, и он сразу приоб-
ретал способность к размножению в клетках Е. coli В. Возможно,
что глюкозилироваипе спасает ДНК фага от разрушения нуклеа-
зами Е. coli (Lehman, Pratt, 1960; Nikolskaya et al., 1964).
Метилирование нуклеиновых кислот
Среди различных модификаций первичной структуры нуклеи-
новых кислот наиболее изучено метилирование. Уже отмечалось,
что метилированные основания найдены как в ДНК (6-метиладе-
нин в бактериях, 5-метилцитозин в высших растениях и живот-
ных), так и в РНК (рибосомной и транспортной).
Наличие метильных групп в нуклеиновых кислотах оказывает
влияние на их структуру. Внедрение гидрофобной метильной груп-
пы в структуру пуринового пли пиримидинового основания преж-
де всего меняет конформацию молекулы нуклеиновой кислоты
(Borek, Christman, 1965) и оказывает влияние па распределение
электронной плотности. Это можно проиллюстрировать на приме-
ре 7-метплгуапина или 7-метилдезоксигуанозина. Введение ме-
тильной группы в положение 7 приводит к тому, что N-гликозид-
ная связь становится лабильной, и в кислой среде происходит от-
щепление основания и освобождение сахарного остатка, а в ще-
лочной среде пуриновое кольцо рвется по связи 8, 9 (Lawley, Bro-
okes, 1963)»
95
МЕТИЛИРОВАНИЕ НУКЛЕИНОВЫХ КИСЛОТ
Следует подчеркнуть, что существуют два типа метилирования
нуклеиновых кислот, различающихся по характеру ферментатив-
ного процесса и по своим биологическим последствиям. Первый
тип, о котором идет речь в этом разделе, обусловлен встройкой ме-
тильных групп в уже готовый полимер, а второй тип осуществля-
ется тогда, когда метильные группы присоединяются к предше-
ственникам нуклеиновых кислот до начала синтеза полимерных
молекул. Эти предшественники встраиваются в ДНК в неизмен-
ном виде.
Так как тимин представляет собой метилированный урацил
(5-метилурацил), то нолириботимидиловая кислота может рас-
сматриваться как метилированный в высокой степени полимер
уридиловой кислоты. Интересно, что полиуридиловая и политими-
диловая кислоты обладают весьма различными температурами
плавления. Полиуридиловая кислота в растворе представляет со-
бой случайную спираль и имеет температуру плавления 8,5°С,
в то время как политимидиловая кислота плавится при 36° С, что
свидетельствует о высокой степени упорядоченности (Shugar, Szer,
1962). Таким образом, добавление метильных групп к положению
5 урацила коренным образом меняет физико-химические характе-
ристики полиуридплового полимера. Столь же сильно изменяется
способность к гибридизации с полиадениловой кислотой. Поли-Т
гораздо легче связываются водородными связями с поли-А, чем
поли-У.
Широкая распространенность в естественных условиях мети-
лированных нуклеиновых кислот поставила прежде всего пробле-
му соответствия Уотсон — Криковских соотношений нуклеотидов
(комплементарности) при синтезе нуклеиновых кислот с сущест-
вованием широкого класса минорных соединений. Действительно,
коль скоро в теории Уотсона—Крика рассмотрены лишь взаимо-
действия канонических оснований (А + Т и Г + Ц), то не явля-
ется ли обнаружение минорных компонентов в ДНК и РНК опро-
вержением или существенным исправлением этой теории? Реше-
ние подобной проблемы стало особенно актуальным после того,
как Шпигельман и Дои (Doi, Spiegelman, 1963) доказали, что
синтез транспортных и рибосомных РНК осуществляется на мат-
рице ДНК и что в клетках, как правило, нет метилированных мо-
номерных предшественников нуклеиновых кислот.
Опасения относительно неверности Уотсон — Криковских соот-
ношений оказались тем не менее напрасными. Хотя в составе ДНК
не содержится столь много типов минорных компонентов, как, ска-
жем, в т-РНК, синтез последней происходит па ДНК в полном
согласии с правилами комплементарности.
Парадоксы, связанные с существованием минорных компонен-
тов, были разрешены открытием в лаборатории Э. Борека фунда-
ментального факта, что все «архитектурные украшения» пукле-
МОДИФИКАЦИЯ СТРУКТУРЫ НУКЛЕИНОВЫХ кислот
96
иновых кислот в виде метильных групп, глюкозных остатков и т. п.
пристраиваются в клетке к уже готовым полимерным каркасам
нуклеиновых кислот. Такая достройка ведется специальными фер-
ментами.
Как бывает нередко, ключом к открытию послужила неожи-
данная находка. В 1955 г. Борек, Райан и Рокенбах (Borek et al.,
1955) выделили ауксотрофпый мутант кишечной палочки —
К1Ж, пе синтезировавший незаменимой аминокислоты метиони-
на. До сих пор считалось, что при отсутствии в клетке или воз-
можностей для синтеза незаменимых аминокислот, или самих
аминокислот в среде, синтез РНК в клетках исчезает и рост оста-
навливается. Однако мутант К12W6 продолжал синтезировать РНК,
Естественно, что авторы попытались исследовать структуру РНК,
синтезируемой в отсутствие метионина, и нашли, что образуемые
РНК (рибосомная и транспортная) целиком потеряли все метили-
рованные основания. Так было установлено, что метионин прини-
мает какое-то участие в метилировании нуклеиновых кислот.
Следующим этаном в доказательстве роли метионина в мети-
лировании были опыты с меченным по С14 метионином (Borek,
1963). Оказалось, что все метилированные основания РНК стали
радиоактивными после добавления к среде С 14-метионина. Впо-
следствии удалось установить, что непосредственным предшест-
венником метильных групп является дериват метионина — S-аде-
позилметпонип, а само включение метильных групп происходит
па уровне готовой полимерной молекулы (Srinivasan, Borek, 1964),
и на характер метилирования до некоторой степени влияют сосед-
ние с метилируемым основания (Doskocil, 1966).
Окончательное доказательство вторичной природы метилиро-
вания было достигнуто исследованиями в нескольких лаборато-
риях (Comb, 1963; Gold et al., 1963a; Srinivasan, Borek, 1964; Starr,
1963; Svensson et al., 1963; Littauer et al., 1963). Наиболее пря-
мыми из них явились опыты по достройке метильных групп в уже
готовой безметилыюй РНК. Для этого Е. colt К12 We была выра-
щена в среде без метионина, но с меткой по Р32; из клеток была
выделена меченная но Р32 РНК, которую ввели в бесклеточную си-
стему Е. colt. Введенная РНК пе несла метильных групп, но пос-
ле культивирования с экстрактом Е. coll эта РНК получила ме-
тильные группы от адепозилметионина , меченного но С 14.
Первое время не удавалось разделить ферменты метилирова-
ния, хотя было ясно, что в экстракте Е. coll имеется несколько та-
ких ферментов (это следовало из того факта, что один п тот же
экстракт в качестве субстрата мог использовать различные соеди-
нения: в урациле и цитозине оп пристраивал метильную группу
к атому углерода; к аденину присоединял СН3 как к углеродно-
му, так и к азотному атому, у гуанина метилировал три атома азо-
та кольца). Фракционирование экстракта осуществили в двух ла-
97
РОЛЬ МЕТИЛЬНЫХ ГРУПП
бораториях: Борека (Fleissner, Borek, 1963) и Гурвица (Gold,
Hurwitz, 1964). Гурвиц сумел получить не менее шести РНК-ме-
тилаз, внедряющих СНз-грунны в различные участки т-РНК (Gold,
Hurwitz, 1964). Установлено, что набор метилаз в различных ис-
точниках различен. Это может до некоторой степени объяснить от-
личия в степени метилирования РНК 1гз клеток разных видов.
С помощью метнлаз, выделенных из тканей различных органов и
животных, удалось добавить метильные группы к транспортной
РНК кишечной палочки (Svensson et al., 1963; Gold et al., 1963b;
Srinivasan, Borek, 1963). Наметилась даже некоторая тенденция,
связанная с видоспецифичностью метилаз. Так, ферменты из близ-
кородственных организмов нередко проявляли сходную активность
в метилировании чужеродной РНК. Помимо метилаз, обслужи-
вающих РНК, были найдены ферменты, метилирующие ДНК. Для
метилаз ДНК отмечена еще более строгая специфичность: бакте-
риальные ДНК содержат лишь только 6-метиладенин, в Днк
растений и животных найден 5-метилцитозин. В лабораториях
Борека и Гурвица была показана способность метилирова-
ния ДНК гетерологичными ферментами, причем отмечено, что один
фермент метилирует цитозин, а другой использует в качестве суб-
страта аденин.
Роль метильных групп
Итак, после ряда весьма успешных поисков причин возникновения
аномалий в первичной структуре ДНК и РНК картина измене-
ния этой первичной структуры начала вырисовываться вполне от-
четливо. Во-первых, стало ясно, что минорные компоненты вовсе
не редкие гости в структуре нуклеиновых кислот (неканонические
основания были найдены и в составе ДНК всех царств живых су-
ществ, и в составе рибосомной и транспортной РНК). Во-вторых,
стало ясно, что никакой отмены основных закономерностей моле-
кулярной генетики это открытие за собой не влечет (встройка ме-
тильных групп в молекулы полимеров велась на уже готовых бло-
ках). Наконец, было найдено большое число ферментов (не менее
10), могущих вставлять различные группировки в структуры ДНК
и РНК.
Распространенность реакций метилирования и отмеченная ви-
доспецифпчность вряд ли могли быть случайными. Опыты с лини-
ей Е. coll K12W6, когда клетки сначала выращивались 3 часа в сре-
де без метионина, а затем всего на 15 мин. переносились в метио-
ниловую среду, убедили в том, что клетка весьма быстро реаги-
рует на возможность ввести метильные группы в нуклеиновые ки-
слоты. Этих 15 мин. было достаточно для полного метилирования
РНК.
4 В. Н. Сойфер
МОДИФИКАЦИЯ СТРУКТУРЫ НУКЛЕИНОВЫХ кислот
98
Богданова и Хесин (1966) и Гурвиц с соавт. (Gold et al., 1964)
показали, что при инъекции ДНК фага Т2 в Е. colt В одним из
ранних ферментов, синтезируемых под контролем генома фага,
является ДНК-метилаза. Синтезированный фермент не отличался
по своей активности от клеточного фермента.
Несмотря па успехи в изучении процесса метилирования, мы
до сих пор пе можем представить себе отчетливо функции метили-
рования. Если еще роль метильных групп в транспортных РНК бо-
лее или менее очевидна, то значение СНз-групп в ДНК остается
полностью неясным. Высказывались предположения, что посколь-
ку метилирование изменяет вторичную структуру ДНК, то это
может служить фактором предохранения от разрушения внутри-
клеточной ДНК нуклеазами. Известно, что во многих случаях
попытки трансформирования чужеродной ДНК оканчивались
безрезультатно именно но этой причине: проникая в клетку, чуже-
родные ДНК тут же разрушались нуклеазами клетки. Это предпо-
ложение стало особенно привлекательным после обнаружения
видоспецифичности дезоксирибонуклеаз (Catlin, 1960), а также
установления связи между метилированием и модификацией фагов
клеткой-хозяином.
Высказывалось предположение о том, что метильные группы
могут играть какую-то роль в начале считывания информации ДНК
(Хесин, 1966). В то же время обнаружено снятие матричной ак-
тивности полиуридиловой и полицитидиловой кислот после их ме-
тилирования (Szer, 1966). На этом основании выдвигалась гипо-
теза, что метилирование служит механизмом выключения мат-
ричной активности.
идпо из первых предположений о функциях метилирования
было высказано Сринивасаном и Бореком (Srinivasan, Borek, 1963).
Они полагали, что ферменты метилирования могут принимать учас-
тие в канцерогенезе. Возможно, что метилирование гуанина при
канцерогенезе обусловливается онкогенным вирусом, входящим
в клетку и предоставляющим информацию для синтеза метили-
рующих ферментов.
Кайе и Фридлендер (Kaye, Fridlender, 1965) высказали пред-
положение о роли метилаз в клеточной дифференцировке высших
организмов и вновь подтвердили возможное их участие в процес-
сах канцерогенеза.
Лудлум и др. (Ludlum et al., 1964) отметили, что метилирова-
ние полиадениловой кислоты резко изменяет ее матричные свой-
ства: даже незначительно метилированная поли-А перестает ко-
дировать синтез полилизина. Подобный эффект наблюдали Шер
и Очоа (Szer, Ochoa, 1964) в отношении полиуридиловой и поли-
риботимидиловой кислот.
Что касается роли метильных групп в структуре т-РНК, то
следует также сказать о большой противоречивости имеющихся дан-
99
ОДНОЦЕПОЧЕЧНЫЕ ДНК
ных. Как уже упоминалось, Ревелл и Литтауэр (Revell, Litlauer,
1966) обнаружили изменение акцепторной способности метилиро-
ванных т-РНК по сравнению с неметилированными. В первом
случае была зарегистрирована большая специфичность связыва-
ния с п-РНК и показано, что метилирование изменяет кодоно-
специфичность фен-т-РНК.
В противовес данным Ревелла и Лпттауэра Флейснер (Fleis-
sner, 1967) не обнаружил никакой разницы в кодирующих свой-
ствах нормальной и субметплированной фенилаланиновой т-РНК.
Однако Капра и Петерковский (Capra, Peterkofsky, 1966, 1968)
установили, что безметпльная лейциловая т-РНК присоединяется
в основном к поли-ЦУ, в то время как нормальная т-РНК форми-
рует комплексы с поли-ЦУ и с поли-УГ с одинаковой легкостью.
Авторы пришли к выводу, что наличие массивной гидрофобной
группы вблизи антикодона способствует выполнению кодирующих
свойств транспортной РНК.
В лаборатории А. А. Баева (Захаряп и др., 1967) был изучен
вопрос о роли метилирования концевой группировки АЦЦ суммар-
ного препарата т-РНК пекарских дрожжей; т-РНК, добытые из
этого источника, химически метилировались, после чего исследо-
вались как физико-химические показатели нативной и метилиро-
ванной т-РНК (кривые плавления, константы седиментации, цир-
кулярный дихроизм, спектр поглощения), так и акцепторная ак-
тивность обоих типов т-РНК. При этом метилирование концевого
триплета т-РНК, отмеченное ранее Эбелем и сотр. (Weil et al.,
1964; Bollack et al., 1965; Ebel et al., 1965), было доказано оконча-
тельно, и, кроме того, установлено, что метилирование концевого
аденозина осуществляется гораздо скорее, чем метилирование адено-
зинов внутри молекулы т-РНК. Тем самым опять была подтверж-
дена роль вторичной структуры для метилирования оснований.
Заканчивая этот раздел, следует еще раз подчеркнуть широкую
распространенность реакций метилирования в живой природе и от-
метить, что наших знаний явно недостаточно для понимания ро-
ли метилирования в осуществлении биологических функций гене-
тического материала.
Модификации вторичной структуры
нук.юпповых кислот
Одноцепочечные ДНК
Всеобщее распространение двунитевых ДНК, предсказанное Уот-
соном и Криком, считалось правильным вплоть до 1959 г., когда
Слнсхеймер (Sinsbeimer, 1959), а затем Тессман (Tessnian, 1959а,
Ь, с) обнаружили в составе бактериофага 0X174 однонитевую
4*
МОДИФИКАЦИЯ СТРУКТУРЫ НУКЛЕИНОВЫХ кислот
100
ДНК. То что нуклеиновая кислота фага 0X174 представлена ДНК,
а не РНК, следовало из устойчивости ее к РНК-азе и к обработке
щелочью, а также из гидролизуемостп днк-азой и положитель-
ной реакции на дезоксипентозу. ,
Вывод об одпоцепочечности был настолько убедительно аргу-
ментирован результатами различных методов исследований, что
никакого сомнения в реальности существования одноцепочечной
ДПК не могло возникнуть.
Прежде всего при измерении оптической плотности препарата
ДНК в ультрафиолетовом свете в диапазоне температур от 0 до
90° С была выявлена аномалия, резко выделявшая ДНК 0X174
от ДНК других видов. Наблюдался плавный рост оптической
плотности вместо четко выраженного скачка при денатурации. Та-
кой плавный рост всегда сопровождал плавление денатурирован-
ной однонптчатой ДНК.
Вторым аномальным свойством ДНК 0X174 было нарушение
правил Чаргаффа: равенства молярных концентраций А и Т и
Г и Ц пе было, концентрация тпмппа но отношению к аденину,
принятому за 1, равнялась 1,32, гуапипа 0,98, цитозина 0,80. По-
следнее также указывало на отсутствие комплементарной спира-
ли Уотсона—Крика.
Отсутствие бисппралытостп убедительно подтвердили резуль-
таты взаимодействия формальдегида с ДНК 0X174. Формальде-
гид, осуществляющий оксиметнлпрованпе аминогрупп оснований
ДНК по схеме: NH2 + СН2О->NH — СН2ОН, может реагировать
лишь со свободными основаниями денатурированной ДНК. Однако
он легко взаимодействовал с ДНК 0X174, что несомненно свиде-
тельствовало в пользу однонитчатости этой молекулы.
Не менее показательной была кинетика инактивации этой ДНК
при распаде Р32, включенного в фосфор сахарофосфатной цепи.
Сравнение кинетики инактивации ДНК 0X174 с таковой для ДНК
Т2 показало, что первая более чем в 10 раз чувствительнее к рас-
паду Р32. Эффективность инактивации в этом случае приближа-
лась к единице; это говорило о том, что каждый распад Р32 раз-
рывал нить ДНК ФХ174. Такое событие могло иметь место
только в том случае, если ДНК была представлена одной
нитью.
ДНК фага 0X174 довольно заметно отличалась от двунптевой
но плотности. При градиентном центрифугировании двунитевой
ДНК была получена цифра 1,73 г/см3, в то время как плотность
ДНК, выделенной из зрелых частиц фага, составляла 1,70 г/см3.
Подтверждение одноцепочечпостп ДНК 0X174 было получе-
но и в экспериментах по мутированию этого фага под действием
азотистой кислоты (Tessman, 1959 а, Ь). Если у фагов с двуните-
вой ДНК для завершения мутации требовалась в большинстве слу-
чаев репликация ДНК:
101
ДВУСПИРАЛЬНАЯ РНК
и потомство мутированной Днк состояло из смеси нормальных и
мутантных форм, то у 0X174 наблюдалось возникновение мутанта,
и все его потомство было чисто мутантным:
0 X 174
Список бактериофагов с одноцепочечной ДНК не ограничил-
ся одним 0X174. Ирвин Тессман исследовал фаг S13, также со-
держащий однопптевую ДНК.
Однонитевую ДНК содержат также фаги 0R (Кау, 1962), fl
и fd (Zinder et al., 1963; Hofschneider, 1963; Kay, Fields, 1962;
Marvin, Hoffman-Berling, 1963; Gesteland, Boodtker, 1964).
Двуспиралъная РНК
Произошло изменение взглядов и на вторичную структуру РНК,
Долгое время исследователи находили только однонитевые моле-
кулы РНК. Правда, многие опыты свидетельствовали в пользу
того, что частичная спирплизация РНК имеет место и такие спи-
ральные участки перемежаются с аморфными бесструктурными
участками. Тем пе менее, взгляд па РНК как па исключительно
однонитевую структуру пришлось пересмотреть после того, как
Гоматоз, Тамм, Дэйле и Франклин в 1962 г. обнаружили в составе
МОДИФИКАЦИЯ СТРУКТУРЫ НУКЛЕИНОВЫХ кислот
102
вирусов животных — реовирусах, а затем в 1963 г. в вирусе ране-
вых опухолей растений двуспиральные РНК.
Обычно нуклеотидный состав РНК различных видов не соот-
ветствует правилам Чаргаффа. В реовирусах имелось четкое ра-
венство молярных концентраций пуринов и пиримидинов, кроме
того, А + У/Ц + Г = 1. РНК реовирусов оказалась устойчивой
к действию панкреатической рибонуклеазы, расщепляющей одно-
нитевую РНК. Как и следовало ожидать для правильной двуце-
почечной структуры, плавного перехода в оптической плотности
молекул РНК реовирусов при их нагревании не наблюдалось.
Имелся узкий интервал температур, при котором поглощение в
ультрафиолете резко повышалось. Температура плавления этой
РНК существенно отличалась от Тпл ДНК. Если ДНК плавилась
около 90° С, то для РНК реовирусов эта величина лежала вблизи
100° С, что указывало на большую стабильность молекулы РНК
при тепловой денатурации. Интересно отметить, что такое же по-
вышение температуры денатурации наблюдается для синтетиче-
ских искусственных двуспиральных рибополимеров.
Наконец, использование формальдегида также говорило о на-
личии строго упорядоченной спиральной конфигурации типа
Уотсон-Криковской двойной спирали, так как формальдегид
не взаимодействовал с РНК реовирусов. Следовательно, амино-
группы азотистых оснований были закрыты для действия формаль-
дегида (из-за наличия водородных связей).
Детальное рентгеноструктурное исследование натриевой соли
РНК реовируса (Langridge, Gomatos, 1963; Tomita, Rich, 1964;
Gomatos et al., 1964) выявило характерное для ориентированных
двунптевых структур рассеяние рентгеновых лучей, дающее ре-
флексы, Сходные с таковыми для A-конфигурации двунитевых
Днк.
Анализ матричной активности РНК реовирусов показал, что
РНК этих вирусов может использоваться РНК-полимеразой для
синтеза полинуклеотидов, состав которых полностью идентичен
матрице. Для синтеза используются рибонуклеозидтрифосфаты.
Внесение актиномицина D подавляло синтез РНК.
Двуспиральность обусловила изменение ряда биологических
свойств вирусов с двунитевой РНК. В частности, скорость раз-
множения реовирусов гораздо меньше, чем вирусов с однонитевой
РНК. Заражение реовпрусами подавляет синтез ДНК клетки-
хозяина.
Кольцевидные ДНК
Первые убедительные доказательства в пользу кольцевид-
ности ДНК были представлены для ДНК бактерий (Жакоб,
Вольман, 1961). Основанием для подобного вывода были данные
103
КОЛЬЦЕВИДНЫЕ ДНК
генетического анализа порядка маркеров, входивших в реципиент-
ную бактерию Е. coli при использовании различных линий Hfr.
Полученные при этом результаты могли быть объяснены только
при наличии кольцевидности нативной ДНК бактерии и возмож-
ности ее разрыва в различных точках. Остроумная гипотеза Жа-
коба и Вольмана, объяснявшая взаимодействие F-фактора и бак-
териальной хромосомы и порядок вхождения хромосом при конъ-
югацищ получила затем подтверждение в экспериментах этих же
авторов. Вывод о циркулярное™ бактериальной ДНК был доказан
электронномикросконически Кэйрпсом (Cairns, 1963).
Кольцевидное™ ДНК была обнаружена и для фаговых ДНК.
Первое доказательство такого рода было дано Фирсом и Синс-
хеймером (Fiers, Sinsheimer, 1962) для ДНК фага 0X174. С по-
мощью ряда физико-химических методов (седиментация, изучение
деградации ДНК зрелых частиц фага фосфодиэстеразой и други-
ми ферментами, исследование профиля денатурации ДНК) они
установили кольцевидное™ ДНК фага 0X174.
Прежде всего они попытались оторвать от З'-конца ДНК 0X174
нуклеотиды с помощью фосфодиэстеразы Е. coli и фосфодиэстера-
зы яда гадюки и от 5'-конца — с помощью фосфодиэстеразы се-
лезенки. Все эти опыты окончились полной неудачей. Применение
ферментов, отщеплявших концевые нуклеотиды, также никоим
образом не сказывалось на инфекционности препаратов ДНК.
Предположив, что концевые нуклеотиды эрапированы от
нуклеаз белками, авторы применили протеазы, надеясь, что после
этого концы молекул станут доступны действию фосфодиэстераз.
Однако и эти попытки были безрезультатными.
Следующее осложнение касалось денатурации ДНК фага
ФХ174. Оказалось, что нагревание не делает доступными для фос-
фодиэстераз концы молекул. Защищенность молекулы от экзону-
клеаз делала весьма вероятным предположение о том, что концы
ее замкнуты сами на себя, причем термостабильность указывала
на достаточную прочность связи. Но, в таком случае, применение
эндонуклеаз, способных разорвать молекулу в середине, должно
было открыть ДНК для действия экзонуклеаз. И действительно,
используя ДНК-азу, авторы после непродолжительной инкубации
ДНК получили препарат, активно гидролизуемый фосфодиэстера-
зами.
Одновременно с разрывом кольца ДНК-азой терялась биоло-
гическая активность ДНК 0X174.
Окончательным свидетельством в пользу кольцевидности ДЩ{
0X174 было поведение ее при ультрацентрифугировании. Было
выявлено наличие двух компонент с константами седиментации
13,1S и 12,1S. Первый компонент составлял 70—90% смеси, был
резистентен к экзонуклеазам, нагреванию, инкубации в щелочной
среде. Кратковременное применение ДНК-азы переводило 13,1S
Модификация структуры нуклеиновых кислот
104
Рис. 30. Электронная микрофотография репликативной формы ДНК фага
0X174
компонент в 12,1S компонент, который был чувствителен к экзо-
нуклеазам и был полностью лишен инфекцпоппостп.
Совокупность всех данных привела Синсхеймера и Фирса к
выводу о том, что ДНК фага 0X174 имеет кольцевую форму и
нить ДНК замкнута в кольцо прочной (возможно ковалентной)
связью.
Позднее Фрайфельдер, Кляйншмидт и Синсхеймер (Freifelder
et al., 1964), модифицировав метод нанесения ДНК на белково-
монослойные пленки, смогли получить электронные микрофото-
графии ДНК ФХ174, на которых была отчетливо видна кольцевид-
ность этой структуры (рис. 30).
Интересная ситуация сложилась в отношении хромосом бак-
териофагов Т2 и Т4. Используя метод трехфакторного скрещива-
ния, Стрейзингер и Брюс (Streisinger, Bruce, 1960) еще в 1960 г.
показали, что генетические маркеры этих фагов образуют непре-
рывную генетическую карту. Этот вывод был подтвержден после
разработки методов изучения так называемых термочувствитель-
ных мутантов (ts-мутанты). Изучив большое число мутантов (бо-
лее 40), равномерно распределенных по генетической карте,
105
КОЛЬЦЕВИДНЫЕ ДНК
Эдгар (см. Bernstein et al., 1965) установил, что полученная кар-
та опять-таки является кольцевой. К тому же выводу привело
исследование янтарных (амбер) мутантов различных генов.
Однако все физико-химические и цитологические методы изу-
чения ДНК Т-четпых фагов говорили о том, что структура их ДНК
линейна. Некоторый намек на решение проблемы несопоставимо-
сти данных генетики, с одной стороны, и физико-хпмии и цитоло-
гии, с другой, содержался в выводах Томаса и Рубенштейна (Tho-
mas, Rubenstein, 1964), обнаруживших несовпадение концевых
генов у молекул ДНК, выделенных из разных популяций фага
Т2. Хотя каждая молекула содержала одинаковый набор генов,
порядок концевых маркеров варьировал от молекулы к молекуле.
Опыты по денатурации показали, что те последовательности, ко-
торые в одном случае находили па концах молекул, в других опре-
делениях обнаруживались в центре молекул.
Такое необычное «перекочевывание» генов из одного места
молекулы в другое пе отмечалось для ряда хорошо изученных фа-
гов как в опытах самих Томаса и Рубенштейна (фаг Т5), так и
в экспериментах Кайзера и сотр. с фагом X (Kaiser, Hogness, 1960;
Kaiser, 1962).
Выход из создавшейся ситуации Томас видел в предположе-
нии о возможности циклических перестановок генов при рекомби-
нациях. Такая перестановка могла объяснить результаты генети-
ческих экспериментов и выводы о перемещении участков ДНК
из концов в середину молекул.
Более того, Томас согласился с предположением Страйзингера,
Эдгара и Денхарта (Streisinger et al., 1964), что концы нитей,
по-видимому, содержат повторяющиеся участки типа: 1, 2, 3, 4,
5...9 1 2 3 или 3 4 5 6...Э 1 2 3 4.
Этот вывод Томасу удалось подтвердить в совместных с Мак
Хатти экспериментах (Thomas, Mac Hattie, 1964), когда молеку-
лы ДНК денатурировали теплом, а затем ренатурировали. При
этом возникали кольцевые структуры, видимые в электронном
микроскопе. Длина колец оказалась равной 55±3 мк и совпадала
с длиной линейных молекул (56 ± 2 мк). Из 143 отчетливо види-
мых молекул 29 оказались циклическими (4 из них были двойны-
ми), остальные 114 были линейными, имели различную длину,
по половина из них превышала 35 мк. Исследование возможности
возникновения кольцевых структур из частично разрушенных мо-
лекул показало, что после деградации кольца не образуются. Та-
ким образом, только полные молекулы ДНК способны к циклиза-
ции.
Всякие попытки получить кольцевую форму молекул фага Т5
кончились неудачно, что еще раз подтвердило отсутствие идентич-
ных последовательностей (повторений) в структуре полппуклео-
тидных нитей ДНК этого фага.
МОДИФИКАЦИЯ СТРУКТУРЫ НУКЛЕИНОВЫХ кислот
106
и нфициру ющего Репликативная
A L b2 С R
Вегетативный фаг
(открытая форма?)
L A R С
Линейная форма
Геном инфицирую- Кольцевая
щего фага (закры- форма
тая форма)
Рис. 31. Схема превращения кольцевой и линейной форм ДНК фагов
Иначе обстоит дело с кольцевидностью ДНК фага X. Кольце-
видные молекулы ДНК фага X возникали в нативных условиях
при размножении в клетке-хозяине. В то же время при выделении
ДНК из фаговых корпускул было установлено, что эти молекулы
линейны (Campbell, 1963; Calef, Licciardello, 1960; Ris, Chand-
ler, 1963; Hershey et al., 1963). При заражении линейными моле-
кулами ДНК фага X бактериальных клеток наблюдался переход
линейных форм в кольцевые. Дальнейшие эксперименты показа-
ли, что этот переход осуществляется благодаря наличию на кон-
цах ДНК фага X так называемых когезивных (липких) концов
(иначе говоря, комплементарных участков), которыми молекула
и смыкается в кольцо.
107
КОЛЬЦЕВИДНЫЕ ДНК
Депротеинизация препаратов ДНК фага % приводит к образо-
ванию линейных молекул, в то время как выдерживание ДНК
в растворах высокой ионной силы способствует переходу в цикли-
ческую форму (Ris, Chandler, 1963). Повышение концентрации
ДНК приводит к объединению молекул «конец в конец» и обра-
зованию длинных нитей (Hershey et al., 1963). Природа липких
концов была изучена в лабораториях Херши и Кайзера. Оказа-
лось, что концы представлены лишь однонптчатыми участками
ДНК с комплементарными последовательностями на концах. С по-
мощью фермента полимеразы Корнберга удалось достроить одно-
нптевые участки до двунитевых, после чего замыкание ДНК в цик-
лическую структуру стало невозможным (Hershey, Burgi, 1965;
Strack, Kaiser, 1965; Kaiser, Inman, 1965), а молекула потеряла
инфекцпоппость.
Появились оценки размера однонитевых участков ДНК (Wang,
Davidson, 1966). Оказалось, что их длина не превышает 10—15 ну-
клеотидов. Закрытие кольца ингибируется низкими концентрация-
ми солей, низкой температурой (Hershey et al., 1963) и формаль-
дегидом (Szybalsky, 1964).
Схема взаимопревращений кольцевой и линейной форм ДНК
фагов представлена на рис. 31.
Таким образом, пристальное изучение нуклеиновых кислот вы-
явило, что в природе имеется много различных модифицирован-
ных форм оснований, нуклеозидов и нуклеотидов, с одной сторо-
ны, и различных структурных модификаций нуклеиновых кислот,
с другой.
Особенно интересным представляется пам открытие кольце-
видной ДНК. При описании репликации нуклеиновых кислот мы
ничего не говорили о регуляции репликации ДНК в клетке. Вме-
сте с тем в настоящее время накоплено много фактов, говорящих
о том, что репликация бактериальных и вирусных ДНК, во-пер-
вых, связана с активностью мембран оболочек клеток, а, во-вто*
рых, с функционированием кольцевых молекул.
Идея «репликона», развитая Ф. Жакобом, в последнее время
была применена не только для бактериальных клеток, но и для
репликации ДНК клеток высших организмов (Mosolov, 1968). По-
видимому, кольцевая форма ДНК имеет большое преимущество
по сравнению с линейными формами не только для низших, но и
для высших организмов. Нет никакого сомнения, что важнейшая
организующая роль принадлежит мембранным структурам ядра
(в случае высших) и оболочки клеток (у микробных организмов).
Репликация вирусов, содержащих
однонитевую нуклеиновую кислоту
Репликативные формы ДНК-содержащих
бактериофагов
После обнаружения одпонитчатости и циркулярное™ ДНК фага
ФХ174 Синсхеймер нашел третью чрезвычайно интересную осо-
бенность этого фага. При заражении клеток Escherichia coll фагом
ФХ174 его ДНК превращалась из однобитовой в двунитевую
структуру. Внутриклеточная ДНК отличалась от ДНК свободных
вирусных частиц по многим показателям: ее плавучая плотность
равнялась 1,725 г/см\ что соответствовало двунитевой структуре,
и резко отличалась от плотности ДНК зрелого фага (1,707 г/сл3);
нагревание очищенной внутриклеточной ДНК 0X174 (Hayashi
et al., 1963b) приводило к четкому гииерхромному эффекту, сопро-
вождающему плавление двунитевой Днк в строго ограниченном
интервале температуры плавления (86,5°). И одиосниральиая, и
двуспиральная ДНК оказались инфекционными при заражении
протопластов бактерий. Возможность того, что двунптевая струк-
тура представляет собой гибрид инти ДНК с синтезирующейся на
пей питью РНК, была отвергнута на том основании, что получен-
ная структура разрушалась ДНК-азой, в то время как гибрид
ДНК—РНК, как известно, устойчив к действию ДНК-аз.
Двупитевая ДНК, образующаяся из одпонитевой после зара-
жения бактериальных клеток, получила название репликативной
формы (РФ).
Особенностью репликативной формы была повышенная устой-
чивость к ультрафиолетовому облучению по сравнению с однопи-
тевой ДНК. Ярус и Синсхеймер (Yarns, Sinsheimer, 1964) пришли
к заключению, что эта устойчивость связана с ренарируемостью
двунитевой ДНК.
Применение шадящих методов выделения позволило сразу в
двух лабораториях (Синсхеймера и Шпигельмапа) выделить дву-
нитевую репликативную форму ДНК 0X174 в виде кольцевой
структуры. Хайаши и сотр., использовав многократную хромато-
графическую очистку ДНК па колонках с метилированным альбу-
мином. нанесенным на кизельгур (МАК-хроматография), смогли
получить репликативную форму, свободную от заметного загрязне-
109 \ РЕПЛИКАТИВНЫЕ ФОРМЫ ДНК
НИИ как клеточной, так и одионитевой ДНК фага (Hayashi et al.,
1963b) и исследовать их форму в электронном микроскопе (Chand-
ler et aL, 1964), после чего кольцевидпость репликативной формы
ДНК 0X174 перестала вы зывать сомнение.
Кольцевидпость РФ ДНК 0X174 следовала также из опытов
Буртона и Сипсхеймера (Burton, Sinsheimer, 1963), которые
не смогли гидролизовать ее с помощью экзонуклеаз, по достиг-
ли этого после использования эндонуклеаз.
Кляйншмидт, Буртоп и Сипсхеймер (Kleinschmidt et al., 1963)
п Чэндлер и др. (Chandler et al., 1964) получили близкие значения
длины окружности кольца РФ (1,64 ± 0,11 и 1,89± 0,04 мк), что
соответствовало молекулярному весу 3,2—3,4-106. Значение моле-
кулярного веса, определенное на основе коэффициентов седимен-
тации (21S), равнялось 6,4-106. Сравнение этих цифр с величиной
молекулярного веса одионитевой ДНК (1,7-106) недвусмысленно
указывало на двутяжевость репликативной формы.
Генетическая важность кольцевидности репликативной формы
была до некоторой степени выяснена в последующих исследова-
ниях Шпигельмана и сотр. (Hayashi et al., 1964). Дело в том,
что длительное время не удавалось разрешить одно из противо-
речий, связанных с репликацией РНК па двупитевой ДНК.
Открытие транскрибирующего фермента (ДН К-зависимой РНК-
полимеразы) н разработка методов очистки ДНК позволили ря-
ду авторов (Geidnschek et aL, 1961; Chamberlin, Berg, 1962;
Hayashi et al., 1963b) изучить характер синтезов РНК in vitro.
Гораздо раньше этих исследований, исходя из чисто логических
предпосылок, Ф. Крик обсуждал возможную неоднозначность ин-
формации, несомой разными нитями одной молекулы ДНК. Дейст-
вительно, если на одной нити будет записано, к примеру, АТГАЦ-
ГГТАЦГ, то на второй (с учетом антпнараллельносги нитей) ин-
формация должна читаться следующим образом: ЦГТАНЦГТЦАТ.
Из этого могло следовать три вывода: 1) в клетке читается
лишь одна нить; 2) читаются две нити, по одна из них тут же
разрушается; 3) обе нити прочтенной ДНК используются для
разных целей.
Первые опыты in vitro (Geidnschek et al., 1961; Chamberlin,
Berg, 1962), казалось, отвергли первую альтернативу. Обе нити
ДНК транскрибировались в информационную РНК-
Однако анализ транскрипции в интактных клетках (Hayashi
et al., 1963а; Greenspan, Marmur, 1963; Tocchini-Valentini et al.,
1963) выявил, что и-РНК дает лишь одна пить ДНК. Противоре-
чие между характером синтезов в условиях in vivo и in vitro было
в значительной мере выяснено Хайаши, Хайашп и Шнпгельманом
(Hayashi et al., 1964). Минимальный линейный размер РФ ДНК
0X174 (около 5500 нуклеотидов), совершенные мцтоды выделе-
ния и очистки позволили авторам получить препарат с 90% содер-
РЕПЛИКАЦИЯ ВИРУСОВ С ОДНОНИТЕВОЙ ДНК И РНК
/
110
жапием кольцевых РФ ДНК 0X174 и почти полным отсутствием
эндонуклеаз. Удалось также получить свободный от примесей пре-
парат ДПК-зависимой РНК-полимеразы.
Проведенный с помощью этого фермента синтез РНК па це-
лых кольцевых структурах репликативной формы, репликативных
формах, разрушенных ультразвуком, и па однонитевой ДНК зре-
лых частиц фага показал, что в условиях пптактностп кольца
синтез РНК осуществляется лишь на одной нити. Этот вывод был
подтвержден анализом соседних нуклеотидов но методу Корнбер-
га (Swartz et al., 1962) и гибридизацией молекул РНК с нитями
ДНК из зрелой и репликативной форм вируса. Стоило разорвать
кольцо, как синтез начинался па обеих нитях ДНК. РНК*, син-
тезированная па неповрежденной кольцевой РФ, могла гибриди-
зироваться с одной из нитей РФ, по была пекомплемептарна
к нити ДНК зрелого фага. Последнее обстоятельство приобрело
особый интерес после изучения характера репликации одпоните-
вых РНК-содержащих вирусов.
Репликативные формы РНК-содержэщих
вирусов
Одновременно с доказательством перехода однопитевой ДНК
бактериальных вирусов в двуспиральную репликативную форму
при их размножении принципиально тот же механизм удвоения
был установлен для РНК-содержащих вирусов.
Монтаньер и Заундерс (Montagnier, Saunders, 1963), исследуя
цикл размножения вируса энцефаломиокардита (ВЭМК), столк-
нулись с фактом удвоения однонитевой РНК в двунптевую струк-
туру после заражения ВЭМК культуры асцитных опухолевых
клеток Кребса II.
Полученная репликативная форма обладала отчетливо выра-
женными свойствами двунптевой формы: опа не гидролизовалась
панкреатической РНК-азой — ферментом, не способным к разру-
шению упорядоченных двуспиральиых структур; репликативная
форма ВЭМК не реагировала с формальдегидом; удельный вес ее,
определенный в градиенте плотности CS2SO4, оказался промежу-
точным между таковым для двунитевой ДНК (1,42 г/см3) или
гибрида РНК-ДНК (1,49) и однонитевой РНК (1,63) и равнялся
1,57 г/см3. Расчет молекулярного веса, произведенный но резуль-
татам седиментационного анализа, показал, что молекулярный вес
репликативной формы (6,7 • 106) примерно вдвое больше моле-
кулярного веса РНК зрелых вирусных частиц. Кривая плавления
двунитевой РНК имела острый переход, вместо плавного перехо-
да у однонитевой РНК. Сумма всех доказательств позволила
Монтаньеру и Заундерс сделать достаточно обоснованный вывод
111 \ РЕПЛИКАТИВНЫЕ ФОРМЫ РНК
\
о переходе однобитовой структуры РНК вирусов в двунитевую
репликативную форму при размножении вирусов.
Это заключение было подтверждено большим количеством
исследований, выполненных на различных РНК-содержащих
вирусах.
Балтимор и др. (Baltimore et al., 1964), использовав радиоизо-
топы, идентифицировали в клетках HeLa, зараженных вирусом
полиомиелита, устойчивые к РНК-азе молекулы РНК вируса,
отличавшиеся к тому же но седиментационным показателям от
обычной однонитевой РНК.
Однако и Монтаньер и Балтимор двунитевую РНК находили
лишь после длительного инкубирования клеток с вирусами, когда
имелось большое количество одпопитевых структур и лишь незна-
чительное— двунитевых. Правда, авторы априори полагали, что
одпонитевые РНК являются продуктами распада двунитевых, но
доказательства предсуществования этих РФ представлено пе было.
Утверждение о том, что первым этапом синтеза вирусной РНК
в клетках, зараженных вирусом, является образование двуните-
вой репликативной формы, получило подтверждение после экспе-
риментов Понса (Pons, 1964). Он исследовал судьбу РНК вируса
полиомиелита типа I в зараженных клетках HeLa.
Через 7 часов после заражения клетки разрушали и из них
выделяли РНК. После центрифугирования в градиенте сахарозы
были получены три фракции РНК: большая часть имела констан-
ту седиментации 25—27 S. меньшая характеризовалась константой
седиментации 16—20 S и имелась фракция низкомолекулярной
РНК - 4 S.
И 25—27 S и 16—20 S РНК обладали инфекционностыо на
культуре HeLa. Применение РНК-азы почти полностью лишало
25—27 S РНК ее инфекционности (более 99% этой РНК разруша-
лось), в то время как 16—20 S РНК теряла лишь 10—30% исход-
ной активности.
Так как разделить одно- и двунитевую структуру одной и той
же РНК в градиенте CS2SO4 по плотности довольно трудно (пла-
вучая плотность однонитевой РНК—1,64 г/см3, а двунитевой —
1,58 г/сл3), то автор применил метод хроматографии смеси РНК,
полученной из зараженных клеток, па колонках с метилирован-
ных альбумином на кизельгуре (МАК). Устойчивая к РНК-азе
двупитевая РНК при этом элюировалась 0,84 М NaCl, в то время
как для элюции однонитевой РНК требовался раствор NaCl
1,04 М. Такое же разделение полиовируспой РНК на два компо-
нента на МАК было отмечено ранее (Maes, Wecker, 1964). С по-
мощью фракционирования на МАК удалось обнаружить рапообра-
зующуюся репликативную форму.
Для этого нормальные и зараженные вирусом полиомиелита
клетки HeLa подвергали импульсному мечению уридином-2-С
РЕПЛИКАЦИЯ ВИРУСОВ С ОДНОНИТЕВОЙ ДНК И РНК / 112
/
с интервалами в 1 час и через каждый час бр!али пробы РНК.
Первые два часа в инфицированных клетках можно было найти
лишь клеточные РНК (с константой седиментации 4S), а спустя
2 часа появилась первая вирусная РНК, причем опа оказалась
двунитевой репликативной формой. Начиная с 3-го часа появля-
лась одпонитевая РНК полиовируса, а после 4 часов с начала за-
ражения количество однонитевой РНК быстро увеличивалось,
а двунитевой оставалось почти без изменения. К 7-му часу доля
РФ составляла лишь 1% от всей РНК вируса.
Обнаружение репликативной двунитевой формы РНК постави-
ло вопрос принципиальной важности. До сих пор был известен
лишь процесс синтеза однонитевой РНК па матрице ДНК, и для
этого процесса был известен фермент, синтезирующий РНК. Одна-
ко в случае двунитевой РНК условия синтеза менялись и мог
понадобиться другой ферментный механизм. Этот вопрос тем бо-
лее требовал разрешения, так как к 1963 году было открыто мно-
го бактериальных и животных вирусов с рибонуклеиновой кисло-
той в качестве информационной молекулы; в частности, были
обнаружены РНК-содержащие фаги f2 (Loeb, Zinder, 1961),
MS2 (Davies et al., 1961), R17 (Paranchych, Graham, 1962), M12
(Hofschneider, 1963), fr (Marvin, Hoffman-Berling, 1963).
Ферменты, реплицирующие РНК
Первым указанием на существование особой ферментной системы,
управляющей синтезом РНК вирусов, содержащих в качестве
матрицы РНК, было обнаружение Купером и Зиндером независи-
мости синтеза такой РНК от синтеза Днк клетки па примере
фага 12 (Cooper, Zinder, 1962). Годом позже Хэйвуд и Сипсхеймер
(Haywood, Sinsheimer, 1963) обнаружили, что подавление синтеза
ДНК клетки актиномицином еще до заражения клеток Escherichia
coli бактериофагом MS2 нисколько не влияет на образование
вполне полноценного потомства этого фага.
Выделение специального фермента, ведущего синтез РНК на
матрице РНК, пе заставило себя долго ждать. Ряд исследователей
описали и выделили РНК-завпсимую РНК-полимеразу (РНК-реп-
лпказу пли РНК-сиптетазу) из животных и бактериальных кле-
ток, зараженных РНК-содержащими вирусами. С помощью этой
РНК-реплпказы удалось in vitro провести синтез РНК после ин-
кубирования меченных по С14 рибонуклеозпдтрифосфатов и за-
травки в виде РНК фага MS2 (Haruna et al., 1963). Синтезиру-
емая in vitro РНК оставалась на матричной РНК, давая, по-види-
мому, двупитевую структуру, подобную репликативной форме.
Интересно, что фермент РНК-репликаза оставался присоединен-
ным к двунитевому комплексу (Weissman et al., 1963).
из
ФЕРМЕНТЫ, РЕПЛИЦИРУЮЩИЕ РНК
В опытах in vi^o Дэвис и Синсхеймер нашли, что фаговые
частицы из потомства фага MS2 не содержат вовсе родительской
РНК, а во всех вирусных частицах имеется вновь синтезирован-
ная РНК (Davies, Sinsheimer, 1963).
Разработав улучшенный метод выделения и очистки РНК-
репликазы из клеток, зараженных фагом MS2, Вейсманн и др.
(Weissmann et al., 1964) смогли подробно описать свойства этого
фермента. Фермент в их опытах всегда обнаруживался прочно
соединенным с РНК. Эта РНК не подвергалась гидролизу РНК-
азой, из чего можно было сделать вывод, что эта РНК — двуни-
тевая. Перенесение комплекса РНК-сиптетаза + присоединенная
двуннтсвая РНК в инкубационную среду с мечеными С14-ури-
динтрифосфатами приводило к синтезу кислотонерастворимого
продукта. Этот синтез новой РНК не ускорялся и не замедлялся
после внесения в инкубационную смесь порции высокомолеку-
лярной РНК из фага MS2 \ актиномицина D, ортофосфатов, ДНК
тимуса теленка или фермента РНК-нуклеотидилтрансферазы,
осуществляющего синтез РНК на ДНК.
Таким образом, выделенный фермент, прочно соединенный
с какой-то двунптевой РНК, осуществлял синтез новой PHI?
независимо от того, какие дополнительные матрицы вводились
в систему.
Какая же РНК синтезировалась этим ферментом? Для ана-
лиза этого вопроса авторы синтезировали в присутствии РНК-
синтетазы достаточное количество радиоактивной РНК и про-
анализировали полученный продукт. Прежде всего было уста-
новлено, что половина меченой вновь синтезированной РНК
чувствительна к РНК-азе и на этом основании может рассмат-
риваться как однонитевая, а половина оказалась устойчивой к
действию РНК-азы и, следовательно, являлась двунитевой. Ана-
лиз этой двунптевой РНК выявил большое сходство в свойствах с
репликативной формой PIT К фага MS2. Опа имела такой же про-
филь денатурации, такую же температуру плавления и плавучую
плотность в Cs2SO4, как и РФ фага MS2.
Чтобы убедиться в идентичности двупнтевого продукта РНК-
синтетазы и РФ фага MS2, авторы применили косвенный, по до-
вольно остроумпый метод. Они денатурировали теплом РПК-сипте-
тазиый продукт, бывший к тому же радиоактивным, и перед ох-
лаждением смеси для перехода к ренатурации внесли в среду
«холодные» (перадиоактивиые) одиопитевые РНК из зрелых
частиц фага MS2. Если, действительно, синтезированная РНК
имеет родство с РНК фага, го одна из нитей вновь сиптезирован-
1 Количество введенной в систему с РНК-синтетазой матричной РНК было
в этих опытах достаточно велико.
РЕПЛИКАЦИЯ ВИРУСОВ С ОДНОНИТЕВОЙ ДНК И РНК /
114
Рис. 32. Синтез дочерних «плюс»-нитей вирусных РНК с «минус»-нити
ной РНК будет комплементарна к РНК фага. Тогда после от-
жига РНК должны будут образоваться комплексы «горячей»
нити РНК с комплементарными «холодными» нитями РНК фага.
Такие наполовину «горячие» двунитевые структуры будут устой-
чивы к действию РНК-аз и могут быть легко выделены из дена-
турационной смеси. В эксперименте удалось выделить наполовину
«горячие» двунитевые РНК. В то же время никаких комплексов
с рибосомной, транспортной РНК или РНК вируса табачной мо-
заики не возникало.
Эти опыты также несомненно указывали на полуконсерва-
тивный механизм репликации однонитевой РНК при образовании
двунитевой репликативной формы.
Суммируя выводы относительно механизма синтеза РНК в
клетках, зараженных РНК-содержащими вирусами, Вейсманн
и др. (Weissmann et al., 1964) предложили следующую схему
последовательности событий в инфицированных клетках.
Внедрившись в клетку-хозяин, нить РНК вируса («плюс»-
нпть): 1) синтезирует комплементарную «минус»-нить, которая
вместе с родительской «плюс»-нитью дает двунитевую реплика-
тивную форму; 2) с репликативной формы как с матрицы начи-
нается синтез новых «плюс»-нитей. Эти «плюс»-нити, одеваясь
белком, дают начало дочерним вирусным частицам (рис. 32).
Вопрос о том, нужны ли для обоих процессов два фермента
или же РНК-репликаза управляет обоими процессами, оставался
открытым. Генетические данные, полученные в лаборатории
Н. Зиндера (опыты с температурочувствительными мутантами),
свидетельствуют о существовании двух ферментов.
115 \ ФЕРМЕНТЫ, РЕПЛИЦИРУЮЩИЕ РНК
Сходство характера синтезов потомства бактериальных РНК
содержащих вирусов и животных вирусов было доказано многи-
ми исследователями.
Балтимор, изучая синтез РНК вируса полиомиелита (Baltimo-
re, 1964), не только нашел такой же фермент, как и для фага
MS2, но и доказал, что в случае полиовируса эта вирусная РНК-ре-
нликаза образуется после внедрения вируса в клетку, а затем па
РНК вируса как на матрице достраивает вторую нить. В опытах
Балтимора удалось также отметить наличие в инфицированных
клетках как однопитевых, так и двунитевых копий родитель-
ской РНК.
Исследования, касавшиеся проблем формирования РНК-со-
держащих вирусов, в короткий срок приобрели исключительно
широкий размах. Репликативные формы, подобные описанным
выше, были найдены у РНК-содержащих фагов: 1‘г (Каегнэг,
Hoffman-Berling, 1964), R17 (Erikson eb al., 1964), 0 (Nonoya-
ma, Ikeda, 1964), M12 (Delius, Hofschneider, 1964); животных ви-
русов: вируса леса Сем лики (Sonnabend et al., 1964), менго
(Reich et al., 1962); растительных вирусов: вируса табачной
мозаики (Shipp, Haselkorn, 1964; Burdon et al., 1964), желтой
мозаики турнепса (Mandel et al., 1964) и др.
По расчетам Шиппа и Хазелькорна в случае вируса табачной
мозаики каждая клетка, зараженная ВТМ, содержит от 102 до
103 двунитевых РФ, и каждая из них дает начало тысяче зрелых
вирусных частиц. Примерно к той же цифре пришли Бурдон
и сотр. (Burdon et al., 1964).
Спиральность двунитевой репликативной формы РНК вируса
MS2 была доказана непосредственным изучением РФ методами
рентгеноструктурного анализа (Langridge et al., 1964). Рентге-
нограмма, полученная от РНК вируса MS2, полностью совпада-
ла с рентгенограммой двунитевой РНК реовирусов. Переход
одной нити в репликативную форму до начала синтеза дочерних
молекул РНК был показан рядом авторов (Weissmann et al.,
1964). Келли и Синсхеймер (Kelly, Sinsheimer, 1964) смогли
пойти дальше и обнаружили, что обработка клетки-хозяина
ингибитором белкового синтеза — хлорамфениколом, начинающа-
яся до инфекции клеток фагом MS2, ингибирует также синтез
вируса, причем угнетепие связано с нарушением образования
репликативной формы.
Точное совпадение молярных концентраций аденина и ура-
цила, с одной стороны, и гуанина и цитозина, с другой, найден-
ное для рибонуклеазо-устойчивого продукта инфекции Е. coli
фагом р (Nonoyama, Ikeda, 1964) еще раз подтвердило компле-
ментарность нитей репликативной формы, подчиняющуюся пра
вилам Уотсона и Крика (с учетом РНК-овой природы копо-
лимера).
РЕПЛИКАЦИЯ ВИРУСОВ С ОДНОНИТЕВОЙ ДНК И РНК
/
116
Таким образом, накопленные данные о судьбе вирусной ну-
клеиновой кислоты, в инфицированных клетках позволили указать
на ряд существенных различий между ДНК-содержащими и РНК-
содержащими вирусами. В первом случае вирусная ДНК, воз-
можно, с участием ферментов клетки-хозяина давала начало
однонитевой информационной РНК. В случае РНК-содержащих
вирусов их РНК управляла синтезом вирусного белка (могла осу-
ществлять эту реакцию in vitro, Nathans et al., 1962) и тем са-
мым выполняла функции информационной РНК. Никакого уча-
стия в синтезе новых вирусных частиц ДНК клетки-хозяина не
принимала. Обнаружение двунитевой репликативной формы РНК
указало на возможный механизм синтеза РНК, полностью под-
чиняющийся полуконсервативному способу репликации, но де-
тали внутриклеточного функционирования этого генетического
механизма оставались невыясненными и сама модель сохраняла
большую степень гипотетичности.
Роль «плюс»- и «минус»-нитей
в синтезе вирусной РНК
Первая детализация представлений о роли двунитевой структуры
в синтезе РНК зрелых частиц («плюс»-нитей) была сделана в
работе Фенвика, Эриксона и Франклина (Fenwik et al., 1964),
По их данным, РНК бактериального вируса R17 может быть
разделена на два основных компонента: 27S и 16S. Первый ком-
понент представляет однонитевую РНК, второй имеет сложную
природу. Когда 16S компонент, меченный по Р2, подвергли дей-
ствию РНК-азы, 30% присущей 16 S метки было утеряно, а
константа седиментации обработанного РПК-азой препарата по-
низилась до 12S. Эта 12S фракция была устойчива к РНК-азе
и, но-впдимому, представляла собой двунитевую структуру. На
этом основании авторы предположили, что РНК с константой
седиментации 16 S состоит из двух частей: двунитевого шнура
и однонитевых отростков.
Ключом к разгадке этой структуры послужили следующие
эксперименты- К клеткам, зараженным фагом, через 30 мин.
после инфекции добавили па 10 сек. радиоактивную метку (Н3-
уридин), после чего клетки отмыли от метки и дали им возмож-
ность расти еще 2 или 10 мин. После этого РНК была выделена
и исследована. Оказалось, что через 10 мин. после введения им-
пульсной метки в клетке произошло два события: 1) появился
однонитевый меченый компонент с константой седиментации
27 S; 2) если сравнивать количество метки в 16 S компоненте
клеток, сразу же разрушенных после введения метки, с коли-
чеством метки в 16 S компоненте клеток, росших еще 10 мин.
117
РОЛЬ «ПЛЮС»- И «МИНУС»-НИТЕЙ
в нерадиоактивпой среде, то
можно заметить резкое умень-
шение метки во втором слу-
чае. После переноса клеток на
10 мин. в нормальную среду
16S компонент сохраняет лишь
10—15% исходной метки.
Связывая эти события во-
едино, можно было сказать, что
значительная часть метки из
16S компонента переходит в
однонитевый 27S компонент.
Рис. 33. Схема синтеза вирусной РНК
Этот вывод авторы наглядно
нредставили в схеме синтеза
РНК (см. рис. 33).
Двунитевая природа РНК, синтезированной ферментом, очи-
щенным от нуклеаз, была подтверждена Амманом и сотр. (Am-
mann et al., 1964), иршменившими электроииомикроскоиическпй
метод изучения вновь образованной РНК. Прямое измерение дли-
ны этих молекул дало цифру порядка 12 000 А.
Келли, Гульд и Синсхеймер (Kelly el al., 1965) использовали
обработанные актиномицином D протопласты Е. coli, у которых
синтез собственной РНК был в значительной мере подавлен.
К сожалению, при такой обработке сильно нарушался и синтез
РНК вируса, введенной в протопласты (выход вируса заметно
понизился). Тем не менее синтезированного в протопластах ма-
териала оказалось достаточно, чтобы выделить некоторое коли-
чество 15 S материала, который был лишь частично резистентен
к панкреатической рибонуклеазе и переходил в 12 S при щадя-
щей обработке нуклеазой. Кроме того, эти авторы нашли часть
20 S одионитевой РНК и мало 27 S РНК. Исходя из этого они
постулировали, что этот 20 S РНК материал есть частично недо-
строенный 27 S материал.
Правда, доказательство перехода части 16 S компонента в 27 S
компонент и в опытах Фенвика и в экспериментах Келли но-
сило косвенный характер. Оставалось также совершенно неяс-
ным, каким образом получалась комплементарная «минус»-нить
в клетках, зараженных «плюс»-нитью, и как происходило ее
взаимодействие с РНК-синтетазой.
Свойства PHК-синтетазы
Первой отличительной особенностью РНК-зависимой РНК-поли-
меразы явилось ее удивительное пренебрежение к любым другим
сортам РНК, кроме собственной, присущей этому виду вируса.
РЕПЛИКАЦИЯ ВИРУСОВ С ОДНОНИТЕВОЙ ДНК И РНК
118
Харуна и др. (Haruna el al., 1963) смогли очистить индуциро-
ванную фагом РНК-нолимеразу в 1000 раз. При такой очистке
фермент уже не был связан с матричной РНК и для своей ра-
боты требовал экзогенной РНК. Добавление к очищенному фер-
менту фага MS2 РНК рибосом или транспортной РНК из Е. coll
не приводило ни к какому заметному синтезу РНК. Ни один из
этих видов РНК не мог интерферировать с матричной функцией
вирусной РНК.
Чрезвычайная специфичность фермента к своей и только
своей вирусной РНК была продемонстрирована Харуна и Шпи-
гельманом (Нагппа, Spiegelman, 1965а). Авторы выделили фер-
мент РНК-репликазу, свободную от примесей рибонуклеаз и фос-
форилаз. На активность фермента не влияло добавление ДНК-аз,
и лишь введение в среду панкреатической рибонуклеазы пол-
ностью снимало синтез полирибонуклеотидов.
Для работы фермента достаточно было добавить 1 мкг специ-
фической РНК на 40 мкг белка. За 2 часа фермент нарабатывал
в 5 раз большее количество РНК, чем ее было внесено с матри-
цей. Фермент сохранял активность в течение 5 часов и требовал
наличия ГТФ и ионов Mg.
Чтобы решить, насколько специфичен фермент в отношении
матрицы, воспользовались новым РНК-содержащим бактери-
альным вирусом QP, открытым И. Ватанабе. РНК этого вируса,
как и РНК фага MS2, имела одну нить, и характер репликации
вируса был сходен с репликацией MS2.
Так как оба фага могли заражать одного бактериального хо-
зяина (мутант Q-13 линии Hfr Е. coli, потерявший в результа-
те мутации рибонуклеазу I и РНК-фосфорилазу), авторы вы-
растили оба фага в сходных условиях, а затем, выделив вирусную
РНК-репликазу, смогли исследовать полимеразную активность
фермента из MS2 и из QP in vitro.
Таблица 5
Ответ Qft-репликазы на введение различных матриц (в имп/мин)
(Haruna, Spiegelman, 1965а)
Матрица (РНК) Синтез РНК в ответ- на введение Матрица (РНК) Синтез РНК в ответ на введение
1 мг 1 мг 2 мг
Q3 4929 4945 Транспортная 15 57
вжмт 146 312 Пул РНК инфици- 146 263
MS2 35 26 рованных клеток
Рибосомная 45 9
119
СВОЙСТВА РНК-СИНТЕТАЗЫ
Таблица 6
Специфичность к матрицам двух РНК-репликаз (синтез РНК в имп/мин)
(Haruna, Spiegelman, 1965а)
Матрица РНК Фермент из клеток, за- раженных фагом Матрица РНК Фермент из клеток, за- раженных фагом
MS2 Q3 MS2 Q0
MS2 1 <23
1 мкг 4742 36 1 мкг 0 2871
2 мкг 4366 65 2 мкг 56 3731
Ферменту вируса QP были предложены в качестве матриц
РНК рибосом и тРНК Е. coli пул РНК из зараженных клеток
РНК вируса желтой мозаики турнепса (ВЖМТ) (табл. 5).
Лишь однонитевая РНК ВЖМТ обладала незначительной мат-
ричной активностью (примерно 6% активности, наблюдаемой
с гомологичной РНК вируса QP).
Полная иеактивность РНК-репликазы была продемонстрирова-
на и для фермента фага MS2 при введении гетерологичной РНК
(табл. 6).
На основании этих экспериментов авторы пришли к выводу,
что очищенная вирусная РНК-зависимая РНК-полимераза обла-
дает следующими свойствами: а) полной зависимостью от гомо-
логичной ей РНК; б) способностью к длительному синтезу РНК
(более 5 часов); в) способностью синтезировать много копий
матричной РНК; г) способностью насыщаться малыми количест-
вами РНК (1 мкг РНК на 40 мкг белка).
До некоторой степени противоположные данные получили
Огест, Шапиро и Сойапг (August et al., 1965). Очистив в 200 раз
РНК-зависимую РНК-полимеразу из клеток, зараженных мутан-
том фага f2, они установили, что добавление любой (однонитевой)
РНК к ферменту приводит к синтезу РНК.
Отмеченная неспособность различать родственную РНК от
чужеродной могла быть следствием как мутантной природы ис-
пользованного фага, так и несовершенством методов выделения и
очистки фермента. Правда, Шапиро и Огест (Shapiro, August,
1965) доказали (анализом соседних нуклеотидов в заново синте-
зированной РНК и во взятой в качестве затравки РНК), что но
вая нить РНК комплементарна к добавленной РНК и, более того,
синтезируется, по-видимому, в антипараллельном направлении.
РЕПЛИКАЦИЯ ВИРУСОВ С ОДПОПИТЕВОГг ДИК II РНК
120
Доказательства in vitro и in vivo
роли репликативных форм
в синтезе вирусной РНК
Долгое время доказательства участия двунитевых структур в
синтезе РНК основывались преимущественно на экспериментах
in vitro.
В 1965 г. Хаузен (Hausen, 1965) доложил о результатах изуче-
ния размножения вируса ME (маленького сферического вируса,
относящегося к группе Columbia SK никорпавирусов) в культуре
клеток L мышиных фибробластов.
Клетки, зараженные вирусом ME, через 4 часа после инфек-
ции обрабатывали актиномицином D, а еще через 15 минут вво-
дили С14-уридин. После 15-мипутной инкубации с С14-уридипом
метка в основном (более 80%) обнаруживалась в кислотонераст-
ворпмой фракции, что указывало на синтез повой РНК. В после-
дующих экспериментах время инкубации с меткой было увели-
чено до 30 мин., после чего клетки разрушали и резистентный к
РНК-азе материал был подвергнут ультрацептрифугировапию.
Его константа седиментации оказалась равной 16S. При тепловой
денатурации резистентный к РНК-азе материал давал типичную
картину плавления двупитевого комплекса и Тпл равнялась
80—85° С.
Чтобы определить время и кинетику синтеза вирусной РНК,
клетки заражали вирусом в присутствии актиномицина D, отмы-
вали от среды на короткие интервалы времени, после чего инкуби-
ровали в течение получаса с С14-уридштом. Через равные проме-
жутки времени в клетках определяли общее содержание РНК и
количество двунптевой РНК, осажденной трихлоруксусной кисло-
той. На протяжении всего цикла внутриклеточного развития об-
разование общего количества вирусной РНК шло параллельно
синтезу двунптевой РНК (рис. 34).
Кроме того, Хаузен в опытах с использованием двух меток
(С14 и Н3) отметил замещение части метки С14 в уже синтези-
рованной двунитевой структуре на добавленный Н3-уридин при
последующей инкубации. Также было зарегистрировано большее
образование «плюс»-нитей по сравнению с «минус»-иитями.
Преимущественный синтез «плюс»-питей РНК фага MS2 был
зарегистрирован и в экспериментах in vitro. Вейсманн (Weissmann,
1965) выделил продукт реакции РНК-зависпмой РНК-полимеразы,
меченный по С14, и подверг его отжигу с избытком нерадиоак-
тивпой двунптевой РНК фага MS2 (репликативной формой).
Почти вся С14-РНК стала резистентной к рибонуклеазе. Автор
интерпретировал этот результат следующим образом: репликатив-
ная форма состоит из «плюс»- и «минус»-нитей, поэтому когда
одпопитевая РНК, меченная по С14 (продукт реакции РНК-поли-
121
РОЛЬ РЕПЛИКАТИВНЫХ ФОРМ В СИНТЕЗЕ РНК
Рис. 34. Сравнение скорости
синтеза двунитевой РНК (1)
и вирусной РНК (2) в L-клет-
ках, зараженных вирусом ME
Применялось 30-мпнутное мече-
ние (Hausen, 1965)
Время инкубации часы
меразы), комнлементпрует с одной из нитей репликативной фор-
мы, то она становится устойчивой к РНК-азе.
Но для того чтобы решить, какая же из нитей репликативной
формы соединяется с С14-РНК, нужен дополнительный экспери-
мент. Таким экспериментом стало добавление к вновь образовав-
шемуся двунитевому комплексу, меченному теперь по С14, боль-
шой порции нерадиоактивной РНК, выделенной из зрелых фаго-
вых частиц («плюс»-нитей). После отжига такой смеси 90% метки
перешло в среду и продукт, содержащий метку, стал чувствитель-
ным к РНК-азе. Это и доказывало, что радиоактивность была в
«плюс»-нити. Тем самым было установлено, что основная часть
продукта РНК-зависимой РНК-полимеразы — есть «плюс»-пить.
Таким образом, широкий круг экспериментов но изучению
размножения РНК-содержащпх вирусов привел к ряду интерес-
ных выводов. Был открыт новый фермент РНК-полимераза, ис-
пользующий в качестве матрицы рибонуклеиновую кислоту. Уда-
лось зарегистрировать существование двух типов РНК — так на-
зываемых «плюс»-ннтей, соответствующих РНК зрелых частиц
вирусов, и «минус»-нитей, являющихся комплементарной копией
«плюс»-нити. Обнаружение двунитевого комплекса, составленного
из «плюс»- и «минус»-пити, поставило вопрос об участии этого
дуплекса в синтезе новых копий РНК. Важным обстоятельством
в этой проблеме явилось установление преимущественного синте-
за «плюс»-нптей в процессе внутриклеточного развития вирусов
и в опытах с очищенным ферментом. Последнее можно было
объяснить асимметричностью синтеза РНК на двунитевой струк-
туре.
Вместе с тем, окончательного решения многих вопросов, свя-
занных как с механизмом работы РНК-репликазы, так и с после-
довательностью событий в инфицированных клетках, достигнуто
не было. Реализация генетической программы РНК-вирусов оста-
валась невыясненной.
Большая часть полученных сведений была добыта из экспери-
ментов in vitro или в опытах с многократной очисткой ферментов.
Не удивительно, что порой получались противоречивые, а иногда
РЕПЛИКАЦИЯ ВИРУСОВ С ОДНОНИТЕВОЙ ДНК И РНК
122
и взаимоисключающие выводы. Так, Харуна и Шпигельман опи-
сали исключительную специфичность РНК-репликазы, использую-
щей в качестве матрицы лишь строго определенную (присущую
виду вируса, из которого экстрагировали фермент) рибонуклеино-
вокислотную матрицу. Однако в опытах Огеста и Шапиро этот же
фермент использовал в качестве матрицы любую предложенную
ему однонитевую РНК. Надлежало решить, в чьих экспериментах
выделенный фермент наиболее походил на эндогенный.
Такое же положение сопровождало и проблему двунитевой
репликативной формы РНК. Многие авторы после очистки кле-
точных экстрактов, осаждения РНК с применением трихлоруксус-
ной кислоты, фенолов, додецилсульфата, ультрацентрифугирова-
ния и т. д. обнаруживали материал несомненной регулярной дву-
нитевой природы. Однако Тубай (Tobey, 1964) не смог найти дву-
нитевой РНК в L-клетках куриных фибробластов, зараженных
вирусом Менго.
Список разногласий и затруднений можно было бы продол-
жить. Было ясно, что дальнейшие успехи в изучении реализации
генетической информации РНК вирусов могли быть достигнуты
лишь при более тщательном изучении механизма работы фермен-
тов, обслуживающих репликацию РНК, исследовании внутри-
клеточных событий после заражения вирусом и чисто генетичес-
ком анализе РНК-содержащих вирусов.
По всем трем направлениям в последнее время был достигнут
вполне определенный прогресс.
Прежде всего мы сейчас знаем гораздо больше о механизме
работы РНК-зависимой РНК-полимеразы. Основные исследования
в этой области выполнены коллективом авторов двух лаборато-
рий — Шпигельмана и Вейсмана.
Первое, что было достаточно подробно изучено — кинетика
РНК-полимеразной реакции in vitro. Харуна и Шпигельман (На-
runa, Spiegelman, 1965b) исследовали кинетику реакции путем
введения в систему с ферментом порций матричной РНК, гораздо
меньших, чем необходимо для насыщения фермента. Одной из
задач такого эксперимента было определение того, как фермент
отличает одну последовательность РНК от другой.
Для опыта была использована РНК-полимераза, тщательно
освобожденная от возможных загрязнений ДНК-зависимой РНК-
полимеразой, рибонуклеазой I и II, РНК-фосфорилазой. Фермент
полностью зависел от добавления затравки в виде РНК, и в систе-
му перед началом синтеза были введены лишь требуемые ионы,
субстраты и матрицы.
Еще ранее было установлено, что насыщающей фермент кон-
центрацией РНК является 1 мкг на 40 мкг ферментного белка.
Для начала реакции в систему ввели 2 мкг РНК фага QP и столь-
ко фермента, чтобы начальное отношение матрицы к ферменту
123
РОЛЬ РЕПЛИКАТИВНЫХ ФОРМ В СИНТЕЗЕ РНК
Рис. 35. Кинетика синтеза
РНК фага в клетках
Е. coli
Стрелка указывает момент пере-
хода от автокаталитической к ли-
нейной кинетике (Haruna, Spiegel-
man, 1965)
мя инкубации часы
было равно Vs от насыщающей кон-
центрации (400 мкг). Последовавшая
затем реакция длительное время про-
текала по экспоненциальному закону,
пока, наконец, не было синтезировано
такое количество РНК, которое пол-
ностью насытило фермент (рис. 35),
После этого скорость синтеза стала ли-
нейной.
Вывод из этого опыта был доста-
точно знаменательным. Следовало при-
знать, что вновь синтезированные молекулы РНК способны всту-
пить в дальнейшую реакцию и, соединившись с неиспользован-
ными молекулами ферментов, обусловить расширенное воспро-
изводство новых молекул РНК, обладавших матричными свой-
ствами. Тем самым реакция носила отчетливо выраженный авто-
каталитический характер. Кроме того, эксперимент демонстри-
ровал неспособность фермента отличать вновь синтезированный
им продукт от введенной первоначально в систему нативной
матрицы.
Подсчет показал, что переход от экспоненциального (автока-
талитического) к линейному синтезу осуществлялся как раз в тот
момент, когда концентрация РНК в реакционной смеси достигала
1 мкг на 40 мкг белка. Синтез продолжался примерно 4 часа и
затем падал. В конце реакции было зарегистрировано 25-крат-
ное увеличение количества РНК по сравнению с внесенной в на-
чале реакции. Большая часть синтезированного продукта имела
константу седиментации, равную 27S. Молекулярный вес генери-
рованной РНК (1 106) не отличался от молекулярного веса ис-
ходной.
Чтобы проверить заключение, что заново синтезированный
продукт может сам стать матрицей для невключенных в реакцию
порций фермента, авторы выделили из реакционной смеси про-
дукт реакции и снова соединили его с ферментом. Это позволило
продолжить реакцию до тех пор, пока не было отмечено 65-крат-
ное увеличение количества синтезированной РНК по сравнению с
внесенной первоначально.
Следующим этапом исследований явилось изучение инфекци-
РЕПЛИКАЦИЯ ВИРУСОВ С ОДНОНИТЕВОЙ ДИК И PITK
124
опной способности синтезированного материала (Spiegelman et al.,
1965). Как и в предыдущем опыте, к смеси фермента, предшест-
венников нуклеиновой кислоты и нужных солевых компонентов
была добавлена РНК из фага Qp. Внесение затравки привело к
автокаталитическому ходу реакции, продолжавшемуся до 90-й
минуты. Через равные промежутки времени из системы отбирали
пробы, из них выделяли РНК и вводили ее в лизоцимпые сферо-
пласты клеток Е. coll. Авторы доказали, что на протяжении всей
реакции рост количества РНК сопровождался увеличением инфек-
пиоиности. За 240 мип. количество РНК увеличилось в 75 раз по
сравнению с количеством, имевшимся в нулевое время, а инфек-
цнопность возросла в 35 раз.
Изящное доказательство того, что именно заново синтезиро-
ванная РНК, а не «активированная» каким-то образом исходная
РНК является инфекционной, было получено Шппгельмапом, Ха
руна и др. в следующем опыте.
Ряд пробирок был заполнен по 0,25 мл стандартной реакци-
онной смеси, по без матричной РНК. В первую пробирку внес-
ли 0,2 мкг РНК фага QP и инкубировали смесь в течение перио-
да, нужного для синтеза нескольких мкг радиоактивной РНК.
Затем равное количество РНК перенесли во вторую пробирку, из
которой, спустя время, достаточное для синтеза повой партии
РНК, взяли новую порцию РНК и снова перенесли в третью про-
бирку и т. д. Если каждый последовательный синтез дает РНК,
служащую источником для инициирования нового синтеза, то,
наконец, наступит время, когда в очередной пробирке не ока-
жется ни одной из взятых первоначально в опыт молекул РНК.
Если во всех пробирках, включая последнюю, число инфекцион-
ных центров будет соответствовать количеству найденной радио-
активной РНК, то это будет наглядным доказательством того,
что заново синтезированная РНК ипфекцпоппа.
В исследованных шестнадцати пробирках распределение ин
(Ьекциопности и радиоактивности показало, что в восьмой про-
бирке было 8,8-105 инфекционных центров после 30 мин. инку-
ба пни, хотя, согласно расчету, в нее не было внесено ни одной
исходной молекулы РНК, а в 15-й пробирке за 20 мин. было син-
тезировано 1,4-1012 новых нитей РНК и зарегистрирована ин-
фекцпопность в 3,2 • 105 инфекционных центров.
Таким образом, РНК, синтезированная in vitro, обладала спо-
собностью запрограммировать синтез новой инфекционной РНК,
полностью соответствующей нативной РНК вируса Qp. Синтети-
ческая РНК давала после размножения в сферопластах Е. coll
серологически неотличимые от нативных частицы вируса Qp.
Установление .того факта, что фермент пе различает выделен-
ную из вируса нативную РНК и полирибопуклеотид, синтезиро-
ванный этим же ферментом in vitro, поставило перед исследова-
125
РОЛЬ РЕПЛИКАТИВНЫХ ФОРМ В СИНТЕЗЕ РНК
телями очередную проблему. Надлежало установить, нужны ли
для узнавания ферментом целые молекулы информационных
РНК, или же фермент распознает лишь какие-то определенные
пункты (участки) этих молекул. В последнем случае фермент
пе мог бы отличить фрагменты молекул РНК, несших участки
узнавания, от целых молекул. Для проверки справедливости этих
альтернатив Харуна и Шпигельмап (Наги на. Spiegel шан, 1965с)
получили два сорта фрагментов молекул РНК фага Q(3, половин-
ки молекул с константой седиментации 17S и четвертинки моле-
кул— 7S. В описанную выше систему (см. стр. 124) для провер-
ки активности ферментов были внесены как целые молекулы
РНК фага QP (27S) и их фрагменты (17S и 7S), так и молекулы
одионитевой РНК из вируса желтой мозаики турнепса. Опыт
проводили в различных условиях: в части опыта ионы Mg++
были заменены на Мп+Н. Так как половина разломанных попо-
лам молекул РНК должна была содержать начальный участок,
то при наличии узнавания ферментом именно этого участка
синтез повой РНК должен был идти с достаточно высокой ско-
ростью.
Однако полученный результат говорил о том, что никакого
чтения при наличии фрагментов, а не целых молекул, не наблю-
дается. Включение радиоактивного предшественника РНК —
С 14-уридииа в кислотонерастворимьтй продукт пе превышало 2%.
Столь же малой матричной активностью характеризовалась PH Ft
из вируса желтой мозаики турнепса (в этом случае включение
метки составило 4% от контроля с целыми молекулами РНК фа-
га QP).
На основании этих опытов следовало отказаться от предпо-
ложения, что фермент использует для узнавания молекул их
начальные или концевые участки. Матрицей для синтезов могли
служить лишь неповрежденные молекулы.
В этих же опытах был получен другой интересный результат.
Как уже упоминалось, в части опытов Mg++ в реакционной сме-
си был заменен на Мп++. Такая замена коренным образом изме-
нила характер синтезов. РНК-репликаза фага QB приобрела спо-
собность читать РНК вируса желтой мозаики турнепса, причем
даже более интенсивно, чем родственную матричную РНК. На-
личие в среде наряду с попами Mg++ ионов Мп++ до некоторой
степени снижало интенсивность синтеза РНК при наличии РНК
из фага QP и резко повышало интенсивность синтезов РНК при
введении чужеродной матрицы — РНК вируса желтой мозаики
турнепса (табл. 7).
Изменение свойств РНК-завпспмой РНК-полимеразы при изме-
нениях ионпого состава среды до некоторой степени напоминало
ситуацию с другими полимеразами нуклеиновых кислот. Известно,
что ДНК-зависимая ДНК-полимераза в присутствии ионов Mir4"
РЕПЛИКАЦИЯ ВИРУСОВ С ОДНОНИТЕВОЙ ДНК И РНК
126
Таблица 7
Влияние ионоч Mg+b и Мп++ на специфический ответ РНК-репликааы
при введении различных матриц
Матрица * Mi<++ (шМ) Мп+ + (лр.-ЛГ) Радиоак- тивность (нлшбшш) Матрица * Мг+ + (мкМ) Мп++ (мкМ) Радиоак- тивность (ium/лшн)
1 Q328S 1 1 1 146 Q328S 1 _ 0,12 474
Q317S — —. 63 Q317S — 0,12 222
ВЖМТ — — 0 ВЩМТ — 0,12 766
Контроль — — 16 Контроль — 0,12 103
Q328S 4 — 4655 QP28S 3 0,2 2804
Q317S 4 — 109 Q317S 3 0,2 240
ВЖМТ 4 .— 218 ВЖМТ 3 0,2 1037
Контроль 4 — 1 Контроль 3 0,2 103
* Реакционная смесь (0,25 мл) содержала: 1 мкг РНК 4- 40 мкг белка. Инкубация при
37° С 20 мин. ВЖМТ относится к РНК, выделенной из вируса желтой мозаики тур-
непса, Q328S—РНК, выделенная из интактных вирусных частиц, Q317S — половин-
ный фрагмент молекулы РНК фага Q0.
начинает включать в строящийся полимер рибозотрифосфаты
(Berg et al., 1963).
Ошибки в работе или модификации активности наблюдаются
и с ферментом РНК-полимегазой, синтезирующей РНК на матри-
це ДНК (транскриптаза). Так, транскриптаза может синтезиро-
вать нолп-А, если в наличии имеется лишь один сорт трифосфа-
тов — АТФ (Chamberlin, Berg, 1962). Этот же фермент может
присоединиться к РНК и построить на ней вторую нить, также
рибонуклеиновую (Krakow, Ochoa, 1963; Nakamoto, Weiss, 1962).
Трудности интерпретации полученных данных
о роли репликативных форм
Появление дополнительной информации о свойствах фермента
(пли ферментов), обеспечивающих размножение РНК-содержа-
щих вирусов, с повой сплои поставило вопрос о последователь-
ности реакций, совершаемых в клетках после заражения их РНК-
содержащими вирусами.
До сих пор всеобщим было мнение, что подобно тому, как для
вирусов с однонитчатой ДНК промежуточной стадией в синтезе
новых копий ДНК является образование двойной репликативной
127
ТРУДНОСТИ ИНТЕРПРЕТАЦИИ РОЛИ РЕПЛИКАТИВНЫХ ФОРМ
формы, так и для РНК-содержащих вирусов реакция синтеза
новых вирусных частиц опосредуется через промежуточную дву-
нитевую структуру РНК.
Применявшиеся для установления этого положения методы,
казалось, точно доказывают существование п роль промежуточной
двунитевой матрицы, являющейся основой для действия РНК-
репликазы. Первое сомнение в справедливости этого заключения
внесли Борст и Вейсман (Borst, Weissmann, 1965). Авторы срав-
нили количество обнаруживаемых резистентных к панкреатиче-
ской рибонуклеазе молекул РНК в грубом (неочищенном) эк-
стракте клеток кишечной палочки, зараженных бактериофагою
MS2, с количеством таких устойчивых к РНК-азе молекул после
выделения РНК из неочищенного экстракта фенолом пли доде-
цилсульфатом. Они обнаружили разительное отличие в цифрах,
полученных в первом и втором случае.
Продукт, образованный неочищенным (crude) экстрактом за
раженных фагом MS2 клеток Е. colt, при 15° дал только 6%
устойчивых к РНК-азе молекул. После экстракции фенолом доля
резистентных к РНК-азе молекул возрастала до 66%. В большой
серии подобных экспериментов величина устойчивого компонента
колебалась от 5 до 10% до выделения и от 50 до 60% после
выделения фенолом. Резистентный к РНК-азе продукт, получен-
ный после выделения фенолом, был охарактеризован как двуни-
тевая РНК.
Выделение РНК с помощью патрийдодецилсульфата, особенно
при 37°, имеет такой же эффект, как и фенол. Так как во всех
экспериментах при выделении РНК из зараженных клеток ис-
пользовали либо фенол, либо додецилсульфат, возможность того,
что обнаруживаемые во многих случаях двунитевые комплексы,
ио сути дела, являются артефактами выделения, резко возрастала.
Правда, Харуна и Шпигельман (Haruna, Spiegelman, 1966)
берут под сомнение последний вывод группы Вейсмана, но, в свою
очередь, приводят аргументы в пользу того, что синтез РНК виру-
сов с однонитевой РНК обходится без двунитевых промежуточных
молекул.
Их доказательство базируется на четырех независимых экспе-
риментах. Прежде всего авторы, отмечая, что РНК фага QP име-
ет молярное отношение аденина к урацилу равным 0,76 (а у ком-
плементарной к «плюс»-нити «минус»-ннти = 1,33), приводят
результаты определений этого отношения A/У. Учет отношения
A/У проводился на разных точках синтеза, начиная от образова-
ния 1,4% РНК по отношению к внесенной в систему матрице
и кончая синтезом 130% новой РНК (табл. 8).
Так как синтез новой РНК начинается с образования молекул
или частей молекул, в которых количество аденина гораздо боль-
ше урацила, то было бы естественно ожидать, что на каком-то
РЕПЛИКАЦИЯ ВИРУСОВ С ОДИОНИТЕВОЙ ДНК И РНК
128
Таблица 8
Состав оснований вновь синтезированной РНК фага Q3
Объем реак- ционной сме- си, Л1Л Количество син- тезированной РНК, % от внесенной мат- рицы Молярное содержание оснований
Ц А У I' А/У
10,0 1,4 22,0 36,3 19,4 22,2 1,87
5,0 2,3 23,1 32,4 22,6 21,6 1,43
2,0 И 23,4 28,2 24,7 23,5 1,14
1,0 37 24,6 27,0 26,6 21,9 1,01
0,50 60 24,0 26,0 28,3 21,7 0,92
0,25 130 25,3 23,9 29,7 21,1 0,81
Молярное содержание оснований
в РНК фара Q3 (среднее) 24,7 22,3 29,4 23,7 0,76
этапе синтезов, когда в клетке появляются молекулы, комплемен-
тарные к исходной, отношение A/У снизится до 1,33, соответст-
вующего комплементарным нитям.
Однако в эксперименте никакого замедления хода кривой на
точке 1,33 пе наблюдалось (рис. 36). Кривая плавно понижалась
вниз, пересекала ординату 1,33 н приближалась к значению 0,75,
характерному для исходных молекул. Таким образом, никакого
доказательства образования комплементарной «минус»-нити на
основе выбранного критерия получить пе удалось. К тому же
начале реакции синтеза РНК, когда общин синтез РНК не пре-
вышал 20% от количества исходной матрицы, 90% вновь синте-
зированных молекул имели константу седиментации <28S, раз-
мера, который характеризовал исходную РНК и, следовательно,
должен был повториться в «минус»-копиях.
Полученные результаты авторы интерпретировали следующим
образом: в начале синтезов появляются идентичные неполные ко-
пии введенной в качестве матрицы РНК фага QP, у которых
в первых 100 нуклеотидах количество аденинов превышает коли-
чество урацилов. К концу реакции накапливаются молекулы,
полностью повторяющие состав исходных молекул.
Вторым критерием, примененным Шпигельманом и Харуна,
был так называемый критерий самокомплементарности. Как мы
помним, Вейсман разработал метод оценки комплементарное™
«плюс»- и «мипус»-питей в двунптевой РНК, основанный на дена-
турации меченых двупитевых структур в присутствии избыточно-
го количества «плюс»-нитей. При последующем охлаждении дена-
турационной смеси возникали двунитевые, резистентные
к панкреатической РНК азе молекулы, и наблюдалось замещение
129
ТРУДНОСТИ ИНТЕРПРЕТАЦИИ РОЛИ РЕПЛИКАТИВНЫХ ФОРМ
Рис. 36. Изменение соотноше-
ния A/У в молекулах вновь
синтезируемой РНК фага (>(3
1 — значение A/У для нити, ком-
плементарной РНК фага Qp;
11 — значение A/У для РНК зре-
лых частиц фага Q0.
По оси абсцисс — синтез новой
РНК фага Q0 в % от внесенной
в систему затравки
радиоактивной «нлюс»-ппти па «холодные» «плюс»-пити, имев-
шиеся в избытке. Харуна и Шпигельман высказали предположе-
ние, что указанный метод доказательства истинной комплементар-
ное™ (с соблюдением правил A-У, Г-Ц) является весьма нестро-
гим. Чтобы удостовериться в этом, они провели следующий опыт.
Фрагментированные и интактные молекулы РНК фага QP, мечен-
ные тритием, отжигали в присутствии избытка таких же РНК,
но без метки. Оказалось, что примерно 3% интактной Н3-РНК и
6% фрагментированных Н3-РНК превращались в устойчивую к
рибонуклеазе структуру за счет комплементарного спаривания с
такими же «плюс»-нитями. Таким образом, обнаруженное в опы-
тах Вейсмана образование устойчивых к РНК-азе структур мог-
ло вовсе пе быть следствием наличия «мипус»-нитей.
Стоит отметить, что в опытах Вейсмана процент комплемен-
тарпости достигал 90 и более, т. е. более чем в 10 раз превышал
уровень самокомплементарности.
Третий метод, использованный Харуна и Шпигельмдном, за-
ключался в том, что па короткие интервалы времени (примерно
на 5% от времени, необходимого для завершения синтеза 100%
РНК) в систему вводили меченые предшественники РНК. Каж-
дый раз время введения метки сдвигалось па 2—4 мин., а после
мечения отбирали пробы РНК и их гибридизировали с нативной
РНК фага Qp. Результаты опыта приведены в табл. 9.
За время, в течение которого в среде находилась метка, по
расчетам авторов, успевало встроиться в полинуклеотидную цепь
около 100—120 нуклеотидов. Для первой порции вновь синтези-
рованной РНК было отмечено самое высокое значение компле-
мептарности (77%). Так как сам исследованный участок занимал
4,4% длины всей нативной РНК, то это означало, что комплемен-
тарный участок занимает 3,4% длины РНК фага Qp. В каждом
последующем по времени определении отмечалась все меньшая
величина комплементарное™. Всего авторы проследили за син-
5 В. Н. Сойфер
РЕПЛИКАЦИЯ ВИРУСОВ С ОДНОНИТЕВОЙ ДНК И РНК
130
Т а б л и ц а 9
Проверка комплементарности между синтезированным продуктом и матрицей
Интервал введения мет- ки, мин. Радиоак- тивность, ими] мин Синтезиро- ванный отре- зок РНК, % от длины интактной матрицы Резистент! ость к РНК-азе в тесте огжига, %
до плавле- ния после рена- турации разница
0-4 9190 1 4,4 19,2 96,3 77,1
4—7 13400 5,4 16,0 67,3 51,3
7—9 13600 5,5 12,6 40,2 27,6
9-11 15100 6,1 11,0 32,0 21,0
11-13 15900 6,5 10,1 28,8 18,7
13-15 13900 5,7 9,5 27,0 17,5
тезой трети молекулы РНК. Хотя они и интерпретировали полу-
ченные результаты как свидетельство против возникновения ис-
тинно комплементарных структур, подсчет суммарной доли комп-
лементарности в их же опытах показывает, что у трети изученных
ими молекул (33,6%) комплементарность отмечена более чем в
11% от всей изученной молекулы.
Одновременно с работой Харуна и Шпигельмана появилось
очередное сообщение из лаборатории Вейсманна (Weissmann,
Feix, 1966), в котором приводились доказательства образования
«минус»-нитей во время синтеза РНК из «плюс»-нити.
Выделенная по методу Харуна и Шпигельмана РНК-репли-
каза инкубировалась с радиоактивными нуклеозидтрифосфатами.
Целостность РНК фага QP, применявшейся в качестве матрицы,
контролировалась измерением коэффициентов седиментации не-
посредственно перед опытом. Как видно из табл. 10, в первые
7 мин. реакции «плюс»-нить зарегистрировать не удалось, а 75 —
80% кислотонерастворимой фракции было найдено в «минус»-ни-
ти. «Плюс»-нить начала появляться лишь на 15-й мин., и ее ко-
личество увеличивалось вплоть до 100-й мин. Количество РНК,
эквивалентное тому, что было внесено с затравкой, синтезирова-
лось к 20-й мин.
Центрифугирование в градиенте сахарозы продукта реакции,
полученного после 40 мин. инкубации, показало, что основная
доля радиоактивного материала седиментировала вблизи 27S—
в зоне, присущей интактной матрице. Резистентная к РНК-азе
РНК осаждалась с константой 14S, что совпадало со значением,
найденным для вирус-специфической двунитевой РНК, получен-
ной in vivo (Fenwik et al., 1964).
131
ТРУДНОСТИ ИНТЕРПРЕТАЦИИ РОЛИ РЕПЛИКАТИВНЫХ ФОРМ
Анализ продукта Qft-репликазы
Таблица 10
Время инкубаци мин. Включение радиоактив- ности, имп/мин Радиоактивность продук- та. резистентного к РНК-азе, % Образование, %
«минус»- нитей «плюс»-нитей
перед обра- боткой фено- лом после обра- ботки
3 •| 9800 Первый 13 : опы т 33 80 Не определи МО
7,5 29400 15 28 76,5 То же
15 65000 17 21 47 32,5
40 104000 21 29 39 39,5
100 126000 25 24 34 51,0
5 15350 Второй пыт 21 61 80 Не опреде-
10 37950 20 33 73 ляли То же
20 86000 21 25 46 »
40 141000 22 34 35 »
80 177000 26 33 38 »
Обсуждая полученные результаты, Вейсмапн и Фикс прихо-
дят к выводу, что образование « минус »-нитп, предшествующее
синтезу большого числа «плюс»-копий, которые войдут в зрелые
частицы новых поколений вируса, доказано как в экспериментах
in vivo, так и in vitro. Последнее утверждение можно даже уси-
лить, сказав, что в первые минуты после инкубации главным об-
разом (если пе целиком) синтезируются «минус»-пити, а во вто-
рой фазе синтезов ситуация меняется на обратную: в основном
образуются «илюс»-нити. Ссылаясь на собственные материалы,
авторы считают возможным говорить о промежуточной роли дву-
нитевой РНК в реакции синтеза «плюс»-нитей.
Таким образом, события, развертывающиеся в клетке после
заражения ее РНК вирусов, содержащих одпонитевую рибону-
клеиновую кислоту, можно разделить на два этапа: а) синтез
«минус»-нитей, комплементарных к введенным в клетку «плюс»-
нитям зрелых частиц вируса; б) синтез на этих «минус»-нитях
большого числа «плюс»-нитей.
Оба этапа порознь были продемонстрированы во многих опы-
тах in vivo и in vitro (August et al., 1965; Shapiro, August, 196b;
Lodish, Cooper, Zinder, 1964; Weissmann, 1965). Однако длитель-
5*
РЕПЛИКАЦИЯ ВИРУСОВ С ОДНОНИТЕВОЙ ДНК И РНК
132
ное время не удавалось узнать, управляет ли обеими реакциями
один фермент, или для их осуществления требуются два отдель-
ных фермента. Справедливость последней альтернативы была
установлена чисто генетическим путем в лаборатории Н. Зин-
дера.
Установив, что синтез РНК с помощью РНК-репликазы может
успешно идти только с целых молекул РНК, Харуна и Шпигель-
ман высказали гипотезу (Haruna, Spiegelman, 1965b), что воз-
можной структурой, обеспечивающей нахождение в одной точке
начала и конца молекулы, является циклическая структура и,
следовательно, именно кольцевая структура важна для правиль-
ного функционирования репликазы. После установления высокой
степени комплементарное™ начального участка строящейся РНК
(5—10% длины целой РНК) к интактным молекулам, а также
доказательства, что в этом первом и комплементарном участке
имеется больше аденинов, чем урацилов, авторы снова вернулись
к гипотезе кольцевидности РНК (Haruna, Spiegelman, 1966).
Согласно высказанному ими предположению, замыкание в кольцо
должно идти за счет образования небольшого двупитевого уча-
стка, причем избыток аденинов па начальном участке должен со-
провождаться избытком урацилов на другом (концевом) участке
молекулы. Такое предположение допускало возможность прямой
экспериментальной проверки. Если РНК-репликаза может узна-
вать именно двуните вый участок, богатый А и У, то тогда введе-
ние полинуклеотидов, богатых А, У или обоими нуклеотидами,
должно ингибировать активность фермента. И, действительно, в
эксперименте с введением синтетических полприбопуклеотидов,
несущих А п У, было отмечено заметное ингибирование фермента
(до 20%), в то время как сополимер, состоящий главным обра-
зом из гуанинов и цитозинов, пе оказывал никакого влияния па
синтез РНК.
С момента открытия РНК-репликазы исследователи постепен-
но совершенствовали методы ее выделения. Сначала, как мы пом-
ним, фермент выделяли только в связанном с РНК (преимуще-
ственно двунитевой) виде. Затем удалось очистить фермепт от
РНК, и он оказался высокоспецифичным в отношении РНК (ис-
пользовал только РНК своего вируса); дальнейшая очистка ли-
шила его этих свойств, и он перестал различать свою РНК от
других одиопитевых РНК (рибосомной и др.).
Оставалось установить, можно ли полностью очистить РНК-
репликазу от примесей РНК п тем не менее сохранить целиком ее
биологические свойства. Для этого Пэйс и Шпигельман (Расе,
Spiegelman, 1966) осуществили трехступенчатую очистку РНК-ре-
пликазы. При этом возможные примеси составляли 1 — 5 бляшко-
образующих единиц (БОЕ) на пробу, или около 40 мкг белка,
иначе говоря, были исчезающе малы (табл. И).
133
ТРУДНОСТИ ИНТЕРПРЕТАЦИИ РОЛИ РЕПЛИКАТИВНЫХ ФОРМ
Таблица 11
Свойства репликазы на различных стадиях очистки фермента.
Стадии очистки Репликаз- ная актив- ность, % Обнаружи- ваемое коли- чество БОЕ/At г белка ОПгзо/ОПзво
После ДЕАЕ 1 100 6,5-Ю11 0,660
После ДЕАЕ и центрифугирования в CsCJ 82 4,6-105 0,602
После ДЕАЕ, CsGl и зонного цен- трифугирования в градиенте сахарозы 69 50 0,604
Важным обстоятельством было то, что фермент после оконча-
тельного центрифугирования обнаруживался в узком пике, что
говорило о мопоморфности белка.
Определение молекулярного веса очищенного белка дало циф-
ру 110 000, что свидетельствовало об отсутствии связи его с РНК
вируса (мол. вес РНК Q(3 и РНК MS2 = 1-105). Такой фермент
осуществлял синтез РНК, которая полностью сохраняла биоло-
гические свойства РНК Qp. Довольно высокий молекулярный вес
фермента, по мнению авторов, указывал на то, что вряд ли РНК
с молекулярным весом 106 могла кодировать два таких белка.
Мы уже говорили, что в ходе своих исследований размноже-
ния фага QP Шпигельман и сотр. пришли к отрицанию биологи-
ческой роли репликативной формы. Правда, затем они признали,
что двунитевые структуры существуют в зараженных клетках
(Spiegelman, Haruna, 1966), по по их млению окончательного
доказательства биологической роли РФ до сих нор представлено
не было.
Следует заметить, что признание роли двунитевой структуры
как промежуточного соединения для синтеза большого числа
«плюс»-нитей вирусной РНК требовало участия в синтезах виру-
се! пе менее двух белков. Действительно, коль скоро однонитевая
«плюс»-нить РНК после заражения клетки превращалась в двой-
ную «плюс— «мипус»-нить, то такое превращение могло осущест-
вляться лишь ферментативно. Поскольку клеточные ферменты
вряд ли могли достраивать РНК на матрице РНК, то следовало
постулировать возникновение вирус-специфического фермента,
осуществляют,его эту реакцию. Но если двунитевая РНК — по-
средник в репликации РНК, то требовалась вторая ферментная
реакция: синтез «плюс»-нитей РНК на двунитевой матрице.
Исключение из этой схемы двунитевой РНК, естественно,
снимало требование о наличии двух ферментов. Для установления
РЕПЛИКАЦИЯ ВИРУСОВ С ОДНОНИТЕВОЙ ДНК И РНК
134
истинной роли двуцепочечной РНК в размножении вирусов тре-
бовалось прежде всего получить чистые препараты дуплексной
РНК. Такие попытки были предприняты в ряде лабораторий.
Хотя методами ультрацентрифугирования в сочетании с об-
работкой РНК-азой удавалось выделить двунитевый продукт с
константой седиментации 12—16S, полностью очистить реплика-
тивную форму от возможных примесей долго пе удавалось.
В том же диапазоне 12—16S осаждаются оба типа рибосомных
РНК, и поэтому для очистки от них нужны были другие методы.
Р. Франклин (Franklin, 1966) смог отделить на колонках с цел-
люлозой РНК бактериофага R17 от других видов РНК. Интерес-
но отметить, что примененный метод элюирования РФ был с
успехом использован для элюции заведомо двунитевых РНК рео-
виру сов.
Эта РНК представляла собой при ультрацентрифугировапии
набор молекул с константами седиментации 16—23S. Можно
было предположить, что 23S компонент представляет собой дву-
нитевую структуру с длинной (растущей?) однонитевой частью.
Обработка 16—23 S материала РНК-азой переводила его в 13 S
компонент. Франклин сумел получить 1 мг РФ, хроматографпчес-
кп обработав 10—12 л инфицированных клеток. Столь большой
материал позволил ему точно определить, что в популяции РФ
имеется от 22 до 28% однонитевых молекул. Им также был по-
казан отчетливый фазовый переход РФ при денатурации.
Свидетельством правильности Уотсон — Криковской структу-
ры репликативной формы могло быть определение точной комп-
лемептарности пар А—У и Г—Ц в РФ. Выделив из клеток, за-
раженных вирусами табачной мозаики и желтой мозаики тур-
непса, резистентный к рибонуклеазе продукт, Ральф и сотр.
(Ralph et al., 1965) прежде всего установили, что резистентность
теряется при нагревании в среде с низкой ионной силой, что
удельный вес при осаждении в CS2SO4 оказывается большим,
чем 1,6 г 1см3, а щелочное переваривание этой структуры дает
З'-рибонуклеотиды. Сравнение нуклеотидного состава РНК из
вирусных частиц и из двунитевого комплекса показало, что если
в первом случае никакого подтверждения правил Чаргаффа от-
мечено пе было, то во втором случае наблюдается отчетливая
комплемеитарпость пар оснований (табл. 12).
Таким образом, возможность самокомплементарности одина-
ковых последовательностей рибополимеров, высказывавшаяся
Шпигельманом, должна быть отброшена.
Теперь требовалось получить недвусмысленные доказательства
роли РФ как промежуточного соединения в размножении РНК ви-
русов. До сих пор самым прямым доказательством включения РФ в
репликацию РНК были опыты Келли и Синсхеймера и Эриксона,
Фенвика и Франклина, показавших, что часть (или даже вся)
135
ТРУДНОСТИ ИНТЕРПРЕТАЦИИ РОЛИ РЕПЛИКАТИВНЫХ ФОРМ
Таблица 12
Нуклеотидный состав РНК вируса табачной мозаики (ВТМ), вируса
желтой мозаики турнепса (ВЖМТ) и их репликативных форм
Исследованный образец Нуклеошдны i cociaa,
Ц Г А У
РНК ВЖМТ 38,0 17,0 23,0 22,0
РФ ВЖМТ (в опыте) 28,2 29,5 22,0 20,0
РФ ВЖМТ (рассчитано согласно комплемента рности) 27,5 27,5 21,1 21,1
РНК ВТМ 18,5 25,1 29,9 26,5
РФ ВТМ (в опыте) 21,8 22,4 30 25,8
РФ ВТМ (рассчитано согласно ком- плементарности) 22,1 22,1 30 25,8
РНК вирусов после инфекции клеток переходит в состав двуни-
тевых комплексов.
Изучив подробно динамику вирусных синтезов в клетках,
зараженных фагом f2, Лодиш и Зиндер (Lodish, Zinder, 1966)
показали более раннее появление двунитевых РНК в клетках.
Последовательность событий после проникновения РНК вирусов
в клетку в опытах Зиндера могла быть описана следующим
образом. От 10-й до 15-й мин. в клетке появлялись молекулы
РНК-репликазы. После этого содержание фермента оставалось на
константном уровне. За первые 10 мин. часть родительской РНК
переходила в двунитевые структуры, что было доказано опытом
с радиоактивной меткой. Клетки Е. coli К38 заражали темпера-
турочувствительным мутантом ts-б фага 1’2, РНК которого была
мечена Р32. Часть клеток была немедленно перенесена в термо-
стат с температурой 34° С (см. рис. 37), а часть — с 43° С. В суспен-
зии клеток, помещенной на 43° С, не наблюдалось никакого пере-
хода радиоактивной метки в двойные нити, развития вирусов
при этой температуре не происходило. Но стоило через 15 мин.
часть культуры, находившейся при 43° С, отмыть и перенести
на 34° С, как было отмечено то же самое превращение одноните-
вых родительских РНК в двунитевые. Количественно переход ро-
дительских РНК в двунитевые формы был небольшим и
не превышал 4% от всей РНК вирусов. Однако проверка инфек-
ционности фага f2 показала, что лишь 2—4%очищенного фага
было инфекционным. Переход лишь 2—4% радиоактивной РНК
фага f2 в двупитевое состояние вряд ли было случайным.
РЕПЛИКАЦИЯ ВИРУСОВ С ОДНОНИТЕВОЙ ДНК II РНК
136
Рис. 37. Переход родительской РНК фага J2 в двунитевую форму при 34° С
(1) и при 43° С (2). На 15-й минуте часть культуры была отмыта, ресуспен-
дирована в новой среде и инкубировалась далее при 34° С (3). Через 15-ми-
нутные интервалы измерялось количество Р32 в двунитевой РНК (Lodish,
Zinder, 1966)
Синтез двунитевой РНК продолжался наиболее интенсивно
между 20 и 50 мин. Однолптевые РНК’ появлялись 10 минутами
позже, и синтез их шел параллельно с синтезом двунитевых мо-
лекул.
Таким образом, основное требование, выдвигавшееся для до-
казательства биологической роли двунитевых структур, а имен-
но, раннее образование их в клетке, предшествующее синтезу
однонитевых РНК, было удовлетворено.
Тем самым с особой силой вставал вопрос о наличии в клет-
ках, зараженных РНК-содержащими вирусами, одного или двух
ферментов. Основные аргументы в пользу существования, по
меньшей мере, двух вирус-специфических ферментов были пред-
ставлены Зипдером и сотр. Эти данные получены при изучении
так называемых температурочувствительных мутантов.
Эти мутанты прежде всего позволили разделить две генети-
ческие функции фага — контроль синтеза фаговой РНК-репли-
казы и контроль синтеза РНК. Когда клетки заражали мутантом
ts-б и поддерживали инфицированные клетки при 43° С, они не
синтезировали ни вирусную РНК-репликазу, ни двунитевую
РНК, пи однопитевую РНК. Последнее было доказано тремя не-
зависимыми методами: изучением образования инфекционной ви-
русной РНК, изотопными и серологическими методами.
Возможное объяснение отсутствия вирусных синтезов при
43° С, сводившееся к тому, что в этом случае РНК фага просто
не проникает внутрь бактерий, было опровергнуто тем, что ин-
кубация таких клеток с вирусом при 43° С и последующий отмыв
их от среды и перенос на 34° С почти немедленно (за 5 мин.)
приводил к синтезу вирусных компонентов. Другое доказательст-
во проникновения РНК фага ts-б при 43° С вытекало из опытов
по комплементации, когда клетки предварительно заражали дру-
137
ТРУДНОСТИ ИНТЕРПРЕТАЦИИ РОЛИ РЕПЛИКАТИВНЫХ ФОРМ
гим мутантом (sus-И), а затем мутантом ts-б. РНК обоих фагов
начинали функционировать и давали двунитевые РНК.
Из опытов с ts-б мутантом следовало, что наиболее ранним со
бытием после инфекции является образование двунитевой РНК.
Блок этого процесса у ts-б мутанта обусловливал остановку всех
остальных процессов.
Вслед за тем было показано, что пеактивность мутантов фа-
гов ts-G в синтезе двунитевых РНК связана с температурочувст-
вптельиостыо самого фермента, становившегося неактивным при
43° С. Таким образом, мутация ts-G находилась в гене, управля-
ющем синтезом фермента, достраивающего вторую нить, и за-
ключалась в том, что мутантный белок терял активность при по-
вышении температуры.
Дальнейшее доказательство того, что ts-G мутация связана
с синтезом фермента, достраивающего вторую нить на родитель-
ской РНК, но не затрагивает функции гена, дающего фермент II,
переводящий двунитевую структуру в однонитевые молекулы, бы-
ло связано с shift-экспериментами, когда инфицированные клетки
сначала росли 30 мин. при 35° С, а затем переносились на 43° С.
После переноса синтез двунитевых молекул полностью и немед-
ленно прекращался, по зато вторая вирусная функция — пере-
вод двунитевых РНК, синтезированных за первые 30 мин. роста
при 35° С, в однонитевые совершался. Количество однонитевых
РНК после переноса на 43° С прогрессивно увеличивалось, хотя
не достигало и 10% от числа таких молекул, синтезированных
клетками, продолжавшими рост при 35° С.
Эти опыты давали, кроме того, и другую ценную информацию:
роль двунитевых молекул как предшественников однонитевых и
как участников в их синтезе была прямо доказана1.
Считать, что па этом завершились перипетии, связанные с
изучением одних из самых маленьких вирусов, вряд ли можно.
Одно то, что для описания трехлетней истории изучения разви-
тия вирусов с однонитевыми РНК потребовалось столько места,
может достаточно красноречиво свидетельствовать о прогрессе в
изучении организмов, являющихся «исключением из правил».
Однако ничто так хорошо не подтверждает правил, как исключе-
ния.
Поэтому столь ценным для развития концепций молекулярной
генетики оказалось как обнаружение «исключений из правил»,
так и доказательство общности событий, сопровождающих жизнь
«правильных» и «неправильных» молекул.
1 До сих пор мы упоминали лишь вирус-специфические ферменты, участ-
вующие в синтезе РНК вирусов. Но, кроме этого, вирус индуцирует обра-
зование белков своей оболочки. Генетическими методами Зиндер доказал
существование гена, управлявшего и этой функцией (Valentine et al., 1964;
Zinder, 1966).
7
Ядерные белки, их взаимодействие
с нуклеиновыми кислотами
Наличие в составе ядерного вещества белкового компонента бы-
ло доказано еще в 1889 г. Альтманом, который, исследуя нукле-
ин Ф. Мишера, сумел расщепить его па две составные части
белковую (протамин или гистон) и нуклеиновокислотную. Альт
ману же принадлежит честь реконструкции нуклеина из этих
компонентов.
В последовавшие затем четыре десятилетия вывод о наличии
белков в составе хромосомного материала высших организмов был
доказан окончательно. Было установлено, что белковая часть
представлена несколькими типами соединений. Прежде всего уда-
лось разделить все белки на кислые и основные. К первому типу
были отнесены так называемые негистоновые белки, ко второ-
му — протамины и гистоны. Следует упомянуть, что помимо бел-
ков и ДНК в составе хромосом были найдены РНК, липиды и ряд
неорганических соединений.
К настоящему времени выполнено большое число исследова-
ний, посвященных изучению состава хромосом высших организ-
мов. Хотя для выяснения качественного и количественного соста-
ва хромосом были применены различные методы, поражает сход-
ство полученных результатов (табл. 13). Из этих данных следу-
ет, что белки представляют собой один из основных компонентов
хромосом.
Примерно то же соотношение белка и ДНК получено при
изучении хроматина пптерфазпых ядер. Хромосомы типа лампо-
вых щеток содержат гораздо больше белка — до 98% (Isawa et
al., 1963а, b).
В последнее время появилось несколько обзоров относительно
строения и функций гистонов (Буш, 1967; Hnilica, 1967).
Н е г и с т о и о в ы е бе л к и изучены менее подробно, чем гисто-
ны. Известно, что они содержат триптофан (Stedman, Stedman, 1943)
и обладают кислыми свойствами. Наряду с этим белком Мирский
после обработки хроматиновых нитей 1 М раствором NaCl полу-
чил нерастворимый остаток (около 10% массы хроматина), сос-
тоящий из РНК и так называемого остаточного белка Мирского,
также богатого триптофаном. Применение неполярных раствори-
телей (Allfrey et al., 1951) позволило резко уменьшить потери
ядерных белков при фракционировании ядер клеток. После этого
139
ФРАКЦИОНИРОВАНИЕ II СОСТАВ ГИСТОНОВ
Таблица 13
Относительное содержание ДНК, РНК и белка (в %) в золиро* анных
метафазных хромосомах
Клетки ДНК РНК Белки Авторы
общее с удер- жание кисло- тораст- вори- мые (ГИСТО- НЫ) кисло - тоне- раство- римые
HeLa 20 16 14 12 66 72 26 Salzman et al., 1966 Maio, Schildkraut, 19 >7
25 16 29 14 46 70 23 23 Franceschin5, Gi moni, 1967 Huberman, Attardi, 1966
Асцитные опухо- левые клетки L-клетки Клетки сирийско- го хомячка Клетки китайско- го хомячка 14 17 17 14 13 15 72 70 68 29 43 Cant Hearst, 1966 Maio, Schildkraut, 19,7 Они же
хромосомы
больших разме- 28 5 67 Salzman, Mendelson
ров 1968
среднего размера 14 И 75 Mendelson et al., 1968
малого размера 10 13 77 Они же
удалось отметить разницу в химическом составе ядер клеток раз-
личного происхождения. Так, было установлено, что сперматозо-
иды содержат гораздо меньше негистоповых белков, чем интерфаз-
ные ядра печени. Поллистер (Pollister, 1952) привел следующий
состав ядра печени (в %): ДНК — 9, РНК — 1, гистоны — 11.
Содержание негистоновых белков колеблется в зависимости от фи-
зиологических условий (Allfrey et al., 1955; Daly et al., 1952);
голодание приводит к резкому падению количества этого компо-
нента (Ito, 1956).
Негистоновые белки до последнего времени остаются мало изу-
ченными.
Протамины и гистон ы. Основные белки подразделяются
на протамины и гистоны. Гистоны обнаружены как непременная
составная часть ядер всех клеток высших организмов. Отмечена
разница в молекулярных весах первых и вторых (средний молеку-
лярный вес протаминов равен 5000, гистоны обладают весом, по-
видимому, не меньшим 12 000). Феликс и соавт. (Felix et al.,
1956) подсчитали, что в одном сперматозоиде содержится 5 млн.
ЯДЕРНЫЕ БЕЛКИ
140
молекул протаминов. Кроме того, было отмечено, что содержание
основных белков ядра пропорционально содержанию в нем ДНК.
До 50% общего содержания аминокислот в протаминах может
приходиться на аргинин, эти ядерные белки содержат мало ли-
зина и гистидина. Протамины были найдены в сперматозоидах
некоторых рыб, и по содержанию основных аминокислот подраз-
деляются на монопротамины, имеющие в своем составе только
один вид основных аминокислот — аргинин (к этим протаминам
относятся клюпеин, сальмин, скомбрин и др.), дипротамины, со-
держащие кроме аргинина либо гистидин, либо лизин (иридии,
лакустрин), и трипротамины, содержащие все три основные ами-
нокислоты (ступин).
Разработка новых методов выделения белков из ядер, а также
новых весьма совершенных методов разделения белков (электро-
форез, хроматография и т. д.) позволили достичь крупных успе-
хов в изучении состава и функций гистонов.
Фракционирование и состав гистонов
Крафт и сотр. (Cruft et al., 1957), использовав метод электрофо-
реза в крахмале, Джонс, Филлипс и Батлер (Johns et al., 1960),
выделив тимусные ядерные белки, и Расмуссен и др. (Rasmussen
et al., 1962), применившие хроматографию на смоле Амберлит
JRC-50, сумели разделить гистоновую фракцию ядерных белков
на три основные группы: fl гистоны с большим содержанием ли-
зина (лизин-богатые), f3 гистоны с большим содержанием арги-
нина (аргинин-богатые) и гистоны с умеренным содержанием ли-
зина — f2. Это деление на три группы было подтверждено мно-
гими исследователями (рис. 38) (см. Phillips, 1962).
Один из белков, богатых лизином, был достаточно подробно
проанализирован Крэмптоном, Стейном и Муром (Crampton et
al., 1957) в отношении аминокислотного состава. Однако наи-
больший прогресс в изучении гистонов (особенно лизин-богатых)
был достигнут в лаборатории Батлера, Джонса и Филлипса в Чес-
тер Битти Институте в Лондоне. Основным объектом их исследо-
вания послужил тимус теленка. Каждая из фракций ядерных бел-
ков была подвергнута детальному изучению и последующей диф-
ференциации. Прежде всего удалось разбить фракцию гистонов
f2 на две подгруппы f2 (а) и f2 (Ь) (рис. 39). Особенно ценным
при этом явилось то, что были разработаны два независимых спо-
соба фракционирования разных фракций гистонов. Аминокис-
лотный анализ белков, выделенных этими двумя разными метода-
ми, привел к полностью совпадающим данным. Различия касались
лишь количества иролина и аланина в N-концевых участках мо-
лекул.
Гимус теленка
10,9% NaCl
Отмыв
Осаждение
1НС1О4
Экстракция Надосадок Трихлоруксусная кислота
Осаждение
Экстракция ti
-------Надосадок
иэтанолом f2(a)+f 3
Осаждение
5 объемов ацетона; Осадок
осадок растворен в
этаноле-^бнНС!
Диализуется против*^. 3 объема
этанола „ ацетона
Н адосадок*
Фракция
fl
Фракция
f3
Фракция
f 2(a)
Экстракция 0 25 н. НС! 5 объемов ацетона
<-► Надосадо к-------------------Фракция
и----------------------------------------------------------f 2(b) f2(b)
Осадок
(выбрасывается)
Рис. 38. Фракционирование гистонов, выделенных из тимуса теленка
Рис. 39. Аминокислотный состав фракций гистонов, изолированных
из тимуса теленка (1) и печени /форели (2)
ЯДЕРНЫЕ БЕЛКИ
\\2
Следующим шагом в разделении гистонных белков был (Johns
1964b) анализ лизин-богатой фракции гистонов fl. После хрома-
тографии на КМ-целлюлозе получены три пика. Материал перво-
го и второго пиков (до 15% всех fl гистонов) отличался высо-
ким содержанием аспарагиновой и глутаминовой кислот (до 30%)
и основных аминокислот (24—25%). Повышенная доля основных
кислот придавала этим белкам основные свойства, и они мигри-
ровали в электрическом поле (электрофорез при pH 9,0) вместе.
Многие аминокислоты, выделенные из фракции 1-го и 2-го пика,
по-видимому, представлены в форме амидов. Наконец, следует от-
метить вдвое меньшее, по сравнению с любыми другими гистона-
ми, содержание треонина.
Таблица 14
Аминокислотыый 'остав лизин-богатых гистонов из тимуса теленка (в ^})
Аминокислота Хроматография fl при pH 9 Ацеюновая преципитация fl
пик 1 пик 2 пик 3 фракции
А 1 в I С
Аспарагиновая кислота 1 11,4 1
Глутаминовая кислота 20,1 30,9 6,2 6,0 6,1 20,0
Глицин 5,6 6,5 7,2 6,7 7,3 7,4
Аланин 10,1 8,3 24,3 26,3 25,5 15,4
Валин 2,4 2,5 5,4 5,4 — 4,5
Лейцин 4- изолейцин 5,6 4,2 6,0 5,3 10,6 5,6
Серин 5,6 7,6 5,6 5,8 5,6 6,9
Треонин 2,9 2,3 5,6 6,1 6,1 4,0
Фенилаланин 3,2 3,5 0,9 0,5 0,8 1,5
Тирозин 2,4 3,0 0,9 0,7 0,9 2,0
Пролин 5,8 7,2 9,2 9,2 9,4 7,2
Гистидин 1,3 0,9 — — — 0,9
Лизин 19,4 19,0 26,8 26,7 26,1 20,9
Аргинин 4,2 4,2 1,8 1,3 1,7 3,8
N-концевые аминокислоты
пролин — — — — — 3,4
аланин —. — — 0,25 — 2,5
глицин — — — 0,05 — 23,2
другие * — — 1,70 — 6,8
Основные N-концевые груп- Ацетил ** Ацетил Гли ции
пы (В 65%)
Вес (г/моль N-концевых 500 000 500 000 28 000
аминокислот)
* Включая лизин, серин, треонин, аспарагиновую и глутаминовую кислоту.
** По Филлипсу (Phillips, 1963).
143
БИОЛОГИЧЕСКАЯ РОЛЬ ГИСТОНОВ
Так как материал, полученный фракционированием на колон-
ке, трудно использовать для анализа N-концевых последователь-
ностей аминокислот, Джонс применил другой метод разделения
этих белков: растворение в 0,01 н. НС1+5% гуанидин НС1 с пос-
ледующим осаждением белков повышающимися количествами
ацетона. Таким путем удалось также получить три фракции fl
гистона и проанализировать не только их суммарный аминокислот-
ный состав, но и N-концевые аминокислоты. Сравнение состава
белков, осажденных ацетоном, с белками, разделенными хрома-
тографически, показывает, что две ацетоновые фракции (А и В)
являются разновидностями 3-го пика хроматограмм, а третья аце-
тоновая фракция (С) скорее всего содержит материал 1-го и 2-го
пиков, полученных на колонке (табл. 14).
Таким образом, можно считать, что лизип-богатые гистоны
первой фракции разделяются на 4 белка: хроматография разделя-
ет их па белки 1-го и 2-го пиков, а ацетоновая преципитация да-
ет возможность разделить материал 3-го пика еще на два белка:
А и В:
Гистоны /1
I
Хроматография на КМ-целлюлозе
I1 ф Х
1 пик 2 пик 3 пик
I
Ацетоновая преципитация
I I
А фракция В фракция
Конечно, подобное деление fl, 1’2 и F3 на группы вряд ли окон-
чательное. Джонс считает возможным разделить f2 (b) еще на
три подгруппы, и фракции Г2 (а) и 1’3 еще па три или четыре под-
группы.
Биологическая роль гистонов
Хотя имеется небольшой прогресс в изучении состава гистонов
(Hnilica, 1967), биологическая роль ядерных белков и в том чис-
ле гистонов остается достаточно туманной. Можно думать,
что гистоны принимают участие в трех важных процессах:
1) поддержание той или иной степени конденсации хромосом;
2) контроль синтеза ДНК и РНК; 3) поддержание целостности
хромосом.
ЯДЕРНЫЕ БЕЛКИ
144
Влияние на конденсацию хроматина
Конденсированные массы хроматина встречаются в составе ге-
терохроматиновых телец интерфазных ядер, в составе митотиче-
ских it мейотпческих хромосом и в спермиях. Вполне попятно, что
роль гистонов и негистоновых белков в поддержании конденсиро-
ванного состояния хроматина может быть достаточно велика. Одна-
ко имеющиеся данные весьма противоречивы. Так, Олфри и др.
(Allfrey et al., 1963) и Литтау и др. (Littau et а]., 1965) обнару-
жили, что удаление лизин-богатых гистонов из конденсированного
хроматина ядер тимуса вызывает диссоциацию его в диффузный
хроматин. Удаление или же, напротив, добавление аргипин-бога-
тых гистонов пе сказывается на состоянии хроматина. Однако те
же Литтау, Бурдик, Олфри и Мирский (Littau et al., 1965) пока-
зали, что соотношение между лизин-богатыми и аргинип-богаты-
ми гистонами одинаково как в эухроматине, так и в гетерохрома-
тине. Эти примеры не единичны (см. Swift, 1964, 1965; Frenster,
1965; Berlowitz, 1965 и др.).
Влияние на синтез информационной РНК
Начало изучению роли гистонов как регуляторов активности ге-
нов положило обнаружение супругами Стэдмап различий в ами-
нокислотном составе гистонов, выделенных из разных органов ря-
да животных (быка, курицы, трески, лосося, человека) (Stedman,
Stedman, 1943, 1947). Как пи бедны были методы аналитического
исследования белков, доступные в те годы Стэдмапам, различия
в составе не могли быть случайными или следствием неточности
методик L
Памятуя о том, что в живой природе все закономерно, они про-
кламировали, что задача гистонов — регуляция работы генов.
«Важное следствие этих результатов, — писали опи, — заклю-
чается, на наш взгляд, в возможности с их помощью заделать
брешь в сегодняшней генетической теории. Нас, как химиков, при-
лагающих паши методы в сфере деятельности цитогенетики, всег-
да озадачивало то, каким образом могут различаться физиологиче-
ские функции клеточных ядер в одном и том же организме (а они,
по-видимому, различаются от одной клетки к другой), если они все
содержат идентичные хромосомы, и, следовательно, идентичные ге-
ны. Физиологические функции ядер — есть, вероятно, следст-
вие генов, которые опи содержат. Они (гены) должны поэтому
быть идентичными во всех ядрах данного организма. Если, одна-
1 Эти различия были особенно отчетливо представлены в обобщающей ра-
боту Стэдманов статье 1951 года (Stedman, Stedman, 1951).
145
БИОЛОГИЧЕСКАЯ РОЛЬ ГИСТОНОВ
ко, постулировать, что ядра содержат некоторый механизм для по-
давления активности отдельных генов или групп генов, п что этот
механизм специфичен для каждого типа клеток, эти трудности ис-
чезнут. Продемонстрированные нами данные, что некоторые ос-
новные белки, имеющиеся в клеточных ядрах, являются несомнен-
но клетко-специфичными, приводят к гипотезе, что одна из их
физиологических функций заключается в том, чтобы действовать
в качестве репрессоров генов» (Stedman, Stedman, 1951, стр. 781).
Несмотря на исключительную важность этого вывода Стэдма-
пов обратиться к изучению основных белков ядер, их призыв раз-
будил лишь немногих и понадобилось еще почти 10 лет, чтобы
воплотить замыслы в реальные работы.
Повышенный интерес к биохимии клеточного ядра, наблюдаю-
щийся в последующие 10 лет, явился причиной нового наступле-
ния на проблему гистоны — нуклеопротеиды.
Прямой экспериментальный подход к этому вопросу стал отча-
сти возможен после открытия того факта, что изолированные ядра
из клеток животного происхождения (например, из клеток тимуса
теленка) могут вести независимый синтез белка (Allfrey, 1954;
Allfrey et al., 1955). При добавлении гистонов, протаминов или
полилизинов к изолированным ядрам наблюдалось уменьшение
включения С 14-аминокислот в белки ядер (Allfrey, Mirsky, 1958)
или С14-аденозина в РНК ядер (Allfrey, 1961). В последующих
работах лаборатории Мирского и Олфри (Allfrey et al., 1963) эф-
фект гистонов как ингибиторов многообразных функций ядра был
выяснен достаточно подробно.
Однако во всех исследованиях этой лаборатории ядро предста-
вало как целое и вычленить специфические структуры, взаимо-
действовавшие с гистонами, не удавалось. Олфри и Мирский опи-
сали ингибирование ядернымп белками синтеза АТФ, уменьше-
ние активности аминокислот, угнетение активности киназ, цито-
хромоксидазы, синтеза РНК, ДНК и т. д.
Такое множественное действие гистонов могло быть следст-
вием многих причин, и проблема начала потихоньку запутывать-
ся. С тем большим интересом была встречена работа двух сотруд-
ников Калифорнийского технологического института Ру-Чп-Ху a li-
ra и Джеймса Боннера, опустившихся еще на ступеньку вниз в тай-
ники клетки: разрушивших ядро и выделивших из него хрома-
тиновый материал (т. е. нуклеопротеин). В 1962 г. они обобщили
результаты исследования, прямо показавшего, что местом прило-
жения ингибирующего действия гистонов являются молекулы дез-
оксирибонуклеиновой кислоты. Авторы очистили выделенный из
зародышей гороха хроматин, а затем разъединили его на белко-
вую и нуклеиновокислотную часть и подвергли продукт разло-
жения центрифугированию в градиенте плотности (Huang, Bon-
ner, 1962).
ЯДЕРНЫЕ БЕЛКИ
146
Содержание ДНК и гистона оказалось почти одинаковым (31
и 33% соответственно), па долю РНК пришлось 18%, столько же
было обнаружено негистоппого белка. Соединение гистонов с бел-
ками оказалось достаточно прочным, так что можно было выде-
лить нуклеопротеидные нити, и, кроме того, такой комплекс рез-
ко отличался по своим физико-химическим показателям от очи-
щенной ДНК. Прежде всего гистоны стабилизировали ДНК про-
тив тепловой денатурации, и температура плавления хромосом-
ных нитей оказалась выше температуры плавления чистой ДНК.
Наиболее интересный материал был получен в той части опы-
та, где сравнивалась активность в отношении синтеза РНК пре-
паратами ДНК, очищенными от гистонов и связанными с ними.
Разительное отличие первых от вторых (почти в 1000 раз) вполне
определенно указывало на ингибирующую роль гистонов. Еще убе-
дительнее этот вывод прозвучал после того, как очищенные ги-
стоны и ДНК (в соотношении 2:1) были реконструированы в ну-
клеопротеид. Реконструкция почти целиком лишала ДНК актив-
ности в поддержании синтеза РНК. Чтобы отвести возражение о
нарушении ДНК во время реконструкции, полученный нуклеопро-
теид был вторично разделен на гистон и ДНК, после чего актив-
ность Днк установилась на прежнем уровне.
В следующем году Боннер, Хуанг и Гилден (Bonner et al., 1963)
сделали очередной шаг в доказательстве биологической роли ги-
стонов. В бесклеточную систему из Escherichia coli, содержавшую
все необходимые компоненты для синтеза РНК и белка (рибосо-
мы, РНК-полимеразу, предшественники РНК и белков, необ-
ходимые ферменты, ионы и т. д.), был внесен хроматин, а в па-
раллельном опыте — очищенная ДНК из клеток проростков го-
роха. По включению меченых аминокислот в белок было установ-
лено, что только при введении ДНК наблюдается синтез белка.
По данным Боннера тг соавторов, включение С 14-лейципа в гло-
булин гороха в бесклеточной системе из Escherichia coli происхо-
дило следующим образом:
Включение в глобу- Включение в глобу-
Препарат лин, % от всего Препарат лип, % о г всего
растворимого белка растворимого белка
Хроматин Очищенная ДНК 0,40
из верхней почки 0,10 из верхней ночки
0,13 0,51
из семядолей 1,45 из семядолей 0,39
1,61 0,31
Нуклеопротеин опять оказался неактивным. Синтезированный
белок был охарактеризован иммунологическими методами, и бы-
ло показано, что он пе отличается от глобулинов, специфичных
для семян гороха.
147
БИОЛОГИЧЕСКАЯ РОЛЬ ГИСТОНОВ
Не менее интересным оказалось то, что выделенпый из семян
хроматин, хотя и в малой степени, но осуществлял управление
синтезом белка. Хроматин из ночек развивающегося растения, в
которых никогда не находили подобного антигена, был полностью
лишен способности направлять синтез глобулина. Отсюдг! был сде-
лан вывод, что гены в хромосомах действительно открыты или за-
крыты (репрессированы) в зависимости от того, из какой ткани
выделен хроматин.
Опять-таки, очистка ДНК из хроматинового материала почек
и семян сняла возможное возражение о разнокачественности ге-
нетических матриц в обоих случаях: ДНК, выделенная из обоих
источников, одинаково слабо вела синтез глобулина.
Эксперименты in vitro часто могут давать искаженную карти-
ну истинных клеточных взаимоотношении. Поэтому всегда осо-
бый интерес представляют одновременные доказательства in vivo
и in vitro, хотя, как правило, первые гораздо труднее получить
п еще труднее интерпретировать. Тем пе менее доказательства
несомненной роли гистонов в регуляции жизнедеятельности клет-
ки получены во многих исследованиях па клеточном и субкле-
точном уровнях.
Прежде всего появились цитохимические доказательства, бла-
гоприятствующие взгляду на гистоны как на репрессоры генов
(Moore, 1963). Изучение соотношения гистонного белка и ДНК у
репрессированной и дерепрессированной ДНК (эухроматиповые и
гетерохроматиновые участки хромосом) выявило примерно равное
количество белка и ДНК в нервом случае и понижение содержа-
ния белков во втором (Frensler el al., 1963).
Возражения, выдвигавшиеся против роли гистонов и основы-
вавшиеся на примерно одинаковом составе гистонов, выделенных
из разных тканей и видов (Bloch, 1963; Busch, Davies, 1958), во-
шли в противоречие с данными о клеточно-специфических разли-
чиях в гистонах (Bonner, Ts’o, 1963; Busch et al., 1963; Neidle, Wa-
elsch, 1964). И все-таки трудности, связанные с работой на живых
системах, были главной причиной того, что наибольшее развитие
в изучении роли гистонов получили исследования in vitro.
Продолжая серию своих работ, Хуанг, Воппер и Мэррей раз-
работали простой метод получения растворимых реконструирован-
ных пуклеогпетонов 1 и с его помощью приготовили ряд препара-
тов ДНК из зародышей гороха и тимуса теленка, соединенной с раз-
личными фракциями гистонов (Huang et al., 1964). Эти нуклео-
гистоны обнаружили заметные различия как в поддержании ДНК-
завпепмого синтеза РНК (табл. 15), так и в степени стабилнза-
В 1964 году Боннер и Хуанг вернулись к вопросу о выделении нуклео-
гистонов и еще раз подробно рассмотрели условия, позволяющие полу-
чать препараты желаемой чистоты и активности (Huang el al., 1964).
ЯДЕРНЫЕ БЕЛКИ
118
Таблица 15
Эффективность различных нуклеогистоп ос в реакции синтеза РНК на ДНК (Neidle, Waelsch, 1964)
Препарат Синтез РНК, мкмкмоли нуклео- тида/мин
РНК-полимера- РНК-полиме- за из хромосом раза из Е. coli гороха
ДНК ' 320 ' 8474 Нуклеогистоп 1в 0 56 Нуклоогистон Пв 24 140 Нуклеогистоп III 80 — Нуклеогистоп IV 216 4000 Нативный нуклеогистоп из 0 — тимуса Нативный нуклеоиротамнн — 7284 (лосось)
ции к тепловой денатурации (разница в температурах плавления
ДНК и нуклеогистона достигала 10° С).
Ингибирующее действие гистонов проявлялось и в том слу-
чае, когда гистон добавлялся прямо в реакционную смесь в ко-
личестве, эквивалентном введенному количеству ДНК. Данные но
влиянию добавления различных гистонов на ДНК-зависимый син-
тез РНК полимеразой Е. coli приведены ниже.
Добавление з систему Скорость синтеза РНК,
для синтега ДНК мкмоли нуклеотидов за 10 мин.
ДНК (без гистонов) 5340
ДНК + гистон I Ь 450
ДНК + гистон II b 850
ДНК + гистон III 3290
ДНК + гистон IV 3770
Во всех описанных работах угнетение синтеза РНК при ис-
пользовании нуклеопротеидов или искусственных комплексов ДНК
с гистонами трактовали лишь как прямое следствие избиратель-
ного подавления гистонами активности РНК-полимеразы. Другое
возможное объяснение — изменение конформации молекул и чис-
то структурное затруднение, связанное с соединением гистона с
ДНК — было экспериментально проверено Зонпепберг и Зубеем
(Sonnenberg, Zubay, 1965).
Главным методическим обстоятельством, отмеченным автора-
ми, является большая трудность получения растворимых нуклео-
149
БИОЛОГИЧЕСКАЯ РОЛЬ ГИСТОНОВ
гистонов; в частности, им не удалось повторить опыты Боннера
и Хуанга и получить растворимый нуклеогистон \ Это привело к
тому, что нуклеогистон при его выделении и переносе в систему
для синтеза РНК превращался в плотный желеподобный осадок.
Возможность проникновения молекул РНК-полимеразы в такой
плотный комок, по мнению авторов, уменьшалась, и это обус-
ловило почти полное снятие синтеза РНК по сравнению с чис-
той ДНК (см. рис. 40). Чтобы добиться разрушения комка, авто-
ры подвергли нуклеогистон (тимус теленка) кратковременной об-
работке ультразвуком. После этого образовался тонкодисперспый
материал, лишь незначительно потерявший гистоны (не более
10% от всех гистонов до озвучивания), и вслед за тем наблюда-
лось резкое усиление синтеза РНК (рис. 40, кривая 4).
В этой связи авторы упомянули цитохимические данные
(Swift, 1964) о количестве гистонов в пуффах гигантских полигон-
ных хромосом. Хотя в пуффах идет интенсивный синтез РНК, за-
метного уменьшения содержания гистонов в этих активных уча-
стках хромосом отмечено пе было1 2. Однако как пи убедительно
звучат эти данные, опи пе могут стопроцентно опровергнуть воз-
можное участие гистонов и в этом случае, хотя бы из-за грубо-
сти цитохимических методов в количественном определении гис-
тонов и полной неспособности этих методов дифференцировать раз-
личные гистоны.
Поэтому можно попять п Зопнеиберг и Зубея, когда они, об-
суждая свои данные, особое внимание обращают на возможную
роль специфических гистонов и подчеркивают, что в высших ор-
ганизмах может быть найдена «иерархия генетических регуля-
торных механизмов. Каждый тип контролирующей системы по-
требует репрессорных веществ, обладающих свойствами, согласу-
ющимися с их ролью, некоторые из них окажутся способными к
репрессированию целых хромосом, функция других сведется к ре-
гулированию больших участков одной или более хромосом, нако-
нец, третьи будут контролировать один или несколько генов» (Son-
nenberg-, Zubay, 1965, стр. 419).
Кстати сказать, и в самом эксперименте Зонпенберг и Зубея
полного устранения регулирующей роли гистонов доказать не уда-
лось. Как видно из рис. 40, синтез РНК на нативных нуклео-
протеидах шел гораздо менее активно, чем на очищенных препа-
ратах ДНК. Разрывы молекул ДНК во время обработки ультра-
звуком не сказывались на матричных свойствах ДНК.
1 Хнилица и Биллей (Hnilica, Billen, 19G4) также нашли, что при низкой
ионной силе растворов часть нуклеогистонов выпадает в осадок и образу-
ет волокна.
2 В лаборатории Олфри и Мирского были получены противоположные ре-
зультаты (Isawa et al., 1963^.
ЯДЕРНЫЕ БЕЛКИ
150
Рис. 40. Включение ЦТФ в
РНК в зависимости от кон-
центрации ДНК или ДНИ.
Концентрация ДНН выражена
в единицах концентрации
ДНК, выделенной из тимуса
теленка
1 — нативная ДНК;
2 — озвученная ДНК;
3 — ДНК, полученная из озвучен-
ного ДНП;
4 — озвученный ДНП;
•5 — нативный ДНП (Sonnenberg,
Zubay, 1965)
Рис. 41. Влияние удаления
гистонов из изолированны г
ядер клеток тимуса теленка,
на синтез РНК в этих клет-
ках
1 — ядра I трипсин;
— трипсин 4 ингибитор трипси-
на;
2а — без гистона;
2б — гистон добавлен на 20-й мин;
3 — «контрольные» ядра
Время инкубации^ мин
Разработка высокочувствительных методов авторадиографии
(Caro, van Tibergen, 1962) дала в руки цитохимиков ценный спо-
соб изучения процессов хромосомной активности в выделенных яд-
рах клеток (Littau et al.7 1964).
Применение этого метода к изолированным ядрам лимфоци-
тов дало ценную информацию в двух направлениях (Allfrey,
151
БИОЛОГИЧЕСКАЯ РОЛЬ ГИСТОНОВ
1966). Прежде всего удалось еще раз показать, что активный син-
тез РНК наблюдается лишь в тех участках хромосом, где матери-
ал диффузен (аналогично пуффам гигантских хромосом Diptera),
а плотные участки хромосом пе принимают участия в синтезе РНК
(вблизи этих участков можно было заметить лишь отдельные, ред-
ко встречающиеся гранулы). Этот вывод находился в полном соот-
ветствии с другими цитологическими доказательствами (Granbou-
lan, Granboulan, 1965; Hay, Revel, 1963; Hsu, 1962).
Второй важный вывод непосредственно касался гистонов. Об-
работка ядер трипсином, разрушавшим ядерные белки на 70%, но
не нарушавшим РНК-полимеразу и не гидролизовавшим негис-
тонные белки (Allfrey et al., 1955), значительно повышала син-
тез РНК (рис. 41), и включение радиоактивных предшественни-
ков в РНК возрастало на 300—400%; добавление гистонов к та-
ким трипсинизпровапным ядрам почти немедленно снижало уров-
ни синтеза РНК до значений, наблюдавшихся в интактных ядрах.
В некоторых опытах (кривая 2 на рис. 41) для уменьшения
активности трипсина использовался ингибитор трипсина из сое-
вых бобов. При этом синтез РНК слегка снижался.
В связи с этими опытами Олфри интересно отметить, что
увеличение скорости синтеза РНК после щадящей обработки
трипсином гигантских хромосом насекомых (Chironomus thummi)
было недавно отмечено Робертом и Крегером (Robert, Kroger,
1965). Причем наибольшее усиление синтеза РНК наблюдалось
в пуффах. Следовательно, хотя в пуффах, по данным цитохимии,
резко падает содержание гистонов, там еще остаются гистоны,
разрушение которых способствует увеличению матричной актив-
ности ДНК. Повышенная чувствительность гистонов пуффов
к трипсину, по сравнению с гистонами других участков хромо-
сом, кроме того, свидетельствует об изменении связей гистонов
и ДНК в активно метаболпрующих участках хромосом.
Несмотря на убедительность данных о подавлении активности
РНК-полпмеразы ядерными белками, механизм этого подавления
совершенно не ясен. Уже из тех данных, которые приведены
в настоящей главе, видно, что многие исследователи пытаются
обосновать идею о том, что специфичность взаимодействия опре-
деленных гистонов с определенными генами обеспечивается на-
личием большого (может быть, огромного) числа гистонов, ко-
торые пока не умеют дифференцировать друг от друга из-за
несовершенства метода их выделения и очистки. Подобная точка
зрения ранее высказывалась Боннером и Тсьо и сейчас активно
поддерживается специалистами из Честер Битти Института в
Лондоне (Батлер, 1968).
Совершенно новая гипотеза о специфичности гпсдонов вы-
сказана Д. Боннером и Р. Ч. Хуангом (1968). В своих экспе-
риментах эти авторы обнаружили, что если выделять гистоны
ЯДЕРНЫЕ БЕЛКИ
152
ДНК
Ген- СГ. СГ2 СГ,
оператор 1
АТГЦА |
УАЦГУ
РНК h I I 1 11
Гистоны —
СГ, СГ, сг.
ПТ! । । ।----1---п-----
АТГЦА
УАЦГУ 1
I_____I
Рис. 42. Гипотеза, объясняющая участие специфических РНК в узнавании
гистонами репрессируемых структурный генов
а — ДНК, находящаяся в активном состоянии (синтезирует и-РНК); б — ДПК, ре-
прессированная гистонами (синтез и-РНК, прекратился); СГЬ СГ2 и т. д.—структур-
ные гены
без применения кислотной обработки, то в составе фракции ги-
стонов непременно обнаруживается некоторая доля молекул РНК.
Было установлено, что величина молекул РНК, входящих в
состав этой фракции, довольно постоянна (около 40 нуклеотидов)
и что в среднем к каждой молекуле РНК присоединено несколь-
ко молекул гистопов. Изменения в составе среды или ионной
силы при выделении РНК-гистонной фракции не влияют па ко-
личество гистонов и РНК и на связи между этими молекулами.
Возможно, что в клетке гистоны постоянно связаны с РНК-
Если это так, то возможно, что проблема специфического
взаимодействия гистонов и отдельных генов может быть рассмот-
рена с новых позиций. Возможно, что не гистоны узнают нуж-
ные последовательности на молекулах Днк, а молекулы РНК.
Соединившись с определенными участками на ДНК (например,
геном-оператором), эта специфическая «гистонная» РНК под-
возит молекулы гистона и они «прикрывают» структурные гены,
входящие в данный оперон (рис. 42).
Подавление ядерными белками
синтеза ДНК
Репрессорная роль гистонов проявилась и на другой функции
ДНК — репликации. Большой ряд экспериментов показал, что
синтез ДНК в значительной мере подавляется при введении в
систему для синтеза ДНК гистонов, пли, наоборот, удаление ги-
153
подавление ядерными белками синтеза днк
стонов и других ядерных белков сказывается весьма значительно
на синтезе ДНК, усиливая его. Это было показано в опытах in
vitro (Hinegardner, Mazia, 1962; Mazia, Hinegardner, 1963; Bazill,
Philpot, 1963; Gogol, Rosenberg, 1964; Gurley et al., 1964) и in
vivo (Irwin et al., 1963).
Ирвин и сотр. в ряде сообщений в 1962—1964 гг. привели
данные об угнетении включения меченых предшественников в
нуклеиновые кислоты при добавлении гистонов к культуре кле-
ток асцитной карциномы Эрлиха (Irwin el al., 1963; Gurley et
al., 1964). Они исследовали влияние гистонов на активность ДНК-
полимеразпой системы, выделенной из клеток регенерирующей
печени крысы. О синтезе ДНК судили но включению Н°-тими-
дина. Весь опыт был разбит па две части: влияние гистонов на
активность тпмидинкипазы и дезоксирибонуклеотидкиназы и вли-
яние гистонов па ДНК-полимеразу.
В свою очередь, были взяты гистоны четырех типов: богатые
аргинином, богатые лизином, гистоны с очень высоким содержа-
нием лизина и пефракционпрованные гистоны тимуса теленка.
Основное отличие ДНК-полимеразной системы от РНК-поли-
меразной заключалось в гораздо меньшем подавлении синтеза
ДНК при использовании равнозначных концентраций гистонов.
Согласно Хуангу и Боннеру (Huang, Bonner, 1962), при одина-
ковом соотношении гистонов и ДНК наблюдается 100% ингиби-
рование синтеза РНК. При таком соотношении гистонов и ДНК
(1:1) в системе для синтеза ДНК аргинин-богатая фракция
угнетала синтез ДНК лишь на 21%, лизин-богатая — на 35%,
фракция гистонов с очень высоким содержанием лизина почти
пе отличалась от лизин-богатой, а нефракциопироваппые гистоны
не оказывали ингибирующего действия.
Значительное угнетение синтеза ДНК регистрировалось лишь
при повышении концентрации гистонов. Нефракционированные
гистоны давали 35 %-ное ингибирование при содержании гисто-
нов, вдвое превышавшем ДНК, и 100%-ное — при четырехкрат-
ном. Аргинин-богатая фракция проявляла еще меньшую актив-
ность и угнетала синтез Днк на 68% при соотношении ги-
стон/ДНК 4:1; лизин-богатая фракция вызывала 12-, 35-, 47-,
80- п 100%-ное ингибирование при соотношениях 0,5 : 1; 1,0 1;
1,5:1; 2,0:1; и 4,0:1 соответственно. Все приведенные цифры
относятся ко второй части эксперимента: изучению ДНК-поли-
меразной активности.
В первой части опыта (тимидинкиназа и дезоксирибонуклео-
тидкиназа) был получен отрицательный результат: активность
кипаз гистонами не ингибировалась.
Таким образом, исследования лаборатории Хольбрука проде-
монстрировали два важных вывода: во-первых, была установ-
лена функциональная неравнозначность различных гистонов,
ЯДЕРНЫЕ БЕЛКИ
154
а, во-вторых, было показано, что регуляции гистонами подчиняют-
ся не все реакции синтеза ДНК.
Первый вывод получил подкрепление в работе Ленерта (Leh-
nert, 1964), установившего гораздо меньшую ингибирующую
способность кислотонерастворимых белков (изучавшуюся по по-
давлению включения Н3-тимидина в ДНК в бесклеточной систе-
ме), чем гистонов. В его опытах, кроме того, было вновь показано
резкое увеличение синтеза ДНК при удалении гистонов из ядер
покоящейся и регенерирующей печени.
Подавление ДНК-спнтезпрующей активности при частичной
очистке ДНК-полимеразы, полученной из клеток Escherichia
coli 15 Т_А_У~, неспособных синтезировать тимин и урацил,
было описано также Хнилицей и Килленом (Hnilica, Billen, 1964).
В противовес данным Герли, Ирвина и Хольбрука ((hirley el
al., 1964) гистон с высоким содержанием лизина почти целиком
подавлял репликацию ДНК при соотношении гистона и ДНК
1 1. В отношении остальных фракций (аргпнин-богатые, лизпи-
богатые гистоны) данные обеих групп исследователей совпадали.
Вновь была отмечена стабилизация ДНК гистонами от тепловой
денатурации. При этом наибольшая резистентность к нагреванию
наблюдалась у нуклеопротеидов, в состав которых входили лизин-
богатые гистоны, в то время как аргинин-богатые гистоны, если
и сдвигали температуру плавления ДНК к более высоким значе-
ниям, то лишь незначительно. Весьма симптоматичным, но мне-
нию авторов, является то обстоятельство, что повышение Тпл
различными фракциями гистонов (фракция 1 > фракция 2Ь >
> фракция 2а > фракция 3) совпадало с аналогичным рядом, по-
лученным после изучения ингибирующего действия индивидуаль-
ных фракций в системе синтеза ДНК. Хнилпца и Киллен,
кроме того, исследовали влияние на ДНК белков неядерного
происхождения — бычьего альбумина, гамма-глобулина, бета-лак-
тоглобул ина, яичного глобулина и глобина, гамма-глобулина че-
ловека, Bi-металлосодержащего глобулина, яичного альбумина,
аминокислот лизина и аргинина. Все эти соединения не оказы-
вали никакого действия на синтез ДНК. Спермин в концентра-
ции 40 мкг/b мкг ДНК ингибировал синтез ДНК на 15%, лизо-
цим оказался несколько активнее (33% угнетения синтеза ДНК
при концентрации 10 мкг белка/5 мкг ДНК и 95% при 40 мкг
белка/5 мкг ДНК). Полилизин (молекулярный вес 40—60 тыс.)
оказался столь же активным, как фракция 1’1 гистонов.
Установление факта влияния гистонов на репликацию ДНК
явилось вторым чрезвычайно важным выводом, подтвердившим
почти пророческие взгляды Стэдманов. Вкупе с данными о роли
гистонов в регуляции синтеза РНК они стали базой для первого
подхода к пониманию причин, обусловливающих чуткое реаги-
рование наследственного аппарата высших организмов к меня-
155
ПОДАВЛЕНИЕ ЯДЕРНЫМИ БЕЛКАМИ СИНТЕЗА ДНК
ющимся условиям как внутриклеточной, так и внеорганизменной
среды.
Конечно, пока мы еще не имеем сколько-нибудь полных
доказательств способа регуляции ДНК- и РНК-полимеразной
реакции клеток. Недавно полученные результаты Ванга (Wang,
1967) о том, что именно во фракции гистонов обнаруживается
ДНК-полимераза, Холоубека и др. (Holoubeck et al., 1966), Хо-
лоубека и Крокера (Holoubeck, Crocker, 1968), Бенджамина
и Геллерпа (Benjamin, Gellhern, 1968), что основные белки
участвуют в контроле репликации ДНК и ее активности в клет-
ках культуры тканей и в органах животных, говорят о том, что
поиски регуляции генной активности в работе гистонов и неги-
стонных белков не напрасны.
Взгляд, разделявшийся рядом биологов относительно исклю-
чительной инертности хромосом, их полного неучастия в мета-
болической деятельности клетки, сменился диаметрально проти-
воположным. Организующее влияние ядра, его в высшей степени
упорядоченная деятельность по направлению характера внутри-
клеточных синтезов через посредство сугубо специализированных
механизмов (информационные и транспортные РНК, рибосомы, фер-
менты синтеза РНК, ДНК, белков и т. д.), все это, как нельзя луч-
ше, характеризовало усложнение наших взглядов на жизнь и роль
ядра, по, с другой стороны, эти же многообразные и все пополняе-
мые сведения позволяли точнее обосновать взгляд на подчиняю-
щуюся контролю среды бурную активность ядра.
В этой связи достаточно сослаться лишь на один пример.
Цитологи на протяжении более полувека говорили о метаболи-
ческой инертности иптерфазного ядра. Сегодня мы знаем, что
пптерфазпое ядро чутко отзывается «на изменения в питании,
стрессе, гормональные раздражения, ионные сдвиги, на индуктив-
ные эффекты соседних тканей, сердечные ритмы и т. п., и нет
больше никаких оснований относить хромосомы илп хромосомную
активность к нацело укрывающейся от постороннего влияния,
иммунной к окружающей среде пли безнадежно потерянной для
корректирования» (Allfrey, 1966, стр. 2026).
Открытие агентов, опосредующих этот коррегирующий конт-
роль в виде гистонов, конечно, лишь первый шаг на пути поз-
нания конкретных веществ, управляющих активностью ядра, но
уже и этот шаг открывает огромные перспективы для дальней-
ших поисков управления наследственностью.
Принцип регулируемости наследственного аппарата был бле-
стяще доказан в знаменитых опытах французских исследователей
Франсуа Жакоба и Жака Моно, обнаруживших особые регулятор-
ные гены микробов — ген-оператор и ген-регулятор. В последнее
время показано, что, по крайней мере, у бактерий имеется еще
один ген регуляторной системы — ген-промотер. У бактерий (Мюл-
156
ЯДЕРНЫЕ БЕЛКИ
.дияе) было выделено вещество, синтезируемое
лер) и фагов (Пта _^Гулятора. Это вещество (репрессор) оказа-
под влиянием гена, мсканизм регуляции в мире высших организмов
лось белком. Хотя * по-видимому, существенно различный, сам
и в мире микробо1^ ’трЯд Л1Г подлежит сомнению.
принцип регуляциИ^р познать закономерности взаимодействия
Тем более вая дНК, установить тонкую специфичность
белков (гистонов) и определенных сайтов на ДНК. Существу-
отдельных гистоно* 1963), что число типов гистонов, имею-
ет мнение (Bonner,* В]1СШПХ организмов, превышает двузначное,
щихся в клетках ^стонов могло бы объяснить, как отдельные
Такое разнообразие подавляются в каждом конкретном случае,
участки хромосом процессом, обеспечивающим внутрихромо-
Другим возможны^^гь гистонов, может быть различная модп-
сомную специфична гистонов. Но и в том, и в другом случае
фикация структур/ * ТОнкая дифференциация во взаимодействии
должна существов^ и различных нуклеиновых кислот. Первые
различных гистоно льтать1 такой дифференциации получены,
положительные pf '
„ Y ^о;1ИМОДСЙСТВИЯ
Специфичность
гистонов и ДНЕ*
ах лаборатории Холбрука (Gurley et al., 1964)
Уже в эксперименТ^вДозначное подавление синтеза ДНК четырь-
было отмечено нер лп гистонов. Аргинин-богатые гистоны проя
мя разными фракн/^ активность в подавлении ДНК-полимеразы,
влялп максимальную ^ны можно было расположить в ряд по сте-
а все изученные Г1^иртрующего действия. Подобную неравноцен-
пени убывания пн< грпл нуклеопротеидов отмечали Хнилица и
ность в увеличешГ.]рЩ 1964).
Киллен (Hnilica, 1 п ^приняли в 1964 г. ряд исследований, целью
Батлер и Джонс что имеется избирательность во взаимо-
которых было пою1* щстонов с разными сортами ДНК. Для это-
действии различны' изучено осаждение ДНК в растворах ппз-
го прежде всего бн исоединении ее с разными фракциями гисто-
кой ионной силы nf p)64) и затем связывание гистонов с РНК.
нов (Butler, Johns, gofee легко происходит взаимодействие ДНК
Оказалось, что на1<^311н-богатая фракция). Почти полная преци-
с fl фракцией (л1 аетсн с fl в том случае, когда весовое от-
пнтация ДНК наб^, ЩК равно 0,8. Другие фракции осаждали
ношение гистонов сторакратном и выше избытке гистонов по
ДНК только при
сравнению с ДНК. ^следование процессов связывания ДНК и
Более детально* |ег, 1964) показало, что добавление гисто-
гистонов (Johns, 1 ДНК (50 мг) в среде с повышенным со-
нов (15 мг) к избУ
157
СПЕЦИФИЧНОСТЬ ВЗАИМОДЕЙСТВИЯ гистонов И ДПК
Таблиц а 16
Нуклеотидный состав ДНК, оставшейся после осаждения ее гистонами
(фракции fl и f3j
ДНК Содержание нуклеотидов, %
Г А Ц т
Исходная ' 28,8 28,0 21,8 26,6
После осаждения гистонами fl фрак- ции 26,0 25,7 23,4 24,8
После осаждения гистонами f3 фрак- ции 24,0 27,2 23,5 25,4
держанием солей (2М NaCl ) и последующий медленный диализ
раствора для понижения его ионной силы (до 0,14 М NaCl) при-
водит к выпадению осадка в виде нуклеогистона.
Оставшаяся в растворе ДНК (20% при введении fl и 10%
в случае f3) была проанализирована в отношении нуклеотидного
состава, и было обнаружено различие в суммарном составе ДНК,
взятой до внесения в раствор гистонов, и составе ДНК, оставшей-
ся после выпадения нуклеогистона. Самое интересное то, что
после введения fl и f3 гистонов имелись, хотя и незначитель-
ные, но вполне определимые отличия в составе оставшихся ДНК
(табл. 16). ,
Последовательное добавление порций ДНК по 50 мг к избыт-
ку гистонов (400 мг) и диализ препарата (до 0,9% концентра-
ции соли) привели к выпадению осадка. При этом каждая новая
порция взаимодействовала с оставшимися в растворе гистонами,
по это взаимодействие было различным. Первые две порции осад-
ка содержали гистоны f2 (a), f2 (b) и f3; третий остаток содер-
жал f2 (a), f2 (b), fl и мало 13 и четвертый лишь 1‘1 (табл. 17).
Анализ этого опыта показывает, что хотя полного истощения
смеси после внесения четырех порций ДНК (200 мг) не наступи-
ло (в растворе осталось еще более 150 мг гистонов), связывание
ДНК с гистопамп резко падало (последняя порция унесла лишь
25 мг по сравнению с 107 мг первой порции). Так как параллель-
но наблюдалось изменение в составе связываемых фракций, и
первой из новых порций осадков исчезла f3 фракция, а затем
f2 (а) и f2 (b), то вывод об избирательности соединения гистонов
с ДНК получил довольно сильное подкрепление. Отличие фрак-
ции fl от других фракций гистонов наблюдается и в том, что до-
ля гистонов в преципитатах, образуемых ДНК с различными
гистонами, была меньше всего для fl (0,9% от веса ДНК), боль-
ЯДЕРНЫЕ БЕЛКИ
158
Таблица 17
Состав нуклеогистоно->, выпадающих в осадок после последовательно?
добавления ДПК к полному набору, гистонов
Порции ДНК (по 50 .иг к смеси гистонов 400 мг) Состав о: ДНК !адка, мг Отноше- ние гис- тон/ДНК в осадке Природа г осадке
Первая 1 47 1 107 2,3 Г2 (а). Г’ (в), f3
Вторая 45 70 1,55 Г2(а), Г’ (в), f3
Третья 40 40 1 .0 Г? (а), Г2(в). Fl и мало f3
Четвертая 40 25 0,62 Только 11
ше всего для £2 (а) (2,3% от веса ДНК) и примерно одинаковой
для £2(Ь) и £3 (1,4 и 1,5% соответственно).
Акирипмизи, Коннер и Тсьо (Akiiiiimisi el al., 1965) постави-
ли перед собой задачу выяснить степень присоединения различ-
ных видов гистонов к ДНК при разной ионной силе, влияние
конформации молекул ДНК (кольцевая против линейной фор-
мы) и механизм присоединения гистонов к ДНК. Понятно, что
полный ответ па эти вопросы получить крайне трудно, по и те
результаты, которые уже имеются, достаточно интересны.
Прежде всего оказалось, что при низкой солевой концентра-
ции (от 0,05 до 0,2 М) присоединение любых гистонов к ДНК
было более сильным для двунитевых молекул, чем для денатури-
рованных. Кри повышении концентрации соли до 1 М фракция
гистонов 1'2 (Ь) (аргннпн-богатые гистоны с повышенным содер-
жанием иролина) соединялась с однонитевой молекулой интен-
сивнее, чем с нативной. Замена случайного полимера на молеку-
лы с правильной спиральной формой больше сказывалась на спо-
собности присоединения гистонов с повышенным содержанием
аргппипа, чем для белков с низким содержанием аргинина.
Наибольшее присоединение гистонов к ДНК обнаружено для
протамина, причем этот белок одинаково хорошо соединяется
как с денатурированными, так и с нативными молекулами. Со-
единение синтетического белка поли-Ь-лизина и гистона £2 (Ь)
гораздо слабее, чем у протамина и гистона IV Общая тенденция,
отмеченная авторами, такова: повышение содержания аргинина
в белке приводит к увеличению коэффициентов связывания.
Присоединение белков к ДНК значительно уменьшается в
диапазоне солевых концентраций от 0,3 до 0,7 М. Авторы счи-
тают, что их данные легче всего объяснить, исходя из коопера-
тивного механизма присоединения белков к ДНК и из предполо-
159
СПЕЦИФИЧНОСТЬ ВЗАИМОДЕЙСТВИЯ ГИСТОНОВ II ДНК
женин, что наряду с электростатическим взаимодействием в со-
здании комплекса принимают участие другие силы. Уменьшение
присоединения гистонов к денатурированной ДНК имеет особый
интерес в связи с тем, что, по-видимому, в активных участках,
осуществляющих синтез информационной РНК, хромосомы нахо-
дятся в деспиралпзованном состоянии, нити ДНК расплетены и
разъединены. Как показано выше, в этих участках наблюдается
резкое уменьшение содержания гистонов. Не исключено, что в
активных участках, кроме того, изменяется качественный состав
гистонов, ибо, в соответствии с данными Акиринмизи и др.,
имеется различие в способности разных гистонов связываться
с двунптевой и одионитевой нуклеиновой кислотой.
Авторам удалось также подтвердить ранние сообщения (Huang
et al, 1964), что pH влияет на характер связи между гистонами
и ДНК.
Появились первые сведения об изменении характера связи с
гистонами при изменении нуклеотидного состава ДНК.
Люси и Батлер (Lucy, Buller, 1955) еще в 1955 г. обнаружили,
что нуклеогнстоны, ДНК в которых имеет повышенное содержа-
ние пар Г—Ц, легче освобождают гистоны или нолилпзин при
уменьшении ионной силы, чем нуклеогнстоны с повышенным со-
держанием нар А—Т. В работе Ленга и Фельзенфельда (Leng,
Felsenfeld, 1966) зависимость присоединения гистонов от нуклео-
тидного состава ДНК продемонстрирована еще нагляднее. Авто-
ры использовали в качестве белковой фракции полилизин со сте-
пенью конденсации, примерно равной 100 аминокислотам, и та-
кой же искусственный полимер — нолнаргинип. Полилизии про-
явил исключительное предпочтение для связывания с ДНК, со-
держащей много нар А—Т, а нолиаргпнип связывался примерно
в равной степени с ДНК, имевшей от 40 до 60% пар Г—Ц, сла-
бее взаимодействовал с ДНК, содержащей 72% Г—Ц, но заметно
активнее давал комплекс с искусственным дезоксирибогомополи-
мером состава дГ — дЦ.
Таким образом, идеи об избирательном связывании гистонов
определенного строения с различными ДНК получают первые
экспериментальные подтверждения. Пока еще мы находимся да-
леко от сколько-нибудь основательных и прямых доказательств,
что есть особые сорта гистонов, узнающих отдельные гены пли
участки генов, мы даже не в состоянии сказать точно, сколько
же типов гистонов нужно для этих целей, но уже начинаем по-
нимать, что различные сорта гистонов, которые мы научились
выделять, проявляют различное сродство к нуклеиновым кис-
лотам.
В таком же положении находятся и наши знания о месте син-
теза разных гистонов. Первые сведения (Birnstiel, Flamm, 1964)
говорят о том, что преимущественным местом синтезов гистонов
ЯДЕРЙЫЕ ЁЕЛКЙ
160
является ядрышко. Это было показано в опытах по включению
меченых С 14-аминокислот и дальнейшему фракционированию
белков. Опять-таки судить о том, все ли гистоны синтезируются
в ядрышке, на основании этих опытов преждевременно.
Модификации первичной структуры гистонов,
влияющие на их активность
В 1963 г. Филлипс (Phillips, 1963) сообщил, что гистоны из тимус-
ного хроматина имеют па N-терминальном конце ацетильную груп-
пу. Годом позже Мэррей (Мнггаи, 1964) в гидролизатах гистонов
нашел e-N-метиллизин. Последующие исследования показали, что,
как и в случае модификации нуклеиновых кислот, ацетилирование
и метилирование гистонов имеет место после постройки полипеп-
тидной) цепи (Allfrey et al., 1964; Allfrey, 1964). Поставщиком
метильных групп является метионин (Murray, 1964; Allfrey et al.,
1964) или аденозил-метионин (Paik, Kim, 1965). В реакции аце-
тилирования донорной группой выступает ацетилкоэнзим A (All-
frey, 1964).
Для определения роли ацетилирования гистонов (Allfrey et
al., 1964) последние были химически ацетилированы, а затем ис-
пытаны в РНК-полимеразной реакции, причем применялись РНК-
полимеразы из трех источников: ядер тимуса теленка, Escherichia
coli и Azotobacter vinelandii. Реакция преимущественно шла по
эпсилон-амино-группам лизина.
Со всеми РНК-полимеразами было отмечено одинаковое тече-
ние реакции. Добавление ацетилированных аргинин-богатых ги-
стонов давало гораздо меньшее ингибирование синтеза РНК, чем
это делали ^модифицированные гистоны. Наименее активными
в подавлении синтеза РНК оказались ацетилированные гистоны
из диффузных участков хромосом.
Другая серия опытов была проведена с лимфоцитами челове-
ка. В обычных условиях эти клетки делятся редко, но стоит до-
бавить к ним фитогемагглютинин — ФГА (белковую фракцию,
выделенную из Phaseolus vulgaris L.), как метаболическая актив-
ность клеток лимфоцитов резко возрастает, они начинают все бо-
лее активно синтезировать белки и РНК, а затем ДНК и гистоны
и после 48—72-часовой инкубации приступают к делению. Как
было показано в ряде экспериментов, ацетилирование гистонов
начиналось вскоре после добавления ФГА (Pogo et al., 1966).
Ацетилирование аргинин-богатых гистонов клетками с ФГА
вплоть до 1 часа после его добавления протекало в 4 раза актив-
нее, чем в контрольных клетках. Более того, увеличение скорости
ацетилирования гистонов предшествовало увеличению скорости
синтеза РНК.
161
МОДИФИКАЦИЯ ПЕРВИЧНОЙ СТРУКТУРЫ гистонов
Рис. 43. Предполагаем
гистонов и гормонов
схема регуляции активности генов с участием
Чтобы проверить, насколько верным является вывод о том,
что увеличение в синтезе РНК связано с предшествующей моди-
фикацией структур гистонов, авторы использовали в качестве
агентов, усиливающих активность РНК-полимеразы, гормоны.
В этом случае также удалось отметить усиление процесса ацети-
лирования.
Появились сведения, что в состав ядерных белков входят так-
же фосфатные группировки (Johnson, Albert, 1953). Ланган и
Липманн (цит. по Allfrey, 1966) доказали ядерную локализацию
высокофосфорилированной белковой фракции и показали, что
предшественниками фосфатных групп являются фосфотреонин
и фосфосерин. В лаборатории Олфри и Мирского были изучены
процессы фосфорилирования ядерных белков в ядрах тимуса.
Оказалось, что активный в поддержании синтеза РНК хроматин
содержит 13,5 мкмолей фосфора на 100 мг ДНК во фракции ну-
клеопротеида, в то время как в неактивном хроматине его количе-
ство снижается до 3,3 мкмоля. Было установлено, что для фос-
форилирования ядерных белков требуется энергия. Такие ингиби-
торы ядерного гликолиза или синтеза АТФ, как 2,4-дшштрофе-
нол или нодацетат, снимают также включение Р32-меченпых ор-
тофосфатов в белки. Применение фптогемагглютипипа привело
к двухкратному увеличению фосфорилирования белков, причем
как и в случае ацетилирования, присоединение фосфатных групп
особенно активно шло в ранние моменты активирования генов. Од-
нако роль ацетилирования, фосфорилирования и метилирования
остается невыясненной, хотя нельзя не согласиться с Олфри, счи-
тающим, что регуляция активности клеточной ДНК не обязательно
Должна включать удаление или присоединение гистонов, а может
сводиться к обратимому ацетилированию или фосфорилированию
6 В. Н. Сойфер
ЯДЕРНЫЕ БЕЛКИ
162
последних. Полученные в последнее время данные, что ацетили-
рование (Allfrey et al., 1968) и фосфорилирование (Langan, 1968)
гистонов влияют на уровень синтеза РНК, вполне согласуются с
подобной точкой зрения.
Неясно, какую роль в регуляции гистонной активности и,
следовательно, в регуляции генной деятельности играют гормоны.
Накапливается все больше данных о том, что гормоны принима-
ют участие в контроле работы генов, но представить сколько-ни-
будь законченный вывод о механизме их влияния невозможно.
Поэтому мы ограничимся лишь схемой, рассматривающей гипо-
тетическое участие гистонов и гормонов в контроле генной ак-
тивности (рис. 43)-
В заключение этой главы следует упомянуть о многочислен-
ных попытках связать ненормальное содержание гистонов в опу-
холевых клетках с процессом малигиизации (Allfrey, 1966). Одна-
ко, как справедливо отмечает Олфри, трудно решить, «являются
ли такие изменения в составе ядерных белков ответственными
за потерю генетического контроля, или они сами — простое отра-
жение ненормального белкового обмена, обусловленного беспо-
рядочной деятельностью хроматина» (Alfrey 1966, стр 2037).
8
Очерк изучения
генетического кода
Одним из наиболее плодотворных направлений молекулярной ге-
нетики было изучение природы и структуры генетического кода.
Возникнув на базе отвлеченных логических построений, эта про-
блема в короткий срок была переведена в русло конкретных био-
химических исследований, закончившихся составлением полной
таблицы всех 64 кодонов.
Необходимость существования системы записи генетических
признаков была давно осознана генетиками. По сути дела, приз-
нание такой необходимости содержалось в классической работе
Н. К. Кольцова (1928), предсказавшего матричную роль наслед-
ственных молекул. Еще ранее стало ясно, что биологическая спе-
цифичность связана с изменениями в структуре белков, а эти
изменения исходят из изменений в последовательности амино-
кислот.
Ж. Леб еще в 1916 г. писал: «Не может быть никакого сомне-
ния в том, что белки, насколько об этом позволяет судить совре-
менное состояние науки, в большинстве, а практически во всех
случаях, являются носителями специфичности» (Loeb, 1916,
стр. 61).
Конкретизируя понятие о том, чем же определяется биологи-
ческая специфичность белков, А. Коссель четырьмя годами рань-
ше утверждал:
«Подобно тому, как буквы алфавита могут сочетаться друг с
другом, образуя бесчисленное множество слоев, так и относитель-
но небольшое число аминокислот (известно около 19) могут пу-
тем разнообразных сочетаний и группировок составить практи-
чески беграничный ряд отличных друг от друга белков»
С открытием генетической роли ДНК проблема кодирования
этой специфичности стала исключительно важной. Действитель-
но, в ранних схемах, описывавших активность генов (в частно-
сти, в схеме Н. К. Кольцова), принималось, что генетическую
специфичность несут белки хромосом, и это позволяло предло-
1 Kossell А. 1912. The proteins, Herter Lecture, John Hopkins Hospital Bulle-
tin, Baltimore. Цит. по Э. Вильсону, 1940, стр. 572.
6*
ОЧЕРК ИЗУЧЕНИЯ ГЕНЕТИЧЕСКОГО КОДА
164
жить простой механизм переноса генетической информации в бел-
ковую информацию цитоплазматических молекул. Открытие ге-
нетической роли ДНК воздвигло принципиальное затруднение для
этой схемы и потребовало нахождения способа перевода структур-
но различных языков: языка последовательности нуклеотидов
ДНК в последовательность аминокислот белка.
Первой попыткой нахождения такого перевода были работы
Колдуэлла и Хиншельвуда (Caldwell, Hinshelwood, 1950) и Даун-
са (Dounce, 1952). Собственно говоря, решения проблемы они
не предлагали, а лишь формулировали саму задачу о необходи-
мости наличия генетического кода, связывающего ДНК и белок.
Проблема кода получила свое современное звучание в работе
астрофизика и физика-теоретика Георгия Гамова (Gamow,
1954а, Ь). Пытаясь разрешить главное затруднение, касавшееся
структурной организации ДНК и белков (наличие лишь 4 струк-
турных единиц в ДПК — нуклеотидов и 20 структурных единиц
в белках — аминокислот), Гамов четко предсказал, что только в
том случае информация в ДНК может быть переведена в инфор-
мацию белка, если принять, что 4 смысловые элемента нуклеи-
новой кислоты — основания комбинируются в группы по 3 осно-
вания. Таких комбинаций по 3 элемента из 4 может быть состав-
лено 64, чего более чем достаточно для кодирования 20 амино-
кислот.
Исходя из этого предсказания, Гамов и предложил свою гипо-
тезу сплошного перекрывающегося кода (см. главу I) и, кроме
того, предположил, что аминокислоты могут узнавать соответ-
ствующий им триплет непосредственно па молекуле ДНК и выст-
раиваться па ней.
Хотя оба последних предположения Гамова оказались невер-
ными, его расчет о необходимости триплетного определения каж-
дой аминокислоты, а, следовательно, о наличии 64 кодонов был
правильным. Но главным положительным следствием работы Га-
мова явилось то, что она вызвала к жизни серию исследований,
сначала в теоретическом, а затем и в практическом плане, завер-
шившихся не только расшифровкой природы кода, ио и установ-
лением строения всех 64 кодонов, кодирующих аминокислоты.
Доказательство триплетной природы
генетического кода
Доказательство триплетной природы генетического кода было
сделано Ф. Криком и др. (Crick et al., 1961).
Работа была проведена на системе ril-мутаций бактериофага
Т4 (подробнее об ril-мутациях см. статью Бензера, 1961). Об-
ласть ril-мутаций состоит из двух цистронов А и В, примыка-
165
ТРИПЛЕТНОСТЬ ГЕНЕТИЧЕСКОГО КОДА
ющих друг к другу. При заражении бактерий двумя г11-мутан-
тами фага Т4, один из которых расположен в цистроне А, а вто-
рой в цистроне В, наблюдается комплементация, или взаимное
добавление функций. Первый фаг дает продукт неповрежденного
цистрона В, а второй фаг обеспечивает синтез продукта цистрона
А. В результате этого в клетке оказываются продукты обоих ге-
нов, необходимых для развития фага, и за счет этого фор-
мируется потомство фагов, использованных для смешанного зара-
жения.
Важной особенностью г! 1-мутантов фага Т4 является их не-
способность расти на линии кишечной палочки — Е. coll К12 (X) и
способность образовывать крупные прозрачные бляшки с четко
очерченным краем (г-бляшкп) на линии Е. coli В.
Поскольку фаги дикого типа дают бляшки и на культуре В и
на культуре К, возникшие г! 1-мутанты легко отобрать. Все
г-мутанты, выявленные на линии В, которые не будут давать бля-
шек па линии К, и есть rll-мутанты. Еще проще работать с обрат-
ными мутантами от rll к дикому типу. Возникновение ревертан-
тов можно легко количественно учесть, если высеять rll-мутанты
па газон Е. coli К12 (X) и подсчитать бляшки. Все они будут об-
разованы ревертантами rll Т4 фага.
Этот методический прием и был применен Криком и сотр.
Для индукции мутаций они использовали аналог акридина —
профлавин, который может либо вставлять одно лишнее основа-
ние в последовательность оснований в ДНК, либо удалять одно
из оснований в ДНК.
С помощью профлавина авторы получили первую г! 1-мута-
цию, которую они обозначили символом FCO (первые две буквы
соответствуют начальным буквам имени и фамилии Фрэнсиса
Крика).
Вслед за тем профлавином обрабатывали уже мутант и смогли
получить от него ревертанты (Крик назвал эти обратные мутации
супрессорами FCO-мутаций). Часть ревертантов возникла спон-
танно.
Если профлавиновый rll-мутант появился в результате выпа-
дения основания, то он, видимо, может ревертировать к дикому
типу после вставки лишнего основания.
Это соображение можно проиллюстрировать следующей схе-
мой. Обозначим запись в Днк в виде следующего чередования
букв:
ABCABGABCABCABCABC
Если исходить из предположения Гамова, что одий значащий
элемент в ДНК (кодон) состоит из трех оснований и с помощью
такого элемента кодируется одна аминокислота (кодон трехбук-
ОЧЕРК ИЗУЧЕНИЯ ГЕНЕТИЧЕСКОГО КОДА
166
венный), то, представив одно основание одной буквой, мы дол-
жны считать, что в приведенной выше записи закодировано 6
аминокислот (АК):
АВС АВС АВС АВС АВС АВС
1АК 2АК ЗАК 4АК 5АК 6АК
При этом Крик делал следующие предположения.
1. Генетический код — неперекрывающийся и генетическая
информация считывается последовательно тройками без пропус-
ка букв и без «запятых»:
АВС АВС АВС АВС АВС АВС
2. Для правильного считывания необходимо, чтобы этот про-
цесс начинался со строго определенной фиксированной точки
(нулевая точка). В противном случае прочитанная запись будет
иметь искаженный или бессмысленный вид:
АВ CAB CAB CAB CAB CAB С
Если принять во внимание эти соображения, то можно легко
объяснить последствия как возникновения профлавиновых му-
тантов, так и механизм возникновения супрессоров.
Если допустить, что первая мутация FCO была следствием
внедрения лишнего основания (ее обозначим« + »-мутацией), то
это приведет к следующему искажению записи
лишняя буква
I
ABC АВА CAB CAB CAB CAB С
Мутант будет нести поражение на всем участке гена, начиная
с лишней буквы.
Как уже упоминалось, от этого мутанта Крик и сотр. получили
18 ревертантов, которые могли возникнуть из-за выпадения од-
ного основания по соседству со вставленным:
Запись до АВС АВА CAB CAB CAB CAB С
выпадения | [
Вставка Выпадение
Запись после ABC АВА CAB АВС АВС АВС
выпадения
Вторая мутация другого знака (« —»-мутация, или выпадение)
восстановила чтение почти на всем протяжении, за исключением
короткого участка, заключенного между вставленной и выпавшей
буквами.
Если изменение двух аминокислот не исказит существенным
образом структуру кодируемого белка, то такая супрессия даст
организмы дикого или псевдодикого фенотипа. Именно такими и
оказались ревертанты, полученные Криком и сотр.
167
ТРИПЛЕТНОСТЬ ГЕНЕТИЧЕСКОГО КОДА
Все
27
22
19
•о -
FC 0( I )
26
FCK-)
FC6(-)
FCIO(-)
Все
FC4K-)
72
73 68
FC9(—)
48
46
80 76
78 78
77 74
94
96
98
Все
86
88
81
Сегменты
Рис. 44. Генетическая карта мутантов их супрессоров, выделенных
Ф. Криком
Применив метод скрещивания, авторы сумели определить, что
все 18 супрессоров на самом деле были двойными мутантами, что
и следовало из приведенной выше схемы. Возврат к псевдодикому
типу был связан с возникновением супрессорной мутации. 18 суп-
рессорных мутаций были картированы на хромосоме фага Т4 и
расположились по обе стороны от мутации FCO.
Естественно, что если первая мутация была принята за « + »-
мутацию, то супрессоры должны быть «—»-мутациями \
Использовав в дальнейшем уже не FCO, а его супрессорных
мутантов, авторы получили ревертанты к ним (иначе говоря, суп-
рессоры уже имевшихся супрессорных мутантов). Они должны
были быть « + »-мутантами.
После этого стала возможной проверка всей гипотезы, ибо,
скрестив мутант, несший первый супрессор (« —»-мутация), с
мутантом, имеющим супрессор следующего порядка (« + »-мута-
ция), нужно было получить псевдодикий фенотип, что и было отме-
чено в эксперименте.
1 Конечный вывод из опыта не изменится, если принять первую мутацию
FCO за «—»-мутацию.
ОЧЕРК ИЗУЧЕНИЯ ГЕНЕТИЧЕСКОГО КОДА
1G8
Так как группа Крика получила большое число супрессорных
мутантов 1-го, 2-го п более высоких порядков и ревертанты к ним,
картировала их (рис. 44) и в результате имела набор большого
числа «-]-»- и «— ^-мутантов, то проверка правильности сделан-
ных предположений не оставила никаких сомнений в их верно-
сти.
Тем самым Крик и сотр. доказали три важных предположения
их общей теории генетического кода.
Во-первых, была доказала непрерывность чтения генетической
записи. При существовании незначащих промежутков в пределах
гена такой результат пе мог быть получен.
Во-вторых, было доказано наличие точно фиксированной точ-
ки начала считывания.
В третьих, опыты Крика доказали, что механизм мутагенного
действия акридинов обусловлен вставкой и выпадением оснований.
Накопеи, эксперименты Крика и сотр. смогли дать ответ и на
вопрос о том, является ли код триплетным (или кратным трем).
Для этого автор скрестил три « + »-мутанта (в ряде опытов
три « — »-мутанта) и во всех случаях получил восстановление
дикого фенотипа.
Установление состава кодонов
Одновременно с работой Крика и др. было выполнено другое важ-
ней шее исследование, касающееся проблемы кода. Речь идет о
работе М. Ниренберга и Г. Маттеи, обнародованной на V Био-
химическом конгрессе в Москве в 1961 г. Авторы изучали синтез
белка в бесклеточной системе Е. coli iipii введении в нее в каче-
стве затравок различных фракций рибосомных РНК из Е. coli и
дрожжей и при добавлении к системе синтетических полинуклео-
тидов (Ниренберг и Маттеи, 1963).
Авторы отметили, что введение в качестве затравки полиури-
диловой кислоты (РНК*, целиком содержащей лишь урацильпые
основания) наблюдается интенсивнейшее включение аминокис-
лот в синтезируемый белок. Ито включение почти в 1000 раз пре-
вышало иифры в контроле, когда в среду затравка не вносилась.
Добавление вместо поли-У уридин-мопо-, ди- и трифосфата
пе приводило к такому включению.
Анализ синтезируемого белка показал, что он состоит лишь из
одной аминокислоты — фенилаланина, и белок следовало назвать
иолпфепплаланином. Внесение в реакционную смесь вместо но-
ли-У других затравок — нолиадепиловой, полицитидиловой, поли-
инозиновой кислот и их смесей це привело к синтезу полифенил-
аланина. Удаление из среды остальных 19 аминокислот не ска-
169
УСТАНОВЛЕНИЕ СОСТАВА КОДОНОВ
зывалось на синтезе белка из оставшейся в среде аминокислоты
фенилаланина.
Таким образом, Ниренберг и Маттеи обнаружили состав пер-
вого из имеющихся в природе 64 кодонов. Оказалось, что ами-
нокислота фенилаланин закодирована в ДНК кодоном ААА (или
УУУ для РНК). V
Работа Нирепберга и Маттеи открыла принципиально новый
подход к изучению состава кодонов. Поскольку в 1961 г. полу-
чение полимеров, в которых имелось бы нужное сочетание ос-
нований, ужо не представляло значительной трудности, то для
изучения состава всех кодонов были использованы кополпмеры,
содержавшие разные сочетания 4 рибонуклеотидов.
Этот принцип был использован в лабораториях М. Ниренбер-
га п С. Очоа. В результате интенсивной работы этих лабораторий
к концу 1962 года была составлена таблица, в которой были при-
ведены составы кодонов для большинства аминокислот. Однако,
в этих данных пе содержалось информации о том, в каком по-
рядке следуют основания в любом конкретном случае. Казалось,
что задача отыскания точной последовательности оснований в ко-
донах является гораздо более трудной, чем все до сих пор сде-
ланное. Тем не менее, и эта задача была решена в кратчайший
срок, благодаря остроумному приему, использованному М. Ни-
ренбергом и Ф. Лодером (Nirenberg, Leder, 1964).
Во всех предыдущих опытах рибосомы в бесклеточных систе-
мах заряжались информационной РНК (безразлично, какого вида
РНК пли какие синтетические полинуклеотиды использовались
для этого) довольно большого размера. Ниренберг и Лодер за-
дались целью определить, какой минимальной длины олигону-
клеотид может быть присоединен к рибосоме с тем, чтобы вызвать
специфическое присоединение амипоацил-т-РНК к рибосоме. Им
удалось показать, что такой минимальной «информационной»
РНК может быть трипуклеотпд. Естественно, что никакого син-
теза белка при введении в рибосому тринуклеотида пе происхо-
дило, а наблюдалось лишь присоединение аминоацил-т-РНК к
рибосоме, но в силу того, что аминоацил-т-РНК была мечена С14,
это присоединение к комплексу рибосома + тринуклеотид мож-
но было легко зарегистрировать.
Авторы исследовали не только то, как меняется сорбционная
способность комплекса рибосома + олигонуклеотид, но и опре-
делили влияние концевых фосфатов на присоединение аминоацил-
т-РНК.
Оказалось, что транспортная РНК эффективно сорбируется
на олигонуклеотидах, несущих фосфатную группу на 5'-конце
или же пе имеющих фосфатных групп на концах (рис. 45). При-
чем, когда на 5'-конце находилась фосфатная группа, присоеди-
нение аминоацил-т-РНК происходило даже несколько активнее
ОЧЕРК ИЗУЧЕНИЯ ГЕНЕТИЧЕСКОГО КОДА
170
Рис. 45. Влияние концевых
фосфатов на присоединение
аминоацил-т-РНК к рибосо-
мам, заряженным олигону-
клеотидами, несущими фосфа-
ты на концах
Рис. 46. Присоединение ами-
ноацил-т-РНК к олигонуклео-
тидам
Рис. 47. Влияние размера оли-
гонуклеотида на присоедине-
ние ацилированной т-РПК
по сравнению с олигонуклеотидами, несущими на этом конце ос-
нование. Если же фосфатная группа имелась на З'-конце олиго-
нуклеотида, происходило резкое снижение сорбционной актив-
ности т-РНК (рис. 46).
Но наиболее важным было наблюдение авторов, касавшееся
минимального размера олигонуклеотида, еще проявляющего спо-
собность сорбировать амипоацил-т-РНК. Присоединение почти не
изменилось при снижении числа оснований в олигонуклеотиде с
12 до 3. Но стоило взять динуклеотид, как присоединение прак-
тически исчезало (рис. 47).
Главное преимущество использованного для изучения состава
кодонов метода заключалось в том, что с помощью чисто хими-
ческого синтеза, последовательно добавляя по одному известному
основанию, можно было получить тринуклеотид точно заданного
состава. Доказав, что такие тринуклеотиды присоединяют ами-
171
ВЫРОЖДЕННОСТЬ КОДА
Т а б л и ц а 18
Таблица генетического кода
Первый нук-i леотид 1 Второй нуклеотид Третий нуклеотид Первый нук- леотид Второй нуклеотид Третий нуклеотид
У Ц А г У Ц А Г
У 'фен Сер Тир Цис А ‘илей Тре Ас н । Сер
Фен Сер Тир Цис Ц Илей Тре Аси Сер ц
Лей Лей Охра Бессмыс- А Илей Тре Лиз Apr А
ленный Мет * Тре Лиз Apr Г
Лей Сер Янтарь Три Г
ц Лей Про Гис Apr У Г Вал Ала Асп Гли У
Лей Про Гис Apr Ц Вал Ала Ас н Гли Ц
Лей Про Глн Apr А Вал Ала Глу Гли А
Лей Про Гл н Apr Г Вал* Ала Глу Гли Г
* У 5'-конца цепи и-РНК данный кодон служит инициатором роста белковой цепи
и кодирует формилметионин.
поацил-т-РНК не случайно, а в согласии с правилами комплемен-
тарности (кодон и-РНК соединяется с антикодоном т-РНК), Ни-
ренберг и сотр. (Nirenberg, Leder et al., 1965) смогли приступить
к непосредственной проверке расположения оснований в кодонах.
Конечно, никакого белкового синтеза при этом не происходило.
Зная, какая из аминокислот мечена, авторы могли точно фикси-
ровать присоединение т-РНК, несущей данную аминокислоту, к
использованному тринуклеотиду. Таким методом довольно быстро
авторы получили почти полную информацию о строении кодонов
генетической записи. Во всяком случае 50 кодонов из 64 могли
быть определены с большой степенью точности.
Таблица кодонов (табл. 18), составленная Ниренбергом и др.,
может считаться окончательной. Недостающая информация, так
же как и проверка данных Ниренберга и Ледера, была получена
ь ряде экспериментов (Byrd, Ohtsuka, Moon, Khorana, 1965;
Nishimura el al., 1965; Khorana et al., 1966; Brammar et al., 1967;
и др.)
Вырожденность кода
Из сопоставления кодонов для лейцина, цистеина и аргини-
на у дикого типа и мутанта можно заключить, что для одной и той
же аминокислоты используются различные кодоны. Это явление,
ОЧЕРК ИЗУЧЕНИЯ ГЕНЕТИЧЕСКОГО КОДА
172
называемое вырожденностью кода, теоретически вытекало из ги-
потезы Гамова, ибо G4 возможных кодона должны были опреде-
лять только 20 аминокислот. Если только не предполагать, что
число бессмысленных кодонов (пе кодирующих пи одной амино-
кислоты) не превышает почти втрое число смысловых кодонов,
то следовало согласиться с тем, что на одну аминокислоту при-
ходится несколько кодонов. Эксперименты in vitro показали вер-
ность предположения о вырожденности кода, а проверка кодонов
in vivo подтвердила истинность этого предположения.
Вырожденность кода дает большие возможности разнообра-
зить «генетический язык» разных групп организмов. Способ-
ность понимать один из кодонов для данной аминокислоты может
отсутствовать у другого организма. По-видимому, универсальным
механизмом узнавания таких отличий служит наличие т-РНК.
распознающих только определенный кодон из всего набора воз-
можных кодонов для данной аминокислоты. Поскольку связы-
вание и-РНК и т-РНК происходит при комплементарном спари-
вании кодона в и-РНК и антикодона в т-РНК, то наличие данного
кодона в и-РНК еще не означает, что он непременно будет прочи-
тан в организме. Если не окажется т-РНК, способной присоеди-
ниться к этому кодону, постановка аминокислоты не произойдет,
а сам он окажется бессмысленным для данного организма.
Экспериментальное подтверждение этого положения следует
из опытов по синтезу белка в бесклеточной системе. Долгое вре-*
мя не удавалось синтезировать белок вируса табачной мозаики,
когда РНК ВТМ вводилась в бесклеточную систему из Е. colt.
Синтезировались короткие отрезки белка ВТМ, но получить за-
копченный белок не удавалось. Резонно было предположить, что
обрыв синтеза белка происходит из-за того, что в E.coli не име-
лось тех т-РНК, которые могли распознать все кодоны, исполь-
зуемые в ВТМ. Поэтому, как только синтез доходил до бессмыс-
ленного для Е. coll кодона, постановки аминокислоты на это ме-
сто не происходило.
Однако стоило взять для синтеза РНК в бесклеточной системе
Е. coli другой РНК-содержащий вирус — бактериофаг f2, способ-
ный к размножению в Е. coli, как его РНК прочитывалась пол-
ностью и образовывался полноценный белок фага (2.
Бессмысленные кодоны
Помимо таких ситуаций, когда код в редких случаях не может
быть прочитан из-за его вырожденности и отсутствия нужной
транспортной РНК, было найдено три кодона — УАА, УАГ и
УГА, которые не кодируют в нормальных условиях никаких ами-
нокислот и являются бессмысленными. Первым таким кодоном
173
СТАРТОВАЯ ТОЧКА ИНФОРМАЦИОННОЙ РНК
является УАГ, условно называемый амбер-кодоном. Возникнове-
ние за счет мутации кодона УАГ в цепи РНК приводит к тому, что
синтез белка па этом кодоне обрывается. Так как амбер-кодоп
может возникнуть в любом гене, то с помощью получения амбер-
кодона (и в особенности так называемых супрессоров амбер-кодо-
нов) можно значительно расширить представление о числе ге-
нов у данного организма. Этот прием особенно успешно был при-
менен для фага Т4.
Второй бессмысленный кодон УАА называется охра-кодоном.
До последнего времени не удавалось окончательно показать, что
кодон У ГА также бессмысленный и аналогичен УАА- и УАГ-ко-
допам, но недавно это было сделано.
Значение бессмысленных кодонов огромно, ибо без них нельзя
себе представить, как останавливается синтез белка в рибосоме
на нужных точках при прохождении через рибосому информа-
ционной РНК сразу с нескольких генов (с одного оперона).
Стартовая точка информационной РНК
Следующей важной проблемой, касающейся функционирования
генетического кода, является проблема точного начала чтения
и-РНК. Как мы видели ранее, от того, начинается ли синтез бел-
ка с надлежащей точки, зависит правильное прочтение информа-
ции всего гена. Однако понять, как клетка узнает начальную точ-
ку, долгое время не удавалось. Сейчас накапливаются данные
о том, что такой стартовой точкой могут быть два кодона — АУГ и
ГУ Г и, возможно, кодон УУГ. Если эти кодоны встречаются в се-
редине и-РНК, то АУГ кодирует метионин, ГУГ — валин и
УУГ — лейцин. Ко всем кодонам, если они стоят в начале и-РНК,
присоединяется метиониновая транспортная РНК, к тому же
имеющая формильную группировку, присоединенную к аминокис-
лоте:
zNH—НС=О
CH3-S-CH2-CH 2-СН <
ХХЮ11
Эта формилметиониновая т-РНК (фмет-т-РНК) участвует в на-
чале синтеза полипептидной цепи у Е. coli, а также при исполь-
зовании синтетических полирибонуклеотидов и природных ин-
формационных РНК.
Помимо формил метиониловой т-РНК была выделена нефор-
милированная метиониновая т-РНК, которая не способна начи-
нать синтез белка и вставляет метионин только в середине строя-
щейся цепи. В то же время было показано, что фмет-т-РНК мо-
жет присоединить формилметионин только в том случае, если
кодон АУГ располагается вблизи 57-конца или на самом Б'-конце
ОЧЕРК ИЗУЧЕНИЯ ГЕНЕТИЧЕСКОГО КОДА
174
и-РНК. Заметим, что чтение и-РНК начинается с 5'-конца и кон-
чается З'-концом. Были выделены специальные кофакторы, кото-
рые сильно ускоряют процесс присоединения формилметионина
к белку при наличии кодона АУГ вблизи б'-кодона, но эти ко-
факторы не оказали никакого влияния на включение глицил-т-
РНК и лизил-т-РНК в присутствии тринуклеотидов ГГУ или
ААА, специфичных для глицина и лизина.
Важная роль фмет-т-РНК для начала белкового синтеза сле-
дует также из факта, что при наличии инициирующего кодона,
формилмет'иониновой т-РНК и кофакторов скорость синтеза бел-
ка возрастает в десятки, а то и в сотни раз. Все заново строя-
щиеся полипептпдные цепи несут на конце формилметионин, но
в дальнейшем формильная группировка, а нередко и метионин мо-
гут быть отщеплены от уже готовых молекул белка с помощью
специальных ферментов. Такое отщепление наблюдалось в ряде
бактериальных клеток. Показано, что инициирующая активность
фмет-т-РНК зависит в сильной степени от наличия ионов Mg++.
9
Развитие представлений о гене
как системе
Дискретность наследственного материала, провозглашенная еще
в древности Демокритом, Гиппократом и другими, была экспе-
риментально доказана во второй половине XIX века в классиче-
ских опытах Грегора Менделя. Среди предшественников Менде-
ля следует назвать прежде всего Иосифа Готлиба Кельрейтера,
члена Российской Академии паук (1733 — 1806 гг.), который впер-
вые показал наличие четко ограниченных наследственных при-
знаков (например, окраска венчика цветка), характеризующих
разные сорта цветковых растений. Следующим важным этапом
в развитии представлении о дискретной природе наследственного
материала явились исследования президента Лондонского садо-
водческого общества Томаса Эндрью Найта (1759—1838 гг.), ус-
тановившего, что: во-первых, чем меньше степень филогенети-
ческого родства взятых для скрещивания растений, тем большим
набором мелких индивидуальных наследственных различий об-
ладают эти растения, и, во-вторых, существуют «неделимые» мел-
кие признаки, которые передаются в скрещиваниях целиком, не
дробясь. Тем самым Найт пришел к выводу о наличии «элемен-
тарных наследственных признаков». Наконец, исследования фран-
цузских ученых Огюста Сажрэ (1763—1851 гг.) и Шарля Но-
дэна (1815—1899 гг.) вплотную подвели биологическую науку к
понятию доминантности и рецессивности в проявлении отдельных
наследственных задатков.
Однако наиболее полное и самое главное — количественное ис-
следование природы наследственных признаков и характера пе-
редачи их во время скрещиваний мы находим в работе Г. Мен-
деля с различными сортами гороха. Мендель впервые четко сфор-
мулировал гипотезу дискретных наследственных факторов,
каждый из которых управляет в организме развитием строго оп-
ределенного элементарного наследственного признака и в своей
активности не зависит от других наследственных факторов (за-
кон чистоты гамет). Мендель же впервые установил количествен-
ные статистические закономерности комбинирования независи-
мых наследственных факторов в скрещиваниях организмов, от-
личающихся по одному, двум, трем и т. д. признакам (закон рас-
щепления) ,
РАЗВИТИЕ ПРЕДСТАВЛЕНИЙ О ГЕНЕ КАК СИСТЕМЕ
176
После переоткрытия законов Менделя в 1900—1901 гг. иссле-
дование наследования признаков приобрели исключительно широ-
кий размах. В это же время (1888—1902 гг.) С. И. Коржинский и
Г де-Фриз обнаружили явление мутаций, т. е. изменения единич-
ных наследственных факторов, чем в значительной мере упрочили
само представление о дискретности наследственного материала.
Мутационная теория де-Фриза, встреченная вначале в штыки мно-
гими биологами, затем получила всеобщее признание в той своей
части, где она трактовала независимое возникновение наследуемых
изменений различных наследственных факторов. Исследование
чистых линий, введенных в науку об изменчивости В. Иогансеном,
неопровержимо доказало, что мутации действительно сопровожда-
ют эволюционное развитие всех без исключения организмов, по-
ставляя материал для эволюции. Открытие Г. А. Надсоном и
Г. С. Филипповым (1925), Г. Мёллером (Muller, 1927; см. русский
перевод Мёллер, 1937) и Л. Стадлером (Stadler, 1928) мутагенно-
го действия рентгеновых лучей и В. В. Сахаровым (1932), М. Е. Ло-
башевым (1937), Ф. Олькерсом (Oehlkers, 1943), Ш. Ауэрбах и
Робсоном (Auerbach, Robson, 1944) и И. А. Рапопортом (1947,
1948а, б) химического мутагенеза начало новую главу в изучении
наследственной изменчивости — искусственное получение мутаций
и резкое усиление интенсивности мутационного процесса.
Примерно в те же годы, когда были переоткрыты законы Мен-
деля, четко определилось другое направление экспериментально-
го изучения процессов наследственности — цитологическое изу-
чение материальных основ наследственности. Бурное развитие
начиная с середины XIX века клеточной теории привлекло к
концу девяностых годов XIX века внимание к ядру как месту
возможного средоточия наследственной информации. В 1902 г.
В. Сэттоп и Т. Бовери отчетливо продемонстрировали паралле-
лизм между независимостью поведения аллеломорфов в скрещи-
ваниях, распределением гомологичных хромосом по гаметам и их
последующим случайным комбинированием в зиготах после вза-
имного оплодотворения этих гамет.
Дальнейшие успехи цитологии наследственности связаны с
исследованиями школы Т. Г. Моргана. В достаточно короткий срок
Морган и его ученики доказали связь наследственных факторов,
по терминологии Бэтсона — генов (1907), и хромосом. Этими ис-
следователями дискретность наследственных факторов была про-
демонстрирована с особой силой. Т. Морган, К. Бриджес, А. Стер-
тевант, Г. Мёллер и Т. Пайптер описали более 500 генов у Droso-
phila melanogaster, распределили их по группам сцепления, иссле-
довали громадное число различных аллелей отдельных гепов. Од-
ной из крупнейших заслуг школы Моргана явилось открытие
перекреста хромосом, позволившего обосновать методы генетиче-
ского картирования. К. Штерн (Stern, 1936), а затем Мак Клинтон
177
ДРОБИМОСТЬ ГЕНА
и др. представили доказательства в пользу хромосомной локали-
зации кроссинговера, а открытие Т. Пайптером (Painter, 1933),
Гейтсом и Бауром (Heitz. Baur, 1933) и К. Бриджесом (Bridges,
1935) гигантских политенных хромосом слюнных желез привело
к созданию цитологических карт наследственности.
Таким образом, к началу тридцатых годов генетика обладала
суммой доказательств о дискретной природе наследственного ма-
териала. Ген был описан не только как элементарная единица на-
следственного материала, по и как структура, ведущая себя как
целое при мутировании и передающаяся целиком при кроссип-
говере. Ген стали именовать единицей функции, мутации и крос-
синговера.
В то же время исключительные по своему значению исследо-
вания поведения гена в эволюции (Г. Харди, С. С. Четвериков,
Р. Фишер, С. Райт, Н. П. Дубинин, Ф. Г. Добржапский, Н. В. Ти-
мофеев-Ресовский) заложили основы генетики популяций.
Все вышесказанное сделало проблему гена центральной не
только в учении наследственности, но и в биологии XX века
вообще.
Доказательство дробимости гена
в опытах по изучению ступенчатого аллеломорфизма
генов scute — achaete
Большое число экспериментов легло в основу представления о
том, что ген — единица мутации. Достаточно сослаться на работу
Кателла (цит. по Тимофееву-Ресовскому, 1925), изучавшего по-
следовательное мутирование ряда локусов Х-хромосом Droso-
phila melanogaster. Автор получил мутации yellow и apricot. Затем
ему удалось вызвать повторные мутации в этих же локусах, при-
чем yellow превратился в spot, a apricot в while. Так как ни разу
не удалось наблюдать «промежуточного» мутирования (аллело-
морф yellow целиком переходил в spot и т. д.; другими словами, не
было отмечено случаев, когда часть гепа оставалась в первом
мутантном состоянии, а часть переходила во второе), автор заклю-
чил, что мутированию всегда подвергается весь ген. К этому же
выводу приводили опыты Н. В. Тимофеева-Ресовского (1925, 1929,
1930а), описавшего обратные мутации у Drosophila, когда из му-
тантных аллеломорфов eosin, forked, hairy, peach, crossveinless
были получены особи с нормальными аллелями, и аналогичные
эксперименты Мёллера, получившего нормальных мух из мутант-
ных по гену forked.
Существенное изменение концепции мутационной и функцио-
нальной неделимости гена последовало из серии работ ио ступен-
РАЗВИТИЕ ПРЕДСТАВЛЕНИЙ О ГЕНЕ КАК СИСТЕМЕ
178
Рис. 48. Расположение щетинок на теле мухи
дрозофилы, контролируемых генами ахета и
скьют
.sc (0)
white (1,5)
tan (27)
vermillion (33)
1 — орбитальные;
2 — оцеллярные;
з — вертикальные;
4 — поствертикальные;
5 — гумеральные;
6 — пресутуральные;
7 — нотоплевральные;
8 — супраалярные;
9 — дорзоцентральные;
10 — посталярные;
11 — скутеллярные;
12 — стерноплевральные;
13 — галтер;
14 — брюшко;
15 — 1-, 2-, 3-я пары
16 — грудь
„small wiiig(54 )
--Ваг (57)
- -fused (59)
"“Beadex (59)
Рис. 49. Расположение генов на Х-хромосоме Dr.
melanogaster
В скобках указано расстояние от начала хромосомы
в морганидах (из Дубинина, 1.929)
чатому аллеломорфизму генов achaete — scute у Drosophila тпе-
lanogaster, выполненных в 1929—1931 гг. Н. П. Дубининым,
А. С. Серебровским и др. Эти эксперименты сыграли столь важ-
ную роль в трансформации взглядов на ген как дискретную еди-
ницу наследственности и в такой сильной мере приблизили гене-
тику к современному воззрению на ген (опередив тем самым нау-
ку более чем на тридцать лет), что мы позволим себе описать
эти опыты более подробно.
Гены scute — achaete управляют у дрозофилы проявлением
щетинок на теле мухи (рис. 48). Ранее (Раупе, 1920) они были
локализованы на 0,0 морганиды Х-хромосомы. В 1929 г. Н. П. Ду-
бинин опубликовал первую работу по обнаружению трех алледот
170
ДРОЁИМОСТЬ ГЕНА
морфов гена scute, занимавших различные участки гена (Дуби-
нин, 1929). История получения sci, sc2 и SC3 такова. Самцов
дрозофил, несших ген Beadex (59 морганида Х-хромосом), облу-
чали рентгеновыми лучами и скрещивали с самками такого строе-
ния sc t v sFcLB Расположение генов па Х-хромосоме
указано на рис. 49. Следовало ожидать появления следующих ти-
пов потомства:
- ?Х —z—~х sc t v si CLB fu
fu sc t v si CLB
Однако среди scTv^TcbB была обнаружена одна муха с
редукцией щетинок на скутеллуме. Последнее могло быть следст-
вием двух причин: либо возникновения в Х-хромосоме самца мута-
ции sc, либо делеции куска этой хромосомы с локусом sc. Чтобы
проверить, какая из альтернатив верна, Дубинин скрестил полу-
ченную самку с самцом строения sc w
Все жизнеспособное потомство от этого скрещивания имело
редукцию щетинок, что доказывало справедливость первой аль-
тернативы. Анализ фенотипа мух, гомозиготных по новой мутации
scute, выявил необычное проявление вновь возникшей мутации
(ее, в отличие от первой sci, Дубинин обозначил как sc2). Многие
щетинки, подавленные аллелем sci, оставались незатронутыми,
в то время как часть щетинок, подавленных sci, были нормаль-
ными в случае sc2. Данные о фенотипах sci и sc2 приведе-
ны ниже:
Щетинки scutci scutc2
Орбитальные — +
Вертикальные +
Оцеллярные — -|-
Скутеллярные — —
Гуморальные + —
Нотоплевральные — -р
Абдоминальные — —
Примечание 4- нормальное состоял
— редукция щетинок
Вслед за тем Дубинин получил мутацию зсз, резко отличав-
шуюся по своему фенотипу от первых двух: в этом случае ре-
дукции подвергались все щетинки, присущие как гену scute, так
и гену achaete.
В связи с необычным проявлением аллеломорфов, обнаружен-
ных Дубининым (sc2 поражает половину щетинок, затронутых scb
sci поражает лишь половину щетинок, подавленных SC3), А. С. Се-
РАЗВИТИЕ ПРЕДСТАВЛЕНИЙ О ГЕНЕ КАК СИСТЕМЕ
180
Рис. 50. Расположение щетинок на теле различных мутанов
scute дрозофилы
ребровский предложил назвать обнаруженное явление ступенча-
тым аллеломорфизмом.
В 1929—1931 гг. были найдены другие аллеломорфы того же
ряда scute — achaele. 11. И. Агол (1929) обнаружил мутацию SC4,
А. О. Гайсинович (1930)—scs, А. С. Серебровский (1930)—асе,
Б. Н. Сидоров — sc8 *, Левит (1930)— - sc9, Н. И. Шапиро (1930) —
SC12, наконец, Дубинин (1930 а, б, 19316) — мутации sc?, scio, sen,
sci3 (рис. 50). Дубинин проанализировал генетическую структуру
и поведение аллеломорфа sc 15, выявленного Г. Мёллером, и еще
раз проверил количественные данные по всем 15 аллеломорфам
scute и achaele. На рис. 51 представлено взаимное расположение
различных аллеломорфов серии скьютовых мутантов.
1 Впоследствии было показано, что это инверсия.
181
ДРОВИМОСТЬ ГЕНА
Анализ фенотипического проявления членов серии scute — ac-
haete потребовал коренных изменений в представлении о гене как
единице функции, мутации и кроссинговера. Если вывод о недели-
мости генов achaete — scute в процессе кроссинговера некоторое
время сохранялся неизменным, то остальные две характеристики
гена следовало пересмотреть и прежде всего понятие гена, мутиру-
ющего как целое. Выявление отдельных центров (по терминологии
Дубинина центрами назывались участки генов, управляющие раз-
витием отдельных щетинок или их групп, мутировавших независи-
мо друг от друга и располагающихся в базигене scute — achaete
различным образом) позволило Дубинину (1929) сделать фунда-
ментальной важности вывод, что ген состоит из отдельных участков.
Столь же логично вытекало из опытов по ступенчатому аллеломор-
физму изменение представлений, абсолютизировавших функцию
гена как структуры, управляющей развитием одного строго опреде-
ленного признака.
Данные по проявлению разных аллеломорфов генов scute —
achaete позволили решить топологическую задачу взаимного рас-
положения центров вдоль базигена. Проведенный анализ устано-
вил, что центры в базигене располагаются линейно (рис. 52).
Не вдаваясь в дискуссию о том, стоит ли считать каждый из цен-
тров базигенов achaete и scute отдельным геном (со своей специ-
фической функцией) или же согласиться с точкой зрения Дубини-
на, что и achaete и scute «хорошие» гены, а действие каждого из
них в целом обусловлено интеграцией функции его отдельных час-
тей, надо отметить, что установление плана расположения центров
в базигепах achaete и .scute впервые в генетике продемонстрирова-
ло наличие генетических блоков генов, связанных общностью их
функционального проявления (явление clusters of genes, подроб-
но изученное М. Демерецом) (Demerec, 1964).
Нельзя также не отметить исключительной важности методов
количественного изучения проявления различных аллелей базиге-
нов ахета и скыот, примененных при исследовании ступенчатого
аллеломорфизма. Необходимость использования количественных
критериев осознана в науке давно. Еще Леонардо да Винчи писал,
что «никакой достоверности нет в пауках там, где нельзя приме-
нить ни одной из математических наук, и в том, что не имеет свя-
зи с математикой». Уже отмечалось, что именно количественные
методы, использованные Г. Менделем, позволили ему решить фун-
даментальной важности вопросы теории гена. Вместе с тем, в био-
логических науках, где исследователи чаще всего имеют дело с
морфологическими категориями, понятия меры и количества раз
виты слабо. Тем существеннее был выигрыш от метода, использо-
ванного еще в двадцатые годы исследователями явления ступен-
чатого аллеломорфизма, при котором определенные признаки изу-
чались не просто феноменологически («проявление — непроявле-
Мутанты Центры базигена scute-achaete
I10 mr de sa vi I3 V2?2 vt ps ni pa or2"3 ' oc or. sepv ex st h I2 w
scute. 1
scute2 i
scute3 ZZZZ7 Ж Ж w 0 Д/h/
scute4 7У// ///// ///// 1 V///7 /////
scute5
scute6
scute7
scute9 V/T/S /////
scute10 1
scute,.
scute 13 ц /////
scute15 ///// '//// f
scute17 //^2 Ж &
Рис. 51. Расположение различных мутантов в базигене scute — achaete
В некоторых работах встречались другие обозначения этих мутантов: 9Ct совпал
с sci4; SC13 = ach3 + sci; scio = ach2; sen = achi. Хотя sc3 и seis повреждают одни и
те же центры, они отличаются по своему поведению в компаундах с другими
мутантами
Рис. 52. Расположение центров в базигене scute-achaete
Н. П. Дубинин считал, что в некоторых
том) могут располагаться генетические
групп щетинок.
Обозначения центров:
I10, I3 и I2 — полулегальные по своему
действию аллеломорфы sc(u,
scj и sc2 соответственно;
шг — редукция микрохет на груди.
Щетинки:
de — дорзоцентральные
Vi и v2 — первая и вторая вертикальные;
П1 и п2 — первая и вторая нотоплевраль-
ные;
vt - вентральные (пара щелинок меж-
ду первой и второй парой ног);
центрах (втором, пятом, восьмом и деся-
детерминанты, отвечающие за несколько
ps — пресутуральные;
ра — посталярные;
ог* и or2—1 — первая вторая — третья
орбитальные;
ос — оцелярные;
sc — скутеллярные;
pv — поствертикальные;
сх — коксальные;
si стернитальные;
h гумеральные;
w — смятые крылья
183
ДРОБИМОСТЬ ГЕЛА
ние»), а подсчитывалось потомство исследуемых мух, в нем отдель-
но определялось число мух с редукцией каждой из индивидуальных
щетинок и после этого определялась величина редукции в процен-
тах. Преимущества этого метода со всей полнотой выявились при
анализе так называемых компаундов, когда в одной клетке после
скрещивания оказывались два различных аллеля гена scute.
Особенно важным для решения вопроса о том, локализуются
ли разные аллели генов scute и achaete в разных участках локусов
(понимая под локусом физическую длину участка хромосомы, за-
ключающего данный геи, по Стертеванту, Мёллеру и Бриджесу,
Proc. Nat. Ac. Sci. U.S.A., 1915, стр. 155), явилось объединение в
одной зиготе гомологов, несших разные аллели ряда scute — achae-
te (такое объединение и получило наименование компаунд). Сам
процесс объединения не представлял труда при наличии самки, го-
мозиготной по одному аллелю (скажем, А), и самца с аллелью
Б его Х-хромосомы. Все самки от такого скрещивания будут нести
сразу и аллель А, и аллель Б. Компаунды всех аллелей скьют-ахе-
та подчинялись строгому правилу. Во-первых, центры базигенов,
подвергнувшиеся мутации в обоих аллелях компаунда, оставались
мутантными и в компаунде, причем степень затронутости почти
всегда соответствовала цифре наименьшего подавления (табл. 19).
Во-вторых, в тех случаях, когда один из центров базигена у од-
ного из членов компаунда был нормальным (диким), а у второго
либо полностью, либо частично подавлен, из такой зиготы разви-
валась нормальная по данному признаку муха.
Весьма интересно для нас то обстоятельство, что именно ана-
лиз компаундов привел авторов ступенчатого аллеломорфизма к
обнаружению явления, называемого сейчас комплементацией. По-
ясним это на примере компаундов sci-j-scs и scs+sce. Как видно
из карты скьютовых мутантов (рис. 53), sci имеет два центра, об-
щих scs (скутеллярные и стернитальные щетинки). То же самое
касается аллеломорфов scs и see. Однако компаунды этих аллело-
морфов дали по всем центрам (включая центры, общие для чле-
нов компаунда) стопроцентное восстановление дикого фенотипа.
Таким образом, уже в 1929 году задолго до работ Д. Понтекорво и
Льюиса (Lewis, 1951; Pontecorvo, 1953) явление комплементации
было открыто в опытах по изучению ступенчатых аллеломорфов
scute — achaete. Вместе с тем абсолютное незнание молекулярного
устройства генетического материала, а также механизмов функци-
онирования генов не позволило разобраться в причинах явления.
Последнее было сделано лишь спустя 30 лет.
В этих же работах по ступенчатому аллеломорфизму впервые
была сделана попытка разобраться в вопросе расположения генов
по хромосоме и о наличии межгенного вещества. Согласно воз-
зрениям классической генетики каждый ген отделен от соседних
Таблица 19 Степень редукции щетинок у мух, несущих одну или две мутации scute в гомозиготном и гетерозиготном состоянии ♦
Тип щетинок на теле мухи Отсутствие щетинок на теле мух, %
cf sci 9 221. SC1 сГ sc3 о 221 SCj cTsc3 О" sc4 9 * sct 9 SCj о 221 sc4
Оцелярные 98 95 0 0 1 44 1 100 95-98 0 44
Поствертикальные 91 61 12 6 97 88,2 61-88 12,6 88
1-я и 2-я орбитальные 99 82 2 0 83,5 100 82—99 2 83
3-я орбитальная 0 0 1 0 48 100 0 1 48
1-я вертикальная 0 0 1 0 82 0 0 1 0
2-я вертикальная 0 0 0 0 41 100 0 0 41
Дорзоцентральная 0 0 0 0 0-76 о 0 0 0 0
Передняя скутеллярная 71 30 70,5 37 8 100 30—71 70— 8
Задняя скутеллярная 91 90 91,5 85 2 100 90 85-91 2
1-я гуморальная 0 0 13 12 5 100 0 10 5
2-я гуморальная 0 0 38 37 35 Б* Ф 100 0 37 35
Пресутуральная 0 0 0 2 70 Е5 100 0 0 70
1-я нотоплевральная 98 93 0 0 94 91 91—98 0 91
2-я нотоплевральная 0 0 0 0 17 4 0 0 4
Супраалярные 0 0 0 0 53 0 0 0 0
Посталярныо 0 0 0 0 25 38 0 0 25
Щетинки между 1-й и 2-й парами ног 0 0 0 0 100 100 0 0 100
♦Цифры означают процент редукции щег гок у муг
melanogaster
О — отсутствие редукции; 10Э — по i юе подавление щетинок на теле Drosophila
185
ДРОБИМОСТЬ ГЕНА
Рис. 53. Взаимное расположе-
ние мутантов scuteh scute5,
scute6
генов межгенным веществом, не несущим наследственной инфор-
мации. Изучение структур гигантских хромосом, казалось бы, це-
ликом и полностью подтверждало справедливость этой точки зре-
ния. Наличие дисков и междискового материала хромосом привело
ряд цитологов к точке зрения, что именно диски несут генную ин-
формацию, а междисковое вещество генетически инертно.
Однако опыты по ступенчатому аллеломорфизму позволили
взглянуть на проблему упаковки гепов в хромосомах по-новому.
Большинство аллелей действительно располагалось внутри либо ба-
зигепа scute, либо базигена achaete (sci, SC2, SC4, SC5, see, sc?, SC9,
scio, sen, SC13), что свидетельствовало в пользу утверждения об
отсутствии непрерывного расположения генов в хромосомах. Бо-
лее того, Дубинин (19316) показал, что границы каждого из бази-
генов (табл. 20) отмечены участками, мутирование которых при-
водит к летали. После обработки солидного экспериментального
материала (только в Fi было изучено 172 947 особей обоего пола —
92 685 и 80 262) Дубинин построил кривую частоты мутирования
по разным центрам базигенов (рис. 54), которая отчетливо пока-
зала, что по краям базигенов расположены летальные центры.
Тогда же Дубинин высказал интересное предположение о том, что
представляет собой межгенный материал, приписав ему функцию
деталей.
Несмотря на, казалось бы, прочный фундамент фактов о нали-
чии межгенных участков хромосом, нашлись факты, противоре-
чащие этому утверждению. Два аллеломорфа scute — achaete, най-
денные Дубининым, а именно SC3 и sc 13, вносили разлад в строй-
ное построение гипотезы генов и межгенного вещества. Эти му-
тации распространялись па протяжении обоих базигенов и почти
целиком захватывали их. Представление об отграпичепности ге-
нов следовало пересмотреть, что и сделал Дубинин уже в первом
сообщении (Дубинин, 1929). «Приведенные факты заставляют нас
говорить о непрерывности хромосомы, где один ген непосредствен-
но переходит в другой» — писал он. Непрерывный характер рас-
положения генов был затем провозглашен Ф. Г. Добржанским в
его афоризме — «хромосома как континуум» (Dobzhansky, 1932).
Конечно, в те годы, когда никаких сведений о строении генети-
Таблица 20
Степень проявления щетинок у различных мутантов scute, /0
Мутант Деталь so10 Дорзоцент- ральная Вертикаль- ная 1-я Супрааляр- ные Логаль sc3 Вертикаль- ная 2-я Вентральные Нотопле- вральная 2-я Пресутураль- ная Нотопле- вральная 1-я Орбитальная 3-я Носталярные Орбитальные 1-я и 2-я О цел ирные Коксальные Постверти- кальные Скупелляр- ныо Гуморальные Г Лета п> sc2
1’0 de Vi sa I3 vt Пз ps П1 ог3 ра ог1-2 ос сх pv 11
scute 1 100 1 100 1 100 100 100 100 100 1 2 100 100 1 2 0 ' 9 ’ 1 19 100
scute 2 100 99 100 100 100 100 100 100 99 100 98 100 96 88 19 75,5
scute 3 24 8 47 59 0 83 30 6 52 75 6,5 56 — 3 95 80
scute 4 100 100 100 0 0 96 0 9 0 62 0 0 0 18 0 0
scute 5 100 100 100 о 100 100 100 100 100 100 100 100 100 100 100 80 100
scute 6 к 100 100 100 100 100 100 100 100 93 99 1,5 0 0 27 8,1 92,2 о И
scute 7 ►Q 100 100 100 л 100 100 100 100 100 84 71 0 0 0 15 0 100 л
scute 8 сб 95 100 66 100 100 100 99 100 100 100 100 100 100 100 100 99,5
scute 9 © 99,3 100 97 ф 100 100 100 100 12 95 95 0 0 0 0 । 0,5 98 ф
scute 10 >—- 15 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100
scute И 100 100 100 100 98 100 100 100 100 100 100 100 100 100 100 100
scute 12 100 30 100 100 100 100 83 100 10 97 1,5 22 15,5 57 49 94
scute 13 0 96 86 100 100 99 98 4 94 87 0 2 0 21 0 100
187
ДРОБИМОСТЬ ГЕНА
Относите,
частота
возникновения
мутаций
Рис. 54. Кривая частоты мутирования в гене
скьют
ческого материала не было, всякие попытки объяснить эту непре-
рывность генов были тщетны. Позже Дубинин (1956) возвращал-
ся к представлению о хромосоме как континууме и пытался обос-
новать его, базируясь на данных молекулярной генетики. Однако
лишь в 1964 г. Дубинин (1964), хотя и в осторожной форме, при-
знал структурную обособленность генов, приводя в качестве при-
мера цистроны А и В области rll бактериофага Т4. Но исследова-
ние именно этой области привело к ситуации, вполне аналогичной
случаю SC3 и sci3. С. Бензер (1960) открыл делецию г1589, затра-
гивающую правый конец цистрона А (его подобласти А3, А4, А5,
Аб) и начало цистрона В. При этом функция цистрона А терялась
целиком, а функция цистрона В оставалась почти не поврежден-
ной (Champe, Benzer, 1962).
Эту делецию изящнейшим образом использовали Ф. Крик и
сотр. (Crick et al., 1961), показав, что мутации могут объединить
оба гена А и В. Обычно мутации в цистроне А пе влияли па мута-
ционный процесс в цистроне В и наоборот; это подтверждало точ-
ку зрения, что между этими цистронами имеется область, которая
разделяет их, позволяя каждому цистрону функционировать неза-
висимо друг от друга. Однако у фагов, несших делецию г1589,
первая же мутация в левом конце цистропа А, нарушившая пра-
вильность считывания триплетов, привела к нарушению чтения и
на всем протяжении цистрона В. В дальнейшем авторы нашли не-
сколько таких же делеций, связывавших цистроны А и В в единое
целое. При наличии любой из них создавалась ситуация, когда оба
цистрона почти целиком выключались в результате мутаций.
После этих опытов стало возможно не только говорить о том,
что в ряде случаев функциональное объединение генов имеет
РАЗВИТИЕ ПРЕДСТАВЛЕНИЙ О ГЕНЕ КАК СИСТЕМЕ
188
место, но и указать на молекулярный механизм, приводящий к та-
кой интеграции. Выше, при разборе данных о природе генетическо-
го кода, упоминалось, что среди 64 кодонов было найдено три так
называемых нонсенс-кодона. не соответствующих ни одной амино-
кислоте и приводящих к обрыву чтения гена. Было установлено
экспериментально, что именно эти кодоны формируют конечную
границу гена.
При изучении молекулярных механизмов функционирования
генов удалось выяснить и один из возможных механизмов ини-
циирования генной активности. Оказалось, что у бактерий началь-
ной тонкой в информационной РНК является кодон для метиони-
(говой аминокислоты, а транспортной РНК, узпатотцей этот ко-
дон. служит формплметттонпповая т-РНК.
Таким образом, последние достижения молекулярной генетики
позволили нарисовать точную картину функционирования генети-
ческого материала, заключенного в пределах цистронов.
Как же можно представить себе молекулярную организацию
межгенного материала? Примыкает ли нопсепс-кодон предыдущего
гена к инициирующему кодону последующего или между ними мо-
жет лежать область, «пустая» в информационном смысле?
Можно высказать три соображения по этому поводу.
Прежде всего следует сказать, что вряд ли имеется тесное при-
мыкание генов друг к другу. Об этом свидетельствуют данные по
топологии и топографии генов; скорее надо признать, что между
генами лежат достаточно протяженные области ДНК, и фермент'’
обеспечивающим генную активность, приходится пройти по ДНК
некоторое расстояние от обрывающего кодона, прежде чем они со-
прикасаются с начальным кодоном. Весьма возможно, что именно
в этой области располагаются управляющие ячейки генной актив-
ности. Речь идет не только об операторных участках, но и о д^лт
гих структурах (папримеп. подавно открытый промотор, к кото-
рому присоединяется РНК-полимераза). которые могут участво-
вать в управлении активностью оперопов.
Таким образом, пространство, заключенное между генами, мо-
жет рассматриваться как «пустое» в смысле синтезов информаци-
онной РНК для определенных ферментов, по оно может быть за-
полнено другими функциональными единицами гепной активности.
Второе соображение, касающееся природы межгенного вещест-
ва. заключается в том, что отсутствие информативной функции в
этих участках должно приводить к их мутационной инертности.
Явление резкого падения частоты мутаций (практически до нуля),
отмеченное в опытах Н. П. Дубинина со скьютами, получает таким
образом объяснение.
Наконец, возможно, что предположение Дубинина о летальнос-
ти повреждений межгенных участков также имеет под собой реаль-
ную молекулярную основу, ибо весьма вероятно, что наличие в
189
ЭФФЕКТ ПОЛОЖЕНИЯ. ПЛЕЙОТРОПИЯ. ГЕНОТИПИЧЕСКАЯ СРЕДА
этих участках структур, управляющих генной активностью, при
повреждении их будет приводить к инактивированию всего гена
или даже ряда генов (оперона в целом) и, следовательно, к летали.
Заканчивая этот раздел, следует еще раз подчеркнуть, что те
представления о гене, которые сложились в период, часто называ-
емый классическим, и обобщенные формулой «гоп — единица фун-
кции, мутации и кроссинговера», оказались во многом неверными.
Исследование ступенчатого аллеломорфизма показало функцио-
нальную и физическую дробимость гена, обнаружило явление ком-
плементации, вплотную подошло к решению проблемы топографии
генов в хромосомах.
Дальнейшее уточнение взглядов па геп было связано с исследо-
ваниями эффекта положения гена.
Эффект положения генов.
Плейотропное действие генов.
Генотипическая среда
Согласно старым взглядам (Мендель, де-Фриз) каждый отдельный
ген лействует на свой индивидуальный признак, и проявление геп-
не зависит не только от внешних воздействий, но и от г ого, в ка-
ком месте он находится. Для Менделя вопрос о соседях данного
гена на хромосомах вообще был лишен смысла, так как ему р
было ничего известно о локализации генов в клетке. Со времени де-
Фриза фактов о внутрихромосомпом расположении геттов было на-
коплено уже достаточно, по тем по метгое вопрос о том, только ли
однтгм признаком ограничивается эффект одного гена, оставался
открытым. Однако, уже в 1913 г. Плате (Plate, 1913) формулиру-
ет представление о множественном, плейотропном действии гена,
а в 1926 г. С. С. Четвериков выдвигает гипотезу о так назы-
ваемой «генотипической среде» (т. е. зависимости проявления ге-
нов от их перестановки в хромосомах и связанной с этим переме-
ной <в их фенотипическом проявлении) и привлекает внмание к
изменению активности гена при перемене места в хромосоме.
В пользу взглядов Четверикова были выполненные незадолго
до этого опыты А. Стертеванта (Sturtevant, 1925), обнаруживше-
го так называемый position effect гена Ваг. Стертевант, изучая
наследование особенностей строения глаз у Drosophila melanoga-
ster, наткнулся на интересный факт наследственной изменчивости
числа фасеток у мух. Была найдена мутация Ваг, снижавшая в го-
мозиготных по этому гену особях число фасеток в глазу до 68—70
(рис. 55). Затем Стертевант обнаружл явление неравного перек-
реста, когда перекрест прошел между смещенными друг относи-
тельно друга хромосомами, в результате чего в одной хромосоме
оказались оба тана Ваг, а другая стала свободной от них (рис. 56).
РАЗВИТИЕ ПРЕДСТАВЛЕНИЙ О ГЕНЕ КАК СИСТЕМЕ
190
<^4^
Гетерозит
ный В;и Ваг
Гстерозигог- Дубль
ный дубль Ваг Ваг
Дикий тип
Рис. 55. Мутанты гена Ваг
Цифры указывают число фасеток в глазе мутанта
Согласно общепринятой точке зрения такое явление пе должно
было иметь последствий для фенотипа, ибо число генов Ваг в од-
ной клетке осталось неизменным. На деле Стертевант обнаружил
явный эффект от перемены места. Вместо 68,12 ± 1,09 фасеток на
В
глаз у мух с расположением генов------, это число снизилось до
В
В В
45,42 ± 0,24 у мух с таким расположением генов Затем
Стертевант выявил мутацию infra-Bar, которая в гомозиготном
состоянии давала возможность развиться 348,4 ± 12,4 фасеткам,
а при переходе их в одну хромосому при неравном перекресте это
Рис. 56 Циг
анализ мутантов Ваг
191
ЭФФЕКТ ПОЛОЖЕНИЯ. ПЛЕЙОТРОПИЯ. ГЕНОТИПИЧЕСКАЯ СРЕДА
число редуцировалось до 200,2. Вывод, к которому пришел Стер-
тевант, заключался в том, что «два аллеломорфа Ваг, лежащих в од-
ной и той же хромосоме, более эффективны, чем те же два алле-
ломорфа, когда они лежат в разных хромосомах» L Вместе с тем
аргументировать эту точку зрения до конца Стертевант не мог,
так как он был лишен возможности доказать, что во время пере-
хода гена из одной хромосомы в другую не происходит его мута-
ционного изменения. В 1932—1934 гг. Пайнтер, Бриджес и Гейтц
описали новый метод цитогенетического изучения с использовани-
ем гигантских хромосом из слюнных желез двукрылых (Diptera),
обнаруженных еще в XIX веке (Бальбиани). Изучение структуры
этих хромосом открыло блестящую возможность непосредственно
следить за перемещениями хромосомного материала при кроссин-
говере, после чего Мёллер, Прокофьева-Бельговская и Косиков
(1936) и одновременно с ними Бриджес (Bridges, 1936) показали,
что при «эффекте положения» гена Ваг, описанном Стертевантом,
действительно имеется переход дисков, охарактеризованных как
ген Бар, в соседнюю хромосому. Но опять-таки окончательно от-
бросить подозрение в мутационном характере эффекта на основа-
нии своих данных они не могли.
В 1932 г. Ф. Г. Добржанский (Dobzhansky, 1932) описал но-
вый пример эффекта положения, связанный с внедрением куска II
хромосомы в Х-хромосому в непосредственной близости от гена Ваг.
В этом случае наблюдалось изменение глаз типа Baroid. Однако
то же подозрение в мутационной природе эффекта оставалось в
силе (разрыв Х-хромосомы мог затронуть ген Ваг и привести к
мутации Baroid).
Достаточно четкое решение вопроса содержала работа Лилиан
Морган (Morgan, 1933). При разрыве сцепленпых Х-хромосом ей
удалось выявить муху, у которой одна из Х-хромосом оказалась
циклической (правый конец соединился с левым, образовав
кольцевую хромосому). Эта «closed» хромосома изменила фенотип
гомозиготных по ней самок, а также самцов, несших такую коль-
цевую хромосому: жизнеспособность и плодовитость особей оказа-
лась пониженной, возникли аномалии строения глаз и ног.
Но стоило кольцевой хромосоме разорваться и стать линейной,
как все эти ненормальности исчезали. Тем самым эффект на хро-
мосомном уровне был доказан. Но доказательства эффекта на ген-
ном уровне получено не было, хотя фактов о возможной роли ме-
ста гена в хромосомах в его проявлении накапливалось все боль-
ше (см. обзор литературы в статьях Н. П. Дубинина и Б. Н. Си-
дорова, 1934; Lewis, 1945; Baker, 1968). Стгверцева-Добржанская и
Добржанский (Sivertzeva-Dobzhansky, Dobzhansky, 1933) описали
1 Slurlevant, 1925, стр. 118.
РАЗВИТИЕ ПРЕДСТАВЛЕНИЙ О ГЕНЕ КАК СИСТЕМЕ
192
понижение доминантности по отношению к гену bobbed яри дуп-
ликациях правых кусков Х-хромосомы. Большое число данных для
генов purple, light, rudimentary, forked и др. было приведено
Добржанским и Стертевантом (Dobzhansky, Sturtevant, 1932).
Но те же авторы пришли к выводу, что ни в одном случае пет чет-
кого доказательства роли изменения положения гена в изменении
его активности. Мёллер н Альтенбург (Muller, Altenburg, 1930)
особенно показательным в этом смысле считают то, что в боль-
шинстве случаев изменения типа эффекта положения сопровож-
дают хромосому-донор (от которой отрывается кусок), но пе хро-
мосому-реципиент (к которой этот кусок присоединяется).
Опровержение последнего утверждения было получено в ра-
боте И. 11. Дубинина и 1). 11. Сидорова (1934). Авторы изучили
19 транслокаций кусков из I, II и III хромосомы на IV хромосо-
му Dr. melanogaster, а также куска V хромосомы на IV в пятихро-
мосомной мухе Дубинина (Дубинин, 1936а). Ровно в половине
всех случаев транслокаций авторы отметили изменение в прояв-
лении гена cubitus interruptus, обнаруженного Типяковым в IV
хромосоме (Тиняков, 1931). Ген cubitus interruptus (с. i.) — ре-
цессивный и вызывает перерыв кубитальных жилок крыла. Схема
опыта была такова: у самок, гомозиготных по дикому гену с. i.,
к IV хромосоме присоединяли кусок любой другой хромосомы с ка-
ким-либо сигнальным геном; таких самок скрещивали с самцами,
гомозиготными по рецессивному мутантному гену с. i. В резуль-
тате скрещивания должно было получиться (рис. 57) все потом-
ство, нормальное по гену с. i., так как все мухи несли рецессивную
мутацию с. i. в гетерозиготном состоянии. Однако в половине мух,
которые имели транслокацию кусков хромосом на IV хромосому,
доминантность нормального гена с. i. исчезла, а рецессивная му-
тация с. i. стала доминантной. В разных транслокациях степень
снижения доминантности была разной, но выяснить, с чем это
связано, авторам не удалось; во всяком случае длина транслоциро-
ванпого куска роли не играла.
Чрезвычайно высокая частота возникновения изменений до-
минантности гена с. i. позволила авторам высказать достаточно
обоснованное суждение, что «возможность в любом количестве
раз (50% транслокаций) изменить действие гена с. i... является
сильным прямым доказательством эффекта положения». В следу-
ющем году Дубинин и др. (1935), использовав хромосомы слюн
пых желез, показали, что когда у IV хромосомы отрывается прок-
симальный, чрезвычайно малый по длине кусок, несущий место
прикрепления нити веретена, и к месту разрыва присоединяется
генетически активный (эухроматическая часть) кусок любой хро-
мосомы, эффект положения наблюдается. Присоединение инерт-
ного материала (гетерохроматиновая часть) не сказывается на
активности геиа (исключение составляет Y-хромосома).
193
ЭФФЕКТ ПОЛОЖЕНИЯ. ПЛЕЙОТРОППЯ. ГЕНОТИПИЧЕСКАЯ СРЕДА
Положение участков хромосом
Эффект
Влияние эффекта положения
Нормальные хромосомы
Транслокация Ш-ей хро-
мосомы на IV хромосому
Рецессивная мутация с.1.
подавляется нормальным
аллелем с.1/
Рецессивная мутация c.i
проявилась
Рис. 57. Эффект положения гена «прерывание жилки»
Так как ген с. i. был локализован авторами в непосредственной
близости от этой точки, то возникло предположение, что измене-
ние доминантности может быть обусловлено все-таки мутацией
(повреждением гена с. i. во время разлома хромосом). Однако ав-
торы экспериментально отвергли эту возможность, выяснив, что
между с. i. и местом разрыва хромосомы иногда оказывается ген
bent, который, «пропуская через себя действие эффекта положения,
не изменяется в такой мере, чтобы это реализовалось сколько-ни-
будь заметно при развитии особи». Последнее обстоятельство было
сильнейшим аргументом в пользу именно эффекта положения, ио,
как правильно отмечали Дубинин и Сидоров (1934, стр. 329),
«полную законченность доказательство получило бы, если бы мы
смогли восстановить через транслокацию постороннего куска в IV
хромосоме исходную структуру IV хромосомы и обнаружить вслед
ствие этого исчезновение эффекта положения».
Это Дубинину и Сидорову удалось осуществить при изучении
эффекта положения гена hairy (Дубинин, Сидоров, 1935). Исход-
ные мухи были гетерозиготны по гену hairy, признак при этом не
проявлялся. Затем IV хромосому путем транслокации объединили
с III, несшей до этого нормальный аллеломорф h, причем разрыв
последней прошел вблизи участка hairy-scarlet, что привело к
проявлению в фенотипе прежде подавленного рецессивного призна-
ка h. После этого путем кроссинговера удалось поменять местами
h и h+ аллели, и как только h+ перешел в хромосому без трансло-
кации, он снова вернул способность подавлять проявление ал-
леля h. Затем авторы еще раз с помощью кроссинговера ввели в
хромосому с транслокацией ген h+, а в парную хромосому — его
мутантный аллель h и снова обнаружили у мух проявление ал-
леля h. Тем самым Дубинину и Сидорову удалось окончательно
Доказать справедливость утверждения о том, что положение гена
7 В. H. Сойфер
Развитие представлений о гене как системе
194
в системе других генов сказывается на его активности, и еще раз
продемонстрировать исключительную важность представлений
о роли целостной системы генов (генома) в функционировании от-
дельных членов этой системы.
Прямые доказательства эффекта положения, полученные Ду-
бининым и Сидоровым для генов cubitus interruptus и hairy (1934,
1935), Паншиным (1935) для гена curled, Джуддом (Judd, 1955)
для гена white у Dr. melanogaster, Бейкером (Baker, 1954) для ло-
куса peach у Dr. virilis, Расселом и Бангамом (Bussell, Bangham,
1961) для локуса brown у мышей, не только сияли сомнения в
реальности существования этого явления, но и показали его широ-
кую распространенность.
Несмотря на убедительность данных относительно эффекта по-
ложения, в настоящее время мы не можем попять причины его
возникновения, и остается прибегать лишь к спекуляциям отно-
сительно возможной роли различных генов-регуляторов, иод вли-
яние которых попадает тот или иной ген при изменении его места
положения, роли функционально различных участков (гетеро- и
эухроматина) хромосом или же влияние па гены, ответственные за
синтез разных видов РНК, в том числе т-РНК и рибосомной РНК.
Следует также указать, что в вопросе взаимодействия генов
существовал, да и сейчас существует исключительный разнобой в
мнениях. Уже упоминалось понятие плейотропного действия ге-
нов, т. е. состояния, при котором «каждый ген зародышевой плаз-
мы воздействует на несколько или даже на многие части тела»
(Морган). Четвериков (1926) ввел понятие «генотипическая сре-
да», которым он пытался объяснить роль перемены места генов
в геномах в эволюции. Но несмотря па важность изучения плейо-
тронии генов, роли генотипической среды в эволюции и других
процессов интерференции генов, они остаются мало исследованны-
ми и требуют дальнейшей разработки.
Возрождение исследований проблемы гена
на молекулярном уровне
От исследований дробпмости гена, взаимодействия генов при эф-
фекте положения, выяснения частоты прямых и обратных мута-
ций исследователи перешли к изучению так называемого псевдо-
аллелнзма. Оказалось, что с помощью кроссппговера можно разде-
лить гены, дающие одинаковый пли близкий фенотипический
эффект. Это явление удалось обнаружить у дрозофилы (Lewis,
1945, 1951; Green, Green, 1949: Green, 1954; McKendrick, Ponte-
corvo, 1952), кукурузы (Laughnan, 1949), ячменя (Stephens, 1951),
аспергилла (Roper, 1950; Pontecorvo, 1953) и нейроспоры (Giles,
1951).
195
ПРОБЛЕМА ГЕНА НА МОЛЕКУЛЯРНОМ УРОВНЕ
Изучение псевдоаллелизма вплотную подвело генетиков к ре-
шению проблемы о функциональном взаимодействии генов и об-
наружению метода изучения этой функциональности, так называе -
мому цис-транс-тесту.
Для характеристики экспериментальной базы этих исследова-
ний у высших организмов разберем одну из первых работ по псев-
доаллелизму, выполненную Грином и Грин в Миссурийском уни-
верситете в США (Green, Green, 1949). Авторы изучали мутации
глаз у дрозофилы и обнаружили, что один и тот же ген lozenge
может находиться в трех аллельных состояниях: lozenge-glossy
(lzK), spectable lozenge (lzs) и нести дикий аллель гена lozenge
(lz+). В скрещиваниях lzgXlzs авторы обнаружили потомство ди-
кого типа lz+ и потомков, несших сразу два аллеля lzg и lzs.
На этом основании они пришли к выводу о существовании пе
одного, как считали ранее, а двух, расположенных в различных
точках хромосомы генах lozenge, хотя оба гена приводили пример-
но к одинаковому фенотипическому выражению. В дальнейшем
были получены еще несколько аллелей, дающих сходный феноти-
пический эффект (изменение морфологии глаза, редукция глазно-
го пигмента, бесплодие самок, несущих эти гены).
Рекомбинационный анализ показал, что можно легко объяснить
эти «странные» совпадения в фенотипическом выражении и раз-
личную локализацию в хромосоме у данных аллелей, если считать,
что они на самом деле пе аллели одного гена, а аллели разных ге-
нов, расположенных рядом и контролирующих одну или несколь-
ко сходных функций. В частности, следовало признать, что при-
знак lozenge контролируется тремя расположенными рядом ге-
нами.
Это открытие внесло принципиальное изменение в традицион-
ную концепцию гена. Оно показало, что структуры, которые на
основании морфологических критериев оценивались как единый
ген, при более детальном анализе предстали в гораздо более слож-
ной форме. Теперь можно было говорить с несомненностью не
только о дробимом гене, но и о гене как системе, об архитектонике
генов и об их иерархии.
Однако наиболее полное и убедительное доказательство этот
положения было достигнуто в экспериментах на молекулярном
уровне. Речь идет прежде всего о работах С. Бензера (1955—
1963 гг.). Бензер, как уже упоминалось в первой главе, разработал
простую методику работы с г! 1-мутантами фага Т4. Он выделил
несколько сотен таких мутантов и предпринял кропотливую рабо-
ту по картированию их внутри гена. При этом он столкнулся с
весьма примечательным фактом, г! 1-мутанты фага Т4, высеянные
на газоне Е. coll К12 (X), хотя и могут инфицировать клетки, но
не могут дать полноценное потомство и лизировать клетки. Таким
образом, потомства (в феногенетическом выражении — бляшек)
7*
РАЗВИТИЕ ПРЕДСТАВЛЕНИЙ О ГЕНЕ КАК СИСТЕМЕ
196
фага Т4 rll на газоне Е. coli К12 (Л) получить невозможно. Одна-
ко Бензер отметил, что при одновременном заражении клеток не
одним типом мутантов, а двумя мутантными фагами удается по-
лучить бляшки, причем анализ потомства показывает, что пример-
но половина его остается первым типом мутантов, а вторая поло-
вина несет вторую гП-мутацпю.
Таким образом, два мутанта как бы дополняли друг друга, ком-
плементировали, за счет чего и возникала бляшка. Следовало при-
знать, что мутантные фагп первого типа давали какой-то один не-
поврежденный продукт, ответственный за образование бляшек на
Е. coli К12 (Z), а фаги второго типа давали второй продукт.
Дальнейшее усложнение анализа было связано с тем, что Бен-
зер решил вводить в клетки Е. coli 1£12 (Л) одни и те же мутант-
ные фаги, но в разных сочетаниях. В одном случае клетки зара-
жались мутантами, несущими по одной мутации (транс-поло-
жение):
----------------------------------Фаг несущий первую
мутацию
--------------------------;с------Фаг несущий вторую
мутацию
В другом случае клетки заражались фагами, несущими сразу
обе этих мутации (г/ас-положение), и диким фагом:
-------X------------------И-------Фаг, несущий первую
и вторую мутации
---------------------------------— Дикий фаг
Этот метод анализа и получил название цис-транс-чесл. Использо-
вав его, Бензер обнаружил, что не всякая пара г! 1-мутантов, взя-
тых в транс-форме, может дать бляшки. Все мутанты разделились
на два типа. Одни комплементпровалп друг с другом (иначе го-
воря были псевдоаллельны, относились к разным генам, или цис-
тронам, как назвал их Бензер), другие не комплементировали друг
с другом и должны были рассматриваться как представители од-
ного цистрона.
На этом основании С. Бензер пришел к выводу, что хотя по
фенотипу rll-мутанты не различимы, они сосредоточены в двух
функционально различных областях (генах, или цистронах)
(рис. 58).
И при анализе псевдоаллелизма, и при разработке цис~транс-
анализа исследователи изучали взаимодействие мутантов, отно-
сящихся так или иначе к разным генам, которые отличались не
только функционально, по и топологически.
, ФУ ! <j»^ , g 8 g У q , , , I , г -*-r- - 4- - -,-ft4 9 9? r9-£
Albi Alb‘2 A2a A2bA2cA2d A2f A2g
A2e Д2Ы
Puc. 58. Расположение ril-мутантов фага T4
РАЗВИТИЕ ПРЕДСТАВЛЕНИЙ О ГЕНЕ КАК СИСТЕМЕ
198
Цистроны
ДНК
и-РНК
Полипептид-
ные цепи
Ферменты
Цепь
реакций
Рис. 59. Структура гистидиновой области Е. coli
Между тем Бензеру удалось перебросить мост между класси-
ческими и молекулярногенетическими экспериментами и в другом
важном аспекте проблемы гепа, а именно: в рекомбинационной
дробимости гена. Выше подробно излагались данные Дубинина
и др. по изучению мутационной дробимости гена scute. Выделение
более двух десятков субгенов в пределах базигена scute неопро-
вержимо доказало мутационную дробимость гена, но оставался
открытым вопрос о том, можно ли раздробить ген с помощью крос-
синговера.
Для высших организмов решение этого вопроса представляло
исключительно трудоемкую задачу. Не обладая методом селекции
пли накопления рекомбинантов среди нерекомбинантов, исследо-
ватели должны были вручную просмотреть десятки тысяч мух,
если они надеялись на то, что процесс перекреста внутри одного
гена может иметь место.
Экспериментальное решение этого вопроса было достигнуто
Н. П. Дубининым, Н. Н. Соколовым и Г. Г. Тиняковым (Dubinin
et al., 1937), которые сумели раздробить ген scute. Для этого им
пришлось проделать фантастическую по объему работу: осущест-
вить и проанализировать результаты 75 тысяч скрещиваний у дро-
зофилы. Через несколько лет Льюис осуществил такой же резуль-
тат на дрозофиле, просмотрев сто тысяч мух.
199
ПРОБЛЕМА ГЕНА НА МОЛЕКУЛЯРНОМ УРОВНЕ
С. Бензер воспользовался исключительно благоприятными воз-
можностями фагов, позволяющими работать с популяциями в мил-
лионы и миллиарды особей, и на системе rll-мутаций доказал, что
внутри гена локализовано примерно столько мутантных точек,
сколько нуклеотидов расположено в этом гене, и что в принципе
каждый мутантный сайт может быть отделен с помощью рекомби-
нации от соседних мутантных сайтов.
Тем самым Бензер пришел к решению трех важнейших проб-
лем. Он доказал принципиальную «равноправность» генов выс-
ших организмов и микробов, обосновал положение о различиях
между единицей рекомбинации, которую он назвал реконом, еди-
ницей мутации, названной им мутоном, и единицей функции —
цистроном, установил конкретную величину каждой из этих
единиц.
В дальнейшем был проведен анализ не только фаговых, но и
многих бактериальных генов. Этот анализ убедительно доказал
дробимость гена и сложность его организации.
Рис. 59 иллюстрирует на примере гистидиновой области бакте-
риальной хромосомы структурную сложность генетического ап-
парата.
10
Мутационная теория:
синтез имеющихся данных
и причины мутагенеза
Мутационная теория за время своего существования, в течение
XX века, испытала несколько серьезных потрясений. Главным из
них было открытие 30—40 лет тому назад возможности искусст-
венного вызывания мутаций радиацией и химическими агентами
и создание 10—15 лет тому назад молекулярной теории мутаций.
Сейчас, по-видимому, наступает третий важнейший этап в разви-
тии теории мутаций. Он связан с раскрытием тех причин и усло-
вие, которые обеспечивают осуществление самого механизма
становления мутаций.
Молекулярная природа изменений
в структуре ДНК при появлении мутаций
После того как Криком, Уотсоном и Гамовым было сформулиро-
вано представление о записи генетической информации, описы-
вающее ее как чередование оснований в структуре молекул Днк
(и соответственно РНК), открылась возможность определить мо-
лекулярные основы мутационного процесса. Любое изменение в
генетической записи, осуществленной чередованием нуклеотидов
в молекулах нуклеиновых кислот, должно приводить к мутациям.
Естественно, что с точки зрения «морфологии» записи можно было
предложить два основных способа изменений структуры гена (рис.
60): точечные и протяженные мутации. Под точечными мутация-
ми подразумеваются изменения, касающиеся отдельных нуклеоти-
дов: замена нуклеотида, выпадение и вставка нуклеотида. При
протяженных мутациях, когда изменение захватывает несколько
нуклеотидов, возникают: выпадение отрезка полинуклеотидной
цепи; вставка; транслокация, т. е. перенос группы оснований в
другое место внутри гена; инверсия \ т. е. поворот отрезка поли-
нуклеотидной цепи на 180°
1 Процессы транслокаций и инверсий в генетической литературе принято
описывать как простые акты присоединения фрагментов ДНК (или хро-
мосом) к другим участкам ДНК с поворотом на 180° или с сохранением
прежнего направления сахаро-фосфатной цепи. Однако несомненно, что
201
МОЛЕКУЛЯРНАЯ ПРИРОДА ИЗМЕНЕНИЙ
Рис. 60. Молекулярные меха-
низмы возникновения мута-
ций при изменении структуры
ДНК. Кружками отмечены
нуклеотиды. Их порядок по-
казан цифрами
а — нормальная структура ДНК;
б — замена оснований в ДНК (ос-
нование 4 заменено на 4', что
привело к замене пары осно-
ваний; показано черными
кружками);
в—точечная деления (пятая
ра нуклеотидов выпала);
г — точечная вставка (между 3
и 4 парами нуклеотидов вне-
дрилась лишняя пара);
д — протяженная делеция (пары
5, 6 и 7 делетированы);
е — транслокация (участок 4,
и 6 переместился на новое
место);
ж — инверсия (участок 4, 5 и 6
повернут на 180°)
1 23456789
з—з з з з з 6—
Q О О О Q О О QO
1 23 4' 567 89
л 3 66136666
° О 9 9 9 9 9Q Q О
1 2 3 4 6 7 8 9
Й 6 6 6 6 Г'6"3‘ 3
9 0000000
123 456789
2 3 3 3 А 3 3 3 3 3 'А
г 999999999 9
1 2 3 4 8 9
л 6 3 3 3 6 3
0 9 9 9 9 9 9
123789456
е 3 3 3 3 '"А
е 999999999
123654789
„ ббЗЗААААА
Ж 999999999
Эти принципы, характеризующие изменения генетического
кода, были разработаны в основном Э. Фризом, Ф. Криком и др.
Поскольку авторы этих принципов разработали вопрос лишь об
описании сущности молекулярных изменений ДНК при мутациях,
но не исследовали причин самого процесса мутаций, эта современ-
ная молекулярная теория мутагенеза может быть охарактеризова-
на как феноменологическая. Вполне понятно, что следующий этап
развития этой теории должен быть связан с раскрытием причин-
ных сторон мутагенеза, так что современные феноменологические
построения должны быть заменены причинной, каузальной тео-
рией мутагенеза, охватывающей все основные причины, связи и
условия, определяющие процесс появления мутаций.
простого присоединения быть не может, и акты транслокации и инверсий
должны обеспечиваться специальными ферментными системами. В част-
ности, при инверсии должно осуществляться ферментативное изменение
концевых нуклеотидов, позволяющее замкнуться сахаро-фосфатным свя-
зям по новому месту присоединения.
МУТАЦИОННАЯ ТЕОРИЯ
202
Рис. 61. Природа транзиции (замена пуринового нуклеотида или основания
на пуриновый и пиримидинового на пиримидиновый) и трансверзий (ориен-
тация пурин — пиримидин заменяется на противоположную)
В своем первоначальном анализе Э. Фриз рассмотрел только
такие типы мутаций, которые обусловливаются заменой одного
нуклеотида другим. В этих случаях мыслимы простые замены, или
транзиции, когда пуриновое основание заменяется пуриновым или
пиримидиновое основание заменяется пиримидиновым, а также
трансверзии, когда пуриновое основание заменяется пиримидино-
вым или наоборот (рис. 61).
Впоследствии Фриз сумел доказать, что многие химические му-
тагены приводят к заменам типа транзиций, и в его опытах име-
лись данные в отношении некоторых мутагенов (например, алки-
лирующих агентов), которые он трактовал как доказательства су-
ществования трансверзий.
В схеме Фриза отсутствовал такой класс точечных мутаций,
как выпадение или вставка одиночных нуклеотидов. Предположе-
ние о возможности существования таких мутаций, а затем и до-
казательство пх возникновения было сделано Ф. Криком и сотруд-
никами в опытах по изучению общей природы кода в 1961 г. Было
показано, что каждый кодон состоит из троек оснований, кодирую-
щих одну аминокислоту. При этом из-за непрерывности чтения
информации внутри гена вставки или выпадения нуклеотидов бу-
дут приводить к сдвигу чтения кода, и в силу этого такие мутации
стали именовать мутациями сдвига рамки или знаковыми мута-
циями (frame-shift mutation).
После завершения опытов по выяснению точной структуры
всех 64 кодонов (Ниренберг, Маттеи, Ледер, Очоа, Корана и др.)
203
ПЕРВИЧНОЕ ПОВРЕЖДЕНИЕ ДНК И МУТАЦИИ
оказалось возможным дать характеристику разных классов мута-
ций по их функциональным особенностям безотносительно того,
вызываются ли они транзициями, трансверзиями или мутациями
сдвига чтения. Таких классов мутаций оказалось три.
а) Миссенс-мутации, или мутации, изменяющие смысловое
значение кодона, что приводит к подстановке другой, несвойствен-
ной исходному кодону аминокислоты в структуре кодируемого
белка. К этим мутациям в принципе могут привести те замены
нуклеотидов (трансверзии и транзиции), которые ведут к образо-
ванию любого из шестидесяти одного значащего триплета.
б) Нонсенс-мутации, при которых возникает бессмысленный
(нонсенс) кодон, но соответствующий пи одной аминокислоте и на
котором обрывается чтение кода. Как правило, это УАГ, УАА и
У ГА кодоны. В тех случаях, когда в данном организме отсутству-
ет соответствующая транспортная РНК, некоторые из кодонов
могут остаться неопознанными во время трансляции, и эти кодоны
также окажутся бессмысленными в этом организме.
в) Замены оснований в кодонах, не приводящие к изменению
смысла кодонов. Например, аминокислота серин кодируется
шестью триплетами, и замены оснований, приводящие к образо-
ванию любого из этих триплетов (УЦУ, УЦЦ, УЦА, УЦГ, АГУ,
АГЦ), не будут изменять смысла кода, ибо в данной точке гена
по-прежнему будет кодироваться та же аминокислота серин. Вы-
полнение этого условия возможно при наличии т-РНК для каж-
дого из этих кодонов.
Изложенная теория мутагенеза правильно описывает конечный
итог мутационных замен в структуре генетического кода. Однако
для понимания явления мутаций необходимо знать как природу
первичных поражений хромосом, так и пути их фиксации в му-
тационном изменении генетического кода.
Первичное повреждение и мутации
в двуспиральной молекуле ДНК
и в процессах синтеза ДНК
Под воздействием мутагенными агентами лучевой или химической
природы может произойти изменение структуры ДНК (или РНК
у РНК-содержащих вирусов), и если это изменение затронет ге-
нетический код организма, может возникнуть мутация.
Какие же химические реакции происходят в ДНК после воз-
действия внешними факторами? Хотя в настоящее время трудно
указать все способы изменения ДНК, мы попытаемся в краткой
форме обобщить имеющиеся данные (рис. 62).
МУТАЦИОННАЯ ТЕОРИЯ
204
ионизирующее и УФ-излучение
Q-caxap;
т
Рис. 62. Места приложения мутационной активности ряда химических
и радиационных мутагенов
Если речь идет о влиянии ультрафиолетового и ионизирующе-
го излучений, то это — димеризация и гидратация пиримидино-
вых оснований, фотохимические реакции с аденином при воздей-
ствии ионизирующими излучениями, одиночные или двойные раз-
рывы сахаро-фосфатного каркаса молекул ДНК, сшивки нитей
ДНК между собой и с молекулами белков, денатурация ДНК.
При действии химических агентов происходит дезаминирова-
ние оснований, алкилирование оснований или сахаров в цени
ДНК, депуринизация и депиримидизация ДНК, вставка или выпа-
дение нуклеотидов и т. д.
Принятая до сих пор молекулярная теория мутаций ограничи-
валась принципами, признававшими, что первичные поврежде-
205
ПЕРВИЧНОЕ ПОВРЕЖДЕНИЕ ДНК И МУТАЦИИ
Т
Рис. 63. Механизм появления транзиции I1 >А при действии на ДНК
ультрафиолетовыми лучами
С—спонтанно; hv — при УФ-облучения; Ц* — гидрат цитозина; У* — гидрат ура-
цила; а — возникновение димеров и гидратов цитозина с их последующим дезами-
нированием в урацилы в структуре ДНК на месте цитозина; б — замена пары Ц — Г
на пару А — Т после дезаминирования цитозина
ния молекулы ДНК могут сами, или претерпев некоторые измене-
ния, затем через неправильное спаривание оснований фиксиро-
ваться в мутацию. Во всех этих построениях не принималось во
внимание влияния ферментативных процессов.
В качестве примера таких мутагенных воздействий рассмот-
рим димеризацию соседних цитозинов или тимина и цитозина при
ультрафиолетовом облучении и дезаминирование цитозина при дей-
ствии азотистой кислоты. В первом случае, как это было показано
в лаборатории Джонса (De Boer, Pearson, Johns, 1967), образую-
щийся димер цитозинов ЦЦ оказывается неустойчивым при ком-
натной температуре и переходит сначала в смешанный димер ци-
тозина-урацила ЦУ (рис. 63), затем в димер урацилов ЪУ, кото-
рый также нестабилен и довольно быстро мапомеризуется па два
урацила. Образовавшийся в структуре ДНК урацил оказывается
мутагенным, ибо он спаривается при последующей репликации
не с гуанином, как это делал цитозин, а с аденином. Происходит
замена пары ГЦ на пару АТ.
Подобная ситуация — замена цитозинов в структуре ДНК на
урацилы после ультрафиолетового облучения была установлена
Яновским, Ито и Хорном (Yanofsky et al., 1966) при изучении
аминокислотных замен А-белка триптофанспнтетазы Е. coli.
Того же результата — дезаминирования цитозина в урацил
можно достичь при действии на ДНК азотистой кислоты, что было
также доказано (правда, на примере РНК-содержащего вируса)
МУТАЦИОННАЯ ТЕОРИЯ
206
Виттманом и Виттман-Лиебольд (Wittman, Wittman-Liebold,
1966) при изучении структуры белка оболочки вируса табачной
мозаики.
Важным в молекулярной теории мутаций является вопрос о
времени воздействия мутагена па молекулу ДНК. Молекула
может находиться в покоящемся состоянии в виде дву-
спиральной молекулы и может быть представлена двумя одноце
почечными матрицами в момент репликации.
Описанные примеры касаются теоретических возможностей,
связанных с воздействием на покоящуюся ДНК. Прямое экспе-
риментальное доказательство возможности вызывания мутаций
в покоящейся ДНК было достигнуто в опытах с пеметаболизи-
рующими бактериальными вирусами и на выделенной трансфор-
мирующей ДНК. Фаги или ДНК обрабатывались мутагеном в
растворе, а после этого, уже в отсутствие мутагена, вводились в
бактериальные клетки, где определялась частота и спектр мута-
ций. Такой метод позволил выявить возникновение мутаций после
обработки фагов рядом химических мутагенов (азотистая кисло-
та, гидроксиламин, гидразины и т. д.).
Возникновение мутаций удалось выявить и после обработки
трансформирующей ДНК химическими мутагенами (Litman,
1961; Бреслер, Перумов. 1962) и облучением (Бреслер, Перумов,
1964).
Долгое время получить мутации у внеклеточного фага под
действием облучения пе удавалось (см. Stahl, 1951). Но в 1961 г.
Кривиский (1961) и в 1962 г. Фользом (Folsome, 1962) обнару-
жили индукцию мутаций у фагов Т4 и Сд и в 1966 г. Сойфер —
у фага Т2 под действием ультрафиолетового облучения (Сойфер,
19666). В 1963—1964 гг. Ардашпикову, Сойферу и Гольдфарбу
(1963; Ardashnikov, Soyfer, Goldfarb, 1964) удалось доказать ин-
дукцию мутаций у впеклсточного фага Т2 при действии ионизи-
рующих излучений (табл. 21).
Тем самым было доказано, что мутации можно индуцировать
внешними воздействиями па покоящиеся генетические структуры.
В феноменологической теории мутагенеза, развивавшейся
Э. Фризом, рассматривалось также возникновение мутаций в реп-
лицирующихся молекулах ДНК при наличии в среде аналогов ос-
нований (5-бромурацила, 2-амипопурина и т. д.). Фриз полагал,
что При этом на втором пли третьем акте репликации произойдет
мутация. По его теории мутации в первой репликации не могли
возникать. В теории мутагенеза, развивавшейся Ф. Криком и
сотр., также считалось, что наличие акридиновых красителей в
среде может привести к мутациям сдвига чтения, и эти мутации
могли возникнуть только в реплицирующихся молекулах ДНК.
Однако важно указать не только па состояние субстрата, под-
вергаемого мутагенному воздействию, но и на характер и направ-
207
ПЕРВИЧНОЕ ПОВРЕЖДЕНИЕ ДНК И МУТАЦИИ
Т а б л и ц а 21
Индукция h-мутаций у с не кл( точного фа. а Т2 при dtucmmu у-лучей
Число опытов Доза облучения, крав Выж °/ Час-о га мута- ций X 10 Во ско 1ько раз Iозросла час о га мутаций
17 ' Контроль 100 1 1,4±0,3 1
18 20 65,1:!-2,3 3,2^0,« 2,3-_[:1,0
18 60 34,82:-1 6 5,8-_Ч,3 4,1-Н.8
20 100 18,2^1,1 !),2х-1,5 6 ,(>2с2,5
17 140 9,3±0,6 11,5г!-2,7 8,2^3,5
14 200 1,0^0,1 •Ц,')±6,0 13,5±7,1
ленность процесса, и на участие в нем ферментных систем репли-
кации, рекомбинации и репарации. Надо также отметить, что для
возникновения видимой мутации мало первичного изменения ге-
нетической матрицы. Это необходимое, но недостаточное условие
появления мутаций. Первичное изменение кодона может пе завер-
шиться регистрируемой мутацией по многим причинам. Укажем
на некоторые из них.
Прежде всего это связано с явлением вырожденности кода,
т. е. наличия нескольких (иногда до шести) разных кодонов, оп-
ределяющих одну и ту же аминокислоту. Расчеты показывают,
что около 20% всех точечных мутаций может остаться неучтен-
ными из-за этой причины.
Другая причина невозможности учесть все точечные мутации
связана с наличием в ДНК участков, пе кодирующих белков.
Супрессорные мутации, уже присутствующие в геноме или
возникающие вновь, будут также снижать число выявляемых му-
таций. Еще больший эффект непроявления мутаций в фенотипе
связан с мутациями, изменяющими структуру белков, но не вли-
яющими на их активность (например, мутации, лежащие вне об-
ласти, кодирующей активный центр ферментов и не меняющие
конформации молекулы).
По-видимому, многие мутации, сопряженные с нарушением
генов регуляторной системы, будут маскировать другие мутации,
возникающие в структурных генах регулируемого оиеропа.
Открытие класса условно-летальных мутаций, в определенных
условиях мало влияющих на. выживаемость, а в других условиях
приводящих организм к гибели, также позволило указатц на из-
менения в генетической записи, не обязательно влияющие на
фенотипическое проявление.
МУТАЦИОННАЯ ТЕОРИЯ
208
Мутагенез
и работа ферментных систем клетки
До открытия индуцированного мутагенеза (1925—1927 гг.—ра-
диационный мутагенез — Г. А. Надсон, Г. С. Филиппов, Г. Мёл-
лер; 1943—1948 гг.—химический мутагенез — И. А. Рапопорт,
Ш. Ауэрбах) генетики в поисках причин спонтанной мутабилыю-
сти обращали внимание в основном па внутренние факторы ор-
ганизмов, что без знания конкретных механизмов изменчивости
приводило фактически к идеалистическому толкованию причин
наследственной изменчивости.
С установлением внешних по отношению организма факторов
(мутагенных факторов), ускоряющих в тысячи раз мутационный
процесс, внимание было всецело обращено на них как на единст-
венную причину наследственной изменчивости. Мнение о том, что
факторами внешней среды (фон космических лучей и разные виды
лучистой энергии, наличие в биосфере некоторой конечной кон-
центрации мутагенных химических соединений, тепловая энер-
гия и т. д.) можно целиком и полностью объяснить причины спон-
танного мутационного процесса, не говоря уже об индуцирован-
ном мутагенезе, приобрело всеобщее распространение. Однако
такой взгляд однобоко представляет детерминистскую сторону
мутационного процесса. Следует искать причины изменчивости
также и в имманентных свойствах живой материи. В настоящее
время успехи биохимии и особенно энзимологии генетических про-
цессов позволяют указать несколько кардинальных биохимических
процессов, составляющих материальную базу для осуществления
жизненных функций и эволюции живой материи, которые вместе
с тем служат причиной появления изменений в структуре наслед-
ственных молекул. Такими процессами являются репарация, реп-
ликация, рекомбинация.
Для доказательства того, что при осуществлении этих процес-
сов в клетке с незначительной, но вполне конечной вероятностью
возникают мутации, мы привлечем некоторые генетико-биохими-
ческие данные, которые подчас самими авторами не рассматри-
вались как доказательства роли энзиматических систе^м клетки в
возникновении мутаций.
При этом внешние воздействия (агенты лучевой и химической
природы) могут, конечно, в большой степени усиливать скорости
мутагенеза и служить триггерами (пускателями) этих фермен-
тативных процессов, так что мутабплыюсть живой клетки и орга-
низма представится равнодействующей внешних и внутренних
факторов мутагенеза.
Репликация. Сущность процесса репликации состоит в вос-
произведении генетической информации, записанной в данной
молекуле ДНК. До последнего времени считалось, что репликация
209
МУТАГЕНЕЗ И РАБОТА ФЕРМЕНТНЫХ СИСТЕМ
связана со временем синтеза ДНК в клетке, когда молекулы ДНК
распадаются на одноцепочечные матрицы, т. е. связана с полу-
консервативным механизмом. Этот механизм, казалось, исключил
возможность появления изменений в структуре строящейся цепи
ДНК. Однако в последние 3—4 года оба эти вывода оказались
поколебленными. Было установлено, что процессы частичной реп-
ликации отдельных участков ДНК могут происходить на стадии,
когда молекула ДНК в целом в двуспиральном состоянии нахо-
дится в состоянии покоя. Это явление связано с процессом pena^
раций — репаративная репликация (см. ниже раздел «Репара-
ция») и с процессом рекомбинаций — дополнительный синтез
ДНК (см. ниже раздел «Рекомбинация»). В обоих этих случаях мы
имеем дело с явлением неконсервативной репликации. Далее бу-
дет показана связь этих явлений с процессами мутаций.
При этом существенным оказалось то обстоятельство, что сам
процесс синтеза ДНК, т. е. репликация в условиях полуконсерва-
тивного воспроизведения молекулы ДНК, не всегда точно воспро-
изводит исходную генетическую информацию. В этих условиях
могут возникать мутационные молекулы ДНК за счет ошибок
репликации.
В лаборатории А. Корнберга в США Холлом и Леманом в
конце 1968 г. было доказано (Hall, Lehman, 1968), что если ис-
пользовать фермент ДНК-полимеразу фага Т4 в реакции синтеза
ДНК in vitro, а в качестве матрицы взять полидезоксицитидило-
вую кислоту, то в синтезируемом продукте — полидезоксигуани-
ловой кислоте с частотой 10“5—10~6 будут встраиваться ошибоч-
ные основания — тимины. Знаменательно, что когда использовался
фермент из ts-мутантного фага Т4, у которого мутация затронула
как раз полимеразный ген, то этот мутантный фермент ошибался
в среднем в 4 раза чаще, чем нормальный. Наконец, частота оши-
бок, даваемых обоими ферментами, возрастала при увеличении в
среде концентраций дезокситимидинтрифосфатов и могла быть
увеличена в 5—20 раз при замещении ионов Mg++ на ионы Мп++.
Количественно частота ошибок реплицирующего фермента
(10~5—Ю“6 па акт репликации) полностью совпала со среднеста-
тистической частотой спонтанного мутагенеза.
Это совпадение вряд ли случайно. Вполне вероятно, что такая
частота ошибок была закреплена эволюционно естественным от-
бором, и все организмы, у которых ДНК-полпмераза отличалась
большей или, напротив, меньшей частотой ошибок, элиминирова-
лись в процессе отбора.
Таким образом, сама ДНК-синтезирующая машина без влия-
ния каких-либо мутагенных факторов вносит ошибки в генетиче-
скую матрицу за счет недостаточной работы ферментов. В этих
условиях становится понятен и механизм, при котором' внешние
условия могут способствовать ускорению мутационного процесса.
\/4 8 В. Н. Сойфер
МУТАЦИОННАЯ ТЕОРИЯ
210
Вполне резонно полагать, что коль скоро в процессе реплика-
ции может происходить накопление генетических ошибок, то
внешними воздействиями можно повлиять на этот процесс, если
не в сторону уменьшения, то в сторону увеличения. Эксперимен-
ты говорят, что это — разумное предположение.
Повышение частоты ошибок при работе реплицирующих фер-
ментов достигается в том случае, когда на клетку или организм
воздействуют химическими веществами, способными влиять на
эффективность работы этих ферментов. Речь идет прежде всего о
красителях акридинового ряда и нитрозогуанидине. В настоящее
время доказано, что эти агенты могут влиять на ДНК в момент
ее репликации. Этим объясняется природа мутаций сдвига рамки,
получаемых под действием профлавина и некоторых других кра-
сителей акридинового ряда. Штрайзингер и сотр. (Streisinger et al.,
1966) показали на системе лизоцимных мутаций фага Т4, что ак-
ридины действительно приводят к мутациям сдвига рамки, что мо-
жет трактоваться как доказательство ошибок реплицирующих
ферментов L Сейчас накапливается много сведений о том, что
нитрозогуапидип вызывает мутации во время репликации днк.
Действие нитрозогуанидина может быть двояким: либо он влияет
непосредственно на строящийся в ходе репликации участок ДНК,
либо на клеточную мембрану в месте локализации реплицирую-
щих ферментов. В обоих случаях мутации возникают в репли-
цирующихся точках ДНК. Этим объясняется, что нитрозогуани-
дином удалось воспользоваться для построения генетической
карты кишечной палочки, не отличающейся от карт, получен-
ных методами скрещивания (Cerda-Olmedo, Hanawalt, Guerola,
1968).
Репарация. В последние 15—20 лет были открыты системы
ферментов, способные восстанавливать нормальную структуру
ДНК, поврежденную при воздействии различными физическими и
химическими факторами. При этом в случае одних процессов ре-
парации ферменты устраняют повреждения, не приводя к струк-
турным нарушениям спирали ДНК, а в других случаях при репа-
рации происходит значительное изменение этой структуры.
Так, при фотореактивации возникшие димеры тимина расщеп-
ляются (мономеризуются) по вновь возникшим связям 5 и 6, обус-
ловившим образование циклобутановой структуры димера.
Реакцию фотореактивации в таком случае можно представить
1 Интересно отметить, что Штрайзингер обнаружил мутации сдвига рамки
в тех участках гена, где тиминовые нуклеотиды повторялись многократ-
но. Возможно, что такое сосредоточение одинаковых оснований может
быть одной из причин появления горячих точек (мест наиболее частого
мутирования в геноме).
211
МУТАГЕНЕЗ И РАБОТА ФЕРМЕНТНЫХ СИСТЕМ
следующим образом:
к х . Видимый
"О О* к0 - •”0 О
‘ \ Реющий фермент \/
N N N N N N
Устранение связи между соседними тиминами при фотореак-
тивацпи будет восстанавливать исходную структуру ДНК.
Другой, известный нам сегодня способ репарации, используе-
мый в клетках микробов и высших организмов — темновая репа-
рация. При темновой репарации сначала из структуры ДНК уда-
ляется поврежденный участок, а затем образовавшаяся брешь
заделывается ДНК-нолимеразой. Весь процесс осуществляется в
5 этанов (см. рис. 14).
Сначала эндонуклеаза, способная разрушать сахаро-фосфатную
пить ДНК во внутренних участках нуклеиновой кислоты, по не с
концов ДНК, надрезает нить ДНК вблизи повреждения. Затем эн-
донуклеаза (по-впдпмому, отличная от первой эндонуклеазы),
разрезая пить с другой стороны повреждения, вырезает повреж-
денный участок. После этого брешь расширяется до значительных
размеров эндонуклеазами, способными отщеплять нуклеотиды с
концов свободной разрезанной нити ДНК. Показано (Ogawa et al.,
1968), что брешь может быть расширена до 500—1000 нуклеоти-
дов На следующем этапе ДНК-иолпмераза (скорее всего отлич-
ная от полимеразы, ведущей полукопсервативную репликацию)
застраивает брешь комплементарно к основаниям, противостоя-
щим бреши в неповрежденной нити. Последняя реакция состоит
в соединении концов вновь отстроенной нити с концом материн-
ской нити. Эта реакция осуществляется с помощью недавно
открытого Ричардсоном и рядом других авторов фермента — по-
линуклеотидлигазы.
Важным вопросом, касающимся функционирования ферментов
темновой репарации, является вопрос о том, какие виды пораже-
ний ДНК узнаются репарпрующими ферментами? Дело в том, что
в настоящее время установлено, что многие виды радиационных и
химических повреждений ДНК устраняются системой ферментов
темновой репарации. К ним относятся повреждения от алкилирую-
щих агентов, азотистой кислоты, 4-иптрохиполипокспда, нитрозо-
гуанидина, митомицина и т. д. Если думать, что па каждый вид
поражения требуется свой фермент, то тогда надо ожидать сущест-
1 Можно высказать предположение, что такое расширение требуется для
того, чтобы поврежденный ген был расширен до его границы (в среднем
ген заключает 1000—1500 нуклеотидов) с тем, чтобы ДНК-полимсраза
могла начинать застройку с границы гена, и при этом возникнет меньше
ошибок, чем если бы она начала работу внутри гена.
9 В. Н. Сойфер
МУТАЦИОННАЯ ТЕОРИЯ
212
Время обработки, часы
Рис. 64. Доказательство нере-
парируемости повреждений,
индуцированных у фага лямб-
да 1 М раствором гидроксил-
амина (растворенным в 1 М
NaCl, pH 7,5)
Фаг обрабатывался внеклеточно,
после чего им инфицировались
клетки Е. coli hcr+ (1, 3) и hcr-
(?, 4). Контроль: фаг обрабаты-
вался 1 М NaCl, после чего им
инфицировали те же клетки hcr+
и her-; 1, 2 — выживаемость фага
в среде 1 М NaCl; 3,4 — в сре-
де с 1 М гидроксиламином в
1 М NaCl
вования в клетках слишком большого числа таких ферментов.
Хэнэвалтом и Хейнесом (Hanawalt, Haynes, 1965) было высказано
предположение о том, что па самом деле репарации подвергаются
те виды поражений, которые существенно изменяют вторичную
структуру ДНК, обусловливая, например, через местное наруше-
ние водородных связей ее локальную денатурацию.
Нами в экспериментах с фагом л, обработанным 1 М раствором
гидроксиламина в 1 М растворе NaCl (Soyfer, 1969а, b) получены
данные, благоприятствующие этой точке зрения. Гидроксиламин,
взаимодействуя с цитозином, дает оксимы цитозина, последние
могут пе нарушать двойной спирали ДНК. Это показывает, что эти
изменения не будут узнаваться эндонуклеазами, а, следовательно,
пе будут репарпроваться. Это и было доказано в эксперименте, ког-
да обработанным внеклеточно фагом инфицировали клетки Е. coli
hcr+ с нормальной системой темновой репарации и клетки Е. coli
her- с дефектом в этой системе. Полное совпадение кривых вы-
живаемости фага в обеих линиях свидетельствовало о нерепариру-
емости гидроксиламинных поражений (рис. 64).
После своего открытия процессы темповой репарации исполь-
зовались для объяснения явления устойчивости генетической ин-
формации. Долгое время проблема консерватизма наследственно-
сти трактовалась с позиций исключительной устойчивости самого
генетического материала. В начале века имела хождение даже идея
о неизменности гена. Теперь очевидно, что гены вовлекаются в
разнообразные процессы изменений и что их устойчивость связана
не с их особой устойчивостью, а с работой ферментов, которые уда-
ляют из молекул ДНК появляющиеся в них повреждения.
213
МУТАГЕНЕЗ И РАБОТА ФЕРМЕНТНЫХ СИСТЕМ
В настоящее время внимательный анализ работы ферментов
темновой репарации показывает, что их деятельность пе безраз-
лична и для процессов становления мутаций.
Связь работы ферментов темновой репарации с процессом му-
тирования была в первую очередь установлена расширением прин-
ципа вырезания эндонуклеазами участков повреждений молеку-
лы ДНК.
Дело в том, что если фермент неспецифически узнает наличие
локального нарушения вторичной структуры ДНК, то, поскольку
в этом месте в нарушение вовлечены как поврежденная пить, так
и нормальный противостоящий участок, возможно, эндонуклеаза
может вырезать и повреждение, и участок нормальной нити (Na-
zim, Auerbach, 19(57). Признав эту возможность (рис. (55), следует
учесть, что вероятность разрезания той или иной нити ДНК зави-
сит от характера повреждения, от количества и качества фермен-
та и от физиологии клетки. Однако если эндонуклеазе! при выре-
зании ошибается даже с той же незначительной частотой, что и
такой «прецизионный» фермент, как ДНК-полимераза (т. е. 10-5—
10-6), то и этого достаточно для получения весьма важных резуль-
татов. Дело в том, что разрезание самой поврежденной нити и про-
тивоположной ей — далеко не равноценные события по своим по-
следствиям. Как было установлено рядом авторов (Rupp, Ho-
ward-Flanders, 1968; Bremer et al., 1968; Hewitt, Billen, 1965),
брешь против димера тиминов не будет застраиваться в ДНК дол-
гое время, а па каждом димере остановка синтеза составляет 10 сек.
Поскольку скорость синтеза ДНК и РНК в бактериях и фа-
гах (Левинталь и др., 1966) и в хромосомах высших организмов
(культура клеток человека, Cairns, 1966) совпадает и равняется
1000—1500 нуклеотидов за секунду, то оказывается, что скорость
застройки бреши против димера надает в 10 000 раз. Этим пред-
ставляется достаточное время для того, чтобы произошел второй
акт разрезания поврежденной нити эндонуклеазой, что приведет к
развалу двойной молекулы ДНК на фрагменты. Возможность осу-
Рис. 65. Схема, поясняющая возможное участие изменении вторичной
структуры ДНК в запуске реакции темновой репарации
вырезание пораженного Вырезание участка нити,
участка противоположной пораженной
МУТАЦИОННАЯ ТЕОРИЯ
214
Рис. 66. Появление двунитевых разрывов ДНК при ошибочном вырезании
участка нити, противоположной поврежденной, согласно механизму Дуби-
нина—Сойфера (Дубинин, Сойфер, 1969)
ществлепия такого процесса и вытекающие отсюда последствия
были разобраны В. Н. Сойфером (1969) и Н. П. Дубининым и
В. Н. Сойфером (1969) (рис. 66). На основе предложенного авто-
рами механизма удается объяснить прежде непонятный факт воз-
никновения хромосомных аббераций, при которых после пораже-
ния одной нити в молекуле ДНК опа разрезается целиком.
Можно привести еще один расчет, показывающий реальность
рассуждений Дубинина и Сойфера об участии репарирующих си-
стем в формировании хромосомных перестроек. По расчетам Сет-
лоу, Свэнсона и Кэррира (Setlow et al., 1963) при облучении уль-
трафиолетовыми лучами с длиной волны 2650 А возникает 1 димер
на 700 микрон длины ДНК на 1 эрг. По данным Троско, Чуи Кэр-
рира (Trosco et al., 1965) индукция димеров происходит одинаково
как в клетках млекопитающих, так и в бактериальных клетках.
Если учесть, что эффективность образования димеров тимина при
2537 А составляет 20% от облучения с длиной волны 2650 A (Swen-
son, Setlow, 1966), а количество ДНК на соматическую клетку у
млекопитающего равняется не менее 5-10~12 г, т. е. в ядре содер-
жится примерно 1010 нуклеотидов и из них 30% тиминовых (Sueo-
215
МУТАГЕНЕЗ И РАБОТА ФЕРМЕНТНЫХ СИСТЕМ
ка, 1961), то можно рассчитать число димеров тимина, возникаю-
Щих в клетке при оолучешш дозой 100 эрг/.им?. ;)то число будст
равно 1,5 • 105 ТТ/ядро (считая, что эффективность индукции диме-
ров примерно 0,05%, Trosco et al., 1965). Если принять частоту
ошибок репарирующей эндонуклеазы, заканчивающихся развалом
молекулы ДНК, за 10"5—10“6, то при дозе 100 эрг/мм2 должен про-
являться в среднем 1 разрыв хромосом на клетку, что и было ранее
обнаружено в эксперименте (Chu, 1962).
Вторая возможность, которая открывается при вырезании нор-
мального участка, противостоящего повреждению,— это вставка
некомплементарного нуклеотида во время репаративной застройки
бреши — репаративной репликации. Показано, что возникновение
димера изменяет матричные свойства тиминов, и они получают
возможность спариваться пе с аденинами, а с гуанинами (Bollum,
Setlow, 1963; Josse, Kaiser, Kornberg, 1961). Такое же пекомпле-
ментарное спаривание наблюдается и при других изменениях ге-
нетических матриц, подвергающихся репарации (алкилирование,
воздействие азотистой кислотой и т. д.).
Поэтому приведенный механизм позволяет понять и природу
полных мутаций и объяснить количественные закономерности по-
явления полных и мозаичных мутаций, наблюдаемых в экспери-
менте (см. Дубинин, Сойфер, 1969; Dubinin, Soyfer, 1969).
Обращаясь к этапу застройки бреши в ДНК, следует отме-
тить, что и на этом этапе репарации может произойти генерация
ошибок в структуре ДНК точно по таким же законам, как это
было описано для процесса нормальной полуконсервативной реп-
ликации (т. е. путем неправильного встраивания оснований при
синтезе). Кроме того, нельзя исключить и таких ошибок, как встав-
ка лишних оснований в застраиваемую цепь, особенно в участ-
ках повторяющихся последовательностей нуклеотидов в облучен-
ной ДНК, ибо в этих участках, как было показано Штрайзппге-
ром, и происходят чаще всего мутации сдвига чтения.
Таким образом, появление мутаций во время репарации мо-
жет происходить за счет ошибок целого ряда ферментов (рис. 67).
Но можно указать и еще одну причину возникновения мута-
ций, связанную с ошибочной работой репарирующих ферментов.
Особенно частое формирование мутаций должно наблюдаться при
полуконсервативной репликации ДНК, сохранившей в своей стру-
ктуре димеры пли иные повреждения, оставшиеся «пропущенны-
ми» репарирующими ферментами в следующие акты репликации.
Такое сохранение димеров тимппа в структуре ДНК на протяже-
нии по крайней мере 4 циклов репликации было описано недавно
Брпджесом и Мансон (Bridge's, Munson, 1968).
Сохранение поврежденных участков в ДНК может при репли-
кации таких молекул закончиться появлением мутаций по мень-
шей мере по трем причинам (рис. 68).
W ! .Гтгщ! ^ттг......ГП
тш бПшГгппп ^ттптыТГ
ттттт
Ошибки вырезания 1 1 Ошибки репарирующей ДНК-полимеразы
Рис. 67 Возникновение мутаций
ментов
1 — исходная ДНК;
2 — ДНК, получившая повреждение, уз-
наваемое репарпрующими фермента-
ми;
3 — ошибка вырезания, заканчивающая-
ся выщеплением участка, противопо-
ложного пораженному;
4 — нормальный репаративный
этапе образования бреши;
5 — двунитевый разрыв ДНК по меха-
низму длительно незаживающей бре-
ши (Дубинин, Сойфер, 1969);
в результате ошибок репарирующих фер-
в — возникновение полной мутации по
механизму Дубинина — Сойфера;
7 — вставка лишнего основания при ре-
паративной репликации;
S — вставка лишнего основания на кон-
це репарируемого фрагмента при
репаративной репликации;
9 — ошибка репарируемой ДНК-полиме-
разы, приводящая к подстановке в
репарируемом фрагменте неверного
основания
Рис. 68. Молекулярный механизм возникновения мутаций в результате
ошибок репарирующих ферментов после прохождения первичного пораже-
ния через несколько актов репликации
Объяснение в тексте
217
МУТАГЕНЕЗ II РАБОТА ФЕРМЕНТНЫХ СИСТЕМ
Рис. 69. Механизм появления мута-
ций по Э. Виткин (Witkin, 1968)
Рис. 70. Возникновение мутаций во
время ошибок рекомбинирующих
ферментов при учете схемы Ши-
бальского — Говарда-Фландерса
а — схема Шибальского — Говарда-
Фландерса:
1 — разрывы молекул;
2 — освобождение однонитевых концов;
3 — синапс;
4 — рекомбинационный («дополнитель-
ный» ) синтез;
<5 — формирование рекомбинантных
лекул;
б — возможные пути индукции мутаций
при рекомбинации.
Объяснении в тексте
Спаривание
дочерних
нитей
- ——— gVM»' — —•—VHA-Wv—
Мутация Мутации не г
(ошибка реком-
бинации)
з mix^.ixi,iiLl,iii тттт.^ Ш-Ш'-щт
4 ПТГ1Т1 1 I I I год
5 Illi I I 1 I I I I I ГТТТ
70
1. Напротив поврежденных
участков встанут неверные осно-
вания.
2. Нестабильные повреждения (например, димеры цитозина
пли тимина — цитозина) изменятся и дадут начало «мутагенным»
основаниям в структуре Днк, что приведет к замене основания
в паре.
МУТАЦИОННАЯ ТЕОРИЯ
218
Рис. 71. Индукция ошибок в резуль-
тате ошибок в работе рекомбина-
ционных ферментов при учете
схемы Вайт ха у за
1 — исходные молекулы ДНК, входящие
в состав двух хромосом;
2 — возникновение однонитевых разры-
вов в одной из нитей каждой из мо-
лекул ДНК;
3 — отхождение однонитевых участке
ДНК в месте разрыва;
4 — «дополнительный» синтез в однони-
тевом участке ДНК (пунктир);
5 — комплементарное спаривание (обра-
зование гетеродуплекса) старых п
вновь синтезированных нитей;
6 — разрушение однонитевых участков;
7 — воссоединение нитей с образованием
рекомбинантных молекул
3. Против поражения при синтезе образуется длительно неза-
живающая брешь, которая будет или неверно застроена (mispai-
ring) или приведет к фрагментации молекулы.
Рекомбинация. Формирование мутаций во время реком-
бинации постулировалось ранее Г). Виткин (Witkin, 1968), одна-
ко механизм, предложенный ею (рис. 69), во-первых, недостаточ-
но аргументирован (не ясно, какую мутационную роль играет ти-
миновый димер, кроме того, что на нем обрывается синтез
дочерней нити ДНК — показана пунктиром), и во-вторых, она
считает, что предложенный ею механизм приложим лишь для
ограниченной группы бактерий.
219
МУТАГЕНЕЗ И РАБОТА ФЕРМЕНТНЫХ СИСТЕМ
Вместе с тем, базируясь на описанных выше принципах, можно
показать что мутации должны возникать и во время рекомби-
нации.
В настоящее время наиболее распространены три схемы ре-
комбинации; Шибальского — Говарда-Фландерса, Холлидея и
Вайтхауза. Имея в виду любую из этих схем, поскольку они при-
влекают для объяснения процессов рекомбинаций механизм допол-
нительного синтеза ДНК, можно считать, что процессы рекомби-
наций должны сопровождаться появлением мутаций. Схема Ши-
бальского — Говарда-Фландерса очень схожа со схемой темновой
репарации (рис. 70). Как и там, при рекомбинации должны снача-
ла осуществиться разрывы сахаро-фосфатпого остова молекул
(этан 1), затем разрушение однонитевых участков (этап 2). Сле-
дующим, третьим этапом рекомбинации должно быть комплемен-
тарное спаривание молекул па ограниченном участке (зона синап-
са). Затем в образовавшейся молекуле (гетеродуплекс), несущей
фрагменты обеих рекомбинирующих молекул, должна произойти
застройка однонитевых участков (этап 4) и, наконец, их воссоеди-
нение (этап 5).
Во время рекомбинационного синтеза (этап 4) любое наруше-
ние, имеющееся в материнской молекуле ДНК, будет закреплено
в мутацию (рис. 70, А — А'). Мутации могут возникнуть и просто
за счет ошибок ДНК-полимеразы, застраивающей брешь
(рис. 70, В). На концах соединяемых фрагментов (рис. 70, В),
а также в участках, где в материнской нити повторены одинаковые
нуклеотиды (рис. 70, Г), могут возникнуть мутации сдвига чте-
ния. Дубинин и Немцева (Dubinin, Nemtseva, 1969) представили
серьезные доказательства, что при кроссинговере у высших про-
исходит реальное разрезание молекул ДНК на фрагменты.
Такой же анализ можно провести, и принимая схему рекомби-
нации Вайтхауза (Whitehouse, 1963). При этом мутации будут
возникать па следующих этапах рекомбинации (рис. 71; на рисун-
ке слева приведена схема рекомбинации по Вайтхаузу, справа —
ошибки, возникающие при рекомбинации). Если в одной из реком-
бинирующих молекул в участке, служащем матрицей для рекомби-
национного синтеза, имеется повреждение (например, димер ТТ), то
оно отреплицируется неверно и даст начало мутации (рис. 71, а).
При рекомбинационном синтезе могут возникнуть мутации за
счет ошибок рекомбинационной ДНК-полимеразы (рис. 71, б).
Если па конце разорванного фрагмента одной нити рекомбиниру-
ющих молекул имелось поражение, то оно может привести к мута-
циям при спаривании с одпопптевым концом другой молекулы
(рис. 71, в). После установления синапса рекомбинирующих мо-
лекул (появление гетеродуплекспой молекулы) остаются однони-
тевые участки, которые должны быть застроены за счет так назы-
ваемого «дополнительного» синтеза. Если при этом в матричной
МУТАЦИОННАЯ ТЕОРИЯ
220
нити имеется поражение, то оно закрепится при дополнительном
синтезе (рис. 71, г). Наконец, в местах дополнительного синтеза
(рис. 71, е) и во время соединения отстроенного фрагмента с ра-
нее имевшимся (рис. 71, д) могут возникать мутации сдвига
чтения за счет вставки лишнего нуклеотида пли соединения недо-
строенной нити с имевшимся фрагментом.
Рассмотренный материал показывает, что современная теория
мутагенеза вступила в новый этап своего развития. Создание мо-
лекулярной теории мутаций Уотсоном, Криком, Фризом и другими
раскрыло сущность тех форм химических преобразований, кото-
рые составляют мутации. Однако ответа на вопрос, каков меха-
низм становления мутаций, эта теория не давала. Сейчас начина-
ется этап, который раскрывает сущность становления мутаций.
Для него центральное место заняло изучение взаимодействия пер-
вичных повреждений молекул ДНК с работой систем темповой ре-
парации. Процесс мутаций оказался глубоко и специфически
связанным с деятельностью ферментных систем клетки. Слож-
ная система ферментных реакций, обеспечивающих жизнь клет-
ки и охрану генетических структур, оказалась связанной и с
процессом мутаций. Этот подход открыл совершенно новые сторо-
ны в явлении мутаций, он ведет нас к углубленному пониманию
сущности мутаций и к новым путям по его овладению.
Заключение
Молекулярная генетика превратилась в широко разветвленную
отрасль науки. Начав с описания молекулярно-генетических со-
бытий у микроорганизмов, специалисты в этой области сейчас пов-
семестно переходят к изучению этих событий у высших организ-
мов. Знаменательно при этом, что большинство кардинальных про-
цессов, обнаруженных у микробов, оказалось сходным в своих
принципиальных чертах с процессами у высших организмов. Та-
ким образом, на уровне микрофизической организации живой ма-
терии выявилось единство всех организмов, населяющих нашу
планету. Эти данные позволяют говорить о едином пути эволю-
ции на нашей планете.
Нельзя переоценить значение молекулярной генетики и для
будущего развития биологии и медицины в целом.
Огромное значение для будущего будут играть последние рабо-
ты генетиков в области выделения индивидуальных генов и искус-
ственного синтеза отдельных генов и ДНК в целом. В конце
1969 года Джон Беквит с сотрудниками в Гарвардской школе ме-
дицинских исследований впервые смогли выделить индивидуаль-
ный ген из лактозного оперона, очистить его, проанализировать
его величину и сфотографировать в электронном микроскопе.
Годом раньше Гобпнд Корана и его группа в США осуществи-
ли впервые полный химический синтез индивидуального гена для
одной из транспортных РНК. Основой для синтеза этого гена яви-
лась расшифровка полной последовательности нуклеотидов в этой
РНК, проведенная в 1964 году Холли с сотрудниками.
Выдающимся открытием последних лет была разработка усло-
вий для искусственного синтеза ДНК в бесклеточной системе. Ис-
пользовав эту систему, Артур Корнберг и сотрудники сумели
синтезировать «живую» молекулу ДНК бактериофага ФХ174.
Новые пути управления мутационным процессом и поддержа-
ния нормальной жизнедеятельности открылись после установле-
ния возможности репарировапня генетических повреждений.
Наиболее важным в этих исследованиях является то, что рО-
нарирующие системы обнаружены сейчас в высших организмах,
включая человека.
ЗАКЛЮЧЕНИЕ
222
На репарирующпе ферменты возлагается много надежд в раз-
работке вопроса о контроле над мутациями. Они позволят увели-
чить количество мутаций, что очень важно для селекции, и подав-
лять возникновение мутаций, что исключительно важно в медици-
не и для сохранения наследственно чистых форм в сельском хо-
зяйстве.
Центральной научной и практической проблемой генетики и
всей биологии является получение направленных мутаций. Долгое
время принималась точка зрения, что стохастический, случайный
характер мутагенеза является столь же жестким законом, как вто-
рой закон термодинамики.
В свете действия ренарирующпх систем, роли метаболизма
клетки, учения о потенциальных поражениях, фактов специфич-
ности мутагенеза и других вырисовывается картина реальных воз-
можностей управления самыми глубинными процессами, лежащи-
ми в основе мутаций.
Последние 10 лет были триумфальными для исследований хи-
мической природы реакций мутагенов с ДНК и РНК. Эти исследо-
вания продемонстрировали разнообразие реакций мутагенов и при-
вели к обоснованию ряда новых принципов. Укажем па возмож-
ность регуляции мутаций в момент удвоения молекул ДНК на ос-
нове того, что последние удваиваются не сразу на всем протяжении,
а начиная с одного конца. Хорошей аналогией процесса раскручи-
вания спирали ДНК и расхождения ее нитей является обычная
застежка — молния.
Было найдено, что ряд мутагенов (нитрозогуанидин и. по-види-
мому, акридиновые красители) могут вызывать мутации только в
той точке молекулы, которая в данный момент подвергается удво-
ению. Использовав это наблюдение, авторы открытия (Cerda-Olme-
do, Hanawalt, G nerol а, 1968) смогли даже построить весьма точную
генетическую карту бактерии кишечной палочки, добавляя через
равные промежутки времени мутаген и изучая, какой же ген из-
менялся в данную минуту.
Это открытие дает принципиально повый подход к решению
проблемы управления мутагенезом. Узнав, какие гены начинают
удваиваться в данный момент, мы, возможно, сможем с помощью
этих мутагенов изменять нужные нам гены, не затрагивая других.
Однако проблема направленною мутагенеза требует, по-види-
мому, принципиально новых решений в вопросе о взаимодействии
генов и энергии мутагенов. До сих пор все использованные мута-
гены иеспецифичпы в том смысле, что они взаимодействуют с от-
дельными группами атомов индивидуальных оснований в ДНК
вне зависимости от их участия в системах различных отдельных
генов. Такими мутагенами служили химически простые молекулы:
кислоты, щелочи, NH2OH, Н2О2 п др. Однако в последнее время
появились данные, что более сложные молекулы (например, стеро-
223
ЗАКЛЮЧЕНИЕ
идные диамины) также вызывают мутации, причем сразу же выя-
вилось, что скорость и характер реакций этих мутагенов коренным
образом отличается от реакций обычных мутагенов. Можно вы
сказать предположение, что если бы удалось найти или синтези-
ровать такие мутагены, которые взаимодействовали бы не с одним
или двумя основаниями, а целостно узнавали бы данный ген или
его большой участок, то тогда вопросы специфичности взаимодей-
ствия генов и мутагенов приобрели бы реальное звучание, и мы,
возможно, вплотную подошли бы к решению проблем мутагенеза.
Центральное место в современной теории мутаций генов и хро-
мосом занимает идея о потенциальных изменениях, существование
которых открыло новую область в генетике.
Потенциальное изменение возникает после первичного пораже-
ния хромосом и длится какое-то время до момента возникновения
первичной мутации.
Полученные экспериментальные данные позволили обосновать
существование трех основных типов потенциальных изменений:
1) потенциальные изменения с коротким сроком жизни, когда му-
тации реализуются в той же фазе клеточного цикла, на которую
воздействовал мутаген; 2) потенциальные изменения с длитель-
ныхм сроком, но фиксирующиеся все же в пределах того клеточного
цикла, на который воздействовал мутаген; длительность жизни из-
менения обеспечивает возможность его перехода из одной фазы
клеточного цикла в другую; 3) сверхдлительиожнвующие репли-
цирующиеся потенциальные изменения, способные проходить че-
рез ряд синтезов Днк.
Современное состояние проблемы потенциальных изменений по-
казывает исключительную важность анализа природы процессов,
ведущих от молекулярных событий, совершающихся в ДНК, через
потенциальные изменения к становлению мутаций. Приходится
признать, что явление потенциальных поражений в хромосомах в
той форме, как оно открыто и исследуется в цитогенетических и
генетических экспериментах, не находит истолкования в известных
нам молекулярных механизмах. Здесь от акта взаимодействия му-
тагена с молекулой ДНК и до появления мутаций на уровне по-
тенциальных изменений лежит неизвестная нам цепь событий.
Обнаружение молекулярной природы метастабилытых состояний,
составляющих сущность потенциальных изменений, будет иметь
не меньшее значение, чем анализ первичных поражений. В этой
новой области генетики лежит одни из ключей к управлению
наследственностью. Нет сомнений, что вопрос о сущности того,
как молекулярные события, совершающиеся в ДПК, через этап по-
тенциальных изменений переходят на уровень структуры, функций
и ауторепродукции хромосом — это одна из главнейших магист-
ралей будущего развития генетики.
Значение генетики для медицины будет возрастать с каждым
ЗАКЛЮЧЕНИЕ
224
годом, ибо генетика касается самых сокровенных сторон биологии
и физиологии человека.
Триумфы медицины связаны с успешной борьбой против ин-
фекционных заболеваний. Однако и ныне ежегодно миллионы лю-
дей гибнут от инфекций. Генетика открывает новые пути и в этой
старой; проблеме. Ярким примером служит создание живых вакцин.
Альберт Сэбин создал «живую вакцину» против полиомиелита
в виде аттенуированного варианта вируса. Этот вариант генетически
отличается от обычного вируса тем, что, не вызывая болезни, он
формирует иммунитет против болезнетворного агента. Вирусологи
по сей день ищут причину перерождения болезнетворного агента
в безвредный. Ясно, что это отличие генетически обусловлено, но
что изменилось: структура белка вирусной оболочки или характер
размножения нуклеиновой кислоты — обнаружить не удалось.
Можно думать, что решение этой проблемы позволит найти еди-
ный рецепт для создания живых вакцин против вирусных заболе-
ваний.
Новые пути в борьбе с инфекционными болезнями были откры-
ты генетикой, давшей способы управления химией клеток микро-
организмов — продуцентов лекарств.
Вспомним антибиотики. Первые штаммы грибов — продуцен-
тов антибиотиков, выделенные Флеммингом, были настолько сла-
быми по своей производительности, что антибиотики в буквальном
смысле были золотыми препаратами. Лишь вмешательство генети-
ков, использовавших свои радиационные н химические методы для
преобразования клеток грибов, дали возможность любому жителю
нашей планеты воспользоваться чудодейственными лекарствами.
Применение антибиотиков изменило в корне соотношение болез-
ней: еще до начала второй мировой войны на первом месте по ча-
стоте смертельных исходов стояли болезни, вызываемые микроба-
ми. Сегодня успехи антпбиотпкотерапии «вывели» вперед болезни
сердца, раковые заболевания и разные формы тяжелых наследст-
венных болезней.
И снова в борьбе с этими бичами здоровья человечества меди-
цина должна опереться на генетику. Блестящие по своему замыс-
лу пересадки сердца, начатые Кристианом Бернардом, по свиде-
тельству специалистов, не представляют каких-либо исключитель-
ных задач в области хирургической техники. Но пеиоддающаяся
обходу или обманному маневру несовместимость тканей привела
к тому, что даже Бернард недавно был вынужден признать бес-
сильной попытку одолеть несовместимость. Ключ к решению этой
задачи лежит в изучении генетических закономерностей, ибо не-
совместимость закодирована в нашей наследственности так же,
как закодирован цвет глаз, строение волос и любые другие призна-
ки. Проблема несовместимости является частью более общей проб-
лемы генетических основ антителообразования. Именно в этой об-
225
ЗАКЛЮЧЕНИЕ
ласти генетики следует ждать в ближайшие 15—20 лет выдающих-
ся по своим последствиям для человека результатов. Основанием
для такого предсказания служат достижения в изучении молеку-
лярной природы наиболее распространенных белков, участвующих
в формировании антител. Хотя подобные работы начались все-
го каких-то 5—7 лет назад, прогресс в этой области весьма
ощутим.
Что касается раковых перерождений, то и здесь от успехов в
познании генетических причин зависит в общем решение всей про-
блемы. Никто не сомневается в том, что причиной рака является
изменение в структуре или в функционировании генетического ап-
парата. Однако понимание того, как, что и почему вызывает пере-
рождение, до сих пор не достигнуто, хотя огромные коллективы
ученых, в которых генетики занимают ведущее место, работают в
этом направлении.
В наши дни успешно разрабатываются методы лечения целого
ряда наследственных болезней, таких как фенилкетонурия, сахар-
ный диабет и другие. Здесь медико-генетическая работа призвана
облегчить страдание людей от действия дефектных генов, получа-
емых ими от родителей.
В обозримом будущем в медицине на первый план войдут
принципиально новые методы генетики, среди которых надо ука-
зать на генотерапию. Наступит время и мы узнаем структуру
вначале части, а потом всех генов человека, что откроет моле-
кулярно-генетические основы наследственных болезней.
Синтез генов позволит ввести в клетку на место поврежденных
генов их нормальные гомологи, что обеспечит коренное лечение
наследственных заболеваний. Широкое распространение получат
также способы нейтрализации действия вредных генов с помощью
введения репрессоров.
Исключительно велико значение генетических исследований в
решении проблем расширения пищевых ресурсов. Прогнозы демо-
графов, ожидающих резкого увеличения населения мира, во вся-
ком случае его удвоения уже к 2000 году, ставят задачу столь же
мощного скачка в производстве пищевых продуктов, резкой ин-
тенсификации сельского хозяйства. Несомненно, что успехи моле-
кулярной генетики в области изучения механизма синтеза белка,
искусственного синтеза генов, изучения генетических основ уп-
равления фотосинтезом позволяют уверенно глядеть в будущее.
Наряду с коренным улучшением селекции следует ожидать рево-
люции в деле промышленного производства пищевого белка, ис-
кусственного синтеза углеводов на базе промышленных установок
по фотосинтезу и управления синтетической активностью микро-
организмов.
Оценивая перспективы будущего развития генетических иссле-
дований и их роли в жизни будущих поколений человека, акаде-
ЗАКЛЮЧЕНИЙ
226
мик Николай Петрович Дубинин пишет: «Успехи генетики подго-
товят биологию к решению самых коренных ее задач, решить
которые выпадает па долю уже следующего двадцать первого
столетия. Главными среди них, по-видимому, будут следующие.
1) Создание клетки как единственно саморегулирующейся и
самовоспроизводящейся открытой живой системы, что будет свя-
зано с пониманием сущности жизни.
2) Обмен жизненными формами между Землей и другими ми-
рами.
3) Деятельность человека может оказаться роковой для сло-
жившейся биосферы на Земле, компонентом которой является сам
человек. Мы начинаем понимать, что взаимодействие видов в при-
роде в конечном счете управляется генетическими законами. Пред-
стоит гигантская работа по регуляции как устойчивости, так и из-
менений в биосфере, что потребует глубочайшего применения
принципов эволюционной генетики.
4) Гигантской задачей является экспериментальное воссозда-
ние тайны появления сознания. Опираясь на генетику поведения,
понимаемую в самом широком смысле этого термина, будет ре-
шаться задача селекционного выведения «мыслящих» животных.
5) Опираясь на достижения генетики человека, общей п моле-
кулярной генетики, на повестку дня будет поставлена проблема
вмешательства в наследственность человека в первую очередь в
отношении генетической, ликвидации наследственных дефектных
генов как источников наследственных болезней и других биоло-
гических дефектов человека.
6) Наконец, проникновение в молекулярно-генетическую сущ-
ность мутаций и всех условий, направляющих этот процесс, обес-
печит решение проблемы направленного мутагенеза, что отдаст
органический мир во власть человека».
ЛИТЕРАТУРА
Азол И. И. 1929. Ступенчатый аллеломорфизм у Dr. melanogaster. К вопросу
о строении и природе гена.—Журн. эксп. биол., 5, вып. 2, 86—101.
Алиханян С. И. 1947. Проблема гена в современной генетике.— Вести, МГУ.
№ 12, 3-20.
Антонов А. С. 1965. Нуклеотидный состав ДНК животных: связь с система-
тикой этих организмов и его эволюция.— Усп. совр. биол., 60, 161—177.
Антонов А. С., Белозерский А. Н. 1961. Сравнительное изучение нуклеотид-
ного состава дезоксирибонуклеиновых кислот некоторых позвоночных
и беспозвоночных животных.—Докл. АН СССР, 138, 1216—1219.
Ардашников С. Н., Сойфер В. Н., Гольдфарб Д. М. 1963. Индукция h-мутаций
у внеклеточного фага Т2 с помощью у-излучения.— Вестп. АМН СССР,
№ 12, 43—50.
Батлер Дж. 1968. Гетерогенность гистонов и их специфичность. В кн.: Ги-
стоны и перенос генетической информации. М., «Мир».
Белозерский А. И., Спирин А. С. 1962. Химия нуклеиновых кислот микро-
организмов.— В кп.: Нуклеиновые кислоты. М., ИЛ, стр. 123—155.
Белозерский А. Н., Шугаева Н. В., Спирин А. С. 1958. Состав дезоксирибо-
нуклеиновых кислот у различных видов актиномицетов.— Докл. АН,
СССР, 119, 330-332.
Бельговский М. Л. 1939. Зависимость частоты мелких перестроек хромосом
у Drosophila melanogaster от дозы рентгеновских лучей.— Изв. АН
СССР, сер. биол., стр. 159.
Бензер С. 1960. Тонкая структура гена,.— В кн.: Химические основы наслед-
ственности. М., ИЛ., стр. 56—77.
Богданова Е. С., Хесин Р. Б. 1966. Метилирование ДНК при развитии бак-
териофага Т2.— В сб.: Конференция Радиобиолог, отдела Института
атомной энергии им. И. В. Курчатова. М., стр. 191—202.
Боннер Д., Хуанг Р. 1968. Гистоны как специфические репрессоры синтеза
РНК в хромосомах.— В кн.: Гистоны и перенос генетической информа-
ции. М., «Мир».
Браше Ж. 1960. Биохимическая цитология. М., ИЛ.
Бреслер С. Е. 1966. Введение в молекулярную биологию. Изд. 2, М.—Л.,
«Наука».
Бреслер С. Е., Перумов Д. А. 1962. Химический мутагенез на выделеппой
дезоксирибонуклеиновой кислоте и трансформация бактерий.— Биохи-
мия, 27, 927.
Бреслер С. Е., Перумов Д. А. 1964. Мутагенез на изолированной ДНК под
действием ультрафиолетового излучения и химических агентов.— Докл.
АН СССР, 158, 967.
Буш Г. 1967. Гистоны и другие ядерпые белки. М., «Мир».
Ванюшин Б. Ф., Белозерский А. Н. 1959. Нуклеотидный состав дезоксирибо-
нуклеиновых кислот высших растений.— Докл. АН СССР, 129, 944—
946.
Вильсон Э. 1936. Клетка и ее роль в развитии и наследственности (перевод
с англ.), т. I. М.—Л., Изд-во АН СССР.
Вильсон Э. 1940. Клетка и ее роль в развитии и наследственности, т. II.
М.- Л., Изд-во АН СССР.
Волкин Э., Астрахан Л. 1961. Метаболизм РНК в клетках Escherichia coll,
зараженных фагом Т2.— В сб. Химические основы наследственности.
М., ИЛ, стр. 686.
ЛИТЕРАТУРА
228
Гайсинович А. 1930. Ступенчатый аллеломорфизм у Dr. melanogaster. III.
Аллеломорф Sc5 — Журн. эксп. биол., 6, вып. 1, 15—24.
Гамов Г., Рич А., Икас М. 1957. Проблема передачи информации от нуклеи-
новых кислот к белкам— В сб.: Вопросы биофизики. М., ИЛ, стр. 205—
263.
Гептнер М. А., Демидова 3. А. 1936. Зависимость между дозами рентгенов-
ских лучей и мутациями отдельных генов у Drosophila melanogaster.—
Биол. журн. 5, 541—550.
Губерниев М. А., Уголева Н. А. 1960. Состав дезоксирибонуклеиновой кис-
лоты у стафилококка 209-Р, чувствительного и устойчивого к некото-
рым антибиотикам.— Докл. АН СССР, 133, 466—468.
Дельбрюк М., Стент Г. 1960. О механизме воспроизведения ДНК.— В кн.:
Химические основы наследственности. М., ИЛ, стр. 562—591.
Дубинин Н. II. 1929. Исследование явления ступенчатого аллеломорфизма у
Drosophila melanogaster. I. Аллеломорфы scute1, scute2, scute3.— Журн.
эксп. биол., 5, вып. 2, 53—85.
Дубинин И. П. 1930а. Ступенчатый аллеломорфизм у Dr. melanogaster. VI.
Аллеломорфы sc7, achaete — scute10, Ach1 — Sc11, Ach3 — Sc13.—Журн.
эксп. биол., 6. вып. 4, 300—324.
Дубинин Н. П. 19306. Исследование ступенчатого аллеломорфизма. VIII.
Центровая теория гена achaete — scute.— Журн. эксп. биол., 6, вып. 4,
325-346.
Дубинин Н. П. 1931а. Исследование ступенчатого аллеломорфизма. IX. Ал-
леломорф achaete5 — scute15.— Журн. эксп. биол., 7, вып. 5—6, 525—551.
Дубинин Н. П. 19316. Исследование ступенчатого аллеломорфизма. X. Зако-
номерности центрового строения ступенчатых аллеломорфов scute и
achaete.— Журн. эксп. биол., 7, вып. 5—6, 601—635.
Дубинин Н. П. 1932. О некоторых основных проблемах генетики.— Биол.
журн., 1, вып. 1—2, 112—146.
Дубинин Н. П. 1934а. Дискретность и непрерывность в строении наследст-
венного вещества.— Тр. по динамике развития, 10, 345—360.
Дубинин Н. П. 19346. Экспериментальное уменьшение числа пар хромосом
у Dr. melanogaster — Биол. журн., 3, № 4, 719—736.
Дубинин Н. П. 1936а. Экспериментальное изменение числа пар хромосом у
Dr. melanogaster.— Биол. журн., 5, вып. 5, 833—843.
Дубинин Н. П. 19366. Новый тип эффекта положения генов.— Биол. журн..
5, вып. 5, 851—874.
Дубинин Н. П. 1956,. Проблемы физических и химических основ наследст-
венности.— Биофизика, 1, вып. 8, 677—695.
Дубинин Н. П. 1961. Проблемы радиационной генетики. М., Атомиздат.
Дубинин Н. П., 1963. Молекулярная генетика и действие излучений на нас-
ледственность. М., АтомиздаТс
Дубинин Н. П. 1964. Теория гена, история и современные проблемы.— Бюлл.
МОИП (сер. биол.), вып. 1, 5—19.
Дубинин Н. П. 1965. Цепной процесс при химическом и радиационном му-
тагенезе.— В кп.: Экспериментальный мутагенез у животных, расте-
ний и микроорганизмов, 1, 3—4, М., Изд. МОИП.
Дубинин Н. П., Дубинина Л. Г. 1968. О длительноживущих потенциальных
изменениях хромосом.— Докл. АН СССР, 179, 1221—1224.
Дубинин Н. П., Сидоров Б. Н. 1933. Базиген achaete — scute — Hairywing.—
Биол. журн., 2, вып. 2—3, 132—144.
Дубинин Н. П., Сидоров Б. Н. 1934. Зависимость действия гена от его поло-
жения в системе.— Биол. журн., 3, вып. 2, 307—331.
Дубинин Н. П., Сидоров Б. Н. 1935. Эффект положения гена hairy.— Биол.
журн., 4, вып. 3, 555—568.
Дубинин И. П., Сойфер В, Н. 1969. Молекулярный механизм возникновения
хромосомных разрывов и полных генных мутаций.— Изв. АН СССР
(сер. биол.), № 5, 637—648.
229
ЛИТЕРАТУРА
Дубинин Н. П., Соколов II. Н., Тиняков Г. Г. 1935. Цитогенетический анализ
эффекта положения.— Биол. журн., вып. 4, 707—715.
Дубинин Н. П., Хвостова В. В., Мансурова В. В. 1941. Хромосомные аберра-
ции, летальные мутации и доза Х-лучей,— Докл. АН СССР, 31, 386—
387.
Дубинина Л. Г., Дубинин II. П. 1967. Доказательство поражения хромосом
алкилирующими соединениями в предсиитетической фазе клеточного
цикла.—Докл. АН СССР, 175, 213—215.
Дубинина Л. Г., Дубинин Н. П. 1968. Новое в действии алкилирующих сое-
динений на мутационный процесс,— Генетика, 4, 5.
Жакоб Ф., Вольман Э. 1961. Пол и генетика бактерий. М., «Мир».
Жакоб Ф., Моно Ж. 1962. Детерминация и специфическая регуляция синте-
за белков.— Тр, V МБК. Сими. 1. М., Изд-во АН СССР, стр. 157.
Захарян Р. А., Венкстерн Т. В., Баев А. А. 1967. Метилированная т-РНК, ее
физико-химические свойства и акцепторная функция — Биохимия, 32,
1068—1078.
Иванов В. Н., Сойфер В. Н. 1965. Супрессорные мутации как причина воз-
никновения максимума относительной частоты мутации.— В сб.: Тези-
сы докладов Симпозиума по генетике микроорганизмов. М., «Медици-
на», стр. 37.
Камшилов М. М. 1935. Является ли плейотропия свойством гена?— Биол.
журн., 4, вып. 1. 113—144.
Карпеченко Г- Д. 1927. Полиплоидные гибриды Raphanus sativus L. X Brassica
oleraceae L. (К проблеме экспериментального видообразования).—Tp.
прикл. бот. генет. и сем., 17, вып. 3, 304—410.
Кедровский Б. В. 1942. Нуклеиновые кислоты клеточной протоплазмы. Их
значение для роста и развития и их роль в заживлении ран.— Усп.
совр. биол., 15, вып. 3, 295—309.
Кедровский Б. В. 1951. Рибонуклеиновая кислота и ее роль в развитии и
функции клетки.— Усп. совр. биол., 31, вып. 1, 38—56.
Кернс Д. 1966. Хромосома Escherichia coli — В ки.: Синтез и структура нук-
леиновых кислот. М., «Мир», стр. 23—29.
Кольцов Н. К. 1928. Физико-химические основы морфологии.— Тез. докл.
Труды третьего Всеросс. съезда зоологов, анатомов и гистологов в Ле-
нинграде 14—20.XII. 1927. М.— Л., Госиздат.
Кольцов Н. К. 1930. Об экспериментальном получении мутации.— Журн.
эксп. биол,, 6, вып. 4.
Кольцов Н. К. 1935. Наследственные молекулы.— Наука и жизнь, № 5—6.
Кривиский А. С. 1961. Наследственная изменчивость бактериофагов под вли-
янием коротковолновых излучений.— Тезисы докладов междувузовской
конференции по экспериментальной генетике, ч. I, стр. 78—80.
Кросби Дж. 1962. Биосинтез пиримидиппуклеотидов.— В кн.: Нуклеиновые
кислоты. М., ИЛ, стр. 270—290.
Левинталь С., Фен Д., Хига А., Циммерман И. 1966. Распад и защита инфор-
мационной РНК у бактерий.— В кн. Синтез и структура пуклеиновьГх
кислот. М., «Мир», стр. 234—250.
Левит С. Г 1930. Ступенчатый аллеломорфпзм у Dr. melanopaster. N. Мута-
ция scute9 и вопрос об аллеломорфах-организаторах.— Жури. эксп. би-
ол., 6, вып. 4, 287—299.
Ли Д. Е. 1963. Действие радиации па живые клетки. М., Атомиздат.
Лобашев М. Е. 1937. О действии химических агентов на мутациопный про-
цесс у Drosophila melanogaster.— Тр. Ленипгр. общ. естествоиспытат..
66, вып. 3, 346—376.
Меллер Г. 1937. Проблема изменчивости гена.— Б кн.: Избр. работы по ге-
нетике. М.. Сельхозгиз, стр. 178—205.
Меллер Г. Г., Прокофьева-Белъговская А. /1., Котиков К. В. 1936. Неравный
ЮВ. Н. Сойфер
ЛИТЕРАТУРА
230
Кроссинговер у мутантов Ваг как результат удвоения маленького участ-
ка хромосомы.— Докл. АН СССР (новая серия'), 1, 83—84.
Мокульская Т. Д., Богданова Е. С., Горленко Ж. М., Замчук Л. А., Моку ль-
ский М. А., Гольдфарб Д. М., Хесин Р. Б. 1966. Структурные переходы
и биологические свойства неглюкозилированной ДНК фага Т2.— В сб.:
Структура, свойства и генетические функции ДНК. Конф, радиобиол.
отдела Института атомной энергии им. И. В. Курчатова. М., стр. 5—16.
Навашин М. С. 1933. Новые данные по вопросу о самопроизвольных мута-
циях.— Биол. журн., 2, вып. 2—3, 111—115.
Нагата Т. 1966. Последовательная редупликация ДНК Е. coli — В кн.: Син-
тез и структура нуклеиновых кислот. М., «Мир», стр. 30—36.
Надсон Г. А., Филиппов Г. С. 1925. О влиянии рентгеновых лучей на поло*
вой процесс и образование мутантов у низших грибов (Мисогасеае).—
Вести, рентгенологии и радиологии, 3, 305—310.
Никитин В. Н., Шерешевская Т. М. 1961. Нуклеотидный состав рибонуклеи-
новой и дезоксирибонуклеиновой кислот печени животных разного воз-
раста.— Биохимия, 26, 1062—1064.
Ниренберг М., Маттеи Г. 1963. Зависимость синтеза белка в бесклеточной
системе от природных или синтетических полирибонуклеотидов.— В сб.:
Молекулярная генетика. М., ИЛ, стр. 69—92.
Никифоров В. Г. 1966. Модификации бактериофагов, вызываемые хозяи-
ном.— Усп. совр. биол., 62, 383—397.
Паншин И. В. 1935. Новое доказательство гипотезы эффекта положения.—
Докл. АН СССР (новая серия), 4, 85—86.
Прокофьева-Бельговская А. А. 1960. Строение хромосомы.— В сб.: Ионизи*
рующие излучения и наследственность. Итоги науки. М., Изд-во АН
СССР, 3, 7-60.
Прокофьева-Бельговская А. А. 1962. Организация и функционирование хро-
мосомы.— Вести. АН СССР, № 12, 60—62.
Рапопорт И. А. 1947. Наследственные изменения, происходящие под влия-
нием диэтилсульфата и диметилсульфата.— Докл. ВАСХНИЛ, 12,
вып. 10.
Рапопорт И. А. 1948а. Действие окиси этилена, глицида и гликолей на ген-
ные мутации.— Докл. АН СССР, 60, 469—472.
Рапопорт И. А. 19486. Алкилирование генной молекулы.— Докл. АН СССР,
59, 1183-1186.
Рис Г., Шандлер Б. 1966. Ультраструктура генетических систем прокарио-
тов и эукариотов.— В кн.: Синтез и структура нуклеиновых кислот. М.,
«Мир», стр. 11—22.
Сахаров В. В. 1932. Иод как химический фактор, действующий на мутаци-
онный процесс у Dr. melanogaster.— Биол. журн., 1, вып. 3—4, стр. 1—8.
Сахаров В. В. 1935. Иод как химический фактор, действующий на мутацион-
ный процесс у Dr. melanogaster. III. Серия на аутосомные летали.—
Биол. журн., 4, вып. 1, 107—113,
Сахаров В. В. 1936. Признак mottled у Dr. melanogaster как следствие эф-
фекта положения.— Биол. журн., 5, вып. 2, 293—302.
Серебровский А. С. 1930. Исследование ступенчатого аллеломорфизма, IV.
Трансгенация scute6 и случай «неаллеломорфизма» членов общей лест-
ницы аллеломорфов.— Жури. эксп. биол., 6, вып. 2, 61—72.
Серебровский А. С., Дубинин Н. П. 1929. Искусственное получение мутаций
и проблема гена.— Журн. эксп. биол., вып. 4, 235—247.
Сидоров Б. Н. 1931. Исследование ступенчатого аллеломорфизма у Dr. me-
lanogaster.— Журн. эксп. биол., 7, вып. 1, 28—40.
Сидоров Б. Н., Соколов Н. Н., Андреев В. С. 1965. Мутагенный эффект эти-
ленимина в ряде клеточных поколений.— Генетика, 1, 112.
Сойфер В. Н. 1965. Мутагенез у внеклеточного бактериофага Т2.— В кн.:
Экспериментальный мутагенез животных, растений и микроорганиз-
мов. М., йзд. МОИП, 1, 137—139.
231
ЛИТЕРАТУРА
Сойфер В. В. 1966а. Мутационный процесс на высоких дозах облучения.—
Бюлл. МОИП. сер. биол., 71, 88—99.
Сойфер В. Й. 19666. Исследование мутационного процесса у бактериофага
Т2. Индукция h-мутаций у внеклеточного фага с помощью ультрафио-
летового облучения.— Вести. АМН, 2, 47—49.
Сойфер В. В. 1969. Молекулярные механизмы мутагенеза. М., «Наука».
Сойфер В. В. 1970а. Функционирование репарируютцих систем у бактерий
и высших организмов: проблема узнавания, участие в мутагенезе и
репликации.— В сб.: Тезисы докладов симпозиума «Молекулярные ме-
ханизмы генетических процессов». М., стр. 81—82.
Сойфер В. В. 19706. Репарирующие системы клетки. М., «Знание».
Сойфер В. В., Дорохов Ю. Л. 1970а. Single-burst анализ размножения фагов
Т4Д и Т4ДУ~ в клетках Е. coli В и Е. coli Bs_i.—Докл. АН СССР, 192,
№4.
Сойфер В. В., Дорохов Ю. Л. 19706. Отсутствие максимума частоты мута-
ций при действии ультрафиолетового света в клетках, дефектных по
темновой репарации.— В сб.: Тезисы докладов симпозиума «Молеку-
лярные механизмы генетических процессов». М., стр. 24.
Сойфер В. В., Матусевич Л. Л., Горошкина Г В. 1970. Димеризация пири-
мидиновых оснований ДНК клеток HeLa при ультрафиолетовом облу-
чении и вырезание димеров в ходе темновой репарации.— Радиобиоло-
гия, 10. вып. 2. 275—278.
Спирин А. С. 1968. Рибосома. М., «Наука».
Спирин А. С., Белозерский А. В. 1957. Сравнительное изучение состава ри-
бонуклеиновых кислот у различных видов бактерий.— Докл. АН СССР,
ИЗ, 650-651.
Спирин А. С., Белозерский А. В., В1угаева В. В., Ванюшин Б. Ф. 1957. Изу-
чение видовой специфичности нуклеиновых кислот у бактерий.— Био-
химия. 22, 744—753.
Стент Г. 1965. Молекулярная биология вирусов бактепий. М., «Мир».
Супермутагены. 1966. М., «Наука». Сб. под редакцией И. А. Рапопорта.
Тейлор Дж. Г. 1964. Репликация и организация ДНК в хромосомах.—В кн.:
Молекулярная генетика. Часть Т. М., «Мир», стр. 78—125.
Тимофеев-Ресовский В. В. 1925. Обратная геновариация у Dr. junebris.—
Журн. эксп. биол., сеп. А. 1.
Тимофеев-Ресовский Б. В. 1929. Обратные и соматические геповариации оп-
ределенного гена в противоположных направлениях под действием рент-
геновских лучей.—Журн. эксп. биол., 5, вып. 1, 25—31.
Тимофеев-Ресовский В. В. 1930а. Обратные геповариации и изменчивость
гена в разных направлениях. II. Обратные геповариации у Dr. melano-
gaster под воздействием рентгеновских лучец.— Журн. эксп. биол., 6,
вып. 1. 3—7.
Тимофеев-Ресовский В. В. 19306. Существует ли «последействие» рентгени-
зации на геновариационный процесс.— Журп. эксп. биол., 6, вып. 2,
79-83.
Тиняков Г. Г. 1931. Краткое сообщение о новом гене в 4-й хромосоме.—
Журн. эксп. биол.. 7. вып. 3, 377—378.
Уотсон Д., Крик Ф. 1957. Структура дезоксирибонуклеиновой кислоты. Про-
блемы цитофизиологии. М., ИЛ, стр. 58—70.
Уотсон Дж. 1967. Молекулярная биология гена. М., «Мир».
Фриз Э. 1962. Молекулярный механизм мутаций.—Тр. V МБК. Симп. 1. М.,
Изд-во АН СССР. стр. 231-257.
Фриз Э. 1964. Молекулярные механизмы мутаций — В кн.: Молекулярная
генетика. М., «Мир», стр. 226—298.
Хесин Р. Б. 1958. Роль дезоксирибонуклеиновых кислот в процессах транс-
формации бактерий.— Усп. совр. бпол., 46, ИЗ—129.
Хесин Р. В. 1965. Роль белков в регуляции биологической активности
ДНК.— Усп. совр. биол., 59, 12—32.
10*
литература
232
Хесин Р. Б. 1966. Вопрос о структуре, свойствах и генетических функциях
ДНК — состояние проблемы и работа радиобиологического отдела ИАЭ
в этой области.— В сб.: Структура, свойства и генетические функции
ДНК. Конф, радиобиол. отдела Института атомной энергии им. И. В.
Курчатова. М.. стр. 423—442.
Хесин Р. Б., Шемякин М. Ф. 1962. Некоторые свойства информационных
рибонуклеиновых кислот и их комплексов с дезоксирибонуклеиновыми
кислотами.— Биохимия, 27. 761—779.
Хэйс У. 1965. Генетика бактерий и бактериофагов. М., «Мир».
Циммер К. Г. 1962. Проблемы количественной радиобиологии. М., Атомпз-
Дат.
Цукеркандлъ Э., Полинг Л. 1964. Молекулярные болезни, эволюция и генная
разнородность.—В сб.: Горизонты биохимии. М.. «Мир», стр. 147—173.
Четвериков С. С 1926. О некоторых моментах эволюционного учения с точ-
ки зрения современной генетики.— Жури. эксп. биол., 2, вып. 1. 3—54.
Шапиро П. П. 1930. Ступенчатый аллеломорфизм у Dr. melanogaster. VII.
Трансгенация яс12 в связи с последующим возникновением yellow6.—
Жури. эксп. бпол., 6, вып. 4, 347—364.
Шемякин М. Ф., Маняков Б. Ф Киселев И. А.. Хесин Р. Б., 1966. Синтез
ДНК на обеих нитях деполимеризованной ДНК.— Биохимия. 31 910.
Щепотьева Е. С., Ардашников С. К., Лурье Т. Е., Ратманов Т. В. 1959. Кис-
лородный эффект пни действии ионизирующих излучений. М.. Медгиз.
Эфроимсон В. 77. 1931. Трансмутпрутощее действие Х-лучей и проблема ге-
нетической эволюции.— Биол. жури., 7. 491.
Ackerman D. 1904. Zur Chemie dor Vogelblutkerne.— Hoppe-Seyler’s Z., 43,
299-304.
Akirinmisi E. O.. Bonner J.. Ts'o P. О. P. 1965. Binding of basic proteins to
DNA.—J. Mol. Biol., if 128—136.
Allfrey V. G. 1954. Amino acid incorporation by isolated thymus nuclei. I. The
role of DNA in protein synthesis.— Proc. Nat. Acad. Sci. U. S. A., 40,
881-885.
Allfrey V. G. 1961. Factors controlling protein synthesis in nuclear ribosomes
in vitro and in vivo.— Tn: The molecular basis of neoplasia. Austin, Univ.
Texas Press, p. 581—604.
Allfrey V. G. 1964. Structural modification of histones and their role in the re-
gulation of RNA synthesis.— Canad. Cancer conf., N. Y Pergamon Press,
6, 313-335.
Allfrey V G. 1966. Control mechanisms in RNA synthesis.— Cancer Res., 26,
2026-2040.
Allfrey V. G., Daly M. M., Mirsky A. E. 1953. Synthesis of protein in the pan-
creas. IT. The role of ribonucleoprotein in protein synthesis.— J. Gen. Phy-
siol.. 37. 157-175.
Allfrey V. G., Daly M. M., Mirsky A. E. 1955. Some observations on protein me-
tabolism in chromosomes of non-dividing cells.— J. Gen. Physiol., 38,
415-424.
Allfrey V. G.. Faulkner B.. Mirsky A. E. 1964. Acetylation and methylation of
histones and their possible role in the regulations of RNA synthesis.—
Proc. Nat. Acad. Sci. U. S. A.. 51. 786—794.
Allfrey V. G.. Litton V. C.. Mirsky A. E. 1963. On the role of histones in regu-
lating ribonucleic acid synthesis in the cell nucleus.— Proc. Nat. Acad.
Sci. U S. A.. 49, 414-421.’
Allfrey V. G., Mirsky A. E. 1958. Some effects of sustituting DNA of isolated
nuclei with other polyelectrolytes.— Proc. Nat. Acad. Sci. U. S. A., 44,
981-991.
Allfrey V. G.. Mirsky A. E., Osawa S. 1955. A protein synthesis in isolated cell
nuclei.— Nature, 176, 1042—1049.
Allfrey V. G., PogoB.G.T.. Litton V. C.. Gershey E. L.. Mirsky A. E. 1968.
Histone acetylation in insect chromosomes.— Science, 159, 314—316.
233
ЛИТЕРАТУРА
Allfrey V. G., Stern H.. Mirsky A. E., Saetren M. 1951. Isolation of cell nuclei
in nonaqueous media.— J. Gon. Physiol., 34, 529.
Alloway J. L. 1933. Further observations on the use of pneumococcus extracts
in affecting transformation of type in vitro.— J. Exper. Mod.. 57. 265.
Altmann R. 1892. Uober Kernstructur und Notzstructuren.— Arch. Anatomic
und Physiol. I
Altmann R. 1890—1894. Die Granularthoorio und ihro Kritik.— Arch. Anatomic
und Physiol.
Ammann J.. Delius H.. Hofschneider P. H. 1964. Isolation and properties of
an intact nhago-specific replicative form of RNA phage M 12.— J. Mol.
Biol.. 10. 557-561.
Ardashnikov S. N.. Soyfer N. V., Goldfarb D. M. 1964. Induction of h-muta-
tions in the extracellular phage T2.—Biochem. and Biophys. Res. Com-
mons. 16. 455—459.
Astbury W. T. 1947. X-ray studios of nucleic acids.— Sympos. Soc. Expor. Biol.,
66-76.
Astbury W. T Bell F 0. 1938. X-ray study of thymonucleic acid — Nature, 141,
747-748.
Auerbach Ch.. Robson J. M. 1944. Production of mutations by alkyl isothiocy-
anate.— Nature. 154, 80—81.
August J. T., Shapiro L., Soyang L. 1965. Replication of RNA viruses. I. Cha-
racterization of a viral RNA-dependent RNA polymerase.—J. Mol. Biol.,
11. 257-271.
Avery О. T.. MacLeod С. M., McCartu M, 1944. Studies on the chemical nature
of the substance inducing transformation in pneumococcal types. I. Indu-
ction of transformation by a deoxyribonucleic acid fraction isolated from
pneumococcus.— J. Exper. Med., 79, 137.
Baker W. K. 1954. Data on the physical distance breakage noint and affected
locus in a v- tyne position effects.— J. Heredity, 45, 65—68.
Baker W. K. 1968. Position-effect variegation.— Adv. Genet.. 14, 133—169.
Baltimore D. 1964. Tn vitro synthesis of viral RNA bv the poliovirus RNA-poly-
merase —Proc. Nat. Acad. Sci. U. S. A.. 51, 450—456.
Baltimore D.. Becker У., Darnell J E. 1964. Virus-specific double stranded RNA
in noliovirus-infected cells.— Science, 143, 1034—1035.
Bazill G. W.. Philpot J. S. L. 1963. Assay of primer DNA in presence of histone
and nucleoprotein and in isolated nuclei. — Biochim. et biophys. acta, 76,
223—233.
Beer M. 1961. Electron microscopy of unbroken DNA molecules.— J. Mol. Bi-
ol., 3. 263-266.
Belozersky A. N.. Spirin A. A. 1958. A correlation between the compositions of
deoxyribonucleic and ribonucleic acids. — Nature, 182, 111—112.
Bendet I., Schachet E., Lauffer M. A. 1962. The size of T3 DNA.— J. Mol. Biol.,
5, 76.
Berg P., Fancher H.. Chamberlin M. 1963. The synthesis of mixed polynucleo-
tides containing ribo- and deoxyribonucleotides by purified preparations of
DNA polymerase from Escherichia coli.—In: Information macromolecules.
H. .1. Vogel, V. Brvson, J. O. Lampen (Eds). N. Y Acad. Press, p. 467—
483.
Berlowitz L. 1965. Analysis of histones in situ in developmentally inactivated
chromatin.— Proc Nat. Acad. Sci. U. S. A.. 54, 476—480.
Bernstein H.. Edgar R.. Denhardt G. 1965. Intragenic complementation among
temperature sensitive mutants of bacteriophage T4D.— Genetics, 51.
987-1002.
Bessman M. J.. Lehman 1. G.. Simms E. S., Kornberg A. 1958. Enzymatic
synthesis of DNA. II. General properties of the reaction. — J. Biol. Chem.,
233, 171-177. v .
Birnstiel M. L., Flamm W, G. 1964. Intranuclear site of histone synthesis.—
Science, 145, 1435—1437.
ЛИТЕРАТУРА
234
Bloch D. P. 1963. Genetic implications of histone behaviour.— J. Cell, and
Compar. Physiol.-, 62, suppl. 1, 87—94.
Boivin A., Ventirely R., Ventirely C. 1948. L’acide desoxyribonucleique du
noyau cellulaire depositaire des characteres hereditaires; arguments d’ord-
re analitique. — C. r. Acad, sci., 226, 1061—1063.
Bollack C., Keth G., Ebel J. P. 1965. Aclqylation des acides nucleiques. I.
Etude comparee de la methylation des acides ribonucldiques en solution
aqueuse et organique. — Bull. Soc. Chim. biol., 47, 765.
Bollum F. J., Setloiv R. B. 1963. Ultraviolet inactivation of DNA primer acti-
vity. I. Effects of differing wavelengths and doses. — Biochim. et biophys.
acta. 68, 599-607.
Bonner J., Huang R. С. C., Giltien R. V. 1963. Chromosomally directed protein
synthesis. — Proc. Nat. Acad. Sci. U. S. A., 50, 893—900.
Bonner J.. Tso P. О. P. 1963. Histone biology and chemistry. — Science, 141,
652—654.
Borek E. 1963. The methylation of transfer RNA: mechanism and function. —
Cold Spring Harbor Sympos Quant. Biol., 28, 139—148.
Borek E., Christman J. 1965. A decrease in absorbancy in T-RNA produced
by enzymatic methylation. — Federat. Proc., 24, 292.
Borek E., Ryan A., Rockenbach J. 1955. Nucleic acid metabolism in relation
to the Ivsogenic phenomen. — J. Bacteriol., 69, 460—467.
Borst P., Weissman C. 1965. Replication of viral RNA. VIII. Studies on the
enzymatic mechanism of replication of MS2 RNA. — Proc. Nat. Acad. Sci.
U.S.A., 54, 982-987.
Brachet J. 1941. The histochemical detection and the microdetermination of
pentose nucleic acids (in animal tissues and during embrionic develop-
ment of Amphibians). — Enzymologia, 10, 87—96.
Brachet J. 1942. La localisation des acides pentose-nucleiques les tissus ani-
maux et les ooufs d’amphibiens en voie de development.— Arch, biol.,
53, 207.
Brammar W. J., Berger H., Yanofsky C. 1967. Altered amino acid sequences
produced by reversions of frameshift mutants of tryptophan synthetase
A gene of E. coli.—Proc. Nat. Acad. Sci. U.S.A., 58, 1499—1506.
Bremer H., Michalke H., Mueller K. 1968. Messenger RNA synthesis in vivo
and in vitro. — In: Annual Report of the Biology Division of Southwest
Center for Advanced Studies for 1967 year. Dallas, p. 6.
Bridges B. A., Munson R. J. 1968. Mutagenesis in Escherichia coli: evidence
for the mechanism of base change mutation by ultraviolet radiation in
a strain deficient in excision-repair. — Proc. Roy. Soc. B, 171, 213—226.
Bridges С. B. 1935. Salivary chromosome maps. — J. Heredity, 26, 60.
Bridges С. B. 1936. The Bar «gene» a duplication. — Science, 83, 210—211.
Brown S. W. 1966. Heterochromatin. — Science. 151, 417—425.
Burdon R. M„ Billeter M. A., Weissman C., Warner R. C., Ochoa S.,
Knight C. A. 1964. Replication of viral RNA. V. Presence of a virus-speci-
fic double-stranded RNA in leaves with tobacco mosaic virus.— Proc.
Nat. Acad. Sci., U. S. A., 52, 768-775.
Burgi E., Hershey A. D. 1961. A relative molecular wight series derived from
the nucleic acids of bacteriophage T2.— J. Mol. Biol., 3, 458—472.
Burgi E., Hershey A. D. 1962. Specificity and concentration limit in self-pro-
tection against mechanical breakage of DNA. — J. Mol. Biol., 4, 313—315.
Burton A., Sinsheimer R. L. 1963. Process of infection with 0X174: effect
of exonucleases on the replicative form. — Science, 142, 962—963.
Busch H., Davies J. R. 1958. Nuclear proteins of tumors and other tissues:
a review. — Cancer Res., 19, 1241.
Busch H., Steele W. J., Hnilica L. S., Taylor C. W., Mavioglu H. 1963. Bioche-
mistry of histones and cell cycle.— J. Cell, and Compar. Physiol., 62,
suppl. 1, 95—110.
235
ЛИТЕРАТУРА
Butler J. A. V., Johns E. W, 1964. Interaction between histones and nucleic
acids.— Biochem. J., 91, 15c—16c.
Byrd C., Ohtsuka E., Moon H., Khorana H. 1965. Synthetic deoxyribo-oligonuc-
leotides as templates for the DNA polymerase of Escherichia coli. New
DNA-like polymers containing repeating nucleotide sequences.— Proc.
Nat. Acad. Sci. U. S. A., 53, 79-86.
Cairns J. 1961. An estimate of the length of the DNA molecule of T2 bacte-
riophage by autoradiography.—J. Mol. Biol., 3, 756—761.
Cairns J. 1962. A minimum estimate for the length of the DNA of Escherichia
coli obtained by autoradiography. — J. Mol. Biol., 4, 407—409.
Cairns 7. 1963. The bacterial chromosome and its manner of replication as
seen by autoradiography. — J. Mol. Biol., 6, 208—213.
Cairns J. 1966. Autoradiography of HeLa cell DNA. — J. Mol. Biol., 15,
372-373.
Caldwell P. C., Hinshelwood C. 1950. Some consideration on autosynthesis in
bacteria.— J. Chem. Soc., 4, 3156—3159.
Calef E., Licciardello G. 1960. Recombination experiments on prophage host
relationship. — Virology, 12, 81—103.
Campbell A. 1963. Segregants from lysogenic hetcrogenotes carrying recom-
binant lambda prophages. — Virology, 20, 344—356.
Cantor К, P., Hearst J. E. 1966. Isolation and partial characterization of me-
taphase chromosome of a mouse ascites tumor. — Proc. Nat. Acad. Sci.
U. S. A., 55, 642-649.
Capra J. D., Peterkofsky A. 1966. The coding properties of methyl-deficient
leucyl-transfer RNA. — J. Mol. Biol., 21, 455—465.
Capra J. D., Peterkofsky A. 1968. Effect of in vitro methylation on the chro-
matographic and coding properties of methyl-deficient leucine transfer
RNA. — J. Mol. Biol., 33, 591—607.
Caro L. G., van Tibergen R. P. 1962. High resolution autoradiography. —
J. Cell Biol., 15, 173-188.
Caspersson T. 1939. Uber die Rolle der Desoxyribosennukleinsaure bei der
Zellteilung. — Chromosoms, 1, 147—156.
Caspersson T. 1941. Studien uber den Eiweissumsatz der Zelle. — Naturwissen-
schaften, 29, 33—43.
Caspersson T. O. 1950. Cell growth and cell function. A cytologycal study.
N. Y., W. W. Norton.
Caspersson T., Brandt K. 1940. Nukleotidumsatz und Wachstum der Presshe-
fe.— Protoplasma, 35, 507—529.
Caspersson T., Nystrom C., Santesson L. 1941. Zytoplasmatische Nukleotide in
tumorzellen.— Naturwissenschaften, 29, 29—30.
Catlin B. W. 1960. Transformation of Neisseria meningitides by deoxyribo-
nucleates from cells and from culture slime.— J. Bacterio!., 79, 579—589.
Cavaliery L. F., Rosenberg В. H. 1961. The replication of DNA. III. Changes
in the number of strands of E. coli DNA during its replication cycle. —
Biophys. J., 1, 337—351.
Cavaliery L., Small T., Sarcar N. 1962. The renaturation of denatured DNA. —
Biophys. J., 2, 339—350.
Cerda-Olmedo E., Hanawalt P., Guerola N. 1968. Mutagenesis of the replication
point by nitrosoguanidine: map and pattern of replication of the Esche-
richia coli chromosome. — J. Mol. Biol., 33, 705—719.
Chamberlin M., Berg P. 1962. Deoxyribonucleic acid directed synthesis of ri-
bonucleic acid by an enzyme from E. coli. — Proc. Acad. Sci. U. S. A., 48,
81-94. , ri
Champe S. P., Benzer S. 1962. Reversal of mutants phenotypes by o-fluorou-
racil: an approach to nucleotide sequence in messenger RNA. — Proc.
Nat. Acad. Sci. U. S. A., 48, 532—546.
Chandler B., Hayashi M,, Hayashi M. N, Spiegelman A. 1964. Circularity of
ЛИТЕРАТУРА
236
the replications form of a single stranded DNA virus. — Science, 143.
47-49.
Chapeville F., Lippman F., von Ehrenstern G., Weinsblum B., Ray W. G.t
Benzer S. 1962. On the role of soluble ribonucleic acid in coding for amino
acids. — Proc. Nat. Acad. Sci. U. S. A., 48, 1086—1092.
Char gaff E. 1950. Chemical specificity of nucleic acids and mechanism of their
enzymatic degradation. — Experientia, 6, 201—209.
Chargaff E. 1951. Structure and function of nucleic acids as cell consti-
tuents. — Federat. Proc., 10, 654—659.
Chovnick A. 1958. Aberrant segregation and pseudoallelism of the garnet locus
in Drosophila melanogaster. — Proc. Nat. Acad. Sci. U. S. A., 44, 333—337.
Chovnick A., Scholet A., Kernnognan R. P,, Talsma J. 1962. The resolving
power of genetic fine structure analysis in higher organisms as exempli-
fied by Drosophila.— Amer. Naturalist, 96, N 890.
Chu E. II. Y. 1962. Photoreactivation and activation spectrum of ultraviolet-
induced mammalian chromosome aberrations. — Genetics, 47, 948.
Comb D. G. 1963. Characterization of the RNA components of the nucleus. —
Federat. Proc., 22, 354.
Cooper S., Zinder N. D. 1962. The growth of an RNA bacteriophage: the role
of DNA synthesis. — Virology, 18, 405. 411.
Crampton C. F., Stein W. H., Moore S. 1957. Comparative studies on chromatog-
raphically purified histones.— J. Biol. Chem., 225, 363—386.
Crick F. H. C., Barnett L., Brenner S., Watts-Tobin R. J. 1961. The general
nature of the genetic code for proteins. — Nature, 192, 1222—1231.
Cruft II. J., Ridley J., Mauritzen, С. M., Stedman E. 1957. Amino acid composi-
tion of the six histones of calf thymocytes.— Nature, 180, 1107.
Daly M. M., Allfrey V. G., Mirsky A. E. 1952. Uptake of N15 glycine by com-
ponents of cell nuclei.— J. Gen. Physiol., 36, 173.
Davidson I. N. 1947. Some factors influencing the nucleic acid content of cells
and tissues.— Cold Spring Harbor Sympos. Quant. Biol., 12, 50—59.
Davies J. E., Sinsheimer R. L. 1963. The replications of bacteriophages M 32. I.
Transfer of parental nucleic acid to progeny phage.— J. Mol. Biol., 6, 203—
231.
Davies J. E., Strauss J. M., Sinsheimer R. L. 1961. Bacteriophage MS2: another
RNA phages.— Science, 134, 1427.
Davison P. F. 1960. Sedimentation of deoxyribonucleic acid isolated under low
hydrodynamic shear.—Nature, 185, 918—920.
Davison P. F., Freifelder D., Rede R., Levinthal C. 1961. The structural unity
of the DNA of T2 bacteriophage.— Proc. Nat. Acad. Sci. U. S. A., 47,
1123-1129.
Dawson M. R., Sia R. H. P. 1931. A technique for inducing transformation of
pneumococcal types in vitro.— J. Exper. Med., 54, 681.
De Boer G., Pearson M., Johns II. E. 1967. Ultraviolet photoproducts in ordered
structures of poly U and their effects on secondary structures.—J. Mol.
Biol., 27, 131-144.
Delius II., Rofschneider P. M. 1964. The effect of inhibition of protein synthe-
sis on the replication of M12 bacteriophage RNA.— J. Mol. Biol., 10, 554.
Dcmerec M. 1935. What is gene? Цит. по Кольцову II. К., 1935.
Demerec M. 1955. What is gene? Twenty years later.—Amer. Naturalist, 89,
№ 844, 5-20.
Demerec M. 1964. Clustering of functionally related genes in Salmonella typhi-
murium.— Proc. Nat. Acad. Sci. U. S. A., 51, 1057—1060.
Demerec M., Demerec Z. E. 1956. Analysis of linkage relationships in Salmo-
nella by transduction technique.— Brookhaven Sumpos. Biol., 8, 75—84.
Dobzhansky T. 1929. A homozygous translocation in Drosophila melanoga-
ster.— Proc. Nat. Acad. Sci. U. S. A., 8, 633—638.
Dobzhansky D 1932. The baroid mutation in Drosophila melanogaster.— Gene-
tics, 17.
237
ЛИТЕРАТУРА
Dobzhansky Т. G., Sturtevant A. H. 1932. Change in dominance of genes lying
ih duplicating fragments of chromosomes.— Proc. 6-th Internet. Congr. Ge-
pet., 2, 45-46.
Doi R. M., Spiegelman S. 1963. Conservation of a viral RNA genome during
replication and translation.— Proc. Nat. Acad. Sci. U. S. A., 49, 353—360.
Doskocil J. 1966. The sequency specificity of methylation of cytosine in bacte-
rial DNA’s.— Collect. Czcchosl. Chem. Commons, 31, 2456—2465.
Doty P., Marmur J., Sueoka N. 1959. The heterogeneity in properties and func-
tioning of deoxyribonucleic acids.— Brookhaven Sympos. Biol., 12, 1—16.
Dounce A. L. 1952. Duplicating mechanism for peptide chain and nucleic acid
synthesis.— Enzymologia, 15, 251—258.
Dubinin N. P. 1932a. Step-allelomorphism in Drosophila melanogaster. The al-
lelomorphs achaete’-scute11. and achaele3-scuto13.— J. Genetics, 25, 163—
181.
Dubinin N. P. 1932b. Step-allelomorphism and the theory of centers of the gene
achaete-scute.— J. Genet., 26, 37—58.
Dubinin N. P. 1933. Step-allelomorphism in Dr. melanogaster.—J. Genet. 27,
443—164.
Dubinin N. P„ Nemtseva L. S. 1969. Chromosome chromatid rearrangements
resulting from the mitotic crossing-over between sister-chromatids in ring
chromosomes of Crepis capillaris.— Mol. and Gen. Genet., 104, 331—338.
Dubinin N. P.. Sokolow N. N., Tiniakov G. G. 1937. Crossingover between the
genes «yellow», «achaete» and «scute».— Drosophila Information Service,
8, 76.
Dubinin N. P., Soyfer V N. 1969. Chromosome breakage and complete genic
mutation production in molecular terms.— Mutat. Res., 8, 353—365.
Dunn D. B., Smith J. D. 1958. The occurrence of 6-methylaminopurine in deo-
xyribonucleic acids.— Biochem. J.>, 68, 627—636.
Dann D. B.. Smith J. D. 1959. The occurrence of methylated purins in nucleic
acids: their distribution in cell and virus nucleic acids.— In: 4-th Internet.
Congr. Biochem., Vienna, 1958. Acad. Press, p. 72—79.
Ebel J. P., Weil J. II.. Reither B.. Heinrich J. 1965. Nature des sites responsab-
les de I’activite acceptrice du s-RNA.— Bull. Soc. chim. biol., 47, 1599—
1608.
Elson D.. Chargaff E. 1954. Regularities in the composition of pentose nucleic
acids.— Nature. 173, 1037—1038.
Elson D.. Chargaff E. 1955. Evidence of common regularities in the composition
of pentose nucleic acids.— Biochim. et Biophys. Acta, 17, 367—376.
Elson D., Gustaffson T., Char gaff E. 1954. The nucleic acids of the sea-urchin
during embryonic development.— J. Biol. Chem., 209, 285—294.
Emmons C. W., Hollaender A. 1939. The action of ultraviolet radiation in der-
matophytes— Amer. J. Bot., 26, 467.
Ephrussi-Taylor H. E. 1955. Current status of bacterial transformations.—Adv.
Virus Res., 3, 275.
Ephrussi-Taylor И. E. 1960. Recombination analysis in microbial systems.— In:
Growth: molecule, cell, organism. N. Y., Basic Books.
Erikson R. L., Fenwiek M. L., Franklin R. M. 1964. Replication of bacteriophage
RNA: studies on the fate of parental RNA.—J. Mol. Biol., 10, 519—529.
Felix K., Fischer H., Krekels A. 1956. Protamines and nucleoprotamines.—
Progr. Biophys. and Biophys. Chem., 6, 2—23.
Fenwik M. L., Erikson R. L., Franklin R. M. 1964. Replication of the RNA of
bacteriophage R 17.— Science, 146, 527—530.
Fiers W.. Sinsheimer R. L. 1962. The structure of the DNA of bacteriophage
0X174. III. Ultracentrifugal evidence for a ring structure.—J. Mol. Biol.,
5, 424-434.
Fleissner E. 1967. Polypeptide synthesis with methyl-deficient soluble RNA.—
Biochemistry, 6, 621—632.
ЛИТЕРАТУРА
238
Fleissner Е., Borek Е. 1963. Properties of the enzyme system which methy-
lates soluble RNA.— Federat. Proc., 22, 229.
Folsome С. E. 1962. Specificity of induction of T4 rll mutants by ultraviolet
irradiation of extracellular phages.— Genetics*, 47, 611—622.
Franceschint P., Giacomoni D. 1967. Isolation and fractionation of metaphase
chromosomes from HeLa cells.— Atti Asoc. Genet. Ital., XII, 248—258.
Franklin R. E., Gosling R. 1953. Molecular configuration in sodium thymo-
nucleato.—Nature, 171, 740—741.
Franklin R. M. 1966. Purification and properties of the replicative interme-
diate of the RNA bacteriophage R 17.— Proc. Nat. Acad. Sci, U.S.A. 55,
1504—1511.
Fredericq О. A., Fontaine F. 1961. The ultraviolet spectrum of deoxyribonuc-
leic acids and their constituents.— J. Mol. Biol., 3, 11 — 18.
Freif elder D., Kleinschmidt А. K., Sinsheim er R. L. 1964. Electron microscopy
of single stranded DNA: circularity of DNA of bacteriophage 0X174.—
Science, 146, 254—255.
Frenster J. H. 1965. Nuclear polyanions acide-repressors of synthesis of ri-
bonucleic acid.— Nature, 206, 680—683.
Frenster J. H., Allfrey V. G., Mirsky A. E. 1963. Repressed and active chro-
matin isolated from interphase lymphocytes.— Proc. Nat. Sci. U.S.A., 50,
1026-1032.
Furberg S. 1950. The crystal of cytidine.— Acta crystallys, 3, 325—333.
Furberg S. 1952. On the structure of nucleic acids.— Acta chem. scand., 6,
634-640.
Gale E. F. 1955. From amino acids to proteins.— In: Amino acids metabolism,
McElroy and B. Glass (Eds). J. Morphins Univ. Press, p. 171—192.
Gale E. F., Folkes J. P. 1954. Effect of nucleic acids on protein synthesis and
amino-acid incorporation in disrupted staphylococcal cells.— Nature, 173,
1223-1227.
Gamow G. 1954a. Possible relation between deoxyribonucleic acid and protein
structure.— Nature, 173, 318.
Gamow G. 1954b. Possible mathematical relation between deoxyribonucleic acid
and protein —Kgl. danske vid. selskab. Biol, medd., 22, N 3, 4—13.
Geiduschek E. P., Nakamoto T., Weiss S. B., 1961. The enzymatic synthesis
of RNA: complementary interaction with DNA.— Proc. Nat. Acad. Sci,
U.S.A., 47, 1405.
Gesteland R. F., Boodtker H. 1964. Some physical properties of bacteriophage
R 17 and its ribonucleic acid.—J. Mol. Biol., 8, 496—507.
Giles N. N. 1951. Studies on the mechanism of reversion in biochemical mu-
tants of Neurospora crassa.— Gold Spring Harbor Sympos. Quant. Biol.,
16, 283- 313.
Gogol E. M., Rosenberg E. 1964. Observation on the regulation of DNA bio-
synthesis.— Biochem. and Biophys. Res. Communs., 14, 565—570.
Gold M.f Hausmann R., Maitra U„ Hurwitz J. 1964. The enzymatic methyla-
tion of RNA and DNA. VIII. Effects of bacteriophage infection on the
activity of the methylating enzymes.— Proc. Nat. Acad. Sci. U. S. A., 52,
292-297.
Gold M., Hurwitz J. 1964. Enzymatic methylation of RNA and DNA.— Fede-
rat. Proc., 23, 374.
Gold M., Hurwitz J., Anders M. 1963a. The enzymatic methylation of RNA
and DNA.— Biochem. and Biophys. Res. Communs., 11, 107—114.
Gold M., Hurwitz J.. Anders M. 1963b. The enzymatic methylation of RNA
and DNA. II. On the species specificity of the methylation enzymes.—
Proc. Nat. Acad. Sci. U.S.A., 50, 164-169.
Gomatos P. J., Klug R. M., Tamm I. 1964. Enzymatic synthesis of RNA with
reovirus RNA as templates. I. Characteristics of the reaction catalyzed by
the RNA polymerase from Escherichia coli.—J. Mol. Biol., 9, 193—207,
239 литература
Granboulan N., Granboulan P. 1965. Cytochemic ultrastructurale du Nucleole.
IL Etude de Sites de Synthese du RNA dans la Nucleole et le Noyau.—
Exper. Cell Res., 38, 604—619.
Green M. M. 1954. Pseudoallelism at the vermillion locus in Drosophila me-
lanogaster.— Proc. Nat. Acad. Sci. U.S.A.-, 40, 92—99.
Green M. M. 1955. Pseudoallelism and gene concept.— Amer. Naturalist, 89,
N 845, 65-71.
Green M. M., Green К. C. 1949. Crossing-over between alleles at the losenge
locus in Drosophila melanogaster.— Proc. Nat. Acad. Sci. U.S.A., 35,
586-591.
Greenspan C., Marmur J, 1963. The in vivo transcription of bacteriophage SP
8 DNA.— Science, 142, 387.
Griffith F. 4928. Significance of pneumococcal types.—J. Hygiene, 27, ИЗ-
159.
Gros F., Hiatt H., Gilbert W., Kurland C. G., Risenbrough R. W., Watson J. D.
1961. Unstable ribonucleic acid revealed by pulse labelling of Escheri-
chia coli.— Nature, 190, 581—585.
Grunberg-Manago M., Ochoa S. 1955. Enzymatic synthesis and breakdown of
polynucleotides: polynucleotide phosphorylase.— J. Amer. Chem. Soc., 77,
3165-3166.
Gull and J. M. 1947. The structures of nucleic acids.— Gold Spring Harbor.
Sumpos. Quant. Biol., 17, 95—103.
Gurley L. R., Irvin J. L., Holbrook D. J. 1964. Inhibition of DNA polymerase
by histones.— Biochem and Biophys. Res, Commons, 14, 527—532.
Hall B. D., Spiegelman S. 1961. Sequence complementarity of T2-DNA and T2-
specific RNA.— Proc. Nat. Acad. Sci. U.S.A., 47, 137.
Hall Z. W., Lehman I. R. 1968. An in vitro transversion by a mutationally
altered T4-induced DNA polymerase.—J. Mol. BioL, 36, 321—333.
Hanawalt P, C.f Haynes R. H. 1965. Repair replication of DNA in bacteria: ir-
relevance of chemical nature of base defect.— Biochem. and Biophys. Res.
commons, 19, 462—467.
Haruna 1., Nozu K., Ohtaka Y., Spiegelman S. 1963. An RNA «replicase» indu-
ced by and selective for a viral RNA. Isolation and properties.— Proc. Nat.
Acad. Sci., 50, 905—912.
Haruna Spiegelman S. 1965a. Specific template requirements of RNA repli-
case.— Proc. Nat. Acad. Sci. U.S.A., 54, 579—587.
Haruna I., Spiegelman S. 1965b. Autocatalytic synthesis of a viral RNA in vit-
ro.— Science, 150, 884—886.
Haruna I., Spiegelman St 1965c. Recognition of size and sequence by an RNA
replicase.— Proc. Nat. Acad. Sci. U. S. A., 54, 1189—1193.
Haruna 1., Spiegelman S. 1966. A search for an intermediate involving a com-
plement during synchronous synthesis by a purified RNA replicase.—
Proc. Nat. Acad. Sci. U.S.A., 55, 1256—1263.
Hattman S., Fukasawa T. 1963. Host-induced modifications of T-even phages
due to defective glucosylation of their DNA.— Proc. Nat. Acad. Sci. U.S.A.,
50, 297.
Hausen P. 1965. Studies on the occurrence of function of a virus induced doub-
le-stranded RNA in the ME virus L-cell system.— Virology, 25, 523—531.
Hay E. D., Revel J. P. 1963. The fine structure of the DNP component of the
nucleus. An electron microscope study utilizing autoradiography to locali-
ze DNA synthesis.— J. Cell Biol., 16, 29—51.
Hayashi M., Hayashi M. N., Spiegelman S. 1963a. Restriction of in vivo gene-
tic transcription to one of the complementary strands of DNA.—Proc.
Nat. Acad. Sci., USA, 50, 664.
Hayashi M.f Hayashi M. N., Spiegelman S. 1963b. Replicating form of a sing-
le-stranded DNA virus: isolation and properties.— Science, 140, 1313—1316.
Hayashi M., Hayashi M. N., Spiegelman S. 1964. DNA circularity and the me-
chanism of strand selection in the generation of genetic messages.— Proc.
Nat. Acad. Sci. U. S. A., 51, 351—359.
ЛИТЕРАТУРА
240
Haywood A. М., Sinsheimer R. L. 1963. Inhibition of protein synthesis in
E. coli protoplasts by actinomycin D.—J. Mol. Biol., 6, 247—250.
Heitz E., Bayer H. 1933. Beweise liir die Chromosomehnatur der Kernschlei-
fen in den Knauel-Kernen von Bibio hortulanus L.— Z. Zellforsch. und
Mikrosk. Anat., 17, 67.
Hershey A., Chase Al. 1952. Independent functions of viral protein and nucleic
acid in growth of bacteriophage.—J. Gen. Physiol., 36, 39—56.
Hershey A. D., Burgi E. 1960. Molecular homogeneity of the deoxyribonucleic
acid of phage T2.— J. Mol. Biol., 2, 143—152.
Hershey A. D., Burgi E., Ingraham L. 1963. Cohesion of DNA molecules isola-
ted from phage lambda.— Proc. Nat. Acad. Sci. U. S. A., 49, 748—755.
Hershey A. D., Burgi E. 1965. Complementary structure of interactions sites
at the end of lambda DNA molecules.— Proc. Nat. Acad. Sci. U. S. A., 53,
325-328.
Hewitt R., Billen D. 1965. Reorientation of chromosome replication after expo-
sure to utraviolct light of Escherichia coli.— J. Mol. Biol., 13, 40—53.
Hinegardner R., Mazia D. 1962. Enzymes of DNA synthesis in nuclei of sea
urchin embryos.— Science, 136. 326.
Hnilica L. S. 1967. Proteins of the cell nucleus.— In: Progress in Nucleic acid
Research and molecular biology, v. 7. N. Y., Acad. Press, p. 25—106.
Hnilica L. S., Billen D. 1964. The effect of DNA histone interactions on the
biosynthesis of DNA in vitro.—Biochim. et biophys. acta, 91, 271—280.
Hoagland M. B„ Zamechnick P. C., Stephenson Al. L. 1957. Intermediate reac-
tions in protein biosynthesis.— Biochim. et bioph. acta, 24, 215.
Hojschneider P. H. 1963. Untersuchungen fiber «kleine» E. coli К 12 Bakterio-
phagen.— Z. Naturforsch., 18b, 203—210.
Hollaender A., Emmons C. A. 1941. Wavelength dependence of mutation pro-
duction in the ultraviolet with special emphasis of fungi.— Cold Spring
Harbor Sympos. Quant. Biol., 9, 179—186.
Hollaender A., Sansome E R., Zimmer K., Demerec M. 1945. Quantitative ir-
radiation experiments with Neurospora crassa.— II. Ultraviolet irradiati-
on.— Amer. J. Bot., 32, 226—235.
Hotchkiss R. D. 1948. Etudes chimiques sur la facteur transformant du pneu-
mocoque. Unite biologiques donees de continuite genetique.— Golloq. in-
ternal. centre nat. rech. sci., 8, 57.
Hotchkiss R. D. 1952. The role of desoxyribonucleates in bacterial transforma-
tions.—In: Phosphorus Metabolism, v. 2. McElroy W. D., B. Glass. (Eds.).
Baltimore. John Hopkins Press, p. 426.
Hotchkiss R. D. 1955. The biological role of the deoxypentose nucleic acids.—
In: Nucleic acids, v. 2. Chargaff E., J. N. Davidson (Eds), p. 435.
Hsu T. C. 1962. Differential rate in RNA synthesis between euchromatin and
heterochromatin.— Exper. Cell Res., 27, 332—334.
Huang R. С. C., Bonner J. 1962. Histone, a suppressor of chromosomal RNA
synthesis.— Proc. Nat. Acad. Sci. U. S. A., 48, 1216—1221.
Huang R. С. C., Bonner J., Murray K. 1964. Physical and biological properties
of soluble nucleohistones.— J. Mol. Biol., 8, 54—64.
Huberman J. A., Attardi G. 1966. Isolation of metaphase chromosomes from He-
La cells.— J. Cell Biol, 31, 95-105.
Irwin J. A., Holbrook D. J., Evans A. //., McAllister II. C., Stiles E. P. 1963. Pos-
sible role of histones in regulation of nucleic acid synthesis.—Exper. Cell
Res, suppl, 9, 359—366.
Isawa AL, Allfrey V., Mirsky A. E. 1963a. Relationship between RNA synthe-
sis and loop structure in lampbrush chromosomes.— Pros. Nat. Acad.
Sci. U. S. A, 49, 544.
Isawa M., Allfrey V. G., Mirsky A. E. 1963b. Composition of the nucleus and
chromosome in the lampbrush stage of the new oocyle.— Proc. Nat. Acad.
Sci. U. S. A, 50, 811-817.
241
ЛИТЕРАТУРА
Ito S. 1956. Interferometric dry mass determination of isolated liver nuclei
from fasting and fed mice.— Federat. Proc., 15, 519—520.
Jesailis M. A. 1956. Differences in the chemical composition of the phage nuc-
leic acids.— Nature, 178, 637, 1956.
Johns E. IF. 1964a. Studies on lisine rich histones.— In: The nucleohistones.
Bonner J., P., Ts o (Eds).—Proc. 1-sl World Conf. Histone Biol. Chem., Ba-
sadena, 1963. San Francisco, Holden Day, p. 52—58.
Johns E. W. 1964b. Studies on histones. 7. Preparation methods for histone
fractions from calf thymus.— Biochem., J. 92, 55.
Johns E. W., Buller J. A. F. 1964. Specilicity of the interactions between his-
tones and deoxyribonucleic acid.— Nature, 204, 853—855.
Johns E. W., Phillips U. M. P., Simpson P., Puller J. А. ИЛ 1960. Improved
fractionations ol arginine rich histones from calf thymus.— Biochem. J.,
77, 631—636
Johnson R. M., Albert J. 1953. Incorporation of P32 into «phosphoprotein» frac-
tion of mammalian tissue.— J. Biol. Chem., 200, 335—344.
Jones W. 1920. Nucleic acids. 2-nd ed., N. Y., Longmans, Green and C°.
Joshi J. G., Guild W. R., Handler P. 1963. The presence of two species of DNA
in some halobacteria.— J. Mol. Biol., 6, 34—38.
Josse I., Kaiser A. D., Kornberg A. 1961. Enzymatic synthesis of DNA. V1H.
Frequences of nearest neighbour base sequence in DNA.— J. Biol. Chem.,
236, 864—875.
Judd В. H. 1955. Direct proof of a variegated-type position effect at the whi-
te locus in Drosophila melanogaster.— Genetics, 40, 739—744.
Kaerner К. C., Hojfman-Berling H. 1964. Synthesis of double stranded RNA
in RNA phage infected E. coli cells.— Nature, 202, 1012—1013.
Kahler H.} Lloyd B. J. 1953. The electron microscopy of sodium desoxyribonuc-
leate.— Biochim. et biophys. acta, 10, 355—359.
Kaiser A. D. 1962. The production of phage chromosome fragments and their
capacity for genetic transfer.— J. Mol. Biol., 4, 275—287.
Kaiser A. D., Hogness D. S. 1960. The transformation of Escherichia coli with
deoxyribonucleic acid isolated from bacteriophage % dg.— J. Mol. Biol., 2,
392.
Kaiser A. D., Inman R. B. 1965. Cohesion and biological activity of bacterio-
phage lambda DNA.— J. Mol. Biol., 13, 78—91.
Kallen R. G., Simon M., Marmur J. J. 1962. The occurrence of a new pyrimidi-
ne base replacing thymine in a bacteriophage DNA 5-hydromethyluracyL—
J. Mol. Biol., 5, 248—250.
Kay D, 1962. The nucleic acid composition of bacteriophage 0R.—J. Gen. Mik-
robiol., 27, 201—207.
Kay D., Fieldes P. 1962. Hydroxymethylcytosine-containing and tryptophan-de-
pendent bacteriophages isolated from city effluents.— J. Gen. Bacteriol.,
27, 143—146.
Kaye A. M., Fridlender B. 1965. Studies on the biological significance of nucleic
acid methylases.— Abstr. Communs 2-nd Meet. FEBS. Vienna, p. 278—279.
Kaye A. M.. Salomon R., Fridlender B. 1967. Base composition and presence
of methylated bases in DNA from a blue-green alga Plectonema borya-
num.— J. Mol. Biol., 24, 479—483.
Kaye A. M., Winocour E. 1968. On the 5-methylcytosine found in the DNA ex-
tracted from Polyoma virus.— J. Mol. Biol., 24, 475—478.
Kelly R. B., Gould J, L., Sinsheimer R. L. 1965. The replication of bacteriopha-
ge MS2. IV. RNA components specifically associated with infection.—J.
Mol. Biol., 11, 562—575.
Kelly R. B., Sinsheimer R. L. 1964 A new RNA component in MS2 infected
cells.— J. Mol. Biol., 8, 602—606.
Khorana H. G., Btichi H., Gupta N., Jacob T. M., Kossel H., Morgan R., Narang
S. A., Ohtsuka E., Weiss R. D. 1966. Polynucleotide synthesis and the gene-
tic code.— Cold Spring Harbor Sympos., 31, 39—49.
ЛИТЕРАТУРА
24
Kisselev N. A., Gavrilova L. P., Spirin A. S. 1961. On configuration of high po
lymer ribonucleic acid macromolecules as revaled by electron microsco
py.— J. Mol. Biol., 3, 778-783.
Kit S. 1960. Compositional heterogeneity of normal and malignant tissue deo
xyribonucleic acids (DNA).— Biochiin and Biophys. Res. Communs, 3
J61-367.
Kit S. 1961. Equilibrium sedimentation in density gradients of DNA prepara
tions from animal tissues.— J. Mol. Biol., 3, 711.
Kit S. 1962. Species differences in animal deoxyribonucleic acids as revealec
by equilibrium sedimentation in density gradients.— Nature, 193
274—275.
Kit S. 1963. Coding by purine and pyrimidine moieties in animals, plants anc
bacteria.— In: Sympos. Information Storage and Neural Control, p. 76—122
Kleinschmidt A. K., Burton A., Sinsheimer R. L. 1963. Electron misroscopy ol
the replicative form of the DNA of the bacteriophage 0X 174.— Science
142,961.
Kleinschmidt A., Lang D., Zahn R. K. 1961. Ober die intrazellulare Formation
von Bakterien-DNS.— Z. Naturforsch. 16b, 730—739.
Knapp E., Schreider H. 1939. Mutations induced in Sphaerocarpus by ultravio-
let light.— Proc. 7-th Internal. Congr. Genet., p. 175.
Kornberg A., Lehman I. C., Simms E. S. 1956. Polydesoxyribonucleotide syn-
thesis by enzymes from Escherichia coli.— Federal. Proc., 15, 291—292.
Kossel A. 1891. Ueber die chemische Zusammensetzung der Zelle.— Arch.
Anat. und Physiol.
Kossel A. 1893. Ueber die Nucleinsaure.— Arch. Anat. und Physiol.
Kossel A. 1896. Ueber die basischen Stoffe des Zellkernes.— Z. Phys. Chem.,
XXII.
Kossel A. 1912. The proteins. Herter Lecture, John Hopkins Hospital Bull. Bal-
timore.
Krakow ]. S., Ochoa S. 1963. Ribonucleic acid polymerase of Azotobacter vine-
landii. I. Priming by polyribonucleotides.— Proc. Nat. Acad. Sci. U.S.A.,
49, 88-94.
Kunitz M. 1940. Crystalline ribonuclease.— J. Gen. Physiol., 24, 15—32.
Kuno S., Lehman 1. 1962. Gentibiose, a constituent of DNA from coliphage
T6.—J. Biol. Chem., 237, 1266-1270.
Langan T. A. 1968. Histone phosphorylation: stimulation by adenosine 3'5'-
monophosphate.— Science, 162, 579—580.
Langridge R., Billeter M. A., Borst P., Burdon R. N., Weissmann C. 1964. The
replicative form of MS2 RNA: an X-ray diffraction study.— Proc. Nat.
Acad. Sci. U.S.A., 52, 114-119.
Langridge R., Gomatos P. J. 1963. The structure of RNA.— Science, 141, 694.
Laughnan J. R. 1949. The action of allelic forms of the gene A in the maize.
II. The relation of crossing-over to mutation of Ab.— Proc. Nat. Acad. Sci.
U.S.A., 35, 167-178.
Lawley P. D., Brookes P. 1963. Further studies on the alkylation of nucleic
acids and their constituent nucleotides.—J. Biochem., 89, 127—138.
Lehman 1. R., Bess man M. J., Simms E. S., Kornberg A. 1959. Enzymatic syn-
thesis of DNA. I. Preparation of substrates and partial purification of an
enzyme from E. coli.— J. Biol. Chem., 233, 163—170.
Lehman I. R., Pratt E, A. 1960. On the structure of the glucosylated hydroxy-
methylcytosine nucleotides of coliphages T2, T4 and T6.— J. Biol. Chem.,
235, 3254-3259.
Lehnert S. M. 1964. The inhibition of DNA synthesis by nuclear proteins.—
Biochim. et biophys. acta, 80, 338—339.
Leng M., Felsenfeld G. 1966. The preferential interactions of polylysine and
polyarginine with specific base sequences in DNA.— Proc. Nat. Acad Sci
U.S.A, 56, 1325-1332.
243
ЛИТЕРАТУРА
Leuchtenberger С., Vendrely R., Vendrely C. 1951. A comparison of the con-
tent of the desoxyribonucleic acid (DNA) in isolated animal nuclei by cy-
tochemical and chemical methods.—Proc. Nat. Acad. Sci USA 37
33-38. ‘ ’’ ’
Levene P. A., Bass L. W. 1931. Nucleic acids. Amer. Chem. Soc. Monogr. Ser.
56, N. Y., Chemical Catalog Co.
Levene P. A., London E. S. 1929. The structure of thymonucleic acids.— J. Biol.
Chem., 83, 793—802.
Levene P. A., Simms H. S. 1926. Nucleic acid structure as determined by ele-
ctrometric titration data.— J. Biol. Chem., 70, 327—341.
Levene P. A., Tipson R. S. 1935. The ring structure of thymidine.—J. Biol.
Chem., 109, 623—630.
Levinthal C. 1956. The mechanism of DNA replication and genetic recombina-
tion in phage.— Proc. Nat. Acad. Sci. U.S.A., 42, 394—404.
Levinthal C., Davidson P. F. 1961. Degradation of deoxyribonucleic acid under
hydrodynamic shearing forces.— J. Mol. Biol., 3, 674—683.
Levinthal C., Thomas C. A. 1957. Molecular autoradiography: the P-ray coun-
ting from single virus particles and DNA molecules in nuclear emulsi-
ons.— Biochim et biophys. acta, 23, 453—465.
Lewis E. B. 1945. The relation of repeats to position effects in Drosophila me-
lanogaster.— Genetics. 30, 137—166.
Lewis E. B. 1950. The phenomenon of position effect.— Adv. Genet., 3, 73—115.
Lewis E. B. 1951. Pseudoallelism and gene solution.— Cold Spring Harbor
Sympos., 16, 159—174.
Lilienfeld A. 1894. Zur Chemie der Leucocyten.— Hoppe-Seyler’s Z., 18,
473-486.
Lima-De-Faria A. 1962. Progress in tritium autoradiography.—Progr. Biophys.,
12, 282—317.
Lindsley D. L. 1965. Chromosome function at the supragenic level.— Nat. Can-
cer Inst. Monogr., 18, 275—290.
Litman R. 1961. Genetic and chemical alteration in the transforming DNA of
pneumococcus caused by ultraviolet light and by nitrous acid.— J. chim.
phys. et phys. chim. biol., 58, 997.
Littau V. C., Allfrey V. G., Frenster J. H., Mirsky A. E. 1964. Active and inac-
tive regions of nuclear chromatin as revealed by electron microscope
autoradiography.— Proc. Nat. Acad. Sci. U.S.A., 52, 93—100.
Littau V. C., Burdick C. J., Allfrey V. G., Mirsky A. E. 1965. The role of histo-
nes in the maintenance of chromatin structure.— Proc. Nat. Acad.* Sci.
U.S.A., 54, 1204—1212.
Littauer U. Z., Muench K., Berg P., Gilbert W., Spahr P. F. 1963. Studies on
methylated bases in transfer RNA.— Cold Spring Harbor Sympos., 28,
157—159.
Lodish H., Cooper S., Zinder N. 1964. Host dependent mutants of bacteriophage
f2. IV. On the biosynthesis of a viral RNA polymerase.— Virology, 24, 60.
Lodish H., Zinder N. D. 1966. Replication of the RNA of bacteriophage f2.—
Science, 152, 372—378.
Loeb J. 1916. The sex of parthenogenetic frogs.— Proc. Nat. Acad. Sci, 2, 61.
Loeb T., Zinder N. D. 1961. A bacteriophage containing RNA.— Proc. Nat. Acad
Sci. U.S.A., 47, 282—289.
Lombard A., Chargaff E. 1956. The pentose nucleic acid of Azotobacter vine-
landii.— Biochim. et biophys. acta, 20, 585—586.
Lombard A., Chargaff E. 1957. Aspects of the invariability of a bacterial ri-
bonucleic acid.— Biochim. et biophys. acta., 25, 549—554.
Lucy J. A., Butler J. A. V 1955. Fractionation of deoxyribonucleoprotein.—
Biochim. et biophys. acta, 16, 431—432.
Ludlum D. B., Warner R. C„ Wahba A. J. 1964. Alkylation of synthetic poly-
nucleotides.— Science, 145, 397—399.
Maes R., Wecker E. 1964. Fractionation of nucleic acids from polio-infected
HeLa cells.— Z. Naturforsch., 19b, 43—45.
ЛИТЕРАТУРА
244
Maio J. J., Schildkraut C. L. 1967. Isolated mammalian metaphase chromoso-
mes. I. General characteristics of nucleic acids and proteins.— J. Mol.
Biol., 24, 29—30.
Mandel H. G., Matthews R. E. F., Matus A., Ralph R. K. 1964. Replicative form
of plant virus RNA.— Biochem. and Biophys. Res Communs., 16, 604—609.
Marmur J., Doty P. 1962. Determination of the base composition of DNA from
its termal denaturation temperature.—J. Mol. Biol., 5, 109—118.
Marshak A., Calvet F. 1949. Specific activity of P32 in cell constituents of rab-
bit liver.— J. Cell, and Compar. Phisiol., 34, 451—455.
Marshak A., Harting J. 1948. Inhibition of cleavage and P32 uptake in Arbacia
by D-usmic acid.—J. Cell, and Compar. Phsiol., 32, 321—325.
Marvin D. A., Hoffman-Berling H. 1963. Physical and chemical properties of
two new small bacteriophages.— Nature, 197, 517—518.
Mathews A. 1897. Zur Chemie der Spermatozoon.—Hoppe-Segler Z., 23, 399—
411.
Mazia D., Hinegardner R. T. 1963. Enzymes of DNA synthesis in nuclei of sea
urchin embryos.— Proc. Nat Acad. Sci. U.S.A., 50, 148—156.
McClintock B. 1938. The production of homozygous deficient tissues with mu-
tant characteristics by means of the aberrant mitotic behaviour of ring-
shaped chromosomes.— Genetics, 23, 315.
McKendrick M. E., Pontecorvo G. 1952. Crossing-over between alleles at the w-lo-
cus in Drosophila melanogaster.— Experientia, 8, 390—391.
Mendelson J., Moore D. E., Salzmon N. P. 1968. Separation of isolated Chinese
hamster metaphase chromosomes into three size-groups.— J. Mol. Biol.,
32, 101—112.
Meselson M., Stahl F. W. 1958. The replication of DNA in Escherichia coli.—
Proc. Nat. Acad. Sci U.S.A., 44, 671-682.
Meselson M., Stahl F. W., Vinograd J. 1957. Equilibrium sedimentation of ma-
cromolecules in density gradients.— Proc. Nat. Acad. Sci. U.S.A., 43,
581-588.
Miescher F. 1894. Die histochemischen und physiologischen Arbeiten. Bd. 1, 2,
Leipzig. Vogel Verlag.
Mirsky A. E., Pollister A. W. 1943. Fibrous nucleoproteins of chromation.—
Biol. Sympos., 10, 247—260.
Mirsky A. E., Ris H. 1949. Variable and constant components of chromosomes.—
Nature, 163, 666—667.
Mitra S. 1954. Effects of X-rays on chromosomes of Lilium longiflorum during
meiosis.— Genetics, 43, 771—789.
Montagnier L., Saunders F. K. 1963. Replicative form of encephalomyocarditis
virus ribonucleic acid.— Nature. 199, 664—667.
Moore В. C. 1963 Histones and differentiation.—Proc. Nat. Acad. Sci. U. S. Ал
50, 1018-1026.
Morgan L. V. 1933. A closed X-chromosome in Dros. melanogaster.— Genetics,
18, 250-291.
Mosolov A. N. 1968. Model of DNA packing in chromosome.—Proc. XII Inter-
nal. Congr. Genetics, 1, 1.
Muller H. J. 1927. Artificial transmutation of the gene.— Science, 66, 84.
Miiller H. J., Altenburg E. 1930. The frequency of translocations produced by
X-rays in Drosophila.— Genetics, 15, No. 4.
Muhammed A. 1966. The yeast photoreactivating enzyme. I. A method for the
large-scale purification and some properties of the enzyme.— J. Biol.
Chem., 241, 516-523.
Murray K. 1964. The occurrence of epsilon-N-methyl lysine in histones.—
Biochemistry, 3, 10—15.
Nakamato T., Weiss S. B. 1962. The biosynthesis of RNA: priming by polyri-
bonucleotides.— Proc. Nat. Acad. Sci. U.S.A., 48. 880—887.
Nathans D., Notani G.. Schwartz J. IL, Zinder N. D. 1962. Biosynthesis of the
245
ЛИТЕРАТУРА
coat protein of coliphage f2 by E. coli extracts.— Proc. Nat. Acad. Sci.
U. S. A., 48, 424-431.
Nazim A., Auerbach Ch. 1967. The origin of complete and mosaic mutants from
mutagenic treatment of single cell.—Mutant. Res., 4, 1—14.
Neidle A., Waelsch H. 1964. Histones: species and tissue specificity.— Science,
145, 1059-1061.
Mikolskaya I. I., Shalina N. M., Tikchonenko T. I. 1964. Phosphodiesterase
specific for denatured DNA.— Biochim. et Bioph. Acta, 91, 354—356.
Nirenberg M., Leder P. 1964. RNA codewords and protein synthesis.— Science,
145, 1399-1407.
Nirenberg M., Leder P., Bernfield M., Brimacombe R., Trupin J., Rottman F.,
O'Neal C. 1965. RNA codewords and protein synthesis. VII. On the general
nature of the RNA code.—Proc. Nat. Acad. Sci. U.S.A., 53, 1161—1168.
Nishimura S., Jones D., Ohtsuka E., Hayatsu H., Jacob T., Khorana H. 1965.
The in vitro synthesis of homopeptides as directed by ribopolynucleotides
containing a repeating trinucleotide sequence. New codon sequences for
lysine, glutamic acid and arginine.— J. Mol. Biol., 13, 283—301.
Nonoyama M., Ikeda Y. 1964. Ribonuclease-resistant RNA found in cells of
E. coli infected with RNA phage.— J. Mol. Biol., 9, 763—771.
Nucleic acids and nucleoproteins. 1947. In: Cold Spring Harbor Sympos.
Quant. Biol.
Oehlkers F. 1943. Die Auslosung von Chromosomenmutationen in der Meio-
sis durch Einwirkung von Chemikalien.— Z. Vererbungslehre, 81, 313—341.
Ogata K., Nohara H., Morita T. 1957. Effect of ribonuclease on theamino-acid-
dependent exchange between labeled inorganic pyrophosphate and adeno-
sinetriphosphate by the pH5 enzyme.— Biochim. et Biophys. Acta, 26, 657.
Ogawa H., Shimada K., Tomizawa J. 1968. Studies on radiationsensitive mutants
of E. coli. I. Mutants defective in the repair synthesis.— Mol. and Gen.
Genet, 101, 227-244.
Okazaki R., Okazaki T., Sakabe K., Sugimoto K., Sugino A. 1968. Mechanism
of DNA chain growth. I. Possible discontinumity and unusual secondary
structure of newly synthesized chains.— Proc. Nat. Acad. Sci, 59, 598—605.
Pace N. R., Spiegelman S. 1966. The synthesis of infections RNA with a repli-
case purifies according to its size and density.— Proc. Nat. Acad. Sci.
U.S.A, 55, 1608-1615.
Paik W. K., Kim S. 1965. Study of the origin of epsilon-N-methyllysine in pro-
teins.— J. Biol. Chem, 240, 4629.
Painter T. S. 1933. A new method for the study of chromosome rearrengements
and the plotting of chromosome maps.— Science, 78, 585.
Palade G. E. 1955. A small particulate component of cytoplasm.— J. Biophys.
and Biochem. Cytol, 1, 59.
Paranchych W., Graham A. E. 1962. Isolation and properties of RNA-containing
bacteriophages.— J. Cell, and Compar. Physiol, 60, 199—208.
Pardee A. B., Prestidge L. S. 1956. The dependence of nucleic acid synthesis in
the presence of amino acids in Escherichia coli.— J. Bacteriol, 71, 677—
683.
Pauling L., Corey R. B. 1953. A proposed structure for the nucleic acids.—
Proc. Nat. Acad. Sci. U. S. A, 39, 84—97.
Pauling L., Corey R. B., Branson H. R. 1951. The structure of proteins, two
hydrogen-bonded helical configurations of the polypeptide chain.— Proc.
Nat. Acad. Sci. U. S. A, 37, 205.
Peacock W. L. 1965. Chromosome replication.—Nat. Cancer Inst. Monogr, 18,
101-131.
Phillips D. M. P. 1962. The histones.— Progr. Biophys. and Biophys. Chem, 12.
211—280.
Phillips D. M. P. 1963. The presence of acetyl groups in histones.— Biochem
J, 87, 258-263,
ЛИТЕРАТУРА
246
Plate L. 1913. Vererbungslehre. Leipzig.
Plant W. D., Mazia D. 1956. The distribution of newly synthesized DNA in
mitotic division.— J. Biophys. Biochem. Cytol. 2, 573—584.
Pogo B. G. T., Allfrey V. G., Mirsky A. E. 1966. Histone acetylation and RNA
synthesis in lymphocytes stimulated by phytogemagglutinin.— Proc. Nat.
Acad. Sci. U.S.A., 55, 805-812.
Hollister A. W. 1952. Photomultiplier apparatus for microspectrophotometry of
cells.— Lab. Invest., 1, 106—114.
Pons M. 1964. Infectious double-stranded poliovirus RNA.— Virology, 24, 467—
473.
Pontecorvo G. 1953. The genetics of Aspergillus nidulans.— Adv. Genet., 5,141.
Prescott D. M., Bender M. A. 1963. Autoradiographic study of chromatid distri-
bution of labelled DNA in two types of mammalian cells in vitro.— Ex-
per. Cell. Res., 29, 430-442.
Ralph R. K., Matthews R. E., Matus A. J.. Mandel H. G. 1965. Isolation and
properties of double-stranded viral RNA from virus infected plants.—
J. Mol. Biol., 11, 202-212.
Rasmussen P. S., Murray K., Luck J. M. 1962. On the complexity of calf
thymus histone.— Biochemistry, 1, 79—89.
Ravin A. W. 1961. The genetic of transformation.— Adv. Genet., 10, 61.
Reich E., Franklin R. M., Shatkin A. J., Tatum E. L. 1962. Action of actinomy-
cin D on animal cells and viruses.— Proc. Nat. Acad. Sci. U. S. A., 48,
1238-1245.
Regan J. D., Trosco J. E., Carrier W. L. 1968. Evidence for excision of ultra-
violet induced pyrimidine dimers from the DNA of cells in vitro.— Bio-
phys. J., 8, 319-325.
Revell M., Littauer U. Z, 1966. The codine properties of methyl deficient phe-
nylalanine transfer RNA from E. coli.— J. Mol. Biol., 9, 46—69.
Rice S. A., Doty P. 1957. The thermal denaturation of deoxyribose nucleic
acid.— J. Amer. Chem. Soc., 79, 3937—3947.
Ris H., Chandler B. L. 1963. The ultrastructure of genetic systems in procaryo-
tes and eucaryotes.— Cold Spring Harbor Sympos.-, 28, 1—8.
Robert M., Kroger M. 1965. Lokalisation zusatzlicher RNS — Synthes in Trip-
sinbehandelten Reisenchromosomen von Chironomus Thummi.— Experi-
entia, 21, 326-328.
Rolfe R. 1962. The molecular arrangement of the conserved subunits of DNA.—
J. Mol. Biol., 4, 22-30.
Rolfe R., Meselson M. 1959. Relative homogeneity of microbial deoxyribonu-
cleic acid.— Proc. Nat. Acad. Sci. U.S.A., 45, 1039—1043.
Roper J. A. 1950. Search for linkage between genes determining a vitamin requi-
rement — Nature, 166, 956—957.
Rubenstein I., Thomas C. A., Hershey A. D. 1961. The molecular weights of
T2 bacteriophage DNA and its first and second breakage products.— Proc.
Nat. Acad. Sci. U. S. A., 47, 1113-1122.
Rupp W. D., Howard-Flanders P. 1968. Discontinuites on the DNA synthesis in
an excision-defective strain of Escherichia coli following ultraviolet irra-
diation.— J. Mol. Biol., 31, 291-304.
Russell L. B., Bangham J. W. 1961. Variegated type position effects in the
mouse.— Genetics, 46, 509—525.
Salzman N. P., Mendelson J. 1968. Isolation and fractionation of metaphase
chromosomes. In: Methods of cell physiology, D. M. Prescott (Ed.), 3, 277—
292, N. Y., Acad. Press.
Salzman N. P., Moore D. E., Mendelson J. 1966. Isolation and characterization
of human metaphase chromosomes — Proc. Nat. Acad. Sci. U.S.A., 56,
1449-1456.
Schildkraut C. L., Marmur J., Doty P. 1962. Determination of the base composi-
tion of deoxyribonucleic acid from its buoyant density in CcCL—J. Mol.
Piol., 4, 430—443.
ЛИТЕРАТУРА
247
Schneider IV. С. 1945. Phosphorus compounds in animal tissues. I. Extraction
and estimation of desoxypentose nucleic acids and pentose nucleic acids.—
J. Biol. Chem., 161, 303.
Schneider W. C., Klug H. L. 1946. Phosphorus compounds in animal tissues,
IV. The distribution of nucleic acids and other phosphorus-containing
compounds in normal and malignant tissues.— Cancer Res., 6, 691—694.
Schramm G., Dannenberg H. 1944. Uber die Ultraviolettabsorbtion des Tabak-
mosaikvirus.— Ber. chem. Ges. Frankfurt, 77, 53—60.
Setlow R. B., Swenson P. A., Carrier W. L. 1963. Thymine dimers and inhibition
of DNA synthesis by ultraviolet irradiation of cells.— Science, 142,
1464-1466.
Shapiro H. S., Chargaff E. 1960. Studies on the nucleotide arrangement in
deoxyribonucleic acids. IV. Patterns of nucleotide sequence in the deoxy-
ribonucleic acid of rye germ and its fractions.— Biochim et Biophys acta,
39, 68-82.
Shapiro L., August J. T. 1965. Replication of RNA viruses. II. The RNA product
of a reaction catalyzed by viral RNA-dependent polymerase.— J. Mol. Biol.,
11, 272.
Shipp W., Haselkorn R. 1964. Double-stranded RNA from tobacco leaves infec-
ted with TMV.— Proc. Nat. Acad. Sci. U.S.A., 52, 401—408.
Shugar D., Szer W. 1962. Secondary structure in poly-ribothymidilic acid.—
J. Mol. Biol., 5, 580-582.
Sinsheimer R. L. 1959. Purifications and properties of bacteriophage 0X174.—
J. Mol. Biol., 1, 37—42.
Sinsheimer R. L. 1963. A single stranded deoxyribonucleic acid from bacterio-
phage 0X174.— J. Mol. biol., 1, 43—53.
Sivertzeva-Dobzhansky N. P.f Dobzhansky T. G. 1933. Deficiency and duplica-
tion for the gene bobbed in D. melanogaster.— Genetics, 18, 173—191.
Sonnabend J., Dalgarno L., Friedmann R. M., Martin R. M. 1964. A possible
replicative form of semliki forest virus RNA.— Biochem. and Biophys. Res.
Communs, 17, 455—460.
Sonnenberg В. P., Zubai G. 1965. Nucleohistone as a primer for RNA synthe-
sis.— Proc. Nat. Acad. Sci. U. S. A., 54, 415—420.
Soyfer V. N. 1969a. Incapacite des enzymes reparantes de reparer les lesions
obtenues par le traitment avec hydroxylamine.— Dans In: Le Ill-eme
Sympos, sur «Les bacteriophages et le phenomenes de bacteriophagie».
Bucurest, p. 27—28.
Soyfer V. N. 1969b. No difference in the reparability of DNA hydroxylamine
lesions in the cells of E. coli К 12 hcr+ and E. coli K12 her- and phage
X grown in those cells.— Microb. Genet. Bull., 1, 18.
Soyfer V. A., Dorohov J. L. 1969. Enhanced reproduction of mutant for re pa-
rability phage T4v~ in E. coli B,_i compared to E. coli B.— Microb. Genet.
Bull., 1, 18-19.
Soyfer V. N., Dorohov J. L. 1970. The hosUcell repair system effects in bac-
teriophages reproduction.— Biochem. and Biophys. Res. Communs (in
press).
Spiegelman S., Haruna I. 1966. A relationale for an analysis of RNA replica-
tion.— Proc. Nat. Acad. Sci. U.S.A., 55, 1539—1554.
Spiegelman S., Haruna I., Holland J. B., Beaudreu G., Mills H, 1965. The
synthesis of a self-propagating and infectious nucleic acid with a purifi-
ed enzyme.— Proc. Nat. Acad. Sci. U.S.A., 54, 919—927.
Spiegelman S., Kamen M. D. 1946. Genes and nucleoproteins in the synthesis
of enzymes.— Science, 104, 581— 584.
Srinivasan P., Borek E, 1963. The species variation of RNA-methylase.— Proc.
Nat. Acad. Sci. U.S.A., 49, 529—533.
Srinivasan P. R., Borek E. 1964. Enzymatic alteration of nucleic acid structu-
re.— Science, 145, 548—553.
ЛИТЕРАТУРА
248
Stadler L. J. 1928. Genetic effects of X-rays in maize.—- Proc. Nat. Acad. Sci.
U.S.A., 14, 69.
Stadler L. J., Uber F. M. 1942. Genetic effects of ultraviolet radiation in maize.
IV. Comparison of monochromatic radiations.— Genetics, 27, 84—118.
Stahl F. W. 1951. Radiobiology of bacteriophage.— In: The viruses, v. II.
Burnet F. M., Stanley W. M. (Eds.) N. Y., Acad. Press, p. 353—385.
Starr J. L. 1963. The incorporation of methyl groups into amino transfer
RNA.—Biochem. and Biophys. Res. Communs., 10, 175—180.
Stedman E., Stedman E. 1943. Chromosomin, a protein constituent of chromoso-
me.— Nature, 152, 267.
Stedman E., Stedman E. 1947. The function of desoxyribose-nucleic acid in the
cell nucleus.— Sympos. Soc. Exper. Biol., 1, 232—251.
Stedman E., Stedman E. 1950. Cell specificity of histones.— Nature, 166, 780—
781.
Stedman E., Stedman E. 1951. The basic proteins of cell nuclei. Phylos. Trans.
Roy. Soc. London B, 235, 565—595.
Steffensen D. 1959. A comparative view of the chromosome.— Brookhaven
Sympos. Biol., 12, 103—124.
Stephens S. G. 1951. «Homologous» genetic loci in Gossipium.— Cold Spring
Harbor Symposia on Guant. Biol., 16, 131—141.
Stern C, 1936. Somatic crossing-over and segregation in D. melanogaster.—
Genetics, 26, 625.
Strack H. B., Kaiser A. D. 1965. On the structure of the ends of lambda
DNA.—J. Mol. Biol., 12, 36-49.
Streisinger G., Bruce V, 1960. Linkage of genetic markers in phages T2 and
T4.— Genetics, 45, 1289.
Streisinger G., Edgar R. S., Denhardt G. H. 1964. Chromosome structure in
phage T4. I. Circularity of the linkage map.— Proc. Nat. Acad.. Sci. U. S. A.,
51, 775-779.
Streisinger G., Okada F., Embrich J.f Newton J., Tsugita A., Terzaghi E.,
Inouye M. 1966. Frameshift mutations and genetic code.— Cold Spring
Harbor Sympos. 31, 77—84.
Sturtevant A. H. 1925. The effects of unequal crossing over at the Bar locus
in Drosophila.— Genetics, 10, 117—147.
Sueoka N. 1961. Variation and heterogeneity of base composition of deoxyri-
bonucleis acids: a complication of old and new data.— J. Mol. Biol., 3, 31—
40.
Svensson L, Boman H. G., Eriksson K. G., Kjellin K. 1963. Studies on micro-
bial RNA. I. Transfer of methyl group from methionine to soluble RNA
from Escherichia coli.— J. Mol. Biol., 7, 254—271.
Swartz M. N., Trautner T, A., Kornberg A. 1962. Enzymatic synthesis of deoxy-
ribonucleic acid. XI. Further study of nearest neighbour base sequences
in deoxyribonucleic acids.—J. Biol. Chem., 237, 1961—1967.
Swenson P. A., Setlow R. B. 1966. Effects of ultraviolet irradiation on macro-
molecular synthesis in Escherichia coli.— J. Mol. Biol., 15, 201—219.
Swift H. 1964. The histones of polytene chromosomes.— In: The nucleohistones.
Bonner J., Ts’o (Eds), San Francisco, Holden-Day, Inc., p. 169—181.
Swift H. 1965. Molecular morphology of the chromosome.— In: The chromoso-
me: structural and functional aspects. Dawe C. J. (Ed.). Tissue Culture
Assoc.
Swift M. 1964. The histones of polytene chromosomes.— In: Nucleohistones,
Bonner J. P., Ts’o P. О. P (Eds). San-Francisco, Holden-Day, Inc.,
p. 169-183.
Symonds N., Stacey K. A., Glower S. W., Schell J., Silver S. 1963. The chemical
basis for a case of host-induced modification in phage T2.— Biochem. and
Biophys. Res. Communs, 12, 220—222.
249
ЛИТЕРАТУРА
Szer W. 1966. Discussion.— In: Genetic elements. N. Y. London, Acad. Press,
p. 330.
Szer W., Ochoa S. 1964. Complexing ability and coding properties of synthetic
polynucleotides.— J. Mol. Biol., 8, 823—824.
Szybalsky W. 1964. Structural modification of DNA: crosslinking, circulariza-
tion and single-strand interruptions.— In: Ablandl. Dtsch. Akad. Wiss. Cl.
Med., II, S. 1-19.
Takahashi I., Marmur J. 1963a. Glucosylated DNA from a transducing phage
for Bacillus subtilis.— Biochem. and Biophys Res. Communs, 10, 289—292.
Takahashi I., Marmur J, 1963b. Replacement of thymidylic acid by deoxyuridi-
lic acid in deoxyribonucleic acid of a transducing phage for Bacillus subti-
lis.— Nature, 197, 794—795.
Taylor J. H. 1957. The time and mode of duplication of chromosomes.— Amer.
Naturalist, 91, 209.
Taylor J. H. 1958a. Sister chromatid exchanges in tritiumlabelled chromoso-
mes.— Genetics, 43, 515—529.
Taylor J, H. 1958b. The mode of chromosome duplication in Crepis capillaris.—
Exper. Cell Res., 15, 350—357.
Taylor J. H. 1960a. Asynchronous duplication of chromosomes in cultured
cells of Chinese hamster.—J. Biophys. and Biochem. Cytol., 7, 455—464.
Taylor J. H. 1960b. Duplication of chromosomes and related events in the celle
cycle.— In: Cell physiology of Neoplasia. Univ. Texas Press, p. 547—572.
Taylor J. H., McMaster R. D. 1954. Autoradiographic and microphotometric
studies of desoxyribose nucleic acid during microgametogenesis in Lilium
lonfiflorum.— Chromosome, 6, 489—521.
Taylor J. H., Woods P. S., Huges W. L. 1957. The organization and duplication
of chromosomes as revealed by autoradiographic studies using tritium
labelled thymidine.— Proc. Nat. Acad. Sci. U.S.A., 43, 122—138.
Tess man I. 1959a. Some unusual properties of the nucleic acid in bacteriopha-
ges S 13 and 0X174.— Virology, 7, 263-275.
Tessman I. 1959b. Mutagenesis in phages 0X174 and T4 and properties of the
genetic material.— Virology, 9, 375.
Tessman I. 1959c. The use of nuclear emulsion in the study of bacteriophage
DNA replication.— Lab. Invest, 8, 245—250.
Thomas C, A., Berns К. I. 1961. The physical characterization of DNA molecu-
les released from T2 and T4 bacteriophages.— J. Mol. Biol., 3, 277—288.
Thomas C. A., Knight J, H. 1959. The sedimentation properties of the large
subunit of DNA released from labelled T4 bacteriophage.— Proc. Nat.
Acad. Sci. U.S.A., 45, 332-334.
Thomas C. A., Mac Hattie L. A. 1964. Circular T2 DNA molecules.— Proc. Nat.
Acad. Sci. U. S. A., 52, 1297-1301.
Thomas C, A., Rubenstein I. 1964. The arrangements of nucleotide sequences
in T2 and T5 bacteriophage DNA molecules.— Biophys. J., 4, 93—106.
Thomas R. 1952. Le composition de I’acide ribonucleique de levure et le prob-
leme de la specificite des acides nucleiques.— Biochim. et Biohys. acta.
8, 71-75.
Thomas R. S. 1961. The chemical composition and particle weight of Tipula
iridescent virus.— Virology, 14, 240—252.
Thomas R. 1962. Recherchcs sur la structure et les fonclions des acides decoxy-
ribonucleiques, etudes genetiques et chimiques. Aclualites biochimiques, 21,
Masson et Cie.
Timojeejj-Ressovsky N. W 1928. Eine somalische Riickgenovariation bei Dro-
sophila melanogaster.—Roux Arch. Enlwicklungs. mech. Organ.-, 113.
TimofeeSf-Ressovsky N. W. 1938. Mutation and geographical variation.— In: The
new systematics. J. Huxley (ed.). Oxford Univ. Press., p. 73—136.
Tobey R. A. 1964. Mengovirus replication conservation of virus RNA.— Viro-
logy, 23, 10-22.
ЛИТЕРАТУРА
250
Tocchini-Valentini G. P., Stodolsky M., Aurisiccio A., Sarnat M., Graziosa F.,
Weiss S. B., Geiduschek E. P. 1963. On the assymetry of RNA synthesis in
vivo.— Proc. Nat. Acad. Sci. U. S. A., 50, 935.
Tomita K. 1., Rich A. 1964. X-ray diffraction investigations of complementary
RNA.— Nature, 201, 1160-1163.
Trosco J. E., Chu E. IL Y., Carrier W. L. 1965. The induction of thymine dimers
in ultraviolet-irradiated mammalian cells.— Radiat. Res., 24, 667—672.
Valentine R. C., Engelhardt D. L., Zinder N. D. 1964. Host-dependent mutants
of bacteriophage f 2. II. Rescue and complementation of mutants.— Viro-
logy, 23, 159-163.
Vendrely C., Vendrely R. 1949a. Sur la teneur individuelle en acide desoxyribo-
nucle que des gametes d’oursins Arbacia et paracentrotus.— Compt. rend.
Soc. biol., 143, 1386-1387.
Vendrely R., Vendrely C. 1948. La teneur du noyau cellulaire en acide desoxy-
ribonucleique a travers les organes, les individus et les especes animales.
Techniques et premiers resultats.— Experientia, 4, fasc. 10, 434—436.
Vendrely R., Vendrely C. 1949b. La teneur du noyau cellulaire en acide deso-
xyribonucleique a travers les organes, les individus et les especes anima-
les. Etude particuliere des Mammiferes.— Experientia, 5, 327—329.
Walen K. 1963. The pattern of DNA synthesis of the marsupial Potorus tri-
lactilis.— In: Genetics today.— XI Internal. Congr. Genet., 1, p. 106.
Wang J,, Davidson N. 1966. Thermodynamic and kinetic studies on the inter-
conversion between the linear and circular forms of phage lambda
DNA.—J. Mol. Biol., 15, 111-113.
Watson J. D., Crick F. H. C. 1953a. Molecular structure of nucleic acids: A stru-
cture for desoxyribonucleic acids.—Nature, 171, 737—738.
Watson J. D., Crick F. H. C. 1953b. Genetical implication of the structure of the
desoxyribose nucleic acid.— Nature, 171, 964.
Watson J. D., Crick F. H. C. 1953c. The structure of DNA.— Gold Spring Har-
bor Sumpos. Quant. Biol., 18, 123—131.
Weil J., Be fort N., Reiter B., Ebel J. P. 1964. Effects of chemical modifications
on the biological properties of s-RNA.— Biochem. and Biophys. Res. Com-
muns., 15, 447.
Weissmann C. 1965. Replication of viral RNA. VII. Further studies on the
enzymatic replications of MS2 RNA.— Proc. Nat. Acad. Sci. U.S.A., 54,
202-207.
W eissmann C., Borst P. 1963. Double-stranded ribonucleic acid formation in
vitro by MS2 phage-induced RNA synthetase.— Science, 142, 1188—1190.
Weissmann C., Borst P., Burdon R. H., Billeter M. A., Ochoa S. 1964. Replica-
tion of viral RNA. IV. Properties of RNA synthesis of MS2 phage RNA.—
Proc. Nat. Acad. Sci. U.S.A., 51, 890—897.
Weissmann C., Feix G. 1966. Replication of viral RNA. XL Synthesis of viral
«minus» strands in vitro.—Proc. Nat. Acad. Sci. U.S.A., 55, 1264—1268.
Weissmann C.f Simon L., Borst P., Ochoa S. 1963. Induction of RNA syntheta-
se in E. coli after infection by the RNA phage MS2.— Gold Spring Harbor
Sympos. Quant. Biol., 28, 99—104.
Whitehouse H. L. K. 1963. A theory of crossingover by means of hibrid deoso-
xyribonucleic acid.— Nature, 199, 1034—1040.
Wilkins M. H. F., Gosling R. G., Seeds W. E. 1951. Physical studies of nucleic
acids. Nucleic acid: an extensible molecule.— Nature, 167, 759—760.
Wilkins M. H. F., Randell J. T. 1953. Gristallinity of spermheads: Molecular
structure of nucleoprotein in vivo.— Biochim. et biophys. acta, 10, 192.
Wilkins M. H. F., Stokes A. R., Wilson H. R. 1953. Molecular structure of de-
soxypentose nucleic acids.—Nature, 171, 738—740.
Williams R. C. 1952. Electron microscopy of sodium decoxy ribonucleate by
use of new freeze-drying method.— Biochim. et biophys. acta, 9, 237—239.
251
ЛИТЕРАТУРА
Witkin Е. М. 1968. The role of DNA repair and recombination in mutagenesis.
In: Proc. XII Intern. Congr. Genet.
Wittman H. G., Wittman-Lieb old B. 1966. Protein chemical studies of two RNA
viruses and their mutants.— Cold Spring Harbor Sympos., 31, 163—172.
Wolff S., Luippold H. E. 1964. Chromosome splitting as revealed by combined
X-ray and labelling experiments.— Exper. Cell Res., 34, 548—556.
Wyatt G. R. 1951a. Recognition and estimation of 5-methylcytosine in nucleic
acids.— Biochem. J., 48, 581—584.
Wyatt G. R. 1951b. The purine and pyrimidine composition of deoxypentose
nucleic acids.— Biochem. J., 48, 584—590.
Wyatt G., Cohen S. S. 1953. The bases of the nucleic acids of some bacterial
and animal viruses. The occurrence of 5-hydroxymethylcytosine.— Bio-
chem. J., 55, 774.
Yarns M.t Sinsheimer R. L. 1964. The UV resistance of double-stranded 0X174
DNA.- J. Mol. Biol., 8, 614-615.
Yanofsky C., Ito J., Horn V. 1966. Amino acid replacements and the genetic
code.— Cold Spring Harbor Sympos., 31, 151—162.
Zamechnik P. C., Keller E. B. 1954. Relation between phosphate energy donors
and incorporation of labelled aminoacids into proteins.— J. Biol. Chem.,
209, 337.
Zamenhof S., Alexander H. E., Leidy G. 1953. Studies on the chemistry of trans-
forming activity. I. Resistance to physical and chemical agents.— J. Ex-
per. Med., 98, 373.
Zinder N. D. 1966. RNA phages.— Annual Rev. Microbiol., 19, 455—472.
Zinder N. D., Valentine R. C., Roger M., Stoeckenius W. 1963. fl, a rodshaped
male specific bacteriophage that contains RNA.— Virology, 20, 638—640.
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
Аберрации 213
Авторадиография 68, 69, 73, 150
Аденин 9, 13, 43, 44, 49, 52, 54, 58,
61, 76, 91, 92, 96, 97, 99, 100, 115,
127-129, 132, 204, 205, 215
S-Аденозилметионин 96
Азотистая кислота 205, 206, 211, 215
Азотистые основания 9, И, 13, 29,
44, 49, 54, 57, 58, 79, 100, 102, 165
Акридин 165, 206, 210, 222
Актиномицин 102, 112, 113, 117, 120
Аланин 87, 88
Алкилирующие агенты, алкилиро-
вание 202, 204, 211, 215
Аллеломорф 177, 181, 191, 193
Аллель 32, 176, 177, 183, 195
Аминоацил-т-РНК 17, 21, 23, 88,
169, 170
Аминокислоты 11—16, 21, 23, 26,
36, 81, 84, 86, 90, 140, 141, 145,
159, 160, 163, 164, 166-168
замены в белках 31, 202, 207
незаменимые 96
Аналоги оснований 206
Анеуплоиды 30
Антикодон 23, 99, 171, 172
Арбацин 43
Ацетилирование 160
Базиген 181—183, 185, 198
Бактерии 17, 20, 40, 41, 50, 54, 65,
74, 84, 102, 136, 165, 184, 217
A zotobacter vinelandii 160
Bacillus subtilis 93
Escherichia coli 64, 66, 73, 85, 87,
96, 97, 102, 108, 112, 115, 123,
127, 135, 146, 148, 154, 160, 172,
173, 195, 198, 205, 212, 222
Holobacterium solinarium 75
Бактериофаги 10, 12, 30, 40, 41, 54,
55
внеклеточные 206
T2 35, 54, 73, 84, 85, 93, 94, 98,
104, 206
ТЗ 73
Т4 33, 73, 93, 104, 106, 164-168,
173, 187, 195-197, 206, 209, 210
Т5 105
Тб 96
Т-четные 93, 104
fl 101
f2 112, 119, 135-137, 172
fd 101
fr 112, 115
M12 112, 115
MS2 112, ИЗ, 115, 118, 120, 127,
133
R17 112
S13 101
Q3 118, 119, 124-126, 133
X 73, 105, 106, 212
фВ 101
0 X174 40, 41,73, 100,101,103,106,
108-110, 221
Белки 9, 10, 18, 21, 42, 45, 103, 137,
139, 206
анализ последовательности амино-
кислот 18
вторичная структура 90
негистоновые 138—139, 144, 146,
151
остаточный белок Мирского 139
первичная структура 11, 90
рибосомные 88, 89
синтез 8, 12, 13, 17, 18, 21, 25, 45,
46, 79-89
схема синтеза 23, 80—82
третичная структура 90
ядерные 138—163
кислые 138
основные 138, 140
Бесклеточная система
для синтеза белка 13, 96, 146, 168,
169, 172
для синтеза ДНК 40—41, 221
Больцмана закон 63
Вилочковая железа 43
Вирусы 17, 40, 74, 76, 91, 203
ВТМ (табачной мозаики) 45, 114,
115, 134, 135, 172, 206
желтой мозаики турнепса 115, 118,
253
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
119, 125, 126, 134, 135
леса Семлики 115
менго 115, 122
насекомых 74
онкогенные 98
пикорнавирусы 120
полиомиелита 111, 112, 115
полиомы 91
раневых опухолей растений 102
реовирусы 102, 115
энцефаломиокардита НО
Вставка и выпадение оснований 30,
200-202, 204
Гаметы 176
Генетическая карта 32, 34, 104, 105,
176, 198, 210, 222
Геном 98, 194, 207, 210
Генотипическая среда 194
Гентибиоза 93
Гены 12, 32,34,36,47, 48, 137, 152,
159, 173, 202, 222
дробимость 33, 34, 177—189, 194
интерференция 194
искусственный синтез 40, 41, 221
контроль синтеза белков 17—26
линейные размеры 84
локализация 32
непрерывность 185—187
операторы 35, 36, 152, 155, 184
плейотропное действие 189, 194
ранние и поздние у фагов 35
регуляторные 35, 36, 155, 194, 207
регуляция активности 34—37
репрессия 34, 144—152
структурные 35, 152
теория 31—34
центры 181
циклические перестановки 105
эффект положения 189—194
achaete 179—182, 185
Ваг 189—191
cubitus interruptus 192, 194
hairy 193, 194
lozenge 195
scute 32, 179—189, 198
Гетерохроматин 144, 147, 192, 194
Гибридизация молекулярная 20, 85,
ПО
Гидраты пиримидиновых оснований
204, 205
Гидроксиламин 206, 212
Гиноксантин 9, 43
Гистоны 10, 34, 35, 43, 138, 139, 151
биологическая роль 134—144
Гистоны
подавление синтеза ДНК 152 —
156
подавление синтеза и-РНК 144—
152
РНК-гистонная фракция 151—152
фракционирование и состав 140—
143
число типов 151
Гистохимические методы 80
Глюкозилирование 92—94
Гормоны 160—162
Горячие точки 210
Градиентное (равновесное) центри-
фугирование 62—65, 73, 75, 84,
100, 110, 111, 136
Группы сцепления 176
Гуанин 9, 13, 16, 43, 44, 49, 52, 54,
58, 61, 76, 91, 93, 96, 98, 100, 115,
132, 205, 215
Дезаминирование 204, 205
2-Дезоксирибоза 9, 13, 44, 47, 58
76, 91, 93
Дезоксирибонуклеотиды 70, 71, 72,
78
Деление клеток 59, 65, 68
Делеции 30, 179, 187
точечные 201
Денатурация ДНК 85, 100, 103, 105,
ИЗ, 120, 134, 146, 154, 157, 159,
204
5,6-Дигидроурацил 94
Димеры пиримидиновых оснований
38, 204, 205, 210, 213, 215—219
частота возникновения 214, 215
N2-Диметил гуанозин 93
Дисперсный способ репликации 62,
63, 65, 66, 67
Дифференцировка 98
ДНК 10, 11, 13, 17, 19, 20, 21, 51, 54,
65, 139, 143, 152, 203
антииараллельность 109
биосинтез 70—72,152,156,160, 209
вторичная структура 31, 90, 91,
98—101, 212, 213
двойная спираль 10, 55, 56, 59, 76,
90,91,96,102,157,159, 206,212
дополнительный (рекомбинацион-
ный) синтез 209, 217—220
затравка 70, 71, 72, 79
инактивация 100
инфекционная 41
искусственный синтез 40, 41, 221
кольцевидные 102—107
конформация 158
матричная активность 94, 151
межмолекулярная агрегация 67
модель Уотсона — Крика 58—61,
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
254
72, 81, 95, 100
молекулярный вес (размер) 72—
75, 91
однонитевая 76, 99—101, 108—
110, 206, 209
открытие 8, 42—46
паракристаллическая структура
55
первичная структура 90—99
разрушение ультразвуком 66, 67
репликация 38, 49, 62—70, 107,
206
роль в живых клетках 8—11, 42—
55, 59-61, 80, 81
состав 53, 54, 71, 75
структура 7, 10, 49, 55—58
структурная формула 71
трансформирующая 206
третичная структура 90
шариковая модель 56
электрометрическое титрование 57
ДНК-аза 84, 98, 100, 103, 118
ДНК-полимераза 38, 40, 41, 78,
125, 153—156, 209, 211, 213, 218
Корнберга 70, 71, 107
рекомбинационная 219
репарирующая 212—216
Доминантность 175, 192
Дрожжи 26, 44, 99
Дрозофила 26, 32, 33
Замены оснований 200, 201, 217
Зиготы 176
Импульсное мечение 20, 84, 111
Инверсия 30, 180, 200, 201
Инициация 12
генов активности 184
синтеза белка 12, 23—25
синтеза ДНК 71
считывания и-РНК 173, 174
Инозиновая кислота 93
Канонические основания 9, 43, 76,
91, 95
Канцерогенез 98
Капсула бактерий 50, 51
Клетка-хозяин 10, 94, 98, 102, 106,
115
Код генетический 163—174, 188, 203
вырожденность 171—173, 207
начало считывания 173, 174
природа 11, 202
структура 7, 8, 11, 164—168
таблица 171
типы 12
Кодоны 8, 12, 13, 16, 17, 21, 25, 26,
163—169, 184, 202, 203, 207
бессмысленные, или нонсенс 25,
172, 173, 184, 203
состав 168—171, 202
Компаунды 183
Комплементарность 38, 58—61, 78,
81, 84, 85, 95, 100, 107, 110, 115,
119, 128-130, 134, 171, 172, 211
Комплементация 33, 165, 183, 189,
196
Консервативный способ репликации
62, 63, 65
Коньюгация 103
Кроссинговер 32, 33, 176, 189, 191,
193, 194, 198, 219
Ксантин 9, 43
Кукуруза 26
Культура клеток и тканей 69, 155
асцитных опухолей 139, 153
L-мышиных фибробластов 120,122,
139
хомяка 139
человека 69, 213
HeLa 24, 38, 85, 111, 139
Липиды 138
Локус 34, 177, 183
Лосось 9, 43, 53, 144
Маркер 103—105
Матрица 17
Межгенное вещество 183, 188
Мелкие гранулы Палада 80
Месельсона — Сталя опыт 62—66
6-Метиладенин 94, 97
6-Метиламинопурин 92
7-Метилгуанин 94
7-Метилдезоксигуанозин 94
З-Метилинозиновая кислота 93
Метилирование 94—99, 160
скорость 97
5-Метилурацил 95
5-Метилцитозин 91, 94, 97
Метионин 96
Микросомы 80
Микроспектрофотометрия 80
Минорные основания (нуклеотиды)
9, 67, 91, 95, 97
Митотический цикл 31
Митохондрия 18, 80
Модификации
гистонов 160—162
структуры ДНК 40, 90—101, ЮЗ-
107
структуры РНК 100—102
Мутабильность 94, 208
Мутагенез
255
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
молекулярные механизмы 26—31,
200-220, 222
радиационный 26, 52, 177, 200,
204, 208
спонтанный 209
у внеклеточных фагов 206, 207, 212
химический 28, 100, 176, 200, 203,
204, 208
Мутанты 17
амбер 105
sus 137
ts 104, 114, 135-137, 209
Мутации 26, 32, 200—220,
и репарация 38, 210—218
лизоцимные 210
миссенс 203
мозаичные 31, 215
нонсенс 203
обратные 32
полные 31, 38, 215
протяженные 200
прямые 32
сдвига чтения 31, 202, 203, 210,
215, 219, 220
супрессорные 207
точечные 29, 31, 200
условно-летальные 207
г II фага Т4 12, 30, 33, 34, 164—
168, 187, 195-197, 199
хроматидные 31
хромосомные 31
Мутон 199
Мыши 50, 51
Неканонические основания (см. ми-
норные основания)
Никель Ренея 87, 88
Нитрозогуанидин 210, 211, 222
Нуклеин 9, 10, 42, 43, 138
Нонсенс-кодон (см. кодоны)
Нуклеиновая кислота 9, 10, 21, 40,
43-45, 49, 50, 52, 54, 55, 94-97,
99, 153, 156, 159, 200, 211
Нуклеогистоны 147—149
Нуклеозиддифосфаты 79
Нуклеозидмонофосфаты 70
Нуклеозиды 49
Нуклеопротеиды 46, 88, 145, 146,
148, 154, 156, 161
Нуклеотиды 11, 12, 31, 49, 50, 55,
57, 59, 73, 79, 96,103,107, 128,129,
152,164,198-201,210, 211,214, 220
Обратная связь 36
5-Оксиметилурацил 93
5-Оксиметилцитозин 9, 91—93
Оперон 35, 152, 173, 188, 189, 198,
207
Пентозы 9, 44, 100
Пепсин 42
Пиримидиновые основания 9, 13, 43,
53, 54, 57, 58, 76, 102, 202
Плазмонуклеиновая кислота 44
Пластиды 18, 80
Пневмококки 50, 51
Повреждения ДНК 31, 210—219
нерепарируемые 31, 212
репарируемые 31, 37, 38, 210, 211
ПолиА 95, 98, 126
ПолиТ 95
ПолиУ 13, 95, 98, 168
ПолиУГ 87, 99
ПолиЦ 98
ПолиЦУ 99
Полидезоксирибонуклеозиды 55
Полилизин 154
Полинуклеотидлигаза 38, 39, 41, 211
Полинуклеотидные нити И, 105,
129, 168, 169, 200
Полипептидная цепь 21, 26, 81, 86,
90, 160, 173
Полиплоиды 30, 102, 132
Полирибонуклеотидфосфорилаза 78
Полирибонуклеотиды 13, 55, 102,
118, 122, 124, 132
Полириботимидиловая кислота 95, 98
Полисахариды 50, 51
Полуконсервативный механизм реп-
ликации 62—67, 69, 114, 116, 209,
211, 215
Последовательность оснований
в ДНК 59-61, 74, 81,164,165,168
в т-РНК 22, 41
Правила Чаргаффа 11, 53, 72, 100
Промотер 155, 184
Протамины 43, 138, 139, 140, 145
Протопласты 117
Профлавин 165, 210
Псевдоаллелизм 194, 195 "
Псевдоуридиловая кислота 93
Пуриновые основания 9, 13, 53, 54,
57, 58, 94, 102, 202
Пуффы 149, 151
Пшеница 44
Ревертанты 165
Рекомбинация 30, 33, 38, 197, 198,
207, 208, 217-219
Рекон 199
Рентгеновы лучи 26, 102, 176, 179
Рентгеноструктурный анализ
ДНК И, 50, 55-58
РНК 102, 115
Репарация 37—41, 108, 207, 208,
210-217, 219, 222
пострепликативная 40
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
256
темновая 38—39, 211—213
у высших организмов 37, 217, 222
Репарирующие системы 31, 37—41
Репликативная форма
ДНК-содержащих вирусов 108—
НО
размер 109, 117
РНК-содержащих вирусов ИО-
137
Репликация 38, 40, 41, 49, 62—70,
107, 152, 155, 206, 208, 210, 215,
216
неконсервативная 209
репаративная 39, 209, 215
скорость 213
Репликон 107
Репрессоры 35—37, 155
Ретикулоциты 24
Рецессивность 175, 192
Рибоза 9, 13, 44, 76, 93
Рибонуклеаза 44, 80,100,102,110—
ИЗ, 120, 127-131, 134
панкреатическая 117, 181, 127
Рибонуклеозидтрифосфаты 112, 126
Рибосомы 17—20, 23, 25, 35, 80, 82,
84, 88, 89, 146, 155, 169
полирибосомы 23
Риккеттсии 74
РНК 9, 13, 17—21, 44, 46, 49, 52,
78-89, 96, 138, 139, 203
адапторная 22, 23, 86
безметильная 96, 97
биосинтез 78—79, 150, 151, 160
двуспиральные 102—137
информационные 20, 23, 25, 35,
83—86, 89, 99, 109, 123, 125, 144—
152, 155, 169, 172, 173, 184
константы седиментации 84
первичная структура 97
растворимая 21, 83, 86
рибосомная 21, 82, 84, 88, 89,
94-98, 118, 119, 132,434, 155,
194
роль в клетке 79—89
структурная формула 76
транспортная 23, 26, 41, 83, 86—
89, 94, 95, 112, 118, 119, 155,
168-173, 184, 203
акцепторная способность 99 а
вторичная структура 22, 77,99,
101
последовательность оснований
22, 41, 74
структура 22, 77, 93, 96, 97
формилметиониновая 23, 25
третичная структура 78
цитоплазматическая 82
рНК-полимераза 37, 40, 41, 102
ДНК-зависимая 109, НО, 122, 126,
146, 148, 149, 151, 153, 155, 160,
161, 184
РНК-зависимая 112—137
РНК-репликаза (см. РНК-полимера*
за, зависимая от РНК)
РНК-спнтетаза (см. РНК-полимера-
за, зависимая от РНК)
Сайт 199
Связи
водородные 11, 20, 58, 60, 78, 85,
90, 95, 102, 212
глюкозидные 92—94
дисульфидные 91
ковалентные 86, 90, 104
Седиментационный анализ (см. так-
же градиентное и ультрацентрифу-
гирование) 83, 103, 109, 125, 128,
130
Синезеленые водоросли 92
Скутеллум 179
Соматические клетки 52
Сперма 9, 43, 52, 139, 144
Спермин 154
Спираль Полинга — Кори 90, 91
Ступенчатый аллеломорфизм 32, 33,
178—189
Субхроматиды 49
Супрессоры
криковские 165—167
нонсенс-кодонов 173
Таутомерный переход 61
Темновая репарация 37
молекулярный механизм 38—40
участие в мутагенезе 38, 211—213
Теория мишени 26
Тетрануклеотидного строения ДНК
гипотеза 49, 50, 52
Тимидин 68, 153, 154
Тимин 9, 13, 43, 49, 52, 54, 58, 61,
76, 91, 95, 100, 154, 210, 211, 214
Тимонуклеиновая кислота 44
Тимус 43, 113, 140—142, 144, 145,
149, 150, 160, 161
Транзиция 29, 30, 202, 203, 205
Трансверзпя 29, 30, 202, 203
Трансдукция 93
Транскрипция 109
Транслокация 30, 192, 193, 200, 201
Трансляция 203
Трансформация у бактерий 10, 50,
51, 98
Треониндезаминаза 36
Триплет 12, 13, 17, 23, 86, 88, 164
187, 203
257
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
Трипсин 149—151
ингибитор 151
Трихлоруксусная кислота 45
Ультразвук 149, 150
Ультрафиолетовое облучение 37, 38,
52, 108, 205, 206, 213
Ультрацентрифугировапие 18, 62—
66, 73, 103, 104, 120, 122, 134
Ураци г 9, 13, 16, 44, 49, 52, 76, 81,
95, 96, 111, 115, 120, 125, 127 —
129, 132, 154, 168, 205
F-Фактор 103
Фельгена реакция 46
Фенилаланин 12, 13, 168
Фенотип 34, 190, 193, 195, 207
псевдодикпй 166, 167
Ферменты 25, 35, 146, 207, 209, 211
активирующие т-РНК 23, 86—88
видоспецифичпость 97
глюкоз или рующие 94
киназы 153
метилирующие 96—98
протеазы 103
рекомбинации 216—218
репарирующие 31, 37—40, 211 —
216
транскриптаза 126—137
фосфодиэстераза 103
Фитогемагглютинин 160
Формальдегид 100, 102, 107, 110
Фосфорилазы 117, 118, 122
Фотореактивация 37, 210, 211
Хлорамфеникол 115
Хроматиды 70
сестринские 68
Хроматин 138, 145-147, 161
конденсированный 143, 144
Хроматография 108, 111, 131, 140,
141, 143
гистонов 140, 143
компонентов ДНК 52—73
Хромонуклеиновая кислота 44
Хромосомы 31—33, 40, 44, 47, 67, 69,
73, 138, 143, 149, 151, 155, 159,
176, 183, 188, 189, 191, 195, 200,
213
гигантские 151, 177, 191
мейотические 68, 144
метафазные 139
микроорганизмов 35, 68, 103
митотические 68, 144
многоиитчатость 70
первичные поражения 203
перестройки 32, 38, 213
разрывы 129, 191, 213, 215
репликация 67—70
типа ламповых щеток 138
Цистеин 87, 88
Цис-транс-тест 195, 196
Цистрон 25, 34, 165—169, 187, 196
Цитозин 9, 13, 43, 44, 49, 52, 54, 58,
61, 76, 91, 93, 96, 97, 100, 115, 132,
205, 212
Цитоплазма’18,19, 44, 45, 79, 80—82
Чистоты гамет закон 175
Экзонуклеазы 38, 39, 103, 109, 211
Электронная микроскопия 17, 19, 23
ДНК 56-58, 108
клеток 80
полисом 23—24
репликативных форм 104, 105, 117
хромосом 70, 103
Электрофорез 140, 142
Эндонуклеазы 38, 39, 98, 103, 109,
" 110, 211, 213, 215
Эндоплазматический ретикулум 18,
19
Эписомы 74
Эухроматин 144, 147, 192, 194
Ядерные мембраны 18
Ядра 9, 10, 18, 42, 45, 46, 73, 79—
82, 107, 138, 139,144,145,155,160
изолированные 145, 150
интерфазные 138, 139, 144, 155
содержание ДНК 52, 53, 73, 214
Ядрышко 160
ОГЛАВЛЕНИЕ
Предисловие 3
1. Ретроспективный обзор истории молекулярной генетики 7
Роль ДНК в живых клетках 8
Генетический код И
Генетический контроль синтеза белка 17
Молекулярные механизмы мутагенеза 25
Теория гена 31
Регуляция генной активности 34
Репарация генетических повреждений 37
Репликация ДНК и проблема искусственного синтеза ДНК и генов 40
2. История установления генетической роли ДНК 42
Открытие ДНК 42
Развитие представлений о биологической роли ДНК 46
ДНК — носитель наследственной информации 30
Структура ДНК 35
Модель Уотсона — Крика 38
Генетический смысл модели Уотсона и Крика 39
3. Репликация и синтез ДНК 32
Репликация ДНК 32
Репликация ДНК в хромосомах высших организмов 37
Биосинтез ДНК 70
Молекулярный вес ДНК 72
Нуклеотидный состав ДНК 74
4. Структура, синтез и функции РНК 76
Структура РНК 76
Биосинтез РНК 78
Формирование взглядов о роли РНК в клетке 79
Доказательство участия РНК в синтезе белков 31
Открытие информационной РНК 33
Транспортная РНК 36
Рибосомная РНК 38
Исследования модификаций структуры нуклеиновых кислот 90
Понятие о первичной, вторичной и третичной структурах белков и
нуклеиновых кислот 90
Модификация первичной структуры ДНК 91
Метилирование нуклеиновых кислот 94
Роль метильных групп 97
259
ОГЛАВЛЕНИЕ
Модификация вторичной структуры нуклеиновых кислот
Одноцепочечные ДНК
Двуспиральная РНК
Кольцевидные ДНК
6. Репликация вирусов, содержащих однонитевую нуклеиновую
кислоту
Репликативные формы ДНК-содержащих бактериофагов
Репликативные формы РНК-содержащих вирусов
Ферменты, реплицирующие РНК
Роль «плюс» и «минус»-нитей в синтезе вирусной РНК
Свойства РНК-синтетазы
Доказательства in vitro и in vivo роли репликативных форм
в синтезе вирусной РНК
Трудности интерпретации полученных данных о роли реплика-
тивных форм
? Ядерные белки, их взаимодействие с нуклеиновыми кислотами
Фракционирование и состав гистонов
Биологическая роль гистонов
Подавление ядерными белками синтеза ДНК
Специфичность взаимодействия гистонов и ДНК
Модификации первичной структуры гистонов, влияющие на их
активность
99
99
101
102
108
108
110
112
116
117
120
126
138
140
143
152
156
160
Очерк изучения генетического кода 163
Доказательство триплетной природы генетического кода 164
Установление состава кодонов 168
Вырожденность кода 171
Бессмысленные кодоны 172
Стартовая точка информационной РНК 173
0. Развитие представлений о гене как системе 175
Доказательство дробимости гена в опытах по изучению ступенча-
того аллеломорфизма генов scute — achaete
Эффект положения генов. Плейотропное действие генов. Геноти-
пическая среда 1ЙУ
Возрождение исследований проблемы гена на молекулярном уров- .Q,
не 1У4
10. Мутационная теория: синтез имеющихся данных и причины
мутагенеза
Молекулярная природа изменений в структуре ДНК при появлении
мутаций 200
Первичное повреждение и мутации в двуспиральной молекуле
ДНК и в процессах синтеза ДНК 203
Мутагенез и работа ферментных систем клетки 208
Заключение 221
Литература 227
Предметный указатель 252
ВАЛЕРИЙ НИКОЛАЕВИЧ СОЙФЕР
Очерки истории
молекулярной генетики
Утверждено к печати
Институтом истории естествознания и техники
Академии наук СССР
Редактор Л. Н. Кузьминова
Технический редактор И. Н. Жмурк
Сдано в набор 19/Ш 1970 г.
Подписано к печати 11/VIII 1970 г.
Формат 60X90V16. Бумага № 1.
Усл. печ. л. 10,25. Уч.-изд. л. 16,8. Тираж 3000 окз.
Т-10264. Тип. зак. 297.
Цена 1 р. 19 к.
Издательство «Наука»
Москва К-62, Подсосенский пер., 21
2-я типография издательства «Наука»
Москва Г-99, Шубинский пер., 10