Author: Кузьменко Н.Е. Рыжова О.Н. Теренин В.И. Агафонов А.А.
Tags: химия задачи по химии учебное пособие
Year: 2018
Text
УДК 54
ББК Г24
Авторский коллектив
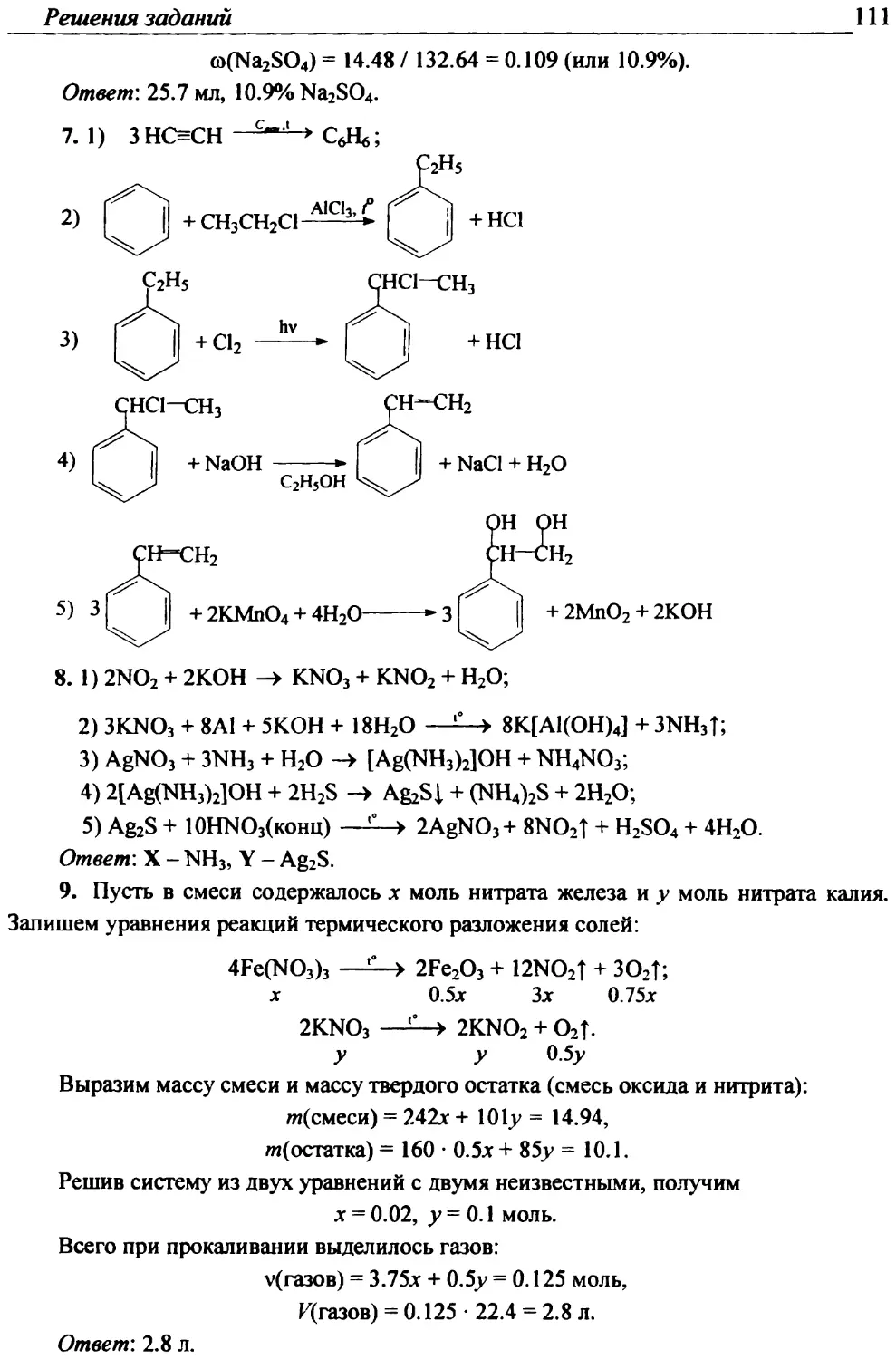
О.Н. Рыжова, доцент, кавд. пед. наук
В.И. Теренин, профессор, докт. хим. наук
Н.Е. Кузьменко, профессор, докт. физ.-мат. наук
А.А. Агафонов, инженер
Р.Л. Антипин, доцент, канд. хим. наук
М.И. Афанасов, профессор, докт. хим. наук
Д.Г. Гулевич, аспирант
Е.Д. Демидова, доцент, канд. хим. наук
В. В. Еремин, профессор, докт. физ.-мат. наук
А.Е. Жирнов, доцент, канд. хим. наук
Е.В. Карпова, доцент, канд. хим. наук
С.Б. Осин, доцент, канд. хим. наук
МГУ - школе. Экзаменационные и олимпиадные задания
по химии: 2018 - М.: Химический ф-т МГУ, 2019.- 135 с.
Цель данного пособия - подготовить школьников к олимпиадам и
абитуриентов к письменным вступительным испытаниям по химии, проводимым в
Московском государственном университете имени М.В. Ломоносова. Оно
продолжает серию пособий и сборников, которые химический факультет
Московского университета ежегодно издает с 1990 года.
В пособии представлены задания заочного и очного туров федеральной
олимпиады «Ломоносов» по химии, включенной в Перечень предметных олимпиад
школьников на 2017/2018 учебный год, а также все варианты экзаменационных
билетов по химии, предлагавшиеся на вступительных испытаниях в МГУ в 2018
году. Для каждого варианта приведены подробные решения заданий или же ответы с
необходимыми комментариями.
Пособие адресовано школьникам старших классов, абитуриентам и учителям
химии.
УДК 54
ББК Г 24
© Химическая ф-т МГУ', 2019.
СОДЕРЖАНИЕ
Предисловие..........................................5
О поступлении на химический факультет МГУ............9
Задания олимпиады «Ломоносов»
Заочный тур
Задания для учащихся 10-11 классов......13
Задания для учащихся 5-9 классов........25
Очный тур
Задания для учащихся 10-11 классов......33
Задания для учащихся 5-9 классов........35
Экзаменационные задания
Дополнительный письменный вступительный экзамен.. 37
Заместительный экзамен (вместо ЕГЭ)..........43
Пробный экзамен..............................47
Решения заданий олимпиады «Ломоносов»
Заочный тур
Задания для учащихся 10-11 классов......49
Задания для учащихся 5-9 классов........63
Очный тур
Задания для учащихся 10-11 классов..........69
Задания для учащихся 5-9 классов........79
Решения экзаменационных заданий
Дополнительный письменный вступительный экзамен .. 82
Заместительный экзамен (вместо ЕГЭ)..........107
Пробный экзамен..............................119
Программа вступительных экзаменов по химии
для поступающих в МГУ имени М.В. Ломоносова..........128
Рекомендуемая литература.............................133
ПРЕДИСЛОВИЕ
Вы держите в руках очередной сборник олимпиадных и экзаменационных задач
по химии из серии, ежегодно издаваемой химическим факультетом МГУ под эгидой
Программы «МГУ - школе».
Московский государственный университет имени М.В. Ломоносова является
одним из двух вузов России, имеющих право проводить дополнительные
вступительные испытания (ДВИ) при приеме на обучение по всем программам
подготовки специалистов, бакалавров и магистров. Поэтому прием на химический
факультет МГУ проходит не только на основании результатов ЕГЭ, но и на
основании традиционного письменного экзамена по химии, который в обязательном
порядке сдают все абитуриенты химического факультета, факультета
фундаментальной медицины и факультета фундаментальной физико-химической
инженерии, поступающие в общем конкурсе. Для всех трех факультетов ДВИ по
химии проходит одновременно в июле после завершения приема документов для
поступления на первый курс.
Поступление на химический факультет возможно не только по результатам
общего конкурса, но и с учетом результатов олимпиад. Одна из них -
многопредметная олимпиада школьников «Ломоносов», за химическую
составляющую которой традиционно отвечает химический факультет. Олимпиада
включает два этапа: заочный (отборочный), который начинается в середине осени и
заканчивается к Новому году, и очный (заключительный), который проходит в марте.
Задания заочного тура участники выполняют в интерактивном режиме, на
решение и оформление заданий выделено 24 часа, при этом каждый участник имеет
две попытки (в ноябре и в декабре). Это означает, что выполненное и отправленное
на проверку задание ноябрьского тура не аннулируется, если автор прислал решение
заданий также и декабрьского тура. Каждый участник имеет возможность выбрать из
двух попыток ту, которую считает наиболее удачной, либо принять участие в
олимпиаде только с одной выполненной попыткой. Право участия в очном этапе
получают победители и призеры заочного этапа, а также победители и призеры
заключительного этапа года, предшествующего году проведения олимпиады.
6
Предисловие
Заключительный этап олимпиады «Ломоносов» организуется одновременно на
химическом факультете МГУ в Москве и на региональных площадках. В 2018 г.
такими площадками стали учебные заведения в Санкт-Петербурге, Астане,
Владивостоке, Красноярске, Барнауле и Уфе. Всем участникам очного тура
предлагается одно и то же задание, а проверка всех работ происходит в МГУ
одновременно и по единым критериям.
Ббльшая часть наших читателей - это потенциальные абитуриенты
естественнонаучных факультетов МГУ, которым еще предстоит написать ДВИ и
поучаствовать в олимпиаде «Ломоносов» по химии, или же учителя и преподаватели
будущих абитуриентов. Поступление в вуз в современных условиях - сложный
процесс как с законодательно-правовой, так и с психологической точки зрения. Чтобы
помочь школьникам, их родителям и учителям лучше ориентироваться, мы включили
в сборник специальный раздел, в котором подробно рассмотрели этапы поступления в
МГУ на примере родного химического факультета (см. стр. 9).
В настоящей книге вашему вниманию предлагаются задания и решения
прошедшего в июле 2018 года ДВИ по химии1, а также варианты письменного
испытания, которое проводилось в формате «вместо ЕГЭ» для отдельных категорий
абитуриентов. Кроме того, в нашем сборнике вы найдете варианты двух заочных
туров олимпиады «Ломоносов» по химии для учащихся 10-11 классов - «Ноябрь» и
«Декабрь» - и их решения. В книгу также включены задания и решения вариантов
заданий, предложенных участникам олимпиады «Ломоносов» на заключительном
этапе. Учащимся 5-9 классов мы традиционно предлагаем отдельные варианты
олимпиадных заданий заочного и очного туров, которые также вошли в книгу.
В сборнике представлены материалы пробного экзамена по химии, впервые
состоявшегося на химическом факультете в апреле 2018 г. Цель пробных экзаменов -
дать школьникам возможность проверить свои силы и знания в обстановке,
максимально приближенной к реальному вступительному испытанию. Участие в
пробном экзамене - платное. Результат пробного экзамена доступен лишь самому
участнику, и он никак не учитывается при поступлении. После завершения проверки
работ пробного экзамена проводится подробный разбор решения. Задания пробных
экзаменов в основном компонуются из экзаменационных задач прошлых лет.
Система зачисления, подразумевающая проведение дополнительного
вступительного экзамена по химии и предоставление льгот победителям и призерам
олимпиад федерального уровня в сочетании с результатами ЕГЭ, позволяет
привлекать для обучения в Московский университет хорошо подготовленных,
лучших выпускников школ. На рис. 1 представлена динамика изменения числа
1 На ДВИ абитуриентам всех факультетов МГУ предлагается одинаковое задание
(в четырех вариантах), резервный вариант предназначен для абитуриентов, не принявших по
уважительной причине участие в экзамене и писавших ДВИ в резервный день.
Предисловие
7
заявлений, поданных в Приемную комиссию химического факультета МГУ за
последние годы (на факультете в 2018 году было 223 бюджетных места).
Рис. 1. Динамика числа заявлений, поданных абитуриентами на химический факультет
МГУ им. М.В. Ломоносова.
Видно, что последние пять лет конкурс на бюджетные места составляет более
двух человек на место, причем в 2018 г. количество заявлений заметно выросло.
На рис. 2 представлены результаты дополнительного вступительного испытания,
состоявшегося в июле 2018 г. В этом экзамене приняли участие 632 абитуриента
химического, медицинского факультетов и факультета фундаментальной физико-
химической инженерии. Неудовлетворительных оценок было получено всего 57 (это
9% от общего числа). Хорошо видно, что подавляющее большинство абитуриентов
хорошо справились с заданиями, набрав более половины баллов. Минимальная
положительная оценка по аналогии с ЕГЭ по химии составляет 36 баллов.
Рис. 2. Баллы за ДВИ по химии, набранные абитуриентами МГУ в 2018 г.
8
Предисловие
Изучившим материалы дополнительного вступительного испытания будет
интересно узнать, как абитуриенты 2018 года справились с каждой из десяти задач
экзаменационного билета. На рис. 3 отображена «решаемость» задач ДВИ, которая
рассчитывается как средний балл всех участников за задание, отнесенный к
максимальной оценке за это задание. Наиболее трудными оказались задачи 4 и 10.
100,0
1 23466789 10
Номер задачи
Рис. 3. Решаемость задач экзаменационного билета ДВИ 2018 г.
Интересен региональный состав абитуриентов (рис. 4а) и первокурсников
(рис. 46) химического факультета. Факультет традиционно гордится широким
представительством регионов, что является отражением планомерной работы по
поиску и привлечению одаренных абитуриентов из России и других стран.
а б
Рис. 4. География абитуриентов (а) и студентов I курса (б) химического
факультета МГУ. поступивших на бюджетные места в 2018 г.
Мы приглашаем читателей познакомиться с материалами вступительных
экзаменов и олимпиад по химии для того, чтобы лучше оценить свои силы и уровень
подготовки. Хорошим подспорьем в работе будут учебные пособия и справочники
авторских коллективов МГУ. Наши рекомендации приведены в конце сборника.
Искренне желаем успеха всем школьникам и абитуриентам!
Предисловие
9
О поступлении на химический факультет МГУ
В настоящее время существуют три траектории зачисления на химический
факультет.
1. Победители и призеры Всероссийской олимпиады школьников
Победители и призеры заключительного этапа Всероссийской олимпиады
школьников имеют право на зачисление в любой вуз на специальность,
соответствующую профилю олимпиады. Зачисление производится без вступительных
испытаний. Это означает, что обладатель диплома такого уровня может не
предоставлять в приемную комиссию свои результаты ЕГЭ. Диплом заключительного
этапа олимпиады действителен четыре года и можег быть получен как в 9, так и в 10
или 11 классах - льготу при поступлении дипломант получает в любом случае.
2. Победители и призеры «перечневых» олимпиад школьников
Менее однозначна ситуация с победителями и призерами заключительных
этапов олимпиад школьников, включенных в федеральный Перечень (так называемые
«перечневые» олимпиады, олимпиады Российского Совета олимпиад школьников).
По химии это олимпиады «Ломоносов», Всесибирская олимпиада школьников,
Московская олимпиада школьников, олимпиада школьников Санкт-Петербургского
государственного университета и некоторые другие. Все олимпиады РСОШ
разделены на олимпиады первого, второго и третьего уровня. Предусмотрены
дипломы I (победители), а также II и III степени (призёры). Обратите внимание на
важные моменты получения олимпиадных льгот.
Во-первых, дипломантам таких олимпиад на химическом факультете могут быть
предоставлены только две возможные льготы - зачисление без экзаменов или же
максимальное количество баллов за ЕГЭ, соответствующий профилю олимпиады.
Отметим, что каждый вуз (и каждый факультет в составе МГУ) самостоятельно
определяет уровни олимпиад и степени дипломов, за которые он будет предоставлять
определенные льготы по каждому из направлений подготовки. Поэтому советуем
заранее уточнить на сайте вуза, какая именно льгота может быть предоставлена в
Вашем случае.
Во-вторых, каждый диплом должен быть обязательно подтвержден оценкой
ЕГЭ не менее 75 баллов по предмету, соответствующему профилю олимпиады, в
противном случае льгота не предоставляется.
В-третьих, предъявлять диплом при поступлении в вуз нужно, только если он
был получен в последний год преподавания в школе предмета, соответствующего
профилю олимпиады. Например, для поступления на химический факультет по
результатам олимпиады «Ломоносов» по химии необходимо, чтобы диплом был
получен в 11 классе, поскольку именно 11 класс является последним годом
преподавания химии в школе.
Процесс зачисления с олимпиадными льготами представлен на схеме 1 (стр. 12).
10
Предисловие
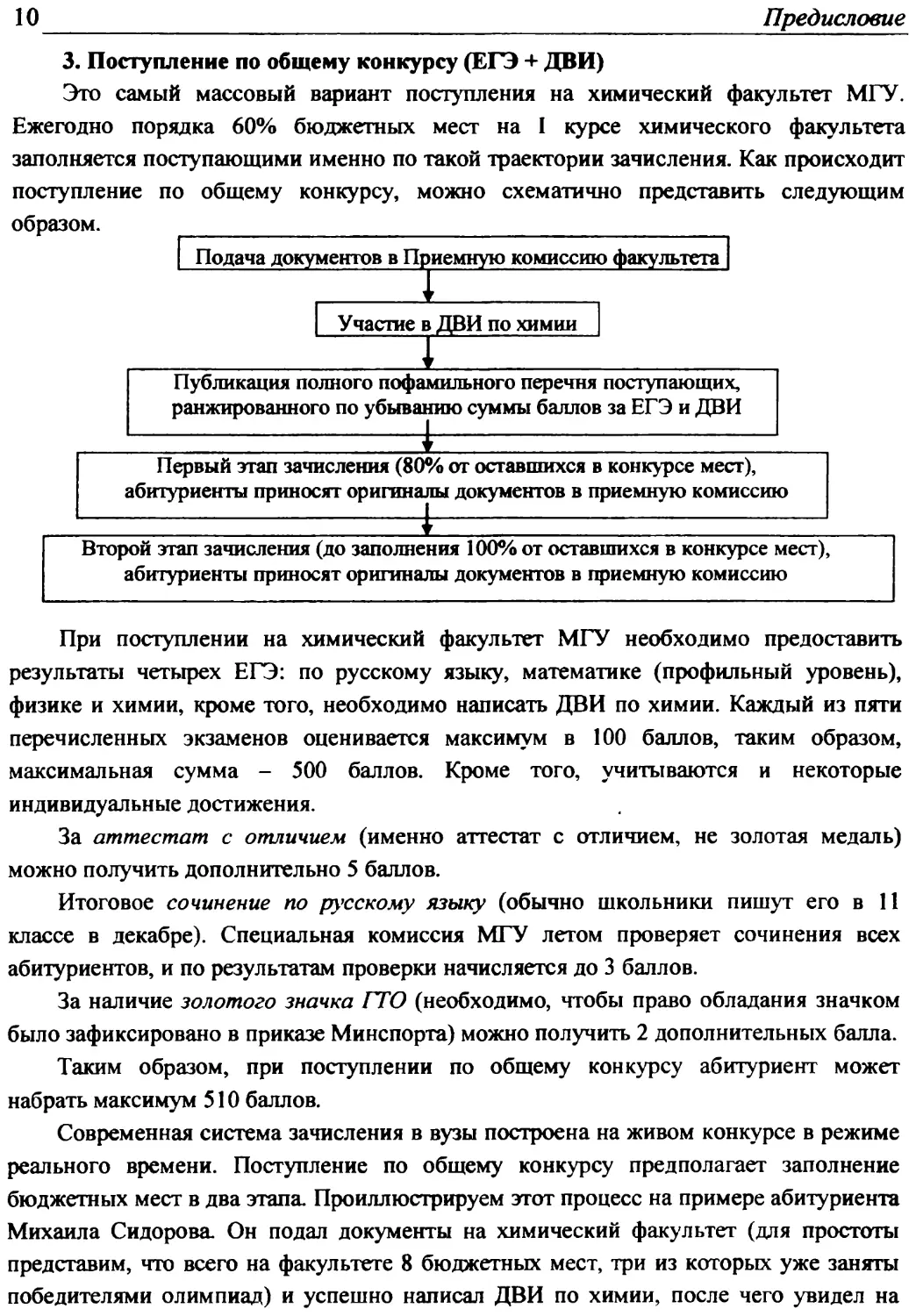
3. Поступление по общему конкурсу (ЕГЭ + ДВИ)
Это самый массовый вариант поступления на химический факультет МГУ.
Ежегодно порядка 60% бюджетных мест на I курсе химического факультета
заполняется поступающими именно по такой траектории зачисления. Как происходит
поступление по общему конкурсу, можно схематично представить следующим
При поступлении на химический факультет МГУ необходимо предоставить
результаты четырех ЕГЭ: по русскому языку, математике (профильный уровень),
физике и химии, кроме того, необходимо написать ДВИ по химии. Каждый из пяти
перечисленных экзаменов оценивается максимум в 100 баллов, таким образом,
максимальная сумма - 500 баллов. Кроме того, учитываются и некоторые
индивидуальные достижения.
За аттестат с отличием (именно аттестат с отличием, не золотая медаль)
можно получить дополнительно 5 баллов.
Итоговое сочинение по русскому языку (обычно школьники пишут его в 11
классе в декабре). Специальная комиссия МГУ летом проверяет сочинения всех
абитуриентов, и по результатам проверки начисляется до 3 баллов.
За наличие золотого значка ГТО (необходимо, чтобы право обладания значком
было зафиксировано в приказе Минспорта) можно получить 2 дополнительных балла.
Таким образом, при поступлении по общему конкурсу абитуриент может
набрать максимум 510 баллов.
Современная система зачисления в вузы построена на живом конкурсе в режиме
реального времени. Поступление по общему конкурсу предполагает заполнение
бюджетных мест в два этапа. Проиллюстрируем этот процесс на примере абитуриента
Михаила Сидорова. Он подал документы на химический факультет (для простоты
представим, что всего на факультете 8 бюджетных мест, три из которых уже заняты
победителями олимпиад) и успешно написал ДВИ по химии, после чего увидел на
Предисловие
И
сайте приемной комиссии следующий пофамильный перечень абитуриентов,
ранжированный по убыванию суммы баллов (все имена и фамилии - вымышленные).
Осталось бюджетных мест: 5
Лица, поступакнцие по общему конкурсу Иа имх |вчнсяеиия в паркий >тап: 4
Во ггарай этмп: 1
«амнпмя, mei отчество соглвсяв докумтв об Сумм» баянов Рюут*гаы осту готтфяьмьм исльачмим ♦ :ХШИШД!ЯЦ 2: XMUW» ЕГЭ} i: МАГГИАТНКДаГЭ» 4?«ИЗИКД<ЕГЭ) Ь РУССКИМ ЯЗЫЦЕГЭ) «ядямщуаяы*» ДОсяевеяже 1 - Апестот с отличием 2 Оценка я WMime 1 ГГО (спорчтяныо Право обцвжмпм Статус
1 Т i 3 4 5 4 1 3
ПЕТРОВ ДМИТРИЙ СЕРГЕЕВИЧ Да 492 * изо 99 98 96 5 1 0 her В конкурсе
1г ИВАНОВ НИКОЛАЙ СЕМЁНОВИЧ Нет 4<Ю 96 1С0 92 94 100 S 2 0 Да В конкурсе
ЯСЕНЕВ ИВАН ОЛЕГОВИЧ Нет «7 100 98 88 94 '00 5 2 0 Да В конкурсе
^АЛЕКСЕЕВ ИВАН АЛЕКСАНДРОВИЧ Да 484 69 90 92 98 100 5 2 0 Нет В конкурсе
ИВАНОВА АННА КИМОВНА Нет 47» за 1И К 92 96 S 2 0 Нет В конкурсе
ЗУБЕНКО ЯНА ИВАНОВНА Нет ♦77 84 100 86 100 100 5 2 0 д* В конкурсе
т МАРКОВ ЯН ПАВЛОВИЧ Да 478 98 130 80 94 9в 5 3 0 Да В конкурсе
8 СИДОРОВ МИХАИЛ Нет 46G 97 W j 7В 100 91 0 2 0 нет В конкурсе
Абитуриент может быть зачислен, если он предоставил в приемную комиссию
оригинал своего аттестата, однако участвовать в конкурсе можно и с копией (важно
помнить, что для зачисления копии не достаточно!). Если раньше приемные комиссии
объявляли значение проходного балла и гарантировали зачисление всем
абитуриентам, набравшим проходной балл и выше при предоставлении оригинала
аттестата, то сейчас значение проходного балла определяется постфактум, уже после
окончания приема, когда уже зачислены все абитуриенты.
Итак, абитуриент Сидоров видит, что в ранжированном перечне он занимает
восьмую позицию, в то время как мест всего пять. Казалось бы, он не поступил, но
это пока не так. Дело в том, что Михаил не подал оригинал своего аттестата (в
соответствующем столбце указано «Нет»), но если он сейчас его принесет, то станет в
конкурсе по оригиналам четвертым, то есть сможет претендовать на зачисление в
первом этапе. Однако Михаилу при подаче оригинала в приемную комиссию нужно
осознавать, что если один из абитуриентов, не подавших оригинал и набравших
сумму баллов выше, чем у него, вдруг тоже решит принести оригинал, то Михаил
будет в конкурсе по оригиналам уже пятым, то есть сможет претендовать на
зачисление лишь во второй этап. Если же еще кто-то из опережающих его
абитуриентов представит оригинал, то Михаил окажется шестым и перестанет
претендовать на бюджетные места. Поэтому нынешним абитуриентам приходится
постоянно отслеживать конкурсную ситуацию.
Все даты начала и окончания приема документов (в том числе и в первый, и
второй этапы зачисления), списки подавших документы, приказы о зачислении, всю
необходимую информацию о ходе приемной кампании любой вуз обязан публиковать
на своем сайте. Поэтому абитуриентам обычно известны все важные даты и
количества бюджетных мест, остается лишь следить за конкурсной ситуацией и
вовремя подать оригинал аттестата, здраво оценив свои шансы.
Схема 1. Система предоставления льгот победителям и призерам заключительных этапов олимпиад школьников из Перечня (РСОШ)
в ходе приемной кампании на химическом факультете МГУ имени М.В. Ломоносова
В каком классе Вы получили диплом олимпиады РСОШ?
Олимпиада «Ломоносов»
Задания заочного тура
Задания для учащихся 10-11 классов
Вариант Ноябрь -1
1. Назовите два атома, у каждого из которых в основном состоянии общее число
d-электронов в два раза больше общего числа 5-электронов, запишите их электронные
конфигурации.
2. Приведите структурные формулы двух изомерных углеводородов C7Hj6,
каждый из которых при хлорировании на свету может образовать одно первичное,
одно вторичное и одно третичное хлорпроизводное. Назовите эти углеводороды.
3. Известны содержащие азот соединения XNY5 и X2NY7. Массовая доля азота в
одном из соединений равна 45.16%, в другом - 31.11%. Расшифруйте эти соединения
и запишите уравнения их взаимодействия с соляной кислотой.
4. Природный магний представляет собой смесь трех изотопов. Относительные
атомные массы 24Mg и 25Mg и их содержание в природной смеси составляют 23.98504
а.е.м. (мольная доля 78.99%) и 24.985584 а.е.м. (10.0%) соответственно. Определите
массовое число третьего изотопа и рассчитайте его относительную атомную массу.
5. Квас - это продукт молочнокислого и спиртового брожения сахаристых
веществ. Для приготовления 2 л домашнего кваса использовали сырье, содержащее
45.28 г глюкозы. В результате брожения был получен напиток, массовая доля спирта
в котором составила 1.15%. Определите pH кваса, считая, что его кислотность
обусловлена только молочной кислотой (Ктс = 1.3 8-10-4), плотность кваса 1 г/мл, а
реакции брожения прошли количественно.
6. При охлаждении водного раствора нитрата неизвестного металла было
получено 0.3 моль кристаллогидрата, в котором массовая доля безводной соли
составляет 59.50%, а масса кристаллизационной воды на 22.8 г меньше массы
безводной соли. Определите состав кристаллогидрата.
7. Запишите уравнения реакций, соответствующих приведенным ниже
превращениям. Расшифруйте неизвестные вещества, укажите условия проведения
реакций. В уравнениях реакций используйте структурные формулы веществ.
14
Олимпиада «Ломоносов», заочный тур
H2N-CH-COOH
СН2
ОН
NaOHfnu) NaNOj НДОХконц.) Н2О Na ОН
-------► А ----► В --------► С------»D---------► Е
t° HCI t° НТ
НВг
F
8. Напишите уравнения реакций, соответствующих приведенным ниже превра-
щениям, и укажите условия их проведения (все неизвестные вещества содержат
фосфор).
КМпО4 КОН, изб. С12, изб. Р2О5,/0
х2 РС1з — Р — хз-------------- Х4 КзРОд
9. Навеску сине-зеленых кристаллов соли Мора растворили в воде,
подкисленной серной кислотой. После пропускания через полученный раствор тока
кислорода и охлаждения до 0°С выпал светло-сиреневый кристаллический осадок А.
Кристаллы А снова растворили в воде при комнатной температуре и обработали
раствором гидроксида калия. Выпавший при этом бурый осадок В растворили в
горячем щелочном растворе гипохлорита калия. К полученному красно-фиолетовому
раствору добавили раствор хлорида бария, что привело к образованию фиолетового
осадка С, содержащего 49.8% бария по массе. Определите состав соединений А, В и
С, напишите уравнения всех упомянутых реакций.
10. Углеводород массой 4.48 г при бромировании дал одно монобром-
производное массой 7.64 г, которое обработали спиртовым раствором щелочи, а затем
- подкисленным раствором перманганата калия. Образовалось соединение X; при
действии на него избытка иода в щелочной среде выпало 31.52 г светло-желтого
осадка, который отделили. Рассчитайте максимальную массу бромэтана, способного
вступить в реакцию с органическим соединением неразветвлённого строения,
содержащимся в маточном растворе. Определите все неизвестные вещества и
напишите уравнения всех упомянутых реакций.
Вариант Ноябрь - 2
1. Назовите два атома, у каждого из которых в основном состоянии общее число
5-электронов в полтора раза меньше общего числа р-электронов, запишите их
электронные конфигурации.
2. Приведите структурные формулы двух изомерных углеводородов С7Н16,
каждый из которых при хлорировании на свету может образовать три первичных
хлорпроизводных. Назовите эти углеводороды.
Задания
15
3. Известны содержащие углерод соединения ХСУ2 и Х2СУ2. Массовая доля
углерода в одном из соединений равна 40.0%, в другом - 26.09%. Расшифруйте эти
соединения и запишите уравнения их взаимодействия с хлором в водном растворе.
4. Известны четыре стабильных изотопа хрома. Относительные атомные массы
52Сг, 53Сг и мСг и их содержание в природной смеси составляют 51.940508 а.е.м.
(мольная доля 83.79%), 52.940649 а.е.м. (9.50%) и 53.938880 а.е.м. (2.365%)
соответственно. Определите массовое число четвертого изотопа и рассчитайте его
относительную атомную массу.
5. Квас - это продукт молочнокислого и спиртового брожения сахаристых
веществ. Для приготовления 1200 мл домашнего кваса использовали сырье,
содержащее 28.26 г глюкозы. В результате брожения был получен напиток с pH 3.383.
Рассчитайте массовую долю спирта в квасе, считая, что его кислотность обусловлена
только молочной кислотой (Л’дас = 1.38-10^), плотность кваса 1 г/мл, а реакции
брожения прошли количественно.
6. При охлаждении водного раствора сульфата неизвестного металла было
получено 0.2 моль кристаллогидрата, в котором массовая доля безводной соли
составляет 61.29%, а масса кристаллизационной воды на 25.2 г меньше массы
безводной соли. Определите состав кристаллогидрата.
7. Запишите уравнения реакций, соответствующих приведенным ниже
превращениям. Расшифруйте неизвестные вещества, укажите условия проведения
реакций. В уравнениях реакций используйте структурные формулы веществ.
HjN CH СООН NaOHfre.) NaNOj HjSO^kohu.) Н2О KMnO4
' -----► А------► В -------»-С——»-D—--------► Е
। 2 е на е Н+ н+
КМпО4ЛН+
F
8. Напишите уравнения реакций, соответствующих приведенным ниже превра-
щениям, и укажите условия их проведения (все неизвестные вещества содержат серу).
HI НВг NaOH, изб. ^2» Н2О
PbS —XI-------Н28О4(конц)---►XI—7ГТГ* ХЗ —Na2S2O3-----------► Х4
9. Навеску бледно-голубых кристаллов соли меди(П), состав которой аналогичен
соли Мора, растворили в воде. После добавления раствора карбоната натрия к
полученному раствору выпал голубовато-зеленый осадок А, содержащий 55.5% меди
по массе, и выделился газ. Осадок А растворили в разбавленной соляной кислоте и
пропустили в получившийся раствор ток сернистого газа. Образовавшийся при этом
белый осадок В растворили в концентрированной соляной кислоте. В образовавшийся
бесцветный раствор пропустили ток сероводорода, при этом выпал темно-серый
16 Олимпиада «Ломоносов», заочный тур
осадок С. Определите состав соединений А, В и С, напишите уравнения всех
упомянутых реакций.
10. Углеводород массой 4.90 г при бромировании дал одно монобром*
производное массой 8.85 г, которое обработали спиртовым раствором щелочи, а затем
- подкисленным раствором перманганата калия. Образовалось соединение Y, при
действии на него избытка иода в щелочной среде выпало 19.7 г светло-желтого
осадка. Маточный раствор, содержащий органическое соединение с неразветвлённым
углеродным скелетом, обработали избытком нитрата бария, полученный при этом
осадок отфильтровали, высушили и прокалили. Рассчитайте массу органического
соединения, полученного при прокаливании. Определите все неизвестные вещества и
напишите уравнения всех упомянутых реакций.
Вариант Ноябрь - 3
1. Назовите два атома, у каждого из которых в основном состоянии общее число
5-электронов в два раза меньше общего числа р-электронов, запишите их электронные
конфигурации.
2. Приведите структурные формулы двух изомерных углеводородов С7Н]6,
каждый из которых при хлорировании на свету может образовать два первичных
хлорпроизводных, но не образует третичных. Назовите эти углеводороды.
3. Известны содержащие хлор соединения XC1Y3 и X2C1Y5. Массовая доля хлора
в одном из соединений равна 70.3%, а в другом - 55.04%. Расшифруйте эти
соединения и запишите уравнения их реакции с избытком аммиака.
4. Природный стронций представляет собой смесь четырех изотопов.
Относительные атомные массы MSr, ^Sr и 88Sr и их содержание в природной смеси
составляют 83.913425 а.е.м. (мольная доля 0.5%), 85.9092602 а.е.м. (9.8%) и 87.905612
а.е.м. (82.7%) соответственно. Определите массовое число четвертого изотопа и
рассчитайте его относительную атомную массу.
5. Квас - это продукт молочнокислого и спиртового брожения сахаристых
веществ. Для приготовления 1400 мл домашнего кваса использовали сырье,
содержащее 57 г глюкозы. В результате брожения был получен напиток с pH 3.161, а
массовая доля спирта в квасе оказалась равной 1.2%. Определите выход реакций
брожения по каждому из путей. Примите, что плотность кваса 1 г/мл, а его
кислотность обусловлена только молочной кислотой (Ктс = 1.38-1 О'4).
6. При охлаждении водного раствора нитрата неизвестного металла было
получено 0.4 моль кристаллогидрата, в котором массовая доля безводной соли
составляет 59.90%, а масса кристаллизационной воды на 32.0 г меньше массы
безводной соли. Определите состав кристаллогидрата.
Задания
17
7. Запишите уравнения реакций, соответствующих приведенным ниже
превращениям. Расшифруйте неизвестные вещества, укажите условия проведения
реакций. В уравнениях реакций используйте структурные формулы веществ.
H2N-CH-COOH
СН2СН(СН3)2
NaOHfTB.) NaNO2 Н^ОДконц.)
------► А-------► В --------►
t° на t°
Вг2 NaOH Вг2
► Е------------------► F
hv CjHjOH 4Q ос
8. Напишите уравнения реакций, соответствующих приведенным ниже
превращениям, и укажите условия их проведения (все неизвестные вещества
содержат хлор).
H2SO4(kohu) SO КОН электролиз
NaCl----------►XI — Cl2---------Х2 Х3 -----------------► Х4 КС1О4
кат Н2О без диафрагмы
9. Образец красно-оранжевого минерала крокоита растворили в азотной кислоте.
Пропускание тока сернистого газа через полученный оранжевый раствор привело к
выпадению белого осадка А, содержащего 68.3% свинца по массе. Осадок А отделили
от образовавшегося зеленого раствора. Добавление к этому раствору раствора
карбоната натрия привело к выпадению грязно-зеленого осадка В. Осадок В
растворили в разбавленной серной кислоте, добавили раствор сульфата калия и
охладили смесь до 0°С, при этом образовался фиолетовый кристаллический осадок С.
Определите состав соединений А, В и С. Напишите уравнения всех упомянутых
реакций.
10. Углеводород массой 2.94 г при бромировании дал одно монобром-
производное массой 5.31 г, которое обработали спиртовым раствором щелочи, а затем
- подкисленным раствором дихромата калия. Образовалось соединение X; при
действии на него избытка иода в щелочной среде выпало 23.64 г светло-желтого
осадка, который отделили. Маточный раствор, содержащий органическое соединение
неразветвлённого строения, подкислили и выделили органическое соединение,
которое при нагревании до 250°С превращается в соединение Z. Рассчитайте массу
соединения Z, определите все неизвестные вещества и напишите уравнения всех
упомянутых реакций.
Вариант Ноябрь - 4
1. Назовите два атома, у каждого из которых в основном состоянии общее число
d-электронов в полтора раза меньше общего числа р-электронов, запишите их
электронные конфигурации.
2. Приведите структурные формулы двух изомерных углеводородов С7Н16,
первый из которых при хлорировании на свету может образовать одно третичное
хлорпроизводное, но не образует вторичных, а другой в таких же условиях образует
одно вторичное хлорпроизводное, но не образует третичных. Назовите эти
углеводороды.
18 Олимпиада «Ломоносов», заочный тур
3. Известны содержащие бром соединения X2BrY3 и XBrY3. Массовая доля
брома в одном из соединений равна 74.77%, а в другом - 84.21%. Расшифруйте эти
соединения и запишите уравнения их реакции с кислородом.
4. Природный кремний представляет собой смесь трех изотопов. Относительные
атомные массы MSi и 29Si и их содержание в природной смеси составляют 27.976927
а.е.м. (мольная доля 92.23 %) и 28.976495 а.е.м. (4.67%) соответственно. Определите
массовое число третьего изотопа и рассчитайте его относительную атомную массу.
5. Квас - это продукт молочнокислого и спиртового брожения сахаристых
веществ. Рассчитайте массу глюкозы, подвергнутой брожению, в результате которого
было получено 1.5 л домашнего кваса с pH 3.383. Массовая доля спирта в квасе
составила 1.3%. Примите, что плотность напитка 1 г/мл, его кислотность обусловлена
только молочной кислотой (Ктс = 1.38-10^), а реакции брожения прошли
количественно.
6. При охлаждении водного раствора хлорида неизвестного металла было
получено 0.6 моль кристаллогидрата, в котором массовая доля безводной соли
составляет 55.28%, а масса кристаллизационной воды на 15.3 г меньше массы
безводной соли. Определите состав кристаллогидрата.
7. Запишите уравнения реакций, соответствующих приведенным ниже
превращениям. Расшифруйте неизвестные вещества, укажите условия проведения
реакций. В уравнениях реакций используйте структурные формулы веществ.
HoN—CH—СООН NaOH(TB.) NiNO2 Н^О^конц.) НВг
2 I -----► А-----
40 °C
Вг2/0°С
(CH2)3NH2
на
170®С
Н2$0«(койц.)
140*С
Е
F
8. Напишите уравнения реакций, соответствующих приведенным ниже
превращениям, и укажите условия их проведения (все неизвестные вещества
содержат азот).
As2O3 охлаждение С12, Сщ^.
HNO3 (50%)------► XI + Х2------->ХЗ — KNO2—►NO--------► Х4 — HNO2
9. Навеску красно-розовых кристаллов марганцевого купороса растворили в
воде. После добавления раствора гидроксида натрия к полученному раствору в
присутствии кислорода выпал коричневый осадок А. Осадок А растворили в
концентрированной соляной кислоте и обработали получившийся бледно-розовый
раствор раствором карбоната натрия, что привело к выпадению розового осадка В,
содержащего 49.7% марганца по массе. Газообразные продукты в этой реакции не
образовывались. Осадок В растворили в разбавленной серной кислоте. К
получившемуся слабо-розовому раствору добавили пероксодисульфат аммония и
Задания
19
каплю раствора нитрата серебра. Раствор стал фиолетово-малиновым, причем окраску
ему придало соединение С. Определите состав соединений А, В и С, напишите
уравнения всех упомянутых реакций.
10. Углеводород массой 3.36 г при бромировании дал одно монобром-
производное массой 6.52 г, которое обработали спиртовым раствором щелочи, а затем
- подкисленным раствором перманганата калия. Образовалось соединение Y, при
действии на него избытка иода в щелочной среде выпало 15.76 г светло-желтого
осадка, который отделили. Рассчитайте максимальную массу 2-иодпропана,
способного прореагировать с органическим соединением неразветвлённого строения,
содержащимся в маточном растворе. Определите все неизвестные вещества и
напишите уравнения всех упомянутых реакций.
Вариант Декабрь -1
1. Запишите уравнение реакции, при помощи которой можно обнаружить
примесь муравьиной кислоты в уксусной кислоте. Кратко опишите признаки
протекания этой реакции.
2. Определите общую формулу гомологического ряда, к которому принадлежит
щавелевая кислота.
3. Смесь содержит кристаллические соли MnSO4-5H2O и KA1(SO4)2 • 12Н2О.
Предложите способ выделения из этой смеси марганца и алюминия в виде любых
индивидуальных соединений.
4. Смесь 5 г карбоната кальция и 1.06 г карбоната натрия поместили в 750 мл
воды при 25°С. Определите массу ионов кальция в растворе над осадком после
установления равновесия, если произведение растворимости СаСО3 при данной
температуре равно 3.8-10-9.
5. Вычислите относительную атомную массу изотопа 86Кг. При расчете
используйте следующие данные: массы нейтрона, протона и электрона равны 1.00866,
1.00728 и 0.0005486 а.е.м. соответственно; 1 а.е.м. = 1.66057-10“24 г; энергия
образования ядер 86Кг из нуклонов составляет 7.237928-1013 Дж/моль.
6. При н. у. шарик радиусом 15 см, наполненный смесью двух газов, завис в
воздухе на некоторой высоте. Оболочка шарика выполнена из нерастяжимого
материала, 1 м2 которого весит 1.65-10"2 кг. Парциальное давление одного из газов в
смеси составляет 20265 Па, этот газ в 6.5 раза легче второго. Плотность воздуха на
высоте зависания шарика равна 1.2946 кг/м3. Определите неизвестные газы.
7. Простое вещество А подвергли высокотемпературному хлорированию, масса
образовавшегося желтого вещества В оказалась больше массы исходного вещества А
в 2.203 раза. При обработке водного раствора вещества В, имеющего зеленый цвет,
раствором аммиака образовалось вещество С, придавшее раствору сине-фиолетовую
окраску. Пропускание в раствор вещества С сероводорода привело к образованию
20 Олимпиада «Ломоносов», заочный тур
черного осадка D. При добавлении к раствору вещества С иодида калия выпал светло-
фиолетовый осадок Е. Какое вещество образуется, если нагреть раствор вещества В с
гипофосфитом натрия? Установите состав зашифрованных веществ, напишите
уравнения всех упомянутых реакций.
8. Запишите уравнения реакций, соответствующих следующей схеме
превращений, укажите условия их протекания. Расшифруйте неизвестные вещества.
В уравнениях реакций используйте струюурные формулы веществ.
КОН(водн, разб) КОН(водн, кони)
С2н2— А — С7н8 —* В ---------А---' С7ИбО-----;---С + D
1 2 3 4 5
После обработки С7НбО избытком концентрированного раствора щёлочи
(реакция 5) была выделена эквимолярная смесь соединений С и D; водный раствор
одного из них подвергли электролизу. Напишите уравнение электролиза, укажите
процессы, протекающие на катоде и аноде.
9. Образец массой 136 г, содержащий черный сульфидный минерал MeCuS с
примесью кварцевого песка, обработали горячей концентрированной азотной
кислотой. К раствору, образовавшемуся после обработки кислотой, добавили избыток
раствора хлорида натрия. При этом образовалось 71.75 г белого осадка, содержащего
75.26% металла Me по массе. Белый осадок прокалили с карбонатом натрия при
900°С, образовавшийся твердый остаток промыли водой. Определите состав и массу
вещества, оставшегося после промывания твердого остатка водой. Установите состав
минерала и его содержание во взятом образце (в масс %). Напишите уравнения всех
реакций.
10. В 1924 г. компания Dow Chemical разработала процесс получения фенола,
включающий реакцию хлорирования бензола и последующий гидролиз
монохлорбензола, который в отсутствие катализатора протекает при 360-400°С и
давлении свыше 300 атм. Рассчитайте выход продуктов монобромирования
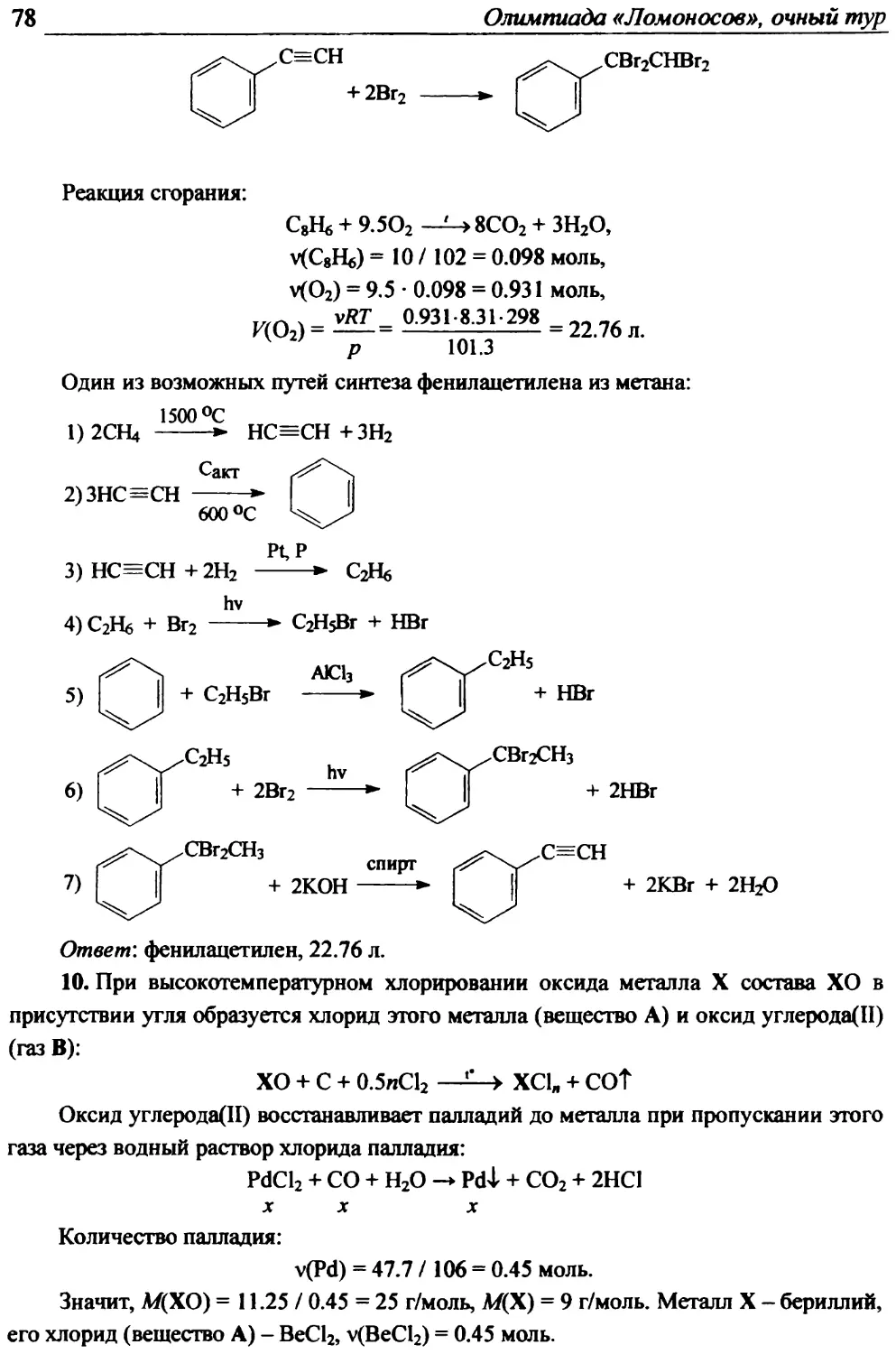
неизвестного монозамещённого циклического углеводорода в присутствии железа по
каждому направлению, если известно, что массовая доля углерода в углеводороде
составляет 91.30%, а при моногалогенировании и дальнейшем нагревании до 380°С с
20%-ным раствором щёлочи при давлении 360 атм было выделено 3 изомера в
молярном соотношении 1:5:4. Напишите уравнения протекающих реакций.
Вариант Декабрь - 2
1. Запишите уравнение реакции, при помощи которой можно обнаружить в этане
примесь этилена. Кратко опишите признаки протекания этой реакции.
2. Определите общую формулу гомологического ряда, к которому принадлежит
молочная кислота.
Задания
21
3. Смесь содержит кристаллические соли MgSO4-7H2O и KCr(SO4)2- 12Н2О.
Предложите способ выделения из этой смеси магния и хрома в виде любых
индивидуальных соединений.
4. Навеску сульфата бария массой 5 г внесли в 500 мл раствора сульфата натрия
с концентрацией 0.005 моль/л. Рассчитайте массу ионов бария в растворе над осадком
после установления равновесия, если произведение растворимости BaSO4 при
температуре опыта равно 1.НО"10.
5. Вычислите относительную атомную массу изотопа 58Fe. При расчете
используйте следующие данные: массы нейтрона, протона и электрона равны 1.00866,
1.00728 и 0.0005486 а.е.м. соответственно; 1 а.е.м. = 1.66057-10-24 г; энергия образо-
вания ядер 58Fe из нуклонов составляет 4.926562 • 1013 Дж/моль.
6. При н. у. шарик радиусом 15 см, наполненный смесью двух газов, завис в
воздухе на некоторой высоте. Оболочка шарика выполнена из нерастяжимого
материала, 1 м2 которого весит 8.49-10“3 кг. Один из газов в полтора раза легче
другого, является простым веществом и содержится в газовой смеси в количестве
0.303 моль. Плотность воздуха на высоте зависания шарика равна 1.2946 кг/м3.
Определите неизвестные газы.
7. Простое вещество А подвергли высокотемпературному хлорированию, масса
образовавшегося голубого вещества В оказалась больше массы исходного вещества А
в 2.203 раза. Пропускание газообразного аммиака над полученным веществом В при
нагревании привело к образованию светло-красного вещества С. При обработке
водного раствора вещества В, имеющего светло-розовый цвет, разбавленным
раствором гидроксида калия выпал розовый осадок D, растворяющийся в избытке
концентрированной соляной кислоты с образованием синего раствора вещества Е.
Какое вещество образуется, если полученный осадок D обработать
концентрированным раствором гидроксида калия, и какова его окраска? Установите
состав зашифрованных веществ и напишите уравнения всех упомянутых реакций.
8. Запишите уравнения реакций, соответствующих следующей схеме
превращений, укажите условия их протекания. Расшифруйте неизвестные вещества.
В уравнениях реакций используйте структурные формулы веществ.
СН3СОС1 Вг2> кон
А14С3 у* Ау-С2Н2 В CsH8O----------- С + D
4
После обработки С8Н8О избытком брома в присутствии щёлочи (реакция 5) была
выделена эквимолярная смесь соединений С и D; водный раствор одного из них
подвергли электролизу. Напишите уравнение электролиза, укажите процессы,
протекающие на катоде и аноде.
9. Образец массой 159.5 г, содержащий черный сульфидный минерал Me3CuS2 с
примесью кварцевого песка, обработали горячей концентрированной азотной
22
Олимпиада «Ломоносов», заочный тур
кислотой. К раствору, образовавшемуся после обработки кислотой, добавили избыток
раствора хлорида натрия. При этом образовалось 129.15 г белого осадка, содержащего
75.26% металла Me по массе. Белый осадок прокалили с оксидом бария при 400°С,
образовавшийся твердый остаток промыли водой. Определите состав и массу
вещества, оставшегося после промывания водой твердого остатка. Установите состав
минерала и его содержание во взятом образце (в масс %). Напишите уравнения всех
реакций.
10. В 1924 г. компания Dow Chemical разработала процесс получения фенола,
включающий реакцию хлорирования бензола и последующий гидролиз
монохлорбензола, который в отсутствие катализатора протекает при 360-400°С и
давлении свыше 300 атм. Рассчитайте выход продуктов монобромирования
неизвестного монозамещённого углеводорода в присутствии железа по каждому
направлению, если известно, что массовая доля водорода в углеводороде составляет
9.43%, а при моногалогенировании и дальнейшем нагревании до 380°С с 25%-ным
раствором щёлочи при давлении 360 атм было выделено 3 изомера в молярном
соотношении 0.15 : 1 : 0.85. Напишите уравнения протекающих реакций.
Вариант Декабрь - 3
1. Запишите уравнение реакции, при помощи которой можно обнаружить в
бутине-2 примесь бутина-1. Кратко опишите признаки протекания этой реакции.
2. Определите общую формулу гомологического ряда, к которому принадлежит
пировиноградная кислота
3. Смесь содержит кристаллические соли ZnSO4 - 7Н2О и (NHOFe^O^ • 12Н2О.
Предложите способ выделения из этой смеси цинка и железа в виде любых
индивидуальных соединений.
4. Навеску бромида серебра массой 2 г внесли в 400 мл раствора бромида натрия
с концентрацией 0.002 моль/л. Рассчитайте равновесную концентрацию ионов
серебра в растворе над осадком, если произведение растворимости бромида серебра
при температуре опыта равно 5.3-10'13.
5. Вычислите относительную атомную массу изотопа 104Pd. При расчете
используйте следующие данные: массы нейтрона, протона и электрона равны 1.00866,
1.00728 и 0.0005486 а.е.м. соответственно; 1 а.е.м. = 1.66057-10"24 г; энергия
образования ядер 104Pd из нуклонов составляет 8.625415-1013 Дж/моль.
6. При н. у. шарик радиусом 12 см, наполненный смесью двух газов, завис в
воздухе на некоторой высоте. Оболочка шарика выполнена из нерастяжимого
материала, 1 м2 которого весит 1.2510-2 кг. Парциальное давление одного из газов
составляет 25331 Па, этот газ в 1.4 раза тяжелее другого. Оба газа - простые
вещества. Плотность воздуха на высоте зависания шарика равна 1.2946 кг/м3.
Определите неизвестные газы.
Задания
23
7. Простое вещество А подвергли высокотемпературному хлорированию, масса
образовавшегося темно-коричневого вещества В оказалась больше массы исходного
вещества А в 2.11 раза. Водный раствор вещества В, имеющий зеленовато-синий
цвет, обработали раствором аммиака. При этом образовалось вещество С, придавшее
раствору ярко-синюю окраску. При пропускании в раствор вещества С сероводорода
выпал черный осадок D, растворимый в горячей концентрированной азотной кислоте
с образованием голубого раствора соединения Е. Кристаллы какого вещества
образуются, если в раствор вещества В добавить сульфат аммония, а затем охладить
смесь? Какого они цвета? Установите состав зашифрованных веществ и напишите
уравнения всех упомянутых реакций.
8. Запишите уравнения реакций, соответствующих следующей схеме
превращений, укажите условия их протекания. Расшифруйте неизвестные вещества.
В уравнениях реакций используйте структурные формулы веществ.
ВГ2 КОН(водн, конц)
C7Hg VА V С?Н’°^ С’Н5ВгО ----5----* С + D
4
После обработки С7Н5ВгО избытком концентрированного раствора щёлочи
(реакция 5) была выделена эквимолярная смесь соединений С и D; водный раствор
одного из них подвергли электролизу. Напишите уравнение электролиза, укажите
процессы, протекающие на катоде и аноде.
9. Образец массой 99.5 г, содержащий черный сульфидный минерал MeCuS с
примесью кварцевого песка, обработали горячей концентрированной азотной
кислотой. К раствору, образовавшемуся после обработки кислотой, добавили избыток
раствора хлорида натрия. При этом образовался белый осадок, содержащий 75.26%
металла Me по массе. Для полного растворения осадка потребовалось 400 мл раствора
тиосульфата натрия с концентрацией 2 моль/л. Определите состав и массу белого
осадка. Установите состав минерала и его содержание во взятом образце (в масс %).
Напишите уравнения всех реакций.
10. В 1924 г. компания Dow Chemical разработала процесс получения фенола,
включающий реакцию хлорирования бензола и последующий гидролиз
монохлорбензола, который в отсутствие катализатора протекает при 360-400°С и
давлении свыше 300 атм. Рассчитайте выход продуктов монобромирования
неизвестного монозамещённого углеводорода в присутствии железа по каждому
направлению, если известно, что массовая доля углерода в углеводороде составляет
90.00%, а при моногалогенировании и дальнейшем нагревании до 380°С с 20%-ным
раствором щёлочи при давлении 360 атм было выделено 3 изомера в молярном
соотношении 1 : 10:9. Напишите уравнения протекающих реакций.
24
Олимпиада «Ломоносов», заочный тур
Вариант Декабрь - 4
1. Запишите уравнение реакции, при помощи которой можно обнаружить в этане
примесь пропина. Кратко опишите признаки протекания этой реакции.
2. Определите общую формулу гомологического ряда, к которому принадлежит
салициловая кислота.
3. Смесь содержит кристаллические соли NiSO4-7H2O и KA1(SO4)2’ 12Н2О.
Предложите способ выделения из этой смеси никеля и алюминия в виде любых
индивидуальных соединений.
4. К 400 мл насыщенного при 25°С раствора MgCO3, находящегося в равновесии
со своим осадком, прилили 95 мл 2%-ного раствора карбоната калия с плотностью
1.02 г/мл. Рассчитайте концентрацию ионов Mg2+ в растворе над осадком, если при
данной температуре произведение растворимости MgCO3 равно 2.110'5.
5. Вычислите относительную атомную массу изотопа ll2Sn. При расчете
используйте следующие данные: массы нейтрона, протона и электрона равны 1.00866,
1.00728 и 0.0005486 а.е.м. соответственно; 1 а.е.м. = 1.66057 10-24 г; энергия
образования ядер 112Sn из нуклонов составляет 9.21237-1013 Дж/моль.
6. При н. у. шарик радиусом 18 см, наполненный смесью двух газов, завис в
воздухе на некоторой высоте. Оболочка шарика выполнена из нерастяжимого
материала, 1 м2 которого весит 9.1-103 кг. Один из газов в 7 раз тяжелее другого и
содержится в газовой смеси в количестве 0.981 моль. Только один из газов является
простым веществом. Плотность воздуха на высоте зависания шарика равна
1.2946 кг/м3. Определите неизвестные газы.
7. Простое вещество А подвергли высокотемпературному хлорированию, масса
образовавшегося бесцветного вещества В оказалась больше массы исходного
вещества А в 1.63 раза. Бесцветный водный раствор вещества В обработали
раствором щелочи. При этом образовался белый осадок С, хорошо растворимый в
аммиаке с образованием вещества D. При пропускании в полученный аммиачный
раствор сероводорода выпал желтый осадок Е. Какое вещество образуется при
прокаливании белого осадка С? Какого оно цвета? Установите состав
зашифрованных веществ и напишите уравнения всех упомянутых реакций.
8. Запишите уравнения реакций, соответствующих следующей схеме
превращений, укажите условия их протекания. Расшифруйте неизвестные вещества.
В уравнениях реакций используйте структурные формулы веществ.
Вг2 Вг2, кон
СбНб—-A -*C8H8Br2j*B—*CeH7OBr------------------+ D
12 J AILI3
4
После обработки С8Н7ОВг избытком брома в присутствии щёлочи (реакция 5)
была выделена эквимолярная смесь соединений С и D; водный раствор одного из них
подвергли электролизу. Напишите уравнение электролиза, укажите процессы,
протекающие на катоде и аноде.
Задания
25
9. Образец массой 50 г, содержащий черный сульфидный минерал Me3CuS2 с
примесью кварцевого песка, обработали горячей концентрированной азотной
кислотой. К раствору, образовавшемуся после обработки кислотой, добавили избыток
раствора хлорида натрия. При этом образовался белый осадок, содержащий 75.26%
металла Me по массе. Для полного растворения осадка потребовалось 500 мл раствора
цианида калия с концентрацией 1.2 моль/л. Определите состав и массу белого осадка.
Установите состав минерала и его содержание во взятом образце (в масс %).
Напишите уравнения всех реакций.
10. В 1924 г. компания Dow Chemical разработала процесс получения фенола,
включающий реакцию хлорирования бензола и последующий гидролиз
монохлорбензола, который в отсутствие катализатора протекает при 360-400°С и
давлении свыше 300 атм. Рассчитайте выход продуктов монохлорирования
неизвестного монозамещённого углеводорода в присутствии железа по каждому
направлению, если известно, что массовая доля водорода в нём составляет 8.69%, а
при моногалогенировании и дальнейшем нагревании до 380°С с 30%-ным раствором
щёлочи при давлении 380 атм было выделено 3 изомера в молярном соотношении
3:10:7. Напишите уравнения протекающих реакций.
Задания для учащихся 5-9 классов
Вариант Ноябрь -1
1. Кальций и бор образуют соединение необычного состава, в котором массовая
доля одного из элементов составляет 38.17%. Установите формулу соединения, если
известно, что формульная единица соединения содержит менее 10 атомов.
2. При разложении неорганического вещества образуются твердое вещество и
смесь газов, имеющая плотность по водороду 21.6. Напишите возможное уравнение
реакции. Ответ подтвердите расчетом.
3. В молекуле XY3 длина связи Х-Y составляет 0.142 нм, а расстояние между
атомами Y равно 0.207 нм. Найдите величину угла между связями ZYXY. Какую
геометрическую форму имеет молекула?
4. Напишите уравнения реакций согласно следующим схемам превращений:
а) К2Сг2О7 + НС1->Х + ...
X + Fe->
б) K2SO3 + KMnO4 + H2SO4 -> Y + ...
Y + NaOH->
Определите неизвестные вещества.
5. Напишите уравнения реакций, в которых степень окисления азота меняется
следующим образом:
№ -> N-3 -+ ЬГ3 -» N" -> N+“ -> N+5
Олимпиада «Ломоносов», заочный тур
6. Хлорсодержащие окислители, используемые для очистки воды или
отбеливания, характеризуют содержанием «активного хлора» - это отношение массы
хлора, полученного взаимодействием окислителя с избытком соляной кислоты, к
массе окислителя (в %). Сколько процентов «активного хлора» содержит 15%-й
раствор гипохлорита натрия? Может ли содержание «активного хлора» превышать
100%? Если да - приведите пример, если нет - объясните, почему.
7. Неорганическое вещество представляет собой белый порошок, хорошо
растворимый в воде. Оно окрашивает пламя в желтый цвет, реагирует с кислотами и
щелочами (в первом случае газ выделяется, во втором - нет). В водном растворе
вещество окисляется кислородом воздуха, при этом видимых изменений не
происходит. Установите формулу вещества, предложите один способ его получения и
напишите уравнения всех описанных реакций.
Вариант Ноябрь - 2
1. Углерод и литий образуют соединение необычного состава, в котором
массовая доля одного из элементов составляет 43.75%. Установите формулу
соединения.
2. При разложении неорганического вещества образуются вода и смесь газов,
имеющая плотность по водороду 13. Напишите уравнение реакции. Ответ
подтвердите расчетом.
3. В молекуле XY3 длина связи X-Y составляет 0.131 нм, а расстояние между
атомами Y равно 0.227 нм. Найдите величину угла между связями ZYXY. Какую
геометрическую форму имеет молекула?
4. Напишите уравнения реакций согласно схемам превращений:
a) Al+ NaOH + Н2О-> X + ...
Х + СиО->
б) K2SO3 + KMnO4 + Н2О -> Y + ...
Y + НВг-> Вг2 + ...
Определите неизвестные вещества.
5. Напишите уравнения реакций, в которых степень окисления кислорода
меняется следующим образом:
О0 -> О0 -> О'1 -> О’1 -> О’2 -> 0+2
6. Хлорсодержащие окислители, используемые для очистки воды или
отбеливания, характеризуют содержанием «активного хлора» - это отношение массы
хлора, полученного взаимодействием окислителя с избытком соляной кислоты, к
массе окислителя (в %). Сколько процентов «активного хлора» содержит пентагидрат
гипохлорита натрия? Может ли содержание «активного хлора» превышать 100%?
Если да - приведите пример, если нет - объясните, почему.
Задания
27
7. Неорганическое вещество представляет собой белый порошок, хорошо
растворимый в воде. Оно окрашивает пламя в желтый цвет, реагирует с щелочами, но
не реагирует с кислотами. При нагревании вещество разлагается в две стадии: сначала
выделяются пары воды, а при сильном прокаливании происходит значительная
потеря массы. Установите формулу вещества, предложите один способ его получения
и напишите уравнения всех описанных реакций.
Вариант Ноябрь - 3
1. Углерод и бор образуют соединение необычного состава, в котором массовая
доля одного из элементов составляет 21.74%. Установите формулу соединения.
2. При разложении неорганического вещества образуется только смесь газов,
имеющая плотность по водороду 12.75. Напишите уравнение реакции. Ответ
подтвердите расчетом.
3. В молекуле XY3 длина связи Х-Y составляет 0.152 нм, а расстояние между
атомами Y равно 0.218 нм. Найдите величину угла между связями ZYXY. Какую
геометрическую форму имеет молекула?
4. Напишите уравнения реакций согласно схемам превращений:
a) Mg + НМОз(разб) -> X + ...
X
б) SO2 + KMnO4 + Н2О -> Y + ...
Y + Zn—>
Определите неизвестные вещества.
5. Напишите уравнения реакций, в которых степень окисления хлора меняется
следующим образом:
СГ1 -► С10 -► С1+5-> СГ1 -> С1+| ->сг1
6. Благодаря развитию промышленности растут выбросы в атмосферу
углекислого газа. Основной природный способ его утилизации - фотосинтез. Однако
возможны и промышленные способы. Напишите по одному уравнению реакций,
позволяющих преобразовать СО2 в практически важное вещество с массовым
содержанием углерода:
а) 12%;
б) 20%;
в) 37.5%;
г) 75%.
7. Неорганическое вещество представляет собой белый порошок, хорошо
растворимый в воде. Оно окрашивает пламя в фиолетовый цвет, реагирует с
щелочами, но не реагирует с кислотами. При нагревании вещество разлагается в две
стадии: сначала выделяются пары воды, а при сильном прокаливании происходит
28 Олимпиада «Ломоносов», заочный тур
значительная потеря массы. Установите формулу вещества, предложите один способ
его получения и напишите уравнения всех описанных реакций.
Вариант Ноябрь - 4
1. Сера и азот образуют соединение необычного состава, в котором массовая
доля одного из элементов составляет 30.43%. Установите формулу соединения, если
известно, что его молекула содержит 8 атомов.
2. При разложении неорганического вещества образуются твердый остаток и
смесь газов, имеющая плотность по водороду 20.67. Напишите уравнение реакции.
Ответ подтвердите расчетом.
3. В молекуле XY3 длина связи X-Y составляет 0.204 нм, а расстояние между
атомами Y равно 0.313 нм. Найдите угол между связями ZYXY. Какую
геометрическую форму имеет молекула?
4. Напишите уравнения реакций согласно схемам превращений:
а) С12 + КОНХ + ...
х-^
б) Fe + H2SO4(kohu) Y +...
Y + Fe->
Определите неизвестные вещества.
5. Напишите уравнения реакций, в которых степень окисления углерода
меняется следующим образом:
С° -> С4 -> С4 -> С*4 -> С° -> С1
6. Хлорсодержащие окислители, используемые для очистки воды или
отбеливания, характеризуют содержанием «активного хлора» - это отношение массы
хлора, полученного взаимодействием окислителя с избытком соляной кислоты, к
массе окислителя (в %). Сколько процентов «активного хлора» содержит:
а) оксид хлора(1)
б) оксид хлора (IV)?
7. Неорганическое вещество представляет собой белый порошок, хорошо
растворимый в воде. Оно окрашивает пламя в желтый цвет, реагирует с кислотами и
щелочами (в первом случае газ выделяется, во втором - нет), легко окисляется
кислородом воздуха с образованием простого вещества. Установите формулу
вещества, предложите один способ его получения и напишите уравнения всех
описанных реакций.
Вариант Декабрь -1
1. Цезий и кислород образуют соединение необычного состава, в котором
массовая доля одного из элементов составляет 96.14%. Установите формулу
соединения.
Задания 29
2. Сколько граммов гидрида натрия надо растворить в 100 г воды для получения
10%-ного раствора щелочи?
3. В молекуле некоторого соединения атомы серы имеют разные валентности.
Предложите формулу одного из таких соединений, изобразите его структурную
формулу и определите степени окисления всех элементов.
4. Какие два вещества вступили в реакцию, если в результате образовались
следующие вещества (коэффициенты не указаны)? Напишите полные уравнения
реакций.
а) КНСО3
б) Mg(NO3)2 + NH4NO3 + Н2О
в) КС1 + Р2О5
г) Н3РО3 + HI
5. Напишите уравнения реакций, в которых степень окисления железа меняется
следующим образом:
Fe° -> Fe+2 -> Fe+3 -> Fe+’ -> Fe4* -> Fert
6. Автомобили, двигатели которых работают на водороде, называют более
«зелеными», т. е. экологически более чистыми, чем те, которые используют
углеводородное топливо. Сравним эти двигатели.
1) Сколько кубометров водорода (н. у.) потребуется для работы автомобильного
двигателя мощностью 75 кВт в течение одного часа?
2) Сколько кубометров углекислого газа (н. у.) выделится в атмосферу при
производстве такого количества водорода из метана в реакции с парами воды?
3) Сколько литров сжиженного газа (примем, что это пропан, его плотность
равна 550 г/л) потребуется для часовой работы такого же двигателя, и сколько при
этом образуется углекислого газа (в м3, н. у.)?
Известно, что кпд водородного двигателя - 20%, кпд двигателя на газе - 40%,
теплота сгорания водорода равна 240 кДж/моль, теплота сгорания пропана равна 2200
кДж/моль.
7. Простые вещества А и Б бурно реагируют между собой с образованием
продукта В. При обработке В углекислым газом выделяется вещество Б и образуется
продукт Г, содержащий 8.70% углерода и 34.78% кислорода по массе. Назовите
неизвестные вещества, напишите уравнения реакций. Ответ подтвердите расчетами.
Вариант Декабрь - 2
1. Цезий и кислород образуют соединение необычного состава, в котором
массовая доля одного из элементов составляет 97.08%. Установите формулу
соединения.
2. Сколько граммов гидрида лития надо растворить в 200 г воды для получения
15%-ного раствора щелочи?
30
Олимпиада «Ломоносов», заочный тур
3. В молекуле некоторого соединения атомы азота имеют разные валентности.
Предложите формулу одного из таких соединений, изобразите его структурную
формулу и определите степени окисления всех элементов.
4. Какие два вещества вступили в реакцию, если в результате образовались
следующие вещества (коэффициенты не указаны)? Напишите полные уравнения
реакций.
a) NaHSO4
б) Mg(NO3)2 + NH4NO3
в) KBr+SO2
г) H2SO4 + НС1
5. Напишите уравнения реакций, в которых степень окисления марганца
меняется следующим образом:
Мп° -> Мп*2 -> Мп*2 -> Мп*4 -> Мп*7 -> Мп** + Мп*4
6. Автомобили, двигатели которых работают на водороде, называют более
«зелеными», т. е. экологически более чистыми, чем те, которые используют
углеводородное топливо. Сравним эти двигатели. Возьмем 50 л жидкого водорода
(плотность 71 кг/м3) и 50 л жидкого пропана (плотность 550 кг/м3).
1) Сколько времени сможет работать на каждом из этих видов топлива
автомобильный двигатель мощностью 50 кВт?
2) Сколько кубометров углекислого газа (н. у.) выделится в атмосферу:
а) при производстве такого количества водорода из метана в реакции с водой;
б) при сгорании такого количества пропана?
Известно, что кпд водородного двигателя - 20%, кпд двигателя на газе - 40%,
теплота сгорания водорода равна 240 кДж/моль, теплота сгорания пропана равна
2200 кДж/моль.
7. Простые вещества А и Б бурно реагируют между собой с образованием
продукта В. При обработке В углекислым газом выделяется вещество Б и образуется
продукт Г, содержащий 11.3% углерода и 45.3% кислорода по массе. Назовите
неизвестные вещества, напишите уравнения реакций. Ответ подтвердите расчетами.
Вариант Декабрь - 3
1. Серебро и углерод образуют соединение необычного состава, в котором
массовые доли элементов отличаются в 4 раза. Установите формулу соединения.
2. Сколько граммов гидрида натрия надо растворить в 100 г 10%-ной соляной
кислоты, чтобы получить раствор, в котором массовые доли соли и кислоты равны?
3. В молекуле некоторого соединения атомы фосфора имеют разные
валентности. Предложите формулу одного из таких соединений, изобразите его
структурную формулу и определите степени окисления всех элементов.
Задания 31
4. Какие два вещества вступили в реакцию, если в результате образовались
следующие вещества (коэффициенты не указаны)? Напишите полные уравнения
реакций.
a) Fe(OH)3 + КС1 + СО2
б) ZnSO4 + S + Н2О
в) Na2SiO3 + СО2
г) Н3РО4 + НС1
5. Напишите уравнения реакций, в которых степень окисления меди меняется
следующим образом:
Си0 -> Си+2 -» Си+1 -» Си*2 -> Си*2 -> Си0
6. Автомобили, двигатели которых работают на водороде, называют более
«зелеными», т. е. экологически более чистыми, чем те, которые используют
углеводородное топливо. Сравним эти двигатели. Возьмем по одному килограмму
жидкого водорода и жидкого пропана (плотность 550 кг/м3).
1) Сколько времени сможет работать на каждом из этих видов топлива
автомобильный двигатель мощностью 60 кВт?
2) Сколько кубометров углекислого газа (н. у.) выделится в атмосферу:
а) при производстве такого количества водорода из метана в реакции с водой;
б) при сгорании такого количества пропана?
Известно, что кпд водородного двигателя - 20%, кпд двигателя на газе - 40%,
теплота сгорания водорода равна 240 кДж/моль, теплота сгорания пропана равна
2200 кДж/моль.
7. Твердое простое вещество А массой 6.4 г обработали хлором и получили
единственный продукт Б, жидкий при обычных условиях. При внесении Б в избыток
воды образуется 4.8 г вещества А, а из получившегося сильнокислого раствора при
нагревании выделяется газ В, имеющий плотность по воздуху 2.2. Определите
неизвестные вещества, напишите уравнения реакций. Ответ подтвердите расчетами.
Вариант Декабрь - 4
1. Марганец и углерод образуют соединение необычного состава, в котором
массовая доля одного из элементов составляет 93.22%. Установите формулу
соединения.
2. Сколько граммов хлорида алюминия надо добавить к 250 г 10%-ного раствора
аммиака, чтобы получить раствор, в котором массовые доли соли и аммиака равны?
3. В молекуле некоторого соединения атомы хлора имеют разные валентности.
Предложите формулу одного из таких соединений, изобразите его структурную
формулу и определите степени окисления всех элементов.
4. Какие два вещества вступили в реакцию, если в результате образовались
следующие вещества (коэффициенты не указаны)? Напишите полные уравнения
реакций.
32
Олимпиада «Ломоносов», заочный тур
а) А1(0Н)э + КС1 + С02
б) КС1 +12 + Н20
в) CaSiCh + С02
г) СО2 + НС1
5. Напишите уравнения реакций, в которых степень окисления хрома меняется
следующим образом:
Сг° -> Сг+2 -> Сг+3 -> Сг* -> Сг* -» Сг+3
6. Автомобили, двигатели которых работают на водороде, называют более
«зелеными», т. е. экологически более чистыми, чем те, которые используют
углеводородное топливо. Сравним эти двигатели.
1) Сколько килограммов водорода потребуется для работы в течение двух часов
автомобильного двигателя мощностью 75 кВт?
2) Сколько кубометров углекислого газа (н. у.) выделится в атмосферу при
производстве такого количества водорода из метана в реакции с парами воды?
3) Сколько килограммов сжиженного газа (примем, что это - пропан)
потребуется для двухчасовой работы такого же двигателя, и сколько при этом
образуется углекислого газа (в м3, н. у.)?
Известно, что кпд водородного двигателя - 20%, кпд двигателя на газе - 40%,
теплота сгорания водорода равна 240 кДж/моль, теплота сгорания пропана равна
2200 кДж/моль.
7. Твердое простое вещество А массой 1.00 г реагирует с избытком газа Б,
образуя кристаллический продукт В массой 6.73 г. Вещество В реагирует с водой в
мольном соотношении 1:1, образуя дымящую на воздухе жидкость Г, содержащую
10.42% кислорода по массе. Определите неизвестные вещества и напишите уравнения
реакций. Ответ подтвердите расчетами.
Задания очного тура
Задания для учащихся 10-11 классов
Вариант 1
1. Красный цвет крови большинства позвоночных обусловлен гемоглобином.
Рассчитайте массовую долю водорода в гемоглобине Q^H^ieNygoOgoeSnFe^
2. Напишите реакции взаимодействия кристаллических хлорида калия и бромида
калия с концентрированной серной кислотой. Сравнив эти реакции, определите,
какой из галогенид-ионов проявляет более сильные восстановительные свойства.
3. В 5.6 л (н. у.) газообразного продукта взаимодействия фтора и простого
вещества X содержится 10.535-1023 атомов и 10.53 5-1024 электронов. Определите
неизвестный газ.
4. Сколько существует изомерных дихлорциклобутанов? Изобразите их
структурные формулы.
5. К 100 г насыщенного при 20°С раствора хлорида двухвалентного металла X
добавили 14.6 г безводной соли, после чего в осадок выпало 37.6 г кристаллогидрата
состава ХС12 • 4Н2О. Определите неизвестный металл, если растворимость его
безводного хлорида при 20°С составляет 68.1 г на 100 г воды.
6. Дипептид, образованный природными аминокислотами, подвергли
щелочному гидролизу. После сплавления продуктов гидролиза со щёлочью и
обработки избытком азотистой кислоты была получена смесь пентандиола-1,5 и
пропанола-1. Установите возможное строение дипептида. Напишите уравнения
протекающих реакций.
7. Разложение пероксида водорода в водном растворе протекает как реакция
первого порядка:
Н2О2 —Н2О+ 1/2 О2
Раствор, содержащий 72 г Н2О2, выдерживали при определенной температуре в
течение 30 мин, и за это время образовалось 20.75 л кислорода (измерено при н. у.).
Рассчитайте период полупревращения пероксида водорода при этой температуре.
8. Запишите уравнения реакций, соответствующих следующей схеме
превращений. Определите неизвестное вещество А, укажите условия протекания
реакций.
K2SO4
H2SO4
34
Олимпиада «Ломоносов», очный тур
9. При полном сгорании углеводорода образовалась газовая смесь с плотностью
по водороду 17.0. Известно, что этот углеводород не обесцвечивает раствор брома в
тетрахлорметане, а при хлорировании на свету образуются два
монохлорпроизводных. Установите структурную формулу углеводорода и
предложите способ его получения из метана (напишите уравнения реакций и укажите
условия их протекания). Вычислите объем кислорода (25°С, 1 атм), необходимый для
сжигания 10 г данного углеводорода.
10. Оксид металла состава Х2О3 массой 35.7 г обработали хлором в присутствии
избытка угля при температуре 1000°С и получили вещество А и газ В. Газ В был
пропущен через избыток аммиачного раствора оксида серебра, что привело к
выпадению 226.8 г осадка. Вещество А обработали 574.71 мл 15%-ного раствора
гидроксида натрия (плотность 1.16 г/мл). Определите состав и массу образовавшегося
при этом осадка, а также массовые доли веществ в растворе над осадком. Предложите
способ получения металла X из исходного оксида. Напишите уравнения всех
упомянутых реакций.
Вариант 2
1. Зеленый цвет фотосинтезирующих организмов обусловлен хлорофиллом.
Рассчитайте массовую долю углерода в хлорофилле С55Н72С^4М&
2. Напишите реакции взаимодействия кристаллических хлорида калия и иодила
калия с концентрированной серной кислотой. Сравнив эти реакции, определите,
какой из галогенид-ионов проявляет более сильные восстановительные свойства.
3. В 4.48 л (н. у.) газообразного продукта взаимодействия мышьяка с одним из
галогенов содержится 7.224-1023 атомов и 9.3912-1024 электронов. Определите
неизвестный газ.
4. Сколько существует изомерных динитроциклопентанов? Изобразите их
структурные формулы.
5. К 100 г насыщенного при 20°С раствора карбоната одновалентного металла X
добавили 10.1 г безводной соли, после чего в осадок выпало 43.1 г кристаллогидрата
состава Х2СО3- ЮН2О. Определите неизвестный металл, если растворимость его
безводного карбоната при 20°С составляет 21.5 г на 100 г воды.
6. Дипептид, образованный природными аминокислотами, подвергли
щелочному гидролизу. После сплавления продуктов гидролиза со щёлочью и
обработки избытком азотистой кислоты была получена смесь пентандиола-1,5 и
метанола. Установите возможное строение дипептида. Напишите уравнения
протекающих реакций.
Задания 35
7. Разложение паров ацетона при 500°С протекает как реакция первого порядка:
С3Н6О —С2Н4 + СО + Н2
Порцию ацетона массой 88 г выдерживали при данной температуре в течение
72 мин и получили 29.738 л этилена (измерено при н. у.). Рассчитайте период
полупревращения ацетона.
8. Запишите уравнения реакций, соответствующих следующей схеме
превращений. Определите неизвестное вещество А, укажите условия протекания
реакций.
НЮ;« * - А
Ва(Ю3)2—-----1С13
9. При полном сгорании углеводорода образовалась газовая смесь с плотностью
по водороду 18.455. Известно, что 0.01 моль этого углеводорода может обесцветить
32 г 10%-го раствора брома в тетрахлорметане. Установите структурную формулу
углеводорода и предложите способ его получения из метана (напишите уравнения
реакций и укажите условия их протекания). Вычислите объем кислорода (25°С,
1 атм), необходимый для сжигания 10 г данного углеводорода.
10. Оксид металла состава ХО массой 11.25 г обработали хлором в присутствии
избытка угля при температуре 1000°С и получили вещество А и газ В. Газ В был
пропущен через избыток водного раствора хлорида палладия (II), что привело к
выпадению 47.7 г осадка. Вещество А обработали 647.93 мл 11%-ного раствора
гидроксида калия (плотность 1.10 г/мл). Определите состав и массу образовавшегося
при этом осадка, а также массовые доли веществ в растворе над осадком. Предложите
способ получения металла X из вещества А. Напишите уравнения всех упомянутых
реакций.
Задание для учащихся 5-9 классов
1. Сульфат двухвалентного металла образует кристаллогидрат, в котором доля
кислорода составляет 55.8% по массе и 50% по молям. Установите формулу
кристаллогидрата.
2. Приведите по одному примеру получения кислот:
а) из двух газов,
б) из двух жидкостей,
в) из жидкого и твердого вещества,
г) из соли и другой кислоты,
д) при разложении соли.
Напишите уравнения соответствующих реакций.
36 Олимпиада «Ломоносов», очный тур
3. Чистую азотную кислоту (плотность 1.51 г/мл) объемом 500 мл аккуратно
прилили к одному литру воды и получили раствор объемом 1380 мл. Рассчитайте
массовую долю и молярную концентрацию HNO3 в этом растворе, а также плотность
раствора.
4. Какие вещества вступили в реакцию, если в результате образовались
следующие вещества (коэффициенты не указаны)? Напишите полные уравнения
реакций.
a) S + НВг
б) NaC102 + NaC103 + H20
в) СаСО3 + С12
г) Pb2(OH)2CO3 + KNO3 + СО2
5. В вашем распоряжении имеется 19.6 г серной кислоты. Как с ее помощью
получить: а) 2.24 л, б) 4.48 л, в) 6.72 л, г) 8.96 л сернистого газа? Напишите уравнения
реакций и приведите расчеты. Все объемы измерены при н. у. Во всех случаях серная
кислота израсходована полностью.
6. Неизвестное вещество состоит из трех элементов - бария, водорода и
кислорода. 12.52 г вещества нагрели до 150°С и выдержали до постоянной массы,
которая составила 6.76 г. Полученное твердое вещество прокалили при 900°С и
получили после охлаждения твердый остаток массой 6.12 г. При выдерживании во
влажной атмосфере этот остаток постепенно присоединяет 1.44 г воды с
образованием чистого твердого вещества. Напишите уравнения всех описанных
реакций. Ответ подтвердите расчетами.
7. Газ X с резким запахом тяжелее водорода в 33 раза. Он легко гидролизуется
даже небольшими количествами воды, превращаясь в смесь двух газов Y и Z, которая
легче воздуха на 3.4%. Эта смесь полностью поглощается известковой водой, при
этом выпадает белый осадок, частично растворимый в разбавленных кислотах с
выделением газа Y. Газ Y входит в состав воздуха и вызывает «парниковый эффект».
Определите формулы всех газов и напишите уравнения всех реакций. Найдите состав
газовой смеси в объемных процентах.
Экзаменационные задания
Дополнительный письменный вступительный экзамен
Вариант 1
1. Изобразите структурную формулу изомера 2-метилбутена-2, в молекуле
которого нет первичных атомов углерода.
2. Напишите электронные конфигурации атома Со и иона Со3+. Рассчитайте
массу неспаренных электронов в ионе Со3+ (масса электрона равна 9.1-10"31 кг).
3. Эквимолярную смесь метана, бутина-1 и пропена пропустили через избыток
аммиачного раствора хлорида меди(1). Как и во сколько раз изменился объём смеси?
Напишите уравнения протекающих реакций.
4. Вычислите растворимость бромида свинца в воде в единицах г/л, если
произведение растворимости составляет ПР(РЬВг2) = 9.1- ЮЛ
5. Через некоторое время после погружения марганцевой пластинки в раствор
AgNO3 ее масса увеличилась на 1.61 г. Какова масса серебра, выделившегося на
пластинке? Предложите соль, при погружении в раствор которой масса марганцевой
пластинки уменьшается.
6. Соединение А при прокаливании разлагается с образованием оксида металла
ХО и смеси газов В и С в объемном соотношении 4:1. Средняя молярная масса
газовой смеси 43.2 г/моль, а плотность по воздуху газа В составляет 1.59. Для полного
восстановления 2.23 г оксида ХО необходимо 0.51 л водорода (350°С, 1 атм).
Определите неизвестные вещества.
7. Напишите уравнения реакций, соответствующих приведенной ниже схеме
превращений, и укажите условия их проведения.
СаС2 -> X -> С2Н4О —» Y —> С4Н10О С4Н8О — C5H9NO
8. Напишите уравнения реакций, соответствующих приведенной ниже схеме
превращений, укажите условия их проведения (X - вещество, содержащее железо).
Fe х Fe(0H)j _ K2FeO4 X — FeSO4 —-> ...
9. Смесь массой 41.2 г, содержащую цинк, фосфор, углерод и неизвестный
металл, обработали избытком раствора аммиака и получили 4.48 л газа (н. у.). Затем
остаток смеси был обработан соляной кислотой, при этом выделилось 5.6 л газа
(н. у.). Последующее нагревание твердого остатка с концентрированным раствором
гидроксида натрия привело к выделению газа, который обесцветил 400 мл 0.4 М
раствора перманганата калия, подкисленного серной кислотой. Наконец, твердый
остаток был переведен в раствор нагреванием с концентрированной серной кислотой,
38 Дополнительное вступительное испытание
при этом выделился газ, способный полностью обесцветить иодную воду,
содержащую 0.3 моль 12. Определите металл, найдите массовые доли компонентов
исходной смеси.
10. Смесь двух карбоновых кислот массой 2.26 г, растворенная в 400 мл воды,
может поглотить без изменения цвета раствора 785 мл хлора (н. у.), при этом
выделяется 224 мл углекислого газа. Определите pH образующегося раствора
(плотность 1 г/мл). Установите строение кислот. Рассчитайте массу углекислого газа,
выделяющегося при обработке исходной смеси кислот избытком подкисленного
раствора перманганата калия. Напишите уравнения протекающих реакций.
Вариант 2
1. Изобразите структурную формулу изомера метилциклопропана, в молекуле
которого нет вторичных атомов углерода.
2. Напишите электронные конфигурации ионов Со2+ и Со3+. Рассчитайте массу
неспаренных электронов в ионе Со3+ (масса электрона равна 9.1-10"31 кг).
3. Эквимолярную смесь пропина, этилена и азота пропустили через избыток
бромной воды. Как и во сколько раз изменился объём смеси? Напишите уравнения
протекающих реакций.
4. Вычислите произведение растворимости (ПР) сульфида серебра Ag2S, если
растворимость его в воде составляет 6.2 -10“’5 г/л.
5. Через некоторое время после погружения цинковой пластинки в раствор СиС12
ее масса уменьшилась на 0.04 г. Какова масса меди, выделившейся на пластинке?
Предложите соль, при погружении в раствор которой масса цинковой пластинки
увеличивается.
6. Соединение А при прокаливании разлагается с образованием оксида металла
ХО и смеси газов В и С в объемном соотношении 4:1. Средняя молярная масса
газовой смеси 43.2 г/моль, а плотность по воздуху газа В составляет 1.59. Полное
восстановление углеродом 2.43 г оксида ХО приводит к образованию 1.41 л угарного
газа (300 °C, 1 агм). Определите неизвестные вещества.
7. Напишите уравнения реакций, соответствующих приведенной ниже схеме
превращений, и укажите условия их проведения.
С3Н7Вг -> X — C4H9OMgBr —► Y —♦ С4Н8 — С4Н10О2 — С8Н14О4
8. Напишите уравнения реакций, соответствующих приведенной ниже схеме
превращений, и укажите условия их проведения (X - вещество, содержащее
марганец).
KMnO4 -> K2MnO4 HC“am-1 > X Mn(OH)2 -> MnO2 -> X —<NH<V-p-P >
Задания
39
9. Смесь массой 64.8 г, содержащую цинк, серебро, медь и неизвестный металл,
обработали избытком раствора гидроксида натрия и получили 4.48 л газа (н. у.). Не
растворившийся в щелочи остаток обработали соляной кислотой, при этом также
выделилось 4.48 л газа (н. у.). Последующее нагревание твердого остатка с
концентрированной азотной кислотой привело к его полному растворению, для
поглощения выделившегося при этом бурого газа потребовалось 800 мл 1 М раствора
КОН. При добавлении к полученному азотнокислому раствору избытка раствора
хлорида калия выпало 28.7 г осадка. Определите металл, найдите массовые доли
компонентов исходной смеси.
10. Смесь двух карбоновых кислот массой 4.87 г, растворенная в 300 мл воды,
может поглотить без изменения цвета раствора 1.008 л хлора (н. у.), при этом
выделяется 112 мл углекислого газа. Установите возможное строение кислот, если
известно, что одна из них - двухосновная. Определите pH образующегося раствора
(плотность 1 г/мл). Рассчитайте массу углекислого газа, выделяющегося при
обработке исходной смеси кислот избытком подкисленного раствора перманганата
калия. Напишите уравнения протекающих реакций.
Вариант 3
1. Изобразите структурную формулу изомера метил циклопентана, в молекуле
которого нет вторичных атомов углерода.
2. Напишите электронные конфигурации Сг3+ и Сг2+. Рассчитайте массу
неспаренных электронов в ионе Сг2* (масса электрона равна 9.110"31 кг).
3. Эквимолярную смесь метана, бутина-1 и пропина пропустили через избыток
аммиачного раствора оксида серебра. Как и во сколько раз изменился объём смеси?
Напишите уравнения протекающих реакций.
4. Вычислите растворимость фторида бария в воде в единицах г/л, если
произведение растворимости составляет ПР(ВаР2) = 1.1-КГ6.
5. Через некоторое время после погружения свинцовой пластинки в раствор
Cu(NO3)2 на ней выделилось 3.2 г меди. Увеличилась или уменьшилась при этом
масса пластинки? На какую величину?
6. Соединение А при прокаливании разлагается с образованием оксида металла
ХО и смеси газов В и С в объемном соотношении 4:1. Средняя молярная масса
газовой смеси 43.2 г/моль, а плотность по воздуху газа С составляет 1.103. Полное
восстановление 7.47 г оксида ХО углем приводит к выделению 4.70 л угарного газа
(300°С, 1 атм). Определите неизвестные вещества.
7. Напишите уравнения реакций, соответствующих приведенной ниже схеме
превращений, и укажите условия их проведения.
СбН5Вг ► X —► C7H5MgO2Br —► Y —► С^НюОдВа —► СвНюО —► Cj3Hi2O
40
Дополнительное вступительное испытание
8. Напишите уравнения реакций, соответствующих приведенной ниже схеме
превращений, и укажите условия их проведения (X - вещество, содержащее хром).
Сг > X -> К[Сг(ОН)4] -> Сг(ОН)з -> K2CrO4—> X —Н1гсо*И> > ...
9. Смесь массой 42.9 г, содержащую алюминий, медь, серебро и неизвестный
металл, обработали избытком раствора гидроксида натрия и получили 10.08 л газа
(н. у.). Нерастворившийся остаток отделили и обработали соляной кислотой, при этом
выделилось 3.36 л газа (н. у.). При последующем нагревании с концентрированной
азотной кислотой твердый остаток полностью растворился, а для поглощения
выделившегося бурого газа потребовалось 500 мл 1М раствора КОН. При
добавлении избытка раствора хлорида калия к полученному азотнокислому раствору
выпало 28.7 г осадка. Определите металл, рассчитайте массовые доли компонентов
исходной смеси.
10. Смесь двух карбоновых кислот массой 2.63 г, растворенная в 500 мл воды,
может поглотить без изменения цвета раствора 1.12 л хлора (н. у.), при этом
выделяется 448 мл углекислого газа. Установите строение кислот, если известно, что
одна из них - двухосновная. Определите pH образующегося раствора (плотность
1 г/мл). Рассчитайте массу углекислого газа, выделяющегося при обработке исходной
смеси кислот избытком подкисленного раствора перманганата калия. Напишите
уравнения протекающих реакций.
Вариант 4
1. Изобразите структурную формулу изомера 2,3-диметилбутена-2, в молекуле
которого есть только вторичные атомы углерода.
2. Напишите электронные конфигурации атома Ni и иона Ni2+. Рассчитайте
массу неспаренных электронов в атоме никеля (масса электрона равна 9.1-Ю"31 кг).
3. Эквимолярную смесь ацетилена, пропина и пропана пропустили через
избыток аммиачного раствора хлорида меди(1). Как и во сколько раз изменился объём
смеси? Напишите уравнения протекающих реакций.
4. Вычислите произведение растворимости (ПР) сульфида меди Cu2S, если
растворимость его в воде составляет 1.410"14 г/л.
5. Через некоторое время после погружения железной пластинки в раствор
CuSO4 на ней выделилось 0.8 г меди. Увеличилась или уменьшилась при этом масса
пластинки? На какую величину?
6. Соединение А при прокаливании разлагается с образованием оксида металла
Х2О3 и смеси газов В и С в молярном соотношении 4:1. Средняя молярная масса
газовой смеси 43.2 г/моль, а плотность по гелию газа В составляет 11.5. Для полного
восстановления 4.56 г оксида Х2О3 необходимо 5.34 л водорода (450°С, 1 атм).
Определите неизвестные вещества.
Задания 41
7. Напишите уравнения реакций, соответствующих приведенной ниже схеме
превращений, и укажите условия их проведения.
С7Н8 -> X -> С7НбО —♦ Y —> С14Н14О — С14Н12 — С7НбО2
8. Напишите уравнения реакций, соответствующих приведенной ниже схеме
превращений, и укажите условия их проведения (X - вещество, содержащее серебро).
CHjCOOAg —>Ag2O —X AgzS -> AgNOj -> X »...
9. Смесь массой 47.3 г, содержащую фосфор, железо, серебро и неизвестный
металл, обработали водой и получили 3.36 л газа (н. у.). Нерастворившийся остаток
обработали избытком горячего концентрированного раствора гидроксида натрия,
выделившийся при этом газ обесцветил 800 мл 0.2 М подкисленного серной кислотой
раствора перманганата калия. Последующее добавление соляной кислоты к твердому
остатку привело к его частичному растворению, и при добавлении к полученному
солянокислому раствору раствора сульфида аммония выпало 17.6 г осадка. Для
окончательного растворения остатка смеси понадобилось 40 мл ЮМ азотной
кислоты. Определите металл, найдите массовые доли компонентов исходной смеси.
10. Смесь двух карбоновых кислот массой 2.31 г обесцвечивает 280 г 2%-ной
бромной воды, при этом выделяется 560 мл (н. у.) углекислого газа. Установите
возможное строение кислот, если известно, что одна из них - двухосновная.
Определите pH образовавшегося раствора (плотность 1.01 г/мл). Рассчитайте массу
углекислого газа, выделяющегося при обработке исходной смеси кислот избытком
подкисленного раствора перманганата калия. Напишите уравнения протекающих
реакций.
Вариант резервный
1. Изобразите структурную формулу изомера 1,2-диметилциклогексана, в
молекуле которого число первичных атомов в четыре раза больше числа
четвертичных.
2. Напишите электронные конфигурации атома V и иона V2+. Рассчитайте массу
неспаренных электронов в ионе V2+ (масса электрона равна 9.1-10"31 кг).
3. Эквимолярную смесь ацетилена, пропена и пропана пропустили через избыток
аммиачного раствора оксида серебра. Как и во сколько раз изменился объём смеси?
Напишите уравнения протекающих реакций.
4. Вычислите растворимость фторида кальция в воде в единицах г/л, если
произведение растворимости составляет ITP(CaF2) = 4- ПГ11.
5. Через некоторое время после погружения марганцевой пластинки в раствор
CuSO4 на ней выделилось 12.8 г меди. Увеличилась или уменьшилась при этом масса
пластинки? На какую величину?
42
Дополнительное вступительное испытание
6. Соединение А при прокаливании разлагается с образованием оксида металла
Х2О3 и смеси газов В и С в объемном соотношении 8:1. Средняя молярная масса
газовой смеси 44.4 г/моль, а плотность по воздуху газа С составляет 1.103. Для
полного восстановления 3.2 г оксида Х2О3 необходимо 3.31 л водорода (400 °C, 1 атм).
Определите неизвестные вещества.
7. Напишите уравнения реакций, соответствующих приведенной ниже схеме
превращений, и укажите условия их проведения.
С7Н8 —> X —» Y —► C9HnOMgBr — С9Н12О — СЛю — С7НбО2
8. Напишите уравнения реакций, соответствующих приведенной ниже схеме
превращений, и укажите условия их проведения (X - вещество, содержащее хром).
Сг2О3 -> NaCrO; > X -> Na2CrO4 -> Na2Cr2O7 ->Х—K0HP-f> ...
9. Смесь массой 58.4 г, содержащую цинк, медь, углерод и неизвестный металл,
обработали избытком раствора аммиака и получили 8.96 л газа (н. у.). Не
растворившийся в аммиаке остаток обработали соляной кислотой, при этом
выделилось 4.48 л газа (н. у.). Последующее нагревание твердого остатка с
концентрированной серной кислотой привело к его полному растворению,
выделившийся при этом газ обесцветил 560 мл 0.5 М раствора перманганата калия.
При добавлении к полученному сернокислому раствору избытка холодного
разбавленного раствора гидроксида калия образовалось 9.8 г осадка. Определите
металл, найдите массовые доли компонентов исходной смеси.
10. Смесь двух карбоновых кислот массой 3.27 г, растворенная в 500 мл воды,
может поглотить без изменения цвета раствора 1.008 л хлора (н. у.), при этом
выделяется 336 мл углекислого газа. Установите строение кислот, если известно, что
одна из них существует в виде двух пространственных изомеров. Определите pH
образующегося раствора (плотность 1 г/мл). Рассчитайте массу углекислого газа,
выделяющегося при обработке исходной смеси кислот избытком подкисленного
раствора перманганата калия. Напишите уравнения протекающих реакций.
Заместительный экзамен (вместо ЕГЭ)
Вариант 1
1. Запишите электронные конфигурации атома К и иона К+.
2. Запишите уравнение реакции алюминия с раствором гидроксида калия.
3. Сколько о- и л-связей содержит молекула изопрена (2-метилбутадиена)?
4. Как повлияет на положение равновесия реакции
N2(r) + 3H2(r)^2NH3(r) + 0
а) повышение температуры;
б) добавление катализатора;
в) добавление водорода?
5. Сколько протонов содержится в 3 г оксида кремния(1У)?
6. Какой объем 5%-ной соляной кислоты (плотность 1.04 г/мл) потребуется для
полной нейтрализации 150 г раствора гидроксида бария с концентрацией 10%?
Рассчитайте массовую долю соли в полученном растворе.
7. Напишите уравнения реакций, соответствующих приведенным ниже
превращениям, и укажите условия их проведения. Используйте структурные
формулы органических веществ.
С6Н6 - X - С7Н7С1 —> Y —> С14Н13Вг С14Н12
8. Напишите уравнения реакций, соответствующих приведенным ниже
превращениям, и укажите условия их проведения (X - вещество, содержащее цинк,
Y - вещество, содержащее азот).
ZnO -> Zn -^Р-е > X -> Zn(NO3)2 —^->Y —NaOH^...
9. Смесь нитратов алюминия и кальция массой 7.54 г прокалили, масса твердого
остатка составила 2.14 г. Найдите объем образовавшейся газовой смеси (н. у.).
10. Смесь двух изомерных метилфенолов, взятых в молярном соотношении 3:1,
обработали избытком бромной воды. Масса органических продуктов реакции
оказалась в 2.646 раза больше массы исходной смеси. Установите возможное
строение метилфенолов. Запишите уравнения реакций, укажите структурные
формулы исходных соединений и продуктов бромирования.
44
Заместительный экзамен (вместо ЕГЭ)
Вариант 2
1. Запишите электронные конфигурации атома S и иона S2".
2. Запишите уравнение реакции иода с горячим водным раствором гидроксида
калия.
3. Сколько о- и л-связей содержит молекула бутина-1?
4. Как повлияет на положение равновесия реакции
С2Н4(г) + Н2О(г) С2Н5ОН(г) - Q
а) повышение давления;
б) понижение температуры;
в) добавление этилена?
5. Сколько протонов содержится в 2.3 г оксида азота(1У)?
6. Какой объем 25%-ного раствора гидроксида натрия (плотность 1.27 г/мл)
потребуется для полной нейтрализации 100 г раствора серной кислоты с
концентрацией 10%? Рассчитайте массовую долю соли в полученном растворе.
7. Напишите уравнения реакций, соответствующих приведенным ниже
. превращениям, и укажите условия их проведения. Используйте структурные
формулы органических веществ.
С2Н2 - X — С8Н10 —► Y —► С8Н8 — С8Н10О2
8. Напишите уравнения реакций, соответствующих приведенным ниже
превращениям, и укажите условия их проведения (X - вещество, содержащее азот, Y
- вещество, содержащее серебро).
NO2 -+ KNO3 - ^-кон^,, > X -> [Ag(NH3)2]OH —V HN°1',‘ > ...
9. Смесь нитратов железа(П1) и калия массой 14.94 г прокалили, масса твердого
остатка составила 10.1 г. Найдите объем образовавшейся газовой смеси (н. у.).
10. Смесь двух изомерных этилфенолов, взятых в молярном соотношении 2:3,
обработали избытком бромной воды. Масса органических продуктов реакции
оказалась в 2.684 раза больше массы исходной смеси. Установите возможное
строение этилфенолов. Запишите уравнения реакций, укажите структурные формулы
исходных соединений и продуктов бромирования.
Вариант 3
1. Запишите электронные конфигурации атома А1 и иона А13+.
2. Запишите уравнение реакции хлора с горячим раствором гидроксида натрия.
Задания
45
3. Сколько о- и л-связей содержит молекула пропина?
4. Как повлияет на положение равновесия реакции
2СО(г) + О2(г) 2СО2(г) + Q
а) повышение давления;
б) добавление катализатора;
в) понижение температуры?
5. Сколько протонов содержится в 6.4 г оксида серы(1У)?
6. Какой объем 15%-ного раствора гидроксида калия (плотность 1.14 г/мл)
потребуется для полной нейтрализации 150 г раствора серной кислоты с
концентрацией 25%? Рассчитайте массовую долю соли в полученном растворе.
7. Напишите уравнения реакций, соответствующих приведенным ниже
превращениям, и укажите условия их проведения. Используйте структурные
формулы органических веществ.
C7He — X — С7Н8О —► Y —► СбН5СООНа ОЩ
8. Напишите уравнения реакций, соответствующих приведенным ниже
превращениям, и укажите условия их проведения (X - вещество, содержащее хлор,
Y - вещество, содержащее фосфор).
КС1 -> КСЮз н— > xt PCI5 > Y c-Si0^° > ...
9. Смесь нитратов цинка и калия массой 19.55 г прокалили, масса твердого
остатка составила 12.55 г. Найдите объем образовавшейся газовой смеси (н. у.).
10. Смесь двух изомерных метилфенолов, взятых в молярном соотношении 1 : 2,
обработали избытком бромной воды. Масса органических продуктов реакции
оказалась в 2.463 раза больше массы исходной смеси. Установите возможное
строение метилфенолов. Запишите уравнения реакций, укажите структурные
формулы исходных соединений и продуктов бромирования.
Вариант 4
1. Запишите электронные конфигурации атома С1 и иона СГ.
2. Запишите уравнение реакции кремния с концентрированным раствором
гидроксида натрия.
3. Сколько о- и л-связей содержит молекула бутадиена?
4. Как повлияет на положение равновесия реакции
СО(г) + 2Н2(г) z±CH3OH(r) + Q
а) повышение температуры;
б) понижение давления;
в) добавление метанола?
46 Заместительный экзамен (вместо ЕГЭ)
5. Сколько протонов содержится в 1.4 г угарного газа?
6. Какой объем 25%-ного раствора азотной кислоты (плотность 1.15 г/мл)
потребуется для полной нейтрализации 250 г раствора гидроксида кальция с
концентрацией 3%? Рассчитайте массовую долю соли в полученном растворе.
7. Напишите уравнения реакций, соответствующих приведенным ниже
превращениям, и укажите условия их проведения. Используйте структурные
формулы органических веществ.
С2Н6 — X — С4Н10 —► Y —► СН3СООК — С2Нб
8. Напишите уравнения реакций, соответствующих приведенным ниже
превращениям, и укажите условия их проведения (X - вещество, содержащее бром,
Y - вещество, содержащее железо).
KBr X -> Br2 -> FeBr3 ...
9. Смесь нитратов калия и меди массой 47.7 г прокалили, масса твердого остатка
составила 24.5 г. Найдите объем образовавшейся газовой смеси (н. у.).
10. Смесь двух изомерных метилфенолов, взятых в молярном соотношении 1:1,
обработали избытком бромной воды. Масса органических продуктов реакции
оказалась в 2.829 раза больше массы исходной смеси. Установите возможное
строение метилфенолов. Запишите уравнения реакций, укажите структурные
формулы исходных соединений и продуктов бромирования.
Пробный экзамен
Вариант 1
1. Запишите уравнения реакций 4-аминофенола а) с соляной кислотой; б) с
раствором щелочи.
2. Рассчитайте давление в баллоне емкостью 5 л, в котором при температуре
35°С содержится смесь 20 г азота, 20 г аргона и 20 г кислорода.
3. Рассчитайте pH раствора фтороводородной кислоты с концентрацией
0.01 моль/л. Константа диссоциации кислоты равна 6.8 - ЮЛ
4. Рассчитайте концентрацию (в масс. %) раствора серной кислоты, полученного
осторожным добавлением 150 г 60%-ного олеума к 100 воды.
5. Как химическим путем из смеси опилок Au, Al и Си выделить эти металлы в
чистом виде? Приведите краткое описание последовательности необходимых
операций, запишите уравнения происходящих реакций и укажите условия их
протекания.
6. В замкнутый реактор поместили 0.1 моль NO и 0.2 моль С12. Определите, как и
во сколько раз изменится скорость элементарной реакции 2NO + С12 —► 2NOC12
к моменту, когда прореагирует 20% хлора.
7. Расшифруйте следующую схему превращений, запишите уравнения шести
реакций и укажите условия их протекания.
СГ1 —2-* CI
I X
С1° —j—* С1+5
8. Расшифруйте следующую схему превращений, запишите уравнения шести
реакций и укажите условия их проведения. В уравнениях реакций используйте
структурные формулы веществ.
С6Н12О6 — СзНбОз —С3Н5О2Вг -C3H7O2N - C12H16O4N2 -> GjH^NOjBr -> C9H12N2O6
9. Смесь двух изомерных спиртов массой 18.0 г нагрели с избытком
пропионовой кислоты в присутствии следов серной кислоты и получили 25.056 г
смеси сложных эфиров. Установите строение спиртов, если известно, что выход
одного из эфиров составил 75%, выход второго - 60%, а масса первого из эфиров в
пять раз больше массы второго.
10. В 134.1 мл воды растворили 42.9 г смеси гидрида неизвестного щелочного
металла X и фосфида цинка. Масса полученного при этом раствора оказалась на 27 г
меньше суммы масс исходных твердых веществ и воды, а массовая доля
образовавшейся соли составила 20.2%. Определите неизвестный металл X и
рассчитайте массовые доли соединений в исходной смеси.
48 Пробный экзамен
Вариант 2
1. Запишите уравнения реакций 4-аминобутановой кислоты а) с соляной
кислотой; б) с раствором щелочи.
2. Рассчитайте давление в баллоне емкостью 8 л, в котором при температуре
40°С содержится смесь 10 г углекислого газа, 20 г неона и 30 г пропана.
3. Рассчитайте pH раствора азотистой кислоты с концентрацией 0.005 моль/л.
Константа диссоциации кислоты равна 4.6 ЮЛ
4. После осторожного добавления 100 г олеума к 80 г воды был получен
60%-ный раствор серной кислоты. Определите состав олеума (масс. %).
5. Как химическим путем из смеси опилок Ag, Fe и Си выделить эти металлы в
чистом виде? Приведите краткое описание последовательности необходимых
операций, запишите уравнения происходящих реакций и укажите условия их
протекания.
6. В замкнутый реактор поместили 0.5 моль СО и 0.4 моль О2. Определите, как и
во сколько раз изменится скорость элементарной реакции 2СО + О2 —► 2СО2
к моменту, когда прореагирует 40% кислорода.
7. Расшифруйте следующую схему превращений, запишите уравнения шести
реакций и укажите условия их протекания.
Мп+7—-Мп+2
Мп44 3 -Мп°
8. Расшифруйте следующую схему превращений, запишите уравнения шести
реакций и укажите условия их проведения. В уравнениях реакций используйте
структурные формулы веществ.
С4Н8 — С2Н4О2 — С2Н3О2С1 — C2H5O2N — C7H12O5N2 — C5H10NO4Cl — C5H10N2O7
9. Смесь двух изомерных карбоновых кислот массой 52.8 г нагрели с избытком
метанола в присутствии следов серной кислоты и получили 45.9 г смеси сложных
эфиров. Установите строение карбоновых кислот, если известно, что выход одного из
эфиров составил 80%, выход второго - 50%, а масса первой карбоновой кислоты в
пять раз больше массы второй.
10. В 111.6 мл воды растворили 16.8 г смеси гидрида неизвестного щелочного
металла X и карбида алюминия. Масса полученного при этом раствора оказалась на
28.4 г меньше суммы масс исходных твердых веществ и воды, а массовая доля
образовавшейся соли составила 11.8%. Определите неизвестный металл X и
рассчитайте массовые доли соединений в исходной смеси.
Решения заданий олимпиады «Ломоносов»
Заочный тур
Задания для учащихся 10-11 классов
Вариант Ноябрь -1
1. Возможный вариант решения: олово Sn \s22s22p63s13p64s13dXQ4p64dXQ5s25p2
и теллур Те 1$22?2р63?3р64?3 J104p64JI05?5p4.
2. Изомерные углеводороды:
СН3- (pH- СнДчрн- СН3
СН3 СН3
СНз-€Н2-СН-СН2-СНз
(Jh2
СН3
2,4-диметилпентан
3-этилпентан
В каждой из молекул все метильные группы СН3 эквивалентны, точно так же,
как метиленовые СН2 или метановые СН.
3. Обозначим атомную массу элемента X зах, а массу элемента Y за у. Каждое из
соединений включает один атом азота, значит, массовая доля азота должна быть
меньше в более тяжелом соединении (в X2NY7). Значит,
14
в XNY5 ®(N) =-------------= 0.4516,
х + 14 + 5у
а в X2NY7
Решение системы
(х + 5у = 17;
[2х + 7у = 31.
дает х = 12, у = 1, эти массы соответствуют углероду и водороду. Итак, искомые
соединения - это CH3NH2 и C2H5NH2, метиламин и этиламин. Реакции аминов с
соляной кислотой приводят к образованию солей:
CH3NH2 + НС1 — CH3NH3+Cr,
C2H5NH2 + НС1 — C2H5NH3+Cr.
Ответ: CH3NH2 и C2H5NH2.
4. В таблице Д.И. Менделеева указана средняя относительная масса магния -
24.305 а.е.м. Она рассчитана исходя из масс и мольных долей изотопов. Найдем
мольную долю третьего изотопа с неизвестной относительной атомной массой Аг:
х= 1 -0.7899-0.10 = 0.1101,
тогда 24.305 = 0.7899 • 23.98504 + 0.10 • 24.985584 + 0.1101 • Аг>
отсюда находим Аг = 25.9824 а.е.м. - это ^Mg.
Ответ: 26Mg, 25.9824 а.е.м.
50
Олимпиада «Ломоносов», заочный тур
5. Реакции молочнокислого и спиртового брожения глюкозы приводят к
образованию молочной кислоты и этанола соответственно:
СбН12О6 —^=^->2СН3СН(ОН)СООН;
СбНиОб 2С2Н5ОН + 2CO2f.
Всего было использовано глюкозы
v(C6H12O6)hcx = 45.28 / 180 = 0.2516 моль.
Масса и количество спирта в полученной порции кваса:
т(кваса) = И - р = 2000 • 1 = 2000 г,
т(спирта) = 0.0115 • 2000 = 23.0 г,
у(спирта) = 23 / 46 = 0.50 моль.
Количество глюкозы, затраченной на получение спирта, составляет
v(C6H12O6)i = 0.5 • у(спирта) = 0.25 моль,
значит, на получение молочной кислоты пошло глюкозы
у(СбН12Об)2 = 0.2516 - 0.25 = 0.0016 моль,
а количество полученной молочной кислоты равно
v( кислоты) = 2v(C6H12O6)2 = 0.0032 моль.
Молярная концентрация молочной кислоты составляет
с = v / V= 0.0032 / 2 = 0.0016 моль/л.
Молочная кислота - слабая, в водном растворе она частично диссоциирует:
СН3СН(ОН)СООН zt СН3СН(ОН)СОО" + Н*,
Запишем выражение для константы диссоциации кислоты, обозначив за х
концентрацию Н*:
к = [Н*][СН3СН(ОН)СОО-] = [Н*]2
дас с-[Н+] с-[НТ
Получили квадратное уравнение:
х2 + 1.3810“S - 2.208 10"7 = 0,
решение которого х = 4.06-10“^ (моль/л). Тогда pH напитка составляет
pH = -IgtH4] = -lg(4.06-10-4) = 3.39.
Ответ: 3.39.
6. Пусть в осадок выпало т г кристаллогидрата Me(NO3)x • лН2О. Обозначим
через А молярную массу безводного нитрата Me(NO3)x. Тогда, по условию задачи:
т = 0.3(Л + 18л),
О.ЗЛ = 0.5950m,
0.3(Л-18л) = 22.8.
Решив систему из трех уравнений, получаем т = 120 г, А = 238 г/моль, л = 9. Для
установления состава необходимо определить неизвестный металл, валентность х
которого нам также не известна. Пусть М- атомная масса металла. Предположим, что
металл одновалентный, тогда
Решения заданий
51
Л/+ 62 = 238, Л/= 176 г/моль. Такого металла нет.
Если металл двухвалентный, тогда
Л/+ 62 • 2 = 238, Л/= 114 г/моль. Такого металла тоже нет.
Если металл трехвалентный, тогда
Л/+ 62 • 3 = 238, Л/= 52 г/моль, это хром.
Состав кристаллогидрата - Cr(NO3)3 • 9Н2О.
Ответ'. Cr(NO3)3 • 9Н2О.
7.
ОН ONa
52
Олимпиада «Ломоносов», заочный тур
8. 1) 2Р + ЗС12(недост.) —► 2РС13;
2) РС13 + 5КОН(р-р) -► К2НРО3 + ЗКС1 + 2Н2О;
3) 5К2НРО3 + 2КМпО4 + 8H2SO4 2MnSO4 + 6K2SO4 + 5Н3РО4 + ЗН2О;
4) 2Р + 5С12(изб.) — 2РС15;
5) ЗРС15 + Р2О5 —5РОС13;
6) Р0С13 + 6К0Н — К3РО4 + ЗКС1 4- ЗН2О.
Ответ: XI - К2НРО3, Х2 - Н3РО4, ХЗ - РС15, Х4 - Р0С13.
9. Соль Мора - (NH4)2Fe(SO4)2 • 6Н2О. При пропускании кислорода через раствор
этой соли железо(П) окисляется до железа(Ш):
4FeSO4 4- О2 4- 2H2SO4 — 2Fe2(SO4)3 4- 2Н2О.
При охлаждении раствора, полученного после пропускания кислорода,
выпадают кристаллы железоаммонийных квасцов (NH4)Fe(SO4)2 • 12Н2О (осадок А):
Fe2(SO4)3 4- (NH4)2SO4 + 24Н2О —2(NH4)Fe(SO4)2 • 12Н2О1.
Взаимодействие раствора квасцов со щелочью приводит к образованию осадка В
- гидроксида железа(Ш) Fe(OH)3:
Fe2(SO4)3 4- 6КОН — 2Fe(OH)3| + 3K2SO4.
Обработка осадка Fe(OH)3 горячим щелочным раствором гипохлорита калия
приводит к образованию феррата(У1) калия, который хорошо растворим:
2Fe(OH)3 + ЗКС1О 4- 4КОН — 2K2FeO4 4- ЗКС1 4- 5Н2О.
При добавлении раствора хлорида бария к красно-фиолетовому щелочному
раствору, содержащему феррат(У1) калия, выпадает фиолетовый осадок феррата(У1)
бария. Расчет показывает, что содержание бария в K2FeO4
со(Ва) = 137 / 257 = 0.533 (или 53.3%)
Решения заданий 53
не совпадает с условием задачи. Предположим, что феррат(У1) бария выпадает в виде
кристаллогидрата BaFeO4 • хН2О:
K2FeO4 + ВаС12 + хН2О BaFeO4 • хН2О| + 2КС1.
Тогда <о(Ва) = 0.498 = 137 / (257 + 18х),
отсюда х = 1. Значит, состав осадка С - BaFeO4 • Н2О.
Ответ. А - (NH4)Fe(SO4)2 • 12Н2О, В - Ре(ОН)з, С - BaFeO4 • Н2О.
10. Поскольку при бромировании образовалось монобромпроизводное, скорее
всего, речь идёт о радикальном замещении в ряду насыщенных углеводородов:
СХНУ + Вг2 — СхНг1Вг + НВг.
Зная массы исходного углеводорода и бромпроизводного, можно составить
уравнение, приравняв их количества вещества:
4.48 7,64
12х + у 12х + у-1 + 80 ’
После подстановки 12х + у = z и решения получаем z = 112. Такая масса
соответствует х = 8, у = 16. Искомый углеводород - циклоалкан C8Hi6 в количестве
v(C8H16) = 4.48 / 112 = 0.04 моль.
При дегидробромировании бромпроизводного был получен циклический алкен,
при жёстком окислении которого образовалось соединение X, вступившее далее в
галоформную реакцию. Из условий задачи можно рассчитать количество вещества
йодоформа (светло-желтый осадок):
v(CHI3) = 31.52 / 394 = 0.08 моль,
что в два раза больше количества исходного углеводорода, следовательно, продукт
окисления циклоалкена может вступить в галоформную реакцию дважды. Поскольку
в маточном растворе осталось органическое соединение неразветвлённого строения,
то единственный вариант исходного циклоалкана - это 1,2-диметилциклогексан:
Уравнение реакции окисления:
5 I |1 + 4KMnO4 + 6H2SO4 —* 5 НзСС(СН2)4ССНз + 4MnSO4 + 2K2SO4 + 6Н2О
^^СНз
Галоформная реакция (известная качественная реакция на метилкетоны):
Н3СС(СН2)4ССНз + 6I2 + 8КОН -----► 2СНЦ+ КОС(СН2)4СОК + 6KI + 6Н2О
54
Олимпиада «Ломоносов», заочный тур
Уравнение взаимодействия продукта с бромэтаном:
О О О О
II II II II
КОС(СН2)4СОК + 2С2Н$Вг -----► С2Н5ОС(СН2)4СОС2Н5 + 2КВг
Масса прореагировавшего бромэтана составляет
т(С2Н5Вг) = 2 • 0.04 • 109 = 8.72 г.
Ответ: 8.72 г.
Вариант Ноябрь-2
1. Возможное решение: скандий Sc k22j22p63523p64523J1 и неон Ne lAs2^6.
2. Изомерные углеводороды:
СНз-СНг-^Н-СНг-СНтСНз сн3-сн —СН—СН2—СН3
СН3 СН3 СН3
3-метилгексан 2,3-диметилпентан
В каждой из молекул имеются три неэквивалентные метильные группы СН3.
3. Неизвестные вещества - СН2О и НСООН. Реакции с хлором:
СН2О + 2С12 + Н2О — СО2 + 4НС1,
НСООН + С12 — СО2 + 2НС1.
4. 50Сг, 49.9432 а.е.м.
5. 1.2%.
6. A12(SO4)3 • 12Н2О.
7. A: C6HHCH2)^NH2; В: CeJlj- (CH^j-OH; С: СбН5-СН=СН2;
D: СбН5-СН(ОН)-СНз; Е: CsHs-CXO^-CH-,; F: QJly-COOH.
8. XI - H2S, Х2 - SO2, ХЗ - Na2SO3, Х4 - Na2S4O6.
1) H2SO4(kohu) + 8HI — 4I2 + H2S + 4H2O;
2) PbfNOjh + H2S — PbS I + 2HNO3;
3) H2SO4(kohu) + 2HBr —* Br2 + SO2 + 2H2O;
4) SO2 + 2ИаОН(изб) -*Na2SO3 + H2O;
5) Na2SO3(p-p) + S —► Na2S2O3;
6) 2Na2S2O3 +12 2NaI + Na2S4O6.
9. A - Cu(OH)2 • 2CuCO3, В - CuCl, C - Cu2S.
10. Исходный циклоалкан - метилциклогексан; масса конечного продукта
(циклопентанона) 4.2 г.
Вариант Ноябрь-3
1. Возможное решение: селен Se b22522p63523p64523J104p4 и аргон Аг
ls22s22p63s23p6.
2. Изомерные углеводороды:
Решения заданий
55
<JH3 <j?H3
СН3-<р -СНгСНуСНз СНз- СНг- с-СН2—сн3
СН3 СНз
2,2- диметилпентан 3,3-диметилпентан
В каждой из молекул имеются две неэквивалентные метильные группы СН3, а
мети новые группы СН, включающие третичный атом углерода, отсутствуют.
3. Неизвестные вещества - СН3С1 и С2Н5С1. Реакции с избытком аммиака:
СН3С1 + 2NH3 — CH3NH2 + NH4CI,
С2Н5С1 + 2NH3 — C2H5NH2 + NH4CI.
4.87Sr, 86.9055 а.е.м.
5. Выход реакции молочнокислого брожения 0.91%, выход реакции спиртового
брожения 57.6%.
6. Fe(NO3)3 • 9Н2О.
7. А: НгИ-СНз-СНг-СНССНзЬ; В: НО-СНг-СНз-СЩСНзЪ;
С. СН2=СН-СН(СН3)2; D: СН2=СН-СВг(СН3)2; Е: СН2=СН-С(СН3)=СН2;
F: СН2Вг-СН=С(СН3)-СН2Вг.
8. XI - НС1, Х2 - SO2C12, ХЗ - КС1, Х4 - КС1О3.
1) NaCl + H2SO4(kohh) — НС1 + NaHSO4;
2) MnO2 + 4HC1 — MnCl2 + Cl2f + 2H2O;
3) Cl2 + SO2 pwnaTOp > SO2C12;
4) SO2C12 + 4KOH — K2SO4 + 2KC1 + 2H2O;
5) KC1 + 3H2O ^jnofa-yte-> KC1O3 + 3H2T;
6) 4KC1O3 - t^1-50-^ 3KC1O4 + KCL
9. A - PbSO4, В - Cr(OH)3, C - KCr(SO4)2 • 12H2O.
10. Исходный циклоалкан - 1,2-диметил циклопентан; масса конечного продукта
(ангидрида глутаровой кислоты) 3.42 г.
Вариант Ноябрь-4
СНз
3,3-диметилпентан
1. Возможное решение: никель Ni 1522s22p63523p64523J8 и мышьяк As
1?2?2р63?3/Л»?3</'°4/А
2. Изомерные углеводороды:
CJH3 С^Нз
сн3- <р - сн - сн3 снз- сн2-(р-сн2-сн3
СН3 CH3
2,2- диметилпентан
В первой молекуле имеется группа СН, включающая третичный атом углерода, а
метиленовых групп СН2 нет. Во второй молекуле есть две эквивалентные
метиленовые группы, включающие вторичные атомы углерода, а третичных атомов
углерода нет.
3. Неизвестные вещества - Н2С=СНВг и СН3Вг. Реакции с кислородом (горение):
Олимпиада «Ломоносов», заочный тур
2СН3Вг + ЗО2 — 2СО2 + 2Н2О + 2НВг,
2С2Н,Вг + 5О2 — 4СО2 + 2Н2О + 2НВг.
4.30Si, 29.9735 а.е.м.
5. 38.384 г.
6. А1С13 -6Н2О.
7. A: H2N-CHHCH2)3-NH2; В: НОЧСН^д-ОН; С: СН2=СН-СН=СН2;
D: СНт-СН=СН-СН2Вг; Е: тетрагидрофуран С4Н8О; F: СН2Вг-СНВг-СН=СН2.
8. XI - NO, Х2 - N02, ХЗ - N2O3, Х4 - NOC1.
1) HNO3(50%) + А$2О3 + 2Н2О — NOT + N02| + гн^Од;
2) NO + N02 в””” > N2O3;
3) N2O3 + 2KOH(p-p) —2KNO2 + H2O;
4) 2KNO2 + 2KI + 2H2SO4 -> Ы + 2K2SO4 + 2NO| + 2H2O;
5) 2NO + Cl2 итуунмтор > 2NOC1;
6) NOCI + H2O — HNO2 + HC1.
9. A - MnO2, В - Mn(OH>2 • 5МпСОз, C - HMnO4.
10. Исходный циклоалкан - метилциклопентан; масса конечного продукта
(2-иодпропана) 13.6 г.
Вариант Декабрь -1
1. Обнаружить примесь муравьиной кислоты поможет реакция «серебряного
зеркала», в которую вступает муравьиная кислота, но не вступает уксусная.
Признаком протекания реакции является появление налета серебра на стенке
пробирки:
НСООН + 2[Ag(NH3)2]OH —2Agj + (NH^CCh + 2NH3 + Н2О.
2. Щавелевая (этандиовая) кислота С2Н2О4
Общая формула гомологического ряда щавелевой кислоты - С„Н2^2О4.
Ответ: С„Н2п_2О4.
3. Растворим смесь в воде и обработаем раствор избытком раствора щелочи:
MnSO4 + КОН(изб) — Мп(ОН)21 + K2SO4,
Al2(SO4)3 + 8КОН(изб) — 2К[А1(ОН)4] + 3K2SO4.
Гидроксид марганца Мп(ОН)2 - малорастворимое соединение (ПР = 1.910"13), не
проявляющее амфотерных свойств и поэтому не растворяющееся в избытке щелочи.
Он выпадет из раствора в виде светло-розового осадка. Алюминий останется в
щелочном растворе в виде тетрагидроксоалюминат-иона. При пропускании в этот
раствор тока углекислого газа выпадет белый осадок гидроксида алюминия А1(ОН)3:
К[А1(ОН)4] + СО2— А1(ОН)з1 + КНСО3
Этим способом можно выделить из исходной смеси марганец в виде Мп(ОН)2,
алюминий - в виде А1(ОН)3 (А12О3 при прокаливании).
Решения заданий
57
4. Количество вещества хорошо растворимой соли равно
v(Na2CO3) = 1.06 / 106 = 0.01 моль.
Пусть в раствор над осадком перешло х моль СаСО3. Тогда равновесные
молярные концентрации Са2+ и карбонат-ионов составляют, соответственно
ДСа2+) = л/0.75,
с(СО32~) = —+001.
0.75
Произведение растворимости карбоната кальция равно
3 R 1Л-9 = х * + 0 01 — *2 + 001*
075 0.75 0.5625
Решение уравнения дает* = 2.1375 10’7 (моль). Тогда
m(Ca2+) = v • Л/= 2.1375-10"7 • 40 = 8.5498-10^ г.
Ответ: 8.55-10-6 г ионов кальция.
5. Масса изотопа равняется сумме масс всех протонов, нейтронов и электронов
за вычетом дефекта массы. В атоме изотопа 86Кг 36 протонов, 50 нейтронов и 36
электронов.
АД^Кг) = 36 • 1.00728 + 50 • 1.00866 + 36 • 0.0005486 - Ат.
Рассчитаем дефект массы. По уравнению Эйнштейна
ДЕ = т • с2,
где с - скорость света, с = 3-108 м/с, Е - энергия образования одного ядра криптона.
Е= 7.237928-1013/6.022-1023 = 1.20191426-10"10 Дж;
Am = Е / с2 = 1.33546-10’27 кг = 0.80422 а.е.м.
А/86Кг) = 85.91061 а.е.м.
Ответ: 85.91061 а.е.м.
6. Поскольку шарик завис в воздухе, сила Архимеда и сила тяжести,
действующие на него, стали равны друг другу. То есть
т(воздуха)-£ = (т(смеси) + т(оболочки))-^
Для расчета масс газов требуется объем шара, а для расчета массы оболочки
шарика необходима площадь поверхности шара:
4лг3
К(шара) = ——; 5(шара) = 4ЛГ2.
т(оболочки) = 4т^т,
где т - масса 1м2 оболочки. Подставим в основную формулу:
/ х 4лг3 , ч 4лг3 , . 2
р(воздуха) • —— = р(смеси) • —— + 4лгт.
После упрощения получаем:
р(воздуха) • = р(смеси) • ~ + т.
Можно выразить и рассчитать плотность газовой смеси:
р(смеси) = р(воздуха) - —= 1.2946 - 3 1.65-10"2 / 0.15 = 0.9646 кг/м3.
58 Олимпиада «Ломоносов», заочный тур
Из уравнения Менделеева-Клапейрона выразим и рассчитаем среднюю
молярную массу газовой смеси:
izz \ Р&Т 0.9646-8.314-273 ллои # oi г /
М(смеси) = -— =-----------------= 0.0216 кг/моль = 21.6 г/моль.
р 101325
Мольная доля первого газа в соответствии с законом Дальтона равна
Xi =pi /р(смеси) = 20265 / 101325 = 0.2,
тогда мольная доля второго составляет х2 = 0.8.
Средняя молярная масса газовой смеси равна
А/(смеси) = Л/1 • *1 + Л/2 * *2 = М ’ *i + 6.5Л/1 ' х2 = М\- 0.2 + 6.5ЛЛ • 0.8 = 5.4 • Л/ь
5.4 = 21.6.
Отсюда Mi = 4 г/моль, значит, этот газ - гелий. Молярная масса второго газа
М2 = 4 • 6.5 = 26 г/моль,
что отвечает ацетилену.
Ответ'. Не и С2Н2.
7. Можно предположить, что простое вещество А - переходный металл (его
соединения имеют разнообразную окраску, он образует комплексное соединение с
аммиаком). Цвета безводного хлорида, водного раствора хлорида, а также
аммиачного комплекса этого металла указывают на никель (простое вещество А).
Ni + С12 —NiCI2.
Проверим отношение масс:
A/(NiCl2) / A/(Ni) = 130 / 59 = 2.203,
что соответствует условию задачи.
Цвет безводного хлорида никеля (вещества В) - желтый, а водный раствор
хлорида никеля имеет зеленую окраску. При добавлении к- этому раствору аммиака
образуется сине-фиолетовый аммиачный комплекс никеля(П) (вещество С):
NiCl2 + 6NH3 [Ni(NH3)6]Cl2.
При пропускании в раствор хлорида гексамминникеля(П) сероводорода
выпадает черный осадок сульфида никеля(П) (вещество D):
[Ni(NH3)6]CI2 + 3H2S — NiSJ, + 2NH4CI + 2(NH4)2S.
При добавлении к раствору хлорида гексамминникеля(П) иодида калия выпадает
светло-фиолетовый осадок малорастворимого иодида, образованного этим
комплексным катионом (вещество Е):
[Ni(NH3)6]Cl2 + 2KI -> [Ni(NH3)6]I2| + 2КС1.
При нагревании раствора хлорида никеля с гипофосфитом натрия происходит
восстановление никеля(П) до металлического никеля (вещества А):
NiCl2 + NaH2PO2 + Н2О —Nil + Н3РО3 + NaCl + НС1
или 2NiCl2 + NaH2PO2 + 2Н2О —2Nij + Н3РО4 + NaCl + ЗНС1.
Ответ'. А - Ni, В - NiCl2, С - [Ni(NH3)6]Cl2, D - NiS, Е - [Ni(NH3)6]I2, образуется
металлический никель.
Решения заданий
59
аСН3
+ НС1
электролиз
(реакция Канниццаро),
+ 2КОН + 2СО2 + Н2
Процессы на электродах:
катод: 2Н* + 2е —► Н2
анод: 2СбН5-СОО" - 2е — + 2CO2f.
9. Кварцевый песок не реагирует с азотной кислотой. Взаимодействие минерала
с кислотой можно представить следующим образом (предположим, что степень
окисления металла Me не меняется, количество вещества минерала составляет х
моль):
MeCuS + I2HNO3 — MeNO3 + Cu(NO3h + H2SO4 + 9NO2t + 5H2O.
Выпадение осадка после обработки раствором хлорида натрия возможно только
в случае образования нерастворимого в кислоте хлорида металла Me:
MeNO3 + NaCl — MeCli + NaNO3.
X X
По условию, в хлориде
<о(Ме) = М/ (М+ 35.5) = 0.7526.
Значит, молярная масса металла М = 108 г/моль, искомый металл - серебро,
белый осадок - хлорид серебра, его количество составляет
х = v(AgCl) = 71.75 / 143.5 = 0.5 моль.
Прокаливание хлорида серебра с карбонатом натрия:
4AgCl + 2Na2CO3 —4NaCl + 4Ag + 2СО2Т + О2Т.
60
Олимпиада «Ломоносов», заочный тур
При промывании водой твердого остатка после прокаливания хлорид натрия
растворяется, остается только серебро. Масса серебра
m(Ag) = 0.5 • 108 = 54 г.
Минерал AgCuS - шромейерит, v(AgCuS) = х = 0.5 моль. Масса минерала
т = 0.5 • 204 = 102 г.
Содержание минерала в исходном образце
ш = 102 / 136 = 0.75 (или 75% по массе).
Ответ’, Ag, 54 г, AgCuS, 75%.
10. Определим простейшую формулу неизвестного углеводорода СХНУ:
91.30 8.70 . . _ о
х : у =------: ----= 1 : 1.143 или 7 : 8.
12 1
Неизвестный углеводород - это толуол С?Н8. При каталитическом бромировании
толуола образуется смесь орто- и иара-замещённых продуктов:
Обработка полученной смеси гидроксидом натрия приводит к образованию трех
изомерных фенолятов:
Образование двух продуктов в каждой реакции объясняется протеканием
процесса через стадию отщепления бромоводорода (образования дегидробензола) с
последующим присоединением нуклеофила, что приводит к получению смеси двух
Решения заданий
61
рсгиоизомеров в соотношении 1:1. Видно, что при бромировании толуола продукт
дою-замещения (2-бромтолуол) образуется в меньшем количестве, следовательно, в
конечной реакционной смеси соль 2-метилфенола присутствует также в меньшем
количестве, а соль 3-метилфенола - в ббльшем. Следовательно, соотношение
количеств 2-бромтолуола и 4-бромтолуола составляет 1 : 4, выход реакции орто-
смещения равен 20%, а реакции одра-замещения - 80%.
Ответ: орто-Ъроммроъаше - 20%, одра-бромирование - 80%.
Вариант Декабрь - 2
1. Обнаружить примесь этилена поможет реакция с бромной водой, в которую
ступает этилен, но не вступает этан. Признаком протекания реакции является
обесцвечивание бромной воды:
СН2=СН2 + Вг2(водн.) —► СН2Вг-СН2Вг.
2. C„H^O3.
3. MgSO4 + КОН(изб) — М&ОНЫ + K2SO4
Cr2(SO4)3 + 8КОН(изб) — 2К[Сг(ОН)4] + 3K2SO4 (или К3[Сг(ОН)6])
К[Сг(ОН)4] + СО2 Сг(ОН)3| + КНСО3
4. 1.51-КГ6 г.
5. 57.9333 а.е.м.
6. Ne и С2Нб.
7. А - Со, В - СоС12, С - [Co(NH3)6]C12, D - Со(ОН)2, Е - Н2[СоС14], образуется
К2[Со(ОН)4] синего цвета.
8. А - СЩ; В - СбН*; С - C6Hs-€OOK; D - СНВг3.
Процессы на электродах:
катод: 2ЬГ + 2е —► Н2
анод: 2СбН5-СОО" - 2е СбН5-СбН5 + 2CO2f.
9. Ag, 97.2 г, Ag3CuS2, 85%.
10. Неизвестный углеводород - этилбензол С8Ню. Выход реакции орто-
замещения 15%, а реакции одра-замещения - 85%.
Вариант Декабрьг-3
1. Обнаружить примесь бутина-1 поможет реакция с аммиачным раствором
оксида серебра, в которую вступает бутин-1, но не вступает бутин-2. Признаком
протекания реакции является образование белого осадка:
СН3СН2ОСН + [Ag(NH3)2]OH CH3CH2C=CAgj + 2NH3 + Н2О.
2. С„Н^2О3.
3. ZnSO4 + 4КОН(изб) K2[Zn(OH)4] + K2SO4,
Fe2(SO4)3 + бКОН(изб) 2Fe(OH)3| + 3K2SO4.
62
Олимпиада «Ломоносов», заочный тур
K2[Zn(OH)4] + 2NH4C1 -► ZiXOHM + 2КС1 + 2NH3 + 2Н2О
или 2K2[Zn(OH)4] + 5СО2 -> Zn(0H)2 ZnCO3l + 4КНСО3 + Н20.
4.2.65-1О~10 моль/л.
5. 103.9041 а.е.м.
6. Ne и N2.
7. А - Си, В - СиС12, С - [CuCNH^jClfc D - CuS, Е - CuCNO^, образуются
кристаллы (NH4)2Cu(SO4)2 • 6Н2О голубого цвета.
8. А - СбН5-СН2Вг, В - СбНг-СНО; С - Вг-€бН<-СООК; D - Вг-СбНд-СНгОН.
Процессы на электродах:
катод: 2FT + 2е —► Н2
анод: 2Вг-СбНд-СОО — 2е —> Вг—С^Нд—С^Нд—Вг + 2СО2|.
9. AgCl, 43.2 г, AgCuS, 82%.
10. Неизвестный углеводород - толуол С7Н8. Выход реакции орто-замещения
20%, а реакции одра-замещения - 80%.
Вариант Декабрь - 4
1. Обнаружить примесь пропина поможет реакция с аммиачным раствором
оксида серебра, в которую вступает пропин, но не вступает этан. Признаком
протекания реакции является образование белого осадка:
СН3С^СН + [Ag(NH3)2]OH — CH3C^CAg| + 2NH3 + Н2О.
2. СЛ^Оз.
3. NiSO4 + КОН(изб) — Ni(OHM + K2SO4,
А12(8О4)з + 8КОН(изб) — 2K[AI(OH)4] + 3K2SO4,
K[A1(OH)4] + CO2 — A1(OH)3! + KHCO3.
4. 7.24- КГ4 моль/л.
5. 111.9048 а.е.м.
6. He и C2H4.
7. A - Cd, В - CdCl2, C - Cd(OH)2, D - [Cd(NH3)4](OH)2, E - CdS; образуется CdO
коричневого цвета.
8. A - СбН5-СН2СН3; В - C6H5-C(O)CH3; С - Вг-СЛт-СООК; D - СНВг3.
Процессы на электродах:
катод: 2Н* + 2е —> Н2
анод: 2Вг—С$Н4—СОО — 2<? —* Вг—С^Нд—С^Нд—Вг + 2CO2f.
9. AgCl, 43.05 г, Ag3CuS2, 90.4%.
10. Неизвестный углеводород - толуол С7Н8. Выход реакции орто-замещения
30%, а реакции одра-замещения - 70%.
Решения заданий
63
Решения заданий заочного тура для 5-9 классов
Вариант Ноябрь -1
1. Пусть формула соединения - CaJBy. Если 38.17% - массовая доля бора, то
уравнение для х и у имеет вид (относительную атомную массу бора принимаем
равной 10.8, так как массовая доля дана с высокой точностью):
0.3817 =——
40.x+ 10.8 у
Это уравнение имеет следующее решение в целых числах: х = 7, у = 16 (Са7В1б).
Однако оно не единственное. Если принять, что 38.17% - массовая доля кальция:
0.3817 =---—-----
40х + 10.8у
получаем х = 1, у = 6. Следовательно, формула соединения - СаВ6, что соответствует
условию задачи.
Ответ'. СаВб.
2. Возможное уравнение разложения:
2Cu(NO3)2 -+->• 2CuO + 4NO2T + О2Т.
4-46 + 32
Проверка: Mp(NO2,O2) = - = 43.2 г/моль, = 43.2 / 2 = 21.6.
Подходит также разложение любого нитрата металла до оксида, когда металл не
меняет степень окисления, например Zn(NO3)2 или A1(NO3)3.
Ответ', например, CuCNO^.
3. Рассмотрим равнобедренный треугольник YXY. Обозначим а угол между
связями ZYXY и применим теорему косинусов:
r(Y-Y)2 = r(X-Y)2 + r(X-Y)2 - 2r(X-Y)2 • cosa,
0.2072 = 0.1422 + 0.1422 - 2 • 0.1422 • cosa,
откуда cosa = -0.0625, a = 93.6°. При таком угле атом X и все атомы Y не могут
лежать в одной плоскости (для этого угол должен был бы равняться 120°), значит,
молекула имеет форму треугольной пирамиды (пример - молекула фосфина РН3).
Ответ'. 93.6°, треугольная пирамида.
4. а)Х-С12.
К2Сг2О7 + 14НС1 — ЗС12Т + 2КС1 + 2СгС13 + 7Н2О;
2Fe + ЗС12 —»2FeCl3.
б) Y-MnSO«.
5K2SO3 + 2KMnO4 + 3H2SO4 — 6K2SO4 + 2MnSO4 + 3H2O;
MnSO4 + 2NaOH — Mn(OH)J + Na2SO4.
5. 1)N2 + 3Mg —»Mg3N2
2) Mg3N2 + 6H2O — 3Mg(OH)2 + 2NH3
3) 4NH3 + 5O2 —=-> 4NO + 6H2O
4) 2NO + O2 — 2NO2
(№->ft3)
(FT3 -> FT3)
(FT3 -> FT2)
(N+2->N+4)
64 Олимпиада «Ломоносов», заочный тур
5) 4NO2 + 02 + 2Н2О->• 4HNO3 (N+4->N+5)
6. Возьмем 100 г раствора гипохлорита натрия, тогда w (NaCl О) = 15 г.
NaClO + 2НС1 — С12Т + NaCl + Н2О.
v(NaC10) = 15 / 74.5 = 0.2 моль,
v(Cl2) = v(NaC10) = 0.2 моль,
m(Cl2) = 0.2 • 71 = 14.2 г.
Процент «активного хлора» в растворе NaClO: 14.2 г /100 г • 100% = 14.2%.
Содержание активного хлора может быть больше 100%. Пример - чистый
хлорат калия:
КСЮз + 6НС1 — ЗС12Т + КС1 + ЗН2О.
Здесь процент «активного хлора»: 3 • 71 /122.5 • 100%= 174%.
Ответ: 14.2%, да, может.
7. Неорганическое вещество - NaHSO3, гидросульфит натрия. Его получение:
SO2 + NaOH — NaHSO3.
Реакции: NaHSO3 + НС1 —► NaCl + SO2T + H2O;
NaHSO3 + NaOH — Na2SO3 + H2O;
2NaHSO3 + O2 -► Na2SO4 + H2SO4.
Благодаря последней реакции гидросульфит натрия используют в качестве
антиоксиданта.
Ответ: NaHSO3.
Вариант Ноябрь - 2
1. Li4C3.
2. (NH^CO,.
(ЫНОзСОз —£-> 2NH3T + СО2Т + Н2О.
3. 120°, плоская молекула.
4. а)Х-Н2.
2А1 + 2NaOH + 6Н2О — ЗН2Т + 2Na[Al(OH)4];
Н2 -I- СиО —> Си + Н2О.
б) Y - МпО2.
3K2SO3 + 2КМпО4 + Н2О — 3K2SO4 + 2MnO2l + 2КОН;
МпО2 + 4НВг —► МпВг2 + Вг2 + 2Н2О.
5. 1)2О3—<• ЗО2 (О°->О°)
2) Ва + О2 — ВаО2 (О0 -> О"1)
3) ВаО2 + H2SO4 — BaSO4l + Н2О2 (О’1 О’1)
4) 2Н2О2 — 2Н2О + О2 (О’* О’2)
5) 2Н2О + 4F2 —> 4HF + 2OF2 (О’2->О+2)
6. 43.2%, да, может.
7. NaHSO4.
Решения заданий
65
Вариант Ноябрь - 3
1. В4С.
2. NH4HS.
NH4HS —£-> NH3T + H2ST.
3. 92°, треугольная пирамида.
4. а) X - Mg(NO3)2 или NH4NO3.
4Mg + 10HNO3 — 4Mg(NO3)2 + NFUNOj + 3H2O;
2Mg(NO3)2 —2MgO + 4NO2 + O2
или NH4NO3 —N2O + 2H2O.
6) Y-H2SO4.
5SO2 + 2KMnO4 + 2H2O -► 2K2SO4 + MnSO4 + 2H2SO4
Zn -1- H2SO4(pa36) —► ZnSO4 -1- H2f.
5. 1) MnO2+ 4HC1 —> MnCl2 + Cl2f + 2H2O (СГ1 2 3 Cl°)
2) 3C12 + 6KOH —КСЮ3 + 5KC1 + 3H2O (Cl° -> СГ5)
3) 2KC10j > 2KC1 + 3O2 (Cl+5 СГ1)
4) KC1 + H2O — KC1O + H2 (СГ1 -> Cl+1)
(электролиз раствора с перемешиванием)
5) КСЮ + H2S —► KCl + S| + Н2О (Cl+1 -> СГ1)
6. a) 12% С - карбонат кальция СаСО3 СаО + СО2 —► СаСО3;
б) 20% С - мочевина, (NH^CO 2NH3 + СО2 -> (NH2)2CO + Н2О;
в) 37.5% С - метанол, СН3ОН СО2 + ЗН2 -► СН3ОН + Н2О;
г) 75% С-метан, CH, СО2 + 4Н2 — СН, + 2Н2О.
7. KHSO4.
Вариант Ноябрь - 4
1. S4N4.
2. AgNO3.
2AgNO3 ~> 2Ag + 2NO2T + O2T.
3. 100°, треугольная пирамида.
4. a) X - KC1O3.
3C12 + 6KOH —KC1O3 + 5KC1 + 3H2O;
2KC1O3 —2KC1 + 3O2
или 4KC1O3 —KC1 + 3KC1O4.
6) Y - Fe2(SO4)3.
2Fe + 6H2SO4(kohu) Fe^SC^h + 3SO2f + 6H2O;
Fe2(SO4)3 + Fe —* 3FeSO4.
5. 1) 4A1 + 3C —£-> AI4C3 (C° -> C4)
2) AI4C3 + 12H2O — 4A1(OH)3 + 3CH,t (CT4 -> C4)
3) CH, + 2O2 — CO2 + 2H2O (CT* -> C+4)
4) CO2 + 2Mg —2MgO + C (C+4 -> C°)
5) Ca + 2C —CaC2 (C° -> C*1)
66
Олимпиада «Ломоносов», заочный тур
6. а) 163%, б) 263%.
7. NaHS.
Вариант Декабрь -1
1. Пусть формула соединения CsxOr Цезий - намного более тяжелый элемент,
чем кислород, поэтому 96.14% - это массовая доля цезия, тогда можно записать
133х
co(Cs)= 0.9614 = ———,
133х + 16у
откуда х = Зу, х : у = 3 : 1. Формула соединения - Cs3O.
Ответ'. Cs3O.
2. Уравнение реакции: NaH + Н2О NaOH + Н2Т.
Пусть в воде растворили х моль NaH, тогда в растворе образовалось х моль
NaOH и выделилось х моль Н2. Выразим массу щелочи и массу раствора:
m(NaOH) = 4Qx (г),
т(р-ра) = 100 m(NaH) - m(H2) = 100 + 22r.
Массовая доля щелочи:
©(NaOH) = 0.1 = 40х / (100 + 22х),
отсюда х = 0.265 моль. Масса гидрида составляла
m(NaH) = 0.265 • 24 = 6.36 г.
Ответ'. 6.36 г.
3. Например, H2S2O5 - дисернистая кислота:
но-s-юн
О
Степени окисления элементов: И4, О-2, S+3 и S+5.
Также условиям задачи удовлетворяет тиосульфат натрия Na2S2O3.
4. а) КОН + СО2 — КНСО3
б) 4Mg + 10НИО3(разб) — 4Mg(NO3)2 + NH4NO3 + 3H2O
в) 5КС1О3 + 6Р — 5КС1 + ЗР2О5
г) Р13 + ЗН2О -> Н3РО3 + 3HI
5. Fe + 2НС1 —♦ FeCl2 + Н2Т
2FeCl2 + Cl2 — 2FeCl3
FeCl3 + ЗКОН — Fe(OH)3i + 3KC1
2FeCl3 + 3C12 + 16KOH — 2K2FeO4 + 12KC1 + 8H2O
K2FeO4 + BaCl2 — BaFeO4i + 2KC1
6. 1) Рассмотрим водородный двигатель. Работа, совершенная двигателем:
А = Wt = 75 кВт • 3600 с = 2.7- 10s кДж.
Необходимая теплота:
Q = А / п = 2.7• 105 / 0.2 = 1.35-106 кДж.
(Fe° -> Fe+2)
(Fe+2 -> Fe+3)
(Fe+3 -> Fe+3)
(Fe+3 -> Fert)
Решения заданий
67
Количество вещества водорода:
v(H2) = Q / бт = 135-106 кДж / 240 кДж/моль = 5625 моль.
Объем водорода:
И(Н2) = v • Ит = 5625 моль • 0.0224 м3/моль = 126 м3.
2) Объем углекислого газа:
СНд + 2Н2О — СО2 + 4Н2,
К(СО2)= Г(Н2)/4 = 31.5 м3.
3) Рассмотрим двигатель на сжиженном газе. Необходимая теплота:
Q = А / п = 2.7-105 / 0.4 = 6.75-105 кДж.
Количество вещества пропана:
v(C3H8) = Q / Qm = 6.75-105 кДж / 2200 кДж/моль - 307 моль.
Объем пропана:
К(С3Н8) = v-М/ р = 307 моль • 44 г/моль / 550 г/л = 24.5 л.
Объем углекислого газа:
С3Н8 + 5О2 — ЗСО2 + 4Н2О.
v(CO2) = 3-307 = 921 моль.
Г(СО2) = v-Km = 921 моль • 0.0224 м3/моль = 20.6 м3.
Получается, что двигатель, работающий на сжиженном газе, более экологичен,
чем водородный, в отношении выделения углекислого газа.
Ответ: 1) 126 м3, 2) 31.5 м3, 3) 24.5 л, 20.6 м3.
7. Продукт Г - карбонат калия. Подтвердим расчетом: в карбонате калия
®(С) = 12 / 138 = 0.087 (или 8.7%),
о(О) = 3 • 16 / 138 = 0.3478 (или 34.78%).
Уравнения описанных в задании реакций:
К + О2 —КО2,
4КО2 + 2СО2 — 2К2СО3 + ЗО2Т.
Ответ: А - К, Б - О2, В - КО2, Г - К2СО3.
Вариант Декабрь - 2
1. Cs4O.
2. 10.4 г.
3. Условиям задачи удовлетворяют N2O - оксид азота(1), нитрит аммония
NHL|NO2. Степени окисления элементов в оксиде: О"2, № и N+2.
4. a) NaOH + SO3 — NaHSO4
б) Mg3N2 + 8HNO3 — 3Mg(NO3)2 + 2NH4NO3
в) 2KBrO3 + 3S — 2KBr + 3SO2
r) SO2C12 + 2H2O — H2SO4 + 2HC1
5. Mn + 2HC1 -»MnCl2 + H2T (Mn° Mn+2)
MnCl2 + 2KOH -» Mn(OH)2i + 2KC1 (Mn+2 Mn+2)
Mn(OH)2 + Cl2 + 2KOH -» MnOj + 2KC1 + 2H2O (Mn+2 -> Mn+4)
68
Олимпиада «Ломоносов», заочный тур
2МпО2 + ЗРЬО2 + 6HNO3 — 2НМпО4 + 3Pb(NO3)2 + 2Н2О (Мп44 -» Мп47)
2НМпО4 + 2КОН—> К2МпО4 + МпО21 + 02Т + 2Н2О. (Мп47 -> Мп* + Мп44)
6. 1) 28.4 мин и 3.06 ч, 2) а) 9.94 м3, б) 42 м3.
7. А - Na, Б - О2, В - Na2O2, Г - Na2CO3.
Вариант Декабрь - 3
1. А&С9.
2. 2.5 г.
3. Р4О8 - октаоксид тетрафосфора. Степени окисления: О 2, Р43 (два атома) и Р+5
(два атома).
4. a) FeCl3 + ЗКНСО3 — Fe(OH)3i + 3CO2f + ЗКС1
или 2FeCl3 + ЗК2СО3 + ЗН2О — 2Fe(OH)3| + 3CO2t + 6КС1, б) 3Zn + 4H2SO< — 3ZnSO4 + SI + 4H2O в) Na2CO3 + SiO2 ——» Na2SiO3 + CO2f r) PC15 + 4H2O -> H3PO4 + 5HC1
5. Cu + Cl2 — CuCl2 (Си0— ► Cu*2)
CuCl2 + Cu 2CuCI (Cu*2 - -+ Cu*1)
2CuCl + Cl2 + 12NH3 + 4H2O — 2[Cu(NH3)4](OH)2 + 4NH4CI (Cu*1 - -> Cu*2)
[Cu(NH3)4](OH)2 + 3H2SO4 CuSO4 + 2(NH4)2SO4 + 2H2O (Cu*2 - -> Cu*2)
CuSO4 + Fe —► FeSO4 -1- Cui 6. 1) 6.7 мин и 5.6 мин, 2) a) 2.8 м3, б) 1.5 м3. 7. А - S, Б - S2C12, В - SO2. (Cu*2 - -> Cu°)
Вариант Декабрь - 4
1. Мп3С.
2. 15.8 г.
3. C12O6 - гексаоксид дихлора. Степени окисления: О 2, СГ5 и СГ7.
4. а) А1С13 + ЗКЯСО3 — Al(OH)3j + ЗСО2Т + ЗКС1 б) КС1О3 + 6HI — КС1 + 312 + ЗН2О в) СаСО3 + SiO2 —CaSiO3 + CO2f г) СОС12 + Н2О — СО2 + 2НС1 или НСООН + С12 — СО2 + 2НС1. 5. СГ + 2НС1 — СгС12 + Н2Т (Сг°-> Сг*2)
2СгС12 + С12 — 2СгС13 (Сг*2 - > Сг*3)
2СгС13 + ЗС12 + 16КОН — 2К2СгО4 + 12КС1 + 8Н2О (Сг*3 - ^Сг*6)
2К2СгО4 + H2SO4 — К2Сг2О7 + K2SO4 + Н2О (Сг*6- ♦ Сг*6)
К2Сг2О7 + 14НС1 — ЗС12 + 2СгС13 + 2КС1 + 7Н2О (Сг*6- > Сг*3)
6. 1) 22.5 кг, 2) 63 м3, 3) 27 кг и 41 м3.
7. А - Р, Б - С12, В - РС15, Г - РОС13.
Очный тур олимпиады «Ломоносов»
Решения заданий для учащихся 10-11 классов
Вариант 1
1. Молярная масса гемоглобина
А/=2954- 12 + 4516- 1 + 780- 14 + 806- 16+12 • 32 + 4 -56 = 64388 г/моль.
Массовая доля водорода в гемоглобине составляет
©(H) = 4516 / 64388 = 0.0701 (или 7.01%).
Ответ: 7.01%.
2. Уравнения реакций:
КС1 + H2SO4(kohu) — НС1Т + KHSO4;
2КВг + 3H2SO4(kohu) — Вг2 + SO2f + 2KHSO4 + 2Н2О.
Реакция хлорида калия с серной кислотой не приводит к изменению степени
окисления хлора, а в реакции бромида калия с серной кислотой происходит
окисление бромид-иона до Вг2. Бромид-ион - более сильный восстановитель.
3. Неизвестное вещество имеет формулу XF„. Количество вещества
v(XF„) = 0.25 моль.
Значит, число молекул в этой порции составляет
У(мол) = 0.25 • Уд,
а число атомов в одной молекуле равно
У(ат) = 10.535-1023/ (0.25-6.02-10й) = 7.
Тогда число атомов фтора в молекуле равно п = 7 - 1 = 6, т. е. формула газа XF6.
Число электронов в одной молекуле У(е) = 10.535-1024 / (0.25-6.02-1023) = 70.
70 = Z+6-9,
Z = 16.
Элемент X - сера, неизвестный газ - SF6.
Ответ: SF6.
4. Структурные формулы дихлорциклобутанов:
Соединения 3 и 4 являются оптическими изомерами транс- 1,2-дихлор-
циклобутана. Молекула соединения 5 (транс-1,3-дихлорциклобутан) обладает
элементом симметрии (плоскость симметрии, показана пунктиром), следовательно,
она не имеет оптических изомеров.
Ответ: 6 изомерных дихлорциклобутанов.
70 Олимпиада «Ломоносов», очный тур
5. Массовая доля ХС12 в насыщенном растворе при 20°С составляет
©(ХС12) = 68.1 / 168.1 = 0.405,
следовательно, в 100 г исходного раствора находилось 40.5 г соли.
После добавления 14.6 г безводной соли к этому раствору выпал осадок
кристаллогидрата, над которым находится насыщенный (40.5%-ный) раствор соли:
®(ХС12) = т(ХС12) / ги(р-ра) = = 0-405,
где х - масса соли в осадке кристаллогидрата. Из полученного уравнения
(55.1 -х)177 = 0.405
находим х = 23.915 (г). Пусть М-молярная масса металла. Массовую долю безводной
соли в кристаллогидрате, равную
© = 23.915/37.6 = 0.636,
Л/ + 71 ~
можно выразить как ————Тогда из уравнения
А/ + 71 = 0.636
М + 143
получаем 55 г/моль (это марганец Мп).
Ответ', марганец.
6. Основное свойство пептидов - способность к гидролизу. Запишем уравнение
щелочного гидролиза дипептида, образованного двумя разными аминокислотами:
H2N—(j:H—с—NH—(j?H—СООН + 2KOH —► H2N—(^н—с—ОК + H2N—(^н—с—ОК + Н2О
Ri R2 Ri Rz
Сплавление продуктов гидролиза со щёлочью (реакция декарбоксилирования)
приводит к образованием соответствующих аминов:
? t°
H2N—(j?H—с—ОК + КОН —► H2N—сн2—R1 + КгСОз
Ri
H2N—(^н—с—OK + КОН —► H2N—сн2— R2 + КгСОз
R2
Образовавшиеся первичные амины реагируют с избытком азотистой кислоты,
образуя спирты:
H^-CHr-Rj + HNO2 — HO-CH^-Rj + N2f + H2O,
H2N-CH2-R2 + HNO2 HO-CH2-R2 + N2f + H2O.
В состав дипептида могут входить аминокислоты, содержащие дополнительные
карбоксильные группы (например, глутаминовая кислота) или аминогруппы
(например, лизин). Можно заключить, что один из радикалов принадлежит молекуле
лизина, а второй - глутаминовой кислоте. Таким образом, можно предположить два
варианта исходного дипептида (2 изомера), отвечающих условию задачи:
Решения заданий
71
H2N—(pH—С—NH—(pH—СООН
(CH2)4NH2 ((рн2)2
COOH
Реакция щелочного гидролиза:
H2N—(рн—с—NH—(pH—COOH
((pH2)2 (CH2)4NH2
COOH
H2N-CFHC-NH-CH—COOH + 3NaOH — H2N—(CH2)4—<pH~COONa
(CH2)4—nh2 (CH2)2 nh2
COOH
NaOOC-(CH2)2-(pH—COONa + 2Н2О
nh2
Прокаливание:
H2N—(CH2)4—(pH—COONa + NaOH — H2N-(CH2)4-<H2-NH2 + Na2CO3
nh2
e
NaOOC-tCHzfe-^H—COONa + 2NaOH— CH3~CH2-CH2-NH2 + 2Na2CO3
NH2
Реакции с азотистой кислотой:
H2N-(CH2)5-NH2 + 2HNO2 — HO—(CH2)$-OH + 2N2t + 2H2O,
НгИ-СНг-СНг-СНз + HNO2 — HO-CHr-CHr-CHa + N2f + H2O.
Ответ’, дипептид образован лизином и глутаминовой кислотой.
Участники олимпиады предложили альтернативное решение. В ходе химических
ревращений, описанных в задаче, пропанол-1 мог образоваться не из глутаминовой,
а из у-аминомасляной кислоты, природной аминокислоты, играющей важную роль в
организме:
<рн2-сн2-сн2-соон
nh2
Решение с лизином и у-аминомасляной кислотой принималось как верное при
обязательном условии - правильной записи уравнений всех реакций.
7. Зависимость массы реагента от времени для реакции первого порядка:
т(0 =
По условию, кислорода получено
v(O2) = 20.75 / 22.4 = 0.926 моль,
значит, пероксида разложилось
v(H2O2) = 0.926 • 2 = 1.853 моль,
т(Н2О2) = 1.853 • 34 = 63 г.
Осталось пероксида т(Н2О2) = 72 - 63 = 9 г. Тогда
72
Олимпиада «Ломоносов», очный тур
30
отсюда —=3, Т]/2 = 30/3 = 10 мин.
Г1/2
Ответ'. 10 мин.
8. Один из вариантов решения:
1) SO2 + С12 —=-► SO2C12,
2) SO2 + I2 + Н2О -> H2SO4 + 2HI,
3) 2H2SO4(kohii.) + Na2SO3(TB.) —> SO2J + 2NaHSO4 + H2O
или 2H2SO4(kohii.) + Cu ——» CuSO4 + SO2f + 2H2O,
4) 5SO2 + 2KMnO4 + 2H2O K2SO4 + 2MnSO4 + 2H2SO4,
5) SO2C12 + 2H2O -> H2SO4 + 2HC1,
6) SO2C12 + 4KOH -> K2SO4 + 2KC1 + 2H2O.
Ответ'. A - SO2.
9. Реакция полного сгорания углеводорода СХН/
QH, + (х+0.25у)О2 —<-► лСО2 + 0.5уН2О.
Найдем среднюю молярную массу образовавшейся газовой смеси (СО2 и Н2О):
Л/ср = 17 • 2 = 34 г/моль.
Выразим среднюю молярную массу смеси через молярные массы и количества
компонентов смеси:
44х±18^5у=34
х + 0.5у
Отсюда получаем соотношение у = 1.25л. Установим простейшую формулу
исходного углеводорода: х : у = 1 : 1.25 = 4 : 5, простейшая формула С4Н5, ей не
соответствует ни один углеводород. Подходит углеводород С8Н10, и, поскольку при
хлорировании образуется смесь двух изомеров, то искомый углеводород - это
этилбензол, а не диметилбензол:
С<Н2СН3
J hv
|| + 2С12 -►
снс1сн3
аСН2СН2С1
+ 2НС1
Реакция сжигания: С8Н10 + Ю.5О2 —8СО2 + 5Н2О,
v(C8Hio) = 10 /106 = 0.094 моль,
v(O2) = 10.5 • 0.094 = 0.987 моль,
Решения заданий
73
Один из возможных путей синтеза этилбензола из метана:
1500 °C
1)2СН4 ----► НС=СН+ЗН2
Сакт
2)ЗНС=СН ------*
600 °C
Pt,P
3) НС=СН + 2Н2 -----► С2Нб
hv
4) С2Нб + Вг2 --► С2Н5ВГ + НВг
+ С2Н5Вг
А1С13
+ НВг
Ответ: этилбензол, 24.13 л.
10. При высокотемпературном хлорировании оксида Х2О3 в присутствии угля
образуется хлорид этого металла (вещество А) и оксид углерода(П) (газ В):
Х2О3 + ЗС + 0.5иС12 —!-► 2ХС1Л + ЗСОТ.
Оксид углерода(11) при пропускании через аммиачный раствор оксида серебра
восстанавливает серебро до металла:
2[Ag(NH3)2]OH + СО — 2Ag Ф + (NHthCOj + 2NH3.
v(Ag) = 226.8 / 108 = 2.1 моль,
v(CO) = 0.5v(Ag) = 1.05 моль,
v(X2O3) = 1.05 / 3 = 0.35 моль.
Значит, Л/(Х2О3) = 35.7 / 0.35 = 102 г/моль, отсюда Л/(Х) = 27 г/моль. Металл X -
алюминий, его хлорид (вещество А) - А1С13.
v(A!Cl3) = 2v(Al2O3) = 0.7 моль.
Для обработки 0.7 моль хлорида алюминия было взято раствора гидроксида
натрия
m(p-pa) = V • р = 574.71 • 1.16 = 666.66 г,
содержащего щелочи
v(NaOH) = 666.66 • 0.15 / 40 = 2.5 моль.
При взаимодействии хлорида алюминия с раствором гидроксида натрия
протекают следующие реакции:
А1С13 + 4NaOH — Na[Al(OH)4] + 3NaCl,
У у Зу
А1С13 + 3NaOH — А1(ОН)3| + 3NaCL
0.7-у 3(0.7—у) 0.7-у 3(0.7-у)
v(NaOH) = 2.5 моль = 4у + 3(0.7 - у), тогда у = 0.4 моль.
v(Al(OH)3) = 0.7 - 0.4 = 0.3 моль,
ш(А1(ОН)3) = 78 • 0.3 = 23.4 г.
В растворе над осадком гидроксида алюминия содержатся соли Na[Al(OH)4] и
NaCl:
74 Олимпиада «Ломоносов», очный тур
v(Na[Al(OH)4]) = 0.4 моль,
v(NaCl) = Зу + 3(0.7 - у) = 2.1 моль.
Масса раствора составляет
т(р-ра) = /и(А1С13) + m(NaOH(p-p)) - m(Al(OH)3) = 133.5 • 0.7+ 666.66 - 23.4 = 736.71 г.
®(Na[Al(OH)4]) = 118 • 0.4 / 736.71 = 0.064 (или 6.40%),
®(NaCl) = 58.5 • 2.1 / 736.71 = 0.1667 (или 16.67%).
Алюминий получают электролизом расплава оксида алюминия в криолите
Na3AlF6: /
2А12О3(расплав) —► 4А1 + ЗО2.
Ответ: 23.4 г осадка АЦОНЬ; 6.40% Na[Al(OH)4], 16.67% NaCl.
Вариант 2
1. Молярная масса хлорофилла
А/= 55 • 12 + 72 • 1 + 5 • 16 + 4 • 14 + 1 • 24 = 892 г/моль.
Массовая доля углерода в хлорофилле составляет
ш(С) = 660 / 892 = 0.7399 (или 73.99%).
Ответ: 73.99%.
2. Уравнения реакций:
КС1 + Н28О4(конц) -> HClf + KHSO4;
8KI + 9H2SO4(kohu) — 4I2 + H2Sf + 8KHSO4 + 4H2O.
Реакция хлорида калия с серной кислотой не приводит к изменению степени
окисления хлора, а в реакции иодида калия с серной кислотой происходит окисление
иодид-иона до 12 (как правильные, принимались уравнения реакций KI с серной
кислотой, в которых сера восстанавливается до S0 или до $О2). Иодид-ион - более
сильный восстановитель.
3. Неизвестное газообразное вещество имеет формулу AsHal„. Количество
вещества равно
v(AsHal„) = 4.48 / 22.4 = 0.2 моль.
Значит, число молекул вещества в этой порции составляет
У(мол) = 0.2 • Уд,
а число атомов в одной молекуле равно
Мат) = 7.224-1023 / (0.2-6.02-1023) = 6.
Тогда число атомов галогена в молекуле равно п = 6 - 1 = 5, т. е. формула газа
AsHal5.
Число электронов в одной молекуле составляет
У(е) = 9.3912-1024/ (0.2 - 6.02-1023) = 78.
78 = 33 + 5-Z,
Z = 9.
Неизвестный элемент - фтор, искомый газ - AsF5.
Ответ: AsF5.
Решения заданий 75
4.
5 6 7
Вещества 3 и 4, а также 5 и 6 являются оптическими изомерами.
Ответ'. 7 изомерных динитроциклопентанов.
5. Массовая доля Х2СО3 в насыщенном растворе при 20°С составляет
ш(Х2СО3) = 21.5 /121.5 = 0.177,
следовательно, в 100 г исходного раствора находилось 17.7 г соли.
После добавления безводной соли к этому раствору выпал осадок
кристаллогидрата, над которым находится насыщенный (17.7%-ный) раствор соли:
®(Х2СО3) = m(X2CO3) / m(p-pa) = = о. 177,
где х - масса соли в осадке кристаллогидрата. Из полученного уравнения
находим х - 15.94 (г). Пусть Л/ - молярная масса металла. Массовую долю соли в
осадке кристаллогидрата, равную
© = 15.94/43.1 =0.37,
2Л/ + 60 т
можно выразить как---------------. Тогда из уравнения
2Л/ + 60 + 10-18
2А/ + 60=0.37
2Л/ + 240
получаем М ~ 23 г/моль (это натрий Na).
Ответ', натрий.
6. Основное свойство пептидов - способность к гидролизу. Запишем уравнение
щелочного гидролиза дипептида, образованного двумя разными аминокислотами:
? ? ч
H2N— <j!H—C-NH—COOH + 2KOH —► H2N—<рн—c—OK + HjN—<рн—с—OK + НгО
Ri R2 Ri Rj
Сплавление продуктов гидролиза co щёлочью (реакция декарбоксилирования)
приводит к образованием соответствующих аминов:
76
Олимпиада «Ломоносов», очный тур
H2N—(j?H—с—ОК + КОН —► H1N—сн2— R1 + К2СО3
R1
H2N—(j?H—с—ОК + КОН —► H2N—сн2— R2 + КгСОз
Rz
Образовавшиеся первичные амины реагируют с избытком азотистой кислоты,
образуя спирты:
H^-CHz-R! + HNO2 — НО-СНг-R! + N2f + Н2О,
H2N-CHr-R2 + HNO2 — HO-CHr-R2 + N2f + H2O.
В составе дипептида могут быть аминокислоты, содержащие дополнительные
карбоксильные группы (например, глутаминовая кислота) или аминогруппы
(например, лизин). Один из радикалов принадлежит молекуле лизина, а второй -
глицину. Можно предположить две формулы исходного дипептида, отвечающих
условию задачи:
О О
II II
H2N-CH2—C-NH—CH—COOH H2N-CH—C-NH—СН2—СООН
(CH2)4NH2 (CH2)4NH2
Реакция щелочного гидролиза дипептида:
H2N-CH-C-ЬЯЬ-СН2-СООН + 2NaOH — H2N-^CH2)4-^H-COONa
(СН2)4—nh2 nh2
+ H2<p—COONa + H2O
NH2
Прокаливание:
H2N—(СН2)4—CHf~NH2 4- Na2CO3
NH2
e
H2p~COONa + NaOH —’ CH3~NH2 + Na2CO3
NH2
Реакции с азотистой кислотой:
H2N-(CH2)5-NH2 + 2HNO2 -> HO—(CH2)5-OH + 2N2| + 2H2O,
H2N-CH3 + HNO2 -* HO-CH3 + N2f + H2O.
Ответ', дипептид образован лизином и глицином.
7. Зависимость массы реагента от времени для реакции первого порядка:
Решения заданий
77
По условию, этилена получено
v(C2H4) = 29.738 / 22.4 = 1.328 моль,
значит, ацетона разложилось такое же количество, и
т(ацетона) = 1.328 • 58 = 77 г.
Осталось т(ацетона) = 88 - 77 = 11 г. Тогда
ll-ss/iy"'
№.п,1.ОУ
uj 88 8
72
отсюда — = 3, Т1/2 = 72 /3 = 24 мин.
Г1/2
Ответ'. 24 мин.
8. Один из вариантов решения:
1)НЮ3 + 5Н1 -»3121 + ЗН2О,
2) 12 + 5Н2О2 (30%) —2НЮ3 + 4Н2О
или I2 + 10HNO3 (конц.) ——-> 2НЮ3 + 10NO2f + 4Н2О,
3) 12+ ЗС12 21С13,
4) 6IC13 + 12Ba(OH)2 2Ва(Ю3Ъ + Ва12 + 9ВаС12 + 12Н2О,
5) 612 + 6Ва(ОН)2 -» ВаСЮзЬ + 5Ва12 + 6Н2О,
6) Ва(Ю3)2+ Н28О4(разб.) -> BaSO4l + 2НЮ3.
Ответ'. А -12.
9. Реакция полного сгорания углеводорода СГН/
CXHV + (х+0.25у)О2 —хСО2 + 0.5уН2О.
Найдем среднюю молярную массу образовавшейся газовой смеси (СО2 и Н2О):
Л/ср = 18.455 • 2 = 36.91 г/моль.
Выразим среднюю молярную массу смеси через молярные массы и количества
компонентов смеси:
м = 44x+18 0.5j> = 36 91
с₽ х + 0.5у
Отсюда получаем соотношение 1.333у = х. Установим простейшую формулу
исходного углеводорода: х : у = 4 : 3, простейшая формула С4Н3, такой формуле не
соответствует ни один углеводород. Истинная формула углеводорода С8Нб. По
условию, 0.01 моль углеводорода присоединяет бром в количестве
v(Br2) = 32 • 0.1 / 160 = 0.02 моль.
Если при бромировании требуется двукратное количество брома, то исходный
углеводород - это алкин или диен. Подходящий углеводород - фенилацетилен:
78
Олимпиада «Ломоносов», очный тур
СВГ2СНВГ2
г
Реакция сгорания:
С8Нб + 9.5О2 —^->8СО2 + ЗН2О,
у(С8Нб) = 10 / 102 = 0.098 моль,
v(O2) = 9.5 • 0.098 = 0.931 моль,
К(О2)=^=0^1±ЗЬ298=22 76л.
р 101.3
Один из возможных путей синтеза фенилацетилена из метана:
1500 °C
1) 2СН4 ---► нс=сн+зн2
3) НС=СН + 2Н3
Сакт
2)ЗНС=СН ------*
600 °C
Pt,P
-----► С2Н6
hv
4) С2Нб + Вг2 ------► С2Н5ВГ + НВг
+ С2Н5Вг
СВГ2СН3
AICI3
СВГ2СН3
+ 2КОН
+ 2НВг
7)
спирт
+ 2КВг + 2Н2О
Ответ', фенилацетилен, 22.76 л.
10. При высокотемпературном хлорировании оксида металла X состава ХО в
присутствии угля образуется хлорид этого металла (вещество А) и оксид углерода(П)
(газ В):
ХО + С + 0.5пС12 —£-> ХС1„ + СОТ
Оксид углерода(П) восстанавливает палладий до металла при пропускании этого
газа через водный раствор хлорида палладия:
PdCl2 + СО + Н2О -» Pdi + СО2 + 2НС1
XX X
Количество палладия:
v(Pd) = 47.7 / 106 = 0.45 моль.
Значит, Л/(ХО) = 11.25 / 0.45 = 25 г/моль, Л/(Х) = 9 г/моль. Металл X - бериллий,
его хлорид (вещество А) - ВеС12, v(BeCl2) = 0.45 моль.
Решения заданий 79
Для обработки 0.45 моль хлорида бериллия было взято раствора гидроксида
калия
т(р-ра) = 647.93 1.10 = 712.72 г,
содержащего щелочи
v(KOH) = 712.72 • 0.11 / 56 = 1.4 моль.
При взаимодействии хлорида бериллия с раствором гидроксида калия протекают
следующие реакции:
ВеС12 + 4КОН — К2[Ве(ОН)4] + 2КС1,
у у Ъ
ВеС12 + 2КОН — Ве(ОН)2| + 2КС1.
0.45-у 2(0.45-у) 0.45-у 2(0.45-у)
v(KOH) = 1.4 моль = 4у + 2(0.45 - у), тогда у = 0.25 моль.
Количество вещества и масса осадка:
v(Be(OH)2) = 0.45 - 0.25 = 0.2 моль,
т(Ве(ОН)2) = 43 0.2 = 8.6 г.
В растворе над осадком гидроксида бериллия находятся соли K2[Be(OH)4] и КС1
в следующих количествах:
v(K2[Be(OH)4]) = у = 0.25 моль, v(KCl) = 2у + 2(0.45 -у) = 0.9 моль.
Масса раствора и массовые доли солей:
m(p-pa) = m(BeCl2) + m(KOH(p-p)) - т(Ве(ОН)2) = 80 • 0.45 + 712.72 - 8.6 = 740.12 г.
ш(К2[Ве(ОН)4]) = 155 • 0.25 / 740.12 = 0.0524 (или 5.24%),
®(КС1) = 74.5 • 0.9 / 740.12 = 0.0906 (или 9.06%).
Бериллий получают из фторида бериллия металлотермией. Для восстановления
металла используют магний или кальций:
BeF2 + Mg —£—> Be + MgF2.
Можно также получить бериллий электролизом расплава его хлорида в
присутствии хлорида натрия: £
ВеС1г(расплав, NaCl) —► Be + Cl2.
Ответ: 8.6 г осадка ВефНЪ; 5.24% К2[Ве(ОН)4], 9.06% КС1.
Решения заданий для 5-9 классов
1. Пусть формула кристаллогидрата - MSO4 • иН2О. Мольная доля кислорода в
4 + и
кристаллогидрате составляет х(О) = 0.5 =----,
6 + Зи
откуда находим значение п = 2.
Выразим массовую долю кислорода в MSO4 • 2Н2О:
ш(О)= 0.558 =
_______616________
А/(М) + 32 + 416 + 218
откуда определяем молярную массу металла А/(М) = 40 г/моль. Это - кальций Са.
Кристаллогидрат - CaSO4 • 2Н2О.
Ответ: CaSO4 • 2Н2О.
80
Олимпиада «Ломоносов», очный тур
2. Возможные варианты реакций:
а) Н2 + С12 — 2НС1
б) SO3 + Н2О — H2SO4
в) Р2О5 + ЗН2О — 2Н3РО4
г) ВаС12 + H2SO4 — BaSO4j + 2НС1,
д) NaHF2 —> NaF + HFT.
Примечание: в пункте д) варианты с кислыми солями неустойчивых кислот -
угольной и сернистой - не принимались, так как в этом случае при разложении
образуется кислотный оксид, а не кислота. Также не принимались гидросульфаты - у
щелочноземельных металлов они не существуют, а у щелочных разлагаются с
выделением воды, а не серной кислоты.
3. Найдем массы компонентов раствора и его массу:
m(HNO3) = 500 • 1.51 =755 г,
ш(Н20) = 1000 г,
т(р-ра) = 1000 + 755 = 1755 г.
Массовая доля кислоты:
co(HN03) = 755 / 1755 = 0.430 (или 43.0%).
Определим молярную концентрацию кислоты:
v(HNO3) = 755 / 63 = 11.98 моль,
c(HNO3) = 11.98 / 1.38 = 8.68 моль/л,
р(р-ра) = 1755 / 1380 = 1.27 г/мл.
Ответ: 43.0%, 8.68 М, 1.27 г/мл.
4. a) H2S + Вг2 — S1 + 2НВг,
б) 2С1О2 + 2NaOH -> NaClO2 + NaClO3 + Н2О,
в) СаОС12 + СО2 —► СаСО3 + С!^
г) 2Pb(NO3)2 + 2К2СО3 + Н2О — РЬ^ОН^СОз + 4KNO3 + СО2.
5. Найдем количество серной кислоты, которое одинаково во всех четырех
опытах: v(H2SO4) = 19.6 / 98 = 0.2 моль.
а) Си + 2HjSO4 -»CuSO4 + SO2t + 2Н2О.
v(SO2) = 0.5 • v(H2SO4) = 0.1 моль,
P(SO2) = 0.1 -22.4 = 2.24 л.
6) Na2SO3 + H2SO4 — Na2SO4 + SO2t + H2O.
v(SO2) = v(H2SO4) = 0.2 моль,
P(SO2) = 4.48 л.
в) S + 2H2SO4 — 3SO2T + 2H2O.
v(SO2) = 1.5 • v(H2SO4) = 0.3 моль,
K(SO2) = 6.72 л.
г) SC12 + H2SO4 -»2SO2T + 2HC1.
v(SO2) = 2 • v(H2SO4) = 0.4 моль,
Решения заданий
81
K(SO2) = 8.96 л.
Возможны и другие варианты решения.
6. Исходное вещество может быть гидроксидом бария, его кристаллогидратом
или кристаллогидратом пероксида бария. В любом случае после прокаливания при
высокой температуре остается ВаО.
v(BaO) = 6.12 / 153 = 0.04 моль.
Всех остальных соединений бария - тоже по 0.04 моль. Найдем их молярные
массы и формулы.
6.76 / 0.04 = 169 г/моль - это соответствует ВаО2,
12.52 / 0.04 = 313 г/моль - это кристаллогидрат ВаО2 • 8Н2О.
При первоначальном нагревании ВаО2 • 8Н2О теряет кристаллизационную воду:
ВаО2 • 8Н2О —!-> ВаО2 + 8H2Ot,
а затем теряет кислород и превращается в оксид бария:
2ВаО2 —!-> 2ВаО + О2.
v(H2O) = 1.44 / 18 = 0.08 моль.
В качестве правильного принимался также вариант с веществами Ва(ОН)2 • 8Н2О
и Ва(ОН)2, хотя он не совсем точно соответствует массам в условии.
Оксид бария присоединяет двойное количество воды, это приводит к
образованию моногидрата гидроксида бария:
ВаО + 2Н2О — ВаСОНЬ Н2О.
7. Парниковый газ Y, входящий в состав воздуха, - это СО2. Молярная масса
смеси СО2 с газом Z составляет = 29 • 0.966 = 28 г/моль.
Поскольку Л/(СО2) > 28 г/моль, следовательно, A/(Z) < 28 г/моль. Кроме того,
известно, что Z реагирует с Са(ОН)2, образуя осадок, не растворимый в разбавленных
кислотах. Этим условиям удовлетворяет только HF.
Найдем состав смеси СО2 и HF. Пусть объемная доля СО2 равна х, тогда
44х 4-20( 1 - х) = 28,
х = 0.333.
Состав смеси: 33.33% СО2, 66.67% HF.
Газ X имеет молярную массу
Л/(Х) = 33 • 2 = 66 г/моль,
и при гидролизе дает смесь СО2 и HF в соотношении 1 : 2:
X + Н2О — СО2 + 2HF.
Газ X - это COF2. Уравнения реакций:
COF2 + Н2О — СО2 + 2HF,
СО2 + Са(ОН)2 — СаСОзФ + Н2О,
2HF + Са(ОН)2 — CaF2i + 2Н2О,
СаСО3 + 2НС1 — СаС12 + CO2t + Н2О.
Ответ: X - COF2, Y - СО2, Z - HF; 33.33% СО2 и 66.67% HF.
Решения экзаменационных задании
Дополнительный письменный вступительный экзамен
Вариант 1
1. Таким изомером является циклопентан, в молекуле которого все атомы
углерода - вторичные:
2. Электронные конфигурации:
Со 1?2?2р63?3р64?3^7 и Со3+1?2Лр63?ЗрбЗ^.
При образовании катиона сначала уходят 45-электроны, и только потом - 3J-
электроны. Таким образом, ион Со3+ содержит 4 неспаренных электрона, их масса
равна
/и = 4 • 9.110-31 = 3.641O-30 кг.
3. Поглотится только бутин-1, метан и пропен не реагируют:
С2Н5-ОСН + [Cu(NH3)2]C1 C2Hs-C^CCul + NH4C1 + NH3,
Аммиак хорошо растворим в воде, поэтому в этой реакции он не выделяется. Так
как исходно были взяты равные объемы газов, объем смеси сократился в 3 / 2 = 1.5
раза (все объемы измеряются при одинаковых условиях).
Ответ: объем уменьшился в 1.5 раза.
4. Растворение бромида свинца:
РЬВг2 « РЬ2+ + 2Вг”
х х 2х
Пусть х моль/л - растворимость (концентрация насыщенного раствора) бромида
свинца в воде, тогда
ПР(РЬВг2) = [Pb2+][Br“j2 = х (2х)2 = 4?,
х = = 1.3-10-2 (моль/л).
Чтобы перейти к единицам г/л, домножим молярную концентрацию на
молярную массу соли (Л/(РЬВг2) = 367 г/моль):
с = 367- 1.3-10-2~ 4.77 г/л.
Ответ: 4.77 г/л.
Решения заданий 83
5. Происходит растворение марганца и выделение серебра на пластинке:
Мп + 2AgNO3 -> Mn(NO3)2 + 2Ag
х 2х
Изменение массы пластинки:
Am = m(Ag) - т(Мп) =108-2*- 55*,
* = 1.61 / 161 = 0.01 моль.
Серебра выделилось m(Ag) = 108 • 0.02 = 2.16 г.
Чтобы масса марганцевой пластинки в ходе реакции уменьшилась, можно
погрузить ее, например, в раствор хлорида хрома(Ш) или железа(Ш):
Мп + 2СгС13 -> МпС12 + 2СгС12.
Еще один вариант - погрузить пластинку в раствор соли аммония. Будет
происходить растворение марганца:
Мп + 2NH4CI -> МпС12 + 2NH3 + H2f
Ответ'. 2.16 г Ag; например СгС13, NH4C1.
6. Определим химический состав газовой смеси.
Л/(В) = 1.59 • 29 = 46 г/моль.
По условию, объемные доли газов В и С равны 0.8 и 0.2 соответственно.
Средняя масса газовой смеси составляет
Мр = ф1 • М(С) + ф2 • А/(В) = 0.2 • М(С) + 0.8 • 46 = 43.2 г/моль,
отсюда Л/(С) = 32 г/моль. Можно сделать предположение, что В - это NO2, а С - О2.
Определим неизвестный металл. Количество водорода, затраченного на
восстановление оксида ХО:
/и ч Pv 101.3 0.51
v(H2) = £— =---------= 0.01 моль.
RT 8.31-623
Реакция восстановления оксида водородом:
ХО + Н2 —X + Н2О,
Л/(ХО) = 2.23 / 0.01 = 223 г/моль,
Л/(Х) = 223 - 16 = 207 г/моль,
значит, неизвестный металл - свинец, а ХО - это оксид свинца(И). Тогда А - это
нитрат свинца Pb(NO3)2:
2Pb(NO3)2 —2РЬО + 4NO2f + O2f.
Ответ: А - Pb(NO3)2; В - NO2; С - О2; ХО - РЬО.
7. 1) СаС2 + 2НС1 —► СаС12 + HOCHJ
2) HOCH + Н2О > СН3-СНО
3) сн3—+ СН3—сн2—MgBr Эфир> СН3—<рн—СН2-СН3
” OMgBr
4) сн3-(рн-сн2-сн3 + Н2о--------► Mg(OH)Br+ СНз-^Н-СНг-СНз
OMgBr ОН
84
Дополнительное вступительное испытание
^-СН2-СНз
5) СНз-С^—СН2—СН3 + СиО —СН3—СН2~СН3 + Си + Н2О
ОН
6) сн3-<р—сн2-сн3 + HCN -KCN> сн3—
о сн
8. 1) 2Fe + 6H2SO4(kohu.) —Fe^SCUh + 3SO2f +6Н2О
2) Fe2(SO4)3 + 6КОН(р-р) -> Fe(OHbi + 3K2SO4
3) 2Fe(OH)3 + 3Br2 + 10KOH(p-p) —2K2FeO4 + 6KBr + 8H2O
4) 4K2FeO4 + 10H2SO4 -> ZFe^SO^ + 4K2SO4 + 3O2f + 10H2O
5) Fe^SC^b + 2KI(p-p) —2FeSO4 + I2{ + K2SO4
6) FeSO4 + BaCl2 —► BaSO4| + FeCl2
Ответ: X - Fe2(SO4)3.
9. Так как фосфор и углерод не реагируют ни с аммиаком, ни с соляной
кислотой, можно предположить, что сначала в растворе аммиака растворился цинк, а
затем неизвестный металл, не прореагировавший с аммиаком, растворился в соляной
кислоте.
При растворении цинка в растворе аммиака выделяется водород:
Zn + 4NH3 + 2Н2О — [Zn(NH3)4](OH)2 + H2t
v(H2) = 4.48 / 22.4 = 0.2 моль,
значит, в соответствии с уравнением реакции, в смеси было 0.2 моль цинка, его масса
составляла
m(Zn) = 0.2 • 65 = 13 г.
Фосфор был переведен в раствор горячей концентрированной щелочью:
4Р + 3NaOH + ЗН2О —РН3| + 3NaH2PO2
Выделившийся фосфин обесцветил подкисленный раствор перманганата калия:
5РН3 + 8КМпО4 + 12H2SO4 — 5Н3РО4 + 8MnSO4 + 4K2SO4 + 12Н2О
v(KMnO4) = с • V = 0.4 • 0.4 = 0.16 моль,
значит, v(PH3) = 0.16-5/8 = 0.1 моль a v(P) = 4 • 0.1 = 0.4 моль. Масса фосфора:
т(Р) = 0.4 • 31 = 12.4 г.
Углерод прореагировал с концентрированной серной кислотой:
С + 2Н28О4(конц.) —СО2Т + 2SO2j + 2Н2О.
Выделившийся газ содержал оксид серы(ГУ), который обесцветил иодную воду:
SO2 +12 + 2Н2О -> H2SO4 + 2HI
По условию, иода было 0.3 моль, следовательно, SO2 было также 0.3 моль, а
оксида углерода - в два раза меньше, 0.15 моль. Значит, v(C) = 0.15 моль, а масса
углерода равна
Решения заданий
85
m(C) = 0.15- 12 =1.8 г.
Неизвестного металла X в смеси было
т(Х) = 41.2 - 13 - 12.4 - 1.8 = 14 г.
Металл X, валентность которого нам не известна, растворился в соляной
кислоте:
X + «НС1 — ХС1„ + 0.5лН2Т
v(H2) = 5.6 / 22.4 = 0.25 моль.
Если металл был одновалентный (п = 1), то Л/(Х) = 14 / 0.5 = 28 г/моль - такого
металла нет. Предположим, что п = 2, тогда Л/(Х) = 14 / 0.25 = 56 г/моль. Металл X -
железо. Состав исходной смеси:
co(Zn) = 13 /41.2 = 0.3155 или 31.55%,
<о(Р) = 12.4 /41.2 = 0.3010 или 30.10%,
<о(С) = 1.8 /41.2 = 0.0437 или 4.37%,
co(Fe) = 14 /41.2 = 0.3398 или 33.98%.
Ответ: железо; 31.55% Zn, 30.10% Р, 4.37% С, 33.98% Fe.
10. Найдем количество хлора:
v(Cl2) = 0.785 / 22.4 = 0.035 моль.
С хлором может реагировать либо муравьиная кислота, которая окисляется до
углекислого газа (при этом образуется НС1), либо непредельная кислота,
присоединяющая хлор по кратной связи. По условию задачи в реакции выделяется
углекислый газ, следовательно, одна из кислот - муравьиная:
НСООН + С12 — СО2Т + 2НС1
v(CO2) = v(HCOOH) = 0.224 / 22.4 = 0.01 моль.
Масса муравьиной кислоты
т(НСООН) = 0.01 • 46 = 0.46 г,
тогда масса второй кислоты равна т = 2.26 - 0.46 = 1.8 г.
Со второй кислотой прореагировал хлор в количестве
v(Cl2) = 0.035 - 0.01 = 0.025 моль,
и, если эта кислота содержит одну двойную связь, тогда
у(кислоты) = v(Cl2) = 0.025 моль.
Найдем ее молярную массу:
М = т / v = 1.8 / 0.025 = 72 г/моль.
Это одноосновная кислота с брутто-формулой С3Н4О2. Формуле соответствует
пропеновая (акриловая) кислота СН2=СН-СООН:
СН2=СН-СООН + С12 — СН2С1-СНС1-СООН.
В результате реакции муравьиной кислоты с хлором в растворе находятся
сильная соляная кислота в количестве 0.02 моль и более слабая 2,3-дихлорпропановая
86
Дополнительное вступительное испытание
кислота В присутствии сильной кислоты диссоциация более слабой подавлена,
значение pH раствора определяется диссоциацией сильной кислоты. Найдем
концентрацию ионов FT.
Масса конечного раствора
т = т(Н2О) + т(кислот) + m(Cl2) - т(СО2) = 400 + 2.26 + 2.49 - 0.44 = 404.3 г.
Поскольку плотность раствора равна единице, объем раствора
V= 404.3 мл = 0.4043 л.
с(НС1) = v / V = 0.02 / 0.4043 = 0.0495 моль/л.
Соляная кислота - сильная, диссоциирует нацело, поэтому [Н4] = 0.0495 моль/л,
pH = -lg[H4] = 1.31.
Найдем количество углекислого газа:
5НСООН + 2КМпО4 + 3H2SO4 — 5СО2Т + K2SO4 + 2MnSO4 + 8Н2О
0.01 0.01
5СН2=СН-СООН + 12КМпО4 + 18H2SO4 -* 15СО2Т + 6K2SO4 + 12MnSO4 + 28Н2О
0.025 0.075
v(CO2) = 0.01 + 0.075 = 0.085 моль.
m(CO2) = 0.085-44 = 3.74 г.
Ответ: НСООН и СН2=СН-СООН; pH 1.31; 3.74 г СО2.
В работах некоторых абитуриентов рассматривалась щавелевая кислота.
Действительно, щавелевая кислота является сильным восстановителем, и можно
предположить, что это она будет реагировать с хлором.
Если мы считаем одну из кислот щавелевой, то вторая кислота - либо
муравьиная, либо неизвестная непредельная кислота, в молекуле которой есть
кратная связь. Рассмотрим первый вариант. Пусть в исходной смеси присутствовало
х моль муравьиной кислоты и у моль щавелевой НООС-СООН. Тогда
НСООН + С12 — СО2 + 2НС1
X XX
НООС-СООН + С12 — 2СО2 + 2НС1
У У 2у
Количества поглощенного хлора и выделившегося СО2 нам известны:
v(Cl2) = х + у = 0.035 моль,
v(CO2) = х + 2у = 0.01 моль.
Как видно, при решении этой системы уравнений получается отрицательное
значение у. Значит, смесь не могла состоять из щавелевой и муравьиной кислот.
Теперь рассмотрим вариант, когда смесь состояла из щавелевой и неизвестной
кислоты. Количество и массу щавелевой кислоты мы можем установить по
количеству выделившегося углекислого газа:
v(C2H2O4) = 0.01 / 2 = 0.005 моль,
Решения заданий
87
m(C2H2O4) = 90 • 0.005 = 0.45 г.
Масса второй кислоты:
т( к-ты) = 2.26 -0.45 = 1.81 г.
Предположим, что в молекуле кислоты есть одна двойная связь. Количество
кислоты определим по хлору:
у(к-ты) = v(Cl2) - v(C2H2O4) = 0.035 - 0.005 = 0.03 моль.
Тогда молярная масса кислоты:
Л/(к-ты) = 1.81 / 0.03 = 60.3 » 60 г/моль,
что соответствует уксусной кислоте, однако она не подходит (нет двойной связи).
Если молекула кислоты содержит тройную связь (или две двойные), то
Л/(к-ты) = 1.81 / 0.015 = 120.6 г/моль.
И одноосновную, и двухосновную кислоту с такой молярной массой подобрать
невозможно. Следовательно, исходное предположение о наличии в смеси щавелевой
кислоты - неправильное.
Вариант 2
1. Таким изомером является метил пропен:
fH3
СН3-С=СН2
2. Электронные конфигурации:
Со2+ 1?2?2р63?3р63</7 и Со3+ 1?2522р63?3рб3^.
При образовании катиона сначала уходят 45-электроны, и только потом - 3d-
электроны. Таким образом, ион Со3+ содержит 4 неспаренных электрона, их масса
равна
/и = 4 • 9.110-31 = 3.6410~зокг.
3. Бромная вода поглощает пропин и этилен, остается только азот:
СНз-ОСН + 2Вг2(водн. р-р)—► CH3-CBrz-CHBr2
СН2=СН2 + Вг2(водн. р-р)—► СН2Вг-СН2Вг.
Так как исходно были взяты равные объемы газов, объем смеси сократился в 3 /1 = 3
раза (все объемы измеряются при одинаковых условиях).
Ответ: объем уменьшился в 3 раза.
4. Растворение сульфида серебра:
A&S =t 2Ag+ + S2"
х 2х х
Пусть х моль/л - растворимость (концентрация насыщенного раствора) сульфида
серебра в воде, чтобы ее рассчитать, разделим приведенную в условии величину на
молярную массу соли (A/(Ag2S) = 248 г/моль):
х = 6.2-10"15 / 248 = 2.5-1017 моль/л
ПР(А&8) = [Ag+]2[S2T = (2х)2 • х = 4?,
88 Дополнительное вступительное испытание
nP(Ag2S) = 4 • (2.5- 1(Г17)3 = 6.3-1О’50.
Ответ: 6.3-1O*50.
5. Происходит растворение цинка и выделение меди на пластинке:
Zn + CuCl2 —♦ ZnCl2 + Си
х х
Изменение массы пластинки: = m(Cu) - m(Zn) = 64х - 65х = -х = -0.04 г,
х = 0.04 моль.
Меди выделилось m(Cu) = 64 • 0.04 = 2.56 г.
Чтобы масса цинковой пластинки увеличилась, необходимо погрузить ее в
раствор соли, содержащей катионы металла, стоящего правее цинка в ряду
активности металлов и имеющего ббльшее значение атомной массы. В качестве такой
соли можно предложить, например, Hg(NO3)2 или AgNO3:
Zn + 2AgNO3 —* Zn(NO3)2 + 2Ag.
Ответ: 2.56 г Си; например AgNO3.
6. Определим химический состав газовой смеси.
А/(В) = 1.59 • 29 = 46 г/моль.
По условию, объемные доли газов В и С равны 0.8 и 0.2 соответственно.
Средняя масса газовой смеси составляет
Мср = ф! • М(С) + фг • А/(В) = 0.2 • М(С) + 0.8 • 46 = 43.2 г/моль,
отсюда М(С) = 32 г/моль. Можно сделать предположение, что В - это NO2, а С - О2.
Определим неизвестный металл. Количество образовавшегося СО
PV 1.41 101.3
v(CO) = =--------= 0.03 моль.
RT 8.31-573
Реакция восстановления оксида металла углеродом:
ХО + С —X + СОТ,
Л/(ХО) = 2.43 / 0.03 = 81 г/моль,
Л/(Х) = 80 - 16 = 65 г/моль,
значит, неизвестный металл - цинк, а ХО - это оксид цинка. Тогда А - Zn(NO3)2.
2Zn(NO3)2 —2ZnO + 4NO2| + O2|.
Ответ: A - Zn(NO3)2; В — NO2; C — O2; XO - ZnO.
7. 1) СНз-СНг-СНз-Вг + Mg -> CH3-CH2-CH2-MgBr
2) CH3-CH2-CH2-MgBr + ECHO — C^-CH^H^H^MgBr
3) CH^HrCHz-CH^MgBr + H2O — СНз-СНг-СНг-СНг-ОН + Mg(OH)Br
4) СНз-СНз-СНг-СНг-ОН —CH3-CH2-CH=CH2 + H2O
5) 3CH3-CH2-CH=CH2 + 2KMnO4 + 4H2O ЗСНз-СНг-СЩОННЗН^ОН) +
+ 2MnO2| + 2KOH
6)CH3-CH2-CH-CH2+2CH3COOH^ —CH + 2H*°
6н ОН СНз
Решения заданий
89
8. 1) 2КМпО4 + K2SO3 + 2КОН(конц) ->2K2MnO4 + K2SO4 + Н2О
(или 2КМпО4(тв.) ——> K2MnO4 + MnO2 + O2j
или 4КМпО4 + 4КОН(конц) —^иж-> 4К2МпО4 + О2| + 2Н2О)
2) К2МпО4 + 8НС1(конц) —МпС12 + 2С12| + 2КС1 + 4Н2О
3) МпС12 + 2NaOH(p-p) -> Mn(OH)2l+ 2NaCl
4) 2Мп(ОН)2 + О2 -> 2МпО2 + 2Н2О
5) МпО2 + 4НС1(конц) -* МпС12 + С12Т + 2Н2О
6) МпС12 + (NH4)2S(p-p) -* MnSl + 2NH4CI
Ответ'. X - МпС12.
9. Так как медь и серебро не реагируют ни со щелочью, ни с соляной кислотой,
можно предположить, что сначала в щелочи растворился цинк, а затем неизвестный
металл, не прореагировавший со щелочью, растворился в соляной кислоте.
При растворении цинка в щелочи выделился водород:
Zn + 2NaOH + 2Н2О — Na2[Zn(OH)4] + H2t
v(H2) = 4.48 / 22.4 = 0.2 моль,
значит, в смеси содержалось 0.2 моль цинка, его масса составляла
m(Zn) = 0.2 • 65 = 13 г.
Оставшиеся в твердой смеси после растворения металла в кислоте медь и
серебро были переведены в раствор концентрированной азотной кислотой:
Си + 4HNO3 — Cu(NO3)2 + 2NO2T + 2Н2О
х 2х
Ag + 2HNO3 — AgNO3 + NO2t + H2O
У У У
Для полного поглощения выделившегося оксида азота(ГУ) по реакции
2NO2 + 2КОН — KNO2 + KNO3 + Н2О
потребовалось щелочи v(KOH) = 0.8 • 1 = 0.8 моль:
2х + у = 0.8
При обработке азотнокислого раствора хлоридом калия выпал осадок AgCl:
AgNO3 + КС1 AgCl! + KNO3
v(AgCl) = 28.7 / 143.5 = 0.2 моль,
значит, в исходной смеси содержалось 0.2 моль серебра, его масса равна
m(Ag) = 0.2- 108 = 21.6 г.
Меди в смеси было v(Cu) = (0.8 - 0.2) / 2 = 0.3 моль,
m(Cu) = 0.3 • 64 = 19.2 г.
Можно найти массу неизвестного металла:
т(Х) = 64.8 - 13 - 21.6 - 19.2 = 11 г.
Металл (валентность его нам не известна) растворился в соляной кислоте:
X + иНС1 -> ХС1„ + 0.5иН2Т
90
Дополнительное вступительное испытание
v(H2) = 4.48 / 22.4 = 0.2 моль.
Предположим, что металл - одновалентный (и = 1). Тогда
Л/(Х) = 11 / 0.4 = 27.5 г/моль - такого металла нет.
Если п = 2, то Л/(Х) “ 11 / 0.2 = 55 г/моль. Металл X - марганец.
Рассчитаем состав исходной смеси:
<o(Zn) = 13 / 64.8 = 0.2006 или 20.06%,
®(Ag) = 21.6 / 64.8 = 0.3333 или 33.33%,
<о(Си) = 19.2 / 64.8 = 0.2963 или 29.63%,
ш(Мп) = 11 / 64.8 = 0.1698 или 16.98%.
Ответ', марганец; 20.06% Zn, 33.33% Ag, 29.63% Си, 16.98% Мп.
10. Найдем количество хлора:
v(Cl2) = 1.008 / 22.4 = 0.045 моль.
С хлором может реагировать либо муравьиная кислота, которая окисляется до
углекислого газа (при этом образуется НС1), либо непредельная кислота,
присоединяющая хлор по кратной связи. По условию задачи в реакции выделяется
углекислый газ, следовательно, одна из кислот - муравьиная:
НСООН + С12 -> СО2Т + 2НС1
v(CO2) = v(HCOOH) = 0.112 / 22.4 = 0.005 моль.
Масса муравьиной кислоты /и(НСООН) = 0.005 • 46 = 0.23 г, тогда масса второй
кислоты равна т = 4.87 - 0.23 = 4.64 г.
Со второй кислотой прореагировал хлор в количестве
v(Cl2) = 0.045 - 0.005 = 0.04 моль.
Если эта кислота содержит одну двойную связь, тогда
у(кислоты) = v(Cl2) = 0.04 моль.
Найдем ее молярную массу:
М = m/v = 4.64/0.04 = 116 г/моль.
Это непредельная двухосновная (по условию) кислота с брутто-формулой
С4Н4О4 - бутендиовая кислота.
НООС-СН=СН-СООН + С12 — НООС-СНС1-СНС1-СООН.
В результате реакции муравьиной кислоты с хлором в растворе находятся
сильная соляная кислота в количестве 0.01 моль и более слабая 2,3-дихлор-
бутандиовая кислота. В присутствии сильной кислоты диссоциация более слабой
подавлена, поэтому величину pH раствора определяет диссоциация сильной кислоты.
Найдем концентрацию ионов Н\
Масса конечного раствора
т = /и(Н2О) + /и(кислот) + /и(С12) -/и(СО2) = 300 + 4.87 + 3.195 - 0.22 = 307.845 г.
Поскольку плотность равна единице, объем раствора составляет
К= 307.845 мл = 0.3078 л.
Решения заданий
91
с(НС1) = v / V = 0.01 / 0.3078 = 0.0325 моль/л.
Соляная кислота - сильная, поэтому [FT] = 0.0325 моль/л,
pH = -lg[H+] = 1.49.
Найдем количество углекислого газа:
5НСООН + 2КМпО4 + 3H2SO4 -> 5CO2f + K2SO4 + 2MnSO4 + 8H2O
0.005 0.005
5HOOC-CH=CH-COOH + 12KMnO4 + 18H2SO4 ->20СО2 +6K2SO4 +12MnSO4 + 28Н2О
0.04 0.16
v(CO2) = 0.005 + 0.16 = 0.165 моль.
m(CO2) = 0.165 • 44 = 7.26 г.
Ответ: НСООН и НООС-СН=СН-СООН; pH 1.49, 7.26 г СО2.
В работах некоторых абитуриентов рассматривалась двухосновная щавелевая
кислота. Действительно, щавелевая кислота является сильным восстановителем, и
можно предположить, что она будет реагировать с хлором.
Если мы будем считать одну из кислот щавелевой, то вторая кислота - либо
муравьиная, либо неизвестная кислота, в молекуле которой есть кратная связь.
Рассмотрим первый вариант. Пусть в исходной смеси присутствовали х моль
муравьиной кислоты и у моль щавелевой НООС-СООН. Тогда
НСООН + С12 — СО2 + 2НС1
XXX
НООС-СООН + С12 — 2СО2 + 2НС1
У У 2у
Количества поглощенного хлора и выделившегося СО2 нам известны:
v(Cl2) = х + у = 0.045 моль,
v(CO2) = х + 2у = 0.005 моль.
Как видно, при решении этой системы уравнений получается отрицательное
значение у. Значит, смесь не могла состоять из щавелевой и муравьиной кислот.
Теперь рассмотрим вариант, когда в смеси были щавелевая и неизвестная
кислоты. Количество и массу щавелевой кислоты мы можем установить по
количеству выделившегося углекислого газа:
v(C2H2O4) = 0.005 / 2 = 0.0025 моль,
т(С2Н2О4) = 90 • 0.0025 = 0.225 г.
Масса второй кислоты:
т(к-ты) = 4.87 - 0.225 = 4.645 г.
Предположим, что в молекуле кислоты есть двойная связь. Количество кислоты
определим по хлору:
у(к-ты) = v(Cl2) - v(C2H2O4) = 0.045 - 0.0025 = 0.0425 моль.
Молярная масса кислоты:
Л/(к-ты) = 4.645 / 0.0425 = 109.3 «109 г/моль.
92
Дополнительное вступительное испытание
Кислоту с такой молярной массой подобрать не удается.
Если кислота содержит тройную связь (или две двойные), то
Л/(к-ты) = 4.645 / 0.02125 = 218.6 г/моль.
Кислоту с такой молярной массой также невозможно подобрать. Следовательно,
исходное предположение о наличии в смеси щавелевой кислоты - неправильное.
Вариант 3
1. Такими изомерами являются, например, 2,3-диметилбутен-2 и 1,2,3-триметил-
циклопропан:
fH3 РЬ
сн3—с=с—сн3 / \
ОТ3 Н3С сн3
2. Электронные конфигурации:
Сг2* 1?2?2р6ЗЛр6Зй!* и С?+
При образовании катиона сначала уходят 45-электроны, и только потом - 3d-
электроны. Ион Сг24" содержит 4 неспаренных электрона, их масса равна
т = 4- 9.110'31 = 3.64-10-30 кг.
3. Поглотятся бутин-1 и пропин, метан не реагирует:
С2Н5-ОСН + [Ag(NH3)2]OH — C2H5-OCAgi + 2NH3 + Н2О,
СН3-С=СН + [Ag(NH3)2]OH -> CH3-OCAgi + 2NH3 + H2O.
Аммиак хорошо растворим в воде, и в этих реакциях выделяться не будет. Так как
исходно были взяты равные объемы газов, объем смеси сократился в 3 /1 =3 раза.
(Все объемы газов измеряли при одинаковых условиях).
Ответ', объем уменьшился в 3 раза.
4. Растворение фторида бария:
BaF2 Ва2+ + 2F
х х 2х
Пусть х моль/л - растворимость (концентрация насыщенного раствора) фторида
бария в воде, тогда
FIP(BaF2) = [Ba2+][F]2 = х (2х)2 = 4х\
х = = 6.5-1 О*3 моль/л.
Чтобы перейти к единицам г/л, домножим молярную концентрацию на
молярную массу соли (A/(BaF2) =175 г/моль):
с = 175- 6.5-10*’ = 1.138 г/л.
Ответ’. 1.138 г/л.
5. Происходит растворение свинца и выделение меди на пластинке:
Pb + Cu(NO3)2 — Pb(NO3)2 + Си
Решения заданий 93
Найдем изменение массы пластинки:
Am = m(Cu) - m(Pb) = 64л - 207л = -143л < 0, масса пластинки уменьшается.
Меди выделилось v(Cu) = 3.2 / 64 = 0.05 моль.
Ат = -143 • 0.05 =—7.15 г,
Ответ: масса пластинки уменьшилась на 7.15 г.
6. Определим химический состав газовой смеси.
Л/(С) = 1.103 • 29 = 31.99 ~ 32 г/моль.
По условию, объемные доли газов В и С равны 0.8 и 0.2 соответственно.
Средняя масса газовой смеси составляет
М₽ = фг MQ + ф2 * МВ) = 0.2 • 32 + 0.8 • МВ) = 43.2 г/моль,
отсюда МВ) = 46 г/моль. Можно сделать предположение, что В - это NO2, а С - О2.
Определим неизвестный металл. Количество угарного газа, образующегося при
восстановлении оксида ХО:
Pv Ю1.3-4.7 Л ,
v(CO) = =----------= 0.1 моль.
7 RT 8.31-573
Реакция восстановления оксида:
ХО + С —X 4- cot,
МХО) = 7.47 / 0.1 = 74.7 г/моль,
MX) = 74.7 - 16 = 58.7 г/моль,
значит, неизвестный металл - никель, а ХО - это оксид никеля. Тогда А - это
Ni(NO3h:
2Ni(NO3)2 —2NiO 4- 4NO2| 4- О2|.
Ответ-. А - Ni(NO3)2; В - NO2; С - О2; ХО - NiO.
7. 1) CeHsBr4- Mg >-> C6H5MgBr
4) 2СбН5-СООН + Ва(ОН)2 — (СбН5СОО)2Ва + 2Н2О
94
Дополнительное вступительное испытание
8. 1) 4Сг + ЗО2 + 12НС1 (р-р) -> 4СгС13 + 6Н2О
2) СгС13 + 4К0Н (р-р, изб) -> K[Cr(OH)4] + ЗКС1
3) 2К[Сг(ОН)4] + С02—>2Сг(ОН)3| + К2СО3 + Н20
4) 2Сг(ОН)3 + ЗВг2 + ЮКОН(р-р) —^->2К2СгО4 + 6КВг + 8Н2О
5) 2К2СгО4 + 16НС1(конц) —2СгС13 + ЗС12Т + 4КС1 + 8Н2О
6) 2СгС13 + 3Na2CO3 + ЗН2О -> 2Сг(ОН)31 + 3CO2f + 6NaCl
Ответ: X - СгС13.
9. Так как медь и серебро не реагируют ни со щелочью, ни с соляной кислотой,
можно предположить, что сначала в щелочи растворился алюминий, а затем
неизвестный металл, не прореагировавший со щелочью, растворился в соляной
кислоте. При растворении алюминия в щелочи выделился водород:
2А1 + 2NaOH + 6Н2О — 2Na[Al(OH)4] + 3H2t
v(H2) = 10.08 / 22.4 = 0.45 моль,
значит, в смеси содержалось алюминия v(Al) = 0.45 /1.5 = 0.3 моль, его масса
т(А1) = 0.3 -27 = 8.1 г.
Оставшиеся в твердом остатке медь и серебро были переведены в раствор
концентрированной азотной кислотой:
Си + 4HNO3 —Cu(NO3)2 + 2NO2T 4- 2H2O
x- 2x
Ag 4- 2HNO3 —AgNO3 4- NO2f 4- H2O
У У У
Для полного поглощения выделившегося оксида азота (IV) по реакции
2NO2 + 2КОН — KNO2 4- KNO3 4- Н2О
потребовалось щелочи: v(KOH) = 0.5 • 1 = 0.5 моль;
2х 4-у = 0.5 моль.
При обработке азотнокислого раствора хлоридом калия выпал осадок хлорида
серебра:
AgNO3 4- КС1 -> AgCl 1 4- KNO3
У У
Тогда v(AgCl) = 28.7 / 143.5 =у = 0.2 моль, значит, в смеси содержалось 0.2 моль
серебра, его масса равна m(Ag) = 0.2 • 108 = 21.6 г,
х = (0.5-0.2)/2 = 0.15 моль,
значит, в смеси было 0.15 моль меди, ее масса равна
m(Cu) = 0.15 • 64 = 9.6 г.
Металла X в смеси было
Решения заданий
95
m(X) = 42.9 - 8.1 - 21.6 - 9.6 = 3.6 г.
Металл растворился в соляной кислоте с выделением водорода:
X + лНС1 — ХС1„ + 0.5пН2Т
v(H2) = 3.36 / 22.4 = 0.15 моль.
Предположим, что металл - одновалентный (п = 1). Тогда
Л/(Х) = 3.6 / 0.3 = 12 г/моль - такого металла нет.
Если п = 2, то Л/(Х) = 3.6 / 0.15 = 24 г/моль. Это - магний, m(Mg) = 3.6 г.
®(А1) = 8.1 / 42.9 = 0.1888 или 18.88%,
со(Си) = 9.6 / 42.9 = 0.2238 или 22.38%,
co(Ag) = 21.6 / 42.9 = 0.5035 или 50.35%,
co(Mg) = 3.6 / 42.9 = 0.0839 или 8.39%.
Ответ', магний; 18.88% А1, 22.38% Си, 50.35% Ag, 8.39% Mg.
10. Найдем количество хлора:
v(Cl2) = 1.12 / 22.4 = 0.05 моль.
С хлором может реагировать либо муравьиная кислота, которая окисляется до
углекислого газа (при этом образуется НС1), либо непредельная кислота,
присоединяющая хлор по кратной связи. По условию задачи в реакции выделяется
углекислый газ, следовательно, одна из кислот - муравьиная:
НСООН + С12 CO2f + 2НС1
v(CO2) = v(HCOOH) = 0.448 / 22.4 = 0.02 моль.
Масса муравьиной кислоты /и(НСООН) = 0.02 • 46 = 0.92 г, тогда масса второй
кислоты равна т = 2.63 - 0.92 = 1.71 г.
Со второй кислотой прореагировал хлор в количестве
v(Cl2) = 0.05 - 0.02 = 0.03 моль.
Если эта кислота содержит одну двойную связь, тогда v(кислоты) = v(Cl2) = 0.03
моль. Найдем ее молярную массу:
М = т / v = \,71 / 0.03 = 57 г/моль.
Двухосновной кислоты с такой массой быть не может. Предположим, что в
молекуле кислоты есть или две двойные, или тройная связь, и один моль кислоты
присоединяет два моля хлора. Тогда
М= m/v = 1.71 / 0.015 = 114 г/моль.
Этой массе соответствует двухосновная кислота с брутго-формулой С4Н2О4 -
бутиндиовая кислота:
НООС-СС-СООН + 2С12 -> НООС-СС12-СС12-СООН
В результате реакции муравьиной кислоты с хлором в растворе находятся
сильная соляная кислота в количестве 0.04 моль и более слабая 2,2,3,3-
тетрахлорбутандиовая кислота. В присутствии сильной кислоты диссоциация более
слабой подавлена, величину pH раствора определяет диссоциация сильной кислоты.
Найдем концентрацию ионов Н+.
96
Дополнительное вступительное испытание
Масса конечного раствора
т = т(Н2О) + т(кислот) + т(С12) - ш(СО2) = 500 + 2.63 + 3.55 - 0.88 = 505.3 г.
Поскольку плотность равна единице, объем раствора равен V= 505.3 мл.
с(НС1) = v / V = 0.04 / 0.5053 = 0.072 моль/л.
Соляная кислота - сильная, поэтому [Н*] = 0.072 моль/л,
pH = -lg[H+] = 1.14.
Найдем количество углекислого газа:
5НСООН + 2КМпО4 + 3H2SO4 — 5CO2f + K2SO4 + 2MnSO4 + 8H2O
0.02 0.02
HOOC-C^C-COOH + 2KMnO4 4- 3H2SO4 — 4СО2 4- K2SO4 4- 2MnSO4 4- 4Н2О
0.015 0.06
v(CO2) = 0.02 4- 0.06 = 0.08 моль.
m(CO2) = 0.08 • 44 = 3.52 г.
Ответ\ НСООН и НООС-ОС-СООН; pH 1.14; 3.52 г СО2.
В работах некоторых абитуриентов рассматривалась двухосновная щавелевая
кислота. Действительно, щавелевая кислота является сильным восстановителем, и
можно предположить, что она будет реагировать с хлором.
Если мы будем считать одну из кислот щавелевой, то вторая кислота - либо
муравьиная, либо неизвестная кислота, в молекуле которой есть кратная связь.
Рассмотрим первый вариант. Пусть в исходной смеси присутствовали х моль
муравьиной кислоты и у моль щавелевой НООС-СООН. Тогда
НСООН 4- С12 — СО2 4- 2НС1
X X X
НООС-СООН + С12 -> 2СО2 4- 2НС1
У У 2у
Количества поглощенного хлора и выделившегося СО2 нам известны:
v(Cl2) = х 4- у = 0.05 моль,
v(CO2) = х 4- 2у = 0.02 моль.
Как видно, при решении этой системы уравнений получается отрицательное
значение у. Значит, смесь не могла состоять из щавелевой и муравьиной кислот.
Теперь рассмотрим вариант, когда в смеси были щавелевая и неизвестная
кислоты. Количество и массу щавелевой кислоты мы можем установить по
количеству выделившегося углекислого газа:
v(C2H2O4) = 0.02 / 2 = 0.01 моль,
т(С2Н2О4) = 90 • 0.01 = 0.9 г.
Масса второй кислоты:
т(к-ты) = 2.63 - 0.9 = 1.73 г.
Предположим, что в молекуле кислоты есть двойная связь. Количество кислоты
определим по хлору:
Решения заданий
97
у(к-ты) = v(Cl2) - v(C2H2O4) = 0.05 - 0.01 = 0.04 моль.
Молярная масса кислоты:
Л/(к-ты) = 1.73 / 0.04 = 43.25.
Карбоновой кислоты с такой молярной массой быть не может.
Если кислота содержит тройную связь (или две двойные), то
Л/(к-ты) = 1.73 / 0.02 = 86.5 г/моль.
Кислоту с такой молярной массой также невозможно подобрать. Следовательно,
исходное предположение о наличии в смеси щавелевой кислоты - неправильное.
Вариант 4
1. Таким изомером является циклогексан:
2. Электронные конфигурации:
Ni b22s22p63s23p64s23dB и Ni2+ 1?2?2р63?3р63</.
Атом никеля содержит 2 неспаренных электрона, их масса
т = 2 -9.1-10’31 = 1.8210 м кг.
3. Поглотятся ацетилен и пропин, пропан не реагирует:
НС^СН + 2[Cu(NH3)2]Cl -> CuC^CCul + 2NH4C1 + 2NH3,
CH3-OCH + [Cu(NH3>2]Cl — CH3-OCCul + NHjCl + NH3.
Аммиак хорошо растворяется в воде, поэтому в ходе реакций он выделяться не будет.
Так как исходно были взяты равные объемы газов, объем смеси сократился в 3 / 1 = 3
раза (все объемы измеряют при одинаковых условиях).
Ответ\ объем уменьшился в 3 раза.
4. Растворение сульфида меди(1):
Cu2S 5* 2Cu+ + S2-
х 2х х
Пусть х моль/л - растворимость (концентрация насыщенного раствора) сульфида
меди в воде, чтобы рассчитать ее, разделим приведенную в условии величину на
молярную массу соли (A/(Cu2S) = 160 г/моль):
х= 1.4-10-'4/ 160 = 8.7-10’17 моль/л
IIP(Cu2S) = [CuTlS2! = (2х)2 • х = 4х3,
IIP(Cu2S) = 4 • (8.7-10'17)3 = 2.6-10-48.
Ответ: 2.6-10~**.
5. Происходит растворение свинца и выделение меди на пластинке:
Fe + CuSO4 —► FeSO4 4- Cu
x x
Изменение массы пластинки:
Am = m(Cu) - m(Fe) = 64л - 56x = 8x > 0, масса пластинки увеличивается.
98 Дополнительное вступительное испытание
Меди выделилось v(Cu) = 0.8 / 64 = 0.0125 моль.
Ат = 8 • 0.0125 = 0.1 г.
Ответ: увеличилась на 0.1 г
6. Определим химический состав газовой смеси.
Л/(В) = 11.5 • 4 = 46 г/моль.
По условию, объемные доли газов В и С равны 0.8 и 0.2 соответственно.
Средняя масса газовой смеси составляет
Нр = ф! • М(С) + фг • Л/(В) = 0.2 • Л/(С) + 0.8 • 46 = 43.2 г/моль,
отсюда М(С) = 32 г/моль. Можно сделать предположение, что В - это NO2, а С - О2.
Определим неизвестный
восстановление оксида ХО:
металл.
Количество водорода, затраченного на
v(H2) = =
RT
101.3-5.34 ЛПО
---------= 0.09 моль.
8.31-723
Реакция восстановления оксида:
Х2О3 + ЗН2 —2Х + ЗН2О,
М(Х2О3) = 4.56 / 0.03 = 152 г/моль,
Л/(Х) = (152 - 48)/2 = 52 г/моль,
значит, неизвестный металл - хром, а Х2О3 - это оксид хрома(Ш). Тогда А - это
Сг(КОз)з:
4Cr(NO3)3 —2Сг2О3 + 12NO2T + 3O2t.
Ответ’. А — Сг(ЫОз)з; В — NO2j С — O2j Х20з — Сг20з.
7. 1) С6Н5-СН3 + 2С12—СбН5-СНС12 + 2НС1
3)
2) СбН5-СНС12 + 2№ОН(водн. р-р) -> С6Н5-СНО + 2NaCl + Н2О
8. Приведем один из возможных вариантов решения:
1) 2CH3COOAg + 2КОН(р-р) -> Ag2Oj + 2СН3СООК + 2Н2О
2) 2Ag2O —4Ag + O2f
Решения заданий 99
3) 4Ag + 2H2S + 02 — 2A&S + 2Н2О
4) A&S + 10HNO3 (конц.) -> 2AgNO3 + 8NO2f + H2SO4 + 4Н2О
5) 2AgNO3 + Zn -> 2Agi + Zn(NO3)2 (или 2AgNO3 —2Ag + 2NO2 + O2)
6) 2Ag + 2H2SO4(kohu) -> Ag2SO4 + SO2f + 2H2O
Ответ'. X - Ag.
9. Так как железо, фосфор и серебро не реагируют с водой, можно
предположить, что в воде растворился неизвестный металл (п - валентность металла):
X + пН2О — Х(ОН)„ + 0.5иН2Т
v(H2) = 3.36 / 22.4 = 0.15 моль.
С горячей щелочью реагирует только фосфор:
4Р + 3NaOH + ЗН2О -> PH3f + 3NaH2PO2
Выделившийся фосфин обесцветил подкисленный раствор перманганата калия,
содержащий 0.8 • 0.2 = 0.16 моль КМпО4:
5РН3 + 8КМпО4 + 12H2SO4 -> 5Н3РО4 + 8MnSO4 + 4K2SO4 + 12Н2О
Значит, в смеси было фосфора v(P) = 0.16 • 5 • 4 / 8 = 0.4 моль,
т(Р) = 0.4 • 31 = 12.4 г.
Оставшееся в смеси железо растворилось в соляной кислоте:
Fe + 2НС1 -> FeCl2 + Н2|
При добавлении сульфида аммония к раствору, содержащему хлорид железа(П),
выпал осадок сульфида железа(П):
FeCl2 + (NH|)2S -> FeSJ, + 2NH4C1,
v(FeS) = 17.6 / 88 = 0.2 моль,
значит, в смеси было 0.2 моль железа:
m(Fe) = 0.2 • 56 = 11.2 г.
Серебро прореагировало с раствором азотной кислоты:
Ag + 2HNO3 AgNO3 + NO2f + H2O
v(HNO3) = 10 • 0.04 = 0.4 моль
v(Ag) = 0.4 / 2 = 0.2 моль,
m(Ag) = 0.2- 108 = 21.6 г.
Металла X в смеси было т(Х) = 47.3 - 12.4 - 11.2 - 21.6 = 2.1 г.
Предположим, что металл одновалентный (п = 1). Тогда
Л/(Х) = 2.1 / 0.3 = 7 г/моль, металл X - литий, m(Li) = 2.1 г.
со(Р) = 12.4 / 47.3 = 0.2622 или 26.22%,
co(Fe) = 11.2 / 47.3 = 0.2368 или 23.68%,
co(Ag) = 21.6 / 47.3 = 0.4566 или 45.66%,
co(Li) = 2.1 / 47.3 = 0.444 или 4.44%.
Ответ: литий; 26.22% Р, 23.68% Fe, 45.66% Ag, 4.44% Li.
10. Найдем количество брома:
v(Br2) = 280 • 0.02 / 160 = 0.035 моль.
100
Дополнительное вступительное испытание
С бромом может реагировать либо муравьиная кислота, которая окисляется до
углекислого газа (при этом образуется НВг), либо непредельная кислота,
присоединяющая бром по кратной связи. По условию задачи в реакции выделяется
углекислый газ, следовательно, одна из кислот - муравьиная.
НСООН + Вг2 — CO2t + 2НВг
v(CO2) = v(HCOOH) = 0.560 / 22.4 = 0.025 моль.
Масса муравьиной кислоты т = 0.025 • 46 = 1.15 г.
Масса второй кислоты т = 2.31 - 1.15 = 1.16 г.
Количество Вг2, прореагировавшего со второй кислотой, равно
v(Br2) = 0.035 - 0.025 = 0.01 моль.
Если эта кислота содержит одну двойную связь, тогда
у(кислоты) = v(Br2) = 0.01 моль,
Л/(кислоты) = m / v = 1.16 / 0.01 = 116 г/моль.
Такой молярной массе соответствует СдЩОд, бутендиовая кислота:
НООС-СН=СН-СООН + Вг2 -> НООС-СНВг-СНВг-СООН
В результате реакции в растворе находятся сильная бромоводородная кислота
(0.05 моль) и более слабая 2,3-дибромбутандиовая кислота. В присутствии сильной
кислоты диссоциация более слабой подавлена, величину pH раствора определяет
диссоциация сильной кислоты. Найдем концентрацию ионов Н*.
Масса конечного раствора:
т = /и(бромн. воды) + т(кислот) - т(СО2) = 280 + 2.31 - 1.1 = 281.21 г.
Объем раствора V= ml р = 281.21 / 1.01 = 278.4 мл = 0.278 л.
с(НВг) = 0.05 / 0.278 = 0.18 моль/л.
pH =-lg[H+] = 0.74.
5НСООН + 2КМпО4 + 3H2SO4 — 5СО2 4- K2SO4 4- 2MnSO4 4- 8Н2О
0.025 0.025
5НООС-СН=СН-СООН 4- 12КМпО4 4- 18H2SO4 —20СО2 4-6K2SO4 4-12MnSO4 + 28Н2О
0.01 0.04
v(CO2) = 0.025 4- 0.04 = 0.065 моль,
m(CO2) = 0.065-44 = 2.86 г.
Ответ: НСООН и НООС-СН=СН-СООН; pH 0.74, 2.86 г СО2.
В работах некоторых абитуриентов рассматривалась двухосновная щавелевая
кислота. Действительно, щавелевая кислота является сильным восстановителем, и
можно предположить, что она будет реагировать с бромом.
Если мы будем считать одну из кислот щавелевой, то вторая кислота - либо
муравьиная, либо неизвестная кислота, в молекуле которой есть кратная связь.
Рассмотрим первый вариант. Пусть в исходной смеси присутствовали х моль
муравьиной кислоты и у моль щавелевой НООС-СООН. Тогда
НСООН 4- Вг2 — СО2 4- 2НВг
х
X
X
Решения заданий
101
НООС-СООН + Вг2 — 2СО2 + 2НВг
У у 2у
Количества поглощенного брома и выделившегося СО2 нам известны:
v(Br2) = х + у = 0.035 моль,
v(CO2) = х + 2у = 0.025 моль.
Как видно, при решении этой системы уравнений получается отрицательное
значение у. Значит, смесь не могла состоять из щавелевой и муравьиной кислот.
Теперь рассмотрим вариант, когда в смеси были щавелевая и неизвестная
кислоты. Количество и массу щавелевой кислоты мы можем установить по
количеству выделившегося углекислого газа:
v(C2H2O4) = 0.025 / 2 = 0.0125 моль,
т(С2Н2О4) = 90 • 0.0125 = 1.125 г.
Масса второй кислоты:
т(к-ты) = 2.31 - 1.125 = 1.185 г.
Предположим, что в молекуле кислоты есть двойная связь. Количество кислоты
определим по брому:
у(к-ты) = v(Br2) - v(C2H2O4) = 0.035 - 0.0125 = 0.0225 моль.
Молярная масса кислоты:
Л/(к-ты) = 1.185 / 0.0225 = 52.7 « 53 г/моль.
Карбоновая кислота с такой молярной массой не существует.
Если кислота содержит тройную связь (или две двойные), то
Л/(к-ты) = 1.73 / 0.01125 = 105.3 « 105 г/моль.
Кислоту с такой молярной массой также не удается подобрать. Следовательно,
исходное предположение о наличии в смеси щавелевой кислоты - неправильное.
Вариант резервный
1. Таким изомером является, например, 2,2-диметилгексен-З:
fH3
СН3-(р-СН=СН-СН2-СН3
сн3
2. Электронные конфигурации:
V ls22s22p*3s23p64?3d’ и V2* 1?2?2р63?Зр634А
Ион V2+ содержит 3 неспаренных электрона, их масса равна
т = 3 • 9.1-10"31 = 2.73-10-30 кг.
3. Поглотится только ацетилен, пропан и пропен не реагируют:
HOCH + 2[Ag(NH3)2]OH — AgOCAgl + 4NH3 + 2Н2О,
Аммиак хорошо растворим в воде, поэтому в этой реакции он не выделяется. Так
как исходно были взяты равные объемы газов, объем смеси сократился в 3 /2 = 1.5
раза (все объемы измеряли при одинаковых условиях).
Ответ: объем уменьшился в 1.5 раза.
102
Дополнительное вступительное испытание
4. Растворение фторида кальция:
CaF2 Са2+ + 2Г
х х 2х
Пусть х моль/л - растворимость (концентрация насыщенного раствора) фторида
кальция в воде, тогда
ПР(СаР2) = [Ca24][Fl2 = х(2х)2 = 4х3,
х = =2.15-10-4 моль/л.
Чтобы перейти к единицам г/л, домножим молярную концентрацию на
молярную массу соли (A/(CaF2) = 78 г/моль):
с = 78 -2.15-10м = 0.017 г/л.
Ответ'. 0.017 г/л.
5. Происходит растворение марганца и выделение меди на пластинке:
Мп + CuSO4 —► MnSO4 + Си
х х
х - т(Си) / Л/= 12.8 / 64 = 0.2 моль.
Изменение массы пластинки: Am = m(Cu) - m(Mn) = 64х - 55х = 9х = 9 • 0.2 = 1.8 г.
Ответ: масса пластинки увеличилась на 1.8 г.
6. Определим химический состав газовой смеси.
Л/(С) = 1 ЮЗ • 29 = 31.99 ~ 32 г/моль.
По условию, объемные доли газов В и С равны 0.88 и 0.11 соответственно.
Средняя масса газовой смеси составляет
Л/ср = Ф1 • Л/(С) + Ф2 • Л/(В) = о. 11 • 32 + 0.88 • М(В) = 44.4 г/моль,
отсюда Л/(В) = 46 г/моль. Можно сделать предположение, что В - это NO2, а С - О2.
Определим неизвестный металл. Количество водорода, потребовавшегося на
восстановление оксида Х2О3:
ZTI х pV 3.31101.3
v(H2) = — =-----------= 0.06 моль.
k 7 RT 8.31-673
Реакция восстановления оксида водородом:
Х2О3 + ЗН2 —2Х + ЗН2О,
v(X2O3) = v(H2) / 3 = 0.02 моль,
Л/(Х2О3) = 3.2 / 0.02 = 160 г/моль,
Л/(Х) = (160 - 48) / 2 = 56 г/моль.
Значит, неизвестный металл - железо, Х2О3 - оксид железа(Ш) Fe2O3. Тогда, с
учетом объемного соотношения выделившихся газов, А - это нитрат железа(П)
Fe(NO3)2.
4Fe(NO3)2 —2Fc2O3 + 8NO2f + O2f.
Ответ: A - Fe(NO3)2; В - NO2; C - O2; X2O3 - Fe2O3.
Решения заданий
103
8. 1) Cr2O3 + 2NaOH(TB.) —2NaCrO2 + H2Of;
2) 2NaCrO2 + 4H2SO4(p-p) -> Na2SO4 + Cr2(SO4)3 + 4H2O;
3) Cr2(SO4)3 + 3Br2 + 16NaOH(p-p) —£-» 2Na2CrO4 + 6NaBr + 3Na2SO4 + 8H2O;
4) 2Na2CrO4 + H2SO4(p-p)-> Na2Cr2O7 + Na2SO4 + H2O;
5) Na2Cr2O7 + 3SO2 + H2SO4-^ Cr2(SO4)3 + Na2SO4 + H2O;
6) Cr2(SO4)3 + 8KOH(p-p, изб.) 2K[Cr(OH)4] + 3K2SO4
Ответ'. X - Cr2(SO4)3.
9. Так как медь и углерод не реагируют ни с аммиаком, ни с соляной кислотой,
можно предположить, что сначала в растворе аммиака растворился цинк, а затем
неизвестный металл, не прореагировавший с аммиаком, растворился в соляной
кислоте.
104 Дополнительное вступительное испытание
При растворении цинка в аммиаке выделяется водород:
Zn + 4NH3 + 2Н2О -► [Zn(NH3)4](OH)2 + Н2Т
v(H2) = 8.96 / 22.4 = 0.4 моль,
значит, в соответствии с уравнением реакции, в смеси было 0.4 моль цинка, его масса
составляет
m(Zn) = 0.4 • 65 = 26 г.
Оставшиеся в смеси медь и углерод были переведены в раствор
концентрированной серной кислотой:
Си + 2H2SO4 —CuSO4 + SO2f + 2Н2О,
X XX
С + 2H2SO4 —СО2| + 2SO2T + 2Н2О
У У
Выделившийся газ содержал оксид серы(ГУ) в количестве (х + 2у) моль, который
обесцветил раствор перманганата калия:
5SO2 + 2КМпО4 + 2Н2О — 2MnSO4 + K2SO4 + 2H2SO4
v(KMnO4) = 0.56 • 0.5 = 0.28 моль
В соответствии с уравнением реакции, v(SO2) = 0.28 • 5 /2 = 0.7 моль.
При обработке сернокислого раствора гидроксидом калия выпал осадок
гидроксида меди:
CuSO4 + 2КОН — Cu(OH)2! + K2SO4
X X
Тогда х = т / М = 9.8 / 98 = 0.1 моль, значит, в исходной смеси содержалось
0.1 моль меди, ее масса
m(Cu) = 0.1 • 64 = 6.4 г.
Рассчитаем количество углерода:
v(C) = у = (0.7 - х) / 2 = 0.3 моль,
значит, в смеси было 0.3 моль углерода, его масса
т(С) = 0.3- 12 = 3.6 г.
Неизвестного металла X в смеси было
т(Х) = 58.4 - 26 - 6.4 - 3.6 = 22.4 г.
Металл X растворился в соляной кислоте:
X + иНС1 — ХС1„ + 0.5иН2Т
v(H2) = 4.48 / 22.4 = 0.2 моль.
Если металл был одновалентный (п = 1), то М(Х) = 22.4 / 0.4 = 56 г/моль. эта
атомная масса соответствует железу, но железо не проявляет степень окисления +1.
Предположим, что п = 2, тогда Л/(Х) = 22.4 / 0.2 = 112 г/моль. Металл X - это
кадмий, m(Cd) = 22.4 г.
Состав исходной смеси:
Решения заданий
105
co(Zn) = 26158.4 = 0.4452 или 44.52%,
©(Cu) = 6.4 / 58.4 = 0.1096 или 10.96%,
©(С) = 3.61 58.4 = 0.0616 или 6.16%,
©(Cd) = 22.4158.4 = 0.3836 или 38.36%.
Ответ', кадмий; 44.52% Zn, 10.96% Р, 6.16% С, 38.36% Cd.
10. Найдем количество хлора:
v(Cl2) = 1.008 / 22.4 = 0.045 моль.
С хлором может реагировать либо муравьиная кислота, которая окисляется до
углекислого газа (при этом образуется НС1), либо непредельная кислота,
присоединяющая хлор по кратной связи. По условию задачи в реакции выделяется
углекислый газ, следовательно, одна из кислот - муравьиная:
НСООН + С12 — СО2| + 2НС1
v(CO2) = v(HCOOH) = 0.336 / 22.4 = 0.015 моль.
Масса муравьиной кислоты
/и(НСООН) = 0.015 • 46 = 0.69 г,
тогда масса второй кислоты равна т = 3.27 - 0.69 = 2.58 г.
Со второй кислотой прореагировал хлор в количестве
v(Cl2) = 0.045 - 0.015 = 0.03 моль.
Молекула кислоты содержит двойную связь, поскольку, по условию, кислота
проявляет цис-транс-изомерию. Найдем ее молярную массу:
v(кислоты) = v(Cl2) = 0.03 моль,
Л/ = mlv = 2.58 / 0.03 = 86 г/моль.
Это одноосновная кислота с брутто-формулой С4НбО2, бутен-2-овая кислота:
СН3-СН=СН-СООН + С12 — СН3-СНС1-СНС1-СООН.
В результате реакции муравьиной кислоты с хлором в растворе находятся
сильная соляная кислота в количестве 0.03 моль и более слабая 2,3-дихлорбутановая
кислота. В присутствии сильной кислоты диссоциация более слабой подавлена,
величину pH раствора определяет диссоциация сильной кислоты. Найдем
концентрацию ионов Н\
Масса конечного раствора
т = м(Н20) + /л(кислот) + /и(С12) - /л(СО2) = 500 + 3.27 + 3.195 - 0.66 = 505.805 г.
Поскольку плотность раствора равна единице, объем раствора
К= 505.8 мл = 0.5058 л.
с(НС1) = v / V= 0.03 / 0.5058 = 0.0593 моль/л.
Соляная кислота - сильная, диссоциирует нацело, поэтому [Н4] = 0.0593 моль/л,
pH = -lg[H+]=1.23.
Найдем количество углекислого газа:
106
Дополнительное вступительное испытание
5НСООН + 2КМпО4 + 3H2SO4 — 5CO2f + K2SO4 + 2MnSO4 + 8H2O
0.015 0.015
CH3-CH=CH-COOH +2KMnO4 +3H2SO4 —СНзСООН +2СО2Т +K2SO4 +2MnSO4 +4Н2О
0.03 0.06
v(CO2) = 0.015 + 0.06 = 0.075 моль.
m(CO2) = 0.075 -44 = 3.3 г.
Ответ: НСООН и СН3-СН=СНЧ:ООН; pH 1.23; 3.3 г СО2.
В работах некоторых абитуриентов рассматривалась щавелевая кислота.
Действительно, щавелевая кислота является сильным восстановителем, и можно
предположить, что она будет реагировать с хлором.
Если мы будем считать одну из кислот щавелевой, то вторая кислота - либо
муравьиная, либо неизвестная непредельная кислота, в молекуле которой есть
кратная связь. Рассмотрим первый вариант. Пусть в исходной смеси присутствовали
х моль муравьиной кислоты и у моль щавелевой НООС-СООН. Тогда
НСООН + С12 — СО2 + 2НС1
X XX
НООС-СООН + С12 — 2СО2 + 2НС1
У У
Количества поглощенного хлора и выделившегося СО2 нам известны:
v(Cl2) = х +у = 0.045 моль, v(CO2) = х + 2у = 0.015 моль.
Как видно, при решении этой системы уравнений получается отрицательное
значение у. Значит, смесь не могла состоять из щавелевой и муравьиной кислот.
Теперь рассмотрим вариант, когда смесь состояла из щавелевой и неизвестной
кислоты. Количество и массу щавелевой кислоты мы можем установить по
количеству выделившегося углекислого газа:
v(C2H2O4) = 0.015 / 2 = 0.0075 моль,
т(С2Н2О4) = 90 • 0.0075 = 0.675 г.
Масса второй кислоты:
/л (к-ты) = 3.27 - 0.675 = 2.595 г.
Предположим, что в молекуле кислоты есть двойная связь. Количество кислоты
определим по хлору:
у(к-ты) = v(Cl2) - v(C2H2O4) = 0.045 - 0.0075 = 0.0375 моль.
Молярная масса кислоты:
Л/(к-ты) = 2.595 / 0.0375 = 69.2 « 69 г/моль,
что не соответствует ни одной непредельной органической кислоте.
Если кислота содержит тройную связь (или две двойные), то
Л/(к-ты) = 2.595 / 0.01875 = 138.4 г/моль.
Кислоту с такой молярной массой также не удается подобрать. Следовательно,
исходное предположение о наличии в смеси щавелевой кислоты - неправильное.
Решения заданий заместительного экзамена (вместо ЕГЭ)
Вариант 1
1. Атом К: 1?2?2р63?Зр645|;капюнК+: 1Л?2р63?Зр6
2.2А1 + 2КОН + 6Н2О -> 2К[А1(ОН)4] + 3H2f.
3. Структурная формула изопрена:
В молекуле изопрена содержится 12 о-связей и 2 л-связи.
Ответ: 12 о- и 2 л-связи.
4. а) Реакция экзотермическая, поэтому повышение температуры сместит
равновесие в сторону исходных веществ.
б) Добавление катализатора не повлияет на положение равновесия в системе,
поскольку катализатор ускоряет как прямую, так и обратную реакции.
в) Добавление водорода (реагента) сместит равновесие в сторону продуктов.
5. Рассчитаем количество вещества SiO2:
v(SiO2) = ml М=3 160 = 0.05 моль.
Количество молекул оксида кремния:
Л' = v(SiO2) Л^А = 0.05 6.02-1023 = 3.01 1022.
В одной молекуле содержится 14 + 2 • 8 = 30 протонов, а во всей порции:
Wp = 30 • 3.01-1022 = 9.ОЗ-1О23.
Ответ-. 9.03-1023.
6. Реакция нейтрализации:
Ва(ОН)2 + 2НС1 -> ВаС12 + 2Н2О.
Найдем количество щелочи:
/и(Ва(ОН)2) = 150 0.1 = 15 г,
v(Ba(OH)2) = 15 / 171 = 0.088 моль.
По уравнению реакции v(HCl) = 2v(Ba(OH)2) = 2 • 0.088 = 0.176 моль.
m(HCl) = 0.176 • 36.5 = 6.42 г,
m(p-pa) = 6.42 10.05 = 128.5 г,
Г(р-ра) = т / р = 128.5 / 1.04 = 123.6 мл.
Масса полученного раствора
т = 150+ 128.5 = 278.5 г,
а масса соли в нем
т(ВаС12) = 0.088 • 208 = 18.3 г.
Массовая доля соли:
108 Заместительный экзамен (вместо ЕГЭ)
ш(ВаС12) = 18.3/ 278.5 = 0.066 (или 6.6%).
Ответ: 123.6 мл, 6.6% ВаС12.
7.
8.
1) ZnO + С —Zn + COf;
2) Zn + 2NaOH + 2H2O —Na2[Zn(OH)4] + H2|;
3) Na2[Zn(OH)4] + 4HNO3 -> Zn(NO3)2 + 2NaNO3 + 4H2O;
4) 2Zn(NO3)2 - 2ZnO + 4NO2| + O2f;
5) 2NO2 + 2NaOH -> NaNO3 + NaNO2 + H2O.
Ответ: X - Na2[Zn(OH)4], Y - NO2.
9. Пусть в смеси содержалось х моль нитрата алюминия и у моль нитрата
кальция. Запишем уравнения реакций термического разложения солей:
4A1(NO3)3 —2А12О3 + 12NO2| + 3O2j;
х 0.5х Зх 0.75.x
2Ca(NO3)2 > 2СаО + 4NO2f + О2|.
у у 2у 0.5у
Выразим массу смеси и массу твердого остатка (смесь оксидов):
т(смеси) = 213х + 164у = 7.54,
т(оксидов) = 102 • 0.5х + 56у = 2.14.
Решив систему из двух уравнений с двумя неизвестными, получим
х-у = 0.02 моль.
Решения заданий 109
Всего при прокаливании выделилось газов:
\<газов) = 3.75х + 2.5у = 0.125 моль,
Г(газов) = 0.125 • 22.4 = 2.8 л.
Ответ: 2.8 л.
10. Существуют три изомера метил фенол а и, соответственно, возможны три
варианта реакции бромирования в растворе, в результате которых получаются два
изомера дибромметилфенола и один - трибромметилфенола:
Молярные массы всех веществ составляют:
Л/(С7Н8О) = 108 г/моль, Л/(С7Н6ОВг2) = 266 г/моль, Л/(С7Н5ОВг3) = 345 г/моль.
Пусть в результате реакции образовалось х моль дибромметилфенола и у моль
трибромметилфенола. Тогда до реакции масса смеси равнялась
тх = 108х + 108у,
а после реакции масса органических продуктов стала равна
т2 - 266х + 345у
По условию, т2: тх = 2.646, или, более детально
266х + 345у_ 2 646
108х + 108у
Сначала рассмотрим случай, когда трибромметилфенола образовалось в три раза
больше по сравнению с дибромметил фенол ом (у = Зх):
266х + 345-3х 1301
------------=------= 3.012 - это не соответствует условию задачи.
108х + 108-Зх 432
Тогда рассмотрим вариант, когда дибромметилфенола образовалось в три раза
больше по сравнению с трибромметил фенол ом (х = Зу):
266-Зу + 345у 1143
---------- --------= 2.646 - это соответствует условию задачи.
108 Зу + 108у 432 7 7
ПО Заместительный экзамен (вместо ЕГЭ)
Итак, в исходной смеси присутствовал один из изомеров, дающих дибромзаме-
щенное производное при бромировании (2- или 4-метилфенол) и 3-метилфенол в
соотношении 3:1.
Ответ. 2- или 4-метилфенол и 3-метилфенол в соотношении 3:1.
Вариант 2
1. Атом S: k22y22p63s^3p4; анион S2-: 1522s22p63523p6.
2. 3I2 + 6NaOH —£-> 5NaI + NaIO3 + ЗН2О.
3. Структурная формула бутина-Г.
V ч
Н-С-С-^-^-Н
В молекуле содержится 9 о-связей и 2 л-связи.
Ответ'. 9 о- и 2 л-связи.
4. а) Реакция протекает с уменьшением количества газообразных веществ,
поэтому повышение давления сместит равновесие в сторону продукта.
б) Реакция эндотермическая, поэтому понижение температуры приведет к
смещению равновесия в сторону реагентов.
в) Добавление этилена (реагента) сместит равновесие в сторону продукта.
5. Рассчитаем количество вещества NO2:
v(NO2) = т / А/= 2.3 / 46 = 0.05 моль.
Количество молекул оксида азота:
N= v(NO2) • Na = 0.05 • 6.0210м = 3.01 1022.
В одной молекуле содержится 7 + 2 • 8 = 23 протона, а во всей порции:
Ур = 23 ЮНО22 = 6.92-10м
Ответ: 6.92-1023.
6. Реакция нейтрализации:
H2SO4 + 2NaOH — Na2SO4 + 2Н2О.
Найдем количество серной кислоты:
m(H2SO4) = 100 • 0.1 = 10 г,
v(H2SO4) = 10 / 98 = 0.102 моль.
По уравнению реакции v(NaOH) = 2v(H2SO4) = 2 • 0.102 = 0.204 моль.
m(NaOH) = 0.2046 • 40 = 8.16 г,
m(p-pa) = 8.16 / 0.25 = 32.64 г,
Г(р-ра) = т / р = 32.64 / 1.27 = 25.7 мл.
Масса полученного раствора
т= 100 + 32.64= 132.64 г,
а масса соли в нем
m(Na2SO4) = 0.102 • 142 = 14.48 г.
Массовая доля соли:
Решения заданий 111
G)(Na2SO4) = 14.48 / 132.64 = 0.109 (или 10.9%).
Ответ'. 25.7 мл, 10.9%Na2SO4.
8. 1) 2NO2 + 2КОН KNO3 + KNO2 + Н2О;
2) 3KNO3 + 8А1 + 5КОН + 18Н2О —8К[А1(ОН)4] + 3NH3f;
3) AgNO3 + 3NH3 + Н2О -> [Ag(NH3)2]OH + NRjNOj;
4) 2[Ag(NH3)2]OH + 2H2S -» AgjSl + (NH4)2S + 2H2O;
5) Ag2S + 10HNO3(kohu) —> 2AgNO3+ 8NO2f + H2SO4 + 4H2O.
Ответ: X - NH3, Y - Ag2S.
9. Пусть в смеси содержалось х моль нитрата железа и у моль нитрата калия.
Запишем уравнения реакций термического разложения солей:
4Fe(NO3)3 —2Fe2O3 + 12NO2f + ЗО2|;
х 0.5л Зл 0.75х
2KNO3 —2KNO2 + O2f.
У У 0.5у
Выразим массу смеси и массу твердого остатка (смесь оксида и нитрита):
т(смеси) = 242х + 101у = 14.94,
^(остатка) = 160 • 0.5х + 85у = 10.1.
Решив систему из двух уравнений с двумя неизвестными, получим
х = 0.02, у = 0.1 моль.
Всего при прокаливании выделилось газов:
v(газов) = 3.75х + 0.5у = 0.125 моль,
Г(газов) = 0.125 • 22.4 = 2.8 л.
Ответ: 2.8 л.
112
Заместительный экзамен (вместо ЕГЭ)
10. Существуют три изомера этилфенола и, соответственно, возможны три
варианта реакций бромирования, в результате
которых получаются два изомера
дибромэтилфенола и один - трибромэтилфенола:
Молярные массы всех веществ составляют:
Л/(С8НюО) = 122 г/моль, Л/(С8Н8ОВг2) = 280 г/моль, Л/(С8Н7ОВг3) = 359 г/моль.
Пусть в результате реакции образовалось х моль дибромэтилфенола и у моль
трибромэтилфенола. Тогда до реакции масса смеси равнялась
т! = 122* + 122у,
а после реакции масса органических продуктов стала равна .
т2 - 280* + 359у
По условию, т2 : ту = 2.684, или, более детально
280х + 359у = 2 684
122х + 122у
Сначала рассмотрим случай, когда дибромэтилфенола образовалось больше по
сравнению с трибромэтилфенолом (х = 1.5у):
280 1.5у + 359у 779 - .
---------------=-----= 2.554 - это не соответствует условию задачи.
122 1.5у + 122у 305
Тогда рассмотрим вариант, когда трибромэтилфенола образовалось больше по
сравнению с дибромэтилфенолом (у = 1.5х):
280х + 359 1.5* 818.5 о ,о.
= = 2.684 - это соответствует условию задачи.
122* + 122 1.5*----305
Итак, в исходной смеси присутствовал 3-этилфенол и один из изомеров, дающих
дибромзамещенное производное при бромировании (2- или 4-этилфенол) в
соотношении 3 : 2.
Ответ: 3-этилфенол и 2- или 4-этилфенол в соотношении 3 : 2.
Решения заданий
113
Варианте
1. Атом Al: U22s22p63y23p1; катион А1+3: l^s^p6.
2. ЗС12 + 6NaOH —5NaCl + NaC103 + ЗН2О.
3. Структурная формула молекулы пропина:
V
н
В молекуле пропина содержится 6 a-связей и 2 л-связи.
Ответ'. 6 а- и 2 л-связи.
4. а) Реакция протекает с уменьшением количества газообразных веществ,
поэтому повышение давления сместит равновесие в сторону продуктов.
б) Добавление катализатора не повлияет на положение равновесия в системе,
поскольку катализатор ускоряет как прямую, так и обратную реакции.
в) Реакция экзотермическая, поэтому понижение температуры сместит
равновесие в сторону продуктов.
5. Рассчитаем количество вещества SO2:
v(SO2) = т / М= 6.4 / 64 = 0.1 моль.
Количество молекул оксида серы:
W = v(SO2) • ЛГА = 0.1 • 6.02-1023 = 6.02-1022.
В одной молекуле содержится 16 + 2 • 8 = 32 протона, а во всей порции:
^p = 32 • 6.02 1022 = 1.93-1024.
Ответ: 1.932-1024.
6. Реакция нейтрализации:
H2SO4 + 2КОН — K2SO4 + 2Н2О.
Найдем количество серной кислоты:
m(H2SO4) = 150 • 0.25 = 37.5 г,
v(H2SO4) = 37.5 / 98 = 0.383 моль.
По уравнению реакции v(KOH) = 2v(H2SO4) = 2 • 0.383 = 0.766 моль.
m(KOH) = 0.766 • 56 = 42.9 г,
m(p-pa) = 42.9 / 0.15 = 286 г,
К(р-ра) = т / р = 286 / 1.14 = 250.9 мл.
Масса полученного раствора
т= 150 + 286 = 436 г,
а масса соли в нем
m(K2SO4) = 0.383 • 174 = 66.64 г.
Массовая доля соли:
o(K2S04) = 66.64 / 436 = 0.153 (или 15.3%).
Ответ: 250.9 мл, 15.3% K2SO4.
114
Заместительный экзамен (вместо ЕГЭ)
4) СбН5-СООН + NaOH(p-p) — C6H5-COONa + Н20
5) C6Hj-COONa + NaOHfre.) —СбНбТ + Na2CO3
Ответ: X - С6Н5-СН2С1; Y - CeHj-COOH.
1) КС1 + ЗН2О —► КСЮ3 + ЗН2| (электролиз без диафрагмы, с перемешиванием);
2) КС1О3 + бНСЦконц) “> ЗС12Т + КС1 + ЗН2О;
3) 2Р + 5С12(изб) —1—> 2РС15;
4) 2РС15 + 8Са(ОН)2 Са3(РО4)21 + 5СаС12 + 8Н2О;
5) Са3(РО4)2 + 5С + 3SiO2 3CaSiO3 + 2Р + 5COf
Ответ: X - Cl2, Y - Са3(РО4)2.
9. Пусть в смеси содержалось х моль нитрата цинка и у моль нитрата калия.
Запишем уравнения реакций термического разложения солей:
2Zn(NO3)2 —2ZnO + 4NO2f + O2f;
X X 2х 0.5х
2KNO3 —2KNO2 + O2f.
У У 0.5у
Выразим массу смеси и массу твердого остатка (смесь оксида и нитрита):
т(смеси) = 189х + 101у = 19.55,
/и(остатка) = 81х + 85у = 12.55.
Решив систему из двух уравнений с двумя неизвестными, получим
х = 0.05, у — 0.1 моль.
Всего при прокаливании выделилось газов:
у(газов) - 2.5х + 0.5у = 0.175 моль,
Г(газов) = 0.175 • 22.4 = 3.92 л.
Ответ: 3.92 л.
Решения заданий
115
10. Существуют три изомера метилфенола и, соответственно, возможны три
варианта реакций бромирования, в результате которых получаются два изомера
дибромметилфенола и один - трибромметилфенола:
Молярные массы всех веществ составляют:
Л/(С7Н8О) = 108 г/моль, МС7НбОВг2) = 266 г/моль, Л/(С7Н5ОВг3) = 345 г/моль.
Пусть в результате реакции образовалось х моль дибромметилфенола и у моль
трибромметилфенола. Тогда до реакции масса смеси равнялась
т\ = 108* + 108у,
а после реакции масса органических продуктов стала равна
т2 = 266* 4- 345у
По условию, т2 : тх = 2.463, или, более детально
.26_6Л ±2^^2.463.
108х + 108у
Сначала рассмотрим случай, когда трибромметилфенола образовалось в два раза
больше по сравнению с дибром метил фенолом (у = 2х):
266х + 345-2* 956
-----------------=-----= 2.951 - это не соответствует условию задачи.
108* +108-2* 324 7 7
Тогда рассмотрим случай, когда дибромметилфенола образовалось в три раза
больше по сравнению с трибромметилфенолом (* = 2у):
266-2у + 345у 877
= ^- = 2.707 - это также не соответствует условию задачи.
Возможен еще один вариант, когда в смеси находятся орто- и мара-изомеры
метилфенола, тогда продуктами бромирования являются два изомера
дибромметилфенола:
266-3* 266
П)8 3 ' ~ То8 = - именно этот вариант соответствует условию задачи.
116 Заместительный экзамен (вместо ЕГЭ)
Итак, в исходной смеси присутствовали 2- и 4-метилфенол в соотношении 2 : 1
или 1 : 2.
Ответ: 2- и 4-метилфенол в соотношении 2 : 1 или 1 : 2.
Вариант 4
1. Атом С1: 1Л?2р63?Зр5; анион СГ: l?2s22p63?3p6.
2. Si + 2NaOH + Н2О -»Na2SiO3 + 2H2f.
3. Изобразим структурную формулу бутадиена:
В молекуле бутадиена содержится 9 о-связей и 2 л-связи.
Ответ: 9 о- и 2 я-связи.
4. а) Реакция экзотермическая, поэтому повышение температуры приведет к
смещению равновесия в сторону реагентов.
б) Реакция протекает с уменьшением количества газообразных веществ, поэтому
понижение давления сместит равновесие в сторону реагентов.
в) Добавление метанола (продукта) сместит равновесие в сторону реагентов.
5. Рассчитаем количество вещества угарного газа:
v(CO) = mlA/= 1.4/28 = 0.05 моль.
Количество молекул оксида углерода(П):
А = v(CO) • Ад = 0.05 • 6.02-1023 = 3.01 1022.
В одной молекуле содержится 6 + 8 = 14 протонов, а во всей порции:
А'р= 14 • З.ОГ1О22 = 4.2Г1О23.
Ответ-. 4.21 1023.
6. Реакция нейтрализации:
Са(ОН)2 + 2HNO3 — Ca(NO3)2 + 2Н2О.
Найдем количество щелочи:
т(Са(ОН)2) = 250 • 0.03 = 7.5 г,
v(Ca(OH)2) = 7.5 / 74 = 0.101 моль.
По уравнению реакции v(HNO3) = 2v(Ca(OH)2) = 2 ♦ 0.101 - 0.202 моль.
m(HNO3) = 0.202 • 63 = 12.73 г,
m(p-pa) = 12.73 / 0.25 = 50.92 г,
И(р-ра) = т / р = 50.92 / 1.15 = 44.3 мл.
Масса полученного раствора
т = 250 + 44.3 = 294.3 г,
а масса соли в нем
m(Ca(NO3)2) = 0.101 • 164= 16.56 г.
Массовая доля соли:
Решения заданий 117
©(СаСКОзЪ) = 16.56 / 294.3 = 0.0563 (или 5.63%).
Ответ'. 44.3 мл, 5.63% Ca(NO3)2.
7. Один из вариантов решения:
1) С2Нб + С12 —С2Н5С1 + НС1
2) 2С2Н5С1 + 2Na - > СНз-СНг-СНг-СНз + 2NaCl
3) гСНз-СНг-СНг-СНз + 5О2 —4СН3-СООН + 2Н2О
4) СНз-СООН + КОН — СНз-СООК + Н2О
5) 2СН3-СООК + 2Н2О — CH3-CH3t + 2CO2f + H2f + 2КОН
Ответ'. X - С2Н5С1; Y - СН3СООН.
8. 1) КВг(тв.) + Н3РО4(конц.) -> НВг|+ КН2РО4
2) МпО2 + 4НВг —► МпВг2 + Вг2 + 2Н2О
3) 2Fe + ЗВг2 —► 2FeBr3
4) 2FeBr3 + 3Na2CO3 + ЗН2О -> 2Fe(OH)3l + 3CO2f + 6NaBr
5) 2Fe(OH)3 + 3C12 + ЮКОН —2K2FeO4 + 6KCI + 8H2O
Ответ'. X - HBr; Y - Fe(OH)3.
9. Пусть в смеси содержалось х моль нитрата калия и у моль нитрата меди.
Запишем уравнения реакций термического разложения солей:
2KNO3 —2KNO2 + O2f.
х х 0.5х
2Zn(NO3)2 —2ZnO + 4NO2T + O2f;
у у 2y 0.5у
Выразим массу смеси и массу твердого остатка (смесь нитрита и оксида):
т(смеси) = 101л + 188у = 47.7,
^(остатка) = 85х + 80у = 24.5.
Решив систему из двух уравнений с двумя неизвестными, получим
х = 0.1, у = 0.2 моль.
Всего при прокаливании выделилось газов:
v(газов) = 0.5х + 2.5у = 0.55 моль,
И( газов) = 0.55 • 22.4 = 12.32 л.
Ответ: 12.32 л.
10. Существуют три изомера метилфенола и, соответственно, возможны три
варианта реакций бромирования, в результате которых получаются два изомера
дибромметилфенола и один - трибромметилфенола:
он В1< I +2Вг2 — 1 Н2° он ЧуСН, 1| | +2НВг Rr
118
Заместительный экзамен (вместо ЕГЭ)
+ ЗВг2
Н2О
Молярные массы всех веществ составляют:
Л/(С7Н8О) = 108 г/моль, Л/(С7Н6ОВг2) = 266 г/моль, Л/(С7Н5ОВг3) = 345 г/моль.
Пусть в результате реакции образовалось х моль дибромметилфенола и х моль
трибромметилфенола (по условию, количества исходных изомеров равны). Тогда до
реакции масса смеси равнялась
mi = 108х + 108х = 216х,
а после реакции масса органических продуктов стала равна
т2 = 266х + 345х = 611х
По условию, т2 : т\ = 2.463. Проверим:
2.829 - это не соответствует условию.
216х
Значит, в смеси находились орто- и идрд-изомеры метилфенола, а продуктами
бромирования являются два изомера дибромметилфенола. Проверим:
266-2х хч
-------= 2.463 - это соответствует условию задачи.
216х
Итак, в исходной смеси присутствовали 2- и 4-метилфенол в мольном
соотношении 1:1.
Ответ'. 2- и 4-метилфенол в соотношении 1:1.
Решения заданий пробного экзамена
Вариант 1
1. Аминофенол - пример органического амфотерного соединения:
2. Рассчитаем количества газов и суммарное количество вещества смеси:
v(N2) = 20 / 28 = 0.714 моль,
v(Ar) = 20 / 40 - 0.50 моль,
v(O2) = 20 /32 = 0.625 моль,
у(смеси) = 0.714 + 0.5 + 0.625 = 1.839 моль.
С использованием уравнения Клапейрона-Менделеева рассчитаем давление в
баллоне:
vRT 1.839 8.314 308 Oy11oa „
р =----=---------------=941.83 кПа.
Ответ’. 941.83 кПа.
3. Слабая фтороводородная кислота обратимо диссоциирует в растворе:
HF Н+ + Г
Исх. конц., моль/л 0.01 0 0
Равновесн. конц. 0.01-х х х
Константа диссоциации кислоты имеет вид
_ [H*][F-] _
”с [HF]
-хх = 6.8- 10Л
0.01-х
Мы получили квадратное уравнение:
X2 + 6.8- Ю-4*- 6.8-10^ = 0.
Из двух его корней выбираем положительный:
х = 2.97-10'3 (моль/л).
Мы нашли равновесную концентрацию ионов Н* в растворе. По определению
pH = -IgCH*] = -Ig(2.97-103) = 2.53.
Ответ: 2.53.
4. Рассчитаем массу и количество SO3 в составе исходного олеума:
m(SO3) = т -со = 150 ♦ 0.6 = 90 г;
v(SO3) = 90/80 = 1.125 моль.
Реакция ангидрида с водой протекает по уравнению:
SO3 + Н2О -> H2SO4,
следовательно, при добавлении олеума к воде образуется 1.125 моль серной кислоты,
масса которой составляет
120
Пробный экзамен
m(H2SO4) = 98 • 1.125 = 110.25 г.
Масса полученного раствора серной кислоты
т(р-ра) = 150 + 100 = 250 г.
Суммарная масса серной кислоты в нем
m(H2SO4) = 60+ 110.25 = 170.25 г.
Рассчитаем концентрацию (массовую долю) серной кислоты
cd(H2SO4) = m(H2SO4) / m(p-pa) = 170.25 / 250 = 0.681 (или 68.1%).
Ответ'. 68.1%.
5. Сначала можно поместить смесь опилок или в раствор щелочи, или в соляную
кислоту. И в том, и в другом случае прореагирует (растворится) только алюминий:
2А1 + 2КОН + 6Н2О -> 2К[А1(ОН)4] + 3H2f;
или 2А1 + 6НС1 -+ 2А1С13 + ЗН2|.
В случае реакции со щелочью (после отделения фильтрованием не
растворившихся Си и Au) алюминий можно выделить из раствора в результате
следующих реакций:
К[А1(ОН)4] + СО2 -> А1(ОН)з! + КНСОз
(осаждение гидроксида алюминия при пропускании углекислого газа в раствор);
2А1(ОН)3 —А120з + ЗН2О (прокаливание остатка);
2А12О3 > 4А1 + 3O2f.
В случае реакции с соляной кислотой (также после отделения не растворившихся
Си и Au) раствор выпариваем, и далее выделяем алюминий электролизом расплава
А1С13:
2А1С13 > 2А1 + ЗС12|.
Оставшуюся смесь опилок золота и меди обработаем азотной кислотой, в
результате чего медь растворится:
Си + 4HNO3 -+ Cu(NO3)2 + 2NO2f + 2Н2О.
Опилки золота отделяем фильтрованием, раствор упариваем, и выделяем медь из
твердой соли следующим образом:
2Cu(NO3)2 —2CuO + 4NO2f + О2Т (прокаливание);
СиО + Н2 —Си + Н2О.
6. Скорость данной элементарной реакции равна
w = ^[NO]2[C12]
Считая объем системы равным V, выразим начальную скорость реакции:
/0.1У 0.2
0 I Г ) V
Прореагировало 20%, или 0.2 • 0.2 = 0.04 моль С12, следовательно, в
соответствии с уравнением реакции прореагировало 0.08 моль NO. Осталось хлора
v(Cl2) = 0.2 - 0.04 = 0.16 моль
и 0.1 - 0.08 = 0.02 моль NO. Скорость реакции к этому моменту времени составит:
Решения заданий
121
/0.02 У 0.16
W = л -----------
V v ) v
следовательно, она уменьшилась в
Ответ', скорость уменьшилась в 31.25 раза.
7. Приведем один из возможных вариантов решения:
1) С12 + 2К —► 2КС1;
2) 2КС1 + 2Н2О — Н2? + 2КОН + С12Т;
3) С12 + 2КОН — КС1 + КСЮ + Н2О;
4) КСЮ + Н2О2 — КС1 + O2f + Н2О;
5) ЗС12 + 6 КОН 5КС1 + КСЮ3 + ЗН2О;
6) КСЮ3 + 6НС1 — КС1 + ЗС12Т + ЗН2О.
8.
СбН12Об -^^2Н3С -СН-С
ОН
Х>Н
(молочнокислое брожение)
Н3С-СН-С +нвг
I Х>Н
ОН
НзС’|Н’С-он+н2°;
Вг
+ 2NH3
Н3С-СН-
I
НзС-СН-С +NH4Br;
I "ОН
NH2
122
Пробный экзамен
+ +
ВгЪз^-СН-СГ + AgNO3--------► NO3"H3N —СН-С +AgBrl
<4 6н2 'он *
$ £
9. Обозначим неизвестные спирты как ROH и R]OH (молярные массы
изомерных радикалов R и R] равны между собой). Уравнения реакций этерификации:
ROH + СН3СН2СООН CH3CH2COOR + Н2О,
RjOH + СН3СН2СООН — CH3CH2COORi + Н2О.
Поскольку по условию задачи массы эфиров относятся как 5:1, примем
количество CH3CH2COOR за 5х моль, а количество CH3CH2COORi за х моль. Тогда
массу смеси эфиров можно выразить как
/л(смеси эфиров) = 5x(R + 73) + х(К + 73) = 25.056 г,
откуда х = 4.176 /(R + 73).
С учетом выхода реакций этерификации в исходной смеси было 5х / 0.75 = 6.67х
моль первого спирта и х / 0.6 = 1.67л- моль второго; их массу выразим как
/л(смеси спиртов) = 6.67x(R + 17) + 1.67x(R + 17) = 18.0 г,
откуда х = 2.16 / (R+ 17).
Приравнивая значения х друг к другу, получаем:
2.16 / (R + 17) = 4.176 / (R + 73),
откуда R = 43.
Поскольку радикал R - это алкил C^H^+b можно составить уравнение
14и+1=43,
из которого п = 3. Значит, неизвестные спирты - это пропанол-1 и пропанол-2.
Ответ', пропанол-1 СН3-СНг-СН2ОН и пропанол-2 СН3-СН(ОН)-СН3.
10. Пусть исходная смесь состояла из х моль гидрида ХН (молярная масса
металла М г/моль) и у моль Zn3P2, тогда массу смеси можно выразить следующим
образом:
/л(смеси) = (Л/+ 1)х + 257у = 42.9 г, или
Мх + х + 257у = 42.9 г. (1)
Запишем уравнения реакций компонентов смеси с водой:
ХН + Н2О —► ХОН + H2f;
х хх
Zn3P2 + 6Н2О — 3Zn(OH)2l + 2PH3f.
У ty 2у
Образовавшаяся щелочь и амфотерный гидроксид взаимодействуют, образуя
растворимую комплексную соль - тетрагидроксоцинкат щелочного металла:
2ХОН + Zn(OH)2 — X2[Zn(OH)4].
х 0.5х 0.5х
Решения заданий 123
Уменьшение массы полученного раствора по сравнению с суммой масс
исходных веществ произошло за счет выделения газов и образования осадка
гидроксида цинка:
Дт(раствора) = 2* + 68у + (Зу - 0.5*) • 99 = 27 г,
365у-47.5* = 27 г. (2)
Масса образовавшегося раствора составляет:
/л(раствора) = 42.9 + 134.1 - 27 - 150 г.
Массовая доля соли по условию равна
<o(X2[Zn(OH)4]) = 0.202 = °'5Л(^0+133), или
Л4х + 66.5х = ЗО.З. (3)
Мы получили систему из трех уравнений (1-3) с тремя неизвестными:
[Мг + * + 257у = 42.9;
<365у- 47.5* = 27;
Мх + 66.5* = 30.3.
Уравнения нелинейные, они содержат произведение Мх. Решить такую систему
можно, выразив Мх из третьего уравнения и подставив полученное выражение в
первое.
Решение системы: * = 0.2 моль, у = 0.1 моль, Л/= 85 г/моль. Неизвестный металл
X - рубидий. Масса его гидрида в исходной смеси равна
m(RbH) = 86 • 0.2 = 17.2 г,
его массовая доля составляет
G)(RbH) = 17.2 / 42.9 = 0.40 (или 40%),
G>(Zn3P2) = 60%.
Ответ: Rb; 40% RbH, 60% Zn3P2.
Вариант 2
1. Аминокислоты - амфотерные органические соединения.
а) КНг-СНг-СНг-СНз-СООН + НС1 — C1"NH3+-CH2-CH2-CH2-COOH
б) NHr-CHz-CHj-CHz-COOH + NaOH — NH2-CH2-CH2-CH2-COONa + Н2О.
2. Рассчитаем количества газов и суммарное количество вещества смеси:
v(CO2) = 10 / 44 = 0.227 моль,
v(Ne) = 20 / 20 = 1.0 моль,
v(C3H8) = 30 / 44 = 0.682 моль,
у(смеси) = 0.227 + 1.0 + 0.682 = 1.909 моль.
С использованием уравнения Клапейрона-Менделеева рассчитаем давление в
баллоне:
^= 1.909.8.3 14.313 =62097кП^
V 8
Ответ: 620.97 кПа.
124
Пробный экзамен
3. Слабая азотистая кислота обратимо диссоциирует в растворе:
HNO2 IT + NCV
Исх. конц.» моль/л 0.005 0 0
Равновесн. конц. 0.005—л х х
Константа диссоциации кислоты имеет вид
я = =4.6-10-4.
[HNOJ 0.005 -х
Мы получили квадратное уравнение:
х2 + 4.610'4л-2.310'6 = 0.
Из двух его корней выбираем положительный:
х = 1.30-10"3 моль/л.
Мы нашли равновесную концентрацию ионов ЬС в растворе. По определению
pH = =-lg(1.3010"3) = 2.89.
Ответ: 2.89.
4. Найдем массу полученного раствора, массу и количество H2SO4 в нем:
т(р-ра) = 100 + 80 = 180 г,
m(H2SO4) = 180 0.6 = 108 г,
v(H2SO4) = 108 / 98 = 1.102 моль.
Пусть исходно в составе олеума было х моль H2SO4 и у моль SO3. Серный
ангидрид провзаимодействовал с водой:
SO3 + Н2О — H2SO4.
У У
Можно составить и решить систему из двух уравнений с двумя неизвестными:
я 4-у = 1.102
98* + 80у = 100
Решение системы: х = 0.658, у = 0.442 (моль).
Массовая доля серного ангидрида в олеуме:
g>(SO3) = 0.442 • 80 / 100 = 0.355 (или 35.5%).
Ответ: 35.5%.
5. Поместим смесь в соляную кислоту. Железо растворится, а смесь серебра и
меди можно отделить от раствора фильтрованием. Раствор выпариваем, чистое
железо выделяем электролизом расплава хлорида.
Fe + 2НС1-> FeCl2 + Н2Т;
РеС12(расплав)—Fe + CljT;
Далее смесь опилок меди и серебра растворяем в азотной кислоте:
Ag + 2HNO3 AgNO3 4- NO2t + Н2О;
Си + 4HNO3 Cu(NO3)2 + 2NO2f 4- 2Н2О.
Серебро осаждаем в виде хлорида, отфильтровываем его и выделяем чистое
серебро:
AgNO3 4- НС1 — AgClj + HNO3;
Решения заданий
125
2AgCl 2Ag4-Cl2t.
Из оставшегося раствора медь осаждаем в виде гидроксида и выделяем из него
чистый металл:
Cu(NO3)2 4- 2NaOH -» Cu(OH)2j 4- 2NaNO3;
Cu(OH)2 CuO 4- H2O;
CuO 4- H2 Cu 4- H2O.
6. Скорость данной элементарной реакции равна
w = jt[CO]2[O2].
Считая объем системы равным V, выразим начальную скорость реакции:
/0.5? 0.4
= к\ —------.
V v) v
Прореагировало 40%, или 0.4 0.4 =0.16 моль О2, следовательно, в соответствии
с уравнением реакции прореагировало 0.32 моль СО. Осталось 0.4 - 0.16 = 0.24 моль
О2 и 0.5 - 0.32 = 0.18 моль СО. Скорость реакции к этому моменту времени составит:
^0
w
следовательно, она уменьшилась в
w0 0.52 0.4 пог
—- =---5----= 12.86 раза.
w 0.182 0.24 f
Ответ', скорость уменьшилась в 12.86 раза.
7. Приведем один из возможных вариантов решения:
1) МпО2 + 4НС1(конц.) — МпС12 + С12| + 2Н2О;
2) МпС12 + О3 + Н2О -> МпО2| 4- 2НС1 4- O2J;
3) MnO2 4- 2С -<-> Мп 4- 2C0J;
4) Мп 4- 2НС1 — МпС12 4- H2f;
5) 2КМпО4 4- 16НС1 — 2МпС12 4- 2КС14- 5Cl2f 4- 8Н2О;
6) 2КМпО4 К2МпО4 4- МпО2 4- О2Г
8. 5СН3-СН=СН-СН3 4- 8КМпО4 4- 12H2SO4 -» ЮСН3СООН 4- 8MnSO4 4-
+ 4K2SO4 + 12Н2О;
СН3СООН 4- С12 СН2СкСООН 4- НС1;
СН2СМЗООН + 2NH3 -» CH2NH2COOH + NH4CI;
Н2С—С 4-H2N-CH-C
I ОН 1„ ч \)Н
NH2 (СН2)2
с
О
П
Н2С—С — NH—СН—С
I
nh2
' + Н2О;
"ОН
(СН2)2
126
Пробный экзамен
П II
H2C-C-NH-CH-C + Н2О + 2НС1 —*-Н2С—С — ОН +
। । »н ।
NH2 (CH2h NHj+Cf
но^ Ч)
СГНзЬГ—ОН—С
I Ч)Н
(СН1)2
с
НОХ ^0
СГНзЬТ-СН-С +AgNO3
(Jltfe 4)14
I
С
НО''
+ X)
NO3H3N+-СН - С + AgCl
«Ьн2ъ °"
НО''
9. Обозначим неизвестные изомерные кислоты как RCOOH и RiCOOH
(молярные массы изомерных радикалов R и R] равны между собой). Уравнения
реакций этерификации:
СН3ОН + RCOOH -> RCOOCH3 + Н20;
СН3ОН + RjCOOH -> R!COOCH3 + Н20.
Поскольку по условию задачи массы кислот относятся как 5 :1, примем
количества кислот за 5х и х моль соответственно. Тогда массу смеси кислот можно
выразить как
/и(смеси кислот) = 5x(R + 45) + x(R + 45) = 52.8,
откуда х = 8.8 / (R + 45).
С учетом процента выхода реакций этерификации количества эфиров составляли
0.8 • 5х = 4х моль RCOOCH3 и 0.5х моль RiCOOCH3; их масса равна:
/л(смеси эфиров) = 4x(R + 59) + 0.5x(R + 59) = 45.9 г,
отсюда х = 10.2 / (R + 59).
Приравнивая значения х друг к другу, получаем:
8.8 / (R + 45) = 10.2 / (R + 59),
откуда R = 43.
Поскольку радикал R - это алкил можно составить уравнение
14и+ 1 = 43,
из которого п = 3. Следовательно, неизвестные кислоты - это бутановая и
метил пропановая.
Ответ-, бутановая СН3СН2СН2СООН и метилпропановая СН3СН(СН3)СООН
кислоты.
10. Пусть исходная смесь состояла из х моль гидрида ХН (молярная масса
металла равна М г/моль) и у моль А14С3, тогда массу смеси можно выразить
следующим образом:
/л(смеси) = (Л/+ 1)х + 144у = 16.8 г, или
Мх + х+ 144у = 16.8 г. (1)
Запишем уравнения реакций компонентов смеси с водой:
Решения заданий
127
хн + н2о -► хон + н2Т;
X XX
AI4C3 + 12Н2О — 4А1(ОН)з| + ЗСНдТ.
У 4у Зу
Образовавшаяся щелочь и амфотерный гидроксид взаимодействуют, образуя
растворимую комплексную соль - тетрагидроксоалюминат щелочного металла:
ХОН + А1(ОН)3 -> Х[А1(ОН)4].
XX X
Уменьшение массы полученного раствора по сравнению с суммой масс
исходных веществ произошло за счет выделившихся газов и осадка гидроксида
алюминия:
Дтп(раствора) = 2х + 48у + (4у - л) • 78 = 28.4 г, или
90у-19л = 7.1 г. (2)
Масса образовавшегося раствора составляет:
ш(раствора) = 16.8 + 111.6 - 28.4 = 100 г;
Массовая доля соли по условию равна
<о(Х[А1(ОН)4]) = 0.118= , или
Мх + 95л =11.8. (3)
Мы получили систему из трех уравнений (1-3) с тремя неизвестными:
{Мх + л + 144у = 16.8;
« 90у- 19л = 7.1;
Мх + 95л = 11.8.
Уравнения нелинейные (содержат произведение Мх). Решить такую систему
можно, выразив произведение Мх из третьего уравнения и подставив полученное
выражение в первое.
Решение системы: х - у ~ 0.1 моль, Л/(металла) = 23 г/моль. Неизвестный металл
- натрий. Массовые доли веществ в исходной смеси:
co(NaH) = 0.1 -23/ 16.8 = 0.1369 (или 13.69%),
ш(А14С3) = 100 - 13.69 = 86.31%.
Ответ: Na; 13.69% NaH, 86.31% А14С3.
ПРОГРАММА ВСТУПИТЕЛЬНЫХ ЭКЗАМЕНОВ ПО ХИМИИ
ДЛЯ ПОСТУПАЮЩИХ В МОСКОВСКИЙ ГОСУДАРСТВЕННЫЙ
УНИВЕРСИТЕТ имени М. В. ЛОМОНОСОВА
Программа по химии для поступающих в Московский государственный
университет состоит из двух разделов. В первом разделе представлены основные
теоретические понятия химии, которыми должен владеть абитуриент с тем, чтобы
уметь обосновать химические и физические свойства веществ, перечисленных во
втором разделе, посвященном элементам и их соединениям.
Экзаменационный билет содержит десять заданий с дифференцированной
оценкой, охватывающих все разделы программы для поступающих.
Продолжительность письменного экзамена равна 4 часам. На экзамене можно
пользоваться своими микрокалькуляторами; справочные таблицы («Периодическая
система химических элементов», «Растворимость оснований, кислот и солей в воде»,
«Ряд стандартных электродных потенциалов») раздаются всем абитуриентам перед
началом экзамена.
Часть I. ОСНОВЫ ТЕОРЕТИЧЕСКОЙ ХИМИИ
Предмет химии. Место химии в естествознании. Масса и энергия. Основные
понятия химии. Вещество. Молекула. Атом. Электрон. Ион. Химический элемент.
Химическая формула. Относительные атомная и молекулярная массы. Моль.
Молярная масса.
Химические превращения. Закон сохранения массы и энергии. Закон
постоянства состава. Стехиометрия.
Строение атома. Атомное ядро. Изотопы. Стабильные и нестабильные ядра.
Радиоактивные превращения, деление ядер и ядерный синтез. Уравнение
радиоактивного распада. Период полураспада.
Двойственная природа электрона. Строение электронных оболочек атомов.
Квантовые числа. Атомные орбитали. Электронные конфигурации атомов в основном
и возбужденном состояниях, принцип Паули, правило Хунда.
Периодический закон Д. И. Менделеева и его обоснование с точки зрения
электронного строения атомов. Периодическая система элементов.
Химическая связь. Типы химических связей: ковалентная, ионная,
металлическая, водородная. Механизмы образования ковалентной связи: обменный и
донорно-акцепторный. Энергия связи. Потенциал ионизации, сродство к электрону,
электроотрицательность. Полярность связи, индуктивный эффект. Кратные связи.
Модель гибридизации орбиталей. Связь электронной структуры молекул с их
геометрическим строением (на примере соединений элементов второго периода).
Программа по химии для поступающих в МГУ 129
Делокализация электронов в сопряженных системах, мезомерный эффект. Понятие о
молекулярных орбиталях.
Валентность и степень окисления. Структурные формулы. Изомерия. Виды
изомерии, структурная и пространственная изомерия.
Агрегатные состояния вещества и переходы между ними в зависимости от
температуры и давления. Газы. Газовые законы. Уравнение Клапейрона-Менделеева.
Закон Авогадро, молярный объем. Жидкости. Ассоциация молекул в жидкостях.
Твердые тела. Основные типы кристаллических решеток: кубические и
гексагональные.
Классификация и номенклатура химических веществ. Индивидуальные
вещества, смеси, растворы. Простые вещества, аллотропия. Металлы и неметаллы.
Сложные вещества. Основные классы неорганических веществ: оксиды, основания,
кислоты, соли. Комплексные соединения. Основные классы органических веществ:
углеводороды, галоген-, кислород- и азотсодержащие вещества. Карбо- и
гетероциклы. Полимеры и макромолекулы.
Химические реакции и их классификация. Типы разрыва химических связей.
Гомо- и гетеролитические реакции. Окислительно-восстановительные реакции.
Тепловые эффекты химических реакций. Термохимические уравнения. Теплота
(энтальпия) образования химических соединений. Закон Гесса и его следствия.
Скорость химической реакции. Представление о механизмах химических
реакций. Элементарная стадия реакции. Гомогенные и гетерогенные реакции.
Зависимость скорости гомогенных реакций от концентрации (закон действующих
масс). Константа скорости химической реакции, ее зависимость от температуры.
Энергия активации.
Явление катализа. Катализаторы. Примеры каталитических процессов.
Представление о механизмах гомогенного и гетерогенного катализа.
Обратимые реакции. Химическое равновесие. Константа равновесия, степень
превращения. Смещение химического равновесия под действием температуры и
давления (концентрации). Принцип Ле Шателье.
Дисперсные системы. Коллоидные системы. Растворы. Механизм образования
растворов. Растворимость веществ и ее зависимость от температуры и природы
растворителя. Способы выражения концентрации растворов: массовая доля, мольная
доля, объемная доля, молярная концентрация. Отличие физических свойств раствора
от свойств растворителя. Твердые растворы. Сплавы.
Электролиты. Растворы электролитов. Электролитическая диссоциация кислот,
оснований и солей. Кислотно-основные взаимодействия в растворах. Протонные
кислоты, кислоты Льюиса. Амфотерность. Константа диссоциации. Ciciichi.
диссоциации. Ионное произведение воды. Водородный показатель. Гидроли< солей.
Равновесие между ионами в растворе и твердой фазой. Произведение растворимости.
130 Программа по химии для поступающих в МГУ
Образование простейших комплексов в растворах. Координационное число.
Константа устойчивости комплексов. Ионные уравнения реакций.
Окислительно-восстановительные реакции в растворах. Определение
стехиометрических коэффициентов в уравнениях окислительно-восстановительных
реакций. Стандартные потенциалы окислительно-восстановительных реакций. Ряд
стандартных электродных потенциалов. Электролиз растворов и расплавов. Законы
электролиза Фарадея.
Часть II. ЭЛЕМЕНТЫ И ИХ СОЕДИНЕНИЯ
НЕОРГАНИЧЕСКАЯ ХИМИЯ
Абитуриенты должны на основании Периодического закона давать
сравнительную характеристику элементов в группах и периодах. Характеристика
элементов включает: электронные конфигурации атома; возможные валентности и
степени окисления элемента в соединениях; формы простых веществ и основные
типы соединений, их физические и химические свойства, лабораторные и
промышленные способы получения; распространенность элемента и его соединений в
природе, практическое значение и области применения соединений. При описании
химических свойств должны быть отражены реакции с участием неорганических и
органических соединений (кислотно-основные и окислительно-восстановительные
превращения), а также качественные реакции.
Водород. Изотопы водорода. Соединения водорода с металлами и неметаллами.
Вода. Пероксид водорода.
Галогены. Галогеноводороды. Галогениды. Кислородсодержащие соединения
хлора.
Кислород. Оксиды и пероксиды. Озон.
Сера. Сероводород, сульфиды, полисульфиды. Оксиды серы (IV) и (VI).
Сернистая и серная кислоты и их соли. Эфиры серной кислоты. Тиосульфат натрия.
Азот. Аммиак, соли аммония, амиды металлов, нитриды. Оксиды азота.
Азотистая и азотная кислоты и их соли. Эфиры азотной кислоты.
Фосфор. Фосфин, фосфиды. Оксиды фосфора (III) и (V). Галогениды фосфора.
Орто-, мета- и дифосфорная (пирофосфорная) кислоты. Ортофосфаты. Эфиры
фосфорной кислоты.
Углерод и его аллотропные формы. Изотопы углерода. Простейшие
углеводороды: метан, этилен, ацетилен. Карбиды кальция, алюминия и железа.
Оксиды углерода (II) и (IV). Карбонилы переходных металлов. Угольная кислота и ее
соли.
Кремний. Силан. Силицид магния. Оксид кремния (IV). Кремниевые кислоты,
силикаты.
Бор. Трифторид бора. Орто- и тетраборная кислоты. Тетраборат натрия.
Благородные газы. Примеры соединений криптона и ксенона.
Программа по химии для поступающих в МГУ 131
Щелочные металлы. Оксиды, пероксиды, гидроксиды и соли щелочных
металлов.
Щелочноземельные металлы, бериллий, магний: их оксиды, гидроксиды и
соли. Представление о магнийорганических соединениях (реактив Гриньяра).
Алюминий. Оксид, гидроксид и соли алюминия. Комплексные соединения
алюминия. Представление об алюмосиликатах.
Медь, серебро. Оксиды меди (I) и (II), оксид серебра (I). Гидроксид меди (II).
Соли серебра и меди. Комплексные соединения серебра и меди.
Цинк, ртуть. Оксиды цинка и ртути. Гидроксид и соли цинка.
Хром. Оксиды хрома (II), (III) и (VI). Гидроксиды и соли хрома (II) и (III).
Хроматы и дихроматы (VI). Комплексные соединения хрома (III).
Марганец. Оксиды марганца (II) и (IV). Гидроксид и соли марганца (II).
Манганат и перманганат калия.
Железо, кобальт, никель. Оксиды железа (II), (II)-(III) и (III). Гидроксиды и
соли железа (II) и (III). Ферраты (III) и (VI). Комплексные соединения железа. Соли и
комплексные соединения кобальта (II) и никеля (II).
ОРГАНИЧЕСКАЯ ХИМИЯ
Характеристика каждого класса органических соединений включает:
особенности электронного и пространственного строения соединений данного класса,
закономерности изменения физических и химических свойств в гомологическом ряду,
номенклатуру, виды изомерии, основные типы химических реакций и их механизмы
Характеристика конкретных соединений включает физические и химические
свойства, лабораторные и промышленные способы получения, области применения
При описании химических свойств необходимо учитывать реакции с участием кик
радикала, так и функциональной группы.
Структурная теория как основа органической химии. Углеродный скекч
Функциональная группа. Гомологические ряды. Изомерия: струит >рнйя и
пространственная. Представление об оптической изомерии. Взаимное влияние ан»м««
в молекуле. Классификация органических реакций по механизму и шря п
частиц.
Алканы и циклоалканы. Конформеры.
Алкены и циклоалкены. Сопряженные диены.
Алкины. Кислотные свойства алкинов.
Ароматические углеводороды (арены). Бен юл и ею юм<м«мм <
ароматической системы и углеводородного радикала (
заместителей в бензольном кольце (орис1пшпы I и II
конденсированных ароматических углсводородАХ
Галогенопроизводные углеводородов илкит*. ’ •• *•
Реакции замещения и от щепления.
132
Программа по химии для поступающих в МГУ
Спирты одно- и многоатомные. Первичные, вторичные и третичные спирты.
Фенолы. Простые эфиры.
Карбонильные соединения: альдегиды и кетоны. Предельные, непредельные и
ароматические альдегиды. Понятие о кето-енольной таутомерии.
Карбоновые кислоты. Предельные, непредельные и ароматические кислоты.
Моно- и дикарбоновые кислоты. Производные карбоновых кислот: соли, ангидриды,
галбгенан гидриды, сложные эфиры, амиды. Жиры.
Нитросоединения: нитрометан, нитробензол.
Амины. Алифатические и ароматические амины. Первичные, вторичные и
третичные амины. Основность аминов. Четвертичные аммониевые соли и основания.
Галогензамещенные кислоты. Оксикислоты: молочная, винная и салициловая
кислоты. Аминокислоты: глицин, аланин, цистеин, серин, фенилаланин, тирозин,
лизин, глутаминовая кислота. Пептиды. Представление о структуре белков.
Углеводы. Моносахариды: рибоза, дезоксирибоза, глюкоза, фруктоза.
Циклические формы моносахаридов. Понятие о пространственных изомерах
углеводов. Дисахариды: целлобиоза, мальтоза, сахароза. Полисахариды: крахмал,
целлюлоза.
Пиррол. Пиридин. Пиримидиновые и пуриновые основания, входящие в состав
нуклеиновых кислот. Представление о структуре нуклеиновых кислот.
Реакции полимеризации и поликонденсации. Отдельные типы
высокомолекулярных соединений: полиэтилен, полипропилен, полистирол,
поливинилхлорид, политетрафторэтилен, каучуки, сополимеры, фенол-
формальдегидные смолы, искусственные и синтетические волокна.
133
РЕКОМЕНДУЕМАЯ ЛИТЕРАТУРА
1. Кузьменко Н.Е, Еремин В.В., Попков В.А. Начала химии. Для поступающих в
вузы. - М.: Лаборатория знаний, 2016, 2017.
Современное и универсальное отечественное пособие по химии для
поступающих в вузы, выдержавшее 16 изданий. Его содержание основано на
учете требований программ вступительных экзаменов по химии ведущих
российских вузов (химических, медицинских, биологических, биоинженерных и
т.п.).
2. Кузьменко Н.Е., Еремин В.В. 2500 задач по химии с решениями для
поступающих в вузы. - М.: Мир и образование, 2002-2004: Экзамен, 2005-2007.
В книге представлены школьные, экзаменационные, олимпиадные задачи. Ко
всем заданиям даны ответы и указания, а также представлены эталонные решения
типичных задач.
3. Кузьменко НЕ., Еремин В.В., Попков В.А. Химия. Для школьников старших
классов и поступающих в вузы: Учебное пособие. - М.: Изд-во МГУ, 2008-2017.
В пособии приводится теоретический материал по всем разделам курса химии.
Оно содержит около 1500 экзаменационных задач, вопросов и упражнений с
подробными решениями и ответами. Диапазон сложности задач достаточно
широк - от самых простых до очень сложных.
4. Еремина Е.А., Рыжова О.Н. Химия: справочник школьника. - М.: Изд-во
Моск, ун-та, 2014-2018. - (Программа МГУ - школе)
Книга содержит все уравнения реакций, предлагаемых на экзаменах по химии
в школах и на вступительных экзаменах в вузах. Незаменима как справочное
пособие для школьников и абитуриентов.
5. Кузьменко Н.Е., Теренин В.И., Рыжова О.Н. и др. Вступительные экзамены и
олимпиады по химии: опыт Московского университета / под ред. Н.Е.
Кузьменко, О.Н. Рыжовой и В.И. Теренина. - М.: Изд-во Моск, ун-та, 2011-2018.
Издание включает все варианты, предлагавшиеся в 2006-2010 годах на
университетских олимпиадах и вступительных экзаменах по химии в МГУ имени
М.В. Ломоносова. Для каждого варианта приведены подробные решения заданий
или ответы и указания к решению.
6. Кузьменко Н.Е., Теренин В.И., Рыжова О.Н. и др. Химия: формулы успеха на
вступительных экзаменах / под ред. Н.Е. Кузьменко и В.И. Теренина. - М.: Изд-
во Моск, ун-та, 2006.
Это издание включает все экзаменационные вариангы, предлагавшиеся в 2003-
2005 годах на вступительных экзаменах по химии на все факультеты МГУ имени
М.В. Ломоносова. Для каждого варианта приведены подробные решения заданий
или же ответы и указания к решению.
134
Рекомендуемая литература
7. Еремин В.В., Кузьменко Н.Е., Дроздов А.А., Лунин В.В., Теренин В.И. Химия:
Учебники для 8-11 классов общеобразовательных учреждений. - М.: Дрофа,
2007-2014.
Это - серия современных школьных учебников по химии, написанная
авторским коллективом МГУ. Главное внимание в них уделяется формированию
у школьников элементарных химических навыков, «химического языка» и
химического мышления, в первую очередь, на веществах, знакомых из
повседневной жизни (кислород, воздух, вода). Стиль изложения материала
позволяет вводить и обсуждать химические понятия и термины в живой и
наглядной форме. Наглядно демонстрируются междисциплинарные связи химии
с естественными и гуманитарными науками. Отличительными особенностями
книг являются простота и наглядность изложения материала, высокий научный
уровень, большое количество иллюстраций, экспериментов и занимательных
опытов. Представлены учебники для базового и углубленного уровней.