Tags: журнал домашняя лаборатория
Year: 2008
Text
ЛАБОРАТОРИЯ
ЯНВАРЬ 2008
ДОМАШНЯЯ
ЛАБОРАТОРИЯ
Интернет-журнал
колхозников, инженегров
и разнорабочих науки.
Адрес редакции:
domlab@inbox.com
СОДЕРЖАНИЕ
Январь 2007
История
Статьи для журнала направ-
лять , указывая в теме пись-
ма «For journal».
Журнал содержит материалы
найденные в Интернет или
написанные для Интернет.
Журнал является полностью
некоммерческим. Никакие го-
норары авторам статей не
выплачиваются и никакие оп-
латы за рекламу не принима-
ются .
Явные рекламные объявления
не принимаются, но скрытая
реклама, содержащаяся в
статьях, допускается и даже
приветствуется.
Редакция занимается только
оформительской деятельно-
стью и никакой ответствен-
ности за содержание статей
не несет.
Баллада о вересковом меде
Шотландский вересковый эль
3
6
Беспокойств,
«Блеск и нищета» высшего образования в России 9
Профессия
Читальня
25
Ликбез
Основы биотехнологии 65
Практическая биотехнология для начинающих
Разведение пивных дрожжей в домашних условиях
Жарим верно дома
Лаборатория
338
Практика
357
360
Технолог!
Эли бочкового созревания 366
Уксус. Что это такое и как его делают 372
Статьи не редактируются,
орфография статей является
делом их авторов.
Опыты в домашней лаборатории
Химичка
379
При использовании материа-
лов этого журнала, ссылка
на него не является обяза-
тельной , но желательной.
Никакие претензии за не-
вольный ущерб авторам, за-
имствованных в Интернет
статей и произведений, не
принимаются. Произведенный
ущерб считается компенсиро-
ванным рекламой авторов и
их произведений.
Электроник
Автоматическое бесконтактное 402
переключающее устройство
Конденсаторное реле сверхдлительных выдержек времени 408
Фотоэлектронные устройства (обвор) 411
Числоимпульсный генератор 418
Благословение
Редакторам
420
По всем спорным вопросам следу-
ет обращаться лично в соответ-
ствующие учреждения провинции
Свободное государство (ЮАР).
При себе иметь, заверенные ме-
стным нотариусом, копии всех
необходимых документов на афри-
каанс, в том числе, свидетель-
ства о рождении, диплома об
образовании, справки с места
жительства, справки о здоровье
и справки об авторских правах
(в 2-х экземплярах).
НА ОБЛОЖКЕ
Тихо, тихо, улитка ползи
По склону горы Фудзи.
С такой обширной областью науки и практики, как био-
технология, следует знакомиться постепенно, не спе-
ша. В этом номере смотрите о ней разделы "Ликбез" и
"Лаборатория".
История
БАЛЛАДА О ВЕРЕСКОВОМ МЕДЕ
Р. Стивенсон
Heather Ale
Вересковый мед
From the bonny bells of heather
They brewed a drink long-syne,
Was sweeter far than honey,
Was stronger far than wine.
They brewed it and they drank it,
And lay in a blessed swound
For days and days together
In their dwellings underground.
Из вереска напиток
Забыт давным-давно.
А был он слаще меда,
Пьянее, чем вино.
В котлах его варили
И пили всей семьей
Малютки медовары
В пещерах под землей.
There rose a king in Scotland,
A fell man to his foes,
He smote the Picts in battle,
He hunted them like roes.
Over miles of the red mountain
He hunted as they fled,
And strewed the dwarfish bodies
Of the dying and the dead.
Summer came in the country,
Red was the heather bell;
But the manner of the brewing
Was none alive to tell.
In graves that were like children’s
On many a mountain head,
The Brewsters of the Heather
Lay numbered with the dead.
The king in the red moorland
Rode on a summer’s day;
And the bees hummed, and the curlews
Cried beside the way.
The king rode, and was angry,
Black was his brow and pale,
To rule in a land of heather
And lack the Heather Ale.
It fortuned that his vassals,
Riding free on the heath,
Came on a stone that was fallen
And vermin hid beneath.
Rudely plucked from their hiding,
Never a word they spoke:
A son and his aged father -
Last of the dwarfish folk.
The king sat high on his charger,
He looked on the little men;
And the dwarfish and swarthy couple
Looked at the king again.
Down by the shore he had them;
And there on the giddy brink -
"I will give you life, ye vermin,
For the secret of the drink. ’’
There stood the son and father
And they looked high and low;
The heather was red around them,
The sea rumbled below.
And up and spoke the father,
Shrill was his voice to hear:
"I have a word in private,
A word for the royal ear.
"Life is dear to the aged,
Пришел король шотландский.
Безжалостный к врагам,
Прижал он бедных пиктов
К скалистым берегам.
На вересковом поле,
На поле боевом
Лежал живой на мертвом
И мертвый — на живом.
Лето в стране настало,
Вереск опять цветет,
Но некому готовить
Вересковый мед.
В своих могилках тесных,
В горах родной земли
Малютки медовары
Приют себе нашли.
Король по склону едет
Над морем на коне,
И рядом реют чайки
С дорогой наравне.
Король глядит угрюмо:
«Опять в краю моем
Цветет медвяный вереск,
А меда мы не пьем!»
Но вот его вассалы
Приметили двоих
Последних медоваров,
Оставшихся в живых.
Вышли они из-под камня,
Щурясь на белый свет,
- Старый горбатый карлик
И мальчик пятнадцати лет.
К берегу моря крутому
Их привели на допрос,
Но ни один из пленных
Слова не произнес.
Сидел король шотландский,
Не шевелясь, в седле.
А маленькие люди
Стояли на земле.
Гневно король промолвил:
- Пытка обоих ждет,
Если не скажете, черти,
Как вы готовили мед!
And honour a little thing;
I would gladly sell the secret,"
Quoth the Pict to the King.
His voice was small as a sparrow’s,
And shrill and wonderful clear:
"I would gladly sell my secret,
Only my son I fear.
"For life is a little matter,
And death is nought to the young;
And I dare not sell my honour
Under the eye of my son.
Take HIM, О king, and bind him,
And cast him far in the deep;
And it’s I will tell the secret
That I have sworn to keep."
They took the son and bound him,
Neck and heels in a thong,
And a lad took him and swung him,
And flung him far and strong,
And the sea swallowed his body,
Like that of a child of ten; -
And there on the cliff stood
father,
Last of the dwarfish men.
"True was the word I told you:
Only my son I feared;
For I doubt the sapling courage
That goes without the beard.
But now in vain is the torture,
Fire shall never avail:
Here dies in my bosom
The secret of Heather Ale."
Сын и отец молчали,
Стоя у края скалы.
Вереск звенел над ними,
В море катились валы.
И вдруг голосок раздался:
- Слушай, шотландский король
Поговорить с тобою
С глазу на глаз позволь!
Старость боится смерти.
Жизнь я изменой куплю,
Выдам заветную тайну!
- Карлик сказал королю.
Голос его воробьиный
Резко и четко звучал:
- Тайну давно бы я выдал,
Е ели бы сын не мешал!
Мальчику жизни не жалко,
the Гибель ему нипочем.
Мне продавать свою совесть
Совестно будет при нем.
Пускай его крепко свяжут
И бросят в пучину вод
-И я научу шотландцев
Готовить старинный мед!..
Сильный шотландский воин
Мальчика крепко связал
И бросил в открытое море
С прибрежных отвесных скал.
Волны над ним сомкнулись.
Замер последний крик...
И эхом ему ответил
С обрыва отец-старик:
- Правду сказал я, шотландцы
От сына я ждал беды.
Не верил я в стойкость юных,
Не бреющих бороды.
А мне костер не страшен.
Пускай со мной умрет
Моя святая тайна
- Мой вересковый мед!
Перевод С. Маршака
ШОТЛАНДСКИЙ ВЕРЕСКОВЫЙ ЭЛЬ1
Брюс Уиллиамс
Вересковый эль без сомнения самое старое пивоваренное наследие Шотландии.
Напиток готовили следующим образом: сначала делали затор из шотландского эле-
вого солода, варили сусло с цветущими верхушками вереска, затем засыпали его
поверхность свежими цветами вереска1, оставляли охладиться и сбраживали 12
дней, пока вереск не почернеет. Эль пили прямо из емкости, называвшейся сгап
(бочка), в которой на четверть по высоте проделывалось отверстие для крана.
Это янтарный, слегка газированный эль с мягкой горечью, крепким маслянистым
телом и виноподобным финалом - поинтересуйтесь у Майкла Джексона. Этот напи-
ток во времена Старого Альянса (Auld Alliance) в 18-ом веке французы называли
шотландским бургундским, а англичане шотландской мальвазией.
История приготовления верескового эля имеет древнюю традицию. Во время ар-
хеологических раскопок на шотландском острове Rhum были обнаружены черепки
эпохи неолита, датированные приблизительно 2000 лет до н.э., на которых были
найдены следы напитка брожения, содержащего вереск. Намного позже, приблизи-
тельно 100 лет до н.э. было известно, что совершенно определенный европейский
народ (кельты) готовили опьяняющий отвар из цветов вереска и меда, но самое
богатое наследие по изготовлению верескового эля относится к временам, когда
Шотландия носила название Piсtland (земля пиктов).
Известный в четвертом веке мореплаватель Пифей (Pytheas) отмечал, что пикты
(Picts) были искусными пивоварами, и в Шотландском словаре говорилось, что
"пикты варят некий великий и ужасный напиток, называемый вересковым элем, из
вереска и некоего неведомого fogg'а11". Короли Пиктланда отразили многие
вторжения европейцев, англосаксов и ирландцев, и они даже прогнали восвояси
силы могущественной Римской империи. За это они обрели славу свирепого наро-
да, обладающего секретным волшебным зельем, которое называлось вересковым
элем. Одна легенда, которая жива и по сей день, была записана Нейлом Мунро,
сэром Гербертом Максвеллом, и она послужила темой для поэмы Роберта Льюиса
Стивенсона - ее изложение отличается лишь в деталях. *
1
Часть статьи.
В 400 году нашей эры ирландский король вторгся в Далриаду (Dalriada) на
юго-западе Шотландии и начал истреблять местных пиктов. Считается, что охва-
ченный диким желанием выиграть сражение, он убил их всех прежде, чем вспомнил
о существовании верескового эля. Он послал свою армию, чтобы найти выживших,
и они вернулись с вождем пиктов и его сыном. Ирландский король собирался уже
пытать их, чтобы выведать тайну верескового эля, когда вождь вдруг согласился
сообщить тайну при условии, что они убьют его сына быстро. Как только его сын
был умерщвлен, старый вождь привел ирландского короля к утесу, где рос урожай
вереска, и, согласно Роберту Льису Стивенсону, промолвил: "Но теперь напрасна
пытка, огонь тут не поможет, вот умирает в моей груди тайна верескового эля."
(В переводе Андрея Кузнецова это звучит так:
«Плевать мне на ваши пытки,
Со мною исчезнет в огне,
Напитка из вереска тайна,
Известная только мне»).
Вождь бросился к королю, и, упав с утеса, они оба разбились насмерть.
Хотя эта легенда основана на реальных событиях, все же пикты не были полно-
стью истреблены. От них был зачищен район Далриады, но традиция изготовления
верескового эля продолжала жить, особенно в горах Шотландии (Highlands, Наго-
рье) .
К 12-ому столетию земли пиктов и Далриады объединились, и это стало назы-
ваться Шотландией, гаэлы называли ее "Alba", а вересковый эль стал в кланах
привычным напитком. Одна легенда в стиле Ceilidh (кейли, вечеринка с музыкой
и танцами в Шотландии) повествует о холодной зиме, проводимой в пещере в На-
горье, где собрался гаэльский клан. Они сидели у котелка с вересковым элем,
который подогревался на огне, рассказывали истории, пели и выпивали. Тем вре-
менем, пар от верескового эля собирался на потолке в виде конденсата и капал
прямо в чашу на земле. Члены клана отпили из чаши и испытали ощущение эйфо-
рии, тепла и спокойствия, которое никогда прежде им было неведомо. "Uisge-
beatha!", воскликнули они, и вода жизни была открыта той ночью. Это название
было вскоре сокращено до "uisge", uis-ge, которое в английском языке было ис-
коверкано и превращено в «виски».
В 18-ом столетии Шотландия переживала свои самые черные дни. После резни в
Glencoe и 50 лет борьбы с Британской империей, восстание Бонни Принс Чарльза
в 1745 было разгромлено из-за подавляющего превосходства противника, и Шот-
ландия потеряла свою независимость. С целью предотвратить впредь любое вос-
стание , британское правительство старалось уничтожить саму систему кланов,
Запретив носить одежду из шотландки или любую другую традиционную одежду На-
горья, было запрещено ношение оружия, гаэльский язык был объявлен вне закона,
в общем общины Нагорья подвергались репрессиям. Все это и сживание людей с
насиженных мест в Нагорье привело к потере многих ремесел и профессий, факти-
чески, целая культура оказалась под угрозой. Вскоре вересковый эль перешел в
разряд легенды. Законодательство при производстве эля воспрещало использова-
ние чего-либо кроме хмеля, солода и воды. Эта этническая чистка, проведенная
британцами, привела к тому, что тысячи шотландцев перебрались в Вест-Индию,
Новую Зеландию, штаты Мэриленд или Южная Каролина в США, что в свою очередь
вызвало массовый исход. Шотландское общество начало эмигрировать и последова-
ло за своими кланами.
20-ый век принес признание шотландскому виски как авторитетному напитку,
полученному путем перегонки, а шотландское пиво отгружали потребителям по
всему миру. Известно, что вересковый эль также производился, возможно, вопре-
ки всему, в отдаленном Нагорье и на островах по древним гаэльским рецептам,
которые женщины-пивовары из клана передали своим потомкам. В 1986 году в
Глазго один гаэльско-говорящий островитянин перевел мне один такой рецепт, и
я, как и до меня это делал Брюс, предпринял ряд попыток, прежде чем достиг
успехов в возрождении верескового эля.
1 Вереск - низкорослый кустарник обычный для торфяных холмов Шотландии. Рас-
тение Bell heather, также называемое Bonnie bells (Erica tetralix, Вереск бо-
лотный и Е. cinerea), имеет колоколообразные цветки по цвету от белого до
фиолетового, цветет с апреля по июнь. Растение Ling heather или Broom heather
(Calluna vulgaris, Вереск обыкновенный) имеет маленькие, бутонообразные цве-
ты, которые бывают белого, красного или фиолетового цвета и цветут с августа
по сентябрь. Вереск произрастает во многих странах и в России тоже.
11 Мох (fog) растет на одревесневшем стебле внутри растения вереска, а не
около цветов, и содержит дикие дрожжи. Fog обладает некоторыми наркотическими
свойствами, которые были исключены из коммерческих рецептов. Мох растет глу-
боко в стеблях, но он летает в воздухе в момент сбора цветов. Он представляет
собой легкий белый порошок, который можно легко удалить, ополоснув растения в
холодной воде.
Беспокойство
«БЛЕСК И НИЩЕТА»
ВЫСШЕГО ОБРАЗОВАНИЯ
В РОССИИ
Кастуева-Жан Т.
Россия унаследовала от советского периода репутацию страны с высо-
кообразованным населением и эффективной системой образования. На са-
мом деле ситуация менее однозначна. За большой популярностью высшего об-
разования и успехами некоторых крупных университетов и институтов скрыва-
ются снижение качества образования и некоторое обесценивание дипломов.
Попытки реформирования наталкиваются на структурные проблемы образова-
тельной системы, а также на коррупцию в педагогической среде. Такая
ситуация затрудняет реальную оценку российских дипломов. Кроме того,
«приватизация» большей части образовательных услуг остро ставит проблему
равенства шансов.
Введение
Высокий уровень образованности населения обусловил научные и в технические
достижения страны в советский период. Для советских людей образо-
вательная и научно-исследовательская система страны, полностью фи-
нансируемая из государственного бюджета, долгое время оставалась наиболее
ощутимым достижением социалистического строя.
После распада СССР, экономический кризис и резкое сокращение госу-
дарственного финансирования вынудили учебные заведения искать стратегии
выживания. В результате реформ, начатых в начале постсоветского периода с
целью модернизации и децентрализации образовательной системы, государствен-
ные учебные заведения получили большую автономию. Были также созданы
условия для развития частных образовательных учреждений. За очень короткий
срок возник рынок образовательных услуг, который с тех пор неуклонно растёт.
Несмотря на призывы педагогического сообщества к «спасению» российско-
го образования, которому угрожают недостаток государственного финансирования
и последствия сокрушительного распада системы, уровень образования в
России продолжает по инерции восприниматься - как внутри страны, так и за
рубежом - как в целом высокий. Этот потенциал часто упоминается среди
главных козырей, которые могут стать залогом мощи и возрождения России.
Представители российской политический элиты постоянно подчёркивают
значение этого предполагаемого потенциала для экономического роста в ус-
ловиях жёсткой международной конкуренции. Так, в одном из своих выступлений
на Заседании Госсовета в августе 2001 года Владимир Путин подчеркнул,
что образование «стало дорогим и самым ценным товаром, а устойчивое развитие
стран уже давно определяется не столько их ресурсами, сколько общим уровнем
образования нации». Образование фигурирует в числе четырёх национальных
проектов, заявленных в сентябре 2005г., и вошло в повестку дня встречи
большой восьмёрки в Санкт-Петербурге в июле 2006г.
Между тем, за этими заявлениями и общим впечатлением качества обра-
зовательной системы скрываются противоречия и контрасты. Повышенный
спрос на высшее образование и успехи отдельных учебных заведений не
могут заслонить собой общего снижения качества образования, усиливающе-
гося неравенства возможностей и обесценивания дипломов.
Количество или качество?
Повышенный спрос на высшее образование
По количественным показателям Россия входит в группу самых образо-
ванных стран мира1. Что касается сферы высшего образования, в 1995-
1996 гг. в 762 российских вузах обучалось 2,791 миллиона студентов; а
1 Например, если сравнивать со странами ОЭСР, Россия Занимает третье место по удельному весу
лиц с высшим образованием среди активного населения (22,3% или 160 человек на тысячу жи-
телей по данным переписи 2002г.). Для сравнения, этот показатель составляет 27,9% в
США, 22,1% в Нидерландах, 16,1% в Японии, 13,8% в Германии, 13% во Франции. Статистиче-
ский сборник «Образование в Российской Федерации», Москва, ГУ-ВШЭ, 2005.
в 2005-2006 гг. уже 1 068 вузов (655 государственных и 413 частных) ве-
дут подготовку 7,064 миллионов студентов2. Этот стремительный рост про-
исходит на фоне демографического спада в стране, который уже начинает про-
являться в снижении количества дошкольных и средних учебных заведений.
Сегодня Россия насчитывает больше студентов, чем за всю свою предыду-
щую историю, включая и советский период. Количество студентов государ-
ственных вузов в 2004-2005 гг. составило 419 человек на 10 000 населения -
цифра тем более значительная, что на то же количество населения выделяется
лишь 170 бюджетных мест. И этот показатель постоянно увеличивается с 1996
г., после окончания периода явного спада спроса на высшее образование между
1990 и 1995гг.
Сегодня больше, чем когда-либо, в глазах россиян образование является при-
оритетом, оправдывающим вложение средств. По некоторым опросам общест-
венного мнения образовательные услуги стали первой статьей расходов рос-
сийских семей, обгоняя семейные сбережения и расходы на медицинское об-
служивание3 . Речь идёт о рынке будущего, поскольку наблюдается настоя-
щий бум в сфере высшего образования, которое стремятся дать своим
детям как минимум 85% российских семей.
Так же высока тяга к обучению в аспирантуре и получению учёных
степеней. В 2003 году количество аспирантов превосходило в 2,5 раза их коли-
чество в 1995 году (140 741 против 62 317)4. В 2005 году Российская госу-
дарственная библиотека зарегистрировала рекордное количество диссертаций -
31 000 (для сравнения - 27 000 в 2004г.)5. Наличие диссертации в России
уже давно негласно рассматривается как необходимое условие для испол-
нения ответственных политических или управленческих должностей. Политики,
чиновники высшего уровня и бизнесмены стремятся к приобретению учёных
степеней. В апреле 2006 г. Независимая газета опубликовала сведения о ко-
личестве «кандидатов VIР» в действительные члены или члены-корреспонденты
Российской академии наук6. Среди депутатов Думы (450 человек), напри-
мер, насчитывается 143 кандидата наук, 71 доктор наук, а 14 депутатов
имеют две учёные степени в разных областях науки.
О качестве дипломов
По инерции или в силу национальной гордости большая часть россиян продол-
жает считать свою систему образования одной из лучших в мире. Так,
после недавнего визита в Оксфорд губернатор Свердловской области Э. Россель
заявил, что не увидел там «ничего особенного», а «с точки зрения среднего и
высшего образования мы далеко впереди Оксфорда7». Опросы общественного мнения
2 Если не указан другой источник, цифровые данные этой статьи Заимствованы из Российского
статистического ежегодника 2005, Федеральная служба государственной статистики Госкомстат,
Москва, 2005, (глава, посвящённая образованию) и с сайта Госкомстата <www.gks.ru>.
3 Социологический опрос «Экономика образования в Зеркале статистики: новые данные»,
Москва, Высшая школа экономики, 2005 г., с.17, <http://isek.hse.ru>.
4 Цит. по: И. Дежина, Изменение кадровой структуры науки России и государственная
политика // Russie.Nei.Visions, №4, июнь 2005.
5 Цит. по: Д.Симакин, Доктора невидимого фронта // Независимая ГаЗета-НГ, 24 марта
2006г.
6 НГ, 14 апреля 2006г. Эта публикация стала причиной скандала в академических кру-
гах, которые в итоге в большинстве проголосовали против этих «кандидатов VIP», часто далё-
ких от исследований и науки (см. НГ, 26 мая 2006г.).
7 НГ, 15 мая 2005.
далеко не так однозначны8, а международные исследования на эту тему даже бьют
тревогу.
Так, если говорить о среднем образовании, Россия находится на последних по-
зициях в рейтинге, составленном по результатам тестов PISA (Program for
International Student Assessment), проведённых Организацией экономического
сотрудничества и развития (ОЭСР) в 2000 и 2003 гг. среди пятнадцатилетних
школьников9. В 2000 г. из 32-х стран-участниц российские подростки заняли
лишь 27-е место по чтению (интерпретация текста, способность его анализиро-
вать, делать выводы, формулировать собственную точку зрения), 26-е по
естественным наукам и 21-е по математике. В 2003 году Россия оказалась
соответственно на 32-ом, 24-ом и 29-ом местах среди 41 страны. Тесты свиде-
тельствуют о трудностях, возникающих у российских учеников при необходи-
мости применить полученные знания вне школьных уроков, использовать про-
тиворечивую или неполную информацию, а также о нехватке критического мышле-
ния .
Эти результаты, совершенно не соответствующие имеющимся у россиян пред-
ставлениям об уровне среднего образования в стране, вызвали шок в
педагогической среде. Многие педагоги выступают отныне за подход, на-
целенный не на приобретение знаний, а на развитие компетенций (так
называемый компетентностный подход), определяемых как способность эффек-
тивно реагировать на незнакомые ситуации10 11.
Что касается сравнений в области высшего образования, можно указать между-
народный рейтинг, опубликованный в августе 2006 года Шанхайским институтом
высшего образования. Среди 500 лучших мировых университетов в нём фи-
гурируют лишь два российских: Московский государственный университет -
МГУ на 72-ом месте (21-е место в рейтинге европейских университетов) и
Санкт-Петербургский государственный университет на 340-ом11. Для сравне-
ния, рейтинг включает 22 французских университета, 20 китайских, 4 бразиль-
ских, 2 польских, и большое количество американских университетов, зани-
мающих бесспорные лидирующие позиции.
Этот рейтинг демонстрирует своего рода международную маргинализацию
большинства российских вузов, подтверждающуюся и относительно небольшим чис-
лом иностранных студентов, проходящих обучение в России. Например, в 2003
году Россия приняла 54 200 иностранных студентов (для сравнения, в том
же году в США обучались 558 000 иностранных студентов, в Германии - 240
619, в Великобритании - 255 233 и во Франции - 221 567)12, из которых
значительная часть обучалась на языковых курсах. Доля России на миро-
8 Согласно опросу ФОМ (Фонда «Общественное мнение») от 9 марта 2006г., большая часть опро-
шенных убеждена в том, что качество российского высшего образования ниже по сравнению с со-
ветской эпохой (50%) или ниже мирового уровня (37%). В то же время, треть россиян считает,
что оно соответствует международному уровню (23%) и даже превосходит его (10%) ,
<bd.fom.ru/report/cat/societas/culture/obrazovanie/high_education/d052224>.
9 <http://pisa.oecd.org>.
10 См. например: А.Каспржак, К.Митрофанов, К.Поливанова и др. «Содержание понятия «качество»
образования в отечественной и Зарубежной образовательной практике», Оренбург, 2005г., 128с.
О.Лебедев, Компетентностный подход в образовании // Школьные технологии, № 5, 2004г.,
сс. 3-12.
11 <http://ed.sjtu.edu.cn/rank/2006/ARWU2006TOP5001ist.htm>.
12 Education at a Glance, OECD Indicators 2004 [Взгляд на образование, Индикаторы ОЭСР],
ОЭСР, Париж, 2004.
вом рынке образовательных услуг не превышает 0,5%13. Такую ситуацию объясня-
ет целый ряд различных факторов: относительная трудность русского языка,
слабая привлекательность политического и экономического имиджа страны, ус-
ловия жизни и т. д. Однако, не последней причиной является и недостаточ-
ная конкурентоспособность российского образования, в целом ещё слабо
интегрированного в европейские и мировые схемы, несмотря на недавнее
(2003) присоединение России к болонскому процессу.
Основным критерием оценки молодого специалиста является его способ-
ность найти работу по профилю на рынке труда и удовлетворять требова-
ниям работодателя. Между тем, исследования, проведённые агентством РейтОР,
специализирующимся на рейтинговании российских образовательных ресурсов, в
одном из семи федеральных округов России (Приволжском), подчёркивают не-
удовлетворённость работодателей качеством принятых на работу новоиспе-
чённых выпускников вузов14. Помимо завышенной оценки своих знаний и тре-
бований высокой зарплаты, работодатели отмечают нехватку как практических,
так и теоретических знаний у молодых специалистов15. Более половины
опрошенных в 2004-2005 гг. работодателей считают, что молодые специали-
сты нуждаются в дополнительной подготовке16. По свидетельству многих руко-
водителей кадровых агентств, лишь 13-20% предприятий готовы принять на
работу молодых специалистов17.
Впрочем, студенты, по всей видимости, и сами осознают недостатки
своих дипломов. То же исследование в Приволжском округе показало, что 59%
студентов желали продолжить образование по завершению первично пройден-
ного пятилетнего цикла, из них 52% заявили о готовности самим финансиро-
вать его и 26% - о желании приобрести другую специальность18. При прочих рав-
ных условиях (без учёта опыта работы), решающим фактором при подборе
кадров на сегодняшнем российском рынке труда является второе высшее
образование.
В ходе различных встреч между представителями деловых кругов, ответ-
ственными лицами из министерства образования и ректорами вузов19, пер-
вые регулярно указывают на архаизм содержания учебных курсов и мето-
дов обучения, цель которых заключается в накоплении знаний в ущерб
самообразованию и развитию критического мышления. Они ратуют за обучение в
форме проектов и case-studies. Эти предложения не вызывают одобрения
большей части профессуры (в частности, ректоров, объединённых в могуществен-
13 Цит. по франко-российскому электронному бюллетеню ROST, выпуск от 29 декабря 2005г.,
<www.rost.fr>.
14 Агентство РейтОР (Рейтингование Образовательных Ресурсов) было создано в марте
2005г. с участием фонда «Вольное дело», финансируемого О. Дерипаской, владельцем ком-
паний БаЗЭл и РусАл. Исследования проводились в мае-декабре 2005 г. среди 3160 вы-
пускников 52 вузов, 800 работодателей различных секторов экономики (машиностроение,
энергетика, телекоммуникации и информационные технологии, менеджмент, нефтегазовая от-
расль) ,
15 Начальная Зарплата молодого специалиста в Москве составляет 250-650 евро, в регионах Зна-
чительно меньше - 60-200 евро, <www.reitor.ru>.
16 См. например: Е.Герасимова, Иллюзия качества // НГ, 10 июня 2005г. О.Герасимова, Деграда-
ция вузовского статуса // НГ, 3 февраля 2006г.
17 Молодёжь - это роскошь // Ведомости, 12 апреля 2006г.
18 <www.reitor.ru/img/uploaded/files/3_Obrazovatelnie_strategii_vipusknikov_vuzov.doc>.
19 Например, Бизнес педсовет, организованный ассоциацией Деловая Россия в августе
2004г., <www.deloros.ru/netcat_files/ll_194.doc>, или встреча В.Путина с предпринимате-
лями, 1 июля 2004г.
ный Союз ректоров России), приверженной сохранению «фундаментального ха-
рактера» российского образования.
Другая проблема: согласно работодателям, профиль дипломированных выпу-
скников не в полной мере удовлетворяет потребностям экономики страны.
Так, например, рынок переполнен экономистами и юристами20, в то время
как в промышленности существует реальная нехватка руководителей средне-
го звена, инженеров и технических менеджеров (в отличие, например, от Индии,
которая сделала особую ставку на подготовку инженеров).
Интерес промышленных групп к образовательной сфере проявляется в
стремлении ассоциироваться с вузами или создать собственные учебные
заведения или факультеты, например, в виде «корпоративных университе-
тов»21, начавших развиваться с 2000 г. Среди первых предприятий, профи-
нансировавших подобные инициативы - Северсталь, владелец которой, А. Морда-
шов, защитил свой диплом MBA по этой теме. Другие предприятия последо-
вали примеру Северстали, чтобы обеспечить своему персоналу надлежащий
уровень обучения: Сухой (авиация), Билайн (телекоммуникации), РусАл (алю-
миний) и др.
Другим примером сотрудничества между вузами и предприятиями является
подписание в апреле 2006 г. соглашения между РуссНефтью и МГУ с целью
создания на базе Московского университета «Высшей школы инновационного
бизнеса МГУ» со статусом факультета. МГУ должен осуществлять подбор
профессорско-преподавательского состава, а РуссНефть может принимать уча-
стие в разработке учебных программ и планов, которые будут удовлетворять по-
требностям компании. Стоит также упомянуть соглашение между О. Дерипаской,
владельцем РусАла, и Экономической академией им. Плеханова, воспринимаемое
корпусом ректоров как своего рода революцию. Оно послужит пробным шаром для
нового статуса автономной некоммерческой организации (АНО), предложенного
правительством, и даст предпринимателю реальное droit de regard над про-
граммой . Этот проект вызывает обеспокоенность многих ректоров, видящих в
нём начало скрытой «приватизации» вузов.
Причины « нище ты »
Б целом, политические элиты и другие общественные круги осознают снижение
качества высшего образования в стране: В. Путин и министр образо-
вания А. Фурсенко не раз публично признавали этот факт. Но союз ректо-
ров, деловые круги, эксперты и министерство образования расходятся во
мнениях о причинах снижения качества. Для ректоров оно связано, с
одной стороны, с недостатком государственного финансирования, что при-
водит к нехватке оборудования и низкому уровню оплаты труда препода-
вателей. С другой стороны, ответственность за это несёт быстрый рост сектора
платных образовательных услуг и появление многих частных вузов или филиалов
сомнительного качества. По мнению ректоров, ультралиберальная ориентация
в сочетании с попытками правительства «привить» западные модели на
20 Эти специальности пользовались наибольшим спросом в начале 90-х годов, и многие вузы,
включая технические, открыли платные факультеты для подготовки экономистов, менеджеров и пр.
21 Этот термин, не имея под собой конкретной юридической базы, охватывает самые разнообразные
формы обучения (речь может идти о последних курсах специализированного факультета, ву-
зе , учебном центре или курсах переподготовки и повышения квалификации), объединённых об-
щей целью - подготовка персонала, отвечающего конкретным потребностям данного пред-
приятия (реже - группы предприятий) и передающая его культуру.
российскую почву разрушают традиционные основы образовательной системы стра-
ны22. В свою очередь, чиновники министерства образования и деловые круги го-
ворят о консерватизме ректоров и их сопротивлении реформам под влиянием кор-
поративных интересов и стремления защитить принцип финансовой автономии вуза
без внешнего контроля.
Финансирование
Между 1992 и 1998гг., сумма бюджетных средств, выделяемая на образование,
сократилась в три раза. В этот период учебные заведения с трудом могли
покрыть свои текущие расходы и обеспечить выплату зарплат. С 1999 г. на-
блюдается рост государственного финансирования: в 2004 году его объём
увеличился на треть по сравнению с серединой девяностых годов. Но, если
доля образования в государственных расходах России сравнима со средним значе-
нием стран ОЭСР (12,7%), уровень финансирования образования в процентном
соотношении к ВВП намного ниже: в течение последних трёх лет он варьировался
между 3,5 и 3,8% от ВВП (из которых 0,5% приходится на высшее образова-
ние), в то время как средний показатель по ОЭСР составляет 6,2%23.
Эти данные далеки от поставленной российскими властями цели - 10% от ВВП.
Расходы на одного студента составляют 23 000 - 25 000 рублей в год (около
700-800 евро) . В январе 2006 года во время встречи со студентами
сельскохозяйственной академии им. Тимирязева, министр Фурсенко признал
эту сумму недостаточной и предложил увеличить её до 75 000 рублей с тем, что-
бы приблизиться по этому показателю к западным странам (во Франции, напри-
мер, в 2003 году годовые расходы на одного студента вуза составили 8 370
евро24) .
Закон об образовании от 1992 года позволил учебным заведениям полу-
чить статус юридических лиц и, соответственно, распоряжаться своими
ресурсами. Многие школы и вузы бросились изыскивать средства для вы-
живания разнообразными способами: сдавать часть своих помещений в
аренду, создавать подсобные хозяйства, автошколы, привлекать спонсоров,
взимать плату за многие услуги и создавать факультеты и отделения в
соответствии с запросами родителей учеников и студентов.
По официальным данным, объём платных услуг в сфере образования воз-
рос от 41 млрд. руб. (1,17 млрд, евро) в 2000г. до 147,5 млрд. руб. в 2005
г25. Около 56% студентов сегодня сами финансируют своё обучение26. Опросы об-
щественного мнения показывают, что идея оплаты высшего образования практи-
чески прижилась в менталитете россиян, готовых отныне инвестировать в
эту сферу. Однако, в нынешней системе явно наблюдается перекос в сторону
платных услуг: платить иногда приходится и за пропуски, и за пересдачу экза-
менов и зачетов и т. д. В начале обучения детей родители зачастую не имеют
чёткого представления о конечной сумме, которую им придётся затратить.
Кроме того, к «платным студентам» нередко наблюдается иное отношение, нежели
к «бюджетникам».
22 См. например: В.Садовничий, (ред.), «Образование, которое мы можем потерять», Москва,
2003г., 368 с.
23 «Экономика образования в Зеркале статистики», op. cit., сс. 7-8.
24 С.Lambert, «L'Enseignement superieur en France et dans les pays de 1'OCDE : etat des
lieux» [ Высшее образование во Франции и в странах ОЭСР: состояние дел], февраль 2006г.,
<http://txtnet.com/educter/pics/lntervention Lambert.pdf>.
25 <www.gks.ru/bgd/regl/b05_01/lssWWW.exe/Stg/dl20/03-50.htm>.
26 НГ, 10 июня 2005.
Педагогические кадры
Объём государственного финансирования не позволяет обеспечить привлека-
тельный уровень зарплат в секторе образования. Средняя зарплата преподавателя
в средней школе составляет 9 300 рублей (270 евро) в Москве и 3 900 рублей
(113 евро) в регионах, а в высшем учебном заведении соответственно 7 500 и 5
000 рублей (217 и 145 евро)27. Для сравнения, в 2004 году средняя зар-
плата в образовании составляла 62% от средней зарплаты в России по всем сек-
торам и 53% от средней зарплаты в промышленности28. Зарплата молодого препо-
давателя вуза ниже прожиточного минимума. Как и в секторе научных исследо-
ваний, преподаватели вузов вынуждены искать другие источники дохода, такие
как репетиторство и т. п. Эти дополнительные доходы могут достигать офи-
циальной зарплаты и даже превышать её. Эта ситуация приводит иногда
к практически фиктивной принадлежности преподавателя к вузу.
В таких условиях неудивительно, что выпускники вузов не стремятся к
работе в системе образования, а также то, что профессия преподавателя стареет
и феминизируется, особенно в средней школе, где женщины составляют 85,3%.
Говоря о качестве преподавательского состава нужно также отметить
разрыв между высшим образованием и наукой. Процент преподавателей, за-
нимающихся исследовательской работой, относительно невелик. По словам рек-
тора Высшей школы экономики Я. Кузьминова, 4/5 вузовских программ осущест-
вляются преподавателями, не участвующими в научных исследованиях29. Среди 3
797 российских научно-исследовательских заведений, вузы представляют лишь
скромную часть (393).
Искажения в отношении общества к высшему образованию
В российском обществе наблюдается некое искажение отношения к высшему
образованию. В декабре 2005г. А. Фурсенко, с сожалением отмечая утрату каче-
ства образования, объяснил его тем, что студенты прежде всего стремятся полу-
чить «бумажку», не заботясь о знаниях, предполагающих получение диплома30.
Не говоря о тех, для кого поступление в вуз является способом избежать
службы в армии31 (по различным опросам эти лица составляют от 5 до
10% абитуриентов) или преследует другие, не связанные с образованием це-
ли, высшее образование стало жертвой своей популярности. Социологи констати-
руют, что оно всё в большей степени играет «социализирующую» роль: диплом
служит своего рода социальным знаком качества. Студенты часто не связывают
напрямую получаемое ими образование с будущей профессиональной карьерой. Они
НГ, 31 августа 2005.
28 «Мониторинг экономики образования», №6 (14), Москва, ГУ-ВШЭ 2005г. <www.isek.hse.ru>.
29 Y. Kuzminov, «Challenges and Opportunities of Educational Reform, the Case of Russia» [Вы-
зовы и возможности реформы образования, пример России], Москва, 2004г.
<www.hse.ru/eng/IMHE_report_eng.pdf>.
30 6 декабря 2005г., <www.rambler.ru/db/news/msg.html?mid=6975208&s=260003051>. Министр не-
однократно высказывал озабоченность по этому поводу, см. также встречу с В. Путиным 4 марта
2005г. в Ново-Огарёво,
31 Закон о воинской обязанности и военной службе от 28 марта 1998г. предоставляет отсрочку
студентам и аспирантам (ст. 24) и освобождает от военной службы граждан, имеющих степень
кандидата или доктора наук (ст. 23) (<www.mil.ru/articles/article3718.shtml>). Министер-
ство обороны весной 2005г. представило предложение об изменении этих правил. Речь
идёт об отмене части отсрочек, среди которых и отсрочки для студентов. Это предложение
вызвало волну протестов.
ведут себя так, как если бы целью проведения пяти лет в вузе являлось полу-
чение диплома, а профессии они реально смогут обучиться во время перво-
го профессионального опыта.
Такой подход имеет множественное объяснение. На выбор профессиональ-
ного пути молодого россиянина влияют многие противоречивые факторы. С
одной стороны, социальное давление и условия на рынке труда укрепляют
привлекательность высшего образования, что, в сочетании с фактически
негативным имиджем других типов учебных заведений (таких как профессиональ-
ные школы - бывшие ПТУ), подталкивает к выбору высшего образования в ущерб
иному профессиональному. С другой стороны, это попытка адаптироваться к
переходу к «экономике знаний»32. К тому же, рынку труда в России незнакомо
понятие избытка квалификации для той или иной должности. Диплом о высшем
образовании нередко требуется работодателем независимо от рабочего мес-
та как некая гарантия серьёзности кандидата.
Рост числа вузов и их относительная доступность для студентов, «про-
валивших» вступительные экзамены на бюджетные места, способствуют укреп-
лению тенденции к массовизации высшего образования. Кроме того, молодёжь
в России заканчивает среднюю школу несколько раньше, чем на Западе (в
16-17 лет) , и родители считают 5 лет учёбы в вузе периодом «дозрева-
ния», позволяющим создать некий «интеллектуальный капитал» до осуществ-
ления настоящего профессионального выбора. По окончанию этого периода прихо-
дит время второго высшего образования, - в некотором смысле, «настоящего» -
получение которого и родители, и студенты готовы сами финансировать.
Такое специфическое отношение к высшему образованию порождает практи-
ку разного рода мошенничества. В некотором смысле, это явление даже ин-
ституционализировано. Многочисленные интернет-сайты предлагают уже готовые
или на заказ в кратчайшие сроки всевозможные рефераты, дипломы или гото-
вые ответы на экзаменационные билеты, содержание которых, по россий-
ской традиции, известно студентам заранее. Сайты предлагают даже такие техно-
логические новинки, как ручки с невидимыми чернилами или программы,
загружаемые на мобильные телефоны33. Процветает рынок дипломных и кур-
совых работ, выполненных на заказ. Можно найти подставных лиц, гото-
вых сдать экзамены за абитуриента. Дипломные работы редко представляют
собой настоящее исследование, в лучшем случае, речь идет об удачной компиля-
ции уже существующих работ (по известному выражению «студенты делают вид,
что пишут, а преподаватели - что проверяют»).
Эта система естественным образом ведёт и к простой покупке дипломов, про-
дажа которых в переходах московского метро продолжает шокировать ино-
странцев. Согласно недавнему опросу ФОМ, 76% опрошенных (91% среди мо-
сквичей) утверждают, что достать «липовый» диплом не составляет ни ма-
лейшей проблемы, 23% уже встречали людей, купивших диплом, и 61% счи-
тает, что фальшивый диплом открывает такие же возможности для профес-
сиональной карьеры, что и настоящий34.
32 М.Арапов, Высшее образование в России: бум или кризис ? // Энергия, №11, 2004г., сс. 74-
79.
33 Несколько примеров таких сайтов: <www.referatoria.ru>, <www.Referatik.ru>,
<www.Studentam.ru>, <http://skomo.firmsite.ru/>, www.ronl.ru/, <shpargalki.info/>,
<http://cityref.ru/>, <www.coolsoch.ru/>, <http://100shops.ru/>, http://shpora-100.com/ и
т. д.
34 Опрос ФОМ от 12 января 2006г.,
Образование или взяточничество?
Губительные последствия коррупции в образовании признаются на самом высоком
уровне. С одной стороны, речь идёт об «откатах» - суммах, которые универси-
теты оставляют чиновникам с целью добиться бюджетного финансирования, ко-
торые иногда оцениваются в 50% от размера самих субсидий35. С другой
стороны, - о взятках, которые родители студентов выплачивают вузам или не-
посредственно не слишком щепетильным преподавателям, чтобы заручиться особым
подходом.
Некоторые эксперты считают, что «чёрный оборот» некоторых институтов и
университетов достигает оборота крупных нефтяных компаний36. В 2002-2003
гг. общая сумма взяток в сфере образования достигла, по некоторым сведениям,
26,4 млрд, рублей (754 млн. евро), из которых половина была выплачена за по-
ступление в вуз и половина за само обучение37.
Согласно одному из исследований, проведённых Высшей школой экономики,
одна семья из пяти (и одна из четырёх в Москве) готова заплатить дополнитель-
ные деньги за поступление в престижную школу, а 18% (24% в Москве) готовы
платить за поступление в престижный вуз38. Таким образом, спрос на подоб-
ный вид услуг высок. Объявления с предложением помощи для поступления в
вуз встречаются в изобилии при общем толерантном отношении общества к ним.
Исследовательская среда также не избежала коррупции. Некоторые аспи-
ранты доверяют целиком или частично написание своих диссертаций «суб-
подрядчикам» . Клиенты VIP покупают свои диссертации «под ключ» (что мо-
жет включать выбор темы, подбор аспирантуры и состав «доброжелательной»
комиссии и т.п.)39. За определённую плату аспиранты могут опубликовать
свои статьи (обязательные для защиты) в журналах, порой псевдонауч-
ных40 . Высшая аттестационная комиссия министерства образования и науки озабо-
чена подобным явлением, поскольку, по некоторым данным, до трети диссертаций
Защищается лицами, не являющимися их авторами. Попытки контроля натыкаются
на глубоко укоренившуюся практику. Например, правительственное решение
о назначении ректоров (должность, которая стала выборной после распада
СССР) с целью большего контроля встретило сильнейшее сопротивление со стороны
ректоров, заговоривших о возврате к советской системе. В любом слу-
чае, эта мера вряд ли привела бы к уменьшению коррупции, настолько
образовательная система изобилует возможностями приобретения символических
и финансовых льгот.
<http://bd.fom.ru/report/cat/societas/culture/obrazovanie/high_education/d0600114>
35 Оценка сделана лидером движения «Против коррупции» Леонидом Трошиным. Откаты душат
систему образования // Интерфакс, 24 марта 2006г.
36 Н.Савицкая, А.Трофимов, Время красной профессуры // НГ, 23 ноября 2005г.
37 Е.Галицкий, М.Левин, Коррупция в российской системе образования // Народное образование,
№10, 2004г., сс. 46-47.
38 Н.Савицкая, Помогу поступить в вуз // НГ, 24 июня 2005г.
39 Д.Симакин, Доктора невидимого фронта // НГ, 24 марта 2006г.
40 <http://tzrus.narod.ru/>, <www.jurnal.nm.ru/>.
Сохранение элитного образования
На фоне общего снижения качества образования сохраняется его элитная часть.
Элитизм проявляется на всё более ранних стадиях обучения и во всё более
яркой форме. На уровне среднего образования, наряду с обычными школа-
ми появились гимназии и лицеи: они предполагают строгий вступительный
отбор (что может вызвать необходимость интенсивной подготовки шестилетнего
ребёнка с родителями или репетитором). Уверенные в своих финансовых
возможностях, эти школы могут позволить себе пригласить на работу лучших пре-
подавателей и предложить качественное обучение. Чтобы набрать лучших выпуск-
ников , вузы заключают с ними соглашения; в старших классах обучение может
вестись преподавателями вузов. Таким образом, их ученики оказываются в
привилегированном положении на вступительных экзаменах. Так образуются своего
рода герметические «коридоры», идущие иногда от детского сада до уни-
верситета , в зависимости от уровня доходов семей41.
Сомнения относительно качества диплома приводят к тому, что работодатели
выбирают целевую группу для своих предложений: кадровые агентства всё
чаще сталкиваются с тем, что многие предприятия требуют дипломы конкрет-
ных вузов.
Среди этих вузов, в большинстве случаев, встречаются те, которые уже
и в советскую эпоху имели репутацию элитных. Пользуясь своим имиджем, они по-
пали в «положительную спираль», недоступную для «непосвящённых»: их имя и ре-
путация привлекают молодёжь из семей с высоким достатком, что способст-
вует дальнейшему финансированию. Эти вузы часто развивают партнёрские отно-
шения с зарубежными высшими школами и университетами и создают уникаль-
ные совместные программы.
Многочисленные рейтинги, зачастую противоречащие друг другу в силу из-
бранных критериев, подпитывают социальное давление в погоне за поступле-
нием в тот или иной престижный вуз. Но разброс между местами, занимаемыми в
различных рейтингах одним и тем же вузом (см. приложение) доказывает всю
сложность объективной оценки. Например, Санкт-Петербургский государственный
университет, фигурирующий на первых местах рейтинга министерства образования,
занимает лишь 15-е в рейтинге Коммерсанта; Финансовая академия, качество об-
разования в которой не вызывает сомнения, получила лишь 28-е место в рейтинге
Фонда Потанина; Московский институт стали и сплавов, не занявший высоких
мест в рейтингах, был отобран как инновационный вуз для финансирова-
ния в рамках национального проекта.
В целом, около 20 вузов, в подавляющем большинстве московских, со-
ставляют сердцевину образовательной системы России: среди них Московский го-
сударственный университет им. Ломоносова, Московский государственный инсти-
тут международных отношений (МГИМО-Университет), Московский государствен-
ный технический университет им. Баумана, Экономическая академия им.
Плеханова, Финансовая академия, Московский физико-технический институт,
Высшая школа экономики, Российский государственный гуманитарный универси-
тет , Московская юридическая академия и некоторые другие.
41 A.Vinokur, (дир.), «Les transformations du systeme educatif de la Federation de Russie»
[Трансформации образовательной системы в Российской Федерации], Париж, ЮНЕСКО, 2001г.,
222 с.
За пределами Москвы имеют хорошую репутацию Санкт-Петербургский государст-
венный университет, Казанский государственный университет и некоторые другие.
Эти заведения известны не только качеством образования, но и социальным
статусом своих выпускников. Исследование, проведённое в 2005г. агентством
РейтОР, касающееся первого высшего образования 505 высокопоставленных
представителей российской политической элиты (правительство, президентская
администрация, полномочные представители президента в федеральных окру-
гах, Совет безопасности, губернаторы), показало, что 40% из них получили об-
разование в московских вузах. За ними следуют центральная и северно-
европейская часть России (17%), Санкт-Петербург (16%), Дальний Восток
(16%) , СНГ (6%) и юг страны (4%) . Тройка лидеров включает МГУ (37 человек) ,
СПГУ (16 человек) и МГИМО (15 человек) . За ними следуют Московская академия
им. Плеханова, Финансовая и Юридическая академии.
Российское государство поддерживает лидирующие вузы, которыми руково-
дят близкие к политическим кругам влиятельные ректоры. МГУ финансиру-
ется отдельной строкой бюджета. Ректор СПГУ Л. Вербицкая недавно выразила
удовлетворение значительным ростом с 2000г. государственного финансирова-
ния, выделяемого своему вузу. В итоге, две трети финансирования alma mater
президента Путина и его двух дочерей обеспечивается за счёт государственного
бюджета. Эти два университета, представляющие гордость и достояние
России, должны, по словам ректора СПГУ, обязательно финансироваться из
государственного бюджета42. Самые престижные вузы наиболее сдержанно отно-
сятся к идее замены вступительных экзаменов Единым государственным эк-
заменом (ЕГЭ), введённым в большинстве регионов. Они выступают за со-
хранение возможности поступления на особых условиях для победителей
региональных и федеральных Олимпиад, что является способом привлечения луч-
ших выпускников.
Национальный проект Образование, заявленный В. Путиным в сентябре 2005г.,
укрепляет эту тенденцию к элитизму, ставя акцент на поддержке лидеров. Вме-
сто распыления кредитов было решено выделить их наиболее успешным. В
мае 2006 года министерство опубликовало список 17 инновационных вузов,
которые получат финансирование (на общую сумму в 10 млрд. рублей или
285 млн. евро). Наиболее крупные суммы (9 950 млн. руб. каждому) бу-
дут выделены . . . МГУ и СПГУ43.
Перспективы
Б российском высшем образовании сложилась разнородная картина: успехи
элитных вузов выделяются на фоне снижения среднего уровня россий-
ских дипломов. Эта ситуация является результатом пятнадцати лет
приспособления и выживания образовательных структур в условиях недоста-
точного финансирования. Большой заслугой российской образовательной системы
является уже то, что она сумела выжить, сохранить свою целостность,
удержать своих лидеров, и даже найти определённое, хотя и хрупкое,
равновесие. Боязнью нарушить его объясняется сегодняшняя сдержанность
ректоров и профессорско-преподавательского состава по отношению к предлагае-
мым правительством реформам.
НГ, 7 апреля 2006.
43 Вот где надо учиться // Московский комсомолец, 2 мая 2006.
Сегодняшний выбор политики российского правительства очевиден: государ-
ство окажет поддержку только лучшим. Совершенно очевидно, что не будет
распыления финансирования для спасения аутсайдеров или уменьшения раз-
рыва между лидерами и всеми остальными. Национальный проект недвусмыслен-
но ставит акцент на поддержке ограниченного числа «точек роста». Он ра-
тует также за создание двух государственных университетов и бизнес-
школы, конкурентоспособных на международном уровне. Осуществление реформы
ГИФО (система государственных именных финансовых обязательств) также при-
ведет к тому, что деньги пойдут за студентом в вузы, пользующиеся наиболь-
шим спросом. Таким образом, смогут выжить только самые сильные или самые
новаторские вузы.
На первый взгляд эта политика не только противоречит устремлениям
профессорско-преподавательского состава, но и массовому спросу на высшее
образование среди населения. Однако, демографические прогнозы тоже говорят
в пользу подобного «естественного отбора». К 2015 году количество де-
тей в России уменьшится на 38% в возрастной группе от 5 до 14 лет и на 47%
среди подростков 15-19 лет по сравнению с 2000 годом44. Возникнет избы-
точность школ и вузов (количество мест в вузах будет практически совпадать с
количеством выпускников средних школ). Демографический спад приведёт к
естественному количественному выравниванию системы (закрытие или объединение
некоторых школ и вузов; массовый выход на пенсию пожилых преподавателей;
большее финансирование на одного учащегося при том же общем объёме
финансирования и т. д.) Это выравнивание может создать благоприятные
условия для повышения качества образования. Подобная ситуация может стать
уникальной возможностью для России, которая стремится диверсифицировать
свою экономику, не довольствоваться положением поставщика сырьевых ре-
сурсов на международных рынках.
Настоящий качественный прорыв представляется возможным при условии
открытия как минимум двух больших строительных площадок.
Во-первых, постепенное устранение коррупции. Эта практика, со всей оче-
видностью, не может быть истреблена в одночасье. Коррупция стала со-
ставной частью равновесия системы и поэтому с ней очень трудно бороться.
Стоит, по-видимому, решать проблемы поочередно: условия приема, вступи-
тельные экзамены, наказание в наиболее вопиющих случаях... В соседней Ук-
раине с целью борьбы с коррупцией было решено полностью отменить вступи-
тельные экзамены в вузах. В России подобное решение было бы - во всяком слу-
чае на сегодняшний день - отвергнуто ректорами.
Во-вторых, повышение престижа профессии преподавателя. Речь идет не
о разовых подарках, как это делается в рамках национального проекта
для преподавателей в сфере среднего образования, предоставляющего пре-
мии 10 000 лучших, а об обеспечении уровня зарплат, гарантирующих пре-
подавателям достойную жизнь и привлекательных для молодёжи. Воссоздание
стабильной связи между преподаванием и научно-исследовательской деятельностью
позволило бы преподавателям поддерживать высокий уровень своих знаний.
Эти две меры послужили бы первыми шагами к продвинутой системе выс-
шего образования, которая вновь могла бы стать козырем России, основой её
44 Цит. по докладу Всемирного Банка «Модернизация российского образования: достижения и
уроки», май 2005г., с. 10.
национальной инновационной
международном уровне.
системы
также инструментом soft power на
а
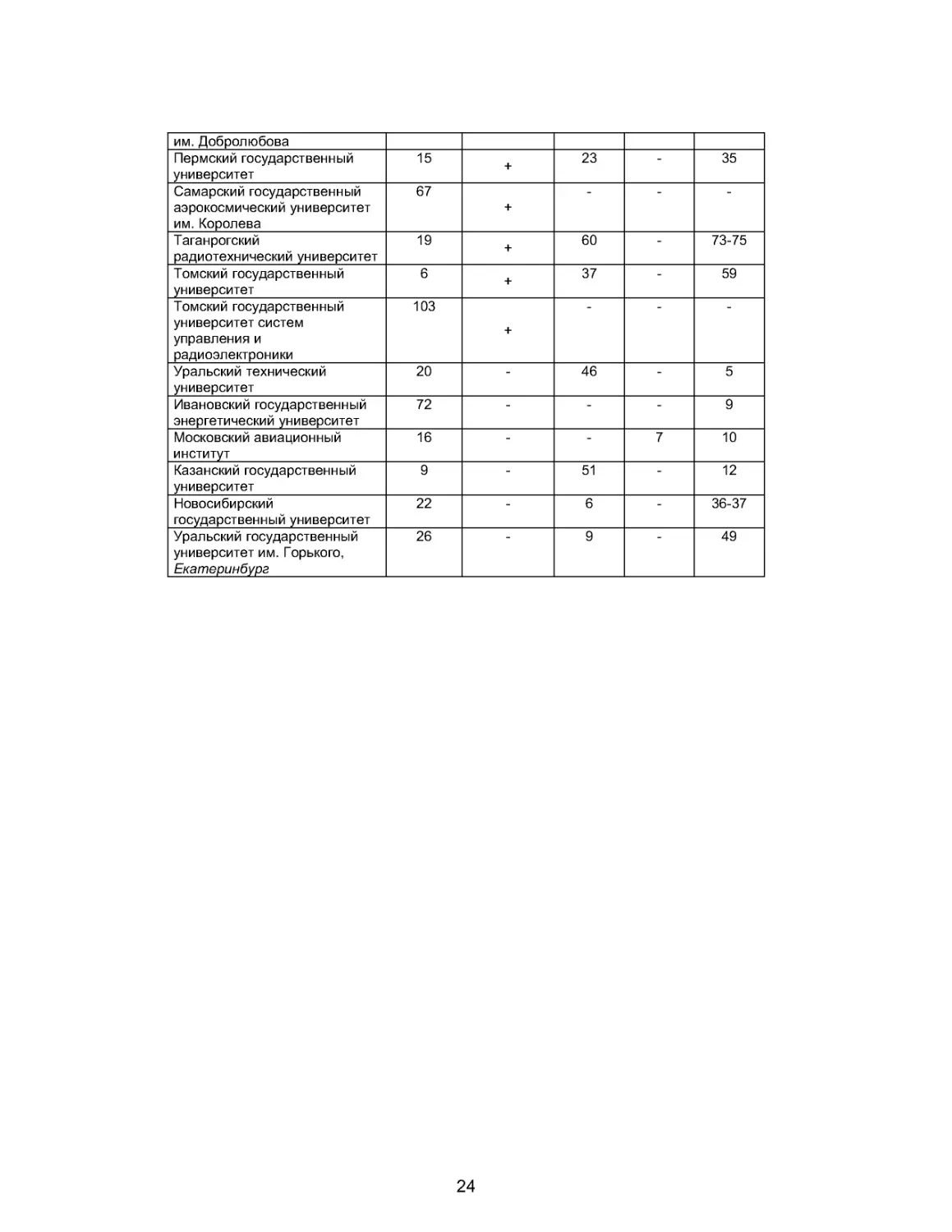
ПРИЛОЖЕНИЕ
Сопоставление рейтингов некоторых
_ 45
государственных вузов России
Источники: <www.mon.gov.ru/proekt/shkola/2474/>,
<www.korochka.ru/universities/гаting/detail.php?ID=1064>, <www.reitor.ru>,
<http://fund.potanin.ru/>.
Приведённые рейтинги основываются на различных критериях: Министерство об-
разования (2005) учитывает самые разнообразные критерии, среди которых
много количественных (количество студентов, кв. метров аудиторий на одного
студента, преподавателей с научным званием, иностранных студентов, научных
исследований, публикаций, библиотек, общежитий и т.п.). Рейтинг прово-
дился отдельно по каждому типу вузов (университет, технический вуз и
т. д.) , что объясняет наличие нескольких первых мест в таблице. Министр
Фурсенко призвал принять во внимание и другие параметры. Следующий рейтинг
министерства должен основываться на списке из 17 инновационных вузов, ото-
бранных в мае 2006 года в рамках национального проекта.
Фонд Потанина (2005-2006) оценивает индивидуальный и профессиональный
потенциал студентов и молодых преподавателей соответствующих вузов.
Агентство РейтОР (июнь 2005) объединяет результаты опросов среди педагогов,
работодателей и СМИ по таким параметрам, как уровень зарплаты выпускников,
быстрота карьерного роста.
Газета Коммерсант (2006) базируется на количестве дипломированных спе-
циалистов , которые были приняты на работу (или запрошены) крупными пред-
приятиями в 2005г.
45
Смотрите ниже.
ПРИЛОЖЕНИЕ: Сопоставление рейтингов некоторых
государственных вузов России
Название вуза Минис- терство образова- ния и науки, 2003, 2005 17 инноваци- онных вузов, выбранных для нацио- нального проекта, май 2006 Фонд Потанин, 2005- 2006 РейтОР июнь 2005 Коммер- сант, 2006
Московский государственный университет им. Ломоносова 1 + 3 1 2
Санкт-Петербургский государственный университет 2 + 4 - 15
Московский государственный технический университет им. Баумана 1 + - 2 1
Государственный университет - Высшая школа экономики 3 + 15 - 6
МГИМО 2 - 8 5 23
Российская экономическая академия им. Плеханова 5 - 32 3 7
Финансовая академия 2 - 28 3
Государственный университет управления 4 - - 6 4
Российский университет Дружбы народов им. П.Лумумбы 4 - 7 10 66
Московская медицинская академия им. Сеченова 1 + - - -
Санкт-Петербургский государственный политехнический университет 6 - 5 - 17
Дальневосточный государственный университет 12 + 25 - -
Кубанский сельскохозяйственный университет - + - - -
Московский государственный институт стали и сплавов 26 + - 18 16
Московский государственный институт электронной техники 8 + - - 77
Московский физико- технический институт (государственный университет) - МФТИ 3 + 12 8 11
Московский инженерно- физический институт 4 - 2 9 18
Московский энергетический институт 7 - - - 8
Санкт-Петербургский государственный горный институт им. Плеханова 5 + - - 26
Нижегородский государственный университет им. Лобачевского 7 + 11 - -
Нижегородский государственный лингвистический университет 11 - 1 - 83-86
23
им. Добролюбова
Пермский государственный университет 15 + 23 - 35
Самарский государственный аэрокосмический университет им. Королева 67 + - - -
Таганрогский радиотехнический университет 19 + 60 - 73-75
Томский государственный университет 6 + 37 - 59
Томский государственный университет систем управления и радиоэлектроники 103 +
Уральский технический университет 20 - 46 - 5
Ивановский государственный энергетический университет 72 - - - 9
Московский авиационный институт 16 - - 7 10
Казанский государственный университет 9 - 51 - 12
Новосибирский государственный университет 22 - 6 - 36-37
Уральский государственный университет им. Горького, Екатеринбург 26 - 9 - 49
24
Читальня
ПРОФЕССИЯ
Азимов А.
Джордж Плейтен сказал с плохо скрытой тоской в голосе:
- Завтра первое мая. Начало Олимпиады!
Он перевернулся на живот и через спинку кровати пристально посмотрел
на своего товарища по комнате. Неужели он не чувствует того же? Неужели
мысль об Олимпиаде совсем его не трогает?
У Джорджа было худое лицо, черты которого еще более обострились за
те полтора года, которые он провел в приюте. Он был худощав, но в его
синих глазах горел прежний неуемный огонь, а в том, как он сейчас вце-
пился пальцами в одеяло, было что-то от затравленного зверя.
Его сосед по комнате на мгновение оторвался от книги и заодно отре-
гулировал силу свечения стены, у которой сидел. Его звали Хали Смани, он
был нигерийцем. Темно-коричневая кожа и крупные черты лица Хали Смани,
казалось, были созданы для того, чтобы выражать только одно спокойствие,
и упоминание об Олимпиаде нисколько его не взволновало.
- Я знаю, Джордж, - произнес он.
Джордж многим был обязан терпению и доброте Хали; бывали минуты,
когда он очень в них нуждался, но даже доброта и терпение могут стать
поперек глотки. Разве сейчас можно сидеть с невозмутимым видом идола,
вырезанного из дерева теплого, сочного цвета?
Джордж подумал, не станет ли он сам таким же через десять лет жизни
в этом месте, и с негодованием отогнал эту мысль. Нет!
- По-моему, ты забыл, что значит май, - вызывающе сказал он.
- Я очень хорошо помню, что он значит, - отозвался его собеседник. -
Ровным счетом ничего! Ты забыл об этом, а не я. Май ничего не значит для
тебя, Джорджа Плейтена... и для меня, Хали Смани, - негромко добавил он.
- Сейчас на Землю за новыми специалистами прилетают космические ко-
рабли, - произнес Джордж. - К июню тысячи и тысячи этих кораблей, неся
на борту миллионы мужчин и женщин, отправятся к другим мирам, и все это,
по-твоему, ничего не значит?
- Абсолютно ничего. И вообще, какое мне дело до того, что завтра
первое мая?
Беззвучно шевеля губами. Смани стал водить пальцем по строчкам кни-
ги, которую он читал, - видимо, ему попалось трудное место.
Джордж молча наблюдал за ним. "К черту! - подумал он. - Закричи, за-
визжи! Это-то ты можешь? Ударь меня, ну, сделай хоть что-нибудь!"
Лишь бы не быть одиноким в своем гневе. Лишь бы разделить с кемни-
будь переполнявшее его возмущение, отделаться от мучительного чувства,
что только он, он один умирает медленной смертью!
В те первые недели, когда весь мир представлялся ему тесной оболоч-
кой, сотканной из какого-то смутного света и неясных звуков, - тогда бы-
ло лучше. А потом появился Смани и вернул его к жизни, которая того не
стоила.
Смани! Он-то стар! Ему уже по крайней мере тридцать. "Неужели и я в
этом возрасте буду таким же? - подумал Джордж. - Стану таким, как он,
через каких-нибудь двенадцать лет?"
И оттого, что эта мысль вселила в него панический страх, он заорал
на Смани:
- Брось читать эту идиотскую книгу! Смани перевернул страницу и,
прочитав еще несколько слов, поднял голову, покрытую шапкой жестких кур-
чавых волос.
- А? - спросил он.
- Какой толк от твоего чтения? - Джордж решительно шагнул к Смани,
презрительно фыркнул: - Опять электроника! - и вышиб книгу из его рук.
Смани неторопливо встал и поднял книгу. Без всякого раздражения он
разгладил смятую страницу.
- Можешь считать, что я удовлетворяю свое любопытство, - произнес
он. - Сегодня я пойму кое-что, а завтра, быть может, пойму немного боль-
ше . Это тоже своего рода победа.
- Победа! Какая там победа? И больше тебе ничего не нужно от жизни?
К шестидесяти пяти годам приобрести четверть знаний, которыми располага-
ет дипломированный инженер-электронщик?
- А может быть, не к шестидесяти пяти годам, а к тридцати пяти?
- Кому ты будешь нужен? Кто тебя возьмет? Куда ты пойдешь с этими
Знаниями?
- Никому. Никто. Никуда. Я останусь здесь и буду читать другие кни-
ги .
- Но этого тебе достаточно? Рассказывай! Ты заманил меня на занятия.
Ты заставил меня читать и заучивать прочитанное. А зачем? Это не прино-
сит мне никакого удовлетворения.
- Что толку в том, что ты лишаешь себя возможности получать удовлет-
ворение?
- Я решил наконец покончить с этим фарсом. Я сделаю то, что собирал-
ся сделать с самого начала, до того как ты умаслил меня и лишил воли к
сопротивлению. Я заставлю их... заставлю...
Омани отложил книгу, а когда Джордж, не договорив, умолк, задал воп-
рос :
- Заставишь, Джордж?
- Заставлю исправить эту вопиющую несправедливость. Все было подс-
троено. Я доберусь до этого Антонелли и заставлю его признаться, что
он... он... Омани покачал головой.
- Каждый, кто попадает сюда, настаивает на том, что произошла ошиб-
ка . Мне казалось, что у тебя этот период уже позади.
- Не называй это периодом, - злобно сказал Джордж. - В отношении ме-
ня действительно была допущена ошибка. Я ведь говорил тебе...
- Да, ты говорил, но в глубине души ты прекрасно сознаешь, что в от-
ношении тебя никто не совершил никакой ошибки.
- Не потому ли, что никто не желает в этом сознаваться? Неужели ты
думаешь, что кто-нибудь из них добровольно признает свою ошибку?.. Но я
заставлю их сделать это.
Во всем виноват был май, месяц Олимпиады. Это он возродил в Джордже
былую ярость, и он ничего не мог с собой поделать. Да и не хотел: ведь
ему грозила опасность все забыть.
- Я собирался стать программистом вычислительных машин, и я действи-
тельно могу им быть, что бы они там ни говорили, ссылаясь на результаты
анализа. - Он стукнул кулаком по матрасу. - Они не правы. И не могут они
быть правы.
- В анализах ошибки исключены.
- Значит, не исключены. Ведь ты же не сомневаешься в моих способнос-
тях?
- Способности не имеют к этому ровно никакого отношения. Мне кажет-
ся, что тебе достаточно часто это объясняли. Почему ты никак не можешь
понять?
Джордж отодвинулся от него, лег на спину и угрюмо уставился в пото-
лок .
- А кем ты хотел стать, Хали?
- У меня не было определенных планов. Думаю, что меня вполне устрои-
ла бы профессия гидропониста.
- И ты считал, что тебе это удастся?
- Я не был в этом уверен.
Никогда раньше Джордж не расспрашивал Омани о его жизни. Мысль о
том, что у других обитателей приюта тоже были свои стремления и надежды,
показалась ему не только странной, но даже почти противоестественной. Он
был потрясен. Подумать только - гидропонист!
- А тебе не приходило в голову, что ты попадешь сюда?
- Нет, но, как видишь, я все-таки здесь.
- И тебя это удовлетворяет. Ты на самом деле всем доволен. Ты счаст-
лив. Тебе здесь нравится, и ничего другого ты не хочешь. Смани медленно
встал и аккуратно начал разбирать постель.
- Джордж, ты неисправим, - произнес он. - Ты терзаешь себя, потому
что отказываешься признать очевидные факты. Ты находишься в заведении,
которое называешь приютом, но я ни разу не слышал, чтобы ты произнес его
название полностью. Так сделай это теперь, Джордж, сделай! А потом ло-
жись в кровать и проспись. Джордж скрипнул Зубами и ощерился.
- Нет! - сказал он сдавленно.
- Тогда это сделаю я, - сказал Омали, и, отчеканивая каждый слог, он
произнес роковые слова.
Джордж слушал, испытывая глубочайший стыд и горечь. Он отвернулся.
В восемнадцать лет Джордж Плейтен твердо знал, что станет дипломиро-
ванным программистом, - он стремился к этому с тех пор, как себя помнил.
Среди его приятелей одни отстаивали космонавтику, другие - холодильную
технику, третьи - организацию перевозок и даже административную деятель-
ность . Но Джордж не колебался.
Он с таким же жаром, как и все остальные, обсуждал преимущества об-
любованной профессии. Это было вполне естественно. Впереди их всех ждал
День образования - поворотный день их жизни. Он приближался, неизбежный
и неотвратимый, - первое ноября того года, когда им исполнится восемнад-
цать лет.
Когда День образования оставался позади, появлялись новые темы для
разговоров: можно было обсуждать различные профессиональные вопросы,
хвалить свою жену и детей, рассуждать о шансах любимой космобольной ко-
манды или вспоминать Олимпиаду. Но до наступления Дня образования лишь
одна тема неизменно вызывала всеобщий интерес - и это был День образова-
ния . ####’’Кем ты хочешь быть? Думаешь, тебе это удастся? Ничегошеньки у
тебя не
выйдет. Справься в ведомостях - квоту же урезали. А вот логистика..."
Или "а вот гипермеханика...", или "а вот связь...", или "а вот гра-
витика..."
Гравитика была тогда самой модной профессией. За несколько лет до
того, как Джорджу исполнилось восемнадцать лет, появился гравитационный
двигатель, и все только и говорили, что о гравитике. Любая планета в ра-
диусе десяти световых лет от звезды-карлика отдала бы правую руку, лишь
бы заполучить хоть одного дипломированного инженера-гравитационника.
Но Джорджа это не прельщало. Да, конечно, такая планета отдаст все
свои правые руки, какие только сумеет наскрести. Однако Джордж слышал и
о том, что случалось в других, только что возникших областях техники.
Немедленно начнутся рационализация и упрощение. Каждый год будут появ-
ляться новые модели, новые типы гравитационных двигателей, новые принци-
пы. А потом все эти баловни судьбы в один прекрасный день обнаружат, что
они устарели, их заменят новые специалисты, получившие образование поз-
же, и им придется заняться неквалифицированным трудом или отправиться на
какую-нибудь захудалую планету, которая пока еще не догнала другие миры.
Между тем спрос на программистов оставался неизменным из года в год,
из столетия в столетие. Он никогда не возрастал стремительно, не взвин-
чивался до небес, а просто медленно и неуклонно увеличивался в связи с
освоением новых миров и усложнением старых.
Эта тема была постоянным предметом споров между Джорджем и Коротыш-
кой Тревельяном. Как все закадычные друзья, они спорили до бесконечнос-
ти, не скупясь на язвительные насмешки, и в результате оба оставались
при своем мнении.
Дело в том, что отец Тревельяна, дипломированный металлург, в свое
время работал на одной из дальних планет, а его дед тоже был дипломиро-
ванным металлургом. Естественно, что сам Коротышка не колеблясь остано-
вил свой выбор на этой профессии, которую считал чуть ли не неотъемлемым
правом своей семьи, и был твердо убежден, что все другие специальности
не слишком-то респектабельны.
- Металл будет существовать всегда, - заявил он, - и когда ты созда-
ешь сплав с заданными свойствами и наблюдаешь, как слагается его крис-
таллическая решетка, ты видишь результат своего труда. А что делает
программист? Целый день сидит за кодирующим устройством, пичкая информа-
цией какую-нибудь дурацкую электронную машину длиной в милю. Но Джордж
уже в шестнадцать лет отличался практичностью.
- Между прочим, вместе с тобой будет выпущен еще миллион металлур-
гов , - спокойно указал он.
- Потому что это прекрасная профессия. Самая лучшая.
- Но ведь ты попросту затеряешься в их массе, Коротышка, и можешь
оказаться где-то в хвосте. Каждая планета может сама зарядить нужных ей
металлургов, а спрос на усовершенствованные земные модели не так уж ве-
лик, да и нуждаются в них главным образом малые планеты. Ты ведь знаешь,
какой процент общего выпуска дипломированных металлургов получает нап-
равление на планеты класса А. Я поинтересовался - всего лишь 13,3 про-
цента. А это означает семь шансов из восьми, что тебя засунут на ка-
кую-нибудь третьесортную планету, где в лучшем случае есть водопровод. А
то и вовсе можешь застрять на Земле - такие составляют 2,3 процента.
- Не вижу в этом ничего позорного, - вызывающе заявил Тревельян.
Земле тоже нужны специалисты. И хорошие. Мой дед был земным металлургом.
- Подняв руку, Тревельян небрежно провел пальцем по еще не существующим
усам.
Джордж знал про дедушку Тревельяна, и, памятуя, что его собственные
предки тоже работали на Земле, не стал ехидничать, а, наоборот, диплома-
тично согласился:
- В этом, безусловно, нет ничего позорного. Конечно, нет. Однако по-
пасть на планету класса А - это вещь, скажешь нет? Теперь возьмем прог-
раммиста. Только на планетах класса А есть такие вычислительные машины,
для которых действительно нужны высококвалифицированные программисты, и
поэтому только эти планеты и берут их. К тому же ленты по программирова-
нию очень сложны и для них годится далеко не всякий. Планетам класса А
нужно больше программистов, чем может дать их собственное население. Это
же чистая статистика. На миллион человек приходится в среднем, скажем,
один первоклассный программист. И если на планете живет десять миллио-
нов , а им там требуется двадцать программистов, они вынуждены обращаться
к Земле, чтобы получить еще пять, а то и пятнадцать специалистов. Верно?
А знаешь, сколько дипломированных программистов отправилось в прошлом
году на планеты класса А? Не знаешь? Могу тебе сказать. Все до единого!
Если ты программист, можешь считать, что ты уже там. Так-то! Тревельян
нахмурился.
- Если только один человек из миллиона годится в программисты, поче-
му ты думаешь, что у тебя это выйдет?
- Выйдет, можешь быть спокоен, - сдержанно ответил Джордж. Он никог-
да не осмелился бы рассказать ни Тревельяну, ни даже своим родителям,
что именно он делает и почему так уверен в себе. Он был абсолютно споко-
ен за свое будущее. (Впоследствии, в дни безнадежности и отчаяния, имен-
но это воспоминание стало самым мучительным.) Он был так же непоколебимо
уверен в себе, как любой восьмилетний ребенок накануне Дня чтения, этого
преддверия следующего за ним через десять лет Дня образования.
Ну, конечно. День чтения во многом отличался от Дня образования.
Во-первых, следует учитывать особенности детской психологии. Ведь вось-
милетний ребенок легко воспринимает многие самые необычные явления. И
то, что вчера он не умел читать, а сегодня уже умеет, кажется ему само
собой разумеющимся. Как солнечный свет, например.
А во-вторых, от этого дня зависело не так уж много. После него толпы
вербовщиков не теснились перед списками, с нетерпением ожидая, когда бу-
дут объявлены результаты ближайшей Олимпиады. День чтения практически
ничего не менял в жизни детей, и они еще десять лет оставались под роди-
тельской кровлей, как и все их сверстники. Просто после этого дня они
уже умели читать.
И Джордж, готовясь к Дню образования, почти не помнил подробностей
того, что произошло с ним в День чтения, десять лет назад.
Он, правда, не забыл, что день выдался пасмурный и моросил сен-
тябрьский дождь. (День чтения - в сентябре. День образования - в ноябре,
Олимпиада - в мае. На эту тему сочиняли даже детские стишки.) Было еще
темно, и Джордж одевался при стенном свете. Родители его волновались го-
раздо больше, чем он сам. Отец Джорджа был дипломированным трубопроклад-
чиком и работал на Земле, чего втайне стыдился, хотя все понимали, что
большая часть каждого поколения неизбежно должна остаться на Земле.
Сама Земля нуждалась в фермерах, шахтерах и даже в инженерах. Для
работы на других планетах требовались только самые последние модели вы-
сококвалифицированных специалистов, и из восьми миллиардов земного насе-
ления туда ежегодно отправлялось всего лишь несколько миллионов человек.
Естественно, не каждый житель Земли мог попасть в их число.
Но каждый мог надеяться, что по крайней мере кому-нибудь из его де-
тей доведется работать на другой планете, и Плейтен старший, конечно, не
был исключением. Он видел (как, впрочем, видели и совершенно посторонние
люди), что Джордж отличается незаурядными способностями и большой сооб-
разительностью . Значит, его ждет блестящая будущность, тем более, что он
единственный ребенок в семье. Если Джордж не попадет на другую планету,
то его родителям придется возложить все надежды на внуков, а когда-то
еще у них появятся внуки!
Сам по себе День чтения, конечно, мало что значил, но в то же время
только он мог показать хоть что-нибудь до наступления того, другого,
знаменательного дня. Когда дети возвращались домой, все родители Земли
внимательно слушали, как они читают, стараясь уловить особенную бег-
лость , чтобы истолковать ее как счастливое предзнаменование. Почти в лю-
бой семье подрастал такой многообещающий ребенок, на которого со Дня
чтения возлагались огромные надежды только потому, что он легко справ-
лялся с трехсложными словами.
Джордж смутно сознавал, отчего так волнуются его родители, и в то
дождливое утро его безмятежный детский покой смущал только страх, что
радостное выражение на лице отца может угаснуть, когда он вернется домой
и покажет, как он научился читать.
Детей собрали в просторном зале городского Дома образования. В этот
месяц во всех уголках Земли в миллионах местных Домов образования соби-
рались такие же группы детей. Серые стены и напряженность, с которой
держались дети, стеснявшиеся непривычной нарядной одежды, нагнали на
Джорджа тоску.
Он инстинктивно поступил так же, как другие: отыскав кучку ребят,
живших с ним на одном этаже, он присоединился к ним.
Тревельян, мальчик из соседней квартиры, все еще разгуливал в длин-
ных локонах, а от маленьких бачков и жидких рыжеватых усов, которые ему
предстояло отрастить, едва он станет к этому физиологически способен,
его отделяли еще многие годы.
Тревельян (для которого Джордж тогда был еще Джорджи) воскликнул:
- Ага! Струсил, струсил!
- Вот и нет! - возразил Джордж и затем доверительно сообщил: - А па-
па с мамой положили печатный лист на мою тумбочку и, когда я вернусь до-
мой, я прочту им все до последнего словечка. Вот! (В тот момент наиболь-
шее мучение Джорджу причиняли его собственные руки, которые он не знал
куда девать. Ему строго-настрого приказали не чесать голову, не тереть
уши, не ковырять в носу и не засовывать руки в карманы. Так что же ему
было с ними делать?)
Зато Тревельян как ни в чем не бывало сунул руки в карманы и заявил:
- А вот мой папа ничуточки не беспокоится.
Тревельян старший почти семь лет работал металлургом на Динарии, и,
хотя теперь он вышел на пенсию и жил опять на Земле, соседи смотрели на
него снизу вверх.
Возвращение на Землю не очень поощрялось из-за проблемы перенаселен-
ности, но все же кое-кому удавалось вернуться. Прежде всего, жизнь на
Земле была дешевле, и пенсия, мизерная в условиях Дипории, на Земле выг-
лядела весьма солидно. Кроме того, некоторым людям особенно приятно де-
монстрировать свои успехи именно перед друзьями детства и знакомыми, а
не перед всей остальной Вселенной.
Свое возвращение Тревельян старший объяснил еще и тем, что, останься
он на Дипории, там пришлось бы остаться и его детям, а Дипория имела со-
общение только с Землей. Живя же на Земле, его дети смогут в будущем по-
пасть на любой из миров, даже на Новию.
Коротышка Тревельян рано усвоил эту истину. Еще до Дня чтения он
беззаботно верил, что в конце концов будет жить на Новия, и говорил об
этом как о деле решенном.
Джордж, подавленный мыслью о будущем величии Тревельяна и сознанием
собственного ничтожества, немедленно в целях самозащиты перешел в нас-
тупление .
- Мой папа тоже не беспокоится. Ему просто хочется послушать, как я
читаю! Ведь он знает, что читать я буду очень хорошо. А твой отец просто
не хочет тебя слушать: он знает, что у тебя ничего не выйдет.
- Нет, выйдет! А чтение - это ерунда. Когда я буду жить на Новик, я
найму людей, чтобы они мне читали.
- Потому что сам ты читать не научишься! Потому что ты дурак!
- А как же я тогда попаду на Новик)? И Джордж, окончательно выведен-
ный из себя, посягнул на основу основ:
- А кто это тебе сказал, что ты попадешь на Новик)? Никуда ты не по-
падешь . Вот! Коротышка Тревельян покраснел.
- Ну, уж трубопрокладчиком, как твой папаша, я не буду!
- Возьми назад, что сказал, дурак)
- Сам возьми!
Они были готовы броситься друг на друга. Драться им, правда, совсем
не хотелось, но возможность заняться чем-то привычным в этом чужом месте
сама по себе была уже облегчением. А к тому же Джордж сжал кулаки и
встал в боксерскую стойку, так что мучительная проблема - куда девать
руки - временно разрешилась. Остальные дети возбужденно обступили их.
Но тут же все кончилось: по залу внезапно разнесся усиленный громко-
говорителями женский голос - и сразу наступила тишина. Джордж разжал ку-
лаки и забыл о Тревельяне.
- Дети, - произнес голос, - сейчас мы будем называть ваши фамилии.
Тот, кто услышит свою фамилию, должен тут же подойти к одному из служи-
телей, которые стоят у стен. Вы видите их? Они одеты в красную форму, и
вы легко их заметите. Девочки пойдут направо, мальчики - налево. А те-
перь посмотрите, какой человек в красном стоит к вам ближе всего...
Джордж сразу же увидел своего служителя и стал ждать, когда его вы-
зовут. Он еще побыл посвящен в тайну алфавита, и к тому времени, когда
дошла очередь до его фамилии, уже начал волноваться. Толпа детей редела,
ручейками растекаясь к красным фигурам.
Когда наконец было произнесено имя "Джордж Плейтен", он испытал не-
выразимое облегчение и упоительную радость: его уже вызвали, а Коротишку
- нет! Уходя, Джордж бросил ему через плечо:
- Ага, Коротышка! А может, ты им вовсе и не нужен? Но его приподня-
тое настроение быстро улетучилось. Его поставили рядом с незнакомыми
детьми и всех повели по коридорам. Они испуганно переглядывались, но за-
говорить никто не осмеливался, и слышалось только сопение да иногда
сдавленный шепот; "Не толкайся!" и "Эй, ты, поосторожней! "
Им раздали картонные карточки и велели их не терять. Джордж стал с
любопытством рассматривать свою карточку. Он увидел маленькие черные
значки разной формы. Он знал, что это называется печатными буквами, но
был не в состоянии представить себе, как из них получаются слова.
Его и еще четверых мальчиков отвели в отдельную комнату и велели им
раздеться. Они быстро сбросили свою новую одежду и стояли теперь голые и
маленькие, дрожа скорее от волнения, чем от холода. Лаборанты быстро, по
очереди ощупывали и исследовали их с помощью каких-то странных инстру-
ментов, кололи им пальцы, чтобы взять кровь для анализа, а потом каждый
брал карточки и черной палочкой торопливо выводил на них аккуратные ряды
каких-то значков. Джордж Пристально вглядывался в эти новые значки, но
они оставались такими же непонятными, как и старые. Затем детям велели
одеться.
Они сели на маленькие стулья и снова стали ждать. Их опять начали
вызывать по фамилиям, и Джорджа Плейтена вызвали третьим.
Он вошел в большую комнату, заполненную страшными аппаратами с мно-
жеством кнопок и прозрачных панелей. В самом Центре комнаты стоял пись-
менный стол, за которым, устремив взгляд на кипу лежавших перед ним бу-
маг, сидел какой-то мужчина.
- Джордж Плейтен? - спросил он.
- Да, сэр, - дрожащим шепотом ответил Джордж, который в результате
длительного ожидания и бесконечных переходов из комнаты в комнату начал
волноваться. Он уже мечтал о том, чтобы все это поскорее кончилось. Че-
ловек за письменным столом сказал:
- Меня зовут доктор Ллойд. Как ты себя чувствуешь, Джордж? Произнося
эту фразу, доктор не поднял головы. Казалось, он повторял эти слова так
часто, что ему уже не нужно было смотреть на того, к кому он обращался.
- Хорошо.
- Ты боишься, Джордж?
- Н-нет, сэр, - ответил Джордж, и даже от него самого не укрылось,
как испуганно прозвучал его голос.
- Вот и прекрасно, - произнес доктор, - Ты же знаешь, что бояться
нечего. Ну-ка, Джордж, посмотрим! На твоей карточке написано, что твоего
отца зовут Питер и что по профессии он дипломированный трубопрокладчик.
Имя твоей матери Эми, и она дипломированный специалист по домоведению.
Правильно?
- Д-да, сэр.
- А ты родился 13 февраля и год назад перенес инфекционное заболева-
ние уха. Так?
- Да, сэр.
- А ты знаешь, откуда мне это известно?
- Я думаю, все это есть на карточке.
- Совершенно верно, - доктор в первый раз взглянул на Джорджа и
улыбнулся, показав ровные зубы. На вид он был гораздо моложе отца Джорд-
жа - и Джордж несколько успокоился. Доктор протянул ему карточку.
- Ты знаешь, что означают эти значки? И хотя Джорджу было отлично
известно, что этого он не знает, от неожиданности он взглянул на карточ-
ку с таким вниманием, словно по велению судьбы внезапно научился читать.
Но значки по-прежнему оставались непонятными, и он вернул карточку док-
тору.
- Нет, сэр.
- А почему?
У Джорджа вдруг мелькнуло подозрение: а не сошел ли с ума этот док-
тор? Разве он этого не знает сам?
- Потому что я не умею читать, сэр.
- А тебе хотелось бы научиться читать?
- Да, сэр.
- А зачем, Джордж?! Джордж в недоумении вытаращил глаза. Никто ни-
когда не задавал ему такого вопроса, и он растерялся.
- Я не знаю, сэр, - запинаясь, произнес он.
- Печатная информация будет руководить тобой всю твою жизнь. Даже
после Дня образования тебе предстоит узнать еще очень многое. И эти зна-
ния ты будешь получать из таких вот карточек, из книг, с телевизионных
экранов. Печатные тексты расскажут тебе столько полезного и интересного,
что не уметь читать было бы так же ужасно, как быть слепым. Тебе это по-
нятно?
- Да, сэр.
- Ты боишься, Джордж?
- Нет, сэр.
- Отлично. Теперь я объясню тебе, с чего мы начнем. Я приложу вот
эти провода к твоему лбу над уголками глаз. Они приклеятся к коже, но не
причинят тебе никакой боли. Потом я включу аппарат и раздастся жужжание.
Оно покажется тебе непривычным, и, возможно, тебе будет немного щекотно,
но это тоже совершенно безболезненно. Впрочем, если тебе все-таки станет
больно, ты мне скажешь, и я тут же выключу аппарат. Но больно не будет.
Ну, как, договорились? Судорожно глотнув, Джордж кивнул.
- Ты готов?
Джордж снова кивнул. С закрытыми глазами он ждал, пока доктор гото-
вил аппаратуру. Родители не раз рассказывали ему про все это. Они тоже
говорили, что ему не будет больно. Но зато ребята постарше, которым ис-
полнилось десять, а то и двенадцать лет, всегда дразнили ожидавших свое-
го Дня чтения восьмилеток и кричали: "Берегитесь иглы!" А другие, отоз-
вав малыша в какой-нибудь укромный уголок, по секрету сообщали: "Они
разрежут тебе голову вот таким большущим ножом с крючком на конце" - и
добавляли множество жутких подробностей.
Джордж никогда не принимал это за чистую монету, но тем не менее по
ночам его мучили кошмары. И теперь, испытывая непередаваемый ужас, он
закрыл глаза.
Он не почувствовал прикосновения проводов к вискам. Жужжание доноси-
лось откуда-то издалека, и его заглушал звук стучавшей в ушах крови, та-
кой гулкий, словно все происходило в большой пустой пещере. Джордж риск-
нул медленно открыть глаза.
Доктор стоял к нему спиной. Из одного аппарата ползла узкая лента
бумаги, на которой виднелась волнистая фиолетовая линия. Доктор отрывал
кусочки этой ленты и вкладывал их в прорезь другой машины. Он снова и
снова повторял это, и каждый раз машина выбрасывала небольшой кусочек
пленки, который доктор внимательно рассматривал. Наконец, он повернулся
к Джорджу, как-то странно нахмурив брови. Жужжание прекратилось.
- Уже все? - прошептал Джордж.
- Да, - не переставая хмуриться, произнес доктор.
- И я уже умею читать? - Джордж не чувствовал в себе никаких измене-
ний .
- Что? - переспросил доктор, и на его губах мелькнула неожиданная
улыбка. - Все идет, как надо, Джордж. Читать ты будешь через пятнадцать
минут. А теперь мы воспользуемся другой машиной, и это уже будет немного
дольше. Я закрою тебе всю голову, и, когда я включу аппарат, ты на неко-
торое время перестанешь видеть и слышать, но тебе не будет больно. На
всякий случай я дам тебе в руку выключатель. Если ты все-таки почувству-
ешь боль, нажми вот эту маленькую кнопку, и все прекратится. Хорошо?
Позже Джорджу довелось услышать, что это был не настоящий выключа-
тель и его давали ребенку только для того, чтобы он чувствовал себя спо-
койнее . Однако он не знал твердо, так ли это, поскольку сам кнопки не
нажимал.
Ему надели на голову большой шлем обтекаемой формы, выложенный из-
нутри резиной. Три-четыре небольшие выпуклости присосались к его черепу,
но он ощутил лишь легкое давление, которое тут же исчезло. Боли не было.
Откуда-то глухо донесся голос доктора:
- Ну, как, Джордж, все в порядке?
И тогда, без всякого предупреждения, его как будто окутал толстый
слой войлока. Он перестал ощущать собственное тело, исчезли чувства,
весь мир, вся Вселенная. Остался лишь он сам и доносившийся из бездонных
глубин небытия голос, который что-то шептал ему... шептал... шептал...
Он напряженно старался услышать и понять хоть что-нибудь, но между
ним и шепотом лежал толстый войлок.
Потом с него сняли шлем. Яркий свет ударил ему в глаза, а голос док-
тора отдавался в ушах барабанной дробью.
- Вот твоя карточка, Джордж. Скажи, что на ней написано? Джордж сно-
ва взглянул на карточку - и вскрикнул. Значки обрели смысл! Они слага-
лись в слова, которые он понимал так отчетливо, будто кто-то подсказывал
их ему на ухо. Он был уверен, что именно слышал их.
- Так что же на ней написано, Джордж?
- На ней написано... написано... "Плейтен Джордж. Родился 13 февраля
64 92 года, родители Питер и Эми Плейтен, место...’’- от волнения он не
мог продолжать.
- Ты умеешь читать, Джордж, - сказал доктор. - Все уже позади.
- И я никогда не разучусь? Никогда?
- Ну конечно же, нет. - Доктор наклонился и серьезно пожал ему руку.
- А сейчас тебя отправят домой.
Прошел не один день, прежде чем Джордж освоился со своей новой, за-
мечательной способностью. Он так бегло читал отцу вслух, что Плейтен
старший не смог сдержать слез умиления и поспешил поделиться этой ра-
достной новостью с родственниками.
Джордж бродил по городу, читая все попадавшиеся ему по пути надписи,
и не переставал удивляться тому, что было время, когда он их не понимал.
Он пытался вспомнить, что это такое - не уметь читать, и не мог. Ему
казалось, будто он всегда умел читать. Всегда.
К восемнадцати годам Джордж превратился в смуглого юношу среднего
роста, но благодаря худобе он выглядел выше, чем был на самом деле. А
коренастый, широкоплечий Тревельян, который был ниже его разве что на
дюйм, по-прежнему выглядел настоящим коротышкой. Однако за последний год
он стал очень самолюбив и никому не позволял безнаказанно употреблять
это прозвище. Впрочем, настоящее имя нравилось ему еще меньше, и его на-
зывали просто Тревельяном или каким-нибудь прилично звучавшим сокращени-
ем фамилии. А чтобы еще более подчеркнуть свое возмужание, он упорно от-
ращивал баки и жесткие, как щетина, усики.
Сейчас он вспотел от волнения, и Джордж, к тому времени тоже сменив-
ший картавое "Джооджи" на односложное гортанное "Джордж", глядел на не-
го , посмеиваясь.
Они находились в том же огромном зале, где их однажды уже собирали
десять лет назад (и куда они с тех пор ни разу не заходили). Казалось,
внезапно воплотилось в действительность туманное сновидение из далекого
прошлого. В первые минуты Джордж был очень удивлен, обнаружив, что все
здесь как будто стало меньше и теснее, но потом он сообразил, что это
вырос он сам.
Собралось их здесь меньше, чем в тот, первый раз, и одни юноши. Для
девушек был назначен другой день.
- Не понимаю, почему нас заставляют ждать так долго, - вполголоса
сказал Тревельян.
- Обычная волокита, - заметил Джордж. - Вез нее не обойдешься.
- И откуда в тебе это идиотское спокойствие? - раздраженно поинтере-
совался Тревельян.
- А мне не из-за чего волноваться.
- Послушать тебя, так уши вянут! Надеюсь, ты станешь дипломированным
возчиком навоза, вот тогда-то я на тебя погляжу. - Он окинул толпу угрю-
мым, тревожным взглядом.
Джордж тоже посмотрел по сторонам. На этот раз система была иной,
чем в День чтения. Все шло гораздо медленнее, а инструкции были розданы
сразу в печатном виде - значительное преимущество перед устными инструк-
циями еще не умеющим читать детям. Фамилии "Плейтен" и "Тревельян"
по-прежнему стояли в конце списка, но теперь они уже знали, в чем дело.
Юноши один за другим выходили из проверочных комнат. Нахмурившись и
явно испытывая неловкость, они забирали свою одежду и вещи и отправля-
лись узнавать результаты.
Каждого окружала с каждым разом все более редевшая кучка тех, кто
еще ждал своей очереди. "Ну, как?", "Очень трудно было?", "Как по-твое-
му, что тебе дали?", "Чувствуешь разницу?" - раздавалось со всех сторон.
Ответы были туманными и уклончивыми. Джордж, напрягая всю волю, дер-
жался в стороне. Такие разговоры - лучший способ вывести человека из
равновесия. Все единогласно утверждали, что больше всего шансов у тех,
кто сохраняет спокойствие. Но, несмотря ни на что, он чувствовал, как у
него постепенно холодеют руки.
Забавно, как с годами приходят новые заботы. Например, высококвали-
фицированные специалисты отправляются работать на другие планеты только
с женами (или мужьями). Ведь на всех планетах необходимо поддерживать
правильное соотношение числа мужчин и женщин. А какая девушка откажется
выйти за человека, которого посылают на планету класса А? У Джорджа не
было на примете никакой определенной девушки, да он и не интересовался
ими. Еще не время. Вот когда его мечта осуществится и он получит право
добавлять к своему имени слова "дипломированный программист", вот тогда
он, как султан в гареме, сможет выбрать любую. Эта мысль взволновала
его, и он постарался тут же выкинуть ее из головы. Необходимо сохранять
спокойствие.
- Что же это все-таки может значить? - пробормотал Тревельян. - Сна-
чала тебе советуют сохранять спокойствие и хладнокровие, а потом тебя
ставят в такое вот положение - тут только и сохранять спокойствие!
- Может быть, это нарочно? Чтобы с самого начала отделить мужчин от
мальчиков? Легче, легче, Трев!
- Заткнись!
Наконец вызвали Джорджа, но не по радио, как в тот раз, - его фами-
лия вспыхнула на световом табло. Джордж помахал Тревельяну рукой.
- Держись, Трев! Не волнуйся.
Когда он входил в проверочную комнату, он был счастлив. Да, счаст-
лив !
- Джордж Плейтен? - спросил человек, сидевший за столом. На миг в
сознании Джорджа с необыкновенной четкостью возник образ другого челове-
ка, который десять лет назад задал такой же вопрос, и ему вдруг показа-
лось, что перед ним тот же доктор, а он, Джордж, переступив порог, снова
превратился в восьмилетнего мальчугана.
Сидевший за столом поднял голову - его лицо конечно, не имело ничего
общего с образом, всплывшим из глубин памяти Джорджа. У этого нос был
картошкой, волосы жидкие и спутанные, а под подбородком висела складка,
словно прежде он был очень толстым, а потом вдруг сразу похудел.
- Ну? - раздраженно произнес он. Джордж очнулся.
- Да, я Джодж Плейтен, сэр.
- Так и говорите. Я - доктор Зэкери Антонелли. Сейчас мы с вами поз-
накомимся поближе.
Он пристально, по-совиному, разглядывал на свет маленькие кусочки
пленки.
Джордж внутренне содрогнулся. Он смутно вспомнил, что тот, другой
доктор (он забыл, как его звали) тоже рассматривал такую же пленку. Неу-
жели это та самая? Тот хмурился, а этот взглянул на него сейчас так, как
будто его что-то рассердило.
Джордж уже не чувствовал себя счастливым. Доктор Антонелли раскрыл
довольно пухлую папку и осторожно отложил в сторону пленки.
- Тут сказано, что вы хотите стать программистом вычислительных ма-
шин .
- Да, доктор.
- Вы не передумали?
- Нет, сэр.
- Это очень ответственная и сложная профессия. Вы уверены, что она
вам по силам?
- Да, сэр.
- Большинство людей, еще не получивших образования, не называют ни-
какой конкретной профессии. Видимо, они боятся повредить себе.
- Наверное так, сэр.
- А вас это не пугает?
- Я полагаю, что лучше быть откровенным, сэр. Доктор Антонелли кив-
нул, но выражение его лица осталось прежним.
- Почему вы хотите стать программистом?
- Как вы только что сказали, сэр, это ответственная и сложная про-
фессия. Программисты выполняют важную и интересную работу. Мне она нра-
вится, и я думаю, что справлюсь с ней. Доктор Антонелли отодвинул папку
и кисло взглянул на Джорджа.
- Откуда вы знаете, что она вам понравится? Вы, наверное, думаете,
что вас тут же подхватит какая-нибудь планета класса А?
"Он пробует запугать меня, - с тревогой подумал Джордж. - Спокойно,
Джордж, говори правду".
- Мне кажется, что у программиста на это большие шансы, - произнес
он, - но, даже если бы меня оставили на Земле, работа эта мне все равно
нравилась бы, я знаю. ("Во всяком случае, это так и я не лгу", - подумал
Джордж.)
- Пусть так, но откуда вы это знаете? Вопрос был задан таким тоном,
словно на него нельзя было ответить разумно, и Джордж еле сдержал улыб-
ку. У него-то имелся ответ!
- Я читал о программировании, сэр, - сказал он.
- Что?
На лице доктора отразилось неподдельное изумление, и это доставило
Джорджу удовольствие.
- Я читал о программировании, сэр, - повторил он. - Я купил книгу на
эту тему и изучал ее.
- Книгу, предназначенную для дипломированных программистов?
- Да, сэр.
- Но ведь вы могли не понять то, что там написано.
- Да, вначале. Но я достал другие книги по математике и электронике
и разобрался в них, насколько мог. Я, конечно, знаю не так уж много, но
все-таки достаточно, чтобы понять, что мне нравится эта профессия и что
я могу быть программистом. (Даже его родители ничего не знали о тайнике,
где он хранил эти книги, и не догадывались, почему он проводит так много
времени в своей комнате и почему не высыпается.) Доктор оттянул пальцами
дряблую складку под подбородком.
- А зачем вы это делали, друг мой?
- Мне хотелось проверить, действительно ли эта профессия интересна.
- Но ведь вам известно, что это не имеет ни малейшего значения. Как
бы вас ни привлекала та или иная профессия, вы не получите ее, если фи-
зическое устройство вашего мозга делает вас более пригодным для занятий
иного рода. Вам ведь это известно?
- Мне говорили об этом, - осторожно ответил Джордж.
- Так поверьте, что это правда. Джордж промолчал.
- Или вы думаете, что изучение какого-нибудь предмета перестроит
мозговые клетки в нужном направлении? А еще одна теорийка рекомендует
беременной женщине чаще слушать прекрасную музыку, если она хочет, чтобы
ребенок стал композитором. Вы, значит, верите в это?
Джордж покраснел. Конечно, он думал и об этом. Он полагал, что, пос-
тоянно упражняя свой интеллект в избранной области, он получит таким об-
разом дополнительное преимущество. Его уверенность в значительной мере
объяснялась именно этим.
- Я никогда... - начал было он, но не нашел, что сказать.
- Ну, так это неверно, молодой человек! К моменту рождения ваш мозг
уже окончательно сформирован. Он может быть изменен ударом, достаточно
сильным, чтобы повредить его клетки, или разрывом кровеносного сосуда,
или опухолью, или тяжелым инфекционным заболеванием - в любом случае
обязательно к худшему. Но повлиять на строение мозга, упорно о чем-то
думая, попросту невозможно. - Он задумчиво посмотрел на Джорджа и доба-
вил : Кто вам посоветовал делать это? Окончательно расстроившись, Джордж
судорожно глотнул и ответил:
- Никто, доктор. Это моя собственная идея.
- А кто Знал об этих ваших занятиях?
- Никто. Доктор, я не хотел ничего плохого.
- Кто сказал, что это плохо? Бесполезно, только и всего. А почему вы
скрывали свои занятия?
- Я... я думал, что надо мной будут смеяться. (Он вдруг вспомнил о
недавнем споре с Тревельяном. Очень осторожно, как будто эта мысль толь-
ко зародилась в самом отдаленном уголке его сознания, Джордж высказал
предположение, что, пожалуй, можно кое-чему научиться, черпая знания,
так сказать, вручную, постепенно и понемногу. Тревельян оглушительно
расхохотался: "Джордж, не хватает еще, чтобы ты начал дубить кожу для
своих башмаков и сам ткать материю для своих рубашек". И тогда он обра-
довался , что сумел хорошо сохранить свою тайну.)
Погрузившись в мрачное раздумье, доктор Антонелли перекладывал с
места на место кусочки пленки, которые рассматривал в начале их разгово-
ра . Наконец он произнес:
- Займемся-ка вашим анализом. Так мы ничего не добьемся. К вискам
Джорджа приложили провода. Раздалось жужжание, и снова в его мозгу воз-
никло ясное воспоминание о том, что происходило с ним в этом здании де-
сять лет назад.
Руки Джорджа были липкими от пота, его сердце отчаянно колотилось.
Зачем, зачем он сказал доктору, что тайком читает книги?
Всему виной было его проклятое тщеславие. Ему захотелось щегольнуть
своей предприимчивостью и самостоятельностью, а вместо этого он проде-
монстрировал свое суеверие и невежество и восстановил доктора против се-
бя. (Он чувствовал, что Антонелли возненавидел его за самодовольную раз-
вязность .)
А теперь он довел себя до такого возбуждения, что анализатор, конеч-
но, покажет полную бессмыслицу.
Он не заметил, когда именно с его висков сняли провода. Он только
вдруг осознал, что доктор стоит перед ним и задумчиво смотрит на него. А
проводов уже не было. Отчаянным усилием воли Джордж взял себя в руки. Он
полностью распростился с мечтой стать программистом. За каких-нибудь де-
сять минут она окончательно рассеялась.
- Наверно, нет? - уныло спросил он.
- Что нет?
- Из меня не выйдет программиста? Доктор потер нос и сказал:
- Одевайтесь, заберите свои вещи и идите в комнату 3.5-С. Там вас
будут ждать ваши бумаги и мое заключение.
- Разве я уже получил образование? - изумленно спросил Джордж. - Мне
казалось, что это только... Доктор Антонелли внимательно посмотрел на
письменный стол.
- Вам все объяснят. Делайте, как я сказал. Джордж почувствовал смя-
тение. Что от него утаивают? Он годится только для профессии дипломиро-
ванного чернорабочего, и его хотят подготовить, заставить смириться с
этой судьбой?
Он сразу полностью уверовал в правильность своей догадки, и ему
пришлось напрячь все силы, чтобы не закричать.
Спотыкаясь, он побрел к своему месту в зале. Тревельяна там не было,
и, если бы Джордж в тот момент был способен осмысленно воспринимать ок-
ружающее, он обрадовался бы этому обстоятельству. В зале вообще уже поч-
ти никого не осталось, а те немногие, которые, судя по их виду, как буд-
то намеревались его порасспросить, были слишком измучены ожиданием своей
очереди в конце алфавита, чтобы выдержать его свирепый, полный злобной
ненависти взгляд.
По какому праву они будут квалифицированными специалистами, а он -
чернорабочим? Чернорабочим! Он был в этом уверен.
Служитель в красной форме повел его по коридорам, полным деловой су-
еты, мимо комнат, в каждой из которых помещалась та или иная группа спе-
циалистов - где два, а где пять человек: механики-мотористы, инжене-
ры-строители, агрономы... Существовали сотни различных профессий, и зна-
чительная их часть будет представлена в этом году по крайней мере одним
или двумя жителями его родного городка.
В эту минуту Джордж ненавидел их всех: статистиков, бухгалтеров,
тех, кто поважнее, и тех, кто помельче. Он ненавидел их за то, что они
уже получили свои знания и им была ясна их дальнейшая судьба, а его са-
мого, все еще не обученного, ждала какая-то новая волокита.
Наконец он добрался до двери с номером 3.5-С. Его ввели в пустую
комнату и оставили одного. На какой-то миг он воспрянул духом. Ведь, ес-
ли бы эта комната предназначалась для чернорабочих, тут уже сидело бы
много его сверстников.
Дверь в невысокой, в половику человеческого роста, перегородке
скользнула в паз, и в комнату вошел пожилой седовласый мужчина. Он улыб-
нулся, показав ровные, явно фальшивые зубы, однако на его румяном лице
не было морщин, а голос сохранил звучность.
- Добрый вечер, Джордж, - сказал он. - Я вижу, что на этот раз к нам
в сектор попал только один из вас.
- Только один? - с недоумением повторил Джордж.
- Ну, по всей Земле таких, как вы, наберется несколько тысяч. Да,
тысяч. Вы не одиноки. Джордж почувствовал раздражение.
- Я ничего не понимаю, сэр, - сказал он. - Какова моя классификация?
Что происходит?
- Полегче, друг мой. Ничего страшного. Это могло бы случиться с кем
угодно. - Он протянул руку, и Джордж, машинально взяв ее, почувствовал
крепкое пожатие. - Садитесь. Меня зовут Сэм Элленфорд. Джордж нетерпели-
во кивнул.
- Я хочу знать, в чем дело, сэр.
- Естественно. Во-первых, Джордж, вы не можете быть программистом. Я
думаю, что вы и сами об этом догадались.
- Да, - с горечью согласился Джордж. - Но кем же я тогда буду?
- Это очень трудно объяснить, Джордж. - Он помолчал и затем отчетли-
во произнес: Никем.
- Что?!
- Никем!
- Что это значит? Почему вы не можете дать мне профессию?
- Мы тут бессильны, Джордж, у нас нет выбора. За нас решает устройс-
тво вашего мозга. Лицо Джорджа стало землистым, глаза выпучились.
- Мой мозг никуда не годится?
- Да как сказать. Но в отношении профессиональной классификации -
можете считать, что он действительно не годится.
- Но почему? Элленфорд пожал плечами.
- Вам, конечно, известно, как осуществляется на Земле программа об-
разования. Практически любой человек может усвоить любые знания, но каж-
дый индивидуальный мозг лучше подходит для одних видов знаний, чем для
других. Мы стараемся по возможности сочетать устройство мозга с соот-
ветствующими знаниями в пределах квоты на специалистов каждой профессии.
Джордж кивнул.
- Да, я знаю.
- Но иногда, Джордж, нам попадается молодой человек, чей интеллект
не подходит для наложения на него каких бы то ни было знаний.
- Другими словами, я не способен получить образование?
- Вот именно.
- Но это безумие. Ведь я умен. Я могу понять... - Он беспомощно ог-
лянулся , как бы отыскивая какую-нибудь возможность доказать, что его
мозг работает нормально.
- Вы неправильно - меня поняли, - очень серьезно произнес Элленфорд.
- Вы умны. Об этом вопроса не встает. Более того, ваш интеллект даже вы-
ше среднего. К сожалению, это не имеет никакого отношения к тому, подхо-
дит ли он для наложения знаний. Вообще сюда почти всегда попадают умные
люди.
- Вы хотите сказать, что я не могу стать даже дипломированным черно-
рабочим? - пролепетал Джордж. Внезапно ему показалось, что даже это луч-
ше , чем открывшаяся перед ним пустота. - Что особенного нужно знать,
чтобы быть чернорабочим?
- Вы недооцениваете чернорабочих, молодой человек. Существует мно-
жество разновидностей этой профессии, и каждая из этих разновидностей
имеет свой комплекс довольно сложных знаний. Вы думаете, не требуется
никакого искусства, чтобы правильно поднимать тяжести? Кроме того, для
профессии чернорабочего мы должны отбирать не только подходящий тип моз-
га, но и подходящий тип тела. Вы не годитесь для этого, Джордж. Если бы
вы стали чернорабочим, вас хватило бы ненадолго. Джордж знал, что не об-
ладает крепким телосложением.
- Но я никогда не слышал ни об одном человеке без профессии, - воз-
разил он.
- Таких людей немного, - ответил Элленфорд. - И мы оберегаем их. -
Оберегаете? - Джордж почувствовал, как в его душе растут смятение и
страх.
- Вы находитесь под опекой планеты, Джордж. С того момента, как вы
вошли в эту дверь, мы приступили к своим обязанностям. - И он улыбнулся.
Это была добрая улыбка. Джорджу она показалась улыбкой собственника,
улыбкой взрослого, обращенной к беспомощному ребенку.
- Значит, я попаду в тюрьму? - спросил он.
- Ни в коем случае. Вы просто будете жить с себе подобными. "С себе
подобными! ’’ Эти слова громом отдались в ушах Джорджа.
- Вам нужны особые условия. Мы позаботимся о вас, - сказал Эллен-
форд.
К своему ужасу, Джордж вдруг залился слезами. Элленфорд отошел в
другой конец комнаты и, как бы задумавшись о чем-то, отвернулся.
Джордж напрягал все силы, и судорожные рыдания сменились всхлипыва-
ниями, а потом ему удалось подавить и их. Он думал о своем отце, о мате-
ри , о друзьях, о Тревельяне, о своем позоре...
- Я же научился читать! - возмущенно сказал он.
- Каждый нормальный человек может научиться этому. Нам никогда не
приходилось сталкиваться с исключениями. Но именно на этом этапе мы об-
наруживаем ... э... э... исключения. Когда вы научились читать, Джордж,
мы узнали об особенностях вашего мышления. Дежурный врач уже тогда сооб-
щил о некотором его своеобразии.
- Неужели вы не можете попробовать дать мне образование? Ведь вы да-
же не пытались сделать это. Весь риск я возьму на себя.
- Закон запрещает нам это, Джордж. Но, послушайте, все будет хорошо.
Вашим родителям мы представим дело в таком свете, что это не огорчит их.
А там, куда вас поместят, вы будете пользоваться некоторыми привилегия-
ми. Мы дадим вам книги, и вы сможете изучать все, что пожелаете.
- Собирать знания по зернышку, - горько произнес Джордж. - И к концу
жизни я буду знать как раз достаточно, чтобы стать дипломированным млад-
шим клерком в отделе скрепок.
- Однако, если не ошибаюсь, вы уже пробовали учиться по книгам.
Джордж замер. Его мозг пронзила страшная догадка.
- Так вот оно что...
- Что?
- Этот ваш Антонелли! Он хочет погубить меня!
- Нет, Джордж, вы ошибаетесь.
- Не разуверяйте меня. - Джорджа охватила безумная ярость. - Этот
поганый ублюдок решил расквитаться со мной за то, что я оказался для не-
го слишком умным. Я читал книги и пытался подготовиться к профессии
программиста. Ладно, какого отступного вы хотите? Деньги? Так вы их не
получите. Я ухожу, и когда я объявлю об этом... Он перешел на крик.
Элленфорд покачал головой и нажал кнопку. В комнату на цыпочках вош-
ли двое мужчин и с двух сторон приблизились к Джорджу. Они прижали его
руки к бокам, и один из них поднес к локтевой впадине его правой руки
воздушный шприц. Снотворное проникло в вену и подействовало почти мгно-
венно .
Крики Джорджа тут же оборвались, голова поникла, колени подогнулись,
и только служители, поддерживавшие его с обеих сторон, не дали ему, спя-
щему , рухнуть на пол.
Как и было обещано, о Джордже позаботились. Его окружили вниманием и
были к нему неизменно добры - Джорджу казалось, что он сам точно так же
обращался бы с больным котенком.
Ему сказали, что он должен взять себя в руки и найти для себя какой-
нибудь интерес в жизни. Потом ему объяснили, что большинство тех, кто
попадает сюда, вначале всегда предается отчаянию и что со временем у не-
го это пройдет. Но он даже не слышал их.
Джорджа посетил сам доктор Элленфорд и рассказал, что его родителям
сообщили, будто он получил особое назначение.
- А они знают?.. - пробормотал Джордж. Элленфорд поспешил успокоить
его:
- Мы не вдавались в подробности.
Первое время Джордж отказывался есть и ему вводили питание внутри-
венно . От него спрятали острые предметы и приставили к нему охрану. В
его комнате поселился Хали Омани, и флегматичность нигерийца подейство-
вала на Джорджа успокаивающе.
Однажды, снедаемый отчаянной скукой, Джордж попросил какую-нибудь
книгу. Смани, который сам постоянно что-то читал, поднял голову и широко
улыбнулся. Не желая доставлять им удовольствия, Джордж чуть было не взял
назад свою просьбу, но потом подумал: "А не все ли равно?"
Он не уточнил, о чем именно хочет читать, и Смани принес ему книгу
по химии. Текст был напечатан крупными буквами, составлен из коротких
слов и пояснялся множеством картинок. Это была книга для подростков, и
Джордж с яростью швырнул ее об стену.
Таким он будет всегда. На всю жизнь он останется подростком, челове-
ком, не получившим образования, и для него будут писать специальные кни-
ги. Изнывая от ненависти, он лежал в кровати и глядел в потолок, однако
через час, угрюмо насупившись, встал, поднял книгу и принялся за чтение.
Через неделю он кончил ее и попросил другую.
- А первую отнести обратно? - спросил Омани. Джордж нахмурился.
Кое-чего он не понял, но он еще не настолько потерял чувство собственно-
го достоинства, чтобы сознаться в этом.
- Впрочем, пусть остается, - сказал Смани. - Книги предназначены для
того, чтобы их читали и перечитывали.
Это произошло в тот самый день, когда он наконец принял приглашение
Смани посмотреть заведение, в котором они находились. Он плелся за ниге-
рийцем, бросая вокруг быстрые злобные взгляды.
О да, это место не было тюрьмой! Ни запертых дверей, ни стен, ни ох-
раны. Оно напоминало тюрьму только тем, что его обитатели не могли его
покинуть.
И все-таки было приятно увидеть десятки подобных себе людей. Ведь
слишком легко могло показаться, что во всем мире только ты один так...
искалечен.
- А сколько здесь живет человек? - пробормотал он.
- Двести пять, Джордж, и это не единственное в мире заведение такого
рода. Их тысячи.
Где бы он ни проходил, люди поворачивались в его сторону и провожали
его глазами - и в гимнастическом зале, и на теннисных кортах, и в библи-
отеке. (Никогда в жизни он не представлял себе, что может существовать
такое количество книг; ими были битком - именно битком - набиты длинные
полки.) Все с любопытством рассматривали его, а он бросал в ответ ярост-
ные взгляды. Уж они-то ничем не лучше его, как же они смеют глазеть на
него, словно на какую-нибудь диковинку! Всем им, по-видимому, было лет
двадцать - двадцать пять.
- А что происходит с теми, кто постарше? - неожиданно спросил
Джордж.
- Здесь живут только более молодые, - ответил Омани, а затем, словно
вдруг поняв скрытый смысл вопроса Джорджа, укоризненно покачал головой и
добавил: Их не уничтожают, если ты это имеешь в виду. Для старшего воз-
раста существуют другие приюты.
- А впрочем, мне наплевать... - пробормотал Джордж, почувствовав,
что проявил к этому слишком большой интерес и ему угрожает опасность
сдаться.
- Но почему? Когда ты станешь старше, тебя переведут в приют, пред-
назначенный для лиц обоего пола. Это почему-то удивило Джорджа.
- И женщин тоже?
- Конечно. Неужели ты считаешь, что женщины не подвержены этому?
И Джордж поймал себя на том, что испытывает такой интерес и волне-
ние , каких не замечал в себе с того дня, когда... Он заставил себя не
думать об этом.
Омани остановился на пороге комнаты, где стояли небольшая телевизи-
онная установка и настольная счетная машина. Перед экраном сидели
пять-шесть человек.
- Классная комната, - пояснил. Омани.
- А что это такое? - спросил Джордж.
- Эти юноши получают образование, - ответил Омани. - Но не обычным
способом, - быстро добавил он.
- То есть они получают знания по капле?
- Да. Именно так учились в старину. С тех пор как он появился в при-
юте, ему все время твердили об этом. Но что толку? Предположим, было
время, когда человечество не знало диатермической печи. Разве из этого
следует, что он должен довольствоваться сырым мясом в мире, где все ос-
тальные едят его вареным или жареным?
- Что толку от этого крохоборства? - спросил он.
- Нужно же чем-то занять время, Джордж, а кроме того, им интересно.
- А какая им от этого польза?
- Они чувствуют себя счастливее. Джордж размышлял над этим, даже ло-
жась спать. На другой день он буркнул, обращаясь к Смани:
- Ты покажешь мне класс, где я смогу узнать что-нибудь о программи-
ровании?
- Ну конечно, - охотно согласился Омани.
Дело продвигалось медленно, и это возмущало Джорджа. Почему кто-то
снова и снова объясняет одно и то же? Почему он читает и перечитывает
какой-нибудь абзац, а потом, глядя на математическую формулу, не сразу
ее понимает? Ведь людям за стенами приюта все это дается в один присест,
Несколько раз он бросал занятия. Однажды он не посещал классов целую
неделю. Но всегда возвращался обратно. Дежурный наставник, который сове-
товал им, что читать, вел телевизионные сеансы и даже объяснял трудные
места и понятия, казалось, не замечал его поведения.
В конце концов Джорджу поручили постоянную работу в парке, а кроме
того, когда наступала его очередь, он занимался уборкой и помогал на
кухне. Ему представили это как шаг вперед, но им не удалось его провес-
ти. Ведь тут можно было бы завести куда больше всяческих бытовых прибо-
ров, но юношам нарочно давали работу, чтобы создать для них иллюзию по-
лезного существования. Только его, Джорджа, им провести не удалось.
Им даже платили небольшое жалованье. Эти деньги они могли тратить на
кое-какие дополнительные блага из числа указанных в списке либо отклады-
вать их для сомнительного использования в столь же сомнительной старос-
ти. Джордж держал свои деньги в открытой жестянке, стоявшей на полке
стенного шкафа. Он не имел ни малейшего представления, сколько там нако-
пилось . Ему это было совершенно безразлично.
Он ни с кем по-настоящему не подружился, хотя к этому времени уже
вежливо здоровался с обитателями приюта. Он даже перестал (вернее, почти
перестал) терзать себя мыслями о роковой ошибке, из-за которой попал сю-
да . По целым неделям ему уже не снился Антонелли, его толстый нос и
дряблая шея, его злобная усмешка, с которой он заталкивал Джорджа в рас-
каленный зыбучий песок и держал его там до тех пор, пока тот не просы-
пался с криком, встречая участливый взгляд склонившегося над ним Смани.
Как-то раз в снежный февральский день Смани сказал ему:
- Просто удивительно, как ты приспособился. Но это было в феврале,
точнее, тринадцатого февраля, в день его рождения. Пришел март, за ним
апрель, а когда уже не за горами был май, Джордж понял, что ничуть не
приспособился.
Год назад он не заметил мая. Тогда, впав в апатию и, потеряв цель в
жизни, он целыми днями валялся в постели. Но этот май был иным.
Джордж знал, что повсюду на Земле вскоре начнется Олимпиада и моло-
дые люди будут состязаться друг с другом в профессиональном искусстве,
борясь за места на новых планетах. На всей Земле будет праздничная ат-
мосфера, волнение, нетерпеливое ожидание последних новостей о результа-
тах состязаний. Прибудут важные агенты-вербовщики с далеких планет. По-
бедители будут увенчаны славой, но и потерпевшие поражение найдут чем
утешиться.
Сколько было об этом написано книг! Как он сам мальчишкой из года в
год увлеченно следил за олимпийскими состязаниями! И сколько с этим было
связано его личных планов... Джордж Плейтен сказал с плохо скрытой тос-
кой в голосе:
- Завтра первое мая. Начало Олимпиады! И это вызвало его первую ссо-
ру с Смани, так что тот, сурово отчеканивая каждое слово, произнес пол-
ное название заведения, где находился Джордж. Пристально глядя на Джорд-
жа , Смани сказал раздельно:
- Приют для слабоумных.
Джордж Плейтен покраснел. Для слабоумных! Он в отчаянии отогнал эту
мысль и глухо сказал:
- Я ухожу.
Он сказал это не думая, и смысл этих слов достиг его сознания, лишь
когда они уже сорвались с языка. Смани, который снова принялся за чте-
ние , поднял голову.
- Что ты сказал? Но теперь Джордж понимал, что говорит.
- Я ухожу! - яростно повторил он.
- Что За нелепость! Садись, Джордж, и успокойся.
- Ну, нет! Сколько раз повторять тебе, что со мной попросту распра-
вились. Я не понравился этому доктору, Антонелли, а все эти мелкие бю-
рократишки любят покуражиться. Стоит только с ними не поладить, и они
одним росчерком пера на какой-нибудь карточке стирают тебя в порошок.
- Ты опять за старое?
- Да, и не отступлю, пока все не выяснится. Я доберусь до Антонелли
и выжму из него правду. - Джордж тяжело дышал, его била нервная дрожь.
Наступал месяц Олимпиады, и он не мог допустить, чтобы этот месяц прошел
для него безрезультатно. Если он сейчас ничего не предпримет, он оконча-
тельно капитулирует и погибнет навсегда.
Омани спустил ноги с кровати и встал. Он был почти шести футов рос-
том, и выражение лица придавало ему сходство с озабоченным сенбернаром.
Он обнял Джорджа за плечи.
- Если я обидел тебя... Джордж сбросил его руку.
- Ты просто сказал то, что считаешь правдой, а я докажу, что это
ложь, вот и все. А почему бы мне не уйти? Дверь открыта, замков здесь
никаких нет. Никто никогда не говорил, что мне Запрещено выходить. Я
просто возьму и уйду.
- Допустим. Но куда ты отправишься?
- В ближайший аэропорт, а оттуда - в ближайший большой город, где
проводится какая-нибудь Олимпиада. У меня есть деньги. - Он схватил жес-
тянку, в которую складывал свой заработок. Несколько монет со звоном
упало на пол.
- Этого тебе, возможно, хватит на неделю. А потом?
- К этому времени я все улажу.
- К этому времени ты приползешь обратно, - сказал Смани с силой, - и
тебе придется начинать все сначала. Ты сошел с ума, Джордж.
- Только что ты назвал меня слабоумным.
- Ну, извини меня. Останься, хорошо?
- Ты что, попытаешься удержать меня? Смани сжал толстые губы.
- Нет, не попытаюсь. Это твое личное дело. Если ты образумишься
только после того, как столкнешься с внешним миром и вернешься сюда с
окровавленной физиономией, так уходи... Да, уходи! Джордж уже стоял в
дверях. Он оглянулся через плечо.
- Я ухожу. Он вернулся, чтобы взять свой карманный несессер.
- Надеюсь, ты ничего не имеешь против, если я заберу кое-что из моих
вещей?
Омани пожал плечами. Он опять улегся в постель и с безразличным ви-
дом погрузился в чтение.
Джордж снова помедлил на пороге, но Омани даже не взглянул в его
сторону. Скрипнув зубами, Джордж повернулся, быстро зашагал по безлюдно-
му коридору и вышел в окутанный ночной мглой парк.
Он ждал, что его задержат еще в парке, но его никто не остановил. Он
зашел в ночную закусочную, чтобы спросить дорогу к аэропорту, и думал,
что хозяин тут же вызовет полицию, но этого не случилось. Джордж вызвал
скиммер, и водитель повез его в аэропорт, не задав ни одного вопроса.
Однако все это его не радовало. Когда он прибыл в аэропорт, на душе
у него было на редкость скверно. Прежде он как-то не задумывался над
тем, что его ожидает во внешнем мире. И вот он оказался среди людей, об-
ладающих профессиями. В закусочной над кассой была укреплена пластмассо-
вая пластинка с именем хозяина. Такой-то, дипломированный повар. У чело-
века, управляющего скиммером, были права дипломированного водителя.
Джордж остро почувствовал незаконченность своей фамилии и из-за этого
ощущал себя как будто голым, даже хуже - ему казалось, что с него содра-
ли кожу. Но он не поймал на себе ни одного подозрительного взгляда. Ник-
то не остановил его, не потребовал у него профессионального удостовере-
ния .
"Кому придет в голову, что есть люди без профессии?" - с горечью по-
думал Джордж.
Он купил билет до Сан-Франциско на стратоплан, улетавший в 3 часа
ночи. Другие стратопланы в крупные центры Олимпиады вылетали только ут-
ром, а Джордж боялся ждать. Даже и теперь он устроился в самом укромном
уголке зала ожидания и стал высматривать полицейских. Но они не явились.
В Сан-Франциско он прилетел еще до полудня, и городской шум обрушил-
ся на него, подобно удару. Он никогда еще не видел такого большого горо-
да, а за последние полтора года привык к тишине и спокойствию.
Да и к тому же это был месяц Олимпиады. Когда Джордж вдруг сообра-
зил, что именно этим объясняются особый шум, возбуждение и суматоха, он
почти забыл о собственном отчаянном положении.
Для удобства приезжающих пассажиров в аэропорту были установлены
Олимпийские стенды, перед которыми собирались большие толпы. Для каждой
основной профессии был отведен особый стенд, на котором значился адрес
того Олимпийского зала, где в данный день проводилось состязание по этой
профессии, затем перечислялись его участники с указанием места их рожде-
ния и называлась планета-заказчик (если таковая была).
Все полностью соответствовало традициям. Джордж достаточно часто чи-
тал в газетах описания Олимпийских состязаний, видел их по телевизору и
даже однажды присутствовал на небольшой Олимпиаде дипломированных мясни-
ков в главном городе своего округа. Даже это состязание, не имевшее ни-
какого отношения к другим мирам (на нем, конечно, не присутствовало ни
одного представителя иной планеты), привлекло множество зрителей.
Отчасти это объяснялось просто самим фактом состязания, отчасти -
местным патриотизмом (о, что творилось, когда среди участников оказывал-
ся земляк, пусть даже совершенно незнакомый, но за которого можно было
болеть!) и, конечно, до некоторой степени - возможностью заключать пари.
Бороться с этим было невозможно.
Джордж убедился, что подойти поближе к стенду не так-то просто. Он
поймал себя на том, что как-то по-новому смотрит на оживленные лица вок-
руг.
Ведь было же время, когда эти люди сами участвовали в Олимпиадах. А
чего они достигли? Ничего!
Если бы они были победителями, то не сидели бы на Земле, а находи-
лись бы где-нибудь далеко в глубинах Галактики. Кем бы они ни были, их
профессии с самого начала сделали их добычей Земли. Или, если у них были
высокоспециализированные профессии, они стали добычей Земли из-за собс-
твенной бездарности.
Теперь эти неудачники, собравшись здесь, взвешивали шансы новых, мо-
лодых участников состязаний. Стервятники!####Как страстно он желал, чтобы
они прикидывали сейчас его шансы! Он маши-
нально шел мимо стендов, держась у самого края толпы. В стратоплане он
позавтракал, и ему не хотелось есть. Зато ему было страшно. Он находился
в большом городе в самый разгар суматохи, которая сопутствует началу
Олимпийских состязаний. Это, конечно, для него выгодно. Город наводнен
приезжими. Никто не станет расспрашивать Джорджа. Никому не будет до не-
го никакого дела. "Никому, даже приюту", - с болью подумал Джордж. Там
за ним ухаживали, как за больным котенком, но если больной котенок возь-
мет да убежит? Что поделаешь - тем хуже для него!
А теперь, добравшись до Сан-Франциско, что он предпримет? На этот
вопрос у него не было ответа. Обратиться к кому-нибудь? К кому именно?
Как? Он не знал даже, где ему остановиться. Деньги, которые у него оста-
лись , казались жалкими грошами.
Он вдруг со стыдом прикинул, не лучше ли будет вернуться в приют.
Ведь можно пойти в полицию... Но тут же яростно замотал головой, словно
споря с реальным противником.
Его взгляд упал на слово "Металлурги", которое ярко светилось на од-
ном из стендов. Рядом, помельче - "Цветные металлы". А под длинным спис-
ком фамилий завивались прихотливые буквы: "Заказчик - Новия".
На Джорджа нахлынули мучительные воспоминания: его спор с Тревель-
яном, когда он был так уверен, что станет программистом, так уверен, что
программист намного выше металлурга, так уверен, что идет по правильному
пути, так уверен в своих способностях...
И вот он расхвастался перед этим мелочным, мстительным Антонелли! Он
же был так уверен в себе, когда его вызвали, и он еще постарался обод-
рить нервничавшего Тревельяна. В себе-то он был уверен!
У Джорджа вырвался всхлипывающий вздох. Какой-то человек обернулся
и, взглянув на него, поспешил дальше. Мимо торопливо проходили люди, по-
минутно толкая его то в одну, то в другую сторону, а он не мог оторвать
изумленных глаз от стенда.
Ведь стенд словно откликнулся на его мысли! Он настойчиво думал о
Тревельяне, и на мгновение ему показалось, что на стенде в ответ обяза-
тельно возникнет слово "Тревельян".
Но там и в самом деле значился Тревельян. Арманд Тревельян (имя, ко-
торое так ненавидел Коротышка, ярко светилось на стенде для всеобщего
обозрения), а рядом - название их родного города. Да и к тому же Трев
всегда мечтал о Новии, стремился на Новию, ни о чем не думал, кроме Но-
Вии. А заказчиком этого состязания была Новия.
Значит, это действительно Трев, старина Трев! Почти машинально он
запомнил адрес зала, где проводилось состязание, и стал в очередь на
скиммер.
"Трев-таки добился своего! - вдруг угрюмо подумал он. - Он хотел
стать металлургом и стал!" Джорджу стало холодно и одиноко, как никогда.
У входа в зал стояла очередь. Очевидно, Олимпиада металлургов обеща-
ла захватывающую и напряженную борьбу. По крайней мере так утверждала
горевшая высоко в небе надпись, и так же, казалось, думали теснившиеся у
входа люди.
Джордж решил, что, судя по цвету неба, день выдался дождливый, но
над всем Сан-Франциско, от залива до океана, натянули прозрачный защит-
ный купол. Это, конечно, стоило немалых денег, но, когда дело касается
удобства представителей других миров, все расходы оправдываются. А на
Олимпиаду их съедется сюда немало. Они швыряют деньги направо и налево,
а за каждого нанятого специалиста планета-заказчик платила не только
Земле, но и местным властям. Так что город, в котором представители дру-
гих планет проводили месяц Олимпиады с удовольствием, внакладе не оста-
вался. Сан-Франциско знал, что делает.
Джордж так глубоко задумался, что вздрогнул, когда его плеча мягко
коснулась чья-то рука и вежливый голос произнес:
- Вы стоите в очереди, молодой человек? Очередь продвинулась, и те-
перь Джордж наконец обнаружил, что перед ним образовалось пустое прост-
ранство . Он поспешно шагнул вперед и пробормотал:
- Извините, сэр.
Два пальца осторожно взяли его за локоть. Он испуганно оглянулся.
Стоявший за ним человек весело кивнул. В его волосах пробивалась обиль-
ная седина, а под пиджаком он носил старомодный свитер, застегивавшийся
спереди на пуговицы.
- Я не хотел вас обидеть, - сказал он.
- Ничего.
- Вот и хорошо! - Он, казалось, был расположен благодушно поболтать.
- Я подумал, что вы, может быть, случайно остановились тут; задержавшись
из-за очереди, и что вы, может быть...
- Кто? - резко спросил Джордж.
- Участник состязания, конечно. Вы же очень молоды. Джордж отвернул-
ся. Он был не в настроении для благодушной болтовни и испытывал злость
ко всем любителям совать нос в чужие дела.
Его внезапно осенила новая мысль. Не разыскивают ли его? Вдруг сюда
уже сообщили его приметы или прислали фотографию? Вдруг этот Седой поза-
ди него ищет предлога получше рассмотреть его лицо?
Надо бы все-таки узнать последние известия. Задрав голову, Джордж
взглянул на движущуюся полосу заголовков и кратких сообщений, которые
бежали по одной из секций прозрачного купола, непривычно тусклые на се-
ром фоне затянутого облаками предвечернего неба. Но тут же решил, что
это бесполезно, и отвернулся. Для этих сообщений его персона слишком
ничтожна. Во время Олимпиады только одни новости заслуживают упоминания:
количество очков, набранных победителями, и призы, завоеванные континен-
тами, нациями и городами.
И так будет продолжаться до конца месяца. Очки будут подсчитываться
на душу населения, и каждый город будет изыскивать способ подсчета, ко-
торый дал бы ему возможность занять почетное место.
Его собственный город однажды занял третье место на Олимпиаде элект-
ротехников, третье место во всем штате! В ратуше до сих пор висит мемо-
риальная доска, увековечившая это событие.
Джордж втянул голову в плечи и засунул руки в карманы, но тут же ре-
шил, что так скорее привлечет к себе внимание. Он расслабил мышцы и по-
пытался принять безразличный вид, но от страха не избавился. Теперь он
находился уже в вестибюле, и до сих пор на его плечо не опустилась
властная рука. Наконец он вошел в зал и постарался пробраться как можно
дальше вперед.
Вдруг он заметил рядом Седого и опять почувствовал страх. Он быстро
отвел взгляд и попытался внушить себе, что это вполне естественно. В
конце концов. Седой стоял в очереди прямо за ним.
К тому же Седой, поглядев на него с приветливой вопросительной улыб-
кой, отвернулся. Олимпиада вот-вот должна была начаться. Джордж припод-
нялся, высматривая Тревельяна, и на время забыл обо всем остальном.
Зал был не очень велик и имел форму классического вытянутого овала.
Зрители располагались на двух галереях, опоясывавших зал, а участники
состязания - внизу, в длинном и узком углублении. Приборы были уже уста-
новлены, а на табло над каждым рабочим местом пока светились только фа-
милии и номера состязающихся. Сами участники были на сцене. Одни читали,
другие разговаривали. Кто-то внимательно разглядывал свои ногти. (Хоро-
ший тон требовал, чтобы они проявляли полное равнодушие к предстоящему
испытанию, пока не будет подан сигнал к началу состязания.)
Джордж просмотрел программу, которая появилась из ручки его кресла,
когда он нажал кнопку, и отыскал фамилию Тревельяна. Она значилась под
номером двенадцать, и, к огорчению Джорджа, место его приятеля находи-
лось в другом конце зала. Он нашел участника под двенадцатым номером:
тот, засунув руки в карманы, стоял спиной к своему прибору и смотрел на
галереи, словно пересчитывал зрителей, но лица его Джордж не видел.
И все-таки он сразу узнал Трева.
Джордж откинулся в кресле. Добьется ли Трев успеха? Из чувства долга
он желал ему самых лучших результатов, однако в глубине его души нарас-
тал бунт. Он, Джордж, человек без профессии, сидит здесь простым зрите-
лем, а Тревельян, дипломированный металлург, специалист по цветным ме-
таллам, участвует в Олимпиаде.
Джордж не знал, выступал ли Тревельян олимпийским соискателем в пер-
вый год после получения профессии. Такие смельчаки находились: либо че-
ловек был очень уверен в себе, либо очень торопился. В этом крылся опре-
деленный риск. Как ни эффективен был процесс обучения, год, проведенный
на Земле после получения образования ("чтобы смазать неразработавшиеся
знания", согласно поговорке), обеспечивал более высокие результаты.
Если Тревельян выступает в состязаниях вторично, он, быть может, не
так уж и преуспел. Джордж со стыдом заметил, что эта мысль ему скорее
приятна.
Он поглядел по сторонам. Почти все места были заняты. Олимпиада со-
берет много зрителей, а значит, участники будут больше нервничать, а мо-
жет быть, и работать с большей энергией - в зависимости от характера.
"Но почему это называется Олимпиадой?" - подумал он вдруг в недоуме-
нии. Он не знал. Почему хлеб называют хлебом? В детстве он как-то спро-
сил отца:
- Папа, а что такое Олимпиада? И отец ответил:
- Олимпиада - значит состязание.
- А когда мы с Коротышкой боремся, это тоже Олимпиада? - поинтересо-
вался Джордж.
- Нет, - ответил Плейтен старший. - Олимпиада - это особенное состя-
зание . Не задавай глупых вопросов. Когда получишь образование, узнаешь
все, что тебе положено знать.
Джордж глубоко вздохнул, вернулся к действительности и уселся пог-
лубже в кресло. Все, что тебе положено знать!
Странно, как хорошо он помнит эти слова! "Когда ты получишь образо-
вание..." Никто никогда не говорил: "Если ты получишь образование..."
Теперь ему казалось, что он всегда задавал глупые вопросы. Как будто
его разум инстинктивно предвидел свою неспособность к образованию и при-
думывал всяческие расспросы, чтобы хоть по обрывкам собрать побольше
знаний.
А в приюте поощряли его любознательность, проповедуя то же, к чему
инстинктивно стремился его разум. Единственный открытый ему путь!
Внезапно он выпрямился. Черт возьми, что это он? Чуть было не попал-
ся на их удочку! Неужели он сдастся только потому, что там перед ним
Трев, получивший образование и участвующий в Олимпиаде? Нет, он не сла-
боумный ! Нет!!
И, словно в ответ на этот мысленный вопль протеста, зрители вокруг
зашумели. Все встали.
В ложу, расположенную в самом центре длинной дуги овала, входили лю-
ди, одетые в цвета планеты Новия, и на главном табло над их головами
вспыхнуло слово "Новия".
Новия была планетой класса А с большим населением и высокоразвитой
цивилизацией, быть может самой лучшей во всей Галактике. Каждый землянин
мечтал когда-нибудь поселиться в таком мире, как Новия, или, если ему
это не удастся, увидеть там своих детей. Джордж вспомнил, с какой нас-
тойчивостью стремился к Новии Тревельян, и вот теперь он состязается за
право уехать туда.
Лампы над головами зрителей погасли, потухли и стены. Поток яркого
света хлынул вниз, туда, где находились участники состязания.
Джордж снова попытался рассмотреть Тревельяна. Но тот был слишком
далеко.
- Уважаемые новианские заказчики, уважаемые дамы и господа! - раз-
дался отчетливый, хорошо поставленный голос диктора. - Сейчас начнутся
Олимпийские состязания металлургов, специалистов по цветным металлам. В
состязании принимают участие...
С добросовестной аккуратностью диктор прочитал список, приведенный в
программе. Фамилии, названия городов, откуда прибыли участники, год по-
лучения образования. Зрители встречали каждое имя аплодисментами, и са-
мые громкие доставались на долю жителей Сан-Франциско. Когда очередь
дошла до Тревельяна, Джордж неожиданно для самого себя бешено завопил и
замахал руками. Но еще больше его удивило то, что сидевший рядом с ним
седой мужчина повел себя точно так же.
Джордж не мог скрыть своего изумления, и его сосед, наклонившись к
нему и напрягая голос, чтобы перекричать шум, произнес:
- У меня здесь нет земляков. Я буду болеть за ваш город. Это ваш
Знакомый? Джордж отодвинулся, насколько мог.
- Нет.
- Я заметил, что вы все время смотрите в том направлении. Не хотите
ли воспользоваться моим биноклем?
- Нет, благодарю вас. (Почему этот старый дурак сует нос не в свое
дело?)
Диктор продолжал сообщать другие официальные сведения, касавшиеся
номера состязания, метода хронометрирования и подсчитывания очков. Нако-
нец он дошел до самого главного, и публика замерла, обратившись в слух.
- Каждый участник состязания получит по бруску сплава неизвестного
для него состава. От него потребуется произвести количественный анализ
этого сплава и сообщить все результаты с точностью до четырех десятых
процента. Для этого все соревнующиеся будут пользоваться микроспектрог-
рафами Бимена, модель ЛЮ-2, каждый из которых в настоящее время неиспра-
вен . Зрители одобрительно зашумели.
- Каждый участник должен будет определить неисправность своего при-
бора и ликвидировать ее. Для этого им даны инструменты и запасные дета-
ли. Среди них может не оказаться нужной детали, и ее надо будет затребо-
вать. Время, которое займет доставка, вычитается из общего времени, зат-
раченного на выполнение задания. Все участники готовы?
На табло над пятым номером вспыхнул тревожный красный сигнал. Номер
пять бегом бросился из зала и быстро вернулся. Зрители добродушно расс-
меялись .
- Все готовы? Табло остались темными.
- Есть какие-нибудь вопросы? По-прежнему ничего.
- Можете начинать!
Разумеется, ни один из зрителей не имел возможности непосредственно
определить, как продвигается работа у каждого участника. Некоторое
представление об этом могли дать только надписи, вспыхивавшие на табло.
Впрочем, это не имело ни малейшего значения. Среди зрителей только ме-
таллург, окажись он здесь, мог бы разобраться в сущности состязания. Но
важно было, кто победит, кто займет второе, а кто - третье место. Для
тех, кто ставил на участников (а этому не могли помешать никакие зако-
ны) , только это было важно. Все прочее их не интересовало.
Джордж следил за состязанием так же жадно, как и остальные, погляды-
вая то на одного участника, то на другого. Он видел, как вот этот, ловко
орудуя каким-то маленьким инструментом, снял крышку со своего микрос-
пектрографа; как тот всматривался в экран аппарата; как спокойно встав-
лял третий свой брусок сплава в зажим и как четвертый накручивал вернь-
ер , причем настолько осторожно, что, казалось, на мгновение застыл в
полной неподвижности.
Тревельян, как и все остальные участники, был целиком поглощен своей
работой. А как идут его дела, Джордж определить не мог. На табло над
семнадцатым номером вспыхнула надпись: "Сдвинута фокусная пластинка".
Зрители бешено зааплодировали.
Семнадцатый номер мог быть прав, но мог, конечно, и ошибиться. В
этом случае ему пришлось бы позже исправить свой вывод, потеряв на этом
время. А может быть, он не заметил бы ошибки и не сумел бы сделать ана-
лиз. Или же, еще хуже, он мог получить совершенно неверные результаты.
Неважно. А пока зрители ликовали.
Зажглись и другие табло. Джордж не спускал глаз с табло номер две-
надцать . Наконец оно тоже засветилось: "Держатель децентрирован. Требу-
ется новый зажим". К Тревельяну подбежал служитель с новой деталью. Если
Трев ошибся, это означает бесполезную задержку, а время, потраченное на
ожидание детали, не будет вычтено из общего времени. Джордж невольно за-
таил дыхание.
На семнадцатом табло начали появляться светящиеся буквы результата
анализа: "Алюминий - 41,2649, магний - 22,1914, медь - 10.1001".
И на других табло все чаще вспыхивали цифры. Зрители бесновались.
Джордж недоумевал, как участники могли работать в таком бедламе, по-
том ему пришло в голову, что, может быть, это даже хорошо: ведь первок-
лассный специалист лучше всего работает в напряженной обстановке.
На семнадцатом табло вспыхнула красная рамка, знаменующая окончание
работы, и семнадцатый номер поднялся со своего места. Четвертый отстал
от него всего лишь на две секунды. Затем кончил еще один и еще.
Тревельян продолжал работать, определяя последние компоненты своего
сплава. Он поднялся, когда почти все состязающиеся уже стояли. Последним
встал пятый номер, и публика приветствовала его ироническими возгласами.
Однако это был еще не конец. Заключение жюри, естественно, задержи-
валось. Время, затраченное на всю операцию, имело определенное значение,
но не менее важна была точность результатов. И не все задачи были одина-
ково трудны. Необходимо было учесть множество факторов. Наконец раздался
голос диктора:
- Победителем состязания, выполнившим задание за четыре минуты две-
надцать секунд, правильно определившим неисправность и получившим пра-
вильный результат с точностью до семи десятитысячных процента, является
участник под номером... семнадцать, Генрих Антон Шмидт из...
Остальное потонуло в бешеном реве. Второе место занял восьмой номер,
третье - четвертый, хороший показатель времени которого был испорчен
ошибкой в пять сотых процента при определении количественного содержания
ниобия. Двенадцатый номер даже не был упомянут, если не считать фразы
"... а остальные участники..."
Джордж протолкался к служебному выходу и обнаружил, что здесь уже
собралось множество людей - плачущие (кто от радости, кто от горя) родс-
твенники, репортеры, намеренные взять интервью у победителей, земляки,
охотники за автографами, любители рекламы и просто любопытные. Были
здесь и девушки, надеявшиеся обратить на себя внимание победителя, кото-
рый почти наверняка отправится на Новик) (а может быть, и потерпевшего
поражение, который нуждается в утешении и имеет деньги, чтобы позволить
себе такую роскошь).
Джордж остановился в сторонке. Он не увидел ни одного знакомого ли-
ца. Сан-Франциско был так далеко от их родного города, что вряд ли Трев
приехал сюда в сопровождении близких, которые теперь печально поджидали
бы его у двери.
Смущенно улыбаясь и кланяясь в ответ на приветствия, появились
участники соревнования. Полицейские сдерживали толпу, освобождая им про-
ход. Каждый из набравших большое количество очков увлекал за собой часть
людей, подобно магниту, двигающемуся по кучке железных опилок.
Когда вышел Тревельян, у входа уже почти никого не было. (Джордж ре-
шил , что он долго выжидал этой минуты.) В его сурово сжатых губах была
сигарета. Глядя в землю, он повернулся, чтобы уйти.
Это было первое напоминание о родном доме за без малого полтора го-
да , которые показались Джорджу в десять раз дольше. И он даже удивился,
что Тревельян нисколько не постарел и остался все тем же Тревом, каким
он видел его в последний раз.
Джордж рванулся вперед.
- Трев!
Тревельян в изумлении обернулся. Он с недоумением взглянул на Джорд-
жа и сразу же протянул ему руку.
- Джордж Плейтен! Вот черт...
Появившееся на его лице радостное выражение тут же угасло, а рука
опустилась, прежде чем Джордж успел пожать ее.
- Ты был там? - Тревельян мотнул головой в сторону зала.
- Был.
- Чтобы посмотреть на меня?
- Да.
- Я не слишком блеснул, а?
Он бросил сигарету, раздавил ее ногой, глядя в сторону улицы, где
медленно рассасывавшаяся толпа окружала скиммеры и уже стояли новые оче-
реди желающих попасть на следующие состязания.
- Ну и что? - угрюмо буркнул Тревельян. - Я проиграл всего во второй
раз. А после сегодняшнего Новия может катиться ко всем чертям. Есть пла-
неты, которые просто вцепятся в меня... Но послушай-ка, ведь я не видел
тебя со Дня образования. Где ты пропадал? Твои родные сказали, что ты
уехал по специальному заданию, но ничего не объяснили подробно. И ты ни
разу мне не написал. А мог бы.
- Да, пожалуй, - неловко произнес Джордж. - Но я пришел сказать, как
мне жаль, что сейчас все так обернулось.
- Не жалей, - возразил Тревельян. - Я ведь уже говорил тебе, что Но-
вия может убираться к черту... Да я мог бы знать заранее! Все только и
говорили, что использован будет прибор Бимена. Никто и не сомневался. А
в проклятых лентах, которыми меня зарядили, был предусмотрен спектрограф
Хенслера! Кто же теперь пользуется Хейслером? Разве что планеты вроде
Гомона, если их вообще можно назвать планетами. Ловко это было подстрое-
но , а?
- Но ты ведь можешь подать жалобу в...
- Не будь дураком. Мне скажут, что мой мозг лучше всего подходил для
Хенслера. Пойди поспорь. Да и вообще мне не везло. Ты заметил, что мне
одному пришлось послать за запасной частью?
- Но потраченное на это время вычиталось?
- Конечно! Только я, когда заметил, что среди запасных частей нет
зажима, подумал, что напутал, и не сразу потребовал его. Это-то время не
вычиталось! А будь у меня микроспектрограф Хенслера, я бы знал, что не
ошибаюсь. Где мне было тягаться с ними? Первое место занял житель Сан-
Франциско , и следующие три тоже. А пятое занял парень из Лос-Анджелеса.
Они получили образование с лент, которыми снабжают большие города. С са-
мых лучших, которые только есть. Там и спектрограф Бимена и все, что хо-
чешь ! Куда же мне было до них! Я отправился в такую даль потому, что
только эту Олимпиаду по моей профессии заказала Новия, и с тем же успе-
хом мог бы остаться дома. Я заранее знал, что так получится! Но теперь
все. На Новии космос клином не сошелся. Из всех проклятых...
Он говорил это не для Джорджа. Он вообще ни к кому не обращался.
Джордж понял, что он просто отводит душу.
- Если ты заранее знал, что вам дадут спектрограф Бимена, разве ты
не мог ознакомиться с ним? - спросил Джордж.
- Я же говорю тебе, что его не было в моих лентах.
- Ты мог почитать... книги.
Тревельян вдруг так пронзительно взглянул на него, что он еле выго-
ворил последнее слово.
- Ты что, смеешься? - сказал Тревельян. - Остришь? Неужели ты дума-
ешь, что, прочитав какую-то книгу, я запомню достаточно, чтобы сравнять-
ся с теми, кто действительно знает?
- Я считал...
- А ты попробуй. Попробуй... Кстати, а ты какую получил профессию? -
вдруг злобно спросил Тревельян.
- Видишь ли...
- Ну, выкладывай. Раз уже ты тут передо мной строишь такого умника,
давай-ка посмотрим, кем стал ты. Раз ты все еще на Земле, значит, ты не
программист и твое специальное задание не такое уж важное.
- Послушай, Трев, - сказал Джордж, - я опаздываю на свидание... Он
попятился, пытаясь улыбнуться.
- Нет, ты не уйдешь. - Тревельян в бешенстве бросился к Джорджу и
вцепился в его пиджак. - Отвечай! Почему ты боишься сказать мне? Кто ты
такой? Ты мне тычешь в нос мое поражение, а сам? Это у тебя не выйдет,
слышишь?
Он неистово тряс Джорджа, тот вырывался. Так, отчаянно борясь и чуть
не падая, они двигались через зал, но тут Джордж услышал глас Рока - су-
ровый голос полицейского:
- Довольно! Довольно! Прекратите это! Сердце Джорджа мучительно сжа-
лось и превратилось в кусок свинца. Сейчас полицейский спросит их имена
и потребует удостоверения личности, а у Джорджа нет никаких документов.
После первых же вопросов выяснится, что у него нет и профессии. А Тре-
вельян, озлобленный своей неудачей, конечно, поспешит рассказать об этом
всем знакомым в родном городке, чтобы утешить собственное уязвленное са-
молюбие .
Этого Джордж не мог вынести. Он вырвался и бросился было бежать, но
ему на плечо легла тяжелая рука полицейского.
- Эй, постойте. Покажите-ка ваше удостоверение. Тревельян шарил в
карманах и говорил отрывисто и зло:
- Я Арманд Тревельян, металлург по цветным-металлам. Я участвовал в
Олимпиаде. А вот его проверьте хорошенько, сержант.
Джордж стоял перед ними, не в силах вымолвить ни слова. Губы его пе-
ресохли, горло сжалось. Вдруг раздался еще один голос, спокойный и веж-
ливый :
- Можно вас на минутку, сержант? Полицейский шагнул назад.
- Что вам угодно, сэр?
- Этот молодой человек - мой гость. Что случилось? Джордж оглянулся
вне себя от изумления. Это был тот самый седой мужчина, который сидел
рядом с ним на Олимпиаде. Седой добродушно кивнул Джорджу. Его гость? Он
что, сошел с ума?
- Эти двое затеяли драку, сэр, - объяснил полицейский.
- Вы предъявляете им какое-нибудь обвинение? Нанесен ущерб?
- Нет, сэр.
- В таком случае всю ответственность я беру на себя. Он показал по-
лицейскому небольшую карточку, и тот сразу отступил.
- Постойте... - возмущенно начал Тревельян, но полицейский свирепо
перебил его:
- Ну? У вас есть какие-нибудь претензии?
- Я только...
- Проходите! И вы тоже... Расходитесь, расходитесь! И собравшаяся
вокруг толпа начала с неохотой расходиться.
Джордж покорно пошел с Седым к скиммеру, но тут решительно остано-
вился .
- Благодарю вас, - сказал он, - но ведь я не ваш гость. (Может быть,
по нелепой случайности его приняли за кого-то другого?) Но Седой улыб-
нулся и сказал:
- Теперь вы уже мой гость. Разрешите представиться. Я - Ладислас
Индженеску, дипломированный историк.
- Но...
- С вами ничего дурного не случится, уверяю вас. Я ведь просто хотел
избавить вас от неприятного разговора с полицейским.
- А почему?
- Вы хотите знать причину? Ну, ведь мы с вами, так сказать, почетные
земляки. Мы же дружно болели за одного человека. А земляки должны дер-
жаться друг друга, даже если они только почетные земляки. Не правда ли?
И Джордж, не доверяя ни Индженеску, ни самому себе, все-таки вошел в
скиммер. Они поднялись в воздух, прежде чем он успел передумать.
"Это, наверное, важная птица, - вдруг сообразил он. - Полицейский
говорил с ним очень почтительно".
Только теперь он вспомнил, что приехал в Сан-Франциско вовсе не ради
Тревельяна, а с целью найти достаточно влиятельного человека, который
мог бы добиться переоценки его способностей.
А вдруг этот Индженеску именно тот, кто ему нужен? И его даже не
придется искать!
Как знать, не сложилось ли все на редкость удачно... удачно... Но
Джордж напрасно убеждал себя. На душе у него было по-прежнему тревожно.
Во время недолгого полета на скиммере Индженеску поддерживал разго-
вор, любезно указывая на достопримечательности города и рассказывая о
других Олимпиадах, на которых ему доводилось бывать. Джордж слушал его
рассеянно, издавал невнятное хмыканье, когда Индженеску замолкал, а сам
с волнением следил за направлением полета.
Вдруг они поднимутся к отверстию в защитном куполе и покинут город?
Но скиммер снижался, и Джордж тихонько вздохнул с облегчением. В го-
роде он чувствовал себя в большей безопасности.
Скиммер опустился на крышу какого-то отеля, прямо у верхней двери,
и, когда они вышли, Индженеску спросил:
- Вы не откажетесь пообедать со мной в моем номере?
- С удовольствием, - ответил Джордж и улыбнулся вполне искренне.
Время второго завтрака давно прошло, и у него начало сосать под ложеч-
кой .
Они ели молча. Наступили сумерки, и автоматически засветились стены.
("Вот уже почти сутки, как я на свободе", - подумал Джордж.) За кофе
Индженеску наконец заговорил.
- Вы вели себя так, словно подозревали меня в дурных намерениях,
сказал он.
Джордж покраснел и, поставив чашку, попытался что-то возразить, но
его собеседник рассмеялся и покачал головой.
- Это так. Я внимательно наблюдал за вами с того момента, как впер-
вые вас увидел, и, мне кажется, теперь я знаю о вас очень многое. Джордж
в ужасе приподнялся с места.
- Сядьте, - сказал Индженеску. - Я ведь только хочу помочь вам.
Джордж сел, но в его голове вихрем неслись мысли. Если старик знал, кто
он, то почему он помешал полицейскому? Да и вообще, с какой стати он ре-
шил ему помогать?
- Вам хочется знать, почему я захотел помочь вам? - спросил Индже-
неску. - О, не пугайтесь, я не умею читать мысли. Видите ли, просто моя
профессия позволяет мне по самой незначительной внешней реакции судить о
мыслях человека. Вам это понятно? Джордж отрицательно покачал головой.
- Представьте себе, каким я увидел вас, - сказал Индженеску. - Вы
стояли в очереди, чтобы посмотреть Олимпиаду, но ваши микрореакции не
соответствовали тому, что вы делали. У вас было не то выражение лица, не
те движения рук. Отсюда следовало, что у вас какая-то беда, но, что са-
мое интересное, необычная, не лежащая на поверхности. Быть может, вы са-
ми не сознаете, что с вами, решил я. И, не удержавшись, последовал за
вами, даже сел рядом. После окончания состязания я опять пошел за вами и
подслушал ваш разговор с вашим знакомым. Ну, а уж к этому времени вы
превратились в такой интересный объект для изучения - простите, если это
звучит бессердечно, - что я просто не мог допустить, чтобы вас забрали в
полицию... Скажите же, что вас тревожит?
Джордж мучился, не зная, на что решиться. Если это ловушка, то зачем
нужно действовать таким окольным путем? Ему же действительно нужна по-
мощь . Ради этого он сюда и приехал. А тут помощь ему прямо предлагают.
Пожалуй, именно это его и смущало. Что-то все получается уж очень прос-
то .
- Разумеется, то, что вы сообщите мне как социологу, становится про-
фессиональной тайной, - сказал Индженеску. - Вы понимаете, что это Зна-
чит?
- Нет, сэр.
- Это значит, что с моей стороны будет бесчестным, если я расскажу о
том, что узнаю от вас, с какой бы целью я это ни сделал. Более того,
никто не имеет права заставить меня рассказать об этом.
- А я думал, вы историк, - подозрительно сказал Джордж.
- Это верно.
- Но вы же только сейчас сказали, что вы социолог. Индженеску расхо-
хотался .
- Не сердитесь, молодой человек, - извинился он, когда был в состоя-
нии говорить. - Но право же, я смеялся не над вами. Я смеялся над Зем-
лей, над тем, какое большое значение она придает точным наукам, и над
некоторыми практическими следствиями этого увлечения. Держу пари, что вы
можете перечислить все разделы строительной технологии или прикладной
механики и в то же время даже не слышали о социологии.
- Ну, а что же такое социология?
- Социология - это наука, которая занимается изучением человеческого
общества и отдельных его ячеек и делится на множество специализированных
отраслей, так же как, например, зоология. Так, существуют культурологи,
изучающие культуру, ее рост, развитие и упадок. Культура, - добавил он,
предупреждая вопрос Джорджа, - это совокупность всех сторон жизни. К
культуре относится, например, то, каким путем мы зарабатываем себе на
жизнь, от чего получаем удовольствие, во что верим, наши представления о
хорошем и плохом и так далее. Вам это понятно?
- Кажется, да.
- Экономист - не специалист по экономической статистике, а именно
экономист - специализируется на изучении того, каким образом культура
удовлетворяет физические потребности каждого члена общества. Психолог
изучает отдельных членов общества и то влияние, которое это общество на
них "Заказывает. Прогнозист планирует будущий путь развития общества, а
историк... Это уже по моей части.
- Да, сэр?
- Историк специализируется на изучении развития нашего общества в
прошлом, а также обществ с другими культурами. Джорджу стало интересно.
- А разве в прошлом что-то было по-другому?
- Еще бы! Тысячу лет назад не было образования, то есть образования,
как мы понимаем его теперь.
- Знак - произнес Джордж. - Люди учились по книгам, собирая знания
по крупицам.
- Откуда вы это знаете?
- Слыхал, - осторожно ответил Джордж и добавил: А какой смысл думать
о том, что происходило в далеком прошлом? Я хочу сказать, что ведь со
всем этим уже покончено, не правда ли?
- С прошлым никогда не бывает покончено, мой друг. Оно объясняет
настоящее. Почему, например, у нас существует именно такая система обра-
зования?
Джордж беспокойно заерзал. Слишком уж настойчиво его собеседник
возвращался к этой теме.
- Потому что она самая лучшая, - отрезал он.
- Да. Но почему она самая лучшая? Послушайте меня минутку, и я попы-
таюсь объяснить. А потом вы мне скажете, есть ли смысл в изучении исто-
рии. Даже до того, как начались межзвездные полеты... - Он внезапно
умолк, заметив на лице Джорджа выражение глубочайшего изумления. - Неу-
жели вы считали, что так было всегда?
- Я никогда не задумывался над этим, сэр.
- Вполне естественно. Однако четыре-пять тысяч лет назад человечест-
во было приковано к Земле. Но и тогда уже техника достигла высокого
уровня развития, а численность населения увеличилась настолько, но любое
торможение техники привело бы к массовому голоду и эпидемиям. Для того
чтобы уровень техники не снижался и соответствовал росту населения, нуж-
но было готовить все больше инженеров и ученых. Однако по мере развития
науки на их обучение требовалось все больше и больше времени. Когда же
впервые были открыты способы межпланетных, а затем и межзвездных поле-
тов, эта проблема стала еще острее. Собственно говоря, из-за недостатка
специалистов человечество в течение почти полутора тысяч лет не могло
по-настоящему колонизировать планеты, находящиеся за пределами Солнечной
системы. Перелом наступил, когда был установлен механизм хранения знаний
в человеческом мозгу. Как только это было сделано, появилась возможность
создать образовательные ленты на основе этого механизма таким образом,
чтобы сразу вкладывать в мозг определенное количество, так сказать, го-
товых знаний. Впрочем, это-то вы знаете. Это позволило выпускать тысячи
и миллионы специалистов, и мы смогли приступить к тому, что впоследствии
назвали "заполнением Вселенной". Сейчас в Галактике уже существует пол-
торы тысячи населенных планет, и число их будет возрастать до бесконеч-
ности .
Вы понимаете, что из этого следует? Земля экспортирует образователь-
ные ленты, предназначенные для подготовки специалистов низкой квалифика-
ции, и это обеспечивает единство культуры для всей Галактики. Так, нап-
ример, благодаря лентам чтения мы все говорим на одном языке... Не удив-
ляйтесь . Могут быть и иные языки, и в прошлом люди на них говорили. Их
были сотни. Земля, кроме того, экспортирует высококвалифицированных спе-
циалистов , и численность ее населения не превышает допустимого уровня.
Поскольку при вывозе специалистов соблюдается равновесие полов, они об-
разуют самовоспроизводящиеся ячейки, и это способствует росту населения
на тех планетах, где в этом есть необходимость. Более того, за ленты и
специалистов платят сырьем, в котором мы очень нуждаемся и от которого
зависит наша экономика. Теперь вы поняли, почему наша система образова-
ния действительно самая лучшая?
- Да, сэр.
- И вам легче понять это, зная, что без нее в течение полутора тысяч
лет было невозможно колонизировать планеты других солнечных систем?
- Да, сэр.
- Значит, вы видите, в чем польза истории? - Историк улыбнулся. - А
теперь скажите, догадались ли вы, почему я вами интересуюсь?
Джордж мгновенно вернулся из пространства и времени назад к действи-
тельности. Видимо, Индженеску неспроста завел этот разговор. Вся его
лекция была направлена на то, чтобы атаковать его неожиданно.
- Почему же? - неуверенно спросил он, снова насторожившись.
- Социологи изучают общество, а общество состоит из людей.
- Ясно.
- Но люди не машины. Специалисты в области точных наук работают с
машинами. А машина требует строго определенного количества знаний, и эти
специалисты знают о ней все. Более того, все машины данного рода почти
одинаковы, так что индивидуальные особенности машины не представляют для
них интереса. Но люди... О, они так сложны и так отличаются друг от дру-
га, что социолог никогда не знает о них все или хотя бы значительную
часть-того, что можно о них знать. Чтобы не утратить квалификации, он
должен постоянно изучать людей, особенно необычные экземпляры.
- Вроде меня, - глухо произнес Джордж.
- Конечно, называть вас экземпляром невежливо, но вы человек необыч-
ный. Вы не стоите того, чтобы вами заняться, и, если вы разрешите мне
это, я в свою очередь по мере моих возможностей помогу вам в вашей беде.
В мозгу Джорджа кружился смерч. Весь этот разговор о людях и о коло-
низации, ставшей возможной благодаря образованию... Как будто кто-то раз-
бивал и дробил заскорузлую, спекшуюся корку мыслей.
- Дайте мне подумать, - произнес он, зажав руками уши. Потом он
опустил руки и сказал историку:
- Вы можете оказать мне услугу, сэр?
- Если она в моих силах, - любезно ответил историк.
- Все, что я говорю в этой комнате, - профессиональная тайна? Вы так
сказали.
- Так оно и есть.
- Тогда устройте мне свидание с каким-нибудь должностным лицом дру-
гой планеты, например с... с новианином. Индженеску был, по-видимому,
крайне удивлен.
- Право же...
- Вы можете сделать это, - убежденно произнес Джордж. - Вы ведь важ-
ное должностное лицо. Я видел, какой вид был у полицейского, когда вы
показали ему свое удостоверение. Если вы откажетесь сделать это, я... я
не позволю вам изучать меня.
Самому Джорджу эта угроза показалась глупой и бессильной. Однако на
Индженеску она, очевидно, произвела большое впечатление.
- Ваше условие невыполнимо, - сказал он. - Новианин в месяц Олимпиа-
ды. . .
- Ну, хорошо, тогда свяжите меня с каким-нибудь новианином по видео-
фону, и я сам договорюсь с ним о встрече.
- Вы думаете, вам это удастся?
- Я в этом уверен. Вот увидите.
Индженеску задумчиво посмотрел на Джорджа и протянул руку к видеофо-
ну.
Джордж ждал, опьяненный новым осмыслением всей проблемы и тем ощуще-
нием силы, которое оно давало. Он не может потерпеть неудачу. Не может.
Он все-таки станет новианином. Он покинет Землю победителем вопреки Ан-
тонелли и всей компании дураков из приюта (он чуть было не расхохотался
вслух) для слабоумных.
Джордж впился взглядом в засветившийся экран, который должен был
распахнуть окно в комнату новиан, окно в перенесенный на Землю уголок
Новии. И он добился этого За какие-нибудь сутки!
Когда экран прояснился, раздался взрыв смеха, но на нем не появилось
ни одного лица, лишь быстро мелькали тени мужчин и женщин. Послышался
чей-то голос, отчетливо прозвучавший на фоне общего гомона.
- Индженеску? Спрашивает меня?
И вот на экране появился он. Новианин. Настоящий новианин. (Джордж
ни на секунду не усомнился. В нем было что-то совершенно внеземное, неч-
то такое, что невозможно было точно определить или хоть на миг спутать с
чем-либо иным.)
Он был смугл, и его темные волнистые волосы были зачесаны со лба. Он
носил танине черные усики и остроконечную бородку, которая толькотолько
закрывала узкий подбородок. Но его щеки были такими гладкими, словно с
них навсегда была удалена растительность. Он улыбался.
- Ладислас, это уже слишком. Мы не протестуем, чтобы за нами, пока
мы на Земле, следили - в разумных пределах, конечно. Но чтение мыслей в
условие не входит!
- Чтение мыслей, достопочтенный?
- Сознайтесь-ка! Вы ведь знали, что я собирался позвонить вам сегод-
ня. Вы знали, что я думал только допить вот эту рюмку. - На экране поя-
вилась его рука, и он посмотрел сквозь рюмку, наполненную бледносирене-
вой жидкостью. - К сожалению, я не могу угостить вас.
Новианин не видел Джорджа, находившегося вне поля зрения видеофона.
И Джордж обрадовался передышке. Ему необходимо было время, чтобы прийти
в себя. Он словно превратился в сплошные беспокойные пальцы, которые
непрерывно отбивали нервную дробь...
Но он все-таки был прав. Он не ошибся. Индженеску действительно За-
нимает важное положение. Новианин называет его по имени.
Отлично! Все устраивается наилучшим образом. То, что Джордж потерял
из-за Антонелли, он возместит с лихвой, используя Индженеску. И ког-
да-нибудь он, став наконец самостоятельным, вернется на Землю таким же
могущественным новианином, как этот, что небрежно шутит с Индженеску,
называя его по имени, а сам оставаясь "достопочтенным", - вот тогда он
сведет счеты с Антонелли. Он отплатит ему за эти полтора года, и он...
Увлекшись этими соблазнительными грезами, он чуть не забыл обо всем
на свете, но, внезапно спохватившись, заметил, что перестал следить за
происходящим, и вернулся к действительности.
- ...не убедительно, - говорил новианин. - Новианская цивилизация
так же сложна и так же высокоразвита, как цивилизация Земли. Новия - это
все-таки не Зестон. И нам приходится прилетать сюда за отдельными специ-
алистами - это же просто смешно!
- О, только за новыми моделями, - примирительным тоном сказал Индже-
неску. - А новые модели не всегда находят применение. На приобретение
образовательных лент вы потратили бы столько же, сколько вам пришлось бы
заплатить за тысячу специалистов, а откуда вы знаете, что вам будет нуж-
но именно такое количество?
Новианин залпом допил свое вино и расхохотался. (Джорджа покоробило
легкомыслие новианина. Он смущенно подумал, что тому следовало бы обой-
тись без этой рюмки и даже без двух или трех предыдущих.)
- Это же типичное ханжество, Ладислас, - сказал новианин. - Вы прек-
расно знаете, что у нас найдется дело для всех последних моделей специа-
листов , которые нам удастся достать. Сегодня я раздобыл пять металлур-
гов . . .
- Знаю, - сказал Индженеску. - Я был там.
- Следили за мной! Шпионили! - вскричал новианин. - Ну, так слушай-
те! Эта новая модель металлурга отличается от предыдущих только тем, что
умеет обращаться со спектрографом Бимена. Ленты не были модифицированы
ни на вот столечко (он показал самый кончик пальца) по сравнению с прош-
логодними. Вы выпускаете новые модели только для того, чтобы мы приезжа-
ли сюда с протянутой рукой и тратились на их приобретение.
- Мы не заставляем вас их приобретать.
- О, конечно! Только вы продаете специалистов последней модели на
Лондонум, а мы ведь не можем отставать. Вы втянули нас в заколдованный
круг, вы лицемерные земляне. Но берегитесь, может быть, где-нибудь есть
из него выход. - Его смех прозвучал не слишком естественно и резко обор-
вался .
- От всей души надеюсь, что он существует, - сказал Индженеску.
Ну, а позвонил я потому...
- Да, конечно, ведь это вы мне позвонили. Что ж, я уже высказал свое
мнение. Наверное, в будущем году все равно появится новая модель метал-
лурга , чтобы нам было за что платить. И она будет отличаться от нынешней
только умением обращаться с каким-нибудь новым приспособлением для ана-
лиза ниобия, а еще через год... Но продолжайте. Почему вы позвонили?
- У меня здесь находится один молодой человек, и я бы хотел, чтобы
вы с ним побеседовали.
- Что? - Видимо, новианина это не слишком обрадовало. - На какую те-
му?
- Не знаю. Он мне не сказал. По правде говоря, он даже не назвал мне
ни своего имени, ни профессии. Новианин нахмурился.
- Тогда зачем же отнимать у меня время?
- Он, по-видимому, не сомневается, что вас заинтересует то, что он
собирается сообщить вам.
- О, конечно!
- И этим вы сделаете одолжение мне, - сказал Индженеску. Новианин
пожал плечами.
- Давайте его сюда, но предупредите, чтобы он говорил покороче. Инд-
женеску отступил в сторону и шепнул Джорджу:
- Называйте его "достопочтенным".
Джордж с трудом проглотил слюну. Вот оно! Джордж почувствовал, что
весь вспотел. Хотя эта мысль пришла ему в голову совсем недавно, он был
убежден в своей правоте. Она возникла во время разговора с Тревельяном,
потом под болтовню Индженеску перебродила и оформилась, а теперь слова
новианина, казалось, поставили все на свои места.
- Достопочтенный, я хочу показать вам выход из заколдованного круга,
- начал Джордж, используя метафору новианина. Новианин смерил его взгля-
дом.
- Из какого это заколдованного круга?
- Вы сами упомянули о нем, достопочтенный. Из того заколдованного
круга, в который попадает Новия, когда вы прилетаете на Землю за... за
специалистами. (Он не в силах был справиться со своими зубами, которые
стучали, но не от страха, а от волнения.)
- Вы хотите сказать, что знаете способ, как нам обойтись без земного
интеллектуального рынка? Я правильно вас понял?
- Да, сэр. Вы можете создать свою собственную систему образования.
- Гм. Без лент?
- Д-да, достопочтенный.
- Индженеску, подойдите, чтобы я видел и вас, - не спуская глаз с
Джорджа, позвал новианин. Историк встал за плечом Джорджа.
- В чем дело? - спросил новианин. - Не понимаю.
- Даю вам слово, достопочтенный, что бы это ни было, молодой человек
поступает так по собственной инициативе. Я ему ничего не поручал. Я не
имею к этому никакого отношения.
- Тогда кем он вам приходится? Почему вы звоните мне по его просьбе?
- Я его изучаю, достопочтенный. Он представляет для меня определен-
ную ценность, и я исполняю некоторые его прихоти.
- В чем же его ценность?
- Это трудно объяснить. Чисто профессиональный момент. Новианин ус-
мехнулся .
- Что ж, у каждого своя профессия. Он кивнул невидимому зрителю или
зрителям за экраном.
- Некий молодой человек, по-видимому, протеже Индженеску, собирается
объяснить нам, как получать образование, не пользуясь лентами.
Он щелкнул пальцами, и в его руке появилась новая рюмка с бледноси-
реневым напитком.
- Ну, говорит, молодой человек.
На экране теперь появилось множество лиц. Мужчины и женщины отталки-
вали друг друга, чтобы поглядеть на Джорджа. На их лицах отражались са-
мые разнообразные оттенки веселья и любопытства.
Джордж попытался принять независимый вид. Все они, и новиане, и зем-
лянин, каждый по-своему изучали его, словно жука, насажанного на булав-
ку. Индженеску теперь сидел в углу и не спускал с него пристального
взгляда.
"Какие же вы все идиоты", - напряженно подумал он. Но они должны по-
нять . Он заставит их понять.
- Я был сегодня на Олимпиаде металлургов, - сказал он.
- Как, и вы тоже? - вежливо спросил новианин. - По-видимому, там
присутствовала вся Земля.
- Нет, достопочтенный, но я там был. В состязании участвовал мой
друг, и ему очень не повезло, потому что вы дали участникам состязания
прибор Бимена, а он получил специализацию по Хенслеру, - очевидно, уже
устаревшая модель. Вы же сами сказали, что различие очень незначительно.
- Джордж показал кончик пальца, повторяя недавний жест своего собеседни-
ка. - И мой друг знал заранее, что потребуется знакомство с прибором Би-
мена .
- И что же из этого следует?
- Мой друг всю жизнь мечтал попасть на Новию. Он уже Знал прибор
Хенслера. Он знал, что ему нужно ознакомиться с прибором Бимена, чтобы
попасть к вам. А для этого ему следовало усвоить всего лишь несколько
дополнительных сведений и, быть может, чуточку попрактиковаться. Если
учесть, что на чашу весов была поставлена цель всей его жизни, он мог бы
с этим справиться...
- А где бы он достал ленту с дополнительной информацией? Или образо-
вание здесь, на Земле, превратилось в частное домашнее обучение?
Лица на заднем плане расплылись в улыбках, которых, по-видимому, от
них и ожидали.
- Поэтому-то он и не стал доучиваться, достопочтенный. Он считал,
что ему для этого нужна лента. А без нее он и не пытался учиться, как ни
заманчива была награда. Он и слышать не хотел, что без ленты можно че-
му-то научиться.
- Да неужели? Так он, пожалуй, даже не захочет летать без скиммера?
- Раздался новый взрыв хохота, и новианин слегка улыбнулся. - А он заба-
вен , - сказал он. - Продолжайте. Даю вам еще несколько минут.
- Не думайте, что это шутка, - сказал Джордж горячо. - Ленты попрос-
ту вредны. Они учат слишком многому и слишком легко. Человек, который
получает знания с их помощью, не представляет, как можно учиться по-дру-
гому. Он способен заниматься только той профессией, которой его заряди-
ли. А если бы, вместо того чтобы пичкать человека лентами, его заставили
с самого начала учиться, так сказать вручную, он привык бы учиться са-
мостоятельно и продолжал бы учиться дальше. Разве это не разумно? А ког-
да эта привычка достаточно укрепится, человеку можно будет прививать не-
большое количество знаний с помощью лент, чтобы заполнить пробелы или
закрепить кое-какие детали. После этого он сможет учиться дальше самос-
тоятельно . Таким способом вы могли бы научить металлургов, знающих
спектрограф Хенслера, пользоваться спектрографом Бимена, и вам не приш-
лось бы прилетать на Землю За новыми моделями. Новианин кивнул и отхлеб-
нул из рюмки.
- А откуда можно получить знания помимо лент? Из межзвездного прост-
ранства?
- Из книг. Непосредственно изучая приборы. Думая.
- Из книг? Как же можно понять книги, не получив образования?
- Книги состоят из слов, а большую часть слов можно понять. Специ-
альные же термины могут объяснить специалисты, которых вы уже имеете.
- А как быть с чтением? Для этого вы допускаете использование лент?
- По-видимому, ими можно пользоваться, хотя не вижу причины, почему
нельзя научиться читать и старым способом. По крайней мере частично.
- Чтобы с самого начала выработать хорошие привычки? - спросил нови-
анин.
- Да, да, - подтвердил Джордж, радуясь, что собеседник уже начал по-
нимать его.
- А как быть с математикой?
- Это легче всего, сэр... достопочтенный. Математика отличается от
других технических дисциплин. Она начинается с некоторых простых принци-
пов и лишь постепенно усложняется. Можно приступить к изучению математи-
ки , ничего о ней не зная. Она практически и предназначена для этого. А
познакомившись с соответствующими разделами математики, уже нетрудно ра-
зобраться в книгах по технике. Особенно если начать с легких.
- А разве есть легкие книги?
- Безусловно. Но если бы их и не было, специалисты, которых вы уже
имеете, могут написать их. Наверное, некоторые из них сумеют выразить
свои знания с помощью слов и символов.
- Боже мой! - сказал новианин, обращаясь к сгрудившимся вокруг него
людям. - У этого чертенка на все есть ответ.
- Да, да! - вскричал Джордж. - Спрашивайте!
- А сами-то вы пробовали учиться по книгам? Или это только ваша тео-
рия?
Джордж быстро оглянулся на Индженеску, но историк сохранял полную
невозмутимость. Его лицо выражало только легкий интерес.
- Да, - сказал Джордж.
- И вы считаете, что из этого что-нибудь получается?
- Да, достопочтенный, - заверил Джордж. - Возьмите меня с собой на
Новию. Я могу составить программу и руководить...
- Погодите, у меня есть еще несколько вопросов. Как вы думаете,
сколько вам понадобится времени, чтобы стать металлургом, умеющим обра-
щаться со спектрографом Бимена, если предположить, что вы начнете учить-
ся, не имея никаких знаний, и не будете пользоваться образовательными
лентами? Джордж заколебался.
- Ну... может быть, несколько лет.
- Два года? Пять? Десять?
- Еще не знаю, достопочтенный.
- Итак, на самый главный вопрос у вас не нашлось ответа. Ну, скажем,
пять лет. Вас устраивает этот срок?
- Думаю, что да.
- Отлично. Итак, в течение пяти лет человек изучает металлургию по
вашему методу. Вы не можете не согласиться, что все это время он для нас
абсолютно бесполезен, но его нужно кормить, обеспечить жильем и платить
ему.
- Но...
- Дайте мне кончить. К тому времени, когда он будет готов и сможет
пользоваться спектрографом Бимена, пройдет пять лет. Вам не кажется, что
тогда у нас уже появятся усовершенствованные модели этого прибора, с ко-
торыми он не сумеет обращаться?
- Но ведь к тому времени он станет опытным учеником и усвоение новых
деталей будет для него вопросом дней.
- По-вашему, это так. Ладно, предположим, что этот ваш друг, напри-
мер, сумел самостоятельно изучить прибор Бимена; сможет ли сравниться
его умение с умением участника состязания, который получил его посредс-
твом лент?
- Может быть, и нет... - начал Джордж.
- То-то же, - сказал новианин.
- Погодите, дайте кончить мне. Даже если он знает кое-что хуже, чем
тот, другой, в данном случае важно то, что он может учиться дальше. Он
сможет придумывать новое, на что не способен ни один человек, получивший
образование с лент. У вас будет запас людей, способных к самостоятельно-
му мышлению...
- А вы в процессе своей учебы придумали что-нибудь новое? - спросил
новианин.
- Нет, но ведь я один, и я не так уж долго учился...
- Да... Ну-с, дамы и господа, мы достаточно позабавились?
- Постойте! - внезапно испугавшись, крикнул Джордж. - Я хочу догово-
риться с вами о личной встрече. Есть вещи, которые я не могу объяснить
по видеофону. Ряд деталей... Новианин уже не смотрел на Джорджа.
- Индженеску! По-моему, я исполнил вашу просьбу. Право же, Завтра у
меня очень напряженный день. Всего хорошего. Экран погас.
Руки Джорджа взметнулись к экрану в бессмысленной попытке вновь его
оживить.
- Он не поверил мне! Не поверил!
- Да, Джордж, не поверил. Неужели вы серьезно думали, что он пове-
рит? - сказал Индженеску. Но Джордж не слушал.
- Почему же? Ведь это правда. Это так для него выгодно. Никакого
риска. Только я и еще несколько... Обучение десятка людей в течение даже
многих лет обошлось бы дешевле, чем один готовый специалист... Он был
пьян! Пьян! Он не был способен понять. Задыхаясь, Джордж оглянулся.
- Как мне с ним увидеться? Это необходимо. Все получилось не так,
как нужно. Я не должен был говорить с ним по видеофону. Мне нужно время.
И чтобы лично. Как мне...
- Он откажется принять вас, Джордж, - сказал Индженеску. - А если и
согласится, то все равно вам не поверит.
- Нет, поверит, уверяю вас. Когда он будет трезв, он... - Джордж по-
вернулся к историку, и глаза его широко раскрылись. - Почему вы называе-
те меня Джорджем?
- А разве это не ваше имя? Джордж Плейтен?
- Вы знаете, кто я?
- Я знаю о вас все. Джордж замер, и только его грудь тяжело вздыма-
лась .
- Я хочу помочь вам, Джордж, - сказал Индженеску. - Я уже говорил
вам об этом. Я давно изучаю вас и хочу вам помочь.
- Мне не нужна помощь! - крикнул Джордж. - Я не слабоумный! Весь мир
выжил из ума, но не я! Он стремительно повернулся и бросился к двери. За
ней стояли два полицейских, которые его немедленно схватили. Как Джордж
ни вырывался, шприц коснулся его шеи под подбородком. И все кончилось.
Последнее, что осталось в его памяти, было лицо Индженеску, который с
легкой тревогой наблюдал за происходящим.
Когда Джордж открыл глаза, он увидел белый потолок. Он помнил, что
произошло. Но помнил, как сквозь туман, словно это произошло с кем-то
другим. Он смотрел на потолок до тех пор, пока не наполнился его белиз-
ной , казалось, освобождавшей его мозг для новых идей, для иных путей
мышления.
Он не знал, как долго лежал так, прислушиваясь к течению своих мыс-
лей .
- Ты проснулся? - раздался чей-то голос. И Джордж впервые услышал
свой собственный стон. Неужели он стонал? Он попытался повернуть голову.
- Тебе больно, Джордж? - спросил голос.
- Смешно, - прошептал Джордж. - Я так хотел покинуть Землю. Я же ни-
чего не понимал.
- Ты знаешь, где ты?
- Снова в... в приюте. - Джорджу удалось повернуться. Голос принад-
лежал Омани.
- Смешно, как я ничего не понимал, - сказал Джордж. Омани ласково
улыбнулся.
- Поспи еще... Джордж заснул.
И снова проснулся. Сознание его прояснилось. У кровати сидел Омани и
читал, но, как только Джордж открыл глаза, он отложил книгу. Джордж с
трудом сел.
- Привет, - сказал он.
- Хочешь есть?
- Еще бы! - Джордж с любопытством посмотрел на Омани. - За мной сле-
дили, когда я ушел отсюда, так? Омани кивнул.
- Ты все время был под наблюдением. Мы считали, что тебе следует по-
бывать у Антонелли, чтобы ты мог дать выход своим агрессивным потребнос-
тям. Нам казалось, что другого способа нет. Эмоции тормозили твое разви-
тие .
- Я был к нему очень несправедлив, - с легким смущением произнес
Джордж.
- Теперь это не имеет значения. Когда в аэропорту ты остановился у
стенда металлургов, один из наших агентов сообщил нам список участников.
Мы с тобой говорили о твоем прошлом достаточно, для того чтобы я мог по-
нять, как подействует на тебя фамилия Тревельяна. Ты спросил, как по-
пасть на эту Олимпиаду. Это могло привести к кризису, на который мы на-
деялись, и мы послали в зал Ладисласа Индженеску, чтобы он занялся тобой
сам.
- Он ведь занимает важный пост в правительстве?
- Да.
- И вы послали его ко мне. Выходит, что я сам много Значу.
- Ты действительно много значишь, Джордж. Принесли дымящееся аромат-
ное жаркое. Джордж улыбнулся и откинул простыню, чтобы освободить руки.
Смани помог ему поставить поднос на тумбочку. Некоторое время Джордж
молча ел.
- Я уже один раз ненадолго просыпался, - заметил он.
- Знаю, - сказал Смани. - Я был здесь.
- Да, я помню. Ты знаешь, все изменилось. Как будто я так устал, что
уже не мог больше чувствовать. Я больше не злился. Я мог только думать.
Как будто мне дали наркотик, чтобы уничтожить эмоции.
- Нет, - сказал Омами. - Это было просто успокоительное. И ты хорошо
отдохнул.
- Ну, во всяком случае, мне все стало ясно, словно я всегда знал
это, но не хотел прислушаться к внутреннему голосу. "Чего я ждал от Но-
вии?" - подумал я. Я хотел отправиться на Новию, чтобы собрать группу
юношей, не получивших образования, и учить их по книгам. Я хотел открыть
там приют для слабоумных... вроде этого... а на Земле уже есть такие
приюты... и много. Смани улыбнулся, сверкнув зубами.
- Институт высшего образования - вот как точно называются эти заве-
дения .
- Теперь-то я это понимаю, - сказал Джордж, - до того ясно, что
только удивляюсь, каким я был слепым. В конце концов, кто изобретает но-
вые модели механизмов, для которых нужны новые модели специалистов? Кто,
например, изобрел спектрограф Бимена? По-видимому, человек по имени Би-
мен. Но он не мог получить образование через зарядку, иначе ему не уда-
лось бы продвинуться вперед.
- Совершенно верно.
- А кто создает образовательные ленты? Специалисты по производству
лент? А кто же тогда создает ленты для их обучения? Специалисты более
высокой квалификации? А кто создает ленты... Ты понимаешь, что я хочу
сказать. Где-то должен быть конец. Где-то должны быть мужчины и женщины,
способные к самостоятельному мышлению.
- Ты прав, Джордж.
Джордж откинулся на подушки и устремил взгляд в пространство. На ка-
кой-то миг в его глазах мелькнула тень былого беспокойства.
- Почему мне не сказали об этом с самого начала?
- К сожалению, это невозможно, - ответил Смани. - А так мы были бы
избавлены от множества хлопот. Мы умеем анализировать интеллект, Джордж,
и определять, что вот этот человек может стать приличным архитектором, а
тот - хорошим плотником. Но мы не умеем определять, способен ли человек
к творческому мышлению. Это слишком тонкая вещь. У нас есть несколько
простейших способов, позволяющих распознавать тех, кто, быть может, об-
ладает такого рода талантом. Об этих индивидах сообщают сразу после Дня
чтения, как, например, сообщили о тебе. Их приходится примерно один на
десять тысяч. В День образования этих людей проверяют снова, и в девяти
случаях из десяти оказывается, что произошла ошибка. Тех, кто остается,
посылают в такие заведения, как это.
- Но почему нельзя сказать людям, что один из... из ста тысяч попа-
дает в такое заведение? - спросил Джордж. - Тогда тем, с кем это случа-
ется, было бы легче.
- А как же остальные? Те девяносто девять тысяч девятьсот девяносто
девять человек, которые никогда не попадут сюда? Нельзя, чтобы все эти
люди чувствовали себя неудачниками. Они стремятся получить профессии и
получают их. Каждый может прибавить к своему имени слова "дипломирован-
ный специалист по тому-то или тому-то". Так или иначе каждый индивид на-
ходит свое место в обществе. Это необходимо.
- А мы? - спросил Джордж. - Мы, исключения? Один на десять тысяч?
- Вам ничего нельзя объяснить. В том-то и дело. Ведь в этом заключа-
ется последнее испытание. Даже после отсева в День образования девять
человек из десяти, попавших сюда, оказываются не совсем подходящими для
творчества, и нет такого прибора, который помог бы нам выделить из этой
десятки того единственного, кто нам нужен. Десятый должен доказать это
сам.
- Каким образом?
- Мы помещаем вас сюда, в приют для слабоумных, и тот, кто не желает
смириться с этим, и есть человек, которого мы ищем. Быть может, это жес-
токий метод, но он себя оправдывает. Нельзя же сказать человеку: "Ты мо-
жешь творить. Так давай, твори". Гораздо вернее подождать, пока он сам
не скажет: "Я могу творить, и я буду творить, хотите вы этого или нет".
Есть около десяти тысяч людей, подобных тебе, Джордж, и от них зависит
технический прогресс полутора тысяч миров. Мы не можем позволить себе
потерять хотя бы одного из них или тратить усилия на того, кто не вполне
отвечает необходимым требованиям. Джордж отодвинул пустую тарелку и под-
нес к губам чашку с кофе.
- А как же с теми, которые... не вполне отвечают требованиям?
- В конце концов они проходят зарядку и становятся социологами. Инд-
женеску - один из них. Сам я - дипломированный психолог. Мы, так ска-
зать , составляем второй эшелон. Джордж допил кофе.
- Мне все еще непонятно одно, - сказал он.
- Что же? Джордж сбросил простыню и встал.
- Почему состязания называются Олимпиадой?
Ликбез
ОСНОВЫ БИОТЕХНОЛОГИИ
Н. А. Кузьмина
ВВЕДЕНИЕ В БИОТЕХНОЛОГИЮ
Биотехнология, или технология биопроцессов, это производственное использо-
вание биологических агентов или их систем для получения ценных продуктов и
осуществления целевых превращений. Биологические агенты в данном случае -
микроорганизмы, растительные и животные клетки, клеточные компоненты: мембра-
ны клеток, рибосомы, митохондрии, хлоропласты, а также биологические макромо-
лекулы (ДНК, РНК,белки - чаще всего ферменты). Биотехнология использует также
вирусную ДНК или РНК для переноса чужеродных генов в клетки.
Человек использовал биотехнологию многие тысячи лет: люди пекли хлеб, вари-
ли пиво, делали сыр, другие молочнокислые продукты, используя различные мик-
роорганизмы, при этом, даже не подозревая об их существовании. Собственно сам
термин появился в нашем языке не так давно, вместо него употреблялись слова
"промышленная микробиология", "техническая биохимия" и др. Вероятно, древней-
шим биотехнологическим процессом было сбраживание с помощью микроорганизмов.
В пользу этого свидетельствует описание процесса приготовления пива, обнару-
женное в 1981 г. при раскопках Вавилона на дощечке, которая датируется при-
мерно 6-м тысячелетием до н. э. В 3-м тысячелетии до н. э. шумеры изготовляли
до двух десятков видов пива. Не менее древними биотехнологическими процессами
являются виноделие, хлебопечение, и получение молочнокислых продуктов. В тра-
диционном, классическом, понимании биотехнология — это наука о методах и тех-
нологиях производства различных веществ и продуктов с использованием природ-
ных биологических объектов и процессов
Термин "новая" биотехнология в противоположность "старой" биотехнологии
применяют для разделения биопроцессов, использующих методы генной инженерии,
новую биопроцессорную технику, и более традиционные формы биопроцессов. Так,
обычное производство спирта в процессе брожения - "старая" биотехнология, но
использование в этом процессе дрожжей, улучшенных методами генной инженерии с
целью увеличения выхода спирта - "новая" биотехнология.
Биотехнология как наука является важнейшим разделом современной биологии,
которая, как и физика, стала в конце XX в. одним из ведущих приоритетов в ми-
ровой науке и экономике.
Всплеск исследований по биотехнологии в мировой науке произошел в 80-х го-
дах, когда новые методологические и методические подходы обеспечили переход к
эффективному их использованию в науке и практике и возникла реальная возмож-
ность извлечь из этого максимальный экономический эффект. По прогнозам, уже в
начале 21 века биотехнологические товары будут составлять четверть всей миро-
вой продукции.
В нашей стране значительное расширение научно-исследовательских работ и
внедрение их результатов в производство также было достигнуто в 80-е годы. В
этот период в стране была разработана и активно осуществлялась первая общена-
циональная программа по биотехнологии, были созданы межведомственные биотех-
нологические центры, подготовлены квалифицированные кадры специалистов-
биотехнологов, организованы биотехнологические лаборатории и кафедры в науч-
но-исследовательских учреждениях и вузах.
Однако в дальнейшем внимание к проблемам биотехнологии в стране ослабло, а
их финансирование сокращено. В результате развитие биотехнологических иссле-
дований и их практическое использование в России замедлилось, что привело к
отставанию от мирового уровня, особенно в области генетической инженерии.
Что касается более современных биотехнологических процессов, то они основа-
ны на методах рекомбинантных ДНК, а также на использовании иммобилизованных
ферментов, клеток или клеточных органелл. Современная биотехнология — это
наука о генно-инженерных и клеточных методах и технологиях создания и исполь-
зования генетически трансформированных биологических объектов для интенсифи-
кации производства или получения новых видов продуктов различного назначения.
В рамках биотехнологии можно выделить 3 основных части:
1. Промышленная биотехнология, где рассматриваются общие принципы осуществ-
ления биотехнологических процессов, происходит знакомство с основными объек-
тами и сферами применения биотехнологии, рядом крупномасштабных промышленных
биотехнологических производств, использующих микроорганизмы.
2. Клеточная инженерия. Основная цель этого раздела - знакомство с методами
ведения культур клеток и практическим использованием этих объектов. В рамках
этого раздела выделяют культивирование растительных клеток и методы культиви-
рования животных клеток, так как подходы к культивированию этих объектов раз-
личаются в силу их принципиальных биологических различий. Клеточная биотехно-
логия обеспечила ускоренное получение новых важных форм и линий растений и
животных, используемых в селекции на устойчивость, продуктивность и качество;
размножение ценных генотипов, получение ценных биологических препаратов пище-
вого, кормового и медицинского назначения.
3. Генная инженерия. Высшим достижением современной биотехнологии является
генетическая трансформация, перенос чужеродных генов и других материальных
носителей наследственности в клетки растений, животных и микроорганизмов, по-
лучение трансгенных организмов с новыми или усиленными свойствами и признака-
ми . По своим целям и возможностям в перспективе это направление является
стратегическим. Оно позволяет решать коренные задачи селекции биологических
объектов на устойчивость, высокую продуктивность и качество продукции при оз-
доровлении экологической обстановки во всех видах производств. Однако для
достижения этих целей предстоит преодолеть огромные трудности в повышении эф-
фективности генетической трансформации и, прежде всего, в идентификации ге-
нов, создании их банков клонирования, расшифровке механизмов полигенной де-
терминации признаков и свойств биологических объектов, обеспечении высокой
экспрессии генов и создании надежных векторных систем. Уже сегодня во многих
лабораториях мира, в том числе и в России, с помощью методов генетической ин-
женерии созданы принципиально новые трансгенные растения, животные и микроор-
ганизмы, получившие коммерческое признание.
Современная биотехнология тесно стыкуется с рядом научных дисциплин, осуще-
ствляя их практическое применение или же являясь их основным инструментом
(рис. 1).
В молекулярной биологии использование биотехнологических методов позволяет
определить структуру генома, понять механизм экспрессии генов, смоделировать
клеточные мембраны с целью изучения их функций и т.д. Конструирование нужных
генов методами генной и клеточной инженерии позволяет управлять наследствен-
ностью и жизнедеятельностью животных, растений и микроорганизмов и создавать
организмы с новыми полезными для человека свойствами, ранее не наблюдавшимися
в природе.
Микробиологическая промышленность в настоящее время использует тысячи штам-
мов различных микроорганизмов. В большинстве случаев они улучшены путем инду-
цированного мутагенеза и последующей селекции. Это позволяет вести широкомас-
штабный синтез различных веществ.
Некоторые белки и вторичные метаболиты могут быть получены только путем
культивирования клеток эукариот. Растительные клетки могут служить источником
ряда соединений - атропин, никотин, алкалоиды, сапонины и др. Клетки животных
и человека также продуцируют ряд биологически активным соединений. Например,
клетки гипофиза - липотропин, стимулятор расщепления жиров, и соматотропин
гормон, регулирующий рост.
Созданы перевиваемые культуры клеток животных, продуцирующие моноклональные
антитела, широко применяемые для диагностики заболеваний. В биохимии, микро-
биологии, цитологии несомненный интерес вызывают методы иммобилизации как
ферментов, так и целых клеток микроорганизмов, растений и животных. В ветери-
нарии широко используются такие биотехнологические методы, как культура кле-
ток и зародышей, овогенез in vitro, искусственное оплодотворение. Все это
свидетельствует о том, что биотехнология станет источником не только новых
продуктов питания и медицинских препаратов, но и получения энергии и новых
химических веществ, а также организмов с заданными свойствами.
штобиология
ге не и
□ ИПХИ1.МЯ
селекция
структура генома,
зксгоессия генома
инженерные
технологии
трансформация клеток,
1Л1аз1.«1дная тех гика
физиология
растеши
ветеринария.
медицина
молекулярная
□иология
генная
инженерия
андрогенез,
му rate нез
ферментация.
автоматизация.
111О1.Ышлейная хмг.вчя
си Н1ез а ш ношено г
азотфиксатиры.
векторы
культура зародышей.
овогенез in vitro.
культура клеток
и ланей
регенерация,
гормоны.
культуры клеток
и ланей
и ммопилизова иные
ферме ты,
энзимология, биогаз
Рис. 1. Связь биотехнологии с другими науками (по В.И.Кефели,
1989)
ПРОМЫШЛЕННАЯ БИОТЕХНОЛОГИЯ
ОСНОВНЫЕ НАПРАВЛЕНИЯ БИОТЕХНОЛОГИИ
Условно можно выделить следующие основные направления биотехнологии: био-
технология пищевых продуктов, препаратов для сельского хозяйства, препаратов
и продуктов для промышленного и бытового использования, лекарственных препа-
ратов, средств диагностики и реактивов, биотехнология также включает выщела-
чивание и концентрирование металлов, защиту окружающей среды от загрязнения,
деградацию токсических отходов и увеличение добычи нефти.
Биоэнергетика
Растительный покров Земли составляет более 1800 млрд, т сухого вещества,
что энергетически эквивалентно известным запасам энергии полезных ископаемых.
Леса составляют около 68% биомассы суши, травяные экосистемы - примерно 16%,
а возделываемые земли - только 8%.
Для сухого вещества простейший способ превращения биомассы в энергию заклю-
чается в сгорании - оно обеспечивает тепло, которое в свою очередь превраща-
ется в механическую или электрическую энергию. Что же касается сырого вещест-
ва, то в этом случае древнейшим и наиболее эффективным методом превращения
биомассы в энергию является получение биогаза (метана).
Метановое «брожение», или биометаногенез, - давно известный процесс превра-
щения биомассы в энергию1. Он был открыт в 1776 г. Вольтой, который установил
наличие метана в болотном газе. Биогаз, получающийся в ходе этого процесса,
представляет собой смесь из 65% метана, 30% углекислого газа, 1% сероводорода
(H2S) и незначительных количеств азота, кислорода, водорода и закиси углеро-
да. Болотный газ дает пламя синего цвета и не имеет запаха1 2. Его бездымное
горение причиняет гораздо меньше неудобств людям по сравнению со сгоранием
дров, навоза жвачных животных или кухонных отбросов. Энергия, заключенная в
28 м3 биогаза, эквивалентна энергии 16,8 м3 природного газа, 20,8 л нефти или
18,4 л дизельного топлива.
Биометаногенез осуществляется в три этапа: растворение и гидролиз органиче-
ских соединений, ацидогенез и метаногенез. В энергоконверсию вовлекается
только половина органического материала — 1800 ккал/кг сухого вещества по
сравнению с 4000 ккал при термохимических процессах, но остатки, или шлаки,
метанового «брожения» используются в сельском хозяйстве как удобрения. В про-
цессе биометаногенеза участвуют три группы бактерий. Первые превращают слож-
ные органические субстраты в масляную, пропионовую и молочную кислоты; вторые
превращают эти органические кислоты в уксусную кислоту, водород и углекислый
газ, а затем метанообразующие бактерии восстанавливают углекислый газ в метан
с поглощением водорода, который в противном случае может ингибировать уксус-
нокислые бактерии. В 1967 г. Брайант и др. установили, что уксуснокислые и
метанообразующие микроорганизмы образуют симбиоз, который ранее считался од-
ним микробом и назывался Methanobacillus omelianskii.
Для всех метанобактерий характерна способность к росту в присутствии водо-
рода и углекислого газа, а также высокая чувствительность к кислороду и инги-
биторам производства метана. В природных условиях метанобактерий тесно связа-
ны с водородобразующими бактериями: эта трофическая ассоциация выгодна для
обоих типов бактерий. Первые используют газообразный водород, продуцируемый
последними; в результате его концентрация снижается и становится безопасной
для водородобразующих бактерий.
1 Очевидно, имеется в виду, в удобное топливо.
2 Метан может и не имеет, а болотный газ очень даже пахнет.
Метановое «брожение» происходит в водонепроницаемых цилиндрических цистер-
нах (дайджестерах) с боковым отверстием, через которое вводится ферментируе-
мый материал. Над дайджестером находится стальной цилиндрический контейнер,
который используется для сбора газа; нависая над бродящей смесью в виде купо-
ла, контейнер препятствует проникновению внутрь воздуха, так как весь процесс
должен происходить в строго анаэробных условиях. Как правило, в газовом купо-
ле имеется трубка для отвода биогаза. Дайджестеры изготовляют из глиняных
кирпичей, бетона или стали. Купол для сбора газа может быть изготовлен из
нейлона; в этом случае его легко прикреплять к дайджестеру, изготовленному из
твердого пластического материала. Газ надувает нейлоновый мешок, который
обычно соединен с компрессором для повышения давления газа.
В тех случаях, когда используются отходы домашнего хозяйства или жидкий на-
воз , соотношение между твердыми компонентами и водой должно составлять 1:1
(100 кг отходов на 100 кг воды), что соответствует общей концентрации твердых
веществ, составляющей 8—11% по весу. Смесь сбраживаемых материалов обычно за-
севают ацетогенными и метаногенными бактериями или отстоем из другого дайдже-
стера. Низкий pH подавляет рост метаногенных бактерий и снижает выход биога-
за; такой же эффект вызывает перегрузка дайджестера. Против закисления ис-
пользуют известь. Оптимальное «переваривание» происходит в условиях, близких
к нейтральным (pH 6,0—8,0). Максимальная температура процесса зависит от ме-
Зофильности или термофильности микроорганизмов (30—40° С или 50—60° С) ; рез-
кие изменения температуры нежелательны.
Обычно дайджестеры загружают в землю, чтобы использовать изоляционные свой-
ства почвы. В странах с холодным климатом их нагревают при помощи устройств,
которые применяют при компостировании сельскохозяйственных отходов. С точки
зрения питательных потребностей бактерий избыток азота (например, в случае
жидкого навоза) способствует накоплению аммиака, который подавляет рост бак-
терий. Для оптимальной переработки соотношение C/N должно быть порядка 30:1
(по весу). Это соотношение можно изменять, смешивая субстраты, богатые азо-
том, с субстратами, богатыми углеродом. Так, C/N навоза можно изменить добав-
лением соломы или жома сахарного тростника.
Отходы пищевой промышленности и сельскохозяйственного производства характе-
ризуются высоким содержанием углерода (в случае перегонки свеклы на 1 л отхо-
дов приходится до 50 г углерода), поэтому они лучше всего подходят для мета-
нового «брожения», тем более, что некоторые из них получаются при температу-
ре, наиболее благоприятной для этого процесса. Желательно перемешивать сус-
пензию сбраживаемых веществ, чтобы воспрепятствовать расслаиванию, которое
подавляет брожение. Твердый материал необходимо раздробить, так как наличие
крупных комков препятствует образованию метана. Обычно длительность перера-
ботки навоза крупного рогатого скота составляет две—четыре недели. Двухне-
дельной переработки при температуре 35°С достаточно, чтобы убить все патоген-
ные энтеробактерии и энтеровирусы, а также 90% популяции Ascaris lumbricoides
и Ancylostoma.
Конференция ООН по науке и технике для развивающихся стран (1979) и экспер-
ты Экономической и социальной комиссии по странам Азии и Тихого океана под-
черкнули достоинства интегрированных сельскохозяйственных программ, исполь-
зующих биогаз. Такие программы направлены на разработку пищевых культур, а
также на производство белка культурами водорослей, создание рыбных ферм, пе-
реработку отходов и превращение различных отбросов в удобрения и энергию в
виде метана. Надо отметить, что 38% от 95-миллионного поголовья крупного ро-
гатого скота в мире, 72% остатков сахарного тростника и 95% отходов бананов,
кофе и цитрусовых приходятся на долю стран Африки, Латинской Америки, Азии и
Ближнего Востока. Не удивительно, что в этих регионах сосредоточены огромные
количества сырья для метанового «брожения». Следствием этого явилась ориента-
ция некоторых стран сельскохозяйственно ориентированной экономикой на био-
энергетику. Например, одним из основных принципов энергетической политики Ин-
дии является производство биогаза в сельских районах. В конце 1979 г. в Индии
работало менее 100 000 установок. В Китае в этот же период насчитывалось 10
млн. установок. Сырьем для загрузки установок в этих странах являются отходы
животноводческих ферм и птицефабрик. В Центральной Америке построены установ-
ки , работающие на отходах производства кофе. В Масатенанго была построена
фабрика, выпускающая 90 м3 биогаза в сутки и 900 т органических удобрений в
год из отходов кофе. Биогаз обеспечивает работу двигателя мощностью 35 л. с.,
являющегося частью устройства, которое лущит кофе со скоростью 3 т/ч, выраба-
тывает 1500 В электроэнергии и обеспечивает работу компрессора. В Израиле с
1974 г. производством биогаза занимается «Ассоциация киббуци индастриз»
(KIA) . Проведены фундаментальные исследования процесса метаногенеза при ак-
тивном участии нескольких университетов и промышленных исследовательских ин-
ститутов под эгидой министерства энергетики. Анаэробное брожение происходит
при 55° С. Исследователям удалось добиться повышения выхода биогаза до 4—6,5
м3 в сутки на каждый кубометр объема цистерны дайджестера (что в десять раз
превышает обычный выход). Биогаз состоит из 62% метана и 38% углекислого га-
за ; последний предполагают использовать в теплицах для ускорения фотосинтеза
культивируемых растений. Отходы переработки, содержащие только 12% твердого
вещества, скармливают рыбам. Это помогло сэкономить половину гранулированных
кормов из злаков, которые обычно употребляют при разведении рыб. Как показали
эксперименты, богатые белками, минеральными солями и витаминами отходы круп-
ного рогатого скота и овец можно использовать в качестве корма для скота, за-
меняя ими до 25% сухого вещества поглощаемой пищи.
Производство биогаза путем метанового «брожения» отходов — одно из возмож-
ных решений энергетической проблемы в большинстве сельских районов развиваю-
щихся стран. И хотя при использовании коровьего навоза только четверть орга-
нического материала превращается в биогаз, последний выделяет тепла на 20%
больше, чем его можно получить при полном сгорании навоза.
Производство биогаза имеет следующие достоинства: это источник энергии,
доступный на семейном и общинном уровне; отходы процесса служат высококачест-
венными удобрениями и в довершение сам процесс способствует поддержанию чис-
тоты окружающей среды. Чтобы обеспечить крупномасштабное развитие и экономи-
ческую выгоду предприятий по производству биогаза, необходимо решить целый
ряд биохимических, микробиологических и социальных проблем. Усовершенствова-
ния касаются следующих областей: сокращения числа стальных элементов в ис-
пользуемом оборудовании; создания оборудования с оптимальной конструкцией;
разработки эффективных нагревателей; нагрева дайджестеров за счет солнечной
энергии; объединения систем производства биогаза с другими нетрадиционными
источниками энергии; конструирования крупномасштабных производственных единиц
для сельских или городских общин; оптимального использования переработанных
отходов и, наконец, усовершенствования процессов брожения и начальной дегра-
дации отходов.
Биотехнология в состоянии внести крупный вклад в решение проблем энергетики
посредством производства достаточно дешевого биосинтетического этанола, кото-
рый кроме того является и важным сырьем для микробиологической промышленности
при получении пищевых и кормовых белков, а также белково-липидных кормовых
препаратов.
Источником углеводородов также могут служить водоросли. У широко распро-
страненной зеленой водоросли Botryococcus braunii (обитающей в пресной и со-
лоноватой воде умеренных и тропических зон) углеводороды в зависимости от ус-
ловий роста и разновидностей могут составлять до 75% сухой массы. Они накап-
ливаются внутри клеток, и водоросли, в которых их много, плавают на поверхно-
сти. После сбора водорослей эти углеводороды легко отделить экстракцией ка-
ким-нибудь растворителем или методом деструктивной отгонки. Таким путем может
быть получено вещество, аналогичное дизельному топливу и керосину.
Встречается несколько разновидностей В.braunii, отличающихся пигментацией и
структурой синтезируемых углеводородов. Зеленая разновидность содержит линей-
ные углеводороды с нечетным (25-31) числом атомов углерода, бедных двойными
связями. Красная водоросль содержит углеводороды с 34-38 атомами углерода и
несколькими двойными связями; это так называемые "ботриококкцены". Смысл су-
ществования двух разновидностей в настоящее время изучается. Углеводороды на-
капливаются в клеточной стенке, их синтез связан с метаболической активностью
водоросли в фазе роста. Выход углеводородов при создании оптимальных условий
культивирования может достигать 60 т/га*год для культуры водорослей, выращи-
ваемой в толще воды в природных или искусственных условиях. Для определения
перспективности использования В.braunii необходимо провести следующие иссле-
дования :
- определить условия, обеспечивающие максимальную скорость роста и образо-
вания углеводов в лабораторных и полевых условиях;
- выяснить, можно ли добиться скорости роста В.braunii, сопоставимой с из-
вестной для других водорослей;
- разработать соответствующие методы выращивания, сбора и переработки;
- оценить применимость получаемого продукта как альтернативного источника
топлива и смазочных веществ. Исследования, связанные с выделением и возможно-
стью утилизации углеводородов В.braunii, могут также способствовать лучшему
пониманию вопроса о происхождении нефти.
Биотехнология обработки стоков
и контроль загрязнения воды
тяжелыми металлами
Развитие промышленности ведет к образованию большого количества отходов, в
том числе отходов, содержащих новые антропогенные компоненты. Методами био-
технологии эти отходы могут быть переработаны в полезные или безвредные про-
дукты.
Бытовые отходы делятся на 2 группы: твердые отходы и сточные воды.
Твердые бытовые отходы состоят из целлюлозосодержащих материалов (до 40 %
бумаги, 2.5% дерева, 8% текстиля) и пищевых отходов (40%). Наиболее экономич-
на и радикальна переработка их метановым брожением, в результате образуется
легко транспортируемое топливо - метан.
Сточные воды обычно содержат сложную смесь нерастворимых и растворимых ком-
понентов различной природы и концентрации. Бытовые отходы, как правило, со-
держат почвенную и кишечную микрофлору, включая патогенные микроорганизмы.
Сточные воды сахарных, крахмальных, пивных и дрожжевых заводов, мясокомби-
натов содержат в больших количествах углеводы, белки и жиры, являющиеся ис-
точниками питательных веществ и энергии.
Стоки химических и металлургических производств могут содержать значитель-
ное количество токсических и даже взрывчатых веществ. Серьезное загрязнение
возникает при попадании в окружающую среду соединений тяжелых металлов, таких
как железо, медь, олово и др.
Цель очистки сточных вод - удаление растворимых и нерастворимых компонен-
тов, элиминирование патогенных микроорганизмов и проведение детоксикации та-
ким образом, чтобы компоненты стоков не вредили человеку, не загрязняли водо-
емы. Бактерии рода Pseudomonas практически всеядны. Например, Р. putida могут
утилизировать нафталин, толуол, алканы, камфару и др. соединения. Выделены
чистые культуры микроорганизмов, способные разлагать специфические фенольные
соединения, компоненты нефти в загрязненных водах и т.д. Микроорганизмы рода
Pseudomonas могут утилизировать и необычные химические соединения - инсекти-
циды, гербициды и другие ксенобиотики. Генетически сконструированные штаммы
микроорганизмов в будущем смогут решить проблему очистки сточных вод и почв,
загрязненных пестицидами и другими антропогенными веществами.
Азотсодержащие соединения (белки, аминокислоты, мочевина) могут быть удале-
ны в биологическом процессе денитрификации-нитрификации. Биологическое удале-
ние азота и фосфора, являющихся причинами эвтрофикации (зарастания озер мик-
роводорослями, которые бурно размножаются, затем отмирают, давая пищу аэроб-
ным бактериям, потребляющими кислород, что приводит к замору рыбы) озер и ка-
налов , находится в стадии экспериментов.
Тяжелые металлы затрудняют биологические процессы очистки стоков и отрица-
тельно влияют на флору и фауну. Природные штаммы микроорганизмов не могут
быть использованы для накопления этих металлов в силу их высоко токсичности.
Однако, есть белок высших организмов - металлотионеин, который активно связы-
вает различные тяжелые металлы. Ген, кодирующий синтез мышиного металлотио-
неина, клонирован в бактериях. Это открывает возможность получения белка в
больших количествах с использование иммобилизованных бактерий и его использо-
вания для связывания и экстракции тяжелых металлов.
Сельскохозяйственная
биотехнология
Биологическая азотфиксация - процесс фиксации атмосферного азота бактерия-
ми, живущими в симбиозе с представителями семейства бобовых. Для ускорения
заселения ризосферы обычно используют бактериальные удобрения, содержащие
культуры азотфиксирующих микроорганизмов, например, клубеньковых бактерий.
Методами генной инженерии выведены мутанты клубеньковых бактерий с повышенной
способностью к азотфиксации. Ведутся работы по созданию азотфиксирующих рас-
тений, способных к симбиозу со злаковыми.
Микробные инсектициды. В последнее время все чаще появляются данные о мута-
генном и канцерогенном действии химических пестицидов, которые плохо разруша-
ются и накапливаются в окружающей среде.
Для получения микробных инсектицидов используются вирусы, грибы, простей-
шие, наиболее удобны - спорообразующие бактерии. Микробные инсектициды высоко
специфичны и действуют только на определенные вредные насекомые, оставляя не-
вредимыми полезные. Патогенность микроорганизмов вызвана действием определен-
ных токсинов, поэтому выработки устойчивости к биопрепаратам у насекомых не
происходит.
Микробные пестициды подвержены биодеградации. Микроорганизмы могут регули-
ровать рост растений и животных, подавлять заболевания. Некоторые бактерии
изменяют кислотность и соленость почвы, другие продуцируют соединения, связы-
вающие железо, третьи - вырабатывают регуляторы роста. Как правило, микроор-
ганизмами инокулируют семена и или растения перед посадкой.
В животноводстве биотехнология также находит применение. Это диагностика,
профилактика, лечение заболеваний с использованием техники моноклональных ан-
тител, генетическое улучшение пород животных. Некоторые вещества, полученные
с помощью микроорганизмов могут использоваться в виде кормовых добавок, дру-
гие - подавляют вредную микрофлору в желудочно-кишечном тракте или стимулиру-
ют образование специфических микробных метаболитов.
Подробнее вопросы бактериальных удобрений и энтомопатогенных препаратов для
сельского хозяйства рассматриваются в главе: "Биотехнология препаратов для
сельского хозяйства", а генно-инженерных модификаций сельскохозяйственных
растений и животных в разделе "трансгенные животные".
Биогеотехнология
Некоторые микроорганизмы могут катализировать определенные окислительно-
восстановительные реакции - окисление Ее и Мп в воде, окисление серосодержа-
щих соединений, окисление-восстановление азотсодержащих соединений. Аэробные
бактерии могут выделять железо, медь, сульфаты.
Биогеотехнология - использование геохимической деятельности микроорганизмов
в горнодобывающей промышленности. Это экстракция и концентрирование металлов
при биологической очистке сточных вод предприятий горнодобывающей промышлен-
ности и флотационных процессах: выщелачивание бедных и отработанных руд, де-
сульфирование каменного угля, окисление пиритов и пиритсодержащих пород.
Своими корнями биогеотехнология уходит в геологическую микробиологию. Мик-
роорганизмы принимали и принимают активное участие в геологических процессах.
Биологические свойства различных групп микроорганизмов и особенности их жиз-
недеятельности в месторождениях полезных ископаемых составляют научные основы
биогеотехнологии.
Биогеотехнология стихийно зародилась еще в XVI в. До нас дошли сведения о
том, что в те далекие времена в Венгрии для получения меди груды добытой руды
орошали водой. Этот нехитрый технологический прием оказался прообразом совре-
менного бактериально-химического метода кучного выщелачивания металлов из
руд. Конечно, тогда еще не знали, что используемый процесс получения меди по
своей природе является микробиологическим. Это стало известно только в 1922
г. благодаря работам немецких ученых Рудольфа и Хельброннера. По-видимому,
1922 г. следует считать официальной датой рождения биогеотехнологии. В даль-
нейшем биогеотехнология развивалась неровно и своего совершеннолетия достигла
к началу 80-х годов нашего века. К этому времени наряду с бактериальным выще-
лачиванием металлов сформировались и другие разделы биогеотехнологии — удале-
ние серы из углей, борьба с метаном в угольных шахтах, повышение нефтеотдачи
пластов.
Биогеотехнология выщелачивания металлов — использование главным образом
тионовых (окисляющих серу и серосодержащие соединения) бактерий для извлече-
ния металлов из руд, рудных концентратов и горных пород. При переработке бед-
ных и сложных руд тысячи и даже миллионы тонн ценных металлов теряются в виде
отходов, шлаков, «хвостов». Происходят также выбросы вредных газов в атмосфе-
ру. Бактериально-химическое выщелачивание металлов уменьшает эти потери. Ос-
нову этого процесса составляет окисление содержащихся в рудах сульфидных ми-
нералов тионовыми бактериями. Окисляются сульфиды меди, железа, цинка, олова,
кадмия ит. д. При этом металлы из нерастворимой сульфидной формы переходят в
сульфаты, хорошо растворимые в воде. Из сульфатных растворов металлы извлека-
ются путем осаждения, экстракции, сорбции. Одним из возможных путей извлече-
ния металлов из растворов является адсорбция металлов клетками живых микроор-
ганизмов , так называемая биосорбция металлов. Металлы включаются в состав
специфических белков - металлотионеинов. Полезными для биогеотехнологии добы-
чи металлов свойствами обладает целый ряд микроорганизмов. Но основным из
них, безусловно, является открытый в 1947 г. Колмером и Кинкелем вид тионовых
бактерий, названный Thiobacillus ferrooxidans. Необходимую для роста энергию
эти бактерии получают при окислении восстановленных соединений серы и двухва-
лентного железа в присутствии свободного кислорода. Они окисляют практически
все известные в настоящее время сульфиды металлов. Источником углерода для
роста бактерий служит при этом углекислый газ. Характерной особенностью их
физиологии является потребность в очень кислой среде. Они развиваются при pH
от 1 до 4,8 с оптимумом при 2—3. Интервал температур, в котором могут разви-
ваться бактерии этого вида, составляет от 3 до 40 ° С с оптимумом при 28°С.
Тионовые бактерии широко распространены в природе. Они обитают в водоемах,
почвах, угольных и золоторудных месторождениях. В значительных количествах
встречаются они в месторождениях серных и сульфидных руд. Но в условиях есте-
ственного залегания таких руд активность тионовых бактерий сдерживается от-
сутствием кислорода. При разработке сульфидных месторождений руды вступают в
контакт с воздухом, и в них развиваются микробиологические процессы, приводя-
щие к выщелачиванию металлов. Применяя определенные биотехнологические меро-
приятия , этот естественный процесс можно ускорить.
Основной технологической операцией этого способа является орошение отвалов
добытой руды растворами, содержащими серную кислоту, ионы двух- и трехвалент-
ного железа, а также жизнеспособные клетки тионовых бактерий. Иногда для уси-
ления процессов выщелачивания внутрь отвала подают воздух. В таких условиях
выщелачивающий раствор фильтруется через толщу руды и в результате микробио-
логических и химических процессов обогащается извлекаемыми из руды металлами.
Затем этот раствор собирают с помощью системы коллекторов, и из него извлека-
ют металлы одним из физико-химических методов. Ежегодно в мире таким способом
добывают сотни тысяч тонн меди, или примерно 5 % от ее общей добычи. В ряде
стран этим способом получают также значительные количества урана.
Биогеотехнология обессеривания углей — использование тионовых бактерий для
удаления серосодержащих соединений из углей. Как бурые, так и каменные угли
нередко содержат значительные количества серы. Общее содержание серы в углях
может достигать 10—12 %. При сжигании углей содержащаяся в них сера превраща-
ется в сернистый газ, который поступает в атмосферу, где из него образуется
серная кислота. Из атмосферы серная кислота выпадает на поверхность земли в
виде сернокислотных дождей.
По имеющимся данным, в некоторых странах Западной Европы в год на 1 га зем-
ли с дождями выпадает до 300 кг серной кислоты. Нетрудно себе представить,
какой ущерб наносят кислотные дожди здоровью человека, его хозяйственной дея-
тельности и окружающей природе. Кроме этого, высокосернистые угли плохо кок-
суются и поэтому не могут быть использованы в цветной металлургии. Микробное
удаление серы из углей, по мнению специалистов, является экономически выгод-
ным, и с ним связывают надежды на решение проблемы сернокислотных дождей.
Первые опыты по направленному удалению серы из угля с использованием микро-
организмов были выполнены в 1959 г. в нашей стране 3. М. Зарубиной, Н. Н. Ля-
ликовой и Е. И. Шмук. В результате этих опытов за 30 суток с участием бакте-
рий Th. ferrooxidans из угля было удалено 23—30 % серы. Позднее несколько ра-
бот по микробиологическому обессериванию угля было опубликовано американскими
исследователями. Им удалось с помощью тионовых бактерий снизить содержание
пиритной серы в каменном угле за четверо суток почти на 50 %.
Этот метод будет сопровождаться попутным выщелачиванием различных металлов.
Известно, что в заметных количествах содержится в углях германий, никель, бе-
риллий , ванадий, золото, медь, кадмий, свинец, цинк, марганец. Попутное полу-
чение ценных металлов при десульфуризации угля должно дать дополнительный
экономический эффект.
Работы по удалению пиритной серы из угля микробиологическим путем проводят-
ся сейчас во многих странах мира. По последним сообщениям в лабораторных ус-
ловиях удается снизить содержание серы в угле путем микробиологического выще-
лачивания за 5 суток почти на 100 %. Микробиологический способ десульфуриза-
ции углей рассматривается как весьма перспективный.
Биогеотехнология и борьба с метаном в угольных шахтах — использование мета-
нокисляющих бактерий для снижения концентрации метана в угольных пластах и
выработанных пространствах.
В пластах каменного угля содержится огромное количество метана, достигающее
сотни кубометров в 1 т угля. При этом чем глубже залегает уголь в недрах зем-
ли, тем больше метана он содержит. При подземной добыче угля метан из разра-
батываемых угольных пластов и образующихся при этом выработанных пространств
поступает в атмосферу шахт. Скопления этого взрывоопасного газа в горных вы-
работках создают постоянную угрозу для жизни шахтеров. Известны случаи круп-
ных взрывов метана в угольных шахтах мира, унесшие сотни человеческих жизней.
Традиционные средства борьбы с метаном в угольных шахтах (вентиляция, ваку-
умная дегазация, увлажнение пластов водой) в условиях постоянной интенсифика-
ции горных работ и перехода на все более глубокие угленосные горизонты часто
уже не могут обеспечить одновременно высокий уровень угледобычи и безопасные
условия труда. В основе биогеотехнологических способов борьбы с метаном лежит
процесс поглощения этого газа метанокисляющими бактериями в угольных пластах
и выработанных пространствах. На данном уровне развития наук этот процесс
представляет собой единственную возможность разрушения молекулы метана при
температурах разрабатываемых угленосных толщ.
Идея об использовании метанокисляющих бактерий для борьбы с метаном в
угольных шахтах принадлежит советским ученым. В 1939 г. А. 3. Юровский, Г. П.
Капилаш и Б. В. Мангуби предложили применять эти бактерии для снижения выде-
ления метана из выработанных пространств. Несмотря на широкое распространение
метанокисляющих бактерий в природе, в угольных пластах и прилегающих породах
они отсутствуют. Поэтому необходимое количество активных метанокисляющих бак-
терий выращивают в ферментерах и в виде суспензии в питательной среде подают
в поровый объем угольных пластов и выработанные пространства. Рабочая суспен-
зия приготовляется непосредственно в шахте. В рудничную воду добавляют задан-
ное количество биомассы метанокисляющих бактерий и недостающие для их актив-
ной жизнедеятельности минеральные соли. Обычно это минеральные соединения
азота и фосфора. В угольный пласт рабочая суспензия нагнетается насосами че-
рез скважины, пробуренные по углю или из подземных выработок, или с поверхно-
сти земли: 1 т угля может принять 20—40 л рабочей суспензии. В угле микроор-
ганизмы распределяются по трещинам и порам.
Таким путем осуществляется насыщение угля метаноокисляющими бактериями. Но
для развития этих бактерий необходим свободный кислород, которого нет в
угольных пластах. Поэтому в насыщенный метанокисляющими бактериями участок
угольного пласта через те же скважины компрессором постоянно прокачивается
воздух. В таких условиях бактерии потребляют содержащийся в угле метан, и за
счет этого происходит уменьшение исходной газоносности угольного пласта. Мик-
робиологические способы борьбы с метаном были неоднократно испытаны в уголь-
ных шахтах. Поступление метана как из угольных пластов, так и из выработанных
пространств в ходе этих испытаний было снижено в среднем в 2 раза. При прочих
равных условиях это позволяет повышать добычу угля примерно в 1,5 раза.
Биогеотехнология и повышение нефтеотдачи пластов — использование различных
групп микроорганизмов для увеличения вторичной добычи нефти.
Нефть, как известно, является в настоящее время основным энергетическим и
химическим сырьем. Однако по некоторым прогнозам мировые запасы нефти могут
быть исчерпаны уже в течение ближайших 50 лет. Вместе с тем существующая тех-
нология позволяет извлекать только половину нефти, содержащейся в месторожде-
ниях. Это обусловлено прочной связью нефти с вмещающими ее породами. Повыше-
ние нефтеотдачи пластов на 10— 15 % было бы равносильно открытию новых место-
рождений . В связи с этим в настоящее время заметно возрос интерес к поиску
путей и средств повышения вторичной добычи нефти.
Один из способов предполагает использование комплекса углеводородокисляющих
и метанобразующих бактерий для увеличения нефтеотдачи пластов основано на ак-
тивации геохимической деятельности этих микробов в нефтяной залежи, куда они
попадают вместе с закачиваемыми через скважины поверхностными водами. Актива-
ция названных микробиологических процессов достигается путем аэрации закачи-
ваемых вод и добавления в них минеральных солей азота и фосфора. Недостаток
этих химических элементов чаще всего лимитирует активность микрофлоры в при-
родных условиях. Нагнетание в нефтяную залежь обогащенной кислородом и мине-
ральными солями воды приводит к образованию аэробной зоны в нефтеносном пла-
сте вокруг нагнетательной скважины. Здесь начинают интенсивно идти процессы
разрушения нефти аэробными углеводородокисляющими микробами. Это сопровожда-
ется накоплением углекислого газа, водорода и низкомолекулярных органических
кислот, которые поступают в анаэробную зону нефтяной залежи. Здесь они пре-
вращаются метанобразующими бактериями в метан. Разрушение нефти и образование
газов приводят к разжижению нефти и повышению газового давления в нефтеносном
пласте, что и должно сопровождаться увеличением добычи нефти из добывающих
скважин.
Биоэлектроника
В области электроники биотехнология может быть использована для создания
улучшенных типов биосенсоров и новых приводящих устройств, называемых биочи-
пы.
Биотехнология делает возможным создание устройств, в которых белки являются
основой молекул, действующих как полупроводники. Для индикации загрязнений
различного происхождения в последнее время стали использовать не химические
реагенты, а биосенсоры - ферментные электроды, а также иммобилизованные клет-
ки микроорганизмов. Ферменты обладают высочайшей чувствительностью.
Биоселективные датчики создают также путем нанесения на поверхность ионосе-
лективных электродов целых клеток микроорганизмов или тканей. Например,
Neurospora europea - для определения NH3, Trichosporon brassiacae - для опре-
деления уксусной кислоты.
В качестве сенсоров используют также моноклональные антитела, обладающие
исключительно высокой избирательностью. Лидерами в производстве биодатчиков и
биочипов являются японские компании, такие как Hitachi, Sharp. Например, ком-
пания Hitachi в начале 90-х годов создает проектную групп численностью в 200
человек исключительно для работ в области биоэлектроники. Компания Sharp про-
водит исследования по разработке компьютеров с биокомпонентами.
Появляется новый тип полупроводников, проводящую функцию в которых осущест-
вляют молекулы белков. Такие ферментные системы работают с большей скоростью,
чем кремниевые полупроводники. Биочипы имеют небольшие размеры, надежны и
способны к самосборке. Еще одна японская компания, Sony, запатентовала способ
производства высококачественных акустических систем из целлюлозы, образуемой
бактериями. Гелеобразная целлюлоза высушивается. Полученный материал имеет
структуру сот и используется в качестве плоской диафрагмы акустических сис-
тем.
Биотехнология в медицине
Антибиотики—самый большой класс фармацевтических соединений, синтез которых
осуществляется микробными клетками. К этому же классу относятся противогриб-
ковые агенты, противоопухолевые лекарства и алкалоиды. В 1980 г. мировое про-
изводство антибиотиков составляло примерно 25000 т, из них 17000 т — пеницил-
лины, 5000 т — тетрациклины, 1200 т — цефалоспорины и 800 т — эритромицины.
В 1945 г. Бротзу из Института гигиены в Кальари (Сардиния) выделил из пробы
морской воды плесень Cephalosporium acremonium, синтезирующую несколько анти-
биотиков ; один из них, цефалоспорин С, оказался особенно эффективен против
устойчивых к пенициллину грамположительных бактерий.
Из нескольких тысяч открытых антибиотиков львиная доля принадлежит актино-
мицетам. Среди актиномицетов наибольший вклад вносит род Streptomyces, вклю-
чая тетрациклины (один только вид Streptomyces griseus синтезирует более пя-
тидесяти антибиотиков). Наиболее распространенными с коммерческой точки зре-
ния оказались пенициллины, цефалоспорины и тетрациклины. Начиная с середины
1960-х гг. в связи с возросшей сложностью выделения эффективных антибиотиков
и распространением устойчивости к наиболее широко применяемым соединениям у
большого числа патогенных бактерий исследователи перешли от поиска новых ан-
тибиотиков к модификации структуры уже имеющихся. Они стремились повысить эф-
фективность антибиотиков, найти защиту от инактивации ферментами устойчивых
бактерий и улучшить фармакологические свойства препаратов.
Большинство исследований было сосредоточено на пенициллинах и цефалоспори-
нах, структура которых включает четырехчленное b-лактамное кольцо. Добавление
к b-лактамному кольцу метоксильной (СН3О)-группы привело к появлению цефами-
цинов, близких к цефалоспоринам и эффективных как против грамотрицательных,
так и против пенициллиноустойчивых микробов. Полусинтез состоит в замене хи-
мическим путем одной боковой цепи b-лактамного кольца на другую в полученной
ферментацией молекуле. Устойчивость к пенициллинам и цефалоспоринам связана с
наличием ферментов, так называемых Ь-лактамаз, которые широко распространены
среди бактерий, актиномицетов, цианобактерий и дрожжей. Так как гены, коди-
рующие эти ферменты, находятся в составе плазмид, устойчивость может переда-
ваться при переносе плазмид от одного бактериального штамма к другому. Иссле-
дователи фирмы «Мерк, Шарп и Доум» открыли новый класс b-лактамных антибиоти-
ков, тиенамицины, продуцируемых Streptomyces cattleya. Тиенамицины чрезвычай-
но эффективны против грамположительных и грамотрицательных бактерий, а также
способны ингибировать b-лактамазы, что значительно повышает возможности этих
антибиотиков. К ингибиторам b-лактамаз относятся также клавулановая и олива-
новая кислоты, идентифицированные исследователями английской фармацевтической
компании «Бичем». Компания выпустила новый антибиотик, аугментин, который
представляет собой комбинацию b-лактамного антибиотика амоксициллина и клаву-
лановой кислоты.
Антибиотики вырабатываются в результате совместного действия продуктов 10—
30 генов, поэтому практически невозможно обнаружить отдельные спонтанные мута-
ции, которые могли бы повысить выход антибиотика с нескольких миллиграммов на
литр в штамме дикого типа до 20 г/л и более пенициллина или тетрациклина в
промышленных штаммах Penicillium chrysogenum или Streptomyces auerofaclens.
Эти высокопродуктивные штаммы были получены в результате последовательных
циклов мутагенеза и селекции. В результате мутаций появились новые вторичные
метаболиты, в том числе 6-деметилхлортетрациклин и 6-деметилтетрациклин. Оп-
ределенные мутанты, так называемые идиотрофы, способны синтезировать только
половину молекулы антибиотика, а среда должна быть обогащена другой ее поло-
виной. Такая форма мутационного биосинтеза привела к открытию новых производ-
ных антибиотиков, среди них принадлежащие к аминоциклитольной группе.
Число противоопухолевых веществ микробного происхождения довольно ограни-
ченно . Блеомицин, выделенный Умезавой с сотр. в Токийском институте микробной
химии из культур Streptomyces verticilliis, представляет собой гликопептид,
который действует, разрывая ДНК опухолевых клеток и нарушая репликацию ДНК и
РНК. Другая группа противоопухолевых агентов создана на основе комбинации
аминогликозпдной единицы и молекулы антрациклина. Недостатком обоих соедине-
ний является их потенциальная опасность для сердца.
В медицине применяют также аминокислоты, например, аргинин. В сочетании с
аспартатом или глутаматом он помогает при заболевании печени. K-Na-аспартат
снимает усталость и облегчает боли в сердце, его рекомендуют при заболевании
печени и диабете. Цистеин защищает SH-ферменты в печени и других тканях от
окисления и оказывает детоксицирующее действие. Он проявляет также защитное
действие от повреждения, вызываемых облучением. Дигидроксифенилаланин и D-
фенилаланин эффективны при болезни Паркинсона. Из полиаминокислот получают
хороший материал для хирургии.
В медицине также используют зеленую водоросль Scenedesmus. Ее культивируют
в жидкой питательной среде (установки дают до 80 тонн водорослей в год), из-
влекают и проводят экстракцию этиловым спиртом. Биомассу отделяют и подверга-
ют ферментативному гидролизу щелочной протеазой. Около 50% белков при этом
распадается до пептидов. Гидролизат содержит почти все незаменимые аминокис-
лоты, представляет собой порошок желтовато-зеленого цвета с приятным запахом
и вкусом. Используется этот продукт для быстрого восстановления организма, а
также как компонент косметических средств. Если вместо обработки этанолом
провести двукратную экстракцию дистиллированной водой, а затем высушить, то
получается порошок светло-желтого цвета. Его используют как биостимулятор и
готовят из него препараты для лечения плохо заживающих ран.
Еще в начале 90-х годов появились статьи, в которых рассматривались пер-
спективы использования сапротрофной микрофлоры как продуцента биологически
активных веществ (БАБ). Предполагается вводить в организм сапрофитные микро-
организмы, которые могли бы жить в условиях симбиоза с нормальной микрофлорой
организма. Вещества, вырабатываемые бактериальными штаммами включаются в сис-
тему биохимических процессов организма. В случае нарушения нормального биохи-
мического статуса организма они корректируют его, а при патологическом про-
цессе - задерживают его или способствуют прекращению. Такое введение получило
название «микробиологическая подсадка». К 1992 году было описано уже более 50
таких штаммов и проанализирован диапазон биологических эффектов секретируемых
БАВ. Для лечения широкого спектра заболеваний (бактериальные инфекции кишеч-
ника, дыхательных путей, гнойных инфекций, аллергий) успешно применяются
штаммы Bacillus subtilis (препарат «Бактисубтил», например, используют при
лечении диареи). Штаммами Е. coli лечат ряд кишечных заболеваний. БАВ, секре-
тируемые сапротрофами, могут регулировать ферментативные процессы в организме
и вступать во взаимодействие с поступающими в организм ксенобиотиками. Штаммы
можно получать непосредственно от человека, тогда они будут представлять его
естественную микрофлору. Можно целенаправленно выводить лабораторные мутант-
ные штаммы, в том числе методами генной инженерии и вводить их в организм.
Способы введения могут быть различны: капсулы, растворимые в кишечном соке,
культуры штаммов-продуцентов на пленочной основе, в виде свечей, а при легоч-
ных заболеваниях - в виде аэрозолей.
Новым направлением в медицине является использование ферментных препаратов
типа «контейнер», изготовление которых стало возможным появлению и совершен-
ствованию методов иммобилизации веществ. Эти препараты представляют собой
микросферы с более или менее твердой и проницаемой оболочкой. Назначение этих
лекарственных препаратов различное. Первым типом «искусственных клеток» сле-
дует назвать микрокапсулы. Фермент, находящийся внутри оболочки, не контакти-
рует с жидкостями и тканями организма, не разрушается протеиназами, не инги-
бируется, не вызывает иммунного ответа организма. Основное достоинство микро-
капсул заключается в том, что их можно имплантировать в нужное место, напри-
мер в непосредственной близости от опухоли. При этом микрокапсула с соответ-
ствующим содержанием будет перерабатывать метаболиты, необходимые для роста
опухолевой ткани, и эта ткань не будет развиваться. Капсулы могут содержать
микроскопические участки тканей. Например, имеются экспериментальные данные
по созданию депо инсулина путем имплантации микрокапсул, содержащих островки
Лангерганса, синтезирующие в поджелудочной железе инсулин. Известно, что те-
рапии диабетических заболеваний уделяется много внимания. Имплантация лекар-
ственного начала избавила бы пациентов от ежедневных инъекций инсулина.
Следует учитывать, что микрокапсулы, вводимые в кровь, могут забивать кро-
веносные сосуды и, следовательно, являться причиной образования тромбов. Од-
нако эффективность микрокапсул при использовании их в виде колонок для диали-
за в аппарате «искусственная почка» несомненна. При этом объем аппаратов и,
соответственно, количество необходимых и очень дорогих растворов резко сокра-
щается. Например, для микрокапсулированной «искусственной почки» требуется
колонка объемом всего 30 мл, которая работает почти в 100 раз быстрее обычно-
го аппарата. Развитие такой техники сдерживается пока высокой стоимостью, а
также необходимостью использовать уже существующую тоже очень дорогую техни-
ку. Вероятно, ферментные реакторы на микрокапсулах будут применяться для де-
градации недиализуемых материалов. Внутрь микрокапсул могут быть включены
магнитные частицы. В этом случае извне подводят магнитное поле и препарат
удерживают вблизи органа-мишени.
В ряде случаев используются высокомолекулярные соединения, растворимые в
определенных условиях и сохраняющие высокую прочность оболочек в других. Так
ведет себя ацетилфталилцеллюлоза, микрокапсулы из которой интактны в желудоч-
ном соке и растворяются в кишечнике, освобождая содержимое. Сейчас интенсивно
исследуются свойства микрокапсул, стенка которых состоит из оболочек эритро-
цитов. Содержимое эритроцитов удаляется, а «тень» заполняется ферментом.
Серьезные успехи достигнуты при лечении аспарагин-зависимых опухолей препара-
тами аспарагиназы в оболочках эритроцитов. Используются оболочки и других
клеток. Так, описаны лекарственные препараты, включенные в оболочки макрофа-
гов. Последние имеют тенденцию накапливаться в очагах воспалений, а следова-
тельно, могут транспортировать туда как низко-, так и высокомолекулярный ле-
карственный препарат. Существенной положительной стороной «теней» клеток в
качестве носителя является их полная совместимость с организмом пациента, по-
скольку этот носитель готовят на основе клеток, выделенных из крови пациента,
и возвращают их ему же с новым содержимым.
Задача введения лекарственного препарата в клетки может быть решена путем
создания контейнеров-переносчиков типа липосом или мицелл. Оболочка липосомы
представляет собой однослойную или многослойную поверхность, образованную, в
свою очередь, бислойной структурой, созданной соединениями, имеющими два гид-
рофобных, достаточно протяженных участка и гидрофильную группу. Гидрофобные
концы слипаются между собой и образуют пленку, обе стороны которой гидрофиль-
ны. Липосома, специфически или неспецифически адсорбировавшись на клетке, мо-
жет быть поглощена ею путем фагоцитоза, и фермент внутри высвобождается.
Хорошо известно, что протеиназы, расщепляя денатурированные белки, способ-
ствуют очищению ран, и следовательно, их заживлению. В этом направлении в
клинической практике с помощью иммобилизованных протеиназ сделано многое. В
качестве носителей для иммобилизации протеолитических ферментов наиболее
употребимы волокнистые материалы на основе целлюлозы, поливинилового спирта,
солей альгиновой кислоты, полиамидное и коллагеновое волокно. Готовят нити, в
которые при формовании включают фермент и используют их в качестве шовного
материала. Сравнительный анализ действия нативных и иммобилизованных протеи-
наз (в основном химотрипсина, трипсина, коллагеназы) показал, что уже на 2-4-
й день рана очищается от некротических масс и по крайней мере вдвое быстрее
наступает грануляция. Убедительные результаты получены при лечении трофиче-
ских язв, лучевых язв кожи. Особенно эффективны иммобилизованные протеиназы
при предоперационной подготовке и после пластических операций. Иммобилизован-
ные протеолитические ферменты с большим успехом применяются в лечении гнойных
заболеваний легких и плевры.
Биотехнологии в
пищевой промышленности
Статистические данные ООН по вопросам продовольствия и сельского хозяйства
свидетельствуют о том, что проблема обеспечения населения нашей планеты про-
дуктами питания внушает серьезные опасения. По этим данным, более половины
населения Земли не обеспечено достаточным количеством продуктов питания, при-
мерно 500 млн. людей голодают, а около 2 млрд, питаются недостаточно или не-
правильно. К концу XX в. население нашей планеты с учетом контроля рождаемо-
сти составило 7,5 млрд. человек. Следовательно, тяжелое уже сейчас положение
с продуктами питания может принять в недалеком будущем для некоторых народов
угрожающие масштабы.
Пища должна быть разнообразной и содержать белки, жиры, углеводы и витами-
ны. Источники энергии — жиры и углеводы в определенных пределах взаимозаме-
няемы, причем их можно заменить и белками, но белки нельзя заменить ничем.
Проблема питания людей в конечном счете заключается в дефиците белка. Там,
где сегодня люди голодают, не хватает прежде всего белка. Установлено, что
ежегодный дефицит белка в мире, по самым скромным подсчетам, оценивается в 15
млн. т. Наибольшую популярность как источники белка приобрели семена маслич-
ных культур — сои, семян подсолнечника, арахиса и других, которые содержат до
30 процентов высококачественного белка. По содержанию некоторых незаменимых
аминокислот он приближается к белку рыбы и куриных яиц и перекрывает белок
пшеницы. Белок из сои широко уже используется в США, Англии и других странах
как ценный пищевой материал.
Эффективным источником белка могут служить водоросли. Увеличить количество
пищевого белка можно и за счет микробиологического синтеза, который в послед-
ние годы привлекает к себе особое внимание. Микроорганизмы чрезвычайно богаты
белком — он составляет 70—80 процентов их веса. Скорость его синтеза огромна.
Микроорганизмы примерно в 10—100 тысяч раз быстрее синтезируют белок, чем жи-
вотные. Здесь уместно привести классический пример: 400-килограммовая корова
производит в день 400 граммов белка, а 400 килограммов бактерий — 40 тысяч
тонн. Естественно, на получение 1 кг белка микробиологическим синтезом при
соответствующей промышленной технологии потребуется средств меньше, чем на
получение 1 кг белка животного. Да к тому же технологический процесс куда ме-
нее трудоемок, чем сельскохозяйственное производство, не говоря уже об исклю-
чении сезонных влияний погоды — заморозков, дождей, суховеев, засух, освещен-
ности , солнечной радиации и т. д.
Применяя обычные технологические линии по производству синтетических воло-
кон, можно получать из искусственных белков длинные нити, которые после про-
питки их формообразующими веществами, придания им соответствующего вкуса,
цвета и запаха могут имитировать любой белковый продукт. Таким способом уже
получены искусственное мясо (говядина, свинина, различные виды птиц), молоко,
сыры и другие продукты. Они уже прошли широкую биологическую апробацию на жи-
вотных и людях и вышли из лабораторий на прилавки магазинов США, Англии, Ин-
дии, стран Азии и Африки. Только в одной Англии их производство достигает
примерно 1500 тонн в год. Интересно, что белковую часть школьных обедов в США
уже разрешено на 30 процентов заменять искусственным мясом, созданным на ос-
нове соевого белка.
Используемое в питании больных Ричмондского госпиталя (США) искусственное
мясо получило высокую оценку главного диетолога. Правда, когда больным давали
антрекот из искусственного мяса, они жаловались на его тестоватость, хотя и
не знали и даже не догадывались о том, что получали не естественный продукт.
А когда мясо подавалось в виде мелко нарезанных кусочков, нареканий не было.
Обслуживающий персонал также употреблял искусственное мясо, не догадываясь о
подделке. Они воспринимали его как натуральную говядину. Врачи госпиталя от-
мечали также положительное влияние рациона на здоровье пациентов и особенно
больных атеросклерозом. В состав такого мяса обязательно включают специально
обработанный искусственный белок, небольшое количество яичного альбумина, жи-
ры, витамины, минеральные соли, природные красители, ароматизаторы и прочее,
что дает возможность «лепить» изделие с заданными свойствами, учитывая при
этом физиологические особенности организма, для которого продукт предназна-
чен . Это особенно важно в диете детей и людей пожилого возраста, больных и
выздоравливающих, когда необходимо лимитировать питание по целому ряду пище-
вых компонентов, что весьма трудно сделать, используя традиционные продукты.
Такое мясо можно резать, замораживать, консервировать, сушить или прямо ис-
пользовать для приготовления различных блюд.
Из 20 аминокислот, входящих в состав белков, 8 аминокислот люди не могут
синтезировать, и их относят к незаменимым. Это изолейцин, лейцин, лизин, ме-
тионин, треонин, триптофан, валин, фенилаланин. Аминокислоты — это не только
питательные вещества, но также ароматические и вкусовые агенты, и потому они
широко используются в пищевой промышленности.
Как питательную добавку в пищу чаще всего вносят лизин и метионин. Глутамат
натрия и глицин употребляют как ароматические вещества для усиления и улучше-
ния вкуса пищи. У глицина освежающий, сладкий вкус. Его вводят в сладкие на-
питки, и кроме того, он проявляет там бактериостатическое действие. Цистеин
предотвращает подгорание пищи, улучшает пекарские процессы и качество хлеба.
Благодаря некоторым бактериям удается получать около 100 г/л глутаминовой
аминокислоты. Ежегодно в мире производят микробиологическим способом 270 000
т этой аминокислоты, основная часть которой идет в пищевую промышленность. По
объему продукции второе место после глутаминовой кислоты занимает лизин — 180
000 т в год. Другие аминокислоты производят в гораздо меньших количествах.
Аминокислоты в большом количестве применяют как добавку к растительным кор-
мам, которые дефицитны по метионину, треонину, триптофану и особенно по лизи-
ну. Если в животных белках содержится 7—9 % лизина, то в белках пшеницы —
только около 3 %. Внесение в корма лизина до содержания 0,3 % позволяет со-
кратить их расход больше чем на 20 %. За последние 8 лет количество аминокис-
лот, добавляемых в корма, выросло в 14 раз. Во многих странах метионин добав-
ляют к соевой муке — белковой добавке кормов. Главная область практического
применения аминокислот — обогащение кормов. Около 66 % общего количества ами-
нокислот, получаемых в промышленности, используют в кормах, 31 % — в пище и 4
% — в медицине, косметике и как химические реактивы. На основе аминокислот
готовят искусственный подсластитель — метиловый эфир L-аспартил-Ь-
фенилаланина, который в 150 раз слаще, чем глюкоза.
Биотехнология молочных продуктов3
Спектр продуктов питания, получаемых при помощи микроорганизмов, обширен.
Это продукты, получаемые в результате брожения - хлеб, сыр, вино, пиво, тво-
рог и так далее. До недавнего времени биотехнология использовалась в пищевой
промышленности с целью усовершенствования освоенных процессов и более умелого
использования микроорганизмов, но будущее здесь принадлежит генетическим ис-
следованиям по созданию более продуктивных штаммов для конкретных нужд, вне-
дрению новых методов в технологии брожения.
Получение молочных продуктов в пищевой промышленности построено на процес-
сах ферментации. Основой биотехнологии молочных продуктов является молоко.
Молоко (секрет молочных желез) - уникальная естественная питательная среда.
Она содержит 82-88% воды и 12-18% сухого остатка. В состав сухого молочного
остатка входят белки (3,0-3,2%), жиры (3,3-6,0%), углеводы (молочный сахар
лактоза - 4,7%), соли (0,9-1%), минорные компоненты (0,01%): ферменты, имму-
ноглобулины, лизоцим и т.д. Молочные жиры очень разнообразны по своему соста-
ву. Основные белки молока - альбумин, казеин. Благодаря такому составу молоко
представляет собой прекрасный субстрат для развития микроорганизмов. В сква-
шивании молока обычно принимают участие стрептококки и молочнокислые бакте-
рии. Путем использования реакций, которые сопутствуют главному процессу сбра-
живания лактозы получают и другие продукты переработки молока: сметану, йо-
гурт, сыр и т.д. Свойства конечного продукта зависят от характера и интенсив-
ности реакций ферментации. Те реакции, которые сопутствуют образованию молоч-
ной кислоты, определяют обычно особые свойства продуктов. Например, вторичные
реакции ферментации, идущие при созревании сыров, определяют вкус отдельных
их сортов. В таких реакциях принимают участие пептиды, аминокислоты и жирные
кислоты, находящиеся в молоке.
Все технологические процессы производства продуктов из молока делятся на
две части: 1) первичная переработка - уничтожение побочной микрофлоры; 2)
вторичная переработка. Первичная переработка молока включает в себя несколько
этапов. Сначала молоко очищается от механических примесей и охлаждается, что-
бы замедлить развитие естественной микрофлоры. Затем молоко сепарируется (при
производстве сливок) или гомогенизируется. После этого проводят пастеризацию
молока, при этом температура поднимается до 80°С, и оно закачивается в танки
или ферментеры. Вторичная переработка молока может идти двумя путями: с ис-
пользованием микроорганизмов и с использованием ферментов. С использованием
микроорганизмов выпускают кефир, сметану, творог, простокваши, казеин, сыры,
биофруктолакт, биолакт, с использованием ферментов - пищевой гидролизат ка-
зеина , сухую молочную смесь для коктейлей и т.д. При внесении микроорганизмов
в молоко лактоза гидролизуется до глюкозы и галактозы, глюкоза превращается в
молочную кислоту, кислотность молока повышается, и при pH 4-6 казеин коагули-
рует .
Молочнокислое брожение бывает гомоферментативным и гетероферментативным.
При гомоферментативном брожении основным продуктом является молочная кислота.
При гетероферментативном брожении образуются диацетил (придающий вкус сливоч-
ному маслу), спирты, эфиры, летучие жирные кислоты. Одновременно идут протео-
3 Вряд ли целесообразно относить этот раздел к биотехнологии, скорее его следует отнести к
пищевой промышленности, которая тоже использует микробиологические процессы. В частности мо-
лочнокислые бактерии работают при солении капусты и огурцов и в еще многих пищевых производ-
ствах. На пике популярности биотехнологии появилось много литературы типа «Биотехнология
производства мяса». Из них выдержки и перекочевывают в обзоры и учебники по биотехнологии.
литические и липолитические процессы, что делает белки молока более доступны-
ми и обогащает дополнительными вкусовыми веществами.
Для процессов ферментации молока используются чистые культуры микроорганиз-
мов, называемые заквасками. Исключение составляют закваски для кефиров, кото-
рые представляют естественный симбиоз нескольких видов молочнокислых грибков
и молочнокислых бактерий. Этот симбиоз в лабораторных условиях воспроизвести
не удалось, поэтому поддерживается культура, выделенная из природных источни-
ков . При подборе культур для заквасок придерживаются следующих требований:
- состав заквасок зависит от конечного продукта (например, для получения
ацидофилина используется ацидофильная палочка, для производства простокваши -
молочнокислые стрептококки);
- штаммы должны отвечать определенным вкусовым требованиям; - продукты
должны иметь соответствующую консистенцию, от ломкой крупитчатой до вязкой,
сметанообразной;
- определенная активность кислотообразования;
- фагорезистентность штаммов (устойчивость к бактериофагам);
- способность к синерезису (свойству сгустка отдавать влагу);
- образование ароматических веществ; - сочетаемость штаммов (без антагониз-
ма между культурами);
- наличие антибиотических свойств, т.е. бактериостатическое действие по от-
ношению к патогенным микроорганизмам;
- устойчивость к высушиванию.
Культуры для заквасок выделяются из природных источников, после чего прово-
дится направленный мутагенез и отбор штаммов, отвечающих перечисленным выше
требованиям. Биотехнологии на основе молока включают, как правило, все основ-
ные стадии биотехнологического производства, которые можно рассмотреть на
примере сыроварения.
Сыроварение - один из древнейших процессов, основанных на ферментации. Сыры
бывают самые разнообразные - от мягких до твердых. Мягкие сыры содержат много
воды, 50-60%, а твердые - мало, 13-34%. На первом этапе идет подготовка моло-
ка (первичная обработка). На втором - готовится культура молочнокислых бакте-
рий. Микроорганизмы подбираются в определенной пропорции, обеспечивающей наи-
лучшее качество. Набор бактерий также зависит от температуры термообработки.
Третья стадия - стадия ферментации, - в сыроварении в некоторых случаях про-
исходит в 2 этапа, до и после стадии выделения. Сначала молоко инокулируют
определенными штаммами микроорганизмов, приводящими к образованию молочной
кислоты, а также добавляют сычужный фермент реннин. Реннин ускоряет превраще-
ние жидкого молока в сгусток (створаживание) в несколько раз. Эта реакция ак-
тивируется молочной кислотой, вырабатываемой бактериями. Функции реннина мо-
гут выполнять и другие протеиназы, но реннин также участвует в процессах про-
теолиза, происходящих в сыре при созревании. После образования сгустка сыво-
ротку отделяют, а полученную творожистую массу подвергают термообработке и
прессуют в формах. Далее сгусток солят и ставят на созревание. Иногда полу-
ченная масса происходит дополнительную обработку, которая заключается в еле-
дующем: заражение спорами голубых плесневых грибов при производстве рокфора;
нанесение на поверхность спор белых плесневых грибов при производстве камам-
бера и бри; нанесение бактерий, необходимых для созревания некоторых сыров.
Некоторые сыры после выделения должны подвергнуться дальнейшей ферментации
(стадия созревания). Микроорганизмы и ферменты в ходе этого процесса гидроли-
зуют жиры, белки и некоторые другие вещества молодого сыра. В результате их
распада образуются вещества, придающие сырам характерный вкус.
Процессы ферментации при производстве многих молочных продуктов, таких как
сметана, творог, многие сыры идут в ферментерах открытого типа. Как правило,
они занимают немного времени. К одним из самых простых относят производство
кефира, простокваш, сметаны и масла. Например, при производстве сметаны к
сливкам добавляют 0,5-1% закваски, используемой при производстве масла. Далее
продукт выдерживают, пока концентрация кислоты не достигнет 0,6%. В заключе-
ние хотелось бы добавить, что процессы получения молочнокислых продуктов
весьма просты и доступны для воспроизводства в домашних условиях. Они не тре-
буют строгих условий соблюдения стерильности, протекают, как правило, при
комнатной или чуть повышенной температуре. Собственно, изначально они были
одними из первых "домашних" биотехнологий, которые были позднее поставлены на
промышленную основу.
ОСНОВНЫЕ ТИПЫ БИОПРОЦЕССОВ
В настоящее время существуют следующие основные типы биопроцессов:
- производство биомассы (например, белок одноклеточных);
- клеточных компонентов (ферменты, нуклеиновые кислоты и т.д.)
- метаболитов (химические продукты метаболической активности), включая пер-
вичные метаболиты, такие как этанол, молочная кислота;
- вторичные метаболиты ;
- односубстратные конверсии (превращение глюкозы во фруктозу);
- многосубстратные конверсии (обработка сточных вод, утилизация лигноцеллю-
лозных отходов).
Производство биомассы
Человек традиционно получает белки, жиры и углеводы (основные компоненты
пищи) из животных и растительных источников. Уже сегодня эти источники не по-
крывают все увеличивающиеся потребности человечества. Выяснилось, что белки и
жиры микроорганизмов с успехом могут заменить белки и жиры традиционного про-
исхождения . Преимущества микроорганизмов как продуцентов белка состоит в вы-
соком содержании белка в биомассе и высокой скорости роста микроорганизмов.
Термин белок одноклеточных (БОК) был предложен в 1966 г. для обозначения
биомассы различных микроорганизмов (бактерий, дрожжей, грибов и водорослей).
Кроме высокого содержания белка микробная биомасса содержит также жиры, нук-
леиновые кислоты, витамины и минеральные компоненты. Источниками получения
пищевого белка могут стать также белковые изоляты из различных видов зеленой
биомассы, в т.ч. из табака.
Для получения БОК используют самые разнообразные субстраты, включая парафи-
ны нефти, метан, водород, метанол, этанол, уксусную кислоту, углекислый газ,
молочную сыворотку, мелассу, крахмал и целлюлозосодержащие отходы промышлен-
ности и сельского хозяйства.
Для промышленного использования перспективными являются термофильные (рас-
тущие при высоких температурах до 50° С) микроорганизмы. Качество биомассы
оценивается по высокому содержанию белка, низкому содержанию нуклеиновых ки-
слот и отсутствию вредных веществ.
Получение спиртов и полиолов
Некоторые дрожжи и бактерии способны продуцировать этанол и бутанол, а
также такие полиспирты как глицерин и 2,3-бутандиол. Эти продукты обычно син-
тезируют из нефти, однако микробное получение этанола и других спиртов вызы-
вает все больший интерес.
В России большая часть этанола получается микробиологическим путем из рас-
тительного сырья. Сдвиг в сторону получения микробиологического этанола на-
блюдается и в др. странах. Найдены бактерии Zymomonas mobilis4, которые вдвое
эффективнее сбраживают углеводы в этанол, чем дрожжи.
В Бразилии производство топливного спирта вносит наибольший вклад в энерго-
баланс страны и составляет миллиарды литров.
Ферментация мелассы различными видами Clostridium может быть использована
для получения не только этанола, но и ацетальдегида, уксусной кислоты, этил-
ацетата и диэтилового эфира. При изменении условий культивирования, например,
в условиях щелочной среды вместо этанола образуется глицерин.
Сырьем могут быть гидролизаты древесины, меласса, крахмал, молочная сыво-
ротка. Отходы производства этанола содержат белки, углеводы, рибофлавин и др.
витамины, и могут использоваться как кормовая добавка.
Штаммы-продуценты первичных метаболитов получают путем индуцированного му-
тагенеза, так как в природе мутации, ведущие к сверхпродукции одного из мета-
болитов вредны. Нарушения в обмене веществ приводят к снижению конкурентоспо-
собности и жизнеспособности микроорганизмов.
Производство вторичных метаболитов
Из всех продуктов, получаемых с помощью микробных процессов, наибольшее
значение имеют вторичные метаболиты. Вторичные метаболиты, называемые также
идиолитами, — низкомолекулярные соединения, не требующиеся для роста в чистой
культуре. Они производятся ограниченным числом таксономических групп и часто
представляют собой смесь близкородственных соединений, относящихся к одной и
той же химической группе.
К вторичным метаболитам относятся антибиотики, алкалоиды, гормоны роста
растений и токсины.
4
Выдерживают концентрацию этанола до 30%.
Молекулы антибиотиков очень разнообразны по составу и механизму действия на
микробную клетку. При этом в связи с возникновением устойчивости патогенных
микроорганизмов к старым антибиотикам постоянно существует потребность в но-
вых. В некоторых случаях природные микробные антибиотические продукты химиче-
ским или энзиматическим путем могут быть превращены в так называемые полусин-
тетические антибиотики, обладающие более высокими терапевтическими свойства-
ми .
Микроорганизмы, производящие вторичные метаболиты, вначале проходят стадию
быстрого роста, тропофазу, во время которой синтез вторичных веществ незначи-
телен. По мере замедления роста из-за истощения одного или нескольких необхо-
димых питательных веществ в культуральной среде микроорганизм переходит в
идиофазу; именно в этот период синтезируются идиолиты.
Эти особенности культурального роста необходимо учитывать при производстве.
Например, в случае антибиотиков большинство микроорганизмов в процессе тро-
пофазы чувствительно к собственным антибиотикам, однако во время идиофазы они
становятся к ним устойчивыми.
Чтобы уберечь микроорганизмы, продуцирующие антибиотики, от самоуничтоже-
ния, важно быстро достичь идиофазы и затем культивировать микроорганизмы в
этой фазе. Это достигается путем варьирования режимов культивирования и со-
ставом питательной среды на стадиях быстрого и медленного роста.
Микробные биотрансформации
Микроорганизмы способны осуществлять реакции трансформации, в которых те
или другие соединения превращаются в новые продукты. Условия протекания этих
реакций мягкие, и во многих случаях микробиологические трансформации предпоч-
тительнее химических.
Пример существующих крупномасштабных промышленных биоконверсий - производ-
ство уксуса из этанола, глюконовой кислоты из глюкозы.
Широко используется микробная модификация стероидов, которые являются слож-
ными полициклическими липидами. Теперь с использованием биоконверсии получают
кортизон, гидрокортизон, преднизолон и целый ряд других стероидов. Применение
и совершенствование микробной технологии в сотни раз снижает себестоимость
производства стероидов.
Производство ферментов
Получение ферментов с помощью микроорганизмов более выгодно, чем из расти-
тельных и животных источников. Микробные клетки продуцируют более 2 тысяч
ферментов, катализирующих биохимические реакции, связанные с ростом, дыханием
и образованием продуктов. Многие из этих ферментов могут быть выделены и про-
являют свою активность независимо от клетки.
В мире производится около 20 ферментов в объеме 65 тыс. тонн (а существует,
как предполагают 25000 ферментов). Например, промышленным способом производят
такие ферменты как амилаза, глюкоамилаза, протеаза, инвертаза, пектиназа, ка-
талаза, стрептокиназа, целлюлаза и др.
Амилазы и протеазы используют в текстильной, хлебопекарной и кожевенной
промышленности. Пектолитические ферменты могут быть использованы для мацера-
ции тканей при переработке растительного сырья, например при получении льно-
волокна. Щелочные протеазы, особенно иммобилизованные, очень эффективно ис-
пользуются в составе моющих средств. Кроме протеолитических ферментов в со-
став моющих средств вводят липазу, целлюлазу, оксидазу и амилазу для удаления
загрязнений крахмального происхождения. Использование иммобилизованной глюко-
зоизомеразы для непрерывного получения глюкозы является наиболее крупным про-
цессом такого рода в мире.
Микробные ферменты активно используют в клинической диагностике при опреде-
лении уровня холестерина в крови и мочевой кислоты. Ферменты предлагают ис-
пользовать для очистки канализационных и водопроводных труб и т.д. и т.п.
Ферменты для медицинских или аналитических целей должны быть высокоочищенны-
ми.
Для повышения стабильности выделенных ферментов используют технику иммоби-
лизации, т.е. связывания ферментов на поверхности нерастворимого в воде носи-
теля , например, органических полимеров, стекла, минеральных солей, силикатов
и т.п. Иммобилизованные ферменты (ИФ) можно длительное время использовать в
биохимических реакторах в условиях непрерывного процесса.
Примеры использования ИФ - изомеризация глюкозы во фруктозу, гидролиз бел-
ков , трансформация стероидов, гормонов и т.д. Новая область применения ИФ -
создание на их основе бессеребряных фотоматериалов. На основе действия фер-
ментов построены биолюминесцентные и иммуноферментные методы анализа, отличи-
тельной чертой которых является высокая чувствительность и абсолютная специ-
фичность .
Аминокислоты,
органические кислоты,
витамины и другие биопродукты
Производство аминокислот относится к одной из наиболее передовых областей
биотехнологии. Аминокислоты получают путем химического синтеза или экстракци-
ей из белковых гидролизатов.
Незаменимые аминокислоты могут получаться микробиологическим путем более
эффективно, чем путем химического синтеза.
За рубежом 60% мощностей по производству аминокислот занимают глутаминовая
кислота, далее идут метионин, лизин и глицин. Глутаминовая кислота произво-
дится при участии в качестве продуцента штамма Corynebacterium. С помощью
микроорганизмов можно получить до 60 органических кислот. Многие из них полу-
чаются в промышленном масштабе - итаконовая, молочная, уксусная, лимонная.
Лимонная кислота во всем мире успешно производится с помощью гриба
Aspergillus niger. Уксусную кислоту получают путем микробиологической конвер-
сии водорода и углекислого газа бактериями Acetobacterium woodi и Clostridium
асеticum.
Витамины синтезируют в основном химическим путем или получают из естествен-
ных источников. Однако рибофлавин (В2) , витамин Bi2 и аскорбиновую кислоту по-
лучают микробиологическим путем. Существует производство рибофлавина на осно-
ве использования дрожжеподобных грибов Eremothecium ashbyii и Ashbia
gossypii• Рибофлавин продуцируется также видами Clostridium и Ascomycetes.
Микроорганизмы являются также ценным источником получения никотиновой ки-
слоты (витамин РР).
Микроорганизмы являются источником получения липидов специального назначе-
ния с заранее определенными свойствами. Микробные жиры заменяют растительные
(а в ряде случаев и превосходят) и могут использоваться в разных отраслях
промышленности, с.-х., медицине.
Микроорганизмы являются важным источником получения полимерных материалов
на основе полисахаридов. Ценным микробным полисахаридом является декстран,
образуемый бактериями рода Leucomonstoc. Декстран служит основой получения
медицинских препаратов (кровезаменителей) и препаратов для биохимических ис-
следований - сефадексов и др. молекулярных сит.
Микроорганизмы являются источником получения нуклеозидов и нуклеотидов и их
производных, поверхностно-активных веществ и т.д.
Биоконверсия лигноцеллюлозных отходов
Растительная биомасса - возобновляемый и легкодоступный источник сырья. Ос-
новные ее компоненты - целлюлоза (2/3), крахмал, гемицеллюлоза, лигнин. Лиг-
нин - высокомолекулярный нерастворимый трехмерный неупорядоченный ароматиче-
ский полимер. Целлюлоза - высокомолекулярный нерастворимый полимер глюкозы.
Она является главным компонентом как растительной биомассы, так и сельскохо-
зяйственных , бытовых отходов, а также отходов деревообрабатывающей и целлю-
лозно-бумажной промышленности.
В основе биологической деградации лигноцеллюлозы лежит действие целлюлоли-
тических ферментов. Реакционная способность природных целлюлозосодержащих ма-
териалов невелика, поэтому сырье для ферментативного осахаривания целлюлозы
должно иметь большую поверхность, а микрофибриллярная структура целлюлозы
должна быть разрушена. Реакционную способность природных субстратов также
снижает наличие лигнина. Наиболее эффективным, а также дорогим и энергоемким
способом предварительной подготовки сырья является размол. Поэтому для пре-
добработки используют воздействие 0.5-2% растворов щелочи, гамма-облучение,
механо-термообработку в разбавленной серной кислоте с последующей экстракцией
лигнина и др. методы.
Гидролиз можно проводить и биологическим способом, с помощью ферментов, вы-
деляемых грибами видов Trichoderma, Aspergillus, Sporotrichum. Далее при ис-
пользовании дрожжей можно получить спирт, при использовании бактерий
Klebsiella или Aeromonas - бутанол. Ряд микроорганизмов рода Clostridium мо-
гут продуцировать уксусную и молочную кислоты, лактат, ацетон из опилок, со-
ломы, отходов сахарного тростника. С помощью Trichoderma reesii биомасса раз-
лагается до сахаров.
Ферменты и неразложившаяся целлюлоза поступают в повторные циклы, а оста-
точный лигнин используется в качестве источника энергии для перегонки спирта.
Технология, разработанная в Арканзасском университете и используемая в про-
мышленности нефтяной компанией «Галф ойл», заключается в одновременном осаха-
ривании целлюлозы и сбраживании сахаров, полученных путем гидролиза. Для это-
го к смеси целлюлозной биомассы и дрожжей добавляют раствор целлюлаз.
Остающийся лигнин также используется для перегонки в качестве топлива, но
пентозы не сбраживаются. Фирма «Био фьюэл индастриз» из Ричмонда намерена по-
строить в шт. Вирджиния фабрику, на которой в 1985 г. будет производиться 500
т этилового спирта в сутки из 2500 т целлюлозных отходов посредством этой
технологии и целлюлаз из Trichoderma reesii.
Третий вид технологии состоит в прямом сбраживании целлюлозными бактериями
гексоз и пентоз, образующихся при гидролизе целлюлозы и гемицеллюлоз. Преиму-
щества этой технологии, разработанной в лабораториях Массачусетского техноло-
гического института, заключаются в следующем: помимо одновременной конверсии
целлюлоз и пентоз в этанол происходит комбинация целлюлозного и спиртового
брожения, а, кроме того, необходимая предварительная обработка субстратов
сводится к минимуму.
При микробной деградации и конверсии целлюлоз и гемицеллюлоз можно получать
этиловый спирт и сырье для химической промышленности (фурфурол, фенолы, кре-
золы) . 200 000 т надлежащим образом переработанной соломы дают 50 000 т эта-
нола и 20 000 т фурфурола. По оценкам некоторых специалистов, при микробной
переработке целлюлозы можно получить до 30% нефтехимикатов. Методы генной ин-
женерии помогут создать штаммы, которые будут лучше адаптированы к этим типам
конверсии и дадут больший выход. Это позволит разработать реальную стратегию
замещения, которая станет эффективной после 2000 г. (к тому времени химия уг-
лерода придет на смену нефтехимии при производстве новых биополимеров, био-
растворителей и биодетергентов). Перенос генов целлюлаз и гемицеллюлаз из
Clostridium thermocellum в другие виды Clostridium позволит превращать целлю-
лозы и гемицеллюлозы в этиловый спирт, ацетон, бутанол, уксусную и молочную
кислоты.
Термофилия определенных штаммов Clostridium (при оптимальной температуре
роста 65—75° С) создает известные преимущества, так как стоимость перегонки
этилового спирта и других растворителей уменьшится, а это сделает производст-
венный процесс более экономичным.
Исследователи из Университета Нового Южного Уэльса (Австралия) и Рутгерско-
го университета (США) обнаружили, что бактерия Zymomonas mobilis, выделяемая
из пальмового вина и мексиканского алкогольного напитка пульке, сбраживает
сахара вдвое быстрее, чем дрожжи. Этот вид также подвергается геномной моди-
фикации, которая позволит разлагать целлюлозу с одновременным сбраживанием
сахаров, получающихся в ходе деградации.
В условиях строгого анаэробиоза можно осуществлять биометаногенез аромати-
ческих соединений. Этот процесс, надо полагать, широко распространен в приро-
де, особенно в отходах и сточных водах, а также при конверсии некоторых био-
цидов . По наблюдениям Ферри и Вольфа, в этом процессе участвуют несколько ви-
дов микробов, ответственных за различные стадии деградации ароматических ко-
лец до ацетата, который является одним из субстратов для метанобактерий (ины-
ми словами, его дегидрирование дает электроны, требующиеся для восстановления
двуокиси углерода в метан). Среди бактерий видов превалируют, судя по всему,
Methanobacterium formicicum и Methanospirillum hungati. Ферри и Вольфу уда-
лось их вывести в чистые культуры.
Бензольное кольцо сначала восстанавливается и затем разрезается на алифати-
ческие кислоты под действием грамотрицательных микроорганизмов. Последние
превращаются в субстраты, используемые метанобактериями. Образующиеся элек-
троны, вероятно, способствуют образованию водорода, который восстанавливает
С02 в СН4.
Разложение бензольного кольца в метан в процессе анаэробиоза не является
правилом. Например, в рубце жвачных животных бензоат и ароматические кислоты,
получающиеся за счет деградации целлюлозы, не приводят к образованию метана;
их можно обнаружить в моче и виде гиппуратов и других сходных соединений. В
природных условиях ароматические соединения получаются при медленном разложе-
нии таннинов и лигнина главным образом благодаря внеклеточным микробным фер-
ментам .
Так как лигнины и таннины составляют значительную часть почвенного органи-
ческого материала, метаногенез этих полимеров — важный процесс в углеродном
цикле биосферы.
Одним их отходов сельского хозяйства является солома. Эти отходы трудно ис-
пользовать , так как скорость разложения соломы невелика. Лучшая утилизация -
инокулирование её ассоциацией целлюлолитических грибов5, азотфиксирующих и
полисахаридообразующих бактерий. В таком виде солому можно запахивать в землю
как органическое удобрение, а можно через определенное время использовать как
высокобелковый витаминизированный корм.
ОБЪЕКТЫ БИОТЕХНОЛОГИИ И
ИХ БИОТЕХНОЛОГИЧЕСКИЕ ФУНКЦИИ
Биотехнологические объекты находятся на разных ступенях организации:
а) субклеточные структуры (вирусы, плазмиды, ДНК митохондрий и хлоропла-
стов, ядерная ДНК);
б) бактерии и цианобактерии;
в) грибы;
г) водоросли;
д) простейшие;
е) культуры клеток растений и животных;
ж) растения - низшие (анабена-азолла) и высшие - рясковые.
Субклеточные структуры будут подробно изучаться в разделе «Основы генетиче-
ской инженерии», культуры растительных и животных клеток - в соответствующих
разделах.
Бактерии и цианобактерии
Микроорганизмов, синтезирующих продукты или осуществляющих реакции, полез-
ные для человека, несколько сотен видов. Биотехнологические функции бактерий
5
А еще лучше выращивать на ней съедобные виды грибов.
разнообразны. Бактерии используются при производстве: - пищевых продуктов,
например, уксуса (Gluconobacter suboxidans), молочнокислых напитков
(Lactobacillus, Leuconostoc) и др.; - микробных инсектицидов (Bacillus
thuringiensis); - белка (Methylomonas); - витаминов (Clostridium - рибофла-
вин) ; - растворителей и органических кислот; - биогаза и фотоводорода.
Полезные бактерии относятся к эубактериям6. Уксуснокислые бактерии, пред-
ставленные родами Gluconobacter и Acetobacter, - это грамотрицательные бакте-
рии, превращающие этанол в уксусную кислоту, а уксусную кислоту в углекислый
газ и воду. Род Bacillus относится к грамположительным бактериям, которые
способны образовывать эндоспоры и имеют перитрихиальное жгутикование.
B.subtilis - строгий аэроб, а В.thuringiensis может жить и в анаэробных усло-
виях. Анаэробные, образующие споры бактерии представлены родом Clostridium.
С.acetobutylicum сбраживает сахара в ацетон, этанол, изопропанол и п-бутанол
(ацетобутаноловое брожение), другие виды могут также сбраживать крахмал, пек-
тин и различные азотсодержащие соединения.
К молочнокислым бактериям относятся представители родов Lactobacillus,
Leuconostoc и Streptococcus, которые не образуют спор, грамположительны и не-
чувствительны к кислороду. Гетероферментативные молочнокислые бактерии рода
Leuconostoc превращают углеводы в молочную кислоту, этанол и углекислый газ.
Гомоферментативные молочнокислые бактерии рода Streptococcus продуцируют
только молочную кислоту, а брожение, осуществляемое представителями рода
Lactobacillus, позволяет получить наряду с молочной кислотой ряд разнообраз-
ных продуктов.
К бактериям рода Corynebacterium, неподвижные грамположительные клетки ко-
торых не образуют эндоспор, относятся патогенные (С.diphtheriae,
□.tuberculosis) и непатогенные почвенные виды, имеющие промышленное значение.
C.glutamicum служит источником лизина и улучшающих вкус нуклеотидов. Корине-
бактерии хотя и считаются факультативными анаэробами, лучше растут аэробно.
Бактерии используются для микробного выщелачивания руд и утилизации горноруд-
ных отходов.
Широко используется такое свойство некоторых бактерий, как диазотрофность,
то есть способность к фиксации атмосферного азота.
Выделяют 2 большие группы диазотрофов:
- симбионты: без корневых клубеньков (азотобактер - лишайники, азоспириллум
- лишайники, анабена - лишайники, азолла), с корневым клубеньками (бобовые -
ризобии, ольха, лох, облепиха - актиномицеты);
свободноживущие: гетеротрофы (азотобактер, клостридиум, метилобактер),
автотрофы (хлоробиум, родоспириллум и амебобактер).
Микробные клетки используют для трансформации веществ.
6 А вредные к кому? В 1977 году царство бактерий разделили на два: эубактерий и архебакте-
рий. У последних нашли отличия в рРНК, структуре клеточной стенки, биохимии. В остальном они
не отличимы от эубактерий. Считается, что архебактерии наиболее древние обитатели Земли (от-
сюда и название), поскольку большинство из них может существовать в экстремальных условиях.
К архебактериям попали, например, метаногены. Естественно, что упомянуто только небольшое
количество используемых родов бактерий.
Бактерии также широко используются в генноинженерных манипуляциях при соз-
дании геномных клонотек, введении генов в растительные клетки (агробактерии).
Производственные штаммы микроорганизмов должны соответствовать определенным
требованиям: способность к росту на дешевых питательных средах, высокая ско-
рость роста и образования целевого продукта, минимальное образование побочных
продуктов, стабильность продуцента в отношении производственных свойств, без-
вредность продуцента и целевого продукта для человека и окружающей среды. В
связи с этим все микроорганизмы, используемые в промышленности проходят дли-
тельные испытания на безвредность для людей, животных и окружающей среды.
Важным свойством продуцента является устойчивость к инфекции, что важно для
поддержания стерильности, и фагоустойчивость.
Все цианобактерии обладают способностью к азотфиксации, что делает их весь-
ма перспективными продуцентами белка. Анабена (Anabaena) - нитчатая сине-
зеленая водоросль. Нити из более или менее округлых клеток, содержат гетеро-
цисты и иногда крупные споры, по всей длине нить одинаковой толщины. В цито-
плазме клеток откладывается близкий к гликогену запасной продукт - анабенин.
Такие представители цианобактерий, как носток, спирулина, триходесмиум съе-
добны и непосредственно употребляются в пищу. Носток образует на бесплодных
землях корочки, которые разбухают при увлажнении. В Японии местное население
использует в пищу пласты ностока, образующиеся на склонах вулкана и называет
их ячменным хлебом Тенгу (Тенгу - добрый горный дух).
Свое шествие спирулина (Spirulina platensis) начала из Африки — население
района озера Чад давно употребляет ее в пищу, называя этот продукт «дихе».
Другое место, откуда начала распространяться спирулина, но иного вида
(Spirulina maxima) — воды озера Тескоко в Мексике. Еще ацтеки собирали с по-
верхности озер и употребляли в пищу слизистую массу сине-зеленой водоросли
спирулины. Впервые галеты "текуитлатл" упомянуты испанцем Кастильо в 1521 г.
Эти галеты продавались на базаре в Мехико и состояли из высушенных слоев
S.maxima. В 1964 году бельгийский ботаник Ж.Леонар обратил внимание на галеты
сине-зеленого цвета, которые местное население изготовляло из водорослей,
растущих в щелочных прудах вокруг озера Чад. Эти галеты представляли собой
высушенную массу спирулины. Анализ образцов Spirulina показал, что в ней со-
держится 65% белков (больше, чем в соевых бобах), 19% углеводов, 6% пигмен-
тов, 4% липидов, 3% волокон и 3% золы. Для белков этой водоросли характерно
сбалансированное содержание аминокислот. Клеточная стенка этой водоросли хо-
рошо переваривается. Как озеро Тескоко, так и водоемы района озера Чад имеют
в воде очень высокое содержание щелочей. Характерно, что в таких озерах спи-
рулина полностью доминирует и растет почти как монокультура — составляет в
отдельных озерах до 99 % общего количества водорослей. Растет спирулина в ще-
лочной среде при pH вплоть до 11. Ее собирают также из озер около г. Мехико,
получая до 2 т сухого веса биомассы водоросли в сутки, и эта продукция рассы-
лается в США, Японию, Канаду. В других странах спирулину культивируют обычно
в искусственных водоемах или специальных емкостях. Спирулину можно культиви-
ровать в открытых прудах или, как в Италии, в замкнутой системе из полиэтиле-
новых труб. Урожайность очень высокая: получают до 20 г сухой массы водоросли
с 1 м2 в день, а расчеты на год показали, что она превысит выход пшеницы при-
мерно в 10 раз.
Преимущества спирулины по сравнению с другими съедобными водорослями не
только в простоте культивирования, но и в несложности сбора биомассы, высуши-
вания ее, например, под солнцем. В ряде стран выращивают спирулину вида
Spirulina platensis. Недавно было показано, что в клетках спирулины, помимо
ценного белка, углеводов, липидов, витаминов, в значительных количествах за-
пасается, например, такое ценное вещество, как поли-Ь-оксибутират. Отечест-
венная фармацевтическая промышленность выпускает препарат «Оплат» на основе
цианобактерии Spirulina platensis. Он содержит комплекс витаминов и микроэле-
ментов и применяется как общеукрепляющее и иммуностимулирующе средство.
Грибы
Биотехнологические функции грибов разнообразны. Их используют для получения
таких продуктов, как:
- антибиотики (пенициллы, стрептомицеты, цефалоспорины);
- гиббереллины и цитокинины (физариум и ботритис);
- каротиноиды (н-р, астаксантин, придающий мякоти лососевых рыб красно-
оранжевый оттенок вырабатывают Rhaffia rhodozima, которых добавляют в корм на
рыбозаводах);
- белок (Candida, Saccharomyces lipolitica);
- сыры типа рокфор и камамбер (пенициллы);
- соевый соус (Aspergillus oryzae).
К грибам относятся7 актиномицеты, дрожжи и плесени. Истинные актиномицеты -
строгие аэробы, они грамположительны и не образуют спор. Наиболее представи-
тельный в этой группе - род Streptomyces, отдельные виды которого продуцируют
широко применяемые антибиотики. При росте на твердых средах актиномицеты об-
разуют очень тонкий мицелий с воздушными гифами, которые дифференцируются в
цепочки конидиоспор. Каждая конидиоспора способна образовать микроколонию.
Антибиотики продуцирует и другой вид актиномицетов, Micromonospora, колонии
которого лишены воздушных гиф и образуют конидиоспоры непосредственно на ми-
целии .
Из 500 известных видов дрожжей первым люди научились использовать
Saccharomyces cerevisiae, этот вид наиболее интенсивно культивируется. К
дрожжам, сбраживающим лактозу, относится Kluyveromyces fragilis, который ис-
пользуют для получения спирта из сыворотки. Saccharomycopsis lipolytica де-
градирует углеводороды и употребляется для получения белковой массы. Все три
вида принадлежат к классу аскомицетов. Другие полезные виды относятся к клас-
су дейтеромицетов (несовершенных грибов), так как они размножаются не половым
путем, а почкованием. Candida utilis растет в сульфитных сточных водах (отхо-
ды бумажной промышленности). Trichosporon cutaneum, окисляющий многочисленные
органические соединения, включая некоторые токсичные (например, фенол), игра-
ет важную роль в системах аэробной переработки стоков. Phaffia rhodozyma син-
тезирует астаксантин - каротиноид, который придает мякоти форели и лосося,
выращиваемых на фермах, характерный оранжевый или розоватый цвет. Промышлен-
ные дрожжи обычно не размножаются половым путем, не образуют спор и полипло-
идны. Последним объясняется их сила и способность адаптироваться к изменениям
7
Точнее говоря и они тоже.
среды культивирования (в норме ядро клетки S.cerevisiae содержит 17 или 34
хромосомы, т.е. клетки либо гаплоидны, либо диплоидны).
Плесени вызывают многочисленные превращения в твердых средах, которые про-
исходят пред брожением. Их наличием объясняется гидролиз рисового крахмала
при производстве сакэ и гидролиз соевых бобов, риса и солода при получении
пищи, употребляемой в азиатских странах. Пищевые продукты на основе сброжен-
ных плесневыми грибами Rhizopus oligosporus соевых бобов или пшеницы содержат
в 5 - 7 раз больше таких витаминов, как рибофлавин, никотиновая кислота) и
отличаются повышенным в несколько раз содержанием белка. Плесени также проду-
цируют ферменты, используемые в промышленности (амилазы, пектиназы и т.д.),
органические кислоты и антибиотики. Их применяют и в производстве сыров, на-
пример , камамбера и рокфора.
Искусственное выращивание грибов способно внести и иной, не менее важный
вклад в дело обеспечения продовольствием возрастающего населения земного ша-
ра . Люди употребляют грибы в пищу с глубокой древности. Поэтому сделать грибы
такой же управляемой сельскохозяйственной культурой, как зерновые злаки, ово-
щи, фрукты, давно уже стало актуальной задачей. Наиболее легко поддаются ис-
кусственному выращиванию древоразрушающие грибы. Это связано с особенностями
их биологии, которые стали нам известны и понятны только сейчас. Их способ-
ность легко расти и плодоносить, использовали с древнейших времен.
Искусственное разведение древоразрушающих грибов получило довольно широкое
распространение. Мицелий съедобных грибов можно выращивают на жидких средах,
например, на молочной сыворотке и др., в специальных ферментерах, в так назы-
ваемой глубинной культуре. Это полностью механизированный и автоматизирован-
ный процесс. Так, в Институте микробиологии Академии наук БССР разработаны и
апробированы в опытном производстве способы получения белковых грибных препа-
ратов даедалина и пантегрина из мицелия древоразрушающих грибов дедалеопсиса
бугристого и пилолистника тигрового, с высоким содержанием белка и биологиче-
ски активных веществ. По содержанию белка 1 кг этих препаратов эквивалентен 2
кг мяса. По биологической ценности белок этих препаратов не уступает расти-
тельным и приближается к животным белкам. Перевариваемость белков данных пре-
паратов составляет свыше 80 %. В основе этого способа получения пищевого бел-
ка лежат полученные микологами данные о том, что плодовые тела грибов и их
грибница близки по своему химическому составу и пищевой ценности. Грибные
белковые препараты даедалин и пантегрин рекомендованы в качестве пищевых до-
бавок после соответствующего медицинского контроля. Исследования в этом на-
правлении продолжаются.
Простейшие
Простейшие относятся к числу нетрадиционных объектов биотехнологии. До не-
давнего времени они использовались лишь как компонент активного ила при био-
логической очистке сточных вод. В настоящее время они привлекли внимание ис-
следователей как продуценты биологически активных веществ.
В этом качестве рациональнее использовать свободноживущих простейших, обла-
дающих разнообразными биосинтетическими возможностями и потому широко распро-
страненными в природе.
Особую экологическую нишу занимают простейшие, обитающие в рубце жвачных
животных. Они обладают ферментом целлюлазой, способствующей разложению клет-
чатки в желудке жвачных. Простейшие рубца могут быть источником этого ценного
фермента. Возбудитель южноамериканского трипаносомоза — Trypanosoma
(Schizotrypanum cruzi) стала первым продуцентом противоопухолевого препарата
круцина (СССР) и его аналога—трипанозы (Франция). Изучая механизм действия
этих препаратов, советские ученые (Г. И. Роскин, Н. Г. Клюева и их сотрудни-
ки) , а также их французские коллеги (Ж. Кудер, Ж. Мишель-Брэн и др.) пришли к
выводу, что эти препараты оказывают цитотоксический эффект при прямом контак-
те с опухолью и ингибируют ее опосредованно, путем стимуляции ретикулоэндоте-
лиальной системы. Выяснилось, что ингирующее действие связано с жирнокислот-
ными фракциями. Характерной особенностью этих организмов является высокое со-
держание ненасыщенных жирных кислот, составляющее у трипаносомид 70—80 %, а у
Astasia longa (свободноживущий жгутиконосец) — 60 % от суммы всех жирных ки-
слот. У жгутиконосцев фосфолипиды и полиненасыщенные жирные кислоты имеют та-
кой же состав и строение, как в организме человека и животных. В мире микро-
бов полиненасыщенные жирные кислоты не синтезируются, а многоклеточные живот-
ные или растения представляют собой более ограниченную сырьевую базу, чем
простейшие, культуры которых можно получать методами биотехнологии независимо
от времени года или климатических условий.
Поскольку липидный метаболизм простейших обладает относительной лабильно-
стью, были изучены пути его регуляции. Применение к простейшим общепринятого
в микробиологии приема повышения биосинтеза липидов за счет снижения содержа-
ния в среде источника азота и увеличения содержания источника углерода приве-
ло к резкому торможению или остановке роста культур. Для создания условий на-
правленного биосинтеза липидов в среды для культивирования жгутиконосцев до-
бавляли предшественники и стимуляторы биосинтеза липидов: малонат, цитрат,
сукцинат, цитидиннуклеотиды в сочетании с определенным режимом аэрации.
Российские ученые получили водорастворимый полусинтетический препарат — ас-
тазилид, представляющий собой комплекс эфиров сахарозы и жирных кислот, пред-
варительно выделенных из A. longa. Для изучения активности и механизма дейст-
вия этого препарата были применены различные модели: бислойные липидные мем-
браны (БЛМ), монослойные культуры почки теленка и карциномы яичника человека,
иммунокомпетентные клетки — перитонеальные макрофаги. Было установлено, что
астазилид вызывает увеличение проводимости, поверхностного натяжения, а также
уменьшение электромеханической стабильности БЛМ.
Полученные данные позволяют предполагать,что в основе физиологических эф-
фектов препарата лежит его значительное мембраноактивное действие. Астазилид
проявляет мягкие детергентные свойства. Возможно, что увеличение проводимости
и некоторая дестабилизация клегочных мембран открывают путь для проникновения
внутрь клетки Са2+ и других ионов, играющих ключевую роль в регуляции метабо-
лизма . При изучении действия астазилида на культуру клеток почки теленка было
установлено, что препарат увеличивает митотический индекс клеток, снижает их
полиморфизм, улучшает адгезивные свойства культуры, обеспечивает более плот-
ное сцепление с субстратом и усиление межклеточных контактов.
Препарат не обладал прямым цитотоксическим действием на культуру опухолевых
клеток, а его противоопухолевое действие, изученное на 8 штаммах перевиваемых
опухолей мышей и крыс, реализовалось через иммунную систему. Астазилид дейст-
вовал главным образом на клеточное звено иммунитета, вызывая повышение фаго-
цитарной активности перитонеальных макрофагов, увеличение способности индуци-
ровать развитие гиперчувствительности замедленного типа и некоторых других
показателей. Препарат предотвращал гибель 60—80 % животных, зараженных бакте-
риальными инфекциями (Е. coli, Ps. aerugenosa), а также лейшманиями. Другой
группой биологически активных веществ простейших являются полисахариды.
Разнообразие полисахаридов, синтезируемых простейшими, достаточно велико.
Особый интерес представляет парамилон, характерный для эвгленоидных жгутико-
носцев. Представители родов Astasia и Euglena способны к сверхсинтезу парами-
лона, составляющему свыше 50 % сухого остатка клеток. Этот полисахарид изуча-
ется как стимулятор иммунной системы млекопитающих. В наших опытах парамилон
A. longa обладал выраженным противоопухолевым эффектом. Действуя опосредован-
но через иммунную систему, парамилон тормозит рост саркомы 180 на 60 % и сни-
жает прививаемость аденокарциномы Эрлиха. Аденокарцинома Эрлиха вообще не
прививалась у 50— 60 % мышей, которым профилактически был введен парамилон в
дозах 3 и 30 мг/кг веса животного. Парамилон, выделенный из A. longa, практи-
чески нетоксичен. Выраженное иммуномодулирующее действие и низкая токсичность
этого препарата являются предпосылкой для его углубленного исследования в со-
четании с препаратами прямого противоопухолевого действия, радиотерапией и
другими адъювантами.
В настоящее время в мире придается большое значение производству глюканов
не только для медицинских целей, но и для пищевой и текстильной промышленно-
сти. До сих пор глюканы получали из культур бактерий или морских водорослей.
Эвглениды являются одним из наиболее перспективных источников этого вещества.
Структурные полисахариды, входящие в состав клеточных мембран простейших,—
это гетерополисахариды, содержащие глюкозу, маннозу, ксилозу, арабинозу, ри-
бозу, галактозу, рамнозу, фруктозу, глюкозамин. Наиболее характерными гетеро-
полисахаридами являются арабиногалактаны, Д-галакто-Д-маннан, фосфаноглюканы
и другие.
Большой интерес представляет выяснение антигенной взаимосвязи между непато-
генными и патогенными для человека видами трипаносомид. Установлено, что при
введении мышам полисахаридов из культур непатогенных для человека простейших
— Herpetomonas sp. и Crithidia fasciculata — повышалась резистентность живот-
ных к Т. cruzi, возбудителю болезни Чагаса у человека. Наличие перекрестных
иммунологических реакций между полисахаридами различных типов послужило осно-
ванием для вывода о том, что антигенная общность между этими веществами обу-
словлена не структурой полимера, а отдельными мономерами или олигомерами оди-
накового химического строения.
Биомасса простейших содержит до 50% белка. Его высокая биологическая цен-
ность заключается в том, что он содержит все незаменимые аминокислоты, причем
со держание свободных аминокислот на порядок выше, чем в биомассе микроводо-
рослей, бактерий и в мясе. Это свидетельствует о широких возможностях приме-
нения свободноживущих простейших в качестве источника кормового белка.
Водоросли
Водоросли используются, в основном, для получения белка. Весьма перспектив-
ны в этом отношении и культуры одноклеточных водорослей, в частности высоко-
продуктивных штаммов рода Chlorella и Scenedesmus. Их биомасса после соответ-
ствующей обработки используется в качестве добавки в рационы скота, а также в
пищевых целях.
Одноклеточные водоросли выращивают в условиях мягкого теплого климата
(Средняя Азия, Крым) в открытых бассейнах со специальной питательной средой.
К примеру, за теплый период года (6—8 месяцев) можно получить 50—60 т биомас-
сы хлореллы с 1 га, тогда как одна из самых высокопродуктивных трав — люцерна
дает с той же площади только 15— 20 т урожая.
Хлорелла содержит около 50 % белка, а люцерна — лишь 18 %. В целом в пере-
счете на 1 га хлорелла образует 20—30 т чистого белка, а люцерна — 2—3,5 т.
Кроме того, хлорелла содержит 40 % углеводов, 7—10 % жиров, витамины А (в 20
раз больше), В2, К, РР и многие микроэлементы. Варьируя состав питательной
среды, можно процессы биосинтеза в клетках хлореллы сдвинуть в сторону накоп-
ления либо белков, либо углеводов, а также активировать образование тех или
иных витаминов.
При завоевании племен майя миссионерами описывался случай, когда испанцы
около полутора лет осаждали крепость на вершине горы. Естественно, что все
продукты давно должны были кончиться, однако крепость не сдавалась. Когда же
она была наконец взята, то испанцы с удивлением увидели в ней небольшие пру-
ды, где культивировались одноклеточные водоросли, из которых индейцы готовили
особый сыр. Испанцы попробовали его и нашли весьма приятным на вкус. Однако
это было уже после того, как испанцы уничтожили абсолютно всех защитников и
секрет племени был утерян. В наше время делались попытки определить этот вид
водорослей, из которых готовился сыр, но они не увенчались успехом.
В пищу употребляют не менее 100 видов макрофитных водорослей как в странах
Европы и Америки, так и особенно на Востоке. Из них готовят много разнообраз-
ных блюд, в том числе диетических, салатов, приправ. Их подают в виде засаха-
ренных кусочков, своеобразных конфет, из них варят варенье, делают желе, до-
бавки к тесту и многое другое. В магазине можно купить консервы из морской
капусты — ламинарии дальневосточных или северных морей. Ее консервируют с мя-
сом, рыбой, овощами, рисом, употребляют при приготовлении супов и др. Она на-
ряду с микроводорослью хлореллой является самой популярной съедобной и кормо-
вой водорослью.
Известны и другие съедобные макрофитные водоросли — ульва, из которой дела-
ют разные зеленые салаты, а также алария, порфира, родимения, хондрус, унда-
рия и др. В Японии продукты, получаемые из ламинариевых, называют «комбу», и
для того, чтобы их вкусно приготовить, существует более десятка способов.
В целом ряде стран водоросли используют как весьма полезную витаминную до-
бавку к кормам для сельскохозяйственных животных. Их прибавляют к сену или
дают как самостоятельный корм для коров, лошадей, овец, коз, домашней птицы
во Франции, Шотландии, Швеции, Норвегии, Исландии, Японии, Америке, Дании и
на нашем Севере. Животным скармливают в виде добавки также биомассу выращи-
ваемых микроводорослей (хлорелла, сценедесмус, дуналиелла и др.).
Гидролизаты белка зеленой водоросли Scenedesmus используются в медицине и
косметической промышленности. В Израиле на опытных установках проводятся экс-
перименты с зеленой одноклеточной водорослью Dunaliella bardawil, которая
синтезирует глицерол. Эта водоросль относится к классу равножгутиковых и по-
хожа на хламидомонаду. Dunadiella может расти и размножаться в среде с широ-
ким диапазоном содержания соли: и в воде океанов, и в почти насыщенных соле-
вых растворах Мертвого моря. Она накапливает свободный глицерол, чтобы проти-
водействовать неблагоприятному влиянию высоких концентраций солей в среде,
где она растет. При оптимальных условиях и высоком содержании соли на долю
глицерола приходится до 85% сухой массы клеток. Для роста этим водорослям не-
обходимы: морская вода, углекислый газ и солнечный свет. После переработки
эти водоросли можно использовать в качестве корма для животных, так как у них
нет неперевариваемой клеточной оболочки, присущей другим водорослям. Они так-
же содержат значительное количество р-каротина. Таким образом, культивируя
эту водоросль, можно получать глицерол, пигмент и белок, что весьма перспек-
тивно с экономической точки зрения.
Наряду с кормами водоросли давно применяют в сельском хозяйстве в качестве
удобрений. Биомасса обогащает почву фосфором, калием, йодом и значительным
количеством микроэлементов, пополняет также ее бактериальную, в том числе
азотфиксирующую, микрофлору. При этом в почве водоросли разлагаются быстрее,
чем навозные удобрения, и не засоряют ее семенами сорняков, личинками вредных
насекомых, спорами фитопатогенных грибов.
Одним из самых ценных продуктов, получаемых из красных водорослей, является
агар — полисахарид, присутствующий в их оболочках и состоящий из агарозы и
агаропектина. Количество его доходит до 30—40 % от веса водорослей (водоросли
лауренция и грацилярия, гелидиум). Водоросли — единственный источник получе-
ния агара, агароидов, каррагинина, альгинатов. В мире в 1980 г. было получено
7 тыс. т агара, 222 тыс. т альгинатов, 10 тыс. т каррагинина. В нашей стране
основным источником агара служит красная водоросль анфельция.
Бурые водоросли являются единственным источником получения одних из самых
ценных веществ водорослей — солей альгиновой кислоты, альгинатов. Альгиновая
кислота — линейный гетерополисахарид, построенный из связанных остатков (3 —
Д-маннуроновой и а — L-гиулуроновой кислот.
Альгинаты исключительно широко применяются в народном хозяйстве. Это изго-
товление высококачественных смазок для трущихся деталей машин, медицинские и
парфюмерные мази и кремы, синтетические волокна и пластики, стойкие к любой
погоде лакокрасочные покрытия, не выцветающие со временем ткани, производство
шелка, клеящих веществ исключительно сильного действия, строительных материа-
лов, пищевые продукты отличного качества — фруктовые соки, консервы, мороже-
ное , стабилизаторы растворов, брикетирование топлива, литейное производство и
многое другое. Альгинат натрия — наиболее используемое соединение — способен
поглощать до 300 весовых единиц воды, образуя при этом вязкие растворы.
Бурые водоросли богаты также весьма полезным соединением — шестиатомным
спиртом маннитом, который с успехом применяют в пищевой промышленности, фар-
мацевтике, при производстве бумаги, красок, взрывчатки и др. Бурые водоросли
в ближайшее время планируется использовать для получения биогаза. Каллусные
культуры макрофитных водорослей могут быть использованы далее в различных на-
правлениях . В случае, если они получены от агарофитов, можно непосредственно
получать из них агар.
Каллусные культуры пищевых макрофитных водорослей, например ламинариевых,
могут в перспективе использоваться для получения белка, непосредственно иду-
щего в пищу и в пищевые добавки, а также в корма сельскохозяйственным живот-
ным. Суспензионные культуры макрофитных водорослей открывают в перспективе
возможности использования их в качестве трофического звена в марикультуре.
Они могли бы также выступать в качестве партнера в искусственно создаваемых
растительных ассоциациях, участники которых обладают полезными свойствами.
Выделяемые клетками культуры экзометаболиты, характерные для исходного вида
водоросли, будут составлять основу трофического обмена при удачном подборе
партнеров в растительной ассоциации или комплексе марикультуры. Необходимо
отметить, что при отсутствии токсического и антагонистического действия выде-
ляемых соединений в естественных условиях существуют разнообразные и много-
численные природные ассоциации, например, повсеместно встречающиеся комплексы
водорослей и бактерий.
Растения
Водный папоротник азолла ценится как органическое азотное удобрение, так
как растет в тесном симбиозе с сине-зеленой водорослью анабена. Это позволяет
симбиотическому организму анабена-азолла накапливать много азота в вегетатив-
ной массе. Анабену-азоллу выращивают на рисовых полях перед посевом риса, что
позволяет снижать количество вносимых минеральных удобрений.
Представители семейства рясковых (Lemnaceae) - самые мелкие и простые по
строению цветковые растения, величина которых редко превышает 1 см. Рясковые
- свободноживущие водные плавающие растения. Вегетативное тело напоминает
лист или слоевище низших растений, поэтому до начала 18 века ряску относили к
слоевищным растениям.
В литературе встречается несколько названий тела рясковых. Самое удачное -
листец. Тело рясковых - особая структура, не дифференцированная на листья и
стебель (листоветвь), представляющая зеленую пластинку, иногда выпуклую с
нижней стороны.
Рясковые (Lemna minor, L. trisulca, Wolfia, Spirodela polyrhiza) служат
кормом для животных, для уток и других водоплавающих птиц, рыб, ондатры. Их
используют и в свежем, и в сухом виде как ценный белковый корм для свиней и
домашней птицы. Рясковые содержат много протеина (до 45 % от сухой массы).
45% углеводов, 5% жиров и остальное - клетчатка и т.д. Они высоко продуктив-
ны, неприхотливы в культуре, хорошо очищают воду и обогащают её кислородом.
Это делает рясковые ценным объектом для морфогенетических, физиологических и
биохимических исследований.
ПЕРСПЕКТИВЫ РАЗВИТИЯ БИОТЕХНОЛОГИИ
Центральная проблема биотехнологии - интенсификация биопроцессов как за
счет повышения потенциала биологических агентов и их систем, так и за счет
усовершенствования оборудования, применения биокатализаторов (иммобилизован-
ных ферментов и клеток) в промышленности, аналитической химии, медицине.
В основе промышленного использования достижений биологии лежит техника соз-
дания рекомбинантных молекул ДНК. Конструирование нужных генов позволяет
управлять наследственностью и жизнедеятельностью животных, растений и микро-
организмов и создавать организмы с новыми свойствами. В частности, возможно
управление процессом фиксации атмосферного азота и перенос соответствующих
генов из клеток микроорганизмов в геном растительной клетки.
В качестве источников сырья для биотехнологии все большее значение будут
приобретать воспроизводимые ресурсы не пищевых растительных материалов, отхо-
дов сельского хозяйства, которые служат дополнительным источником как кормо-
вых веществ, так и вторичного топлива (биогаза), органических удобрений.
Одной из бурно развивающихся отраслей биотехнологии считается технология
микробного синтеза ценных для человека веществ. По прогнозам, дальнейшее раз-
витие этой отрасли повлечет за собой перераспределение ролей растениеводства
и животноводства с одной стороны, и микробного синтеза - с другой, в формиро-
вании продовольственной базы человечества.
Не менее важным аспектом современной микробиологической технологии является
изучения участия микроорганизмов в биосферных процессах и направленная регу-
ляция их жизнедеятельности с целью решения проблемы охраны окружающей среды
от техногенных, сельскохозяйственных и бытовых загрязнений.
С этой проблемой тесно связаны исследования по выявлению роли микроорганиз-
мов в плодородии почв (гумусообразовании и пополнении запасов биологического
азота), борьбе с вредителями и болезнями сельскохозяйственных культур, утили-
зации пестицидов и др. химических соединений в почве. Имеющиеся в этой облас-
ти знания свидетельствуют о том, что изменение стратегии хозяйственной дея-
тельности человека от химизации к биологизации земледелия оправдывается как с
экономической, так и с экологической точек зрения. В данном направлении перед
биотехнологией может быть поставлена цель регенерации ландшафтов.
Ведутся работы по созданию биополимеров, которые будут способны заменить
современные пластмассы. Эти биополимеры имеют существенное преимущество перед
традиционными материалами, так как нетоксичны и подвержены биодеградации, то
есть легко разлагаются после их использования, не загрязняя окружающую среду.
Биотехнологии, основанные на достижениях микробиологии, наиболее экономиче-
ски эффективны при комплексном их применении и создании безотходных произ-
водств, не нарушающих экологического равновесия. Их развитие позволит заме-
нить многие огромные заводы химической промышленности экологически чистыми
компактными производствами.
Важным и перспективным направлением биотехнологии является разработка спо-
собов получения экологически чистой энергии. Получение биогаза и этанола были
рассмотрены выше, но есть и принципиально новые экспериментальные подходы в
этом направлении. Одним из них является получение фотоводорода. Если из хло-
ропластов выделить мембраны, содержащие фотосистему, то на свету происходит
фотолиз воды - разложение на кислород и водород. Моделирование процессов фо-
тосинтеза, происходящих в хлоропластах, позволило бы запасать энергию Солнца
в ценном топливе - водороде. Преимущества такого способа получения энергии
очевидны:
• наличие избытка субстрата, воды;
• нелимитируемый источник энергии - Солнце;
• продукт (водород) можно хранить, не загрязняя атмосферу;
• водород имеет высокую теплотворную способность (29 ккал/г) по сравнению с
углеводородами (3.5 ккал/г);
• процесс идет при нормальной температуре без образования токсических пром-
жуточных продуктов;
• процесс циклический, так как при потреблении водорода регенерируется суб-
страт - вода.
Другой механизм превращения энергии у галофитных бактерий Halobacterium
halobium, которые используют энергию солнца, поглощаемую пурпурным пигментом
бактериородопсином, находящимся в мембране клетки. Поглощение света вызывает
химические и физические изменения в мембране, приводящие к направленному
транспорту протонов водорода с одной стороны мембраны на другую и созданию
электрохимического градиента. Следствием этого является синтез аденозинтри-
фосфорной кислоты. Н.halobium можно культивировать в мелких водоемов с высо-
ким содержанием NaCl и других минеральных солей. Из 10 литров бактериальной
культуры можно получить 0,5 грамма мембран, содержащих до 100000 молекул пиг-
мента. Пигмент можно фиксировать на подложках, обладающих физическими и хими-
ческими свойствами для транспорта протонов.
ОСНОВНЫЕ ПРИНЦИПЫ ПРОМЫШЛЕННОГО
ОСУЩЕСТВЛЕНИЯ БИОТЕХНОЛОГИЧЕСКИХ ПРОЦЕССОВ
Стадии биотехнологического производства
Большое разнообразие биотехнологических процессов, нашедших промышленное
применение, приводит к необходимости рассмотреть общие, наиболее важные про-
блемы, возникающие при создании любого биотехнологического производства. Про-
цессы промышленной биотехнологии разделяют на 2 большие группы: производство
биомассы и получение продуктов метаболизма. Однако такая классификация не от-
ражает наиболее существенных с технологической точки зрения аспектов промыш-
ленных биотехнологических процессов. В этом плане необходимо рассматривать
стадии биотехнологического производства, их сходство и различие в зависимости
от конечной цели биотехнологического процесса. В общем виде система биотехно-
логического производства продуктов микробного синтеза представлена на рис. 1.
Существует 5 стадий биотехнологического производства.
Две начальные стадии включают подготовку сырья и биологически действующего
начала. В процессах инженерной энзимологии они обычно состоят из приготовле-
ния раствора субстрата с заданными свойствами (pH, температура, концентрация)
и подготовки партии ферментного препарата данного типа, ферментного или иммо-
билизованного. При осуществлении микробиологического синтеза необходимы ста-
дии приготовления питательной среды и поддержания чистой культуры, которая
могла бы постоянно или по мере необходимости использоваться в процессе. Под-
держание чистой культуры штамма-продуцента - главная задача любого микробио-
логического производства, поскольку высокоактивный, не претерпевший нежела-
тельных изменений штамм может служить гарантией получения целевого продукта с
заданными свойствами.
Третья стадия - стадия ферментации, на которой происходит образование целе-
вого продукта. На этой стадии идет микробиологическое превращение компонентов
питательной среды сначала в биомассу, затем, если это необходимо, в целевой
метаболит.
На четвертом этапе из культуральной жидкости выделяют и очищают целевые
продукты. Для промышленных микробиологических процессов характерно, как пра-
вило, образование очень разбавленных растворов и суспензий, содержащих, поми-
мо целевого, большое количество других веществ. При этом приходится разделять
смеси веществ очень близкой природы, находящихся в растворе в сравнимых кон-
центрациях, весьма лабильных, легко подвергающихся термической деструкции.
Заключительная стадия биотехнологического производства - приготовление то-
варных форм продуктов. Общим свойством большинства продуктов микробиологиче-
ского синтеза является их недостаточная стойкость к хранению, поскольку они
склонны к разложению и в таком виде представляют прекрасную среду для разви-
тия посторонней микрофлоры. Это заставляет технологов принимать специальные
меры для повышения сохранности препаратов промышленной биотехнологии. Кроме
того, препараты для медицинских целей требуют специальных решений на стадии
расфасовки и укупорки, так должны быть стерильными. Далее приводится характе-
ристики каждой из стадий промышленного микробиологического синтеза.
{ Подготовка
{ Питательная среда
Разделение
л.’
f Кульгууаганая шцдкесть
Г Биом асса зкивых
i клеток
Пряден ение
Рис. 2. Система биотехнологического производства
Технология приготовления
питательных сред для биосинтеза
Основу питательных сред для культивирования микроорганизмов составляют ис-
точники углерода. Кроме углерода клетки микроорганизмов в процессе роста ис-
пытывают потребность в азоте, фосфоре, макро- и микроэлементах. Все вещества
этого рода находятся в питательных средах в виде солей, исключение составляют
среды, где азот и фосфор могут усваиваться растущими культурами из органиче-
ских источников, например автолизатов или гидролизатов микробного или живот-
ного происхождения.
Отделения приготовления питательной среды представляет собой цех, оборудо-
ванный емкостями для хранения жидких и твердых веществ, средствами их транс-
портировки и аппаратами с перемешивающими устройствами для приготовления рас-
творов , суспензий или эмульсий. При этом питательные соли хранятся обычно в
твердом виде, а приготовление их смеси с заданным соотношением компонентов
производится в аппарате с мешалкой, куда подаются твердые компоненты в необ-
ходимом количестве и далее происходит их растворение. Иногда соединяются и
перемешиваются заранее приготовленные растворы. Жидкие и твердые источники
углерода обычно вводят в уже готовую питательную среду непосредственно перед
ферментацией, так как это устраняет опасность заражения посторонней микрофло-
рой, вероятность которого возрастает при хранении готовой питательной смеси.
При непрерывном культивировании в производстве микробного белка углеводоро-
ды и растворы солей вводят в ферментер раздельно по индивидуальным линиям, а
смешение и эмульгирование нерастворимых в воде n-алканов происходит уже в са-
мом биореакторе. При культивировании бактерий на метане последний постоянно
барботируют в аппарат через специальные устройства.
При периодической ферментации в начале процесса инокулят (засевная доза
микроорганизмов) вносится в уже готовую питательную среду, содержащую все
компоненты. Поэтому источники углерода вводят непосредственно перед засевом
или отдельные компоненты среды вводят по мере потребления их культурой, под-
держивая в ферментере некоторую оптимальную их концентрацию, которая на раз-
ных этапах ферментации может меняться по определенному закону.
Важнейшим элементом приготовления питательных сред является соблюдение тре-
бований асептики. Это либо создание заданного значения pH, обеспечивающего
подавление посторонних микроорганизмов, либо полная стерилизация всех пода-
ваемых потоков и самого биореактора.
Для стерилизации газовых потоков (в первую очередь воздуха) используют про-
цесс фильтрации через специальные волокнистые фильтры с последовательно рас-
положенными фильтрующими элементами. Фильтрующий материал периодически стери-
лизуется подачей острого пара в отключенный фильтр через заданные промежутки
времени. Жидкостные потоки стерилизуют различными методами, из которых прак-
тический интерес представляют термический, радиационный, фильтрационный и от-
части химический.
Термический - самый распространенный, при температурах порядка 120-150°С.
Радиационный - гамма-излучение, применяется редко из-за трудностей создания
и эксплуатации мощных источников этого излучения.
В отдельных случаях применяют химические стерилизующие агенты (вещества с
ярко выраженным асептическим действием). Основная проблема в этом случае -
необходимость устранения стерилизующего агента из питательной среды после ги-
бели микрофлоры до внесения инокулята. Химические антисептики должны быть не
только высокоэффективны, но и легко разлагаемы при изменении условий после
завершения стерилизации. К числу лучших относится пропиолактон, обладающий
сильным бактерицидным действием и легко гидролизуемый в молочную кислоту.
Мало распространен и метод фильтрации, что объясняется аппаратными трудно-
стями. Метод основан на способности полупроницаемых мембран с крупными порами
пропускать жидкую фазу и концентрировать клетки микроорганизмов. В принципе
этот метод является идеальным для стерилизации термически неустойчивых жидких
и газовых средств, поскольку может осуществляться при низкой температуре и
требует лишь градиента давления по разные стороны мембраны. Основная труд-
ность - наличие термостойких мембран, способных выдерживать многократную сте-
рилизацию их самих. В настоящее время эта проблема решается путем применения
термостойких полимеров в производстве мембран.
В заключение заметим, что ряд субстратов не требует стерилизации, так как
они сами обладают асептическим действием; сюда относят метанол, этанол, кон-
центрированная уксусная кислота и др. В этом случае ограничиваются стерилиза-
цией прочих элементов питательной среды.
Поддержание чистой культуры
и получение засевной дозы
В технологическом процессе используются полезные свойства штамма, следова-
тельно, необходимо сохранять и, если возможно, улучшать его производственные
качества. Поэтому в биотехнологическом производстве имеется отделение чистой
культуры, задачей которого является постоянное и надежное воспроизведение по-
лезных свойств продуцента, найденных или достигнутых в свое время в ходе ла-
бораторных исследований. Такое отделение проводит лабораторные операции по
контролю и сохранению чистой культуры, а также маломасштабное культивирование
для постоянной передачи штамма на стадию ферментации.
Фактически это микробиологическая лаборатория, с музеем штаммов-
продуцентов. В ходе контрольных высевов и маломасштабных ферментаций (в про-
бирках, колбах ит. д.) контролируется устойчивость всех имевшихся или приоб-
ретенных признаков, послуживших основанием для рекомендации к промышленному
применению этих культур. По мере необходимости из отделения чистой культуры
поступает заданная масса инокулята, идущая в производство.
При периодическом процессе культивирования (при производстве метаболитов) в
отделении чистой культуры готовят засевную дозу клеток для каждой из операций
основного производства. При непрерывном производстве кормового белка этого не
требуется, однако для повышения качества продукта предпочитают время от вре-
мени вводить клетки штамма-продуцента из отделения чистой культуры. Для этого
в отделении имеется ферментационная часть, где производится выращивание дос-
таточно крупных партий микроорганизма продуцента.
Посевные дозы выращиваются последовательно в колбах и бутылях на 10-20 лит-
ров , находящихся на качалках или просто в термостатируемом помещении, и далее
в последовательности ферментеров объемом (по необходимости) 10, 100, 500 и
1000 литров, в которых осуществляется перемешивание, аэрация и термостатиро-
вание культуральной жидкости с клетками.
Отделение чистой культуры должно иметь достаточно большую коллекцию штаммов
продуцентов, так как возможны временные переходы с одного штамма на другой,
вызванные различными причинами. Например, сезонные изменения температуры час-
тично компенсируются подбором достаточно продуктивных термотолерантных штам-
мов. Кроме того, микробиологическая промышленность зачастую вынуждена исполь-
зовать в качестве компонентов питательных сред отходы сельского хозяйства и
пищевой промышленности (меласса, кукурузный экстракт), что ведет к сезонным
изменениям сырья и предполагает адаптацию продуцента к особенностям среды.
Все это делает роль микробиологической службы производства достаточно высо-
кой .
Ферментация
Стадия ферментации - центральная среди этапов промышленного производства.
Под ферментацией понимают всю совокупность последовательных операций от вне-
сения в заранее приготовленную и термостатированную среду инокулята до завер-
шения процессов роста, биосинтеза или биотрансформации.
Ферментация проходит в специальных емкостях, называемых ферментерами или
биореакторами. Конструкция биореактора приведена на рис. 3. Основными элемен-
тами ферментера являются двойные стенки, промежуток между которыми заполняет-
ся охлаждающей или нагревающей жидкостью, входные отверстия для газовых и
жидких потоков, система контроля за составом питательной среды и условиями
внутри реактора.
Поскольку в промышленной биотехнологии выделяют 2 типа процессов - накопле-
ние биомассы и накопление ценных веществ, возникающих в ходе роста и после-
дующего развития культуры, то меняется и характер построения производства во
времени. Биомасса одноклеточных выращивается непрерывным способом в аппаратах
хемостатного типа, а все процессы второй группы осуществляются периодически,
когда в одном и том же аппарате в производственном цикле протекают все необ-
ходимые фазы развития клеток и биосинтеза. Процессы двух рассматриваемых ти-
пов отличаются по требованиям к степени асептики, что связано с их объёмами -
белок одноклеточных выпускается миллионами тонн сухого вещества, а выпуск
продуктов второго типа составляет, как максимум, тысячи или десятки тысяч
тонн. Поэтому в производстве белковых веществ ограничиваются достаточно высо-
кой, но не 100% степенью асептики, обеспечивая последнюю подбором режима
культивирования, подходящего для продуцента, но неблагоприятного для возмож-
ных примесных штаммов.
Технологическое оформление процессов промышленной биотехнологии в значи-
тельной мере определяется отношением микроорганизма-продуцента к кислороду.
При использовании аэробных культур ферментационное оборудование и нормы тех-
нологического режима подбираются таким образом, чтобы массообмен (перенос ки-
слорода из газовой в жидкую фазу) обеспечивал поступление кислорода к клеткам
в количествах, необходимых и оптимальных для данной культуры в данной фазе
роста.
Промышленное использование факультативных анаэробов не ставит задачи абсо-
лютного исключения кислорода из среды, поэтому процессы этого типа (брожение)
технологически проще аэробных. В начальной фазе этих процессов требуется лишь
удалить кислород из газовой фазы над культуральной жидкостью, что может быть
достигнуто введением инертного газа или просто вытеснением воздуха углекисло-
той, выделяемой клетками при метаболизме.
Технологическое оформление строго анаэробных процессов сложнее, чем для
процессов брожения, так как в этом случае необходимо полностью исключить воз-
можность попадания кислорода в газовую, а оттуда и в жидкую среду.
Ру ьашка
Приток
воздуха
Питательная
среда
Выход
воздуха
Рис. 3. Устройство ферментера
Вопросы термостатирования ферментационного процесса (подвода или отвода те-
пла в ходе ферментации) являются очень острыми в целом ряде производств био-
технологии. В аэробных условиях микробиологический синтез протекает со значи-
тельным тепловыделением, что вызывает необходимость отвода тепла из аппаратов
большого объема (сотни и тысячи кубометров). Технологические требования к
скорости теплоотвода очень жесткие из-за узкого температурного оптимума роста
культуры (2-3°С) . Наиболее приемлимый на практике способ теплоотвода - охлаж-
дение водой через змеевики, рубашки и др. устройства - осложняется небольшой
разностью температур между содержимым биореактора (32-34 °C для дрожжей
Candida) и охлаждающей водой (20°С) , температура которой в жаркое время года
еще выше. Поэтому в реакторе создается развитая поверхность газообмена, уве-
личивается скорость движения жидкостей и т.д.
Важно также поддерживать определенный состав питательной среды. В непрерыв-
ных процессах биосинтеза задача технолога сводится к поддержанию концентрации
всех питательных веществ (и кислорода) и дозированному введению кислоты или
щелочи для рН-статирования системы на заданном уровне. Простейшим вариантом
управления стадией ферментации в периодическом режиме является изменение кон-
центраций компонентов среды и её pH, а также введение необходимых добавок по
заранее разработанной программе, реализуемой технологом в каждом цикле фер-
ментации. Этот способ относительно прост и легко поддается автоматизации.
Во многих случаях необходимо возможно полно исчерпывать компоненты пита-
тельной среды, чтобы они не попадали на последующие стадии переработки. Эта
необходимость может быть вызвана рядом причин:
- дороговизна или дефицитность субстрата;
- вредное воздействие субстрата на качество готового продукта (например,
при производстве дрожжей на парафинах, когда выделение остаточных количеств
углеводородов из клеточной массы затруднено, поэтому добавляют дополнительные
секции для дозревания или утилизации запасенных в цитоплазме углеводородов);
- затруднения, возникающие на стадии выделения и очистки метаболитов при
одновременном присутствии в культуральной жидкости неутипизированных веществ.
Общие принципы разделения веществ
Продукты микробного синтеза поступают из биореактора в виде водных суспен-
зий или растворов, при этом характерно невысокое содержание основного компо-
нента и наличие многих примесных веществ.
В большинстве промышленных производств на первом этапе переработки культу-
ральной жидкости производят отделение массы продуцента от жидкой фазы - сепа-
рацию. Жидкость далее также подвергается переработке, если содержит метаболи-
ты, представляющие практическую ценность. В производствах, где целевым про-
дуктом являются клетки как источник белка, культуральная жидкость подвергает-
ся лишь очистке, позволяющей использовать водную фазу многократно и снизить
образование сточных вод.
Технологические приемы, используемые для отделения клеток от среды зависят
от природы продуцента. Например, сахаромицеты (хлебопекарные дрожжи) имеют
относительно большие клетки и способны флотироваться, поэтому после сгущения
биомассы флотацией их отделяют на обычных барабанных вакуум-фильтрах. В даль-
нейшем биомассу, снятую с фильтра, подвергают прессованию и получают продукт
с высоким содержанием живых клеток, имеющих высокую хлебопекарную активность.
Дрожжи же рода Candida, служащие источником кормового белка плохо флотиру-
ются и фильтруются. Поэтому дрожжи, растущие на углеводородах, а также бакте-
рии-продуценты белка на основе метана и метанола, на первом этапе сепарируют-
ся, причем в несколько ступеней. Оставшаяся вода удаляется путем выпаривания,
а все компоненты жидкой фазы остаются в конечном продукте. К аналогичному
приему прибегают и при производстве бактериальных энтомопатогенных препаратов
и удобрений. Конечный продукт удается получить в активной форме лишь в прин-
ципе отказавшись от выделения его из культуральной жидкости: содержимое реак-
тора выпаривают и сушат в условиях, обеспечивающих жизнеспособность конечного
продукта. Неутилизированные компоненты культуральной жидкости могут отразить-
ся на способности продукта к хранению.
При выделении и очистке метаболитов биомасса, если она не содержит заметных
количеств целевого продукта, осаждается добавлением извести или других твер-
дых компонентов, увлекающих клетки или мицелий на дно - физическое осаждение.
Отделение твердой фазы (мелкодисперсный клеточный материал, внутриклеточные
биополимеры возможно и методом фильтрации. Так как фильтруемая суспензия
склонная к гелеобразованию, то производительность фильтров быстро падает.
Предотвратить это можно добавлением в смесь или на фильтрующую ткань размоло-
тых вулканических пород, содержащих оксиды кремния и алюминия, тогда осадки
приобретают пористую структуру.
Некоторые виды биомассы отделяют центрифугированием. Осаждение взвешенных
частиц происходит под действием центробежной силы. После разделения образует-
ся 2 фракции: биомасса (твердая) и культуральная жидкость.
Культуральная жидкость перерабатывается путем экстракции, ионообмена, кри-
сталлизации или с помощью микро- и ультрафильтрации через полимерные мембраны
со специально подобранным размером пор.
Для выделения и очистки продуктов, находящихся внутри клеток продуцента
(например интерферонов, гормонов) вводится стадия разрушения клеточных оболо-
чек (дезинтеграция биомассы); обычно для этого применяются механические, хи-
мические или комбинированные методы.
К физическим методам дезинтеграции относятся обработка ультразвуком, враще-
ние лопасти или вибратора, встряхивание со стеклянными бусами, продавливание
через узкое отверстие под давлением, раздавливание замороженной клеточной
массы, растирание в ступке, осмотический шок, замораживание-оттаивание, де-
компресия (сжатие с последующим резким снижением давления).
Химические и химико-ферментативные методы более избирательны. Клетки могут
быть разрушены толуолом или бутанолом, антибиотиками, ферментами. Культураль-
ную жидкость освобождают от сопутствующих растворимых веществ и фракциониру-
ют .
Освобождение от растворимых веществ производят несколькими способами:
1. Осаждение - физическое (нагревание, охлаждение, разбавление, концентри-
рование) или химическое (с помощью органических и неорганических веществ).
Осаждение органическими растворителями основано на снижении диэлектрической
постоянной среды8. Устойчивость белковых растворов обусловлена наличием гид-
ратного слоя у молекулы. Если его разрушить, белки осаждаются. Для этого мо-
лекулы добавляемых веществ должны быть более гидрофильны, чем молекулы бел-
ков . В качестве осадителей используют этанол, метанол, ацетон, изопропанол.
При разных количествах растворителя и разных значения pH осаждаются разные
фракции. Пример: 50% этанол осаждает 80% протеазы и 3-5% амилазы, 70% спирт
осаждает 98% амилазы.
Высаливание - механизм тот же, что и при действии органических веществ,
гидратируются диссоциирующие ионы неорганических солей. Как наиболее дешёвый
реагент используют сульфат аммония. Также применяют сульфаты натрия, магния и
фосфат калия.
2. Экстракция.
При твердожидкофазной экстракции вещество из твердой фазы переходит в жид-
кую, при жидкожидкофазной - из одной жидкости в другую (например, хлорофилл
из спиртовой вытяжки переходит в бензин). Для извлечения антибиотиков, вита-
минов , каротиноидов, липидов применяют жидкожидкофазную экстракцию, когда
культуральную жидкость смешивают с органическими растворителями.
8 Это не совсем та публикация, в которой стоит рассматривать эту теорию. Проще сказать, что
белки, как правило, плохо растворяются в органических растворителях.
3. Адсорбция - частный случай экстракции, когда экстрагирующий агент -
твердое тело. Адсорбция применяется для веществ, имеющих функциональные груп-
пы, заряженные положительно или отрицательно. В качестве адсорбента использу-
ют иониты на основе целлюлозы: - катионит - карбоксиметилцеллюлоза (КМЦ); -
анионит - диэтиламиноэтилцеллюлоза (ДЭАЭ), а также сефадексы на основе декст-
рана и т.д. Адсорбция идет по ионообменному механизму.
Методы тонкой очистки
и разделения препаратов
Более тонкую очистку веществ осуществляют несколькими способами.
Наибольшее распространение получила хроматография. Каплю образца9 наносят
на специальную бумагу (хроматография на бумаге) или пластинку стекла или пла-
стмассы, покрытую тонким слоем инертного сорбента, например, целлюлозы или
силикагеля (хроматография в тонком слое или тонкослойная хроматография). За-
тем такую пластинку одним концом помещают в смесь растворителей (например,
воды и спирта).
По мере движения растворителей по пластинке, они подхватывают те молекулы
образца, которые растворяются в них. Растворители выбирают таким образом,
чтобы они связывались сорбентом по-разному. В результате молекулы образца,
более растворимые в связанном растворителе, движутся медленнее, а другие, бо-
лее растворимые в слабо сорбированном растворителе, движутся быстрее. Через
несколько часов пластинку сушат, окрашивают и определяют положение различных
молекул.
Можно разделять молекулы методом хроматографии на колонках (колоночная хро-
матография) . В этом случае смесь молекул в растворе пропускают через колонку,
содержащую твердый пористый матрикс. В результате взаимодействия с матриксом
различные молекулы проходят через колонку с различной скоростью. После того
как они достигнут в определенной последовательности дна колонки, их собирают
отдельными фракциями.
В настоящее время разработано и применяется множество матриксов различных
типов, используя которые можно делить белки согласно их:
заряду (ионообменная хроматография),
гидрофобности (гидрофобная хроматография),
размеру (хроматография гель-фильтрацией)
или способности связываться различными химическими группами (аффинная хро-
матография) .
При ионообменной хроматографии нерастворимый матрикс содержит ионы, задер-
живающие молекулы с противоположным зарядом. Для разделения молекул использу-
ются следующие матриксы: диэтиламиноэтилцеллюлоза (ДЭАЭ-целлюлоза) - заряжена
9 Это описание идеи лабораторного метода анализа. «Капля образца» как-то плохо ассоциируется
с названием главы «Основные принципы промышленного осуществления биотехнологических процес-
сов» .
положительно; карбоксиметилцеллюлоза (КМ-целлюлоза) и фосфоцеллюлоза - заря-
жены отрицательно. Силы взаимодействия между молекулами в растворе и ионооб-
менником определяются ионной силой и pH элюирующего раствора.
Гидрофобные колонки наполнены шариками, из которых выступают гидрофобные
цепи; в таких колонках задерживаются белки с обнаженными гидрофобными участ-
ками.
Колонки, предназначенные для гель-фильтрации, заполнены крошечными пористы-
ми инертными шариками; при использовании таких колонок происходит разделение
белков по размерам. Молекулы небольшого размера по мере прохождения через ко-
лонку проникают внутрь шариков, а более крупные молекулы остаются в промежут-
ках между шариками. В результате они быстрее проходят через колонку и выходят
из нее первыми. В качестве матрикса можно использовать зерна поперечно-
сшитого полисахарида (декстран или агароза).
Гель-фильтрация обычно используется и для разделения молекул, и для опреде-
ления их размеров.
Гораздо более эффективен метод аффинной хроматографии (хроматография по
сродству). В основе этого метода лежат биологически важные взаимодействия,
происходящие на поверхности белковых молекул. При аффинной хроматографии ис-
пользуется нерастворимый матрикс, ковалентно связанный со специфичными лиган-
дами (антителами или субстратом ферментов), которые присоединяют определенный
белок.
Связываемые иммобилизованным субстратом молекулы фермента можно элюировать
концентрированными растворами субстрата в свободной форме, а молекулы, свя-
занные с иммобилизованными антителами, можно элюировать за счет диссоциации
комплекса антитело-антиген концентрированными растворами соли или растворами
низкого или высокого pH. Однократная хроматография на такой колонке позволяет
зачастую достигнуть очень высокой степени очистки препарата.
Разрешение обычной колоночной хроматографии ограничено негомогенностью мат-
риксов (например, целлюлозы), что вызывает неравномерное протекание раствори-
теля через колонку. Разработанные недавно хроматографические смолы (в основу
которых обычно положен кремний) имеют форму мельчайших сфер от 3 до 10 мкм в
диаметре, которые упакованы в специальный чехол и образуют гомогенную колон-
ку. Такие колонки для высокоэффективной жидкостной хроматографии (ВЖХ) обес-
печивают высокий уровень разрешения. Поскольку частицы носителя в колонках
для ВЖХ упакованы очень плотно, в отсутствие высокого давления скорость пото-
ка через них незначительна. По этой причине такие колонки обычно помещают в
стальные цилиндры, соединенные со сложной системой насосов и шлангов, которые
обеспечивают необходимое для высокой скорости протока давление.
В традиционной колоночной хроматографии скорость протекания через колонку
может быть довольно низкой (примерно один объем колонки в час) , таким обра-
зом, у разделяемых растворов достаточно времени для уравновешивания с внут-
ренним содержимым крупных частиц матрикса. В условиях ВЖХ происходит быстрое
уравновешивание растворов с внутренним содержимым крошечных сфер, так что
растворы, обладающие различным сродством к матриксу, эффективно разделяются
даже при высокой скорости потока. Таким образом, ранее для достижения плохого
разделения с помощью колоночной хроматографии требовались часы, а в настоящее
время благодаря ВЖХ качественное фракционирование занимает минуты. Вот почему
именно этот метод чрезвычайно популярен сейчас для разделения и белков, и ма-
лых молекул.
Экстракты разрушенных клеток можно фракционировать, подвергая их высокоско-
ростному центрифугированию. Такая обработка делит клеточные компоненты по их
размеру: более крупные частицы при центрифугировании движутся быстрее. Круп-
ные компоненты экстракта, в том числе ядра или неразрушенные клетки, быстро
оседают (седиментируют) при относительно низких скоростях и образуют осадок
на дне центрифужной пробирки. Центрифугирование является, как правило, первым
этапом фракционирования, с его помощью разделяются только значительно отли-
чающиеся по размеру компоненты. Чтобы достигнуть более высокой степени разде-
ления фракций, необходимо гомогенат наслоить тонким слоем поверх солевого
раствора.
При ультрацентрифугировании различные фракции седиментируют с различной
скоростью и образуют отдельные полосы, которые можно выделить. Во избежание
перемешивания осажденных компонентов солевой раствор должен содержать инерт-
ный и хорошо растворимый материал (например, сахарозу), плотность которого
постепенно увеличивается сверху вниз, формируя градиент плотности. При седи-
ментации сквозь такие градиенты сахарозы различные компоненты клетки собира-
ются в отдельные полосы, которые можно выделить.
Скорость седиментации каждого из компонентов определяется его размерами и
формой и обычно выражается с помощью коэффициента седиментации, обозначаемого
S10. Скорость вращения до 80000 об/мин, так что на разделяемые частицы дейст-
вуют силы, превосходящие силу тяготения более чем в 500000 раз. Под действием
столь больших сил даже сравнительно небольшие макромолекулы, такие, как тРНК
или простейшие ферменты, разделяются и распределяются в строгом соответствии
со своими размерами. Измерение коэффициента седиментации макромолекулярных
комплексов обычно используют для определения их общей массы и количества,
входящих в их состав субъединиц.
Ультрацентрифуга разделяет клеточные компоненты не только по массе, но и по
плавучей плотности. В этом случае образец седиментирует в крутом градиенте,
образованном высококонцентрированным раствором сахарозы или хлористого цезия.
Компоненты клеток опускаются по градиенту до тех пор, пока не достигнут уча-
стка, плотность раствора, в котором равна собственной плотности компонентов.
Дальнейшей седиментации компонентов не происходит и они «застревают» на этом
уровне. Таким образом, в центрифужной пробирке возникает набор различных по-
лос .
Метод центрифугирования в градиенте хлористого цезия был разработан в 1957
году для доказательства полуконсервативности репликации ДНК.
Электрофорез - метод разделения белков и нуклеиновых кислот в свободном
водном растворе и пористом матриксе, в качестве которого можно использовать
полисахариды, например, крахмал или агарозу. Биомолекулы обычно несут суммар-
ный положительный или отрицательный заряд, обусловленный наличием на их по-
верхности положительно или отрицательно заряженных групп аминокислот.
Если белковые молекулы поместить в электрическое поле, они начинают переме-
щаться со скоростью, которая определяется их суммарным зарядом, а также фор-
10
Ну, или другой буквой.
мой и размерами. В середине 60-х годов был разработан модифицированный метод
электрофореза - электрофорез в полиакриламидном геле в присутствии додецил-
сульфата натрия (ДСН-ПААГ). При использовании данного метода белки мигрируют
в инертном матриксе-полиакриламидном геле с высоким содержанием поперечных
сшивок. Обычно гель готовят полимеризацией мономеров непосредственно перед
использованием. Размеры пор геля могут быть подобраны произвольно с тем, что-
бы гель мог замедлить миграцию определенных молекул. При этом белки находятся
в растворе, содержащем мощный, отрицательно заряженный детергент - додецил-
сульфат натрия или ДСП (SDS).Связываясь с гидрофобными участками белковой мо-
лекулы, этот детергент вызывает развертывание белковых молекул в длинные вы-
тянутые цепи. Каждая молекула белка связывает значительное количество молекул
детергента, приобретая суммарный отрицательный заряд. По этой причине белок
после того, как будет приложено напряжение, начнет двигаться в направлении
положительного электрода.
Белки одного размера ведут себя сходным образом, поскольку, во-первых, их
природная структура полностью нарушена ДСП так, что их форма идентична, во-
вторых, они связывают одинаковое количество ДСП и приобретают одинаковый не-
гативный заряд. Крупные белки, обладающие большим зарядом, подвергаются дей-
ствию значительных электрических сил, а также более существенному торможению.
В обычных растворах эти эффекты, как правило, взаимно погашаются, но в порах
полиакриламидного геля, действующего как молекулярное сито, большие молекулы
тормозятся значительно сильнее, чем малые, поэтому оказываются ближе к стар-
товой линии. Смесь молекул делится на ряд полос, расположенных в соответствии
с их молекулярной массой.
Выявить эти полосы можно путем окрашивания соответствующим красителем11.
Например, белки индентифицируются красителем кумасси синим. Известно, что
близко расположенные полосы в геле могут перекрываться. Этот эффект препятст-
вует выявлению большого количества белков (не больше 50) с помощью одномерных
методов их разделения.
Метод двумерного гель-электрофореза, в котором объединены две различные
процедуры разделения, позволяет идентифицировать более 1000 белков. Результа-
ты при этом получают в виде «двумерной» белковой карты.
При работе данным методом на первом этапе белки разделяют по их заряду. Для
этого образец помещают в небольшой объем раствора, содержащего неионный (не-
заряженный) детергент-меркаптоэтанол, и в качестве денатурирующего агента-
мочевину. В этом растворе происходит солюбилизация, денатурация и диссоциация
всех без исключения полипептидных цепей; при этом изменения заряда цепей не
происходит.
Диссоциированные полипептидные цепи разделяют затем методом изоэлектриче-
ского фокусирования, основанном на изменении заряда белковой молекулы при из-
менении pH окружающей среды. Каждый из белков может быть охарактеризован изо-
электрической точкой - значением pH, при котором суммарный заряд белковой мо-
лекулы равен нулю, и, следовательно, белок не способен перемещаться под дей-
ствием электрического поля. При изоэлектрическом фокусировании белки подвер-
гаются электрофорезу в геле, в котором с помощью специальных буферов создает-
ся градиент pH. Под действием электрического поля каждый белок перемещается в
ту зону градиента, которая соответствует его изоэлектрической точке и остает-
11
Наверное как-то надо разделить лабораторные и промышленные методы.
ся в ней.
Так происходит разделение белков в одном направлении двумерного гель-
электрофореза. На втором этапе гель, содержащий разделенные белки, снова под-
вергается электрофорезу, на этот раз в направлении перпендикулярном тому, что
на первом этапе. В этом случае электрофорез ведут в присутствии ДСН и белки
разделяют по их молекулярной массе, как в одномерном ДСН-ПААГ. Исходный гель
пропитывают додецил-сульфатом натрия и, поместив его на блок ДСН-ПААГ-геля,
проводят электрофорез, в ходе которого каждая из полипептидных цепей мигриру-
ет сквозь блок геля и образует в нем отдельную полосу. Неразделенными в ре-
зультате остаются только те бели, которые неразличимы как по изоэлектрической
точке, так и по молекулярной массе; такое сочетание встречается очень редко.
Получение товарных форм препаратов
Все товарные формы биопрепаратов с точки зрения технологии их получения
можно разделить на три основные группы.
1. Биопрепараты, имеющие в товарном продукте в качестве основного компонен-
та жизнеспособные микроорганизмы. К этой группе относятся средства защиты
растений, бактериальные удобрения, закваски для силосования кормов, биодегра-
данты, другие активные средства биотрансформации.
2. Биопрепараты, в состав которых входит инактивированная биомасса клеток и
продукты ее переработки. Это кормовые дрожжи, грибной мицелий и т.д.
3. Биопрепараты на основе очищенных продуктов метаболизма микроорганизмов.
К ним относятся витамины, аминокислоты, ферменты, антибиотики, биолипиды, по-
лисахариды, продукты комплексной переработки микробных масс и метаболитов.
В зависимости от принятых на предыдущей стадии решения товарные формы пред-
ставляют собой либо сложную смесь, содержащую некоторое количество основного
вещества, либо высокоочищенный препарат, отвечающий ряду специальных требова-
ний .
Продукт может выпускаться в жидком (например жидкий концентрат лизина) или
сухом виде (белково-витаминный концентрат, энтомопатогенные препараты, кормо-
вой концентрат лизина). Стадия фасовки рассмотренных комплексных препаратов
заключается в помещении их в тару (мешки, барабаны и т.п.), размеры и тип ко-
торой определяются потребностями заказчика и свойствами продукта (его слежи-
ваемостью, гигроскопичностью, стойкостью к загниванию и т.д.). Другие требо-
вания предъявляются к медицинским препаратам и биохимическим реактивам.
ПРОИЗВОДСТВО БЕЛКА МИКРООРГАНИЗМОВ
Продуценты белка
Производство микробной биомассы - самое крупное микробиологическое произ-
водство . Микробная биомасса может быть хорошей белковой добавкой для домаш-
них животных, птиц и рыб. Производство микробной биомассы особенно важно для
стран, не культивирующих в больших масштабах сою (соевую муку используют как
традиционную белковую добавку к кормам).
При выборе микроорганизма учитывают удельную скорость роста и выход био-
массы на данном субстрате, стабильность при поточном культивировании, величи-
ну клеток. Клетки дрожжей крупнее, чем бактерий, и легче отделяются от жидко-
сти при центрифугировании. Можно выращивать полиплоидные мутанты дрожжей с
крупными клетками. В настоящее время известны только две группы микроорганиз-
мов, которым присущи свойства, необходимые для крупномасштабного промышленно-
го производства: это дрожжи рода Candida на n-алканах (нормальных углеводоро-
дах) и бактерии Methylophillus methylоtrophus на метаноле.
Микроорганизмы можно выращивать и на других питательных средах: на газах,
нефти, отходах угольной, химической, пищевой, винно-водочной, деревообрабаты-
вающей промышленности. Экономические преимущества их использования очевидны.
Так, килограмм переработанной микроорганизмами нефти дает килограмм белка, а,
скажем, килограмм сахара12 — всего 500 граммов белка. Аминокислотный состав
белка дрожжей практически не отличается от такового, полученного из микроор-
ганизмов , выращенных на обычных углеводных средах. Биологические испытания
препаратов из дрожжей, выращенных на углеводородах, которые проведены и у нас
в стране и за рубежом, выявили полное отсутствие у них какого-либо вредного
влияния на организм испытуемых животных. Опыты были проведены на многих поко-
лениях десятков тысяч лабораторных и сельскохозяйственных животных. В непере-
работанном виде дрожжи содержат неспецифические липиды и аминокислоты, био-
генные амины, полисахариды и нуклеиновые кислоты, а их влияние на организм
пока еще плохо изучено. Поэтому и предлагается выделять из дрожжей белок в
химически чистом виде. Освобождение его от нуклеиновых кислот также уже стало
несложным.
В современных биотехнологических процессах, основанных на использовании
микроорганизмов, продуцентами белка служат дрожжи, другие грибы, бактерии и
микроскопические водоросли. С технологической точки зрения наилучшими из них
являются дрожжи. Их преимущество заключается прежде всего в "технологично-
сти": дрожжи легко выращивать в условиях производства. Они характеризуются
высокой скоростью роста, устойчивостью к посторонней микрофлоре, способны ус-
ваивать любые источники питания, легко отделяются, не загрязняют воздух спо-
рами. Клетки дрожжей содержат до 25% сухих веществ. Наиболее ценный компонент
дрожжевой биомассы - белок, который по составу аминокислот превосходит белок
зерна злаковых культур и лишь немного уступает белкам молока и рыбной муки.
Биологическая ценность дрожжевого белка определяется наличием значительного
количества незаменимых аминокислот. По содержанию витаминов дрожжи превосхо-
дят все белковые корма, в том числе и рыбную муку. Кроме того, дрожжевые
клетки содержат микроэлементы и значительное количество жира, в котором пре-
обладают ненасыщенные жирные кислоты. При скармливании кормовых дрожжей коро-
вам повышаются удои и содержание жира в молоке, а у пушных зверей улучшается
качество меха.
В последнее время в качестве продуцентов белка стали использовать бактерии,
которые отличаются высокой скоростью роста и содержат в биомассе до 80% бел-
ка. Бактерии хорошо поддаются селекции, что позволяет получать высокопродук-
тивные штаммы. Их недостатками являются трудная осаждаемость, обусловленная
малыми размерами клеток, значительная чувствительность к фаговым инфекциям и
высокое содержание в биомассе нуклеиновых кислот. Последнее обстоятельство
неблагоприятно только в том случае, если предусматривается пищевое использо-
вание продукта. Снижать содержание нуклеиновых кислот в биомассе, употребляе-
12 Ну сахар как-то приятнее, да и с нефтью обещают проблемы, все идет к тому, что как раз то-
пливо будут получать ферментацией сахаров.
мой на корм животным, нет необходимости, так как мочевая кислота и ее соли,
образующиеся при разрушении азотистых оснований, превращаются в организме жи-
вотных в алантоин, который легко выделяется с мочой. У человека избыток солей
мочевой кислоты может способствовать развитию ряда заболеваний.
Следующую группу продуцентов белка составляют грибы. Они привлекают внима-
ние исследователей благодаря способности утилизировать самое разнообразное по
составу органическое сырье: мелассу, молочную сыворотку, сок растений и кор-
неплодов, лигнин- и целлюлозосодержащие твердые отходы пищевой, деревообраба-
тывающей, гидролизной промышленности. Грибной мицелий богат белковыми вещест-
вами, которые по содержанию незаменимых аминокислот ближе всего к белкам сои.
Вместе с тем белок грибов богат лизином, основной аминокислотой, недостающей
в белке зерновых культур. Это позволяет на основе зерна и грибной биомассы
составлять сбалансированные пищевые и кормовые смеси. Грибные белки имеют
достаточно высокую биологическую ценность и хорошо усваиваются организмом.
Положительным фактором является и волокнистое строение выращенной культуры.
Это позволяет имитировать текстуру мяса, а с помощью различных добавок - его
цвет и запах. Хранят грибной мицелий обычно в замороженном виде.
В качестве субстрата грибами используются глюкоза и другие питательные ве-
щества, а общим источником азота служат аммиак и аммонийные соли. После за-
вершения стадии ферментации культуру подвергают термообработке для уменьшения
содержания рибонуклеиновой кислоты, а затем отделяют мицелий методом вакуум-
ного фильтрования.
Источниками белковых веществ могут служить и водоросли. При фототрофном
способе питания и образования биомассы они используют углекислый газ атмосфе-
ры . Выращивают водоросли, как правило, в поверхностном слое прудов, где с
площади 0,1 га можно получить столько же белка, сколько с 14 га посевов фасо-
ли. Белок водорослей пригоден не только для кормовых, но и пищевых целей.
Наконец, хорошими продуцентами белка являются рясковые, которые накапливают
протеина до 45% от сухой массы, а также до 45% углеводов. Однако, несмотря на
свои малые размеры, они не принадлежат к вышеперечисленным производителям
белка (микроорганизмам), так как не только являются многоклеточными организ-
мами, но и относятся к высшим растениям.
Субстраты для получения белка
В качестве источников вещества и энергии микроорганизмы используют самые
разнообразные субстраты - нормальные парафины и дистилляты нефти, природный
газ, спирты, растительные гидролизаты и отходы промышленных предприятий.
Для выращивания микроорганизмов с целью получения белка хорошо бы иметь бо-
гатый углеродом, но дешевый субстрат. Этому требованию вполне отвечают нор-
мальные (неразветвленные) парафины нефти. Выход биомассы может достигать при
их использовании до 100% от массы субстрата. Качество продукта зависит от
степени чистоты парафинов. Дрожжи, выращенные на недостаточно очищенных пара-
финах, содержат неметаболизированные компоненты. При использовании парафинов
достаточной степени очистки, полученная дрожжевая масса может успешно приме-
няться в качестве дополнительного источника белка в рационах животных. В на-
шей стране мало районов, пригодных для выращивания сои, являющейся основным
источником белковых добавок. Поэтому наложено крупнотоннажное производство
кормовых дрожжей на п-парафинах. Действует несколько Заводов мощностью от 70
до 240 тыс. тонн в год13. Сырьем служат жидкие очищенные парафины.
Одним из перспективных источников углерода для культивирования продуцентов
белка высокого качества считается метиловый спирт. Его можно получать методом
микробного синтеза на таких субстратах, как древесина, солома, городские от-
ходы. Использование метанола в качестве субстрата затруднено из-за его хими-
ческой структуры: молекула метанола содержит один атом углерода, тогда как
синтез большинства органических соединений осуществляется через двухуглерод-
ные молекулы. Наилучшими продуцентами на этом субстрате считаются бактерии,
потому что они могут расти на метаноле с добавлением минеральных солей. Про-
цессы получения белка на метаноле достаточно экономичны. По данным концерна
Ай-Си-Ай (Великобритания), себестоимость продукта, производимого на метаноле,
на 10-15% ниже, чем при аналогичном производстве, базирующемся на основе вы-
сокоочищенных n-парафинов. Высокобелковые продукты из метанола получают фирмы
ряда развитых стран мира: Великобритании, Швеции, Германии, США, Италии. Про-
дуцентами белка служат бактерии рода Methylomonas. Например, западногерман-
ская фирма Хёхст производит из метанола бактериальную биомассу на установке
производительностью 1000 тонн в год. В продукте содержится 60% белка. Цель
фирмы - получение пищевого белка.
Использование этанола как субстрата снимает проблему очистки биомассы от
аномальных продуктов обмена с нечетным числом углеродных атомов. Стоимость
такого производства несколько выше. Биомассу на основе этанола производят в
Чехословакии, Испании, Германии, Японии, США.
В США, Японии, Канаде, ФРГ, Великобритании разработаны технологические про-
цессы получения белка на природном газе. Выход биомассы в этом случае может
составлять 66% от массы субстрата. В разработанном в Великобритании процессе
используется смешанная культура: бактерии Methylomonas, усваивающие метан,
Hypomicrobium и Pseudomonas, усваивающие метанол, и два вида неметилотрофных
бактерий. Культура характеризуется высокой скоростью роста и продуктивностью.
Главные достоинства метана (кстати сказать, основного компонента природного
газа) - доступность, относительно низкая стоимость, высокая эффективность
преобразования в биомассу метаноокисляющими микроорганизмами, значительное
содержание в биомассе белка, сбалансированного по аминокислотному составу.
Бактерии, растущие на метане хорошо переносят кислую среду и высокие темпера-
туры, в связи с чем устойчивы к инфекциям.
Субстратом для микробного синтеза может быть и минеральный углерод - угле-
кислый газ. Окисленный углерод в данном случае с успехом восстанавливается
микроводорослями при помощи солнечной энергии и водородоокисляющими бактерия-
ми при помощи водорода. На корм скоту используют суспензию водорослей. Для
работы установок по выращиванию водорослей необходимы стабильные климатиче-
ские условия - постоянные температуры воздуха и интенсивность солнечного све-
та .
Наиболее перспективно получение белка с помощью водородоокисляющих бакте-
рий, которые развиваются за счет окисления водорода кислородом воздуха. Энер-
гия , высвобождающаяся в этом процессе, идет на усвоение углекислого газа. Для
получения биомассы используются, как правило, бактерии рода Hydrogenomonas.
Первоначально интерес к ним возник при разработке замкнутых систем жизнеобес-
13
Учебник был написан до перестройки.
печения, а затем их стали изучать с точки зрения использования в качестве
продуцентов высококачественного белка. В институте микробиологии Геттинген-
ского университета (Германия) разработан способ культивирования водородоокис-
ляющих бактерий, при котором можно получать 20 г сухого вещества на 1 литр
суспензии клеток. Возможно, в будущем эти бактерии станут основным источником
пищевых микробных белков.
Исключительно доступным и достаточно дешевым источником углеводов для про-
изводства микробного белка является растительная биомасса. Любое растение со-
держит разнообразные сахара. Целлюлоза - полисахарид, состоящий из молекул
глюкозы. Гемицеллюлоза состоит из остатков арабинозы, галактозы, маннозы,
фруктозы. Проблема в том, что полисахариды древесины связаны жесткими оксифе-
нилпропановыми звеньями лигнина - полимера, почти не поддающегося разрушению.
Поэтому гидролиз древесины происходит только в присутствии катализатора - ми-
неральной кислоты и при высоких температурах. При этом образуются моносахара
- гексозы и пентозы. На жидкой, содержащей сахара, фракции гидролизата выра-
щивают дрожжи. При кислотном гидролизе древесины образуется ряд побочных про-
дуктов (фурфурол, меланины), а из-за высоких температур может произойти кара-
мелизация сахаров. Эти вещества препятствуют нормальному росту дрожжей, их
отделяют от гидролизата и по возможности используют. В качестве продуцентов
используют штаммы Candida scotti и С.tropicalis.
Наиболее крупным производителем сырья для гидролизной промышленности явля-
ются деревообрабатывающие предприятия, отходы которых достигают ежегодно де-
сятки миллионов тонн. К сожалению, нерационально или не используются вообще
отходы производства лубяных волокон (из льна и конопли), картофелекрахмально-
го производства, пивоваренной, плодоовощной, консервной промышленности, свек-
ловичный жом.
Особого внимания заслуживают способы прямой биоконверсии продуктов фотосин-
теза и их производных в белок с помощью грибов. Эти организмы благодаря нали-
чию мощных ферментных систем способны утилизировать сложные растительные суб-
страты без предварительной обработки. Исследования условий биоконверсии рас-
тительных субстратов в микробный белок активно ведутся в США, Канаде, Индии,
Финляндии, Швеции, Великобритании, в нашей стране и других странах мира. Од-
нако в литературе сведения о широкомасштабном производстве белков микробного
происхождения немногочисленны. Наиболее известным и доведенным до стадии про-
мышленной реализации является процесс "Ватерлоо", разработанный в университе-
те Ватерлоо в Канаде. Это процесс, основанный на выращивании целлюлозоразру-
шающих грибов Chaetomium cellulolyticum, можно осуществлять как в глубинной
культуре, так и поверхностным методом. Содержание белка в конечном продукте
(высушенном грибном мицелии) составляет 45%. Финская фирма "Тампелла" разра-
ботала технологию и организовала производство белкового кормового продукта
"Пекило" на отходах целлюлозно-бумажного производства. Продукт содержит до
60% протеина с хорошим аминокислотным профилем и значительное количество ви-
таминов группы В.
В большинстве стран - производителей молока традиционным способом утилиза-
ции сыворотки является скармливание её животным. Степень конверсии белка сы-
воротки в белок животного весьма невысока (для выработки 1 кг животного белка
необходимо 1700 кг сыворотки). В последние 10-15 лет из сыворотки методом
ультрафильтрации выделяют белки высокого качества, на основе которых делают
заменители сухого обезжиренного молока и другие продукты. Концентраты можно
использовать как пищевые добавки и компоненты детского питания. Из сыворотки
производится и молочный сахар - лактоза, применяемая в пищевой и медицинской
промышленности. При всем при этом объем промышленной переработки сыворотки
составляет 50-60% от её общего производства. Следовательно, налицо большие
потери ценнейшего молочного белка и лактозы. Более того, возникает проблема
утилизации отходов, так как процесс естественного разложения сыворотки проис-
ходит крайне медленно. Лактоза молочной сыворотки может служить источником
энергии для многих видов микроорганизмов, сырьем для производства продуктов
микробного синтеза (органических кислот, ферментов, спиртов, витаминов) и
белковой биомассы. Из всех известных микроорганизмов самым высоким коэффици-
ентом конверсии белка сыворотки в микробный белок обладают дрожжи.
Впервые дрожжи на молочной сыворотке стали выращивать в Германии. В качест-
ве продуцентов применяли различные штаммы сахаромицетов. Разработаны способы
получения микробных продуктов, основанные на использовании лактозы как моно-
культурой, так и смесью дрожжей и бактерий. В настоящее время в качестве про-
дуцентов используют дрожжи родов Candida, Trichosporon, Torulopsis. Молочная
сыворотка с выросшими в ней дрожжами по биологической ценности значительно
превосходит исходное сырье и её можно использовать в качестве заменителя мо-
лока. Приведенный перечень микроорганизмов и процессов получения белка одно-
клеточных не является исчерпывающим. Однако потенциал этой новой отрасли про-
изводства используется далеко не полностью. Кроме того, мы еще не знаем всех
возможностей деятельности микроорганизмов в качестве продуцентов белка, но по
мере углубления наших знаний, они будут расширены.
ТЕХНОЛОГИЯ ПОЛУЧЕНИЯ
МИКРОБНЫХ ЛИПИДОВ
Под липидами подразумеваются все растворимые в неполярных растворителях
клеточные компоненты микроорганизмов. В настоящее время ведутся поиски новых
источников получения жиров, в том числе и на технические нужды. Этим источни-
ком могут стать микроорганизмы, липиды которых после соответствующей обработ-
ки пригодны для использования в различных отраслях промышленности: медицин-
ской, химико-фармакоцевтической, лакокрасочной, шинной и других, что позволит
высвободить значительные количества масел животного и растительного происхож-
дения .
Технологический процесс получения микробных липидов, в отличие от получения
белковых веществ, обязательно включает стадию выделения липидов из клеточной
массы методом экстракции в неполярном растворителе (бензине или эфире). При
этом получают одновременно два готовых продукта: микробный жир (биожир) и
обезжиренный белковый препарат (биошрот).
Сырьем для этого процесса являются те же среды, что и для производства кор-
мовой биомассы. В процессе культивирования микроорганизмов на различных сре-
дах получаются три класса липидов: простые, сложные липиды и их производные.
Простые липиды - нейтральные жиры и воски. Нейтральные жиры (основные За-
пасные компоненты клетки) - эфиры глицерина и жирных кислот, основная масса
которых триацилглицериды (есть, впрочем ещё и моно- и диглицериды). Воски -
эфиры жирных кислот или моноооксикислот и алифатических спиртов с длинной уг-
леродной цепью. По структуре и свойствам близки к нейтральным липидам. Наи-
большее количество нейтральных липидов синтезируют дрожжи и мицелиальные гри-
бы. Простые липиды находят применение как технологические смазки в процессах
холодной и тепловой обработки металлов. Продуцентами сложных липидов являются
в основном бактерии.
Сложные липиды делятся на две группы: фосфолипиды и гликолипиды. Фосфолипи-
ды (фосфоглицериды и сфинголипиды) входят в состав различных клеточных мем-
бран и принимают участие в переносе электронов. Их молекулы полярны и при pH
7,0 фосфатная группа несет отрицательный заряд. Концентрат фосфолипидов нахо-
дит применение в качестве антикоррозийной присадки к маслам и как добавка при
флотации различных минералов. Гликолипиды в отличие от фосфолипидов не содер-
жат молекулы фосфорной кислоты, но также являются сильнополярными соединения-
ми за счет наличия в молекуле гидрофильных углеводных групп (остатков глюко-
зы, маннозы, галактозы и др.).
К производным липидов относят жирные кислоты, спирты, углеводороды, витами-
ны Д, Е и К. Жирные кислоты представлены насыщенными и ненасыщенными с одной
двойной связью кислотами нормального строения и четным числом углеродных ато-
мов (пальмитиновая, стеариновая, олеиновая). Среди диеновых жирных кислот
можно выделить линолевую. Двойные связи в ненасыщенных жирных кислотах мик-
робных липидов часто располагаются так, что делят их на части, число углерод-
ных атомов в которых кратно трем. Очищенные монокарбоновые кислоты с числом
углеродных атомов 14-18 находят широкое применение в мыловаренной, шинной,
химической, лакокрасочной и других отраслях промышленности.
Спирты, присутствующие в липидах, делятся на три группы: спирты с прямой
цепью, спирты с р-ионовым кольцом, включающие витамин А и каротиноиды, а так-
же стерины - компоненты неомыляемой части липидов (например, эргостерин, об-
лучение которого ультрафиолетовым светом позволяет получать витамин Д2).
Для промышленного использования важное значение имеет способность усиленно
накапливать липиды. Этой способностью обладают немногие микроорганизмы, в
первую очередь дрожжи. Процесс образования липидов у большинства дрожжей со-
стоит из двух четко разграниченных стадий:
- первая характеризуется быстрым образованием белка в условиях усиленного
снабжения культуры азотом и сопровождается медленным накоплением липидов (в
основном глицерофосфатов и нейтральных жиров);
- вторая - прекращением роста дрожжей и усиленным накоплением липидов (в
основном нейтральных).
Типичными липидообразователями являются дрожжи Cryptococcus terricolus. Они
могут синтезировать большое количество липидов (до 60% от сухой массы) в лю-
бых условиях, даже наиболее благоприятных для синтеза белка.
Из других липидообразующих дрожжей промышленный интерес представляют дрожжи
С.guilliermondii, утилизирующие алканы. Они синтезируют в основном фосфолипи-
ды. Накапливают большие количества липидов и активно развиваются на углевод-
ных субстратах (на мелассе, гидролизатах торфа и древесины) также дрожжи ви-
дов Lipomyces lipoferus и Rhodotorula gracilis. У этих видов дрожжей липоге-
нез сильно зависит от условий культивирования. Эти продуценты накапливают
значительные количества (до 70%) триацилглицеридов.
Микроскопические грибы пока не получили большого распространения в получе-
нии липидов, хотя жир грибов по своему составу близок к растительному. Выход
жиров у Asp.terreus, например, на углеводных средах достигает 51% от абсолют-
но сухого веса (АСВ). Липидный состав грибов представлен в основном нейтраль-
ными жирами и фосфолипидами.
Липиды, синтезируемые бактериями, своеобразны по своему составу, так как
включают в основном сложные липиды, тогда как нейтральные жиры составляют не-
значительную часть биомассы. При этом бактерии производят разнообразные жир-
ные кислоты (содержащие от 10 до 20 атомов углерода) , что важно для промыш-
ленного получения специфических жирных кислот. Водоросли перспективны для
культивирования в качестве липидообразователей, так как не нуждаются в орга-
ническом источнике углерода. Химический состав (соотношение белков и жиров)
водорослей также сильно варьирует в зависимости от содержания в среде азота.
Недостатки - малая скорость роста и накопление токсических соединений в клет-
ках , - ограничивают промышленное применение.
Итак, основную роль в процессе биосинтеза липидов играют различные штаммы
дрожжей. Они используют те же источники сырья, что и для получения кормового
белка, причем от ценности углеродного питания зависят выход биомассы, количе-
ство и состав синтезируемых липидов. Для обеспечения направленного биосинтеза
липидов в питательной среде употребляются легкоассимилируемые источники азо-
та .
На сдвиг биосинтеза в сторону образования липидов или белка влияет соотно-
шение углерода и азота в среде. Так, повышение концентрации азота вызывает
снижение липидообразования, а недостаток азота при обеспеченности углеродом
ведет к понижению выхода белковых веществ и высокому процентному содержанию
жира. Установлено, что оптимальное соотношение N:C тем меньше, чем труднодос-
тупнее для дрожжей источник углерода. Обычно для углеводородного сырья соот-
ношение N:C = 1:30, а для углеводного - 1:40. Накопление липидов возможно
только при наличии в среде фосфора. При его недостатке источники углерода ис-
пользуются не полностью, при избытке - накапливаются нелипидные продукты. На
фракционный состав липидов изменение содержания фосфора влияния не оказывает.
Воздействие остальных элементов среды (микро- и макроэлементов) сказывается
на интенсивности роста дрожжей и скорости утилизации источника углерода, что
влияет и на количество накопленных липидов, но не на их качество.
На фракционный состав синтезируемых липидов оказывают другие условия куль-
тивирования: аэрация, pH и температура. От интенсивности аэрации зависит син-
тез фосфоглицеридов, жирных кислот и триацилглицеридов. При недостаточной
аэрации липиды содержат в 4 раза меньше триацилглицеридов, в 2 раза больше
фосфоглицеридов и в 8 раз больше жирных кислот, чем при нормальной. При ин-
тенсификации аэрации возрастает степень ненасыщенности липидов и увеличивает-
ся относительное количество всех групп ненасыщенных кислот. Повышение pH сре-
ды ведет к увеличению содержания фосфоглицеридов и жирных кислот при одновре-
менном снижении количества триацилглицеридов. Оптимальные температуры роста и
липидообразования для клеток совпадают, причем содержание липидов не зависит
от температуры культивирования. Однако, регулируя температуру, можно созда-
вать разные соотношения насыщенных и ненасыщенных жирных кислот в составе
фосфолипидных мембран.
Для углеводных субстратов наиболее отработана технология получения липидов
на гидролизатах торфа и древесины. Как показали исследования, соотношение
гидролизатов торфа и древесины 1:4 обеспечивает наибольший выход биомассы в
стадии культивирования (до 10 г/л) при максимальном содержании липидов (до
51% от АСВ) и высоком коэффициенте усвоения субстрата (до 0,54) . Из 1 тонны
абсолютно сухого торфа после его гидролиза и ферментации можно получить 50-70
кг микробного жира с преимущественным содержанием триацилглицеридов.
ТЕХНОЛОГИЯ ФЕРМЕНТНЫХ
ПРЕПАРАТОВ
Ферменты, получаемые
промышленным способом,
их применение
Классификация ферментов основана на механизме их действия и включает 6
классов.
Ферменты как биокатализаторы обладают рядом уникальных свойств, например,
таких как высокая каталитическая активность и избирательность действия. В ря-
де случаев ферменты обладают абсолютной специфичностью, катализируя превраще-
ние только одного вещества. Для каждого фермента существует свой оптимум pH,
при котором его каталитическое действие максимально. При резком изменении pH
ферменты инактивируются из-за необратимой денатурации. Ускорение реакции при
повышении температуры также лимитировано определенными пределами, поскольку
уже при температуре 40-50°С многие ферменты денатурируют. Эти свойства фер-
ментов приходится учитывать при разработке технологии нового препарата.
Поскольку ферменты - вещества белковой природы, в смеси с другими белками
их количество определить практически невозможно14. Наличие фермента в препа-
рате может быть установлено лишь по протеканию той реакции, которую катализи-
рует фермент. При этом количественную оценку содержания фермента можно дать,
определив либо количество образовавшихся продуктов реакции, либо количество
израсходовавшегося субстрата. За единицу активности фермента принимают то его
количество, которое катализирует превращение одного микромоля субстрата в 1
минуту при заданных стандартных условиях - стандартная единица активности.
По решению Международного биохимического союза активность решено определять
при t = 30°С по начальной скорости реакции, когда концентрация насыщения фер-
мента и временная зависимость близка к кинетике реакции нулевого порядка. Ос-
тальные параметры реакции индивидуальны для каждого фермента. Активность фер-
ментного препарата выражается в микромолях субстрата, прореагировавшего под
действием 1 мл ферментного раствора или 1 грамма препарата в оптимальных ус-
ловиях за 1 минуту. Если ферментный препарат не содержит балласта, то его ак-
тивность выражается в тех же стандартных единицах на 1 мг фермента. Если же
есть балласт, то активность считается на 1 мг белка в ферментном препарате.
Активность выпускаемого препарата - важнейший нормируемый показатель качест-
ва .
Основную часть ферментов, получаемых промышленным способом, составляют гид-
ролазы. К ним относятся, в первую очередь амилолитические ферменты: а-
амилаза, р-амилаза, глюкоамилаза. Их основная функция - гидролиз крахмала и
гликогена. Крахмал при гидролизе расщепляется на декстрины, а затем до глюко-
зы. Эти ферменты применяются в спиртовой промышленности, хлебопечении.
Протеолитические ферменты образуют класс пептидгидролаз. Их действие заклю-
14
Очевидно имеется в виду простыми химическими анализами.
чается в ускорении гидролиза пептидных связей в белках и пептидах. Важная их
особенность - селективный характер действия на пептидные связи в белковой мо-
лекуле. Например, пепсин действует только на связь с ароматическими аминокис-
лотами, трипсин - на связь между аргинином и лизином. В промышленности проте-
олитические ферменты классифицируют по способности проявлять активность в оп-
ределенной области pH: - pH 1.5 - 3.7 - кислые протеазы; - pH 6.5 - 7.5 -
протеазы; - pH >8.0 - щелочные протеазы. Протеазы находят широчайшее приме-
нение в разных отраслях промышленности:
- мясная - для смягчения мяса;
- кожевенная - смягчение шкур;
- кинопроизводство - растворение желатинового слоя при регенерации пленок;
- парфюмерная - добавки в зубную пасту, кремы, лосьоны;
- производство моющих средств - добавки для удаления загрязнений белковой
природы;
- медицина - при лечении воспалительных процессов, тромбозов и т.д.
Пектолитические ферменты уменьшают молекулярную массу и снижают вязкость
пектиновых веществ. Пектиназы делятся на две группы - гидролазы и трансэлими-
назы. Гидралазы отщепляют метильные остатки или разрывают гликозидные связи.
Трансэлиминазы ускоряют негидролитическое расщепление пектиновых веществ с
образованием двойных связей. Применяются в текстильной промышленности (выма-
чивание льна перед переработкой), в виноделии - осветление вин, а также при
консервировании фруктовых соков.
Целлюлолитические ферменты очень специфичны, их действие проявляется в де-
полимеризации молекул целлюлозы. Обычно используются в виде комплекса, дово-
дящего гидролиз целлюлозы до глюкозы (в гидролизной промышленности). В меди-
цинской промышленности их используют для выделения стероидов из растений, в
пищевой - для улучшения качества растительных масел, в сельском хозяйстве -
как добавки в комбикорма для жвачных животных.
Существует ряд факторов, влияющих на биосинтез ферментов. В первую очередь,
к ним относится генетический. Состав и количество синтезируемых ферментов на-
следственно детерминированы. Применяя мутагены можно изменить генетические
свойства микроорганизмов и получить штаммы с ценными для промышленности свой-
ствами. К мутагенным факторам относятся ионизирующее и неионизирующее излуче-
ния, изотопы, антибиотики, другие химические соединения, преобразующие на-
следственные элементы клетки. Несмотря на определяющую роль генетического
фактора в биосинтезе ферментов, производительность биотехнологических процес-
сов зависит и от состава питательной среды. При этом важно не только наличие
источников основных питательных веществ, но и веществ, играющих роль индукто-
ров или репрессоров биосинтеза данного конкретного фермента или их групп. Ме-
ханизм этого явления еще не вполне изучен, но сам факт должен учитываться при
выборе технологии.
Рассмотрим несколько примеров. Фермент липаза почти не синтезируется грибом
Asp.awamori на среде без индуктора, добавление жира кашалота усиливает био-
синтез фермента в сотни раз. При добавлении же в среду крахмала и при полном
исключении минерального фосфора интенсивно синтезируется фосфатаза. Не только
наличие индуктора способно увеличивать выход фермента. Важную роль играет со-
став питательной среды и условия культивирования. При разработке процесса
биосинтеза а-амилазы культурой Asp.oryzae замена сахарозы (как источника уг-
лерода) на крахмал увеличила активность фермента в 3 раза, добавление солодо-
вого экстракта (из проросших семян злаковых) ещё в 10 раз, а повышение кон-
центрации основных элементов питательной среды на 50% - ещё в 2 раза.
Для интенсификации процесса роста и синтеза ферментов добавляют различные
факторы роста, например, аминокислоты, пуриновые основания и их производные,
РНК и продукты её гидролиза. В качестве источника углерода используют крах-
мал, кукурузный экстракт, соевую муку, гидролизаты биомассы дрожжей. Микроор-
ганизмы могут утилизировать и минеральные источники азота. В состав питатель-
ных сред входят и ионы Mg, Мп, Zn, Fe, Си и др. металлов. Механизм действия
большинства из них неизвестен. Некоторые входят в состав фермента. Ионы Са
повышают устойчивость а-амилазы, ионы Fe и Мд активизируют и стабилизируют
протеолитические ферменты.
Оптимальный состав питательной среды для каждого продуцента может быть оп-
ределен двумя способами: эмпирический и построение математической модели с
использованием компьютера. Последний, естественно, предпочтительнее. По ха-
рактеру культивирования все технологические процессы производства ферментных
препаратов делятся на две большие группы: глубинный и поверхностный методы.
Глубинный метод культивирования
продуцентов ферментов
В этом случае микроорганизмы выращиваются в жидкой питательной среде. Тех-
нически более совершенен, чем поверхностный, так как легко поддается автома-
тизации и механизации. Концентрация фермента в среде при глубинном культиви-
ровании обычно значительно ниже, чем в водных экстрактах поверхностной куль-
туры. Это вызывает необходимость предварительного концентрирования фильтрата
перед его выделением.
При глубинном культивировании продуцентов ферментов выделяют, как и в любом
биотехнологическом процессе, 5 этапов.
1. Приготовление питательных сред зависит от состава компонентов. Некоторые
предварительно измельчают, отваривают или гидролитически расщепляют. Готовые
к растворению компоненты подают при постоянном помешивании в емкость для при-
готовления среды в определенной последовательности. Стерилизацию среды прово-
дят либо путем микрофильтрации с помощью полупроницаемых мембран, либо при
помощи высоких температур. Время обработки в этом случае зависит как от ин-
тенсивности фактора, так и от уровня обсемененности объекта. Стерилизуются
также все коммуникации и аппараты. Воздух очищается до и после аэрирования.
До - потому что содержит частицы пыли органической и неорганической природы,
после - так как несет клетки продуцента.
2. Получение засевного материала. Для засева питательной среды материал го-
товят также глубинным методом. Вид его зависит от продуцента: для грибов это
мицелиальная вегетативная масса, для бактерий - молодая растущая культура на
начальной стадии спорообразования. Получение посевного материала состоит в
увеличении массы продуцента в 3-4 стадии. Объем посевного материала зависит
от физиологических особенностей продуцента. Если продуцент размножается толь-
ко вегетативно, он резко возрастает (до 5-20%). Если же происходит обильное
спороношение - сокращается до 1%.
3. Производственное культивирование. Биосинтез ферментов в глубинной куль-
туре протекает в течение 2-4 суток при непрерывной подаче воздуха и перемеши-
вании. Высокая концентрация питательных веществ на первых этапах могут тормо-
зить рост биомассы продуцента, поэтому часто свежая среда или некоторые её
компоненты вводятся в ферментер на стадии активного роста. Температурный оп-
тимум находится в интервале 22-32°С. В современных технологических процессах
ведется непрерывное автоматическое определение содержания в среде углеводов,
количества образовавшихся метаболитов и концентрации клеток. Данные поступают
в ЭВМ, которая определяет стратегию коррекции процесса и автоматически регу-
лирует его. Этим достигается максимальная производительность и наилучшее ка-
чество продуктов.
4. Выделение. В мицелии трёхсуточной культуры обычно остается не более 15%
ферментов. Остальные выделяются в окружающую клетки жидкую среду. В этом слу-
чае препараты ферментов выделяют из фильтратов после отделения биомассы.
5. Получение товарной формы.
Поверхностный метод культивирования
продуцентов ферментов
При поверхностном методе культура растет на поверхности твердой увлажненной
питательной среды15. Мицелий полностью обволакивает и довольно прочно скреп-
ляет твердые частицы субстрата, из которого получают питательные вещества.
Поскольку для дыхания клетки используют кислород, то среда должна быть рых-
лой, а слой культуры-продуцента небольшим.
Выращивание производственной культуры происходит обычно в асептических ус-
ловиях, но среду и кюветы необходимо простерилизовать. Перед каждой новой за-
грузкой также необходима стерилизация оборудования.
Преимущества поверхностной культуры: значительно более высокая конечная
концентрация фермента на единицу массу среды (при осахаривании крахмала 5 кг
поверхностной культуры заменяют 100 кг культуральной жидкости), поверхностная
культура относительно легко высушивается, легко переводится в товарную форму.
Посевной материал может быть трёх видов:
- культура, выросшая на твердой питательной среде;
- споровый материал;
- мицелиальная культура, выращенная глубинным способом.
В три этапа получают и посевную культуру. Сначала музейную культуру проду-
цента пересевают на 1 - 1.5 г увлажненных стерильных пшеничных отрубей в про-
бирку и выращивают в термостате до обильного спорообразования. Второй этап -
аналогично, но в колбах, третий - в сосудах с 500 г среды.
15
Грибная культура, например плесени.
Основу питательной среды составляют пшеничные отруби, как источник необхо-
димых питательных и ростовых веществ. Кроме того, они создают необходимую
структуру среды. Для повышения активности ферментов к отрубям можно добавлять
свекловичный жом, соевый шрот, крахмал, растительные отходы. Стерилизуют сре-
ду острым паром при помешивании (температура - 105-140° С, время 60-90 ми-
нут) . После этого среду засевают и раскладывают ровным слоем в стерильных кю-
ветах. Кюветы помещают в растильные камеры. Культивируют в течение 36-48 ча-
сов .
Рост делится на три периода, примерно равных по времени. Сначала происходит
набухание конидий и их прорастание (температура не ниже 28° С) , затем рост
мицелия в виде пушка серовато-белого цвета (необходимо выводить выделяемое
тепло) и образование конидий. Для создания благоприятных условий роста и раз-
вития продуцента необходима аэрация и поддержание оптимальной влажности (55-
70%) .
Выросшая в неподвижном слое при поверхностном культивировании культура
представляет корж из набухших частиц среды, плотно связанных сросшимся мице-
лием. Массу размельчают до гранул 5-5 мм. Культуру высушивают до 10-12% влаж-
ности при температурах не выше 40°С, не долее 30 минут. Иногда препарат при-
меняют прямо в неочищенном виде - в кожевенной и спиртовой промышленности. В
пищевой и особенно медицинской промышленности используются ферменты только
высокой степени очистки.
Схема очистки сводится к следующему:
- освобождение от нерастворимых веществ;
- освобождение от сопутствующих растворимых веществ;
- фракционирование (как правило, хроматографическими методами).
Для выделения фермента из поверхностной культуры необходима экстракция. Как
правило, экстраген - вода. При этом в раствор переходят сахара, продукты гид-
ролиза пектиновых веществ и целлюлозы. Стадию выделения и очистки завершает
сушка. После сушки препарат должен содержать не более 6-8% влаги, тогда он
может в герметичной упаковке храниться до года без потери активности.
Стандартизация ферментного препарата - доводка активности фермента до стан-
дартной, соответствующей требованиям ГОСТ. Для этого используются различные
нейтральные наполнители - крахмал, лактоза и др.
Учитывая огромные перспективы применения ферментных препаратов в различных
отраслях промышленности и сельского хозяйства, медицине, можно сделать заклю-
чение о необходимости расширения исследований в этой области для оптимизации
технологии и гарантийного получения высокоактивных и стабильных препаратов
микробных ферментов.
БИОТЕХНОЛОГИЯ ПРЕПАРАТОВ
ДЛЯ СЕЛЬСКОГО ХОЗЯЙСТВА
Препараты, производимые для сельского хозяйства, делятся на 3 группы:
- энтомопатогенные препараты;
- бактериальные удобрения;
- антибиотики.
Отечественное биотехнологическое производство выпускает 3 группы энтомопа-
тогенных препаратов:
1. Бактериальные препараты на основе Bacillus thuringiensis - энтобактерин-
3, дендробациллин, инсектин, токсобактерин.
2. Грибной препарат боверин на основе гриба Beauveria bassiana.
3. Препараты на основе вирусов ядерного полиэдра (вирин-ЭНШ, вирин-ЭКС и
ДР-) .
Все микробные патогены выпускаются в виде смачивающих порошков, паст, реже
- гранул, эмульсии спор и кристаллов. При непосредственном применении предпо-
лагается использование различных добавок в виде растворителей, прилипателей,
способствующих повышению их эффективности. Технология получения бактериальных
энтомопатогенных препаратов. Наибольшее распространение среди промышленно вы-
пускаемых микробных патогенов получили бактериальные препараты. Их отличи-
тельными особенностями являются высокая вирулентность по отношению к насеко-
мым-вредителям, безопасность для окружающей флоры и фауны, достаточно высокая
скорость воздействия на вредителей и др. В настоящее время производятся пре-
параты против более 160 видов насекомых.
Бактериальные энтомопатогенные
препараты
Из всех энтомопатогенных бактерий наиболее исследованы грамположительные
бактерии Вас.thuringiensis. Она не только разрушает насекомое, попадая
внутрь, но и продуцирует ряд токсичных продуктов. Среди этих токсичных про-
дуктов выделяют 4 компонента:
- а-экзотоксин, или фосфолипаза С, - продукт растущих клеток бактерий. Ток-
сическое действие фермента связывают с индуцируемым им распадом незаменимых
фосфолипидов в ткани насекомого, что приводит к гибели последнего.
- р-экзотоксин - накапливается в культуральной жидкости при росте клеток.
Считают, что молекула р-токсина состоит из нуклеотида, связанного через рибо-
зу и глюкозу с аллослизевой кислотой. Его действие, видимо, обусловлено инги-
бированием нуклеотидазы и ДНК-зависимой РНК-полимераЗы, связанных с АТФ, что
приводит к прекращению синтеза РНК. По сравнению с другими токсинами действу-
ет медленнее, в основном при переходе от одного цикла развития к другому. По
наблюдениям, р-экзотоксин - мутаген, поражающий генетический аппарат особей.
- у-эк3отоксин “ малоизученный компонент, неидентифицированный фермент (или
группа ферментов).
- 5-эндотоксин - параспоральный кристаллический эндотоксин. Образуется в
процессе споруляции бактерии в противоположной от формирующейся споры части
бактерии. На завершающей стадии спорообразования токсин приобретает форму 8-
гранного кристалла. Кристаллы состоят из белка, аминокислотный состав которо-
го близок для различных штаммов. Доказано, что кристаллический белок в кишеч-
нике восприимчивых насекомых распадается на молекулы протоксина. Протоксин
под действием протеиназ распадается на токсические фрагменты. Различие в вос-
приимчивости некоторых видов насекомых к действию кристалла, по-видимому,
связано с присутствием специальных кишечных протеаз, осуществляющих гидролиз
кристаллов in vivo. Такими протеазами обладают не все насекомые, отсюда и из-
бирательность действия 5-токсина. Чтобы насекомое погибло, кристаллы должны
попасть в его организм. После поглощения кристаллов гусеницы перестают пи-
таться. Первичным местом действия 5-токсина является средний отдел кишечника.
В зависимости от реакции на кристаллы насекомые делятся на три группы:
- характерен общий паралич;
- паралич среднего отдела кишечника;
- реакция на препарат в целом: гибель в результате прорастания спор и по-
следующего размножения бактерий.
Бактерии Вас. thuringiensis антагонистичны к 130 видам насекомых. Наиболь-
ший эффект достигается при применении препаратов этой группы против листогры-
зущих вредителей. Наиболее распространенные препараты на основе различных ва-
риаций Вас. thuringiensis: энтобактерин, инсектин, алестин, экзотоксин, ток-
собактерин, дендробациллин, битоксибациллин.
Промышленное производство энтомопатогенных бактерий (ЭБ) заключается в глу-
боком культивировании. При этом ставится задача получения максимального титра
клеток в культуральной жидкости и накопления токсина. Требования к промышлен-
ным штаммам ЭБ: принадлежность штамма к определенному серотипу, высокая виру-
лентность и продуктивность на промышленных средах, устойчивость к комплексу
фагов и т.д. Технология производства включает все стадии, типичные для любого
биотехнологического производства. Температуру культивирования на всех стадиях
поддерживают постоянной (28-30°С) , продолжительность ферментации составляет
35-40 часов. Используют дрожже-полисахаридную среду, содержащую в процентах:
кормовые дрожжи - 2-3; кукурузную муку - 1-1.5; кашалотовый жир - 1. Перед
началом культивирования pH составляет около 6.3, к концу ферментации - повы-
шается до 8.0 - 8.5, что может привести к разрушению кристаллов на более мел-
кие фрагменты и затруднить их выделение. Чтобы предотвратить это, культураль-
ную жидкость перед переработкой подкисляют до 6.0 - 6.2. Культивирование За-
канчивают при степени споруляции 90-95% и титре спор не менее 109 в 1 мл. По-
сле сепарации культуральной жидкости получают пасту влажностью 85% с выходом
около 100 кг в 1 кубометре культуральной жидкости и титром порядка 20*109
спор в 1 грамме. Фугат можно употребить для приготовления питательной среды,
но не более 1-2 раз, так как в культуральной жидкости накапливаются вещества,
ингибирующие развитие культуры. Фугат находит свое применение в качестве сы-
рья при производстве кормовых дрожжей, что обеспечивает сокращение промышлен-
ных стоков и снижает расход воды. Пасту перемешивают в течение получаса для
однородного распределения спор и кристаллов и отбирают пробы на проверку тит-
ра , влажности, вирулентности, наличия фага.
Конечный продукт - смачивающий порошок или стабилизированная паста. Первый
получают путем высушивания увлажненной пасты на распылительной сушке. Готовый
препарат фасуют по 20 кг в четырехслойные крафт-мешки с полиэтиленовым вкла-
дышем. Вторую - внесением в пату КМЦ. При смешении молекулы КМЦ сорбируют
белковые кристаллы и споры, заряжая их отрицательно, что способствует равно-
мерному распределению активного начала по всему объёму и увеличению срока
хранения. Готовый препарат - вязкая жидкость кремового или светло-серого цве-
та, без запаха, не замерзающую при хранении. Препарат предназначен для борьбы
с садово-огородными вредителями, эффективен против 60 видов насекомых. Приме-
няют путем опрыскивания растений водной эмульсией в период активного роста
вредителя. Основная масса вредителей погибает в течение 2-10 дней. На 1 га
расходуют: для овощных культур 1-3 кг, садовых - 3-5 кг.
Грибные энтомопатогенные
препараты
Энтомопатогенные препараты на основе микроскопических грибов вызывают у на-
секомых микозы. Грибы обладают рядом особенностей:
- поражение происходит через кутикулу;
- насекомые поражаются в фазе развития куколки и имаго;
- большая скорость роста и огромная репродуктивная способность, в виде спор
могут длительное время находится в природе без снижения энтомопатогенной ак-
тивности ;
- высокая специфичность, вирулентность сильно зависит от штамма гриба.
Действие грибного препарата на насекомое начинается с проникновения споры в
полость тела через кожные покровы. Попав в тело, спора прорастает в гифу, за-
тем разрастается мицелий, от которого отчленяются конидии. Оказавшись в теле,
конидии циркулируют в гемолимфе. Уже на этой стадии возможно поражение насе-
комого вследствие выделения некоторыми штаммами значительного количества ток-
синов . В отсутствие токсина мицелий постепенно заполняет все тело насекомого,
прежде всего поражается мышечная ткань. Рост гриба продолжается до тех пор,
пока все ткани не будут разрушены. Могут образовываться конидиеносцы, проры-
вающие кутикулу и обволакивающие мертвую личинку.
В промышленном производстве используются отдельные штаммы в основном трех
родов: Beaveria, Metarrhizium, Entomophtora. В нашей стране освоено промыш-
ленное производство препарата боверина на основе B.bassiana. Готовый препарат
- порошок кремового или белого цвета, содержащий в 1 г от 1.5 до 6 млрд, ко-
нидиоспор. Препарат безвреден для теплокровных животных и человека, не вызы-
вет ожогов у растений.
Получать боверин, можно используя, как поверхностное, так и глубинное куль-
тивирование. Первый способ более трудоемок и длителен, поэтому имеет ограни-
ченное значение. Производство конидиоспор при выращивании его в жидкой среде
также непростая задача. Основная трудность в том, что при этом способе куль-
тивирования гриб размножается вегетативно, образуя гонидии. Гонидии по виру-
лентности не уступают конидиям, однако неустойчивы к высоким температура на
стадии высушивания. При традиционной распылительной сушке погибает 90% гони-
диоспор и 20-50% конидиоспор. Проблема решается подбором питательной среды и
условий ферментации, обеспечивающих переход 90% выращенных клеток в конидиос-
поры.
Технология получения боверина методом глубинного культивирования включает
обычные стадии. Питательная среда содержит в процентах: дрожжи кормовые - 2,
крахмал - 1, хлорид натрия - 0.2, хлорид марганца - 0.01, хлорид кальция -
0.05. Последний компонент обеспечивает устойчивость конидий к неблагоприятным
факторам, поэтому его содержание может сильно варьировать (до 5%) . Культиви-
руют при pH 4.5-5.6, температуре 25-28°С 3-4 суток в условиях постоянного пе-
ремешивания и аэрации. В среде необходимо также наличие аминного азота, так
как его недостаток снижает скорость роста культуры и процент образования ко-
нидиоспор, избыток ведет к образованию гонидий. Культуральную жидкость под-
вергают сепарации и фильтрованию, после чего пасту сушат на распылительной
сушке.
Вирусные энтомопатогенные
препараты
Из всех энтомопатогенных препаратов вирусные обладают наибольшей специфич-
ностью по отношению к насекомому-хозяину. Они поражают не более одного вида.
Их ярко выраженная специфичность обуславливает практическую безвредность ви-
русных препаратов для человека, флоры и фауны.
Вирусы отличает высокая устойчивость к неблагоприятным факторам окружающей
среды, они способны сохранять активность в течение 10-15 лет, находясь вне
насекомого. Заражение вирусом происходит при питании вредителя. Попавшие в
кишечник тельца-включения при щелочных значениях pH разрушаются. Освобожден-
ные вирионы проникают через стенку кишечника в клетки, где в ядрах происходит
репликация вирусов. Высвободившиеся вирусы заражают другие клетки, что в ито-
ге приводит к гибели насекомого. Отличительной особенностью вирусов является
то, что они могут размножаться только в живой ткани. Это создает определенные
трудности в организации промышленного производства, так как технология раз-
множения вирусов должна быть связана с использованием живых насекомых-хозяев.
В нашей стране осуществляется выпуск трех вирусных энтомопатогенных препа-
ратов: вирин-ЭКС (против капустной совки), ЭНШ (против непарного шелкопряда)
и АББ (против американской белой бабочки).
Производство любого из вирусных препаратов начинают с разведения насекомо-
го-хозяина на искусственных питательных средах, обеспечивающих их физиологи-
чески здоровое состояние. На определенной стадии развития (обычно на стадии
гусеницы) насекомых заражают, добавляя вирусную суспензию к корму. При этом
инокулят предварительно получают от нескольких больных личинок. После зараже-
ния насекомых выдерживают в строго определенных условиях, обеспечивающих мак-
симальное накопление вируса в тканях. Через 7-9 суток собирают мертвые и от-
мирающие личинки, подсушивают при температуре 33-35°С, измельчают механиче-
ским способом для вывода телец-включений из тканей. К полученной массе добав-
ляют физиологический раствор или дистиллированную воду из расчета 1 мл на гу-
сеницу, взвесь полученных тканей фильтруют.
При производстве вирин-ЭКС полиэдры осаждают из фильтрата центрифугировани-
ем. Осадок суспендируют в минимальном количестве дистиллированной воды и до-
бавляют простерилизованный глицерин до титра 1 млрд, полиэдров в 1 мл. Гото-
вый препарат разливают во флаконы. При производстве вирин-ЭНШ в фильтрат до-
бавляют лактозу, а после перемешивания ацетон в соотношении 4:1 к объему сус-
пензии . После отстаивания надосадочную жидкость сливают, осадок подсушивают
до полного удаления ацетона. Если препарат планируется выпускать в виде по-
рошка, то сухой осадок смешивают с мелкодисперсным наполнителем (каолином,
например) до получения титра полиэдров 1 млрд, полиэдров в 1 грамме.
Масляную форму препарата получают путем диспергирования осадка в стерильном
50% растворе глицерина до титра 2 млрд, полиэдров в 1 мл, а затем добавляют
равный объем солярового масла, перемешивают и разливают по флаконам. Вирусные
энтомопатогенные препараты применяют путем внесения полиэдров в плотные попу-
ляции насекомых-вредителей с целью возникновения в них эпизоотий. Данный спо-
соб обработки предполагает внесение небольших количеств препарата. В другом
случае опрыскивание или опыление производят на зараженных участках в период
рождения личинок или на ранних стадиях их развития.
Бактериальные удобрения на
основе клубеньковых бактерий
Микрофлора почвы оказывает непосредственное влияние на её плодородие и, как
следствие, на урожайность растений. Почвенные микроорганизмы в процессе роста
и развития улучшают структуру почвы, накапливают в ней питательные вещества,
минерализуют различные органические соединения, превращая их в легко усвояе-
мые растением компоненты питания. Для стимуляции этих процессов применяют
различные бактериальные удобрения, обогащающие ризосферу растений полезными
микроорганизмами. Микроорганизмы, используемые для производства бактериальных
препаратов, способствуют снабжению растений не только элементами минерального
питания, но и физиологически активными веществами (фитогормонами, витаминами
и др.).
В настоящее время выпускают16 такие бактериальные удобрения, как нитрагин,
ризоторфин, азотобактерин, фосфобактерин, экстрасол.
Отечественная промышленность выпускает два вида препаратов клубеньковых
бактерий: нитрагин и ризоторфин. Оба препарата производятся на основе актив-
ных жизнеспособных клубеньковых бактерий из рода Rhizobium. Эти бактерии в
симбиозе с бобовыми культурами способны фиксировать свободный азот атмосферы,
превращая его в соединения, легкоусвояемые растением.
Бактерии рода Rhizobium - строгие аэробы. Среди них различают активные, ма-
лоактивные и неактивные культуры. Критерием активности клубеньковых бактерий
служит их способность в симбиозе с бобовым растением фиксировать атмосферный
азот и использовать его в виде соединений для корневого питания растений.
Фиксация атмосферного азота возможна только в клубеньках, образующихся на
корнях растений. Возникают они при инфицировании корневой системы бактериями
из рода Rhizobium. Заражение корневой системы происходит через молодые корне-
вые волоски. После внедрения бактерии прорастают внутри них до самого основа-
ния в виде инфекционной нити. Выросшие нити проникают сквозь стенки эпидерми-
16
Учебник был написан до перестройки.
са в кору корня, разветвляются и распределяются по клетками коры. При этом
индуцируется деление клеток хозяина и разрастание тканей. В месте локализации
бактерий на корне растения-хозяина образуются клубеньки, в которых бактерии
быстро размножаются и располагаются по отдельности или группами в цитоплазме
растительных клеток. Сами бактериальные клетки увеличиваются в несколько раз
и меняют окраску. Если клубеньки имеют красноватую или розовую окраску, обу-
словленную наличием пигмента легоглобина (леггемоглобина) - аналог гемоглоби-
на крови животных, то они способны фиксировать молекулярный азот. Неокрашен-
ные ("пустые") или имеющие зеленоватую окраску клубеньки не фиксируют азот.
Бактерии, находящиеся в клубеньках, синтезируют ферментную систему с нитро-
геназной активностью, восстанавливающую молекулярный азот до аммиака. Ассими-
ляция аммиака происходит, в основном, путем вовлечения его в ряд ферментатив-
ных превращений, приводящих к образованию глутамина и глутаминовой кислоты,
идущих в дальнейшем на биосинтез белка.
Помимо критерия активности в характеристике клубеньковых бактерий использу-
ют критерий вирулентности. Он характеризует способность микроорганизма всту-
пать в симбиоз с бобовым растением, то есть проникать через корневые волоски
внутрь корня и вызывать образование клубеньков. Большое значение имеет ско-
рость такого проникновения. В симбиотическом комплексе растение - Rhizobium
бактерии обеспечиваются питательными веществами, а сами снабжают растение
азотистым питанием. С вирулентностью связана и видовая избирательность, кото-
рая характеризует способность данного вида бактерий к симбиозу с определенным
видом бобового растения. Классификация различных видов Rhizobium учитывает
растение-хозяина, например: Rhizobium phaseoli - для фасоли, Rhizobium lupini
- для люпина, сараделлы и т.д. Вирулентность и видоспецифичность взаимосвяза-
ны и не являются постоянными свойствами штамма.
Задачей производства бактериальных удобрения является максимальное накопле-
ние жизнеспособных клеток, сохранение их жизнеспособности на всех стадиях
технологического процесса, приготовление на их основе готовых форм препарата
с сохранением активности в течение гарантийного срока хранения.
Отечественная промышленность выпускает два вида нитрагина: почвенный и су-
хой. Впервые культура клубеньковых бактерий на почвенном субстрате была при-
готовлена в 1911 году на бактериально-агрономической станции в Москве. В на-
стоящее время его производство имеет ограниченное значение, так как техноло-
гия довольно сложна и трудоёмка при выполнении отдельных операций. Более пер-
спективна технология производства сухого нитрагина.
Сухой нитрагин - порошок светло-серого цвета, содержащий в 1 г не менее 9
млрд, жизнеспособных бактерий в смеси с наполнителем. Влажность не превышает
5-7%. Промышленное производство имеет типичную схему. Необходимо отметить,
что важно подбирать штаммы, устойчивые к высушиванию. Для производства посев-
ного материала исходную культуру клубеньковых бактерий выращивают на агаризо-
ванной среде, содержащей отвар бобовых семян, 2% агара и 1% сахарозы, затем
культуру размножают в колбах на жидкой питательной среде в течение 1-2 суток
при 28-30°С и pH 6.5-7.5. На всех этапах промышленного культивирования приме-
няют питательную среду, включающую такие компоненты, как меласса, кукурузный
экстракт, минеральные соли в виде сульфатов аммония и магния, мел, хлорид на-
трия и двузамещенный фосфат калия. Основная ферментация идет при тех же усло-
виях в течение 2-3 суток. Готовую культуральную жидкость сепарируют, получа-
ется биомасса в виде пасты с влажностью 70-80%. Пасту смешивают с защитной
средой, содержащей тиомочевину и мелассу (1:20) и направляют на высушивание.
Сушат путем сублимации (в вакуум-сушильных шкафах). Высушенную биомассу раз-
малывают . Производительнее высушивание в распылительных сушках, но при этом
75% клеток теряют жизнеспособность. Препараты сухого нитрагина фасуют и гер-
метизируют в полиэтиленовые пакеты по 0.2 - 1 кг, хранят при температуре 15°С
не более 6 месяцев. Семена опудривают перед посевом. Внесение нитрагина повы-
шает урожайность в среднем на 15-25%.
Препарат клубеньковых бактерий может выпускаться и в виде ризоторфина.
Впервые торфяной препарат клубеньковых бактерий был приготовлен в 30-х годах,
но технология была создана в 1973-77 гг. Для приготовления ризоторфина торф
сушат при температуре не выше 100°С и размалывают в порошок. Наиболее эффек-
тивным способом стерилизации является облучение его гамма-лучами. Перед сте-
рилизацией размолотый, нейтрализованный мелом и увлажненный до 30-40% торф
расфасовывают в полиэтиленовые пакеты. Затем его облучают и заражают клубень-
ковыми бактериями, используя шприц, с помощью которого впрыскивается пита-
тельная среда, содержащая клубеньковые бактерии. Прокол после внесения бакте-
рий заклеивается липкой лентой. Каждый грамм ризоторфина должен содержать не
менее 2.5 млрд, жизнеспособных клеток с высокой конкурентоспособностью и ин-
тенсивной азотфиксацией. Препарат хранят при температуре 5-6°С и влажности
воздуха 40-55%. Пакеты могут быть весом от 0.2 до 1.0 кг. Доза препарата со-
ставляет 200 г на га. Заражение семян производят следующем образом: ризотор-
фин разбавляют водой и процеживают через двойной слой марли. Полученной сус-
пензией обрабатывают семена. Семена высевают в день обработки или на следую-
щий .
Обработка семян бобовых культур прочно вошла в мировую сельскохозяйственную
практику. Крупнейшими производителями таких препаратов являются США и Австра-
лия .
Технология получения
азотобактерина
Азотобактерин - бактериальное удобрение, содержащее свободноживущий почвен-
ный микроорганизм Azotobacter chroococcum, способный фиксировать до 20 мг ат-
мосферного азота на 1 г использованного сахара. Внесенные в качестве удобре-
ния в почву бактерии также выделяют биологически активные вещества (никотино-
вую и пантотеновую кислоты, пиридоксин, биотин, гетероауксин, гиббереллин и
др.) . Эти вещества стимулируют рост растений. Кроме того, продуцируемые
Azotobacter фунгицидные вещества из группы анисомицина угнетают развитие не-
которых нежелательных микроскопических грибов в ризосфере растения.
Все виды Azotobacter строгие аэробы. Чувствительны к содержанию в среде
фосфора и развиваются лишь при высоком его содержании в питательной среде.
Азотфиксирующая способность культуры подавляется аммиаком (вообще содержание
в среде связанного азота угнетает азотфиксацию). Стимулируют процесс фиксации
азота соединения молибдена.
Установлено, что при фиксации азота процесс его восстановления протекает на
одном и том же синтезируемом азотобактером ферментном комплексе и лишь конеч-
ный продукт (аммиак) отделяется от фермента. Нитрогеназная азотфиксирующая
система представляет собой мультиферментный комплекс, содержащий не связанное
с геном железо, молибден и SH-группы.
Микробиологическая промышленность выпускает несколько видов азотобактерина:
сухой, почвенный и торфяной. Технология получения сухого азотобактерина имеет
много общего с технологией производства сухого нитрагина. Сухой азотобактерин
- активная культура высушенных клеток азотобактера с наполнителем. В 1 г пре-
парата содержится не менее 0.5 млрд, жизнеспособных клеток. Культуру микроор-
ганизма выращивают методом глубинного культивирования на среде, содержащей те
же компоненты, что и при культивировании клеток Rhizobium. Дополнительно вво-
дят только сульфаты железа и марганца, а также сложную соль молибденовой ки-
слоты, pH 5.7-6.5.
Процесс ферментации проводят до стационарной фазы развития культуры, так
как в этой фазе биологически активные вещества выделяются из клетки и остают-
ся в культуральной жидкости. Биологически активные вещества могут также пол-
ностью или частично теряться при высушивании, однако жизнеспособные клетки
быстро восстанавливают способность их продуцировать. Высушенную культуру
стандартизируют, фасуют в полиэтиленовые пакеты по 0.4-2 кг и хранят при тем-
пературе 15°С не более 3 месяцев.
Почвенный и торфяной азотобактерин представляют собой активную культуру
азотобактера, размноженную на твердой питательной среде, и содержат в 1 г не
менее 50 млн. жизнеспособных клеток. Для их приготовления берут плодородную
почву или разлагающийся торф с нейтральной реакцией среды. К просеянному суб-
страту добавляют 2% извести и 0.1% суперфосфата. По 500 г полученной смеси
переносят в бутыли емкостью по 0.5 л, увлажняют на 40-60% по объему водой,
закрывают ватными пробками и стерилизуют. Посевной материал готовят на агаро-
вых средах, содержащих 2% сахарозы и минеральные соли. Когда агар полностью
покрывается слизистой массой коричневого цвета, полученный материал стерильно
смывается дистиллированной водой и переносится на приготовленный субстрат.
Содержимое бутылок тщательно перемешивают и термостатируют при 25-27°С. Куль-
тивирование продолжают до тех пор, пока бактерии не размножатся до необходи-
мого количества. Полученный препарат сохраняет свою активность в течение 2-3
месяцев.
Использовать азотобактерин рекомендуется только на почвах, содержащих фос-
фор и микроэлементы. Азотобактерин применяют для бактеризации семян, рассады,
компостов. При этом урожайность увеличивается на 10-15%. Семена зерновых
опудривают сухим азотобактерином из расчета 100 млрд, клеток на 1 гектарную
порцию семян. Картофель и корневую систему рассады равномерно смачивают вод-
ной суспензией бактерий. Для получения суспензии 1 гектарную норму (300 млрд,
клеток) разводят в 15 литрах воды. При обработке почвенным или торфяным азо-
тобактерином семена перемешивают с увлажненным препаратом и для равномерного
высева подсушивают. Корневую систему рассады смачивают приготовленной суспен-
зией.
Технология получения
фосфобактерина
Фосфобактерин - бактериальное удобрение, содержащее споры микроорганизма
Bacillus megaterium var. phosphaticum. Представляет собой порошок светло-
серого или желтоватого цвета.
Бактерии обладают способностью превращать сложные фосфорорганические соеди-
нения (нуклеиновые кислоты, нуклеопротеиды и т.д.) и трудноусвояемые мине-
ральные фосфаты в доступную для растений форму. Кроме этого бактерии выраба-
тывают биологически активные вещества (тиамин, пиридоксин, биотин, пантотено-
вую и никотиновую кислоты и др.), стимулирующие рост растения. Фосфобактерин
относится к числу препаратов со стимулирующим эффектом.
Bacillus megaterium var. phosphaticum представляют собой мелкие, грамполо-
жительные аэробные спорообразующие палочки размером 2*6 мкм. Клетки содержат
значительное количество соединений фосфора. В ранней стадии развития это под-
вижные одиночные палочки, при старении образуют эндоспоры, локализующиеся в
одном из концов клетки. В силу вышеизложенного технология выращивания сводит-
ся к получению спор.
В целом производство фосфобактерина похоже на производство азотобактерина и
препаратов клубеньковых бактерий. Состав питательной среды в процентах: куку-
рузный экстракт -1.8, меласса - 1.5, сульфат аммония - 0.1, мел - 1, осталь-
ное - вода. Культивирование ведется глубинным методом в строго асептических
условиях при постоянном перемешивании и принудительной аэрации до стадии об-
разования спор. Основные параметры проведения процесса: температура 28-30°С,
pH 6.5-7.5, длительность культивирования 1.5-2 суток.
Полученную в ходе культивирования биомассу клеток отделяют центрифугирова-
нием и высушивают в распылительной сушилке при температуре 65-75°С до оста-
точной влажности 2-3%. Высушенные споры смешивают с наполнителем. Готовый
препарат должен содержать не менее 8 млрд, клеток в 1 г. Расфасовывают препа-
рат в полиэтиленовые пакеты по 50-500 г. В отличие от нитрагина и азотобакте-
рина фосфобактерин обладает большей устойчивостью при хранении.
Фосфобактерин рекомендуют применять на черноземных почвах, которые содержат
наиболее значительное количество фосфороорганических соединений. Необходим
для повышения урожайности зерновых, картофеля, сахарной свеклы и др. сельско-
хозяйственных растений. Семена обрабатывают смесью сухого фосфобактерина с
наполнителем (золой, почвой и др.) в соотношении 1:40. На 1 гектарную порцию
требуется 5 г препарата и 200 г наполнителя. Клубни картофеля равномерно ув-
лажняют суспензией спор, приготовленной из расчета 15 г препарата на 15 л во-
ды. Урожай при этом повышается на 10%.
Антибиотики для сельского хозяйства
Антибиотики применяют в нескольких целях:
- для борьбы с болезнями животных;
- для борьбы с болезнями растений;
- как стимуляторы роста животных;
- при консервировании продуктов;
- в научных исследованиях (в области биохимии, молекулярной биологии, гене-
тике, онкологии).
Современное определение термина17 "антибиотик" принадлежит М.М.Шемякину и
А.С.Хохлову (1961), которые предложили считать антибиотическими веществами
17
Лишнее определение Здесь, лучше в начале публикации.
все продукты обмена любых организмов, способные избирательно убивать или по-
давлять рост и развитие микроорганизмов.
Полная химическая структура установлена только для трети антибиотиков, а
может быть получена химическим путем лишь половина из них. Синтез микроорга-
низмами антибиотиков - одна из форм проявления антагонизма, связан с опреде-
ленным характером обмена веществ, возникшим и закрепленным в ходе эволюции.
Воздействуя на постороннюю микробную клетку, антибиотик вызывает нарушения в
её развитии. Некоторые антибиотики способны подавлять синтез оболочки бакте-
риальной клетки в период размножения, другие изменяют проницаемость цитоплаз-
матической мембраны, некоторые ингибируют реакции обмена веществ. Механизм
действия антибиотиков выявлен не полностью.
В течение многих лет антибиотики используют как стимуляторы роста сельско-
хозяйственных животных и птицы, как средства борьбы с заболеваниями растений
и посторонней микрофлорой в ряде бродильных производств, как консерванты пи-
щевых продуктов. Механизм стимулирующего действия антибиотиков также не до
конца выяснен. Предполагают, что стимулирующий эффект низких концентраций ан-
тибиотиков на организм животного связан с двумя факторами:
- воздействие на микрофлору кишечника,
- непосредственное влияние на организм животного.
В первом случае антибиотики снижают число вредных и увеличивают количество
полезных для организма микроорганизмов. Во втором случае - снижают pH содер-
жимого кишечника, уменьшают поверхностное натяжение клеток организма, что
способствует ускорению их деления. Кроме того, антибиотики увеличивают коли-
чество ростовых гормонов, приспособляемость организма к неблагоприятным усло-
виям и т. д. Кормовые антибиотики применяют в виде неочищенных препаратов,
представляющих собой высушенную массу продуцента, содержащую помимо антибио-
тика аминокислоты, ферменты, витамина группы В и другие биологически активные
вещества.
Все производимые кормовые антибиотики: а) не используются в терапевтических
целях и не вызывают перекрестной резистентности бактерий к антибиотикам, при-
меняемым в медицина; б) практически не всасываются в кровь из пищеварительно-
го тракта; в) не меняют своей структуры в организме; г) не обладают антиген-
ной природой, способствующей возникновению аллергии.
В настоящее время выпускаются несколько видов кормовых антибиотиков: препа-
раты на основе хлортетрациклина (биовит, кормовой биомицин), бацитрацин, гри-
зин, гигромицин Б и др. Из этих препаратов только бацитрацин представляет со-
бой высушенную культуральную жидкость, полученную в результате глубинного вы-
ращивания Bacilus licheniformis. Остальные антибиотики являются продуктами
жизнедеятельности разных видов Actinomyces.
Антибиотики используют и как средство борьбы с различными фитопатогенами.
Воздействие антибиотика сводится к замедлению роста и гибели фитопатогенных
микроорганизмов, содержащихся в семенах и вегетативных органах растений. К
таким антибиотикам относятся фитобактериомицин, трихотецин, полимицин.
Применение антибиотиков в пищевой промышленности позволяет снизить длитель-
ность термообработки продуктов питания при их консервировании. Используемые
антибиотики воздействуют на клостридиальные и термофильные бактерии, устойчи-
вые к нагреванию. Наиболее эффективным признан низин, который практически не
токсичен для человека и позволяет вдвое снизить время термообработки.
В заключение хотелось бы отметить, что в настоящем пособии не рассмотрены
промышленные производства всех веществ, получаемых с помощью биотехнологии.
Однако получить представление об основных принципах организации и осуществле-
ния биотехнологических процессов при производстве первичных и вторичных мета-
болитов, а также жизнеспособных микроорганизмов можно, думается, и из приве-
денного выше материала. Кроме того, рассмотренные примеры могут быть исполь-
зованы в той или иной форме при изложении материала на уроках биологии.
ИММОБИЛИЗОВАННЫЕ ФЕРМЕНТЫ
Общая характеристика
В современной биотехнологии одно из видных мест принадлежит ферментам. Фер-
менты и ферментные системы широко используются в различных отраслях промыш-
ленности, медицине, сельском хозяйстве, химическом анализе и т.д.
Ферменты - вещества белковой природы и поэтому неустойчивы при хранении, а
также чувствительны к тепловым воздействиям. Кроме того, ферменты не могут
быть использованы многократно из-за трудностей в отделении их от реагентов и
продуктов реакции. Решить эти проблемы помогает создание иммобилизованных
ферментов. Начало этому методу было положено в 1916 году, когда Дж.Нельсон и
Е.Гриффин адсорбировали на угле инвертазу и показали, что она сохраняет в та-
ком виде каталитическую активность. Сам термин "иммобилизованные ферменты
узаконен в 1971 году, и означает любое ограничение свободы передвижения бел-
ковых молекул в пространстве.
Преимущества иммобилизованных ферментов перед нативными предшественниками:
1. Гетерогенный катализатор легко отделим от реакционной среды, что дает
возможность остановить реакцию в любой момент, использовать фермент повторно,
а также получать чистый от фермента продукт.
2. Ферментативный процесс с использованием иммобилизованных ферментов можно
проводить непрерывно, регулируя скорость катализируемой реакции и выход про-
дукта .
3. Модификация фермента целенаправленно изменяет его свойства, такие как
специфичность (особенно в отношении макромолекулярного субстрата), зависи-
мость каталитической активности от pH, ионного состава и других параметров
среды, стабильность к денатурирующим воздействиям.
4. Можно регулировать каталитическую активность иммобилизованных ферментов
путем изменения свойств носителя действием физических факторов, таких как
свет и звук. Иммобилизовать ферменты можно как путем связывания на нераство-
римых носителях, так и путем внутримолекулярной или межмолекулярной сшивки
белковых молекул низкомолекулярными бифункциональными соединениями, а также
путем присоединения к растворимому полимеру.
Классификация носителей
Для получения иммобилизованных ферментов используется ограниченное число
как органических, так и неорганических носителей. К носителям предъявляются
следующие требования (Дж.Порат, 1974):
- высокая химическая и биологическая стойкость;
- высокая химическая прочность;
- достаточная проницаемость для фермента и субстратов, пористость, большая
удельная поверхность;
- возможность получения в виде удобных в технологическом отношении форм
(гранул, мембран);
- легкая активация;
- высокая гидрофильность;
- невысокая стоимость.
Классификация носителей схематично представлена на рисунке 4.
Рис. 4. Классификация носителей для иммобилизованных ферментов
Следует отметить, что органические носители (как низко-, так и высокомоле-
кулярные) могут быть природного или синтетического происхождения. Природные
полимерные органические носители делят в соответствии с их биохимической
классификацией на 3 группы: полисахаридные, белковые и липидные.
Синтетические полимеры также можно разделить на группы в связи с химическим
строением основной цепи макромолекул: полиметиленовые, полиамидные, полиэфир-
ные .
Для иммобилизации ферментов наиболее широко используются природные полиса-
хариды и синтетические носители полиметильного типа, остальные применяются
значительно реже. Большое значение природных полимеров в качестве носителей
для иммобилизации объясняется их доступностью и наличием реакционно-способных
функциональных групп, легко вступающих в химические реакции. Характерной осо-
бенностью этой группы носителей также является их высокая гидрофильность. Не-
достаток природных полимеров - неустойчивость к воздействию микроорганизмов и
довольно высокая стоимость.
Наиболее часто для иммобилизации используются такие полисахариды, как цел-
люлоза, декстран, агароза и их производные. Целлюлоза гидрофильна, имеет мно-
го гидроксильных групп, что позволяет модифицировать её, замещая эти группы.
Для увеличения механической прочности целлюлозу гранулируют путем частичного
гидролиза, в результате которого разрушаются аморфные участки. На их место
для сохранения пористости между кристаллическими участками вводят химические
сшивки. Гранулированную целлюлозу довольно легко превратить в различные ионо-
обменные производные, такие как ДЭАЭ-целлюлоза, КМЦ и т.д.
Широко распространены носители на основе декстрана, выпускаемые под назва-
нием "сефадексы". При высушивании они легко сжимаются, в водном растворе
сильно набухают. В этих носителях размер пор в геле регулируется степенью
сшитости. К группе декстранов относят и крахмал. Химически модифицированный
крахмал сшивается агентами, такими как формальдегид. Таким способом был полу-
чен губчатый крахмал, обладающий повышенной устойчивостью по отношению к фер-
ментам, гидролизу. Водорастворимые препараты на основе декстрана часто приме-
няются как носители лекарственных средств в медицине.
Хорошим носителем считается агар. Его свойства улучшаются после химической
сшивки, например, диэпоксидными соединениями. Такой агар становится устойчи-
вым к нагреванию, прочен, легко модифицируется.
Белки в качестве носителей обладают рядом достоинств: вместительны, способ-
ны к биодеградации, могут применяться в качестве тонкой (толщиной 80 мкм)
мембраны. Иммобилизацию ферментов на белковых носителях можно проводить как в
отсутствие, так и в присутствии сшивающих агентов. Белки используются и в
фундаментальных биологических исследованиях, и в медицине. К недостаткам бел-
ков в качестве носителей относят их высокую иммуногенность (за исключением
коллагена и фибрина). Наиболее для иммобилизации используются структурные
(кератин, фибрин, коллаген), двигательные (миозин) и транспортные (альбумин)
белки.
Синтетические полимерные носители применяются для ковалентной и сорбционной
иммобилизации ферментов, для получения гелей, микрокапсул. Полимеры на основе
стирола применяются сорбционной иммобилизации. Они могут иметь макропористую,
изопористую структуру, а также гетеропористую структуру. Для получения поли-
мерных гидрофильных носителей широко используется акриламид - производное ак-
риловой кислоты.
Широкое распространение получил метод включения ферментов и клеток в поли-
акриламидный гель, имеющий жесткую пространственную сетчатую структуру. Поли-
акриламидный гель устойчив к химическим воздействиям. Очень интересную группу
представляют полиамидные носители. Это группы различных гетероцепных полиме-
ров с повторяющейся амидной группой -С(О)-NH-. Например, полимеры на основе
N-винилпирролидона используются для получения иммобилизованных ферментов,
способных медленно распадаться в организме. Кроме того, они биологически
инертны, что особенно важно при использовании в медицинских целях. Существен-
ным недостатком большинства полимерных носителей является их способность на-
капливаться в организме. В этом отношении предпочтение отдается природным по-
лимерам, которые гидролизуются ферментами. Поэтому в состав лекарственных
препаратов часто входит декстран, а из синтетических носителей - полимеры на
основе N-винилпирролидона. В настоящее время ведутся эксперименты по созданию
синтетических полимеров, расщепляющихся с образованием нетоксичных продуктов
обмена.
Методы иммобилизации ферментов
Существует два основных метода иммобилизации ферментов: физический и хими-
ческий .
Физическая иммобилизация ферментов представляет собой включение фермента в
такую среду, в которой для него доступной является лишь ограниченная часть
общего объема. При физической иммобилизации фермент не связан с носителем ко-
валентными связями. Существует четыре типа связывания ферментов:
- адсорбция на нерастворимых носителях;
- включение в поры геля;
- пространственное отделение фермента от остального объема реакционной сис-
темы с помощью полупроницаемой перегородки (мембраны);
- включение
только в одной
в двухфазную среду, где фермент растворим и может находиться
из фаз.
полимерная
сетка геля
твердый водный
носитель раствор
Рис. 5. Способы иммобилизации ферментов: а - адсорбция на нерастворимых
носителях, б - включение в поры геля, в - отделение фермента с помощью
полупроницаемой мембраны, г - использование двухфазной реакционной среды
Перечисленные подходы проиллюстрированы рисунке 5.
Адсорбционная иммобилизация является наиболее старым из существующих спосо-
бов иммобилизации ферментов, начало ей было положено еще в 1916 г. Этот спо-
соб достаточно прост и достигается при контакте водного раствора фермента с
носителем. После отмывки неадсорбировавшегося белка иммобилизованный фермент
готов к использованию. Удерживание адсорбированной молекулы фермента на по-
верхности носителя может обеспечиваться за счет неспецифических ван-дер-
ваальсовых взаимодействий, водородных связей, электростатических и гидрофоб-
ных взаимодействий между носителем и поверхностными группами белка. Вклад ка-
ждого из типов связывания зависит от химической природы носителя и функцио-
нальных групп на поверхности молекулы фермента. Взаимодействия с носителем
могут оказаться настолько сильными, что сорбция биокатализатора может сопро-
вождаться разрушением его структуры. Например, при адсорбции некоторых расти-
тельных клеток на гранулах цитодекса клеточная стенка деформируется, повторяя
рельеф поверхности частиц носителя. Преимуществом метода адсорбционной иммо-
билизации является доступность и дешевизна сорбентов, выступающих в роли но-
сителей. Им также можно придать любую конфигурацию и обеспечить требуемую по-
ристость . Важным фактор - простота применяемых методик. При адсорбционном
связывании можно решить и проблему очистки фермента, так как связывание белка
с носителем во многих случаях достаточно специфическое. К сожалению, проч-
ность связывания фермента с носителем не всегда достаточно высока, что огра-
ничивает применение метода. К недостаткам адсорбционной иммобилизации следует
отнести отсутствие общих рекомендаций, позволяющих сделать правильный выбор
носителя и оптимальных условий иммобилизации конкретного фермента.
Некоторых из перечисленных затруднений можно избежать при иммобилизации
ферментов путем включения в гели. Суть этого метода иммобилизации состоит в
том, что молекулы фермента включаются в трехмерную сетку из тесно переплетен-
ных полимерных цепей, образующих гель. Среднее расстояние между соседними це-
пями в геле меньше размера молекулы включенного фермента, поэтому он не может
покинуть полимерную матрицу и выйти в окружающий раствор, т.е. находится в
иммобилизованном состоянии. Дополнительный вклад в удерживание фермента в
сетке геля могут вносить также ионные и водородные связи между молекулой фер-
мента и окружающими ее полимерными цепями. Пространство между полимерными це-
пями в геле заполнено водой, на долю которой обычно приходится значительная
часть всего объема геля. Например, широко применяемые гели полимеров акрило-
вой кислоты в зависимости от концентрации полимера и его природы содержат от
50 до 90% воды.
Для иммобилизации ферментов в геле существует два основных способа. При од-
ном из них фермент помещают в водный раствор мономера, а затем проводят поли-
меризацию, в результате чего образуется полимерный гель с включенными в него
молекулами фермента. В реакционную смесь часто добавляют также бифункциональ-
ные (содержащие в молекуле две двойные связи) сшивающие агенты, которые при-
дают образующемуся полимеру структуру трехмерной сетки. В другом случае фер-
мент вносят в раствор готового полимера, который затем каким-либо образом пе-
реводят в гелеобразное состояние. Способ иммобилизации ферментов путем вклю-
чения в полимерный гель позволяет создавать препараты любой геометрической
конфигурации, обеспечивая при этом равномерное распределение биокатализатора
в объеме носителя. Метод универсален, применим для иммобилизации практически
любых ферментов, полиферментных систем, клеточных фрагментов и клеток. Фер-
мент, включенный в гель, стабилен, надежно защищен от инактивации вследствие
бактериального заражения, так как крупные клетки бактерий не могут проникнуть
в мелкопористую полимерную матрицу. В то же время, эта матрица может созда-
вать значительные препятствия для диффузии субстрата к ферменту, снижая ката-
литическую эффективность иммобилизованного препарата, поэтому для высокомоле-
кулярных субстратов данный метод иммобилизации не применим вообще.
Общий принцип иммобилизации ферментов с использованием мембран заключается
в том, что водный раствор фермента отделяется от водного раствора субстрата
полупроницаемой перегородкой. Полупроницаемая мембрана легко пропускает не-
большие молекулы субстрата, но непреодолима для крупных молекул фермента. Су-
ществующие модификации этого метода различаются лишь способами получения по-
лупроницаемой мембраны и ее природой. Водный раствор фермента можно включать
внутрь микрокапсул, представляющих собой замкнутые сферические пузырьки с
тонкой полимерной стенкой (микрокапсулирование). При двойном эмульгировании
получается водная эмульсия из капель органического раствора полимера, содер-
жащих, в свою очередь, еще более мелкие капли водного раствора фермента. Че-
рез некоторое время растворитель затвердевает, образуя сферические полимерные
частицы с иммобилизованным в них ферментом. Если вместо водонерастворимого
отвердевающего полимера используются жидкие углеводороды с высокой молекуляр-
ной массой, метод называется иммобилизацией путем включения в жидкие мембра-
ны. К модификациям метода иммобилизации ферментов с использованием полупрони-
цаемых оболочек относятся также включение в волокна (при этом вместо капель,
содержащих ферменты, получаются нити) и включение в липосомы. Применение сис-
тем мембранного типа позволяет получать иммобилизованные препараты с высоким
содержанием фермента. Метод, как и предыдущий, достаточно универсален, т . е.
применим как ферментам, так и к клеткам, а также их фрагментам. Благодаря вы-
сокому отношению поверхности к объему и малой толщине мембраны удается избе-
жать значительных диффузионных ограничений скорости ферментативных реакций.
Основной недостаток мембранных систем - невозможность ферментативного превра-
щения высокомолекулярных субстратов.
При иммобилизации ферментов с использование систем двухфазного типа ограни-
чение свободы перемещения фермента в объеме системы достигается благодаря его
способности растворяться только в одной из фаз. Субстрат и продукт фермента-
тивного превращения распределяются между обеими фазами в соответствии с их
растворимостями в этих фазах. Природа фаз подбирается таким образом, что про-
дукт накапливается в той из них, где фермент отсутствует. После завершения
реакции эту фазу отделяют и извлекают из нее продукт, а фазу, содержащую фер-
мент , вновь используют для проведения очередного процесса. Одним из важнейших
преимуществ систем двухфазного типа является то, что они позволяют осуществ-
лять ферментативные превращения макромолекулярных субстратов, которые невоз-
можны при применении жестких носителей с ограниченным размером пор.
Главным отличительным признаком химических методов иммобилизации является
то, что путем химического взаимодействия на структуру фермента в его молекуле
создаются новые ковалентные связи, в частности между белком и носителем. Пре-
параты иммобилизованных ферментов, полученные с применением химических мето-
дов, обладают по крайней мере двумя важными достоинствами. Во-первых, кова-
лентная связь фермента с носителем обеспечивает высокую прочность образующе-
гося конъюгата. При широком варьировании таких условий, как pH и температура,
фермент не десорбируется с носителя и не загрязняет целевых продуктов катали-
зируемой им реакции. Это особенно важно при реализации процессов медицинского
и пищевого назначения, а также для обеспечения устойчивых, воспроизводимых
результатов в аналитических системах. Во-вторых, химическая модификация фер-
ментов способна приводить к существенным изменениям их свойств, таких как
субстратная специфичность, каталитическая активность и стабильность. Химиче-
ская иммобилизация ферментов является искусством, уровень которого определя-
ется, в первую очередь, умением экспериментатора. Основная задача эксперимен-
татора заключается в формировании новых ковалентных связей в молекуле фермен-
та при использовании его функциональных групп, несущественных для проявления
его каталитической активности. При химической модификации фермента его актив-
ный центр желательно защищать. При сопоставлении различных приемов иммобили-
зации химические методы для крупномасштабных биотехнологических процессов ка-
жутся малопривлекательными из-за сложности и дороговизны. В промышленных про-
цессах обычно используются те или иные методы физической иммобилизации.
Применение иммобилизованных
ферментов
Особенно ощутимый вклад иммобилизованные ферменты внесли в тонкий органиче-
ский синтез, в анализ, в медицину, в процессы конверсии энергии, в пищевую и
фармацевтическую промышленности.
Для синтетической органической химии важно то, что в двухфазных реакционных
средах фермент сохраняет каталитическую активность даже при исключительно ма-
лом содержании воды, поэтому равновесие катализируемой реакции (выход продук-
та) экспериментатор может регулировать в широких пределах, подбирая нужный
органический растворитель. Иммобилизованные ферменты дали толчок к созданию
принципиально новых методов "безреагентного" непрерывного анализа многокомпо-
нентных систем органических (в ряде случаев и неорганических) соединений.
В будущем важную роль в контроле окружающей среды и в клинической диагно-
стике должны сыграть такие методы, как биолюминесцентный анализ и иммунофер-
ментный анализ.
В медицине иммобилизованные ферменты открыли путь к созданию лекарственных
препаратов пролонгированного действия со сниженной токсичностью и аллергенно-
стью. Иммобилизационные подходы способствуют решению проблемы направленного
транспорта лекарств в организме.
Проблемы биоконверсии массы и энергии в настоящее время пытаются решить
микробиологическим путем. Тем не менее иммобилизованные ферменты вносят ощу-
тимый вклад в осуществление фотолиза воды и в биоэлектрокатализ.
Заслуживает внимание и использование иммобилизованных ферментов в процессах
переработки лигноцеллюлозного сырья.
Иммобилизованные ферменты могут использоваться и как усилители слабых сиг-
налов . На активный центр иммобилизованного фермента можно подействовать через
носитель, подвергая последний ультразвуковой обработке, механическим нагруз-
кам или фотохимическим превращениям. Это позволяет регулировать каталитиче-
скую активность системы фермент - носитель под действием механических, ульт-
развуковых и световых сигналов. На этой основе были созданы механо- и звуко-
чувствительные датчики и открыт путь к бессеребряной фотографии.
Промышленные процессы с применением иммобилизованных ферментов внедрены
прежде всего в пищевую и фармацевтическую промышленность. В пищевой промыш-
ленности с участием иммобилизованных ферментов идут процессы получения глюко-
зо-фруктовых сиропов, глюкозы, яблочной и аспарагиновой кислоты, оптически
активных L- аминокислот, диетического безлактозного молока, сахаров из молоч-
ной сыворотки и др.
В медицине иммобилизованные ферменты используются также как лекарственные
препараты, особенно в тех случаях, когда необходимо локальное воздействие.
Кроме того, биокатализаторы широко используются в различных аппаратах для
перфузионной очистки различных биологических жидкостей. Возможности и пер-
спективы использования в медицине ферментов в иммобилизованном состоянии го-
раздо шире, чем достигнутые на сегодняшний день, именно на этом пути медицину
ждет создание новых высокоэффективных методов лечения.
ИММОБИЛИЗОВАННЫЕ КЛЕТКИ
МИКРООРГАНИЗМОВ
В 70-х годах XX века появились первые публикации об иммобилизации клеток
микроорганизмов, а первое промышленное применение иммобилизованных клеток бы-
ло осуществлено в Японии в 1974 г. С их помощью получали аспарагиновую кисло-
ту.
Иммобилизованные клетки имеют ряд преимуществ как перед иммобилизованными
ферментами, так и перед свободными клетками:
- отсутствие затрат на выделение и очистку ферментов; - снижение затрат на
выделение и очистку продуктов реакции;
- более высокая активность и стабильность;
- возможность создания непрерывных и полунепрерывных автоматизированных
процессов;
- способность к длительному функционированию полиферментных систем без эк-
зогенных кофакторов.
Для иммобилизации могут быть использованы клетки в различном состоянии: жи-
вые и поврежденные в различной степени. Одностадийные реакции могут осуществ-
лять и живые, и поврежденные клетки. Полиферментные реакции проводят с приме-
нением живых клеток, которые могут длительное время регенерировать АТФ и ко-
ферменты (НАДФ, НАД).
Проблема использования ферментативной активности иммобилизованных микроор-
ганизмов имеет глубокие корни. Более 150 лет назад быстрый способ получения
уксуса был основан на применении микроорганизмов, адсорбированных на древес-
ной стружке. Методы иммобилизации клеток схожи с методами иммобилизации фер-
ментов .
Химический метод основан на образовании ковалентных связей с активированным
носителем, на поперечной сшивке клеток за счет активных групп в клеточной
оболочке с бифункциональными реагентами (например, глутаровым альдегидом)
К физическим методам относятся адсорбция и агрегация.
Иммобилизация клеток путем включения в различные гели, мембраны, волокна
основана на химических и физических взаимодействиях. Химические методы ис-
пользуются реже по сравнению с другими методами и малопригодны для иммобили-
зации живых клеток. Гораздо большее распространение получило включение клеток
в состав гелей, мембран и волокон. При таком способе иммобилизации клетки мо-
гут сохранять жизнеспособность и в присутствии питательной среды размножаться
в приповерхностных слоях гелей. Биокаталитическая активность целых иммобили-
зованных клеток в настоящее время может быть использована в различных отрас-
лях науки и техники:
- при биосинтезе и трансформации таких соединений, как аминокислоты, орга-
нические кислоты, антибиотики, стероиды углеводы, углеводороды, нуклеотиды и
нуклеозиды;
- в пивоварении и виноделии;
- при очистке сточных и природных вод;
- при извлечении металлов из сточных вод; - при ассимиляции солнечной энер-
гии;
- при изготовлении водородных солнечных элементов; - в азотфиксации;
- в аналитических целях при изготовлении электродов.
Наибольшее количество исследований по иммобилизации клеток микроорганизмов
проведено японскими исследователями. Особые успехи были достигнуты ими в об-
ласти синтеза аминокислот, органических кислот и антибиотиков. В Московском
государственном университете был разработан метод получения аспарагиновой ки-
слоты, который по эфективности не уступает японским. Клетки E.coli, включен-
ные в армированный полиакриламидный гель, были с успехом использованы для по-
лучения аспарагиновой кислоты, период полужизни катализатора - 110 суток. Им-
мобилизовать можно не только клетки микроорганизмов, но и клетки растительных
и животных тканей, используя их для синтеза физиологически активных соедине-
ний .
Интересные возможность открываются и при иммобилизации клеточных органелл
как активных полиферментных систем. Все это свидетельствует о перспективности
развития одного из направлений биотехнологии, связанного с изучением и приме-
нением иммобилизованных клеток.
БИОТЕХНОЛОГИЯ И ЭКОЛОГИЧЕСКИЕ
ПРОБЛЕМЫ
Биодеградация ксенобиотиков
В удалении ксенобиотиков из окружающей среды важны несколько факторов:
- устойчивость ксенобиотиков к различным воздействиям;
- растворимость их в воде;
- летучесть ксенобиотиков;
- pH среды;
- способность ксенобиотиков поступать в клетки микроорганизмов; -
сходство ксенобиотиков и природных соединений, подвергающихся естественной
биодеградации.
Для биодеградации ксенобиотиков лучше использовать ассоциации микроорганиз-
мов, так как они более эффективны, чем отдельно взятые виды. При этом типы
связей в подобной ассоциации могут быть различны. Один вид микроорганизмов
может непосредственно участвовать в разложении ксенобиотиков, а другой - по-
ставлять недостающие питательные вещества. Это может быть метаболическая
«атака» на субстрат, когда синтезируются разные компоненты ферментативного
комплекса, или же цепочка ферментативных реакций (многосубстратные конверсии)
и т.д.
Особенно трудно разлагаются такие биоциды, как детергенты, пластики и угле-
водороды. Самыми способными к борьбе с загрязнителями различного типа являют-
ся представители рода Pseudomonas - они практически «всеядны». Клетки этих
микроорганизмов содержат оксидоредуктазы и гидроксилазы, способные разлагать
большое число молекул углеводородов и ароматических соединений, таких как
бензол, ксилол, толуол. Гены, кодирующие эти ферменты, находятся в составе
плазмид. Например, плазмида ОСТ отвечает за разложение октана и гексана, XYL
- ксилола и толуола, NAH - нафталина, САМ - камфары. Плазмиды САМ и NAH обес-
печивают собственный перенос, индуцируя скрещивание бактериальных клеток; ос-
тальные плазмиды могут быть перенесены только в том случае, если в бактерии
введены другие плазмиды, обеспечивающие скрещивание.
В 1979 г. Чакрабарти (в то время совместно с компанией «Дженерал электрик»)
после успешных скрещиваний получил штамм, содержащий плазмиды XYL и NAH, а
также гибридную плазмиду, полученную путем рекомбинации частей плазмид САМ и
ОСТ (сами по себе они несовместимы, т. е. не могут сосуществовать как отдель-
ные плазмиды в одной бактериальной клетке). Этот штамм способен быстро расти
на неочищенной нефти, так как он метаболизирует углеводороды гораздо актив-
нее, чем любой из штаммов, содержащих только одну плазмиду. Штамм может быть
особенно полезен в очистных водоемах для сточных вод, где можно контролиро-
вать температуру и другие внешние факторы.
Эти микроорганизмы удобно использовать для очистки нефтяных пятен на суше
или море при различных авариях. Для большей эффективности создают микроэмуль-
сию, содержащую бактериальные штаммы и капсулы со смесью основных питательных
элементов - азота, фосфора и калия внутри. Добавление этих веществ стимулиру-
ет размножение бактериальных штаммов. Применение такого метода позволяет очи-
стить от 70 до 90% загрязненной поверхности, за это же время очищается всего
порядка 10-20% необработанной поверхности.
Преимущество бактериальной очистки по сравнению с химической в том, что она
не вызывает появления нового загрязняющего агента в окружающей среде. Плот-
ность фитопланктона после бактериальной очистки повышается. Некоторые микро-
организмы способны изменять молекулу ксенобиотика и делать ее доступной и
привлекательной для других микроорганизмов («кометаболизм»). Примером может
служить разложение инсектицида паратиона под действием двух штаммов
Pseudomonas - Р. aeruginosa и Р. stuzeri. В некоторых случаях происходит не-
полное превращение молекулы ксенобиотика - фосфорилирование, метилирование,
ацетилирование и т. д. , результатом которого является утрата этим веществом
токсичности.
Одним из сильных загрязнителей является ЭДТА (этилендиаминтетрауксусная ки-
слота) . Причина в том, что ЭДТА связывает тяжелые металлы, способствуя их на-
коплению в почве. Бактрии родов Pseudomonas и Bacillus способны за две недели
разрушить все связи комплекса Fe-ЭДТА. Эти бактерии успешно применяются для
очистки бытовых сточных вод, куда попадают детергенты моющих средств. Кроме
Pseudomonas, биодеградацию ксенобиотиков могут осуществлять и представители
родов Acinetobacter, Metviosinus.
Однако в некоторых случаях внесение этих микроорганизмов в почву может из-
менить экосистему местности. Избежать этого можно ограничивая время жизнедея-
тельности бактерий. Например, облучая штаммы ультрафиолетом, получили мутант,
ауксотрофный по лейцину. Бактерии размножают в питательной среде, содержащей
лейцин. Суспензией микроорганизмов в питательной среде пропитывают древесную
стружку, которую разбрасывают по загрязненной территории. Количество лейцина
рассчитывается на время, достаточное для уничтожения вредных примесей, поэто-
му после очистки мутантные штаммы гибнут.
Еще эффективнее, чем бактерии, справляются с почвенными загрязнителями гри-
бы . Они могут разрушать такие вещества, как пентахлорбензол, пентахлофенол. В
одном из экспериментов грибами обработали около 10000 тонн почвы с территории
деревоперерабатывающего комплекса. В этой почве содержание пентахлорфенола
достигало 700 мг/кг, но За год деятельности оно снизилось до 10 мг/кг, что
является допустимой нормой. Бактерии смогли бы переработать эту почву лишь за
4-5 лет. Грибы активны и зимой, разрушают высокомолекулярные полиароматиче-
ские углеводороды, действуют внеклеточно, выделяя неспецифические ферменты.
Стоимость грибной и бактериальной очистки одинаковы, но применение грибов по-
зволяет сокращать сроки деградации и существенно удешевляет ее.
Аэробные системы очистки
Биологическая переработка отходов опирается на ряд дисциплин: биохимию, ге-
нетику, химию, микробиологию, вычислительную технику. Усилия этих дисциплин
концентрируются на трех основных направлениях:
- деградация органических и неорганических токсичных отходов; - возобнов-
ление ресурсов для возврата в круговорот веществ углерода, азота, фосфора,
азота и серы;
- получение ценных видов органического топлива.
При очистке сточных вод выполняют четыре основные операции:
1. При первичной переработке происходит усреднение и осветление сточных вод
от механических примесей (усреднители, песколовки, решетки, отстойники).
2. На втором этапе происходит разрушение растворенных органических веществ
при участии аэробных микроорганизмов. Образующийся ил, состоящий главным об-
разом из микробных клеток, либо удаляется, либо перекачивается в реактор. При
технологии, использующей активный ил, часть его возвращается в аэрационный
тенк.
3. На третьем (необязательном) этапе производится химическое осаждение и
разделение азота и фосфора.
4. Для переработки ила, образующегося на первом и втором этапах, обычно ис-
пользуется процесс анаэробного разложения. При этом уменьшается объем осадка
и количество патогенов, устраняется запах и образуется ценное органическое
топливо - метан.
На практике применяются одноступенчатые и многоступенчатые системы очистки.
Одноступенчатая схема очистки сточной воды представлена на рис. 6.
Рис. 6. Принципиальная схема очистных сооружений:
1 - пескоуловители; 2 - первичные отстойники; 3 - аэротенк; 4 -
вторичные отстойники; 5 - биологические пруды; 6 - осветление; 7
- реагентная обработка; 8 - метатенк; АИ - активный ил
Сточные воды поступают в усреднитель, где происходит интенсивное перемеши-
вание стоков с различным качественным и количественным составом. Перемешива-
ние осуществляется за счет подачи воздуха. В случае необходимости в усредни-
тель подаются также биогенные элементы в необходимых количествах и аммиачная
вода для создания определенного значения pH. Время пребывания в усреднителе
составляет обычно несколько часов. При очистке фекальных стоков и отходов
нефтепереработки необходимым элементом очистных сооружений является система
механической очистки - песколовки и первичные отстойники. В них происходит
отделение очищаемой воды от грубых взвесей и нефтепродуктов, образующих плен-
ку на поверхности воды.
Биологическая очистка воды происходит в аэротенках. Аэротенк представляет
собой открытое железобетонное сооружение, через которое проходит сточная во-
да, содержащая органические загрязнения и активный ил. Суспензия ила в сточ-
ной воде на протяжении всего времени нахождения в аэротенке подвергается
аэрации воздухом. Интенсивная аэрация суспензии активного ила кислородом при-
водит к восстановлению его способности сорбировать органические примеси.
В основе биологической очистки воды лежит деятельность активного ила (АИ)
или биопленки, естественно возникшего биоценоза, формирующегося на каждом
конкретном производстве в зависимости от состава сточных вод и выбранного ре-
жима очистки. Активный ил представляет собой темно-коричневые хлопья, разме-
ром до нескольких сотен микрометров. На 70% он состоит из живых организмов и
на 30% - из твердых частиц неорганической природы. Живые организмы вместе с
твердым носителем образуют зооглей - симбиоз популяций микроорганизмов, по-
крытый общей слизистой оболочкой. Микрооганизмы, выделенные из активного ила
относятся к различным родам: Actynomyces, Azotobacter, Bacillus, Bacterium,
Corynebacterium, Desulfomonas, Pseudomonas, Sarcina и др. Наиболее многочис-
ленны бактерии рода Pseudomonas, о всеядности которых упоминалось ранее. В
зависимости от внешней среды, которой в данном случае является сточная вода,
та или иная группа бактерий может оказаться преобладающей, а остальные стано-
вятся спутниками основной группы.
Существенная роль в создании и функционировании активного ила принадлежит
простейшим. Функции простейших достаточно многообразны; они сами не принимают
непосредственного участия в потреблении органических веществ, но регулируют
возрастной и видовой состав микроорганизмов в активном иле, поддерживая его
на определенном уровне. Поглощая большое количество бактерий, простейшие спо-
собствуют выходу бактериальных экзоферментов, концентрирующихся в слизистой
оболочке и тем самым принимать участие в деструкции загрязнений. В активных
илах встречаются представители четырех классов простейших: саркодовые
(Sarcodina), жгутиковые инфузории (Mastigophora), реснитчатые инфузории
(Ciliata), сосущие инфузории (Suctoria).
Показателем качества активного ила является коэффициент протозойности, ко-
торый отражает соотношение количества клеток простейших микроорганизмов к ко-
личеству бактериальных клеток. В высококачественном иле на 1 миллион бактери-
альных клеток должно приходиться 10-15 клеток простейших. При изменении со-
става сточной воды может увеличится численность одного из видов микроорганиз-
мов , но другие культуры все равно остаются в составе биоценоза.
На формирование ценозов активного ила могут оказывать влияние и сезонные
колебания температуры, обеспеченность кислородом, присутствие минеральных
компонентов. Все это делает состав или сложным и практически невоспроизводи-
мым. Эффективность работы очистных сооружений зависит также от концентрации
микроорганизмов в сточных водах и возраста активного ила. В обычных аэротен-
ках текущая концентрация активного ила не превышает 2-4 г/л.
Увеличение концентрации ила в сточной воде приводит к росту скорости очист-
ки, но требует усиления аэрации, для поддержания концентрации кислорода на
необходимом уровне. Таким образом, аэробная переработка стоков включает в се-
бя следующие стадии:
1) адсорбция субстрата на клеточной поверхности;
2) расщепление адсорбированного субстрата внеклеточными ферментами;
3) поглощение растворенных веществ клетками;
4) рост и эндогенное дыхание;
5) высвобождение экскретируемых продуктов;
6) "выедание" первичной популяции организмов вторичными потребителями.
В идеале это должно приводить к полной минерализации отходов до простых со-
лей, газов и воды. На практике очищенная вода и активный ил из аэротенка по-
даются во вторичный отстойник, где происходит отделение активного ила от во-
ды. Часть активного ила возвращается в систему очистки, а избыток активного
ила, образовавшийся в результате роста микроорганизмов, поступает на иловые
площадки, где обезвоживается и вывозится на поля. Избыток активного ила можно
также перерабатывать анаэробным путем. Переработанный активный ил может слу-
жить и как удобрения, и как корм для рыб, скота.
Система полной доочистки может состоять из множества элементов, которые оп-
ределяются дальнейшим назначением сточной воды. Возможно применение биологи-
ческих прудов, где биологически очищенная вода проходит осветление и насыща-
ется кислородом. Пруды также относятся к системе биологической очистки, в ко-
торой под воздействием биоценоза активного ила происходит окисление органиче-
ских примесей. Состав биоценозов биологических прудов определяется глубиной
нахождения данной группы микроорганизмов. В верхних слоях развиваются аэроб-
ные культуры, в придонных - факультативные аэробы и анаэробы, способные осу-
ществлять процессы метанового брожения или восстановление сульфатов. Насыще-
ние воды кислородом происходит за счет процессов фотосинтеза, осуществляемого
водорослями, из которых особенно широко представлены Clorella, Scenedesmus,
встречаются эвгленовые, вольвоксовые и т.д. В прудах также в той или иной ме-
ре представлена микро- и макрофауна: простейшие, черви, коловратки,насекомые
и др. В биопрудах из воды хорошо удаляются нефтепродукты, фенолы и другие ор-
ганические соединения. В некоторых случаях воду после биологической очистки
подвергают реагентной обработке - хлорированию или озонированию.
Интенсифицировать процессы биологической очистки можно путем аэрации сус-
пензии активного ила чистым кислородом. Этот процесс можно осуществить в мо-
дифицированных аэротенках закрытого типа - окситенках, с принудительной аэра-
цией сточной воды. В отличие от аэротенков в биофильтрах (или перколяционных
фильтрах) клетки микроорганизмов находятся в неподвижном состоянии, так как
прикреплены к поверхности пористого носителя. Образовавшуюся таким образом
биопленку можно отнести к иммобилизованным клеткам. В этом случае иммобилизо-
вана не монокультура, а целый консорциум, неповторимый по качественному и ко-
личественному составу и различающийся в зависимости от его местонахождения на
поверхности носителя. Очищаемая вода контактирует с неподвижным носителем, на
котором иммобилизованы клетки и за счет их жизнедеятельности происходит сни-
жение концентрации загрязнителя.
Преимущество применения биофильтров состоит в том, что формирование кон-
кретного ценоза приводит к практически полному удалению всех органических
примесей. Недостатками этого метода можно считать:
- нереальность использования стоков с высоким содержанием органических при-
месей ;
- необходимость равномерного орошения поверхности биофильтра сточными вода-
ми, подаваемыми с постоянной скоростью;
- сточные воды перед подачей должны быть освобождены от взвешенных частиц
во избежание заиливания.
В качестве носителей можно использовать керамику, щебень, гравий, керамзит,
металлический или полимерный материал с высокой пористостью. Для биофильтров
характерно наличие противотока воды, которая поступает сверху и воздуха, по-
дающегося снизу. Оторвавшиеся частицы микробной пленки после отделения их во
вторичном отстойнике не возвращаются обратно в биофильтр, а идут на иловые
площадки или в анаэробную преработку.
Существуют также системы, сочетающие в себе как систему биофильтров, так и
активного ила в аэротенках. Это так называемые аэротенки-вытеснители. В аэри-
руемую сточную воду помещают либо стеклоерши, либо создают систему сеток
внутри тенка, в которые вкладываются прокладки из пористого полиэфира. В пус-
тотах этих прокладок и на поверхности стеклоершей происходит накопление био-
ценоза активного ила. Носитель периодически удаляется из тенка, биомасса сни-
мается, после чего носитель возвращается в реактор.
Система с иммобилизованными на мобильном носителе клетками отличается от
биофильтров своей экономичностью, так как используются высокие концентрации
микроорганизмов и нет необходимости осаждать конечные продукты. Такая система
может найти применение в очистке локальных стоков, с узким спектром загрязне-
ний. Их целесообразно очищать в самостоятельных биологических системах, не
смешивая со стоками других производств. Это позволяет получить биоценозы мик-
роорганизмов , адаптированные к данному узкому спектру загрязнений, при этом
скорость и эффективность очистки резко возрастают.
Анаэробные системы очистки
Как уже упоминалось, избыток активного ила может перерабатываться двумя
способами: после высушивания как удобрение или же попадает в систему анаэроб-
ной очистки. Такие же способы очистки применяют и при сбраживании высококон-
центрированных стоков, содержащих большое количество органических веществ.
Процессы брожения осуществляются в специальных аппаратах - метатенках.
Распад органических веществ состоит из трех этапов:
- растворение и гидролиз органических соединений;
- ацидогенез;
- метаногенез.
На первом этапе сложные органические вещества превращаются в масляную, про-
пионовую и молочную кислоты. На втором этапе эти органические кислоты превра-
щаются в уксусную кислоту, водород, углекислый газ. На третьем этапе метано-
образующие бактерии восстанавливают диокись углерода в метан с поглощением
водорода. По видовому составу биоценоз метатенков значительно беднее аэробных
биоценозов.
Насчитывают около 50 видов микроорганизмов, способных осуществлять первую
стадию - стадию кислотообразования. Самые многочисленные среди них - предста-
вители бацилл и псевдомонад. Метанообразующие бактерии имеют разнообразную
форму: кокки, сарцины и палочки. Этапы анаэробного брожения идут одновремен-
но , а процессы кислотообразования и метанообразования протекают параллельно.
Уксуснокислые и метанообразующие микроорганизмы образуют симбиоз, считавшийся
ранее одним микроорганизмом под названием Methanobacillus omelianskii.
Процесс метанообразования - источник энергии для этих бактерий, так как ме-
тановое брожение представляет собой один из видов анаэробного дыхания, в ходе
которого электроны с органических веществ переносятся на углекислый газ, ко-
торый восстанавливается до метана. В результате жизнедеятельности биоценоза
метатенка происходит снижение концентрации органических веществ и образование
биогаза, являющегося экологически чистым топливом. Для получения биогаза мо-
гут использоваться отходы сельского хозяйства, стоки перерабатывающих пред-
приятий, содержащих сахар, бытовые отходы, сточные воды городов, спиртовых
заводов и т.д.
Метатенк представляет собой герметичный ферментер объемом в несколько куби-
ческих метров с перемешиванием, который обязательно оборудуется газоотделите-
лями с противопламенными ловушками. Метатенки работают в периодическом режиме
загрузки отходов или сточных вод с постоянным отбором биогаза и выгрузкой
твердого осадка после завершения процесса. В целом, активное использование
метаногенеза при сбраживании органических отходов - один из перспективных пу-
тей совместного решения энергетических и экологических проблем, который по-
зволяет агропромышленным комплексам перейти на автономное энергообеспечение.
Показатели загрязненности
сточных вод
На всех этапах очистки сточных вод ведется строгий контроль за качественным
составом воды. При этом проводится детальный анализ состава сточной воды с
выяснением не только концентраций тех или иных соединений, но и более полное
определение качественного и количественного состава загрязнителей. Необходи-
мость такого анализа определяется спецификой системы переработки, так как в
сточных водах могут присутствовать токсические вещества, способные привести к
гибели микроорганизмов и вывести систему из строя.
Определение таких показателей, как органолептические (цвет, вид, запах,
прозрачность, мутность), оптическая плотность, pH, температура не вызывает
трудностей. Сложнее определить содержание органических веществ в сточной во-
де, которое необходимо знать для контроля работы очистных сооружений, повтор-
ного использования сточных вод в технологических процессах, выбора метода
очистки и доочистки, окончания процесса очистки, а также оценки возможности
сброса воды в водоемы.
При определении содержания органических веществ широко используются два
способа: химическое потребление кислорода и биохимическое потребление кисло-
рода. В первом случае методика основана на окислении веществ, присутствующих
в сточных водах, 0,25% раствором дихромата калия при кипячении пробы в тече-
ние 2 часов в 50% (по объему) растворе серной кислоты. Для полноты окисления
органических веществ используется катализатор - сульфат серебра. Дихроматный
способ достаточно прост и легко автоматизируется, что обуславливает его широ-
кое распространение.
Биохимическое потребление кислорода измеряется количеством кислорода, рас-
ходуемым микроорганизмами при аэробном биологическом разложении веществ, со-
держащихся в сточных водах при стандартных условиях за определенный интервал
времени. Определение биохимического потребления кислорода требует специальной
аппаратуры. В герметичный ферментер помещается определенное количество иссле-
дуемой сточной воды, которую засевают микроорганизмами. В процессе культиви-
рования регистрируется изменение количества кислорода, пошедшего на окисление
соединения, присутствующего в сточных водах. Лучше всего культивировать мик-
роорганизмы из уже работающих биологических систем, адаптированных к данному
спектру загрязнений.
Определение лишь одного из показателей качества сточной воды (химического
или биохимического потребления кислорода) не всегда позволяет оценить как ее
доступность для биологической очистки, так и степень конечной очистки. Так,
например, имеется целые группы соединений, определение химического потребле-
ния кислорода для которых невозможно, хотя эти соединения вполне доступны для
биохимического определения кислорода и наоборот. Все это говорит о том, что
для оценки чистоты сточных воды необходимо использовать одновременно оба ме-
тода .
Биотехнология будет оказывать многообразное и все возрастающее влияние на
способы контроля за окружающей средой и на ее состояние. Хорошим примером та-
кого рода служит создание новых, более совершенных способов переработки отхо-
дов , однако применение биотехнологии в данной сфере отнюдь не ограничивается
этим. Биотехнология будет играть все большую роль в химической промышленности
и сельском хозяйстве, помогая создать замкнутые и полузамкнутые технологиче-
ские циклы, решая хотя бы отчасти существующие здесь проблемы.
ЛИТЕРАТУРА К РАЗДЕЛУ
«ПРОМЫШЛЕННАЯ БИОТЕХНОЛОГИЯ"
1. Альберте Б., Брей Д. , Льюис Дж. и др. Молекулярная биология клетки. Т.
1. М.: Мир, 1994.
2. Артамонов В.И. Занимательная физиология растений. М. : Агропромиздат,
1991. 336 с.
3. Безбородов А.М. Ферменты микроорганизмов и их применение // Биотехноло-
гия. М. : Наука, 1984.
4. Березин И.В., Клесов А.А. , Швядас В.К. и др. Инженерная энзимология. М.:
Высшая школа, 1987. 144 с.
5. Березин И.В., Клячко Н.Л., Левашев А.В. и др. Иммобилизованные ферменты.
М.: Высшая школа, 1987. 160 с.
6. Биология наших дней. Вып. 2. - М.: Знание, 1987. 160 с.
7. Биотехнология. Принципы и применение /Хиггинс И., Бест Д., Джонс Дж. М.:
Мир, 1988. 480 с.
8. Биотехнология сельскохозяйственных растений. М. : Агропромиздат, 1987.
301 с.
9. Биотехнология - сельскому хозяйству /Лобанок А.Г., Залашко М.В., Аниси-
мова Н.И. и др. Минск: Урожай, 1988. 199 с.
10. Биотехнология растений: культура клеток. М. : Агропромиздат, 1989. 280
с.
11. Быков В.А., Крылов И.А., Манаков М.Н. и др. Микробиологическое произ-
водство биологически активных веществ и препаратов. М. : Высшая школа, 1987.
142 с.
12. Быков В.А., Манаков М.Н., Панфилов В.И. и др. Производство белковых ве-
ществ. М.: Высшая школа, 1987. 142 с.
13. Варфоломеев С.Д., Панцхава Е.С. Биотехнология преобразования солнечной
энергии. Современное состояние, проблемы, перспективы // Биотехнология. М. :
Наука, 1984.
14. Голубовская Э.К. Биологические основы очистки воды. М. : Высшая школа,
1978. 270 с.
15. Грачева И.М., Гаврилова Н.М., Иванова Л.А. Технология микробных белко-
вых препаратов, аминокислот и жиров. М.: Пищевая промышленность, 1980. 448 с.
16. Егоров Н.С. Основы учения об антибиотиках. М.: Высшая школа, 1986. 448
с.
17. Иммобилизованные клетки и ферменты. Методы / Под ред. Дж. Вудворта. М.:
Мир, 1988. 215 с.
18. Казанская Н.Ф., Ларионова Н.И., Торчилин В.П. Ферменты и белковые пре-
параты в медицине // Биотехнология. М.: Наука, 1984.
19. Каравайко Г.И. Биогеотехнология металлов // Биотехнология. М. : Наука,
1984 .
20. Кефели В.И., Дмитриева Г.А. Биотехнология: курс лекций. Пущино, 1989.
96 с.
21. Клесов А.А. Применение иммобилизованных ферментов в пищевой промышлен-
ности//Биотехнология. М.: Наука, 1984.
22. Мартинек К. Иммобилизованные ферменты // Биотехнология. М. : Наука,
1984 .
23. Методы культивирования клеток. Л.: Наука, 1988. 313 с.
24. Печуркин Н.С., Брильков А.В., Марченкова Т.В. Популяционные аспекты
биотехнологии. Новосибирск: Наука, 1990. 173 с.
25. Пирузян Л.А., Михайловский Е.М. Сапротрофная микрофлора в качестве про-
дуцента биологически активных веществ для целей микробной сапротрофной фарма-
котерапии // Изв. АН Серия биологическая, 1992. № 6. С. 860 - 866.
26. Реннеберг Р., Реннеберг И. От пекарни до биофабрики. М.: Мир, 1991. 112
с.
27. Рычков Р.С., Попов В.Г. Биотехнология перспективы развития // Биотехно-
логия. М.: Наука, 1984.
28. Сассон А. Биотехнология: свершения и надежды. М.: Мир, 1987. 411 с.
29. Скрябин Г.К., Кощеенко К.А. Иммобилизованные клетки микроорганизмов //
Биотехнология. М.: Наука, 1984.
30. Тривен М. Иммобилизованные ферменты. М.: Мир, 1983. 213 с. 27.
31. Хотянович А.В. Методы культивирования азотфиксирующих бактерий, способы
получения и применение препаратов на их основе (методические рекомендации).
Л. , 1991. 60 с.
32. Шлегель Г. Общая микробиология. М.: Мир, 1987. 566 с.
КУЛЬТУРЫ РАСТИТЕЛЬНЫХ КЛЕТОК18
КУЛЬТУРЫ КЛЕТОК
ВЫСШИХ РАСТЕНИЙ
Использование культуры
растительных клеток
Культуры клеток высших растений имеют две сферы применения:
1. Изучение биологии клетки, существующей вне организма, обуславливает ве-
дущую роль клеточных культур в фундаментальных исследованиях по генетике и
физиологии, молекулярной биологии и цитологии растений. Популяциям раститель-
ных клеток присущи специфические особенности: генетические, эпигенетические
(зависящие от дифференцированной активности генов) и физиологические. При
длительном культивировании гетерогенной по этим признакам популяции идет раз-
множение клеток, фенотип и генотип которых соответствуют данным условиям вы-
ращивания, следовательно, популяция эволюционирует. Все это позволяет счи-
тать, что культуры клеток являются новой экспериментально созданной биологи-
ческой системой, особенности которой пока мало изучены. Культуры клеток и
тканей могут служить адекватной моделью при изучении метаболизма и его регу-
ляции в клетках и тканях целого растения.
2. Культивируемые клетки высших растений могут рассматриваться как типичные
микрообъекты, достаточно простые в культуре, что позволяет применять к ним не
только аппаратуру и технологию, но и логику экспериментов, принятых в микро-
биологии. Вместе с тем, культивируемые клетки способны перейти к программе
развития, при которой из культивируемой соматической клетки возникает целое
растение, способное к росту и размножению. Можно назвать несколько направле-
ний создания новых технологий на основе культивируемых тканей и клеток расте-
ний :
1. Получение биологически активных веществ растительного происхождения:
- традиционных продуктов вторичного метаболизма (токсинов, гербицидов, ре-
гуляторов роста, алкалоидов, стероидов, терпеноидов, имеющих медицинское при-
менение) ;
- синтез новых необычных соединений, что возможно благодаря исходной неод-
нородности клеточной популяции, генетической изменчивости культивируемых кле-
ток и селективному отбору клеточных линий со стойкими модификациями, а в не-
которых случаях и направленному мутагенезу;
- культивируемые в суспензии клетки могут применятся как мультиферментные
системы, способные к широкому спектру биотрансформаций химических веществ
(реакции окисления, восстановления, гидроксилирования, метилирования, демети-
лирования, гликолизирования, изомеризации). В результате биотрансформации по-
18
Это специальность автора публикации.
лучают уникальные биологически активные продукты на основе синтетических со-
единений или веществ промежуточного обмена растений других видов.
2. Ускоренное клональное микроразмножение растений, позволяющее из одного
экпланта получать от 10000 до 1000000 растений в год, причем все они будут
генетически идентичны.
3. Получение безвирусных растений.
4. Эмбриокультура и оплодотворение in vitro часто применяются для преодоле-
ния постгамной несовместимости или щуплости зародыша, для получения растений
после отдаленной гибридизации. При этом оплодотворенная яйцеклетка вырезается
из завязи с небольшой частью ткани перикарпа и помещается на питательную сре-
ду. В таких культурах можно также наблюдать стадии развития зародыша.
5. Антерные культуры - культуры пыльников и пыльцы используются для получе-
ния гаплоидов и дигаплоидов.
6. Клеточный мутагенез и селекция. Тканевые культуры могут производить ре-
генеранты, фенотипически и генотипически отличающиеся от исходного материала
в результате сомаклонального варьирования. При этом в некоторых случаях можно
обойтись без мутагенной обработки.
7. Криоконсервация и другие методы сохранения генофонда.
8. Иммобилизация растительных клеток.
9. Соматическая гибридизация на основе слияния растительных протопластов.
10. Конструирование клеток путем введения различных клеточных оганелл.
11. Генетическая трансформация на хромосомном и генном уровнях.
12. Изучение системы «хозяин - паразит» с использованием вирусов, бактерий,
грибов и насекомых).
История метода
Самые ранние работы по изолированию культур принадлежат Блоцишевскому
(1876), Брауну и Моррису (1892), Боннэ, Саксу (1893). В этих исследованиях
Зародыши вычленялись из семени и выращивались в искусственных условиях. Пер-
вым исследователем, занявшимся установлением минимального размера экспланта,
был Карл Рехингер (1893) . Он выращивал тонкие срезы корня свеклы и одуванчика
и сегменты стебля тополя на песке с применением водопроводной воды, без сте-
рильных условий. Эти исследования показали, что каллус образуется при толщине
среза не менее 1,5 мм. Еще в 19 веке X. Фёхтинг провел ряд экспериментов, до-
казывающих тотипотентность клетки. При этом им убедительно показана поляр-
ность как органов, так и клеток.
Основы экспериментальной эмбриологии растений были заложены исследованиями
Моссарта (1902), который наблюдал набухание завязей некоторых растений после
обработки их спорами Licopodium, нежизнеспособными поллиниями и водными экс-
трактами пыльцы. В связи с этим было высказано предположение, что пыльцевая
трубка не только обеспечивает передвижение спермиев к яйцеклетке, но и пере-
носит в завязь ауксины, стимулирующие ее рост.
Г. Габерланд (1902) научился культивировать отдельные клетки в течение не-
которого времени. Но он выбрал для культивирования зеленые клетки, изолиро-
ванные из клеток палисадной паренхимы Lamium purpureum и волосков традескан-
ции вирджинской и медуницы мягкой, резонно рассудив, что при этом отпадет
потребность в источниках углеводов. Однако упустил из виду то, что ассимили-
рующие зеленые клетки - зрелые и высокодифференцированные, потеряли способ-
ность к меристематической деятельности. Исходное предположение автора, что
содержащие хлорофилл клетки полностью обеспечивают себя питательными вещест-
вами, необходимыми для их жизнедеятельности и роста, не было подтверждено
экспериментально. Габерланд также выдвинул гипотезу о тотипотентности любой
живой клетки растения, которая впоследствии была подтверждена эксперименталь-
но. Ряд ученых, в том числе и его ученики, последовали его примеру и получи-
ли отрицательные результаты. Некоторые на основании этого усомнились в гипо-
тезе тотипотентности растительных клеток. Исследования Габерландта с фото-
синтезирующими клетками были неудачны, что привело к потере интереса к куль-
тивированию тканей и клеток растений. Однако они все же положили начало поис-
ку адекватных питательных смесей и условий, необходимых для поддержания роста
органов, тканей и клеток растений.
Толчком к возобновлению работ послужили исследования Гаррисона, проведенные
в 1904 - 1907 гг. Он вырастил нейробласты лягушки в лимфатической жидкости,
доказав возможность выращивания in vitro изолированных клеток. Большое влия-
ние на направление дальнейших работ с растительными клетками оказали работы
зоологов Карреля и Барроуза (1911), культивировавших ткани и клетки млекопи-
тающих на среде сложного состава, содержащей плазму крови и экстракты эмбрио-
нальных тканей.
Французский ученый Мольяр уже в 1921 культивировал сегменты корня и гипоко-
тиля молодых побегов редьки. Они были способны к росту в условиях культуры,
но при этом не происходило формирования новых тканей.
В 1922 г. один из учеников Рехингера - Коттэ начал эксперименты с лишенными
пигментов меристематическими тканями - изолированными кончиками корней, и до-
бился успеха. Практически одновременно и независимо от Коттэ Роббинс подобрал
состав питательной среды, обеспечивающий в культуре рост апикальной меристемы
корня томатов и кукурузы. Эти опыты положили начало культивированию изолиро-
ванных органов растений на питательных средах. Не всегда эти исследования бы-
ли успешны. Под влиянием работ Карреля и Барроуза в 1927 году Прат начал
культивировать клетки растений на средах с добавками растительных экстрактов.
Результаты его экспериментов были отрицательны, так как он избрал неудачные
объекты для исследований.
Начало длительным и удачным исследованиям по культивированию клеток и тка-
ней растений положили работы американского исследователя Ф. Уайта и француза
Р. Готре. Они показали, что изолированные органы и ткани могут расти в куль-
туре неограниченно долгое время, если их пересаживать на свежую питательную
среду. Такую же способность наблюдал Ф. Уайт для клеток опухолевого происхож-
дения. Результаты чужих и собственных экспериментов Уайт обобщил в монографии
«Культура растительных тканей», которая была переведена на русский язык и из-
дана в СССР в 1949 году. В ней он выделяет несколько периодов в истории раз-
вития метода культуры клеток, тканей и органов растений:
1. 1834 -1900 гг. - создание и разработка клеточной теории.
2. 1900 -1922 гг. - сформулирована идея культуры тканей.
3. 1922 - 34 гг. - безуспешные поиски методов, обеспечивающих длительное
культивирование тканей.
4. 1934 - 39 гг. - детальная разработка техники культуры растительных тка-
ней .
Период 1940 - 1960 гг. значительно расширил список видов, выращиваемых in
vitro. В монографию Готре, вышедшую в 1959 г., включено уже 142 вида. Были
разработаны составы питательных сред, изучено значение микро- и макроэлемен-
тов для поддер-жания нормальной ростовой активности тканей, определено влия-
ние витаминов и стимуляторов роста. Проводились работы по выявлению значения
различных натуральных экстрактов (из эндосперма кокосового ореха, каштана,
кукурузы и других рас-тений) для поддержания неорганизованного клеточного
роста, а также для стимуляции органогенеза. Показано значение кинетина для
пролиферации клеток in vitro и индукции стеблевого морфогенеза. Изучением
этих вопросов занимались такие ученые, как Р. Хеллер, И. Нич, Ф. Скуг, Ф.
Стевард, Р. Г. Бутенко. В это же время разработаны методы получения и выращи-
вания клеточных суспензий, а также культивирования отдельной клетки, деление
ко-торой индуцируется с помощью ткани-няньки.
В 1960 - 1975 гг. положено начало методу получения изолированных протопла-
стов из тканей корня и плодов томатов путем обработки их смесью пектолитиче-
ских и целлюлолитических ферментов. Основоположник этого метода - Э. Коккинг.
Такебе с сотрудниками были определены условия культивирования изолированных
протопластов, при которых они образуют клеточные стенки, делятся и дают нача-
ло клеточным линиям, способным к морфогенезу. Были разработаны методы гибри-
дизации соматических клеток путем слияния протопластов и введения в них ви-
русных РНК, клеточных органелл, бактерий. В лабораториях Р. Г. Бутенко, Ю. Ю.
Глебы проводились исследования поведения ядерного и цитоплазматического гено-
мов партнеров в гибридных клеточных линиях и потомстве соматических гибридов
растений - регенерантов. В этот же период были разработаны методы получения
безвирусных растений из меристематических тканей. Начались эксперименты по
созданию установок для глубинного культивирования клеток.
Начиная с 1976 г., разрабатывались методы электрослияния протопластов и се-
лекции гибридных клеток, культивирования гаплоидных клеток и получения новых
форм и сортов сельскохозяйственных растений. Удалось создать системы иммоби-
лизованных клеток для получения различных химических соединений и их био-
трансформации. Ведутся работы по переносу генов в растительные клетки и полу-
чению трансгенных растений.
Культуры соматических клеток
В основе культивирования растительных клеток лежит свойство тотипотентно-
сти, благодаря которому соматические клетки растения способны полностью реа-
лизовать наследственную информацию, то есть обеспечить развитие всего расте-
ния. Следует отметить, что в отличие от животной, растительная клетка предъ-
являет менее жесткие требования к условиям культивирования.
Изменяя условия (добавляя в состав питательной среды те или иные гормоны),
можно вызвать дифференциацию недетерминированных клеток. Культура раститель-
ной ткани позволяет получить многочисленные популяции в сравнительно короткое
время и в ограниченном пространстве. Клетки в условиях in vitro лишаются
очень многих важных взаимодействий, которые определяют их судьбу и дифферен-
циацию в целом организме. В определенных пределах дифференциация культивируе-
мых клеток поддается контролю со стороны экспериментатора.
Основным типом культивируемой растительной клетки является каллус. Каллус-
ная ткань - один из видов клеточной дифференцировки, возникает путем неорга-
низованной пролиферации дедифференцированных клеток органов растения. У рас-
тений в природе каллусная ткань возникает в исключительных обстоятельствах
(например, при травмах) и функционирует непродолжительное время. Эта ткань
защищает место поранения, может накапливать питательные вещества для анатоми-
ческой регенерации или регенерации утраченного органа.
Образование каллуса не всегда связано с травматическим воздействием. Каллус
может возникнуть и в результате пролиферации внутренних тканей экспланта без
связи с поверхностью среза из-за нарушения гормонального баланса. Растущий
каллус разрывает слои ткани и развивается на поверхности. Для получения куль-
тивируемых каллусных клеток фрагменты тканей различных органов высших расте-
ний - корней, листьев, стеблей, пыльников, зародышей (экспланты) помещают на
искусственную среду, содержащую ауксины, в пробирки, колбы, чашки Петри (in
vitro).
В качестве ауксинов используют 2,4-дихлорфеноксиуксусную кислоту (2,4-Д),
а-нафтилуксусную кислоту (НУК), индолил-масляную кислоту (ИМК), индолилуксус-
ную кислоту (ИУК) в концентрации 0,5 - 10 мг /л, в зависимости от вида экс-
планта .
Процессу образования каллуса предшествует дедифференцировка тканей эксплан-
та. При дедифференцировке ткани теряют структуру, характерную для их специфи-
ческих функций в растении, и возвращаются к состоянию делящихся клеток. Если
эксплант, используемый для получения каллуса, является фрагментом органа, то
имеет в своем составе эпидермальные клетки, клетки камбия, сосудистой систе-
мы, сердцевинной и первичной коровой паренхимы. Преимущественно пролиферируют
клетки камбия, коры, сердцевинной паренхимы.
Различное тканевое происхождение каллусных клеток является одной из причин
гетерогенности каллусной ткани, так как некоторые функциональные особенности
исходных клеток передаются в ряду клеточных поколений как стойкие модифика-
ции. В качестве примера можно привести процессы, происходящие при дедифферен-
цировке апикальной меристемы стебля. После помещения на питательную среду ме-
ристемы стебля томатов отмечено прекращение митоза, клетки увеличиваются в
размерах, теряют характерную для меристематической ткани форму, изменяется
структура ядра и цитоплазмы. В готовящейся к делению клетке возрастает синтез
всех форм РНК, исчезают тканеспецифичные белки-антигены и появляются белки,
специфичные для делящихся клеток и для каллусной ткани. Эти наблюдения свиде-
тельствуют об изменениях в активности генов и белкового аппарата клетки при
дедифференцировке.
Активаторами матричной активности ДНК хроматина или активности РНК-полиме-
разы являются фитогормоны. Рецепторные для фитогормонов белки, локализованные
в мембранах, по-видимому, оказывают влияние в присутствии фитогормонов на
структуру и функцию мембран. Возможно, это обуславливает действие фитогормо-
нов на генную активность.
Одним из важнейших гормонов, применяемых при культивировании in vitro явля-
ется ауксин, который активирует деление и растяжение клеток. Проникая в клет-
ки, ИУК связывается со специфическими рецепторами, оказывая влияние на функ-
циональную активность мембран, полирибосом и работу ядерного аппарата. Уста-
новлено, что в плазмалемме ауксин индуцирует работу Н+-помпы, в результате
чего матрикс клеточных стенок размягчается, что является необходимым условием
для роста и растяжения клеток. Включенная Н+-помпа усиливает поглотительную
активность тканей, обогащенных ауксином. Предполагается, что поступление аук-
сина в клетку способствует усилению секреции кислых гидролаз и полисахаридов,
необходимых для дальнейшего роста клеточных стенок. Под влиянием ауксина
уменьшается продолжительность различных периодов митотического цикла. Так,
предполагается, что уменьшается продолжительность периода удвоения числа кле-
ток, продолжительность S - периода, Gi - периода19. Все это приводит к значи-
тельному ускорению темпов размножения клеток.
Общим моментом в действии ауксинов на деление клеток является также предва-
рительное усиление синтеза и накопление РНК. Стимулирующее действие ауксинов
на синтез РНК может быть связано с восстановлением клеток после голодания пе-
ред их вхождением в митотический цикл, но может быть также приурочено к про-
хождению клетками этапов митотического цикла. Особенно отчетливо необходи-
мость синтеза РНК проявляется при прохождении клетками Gi - периода. Под
влиянием ауксина усиливается синтез р-РНК, но имеет место и появление новых
информационных РНК, причем на очень ранних этапах действия.
Осуществление клетками подготовки к делению на всех этапах митотического
цикла зависит от синтеза белков. Ауксин вызывает как общую стимуляцию их син-
теза , так и появление новых белков. Это позволяет предположить существование
в хроматине структурных генов, транскрипция которых специфически индуцируется
ауксином. Реализация действия ауксина на хроматин и последующее деление осу-
ществляется вследствие его проникновения в цитоплазму, образования комплекса
с цитоплазматическим ауксиновым рецептором и воздействием этого комплекса на
транскрипционную активность хроматина. Кроме этого ауксин усиливает окисли-
тельную и фосфорилирующую активность митохондрий, в результате чего улучшает-
ся энергетическое и субстратное обеспечение процессов синтеза РНК и белков,
репликация ДНК, а также осуществление самого митоза. Этот эффект обнаружива-
ется очень рано и, как и синтез РНК, зависит от проникновения ауксина в клет-
ку.
Для возбуждения процессов подготовки к делению достаточно начального крат-
ковременного действия ауксина. Поэтому процессы, происходящие в клетках под
влиянием ауксина, можно разделить на первичные, непосредственно индуцирован-
ные ауксином, и вторичные, являющиеся следствием первичного индуцирующего
действия. Исходя из этого, можно предположить, что в митотическом цикле рас-
тительных клеток имеются кратковременные переходы, когда необходимо присутст-
вие ауксина в клетках, и более продолжительные периоды, когда присутствие
ауксинов в клетке не является необходимым.
19
Ну, конечно, все сразу догадались, что это такое.
Морфофизиологическая характеристика
каллусных тканей
Выделяют два типа культивируемых растительных клеток: нормальные и опухоле-
вые .
Опухолевые клетки морфологически мало отличаются от каллусных. Физиологиче-
ским различием является гормононезависимость опухолевых клеток. Благодаря
этому свойству опухолевые клетки делятся и растут на питательных средах без
добавок фитогормонов. Эти клетки также лишены способности дать начало нор-
мально организованным структурам (корни, побеги) в процессе органогенеза.
Иногда они образуют тератомы (уродливые органоподобные структуры), дальнейшее
развитие которых невозможно.
Нормальные клетки в культуре могут существовать в двух видах: в виде сус-
пензии в жидкой питательной среде и на поверхности твердой питательной среды
в виде каллуса. Поверхностное культивирование осуществляют на полужидкой ага-
ризованной среде, среде с добавлением других желирующих полимеров, на дисках
из полиуретана, на мостиках из фильтровальной бумаги, полупогруженных в жид-
кую питательную среду. Можно также использовать комочки ваты, пропитанные пи-
тательной средой, которые сверху покрываются кусочком фильтровальной бумаги.
Каллусная ткань, выращиваемая поверхностным способом, представляет собой
аморфную массу тонкостенных паренхимных клеток, не имеющую строго определен-
ной анатомической структуры. Цвет массы может быть белым, желтоватым, зеле-
ным, красным. В зависимости от происхождения и условий выращивания каллусные
ткани бывают:
- рыхлые, сильно оводненные, легко распадающиеся на отдельные клетки;
- средней плотности, с хорошо выраженными меристематическими очагами;
- плотные, с зонами редуцированного камбия и сосудов. Как правило, в дли-
тельной культуре на средах, содержащих ауксины, каллусные ткани теряют пиг-
ментацию и становятся рыхлыми.
В цикле выращивания каллусной ткани клетки после ряда делений приступают к
росту растяжением, дифференцируются как зрелая каллусная ткань и деградируют.
Для того чтобы не произошло старения, утраты способности к делению и дальней-
шему росту, а также отмирания каллусных клеток, первичный каллус переносят на
свежую питательную среду через 28 - 30 дней, то есть проводят пассирование
или субкультивирование каллусной ткани.
Неорганизованно растущая каллусная ткань характеризуется тремя типами кле-
ток: мелкими, средними и крупными. При пассировании ткани на среду, содержа-
щую индукторы органогенеза, мелкие клетки приступают к делению и формируют
меристематические очаги. Деление клеток меристематического очага приводит ли-
бо к формированию почек и последующему развитию из них побегов (геммогенез),
либо к ризогенезу (рис. 7, 8)20.
Клетки меристемы с самых ранних стадий развития отличаются от каллусных вы-
соким содержанием РНК и белка. При образовании соматических эмбриоидов кал-
20
Отсутствуют t как таковые.
лусная клетка средних размеров обособляется, ограничивается плотной оболоч-
кой, теряет крупные вакуоли. Она содержит крупное структурированное ядро с
ядрышком. Клетка делится митотически, в результате чего возникают 2 клетки
проэмбрио. Последующие деления клеток приводят к формированию шаровидного за-
родыша, а также органа, аналогичного суспензорам в зародышевом мешке семяпоч-
ки. Дальнейшее развитие соматического эмбриона через ряд стадий ведет к реге-
нерации целого растения с корнями и побегами (рис. 9, 10) , так как в этом
случае формируется биполярная структура.
Каллусы с высоким морфогенетическим потенциалом обычно матовые, компактные,
структурированные, имеют зеленые хлорофиллсодержащие участки, которые пред-
ставляют собой зоны морфогенеза. Впоследствии там формируются побеги или рас-
тения-регенеранты. В культуре также встречаются каллусы рыхлые, не имеющие
глобулярного характера. Такие каллусы либо совсем не способны к органогенезу,
либо формируют только корни. Появление корней свидетельствует о сдвиге гормо-
нального баланса в сторону ауксинов, что препятствует образованию побегов.
Эти каллусы могут остаться ризогенными, и регенерировать из них растения не
удастся. Неморфогенные каллусы могут быть переведены в суспензионную культуру
для получения вторичных метаболитов.
Переход специализированных неделящихся клеток к пролиферации связан с их
дедифференциацией, другими словами — утратой специализации. В основе этого
процесса, как и при дифференциации клеток в интактном растении, лежит диффе-
ренциальная активность генов. Структура и функции клеток определяются актив-
ностью генов, и если клетки различаются по своей структуре и функциям, то это
обусловлено различиями в экспрессии их генов, то есть специализация обеспечи-
вается «включением» разных генов в разных клетках. Обычно активна небольшая
часть (5%) всего пула генов, свойственных данному виду. В этот состав актив-
ных генов входят, кроме видоспецифичных и обязательных для поддержания кле-
точного метаболизма, гены, активные только в данном органе, ткани, клетке, а
также гены, активные лишь в определенном возрасте или начавшие работать толь-
ко под влиянием изменившихся внешних условий.
Возникновение физиологических и структурных различий между клетками и тка-
нями растений, связанное с их функциональной специализацией, называют процес-
сом дифференциации. Понятие «дифференциация» отражает превращение эмбриональ-
ной, меристематической клетки в специализированную. Меристематические клетки,
однотипные по структуре и функции, начинают развиваться различными путями,
создавая ткани разных органов. Как это осуществляется — один из труднейших
вопросов клеточной биологии. Между геномами в клетках, которые приобретают
разную форму и функцию, по-видимому, нет качественных различий, и клетки эти
начинают различаться только вследствие разной экспрессии генов. Вновь возник-
шая клетка обладает широкими потенциями и может развиваться по любому из мно-
гих путей в морфологическом и физиологическом смысле.
Детерминация (определение) пути развития каждой клетки является основой фи-
зиологии развития. Вступление на тот или иной путь развития определяется осо-
бым набором белков, т. е. каждая специализированная клетка вырабатывает толь-
ко ей свойственные белки, что является следствием дифференциальной активности
генов — экспрессии одной группы генов при одновременной репрессии других.
Способность одной-единственной зрелой соматической клетки дать начало целому
организму (тотипотентность) показывает, что в процессе нормальной клеточной
дифференциации у растений не происходит утраты или необратимой инактивации
каких-либо генов.
У растений почти всякая дифференциация обратима при условии, если дифферен-
цированная клетка живая, в протопласте сохранилось ядро и не образовалась
вторичная оболочка. Даже такие высокоспециализированные клетки, как микроспо-
ры, с помощью ряда экспериментальных процедур можно заставить пролиферировать
и дать начало целому растению. Итак, в определенных условиях многие из зрелых
растительных клеток сохраняют способность делиться, а в некоторых случаях да-
же вступить на новый путь развития. Однако вопрос о том. как это происходит,
какие события на молекулярном уровне сопровождают этот процесс, остается от-
крытым .
Таким образом, после деления перед каждой дочерней клеткой открывается одна
из трех возможностей. Клетка может оставаться эмбриональной и вновь вступить
в клеточный цикл с последующим митозом либо может оказаться как бы «вне цик-
ла» (Go), перестав делиться, и наконец, приобретя компетенцию, постепенно де-
терминироваться и вступить на путь дифференцировки (специализации). Компетен-
ция — способность клетки воспринимать индуцирующее воздействие и специфически
реагировать на него изменением развития.
Индуцирующее воздействие могут оказывать различные факторы: гормоны, про-
дукты жизнедеятельности соседних клеток, других тканей, электрофизиологиче-
ские сигналы ит. д. Детерминация — приобретение клеткой состояния готовности
к реализации определенных наследственных свойств.
Детерминация приводит к развитию по определенному пути с одновременным ог-
раничением возможности развития в других направлениях. Детерминация компе-
тентной клетки может начинаться сразу же после деления в начале роста прото-
плазмы. Детерминированная определенным образом клетка приобретает узкую спе-
циализацию, то есть дифференцируется и превращается в клетку какой-либо тка-
ни. Из гормональных факторов в дифференциации и морфогенезе первостепенная
роль отводится ауксинам и цитокининам.
В отношении органогенеза Скугом и Мурасиге была выдвинута концепция, со-
гласно которой можно получить образование стеблей, корней или недифференциро-
ванный рост каллуса, изменяя относительное содержание ауксинов и цитокининов.
В самом простом случае (табак) индукция и образование каллуса наблюдается при
сбалансированном отношении ауксинов к цитокининам, стеблевые почки образуются
при повышении уровня цитокининов по отношению к ауксинам, корни формируются
при высоком содержании ауксинов в среде. В большинстве случаев формирование
органов в культуре клеток можно объяснить гормональной теорией регуляции, но
для некоторых видов она оказывается несостоятельной. Одни и те же физиологи-
чески активные вещества регулируют и деление клеток при недифференцированном
росте каллуса, и клеточные деления, связанные с дифференциацией. Если диффе-
ренциация включает изменения в экспрессии генов на уровне транскрипции, тогда
должны существовать и другие специфические вещества, определяющие компетент-
ность клетки к обработке экзогенными фитогормонами.
Есть системы, не реагирующие на гормональные обработки. Клетки этих тканей
не способны к дифференциации, или, пролиферирующие in vitro, не проявляют то-
типотентности. Морфогенная способность клона зависит от генотипа. Имеет зна-
чение и орган, от которого взят первичный эксплант. Ткани одного и того же
органа имеют разную способность к морфогенезу. Например, флоэмная ткань корня
моркови дает начало корням, а ксилемная - формирует эмбриоиды.
Для понимания механизмов морфогенеза необходимо рассмотреть комплекс морфо-
физиологических процессов, протекающих в каллусной ткани, так как эти процес-
сы лежат в основе того, что из каллуса при определенных условиях выращивания
дифференцируется растение. В процессе культивирования отмечено возникновение
новых микротрубочек в клетке in vitro, изменение ее размеров, активности ри-
босом, состояния пластидных пигментов, запасающих веществ. Роль микротрубо-
чек, микрофиламентов и других структур в клеточном взаимодействии пока не вы-
яснена. Эти структурные образования появляются обычно при регенерации и ка-
ким-то образом причастны к клеточному делению, взаимодействию между клетками,
структуре- и формообразованию. Изменяется также структура и активность аппа-
рата Гольджи, который выполняет важную функцию при клеточном делении.
Появляются многоядерные клетки, отмечается полиплоидизация в результате на-
рушения митоза. Характерное несинхронное течение митотических циклов является
одним из условий морфологической гетерогенности клеток ткани. Важно, что при
выращивании in vitro наблюдается генетическая гетерогенность клеток, появле-
ние мутантов с отличительными особенностями органогенеза. В основе лежат из-
менения состояния хромосом в виде транслокаций, делеций, другие нарушения
связаны с полиплоидизацией.
Клетка, введенная в культуру, претерпевает последовательные изменения: пе-
реход к дедифференцированному состоянию, эмбриональному росту и, благодаря
способности каллуса к вторичной дифференциации, формообразованию. Взаимодей-
ствие между клетками выступает как решающий фактор их дифференциации и спе-
циализации. Процесс дифференциации клеток обусловлен различной степенью ре-
прессии и дерепрессии генетической информации.
В ассоциации клеток каллусной ткани одни клетки занимают определенное поло-
жение и осуществляют посредством физико-химических контактов влияние на дру-
гие, чем определяется их структурно-функциональное состояние. Межклеточные
взаимодействия осуществляются с помощью соответствующих донорно-акцепторных
молекул цитоплазматической мембраны. Этими молекулами могут быть низкомолеку-
лярные белки, комплексы углеводов с белками, фитогормоны, ингибиторы, поляр-
ные соединения и другие. Но во всех случаях на основе нуклеинов©-белкового,
белково-углеводного и иного типа узнавания они будут способствовать слипанию
или отталкиванию клеток, будут выступать как эффекторы или апорепрессоры. В
клетке реципиента с помощью специальных рецепторов эти молекулы будут связы-
ваться и изменять в эпигенезе реакцию генетической информации. Таким образом,
в основе дифференциации клетки лежат процессы репрограммирования, репрессии,
дерепрессии генетической информации. Это приводит к образованию специализиро-
ванных клеток, которые становятся способными к взаимодействию, ассоциации,
образованию геометрических форм, к органо- и морфогенезу.
Важнейшим условием морфогенеза является адгезия клеток, в результате кото-
рой образуется ткань и орган. Поверхностные рецепторы, а также различные
структуры типа микротрубочек обуславливают узнавание, сближение, слипание
клеток в процессе дифференциации, ткане- и формообразования. Вещества, актив-
ные в процессах структур©- и формообразования, синтезируются под контролем
ядра при поступлении сигналов из цитоплазмы клетки, а также экзогенных им-
пульсов , эффекторов. При этом связующим звеном между генетической информаци-
ей, ее реализацией и эффектором выступают аллостерические белки, которые со-
бирают , накапливают внешнюю информацию и преобразуют ее, в результате чего
изменяют свою конформацию и вступают во взаимодействие с ©пероном.
Генетическая обусловленность процессов морфогенеза отражается в изменении
синтеза и-РНК, белков, активных ферментов, то есть в комплексе скоординиро-
ванных во времени и пространстве реакций, обуславливающих дифференциацию ак-
тивности генов. Появление некоторых белков свидетельствует об их участии в
морфогенезе и запуске морфогенетических реакций. Установлен специфический
фактор пептидной природы, стимулирующий морфогенез. Изучая генетический кон-
троль каллусообразования и органогенеза, ученые предположили, что интенсив-
ность образования каллуса находится под генетическим контролем.
О генетической обусловленности признака регенерации в условиях in vitro
свидетельствуют следующие факты:
1. Отсутствие определенных плеч хромосом (например, в клетках Triticum
timopheevii при длительном культивировании теряются плечи хромосом генома At)
может приводить к снижению выхода регенерантов.
2. С помощью гибридизации можно повысить интенсивность регенерации в кал-
лусной ткани.
3. Использование разных по составу питательных сред для регенерации способ-
ствует разному уровню экспрессии генов, которые определяют этот признак.
4. В основе генетического контроля таких признаков, как частота каллусооб-
разования, частота образования морфогенных каллусов и количество зон регене-
рации для озимой пшеницы основными являются сверхдоминирование, неполное до-
минирование и эпистаз; для озимой твердой -эпистаз, неполное доминирование и
сверхдоминирование; для яровой твердой - эпистаз.
Одни генетические системы контроля для всех признаков проявляются стабильно
(эпистаз), а другие (сверхдоминирование) - значительно изменяются в зависимо-
ти от признаков и генотипов. Но следует отметить, что каллусогенез и регене-
рация растений не являются сопряженными процессами, вероятно, они контролиру-
ются различными генетическими механизмами. Общей закономерностью для культи-
вируемых тканей остается возрастание цитогенетической вариабельности в про-
цессе культивирования. С этим коррелирует в большинстве случаев потеря морфо-
генного потенциала. Способность к морфогенезу зависит и от состояния ядра.
Как правило, регенерирующие в культуре тканей растения являются диплоидными,
хотя ткани, из которых они произошли, имеют разный уровень плоидности.
Таким образом, для индукции морфогенеза in vitro необходимо вызвать неодно-
родность в клеточных популяциях и тканях. Любые воздействия, приводящие к
увеличению неоднородности в культуре клеток, в пространственном распределении
гормонов, будут способствовать дифференциации клеток и формообразованию в
каллусе. Доказательством этого могут также служить эксперименты, проведенные
с каллусной тканью пшеницы и кукурузы в космических условиях. Эти эксперимен-
ты были описаны М. Карабаевым (1994). В условиях космического полета можно
выделить 2 принципиальных стадии клеточного ответа на экстремальные условия:
1. Эта стадия, или стадия адаптации, продолжается 10 - 12 дней и связана с
адаптацией культуры к стрессу. Она сопровождается общим уменьшением жизнеспо-
собности клеток и потерей значительного числа клеток. В этих условиях число
жизнеспособных, стрессоустойчивых клеток постепенно возрастает.
2. Инициируется деление и меняется распределение клеток в популяции, умень-
шается градиент элементов питательной среды, так же как и градиент продуктов
жизнедеятельности клеток. Независимо от продолжительности космического поле-
та, развитие клеток и структур, ответственных за клеточную дифференциацию,
эмбриогенез и регенерацию растений подавляется космическими условиями. Основ-
ная причина этого может быть связана со специфическим распределением клеток в
клеточной популяции и слабостью межклеточных контактов под действием невесо-
мости . Анализ этих данных позволяет заключить, что гравитация имеет большое
значение для развития растений, так как условия Земли способствуют более тес-
ному взаимодействию гетерогенных спорадично растущих клеточных структур, а
это впоследствии влияет на индукцию клеточной дифференциации.
Суспензионные культуры
Суспензионные культуры - отдельные клетки или группы клеток, выращиваемые
во взвешенном состоянии в жидкой среде. Представляют собой относительно гомо-
генную популяцию клеток, которую легко подвергнуть воздействию химических ве-
ществ .
Суспензионные культуры широко используются в качестве модельных систем для
изучения путей вторичного метаболизма, индукции ферментов и экспрессии генов,
деградации чужеродных соединений, цитологических исследований и др.
Признаком "хорошей" линии служит способность клеток к перестройке метабо-
лизма и высокая скорость размножения в конкретных условиях культивирования.
Морфологические характеристики такой линии:
- высокая степень дезагрегации (5-10 клеток в группе);
- морфологическая выравненность клеток (небольшие размеры, сферическая или
овальная форма, плотная цитоплазма);
- отсутствие трахеидоподобных элементов.
Клеточную суспензию получают, помещая каллусную ткань в колбу с жидкой пи-
тательной средой. Суспензия перемешивается в колбе на качалке, имеющей ско-
рость перемешивания 100 - 120 об/мин. При первом переносе на свежую среду
удаляют крупные кусочки исходного каллуса и крупные агрегаты, фильтруя через
1-2 слоя марли, нейлоновые сита, шприц с соответствующим отверстием. Для
инициализации суспензионной культуры необходимо 2 - 3 г свежей массы каллус-
ной культуры на 60 - 100 мл жидкой питательной среды. Однако для каждой линии
культуры клеток существует минимальный объем инокулята, при меньшем размере
которого культура не растет.
Рост суспензионных культур клеток можно оценивать по одному или нескольким
следующим параметрам:
1. Объем осажденных клеток (ООК) . Переносят небольшой объем суспензионной
культуры в мерную пробирку объемом 15 мл, лучше всего коническую. Центрифуги-
руют 5 минут при 200 д. ООК - величина, которую составляет объем осадка от
объема суспензии, обычно в %.
2. Число клеток. Подсчитывается в камере Фукса-Розенталя.
3. Сырая и сухая масса. Суспензия клеток фильтруется через смоченный и
взвешенный фильтр, вложенный в воронку Бюхнера под слабым вакуумом. Клетки
промывают дистиллированной водой, оттягивают воду под вакуумом и взвешивают
снова вместе с фильтром. Сухая масса - определяется аналогично, но взвешива-
ется сухой фильтр, а клетки сушат вместе с фильтром в термостате при 60°С до
постоянной массы.
4. Содержание белка. Для определения белка клетки собирают на фильтре из
стекловолокна, дважды промывают кипящим раствором 70% этанола, сушат ацето-
ном, гидролизуют IM NaOH при температуре 85°С полтора часа. Затем фильтруют и
определяют белок по Лоури.
5. Проводимость среды. Определяют с помощью кондуктометра. Как правило, она
обратно пропорциональна свежей массе клеток.
6. Жизнеспособность клеток. Оценивают, изучая движение цитоплазмы под мик-
роскопом, а также с помощью прижизненных красителей (флюоресцеиндиацетат, со-
ли тетразолия, синий Эванса). Перед использованием подбирают pH инкубационно-
го буфера, концентрацию красителя, время инкубации, строят калибровочные кри-
вые для смеси живых и убитых клеток.
По полученным данным строят ростовые кривые, которые имеют S-образную форму
и состоят из нескольких участков: 1- латентная, или лаг-фаза, где видимый
рост не наблюдается ни по одному из критериев; 2 - экспоненциальная, рост с
ускорением; 3 - линейная, где скорость роста постоянна; 4 - фаза замедленного
роста; 5 - стационарная фаза; 6 - фаза деградации клеток (рис. II)21.
Реальная ростовая кривая может несколько отличаться от модельной. На форму
ростовых кривых влияют и генетическая характеристика популяции (вид расте-
ния) , и количество инокулята, и условия выращивания (состав среды, начальное
значение pH, состав газовой фазы, скорость перемешивания).
Необходимо отметить, что ростовые кривые для разных критериев не идентичны.
Дисбаланс между скоростями клеточного размножения (число клеток), синтеза
структурных элементов клетки (сухая масса) и увеличения объема и содержания
вакуолей (сырая масса) отражает специфику онтогенеза высшего растения.
Для глубинного культивирования растительных клеток применимы способы, раз-
работанные в микробиологии. Различают два вида систем культивирования: откры-
тую и закрытую.
Для закрытой системы характерен периодический режим выращивания. Клеточная
масса (инокулят) помещается в определенный объем среды. Система закрыта по
всем параметрам, кроме газов, до конца выращивания. Периодически подается
свежая питательная среда, а старая удаляется в том же объеме. Клетки остаются
в системе в течение всего цикла выращивания.
Открытые (проточные) культуры характеризуются поступлением свежей питатель-
ной среды, при котором отбирается не только старая питательная среда, но и
часть урожая клеточной массы.
Наиболее изучено и распространено закрытое глубинное культивирование. Для
аэрации и перешивания используют различную аппаратуру: роллеры, качалки, маг-
нитные мешалки и т.д. Очень большое значение для роста и биосинтеза клеток in
21 Рисунок отсутствует (также как 9-й и 10-й, о которых даже не упоминается). Впрочем, о чем
идет речь можно догадаться, пользуясь пояснениями к рисунку.
vitro имеют технические характеристики систем культивирования. При масштаби-
ровании от небольших по объему культур в колбах до больших многолитровых фер-
ментеров меняются многие параметры культивирования, в частности аэрация и пе-
ремешиваемость.
Для культивирования суспензий в производственных масштабах применяется ап-
паратура, разработанная для микробиологической промышленности, однако иссле-
дования последних лет показали, что растительные клетки в силу своих специфи-
ческих особенностей требуют особых сосудов для культивирования. Клетки расте-
ний в десятки, сотни раз крупнее клеток бактерий и грибов, кроме того, их
размеры меняются в процессе онтогенеза. Если в начале экспоненциальной фазы
роста они мелкие и плотные, то в стационарной фазе роста они сильно увеличи-
ваются в размерах и вакуолизируются. Чем крупнее становится клетка, тем боль-
ше возрастает опасность ее механического повреждения в процессе перемешива-
ния. В то же время клетки растений, крупные и тяжелые, требуют эффективного
перемешивания. Оседание их приводит к появлению «мертвых» зон в сосудах, в
которых происходит быстрое накопление и старение клеток. Для культуры клеток
женьшеня отрицательное влияние механического стресса при выращивании в фер-
ментере с турбинными мешалками сказывалось на жизнеспособности клеток уже при
скоростях мешалок свыше 100—350 об/мин, это отрицательно влияло на синтез ими
антрахинонов. Устойчивость штамма к механическому стрессу является важным
требованием к культуре и трудной задачей для исследователей.
Мягкое перемешивание и аэрацию обеспечивает пневматический способ перемеши-
вания потоком сжатого стерильного воздуха, подаваемого в ферментер с восходя-
щим током воздуха. К сожалению, и этот способ имеет свой недостаток, потому
что в культуральной среде возникает избыток воздуха, приводящий к кислородно-
му голоданию22. От концентрации кислорода в среде зависят рост и вторичный
метаболизм клеток. В микробиологических системах изучена взаимозависимость
роста биомассы, выхода искомого продукта и снабжения кислородом. Для растений
таких данных нет.
На рост клеток, кроме кислорода, могут влиять и другие газы. Например, уг-
лекислый газ может существенно влиять на длину лаг-фазы. Высокая степень
аэрации может оказывать негативное действие на рост и синтез продуктов вто-
ричного метаболизма, поскольку удаляются углекислый газ и летучие соединения.
Клетки растений in vitro по сравнению с микроорганизмами имеют низкую интен-
сивность дыхания, что тоже должно учитываться при конструировании сосуда для
культивирования. Сравнивали рост и образование метаболитов клетками в фермен-
терах разных типов. Клетки моринды лимонолистной, культивируемые в ферменте-
рах с продувкой воздуха, содержали антрахинона на 30% больше, чем в перемеши-
ваемых колбах, и в два раза больше, чем в ферментерах других систем. Выход
биомассы клеток не менялся в зависимости от типа биореактора. Клетки барвинка
розового (Catharantus roseus) также синтезировали больше индольных алкалоидов
при культивировании в ферментере с продувкой воздуха, чем в биореакторах с
механическим перемешиванием.
Отличительная особенность суспензионных культур клеток растений — высокая
плотность, необходимая для роста. Поэтому другим осложнением при культивиро-
вании клеток растений является увеличение вязкости, сопровождающее рост био-
массы. Это ведет к адгезии. Адгезия (прилипание) клеток друг к другу, на по-
верхностях культурального сосуда и погруженных в него мешалок и датчиков вы-
22
Загадочная фраза.
зывает затруднения. В верхней части сосуда постепенно может образовываться
пена, состоящая из выделяемых клетками белков и полисахаридов. В процессе
культивирования клетки слипаются и часть из них скапливается в этой пене, об-
разуя «корку», или «безе». С увеличением биомассы клеток увеличивается и эта
«корка», снижая интенсивность перемешивания, что, в конце концов, может при-
вести культуру к гибели.
Клетки растений обладают меньшей физиологической и метаболической активно-
стью по сравнению с микроорганизмами. Время генерации (интервал времени между
двумя последовательными клеточными делениями) растительной клетки в 60—100
раз превосходит время генерации микробной клетки. Пул пролиферирующих клеток
не превышает 50—60%, многие клетки быстро прекращают деление и переходят в
фазу покоя.
Все эти обстоятельства определяют продолжительный рост популяции клеток при
накопительном, или периодическом, выращивании. Поддержание стерильности дли-
тельное время также является одной из технических проблем, особенно при не-
прерывном культивировании.
Периодическое, или накопительное, культивирование — это самый простой спо-
соб выращивания клеток, являющийся пока традиционным. Суспензионные культуры
используют для промышленного получения вторичных метаболитов. Вещества, про-
дуцируемые растительными клетками, используются в медицине, парфюмерной про-
мышленности, растениеводстве и других отраслях промышленности. К ним относят-
ся: алкалоиды, терпеноиды, гликозиды, полифенолы, полисахариды, эфирные мас-
ла, пигменты, антиканцерогены (птотецин, харрингтонин), пептиды (ингибиторы
фитовирусов). В настоящее время в разных странах около ста видов растений ис-
пользуется в биосинтетической промышленности для получения экономически важ-
ных веществ, среди них — женьшень, раувольфия змеиная, наперстянка шерстистая
и пурпурная, диоскорея дельтовидная, воробейник, беладонна, паслен дольчатый,
дурман обыкновенный, ландыш майский, клещеви на, агава, мак снотворный и др.
Получение вторичных метаболитов имеет свои особенности. Деление клеток,
приводящее к увеличению клеточной биомассы, и синтез вторичных метаболитов
разобщены во времени. Накопление вторичных метаболитов возрастает в фазе за-
медленного роста клеточной популяции и достигает максимума в стационарной фа-
зе. Некоторые алкалоиды активно синтезируются в фазе максимальной митотиче-
ской активности (экспоненциальный рост), что является исключением. Знание та-
ких закономерностей позволяет регулировать процессы получения ценных веществ.
Механизмы и условия, блокирующие активный рост клеток и клеточную пролифера-
цию , одновременно активируют ферменты вторичного метаболизма. Неспецифические
стрессовые условия, воздействующие на клетки в конце экспоненциальной фазы,
могут стимулировать переход к синтезу вторичных метаболитов и увеличивать их
выход. Необходимо учитывать, что вопрос взаимодействия первичного и вторично-
го метаболизма, рассмотренный нами в упрощенном виде, намного сложнее.
Культивирование
отдельных клеток
Отдельные клетки культивируют для получения клонов, изучения их генетиче-
ской и физиологической изменчивости или стабильности. Кроме того, культивиро-
вание отдельных клеток позволяет изучать условия, определяющие возникновение
стимулов к делению у клеток, изолированных от влияния других клеток популяции
или ткани. Отдельные клетки также важны для клоновой селекции мутантных, гиб-
ридных и трансформированных линий. Обычно в такие клетки вводят маркерные ге-
ны, которые позволяют осуществлять селекцию.
Кроме того, отдельные клетки могут служить моделью для сравнительного изу-
чения физиологических процессов в ткани и изолированной клетке. Например, для
изучения фотодыхания можно сравнивать процесс фотосинтеза на уровне отдельных
клеток мезофилла листа и целой ткани.
Выращивание изолированных клеток складывается из двух этапов:
1) изолирование неповрежденной клетки растительной или каллусной ткани;
2) создание условий, благоприятных для роста и развития изолированной клет-
ки .
На первом этапе необходимо выделить неповрежденную и жизнеспособную клетку
из ткани целого растения или каллусной ткани. Этого можно достичь путем обра-
ботки ткани пектиназами, что ведет к мацерации ее клеток. Однако не всегда
после такой обработки клетки сохраняют способность к последующим делениям и
образованию ткани. Лучше получать отдельные клетки из суспензионных культур
или рыхлого каллуса. Идеальными отдельными клетками являются протопласты, об-
разовавшие клеточную стенку.
Далее клетки изолируют либо при помощи микроманипуляторов, либо путем ряда
последовательных разведений. При первых же попытках культивирования отдельных
клеток возникла важная научная проблема: как заставить делиться клетки, изо-
лированные от влияния других клеток популяции или тканей? Отдельные клетки
вели себя иначе, чем их скопления в виде агрегатов в суспензии или каллусной
массы на поверхности питательной среды.
При ее решении возникла гипотеза о «факторе кондиционирования». Так было
названо вещество, стимулирующее деление отдельных клеток. Определено, что
этот фактор имеет химическую природу, термолабилен, водорастворим, низкомоле-
кулярен (М.К. Павлова, Р.Г. Бутенко, 1965), видонеспецифичен, не заменяет из-
вестные фитогормоны, синергичен с брассиностероидами. Было предложено не-
сколько вариантов культивирования отдельных клеток.
Впервые подобрать условия, подходящие для деления отдельных клеток, удалось
в 1954 году Мьюиру, Хильденбранту и Райкеру. Этот способ получил название ме-
тода «ткани - няньки» (рис. 12).
о
\ фильтр
- клетка
.< \--------каллус
X г1-----питательная среда
Рис. 12. Схема использования каллуса в качестве «ткани - няньки»
Клетку изолируют при помощи микроманипулятора из рыхлого каллуса непосред-
ственно на кусочек фильтра размером 8*8 мм, помещенный на верхушку каллус-
ной ткани, из которой была взята клетка. Каллус должен находится в фазе ак-
тивного роста. Можно также в качестве «няньки» использовать каллусную ткань
другого растения родственного вида. В этом случае клетки растут и делятся. По
мере старения каллуса - няньки фильтр с клетками переносится на молодой кал-
лус. Когда ткань из клетки достигает размеров 0,5-1 мм, то ее можно высажи-
вать непосредственно на питательную среду.
Проводились также эксперименты по высаживанию клетки непосредственно на
агаризованную среду, но обязательно рядом с фильтром, который в течение не-
скольких дней контактировал с молодой, интенсивно растущей каллусной тканью.
Поскольку эти работы показали, что постоянный контакт клетки через фильтр с
каллусной массой не является обязательным для деления клетки, то было предло-
жено использовать старую культуральную среду для стимуляции одиночной клетки
к делению.
Можно также использовать метод «кормящего слоя». Для этого берут суспензию
клеток того же вида, что и одиночная клетка, или близкого вида. Клеточная
суспензия должна находиться в ранней экспоненциальной фазе ростового цикла. В
1959 году Бергман предложил фильтровать суспензионную культуру (в его экспе-
риментах это были табак и фасоль) стерильно через один слой батиста (ячейки
0,3 * 0,1 мм). В результате получали суспензию, на 90% состоящую из отдельных
клеток. Эту суспензию смешивали с агаризованной питательной средой того же
состава, что использовался при культивировании суспензии (среда содержала
0,6% агара). Смесь разливали тонким слоем (1 мм) в чашки Петри. Агар разделял
клетки, но не препятствовал обмену химическими сигналами между ними, а толщи-
на слоя позволяла смотреть за их поведением под микроскопом.
Индукция делений отдельных клеток возможна при применении очень богатой пи-
тательной среды, например, среды Као и Михайлюка. При этом объем среды, в ко-
торую помещаются клетки, должен был минимальным (микрокапли объемом до 20
мкл) .
Все эти способы культивирования позволяют клетке «ощущать» фактор кондицио-
нирования. Он либо вырабатывается в достаточном количестве клетками «кормяще-
го слоя», «ткани - няньки», либо содержится в суспензии, где ранее культиви-
ровались клетки, либо не теряется в большом объеме среды. Таким образом, фак-
тор, вызывающий деление клеток, вырабатывается самими клетками, но в неболь-
шом количестве. И только увеличивая число клеток, вырабатывающих этот фактор,
чтобы он не рассеивался в больших объемах питательной среды, или же уменьшая
объем среды, в котором будет выращиваться клетка, можно заставить ее делить-
ся .
Культуры гаплоидных клеток
Большой интерес для селекционеров представляют гаплоидные растения. Гаплои-
ды получают двумя способами.
Первый способ классический - отдаленная гибридизация, когда в зиготе отда-
ленного гибрида хромосомы одного из видов элиминируют.
Второй способ основан на методиках культивирования in vitro, где из неопло-
дотворенных половых клеток с редуцированным набором хромосом можно регенери-
ровать целые растения. Обычно они стерильны, так как у них нарушено формиро-
вание мужских и женских гамет. При культивировании in vitro, однако, может
произойти спонтанное удвоение хромосом, или его можно вызвать искусственно,
например, обработав колхицином клетки или растения. Дигаплоиды фертильны и
вполне жизнеспособны.
Гаплоиды и дигаплоиды имеют ряд преимуществ в селекционной работе:
• гаплоидные растения имеют один набор хромосом, характерный для гамет, что
дает селекционерам возможность наблюдать мутации сразу же в ходе осмотра гап-
лоидных растений, поскольку все рецессивные генные мутации в гаплоидных орга-
низмах не маскируются доминантными аллелями;
• если гаплоидные клетки подвергнуть полиплоидизации с помощью колхицина,
то возникнут дигаплоиды, характеризующиеся абсолютной гомозиготностью. Скре-
щивание гомозиготных линий дает, как правило, высокопродуктивное потомство. С
другой стороны, в настоящее время картофель не размножают семенами из-за пе-
строты потомства, а создание с помощью гаплоидов гомозиготных линий устранит
этот недостаток;
• гомозиготные растения используются селекционерами и в других целях: коли-
чественный генетический анализ, изучение взаимодействия генов, изучение гене-
тической изменчивости, определение групп сцепления, установление числа генов,
действующих на количественные признаки, определение локализации полигенов и
т.д.
• гаплоидные растения лишены летальных или сублетальных мутаций, ведущих к
гибели или ослаблению потомства.
Гаплоиды высших растений можно получить из эксплантов, взятых на любой ста-
дии развития гаметофита после редукционного деления клеток спорогенной ткани
пыльника.
Наиболее распространены следующие методы индуцирования гаплоидов:
1. Индуцированный андрогенез в культуре пыльников и пыльцы.
2. Селективная элиминация хромосом в гибридном зародыше. Этот метод чаще
всего используется в селекции злаковых.
3. Псевдогамия - развитие гаплоидного зародыша после оплодотворения инород-
ной пыльцой без оплодотворения яйцеклетки или же развитие изолированной семя-
почки (гиногенез).
В клеточной инженерии чаще применяется первый метод. Впервые гаплоидные
растения были получены в 1964 году индийскими исследователями С. Гуха и С.
Махешвари при культивировании пыльников дурмана. С тех пор таким методом по-
лучены гаплоидные растения более чем у 200 видов, в том числе у пшеницы, яч-
меня, ржи, риса, картофеля и других культур. Для культуры пыльников использу-
ют целые пыльники, стерильно выделенные из бутонов в определенной фазе разви-
тия. Их помещают на твердую питательную среду, либо на поверхность жидкой пи-
тательной среды. В редких случая культивируют бутоны или соцветия.
Получение гаплоидных растений из изолированных пыльников может идти по двум
направлениям: прямая регенерация соматических зародышей и косвенная - через
каллусогенез. В первом случае внутри пыльников из отдельных пыльцевых зерен
формируются проэмбриональные структуры, которые при определенных условиях
культивирования развиваются в эмбриоиды, дающие начало гаплоидным растениям.
Эмбриоиды - зародышеподобные структуры. Во втором - пыльца делится, но клет-
ки, возникшие в результате делений, быстро увеличиваются в размерах и, разры-
вая оболочку пыльцевого зерна, образуют каллус. В результате дальнейшего мор-
фогенеза из этих каллусных клеток регенерируют растения. При этом растения
могут иметь разную степень плоидности - ди, поли, анеуплоидные. Последние
часто стерильны, но после обработки растений колхицином происходит удвоение
числа хромосом, в результате чего можно получить фертильные гомозиготы.
Культура пыльцы представляет собой культивирование микроспор, освобожденных
от соматических тканей пыльника, в жидкой среде. Пыльцу от соматической ткани
пыльника отделяют несколькими способами:
1. Спонтанное высвобождение (пассивный способ) - пыльники определенным об-
разом обрабатываются, инкубируются на жидкой среде, где лопаются, а пыльца
высвобождается и всплывает наверх.
2. Гомогенизация и фильтрация. Пыльники, культивируемые в жидкой среде,
разрушают, надрезая скальпелем и осторожно надавливая, затем фильтруют (поры
фильтра 50 -100 мкм) и центрифугируют. Осадок промывают и суспендируют в жид-
кой среде.
3. Разрезание - разрезают стенку пыльника. Этот метод применяется редко,
так как трудоемок и длителен.
Пыльцевой эмбриогенез обусловлен функциональной и структурной детерминацией
пыльцевого ядра и клеток гаметофита, поэтому в развитии могут принимать уча-
стие: - лишь вегетативные клетки, - лишь генеративные клетки, - оба типа кле-
ток, если вегетативные и генеративные клетки сольются, при этом образуется
диплоидный эмбриоид. Для пасленовых характерен только эмбриогенез, для злако-
вых - образование, как каллусов, так и эмбриоидов. Среди гаплоидов много аль-
биносов (особенно у злаков). Наибольший выход регенерантов-альбиносов в куль-
туре пыльцы, что вызвано, по-видимому, нарушениями развития пыльцы. Причина
не установлена, возможно, это результат мутаций в микроспорах при культивиро-
вании .
При отдаленной гибридизации некоторых видов установлено явление селективной
элиминации хромосом одного из родителей на ранней стадии развития гибридного
зародыша. Это явление хорошо изучено у ячменя. При скрещивании диплоидных яч-
меней Hordeum vulgare (культурный) и Н. bulbosum (многолетний луковичный ди-
кий) на стадии роста зародыша и эндосперма (через 5 дней после оплодотворе-
ния) происходит выпад хромосом дикого вида. Возникает гаплоид с набором хро-
мосом Н. vulgare. Через 15 суток после оплодотворения рост гибридного зароды-
ша на материнском растении прекращается, но при культивировании in vitro из
таких зародышей развиваются проростки. Частота и количество образовавшихся
растений при этом способе очень высоки. Кроме того, растения-альбиносы не об-
разуются. С помощью этого метода были выведены сорта Исток и Одесский-115 -
за 4 года вместо 10 - 12 лет обычной селекции. В Канаде так были получены
сорта Минго и Родео.
Элиминация хромосом встречается и у других родов. Если в качестве опылителя
использовать дикий ячмень, то можно индуцировать гаплоиды у ржи и пшеницы.
Работы по получению гаплоидов в культуре женского гаметофита начались в 50-
е годы. В последнее время интерес к ним возрос. У растений с мужской стериль-
ностью культивирование неоплодотворенных семяпочек является единственной воз-
можностью получения гаплоидов. Женский гаметофит может быть источником полу-
чения гаплоидов и у растений с низким морфогенетическим потенциалом каллусной
ткани, либо если каллусная ткань регенерирует растения-альбиносы. У некоторых
растений, например у ячменя и риса, индукция зеленых растений намного выше
при гиногенезе по сравнению с андрогенезом.
В зависимости от того, какая клетка зародыша даст начало новому организму,
различают партеногенез и апогамию. Партеногенез - развитие яйцеклетки без оп-
лодотворения. При апогамии зародыш развивается из синергиды или антиподы. В
ранних работах наблюдалась пролиферация соматических тканей зародышевого меш-
ка . Впервые гаплоидный каллус из неоплодотворенной семяпочки был получен в
1964 году Тулеком в культуре гингко, но органогенез индуцировать не удалось.
Это случилось лишь в 1976 году, когда Сан Ноум при работе с культурой неопло-
дотворенных завязей ячменя получил нормальные зеленые гаплоидные растения.
Гиногенез может идти двумя путями - через эмбриогенез и через каллусогенез.
В работах Сан Наума с ячменем было показано, что гаплоидные эмбриоиды преиму-
щественно образовывались из антипод, а каллус - из синергид. У риса и эмбио-
генез, и каллусогенез давали синергиды, а антиподы в итоге дегенерировали. У
табака гаплоидный эмбриогенез характерен для яйцеклеток, у скерды - для анти-
под.
НОВЫЕ ЭКСПЕРИМЕНТАЛЬНЫЕ СИСТЕМЫ
ДЛЯ ИЗУЧЕНИЯ СИНТЕЗА ВТОРИЧНЫХ
МЕТАБОЛИТОВ С ИСПОЛЬЗОВАНИЕМ
КУЛЬТУРЫ ТКАНЕЙ РАСТЕНИЙ
Иммобилизация растительных клеток:
необходимость, основные методы
Культуры клеток и тканей растений считаются потенциальным источником специ-
фических вторичных метаболитов, к которым относятся такие соединения, как ал-
калоиды, стероиды, масла и пигменты. Многие из этих веществ все еще получают
путем экстракции из растений. Не ко всем видам растений в настоящее время
применимы методы микробиологической промышленности. За исключением некоторых
видов растений, суспензионные и каллусные культуры клеток синтезируют вторич-
ные метаболиты в меньших количествах, чем целые растения. При этом рост био-
массы в ферментере может быть значительным.
Новым подходом, направленным на увеличение выхода вторичных метаболитов,
является иммобилизация клеток и тканей растений. Первая удачная попытка за-
фиксировать целые клетки была осуществлена в 1966 г. Мосбахом. Он зафиксиро-
вал клетки лишайника23 Umbilicaria pustulata в полиакриламидном геле. На сле-
дующий год ван Вецель выращивал клетки эмбрионов животных, иммобилизованных
на микрошариках ДЭАЭ (диэтиламиноэтил сефадекса, на основе декстрана). После
23 Лишайник не растение, а симбиоз микроскопических грибов, Зеленых микроводорослей и/или
цианобактерий.
этого клетки были иммобилизованы на разных субстратах. В основном это были
клетки микроорганизмов.
Методы иммобилизации клеток делят на 4 категории:
1. Иммобилизация клеток или субклеточных органелл в инертном субстрате. На-
пример, rktnrb Catharanthus roseus, Digitalis lanata в альгинатных, агарозных
шариках, в желатине и т.д. Метод предполагает обволакивание клеток одной из
различных цементирующих сред - альгинат, агар, коллаген, полиакриламид.
2. Адсорбция клеток на инертном субстрате. Клетки прилипают к заряженным
шарикам из альгината, полистирола, полиакриламида. Метод применялся в экспе-
риментах с животными клетками, а также клетками Saccharomyces uvarum, S.
cerevisiae, Candida tropicalis, E. coli.
3. Адсорбция клеток на инертном субстрате с помощью биологических макромо-
лекул (таких, как лектин). Применяется редко, есть сведения об экспериментах
с различными линиями клеток человека, эритроцитами крови барана, адсорбиро-
ванными на покрытой белком агарозе.
4. Ковалентное связывание с другим инертным носителем типа КМЦ. Очень редко
применяется, известна удачная иммобилизация для Micrococcus luteus. В основ-
ном проводились эксперименты по иммобилизации клеток животных и микроорганиз-
мов . В последнее время интерес к иммобилизации клеток растений значительно
возрос, это связано с тем, что иммобилизованные клетки имеют определенные
преимущества перед каллусными и суспензионными культурами при использовании
их для получения вторичных метаболитов.
Физиологические основы
преимущества иммобилизованных
растительных клеток перед
традиционными способами
культивирования
В литературе имеются многочисленные данные о том, что существует положи-
тельная корреляция между накоплением вторичных метаболитов и степенью диффе-
ренцировки в культуре клеток. Кроме того, лигнин, например, откладывается в
трахеидах и сосудистых элементах ксилемы только после завершения процессов
дифференцировки, что было показано в экспериментах как in vivo, так и in
vitro. Полученные данные свидетельствуют о том, что дифференциация и накопле-
ние вторичных продуктов обмена веществ происходит в конце клеточного цикла.
При снижении роста процессы дифференциации ускоряются.
Изучение содержания алкалоидов, накапливаемых многими растениями in vitro,
показало, что компактные, медленно растущие культуры клеток содержат алкалои-
ды в больших количествах, чем рыхлые, быстро растущие культуры. Организация
клеток необходима для их нормального метаболизма. Наличие организованности в
ткани и ее последующее действие на различные физические и химические градиен-
ты - четкие показатели, по которым различаются высоко- и низкопродуктивные
культуры. Очевидно, что иммобилизация клеток обеспечивает условия, приводящие
к дифференциации, упорядочивает организацию клеток и способствует тем самым
высокому выходу вторичных метаболитов.
Иммобилизованные клетки имеют ряд преимуществ:
1. Клетки, иммобилизованные в или на инертном субстрате, образуют биомассу
гораздо медленнее, чем растущие в жидких суспензионных культурах.
Какова же связь между ростом и метаболизмом? При чем здесь клеточная орга-
низация и дифференцировка? Предполагают, что эта взаимосвязь обусловлена дву-
мя типами механизмов. Первый механизм основан на том, что рост определяет
степень агрегации клеток, оказывая косвенное влияние на синтез вторичных ме-
таболитов. Организация в данном случае является результатом агрегации клеток,
а достаточная степень агрегации может быть получена только в медленно расту-
щих культурах. Второй механизм связан с кинетикой скорости роста и предпола-
гает, что «первичный» и «вторичный» пути метаболизма по-разному конкурируют
за предшественники в быстро и медленно растущих клетках. Если условия среды
благоприятны для быстрого роста, то в первую очередь синтезируются первичные
метаболиты. Если быстрый рост блокирован, то начинается синтез вторичных ме-
таболитов. Таким образом, низкая скорость роста иммобилизованных клеток спо-
собствует высокому выходу метаболитов.
2. Кроме медленного роста иммобилизация клеток позволяет им расти в тесном
физическом контакте друг другом, что благоприятно отражается и на химических
контактах.
В растении любая клетка окружена другими клетками, но ее положение меняется
в ходе онтогенеза в результате деления как этой, так и окружающих клеток. От
положения клетки в растении зависит степень и тип дифференциации этой клетки.
Следовательно, физическое окружение клетки влияет на ее метаболизм. Каким об-
разом? Регуляция синтеза вторичных метаболитов находится как под генетиче-
ским, так и под эпигенетическим (внеядерным) контролем, то есть любые измене-
ния в цитоплазме могут привести к количественным и качественным изменениям в
образовании вторичных метаболитов. В свою очередь, цитоплазма представляет
собой динамическую систему, находящуюся под влиянием окружающей среды.
Из внешних условий на метаболизм существенное влияние оказывают 2 важных
фактора: концентрация кислорода и углекислого газа, а также уровень освеще-
ния . Свет играет роль и в процессе фотосинтеза, и в таких физиологических
процессах, как деление клеток, ориентация микрофибрилл, активация ферментов.
Интенсивность и длина световой волны определяется положением клетки в массе
других клеток, то есть зависят от степени организованности ткани. В организо-
ванной структуре существуют центробежные градиенты концентрации 02 и С02, ко-
торые играют исключительно важную роль в процессе дифференциации.
Таким образом, вторичный метаболизм в крупных агрегатах клеток с небольшим
отношением площади к объему (S/V) отличается от такового изолированных клеток
и мелких групп клеток в результате действия градиентов концентрации газов.
Аналогично действуют градиенты регуляторов роста, питательных веществ, меха-
нического давления. Условия окружения у диспергированных клеток и клеток в
виде агрегатов различны, поэтому пути метаболизма у них также различаются.
3. Регулировать выход вторичных метаболитов можно также, изменяя химический
состав окружающей среды.
Изменение состава среды для каллусной и суспензионной культуры сопровожда-
ется определенными физическим манипуляциями с клетками, что может привести к
повреждению или загрязнению культур. Эти трудности можно преодолеть, исполь-
зуя циркуляцию больших объемов питательной среды вокруг физически неподвижных
клеток, что позволяет осуществлять последовательные химические воздействия.
4. В некоторых случаях возникают проблемы с выделением идиолитов.
При использовании иммобилизованных клеток относительно легко осуществляется
обработка их химическим веществами, индуцирующими высвобождение требуемых
продуктов. Это также снижает ингибирование по типу обратной связи, которое
ограничивает синтез веществ вследствие накопления их внутри клетки. Культиви-
руемые клетки некоторых растений, например, Capsicum frutescens выделяют вто-
ричные метаболиты в окружающую среду, а система иммобилизованных клеток по-
зволяет отбирать продукты без повреждения культур. Таким образом, иммобилиза-
ция клеток способствует легкой изоляции идиолитов.
Системы культивирования
иммобилизованных клеток
Существует 2 типа систем культивирования иммобилизованных клеток:
1. Система культуры с плоской основой, клетки выращиваются в горизонтально
расположенном сосуде.
2. Система колоночной культуры, где клетки выращиваются в вертикальном со-
суде.
В обеих системах жидкая среда циркулирует вокруг физически неподвижных кле-
ток .
Система культуры с плоской основой (рис. 13)
Рис. 13. Система культуры с плоской основой
Питательная среда капает под действием силы тяжести из цилиндрического со-
суда объемом 70 мл (1) в стеклянный сосуд для культивирования (3) объемом 350
мл, где находятся клетки (40 - 50 г сырой массы), посаженные на субстрат -
подстилку из нетоксичной полипропиленовой ткани. Питательная среда проникает
сквозь ткань под действием капиллярных сил, снабжая клетки. После этого ис-
пользованная питательная среда откачивается из сосуда для культивирования с
помощью перистальтического насоса (2) обратно в резервуар и используется по-
вторно .
Исследования, проведенные с этой системой, показали, что клетки Solanum
niger, культивируемые на плоской основе (среда Мурасиге-Скуга с добавлением
2,4-Д и кинетина) способны потреблять питательные вещества и быстро реагируют
на недостаток ортофосфата. Увеличение сырой массы идет гораздо медленнее, чем
в суспензионных культурах. Количество жизнеспособных клеток такое же и дости-
гает 70 - 80%. Количество алкалоидов через 7 суток культивирования достигает
12 мг/г сухой массы, в суспензии же через 18 дней культивирования оно состав-
ляет 10 мг/г сухой массы. В местах, где питательная среда капает прямо на
клетки, через 3-4 дня культивируемая ткань становится темной и отличается
от остальной, которая у S. niger окрашена в светло-бежевый цвет. Клетки в зо-
нах капания часто бывают более компактны, содержат больше алкалоидов. Если
клетки изолировать из зон капания и поместить в чашки Петри с агаром, содер-
жание алкалоидов падает, при возвращении в прежние условия культивирования
вновь аккумулируются высокие количества метаболитов.
Кроме того, в клетки вводились предшественники вторичных метаболитов. Отме-
чено, что синтез капсацина клетками Capsicum frutencens увеличивается в тыся-
чи раз при добавлении в среду 5 мл изокаприновой кислоты. При этом капсацин
не накапливается внутри клеток, а секретируется в питательную среду. Установ-
лено, что клетки, иммобилизованные на плоской основе, способны потреблять пи-
тательные вещества из среды, в том числе и кислород, имеют низкую скорость
роста, каллусоподобное расположение, способны к тесному межклеточному контак-
ту. В целом, они имеют более высокий уровень синтеза вторичных метаболитов.
Несмотря на эти преимущества, промышленное культивирование имеет существен-
ный недостаток: горизонтальная конструкция аппарата создает неудобства при
работе и требует большой площади. Эти недостатки устраняются в другой систе-
ме. Система колоночной культуры (рис. 14)
В такой системе возрастает число клеток, на которые капает среда, что уве-
личивает "зону капания", где происходит накопление больших количеств вторич-
ных метаболитов.
Сосуд для культивирования из горизонтального превращается в вертикальный. В
сосуде с питательной средой (1) 50 мл жидкой среды, которая под действием си-
лы тяжести капает в вертикальную стеклянную колонку, содержащую иммобилизо-
ванные клетки (3). Среду собирают со дна колонки и вновь используют в цикле,
перекачивая с помощью перистальтического насоса в резервуар со средой.
Как разместить клетки внутри колонки, чтобы капающая среда не спрессовала
их в плотную массу на дне колонки? Закрепить в нейлоновую сеть, корзиночки,
используя инертный, проницаемый и стабильный гель. Между корзиночками образу-
ется воздушное пространство, сеточка структурирует гель, а клетки могут про-
растать через корзиночки, контактируя друг с другом.
Подходящим материалом для размещения клеток оказались нейлоновые мочалки.
Материал нетоксичен, легко режется, выдерживает автоклавирование. В качестве
субстратов для погружения клеток используют агар и альгинат кальция.
Рис. 14. Система культуры в колонке
Агар традиционно используется в работе с культурами клеток и тканей. 2%
(масса к объему) раствор агара в дистиллированной воде автоклавируют при 1
атмосфере в течение 20 минут и охлаждают на водяной бане до 35 - 40°С. Клетки
суспензионной культуры в стационарной фазе роста пропускают через сито с диа-
метром пор 1 мм и смешивают в пропорции 1:1 (V:V) с незастывшим агаром. Сте-
рильные кусочки мочалки 2-3 * 1 * 1 см с помощью стерильного пинцета опускают
в смесь клеток с агаром, а когда агар начинает застывать, помещают в стериль-
ные колонки с внутренним диаметром 15 * 2,5 см. В каждую колонку помещают
примерно 10 сеточек, таким образом, на колонку приходится 5 - 7 г сырой массы
клеток.
Аналогично иммобилизуют клетки с использованием альгината кальция. В этом
инертном субстрате, например, успешно были иммобилизованы А. Альферманном с
сотрудниками клетки наперстянки шерстистой (Digitalis lanata). 2% раствор
альгината натрия автоклавируют, охлаждают до комнатной температуры, смешивают
с клетками и переносят в стерильный раствор 0,05 М СаС1г в дистиллированной
воде на 10 минут, чтобы образовывающийся альгинат кальция затвердел внутри и
вокруг кусочков мочалки, обволакивая клетки. Молекулы альгината поперечно
сшиваются катионами кальция, при этом происходит его стабилизация. Затвердев-
ший материал трижды промывают в стерильной дистиллированной воде и вносят в
стеклянные колонки.
Как показали дальнейшие исследования, рост клеток в альгинате был лучшим,
чем в агаре, что связано, вероятно, с негативным действием расплавленного
агара, температура которого составляет около 40°С, на клетки в процессе иммо-
билизации. Поэтому эксперименты по изменению условий окружающей среды прово-
дились в колонках, где клетки Datura innoxia и Capsicum frutencens были иммо-
билизованы в альгинате кальция.
Скорость потребления ортофосфата, нитратов, аммония и сахарозы в клетках
колоночной культуры ниже, чем в горизонтальной системе. Жизнеспособность кле-
ток, по сравнению с суспензионными культурами, заметно не снижается (60 -
65%), содержание алкалоидов через 8-10 суток составляет 12 - 13 мг/г сухой
массы клеток, алкалоиды в питательную среду не выделяются, а pH среды после 8
суток культивирования снижается на 0,4 единицы, до 5,4. Определение скорости
потребления кислорода показывает предположительную нехватку его на 4-8 су-
тки культивирования.
Культуры, освещаемые люминесцентными лампами, потребляют питательные веще-
ства интенсивнее, рост клеток лучше также в освещенных культурах. В свето-
культуре повышается жизнеспособность клеток и содержание алкалоидов. Так как
клетки не зеленеют, для поддержания нормального клеточного метаболизма необ-
ходимы и другие световые эффекты.
Добавление предшественников не всегда однозначно влияет на рост, потребле-
ние питательных веществ и синтез метаболитов. Например, действие орнитина на
клетки Datura innoxia скорее отрицательно, а изокаприновой кислоты на клетки
Capsicum frutencens - скорее положительно, так как сырая масса увеличивается,
но выход капсомицина остается прежним. В обоих случаях синтез метаболитов не
ингибируется альгинатным гелем.
Полученные результаты свидетельствуют о сохранении жизнеспособности клеток
многих видов растений при иммобилизации. Иммобилизованные клетки, полученные
из рыхлых, быстро растущих суспензионных культур, замедляют рост и приобрета-
ют сходство с клетками каллусной культуры. Эти клетки более взаимосвязаны,
чем в жидкой культуре, что ведет к возникновению определенного физического и
химического градиентов.
Иммобилизованные клетки аккумулируют больше алкалоидов, чем в жидкой куль-
туре, что ведет к возникновению определенных физических и химических градиен-
тов. Это способствует переходу клеток в стационарную фазу, что приводит к ус-
корению образования алкалоидов и других веществ вторичного происхождения.
Общие рекомендации к культивированию клеток на основе полученных результа-
тов .
1. Клетки должны выращиваться физически стационарно, в тесном контакте друг
с другом, чтобы стимулировалось развитие физических и химических градиентов и
обеспечивалась частичная дифференцировка культуры. Некоторые виды растений
необходимо культивировать при освещении и индуцировать образование хлоропла-
стов, чтобы обеспечить уровень метаболизма, близкий к происходящему в клетках
интактного растения.
2. Состав питательной среды и уровень кислорода необходимо регулировать для
замедления роста культуры. Рекомендуется использовать регуляторы роста для
имитации процессов дифференциации, происходящих in vivo.
3. Клетки необходимо снабжать предшественниками, но в низких концентрациях.
Предшественники должны быть максимально близки в цепочке превращений к исход-
ному продукту.
4. Желательно использовать клетки, которые секретируют необходимые метабо-
литы в питательную среду или клетки, у которых такую секрецию можно индуциро-
вать .
ПРОТОПЛАСТЫ РАСТИТЕЛЬНЫХ
КЛЕТОК КАК ОБЪЕКТ
БИОЛОГИЧЕСКОГО КОНСТРУИРОВАНИЯ
Применение изолированных
протопластов
Протопласты являются уникальной моделью для изучения фундаментальных физио-
логических проблем у растений. Они незаменимы при изучении состава, структуры
и функционирования плазмалеммы в норме и при воздействии на нее гормонами,
ингибиторами, фитототоксинами, а также при взаимодействии самих протопластов
в популяции. Кроме того, протопласты могут использоваться для определения со-
става и архитектоники первичной клеточной стенки и изучения механизма ее ре-
парации после разрушения.
На схеме (рис. 15) представлены основные направления физиологических ис-
следований с использованием культуры изолированных протопластов.
Таким образом, изолированные протопласты имеют ряд областей применения, как
теоретического, так и прикладного характера:
1. Изучение химии и структуры клеточной стенки (и при разрушении, и при
синтезе «de novo»).
2. Изучение свойств плазмалеммы, трансмембранных перемещений.
3. «Мягкое» выделение органелл.
4. Наблюдение за закономерностями дифференцировки клеток при слиянии прото-
пластов , отслеживание взаимодействия ядра и цитоплазмы в полученной гибридной
клетке, изучение соматических гибридов.
5. Введение чужих органелл.
6. Введение чужеродных генов в растительную клетку (трансгенез).
Рис. 15 (ниже). Изолированные протопласты - объект и модель в
физиологических исследованиях (по Р.Г. Бутенко, 1981)
Изучение состава и структуры клеточной
стенки методом разрушения
специфическими ферментами
Способы получения и
культивирования протопластов
Получение протопластов
Протопласт - клетка, лишенная целлюлозной оболочки, окруженная цитоплазма-
тической мембраной, сохраняющая все свойства, присущие растительной клетке.
Впервые протопласты в 1892 г. выделил Дж. Клеркер, который использовал меха-
нический способ. При этом способе у плазмолированных клеток разрезают клеточ-
ную стенку, протопласты выходят в среду. В настоящее время метод претерпел
модификации, улучшен, но имеет ряд ограничений:
- невысокая производительность,
- можно использовать ткани только с экстенсивным плазмолизом,
- трудоемкость и длительность.
Другой метод выделения протопластов
ментов. В 1952 году Салтон с помощью
- энзиматический, с использованием фер-
фермента лизоцима впервые разрушил кле-
точную стенку бактерий. В 1960 году Коккинг обработал кончики корней томата
гидролитическим ферментом из культуральной жидкости плесневых грибов
(Myrothecium verrucaria) и впервые получил изолированные протопласты высших
растений энзиматическим способом.
Преимущества энзиматического метода по сравнению с механическим:
- одновременно выделяется большое количество протопластов (до 10 млн. из
грамма ткани или клеток),
- клетки не подвергаются сильному осмотическому стрессу,
- клетки не повреждаются,
- метод сравнительно быстрый.
Для удаления клеточной стенки используют ферменты трех типов: целлюлазы,
гемицеллюлазы и пектиназы. Комбинация ферментов и их соотношение специфично
для каждого типа клеток.
Выделение протопластов проводят в три этапа:
- обработка ферментами,
- выделение протопластов из клеточных стенок,
- отделение интактных протопластов от клеточных осколков.
Стандартная методика протопластов (по Такебе) из тканей листа Nicotiana
tabacum:
Зрелый, сформировавшийся лист отделяют от взрослого растения в возрасте 60
- 80 дней, окунают в 70% этанол, а затем помещают на 15 - 20 минут в 10% рас-
твор гипохлорита кальция и многократно промывают дистиллированной водой. С
помощью пинцета нижний эпидермис снимают, очищенные от эпидермиса листья раз-
резают скальпелем на небольшие кусочки площадью 4 кв. см. Для лучшего снятия
эпидермиса листья должны немного подвянуть, можно также ограничить снабжение
водой перед срезанием листьев.
Далее ткань обрабатывают последовательно или одновременно пектиназой, вызы-
вающей мацерацию, и целлюлазой, разрушающей клеточные стенки. Оптимальная
концентрация ферментов, как и время обработки, индивидуальны для разных тка-
ней. Протопласты должны находиться в растворе ферментов минимальное количест-
во времени, после чего следует тщательная промывка. Ферменты стерилизуют че-
рез бактериальные фильтры.
Регуляция водообмена клетки связана с наличием клеточной стенки. Когда про-
топласт "голый", один из компонентов регуляции водообмена теряется, поэтому
важное значение приобретают осмотические свойства среды выделения и культиви-
рования. Среда должна быть немного гипертонической, чтобы протопласты находи-
лись в слегка плазмолизированном состоянии. Эти условия тормозят метаболизм и
регенерацию клеточной стенки. В качестве осмотических стабилизаторов исполь-
зуют сахара (глюкозу, маннит, сорбит, ксилозу), ионные осмотики (СаС1г, КС1)
в концентрации 0,3 - 0,8 моль/литр. Концентрации подбираются индивидуально
для каждого растительного объекта.
Удобнее обрабатывать ткани ферментами в чашке Петри, которую держат под уг-
лом 15°. Смесь ферментов с протопластами переносят в центрифужные пробирки.
Отделить протопласты от ферментативной смеси можно двумя способами: либо
фильтрация с центрифугированием, либо флотация.
При фильтрации смесь пропускают через фильтры с размерами пор 40 мкм. На
фильтре при этом остаются комки клеток и их большие осколки. При дальнейшем
центрифугировании оседают протопласты, осколки остаются в супернатанте. При
повторном центрифугировании идет отмывка от фермента, после чего протопласты
переносятся в среду для культивирования.
Метод флотации предложен О. Гамборгом с сотрудниками в 1981 году, и предна-
значается для ослабленных протопластов. Он основан на том, что протопласты
имеют более низкую плотность, чем органеллы или остатки клеточных стенок. К
исходной смеси добавляют раствор сахарозы и центрифугируют при скорости от 40
- 80 до 350 д. Чистые протопласты плавают, осколки оседают на дно.
Протопласты можно выделять также из суспензионных и клеточных культур. Луч-
ше всего - в поздней стадии логарифмического роста, когда клеточные стенки
легче поддаются разрушению, протопласты наиболее жизнеспособны.
Далее протопласты культивируют в тех же условиях, что и клетки. Состав со-
лей может быть несколько изменен. Среда состоит из осмотического стабилизато-
ра, неорганических соединений, источника углерода, азота, витаминов, фитогор-
монов. Условия культивирования: pH среды 5,4 - 5,8, температура 22 - 28°С,
невысокая освещенность (не более 2000 лк).
Способы культивирования протопластов
Существуют два способа культивирования протопластов: метод жидких капель и
метод платирования.
В первом случае суспензию протопластов в виде капель помещают на пластико-
вые чашки Петри. Вариацией этого способа является культивирование единичных
изолированных протопластов в микрокаплях объемом 1 мкл, предложенное Ю. Гле-
бой в 1978 г.
Во втором - суспензию протопластов наливают в пластиковые чашки Петри, до-
бавляют равный объем той же среды с 1% агаром при температуре не выше 45°С.
После остывания чашки Петри переворачивают и культивируют при 28°С. В данном
случае протопласты фиксированы в одном положении и физически отделены друг от
друга. Это дает возможность наблюдать за развитием интактного протопласта:
формированием клеточной стенки, делением, ростом и развитием растения.
Вариантом этой техники является использование кормящих протопластов или
клеток, подвергнутых воздействию рентгеновского или у-и3лУчения/ что блокиру-
ет их способность к делению. Такие протопласты или клетки смешивают с жизне-
способными протопластами и они поддерживают и стимулируют их рост.
Сразу после удаления раствора фермента начинается образование клеточной
стенки. Труднее добиться деления клеток и регенерации растений. Регенерация
растений осуществляется либо через эмбриогенез, либо через развитие каллуса с
дальнейшей индукцией морфогенеза. Добиваются этого добавлением в среду аукси-
нов или сочетания ауксинов с цитокининами.
На пролиферацию клеток, возникших из протопластов, влияет 4 фактора:
- видовая специфичность и физиологическое состояние исходной ткани расте-
ния,
- способ и условия выделения протопластов,
- плотность высева протопластов,
- состав питательной среды.
Слияние протопластов -
парасексуальная гибридизация
Изолированные протопласты, еще не образовавшие клеточной стенки, могут сли-
ваться между собой. Слияние протопластов - своеобразный метод гибридизации,
так называемая парасексуальная, или соматическая гибридизация. В отличие от
обычной, где сливаются половые клетки (гаметы), в качестве родительских при
парасексуальной гибридизации используются диплоидные клетки растений. Вне-
ядерные генетические детерминанты у большинства высших растений наследуются в
половом процессе строго одноядерно и матерински. Техника парасексуальной гиб-
ридизации может позволить:
- скрещивание филогенетически отдаленных видов растений (организмов),
- получение асимметричных гибридов, несущих генный набор одного из родите-
лей наряду с несколькими хромосомами, органеллами или цитоплазмой другого,
- слияние трех и более клеток,
- получение гибридов, представляющих сумму генотипов родителей,
- перевод мутаций в гетерозиготное состояние, что позволяет получать жизне-
способные формы при слиянии протопластов, поскольку мутагенез довольно часто
дает дефектное по морфогенезу растение,
- получение растений, гетерозиготных по внеядерным генам и др.
Парасексуальная гибридизация важна для анализа как ядерных генов, так и
внеядерных геномов. Цитоплазматический геном кодирует ряд признаков - ско-
рость фотосинтеза, устойчивость к патогенам, абиотическим факторам и т. д.
Наличие косегрегация генов (признаки, контролирующие внеядерный геном, сегре-
гируют совместно) свидетельствует о физическом сцеплении генов.
Слияние бывает спонтанным (чаще у протопластов из молодых тканей или сус-
пензионных культур) и индуцированным. Для стимуляции слияния протопластов
предложен ряд методов, как физических, так и химических.
При физическом способе слияния протопластов, разработанном Г. Циммерманом с
сотрудниками в 1981 году, протопласты помещают в камеру с неоднородным элек-
трополем. На электродах образуются агрегаты из 2-3 протопластов, либо це-
почки из 5-6 протопластов между электродами. Дополнительный единичный им-
пульс постоянного тока приводит к образованию пор в сильно сжатых мембранах,
происходит перетекание цитоплазмы, так как переменный ток удерживает прото-
пласты вместе некоторое время, и протопласты в таких агрегатах сливаются.
Затухающий ток приводит к возвращению сферической формы у слившихся протопла-
стов .
В основе слияния лежит различное действие постоянного и переменного элек-
трического тока на плазмалемму. Постоянное эклектическое поле сжимает мембра-
ны, ведя к их локальному разрушению, а переменное электрополе вызывает лате-
ральную диффузию белков мембраны, образуя свободные от гликопротеидов липид-
ные области, где противоположные мембраны могут установить контакт.
Чаще для индукции слияния протопластов используют методику "ПЭГ - высокие
значения pH - высокая концентрация Са2+", которая дает до 50% слившихся про-
топластов (pH 9-11, концентрация Саг+ 100 - 300 ммоль/л) . В присутствии по-
лиэтиленгликоля наблюдается сильная адгезия протопластов, после удаления по-
лиэтиленгликоля и добавления кальция - их слияние. Предполагают, что pH и ио-
ны кальция увеличивают текучесть мембран, что связано с их жидкостно-
мозаичной структурой.
При слиянии протопластов различных растений, например, А и В, могут с рав-
ной вероятностью образовываться комбинации АА, ВВ и АВ. Желаемый продукт
слияния - АВ, поэтому разрабатываются способы увеличения частоты слияния
именно такого типа и избирательного выделения только продукта слияния АВ.
Один из таких методов заключается в следующем. Поверхность протопласта обычно
несет отрицательный заряд. Путем обработки ее фосфолипидом, несущим положи-
тельный заряд, можно временно придать поверхности протопласта положительный
заряд. Если теперь протопласты А, имеющие положительный заряд, смешать с не-
обработанными протопластами В, несущими отрицательный заряд, то будут в ос-
новном образовываться комбинации АВ в результате притяжения разноименных за-
рядов .
Разработаны также методы маркирования протопластов того или иного растения
с помощью разных флуоресцентных красителей. Если обработать протопласты одно-
го растения флуоресцеинизотиоцианатом (FITC), а протопласты другого растения
родаминизотиоцианатом (RITC), то можно, не изменяя активности клеток, поме-
тить их желто-зеленой (FITC) или красной (RITC) флуоресценцией. Гибриды, об-
разовавшиеся путем слияния разных типов клеток, будут иметь оба цвета флюо-
ресценции - желто-зеленый и красный.
Протопласты могут сливаться как попарно, так и в большем количестве. Много-
ядерные продукты слияния, как правило, разрушаются. Первое сообщение о полу-
чении соматических гибридов на уровне растений появилось в 1972 году (Карлсон
и коллеги), в нашей стране подобное осуществили в лаборатории Бутенко Р.Г. в
1975 году.
Судьба геномов (ядерного и цитоплазматического) после слияния протопластов
может быть различной:
1. Ядерные генетические детерминанты наследуются как дву-, так и однороди-
тельски. В последнем случае ядра не сливаются и впоследствии сегрегируют в
процессе клеточных делений.
2. Внеядерные генетические детерминанты наследуются двуродительски. При
этом в межвидовых комбинациях прослеживается тенденция к соматическому выщеп-
лению и элиминации одного из родительских цитоплазматических геномов.
3. Возникновение гибридных клеток и растений в результате слияния более чем
двух родительских клеток.
Таким образом, слияние протопластов приводит либо к образованию гибрида,
либо к образованию цибрида. Соматический гибрид - продукт слияния и цитоплаз-
мы, и ядра обоих протопластов. Цибрид (цитоплазматический гибрид) - растение-
регенерант, содержащее цитоплазму обоих родителей и ядро одного из них. Циб-
риды получают, облучая перед слиянием один из протопластов у-лУ431411 Для раз-
рушения ядра. Скрининг таких клеток проводится по генам - маркерам ядерного и
цитоплазматических (митохондриального и хлоропластного) геномов. Есть указа-
ния на рекомбинацию ДНК митохондрий и хлоропластов в гибридных клетках (Ю.Ю.
Глеба, К.М. Сытник, 1984).
При слиянии могут образовываться и так называемые асимметричные гибриды -
продукты слияния, имеющие полный хромосомный набор одного из партнеров и
часть хромосом другого партнера. Такие гибриды часто возникают при слиянии
клеток организмов, филогенетически удаленных друг от друга. В этом случае
вследствие неправильных делений клетки, обусловленных некоординированным по-
ведением двух разнородных наборов хромосом, в ряду поколений теряются частич-
но или полностью хромосомы одного из родителей. Асимметричные гибриды бывают
устойчивее, плодовитее и жизнеспособнее, чем симметричные, несущие полные на-
боры генов родительских клеток. В целях асимметричной гибридизации возможна
избирательная обработка клеток одного из родителей для разрушения части его
хромосом. Возможен прицельный перенос в клетку нужной хромосомы.
Гибриды могут быть получены путем слияния трех и более родительских клеток.
Из таких гибридных клеток могут быть выращены растения - регенеранты.
Виды соматических гибридов
Впервые зрелый межвидовой гибрид, полученный в результате парасексуальной
гибридизации протопластов 2 сортов табака (Nicotiana glauca, с 24 хромосомами
и N.langsdorfii с 18 хромосомами), описан Карлсоном в 1972 г. Каллус амфипло-
идного гибрида мог расти на безгормональной среде. Гибридное растение цвело.
С тех пор были получены жизнеспособные внутривидовые, межвидовые, межродовые
гибриды.
Осуществлено слияние протопластов культурного картофеля сорта Приекульский
ранний (Solanum tuberosum) с протопластами дикого картофеля (S. chacoense).
Известно, что у дикого картофеля клубни очень мелкие. Вместе с тем, растение
устойчиво ко многим заболеваниям. Картофель сорта Приекульский ранний образу-
ет крупные клубни, но растения этого сорта восприимчивы к болезням. Размеры
протопластов у этих растений разные. Соматические гибриды по форме листьев и
кустов, размеру клубней занимали промежуточное положение между культурными и
дикими растениями. Вместе с тем гибрид, полученный в результате соматической
гибридизации, оказался устойчивым к вирусу «У», чем отличался от полового
гибрида.
Первая попытка по созданию межродовых гибридов принадлежит Г. Мельхерсу,
создавшему в 1978 году гибрид картофель + томат, так называемый томатофель.
Гибрид был стерилен, морфологически аномален: толстые корни, отсутствие ти-
пичных столонов, махровые цветки. Было еще несколько попыток получения таких
гибридов, но все растения стерильны. Эти эксперименты показали ограниченность
применения парасексуальной гибридизации для прикладной селекции. Японскими
исследователями (X. Кисака с соавт., 1997) путем электрослияния протопластов
ячменя и риса был получен межродовой соматический гибрид. Протопласты риса
получали из суспензионной культуры, а протопласты ячменя были изолированы из
молодых листьев. Часть полученных каллусов сформировали зеленые участки и по-
беги. Только один побег сформировал корни, и это растение было успешно пере-
несено в почву. По морфологии было близко к растениям риса. Цитологический
анализ показал, что растение имело и маленькие хромосомы от риса, и большие
от ячменя. Были проанализированы также митохондриальная и хлоропластная ДНК.
Растение содержало новые последовательности и в митохондриальной, и в хлоро-
пластной ДНК, которые не обнаруживались ни в одном из родителей.
Ю. Ю. Глебой с сотрудниками проводились многочисленные эксперименты по соз-
данию межтрибных гибридов. Триба - таксономическая единица между семейством
и родом. Получены удачные гибриды между Arabidopsis и Brassica (турнепс)
Arabidobrassica. У гибридных линий индуцировали морфогенез корней и растения.
Растения генетически и морфологически униформны, не цвели. На вид - уродливы,
очень много тератомоподобных образований, похожих на цветки.
Была осуществлена гибридизация 2-х родов пасленовых Datura innoxia + Atropa
belladonna. Удалось регенерировать растения. Во всех случаях выявлены хромо-
сомы обоих родительских видов. Амфиплоиды оказались неспособны к стеблевому
морфогенезу, в линиях с полиплоидным и анеуплоидным наборами хромосом получа-
ли аномальные стебли. Регенерировавшие растения были стерильны, похожи на
дурман, но содержали небольшое количество хромосом красавки.
В других экспериментах сливали протопласты красавки с каллусными клетками
китайского табака. Получили 12 клонов. В клетках всех клонов обнаружили хро-
мосомные типы обоих родителей, через год только у двух клонов происходила
полная элиминация хромосом красавки.
Морковь + сныть: из образовавшейся каллусной ткани через полгода регенери-
ровали аномальные растения. Одно из них цвело, но у цветка отсутствовали
пыльники и пестик.
Интересные эксперименты были проведены в этой же лаборатории по гибридиза-
ции хлорофиллдефектного табака с красавкой. После слияния получили 40 фото-
синтезирующих колоний, из них 4 клеточных линии дали нормальные растения кра-
савки, 4 - аномальные по морфологии гибриды табак + красавка, остальные - зе-
леные, иногда пестролистные растения, идентичные табаку, которые цвели, дава-
ли семена. Они содержали хромосомы табака и пластиды красавки. Это были пер-
вые фертильные межтрибные гибриды.
Первые работы по получению межсемейственных гибридов проведены К.Као и
В.Веттером в 1976-77 гг. (соя + табак). Позднее в лаборатории Ю.Ю.Глебы про-
вели аналогичные эксперименты пасленовые + бобовые и лилейные (горошек + та-
бак и лук + табак). И.Ф.Каневскому удалось индуцировать морфогенез стеблепо-
добных тератом в культуре межсемейственных гибридов N.tabacum + Vicia faba.
Практически во всех случаях наблюдалась видоспецифичная элиминация хромосом
одного из родителей. В культурах межсемейственных гибридов наблюдалось много
многоядерных клеток, клеток с мини ядрами, в метафазах делений встречались
гигантские хромосомы. Отмечена асинхронность в расхождении родительских хро-
мосом в анафазе. Морфогенез у такого материала отмечен не был.
Для отдаленных гибридов характерно:
1. Относительная стабильность гибридного состояния, при котором не наблюда-
ется полной элиминации генетического материала одного из родителей.
2. Генетические перестройки (реконструкция и частичная элиминация хромо-
сом) .
3. Генетическая разнокачественность клонов гибридных клеток.
4. Ограниченная морфогенетическая способность.
Изучение межцарственных гибридов клеток "животное + растение24" показало,
что на этапе слияния видоспецифичность не проявляется, поэтому можно слить
даже животную и растительную клетки. На более поздних этапах онтогенеза эти
различия сказываются, что было установлено в экспериментах по слиянию прото-
пластов арабидопсиса и табака с лимфоцитами человека. При этом происходило
слияние цитоплазмы, ядра не сливались. Эдвард Коккинг параллельно проводил
изучение ультраструктуры таких гибридов, работая с клетками амфибий и прото-
пластами моркови. После объединения клеток ядра амфибии были окружены тонким
слоем собственной цитоплазмы, но уже через 48 часов отмечалось полное смеши-
вание цитоплазмы и регенерация клеточной стенки вокруг гетерокариона.
КОНСТРУИРОВАНИЕ КЛЕТОК
Протопласты широко используются также в качестве реципиентов для клеточных
органелл. В 1973 году И. Потрикусс и Ф. Хоффман успешно трансплантировали
изолированные ядра петуньи в протопласты табака. Каким образом можно ввести
ядро или другие клеточные органеллы в протопласт?
При использовании сэндвич-метода трансплантацию проводят в условиях слабого
деплазмолиза протопласта. Перед введением протопласты и ядра обрабатывают ли-
зоцимом, который модифицирует клеточную мембрану. Далее осуществляют попере-
менное осаждение ядер и протопластов центрифугированием. В результате центри-
фугирования в пробирках формируется несколько чередующихся слоев. Центрифуж-
ные пробирки заполняют раствором осмотика (маннита) без лизоцима и центрифу-
гируют полчаса при 140 д, оставляют на 2 часа при температуре +4°C. Осадок
ресуспендируют и просматривают под микроскопом. Ядра можно обнаружить и в ци-
топлазме , и в вакуолях. В некоторых случаях при поглощении ядра образуются
жизнеспособные гибриды, в других - в клеточном цикле происходит потеря инте-
грации между чужеродным ядром и ядром хозяина.
Клеточные органеллы можно также переносить посредством липосом. Широкий
спектр одно- и многоламелльных частиц, которые сливаются с мембранами прото-
пластов , получен с применением таких веществ, как фосфатидилсерин, холистерол
и т.д. Можно также переносить органеллы путем микроинъекций. Этот метод широ-
24
Моя фантазия дальше прыгающих огурцов не идет, а ваша?
ко используется для введения в клетку ДНК, РНК, а недавно был успешно исполь-
зован и для переноса клеточных органелл у растений.
Кроме ядра трансплантируют и другие органеллы, такие как митохондрии и хло-
ропласты. Выбор этих органелл объясняется их полуавтономностью, то есть нали-
чием собственной ДНК и способность делиться самостоятельно, независимо от де-
ления самой клетки. Кроме того, эти органеллы контролируют важнейшие физиоло-
гические процессы растительной клетки, такие как фотосинтез и дыхание. Напри-
мер, перенос хлоропластов может использоваться для выведения новых форм хо-
зяйственно важных сортов растений. Трансплантация высокоэффективных хлоропла-
стов может способствовать активации фотосинтеза и повышению продуктивности
растения.
Одним из важных моментов является сохранение клеточных органелл, поэтому
для переноса их в последнее время используются субпротопласты - фрагменты,
полученные из протопластов. Они могут содержать большую часть цитоплазмы, но
без ядра (цитопласты), ядро с небольшим количеством цитоплазмы (кариопласты
), часть хромосом с небольшим количеством цитоплазматического материала (мик-
ропротопласты) .
Биологическое конструирование на уровне клетки может оказаться полезным и
перспективным для создания клеток, клеточных систем и целых растений, удовле-
творяющих потребности человека. Под биологическим конструированием следует
понимать не только введение отдельных органелл (рис. 16). Аналогичным образом
в клетку можно вводить и чужеродный генетический материал как в виде фрагмен-
тов ДНК, так и в виде отдельных хромосом. Кроме того, в изолированные прото-
пласты можно вводить клетки микроорганизмов, создавая таким образом искусст-
венные ассоциации.
митохондрии
Растение с заданными
признаками
Рис. 16. Конструирование клеток (по Р.Г. Бутенко, 1987)
КЛЕТОЧНАЯ СЕЛЕКЦИЯ
Методы клеточной селекции
Одно из направлений клеточных технологий — это использование их в селекции,
которое облегчает и ускоряет традиционный селекционный процесс в создании но-
вых форм и сортов растений. Существующие методы культивирования изолированных
клеток и тканей in vitro условно можно разделить на две группы.
Первая группа — это вспомогательные технологии, которые не подменяют обыч-
ную селекцию, а служат ей. К ним можно отнести: оплодотворение in vitro (пре-
одоление прогамной несовместимости), культивирование семяпочек и незрелых
гибридных зародышей (преодоление постгамной несовместимости) , получение гап-
лоидов путем культивирования пыльников и микроспор, криосохранение изолиро-
ванных клеток, тканей и органов, клональное микроразмножение отдаленных гиб-
ридов .
Вторая группа методов ведет к самостоятельному, независимому от традицион-
ных методов селекции, получению новых форм и сортов растений: клеточная се-
лекция с использованием каллусной ткани, соматическая гибридизация (слияние
изолированных протопластов и получение неполовых гибридов), применение мето-
дов генной инженерии.
В отдаленной гибридизации находят применение такие методы культуры изолиро-
ванных тканей, как оплодотворение in vitro, эмбриокультура (выращивание изо-
лированных зародышей на искусственных питательных средах), клональное микро-
размножение ценных гибридов, а также получение гаплоидов in vitro и криосо-
хранение .
Оплодотворение in vitro (преодоление прогамной несовместимости) проводится
в том случае, когда невозможно осуществить оплодотворение между выбранными
парами в естественных условиях. Это вызвано несколькими причинами:
1) физиологические (несоответствие во времени созревания пыльцы и т. д.);
2) морфологические (короткая пыльцевая трубка или блокирование роста ее на
разных этапах развития и т. д.).
Оплодотворение in vitro можно осуществить двумя способами:
а) культивирование на искусственной агаризованной питательной среде завязи
с нанесенной на нее готовой пыльцой;
б) завязь вскрывается и на питатель-ную среду переносятся кусочки плаценты
с семяпочками, вблизи которых или непосредственно на ткани плаценты культиви-
руется готовая пыльца.
Визуально определить, прошло оплодотворение in vitro или нет, можно по бы-
стро увеличивающимся в размерах семяпочкам. Сформировавшийся зародыш, как
правило, не переходит в состояние покоя, а сразу прорастает и дает начало
гибридному поколению. Плацентарное оплодотворение in vitro позволило преодо-
леть несовместимость в скрещивании сортов культурного табака N. tabacum с ди-
кими видами N. rosulata и N. debneyi и сделало возможным получение межвидовых
гибридов табака в опытах М.Ф. Терновского и др. (1976), Шинкаревой (1986).
Постгамная несовместимость при отдаленной гибридизации возникает после оп-
лодотворения. Часто при этом образуются щуплые невсхожие семена. Причиной мо-
жет быть расхождение во времени развития зародыша и эндосперма. Из-за слабого
развития эндосперма зародыш бывает неспособен к нормальному прорастанию. В
таких случаях из зрелой щуплой зерновки изолируют зародыш и выращивают его в
питательной среде.
Выращивание зародышей в искусственной питательной среде называется эмбрио-
культурой. Среда для выращивания зрелого зародыша может быть простой, без до-
бавок физиологически активных веществ (например, среда Уайта) или любая дру-
гая, содержащая минеральные соли и сахарозу. При более отдаленных скрещивани-
ях нарушения в развитии зародыша могут наблюдаться уже на ранних этапах, что
выражается в отсутствии дифференцировки, замедленном росте. В этом случае
культура зародыша состоит из двух этапов — эмбрионального роста зародыша, во
время которого продолжается его дифференцировка, и прорастания подросшего за-
родыша . Для первого этапа требуется более сложная по составу среда с повышен-
ным содержанием сахарозы, с добавками различных аминокислот, витаминов и гор-
монов .
Применение эмбриокультуры в селекции приобретает в последнее время большое
значение для получения отдаленных гибридов зерновых, злаковых и других сель-
скохозяйственных культур. Показана возможность увеличения выхода пшенично-
ржаных гибридов путем доращивания незрелых зародышей, а также использования
эмбриокультуры для преодоления постгамной несовместимости при гибридизации
пшеницы с колосняком.
Метод эмбриокультуры находит все более широкое применение в межвидовой гиб-
ридизации овощных растений. Для лука разработаны приемы выращивания in vitro
абортивных зародышей от гибридных семян с разных этапов эмбриогенеза, выращи-
вание зародышей от частично фертильных межвидовых гибридов. Культура изолиро-
ванных зародышей используется в селекции томатов и других овощных растений.
Исследована гормональная регуляция роста и развития зародышей томата in
vitro. Обсуждается возможность применения эмбриокультуры для получения отда-
ленных гибридов подсолнечника, изучаются факторы, контролирующие рост и раз-
витие in vitro зародышей подсолнечника, выделенных в разные сроки после опы-
ления .
Культура изолированных зародышей как вспомогательный метод при отдаленной
гибридизации применяется не только для преодоления постгамной несовместимо-
сти, но также с целью микроразмножения ценных гибридов. В этом случае микро-
размножение идет путем каллусогенеза, индукции морфогенеза и получения расте-
ний-регенерантов из каллусной ткани. Техника клонирования незрелых зародышей
позволяет размножать ценные генотипы растений на ранних стадиях жизненного
цикла. Еще одна возможность применения культуры зародышей — использование ее
в клеточной селекции.
Генетические основы
применения культуры
клеток растений
в селекционных целях
Клетки в культуре in vitro отличаются по морфологии, по биохимическим
свойствам, по физиологическому состоянию и генетически. Разнообразие (вариа-
бельность) среди клеточных линий или растений-регенерантов называют сомакло-
нальной вариабельностью. Генетическая природа и механизм возникновения сома-
клональной изменчивости пока мало изучены. Однако четко можно выделить зави-
симость возникновения сомаклональных вариантов, прежде всего, от генетической
гетерогенности соматических клеток исходного экспланта, генетической и эпиге-
нетической изменчивости, индуцируемой условиями культивирования in vitro, а
также от генотипа и исходного экспланта.
Полиморфизм культивируемых клеток можно объяснить видовыми и возрастными
особенностями, уровнем плоидности, влиянием состава питательной среды и усло-
вий культивирования, отсутствием коррелятивных связей. Последний фактор, ве-
дущий к нарушению жесткой регуляции, существовавшей в целом растении, видимо,
является основной причиной спонтанной изменчивости клеток in vitro.
Любой фрагмент растения представляет собой мозаику различных тканей, и в
зависимости от того, какая ткань даст начало каллусу, возникшие даже из оди-
наковых эксплантов каллусы будут гетерогенными и отличающимися друг от друга.
Одинаковых, в полном смысле, эксплантов в природе быть не может, следователь-
но, неоднородность исходного материала (видовая, возрастная, физиологическая)
предопределяет разнокачественность клеток в культуре.
Физиологическая гетерогенность состоит в том, что клетки в популяции нахо-
дятся в разном физиологическом состоянии, т. е. делятся, растут, стареют, по-
гибают . Такая культура называется асинхронной. Заставить популяцию клеток
высших растений проходить фазы клеточного цикла одновременно, т. е. синхрони-
зировать их почти невозможно. Потому что та часть клеток, которая способна в
данный момент к делению, составляет 2—4%. Неблагоприятные условия (низкая
температура, исключение важных компонентов питания), задерживающие деление, в
какой-то степени способствуют накоплению числа клеток, готовых к делению. Бо-
лее эффективны некоторые химические вещества, блокирующие определенные стадии
подготовки к делению. В лучших случаях синхронизация может быть достигнута у
10—30% клеток, но при последующих делениях популяция опять быстро утрачивает
синхронность.
Следует подчеркнуть, что физиологическая вариабельность клеток в суспензи-
онной культуре меньше по сравнению с культурой каллусной ткани на агаре, что
связано с более однородными условиями питания, аэрации и удаления токсических
метаболитов из клеточного окружения в жидкой перемешиваемой среде.
Гетерогенность культивируемых клеток обусловлена генетической, эпигенетиче-
ской и модификационной изменчивостью. Генетические, или мутационные, измене-
ния приводят к изменению генотипа, которое может быть унаследовано. Мутации
(изменения количества или структуры ДНК) происходят на генном, хромосомном и
геномном уровнях.
Генная, или точечная, мутация означает изменение структуры ДНК в одном ло-
кусе. Генные мутации приводят к сильным или слабым изменениям морфологиче-
ских, биохимических и физиологических свойств клетки. Мутации, возникающие в
результате изменения макроструктуры хромосом, называются хромосомными мута-
циями, или хромосомными аберрациями (перестройками). Структурные перестройки
хромосом возникают в результате инверсии, делеции, дупликации, транслокации и
транспозиции. Геномные мутации связаны с изменением числа хромосом в ядре, т.
е. с изменениями в кариотипе.
Все виды названных генетических изменений имеют место у клеток in vitro.
Наиболее подробно исследована хромосомная изменчивость клеток in vitro. Даже
клетки одной и той же ткани, выращиваемые в одном сосу-де, могут значительно
различаться между собой по хромосомным наборам (диплоидные, полиплоидные,
анеуплоидные). Причины генетической изменчивости многообразны:
1) нарушение коррелятивных связей при выделении первичного экспланта из
растения, т. е. отсутствие организменного контроля;
2) действие компонентов среды;
3) влияние продуктов метаболизма, накапливающихся в среде;
4) гетерогенность исходного материала и селекция клеток определенного ти-
па .
Хромосомная изменчивость является результатом нарушений митоза, называемых
эндомитозом и эндоредупликацией. При эндомитозе происходит спирализация хро-
мосом и начинается митоз, но нарушается веретено деления, сохраняется оболоч-
ка ядра, хромосомы не расходятся и деспирализуются внутри ядерной оболочки.
Это приводит к возрастанию числа хромосом, увеличению размеров ядра и клеток.
Эндоредупликация не сопровождается образованием хромосом и делением ядра, хо-
тя содержание ДНК в ядре тоже увеличивается. К образованию полиплоидных и
анеуплоидных клеток также приводят нарушения в митозе, связанные с неправиль-
ным распределением хромосом.
Клетки различного уровня плоидности различаются по скорости деления и рос-
та, по устойчивости к неблагоприятным воздействиям, начинают конкурировать, и
одни из них начинают преобладать. Такой процесс возрастающего доминирования в
популяции клеток определенного типа называется клеточной селекцией. Доминиро-
вание может быть вызвано преимущественной пролиферацией одних клеток или ус-
пешной элиминацией (удалением) других. Такую селекцию правильнее называть ав-
тоселекцией, потому что она протекает спонтанно, без специального воздействия
какими-либо стрессовыми факторами. В процессе автоселекции формируется наибо-
лее приспособленный к данным условиям кариотип. Вероятно, клетки приспосабли-
ваются к новым условиям существования путем отбора более жизнеспособных поли-
плоидных клеток. Интересно, что изменение условий выращивания меняет направ-
ление отбора. Показано, например, что высокие концентрации 2,4-Д и кинетина
увеличивают возможность полиплоидизации.
То, что условия выращивания играют важную роль в формировании цитогенетиче-
ской гетерогенности, хорошо видно из опытов с тканью гаплопаппуса. В лабора-
тории Р. Г. Бутенко в течение двух лет культивировались меристематические
клетки этого растения, пассажи проводились раз в месяц. В итоге исходные дип-
лоидные клетки на 95% приобрели другие уровни плоидности. Шведский исследова-
тель Т. Эриксон, работая с этой же тканью, пересаживал ее на свежую питатель-
ную среду через каждые 2 дня. При этом штамм сохранил стабильную диплоидную
характеристику. Однако способ выращивания не может полностью гарантировать
генетическую стабильность в популяции клеток, так как генетической гетероген-
ностью может обладать сам исходный материал. У многих растений дифференциро-
ванные ткани имеют клетки разной плоидности. Специализированные клетки, на-
пример клетки зеленой ассимилирующей паренхимы листа, запасающих тканей мяси-
стых корней, клубней, зачастую являются полиплоидными.
Спонтанное или индуцированное каким-либо фактором образование различных ва-
риантных форм растений можно использовать для улучшения уже существующих сор-
тов сельскохозяйственных культур.
Как было отмечено, клетки in vitro становятся разнокачественными также бла-
годаря эпигенетическим изменениям, т.е. изменениям в программе считки генов
или потенции к их активации. Эти изменения генной активности являются насле-
дуемыми .
К ненаследуемым изменениям у клеток в культуре относятся модификационные
изменения, которые в большинстве носят адаптивный, приспособительный харак-
тер. Эти изменения не затрагивают генетических структур клетки, они соответ-
ствуют физиологической адаптации, при которой границы изменений не превышают
норму реакции, обусловленной генотипом.
Гетерогенность клеток in vitro возрастает с увеличением продолжительности
их культивирования. Различные типы морфогенеза, соматический эмбриогенез или
органогенез, также могут по-разному сказываться на генетических изменениях и,
соответственно, на фенотипе растений. Экспериментально установлено, что при
соматическом эмбриогенезе время прохождения цикла клетка—растение значительно
короче, чем при органогенезе, поэтому степень сходства получаемого материала
и исходного родительского генотипа может быть значительно выше.
Сомаклональные варианты имеют, несомненно, практическое применение в сель-
скохозяйственной практике, в силу появления форм, отличающихся от родитель-
ских по различным биохимическим, качественным и количественным признакам, а
также цитогенетическим характеристикам. Например, получены сомаклоны картофе-
ля сорта Зарево, отличающиеся высокой урожайностью, повышенной устойчивостью
к заболеваниям, более высоким содержанием в клубнях протеина и крахмала. При-
чем наследование важных признаков при размножении клубнями сохранялось в те-
чение трех лет полевых испытаний (В.В. Сидоров и др., 1984, 1985). Для расте-
ний табака получены через каллусную культуру сомаклоны, устойчивые к вирусу
табачной мозаики. В настоящее время метод культуры тканей начал широко ис-
пользоваться в селекции не только кормовых и технических культур, но и деко-
ративных и лекарственных растений. Примером тому может служить новый сорт пе-
ларгонии Velvet Rose, полученный через каллусную культуру.
Таким образом, полученные положительные результаты свидетельствуют о необ-
ходимости более эффективного внедрения различных приемов получения сомакло-
нальных вариантов в практику селекционной работы, и наиболее реальным являет-
ся применение сомаклональной изменчивости для улучшения или «доработки» уже
существующих сортов или линий по отдельным недостающим признакам.
Несмотря на то, что существует генетическая нестабильность культур изолиро-
ванных тканей и клеток растений, она не может обеспечить потребности селек-
ционеров в генетическом разнообразии. В связи с этим для ускорения селекцион-
ного процесса в культуре клеток используются химические и физические мутаге-
ны. Обработка ткани раувольфии змеиной азотистым ипритом в концентрации 2,5 *
10”3 М привела к повышению уровня аберраций хромосом в первом пассаже до 32%,
вызвала сдвиг популяции в сторону увеличения триплоидов. В результате удалось
получить штамм с более высокой биосинтетической активностью по сравнению с
исходной тканью.
Спонтанный и индуцированный мутагенез в культуре клеток, тканей и протопла-
стов позволяет получать растения, представляющие практический интерес для
селекционеров. Важное практическое значение имеет создание форм растений, ус-
тойчивых к неблагоприятному действию факторов внешней среды, таких как низкие
температуры, засоление почв, загрязнение природной среды токсическими вещест-
вами, поражение вредителями и возбудителями болезней. Эти факторы могут быть
использованы в качестве селективного фона в процессе клеточной селекции.
Клетки, сохранившие при этом жизнеспособность, могут быть регенерированы в
целые растения.
Принципиальной разницы в результатах клеточной селекции при спонтанном и
индуцированном мутагенезе нет. Для повышения частоты мутаций в соматических
клетках обычно используют такие мутагены, как нитрозогуанидин, нитрозометил-
мочевина, метилметансульфонат. Реже применяют облучение ультрафиолетом, у-
квантами 60Со и нейтронами.
В качестве селективных агентов используют антибиотики, ингибиторы синтеза
нуклеиновых кислот, аналоги пуриновых и пиримидиновых оснований, фито- и па-
тотоксины, агенты, вызывающие солевой и водный стресс, аналоги аминокислот и
т. д.
Для проведения клеточной селекции используют следующие приемы:
— прямая (позитивная) селекция, при которой выживает лишь определенный ис-
комый мутантный тип клеток;
— непрямая (негативная) селекция, основанная на избирательной гибели деля-
щихся клеток дикого типа и выживания метаболически неактивных клеток, но тре-
бующая дополнительной идентификации у них мутационных изменений;
— тотальная селекция, при которой индивидуально тестируются все клеточные
клоны;
— визуальная селекция и неселективный отбор, когда вариантная линия может
быть идентифицирована среди всей популяции клеток визуально или при использо-
вании биохимических методов (тонкослойная или жидкостная хроматография, ра-
диоиммунный анализ, микроспектрофотометрия и др.).
Из перечисленных выше приемов клеточной селекции прямая селекция является
наиболее распространенным методом и используется главным образом для выделе-
ния растений-регенерантов, устойчивых, например, к гербицидам, антибиотикам,
токсинам, тяжелым металлам, солям и другим антиметаболитам.
Виды культур
растительных клеток,
используемые
в клеточной селекции
Для проведения работ по клеточной селекции растений в условиях in vitro в
качестве объекта исследования могут быть использованы каллусные, суспензион-
ные культуры или изолированные протопласты. Выбор объекта зависит от наличия
разработанных технологий применительно к различным видам растений, а также от
конечных целей исследования.
Каллусная ткань представляет собой легко доступный материал, который наибо-
лее часто используют для клеточной селекции. Как правило, работу проводят на
первичной или пересадочной каллусной ткани, которая не утрачивает способности
к регенерации на протяжении ряда субкультивирований. Однако при работе с кал-
лусными культурами многие исследователи отмечают существенные недостатки дан-
ного объекта: медленный рост ткани, неравноценное для всех клеток действие
токсических веществ, которые применяются в качестве селективного фактора, а
также потеря регенерационной способности в процессе культивирования каллусных
клеток. Несомненно, проводить селекцию целесообразно на уровне одиночных кле-
ток (суспензионная культура, протопласты). Однако для многих видов растений
не разработаны эффективные технологии и способы культивирования одиночных
клеток. Поэтому, несмотря на перечисленные выше недостатки использования кал-
лусных культур, этот способ селекции остается для некоторых видов растений
пока единственным.
Получение стабильно устойчивых линий — процесс длительный. Как правило, се-
лекция начинается с получения достаточного количества каллусной массы из изо-
лированных растительных эксплантов, использующейся в дальнейшем для определе-
ния концентрации селективного фактора (построение дозовой кривой), при кото-
рой наблюдается одновременно рост каллусной ткани, и в то же время часть кал-
лусных колоний погибает. Выбранная концентрация селективного фактора призна-
ется оптимальной и используется в дальнейших экспериментах. Так как первично
полученные на средах с селективными факторами колонии клеток могли возникнуть
вследствие физиологической адаптации или определенного состояния дифференци-
ровки клеток и не быть генетически устойчивыми, то в течение последующих 4—6
субкультивирований на селективной среде проверяется стабильность устойчивости
полученных клонов. Затем их переносят на среду без селективного фактора и
субкультивируют еще 2—3 пассажа. И только после повторного возвращения в се-
лективные условия отбирают стабильные клоны, из которых пытаются получить
растения-регенеранты. Однако работы, проведенные с получением растений, ус-
тойчивых к повышенным солям, а также к токсинам, выделенным из грибов—возбу-
дителей болезней, показали, что устойчивость клетки и растения к исследуемому
селективному фактору может совпадать и не совпадать. Прямая корреляция между
устойчивостью растений и клеток in vitro отмечена лишь для низких температур,
устойчивостью к гербицидам, высоким концентрациям алюминия и другим факторам.
Большое число работ по культивированию каллуса, с целью получения нового
селекционного материала, проведено на пшенице, ячмене, рисе, сорго, а также
на картофеле, томатах, люцерне и, крайне редко, на древесных. Уже достигнуты
первые положительные результаты по получению растений пшеницы, риса, картофе-
ля, устойчивых к NaCI или Na2S04. Получены клетки, а из них растения моркови,
которые синтезируют в 20 раз больше метионина, в 30 раз — триптофана, в 5 раз
— лизина путем добавления в питательную среду токсичных аналогов аминокислот.
Для картофеля получены растения, устойчивые к кольцевой гнили. Что касается
древесных, то для них работы в этом направлении крайне редки и часто имеют
поисковый характер. Таким образом, использование каллусной культуры в селек-
ционных целях открывает огромные возможности в создании новых форм растений,
несущих ценные признаки, необходимые для человечества.
Наряду с перечисленными выше объектами (каллусная, суспензионная культура,
изолированные протопласты), в качестве исходного материала для селекции могут
быть использованы культуры соматических или андрогенных эмбриоидов, такие ор-
ганогенные экспланты, как сегменты листьев или различные меристематические и
стеблевые части растений, а также культура изолированных зародышей. Например,
путем культивирования и селекции in vitro зародышей из семян получены расте-
ния ячменя, устойчивые к аналогам аминокислот, с улучшенным содержанием
белка. Для картофеля разработан эффективный метод обработки побегов и че-
ренков мутагеном, приводивший к получению химерных мутантов хлорофиллдефект-
ности и антибиотикоустойчивости. При культивировании пыльников яровой пшеницы
сорта Саратовская-29 и Московская-35 на питательных средах с повышенным со-
держанием солей хлорида натрия получены соматические эмбриоиды, а в дальней-
шем растения-регенеранты, проявившие повышенную солеустойчивость (Беккужина
1993).
Таким образом, проведение селекции на клеточном уровне позволяет создавать
новые формы растений в 2—4 раза быстрее по сравнению с традиционными способа-
ми селекции.
Преимущества метода
клеточной селекции
in vitro
По сравнению с экспериментальным мутагенезом на уровне целых растений метод
мутагенеза на уровне клеток имеет ряд преимуществ:
- экономится площадь, так как в одной чашке Петри диаметром 10 см можно
культивировать 107 - 108 клеток, а для такого же количества растений необхо-
дима площадь свыше тысячи гектаров;
- мутантные признаки на уровне отдельных клеток проявляются довольно быст-
ро;
- возможно получение новых типов мутаций, в том числе и биохимического ха-
рактера ;
- экономится время и трудозатраты на получение нового желаемого признака.
Основным требованием для успешного использования клеточного мутагенеза яв-
ляется хорошо разработанная система регенерации растений. Важным условием яв-
ляется также возможность получения гаплоидов у того или иного вида растений.
В дальнейшую селекционную работу включаются только те генотипы, у которых му-
тации проявляются на уровне целого растения.
Растения с измененными признаками, полученные в результате мутагенеза на
клеточном уровне, называются вариантами (термин «мутант» используется тогда,
когда мутация подтверждается генетическими или молекулярно-генетическими ме-
тодами) . Рекомендуются следующие обозначения: R0 - растения-регенеранты, по-
лученные из соответствующих клеточных клонов, Rl, R2 и т.д. - первое и после-
дующее поколения после самоопыления.
Общая схема получения мутантных форм путем селекции на клеточном уровне
состоит из нескольких этапов (рис. 17):
Измененные при мутагенной обработке клетки могут быть выделены в условиях
культивирования in vitro путем прямого и непрямого отборов, а также при тес-
тировании отдельных клеточных колоний. Прямой отбор состоит в добавлении к
питательным средам отдельных компонентов, к которым обычные, неизмененные
клетки не устойчивы. Непрямой отбор (негативная селекция) заключается в соз-
дании условий культивирования, при которых рост неизмененных клеток либо за-
держивается, либо эти клетки погибают (например, культивирование при низких
или высоких температурах на средах с недостатком отдельных компонентов и
т. д.) .
Существует ряд факторов, ограничивающих селекцию in vitro. Многие хозяйст-
венно важные признаки, такие, как урожайность, количество зерна, устойчи-
вость к пестицидам и другие трудно или практически невозможно получить при
культивировании in vitro поскольку они не проявляются на клеточном уровне.
Недостаточно также биохимических и молекулярных маркеров, которые коррелиро-
вали бы с этими признаками на уровне целых растений.
Не все селектируемые признаки, проявляющиеся на уровне клеток, сохраняются
на уровне растений - регенерантов. Тому несколько причин: некоторая часть из-
менений не затрагивает генетический аппарат клетки, поэтому не сохраняется у
потомков; генетические изменения могут элиминироваться в процессе дифферен-
циации и мейоза; функция мутированного гена может быть ограничена состоянием
дифференцируемых и культивируемых клеток; мутация одного гена может сопровож-
даться активацией различных генов, кодирующих изоферменты; часть генотипов
неспособна регенерировать нормальные фертильные растения.
&
Обработка мутагеном суспензии клеток или протопластов
Инкубация клеток в жидкой питательной среде
р ----
Перенесение суспензии в селективные условия
Выделение развивающихся колоний
j==
Отбор резистентных к селективному фактору клонов
Индукция органогенеза
Получение измененных растений
Рис. 17. Схема получения мутантных форм путем клеточной селекции
(по В.И. Артамонову, 1989)
КЛОНАЛЬНОЕ МИКРОРАЗМНОЖЕНИЕ
И ОЗДОРОВЛЕНИЕ РАСТЕНИЙ
Преимущества микроклонального
размножения перед традиционными
способами размножения растений.
История метода.
В природе существует два способа размножения растений: половой (семенной) и
вегетативный. Оба эти способа имеют как свои преимущества, так и недостатки.
К недостаткам семенного размножения относятся генетическая пестрота семен-
ного материала и длительность ювенильного периода.
При вегетативном размножении генотип материнского растения сохраняется, а
также сокращается длительность ювенильного периода. Однако большинство видов
плохо размножается вегетативным способом, к ним относятся многие древесные
породы. Например, эффективность размножения, даже на ювенильной стадии, дуба,
сосны, ели, орехоплодных не очень высока. Кроме того, с помощью черенкования
невозможно размножать многие виды древесных растений в возрасте старше 10-15
лет. Трудно получить стандартный посадочный материал, так как существует воз-
можность накопления и передачи инфекции. Операции по размножению с помощью
прививок сложны и трудоемки.
Достижения в области культуры клеток и тканей привели к созданию принципи-
ально нового метода вегетативного размножения - клонального микроразмножения.
Клональное микроразмножение - получение in vitro, неполовым путем, генетиче-
ски идентичных исходному экземпляру растений. В основе метода лежит уникаль-
ная способность растительной клетки реализовывать присущую ей тотипотент-
ность. Термин "клон" был предложен в 1903 году Уэбстером (от греческого klon
- черенок или побег, пригодный для размножения растений). В соответствии с
научной терминологией клонирование подразумевает получение идентичных орга-
низмов из единичных клеток. Этот метод имеет ряд преимуществ перед существую-
щими традиционными способами размножения:
- получение генетически однородного посадочного материала;
- освобождение растений от вирусов за счет использования меристемной куль-
туры;
- высокий коэффициент размножения (105 - 106 - для травянистых, цветочных
растений, 104 - 105 - для кустарниковых древесных растений и 104 - для хвой-
ных) ;
- сокращение продолжительности селекционного процесса;
- ускорение перехода растений от ювенильной к репродуктивной фазе развития;
- размножение растений, трудно размножаемых традиционными способами;
- возможность проведения работ в течение всего года;
- возможность автоматизации процесса выращивания.
Пионером клонального микроразмножения считается французский ученый Жан Мо-
рель, который в 50-х годах нашего столетия получил первые растения - регене-
ранты орхидей. В это время техника культивирования апикальных меристем in
vitro была уже хорошо разработана. Как правило, исследователи в качестве пер-
вичного экспланта использовали верхушечные меристемы травянистых растений:
гвоздики, хризантемы, подсолнечника, гороха, кукурузы и т.д. В нашей стране
работы по клональному микроразмножению были начаты в 30-х годах в лаборатории
культуры тканей и морфогенеза ИФРа. Под руководством Р.Г.Бутенко были изучены
условия микроразмножения картофеля, сахарной свеклы, гвоздики, герберы и др.
растений и предложены промышленные технологии. В дальнейшем исследования по
клональному микроразмножении охватили и древесные растения.
Первые работы по культуре тканей древесных растений были опубликованы в се-
редине 20-х годов нашего столетия и связаны с именем Готре, который показал,
что камбиальные ткани некоторых растений способны к каллусогенезу in vitro.
Но первые растения - регенеранты осины, доведенные до почвенной культуры, бы-
ли получены лишь в середине 60-х годов Матесом.
Культивирование тканей хвойных пород in vitro долгое время редко использо-
валось как объект исследования. Это было связано со специфическими трудностя-
ми культивирования тканей, изолированных из растения. Известно, что древес-
ные, и особенно хвойные растения характеризуются медленным ростом, трудно
укореняются, содержат большое количество вторичных соединений (фенолы, терпе-
ны и т.д.), которые в изолированных тканях активируются. Окисленные фенолы
обычно ингибируют деление и рост клеток, что ведет к гибели первичного экс-
планта или уменьшению способности тканей древесных растений к регенерации ад-
вентивных почек, которая с возрастом растения-донора исчезает практически
полностью. В настоящее время, несмотря на перечисленные трудности, насчитыва-
ется более 200 видов древесных растений из 40 семейств, которые были размно-
жены in vitro (каштан, дуб, береза, клен, сосна, ель, секвойя и др.).
Факторы, влияющие на процесс
клонального микроразмножения
На эффективность микроклонального размножения влияет масса факторов раз-
личной природы. Это физиологические особенности вводимого в культуру расте-
ния, химические и физические условия культивирования. Наиболее важным момен-
том является выбор материнского растения и экспланта.
При выборе материнского растения необходимо учитывать его физиологические,
сортовые и видовые особенности. Исходные растения должны быть здоровы, не по-
ражены грибными, бактериальными и вирусными болезнями. Кроме того, они должны
находится в состоянии интенсивного роста (выход из фазы покоя и переход к ак-
тивному росту). Луковицы, корневища и клубни в состоянии покоя непригодны,
перед введением в культуру их предварительно обрабатывают высокими или низки-
ми температурами. Способность к размножению также детерминирована генетиче-
ски. Например, земляника размножается всеми способами, облепиха - ни одним,
хотя в природе черенкуется. Двудольные обладают большей регенерационной спо-
собностью , чем однодольные и древесные.
При выборе экспланта необходимо учитывать его возраст, строение и происхож-
дение . Для обеспечения максимальной стабильности клонируемого материала, во
избежание появления аномальных растений в качестве экспланта желательно ис-
пользовать молодые, слабодифференцированные ткани. Кроме того, экспланты от
ювенильных растений лучше укореняются, чем от зрелых, особенно это касается
древесных пород. Лучше всего использовать кончики стеблей, пазушные почки,
зародыши, молодые листья, черенки, соцветия, чешую луковиц, то есть эксплан-
ты, содержащие меристемы. Опыты с эмбрионами кукурузы, проведенные Грином и
Филипсом в 1975 году, показали, что при извлечении эмбрионов из зрелых семян
они образуют каллус и корни. Если же изолировать их через 2-3 недели после
опыления, то образуются и каллус, и растения. Вероятно, это связано с разво-
рачиванием генетической программы в онтогенезе растения. Следует отметить,
что не всегда молодые ткани являются удачным объектом для размножения. У эхе-
верии на эксплантах из молодых листьев возникают только корни, из старых -
только побеги, из средних по возрасту - и побеги, и корни. Чем меньше размер
экспланта, тем меньше его регенерационная способность. С другой стороны, в
крупном экспланте увеличивается возможность появления в его клетках вирусов и
других патогенов, что препятствует оздоровлению тканей.
Длительность культивирования также влияет на эффективность микроразмноже-
ния. Физиологическое состояние экспланта меняется в течение пассажей, при
длительном культивировании частота укореняемости побегов возрастает. Возмож-
но, что при этом эксплант приобретает признаки ювенильности, что ведет к по-
вышению его морфогенетического потенциала.
Успех введения в культуру часто определяется эффективностью стерилизации.
Выбор стерилизующего агента определяется особенностями экспланта. Для нежных
тканей концентрация стерилизующего агента должна бать снижена, чтобы сохра-
нить жизнеспособность экспланта. Часто внутреннее заражение исходных эксплан-
тов бывает намного сильнее, чем поверхностное, поэтому экспланты предвари-
тельно обрабатывают фунгицидами и антибиотиками против грибной и бактериаль-
ной инфекций. Хорошие результаты дает обработка растений бензоатом натрия.
В зависимости от вида растений необходимо испытывать как твердые, так и
жидкие питательные среды. Иногда жидкие среды имеют преимущество, так как
обеспечивают большую подвижность трофических элементов. Например, при размно-
жении роз более успешным было культивирование побегов на двухслойной пита-
тельной среде: нижний слой - агаризованный, верхний - жидкий. На эффектив-
ность размножения могут также влиять расположение экспланта (горизонтальное
или вертикальное), тип пробок (ватные, пластмассовые, стеклянные, металличе-
ские и т.д.), а также соотношение объема эксплантов и количества питательной
среды для оптимального освещения и газообмена эксплантов.
Состав питательной среды необходимо подбирать для каждого вида растений. На
клональное микроразмножение влияют гормоны, минеральные соли, витамины и уг-
леводы. При микроразмножении in vitro часто используют среды Мурасиге и Ску-
га, Линсмайера и Скуга, Шенка и Хильдебрандта, Нича, Гамборга, Хеллера и дру-
гие . Обычно используют среду Мурасиге-Скуга, которая содержит много неоргани-
ческого азота, что стимулирует процессы органогенеза и соматического эмбрио-
генеза. В наших экспериментах (Кузьмина Н.А., Внукова В.В., 1997) выход мор-
фогенных каллусов твердой пшеницы был выше на среде Мурасиге-Скуга по сравне-
нию со средой Гамборга, которая одержала окисленные формы азота. Среда Мура-
сиге-Скуга также способствовала стабилизации хромосомного набора клеток твер-
дой пшеницы при высоком содержании ауксина в среде. Вообще вопрос оптимально-
го соотношения NH4/NO3 остается открытым, так как литературные данные весьма
противоречивы и универсального рецепта для всех видов растений нет. В качест-
ве источника углеродного питания используют различные углеводы типа сахарозы,
глюкозы, фруктозы, галактозы. Разные культуры требуют различной концентрации
углеводов на разных этапах клонального микроразмножения.
К физическим факторам выращивания относятся температура и условия освеще-
ния. На первых двух этапах освещенность колеблется от 1000 до 3000 Лк, фото-
период 14 - 16 часов, но эти параметры зависят от культуры. Высокая интенсив-
ность света может вызывать хлорозы и задерживать развитие, но при переносе в
почву эти растения чувствуют себя лучше и растут энергичнее. Спектральный со-
став также играет немаловажную роль. Некоторые исследователи (Катаева Н.В.,
Аветисов В.А, 1981) указывают на синий свет как основной компонент морфогене-
за. Красный свет стимулирует образование почек у табака, у салата - образова-
ние побегов, у березы - укоренение. В работах Т.Н. Константиновой с соавто-
рами (1987) показано, что синий свет усиливает закладку вегетативных почек у
побегов табака в условиях in vitro , а красный стимулирует развитие цветочных
почек. Однако при добавлении цитокининов и ауксинов в различной концентрации
соотношение процессов дифференциации цветочных и вегетативных почек меняется,
в некоторых случаях наблюдается даже противоположный эффект. В исследованиях
Р. А. Карначук и Е. С. Гвоздевой (1998) наибольший выход морфогенных каллусов
пшеницы, формирующих растения и побеги, отмечен на зеленом свету. Важное зна-
чение играет также сочетание спектрального состава света и гормональных фак-
торов среды.
Температура культивирования обычно варьирует в интервале 22 - 26°С днем и
18 - 22°С ночью. В некоторых случаях понижение температуры ведет к повышению
эффективности размножения. Для повышения коэффициента размножения необходимо
каждому виду с учетом его естественного ареала произрастания подбирать инди-
видуальные условия культивирования. Относительная влажность воздуха - 65 -
70%
Этапы клонального
микроразмножения
Процесс клонального микроразмножения можно разделить на 4 этапа:
1. Выбор растения-донора, изолирование эксплантов и получение хорошо расту-
щей стерильной культуры.
2. Собственно микроразмножение, когда достигается получение максимального
количества меристематических клонов.
3. Укоренение размноженных побегов с последующей адаптацией их к почвенным
условиям, а при необходимости депонирование растений-регенерантов при пони-
женной температуре (+2°С, +10°С) .
4. Выращивание растений в условиях теплицы и подготовка их к реализации или
посадке в поле.
Для культивирования тканей на каждом из четырех этапов требуется применение
определенного состава питательной среды.
На первом этапе необходимо добиться получения хорошо растущей стерильной
культуры. В тех случаях, когда трудно получить исходную стерильную культуру
экспланта, рекомендуется вводить в состав питательной среды антибиотики (тет-
рациклин, бензилпенициллин и др.) в концентрации 100—200 мг/л. Это в первую
очередь относится к древесным растениям, у которых наблюдается тенденция к
накоплению внутренней инфекции.
На первом этапе, как правило, используют среду, содержащую минеральные соли
по рецепту Мурасига и Скуга, а также различные биологически активные вещества
и стимуляторы роста (ауксины, цитокинины) в различных сочетаниях в зависимо-
сти от объекта. В тех случаях, когда наблюдается ингибирование роста первич-
ного экспланта, за счет выделения им в питательную среду токсичных веществ
(фенолов, терпенов и других вторичных соединений), снять его можно, используя
антиоксиданты. Это возможно двумя способами: либо омывкой экспланта слабым
его раствором в течение 4—24 ч, либо непосредственным добавлением в питатель-
ную среду. В качестве антиоксидантов используют: аскорбиновую кислоту (1
мг/л), глютатион (4—5 мг/л), дитиотриэтол (1—3 мг/л), диэтилдитиокарбомат (2—
5 мг/л), поливинилпирролидон (5000—10000 мг/л). В некоторых случаях целесооб-
разно добавлять в питательную среду адсорбент - древесный активированный
уголь в концентрации 0,5—1%. Продолжительность первого этапа может колебаться
от 1 до 2 месяцев, в результате которого наблюдается рост меристематических
тканей и формирование первичных побегов.
2 этап — собственно микроразмножение. На этом этапе необходимо добиться по-
лучения максимального количества мериклонов, учитывая при этом, что с увели-
чением субкультивирований увеличивается число растений-регенерантов с ненор-
мальной морфологией и возможно наблюдать образование растений-мутантов.
Как и на первом этапе, используют питательную среду по рецепту Мурасига и
Скуга, содержащую различные биологически активные вещества, а также регуля-
то-ры роста. Основную роль при подборе оптимальных условий культивирования
эксплантов играют соотношение и концентрация внесенных в питательную среду
цитокининов и ауксинов. Из цитокининов наиболее часто используют БАЛ в кон-
центрациях от 1 до 10 мг/л, а из ауксинов—ИУК и НУК в концентрациях до 0,5
мг/л.
При долгом культивировании растительных тканей на питательных средах с по-
вышенным содержанием цитокининов (5—10 мг/л) происходит постепенное нако-
пление их в тканях выше необходимого физиологического уровня, что приводит к
появлению токсического действия и формированию растений с измененной морфоло-
гией. Вместе с тем, возможно наблюдать такие нежелательные для клонального
микроразмножения эффекты, как подавление пролиферации пазушных меристем, об-
разование витрифицированных (оводненных) побегов и уменьшение способности
растений к укоренению. Отрицательное действие цитокининов возможно преодо-
леть , по данным Н.В. Катаевой и Р.Г. Бутенко, путем использования питательных
сред с минимальной концентрацией цитокининов, обеспечивающих стабильный коэф-
фициент микроразмножения, или путем чередования циклов культивирования на
средах с низким и высоким уровнем фитогормонов.
3 и 4 этапы — укоренение микропобегов, их последующая адаптация к почвенным
условиям и высадка в поле являются наиболее трудоемкими этапами, от которых
зависит успех клонального микроразмножения. На третьем этапе, как правило,
меняют основной состав среды: уменьшают в два, а иногда и в четыре раза кон-
центрацию минеральных солей по рецепту Мурасига и Скуга или заменяют ее сре-
дой Уайта, уменьшают количество сахара до 0,5—1% и полностью исключают цито-
кинины, оставляя один лишь ауксин. В качестве стимулятора корнеобразования
используют р-индолил-3-масляную кислоту (ИМК), ИУК или НУК.
Укоренение микропобегов проводят двумя способами:
1) выдерживание микропобегов в течение нескольких часов (2—24 ч) в стериль-
ном концентрированном растворе ауксина (20—50 мг/л) и последующее их культи-
вирование на агаризованной среде без гормонов или непосредственно в подходя-
щем почвенном субстрате (импульсная обработка);
2) непосредственное культивирование микропобегов в течение 3—4 недель на
питательной среде, содержащей ауксин в невысоких концентрациях (1—5 мг/л в
зависимости от исследуемого объекта). В последнее время предложен метод уко-
ренения пробирочных растений в условиях гидропоники. Этот метод позволяет
значительно упростить этап укоренения и одновременно получать растения, адап-
тированные к естественным условиям. Для картофеля возможно использовать без-
субстратную гидропонику для получения мини-клубней. Затенение нижней части
культуральных сосудов плотной черной материей или добавление в питательную
среду активированного угля способствует укоренению микропобегов.
Пересадка растений-регенерантов в субстрат является ответственным этапом,
завершающим процесс клонального микроразмножения. Наиболее благоприятное вре-
мя для пересадки пробирочных растений — весна или начало лета.
Растения с двумя-тремя листьями и хорошо развитой корневой системой осто-
рожно вынимают из колб или пробирок пинцетом с длинными концами или специаль-
ным крючком. Корни отмывают от остатков агара и высаживают в почвенный суб-
страт, предварительно простерилизованный при 85—90° С в течение 1—2 ч. Для
большинства растений в качестве субстратов используют торф, песок (3:1);
торф, дерновую почву, перлит (1:1:1) ; торф, песок, перлит (1:1:1) . Исключение
составляют семейство орхидных, для которых готовят субстрат, состоящий из
сфагнового мха, смеси торфа, листьев бука или дуба, сосновой коры (1:1:1).
Приготовленным заранее почвенным субстратом заполняют пикировочные ящики
или торфяные горшочки, в которых выращивают растения-регенеранты. Горшочки с
растениями помещают в теплицы с регулируемым температурным режимом (20—22°
С) , освещенностью не более 5 тыс. лк и влажностью 65—90%. Для лучшего роста
растений создают условия искусственного тумана. В тех случаях, когда нет воз-
можности создать такие условия, горшочки с растениями накрывают стеклянными
банками или полиэтиленовыми пакетами, которые постепенно открывают до полной
адаптации растений.
Через 20—30 дней после посадки хорошо укоренившиеся растения подкармливают
растворами минеральных солей Кнудсона, Мурасига и Скуга, Чеснокова, Кнопа (в
зависимости от вида растений) или комплексным минеральным удобрением. По мере
роста растений их рассаживают в большие емкости со свежим субстратом. Даль-
нейшее выращивание акклиматизированных растений соответствует принятой агро-
технике выращивания для каждого индивидуального вида растений.
Процесс адаптации пробирочных растений к почвенным условиям является наибо-
лее дорогостоящей и трудоемкой операцией. Нередко после пересадки растений в
почву наблюдается остановка в росте, опадение листьев и гибель растений. Эти
явления связаны, в первую очередь, с тем, что у пробирочных растений нарушена
деятельность устьичного аппарата, вследствие чего происходит потеря большого
количества воды. Во-вторых, у некоторых растений в условиях in vitro не про-
исходит образования корневых волосков, что приводит, в свою очередь, к нару-
шению поглощения воды и минеральных солей из почвы. Поэтому целесообразно на
третьем или четвертом этапах клонального микроразмножения применять искусст-
венную микоризацию растений (для микотрофных), учитывая их положительную роль
в снабжении растений минеральными и органическими питательными веществами,
водой, биологически активными веществами, а также в защите растений от пато-
генов .
Индийскими учеными предложен простой метод предотвращения быстрого обезво-
живания листьев растений, выращенных in vitro, во время их пересадки в поле-
вые условия. Метод заключается в том, что листья в течение всего акклиматиза-
ционного периода следует опрыскивать 50%-ным водным раствором глицерина или
смесью парафина, или жира в диэтиловом эфире (1:1) . Применение этого метода
помогает избежать длинных и затруднительных процессов закаливания пробирочных
растений и обеспечивает 100%-ную их приживаемость.
Методы клонального
микроразмножения
Существует много методов клонального микроразмножения, а также различных их
классификаций. Согласно одной из них, предложенной Мурасиге в 1977 году, про-
цесс можно осуществлять следующими путями:
1. Активация пазушных меристем.
2. Образование адвентивных побегов тканями экспланта.
3. Возникновение адвентивных побегов в каллусе.
4. Индукция соматического эмбриогенеза в клетках экспланта.
5. Соматический эмбриогенез в каллусной ткани.
6. Формирование придаточных эмбриоидов в ткани первичных соматических заро-
дышей (деление первичных эмбриоидов).
Н. В. Катаева и Р. Г. Бутенко (1983) выделяют два принципиально различных
типа клонального микроразмножения:
1. Активация уже существующих в растении меристем (апекс стебля, пазушные и
спящие почки стебля).
2. Индукция возникновения почек или эмбриоидов de novo:
а) образование адвентивных побегов непосредственно тканями экспланта;
б) индукция соматического эмбриогенеза;
в) дифференциация адвентивных почек в первичной и пересадочной каллусной
ткани.
Основной метод, использующийся при клональном микроразмножении растений -
активация развития уже существующих в растении меристем. Он основан на снятии
апикального доминирования (рис. 18).
Этого можно достичь двумя путями:
а) удалением верхушечной меристемы стебля и последующим микрочеренкованием
побега in vitro на безгормональной среде;
б) добавлением в питательную среду веществ цитокининового типа действия,
индуцирующих развитие многочисленных пазушных побегов. Как правило, в качест-
ве цитокининов используют 6-бензиламинопурин (БАЛ) или 6-фурфуриламинопурин
(кинетин) и зеатин.
Полученные таким образом побеги отделяют от первичного экспланта и вновь
самостоятельно культивируют на свежеприготовленной питательной среде, стиму-
лирующей пролиферацию пазушных меристем и возникновение побегов более высоких
порядков.
Ц> A
Рис. 18. Схема размножения растений методом активации уже суще-
ствующих меристем (по А. Р. Родину, Е. А. Калашниковой, 1993): 1
- путем удаления верхушечной меристемы: 2 - добавлением цитоки-
нинов в среду (б/г - среда без гормонов, Ц - цитокинин, А - аук-
син)
Часто в качестве экспланта используют верхушечные или пазушные почки, кото-
рые изолируют из побега и помещают на питательную среду с цитокининами. Обра-
зующиеся пучки побегов делят, при необходимости черенкуют и переносят на
свежую питательную среду. После нескольких пассажей, добавляя в питательную
среду ауксины, побеги укореняют in vitro (рис. 19), а затем переносят в поч-
ву, где создают условия, способствующие адаптации растений (рис. 20).
Рис. 19. Образование корней побегами розы при добавлении в пита-
тельную среду 2 мг/л 2,4-Д
Рис. 20. Адаптация пробирочных роз к почвенным условиям
В настоящее время этот метод широко используется в производстве посадочного
материала сельскохозяйственных культур, как технических, так и овощных, а
также для размножения культур промышленного цветоводства (например, гвоздики,
рис. 21), тропических и субтропических растений, плодовых и ягодных культур,
древесных растений. Для некоторых культур, таких как картофель, технология
клонального размножения поставлена на промышленную основу. Применение метода
активации развития существующих меристем позволяет получать из одной меристе-
мы картофеля более 100000 растений в год, причем технология предусматривает
получение в пробирках микроклубней - ценного безвирусного семенного материа-
ла .
Рис. 21. Пробирочная гвоздика
Второй метод - индукция возникновения адвентивных почек непосредственно
тканями экспланта. Он основан на способности изолированных частей растения
при благоприятных условиях питательной среды восстанавливать недостающие ор-
ганы и таким образом регенерировать целые растения. Можно добиться образова-
ния адвентивных почек почти из любых органов и тканей растения (изолированно-
го зародыша, листа, стебля, семядолей, чешуек и донца луковиц, сегментов кор-
ней и зачатков соцветий). Этот процесс происходит на питательных средах, со-
держащих цитокинины в соотношении с ауксинами 10:1 или 100:1. В качестве аук-
сина используют ИУК или НУК. Таким способом были размножены многие представи-
тели семейства лилейных, томаты, древесные растения (из зрелых и незрелых за-
родышей) .
Достаточно хорошо разработана технология клонального размножения земляники,
основанная на культивировании апикальных меристем. Меристематические верхушки
изолируют из молодых, свободных от вирусных болезней растений, и выращивают
на питательной среде МС, содержащей ВАЛ в концентрации 0,1 - 0,5 мг/л. Через
3-4 недели культивирования меристема развивается в проросток, в основании
которого формируются адвентивные почки, быстро растущие и дающие начало новым
почкам. В течение 6-8 недель образуется конгломерат почек, связанных между
собой соединительной тканью и находящихся на разной стадии развития. Появля-
ются листья на коротких черешках, в нижней части которых формируются новые
адвентивные почки. Эти почки разделяют и пересаживают на свежую питательную
среду. На среде без регуляторов роста за 4 - 5 недель формируются нормальные
растения с корнями и листьями. От одного материнского растения таким образом
можно получить несколько миллионов растений-регенерантов в год.
Третий метод, практикуемый при клональном микроразмножении, основывается на
дифференциации из соматических клеток зародышеподобных структур, которые по
своему виду напоминают зиготические зародыши (рис. 22) . Этот метод получил
название соматического эмбриогенеза. В отличие от развития in vivo, соматиче-
ские зародыши развиваются асексуально вне зародышевого мешка и по своему
внешнему виду напоминают биполярные структуры, у которых одновременно наблю-
дается развитие апикальных меристем стебля и корня. Согласно Стеварду, сома-
тические зародыши проходят 3 стадии развития: глобулярную, сердцевидную, тор-
педовидную и в конечном итоге имеют тенденцию развития в проросток. На рисун-
ке 3 показан конечный результат развития - растение пшеницы.
стадии развития эмбриоидов
Рис. 22. Соматический эмбриогенез в каллусной ткани
Наиболее впечатляющим применением метода соматического эмбриогенеза стало
размножение гвинейской масличной пальмы (Elaeis guineensis), масло которой
широко используется при производстве маргарина и пищевого масла. Масличная
пальма в природе не образует побегов и боковых ростков, что затрудняет ее ве-
гетативное размножение. Культивирование черенков in vitro также невозможно.
Было решено получить скопления клеток недифференцированной ткани (каллусы)
путем дедифференцировки специфических тканей, а затем культивировать их до
регенерации целых проростков. В первой культуральной среде каллусы из фраг-
ментов листьев развивались в течение 90 дней, при переносе во вторую и третью
культуральные среды превращались в "эмбриоиды". Эмбриоиды размножались само-
произвольно, в течение месяца число эмбриоидов возрастало втрое, а за год из
10 эмбрионов можно было получить потомство численностью 500000 растений.
Формирование эмбриоидов в культуре тканей осуществляется в несколько эта-
пов. Сначала происходит дифференциация клеток под влиянием ауксинов, добав-
ленных в питательную среду (2,4-Д) и превращение их в эмбриональные. Получить
эмбриоиды из этих клеток можно уменьшая концентрацию ауксинов или исключая их
из питательной среды. Соматические зародыши представляют собой полностью
сформированные зародыши, из которых путем соответствующего капсулирования
можно получить искусственные семена.
Четвертый метод клонального микроразмножения - дифференциация адвентивных
почек в первичной и пересадочной каллусной ткани (рис. 23).
почки
каллус
растение-регенерант
Рис. 23. Дифференциация придаточных почек в каллусной ткани
Практически он мало используется с целью получения посадочного материала in
vitro. Это связано с тем, что при частом пассировании каллусной ткани может
изменяться плоидность регенерируемых растений, наблюдаются структурные пере-
стройки хромосом и накопление генных мутаций. Наряду с генетическими измене-
ниями отмечаются и морфологические: низкорослость, неправильное жилкование
листьев, образование укороченных междоузлий, пониженная устойчивость к болез-
ням и вредителям. В то же время, некоторые недостатки этого метода в селекци-
онной работе оборачиваются преимуществами. Кроме того, в некоторых случаях он
является единственно возможным способом размножения растений в культуре тка-
ней. Через каллусную культуру успешно размножаются сахарная свекла, злаковые
(рис. 24), представители рода Brassica, подсолнечник и другие культуры.
Рис. 24. Формирование побегов каллусной тканью пшеницы
Оздоровление посадочного
материала от вирусов
Основное преимущество клонального микроразмножения - получение генетически
однородного, безвирусного посадочного материала. Предположение о возможности
отсутствия вирусов в меристематических тканях больных растений впервые было
высказано в 1936 г. Чунгом, а позднее, в 1943 г. , и Уайтом. В 1949 г. этот
факт был подтвержден экспериментально. В 1952 г. Морелю и Мартену из Нацио-
нального агрономического института (Франция) удалось получить безвирусные ге-
оргины из зараженных растений.
Структурной основой используемого на практике явления служит специфика
строения точки роста растений: дистальная ее часть, представленная апикальной
меристемой, у разных растений имеет средний диаметр 200 мкм и высоту от 20 до
150 мкм. В нижних слоях дифференцирующиеся клетки меристемы образуют прокам-
бий, дающий начало пучкам проводящей системы.
Известно, что успех клонального микроразмножения зависит от меристематиче-
ского экспланта. При этом отмечается закономерность: чем больше листовых за-
чатков и тканей, тем легче идут процессы морфогенеза, заканчивающиеся образо-
ванием целого растения. Вместе с тем, при таком развитии конуса нарастания
увеличивается риск быстрой транспортировки вируса по проводящей системе. Кро-
ме того, даже небольшой меристематический эксплант может содержать вирусы,
проникшие в клетки в результате медленного распространения через плазмодесмы.
В целом, эффективность применения апикальной меристемы в качестве метода
оздоровления зараженных вирусами растений может оказаться довольно низкой.
Снизить риск попадания вирусов в здоровые ткани можно путем применения пред-
варительной термо- или химиотерапии исходных растений.
Метод термотерапии применяется как в условиях in vivo, так и in vitro и
предусматривает использование горячего сухого воздуха. Для объяснения меха-
низма освобождения растений от вирусов в процессе термотерапии существуют
различные гипотезы. Согласно одной их них при высоких температурах разрушают-
ся белковая оболочка и нуклеиновая кислота вируса. Вторая гипотеза предпола-
гает действие высоких температур на вирусы через метаболизм растений. При та-
кой температуре начинает преобладать деградация вирусных частиц, а синтез их,
наоборот, уменьшается. Растения, подвергающиеся термотерапии, помещают в тер-
мокамеры, где температура в течение первой недели повышается с 25 до 37°С пу-
тем ежедневного увеличения температуры на 2 градуса. Все остальные режимы
обязательно поддерживаются в оптимальном состоянии: освещенность, высокая от-
носительная влажность воздуха, определенный фотопериод. Продолжительность
термостатирования зависит от состава вирусов и их термостойкости. Если для
гвоздики достаточно 10-12 недельного воздействия теплом, то для хризантемы
этот период превышает 12 недель.
Помимо положительного действия высоких температур на освобождение от виру-
сов , выявлено аналогичное влияние их на точку роста и процессы морфогенеза
некоторых цветочных культур (гвоздики, фрезии) в условиях in vitro. Высокие
температуры увеличивают коэффициент размножения на 50 - 60%, повышаю адапта-
цию пробирочных растений к почвенным условиям и позволяют получить больше
безвирусных маточных растений.
Другой способ оздоровления - химиотерапия. В питательную среду, на которой
культивируют апикальные меристемы, добавляют препарат вирозола в концентрации
20 - 50 мг/л. Это противовирусный препарат широкого спектра действия. Приме-
нение его позволяет увеличить число безвирусных растений с 40% до 80 - 100%.
СОЗДАНИЕ ИСКУССТВЕННЫХ АССОЦИАЦИЙ
КУЛЬТИВИРУЕМЫХ КЛЕТОК
ВЫСШИХ РАСТЕНИЙ С МИКРООРГАНИЗМАМИ
Цели создания ассоциаций
Создание искусственных ассоциаций - новое, сравнительно молодое направление
клеточной инженерии по получению новых клеток и клеточных систем путем введе-
ния микроорганизмов в клетки или в популяции культивируемых клеток растений.
Экспериментальные клеточные системы называются ассоциациями.
Ассоциации могут быть как внутриклеточные (эндосимбиотического типа), так и
межклеточные (экзосимбиотического типа).
В первом случае микроорганизмы вводят в изолированные протопласты высших
растений. Во втором - совместно культивируют клетки и ткани растений с микро-
организмами .
При создании ассоциаций предполагается, что клетки и их популяции должны
приобретать новые свойства, обусловленные присутствием в них микроорганизмов.
Цели создания популяций:
1. Экспериментальная проверка гипотезы теории симбиотического происхождения
эукариотической клетки, которое предположительно проходило через стадии эндо-
и экзосимбиоза. Реконструкция отдельных стадий эволюционного процесса симбио-
генеза.
2. Моделирование природных симбиотических отношений растений и микроорга-
низмов, играющих огромную роль в процессе фиксации атмосферного азота (обес-
печение связанным азотом природных экосистем, а также агроценозов).
3. Повышение продуктивности растительных клеток-продуцентов экономически
важных веществ.
4. Получение растений с новыми свойствами, при условии, что отношения,
складывающиеся между клетками партнеров при совместном выращивании, сохраня-
ются в растениях-регенерантах. В литературе обсуждаются возможность улучшения
таким способом сельскохозяйственных растений, а также получение растений со
способностью к автономной фиксацией азота.
Первые две цели имеют значение для решения теоретических вопросов биологии,
последние две носят ярко выраженный прикладной характер.
Повышение продуктивности сельскохозяйственных растений
Одна из целей культивирования растительных клеток - получение важных для
медицины и ряда отраслей промышленности веществ. Для того чтобы производство
было рентабельным, необходимо культивировать их на простых по составу пита-
тельных средах. В то же время, среды достаточно сложны по составу и включают
в себя витамины, гормоны, источники углеродного питания, так как клетки в
культуре являются гетеротрофами или обладают ограниченной способностью к фо-
тосинтезу. Совмещение в культивируемых клетках способности к фотосинтезу и
биосинтезу специфических продуктов - маловероятно. Поэтому введение в такие
культуры микроорганизмов, синтезирующих субстраты для роста растительных кле-
ток или предшественники для биосинтеза полезных веществ представляется весьма
заманчивым.
В микробиологии опыт смешанного культивирования есть. Он показывает, что
системы микроорганизмов более эффективны, чем монокультуры. Их используют для
очистки сточных вод, получения ферментов, биологически активных веществ (аук-
сины, витамины, антибиотики). Считается, что в биотехнологии найдут примене-
ние смешанные популяции, включающие в себя как сочетания нескольких штаммов
микроорганизмов, так и представителей царств растений и животных.
Улучшение сельскохозяйственных растений предполагает получение растений,
способных к фиксации молекулярного азота.
При внесении удобрений используется от 30 до 50% внесенного азота. Другой
путь поступления азота - биологическая фиксация молекулярного азота. Большая
часть осуществляется азотфиксирующими симбионтами, но этот процесс характерен
лишь для некоторых видов высших растений и микроорганизмов. Для повышения до-
ли биологической фиксации азота используют 3 подхода:
1. Инокуляция азотфиксирующими микроорганизмами (бактериальные удобрения).
Недостаток - низкая выживаемость интродуцируемых чистых культур и вытеснение
их естественной почвенной микрофлорой.
2. Создание азотфиксирующих растений методами генной инженерии. При этом
предлагается вводить гены nif в протопласты высших растений. Препятствия на
этом пути: процесс требует большого количества энергии, которой нет в расти-
тельной клетке, нет также систем транспорта, запасов железа и молибдена, не-
обходимых для синтеза нитрогеназы, нет систем защиты нитрогеназы от инактива-
ции кислородом.
3. Введение целых азотфиксирующих организмов в растения. Такие ассоциации
должны учитывать особенности организации природных азотфиксирующих симбиозов:
- целостность обоих партнеров,
- интеграция партнеров в пределах организма макросимбионта,
- относительная обособленность макросимбионта.
С помощью клеточной инженерии можно осуществить жизнедеятельность азотфик-
сирующих организмов в клетках и тканях культурных растений. При этом возможна
проверка большого числа сочетаний партнеров. В процессе культивирования воз-
можна также адаптация партнеров друг к другу. Кроме того, бактериальные сим-
бионты могут быть интегрированы в ткани растений с сохранением их интактно-
сти, что позволит оградить нитрогеназу от кислорода, выделяемого растением в
процессе фотосинтеза.
В настоящее время эти положения могут быть подтверждены рядом эксперимен-
тов .
Создание эндосимбиотических
ассоциаций
В изолированные протопласты растений вводили микроорганизмы следующих сис-
тематических групп: бактерии, дрожжи, цианобактерии, цианеллы.
Существует несколько способов введения микроорганизмов в протопласты (рис.
24) :
1. Эндоцитоз (инвагинация плазмалеммы), при этом везикула с микроорганизмом
высвобождается в цитоплазме протопласта.
2. Интеграция (слияние) мембран протопласта и микроорганизма, органеллы во-
дорослей высвобождаются в цитоплазму протопласта, но при этом они не окружены
плазмалеммой протопласта.
3. Заключение микроорганизма в искусственные мембраны - липосомы. Например,
в протопласты лука вводили цианобактерии, заключенные в липидные капли.
Каждый из методов имеет свои достоинства и недостатки. В первом случае ве-
зикулы окружены цитоплазматической мембраной протопласта, в результате чего
может произойти слияние с лизосомами и разрушение микроорганизма.
Во втором случае происходит нарушение целостности микроорганизма: в цито-
плазме оказываются органеллы.
а) эндоцитоз (поглощение путем инвагинации мембраны)
в) слияние мембраны протопласта с липосомой
Рис. 24. Введение микроорганизмов в изолированные протопласты
высших растений (по L. Folke, O.Gamborg, 1981)
В третьем случае в цитоплазме оказываются интактные микроорганизмы, что яв-
ляется одним из условий воспроизведения естественного симбиоза. Такого же ре-
зультата можно достичь используя метод микроинъекций (например - цианобакте-
рий) в пространство между стенкой и плазмолированной клеткой лука. Этот спо-
соб можно рассматривать либо как стадию перед попаданием бактерий в цитоплаз-
му , либо как получение ассоциаций межклеточного типа.
К сожалению, жизнеспособных систем на основе изолированных протопластов в
настоящее время не получено, так как в процессе культивирования происходило
разрушение либо микроорганизма, либо протопласта. Необходимы дальнейшие ис-
следования .
Экзосимбиотические
ассоциации
Партнеры те же, в основном - азотфиксаторы (Rhizobium, Azotobacter,
Azospirillum), Chlorella и различные виды грибов. Общий принцип создания та-
ких ассоциаций - совместное культивирование клеток растений с микроорганизма-
ми. Способы ведения микроорганизмов в культуру могут быть различны: внесение
микроорганизмов непосредственно в культуру; высев на поверхности агара рядом
с каллусом, но без соприкосновения; разделение бактериальных клеток и культу-
ры мембранами, обеспечивающими обмен продуктами метаболизма, но не допускаю-
щими контакта между партнерами.
Рассмотрим результаты попыток создания ассоциаций с различными партнерами.
Ассоциации с клубеньковыми
бактериями
Сначала создавались упрощенные модельные системы для изучения симбиоза бо-
бовых растений с клетками растений. Каллусную ткань сои инфицировали клетками
Rhizobium. Были получены подобия инфекционных нитей и бактероидов в каллусной
клетке. В таких ассоциациях клетки бактерий проявляли нитрогеназную актив-
ность (НГА, отсутствующую в чистой культуре. Это свидетельствовало о процессе
азотфиксации.
Далее были созданы и азотфиксирующие ассоциации Rhizobium с культурами тка-
ней небобовых растений. В таких ассоциациях клетки бактерий были локализованы
на поверхности растительных клеток, проникали вглубь каллуса по межклетникам
и изредка обнаруживались внутри клеток. В основном сохраняли палочковидную
форму без образования бактероидов. В большинстве таких экспериментов бактери-
альные клетки угнетали рост растительных и усиливали их отмирание. Сообщения
о положительном взаимном влиянии единичны. Есть одна удачная попытка регене-
рации растений табака из ассоциации каллусной ткани с Rhizobium.
Ассоциации со свободноживущими
азотфиксаторами
Azotobacter, Azospirillum живут в ризосфере растений и иногда образуют с
ними ассоциации. Главная задача проведения экспериментов с этими бактериями -
получение эффективных азотфиксирующих систем, растущих на среде без связанно-
го азота, с перспективой регенерации растений.
В таких экспериментах была обнаружена видовая специфичность. Каллусные
культуры табака, проса быстро "обрастали" Azospirillum, но через 4 недели по-
гибали. Ткань сахарного тростника субкультивировали в аналогичных условиях 18
месяцев, при этом стабильные ассоциации формировались только на среде с низ-
ким содержанием связанного азота или без него. Бактерии проявляли НГА во всех
случаях.
И Azotobacter, и Azospirillum в соответствующих ассоциациях были локализо-
ваны на поверхности или в межклетниках и никогда не проникали внутрь клетки.
Растения-регенеранты пока не получены.
Ассоциации с зелеными
водорослями
Каллус моркови инокулировали одним из штаммов Chlorella, культивировали на
свету на среде с дефицитом азота, каллус жил несколько месяцев. Контрольные
же растения погибали. Клетки водоросли не проникали внутрь растительных.
Ассоциации с грибами
Ткань руты раздельно культивировали с различными грибами, при этом на клет-
ки растений влияли диффундирующие через агар выделения гриба. В некоторых
случаях добавляли культуральную жидкость грибов. Совместное культивирование с
Botritis allii увеличивало синтез алкалоидов в 10 раз по сравнению с контро-
лем, а добавление культуральной жидкости - в 50 раз.
Цианобактерии в
искусственных ассоциациях
с растительными клетками
Цианобактерии как партнеры в искусственных ассоциациях имеют ряд особенно-
стей:
- предполагают, что древние цианобактерии сыграли роль в формировании эука-
риотической клетки;
- чаще других фототрофов вступают в симбиотические отношения с другими ор-
ганизмами в природе;
- в симбиозах осуществляют различные метаболические функции: с автотрофами
играют роль азотфиксаторов, с гетеротрофами обеспечивают партнеров продуктами
фотосинтеза;
- способны выделять в среду углеводы, аминокислоты, пептиды, витамины, гор-
моны ;
- в процессе фотосинтеза выделяют кислород, которые растения в процессе ды-
хания потребляют;
- находят практическое применение в улучшении обеспечения растений связан-
ным азотом.
Препятствием могут служить различные требования к условиям культивирования:
у клеток растений оптимум pH 5 - 5.5, а цианобактерий нейтрально-щелочной (7
- 10) ; для растительных клеток температурный оптимум 24 - 27°С, для бактерий
- 30 - 40°С; концентрация минеральных солей в среде для выращивания расти-
тельных клеток выше, чем требуется для цианобактерий.
В исследованиях, проведенных на кафедре клеточной физиологии и иммунологии
МГУ, проверялись различные сочетания партнеров, с использованием как каллус-
ных, так и суспензионных культур. Был отмечен ряд физиологических реакций: от
ингибирования одного партнера другим до взаимной стимуляции процессов жизне-
деятельности .
В суспензионных культурах клеток табака и АпаЬаепа nidulans отмечено сле-
дующее :
- взаимная стимуляция роста, когда в условиях, неоптимальных для роста каж-
дого компонента системы, происходила взаимная стимуляция;
- двухфазность ростовых процессов: за пиком роста цианобактерий следует пик
роста растительных клеток, сопровождающийся частичной деградацией цианобакте-
рий. Предполагается, что в первой фазе роста отношения партнеров носят харак-
тер мутуализма;
- цианобактерии адсорбируются на поверхности клеток, проникают вглубь кле-
точных агрегатов, но часть партнеров остается в суспензии в свободном состоя-
нии;
- растительные клетки потребляют продукты фотосинтеза цианобактерий;
- между клетками растений и микроорганизмов устанавливаются метаболические
взаимодействия, которые могут привести к стимуляции видоспецифических биосин-
тезов растительных клеток.
Ассоциации каллусных тканей с цианобактериями получали двумя способами:
- использовали изолированные протопласты, выделенные из дефицитных по хло-
рофиллу участков мезофилла листа,
- использовали каллус, выделенный из бесхлорофильного участка листа, к ко-
торому подсевали суспензию A.variablis.
При этом каллусные культуры стабильно росли не менее 2 лет. Антагонизма не
было.
Добавляя в среду ауксины и цитокинины, удалось вызвать органогенез у каллу-
са табака, ассоциированного с цианобактерией. Сформировались белые побеги ре-
генерантов табака с участками сине-зеленого цвета, содержащими бактерии. В
регенерантах из каллуса цианобактерии имели внутритканевую локализацию и об-
наруживались только в листьях. Их также находили на поверхности листа, стебля
(рис. 25), в сосудистой системе, устьицах.
Результаты по получению ассоциаций цианобактерий с растениями - регенеран-
тами представляют интерес в связи с проблемой повышения доли биологически
связанного азота в азотном питании растений.
Рис 25. Цепочки Anabaena variabilis в углублениях складчатой по-
верхности стебля табака (по Р. Г. Бутенко и др., 1987)
МЕТОДЫ СОХРАНЕНИЯ
ГЕНОФОНДА
При получении клеточных линий с полезными признаками встает проблема сохра-
нения этих признаков. Растения могут хранить генетическую информацию в семе-
нах, однако этот источник не вполне надежен, так как со временем из-за мута-
ций всхожесть семян падает. Кроме того, некоторые растения размножаются толь-
ко вегетативно. Этим обусловлена необходимость сохранения части материала in
vitro. С другой стороны, в некоторых случаях удается получить новые клеточные
линии, синтезирующие большее количество вторичных метаболитов, то есть более
продуктивные, которые тоже нуждаются в сохранении.
Для исследования физиологических и биохимических процессов, протекающих в
тканях, также требуются стандартные исходные культуры, чем вызвана необходи-
мость сохранять материал в течение определенного промежутка времени, когда
идут серийные эксперименты. Все это делает проблему сохранения генофонда
весьма актуальной.
Можно, конечно, пассировать и перевивать клеточные культуры. Однако при
этом возникает опасность сомаклональной изменчивости, накопления мутаций,
контаминаций (заражения чужеродным генетическим материалом). Это также требу-
ет определенных финансовых и трудовых затрат (необходимость частых пересадок,
расходы, связанные со средой и т.д.). Цель исследователей состоит в увеличе-
нии интервала между пересадками. Существует разные подходы к сохранению куль-
тур:
криосохранение
замедление роста
- сушка (распылительная и лиофильная) - для клеток микроорганизмов.
Криосохранение
Криосохранение - замораживание при сверхнизких температурах. Обычно его
проводят в жидком азоте, при температуре -196оС.
Успех низкотемпературной консервации зависит от ряда факторов:
- вид и тип клеток,
- их концентрация в суспензии,
- состав среды для консервирования,
- вид и концентрация криопротектора,
- режим охлаждения и отогрева,
- способ реабилитации клеток после отогрева.
Существенную роль в успешном замораживании клеток играет их морфофизиологи-
ческое состояние: клетки, находящиеся в стационарной фазе роста, менее устой-
чивы к повреждающему действию низкотемпературной консервации, чем клетки, на-
ходящиеся в экспоненциальной фазе роста. Клетки для замораживания отбирают в
середине экспоненциальной фазы ростовой кривой.
Немаловажное значение имеет и плотность замораживаемой суспензии. Оптималь-
ные результаты по восстановлению клеток были получены при замораживании кле-
точной суспензии плотностью 1*105 - 5*106 клеток в 1 мл.
Для растительных клеток часто требуется предварительное культивирование в
особых условиях. В среду добавляют различные вещества, например:
- 2-6% маннит или сорбит для уменьшения размера вакуолей;
- аминокислоты, в первую очередь пролин, который служит для связывания воды
в клетке (концентрация до 1 моля или 11,5%) , аспарагин, у-аминомаслянУЕ° ки-
слоту ;
- диметилсульфоксид (ДМСО), который добавляют к среде для предкультивирова-
ния в концентрации от 2,5 до 10% на 48 часов для увеличения проницаемости ци-
топлазматической мембраны;
- кроме того, применяют искусственное закаливание к холоду, когда снижают
температуру культивирования, имитируя естественный осенний процесс подготовки
к периоду зимнего покоя (применим только для растений умеренного климата).
Клеточные культуры выдерживают несколько суток при температуре +8 - +10оС, а
затем при +2 - +5оС в течение 1-6 недель.
Процесс замораживания растительных клеток от животных отличает, в основном,
наличие этапа предварительного культивирования.
Криопротекторы - вещества, позволяющие снизить повреждающее действие физи-
ко-химических факторов при криоконсервировании. К ним относятся сахароза,
декстран, этиленгликоль, поливинилпирролидон, диметилсульфоксид (ДМСО), гли-
церин. Для определения токсичности криопротектора клетки выдерживают при ком-
натной температуре в различных его концентрациях в течение 30 - 50 минут, по-
сле чего определяют их жизнеспособность. Дополнительно оценивают его протек-
тивные свойства путем пробного замораживания и оттаивания культур. Наиболее
часто в качестве криопротекторов используют глицерин и ДМСО. Перед добавлени-
ем криопротектора суспензию клеток концентрируют путем центрифугирования, на-
досадочную жидкость сливают. Криопротекторы вносят в культуру за час до замо-
раживания, что приводит к изменению проницаемости мембраны, изменению точки
замерзания и оттаивания.
Программы охлаждения могут быть различными, но для всех них характерна мед-
ленная скорость охлаждения. При замораживании происходит образование льда
внутри и снаружи клеток. Характер этих изменений зависит от изучаемого образ-
ца и обработки криопротекторами, но главным образом, от скорости охлаждения.
При медленном охлаждении происходит образование внеклеточного льда, приводя-
щее к обезвоживанию клетки до того, как будет достигнута точка замерзания ци-
топлазмы. При быстром охлаждении клетки быстрее замораживаются изнутри, мед-
леннее обезвоживаются, что приводит к образованию кристаллов льда внутри
клетки. В этом случае клетки повреждаются. Обычно охлаждение проводят в два
этапа (рис. 26):
Рис. 26. Замораживание клеток: а) быстрое, б) медленное, поэтапное
1. От +20 до -28оС со скоростью 1 градус в минуту (для растительных клеток
скорость замораживания 0,5 градуса в минуту до -35°С) , выдерживают при этой
температуре 15 минут.
2. Погружение в жидкий азот (мгновенное охлаждение до - 196°С) .
Замораживание производят в специальных аппаратах. При их отсутствии - на
спиртовой бане (0,5 - 1 литр спирта наливают в термос с металлической колбой,
погружают в него ампулы на 15 минут и добавляют при помешивании жидкий азот
или сухой лед; доводят температуру до -32°С (температура должна быть не выше
-28 и не ниже -32°С) . Далее переносят ампулы в жидкий азот.
При размораживании ампулы пинцетом переносят в водяную баню с температурой
+37 - +40°С, ампула объемом в 1 мл размораживается в течение 0,5 - 1 минуты.
После размораживания клетки отмывают либо в ростовой среде (животные), либо
в поддерживающей среде. Растительные клетки также можно отмывать 3 - 10% рас-
твором сахарозы.
Далее клетки проверяют на жизнеспособность с помощью витальных красителей,
окрашивающих мертвые клетки. Окончательным критерием служит четкое возобнов-
ление роста на стандартных питательных средах, используемых для данной куль-
туры.
Перевиваемые культуры животных клеток после размораживания имеют повышенную
чувствительность к вирусам, которая проявляется в течение первых двух пасса-
жей. Далее чувствительность возвращается к исходной.
Замедление роста
Замедления роста можно добиться следующими методами:
1. Хранение под слоем минерального масла (для бактериальных и грибных куль-
тур) .
2. Изменение газового состава и атмосферного давления внутри культурального
сосуда.
3. Изменение светового режима.
4. Охлаждение до температуры прекращения активного роста.
5. Применение гормональных и осмотических ингибиторов. Из гормональных ин-
гибиторов наиболее часто используют хлорхолинхлорид (для растительных кле-
ток) , из осмотических - маннит в концентрации 3-6%.
6. Замена СаС1г на Са(ЫОз)2 в питательных средах.
Для картофеля в качестве способа, позволяющего сохранить генофонд, рекомен-
дуется клубнеобразование в пробирках.
БЕСКЛЕТОЧНЫЕ СИСТЕМЫ
Мембраны хлоропластов
Американский ученый М. Кальвин, чьи исследования в области изучения меха-
низма фотосинтеза были отмечены Нобелевской премией, в 1972 году выдвинул
идею создания фотоэлемента, в котором в качестве источника электрического то-
ка служили мембраны хлоропластов. Основной компонент таких мембран - хлоро-
филл, способный при освещении отдавать и принимать электроны. В качестве про-
водника, контактирующего с хлорофиллом, Кальвин использовал оксид цинка. Мем-
браны, содержащие хлорофилл, помещали в раствор ферментов, действующих как
катализаторы ЭТЦ. На свету происходит фотолиз воды: Н20 -> Н2 + 1/2 02. При ос-
вещении этой системы в ней также возникал электрический ток плотностью 0,1
мкА на см2. Такой фотоэлемент функционировал недолго, поскольку хлорофилл
вскоре терял способность отдавать электроны. Для того чтобы продлить время
действия фотоэлемента, был использован дополнительный источник электронов -
гидрохинон. В такой системе хлорофилл отдавал не только свои электроны, но и
электроны гидрохинона. Полученный таким образом фотоэлемент площадью 10 м2
может обладать мощностью 1 кВт.
Японский ученый Фудзио Такахаси для получения электроэнергии использовал
хлоропласты из листьев салата. Транзисторный приемник, к которому была при-
соединена такая солнечная батарейка, успешно работал.
Если из системы убрать проводник и индуцировать образование водорода и ки-
слорода , то система может служить также прототипом фотореактора, при помощи
которого энергия Солнца запасается в ценном топливе - водороде.
Преимущества системы:
- наличие избытка субстрата - воды,
- нелимитируемый источник энергии - Солнце,
- продукт (водород) можно хранить, не загрязняя атмосферу,
- продукт имеет высокую теплотворную способность (29 ккал/г) по сравнению с
углеводородами (3,5 ккал/г),
- процесс протекает при нормальной температуре без образования промежуточ-
ных токсических веществ,
- процесс циклический, так как при окислении продукта образуется субстрат -
вода.
Мембраны хлоропластов можно иммобилизовать, закрепляя их в геле.
Получение фотогальванических
элементов с использованием
бактериальных мембран
Другой механизм превращения энергии существует у галофильных бактерий.
Halobacterium halobium используют энергию света, поглощаемую пурпурным пиг-
ментом бактериородопсином, находящимся в мембране клеток. Этот белок с не-
обычными свойствами был выделен и описан в 1973 году У. Стохениусом и Д. Ос-
терхельтом. С его помощью бактерии улавливают энергию Солнца. Поглощение све-
та вызывает химические и физические превращения в молекуле пигмента, приводя-
щие к переносу протонов с одной стороны мембраны на другую, при этом создаёт-
ся электрохимический градиент. Разность потенциалов может быть использована
для генерирования электрического тока.
Бактериородопсин несложно выделить из бактерий. Для этого бактерии помещают
в воду, где они переполняются водой25 и лопаются. Мембраны, содержащие бакте-
риородопсин, не разрушаются в воде из-за прочной упаковки молекул пигмента,
которые образуют белковые кристаллы - так называемые фиолетовые бляшки. В них
молекулы бактериородопсина объединены в триады, а триады - в правильные шес-
тиугольники. Бляшки крупные, легко отделяются центрифугированием. После про-
мывания осадка получается паста фиолетового цвета. На 75% она состоит из бак-
териородопсина и на 25% из фосфолипидов, заполняющих промежутки между белко-
выми молекулами.
Бактериородопсин устойчив к факторам внешней среды: не утрачивает актив-
ность при нагревании до 100°С, хранится в холодильнике годами, устойчив к ки-
слотам и химическим окисляющим агентам. Устойчивы и фосфолипиды фиолетовых
бляшек.
H.halobium можно культивировать в водоемах с высокой концентрацией хлори-
стого натрия и других минеральных солей. Из 10 литров бактериальной культуры
получают 0,5 грамма мембран, содержащих 100000 молекул пигмента. Бактериоро-
допсин осаждают с помощью катионов кальция или другим способом. Пигмент можно
фиксировать на подложках, обладающих физическими и химическими свойствами для
транспорта протонов, и создавать на их основе системы, генерирующие электри-
ческий ток. При освещении таких систем на мембране обнаруживается электриче-
ский потенциал, то есть бактериородопсин функционирует как генератор электри-
ческого тока. В лаборатории В. П. Скулачева были созданы фотогальванические
элементы для генерирования тока силой 800 мкА. В них применялись мембранные
фильтры, пропитанные фосфолипидами с бактериородопсином и хлорофиллом. Такие
фильтры, соединенные последовательно, могут служит в качестве электрической
батареи.
Бесклеточные
белоксинтезирующие
системы (ББСС)
ББСС используются для изучения матричной активности иРНК и анализа трансли-
руемых с них полипептидов. В их состав входят: рибосомы, матрица (искусствен-
ная или природная РНК) , белковые факторы трансляции, аминоацил т-РНК, АТФ,
одновалентные и двухвалентные катионы (К, Са), буферный раствор для поддрежа-
ния гомеостаза, аминокислоты. В генной инженерии бесклеточные белоксинтези-
рующие системы используются для исследования кодирующего потенциала и меха-
низмов экспрессии клонированных генов in vitro, и на промежуточных этапах
конструирования рекомбинантных генов для идентификации мРНК или фрагментов
ДНК по кодируемым белкам.
По происхождению компонентов ББСС можно классифицировать как прокариотиче-
ские и эукариотические. Наиболее распространенные прокариотические белоксин-
тезирующие системы - на основе экстрактов из кишечной палочки (E.coli). Из
эукариотических белоксинтезирующих систем для трансляции матриц эукариот при-
меняют 2 основные системы: из ретикулоцитов кролика и из зародышей пшеницы.
Эти системы являются универсальными, в них можно транслировать любые матрицы.
25 Имеется в виду За счет разности осмотических давлений внутри и снаружи клетки. Для боль-
шинства бактерий это крайне трудно сделать без специальных мер, иначе бы не требовались
средства антисептики.
Для проведения анализа готовят реакционную смесь, состоящую из ретикулоцит-
ного лизата или экстракта зародышей и смеси аминокислот, меченых аминокислот,
АТФ, буфера, матричной РНК и других компонентов. Смесь инкубируют, после чего
проверяют включение метки во вновь синтезированные белки (по радиоактивности)
и тестируют белки с помощью электрофореза.
Трансляция in vitro полезна при уточнении роли отдельных компонентов систе-
мы синтеза белка, так как их можно удалять и добавлять по мере необходимости.
Ее использование помогает при расшифровке генетического кода. В некоторых
бесклеточных системах транслируют предварительно очищенную мРНК или использу-
ют эндогенную мРНК, присутствующую в полисомах. В других белоксинтезирующих
системах - системах сопряженной транскрипции и трансляции, - синтез мРНК и ее
трансляция рибосомами идут одновременно. В качестве матричной РНК также ис-
пользуются искусственные полинуклеотиды известного состава. В настоящее время
механизмы трансляции in vitro применяются и для определения механизмов рас-
пределения белка по различным внутренним компартаментам. Подробнее можно по-
читать здесь: бесклеточные системы синтеза белка
ЛИТЕРАТУРА К РАЗДЕЛУ
«КУЛЬТУРЫ РАСТИТЕЛЬНЫХ КЛЕТОК»
1. Артамонов В.И. Биотехнология - агропромышленному комплексу. М.: Наука,
1989. 160 с.
2. Артамонов В.И. Сельские профессии биотехнологии. М. : Изд-во МСХА,
1992. 127 с.
3. Атанасов А. Биотехнология в растениеводстве. Новосибирск: ИЦ и Г СО
РАН, 1993. 241 с.
4 . Баулина О.И., Лобакова Е.С., Корженевская Т.Г., Бутенко Р.Г., Гусев
М.В. Ультраструктура клеток женьшеня и цианобактерии Chlorogloepsis fritschii
в ассоциации при культивировании в темноте. // Вестник Московского универси-
тета. Сер. Биология. 1995. №2. С. 3 - 16.
5 . Бекер М.Е., Лиепиньш Г.К., Райпулис Е.П. Биотехнология. М. : Агропром-
издат, 1990. 334 с.
6. Беккужина С.С., Никифорова И.Д. Клональное размножение и тестирование
на солеустойчивость растений - регенерантов яровой пшеницы. // Новые методы
биотехнологии растений. Тез. II российского симпозиума. Пущино, 1993. С. 113.
7. Биотехнология. / Под ред. А.А. Баева. М.: Наука, 1984. 309 с.
8. Биотехнология сельскохозяйственных растений. М. : Агропромиздат, 1987.
С.241 - 244.
9. Блинов А.Г. Бесклеточные белоксинтезирующие системы. // Методы молеку-
лярной генетики и генной инженерии. Новосибирск: Наука, 1990. С. 80 - 86.
10. Борисюк Н.В. Молекулярно - генетическая конституция соматических гиб-
ридов. // Биотехнология. Итоги науки и техники ВИНИТИ АН СССР. М. , 1988. Т.
9. С. 73 -113.
11. Борнман X. Реконструкция клеток растений: Brassica в качестве объекта
изучения. // Биология культивируемых клеток и биотехнология растений. М. :
Наука, 1991. С. 85 - 95.
12. Бутенко Р.Г. Изолированные протопласты растений - объект и модель для
физиологических исследований. // Культура клеток растений. М. : Наука, 1981.
С. 69 - 84.
13. Бутенко Р.Г. Клеточные технологии для получения экономически важных
веществ растительного происхождения. // Культура клеток растений и биотехно-
логия. М.: Наука, 1986. С. 3 - 20.
14. Бутенко Р.Г. Культура изолированных тканей и физиология морфогенеза
растений. М.: Наука,1964. 272 с.
15. Бутенко Р.Г. и др. Клеточная инженерия. - М.: Высшая школа, 1987.
16. Валиханова Г. Ж. Биотехнология растений. Алматы: Конжык, 1996. 272 с.
17. Валиханова Г.Ж., Рахимбаев И.Р. Культура клеток и биотехнология рас-
тений. Учебное пособие. Алма-Ата: изд. КазГУ, 1989. 80 с.
18. Высоцкая О.Н. Длительное сохранение in vitro коллекции растений зем-
ляники. // Физиология растений. 1994. Т. 41, № 6. С. 935 - 941.
19. Высоцкий В.А. Клональное микроразмножение растений. // Культура кле-
ток растений и биотехнология. М.: Наука, 1986. С. 91 - 102.
20. Глеба Ю.Ю. Гибридизация соматических клеток растений. // Культура
клеток растений. М.: Наука, 1981. С. 85 - 91.
21. Глеба Ю.Ю., Зубко М.К. Теоретические и прикладные аспекты клеточной
инженерии растений // Биотехнология. Итоги науки и техники ВИНИТИ АН СССР.
М., 1988. Т. 9. С. 3-72.
22. Глеба Ю.Ю., Сытник К.М. Слияние протопластов и генетическое конструи-
рование высших растений. Киев: Наук, думка, 1982. 104с.
23. Дмитриева Н.Н. Проблема регуляции морфогенеза и дифференциации в
культуре клеток и тканей растений. // Культура клеток растений. М. : Наука,
1981. С.113-123.
24. Зоринянц С.Э. Цитофизиологические характеристики и реорганизация ге-
нома длительно культивируемой суспензии клеток Triticum timopheevii. Автореф.
дисс... к.б.н. М., 1996. 24 с.
25. Калинин Ф.Л., Сарнацкая В.В., Полищук В.Е. Методы культуры ткани в
физиологии и биохимии растений. Киев: Науковадумка, 1980. 488 с.
26. Карабаев М. Культивируемые клетки пшеницы и кукурузы: физиологические
и биотехнологические аспекты. Автореф. дисс... д.б.н. М., 1994. 49 с.
27. Карначук Р.А. , Гвоздева Е.С. Влияние света на баланс фитогормонов и
морфогенез в культуре ткани зародышей пшеницы. // Физиология растений. 1998.
Т. 45, № 2. С. 289 - 295.
28. Катаева Н.В., Аветисов В.А. Клональное размножение в культуре ткани.
// Культура клеток растений. М.: Наука, 1981. С.137-149.
2 9 . Катаева Н.В., Бутенко Р.Г. Клональное микроразмножение растений. М.:
Наука, 1983. 96 с.
30. Кефели В.И., Дмитриева Г.А. Биотехнология: курс лекций. Пущино, 1989.
96 с.
31. Кирай 3., Барабаш 3. Результаты и перспективы использования биотехно-
логии в растениеводстве и защите растений. // Международный агропромышленный
журнал. 1990. № 3. С. 7 - 10.
32. Константинова Т.Н., Аксенова Н.П., Сергеева Л.И., Чайлахян М.Х. Вза-
имное влияние света и гормонов на регуляцию морфогенетических процессов в
культуре in vitro. // Физиология растений. 1998. Т. 34, № 4. С. 795 - 802.
33. Корженевская Т.Г., Бутенко Р.Г., Гусев М.В. Ассоциации цианобактерий
с культивируемыми клетками и тканями высших растений. // Культура клеток рас-
тений и биотехнология. М.: Наука, 1986. С. 225 - 242.
34. Кузьмина Н.А., Внукова В.В. Влияние состава питательной среды на хро-
мосомные числа твердой пшеницы (Triticum durum Desf.) in vitro. // Естествен-
ные науки и экология. Вып. 2. Омск: изд-во ОмГПУ, 1997. С. 28 - 33.
35. Кучко А.А. Гибридизация соматических клеток растений методом слияния
изолированных протопластов. // Культура клеток растений и биотехнология. М. :
Наука, 1986. С. 144 - 159.
36. Левенко Б.А., Сергеева Л.Е., Виноградов В.А., Ларькина Н.И., Миронов
Е.К. Отбор и анализ устойчивых к солевому и водному стрессу клеточных линий
табака и регенерантов из них. // Экспериментальная генетика растений в уско-
рении селекционного процесса. - Киев: Наукова думка, 1989. - с. 101-110.
37. Мамаева С.Е. Хромосомный анализ культивируемых клеток. // Методы
культивирования клеток. Л.: Наука, 1988. С. 78 98.
38. Методы клеточной биотехнологии растений. Киев, 1987. 53 с.
39. Методы молекулярной биологии, биохимии и биотехнологии растений. Ал-
ма-Ата: Наука, 1988. 168 с.
40. Милов Д., Изворска Н. Состояние и дальнейшее развитие работы с куль-
турами in vitro. // Международный агропромышленный журнал. № 2. 1990. С. 72 -
78.
41. Новак Ф.Й. Индукция гаплоидов в культуре тканей и их значение в се-
лекции растений. // Культура клеток растений и биотехнология. М. : Наука,
1986. С. 171 - 195.
42. Носов А.М. Регуляция синтеза вторичных соединений в культуре клеток
растений. // Биология кульивируемых клеток и биотехнология. М.: Наука, 1991.
С. 5 - 19.
43. Попов А.С. Криоконсервация клеток растений. // Методы культивирования
клеток. Л.: Наука, 1988. С. 70 - 77.
44. Родин А.Р., Калашникова Е.А. Использование методов клеточной и генной
инженерии для получения посадочного материала древесных пород. Учебное посо-
бие. М.: МГУЛ, 1993. 90 с.
45. Сельскохозяйственная биотехнология: Учеб. / В. С. Шевелуха, Е. А. Ка-
лашникова , С. В. Дегтярев и др. : Под ред. В. С. Шевелухи. М. : Высш. школа,
1998. 416 с.
46. Смоленская И.Н., Носов А.В. Методы получения и культивирования прото-
пластов. // Методы культивирования клеток.Л.: Наука, 1988. С. 164 - 175.
47. Уайт Ф.Р. Культура растительных тканей. М. : Иностранная литература.
1949. 160 с.
48. Урманцева В.В. Культивирование каллусных тканей на твердых средах. //
Методы культивирования клеток. Л.: Наука, 1988. С. 232 - 241.
49. Цуцаева А.А. , Петренко Т.Ф. Криоконсервация культивируемых клеток жи-
вотных. // Методы культивирования клеток. Л.: Наука, 1988. С. 63 - 69.
50. Шегебаев 0.0., Абдуллаев К.К., Жамбакин К.Ж. Генетико-
битехнологические исследования в селекции пшеницы. // Биотехнология в селек-
ции селькохозяйственных культур. Алматы, 1993. С. 28 - 48.
51. Эмбриология растений: использование в генетике, селекции, биотехноло-
гии. М.: Агропромиздат, 1990. Т.2. 463 с.
52. Karabaev М. , Shegebaev О. Cultivated cells of wheat and maiz:
biotechnology and breeding. // Abstracts 5th International Wheat Conference
June 10-14, Turkey, Ankara, 1996. P. 366.
53. Kisaka H., Kisaka M. , Kanno A., Kameya T. Intergeneric somatic
hybridization of rice (Oryza sativa L.) and barley (Hordeum vulgare L.) by
protoplast fusion. // Plant Cell Reports. Vol. 17, № 5. 1998. P. 362-367.
54. Kumlehn J., Schieder 0. , Lorz H. In vitro development of wheat
(Triticum aestivum L.) from zygote to plant via ovule culture. // Plant Cell
Reports. Vol. 16. №10.1997. P. 663-667.
КУЛЬТУРЫ ЖИВОТНЫХ КЛЕТОК
КУЛЬТИВИРОВАНИЕ КЛЕТОК
История метода
Признание идеи о том, что клетки тканей высших животных можно выделить из
организма и затем создать условия для роста и воспроизводства их in vitro,
датируется первым десятилетием XX века. После того как стало известно, что
подобные процессы реальны, наступил второй этап работ, начало которому поло-
жила демонстрация возможности выращивания и репродукции в таких клетках
фильтрующихся инфекционных агентов—вирусов. Третий этап истории начинается со
времени, когда была показана практическая возможность получения в клетках жи-
вотных больших количеств вирусного материала для применения в вакцинных пре-
паратах, и простирается до времени, когда: 1) стало возможным вставить в
клетки специфические экзогенно полученные гены и получить их экспрессию и 2)
подтверждена возможность выращивания в культуре из одиночной клетки целой по-
пуляции. Когда такие популяции получали из клетки, выделявшей в окружающую
среду антитела, то все молекулы антител в надосадочной жидкости были одинако-
выми. Причины и следствия этих двух феноменов в настоящее время интенсивно
исследуются и они знаменуют собой начало четвертого этапа работ в данной об-
ласти .
Чтобы показать способность клеток животных расти и делиться в культуре, по-
требовалось овладеть рядом подходов и методик. Особенности их приведены ниже.
1. Методики получения клеток, свободных от экзогенных прокариотов и грибов.
2. Методики разработки среды, в которых рост «вырезанных из ткани» или
изолированных клеток не подавляется.
3. Методики наблюдения за клетками в динамике их развития.
4. Методики непрерывного культивирования культур клеток животных in vitro и
поддержания их свободными от других биологических агентов.
Научную основу для разработки этих методик составляет представление о клет-
ке как основном структурном элементе живых организмов животного и раститель-
ного происхождения. Идея о том, что клетки тканей животных можно выделить из
организма и затем создать условия для роста и воспроизводства их in vitro
возникла на базе концепции, принадлежащей Клоду Бернару. Он предположил, что
не только живые организмы способны сохранять постоянство внутренних условий,
вне зависимости от изменений в окружающей среде. Клетка вне организма живот-
ного тоже будет стремиться поддерживать свои внутренние условия. Если разли-
чия между внутренними и внешними условиями будут незначительными, то высока
вероятность роста и деления клетки. Такое понимание явления приводит к необ-
ходимости разработки сред, способных поддерживать и стимулировать рост клеток
вне организма.
Чуть позже, в 1885 году, У. Ру (W. Roux) показал возможность сохранения вне
организма живых тканей на практике. Он сохранял в жизнеспособном состоянии
оболочку куриного эмбриона в теплом физиологическом растворе. Впоследствии он
стал автором, активно публиковавшимся по проблемам эмбриологии in vitro.
Позднее, в 1897 г., Лёб (Loeb) поддерживал в жизнеспособном состоянии клетки
крови и соединительной ткани в пробирках с сывороткой и плазмой крови. Льюн-
грен (1898) показал возможность поддержания эксплантатов кожи человека в жиз-
неспособном состоянии в кислой среде с сохранением способности к реимпланта-
ции. Дополнительные эксперименты были проведены Джолли (1903), наблюдавшим
деление клетки в висячей капле, содержащей лейкоциты саламандры, а Биб и
Эвинг (1906) подтвердили это при пересадке лимфосаркомной ткани собаки.
Продолжая работы Ру, Росс Харрисон усовершенствовал методику «висячей кап-
ли». Он использовал небольшие кусочки ткани, отторгнутые от медуллярного со-
суда лягушки к внедренные в ее лимфатический тромб, и выдерживал их в виде
капли на нижней стороне покровного стекла, расположенного поверх углубления в
предметном стекле. В 1907 г. ему удалось наблюдать с помощью такой «камеры»
рост нервных клеток в течение нескольких недель; он установил, что скорость
роста этих клеток составляет 20 мкм за 25 мин. В то время как эксперименты
Харрисона были направлены на то, чтобы получить ответы на вопросы, относящие-
ся к физиологии нервных клеток лягушки, методика, которой он пользовался, бы-
ла применена Барроузом для других клеток тканей теплокровных животных. Этот
исследователь в 1910 г. вместо лимфатического тромба использовал тромб плазмы
курицы.
В 1913 г. Алексис Каррель применил плазму крови, обогащенную экстрактом эм-
бриона . Добавка такого экстракта ускоряла рост тканей. Примененная методика
обеспечивала значительно большую вероятность успеха, чем та, которую исполь-
зовали Левис (1911) и Рид (1908 г.). Рид готовила культуры клеток из костного
мозга морской свинки и пыталась выращивать эксплантаты на среде определенного
химического состава. Работа Карреля привлекла большое внимание, так как она
была опубликована под интригующим названием — культивирование «бессмертных»
клеток. Инкубация клеток сердца куриною эмбриона была начала 17 января 1912
г. Пересев клеток продолжил Эблинг, как он сам заявлял, работая с ними 34 го-
да . Поскольку Каррель был хирургом и весьма сведущим в вопросах асептики, он
смог внести существенный вклад в культивирование клеток животных in vitro. В
то же время организация и технические условия проводимых экспериментов были
очень громоздкими. Ассистенты Карреля были одеты в длиннополые резиновые ха-
латы темного цвета с капюшонами для полного прикрытия головы. Процедуры были
длительными и отягощенными многими деталями. В результате тех требований, ко-
торые выдвигались автором в отношении сложных мер предосторожности для пре-
дотвращения контаминации, вокруг данного предмета создалась атмосфера таинст-
венности и исключительности, что скорее тормозило прогресс, чем способствова-
ло ему. Тем не менее, им было достигнуто многое. В частности, даже при отсут-
ствии антибиотиков он добился успеха в пересадке клеток, используя хирургиче-
скую технику для отторжения отдельных колоний и переноса их в новые условия
роста. Каррель также продемонстрировал своим коллегам научное значение тех
наблюдений, которые могут быть сделаны в процессе пересадки клеток.
В ходе проделанных работ был внесен ряд поправок в рецептуру среды культи-
вирования. В частности, Тирод модифицировал раствор Рингера и в дополнение к
куриной сыворотке и эмбриональному экстракту стал использовать коагулят фиб-
рина. Для наблюдения за делящимися клетками животных Канти в 1928 г. разрабо-
тал метод кинофотомикрографии. В этот же период был разработан дополнительный
и очень существенный подход в технике работы с клетками. Имеется в виду при-
менение трипсина для высвобождения клеток из тканевой матрицы, в которой они
находятся. Однако эта методика не находила признания до тех пор, пока в 1937
г. Симмс и Стидлман использовали ее для пассирования клеток между культурами
плазмы. Эта методика дает возможность успешно применять в культурах индивиду-
альные клетки, а не ткани.
Впервые клоны клеток в культуре из одиночной клетки были получены Эрлом с
сотрудниками в 1948 году. Игл (1955) систематически исследовал пищевые по-
требности клеток в условиях. До тех пор пока в 1961 г. Хейфлик и Мурхед не
выделили линию диплоидных клеток человека (НДС) WI-38, считалось, что один
раз установившаяся клеточная линия имеет неограниченное время жизни. Относи-
тельно линии WI-38 было показано, что период ее существования в культуре ог-
раничивается приблизительно 50 удваиваниями популяции. Перед отмиранием попу-
ляции для клеток этой линии характерен феномен старения. Однако при отмирании
эти клетки оставались диплоидными и не имели признаков злокачественных изме-
нений. Клетки, выделенные из раковых опухолей или трансформированные в ходе
культивирования, характеризуются «бессмертностью» и коррелируют с гетеропло-
идностью. Первые суспензионные культуры клеток животных, как правило, основы-
вались на клетках злокачественных тканей. Это — клетки HeLa, выделенные из
раковой опухоли шейки матки человека. Перевиваемая линия карциномы шейки мат-
ки была выделена еще в 1952 году Джеем с сотрудниками, она используется и в
настоящее время во многих лабораториях мира.
Последующий этап в истории культивирования диплоидных клеток человека свя-
зан с установлением факта, что они являются генетически стабильными и свобод-
ными от всех известных латентных и онкогенных вирусов. Поэтому линии диплоид-
ных клеток человека разрешено применять для получения продуктов, предназна-
чаемых для людей. Эта догма остается действующей и в настоящее время, хотя
новейшие открытия отчетливо показали присутствие в клетках, выделенных из
нормальных тканей, потенциальных онкогенов, идентичных тем, которые найдены в
таких известных онкогенных вирусах, как вирус саркомы Рауса и вирус саркомы
Молони. Раус еще в 1910 году индуцировал опухоль, использовав профильтрован-
ный экстракт куриной опухоли. Эта опухоль была индуцирована РНК-вирусом (ви-
рус саркомы Рауса). Позднее было установлено, что ряд вирусов способен инду-
цировать возникновение опухолей, такие вирусы были названы онкогенными.
Введение клеток в
культуру, их происхождение
В соответствии с целями и задачами экспериментальной работы можно выделить
два направления культивирования животных клеток:
- культуры клеток;
- культуры органов и тканей (органные культуры).
Культуры клеток лишены структурной организации, теряют характерную гистио-
типическую архитектуру и связанные с ней биохимические признаки и обычно не
достигают равновесного состояния при отсутствии специальных условий. Клетки в
культурах размножаются, что обеспечивает получение большой массы клеток, за-
тем их идентифицируют (по фенотипическим признакам, путем выращивания в се-
лективной среде, генотипически), разделяют на идентичные параллели и, если
это необходимо, сохраняют. Динамические свойства культивируемых клеток часто
трудно контролировать, также трудно реконструировать in vitro некоторые кле-
точные взаимодействия, наблюдаемые in vivo. В связи с этим некоторые исследо-
ватели предпочитают использовать клеточные системы, сохраняющие структурную
целостность исходной ткани.
Список типов клеток, которые уже введены в культуру, достаточно велик. Это
элементы соединительной ткани человека (фибробласты), скелетные ткани (кость
и хрящи), скелетные, сердечные и гладкие мышцы, эпителиальные ткани (печень,
легкие, почки и др.), клетки нервной системы, эндокринные клетки (надпочечни-
ки, гипофиз, клетки островков Лангерганса), меланоциты и различные опухолевые
клетки.
Популяция клеток не всегда гомогенна и обладает фиксированным фенотипом.
Некоторые культуры, например, кератиноциты эпидермиса, содержат стволовые
клетки, клетки-предшественники и кератинизированные чешуйчатые клетки. В та-
кой культуре происходит постоянное обновление за счет стволовых клеток, про-
лиферация и созревание клеток-предшественников, а также необратимая дифферен-
цировка, сопровождающаяся "слущиванием" чешуйчатых клеток в культуральную
среду.
Какую ткань лучше брать для введения в культуру, взрослую или эмбриональ-
ную, нормальную или опухолевую? Культуры, полученные из эмбриональных тканей,
характеризуются лучшей выживаемостью и более активным ростом по сравнению с
соответствующими зрелыми тканями. Причиной этого служит низкий уровень спе-
циализации и наличие реплицирующихся клеток-предшественников в эмбрионах.
Пролиферативная способность взрослых тканей ниже, они содержат больше неделя-
щихся специализированных клеток. Получение первичных культур клеток взрослых
тканей и их размножение является более сложной задачей, продолжительность
жизни таких культур, как правило, невелика. Нормальные ткани дают начало
культурам с ограниченным временем жизни, тогда как культуры, полученные из
опухолей, способны пролиферировать неограниченно долгое время. Дифференциров-
ка нормальных клеток в культуре сопровождается обычно полным прекращением
пролиферации клеток. В культурах опухолевых клеток возможна частичная диффе-
ренцировка при сохранении способности к пролиферации.
Свежевыделенные культуры носят название первичных культур до начала пасси-
рования или субкультивирования. Клетки первичной культуры обычно гетерогенны
и характеризуются низкой пролиферацией. В них наиболее полно представлены ти-
пы клеток той ткани, откуда они были получены. Пассирование обеспечивает воз-
можность продления существования культуры, возможность клонирования, исследо-
вания и сохранения свойств клеток. При этом получаются более однородные попу-
ляции, а также теряются специализированные клетки. После нескольких пересевов
линия клеток либо гибнет, либо трансформируется и становится постоянной кле-
точной линией. Свойством "бессмертности" обладают в основном клетки, получен-
ные из опухолей. Появление постоянной линии клеток констатируется по морфоло-
гическим изменениям (уменьшение размера клеток, снижение их адгезивности, ок-
ругление, увеличение ядерно/цитоплазматического отношения, по увеличению ско-
рости роста (время удвоения клеток в культуре снижается с 36 - 48 до 12 - 36
часов), по снижению зависимости от сыворотки, по увеличению эффективности
клонирования, по снижению зависимости от субстрата, по увеличению гетеропло-
идности (хромосомные различия между клетками) и анеуплоидности и по увеличе-
нию опухолеродности. Нормальные клетки могут трансформироваться в постоянную
линию, не становясь при этом злокачественными.
Характеристика клеток,
культивируемых in vitro
Клетки одного и того же типа в ткани взаимодействуют друг с другом и согла-
совывают скорость деления, чтобы поддерживать надлежащую плотность популяции.
«Социальный» контроль такого рода четко проявляется при реакциях на поврежде-
ние. Например, когда поврежден эпителий, клетки по краям раны стимулируются к
делению и наползанию на обнаженную поверхность до тех пор, пока она вновь не
будет закрыта; в этот момент быстрая пролиферация и движение клеток прекраща-
ются. Сходное явление можно наблюдать на диссоциированных клетках в культуре.
Эпителиальные клетки или фибробласты, помещенные в чашку, в присутствии сыво-
ротки будут «приклеиваться» к поверхности, распластываться и делиться до тех
пор, пока не образуется сплошной монослой, в котором соседние клетки соприка-
саются .
Адгезивные контакты обеспечиваются образованием комплексов из поверхностных
рецепторов мембраны клетки. В результате поперечного движения гликопротеидов
в мембране образуются электронноплотные бляшки гликопротеиновых комплексов.
Такие бляшки формируются в ответ на воздействие антител, агглютинирующих
агентов (лектины) или соседних клеток. При адгезии субстрат действует как
многовалентное антитело, а образующиеся бляшки называют «адгезивными пятна-
ми» . Эти пятна богаты «адгезивными белками» и всегда выделяют элементы цито-
скелета, которые удерживают гликопротеиды. Благодаря такому действию уменьша-
ется «разжижение» мембраны, и клетка предохраняется от округления. Образовав-
шиеся на клетке адгезивные пятна формируют выступы, с помощью которых и про-
исходит перемещение. Выступы цитоплазмы (ложноножки, псевдоподии) при контак-
те с соседней мембраной ингибируют движение. Клетки в этом случае направляют
свои псевдоподии в другом направлении (феномен контактного ингибирования).
Когда культура станет монослойной, активность ложноножек и движение клеток
прекращается. Нормальные клетки перестают делиться, это явление, известно как
торможение пролиферации, зависимое от плотности. Если такой монослой «пора-
нить» иглой таким образом, чтобы на чашке образовалась свободная от клеток
полоска, клетки с краев этой полоски начинают продвигаться на свободное место
и делиться. Вначале такие явления объясняли только контактным торможением
клеточного деления, но это, видимо, не отражает сути дела.
Плотность клеточной популяции, при которой клетки в сплошном монослое пере-
стают делиться, увеличивается с повышением концентрации факторов роста в сре-
де . Кроме того, оказалось, что если культуральная жидкость будет протекать по
поверхности чашки с островками клеток, то клетки, омываемые средой, только
что прошедшей над другими клетками, будут делиться медленнее, чем те, которые
омываются средой, прошедшей над свободными от клеток участками. В среде, про-
текавшей над клетками, недостает каких-то важных питательных веществ или фак-
торов роста.
Фактор роста обычно присутствует в среде в концентрации около 1О”10 М (при-
мерно одна молекула в объеме сферы диаметром 3 мкм). Один фибробласт имеет
около 105 рецепторов фактора роста, каждый из которых обладает очень высоким
сродством к нему. Таким образом, у каждой клетки достаточно рецепторов, чтобы
связать все молекулы ростовых факторов в объеме сферы диаметром около 150
мкм.
Кроме того, полагают, что значительная часть фактора роста, связанного ре-
цепторами клеточной поверхности, быстро поглощается путем эндоцитоза и разру-
шается. Из этого ясно, что соседние клетки конкурируют между собой за малей-
шие количества факторов роста. Такого рода конкуренция важна как для клеток в
ткани, так и для культивируемых клеток, она предотвращает рост популяции выше
некоторого уровня ее плотности.
Конкуренция за факторы роста и питательные вещества не единственный фактор,
влияющий на скорость деления в клеточной культуре. Форма клеток во время их
распластывания и движения по поверхности субстрата на свободные места тоже
сильно влияет на их способность делиться. При культивировании нормальных кле-
ток в суспензии, когда они не прикреплены к твердой поверхности и поэтому
имеют округлую форму, они почти никогда не делятся (зависимость деления от
прикрепления). Влияние распластывания клеток на пролиферацию можно продемон-
стрировать при выращивании клеток на субстратах с различной адгезивностью по-
верхности или на таких субстратах, где имеются лишь крошечные адгезивные уча-
стки, на которых клетка может прикрепиться, но не может распластаться. Часто-
та деления клеток возрастает с увеличением степени их распластывания. Возмож-
но , что сильно распластанные клетки могут улавливать больше молекул фактора
роста и поглощать больше питательных веществ благодаря своей большей поверх-
ности .
Однако некоторые типы клеток, почти не способные к пролиферации в суспен-
зии, охотно делятся, как только им удается вступить в контакт с участком суб-
страта, даже если этот участок настолько мал, что клетка не может на нем рас-
пластаться. Такие «фокальные» контакты являются местами соединения (хотя и
непрямого) внутриклеточных актиновых филаментов с молекулами внеклеточного
матрикса. Эти и другие наблюдения определенно наводят на мысль, что контроль
клеточного деления каким-то образом связан с организацией цитоскелета. Хотя
механизм и функции этой связи не ясны, можно думать, что зависимость деления
клеток от их прикрепления, вероятно, позволяет ткани сохранять целостность и
предотвращает пролиферацию клеток, обособившихся от нормального окружения.
Цикл прикрепления и открепления, вероятно, позволяет перегруппировать адге-
зивные контакты как между клетками, так и между клетками и матриксом, чтобы
встроить вновь возникшие дочерние клетки в ткань, перед тем как они смогут
начать следующий цикл деления. Ослабление контактов, видимо, составляет важ-
ную особенность пролиферативного поведения большинства типов клеток. Напри-
мер, в ранней стадии реакции фибробластов на ростовой фактор отмечается раз-
рушение их фокальных контактов. Потеря управляемости роста у раковых клеток
почти всегда связана с необратимым уменьшением клеточной адгезивности, кото-
рое проявляется также в потере фокальных контактов при выращивании таких кле-
ток в культуре.
Изменение ростовых свойств культивируемых клеток называется трансформацией.
Трансформация — процесс необратимый и, очевидно, включает генетические изме-
нения в той специфической части наследственной информации, которая контроли-
рует неопластический фенотип, добавляемый к трансформированному геному хозяи-
на. Изменение ростовых свойств является одной из адаптивных особенностей, по-
зволяющей клеткам пролиферировать в условиях, неблагоприятных для нетрансфор-
мированных клеток. Таким образом, в условиях, которые ограничивают рост нор-
мальных клеток, трансформированные клетки будут расти до более высокой плот-
ности популяции, что, по-видимому, будет связано с их пониженной потребностью
в факторах роста. Существуют доказательства, что основное изменение при
трансформации связано с изменением транспорта питательных веществ через кле-
точную мембрану, а это, в свою очередь, может сделать клетки менее зависимыми
от «геометрических» факторов роста.
Трансформированные клетки способны расти в условиях, в которых геометриче-
ские характеристики, а именно отношение площади поверхности к объему менее
благоприятны. Следовательно, трансформированные клетки будут расти в суспен-
зионных культурах, образуя сферические клоны. Так, трансформированные клетки,
будучи введенными иммунологически толерантным животным в относительно неболь-
ших количествах, могут образовывать опухоли. По этой причине трансформация
иногда приравнивается к злокачественным изменениям. Трансформация может быть
или вирусной, или «спонтанной». Большинство исследований выполнены с клетка-
ми, подвергнутыми вирусной трансформации. Когда при этом использовали хорошо
известные трансформирующие вирусы, такие, как вирусы SV40 и полиомы, то свой-
ства трансформированных клеток проявлялись очень наглядно и были описаны под-
робно . Аналогичные изменения, наблюдавшиеся после спонтанной трансформации,
привели к предположению, что такая трансформация является результатом актива-
ции последовательностей генов (онкогенов), уже присутствовавших в геноме
трансформированной до этого клетки, сходной с таковой в вирусном геноме. Мно-
гие исследования подтвердили, что спонтанно трансформированные клетки имеют
такую же последовательность оснований в ДНК, как и в клетках, трансформиро-
ванных вирусами. Но в одной из работ было показано, что аналогичные (может
быть, неразличимые) изменения вызываются также точечными мутациями в нормаль-
ных генах. Старение характерно для клеток, имеющих ограниченный потенциал
пролиферации, то есть низкую плотность насыщения при идеальных условиях куль-
тивирования . Примером могут служить линии диплоидных клеток человека. Повы-
шенная способность к росту трансформированных клеток означает, что трансфор-
мация преобладает над процессом старения.
Старение, безусловно, зависит от генетических факторов, так как каждый вид
имеет характерную продолжительность жизни, но вариабельность внутри популяций
по этому показателю свидетельствует также о влиянии фенотипа. При адаптирова-
нии диплоидных клеток человека (линия WI38) уже с самого начала было показа-
но, что культивируемые клетки могут проявлять феномен старения и имеют огра-
ниченное время жизни (50±10 удваиваний популяции). Зависящие от возраста из-
менения, которые при этом наблюдались, включали удлинение межмитотических ин-
тервалов (19±25% — 31 ±41%/час), изменение метаболизма, уровней ферментов и
экспрессии продукта. Следует отметить, что не установлено четкой связи между
продолжительностью жизни в зависимости от происхождения клетки (мышь, чело-
век) и потенциалом удваивания их клеток в культуре.
Ограниченные по продолжительности жизни клеточные линии, например линии ди-
плоидных клеток фибробластов, не являются идеальными объектами для целей про-
изводства, поскольку их должны использовать до того, как в клетках произойдут
серьезные изменения старения. В практических отношениях это означает, что пе-
риод жизни этих клеток, когда их можно применять в целях производства, заклю-
чается между 12 и 30 пассажами (в первом случае — для приготовления посевного
материала). Трансформированные же клетки не имеют ограниченной продолжитель-
ности жизни, и это обусловливает такое их преимущество в биотехнологии, как
использование в качестве субстрата для генерации различных продуктов в соче-
тании с более высокими плотностями популяции клеток, более высокими скоростя-
ми роста и способностью расти в суспензиях.
Питательные среды и
условия культивирования
После извлечения клеток из ткани или организма и помещения их в культуру
культуральная среда должна обеспечивать все внешние условия, которые клетки
имели in vivo. Это обеспечивает выживание клеток, их пролиферацию и дифферен-
цировку. Внеклеточная среда должна обеспечивать клетки питательными и гормо-
нальными факторами, т.е. обладать всем необходимым для роста и выживания кле-
ток .
Культуры клеток животных и человека предъявляют определенные требования к
жидкой (питательная среда), газообразной (концентрация газов) и твердой (по-
верхность субстрата) фазе. Питательная среда представляет собой раствор опре-
деленного состава, к которому добавляются компоненты невыясненного биологиче-
ского происхождения (добавки плазмы, сыворотки крови, тканевые экстракты и
т.д.). Основу питательных сред составляют солевые растворы. Минеральные ком-
поненты в этих растворах подобраны так, что раствор выполняет буферные функ-
ции, поддерживая постоянный кислотно-щелочной баланс среды в процессе культи-
вирования. Постоянство pH среды является одним из главных требований условий
культивирования.
Для приготовления питательных сред обычно используются солевые растворы Эр-
ла и Хенкса. Эти растворы, как и фосфатно-солевой буфер Дульбекко и Фогта ис-
пользуются также для орошения и промывки клеток при пассировании культур, вы-
делении клеточных линий и других манипуляциях с культурами клеток. Другим
важным условием культивирования является осмотическое давление. Оно определя-
ется числом молей осмотически активных частиц (ионов и неионизированных моле-
кул) растворенных веществ на 1 кг растворителя (осмоляльность) или на 1 литр
раствора (осмолярность). В разбавленных водных растворах эти величины близки.
Осмоляльность раствора26 (осмоль/кг) = S mi*xi, где т± концентрация i-ro рас-
творенного вещества (моль/кг), х± количество частиц, на которые диссоциирова-
ла его молекула. Например, для раствора Эрла расчетная величина осмоляльности
равна 310.6 мосмоль/кг, реальная 283. Диапазоны pH и осмоляльности, при кото-
рых происходит размножение клеток, узки и варьируют в зависимости от типа
клеток. Например, для клонального роста диплоидных фибробластов человека WI38
оптимальны рН=7.30 + 0.15 и осмоляльность 285 + 40 мосмоль/кг, а для фиброб-
ластов из эмбриона цыпленка 7.12 + 0.18 и 300 + 20 соответственно. Для под-
держания pH в большинстве сред используется бикарбонатный буфер: НСОз = СО2 +
ОН, если выделяется углекислый газ, увеличивается концентрация ОН. Растворы
могут содержать малое количество бикарбонатного буфера (раствор Хенкса), они
предназначены для поддержания pH в плотно закрытых сосудах. В других (раство-
ре Эрла) бикарбоната больше, они используются в системах с повышенным парци-
альным давлением СО2 • Если культуры ведутся вне СО2-инкубатора, где pH под-
держивать труднее, необходимы альтернативные буферные системы. Хорошим буфе-
ром является HEPES 4-(2-оксиэтил)1-пиперазинэтансульфоновая кислота. HEPES
легко растворим в воде, не связывает двухвалентные катионы, не цитотоксичен
до концентрации 0.05 Моль. Применяется в концентрациях 0.01 0.03 М.
Стандартные среды для ведения культур животных клеток. Среды Игла МЕМ
(minimal essential medium) и ВМЕ (basal medium, Eagle). Чаще используется
МЕМ. Она содержит минеральные вещества, аминокислоты (13 незаменимых), 6 во-
дорастворимых витаминов, холин и инозит, выполняющие роль углеводородного
26
Лишнее. Это материал другого учебника. Если уж вдаваться в подробности, то везде.
субстрата. МЕМ используется только с сывороткой, так как в ней отсутствуют
биотин, витамин В12, ионы железа и микроэлементы. Основа раствор Эрла.
Среда Дульбекко DME или DMEM (двойная модификация среды Игла). Используется
при культивировании клеток различных типов, в том числе нетрансформированных
клеток и гибридом. Является основой для бессывороточных сред. Содержит двой-
ную концентрацию аминокислот, глицин, серин, пируват, железо. При использова-
нии этой среды необходим инкубатор с 10% концентрацией СОг.
Среда Пскова IMDM - модификация среда Дульбекко. Добавлены незаменимые
аминокислоты, биотин, витамин Bi2, селенит натрия. В среду введен HEPES и
уменьшены концентрации NaCl и ЫаНСОз. Среда бессывороточная, обычно использу-
ется для культивирования лимфоцитов и кроветворных клеток.
Среда МакКоя 5А и серия сред RPMI. Среда МакКоя 5А разработана в 1958 году
для поддержания клонального роста клеток карциносаркомы Уолкера 256 в присут-
ствии сыворотки, а затем уже других первичных культур и различных клеточных
линий. Обычно производится в модификации Ивката и Грейса (RPMI) и предназна-
чена для культивирования лейкоцитов в присутствии сыворотки, часто применяет-
ся и для культивирования гибридом. Концентрация СО2 в атмосфере при культиви-
ровании 5%.
Среда 199 разработана в 1950 году для культивирования фрагментов сердца из
эмбриона цыпленка. Для среды характерны широкий спектр питательных веществ и
невысокая их концентрация. Используется без добавок, как поддерживающая для
первичных клеток, а с сывороткой как ростовая среда для быстро размножающихся
клеток. Нормальные, сохраняющие специфические функции клетки на стандартных
средах не размножаются (если не трансформированы). Для оптимального роста
клеток обычно добавляют 5 - 20% фетальной (эмбриональной) сыворотки.
Сыворотка представляет собой чрезвычайно сложную смесь мелких и крупных мо-
лекул , способных как вызывать, так и тормозить рост клеток. К главным функци-
ям сыворотки относятся: обеспечение гормональными факторами, стимулирующими
рост клеток и их функции; обеспечение факторами прикрепления и распластывания
клеток; обеспечение транспортными белками, переносящими гормоны, минеральные
вещества, липиды и т.д. Белки сыворотки, прямо и специфически участвующие в
стимуляции клеточного деления, называются факторы роста.
Большинство ростовых факторов присутствуют в сыворотке в концентрации не-
скольких нанограммов на миллилитр и ниже. Некоторые из этих факторов специ-
фичны для клеток на определенной стадии дифференцировки, действие других не
ограничено каким-либо одним типом клеток. Один и тот же тип клеток может быть
стимулирован различными ростовыми факторами. Например, фибробласты размножа-
ются в ответ на фактор роста фибробластов, фактор роста эпидермиса, фактор
роста, синтезируемый тромбоцитами и соматомедины. Все эти вещества являются
митогенами (стимулируют митоз). Другим важным фактором роста практически для
всех типов клеток является гормон инсулин. Из других гормонов наиболее часто
применяются глюкокортикоиды (гидрокортизон, дексаметазон), стероиды (эстради-
ол, тестостерон, прогестерон) и гормоны щитовидной железы (трииодтиронин).
Гормоны стимулируют или подавляют рост в зависимости от типа клеток и их
плотности. Глюкокортикоиды, например, влияют на пролиферацию клеток, изменяя
их чувствительность к факторам роста.
Для переноса низкомолекулярных факторов (витаминов, аминокислот, липидов и
других) необходимы транспортные белки. В этой роли выступает альбумин. Транс-
порт железа обеспечивает трансферрин, а поверхность большинства культивируе-
мых клеток содержит рецепторы для этого белка. К факторам прикрепления и рас-
пластывания клеток относятся коллаген и фибронектин, более специализированы
хондронектин (адгезия хондроцитов) и ламинин (адгезия эпителиальных клеток).
В последние годы разработаны бессывороточные среды для размножения клеток.
Чаще всего эти среды узко специализированы, т.е. предназначены для определен-
ного типа клеток. К базовой среде добавляется инсулин, трансферрин, гидрокор-
тизон или его аналог дексаметазон и т.д. Бессывороточные среды имеют опреде-
ленные преимущества: улучшение воспроизводимости результатов опыта вследствие
большей стабильности состава среды; снижение риска заражения культуры вируса-
ми, грибами, микоплазмой; облегчение очистки продуктов клеточного метаболиз-
ма; снижение влияния дополнительных белков на результаты биологических иссле-
дований; отсутствие цитотоксичности сыворотки. Культивирование клеток в при-
сутствии сыворотки обнаруживает и ряд недостатков: для большинства тканей сы-
воротка не является физиологической жидкостью, с которой они контактировали в
исходной ткани, поэтому, например, сыворотка вызывает рост фибробластов, но
тормозит рост эпидермальных кератиноцитов; сыворотка может быть цитотоксич-
ной, так как содержит полиаминоксидазу, действующую на полиамины (спермин,
спермидин), являющиеся продуктами секреции быстро пролиферирующих клеток (эм-
бриональная сыворотка содержит относительно много такого фермента); значи-
тельная вариабельность состава сывороток разных партий; сыворотки могут со-
держать недостаточное количество специфических ростовых факторов, что вызыва-
ет необходимость добавления их к культурам клеток.
Многие клетки млекопитающих, прежде чем приступить к пролиферации и образо-
вать клеточный монослой, должны прикрепиться к субстрату и распластаться на
нем. В связи с этим встает вопрос о подходящем материале. В качестве субстра-
та в настоящее время используют несколько материалов. Стекло лучше всего пи-
рекс (алюмоборосиликатное стекло), так как натрийсиликатное стекло может под-
щелачивать среду и его необходимо кипятить в слабой кислоте перед употребле-
нием. С каждым использованием пригодность такого стекла падает. Пластик - ча-
ще всего используют полистирол, поликарбонат, поливинилхлорид, тефлон и дру-
гие. Металлы - подходит как нержавеющая сталь, так и титан, так как эти веще-
ства химически инертны и обладают высоким отрицательным поверхностным заря-
дом. Клетки прикрепляются за счет электростатических взаимодействий, поэтому
поверхность культуральных сосудов должна быть смачиваемой и отрицательно за-
ряженной . Этого можно достичь химической обработкой окисляющими агентами или
физическими воздействиями (высоковольтным разрядом, ультрафиолетовым светом,
бомбардировкой высокоэнергетическими электронами). Фирмы, производящие пла-
стиковую посуду, используют эти методы. Некоторые исследователи, несмотря на
это, предпочитают даже новую посуду перед посадкой клеток обрабатывать смесью
концентрированной серной кислоты и бихромата калия (хромовая смесь), после
чего следует тщательная промывка. Иногда поверхность сосуда покрывают вещест-
вом, облегчающим прикрепление клеток. Наиболее часто для этого используют
коллаген и полиаминокислоты.
Системы культивирования клеток
Существует 2 основных системы культивирования клеток.
1. Непроточные культуры - тип культур, в котором клетки вводят в фиксиро-
ванный объем среды. По мере роста клеток происходит использование питательных
веществ и накопление метаболитов, поэтому среда должна периодически меняться,
что приводит к изменению клеточного метаболизма, называемого еще и физиологи-
ческой дифференцировкой. Со временем, в результате истощения среды происходит
прекращение пролиферации клеток.
Увеличить продолжительность жизни непроточных культур можно несколькими
способами:
- прерывистый (часть культуры заменяется равным объемом свежей среды);
- постоянный (объем культуры увеличивается с постоянной низкой скоростью, а
небольшие порции клеток периодически удаляются);
- перфузионный (осуществляется постоянное поступление свежей среды в куль-
туру и одновременное удаление равного объема использованной (бесклеточной)
среды. Перфузия может быть открытой, когда из системы удаляется вся среда, и
закрытой, когда удаляемая среда проходит через дополнительный сосуд, где вос-
станавливается ее pH и осуществляется аэрирование, и возвращается в культу-
ральный сосуд.
Все системы непроточных культур характеризуются накоплением отходов в той
или иной форме и непостоянством внешних условий.
2. Проточные культуры обеспечивают истинные гомеостатические условия без
изменения концентрации питательных веществ и метаболитов, а также числа кле-
ток. Гомеостаз обусловлен постоянным вхождением среды в культуру и одновре-
менным удалением равного объема среды с клетками. Такие системы пригодны для
суспензионных культур и монослойных культур на микроносителях.
Существует 2 крупных направления в культивировании животных клеток: моно-
слойные культуры и суспензионные культуры.
Суспензионные культуры предпочтительнее с точки зрения увеличения выхода
клеток.
Монослойные культуры также обладают рядом преимуществ:
1. Легко провести полную замену среды и промыть клетки перед добавлением
свежей питательной среды. Это важно в тех случаях, когда рост клеток идет в
одних условиях, а наработка продукта в других условиях, например при переносе
клеток из среды с сывороткой в бессывороточную среду. Можно также полностью
удалять нежелательные компоненты.
2. Позволяют обеспечить высокую плотность клеток.
3. У многих клеток экспрессия требуемого продукта идет эффективнее, если
клетки прикреплены к субстрату.
4. Монослойные культуры могут быть использованы для любого типа клеток, что
обеспечивает наибольшую гибкость исследований.
5. В некоторых случаях, например для распространения вирусов, требуются
тесные межклеточные контакты.
Недостатками монослойных культур являются:
- требования большого пространства;
- возрастание стоимости и трудоемкости при увеличении масштаба;
- недостаточно эффективный контроль, обусловленный трудностями отбора про-
бы;
- сложности в определении и контролировании pH, концентрации кислорода.
Необходимо отметить, что применение микроносителей устраняет эти недостат-
ки. Существует много различных разновидностей этого способа культивирования.
Рассмотрим три основных направления (рис. 27):
1. Чашка Колле, плоский флакон
с клетками на дне
2. Вращающаяся бутыль (круглый сосуд)
с клетками на дне и стенках
3. Колонка с клетками на микроносителях
pH, давление, С02, температура
компоненты питательной среды
стеклянные бусы
перистальтический насос
система контроля и регенерации среды
1. Культивирование в плоских флаконах (матрацах).
2. Культивирование во вращающихся бутылях, когда в каждый момент времени
1520% поверхности бутыли покрыто питательной средой, а клетки находятся попе-
ременно то в среде, то в воздухе.
3. Культивирование в колонках на микроносителях, в качестве которых высту-
пают плотно упакованные, не смещающиеся стеклянные бусы диаметром 35 мм,
стопка пластин и др., а питательная среда омывает их, протекая сверху вниз.
Использование культуры
клеток человека
Практически любые клетки человека могут быть введены в культуру и служить
средством и объектом во многих медико-биологических исследованиях.
Благодаря культивированию клеток возможности исследования и диагностики
расширяются почти беспредельно, так как имеется возможность оценки не только
морфологических и биохимических изменений, но и изменений в поведении клеток,
их реакции на различные агенты, в том числе и на лекарственные воздействия.
Кроме того, если в ряду поколений воспроизводится дефект, свойственный клет-
кам in vivo, значит это дефект наследственный.
Наибольшее распространение получили культуры фибробластов. Широкое исполь-
зование фибробластов для изучения патогенеза и диагностики наследственных бо-
лезней обусловлено не только легкостью их культивирования, но и тем, что со-
единительная ткань, главным клеточным элементом которой являются фибробласты,
составляет значительную часть массы тела. Кроме того, фибробласты составляют
строму многих органов, являются важными участниками их морфогенеза и создают
условия микроокружения, необходимого для дифференцировки и функционирования
специализированных клеток. В фибробластах имеется фермент моноаминоксидаза,
изменения активности которого характерны для некоторых нервных и психических
заболеваний. Фибробласты содержат рецепторы к глюкокортикоидным гормонам, ин-
сулину , некоторым нейромедиаторам.
Гринбергом в 1978 году была доказана возможность экстраполяции данных, по-
лученных на культивируемых фибробластах, на условия in vivo.
Во-первых, фибробласты in vitro сохраняют важнейшие черты, свойственные
клеткам в организме, а также онтогенетические и индивидуальногенотипические
свойства организмадонора.
Во-вторых, не существует другого такого типа клеток, который в полной мере
мог бы представлять свойства клеток организма.
В-третьих, изменения, которые возникают при введении фибробластов в культу-
ру, можно легко контролировать и свести к минимуму при создании соответствую-
щих условий.
Все вышеперечисленное также способствует использованию фибробластов для
изучения клеточных, биохимических, молекулярных аспектов патогенеза ряда бо-
лезней, в том числе и связанных с наследственными дефектами нервной системы.
Культивирование клеток
и тканей беспозвоночных
Интерес к клеточным культурам беспозвоночных связан с разнообразием и ори-
гинальностью роста и метаморфоза, которые могут быть объектом для изучения
основных процессов клеточной дифференцировки и регуляции активности генов. С
другой стороны, при рассмотрении способов получения энтомопатогенных препара-
тов отмечалось, что вирусы могут размножаться только при использовании живых
клеток насекомых, в связи с чем, для получения вирусных препаратов необходи-
мым условием являлось предварительное разведение насекомых-хозяев. Использо-
вание клеточных культур беспозвоночных позволяет решить эту проблему.
Среды для культивирования клеток и тканей насекомых сильно варьируют по со-
ставу. При составлении сред используются данные по составу гемолимфы. Среды
отличаются от сред для клеток и тканей млекопитающих наличием органических
кислот, повышенным содержанием аминокислот и более высоким осмотическим дав-
лением .
Для получения культуры клеток и тканей беспозвоночных используют эмбрионы,
имагинальные диски и органы насекомых:
имагинальные диски (зачатки взрослых органов насекомых) используют для изу-
чения процессов дифференцировки in vitro;
эмбрионы с удаленной оболочкой используют для изучения начальных стадий
развития насекомых;
отдельные органы для различных целей. Например, слюнные железы Diptera для
изучения процессов пуффирования в политенных хромосомах (пуф вздутие хромосом
при "включении" ДНК на транскрипцию, когда определенные участки ее раскручи-
ваются и РНК-синтезирующие ферменты начинают синтез РНК; при линьке насекомых
пуфы появляются в определенной последовательности).
КУЛЬТИВИРОВАНИЕ ОРГАНОВ
Органная культура - культивирование in vitro органа или части органа, в ко-
торых сохраняются анатомическая связь и функционирование тканей, максимально
приближенные к таковым в условиях in vivo, то есть в организме. Миграция изо-
лированных клеток на периферии экспланта подавляется специальными условиями
культивирования, в результате чего могут даже образовываться дифференцирован-
ные структуры. Например, на периферии эксплантов легочной ткани развиваются
новые мелкие бронхи, состоящие из альвеол, окаймленных бронхиальным эпители-
ем.
Органная культура сохраняет межклеточные взаимодействия, в течение долгого
периода поддерживает гистологическую и гистохимическую дифференцировку, как
правило, остается в не растущем состоянии в течение нескольких дней и даже
недель. Эти культуры не способны к размножению.
Ткани, зависимые от гормонов, сохраняют чувствительность к ним и характер-
ные ответы, эндокринные органы продолжают секрецию специфических гормонов и
т.д. Наибольшее сходство процессов морфогенеза in vivo и in vitro отмечено
для эмбриональных тканей.
Первые исследования в области культивирования органов и тканей относятся к
концу прошлого века. Уже в 1897 году немецкий ученый Лёб (В.Loeb) опубликовал
данные о культивировании фрагментов печени, почек, щитовидной железы и яични-
ков кролика на небольших кровяных сгустках в культуральных пробирках. Даль-
нейшие исследования показали, что для предотвращения центральных некрозов в
эксплантах пробирки должны быть заполнены кислородом. В результате многочис-
ленных экспериментов было также установлено, что большинство органов или их
фрагментов, за исключением кожи, растут на твердом субстрате лучше, чем в
жидкой среде.
Что же можно использовать в качестве субстрата? Существует несколько видов
техники культивирования органов. В качестве субстрата можно использовать сгу-
сток плазмы. Этот способ был предложен Феллом и Робинсоном и получил название
"техника часового стекла", став классической техникой морфогенетического ана-
лиза эмбриональных органов (рис. 28).
Культивирование проводят во впадине часового стекла на поверхности сгустка,
состоящего из плазмы цыпленка и эмбрионального экстракта кур. Часовое стекло
помещают в чашку Петри и закрывают сверху влажной ватой или фильтровальной
бумагой для предотвращения высыхания. Культивируют в термостате при 37,5°С.
Существуют модификации этого метода, при которых часовое стекло покрывается
крышкой, приклеенной воском и другие. Недостатком метода, ограничивающим при-
менение его в биологических исследованиях, является разжижение сгустка в ок-
рестностях экспланта, который в результате оказывается в жидкости. Кроме то-
го, сложный состав среды затрудняет проведение биохимических исследований.
Рис. 28. Метод часовых стекол (по Феллу и Робинсону, 1929)
Эти недостатки устраняются при использовании сгустка агара. Такая техника
была предложена Спраттом (рис. 29). Метод основан на получении агарового геля
1-4% концентрации, основу которого составляют забуференные солевые растворы
или питательные среды типа 199 с добавлением эмбриональной сыворотки.
Рис. 29. Метод часовых стекол с агаровым сгустком (по Вольффу и
Хафену, 1952)
В середине 20-го века Чен обнаружил, что культуры можно выращивать на бу-
мажных плотиках, плавающих на поверхности жидкости в часовом стекле. С целью
улучшения техники позднее бумагу обрабатывали силиконом, комбинировали с мил-
липоровыми фильтрами, а затем перешли на плотики из ацетата вискозы. Этот ма-
териал хорошо растворяется в ацетоне, что облегчает подготовку ткани для гис-
тологического анализа.
Метод культивирования на плотиках не лишен недостатков, основной из них -
погружение ткани в среду при затоплении плотика. Решение этой проблемы было
предложено Троувеллом, который предложил культивировать органы на поверхности
металлической сетки (рис. 30) . Сетка представляет собой квадрат размерами
25*25 мм с отогнутыми краями, образующими четыре ножки высотой около 4 мм.
Скелетные ткани культивируют непосредственно на сетке, тогда как мягкие вна-
чале эксплантируются на бумагу, а затем помещаются на сетку.
Рис.30. Модифицированный метод Троувелла (по И. Ласнитски, 1989)
В 1976 году, для длительного культивирования взрослых тканей человека, та-
ких как эпителий бронхов и молочной железы, пищевод и др. был предложен метод
поочередного культивирования в жидкой среде и газовой фазе. Для этого экс-
планты прикрепляются ко дну пластикового сосуда и покрываются средой. Сосуды
помещают в камеру с определенным газовым составом, а камера помещается на ка-
чающуюся платформу.
ГИБРИДИЗАЦИЯ ЖИВОТНЫХ КЛЕТОК
История метода
Предположение о том, что соматические клетки могут сливаться друг с другом,
было высказано еще в начале XIX века в связи с открытие многоядерных клеток.
В историческом аспекте представляет интерес то обстоятельство, что открытие
поликарионов как бы подтверждало ошибочное представление Шлейдена, который
считал, что новые клетки зарождаются в виде пузырьков внутри цитоплазматиче-
ской мембраны родительских клеток. Разделявший эту точку зрения Рудольф Вир-
хов представил в 1851 г. рисунок многоядерной опухолевой клетки в полной уве-
ренности, что ядра являются эндогенными зачатками новых клеток. Кроме того,
открытие поликарионов подлило масла в огонь борьбы с клеточной теорией. Про-
тивники ее выдвинули гипотезу, согласно которой организм представляет собой
единую тканевую массу с непрерывной цитоплазмой, а существование поликарионов
рассматривали как подтверждение этой гипотезы. Со временем восторжествовала
клеточная теория, а существование поликарионов отнесли к разряду интересных
исключений.
Гибриды соматических клеток были открыты лишь в 60-х годах нашего столетия.
В 1960 г. Барский с сотрудниками сообщили о выделении линии гибридных клеток.
Гибридные клетки были получены путем смешения двух линий, выделенных ранее из
1 клетки мышиной саркомы. Исходные линии отличались по числу и морфологии
хромосом, а также по способности к образованию опухоли при введении их мышам.
Гибридные клетки содержали число хромосом, отличное от исходных клеточных ли-
ний, а также содержали поверхностные антигены клеток обеих родительских ли-
ний . Далее было установлено, что клеточные гибриды можно получить, используя
клетки различных видов животных. В качестве агента, индуцирующего слияние,
выступал инактивированный вирус HVJ, называемый также вирусом Сендай. С этих
пор вирус Сендай стал широко использоваться в экспериментах по слиянию кле-
ток .
При изучении межвидовых гибридных клеток, способных к пролиферации были
сделаны два очень важных наблюдения:
- в гибридах могут проявиться оба генома;
- в долгоживущих межвидовых гибридах элиминируются хромосомы одного вида.
Слияние клеток не обязательно должно быть чем-то стимулировано. Как in
vivo, так и in vitro оно может проходить и без добавления специальных аген-
тов. Несмотря на то, что все слияния такого рода можно считать спонтанными,
некоторые из них постоянно происходят в процессе онтогенеза, а следовательно,
эволюционно запрограммированы. До сих пор нерешенной остается одна из труд-
нейших загадок биологии, состоящая в том, что мембраны, находящиеся внутри
клетки сливаются часто, тогда как мембраны, разграничивающие клетки, сливают-
ся редко. Например, пузырьки аппарата Гольджи сливаются друг с другом, обра-
зуя клеточные пластинки при цитокинезе у растений, мембраны ЭР - с элементами
АГ при переносе вновь синтезированных белков и т.д.
В то же время нормальные клетки в естественных условиях крайне редко слива-
ются друг с другом. Исключение составляет процесс оплодотворения. Кроме того,
в качестве подобного рода исключения выступает процесс плазмогамии у высших
грибов, когда одноядерные гаплоидные клетки сливаются, образуя двуядерные
(дикарионы). Такие клетки размножаются митотически, оставаясь двуядерными, и
в результате образуют всем хорошо известные плодовые тела.
В естественных условиях слияние клеток происходит и у млекопитающих. Напри-
мер, клетки могут сливаться при формировании мышечных трубочек. Еще в XIX ве-
ке было показано, что миофибриллы поперечно-полосатых мышц образуются в поли-
карионах - крупных удлиненных многоядерных клетках. Поликарионы - продукт
слияния одноядерных миобластов. Слияние опухолевых клеток - довольно обычное
явление, при этом опухолевые клетки in vivo иногда сливаются и с нормальными.
Эксперименты по спонтанному слиянию клеток проводились и in vitro. При прове-
дении подобных экспериментов получают так называемых "химерных" или аллофеных
мышей - животных, в тканях которых содержатся клетки различных генотипов
(рис. 31).
Рис. 31. Получение аллофенных мышей
Методы создания химер
1. Агрегационный - был предложен практически одновременно и независимо друг
от друга Тарковским в Варшаве и Минц в Филадельфии (1961-1962 гг.).
Из матки беременных самок-докторов извлекают зародыши, достигшие стадии 8
бластомеров. Бластомеры, полученные от двух животных с различными генотипами
(например, от мышей с белой черной окраской шерсти) помещают в условия, спо-
собствующие их агрегации и образованию 16-ти клеточного зародыша. Такие со-
ставные зародыши развиваются in vitro до стадии бластоцисты, после чего их
вводят в матку приемной матери, у которой предварительно вызывают ложную бе-
ременность путем введения соответствующих гормонов. В результате получаются
аллофенные мышата. Когда у мышонка появляется шерсть, окраска у него оказыва-
ется не белой или черной, как у родителей, а смешанной, с чередующимися чер-
ными и белыми пятнами или полосами. Это доказывает, что ткани животных-химер
мозаичны, т.е. состоят из "белых" и "черных" клеток.
Внутренние ткани таких животных, естественно, также мозаичны, хотя это про-
является не так очевидно, как в случае окраски шерсти. Различия могут касать-
ся белков, выполняющих ферментативную функцию: они могут катализировать одни
и те же реакции у мышей-родителей, нуждаться в одних и тех же кофакторах, но
при этом быть не идентичными, хотя и сходными. Такие белки называются изофер-
ментами, и их можно разделить с помощью электрофореза. Агрегационные химеры
можно получать не только между двумя эмбрионами, но и между различным числом
изолированных бластомеров или отдельными частями эмбрионов. Масса химерных
эмбрионов не больше обычной и подвержена действию механизмов эмбриональной
регуляции. Преимущество метода - не требует вмешательства микрохирургической
техники, поэтому широко используется в эмбриогенетике.
2. Инъекционный - был разработан Р. Гарднером в 1968 г.
Используются эмбрионы на стадии бластоцисты. Бластоцисту фиксируют и, ис-
пользуя микроманипуляторы, вводят путем инъекции клетки внутриклеточной массы
бластоцисты доноров в бластоцель эмбриона - рецепиента. Этим методом можно
инъецировать не только внутриклеточную массу ранних эмбрионов, но и более
дифференцированные клетки.
Инъекционный метод нашел применение при получении межвидовых химер. Первые
межвидовые химеры были получены между двумя ближайшими видами мышей, которые
обычно не скрещиваются: М. muskulus и М. caroli. Причем было отмечено, что
химерные эмбрионы, полученные инъекционным методом, нормально развивались
только при пересадке их в матку того вида, чья бластоциста была использована
в качестве рецепиента. Например, в бластоцисту М. muskulus вводили внутрикле-
точную массу эмбриона М. caroli. Полученные химеры имплантировались в матку
М. muskulus и благополучно развивались там, а в организме М. caroli погибали
спустя две недели.
Межвидовые химерные зародыши между мышью и крысой путем агрегации были по-
лучены только в 70-х годах. Первые химерные животные были получены только в
1973 году Р. Гарднером и М. Джонсоном. Успех этих экспериментов позволил при-
ступить в 80-х годах к созданию химерных сельскохозяйственных животных. Выяс-
нилось, что агрегационный метод неприемлем для получения химер крупного рога-
того скота. Химер телят Bos indicus + Bos taurus удалось получить только инъ-
екционным методом.
В 1984 году были получены межвидовые химеры между овцой и козой - овцекозы,
причем практически одновременно в Англии и ФРГ. Использовались оба метода.
Половым путем овцы и козы не скрещиваются, так как имеют разный набор хромо-
сом: коза 2п = 60, овца 2п = 54. В ФРГ в 1985 году были получены химерные те-
лята после агрегации половинок 32-клеточных эмбрионов от коров швицкой (бу-
рой) и голштино - фризской пород. В фенотипе химер сочетались обе масти - бу-
рая и черно - пестрая.
Химерные животные не передают потомкам генетическую мозаичность. У них про-
исходит расщепление, как у гетерозигот, поэтому ценные генетические комбина-
ции нарушаются. Но на протяжении 1 поколения хозяйственно ценные признаки
поддерживаются, поэтому можно, например, сочетать как молочную, так и мясную
продуктивность.
Химерность довольно часто встречается и у растений. Как правило, она суще-
ствует в скрытом виде, не проявляясь фенотипически. Однако пластидные мутации
позволяют увидеть ее непосредственно на растении. Чаще всего спонтанная хи-
мерность наблюдается у гетерозиготных растений. Различные клеточные типы чет-
ко разделены в пространстве, образуя отдельные слои при делении апикальных
меристем. Примером видимой мутации хлоропластов и образования химерного рас-
тения является пестролистность или появление секторов ткани другого цвета.
Механизм слияния клеток
Для индукции слияния клеток используются вещества различной природы. Ионы
Саг+, полиэтиленгликоль, лизолецитин, моноолеат глицерина, вирус Сендай.
Лизолецитин - поверхностно-активное вещество липидной природы, продукт де-
градации лецитина путем обработки последнего фосфолипазой А. Лизолецитин по-
вреждает мембраны и токсичен для живых систем. Цитотоксический эффект этого
вещества можно уменьшить снижая его концентрацию или добавляя во время обра-
ботки альбумин.
Моноолеат глицерина также соединение липидной природы, но его повреждающее
действие менее выражено, а частота слияния клеток при применении этого веще-
ства возрастает в 4-7 раз по сравнению со спонтанным процессом. К другим агг-
лютинирующим агентам, способность которых вызывать слияние клеток, была ис-
следована специально, относятся лектины растений и антитела.
Преимущество вируса Сендай как сливающего агента заключается в полном от-
сутствии цитотоксического эффекта. Вирус перед употреблением инактивируют,
облучая ультрафиолетовой лампой в течение 5 минут, при этом он теряет способ-
ность к размножению, но сохраняет способность сливать клетки. Вирус Сендей
имеет два недостатка:
- необходимость наращивать, титровать, концентрировать и инактивировать ви-
рус;
- клетки растений и грибов не имеют рецепторов к этому вирусу, поэтому он
неприменим для их гибридизации.
Первый этап слияния (рис. 32) - сближение мембран соседних клеток и уста-
новление между ними тесного контакта. Мембраны должны быть приближены друг к
другу на расстояние в несколько ангстрем так, чтобы между ними стали возможны
взаимодействия, подобные гидрофобным связям. Вызывают подобное сближение
агенты, индуцирующие агглютинацию клеток. Миксовирусы, например, вирус Сен-
дай, наряду с другими вирусами, которые не обусловливают слияния, прежде все-
го, вызывают агглютинацию клеток, т.е. достаточно тесное их сближение, необ-
ходимое для успешного последующего слияния.
Полиэтиленгликоль также вызывает агрегацию клеток, хотя механизм действия
его неизвестен. Возможно, благодаря тому, что в водном растворе ПЭГ несет не-
большой отрицательный заряд, молекулы этого размера достаточно велики, чтобы
между клетками возникали электростатические связи. Подтверждением этой гипо-
тезы является усиление агглютинации клеток, вызываемой ПЭГ: двухвалентные ио-
ны, по-видимому, образуют мостики между ПЭГ и отрицательно заряженными угле-
водами, находящимися на клеточной поверхности. Согласно другой гипотезе, про-
топласты сливаются в результате дегидратации. Поглощение воды индуцирует об-
разование пор на поверхности мембраны и происходит перетекание внутриклеточ-
ного материала. После слияния участки с порами сохраняются некоторое время.
Существует два предположения, объясняющие возникновение пор:
1. При высокой концентрации ПЭГ (20 - 30%) вся свободная вода поглощается
им, вызывая разрывы в мембране;
2. ПЭГ уменьшает полярность воды, что вызывает перераспределение полярных и
гидрофобных компонентов мембраны, стабилизирующих липидные слои.
С особым успехом для этих целей используется ПЭГ с молекулярным весом от
1500 до 7500.
Лектины и антитела - двух- или поливалентные соединения, и их агглютинирую-
щая функция связана со способностью одной молекулы какого-либо из этих соеди-
нений взаимодействовать с рецепторами, находящимися на поверхности двух кле-
ток, что и приводит к образованию связи между клетками. Достаточное количест-
во таких молекулярных связей может удерживать клетки вместе, препятствуя их
расхождению либо в результате броуновского движения, либо в результате элек-
тростатического отталкивания, либо в результате активной миграции клеток.
На втором этапе гликопротеиды, расположенные на поверхности, начинают вы-
свобождаться из участков мембраны, лежащих между вирионами, и притягиваются к
местам прикрепления вирусных частиц. Углеводные компоненты - наименее изучен-
ная часть клеточной поверхности. В мембранах они встречаются в виде нейтраль-
ных сахаров, а также ковалентно связываются с липидами или белками. Именно в
таком виде они активно участвуют во многих биологических процессах. Установ-
лено, что гликопротеиды определяют антигенную специфичность клеток, несут от-
рицательный заряд, характерный для клеток при физиологически нейтральных pH,
принимают участие в распознавании и адгезии клеток, определяют рецепторные
участки для вирусов, бактерий, агглютинирующих агентов, принимают участие в
процессе регуляции проницаемости мембран для ионов. Эти свойства и определяют
их участие в слиянии клеток.
Рис. 32. Этапы слияния клеток (по Н. Рингертцу, Р. Сэвиджу,
1979) :
А - 1-й этап, сближение цитоплазматических мембран: 1- гликопро-
теиды, 2 - липиды, 3 - плазматические мембраны, 4 - митохондрии,
5 - микрофиламенты, 6 - частицы вируса Сендай;
Б - 2-й этап, выход гликопротеидов и обнажение липидных слоев
мембраны;
В - 3-й этап, образование мицелл;
Г - начало 4-го этапа, слияние мембран, образование цитоплазма-
тических мостиков.
Углеводы препятствуют слиянию клеток, так как разделяют липидные слои мем-
бран, не давая им соприкасаться, так как на поверхности нормальной клетки ре-
цепторные участки расположены редко или поодиночке. В результате трансформа-
ции вирусом происходит их объединение в группы. Гликопротеиды мигрируют в
мембране к месту адсорбции вируса, оставляя свободными соседние участки, где
и происходит слияние клеток. В некоторых случаях в удалении углеводных групп,
препятствующих слиянию клеток, принимают участие лизосомные ферменты. При
этом происходит соединение лизосом или пузырьков АГ с плазматической мембра-
ной , и локальное высвобождение гликозидаз. Такая лизосомная активность может
быть запрограммирована (в гаметах, миобластах, макрофагах, т.е. клетках, сли-
вающихся в естественных условиях) или вызвана экспериментально при индуциро-
ванном слиянии клеток.
Третий этап - мицелизация обнажившихся липидов двух противолежащих мембран.
Мицеллы - липидные капли, где молекулы липидов гидрофильными головками обра-
щены к воде, а гидрофобные "хвосты" жирных кислот спрятаны внутрь. Этот про-
цесс усиливается при высоких значениях pH и высокой концентрации ионов каль-
ция. В обеих клетках начинается эндоцитоз вирусных частиц.
Четвертый этап - слияние мембран. Благодаря мостикам, образуемым Саг+, раз-
мер мицелл уменьшается. Под действием АТФ и Саг+, активизируются микрофила-
менты. Возникший цитоплазматический мостик стабилизируется и расширяется бла-
годаря функционированию микрофиламентов. На последних этапах слияния клеток
важную роль играет наличие АТФ. АТФ образуется благодаря деятельности мито-
хондрий. Поликарионы, образующиеся при слиянии двух или трех клеток, пред-
ставляют собой не бесформенные раздутые или двулопастные шары цитоплазмы, а
принимают форму, характерную для одной из родительских клеток или промежуточ-
ную между ними. Форму клетки определяют микротрубочки и микрофиламенты. В
процессе слияния клеток микрофиламенты актиномиозинового типа, расположенные
под цитоплазматической мембраной, принимают непосредственное участие, так как
обеспечивают объединение цитоплазм слившихся клеток и стабилизацию вновь об-
разованной системы. Однако, формирование цитоскелета - энергозависимый про-
цесс, требующий большого количества АТФ. Видимо, этим обусловлено присутствие
митохондрий в местах слияния клеточных мембран.
МОНОКЛОНАЛЬНЫЕ АНТИТЕЛА
Функциональная структура
антител
Слияние клеток лежит в основе получения гибридных клеток, продуцирующих ан-
титела. Антитела - белки сыворотки крови, которые синтезируются в организме
как проявление защитной реакции при попадании в него чужеродного вещества
(антигена). Иммунная система вырабатывает специфические антитела на огромное
множество антигенов. В основе такой способности лежит наличие большого много-
образия клонов лимфоцитов, каждый из которых вырабатывает антитела с узкой
специфичностью. В совокупности называемые иммуноглобулинами (1g), антитела
составляют один из главных белковых компонентов крови - по весу около 20%
суммарного белка плазмы.
В качестве антигенов выступают различные вещества: клетки микроорганизмов,
вирусы, белки, нуклеиновые кислоты, в некоторых случаях низкомолекулярные ве-
щества типа антибиотиков или пестицидов. Антитела образуются не против всей
молекулы белка или бактериальной клетки, а только к небольшим участкам на их
поверхности, получивших название антигенных детерминант. В случае белковой
молекулы антигенной детерминантой являются участки поверхности, содержащие
около 5 аминокислотных остатков.
Простейшие молекулы антител имеют форму буквы Y с двумя идентичными анти-
ген-связывающими участками - по одному на конце каждой из двух "ветвей". Свя-
зывание антигенных детерминант приводит к потере определенных функций молеку-
лы или клетки, на чем и основан защитный механизм действия антител. Поскольку
участков два, они могут сшивать антигены:
молекула с 1 антигенной детерминантой
антитело
Если молекула антигена имеет три или большее число антигенных детерминант,
то антитела могут сшивать их в обширную сеть. Достигнув определенных разме-
ров , такая сеть может выпасть из раствора в осадок:
Тенденция больших иммунных комплексов к осаждению (преципитации) удобна для
выявления антител и антигенов. Образование таких комплексов может приводить к
агглютинации (склеиванию) молекул. Это явление лежит в основе определения
групп крови, когда эритроциты склеиваются антителами той или иной специфично-
сти - реакция гемагглютинации.
Молекула антитела образована четырьмя полипептидными цепями (рис. 33).
Две из них - идентичные легкие (L-цепь, из 220 аминокислот), а две - тяже-
лые (Н-цепь, из 440 аминокислот). Все четыре цепи соединены между собой неко-
валентными и ковалентными (дисульфидами) связями. Антиген-связывающие участки
образуются за счет одной Н и одной L-цепи. Эффективность реакций связывания
антигена возрастает благодаря гибкому шарнирному участку антитела, который
позволяет изменять расстояние между двумя антиген-связывающими участками.
Шарнирный участок находится на Н-цепи. Н-цепь образует также "хвостовой" уча-
сток молекулы, который содержит также одну или несколько олигосахаридных це-
почек, функция которых неясна. Как L, так и Н-цепь построены из повторяющихся
сегментов, или доменов, каждый из которых сворачивается независимо, образуя
компактную функциональную единицу (эпитоп). Эти участки также могут выступать
в качестве антигенных детерминант и, соответственно, связываться другими ан-
тителами .
Антиге н- связ ыв ающий
участок
Антиген-связывающий
участок
Н-цепи
Рис. 33. Строение антитела
Получение моноклональных
антител
Как образуются антитела? Иммунный ответ - сложный процесс межклеточных
взаимодействий различных типов лимфоидных клеток с участием специальных гор-
монов, в результате чего В-лимфоциты начинают активно синтезировать и выде-
лять в кровь специфические антитела против данного антигена. На поверхности
В-лимфоцитов существуют рецепторы, аналогичные антителам, взаимодействие ко-
торых с антигеном в сложном межклеточном комплексе служит стимулом для начала
биосинтеза антител.
Получение антител для нужд человека начинается с иммунизации животных. По-
сле нескольких инъекций антигена в присутствии стимуляторов иммунного ответа
в сыворотке крови накапливаются специфические антитела. Антитела выделяют из
сыворотки в виде g-глобулиновой фракции, осаждая сыворотку крови сульфатом
аммония, спиртом, ПЭГ и другими веществами. Полученные антитела содержат мно-
го примесных белков. Высокоочищенные антитела выделяют с помощью ионообменной
хроматографии.
Стандартные препараты получить довольно сложно, так как состав их зависит
от вида животного, его индивидуальных особенностей, цикла иммунизации, других
малоконтролируемых факторов. В то же время, для современного биохимического
анализа очень важна специфичность, то есть способность выделить данное веще-
ство в сложных многокомпонентных средах, таких, как сыворотки крови, сок рас-
тений , ферментная среда. Такое возможно при использовании иммунохимического
метода, использующего антитела, взаимодействующие узко специфично по принципу
"антиген - антитело". Для проведения такого анализа необходимы абсолютно
идентичные антитела, синтез которых обычными способами не приемлим.
Решение проблемы было предложено в 1975 году английскими учеными Георгом
Кёлером и Цезарем Мильштейном. Они разработали методику получения клеточных
гибридов - гибридом. Гибридомы образуются в результате слияния лимфоцитов,
взятых от иммунизированных животных, с клетками миеломы костного мозга, куль-
тивируемыми in vitro.
Животное иммунизируют, в ответ на введение антигена в организме мыши акти-
визируются продуцирующие антитела В-лимфоциты. Эти клетки могут жить только в
организме хозяина, при переводе на искусственную питательную среду они гиб-
нут. Если слить иммунную клетку с опухолевой, образуются гибридные клетки,
способные неограниченно долго жить в искусственных средах. Одновременно они
сохраняют способность синтезировать антитела.
Гибридомы, синтезирующие определенные виды антител, отбирают на селективных
ростовых средах. Затем их помещают в культуральную жидкость, в которой они
размножаются и образуют много родственных клеток (клон). Такие клоны могут
синтезировать антитела, получившие название моноклональных (МКА). МКА - анти-
тела, однородные по структуре и специфичности, которые можно производить в
неограниченных количествах.
Другой метод получения антител основан на инъекции полученной гибридомы в
брюшную полость мышки. Там гибридома реплицируется и вызывает образование ас-
цитной опухоли (скопления клеток, плавающих в жидкости, заполняющей брюшную
полость). Асцитная жидкость, выделенная из этой мыши, представляет суспензию,
содержащую антитела. Клетки и белки, не относящиеся к МКА, удаляются. Остав-
шийся материал, представленный преимущественно антителами, используют. Этот
метод позволяет получать высококонцентрированные препараты антител. Но массо-
вое производство требует одновременного использования нескольких тысяч мышей.
Кроме того, получаемый материал требует доочистки. Это дорого и трудоемко,
поэтому в настоящее время предпочтение отдается первому способу, с использо-
ванием культуры клеток.
Методы анализа на основе
моноклональных антител
Высокая специфичность антител в отношении антигена превращает их в мощный
инструмент для идентификации различных веществ, будь то макромолекулы, кле-
точные фрагменты или целые клетки.
Начало широкому использованию антител в диагностических целях положил в
1955 году американский иммунолог А. Кунс. Он присоединил к антителам светя-
щийся краситель. Флюоресцирующие антитела сделали видимыми места расположения
интересующих его молекул в клетке. Этот метод получил название иммунофлюорес-
центного . Чувствительность метода можно повысить несколькими путями.
В первом случае иммунный ответ усиливается за счет применения антител не-
скольких порядков:
меченые
антитела
2-го порядка
Антиген иммобилизуется на подложке, к нему добавляются антитела 1-го поряд-
ка, связывающиеся непосредственно с антигеном. В исследуемый образец добавля-
ются антитела 2-го порядка, связывающиеся с антигенными детерминантами анти-
тел 1-го порядка. Антитела 2-го порядка имеют флюоресцирующую (или другую)
метку. Поскольку участков связывания может быть несколько, то реакция прояв-
ляется более отчетливо.
Другая система усиления сигнала основана на высоком сродстве биотина (низ-
комолекулярного растворимого витамина) г стрептавидину (бактериальному бел-
ку) . Здесь возможны два варианта:
А. Если возможно коваленаГтно связать биотин непосредственно с антителами,
то стрептавидин метят маркером и используют аналогично антителам второго по-
рядка :
антиген
антитело
+ биотин
меченый
стрептавидин
Б. Система "биотин-антитело + стрептавидин + меченый биотин":
антитело
+ биотин
меченый
биотин
В этом случае образуется целая сеть из молекул стрептавидина, связанного с
меченым биотином. Следовательно, происходит многократное усиление сигнала.
Применение антител второго и третьего порядков позволяет также упрощать
процедуру определения микроорганизмов в мазке. При этом не обязательно иметь
меченые антитела против всех бактерий. Достаточно иметь обычные антитела кро-
лика или мыши против интересующего микроорганизма и меченые МКА против этих
иммуноглобулинов. Если микроорганизм в мазке присутствует, то к нему
"приклеятся" специфические антитела, а к ним уже - меченые. В результате ма-
зок будет светится при люминесцентной микроскопии. Фотометрические или флуо-
ресцентные методы могут быть использованы не во всех случаях, например, если
измерение проводят очень мутной среде.
Кроме красителя в качестве метки можно использовать фермент (иммунофермент-
ный анализ) или радиоактивный изотоп (иммунорадиологический). От чувствитель-
ности детекции маркера зависит чувствительность метода анализа.
Радиоактивные метки.
Выбор маркера и способа его «привязки» к антигену является одним из важных
этапов в проведении анализа. Первоначально широко применялись радиоизотопные
метки (радиоиммунный анализ - РИА), предложенные американскими исследователя-
ми (С. А. Берсон, Р. С. Ялоу, 1959). Однако в последние годы все более широ-
кое использование в качестве маркеров находят ферменты. Это обусловлено рядом
принципиальных трудностей, связанных с применением изотопных маркеров. Так,
изотоп 1251 имеет время полураспада 60 суток, чем ограничивается срок его ис-
пользования. Изотоп 3Н имеет длительное время жизни (12.5 лет), однако под
действием бэта-излучения происходит распад молекул антигена, в результате че-
го время жизни меченых 3Н-соединений тоже ограничено. Кроме того, эффектив-
ность счета трития существенно ниже, чем 1251. Ограничивающими факторами РИА
являются сложность и высокая стоимость оборудования, необходимость централи-
зованной системы распределения иммунохимических наборов, меченных радиоактив-
ными изотопами, определенная опасность изотопов для окружающей среды. Учиты-
вая трудности использования радиоизотопных меток, были предложены в качестве
маркеров ферменты.
При иммуноферментном анализе антиген связывается с поверхностью лунки поли-
стирольного планшета. В лунку добавляют антитела, несущие фермент в качестве
метки, инкубируют и отмывают. Далее приливают субстрат, который меняет окра-
ску при взаимодействии с этим ферментом. Изменение окраски можно измерить с
помощью спектрофотометрии. Таким способом проводится индикация и количествен-
ная оценка биоорганических соединений с чувствительностью до 10”12 г/литр.
В настоящее время известно более 2000 разных ферментов, однако, только не-
которые находят применение в иммуноферментном анализе. Это объясняется высо-
кими требованиями, предъявляемыми к свойствам ферментов. Фермент должен быть
высоко активен, а продукты его реакции детектироваться с высокой чувствитель-
ностью, он должен быть стабилен, так чтобы его активность сохранялась не ме-
нее одного года. Содержание фермента-маркера в определяемом образце должно
быть минимальным. Именно из-за этого для разных объектов используют разные
ферменты. Во многих случаях, когда необходим качественный результат, оценка
иммунохимической реакции может быть проведена визуально.
Для введения ферментативной метки разработано много разных химических, био-
химических и иммунологических способов.
Первым реагентом, использованным для синтеза иммуноферментных конъюгатов,
был глутаровый альдегид, реагирующий с аминогруппами лизина белковых молекул.
С помощью глутарового альдегида получены конъюгаты антител и антигенов с пе-
роксидазой, щелочной фосфатазой, глюкоамилазой. В настоящее время широко ис-
пользуются иммунопероксидазные конъюгаты и конъюгаты с бэта-галактозидазой.
Ковалентные методы получения иммуноферментных конъюгатов нашли весьма широ-
кое распространение, однако, к некоторых случаях действие сшивающего реагента
отрицательно сказывается на ферментативной и иммунологической активности ком-
понентов гибридной макромолекулы. В связи с этим определенный интерес пред-
ставляют иммунологические методы введения ферментной метки.
Один из подходов получил название метода «гибридных антител». Ферментатив-
ным гидролизом получают Fab-фрагменты молекул антител против определяемого
антигена и используемого фермента. Затем смесь продуктов гидролиза подвергают
восстановлению меркаптоэтанодом; при этом Fab-фрагменты обратимо диссоциируют
на симметричные части. После удаления восстанавливающего агента молекулы сно-
ва ассоциируют, образуя гибридные молекулы антител, специфичные к определяе-
мому антигену и ферменту. При добавлении фермента образуется комплекс антите-
ло-фермент (рис. 19, а). Гибридомная технология открывает принципиально новый
путь получения гибридных антител, который заключается в том, что сливаются
моноклональные клетки, специфичные против данного антигена и фермента-
маркера, в результате чего образуются гибридомы второго поколения, синтези-
рующие антитела, с двумя специфичностями.
Другой путь заключается в том, что получают антитела одного и того же вида
животного (например, кролика) против определяемого антигена и фермента, кото-
рые соединяют между собой через антитела другого вида животных (антитела ба-
рана против кролика). Добавление фермента к такой тройной молекуле также при-
водит к образованию комплекса антитело—фермент. В настоящее время разрабаты-
ваются подходы получения гибридных антител методами клеточной и генной инже-
нерии, что позволит существенно упростить способ их получения.
Стабильность иммуноферментных конъюгатов при хранении — важнейший параметр,
обусловливающий возможность их практического использования. Методы направлен-
ной стабилизации конъюгатов пока еще не разработаны. Не существует также кор-
реляции между стабильностью конъюгатов и методом их получения. Однако высокая
стабильность гибридных молекул обеспечивает их применение на практике и зна-
чительно превосходит стабильность антител и антигенов, меченных радиоактивны-
ми изотопами. В лиофилизованном состоянии ферментные конъюгаты сохраняют свои
свойства до двух лет.
Кроме ферментов в качестве маркеров могут быть использованы субстраты. В
частности, в иммунокофакторном анализе применяются в качестве меток АТФ и
НАД, которые могут быть «пришиты» к молекуле антигена через адениновый оста-
ток таким образом, что сохраняется их способность взаимодействовать с фермен-
том. Аналогично были использованы субстраты пероксидазы (люминол, изолюми-
нол) , которые могут быть окислены пероксидом водорода в реакции хемилюминес-
ценции, катализируемой пероксидазой.
Применение моноклональных
антител
Наиболее широко используются моноклональные антитела в медицинской диагно-
стике. Разработаны сумки-укладки для постановки диагнозов. Если к антителами
присоединить радиоактивные или магнитоактивные материалы и ввести их в живой
организм, то можно выявить в нем патологические зоны. Такие МКА присоединяют-
ся к пораженным болезнью клеткам организма, а соответствующие индикаторные
материалы позволяют выяснить их местонахождение.
МКА используются и в процессах очистки веществ. Современные технологии ос-
нованы на присоединении антител к твердой матрице носителя. К ним добавляют
смесь молекул, содержащую искомый антиген. Затем комплексы антиген - антитело
отмываются от примесей, не связанных с матрицей. После разрушения ковалентных
связей антиген - антитело в растворе остаются свободные антигены.
Если получить антитела определенного типа и иммунизировать ими животное, то
образуются анти-антитела (антиидиотипные антитела). Они действуют на иммунную
систему как псевдоантиген и поэтому могут быть использованы для ее стимуля-
ции . На этом принципе основано получение вакцин нового типа. Наборы МКА могут
быть также предназначены для борьбы с аллергенами.
Моноклональные антитела и "мишенная" лекарственная терапия. Предполагается,
что большое разнообразие раковых заболеваний обусловлено активацией эндоген-
ных генов, вызванной химическими агентами, внутренними хромосомными пере-
стройками. Эти гены кодируют определенные белки, и поэтому раковые клетки мо-
гут содержать уникальные белки на поверхности клетки. Возможно, именно эти
белки участвуют в супрессии роста Здоровых клеток. Инактивируя эти белки,
можно тормозить рост раковых клеток.
Благодаря высокий специфичности МКА широко используются в качестве Зондов
для точного определения природы молекул поверхности клеток и клеточных орга-
нелл . С их помощью также можно проводить детекцию активности ферментов.
Методы иммуноферментного анализа применяют в диагностике вирусных заболева-
ний растений. Это позволяет сократить время получения безвирусного посадочно-
го материала, отбирать новые вирусоустойчивые сорта. При генноинженерных экс-
периментах можно быстро отбирать клоны - продуценты.
КЛОНИРОВАНИЕ ЖИВОТНЫХ
История метода
Все клетки организма животных несут одинаковую генетическую информацию. Од-
нако в процессе морфогенеза соматические клетки дифференцируются, в результа-
те чего часть генома репрессируется. Чем выше уровень специализации клеток,
тем меньше их тотипотентность. Эта закономерность была установлена в экспери-
ментах по пересадке ядер.
Впервые трансплантацию ядер соматических клеток зародышей в энуклеированные
клетки лягушки осуществили американские исследователи Р. Бриггс и Т. Кинг в
1952 году. Ученые, пользуясь микропипеткой, удаляли ядра из яйцеклеток шпор-
цевой лягушки, а вместо них пересаживали ядра клеток эмбрионов, находящихся
на разных стадиях развития. Проведенные исследования показали, что ядра ран-
них эмбрионов в стадии поздней бластулы и даже ранней гаструлы обладают тоти-
потентностью и обеспечивают нормальное развитие эмбрионов. Если брать ядра из
клеток зародыша на ранней стадии его развития - бластуле, то примерно в 80%
случаев зародыш благополучно развивается дальше и превращается в нормального
головастика. Если же развитие зародыша, донора ядра, продвинулось на следую-
щую стадию - гаструлу, то лишь менее чем в 20% случаев оперированные яйце-
клетки развивались нормально. При пересадке ядер из более дифференцированных
клеток (мезодермы и средней кишки) поздней гаструлы у эмбрионов наблюдалось
недоразвитие и даже отсутствие нервной системы. После пересадки ядра из кле-
ток более позднего развития яйцеклетки вообще не развивались.
Более широкие исследования, охватывающие не только амфибий, но и рыб, а
также дрозофил, в 1962 г. были начаты английским биологом Дж. Гордоном. Он
первым в опытах с южноафриканскими жабами Xenopus laevis в качестве донора
ядер использовал не зародышевые клетки, а уже вполне специализировавшиеся
клетки эпителия кишечника плавающего головастика. Ядра яйцеклеток реципиентов
он не удалял хирургическим путем, а разрушал ультрафиолетовыми лучами. В
большинстве случаев реконструированные яйцеклетки не развивались, но примерно
десятая часть их них образовывала эмбрионы. 6,5% из этих эмбрионов достигали
стадии бластулы, 2,5% - стадии головастика и только 1% развился в половозре-
лых особей. Однако появление нескольких взрослых особей в таких условиях мог-
ло быть связано с тем, что среди клеток эпителия кишечника развивающегося го-
ловастика довольно длительное время присутствуют первичные половые клетки,
ядра которых могли быть использованы для пересадки. В последующих работах,
как сам автор, так и многие другие исследователи не смогли подтвердить данные
этих первых опытов.
Позже Гордон модифицировал эксперимент. Поскольку большинство реконструиро-
ванных яйцеклеток (с ядром клетки кишечного эпителия) погибают до завершения
стадии гаструлы, он попробовал извлечь из них ядра на стадии бластулы и снова
пересадить их в новые энуклеированные яйцеклетки (такая процедура называется
"серийной пересадкой" в отличие от "первичной пересадки"). Число зародышей с
нормальным развитием после этого увеличивалось, и они развивались до более
поздних стадий по сравнению с зародышами, полученными в результате первичной
пересадки ядер.
Затем Гердон вместе с Ласки (1970) стали культивировать in vitro (вне орга-
низма в питательной среде) клетки почки, легкого и кожи взрослых животных и
использовать уже эти клетки в качестве доноров ядер. Примерно 25% первично
реконструированных яйцеклеток развивались до стадии бластулы. При серийных
пересадках они развивались до стадии плавающего головастика. Таким образом
было показано, что клетки трех разных тканей взрослого позвоночного (X.
laevis) содержат ядра, которые могут обеспечить развитие по крайней мере до
стадии головастика.
В свою очередь Ди Берардино и Хофнер (1983) использовали для трансплантации
ядра неделящихся и полностью дифференцированных клеток крови - эритроцитов
лягушки Rana pipiens. После серийной пересадки таких ядер 10% реконструиро-
ванных яйцеклеток достигали стадии плавающего головастика. Эти эксперименты
показали, что некоторые ядра соматических клеток способны сохранять тотипо-
тентность .
Причины, по которым ядра клеток взрослых животных и даже поздних эмбрионов
остаются тотипотентными, пока точно не установлены. Решающую роль играет
взаимодействие ядра и цитоплазмы. Содержащиеся в цитоплазме животных вещества
принимают участие в регулировании экспрессии клеточного генов ядра. Не исклю-
чено, что ядра дифференцированных клеток не могут изменить асинхронную репли-
кацию ДНК на синхронную, характерную для ранних стадий эмбриогенеза. В связи
с этим вопрос о возможности активации генов в дифференцированных соматических
клетках представляет особую важность. Работы М. ди Бернардино и Н. Хоффера
показали, что цитоплазма ооцитов амфибий содержит факторы, восстанавливающие
тотипотентность ядер дифференцированных соматических клеток. Эти факторы ре-
активируют репрессированные участки генома.
В 1985 г. была описана технология клонирования костных рыб, разработанная
советскими учеными Л.А. Слепцовой, Н.В. Дабагян и К.Г.Газарян. Зародыши на
стадии бластулы отделяли от желтка. Ядра клеток зародышей впрыскивали в цито-
плазму неоплодотворенных икринок, которые начинали дробиться и развивались в
личинки. Эти эксперименты показали, что потеря ядром тотипотентности в про-
цессе онтогенеза связана не с утерей генов, а их репрессией. При культивиро-
вании соматических клеток in vitro частота тотипотентности ядер увеличивает-
ся. Генетический механизм стабильной репрессии генома дифференцированных кле-
ток не выяснен, способы восстановления тотипотентности не разработаны, поэто-
му в основном ведется клонирование путем трансплантации ядер эмбриональных
клеток.
Пересадки ядер у млекопитающих начались позднее, в 80-х годах. Это было
связано с техническими трудностями, так как зигота млекопитающих имеет не-
большие размеры. Например, диаметр зиготы мыши приблизительно 60 мкм, а диа-
метр оплодотворенной яйцеклетки лягушки около 1200 мкм, т.е. в 20 раз больше.
Зигота коровы несколько крупнее, чем зигота мыши, диаметр ее составляет 160
мкм, но пронуклеусы скрыты яичным желтком, поэтому перед микроманипуляциями
необходима специальная обработка зигот.
Несмотря на перечисленные трудности, первые сообщения о получении клонов
мышей, идентичных донору, появились уже в 1981 году. В качестве донора были
использованы эмбриональные клетки одной из линий мышей, взятые на стадии бла-
стоцисты. Достоверность полученных данных вначале была поставлены под сомне-
ние, так как воспроизвести результаты проведенных экспериментов в других ла-
бораториях не удавалось, однако пару лет спустя Дж. Мак Грат и Д. Солтер так-
же достигли успеха. В этих экспериментах клоны мышей удавалось получить лишь
в том случае, если трансплантировали ядра эмбрионов на стадии не позднее 2
бластомеров. Было показано, что ядра 8-клеточных зародышей и клеток внутрен-
ней клеточной массы бластоцисты не обеспечивают развитие in vitro реконструи-
рованных яйцеклеток даже до стадии морулы, которая предшествует стадии бла-
стоцисты. Небольшая часть (5%) ядер 4-клеточных зародышей дает возможность
развиваться только до стадии морулы. Эти и многие другие данные показывают,
что в эмбриогенезе у мышей клеточные ядра рано теряют тотипотентность, что
связано очевидно, с очень ранней активацией генома зародыша - уже на стадии
2-х клеток. У других млекопитающих, в частности, у кроликов, овец и крупного
рогатого скота, активация первой группы генов в эмбриогенезе происходит позд-
нее, на 8-16-клеточной стадии. Возможно, поэтому первые значительные успехи в
клонировании эмбрионов были достигнуты на других видах млекопитающих, а не на
мышах. Тем не менее, работы с мышами, несмотря на их непростую судьбу, значи-
тельно расширили наши представления о методологии клонирования млекопитаю-
27
щих .
Методы трансплантации ядер
В нашей стране Б.В. Конюховым и Е.С. Платоновым в 1985 г. был разработан
метод менее травматического переноса ядер методом микроманипуляции. Он проте-
кает в два этапа: сначала тонкой микропипеткой прокалывают зоны пеллюцида и
плазматической мембраны и извлекают пронуклеусы, а затем другой пипеткой,
большего диаметра (12 мкм) в то же отверстие вводят диплоидное ядро донора. В
этом случае меньше травмируется цитоплазма зиготы и транспортируемое ядро до-
нора .
Трансплантация ядер может осуществляться и другим способом, с использовани-
ем цитохалазинов (веществ, синтезируемых грибами).
Цитохалазин В разрушает структуру микрофиламентов и способствует уникально-
му расположению ядра. Ядро остается соединенным с клеткой тоненьким стебель-
ком цитоплазмы. При центрифугировании этот мостик разрывается, образуются
безъядерные клетки (цитопласты) и кариопласты, представляющие собой ядра, ок-
руженные тонким слоем цитоплазмы и цитоплазматической мембраной. Цитопласты
отделяют от интактных клеток в градиенте плотности. Они сохраняют способность
прикрепляться к поверхности культурального сосуда и могут быть использованы
для слияния с кариопластами других клеток с целью получения жизнеспособной
клетки.
Методы выделения кариопластов несколько сложнее и включают в себя ряд опе-
рации по центрифугированию, разделению в градиенте плотности и т.д. В некото-
рых случаях к смеси клеток и кариопластов добавляют частицы тантала диаметром
1-3 мкм. Они проникают в клетки и никогда в кариопласт, поэтому более тяже-
лые клетки осаждаются быстрее кариопластов.
27
В результате чего научились клонировать овец, свиней и ... возможно человека.
Цитопласты содержат все виды органелл, присущие нормальной клетке, сохраня-
ют способность прикрепляться к субстрату, образовывать складчатую мембрану,
передвигаться, осуществлять пиноцитоз.
Кариопласты окружены тонким слоем цитоплазмы (около 10% от всей клеточной
цитоплазмы), содержат компактный эндоплазматический ретикулум, несколько ми-
тохондрий и рибосом. У некоторых клеточных линий 1/10 кариопластов способна
восстановить весь утраченный объем цитоплазмы и восстановиться в жизнеспособ-
ные клетки.
Для реконструкции клеток суспензию кариопластов в солевом буфере добавляют
к монослою культуры цитопластов из пропорции 100 кариопластов на 1 цитопласт.
Цитопласты должны быть уже покрыты инактивированными вирусными частицами. Ин-
кубируют при температуре 4°C 45 минут, а затем еще 45 минут при температуре
37°С. Отмывают раствором Эрла для удаления не слившихся кариопластов.
Клонирование млекопитающих
Американские исследователи С. Стик и Дж. Робл, используя методику МакГрата
и Солтера, в 1988 г. получили 6 живых кроликов, пересадив ядра 8 клеточных
эмбрионов одной породы в лишенные ядра яйцеклетки кроликов другой породы. Фе-
нотип родившихся полностью соответствовал фенотипу донора. В этих эксперимен-
тах только 6 из 164 реконструированных яйцеклеток (3,7%) развились в нормаль-
ных животных. Это, конечно, очень низкий выход, практически не позволяющий
рассчитывать на получение таким методом клона генетически идентичных живот-
ных. Ценность этой работы тем не менее в том, что она показала возможность
клонирования эмбрионов кроликов.
Первые успешные эксперименты по клонированию сельскохозяйственных животных
были проведены С. Уилладсином (S.Willadsen) в 1986 г. Он сливал безъядерные
яйцеклетки с бластомерами, выделенными из 8 и 16-клеточного эмбриона овцы.
Дж. Робл и его сотрудники в 1987 провели работы по пересадке ядер крупного
рогатого скота. Они пересаживали в зиготы кариопласты - мужской и женский
пронуклеусы вместе с окружающей их цитоплазмой, а также ядра 2-, 4- или 8-
клеточных эмбрионов коровы. Сначала зиготы центрифугировали чтобы освободить
пронуклеусы от окружающих их гранул желтка, после чего ядра были хорошо видны
под микроскопом, что значительно облегчало их удаление. При помощи манипуля-
тора и заостренной стеклянной микропипетки извлекали один из бластомеров вме-
сте с ядром из ранних зародышей и переносили его в энуклеированную зиготу.
Реконструированные зародыши были заключены в агаровый цилиндр и пересажены
в перевязанный яйцевод овцы. Через пять дней культивирования их вымывали, ос-
вобождали от агара и исследовали. Реконструированные зародыши в этой работе
развивались только в тех случаях, когда в зиготы пересаживали пронуклеусы:
17% таких зародышей достигли стадии морулы или бластоцисты. Два зародыша были
пересажены второму реципиенту - в матку коровы, и развитие их завершилось ро-
ждением живых телят. Если в качестве доноров использовали ядра 2-, 4- или 8-
клеточных зародышей, то реконструированные яйцеклетки не развивались даже до
стадии морулы.
Позже были и более успешные работы. С. Уиладсин (1989), в частности, сооб-
щил, что ему удалось получить четырех генетически идентичных бычков холстейн-
ской породы в результате пересадки в реципиентные яйцеклетки ядер бластомеров
одного 32-клеточного зародыша. Автор утверждал, что большинство ядер сохраня-
ет тотипотентность на 32-клеточной стадии, а значительная их часть даже на
64-клеточной стадии, обеспечивая нормальное развитие реконструированных яйце-
клеток до стадии ранней бластоцисты в яйцеводе овцы. После пересадки в матку
коров - окончательных реципиентов, как полагает автор, они могут и дальше
нормально развиваться.
К. Бондиоли и соавторы (1990), используя в качестве доноров ядер 16-64-
клеточные зародыши коров, трансплантировали 463 реконструированных зародыша в
матку синхронизированных реципиентов, и было получено 92 живых теленка. Семь
из них были генетически идентичны, представляя собой клон, полученный в ре-
зультате пересадки ядер клеток одного донорского эмбриона.
Таким образом, клеточные ядра зародышей крупного рогатого скота достаточно
долго сохраняют тотипотентность и могут обеспечить полное развитие реконст-
руированных яйцеклеток. Иначе говоря, методические трудности клонирования за-
родышей крупного рогатого скота практически решены.
Экспериментов по клонированию свиней немного. Успешные исследования провели
Р. Пратер с сотрудниками в 1989 г. Скудность данных, видимо, связана с опре-
деленными трудностями работы с этим объектом.
В 1993-1995 годах, группа исследователей под руководством Я. Уилмута (Ian
Wilmut) из Рослинского института получила клон овец - 5 идентичных животных,
донорами ядер которых была культура эмбриональных клеток. Клеточную культуру
получали следующим образом: выделяли микрохирургически эмбриональный диск из
9-дневного овечьего эмбриона (бластоцисты) и культивировали клетки in vitro в
течение многих пассажей (по крайней мере до 25) . Сначала клеточная культура
напоминала культуру стволовых недифференцированных эмбриональных клеток, но
вскоре, после 2-3-х пассажей, клетки становились уплотненными и морфологиче-
ски сходными с эпителиальными. Эта линия клеток из 9-дневного зародыша овцы
была обозначена как TNT4.
Чтобы донорское ядро и реципиентная цитоплазма находились на сходных стади-
ях клеточного цикла, останавливали деление культивируемых клеток TNT4 на оп-
ределенной стадии (GO) и ядра этих клеток пересаживали в энуклеированные яй-
цеклетки (соответственно на стадии метафазы II). Реконструированные эмбрионы
заключали в агар и трансплантировали в перевязанные яйцеводы овец. Через 6
дней эмбрионы вымывали из яйцевода первого реципиента и исследовали под мик-
роскопом. Отбирали те, которые достигли стадии морулы или бластоцисты и пере-
саживали их в матку овцы - окончательного реципиента, где развитие продолжа-
лось до рождения. Родилось 5 ягнят (самок) из них 2 погибли вскоре после рож-
дения, 3-й в возрасте 10 дней, а 2 оставшихся нормально развивались и достиг-
ли 8-9-месячного возраста. Фенотипически все ягнята были сходны с породой
овец, от которой получали исходную линию клеток TNT4. Это подтвердил и гене-
тический анализ.
Эта работа, особенно в части культуры эмбриональных клеток, - значительное
достижение в клонировании млекопитающих, хотя она и не вызвала столь шумного
интереса, как статья того же Уилмута с соавторами, опубликованная в начале
1997 года, где сообщалось, что в результате использования донорского ядра
клетки молочной железы овцы было получено клональное животное - овца по клич-
ке Долли. Последняя работа методически во многом повторяет предыдущее иссле-
дование 1996 года, но в ней ученые использовали эмбриональные и фибробласто-
подобные клетки плода и клетки молочной железы взрослой овцы. Клетки молочной
железы получали от шестилетней овцы породы финн дорсет, находящейся на по-
следнем триместре беременности. Все три типа клеточных культур имели одинако-
вое число хромосом - 54, как обычно у овец. Эмбриональные клетки использовали
в качестве доноров ядер на 7-9-м пассажах культивирования, фибробластоподоб-
ные клетки плода - на 4-6-м пассажах и клетки молочной железы - на 3-6-м пас-
сажах. Деление клеток всех трех типов останавливали на стадии GO и ядра кле-
ток пересаживали в энуклеированные ооциты (яйцеклетки) на стадии метафазы II.
Был использован метод электрослияния. Большинство реконструированных эмбрио-
нов сначала культивировали в перевязанном яйцеводе овцы, но некоторые и in
vitro в химически определенной среде. Коэффициент выхода морул или бластоцист
при культивировании in vitro в одной серии опытов был даже вдвое выше, чем
при культивировании в яйцеводе.
Выход морул или бластоцист в серии опытов с культурой клеток молочной желе-
зы был примерно втрое меньше, чем в двух других сериях, когда в качестве до-
норов ядер использовали культуру фибробластов плода или эмбриональных клеток.
Число живых ягнят в сравнении с числом пересаженных в матку окончательного
реципиента морул или бластоцист было также в два раза ниже. В серии опытов с
клетками молочной железы из 277 реконструированных яйцеклеток был получен
только один живой ягненок, что говорит об очень низкой результативности тако-
го рода экспериментов (0,36%). Анализ генетических маркеров всех семи родив-
шихся в трех сериях экспериментов живых детенышей показал, что клетки молоч-
ной железы были донорами ядер для одного, фибробласты плода - для двух и эм-
бриональные клетки - четырех ягнят. Овца по кличке Долли развилась из рекон-
струированной яйцеклетки, донором ядра которой была культивируемая клетка мо-
лочной железы овцы породы финн дорсет и фенотипически не отличается от овец
этой породы, но сильно отличается от овцы-реципиента. Анализ генетических
маркеров подтвердил этот результат.
Успех авторов этой работы, прежде всего, связан с использованием длительных
клеточных культур, так как после многих пассажей в культуре клеток могли быть
отобраны малодифференцированные стволовые клетки, которые, вероятно, и были
использованы как доноры ядер. Большое значение также имел тот факт, что авто-
ры, учитывая результаты своих предыдущих работ, синхронизировали стадии кле-
точного цикла яйцеклеток реципиентов и клеток доноров.
Аналогичные эксперименты проводили позднее Tanja Dominko и сотрудники лабо-
ратории Висконсинского университета, которые обеспечили клонирование эмбрио-
нов из клеток кожи ушей взрослого рогатого скота. Эмбрионы, генетически иден-
тичные корове, пожертвовавшей клетки уха, были внедрены в матки коров - реце-
пиентов. Наблюдалась постепенная гибель эмбрионов, поэтому жизнеспособных те-
лят не получили. Причины пока не установлены.
В августе 1997 года появилось сообщение о том, что Алан Троунсон (Австра-
лия) разработал технологию, которая позволяет сформировать эмбрион из 16, 32
или 64 клеток и затем каждая из них может использоваться для формирования 16,
32 или 64 идентичных эмбрионов. Коллектив исследователей во главе с Аланом
Троунсоном создал 470 генетически идентичных эмбрионов рогатого скота от
единственной бластоцисты. Такая технология обеспечивает безграничный источник
генетического материала для клонирования.
Несмотря на отсутствие немедленных практических результатов сделанного от-
крытия, теоретическую значимость его трудно переоценить. Впервые было доказа-
но, что гены запрограммированы обратимо. Дальнейшие исследования могут позво-
лить понять, как регулируется работа генов, дифференциация клеток, почему
клетки в одних случаях растут и размножаются управляемо, а в других (при ра-
ке ) - неконтролируемо.
Уже сейчас корпорация Genzyme Transgenics планирует исследования с целью
создания трансгенного крупного рогатого скота, содержащего в молоке человече-
ский альбумин. Был куплен патент на получение эмбрионов, содержащих геном
клеток соединительной ткани (фибробластов), включающий ген, ответственный за
синтез человеческого белка. Несколько коров в настоящее время беременны
трансгенными телятами. Подобная технология позволяет увеличить эффективность
создания трансгенных молочных животных, так как при обычном впрыскивании ге-
нов в оплодотворенную яйцеклетку рождается только 5 - 10% трансформированных
животных, из них - несколько самцов, не дающих молока. Использование новой
технологии клонирования позволяет получать животных только женского пола,
дающих трансгенный протеин.
РЕГУЛИРОВАНИЕ ВОСПРОИЗВОДСТВА
СЕЛЬСКОХОЗЯЙСТВЕННЫХ ЖИВОТНЫХ
Воспроизводство животных - это основной фактор, лимитирующий эффективность
производства животноводческих продуктов на промышленной основе. Причины,
препятствующие достижению оптимальных результатов в воспроизводстве домашнего
скота различны. Новые методы расширяют возможности регулирования воспроизвод-
ства . Они связаны с манипулированием на уровне клеток или эмбрионов, с ис-
пользованием физиологически активных соединений, поэтому названы биотехноло-
гическими. К числу этих методов относят: стимуляцию и синхронизацию окоты,
суперовуляцию, искусственное осеменение, трансплантацию эмбрионов, хранение
гамет и эмбрионов, целенаправленное получение двоен, регулирование пола, ран-
нюю диагностику беременности, управление процессом родов, создание химер и
др.
Стимуляция и синхронизация окоты осуществляется с помощью прогестерона -
женского полового гормона стероидной природы, регулирующего ход эстрального
цикла, простагландинов, а также их комбинации. Этот прием позволяет вызывать
появление окоты у групп племенных животных в один и тот же период времени.
В США для синхронизации окоты у телок в молочном и мясном скотоводстве вы-
пускается новый препарат под названием "Синхромейт-В". Он представляет сово-
купность двух гормонов, один из которых имплантируется под кожу, а другой
инъецируется внутримышечно. Имплант помещается под кожу уха телки и сразу же
после этого следует инъекция другого гормона. Под действием этих двух гормо-
нов эстральный цикл телки прерывается и временно останавливается. Через неко-
торое время имплант удаляют из уха животного, начинается новый эстральный
цикл. Так как имплант удаляется одновременно у всех телок, то и цикл начина-
ется в одно и то же время.
Применение гормональных препаратов снимает необходимость ежедневного кон-
троля за состоянием половой активности животных. Преимущество синхронизиро-
ванной охоты состоит в реальной возможности формирования однородных групп жи-
вотных в период осеменения, одновременности рождения приплода, точном учете
кормов в группах.
Суперовуляция
Потенциальные возможности воспроизводства самок млекопитающих огромны. В их
яичниках содержатся десятки и сотни тысяч овоцитов. Однако в процессе онтоге-
неза лишь небольшая часть из них реализуется в виде потомков. Остальные ово-
циты подвергаются атрезии (обратному развитию) и воспроизводстве не участву-
ют .
Суперовуляция - состояние, вызванное гормонами, когда в яичниках животных
развивается и овулирует в несколько раз больше яйцеклеток. В зависимости от
вида число овулирующих яйцеклеток может быть увеличено в 3 - 8 и даже в 50
раз. С помощью этого приема становится возможным получение большего количест-
ва эмбрионов от лучших по продуктивности коров.
Искусственное осеменение28
Искусственное осеменение животных является самым старым и хорошо отработан-
ным биотехнологическим методом разведения сельскохозяйственных животных. При-
менение этого метода позволяет ограничить распространение половых инфекций,
которые нередко служат причиной бесплодия животных. Оно также позволяет эф-
фективно использовать генетический потенциал лучших производителей. Экономи-
ческий эффект от искусственного осеменения обусловлен снижением затрат на со-
держание большого поголовья производителей, возможностью быстрого размножения
генотипа с хозяйственно - полезными признаками, улучшением генетического по-
тенциала ремонтного стада.
Трансплантация эмбрионов
Трансплантация эмбрионов в настоящее время является одной из наиболее акту-
альных проблем в области животноводства. С помощью пересадки эмбрионов можно
резко увеличить выход числа потомков от высокопродуктивных коров. Трансплан-
тация эмбрионов, или эмбриотехнология, заключается в получении одного или не-
скольких эмбрионов из матки племенных животных (доноров) и пересадке в матку
коров (рецепиентов), где эмбрионы развиваются до отела. Этот метод в сочета-
нии с суперовуляцией у доноров позволяет получить большое потомство от высо-
копродуктивных животных. Этим способом эмбрионы можно внедрить в ту или иную
породу в другие регионы, используя в качестве рецепиентов коров мясных пород.
Применение этого метода также упрощает обмен генофондом сельскохозяйственных
животных между странами и континентами. Пересадка эмбрионов может быть ис-
пользована для получения потомства от ценных, но бесплодных коров, утративших
способность к размножению в результате несчастного случая, болезни или по
возрасту.
Когда было установлено, что кролик обладает иммунитетом по отношению к ящу-
ру, была выдвинута идея использования метода трансплантации для оздоровления
потомства зараженных ящуром животных. Половые пути кролика, куда транспланти-
руются эмбрионы, способны разрушать вирус ящура в эмбрионах. Трансплантация
может быть использована и для временного хранения эмбрионов. В яйцеводах
крольчих удается осуществлять трансконтинентальную перевозку эмбрионов овец.
28 Вообще-то все упомянутое в этой главе следует отнести к сельскому хозяйству или даже к ве-
теринарии , но автору публикации видней.
Извлечение эмбрионов до 70-х годов производили в основном хирургическим пу-
тем, впоследствии он был заменен менее травматичным и трудоемким нехирургиче-
ским, основанным на введении в матку особого зонда по естественному каналу.
Зонд имеет три канала. Один из каналов предназначен для надувания баллончика,
который закупоривает рог матки, препятствуя вытеканию жидкости. По другому
каналу вводится физиологический раствор с температурой 25-30°С, который вымы-
вает эмбрионы и возвращается вместе с ними через третий канал зонда в про-
бирку, помещенную в водяную баню с температурой 35°С. Из этой жидкости извле-
каются эмбрионы. В среднем при суперовуляции от донора можно получить от 5 до
7 эмбрионов.
Трансплантацию производят с помощью специального зонда или пистолета для
осеменения. Эмбрионы помещаются в рога матки. Стельность у самок - рецепиен-
тов проверяется по уровню прогестерона в плазме крови на 21-й день.
Регулирование пола
В практике разведения животных очень важно научиться управлять образованием
в потомстве мужских и женских особей. Метод разделения эмбрионов по полу ос-
нован на определении белков, специфичных для самцов. Этом метод широко приме-
няется в животноводческой практике многих стран. В Канаде уже с 1975 года
рождаются телята, разделенные по полу на стадии эмбрионов. В перспективе для
целенаправленного получения особей мужского или женского пола может быть при-
менен метод микрохирургической замены X и У хромосом. Такие манипуляции уже
проводились на растительных клетках и яйцеклетках земноводных.
ЛИТЕРАТУРА К РАЗДЕЛУ
«КУЛЬТУРЫ ЖИВОТНЫХ КЛЕТОК»
1 . Албертс Б., Брей Д. , Льюис Дж. и др. Молекулярная биология клетки. Т. 1.
М. : Мир, 1994.
2 .Артамонов В.И. Биотехнология - агропромышленному комплексу. М. : Наука,
1989. 160 с.
3 .Артамонов В.И. Сельские профессии биотехнологии. М. : Изд-во МСХА, 1992.
127 с.
4 .Бекер М.Е., Лиепиньш Г.К., Райпулис Е.П. Биотехнология. М. : Агропромиз-
дат, 1990. 334 с.
5 .Березин И.В., Клесов А.А., Швядас В.К., Угарова Н.Н., Варфоломеев С.Д.,
Ярополов А.И., Казанская Н.Ф., Егоров А.М. Инженерная энзимология. // Биотех-
нология. Кн. 8. М.: Высшая школа, 1987. 143 с.
6 .Герасименко В.Г. Биотехнология. Киев: Выща школа, 1989. 343 с.
7 .Гринберг К.Н., Кухаренко В.И., Ляшко В.Н., Терехов С.М., Пичугина Е . М. ,
Фрейдин М.И., Чериков В.Г. Культивирование фибробластов человека для диагно-
стики наследственных болезней. // Методы культивирования клеток. Л. : Наука,
1988. С. 251 - 260.
8 .3авертляев Б.П. Биотехнология в воспроизводстве и селекции крупного рога-
того скота. Л.: Агропромиздат, 1989. 255 с.
Э .Какпаков В.Т. Культивирование клеток и тканей беспозвоночных. // Методы
культивирования клеток. Л.: Наука, 1988. С. 241 - 250.
10 .Конюхов Б. В. Долли - случайность или закономерность? // Человек. 1998.
№ 3
И.Крыжанов М.А., Залесских А.Ф., Троицкая М.В., Соловьев В.В., Тихомиров
А.И. Культивирование клеточной линии НЕР-2 на микроносителях с целью получе-
ния вируса полиомиелита. // Биотехнология и генетика. Н.Новгород, 1991. С.
87 - 92.
12 .Прудовский И.А., Сухарев С.И. Гибридизация клеток животных. // Методы
культивирования клеток. Л.: Наука, 1988. С. 176 - 193
13 .Рингертц Н., Сэвидж Р. Гибридные клетки. М.: Мир, 1979. 412 с.
14 .Спиер Р.Е., Адамс Г.Д., Гриффитс Дж.Б. и др. Биотехнология клеток живот-
ных. М.: Агропромиздат, 1989. Т. 1, 2.
15 .Тартаковский А.Д. Питательные среды для культивирования клеток млекопи-
тающих. // Методы культивирования клеток. Л.: Наука, 1988. С. 44 - 63.
16 .Фрешни Р. Культура животных клеток. Методы. М.: Мир, 1989. 318 с.
17 .Фридлянская И.И. Получение моноклональных антител (гибридомная техноло-
гия). // Методы культивирования клеток. Л.: Наука, 1988. С. 194 - 205.
18 .Цуцаева А.А. , Петренко Т.Ф. Криоконсервация культивируемых клеток живот-
ных. // Методы культивирования клеток. Л.: Наука, 1988. С. 63 - 69.
19 .Wilmut I. et al. Viable offspring derived from fetal and adult mammalian
cell line // Nature. 1997. V.385. P. 810-813.
ГЕННАЯ ИНЖЕНЕРИЯ
ВВЕДЕНИЕ В ГЕНЕТИЧЕСКУЮ
ИНЖЕНЕРИЮ
Возможности генной
инженерии
Важной составной частью биотехнологии является генетическая инженерия. Ро-
дившись в начале 70-х годов, она добилась сегодня больших успехов. Методы
генной инженерии преобразуют клетки бактерий, дрожжей и млекопитающих в "фаб-
рики" для масштабного производства любого белка. Это дает возможность деталь-
но анализировать структуру и функции белков и использовать их в качестве ле-
карственных средств. В настоящее время кишечная палочка (Е. coli) стала по-
ставщиком таких важных гормонов как инсулин и соматотропин. Ранее инсулин по-
лучали из клеток поджелудочной железы животных, поэтому стоимость его была
очень высока. Для получения 100 г кристаллического инсулина требуется 800-
1000 кг поджелудочной железы, а одна железа коровы весит 200 - 250 грамм. Это
делало инсулин дорогим и труднодоступным для широкого круга диабетиков. В
1978 году исследователи из компании "Генентек" впервые получили инсулин в
специально сконструированном штамме кишечной палочки. Инсулин состоит из двух
полипептидных цепей А и В длиной 20 и 30 аминокислот. При соединении их ди-
сульфидными связями образуется нативный двухцепочечный инсулин. Было показа-
но, что он не содержит белков Е. coli, эндотоксинов и других примесей, не да-
ет побочных эффектов, как инсулин животных, а по биологической активности от
него не отличается. Впоследствии в клетках Е. coli был осуществлен синтез
проинсулина, для чего на матрице РНК с помощью обратной транскриптазы синте-
зировали ее ДНК-копию. После очистки полученного проинсулина его расщепили и
получили нативный инсулин, при этом этапы экстракции и выделения гормона были
сведены к минимуму. Из 1000 литров культуральной жидкости можно получать до
200 граммов гормона, что эквивалентно количеству инсулина, выделяемого из
1600 кг поджелудочной железы свиньи или коровы.
Соматотропин - гормон роста человека, секретируемый гипофизом. Недостаток
этого гормона приводит к гипофизарной карликовости. Если вводить соматотропин
в дозах 10 мг на кг веса три раза в неделю, то за год ребенок, страдающий от
его недостатка, может подрасти на 6 см. Ранее его получали из трупного мате-
риала, из одного трупа: 4-6 мг соматотропина в пересчете на конечный фарма-
цевтический препарат. Таким образом, доступные количества гормона были огра-
ничены, кроме того, гормон, получаемый этим способом, был неоднороден и мог
содержать медленно развивающиеся вирусы. Компания "Genentec" в 1980 году раз-
работала технологию производства соматотропина с помощью бактерий, который
был лишен перечисленных недостатков. В 1982 году гормон роста человека был
получен в культуре Е. coli и животных клеток в институте Пастера во Франции,
а с 1984 года начато промышленное производство инсулина и в СССР. При произ-
водстве интерферона используют как Е. coli, S. cerevisae (дрожжи), так и
культуру фибробластов или трансформированных лейкоцитов. Аналогичными метода-
ми получают также безопасные и дешевые вакцины.
На технологии рекомбинантных ДНК основано получение высокоспецифичных ДНК-
Зондов, с помощью которых изучают экспрессию генов в тканях, локализацию ге-
нов в хромосомах, выявляют гены, обладающие родственными функциями (например,
у человека и курицы). ДНК-зонды также используются в диагностике различных
заболеваний.
Технология рекомбинантных ДНК сделала возможным нетрадиционный подход "бе-
лок-ген", получивший название "обратная генетика". При таком подходе из клет-
ки выделяют белок, клонируют ген этого белка, модифицируют его, создавая му-
тантный ген, кодирующий измененную форму белка. Полученный ген вводят в клет-
ку. Если он экспрессируется, несущая его клетка и ее потомки будут синтезиро-
вать измененный белок. Таким образом, можно исправлять дефектные гены и ле-
чить наследственные заболевания.
Если гибридную ДНК ввести в оплодотворенное яйцеклетку, могут быть получены
трансгенные организмы, экспрессирующие мутантный ген и передающие его потом-
ками. Генетическая трансформация животных позволяет установить роль отдельных
генов и их белковых продуктов, как в регуляции активности других генов, так и
при различных патологических процессах. С помощью генетической инженерии соз-
даны линии животных, устойчивых к вирусным заболеваниям, а также породы жи-
вотных с полезными для человека признаками. Например, микроинъекция рекомби-
нантной ДНК, содержавшей ген соматотропина быка в зиготу кролика позволила
получить трансгенное животное с гиперпродукцией этого гормона. Полученные жи-
вотные обладали ярко выраженной акромегалией.
Сейчас даже трудно предсказать все возможности, которые будут реализованы в
ближайшие несколько десятков лет.
Генная инженерия
как наука, методы
Генетическая инженерия - конструирование in vitro функционально активных
генетических структур (рекомбинантных ДНК), или иначе - создание искусствен-
ных генетических программ (Баев А. А.). По Э. С. Пирузян генетическая инжене-
рия - система экспериментальных приемов, позволяющих конструировать лабора-
торным путем (в пробирке) искусственные генетические структуры в виде так на-
зываемых рекомбинантных или гибридных молекул ДНК.
Речь идет о направленном, по заранее заданной программе конструировании мо-
лекулярных генетических систем вне организма с последующим введением их в жи-
вой организм. При этом рекомбинантные ДНК становятся составной частью генети-
ческого аппарата рецепиентного организма и сообщают ему новые уникальные ге-
нетические, биохимические, а затем и физиологические свойства.
Цель прикладной генетической инженерии заключается в конструировании таких
рекомбинантных молекул ДНК, которые при внедрении в генетический аппарат при-
давали бы организму свойства, полезные для человека.
Технология рекомбинантных ДНК использует следующие методы:
- специфическое расщепление ДНК рестрицирующими нуклеазами, ускоряющее вы-
деление и манипуляции с отдельными генами;
- быстрое секвенирование всех нуклеотидов очищенном фрагменте ДНК, что по-
зволяет определить границы гена и аминокислотную последовательность, кодируе-
мую им;
- конструирование рекомбинантной ДНК;
- гибридизация нуклеиновых кислот, позволяющая выявлять специфические по-
следовательности РНК или ДНК с большей точностью и чувствительностью, осно-
ванную на их способности связывать комплементарные последовательности нуклеи-
новых кислот;
- клонирование ДНК: амплификация in vitro с помощью цепной полимеразной ре-
акции или введение фрагмента ДНК в бактериальную клетку, которая после такой
трансформации воспроизводит этот фрагмент в миллионах копий;
- введение рекомбинантной ДНК в клетки или организмы.
История генетической
инженерии
Генная инженерия появилась благодаря работам многих исследователей в разных
отраслях биохимии и молекулярной генетики. На протяжении многих лет главным
классом макромолекул считали белки. Существовало даже предположение, что гены
имеют белковую природу. Лишь в 1944 году Эйвери, Мак Леод и Мак Карти показа-
ли, что носителем наследственной информации является ДНК. С этого времени на-
чинается интенсивное изучение нуклеиновых кислот. Спустя десятилетие, в 1953
году Дж. Уотсон и Ф. Крик создали двуспиральную модель ДНК. Именно этот год
принято считать годом рождения молекулярной биологии.
На рубеже 50 - 60-х годов были выяснены свойства генетического кода, а к
концу 60-х годов его универсальность была подтверждена экспериментально. Шло
интенсивное развитие молекулярной генетики, объектами которой стали Е. coli,
ее вирусы и плазмиды. Были разработаны методы выделения высокоочищенных пре-
паратов неповрежденных молекул ДНК, плазмид и вирусов. ДНК вирусов и плазмид
вводили в клетки в биологически активной форме, обеспечивая ее репликацию и
экспрессию соответствующих генов. В 70-х годах был открыт ряд ферментов, ка-
тализирующих реакции превращения ДНК. Особая роль в развитии методов генной
инженерии принадлежит рестриктазам и ДНК-лигазам.
Историю развития генетической инженерии можно условно разделить на три эта-
па .
Первый этап связан с доказательством принципиальной возможности получения
рекомбинантных молекул ДНК in vitro. Эти работы касаются получения гибридов
между различными плазмидами. Была доказана возможность создания рекомбинант-
ных молекул с использованием исходных молекул ДНК из различных видов и штам-
мов бактерий, их жизнеспособность, стабильность и функционирование.
Второй этап связан с началом работ по получению рекомбинантных молекул ДНК
между хромосомными генами прокариот и различными плазмидами, доказательством
их стабильности и жизнеспособности.
Третий этап - начало работ по включению в векторные молекулы ДНК (ДНК, ис-
пользуемые для переноса генов и способные встраиваться в генетический аппарат
клетки-рецепиента) генов эукариот, главным образом, животных.
Формально датой рождения генетической инженерии следует считать 1972 год,
когда в Стенфордском университете П. Берг, С. Коэн, X. Бойер с сотрудниками
создали первую рекомбинантную ДНК, содержавшую фрагменты ДНК вируса SV40,
бактериофага и Е. coli.
ФЕРМЕНТЫ ГЕНЕТИЧЕСКОЙ ИНЖЕНЕРИИ
Основные группы
ферментов
Генетическая инженерия - потомок молекулярной генетики, но своим рождением
обязана успехам генетической энзимологии и химии нуклеиновых кислот, так как
инструментами молекулярного манипулирования являются ферменты. Если с клетка-
ми и клеточными органеллами мы подчас можем работать микроманипуляторами, то
никакие, даже самые мелкие микрохирургические инструменты не помогут при ра-
боте с макромолекулами ДНК и РНК. Что же делать? В роли "скальпеля", "ножниц"
и "ниток для сшивания" выступают ферменты.
Только они могут найти определенные последовательности нуклеотидов, "разре-
зать" там молекулу или, наоборот, "заштопать" дырку в цепи ДНК. Эти ферменты
издавна работают в клетке, выполняя работы по репликации (удвоению) ДНК при
делении клетки, репарации повреждений (восстановлению целостности молекулы),
в процессах считывания и переноса генетической информации из клетки в клетку
или в пределах клетки. Задача генного инженера - подобрать фермент, который
выполнил бы поставленные задачи, то есть смог бы работать с определенным уча-
стком нуклеиновой кислоты.
Следует отметить, что ферменты, применяемые в генной инженерии, лишены ви-
довой специфичности, поэтому экспериментатор может сочетать в единое целое
фрагменты ДНК любого происхождения в избранной им последовательности. Это по-
зволяет генной инженерии преодолевать установленные природой видовые барьеры
и осуществлять межвидовое скрещивание.
Ферменты, применяемые при конструировании рекомбинантных ДНК, можно разде-
лить на несколько групп:
- ферменты, с помощью которых получают фрагменты ДНК (рестриктазы);
- ферменты, синтезирующие ДНК на матрице ДНК (полимеразы) или РНК (обратные
транскриптазы);
- ферменты, соединяющие фрагменты ДНК (лигазы);
- ферменты, позволяющие осуществить изменение структуры концов фрагментов
ДНК.
Рестриктазы
Рестриктазы (рестрицирующие эндонуклеазы, эндонуклеазы рестрикции) - это
ферменты, узнающие и атакующие определенные последовательности нуклеотидов в
молекуле ДНК (сайты рестрикции).
Еще в 1953 году было обнаружено, что ДНК определенного штамма Е. coli, вве-
денная в клетки другого штамма (например, ДНК штамма В-в клетки штамма С)
не проявляет, как правило, генетической активности, так как быстро расщепля-
ется на мелкие фрагменты. В 1966 году было показано, что это явление связано
со специфической модификацией хозяйской ДНК - она содержит несколько метили-
рованных оснований, отсутствующих в немодифицированной ДНК, причем метилиро-
вание (добавление к основанию метильной группы) происходит уже после заверше-
ния репликации. Бактерия способна отличить свою собственную ДНК от любой
вторгающейся «чужеродной» именно по типу ее модификации. За «метку» отвечают
метилирующие ферменты модификации, так называемые ДНК-метилазы. Различие в
модификации делает чужеродную ДНК чувствительной к действию рестрицирующих
ферментов, которые узнают отсутствие метильных групп в соответствующих сай-
тах .
Системы рестрикции и модификации широко распространены у бактерий; их суще-
ствование играет важную роль в защите резидентной ДНК от загрязнения последо-
вательностями чужеродного происхождения. Рестриктаза, которая расщепляла не-
метилированную ДНК была выделена в 1968 г. Мезельсоном и Юанем. Этот фермент
был высокоспецифичен по отношению к определенной последовательности ДНК, но
расщеплял молекулы неспецифически, в другом месте, на некотором удалении от
участка узнавания. Вскоре, в 1970 г. Смит и Вилькокс выделили из Haemophilus
influenzae первую рестриктазу, которая расщепляла строго определенную после-
довательность ДНК (Hind III). Поскольку разные бактерии по-разному метят свою
ДНК, то и рестриктазы должны узнавать разные последовательности. И действи-
тельно, с тех пор выделены рестриктазы, узнающие более 150 сайтов рестрикции
(мест расщепления ДНК).
Полимеразы
Впервые ДНК-полимераЗа была выделена Корнбергом с сотрудниками в 1958 году
из Е. coli.
ДНК-полимераза I Е. coli (Pol I) не связывается с молекулами двухцепочечной
кольцевой ДНК. Однако если такие молекулы денатурировать и получить одноцепо-
чечные формы, то с последними полимераза связывается в количествах, пропор-
циональных длине этих участков — примерно одна молекула на 300 нуклеотидных
остатков. Pol 1 связывается с одноцепочечными участками двойной спирали ДНК,
в местах одноцепочечных разрывов с 3’-гидроксилом и 5’-фосфатом, а также с
концами двухцепочечных молекул ДНК.
Фермент состоит из мономерной полипептидной цепи с молекулярной массой 103
кДа и имеет 3-х доменную структуру. Каждый домен обладает своей ферментатив-
ной активностью: 5' - 3' полимеразной, 3' - 5' экзонуклезной, 5' - 3' экзо-
нуклеазной .
1. 5’— 3’ полимеразная активность. Для реакции необходимо наличие одноцепо-
чечной ДНК-матрицы и комплементарного участку этой цепи фрагмента — праймера
(Затравки) с 3’-ОН концом.
2. 3’- 5’ экзонуклеазная активность. Гидролизует одноцепочечную или двухце-
почечную ДНК с 3’-ОН конца. 3’—5’ нуклеаза расщепляет диэфирную связь только
в неспаренных участках ДНК. Известно, что при полимеразной реакции с опреде-
ленной частотой возможно включение в растущую цепь некомплементарного нуклео-
тида. Однако полимераза не может присоединять нуклеотид к неправильно спарен-
ному концу, образовавшемуся при ее участии. На помощь приходит 3’—5’ экзонук-
леаза, убирающая ошибочный нуклеотид, на место которого затем присоединяется
правильный нуклеотид-предшественник. 3’—5’ экзонуклеолитическая активность
проявляется в направлении, обратном синтезу ДНК (см. рис. 34). Таким образом,
3’—5’ экзонуклеазная активность ДНК-полимеразы играет важную роль в точности
полимеризации, направляемой матрицей. Эффективность, или число оборотов, дан-
ной экзонуклеазы в оптимальных условиях составляет 2% от числа оборотов субъ-
единицы с полимеразной активностью.
3. 5’— 3’ экзонуклеазная активность. Деградирует одну цепь двухцепочечной
ДНК, начиная со свободного 5’-конца. В отличие от 3’—5’ экзонуклеазы 5’—3’
экзонуклеаза расщепляет диэфирную связь только в спаренных участках двухцепо-
чечной молекулы ДНК. Более того, в то время как 3’—5’ нуклеаза отщепляет од-
номоментно только один нуклеотид, 5’—3’ нуклеаза может вы-презать с 5’- конца
олигонуклеотиды длиной до десяти остатков (около 20% продуктов гидролиза):
Скорость нуклеазного отщепления увеличивается на порядок при одновременно
протекающей реакции полимеризации. При этом увеличивается относительное коли-
чество олигонуклеотидов в продуктах гидролиза ДНК.
Такое сочетание ферментативных активностей позволяет ДНК-полимеразе I Е.
coli играть активную роль в репарации повреждений ДНК in vivo. N - концевой
домен соединен с соседним петлей из аминокислотных остатков и легко отделяет-
ся с помощью протеолитических ферментов. Оставшаяся часть бифункциональна,
так как состоит из полимеразы и 3' - 5' экзонуклезы. Она названа фрагментом
Кленова (по фамилии одного из авторов, описавших ее) . Фрагмент Кленова (Pol
IK) обычно используют для достройки одноцепочечных 5’-концов на двухцепочеч-
ной ДНК, часто генерируемых рестриктазами, до тупых; для синтеза второй цепи
на одноцепочечной ДНК, а также для гидролиза одноцепочечных 3’-концов на
двухцепочечных молекулах ДНК.
Место расщепления
Рис. 34. ДНК-полимераЗа I Е. coli: а) структура, б) модель взаи-
модействия с молекулой ДНК (Щелкунов С. Н., 1994)
Обратная транскриптаза
Обратная транскриптаза используется для транскрипции м-РНК в комплементар-
ную цепь ДНК. При изучении ретровирусов, геном которых представлен молекулами
одноцепочечной РНК, было обнаружено, что в процессе внутриклеточного развития
ретровирус проходит стадию интеграции своего генома в виде двухцепочечной ДНК
в хромосомы клетки-хозяина. В 1964 г. Темин выдвинул гипотезу о существовании
вирусспецифичного фермента, способного синтезировать на РНК-матрице компле-
ментарную ДНК. Усилия, направленные на выделение такого фермента, увенчались
успехом, и в 1970 г. Темин с Мизутани, а также независимо от них Балтимор от-
крыли искомый фермент в препарате внеклеточных вирионов вируса саркомы Рауса.
Данная РНК-зависимая ДНК-полимераза получила название обратная транскриптаза,
или ревертаза.
Наиболее детально изучена ревертаза ретровирусов птиц. Каждый вирион содер-
жит около 50 молекул этого фермента. Обратная транскриптаза состоит из двух
субъединиц — а (65 кДа) и Ь (95 кДа), присутствующих в эквимолярном количест-
ве . Обратная транскриптаза обладает, по крайней мере, тремя ферментативными
активностями:
1) ДНК-полимеразной, использующей в качестве матрицы как РНК, так и ДНК;
2) активностью РНКазы Н, гидролизующей РНК в составе гибрида РНК—ДНК, но не
одно- или двухцепочечную РНК;
3) ДНК-эндонуклеаЗной активностью.
Первые две активности необходимы для синтеза вирусной ДНК, а эндонуклеаза,
по-видимому, важна для интеграции вирусной ДНК в геном клетки-хозяина. Очи-
щенная обратная транскриптаза синтезирует ДНК как на РНК-, так и на ДНК-
матрицах. Чтобы начать синтез, ревертазе, как и другим полимеразам, необходим
короткий двухцепочечный участок (праймер). Праймером может служить одноцепо-
чечный сегмент как РНК, так и ДНК, которые в процессе реакции оказываются ко-
валентно связанными с новосинтезированной цепью ДНК.
мРНК
ci РНК ,*
□ 1 11 о
1 Поли (А ]-налиме-
ттМ, , £я,М«,Я>
олиго (d Т) - праймер
IltlHIIlljUW
3*
51
Рееертаза
поли (A) i
**--* J
* 51
----- """ д'
Щелочной гидролиз
РНК
оц-кДНК
<шг?--------
Ф/kkjuswt? Кленова
ДНК-полимеразы 1
Ревертаза
ди-кЛНК
:<||||||||Н111111П1111Н1Ю
I Нуклеаза 87
_t дц-кДНК _1
и - - — _ □
51---------------------WV4AA д'
Рис. 35. Схема синтеза двухцепочечных ДНК-копий молекул РНК
Обратную транскриптазу преимущественно используют для транскрипции матрич-
ной РНК в комплементарную ДНК (кДНК). Реакцию обратной транскрипции проводят
в специально подобранных условиях с использованием сильных ингибиторов РНКаз-
ной активности. При этом удается получать полноразмерные ДНК-копии целевых
молекул РНК. В качестве праймера при обратной транскрипции поли (А)-
содержащих мРНК используют олиго (dT) , а для молекул РНК, не имеющих 3 ’-поли
(А) концов, — химически синтезированные олигонуклеотиды, комплементарные 3’-
концу изучаемой РНК. После синтеза на мРНК комплементарной цепи ДНК и разру-
шения РНК (обычно применяют обработку щелочью) осуществляют синтез второй це-
пи ДНК. При этом используют способность ревертазы образовывать на 3’-концах
одноцепочечных кДНК самокомплементарные шпильки, которые могут выполнять
функции праймера.
Матрицей служит первая цепь кДНК. Данная реакция может катализироваться как
ревертазой, так и ДНК-полимеразой I Е. coli. Показано, что сочетание этих
двух ферментов позволяет повысить выход полноценных двухцепочечных молекул
кДНК. По окончании синтеза первая и вторая цепи кДНК остаются ковалентно свя-
занными петлей шпильки, служившей праймером при синтезе второй цепи. Эту пет-
лю расщепляют эндонуклеазой S1, специфически разрушающей одноцепочечные уча-
стки нуклеиновых кислот. Образующиеся при этом концы не всегда оказываются
тупыми, и для повышения эффективности последующего клонирования их репарируют
до тупых с помощью фрагмента Кленова ДНК-полимераЗы I Е. coli. Полученную
двухцепочечную кДНК можно затем встраивать в клонирующие векторы, размножать
в составе гибридных молекул ДНК и использовать для дальнейших исследований.
Лигазы
В 1961 г. Мезельсон и Вейгл на примере фага 1 показали, что рекомбинация
включает разрыв и последующее воссоединение молекул ДНК. Это положило начало
поискам фермента, участвующего в сшивании фрагментов ДНК. В 1967 году такой
фермент был найден и получил название ДНК-лигаза. Он катализирует синтез фос-
фодиэфирной связи в 2-х цепочечной молекуле нуклеиновой кислоты.
Иными словами, ДНК-лигазы сшивают рядом расположенные нуклеотиды, образуя
связь между остатками сахаров. ДНК-лигазы абсолютно необходимы в процессах
репарации ДНК, в процессах репликации - при удвоении цепи ДНК.
Существует 2 типа ДНК-лигаз, отличающихся по потребностям в кофакторах и
способу действия. ДНК-лигаза Е. coli в качестве кофактора использует дифосфо-
пиридиннуклеотид, а лигаза фага Т4 - АТФ в присутствии Мд2+. Лигаза фага Т4
более универсальна, так как помимо лигирования липких концов способна катали-
зировать реакцию воссоединения двухцепочечных фрагментов ДНК с тупыми конца-
ми. Она используется чаще.
Ферменты, изменяющие
структуру концов
фрагментов ДНК
Терминальная трансфераза (концевая дезоксинуклеотидилтрансфераза) была об-
наружена Боллумом в 1962 году в тимусе теленка. Субстратом терминальной
трансферазы при использовании в качестве кофактора ионов Мд2+ является одно-
цепочечная ДНК с 3’-ОН концом или двухцепочечная ДНК с выступающим одноцепо-
чечным 3 ’-ОН концом. Если в качестве кофактора используются Со2+, этот фер-
мент может катализировать присоединение дезоксинуклеотидов к 3'-ОН концу
двухцепочечной ДНК с тупыми концами. При введении в реакцию, направляемую
терминальной трансферазой, лишь одного типа дезоксинуклеотидов образуются мо-
лекулы ДНК, имеющие гомополимерные 1-цепочечные 3’-концы. Таким же образом
можно достроить другим молекулам ДНК гомополимерные 3’-концы, комплементарные
первым. Смешение полученных препаратов ДНК при определенных условиях может
приводить к формированию гибридных молекул ДНК.
Именно с помощью концевой дезоксинуклеотидилтрансферазы в 1972 г. был вы-
полнен первый эксперимент по рекомбинации молекул ДНК in vitro.
Поли (А) - полимераза Е. coli была открыта Сиппелом в 1973 году. Она ката-
лизирует присоединение к 3'-ОН концу одноцепочечных молекул РНК поли (А) по-
следовательностей. Применяется при подготовке молекул РНК к копированию с них
комплементарной ДНК для введения радиоактивной метки в 3'-конец РНК.
КЛАССИФИКАЦИЯ, НОМЕНКЛАТУРА
И ХАРАКТЕРИСТИКА РЕСТРИКТАЗ
Классификация рестриктаз
Общепринято термины "рестриктаза", "эндонуклеаза рестрикции" и "сайт специ-
фическая эндодезоксирибонуклеаза" считать синонимами.
Все рестрикционные эндонуклеазы бактерий узнают специфические, довольно ко-
роткие последовательности ДНК и связываются с ними. Этот процесс сопровожда-
ется разрезанием молекулы ДНК либо в самом сайте узнавания, либо в каком-то
другом, что определяется типом фермента. Наряду с рестрикционной активностью
бактериальный штамм обладает способностью метилировать ДНК; для этого процес-
са характерна такая же специфичность в отношении последовательностей ДНК, как
и для рестрикции. Метилаза добавляет метильные группы к адениновым или цито-
зиновым остаткам в том же сайте, в котором связывается рестрикционный фер-
мент . В результате метилирования сайт становится устойчивым к рестрикции.
Следовательно, метилирование защищает ДНК от разрезания.
Различают 3 основных класса рестриктаз: 1, 2 и 3.
Все рестриктазы узнают на двуспиральной ДНК строго определенные последова-
тельности, но рестриктазы 1-го класса осуществляют разрывы в произвольных
точках молекулы ДНК, а рестриктазы 2-го и 3-го классов узнают и расщепляют
ДНК в строго определенных точках внутри сайтов узнавания или на фиксированном
от них расстоянии.
Ферменты типов 1 и 3 имеют сложную субъединичную структуру и обладают двумя
типами активностей - модифицирующей (метилирующей) и АТФ-зависимой эндонукле-
азной.
Ферменты второго класса состоят из 2 отдельных белков: рестрицирующей эндо-
нуклеазы и модифицирующей метилазы, поэтому в генной инженерии используются
исключительно ферменты 2-го класса. Они нуждаются в ионах магния в качестве
кофакторов.
В настоящее время выделено более 500 рестриктаз класса 2, однако среди фер-
ментов, выделенных из различных микроорганизмов, встречаются такие, которые
узнают на ДНК одни и те же последовательности. Такие пары или группы называют
изошизомерами. Различают истинную изошизомерию, когда ферменты узнают одну и
ту же последовательность нуклеотидов и разрывают ДНК в одних и тех же точках,
и ложную, когда ферменты, узнавая один и тот же сайт на ДНК, производят раз-
рывы в разных точках в пределах того же сайта.
Большинство рестриктаз класса 2 узнают последовательности, содержащие от 4
до 6 нуклеотидных пар, поэтому рестриктазы делят на мелко- и крупнощепящие.
Мелкощепящие рестриктазы узнают тетрануклеотид и вносят в молекулы гораздо
больше разрывов, чем крупнощепящие, узнающие последовательность из шести нук-
леотидных пар. Это связано с тем, что вероятность встречаемости определенной
последовательности из четырех нуклеотидов гораздо выше, чем последовательно-
сти из шести нуклеотидов. Например, в ДНК бактериофага Т7, состоящей из 40000
пар оснований, отсутствует последовательность, узнаваемая рестриктазой R1 из
Е. coli.
К мелкощепящим относятся рестриктазы Нра II и Alu (из Arthrobacter luteus),
к крупнощепящим - Есо R I (из Escherichia coli) и Hind III. Если предполо-
жить , что участки узнавания рестриктаз распределены вдоль цепи ДНК случайно,
то мишень для ферментов, узнающих последовательность (сайт) из четырех нук-
леотидов, должна встречаться в среднем 1 раз через каждые 256 пар оснований,
а для ферментов, узнающих шесть нуклеотидов, - через 4096 пар оснований. Если
сайт рестрикции окажется внутри гена, то обработка ДНК-рестриктазой приведет
к его инактивации. Вероятность такого события очень велика при обработке мел-
кощепящими рестриктазами и незначительна при применении крупнощепящих эндо-
нуклеаз . Поэтому с целью получения неповрежденного гена расщепление проводят
поочередно несколькими крупнощепящими рестриктазами, либо применяют прием
"недорестрикции", т.е. рестрикцию проводят в таких условиях, когда происходит
расщепление лишь в одном сайте.
Номенклатура и
характеристика
рестриктаз
В 1973 году Смит и Натане предложили номенклатуру рестриктаз, включающую
следующие пункты:
1. Аббревиатура названия каждого фермента является производной от бинарного
названия микроорганизма, содержащего данную метилазно-рестриктазную систему.
Составляют по правилу: к первой прописной букве названия рода добавляют две
первые строчные буквы вида.
Streptomyces albus - Sal, Escherichia coli - Eco
2. В случае необходимости добавляют обозначение серотипа или штамма, напри-
мер , Есо В.
3. Различные системы рестрикции - модификации, кодируемые одной бактериаль-
ной клеткой, обозначают римскими цифрами: Hind II, Hind I, Hind III
(Haemophilus influenzae).
4. Рестриктазы обозначают буквой R (R Hind III) , метилазы - M (M Hind III) .
Открытие новых рестриктаз заставило Робертса в 1978 году внести дополнения
в систему рациональных обозначений ферментов: если сокращенное название сов-
падает для нескольких ферментов, то 2 первые буквы аббревиатуры остаются не-
изменными, а третья берется из последующих букв видового названия:
Haemophilus parainfluenzae - Нра I
Haemophilus parahaemolyticus - Hph I.
Рестриктазы по-разному расщепляют ДНК (рис. 36).
Одни вносят разрывы по оси симметрии узнаваемой последовательности (Нра I,
Ssp I).
Другие - со сдвигом, со "ступенькой" (Pst I).
В первом случае образуются так называемые "тупые" концы, а во втором -
"липкие", то есть фрагменты имеют на своих концах однонитевые взаимно компле-
ментарные участки длиной в четыре нуклеотида. Такие фрагменты особенно удобны
для создания рекомбинантных ДНК.
Hpal
Рис. 36.
Механизм действия
рестриктаз
В качестве мишеней (мест узнавания) часто выступают палиндромы из 4-6 пар
оснований - сайты рестрикции. Точки узнавания рестриктазами симметричны отно-
сительно поворота на 180°С, то есть последовательность нуклеотидов слева на-
право в одной нити такая же, как справа налево в другой. Симметрия подразуме-
вает, что те из них, которые должны быть метилированы, встречаются на обеих
цепях ДНК. В результате сайт-мишень может быть полностью метилирован (обе це-
пи модифицированы), полуметилирован (только одна цепь метилирована) или не
метилирован.
Полностью метилированный сайт не подвержен ни рестрикции, ни модификации.
Полуметилированный сайт не узнается ферментом рестрикции, но может быть пре-
вращен с помощью метилазы в полностью метилированный. У бактерий метилирова-
ние, как правило, связано с сохранением имеющегося состояния модификации. Ре-
пликация полностью метилированной ДНК ведет к образованию полуметилированной
ДНК. Вероятно, узнавание полуметилированных сайтов представляет собой обычный
этап функционирования метилазы in vivo.
Неметилированный сайт-мишень пред-пставляет собой субстрат либо для рестрик-
ции, либо для модификации in vitro. В клетке немодифицированная ДНК с большей
вероятностью рестрицируется. Реакция разрезания осуществляется в две ступени.
Сначала разрезается одна цепь ДНК, а затем рядом разрезается другая. В облас-
тях, прилегающих с каждой стооны к сайту разрезания, может иметь место экзо-
нуклеотическая деградация. Происходит эффективный гидролиз АТФ, роль которого
еще не выяснена.
Каким образом фермент узнает один сайт, а разрезает другой, достаточно уда-
ленный? Важно отметить, что белок никогда не отделяется от молекулы ДНК, с
которой он первоначально связался. Если фермент инкубировать со смесью моди-
фицированной и немодифицированной ДНК, он предпочтительно разрезает немодифи-
цированную ДНК. Следовательно, узнавая сайт связывания, белок не отделяется
от неметилированной ДНК для того, чтобы найти сайт разрезания.
Существуют две альтернативные модели, объясняющие взаимосвязь между сайтами
узнавания и разрезания: в соответствии с одной из них движется фермент, со-
гласно другой модели, перемещается ДНК. Если движется фермент, то его переме-
щение вдоль ДНК будет продолжаться до тех пор, пока он не сделает выбор сайта
разрезания. Если же движется ДНК, то фермент остается прикрепленным в сайте
узнавания, а ДНК протаскивается через второй сайт связывания на ферменте, и
это продолжается до тех пор, пока фермент не достигает области разрезания
(пока не охарактеризованной). Получены электронно-микроскопические данные,
свидетельствующие, что фермент вызывает образование петли в ДНК и остается,
по-видимому, связанным с сайтом узнавания после разрезания; эти данные под-
тверждают вторую модель.
ПОСТРОЕНИЕ РЕСТРИКЦИОННЫХ КАРТ
Ферменты рестрикции стали эффективным инструментом исследования. Они позво-
ляют превращать молекулы ДНК очень большого размера в набор фрагментов длиной
от нескольких сотен до нескольких тысяч оснований. С помощью метода электро-
фореза в агарозном геле (см. раздел 1) фрагменты ДНК, различающиеся по разме-
ру , можно легко разделить, а затем исследовать каждый фрагмент отдельно.
Короткие фрагменты мигрируют намного быстрее, чем длинные. При сравнительно
высокой концентрации агарозы большие фрагменты вообще не могут проникнуть в
гель. В процессе миграции рестрикционные фрагменты не деградируют, их можно
элюировать (вымывать) в виде биологически активных двуцепочечных молекул. При
окрашивании гелей красителями, связывающимися с ДНК, выявляется набор полос,
каждая из которых отвечает рестрикционному фрагменту, молекулярную массу ко-
торого можно определить, проведя калибровку с помощью ДНК с известными моле-
кулярными массами.
Сравнение размеров фрагментов ДНК, полученных после обработки определенного
участка генома набором рестрицирующих нуклеаз позволяет построить рестрикци-
онную карту, на которой указано положение каждого сайта рестрикции относи-
тельно других участков.
Молекулу ДНК длиной 5000 пар нуклеотидов (п. н.). обрабатывают отдельно ре-
стриктазами А и В. Фрагменты разделяют электрофорезом. Фермент А разрезал ДНК
на 4 фрагмента размером 2100, 1400, 1000 и 500 п. н. Обработка рестриктазой В
дала 3 фрагмента: 2500, 1300 и 1200 п. н. (рис. 37). Для определения располо-
жения сайтов рестрикции этих ферментов на следующем этапе применяют процедуру
двойного расщепления - обрабатывают ДНК двумя эндонуклеазами. Обработка изу-
чаемого фрагмента одновременно двумя рестриктазами дала 6 фрагментов: 1900,
1000, 800, 600, 500, 200 п.н.
Днк
(стандартные
фрагменты
известного
размера)
Рис. 37. Результаты электрофореза после обработки фрагмента ДНК
разными рестриктазами.
рестрик-
тазои А
рестрик-
талон В
Наиболее полный вариант
зультате расщепления одной рестриктазой
фрагментов, полученных
электрофореза. В нашем
элюировать каждый фрагмент, образующийся в ре-
а затем обработать его второй. Смесь
после такой обработки, также анализируют с помощью
примере были получены следующие результаты:
4-х А-фрагментов рестриктазой В
Обработка каждого из
2100 - 1900 и 200,
1400 - 800 и 600,
1000 - 1000 (изменений нет)
500 - 500 (изменений нет)
Обработка каждого из 3-х В-фрагментов рестриктазой А
2500 - 1900 и 600
1300
1200
800 и 500
1000 и 200
Анализ полученных результатов показывает, что каждый из ферментов, получен-
ный при расщеплении A-фрагментов рестриктазой В можно обнаружить в образцах,
полученных при расщеплении В-фрагментов рестриктазой А. Ключом к рестрикцион-
ному картированию являются перекрывающиеся фрагменты. Такими в рассматривае-
мом примере являются В-фрагмент 2100 и А-фрагмент 2500. При обработке другой
рестриктазой они дают фрагмент 1900.
Из данных о расщеплении этих фрагментов мы предполагаем, что с одной сторо-
ны на расстоянии 200 п.н. от фрагмента 1900 находится следующий A-сайт, а с
другого конца, на расстоянии 600 п.н. - следующий В-сайт (рис. 38). При обра-
ботке двумя эндонуклеазами фрагмент 200 п. н. образуется 1 раз, при обработке
рестриктазой А из В-фрагмента 1200, т. е. фрагмент 1200 лежит слева. Остается
определить, как продолжается карта вправо. Очевидно, это А-фрагмент 1400, так
как он рассечен рестриктазой В на фрагменты 600 и 800. Вправо от фрагмента
2500 следует отложить, очевидно, фрагмент 1300. Тогда логично наличие А-
фрагмента 500 и деления В-фрагмента 1300 рестриктазой А на 800 и 500.
При построении рестрикционных карт обычно используют несколько рестриктаз,
поэтому приходится анализировать сложные соотношения между фрагментами, полу-
ченными при действии разных ферментов. Для упрощения процедуры картирования
можно применять неполное расщепление. В определенных условиях рестриктаза уз-
нает и расщепляет не все сайты в молекуле ДНК. Например, при частичном расще-
плении ДНК ферментом А могут образовываться фрагменты 3100 п.н., 1400 п.н. и
500 п.н. Сопоставив их с данными полного расщепления (2100, 1400, 1000 и
500) , можно сразу поставить рядом 2100 и 1000 (фрагмент 3100) . А получив
фрагмент 3500 - расположить рядом 2100 п.н. и 1400 п.н.
1000 2100 1400 500
А I i I i I i I I 1000 200 1900 600 800 500
А+В I I I II I I II II I 1000 2500 1300
В I II II I Карта этого фрагмента ДНК: АВ АВА II III
1000 11 III 200 1900 600 $00 500
Рис. 38. Анализ фрагментов рестрикции и карта фрагмента ДНК
Другой прием - введение радиоактивной концевой метки. Концевые фрагменты
определяются в этом случае по включению метки. Можно также сопоставить фраг-
менты путем гибридизации нуклеиновых кислот. Перекрывающиеся фрагменты (в
данном случае 2100 и 2500) будут гибридизоваться.
Первая карта была получена для вируса SV40 (обезьяний вирус, вызывающий
злокачественную трансформацию), содержащего 5423 пары оснований. Использовали
рестриктазу Hind-II, расщепляющую кольцевую ДНК вируса на 11 фрагментов. По-
рядок их расположения в ДНК был установлен путем исследования наборов фраг-
ментов , образующихся по мере того, как расщепление доходит до конца. Первый
разрыв превращал кольцевую молекулу в линейную, которая затем расщеплялась на
все меньшие и меньшие фрагменты. Исследовали вначале наборы перекрывающихся
фрагментов, а затем продукты полного расщепления. Таким образом, была получе-
на рестрикционная карта кольцевой вирусной ДНК, на которую были нанесены сай-
ты расщепления рестриктазой. Повторив подобные эксперименты с другой рестрик-
тазой можно получить более подробную карту, где отмечено много сайтов рест-
рикции .
Располагая такой информацией, можно идентифицировать на ДНК биологически
важные участки. Поскольку рестрикционная карта отражает расположение опреде-
ленной последовательности нуклеотидов в данном участке, сравнение таких карт
для двух или более родственных генов позволяет оценить гомологию между ними.
Анализируя рестрикционные карты, можно сравнивать определенные участки ДНК
разных видов животных без определения их нуклеотидной последовательности. Та-
ким образом, например, было установлено, что хромосомные участки, кодирующие
цепи гемоглобина у человека, орангутанга и шимпанзе сохранились в практически
неизменном виде в течение последних 5-10 млн. лет (с тех пор как виды ди-
вергировали).
Метод рестрикционного картирования позволяет увидеть крупные генетические
изменения, такие как делеции или инсерции. При этом происходит уменьшение или
увеличение рестрикционных фрагментов, а также исчезновение или возникновение
сайтов рестрикции.
Один из приемов картирования - фингерпринт («метод отпечатков пальцев» или
DNA-fingerprint). Он подразумевает использование неупорядоченных и неполных
наборов фрагментов, которые являются характеристикой генома, хотя описывает
его не полностью.
КОНСТРУИРОВАНИЕ
РЕКОМБИНАНТНЫХ ДНК
Под рекомбинантными понимают ДНК, образованные объединением in vitro (в
пробирке) двух или более фрагментов ДНК, выделенных из различных биологиче-
ских источников. Ключевыми в этом определении являются слова "фрагмент ДНК" и
"объединение in vitro", что указывает на сущность генетической инженерии и ее
отличие от всех остальных методов получения гибридных (или химерных) организ-
мов , таких как генетическая селекция, эмбриональная инженерия и т.д.
Фрагменты ДНК, в том числе и фрагменты, содержащие гены, получают с исполь-
зованием ферментов рестриктаз. Рестриктазы могут образовывать фрагменты, как
с тупыми, так и с липкими концами. Сшивка фрагментов ДНК производится тремя
основными методами, зависящими от того, какие концы имеют фрагменты сшиваемых
ДНК.
Сшивка по одноименным "липким" концам (рестриктазно лигазный метод)
Этот метод является самым распространенным и популярным. Впервые этим спо-
собом гибридная ДНК была получена С. Коэном с сотрудниками в 1973 году. Не-
которые рестриктазы, например Pst I, внося в цепи ДНК симметричные, располо-
женные наискось друг от друга разрывы на равных расстояниях от центра сайта
узнавания и образующие "ступеньку" (рис. 36). Эти комплементарные друг другу
участки имеют тенденцию к ассоциации за счет спаривания оснований, и поэтому
их называют комплементарными или липкими концами. Спаривание оснований проис-
ходит только между комплементарными последовательностями, поэтому ААТТ-концы,
образуемые Есо RI, не будут спариваться, например, с АГЦТ-концами, образуемы-
ми Hind III. Но любые два фрагмента (независимо от их происхождения), образо-
вавшиеся под действием одной и той же рестриктазы, могут слипаться за счет
образования водородных связей между однонитиевыми участками комплементарных
нуклеотидов (рис. 39).
ре ст ри кг аз а,.
Hind Ш
рестрикгаза^
Hindin
Рис. 39. Схема рестриктазно-лигазного метода
лигаза
Однако после такого спаривания полной целостности двойной спирали не вос-
становится, поскольку останется два разрыва в фосфодиэфирном остове. Для его
восстановления, то есть сшивания, или лигирования нитей используют фермент
ДНК-лигазу. Этот фермент в живой клетке выполняет ту же функцию - сшивание
фрагментов ДНК, синтезирующихся при репликации.
Сшивка по "тупым" концам (коннекторный метод)
Липкие концы не абсолютно необходимы для связывания фрагментов ДНК. Тупые
концы также могут быть соединены за счет действия ДНК-лигазы, если и лигаза,
и тупые концы присутствуют в реакционной смеси в высоких концентрациях. В
этом случае реакция лигирования имеет свои особенности и ее эффективность ни-
же, чем при сшивке по липким концам. Впервые такие эксперименты были выполне-
ны в 1972 году Полем Бергом в Стенфордском университете, США. Липкие концы
также можно ферментативным путем присоединить к молекулам ДНК с тупыми конца-
ми . Для этого используют фермент - концевую трансферазу из тимуса теленка,
которая присоединяет нуклеотиды к 3-концам цепей ДНК. Если к 3’-концам одного
из рекомбинируемых in vitro фрагментов ДНК с помощью концевой дезоксинуклео-
тидил трансферазы достроить одноцепочечные олиго (dA)-сегменты определенной
длины, а к концам другого фрагмента — олиго (dT)-сегменты примерно такой же
длины, то при смешении полученных таким образом фрагментов происходит спари-
вание за счет образования водородных связей между олиго (dA)- и олиго (dT) -
последовательностями (рис. 40) . Для ковалентного соединения двух фрагментов
используется ДНК-лигаза. Эти процедуры составляют основу для второго общего
метода получения рекомбинантных молекул ДНК.
-A T Г____ ТТТТТ ЦЦА-
-Т А ЦААААА1 Г Г Т-
фрагмент 1 фрагмен 2
-АТГ ТТТТТЦЦА-
-Т А Ц А А А А А Г Г Т-
«сшитая» ДНК
Рис. 40. Пришивание «липких» концов и сшивка фрагментов ДНК
Поскольку можно формировать достаточно длинные взаимокомплементарные одно-
цепочечные концы, гибридные молекулы образуются с высокой эффективностью. В
частности, поэтому при клонировании ДНК-копий матричных РНК, которые доступны
в ограниченных количествах, обычно используют коннекторный метод. При таком
способе соединения между фрагментами встраиваются участки ААААА. Такие допол-
нительные последовательности ТТТТТ могут влиять на функции соединяемых моле-
кул и поэтому всегда, когда только возможно, для получения рекомбинантных мо-
лекул ДНК пользуются липкими концами, образовавшимися в результате действия
рестриктаз.
Сшивка фрагментов с разноименными липкими концами
В ситуации, когда необходимо сшить фрагменты, образованные разными эндонук-
леазами рестрикции, и имеющие разные, то есть некомплементарные друг другу
липкие концы, применяют так называемые линкеры (или "переходники"). Линкеры -
это химически синтезированные олигонуклеотиды, представляющие собой сайты ре-
стрикции или их комбинацию. Впервые эту идею предложил Шеллер с сотрудниками
в 1977 году.
Существуют большие наборы таких генных "переходников". Естественно, что при
использовании линкеров должна учитываться необходимость соблюдения правил
экспрессии генетической информации. Часто в середину линкера помещают какой-
либо регуляторный генетический элемент, например, промотор или участок, свя-
занный с рибосомой. В этом случае линкеры обеспечивают не только объединение
генов, но и обуславливают их экспрессию. Существуют линкеры "тупой конец -
липкий конец".
При необходимости липкие концы можно превратить в тупые. Это достигается
либо отщеплением липких концов с помощью фермента - эндонуклеазы S1, которая
разрушает только одноцепочечную ДНК, либо липкие концы "застраивают", то есть
с помощью ДНК-полимеразы I на однонитевых липких концах синтезируют вторую
нить.
ОПРЕДЕЛЕНИЕ НУКЛЕОТИДНОЙ
ПОСЛЕ ДОВАТЕ ЛЕНОСТИ
(СЕКВЕ НИРОВАНИЕ) ДНК
Описанные методы, позволившие идентифицировать генетически важные участки
ДНК, имели большое значение сами по себе. Но они также проложили путь к раз-
работке исключительно эффективных методов секвенирования ДНК и создания ре-
комбинантных молекул. Секвенирование позволяет довольно быстро определить
полную нуклеотидную последовательность сегмента длиной 100 - 500 нуклеотидных
пар, образующегося при расщеплении ДНК рестрикционными эндонуклеазами.
Метод Маскама и Гилберта
(химический)
Один из методов основан на химической деградации ДНК. Он был предложен в
1976 году Максимом и Гилбертом и назван их именем. Суть метода сводится к
следующему: один из концов фрагмента ДНК метят с помощью изотопа фосфора 32Р.
В последнее время вместо радиоактивной вводят флюоресцирующую метку. Ее можно
«цеплять» и к нуклеотидам, причем для каждого типа нуклеотидов подбирать раз-
личную окраску. Препарат меченой ДНК делят на четыре порции и каждую из них
обрабатывают реагентом, специфически разрушающим одно или два из четырех ос-
нований, причем условия реакции подбирают таким образом, чтобы на каждую мо-
лекулу ДНК приходилось лишь несколько повреждений.
Разрушение идет в 2 этапа. На первом этапе происходит модификация азотисто-
го основания и последующее выщепление его. На втором этапе производят гидро-
лиз ДНК в местах выщепления оснований. Пуриновые основания модифицируются ди-
метилсульфатом. Адениновые остатки метилируются по третьему атому азота, гуа-
ниновые - по положению N7. Если такую модификацию обработать 0,1 М НС1 при
0°С, то выщепляется метиладенин. При последующей инкубации в щелочной среде
(0,1 М NaOH) при температуре +90°С происходит разрушение сахаро-фосфатной
связи в местах выщепления оснований. Обработка поврежденных молекул пипериди-
ном приводит к гидролизу ДНК по остаткам метилгуанина. Пиримидиновые основа-
ния модифицируются гидразином. В бессолевой среде модифицируется и цитозин, и
тимин, в присутствии 2 М NaCl модифицируется только цитозин. При дальнейшей
обработке пиперидином происходит расщепление ДНК по точкам модификации. Можно
использовать и другие реакции химической модификации оснований и расщепления
по ним молекул ДНК. В результате получается набор меченых фрагментов, длины
которых определяются расстоянием от разрушенного основания до конца молекулы.
Фрагменты, образовавшиеся во всех четырех реакциях, подвергают электрофорезу
в четырех соседних дорожках; затем проводят радиоавтографию, и те фрагменты,
которые содержат радиоактивную метку, оставляют "отпечатки" на рентгеновской
пленке. По положению отпечатков можно определить, на каком расстоянии от ме-
ченого конца находилось разрушенное основание, а зная это основание - его по-
ложение. Так набор полос на рентгеновской пленке определяет нуклеотидную по-
следовательность ДНК. Аналогично наблюдают флюоресцентное окрашивание. Если
для каждого из четырех нуклеотидов был подобран свой цвет флюоресцентной мет-
ки, то при электрофорезе их наносят на 1 дорожку. Тогда расположение нуклео-
тидов отмечено штрихами разного цвета, а процедуру считывания легко автомати-
зировать .
Метод Сэнгера
(ферментативный)
Другой метод, разработанный Сэнгером и носящий его имя, основан не на хими-
ческом, а на ферментативном подходе. Сэнгер использовал ДНК-полимеразу I. В
клетке этот фермент участвует в процессе репликации, заполняя пробелы между
вновь синтезированными фрагментами ДНК (фрагментами Оказаки). Для работы фер-
мента в пробирке требуются предшественники ДНК - дезоксирибонуклеотидтрифос-
фаты (dNTP), а также одноцепочечная матрица, на которой должен быть небольшой
двухцепочечный участок - затравка, с которого начинается синтез (рис. 41) .
Были также синтезированы модифицированные дидезоксирибонуклеотиды, в которых
дезоксирибоза 3'-ОН отсутствует, для каждого из четырех оснований ДНК. ДНК-
полимераза включает эти предшественники в ДНК. Однако, включившись в ДНК, мо-
дифицированное основание не может образовать фосфодиэфирную связь со следую-
щим дезоксирибонуклеотидом. В результате рост (элонгация) данной цепи оста-
навливается (терминируется) в том месте, где в ДНК включился дидезоксирибо-
нуклеотид (ddNTP). Поэтому их называют терминаторами элонгации.
5 ( AQCCTGAGT —
лад мС aaG <ж>Т
Рис. 41. Ферментативный метод секвенирования ДНК
Реакционная смесь по Сэнгеру состоит из цепи ДНК, нуклеотидную последова-
тельность которой надо определить, короткого фрагмента "меченой" ДНК, компле-
ментарной концевому отрезку этой цепи (затравка), одного из четырех ddNTP и
соответствующего dNTP в строго определенном соотношении (чтобы они конкуриро-
вали) , а также остальных трех dNTP. Готовят четыре смеси, каждая из которых
содержит один из четырех ddNTP. В каждой из пробирок образуется набор меченых
фрагментов разной длины. Длина их зависит от того, в каком месте в цепь вклю-
чен дефектный нуклеотид. Полученные меченые фрагменты ДНК разделяют в полиак-
риламидном геле (с точностью до одного нуклеотида), проводят радиоавтографию
и по картине распределения фрагментов в четырех пробах устанавливают нуклео-
тидную последовательность ДНК (рис. 41).
В настоящее время определение точной нуклеотидной последовательности любого
сегмента ДНК умеренной длины - вполне разрешимая задача. Уже определена по-
следовательность нескольких сотен генов про- и эукариот. Зная последователь-
ность гена и генетический код, легко определить аминокислотную последователь-
ность кодируемого им белка. Раньше для определения структуры белка приходи-
лось делать тщательный и весьма трудоемкий анализ выделенного и очищенного
белка. Сейчас часто бывает проще определить структуру белка через нуклеотид-
ную последовательность, чем с помощью прямого секвенирования. Если секвениро-
вание белка занимает месяцы и даже годы, то ДНК удается секвенировать за не-
сколько недель.
Определение последовательности ДНК привело также к тому, что были обнаруже-
ны области, которые не кодируют белки, но принимают участие в регуляции экс-
прессии генов и репликации ДНК. В 1996 году был секвенирован геном дрожжей, в
1998 г. - геном арабидопсиса, в 2000 году - геном человека, однако в данном
случае речь идет только об установлении последовательности нуклеотидов, так
как генетическая структура и функции отдельных участков генома еще не иденти-
фицированы, это более сложная задача.
Сразу вслед за разработкой быстрых методов секвенирования появились столь
же быстрые и простые методы синтеза сравнительно длинных олигонуклеотидов с
определенной, заранее заданной последовательностью. Теперь за три-четыре дня
можно синтезировать последовательность из 12 - 20 нуклеотидов. Автоматизация
этой процедуры еще более облегчает и ускоряет синтез. Появились приборы -
ДНК-синтезаторы, которые выполняют эту работу за несколько часов.
ГИБРИДИЗАЦИЯ КАК ВЫСОКОЧУВСТВИТЕЛЬНЫЙ
МЕТОД ВЫЯВЛЕНИЯ СПЕЦИФИЧЕСКИХ
ПОСЛЕДОВАТЕЛЬНОСТЕЙ НУКЛЕОТИДОВ
Если водный раствор ДНК нагреть до 100°С и повысить pH до 13, то ДНК диссо-
циирует на 2 цепи (денатурирует), так как комплементарные связи между основа-
ниями разрушаются. В 1961 году было обнаружено, что этот процесс обратим: вы-
держивание ДНК при температуре 65°С вело к восстановлению структуры двойной
спирали. Этот процесс называется ренатурация или гибридизация. Процессы гиб-
ридизации происходят между любыми одинарными цепями, если они комплементарны:
ДНК - ДНК, РНК - РНК, ДНК - РНК.
Для теста необходимо иметь чистый одноцепочечный фрагмент ДНК, комплемен-
тарный той последовательности, которую хотим обнаружить. Этот фрагмент полу-
чают либо клонированием, либо путем химического синтеза. Одноцепочечная ДНК,
используемая в качестве индикатора, называется ДНК-зонд. Она может содержать
от 15 до 1000 нуклеотидов.
ДНК-зонды применяются в различных целях. Гибридизация ДНК-зонда с РНК, вы-
деленной из анализируемой клетки, может выявить наличие или отсутствие экс-
прессии гена. Если гибридизации не происходит, значит, ген молчит, не работа-
ет. ДНК-зонды также позволяют проводить диагностику наследственных болезней.
В большинстве случаев мутации, ведущие к наследственным болезням, рецессив-
ны, то есть болезнь развивается, если человек получает дефектные гены от обо-
их родителей. Аномальные эмбрионы лучше выявлять до рождения. Например, для
серповидноклеточной анемии в мутантном гене, кодирующем бэта-цепь гемоглоби-
на, последовательность ГАГ заменена на ГТГ. В этом случае синтезируют олиго-
нуклеотид длиной около 20 оснований, метят радиоактивной меткой. Из эмбрио-
нальных клеток, содержащихся в амниотической жидкости, выделяют ДНК и исполь-
зуют ее для гибридизации. Если эмбрион дефектен, то тест будет положительным.
Анализ проводят по следующей схеме (рис. 42) : исследуемую ДНК гидролизуют
рестриктазами, фракционируют электрофорезом, переносят разделенные фрагменты
на нитроцеллюлозный фильтр и проводят реакцию гибридизации с мечеными олиго-
нуклеотидами. Этот метод был разработан Саузерном в 1975 году. В отечествен-
ной литературе его принято называть «южный блоттинг». «Блоттинг» - в переводе
с английского означает «промокашка», «саузерн» - «южный», в данном случае иг-
ра слов: фамилия ученого переводится как географическое направление.
Молекулы ДНК разгоняют в агарозном геле электрофорезом. ДНК в геле денату-
рируют щелочью. Щелочь нейтрализуют и пластину геля покрывают листом нитро-
целлюлозы. Сверху на нитроцеллюлозу помещают стопку листов фильтровальной бу-
маги, обеспечивая медленный ток буферного раствора через гель в направлении,
перпендикулярном направлению электрофореза. ДНК диффундирует из геля и связы-
вается с нитроцеллюлозным фильтром. После прогревания фильтра при 80°С в ва-
кууме ДНК необратимо связывается с нитроцеллюлозой. Расположение полос иммо-
билизованной ДНК точно соответствует их расположению в геле.
ДНК, связанную с нитроцеллюлозным фильтром, можно гибридизовать с радиоак-
тивно меченой ДНК. Блоттинг по Саузерну является исключительно полезным также
и для локализации изучаемых генов в определенных фрагментах, полученных в ре-
зультате гидролиза различными рестриктазами гибридных молекул ДНК, хромосом-
ной ДНК ит. д.
Реет рик т иру ющан
Рис. 42. Блоттинг ДНК по Саузерну
Аналогичным методом на нитроцеллюлозу переносят молекулы РНК (Северный
блоттинг) и белка (Западный блоттинг). Из частей света осталась свободной
только западная, хотя вакантными остались 2 класса макромолекул - углеводы и
липиды.
Одним из наиболее точных и современных методов анализа является использова-
ние чипов. Они представляют собой пластинки с иммобилизованными меченными
ДНК-зондами. Каждая такая пластинка может содержать несколько десятков тысяч
зондов, расположенных в определенной последовательности. Метка проявляется
только в спаренных двухцепочечных фрагментах. Если в исследуемом образце есть
последовательности, комплементарные последовательностям зонда, то гибридиза-
цию можно определить визуально или с помощью специальных приборов. Как прави-
ло, детекторы соединены с компьютером, то есть процедура считывания и обра-
ботки информации автоматизирована.
Такие ДНК-чипы можно применять для комплексной диагностики инфекционных за-
болеваний, наследственных дефектов, установления экспрессии тех или иных ге-
нов (в этом случае идет гибридизация с мРНК), то есть отслеживания нарушений
обмена веществ. Они дешевы, очень надежны, просты в обращении и могут много-
кратно использоваться. Недостаток - дорогая аппаратура для детекции.
МЕТОДЫ КЛОНИРОВАНИЯ ДНК
После того, как ДНК сшита в пробирке, ее необходимо размножить.
Существует два подхода к клонированию ДНК. Первый подход предполагает ис-
пользование бактериальных или дрожжевых клеток для размножения введенной в
них чужеродной ДНК. Второй способ представляет собой амплификацию ДНК in
vi tro.
Клонирование ДНК in vivo
Используя микроорганизмы, можно создавать два типа библиотек ДНК: геномную
и клоновую (кДНК).
Геномная библиотека
Если геном какого-либо организма разрезать, вставить в плазмидные или ви-
русные вектора и ввести в клетку, то в таком виде его можно сохранить. При
разрезании плазмидной или фаговой ДНК вероятность выпадения целых и неизме-
ненных кусков генома довольно высока.
Такой способ получения геномной библиотеки получил название «метод дробови-
ка» , так как геном в данном случае представлен отдельными фрагментами.
Принципы создания плазмидных и вирусных векторов общие, поэтому рассмотрим
их на примере плазмидных. Следует отметить, что из вирусных ДНК лучше исполь-
зовать ДНК фагов, так как они имеют большую емкость и позволяют вставлять бо-
лее крупные куски генома.
Очищенные кольцевые молекулы ДНК обрабатывают рестриктазой, получая линей-
ную ДНК. Клеточную ДНК обрабатывают той же рестриктазой, добавляют к плазмид-
ной, добавляют лигазы. Таким образом, получают рекомбинантную плазмидную ДНК,
которую вводят в бактериальные или дрожжевые клетки. Плазмида реплицируется с
образованием многих копий. Многие плазмиды несут ген устойчивости к антибио-
тикам, и если в рекомбинантной плазмиде есть такой ген, то клетки легко выяв-
лять, выращивая на среде с антибиотиком.
Каждая такая колония представляет собой клон или потомство одной клетки.
Плазмиды одной колонии содержат клон геномной ДНК, а совокупность плазмид
можно назвать библиотекой геномной ДНК. Недостаток такого метода в том, что
фрагменты ДНК образуются в огромном количестве. Разрезание геномной ДНК опре-
деляется случаем, поэтому лишь часть фрагментов содержат полноценные гены.
Некоторые фрагменты могут содержать только часть гена или же интронные после-
довательности .
Библиотека кДНК
Создание кДНК начинается с синтеза на матрице РНК с помощью обратной транс-
криптазы комплементарной нити ДНК. Затем создают щелочные условия, разрушают
цепь РНК на нуклеотиды, после чего с помощью ДНК-полимеразы синтезируют ком-
плементарную цепь ДНК. При этом образуется фрагмент ДНК с тупыми концами. Та-
кую ДНК встраивают в плазмиды и вводят в клетки бактерий. При амплификации
плазмиды образуется клон комплементарной копии ДНК (кДНК).
Преимущества клоновой ДНК перед клонами геномной ДНК в том, что кодирующая
белок нуклеотидная последовательность гена ничем не прерывается.
Гены эукариот содержат интроны, которые должны удаляться из транскриптной
РНК перед превращением ее в матричную, после чего следует сплайсинг (сращива-
ние) . Бактериальные клетки не могут осуществлять такую модификацию РНК, обра-
зовавшуюся путем транскрипции гена эукариотической клетки. Поэтому если пре-
следуют получение белка путем экспрессии клонированного гена, то лучше ис-
пользовать банк кДНК, полученной на основе матричной РНК.
Полимеразная цепная реакция
В 1985 году К. Мюллис с сотрудниками разработали метод клонирования после-
довательностей ДНК in vitro, который получил название полимеразной цепной ре-
акции (ПЦР).
К анализируемому образцу ДНК добавляют в избытке 2 синтетических олигонук-
леотида - праймера размером около 20 нуклеотидов. Каждый из них комплемента-
рен одному из 3'-концов фрагмента ДНК. ДНК нагревают для разделения цепей
двойной спирали, а при охлаждении происходит гибридизация праймеров с компле-
ментарными участками фрагментов ДНК. В результате в растворе будут находиться
однонитевые ДНК с короткими двухцепочечными участками - затравками (праймера-
ми) . При добавлении нуклеотидов и ДНК-полимеразы синтезируются комплементар-
ные цепи и образуются идентичные фрагменты ДНК (первый цикл, рис. 43). Реак-
ция останавливается и ДНК снова денатурируется прогреванием.
Разделившиеся комплементарные цепи ДНК
5’ 3’
Синтез ДНК
3’ 5’
Рис. 43. Первый цикл полимеразной цепной реакции
В процессе охлаждения праймеры, находящиеся в избытке, вновь эффективно
гибридизуются, но уже не только с цепями исходной ДНК, но и с вновь синтези-
рованными. Внесение в систему ДНК-полимеразы инициирует второй цикл полиме-
разной реакции. Многократное повторение описанной процедуры позволяет провес-
ти 30 и более циклов ферментативного удлинения праймеров. При этом число сег-
ментов ДНК, ограниченных с обоих концов используемыми праймерами, с каждым
циклом ПЦР увеличивается экспоненциально (приближается к зависимости 2п, где
п — число циклов). Выход всех других продуктов реакции увеличивается по ли-
нейной зависимости (рис. 44). Таким образом, в процессе рассматриваемой реак-
ции эффективно амплифицируется только та последовательность ДНК, которая ог-
раничена праймерами.
Первоначально для ПЦР использовали фрагмент Кленова ДНК-полимеразы I Е.
coli. Однако недостатком данного подхода являлось то, что после каждого цикла
реакции необходимо было вносить в реакционную смесь новую порцию фермента.
Кроме того, в оптимальных температурных условиях такой полимеразной реакции
(37°C) появлялись вторичные участки связывания праймеров и наблюдалась ампли-
фикация незапланированных сегментов генома, т. е. специфичность амплификации
не была полной. Существенное улучшение метода полимеразной цепной реакции бы-
ло достигнуто после замены фрагмента Кленова на ДНК-полимеразу термофильной
бактерии Thermus aquaticus (Taq-полимераза). Температурный оптимум реакции,
направляемой Taq-полимеразой, находится в районе 70°С. Другим важным свойст-
вом является то, что данная полимераза не инактивируется после длительной ин-
кубации при 95°С.
Используя Taq-полимеразу, удалось решить сразу две проблемы. Во-первых,
термостабильная полимераза не инактивируется на этапе денатурации ДНК, и по-
этому нет необходимости после каждого цикла реакции добавлять новую порцию
фермента. Такое упрощение процедуры позволило автоматизировать проведение
ПЦР, так как теперь требовалось лишь перенесение образца с определенным ин-
тервалом времени в разные температурные условия: 90—95°С (температура денату-
рации) и 60—70°С (температура ренатурации ДНК и ферментативной реакции). Во-
вторых, высокий температурный оптимум реакции, катализируемой Taq-
полимеразой, позволяет подбирать жесткие температурные условия отжига, обес-
печивающие гибридизацию праймеров только в заданном районе изучаемого генома,
что существенно повышает специфичность и чувствительность метода.
4
цикл
Рис. 44. Схема полимеразной цепной реакции
Используя метод ПЦР, можно in vitro селективно обогащать препарат ДНК фраг-
ментом с определенной последовательностью в миллион и более раз. Это позволя-
ет надежно выявлять однокопийные гены и их варианты в таких больших и сложных
геномах, каким является геном человека. Чувствительность метода такова, что
амплифицировать в ПЦР и выявить целевую последовательность можно даже в том
случае, если она встречается однажды в образце из 105 клеток. Получаемый сег-
мент ДНК надежно выявляется в виде дискретной полосы после электрофоретиче-
ского разделения молекул ДНК и окраски их этидиум бромидом. Если к праймеру
пришить фермент, то ферментная метка будет накапливаться при амплифицирова-
нии. Продукт амплификации проверяется по принципу ИФА, то есть добавляется
субстрат и отмечается изменение окраски. В качестве метки можно использовать
стрептавидин. Его можно пришивать как к праймеру, так и к нуклеотидам. В по-
следнем случае нуклеотиды, меченные стрептавидином, добавляются к обычным,
идущим на синтез комплементарной цепи ДНК. Этим достигается еще большее уси-
ление сигнала.
Размноженный in vitro фрагмент получают в количествах, достаточных для его
прямого секвенирования. Поскольку при этом не требуется промежуточный этап
клонирования фрагмента ДНК в молекулярных векторах, ПЦР иногда называют бес-
клеточным молекулярным клонированием (cell-free molecular cloning). Автомати-
зированная процедура Taq-полимеразной цепной реакции, состоящая из 30 и более
циклов, занимает 3—4 часа, что существенно быстрее и проще процедуры клониро-
вания определенного фрагмента ДНК в составе векторных молекул.
Применение метода
полимеразной цепной реакции
Полимеразную цепную реакцию используют для анализа индивидуальных вариаций
последовательности нуклеотидов определенных локусов, для повышения эффектив-
ности клонирования целевых последовательностей изучаемых геномов и их прямого
секвенирования, для детекции в организме патогенных микроорганизмов и т. п.
Используя 32Р-меченные синтетические олигонуклеотиды, можно выявлять еди-
ничные замены нуклеотидов в выбранных локусах геномной ДНК человека (или дру-
гих организмов). Для этого в обычном варианте метода исследуемую ДНК гидроли-
зуют рестриктазами, фракционируют электрофорезом, переносят разделенные фраг-
менты по Саузерну на нитроцеллюлозный фильтр, который гибридизуют с данным
меченым олигонуклеотидом в условиях, при которых даже точечная замена нуклео-
тидов в анализируемой последовательности приводит к разрушению комплекса ДНК-
олигонуклеотид.
Использование полимеразной цепной реакции для амплификации анализируемого
локуса позволяет существенно упростить рассмотренный подход и повысить его
чувствительность и специфичность. При этом для анализа аллельных вариантов
генов достаточно всего 1 нг геномной ДНК человека, а гибридизацию можно про-
водить с негидролизованной рестриктазами ДНК, иммобилизованной на нитроцеллю-
лозном фильтре в виде небольшого пятна. Такой вариант метода позволил разра-
ботать новые диагностические тесты на генетические и инфекционные заболева-
ния. В частности, этот подход используют для ранней диагностики наличия в ор-
ганизме вируса иммунодефицита человека (ВИЧ), что не удается осуществить дру-
гими методами. При этом не требуется работать с радиоактивными изотопами, так
как амплифицированный сегмент вирусной ДНК выявляется напрямую после электро-
форетического разделения ДНК и окраски их бромистым этидием.
Метод ПЦР позволил проанализировать наличие последовательностей вирусов па-
пилломы человека в срезах биопсий новообразований шейки матки человека, зали-
тых парафином за 40 лет до данного исследования. Более того, с помощью ПЦР
удалось амплифицировать и клонировать фрагменты митохондриальной ДНК из иско-
паемых останков мозга человека возраста 7 тысяч лет!
На лизатах индивидуальных сперматозоидов человека продемонстрирована воз-
можность одновременно анализировать два локуса, расположенных на разных него-
мологичных хромосомах. Такой подход обеспечивает уникальную возможность тон-
кого генетического анализа и изучения хромосомной рекомбинации, ДНК-
полиморфизма и др. Метод анализа индивидуальных сперматозоидов сразу нашел
практическое применение в судебной медицине, так как HLA-типирование гаплоид-
ных клеток позволяет определять отцовство или выявлять преступника (комплекс
HLA представляет собой набор генов главного комплекса гистосовместимости че-
ловека; локусы комплекса HLA — наиболее полиморфные из всех известных у выс-
ших позвоночных: в пределах вида в каждом локусе существует необычайно боль-
шое число разных аллелей — альтернативных форм одного и того же гена).
Используя ПЦР, можно выявлять правильность интеграции чужеродных генетиче-
ских структур в заранее определенный район генома изучаемых клеток. Суммарная
клеточная ДНК отжигается с двумя олигонуклеотидными затравками, одна из кото-
рых комплементарна участку хозяйской ДНК вблизи точки встраивания, а другая —
последовательности интегрированного фрагмента в антипараллельной цепи ДНК.
Полимеразная цепная реакция в случае неизмененной структуры хромосомной ДНК в
предполагаемом месте встройки приводит к образованию фрагментов одноцепочеч-
ной ДНК неопределенного размера, а в случае запланированной встройки — двух-
цепочечных фрагментов ДНК известного размера, определяемого расстоянием между
местами отжига двух праймеров. Причем степень амплификации анализируемого
района генома в первом случае будет находиться в линейной зависимости от ко-
личества циклов, а во втором — в экспоненциальной. Экспоненциальное накопле-
ние в процессе ПЦР амплифицируемого фрагмента заранее известного размера по-
зволяет визуально наблюдать его после электрофоретического фракционирования
препарата ДНК и делать однозначное заключение о встройке чужеродной последо-
вательности в заданный район хромосомной ДНК.
ВВЕДЕНИЕ НОВОГО
ГЕНА В КЛЕТКУ
Ввести рекомбинантный ген в клетку можно 2 способами: используя вектора или
путем прямого введения.
Требования к векторной ДНК, ее состав
Вектор - молекула ДНК или РНК, состоящая из двух компонентов: векторной
части (носителя) и клонируемого чужеродного гена. Задача вектора - донести
выбранную ДНК в клетку-рецепиент, встроить ее в геном, позволить идентифика-
цию трансформированных клеток, обеспечить стабильную экспрессию введенного
гена.
Таким образом, вектор должен быть небольшим, способным поддерживаться в
клетке-хозяине (реплицироваться), многократно копироваться (ампфлицировать-
ся) , экспрессировать соответствующий ген (содержать соответствующие регуля-
торные последовательности), должен иметь маркерный ген, позволяющий различать
гибридные клетки для эффективной селекции их; должен быть способен переда-
ваться в клетку соответствующего организма.
Регуляторные последовательности, отвечающие за стабильную экспрессию гена,
будут рассмотрены позднее.
Можно выделить 2 группы маркерных генов, позволяющие отличить трансформиро-
ванные клетки:
1. Селективные гены, отвечающие за устойчивость к антибиотикам (канамицину,
тетрациклину, неомицину и др.), гербицидам (у растений). Это могут быть гены
ауксотрофности по какому-либо субстрату и т.д. Основной принцип работы такого
маркера - способность трансформированных клеток расти на селективной пита-
тельной среде, с добавкой определенных веществ, ингибирующих рост и деление
нетрансформированных, нормальных клеток.
2. Репортерные гены, кодирующие нейтральные для клеток белки, наличие кото-
рых в тканях может быть легко тестировано.
Чаще всего в качестве репортерных используются гены [3-глюкуронидазы (GUS) ,
зеленого флюоресцентного белка (GFP), люциферазы (LUC), хлорамфениколацетил-
трансферазы (CAT). К настоящему времени из этого арсенала наиболее часто ис-
пользуют гены GUS и GFP и, в меньшей степени, LUC и CAT. Используемый в на-
стоящее время как репортерный ген GUS является модифицированным геном из
Escherichia coli, кодирующим [3-глюкуронидазу с молекулярной массой 68 кД. GUS
активен в широком диапазоне условий среды с оптимумом при pH 5-8 и 37°С. Он
может гидролизовать обширный спектр природных и синтетических глюкуронидов,
что позволяет подбирать соответствующие субстраты для спектрофотометрического
или флюориметрического определения активности фермента, а также для гистохи-
мического окрашивания тканей in situ (например, в синий цвет). Фермент доста-
точно стабилен: он устойчив к нагреванию (время полужизни при 55°С составляет
около 2 ч) и к действию детергентов. В процессе замораживания-оттаивания по-
тери активности GUS не происходит. В составе химерных белков, созданных ген-
но-инженерными методами, GUS обычно сохраняет свою функциональную активность.
В живых клетках белок GUS также весьма стабилен и активен от нескольких часов
до нескольких суток.
GFP (green fluorescent protein - зеленый флюоресцентный белок, или белок
зеленой флюоресценции) был обнаружен Shimomura с соавт. в 1962 г. у люминес-
цирующей медузы Aequorea victoria. Ген GFP был клонирован в 1992 г. Prasher и
соавт., и уже через несколько лет началось активное использование этого гена
как репортерного в работах с самыми разными про- и эукариотическими организ-
мами. В настоящее время ген GFP применяется в сотнях работ во всем мире, и
число их стремительно нарастает. Столь быстрый рост вызван особыми свойствами
белка GFP, а именно его способностью флюоресцировать в видимой (зеленой) об-
ласти спектра при облучении длинноволновым УФ. Эта флюоресценция обусловлена
непосредственно белком, для ее проявления не требуется субстратов или кофак-
торов . Благодаря этому свойству ген GFP является очень перспективным репор-
терным геном, позволяющим проводить разнообразные прижизненные (недеструктив-
ные) исследования с трансгенными организмами.
Многочисленные производные GFP получили общее название AFP (autofluorescent
proteins - автофлюоресцентные белки). Из морской анемоны Discosoma sp. недав-
но выделен еще один белок DsRed, флуоресцирующий в красном свете. Еще не-
сколько аналогичных флюоресцирующих белков было выделено в самое последнее
время учеными Российской академии наук из различных коралловых полипов поряд-
ка Anthozoa. Он может быть денатурирован очень высокой температурой, крайними
Значениями pH или сильными восстановителями типа ЫагЗОд. При возвращении к
физиологическим условиям GFP в значительной степени восстанавливает способ-
ность к флюоресценции. В составе химерных белков, созданных генноинженерными
методами, GFP обычно сохраняет свою функциональную активность. В живых клет-
ках белок GFP также очень стабилен.
CAT - гены отвечают за синтез хлорамфениколацетилтрансферазы (выделены из
Escherihia coli). Этот фермент катализирует реакцию переноса ацетильной груп-
пы от ацетил-КоА к хлорамфениколу. Определяется гистохимически, по изменению
окраски ткани при добавлении соответствующего субстрата.
LUC - ген кодирует фермент люциферазу (клонирована из бактерий и светляч-
ка) . Она вызывает свечение трансформированных клеток. Бактериальный фермент
состоит из двух субъединиц. Для определения активности ферментов необходимо
специальное оборудование - флуориметр и цифровая видеокамера с амплификатором
светового сигнала. Фермент теряет активность при действии детергентов и повы-
шенной температуры. Замена селективных генов на репортерные при отборе транс-
генных растений часто весьма желательна, так как возможность потенциального
риска для окружающей среды и здоровья человека при использовании репортерных
генов практически исключена. Однако область применения репортерных генов ши-
ре, чем просто контроль трансгеноза. Другое, и, очевидно, более важное назна-
чение репортерных генов состоит в том, чтобы выявлять (по возможности количе-
ственно) временные и пространственные особенности экспрессии данного конкрет-
ного гена, будь то собственного или чужеродного. Присоединение репортерного
гена к одной лишь промоторной области позволяет исследовать в "чистом виде"
ее роль в регуляции экспрессии изучаемого гена на уровне транскрипции.
Замена белок-кодирующей области гена на репортерную при сохранении участка,
кодирующего 5’-концевую не транслируемую последовательность мРНК, позволяет
оценить роль этой последовательности в процессах транспорта мРНК из ядра в
цитоплазму и инициации трансляции.
Одно из самых важных свойств гена - способность к экспрессии. За это свой-
ство отвечают различные генетические элементы, которые мы должны встроить в
векторную молекулу, несущую ген.
Регуляция экспрессии
гена у прокариот
Многие бактериальные гены устроены таким образом, что они способны функцио-
нировать с существенно разной эффективностью. У Е. coli, например, относи-
тельное содержание различных белков варьирует в очень широких пределах (от
менее чем 0.1% до 2%) в зависимости от их функций; при этом каждый белок в
хромосоме Е. coli кодируется единственным геном. Такие вариации обусловлены
действием системы контроля генной экспрессии, которая осуществляется главным
образом на уровне транскрипции ДНК. Таким образом, чаще всего уровень актив-
ности гена связан с количеством синтезируемой на нем мРНК, то есть с активно-
стью фермента РНК-полимеразы.
Последовательности ДНК, расположенные перед началом структурного гена и оп-
ределяющие степень активности РНК-полимеразы, называются регуляторными после-
довательностями. Одна из таких последовательностей представляет собой участок
ДНК, с которым связывается РНК-полимераЗа. Этот участок называется промото-
ром.
Последовательность оснований промотора определяет частоту инициации синтеза
иРНК, причем замена одного основания в этой последовательности может привести
к уменьшению частоты инициации в 1000 раз.
Промотор может быть сильным и слабым. Сильный промотор инициирует синтез
иРНК часто, слабый - гораздо реже. С другой стороны, промотор может быть ре-
гулируемым и нерегулируемым. Например, промотор [3-лактамазы нерегулируемый,
но сильный. Использование таких промоторов не всегда удобно. Дело в том, что
большое количество белка может блокировать рост бактерий. Кроме того, интен-
сивная транскрипция рекомбинантной ДНК может помешать репликации плазмиды, и
она будет утрачена. Поэтому удобнее использовать регулируемые сильные промо-
торы (индуцибельные), включение которых, а значит и синтез чужеродного белка
можно осуществить, когда получена большая бактериальная масса.
Некоторые плазмидные векторы содержат промотор, работа которого регулирует-
ся температурочувствительным белковым продуктом гена-репрессора. Белок-
репрессор активен при определенных температурах и блокирует действие промото-
ра. Повысив температуру до 42°С, можно "включить" промотор и быстро получить
большое количество требуемого белка.
В качестве индуцибельных промоторов используют также Тгр-промотор триптофа-
нового оперона, который регулируется триптофановым голоданием, 1ас-промотор
лактазного оперона, который индуцируется субстратом (лактозой) и другие.
Интенсивность транскрипции определенных структурных генов может зависеть от
эффективности ее терминации, в частности, от того, как часто РНК-полимераза
прекращает синтез РНК, не дойдя до этих генов. Сравнительно недавно обнаруже-
но, что во многих оперонах E.coli, контролирующих биосинтез аминокислот, меж-
ду промотором и первым структурным геном имеется терминирующая последователь-
ность . В определенных условиях происходит образование терминирующего сигнала,
ослабляющего интенсивность транскрипции.
Это явление получило название аттенуации, а участок ДНК - аттенуатор (осла-
битель) . Как и репрессия, аттенуация зависит от присутствия в среде соответ-
ствующих аминокислот. Например, избыток триптофана в клетках триптофанзависи-
мых мутантов, дефектных по репрессору, только 1 из 10 молекул РНК-полимеразы,
начавших транскрипцию, преодолевает аттенуатор и считывает структуру генов.
Удаление триптофана втрое повышает эффективность транскрипции генов. В отли-
чие от репрессии, антенуация зависит не от самой аминокислоты, а от триптофа-
нил - тРНК (аминокилоты, присоединенной к соответствующей тРНК).
На эффективность продуктивности рекомбинантной ДНК в существенной степени
влияет количество копий этой ДНК в расчете на клетку. Суммарная активность
экспрессируемого гена растет с ростом копийности плазмиды. Таким образом, ис-
пользуя многокопийные плазмиды, можно достичь сверхсинтеза нужных белковых
продуктов. Обычно используемые плазмидные векторы (pBR 322 и др.) поддержива-
ются в клетке в количестве 20-50 копий. Сейчас исследователи имеют в своем
распоряжении температурно-чувствительные мутантные плазмиды, способные нако-
пить до одной-двух тысяч копий на клетку, не нарушая ее жизненно-важных функ-
ций. Таким образом, можно достичь сверхпродукции плазмидных генов бактериаль-
ными штаммами-сверхпродуцентами.
Регуляция экспрессии у Е. coli происходит также и на уровне трансляции. По-
следовательность оснований длиной 6-8 нуклеотидов, расположенная непосредст-
венно перед инициирующим кодоном АУГ, определяет эффективность трансляции.
Эта последовательность представляет собой участок связывания мРНК с рибосо-
мой. Как правило, он отстоит на 8 нуклеотидов от инициирующего кодона, и его
сдвиг в ту или иную сторону может резко снижать эффективность трансляции со-
ответствующей мРНК. Описанный участок называется последовательностью Шайна-
Дальгарно, по имени исследователей, впервые его идентифицировавших.
В состав вектора кроме всего прочего должен входить маркерный ген, позво-
ляющий селектировать измененные клетки. Часто в качестве селективных исполь-
зуют широко распространенные в природе гены ферментов, модифицирующих анти-
биотики и инактивирующие их действие.
Особенности организации
генома эукариот
У эукариотических организмов механизм регуляции транскрипции гораздо более
сложен. В результате клонирования и секвенирования генов эукариот обнаружены
специфические последовательности, принимающие участие в транскрипции и транс-
ляции .
Для эукариотической клетки характерно:
1. Наличие интронов и экзонов в молекуле ДНК.
2. Созревание и-РНК - вырезание интронов и сшивка экзонов.
3. Наличие регуляторных элементов, регулирующих транскрипцию, таких как:
а) промоторы - 3 вида, на каждый из которых садится специфическая полимера-
за. Pol I реплицирует рибосомные гены, Pol II - структурные гены белков, Pol
III - гены, кодирующие небольшие РНК. Промотор Pol I и Pol II находятся перед
участком инициации транскрипции, промотор Pol III - в рамках структурного ге-
на ;
б) модуляторы - последовательности ДНК, усиливающие уровень транскрипции;
в) усилители - последовательности, усиливающие уровень транскрипции и дей-
ствующие независимо от своего положения относительно кодирующей части гена и
состояния начальной точки синтеза РНК;
г) терминаторы - специфические последовательности, прекращающие и трансля-
цию , и транскрипцию.
Эти последовательности по своей первичной структуре и расположению относи-
тельно инициирующего кодона отличаются от прокариотических, и бактериальная
РНК-полимераза их не "узнает". Таким образом, для экспрессии эукариотических
генов в клетках прокариот нужно, чтобы гены находились под контролем прока-
риотических регуляторных элементов. Это обстоятельство необходимо учитывать
при конструировании векторов для экспрессии.
Типы векторов для
введения гена в клетку
Существует несколько типов векторов:
Бактериальные плазмиды
Основная масса клеточной ДНК бактерий содержится в хромосоме (в хромосоме
Е. coli, например, 4 млн. пар нуклеотидов). Однако кроме хромосом бактерии
содержат большое количество очень маленьких кольцевых молекул ДНК плазмид
длиной несколько тысяч пар оснований (молекулярная масса от 1,5 до 300 мега-
дальтон, 1 МД = 1500 п.о). Такие мини-хромосомы называют плазмидами.
Как правило, плазмиды имеют в своем составе гены устойчивости к антибиоти-
кам, ионам тяжелых металлов (R-плазмиды), а также гены, контролирующие ката-
болизм некоторых органических соединений (плазмиды биодеградации, или D-
плазмиды). Поскольку эти гены находятся в плазмидах, они представлены гораздо
большим числом копий. Высокая копийность плазмид обеспечивает клетке синтез
большого количества ферментов, химически нейтрализующих антибиотики или ксе-
нобиотики, что и обеспечивает устойчивость к последним. Плазмиды, по-
видимому, вездесущи, так как их выделяют из разных штаммов и видов бактерий,
но не являются обязательными компонентами генома, а в некоторых природных
штаммах плазмиды не обнаружены вообще.
Поскольку плазмидная ДНК значительно меньше хромосомной, ее довольно легко
выделить в чистом виде. В присутствии ионов кальция плазмиды легко поглощают-
ся бактериями-рецепиентами, даже если те их никогда не содержали, и в клетках
бактериального потомства можно обнаружить много копий поглощенной плазмиды.
Однако бактериальная клетка обычно может содержать в своем составе плазмиды
одного типа. Это явление несовместимости плазмид. Существуют группы несовмес-
тимости - Inc-группы (от английского incompatibility _ несовместимость). В
такой группе может быть несколько плазмид, совместимых между собой, но не со-
вместимых с другими плазмидами. У этих плазмид сходны многие признаки и часто
Значительна гомология ДНК.
Число копий плазмиды в клетке может существенно варьировать. Это зависит от
генетических особенностей как клетки, так и плазмиды. Плазмиды, находящиеся
"под ослабленным контролем", могут размножаться до тех пор, пока их количест-
во не достигнет 10-200 копий на клетку. Если же плазмида находится "под стро-
гим контролем", она реплицируется с той же скоростью, что и главная хромосо-
ма. Такие плазмиды содержатся в клетке в одной или в нескольких копиях. Есте-
ственно, что для клонирования рекомбинантных ДНК стараются использовать плаз-
миды первого типа. Но это не обязательно, так как плазмиды в присутствии хло-
рамфеникола могут умножаться независимо от деления хромосомы, и количество
копий плазмиды может многократно увеличиваться.
Одна их наиболее часто употребляемых плазмид для клонирования pBR 322 соз-
дана на основе плазмид природного происхождения, выделенных из Е. coli. Эта
плазмида содержит гены устойчивости к двум антибиотикам: ампициллину и тетра-
циклину, причем в генах устойчивости к этим антибиотикам имеются сайты рест-
рикции. Если фрагмент чужеродной ДНК встраивается в один из генов устойчиво-
сти, то последний инактивируется. Следовательно, успешное встраивание фраг-
мента чужеродной ДНК в один из этих генов легко детектировать по исчезновению
у бактерий устойчивости к данному антибиотику. Но при этом сохраняется устой-
чивость к другому антибиотику. Таким образом, вектор дает возможность детек-
тировать только те клоны бактерий, которые содержат рекомбинантную плазмиду.
Вирусы
Есть вирусы, которые не ведут к гибели клетки, но встраиваются в геном
клетки-хозяина и размножаются вместе с ней, либо вызывают ее неконтролируемый
рост, т.е. превращают в раковую. К таким относятся ДНК-вирусы SV-40 и вирус
полиомы. Внедрение некоторых опухолевых РНК-вирусов ведет к отпочковыванию
вирусных частиц от клетки без ее лизиса. К таким вирусам относятся, например,
ретровирусы (вирус саркомы Рауса и СПИДа). Для бактериальных клеток в качест-
ве вектора часто используют бактериофаги.
Вирусы являются одними из главных кандидатов на роль векторов для введения
чужеродной ДНК. При вирусной инфекции каждая клетка может получить большое
число копий чужеродного гена. ДНК можно встраивать так, чтобы она находилась
под контролем сильных вирусных промоторов, что обеспечит высокий уровень экс-
прессии гена, и его продукты будут более доступны для исследования.
В последние годы сконструированы многочисленные "челночные" векторы и их
рекомбинантные производные, способные к репликации в животной и бактериальной
клетке и эффективно экспрессирующие клонируемый ген в животной клетке. Наибо-
лее распространенные векторы состоят из плазмиды pBR322 и интактного раннего
района транскрипции ДНК SV40, а нужный ген встраивается под контроль промото-
ра поздних генов или дополнительного раннего промотора. Например, в ДНК SV4 О
был встроен ген р-глобина кролика, который экспрессировался в линии клеток
обезьяны, зараженных рекомбинантным вирусом: в клетках синтезировались и мРНК
гена глобина, и сам белок.
Вирус должен быть жизнеспособным после рекомбинирования его ДНК. Легче все-
го вирусы вводятся в бактерии. Недостатком вирусов как векторов является их
небольшая емкость. Кроме того, вирусы заражают небольшой круг хозяев.
Существуют гибридные вектора, содержащие ДНК фага и плазмиды. К ним отно-
сятся, например, космиды и фазмиды.
Космиды - плазмидные вектора, в которые встроен участок генома фага Л,
обеспечивающий возможность упаковки этой молекулы ДНК в фаговую частицу. Фа-
говые частицы обеспечивают хорошее проникновение гибридной ДНК в клетку (пу-
тем инъекции), после чего происходит замыкание ДНК в кольцо по липким концам
и репликация ее по плазмидному типу.
Фазмиды также являются гибридами между фагом и плазмидой. После встройки
чужеродной ДНК могут в одних условиях развиваться как фаги, в других - как
плазмиды.
Вироиды
Из всех известных в настоящее время инфекционных агентов имеют ранг наибо-
лее странных. Известно, что самые мелкие вирусы, способные к независимой реп-
ликации, имеют размеры генома, соответствующие молекулярной массе 1 М, то
есть около 1500 тыс. пар оснований. Это считали минимальным количеством гене-
тической информации, необходимой для кодирования вирусоспецифических продук-
тов и подавления метаболизма хозяйской клетки.
Однако в 1971 году были открыты инфекционные агенты, представляют собой
очень короткую цепь 1 нитевой ковалентно связанной кольцевой РНК, состоящую
из 270-300 нуклеотидов (на три порядка меньше самых минимальных вирусов), не
заключенную в белковую оболочку. Это необычные патогены - самые простые и са-
мые маленькие из всех известных.
Каким образом вироиды продуцируют симптомы болезни в инфицированных расте-
ниях, не известно до сих пор. Установлено, что они реплицируются ферментами
клетки-хозяина, не транслируются в видоспецифичные полипептиды, интегрируются
в геном клетки-хозяина.
Вироиды заражают персиситентно (не происходит выздоровления). Вызывают сис-
темную инфекцию, т.е. мигрируют из сайта внедрения в другие части растений,
переносятся механически или через клеточный сок, через семена, пыльцу. Вирои-
ды также связаны с ядерными фракциями растений и могут размножаться в ядрах.
При работе с вироидами получают 1-нитевую ДНК- копию РНК и достраивают ком-
плементарную нить для получения 2-нитевой ДНК вироида. Такая 2-цепочечная ДНК
встраивается в плазмиду и передается в клетки Е. coli для клонирования. Счи-
тывание гена начинается с промотора, который узнается РНК-полимеразой, отве-
чающей за транскрипцию ДНК в матрицу РНК. Обычно это фрагмент ДНК из 41-44
пар оснований. Ген считывается слева направо, от 5' к 3' концу гена и закан-
чивается в терминальной области гена. За промотором начинается стартовый сайт
транскрипции, за которым следует смысловая часть гена. Промоторная область
гена содержит определенные короткие сочетания нуклеотидов, характерные для
бактериальных генов, или для генов высших организмов. Такие сочетания служат
сигналами для РНК-полимеразы, которая присоединяется к промоторной части гена
и начинает его считывать.
Однонитевые и двунитевые ДНК способны инициировать репликацию вироида в ме-
ханически инокулированных растениях табака. Энзиматически in vitro синтезиро-
ваны также РНК вироидов, высокоинфекционные для растений. Векторные системы
могут быть разработаны на основе самих РНК, на основе вироидоспецифичных ДНК,
а также в комбинации вироидоспецифичных ДНК с Ti-плазмидами. Вироиды инфици-
руют своих хозяев в течение всего их жизненного цикла, поэтому в случае ис-
пользования вироидных векторных систем можно ожидать постоянной экспрессии
чужеродного гена в растении.
Плазмиды агробактерий
В качестве векторов могут использоваться опухолеобразующие плазмиды бакте-
рий. Виды Agrobacterium эволюционно родственны клубеньковым бактериям, отно-
сящимся к роду Rhizobium, и имеют много общих с ними черт. Однако характер
взаимодействия агробактерий с растением имеет своеобразные особенности.
Взаимодействие видов Agrobacterium с растениями представляет особый инте-
рес, так как при этом виде паразитизма один из партнеров специфически видоиз-
меняет свойства хозяина, встраивая свои гены в его геном. Кроме того, это
служит уникальным примером миграции ДНК прокариот в эукариотическую клетку.
ДНК митохондрий и хлоропластов Хлоропласты и митохондрии содержат полноценную
генетическую систему, то есть все компоненты, необходимые для экспрессии ге-
нетической информации: ДНК, ДНК-полимеразы, РНК-полимеразы и белоксинтезирую-
щий аппарат (рибосомы, т-РНК, аминоацил-тРНК-синтетазы).
Хлоропластная и митохондриальная ДНК также привлекают внимание ученых в ка-
честве возможных векторов для переноса генов в клетку. Структурная организа-
ция этих клеточных субгеномов существенно различается.
Хлоропласты и другие пластиды обладают одинаковой генетической информацией,
так называемым пластомом. У высших растений он представляет собой замкнутую
молекулу ДНК длиной 150 т.н.п., достаточную для кодирования примерно 100 бел-
ков. Для синтеза пластид необходимо значительно больше белков. Остальные бел-
ки кодируются ядром, синтезируются в цитоплазме и поступают в хлоропласты.
Некоторые важнейшие белки хлоропластов состоят из нескольких субъединиц,
часть из них синтезируется на рибосомах цитоплазмы и транспортируется в хло-
ропласт, где они объединяются с другими полипептидами, закодированными в са-
мом хлоропласте и там же синтезируемыми. Таким образом, для биосинтеза функ-
ционально активного хлоропласта требуется согласованная экспрессия генома и
пластома.
Различные типы пластид содержат неодинаковые количества идентичных копий
пластома: от 10 - 20 копий в пластидах корней и зрелых хлоропластах до сотен
копий в молодых хлоропластах картофеля. Такой уровень амплификации позволяет
надеяться на надежную экспрессию чужеродной ДНК при использовании их в каче-
стве векторов в генно-инженерных экспериментах. Кроме того, гены рибосомаль-
ной РНК пластид и большой субъединицы РБФК кодируются геномом хлоропластов.
Возможно, введение сильных промоторов в эти гены и дополнительная их модифи-
кация существенно повлияют на фотосинтетическую активность растительной тка-
ни .
Гены растений также способны к экспрессии в клетках Е. coli. Это гены боль-
шой субъединцы РБФК. Преимущество хлоропластных генов заключается в том, что
их экспрессия к клетках кишечной палочки может быть достигнута путем простого
объединения транскрибируемых последовательностей, т. к. в ДНК хлоропластов и
бактерий до начала стартовых кодонов трансляции расположена одинаковая нук-
леотидная последовательность. Это дает возможность синтезировать растительные
экономически важные полипептиды с помощью клеток прокариот.
В отличие от хлоропластной, ДНК митохондрий характеризуются исключительным
разнообразием, и их величина колеблется от 200 до 2400 т.н.п. Однако никакой
корреляции между размером митохондриального генома и числом белковых продук-
тов, синтезируемых изолированными митохондриями, не наблюдается. Это явление,
а также большие размеры митохондриальной ДНК, по-видимому, можно объяснить
присутствием ДНК, бесполезной для функционирования митохондрий.
В составе митохондриальной ДНК имеются структурные гены, кодирующие поли-
пептиды, гены рибосомных и транспортных РНК. Однако большая часть белков ми-
тохондрий, как и хлоропластов, кодируется ядерными генами. Но если геном хло-
ропластов представлен гомогенной популяцией крупных кольцевых молекул, то в
митохондриях содержится несколько классов кольцевых молекул, не все функции
которых еще ясны.
Митохондриальный геном животных организмов намного меньше, 15 - 19 т.н.п.,
и более консервативен по структуре. Гены митохондрий кодируют 2 группы при-
знаков - работу дыхательных систем и устойчивость к антибиотикам и другим
ядам. В митохондриальном геноме растений есть также гены, отвечающие за при-
знак мужской стерильности цитоплазмы.
Транспозоны
Транспозоны - сегменты ДНК, которые контролируют собственную транспозицию
(перемещение) из одного сайта ДНК в другой путем вырезания из исходного сайта
и внедрения в новый сайт хромосомы или плазмиды. Впервые были открыты в 40-х
годах американской ученой Барбарой Мак-Клинток у кукурузы. Эти гены, инденти-
фондированные по их способности подавлять экспрессию других генов кукурузы,
находящихся рядом с ними, не имели фиксированного положения в хромосоме. Они
как бы передвигались по всему геному растения. Регуляторные элементы могли
встраиваться и выщепляться, причем после их выщепления зачастую начинали
функционировать ранее молчащие гены.
Оказалось, что гены, ассоциированные с регуляторными элементами, станови-
лись нестабильными и часто мутировали из-за нестабильности самих этих элемен-
тов. В течение многих лет кукуруза оставалась единственной системой, в кото-
рой обнаруживались такие подвижные генетические элементы. Сейчас - и у бакте-
рий , дрозофил и других организмов.
Механизм перемещения фрагментов ДНК по геному до конца не выяснен. ДНК пе-
реносится ферментом транспозазой. Фермент кодируется последовательность дли-
ной около 20 нуклеотидов в середине транспозона. Он специфически взаимодейст-
вует с концевыми инвертированными повторами мобильного элемента и может выре-
зать его из хромосомы. Вырезание может происходить точно - с восстановлением
исходной структуры участка ДНК, и неточно, то есть с делециями и вставками от
одного до нескольких нуклеотидов. Это приводит к появлению стабильных мутаций
и является одним из механизмов создания новых последовательностей ДНК.
Как правило, мобильные генетические элементы многократно повторены в геноме
и образуют гетерогенные семейства, члены которых диспергированы по хромосо-
мам. Большая часть членов каждого семейства являются дефектными копиями и не
кодируют какой-либо функции, хотя сохраняют способность к перемещению. Пове-
дение транспозонов можно расценить как паразитическое. Длина их от 2 до 10
тысяч нуклеотидных пар. У высших эукариот на долю транспозонов приходится
примерно 10% ДНК клетки. Большинство их перемещается изредка, но, так как их
в клетке довольно много, транспозиция оказывает значительное влияние на раз-
нообразие видов.
Биологический смысл перемещения отдельных сегментов ДНК:
- прерывание соответствующего гена, что ведет к эволюции;
- регуляция деятельности генов, так как транспозоны могут нести сигналы для
начала считывания генов. В новых областях усиливают или запрещают работу ге-
на .
Транспозоны также участвуют в горизонтальном переносе генов.
У бактерий были обнаружены 2 класса подвижных генов, различающихся по длине
и сложности организации.
1. Инсерционные последовательности, или 1S элементы, имеющие длину около
тысячи пар нуклеотидов и содержащие только ген, отвечающий за их перемещение.
2. Транспозоны, длиной от 3 до 20 т. н. п. , состоящие из ряда дополнитель-
ных генов, отвечающих за устойчивость бактерий к различным токсическим веще-
ствам.
Поскольку подвижные гены могут перемещаться в пределах генома с одного мес-
та на другое, то они могут быть весьма эффективными векторами для передачи
рекомбинантной ДНК. Генетическая трансформация с помощью векторов на основе
транспозонов была впервые осуществлена на дрозофиле. С помощью транспозируе-
мого элемента Р дрозофиле был передан ген, обуславливающий коричневую окраску
глаз. Перенос генов при помощи транспозонов имеет большие преимущества, так
как он происходит с высокой частотой и не влечет значительных перестроек ин-
тегрируемой ДНК. Кроме того, этим методом можно переносить достаточно большие
фрагменты ДНК.
Способы прямого
введения гена
в клетку
Прямое введение гена в клетку осуществляют несколькими способами:
Трансфекция
Микроинъекция
Электропорация
Метод «мини-клеток»
Упаковка в липосомы
Электронная пушка
При трансфекции ДНК адсорбируется на кристаллах фосфата кальция (Грэхем Ван
дер Эб, 1973). Образуются частицы кальциевого преципитата. Они поглощаются
клеткой путем фагоцитоза.
Для повышения эффективности трансформации к специфической ДНК, содержащей
ген, по которому будет производится селекция, добавляется неспецифическая
ДНК-носитель. Обычно для этой цели берут ДНК из тимуса теленка или спермы ло-
сося. Часть ДНК связывается с мембраной и не попадает в клетки. ДНК акцепти-
руют от 15 до 90% клеток. Через несколько суток после введения небольшая доля
клеток способны экспрессировать чужеродные гены, но затем уровень экспрессии
падает и более или менее стабильную трансформацию претерпевает 10”3 - 10”5
клеток.
Для трансфекции используется и ДЭАЭ-декстран, полимер, адсорбирующий ДНК.
Эффект вхождения в клетки и время экспрессии высоки, но частота стабильной
трансформации ниже, чем при использовании преципитата кальция. Частоту транс-
фекции увеличивает глицериновый шок (4 минуты в 15% растворе глицерина в
НЕРЕS-буфере).
В клетки можно вводить любой ген, если заранее лигировать его с клонирован-
ным селективным маркером. Однако дальнейшие исследования показали, что лиги-
рование вне клетки не обязательно. Клетки, поглощающие селективный ген, вме-
сте с ним поглощают и другую ДНК, имеющуюся в кальциевом преципитате. Таким
образом, пользуясь методом котрансформации, практически любой клонированный
сегмент ДНК можно ввести в культивируемые клетки эукариот, если включить эту
ДНК вместе с селективным маркером в состав смеси для образования кальциевого
преципитата.
Для трансфекции можно использовать хромосомы или фрагменты хромосом. Клет-
ки-доноры блокируются на стадии митоза. Митотические хромосомы высвобождаются
под воздействием осмотического шока и гомогенизации. Их очищают путем диффе-
ренциального центрифугирования. Хромосомы осаждают на поверхности клеток хло-
ристым кальцием, а через несколько часов обрабатывают реагентом, способным
перфорировать мембраны (например, глицерином).
Для обработки клеток-рецепиентов используются грубо очищенные препараты
хромосом, так как хромосомы при этом разрушаются меньше всего. Количество
хромосом для обработки 1 клетки ограничено. Лучше использовать не более 20
хромосом на 1 клетку-рецепиент, так как при высоких концентрациях хромосом в
суспензии они агглютинируют. Рецепиентная клетка содержит фрагменты донорных
хромосом, которые могут встраиваться в геном, могут реплицироваться самостоя-
тельно . Во введенных фрагментах часто наблюдаются делеции.
Не все клетки способны к трансформации геномной ДНК с высокой частотой. Че-
ловеческие фибробласты эффективно включают плазмидную ДНК и почти не включают
геномную.
Микроинъекция ДНК в клетки млекопитающих стала возможной с появлением при-
бора для изготовления микропипеток диаметром 0.1-0.5 микрона и микроманипуля-
тора (рис. 45). Так, плазмиды, содержащие фрагмент вируса герпеса с геном ти-
мидинкиназы (ТК) и плазмиду pBR322, были инъецированы в ТК-клетки и было по-
казано, что ТК-ген проник в ядра и нормально в них реплицировался. Метод вве-
дения ДНК с помощью микроинъекций был разработан в начале 70-х годов Андерсо-
ном и Диакумакосом. В принципе, при наличии хорошего оборудования можно за 1
час инъецировать 500-1000 клеток, причем в лучших экспериментах в 50% клеток
наблюдается стабильная интеграция и экспрессия инъецированных генов. Преиму-
щество описываемого метода заключается также в том, что он позволяет вводить
любую ДНК в любые клетки, и для сохранения в клетках введенного гена не тре-
буется никакого селективного давления.
Рис. 45. Введение ДНК путем микроинъекции
Электропорация основана на том, что импульсы высокого напряжения обратимо
увеличивают проницаемость биомембран. В среду для электропорации добавляют
клетки и фрагменты ДНК, которые необходимо ввести в клетки (рис. 46) . Через
среду пропускают высоковольтные импульсы (напряжение 200 - 350 В, длитель-
ность импульса 54 мс) , приводящие к образованию пор (электропробой) в цито-
плазматической мембране, время существования и размер которых достаточны,
чтобы такие макромолекулы, как ДНК, могли из внешней среды войти в клетку в
результате действия осмотических сил. При этом объем клетки увеличивается.
Напряженность электрического поля и продолжительность его действия, концен-
трации трансформирующей ДНК и реципиентных клеток для каждой системы клеток
подбирают экспериментально с тем, чтобы достичь высокого процента поглощения
ДНК выжившими клетками. Показано, что в оптимальных условиях электропорации
количество трансформантов может достигать 80% выживших клеток.
Электропорация — физический, а не биохимический метод, и это, по-видимому,
обусловливает его широкое применение. Многочисленные исследования продемонст-
рировали, что электропорация может успешно использоваться для введения моле-
кул ДНК в разные типы клеток, такие как культивируемые клетки животных, про-
стейшие, дрожжи, бактерии и протопласты растений. Электропорирующий эффект
высоковольтного разряда на бислойную липидную мембрану, по-видимому, зависит
от радиуса ее кривизны. Поэтому мелкие бактериальные клетки эффективно погло-
щают ДНК при значительно большей напряженности (10 кВ/см и более), чем круп-
ные животные и растительные клетки, эффективно поглощающие ДНК при напряжен-
ности поля 1—2 кВ/см.
Электропорация — наиболее простой, эффективный и воспроизводимый метод вве-
дения молекул ДНК в клетки. Однако до недавнего времени этот метод использо-
вался в ограниченном числе лабораторий в связи с отсутствием серийных прибо-
ров — электропораторов. Появление и совершенствование таких приборов в бли-
жайшие годы приведет к широкому применению данного подхода в генетической ин-
женерии самых разных типов клеток.
Раствор ДНК
Рис. 46. Метод электропорации
«Мини-клетки» получают путем блокирования донорных клеток митозе колцеми-
дом. При продолжительной обработке клеток колцемидом в них вокруг каждой хро-
мосомы формируется новая ядерная мембрана. Обработка цитохалазином В и цен-
трифугирование приводит к образованию мини-клеток, представляющих микроядра,
инкапсулированные в цитоплазматическую мембрану.
Полученные мини-клетки очень чувствительны к разного рода воздействиям, по-
этому для слияния подбирают специальные мягкие условия. Метод трудный, ка-
призный, эффективность низкая - 10”6 - 10”7.
Упаковка в липосомы используется для защиты экзогенного генетического мате-
риала от разрушающего действия рестриктаз.
Липосомы - сферические оболочки, состоящие из фосфолипидов. Получают их пу-
тем резкого встряхивания смеси водного раствора и липидов, либо обрабатывая
ультразвуком водные эмульсии фосфолипидов. Липосомы, состоящие из фосфатидил-
серина и холестерина наиболее пригодны для введения ДНК в клетки животных и
растений. Системы переноса с помощью липосом низкотоксичны по отношению к
клеткам.
Метод биологической баллистики (биолистики) является одним из самых эффек-
тивных на сегодняшний день методов трансформации растений, особенно однодоль-
ных .
Суть метода заключается в том, что на мельчайшие частички вольфрама, диа-
метром 0,6—1,2 мкм, напыляется ДНК вектора, содержащего необходимую для
трансформирования генную конструкцию. Вольфрамовые частички, несущие ДНК, на-
носятся на целлофановую подложку и помещаются внутрь биолистической пушки.
Каллус или суспензия клеток наносится в чашку Петри с агаризированной средой
и помещается под биолистическую пушку на расстоянии 10—15 см. В пушке вакуум-
ным насосом уменьшается давление до 0,1 атм. В момент сбрасывания давления
вольфрамовые частички с огромной скоростью выбрасываются из биолистической
пушки и, разрывая клеточные стенки, входят в цитоплазму и ядро клеток.
Обычно клетки, располагающиеся непосредственно по центру, погибают из-за
огромного количества и давления вольфрамовых частиц, в то время как в зоне
0,6—1 см от центра находятся наиболее удачно протрансформированные клетки.
Далее клетки осторожно переносят на среду для дальнейшего культивирования и
регенерации.
С помощью биолистической пушки были протрансформированы однодольные расте-
ния, такие, как кукуруза, рис, пшеница, ячмень. При этом были получены ста-
бильные растения-трансформанты. Кроме успехов в получении трансгенных одно-
дольных, биолистическая трансформация применяется для прямого переноса ДНК в
эмбриогенную пыльцу и дальнейшего быстрого получения трансгенных дигаплоидных
растений, которые являются важным этапом в селекционной работе. В настоящее
время этим методом была проведена трансформация растений табака, и после ре-
генерации гаплоидных растений, получены стабильные трансформанты.
Генетические манипуляции
с бактериальными клетками
В настоящее время бактерия Е. coli является самой изученной клеткой из всех
существующих. У большинства наиболее полно изученных фагов клеткой - хозяином
является также Е. coli.
Протопласт Е. coli одет в муреиновый мешок, прилегающий к внешней мембране.
Е. coli относится к микроорганизмам, не обладающим физиологической компетент-
ностью к поглощению экзогенной ДНК. Поэтому необходимо создать условия, по-
зволяющие преодолеть барьер клеточной стенки. Сначала получают сферопласты
путем обработки клеток лизоцимом в изотоническом растворе.
Липополисахаридный слой внешней мембраны грамотрицательной бактерии стаби-
лизирован двухвалентными катионами, поэтому для разрыхления внешней мембраны
Е. coli используется комплексообразователь этилендиаминтетрауксусная кислота
(EDTA) , которая связывает двухвалентные катионы. При обработке EDTA часть ли-
пополисахаридов высвобождается из внешней мембраны клетки, и лизоцим может
достигнуть муреинового мешка и гидролизовать его. Это ведет к повышению про-
ницаемости клеточной оболочки. Усовершенствование методов получения сферопла-
стов Е. coli и их трансфекции позволили достичь достаточно высокой эффектив-
ности трансформации молекулами ДНК различных фагов.
Обнаружено, что на инфекционность существенное влияние оказывает форма мо-
лекул фаговых ДНК, которую они принимают in vivo. Фаги с кольцевой или линей-
ной, но быстро замыкающейся ДНК (лямбоидные фаги) характеризуются наибольшей
эффективностью трансфекции.
Успешное проведение экспериментов на кишечной палочке стало стимулом для
проведения аналогичных исследований с другими прокариотическими организмами.
Наибольших успехов удалось достичь с клетками Bacillus subtilis. В. subtilis
- непатогенный почвенным микроорганизм, растущий в строго аэробных условиях.
Бациллы не образуют токсинов и непатогенны ни для животных, ни для человека,
тогда как клеточная стенка Е. coli содержит эндотоксин, который довольно
трудно отделить от продуктов генной инженерии. Кроме того, клеточная стенка
бацилл имеет простую структуру и бактерии могут секретировать многие белки в
культуральную жидкость. 20 различных видов бацил секретируют в культуральную
жидкость более 40 ферментов с внеклеточной локализацией. Е. coli секретирует
в среду относительно мало белков, а выделение и очистка их затруднены. В ба-
циллах также обнаружены плазмиды и фаги, которые к настоящему моменту уже хо-
рошо изучены.
Чужеродные гены клонируют в так называемых челночных векторах. Эти вектора
с одинаковым успехом реплицируются в клетках нескольких хозяев, в данном слу-
чае, в клетках Е. coli и В.subtilis. Векторы были получены комбинацией in
vitro фрагментов этих плазмид.
Гены Е. coli со своими регуляторными районами не функционируют в
В.subtilis, поэтому были использованы собственные гомологичные районы
В.subtilis.
Для конструирования рекомбинантной ДНК, содержащей в своем составе ген, ко-
торый должен экспрессироваться, придерживаются следующей стратегии. Синтези-
руют кДНК или из клонотеки выделяют клетки, несущие фрагмент генома с нужным
геном, и клонируют их в соответствующем векторе. Фрагменты геномной ДНК под-
вергают модификации - удаляют из них некодирующие области и участки соседних
генов. Часто для проведения этой операции необходимо секвенирование данного
фрагмента ДНК. Затем конструируются промежуточные рекомбинантные ДНК, в кото-
рых ген помещается под контроль бактериальных регуляторных элементов (промо-
тор, оператор, точка связывания с рибосомами). Эти регуляторные элементы вы-
деляют из гибридных плазмид, сконструированных специально как источники регу-
ляторных элементов. Полученная конструкция встраивается в подходящий вектор,
например, pBR 322, и ген экспрессируется в бактериальной клетке.
Однако удобнее встраивать ген в специальный вектор для экспрессии, который
уже содержит регуляторные элементы, обеспечивающие активную экспрессию после
введения рекомбинантной плазмиды в бактериальную клетку. К таким эффективным
регуляторным участкам относится, например, сильный промотор гена бэта-
лактамазы (ген устойчивости к пенициллину, входящий в состав плазмиды pBR
322). Ряд генов, в том числе и ген инсулина, встраивали в сайт рестрикции Pst
I, который расположен в структурной части гена. Промотор этого гена обеспечи-
вает эффективную транскрипцию, которая продолжается до тех пор, пока РНК-
полимераза не дойдет до сигнала терминации встроенного гена.
В качестве примера маркирования вектора могут служит первые эксперименты с
Е. coli, а точнее с одной из ее плазмид pBR322, проведенные Гилбертом для по-
лучения инсулина. Плазмида pBR322 содержит 2 гена, которые определяют устой-
чивость к ампициллину и тетрациклину. Рестриктаза PstI расщепляет плазмиду в
средней части гена, кодирующего фермент устойчивости к апициллину. После рас-
щепления плазмиды на ее концы с помощью концевой трансферазы надстраивали по-
следовательность из четырех нуклеотидов с остатками гуанина. Затем, как обыч-
но, с помощью лигаз "вшивали" ген проинсулина, получая рекомбинантную ДНК.
Встроенный в плазмиду фрагмент ДНК нарушал синтез фермента, разрушающего ам-
пициллин, но ген, обеспечивающий устойчивость к тетрациклину, оставался ак-
тивным. Трансформированные таким образом клетки Е. coli синтезировали гибрид-
ный белок, содержащий последовательности пенициллазы и проинсулина, поэтому
биологически активный инсулин получали путем отщепления пенициллазы и средний
сегмент проинсулина.
С другой стороны, если фрагмент чужеродной ДНК встраивается в один из генов
устойчивости, то последний инактивируется. Следовательно, успешное встраива-
ние фрагмента чужеродной ДНК в один из этих генов легко детектировать по ис-
чезновению у бактерий устойчивости к данному антибиотику.
ВВЕДЕНИЕ ГЕНОВ В
КЛЕТКИ МЛЕКОПИТАЮЩИХ
Манипуляции с клетками млекопитающих можно разделить на 2 большие группы:
эксперименты с соматическим клетками и эксперименты по трансформации половых
клеток. В последнем случае конечный результат - получение трансгенных орга-
низмом .
Характеристика векторов
для переноса генов в
животные клетки
Одними из лучших носителей для введения чужеродной информации в животную
клетку являются вектора на основе ретровирусов, например, на основе вируса
лейкоза мышей. Они обеспечивают высокоэффективный перенос генов и их стабиль-
ное встраивание в хромосому клеток-мишеней. В основном трансформации животных
клеток осуществляют либо с помощью ретровирусов (около 40% от всех трансфор-
маций) , либо путем упаковки ДНК в липосомы (25%), реже используют аденовиру-
сы, так как они могут вызывать сильный иммунный ответ, кроме того, невозможно
их повторное введение.
Если проблема доставки чужеродной ДНК in vitro практически решена, а ее
доставка в клетки-мишени разных тканей in vivo успешно решается (главным об-
разом путем создания конструкций, несущих рецепторные белки, в том числе и
антигены, специфичные для тех или иных тканей), то другие характеристики су-
ществующих векторных систем - стабильность интеграции, регулируемая экспрес-
сия, безопасность — все еще нуждаются в серьезных доработках.
Прежде всего, это касается стабильности интеграции. До настоящего времени
интеграция в геном достигалась только при использовании ретровирусных либо
аденоассоциированных векторов. Повысить эффективность стабильной интеграции
можно путем совершенствования генных конструкций типа рецептор-опосредованных
систем, либо путем создания достаточно стабильных эписомных векторов (то есть
ДНК-структур, способных к длительной персистенции внутри ядер).
В последнее время особое внимание уделяется созданию векторов на базе ис-
кусственных хромосом млекопитающих (МАС - mammalian artificial chromosomes).
Благодаря наличию основных структурных элементов обычных хромосом такие мини-
хромосомы длительно удерживаются в клетках и способны нести полноразмерные
(геномные) гены и их естественные регуляторные элементы, которые необходимы
для правильной работы гена, в нужной ткани и в должное время. Такие искусст-
венные хромосомы уже созданы для дрожжей (YAK), так как геном дрожжей полно-
стью картирован.
Для идентификации модифицированных клеток, необходимы маркеры. Если транс-
формируют соматические клетки, то применяют обычно селективные маркеры. Ак-
сель с коллегами из колледжа терапии и хирургии Колумбийского университета
исправили, таким образом, генетический дефект клеток мыши. Они взяли фрагмент
ДНК, содержащий ген тимидинкиназы (ТК), который получен из вируса герпеса,
смешали эту ДНК с несколькими миллиграммами ДНК-носителя из спермы лосося и
осадили ДНК на культуру L-клеток мыши, в которых ген ТК отсутствовал (ТК-). С
частотой 1 на 100000 клетки приобретали ген ТК, поэтому на селективной среде,
которая не позволяла расти ТК- - клеткам, росли и нормально размножались ТК+
- клетки.
Другой селективный маркер - ген, кодирующий дигидрофолатредуктазу (ДГФР),
можно использовать при трансформации немутантных линий клетки. Благодаря экс-
прессии многих копий этого гена животная клетка вместе с плазмидой приобрета-
ет устойчивость к высоким концентрациям ингибитора фермента, и таким образом
трансформантов можно отбирать при высоких концентрациях ингибитора.
Разработано еще два универсальных вектора, содержащих генные маркеры, рабо-
тающие в нормальных клетках. Они построены по одному и тому же принципу: про-
кариотические гены, определяющие фенотип трансфецированных клеток, соединены
с эукариотическими регуляторными сигналами.
Один из векторов состоит из прокариотического гена устойчивости к антибио-
тику неомицину, встроенного в раннюю область генома SV-40. Эукариотические
клетки чувствительны к аналогу неомицина G 418, который инактивируется про-
дуктом гена. Таким образом, трансфецированные клетки приобретают способность
расти на среде, содержащей G 418.
Генетическая транформация
соматических клеток
млекопитающих
Культуры трансформированных клеток млекопитающих используют для получения
различных веществ. Хотя культуры клеток животных, особенно при массовом выра-
щивании, гораздо менее экономичны, чем бактериальные или дрожжевые культуры,
они обладают существенным преимуществом - способностью осуществлять мелкие,
но весьма важные модификации белков - продуктов гена млекопитающих. Например,
для эффективного функционирования ряда белков необходимо присоединение к ним
цепочек из молекул углеводов или липидов. Образование и присоединение таких
цепочек - обычный процесс для клеток млекопитающих, тогда как бактериальная
клетка не способна производить подобные модификации.
Помимо создания клеток-продуцентов, трансформация соматических клеток мле-
копитающих позволяет изучать тонкие механизмы регуляции экспрессии генов и
целенаправленно модифицировать генетический аппарат клетки животных, а при
необходимости и человека, что имеет огромное значение для медицинской генети-
ки .
Культуры клеток млекопитающих могут оказаться эффективным источником выде-
ления некоторых вирусных антигенов с целью получения вакцин для животных и
человека. Получение таких вакцинных культур клеток осуществимо при помощи
техники рекомбинантных ДНК и эффективных векторов экспрессии для клеток мле-
копитающих и человека. При использовании ДНК-вакцин в организм вводится не
антиген, а ген, кодирующий синтез этого антигена. Ген встраивается в плазми-
ду, а плазмида вводится организм путем обыкновенной инъекции.
ДНК-вакцины имеют хорошие перспективы в животноводстве. Фибер - белок ви-
русной оболочки. Эпитоп фибера кодирует синтез протективных антител. Одно из
заболеваний птиц - синдром снижения яйценоскости (ССЯ) вызывается вирусом.
После анализа ДНК этого вируса был выделен ген, кодирующий фибер, проклониро-
ван и встроен в плазмиду. Рекомбинантная вакцина при введении ее в организм
принесет ДНК фибера в клетку, выработка вирусного белка спровоцирует синтез
специфических антител, т. е. вызовет иммунный ответ.
Достоинством таких вакцин является очень маленький объем - для иммунизации
одной мыши достаточно 10-50 мкг плазмиды, одной коровы - 200-300 мкг. Плазми-
да сохраняется в организме до 1 года. В стадии клинических испытаний в на-
стоящее время находятся ДНК-вакцины против микоплазм, возбудителя туберкуле-
за , сальмонеллеза, лейшманиоза.
Развитие злокачественной опухоли в организме обычно подавляет иммунитет.
Проблема в том, чтобы подхлестнуть иммунную систему в целом и направить ее
действие против раковых клеток. Исследователи из Медицинской школы в Энн-
Арборе (Мичиган) придумали метод борьбы с раком. В опухолевые клетки толстой
кишки подопытных мышей ввели гены, кодирующие белки другой линии мышей. Это
можно осуществить с помощью липосом или вируса. После появления на внешней
стороне клеточной мембраны этих белков иммунная система атаковала такие клет-
ки. 20% больных мышей выздоровели, у 70% опухоль уменьшилась, в контрольной
группе все умерли. Лимфоциты боролись не только с «меченными» клетками опухо-
ли, но и клетками метастаз, следовательно, иммунная система «проснулась». В
настоящее время ведутся эксперименты на людях с раком кожи.
Генотерапия
Лечение заболеваний с помощью генов получило название генотерапии. Сейчас в
мире насчитывается порядка 400 проектов, посвященных лечению с помощью гено-
теропии.
Разработке программы генной терапии предшествуют тщательный анализ тканес-
пецифической экспрессии соответствующего гена, идентификация первичного био-
химического дефекта, исследование структуры, функции и внутриклеточного рас-
пределения его белкового продукта, а также биохимический анализ патологиче-
ского процесса. Все эти данные учитываются при составлении соответствующего
медицинского протокола.
Апробацию процедуры генокоррекции наследственного заболевания проводят на
первичных культурах клеток больного, в которых в норме функционально активен
данный ген. На этих клеточных моделях оценивают эффективность выбранной сис-
темы переноса экзогенной ДНК, определяют экспрессию вводимой генетической
конструкции, анализируют ее взаимодействие с геномом клетки, отрабатывают
способы коррекции на биохимическом уровне. Используя культуры клеток, можно
разработать систему адресной доставки рекомбинантных ДНК, однако проверка на-
дежности работы этой системы может быть осуществлена только на уровне целого
организма. Поэтому такое внимание в программах по генной терапии уделяется
экспериментам in vivo на естественных или искусственно полученных моделях со-
ответствующих наследственных болезней у животных.
Успешная коррекция генетических дефектов у таких животных и отсутствие не-
желательных побочных эффектов генной терапии являются важнейшей предпосылкой
для разрешения клинических испытаний. Таким образом, стандартная схема гено-
коррекции наследственного дефекта включает серию последовательных этапов. Она
начинается созданием полноценно работающей (экспрессирующейся) генетической
конструкции, содержащей смысловую (кодирующую белок) и регуляторную части ге-
на. На следующем этапе решается проблема вектора, обеспечивающего эффектив-
ную, а по возможности и адресную доставку гена в клетки-мишени. Затем прово-
дится трансфекция (перенос полученной конструкции) в клетки-мишени, оценива-
ется эффективность трансфекции, степень коррегируемости первичного биохимиче-
ского дефекта в условиях клеточных культур (in vitro) и, что особенно важно,
in vivo на животных - биологических моделях. Только после этого можно присту-
пать к программе клинических испытаний.
Существует два типа генотерапии: заместительная и корректирующая.
Заместительная генотерапия заключается во вводе в клетку неповрежденного
гена. Внесенная копия заменит по функциям сохранившийся в геноме больного де-
фектный ген. Все проводимые сегодня клинические испытания используют внесение
в клетку дополнительных количеств ДНК.
При корректирующей терапии предполагается замена дефектного гена нормальным
в результате рекомбинации. Пока этот метод на стадии лабораторных испытаний,
так как эффективность его еще очень низка.
В зависимости от способа введения экзогенных ДНК в геном пациента генная
терапия может проводиться либо в культуре клеток (ex vivo), либо непосредст-
венно в организме (in vivo). Клеточная генная терапия или терапия ex vivo
предполагает выделение и культивирование специфических типов клеток пациента,
введение в них чужеродных генов, отбор трансфецированных клеток и реинфузию
их тому же пациенту.
Примером может служить лечение комбинированного иммунодефииицита. Комбини-
рованный иммунодефицит может быть результатом дефекта гена аденозиндезамина-
зы. Впервые попытка лечения такого больного методами генотерапии была пред-
принята в США в 1990 г. У больного ребенка извлекли Т-лимфоциты, трансформи-
ровали ретровирусным вектором, введя нормальный ген аденозиндезаминазы и вер-
нули клетки в организм. Введение приходится повторять. Более эффективна ана-
логичная трансформация стволовых клеток костного мозга.
Генная терапия in vivo основана на прямом введении клонированных и опреде-
ленным образом упакованных последовательностей ДНК в специфические ткани
больного. В настоящее время не существует общедоступного метода культивирова-
ния клеток легких, поэтому при легочных заболеваниях единственный способ дос-
тавить чужеродный ген - это ввести его прямо в организм. Муковисцидоз - весь-
ма распространенное среди людей белой расы тяжелое наследственное заболевание
легких, которое поражает, например, в семьях из Центральной Европы одного но-
ворожденного из 2500 и для которого установлен дефектный ген, кодирующий бе-
лок-регулятор трансмембранной проводимости. Основное проявление дефектного
гена - пневмония. Поражаются все эпителиальные клетки. Основная проблема -
как доставить ген в клетки, покрытые слизью, которая препятствует трансформа-
ции. Неповрежденную копию "гена заболевания", включенную в аденовирусный век-
тор или липосому, вводят в форме аэрозоля в дыхательные пути больного.
Для коррекции нарушения при прогрессирующей мышечной дистрофии Дюшенна (за-
болевании мальчиков, связанном с дефектами Х-хромосомы) нормальный ген, коди-
рующий белок дистрофии, пытались прямо вкалывать в мышечные волокна, исполь-
зуя либо "голую" ДНК, либо аденовирусный вектор. Другие исследователи транс-
плантировали больному миобласты после генетической коррекции. Ранее неподвиж-
ный ребенок приобретал способность двигаться! К сожалению, во всех этих опы-
тах удается получить только временный терапевтический эффект, и процедура
введения гена должна неоднократно повторяться.
Список наследственных заболеваний, которые пытаются или планируют лечить
генами, велик. Это и ревматоидный артрит, и фенилкетонурия, и заболевания,
связанные с недостатком гормонов (инсулина, эритропоэтина, гормона роста). В
случае хронической анемии, связанной с дефицитом эритропоэтина, на основании
опытов на животных предлагается принципиально новый подход к лечению. Так как
каждая из наших клеток содержит один и тот же геном, можно заставить фиброб-
ласты кожи, которые в норме не производят эритропоэтина, синтезировать этот
гормон. Для этого нужно ввести в геном новую контролирующую область и тем са-
мым снять запрет со считывания (экспрессии) гена эритропоэтина, присутствую-
щего, но "молчащего" в фибробластах.
Практически в любой области медицины либо начаты клинические испытания ле-
чения наследственных заболеваний с помощью генотерапии, либо в опытах на жи-
вотных разрабатываются подходы к такому лечению. По мере усовершенствования
методов доставки генов и контроля их экспрессии список заболеваний, к которым
можно применять генотерапию, будет безусловно расширяться.
Генотерапия применима не только к наследственным заболеваниям. Предстоит
решить проблему лечения генами "чумы XX века" — синдрома приобретенного имму-
нодефицита (СПИД), возникающего при заражении вирусом иммунодефицита человека
(ВИЧ). ВИЧ представляет собой ретровирус, поражающий Т-лимфоциты и макрофаги.
Болезнь удалось бы победить, если бы были найдены новые гены, введение кото-
рых в зараженные ВИЧ лимфоциты останавливало бы дальнейшее размножение виру-
са. Предложено множество хитроумных способов борьбы со СПИДом с помощью прив-
несенных генов. Все они основаны на новейших данных о строении и функциониро-
вании генома ретровируса. Например, вводя прямо в мышцы больного ретровирус-
ные векторы, несущие отдельные гены ВИЧ, ученые рассчитывали на то, что гены
ВИЧ после внедрения в ДНК хромосом хозяина смогут дать информацию для синтеза
вирусных белков и произойдет "противоСПИДная" иммунизация больного этими бел-
ками. Однако еще не получено ощутимых результатов, которые сулили бы успех в
борьбе с вирусом дикого типа, коварство которого заключается в его изменчиво-
сти .
Огромные перспективы открывает использование генотерапии для лечения онко-
логических заболеваний. Многолетние усилия ученых привели к пониманию того,
что рак — это генетическое заболевание и его развитие происходит многостадий-
но, в результате серии генетических нарушений, накапливающихся в клетке. Сле-
довательно, каждый из таких отдельных генетических эффектов может стать точ-
кой приложения генотерапевтического подхода.
Получение трансгенных животных
Если вводить ДНК в клетки многоклеточного организма, то результатом транс-
формации будет изменение свойств лишь небольшого числа клеток, которые приоб-
рели новый ген или гены. Следовательно, для изменения свойств всего организма
следует изменять геном половых клеток, которые перенесут новые свойства по-
томкам. У растений и животных целесообразно изменять такие свойства, как ско-
рость роста, устойчивость к заболеваниям, способность адаптироваться к новым
внешним условиям. В качестве маркеров в этом случае можно использовать поли-
морфизм длины рестрикционных фрагментов (AFLP), анализ мини-сателлитов, ана-
лиз микросателлитной ДНК (SSR), гибридизацию и т.д.
Разработаны способы введения генов в эмбриональные клетки млекопитающих,
мух и некоторых растений. От работы с довольно крупными яйцами амфибий пере-
шли к изучению яйцеклеток и эмбрионов мыши, которая представляет наиболее
изученное в генетическом отношении млекопитающее.
Микроинъекцию клонированных генов производят в один или оба пронуклеуса
только что оплодотворенной яйцеклетки мыши. Чаще выбирают мужской пронуклеус,
привнесенный сперматозоидом, так как его размеры больше. После инъекции яйце-
клетку немедленно имплантируют в яйцевод приемной матери, или дают возмож-
ность развиваться в культуре до стадии бластоцисты, после чего имплантируют в
матку.
Можно вводить ген в сперматозоиды и затем проводить ими оплодотворение. Та-
ким образом были инъецированы гены интерферона и инсулина человека, ген р-
глобина кролика, ген тимидинкиназы вируса простого герпеса и кДНК вируса лей-
кемии мышей. Число молекул, вводимое за одну инъекцию, колеблется от 100 до
300 000, а их размер - от 5 до 50 кб. Выживает обычно 10 - 30% яйцеклеток, а
доля мышей, родившихся из трансформированных яйцеклеток варьирует от несколь-
ких до 40%. Таким образом, реальная эффективность составляет около 10%.
Интеграция чужеродных генов неспецифична по отношению к хромосомам, а число
копий чужеродного гена может различаться от нескольких штук до 100 и более.
Эти гены образуют группу тандемных повторов, объединенных по типу "голова к
хвосту". Чужеродная ДНК после инъекции была обнаружена как в соматических,
так и в половых клетках. Это означает, что интеграция проходит на самых ран-
них стадиях развития зиготы.
В нескольких случаях гетерологичная ДНК наследовалась в трех поколениях мы-
шей, что свидетельствует о стабильной интеграции. Интегрировавшая в половые
клетки ДНК передается как менделевский ген. Установлено, что уровень экспрес-
сии чужеродного гена зависит от места интеграции ДНК с хромосомами и от сте-
пени ее метилирования, а также от дифференцировки тканей. В некоторых случаях
удалось получить тканеспецифическую экспрессию. Важно отметить что специфиче-
ские чужеродные гены можно встраивать в геном клетки таким образом, что они
подчиняются нормальным регуляторным сигналам.
В 1981 году Константный и Лэси (Оксфорд) провели инъекцию в яйцеклетки мыши
фрагменты хромосомной ДНК кролика длиной 19 килобаз. Эти фрагменты содержали
ген р-глобина кролика. Яйцеклетки культивировали до стадии бластоцисты и им-
плантировали в матку. У 24 мышей, родившихся в результате развития импланти-
рованных яйцеклеток, проведены частичная гепатоэктомия. Анализ ДНК из клеток
печени показал, что у 9 мышей встречается от 1 до 20 копий на клетку гена ₽-
глобина. После спаривания 4 трансформированных самцов с нормальными самками
получили потомство из 18 животных. 6 из них также имели ген р-глобина. Уста-
новлено, что интеграция гена в клетки млекопитающих происходит случайным об-
разом и не связана с конкретными областями хромосомы. Ген нестабилен, может
быть утрачен или стать неактивным. Вместе с геном необходимо вводить регуля-
торные последовательности.
Метод введения генов в эмбриональные клетки имеет ограничения. Не всегда
удается встроить чужеродную ДНК в заданный участок хромосомы. Разработанные
методические примы пока не позволяют заменить имеющийся в геноме ген, вытес-
няя его, не всегда удается подчинить новый ген системе регуляции организма.
При трансгенозе могут возникать неожиданные проблемы. Например, одни из
первых работ по генетической транформации животных проводились путем встраи-
вания генов гормона роста. Перенос гена гормона роста крысы мышам увеличивал
рост мышей в 2 раза. Эксперименты по трансгенозу генов гормона роста быка
кроликам также увенчались успехом. А вот аналогичные эксперименты по модифи-
кации крупного рогатого скота привели к увеличению прироста всего на 10-20%.
Очевидно, это связанно с тем, что у мышей сохраняется широкая норма реакции,
и встраивание генов, увеличивающих количество гормона, заставляет генотип
реализоваться максимально полно. У домашнего скота в результате направленной
селекции организмы работают на верхнем пределе нормы реакции, отсюда ожидае-
мый эффект не проявился.
В нашей стране получены свиньи, несущие ген соматотропина. Они не отлича-
лись по темпам роста от нормальных животных, но изменение обмена веществ ска-
залось на содержании жира. У таких животных ингибировались процессы липогене-
за и активировался синтез белка. К изменению обмена веществ приводило и
встраивание генов инсулиноподобного фактора. Такие трансгенные свиньи были
созданы для изучения цепочки биохимических превращений гормона, а побочным
эффектом явилось укрепление иммунной системы.
Самая мощная белоксинтезирующая система находится в клетках молочной желе-
зы. Если поставить гены чужих белков под контроль казеинового промотора, то
экспрессия этих генов будет мощной и стабильной, а белок будет накапливаться
в молоке (животное-ферментер). Уже получены трансгенные коровы, в молоке ко-
торых содержится человеческий белок лактоферрин. Этот белок планируют приме-
нять для профилактики гастроэнтерологических заболеваний у людей с низкой им-
мунорезистентностью. Это больные СПИДом, недоношенные младенцы, больные ра-
ком, прошедшие радиотерапию. Ведутся клинические испытания такого молока. Уже
сейчас корпорация Genzyme Transgenics планирует исследования с целью создания
трансгенного крупного рогатого скота, содержащего в молоке человеческий аль-
бумин. Был куплен патент на получение эмбрионов, содержащих геном клеток со-
единительной ткани (фибробластов), включающий ген, ответственный за синтез
человеческого белка. Подобная технология позволяет увеличить эффективность
создания трансгенных молочных животных, так как при обычном впрыскивании ге-
нов в оплодотворенную яйцеклетку рождается от только 5 - 10% трансформирован-
НЫХ ЖИВОТНЫХ, ИЗ них
несколько самцов, не дающих молока.
Использование новой технологии клонирования позволяет получать животных
только женского пола, дающих трансгенный протеин. Альбумин используется в те-
рапии для поддержания осмотического давления в крови. Ежегодно в мире требу-
ется около 440 тысяч литров плазмы крови для выделения этого белка (стоимость
около 1,5 млрд. $) . Каждая молочная корова может произвести 80 кг рекомби-
нантного человеческого альбумина ежегодно. Genzyme Transgenics занимается
разработкой аналогичных методов получения человеческого гормона роста и р-
интерферона.
В Англии созданы трансгенные овцы, молоко которых содержит фактор свертыва-
ния крови.
В нашей стране были попытки создать овец, продуцирующих химозин (фермент
для сыроварения) . Было получено 2 овцы, у одной - ген не экспрессировался, у
второй содержание химозина достигало 300 мг/л. Однако потомство этой овцы да-
вало низкие удои - порядка 50 кг за период лактации. Причина заключалась в
том, что химозин вырабатывается в виде предшественника - прохимозина, который
превращается в активный фермент при рН=5. Было запланировано получать именно
прохимозин, но в каких-то участках вымени происходило снижение pH, что приво-
дило к активации химозина непосредственно в организме. Активный химозин свер-
тывал молоко, а оно закупоривало протоки вымени. Сейчас пытаются решить эту
проблему.
В Подмосковье получены кролики, выделяющие у-интеРФеРон/ эритропоэтин, но
кролики не являются традиционными продуцентами молока. Эксперименты же по
трансформации сельскохозяйственных животных очень дорогостоящи - одно транс-
генное животное стоит десятки и сотни тысяч долларов.
Трансгенных животных получают и для целей ксенотрансплантации. Одним из из-
любленных доноров органов являются свиньи, так как имеется анатомическое
сходство органов и сходство иммунологических свойств. Реакции отторжения при
трансплантации имеют сложный механизм. Одним из сигналов для атаки организма
на чужой орган являются белки, локализованные на внешней поверхности мембра-
ны . У трансгенных свиней эти белки заменены на человеческие.
Еще одно направление трансгеноза - получение устойчивых к болезням живот-
ных. Животноводство держится на вакцинах, так как селекция ведется преимуще-
ственно на хозяйственно ценные признаки - шерстистость, молочность и т. д.
Повышение устойчивости - дело генных инженеров. К защитным белкам относятся
интерфероны, поэтому ген интерферона встраивали различным животным. Трансген-
ные мыши получили устойчивость, они не болели или болели мало, а вот у свиней
такого эффекта не обнаружено.
Другое направление - введение генов, кодирующих антисмысловую РНК. Для жи-
вотноводства острой проблемой являются лейкозы, вызываемые РНК-вирусами.
Трансгенные кролики, несущие гены, отвечающие за присутствие в клетке анти-
смысловой РНК, были устойчивы к лейкозам.
Трансгенных животных можно использовать для изучения наследственных заболе-
ваний мозга и нервной системы. Гены болезни Альцгеймера (отложение белка ₽-
амилоида приводит к образованию характерных бляшек) и гены, отвечающие за
развитие эпилепсии, болезней мозга вводятся в геном нормальных животных; при
этом получают трансгенных животных-моделей, на которых можно испытывать раз-
личные терапевтические приемы.
Трансгенных животных стали использовать для исследования воспалительных и
иммунологических заболеваний человека, например, ревматоидного артрита. Моде-
лируются болезни, связанные с липидным обменом.
ГЕННАЯ ИНЖЕНЕРИЯ РАСТЕНИЙ
Трансформация
растительного
генома
Генетическая конструкция, вводимая в растительную клетку обычно включает:
белок-кодирующую структурную последовательность, сигнальные элементы трансля-
ции и транскрипции, а также маркерные гены.
Наиболее важными из регуляторных последовательностей являются проксимальный
участок промотора, связывающий РНК-полимеразу; участок, кодирующий 5’-конец
мРНК, необходимый для связывания с рибосомой и инициации трансляции, и эука-
риотический сигнал полиаденилирования на 3’-конце мРНК. Среди эукариотических
организмов эти конститутивные сигнальные элементы оказались, к счастью, высо-
коконсервативными и достаточно универсальными, так что растительные клетки в
основном правильно экспрессируют чужеродные гены не только растений других
видов, но и млекопитающих, дрожжей и других эукариот.
Однако для генов бактериального происхождения необходима замена их консти-
тутивных сигнальных элементов на соответствующие эукариотические. Помимо это-
го, для лучшей экспрессии гена на уровне трансляции мРНК желательно прибли-
зить набор кодонов к типичному для растения. Обычно для этого посредством на-
правленных точечных мутаций заменяют "редкие" кодоны на синонимичные "час-
тые", что не сказывается на первичной структуре белка. В результате экспрес-
сия гена может быть усилена до 300 раз.
Иногда в структурной части генов прокариотического происхождения могут при-
сутствовать какие-либо нежелательные сигнальные последовательности, например,
узнаваемые на уровне мРНК ферментами сплайсинга или деградации, либо фермен-
тами модификации на уровне белка. Наличие таких скрытых ("криптических") сиг-
налов ведет к резкому снижению экспрессии гена в растении, поэтому их обычно
удаляют также путем точечных замен оснований.
Минимальный промотор, связывающий РНК-полимеразу, как правило, недостаточен
для обеспечения заметного, а тем более тканеспецифичного уровня транскрипции.
Для усиления экспрессии встроенного гена и придания ей заданных характеристик
используют полноразмерные промоторы, включающие энхансеры (усилители) и (или)
факторзависимые цис-элементы. Это приводит к тому, что подготовленный для
трансформации ген, как правило, является химерным, т.е. включает фрагменты
ДНК из одного вида, соединенные с фрагментами ДНК из другого вида.
Набор известных к настоящему дню промоторов достаточно разнообразен и по-
стоянно пополняется. Конститутивные промоторы применяются для наработки суще-
ственных количеств продукта гена во всем растении. Для двудольных растений
такими эффективными промоторами являются, например, 353-промотор вируса моза-
ичности цветной капусты (CaMV) и nos-промотор гена нопалин-синтазы агробакте-
рий; для однодольных - промоторы гена алкогольдегидрогеназы кукурузы (Adh) и
гена актина 1 риса (Act).
Помимо конститутивных, известно большое число специфических промоторов, ко-
торые активны лишь в отдельных органах, тканях или клетках, либо на отдельных
стадиях онтогенеза растения. Примером может служить промотор гена пататина
картофеля, работающий практически только в клубнях. Имеются также промоторы,
активность которых проявляется в листьях, корнях, меристемах и других местах
специфической локализации. Интенсивно изучаются и используются также индуци-
бельные промоторы, которые активируются лишь при определенных условиях: тем-
пературы, освещения, концентрации фитогормонов и т.д.
Многие из таких промоторов достаточно универсальны, например, некоторые
промоторы генов теплового шока. В частности, промотор гена hsp70 из дрозофилы
равно эффективен в клетках растений. Особый интерес представляют промоторы,
индуцируемые низкомолекулярными химическими эффекторами, часто не свойствен-
ными растениям. В зависимости от типа промотора, индукторами могут служить
тетрациклин, дексаметазон, бензотиадиазол, этанол, ионы меди и другие соеди-
нения. Эти промоторы очень важны для фундаментальных исследований трансгенных
растений, позволяя четко дифференцировать первичные и вторичные эффекты изу-
чаемого гена и тем самым прояснить его истинную биологическую функцию. Они
перспективны также для биотехнологии, так как позволяют вызвать экспрессию
гена в заданный период, когда она уже либо не препятствует нормальному росту
и развитию растения, либо не вызывает иных отрицательных последствий.
Регулируемые извне индуцибельные промоторы, контролирующие соответствующие
гены, могут способствовать одновременному прохождению растениями основных
стадий онтогенеза (переход к цветению, опадение листьев и др.), что важно для
практики сельского хозяйства. Есть промотор, индуцирующийся при механическом
стрессе (поранении) или при обработке растений элиситорами. Использование та-
кого промотора, соединенного с целевым геном, дает возможность выращивать
трансгенные растения как обычные вплоть до стадии уборки урожая, а далее
срезка растений индуцирует экспрессию целевого гена, продукт которого накап-
ливается в собранной биомассе.
Введение генов в
растительные клетки
Ввести чужеродную ДНК в растения можно различными способами.
Для двудольных растений существует естественный вектор для горизонтального
переноса генов: плазмиды агробактерий. Что касается однодольных, то, хотя в
последние годы достигнуты определенные успехи в их трансформации агробактери-
альными векторами, все же подобный путь трансформации встречает существенные
затруднения.
Для трансформации устойчивых ("рекальцитрантных") к агробактериям растений
разработаны приемы прямого физического переноса ДНК в клетку, многие из кото-
рых взяты из практики работы с клетками бактерий или животных. Эти методы
достаточно разнообразны, они включают: бомбардировку микрочастицами или бал-
листический метод; электропорацию; обработку полиэтиленгликолем; перенос ДНК
в составе липосом и др.
Наиболее продуктивным и чаще всего используемым является метод бомбардиров-
ки микрочастицами. При достаточной скорости эти частицы могут непосредственно
проникать в ядро, что сильно повышает эффективность трансформации. Этим же
методом можно, впрочем, трансформировать и другие ДНК-содержащие клеточные
органеллы - хлоропласты и митохондрии.
В последнее время был разработан и успешно применен также комбинированный
метод трансформации, названный агролистическим. При этом чужеродная ДНК вво-
дится в ткани каким-либо физическим методом, например, баллистическим. Вводи-
мая ДНК включает как Т-ДНК вектор с целевым и маркерным геном, так и агробак-
териальные гены вирулентности, поставленные под эукариотический промотор.
Временная экспрессия генов вирулентности в растительной клетке приводит к
синтезу белков, которые правильно вырезают Т-ДНК из плазмиды и встраивают ее
в хозяйский геном, как и при обычной агробактериальной трансформации.
После проведения тем или иным способом трансформации растительной ткани ее
помещают in vitro на специальную среду с фитогормонами, способствующую раз-
множению клеток. Среда обычно содержит селективный агент, в отношении которо-
го трансгенные, но не контрольные клетки приобретают устойчивость. Регенера-
ция чаще всего проходит через стадию каллуса, после чего при правильном под-
боре сред начинается органогенез (побегообразование). Сформированные побеги
переносят на среду укоренения, часто также содержащую селективный агент для
более строгого отбора трансгенных особей.
Экспрессия генетического
материала в трансгенных
растениях
При изучении экспрессии чужеродных генов в растительных клетках исследова-
тели столкнулись с рядом новых явлений. Выяснилось, что трансформированные
идентичной конструкцией ДНК трансгенные клоны, полученные параллельно в одном
и том же опыте, значительно различаются по уровню экспрессии введенного гена.
Показано, что уровень экспрессии зависит от многих факторов и в значительной
мере от того в какую область ядерного хроматина попал введенный ген.
Экспрессия трансгена, как правило, высока при его попадании в область ак-
тивного хроматина. Кроме того, оказалось, что при встраивании в ядерный геном
конструкция ДНК нередко претерпевает существенные изменения (перестройки, ду-
пликации, инверсии и т.д.), что также приводит в основном к снижению экспрес-
сии .
Было установлено также, что обычно применяемые процедуры трансформации во-
все не безразличны и для хозяйского генома.
Во-первых, встраивание трансгена может нарушить первичную структуру какого-
либо хозяйского гена и тем самым вызвать его инактивацию. Это событие, по-
видимому, не так редко, особенно с учетом того, что трансгены чаще встраива-
ются в транскрибируемые области хроматина (эухроматин). В последующих поколе-
ниях такой инактивированный ген может перейти в гомозиготное состояние, выра-
жаясь в непредусмотренной и обычно нежелательной фенотипической мутации.
Во-вторых, при агробактериальном или физическом переносе генов в раститель-
ный геном в последнем нередко отмечаются разного рода перестройки, вплоть до
транслокации фрагментов хромосом. Все это также может менять нормальное функ-
ционирование генома растения.
Еще одна важная проблема, которая открылась благодаря генетической инжене-
рии растений - это проблема замолкания генов (gene silencing). Было обнаруже-
но, что у достаточно заметной доли трансгенных растений интродуцированный ген
через какое-то время теряет свою активность, хотя физически сохраняется в ге-
номе. Таким образом, было установлено, что растение обладает способностью ак-
тивно противостоять экспрессии чужеродной ДНК.
Проблема замолкания генов имеет большое практическое значение, так как у
генетически трансформированных сельскохозяйственных культур трансгены должны
функционировать стабильно. За последние годы удалось выяснить механизмы и не-
которые условия, способствующие замолканию генов. Одним из основных факторов
является число идентичных копий гена, встроенных в геном: чем больше таких
копий и чем они протяженнее, тем больше вероятность замолкания генов. Откуда
следуют практические рекомендации генным инженерам: трансгенные культуры
должны содержать не более одного встроенного гена на гаплоидный геном; сиг-
нальные части трансгена (промоторы, терминаторы и др.) не должны иметь длин-
ных гомологий (более 100-300 п.о. ДНК) с участками хозяйского генома; фраг-
менты векторной плазмидной или вирусной ДНК должны быть по возможности полно-
стью удалены из конструкции перед трансформацией.
Уровень и стабильность экспрессии трансгенов в растении можно повысить при
специальном конструировании концов вводимой ДНК. Так, добавление терминаторов
транскрипции предотвращает нежелательное прохождение через трансген РНК-
полимеразы, если промотор хозяйского генома случайно оказывается поблизости
от места встраивания. При концевом добавлении сравнительно коротких (>300 п.
о.) участков связывания ядерного матрикса (МА.Р) трансген имеет больше шансов
образовать независимую петлю хроматина или включиться в состав транскрибируе-
мого эухроматина. В обоих случаях это приводит к повышению и стабилизации
уровня экспрессии трансгена.
В ряде случаев, особенно у злаков, введение интрона в район 5’-конца мРНК
целевого гена резко усиливает его транскрипцию. Помимо этого, в составе мРНК
обнаружены цис-элементы, определяющие степень ее стабильности в растительной
клетке. Правильный генно-инженерный дизайн таких элементов может также спо-
собствовать оптимальному накоплению мРНК в трансгенных растениях, предназна-
ченных для биотехнологического применения.
Стабильно введенный ген должен передаваться потомству при семенном размно-
жении, поэтому важно определить этот параметр на практике. Уровень транскрип-
ции введенного гена оценивается обычно с помощью традиционного Northern-
блотинга или недавно предложенных количественных версий RT PCR (на мРНК с по-
мощью обратной транскриптазы синтезируется комплементарная цепь ДНК, которая
и размножается в полимеразной цепной реакции). В ряде случаев экспрессию гена
проще и надежнее контролировать по конечному белковому продукту или тому эф-
фекту, который этот белок вызывает.
Однако необходимо использование разных методов для доказательства истинной
трансгенности данного растения, чтобы исключить "псевдотрансгенные" черты,
вызванные сомаклональной (эпигенетической) изменчивостью или неполной элими-
нацией агробактерий
Для изучения молекулярной конституции генома трансгенных организмов можно
использовать полиморфизм длины рестрикционных фрагментов. Метод основан на
том, что гомологичные последовательности ДНК гибридов и их родителей при раз-
резании рестриктазами могут попасть во фрагменты разной длины. В качестве
маркеров родительских геномов можно использовать и часто повторяющиеся после-
довательности ДНК. Повторяющиеся последовательности составляют значительную
часть генома типичного растения. Большая часть последовательностей повторяет-
ся до 1000 раз на геном. У многих растений выявлены еще более частые повторы
(100000 - 1000000 копий на геном), которые составляют до 20% генома. Они име-
ют отличный от остальной клеточной ДНК "Г-Ц" состав и в градиенте хлористого
цезия выявляются в виде сателлитного компонента. В геномах даже очень близких
видов амплифицируются разные типы повторов, поэтому они становятся своеобраз-
ными "отпечатками пальцев" близкородственных геномов. Высокотандемные после-
довательности ДНК относительно легко клонируются, так как после расщепления
рестриктазой, имеющей сайт узнавания в повторе, эти последовательности легко
выявляются в виде полос при электрофоретическом разделении фрагментов и могут
быть элюированы из геля в чистом виде. Их можно использовать в качестве зон-
дов . Использование высокоповторяющихся последовательностей в качестве молеку-
лярных зондов позволяет вести одновременный скрининг большого количества об-
разцов грубоочищенной ДНК регенерировавших после слияния протопластов расте-
ний или каллусов методом дот-гибридизации.
Как другой биохимический маркер при анализе соматических гибридов может ис-
пользоваться рибулозо-1,5-бифосфат карбоксилаза/оксигеназа. Причины: необы-
чайно высокое содержание его в листьях (до 50% растворимого белка), хорошо
разработанные методы выделения и анализа, а также то, что составляющие этот
белок субъединицы кодируются как ядерным (мол. масса 14 кД) , так и хлоропла-
стным (большая субъединица, мол. масса 55 кД) геномами.
Характеристика Ti- и Ri-плазмид
A. tumefaciens вызывает образование опухолей стебля двудольных растений -
так называемых корончатых галлов. Бактерии прикрепляются к клетками растения
в местах повреждений. Сайтами связывания на поверхности бактерий, видимо, яв-
ляются молекулы р-глюкана и О-антигенной цепи липополисахарида внешней мем-
браны.
Бактерии связываются с рецепторами высшего растения, состоящими из белка и
пектина; лектины в данном случае не имеют значения. Бактериальные сайты свя-
зывания и рецепторы растений являются констуитивными, т.е. оба партнера обла-
дают ими еще до момента взаимодействия. Первый шаг взаимодействия с растением
- узнавание - следует рассматривать как специфическую адгезию растений. Как
только бактерии прикрепились к поверхности клеток растения, они начинают об-
разовывать целлюлозные фибриллы. Эти фибриллы можно увидеть в сканирующем
электронном микроскопе уже через 90 минут после добавления бактерий к суспен-
зии культуры клеток ткани моркови. К 10 часам инкубации фибриллы формируют
сеть, покрывающую поверхность растительных клеток. Фибриллы служат более
прочному закреплению бактерий на поверхности хозяина. За целлюлозные фибриллы
могут зацепиться свободно плавающие клетки бактерий. Фиксируя их у поверхно-
сти растения, фибриллы увеличивают множественность заражения. В результате
размножения образуются скопления бактерий на поверхности растения.
Клеточная стенка растения повреждается вследствие выделения бактериями пек-
толитических ферментов, что обеспечивает плотный контакт бактерий с плазма-
леммой растительной клетки. Этот контакт необходим для передачи ДНК от бакте-
рий в растительную клетку. Передача ДНК происходит без нарушения целостности
мембраны растительной клетки, но требует определенного её состояния - компе-
тентности .
Способность A. tumefaciens индуцировать у растений образование опухолей ти-
па "корончатого галла" коррелирует с наличием у них Ti-плазмиды. Опухолевая
трансформация проявляется в гипертрофии возникающей после проникновения агро-
бактерий в пораненные участки (сайты) растений (рис. 47). Трансформация явля-
ется результатом стабильного ковалентного включения (инсерции или интеграции)
сегмента («transferred» или Т-ДНК) большой плазмиды (pTi - tumor inducing или
pRi — root inducing) бактерий в ядерную ДНК растительной клетки.
Другой вид агробактерий - A. rhizogenes, - вызывает заболевание, именуемое
"бородатый корень", при котором в зоне повреждения корня образуется масса но-
вых корешков. A. rubi обычно индуцируют неорганизованные опухоли (тератомы),
штаммы A. radiobacter авирулентны.
В отличие от большинства тканей взятых из нормальных растений, трансформи-
рованные ткани в культуре in vitro в асептических (стерильных) условиях спо-
собны неограниченно расти в отсутствие экзогенно добавленных ауксинов и цито-
кининов. Кроме того, трансформированные ткани часто синтезируют одну или бо-
лее групп соединений, названных опинами, которые обычно не обнаруживаются в
нетрансформированных растительных тканях.
Рис. 47. Генетическая колонизация растения A. tumefaciens:
1- агробактерии существуют в ризосфере;
2- строение A. tumefaciens;
3- встраивание Т-ДНК в геном;
4- образование опухоли.
Наиболее подробно изучены опухоли — корончатые галлы, индуцируемые
Agrobacterium tumefaciens. Они представляют собой истинно злокачественные
опухоли, которые могут расти в культуральной среде в отсутствие стимуляторов
роста — фитогормонов, необходимых для роста нормальных тканей.
Опухоли можно поддерживать в течение многих лет in vitro, и при их исполь-
зовании они способны вызывать опухоли у здоровых растений. В природных усло-
виях корончатые галлы образуются в месте соединения корня со стеблем (у кор-
невой шейки), откуда и произошло их название корончатый галл. Однако коронча-
тые галлы могут развиваться и на подземных частях растения, например, на кор-
нях плодовых деревьев, и на надземных, например, на стебле винограда.
В лаборатории эти заболевания можно вызвать у здоровых растений эксперимен-
тально , путем инфицирования их бактериями. Растения перед инокуляцией должны
быть поранены, при этом опухоли возникают в поврежденных сайтах растения,
обычно на стебле или листьях растения. Кроме целых растений в качестве тест-
объектов используются экспланты, например ломтики моркови и кусочки других
органов растений.
Ткани корончатых галлов содержат более высокие уровни ауксина и цитокини-
нов . Выявлено еще одно наследуемое изменение в клетках корончатых галлов —
это синтез опинов. Необычное для растений соединение, производное аргинина,
обнаруженное лишь в определенных опухолевых линиях, было названо октопином.
Затем было показано, что другими опухолевыми линиями синтезируется еще одно
соединение — нопалин, также производное аргинина. В зависимости от типа инду-
цируемого в опухоли опина штаммы A. tumefaciens и находящиеся в них Ti-
плазмиды получили соответствующее обозначение — октопиновые или нопалиновые.
Агробактерии, индуцирующие опухоли, в которых не обнаруживается ни нопалин,
ни октопин, ранее обозначались как штаммы нулевого типа. Позднее было показа-
но, что в опухолях нулевого типа синтезируются опины третьего класса — агро-
пины. Обнаружены также и другие типы опинов. Поскольку все опины обнаружива-
ются только в опухолевых клетках и отсутствуют в клетках нормальных растений
или клетках растительных опухолей других типов, то опины могут рассматривать-
ся как специфические биохимические маркеры для клеток корончатых галлов.
Опухоли, развивающиеся из одной или нескольких клеток, быстро разрастаются
в крупные образования, диаметр которых на определенных видах деревьев может
достигать одного метра. Типичная неорганизованная опухоль представляет собой
более или менее округлую дедифференцированную массу клеток (каллус), которая
может иметь гладкую или шероховатую поверхность, быть паренхиматозной или од-
ревесневшей. Иногда на периферии таких опухолей формируются листовидные
структуры (тератомы), иногда — придаточные корни. Нередко на зараженных рас-
тениях наблюдаются вторичные опухоли, значительно удаленные от первичных.
Обычно они обнаруживаются выше первичной опухоли, что предполагает движение
бактерий или трансформирующего агента в направлении транспирации.
Распространение Agrobacterium и других фитопатогенных бактерий по межклет-
никам и ксилеме является хорошо доказанным фактом. Агробактерии могут пере-
двигаться на большие дистанции со значительной скоростью. Очевидно, это не
является единственной причиной индукции вторичных опухолей. Организацию опу-
холей, а именно форму, величину и характер развития, определяют три фактора:
• штамм агробактерий,
генотип растения-хозяина,
• физиологическое состояние инфицируемых растительных клеток.
Agrobacterium имеет очень широкий круг растений-хозяев и может инфицировать
практически все двудольные растения. Долгое время считалось, что однодольные
растения не чувствительны к агробактериальной инфекции. В настоящее время по-
казано, что при соблюдении определенных условий агробактерии могут инфициро-
вать однодольные растения, в частности представителей таких семейств, как
Amaryllidaceae, Liliaceae, Gramineae, Iridaceae и некоторых других. Однако
существуют определенные вариации круга хозяев для различных штаммов
Agrobacterium: некоторые штаммы способны вызывать галлообразование на отдель-
ных видах растений, но не инфицируют другие. Различные сорта одного и того же
растения также могут иметь различную чувствительность к данному бактериально-
му штамму.
Невозможность заражения в природе обуславливается отсутствием соответствую-
щих рецепторов, необходимых для взаимодействия с бактериями. Другим фактором,
препятствующим инфицированию однодольных агробактериями, возможно, является
отсутствие в клетках растений низкомолекулярных индукторов вирулентности
Agrobacterium, например ацетосирингона, которые обычно присутствуют в клеточ-
ном соке при поранении двудольных растений.
Подробная информация о структуре плазмид Agrobacterium получена путем их
рестрикционного или физического картирования. В результате исследований обна-
ружено четыре основных области гомологии между октопиновой и нопалиновой
плазмидами. Две консервативные (области А и D) вовлечены в онкогенность, еще
одна (В) соответствует области контроля репликации плазмиды, в то время как
последняя (С) кодирует функции конъюгативного переноса (рис. 48) .
Таким образом, кроме Т-ДНК в плазмидах имеются область, кодирующая функцию
конъюгации (Тга), область репликации (Ori V) и область вирулентности (Vir).
Последовательности Ti-плазмиды, фланкирующие Т-ДНК (пограничные или концевые
области), играют важную роль в интеграции в растительный геном и содержат не-
совершенные прямые повторы по 24—25 п.н. Делеция левой границы Т-ДНК не влия-
ет на опухолеобразование, но удаление правой пограничной области приводит
практически к полной утрате вирулентности. Показано, что делеция правого по-
втора или его части приводит к потере способности Т-ДНК включаться в расти-
тельную ДНК.
Рис. 48. Структура Ti-плазмид нопалинового и октопинового типа
Учитывая важную роль концов Т-области в переносе Т-ДНК, можно предположить,
что любой сегмент ДНК, встроенный между этими концами, может быть перенесен в
растения как часть Т-ДНК. Плазмиды модифицируют таким образом, чтобы удалить
все онкогенные последовательности, так как они не принимают участие ни в пе-
реносе , ни в интеграции в геном клетки-хозяина. На место этих генов можно
встроить чужеродную ДНК, а плазмида теряет свои онкогенные свойства. Неонко-
генные Т-ДНК, присутствующие в растениях - регенерантах, передаются согласно
Законам Менделя.
Введение ДНК в
клетки растений
с помощью Ti- и Ri-плазмид
Разработаны два метода для введения Ti-плазмидных последовательностей, со-
держащих нужный ген, в растение.
Первый метод — метод «промежуточных векторов» (коинтегративных векторов) —
основан на использовании плазмиды кишечной палочки pBR 322 (рис. 49).
Интеграция Т ДНК
с новым геном
Рис. 4 9. Создание коинтегративного вектора на основе Ti -
плазмиды: Рр - расщепление рестриктазой
Т-ДНК вырезают из Ti-плазмиды с помощью рестриктаз и встраивают в плазмиду
pBR 322 для клонирования в Е. coli. Бактерии, содержащие плазмиду с Т-ДНК,
размножают, после чего эту плазмиду выделяют. Затем в клонированную Т-ДНК с
использованием рестриктаз встраивают нужный ген. Эту рекомбинантную молекулу,
содержащую Т-ДНК со встроенным в нее геном, снова размножают в большом коли-
честве, то есть клонируют в кишечной палочке. Затем с помощью конъюгации вво-
дят в клетки агробактерии, несущие полную Ti-плазмиду.
Между Т-сегментами нативной Ti-плазмиды и промежуточного вектора происходит
гомологичная рекомбинация. В результате этого Т-ДНК со встроенным геном вклю-
чается в нативную Ti-плазмиду, замещая нормальную ДНК. Получаются клетки А.
tumefaciens, несущие Ti-плазмиды со встроенными в Т-сегмент нужными генами.
Далее их перенос в клетки растения осуществляется обычным способом, характер-
ным для агробактерий.
Второй метод основан на создании системы бинарных (двойных) векторов.
Последние исследования показали, что для заражения и трансформации не нужна
целая Ti-плазмида, а достаточны только пограничные области Т-ДНК и один уча-
сток Ti-плазмиды, ответственный за вирулентность. Причем эти два участка ДНК
не обязательно должны находиться в одной и той же плазмиде. Если клетки агро-
бактерий содержат Ti-плазмиду с сегментом vir и другую плазмиду с Т-ДНК, эти
бактерии могут трансформировать клетки растений. При этом Т-ДНК с любыми
встроенными в нее генами интегрирует с геномом растения, для этого не нужна
гомологичная рекомбинация в бактериальных клетках. Для осуществления экспрес-
сии чужеродных генов, нужен специфический промотор из Т-ДНК, например, промо-
тор нопалинсинтетазы.
Показано, что он функционирует в клетках растений и может быть легко соеди-
нен с кодирующей последовательностью чужеродного гена в широко распространен-
ных субклонах Ti-плазмид. Другое преимущество данного промотора заключается в
том, что он функционирует в каллусах и в большинстве органов растений. Эффек-
тивность трансформации с помощью модифицированной Т-ДНК агробактерий превос-
ходит на сегодняшний день все другие способы переноса генов в растение.
О механизмах, с помощью которых агробактерия переносит Т-ДНК ядра растений,
известно очень мало: Т-сегменты ДНК октопиновых и нопалиновых плазмид встраи-
ваются в разные, по-видимому, случайные, точки хромосом хозяина, но при этом
они никогда не интегрируют с ДНК митохондрий и хлоропластов.
Для введения сконструированных Ti-плазмид в растительную клетку может быть
использовано несколько методов. Наиболее простой из них природный способ —
это инокуляция сконструированных штаммов в поврежденные (пораненные) области
растения.
Другой метод состоит в трансформации протопластов путем сокультивирования
их с агробактериями. Методика сокультивации может рассматриваться как индук-
ция опухолей в искусственных условиях: вирулентные агробактерии временно со-
вместно культивируются с протопластами. Если агробактерии добавляются к све-
жевыделенным или однодневным протопластам, не наблюдается ни присоединения
бактерий, ни трансформации. Существенным условием для трансформации является
наличие вновь образуемых клеточных стенок у 3-дневных протопластов. Это под-
тверждается применением ингибиторов образования клеточной стенки, которые ин-
гибируют и присоединение бактерий. После периода сокультивации (более суток),
в течение которого наступает агрегация протопластов с бактериями, свободные
бактерии удаляются повторным отмыванием. Далее растительные клетки культиви-
руются на среде с добавлением гормонов, а через 3—4 недели небольшие колонии
высеваются на безгормональную среду. На этой среде выживают только колонии
трансформированных клеток.
Так были получены трансформированные растения-регенеранты табака и петунии.
Этот метод дает возможность существенно расширить круг хозяев агробактерий,
включая виды семейства злаковых. Эффективность кокультивирования может быть
повышена применением индукторов слияния клеток (ПЭГ, кальций и др.).
Трансформация протопластов может быть проведена также сокультивированием их
непосредственно с Ti-плазмидами, такие опыты были проведены с протопластами
петунии, табака. Очень низкая эффективность включения Т-ДНК в протопласты,
наблюдавшаяся в первых экспериментах, была затем увеличена благодаря химиче-
ской стимуляции (ПЭГ). Из трансформированных клеток были получены трансгенные
растения. Преимуществом этого метода является то, что отпадает необходимость
в промежуточных векторах.
Достижения генной
инженерии растений
Первые трансгенные растения (растения табака со встроенными генами из мик-
роорганизмов) были получены в 1983 г. Первые успешные полевые испытания
трансгенных растений (устойчивые к вирусной инфекции растения табака) были
проведены в США уже в 1986 г.
После прохождения всех необходимых тестов на токсичность, аллергенность,
мутагенность и т. д. первые трансгенные продукты появились в продаже в США в
1994 г. Это были томаты Flavr Savr с замедленным созреванием, созданные фир-
мой "Calgen", а также гербицид-устойчивая соя компании "Monsanto". Уже через
1-2 года биотехнологические фирмы поставили на рынок целый ряд генетически
измененных растений: томатов, кукурузы, картофеля, табака, сои, рапса, кабач-
ков , редиса, хлопчатника.
В настоящее время получением и испытанием генетически модифицированных рас-
тений занимаются сотни коммерческих фирм во всем мире с совокупным капиталом
более ста миллиардов долларов. В 1999 г. трансгенные растения были высажены
на общей площади порядка 40 млн. га, что превышает размеры такой страны, как
Великобритания. В США генетически модифицированные растения (GM Crops) со-
ставляют сейчас около 50% посевов кукурузы и сои и более 30-40% посевов хлоп-
чатника. Это говорит о том, что генно-инженерная биотехнология растений уже
стала важной отраслью производства продовольствия и других полезных продук-
тов , привлекающей значительные людские ресурсы и финансовые потоки. В ближай-
шие годы ожидается дальнейшее быстрое увеличение площадей, занятых трансген-
ными формами культурных растений.
Первая волна трансгенных растений, допущенных для практического применения,
содержала дополнительные гены устойчивости (к болезням, гербицидам, вредите-
лям, порче при хранении, стрессам).
Нынешний этап развития генетической инженерии растений получил название
"метаболическая инженерия". При этом ставится задача не столько улучшить те
или иные имеющиеся качества растения, как при традиционной селекции, сколько
научить растение производить совершенно новые соединения, используемые в ме-
дицине , химическом производстве и других областях. Этими соединениями могут
быть, например, особые жирные кислоты, полезные белки с высоким содержанием
незаменимых аминокислот, модифицированные полисахариды, съедобные вакцины,
антитела, интерфероны и другие "лекарственные" белки, новые полимеры, не за-
соряющие окружающую среду и многое, многое другое. Использование трансгенных
растений позволяет наладить масштабное и дешевое производство таких веществ и
тем самым сделать их более доступными для широкого потребления.
Улучшение качества запасных белков
Запасные белки основных культурных видов кодируются семейством близкородст-
венных генов. Накопление запасных белков семян - сложный биосинтетический
процесс. Первая генно-инженерная попытка улучшения свойства одного растения
путем введения гена запасного белка от другого была, проведена Д. Кемпом и Т.
Холлом в 1983 г. в США. Ген фазеолина бобов с помощью Ti-плазмиды был перене-
сен в геном подсолнечника. Результатом этого опыта было лишь химерное расте-
ние , получившее название санбин. В клетках подсолнечника были обнаружены им-
мунологически родственные фазеолиновые полипептиды, что подтверждало факт пе-
реноса гена между растениями, относящимися к различным семействам
Позднее ген фазеолина был передан клеткам табака: в растениях-регенерантах
ген экспрессировался во всех тканях, хотя и в малых количествах. Неспецифиче-
ская экспрессия фазеолинового гена, так же как и в случае переноса его в
клетки подсолнечника, сильно отличается от экспрессии этого гена в зрелых се-
мядолях бобов, где фазеолин составлял 25—50% от общего белка. Этот факт ука-
зывает на необходимость сохранения и других регуляторных сигналов этого гена
при конструировании химерных растений и на важность контроля экспрессии генов
в процессе онтогенеза растений.
Ген, кодирующий запасной белок кукурузы - зеин, после интеграции его в Т-
ДНК был перенесен в геном подсолнечника следующим образом. Штаммы агробакте-
рий, содержащие Ti-плазмиды с геном зеина, использовали для индукции опухолей
в стеблях подсолнечника. Некоторые из полученных опухолей содержали мРНК,
синтезируемые с генов кукурузы, что дает основание рассматривать эти резуль-
таты как первое доказательство транскрипции гена однодольного растения в дву-
дольном. Однако присутствие зеинового белка в тканях подсолнечника не обнару-
жилось .
Более реальной задачей для генетической инженерии считается улучшение ами-
нокислотного состава белков. Как известно, в запасном белке большинства зла-
ковых наблюдается дефицит лизина, треонина, триптофана, у бобовых — метионина
и цистеина. Введение в эти белки дополнительных количеств дефицитных амино-
кислот могло бы ликвидировать аминокислотный дисбаланс. Методами традиционной
селекции удалось существенно повысить содержание лизина в запасных белках
злаковых. Во всех этих случаях часть проламинов (спирторастворимые запасные
белки злаковых) заменялась другими белками, содержащими много лизина. Однако
у таких растении уменьшались размеры зерна и снижалась урожайность. По-
видимому, проламины необходимы для формирования нормального зерна, и их заме-
на другими белками отрицательно влияет на урожайность. Учитывая это обстоя-
тельство, для улучшения качества запасного белка зерновых нужен такой белок,
который не только отличался бы высоким содержанием лизина и треонина, но и
мог полноценно заменить определенную часть проламинов при формировании зерна.
Растения могут производить и белки животного происхождения. Так, встраива-
ние в геном растений Arabidopsis thaliana и Brassica napus химерного гена,
состоящего из части гена запасного 25-белка арабидопсиса и кодирующей части
для нейропептида — энкефалина, приводило к синтезу химерного белка до 200 нг
на 1 г семени. Два структурных белковых домена были связаны последовательно-
стью, узнаваемой трипсином, что давало возможность в дальнейшем легко изоли-
ровать чистый энкефалин.
В другом эксперименте удалось после скрещивания трансгенных растений, в од-
ном из которых был встроен ген гамма-субъединицы, а во втором - ген каппа-
субъединицы иммуноглобулина, получить у потомства экспрессию обеих цепей. В
результате растение формировало антитела, составляющие до 1,3% суммарного
белка листьев. Также было показано, что в растениях табака могут собираться
полностью функциональные секреторные моноклональные иммуноглобулины. Секре-
торные иммуноглобулины обычно выделяются в ротовую полость и желудок человека
и животных и служат первым барьером на пути кишечных инфекций. В упомянутой
выше работе получили продукцию в растениях моноклональных антител, которые
были специфичны для Streptococcus mutans - бактерий, вызывающих зубной кари-
ес. Предполагается, что на основе таких моноклональных антител, продуцируемых
трансгенными растениями, удастся создать действительно антикариесную зубную
пасту. Из других белков животного происхождения, которые представляют интерес
для медицины, показана продукция в растениях человеческого р-интерферона.
Разработаны также подходы, позволяющие получать бактериальные антигены в
растениях и использовать их в качестве вакцин. Получен картофель, экспресси-
рующий олигомеры нетоксичной субъединицы р-токсина холеры. Эти трансгенные
растения могут быть использованы для получения дешевой вакцины от холеры.
Жиры
Важнейшим сырьем для получения разного рода химических веществ являются
жирные кислоты — основной компонент растительного масла. По своей структуре
это углеродные цепи, которые обладают различными физико-химическими свойства-
ми в зависимости от своей длины и степени насыщения углеродных связей. В 1995
году была закончена экспериментальная проверка и получено разрешение от феде-
ральных властей США на выращивание и коммерческое использование трансгенных
растений рапса с измененным составом растительного масла, включающего вместе
с обычными 16- и 18-членными жирными кислотами также и до 45% 12-членной жир-
ной кислоты - лаурата. Это вещество широко используется для производства сти-
ральных порошков, шампуней, косметики.
Экспериментальная работа заключалась в том, что был клонирован ген специфи-
ческой тиоэстеразы из растения Umbellularia califomica, где содержание лаура-
та в жире семян достигало 70%. Структурная часть гена этого фермента под кон-
тролем промотора-терминатора гена белка, специфического для ранней стадии се-
мяобразования, была встроена в геном рапса и арабидопсиса, что и привело к
увеличению содержания лаурата в масле этих растений.
Из других проектов, связанных с изменением состава жирных кислот, можно
упомянуть работы, ставящие целью повышение или снижение содержания ненасыщен-
ных жирных кислот в растительном масле. Интересными представляются экспери-
менты с петрозелиновой кислотой — изомером олеиновой кислоты, где двойная
связь находится за шестым углеродным членом. Эта жирная кислота входит в со-
став масла кориандра и определяет его более высокую температуру плавления
(33°С), в то время как при наличии олеиновой кислоты температура плавления
составляет только 12°C. Предполагается, что после переноса генов, определяю-
щих синтез петрозелиновой кислоты, в растения - продуценты растительного мас-
ла удастся производить диетический маргарин, содержащий ненасыщенную жирную
кислоту. Кроме того, из петрозелиновой кислоты очень легко получать лаурат
путем окисления озоном. Дальнейшее изучение специфики биохимического синтеза
жирных кислот, по-видимому, приведет к возможности управлять этим синтезом с
целью получения жирных кислот различной длины и различной степени насыщения,
что позволит значительно изменить производство детергентов, косметики, конди-
терских изделий, затвердителей, смазочных материалов, лекарств, полимеров,
дизельного топлива и многого другого, что связано с использованием углеводо-
родного сырья.
Полисахариды
Проводится работа по созданию трансгенных растений картофеля и других крах-
малнакапливающих культур, в которых это вещество будет находиться в основном
в виде амилопектина, то есть разветвленной форме крахмала, или же в основном
только в виде амилозы, то есть линейных форм крахмала. Раствор амилопектина в
воде более жидкий и прозрачный, чем у амилозы, которая при взаимодействии с
водой образует ригидный гель. Так, например, крахмал, состоящий в основном из
амилопектина, по-видимому, будет иметь спрос на рынке производителей различ-
ных питательных смесей, где сейчас в качестве наполнителя используется моди-
фицированный крахмал. Генетической модификации могут подвергаться также гено-
мы пластид и митохондрий. Такие системы позволяют значительно увеличить со-
держание продукта в трансгенном материале.
Создание гербицидоустойчивых растений
В новых, интенсивных сельскохозяйственных технологиях гербициды применяются
очень широко. Это связано с тем, что на смену прежним экологически опасным
гербицидам широкого спектра действия, обладающим токсичностью для млекопитаю-
щих и длительно сохраняющимся во внешней среде, приходят новые, более совер-
шенные и безопасные соединения. Однако они обладают недостатком — подавляют
рост не только сорняков, но и культурных растений. Такие высокоэффективные
гербициды, как, глифосат, атразины интенсивно изучаются на предмет выявления
механизма толерантности к ним некоторых сорняков. Так, на полях, где широко
используют атразин, довольно часто появляются атразинустойчивые биотипы у
многих видов растении.
Изучение механизма устойчивости к гербицидам с целью получения методами ге-
нетической инженерии культурных растений, обладающих этим признаком, включает
следующие этапы: выявление биохимических мишеней действия гербицидов в расти-
тельной клетке: отбор устойчивых к данному гербициду организмов в качестве
источников генов устойчивости: клонирование этих генов: введение их в куль-
турные растения и изучение их функционирования
Существуют четыре принципиально различных механизма, которые могут обеспе-
чивать устойчивость к тем или иным химическим соединениям, включая гербициды:
транспортный, элиминирующий, регуляционный и контактный. Транспортный меха-
низм устойчивости заключается в невозможности проникновения гербицида в клет-
ку. При действии элиминирующего механизма устойчивости вещества, попавшие
внутрь клетки, могут разрушаться с помощью индуцируемых клеточных факторов,
чаще всего деградирующих ферментов, а также подвергаться тому или иному виду
модификации, образуя неактивные безвредные для клетки продукты. При регуляци-
онной резистентности белок или фермент клетки, инактивирующийся под действием
гербицида, начинает усиленно синтезироваться, ликвидируя, таким образом, де-
фицит нужного метаболита в клетке. Контактный механизм устойчивости обеспечи-
вается изменением структуры мишени (белок или фермент), взаимодействием с ко-
торым связано повреждающее действие гербицида
Установлено, что признак гербицидоустойчивости является моногенным, то есть
признак детерминируется чаще всего одним-единственным геном. Это очень облег-
чает возможность использования технологии рекомбинантной ДНК для передачи
этого признака. Гены, кодирующие те или иные ферменты деструкции и модифика-
ции гербицидов, могут быть с успехом использованы для создания гербицидо-
устойчивых растении методами генетической инженерии.
Традиционные методы селекции создания сортов, устойчивых к гербицидам,
очень, длительны и малорезультативны. Наиболее широко применяемый за рубежом
гербицид глифосат (коммерческое название Roundup) подавляет синтез важнейших
ароматических аминокислот, воздействуя на фермент 5-енолпирувилшикимат-З-
фосфатсинтазу (ЕПШФ-синтаЗа). Известные случаи устойчивости к этому гербициду
связаны либо с повышением уровня синтеза этого фермента (регуляционный меха-
низм) , либо с возникновением мутантного фермента, нечувствительного к глифос-
фату (контактный механизм). Из устойчивых к глифосфату растений был выделен
ген ЕПШФ-синтаЗы и поставлен под промотор вируса мозаики цветной капусты. С
помощью Ti-плазмиды эта генетическая конструкция была введена в клетки пету-
нии . При наличии одной копии гена в регенерированных из трансформированных
клеток растениях синтезировалось фермента в 20 - 40 раз больше, чем в исход-
ных растениях, но устойчивость к глифосфату увеличилась только в 10 раз.
К числу наиболее распространенных гербицидов, используемых при обработке
зерновых культур, относится атразин. Он подавляет фотосинтез, связываясь с
одним из белков фотосистемы II и прекращая транспорт электронов. Устойчивость
к гербициду возникает в результате точечных мутаций в этом пластохинон связы-
вающем белке (замена серина на глицин), вследствие чего он теряет способность
взаимодействовать с гербицидом. В ряде случаев удалось осуществить перенос
гена мутантного белка в чувствительные к атразину растения с помощью Ti-
плазмиды. Интегрированный в хромосому растений ген устойчивости был снабжен
сигнальной последовательностью, которая обеспечивала транспорт синтезируемого
белка в хлоропласты. Химерные растения проявляли значительную устойчивость к
таким концентрациям атразина, которые вызывали гибель контрольных растений с
геном белка дикого типа. Некоторые растения способны инактивировать атразин
путем отщепления остатка хлора ферментом глутатион-Б-трансфераза. Этот же
фермент инактивирует и другие родственные гербициды триазинового ряда (пропа-
зин , симазин и др.).
Существуют растения, естественная устойчивость которых к гербицидам основа-
на на детоксикации. Так, устойчивость растений к хлорсульфурону может быть
связана с дезактивацией молекулы гербицида путем его гидроксилирования и по-
следующего гликозилирования введенной гидроксильной группы. Создание расте-
ний, устойчивых к патогенам и вредителям Устойчивость растений к тем или иным
патогенам чаще всего является сложным мультигенным признаком.
Одновременная передача нескольких локусов трудна даже методами генной инже-
нерии, не говоря о классических методах селекции. Более простым является дру-
гой путь. Известно, что у устойчивых растений при атаке патогенов изменяется
метаболизм. Накапливаются такие соединения, как Н2Ог, салициловая кислота,
фитоаллексины. Повышенный уровень этих соединений способствует противостоянию
растения в борьбе с патогенами.
Вот один из примеров, доказывающий роль салициловой кислоты в иммунном от-
вете растений. Трансгенные растения табака, которые содержат бактериальный
ген, контролирующий синтез салицилат гидролазы (этот фермент разрушает сали-
циловую кислоту), были неспособны к иммунному ответу. Поэтому изменение ген-
но-инженерным путем уровня салициловой кислоты или выработки в растениях в
ответ на патоген Н2О2 может быть перспективным для создания устойчивых транс-
генных растений.
В фитовирусологии широко известен феномен индуцированной перекрестной ус-
тойчивости растений к вирусным инфекциям. Сущность этого явления состоит в
том, что заражение растения одним штаммом вируса предотвращает последующую
инфекцию этих растений другим вирусным штаммом. Молекулярный механизм подав-
ления вирусной инфекции пока неясен. Показано, что для иммунизации растений
достаточно введения отдельных вирусных генов, например генов капсидных бел-
ков. Так, ген белка оболочки вируса табачной мозаики перенесли в клетки таба-
ка и получили трансгенные растения, у которых 0,1% всех белков листьев был
представлен вирусным белком. Значительная часть этих растений при инфицирова-
нии вирусом не проявляла никаких симптомов заболевания. Возможно, что синте-
зирующийся в клетках белок оболочки вируса мешает вирусной РНК нормально
функционировать и формировать полноценные вирусные частицы. Установлено, что
экспрессия капсидного белка вируса табачной мозаики, вируса мозаики люцерны,
вируса огуречной мозаики, Х-вируса картофеля в соответствующих трансгенных
растениях (табак, томаты, картофель, огурцы, перцы) обеспечивает высокий уро-
вень их защиты от последующей вирусной инфекции. Причем у трансформированных
растений не отмечалось снижения фертильности, нежелательного изменения росто-
вых и физиологических характеристик исходных экземпляров и их потомства. По-
лагают , что индуцированная устойчивость растений к вирусам обусловлена особым
антивирусным белком, очень похожим на интерферон животных. Представляется
возможным методом генетической инженерии усилить экспрессию гена, кодирующего
этот белок, путем его амплификации или подстановки под более сильный промо-
тор .
Следует отметить, что использование генетической инженерии для защиты рас-
тений от различных патогенных микроорганизмов в значительной мере сдерживает-
ся недостаточностью знаний о механизмах защитных реакций растений. Для борьбы
с насекомыми-вредителями в растениеводстве используются химические средства —
инсектициды. Однако они оказывают вредное влияние на млекопитающих, убивают и
полезных насекомых, загрязняют окружающую среду, дороги, и, кроме того, насе-
комые довольно скоро приспосабливаются к ним. Известно более 400 видов насе-
комых, устойчивых к используемым инсектицидам. Поэтому все большее внимание
привлекают биологические средства борьбы, обеспечивающие строгую избиратель-
ность действия и отсутствие адаптации вредителей к применяемому биопестициду.
Уже довольно давно известна бактерия Bacillus thuringiensis, продуцирующая
белок, являющийся очень токсичным для многих видов насекомых, в то же время
безопасный для млекопитающих. Белок (дельта-эндотоксин, CRY-белок) продуциру-
ется различными штаммами В. thuringiensis. Взаимодействие токсина с рецепто-
рами строго специфично, что усложняет подбор комбинации токсин—насекомое. В
природе найдено большое количество штаммов В. thuringiensis, чьи токсины дей-
ствуют только на определенные виды насекомых. Препараты В. thuringiensis в
течение десятилетий использовали для контроля насекомых на полях. Безопас-
ность токсина и его составных белков для человека и других млекопитающих пол-
ностью доказана. Встраивание гена этого белка в геном растений дает возмож-
ность получить трансгенные растения, не поедаемые насекомыми.
Кроме видоспецифичности по действию на насекомых встраивание прокариотиче-
ских генов дельта-токсинов в геном растений даже под контролем сильных эука-
риотических промоторов не привело к высокому уровню экспрессии. Предположи-
тельно такое явление возникло в связи с тем, что эти бактериальные гены со-
держат значительно больше адениновых и тиминовых нуклеотидных оснований, чем
растительная ДНК. Эта проблема была решена путем создания модифицированных
генов, где из природного гена вырезали и добавляли те или иные фрагменты с
сохранением доменов, кодирующих активные части дельта-токсина. Так, например,
с помощью таких подходов был получен картофель, устойчивый к колорадскому жу-
ку. Получены трансгенные растения табака, способные синтезировать токсин. Та-
кие растения были нечувствительны к гусеницам Manduca sexta. Последние поги-
бали в течение 3 суток контакта с токсинпродуцирующими растениями. Токсинооб-
разование и обусловленная им устойчивость к насекомым передавалась по наслед-
ству как доминантный признак.
В настоящее время так называемые Bt-растения (от В. thuringiensis) хлопка и
кукурузы занимают основную долю в общем объеме генетически модифицированных
растений этих культур, которые выращивают на полях США.
В связи с возможностями генной инженерии конструировать энтомопатогенные
растения на основе токсина микробного происхождения еще больший интерес к се-
бе вызывают токсины растительного происхождения. Фитотоксины являются ингиби-
торами белкового синтеза и осуществляют защитную функцию, направленную против
насекомых-вредителей микроорганизмов и вирусов. Лучше всех среди них изучен
рицин, синтезируемый в клещевине: его ген клонирован и установлена нуклеотид-
ная последовательность. Однако высокая токсичность рицина для млекопитающих
ограничивает генно-инженерные работы с ним только техническими культурами, не
используемыми в пищу человека и на корм животным. Токсин, вырабатываемый фи-
толаккой американской, эффективен против вирусов и безвреден для животных.
Механизм его действия заключается в инактивации собственных рибосом при про-
никновении в клетки различного рода патогенов, в том числе фитовирусов. Пора-
женные клетки некротизируются, предотвращая размножение патогена и его рас-
пространение по растению. В настоящее время проводятся исследования по изуче-
нию гена этого белка и передаче его в другие растения.
Вирусные болезни широко распространены среди насекомых, поэтому для борьбы
с насекомыми-вредителями можно использовать природные вирусы насекомых, пре-
параты которых называют вирусными пестицидами. В отличие от ядохимикатов они
обладают узким спектром действия, не убивают полезных насекомых, они быстро
разрушаются во внешней среде и не опасны для растений и животных. Наряду с
вирусами насекомых используются как биопестициды некоторые грибы, поражающие
насекомых-вредителей. Применяемые сейчас биопестициды являются природными
штаммами энтомопатогенных вирусов и грибов, однако не исключена возможность
создания в будущем методами генетической инженерии новых эффективных биопес-
тицидов .
Повышение устойчивости растений к стрессовым условиям
Растения очень часто подвергаются воздействию различных неблагоприятных
факторов окружающей среды: высокие и низкие температуры, недостаток влаги,
засоление почв и загазованность среды, недостаток или, напротив, избыток не-
которых минеральных веществ и т. д. Этих факторов множество, поэтому и спосо-
бы защиты от них многообразны — от физиологических свойств до структурных
приспособлений, позволяющих преодолевать их пагубное действие.
Устойчивость растений к тому или иному стрессовому фактору является резуль-
татом воздействия множества разных генов, поэтому говорить о полной передаче
признаков толерантности от одного вида растения другому генно-инженерными ме-
тодами не приходится. Тем не менее у генетической инженерии имеются опреде-
ленные возможности для повышения устойчивости растений. Это касается работы с
отдельными генами, контролирующими метаболические ответы растений на стрессо-
вые условия, например сверхпродукцию пролина в ответ на осмотический шок, на
действие засоления, синтез особых белков в ответ на тепловой шок и т. д.
Дальнейшее углубленное изучение физиологической, биохимической и генетической
основы ответной реакции растения на условия среды, несомненно, позволит при-
менять методы генетической инженерии для конструирования устойчивых растений.
Пока можно отметить лишь косвенный подход для получения морозоустойчивых
растений, основанный на генно-инженерных манипуляциях с Pseudomonas syringae.
Этот микроорганизм, сосуществующий с растениями, способствует их повреждению
ранними заморозками. Механизм явления связан с тем, что клетки микроорганизма
синтезируют особый белок, локализующийся во внешней мембране и являющийся
центром кристаллизации льда. Известно, что формирование льда в воде зависит
от веществ, могущих служить центрами образования льда. Белок, вызывающий фор-
мирование кристаллов льда в различных частях растения (листья, стебли, кор-
ни) , является одним из главных факторов, ответственных за повреждение тканей
растений, чувствительных к ранним заморозкам. Многочисленные эксперименты в
строго контролируемых условиях показали, что стерильные растения не поврежда-
лись заморозками вплоть до —6—8°С, тогда как у растений, имеющих соответст-
вующую микрофлору, повреждения возникали уже при температурах —1,5—2 ° С. Му-
танты этих бактерий, потерявшие способность синтезировать белок, вызывающий
формирование кристаллов льда, не повышали температуру образования льда, и
растения с такой микрофлорой были устойчивы к заморозкам. Штамм таких бакте-
рий, распыленный над клубнями картофеля, конкурировал с обычными бактериями,
что приводило к повышению морозоустойчивости растений. Возможно, такие бакте-
рии, созданные с помощью методов генной инженерии и используемые в качестве
компонента внешней среды, будут служить для борьбы с заморозками.
Повышение эффективности биологической азотфиксации
Хорошо изучен фермент ответственный за восстановление молекулярного азота
до аммония — нитрогеназа. Структура нитрогеназы одинакова у всех азотфикси-
рующих организмов. При фиксации азота непременным физиологическим условием
является защита нитрогеназы от разрушения под действием кислорода. Лучше всех
среди азотфиксаторов изучены ризобии, образующие симбиоз с бобовыми растения-
ми, и свободноживущая бактерия Klebsiella pneumoniae. Установлено, что у этих
бактерий за фиксацию азота ответственно 17 генов — так называемых nif-генов.
Все эти гены сцеплены друг с другом и расположены в хромосоме между генами
ферментов биосинтеза гистидина и генами, определяющими усвоение шикимовой ки-
слоты. У быстрорастущей ризобии nif-гены существуют в форме мегаплазмиды, со-
держащей 200—300 тысяч пар нуклеотидов.
Среди генов азотфиксации выявлены гены, контролирующие структуру нитрогена-
зы, белковый фактор, принимающий участие в транспорте электронов, регулятор-
ные гены. Регуляция генов азотфиксации довольно сложна, поэтому генно-
инженерный перенос азотфиксирующей функции от бактерий непосредственно высшим
растениям в настоящее время уже не обсуждается. Как показали эксперименты,
даже в самом простом эукариотическом организме — дрожжах не удалось добиться
экспрессии nif-генов, хотя они и сохранялись в течение 50 генераций.
Эти опыты показали, что диазотрофность (азот-фиксация) свойственна исключи-
тельно прокариотическим организмам, и nif-гены не смогли преодолеть барьер,
разделяющий прокариоты и эукариоты, из-за слишком сложной своей структуры и
регуляции генами, расположенными вне nif-области. Возможно, более удачным
окажется перенос nif-генов с помощью Ti-плазмид в хлоропласты, поскольку ме-
ханизмы экспрессии генов в хлоропластах и в клетках прокариот близки. В любом
случае нитрогеназа должна быть защищена от ингибирующего действия кислорода.
Кроме того, фиксация атмосферного азота — очень энергоемкий процесс. Вряд ли
растение под влиянием nif-генов может так кардинально изменить свой метабо-
лизм, чтобы создать все эти условия. Хотя не исключено, что в будущем метода-
ми генетической инженерии можно будет создать более экономно работающий нит-
рогеназный комплекс.
Более реально использование генноинженерных методов для решения следующих
задач: повышение способности ризобии колонизировать бобовые растения, повыше-
ние эффективности фиксации и ассимиляции азота путем воздействия на генетиче-
ский механизм, создание новых азотфиксирующих микроорганизмов путем введения
в них nif-генов, передача способности к симбиозу от бобовых растений к дру-
гим.
Первостепенной задачей генетической инженерии для повышения эффективности
биологической фиксации азота является создание штаммов ризобии с усиленной
азотфиксацией и колонизирующей способностью. Колонизация бобовых растений ри-
зобиями протекает очень медленно, лишь единичные из них дают начало клубень-
кам. Это происходит потому, что местом инвазии ризобии является только одна
небольшая область между точкой роста корня и ближайшим к ней корневым волос-
ком, находящимся на стадии формирования. Все остальные части корня и развив-
шиеся корневые волоски растения нечувствительны к колонизации. В ряде случаев
сформировавшиеся клубеньки оказываются неспособными фиксировать азот, что за-
висит от многих растительных генов (выявлено не менее пяти), в частности от
неблагоприятного сочетания двух рецессивных генов.
Традиционными методами генетики и селекции удалось получить лабораторные
штаммы ризобий с более высокой колонизирующей способностью. Но они в полевых
условиях испытывают конкуренцию со стороны местных штаммов. Повышение их кон-
курентоспособности , видимо, можно осуществить генноинженерными методами. По-
вышение эффективности процесса азотфиксации возможно применением генноинже-
нерных приемов, основанных на увеличении копий гена, усилении транскрипции
тех генов, продукты которых образуют «узкое» место в каскадном механизме
азотфиксации, путем введения более сильных промоторов и т. п. Важно повышение
коэффициента полезного действия самой нитрогеназной системы, осуществляющей
непосредственное восстановление молекулярного азота в аммиак.
Повышение эффективности фотосинтеза
С4-растения характеризуются высокими темпами роста и скоростью фотосинтеза,
у них практически отсутствует видимое фотодыхание. У большинства сельскохо-
зяйственных культур, относящихся к Сз-растениям, высокая интенсивность фото-
дыхания. Фотосинтез и фотодыхание — тесно связанные процессы, в основе кото-
рых лежит бифункциональная активность одного и того же ключевого фермента —
рибулозобисфосфат-карбоксилазы (РуБФК). РуБФ-карбоксилаза может присоединять
не только С02, но и 02, то есть осуществляет реакции карбоксилирования и ок-
сигенирования. При оксигенировании РуБФ образуется фосфогликолат, который
служит основным субстратом фотодыхания — процесса выброса С02 на свету, в ре-
зультате чего теряется часть фотосинтетических продуктов. Низкое фотодыхание
у Сд-растений объясняется не отсутствием ферментов гликолатного пути, а огра-
ничением оксигеназной реакции, а также реассимиляцией С02 фотодыхания.
Одной из задач, стоящих перед генетической инженерией, является исследова-
ние возможности создания РуБФК с преобладающей карбоксилазной активностью.
Получение растений с новыми свойствами
В последние годы ученые используют новый подход для получения трансгенных
растений с "antisense RNA" (перевернутой или антисмысловой РНК), который по-
зволяет управлять работой интересуемого гена. В этом случае при конструирова-
нии вектора копию ДНК (к-ДНК) встраиваемого гена переворачивают на 180°. В
результате в трансгенном растении образуется нормальная молекула мРНК и пере-
вернутая, которая в силу комплементарности нормальной мРНК образует с ней
комплекс и закодированный белок не синтезируется.
Такой подход использован для получения трансгенных растений томатов с улуч-
шенным качеством плодов. Вектор включал к-ДНК гена PG, контролирующего синтез
полигалактуроназы - фермента, участвующего в разрушении пектина, основного
компонента межклеточного пространства растительных тканей. Продукт гена PG
синтезируется в период созревания плодов томатов, а увеличение его количества
приводит к тому, что томаты становятся более мягкими, что значительно сокра-
щает срок их хранения. Отключение этого гена в трансгенах позволило получить
растения томатов с новыми свойствами плодов, которые не только значительно
дольше сохранялись, но и сами растения были более устойчивы к грибным заболе-
ваниям .
Такой же подход можно применить для регулирования сроков созревания тома-
тов, а в качестве мишени в этом случае используют ген EFE (ethylene-forming
enzyme), продуктом которого является фермент, участвующий в биосинтезе этиле-
на . Этилен - это газообразный гормон29, одной из функций которого является
контроль за процессом созревания плодов.
Стратегия антисмысловых конструкций широко применима для модификации экс-
прессии генов. Эта стратегия используется не только для получения растений с
новыми качествами, но и для фундаментальных исследований в генетике растений.
Следует упомянуть еще об одном направлении в генной инженерии растений, кото-
рое до недавнего времени в основном использовали в фундаментальных исследова-
ниях - для изучения роли гормонов в развитии растений. Суть экспериментов за-
ключалась в получении трансгенных растений с комбинацией определенных бакте-
29 Этилен (этен) — простейший из алкенов, Н2С=СН2, ненасыщенный углеводород, бесцветный газ.
Этилен и его гомологи встречаются в природных и нефтяных газах. Помимо всего прочего ускоря-
ет созревание плодов.
риальных гормональных генов, например только iaaM или ipt т.д. Эти экспери-
менты внесли существенный вклад в доказательство роли ауксинов и цитокининов
в дифференцировке растений.
В последние годы этот подход стали использовать в практической селекции.
Оказалось, что плоды трансгенных растений с геном iaaM, находящимся под про-
мотором гена Def (ген, который экспрессируется только в плодах), являются
партенокарпическими, то есть сформировавшимися без опыления. Партенокарпиче-
ские плоды характеризуются либо полным отсутствием семян, либо очень неболь-
шим их количеством, что позволяет решить проблему "лишних косточек", например
в арбузе, цитрусовых и т.д. Уже получены трансгенные растения кабачков, кото-
рые в целом не отличаются от контрольных, но практически не содержат семян.
Обезоруженную, лишенную онкогенов Ti-плазмиду ученые активно используют для
получения мутаций. Этот метод носит название Т-ДНК-инсерционного мутагенеза.
Т-ДНК, встраиваясь в геном растения, выключает ген, в который она встроилась,
а по утрате функции можно легко отбирать мутанты (явление сайлесинга - замол-
кания генов). Этот метод замечателен также тем, что позволяет сразу обнару-
жить и клонировать соответствующий ген. В настоящее время таким способом по-
лучено множество новых мутаций растений и соответствующие гены клонированы.
М. А. Раменской на основе Т-ДНК мутагенеза получены растения томатов с неспе-
цифической устойчивостью к фитофторозу. Не менее интересен и другой аспект
работ - получены трансгенные растения с измененными декоративными свойствами.
Один из примеров - это получение растений петунии с разноцветными цветками.
На очереди голубые розы с геном, контролирующим синтез голубого пигмента,
клонированным из дельфиниума.
Проблемы биобезопасности
трансгенных растений
Одним из главных возражений против употребления "трансгенных" продуктов пи-
тания является наличие во многих из них генов устойчивости к антибиотику (в
частности, к канамицину), которые содержались в исходной конструкции ДНК в
качестве селективных.
Предполагается, что эти гены устойчивости могут при переваривании пищи пе-
редаваться эндогенной микрофлоре, в том числе патогенной, в результате чего
микробы могут приобрести резистентность к данному антибиотику. Однако в ре-
альности вероятность такого события ничтожно мала - многочисленные экспери-
менты и наблюдения в природе относительно подобного горизонтального переноса
генов до сих пор давали только отрицательные результаты.
Не стоит забывать, что встраиваемые в растения гены устойчивости "настрое-
ны" для экспрессии лишь в эукариотических, но не бактериальных клетках. Надо
учесть и то, что эти селективные гены взяты из природных популяций микроорга-
низмов, где они сейчас широко распространены в результате активного примене-
ния антибиотиков в медицинской практике. Поэтому вероятность попадания гена
устойчивости к антибиотику в микрофлору человека из природного резервуара не-
сравнимо реальнее, чем при употреблении трансгенных растений. Однако, учиты-
вая настроения общественности, разрабатываются подходы, для исключения при-
сутствия "подозрительных" генов в коммерциализированных трансгенных формах.
В большинстве случаев маркерные гены устойчивости к антибиотикам сейчас за-
меняют на гены устойчивости к гербицидам. Правда, применение "гербицидных"
генов также встречает возражения, но уже защитников окружающей среды. Предло-
жено несколько способов избирательной элиминации маркерного гена после полу-
чения желаемого трансгенного растения, когда он фактически уже не нужен.
Очень перспективным представляется замена селективных генов на репортерные
при отборе трансгенных форм растений, либо использование альтернативных се-
лективных генов, таких как гены синтеза фитогормонов или гидролиза особых
форм полисахаридов при выращивании растений в культуральной среде. Таким об-
разом, даже эта виртуальная опасность, связанная с генами устойчивости к ан-
тибиотику , в скором времени перестанет существовать.
Что касается возможной токсичности или аллергенности трансгенных растений,
то здесь применяют те же жесткие стандарты, как и для полученных традиционным
путем новых сортов культурных растений или новых видов продуктов питания. Ни-
каких особых отличий трансгенных растений от обычных по этим параметрам ожи-
дать не приходится (разве что в лучшую сторону при блокировании синтеза ток-
синов или аллергенов), да и действительно, как правило, не наблюдается на
практике.
Проблема возможного ущерба для окружающей среды имеет несколько аспектов.
Во-первых, существует опасение, что устойчивые к гербицидам культурные расте-
ния могут при межвидовом опылении передавать эти гены близкородственным сор-
някам, которые могут превратиться в неистребимые суперсорняки (superweeds).
Хотя вероятность такого нежелательного развития событий для большинства сель-
скохозяйственных культур очень мала, генные инженеры и ученые-аграрии активно
разрабатывают подходы для исключения подобной опасности. Здесь, правда, надо
отметить, что данный вопрос также не нов, так как в практике сельского хозяй-
ства уже давно используется ряд устойчивых к гербицидам сортов, полученных
путем обычной селекции. При этом никакой экологической катастрофы широкое ис-
пользование таких устойчивых сортов до сих пор не вызвало30.
Тем не менее, и в этом случае, чтобы отвести любые возражения от трансген-
ных растений, пробуют, например, вводить в растения не один, а сразу несколь-
ко генов устойчивости к разным гербицидам. Передача нескольких генов сорнякам
гораздо менее вероятна, чем одного гена. Кроме того, мультигербицидная устой-
чивость позволит чередовать разные гербициды при обработке посевов, что не
даст возможности для распространения какого-либо определенного гена устойчи-
вости в сорняках.
Предлагается также вводить гены устойчивости не в ядерный, а в хлоропласт-
ный геном. Это может предотвратить нежелательный дрейф генов с помощью пыль-
цы, так как хлоропласты наследуются только по материнской линии.
Еще один генно-инженерный путь борьбы с сорняками без использования генов
резистентности к гербицидам вообще - биотрансгенный. Речь идет об использова-
нии мелких животных, например, кроликов, для поедания сорняков на полях. При
этом чтобы оградить от поедания культурные растения, в них можно ввести ка-
кой-либо ген, делающий их непривлекательными (запах, вкус) для данного живот-
ного. Такой биотрансгенный подход сразу снял бы большинство выдвигаемых сей-
час возражений против трансгенных культур.
30 За свою историю человек адаптировался к очень многим вещам и явлениям. Остается надеяться,
что в случае чего он сумеет адаптироваться и к отрицательным последствиям биотехнологической
революции.
Близкие по сути экологические возражения касаются трансгенных растений со
встроенными "инсектицидными" генами, способных, как считают, спровоцировать у
насекомых-вредителей возникновение массовой резистентности. Здесь также пред-
ложены действенные способы для уменьшения этой опасности, например, использо-
вание генов нескольких разных токсинов и/или индуцибельных промоторов, быстро
активирующихся при нападении насекомых на растение. Данная проблема, в общем,
не нова, так как многие из инсектицидов, используемых сейчас на "генном уров-
не", давно применяют в виде чистого вещества для опрыскивания посевов.
Еще одно нежелательное следствие использования трансгенных растений с гена-
ми инсектицидов заключается в том, что пыльца этих растений может быть ток-
сичной и для полезных насекомых, которые данной пыльцой питаются. Некоторые
экспериментальные данные говорят о том, что такая опасность действительно су-
ществует , хотя о ее возможных масштабах говорить пока трудно. Однако и здесь
уже предложены и испытаны адекватные генно-инженерные решения, например, ис-
пользование трансгеноза через хлоропластную ДНК, или промоторов, не работаю-
щих в пыльце.
ЛИТЕРАТУРА К РАЗДЕЛУ
«ГЕННАЯ ИНЖЕНЕРИЯ»
1. Албертс Б., Брей Д., Льюис Дж. и др. Молекулярная биология клетки. Т. 1
- 3. М.: Мир, 1994.
2. Анализ генома. Методы / Под ред. К. Дейвиса. М.: Мир, 1990. 246 с.
3. Атанасов А. Биотехнология в растениеводстве. Новосибирск: ИЦиГСО РАН,
1993. - 241 с.
4. Барановов В. С. Генная терапия - медицина XXI века // Соросовский обра-
зовательный журнал. № 3. 1999. С. 3 - 68.
5. Бекер М. Е., Лиепиньш Г.К., Райпулис Е.П. Биотехнология. М.: Агропромиз-
дат, 1990. 334 с.
6. Борисюк Н.В. Молекулярно - генетическая конституция соматических гибри-
дов // Биотехнология. Итоги науки и техники ВИНИТИ АН СССР. М. , 1988. Т. 9.
С. 73 -113.
7. Валиханова Г. Ж. Биотехнология растений. Алматы: Конжык, 1996. 272 с.
8. Глеба Ю. Ю. Биотехнология растений // Соросовский образовательный жур-
нал. № 6. 1998. С. 3-8.
9. Глебов О. К. Генетическая трансформация соматических клеток // Методы
культивирования клеток. Л.: Наука, 1988.
10. Гольдман И. Л., Разин С. В., Эрнст Л. К., Кадулин С. Г., Гращук М. А.
Молекулярно-биологические аспекты проблемы позиционно-независимой экспрессии
чужеродных генов в клетках трансгенных животных // Биотехнология. 1994. № 2.
11. Дыбан А. П., Городецкий С. И. Интродукция в геном млекопитающих чуже-
родных генов: пути и перспективы // Молекулярные и клеточные аспекты биотех-
нологии. Л.: Наука, 1986. С. 82 - 97.
12. Егоров Н. С., Самуилов В. Д. Современные методы создания промышленных
штаммов микроорганизмов // Биотехнология. Кн. 2. М. : Высшая школа, 1988. 208
с.
13. Зверева С. Д., Романов Г. А. Репортерные гены для генетической инжене-
рии растений: хара-пктеристика и методы тестирования // Физиология растений.
2000. Т. 47, № 3. С. 479-488.
14. Лещинская И. Б. Генетическая инженерия // Соросовский образовательный
журнал. 1996. №1. С. 33 - 39.
15. Ли А., Тинланд Б. Интеграция т-ДНК в геном растений: прототип и реаль-
ность // Физиология растений. 2000, том 47, № 3. С. 354-359
16. Лутова Л. А., Проворов Н. А., Тиходеев О. Н. и др. Генетика развития
растений. СПб.: Наука, 200. 539 с.
17. Льюин Б. Гены. М.: Мир, 1987. 544 с.
18. Пирузян Э. С., Андрианов В. М. Плазмиды агробактерий и генная инженерия
растений.М.: Наука, 1985. 280 с.
19. Пирузян Э. С. Генетическая инженерия растений.М.: Знание, 1988. 64 с.
20. Пирузян Э. С. Основы генетической инженерии растений.М.: Наука, 1988.
304 с.
21. Пирузян Э. С. Проблемы экспрессии чужеродных генов в растениях // Итоги
науки и техники ВИНИТИ. Сер. Биотехнология. 1990. Т. 23. 176 с.
22. Попов Л. С., Языков А. А. Трансгенные животные как модели для изучения
репродукции эмбрионального развития и заболеваний человека // Успехи совре-
менной биологии.1999. Т 119, № 1. С. 30-41.
23. Романов Г. А. Генетическая инженерия растении и пути решения проблемы
биобезопасности // Физиология растений, 2000. Том 47, № 3. С. 343-353
24. Сельскохозяйственная биотехнология: Учеб. /В. С. Шевелуха, Е. А. Ка-
лашникова, С. В. Дегтярев и др.: Под ред. В. С. Шевелухи. М. : Высш, школа,
1998. 416 с.
25. Сингер М., Берг П. Гены и геномы. Т. 1-2. М.: Мир, 1998.
26. Томилин Н. В., Глебов О. К. Генетическая трансформация клеток млекопи-
тающих // Молекулярные и клеточные аспекты биотехнологии. Л.: Наука, 1986. С.
62 - 82.
27. Фаворова О. О. Лечение генами - фантастика или реальность? // Соросов-
ский образовательный журнал. № 2. 1997. С. 21-27.
28. Щелкунов С. Н. Генетическая инженерия. Ч. 1. Новосибирск: Изд-во Ново-
сибирского ун-та, 1994. 304 с.
Лаборатория
ПРАКТИЧЕСКАЯ БИОТЕХНОЛОГИЯ1
ДЛЯ НАЧИНАЮЩИХ
Кузьмина Н.А.
Википедия
Биотехнология — это интеграция естественных и инженерных наук, позволяющая
наиболее полно реализовать возможности живых организмов или их производные
для создания и модификации продуктов или процессов различного назначения.
Чаще всего применяется в медицине, пищевой промышленности, также для реше-
ние проблем в области энергетики, охране окружающей среды, и в научных иссле-
дованиях .
В последние десятилетия биология бурно развивается и создаёт новые научные
направления. Новое комплексное направление — физико-химическая биология,
включающая в себя биохимию, биофизику, молекулярные биологию и генетику, био-
органическую химию и некоторые другие дисциплины, — не только помогает решать
задачи, которые давно ставила перед биологией производственно-техническая
практика, но и намечает пути принципиально нового биологического производст-
ва .
1 В данной статье рассмотрено только культивирование клеток высших растений и живот-
ных, но излагаемые методы и приемы могут быть полезны и в других разделах биотехно-
логии.
В результате стремительного прогресса разных составных частей физико-
химической биологии, возникло новое направление в науке и производстве, полу-
чившее наименование биотехнологии. Это направление сформировалось за послед-
ние два десятка лет и уже сейчас получило мощное развитие.
Особенно интенсивно биотехнология стала развиваться с 1981 года. Задачи фи-
зико-химической биологии очень обширны. Объединяет их то, что основу, суть
каждой задачи составляет познание природы живого и использование в практике
знаний о процессах и материальных структурах живых организмов. Стремительно
расширяющиеся знания о процессах жизнедеятельности позволяют не только при-
спосабливать эти процессы для практических целей, но и управлять ими, а также
создавать весьма перспективные в практическом отношении новые системы, не су-
ществующие в природе, хотя и аналогичные существующим.
Биотехнология в целом представляет собой систему приёмов направленного ис-
пользования процессов жизнедеятельности живых организмов для получения про-
мышленным способом ценных продуктов.
Меня часто спрашивали - и учителя, и школьники - нельзя ли завести какие-
либо простенькие культуры, иллюстрирующие биотехнологические процессы для ис-
пользования на уроках? Можно, и в этом нет ничего суперсложного. Знаменитому
физику Резерфорду, который и сам ставил блестящие эксперименты, имея порой в
распоряжении простое оборудование, приписывают высказывание о том, что на-
стоящий ученый сможет провести эксперимент при помощи палки и веревки.
Ну, например, для стерилизации сред нужен автоклав. Чем его можно заменить?
Очень просто - скороварка. А если вы найдете скороварку с 2 режимами работы -
на 1 и 1,5 атмосферы - будет вообще замечательно. Ах, скажете вы - а где мы
возьмем агар-агар2? Можно заменить его крахмалом или желатином. Конечно, при-
дется немного поэкспериментировать с концентрацией и режимами стерилизации,
но в конце концов, уверена, вы подберете себе что-нибудь подходящее. Да, со-
став пищевого желатина и пищевого крахмала далек от химически чистого, но для
простых экспериментов сойдут и эти пищевые продукты. Желатин не переносит
стерилизацию под давлением? Попробуйте прием "дробной стерилизации" - 3 раза
с интервалом в день по полчаса обрабатывайте пробирки со средой паром в ско-
роварке. Обычно для убивания вегетативных форм микроорганизмов этого доста-
точно .
Если у вас нет ни агара, ни желатина, ни крахмала - культивируйте на плоти-
ках из фильтровальной бумаги. Когда мы проводили работы по селекции каллусов
на среде с ПЭГ (очень сильный осмотик, имитирующий засуху в этих эксперимен-
тах) , то столкнулись с проблемой - агар в присутствии высоких концентраций
полиэтиленгликоля не застывал после автоклавирования. Выход был найден - на
дно пробирок или баночек клали комочек ваты (рыхлый), сверху - вырезанный по
2 Вопрос об агаре поднимался и в предыдущих номерах журнала «Домашняя лаборатория».
Можно, например, отмыть агар ив мармелада. В целом редакция согласна с автором ста-
тьи, о том, что к данному материалу нужно подходить творчески. В микробиологии, ме-
тоды которой используют биотехнологи, очень сильны традиции. Если кто-то что-то при-
менил, например состав какой-либо питательной среды, то он будет воспроизводится
другими микробиологами десятки и даже сотни лет. Собственно говоря, никто не задумы-
вается , хорош он или плох, оптимален или нет. На практике же ему всегда можно найти
доступную замену и порой более эффективную.
диаметру сосуда кусочек фильтровальной бумаги, заливали жидкой питательной
средой так, чтобы ее уровень не превышал 1 мм над поверхностью бумаги. Высота
столбика среды в пробирке диаметром 2 см - примерно 1-1,5 см, в баночке из
под детского питания - 0,5 см.
В качестве мерной посуды можно использовать то, что продается в хозяйствен-
ных магазинах для домовитых хозяек - мерные стаканы. Для более мелких доз - в
аптеке вы найдете шприцы в ассортименте, которые прекрасно заменят вам мерные
пробирки и пипетки. Ультрафиолетовые лампы сейчас можно купить в хозяйствен-
ном магазине. Там же вы найдете хлорный отбеливатель для стерилизации экс-
планта . Сухожаровой шкаф с успехом заменит обычная духовка газовой или элек-
трической плиты.
Правила стерильной работы в лаборатории
Выращивание изолированных клеток, тканей, органов, растений-регенерантов,
водных культур и грибов, используемых в биотехнологии, проводят в условиях
полной асептики, т.е. стерильно. Особое внимание следует обратить на чистоту
посуды, предназначенной для приготовления питательных сред и их компонентов;
на подготовку объектов к пересадке, пассированию и культивированию. Только
некоторые объекты (хлорелла, азолла) можно выращивать в нестерильных услови-
ях .
Приемы и методы стерилизации
Стерилизация - полное уничтожение микроорганизмов и их покоящихся форм (на-
пример, спор). Существуют разные методы стерилизации: с помощью влажного па-
ра, сухого пара, облучения ультрафиолетовыми лучами, обработки химическими
веществами и микрофильтрации.
Обработка влажным паром производится в автоклавах. Вегетативные клетки бак-
терий и грибов гибнут через 5-10 минут уже при температуре около 60°С; для
гибели спор дрожжей и грибов требуется температура 120°С в течение 15 минут.
Продолжительность автоклавирования зависит от величины (теплоемкости) проби-
рок, колб и объема питательной среды в них. Иногда автоклавируют несколько
раз - дробная стерилизация. Этот прием используют для стерилизации, как пита-
тельных сред, так и посуды.
Стерилизация посуды.
Большинство культур в лабораторных условиях выращивают в пробирках, колбах
Эрленмейера различного объема и чашках Петри одно- или многоразового исполь-
зования . Вначале посуду тщательно моют с использованием детергентов, а также
раствора двухромовокислого калия в серной кислоте (хромпика3) . Вымытую посуду
ополаскивают водопроводной, затем дистиллированной водой и высушивают в су-
шильном шкафу. Чтобы избежать заражения стерильных предметов из воздуха, пе-
ред стерилизацией их закрывают ватными пробками, заворачивают в оберточную
бумагу или закрывают фольгой (у стаканов, колб достаточно завернуть только
горлышко). Затем посуду можно стерилизовать двумя способами:
3 Это пришло от химиков. На практике лучше всего мыть с применением пищевой соды.
Следовые количества детергентов отмыть очень сложно, и как результат они влияют от-
рицательно на рост клеток. Хромпик же вещь вообще очень агрессивная, мыть им посуду
следует только после пятидесятилетнего использования. Это мнение редакции, но прове-
рено на опыте.
1. Посуду выдерживают в автоклаве под давлением в течение 20-40 минут
при температуре 100-130°С. Продолжительность автоклавирования зависит от его
режима: при давлении 0.5 атмосферы - 20-40 минут, при 1 атм. - 15 минут.
2. При сухом способе стерилизации чашки Петри, колбы, стаканы, заверну-
тые в плотную бумагу, стерилизуют в сушильном шкафу при температуре 140°С в
течение 2 часов, при температуре 180°С - 30 минут. При более высоких темпера-
турах ватные пробки буреют, а бумага становится ломкой.
Стерилизация инструментов.
Инструменты (скальпели, пинцеты, иглы и т.д.) стерилизуют в сушильном шкафу
способом № 2. Шприцы, ножницы, пробочные сверла удобнее кипятить. Металличе-
ские предметы нельзя автоклавировать: под воздействием пара они ржавеют и ту-
пятся. Непосредственно перед работой и в процессе её инструменты помещают в
стакан со спиртом и обжигают в пламени спиртовки. Стерильный инструмент ис-
пользуют только для одноразовой манипуляции! Перед повторным употреблением
его снова окунают в спирт и обжигают.
Стерилизация материалов.
Вату, марлю, ватные пробки, фильтровальную бумагу, халаты, косынки стерили-
зуют в автоклаве под давлением 2 атм. в течение 25-30 мин.
Стерилизация питательных сред.
Автоклавирование питательных сред для выращивания культур тканей проводят
после их разлива в пробирки или колбы под давлением 0.7-0.8 атм. при темпера-
туре 115-120°С в течение 15 - 30 минут, в зависимости от объема среды. Если в
результате стерилизации среда помутнела, следовательно, неправильно выбран
режим стерилизации4.
Холодная стерилизация.
Органические жидкости, не выносящие нагревания, освобождаются от бактерий
при пропускании через стерильные мелкопористые бактериальные фильтры с диа-
метром пор 0.45 мкм.
Как изготовить микробиологическую пробку
№
Для предотвращения заражения культур из воздуха и их
преждевременного высыхания пробирки и колбы закрывают
пробками. Пробки для посуды условно можно разделить на
ватные (традиционные микробиологические) и крышечки из
фольги.
С ватными пробками проще работать начинающим - меньше
риска получить ожог. Пробки должны плотно входить в
пробирку (колбу) на 2-3 см, или на 2/3 своей длины; при
открывании хорошо закрытой посуды раздается характерный хлопок.
Недостки микробиологических пробок - довольно трудоемки в изготовлении,
часто прожигаются, не очень удобны при долговременном культивировании. Если
для микробиологических культур сроки культивирования редко превышают 2 неде-
ли, то для растительных клеток продолжительность субкультивирования - как ми-
нимум 3 недели. За это время среда начинает подсыхать. Поэтому в таких случа-
4 Некоторые соли в средах при стерилизации выпадают в осадок, например MgSO4 при
стерилизации с фосфатным буфером. В таких случаях их стерилизуют раздельно и потом
сливают в стерильных условиях.
ях важно закрывать ватную пробку сверху герметично парафильмом или пищевой
пленкой.
Крышечка из фольги проще в работе - легко изготавливается (вырезается кру-
жочек или квадратик по диаметру горлышка пробирки или колбы + один - полтора
сантиметра для отгибания вниз).
Фольгу нужно брать плотную. Если нет плотной - тонкая фольга складывается в
3-4 раза. При обжигании краешков такой пробки нужно
быть аккуратным, чтобы не получить ожог, так как
фольга металлическая и хорошо проводит тепло. После
одевания пробки самый краешек, загнутый вниз на
пробирку или колбу, оборачивается узенькой полоской
парафильма или пищевой пленки в 2-3 оборота, таким
образом краешки плотно прилегают к посуде, и крышка держится надежнее, герме-
тичнее закрывает, снижается риск контаминации (занесения посторонней микро-
флоры)
Изготовление микробиологической пробки
Сложить вдвое кусок марли, накрыть им верхнюю часть пробирки. На середину
куска, закрывающего отверстие пробирки, положить вату, протолкнуть в пробирку
на глубину примерно 3-4 см. Вату очень плотно утрамбовать, затем концы марли
скрутить в центре, обвязать ниткой, лишнее обрезать. Обрезки марли можно ис-
пользовать вместе с ватой при изготовлении пробок. Проверить качество пробок:
хлопок в момент открывания пробирки, очень твердая ("каменная") на ощупь.
Для колб пробки готовят следующим образом: прямоугольный слой ваты скатать
в виде очень плотного, до твердости валика нужных размеров, учитывая диаметр
и длину горла колбы, обернуть его двойным марлевым слоем.
Не использовать пробки, изготовленные только из ваты - они легко воспламе-
няются при обжигании!
Работа в ламинарном боксе
Все операции, связанные с разливом питательных сред, пересадкой каллусов,
тканей, микроорганизмов, ведут в специальных комнатах или ламинарных боксах,
где обеспечиваются стерильные условия работы. Ламинарный бокс (ламинар)
приспособление для работы в стерильных условиях. Асептические условия в лами-
наре создаются с помощью тока воздуха. Ламинарное движение воздуха - движе-
ние, при котором струйки воздуха двигаются параллельно, обтекая препятствие
равномерными слоями. Ток воздуха, проходя через ламинар, движется к исследо-
вателю5 , что позволяет освобождать внутреннее пространство ламинара от спор
микроорганизмов.
Подготовка бокса к работе
В специальных комнатах (микробиологических боксах) проводят влажную уборку
с дезинфицирующими агентами. Для надежности стерилизации перед началом рабо-
ты помещение лаборатории и внутреннее пространство ламинара облучают УФ-
лучами. Облучение ультрафиолетовыми лучами (260 нанометров) - наиболее часто
используется в лабораториях для стерилизации помещений, настольных боксов.
При длительном воздействии эти лучи вызывают гибель всех бактерий. Бактерии
погибают очень быстро, а споры грибов значительно медленнее. Поэтому в боксах
устанавливают бактерицидные лампы БУФ-15 или БУФ-30, которые включаются на 30
5 Для работы с патогенами применяют ламинары с вертикальным потоком воздуха. Главное
же заключается в том, что подаваемый воздух очищается от пыли, бактерий и спор, пу-
тем пропускания черев электростатический фильтр.
минут за 1 час до работы. Кроме того, рекомендуется проводить профилактиче-
ское облучение боксов в течение 2 часов.
Непосредственно перед работой необходимо протереть настольный бокс или
внутренние поверхности ламинара этиловым спиртом6, разложить в нем необходи-
мые инструменты и материалы: спирт в закрытой посуде, спиртовку (горелку),
спички, простерилизованный инструмент и посуду.
Рабочее место при отсутствии ламинара
Наличие ламинара - это отлично, просто замечательно. Но что делать, если
его нет? Или появится в обозримо-необозримом будущем, а культуры клеток заво-
дить нужно уже сейчас?
Шаг первый - постарайтесь найти малопосещаемое людскими массами помещение -
чем меньше посетителей - тем меньше источников загрязнения.
Шаг второй - всегда перед работой проводите влажную уборку всей комнаты и
стерилизуйте ее кварцевой (ультрафиолетовой) лампой.
А теперь, собственно - о рабочем месте. В нашем случае оно выглядело при-
мерно так: стол, покрытый ламинатом. Лучше - железный, но сойдет и покрашен-
ный масляной краской. В идеале - поверхность стола должна быть негорючей.
Именно поэтому железный стол - лучше всего. Ламинат тоже загорается не сразу,
хуже всего в этом отношении масляная краска, а еще пуще всякие дерматины и
сукно. Они противопоказаны категорически.
Прямо перед вами на столе должны лежать следующие предметы: кафельная плит-
ка или кусок стекла размером 15x15 см или чуть больше. Кафельная плитка -
лучше, она выдерживает нагрев, а стекло может лопнуть. Спиртовка, стаканчик с
96% спиртом (или 200-300 граммовая высокая баночка из-под кофе, детского пи-
тания, фруктовых пресервов), широкая кисточка для рисования, мокрая марлевая
салфетка или тряпочка размером 30X30, свернутая в несколько раз (смочена во-
дой!), пинцет, скальпель, пробирки/баночки с питательной средой, пробир-
ки/чашки Петри с материалом для размножения.
Порядок работы
Протираете влажной тряпочкой поверхность стола, ополаскиваете тряпочку и
выжимаете ее. Кладете свернутую под ПРАВУЮ руку, справа от кафельной плитки.
Располагаете подручные средства. Кафельная плитка лежит прямо перед вами, в
6 Не помешает, конечно, если бокс или ламинар имеет стеклянные стенки, если стенки
ив оргстекла, то оно потрескается.
центре рабочего места. За кафельной плиткой по центру стоит спиртовка. Рядом
с ней, на расстоянии 10 см или чуть больше стоит стаканчик со спиртом, полу-
чается, он будет находиться сразу за тряпочкой справа от вас. Слева от плитки
располагаются пробирки со средой и материал, который вы будете вводить в
культуру или пассировать. Расстояние от плитки до среды и от плитки до тря-
почки не менее 10 см влево и вправо, соответственно. Скальпель и пинцет по-
гружены в спирт примерно на 2/3 своей длины (поэтому важно, чтобы баночка бы-
ла узкой и высокой и была почто до верха наполнена спиртом. Кисточка также
стоит в стаканчике со спиртом.
Берете кисточку, мажете спиртом поверхность плитки. Ставите кисточку в
спирт. Зажигаете спиртовку, вынимаете скальпель, поджигаете в пламени спир-
товки и поджигаете горящим скальпелем спирт на поверхности плитки. Кладете
скальпель справа на кафельную плитку (она может еще продолжать гореть) так,
чтобы острие скальпеля смотрело вверх (то есть на ребро плитки), но так, что-
бы большая часть скальпеля, включая острие, находилось именно над плиткой, в
пламени. Правой рукой берете пинцет из баночки со спиртом, перекладываете в
левую руку, поджигаете от спиртовки и кладете слева на плитку - аналогично
скальпелю. ВНИМАНИЕ - если вы проводите эти процедуры впервые - отрабатывайте
навыки, окуная инструменты в спирт на четверть длины и не пугайтесь пламени,
оно исчезает в течение минуты. Влажная тряпочка - ваша страховка на случай,
если вы подожжете что-то не то, например, запаникуете и бросите горящий инст-
румент в баночку со спиртом. Тогда сразу накрывайте влажной тряпкой источник
огня, без доступа кислорода огонь тухнет моментально.
В результате этих манипуляций вы имеете абсолютно стерильную поверхность
плитки со стерильными инструментами на ней. Постарайтесь контролировать свои
движения и доставать экспланты, открывать пробирки не над плиткой непосредст-
венно, а в зоне между плиткой и горящей спиртовкой, то есть за плиткой. На
стерильной плитке вы можете резать эксплант, класть его пинцетом на кончик
скальпеля для последующего переноса на питательную среду и она должна оста-
вать стерильной. Старайтесь не трясти над ней рукавами халата. Использованные
инструменты снова погружаете в спирт. Перед каждым новым эксплатном все опе-
рации по стерилизации, начиная с обжигания поверхности плитки, повторяются.
Помните, что скальпель вы держите указательным и большим пальцем (он лежит на
указательном и среднем, зажатый большим пальцем, а крышки с пробирок снимаете
мизинцем, предварительно пронеся горлышко пробирки через пламя спиртовки.
Стерилизация растительного экспланта
Стерильная культура - культура, свободная от эпифитных и ризосферных микро-
организмов .
Работающий должен вымыть руки с мылом и протереть их спиртом, надеть сте-
рильный халат, завязать волосы стерильной косынкой.
Перед стерилизацией объекта его тщательно моют теплой водой с мылом, промы-
вают дистиллированной водой, очищают от излишних тканей, снимают кожуру у
корнеплодов и корней, кору у побегов, поверхностные листья у верхушек побе-
гов, промывают дистиллированной водой и помещают на несколько секунд в 70%
спирт (семена на 1-2 минуты). После этого сегменты корней, побегов, стеблей,
клубней или семена переносят в стерилизующий раствор.
Вид стерилизующего агента, его концентрация и время действия, зависящие от
особенностей тканей исходных растений, необходимо подобрать таким образом,
чтобы убить микроорганизмы и не повредить ткани экспланта. Для поверхностной
стерилизации растительных объектов применяют следующие средства стерилизации:
сулему (двуххлористая ртуть) (0.1%), хлорамин (2-10%), гипохлорит кальция (7-
10% Са(СЮ)г) или натрия (NaOCl) , перекись водорода (13-18%) и др. Хлорамин
можно купить в аптеке. Для стерилизации можно использовать также хлорсодержа-
щие растворы отбеливателей из хозяйственных магазинов, например, средство
"Белизна". Свежие растворы отбеливателей при стерилизации нежных эксплантов,
таких как молодые листочки, нужно разводить в 2 или даже в 3 раза. Эффектив-
ность стерилизации возрастает при добавлении нескольких капель твина-80 и
твина-20 на литр стерилизующего раствора.
Продолжительность стерилизации меристем сулемой - 5 минут, семян - 15-20
минут, пергидролем соответственно 15 и 30 минут.
После стерилизации материал переносят в стерильную дистиллированную воду,
выдерживают 10 минут, затем меняют воду ещё два раза, выдерживая в каждой
порции по 15-20 минут. В стерильных чашках Петри или на стерильных листах бу-
маги, или на обожженной кафельной плитке обрезают стерильным скальпелем концы
сегментов исходного материала, где клетки могут быть повреждены, и из средних
зон нарезают кусочки тканей, которые высаживают на инициальную среду для об-
разования каллусов. При стерилизации отрезков стебля или верхушечных почек в
растворах сулемы или гипохлорита рекомендуется парафинировать срезы, чтобы
стерилизатор не проник в сосуды, что может привести к интоксикации ткани.
Ход работы
Простерилизовать инструменты, посуду и питательные среды, необходимые для
проведения работ по выращиванию стерильных проростков и выращивания каллусных
тканей.
1. Завернуть в плотную бумагу и простерилизовать сухим жаром в сушильном
шкафу стеклянную посуду - колбы, чашки Петри.
2. Подвергнуть предварительной стерилизации в сушильном шкафу скальпели и
пинцеты. Перед помещением в сушильный шкаф завернуть инструменты в плотную
бумагу.
3. Простерилизовать в автоклаве дистиллированную воду в колбе. Для получе-
ния стерильной воды налейте в колбу 1/3 часть объема дистиллированной воды,
закройте ватной пробкой, а сверху плотной бумагой или целлофаном, можно обер-
нуть горлышко фольгой. Автоклавировать 30 минут при 1 атмосфере.
4. Простерилизовать в автоклаве в течение 20 мин при давлении 1 атм. про-
бирки с питательной средой, закрытые фольгой или ватными пробками, обернутыми
плотной бумагой или целлофаном.
Питательные среды для растительных биотехнологических объектов
Успех в культивировании объектов зависит от правильного выбора питательной
среды и тщательности её приготовления. В состав питательных сред входят мак-
ро- и микроэлементы (N, Р, К, Са, S, Mg, Ее, В, Zn, Си, Со, Мп, J, Мо); вита-
мины Bi, В6, Bi2, РР и другие; углеводы (сахароза, глюкоза, маннит); фитогор-
моны (чаще всего цитокинины и ауксины в определенном соотношении). Ауксины
вызывают клеточную дедифференцировку, цитокинины индуцируют деление дедиффе-
ренцированных клеток и необходимы для получения каллусных тканей.
На средах без гормонов растут "привыкшие" и опухолевые ткани.
Для получения стеблевого морфогенеза снижают содержание ауксинов.
Из ауксинов чаще всего применяют 2,4-дихлорфеноксиуксусную кислоту (2,4-Д)
- 0.1-10 мг/л, нафтилуксусную кислоту (НУК) - 0.1-2 мг/л, ИУК - 1-30 мг/л.
Для индукции каллусогенеза используют более высокие концентрации ауксинов,
в дальнейшем ткань может расти при более низком содержании ауксинов.
В качестве цитокининов используют кинетин, 6-бензиламинопурин (ВАЛ), зеатин
(0.001-10 мг/л); из них кинетин наименее активен. В состав некоторых сред
входит аденин. Иногда используют гибберелловую кислоту (ГК) . В качестве рос-
тактиваторов применяют также кокосовое молоко, дрожжевой экстракт, гидролизат
казеина и др.
Состав питательных сред для культивирования биотехнологических объектов за-
висит от типа их питания:
- среда без глюкозы - для хлореллы, цианобактерий;
- среда без витаминов и гормонов - для грибов (фузариума, ботритиса) и для
ряски (Lemna);
- среда с азотом, сахарами, витаминами и гормонами - для культивирования
клеток и тканей высших растений.
Разработано много питательных сред, но большинство из них представляют мо-
дификации основных: Мурасиге-Скуга (МС), Уайта, Шенка-Хильдебрандта, Гамборга
(В5), Линсмайера-Скуга, Хеллера, Чапека и др. Составы питательных сред, полу-
чивших наибольшее распространение, приведены в справочниках по физиологии
растений и биотехнологии. Ниже вы найдете прописи для базовых сред для куль-
тивирования растительных клеток: среда Мурасиге-Скуга и среда Гамборга, неко-
торые микробиологические среды.
Состав питательных сред для растительных клеток
Среда Мурасиге-Скуга
Компоненты Концентрация солей в 1 литре готового маточного раствора,мг маточный раствор макроэлементов NH4NO3 33000 KNO3 38000 СаС12*2Н2О 8800 MgSO4*7H2O 7400 КН2РО4 3400 маточный раствор микроэлементов KJ 166 Н3ВО3 1240 MnSO4*H2O 44 60 ZnSO4*7H2O 1720 Na2Mo04*2H20 50 CuSO4*5H2O 5 СоС12*6Н20 5 маточный раствор хелатного железа FeSO4*7H2O 5560 Ыа2ЭДТА*2Н2О 74 60 витамины и органические вещества Мезоинозит 20000 Никотиновая кислота 100 Пиридоксин-НС1 100 Тиамин-НС1 100 Глицин 400 Добавлять в виде порошка в среду перед варкой Сахароза - ЗОг/л Агар-агар - 7 г/л pH готовой среды - 5.6-5.8 Объем маточного р-ра, мл для приготовления 1 литра среды 50 5 5 5
* для получения стерильных проростков на 1 литр среды берут 1/2 часть ма-
точных растворов, т. е. вместо 50 мл раствора макроэлементов берут 25 мл и
т.д.
Среда Гамборга (В5)
Компоненты Концентрация солей Объем маточного р-ра,
в 1 литре маточного маточный раствор макроэлементов (NH4)2SO4 2680 KNO3 50000 СаС12*2Н2О 3000 MgSO4*7H2O 5000 NaH2PO4*H2O 3000 маточный раствор микроэлементов KJ 75 Н3ВО3 3300 MnSO4*H2O 1000 ZnSO4*7H2O 200 Na2Mo04*2H20 25 CuSO4*5H2O 25 СоС12*6Н20 2.5 маточный раствор хелатного железг FeSO4*7H2O 5560 Ыа2ЭДТА*2Н2О 74 60 витамины и органические вещества Мезоинозит 10000 Никотиновая кислота 100 Пиридоксин-НС1 100 Тиамин-НС1 1000 Добавлять в виде порошка в среду Сахароза - 30 г/л Агар-агар - 7 г/л pH готовой среды - 5.5 готового раствора,мг i перед варкой: мл для приготовления 1 литра среды 50 10 5 10
Питательные среды для микроорганизмов и их приготовление7
1. Приготовление бобового агара
В 1 литре воды кипятят 100 г белой фасоли или белых бобов до готовности,
избегая растрескивания бобов и превращения крахмала в клейстер. Отвар фильт-
руют в горячем виде и добавляют 2% агара. Стерилизуют в автоклаве как обычно.
2. Приготовление среды для хлореллы
В качестве среды для культивирования зеленых водорослей можно использовать
раствор Кнопа (г/литр раствора):
Ca(NO3)2 - 0.25
MgSO4*7H2O - 0.06
КН2РО4 - 0.06
КС1 - 0.08
7 Следует помнить, что сред придумано великое множество, к ним нужно относится как,
примерно к кулинарным рецептам. Например, почему-то для грибов всегда рекомендуется
агар Чапека, но на практике он используется редко и не все грибы растут на нем. Его
достоинство по сравнению с картофельным агаром, например, только в том, что состав
его легко воспроизводим и постоянен (если забыть о примесных микроэлементах солей).
Это важно в плане воспроизводимости научных исследований, в плане публикаций, но не
в плане практического применения.
Ге2С1б - одна капля 1% раствора (можно заменить раствором хелатного железа
из среды МС, 50 мл маточного раствора).
На растворе Кнопа можно также выращивать и ряску.
3. Приготовление среды для цианобактерий
Для культивирования цианобактерий рекомендуется среда Чу N 10 (г/литр рас-
твора) :
Ca(NO3)2 - 0.04
MgSO4*7H2O - 0.025
КН2РО4 - 0.01
Na2CO3 - 0.02
Na2SiO3*9H2O - 0.025
FeCl3*6H2O - 0.0008 (также можно заменить хелатом железа)
4. Приготовление питательного агара для грибов (агар Чапека)
Состав среды Чапека (г/литр раствора):
Сахароза - 30 г
NaNO3 - 3 г
КН2РО4 - 1 г
MgSO4*7H2O - 0.5 г
КС1 - 0.5 г
FeSO4*7H2O - 0.01 г
Агар-агар 15 г
На дно колбы насыпать агар (можно брать пол-литровые обычные бутылки, тогда
на 1 литр среды необходимы 3 бутылки, в каждую их которых насыпать 1/3 агара,
т.е. 5 грамм) и залить раствором солей. Колбу или бутылки поставить в авто-
клав на стерилизацию на 20 минут. После стерилизации, покачивая колбу, тща-
тельно перемешать содержимое, иначе агар останется на дне, и застынет только
нижний слой среды.
В боксе среду разлить по стерильным чашкам Петри или пробиркам. Проверить
на бактериальное заражение, выдержав 3-4 дня при комнатной температуре. В
дальнейшем лучше хранить в холодильнике, так как там среда меньше испаряется.
5. Среда Прата для хранения коллекции культур водорослей
Длительно выдерживать зеленые водоросли без пересева не рекомендуется, так
как водоросли могут прекратить свой рост в результате самоотравления продук-
тами жизнедеятельности. Признаками такого угнетения могут служить пожелтение
культуры, появление белесого оттенка на среде и ее помутнение. Сохранить кол-
лекцию водорослей можно на твердых питательных средах, где рост культуры за-
медлен, поэтому частые пересевы не требуются (раз в месяц, а если хранить при
слабом рассеянном свете при температуре 10-15°С, то и раз в два месяца) .
Состав среды Прата (г/литр раствора):
KNO3 - 0.10
MgSO4*7H2O - 0.01
К2НРО4 - 0.01
FeCl3*6H2O - 0.001
агар-агар - 12 г
Среду простерилизовать.
Методики культивирования клеток
Начнем с того, что растительные и животные клетки предъявляют совершенно
различные требования к условиям культивирования.
Для животных клеток диапазон оптимального существования очень узок. Это ка-
сается и температурных условий, и состава питательных сред (необходимо строго
выдерживать pH, молярность и т.д.), и газового состава. Пожалуй, наименее
требовательны они к освещению. Для выращивания животных клеток всегда исполь-
зуют готовые фабричные питательные среды, а для длительного поддержания линии
нужен термостат. Для некоторых видов клеток газовый состав воздуха можно
обеспечить, поместив флаконы с культурой в эксикатор (емкость с притирающейся
крышкой) в который также помещают горящую свечку. Когда эксикатор плотно за-
крыт, свеча затухает сама при концентрации углекислого газа в воздухе 5%.
Подробнее о условиях культивирования животных клеток и культивировании ор-
ганов можно прочесть в учебнике по биотехнологии.
Заводить и вести культуру растительных клеток гораздо проще. Растительные
культуры поддерживают при температурах от 22 до 27°С, в темноте или при осве-
щении. Среды для них - несложные, и их легко приготовить самому. Культивиро-
вать можно на твердых питательных средах с добавлением агар-агара, крахмала
(методика изложена в главе "питательные среды" или на жидких питательных сре-
дах, с использованием мостиков из ваты и фильтровальной бумаги.
Суспензионные культуры растительных клеток поддерживать гораздо сложнее -
необходима мешалка для постоянного перемешивания среды. Иначе эксплант погиб-
нет , в первую очередь, от отсутствия доступа кислорода.
Условия освещения различны в зависимости от поставленных вами задач. Кал-
лусную ткань обычно получают в темноте. Клональное микроразмножение проводят
при освещении. В качестве источника света лучше пригодны лампы дневного све-
та . Они не нагревают камеру и имеют более или менее подходящий для растений
спектральный состав света.
ПОЛУЧЕНИЕ КАЛЛУСНОЙ ТКАНИ У РАЗНЫХ РАСТИТЕЛЬНЫХ ОБЪЕКТОВ
Каллус - определенным образом организованная масса ткани, состоящая из де-
дифференцированных клеток. Образование и рост каллусной ткани контролируется
фитогормонами типа ауксинов и цитокининов. Под действием ауксинов происходит
дедифференцировка, а под влиянием цитокининов - интенсивное деление, в ре-
зультате которого образуется ткань.
Спонтанное образование каллусной ткани в природе мы можем наблюдать на мес-
те повреждения. Каллусные клетки затягивают рану, а впоследствии дифференци-
руются в утраченные ткани растения. Например, когда вы черенкуете розы или
другие древесные растения, то на месте нижнего среза, погруженного в воду вы-
растает мозолеобразое образование - каллус, из которого затем формируются
корни, происходит укоренение черенка. Очень часто каллус формируется на по-
врежденных корнеплодах моркови (особенно в месте среза листьев), на черешках
кочанов капусты.
Каллусную ткань также можно получить на искусственных питательных средах,
включающих фитогормоны, используя фрагменты самых разных частей растения:
стеблей, корней, тканей клубня, листьев, зародышей, семядолей и т. д. Такие
фрагменты называются эксплантами.
Получение каллусной ткани из листьев табака
Табак - классический объект для получения каллусной ткани и дальнейших ее
исследований. Клетки табака легко дедифференцируются и переходят к делению,
образуя быстро растущую каллусную ткань. Кроме того, в каллусной ткани табака
легко вызвать регенерацию.
Каллусообразование очень хорошо идет у основания листьев табака, особенно в
зоне, примыкающей к срединной жилке. Для получения каллуса пригодны как сте-
рильные , так и нестерильные растения. Нестерильные растения стерилизуют в
растворе хлорамина, перекиси водорода или других стерилизующих агентов.
Материалы и оборудование
Растения табака любого возраста, стерильные или нестерильные, этанол, 4%
раствор хлорамина, пробирки со стерильной водой (3 штуки), скальпель, пинцет,
спиртовка, кафельная плитка, стаканчик, подставки для инструмента, кисточка,
чашка Петри, спички, пробирки со средой МС с добавлением гормонов: 2 мг 2,4-Д
и 0,2 мг кинетина на литр среды.
Ход работы
Листья табака промыть в мыльном растворе, отмыть от мыла водопроводной во-
дой, ополоснуть дистиллированной. Погрузить на 1 минуту в стаканчик с этано-
лом, вынуть, после чего поместить в чашку Петри и залить стерилизующим рас-
твором на 10 минут. Раствор слить, промыть трижды стерильной дистиллированной
водой из пробирок, в каждой из порций держать не менее 5 минут.
Если берутся пробирочные растения, то предварительная стерилизация не тре-
буется .
Стерильные листья табака положить на предварительно обожженую кафельную
плитку, стерильным скальпелем вырезать фрагменты у основания листьев, приле-
гающие к средней жилке, длиной 1-1.5 см, шириной 1 см. Перенести подготовлен-
ные участки листьев в пробирки или чашки Петри с питательной средой МС, со-
держащей гормоны, поместить в термостат при температуре 26°С. Через 3 недели
рассмотреть результат.
Получение и культивирование каллуса из стебля картофеля
Материалы и оборудование
Стерильные растения картофеля в пробирке или нестерильные проростки клубней
картофеля, длиной 10-15 см. , этанол, 4% раствор хлорамина, пробирки со сте-
рильной водой (3 штуки), скальпель, пинцет, спиртовка, кафельная плитка, ста-
канчик, подставки для инструмента, кисточка, стерильная чашка Петри, спички,
чашки Петри или колбы со средой МС (с добавлением гормонов - 4 мг 2,4-Д и 0.2
мг кинетина на литр среды).
В ответ на поранение паренхимные клетки, помещенные в питательную среду,
содержащую фитогормоны, дедифференцируются, переходят к делению и образуют
каллус. У картофеля каллус может быть получен из тканей стебля, листа, клуб-
ня , пыльника.
Ход работы
Если используется стерильное растение из пробирки, то горлышко пробирки об-
жечь спиртом. Пинцетом вынуть стерильное растение из пробирки и поместить его
в стерильную чашку Петри. Если берется нестерильное растение, то после про-
мывки его оставляют в чашке Петри. Придерживая крышку в полуоткрытом состоя-
нии, стерильным скальпелем вырезать скальпелем участки стебля длиной 5-10 мм,
не захватывая междоузлия. Обжечь инструменты, перенести вырезанный участок на
плитку, надсечь экспланты в нескольких местах для появления в дальнейшем ра-
невого каллуса. Поместить их в колбу или чашку Петри со стерильной средой,
чуть вдавливая их пинцетом, для усиления контакта со средой. В одну чашку
Петри помещают 5-10 эксплантов. Закрыть колбу или чашку Петри. Чашки Петри
заклеить парафилмом или пищевой пленкой. Поместить в термостат без освещения
и выдержать 3 недели при температуре 22-25°С. Через 3 недели рассмотреть об-
разовавшийся каллус.
Получение и культивирование каллусной ткани из зародышей пшеницы
Материалы и оборудование
Зрелые зерновки пшеницы, пробирки со стерильной средой Гамборга с добавле-
нием 5 мг на литр 2,4-Д (см. прописи питательных сред для растительных кле-
ток), стерильный пинцет, скальпель, кисточка, стаканчик с этанолом, 4% хлора-
мин, чашка Петри, кафельная плитка, колба со стерильной водой, спиртовка,
спички.
Каллусы, полученные из зародышей пшеницы, используют для селекции растений
на солеустойчивость, засухоустойчивость, устойчивость к другим неблагоприят-
ным факторам.
Ход работы
Семена пшеницы промыть водой с мылом, затем водопроводной водой, ополоснуть
дистиллированной водой. Поместить в чашку Петри, залить этанолом на 5 минут,
этанол слить в стаканчик, залить хлорамином на 15 минут, трижды промыть сте-
рильной дистиллированной водой, выдерживая по 5 минут в каждой смене. Зернов-
ку пинцетом поместить на плитку, вычленить зародыш, разрезать его поперек на
2 части. Верхнюю половинку зародыша, обращенную в зерновке к центру, помес-
тить срезом на поверхность питательной среды в пробирке. Поместить в климока-
меру при температуре 25°С. Через три недели рассмотреть результаты.
Напоминание: не забудьте ознакомиться с методикой стерильной работы и ме-
тодикой стерилизации растительного экспланта.
МИКРОКЛОНАЛЬНОЕ РАЗМНОЖЕНИЕ
Микроразмножение томатов или табака черенкованием побегов
Материалы и оборудование
Пробирочные растения томатов или табака, пробирки с питательной средой МС,
стерильные скальпели, пинцеты, чашки Петри.
Размножать некоторые растения можно путем черенкования в пробирочной куль-
туре . Для этого растения разрезают на части. Черенки пересаживают в пробирки
с питательной средой МС. Размножение черенкованием основано на подавлении
апикального доминирования и активации пазушных меристем путем удаления верху-
шечного побега. При помещении побега на питательную среду из пазушных мери-
стем появляется побег. Черенкование проводят с интервалом 14-21 день. Из 1
растения получают 5-8 черенков, за 2-3 месяца это составит 3-5 тысяч растений
(при условии, что вы все делаете правильно и в условиях абсолютной стерильно-
сти) .
Ход работы
Пробирочное растение вынуть из пробирки, поместить в стерильную чашку Пет-
ри, разрезать на части (отрезок стебля с листом и пазушной почкой), часть
стебля над листом должна быть при этом в 2-3 раза меньше, чем часть ниже лис-
та . Необходимо соблюдать строгую стерильность. Черенки перенести на свежую
питательную среде в пробирки. Для предотвращения попадания микроорганизмов в
пробирки обжечь горлышко и ватную пробку в пламени спиртовки. Пробирку поста-
вить в световую камеру. Наблюдать за развитием побега.
Клональное микроразмножение роз
Материалы и оборудование
Однолетние побеги роз, скальпель, кисточка, пинцет, стаканчик с этанолом,
пробирки со стерильной водой, 4% раствор хлорамина, чашка Петри, кафельная
плитка, спиртовка, спички, пробирки с модифицированной питательной средой МС,
ее компонетны:
макроэлементы по прописи МС
микроэлементы по прописи МС
хелат железа
витамины по прописи МС
источник углерода: глюкоза - 40 г/л
агар-агар 7 г/л
гормоны: гиббереллин - 0.1 мг/л, 6-БАП - 2 мг/л
pH готовой среды 5.6-5.8).
Ход работы
В качестве экспланта используют боковые почки из средней части 1-летнего
побега. Побеги промывают водопроводной водой с мылом, ополаскивают дистилли-
рованной водой, вырезают почку. Стерилизуют сначала 70% этанолом в течение 1
минуты, а затем в растворе хлорамина 10 минут. Трижды промывают стерильной
дистиллированной водой (в каждой порции по 10 минут). Срезы обновляют, снима-
ют почечные чешуи и переносят почки на агаризованную питательную среду в про-
бирки. В некоторых случаях экспланты переносят на свежую питательную среду,
так как в среду выделяются полифенолы. Культивируют при температуре 18-25°С,
освещенности 500-1000 люкс, 16-часовом фотопериоде. Пассируется через 3-4 не-
дели. Для укоренения побеги переносят на среду Гамборга (В5) с добавлением 1
мг/л ИУК и увеличивают интенсивность освещения до 2000 люкс.
Перенос посадочного материала в почву
Материалы и оборудование
Пробирки с растениями, горшки с почвой; почву желательно прогреть или про-
автоклавировать до посадки растений
Ход работы
Сделать пробиркой углубление в увлажненной почве в горшке. Пробирочное рас-
тение вынуть из пробирки, поместить в горшки с почвой, не отмывая агаровой
среды. Уплотнить почву вокруг растения. Первые 3-5 дней желательно прикрывать
растения стеклянным колпаком. Через 10 дней растения пересаживают на постоян-
ное место в теплице.
ПОДДЕРЖАНИЕ И СОХРАНЕНИЕ КЛЕТОЧНЫХ КУЛЬТУР
Поддержание и сохранение культуры картофеля
Материалы и оборудование
Пробирки с растениями картофеля, стерильный пинцет, скальпель, кисточка,
стаканчик с этанолом, чашка Петри, кафельная плитка, спиртовка, спички, про-
бирки с питательной средой МС .
Для замедления роста растений из черенков ТУР (ретардант, применяемый в
сельском хозяйстве против полегания стеблей растений - хлорхолинхлорид, ССС)
в концентрации 0.4-0.5 мл/л добавляют в среду МС, при этом промежуток между
двумя последующими черенкованиями увеличивается с 1 до 4 месяцев, а высота со
сближенными междоузлиями не превышает 3-4 см. Растения приобретают темно-
зеленую окраску.
Одним из способов сохранения и поддержания коллекции in vitro является
клубнеобразование в пробирках. На процесс образования клубней in vitro оказы-
вает влияние фотопериод, температура, ростовые вещества, содержание сахарозы
в питательной среде.
Ход работы
Черенки переносят на модицифированную питательную среду МС для образования
клубней картофеля, ее компоненты:
Макроэлементы по прописи МС
Микроэлементы по прописи МС
Источники железа
Витамины по прописи МС + аденин - 0.25 мг/л
Источник углерода: сахароза - 70 г/л
Агар-агар - 7 г/л
Гормоны: ИУК - 1 мг/л
pH готовой среды 5.6-5.8.
Культивирование черенков проводится под люминесцентными лампами при 10 ча-
совом фотопериоде, освещенности 3.5-4 тыс.люкс, влажности 70%. После трехне-
дельного выдерживания на 10-часовом фотопериоде растения переносят на 2 суток
в темноту, а затем на 16 часовой период и оставляют в этих условиях до завер-
шения клубнеобразования. После отмирания растений и достижения микроклубнями
размера 0.7-1.4 см их извлекают из пробирок (в стерильных условиях) и хранят
в пробирках, закрытых ватными пробками, в холодильнике, при температуре +2 -
+4°С.
КУЛЬТИВИРОВАНИЕ ЖИВОТНЫХ КЛЕТОК
Культивирование фибробластов человека
Культуральная посуда и оборудование
Пипетки мерные от 1 до 10 мл, пипетки Пастера, пенициллиновые флаконы, про-
бирки Лейтона, мерные флаконы от среды разных объемов, пробки резиновые N 10,
12.5, 14.5, 24; стекла покровные для микроскопии, предварительно нарезанные
для помещения их в пенициллиновые флаконы, пинцеты глазные анатомические и
хирургические, зажим Кохера, бритва безопасная, препаровальная игла из нержа-
веющей стали, резиновая груша для работы с пипетками (с надетой резиновой
трубкой), инвертированный микроскоп, ламинар-бокс, термостат.
Питательная среда
Фибробласты успешно культивируют на разных средах, но рекомендуется исполь-
зовать следующий состав питательной среды - среда Игла - 90-85%, сыворотка
крупного рогатого скота - 5-10%, пуповинная сыворотка человека (фетальная сы-
воротка) - 5%, глютамин - 150 мг на 500 мл готовой среды. Готовую среду и её
компоненты рекомендуется хранить при 4°С. При культивировании эксплантов ре-
комендуется использовать антибиотики (40-60 мкг канамицина на 1 литр среды).
Ход работы
1. Взятие биопсии. Фибробласты можно получать из многих тканей и органов.
Проще всего - фибробласты дермального слоя кожи. Наиболее удобно брать био-
псию со внутренней стороны предплечья левой руки (нижняя треть). Кожу дезин-
фицируют 70% этиловым спиртом. Не рекомендуется употреблять другие дезинфици-
рующие растворы, так как в случае проникновения в биопат они могут оказать
токсическое действие. После дезинфекции кожу захватывают глазным хирургиче-
ским пинцетом, оттягивают и отрезают кусочек кожи непосредственно под бранша-
ми пинцета. Не следует стремиться взять глубокие слои кожи. При правильно
взятой биопсии, захватывающей эпидермис и сосочковый слой кожи, кровотечение
минимально. Отсечение лучше проводить лезвием безопасной бритвы, простерили-
зованной (как и пинцет) путем погружения в этиловый спирт с последующим под-
жиганием. Отсеченный кусочек погружается в заранее приготовленный пеницилли-
новый флакон со средой. На рану накладывают бактерицидный пластырь. Фрагмент
кожи может храниться в питательной среде при 4°С в течение 3-4 суток без ут-
раты фибробластами способности к росту.
2. Получение экспланта. В стерильную чашку Петри с каплей 0.25% раствора
трипсина или питательной среды помещают фрагмент кожи. Придерживая пинцетом,
нарезают на мелкие кусочки величиной с булавочную головку и меньше стерильным
лезвием безопасной бритвы, зажатой в зажим Кохера или Пеана. При помощи изо-
гнутой препаровальной иглы кусочки извлекают из капли и помещают на покровное
стекло, находящееся в пенициллиновом флаконе или пробирке Лейтона. Уложенные
кусочки накрывают другим покровным стеклом, слегка прижимая препаровальной
иглой. Наливают в культуральный сосуд питательную среду так, чтобы она покры-
ла верхнее стекло. Покровные стекла с зажатыми между ними кусочками кожи при
помощи пинцета кладут на боковую стенку пенициллинового флакона. Флаконы
плотно закрывают пробкой и устанавливают на подставке под углом примерно в
30°. Культуры инкубируют в термостате при 37°С. В течение недели следят за
цветом среды. Изменение цвета индикатора к желто-оранжевому свидетельствует о
хорошем состоянии экспланта.
Через неделю ежедневно начинают просматривать культуру под микроскопом.
Можно использовать как инвертированный, так и обычный микроскоп. В последнем
случае следует осторожно повернуть флакон, при этом стекла с культурой прили-
пают к боковой стенке флакона и могут быть исследованы при малом увеличении.
Вокруг кусочков вначале появляются единичные фибробласты, которые заметны в
виде длинных веретеновидных клеток, либо появляется слой эпителия, окружающий
фрагмент в виде "кружевного" ореола. При появлении зоны выроста клеток следу-
ет сменить среду. Когда клетки займут все пространство между кусочками (это
видно невооруженным глазом или при помощи лупы), их пересевают.
Пересев фибробластов человека
Материалы и оборудование
Флаконы с питательной средой, трипсин, покровные стекла, пипетки, препаро-
вальные иглы.
Пересевы производят для получения количества клеток, достаточного для цито-
генетического или биохимического исследования, а также для криоконсервации.
Клеточный штамм считают установившимся, если после пассирования в течение
первых 5 пассажей прирост клеток спустя 3-4 суток после пересева превосходит
количество посеянных минимум вдвое, что позволяет пересевать такие клетки в
отношении 1:2 (из одного сосуда в два).
Ход работы
Удаляют питательную среду из культурального сосуда и наливают 2-3 мл подог-
ретого 0.25% раствора трипсина (или смесь версен-трипсин). Через 2 минуты
удаляют трипсин, оставив его только между стеклами. Инкубируют в термостате
15-20 минут при 37°С. Ход трипсинизации можно контролировать, просматривая
культуры под микроскопом.
По окончании трипсинизации при помощи препаровальной иглы отделяют одно
стекло от другого и при помощи тонко оттянутой пипетки смывают клетки неболь-
шим количеством среды (1 мл). При этом несколько раз пропускают через пипетку
суспензию клеток и кусочки. Суспензию клеток переносят в пенициллиновый фла-
кон и добавляют среду до 2-3 мл. Оставшиеся в прежнем сосуде кусочки снова
укладывают между двух покровных стекол и заливают средой. От этих вторично
культивируемых эксплантов может быть получен второй "урожай" клеток.
Флакон с пересаженными растущими фибробластами просматривают ежесуточно под
микроскопом. Когда образуется слившийся слой клеток, производят второй пере-
сев (обычно через 4-7 суток).
Контроль штаммов
Ежедневный просмотр культуральных сосудов для оценки цвета среды и её про-
зрачности. Резкое изменение цвета и появление мути может свидетельствовать о
бактериальном или грибковом заражении. Если цвет индикатора среды не изменя-
ется после пересева или сдвигается в сторону малинового, это может быть свя-
зано с отсутствием размножения клеток, с недостаточным количеством для данно-
го объема или гибелью. При помощи инвертированного микроскопа оценивается
морфология клеток и слоя в целом.
В нормальных условиях фибробласты - веретенообразные вытянутые клетки с
прозрачной цитоплазмой. Отсутствие рисунка на субстрате (фибробласты обладают
ориентированным ростом), появление зернистости в цитоплазме, пустые места в
слое клеток, распластанность клеток свидетельствует об их дегенерации в ре-
зультате токсических или иных вредных воздействий. Небольшое количество среды
после каждого пересева отливают для проверки на стерильность, которую произ-
водят путем посева на агар.
Практика
РАЗВЕДЕНИЕ ПИВНЫХ ДРОЖЖЕЙ В ДОМАШНИХ УСЛОВИЯХ
Е. Свидерский
Довольно часто перед домашним пивоваром встает вопрос, где взять качествен-
ные пивные дрожжи. Сейчас достаточно много фирм предлагают сухие дрожжи низо-
вого брожения, которые великолепно подходят для домашнего пивоварения. Однако
их ассортимент в России очень ограничен. Как правило, дрожжи «интересных»
сортов привозятся из заграничных командировок. При этом их количества весьма
ограничены и без принятия соответствующих мер все расходуется за пару варок,
поэтому становится актуальна проблема размножения дрожжей дома.
Самый простой способ практически не требует усилий. Достаточно после броже-
ния собрать дрожжевой осадок в банку и хранить в холодильнике под слоем чис-
той воды. Однако при этом дрожжи очень быстро деградируют, в них попадают по-
сторонние бактерии и через пару варок их смело можно выбрасывать, ничего при-
личного с их помощью уже сбродить не удастся. Если хочется сохранить дрожже-
вую культуру надолго и с минимальными потерями качества, придется основатель-
но потрудиться.
Во-первых, очень возрастают требования к стерильности. Если маленькое попа-
дание посторонних бактерий в ферментатор обычно не фатально, то в данном слу-
чае оно способно сильно испортить ситуацию.
Для начала готовим питательную среду. Кипятим примерно 6-8% раствор Малтак-
са1 минут 15-20 до его стерилизации. Остужаем раствор, сливаем чистую жид-
кость от белковых хлопьев на дне. Кипятим еще раз, прямо в банке на водяной
бане (водяная баня - это обычная кастрюля, в которую налито сантиметров 5-10
воды), при этом простерилизуется как банка, так и жидкость. Охлаждаем банку в
закрытом виде. Дальше зажигаем газ, ставим банку рядом с огнем (сантиметров
5-10) , открываем крышку и стерильной ложкой (можно ее прокалить на том же га-
зу) взбалтываем Малтакс, чтобы немного насытить его кислородом. Огонь нужен
для того, чтобы создать восходящий поток воздуха. При этом есть гарантия, что
в процессе перелива никакая пылинка или злобная бактерия не упадут в нашу
банку сверху.
Засыпаем дрожжи, закрываем, но не герметично и ставим в темное место. Спус-
тя пару дней, не дожидаясь полного окончания брожения, необходимо поставить
банку в холодильник, чтобы остановить брожение. Ждем еще с день-два, дрожжи
оседают на дно. Аккуратно сливаем жидкость (совсем хорошо перед этим проте-
реть спиртом горловину банки и делать переливы у огня).
После этого промываем дрожжи. Для этого сливаем с дрожжевого осадка жид-
кость, наливаем чистую стерильную охлажденную воду, закрываем, взбалтываем, и
оставляем на день в холодильнике. Повторяем процедуру 2-3 раза.
Теперь дрожжевой осадок нужно поставить на хранение. Вариант попроще: на-
лить немножко воды (разумеется, прокипяченной, стерильной и охлажденной),
взболтать и разлить по стерильным баночкам, после чего хранить в холодильнике
примерно при плюс 5 градусах. Более продвинутый вариант - добавить в воду
процентов 10-15 глицерина и хранить в нулевой камере при температуре около
нуля. В первом случае срок хранения примерно месяца 2, во втором - около 4
месяцев, потом требуется процедуру размножения дрожжей повторить. Перед упот-
реблением дрожжи нужно разбраживать, т.к. их концентрация намного меньше, чем
в случае применения сухих дрожжей.
Разбраживать дрожжи желательно за день до варки пива. Для этого нужно про-
кипятить в баночке раствор Малтакса, как мы делали для размножения дрожжей.
Остудить и влить туда дрожжи из хранения. Перед этим их очень желательно по-
держать при комнатной температуре хотя бы час, чтобы перепад температур дрож-
жей и питательной среды был не более 10 градусов. Потом закрываем банку (не
герметично) и оставляем на ночь. На следующий день проверяем, появился ли в
банке характерный слой пены. Если нет, варку лучше отложить, т.к. все равно
полученное сусло нечем будет сбродить. Если же брожение началось, проводим
варку сусла и после его охлаждения вливаем в него содержимое банки с дрожжами
(перед переливом взболтать).
Если хочется еще продлить сроки использования дрожжей, придется потрудиться
дополнительно и провести очистку дрожжевой культуры от посторонних примесей,
которые туда все равно попадут, несмотря на все старания. Понадобится чашка
Петри (штуки 2-3). Готовим питательную среду. Для этого в вышеупомянутый рас-
твор Малтакса засыпаем желатин из расчета примерно 10-15% по массе. Тонким
слоем наливаем на чашку (разумеется, все стерильное и около огня). Накрываем
и ждем затвердевания. Разбавляем раствор дрожжей раз этак в 1000. Капаем кап-
1 Что это такое найти не удалось, но по смыслу это просто питательная среда для выращивания
дрожжей. Скорее всего, имеется в виду какой-нибудь фирменный концентрат солодового экстракта
(malt - солод). Самое лучшее использовать вместо него простерилизованное пивное сусло.
лю на застывший желатин, равномерно распределяем прокаленной ложкой, накрыва-
ем и оставляем. Потом разбавляем еще на порядок и еще на порядок, окучивая
оставшиеся чашки. Через пару дней на желатине прорастут колонии из попавших
туда клеток. Выбираем ту чашку, где эти колонии пространственно разделены
(при большой концентрации исходных дрожжей там сплошная каша будет). Дрожжи
там смотрятся как маленькие точки, а всякая бяка как маленькие мутные пятныш-
ки. Несколько точек соскребаем иголкой (опять все стерильное) и кидаем в не-
большой бутылёк с раствором Малтакса, там они слегка размножаются, после чего
переносим их в большую банку и продолжаем процесс2.
При выполнении этих мер вполне можно в домашних условиях получать чистую
дрожжевую культуру. Разумеется, это не самый простой путь, но разве кто-то
обещал легкую жизнь?
2 Несмотря на примитивизм, это чисто микробиологическая техника работы. Остается только до-
бавить , что дрожжи для лагера могут расти при низких температурах, в холодильнике, а именно
там желатиновое желе сохраняет свое твердое состояние.
Практика
ЖАРИМ ЗЕРНО ДОМА
Г. Сандерс и С. Лэсей
ЗАЧЕМ1?
В дебрях Северного Куинсленда1 2 просто полным-полно тропических фруктов, но
ни одной солодовни, сколько ни кричи «куи!»3. На заре пивоварения считайте,
что Вам повезло, если удавалось достать хотя бы солод Schooner4. И когда это
случалось, он был столь же свежим, как и проеденный червями кенгуру. Вот то-
гда то я и начал экспериментировать. Быстрая обжарка этого зерна в духовке
приводила самое несвежее зерно хотя бы в более-менее приличное состояние.
С годами обстоятельства менялись к лучшему, стал появляться кристаллический
солод, а также свежий солод Schooner. Все бы ничего, да у нашего кристалличе-
ского были (и до сих пор еще остаются) неизвестно какие характеристики и
цветность. Сегодня предлагается довольно хороший ассортимент, хотя практиче-
ски невозможно заполучить специальное зерно, такое как Special В, копченый
или коричневый солод, а поставки других видов солода в лучшем случае неста-
бильны .
1 Имеется в виду солод. Чтобы придать пиву темный цвет при Затирании добавляется какое-то
количество тесного, обжаренного солода.
2 Тропический Северный Куинсленд (Квинсленд) - один из самых красочных регионов мира, распо-
ложен в Австралии.
3 "Куу-и!" (возглас австралийских аборигенов, широко употребляемый и англо-австралийцами,
аналог «ау», «эй»), а вовсе не то, что вы подумали.
4 Солод Schooner, особенно выпускаемый для внутреннего рынка, был не самого высокого качест-
ва, в частности из-за невысокой ферментативной активности.
Поэтому для меня, домашняя обжарка основывалась на необходимости. Но также
она обладает одним преимуществом, которое многие пивовары-цеховики на самом
деле упускают. Это все равно, что покупать свежеиспеченный или суточной хлеб,
разница ЧУВСТВУЕТСЯ. Так что, испытываете ли Вы трудности с поставками жаре-
ных солодов или просто хотите попробовать добавить особую нотку в ваше пиво,
Вы можете прийти к выводу, что Вам действительно хочется попытаться пожарить
солод дома.
КАКОЕ ОБОРУДОВАНИЕ ПОНАДОБИТСЯ?
Всего лишь духовка, термометр для духовки и противни. Вот теперь можно было
бы купить ртутный стеклянный термометр, который меряет до 300°С, но есть ва-
риант намного дешевле. Зайдите в какой-нибудь магазин для кулинаров и поищите
плоский металлический термометр для духовки. Они, может быть, не очень точ-
ные, но достаточно хороши для рассматриваемой работы, и довольно дешевы. С
ними можно работать в горячем виде, их можно ронять, швыряться ими в гневе,
они идеальны.
Обычные термометры также могут подойти, но они должны быть в состоя-
нии выдерживать высокие температуры. У меня есть ртутный термометр,
который выдерживает до 350°С. Главный их недостаток в том, что на них
непросто прочитать показания и когда достаешь их из духовки, они очень
горячие. Это верный способ их разбить.
"Зачем термометр?" спросите Вы. "У меня чудесная духовка, я могу на-
строить на ней нужную температуру, местную радиостанцию и даже поймать
полицейскую частоту". Ну, эти шкалы редко бывают точными, а датчик на
самом деле находится на стенке духовки, а не на самом зерне. Вам нужно
мерить температуру на поверхности зерна. Вот где также хорошо подойдут
эти металлические термометры. Вы можете положить их сверху на зерно, и
следить через окно вашей духовки за температурой зерна.
Разберитесь с Вашей духовкой, Вы должны знать, что в ней происходит на са-
мом деле. Установите ваш поднос примерно посередине и выставите регулятор на
100°C. Пронаблюдайте, когда температура стабилизируется, проделайте это снова
скажем при 150°С и так далее. Обратите внимание, какие изменения происходят с
температурой. А также посмотрите, как различная высота, на которую устанавли-
вается противень, влияет на изменение температуры.
Так, что же Вам нужно? Две вещи.
1. Вам нужно узнать, что на самом деле нужно выставить на ручке-регуляторе,
чтобы получить требуемую температуру.
2. Вам нужно добиться минимальных колебаний температуры. Многие духовки
имеют так называемые «горячие пятна», их нужно избегать. Обычно следует уста-
новить поддон(ы) посередине духовки.
Вам также понадобится противень для зерна. Идеально подойдет что-нибудь та-
кое, во что можно было бы насыпать слой примерно в один дюйм толщиной. Если
он не совсем чист, выложите его алюминиевой фольгой.
ПРОЦЕСС
То, что происходит на солодовне, на самом деле довольно простой процесс. В
основном, как только ячмень прорастает, происходит одна из двух следующих ве-
щей :
1. Ячмень сушат и затем жарят. Чем дольше Вы его жарите, и чем выше темпе-
ратура , тем зерно получается темнее. Привожу базовые солода. В порядке повы-
шения цветности это pilsener, пэйл, венский, мюнхенский, янтарный, бискит,
коричневый, шоколадный, темный (или могут быть похожие названия); либо
2. Ячмень оставляют влажным и жарят. Опять же, чем дольше и горячее жарите,
тем темнее результат. Таким образом Вы получаете карамельный солод. Опять же
в порядке повышения цветности: carapils, caravienna, caraMunich, различные
кристаллические солода, специальный В.
Существует еще пара других вариантов. Прокоптите зерно, и Вы получите rauch
(раух) солод, опять же обжарка просто сырого ячменя добавит пиву дополнитель-
ный вкус. Жарьте его до тех пор, пока он не станет черным, и у Вас будет жа-
реный ячмень для стаута. Зачем же останавливаться на ячмене, чем не подходит
пшеница или рожь? Варианты бесконечны.
На этой фотографии показано, что Вы можете жарить зерно даже в
микроволновой печи, если в ней установлен специальный датчик.
Обратите внимание, преимущество здесь за простым металлическим
термометром для духовки. Он легко читается, и его не нужно уби-
рать. Он показывает 130°С, в то время как я поджариваю кристал-
лический солод.
Но давайте рассмотрим основные солода. Все они в основном происходят от од-
ного из базовых солодов, pilsner и carapils5. То, что солодовник делает с ни-
ми впоследствии, определяет конечный продукт. То есть, Вы можете взять
carapils и сделать Belgian special В (бельгийский специальный В) , если Вы
знаете, как этого добиться. Но Вы можете также использовать кара-мюнхенский и
сделать специальный В. Фактически, пока Вы идете "по линейке вверх", Вы може-
те сделать любой солод из более светлого. Так какие же солода мне нужно иметь
дома, из тех которые понадобятся. Можно обзавестись pilsener солодом, как им-
портным, так и отечественным. Он не дешевый, даже если берете оптом, и он
особенно хорош для светлых континентальных лагеров. Поэтому я его оставляю,
чтобы использовать самому. Дальше идет пэйл солод (обычно Schooner). Теперь
это солод для пивзаводов-гигантов, который производится в промышленных мас-
5 Не будем Забывать, что речь идет об Австралии. Кстати самое плохое пиво делается именно
там, наверное потому что жарко.
штабах. Он не столь же хорош, как и pilsener солод, мне кажется, он слегка
декстриновый, но он хорошо модифицированный, дешевый и легкодоступный. Это
мой любимый солод для получения обычных жареных солодов. У меня с ним нет
проблем при получении из него солодов вплоть до шоколадного.
Для карамельных солодов я использую темный carapils (или очень светлый ка-
ра-венский, выбор за Вами). Я предпочитаю темноватый carapils, чтобы гаранти-
ровать наличие в нем карамельного вкуса. Из него я без проблем получаю все
виды карамельного солода, даже бельгийский Специальный В.
Так каковы же методы, которыми мы можем воспользоваться, чтобы пожарить
свое зерно. Один метод, который я не одобряю, носит название "быстрый и рез-
кий" . При этом методе Вы производите сильный нагрев за короткий промежуток
времени. Метод прекрасно работает, зерно жарится очень быстро. Но я его тер-
петь не могу, потому что на самом деле он не соответствует тому, что происхо-
дит на солодовне, он не дает однородного результата, используя его слишком
легко все испортить, и Вам необходимо почти постоянно перемешивать солод во
избежание появления горячих пятен и горения. НО, этот метод действительно по-
зволяет Вам в критической ситуации быстро получить немного жареного зерна.
Его стоит попробовать, когда больше уже ничего не поделаешь, но я не собира-
юсь распространяться на эту тему.
ШАГ ЗА ШАГОМ
На самом деле в этом нет ничего сложного. Все, что Вам нужно сделать, это
выставить нужную температуру и дать духовке прогреться. Тем временем на под-
носе разложите зерно толщиной примерно в дюйм6. Не кладите слишком много.
Лучше сделать несколько партий, чем выложить зерно более толстым слоем. Тер-
мометр положите на зерно, и поставьте его в духовку. На прогрев зерна до нуж-
ной температуры понадобится около двадцати минут (в зависимости от духовки).
Не ВКЛЮЧАЙТЕ таймер, пока все Зерно не прогреется до нужной температуры. Бы-
стро перемешайте и включите таймер.
Фотография закрытой дверцы духовки. Хотя на фотографии не очень
хорошо видно, преимущества такого типа термометра очевидны. Нет
необходимости открывать дверь духовки. Вы можете легко прочитать
показания температуры через окошко.
Все, что Вам остается теперь делать, это перемешивать каждые полчаса, пока
не будет готово. Ну, пока что все и ёжику понятно. Если Вы используете больше
6
2,5 см.
одного поддона, неплохо, если они при этом бы еще и вращались. Так, что за
зерно, сколько времени и какая температура. Потребуется немного поэксперимен-
тировать в зависимости от вашей духовки, но чтобы все то, что Вы делаете, по-
лучилось , нужно достать образцы промышленного солода для сравнения их между
собой (если получится). На самом деле Вы удивитесь, насколько близкий резуль-
тат у Вас может получиться. Но что делать, если нет никаких образцов. Тогда
Вы примерно соблюдаете температурные режимы, принятые на солодовнях.
Если Вы не особенно любознательны и хотите копировать то, что делает кто-то
еще, тогда я скажу Вам температуры, которые использую я.
ОБЫЧНЫЕ СОЛОДА - ПЭЙЛ СОЛОД В КАЧЕСТВЕ ОСНОВЫ (НАПР., SCHOONER)
Дортмундский 95°С 1 час
Венский 100°С 1 час
Светлый мюнхенский 105°С 1-2 часа
Темный мюнхенский 110°С 1-2 часа
Янтарный/Amber 140°С 1 час
Biscuit от 150 до 170°С до 1 часа (в зависимости от вкуса, который нужно получить)
Коричневый/Brown 180°С до получаса
Шоколадный/Chocolate 200°С до 1 часа
При жарке сырого ячменя мне нравится подержать его 45 минут при 190°С, За-
тем 30 минут при 230°С, или пока 10 % зерен не станут очень темными, а 10 %
светло-коричневыми. Вы заметите, что чем сильнее нагрев, тем фактор времени
становится более гибким. Это происходит оттого, что при более низкой темпера-
туре можно не заметить, что имеют место значительные изменения, в то время
как они действительно происходят. При более высокой температуре Вы заметите,
что изменения происходят довольно быстро, и Вы даже можете определить цвет
вашего солода. Поэтому, если в Вашем рецепте уже заложено много темных доба-
вок, Вы делаете свой жареный солод более светлым. Ну и конечно, если рецепт
предполагает светлый цвет, Вы также можете сделать его более темным. Все это
замечательно подходит для создания рецепта.
Существует один фокус, позволяющий добиться наличия в венских и мюнхенских
солодах вкусных меланоидинов. Я обнаружил что, если зерно предварительно не-
много увлажнить приблизительно на час, часть сахара выступает на поверхности.
В течение сушки он снова высыхает, но смачивание способствует появлению до-
полнительного цвета, но что еще более важно, лучшей выработке меланоидинов.
Для получения раух (rauch) солода я также немного сильнее увлажняю зерно и
копчу его в горячем дыму. Поглощенный солодом аромат дыма получается намного
сложнее и насыщенней (поэтому я могу использовать гораздо меньше).
Ну а теперь, что же нам делать с карамельными солодами? Ну, если Вы их не-
много увлажните, то сохраните ту самую карамельную образующую, таким образом
Вы можете получить собственный кара-венский, кара-мюнхенский и бельгийский
специальный В солода. Пожарите их без увлажнения, и Вы получите очень хорошую
замену кристаллическому солоду.
НАЧИНАЕМ С БОЛЕЕ ТЕМНОГО КАРАПИЛСА ВСЕ ТЕМПЕРАТУРНЫЕ РЕЖИМЫ ОКОЛО 12ОС
Cara-Vienna ДО 1 часа
Cara-Munich 1-2 часа
Светлый crystal 1-2 часа
Темный Crystal 2-3 часа
Special В 2-3 часа
Теперь последний совет. Я всегда жарю зерно накануне его использования. Это
как раз тот самый синдром свежего хлеба. Чем свежее, тем лучше. На самом деле
я делаю исключение для своего "беспощадного" раух солода. Я даю ему провет-
риться несколько недель, с тем, чтобы из него ушли некоторые наиболее летучие
вещества. Солод получается мягче. Существует также противоположное мнение, из
которого следует, что любому солоду домашней жарки необходимо дать "полежать"
неделю-другую для "созревания". Само собой разумеется, я не подписался на эту
теорию, но, честно говоря, Вы должны понимать, что некоторые люди верят это-
му, и Вы вольны сами для себя все решить.
Ну, вот, пожалуй, и все. Ваш выход!
Технологии
ЭЛИ БОЧКОВОГО СОЗРЕВАНИЯ
Д. Буш
Англия имеет много отличительных особенностей, которые внесли свой вклад в
мир пивоварения, но ни одна из них не отличается той же уникальностью и важ-
ностью как традиция производства элей бочкового созревания. Бочковой, или как
его часто называют, риэл эль является специальным пивом, которое подается
особым образом, при помощи ручного насоса из подвала. Несмотря на то, что
Вам, возможно, рассказывали в Соединенных Штатах, бочковой эль не теплый и не
без газа. Его разливают при температуре подвала, от 54 до 59 градусов F (от
12 до 15 градусов С), и естественно, хоть и слегка, но он газированный. В ре-
зультате, по палатальным ощущениям (mouthfeel) он отличается от "газированно-
го" пива из кега.
Температура и карбонизация оказывают большое влияние на вкусовое восприятие
пива, и комбинация подвальной температуры, низкого содержания С02 и зачастую
резкого хмельного аромата и вкуса - все это смешивается во рту - и выявляет
совершенно особый и приятный эль. В то время как весь спектр бочковых элей
обобщить довольно нелегко, карбонизация, температура, степень охмеления и
продукты брожения обычно являются определяющими факторами во вкусовом воспри-
ятии всех бочковых элей. Многие бочковые эли обладают многочисленными фрукто-
выми нотками, которые рождаются в ферментере и постепенно ослабевают и пере-
мешиваются в процессе созревания и выдержки. Важным моментом является то, что
они должны присутствовать и то, что они проявляют себя в различной степени
сложности на протяжении всего нахождения в бочке. Одним из замечательных ас-
пектов бочкового эля является то, что это пиво живет, дышит, и оно изменится
за неделю или около того в промежутке между шпунтованием или закупориванием и
последним движением ручного насоса.
ПРОИЗВОДСТВО БОЧКОВЫХ ЭЛЕЙ
Бочковые эли, изготавливаемые в Англии, являются пивом верхового брожения,
часто производимым в открытых ферментерах. Открытые ферментеры - это то, что
и кажется - емкость без верхней части. Ферментеры часто представляют собой
большой цилиндр с навесной крышкой. Многие из них терморегулируются (охлажда-
ются) при помощи системы труб, которые погружены в бродящее сусло. Через тру-
бопровод прокачивается охлажденная вода или охлажденный гликоль, что позволя-
ет пивовару контролировать температуру в процессе брожения.
В то время как закрытые танки используются на некоторых более крупных пиво-
варенных заводах, открытые ферментеры являются традиционной практикой, и не-
которые известные пивзаводы полагаются на старые системы открытого брожения
Burton Union и Yorkshire Squares.
Оба типа этих открытых бродильных аппаратов разработаны таким образом, что
бродильному оттеку или кройзену (kraeusen, шапка бродящей пены*) дают вытечь
из ферментера в сборный резервуар, затем его удаляют или возвращают в главный
ферментер. Эта техника обычно способствует тому, что в ферментер поступает
дополнительный кислород, что в свою очередь приводит к слегка повышенному
уровню диацетила в пиве. Обычно это не является отрицательным моментов для
данного пива. Использование открытого брожения может показаться странным пи-
воварам, которые идут на все, лишь бы не допустить воздушного заражения, но
это не является причиной для беспокойства в английском пивоварении. Как и все
пивовары, английские элевые пивовары очень внимательны в вопросах санобработ-
ки всего, что контактирует с полученным суслом, особенно, когда его темпера-
тура становится ниже 170 градусов F (76.5 градусов С). Чистый и продезинфици-
рованный ферментер в сочетании с чистыми, здоровыми дрожжами, заданными в ко-
личестве от 6 до 12 миллионов клеток на миллилитр, обеспечит быстрое начало
брожения, и соответственно выработку большого количества СОг, который покроет
бродящее сусло, и таким образом защитит пиво от витающей в воздухе инфекции.
Как только брожение активизируется, pH пива быстро понизится с начального
уровня, который равен 5.0, где-то до середины диапазона, составляющего 4, а
при использовании некоторых рас, вплоть до 4.1. Это подкисление сусла наряду
с большим образованием СО2 приводит к возникновению среды, весьма неблагопри-
ятной для большинства бактерий, находящихся в воздухе. Главное, и это отно-
сится ко всему пивоварению, состоит в том, чтобы внести достаточное количест-
во чистой, здоровой суспензии дрожжевой культуры.
Используя открытые бродильные аппараты, пивовар должен снимать с пива дрож-
жевую шапку между вторым и третьим днем нормального брожения. То, что подни-
мается на поверхность после первого дня, удаляется с целью уменьшения количе-
ства твердых частиц, которые могут привести к возникновению проблем с терпко-
стью. Использование открытых ферментеров обеспечивает легкий способ наблюде-
ния и выполнения требований по снятию пены в элях верхового брожения. При ис-
пользовании обычных рас верхового брожения, здоровые белые дрожжи собирают на
третий или четвертый день брожения и сохраняют их для повторного использова-
ния .
Дрожжи, собранные в процессе здорового брожения, могут быть повторно ис-
пользованы на протяжении сотен поколений, при условии, что на пивзаводе со-
блюдается чистота, а пивовар внимательно следит за характеристиками брожения.
Любое ухудшение работы дрожжей должно быть исправлено заменой штамма свежим.
Брожение обычно завершается за пять-семь дней при температуре от 60 до 70
градусов F (от 15.5 до 21 градуса С). После этого пиво переливают в танки для
выдержки, где оно может находиться, проходя непродолжительный период созрева-
ния. В качестве альтернативы, негазированное пиво можно перелить непосредст-
венно в бочку. Важным моментом является то, что перелив необходимо произво-
дить так, чтобы в негазированном пиве оставалось бы около 1° Плато (1.004)
остаточного экстракта, количество дрожжевых клеток составляло бы от 0.25 до 2
миллионов на миллилитр негазированного пива. Остаточный экстракт также может
быть обеспечен в виде праймер-сахаров. Это достигается путем приготовления
раствора пивоваренного сахара (глюкозы) плотностью 1.150 (34 ° Плато) и до-
бавления его в бочку в количестве от 0.35 до 1.75 литра на гектолитр. Также
может быть использован оттек сусла или кройзен пиво, но в последнем случае,
чрезмерное количество дрожжевых клеток может помешать процессу осветления в
бочке.
Когда бочки будут заполнены, в емкость добавляют осветлитель, обычно в фор-
ме рыбьего клея (isinglass) в количествах от одного до пяти литров на британ-
ский баррель. Isinglass состоит из коллагеновых молекул, которые обладают об-
щим положительным зарядом. Поскольку дрожжи имеют общий отрицательный заряд,
в результате образуется электростатическое притяжение, которое приводит к
слипанию дрожжей и частиц рыбьего клея, а затем к выпадению их в осадок. В
процессе осветления понадобится около суток для достижения "отменного блеска"
пива. Пиво с остаточным уровнем дрожжей от 2 и более миллионов клеток на мил-
лилитр осветлить будет сложнее. Многие пивовары в момент наполнения бочки
также добавляют хмель в виде шишек в количестве от половины до трех унций на
баррель. С появлением современных способов тарирования, таких как бочонки
polypin, некоторые пивовары стали использовать экстракты хмелевого масла для
того, чтобы имитировать некоторые характеристики, присущие элям с бочковым
охмелением. Теперь бочковой эль можно отправлять в подвал бара.
СОЗРЕВАНИЕ БОЧКОВЫХ ЭЛЕЙ
После того, как бочка отправлена в местный паб, работа по окончательному
созреванию пива уже не является прямой ответственностью пивовара. Эта задача
возлагается на владельца бара или погребного мастера (cellarmaster). В старые
времена в обязанность погребного мастера входило добавление осветлителей в
бочки по прибытии их с пивзавода, но сегодня это не принято. После доставки в
паб бочку помещают на стеллаж и дают ей отстояться два-три дня. В это время в
бочке происходит вторичное брожение, или бочковое созревание. За день перед
началом использования, бочку нужно подготовить для розлива. Это делается пу-
тем вбивания твердой пробки (непористой деревянной втулки) в шпунт (круглое
пробочное устройство на верхней части бочки или эквивалент затычки на старых
американских кегах). Втулка - это по существу примитивный СОг клапан, непо-
ристая втулка используется для закрывания бочки на ночь на хранение, в то
время как пористая втулка используется при розливе, впуская воздух и позволяя
пиву вытекать при помощи пивного насоса. Когда втулку первый раз вколачивают
в бочку, погребной мастер дает углекислому газу выйти из бочки, предотвращая
таким образом повышение уровня СОг, который не приветствуется любителями риэл
эля. Заключительный шаг в подготовке бочки к использованию состоит в забива-
нии крана в keystone (собственно отверстие, через которое "выходит" пиво).
Как минимум сутки потребуются для отстаивания, чтобы получить гарантию, что
процесс подготовки не взболтал слишком много дрожжей. На следующий день, по-
гребной мастер попробует пиво, чтобы определять, что оно готово. Это чрезвы-
чайно важная часть процесса и основная причина, почему многие бочковые эли не
подаются при наступлении своего вкусового пика. Некоторому пиву требуется не-
много больше времени, чем другим, для достижения этого максимума.
РОЗЛИВ БОЧКОВЫХ ЭЛЕЙ
Когда погребной мастер решит, что новая бочка готова к розливу, подсоединя-
ют линию розлива пива, которая соединяет бочку и устройство beer engine. Beer
engine - это всего лишь причудливый ручной насос, который "тянет" пиво из
бочки. По мере того, как пиво уходит из бочки, воздух просачивается через по-
ристую втулку. По этой причине бочковые эли лучше всего в первые несколько
дней розлива, и известны тем, что становятся все более и более непригодными
для питья после трех или четырех дней. Окисленное пиво в любой стране не
очень приятно, и бочки, которые простояли слишком долго, демонстрируют силь-
ный эффект окисления. В попытке противостоять некоторым отрицательным послед-
ствиям окисления, пивовары и владельцы баров изобрели несколько методов вве-
дения СОг в бочку. Наименее спорным является метод создания защитного слоя из
углекислоты, когда в бочку впрыскивается чрезвычайно малое количество (от 1
до 2 psi) С02 газа. Поскольку С02 тяжелее воздуха, он образует "покров" над
пивом, определенным образом защищая его от кислорода.
Другой метод использует собственно емкости с СОг для выталкивания пива, и
для вытягивания пива из бочки также используются механические насосы. Привер-
женцы традиций презирают любые способы применения СОг для сохранения качества
пива, пытаясь убедить, что все они в результате приводят к получению какого-
то "газированного" пива. Кампания за Риэл Эль (CAMRA) является наиболее не-
преклонной в том, чтобы риэл эль разливался только при помощи beer engine без
применения "покровного" давления.
С этой целью, CAMRA отказывается указывать в ежегодно издаваемой бесценной
книге "Гид хорошего пива" (Good Beer Guide) те пабы, где используются СОг
системы. В то время как CAMRA. так замечательно придерживается традиций, воз-
можно, нереально будет ждать от самых маленьких пабов в самых удаленных мес-
тах, чтобы они могли заботиться о бочковых элях точно также, как это делается
в более оживленных пабах.
Если применяется бочковое охмеление, используют небольшое устройство типа
сита, чтобы хмель оставался в бочке и не попадал в чей-нибудь стакан. На кон-
це раздаточного крана используется распыляющее устройство, заставляющее пиво
проходить через несколько небольших отверстий, что приводит к выбросу газа в
пиво и стакан и к образованию густой пены. Бочковые эли также могут разли-
ваться непосредственно из бочки самотеком. При таком способе бочку устанавли-
вают таким образом, чтобы выпускное отверстие смотрело вниз. Открыв кран и
воздушный вентиль, пиво будет литься из бочки самотеком. Если при данном ме-
тоде используется сода-кег, погружную трубку для жидкости необходимо удалить
или значительно обрезать. Это отличный способ розлива качественного пива, ес-
ли пиво будет выпито за один вечер.
СОВЕТЫ ПИВОВАРАМ
Производство бочковых элей не особенно отличается от производства обычного
домашнего пива. В обоих случаях, пиво газируется естественным способом в за-
крытом сосуде. Главное отличие в количестве образующейся карбонизации. Обыч-
ные эли и лагеры газируются приблизительно до 2.5 объемов СОг, в то время как
для бочковых элей эта цифра приближается к 1.5 -1.75 от объема. При изготов-
лении бочковых элей существует 2 способа, которым можно следовать:
(1) Дайте брожению закончиться, затем добавьте небольшое количество сбражи-
ваемого сырья.
(2) Тщательно контролируйте брожение, и когда конечная плотность будет в
пределах 1° Плато, закупорьте бочку. Этот способ предпочтительней, но осуще-
ствить его может быть не так легко, потому что пивовар довольно точно должен
знать, какой будет конечная плотность. Эта метод можно упростить, если ис-
пользовать для розлива сода-кег из нержавеющей стали, и внимательно стравли-
вать избыток давления, когда бочонок будет насыщаться газом.
Использование осветлителей может стать еще одним дополнительным усилием, и
многие домашние пивовары могут не захотеть с этим связываться. В этом случае,
убедитесь, что Вы используете дрожжи, которые известны своими превосходными
флоккуляционными свойствами. Если осуществляется бочковое охмеление, следует
использовать только свежий шишковой хмель или цельный прессованный хмель
(plugs). Поместите хмель в проницаемый мешок, используйте продезинфицирован-
ный груз, чтобы мешочек опустился на дно бочки. Если Вы собираетесь подавать
пиво как настоящий бочковой эль, можно использовать подачу самотеком, но в
идеале бочка должна быть опустошена за один вечер.
Исторически, индийский пэйл эль имел значительно более высокую первоначаль-
ную плотность, но по своему опыту я знаю, что сегодня она снизилась до 1.035
- 1.045, и это просто более сильно охмеленная версия биттера. Крепкие эли
можно найти даже со столь "низкой" первоначальной плотностью, как 1.051, но
часто они имеют плотность в районе 1.062. Обратите внимание, что, несмотря на
относительно низкое содержание спирта по объему у всех типов пива, кроме
крепкого эля, это пиво имеет много несброженных веществ, которые придают боч-
ковым элям богатое тело и полноту вкуса. Несброженные вещества состоят глав-
ным образом из декстринов, которые нормальные дрожжи не могут усвоить. Эти
декстрины переходят в неизменном виде в готовое пиво. Использование карамель-
ных солодов (обычно называемых кристаллическим солодом) всегда увеличивает в
пиве количество несбраживаемых веществ. Карамельные солода обычно используют-
ся при производстве бочкового эля. Многие пивовары делают сусло с первона-
чальной плотностью 1.055 или выше и растворяют его в ферментере, добавляя ки-
пяченную охлажденную воду, чтобы получить первоначальную плотность 1.035. Ис-
пользуя этот способ, определенная степень карамелизации может быть достигнута
при варке в котле, что может положительным образом сказаться на вкусовых при-
знаках .
СЛОВАРЬ ТЕРМИНОВ
Burton Unions - Классическая техника брожения, при которой дрожжевой оттек
из ферментера собирается в сборном танке, а затем повторно возвращается назад
в ферментер.
Isinglass (рыбий клей) - оклеивающее вещество, изготавливаемое из перерабо-
танных плавательных пузырей рыбы, в основном осетра. При использовании твер-
дого осветлителя isinglass, добавьте от 30 до 60 миллиграммов на литр. Пере-
мешивайте одну минуту с обеспложенной водой, дайте постоять, снова перемешай-
те, и дайте отстояться, затем добавляйте. Нормы внесения меняются в зависимо-
сти от плотности, состава солодовой засыпи и технологического процесса. Про-
ведите небольшой тест, чтобы определить производительность клея в вашей сис-
теме. Isinglass также используется в баках для созревания в количестве двух
унций на один галлон или, грубо, в 2 процентной концентрации.
Осветлитель (оклеивающие вещества, клей) - материалы, которые помогают ос-
ветлить эли бочкового созревания. Включает isinglass, желатин, а при необхо-
димости удаления белка, алгинол (alginol) (отрицательно заряженные полисаха-
риды) .
Остаточный экстракт - не следует путать с конечной плотностью, остаточный
имеет отношение к количеству сбраживаемых веществ, оставшихся на определенный
момент. Эти сбраживаемые вещества будут переработаны дрожжами во взвешенном
состоянии по прошествии определенного времени.
Стеллаж - деревянное устройство, используемое для установки на нем бочки,
приготовленной для розлива.
Конечная плотность - окончательная плотность пива, измеренная после того,
как все сбраживаемые вещества были использованы дрожжами.
Пиво верхового брожения - пиво, сброженное путем применения дрожжевых штам-
мов верхового брожения, Saccharomyces cerevesae. Дрожжи этого класса обычно
сбраживают сусло, действуя у поверхности ферментера, и поднимаются на поверх-
ность в конце брожения.
Несбраживаемые вещества - это в основном декстрины, которые нормальные пи-
воваренные дрожжи не могут переработать. В результате, эти "бодибилдеры"
(строители тела) переходят в готовое пиво и привносят сладость, тело и полно-
ту вкуса. Несбраживаемые вещества можно грубо подсчитать по конечной плотно-
сти. Пиво, которое имеет первоначальную плотность 1.040 и конечную плотность
1.010, имеет 10/40 несброженных веществ или 25 процентов.
Yorkshire Squares - Классические квадратные ферментеры, изготовленные из
сланца, на пивзаводе Samuel Smith brewery. Yorkshire Squares состоят из чаше-
видных сланцевых устройств, которые расположены выше ферментеров, что позво-
ляет собирать дрожжевой оттек для его удаления или, если его оставляют, для
повторного внесения в ферментер.
Технологии
УКСУС
ЧТО ЭТО ТАКОЕ И КАК ЕГО ДЕЛАЮТ
Н. КУСТОВА
Множество блюд в кухнях разных народов мира невозможно приготовить без ук-
суса. Не обойтись без него в заготовках, да и в качестве простой приправы ук-
сус подают ко многим кушаньям. Изготовление уксуса, как и виноделие, один из
древнейших технологических процессов, освоенных человеком. Но если в произ-
водстве вина за последние несколько тысячелетий не произошло принципиальных
изменений (использование современного оборудования не в счет), то в производ-
стве уксуса в 70-х годах XX века случилась настоящая революция.
Начнем с того, что главным компонентом пищевого уксуса является уксусная
кислота. Получать ее можно двумя способами: химическим - из продуктов сухой
перегонки древесины и микробиологическим - в результате уксуснокислого броже-
ния спиртосодержащих жидкостей, таких, как виноградное вино, сидр, пивное
сусло, забродившие мед и соки различных фруктов или водный раствор этилового
спирта (С2Н5ОН). В таких жидкостях окисление этанола до уксусной кислоты про-
водят в большинстве случаев уксусные бактерии Acetobacter aceti. В результате
в готовом продукте оказывается не только кислота, но и небольшое количество
сложных эфиров, альдегидов и других органических соединений. Именно благодаря
этим веществам пищевой уксус обретает присущий ему особый вкус и приятный
аромат. Разведенная же водой уксусная кислота, полученная химическим путем,
лишена таких качеств. Считается, что в пищевой промышленности и в быту лучше
использовать уксус, изготовленный биохимическим способом.
Технология производства уксуса имеет интересную и сложную историю. Еще в
первом тысячелетии до новой эры виноделы заметили, что, если вино оставить в
открытом сосуде, оно через некоторое время прокисает и превращается в уксус.
Этим наблюдением и пользовались долгое время, не вдаваясь особенно в суть то-
го, что происходит при этом с продуктом.
Один из самых "древних" способов производства уксуса принято называть орле-
анским. В деревянные бочки особой формы, расположенные в утепленном помещении
в несколько рядов одна над другой, в начале процесса заливают 10-12 л готово-
го нефильтрованного уксуса. Эта порция - своего рода закваска, ведь в не-
фильтрованном уксусе содержится достаточно большое количество бактерий. К ук-
сусу приливают примерно 10 л профильтрованного вина. Через восемь дней, если
процесс идет нормально, доливают еще 10 л, и так до тех пор, пока бочка не
заполнится до половины объема. После этого около 40 л готового продукта сли-
вают, а к оставшемуся - вновь добавляют фильтрованное вино, и цикл повторяет-
ся1 . Весь цикл занимает от недели до месяца, зато продукт обладает таким вы-
соким качеством, что этот неэффективный способ до сих пор применяется в вино-
дельческих районах Франции.
Наряду с орлеанским способом существовал метод, описанный немецким ученым
Бургавом (Boerhave) в 1732 году. Сейчас эта технология известна под названием
"метод Шуценбаха". Суть его в том, что спиртосодержащую жидкость (в описании
Бургава упоминается раствор хлебного спирта) пропускали сверху вниз через
объем, заполненный тщательно вымоченными в уксусе крупными буковыми стружка-
ми. Эта технология оказалась значительно более производительной, чем орлеан-
ский способ, и во всем мире она используется до сих пор1 2.
И все же до работ Пастера в середине XVIII века не было понятно, за счет
чего вино превращается в уксус. Пастер в большой статье "Исследование свойств
уксуса" ("Etude sur le vinaegre") показал, что стерильный раствор спирта в
воде на открытом воздухе практически не окисляется, а образование уксусной
кислоты происходит благодаря работе уксусных бактерий. И для того, чтобы
спирт окислялся эффективно, в жидкости необходимо создать оптимальные условия
для их развития. Оказалось, что лучше всего эти микроорганизмы чувствуют себя
при температуре около 30°С и при концентрации спирта, не превышающей 12-14%.
Дальнейшие (уже современные) исследования показали, что максимальная скорость
роста A.aceti достигается при более низкой концентрации спирта. Характерной
особенностью этих бактерий является и высокая потребность в кислороде. Долгое
время считалось, что из-за сравнительно низкой растворимости кислорода в воде
(и в растворе этилового спирта тоже) бактерии могут развиваться только на по-
верхности жидкости или в ее тонкой пленке. Это не противоречило и имевшемуся
к тому времени промышленному опыту. При орлеанском методе бактерии развивают-
ся в основном в верхнем слое жидкости в виде слизистой пленки, а при методе
Шуценбаха жидкость стекает тонким слоем по поверхности стружек (рис. 1). Про-
изводительность аппаратуры, что по одному, что по другому способу, обычно со-
ставляет от 2 до 8 кг 100%-ной уксусной кислоты с 1 м3 объема аппарата в су-
тки .
1 В теории культивирования микроорганизмов, это называется отьемно-доливным культивировани-
ем.
2 Иммобилизация клеток микроорганизмов. «Ничто не ново под луной».
Рис. 1. Аппарат Шуценбаха:
1 - деревянная коническая емкость;
2 - слой буковых стружек.
Основным аппаратом, в котором получают уксусную кислоту по методу Шуценба-
ха, является деревянный чан конической формы. На расстоянии 200-300 мм от ос-
новного днища в нем устанавливают горизонтальную перфорированную перегородку.
Верхняя часть аппарата на 2/3 заполняется стружками, которые орошаются пита-
тельной для бактерий средой, содержащей некоторое количество уксусной кислоты
(чаще всего это 6%-ный раствор), этиловый спирт (3-4%) и небольшое количество
аммонийных и фосфатных солей. По мере протекания раствора бактерии, закрепив-
шиеся, или, как теперь принято говорить, иммобилизованные на стружках, окис-
ляют спирт в уксусную кислоту. В нижней части аппарата скапливается готовая
продукция - 9%-ный уксус. В процессе окисления выделяется тепло, которое по-
вышает температуру внутри аппарата до 30-35°С. В результате разницы темпера-
тур создается естественная и довольно интенсивная конвекция. Воздух поступает
в патрубки под ложным днищем, проходит через аппарат и выходит в верхней его
части. Так сама собой осуществляется аэрация, необходимая для работающих бак-
терий .
Несколько слов стоит сказать о стружках. Это не просто отходы от обработки
древесины. Для загрузки в аппараты подходят только буковые стружки, закручен-
ные в рулон диаметром от 2 до 5 см и высотой от 3 до 6 см. Серьезные требова-
ния предъявляются и к древесине. Она должна быть совершенно лишена любых ви-
дов гнили. Словом, стружки для уксусного производства - вещь совсем не деше-
вая .
В аппарат Шуценбаха загружается 1-1,5 м3 стружек. На одном предприятии ра-
ботают десятки таких аппаратов. Производительность аппаратуры при работе по
данному способу низка и составляет не более 1,5 кг уксусной кислоты на 1 м3
стружек в сутки (в пересчете на 100%-ную уксусную кислоту) . При этом выход
уксуса (от теоретически возможного при использовании исходного количества
этилового спирта) не превышает 75%. Процесс ведется непрерывно, десятилетия-
ми, без смены бактерий и стружки. Высокая кислотность заливаемого в аппарат
раствора необходима для того, чтобы другие бактерии не могли "заселить" аппа-
рат и испортить таким образом продукт. Это дает возможность вести производст-
во уксуса без соблюдения стерильности. Единственный спутник уксусных бактерий
в этом процессе - мелкие нематоды - угрицы. Они питаются бактериями и тоже
легко переносят высокие концентрации уксусной кислоты. Уксус очищают от них
фильтрованием после пастеризации, в результате которой они погибают и выпада-
ют в осадок.
В настоящее время на подавляющем большинстве предприятий производство уксу-
са ведут циркуляционным способом Фрингса. Эта технология имеет немало общего
с методом Шуценбаха. Здесь также используются аппараты, наполненные стружка-
ми, также на стружках иммобилизованы уксуснокислые бактерии, и также масса
стружек орошается питательным раствором, содержащим спирт, уксусную кислоту и
минеральные соли. Однако есть и существенные различия между этими методами.
Прежде всего, это касается размера аппаратов. На некоторых предприятиях объем
их заполненной стружками рабочей камеры достигает 60 м3. В такой аппарат
(рис. 2) через специальную распределительную систему подают 10%-ный раствор
спирта со скоростью в несколько раз большей, чем по методу Шуценбаха. При по-
мощи насоса раствор многократно циркулирует через аппарат до тех пор, пока
весь спирт не окислится и не образуется 9%-ный раствор кислоты. Около 10% ис-
ходного чистого спирта в этом процессе теряется. Цикл длится 5-6 дней, после
чего повторяется.
Рис. 2. Аппарат Фрингса: 1 - корпус; 2 - ложное перфорированное
днище; 3 - слой буковых стружек; 4 - циркуляционный насос; 5 -
змеевик системы термостатирования; 6 - распределительное устрой-
ство .
В аппаратах большого объема тепловыделение оказывается настолько значитель-
ным, что в них приходится встраивать специальные теплообменники. Чаще всего в
рабочей камере располагают змеевики, по которым циркулирует охлаждающая вода,
но иногда приходится устраивать еще и дополнительные, так называемые выносные
теплообменники, которые устанавливают снаружи аппарата в циркуляционном кон-
туре.
При получении уксуса циркуляционным способом удельная производительность
достигает 6-8 кг кислоты в сутки на 1 м3 рабочего объема аппарата.
Но и у этого метода оказались существенные недостатки, главным из которых
был, пожалуй, размер аппаратов. В начале шестидесятых годов XX века появилась
технология, при которой уксуснокислые бактерии стали культивировать в специ-
альных аппаратах - ферментерах в жидкости, - так называемый метод периодиче-
ского глубинного культивирования.
Ферментеры для глубинного культивирования уксусных бактерий - это изготов-
ленные из нержавеющей стали емкости, внутри которых размещаются перемешиваю-
щие устройства и аэраторы различных конструкций (рис. 3).
Рис. 3. Схема ферментера для производства уксуса: 1 - корпус из
нержавеющей стали; 2 - перемешивающее устройство; 3 - аэратор
(его обычно называют барботером); 4 - змеевик системы термоста-
тирования.
Процесс получения уксуса при периодическом глубинном способе заключается в
следующем. От предыдущего цикла в аппарате остается жидкость (примерно 1/3
рабочего объема аппарата), которая служит посевным материалом для следующего
цикла. В аппарат заливается до рабочего объема питательная смесь, содержащая
уксусную кислоту и этанол. Перемешивающее устройство интенсивно перемешивает
жидкость, а через аэратор непрерывно подается воздух. В начале цикла условия
жизни для бактерий резко меняются, и в результате некоторое время не наблюда-
ется их заметного роста, эта стадия в развитии микроорганизмов называется
лаг-фазой. По окончании лаг-фазы концентрация спирта начинает уменьшаться, а
кислоты - наоборот, расти. Некоторое время в аппарат приходится порциями до-
бавлять раствор спирта. После того как концентрация уксуса достигает 9-10%,
около 2/3 объема жидкости отбирается как готовый продукт, и цикл повторяется.
Производительность глубинных аппаратов в несколько раз выше, а сами они в
несколько раз меньше, чем аппараты, заполненные стружками, в них значительно
меньше потери этанола. Кроме того, отпадает необходимость применения древес-
них стружек. Немаловажно и то, что при глубинном способе возрастает культура
производства.
В начале 70-х годов прошлого столетия у группы сотрудников кафедры "Машины
и аппараты микробиологических производств" в Московском институте химического
машиностроения (теперь это Московский государственный университет инженерной
экологии), возглавляемой профессором Петром Ивановичем Николаевым, возникла
идея совместить в промышленном масштабе микробиологические методы с приемами
постановки и ведения процессов, хорошо отработанными в химической технологии.
Для этого пришлось провести целый комплекс серьезных исследований. Вот ведь
парадокс: процесс был известен уже как минимум два с половиной тысячелетия,
но до середины XX века оставался в основном эмпирическим. До этого момента
усовершенствования технологий касались, прежде всего, устройства аппаратов, а
микробиологические аспекты разрабатывались весьма слабо.
В 60-е годы стали появляться работы, посвященные физиологии и биохимии ук-
сусных бактерий. Они были направлены на изучение влияния концентрации кисло-
рода и состава питательной среды, включая как минеральный фон, так и влияние
этанола и самой уксусной кислоты. В это же время на кафедре микробиологии Ле-
нинградского университета под руководством профессора М. С. Лойцянской были
проведены исследования систематики, морфологии и физиологии этих бактерий.
Были выделены штаммы бактерий, растущих в очень простой по составу среде, об-
ладающей большой окислительной активностью, что оказалось необычайно полезно
для промышленного производства уксуса.
Оптимальная температура для роста Acetobacter aceti - 25-30°С. В качестве
источника азота уксуснокислые бактерии используют минеральные соли, предпоч-
тительно аммонийные. Ацетобактеры сами синтезируют все необходимые витамины и
поэтому растут в питательных средах без их добавления.
Лучшим соединением углерода для бактерий рода Acetobacter является уксусная
кислота. Хорошо растут они также в средах, содержащих этиловый спирт или мо-
лочную кислоту, превращая их в уксусную.
Исследованиями Ю. Л. Игнатова было показано, что накапливаемая в процессе
уксусная кислота снижает окислительную активность бактерий и уменьшает удель-
ную скорость роста клеток. Этот факт позволил П. И. Николаеву с сотрудниками
организовать процесс получения уксусной кислоты в батарее из нескольких аппа-
ратов глубинным способом в непрерывном режиме. В результате получилась ориги-
нальная технологическая схема, в которой процесс получения 9%-ной уксусной
кислоты ведут в четырех-пяти последовательно соединенных ферментерах (рис.
4) . В такой батарее, в первых двух, по ходу жидкости, аппаратах при сравни-
тельно низкой концентрации уксусной кислоты бактерии размножаются с большой
скоростью при высокой окислительной активности, что обеспечивает высокую про-
дуктивность процесса. В последних по ходу жидкости аппаратах, работающих, на-
против, при высоких концентрациях уксусной кислоты, продуктивность снижается,
в них происходит в основном доокисление оставшегося в растворе спирта. Общая
производительность всех аппаратов батареи значительно выше, чем одного, вы-
пускающего уксус 9%-ной концентрации. Ю.Л. Игнатов показал, что производи-
тельность единицы рабочего объема аппарата, работающего по батарейному спосо-
бу, может достигать 49,4 кг уксусной кислоты с 1 м3 в сутки.
Разработанный способ был на удивление быстро внедрен на нескольких заводах.
Сейчас по этой технологии работают Экспериментальный пищекомбинат в Балашихе,
уксусные цеха в городах Горловка и Днепродзержинск на Украине, Завод в Слова-
кии .
Рис. 4. Схема установки для получения уксуса в непрерывном режи-
ме. Переток жидкости из аппарата в аппарат происходит из-за раз-
ницы давлений в "воздушной подушке", возникающей за счет разного
Заглубления переточных труб h: h2 > h3 > h4 > h5.
Краткие сведения о
химизме окисления
этанола в уксусную кислоту
Acetobacter aceti
Итоговая реакция окисления этилового спирта в уксусную кислоту выглядит
следующим образом:
Acetobacter aceti
С2Н5ОН -> СН3СООН + Н20 + Q
По современным представлениям, окисление этилового спирта уксуснокислыми
бактериями вида Acetobacter aceti - двухфазный процесс. Этанол окисляется ал-
коголь- и альдегиддегидрогеназами с образованием уксусной кислоты и двух мо-
лекул НАДН2. (Этот фермент отвечает за перенос водорода в дыхательной цепи.)
Алкогольдегидрогеназа Acetobacter aceti содержит недавно открытую простати-
ческую группу метоксантин, или пирролохинолинхинон. Этот фермент находится на
внешней стороне плазматической мембраны и катализирует окисление этанола в
уксусную кислоту. Метоксантин частично попадает в питательную среду и в пище-
вой уксус, придавая ему слегка желтоватую окраску.
Химичка
ОПЫТЫ В ДОМАШНЕЙ ЛАБОРАТОРИИ
ТЕХНИКА БЕЗОПАСНОСТИ
Этот раздел был создан исключительно для вашей безопасности, поэтому про-
чтите его, пожалуйста. Все опыты полностью безопасны, если у вас есть доста-
точные химические знания. Так что перед работой обязательно проанализируйте
описание эксперимента, просмотрите примечания про технику исполнения и прави-
ла безопасности. В случае необходимости обратитесь за консультацией к учителю
или почитайте дополнительную литературу. Можете быть уверены, что при точном
выполнении приведённых ниже советов вы не получите травм или отравлений при
работе с химическими веществами. Итак, вот основные и самые важные правила:
1)НИКОГДА не пробуйте на вкус и не нюхайте химические вещества!
2) При работе с открытым пламенем соблюдайте правила противопожарной безо-
пасности .
3)Если вы хотите добавить спирт в спиртовку, то её обязательно необходимо
потушить перед доливанием.
4)Если вам необходимо сделать раствор кислоты, то необходимо лить кислоту в
воду, а не наоборот. Для того чтоб запомнить это, существует простенький сти-
шок :
Сначала вода, потом кислота,
иначе случится большая беда!
5)После проведения ЛЮБОГО эксперимента тщательно вымойте руки.
6)Никогда не кушайте во время проведения эксперимента.
7)Никогда не кладите еду на стол, на котором проводится опыт или на котором
находятся реактивы.
8) При проведении опытов берите только те количества вещества и соблюдайте
те пропорции, которые указаны в описании опыта.
9)Если необходимо понюхать какое-либо вещество, то не подносите его к носу,
а совершите несколько движений рукой от вещества к носу и понюхайте воздух.
10)После проведения эксперимента обязательно вытрите стол, на котором он
проводился.
11)Если необходимо нагреть что-либо в стеклянной химической посуде, то сна-
чала слегка нагрейте эту ёмкость проводя ей над пламенем спиртовки.
Несколько полезных советов.
Вот несколько советов, которые могут вам понадобиться для проведения многих
опытов:
1)Во время работы с различными солями желательно надеть одноразовые резино-
вые перчатки, т. к. кожа имеет свойство впитывать вещества, попавшие на неё.
2)Наиболее токсичными являются соли следующих металлов: Hg, Pb, Cd, Со, Ni,
Zn, Ba, Sb, Sr, Cr; менее токсичны соли Cu, Fe, Al, Ад; и наименее токсичны
соли Са, К, Na и Мд. Но работать необходимо осторожно со всеми веществами.
3)Я советую завести специальное полотенце (предпочтительно вафельное) для
вытирания вымытой химической посуды.
4)Если после кипячения раствора на стенках химической посуды остался несмы-
ваемый налёт, то его можно удалить, ополоснув ёмкость раствором соляной ки-
слоты .
5)Если для проведения эксперимента вам необходим пробиркодержатель, а у вас
его нет, то его можно сделать из обычной деревянной (не пластмассовой!) при-
щепки .
ГДЕ ВЗЯТЬ ХИМИЧЕСКИЕ
РЕАКТИВЫ ДЛЯ ОПЫТОВ?
Если вы по каким-то причинам не можете заказать специальные химические ре-
активы, попробуйте найти их среди товаров народного потребления (на примере
Москвы):
Азотная кислота - на Митинском радиорынке.
Алюминий - на строительном рынке, в пунктах приема металлолома
Аммиак водный (нашатырный спирт) - в аптеке.
Ацетат свинца - в аптеке.
Ацетон (диметилкетон) - в хозмаге среди растворителей.
Бензин - в хозмаге среди растворителей, на автозаправочной станции.
Борная кислота - в аптеке.
Висмут - в припоях, особенно легкоплавких.
Гексаметилентетрамин (уротропин, сухой спирт) - в туристическом магазине.
Гидрокарбонат натрия (сода) - в продовольственном магазине.
Гидроксид калия (КОН) - на Митинском радиорынке.
Гидроксид кальция (гашеная известь1) - на строительном рынке, в крупном
хозмаге.
Гидроксид натрия (едкий натр) - в хозмаге продается как средство для прочи-
стки труб "Крот".
Гидропирит - в аптеке.
Глицерин1 2 - на радиорынке, в магазинах радиодеталей.
Глюкоза - в аптеке.
Графит - в простых карандашах, на радиорынке.
Диоксид кремния (кварцевый песок) - на строительном рынке.
Дистиллированная вода - в аптеке.
Дихлорэтан - в хозмаге (клей для оргстекла).
Дихромат калия К2Сг2О7 - используется как оранжевая краска, продаётся в виде
порошка под названием "хромпик".
1 Или лучше негашеная, погасить (Залить водой) можно самим.
2 В аптеке.
Йод - в аптеке.
Желатин - в продовольственном магазине.
Золото - в ювелирных ларьках3, в магазинах сырья для ювелиров.
Карбамид (мочевина) - в хозмаге, в отделе удобрений.
Карбонат кальция (мел) - в канцтоварах, на строительном рынке.
Карбонат натрия (стиральная сода, кальцинированная сода) - в хозмаге.
Кевлар (нить) - в рыболовном магазине.
Крахмал - в продовольственном магазине.
Интерферон - в аптеке.
Изопропанол (баллончик для очистки дисплеев и контактов) - в крупных компь-
ютерных и радиомагазинах.
Лимонная кислота - в продовольственном магазине.
Марганцевокислый калий КМпО4 - марганцовка, продаётся в аптеках.
Медь - в пунктах приема металлолома, в электротехнических изделиях
Нафталин - в хозмаге (средство от моли).
Нитрат аммония (аммиачная селитра) - в хозмаге, среди удобрений.
Нитрат калия KNO3 (калиевая селитра) и нитрат натрия NaNOg (натриевая се-
литра) - удобрения, продающиеся в с/х магазинах.
Нитрат кальция (кальциевая селитра) - в хозмаге, среди удобрений.
Нитрат серебра (ляписный карандаш) - в аптеке.
Оксид кальция (негащеная известь) - в хозмаге, на строительном рынке.
Оксид магния (жженая магнезия) - в аптеке.
Оксид хрома(III) Сг20з - очень устойчивая зелёная краска, называется "хро-
мовый зелёный". Продаётся в хоз. магазинах.
Олово - в припоях.
Ортофосфорная кислота - на Митинском радиорынке.
Парафин - в хозмаге, в свечках.
3
Не Забудьте стереть отпечатки пальцев.
Перманганат калия (марганцовка)
в аптеке.
Пероксид водорода (перекись водорода) - в аптеке.
Персульфат аммония - на радиорынке, в магазинах для любителей традиционной
(нецифровой) фотографии.
Порох - в охотничьих магазинах, петардах и фейерверках.
Резорцин - в аптеке.
Сахароза (сахар) - в продовольственном магазине.
Сера S - продаётся в виде порошка и серных шашек. Порошок применяется для
опрыскивания растений, а шашки для выкуривания насекомых-вредителей.
Серебро - в ювелирных ларьках, в магазинах сырья для ювелиров.
Свинец4 - в пунктах приема металлолома, в автомобильных аккумуляторах
Серная кислота - в автомагазине.
Силикат натрия Na2SiO3 (метасиликат) - в хозмаге, на строительном рынке -
это силикатный клей, продающийся в магазинах канцелярских принадлежностей.
Часто его продают на разлив под названием "жидкое стекло".
Слюда - на Митинском радиорынке.
Соляная кислота - на Митинском радиорынке.
Стеарат натрия (хозяйственное мыло) - в хозмаге.
Сульфат железа FeSO4 * 7Н2О (железный купорос) - в хозмаге, с/х магазинах.
Сульфат меди СиБОд * 5Н2О (медный купорос) - в хозмаге, среди средств по
борьбе с плесенью.
Сульфит натрия - в магазинах для любителей традиционной (нецифровой) фото-
графии - проявитель.
Тетраборнокислый натрий (бура) Na2B4O7 * ЮН2О - это вещество используется
для пайки. Купить его можно на радиорынке.
Тимол - в аптеке.
Ферроцианид калия (желтая кровяная соль) - в магазинах для любителей тради-
ционной (нецифровой) фотографии.
Фоторезист - на радиорынке, в магазинах радиодеталей.
Фторопласт - на Митинском радиорынке.
4
Есть кабели со свинцовой оболочкой. Встречается в больших изоляторах.
Уайт-спирит
в хозмаге.
Уголь активированный - в аптеке.
Уголь древесный - в хозмаге.
Уголь каменный - на строительном рынке.
Уксусная кислота - в продовольственном магазине.
Фенолфталеин - входит в состав некоторых слабительных препаратов, таких,
как пурген и фенолфталеин. Продаётся в аптеках.
Формиат натрия - в хозмаге или на строительном рынке - это жидкость для
отопительных систем.
Хлорид аммония - на радиорынке.
Хлорид-гипохлорит кальция (хлорка) - в хозмаге.
Хлорид железа (хлорное железо) - на радиорынке, в радиомагазине.
Хлорид кальция - в аптеке.
Хлорид натрия (поваренная соль) - в продовольственном магазине.
Целлюлоза (вата) - в аптеке.
Цинк - в батарейках (особенно советских).
Этиленгликоль - в автомагазине - это антифриз5.
Этиловый спирт С2Н5ОН - лучше всего покупать его в аптеках.
Лабораторная посуда
Пробирка химическая используется для проведения боль-
шинства простейших опытов и как деталь собираемых при-
боров .
Г 80
100 -
ml -да
□с
Стакан с носиком служит для хранения жидких и твердых
веществ, а также для проведения простейших химических
операций (растворение, нагревание).
Колба коническая используется для хранения жидких и
твердых веществ, а также для проведения различных хи-
мических операций.
5
Но не всякий.
Колба круглодонная служит для проведения разнообразных
химических операций при нагревании.
Колба с отростком предназначена для перегонки и разде-
ления жидкостей при нагревании.
Колба плоскодонная служит для проведения химических
операций, а также для хранения жидких и твердых ве-
ществ .
Мерная посуда: цилиндр (рис), стакан и пробирка — ис-
пользуют для измерения объема жидкостей.
Воронка конусообразная служит для переливания жидко-
стей и фильтрования.
Стеклянная палочка предназначена для размешивания ве-
ществ в химической посуде. Для предохранения посуды от
случайного растрескивания при размешивании веществ на
конец стеклянной палочки надевают кусочек резиновой
трубки.
Ложка фарфоровая (1), шпатель (2) служат для взятия
твердых и сыпучих веществ. Ложка-дозатор (3) предна-
значена для взятия определенной порции вещества.
Чашка фарфоровая применяется для выпаривания жидко-
стей.
Тигель фарфоровый предназначен для нагревания и прока-
ливания твердых веществ при высокой температуре.
Треугольник фарфоровый используется для размещения в
нем тигля. Треугольник помещают на кольцо штатива.
Ступка с пестиком служат для размельчения и растирания
твердых веществ.
Штатив для пробирок, служит для размещения в нем про-
бирок .
Зажим пробирочный служит для закрепления пробирки, ес-
ли вещество в пробирке требуется нагреть в пламени.
Зажим пружинный используют для зажимания резиновых
трубок при монтаже различных приборов.
Промывалка служит для промывания осадков дистиллиро-
ванной водой, для смывания осадков с фильтров и стенок
сосудов. Ее используют также для хранения небольших
количеств дистиллированной воды.
Воронка делительная предназначена для разделения не-
смешивающихся жидкостей, имеющих разную плотность.
Склянка с пипеткой служит для хранения растворов реак-
тивов при работе с малыми количествами веществ.
Пластина для капельного анализа (керамическая или
стеклянная) используется при выполнении опытов с очень
малыми количествами веществ в объеме 1-2 капель.
Прокладка керамическая огнезащитная используется при
нагревании веществ в стеклянной посуде. Прокладку раз-
мещают на кольце металлического штатива.
ПРИБОРЫ ДЛЯ ПОЛУЧЕНИЯ ГАЗОВ
(В.Н.Верховский "Техника Химического Эксперимента")
Приборы периодического действия
Вот простейший из вышеуказанных приборов, состоящий из банки с жидкостью и
пробирки с веществом. Пробирка держится в пробке, вставленной в горло склян-
ки , и может быть погружена в жидкость. На конце пробирки сделано
отверстие таких размеров, чтобы через него не могли проскочить
помещенные в пробирку кусочки твердого вещества. На дно пробирки
кладут несколько кусков стекла. Через отверстие в пробирку вхо-
дит налитая в банку жидкость. Газ выходит через присоединенную к
пробирке газоотводную трубку. Чем большее сопротивление должен
преодолеть газ, тем глубже должна быть погружена в жидкость про-
бирка. Отверстие в дне пробирки можно сделать при помощи напиль-
ника, точильного камня или карборундового бруска, спилив самую
нижнюю часть дна (держать напильник перпендикулярно к оси про- Рис.1
бирки). Но лучше «продуть» отверстие, нагрев дно пробирки на
остром пламени паяльной горелки или оттянуть конец пробирки и обрезать его. В
последнем случае вместо пробирки можно воспользоваться трубкой подходящего
диаметра. Пробка, вставленная в пробирку, должна хорошо держать. Пробка же, в
которой укреплена пробирка, наоборот, не должна прилегать слишком плотно к
горлышку банки, чтобы жидкость в банке имела сообщение с атмосферой. Можно
прорезать в пробке сбоку продольную щель. Если пробирка плохо
Иг—-1 держится в отверстии пробки и съезжает вниз, ее можно укреплять
при помощи небольшого клина из спички и т. п. Вместо пробирки
можно воспользоваться сеткой из такого материала, на который не
г Д Л действует жидкость, служащая для получения газа. Например, при
получении оксида углерода СОг взаимодействием мрамора с разбав-
. ленной соляной кислотой берут медную сетку, делают из нее мешочек
—_-=_или корзиночку (рис. 2) , которую подвешивают на крючке из прово-
1 локи или стеклянной палочки. Крючок можно передвигать в пробке,
______J вставленной в банку с жидкостью. Газ выходит через газоотводную
Рис.2_трубку, находящуюся в той же пробке.
Такие приборы позволяют регулировать ток газа. Это имеет большое преимуще-
ство, особенно если требуется ровная струя газа или во время опыта необходимо
изменять силу тока газа, а также если газ бывает нужен в определенные проме-
жутки времени. Пока газ не нужен, реакция не идет и вещества не расходуются
без надобности. Простейший небольшой прибор такого рода отличается от данного
на рисунке 1 прибора тем, что снабжен краном или зажимом на каучуке. При за-
крывании крана образующийся газ вытесняет жидкость из пробирки, и реакция
прекращается. Таким образом, для прекращения реакции нет необходимости подни-
мать пробирку. (В пробке должен быть вырез 1.) Чтобы прибор хорошо действо-
вал, конец пробирки с твердым веществом лучше оттянуть подлиннее. Кусочки ве-
щества не должны быть слишком мелкие, чтобы они не проваливались глубоко, в
оттянутый конец пробирки, иначе после закрывания крана жидкость будет касать-
ся твердого вещества и газ будет непрерывно выходить из пробирки. Если про-
бирка хорошо оттянута и куски твердого вещества достаточно крупные, то между
твердым веществом и жидкостью будет оставаться слой газа, который и будет
препятствовать их соприкосновению, пока прибор не работает. В ,
нижнюю часть пробирки можно положить куски стекла для лучшего _____ ’
разделения твердого вещества от жидкости в то время, когда Г5"
кран закрыт. Обычно после закрывания крана некоторое количест- _ |
во газа выходит наружу (пробулькивает), пока идет реакция меж- Lj.
ду твердым веществом и не успевшей стечь с него жидкостью. Ес- В
ли прибор не используют долгое время, пробирку с твердым веще- \ Ч__J )
ством можно поднять, как в приборе, изображенном на рисунке 4.
Нижнее отверстие пробирки с твердым веществом должно быть дос- ^ис
таточно велико (2—3 мм), так как через него во время действия прибора прохо-
дят два тока жидкости: вверх — реагирующая жидкость, вниз — более тяжелый
раствор, содержащий продукты реакции между жидкостью и твердым веществом
(обычно раствор соли). На рисунке 4 изображен приборчик для получения газов.
В одно из колен U-образной трубки в корзиночке из медной сетки помещены ку-
сочки твердого вещества (цинк, мрамор и др.). В трубку наливают разбавленную
кислоту. Когда зажим закрыт, прибор не действует.
В качестве автоматического прибора можно использовать склянку Тищенко. Ку-
сочки твердого вещества должны быть в этом случае достаточно мелки, чтобы они
проходили в узкое горлышко склянки. Для наполнения кислотой склянку наклоняют
почти горизонтально и кислоту наливают через воронку с узким, оттянутым и
изогнутым концом, который входил бы в боковой отросток склянки. Зажим при
этом должен быть закрыт. Можно также сначала налить в склянку через горлышко
кислоту, затем присоединить к отростку склянки каучук, через который ртом вы-
сасывать воздух, пока кислота не перейдет в левую половину склянки, после
Рис 5
бирку (кусочки твердого вещества
чего зажать каучук (пальцами или зажимом),
всыпать через горлышко цинк, вставить в
склянку пробку и снять каучук с отростка.
Склянку Тищенко следует выбрать с возможно
малым отверстием в перегородке. Большое
преимущество такого прибора — устойчивость
и простота обращения при работе. Для лабо-
раторных опытов учащихся очень удобны не-
большие автоматические приборы, имеющиеся
в продаже, а также самодельные — из боль-
шой пробирки или широкой стеклянной трубки
(рис. 5). Твердое вещество (цинк, мрамор и
пр.) помещают в этих приборах на резиновый
кружок с вырезами (рис.5), надетый на
трубку воронки и свободно входящий в про-
не должны проваливаться в вырезы и в зазор
между кружком и стенками реакционного сосуда). Жидкость наливают через ворон-
ку при открытом (винтовом) зажиме в таком количестве, чтобы слой ее над
твердым веществом был высотой 2—3 см. При перекрытии
резиновой газоотводной трубки зажимом жидкость дав-
лением газа вытесняется в воронку, стекает с твердо-
го вещества через вырезы в резиновом кружке, и реак-
ция прекращается. Для возобновления ее достаточно
открыть зажим. Все эти приборы употребляют главным
образом для получения небольших количеств газов при
лабораторных опытах учащихся. Чтобы получать большие
количества газа, который выходил бы из прибора силь-
ной струей, пользуются общеизвестными приборами Сен-
Клер-Девиля и Киппа. Прибор Сен-Клер-Девиля изобра-
жен на рисунке 6. Он состоит из двух склянок с тубу-
лусами (в 1—4 и более литров), соединенных каучуко-
вой трубкой. В одной склянке находится твердое веще-
ство, в другую наливают жидкость. Склянку с жидко-
стью помещают выше склянки с твердым веществом, но жидкость попадает к твер-
дому веществу только в том случае, если открыт кран или зажим на газоотводной
трубке и жидкость может вытеснить из склянки с твердым веществом находящийся
в ней газ (при начале работы — воздух). После закрывания крана или зажима об-
разующийся газ вытесняет жидкость обратно в стоящую выше склянку, и реакция
прекращается. Чем выше поставлена склянка с жидкостью относительно склянки с
твердым веществом, тем сильнее может быть струя газа и тем большее сопротив-
ление она может преодолеть. Возможность получать значительное давление газа
составляет большое преимущество прибора Сен-Клер-Девиля по сравнению с боль-
шинством других приборов для получения газов при взаимодействии жидкости
твердым веществом. При устройстве прибора Сен-Клер-Девиля на дно склянки,
предназначаемой для твердого вещества, насыпают сначала слой битого стекла,
фарфора, стеклянных бус, крупного гравия, черепков от глиняной посуды и т.
п. , а затем уже насыпают твердое вещество, участвующее в реакции получения
газа.
Насыпание индиферентного вещества имеет еще то преимущество, что после
окончания работы, когда главная масса жидкости вытеснена в верхнюю склянку,
часть нижней склянки, заполненная стеклом и т. п. , представляет собой резер-
вуар, наполняющийся газом, который продолжает выделяться вследствие действия
на твердое вещество, еще не успевшей стечь с него, части жидкости. Чем больше
слой индиферентного вещества, тем меньше газа может выйти из прибора через
соединительную трубку и через слой жидкости в верхней склянке. Газ выходит
обыкновенно большими пузырями, что сопровождается сильным бульканьем, отвле-
кающим внимание учащихся от опыта. Чтобы
избежать этого, следует не сразу закрывать
кран, а несколько раз приоткрывать его,
чтобы выпустить избыток газа, если позво-
ляют условия опыта. При прохождении пузы-
рей газа через слой жидкости в верхней
склянке из нее могут вылетать брызги жид-
кости, поэтому в склянку с жидкостью
вставляют небольшую воронку, которая слу-
жит также и для наливания свежей жидкости.
Пробки к нижним тубулусам склянок для ап-
парата Сен-Клер-Девиля должны быть обяза-
тельно резиновые, их необходимо привязы-
вать . Длина каучуковой трубки, соединяющей
склянки большого объема, 50—60 см, наруж-
ный диаметр около 1 см, а толщина стенок
1,5—2 мм. Стеклянные трубки, вставленные в
нижние пробки и служащие для надевания со-
единяющего склянки каучука, должны быть хорошо оплавлены, концы их могут вы-
ставляться из пробок не более чем на 3—4 см. Соединительную резиновую трубку
следует к ним привязать, для чего на концах стеклянных трубок желательно сде-
лать небольшие перетяжки, как на соединительных и переходных трубках. Для ре-
гулирования выхода газа применяют стеклянный кран, согнув одну из трубок его
под прямым углом, но можно удовольствоваться и винтовым зажимом. Пока прибор
не нужен, склянку с кислотой ставят ниже склянки с твердым веществом: прибор
в таком положении может храниться долгое время. Для удобства пользования и
хранения полезно сделать для прибора Сен-Клер-Девиля деревянный ящик, откры-
тый с одной стороны. При хранении прибора можно склянку с жидкостью ставить
внутрь ящика, а с твердым веществом — наверх. В таком виде прибор занимает
мало места. При снаряжении прибора твердого вещества обыкновенно накладывают
побольше, чтобы не приходилось очень часто переснаряжать
его (но следует иметь в виду, что, чем больше твердого
вещества, тем больше будет выделяться газа после закры-
вания крана). Жидкости наливают не более половины склян-
ки. Если образующийся газ горюч, то каждый раз после до-
бавления в прибор твердого вещества вытесняют из прибора
весь воздух, чтобы не образовалась взрывчатая смесь. При
отсутствии склянок с тубулусами можно сделать прибор
Сен-Клер-Девиля из обычных склянок (бутылок) достаточно-
го объема (рис.8). В таком приборе жидкость переливается
в реакционную склянку с помощью сифонной трубки и вытес-
няется в верхний сосуд давлением газа при перекрывании
газоотводной трубки зажимом.
Аппарат Киппа
Широко используется аппарат Киппа(рис.10 и 11) Твердое вещество помещают в
средней части сосуда, отделенной от нижней перетяжкой, благодаря чему оно не
соприкасается с остающейся на дне прибора жидкостью, когда прибор отключен.
Нижняя часть сосуда в приборе Киппа играет ту же роль, что и пространство ме-
жду кусками индиферентного вещества в приборе Сен-Клер-Девиля. Воронка
ветствующим приспособлением из
вставлена в прибор на шлифе, газоотводная
трубка с краном или зажимом — на пробке,
лучше каучуковой. Нижний тубулус служит для
выливания отработавшей жидкости. Твердое ве-
щество вносят через тубулус. Чтобы твердое
вещество не проваливалось вниз, отверстие
между средним шаром и нижней частью прибора
закрывают кружком из твердой резиновой пла-
стины. В этом кружке прорезают широкое от-
верстие посередине для трубки воронки прибо-
ра и несколько небольших отверстий, через
которые свободно могла бы проходить жид-
кость. Иногда приборы Киппа делают с соот-
стекла в виде вставленной в перетяжку сосуда
широкой трубки с отверстиями (рис.11). Эта трубка, вставленная в перетяжку
сосуда, должна иметь достаточно большие отверстия, расположенные не слишком
высоко. В противном случае кислота не успевает стекать в нижнюю часть прибора
или не имеет возможности стечь, и реакция продолжается еще долгое время после
Закрытия крана. Выделяющийся газ при этом проходит в нижнюю часть прибора и
через трубку воронки пробулькивает в верхний шар большими
пузырями, вызывая напрасный расход реактивов и разбрызгива-
ние кислоты из отверстия (рекомендуется поэтому всегда дер-
жать в верхнем отверстии шара небольшую воронку). Если
вставная трубка имеет очень маленькие или слишком низко
расположенные отверстия, то лучше удалить ее совсем, заме-
нив резиновым или пластмассовым кружком, или вставить в от-
верстие перетяжки свернутую в трубку пластмассовую сетку,
из которой обычно делают сейчас прокладки для пластинок
свинцовых аккумуляторов. Прежде чем снаряжать прибор, сле-
дует смазать вазелиновой мазью все пришлифованные части.
Нижнюю и верхнюю (с краном) пробки необходимо привязать
медной проволокой. Очень удобны для этого тонкие электриче-
ские многожильные провода в пластмассовой изоляции. Если
пробки притертые, то сначала обматывают в 3—4 витка провод
у толстого ранта тубулуса, наложив провод так, чтобы оста-
лись два одинаковых длинных конца. Эти концы скручивают, перекидывают скру-
ченную часть на головку пробки, охватывая ее проводом с двух сторон, снова
скручивают концы и перекидывают провод к ранту тубулуса, охватывая горло его
с двух сторон, и опять скручивают концы. Во избежание потери времени на раз-
вязывание и привязывание пробки, что приходится делать при каждой перезаряд-
ке, удобнее сделать для нее запор, изображенный на рисунке 12. Для устройства
этого запора горло тубулуса обвивают проволокой, на которой делают две петли
— одна против другой. В одну петлю вставляют конец длинной медной или лучше
алюминиевой пластинки и огибают ее вокруг проволоки так, чтобы полоска могла
откидываться на петле, как на шарнире. Пластинка должна быть вырезана и вы-
гнута так, как показано на рисунке, чтобы она охватывала пробку с обеих сто-
рон двумя боковыми отростками, оставленными посередине пластинки. Свободный
Рис 12
конец пластинки выгибают в виде
крючка, который может быть при-
тянут ко второму сделанному на
проволоке кольцу при помощи ко-
лечка, отрезанного от каучуко-
вой трубки. Проволоку и пла-
стинку лучше всего взять алюми-
ниевые. Тогда приспособление будет служить много лет. Придется только иногда
менять резиновое колечко.
ПРИЕМЫ ОБРАБОТКИ
СТЕКЛА И ПРОБОК
Резание стеклянных трубок
Чтобы отрезать кусок трубки определенной длины, нужно сначала отметить ме-
сто надреза, взять трубку в левую руку, зажать ее между указательным и боль-
шим пальцами и ножом для резки стекла или трехгранным напильником сделать ца-
рапину. После этого, держа трубку обеими руками так, чтобы царапина приходи-
лась между ними, слегка согнуть трубку со стороны, противоположной царапине.
На месте царапины трубка обычно ломается. Если при небольшом усилии этого не
произойдет, царапину несколько расширить и растягивание повторить. После того
как трубка отрезана, концы ее следует оплавить. Для этого внести конец трубки
наклонно в несветящееся пламя горелки, все время поворачивая трубку вокруг
оси до тех пор, пока конец не накалится. Затем вынуть трубку из пламени и по-
ложить для остывания на сетку с асбестом (но не на стол!)
Сгибание стеклянных трубок
Надеть на горелку насадку («ласточкин хвост»), зажечь горелку и равномерно
нагреть место сгиба (см. рисунок), спокойно вращая трубку вокруг оси. Когда
трубка размягчается, вынуть ее из пламени и плавно согнуть. Правильность сги-
ба зависит от равномерности нагревания и плавности сгибания. При быстром сги-
бании трубка будет иметь на сгибе впадину сверху или выемку снизу, что недо-
пустимо .
Правильное и неправильное пользование пробками и трубками 1 -
резание трубки; 2 - правильно согнутая трубка; 3 и 4 - непра-
вильно согнутые трубки; нагревание трубки в пламени "ласточкино-
го хвоста"; 6 - трубка, согнутая под прямым углом; 7 - вытягива-
ние трубки.
Вытягивание стеклянных трубок
Довольно часто требуется оттянуть трубку или же вытянуть капилляр. Для это-
го трубку надо нагреть на протяжении 4—5 см в пламени горелки, все время вра-
щая трубку вокруг оси. После размягчения оттянуть ее до нужного диаметра. Ес-
ли нужно получить капилляр (очень тонкую трубку с маленьким диаметром), то
нагретую до размягчения трубку вынимают из пламени и быстро, но плавно растя-
гивают обеими руками в оба конца.
Подбор пробок
В лаборатории употребляют три сорта пробок: корковые, резиновые и стеклян-
ные . Выбирать корковую пробку следует такого размера, чтобы диаметр ее был
немного больше внутреннего диаметра горла сосуда. Затем пробку надо вложить в
пробочный пресс и поворачивая, обжимать до тех пор, пока она не станет эла-
стичной и будет плотно входить в горло сосуда. Держа левой рукой горло сосуда
у отверстия правой осторожно вставляют пробку в горло, вращая и как бы ввин-
чивая ее. Пробка должна плотно входить в отверстие.
Сверление пробок
Чтобы просверлить в пробке отверстие, надо сделать на суженной части обжа-
той пробки отметку той стеклянной трубкой, для которой делается отверстие.
Затем подобрать пробочное сверло (рис.) несколько меньшего диаметра, чем на-
ружный диаметр отметки. Сверлить пробку в горизонтальном положении, держа ее
в левой руке, а сверло — в правой. Сверлить лучше всего следующим образом:
слегка надавливая правой рукой на сверло, делать полуобороты сверлом вправо и
влево. Когда сверло войдет в пробку почти до самого края, положить ее на до-
щечку или на другую пробку и тогда уже осторожно сделать окончательный про-
рез. Если его делать на весу, то, как правило, края прореза будут рваные. По
окончании сверления вытолкнуть шомполом пробковый цилиндрик из сверла. Диа-
метр сверла при сверлении каучуковых пробок подбирать равным или немного
большим вставляемой трубки. В качестве смазывающих веществ, облегчающих свер-
ление резиновых пробок, обычно употребляют вазелиновое масло, глицерин или
раствор щелочи. Для подгонки трубок к отверстию корковой пробки иногда делают
расточку отверстия круглым напильником. Когда отверстие в пробке готово, смо-
чить кончик отрезанной стеклянной трубки водой и вставить ее в пробку, все
время держа трубку правой рукой на расстоянии 2—3 см от пробки и как бы ввин-
чивая ее. Держать пробку и стеклянную трубку так, чтобы руки были близко одна
к другой. От частого употребления сверла тупятся. Тупое сверло рвет пробку, а
не режет ее. Чтобы наточить сверло, применяют специальные ножи для точки
сверл. Сверло надевают на коническую часть точила, нож прижимают к сверлу.
При поворачивании ножа сверло, неподвижно зажатое в левой руке, точится до-
вольно хорошо и быстро.
Сверление пробок: 1 - набор сверл для пробок; 2 - точка сверла;
3 - машинка для сверления пробок; 4 - сверление пробки; 5
пробкомялка (жом) для пробок
ОПЫТЫ С МЕТАЛЛАМИ
Никелиров ание
металлических
предметов
Металлические изделия и предметы очищают от грязи, обезжиривают раствором
соды, промывают в воде, на несколько секунд опускают в 50%-ный раствор азот-
ной кислоты и повторно промывают дистиллированной водой. Подготовленное изде-
лие выдерживают 30-50 минут в горячем растворе, содержащем на 1 л воды 280 г
гептагидрата сульфата никеля и 100 мл концентрированной соляной кислоты. По-
сле получения никелевого покрытия (оно получается плотным и блестящим) изде-
лие промывают водой и полируют суконкой.
Кристаллы меди
Все умеют выращивать кристаллы различных солей. А вот кристаллы меди не
всякий сумеет вырастить. Для этого необычного опыта понадобиться: СиБОд, по-
варенная соль, кусок жести и стакан (можно обыкновенный). Из куска жести вы-
режьте круг, чтобы он свободно входил в стакан. В стакан на-
сыпьте порошок сульфата меди(медного купороса) слоем в 5 мм и
Засыпьте этот слой солью. ВНИМАНИЕ! Слои не перемешивать. За-
кройте слои кружком из фильтровальной бумаги и накройте круж-
ком из жести. В стакан налейте раствор соли.
Через две недели вырастут довольно крупные кристаллы меди.
Чтобы они хорошо сохранились поместите их в пробирку с рас-
твором серной кислоты.
Горение металлов
Горение металлов в кислороде, хлоре широко известно. Менее знакомо горение
металлов в парах серы. В штатив укрепляют вертикально большую пробирку, на-
полненную на одну треть серой, и нагревают до кипения серы. Затем в пробирку
опускают пучок тонкой медной проволоки (можно предварительно нагреть) и на-
блюдают бурную реакцию.
ОБМЕННЫЕ РЕАКЦИИ
Золотой дождь
Существует множество веществ с сильной температурной зависимостью раствори-
мости . Именно на этом явлении и основан данный опыт.
Для проведения этого опыта необходимо взвесить равные
количества ацетата свинца(II) и йодида калия. Далее го-
товят два раствора. В два химических стакана наливают
по 50 мл дистиллированной воды. В один добавляют 1 мл
столового уксуса (или ~0,2 мл концентрированной уксус-
ной кислоты) и растворяют ацетат свинца. Кислота добав-
ляется для того, чтобы подавить гидролиз ионов РЬ2+. Во
втором растворяют KI. Затем оба раствора сливают в кол-
бу из огнеупорного стекла объёмом 150 мл. При этом про-
исходит реакция двойного обмена между ацетатом свинца и
йодидом калия:
РЬ(СН3СОО)2 + 2KI => 2КСН3СОО + РЫ2
После смешивания растворов выпадает жёлтый осадок йодида свинца(II). Смеси
растворов в колбе необходимо дать отстояться, чтобы осадок осел полностью.
После этого с осадка осторожно сливают жидкость и вместо неё доливают 100 мл
дистиллированной воды. Теперь раствор необходимо нагреть до кипения и кипя-
тить в течении 2-3 мин. Осадок должен раствориться полностью. Если всё было
сделано правильно, то после охлаждения раствора выпадет множество золотистых
кристалликов, которые при встряхивании колбы будут парить в толще воды. Раз-
мер кристалликов очень сильно зависит от скорости охлаждения: чем медленнее
охлаждать, тем более крупными и красивыми будут кристаллики. Для большей их
прочности перед кипячением в раствор добавляют немного глицерина (~0,5 мл на
100 мл раствора).
Затвердевание жидкости
В химический стакан наливают 20-50 мл силикатного клея (силикат натрия) и
добавляют 2-3 мл раствора соляной кислоты (1:1) и тут же перемешивают стек-
лянной палочкой. Через 30-40 секунд жидкость загустеет и ее уже нельзя вылить
из стакана.
Неорганический сад
Другой, но не менее интересный опыт с силикатом натрия. Готовят горячий
(около 60 °C) насыщенный раствор силиката натрия в 100 г
воды. Полученный раствор медленно охлаждают до комнатной
температуры, при этом образуется вяз кая масса, напоминаю-
щая по консистенции силикатный клей. Затем берут несколько
кристаллов различных окрашенных солей, например, меди, ко-
бальта и никеля. Кристаллы осторожно помещают на дно ста-
кана и оставляют на ночь. Утром можно полюбоваться на "не-
органический сад", который вырастет из "семян" - кристал-
лов .
В методическом отношении, опыт интересен тем, что пока-
зывает один из вариантов (хотя и не самый распространен-
ный) образования в природе силикатов, показывает явление
осмоса (хотя в школе его не изучают) и еще раз доказывает,
что химия не скучная наука.
Уравнение реакции в случае с медным купоросом:
CuSO4 + Na2SiO3 = CuSiO3 + Na2SO4
"Заживление раны"
Этот опыт демонстрируется в различных вариантах. Перед вами один из них.
Кожу руки обильно смачивают "йодом" (слабый раствор хлорного железа), якобы
для дезинфекции. После этого набирают в тонкую трубочку раствор роданида ка-
лия и проводят концом этой трубочки по смоченному месту (для усиления эффекта
опыта можно использовать тупой нож). На руке появляется "кровоточащая рана",
которую легко смывают затем обычной водой, а руку вытирают насухо полотенцем.
Примечание: Реакцию образования раствора роданида железа (III) можно ис-
пользовать для получения хорошей имитации крови.
ОПЫТЫ ПО ОРГАНИЧЕСКОЙ ХИМИИ
Холодное пламя
Ингредиенты:
- сухая борная кислота, чайная ложка
- этиловый спирт, чайная ложка
- концентрированная серная или соляная кислота, одна капля
Все это помещается в блюдце, перемешивается и слегка подогревается на теп-
лой (чтобы можно было держать руку) водяной бане. Выделяющийся эфир борной
кислоты можно поджечь (не поднося спичку близко к блюдцу, чтобы не зажечь
спирт). Эфир борной кислоты горит очень объемным, слегка зеленоватым пламе-
нем, которое не только не обжигает, но даже не греет ощутимо, в нем спокойно
можно держать руку, однако после того, как эфир борной кислоты весь выгорит,
может начать гореть спирт, а его пламя действительно обжигает.
Выделение кофеина из чая
Эксперимент основан на способности кофеина, подобно иоду, подвергаться воз-
гонке (сублимации - свойство вещества при нагревании переходить в газ минуя
жидкое состояние). Для проведения опыта необходимы две столовые ложки листо-
вого чая. Чай перетирают в ступке до мелкого порошка, затем переносят в сухую
фарфоровую выпаривательную чашку, которая сверху накрывается большой стеклян-
ной воронкой, причем края воронки должны выдаваться за края чашки примерно на
1 см. После этого нагревают чашку над пламенем горелки. Кофеин сублимируется
и вновь конденсируется на воронке в виде белых кристаллов.
Получение
ф енол ф ормаль дегидной
смолы
В пробирку помещают 10 капель жидкого фенола и 8 капель 40% формальдегида.
Смесь нагревают на водяной бане до растворения фенола. Через 3 минуты в про-
бирку добавляют 5 капель концентрированной соляной кислоты и помещают ее в
стакан с холодной водой. После образования в сосуде двух четких фаз следует
слить воду и вылить полимер из пробирки. В течение нескольких минут образо-
вавшаяся новолачная смола затвердевает.
Получение
искусственного
шелка
Около 20 г гидрокарбоната меди растворяют в 25%-ном растворе аммиака путем
его постепенного добавления к соли и при постоянном помешивании. В полученный
медноаммиачный раствор вносят медицинскую вату небольшими порциями и переме-
шивают до полного растворения клетчатки и получения вязкой массы. Растворение
ваты идет медленно, поэтому опыт можно отложить на 1-3 дня. Для получения ни-
тей искусственного волокна медноаммиачный раствор клетчатки набирают в меди-
цинский шприц и выдавливают через иглу, погруженную в осадительный раствор,
представляющий собой 10-15%-ный раствор серной или соляной кислоты.
УГЛЕВОДОРОДЫ
Получение метана
Реактивы: Ацетат натрия (безводный!), гидроксид натрия.
Оборудование: Круглодонная колба, пробирка, лабораторный штатив (2), газо-
отводная трубка и пробка.
Методика:
В сухую пробирку или круглодонную колбу вносят тщательно прокалённый ацетат
натрия CH3COONa и гидроксид натрия NaOH в соотношении 1:3 (по объему) . Затем
в пробирку вставляют пробку с газоотводной трубкой и, как обычно, проверяют
прибор на герметичность. После чего, начинают нагревать смесь, сначала уме-
ренно, затем более сильно. Образующийся метан СН4 собирают в пробирку методом
вытеснения воды или воздуха, а затем поджигают. Газ сгорает подобно водороду
- спокойно или со свистом - это зависит от чистоты полученного метана СН4.
Реакция:
CH3COONa + NaOH = Na2CO3 + СН4
СН4 + 2О2 = 2Н2О + СО2
Получение этилена
и его свойства
Реактивы: Этанол (96%), серная кислота концентрированная, перманганат ка-
лия , бромная вода.
Оборудование: Колба Вюрца (пробирка), спиртовка, прибор для собирания га-
зов, ванночки с растворами (стаканчики).
Методика:
В пробирку или, что лучше в колбу Вюрца наливают 5 мл этанола и 2 мл серной
кислоты. Смесь нагревают до 180°, при этой температуре начинает выделяться
этилен (при более низкой температуре образуется эфир). Сначала этилен собира-
ют в пробирку методом вытеснения воды и поджигают (газ легко сгорает). Затем
газоотводную трубку прибора последовательно опускают в стаканчики или ванноч-
ки с раствором перманганата калия и с бромной водой. Наблюдают исчезновение
(или значительное ослабление окраски).
Реакция:
С2Н5ОН +(H2SO4)= С2Н4 + Н2О
Получение ацетилена
Реактивы: Карбид кальция, перманганат калия, вода.
Оборудование: Коническая колба, пробка с трубкой
Методика:
В коническую колбу объемом 100 мл кладут кусочек карбида кальция, наливают
воду и затыкают пробкой с короткой трубкой. Сначала газ пропускают в подкис-
ленный раствор перманганата калия, затем резиновую часть трубки снимают и
поджигают ацетилен. Газ горит коптящим пламенем.
Реакция:
СаС2 + 2Н2О = Са(ОН)2 + С2Н2
Свойства бензола
Реактивы: Бензол, перманганат калия, бром, азотная кислота (65%), серная
кислота конц., железные опилки.
Оборудование: Пробирки, химические стаканчики, делительная воронка
Методика:
1. Запах бензола. Учащимся дают понюхать в пробирке бензол, и объясняют,
что название "ароматические углеводороды" на прямую не связано с запахом бен-
зола .
2. Отношение к воде и перманганату калия. В химический стакан наливают рас-
твор перманганата калия (не слишком концентрированный), а затем бензол. Смесь
расслаивается, причем граница раздела двух фаз становится зеркальной, но пер-
манганат не обесцвечивается.
3. Горение бензола (под тягой!). В фарфоровую чашку наливают 1 мл бензола и
поджигают горящей лучинкой. Бензол сгорает ярким коптящим пламенем. Примеча-
ние : категорически советую проводить опыт под тягой - нашей школе пришлось
отмывать потолок от копоти!
4. Бромирование бензола. В колбу с длинной вертикальной трубкой ("обратный
холодильник") наливают 4 мл бензол и 2 мл чистого брома. Реакция не протека-
ет. Затем в смесь на кончике ножа добавляют железных опилок и закрывают проб-
кой с холодильником. Начинается довольно бурная реакция, по окончании которой
на дно оседает тяжелый слой бромбензола.
5. Нитрование бензола. В колбу с обратным холодильником наливают 8 мл кон-
центрированной серной кислоты и 5 мл азотной (65%). Полученную нитрующую
смесь охлаждаю под сильной струёй воды. Затем добавляют 5 мл бензола. Смесь
встряхивают. Если реакция пойдет медленно. Всплывающий желтый слой и есть
нитробензол. Его можно отделить на делительной воронке и использовать для
дальнейших опытов (получение анилина и др.).
Внимание! Нитробензол ядовит! (ТЯГА!)
Реакции:
2С6Н6 + 15О2 = 12СО2 + 6Н2О
С6Н6 + Вг2 = С6Н5Вг + НВг
С6Н6 + HNO3 = C6H5NO2 + Н20
Определение углерода
и водорода в парафине
Реактивы: Парафин, оксид меди (2) , сульфат меди (безводный), известковая
вода.
Оборудование: Пробирки (2), штатив (штатив-держатель), пробка с газоотвод-
ной трубкой, спиртовка
Методика:
В пробирку помещают оксид меди и парафин в объемном отношении 1:5. На её
стенку аккуратно кладут обезвоженный сульфат меди, после чего, закрывают при-
бор пробкой с газоотводной трубкой и проверяют на герметичность. Смесь начи-
нают осторожно нагревать. Когда парафин расплавится, трубку прибора опускают
в известковую воду.
Нагревание продолжают 5-10 минут, при этом: известковая вода мутнеет, суль-
фат меди синеет, на дне пробирки образуются зернышки металлической меди.
Реакция:
СпН2п+2 + (3n+l)CuO = nCO2 + H2n+iO
СПИРТЫ
Горение этанола
Реактивы: серная кислота конц., перманганат калия, спирт.
Оборудование: Спиртовка, стеклянные пластинки, стеклянные палочки
Методика:
Горение спирта в принципе, не нуждается в демонстрации, однако если этот
опыт поставить эффектно, то можно произвести благоприятное впечатление на
учащихся, а заодно повторить курс неорганической химии.
На стеклянную или фарфоровую пластинку наносят немного кристалликов перман-
ганата калия и прикасаются к ним стеклянной палочкой, смоченной в серной ки-
слоте .
При этом образуется сильный, и к тому же взрывоопасный (!) окислитель - ок-
сид марганца (VII).
Далее, стеклянную палочку подносят к фитилю спиртовки (фитиль должен быть
мокрым), при этом спирт загорается.
Реакции:
2КМпО4 + H2SO4 = Мп2О7 + Н2О + K2SO4
2С2Н5ОН + 2О2 = 4СО2 + 6Н2О + Q
Качественная реакция
на многоатомные спирты
Реактивы: Глицерин (при отсутствии можно заменить сахорозой), раствор суль-
фата меди, гидроксида натрия.
Оборудование: Демонстрационные цилиндры
Методика:
В демонстрационную пробирку или цилиндр наливают немного глицерина (обра-
тить внимание учащихся на вязкость глицерина - причины: обилие водородных
связей, "маслообразность" - влияние углеводородной цепи) и разбавляют водой.
В другом цилиндре готовят осадок гидроксида меди, смешивая растворы гидрокси-
да натрия и сульфата меди. Содержимое цилиндров сливают вместе и перемешива-
ют. Наблюдают образование соединения с красивой, "васильковой" окраской.
При подготовке учащихся к практическим работам опыт показывают в другой по-
следовательности . В пробирку наливают раствор глицерина, добавляют гидроксид
натрия (должен быть избыток), а затем сульфат меди. В этом случае, также на-
блюдается "васильковая" окраска, однако образование гидроксида меди не проис-
ходит, проведение опыта сильно упрощается, что важно для проведения практиче-
ских работ.
Реакция:
СН2СНСН2(ОН)3 + Си (ОН) 2 = СН2СНСН2 (ОН)О2Си
(уравнение дано в упрощённом виде)
Химические и физические
свойства фенола
Реактивы: Фенол, лакмус или метилоранж, гидроксид натрия, соляная кислота,
бромная вода, азотная кислота, хлорид железа (III)
Оборудование: Химические стаканы, демонстрационные пробирки, пробиркодержа-
тель , спиртовка
Методика:
1. К воде, налитой в химический стакан, прибавляют с помощью шпателя фенол
и перемешивают смесь. Констатируют образование эмульсии, которая вскоре рас-
слаивается . Объясняют, что нижний слой - раствор воды в феноле, верхний -
раствор фенола в воде.
2. К части эмульсии полученной в предыдущем опыте прибавляют какой-нибудь
индикатор. Среда - кислая. Значит фенол - кислота. Чтобы это подтвердить, к
эмульсии прибавляют концентрированный раствор гидроксида натрия. Раствор ста-
новится прозрачным. На доске пишут соответствующую реакцию. Теперь, к полу-
ченному раствору фенолята натрия приливают раствор соляной кислоты. Снова об-
разуется эмульсия, пишут уравнение, делают вывод о том, что фенол - кислота
слабая.
3. Эмульсию фенола смешивают в демонстрационной пробирке с бромной водой.
Выпадает белый осадок трибромфенола. Пишут реакцию, рассматривают взаимное
влияние фенил-радикала и ОН-группы друг на друга.
4. Нитрование фенола. Опыт также иллюстрирует о,п-замещение в феноле. В
пробирку насыпают немного фенола и расплавляют его (при этом демонстрируется
его легкоплавкость - т.пл. 40 °C) . После плавления смесь выливают в химиче-
ский стакан с раствором азотной кислоты (2:3). При этом образуются различные
продукты, в частности - пикриновая кислота (2,4,6-тринитрофенол - пикриновая
кислота).
5. Качественная реакция на фенолы. Все фенолы с хлоридом железа (III) дают
фиолетовое окрашивание.
Качественное определение
спиртов и фенолов
Реактивы: Парафин, оксид меди (2) , сульфат меди (безводный), известковая
вода.
Оборудование: Пробирки, штатив (штатив-держатель), пробка с газоотводной
трубкой, спиртовка
Методика:
Задание: В трех предложенных вам пробирках находятся следующие вещества:
а) фенол
б) этанол
в) пропантриол-1,2,3
Используя предложенные реактивы, определите содержимое каждой пробирки
Реактивы: Растворы гидроксида натрия, сульфата меди (II) , хлорида железа
(III) •
АЛЬДЕГИДЫ
Получение альдегида
Реактивы: спирт этиловый, медная проволока.
Оборудование: спиртовка, химический стакан
Методика:
Из медной проволоки делают небольшую спиральку, которую раскаляют в пламени
спиртовки и опускают в спирт. Эту операцию повторяют несколько раз. Получен-
ный раствор обладает всеми свойствами альдегидов.
Реакция:
СН3СН2ОН + CuO = СНзСНО + Н20
Реакция полимеризации
формальдегида
Реактивы: формальдегид
Оборудование: демонстрационные пробирки, пробка с газоотводной трубкой,
спиртовка
Методика:
В демонстрационную пробирку наливают 10 мл 40%-ного раствора формальдегида.
Пробирку начинают нагревать в пламени спиртовки. Раствор начинает мутнеть
(образуется параформ - полимер формальдегида).
В другую пробирку насыпают немного сухого параформа, закрывают пробирку
пробкой с газоотводной трубкой и начинают нагревать. В этом случае происходит
мономеризация (деполимеризация) и образуется газообразный формальдегид (поро-
шок улетучивается).
Реакция:
пСН2О = (СН2О)П
Получение
ф енол ф ормаль дегидной
смолы
Реактивы: Фенол, формалин, соляная кислота (1:2) .
Оборудование: пробирки, спиртовка, фильтровальная бумага
Методика:
В пробирку помещают смесь 2,5 г фенола и 5 мл формалина. Ничего не происхо-
дит. Затем добавляют 7-10 капель соляной кислоты (катализатор). При этом на-
чинается катализатор. Смесь охлаждают и дают ей отстояться. При этом в зави-
симости от условий образуется либо желтая смола, либо кусочек уже твердой бе-
лой смолы.
Реакция серебряного
зеркала
Реактивы: Нитрат серебра (раствор 2%), аммиак (раствор 25%, разбавить в 8
раз), формалин (или другой альдегид), бихромат калия, серная кислота концен-
трированная (или готовая хромовая смесь).
Оборудование: ершик, пробирки, химический стакан, спиртовка, пробиркодержа-
тель
Методика:
Для проведения реакции берут пробирку или колбу, два раза моют ее ершиком,
промывают хромовой смесью и ополаскивают дистиллированной водой. Эта стадия
подготовки очень важна, т.к. от чистоты сосуда зависит исход опыты.
В сосуд наливают на 1/4 раствор нитрата серебра и по каплям начинают добав-
лять раствор аммиака до полного растворения образовавшегося в начале осадка.
К полученному раствору добавляют раствор альдегида. Полученную смесь аккурат-
но нагревают до потемнения растворы. Затем раствор выливают и показывают уча-
щимся серебряное зеркало. Если зеркало не получилось, то не стоит браковать
опыт: черный осадок это тоже серебро, только в виде мелкого порошка.
ПРИМЕЧАНИЕ: Аммиачную смесь не рекомендуется готовить заранее, т.к. при
стоянии раствора в нем могут образоваться взрывчатые вещества - соли гремучей
кислоты.
Реакция:
НСНО + Ag2O = НСООН + 2Ад
Реакция с гидроксидом меди
Реактивы: гидроксид натрия, сульфат меди, раствор альдегида.
Оборудование: пробирки, химический стакан, спиртовка, пробиркодержатель
Методика:
В демонстрационную пробирку наливают раствор сульфата меди и добавляют к
нему по каплям раствор гидроксида меди. Констатируют образование синего осад-
ка гидроксида меди. Затем с осадка сливают часть жидкости и приливают к полу-
ченному осадку раствор альдегида. Смесь нагревают в пламени спиртовки, при
этом происходит постепенное изменение окраски по схеме: синее-черное-зеленое-
красное-желтое.
Реакция:
CuSO4 + 2NaOH = Cu(OH)2 + Na2SO4
НСНО + CuO = Cu2O + НСООН
Электроника
АВТОМАТИЧЕСКОЕ БЕСКОНТАКТНОЕ
ПЕРЕКЛЮЧАЮЩЕЕ УСТРОЙСТВО1
В. Новожилов
Автоматическое бесконтактное переключающее устройство (АБПУ) предназначено
для последовательной коммутации до десяти электрических цепей. Оно может
оказаться хорошим помощником в световой организации демонстрационных и
выставочных залов, клубов, дискотек, а также может быть с успехом
использовано радиолюбителями для коммутации различных цепей. Частоту
переключения цепей в АБПУ можно изменять в широких пределах. Предусмотрена
также возможность в процессе переключения зафиксировать любой канал на
длительное время, продолжить коммутацию либо вернуться в начальное положение
с любого положения и с этого положения продолжать коммутацию в прежней
последовательности. Номер каждого включенного канала высвечивается
светодиодным индикатором, что позволяет непосредственно наблюдать за частотой
переключения каналов.
Отличительной особенностью устройства является отсутствие каких бы то ни
было механических контактных групп, склонных к обгоранию при коммутации цепей
с повышенным током нагрузки, что обеспечивает повышенную надежность, а также
отсутствие в процессе коммутации радиопомех. Питание АБПУ производится от
встроенного стабилизированного выпрямителя с выходным напряжением 5 В±10 %.
Потребляемый устройством ток от источника питания при токовой нагрузке на
каждый канал до 3 А не превышает 100 мА. Поэтому его можно питать также и от
набора сухих гальванических элементов, имеющихся в широкой продаже.
R2 /к
DD2J
01)2.2 033 КМИН
J
"7
с
I)
,<
..С/'Бы’/ОВ
00/1 * Off/.? 00/3
-R! 4Jk
L1
а Г
DDL 4₽
ffCFlM Х
I
ОС
2
004
К155Ш
а
6
с
а
m 5В?
^„Запись
Л БыВобам
пития
микросхем
DPS К5/4ИД2 HGi АЛСЗ?4£
I
ОС
Общ.
8
3
0
/
★5 В
С5 10мк>10В
001 К155МЗ
002 K/55TMZ
Блоки
тмнзислпр-
ми шней
6Ю5Ш-
т
S
и
а
с
о
R
т
Рис. 1. Принципиальная схема АБПУ
Принципиальная схема АБПУ приведена на рис. 1. Устройство собрано на пяти
микросхемах серии К155 и одной — К514. На элементах DD1.1 — DD1.3 выполнен
генератор прямоугольных импульсов. С помощью переменного резистора R1 можно
вручную изменять частоту генерации. Импульсы с выхода генератора поступают на
вход делителя частоты, который состоит из двух последовательно включенных
делителей на 2 (D-триггеры микросхемы DD2) и делителя на 10 (DD3) . Таким
образом, коэффициент деления равен 40. Импульсы с частотой повторения в 40
раз меньшей частоты задающего генератора поступают далее на двоично-
десятичный 4-разрядный счетчик DD4, работающий в коде 1 — 2 — 4 — 8, выходы
которого подключены к дешифраторам DD5 и DD6. Дешифратор DD5 управляет
контрольным семисегментным светодиодным индикатором HG1, а к выходам
дешифратора DD6 подключены блоки десяти транзисторных ключей. В процессе
счета импульсов транзисторные ключи поочередно открываются, управляя
включением тех или иных цепей.
При подаче уровня логического 0 на вход S элемента DD2.1 нажатием кнопки с
фиксацией SB2 счет прекращается, и счетчик хранит ранее полученную информа-
цию. Таким образом, на неограниченное время остается включенным тот
транзисторный ключ, который был включен в момент нажатия кнопки. При
повторном нажатии кнопки SB2 на вход S элемента DD2.1 поступает уровень
логической 1, счет импульсов возобновляется и происходит дальнейшее
переключение транзисторных ключей.
При нажатии на кнопку без фиксации SB1 делители DD2, DD3 и счетчик DD4
устанавливаются в нулевое состояние и после отпускания этой кнопки, если
кнопка SB2 разомкнута, счет начинается с 1.
Блоки транзисторных ключей могут быть реализованы по самым различным схемам
в зависимости от характера коммутируемой нагрузки — номинальных значений
напряжения и тока. На рис. 2 показаны некоторые возможные варианты схемного
выполнения транзисторных ключей.
Рис. 2. Схемы транзисторного ключа: а — первый вариант ключа; б
— схема мощного ключа; в — схема ключа для коммутации головных
телефонов
Транзисторный ключ, схема которого показана на рис. 2, а, рассчитан на ток
нагрузки до 1 А, однако в том случае, если выходной транзистор будет снабжен
теплоотводом, ток нагрузки может быть увеличен до 3 А. Если вместо
транзистора КТ315А использовать КТ315И, номинальное напряжение нагрузки и
напряжение питания ключа может быть увеличено до 60 В. Допустим, что вход
этого ключа присоединен к выходу 3 дешифратора D6. Когда на входы дешифратора
будет подан код, соответствующий десятичному числу 2, на выходе 3 дешифратора
окажется низкий потенциал, соответствующий уровню логического 0. Транзистор
VT1.1 окажется заперт, а транзистор VT2.1 открыт до насыщения, и нагрузка
окажется под током. При смене кода на входе дешифратора на его выходе 3
появится высокий потенциал, соответствующий уровню логической 1. Транзистор
VT1.1 откроется, а транзистор VT2.1 закроется. Нагрузка будет выключена.
Сопротивление резистора R2.1 подбирается таким, чтобы насытить выходной тран-
зистор в открытом его состоянии. В качестве нагрузки на схеме показана лампа
накаливания, но можно использовать и другие потребители.
На рис 2, б показана схема мощного ключа, выходной каскад которого собран
на транзисторе П210А. Для использования выходного р-п-р транзистора Здесь
понадобилось добавить к предыдущей схеме один инвертирующий каскад. При
указанных на схеме сопротивлениях резисторов ключ обеспечивает в нагрузке ток
0,6 А. При уменьшении сопротивления резистора R2.2 увеличивается ток базы
транзистора VT2.2 при запертом транзисторе VT1.2, уменьшается сопротивление
коллектор — эмиттер VT2.2, что приводит к увеличению тока базы выходного
транзистора и соответствующему увеличению тока нагрузки. При сопротивлении
резистора R2.2, равном 1 кОм, ток нагрузки достигает 1,8 А. Для дальнейшего
увеличения тока нагрузки нужно уменьшать сопротивления всех трех резисторов с
соответствующим увеличением их мощности рассеяния.
На рис. 2, в показана схема одного из вариантов транзисторного ключа для
коммутации головных телефонов. На транзисторе VT2.3 собран однокаскадный
усилитель звуковой частоты. Транзистор VT1.3 используется в ключевом режиме.
Вход 1 блока подключается к источнику звукового сигнала, а вход 2 — к одному
из выходов дешифратора DD6. Когда на выходе дешифратора, к которому подключен
блок, потенциал соответствует уровню логического 0, транзистор VT1.3 заперт,
на работу схемы не влияет и входной сигнал усиливается усилителем. Когда же
на вход 2 поступает потенциал, соответствующий уровню логической I,
транзистор VT1.3 отпирается. При этом выходной транзистор запирается и сигнал
на выход не проходит. Если головные телефоны подключены к выходам нескольких
блоков транзисторных ключей, входы 2 которых соединены с выходами
дешифратора, можно будет поочередно прослушивать звуковые сигналы от разных
источников, подключенных ко входам 1 ключей, выбирая тот сигнал, который
необходим.
Конструктивно АБПУ может быть выполнено либо в виде отдельного устройства,
либо в виде составного модуля какого-либо аппарата, в зависимости от выбран-
ного назначения. Расположение элементов схемы произвольное. Конденсаторы С2 —
С4 должны быть подключены непосредственно к выводам питания микросхем DD2,
DD3 и DD4 для обеспечения помехоустойчивости. Индикатор, кнопки управления и
переменный резистор регулировки скорости коммутации целесообразно вывести на
переднюю панель. Блоки транзисторных ключей при необходимости могут быть
выполнены на отдельных платах и располагаться непосредственно около нагрузок.
При этом они соединяются с цифровой частью АБПУ жгутом проводов, длина
которого во избежание сбоев не должна превышать 10 м. Если выходные тран-
зисторы ключей необходимо установить на теплоотво-дах, необходимо либо
изолировать корпус транзистора от теплоотвода слюдяной прокладкой (при этом
тепло-отвод может быть электрически соединен с общей шиной), либо изолировать
теплоотвод от общей шины (при этом транзистор может быть электрически
соединен своим корпусом с теплоотводом). В последнем случае обеспечивается
лучший отвод тепла.
Налаживание АБПУ начинают с проверки правильности монтажа согласно
принципиальной схеме, после чего подключают питание с соблюдением полярности.
Блоки транзисторных ключей пока не подключают.
30
К DB5
Рис. 3. Печатная плата АБПУ (I часть)
го- J
Рис. 4. Печатная плата АБПУ (II часть)
Правильно собранная цифровая часть устройства обычно начинает работать
сразу, необходимо лишь с помощью осциллографа убедиться в наличии на выходе 8
элемента DD1 прямоугольных импульсов. В противном случае необходимо подобрать
емкость конденсатора С1. Индикатор должен высвечивать периодически сменяю-
щиеся цифры от 0 до 9, скорость переключения которых должна плавно
регулироваться переменным резистором R1. При нажатии кнопки «Запись» счет
должен прекратиться, а индикатор должен высветить какую-либо цифру. Допустим,
что высвечивается цифра 8. Тогда с помощью осциллографа или вольтметра нужно
проверить наличие уровня логического 0 на выходе 9 дешифратора DD6 и уровня
логической 1 на остальных выходах этого дешифратора. При повторном нажатии на
кнопку «Запись» вновь должна начаться поочередная смена цифр на индикаторе.
Остановив счет на другой цифре, опять проверяют уровни на выходах дешифратора
DD6. Так проверяются все 10 выходов этого дешифратора, причем уровень
логического 0 должен быть только на том выходе, который соответствует цифре,
высвеченной индикатором. При нажатии кнопки «Сброс» индикатор должен
высвечивать цифру 0. После этого несколько раз выключают и вновь включают
питание. Генератор должен надежно запускаться, в противном случае следует
заново подобрать емкость конденсатора С1.
После налаживания цифровой части АБПУ можно к выходам дешифратора
подключить блоки транзисторных ключей с их нагрузками. При налаживании ключей
в зависимости от напряжения и тока нагрузки может понадобиться подбор
сопротивлений резисторов для получения насыщенного состояния выходного
транзистора в открытом состоянии.
Налаживание транзисторного ключа, схема которого показана на рис. 2, в,
производится следующим образом. Не подавая на вход 1 сигнал, устанавливают
кнопкой «Запись» на входе 2 ключа уровень логического 0 и подбором
сопротивления резистора R2.3 добиваются получения напряжения на коллекторе
транзистора VT2.3, равного +3 В. Затем подают на вход 1 сигнал от какого-либо
источника и убеждаются в его неискаженности при помощи осциллографа,
подключенного к головным телефонам. Уровень входного сигнала подбирается со-
ответствующим регулятором уровня источника. Затем кнопкой «Запись»
устанавливают на входе 2 ключа уровень логической 1. Звук в телефонах должен
полностью исчезнуть. При этом может понадобиться подбор сопротивления
резистора R1.3. На этом процесс налаживания заканчивается.
Чертеж печатной платы АБПУ приведен на рис. 3, 4.
1 Возможно, что элементная база всех схем в журнале устарела, но легко может
быть заменена на более современную, если это действительно необходимо
КОНДЕНСАТОРНОЕ РЕЛЕ
СВЕРХДЛИТЕЛЬНЫХ ВЫДЕРЖЕК ВРЕМЕНИ
А. Аристов
Один из распространенных автоматов выдержки времени — конденсаторное реле,
поскольку оно, как правило, просто по конструкции и легко налаживается. Но
выдержки времени этих реле обычно не превышают нескольких минут. Для получе-
ния же больших выдержек приходится использовать конденсаторы значительной ем-
кости, обладающие пониженными сопротивлениями утечки, что снижает стабиль-
ность и надежность работы реле.
Используя предлагаемый принцип конструирования конденсаторных реле времени,
нетрудно построить автомат с выдержкой времени до... нескольких месяцев, при-
чем времязадающий, конденсатор потребуется емкостью всего в несколько микро-
фарад. Принцип работы подобного реле поясняет рис. 1. Времязадающий конденса-
тор С1 после заряда его через выключатель S1 до напряжения источника питания
подключается к разрядному резистору R1 и электронному ключу через выключатель
S2, контакты которого замыкаются на непродолжительное время через определен-
ные интервалы вспомогательным автоматом. Иначе говоря, конденсатор разряжает-
ся короткими порциями, что равносильно увеличению емкости конденсатора, а
значит, выдержки реле времени во столько раз, во сколько продолжительность
между замыканиями контактов выключателя S2 больше продолжительности их замк-
нутого состояния (можно сказать, что это значение соответствует скважности
импульсов, управляющих контактами выключателя). Когда конденсатор разрядится
до определенного напряжения, сработает пороговое устройство — электронный
ключ — и реле К1 включит (или выключит) нагрузку.
А теперь познакомимся со схемой реле времени (рис. 2), построенного на ос-
нове рассмотренного принципа. Времязадающий конденсатор здесь — С1. Он под-
ключен через контакты К2.1 герконового реле К2 к пороговому устройству на од-
нопереходном транзисторе VI. Контакты замыкаются периодически через опреде-
ленные интервалы времени, задаваемые генератором, который управляет работой
реле К2.
Предположим, что конденсатор С1 уже заряжен до напряжения источника питания
и отсчет выдержки времени начался. В те моменты, когда контакты замкнуты,
конденсатор С1 разряжается через резистор R2 (параллельно ему можно подклю-
чить выключателем S1 резистор R3 и ускорить разряд конденсатора в 20 раз,
уменьшив тем самым во столько же установленную выдержку времени). Реле под-
ключено к генератору импульсов большой скважности, поэтому контакты замкнуты
в течение сравнительно короткого времени, а в течение более длительного пе-
риода разомкнуты и конденсатор не разряжается.
Рис.1. Функциональная схема конденсаторного реле
Управляющие работой реле импульсы дифференцируются цепочкой C3R7R4, в ре-
зультате чего в момент окончания управляющего импульса (то есть во время зад-
него фронта его) в цепь базы 2 однопереходного транзистора поступает короткий
отрицательный импульс амплитудой около 0,8 В, «разрешающий» открывание тран-
зистора. Но напряжение на эмиттере транзистора пока велико, и он остается за-
крытым. Когда конденсатор разрядится до определенного напряжения и в этот мо-
мент на базу 2 поступит очередной отрицательный импульс, транзистор включит-
ся .
Конденсатор С1 на короткое время (0,1...0,5 мс) окажется подключенным через
открытый переход эмиттер-база 1 транзистора VI к резистору R5 и начнет заря-
жаться через него. В результате на резисторе появится положительный импульс,
который через конденсатор С2 и диод V2 поступит на управляющий электрод три-
нистора V4 и откроет его. Сработает реле К. 1 и контактами К. 1.2 (на схеме не
показаны) замкнет (или разомкнет) цепь нагрузки. Поскольку при этом откроется
диод У5, реле К2 окажется подключенным параллельно реле KL. Через замкнувшие-
ся контакты К1.1, резистор R1 и контакты К2.1 конденсатор С1 зарядится до на-
пряжения источника питания. Автомат готов к последующему отсчету выдержки.
Диод V2 защищает управляющий р-п переход тринистора от опасного для него
обратного напряжения. Диоды V3 и V9 нужны для подавления экстратоков, воз-
никающих при отпускании реле.
Чтобы начать новый цикл отсчета времени, реле нужно установить в исходное
состояние, когда закрыт тринистор, а реле К1 обесточено. Для этого достаточно
Замкнуть контакты выключателя S2. Конденсатор С4 быстро зарядится через рези-
стор R9 до уровня напряжения на катоде тринистора, а конденсатор С5 будет бо-
лее медленно заряжаться через резисторы RIO, R11 до напряжения включения од-
нопереходного транзистора V6. Через некоторое время этот транзистор включится
и создаст положительный импульс напряжения на резисторе R9. Он окажется со-
единенным последовательно с напряжением на конденсаторе С4 и создаст на като-
де тринистора более положительное напряжение по отношению к аноду. Тринистор
Закроется, реле К1 отпустит и контактами К1.2 переключит нагрузку. Контакты
К1Л разомкнутся. Диод V5 закроется, и реле К2 вновь начнет периодически вклю-
чаться и выключаться.
Рис. 2. Принципиальная
схема конденсаторного реле.
Интервал времени между замыканием контактов выключателя S2 и отпусканием
реле К1 можно установить переменным резистором R10 в пределах 0,15... 5 с.
Для увеличения этого интервала достаточно подключить параллельно конденсатору
С5 дополнительный конденсатор соответствующей емкости.
Такое, на первый взгляд, сложное устройство переключения реле времени в ис-
ходное состояние позволяет при необходимости автоматизировать работу устрой-
ства и добиться его периодического включения без постороннего вмешательства.
После установки нужных выдержки и паузы реле будет отсчитывать заданные ин-
тервалы, включать (или выключать) нагрузку, а после некоторого перерыва вновь
переходить в режим отсчета времени. Такой автомат сможет, например, подсыпать
корм рыбам или мелким животным, поливать цветы во время отпуска, а совместно
с кинокамерой — проводить покадровую съемку медленно протекающих процессов,
таких как рост цветка.
Генератор импульсов, управляющих реле К2, собран на кремниевых транзисторах
V7 и V8, включенных как аналог однопереходного транзистора. Генератор выра-
батывает импульсы прямоугольной формы и амплитудой, близкой к напряжению пи-
тания. Длительность импульсов около 20 мс, частоту их следования можно плавно
изменять переменным резистором R12. В итоге выдержку времени удается плавно
устанавливать в пределах 2,5...80 мин или 45 мин...26 ч (в зависимости от по-
ложения контактов выключателя S1). Кроме того, возможна установка фиксирован-
ных выдержек, если переключатель S3 устанавливать в другие положения. Так при
подключении им к генератору резистора R14 выдержка может быть 3 мин или 1 ч
(соответственно при замкнутых и разомкнутых контактах выключателя S1) . Если
же будет подключен резистор R13, выдержка соответственно станет 36 ч или 30
суток. В четвертом положении переключателя к генератору импульсов будет под-
ключен разъем XI, в гнезда которого можно вставить выводы резистора, задающе-
го любую другую выдержку реле.
На однопереходном транзисторе V10 собран вспомогательный генератор, импуль-
сы которого выполняют такую же роль для генератора на транзисторах V7, V8,
что и импульсы последнего для каскада на транзисторе VI.
Детали реле времени можно разместить в любом подходящем корпусе. При монта-
же их следует помнить, что соединение выводов конденсатора С1 с контактом
группы К2.1 должно быть выполнено только над платой («в воздухе»), чтобы
обеспечить лучшую изоляцию этой точки и предотвратить дополнительный разряд
конденсатора.
Однопереходные транзисторы — любые из серии КТ117, биполярные можно заме-
нить любыми аналогичными - кремниевыми транзисторами соответствующей структу-
ры. Тринистор — любой из серии КУ101. Реле К1 — на напряжение 12 В, при токе
срабатывания не более 50 мА. Реле К2 — самодельное. Обмотка его содержит 3000
витков провода ПЭВ-1 0,1, намотанных на каркасе из картона, изготовленного по
размерам геркона, выполняющего роль контактов К2.1. Из герконов лучше приме-
нить тот, который рассчитан на работу при токах в доли микроампера. Для на-
дежности работы реле внутрь каркаса катушки желательно поместить два геркона
и соединить их выводы параллельно. Подойдет и готовое герконовое реле, сраба-
тывающее при напряжении 4..8 В.
Для питания реле использован блок БП-9/12, но вполне пригоден и любой дру-
гой источник напряжешь ем 12 В, рассчитанный на ток нагрузки не менее 80 мА.
Если при расчете или подборе времязадающих резисторов R2, R3, R12 — R14
окажется, что сопротивление любого из них не должно превышать 500 кОм, ге-
нератор на транзисторе VI0 можно исключить.
Налаживание реле сводится к подбору времязадающих резисторов и градуировке
шкал переменных резисторов R10 и R12.
В случае использования автомата для отсчета непродолжительных выдержек вре-
мени, например при проявлении фотопленки, его запускают кратковременным вклю-
чением выключателя S2. Когда же автомат должен работать длительное время, на-
пример для подкармливания рыб в отпуске, контакты этого выключателя должны
быть замкнуты постоянно.
ФОТОЭЛЕКТРОННЫЕ УСТРОЙСТВА
(обзор)
В. Лемке
Фотоэлектронные (оптоэлектронные) устройства (ФЭУ) широко применяются в
устройствах автоматики, телемеханики, оптической связи, фотоизмерительной и
другой технике. Исходя из назначения, они должны соответствовать определенным
требованиям, например таким: высокая чувствительность, достаточное быстродей-
ствие , способность работы в нужной части оптического диапазона и требуемом
диапазоне температуры, помехоустойчивость, простота и экономичность устройст-
ва ит. д. Выполнение заданных требований достигается соответствующим выбором
светочувствительных элементов и фильтров для них, схемы усилительных каскадов
исполнительных устройств и т. д.
В качестве светочувствительного элемента в ФЭУ могут быть использованы фо-
торезисторы, фотодиоды, фототранзисторы, фотоэлементы, фотоумножители, оп-
троны с открытым оптическим каналом и т. д.
В зависимости от типа используемого светочувствительного элемента в ФЭУ
есть свои особенности, которые должны учитываться и для более полного исполь-
зования возможностей светочувствительного элемента и для более рационального
построения устройства.
Обычно в своих конструкциях радиолюбители используют фотодиоды и фоторези-
сторы.
Фотодиод — полупроводниковый прибор, являющийся приемником лучистой энер-
гии, которая, воздействуя на фотодиод, переводит его из закрытого состояния в
открытое. В зависимости от типа фотодиода максимум спектральной чувствитель-
ности может находиться в видимой области или в области инфракрасного излуче-
ния . Фотодиоды могут работать и в вентильном режиме, преобразуя световую
энергию в ЭДС значением 0.5 ... О.7 В.
Фоторезисторы представляют собой активные полупроводниковые резисторы, чув-
ствительные к световому излучению в широком интервале длин волн, включая
ультрафиолетовый и инфракрасный спектры. Для фоторезисторов характерно то,
что они обладают высоким сопротивлением в темноте, которое при освещении рез-
ко уменьшается. Существует большое разнообразие фЭУ, отличительную особен-
ность которых определяет применяемый светочувствительный элемент.
В сравнении по параметрам с фотодиодами фоторезисторы отличаются высоким
отношением светового тока к темновому, однако, значительно уступают фотодио-
дам в быстродействии. Рабочее напряжение фотодиодов составляет 10...2О В, а
фоторезисторов — 1,3...350 В.
На практике ФЭУ выполняются, как правило, в следующих основных вариантах:
светочувствительный элемент без усилительных элементов в цепи управляющего
устройства;
с использованием усилителя постоянного тока (УПТ);
с использованием порогового элемента;
светочувствительный элемент в цепи генератора импульсов;
с модуляцией управляющего луча.
ФЭУ с фоторезистором или фотодиодом в цепи управляющего устройства без ис-
пользования усилительных элементов отличаются простотой, но имеют низкую чув-
ствительность и поэтому на практике применяются редко, например в устройствах
«автостопа», где источник света находится в непосредственной близости от фо-
торезистора иди в автоматах включения и отключения ночного освещения, если в
качестве исполнительного устройства применить тринисторы или электромагнитные
реле с малым током срабатывания, а также для измерения интенсивности светово-
го излучения при включении микроамперметра последовательно с фоторезистором.
Световой ток фотодиода намного меньше светового тока фоторезистора и состав-
ляет десятки микроампер, поэтому нецелесообразно его ставить в цепи последо-
вательно с исполнительными устройствами без усилительных элементов.
В ФЭУ с УПТ желательно использовать фоторезисторы, так как при увеличении
температуры окружающей среды на 30...40°С темновой ток фотодиодов увеличи-
вается в несколько раз, что вызывает нестабильность работы ФЭУ.
Из применяемых в настоящее время ФЭУ с УПТ можно выделить три основные
группы:
1. Фоторезистор включен между базой транзистора первого каскада УПТ и мину-
сом (для транзистора р-п-р структуры) или плюсом (для транзистора п-р-п
структуры) источника питания.
2. Фоторезистор включен между базой и эмиттером входного транзистора УПТ.
3. Фоторезистор включен в цепь УПТ, выполненного на интегральных микросхе-
мах .
Однокаскадный УПТ на транзисторе, а также УПТ на составном транзисторе, яв-
ляющийся разновидностью однокаскадного УПТ с более высоким коэффициентом уси-
ления, применяют в ФЭУ первой группы, например в автоматах управления освеще-
нием, в измерительных приборах. Для ФЭУ тревожной сигнализации, в устройствах
для подсчета и сортировки штучных изделий и т. п. обычно применяются двухкас-
кадные УПТ. Повышения чувствительности ФЭУ первой группы можно добиться не
только подбором по соответствующим параметрам транзисторов (указано ниже), но
и путем увеличения напряжения источника питания. Лучше для питания ФЭУ ис-
пользовать два источника: один с напряжением 5...20 В для питания УПТ, а дру-
гой, с более высоким напряжением, для питания фоторезистора. Подбирая напря-
жение второго источника в пределах 20... 250 В, добиваются наибольшей чувст-
вительности ФЭУ. Практические конструкции ФЭУ с УПТ первой группы приведены в
«Радио», 1975, № 3, с. 37 и № 10, с. 64.
ФЭУ, в которых фоторезистор включен между базой и эмиттером транзистора
входного каскада УПТ, питаются от источника с меньшим напряжением, чем ФЭУ
первой группы. В них не полностью используются возможности фоторезистора, по-
этому ФЭУ даже с многокаскадными УПТ по чувствительности уступают ФЭУ с одно-
каскадными УПТ первой группы. Одно из ФЭУ с УПТ второй группы описано в «Ра-
дио», 1980, № 9, с. 38.
Чувствительность ФЭУ с УПТ на транзисторах зависит от статического коэффи-
циента передачи тока (h2is) транзисторов (особенно оконечного) и рабочего тока
электромагнитного реле (или других исполнительных элементов). Чем больше ко-
эффициент h2i3 транзистора и меньше ток реле, тем выше чувствительность ФЭУ.
Транзистор, ко входу которого подключается фоторезистор, должен обладать как
можно меньшим обратным током коллектора (1кбо <2 мкА) . Лучшие результаты дает
применение кремниевых транзисторов.
В радиолюбительской практике используются чаше всего двухкаскадные УПТ на
транзисторах, так как построение многокаскадных УПТ связано с усложнением
процесса установки режимов работы транзисторов при настройке ФЭУ. Поэтому для
дальнейшего повышения чувствительности можно использовать УПТ, выполненные на
интегральных микросхемах (ИМС) с высоким коэффициентом усиления. Однако при
этом снижается помехозащищенность ФЭУ и использовать его можно при условии
неизменности освещенности помещения, в котором установлен фоторезистор.
ФЭУ выполняют на интегральных микросхемах не только для повышения их чувст-
вительности, но и для уменьшения габаритов самих конструкций, повышения эко-
номичности. Кроме того, в автоматических устройствах, выполненных на цифровых
ИМС, легче согласовать выход ФЭУ со входом ИМС. Вариант ФЭУ, выполненного па
одном элементе 2И-НЕ, описан в «Радио», 1977, № 3, с. 60. По чувствительности
оно эквивалентно ФЭУ с однокаскадным УПТ первой группы и ее можно улучшить,
если на фоторезистор отдельно подавать большее напряжение источника питания.
Следует учесть, что в данном случае логический элемент выполняет функцию не
порогового элемента, а УПТ, поэтому если освещенность светочувствительного
элемента резко не изменяется, то и напряжение на выходе элемента может быть в
пределах 0,4 ... 2,4 В.
Если в ФЭУ на цифровых ИМС фоторезистор необходимо вынести на несколько
метров, то для повышения помехоустойчивости и улучшения согласования с про-
водной линией связи следует применять логические элементы с открытым коллек-
торным выходом (например, элементы ИМС К155ЛА7, К155ЛА8) или использовать
транзисторный согласующий каскад, который будет повышать и чувствительность
ФЭУ.
ФЭУ, в которых в качестве управляющих элементов используются электромагнит-
ные реле,4 обладают большим гистерезисом, так как ток срабатывания реле боль-
ше тока отпускания. Поэтому включение и отключение исполнительных устройств
происходит не при одинаковой освещенности фоторезистора. Кроме того, в таких
ФЭУ при включении и выключении наблюдается нечеткое срабатывание, проявляю-
щееся в виде «дребезга», особенно в случаях относительно медленного нараста-
ния и убывания среднего уровня освещенности фоторезистора или когда уровень
его освещенности имеет значительные колебания относительно среднего уровня.
Чтобы избавиться от этих недостатков, нужно обеспечить не плавное, а резкое
(скачкообразное) изменение силы тока, проходящего через обмотку реле, т. е.
необходимо использовать для этого УПТ, обладающие пороговым эффектом (напри-
мер, триггеры с эмиттерной связью).
ФЭУ без пороговых элементов чаще всего используют для фотоизмерительных
приборов и в тех устройствах, где необходимо плавное изменение значения регу-
лирующего параметра, пропорционально изменению освещенности светочувствитель-
ного элемента.
ФЭУ с использованием порогового элемента получили более широкое распростра-
нение .
Иногда для простоты в качестве порогового элемента используют стабилитрон,
включая его между выходом УПТ и базой транзистора ключевого каскада, нагруз-
кой которого служит электромагнитное реле или другое управляющее устройство.
При достижении на нагрузочном резисторе УПТ падения напряжения, превышающего
напряжение пробоя стабилитрона, он открывается и подает напряжение для управ-
ления ключевым каскадом. Однако такие устройства имеют ограниченное при-
менение, так как не для всякого ФЭУ можно подобрать стабилитрон с нужным на-
пряжением пробоя, кроме того, следует учитывать и разброс параметров стабили-
тронов и невозможность плавного регулирования этого порога без усложнения
устройства.
Более широкое распространение в радиолюбительской практике получили ФЭУ с
использованием в качестве порогового элемента триггера Шмитта, принцип работы
которого подробно рассмотрен в статье В. Крылова и В. Лапшина «Триггер с
эмиттерной связью», опубликованной в сборнике «В помощь радиолюбителю», вып.
52. Некоторые ФЭУ с использованием триггера Шмитта описаны в «Радио», 1975, №
б, с. 35 и 1977, № 12, с. 55.
В последнее время в устройствах автоматики все чаще применяют ИМС. При ис-
пользовании для ФЭУ в качестве порогового элемента триггера Шмитта на тран-
зисторах очень трудно, даже усложняя конструкцию, получить в исходном состоя-
нии выходное напряжение, близкое к нулю. Т. е. на выходе триггера всегда при-
сутствует потенциал, превышающий по значению логический 0.
Для автоматических устройств, выполняемых на ИМС, целесообразно применять
ФЭУ с использованием в качестве порогового элемента триггер Шмитта в ин-
тегральном исполнении.
На рис. 1 приведена схема ФЭУ, обладающего хорошей чувствительностью. Для
согласования высокого входного сопротивления фоторезистора R1 со входом триг-
гера DD1 и для исключения влияния соединительной линии от вынесенного фоторе-
зистора применен каскад на транзисторе VT1, выполняющий функцию УПТ и улуч-
шающий крутизну фронта сигнала с фоторезистора. При затемненном фоторезисторе
R1 на базу транзистора VT1 подается положительное напряжение около 0,7 В. В
это время транзистор открыт, напряжение на его коллекторе (не более 0,8 В)
меньше порога срабатывания триггера, поэтому на его выходе присутствует по-
тенциал логической 1. При освещении фоторезистора его сопротивление уменьша-
ется, напряжение на базе транзистора уменьшается до минус 0,8...1,6 В, в ре-
зультате он закрывается, напряжение на коллекторе возрастает до значения,
превышающего порог срабатывания триггера и на его выходе появляется логиче-
ский 0. Подбором резистора RJ при затемненном фоторезисторе устанавливают на
входе триггера напряжение 0,8 В, а подстроечным резистором R3 добиваются мак-
симальной чувствительности ФЭУ.
Рис. 1. Принципиальная схема ФЭУ с использованием триггера Шмит-
та в интегральном исполнении
Если нужно чтобы при освещенном фоторезисторе на выходе триггера DD1 была
логическая 1, коллектор транзистора VT1 следует подключить к выводу «+5 В»,
его эмиттер — непосредственно к входам триггера, резисторы R5 и R6 исключить
совсем, а сопротивления резисторов R4 и R7 уменьшить соответственно до 820 и
910 Ом. В этом случае с уменьшением уровня освещенности напряжение на базе
транзистора увеличивается от нуля до плюс 2 В. Транзистор при этом открывает-
ся и напряжение на его эмиттере возрастает от 0,9 до 2 В, превышая порог сра-
батывания триггера, в результате на выходе триггера появляется потенциал ло-
гического 0. Порог срабатывания триггера устанавливают подбором резистора R7.
Однако сопротивление этого резистора не должно быть меньше 620 Ом, иначе
триггер может самовозбудиться.
Напряжение источника питания, равное 22 В (17 + 5) для фоторезистора ФСК-2,
можно считать оптимальным для получения максимальной чувствительности.
Существенным недостатком триггеров с эмиттерной связью является наличие
гистерезиеа, т. е. напряжение отпускания всегда меньше напряжения срабатыва-
ния триггера. Величина гистерезиса триггера составляет обычно десятые доли
вольта. Меры по уменьшению гистерезиса рассмотрены в статье «Триггеры с эмит-
терной связью», помещенной в сборнике «В помощь радиолюбителю», вып. 52, но
они, к сожалению, значительно усложняют устройства. В качестве порогового
элемента в ФЭУ лучше всего, пожалуй, применять не триггер Шмитта, а электрон-
ное реле В. И. Турченкова (принцип работы описан в «Радио», 1974, № 1, с.
37), обладающее рядом преимуществ, в том числе и меньшим гистерезисом и полу-
чением возможности хорошего согласования со входами цифровых ИМС. Примером
может служить ФЭУ, описанное в «Радио», 1983, № 11, с. 48. Но в таком вариан-
те ФЭУ применены два источника питания и не полностью использованы возможнос-
ти электронного реле В. И. Турченкова.
Порог срабатывания и отпускания электронного реле В И. Турченкова зависит
от входного тока (от внешнего источника), текущего через коллекторный переход
первого транзистора, и номинала резистора в коллекторной цепи этого транзи-
стора. Отсюда следует, что простое ФЭУ на базе электронного реле В. И. Тур-
ченкова можно создать без источника входного тока, заменив резистор в коллек-
торной цепи первого транзистора фоторезистором с большим темновым сопротивле-
нием.
RZ*
VT2
VTi НИШ
----—Я9)В
RI
т-г
Рис. 2. Схема ФЭУ, выполненного на базе порогового элемента
(электронного реле) В.И. Турченкова
_ /РуСТЗМ
1/72 (рм?) Г, зяектри-
>1и я мюришсшора
I | дадоткг
I <--*--58
Рис. 3. Согласующий каскад ФЭУ О входами логических элементов
ИМС и тринисторами
На рис. 2 приведена схема практически проверенного и сравнительно простого
варианта ФЭУ. Оно представляет собой однокаскадный УПТ на транзисторе VT1,
включенном по схеме с общей базой. Диод VD1 и усилительный каскад на транзи-
сторе VT2 (его эмиттерный переход является активной нагрузкой УПТ) выполняют
роль цепи обратной связи между коллектором и эмиттером транзистора VT1. Изме-
нение порога срабатывания и отпускания достигается подбором резистора R2. При
настройке его лучше заменить переменным резистором, которым устанавливают при
освещенном фоторезисторе R1 на выходе ФЭУ напряжение меньше или равное 0,3 В
При освещенном фоторезисторе, когда его сопротивление мало, проходящий через
него ток удерживает транзистор VT2 в открытом состоянии в режиме насыщения, а
выходное напряжение близко к нулю. При затемнении фоторезистора его сопротив-
ление увеличивается, проходящий через него ток уменьшается, а следовательно,
уменьшается и положительное напряжение на базе транзистора VT2 и ток базы,
вызывая уменьшение эмиттерного тока этого транзистора В результате лави-
нообразного процесса транзистор VT2 закрывается При этом выходное напряжение
резко увеличивается до значения, равного половине напряжения источника пита-
ния .
Это ФЭУ имеет очень высокое выходное сопротивление, поэтому для согласова-
ния со входами цифровых ИМС и с тринисторными ключами необходимо применять
эмиттерный повторитель (рис. 3) . В эмиттерную цепь транзистора вместо рези-
стора R2 можно включить электромагнитное реле (например, РЭС-15), увеличив
напряжение источника питания этого каскада до 16... 24 В (в зависимости от
типа используемого реле).
На практике иногда применяют ФЭУ, в которых светочувствительный элемент
включен в цепь положительной обратной связи генератора импульсов. В некоторых
вариантах таких ФЭУ изменение уровня освещенности светочувствительного эле-
мента вызывает самовозбуждение или срыв колебаний генератора (см., например,
Радио, 1973, № 4, с. 69, 1974, № 10, с. 36) . Причем устранение гистерезиса
электромагнитного реле в этом случае значительно усложняет ФЭУ, так как оно
включает в себя генератор, усилитель импульсов, выпрямитель и ключевой кас-
кад. Поэтому подобные ФЭУ могут найти применение лишь в тех случаях, когда
необходима звуковая сигнализация об изменении уровня освещенности. В других
вариантах таких ФЭУ изменение уровня освещенности светочувствительного эле-
мента изменяет частоту генерируемых колебаний («Радио», 1973, Ко 12, с. 40) .
Подобные ФЭУ можно применять не только в качестве индикаторов инфракрасных,
рентгеновских и гамма-лучей, интенсивности освещенности, но и в устройствах
автоматической плавной регулировки.
Однако оба варианта таких ФЭУ из-за своей сложности применять не всегда це-
лесообразно, они, кроме того, обладают очень низкой чувствительностью.
Схема более совершенного и к тому же простого ФЭУ для автоматического регу-
лирования освещенности приведена в сборнике «В помощь радиолюбителю», вып.
61. В нем фоторезистор включен в цепь УПТ, который в зависимости от уровня
освещенности, увеличивая или уменьшая ток зарядки конденсатора, изменяет час-
тоту колебаний генератора, управляющего тринисторным каскадом для изменения
напряжения на нагрузке.
Для устройств дистанционного управления и автоматов с использованием ФЭУ,
работающих в «режиме направленного излучения (а также в режиме прерывания лу-
ча и в режиме локатора), в которых светочувствительный элемент подвергается
воздействию солнечного света и других мощных источников светового излучения,
необходимо для повышения помехозащищенности применять импульсный (модулиро-
ванный) световой сигнал в видимой или инфракрасной части спектра оптического
диапазона волн.
Источником импульсного видимого светового сигнала может служить лампа нака-
ливания, включенная на выходе несимметричного мультивибратора, а приемником —
фоторезистор, включенный в цепь первого каскада усилителя переменного напря-
жения (см. «Радио», 1977, № 3, с. 49).
Для дистанционного управления и передачи звука на небольшие расстояния все
чаще используют инфракрасные волны оптического диапазона (так называемые ИК-
лучи).
В устройствах дистанционного управления на ИК-лучах в качестве излучающего
элемента применяют светодиод ИК-излучения, которому свойственна меньшая инер-
ционность по сравнению, например, с лампой накаливания. Благодаря этому излу-
чение фотодиода эффективно модулируется по амплитуде прямоугольными им-
пульсами с достаточно высокой частотой следования (около 10 кГц), что обеспе-
чивает высокую чувствительность и стабильность коэффициента усиления приемни-
ка. Излучаемый светодиодом импульсный ИК-сигнал принимается фотодиодом ИК-
диапазона, продетектированный сигнал звуковой частоты поступает на усилитель
переменного напряжения, усиливается и после выпрямления подается на исполни-
тельные устройства.
Описания радиолюбительских ФЭУ на ИК-лучах опубликованы в «Радио» (см.
1978, № 8, с. 18; 1981, № 1, с. 22; 1981, № 3, с. 46; 1982, № 1, с. 25; 1984,
№ 4 , с. 32) .
Для получения высокой чувствительности приемника ИК-излучения обычно ис-
пользуют входной каскад на полевом транзисторе. В остальных каскадах усиления
целесообразно применять ИМС. Хорошие результаты дает применение операционных
усилителей (ОУ) с большим коэффициентом усиления, например К140УД7. Для Даль-
нейшего упрощения приемника ИК-излучения нужно применять ОУ К140УД8А, входные
каскады которого выполнены на полевых транзисторах. Работоспособность такого
приемника сохраняется даже при понижении напряжения источника питания.
ЧИСЛОИМПУЛЬСНЫИ ГЕНЕРАТОР
А. Евсеев
Иногда в устройствах импульсной техники, автоматики, электронных игровых
автоматах возникает необходимость получить определенное число импульсов при
нажатии соответствующей кнопки.
Принципиальная схема устройства, реализующего такую возможность, приведена
на рис. 1. Функционально оно включает в себя генератор импульсов, счетчик и
дешифратор. Генератор прямоугольных импульсов собран на логических элементах
DD1.3 и DD1.4. Частота следования импульсов около 10 Гц. С выхода генератора
импульсы поступают на вход двоично-десятичного счетчика, выполненного на мик-
росхеме DD2. Четыре выхода счетчика соединены со входами микросхемы DD3,
представляющей собой дешифратор на 4 входа и 16 выходов.
Г/ 20 №*53
К Ш.7
м/ т м
К155МЗ
т
Ш
П
т
и
7$
4s
К
пс
К*
Щ55ИДЗ
&
S8&
Д55
№400 к
V77
г
i
5
7
й
0
ЛИ
Й
О
*4
fj
VTtfTZ
КТЗ!5Б
w*
___
у
2
4
S
№360
Рис. 1. Принципиальная схема генератора
При подаче питающего напряжения на правых (по схеме) контактах всех пятна-
дцати кнопок SB1 — SB15 будет логический 0, обеспечиваемый наличием низко-
омного резистора R5. Этот логический уровень подается на вход ждущего мульти-
вибратора , выполненного на элементах DD1.1, DD1.2 и конденсаторе С1, гасящем
импульсы дребезга контактов кнопок. «На выходе ждущего мультивибратора — ло-
гический 0, поэтому генератор импульсов не работает. При нажатии одной из
кнопок конденсатор СЗ мгновенно заряжается через диод VD1 до уровня логиче-
ской 1, в результате чего на выходах 2 и 3 счетчика DD2 появляется низкий ло-
гический уровень, устанавливающий его в рабочее состояние. Одновременно через
замкнутый контакт нажатой кнопки логическая 1 подается на вход ждущего муль-
тивибратора, и импульсы генератора поступают на вход счетчика. При этом на
выходах дешифратора последовательно появляется логический 0. Как только он
появится на выходе, с которым соединен контакт нажатой кнопки, подача импуль-
сов на вход счетчика прекратится. С вывода Я элемента DD1.4 будет снято число
импульсов, соответствующее номеру нажатой кнопки. Если продолжать удерживать
кнопку нажатой, то через некоторое время конденсатор СЗ разрядится через ре-
зистор R2, счетчик DD2 установится в нулевое состояние, и генератор выдаст
новую серию импульсов. Понятно, что до окончания серии импульсов кнопку нель-
зя отпускать.
В устройстве использованы резисторы МЛТ-0,25; электролитические конденсато-
ры — К50-6. Транзисторы VT1, VT2 могут быть серий КТ312, КТ315, КТ201; диод
VD1 - серий Д7, Д9, Д311. Кнопки SB1 - SB 15 - П2К, КМ1-1 и др.
Настройка числоимпульсного генератора заключается в установке подбором ре-
зистора R1 и конденсатора С2 требуемой частоты следования импульсов генерато-
ра, которая может быть в пределах от единиц герц до десятков килогерц. При
частоте выше 100 Гц для выдачи полной серии импульсов будет требоваться время
не более 0,15 с, поэтому кнопку можно не удерживать пальцем — короткого нажа-
тия ее вполне достаточно для формирования пачки импульсов.
Благословение
РЕДАКТОРАМ
Поверьте мне: судьбою несть
Даны нам тяжкие вериги.
Скажите, каково прочесть
Весь этот вздор, все зти книги, —
И все зачем? — чтоб вам сказать,
Что их не надобно читать!..
Зато какое наслажденье,
Как отдыхает ум и грудь,
Коль попадется как-нибудь
Живое, свежее творенье!
М.Ю. Лермонтов
Многое в нашем мире было сделано любителями, не профессионалами. За такую
работу денег не платят. Сколько фунтов стерлингов получил сэр Исаак Ньютон за
свой первый закон механики, сколько за второй и сколько за третий? Глупый во-
прос , нисколько. Средства для жизни он добывал за счет должности смотрителя
Королевского Монетного Двора. До начала двадцатого века почти вся наука была
создана любителями, людьми творческими, увлекающимися. Даже сам Эйнштейн соз-
давал теорию относительности работая в патентном ведомстве. Тогда как тысячи
тысяч профессиональных научных сотрудников двадцатого века, получая зарплату,
не создали ничего примечательного.
Журнал «Домашняя лаборатория» тоже был создан любителями именно для любите-
лей научно-технического творчества. Естественно, что журнал редакторам не
платит, поскольку он не делает деньги и не стремиться к этому. В наше меркан-
тильное время, когда деньги - мерило всего, редактором такого журнала может
стать только энтузиаст.
Журнал «Домашняя лаборатория» отличается от других изданий, прежде всего
тем, что он создан и циркулирует в Интернет. В единой, но распределенной
структуре. И его редакция также распределена. Не важно где расположены его
редакторы. Это может быть и потомок русских эмигрантов проживающий в ЮАР, и
русскоязычный канадец, и знающий русский болгарин, и потомственный москвич, и
житель далекого Томска в Сибири. Это не важно. Важно то, что это все люди ув-
лекающиеся, творческие, интересующиеся самыми разнообразными областями науч-
ных знаний.
Редактор журнала оказывается в гуще научных веяний во всей их широте и раз-
нообразии . Роскошная пища для ума! Новая информация - это расширение вашей
эрудиции, осознание ее - ваше самосовершенствование. А если вы узкий специа-
лист, вы можете уже в силу своей должности редактора наткнуться на гипотезу
или эксперимент из смежной области, которые дадут новый поворот в решении ва-
шей научной проблемы. Вы попадаете в богатейшую информационную среду - пита-
тельную среду для ученого человека, для его интеллекта.
Не минуют вас и проблемы этические. Ведь вы выступаете в роли судьи, вы вы-
носите приговор по делу, которое может быть для кого-то жизненно важным.
Имеете ли вы право на такой образ действий? Достаточно ли ваших знаний для
объективности вашего решения? Наконец, не захватил ли вас «синдром уборщицы»,
которая, будучи облечена атрибутами власти в виде швабры и тряпки, может на-
орать на идущего по коридору нобелевского лауреата? Такого рода этические
проблемы за вас никто не решит. Решая их самостоятельно, вы очертите место
своей личности в этом мире, а значит, достигните духовного усовершенствова-
ния .
И, наконец, может быть, главное. Современное общество уже называют информа-
ционным. Когда-то, в каменном веке, человечество умело обращаться только с
веществом, затем оно овладело энергией, и вот теперь вышло на высшую ступень
овладения информацией. И редакторы журнала «Домашняя лаборатория» должны вла-
деть, и владеют всеми современными информационно-компьютерными технологиями.
Обработка научной информации, копание в навозной куче в поисках жемчужного
зерна, отделение плевел от зерен - важнейший для человечества род деятельно-
сти .
Вы стали редактором? Отсеивайте разумное, доброе, вечное! Успехов вам в
этой благородной деятельности!
В ДОБРЫЙ ПУТЬ!