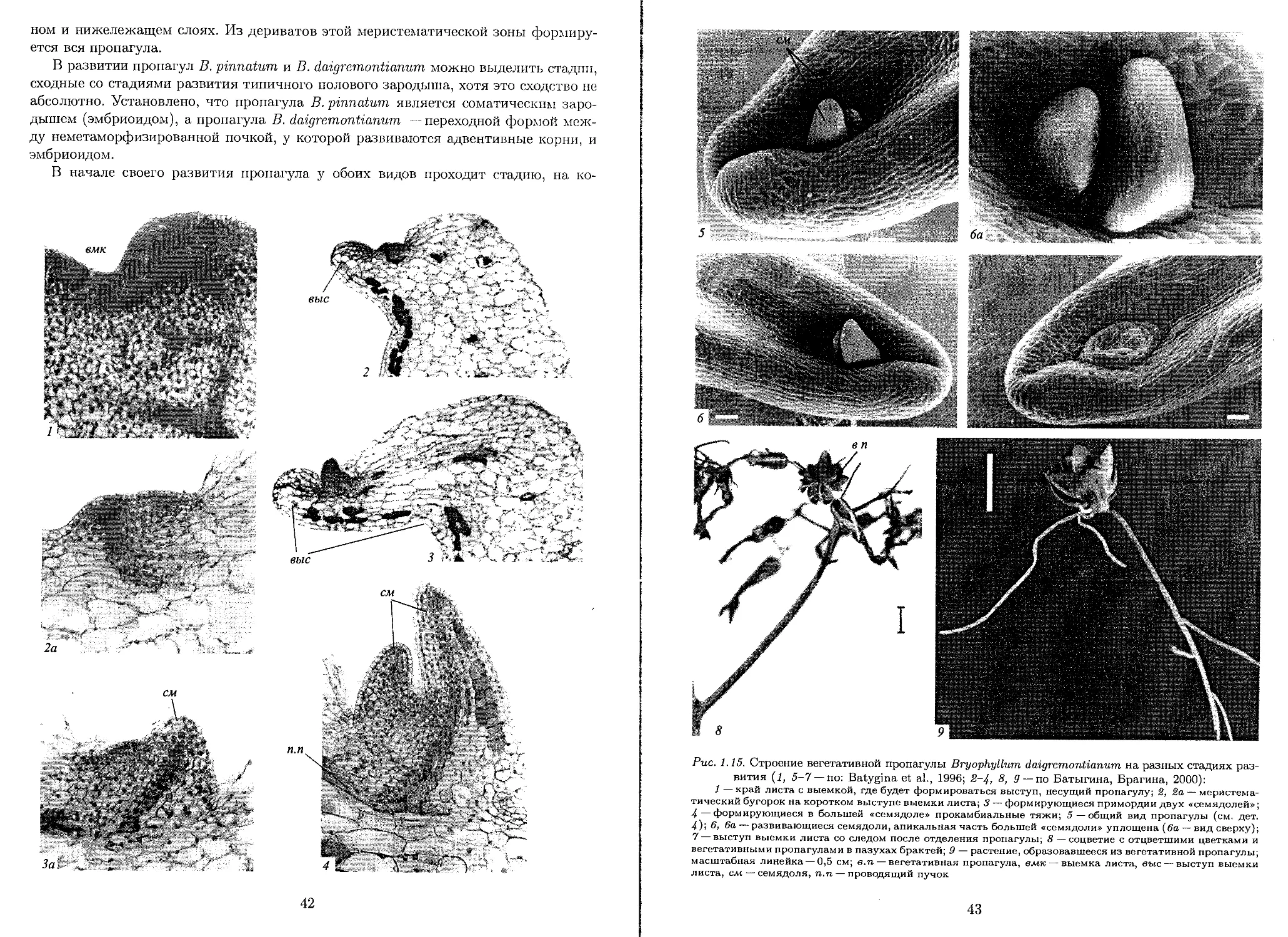
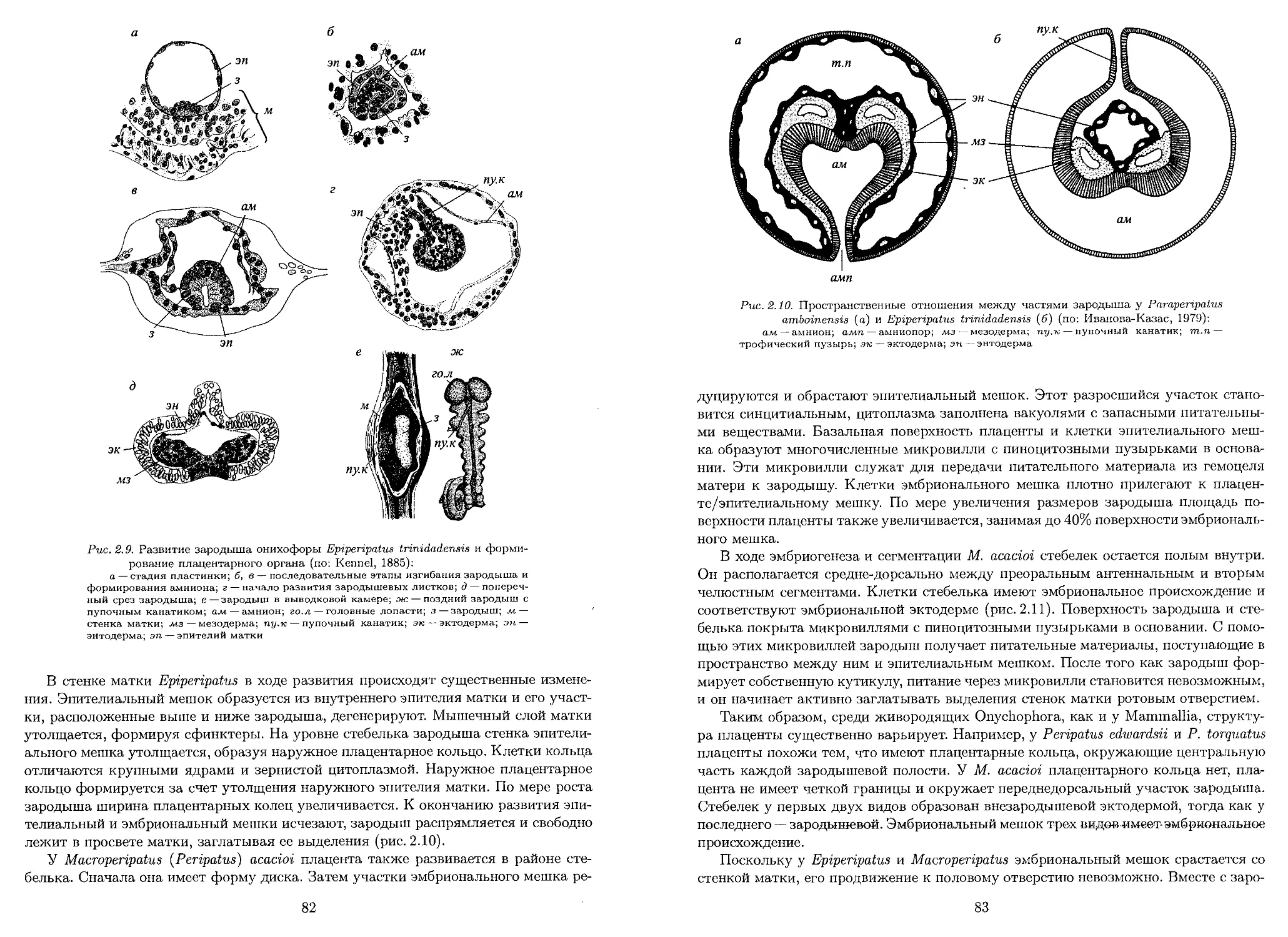
Author: Батыгина Т.Б. Брагина Е.А. Ересковский А.В. Островский А.Н.
Tags: эмбриология растений эмбриология животных онтогенез развитие отдельных организмов ботаника зоология биология беспозвоночные живорождение размножение низшие хордовые
ISBN: 5-288-03803-1
Year: 2006
Батыгина Татьяна Борисовна —член-корреспондент РАН, лидер ведущей научной
школы России «Разработка теоретических основ семенной репродукции цветковых
растений», профессор Санкт-Петербургского государственного университета,
заведующая лабораторией эмбриологии и репродуктивной биологии Ботанического
института им. В Л. Комарова РАН. заслуженный деятель науки РФ, лауреат
Государственной премии (1993) и премии Правительства РФ (2002) в области науки
и техники. Область научных интересов — биология развития, онтогенез, морфогенез,
генетический контроль эмбриогенеза, стволовые клетки. Автор более 450 научных
работ, монографий «Эмбриология пшеницы» (1974), «Хлебное зерно» (1987),
«Размножение растений» (2002) и «Эмбриологические основы андроклинии пшеницы»
(2005). Один из авторов и ответственный редактор пятитомной монографии
«Сравнительная эмбриология цветковых растений» (1981-1990) и трехтомного
энциклопедического издания «Эмбриология цветковых растений. Терминология
и концепции» (1994, 1997, 2000).
Брагина Елена Александровна — кандидат биологических наук, научный сотрудник
Ботанического института им. В.Л.Комарова РАН. Закончила биолого-почвенный
факультет СПбГУ, кандидат биологических наук. Область научных интересов —
биология развития, системы репродукции растений, вивипария, морфогенез вегета-
тивных и генеративных структур у орхидных и толстянковых. Автор 27 научных работ
по эмбриологии и репродуктивной биологии живородящих растений. Один из авторов
трехтомного издания «Эмбриология цветковых растений. Терминология и концепции»
(1997, 2000). За творческий вклад в работу «Эмбриологические основы семенного
размножения цветковых растений. Теоретические и прикладные аспекты» удостоена
премии Правительства РФ (2002) в области науки и техники.
Ересковский Александр Вадимович — доктор биологических наук,
профессор кафедры эмбриологии биолого-почвенного факультета
Санкт-Петербургского государственного университета Область научных
интересов — сравнительная эмбриология беспозвоночных, жизненные циклы
эмбриональное развитие эволюция полового размножения и экология губок
Автор более 70 научных работ в том числе монографии «Сравнительная
эмбриология губок (Porifera)» (2005).
Островский Андреи Николаевич — кандидат биологических наук,
доцент кафедры зоопо)ии беспозвоночных биолого почвенного факультета
Санкт-Петербургского государственного университета Область научных
интересов — поведение систематика жизненные циклы и эволюция
полового размножения морских мшанок (Bryuzoa: Stenolaemata
и Gymnolaemata). Автор 35 научных и 50 научно популярных статен
9785288 038037
ИЗДАТЕЛЬСТВО С.-ПЕТЕРБУРГСКОГО УНИВЕРСИТЕТА
ЖИВОРОЖДЕНИЕ У РАСТЕНИЙ И ЖИВОТНЫХ: беспозвоночных и низших хордовых
ЖИВОРОЖДЕНИЕ
У РАСТЕНИЙ И ЖИВОТНЫХ:
беспозвоночных и низших хордовых
Т. Б. Батыгина, Е. А. Брагина,
А. В. Ересковский, А. Н Островский
ИЗДАТЕЛЬСТВО С -ПЕТЕРБУРГС
(ОГО УНИВЕРСИТЕТА
RUSSIAN ACADEMY OF SCIENCES
V.L. KOMAROV BOTANICAL INSTITUTE
ST. PETERSBURG STATE UNIVERSITY
T. B. BATYGINA, E. A. BRAGINA,
A. V. ERESKOVSKY, A. N. OSTROVSKY
VIVIPARITY
IN PLANTS AND ANIMALS:
INVERTEBRATES
AND LOWER CHORDATES
PUBLISCHING HOUSE OF ST. PETERSBURG STATE UNIVERSITY
2006
БОТАНИЧЕСКИЙ ИНСТИТУТ им. В. Л. КОМАРОВА
РОССИЙСКОЙ АКАДЕМИИ НАУК
САНКТ-ПЕТЕРБУРГСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Т. Б. БАТЫГИНА, Е. А. БРАГИНА,
А. В. ЕРЕСКОВСКИЙ, А. Н. ОСТРОВСКИЙ
ЖИВОРОЖДЕНИЕ
РАСТЕНИЙ И ЖИВОТНЫХ:
БЕСПОЗВОНОЧНЫХ
И НИЗШИХ ХОРДОВЫХ
Рекомендовано Ученым советом
Санкт-Петербургского государственного университета
в качестве учебного пособия для студентов университетов,
специализирующихся по направлению «Биология»
ИЗДАТЕЛЬСТВО С.-ПЕТЕРБУРГСКОГО УНИВЕРСИТЕТА
2006
УДК 581.3+591.3
ББК 28.53+28.63
Б28
Рецензенты: д-р биол. наук, проф. Е. А. Мирославов (Ботан. ин-т им. В. Л.Комарова
РАН), д-р биол наук, проф. Ю. В. Мамкаев (Зоол. ин-т РАН)
Печатается по постановлению Редакционно-издательского совета
биолого-почвенного факультета С.-Петербургского государственного университета
Батыгина Т. Б., Брагина Е. А., Ересковский А. В., Островский А. Н.
Б28 Живорождение у растений и животных: беспозвоночных и низших
хордовых: Учебное пособие. — СПб.: Изд-во С.-Петерб. ун-та, 2006.134 с.
ISBN 5-288-03803-1
Учебное пособие представляет собой первое обобщение и анализ явления живорождения
(вивипарии) у цветковых растений, беспозвоночных и низших хордовых. На основании ориги-
нальных и литературных данных описан морфогенез репродуктивных структур у живородя-
щих видов растений и животных. Большое внимание уделено функциональной морфологии и
генетике живорождения в разных группах растений и животных; предложены оригинальные
классификации этого явления. Обсуждаются причины возникновения вивипарии. Определена
роль живорождения в системе репродукции ряда видов, рассмотренной в популяционно-эко-
логическом аспекте. Приводятся списки видов растений и животных, для которых характерно
живорождение, с указанием его формы. Особое внимание уделяется объяснению употребляе-
мых понятий и терминов.
Книга предназначена для преподавателей, аспирантов и студентов биологических и агро-
номических вузов, научных работников.
ББК 28.53~h28.63
Издание осуществлено при финансовой поддержке Российского фонда
фундаментальных исследований (издательский проект №04-04-62039)
The text-book is proved to be the first generalization and analysis of vivipary in flowering
plants, invertebrates and lower chordates. On the base of original and literature data the
morphogenesis of reproductive structures in viviparous plant and animal species was described.
Much attention was drawn to functional morphology and genetics of vivipary in different groups of
plants and animals. The original classifications of this phenomenon are suggested. The courses of
vivipary arising in the plant and animal world are discussing. The role of vivipary in reproduction
system of certain species was determined. Population and ecological aspects of reproduction in
viviparous species are examined. The lists of plant and animal species, for which vivipary is
typical, are given with indication of its form. A special attention is paid to explanation of notions
and terms related to reproduction systems and viviparous organisms. Original figures and photos
were used as illustrative material.
This book is intended for teachers, Ph.D students and students, scientific workers.
The edition is realized with the support of the Russian Foundation of Basic Researches (grant
№04-04-62039).
На первой полосе обложки в верхнем ряду — живорождение у Bryophyllum daigremontianum\
в нижнем ряду слева — колония Tubulipora sp., справа — выводковые камеры Celleporella hyalina.
© Т. Б. Батыгина,
Е. А. Брагина,
А. В. Ересковский
А. Н. Островский, 2006
© Издательство
С.-Петербургского
университета, 2006
ISBN 5-288-03803-1
СОДЕРЖАНИЕ
Введение................................................................ 9
1. Вивипарии у растений................................................ 16
1.1. Классификация вивипарии у цветковых растений.................... —
1.2. Генеративная вивипария......................................... 18
1.2.1. Общие представления о семени и покое семян у растений... —
1.2.2. Живорождение у мангровых. Физиологические механизмы..... 20
1.3. Вегетативная вивипария......................................... 27
1.3.1. Гемморизогенная вивипария................................. 29
1.3.2. Эмбриоидогенная вивипария................................. 41
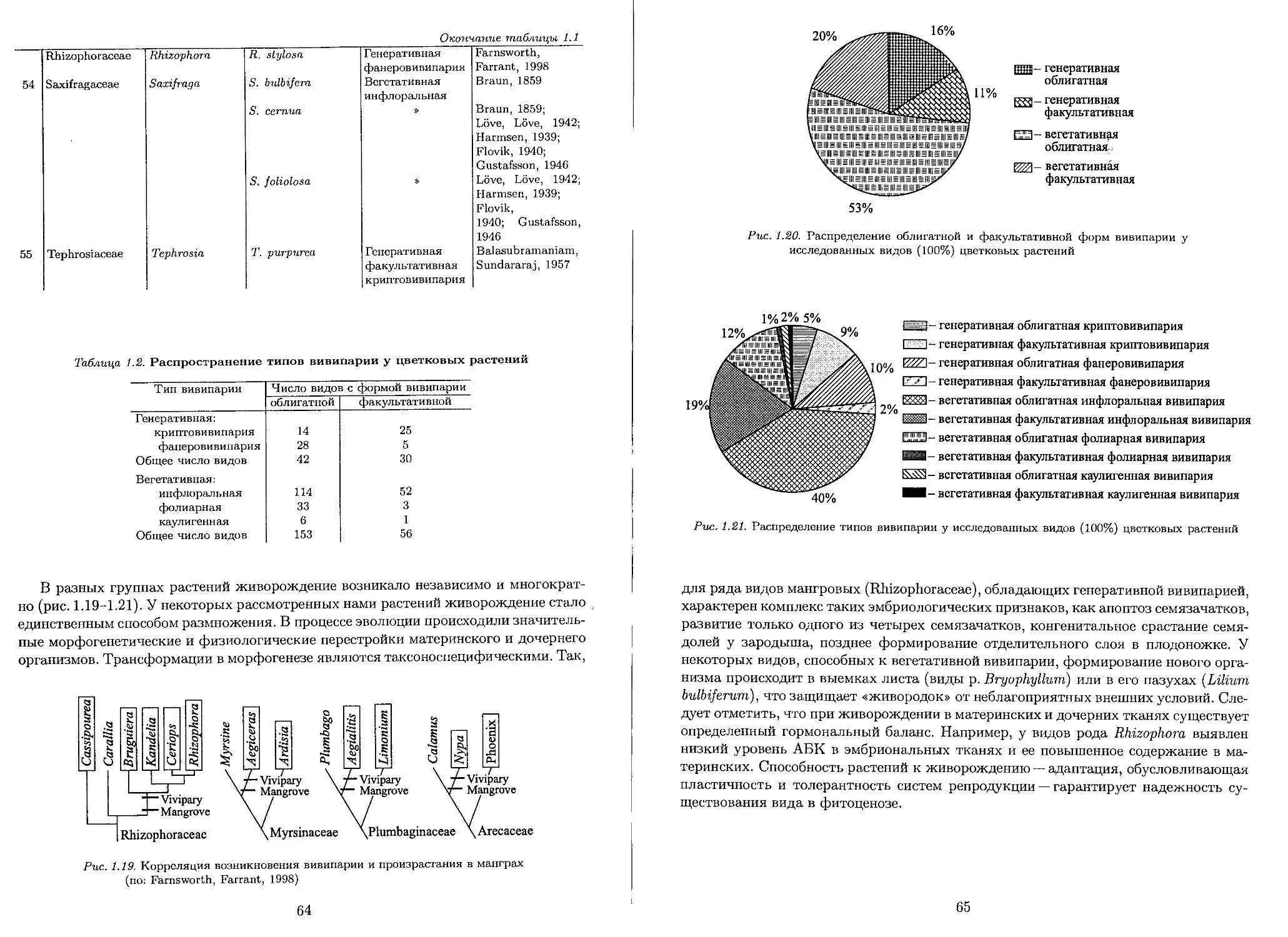
1.4. Генетические основы вивипарии.................................. 47
1.5. Причины возникновения вивипарии................................ 48
1.6. Репродуктивная стратегия живородящих растений.................. 50
Рекомендуемая литература............................................ 66
2. Живорождение у беспозвоночных и низших хордовых животных 68
2.1. Основные понятия и классификация................................ —
2.2. Характеристика живорождения у конкретных групп животных...... 73
Тип Porifera...................................................... —
Класс Calcispongiae............................................. —
Тип Cnidaria..................................................... 76
Тип Ctenophora................................................... 77
Тип Nemertini..................................................... —
Тип Annelida...................................................... —
Класс Polychaeta................................................ —
Тип Mollusca...................................................... —
Тип Onychophora.................................................. 78
Тип Chelicerata.................................................. 85
Класс Arachnida................................................ 86
Отряд Scorpiones............................................. —
Отряд Pseudoscorpiones...................................... 89
Отряд Acari................................................. 92
Тип Uniramia...................................................... —
Класс Insecta................................................... —
Тип Echinodermata................................................ 97
Класс Holoturoidea.............................................. —
Класс Asteroidea................................................ —
5
Класс Ophiuroidea.................................................
Lophophorata (Tentaculata)............................................
Тип Phoronida...................................................... 98
Тип Bryozoa (Ectoprocta)............................................ —
Класс Stenolaemata............................................. 100
Отряд Cyclostomata............................................ —
Класс Gymnolaemata............................................. 101
Отряд Ctenostomata............................................ —
Отряд Cheilostomata......................................... 102
Класс Phylactolaemata.......................................... 104
Тип Brachiopoda................................................... 105
Тип Kamptozoa (Entoprocta)........................................ 106
Тип Chordata...................................................... 108
Класс Ascidiacea................................................. —
Класс Salpae................................................... 110
2.3. Эволюция живорождения у беспозвоночных и низших хордовых жи-
вотных............................................................... 115
Рекомендуемая литература............................................ 118
Словарь основных терминов.............................................. 119
Предметный указатель................................................... 125
Указатель латинских названий растений.................................. 129
Указатель латинских названий беспозвоночных и низших хордовых......... 131
CONTENTS
Introduction...............................................................
1. Viviparity in plants...................................................
1.1. Classification of viviparity in plants.............................
1.2. Generative viviparity..............................................
1.2.1. General notions about seed and seed dormancy in plants........
1.2.2. Viviparity in mangroves. Physiological mechanisms.............
1.3. Vegetative viviparity..............................................
1.3.1. Gemmorhizogenic viviparity....................................
1.3.2. Embryoidogenic viviparity.....................................
1.4. Genetic principles of viviparity...................................
1.5. Reasons of viviparity appearance...................................
1.6. Reproductive strategy in viviparous plants.........................
Recommended literature..................................................
2. Viviparity in invertabrates and lower chordates........................
2.1. General notions and classification.................................
2.2. Characterization of viviparity in concrete groups..................
Type Porifera........................................................
Class Calcispongiae...............................................
Type Cnidaria........................................................
Type Ctenophora......................................................
Type Nemertini.......................................................
Type Annelida........................................................
Class Polychaeta..................................................
Type Mollusca........................................................
Type Onychophora.....................................................
Type Chelicerata.....................................................
Class Arachnida...................................................
Order Scorpiones...............................................
Order Pseudoscorpiones.........................................
Order Acari....................................................
Type Uniramia........................................................
Class Insecta.....................................................
Type Echinodermata...............................................
Class Holoturoidea................................................
Class Asteroidea..................................................
7
Class Ophiuroidea.................................................
Lophophorata (Tentaculata)............................................
Type Phoronida....................................................... 98
Type Bryozoa (Ectoprocta)............................................ —-
Class Stenolaemata............................................... 100
Order Cyclostomata.............................................. -
Class Gymnolaemata............................................... 101
Order Ctenostomata.............................................. —
Order Cheilostomata........................................... 102
Class Phylactolaemata............................................ 104
Type Brachiopoda.................................................... 105
Type Kamptozoa (Entoprocta)......................................... 106
Type Chordata....................................................... 108
Class Ascidiacea................................................... —
Class Salpae..................................................... 110
2.3. Evolution of viviparity in invertebrates and lower chordates...... 115
Recommended literature................................................. 118
Dictionary of principal terms............................................. 119
Index..................................................................... 125
Index of latin plant names................................................ 126
Index of latin invertebrates and lover chordates names.................... 131
ВВЕДЕНИЕ
Одним из важнейших направлений современной биологии является изучение эм-
бриологических и молекулярно-генетических основ репродукции растений и живот-
ных. Размножение обеспечивает непрерывность и преемственность жизни; это уни-
версальное свойство всех живых организмов. Несмотря на большое число исследова-
ний остается не совсем ясной биологическая сущность отдельных способов, типов и
форм размножения, их взаимосвязи, а также роль в эволюции. Особое место в систе-
ме репродукции животных и растений занимает живорождение, или вивипария (лат.
vivus — живой, pario — рожать). Термин «живорождение» чаще всего употребляют
в зоологии, «вивипария» — в ботанике. В англоязычной литературе встречаются две
формы написания термина: viviparity и vivipary.
Изучение явления живорождения имеет значение для решения фундаменталь-
ных проблем: морфогенеза, взаимоотношений материнского и дочернего организ-
мов, транспорта питательных веществ и гормонов, их влияния на развитие дочер-
него организма, становления его автономности, репродуктивной стратегии вида с
позиций надежности биологических систем, и практических задач: установления
оптимальных условий для хранения семян и сохранения их всхожести, сокращения
сроков прорастания семян, получения массового количества регенерантов в культу-
ре in vitro с дальнейшей репатриацией редких видов.
Живорождение у животных известно с давних пор. Аристотель (IV век до н.э.)
разделял животных на живородящих и яйцеживородящих. При классификации рас-
тений впервые этот признак использовал К. Линней (1737) для определения видов
родов Festuca и Роа.
Способность организма к живорождению нашла отражение в названиях видов
растений (Festuca ovina var. vivipara, Polygonum viviparum, Eriogonum viviparum, Poa
viviparum, Remusatia vivipara, Asplenium viviparum) и животных (Xenopleura vivipara,
Viviparus viviparus, Zoarces viviparous, Barbus viviparous, Lacerta vivipara, Patriella
vivipara, P. paravivipara).
Вивипария у растений — способ воспроизведения потомства, при котором из по-
лового зародыша в семени либо из выводковой почки образуются проростки (про-
пагулы) на материнском организме без периода покоя. Генотип потомков зависит от
происхождения и строения пропагул.
В настоящее время вивипария обнаружена у 281 вида цветковых растений
из 43 семейств, находящихся на разных уровнях филогенетической системы
(Nymphaeaceae, Ranunculaceae, Orchidaceae, Роасеае). Кроме того, известно 197 ви-
дов живородящих папоротников, принадлежащих восьми семействам. Первый обзор
живородящих растений был сделан А. Брауном в 1859 г. Объем понятия вивипария
9
остается дискуссионным в связи со слабой изученностью ее структурно-функци-
ональных основ. Одни авторы под вивипарией подразумевают процесс прораста-
ния семян на материнском растении у представителей родов Rhizhophora, Bruguiera,
Kandelia, Ceriops и Avicenia. Другие ученые считают, что это образование новых
растений на разных органах (листе, стебле, соцветии) материнского растения {Роа
viviparum, Polygonum viviparum, Cardamine, Bryophyllum). Однако зачастую явление
вивипарии понимают широко и относят к нему формирование проростков как из се-
мян у мангровых, так и из вегетативных диаспор у живородящих растений других
видов.
Морфогенез репродуктивных структур у живородящих растений (за исключени-
ем мангровых, мутантов кукурузы, пшеницы и арабидопсиса) изучен фрагментарно,
что тормозит выяснение молекулярно-генетических основ вивипарии.
На сегодняшний день комплексные исследования репродуктивной биологии жи-
вородящих растений проводятся лишь на немногих видах. Все это привело к тому,
что остается неясным соотношение семенного и вегетативного размножения в систе-
ме репродукции живородящих растений.
Живорождением у животных называют такой способ воспроизведения потом-
ства, при котором зародыш развивается в материнском организме и рождается в
большей или меньшей степени развитый детеныш, свободный от яйцевых оболо-
чек. Живородящие формы были среди аммонитов. В жилой камере раковины верх-
неюрской Oppelia sterospis найдены 60 маленьких аптихий, т. е. остатки раковин
60 детенышей. Обнаружены отпечатки других аммонитов {Dactylioceras commune,
Harpoceras lythense) вместе с молодью внутри раковины.
Среди беспозвоночных живорождение характерно для некоторых губок, кишеч-
нополостных, червей, онихофор, ряда членистоногих, моллюсков, мшанок и иглоко-
жих. Среди хордовых живорождение наблюдается у сальп, асцидий, многих акул и
скатов, некоторых карпозубых, жаб, червяг, саламандр, черепах, ящериц и змей, у
млекопитающих, за исключением клоачных — ехидны и утконоса.
Развитие зародыша при живорождении может происходить в яичнике (у тлей,
скорпионов, бельдюг), в яйцеводах или их расширениях, преобразованных в матку
(у акул, некоторых земноводных, пресмыкающихся, большинства млекопитающих),
а также во влагалище (у Glossina, Tachinidae). Развитие также может осуществ-
ляться в полости тела и специализированных выводковых образованиях. У многих
живородящих животных вокруг зародыша образуются зародышевые оболочки.
Источниками питания зародыша живородящих организмов могут служить: за-
пасы питательных веществ (у жаб); вещества, образующиеся при распаде неразви-
вающихся яиц (у протея, черной саламандры); вещества, доставляемые из материн-
ского организма. При питании зародыша за счет веществ материнского организма
образуются специальные приспособления, имеющие общее название плаценты. Эти
приспособления формируются в результате взаимодействия определенных участков
тела зародыша с тканями материнского организма (у некоторых членистоногих,
акул, млекопитающих).
У некоторых панцирных клещей, или орибатидов (Oribatei) наблюдается весьма
своеобразное явление, получившее название «посмертное живорождение». Самка
погибает, не отложив яиц, которые затем развиваются в трупе матери. Вылупившие-
ся личинки выходят наружу через анальные створки или через ротовые органы. Яй-
цеживорождение — способ воспроизведения потомства, при котором зародыш до-
стигает полного развития в яйце, находящемся в теле матери, и освобождается от
10
яйцевых оболочек после откладки яйца или в организме самки. Видов, которым
свойственно яйцеживорождение, довольно много (некоторые кишечнополостные,
гребневики, немертины, многощетинковые черви, моллюски, некоторые скорпионы,
клещи (гамазовые), иглокожие, живородящая ящерица, веретеница, обыкновенная
гадюка, некоторые морские змеи, ужи). В ряде случаев наблюдается неполное яй-
цеживорождение, когда зародыш начинает развиваться в яйце, находящемся в теле
матери, но достигает полного развития лишь после откладывания яйца (некоторые
кольчатые и круглые черви). В противоположность яйцеживорождению следует от-
метить яйцерождение.
Яйцерождение — способ воспроизведения животными потомства, при котором
развитие зародыша происходит в отложенных во внешнюю среду яйцах. Яйцерожде-
ние характерно для большинства беспозвоночных, рыб, амфибий, пресмыкающихся,
птиц и однопроходных млекопитающих.
Живорождение довольно широко представлено у животных. Однако основное
внимание специалистов, изучающих это явление, обращено к позвоночным, главным
образом к млекопитающим. Именно на примере позвоночных разрабатывалась тер-
минология и классификация живорождения, создавались основные теоретические
и эволюционные построения. Беспозвоночные до настоящего времени оставались
вне основных исследований живорождения. Нет обобщающих работ по живорож-
дению у многоклеточных животных, часто встречается путаница в терминологии
по размножению беспозвоночных. В то же время у беспозвоночных встречаются са-
мые разнообразные формы и способы вынашивания зародышей, имеется и широкий
спектр приспособлений, вовлеченных в питание эмбриона. Отметим, что живорож-
дение встречается у различных животных вне зависимости от условий их существо-
вания и филогенетического положения.
У различных исследователей представление о живорождении обычно склады-
валось при изучении одной группы растений и животных. Однако для выяснения
общих закономерностей, определяющих появление живорождения и его эволюцию,
подобный путь исследования недостаточен. Для этого необходимо сравнительное
изучение развития структур, вовлеченных в живорождение, у различных видов рас-
тений и животных, в том числе и из филогенетически удаленных групп.
Впервые сделана попытка обобщить данные по биологии живородящих рас-
тений и животных. Книга состоит из двух частей: «Вивипария у растений»
(Т. Б. Батыгина, Е. А. Брагина) и «Живорождение у беспозвоночных и низших хор-
довых» (А. В. Ересковский, А. Н. Островский).
В первой части анализируются имеющиеся классификации и предложена ори-
гинальная классификация вивипарии у растений, приводится морфологическая ха-
рактеристика структурных единиц, обеспечивающих ту или иную форму живорож-
дения. Рассматриваются данные, касающиеся генетических основ и гормональной
регуляции этого явления. Обсуждаются причины возникновения вивипарии в расти-
тельном мире и ее эволюционная роль. При написании данной части были использо-
ваны пятитомное издание «Сравнительная эмбриология цветковых растений» (1981,
1983,1985,1987,1990), шеститомная сводка «Сравнительная анатомия семян» (1985,
1988,1991,1992,1996, 2000) и трехтомное энциклопедическое издание «Эмбриология
цветковых растений. Терминология и концепции» (1994, 1997, 2000). Для уточнения
отдельных терминов и понятий в работе использовались «Латинско-русский словарь
для ботаников» Н. Н. Забинковой и М. Э. Кирпичникова (1957) и «Русско-латинский
словарь для ботаников» М. Э. Кирпичникова и Н. Н. Забинковой (1977).
И
Во второй части рассматриваются случаи живорождения у свободноживущих
беспозвоночных. В нее не вошли паразитические организмы ввиду особых отноше-
ний между развивающимся зародышем и организмом хозяина. Наиболее подробно
рассмотрены случаи истинного живорождения, когда между развивающимся заро-
дышем и материнским организмом устанавливаются трофические отношения. Яй-
цеживорождение упоминается лишь вкратце. Работ по физиологии и иммунологии
взаимоотношений между материнским организмом и зародышем при живорождении
у беспозвоночных нет, поэтому основное внимание уделено морфологии живорож-
дения. Предложена оригинальная классификация типов истинного живорождения
и рассмотрены основные этапы эволюции этого феномена.
При написании второй части авторы использовали монографии крупнейших эм-
бриологов и зоологов: О. М. Ивановой-Казас «Сравнительная эмбриология беспо-
звоночных животных» (1977, 1978, 1979, 1981); Г. А. Шмидта «Типы эмбриогенеза и
их приспособительное значение» (1968); D.T. Anderson «Embryology and phylogeny
in Annelids and Arthropods» (1973); «Reproductive Biology of Invertebrates», т. IV под
ред. К. G. Adiyodi и R. G. Adiyodi (1990-1991); P. Барнса с соавторами «Беспозвоноч-
ные. Новый обобщенный подход» (1992). Корректировка отдельных терминов и по-
нятий проводилась в соответствии с «Латинско-русским словарем» И. X. Дворецкого
(1976), «Кратким эмбриологическим словарем» А. А. Клишова (1972) и «Биологи-
ческим энциклопедическим словарем» под ред. М. С. Гилярова (1986).
Приводятся списки видов растений и животных, для которых характерно живо-
рождение, с указанием его формы, составленные по литературным и оригинальным
данным. В книге использованы оригинальные рисунки, а также фотографии, заим-
ствованные из отечественных и зарубежных изданий. Мы выражаем благодарность
авторам за разрешение воспроизвести нужные материалы. Мы сердечно благодарим
проф. Е. А. Мирославова, проф. Ю. В. Мамкаева, проф. А. К. Дондуа, канд. биол. на-
ук В. Е. Васильеву за критические замечания и ценные советы, которые были учтены
при подготовке рукописи. Благодарим И. А. Стогова за техническую помощь. Авто-
ры будут признательны читателям за предложения и замечания, так как предпола-
гают в дальнейшем издание монографии с внесением новых данных по вивипарии у
растений и включением результатов по живорождению у других видов животных.
Подготовка издания выполнена при поддержке гранта Президента jVHIII-
2148.2003.4 и Фонда содействия отечественной науке.
Т. Б. Батыгина, Е.А. Брагина, А. В. Ересковский, А. Н. Островский
INTRODUCTION
Study of embryological and molecular-genetic principles of reproduction of plants
animals and is one of the most important fields of the modern biology. Reproduction
provides a succession of life being a universal feature of all living organisms. Despite of
many studies, a biological sense of some, modes types and forms of propagation is still
unclear, as well as their relationships and the evolutionary role. A viviparity (lat. vivus —
living, pario — to give birth) takes up a special place among them1.
Studies of viviparity is fundamentally important for the research on morphogenesis,
relationships between maternal and daughter organisms, transport of nutrients and
hormones, their influence on the daughter organism development, formation of its
autonomy, and reproductive strategy of species. It is also important for solving such
applied tasks as a selection of optimal conditions for seeds’ storing and their germination,
cultivation of the endangered species in vitro for further repatriation.
Animal viviparity has been already known to Aristotle (IV century BC). He used it as
a character to divide the animals in viviparous and ovoviviparous. Linnaeus also applied
this character classifying species from the genera Festuca and Poa.
Scientifical names of some plants (Festuca ovina var. vivipara, Polygonum viviparum,
Eriogonum viviparum, Poa viviparum, Remusatia vivipara, Asplenium viviparum) animals
(Xenopleura vivipara, Viviparus viviparus, Zoarces viviparous, Barbus viviparous, Lacerta
vivipara, Patriella vivipara, P. paravivipara) as well as were created being based on the
term “viviparity”.
Viviparity in plants — special type of reproduction wherein an embryo in a seed or
fruit, or brood bud develop and form seedlings (propagules) without dormancy period
on the maternal plant. Genotype of the descendants depends on the propagule origin.
At the moment this phenomenon has been discovered in 281 species of the flowering
plants belonging to 55 families (Nymphaeaceae, Ranunculaceae, Orchidaceae, Poaceae).
Besides, there are 197 species of viviparous ferns of 8 families. First review on the
viviparous plants has been made by Braun (1859). However, the term “viviparity” is
still uncertain and debatable because of inadequate information structuras functional
bases. J'
There is no a common opinion what the^term “viviparity” means: either germination
of seeds on the maternal plant in some Rnizhophora, Bruguiera, Kandelia, Ceriops и
Avicenia or young plants development on the different parts (leaf, stem, inflorescence)
of the mother plant in Poa viviparum, Polygonum viviparum, Cardamine, Bryophyllum.
However, most of the botanists classify both a germination of mangroves seeds as well as
vegetative diaspores in other plant species under viviparity.
V м f ri. >
1 There are two terms in the literature: viviparity и vivipary.
13
Morphogenesis of the reproductive structures has been poorly studied in viviparous
plants (except mangroves, mutants maize, wheat and Arabidopsis), that hampers
genetical and molecular research on viviparity. At present very restricted number
of species are investigated by such complex approach. This resulted in an unclear
understanding of the correlation between the seed and vegetative types of propagation
among them.
Vivivparity in animals — type of sexual reproduction wherein either larva or juvenile
develops inside the body of the maternal organism, and is released free of egg envelopes.
Viviparous species are already known among ammonites. Remains of 60 juvenile shells
have been encountered inside the adult shell of Oppelia sterospis from the Upper Jurassic.
The juveniles have been also found in Dactylioceras commune and Harpoceras lythense.
Among invertebrates a viviparity is known in some cnidarians, worms, onichophorans,
some arthropods, molluscs, echinoderms and some other groups. Among chordates it
is characteristic of salps, many sharks and rays, some tooth-carps, caecilian, toads,
salamanders, turtles, lizards and snakes, and majority of mammalians (except echidnas
and platypus).
In the case of animal viviparity, an embryogenesis may occur in the ovary (aphides,
scorpions, some fish), oviducts or uterus (sharks, some amphibians, reptiles, most of
mammalians), and vagina (Glossina, Tachinidae). It is also may take a place in a body
cavity and in the special brood chambers. There are embryonal envelopes formed in many
viviparous animals.
Nutrients for the development are obtained from the eggs (toads), abortive eggs
(proteus, black salamander) or the parental organism. In the last case the special organs
are developed providing nutrition, gas exchange and waste removal. These organs are
generally termed placenta, forming as a result of the contact between embryo and the
parent tissues (some arthropods, sharks, mammalians).
In some ticks (Oribatei) there is a unique «posthumous viviparity». Eggs start divisions
in the female’s body after her death. Larvae get out either through the maternal anus or
mouth.
Ovoviviparity - type of reproduction wherein an embryogenesis occurs in
the egg within the parental organism, and juveniles hatch either after the egg
laying or inside mother. The number of ovoviviparous animals is quite large
(some cnidarians, ctenophorans, nemerteans, polychaetes, molluscs, scorpions, ticks,
echinoderms, viviparous lizard, blind worm, some see snakes, common viper, grass-snakes.
There is also uncomplete ovoviviparity known in some species. In this case embryonal
development starts in the egg, being in the parental organism, and completes after egg
laying (some Annelida and Nematoda).
In contrast with ovoviviparity may be considered oviparity.
Oviparity — type of reproduction wherein embryogenesis occurs within the egg
being laid in the surrounding medium. Oviparity is characteristic of the majority
of invertebrates, fish, amphibians, reptiles, birds and, exceptionally, mammalians
(Monotremata).
Viviparity is widespread among animals. However, zoologists were mainly
concentrated on viviparous vertebrates, especially mammalians. Terminology, classifi-
cation, andmain evolutionary hypotheses on viviparity were worked out, being based on
vertebrates. Invertebrates were usually ignored. This resulted in an absence of general
works on this phenomenon in Metazoa, and confusion in terms. In the same time,
invertebrates demonstrate very wide spectrum of brooding types and adaptations for
14
extraembryonal nutrition. Noteworthy, viviparity evolved in many groups of animals,
living in different environments and belonging to different taxa.
It is clear now that both comparative morphological and embryological research of
brooding structures are necessary to elucidate the general trends in the evolution of
viviparity among plants as well animals from the phylogenetically distant taxa.
This book is the first attempt to generalize the data on viviparous plants and animals.
It consists of 2 parts: Viviparity in plants (T. B. Batygina, E. A. Bragina) and Viviparity
in invertebrates and lower chordates (A. V. Ereskovsky, A. N. Ostrovsky).
The first part analyses existing classifications of viviparity in plants, and describes
morphology of organs and structures involved. Data on the genetical aspects and hormone
regulation of viviparity are considered, and its origin and role in the plant species
evolution are discussed. To prepare the part following books and dictionaries were
used: Comparative embryology of flowering plants (1981, 1983, 1985, 1987, 1990, 5
Vols.), Comparative anatomy of seeds (1985, 1988, 1991, 1992, 1996, 2000, 6 Vols.), and
Embryology of flowering plants. Terminology and concepts (1994, 1997, 2000, 3 Vols.),
Latin-Russian dictionary for botanists (N. N. Zabinkova, M. E. Kirpichnikov, 1957 and
1977 Editions).
The second part deals with viviparity in non-parasitic invertebrates and lower
chordates. Parasites were not included because of the specific relationships between
embryo and host organism. True viviparity wherein extraembryonal nutrition takes place
is considered in details. Ovoviviparity is mentioned in short. Since there are no works on
physiology and immunology of viviparity in invertebrates, the main attention of the part
gives to information on morphology. New classification of viviparity is proposed, and its
main evolutionary stages are inferred and discussed. Following books and dictionaries
were used: Comparative embryology of invertebrates (О. M. Ivanova-Kazas, 1977,
1978, 1979, 1981), Types of morphogenesis and their adaptive meaning (G. A. Schmidt,
1968), Embryology and phylogeny in annelids and arthropods (D. T. Anderson, 1973),
Reproductive biology of invertebrates (K. G. Adiyodi, R. G. Adiyodi, eds., 1990-1991,
vol. IV), Invertebrates. New synthesis (R. Barnes et al., 1992), Latin-Russian dictionary
(I. H. Dvoretsky, 1976), Short embryological dictionary (A. A. Klishov, 1972), Biological
encyclopaedic dictionary (M. S. Giljarov, ed., 1986).
Additionally, we give the lists of the viviparous plants and animals, mentioning
the type of viviparity. The compilation has been made using the original data as well
as the data from the literature. The original and loan drawings and photos illustrate
the book, and we sincerely thank their authors who kindly permitted us to use them.
We want to thank Prof. E. A. Miroslavov, Prof. Yu. V. Mamkaev, Prof. A. K. Dondua,
Dr. V. E. Vasilyeva and for censorious remarks and advices. Special thanks are given
to I. A. Stogov for technical assistance. The authors will be grateful to readers for the
propositions and remarks because they are going to publish the book in future involving
new data on the viviparity phenomenon in plants and including some results on the
viviparity in some more animal species.
The edition is realized with the support of the President grant on supporting the
Leading Scientific Schools of Russia N HUI-2148.2003.4 and Foundation of Assistance
the Science of our country.
T. B. Batygina, E. A. Bragina, A. V. Ereskovsky, A. N. Ostrovsky
1. ВИВИПАРИЯ У РАСТЕНИИ
1.1. КЛАССИФИКАЦИЯ ВИВИПАРИИ
У ЦВЕТКОВЫХ РАСТЕНИЙ
Объем понятия «вивипария» до настоящего времени остается дискуссионным в
связи со слабой изученностью его структурно-функциональных особенностей. При-
крепленный образ жизни растений обусловил появление специальных структур для
их расселения. Диаспора (греч. dia — приставка со значением сквозного движения,
spora — сеяние, посев, потомок) — единица распространения, представляющая собой
часть растения (или целое растение) различной морфологической природы, есте-
ственно отделяющуюся от материнского организма.
На основании того что существуют диаспоры двух типов (генеративные и вегета-
тивные), Р. Сернардер в 1927 г. предложил разделить вивипарию на генеративную
(образование проростков у мангровых) и вегетативную (образование проростков в
соцветии у Роа bulbosa, Festuca ovina var. vivipara). В зависимости от роли, которую
играет это явление в жизни растения, он различал облигатную и факультативную
вивипарию.
Некоторые исследователи считают истинной, или настоящей вивипарией толь-
ко способ прорастания зародыша на материнском растении у ряда мангровых.
Трансформацию отдельных цветков или их частей либо всех цветков соцветия в
вегетативные побеги, служащие нередко органами вегетативного размножения (вы-
водковые почки, луковички, клубеньки), относят к так называемой ложной виви-
парии, или псевдовивипарии. По мнению Г. Э. Шульц, псевдовивипария'—это одно
из проявлений пролификации. ’' £
Случай, когда только верхние цветки в соцветии преобразованы в выводковые
почки, а нижние цветки имеют нормальное строение, некоторые авторы называ-
ют полувивипарией. Иногда к живорождению относят аномальные видоизменения
цветка, при этом используется словосочетание «тератологическая вивипария».
Ряд авторов рассматривают образование выводковых почек на месте цветков
или соцветий, а также их образование в дополнение к цветкам как вегетативный
апомиксис.
Попытка учесть все случаи вивипарии была предпринята П. А. Генкелем в 1979 г.
Он предложил следующую классификацию:
1) эувивипария: i
а) репродуктивная вивипёрия— прорастание единственного семени на мате-
ринском растении;
б) криптовивипария — зародыш прорастает внутри плода, находящегося на ма-
теринском растении;
в) репродуктивно-вегетативная вивипария — вместо семян в соцветии образу-
ются выводковые почки.
16
2) псевдовивипария:
а) вегетативная псевдовивипария — образование выводковых почек на стебле,
листе и в пазухах листьев;
б) репродуктивная псевдовивипария —прорастание семян в снопах при влаж-
ной погоде (материнское растение мертвое).
С нашей точки зрения, принцип, положенный в основу разделения явления ви-
випарии на эу- и псевдовивипарию, не совсем корректен, так как случаи вивипарии,
имеющие общую структурную основу, Генкель рассматривает в качестве разных
проявлений вивипарии. Так, выводковые почки, образующиеся в цветке, соцветии,
на листе и стебле и имеющие одинаковое происхождение - из соматических («телес-
ных») клеток спорофита, автор отнес к разным категориям вивипарии. Прорастание
семян в снопах при влажной погоде логичнее отнести к эувивипарии, поскольку оно
происходит без периода покоя, как и при развитии полового зародыша мангровых.
Разделение вивипарии на истинную (эувивипарию) и ложную (псевдовивипа-
рию), на наш взгляд, не оправдано, так как в обоих случаях образуется новое жиз-
неспособное растение. Предложенная Генкелем классификация вряд ли может быть
использована, так как она не только не вносит ясности в понимание сложного яв-
ления вивипарии, но и запутывает исследователей. Однако несомненной заслугой
автора является выделение прорастания семени в плоде (криптовивипарии) в каче-
стве особого типа вивипарии.
При разработке оригинальной классификации мы использовали разделение ви-
випарии на генеративную и вегетативную, предложенное Сернардером в 1927 г.
Кроме того, мы исходили из положения, выдвинутого великим итальянским эмбрио-
логом Э. Батталья, о том, что репродукция растений бывает гетерофазной (мейоз и
оплодотворение) и гомофазной (без мейоза и оплодотворения). При этом нами учи-
тывались способ и место образования нового растения, путь морфогенеза, т. е. его
происхождение, а также генотип (рис. 1.1).
Генеративная вивипария. Осуществляется на базе генеративной диаспоры,
содержащей половой зародыш, который прорастает на материнском растении. При
этом образовавшийся проросток либо освобождается от плодовых оболочек (фане-
Рис. 1.1. Классификация вивипарии (по: Батыгина, Брагина, 2000):
звездочками отмечены формы вивипарии, еще не обнаруженные у растений, но тео-
ретически возможные, в частности у видов, имеющих семена с несколькими зародышами
17
ровивипария, греч. phaner(o) — явный +vwus + pario), либо остается в них {крип-
товивипария, греч. kriptos — скрытый+twMS + pario).
Вегетативная вивипария. Осуществляется на базе вегетативной диаспоры,
возникшей без участия полового процесса (мейоза и оплодотворения). Развитие веге-
тативных диаспор может идти двумя путями морфогенеза — гемморизогенезом или
эмбриоидогенезом. Соответственно мы разделяем вегетативную вивипарию на ге.м-
моризогенную и эмбриоидогенную. При систематизации явления вивипарии учиты-
вается также место формирования вегетативных диаспор на растении (соцветие —
инфлоралъная вивипария, лист — фолиарная, стебель — каулигенная, корень — ризо-
генная). К вегетативной вивипарии следует относить также формирование пророст-
ков в результате метаморфоза пестика.
Под полувивипарией мы понимаем образование и прорастание вегетативных
диаспор в соцветии при наличии в нем нормальных цветков, а также формирова-
ние растением двух типов соцветий (только с вегетативными диаспорами и только с
цветками). Как генеративная вивипария, так и вегетативная могут иметь облигат-
ную и факультативную форму.
Следует разделять случаи образования вегетативных диаспор, прорастающих на
материнском растении и случаи метаморфоза цветка вследствие пролификации.
1.2. ГЕНЕРАТИВНАЯ ВИВИПАРИЯ
1.2.1. Общие представления о семени
и покое семян у растений
Как известно, основной генеративной диаспорой у семенных растений являет-
ся семя, развивающееся (обычно после оплодотворения) из семязачатка. Наибо-
лее часто встречаются семена, состоящие из трех основных структур: зародыша,
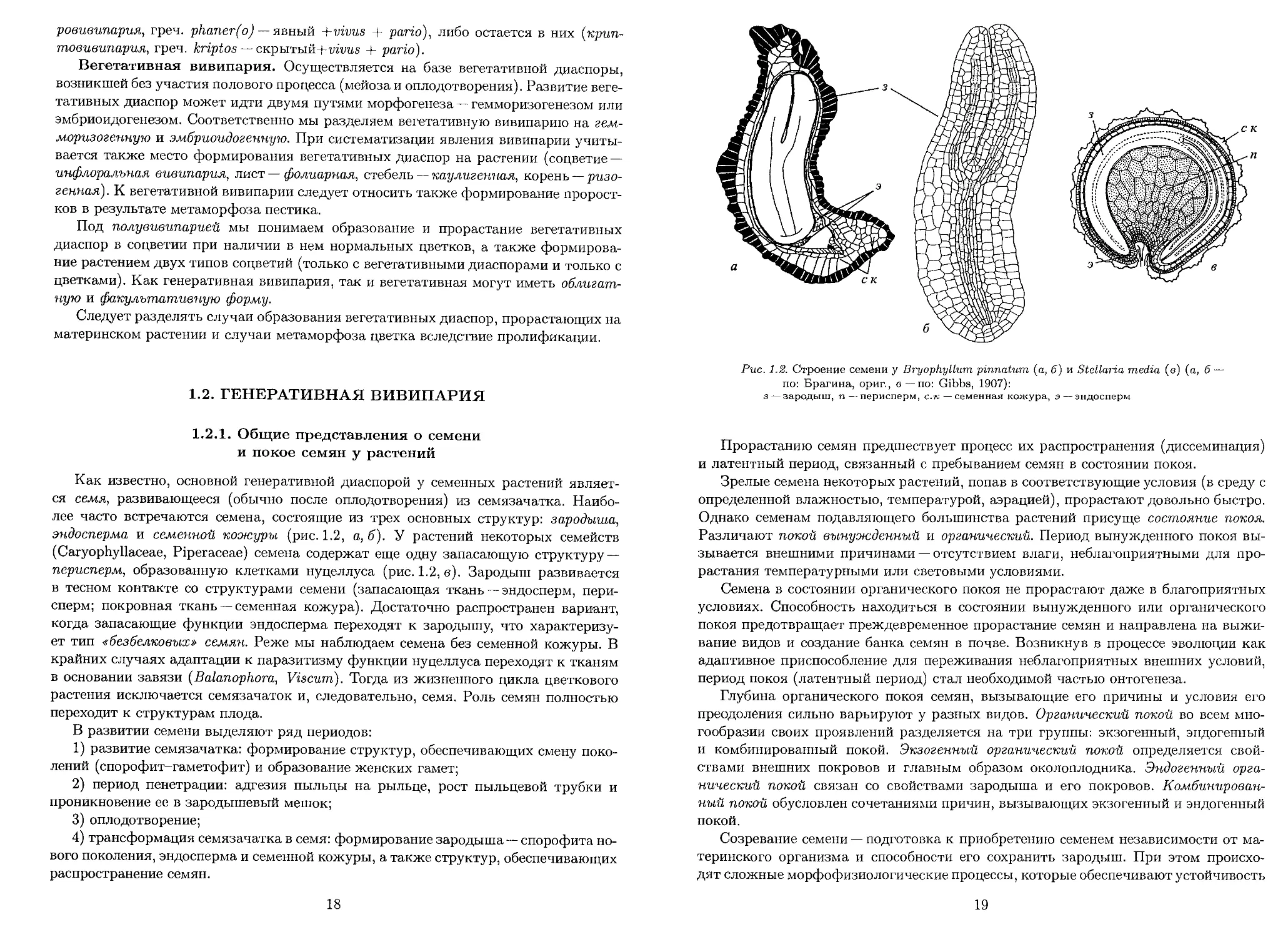
эндосперма и семенной кожуры (рис. 1.2, а, б). У растений некоторых семейств
(Caryophyllaceae, Piperaceae) семена содержат еще одну запасающую структуру —
перисперм, образованную клетками нуцеллуса (рис. 1.2, в). Зародыш развивается
в тесном контакте со структурами семени (запасающая ткань — эндосперм, пери-
сперм; покровная ткань —семенная кожура). Достаточно распространен вариант,
когда запасающие функции эндосперма переходят к зародышу, что характеризу-
ет тип «безбелковых» семян. Реже мы наблюдаем семена без семенной кожуры. В
крайних случаях адаптации к паразитизму функции нуцеллуса переходят к тканям
в основании завязи {Balanophora, Viscum). Тогда из жизненного цикла цветкового
растения исключается семязачаток и, следовательно, семя. Роль семян полностью
переходит к структурам плода.
В развитии семени выделяют ряд периодов:
1) развитие семязачатка: формирование структур, обеспечивающих смену поко-
лений (спорофит-гаметофит) и образование женских гамет;
2) период пенетрации: адгезия пыльцы на рыльце, рост пыльцевой трубки и
проникновение ее в зародышевый мешок;
3) оплодотворение;
4) трансформация семязачатка в семя: формирование зародыша — спорофита но-
вого поколения, эндосперма и семенной кожуры, а также структур, обеспечивающих
распространение семян.
18
Рис. 1.2. Строение семени у Bryophyllum pinnatum (а, б) и Stellaria media (в) (а, б —
по: Брагина, ориг., с—по: Gibbs, 1907):
з — зародыш, п — перисперм, с.к — семенная кожура, э — эндосперм
Прорастанию семян предшествует процесс их распространения (диссеминация)
и латентный период, связанный с пребыванием семян в состоянии покоя.
Зрелые семена некоторых растений, попав в соответствующие условия (в среду7 с
определенной влажностью, температурой, аэрацией), прорастают довольно быстро.
Однако семенам подавляющего большинства растений присуще состояние покоя.
Различают покой вынужденный и органический. Период вынужденного покоя вы-
зывается внешними причинами — отсутствием влаги, неблагоприятными для про-
растания температурными или световыми условиями.
Семена в состоянии органического покоя не прорастают даже в благоприятных
условиях. Способность находиться в состоянии вынужденного или органического
покоя предотвращает преждевременное прорастание семян и направлена на выжи-
вание видов и создание банка семян в почве. Возникнув в процессе эволюции как
адаптивное приспособление для переживания неблагоприятных внешних условий,
период покоя (латентный период) стал необходимой частью онтогенеза.
Глубина органического покоя семян, вызывающие его причины и условия его
преодоления сильно варьируют у разных видов. Органический покой во всем мно-
гообразии своих проявлений разделяется на три группы: экзогенный, эндогенный
и комбинированный покой. Экзогенный органический покой определяется свой-
ствами внешних покровов и главным образом околоплодника. Эндогенный орга-
нический покой связан со свойствами зародыша и его покровов. Комбинирован-
ный покой обусловлен сочетаниями причин, вызывающих экзогенный и эндогенный
покой.
Созревание семени — подготовка к приобретению семенем независимости от ма-
теринского организма и способности его сохранить зародыш. При этом происхо-
дят сложные морфофизиологические процессы, которые обеспечивают устойчивость
19
зрелого семени к высыханию. У большинства растений в зрелом семени метаболи-
ческая активность снижена.
Прорастание определяют как последовательность событий, в результате кото-
рых семя выходит из состояния покоя и происходит образование проростка из за-
родыша. Однако некоторые растения, преимущественно относящиеся к крупносе-
мянным тропическим видам (представителям почти 60 семейств), и мутанты ара-
бидопсиса и кукурузы утратили период покоя и прорастают либо на материнском
организме, либо сразу после отделения. Рассмотрим развитие семязачатка, семени
и проростка у растений указанной группы.
1.2.2. Живорождение у мангровых.
Физиологические механизмы
Облигатная форма генеративной вивипарии отмечена у многих видов растений
мангровых зарослей (древесно-кустарникового растительного сообщества), располо-
женных в различных частях тропического пояса: Восточной Африки, Южной Азии,
Австралии и Океании (рис. 1.3). Западное побережье Африки и тропические обла-
сти Америки менее богаты манграми. Это типичная прибрежная растительность
морских заливов, проливов, лагун и устьев больших рек. Представители мангровых
произрастают в условиях временного или постоянного затопления соленой водой.
Для многих из них (в частности, для Rhizophora, Bruguiera, Ceriops) характерно
необычное прорастание семени: зародыш развивается без периода покоя, выходит
из семенной кожуры и пробивает стенку плода, которая остается вместе с пророст-
ком на материнском растении.
Рис. 1.3. Карта распространения мангр
(отмечено точками по данным П. А. Каплин и др., 1991)
У растений рода Rhizophora в завязи формируются четыре семязачатка, однако
после оплодотворения обычно развиваются только один (рис. 1.4).
У R. mangle только в 4-5% случаев развиваются два семязачатка. Кроме того,
20
Рис. 1-4-
21
Рис. 1-4- (продолжение)
22
Рис. 1.4. (окончание). Облигатная генеративная вивипария у видов сем. Rhizophoraceae (1-20) и
сем. Avicenniaceae (21) (1, 3-5, 7-11 —по: Кернер, 1902; 2, 6, 12 —по: Kipp-Goller, 1940;
13-18 — по: Juncosa, 1982; 19, 20 —по: Carey, 1934; 21 —по: Padmanabhan, 1964):
1—3— строение цветка (1, 2) и завязи (5) у Rh-izophora conjugata (1, 3) и R.mucronata (2)', 4—
внешний вид плодов R. conjugata на ветви дерева; 5-12 — последовательные стадии прорастания пло-
да у R. conjugata (5, 6, 8-11) и R.mucronata (7, 12): 5, 6 — начало второй фазы прорастания — выход
гипокотиль-корневой оси из покровов семени, 7 — конец второй фазы—’базальная часть зародыша вы-
шла за пределы плода, 8-12—третья фаза — удлинение основания «семядольного тела» (семядольной
трубки) (8), отделение гипокотиль-корневой оси с апексом побега от «семядольного тела» (9-10), разви-
тие зачатков листьев на апексе побега (11) и заложение боковых корней в гипокотиле (12, поперечный
срез); 13-18 — развитие зародыша и стадии его прорастания у R. mangle: 13 — зигота; 14 — выход эндо-
сперма, окружающего зародыш, из семязачатка через микропиле, стрелкой указаны клетки эндосперма,
содержащие танины, 15 — строение зародыша в начале первой фазы роста, формирование «семядольно-
го тела», 16 — строение плода с «проросшим» зародышем во время первой фазы его роста (преобладает
рост апикальной части «семядольного тела», зародыш еще полностью не вышел за пределы интегумен-
та), 17 — то же, но на второй фазе прорастания, преобладает рост базальной части «семядольного тела»,
увеличивается длина проростка, 18 — строение оси проростка во второй фазе развития, выход гипоко-
тиль-корневой оси из семенной кожуры через микропиле, но не из плода; 19, 20 — плод R.mucronata
с двумя прорастающими зародышами (19) и его сформированный проросток (20) \ 21 —зрелый плод
Avicennia officinalis, выход зародыша и окружающего его эндосперма из семенной кожуры; 13— х490;
14 — Х50; 15 — Х150; 16, 17 — х2,5; 18 — х35; 19 — Х0, 43; 20 — х0,3; 21 — X 25; а.с — абортированный
семязачаток, а.м.к — апикальная меристема корня, в.и — внутренний интегумент, г — гипокотиль, з — за-
родыш, и.м — интерколярная меристема, к.к — каменистые клетки, н.ч.с — нижняя часть столбика, п—
пыльник, n.ni, п.П2 — проводящий пучок, идущий к семязачатку и проростку соответственно, пр.б.к —
примордий бокового корня, с — семязачаток, син —- неразрушенная синергида, с.к —семенная кожура,
с.т—семядольное тело, ч — чашелистик, чеч — чечевичка, э —эндосперм
для этого вида отмечена партенокарпия (18%). Эмбриогенез зародыша проходит по
Onagr ad-типу2.
2Onagrad-THn эмбриогенеза характеризуется заложением поперечной клеточной перегородки
при делении зиготы, Т-образным расположением клеток четырехклеточного зародыша и обра-
зованием основных его структур из производных апикальной клетки, а подвеска и гипофизиса из
базальной клетки двуклеточного проэмбрио.
23
Способ заложения семядолей и ранние этапы их развития у представителей
Rhizophoraceae необычны для покрытосеменных. Семядоли в результате копгени-
талъного срастания долгое время растут как единое «семядольное тело».
В позднем эмбриогенезе и постсеменном развитии представителей родов
Rhizophora, Bruguiera и Ceriops выделяют три фазы роста и прорастания зародыша:
1) рост зародыша в семени;
2) «прорастание»;
3) подготовка к отделению проростка.
В период первой фазы наиболее активный рост происходит в апикальной части
«семядольного тела». Оно срастается с внутренним интегументом, образуя плацен-
тарный орган, через который осуществляется питание зародыша. После того как
«семядольное тело» заполнит полость семени, формируется гипокотиль в резуль-
тате активного роста базальной части зародыша. Происходит активный рост эндо-
сперма, который выступает из раскрывшегося микропиле и глубоко внедряется в
аэренхимную часть плода, а также проникает между семенной кожурой и стенкой
плода, функционируя как гаусторий, при этом в его наружных слоях наблюдается
меристематическая активность. В самом наружном слое эндосперма проявляются
признаки специализации, характерные для передаточных клеток. Большая часть
эндосперма внутри семени к концу первой фазы разрушается и потребляется заро-
дышем.
Во время фазы «прорастания» сначала происходит разрастание гипокотиля,
дифференциация его тканей. Зародыш R. mangle прорастает через 70 дней после
опыления, когда длина плода достигает 1,8 см. Из крошечного зародыша длиной
1 мм вырастает проросток 15-65 см, а иногда и до 1 м. Одновременно происходит
уплотнение тканей гипокотиля и кончика корня в результате отложения таннинов,
друз оксалата кальция, при этом дифференцируются трихобласты и каменистые
клетки. Выход кончика главного корня из стенки плода происходит, когда его длина
составляет 2,5 см, а возраст примерно 100 дней. Далее закладываются адвентивные
и боковые корни (5-10). Обычно главный корень отмирает до отделения проростка,
у Bruguiera он сохраняется. На поверхности гипокотиля дифференцируются чечеви-
цеподобные образования (Ceriops, Rhizophora) или устьица (Bruguiera), осуществля-
ющие газообмен. Тело семядоли снаружи от микропиле приобретает форму «фри-
гийского колпачка» и служит опорой для тяжелого проростка. В процессе развития
проростка происходит дифференциация его проводящей системы. В результате ак-
тивности апикальной меристемы побега у Ceriops candolleana и Rhizophora mangle
возникают три пары эпикотилярных листьев с прилистниками (первая из которых
у R. mangle отмирает еще до отделения от материнского растения).
В фазу подготовки к отделению проростка продолжается дифференциация его
проводящей системы и дальнейшее развитие боковых корней. Начинается активный
рост базальной части «семядольного тела» и формирование семядольной трубки,
прикрывающей почечку. Базальный рост осуществляется до тех пор, пока почечка
в окружении семядольной трубки не окажется за пределами плода. Отделительный
слой образуется либо на уровне почечки в семядольном узле (у Rhizophora), либо
между семядолями и гипокотилем (у Bruguiera). Проростки остаются на дереве 30-
39 недель, иногда год.
Под действием силы тяжести проростки падают (у В. eriopetala вместе с плодом)
и втыкаются в ил почти вертикально. Опавшие проростки, лежащие на более плот-
ном грунте, укореняются лежа и постепенно поднимаются. Проростки мангровых
24
способны до года сохранять жизнеспособность в морской воде или при длительном
(до 68 дней) высушивании. Во время прилива отмечено перемещение проростков
на значительные расстояния, дальность перемещений во многом зависит от массы
проростков.
Генеративная вивипария, точнее криптовивипария, установлена также у пред-
ставителей других семейств, входящих в фитоценоз мангр: Avicenniaceae (A vicema),
Arecaceae (Nypa), Cymodoceaceae (Amphibolis), Myrsinaceae (Aegiceras), Pellicieraceae
(Pelliciera) и Plumbaginaceae (Aegialitis).
Кроме того, генеративная вивипария характерна для некоторых мутантов Zea и
Arabidopsis. Семена ряда мутантов кукурузы нормально развиваются до позднего
эмбриогенеза. В начале фазы восковой спелости плюмула начинает удлиняться и
семена прорастают, оставаясь прикрепленными к початку. Семена некоторых виви-
парных мутантов имеют белый или бледно-желтый эндосперм и образуют альби-
носные проростки вследствие нарушения синтеза каротиноидов и хлорофилла.
К факультативной генеративной вивипарии следует отнести случаи прежде-
временного прорастания зародышей в зерновках хлебных злаков и в плодах яблони,
земляники, некоторых тыквенных и бобовых. Факультативную вивипарию может
вызвать стрессовое воздействие, например резкое изменение влажности и темпера-
туры.
Ряд авторов отмечают в вивипарных проростках особую железистую ткань, ко-
торая проявляет высокую фосфатазную активность и поставляет питательные веще-
ства против нормального осмотического градиента. Вивипарные проростки мангро-
вых, еще прикрепленные к родительскому растению, содержат небольшое количе-
ство хлоридов, и осмотическое давление в клетках проростка ниже, чем почвенного
раствора, а также клеточного сока материнского растения.
Динамика роста плода была подробно изучена у Rhizophora mangle. Во время раз-
вития у всех частей плода наблюдали сходный характер роста: период быстрого экс-
поненциального роста за первые 100 дней и период медленного роста после выхода
гипокотиля из стенки плода. В последние 45 дней жизни проростка на материнском
растении стенка плода и теста не росли, а скорость роста проростка уменьшалась.
Содержание воды в стенке плода (65%) и в зародыше (80%) было постоянным на
протяжении всего периода развития и только к моменту отделения проростка сни-
жалось до 58 %.
Не способные к длительному хранению семена невивипарных и семена вивипар-
ных видов отличаются от покоящихся семян тем, что уровень оводненности, необ-
ходимый для поддержания метаболизма и эмбриогенеза, остается сравнительно вы-
соким на протяжении развития зародыша. У семян тех видов, которым свойствен
период покоя, обезвоживание развивается во второй половине эмбриогенеза и корре-
лирует с увеличением содержания абсцизовой кислоты (АБК). Напротив, снижени-
ем уровня АБК и чувствительности к этому гормону зародышей из семян, не устой-
чивых к высыханию, и гормональных мутантов можно частично объяснить потерю
покоя у этих видов. Например, у Theobroma cacao, Quercus robur и Avicennia marina
содержание АБК в течение всего онтогенеза низкое. Семена АБК-недостаточных и
АБК-нечувствительных мутантов кукурузы и арабидопсиса проявляют неустойчи-
вость к высыханию, уменьшение накопления белков, что часто приводит к прежде-
временному прорастанию, при этом у материнского растения отмечаются симпто-
мы нарушенного водного баланса. Кроме того, преждевременное прорастание семян
вызывает обработка АБК-ингибитором флюридоном на ранних стадиях созревания
25
зародыша. Экзогенное добавление АБК к культивируемым зародышам вызывает и
пролонгирует устойчивость к высыханию и ингибирует прорастание. Действие АБК
может быть связано с апрегуляцией генов, вызывающих синтез белков-шеперонов.
так называемых дегидринов, которые защищают клеточные структуры устойчивых
организмов во время обезвоживания. Изменение осмотических потенциалов также
вызывает сигнал на обезвоживание зародыша, и АБК может, зависимо или незави-
симо, участвовать в передаче этого сигнала. Все вышесказанное свидетельствует о
том, что АБК наделяет семена устойчивостью к высыханию, чтобы подготовить их
к созреванию.
Известно, что под действием АБК и бензиладенина изменяется развитие зароды-
шей многих растений. Однако у R. mangle эти вещества не влияют на синтез РНК,
белка и скорость роста зародышей в культуре in vitro.
Для проверки гипотезы о том, что вивипарные мангровые имеют низкий уровень
АБК, необходимый для поддержания осмотического давления в тканях, подвержен-
ных солевому стрессу, по сравнению с уровнем АБК у невивипарных, немангро-
вых видов, был проведен анализ содержания АБК в тканях зародыша, перикарпа
и листьях материнского растения у растений из четырех семейств: Rhizophoraceae,
Myrsinaceae, Plumbaginaceae, Агесасеае. Мангровые постоянно обитают в соленой во-
де, и можно ожидать, что в вегетативных тканях взрослых растений концентрация
АБК высокая.
У зародышей десяти вивипарных видов: Bruguiera exaristata, В. gymnorrhiza,
Ceriops decandra, C. tagal, Kandelia candel, Rhizophora mangle, R. stylosa (Rhizopho-
raceae), Aegiceras corniculatum (Myrsinaceae), Aegialitis annulata (Plumbaginaceae),
Nypa fruticans (Агесасеае), уровень АБК во время онтогенеза низкий по срав-
нению с зародышами невивипарных видов: Cassipourea elliptica (Rhizophoraceae),
Ardisia escallonioides (Myrsinaceae), Limonium peregrinum (Plumbaginaceae), Phoenix
reclinata (Агесасеае). При этом у вивипарных зародышей не отмечено заметных ко-
лебаний в уровне АБК. Однако во время развития в ответ на высушивание они
способны продуцировать больше АБК.
При сравнении уровней АБК в материнских и зародышевых тканях растений
вивипарных и невивипарных видов выяснено, что уровень АБК как в материнских,
так и в эмбриональных тканях у мангровых (Rhizophoraceae, Агесасеае) значитель-
но ниже, чем у немангровых. У всех изученных видов уровень АБК в тканях мате-
ринских растений был выше в процессе гистогенной дифференциации зародыша, а
затем снижался. Среди видов мангровых содержание АБК в листьях материнского
растения всегда выше, чем содержание в зародыше. Напротив, содержание АБК в
листьях растений у немангровых видов было значительно ниже, чем в зародыше, за
исключением видов сем. Myrsinaceae, у которых листья по содержанию АБК несиль-
но отличались от эмбриональной ткани. У мангровых уровень АБК в листьях более
высокий по сравнению с немангровыми.
К сожалению, в литературе нет данных о динамике других фитогормонов при
развитии зародыша и проростка у мангровых.
1.3. ВЕГЕТАТИВНАЯ ВИВИПАРИЯ
При вегетативной вивипарии диаспоры, или пропагулы прорастают на мате-
ринском организме. К категории вегетативных диаспор относятся диаспоры, об-
разующиеся как при гемморизогенезе (структурная единица — выводковая поч-
ка), так и при эмбриоидогенезе (структурная единица — эмбриоид-проросток). Вы-
водковая почка может быть немегпаморфизированной пазушной или придаточ-
ной почкой с адвентивным корнем и метаморфизированной структурой - луко-
вичкой или клубеньком стеблевого либо корневого происхождения (рис. 1.5). Ва-
риабельность организации выводковых почек в значительной степени связана с
экологией вида и способом заложения их инициалей — эндогенным или экзоген-
ным. В англоязычной литературе термин «выводковая почка» представлен сло-
вом «bulbil» (воздушная луковичка, выводковая почка, детка) или словосочета-
нием «brood bud» (луковичка, выводковая почка). Для обозначения луковичек
Allium, образующихся в соцветии, используют термин «topset». В зависимости от
места возникновения на растении выделяют листовые и стеблевые выводковые
почки.
Рис. 1.5. Типы выводковых почек (по: Васильев и др., 1978):
1 — неметаморфизированная пазушная или придаточная почка с адвентивным кор-
нем; 2 — луковичка; 3 — клубенек стеблевого происхождения; 4 — клубенек корневого про-
исхождения; ад.к — адвентивный корень, — ось побега, апекс побега
Листовые выводковые почки возникают из клеток листа в разных его частях,
часто в районе жилок, и развиваются как до отделения его от стебля, так и по-
сле. Способность образовывать почки различных типов на листьях обнаружена у
цветковых растений 446 видов, но только у части видов почки выводковые.
Место возникновения выводковых почек на листе таксоноспецифично (рис. 1.6).
Так, образование выводковых почек на верхней стороне листовой пластинки ха-
рактерно для Drosera intermedia, D. rotundifolia (Droseraceae) и Arabis pumila
(Brassicaceae). Формирование выводковых почек вдоль главной жилки отме-
чено у Hyacinthus pouzolsii (Hyacinthaceae). В основании листовой пластинки
они образуются у Nymphaea guineensis, N. micrantha (Nymphaeaceae), Cardamine
mathioli и C. pratensis (Brassicaceae). По краю листа выводковые почки располо-
жены у Bryophyllum daigremontianum (Crassulaceae), в апикальной части листа —
у В. tubiflorum (Crassulaceae) и Hammarbya paludosa (Orchidaceae). У Ornithogalum
scilloides (Ornithogalaceae) выводковые почки развиваются как на верхней, так и на
нижней стороне листа.
27
— выводковая почка
| | — верхняя сторона листовой
пластинки
— нижняя сторона листовой
пластинки
Рис. 1.6. Расположение выводковых почек на листе (по: Батыгина, Брагина,
2000):
1 — по всей поверхности верхней стороны листовой пластинки (Drosera intermedia,
D. rotundifolia, Arabis pumila)-, 2 — вдоль главной жилки (Hyacinthus pouzolsii)-, 3 — в
основании листовой пластинки (Pineilia tuberifera, Nymphaea micrantha, N. guineensis,
Cardamine pratensis, C. mathioli)', 4 — на черешке листа (Pineilia tuberifera)', 5 — по краю
листовой пластинки (Bryophyllum daigremontianum, В. pinnatum)', 6 — по краю апикаль-
ной части (Hammarbya paludosa, Bryophyllum tubiflorum)', 7 —на нижней стороне на
небольшом удалении от края (Ceraptopteris thalictroides); 8 — на всей поверхности верхней
и нижней стороны (Omithogalum scilloides)
Известен случай появления почек (вероятно, выводковых) на плодолистиках
Crinum и Amaryllis. При попадании во влажную землю они развивались в новые
растения.
Стеблевое происхождение имеют выводковые почки папоротников, так как
вайя представляет собой филлокладий. Среди 140 видов папоротников, способ-
ных к образованию почек на вайях, имеются виды, у которых они возникают по-
стоянно (Asplenium bulbiferum, A. celtidifolium, A.flagelliferum, A. viviparum). Фор-
мирование выводковых почек происходит в разных частях вайи: на поверхно-
сти зеленых долек (у вышеупомянутых видов), на черешках отдельных лопастей
(Ceratopteris thalictroides), в развилке вайи (Gleichenia alpina) или на верхушке вайи
(A. cirrhatum, A. flagellifolium, A. edgeworthii, A. rhachirhizon).
У цветковых растений стеблевые выводковые почки возникают на гипокотиле
(Anagallis phoenicea, Euphorbia helioscopia, E. peplus, Linaria vulgaris), в пазухах ли-
стьев (Dentaria, Lilium, Ranunculus ficaria) или на соцветии (Allium, Роа, Polygonum
viviparum).
Взаимоположение цветков и выводковых почек на соцветии у разных видов раз-
личается (рис. 1.7). Например, у Gagea arvensis (Liliaceae) выводковые почки распо-
ложены в нижней части соцветия, у Polygonum viviparum (Polygonaceae), Allium
senescens и A. oleraceum (Alliaceae) они встречаются на всем протяжении соцве-
тия, чередуясь с цветками. Для этих же видов характерно образование соцветий,
состоящих только из выводковых почек. У многих видов (Gagea bulbifera, Lilium
bulbiferum, L. lancifolium, L. tigrinum — Liliaceae, Dentaria bulbifera — Brassicaceae,
28
• —выводковая почка V —цветок
Рис. 1.7. Расположение выводковых почек на соцветии (по: Батыгина, Брагина,
2000):
1 — в нижней части соцветия [Gagea arvensis)] 2 — на всем протяжении соцветия вме-
сте с цветками: а — Polygonum viviparum, б — Allium senescens, А. oleraceum; 3 — на со-
цветии только выводковые почки: а — Polygonum viviparum, б — Allium vineale, в — Gagea
liotardi] 4> 5 — на всем протяжении соцветия в пазухах прицветников вместе с цветками
[4 — Lilium bulbiferum, Gagea bulbifera, Sparaxis bulbifera, Saxifraga bulbifera) и в пазухах
листьев (5 — Dioscorea bulbifera)
Saxifraga bulbifera, S. cemua — Saxifragaceae) развитие выводковой почки происхо-
дит в пазухе прицветников одновременно с цветком.
Рассмотрим морфогенез выводковых почек и эмбриоидов при различных формах
живорождения.
1.3.1. Гемморизогенная вивипария
Инфлоралънная вивипария
Впервые инфлоральная вивипария была описана К. Линнеем (1737, 1755) у
Festuca ovina. Живородящие формы встречаются у злаков довольно часто, однако
у некоторых видов это исключение. Живородящие формы злаков тяготеют к гор-
ным районам Европы, прилегающим к Атлантике вплоть до Северного Ледовитого
океана, к горам Средней Европы и Альпам, а также к территориям всего континен-
тального севера России. Из 130 видов злаков Шотландии четыре вида живородящие
(Descharnpsia alpina, Festuca vivipara, Роа alpina, P. xjemtlandica), 28 способны к про-
лиферации. Растениям, выросшим из вегетативных диаспор, которые образовались
на соцветии, тенденция к вивипарии свойственна в большей степени, чем растениям,
полученным из семян. Вероятно, живородящие формы злаков — экотипы, тесно свя-
занные с формами, которые образуют нормальные семена. Возможно, живородящие
формы заменили семенные в их прежних местообитаниях.
Вивипарные овсяницы высокогорных широт (о. Шпицберген и восточная часть
Канадского архипелага) размножаются только вегетативно, генеративных органов
у них нет. Однако по южной окраине ареала наблюдается «полувивипария», при ко-
торой становится возможной гибридизация вивипарных овсяниц с невивипарными,
если таковые произрастают поблизости.
Подробно изучено образование выводковых почек (луковичек) у живородящих
и полувивипарных форм Роа bulbosa (рис. 1.8). На начальной стадии формирова-
29
Рис. 1.8.
30
Рис. 1.8 (окончание). Развитие выводковой почки (луковички) у Роа bulbosa (Роасеае) на соцветии
при облигатной вегетативной вивипарии (1-17, 19 — по: Пополина, 1960; 18 — по: Пополина,
1962):
1-15а— строение колоска на различных стадиях развития у семенной (1-6а), вивипарной (7-12) и
полувивипарной (13-15а) форм; 6а, 10а, 15а — увел, детали; 16, 17 — строение луковички на продольном
(16) и поперечном (17) срезах в зоне апекса побега, 18, 19 — внешний вид непроросшей (18) и проросшей
(19) луковичек; а.п — апекс побега, -к —корпус, кл— колеоптиль, кор — корень, к.н — конус нарастания,
к.ч— колосковые чешуи, ло — лодикула, л.в — листовой валик, л.ч— листоподобные чешуи, м.л-—мо-
лодой лист, м.т — теханическая ткань, н.ц.ч— нижняя цветковая чешуя, пс — пестик, п.б — пестичный
бугорок, п.к — примордий корня, п.п — проводящий пучок, идущий к семязачатку, сте— укороченный
стебель, т— тычинка, ту — туника, т.б— тычиночный бугорок, ц.б — цветковый бугорок, ц.ч — цветко-
вая чешуя, ч.л— чешуеподобные листья
ния колосок живородящей формы по своему строению подобен вегетативному побе-
гу, который в процессе дальнейшего развития превращается в луковицу. В составе
сформированной луковички точка роста, окруженная молодыми листьями, укоро-
ченный стебель (донце), примордии адвентивных корней, пять-семь листоподобных
образований, развивающихся вместо частей цветка, и колосковые чешуи. Сначала
формируются примордии колосковых чешуй, а затем акропетально закладываются
примордии листоподобных образований. Колосковые чешуи и первая пара листопо-
добных образований в период выбрасывания метелки выполняют ассимиляционную
и защитную функции. Вторая и третья пары листьев имеют пластинку и влагалище,
в тканях которого происходит отложение запасных питательных веществ (крахмала
и гемицеллюлозы). Во влагалищной части листа развита механическая ткань. В эпи-
дермальных, субэпидермальных и паренхимных клетках влагалища накапливается
антоциан, служащий для защиты луковички от низких температур. Зрелая вывод-
31
ковая луковичка в естественных условиях впадает в покой, длительность которого
определяется конкретными условиями обитания. Вопрос о том, прорастает ли она
на материнском растении, остается открытым.
У злаков некоторых видов (например, Р. alpina var. vivipara) возможен времен-
ный возврат живородящей формы к плодоносящей. Отмечены случаи метаморфоза
цветка или колоска Triticum в вегетативный побег, в основании которого формиро-
вались корни. При этом ось цветка превращалась в листовую пластинку, а чешуя —
во влагалище листа.
Инфлоральная гемморизогенная вивипария наблюдается также у Polygonum
viviparum — широко распространенного вида в арктической и умеренной зонах
(рис. 1.9). Выводковые почки (клубеньки) у этого вида формируются в пазухе кро-
ющих листьев соцветия. Выводковая почка образована в основном базальным меж-
доузлием — гипоподием, и утолщенными осями верхних междоузлий. Терминальная
почка клубенька, а за ней и боковые пазушные почки начинают раскрываться на
материнском растении, образуя розетки из двух-трех зеленых листьев, длина кото-
рых достигает иногда 10 12 мм. В таком состоянии клубеньки опадают на землю и
в условиях повышенной влажности укореняются, образуя новые растения.
Габитус этого растения значительно варьирует в зависимости от условий ме-
стообитания. Отмечается изменчивость размеров растения, количества цветков и
клубеньков в соцветии, окраски околоцветника и клубеньков. Выявлена обратная
корреляция между количеством цветков и клубеньков. Несмотря на наличие цвет-
ков в соцветии Р. viviparum в некоторых популяциях не было найдено жизнеспособ-
ных семян. Однако в других популяциях половая репродукция все же возможна.
Внутренние (генотип растения, количество соцветий на одном растении) и внеш-
ние (плотность растительного покрова) биотические факторы играют определенную
роль в контроле образования и развития цветков и клубеньков.
Клубеньки Р. viviparum и Ranunculus ficaria различаются по строению. В пазухе
листа R. ficaria находится пазушная почка, в основании которой образуется адвен-
тивный корень. Он быстро разрастается в толщину, в то время как почка остается
прежних размеров и практически не заметна на образовавшемся клубеньке. Этот
клубенек имеет корневое происхождение.
Растения большинства видов Allium легко размножаются семенами и не обра-
зуют выводковых почек (луковичек) в соцветии. Однако некоторые представители
рода (см. табл. 1) имеют соцветия, в которых цветки частично или полностью заме-
щены луковичками (рис. 1.10). Растения этих видов не образуют семян или образуют
их очень редко. Луковичконосные растения обычно сходны по строению вегетатив-
ных органов и цветков с представителем рода с соцветием, состоящим только из
цветков. Сейчас такие растения рассматриваются систематиками как принадлежа-
щие одному виду. Если ареалы луковичконосной и цветоносной форм не совпадают,
тогда луковичконосную форму рассматривают как подвид.
Способность диплоидных, триплоидных или тетраплоидных рас продуцировать
луковички сохраняет эти формы от вымирания. Некоторые виды лука представлены
в южной части своих ареалов особями, размножающимися только семенами, а в се-
верной — стерильными особями, размножающимися луковичками. Иногда вся попу-
ляция представлена луковичконосной формой; иногда встречается лишь несколько
таких особей.
Биологическая особенность растений A. proliferum состоит в том, что они раз-
множаются только вегетативным способом — прикорневыми луковицами (детками)
32
Рис. 1.9. Последовательные стадии формирования выводковых почек (клубеньков) на соцветии у
Polygonum viviparum (Polygonaceae) и их прорастания при полувивипарии (7) и вивипарии
(2) (1, 2, 5-11 — по: Кернер, 1902; 5, 4 — по: Engell, 1973):
3, 4 —строение клубенька до его отделения от материнского растения (5) и запасающая паренхимная
ткань в его нижней части (^); 5-10— последовательные стадии развития клубенька после отделения от
материнского растения (5а—то же, что на дет. 5, увел.); 11 —отделившийся от материнского растения
клубенек на более поздней стадии чем на дет. 5; 3 — х25, 4 — х250, 5, 6-10 — х2; выв.п — выводковые
почки, цв — цветки
и выводковыми почками (луковичками). В пределах одного соцветия луковички
неоднородны по массе и размерам. Краевые луковички в среднем имеют значитель-
но большую массу и размеры, чем центральные. Однако как среди краевых, так
33
Рис. 1.10. Живорождение у Allium caeruleum (Брагина, ориг.):
1 —соцветие, состоящее только из цветков; 2 — соцветия, состоящие из цветков и лу-
ковичек (а, и только из луковичек (в); 3 — соцветие с цветками (а) и образовавшимися
на нем луковичками (6) на разных стадиях развития; масштабная линейка— 1 см
и среди центральных луковичек существуют различия в размерах, массе и биоло-
гических особенностях развивающихся из них растений вследствие неоднородности
исходных материнских клеток и условий питания. Растения, развивающиеся из лу-
ковичек одинаковой массы, но разного местоположения, отличаются темпами роста
(начало появления стрелки над луковицей, продолжительность и интенсивность ее
роста). Растения, выросшие из краевых луковичек, запаздывают с началом появ-
ления стрелки на три-шесть дней, рост стрелки и формирование на ней луковичек
продолжается 21-24 дня, в то время как у луковичек из центра—18-21 день.
В условиях Москвы при посадке A. proliferum в середине августа темпы разви-
тия и морфологические изменения луковичек следующие: к началу зимы луковички
34
имеют в среднем шесть зеленых листьев, при этом три из них вышли из луковички.
В конце апреля заложившиеся осенью листья трогаются в рост, одновременно проис-
ходит деление клеток конуса нарастания луковички, заложение очередного листа, а
также замещающей луковицы. К началу мая в конусе нарастания меристемы стрел-
ки A. proliferum обособляются группы клеток, из которых в дальнейшем образуются
луковички. Эти группы клеток располагаются на конусе нарастания стрелки по спи-
рали. К моменту выхода стрелки из луковицы (конец мая — начало июня) каждая
луковичка имеет три-четыре низовых мясистых листа. Рост стрелки заканчивается
в третьей декаде июня, с этого момента низовые листья луковичек начинают раз-
растаться и луковички увеличиваются в диаметре, что приводит к разрыву обертки.
В это же время у луковичек, находящихся на стрелке, закладываются придаточные
корни. Луковички отделяются от стрелки в результате образования отделительного
слоя после опробковения паренхимных клеток стрелки.
Несмотря на глубокую древность культуры A. sativum этот полиморфный вид
еще недостаточно изучен. Известны как стрелкующиеся разновидности чеснока с
различной степенью дегенерации полового аппарата, так и нестрелкующиеся, пол-
ностью потерявшие способность к семенному размножению. Число выводковых по-
чек у форм A. sativum различно, у сванетской формы их развивается от 60 до 100.
Выводковая почка чеснока морфологически близка к зубку, но она значительно
меньше и имеет кроме питательной и кожистой чешуй пленчатую чешую. Выса-
женная в грунт выводковая почка в первый год не закладывает дочерних почек и
поэтому не образует зубков, дочерние почки закладываются только на следующий
год.
У A. sativum семена образуются лишь при особо благоприятных внешних услови-
ях или экспериментальных воздействиях (микроэлементы — бор, марганец, длинный
день, удаление луковичек). У A. sativum вследствие ярко выраженной протандрии
угнетающее влияние луковичек сказывается на микроспорогенезе. Выводковые поч-
ки только начинают закладываться, когда микроспорогенез подходит к концу. Ко
времени формирования женского гаметофита интенсивно развиваются выводковые
почки, на образование которых расходуются питательные вещества, необходимые
для развития генеративных органов. Это, вероятно, приводит к недостатку пита-
ния цветков, что, в свою очередь, вызывает нарушения мегаспорогенеза. Аномалии
в развитии женской сферы проявляются в дегенерации археспориальной клетки,
нарушении мейоза (выпадение в цитоплазму частичек хроматина или целой хромо-
сомы в метафазе, неравномерное распределение хромосом в анафазе), дифференци-
ации и поляризации зародышевого мешка.
Размеры, количество и скорость развития луковичек у A. sativum различаются в
зависимости от генотипа. Среди 12 клонов A. sativum было выделено четыре морфо-
логических типа, различающихся по соотношению цветков и луковичек в соцветии.
После формирования шести-семи листьев и листовых примордиев при благоприят-
ных условиях апикальная меристема чеснока становится генеративной. Во время
этого перехода быстро развивается покрывало (профилл), охватывающее апикаль-
ную меристему.
У многих видов Allium дифференциация соцветия происходит перед растяжени-
ем стрелки. Однако у чеснока разрастанию генеративной меристемы и последующей
дифференциации примордиев цветков предшествует удлинение стрелки до 5-7 мм
(рис. 1.11). Позднее части апикальной меристемы формируют несколько утолщений,
каждое из них дает несколько примордиев цветков, которые развиваются асинхрон-
35
но. По периферии соцветия появляются листоподобные брактеи, которые растут
быстрее, чем развивающийся примордий цветка. Индивидуальная дифференциация
д.о
Рис. 1.11. Развитие цветков и луковичек у Allium sativum (по: Kamenetsky, Rabinowitch,
2001):
1—апекс побега (генеративная меристема), 2 — дифференциация центров развития в ре-
продуктивной меристеме, видны первые примордии цветков (апекс — 0,5 мм диаметр, цветочная
стрелка длиной 5—7 мм), 3 — формирующееся соцветие, видны примордии цветков на разных ста-
диях развития, 4 —примордии луковичек, возникшие из меристем, в основании соцветия; мас-
штабная линейка —0,1 мм; г.м — генеративная меристема, д.о — доли околоцветника, л— луко-
вичка, л.б — листоподобные брактеи, пк— покрывало, п.т— примордий тычинки, п.ц — примор-
дий цветка
36
цветка начинается, когда диаметр соцветия составит 2-3 мм. Когда длина стрелки
достигает 15 см, цветоножки вытягиваются и соцветие становиться сферическим. В
это время по периферии соцветия появляются новые недифференцированные при-
мордии диаметром 0,15 мм, которые быстро развиваются в луковички. К моменту
раскрытия соцветия развитие луковичек приводит к дегенерации цветков.
Факультативная инфлоральная вивипария отмечена у представителей рода
Cymbopogon при увеличении влажности воздуха и почвы (после сезона дождей в
Индии). Образование новых растений происходит на прошлогодних соцветиях: ли-
бо на каждом узле соцветия, либо на оси оберток старых кистей. У Bryophyllum
daigremontianum формирование новых растений на соцветии наблюдалось в конце
цветения.
Экспериментальная индукция инфлоральной гемморизогенной вивипарии была
описана у Agrostis vulgaris и Deschampsia flexuosa. Выращивание растений в услови-
ях короткого дня (10 ч) вызывало усиление ветвления, удлинение периода вегетации
и появление на подгоне метелок с вивипарными колосками. Было отмечено увеличе-
ние числа цветков в колоске и изменение строения только нижних или всех колосков
либо всей метелки. Наблюдалось позеленение оснований колосковых и цветковых
чешуй, а также редукция тычинок и завязей. Большинство метелок имело полуви-
випарный характер — одни колоски были фертильными, другие представляли собой
укороченные побеги. Однако самопроизвольного отделения укороченных побегов в
условиях эксперимента не наблюдалось.
Фолиарная вивипария
Образование новых растений на листьях описано у представителей различ-
ных семейств: Amaryllidaceae (Curculigo), Araceae (Atherurus ternatus), Brassicaceae
(Arabis pumila, Brassica oleracea, Cardamine pratensis, C. silvatica, C. uliginosa,
Nasturtium officinale, Rorippa palustris), Crassulaceae (Echeveria, Rochea falcata),
Droseraceae (Drosera anglica), Gesneriaceae (Chirita scinensis, Episcia bicolor),
Liliaceae (Allium, Fritillaria, Gagea sinensis, Hyacinthus), Nymphaeaceae (Nymphaea
guineensis), Orchidaceae (Hammarbya paludosa), Ornithogalaceae (Omithogalum),
Papaveraceae (Chelidonium majus), Pinguiculaceae (Pinguicula backeri).
Вивипария среди орхидных отмечена только у одного вида — Hammarbya
paludosa. Вегетативные пропагулы Н. paludosa образуются не только на листьях,
но и в редких случаях на прицветниках (рис. 1.12; 1.13). На одном листе может
быть от 7 до 35 пропагул, при этом на нижних листьях их больше, чем на верх-
них. Пропагулы формируются экзогенно за счет пролиферации верхнего эпидер-
миса листа. Из образовавшихся меристематических очагов развиваются меристе-
матические бугорки, имеющие дорсовентральное строение. На внешней стороне
меристематического бугорка начинаются периклинальные деления, которые рас-
пространяются по всей окружности. Это приводит к образованию серповидного
валика и затем, в процессе его дальнейшего роста, к формированию сплошного
кольца (примордия первого листа). Первый лист пропагулы постепенно обрастает
среднюю часть меристематического бугорка, в то же время формируется внутрен-
няя часть пропагулы. Последняя в ходе своего развития приобретает яйцевидную
форму.
Позднее дифференцируются клетки внутренней части пропагулы («яйцевидной
структуры»), в которой можно выделить три зоны — апикальную, среднюю и ба-
37
Рис. 1.12. Hammarbya paludosa (Orchidaceae) (no: Batygina, Bragina, 1997):
a — цветок, б, в — адаксиальная (б>) и абаксиальная (в) сторона листа, 1, 2,3,4 — первый, второй, тре-
тий, четвертый лист соответственно; д.ч— дорсальный чашелистик, л.л — латеральный лепесток, лт.ч—
латеральный чашелистик, н.ч — нижний чашелистик.
зальную. Эти зоны отличаются по размерам клеток и содержанию в них крахмала.
На более поздней стадии развития «яйцевидная структура» приобретает дорсовен-
тральное строение за счет разрастания одной из ее латеральных сторон. В резуль-
тате меристематические клетки в апикальной зоне «смещаются» на латеральную
сторону верхушки «яйцевидной структуры». От зоны этих клеток через всю пропа-
38
39
Рис. 1.13. Развитие выводковой почки (пропагулы) на листе у Hammarbya paludosa
(Orchidaceae) при облигатной вегетативной вивипарии (по: Batygina, Bragina, 1997):
1 — внешний вид пропагул на адаксиальной поверхности листа на разных стадиях развития
(в центральной части листа пропагулы более развиты, чем в его латеральных частях); 2 — разрос-
шийся край листа, на котором будут формироваться пропагулы; 3 — внешний вид трех пропагул
(I, II, III) на стадии заложения первого листа в их апикальной части (I пропагула еще без примор-
дия листа); 4> 4а— пропагула, вид сбоку (-4) и сверху (^а) на стадии сформированного первого
листа, края листа на верхушке могут быть не сомкнуты (^а) или сомкнуты (см. дет. 5, 6)', 5, 6 —
пропагулы на более поздней стадии развития, формирование вторичной пропагулы (6) на краю
первого листа; 7-11 —внутреннее строение пропагулы на стадиях формирования меристематиче-
ского бугорка (7-9), развития его дорсовентральности (9), заложения примордия первого листа
(10) и развития апекса побега (11)', масштабная линейка: 1—1000 мкм, 2-4, 5, 6 — 100 мкм,
4а — 10 мкм, 7-11 — 0,03 мм; густоплазменные клетки показаны плотной точкой, крахмал — ред-
кой точкой, фиброзные утолщения — штриховкой, центральный тяж клеток изображен с ядрами;
а.п — апекс побега, ад.с — адаксиальная сторона листа, вт.п — вторичная пропагула, н — ножка,
п.в.ч — примордий внутренней части пропагулы, л\ — первый лист, п.л— примордий листа
гулу проходит центральный тяж вытянутых клеток. За счет дериватов апикальной
меристемы формируется апекс побега с примордиями трех листьев.
Первый лист пропагулы выполняет защитную и трофическую функции. Особен-
ностью развития первого листа пропагулы является высокая степень тотипотентно-
сти его клеток, за счет которых в определенных условиях образуются вторичные
пропагулы. В конце периода вегетации (ноябрь) у пропагулы не наблюдалось фор-
мирования адвентивного корня. Возможно, его заложение и развитие происходят
после отделения пропагулы от листа (зимой или ранней весной). Следует отметить,
что взрослые растения Hammarbya характеризуются слабо развитой корневой си-
стемой (один-два адвентивных корня).
40
1.3.2. Эмбриоидогенная вивипария
Фолиарная вивипария
Фолиарная эмбриоидогенная вивипария характерна для ряда представителей
рода Bryophyllum (рис. 1.14-1.16). Вегетативные пропагулы развиваются в усло-
виях длинного дня. Возникновение пропагул неразрывно связано с морфогенезом
материнского листа. Форма листовой пластинки и основные черты ее структуры
определяются очень рано и отчетливо выражены у второй пары листьев пророст-
ка. Паренхиматизация листа идет в базипетальном направлении. Мезофилл ли-
ста однородный, между его клетками почти нет межклетников. Жилкование листа
перистое.
При развитии листа в выемках, формирующихся по его краю, остаются меристе-
матические клетки (dormant meristem), расположенные в эпидермисе и субэпидер-
мисе. Из них впоследствии образуется меристематическая зона, увеличение числа
слоев клеток которой происходит за счет периклинальных делений в субэпидермаль-
Рис. 1.Ц. Общий вид растения Bryophyllum daigremontianum (Брагина, ориг.)
41
ном и нижележащем слоях. Из дериватов этой меристематической зоны формиру-
ется вся пропагула.
В развитии пропагул В. pinnatum и В. daigremontianum можно выделить стадии,
сходные со стадиями развития типичного полового зародыша, хотя это сходство не
абсолютно. Установлено, что пропагула В. pinnatum является соматическим заро-
дышем (эмбриоидом), а пропагула В. daigremontianum —переходной формой меж-
ду неметаморфизированной почкой, у которой развиваются адвентивные корни, и
эмбриоидом.
В начале своего развития пропагула у обоих видов проходит стадию, на ко-
си
42
Рис. 1.15. Строение вегетативной пропагулы Bryophyllum daigremontianum на разных стадиях раз-
вития (1, 5-7— по: Batygina et al., 1996; 2~4, 8, 9 — по Батыгина, Брагина, 2000):
1 —край листа с выемкой, где будет формироваться выступ, несущий пропагулу; 2, 2а — меристема-
тический бугорок на коротком выступе выемки листа; 3 — формирующиеся примордии двух «семядолей»;
4— формирующиеся в большей «семядоле» прокамбиальные тяжи; 5 — общий вид пропагулы (см. дет.
4); 6, 6а — развивающиеся семядоли, апикальная часть большей «семядоли» уплощена (6а — вид сверху);
7 — выступ выемки листа со следом после отделения пропагулы; 8 — соцветие с отцветшими цветками и
вегетативными пропагулами в пазухах брактей; 9 — растение, образовавшееся из вегетативной пропагулы;
масштабная линейка — 0,5 см; в.п — вегетативная пропагула, вмк— выемка листа, e-btc— выступ выемки
листа, см — семядоля, п.п— проводящий пучок
43
Рис. 1.16. Факультативная вегетативная вивипария, отдельные стадии развития вегетативной про-
пагулы у Bryophyllum pinnatum (1-36 — по: Batygina et al., 1996; 4 —по: Кернер, 1902; 5 —
по: Васильев и др., 1978):
1 — строение края листа с выемкой, где видна меристематическая зона из клеток которой будет фор-
мироваться пропагула; 2— пропагула, имеющая две «семядоли», два примордия адвентивных корней,
проводящая система пропагулы связана с проводящей системой материнского листа; 5, За, 36 — общий
вид пропагулы, находящейся в выемке края листа, видны два примордия «семядолей» (адаксиальный
примордий больше) и разрастания адаксиальной поверхности листа вследствие эндогенного заложения
адвентивных корней пропагулы под ними (3 — вид сбоку, За — вид снизу, 36 — вид сверху), ^,5 — слож-
ный лист В. pinnatum (4) и побег Bryophyllum sp. (5) с новыми растениями, образовавшимися из про-
пагул; ад.к — адвентивный корень, ад.с — адаксиальная сторона листа, At.з — меристематическая зона,
п.п — проводящий пучок, см — семядоля; масштабная линейка: 3, За — 1000 мкм, 36 — 100 мкм.
торой она представлена меристематической зоной, не граничащей с проводящим
пучком материнского листа. Затем, в результате пролиферации ее клеток, мери-
стематическая зона увеличивается в объеме и соприкасается с проводящим пуч-
44
ком материнского листа. Впоследствии меристематическая зона трансформируется
в меристематический бугорок. Последний изолирован от других клеток листа клет-
ками, содержащими таннины. На этой стадии развития пропагула сходна с поло-
вым зародышем на глобулярной стадии развития. Позже в апикальной части ме-
ристематического бугорка супротивно друг другу закладываются два листоподоб-
ных органа — «семядоли». У В. daigremontianum эту стадию можно рассматривать
как стадию раннего «сердечка». У В. pinnatum стадия раннего «сердечка» харак-
теризуется наличием инициалей «семядолей» и адвентивного корня. Пропагула В.
pinnatum, в отличие от пропагулы В. daigremontianum, на всех стадиях развития
не связана с проводящей системой материнского листа. На стадии позднего «сер-
дечка» пропагула В. pinnatum впадает в состояние покоя. В пределах листа пропа-
гулы находятся на разных стадиях развития. Разброс в стадиях развития пропа-
гул в большей мере проявляется при увеличении возраста листьев и материнского
растения.
После выхода из состояния покоя пропагула достигает стадии «торпеды» и через
40-45 дней отделяется от материнского растения в виде растения с «семядолями»,
тремя-пятью парами хорошо развитых листьев и системой адвентивных корней.
Развитие пропагул в условиях длинного дня связано с изменением в базипе-
тальном транспорте ауксина из апекса побега и индукцией синтеза ауксина в про-
нагулах. В этот период эндогенное содержание цитокининов в листовой пластин-
ке возрастает от основания листа к его верхушке. Такое распределение цитокини-
нов, возможно, следует рассматривать как один из факторов, определяющих ба-
зипетальное развитие пропагул. Вероятно, увеличение значения отношения (зеа-
тин + зеатинрибозид) / индолил-уксусная кислота, или (3 + ЗР) / ИУК индуцирует
деление клеток в меристематической зоне на краю листа, из которой формируется
меристематический бурогок пропагулы. По мере развития пропагулы становятся ат-
трагирующими центрами не только ассимилятов, но и цитокининов, поступающих
к ним из корней. На стадии «сердечка» величина отношения (3 + ЗР)/ИУК стано-
вится больше 1, что сопровождается инициацией прокамбия в большей «семядоле».
В условиях короткого дня значение отношения (3 + ЗР)/ИУК меньше 1 вслед-
ствие увеличения содержания ИУК, что, вероятно, и обусловливает подавление
роста пропагул. Специфическая способность индуцировать образование вегета-
тивных пропагул в условиях короткого дня у Bryophyllum присуща только 6-
бензиламинопурину и кинетину. Индолил-уксусная кислота, гиббереллины и трий-
одбензойная кислота способны стимулировать развитие пропагул только при нали-
чии цитокинина. Стимулирующее действие на их рост оказывает а-нафтилуксусная
кислота.
Каулигенная вивипария
Отмечена у Ranunculus sceleratus. Эмбриоиды формируются экзогенно на стеб-
лях проростков, полученных в культуре in vitro в результате эмбриоидогенеза. Спер-
ва эмбриоиды появляются в базальной части гипокотиля, а затем по всему стеблю.
Они развиваются асинхронно. Некоторые эпидермальные клетки проростка делят-
ся и формируют четырех- и восьмиклеточные проэмбрио. Инициальная клетка эм-
бриоида имеет густую цитоплазму, богатую рибосомами, мелкие вакуоли и крупное
ядро. В ходе последующих делений отделяется протодерма и образуется глобуляр-
ный эмбриод. Далее меристематическая активность прослеживается в двух участках
45
апикальной части эмбриоида— в месте возникновения семядолей. После прохожде-
ния стадии сердечка гипокотиль-корневая ось и семядоли удлиняются, в них обра-
зуются ггрокамбиальпые тяжи. Зрелые эмбриоиды белые или светло-зеленые, име-
ют гипокотиль-корневую ось и две (иногда три) семядоли, их строение аналогично
строению зиготического зародыша из семени, развитие которого проходит согласно
Onagrad-типу. Эти эмбриоиды также дают проростки.
Рис. 1.17. Последовательные стадии развития вегетативной диаспоры Asplenium viviparum (по:
Денисова, 2002):
1—меристематический центр диаспоры (начало глобулярной фазы); £ —стадия гистогенеза; 3—
стадия органогенеза; 4 —стадия зачатков двух вай (возникновение единой проводящей системы диас-
поры и материнской вайи) 5-—ювенильный спорофит, же—железистый волосок, и.к.в — инициальная
клетка вайи, и.к. к — инициальная клетка корня, и.к.с — инициальная клетка стебля, м — клетки мезофил-
ла листа, мтк— элементы метаксилемы, м.ц — меристематический центр диаспоры, н — клетки ножки,
пр — прокамбиальные клетки диаспоры, прк — элементы протоксилемы проводящего пучка родительской
вайи, пр.п — проводящий пучок материнской вайи, пр.п.в — проводящий пучок вайи диаспоры, пр.п.к —
проводящий пучок корня диаспоры, э — эндодерма, эм — клетки эмергенцев
Формирование эпифильных выводковых почек более характерно для папоротни-
ков, чем для цветковых растений. В условиях оранжерейной культуры представите-
ли Asplenium bulbiferum и A. viviparum размножаются только вегетативным путем,
так как их споры стерильны. Вегетативные диаспоры закладываются одновременно
с сорусами. На одной средневозрастной особи A. viviparum развиваются примерно
7500 вегетативных диаспор, на одной вайе от 40 до 700 в зависимости от форма-
ции вайи, фертильные вайи отличаются более обильным образованием вегетатив-
46
ных диаспор. Репродуктивное усилие у A. bulbiferum ниже, чем у A. viviparum, —на
растении образуются в среднем 560 выводковых почек, на одной вайе 10-60 соответ-
ственно. Формируются выводковые почки у растений того и другого вида в уголках
жилок на верхней поверхности перышек. На одной вайе выводковые почки разно-
возрастны. В средней и базальной частях вайи диаспоры развиваются медленнее,
чем в апикальных ее частях и на верхушке перьев. Ранние периоды морфогенеза
вегетативных диаспор A. bulbiferum и A. viviparum (рис. 1.17) протекают сходным
образом и включают четыре фазы:
1) инициации — образования меристематических центров из протодермальных и
субпротодермальных клеток;
2) примордия диаспоры — образования бугорка в виде скопления однородных ме-
ристематических клеток;
3) органо- и гистогенеза — вычленения инициалей стебля, вайи и корня и обра-
зование тяжей прокамбия;
4) возникновения единой проводящей системы родительского листа и диаспоры.
1.4. ГЕНЕТИЧЕСКИЕ ОСНОВЫ ВИВИПАРИИ
При нормальном развитии семени фаза созревания включает синтез запасных
питательных веществ, прекращение роста зародыша и развитие устойчивости к вы-
сыханию. Как известно, ключевым регулятором генной экспрессии в позднем эм-
бриогенезе является АБК, которая опосредует ответы на различные экстремальные
воздействия. Изменение в синтезе и чувствительности к АБК может быть одной из
причин, приводящих к вивипарии.
По содержанию и степени чувствительности к АБК вивипарные мутанты куку-
рузы были разделены на два класса. У мутантов первого класса (vp2,vp5,psl(vp7),
vp8, vp9) отмечается пониженный уровень АБК и изменение синтеза каротиноидов
(за исключением vp8).
У мутанта tipi, отнесенного ко второму классу, уровень эндогенной АБК в за-
родыше не изменен, однако мутант нечувствителен к экзогенному гормону. Кроме
того, у мутанта vpl подавлен синтез антоцианов в клетках алейронового слоя. Про-
дукт гена Viviparous-1 (VP-1) входит в состав регуляторных белков, стимулирующих
созревание и покой зерновки. Продукт гена VP-1 является фактором транскрипции
и требуется для экспрессии генов Cl, Globulin и Ет. Кроме того, белок VP1 вы-
ступает репрессором для генов а-амилазы, функционирующих при прорастании в
клетках алейронового слоя.
В семенах вивипарных мутантов кукурузы обнаружены гены, участвующие в
синтезе и узнавании АБК. Зародыши одного из мутантов (vp 14) имеют нормальную
чувствительность к АБК. Однако содержание АБК у мутантных зародышей было
на 70% ниже, чем у зародышей дикого типа, что указывает на нарушение в синтезе
АБК. Белок VP14 катализирует реакцию расщепления каротиноидов.
Многие вивипарные мутанты арабидопсиса имеют аналогичные вивипарным му-
тантам кукурузы фенотипы (например, мутант а&гЗ). Мутация аЫЗ затрагивает
период покоя семени, накопление запасных белков и жиров, распад хлорофилла,
способность отвечать на действие АБК и устойчивость к высыханию. Характери-
стики существующих мутантных afo'3-аллелей подтвердили гипотезу о том, что бе-
лок ABI3 участвует в каскаде реакций восприятия и трансдукции АБК. Нормальное
восприятие АБК геном ABI3 — необходимое, но не достаточное условие для многих
47
критических этапов, связанных с эмбриогенезом у арабидопсиса. Сходные последо-
вательности и аналогичные фенотипы VP1 и ABI3 наводят на мысль о том, что они
являются функционально гомологичными генами.
У мутантов арабидопсиса leafy cotyledon (Zecl) и fus3 преждевременно проросшие
семена встречаются редко. Сравнение этих мутантов дает основание полагать, что
гены LEC1 и FUS3 могут выполнять связанные, но не идентичные функции во
время эмбриогенеза. Они кодируют регуляторные факторы, которые активируют
широкий спектр эмбриогенетических программ начиная со стадии сердечка. FUS3
и LEC1 позитивно регулируют повышенное содержание белка ABI3 в семени.
Вивипария определяется генотипом зародыша и не зависит от генотипа эндо-
сперма.
Возможно, что механизмы регуляции вивипарии у мангровых окажутся сходны-
ми с таковыми у мутантов кукурузы и арабидопсиса. Вероятно, можно будет найти
некоторое сходство в регуляторных процессах, происходящих при вегетативной ви-
випарии.
1.5. ПРИЧИНЫ ВОЗНИКНОВЕНИЯ ВИВИПАРИИ
Потенциальная способность к вивипарии универсальна для цветковых растений:
они имеют такой генетический признак, как автономность зародыша. Это свойство
зародыша, характеризующее его способность к саморегуляции и независимому от
материнского растения развитию. Зародыш становится автономным на определен-
ном этапе эмбриогенеза, специфичном для каждого таксона. Это наиболее важный
из критических периодов онтогенеза, так как именно с него начинается переход за-
родыша (нового спорофита) на самостоятельный путь развития. Относительную ав-
тономность зародыш приобретает, когда становится независимым от действия ряда
факторов материнского организма (гормонов, питательных веществ и др.). Полная
автономность зародыша достигается по завершении прорастания семени и образо-
вания проростка, когда все связи (структурные и функциональные) с материнским
организмом (плодом, семенем) исчезают.
Вивипария возникла независимо у разных групп растений. Явление вивипарии
наблюдается у растений в различных экологических условиях. Так, облигатная ге-
неративная вивипария характерна для растительности мангровых. Эта особенность
наряду с другими приспособлениями явилась адаптацией к жизни в условиях пе-
риодического затопления и высокого засоления. Прорастание семени у мангровых
на материнском растении способствует формированию солеустойчивого и способно-
го к быстрому укоренению проростка. Содержание солей в проростке с возрастом
увеличивается. Приспособление проростка к засолению осуществляется с помощью
постепенного поступления солей из материнского растения. Проросток значитель-
но более пластичен, чем взрослое растение со сложившимися приспособлениями к
определенной степени засоления почвы. Чем более солеустойчиво материнское рас-
тение, тем быстрее и легче осуществляется адаптация молодого растения к засоле-
нию. Выдвинуто предположение, что вивипария у мангровых возникла в результате
задерживающего влияния хлор-иона на опадение плодов в сочетании с отсутствием
периода покоя в образовавшемся семени.
Живорождение у мангровых развито в разной степени. Некоторые представи-
тели, например Acanthus ilicifolius, не являются вивипарными видами, в то время
как Avicennia и Aegiceras относятся к криптовивипарным родам. Удивительно, что
48
одни мангровые для снижения влияния солености почвы на проростки приобрели
способность к крипто- или фанеровивипарии, другие же (например, A. ilicifolius)
приурочили прорастание своих семян к периоду муссонных дождей.
Способность растения к факультативной генеративной вивипарии выступает
одним из резервов системы репродукции. При изменении внешних условий какая-то
часть семян способна дать жизнеспособные проростки.
Многие исследователи пытались выявить причины возникновения вегетативной
вивипарии у цветковых растений. В частности, считают, что живородящие формы
злаков - спонтанно возникшие, наследственные и более или менее устойчивые му-
тации. На основании сходства в характере деградации полового аппарата у живо-
родящих форм злаков и многих гибридов выдвинута гипотеза о гибридном про-
исхождении живородящих растений. Некоторые исследователи пытались связать
живорождение с полиплоидией.
Полагают также, что определенный световой режим, температура и влажность
предрасполагают растения к вивипарии. Однако условия, вызывающие вивипарию
у злаков, видоспецифичны. Некоторые формы вивипарии (например, у Agrostis
vulgaris, Deschampsia flexuosa, Triticum) были выявлены при культивировании рас-
тений в условиях короткого дня. У видов рода Роа (Р. arctica, Р. chaixii, Р. bulbosa)
и у гибридов Р. chaixii х Р. longifolia, Р. longifolia х Р. pratensis вивипарию сти-
мулируют короткий день и низкая температура, в то время как для индукции
вивипарии у Bromus pumpellianus необходимы умеренная температура, длинный
день и повышенная влажность. Эти данные и данные о разной степени проявле-
ния вивипарии у растений одного вида из разных точек ареала говорят о том,
что на вивипарию оказывают влияние условия местообитания растения. Кроме то-
го, на изменение внешних условий реагируют только растения определенного гено-
типа.
Живородящие растения, для которых характерна вегетативная вивипария, про-
израстают главным образом в полярных, высокогорных и пустынных районах. Эти
растения имеют в своем распоряжении очень короткий период, когда условия бла-
гоприятны для того, чтобы оставить потомство. В ряде случаев образование семян
затруднено или невозможно вследствие отсутствия опылителей, нарушений в раз-
витии мужского и женского гаметофита (например, некоторые виды Allium). Тогда
почти единственной возможностью поддерживать и увеличивать численность попу-
ляции становится способность к вегетативной вивипарии.
Как известно, у ряда растений в системе репродукции сочетаются процессы нор-
мального развития семян и формирования живородков, что обеспечивает накопле-
ние в популяции потомков с различными генотипами (виды рода Роа и Polygonum
viviparum). Способность к вивипарии арктических видов злаков позволила им быст-
ро заселить освободившиеся от ледника земли.
В зависимости от конкретных условий растение может оставить достаточное ко-
личество потомков либо за счет размножения семенами, либо за счет вегетативных
вивипарных диаспор. Полувивипарные особи или популяции способны увеличивать
численность двумя способами. Как было отмечено, гетерогенность популяций по
степени выраженности вивипарии оставляет возможность для гибридизации с по-
ловыми формами (F. vivipara).
Формирование живородков на вегетативных органах позволяет разнести в про-
странстве, а в некоторых случаях во времени семенное и вегетативное размножение
(Bryophyllum, Cardamine, Hammarbya). Разная степень выраженности вивипарии в
49
той или иной популяции обеспечивает пластичность системы репродукции. Сохра-
нение биологического разнообразия во многом зависит от успешного сочетания раз-
личных способов размножения (в том числе и образования вивипарных диаспор) в
общей системе репродукции вида.
1.6. РЕПРОДУКТИВНАЯ СТРАТЕГИЯ
ЖИВОРОДЯЩИХ РАСТЕНИЙ
Каждый вид обладает своеобразной системой репродукции, которая обеспечива-
ет воспроизведение и размножение вида. Каждая система репродукции имеет опре-
деленную пластичность и толерантность. Успех воспроизведения и размножения,
как и любого другого биологического процесса, зависит в определенной степени
от экологической обстановки. В пределах одного свойственного виду фитоценоза
под влиянием метеорологических или биотических факторов могут меняться типы
размножения, календарные сроки или ритм размножения, а также качественные
и количественные показатели продуктивности вида. Эти изменения происходят на
уровне как отдельных особей, так и популяции.
Воспроизведение и размножение растений, в частности живородящих, происхо-
дит посредством образования разнообразных генеративных и вегетативных диаспор.
Для различных видов живородящих растений характерно семенное либо вегетатив-
ное, либо оба типа размножения.
Многим мангровым (Bruguiera, Ceriops, Kandelia, Rhizophora) свойственна об-
лигатная генеративная вивипария, т. е. размножение с помощью проростков, воз-
никших на базе полового зародыша. Вегетативное размножение у этих видов не от-
мечено. В условиях стресса (например, при резком изменении влажности воздуха)
некоторые растения из сем. Cucurbitaceae проявляют способность к факультатив-
ной криптовивипарии.
Наибольшее разнообразие способов репродукции встречается у растений, кото-
рым свойственна вегетативная вивипария: гемморизогенная или эмбриоидогенная.
Так, виды рода Festuca высокогорных широт размножаются только посредством
гемморизогенной вивипарии. Однако на южной окраине ареала для вивипарных
овсяниц характерно сочетание семенного и вегетативного размножения. Количе-
ство растений F. vivipara, у которых отмечена вивипария, и степень модификаций
колосков варьируют в зависимости от группы растений, их местообитания и се-
зонных условий. Растения также различаются по числу фертильных цветков, при
этом тетраплоиды из береговой популяции продуцируют их больше, чем из альпий-
ской. В соцветиях у гибрида F. rubra х F. vivipara часть колосков регулярно транс-
формируется в воздушные луковички, остальные цветки в соцветии оказываются
стерильными.
В системе репродукции Роа alpigena, Р. bulbosa и Р. sublanata успешно соче-
таются разные способы образования нового индивидуума: посредством семян, вы-
водковых почек в соцветии и луковиц в основании стебля. Количество полноцен-
ных семян у Р. alpigena и Р. sublanata сопоставимо с таковым у семенных форм, а
всхожесть даже выше нормы. Растения Р. alpigena и Р. sublanata из разных место-
обитаний различаются по количеству и качеству производимых ими вегетативных
диаспор. Так, Р, alpigena образует множество мелких, быстро теряющих всхожесть
диаспор, которые успешно занимают небольшие свободные промежутки в массе со-
мкнутой злаковой синузии и не разносятся на значительные расстояния. Напротив,
50
крупные, долго сохраняющие жизнеспособность пропагулы Р. sublanata переносятся
далеко.
Некоторые формы живородящих злаков (F. vivipara) способны произвести
несколько метелок с фертильными цветками обычно в самом конце вегетационного
периода.
Как известно, система семенного размножения у цветковых включает механиз-
мы, участвующие в образовании инициальных клеток половых и соматических заро-
дышей, формировании семян и плодов, которые могут порознь или в комплексе друг
с другом поддерживать существование популяций вида в достаточно большом ряду
поколений. Согласно П. Г. Куприянову (1989), основными параметрами семенного
размножения являются те механизмы или элементы системы репродукции, которые
влияют на генетическую структуру популяций вида.
У вивипарных представителей рода Allium выявлены частичные наруше-
ния в мейозе как при микро-, так и при мегаспорогенезе, обусловливаю-
щие в дальнейшем значительную степень стерильности у этих видов. Причи-
на этих аномалий — развитие луковичек в соцветии, удаление которых, как сле-
дует из результатов эксперимента, стимулирует образование нормальных цвет-
ков. Таким образом, у луков существуют все переходы от соцветий, состоя-
щих только из цветков (Л. aflatunense, А. decipiens), к соцветиям, состоящим
из цветков и луковичек (A. oleraceum, A. senescens) или только из луковичек
(A. proliferum). В зависимости от способности к образованию луковичек и степе-
ни стерильности семян Е. И. Устинова (1944) разделяет вивипарные луки на три
группы:
1) число цветочных почек в соцветии равно или несколько меньше числа луко-
вичек, фертильность семян 0,5-1,5% (Л. coeruleum, A. oleraceum)',
2) в соцветии преобладают луковички, семена стерильны (Л. carinatum,
A. scorodoprasum);
3) в соцветии обычно только луковички, семена стерильны (Л. proliferum).
Вариации в соотношении количества семян и вегетативных диаспор (клубеньков)
отмечены также и у некоторых двудольных, в частности у Polygonum viviparum. При
цитологическом исследовании растений Р. viviparum, взятых из пяти разных точек
ареала, установлено, что в Исландии это гептаплоид, на Фаройских островах — ок-
таплоид, а в Гренландии, Англии, Чехии и Словакии наблюдается наноплоидная ва-
риация. Растения отличались по общей длине колоса, по размеру той части колоса,
на которой цветки были замещены клубеньками, и по морфологии поддерживающих
клубеньки листьев. Клубеньки из пяти местообитаний различались по размерам и
цвету. Среди растений Р. viviparum из 12 местообитаний на территории централь-
ной Норвегии большинство имело преобладающую тенденцию к замещению цветков
клубеньками.
Для ряда живородящих растений характерно образование проростков на листе
или в пазухе листа (Cardamine, Nymphaea, Bryophyllum, Hammarbya paludosa).
В условиях стресса (например, при резком повышении влажности воздуха) расте-
ния, способные к факультативной гемморизогенной вивипарии (Cymbopogon), мо-
гут оставить дополнительное потомство.
Живородящие растения в зависимости от внешних условий (длины дня, темпера-
туры, влажности и др.), генотипа и возраста способны продуцировать либо семена,
либо вегетативные проростки, либо одновременно оба типа диаспор. Причем в отли-
чие от растений, для которых характерна флоральная гемморизогенная вивипария,
51
52
формирование вегетативных проростков на листьях и в их пазухах практически не
связано с развитием соцветия. Это дает определенную автономность при формиро-
вании выводковых почек, а следовательно, большую пластичность при образовании
новых растений. Популяции живородящих растений гетерогенны по генотипу и воз-
растному составу благодаря сочетанию различных способов размножения и времени
появления потомства.
Из анализа литературы и оригинальных данных следует, что вивипария встре-
чается у 281 вида цветковых растений (табл. 1.1; 1.2). Вивипария отмечена в 55
семействах, входящих в состав 42 порядков (рис. 1.18).
Таблица 1.1. Список цветковых растений, у которых отмечена вивипария
Но- мер Семейство Род Вид Тип вивипарии Источник
1 Acanthaceae Acanthus A. ilicifolius Генеративная криптовивипария Joshi et al., 1972
2 Aegicerataceae Aegicerias A. majus » Генкель, 1962
3 Agavaceae Agave A. angustifolia Вегетативная Berger, 1915;
инфлоральная Granick, 1944; Darlington, Janaki-Ammal, 1945; Gustafsson, 1946; Nygren, 1954
A. bulbifera » Braun, 1859
A. candelabrum » Berger, 1915; Granick, 1944; Darlington, Janaki-Ammal, 1945; Gustafsson, 1946; Nygren, 1954
A. cantula » Berger, 1915; Granick, 1944; Darlington, Janaki-Ammal, 1945; Gustafsson, 1946
A. fourcroydes Berger, 1915; Granick, 1944; Darlington, Janaki-Ammal, 1945; Gustafsson, 1946; Nygren, 1954
A. jaquiniana » Braun, 1859
A. lespinassei Berger, 1915; Granick, 1944; Darlington, Janaki-Ammal, 1945; Gustafsson, 1946; Nygren, 1954
A. lurida » »
A. salmiana var. >> Braun, 1859;
sisalana Berger, 1915; Granick, 1944; Darlington, Janaki-Ammal, 1945
53
Продолжение таблицы 1.1
4 Alismataceae Alisma A. sobolifera A. vivipara A. zapupe A. intermedium Вегетативная инфлоральная » Braun, 1859 Braun, 1859; Berger, 1915; Granick, 1944; Darlington, Janaki-Ammal, 1945; Gustafsson, 1946; Nygren, 1954 Berger, 1915; Granick, 1944; Darlington, J anaki-Ammal, 1945; Gustafsson, 1946; Nygren, 1954 Braun,1859
A. natans » »
A. parnassifolium » »
A. radicans » »
5 Alliaceae Allium A. aflatunense » Филимонова, Миркамилов, 1970
A. ampeloprasum £ Stearn, 1978
A. ascalonicum » Darlington, Janaki-Ammal, 1945; Gustafsson, 1946; Nygren, 1954
A. caeruleum » Gustafsson, 1946
A. caesium » Введенский, 1935; Fritsch (IPK)
A. canadense » Fritsch (IPK)
A. candelabrum » Braun, 1859
A. cantula » »
A. carinatum » Braun, 1859; Diannelidis, 1944; Geitler, 1944; Gustafsson, 1946; Nygren, 1954
А. сера » Braun, 1859;
var. pro liferum Darlington, Janaki-Ammal, 1945; Gustafsson, 1946; Nygren, 1954
A. comutum » Fritsch (IPK)
A. fetissovii » Филимонова, Миркамилов, 1970
A. fistulosum » Stearn, 1978
A. fourcroydes » Braun, 1859
A. griffithianum Вегетативная Введенский,
факультативная инфлоральная 1935
A. guttatum Вегетативная инфлоральная Fritsch (IPK)
A. lespinassei » Braun, 1859
A. lipskyanum Вегетативная Fritsch, 1998
факультативная инфлоральная
54
Продолжение таблицы 1.1
Alliaceae Allium A. longicuspis Вегетативная Филимонова,
инфлоральная Миркамилов, 1970; Fritsch (IPK)
A. lurida » Braun, 1859
A. macrostemon » Введенский, 1935; Fritsch (IPK)
A. magicum Вегетативная фолиарная Кудряшова, 1982
A. moly Вегетативная инфлоральная Fritsch (IPK)
A. oleraceum » Braun, 1859; Gustafsson, 1946; Nygren, 1954
A. ophioscorodon » Braun, 1859
A. paniculatum » Fritsch (IPK)
A. proliferum » Darlington, Janaki-Ammal, 1945; Gustafsson, 1946; Nygren, 1954
A. roseum » Gustafsson, 1946;
var. bulbiferum Nygren, 1954
A. sativum » Braun, 1859; Darlington, Janaki-Ammal, 1945; Gustafsson, 1946
A. schoenoprasum » Gustafsson, 1946; Nygren, 1954
A. scordoprasum » Braun, 1859; Darlington, Janaki-Ammal, 1945; Gustafsson, 1946; Nygren, 1954
A. sordidiflorum » Fritsch (IPK)
A. scorzonerifolium » Stearn, 1978
A. senescens » »
A. sphaerocephalon »
A. sub vineale » Fritsch (IPK)
A. tulipaefolium » Чернов, 1929
A. victoris Вегетативная факультативная инфлоральная Fritsch, 1998
A. vineale Вегетативная Braun, 1859;
инфлоральная Darlington, Janaki-Ammal, 1945; Gustafsson, 1946; Nygren, 1954
A. viviparum » Darlington, Janaki-Ammal, 1945; Gustafsson; 1946; Nygren, 1954
A. umbilicatum » Fritsch (IPK)
55
Продолжение таблицы 1.1
6 Amaryllidaceae Fourcroya F. cubensis Вегетативная Ernst, 1918;
инфлоральная Darlington, Janaki-Ammal, 1945; Nygren, 1954
F. gigantea » Ernst, 1918; Darlington, Janaki-Ammal, 1945; Nygren, 1954
F. longaeva » Braun, 1859
7 Apiaceae Cicuta C. zapupe » »
C. bulbifera » »
Eryngium E. viviparum »
Levisticum L. officinale Вегетативная фолиарная »
8 Araceae A morphophallus A. bulbifer Braun, 1859
Anubias A. heterophylla Генеративная Рудский (СПбГУ),
факультативная фанеровивипария 2004
Remusatia R. vivipara Вегетативная Goebel, 1931
каулигенная
9 Arecaceae Nypa N. ruticans Генеративная Farnsworth,
криптовивипария Farrant, 1998
10 Asphodelaceae Bulbine B. asiatica » Braun,1859
Chlorophytum C. stembergianum Вегетативная инфлоральная »
11 Asteraceae Pulicaria P. vulgaris modif. vivipara » Andrei, 1969
12 Avicenniaceae Avicennia sp. Генеративная криптовивипария Генкель, 1962
A. marina » »
A. nitida » »
A. officinalis » Shimper, 1898; Sernarder, 1927; Генкель, 1962
13 Balsaminaceae Impatiens I. balsamina Генеративная Balasubramaniam,
факультативная криптовивипария Sundararaj, 1957
14 Begoniaceae — — Вегетативная инфлоральная Braun, 1859
15 Bombacaceae Hibiscus H. diverrsifolius Генеративная факультативная криптовивипария »
16 Brassicaceae Arabidopsis A. thaliana Генеративная Koornneef et al.,
(мутанты) фанеровивипария 1984
Arabis A. pumila Вегетативная фолиарная Braun, 1859
Cardamine C. mathioli » »
C. pratensis » »
17 Bromeliaceae Ananas sp. Вегетативная факультативная инфлоральная »
Hohenbergia H. strobilina » »
18 Caricaceae Carica C. papaya Генеративная Braun, 1859;
факультативная Balasubramaniam,
криптовивипария Sundararaj, 1957
19 Caryophyllaceae Agrostemma sp. Генеративная фанеровивипария »
56
Продолжение таблицы 1.1
Caryophyllaceae Agrostemma A. githago Ген ер ати вная Sernarder, 1927
20 Chenopodiaceae Atriplex A. crassifolia факультативная фанеровивипария Вегетативная Joshi, 1932
21 Combretaceae Sueda Laguncularia S. fructicosa L. racemosa факультативная инфлоральная » Генеративная » Генкель, 1962
22 Convolvulaceae Ipomoea I. glaberrima фанеровивипария Генеративная Balasubramaniam,
23 Crassulaceae Bryophyllum I. peltata B. beauverdii факультативная криптовивипария » Вегетативная Sundararaj, 1957 » Friedmann, 1975
Kalanchoe B. brevicalyx B. calcicola B. daigremon- tianum B. fedtschenkoi B. gastonis-bonieri B. macrochlamys B. mamierana B. miniatum B. pinnatum B. poncarei B. proliferum B. rosei B. scandens B. schizophyllum B. serratum B. tubiflorum B. ualdheimii K. ambolensis K. campanulata K. jongmansii K. laxiflora K. minginii K. pseudo- campanulata K. pubescens K. rolandi- bonapartei фолиарная Вегетативная фолиарная инфлоральная Вегетативная фолиарная » » Вегетативная инфлоральная Вегетативная фолиарная инфлоральная Вегетативная фолиарная Вегетативная фолиарная инфлоральная Вегетативная фолиарная Вегетативная инфлоральная Вегетативная фолиарная » » Вегетативная инфлоральная » » Вегетативная фолиарная Вегетативная инфлоральная фолиарная Вегетативная ин- флоральная » Friedmann, 1975 » Catarino, 1965; Friedmann, 1975 Friedmann, 1975 >> » » Braun, 1859; Catarino, 1969; Friedmann, 1975 Friedmann, 1975 Braun, 1859; Friedmann, 1975 Friedmann, 1975 Catarino, 1965 Friedmann, 1975 » » » » >> » » »
57
Продолжение таблицы 1.1
Crassulaceae Kalanchoe K. rotundifolia Вегетативная Удалова, 1994
24 Cucurbitaceae Sempervivum Benincasa K. thyrsiflora K. topmensona soboliferum B. cerifera фолиарная » » Генеративная Горницкая, 1995 » Ильинский, 1945 Balasubramaniam,
25 Cymodoceaceae Cucurbita Luffa Amphibolis C. melopepo L. cylindrica sp. факультативная криптовивипария Генеративная криптовивипария Генеративная факультативная криптовивипария Генеративная Sundararaj, 1957 Braun, 1859 Balasubramaniam, Sundararaj, 1957 Juncosa, 1982
26 Cyperaceae Carex C. aquatilis фанеровивипария Генеративная Sernarder, 1927
27 Dioscoreaceae Eleocharis Scirpus Dioscorea E. prolifera E. vivipara S. atrovirens D. batatas факультативная криптовивипария Вегетативная инфлоральная » Вегетативная Braun, 1859 » »
28 Dipterocarpaceae Dryobalanops D. bulbifera D. triphylla D. camphora инфлоральная, каулигенная » » Генеративная » » Balasubramaniam,
29 Dracenaceae Dracaena sp. факультативная криптовивипария » Sundararaj, 1957 Balasubramaniam,
30 Droseraceae Drosera D. intermedia Вегетативная Sundararaj, 1957 Braun,1859
31 Epilobiaceae Epilobium D. rotundifolia sp. факультативная фолиарная » Генеративная » Balasubramaniam,
32 Euphorbiaceae Croton sp. факультативная криптовивипария Генеративная Sundararaj, 1957 »
33 Fabaceae Cassia C. occidentalis факультативная криптовивипария » »
34 Hyacinthaceae Medicago Trigonella Hyacinthus M. falcata M. sativa T. coerulea H. pouzolsii » » Вегетативная Braun,1859 » » >>
35 Juncaceae Juncus sp. факультативная фолиарная Генеративная Braun, 1859;
К ! J. subnodulosus J. triglumis J. uliginosus var. viviparus факультативная фанеровивипария Генеративная факультативная криптовивипария » Вегетативная инфлоральная Balasubramaniam, Sundararaj, 1957 Van Zinderen Bakker, 1937 Sernarder, 1927 Braun, 1859
58
Продолжение таблицы 1.1
36 Liliaceae Gagea G. arvensis Вегетативная Braun, 1859
Lilium G. bulbifera G. liotardi L. bulbifera L. bulbiferum L. lancifolium L. tigrinum инфлоральная >> » Вегетативная инфлоральная, каулигенная » » » Nygren, 1954 Braun, 1859 ъ
37 Lysimachiaceae Lisimachia L. stricta Вегетативная инфлоральная
38 Meliaceae Xylocarpus X. granatum Генеративная криптовивипария Генкель, 1962
39 Moraceae Artocarpus A. integrifolia Генеративная факультативная криптовивипария Balasubramaniam, Sundararaj, 1957
40 Myrsinaceae Aegiceras A. corniculatum A. majus Генеративная криптовивипария » Farnsworth, Farrant, 1998 Joshi et al., 1972
41 Nymphaeaceae Nymphaea N. alba N. guineensis N. lotus N. micrantha Вегетативная инфлоральная Вегетативная фолиарная Вегетативная инфлоральная Вегетативная фолиарная » » » »
42 Onagraceae Epilobium sp. E. palustre Генеративная факультативная фанеровивипария Генеративная факул ьтати вн ая криптовивипария » Sernarder, 1927
43 Orchidaceae Hammarbya (Malaxis) H. paludosa Вегетативная фолиарная Braun, 1859; Taylor, 1967; Batygina, Bragina, 1997
44 Ornithogalaccae Omithogalum 0. scilloides » Braun, 1859
45 Papaveraceae Chelidonium Papaver C. majus laciniatum P. somniferum ъ Генеративная факультативная криптовивипария » Balasubramaniam, Sundararaj, 1957
46 Pelliceraceae Pelliciera sp. Генеративная криптовивипария Juncosa, 1982
47 Perseaceae Persea P. gratissima Генеративная факультативная криптовивипария Braun, 1859
48 Plantaginaceae Plantago P. lanceolata P. major modif. vivipara Вегетативная инфлоральная » » Andrei, 1969
49 Plumbaginaceae Aegialitis A. annulata Генеративная криптовивипария Farnsworth, Farrant, 1998
50 Poaceae Agropyron A. repens Вегетативная факул ьтати в н ая инфлоральная Wycherley, 1954; Harmer, 1984
59
Продолжение таблицы 1.1
Роасеае Agrostis A. stolonifera Вегетативная Gustafsson, 1946;
Alopecurus A. tenuis A. vulgaris A. pratense факультативная инфлоральная » » Nygren, 1954; Harmer, 1984 Шульц, 1939 Wycherley, 1954;
A nthoxanthum A. odoratum » Harmer, 1984 Exo, 1916;
Apluda A. mutica Harmer, 1984; Shanthamma, 1982 Jain, 1968; Jain,
Arrhenantherum A. elatius » Pal, 1969 Wycherley, 1954;
Avena A. sativa Генеративная Harmer, 1984 Balasubramaniam,
Brachypodium B. pinnatum факультативная фанеровивипария Вегетативная Sundararaj, 1957 Exo, 1916;
Bouteloua B. hirsuta факультативная инфлоральная >> Harmer, 1984 Hill, 1982
Bromus B. erectus Exo, 1916;
Cryp sis B. inermis var. inermis B. secalinus C. alopecuroides » Вегетативная Harmer, 1984 Jain, 1968; Jain, Pal, 1969; Harmer, 1984 Exo, 1916; Harmer, 1984 Andrei, 1969
Cymbopogon modif. vivipara C. flexuosus инфлоральная Вегетативная Dutt, Bradu, 1973
Cynosurus C. jwarancusa C. khasianus C. winterianus C. cristatus факультативная инфлоральная » » » >> » Naveenet al., 1977 Wycherley, 1954;
Dactylis D. glomerata » Harmer, 1984 Sernarder, 1927;
Deschampsia D. alpina Вегетативная Wycherley, 1954; Harmer, 1984 Flovik, 1938, 1940;
D. caespitosa D. flexuosa D. rhenana инфлоральная Вегетативная факультативная инфлоральная Вегетативная инфлоральная Hagerup, 1939; Шульц, 1939; Nannfeldt, 1940; Gustafsson, 1946; Nygren, 1954 Gustafsson, 1946; Nannfeldt, 1940; Wycherley, 1954; Bor, 1960; Hedberg, 1986 Шульц, 1939; Harmer, 1984 Nannfeldt, 1940; Gustafsson, 1946; Nygren, 1954
60
Продолжение таблицы 1.1
Роасеае Eletrigia Eleusine Euchlaene Festuca Holcus Glycerin Koeleria Leymus Lolium Oryza Panicum Pennisetum Phleum Poa E. repens subsp. repens E. coracana E. indica E. mexicana гибриды c Zea mays F. heterophylla F. ovina F. rubra F. vivipara H. lanatus H. mollis G. fluitans G. maxima G. plicata K. cristata L. racemosus subsp. racemosus L. perenne 0. sativa (мутанты) P. auritum P. typhoides P. pratense P. alpigena Вегетативная факультативная инфлоральная Вегетативная инфлоральная Вегетативная факультативная инфлоральная Вегетативная инфлоральная Вегетативная факультативная инфлоральная >> » » » » Генеративная фанеровивипария Вегетативная факультативная инфлоральная Генеративная факультативная криптовивипария Вегетативная факультативная инфлоральная Вегетативная инфлоральная Николаенко, 1983 Nygren, 1954 Glifford, 1959 Bhadur Sing, Ripusudan L. Paliwal, 1960 Turesson, 1926, 1930, 1931; Flovik, 1938; Love, Love, 1942; Gustafsson, 1946; Salvesen, 1986 Nannfeldt, 1940; Love, Love, 1942; Gustafsson, 1946; Wycherley, 1954; Harmer, 1984 Salvesen, 1986 Exo, 1916; Harmer, 1984 » » Harmer, 1984 Exo, 1916; Harmer, 1984 » Николаенко, 1983 Wycherley, 1954; Harmer, 1984 Miyoshi et al., 2000 Jain, 1968; Jain, Pal, 1969 Balasubramaniam, Sundararaj, 1957 Wycherley, 1954; Harmer, 1984 Сарапульцев, 1998
61
Продолжение таблицы 1.1
51 Роасеае Polygonaceae Роа Setaria Trisetum Triticum Zea Polygonum P. alpina P. annua P. arachnifera P. arctica subsp. stricta subsp. vivipara P. bulbosa P. chaixii P. chaixii X P. longifolia P. herjedalica (alpina X pratensis) P. jemtlandica (flexuosa x alpina) P. longifolia X P. pratensis P. pratensis subsp. alpigena var. vivipara P. sublanata P. triviales S. viridis T. spicatum sp. Z. mays (мутанты) P. bulbiferum Вегетативная инфлоральная Вегетативная факультативная инфлоральная Вегетативная инфлоральная » Вегетативная факультативная инфлоральная Вегетативная инфлоральная » Вегетативная факультативная инфлоральная Вегетативная инфлоральная Вегетативная факультативная инфлоральная >> Генеративная фанеровивипария Вегетативная инфлоральная Braun, 1859; Miintzing, 1933, 1940; Akerberg, 1941; Love, Love, 1942; Hakansson, 1943, Gustafsson, 1946; Bor, 1960; Harmer, 1984 Exo, 1916; Harmer, 1984 Brown, 1939; Hartung, 1946; Clausen et al., 1952 Flovik, 1938, 1940; Nannfeldt, 1940; Engelbert, 1940, 1941; Gustafsson, 1946 Braun, 1859; Akerberg, 1941; Harturg, 1946; Gustafsson, 1946; Bor, 1960 Harmer, 1984 Nygren, Almagarci, 1962 Gustafsson, 1946 Nygren, Almagard, 1962 Miintzing, 1933, 1940; Flovik, 1938; Brown 1939; Engelbert, 1940; Akerberg, 1941; Gustafsson, 1946; Wycherley, 1954; Bor, 1960; Harmer, 1984 Сарапульцев, 1998 Wycherley, 1954; Harmer, 1984 Exo, 1916; Harmer, 1984 Latting, 1972 Заблуда, 1948 Гандилян, 1961 Robertson, 1955; Neill et al., 1987 Braun, 1859
62
Продолжение таблицы 1.1
52 53 Polygonaceae Ranunculaceae Rhizophoraceae Polygonum Rumex Aconitum Ficaria Bruguiera Ceriops Kandelia Rhizophora P. vivparum R. domesticus A. excelsum F. ranunculoides sp. B. caryophylloides B. conjugata B. eriopetala B. exaristata B. gymnorrhiza B. parviflora B. sexangula sp. C. candolleana C. decandra C. roxburghiana C. tagal sp. K. candel K. rheedii sp. R. apiculata R. conjugata R. mangle R. mucronata Вегетативная инфлоральная Генеративная факультативная криптовивипария Вегетативная факультативная каулигенная Вегетативная каулигенная Генеративная фанеровивипария » » ?> » » » » » » » » >> » » » » » >> » » Linne, 1737; Braun, 1859; Love, Love, 1942; Gustafsson, 1946; Nygren, 1954; Engell, 1973 Sernarder, 1927 Бабро (БИН) Braun, 1859 Braun, 1859; Генкель, 1962 Плиско, 1996 Генекель, Фан И-сунь, 1958; Плиско, 1996 Farnsworth, Farrant, 1998 Kipp-Goller, 1940; Плиско, 1996 Schimper, 1898; Sernarder, 1927; Генкель, 1962; Плиско, 1996 Плиско, 1996 Braun, 1859; Генкель, 1962 Carey, 1934; Kipp-Goller, 1940; Плиско, 1996 Farnsworth, Farrant, 1998 Плиско, 1996 Генкель, 1979; Плиско, 1996 Braun, 1859; Генкель, 1962 Schimper, 1898; Генекель, Фан И-сунь, 1958 Schimper, 1898; Sernarder, 1927; Плиско, 1996 Braun, 1859 Генекель, Фан И-сунь, 1958 Кернер, 1901; Плиско, 1996 Генкель, 1979; Juncosa, 1982; Плиско, 1996 Carey, 1934; Kipp-Goller, 1940; Генекель, Фан И-сунь, 1958
63
Окончание таблицы 1.1
Rhizophoraceae Rhizophora R. stylosa Генеративная фанеровивипария Farnsworth, Farrant, 1998
54 Saxifragaceae Saxifraga S. bulbifera Вегетативная инфлоральная Braun, 1859
S. cernua » Braun, 1859; Love, Love, 1942; Harmsen, 1939; Flovik, 1940; Gustafsson, 1946
S. foliolosa » Love, Love, 1942;
Harmsen, 1939; Flovik, 1940; Gustafsson, 1946
55 Tephrosiaceae Tephrosia T. purpurea Генеративная Balasubramaniam,
факультативная криптовивипария Sundararaj, 1957
Таблица 1.2. Распространение типов вивипарии у цветковых растений
Тип вивипарии Число видов с формой вивипарии
облигатной факультативной
Генеративная: криптовивипария 14 25
фанеровивипария 28 5
Общее число видов 42 30
Вегетативная: инфлоральная 114 52
фолиарная 33 3
каулигенная 6 1
Общее число видов 153 56
В разных группах растений живорождение возникало независимо и многократ-
но (рис. 1.19-1.21). У некоторых рассмотренных нами растений живорождение стало
единственным способом размножения. В процессе эволюции происходили значитель-
ные морфогенетические и физиологические перестройки материнского и дочернего
организмов. Трансформации в морфогенезе являются таксоноспецифическими. Так,
Рис. 1.19. Корреляция возникновения вивипарии и произрастания в манграх
(по: Farnsworth, Farrant, 1998)
64
53%
ВйЯ- генеративная
облигатная
R^a- генеративная
факультативная
ES- вегетативная
облигатная..
вегетативная
факультативная
Рис. 1.20. Распределение облигатной и факультативной форм вивипарии у
исследованных видов (100%) цветковых растений
1- генеративная облигатная криптовивипария
I I- генеративная факультативная криптовивипария
генеративная облигатная фанеровивипария
Г/J- генеративная факультативная фанеровивипария
1ЯЯЭД-вегетативная облигатная инфлоральная вивипария
IM- вегетативная факультативная инфлоральная вивипария
ЕЛЕН- вегетативная облигатная фолиарная вивипария
ИМ- вегетативная факультативная фолиарная вивипария
RvtSI- вегетативная облигатная каулигенная вивипария
вегетативная факультативная каулигенная вивипария
Рис. 1.21. Распределение типов вивипарии у исследованных видов (100%) цветковых растений
для ряда видов мангровых (Rhizophoraceae), обладающих генеративной вивипарией,
характерен комплекс таких эмбриологических признаков, как апоптоз семязачатков,
развитие только одного из четырех семязачатков, конгенитальное срастание семя-
долей у зародыша, позднее формирование отделительного слоя в плодоножке. У
некоторых видов, способных к вегетативной вивипарии, формирование нового орга-
низма происходит в выемках листа (виды р. Bryophyllum) или в его пазухах (Lilium
bulbiferum), что защищает «живородок» от неблагоприятных внешних условий. Сле-
дует отметить, что при живорождении в материнских и дочерних тканях существует
определенный гормональный баланс. Например, у видов рода Rhizophora выявлен
низкий уровень АБК в эмбриональных тканях и ее повышенное содержание в ма-
теринских. Способность растений к живорождению — адаптация, обусловливающая
пластичность и толерантность систем репродукции — гарантирует надежность су-
ществования вида в фитоценозе.
65
РЕКОМЕНДУЕМАЯ ЛИТЕРАТУРА
Батыгина Т. Б. Эмбриологические основы пластичности и адаптивные возможности систем
репродукции цветковых растений // Биологическое разнообразие: подходы к изучению и сохране-
нию / Под ред. Б. А. Юрцева. СПб.: Изд-во Зоол. ин-та РАН, 1992. С. 201-212.
Батыгина Т Б. Эмбриоидогения — новая категория способов размножения цветковых расте-
ний / Под ред. Э. С. Терехина// Проблемы репродуктивной биологии семенных растений / Тр,
Ботан. ин-та РАН. СПб., 1993. Вып. 8. С. 15-25.
Батыгина Т. Б. Апомиксис, агамоспермия и вивипария и их роль в системе репродукции цвет-
ковых растений // Тр. Межд. симп. «Апомиксис у растений: состояние проблемы и перспективы
исследований». Саратов: Изд-во Сарат. гос. ун-та, 1994. С. 16-18.
Батыгина Т. Б. Эмбриоидогения // Эмбриология цветковых растений. Терминология и кон-
цепции / Под ред. Т. Б. Батыгиной. СПб.: Мир и семья-95, 1997. В 3 т. Т. 2. С. 628—634.
Батыгина Т. Б. Генетическая гетерогенность семян: эмбриологические аспекты // Физиол.
раст. 1999. Т. 46, №3. С. 438-454.
Батыгина Т. Б., Брагина Е. А. Вивипария // Эмбриология цветковых растений. Терминология
и концепции. Т. 3. Системы репродукции / Под ред. Т. Б. Батыгиной. СПб.: Мир и семья, 2000а. В
3 т. Т.З. С. 39-62.
Батыгина Т. Б., Брагина Е. А. Выводковая почка // Там же. 20006. С. 315-321.
Батыгина Т. Б., Брагина Е. А. Репродуктивная стратегия живородящих растений // Там же.
2000в. С. 507-510.
Батыгина Т.Б., Васильева В. Е. Размножение растений. СПб.: Изд-во С.-Петерб. ун-та, 2002.
232 с.
Брагина Е. А., Батыгина Т. Б. Диаспора // Эмбриология цветковых растений. Терминология
и концепции / Под ред. Т. Б. Батыгиной. СПб.: Мир и семья, 2000. В 3 т. Т.З. С. 420-428.
Васильева В. Е., Батыгина Т Б. Автономность зародыша/ Под ред. Т. Б. Батыгиной. СПб.:
Мир и семья-95, 1997. В 3 т. Т. 2. С. 579-588.
Васильев А. Е., Воронин Н. С., Еленевский А. Г., Серебрякова Т И. Ботаника. Анатомия и
морфология растений. М.: Просвещение, 1978. 478 с.
Генкель П. А. К познанию вивипарии в растительном мире // Журн. общ. биол. 1979. Т. 40,
№ 1. С. 60-66.
Денисова Е. В. Морфология и морфогенез вегетативных диаспор (выводковых почек) двух
видов Asplenium L. в связи с проблемой эмбриоидогении: Автореф. дис. ... канд. биол. наук. М.,
2002. 16 с.
Каплин П.А., Леонтьев О. К., Лукьянова С. А., Никифоров Л. Г. Берега. М.: Мысль, 1991.
479 с.
Кернер А. фон Марилаун. Жизнь растений / Под ред. И. П. Бородина. В 2 т. Т. 2. СПб.: Про-
свещение, 1902. 841 с.
Куприянов П. Г. Диагностика систем семенного размножения в популяциях цветковых расте-
ний / Под ред. Н. А. Шишкинской. Саратов: Изд-во Сарат. гос. ун-та, 1989. 160 с.
Левина Р. Е. Репродуктивная биология семенных растений (обзор проблем). М.: Наука, 1981.
96 с.
Плиско М. А. Семейство Rhizophoraceae // Сравнительная анатомия семян. Двудольные.
Rosidae I / Под ред. А. Л. Тахтаджяна. СПб.: Мир и семья, 1996. Т. 5. С. 134-150.
Пополина Т Г. Морфологические особенности формирования органов плодоношения у Роа
bulbosa L. // Ботан. журн. 1960. Т. 45, №7. С. 1032-1039.
Пополина Т. Г. Анатомо-морфологические особенности мятлика луковичного (Роа bulbosa L.)
семенной и живородящей форм // Тр. Ботан. ин-та АН ССР. Сер. VII. 1962. Т. 45, вып. 5. С. 166-
175.
Терехин Э. С. Семя и семенное размножение. СПб.: Мир и семья-95, 1996. 377 с.
Устинова Е. И. Сравнительно-эмбриологическое исследование нормальных и вивипарных ви-
дов лука (Allium) // Ботан. журн. 1944. Т. 29, №5. С. 232-239.
Чайлахян М.Х. Регуляция цветения высших растений. М.: Наука, 1988. 558 с.
Batygina Т. В., Bragina Е.А. Embryology and reproductive biology of Hammarbya paludosa (L.)
Kunze (Orchidaceae) / / Bull. Acad. Sci. Polon. 1997. Vol. 45, N 2—4. P. 107-118.
Batygina T.B., Bragina E.A., Titova G.E. Morphogenesis of propagules in viviparous species
Bryophyllum daigremaontianum and B. calycinum // Acta Soc. Bot. Polon. 1996. Vol. 65, N 1—2. P. 127-
133.
Braun A. Uber Polyembryonie und Keimung von Caelebogygne. Berlin: Abhandl., 1859. S. 109-263.
66
Carey G. Further investigations on the embryology of viviparous seeds // Proc. Linn. Soc. New
South Wales. 1934. Vol. 59, №5/6. P. .392-410.
Catarino F. M. Some effects of kinetin on growth, breaking of dormancy and senescence in
Bryophyllum // Portugaliae Acta. Biol., Ser. A. 1965. Vol. 9, N 1-2. P. 211-248.
Dooner H. K. Viviparous-1 mutation in maize conditions pleiotropic enzyme deficiencies in the
aleurone // Pl. Physiol. 1985. Vol. 77, N 2. P. 486-488.
Embryology of flowering plants. Terminology and concepts / Ed. T. B. Batygina. Enfield (MH), USA;
Plumouth, UK: Science Publishers Inc. Vol. 1. Generative organs of flower. 2002. 421 p.; Vol. 2. Seed. 2006.
786 p.
Engell K. A preliminary morphological, cytological, and embryologycal investigation in Polygonum
viviparum // Bot. Tidsskr. 1973. Bd67, H.4. P. 305-316.
Farnsworth E. J., Farrat J. M. Reductions in absisic acid are linked with viviparous reproduction in
mangroves // Amer. J. Bot. 1998. Vol. 85, N 6. P. 760-769.
Juncosa A. M. Developmental morphology of the embryo and seedling of Rhizophora mangle L.
(Rhizophoraceae) // Amer. J. Bot. 1982. Vol. 69, N 10. P. 1599-1611.
Gibbs L.S. Notes on the development and structure of the seed in the Alsinoideae // Ann. Bot.
1907. Vol. 21, N31. P. 25-55.
Giraudat J)., Hauge В. M., Valon C., Smalle J., Parcy F., Goodman H. M. Isolation of the
Arabidopsis ABI3 gene by positional cloning // Plant Cell. 1992. Vol. 4, N 10. P. 1251-1261.
Kamenetsky R., Rabinowitch H. D. Floral development in bolting garlic // Sex Plant Reprod., 2001.
Vol. 13. P. 235-241.
Kipp-Goller A. Uber Bau und Entwicklung der viviparen Mangrovenkeimlingen // Z. Bot. 1940.
Bd35, H. 1. S. 1-40.
McCarty D. R. Genetic control and integration of maturation and germination pathways in seed
development // Annual Rev. Pl. Physiol. Pl. Mol. Biol. 1995. Vol. 46. P. 71-93.
Padmanabhan D. The embryology of Avicennia officinalis — ll. Endosperm // Phytomorphology.
1964. Vol. 14, N 3. P. 442-451.
Robertson D. S. The genetics of vivipary in maize // Genetics. 1955. Vol. 44. P. 745-760.
Semarder R. Zur Morphologie und Biologie der Diasporen // Nova Acta Reg. Soc. Ups. Vol. extra
ordinem editum. Uppsala: Almqvist &z Wiksells Boktryckeri A.-B., 1927. S. 1-104.
2. ЖИВОРОЖДЕНИЕ У БЕСПОЗВОНОЧНЫХ
И НИЗШИХ ХОРДОВЫХ животных
2.1. ОСНОВНЫЕ ПОНЯТИЯ И КЛАССИФИКАЦИЯ
Из анализа литературы следует, что проблематика, связанная с феноменом жи-
ворождения у беспозвоночных животных, — одна из самых слабо разработанных в
биологии. Обычно данное явление рассматривается в пределах той или иной таксо-
номической группы рангом не выше отряда или класса, вследствие этого нет унифи-
цированной терминологии и понятий, применимых для всех животных. Этому спо-
собствует также и незначительное количество специальных морфологических, осо-
бенно ультраструктурных, и физиологических исследований по особенностям раз-
вития зародыша внутри материнского организма, взаимоотношениям матери и за-
родыша, природе поступающих к зародышу дополнительных питательных веществ
и способам их передачи. Наиболее частым заблуждением, встречающимся в литера-
туре, является отнесение любой формы нахождения или развития зародыша внутри
материнского организма к живорождению.
В репродуктивной биологии выделяют три основных типа воспроизведения
потомства у животных при половом размножении: яйцерождение, яйцеживорож-
дение и живорождение. Яйцерождение характеризуется тем, что развитие зароды-
ша происходит вне тела самки, во внешней среде под защитой яйцевых оболочек.
Яйцерождение может быть прямым и личиночным. Оно характерно для большин-
ства представителей беспозвоночных, круглоротых, рыб, земноводных, пресмыкаю-
щихся, птиц, а также однопроходных млекопитающих. В зоологической литературе
животных с яйцерождением часто называют яйцекладущими.
При яйцеживорождении зародыш, окруженный яйцевыми оболочками, нахо-
дится внутри материнского организма в течение всего или большей части периода
развития. В некоторых случаях зародыш может освобождаться от яйцевых оболо-
чек до откладки яйца. Никаких временных специализированных органов питания
между зародышем и материнским организмом не обнаружено. Яйцеживорождение
может быть прямым и личиночным. Оно встречается.у многих беспозвоночных, а
среди позвоночных описано у рыб и пресмыкающихся.
Живорождение (истинное живорождение, или вивипария) характеризуется
тем, что зародыш, лишенный яйцевых оболочек, развивается в материнском ор-
ганизме, при этом между развивающимся зародышем и материнским организ-
мом формируются временные специализированные органы, обеспечивающие пи-
тание, дыхание и удаление продуктов обмена зародыша. Живорождение мо-
жет быть прямым и личиночным. Живорождение менее широко распростране-
но среди беспозвоночных, чем яйцерождение и яйцеживорождение. Оно встре-
чается как у водных, так и наземных беспозвоночных (табл. 2.1): у представи-
телей типов Porifera (класс Calcispongiae, подкласс Calcaronea), Bryozoa (класс
Stenolaemata, класс Gymnolaemata), некоторых Kamptozoa, Mollusca (некоторые
68
Gastropoda), Chelicerata (отряды Scorpiones, Pseudoscorpiones, Acari), Uniramia
(некоторые Insecta), Onychophora, некоторых Echinodermata, Chordata — подтип
Urochordata (класс Salpae, некоторые Ascidiacea). Среди позвоночных живорожде-
ние характерно для некоторых акул и скатов и большинства млекопитающих.
Таблица 2.1. Распространение различных форм яйцеживорождения и живорождения
у беспозвоночных и низших хордовых животных
Группа Яйцеживо- рождение Живорождение
личи- ночное прямое лецито- трофное цито- трофное аденотрофное плацентарное
абсорбо- трофное деглюто- трофное
Кл. Calcispongiae П/кл. Calcaronea Кл. Demospongiae Кл. Hexactinellida Homoscleromorpha + + + + Тип Pori + fera
Тип Cnidaria
Кл. Hydrozoa +
Кл. Scyphozoa +
Chrysaora hysoscella Кл. Cubozoa + +
Кл. Anthozoa +
Тип Ctenophora
О. Platyctenida | l + l I
Тип Plathelminthes
Кл. Turbellaria
О. Acoela
Diopistoporus +
O. Prolecithophora +
O. Neorhabdocoela +
Тип Nemertini
O. Heteronemertini Lineus viviparus 0. Hoplonemertini Prosorochmus +
viviparus Geonemertes +
agricola Тип Acanthocephala + +? +?
Тип Annelida
Кл. Polychaeta Exogone hebes + +
Raphidrillus branchiatus +
Тип Mollusca
Кл. Bivalvia Кл. Gastropoda Littorina saxatilis + +
69
Продолжение табл. 2.1
Janthina janthina Veloplacenta maculata Кл. Solenogastres Halomenia Тип Pentastomida + + + +
Тип Chelicerata
Кл. Arachnida
0. Scorpiones
Сем. Vejovidae + +
Сем. Buthidae
Lychas tricarinatus +
Сем. Scorpionidae +
0. Pseudoscorpiones + +
0. Acari
Pediculopsis +? +?
Knemidocoptes +? +?
Тип Onychophora
Сем. Peripatopsidae + +
Сем. Peripatidae +
Тип Uniramia
Кл. Insecta +
O. Diptera
Сем. Ctenostilidae +
Сем. Lucilinae +
Сем. Chloropidae +
Сем. Anthomyidae +
Сем. Helicoboscinae +
Сем. Muscidae +
Сем. Cecidomydae +
O. Strepsiptera +
O. Blattoidea +
O. Psocoptera +
O. Homoptera +
O. Heteroptera +
Тип Echinodermata
Кл. Asteroidea + +
Кл. Ophiuroidea +
Amphipholis
japonica +
A. squamata +
Кл. Holothuroidea + +
Oneirophanta
mutabilis +
Тип Bryozoa
Кл. Stenolaemata
o. Cyclostomata +
Кл. Gymnolaemata + +
o. Ctenostomata + +
Valkeria uva +
Nolella dilatata +
70
Окончание табл. 2.1
N. papuensis +
Mimosella cookae +
Sundanella sibogae О. Cheilostomata + +
Gregarinidra +
serrata Isosecuriflustra angusta +
Bugula +
Bicellariella ciliata +
Beania bilaminata +
Scrupocellaria ferox +
S. scruposa +
Cellaria +
Figularia figularis +
Costaticella +
Pterocella scutella +
Paracribricellina cribraria +
Celleporella hyalina Myriapora truncata + +
Calyptotheca variolosa +
Urceolipora папа +
Reciprocus regalis +
Epistomia bursaria +
Synnotum aegyptiacum +
Кл, Phylactolaemata +
Plumatelia +
Fredericella +
Тип Kamptozoa
Сем. Loxosomatidae
Loxosomella
leptoclini
Loxosomella
vivipara
Тип Chordata
П/т. Urochordata
Кл. Ascidiacea
Botrylloides
Hypsistozoa
fasmeriana
Кл. Salpae
Примечание. Для всех включенных в таблицу мшанок отряда Gymnolaemata, за исключе-
нием родов Celleporella и Bugula, тип живорождения указан предварительно; в настоящий момент
у большинства из них обнаружен гипертрофированный эпителий выводковой камеры, личинки
же исследованы не были. О строении плаценты у ктеностомных мшанок родов Valkeria и Nolella
данных нет.
71
Основное биологическое значение живорождения заключается в защите разви-
вающихся зародышей материнским организмом от внешних неблагоприятных усло-
вий.
Приведем следующие общие характеристики живорождения:
1) малые размеры алециталъного или олиголециталъного яйца;
2) малые первоначальные размеры зародыша;
3) увеличение размеров зародыша в ходе его развития;
4) развитие зародыша в яичнике, половых путях, полости тела или специализи-
рованных выводковых образованиях самки;
5) возникновение особых приспособлений {провизорных органов) как у зароды-
ша, так и у матери, для осуществления необходимых физиологических функций
зародыша: питания, дыхания, удаления продуктов обмена;
6) развитие ювенильной особи или личинки в материнском организме;
7) основным источником пищи развивающегося зародыша служит не желток
яйца, а вещества, получаемые от материнского организма.
При живорождении зародыш может развиваться:
1) в яичнике;
2) в половых путях (яйцеводы, матка);
3) в целомических полостях;
4) в гемоцеле;
5) в специальных временных и постоянных образованиях (в бурсе, овицелле,
выводковой камере и др.).
Единой классификации различных форм живорождения у беспозвоночных жи-
вотных до настоящего времени не было. В то же время делались попытки клас-
сифицировать живорождение в пределах отдельных групп беспозвоночных: класса
Insecta и типа Onychophora, однако представленные схемы не являются универсаль-
ными для других групп беспозвоночных.
При рассмотрении различных случаев живорождения, по нашему мнению, сле-
дует исходить прежде всего из характера взаимоотношений между матерью и раз-
вивающимся внутри нее зародышем, а также из способа поступления питательных
веществ от матери к зародышу. На основании такого подхода мы выделяем четыре
типа живорождения (рис. 2.1). Предлагаемую классификацию не следует рассмат-
ривать с эволюционных позиций.
Лецитотрофное живорождение (греч. lekithos — желток, trophe — питать). В
качестве питательного материала зародыш использует исключительно желточные
включения яйца. От яйцеживорождения отличается тем, что в ходе эмбриогенеза
зародыш освобождается от яйцевых оболочек, но дальнейшее развитие проходит
в теле самки. Возможно прикрепление зародыша к стенке половых путей матери.
Живорождение
Лецитотрофное | | Цитотрофное | |Аденотрофное| | Плацентарное |
|Абсорботрофное | | Деглютотрофное|
Рис. 2.1. Классификация живорождения у беспозвоночных и низших
хордовых животных
72
Данный термин был предложен для отряда Diptera (класс Insecta) Р. Мейером с
соавторами (1999).
Цитотрофное живорождение (греч. kytos — клетка, trophe — питать). Мы
предлагаем обозначить этим термином такую форму взаимоотношения материн-
ского организма и эмбриона, при которой последний получает дополнительные пи-
тательные вещества путем их передачи от отдельных специализированных клеток
матери определенным специализированным клеткам зародыша. При этом ткани или
органы, подобные плаценте, не образуются.
Аденотрофное живорождение (лат. ad — дополнительный, греч. trophe — пи-
тать). Источником питания зародышей на ранних этапах развития служит желток
яйца, а на более поздних стадиях они активно питаются выделениями половых пу-
тей матери или специальных временных и постоянных образований. В случае адено-
трофного живорождения зародыш может прикрепляться к стенке выводковой по-
лости либо находиться во взвешенном состоянии. Термин был введен в научный
оборот Х.Р. Хаганом (1951) для насекомых. Мы предлагаем выделить в пределах
аденотрофного живорождения два варианта:
1) абсорботрофное живорождение (лат. ab-sorbeo — всасывать, впитывать, греч.
trophe — питать), когда растворенные питательные вещества зародыш поглощает по-
кровными клетками всей поверхности тела либо определенными, специализирован-
ными участками путем пиноцитоза или фагоцитоза;
2) деглютотрофное живорождение (лат. deglutio — проглатывать, греч. trophe —
питать), когда питательные вещества проникают в зародыш в результате активного
их заглатывания либо поступления в кишечник по специализированным провизор-
ным органам зародыша.
Плацентарное живорождение. Формируется специальный орган—плацента
(греч. placus — лепешка), осуществляющий питание зародыша. В образовании пла-
центы участвуют как ткани матери, так и ткани зародыша. В некоторых случаях
на ранних этапах развитие эмбриона происходит за счет плаценты, тогда как затем
он переходит к активному заглатыванию выделений половых путей самки.
2.2. ХАРАКТЕРИСТИКА ЖИВОРОЖДЕНИЯ У КОНКРЕТНЫХ
ГРУПП ЖИВОТНЫХ
Тип Porifera
Практически все губки, за исключением представителей нескольких отрядов
класса Demospongiae, являются яйцеживородящими (Ересковский, 2005). В наибо-
лее примитивной форме живорождение встречается у известковых губок подклас-
са Calcaronea (класс Calcispongiae), которое мы предлагаем назвать цитотрофным
живорождением (см. выше).
Класс Calcispongiae
Известковые губки характеризуются тем, что их минеральный скелет образо-
ван исключительно карбонатом кальция. Скелет губок подкласса Calcaronea состо-
ит из свободных спикул — диактин (двулучевых игл) и/или сагитальных триактин
(трехлучевых игл) и тетрактин (четырехлучевых). Представители подкласса имеют
чрезвычайно разнообразные размеры, форму, организацию скелета (рис. 2.2), Водо-
носная система может быть асконоидной, сиконоидной, силлеибидной или лейконо-
73
идной. Хоаноциты Calcaronea характеризуются апикально расположенным ядром.
Корешок жгутика всегда контактирует с апикальной частью ядра хоаноцита. Как
и у всех губок, у Calcaronea отсутствуют пищеварительная, мышечная и нервная
системы, а также гонады. Осеменение внутреннее. Calcaronea — живородящие губ-
ки, для них характерна личинка амфибластула, на ранней стадии обозначаемая как
стомобластула. Все Calcaronea обитают в морях.
Рис. 2.2. Внешний вид известковой губки Sycon sp.:
а — атриум; с —спикулы; х.к — хоаноцитные камеры
Яйцо Calcaronea изолециталъное, олиголецитальное. Дробление полное, асин-
хронное, неравномерное, инкурвационное по типу табличной палинтомии. В те-
чение всего развития зародыш сохраняет бластульную организацию, однако бла-
стула инвертированная — стомобластула. Формирование амфибластульной личинки
сопровождается выворачиванием {экскурвацией') стомобластулы.
Во время формирования зародышей Calcaronea формируются специальные при-
способления, обеспечивающие их питание. Впервые эмбриональная капсула, состо-
ящая из уплощенных клеток, была описана Ф. Шульце (1875) у Scypha cf. ciliatum.
Согласно О. Дюбоску и О. Тюзэ (1937), эмбриональная капсула состоит из двух каче-
ственно разнородных частей: защитной мембраны, формирующейся из амебоцитов,
и плацентарной мембраны, образующейся позже из хоаноцитов материнской губки.
Защитная мембрана покрывает жгутиковую полусферу стомоб л астулы, а клетки
плацентарной мембраны контактируют с зернистыми клетками зародыша. Плацен-
тарная мембрана обеспечивает питание зародыша и принимает участие в процессе
экскурвации.
74
Впоследствии Р. Люфти (1957), а затем и М. Галлиссиан (1983) после электронно-
микроскопических исследований подтвердили данные Дюбоска и Тюзэ о происхож-
дении плацентарной мембраны из трансформированных материнских хоаноцитов,
которые постепенно распространяясь вокруг зародыша, окружают его у Grantia
compressa (рис. 2.3, а, б). В то же время ни эмбриональной капсулы, ни плацен-
тарной мембраны не было описано на электронно-микроскопическом уровне у Sycon
ciliata {—Sycon ciliatum) и у 5. calcaravis.
Поступление питательных веществ в зародыш обеспечивается взаимодействием
его макромеров с клетками плацентарной мембраны, которые в течение всего разви-
тия тесно связаны с зародышем. В клетках плацентарной мембраны имеются много-
численные пищеварительные вакуоли гетерогенной природы. У G. compressa часть
этих клеток фагоцитируется зернистыми бластомерами, часть проникает в полость
личинки. Желточные включения ооцита у G. compressa и S. ciliatum обеспечива-
ют развитие зародыша только до стадии стомобластулы. С началом экскурвации в
зернистых бластомерах появляются включения экзогенной природы, которые фор-
мируются за счет фагоцитоза макромерами клеток плацентарной мембраны. Пред-
полагается, что из-за недостатка запасных питательных веществ зародыш задолго
до окончания дробления вынужден начинать самостоятельное питание. Именно это
и является причиной столь ранней трофической специализациии макромеров стомо-
бластулы. Плацентарная мембрана обособляется от хоаноцитов жгутиковой камеры
лишь после формирования амфибластулы (рис. 2.3, г).
Рис. 2.3. Экскурвации стомобластулы Sycon (по: Franzen, 1988):
а — стомобластула, начало формирования плацентарной мембраны за счет выростов
вспомогательных клеток (стрелки); б — начальная и в — средняя стадии экскурвации,
сопровождаемые ростом плацентарной мембраны (стрелки); г — финальная стадия экс-
курвации: вс — вспомогательные клетки; мс.к — жгутиковые клетки; к.к — клетка креста;
ма — макромеры; м.к — материнские клетки; пл.м — плацентарная мембрана; х — хоано-
циты; эп — эндопинакоцит
Необычны трофические взаимоотношения между развивающимся зародышем и
материнским организмом у реликтовых «фаретронных» губок с лейконоидной орга-
75
Рис. 2-4- Экскурвация стомобластулы Petrobiona (по: Короткова, 1981):
а — сформированная стомобластула, объединенная с хоаноцитной камерой; б — за-
ключительный этап экскурвации; в—амфибластула в полости хоаноцитной камеры;
амф — амфибластула; з.к — зернистые клетки; м.к— материнские клетки; п.к — питаю-
щие клетки; ст — стомобластула; х — хоаноциты; х.к — хоаноцитная камера
низацией Petrobiona massiliana (рис. 2.4). После образования ранней стомобластулы
хоаноциты соседней с зародышем хоаноцитной камеры трансформируются в пи-
тающие клетки, накапливающие липиды. Часть этих клеток проникает в полость
стомобластулы через фиалопор. Сформированная стомобластула состоит из много-
численных жгутиковых клеток и четырех зернистых клеток, окружена тонким сло-
ем коллагена и редкими уплощенными клетками материнской губки (рис. 2.4, а). Во
время экскурвации безжгутиковые зернистые клетки становятся амебоидно подвиж-
ными и проникают в соседнюю хоаноцитную камеру, в которой и происходит выво-
рачивание личинки (рис. 2.4, б). В результате амфибластула оказывается лежащей в
эмбриональной капсуле, стенки которой образованы трансформированными хоано-
цитами жгутиковой камеры. Трансформированные хоаноциты, контактирующие с
зернистыми клетками, превращаются в питающие клетки. Часть из них проникает
в полость амфибластулы (рис. 2.4, е).
Тип Cnidaria
Для книдарий живорождение не характерно. В то же время яйцеживорожде-
ние или вынашивание зародышей в теле матери встречается у представителей всех
классов. Так, у Chrysaora hysoscella (класс Scyphozoa) развитие зародышей проис-
ходит в яичнике. Предполагается, что здесь они получают трофический материал
от материнского организма. Свидетельством этому может служить тот факт, что
76
на стадии бластулы объем зародыша увеличивается по отношению к объему яйца в
50-100 раз. Вероятно, данный тип живорождения можно отнести к аденотрофному
абсорботрофному, поскольку при развитии книдарий формируется личинка плану-
ла, не имеющая ротового отверстия, следовательно, питательные вещества могут
поглощаться только через покровные клетки зародыша.
Тип Ctenophora
Настоящее живорождение у гребневиков не описано. Яйцеживорождение встре-
чается исключительно у бентосных представителей' отряда Platyctenida (ро-
ды Coeloplana и Tjalfiella). у которых зародыш может развиваться как в особых
выводковых камерах, формирующихся на аборальной поверхности животного, так и
внутри гастроваскулярной системы.
Тип Nemertini
Практически все исследованные немертины — яйцеродящие (яйцекладущие) жи-
вотные, однако Lineus viviparus (отряд Heteronemertini) и Prosorochmus viviparus
(отряд Hoplonemertini) свойственно яйцеживорождение, а наземной немертине
Geonemertes agricola (отряд Hoplonemertini) — живорождение (Сое, 1904). К сожа-
лению, в последнем случае нет подробного описания взаимоотношений между заро-
дышем и материнским организмом, однако можно предположить, что здесь имеет
место аденотрофное живорождение.
Тип Annelida
Класс Polychaeta
Подавляющее большинство полихет — яйцеродящие (яйцекладущие) животные.
Иногда встречается яйцеживорождение, при котором развитие зародышей проис-
ходит в целоме или расширенных половых протоках матери. Единственный случай
живорождения описан у Raphidrillus nemasoma, когда эмбрионы на стадии бластулы
и гаструлы получают дополнительное питание от материнского организма. В этот
период зародыши контактируют с гонадой, представляющей собой скопление рас-
тущих ооцитов, расположенных вдоль кровеносного сосуда. Поскольку на ранних
стадиях развития пищеварительная система отсутствует, то данный вид, вероятно,
можно отнести к аденотрофному абсорботрофному. Развитие R. nemasoma прямое,
без метаморфоза. К сожалению, более подробных данных о строении и организации
этой связи не имеется. Возможно, что при развитии зародыша в целоме материн-
ского червя солоноватоводной нереиды Nereis limnicola трофические вещества по-
ступают к нему в виде целомоцитов, однако прямых доказательств не представлено.
Тип Mollusca
В пределах типа у представителей почти всех классов помимо обычной откладки
яиц встречается яйцеживорождение. Так, у Halomenia (класс Solenogastres) вына-
шивание зародышей осуществляется в клоакальной полости моллюска. У двуствор-
чатых моллюсков (класс Bivalvia) наиболее часто яйцеживорождение встречается в
семействе Sphaeridae.
77
Для представителей класса Gastropoda яйцеживорождение — явление достаточ-
но редкое. Оно описано, например, у Littorina saxatilis: развитие эмбрионов осу-
ществляется в специальной выводковой камере — расширенном участке дистальной
части женского полового протока. У Viviparus viviparus мелкие яйца (диаметром до
18 мкм) вынашиваются в яйцеводе, выполняющем функции матки. Каждое яйцо
одето толстым слоем питательного белка и тонкой наружной оболочкой. Зароды-
ши Janthina janthina питаются слизистыми выделениями половых путей матери,
что можно рассматривать как абсорботрофный вариант аденотрофного живорож-
дения по нашей классификации. У Veloplacenta maculata предполагается наличие у
зародышей питающего плацентоподобного аппарата в виде паруса (велума), тесн0
контактирующего со стенкой матки, в которой он развивается. Возможно, этот вид
можно отнести к животным с плацентарным живорождением.
Тип Onychophora
Все представители типа Onychophora являются наземными животными, обита-
ющими в тропических и субтропических областях южного полушария. Это билате-
рально-симметричные организмы с удлиненно-цилиндрической, червеобразной фор-
мой тела (рис. 2.5). Голова несет пару мягких антенн с кольчатой наружной сегмен-
тацией, пару челюстей и пару оральных папилл. По всей длине тела насчитывается
14-43 пары коротких нечленистых мясистых ног. Каждая нога представляет со-
бой полое выпячивание стенки тела с терминальной подушечкой, парой коготков
и внутренней мускулатурой. Тело покрыто очень тонкой гибкой хитинизированной
кутикулой. Под эпителием расположены слои кольцевой, косой и продольной глад-
кой мускулатуры. Каждой паре ног соответствует пара остий сердца и пара вы-
делительных органов. В роли гидростатического скелета служит хорошо развитый
гемоцель. Сердце трубчатое, других циркуляторных элементов нет. .Полость тела
смешанная, но часть целома сохраняется в виде концевых пузырьков нефридиев и
Рис. 2.5. Схематический продольный разрез через тело онихофоры (а; по: Барнс
и др., 1993); внешний вид онихофоры Peripatopsis capensis (5; по: Догель,
1981):
ан — анус; ант— антенна; в.о — выделительный орган; ге—гемоцель; гл — глаз; го —
гонада; к — кишка; к.э/с — клейкая железа; р.п — ротовая папилла
78
половых желез. Кишечник сквозной, прямой. Нервная система с головным мозгом
и парой очень широко расставленных вентральных нервных тяжей, соединенных 9~
10 комиссурами в каждом из несущих конечности «сегментов», но без четко выра-
женных ганглиев.
Онихофоры — раздельнополые животные с парными гонадами. Женская поло-
вая система состоит из двух яичников, открывающихся в непарный атриум. Роль
яйцеводов (а у живородящих видов — матки) играют видоизмененные нефридии.
Осеменение у онихофор внутреннее и осуществляется с помощью сперматофоров.
Развитие прямое.
Среди онихофор встречаются яйцекладущие (редко), яйцеживородящие и жи-
вородящие виды. У яйцеживородящих онихофор яйца полилецитальные, олиголе-
циталъные либо алецитальные. Д. Андерсон (1973) выделил в качестве неплацен-
тарного живорождения те случаи, когда зародыши, развивающиеся из олиголеци-
тальных яиц, получают питание за счет выделений половых путей матери, но без
образования плаценты. Этот же термин был использован и О. М. Ивановой-Казас
(1979). По нашей классификации данный тип живорождения должен быть отнесен к
аденотрофному, которое характерно для южноафриканских видов рода Peripatopsis.
Согласно описаниям развития взаимоотношений зародыша и материнского организ-
ма аденотрофное живорождение Peripatopsis можно отнести к абсорботрофному.
Более подробно остановимся на плацентарном живорождении. В максимально
выраженной форме оно представлено у центрально- и южноамериканских родов
Epiperipatus и Macroperipatus. У представителей рода Paraperipatus встречаются пе-
реходные формы от аденотрофного к плацентарному живорождению.
Яйца онихофор с плацентарным живорождением невелики — диаметром 33-
200 мкм, желтка немного или вовсе нет. Необычной особенностью этих яиц является
большое количество гликогена, концентрирующегося в центральной части цитоплаз-
мы. Гликоген представляет собой источник энергии, который быстро утилизируется
на начальных этапах развития. Алецитальные яйца у живородящих онихофор го-
раздо мельче, чем подобные яйца у яйцеживородящих видов. Дробление полное, не
вполне равномерное, приводящее к формированию стерробластулы или полой бла-
стулы. Формирование зачатка энтодермы чаще осуществляется путем выселения
клеток первичной бороздки.
У Paraperipatus amboinensis яйцевая оболочка сбрасывается в ходе дробления, и
зародыш рано начинает всасывать жидкость, превращаясь в бластодермический пу-
зырек. После развития энтодермы стенка трофического пузыря, представляющего
собой внезародышевую бластодерму, становится двухслойной, а зародышевая по-
лоска погружается в него (рис. 2.6). Трофический пузырь образует многочисленные
складки (рис. 2.7). Формируется подобие амниотической полости, но с открытым
амниопором. Стенки трофического пузыря тесно прилегают к стенкам матки. Эк-
тодерма зародыша и эпителий матки в некоторых местах утолщаются и образуют
многочисленные складки (рис. 2.7). Клетки, выстилающие стенку матки, сильно ва-
куолизируются, затем появляются вакуоли и в клетках эктодермы трофического
пузыря, а в энтодерме начинается отложение запасных питательных веществ. До
окончания органогенеза зародыш выходит на поверхность, а трофический пузырь
редуцируется. На более поздних стадиях развития зародыш всасывает питательные
вещества через рот.
У Epiperipatus и Macroperipatus трофические отношения между матерью и за-
родышем осуществляются с помощью плаценты. У Epiperipatus trinidadensis и
79
эк
Рис. 2.6. Формирование плацентарного органа в ходе развития онихофоры
Paraperipatus amboinensis (по: Pflugfelder, 1948):
а — стадия бластулы; б, в — последовательные этапы иммиграции энтодермы; г — им-
миграция мезодермы; з— зародыш; мз— мезодерма; т.п — трофический пузырь; эк — эк-
тодерма; эн — энтодерма; эп — эпителий матки
Macroperipatus (Peripatus) acacioi в каждой матке одновременно содержится шесть-
восемь зародышей. Каждый зародыш занимает постоянное положение в матке до
начала органогенеза.
Рис. 2.7. Продольные срезы через матку онихофоры Paraperipatus
amboinensis (по: Pflugfelder, 1948):
а~в — последовательные стадии развития; амп— амниопор; г.к — го-
ловной конец; з.к — задний конец; з.п — зародышевая полоска; пщ — пи-
щевод; т.п — трофический пузырь
Анатомически стенка матки Macroperipatus имеет довольно сложное строение
(рис. 2.8). Снаружи она покрыта тонким эпителием, который подстилает базаль-
80
ная ламина, затем следуют три слоя мускулатуры: два—кольцевой и один, про-
межуточный— продольной. Слой кольцевой мускулатуры, прилегающий к полости
матки, подостлан базальной ламиной. В этих мышечных слоях разбросаны пучки
коллагена. Полость матки выстлана однослойным эпителием.
Рис. 2.8. Строение стенки матки Peripatus (Macroperipatus) acacioi
(по: Camigla, Walker, 1995):
б.л — базальная ламина; к.м — кольцевая мускулатура; п.м — про-
дольная мускулатура; пр — просвет матки; тр — трахея; эп — эпителий
матки
На стадии бластулы между стенкой матки и зародышем сохраняется свобод-
ное пространство. Затем эпителий матки вблизи зародыша утоньшается и обособ-
ляется в форме замкнутого пузыря — эпителиального мешка. Между зародышем
и стенкой матки располагаются крупные вакуолярные клетки с многочисленными
микровиллями, обращенными в полость матки. Предполагается, что активность ва-
куолярных клеток, выделяющих секрет в просвет матки, подготавливает ее стенку
к прикреплению зародыша. На стадии 32 бластомеров зародыш распластывается
на стенке эпителиального мешка в виде пластинки, которая куполообразно изгиба-
ется (рис. 2.9). В основании купола находятся клетки, отличающиеся от остальных
формой и структурой ядер и наличием ядрышек (рис. 2.9). В дальнейшем из этих
клеток развивается зародышевая часть плаценты. Из выпуклой поверхности заро-
дыша в полость эпителиального мешка выселяются амебоидные клетки. Впослед-
ствии они формируют однослойный эмбриональный мешок, подстилающий изнутри
эпителиальный мешок. Топографически и физиологически амнион Е. trinidadensis
напоминает трофический пузырь Paraperipatus, однако существенно отличается спо-
собом образования.
Внутренний конец зародыша расширяется, и зародыш принимает грибовидную
форму. Его базальная часть вытягивается в форме стебелька («пупочного канати-
ка»), который одним концом прикрепляется к будущей спинной стороне зародыша,
а другим — к стенке эпителиального мешка. Терминальная часть стебелька разрас-
тается, образуя зародышевую часть плаценты (рис. 2.9). В дальнейшем зародыш
растет в проксимальном направлении, оставаясь, таким образом, прикрепленным
передним концом (рис. 2.9). Ротовое и анальное отверстия открываются независимо
друг от друга кпереди от первичной бороздки.
81
Рис. 2.9. Развитие зародыша онихофоры Epiperipatus trinidadensis и форми-
рование плацентарного органа (по: Kennel, 1885):
а — стадия пластинки; б, в — последовательные этапы изгибания зародыша и
формирования амниона; г — начало развития зародышевых листков; д — попереч-
ный срез зародыша; е — зародыш в выводковой камере; мс — поздний зародыш с
пупочным канатиком; ом— амнион; го.л— головные лопасти; з — зародыш; м —
стенка матки; мз— мезодерма; пу.к— пупочный канатик; эк — эктодерма; эн —
энтодерма; эп — эпителий матки
В стенке матки Epiperipatus в ходе развития происходят существенные измене-
ния. Эпителиальный мешок образуется из внутреннего эпителия матки и его участ-
ки, расположенные выше и ниже зародыша, дегенерируют. Мышечный слой матки
утолщается, формируя сфинктеры. На уровне стебелька зародыша стенка эпители-
ального мешка утолщается, образуя наружное плацентарное кольцо. Клетки кольца
отличаются крупными ядрами и зернистой цитоплазмой. Наружное плацентарное
кольцо формируется за счет утолщения наружного эпителия матки. По мере роста
зародыша ширина плацентарных колец увеличивается. К окончанию развития эпи-
телиальный и эмбриональный мешки исчезают, зародыш распрямляется и свободно
лежит в просвете матки, заглатывая ее выделения (рис. 2.10).
У Macroperipatus (Peripatus) acacioi плацента также развивается в районе сте-
белька. Сначала она имеет форму диска. Затем участки эмбрионального мешка ре-
82
амп
Рис. 2.10. Пространственные отношения между частями зародыша у Paraperipatus
amboinensis (а) и Epiperipatus trinidadensis (б) (по: Иванова-Казас, 1979):
ам— амнион; амп — амниопор; мз— мезодерма; пу.к — пупочный канатик; т.п —
трофический пузырь; эк — эктодерма; эн — энтодерма
дуцируются и обрастают эпителиальный мешок. Этот разросшийся участок стано-
вится синцитиальным, цитоплазма заполнена вакуолями с запасными питательны-
ми веществами. Базальная поверхность плаценты и клетки эпителиального меш-
ка образуют многочисленные микровилли с пиноцитозными пузырьками в основа-
нии. Эти микровилли служат для передачи питательного материала из гемоцеля
матери к зародышу. Клетки эмбрионального мешка плотно прилегают к плацен-
те/эпителиальному мешку. По мере увеличения размеров зародыша площадь по-
верхности плаценты также увеличивается, занимая до 40% поверхности эмбриональ-
ного мешка.
В ходе эмбриогенеза и сегментации М. acacioi стебелек остается полым внутри.
Он располагается средне-дорсально между преоральным антеннальным и вторым
челюстным сегментами. Клетки стебелька имеют эмбриональное происхождение и
соответствуют эмбриональной эктодерме (рис. 2.11). Поверхность зародыша и сте-
белька покрыта микровиллями с пиноцитозными пузырьками в основании. С помо-
щью этих микровиллей зародыш получает питательные материалы, поступающие в
пространство между ним и эпителиальным мешком. После того как зародыш фор-
мирует собственную кутикулу, питание через микровилли становится невозможным,
и он начинает активно заглатывать выделения стенок матки ротовым отверстием.
Таким образом, среди живородящих Onychophora, как и у Mammailia, структу-
ра плаценты существенно варьирует. Например, у Peripatus edwardsii и Р. torquatus
плаценты похожи тем, что имеют плацентарные кольца, окружающие центральную
часть каждой зародышевой полости. У М. acacioi плацентарного кольца нет, пла-
цента не имеет четкой границы и окружает переднедорсальный участок зародыша.
Стебелек у первых двух видов образован внезародышевой эктодермой, тогда как у
последнего — зародышевой. Эмбриональный мешок трех видов имеет-эмбриональное
происхождение.
Поскольку у Epiperipatus и Macroperipatus эмбриональный мешок срастается со
стенкой матки, его продвижение к половому отверстию невозможно. Вместе с заро-
83
с.м
Рис. 2.11. Взаимоотношения развивающегося зародыша онихофоры Peripatus
acacioi со стенкой матки материнского организма (по: Campiglia, Walkler,
1995):
ва.к — вакуолярные клетки; п.з.р— постериорная зона роста; пре — просвет мат-
ки; пр.с — преоральный сегмент; с — стебелек; с.м — стенка матки; с. п — синцитиаль-
ная плацента; эльим — эмбриональный мешок; эп — эпителий матки; эп.м — эпители-
альный мешок
дышем происходит перемещение и стенки матки. В ее проксимальном конце фор-
мируется зона активной пролиферации. Здесь происходят нарастание и дифферен-
цировка стенки матки, а на противоположном дистальном конце этого органа его
ткани после выхода зародыша подвергаются резорбции.
Зародыш питается за счет матери в ходе своего развития. Об этом свидетельству-
ет тот факт, что, например, из яйца Epiperipatus диаметром 46 х 32 мкм развивается
зародыш диаметром 20 мм, у Macroperipatus при диаметре яйца около 200 мкм за-
родыш достигает диаметра 40 мм, а у Peripatus trinidadensis из яйца диаметром
40 мкм формируется зародыш длиной 22 мм.
В конце XIX века полагали, что при переходе к наземному образу жизни от-
кладка яиц в воду и развитие из них личинок стали невозможными для предков
Onychophora. Это привело к тому, что эмбриогенез стал осуществляться внутри
материнского организма, причем питание зародышей обеспечивалось за счет выде-
лений половых путей матери. Дальнейшие эволюционные изменения шли в двух на-
правлениях. Одно из них привело к развитию плацентарного живорождения, когда
зародыш начал паразитировать, прикрепляясь к стенке матки, другое — к укороче-
нию периода питания зародыша за счет матери и накоплению желтка в яйцах.
О. М. Иванова-Казас (1979) считает, что непосредственный переход от свободно-
го развития к живорождению с питанием за счет матери маловероятен, так же как
84
и второй путь —от живорождения к яйцеживорождению и яйцерождению. Живо-
рождение всегда развивается на основе яйцеживо рождения. Действительно, исчез-
новение личинки и накопление желтка в яйцах произошли у предков онихофор,
вероятнее всего, в связи с переходом к наземному образу жизни. Задержка развива-
ющихся яиц в половых путях самки послужила предпосылкой перехода к яйцеживо-
рождению. У полилецитальных яиц дробление могло стать дискоидальным, а бла-
стодерма разделилась на зародышевую полоску и желточный мешок (трофический
пузырь). Этот провизорный орган утерял роль вместилища желтка у Peripatopsis, но
принял на себя функцию всасывания питательных веществ. Дальнейшее развитие
приспособлений к питанию зародыша в организме матери привело к возникновению
плаценты.
Тип Chelicerata
Представители типа Chelicerata относятся к билатерально симметричным члени-
стоногим животным (рис. 2.12). Тело разделено на два отдела. Передний (просома)
образован акроном и шестью сегментами, несущими придатки, и полностью или
частично прикрыт карапаксом. Задний отдел (опистосома) без придатков, или же
они сильно модифицированы. Придатки одноветвистые. На просоме это пара хели-
цер (клешневидных либо в форме ложных клешней или стилетов), пара педипальп
(часто клешневидных) и четыре пары ходильных ног. Антенн и челюстей нет. Глаза
простые или сложные, иногда отсутствуют. Опистосома у некоторых форм снаружи
разделена на сегменты (до 12), а в ряде случаев, кроме того, на широкую переднюю
мезосому и узкую заднюю метасому. Тело оканчивается анальным сегментом —
тельсоном, иногда трансформирующимся в шип или жало. Экзоскелет хитиновый,
необызвествленный. Иногда в просоме имеется еще и пластинчатый мезодермаль-
ный эндоскелет. Кишечник сквозной, прямой; от среднего его отдела отходят две-
шесть пар слепых выростов (дивертикулов), секретирующих ферменты и усваива-
ющих продукты пищеварения. Выделительная система состоит из слепо оканчива-
ющихся коксалъных желез в просоме и/или разветвленных мальпигиевых сосудов
Рис. 2.12. Схематический продольный разрез Chelicerata (по: Барнс и др., 1993):
ан — анус; г.м— ганглиозная масса; го — гонада; к — кишка; кл.п— клешня педи-
пальпы; кп — карапакс; л.к — легочная книжка; м.с — мальпигиевы сосуды; п.ж: — пи-
щеварительная железа; се — сердце; ср.г — срединные глаза; хе — хелицеры; х.н — хо-
дильные ноги
85
опистосомы, отходящих от среднего отдела кишечника. Органы дыхания представ-
лены жабрами, легкими и/или трахеями. Нервная система состоит из отдельных
ганглиев, располагающихся по всей длине тела или, чаще, в виде одного крупного
просомального нервного узла. Раздельнополые животные. Развитие прямое.
Класс Arachnida
Отряд Scorpiones
Представители отряда Scorpiones — сухопутные животные, обитающие в обла-
стях с теплым и часто сухим климатом. Они характеризуются клешневидными педи-
пальпами, длинным сегментированным брюшком с гибким тонким заднебрюшием,
заканчивающимся тельсоном (рис. 2.13). Половая система скорпионов располагается
в мезосоме. Яичники парные в виде продольных трубочек, соединенных четырьмя-
пятью поперечными перемычками. Короткие яйцеводы впадают в непарную поло-
вую камеру, открывающуюся наружу на восьмом сегменте. Осеменение внутреннее.
Рис. 2.13. Внешний вид скорпиона (по: Барнс и др., 1993)
Для всех скорпионов характерно живорождение. На основании различий в то-
пологии развивающихся зародышей М. Лоури (1896) разделил всех скорпионов на
апойкогенных — развивающихся вне фолликула, и катойкогенных — на начальных
стадиях развивающихся в фолликуле яичника. Как правило, апойкогенные скор-
пионы имеют крупные, полилецитальные яйца. В этом случае мы имеем дело с
яйцеживорождением, поскольку зародыш не получает питания от матери. Яйца у
скорпионов покрыты хорионом. У катойкогенных скорпионов яйца мелкие, диамет-
ром от 40 до 120 мкм, олиго- или алецитальные. Дробление полное, равномерное,
асинхронное и относится к неупорядоченному типу. В ходе дробления хорион исче-
зает. В результате формируется равномерная стерробластула с небольшой полостью.
В половых путях самок этих видов возникают специальные приспособления для пи-
тания зародыша. Следовательно, здесь можно говорить о живорождении. Впервые
питание зародышей скорпионов за счет матери было описано в XIX веке Мюллером.
86
У некоторых апойкогенных скорпионов в половых путях самки формируются
структуры, участвующие в питании зародыша. Так, у Vejovidae герминативный
эпителий наиболее высокий в тех участках расширения матки, где развивается
зародыш. Предполагается, что именно он секретирует вещества, используемые эм-
брионом. Подобный тип живорождения можно отнести к аденотрофному. В то же
время развитие сопровождается формированием амниона и серозы.
Более сложный аппарат для питания зародыша образуется у Lychas tricarinatus
(семейство Buthidae). Это образование имеет форму трубки, отходящей от спинной
стороны зародыша в районе третьего-четвертого сегментов мезосомы. Она поме-
щается в полости тела матери, выпячивая стенку яичника (рис. 2.14). Внутренний
конец трубки проходит сквозь кожные покровы и сердце зародыша, открываясь в
его среднюю кишку. Питательные вещества, продуцируемые в концевом утолщении,
через трубку попадают в кишечник зародыша. К сожалению, неизвестно, принима-
ют ли участие ткани материнского организма в построении этой питающей труб-
ки. Подобный тип взаимоотношений матери и развивающегося зародыша, вероятно,
можно было бы отнести к деглютотрофному аденотрофному, либо к переходному
между аденотрофным и плацентарным.
Рис. 2.Ц. Плацентарный аппарат скорпиона Lychas tricarinatus (по: Dawidoff, 1949):
с.At — стенка матки; н.с — брюшные нервные стволы; п.т — плацентарная трубка;
се — сердце; сз — сероза; с.к — средняя кишка; эк — эктодерма
У катойкогенных скорпионов питание эмбриона в теле матери происходит ина-
че. Так, у представителей семейства Scorpionidae плаценты нет, и зародыш полу-
чает питательные материалы, выделяемые тканями матери, через рот. У Hormurus
australisiae и Heterometrus scaber дивертикулы овариальных трубок, в которых про-
исходит развитие зародышей, подразделяются на несколько отделов. Наиболее важ-
ными из них являются основной отдел, играющий роль инкубационной камеры, и
«аппендикс» —длинный узкий дистальный придаток (рис. 2.15). Последний выпол-
няет роль железы, выделяющей питательные вещества.
Формирование энтодермы осуществляется путем деляминации (Hormurus) либо
по типу униполярной иммиграции (Heterometrus). Затем зародыш принимает оваль-
ную форму, длинная ось которого соответствует переднезадней оси. Передний конец
зародыша обращен к основанию аппендикса, где развивает глубокое стомодеальное
87
КЛ.П
Рис. 2.15. Срез через дивертикул овариальной трубки с четырех-
клеточным зародышем скорпиона Hormurus australasiae (по:
Pfliigfelder, 1930):
an — аппендикс; г.э — герминативные эпителий; з — зародыш; кл.п—
клеточная пробка; н.с.д — наружный слой стенки дивертикула; ов — ова-
риальная трубка; ц.к— центральный канал аппендикса
впячивание эктодермы. На внутренней стенке стомодеума прорывается отверстие,
через которое питательная жидкость попадает в полость зародыша.
В начале эмбрионального развития фолликулярные клетки, примыкающие к
дистальному концу дивертикула, активно пролиферируют, формируя «пробку»,
состоящую из крупных железистых клеток. Она растет в дистальном направле-
нии, выпячивая наружную стенку дивертикула, образуя таким образом аппендикс
(рис. 2.16, a-в). В терминальном участке аппендикса клетки «пробки» не изменя-
ются, тогда как по его длине проходит клеточный тяж, пронизанный продольными
канальцами, открывающимися в полость инкубационной камеры. Считается, что
именно в концевом вздутии аппендикса синтезируются те питательные вещества, ко-
торые передаются зародышу через тяж. Возможно, что источником питательных ве-
ществ служат также клетки, выстилающие инкубационную камеру и многослойный
участок фолликулярной оболочки в районе переднего конца зародыша (рис. 2.16, г).
На поздних стадиях развития Heterometrus на проксимальном конце осевого тяжа
аппендикса образуется сосочек, зажатый между хелицерами зародыша. Питатель-
ная жидкость попадает из осевого канала в пространство между рострумом (верхней
губой) и хелицерами и заглатывается зародышем. Об этом свидетельствует раннее
развитие мускулатуры пищевода. Подобный характер питающего аппарата описан
для Urodactus abruptus и Ischnurus ochropus. Данный тип живорождения можно от-
нести к деглютотрофному аденотрофному.
По мере развития зародыши катойкогенных скорпионов существенно увеличива-
ются в размерах. Так, из яйца Heterometrus scaber диаметром 40 мкм развивается
зародыш длиной 19 мм.
Глубокие различия в строении приспособлений, обеспечивающих питание заро-
88
кл.п
3
н.с.д
9^9
0в>О00ф в>
0 ее
9 9а 0
и. эи
е ®®е
а ® а®
®£э®0
,‘Л; V'
„»*авеве
® а ®®Т®
® а®»®в®
©в®0ев
JOT?
вв®вв%в
® ®Лвее
Д® ?а «®е
«®е®еев
®в® ®®е е0®
/®9Й ®®е @9
/ ® ® ® ® ® ® 0
®е в® ® ® X®
9 ®Ъ®в®
е® е i®®в«£
Рис. 2.16. Схема развития зародыша скорпиона Hormurus australasiae и формирование плацентар-
ного органа (по: Pfliigfelder, 1930):
а — медианный срез конца дивертикула овариальной трубки с зародышем на двухклеточной стадии;
б — фолликул с зародышем на стадии 28 бластомеров; в — фолликул с двухслойным зародышем; г —
поздняя стадия морфогенеза; з— зародыш; к — кишка с желтком; кл.п — «клеточная пробка»; н.с.д —
наружный слой стенки дивертикула; пд— зачаток педипальпы; п.к— передняя кишка; п.ф— полость
фолликула; п.эп — перитонеальный эпителий; р — рот; клетки фолликула; ф.об — фолликулярная
оболочка; эк — эктодерма; эн — энтодерма
дышей у скорпионов из разных семейств (Vejovidae, Buthidae, Scorpionidae), свиде-
тельствуют, по мнению О. М. Ивановой-Казас (1979), об их независимом возникно-
вении и эволюции.
Отряд Pseudoscorpiones
Представители отряда — мелкие наземные паукообразные, похожие на скорпи-
онов, но без удлиненной опистосомы и жала. Педипальпы в виде больших клеш-
ней (рис. 2.17). Дыхательный аппарат представлен двумя парами трахей. Хелицеры
несут паутинные железы. Осеменение внутреннее с помощью сперматофоров. Непар-
89
Рис. 2.17. Внешний вид псевдоскорпиона (по: Барнс и др., 1993)
ный яичник открывается двумя яйцеводами в половую камеру, снабженную двумя
семяприемниками и акцессорными железами.
Псевдоскорпионы считаются живородящими животными. Яйца и зародыши вы-
нашиваются в особой выводковой сумке, стенки которой образованы затвердевшими
Рис. 2.18. Раннее развитие псевдоскорпиона Pselaphochernes scorpioid.es (по: Weygoldt, 1964):
а — четвертое деление дробления; б — позднее дробление; в, г — последовательные этапы формиро-
вания бластодермы; д~ образование мезэнтодермы; е — начало сегментации; блд— бластодерма; мс.я —
желточное ядро; ма — макромеры; ми — микромеры; мэн — мезэнтодерма; об — эмбриональная оболочка;
хр — хорион
90
выделениями желез половой камеры. Яйца псевдоскорпионов мелкие, олиголеци-
тальные, поскольку развивающийся зародыш получает необходимые белковые веще-
ства из питательной жидкости, секретируемой стенками яичника, и через половое
отверстие попадающие в выводковую сумку.
Дробление псевдоскорпионов после четвертого цикла становится неравномер-
ным: макромеры дают начало желточной энтодерме, большая часть микромеров
формирует бластодерму, а несколько микромеров остаются инертными, располага-
ясь между поверхностью зародыша и яйцевой оболочкой. У Pselaphochernes потомки
этих бластомеров сольются в синцитиальную эмбриональную оболочку (рис. 2.18).
Эмбриональная оболочка участвует в процессе всасывания питательной жидкости.
У Neobisium эта оболочка сильно набухает (рис. 2.19). Предполагается, что эмбри-
ональная оболочка не только накапливает питательные вещества, но и передает их
зародышу, благодаря чему его размеры существенно увеличиваются. Эмбриональ-
ная оболочка разрушается после развития эмбриональной глотки.
Рис. 2.19. Зародыш псевдоскорпиона Neobisium на стадии формиро-
вания бластодермы (по: Weygoldt, 1965):
блд — бластодерма; ма — макромеры; об — эмбриональная оболочка
В ходе органогенеза зародыши ориентируются таким образом, что их брюшная
сторона обращена к телу матери, а передние концы — к половому отверстию матери,
из которого выделяется питательная жидкость. На основании педипальп у Neobisium
и первой пары ходных ног у Pselaphochernes развиваются отростки, участвующие в
формировании сосательного органа.
Данный тип живорождения можно отнести к аденотрофному, который на ран-
них этапах представляет собой абсорботрофное, а в дальнейшем становится деглю-
тотрофным.
Переход к питанию зародыша за счет матери у псевдоскорпионов, по мнению
О. М. Ивановой-Казас (1979), стал причиной обеднения яиц желтком, уменьшения
их размеров, перехода к полному дроблению, а также отсутствия в бластодерме
четкого подразделения на зародышевую полоску и внезародышевую часть.
91
Отряд Acari
Для клещей не характерно вынашивание зародышей, однако у некоторых ви-
дов встречается яйцеживорождение (Иванова-Казас, 1979), а у Pediculopsis и
Knemidocoptes предполагается наличие аденотрофного живорождения. Однако по-
дробных сведений о том, каким образом происходит питание зародышей указанных
видов в теле матери, нет.
Тип Uniramia
Класс Insecta
Насекомые — двусторонне-симметричные членистоногие, в основном наземные,
реже — пресноводные формы. Тело разделено на два отдела — голову, образованную
акроном и четырьмя сегментами, три из которых несут придатки, и туловище, ко-
торое дифференцировано на грудь (торакс), состоящую из трех сегментов с тремя
парами ног и двумя парами крыльев, и брюшко (абдомен), включающее до один-
надцати сегментов. Придатки одноветвистые. На голове находится по паре антенн
(усиков), мандибул (жвал) и максилл (челюстей). Вторая пара максилл у большин-
ства форм сливается, образуя нижнюю губу (лябиум). По бокам головы располо-
жены сложные глаза (рис. 2.20). Кишечник сквозной, прямой, без пищеварительных
дивертикулов. Полость тела смешанная (миксоцелъ). В гемоцеле находится жировое
тело, часто тесно связанное с кишечником. Выделительная система представлена
одной-двумя парами максиллярных желез в голове, и 1-75 парами неветвящихся
эктодермальных мальпигиевых сосудов, отходящих от задней кишки вблизи места
ее соединения со средней кишкой. Органы газообмена парные в виде трахей. Раз-
дельнополые и, по большей части, яйцекладущие животные. Осеменение внутреннее
путем копуляции. Половая система самок состоит из двух яичников, впадающих в
яйцеводы. Парные яйцеводы сливаются, образуя непарный канал, открывающийся
Рис. 2.20. Продольный разрез насекомого (по: Барнс и др., 1993):
ан — анус; ант — антенна; с.г — сложный глаз; го — гонада; д—дыхальца (стигмы);
кр— крылья; м.с — мальпигиевы сосуды; н — ноги; н.т—нервный тяж; пр.к—прямая
кишка; р — рот; се — сердце; с.мс—слюнные железы
92
наружу половым отверстием на 7- или 8-м сегменте брюшка. По типу постэмбрио-
нального развития насекомых подразделяют на Hemimetabola — с неполным превра-
щением (прямое развитие) и Holometabola—с полным или личиночным развитием.
Яйца насекомых имеют хорошо выраженную желточную оболочку и хорион, вы-
деляемый фолликулярными клетками. Обычно яйца крупные со средним диаметром
1-2 мм, переполненные желтком (полилецитальные). Дробление у подавляющего
большинства Insecta поверхностное. В результате делений ядра яйца образуются
группы ядер дробления, которые, продолжая делиться, смещаются на периферию и
формируют синцитиальную бластодерму. В дальнейшем она становится клеточной.
Затем бластодерма дифференцируется на зародышевую и внезародышевую. Первая
в виде зародышевой полоски располагается на будущей вентральной стороне, а вто-
рая занимает остальную площадь эмбриона. Все формообразовательные процессы
осуществляются только в пределах зародышевой полоски.
Подавляющее большинство насекомых являются яйцекладущими животными.
Яйцеживородящие и живородящие виды встречаются в И отрядах: Ephemeroptera,
Dermaptera, Psocoptera, Thysanoptera, Blattoidea, Hemiptera, Neuroptera, Coleoptera,
Strepsiptera, Diptera, Lepidoptera. Для большинства перечисленных отрядов жи-
ворождение представляет собой редкое явление. Исключение составляет отряд
Hemiptera, включающий ряд живородящих партеногенетических видов, и Diptera,
у которых живорождение независимо возникало более 50 раз. К сожалению, работ
по формированию питающего аппарата зародыша в эмбриогенезе мало.
Существует несколько классификаций живорождения у насекомых. Согласно
классификации X. Хагана (1951), принятой также О. М. Ивановой-Казас (1981),
можно выделить четыре формы живорождения у насекомых: яйцеживорождение,
аденотрофное, гемоцельное, плацентарное или псевдоплацентарное живорождение.
С нашей точки зрения, эта классификация не достаточно корректна, так как в ней в
качестве равноценных признаков использованы характер взаимоотношений между
зародышем и организмом матери и локализация зародыша в теле матери.
Другая классификация была предложена Р. Мейером с соавторами для отря-
да Diptera (1999). Согласно этой классификации в зависимости от того, рождает-
ся личинка или куколка, можно выделить ларвипарию (larviparous) и пупипарию
(pupiparous) соответственно. Живорождение может быть факультативным и об-
лигатным. В зависимости от того, какое количество зародышей одновременно раз-
вивается в половых путях самки, в качестве вариантов облигатного живорождения
выделяют мулътиларвипарию (более 12 зародышей), олиголарвипарию (2-12) и уни-
ларвипарию (1 зародыш).
Здесь используется предложенная нами классификация живорождения.
Лецитотрофное живорождение описано у ряда семейств отряда Diptera (напри-
мер, Ctenostilidae, Lucilinae, Chloropidae, Anthomyidae, Helicoboscinae, Muscidae).
В семействе Cecidomydae (отряд Diptera) абсорботрофное аденотрофное живо-
рождение сочетается с педогенезом —- партеногенетическим размножением на ран-
ней стадии развития. Ооциты личинок Miastor metraloas и Heteropeza рудтаеа со-
держат небольшое количество жировых включений, яйцевой оболочки нет, и ее
роль выполняет фолликулярный эпителий. После единственного деления созрева-
ния ооциты остаются в гемоцеле материнской личинки, приступая к поверхност-
ному дроблению. В ходе развития образуется бластодерма, зародышевая полоска,
амнион и сероза. Зародыш начинает увеличиваться уже на стадии дробления. В
процессе развития в теле зародыша увеличивается запас жировых отложений и на-
93
чинается накопление гликогена. Эти вещества концентрируются в основном в цен-
тральной части зародыша и в гипертрофированных клетках серозы. Предполагают,
что в усвоении и передаче питательных веществ из гемолимфы материнской личин-
ки в зародыш участвует сероза. Длина родившегося зародыша Heteropeza рудтаеа
составляет 1-2 мм, ширина 150-200 мкм, размеры яйца 80-115 х 35-70 мкм со-
ответственно. Перед выходом дочерних личинок происходит разрушение и гибель
материнской личинки, что сближает живорождение Cecidomydae с эмбриональным
паразитизмом Hymenoptera.
Абсорботрофное аденотрофное живорождение, по-видимому, характерно и для
некоторых веерокрылок (отряд Strepsiptera), хотя оно изучено плохо. У Xenos bohlsi
яйца полилецитальные. Бластодерма покрывает не всю поверхность желтка, а об-
разует лишь колпачок на вегетативном полюсе (рис. 2.21, А, а), который, вероятно,
выполняет трофическую роль. Затем края колпачка заворачиваются и образуют
оболочку, подобную амниону (рис. 2.21, А, б). Клетки, оставшиеся на желтке, фор-
мируют зародышевую полоску. В дальнейшем зародышевая полоска удлиняется и
развитие идет обычным образом.
В яйцах Stylops sp. (Strepsiptera) желтка мало и дробление тотальное. Желток
попадает в одну из клеток, занимающую центральное положение (рис. 2.21, Б, а, б).
Происходит кариокинез этой клетки, что приводит к образованию желточного син-
цития. После этого многоядерный желточный комок выходит на поверхность за-
Рис. 2.21. Раннее развитие веерокрылок Xenos bohlsi (A), Stylops sp. (Б)
и Halictoxenos simplicis (5) (по: ИвановаЖазас, 1995):
а-г— последовательные этапы развития; ам— амнион; блд — бластодер-
ма; мс — желток; мсе.к — желточные клетки; з.д — зародышевый диск; э.о —
эмбриональная оболочка
94
родыша, а оставшиеся бластомеры формируют полый клеточный шар. Клетки,
контактирующие с желтком, вытягиваются и соответствуют зародышевой полоске,
остальные клетки образуют амнион (рис. 2.21, В, в, г). На ранних стадиях развития
Halictoxenos simplicis, для которого характерна полиэмбриония, в составе зароды-
ша выделяется центральная цитоплазматическая масса, соответствующая желтку, и
периферический слой клеток бластодермы (рис. 2.21, В). Центральная масса распа-
дается на отдельные клетки, мигрирующие через разрыв бластодермы наружу, где
они формируют замкнутую оболочку — «трофамнион». К настоящему амниону он не
имеет отношения, поскольку образуется за счет клеток, соответствующих желточ-
ному синцитию. Ядра «трофамниона» формируют несколько скоплений, возле кото-
рых бластодерма утолщается и начинается развитие многочисленных зародышевых
полосок. В промежутках между зародышевыми полосками бластодерма становит-
ся тонкой и соответствует амниону. Затем внезародышевая бластодерма врастает
между зародышами, изолируя их друг от друга, а весь полигерм распадается на от-
дельные зародыши с собственным амнионом и «трофамнионом». У представителей
данного отряда развитие осуществляется в половых путях самки.
Плацентарное живорождение отмечено у представителей отрядов Blattoidea,
Psocoptera, Homoptera, Heteroptera и некоторых Dermaptera.
Яйца Apiomorpha urnalis (отряд Homoptera) мелкие (диаметром примерно
40 мкм) и лишены хориона. После третьего деления дробления на концах вытянуто-
го зародыша обособляются два ядра бластодермы, тогда как из оставшихся шести
ядер образуется желточный синцитий (рис. 2.22). На 16-ядерной стадии 12 «клеток»
становятся вителлофагами, прекращая деления, а из четырех клеток бластодермы
три увеличиваются и прекращают деления, а одна оставшаяся клетка продолжает
деления. Ее потомки формируют сферическую группу клеток, которая сплющивает-
ся в виде двухслойной пластинки. Один слой дает амнион, а другой — зародышевую
полоску. Клетки серозы вакуолизируются, увеличиваются и прижимаются к упло-
щенному фолликулярному эпителию. Возможно, роль плаценты выполняют сероза
и фолликулярный эпителий.
Трофическую функцию на ранних этапах развития клопа Hesperoctenes fumarius
также выполняет сероза. Однако в дальнейшем сероза и амнион разрушаются, а из
гипертрофированных плейроподий (первой пары брюшных конечностей) развивает-
ся новая трофическая оболочка. Материнская часть плаценты у особей этого вида
сначала представлена фолликулярным эпителием, а затем стенкой яйцевода.
Сложная плацента, состоящая из зародышевой части (амнион и сероза) и ма-
теринской части (разрастание фолликулярного эпителия), образуется при развитии
уховертки Hemimerus talpoides (отряд Dermaptera).
Одной из причин возникновения живорождения у насекомых считается предо-
хранение зародыша от высыхания. Во всех случаях перехода насекомых к живо-
рождению в эмбриональном развитии у представителей разных групп проявляются
сходные эволюционные тенденции:
1) исчезновение хориона;
2) уменьшение количества желтка;
3) переход от поверхностного дробления к полному;
4) возникновение различных структур, обеспечивающих питание зародыша, ча-
ще всего в виде оболочки; к ним относятся: амнион или сероза (Apiomorpha,
Hesperoctemes, Hemimerus), видоизмененные конечности (Hesperoctenes, Diploptera),
желточные клетки (Helictoxenes), фолликулярные клетки или стенки яйцевода ма-
95
Рис. 2.22. Ранние стадии развития щитовки Apiomorpha urnalis (по: Buchner, 1957):
а, б — стадии 4 и 8 бластомеров; в — обособление серозы; г — стадия «розетки»; д — стадия зароды-
шевой полоски; ом— амнион; з.п — зародышевая полоска; п.в — первичный вителлофаг; п.з — половой
зачаток; рз — «розетка»; р.т — редукционное тельце; сер — сероза; я. д — ядра дробления
тери (Apiomorpha, Hemimerus, Stictococcus), где отмечается ряд морфологических
изменений, свидетельствующих о выполнении ими трофической функции.
О. М. Иванова-Казас (1964) установила, что сходные тенденции проявляются у
насекомых и при переходе к паразитизму.
96
Тип Echinodermata
Иглокожим живорождение, за единичными исключениями, не свойственно. Ино-
гда к живорождению у Echinodermata относят развитие зародышей в гонадах или
половых протоках, частично приспособленных для инкубирования. Однако при де-
тальном анализе оказывается, что зародыши в большинстве таких случаев не полу-
чают питательного материала от материнского организма. Таким образом, в этих
случаях нет настоящего живорождения, а имеет место яйцеживорождение.
Класс Holoturoidea
В пределах этого класса вынашивание зародышей встречается в той или иной
форме практически во всех семействах (Касьянов и др., 1983). Однако чаще всего
имеет место не живорождение, а яйцеживорождение.
Различные варианты вынашивания зародышей голотурий в инкубационных сум-
ках — выпячиваниях стенки тела, у Cucumaria glacialis и в целоме у Synapta
hydriformis, Chriodota rotifera, Phyllophora uma, проходят по типу яйцеживорожде-
ния. У представителей двух видов: Taeniogyrus confortus и Oneirophanta mutabilis
развитие происходит прямо в яичнике. В последнем случае из яиц диаметром
200 мкм развиваются зародыши до 30 мм длиной. Не исключено, что у О. mutabilis
происходит питание зародышей выделениями стенки яичника, т. е. имеет место аде-
нотрофное живорождение. К сожалению, аппарат питания не описан. Живородя-
щим видом также можно, по-видимому, считать Leptosynapta clarki.
Класс Asteroidea
У морских звезд не обнаружено настоящего живорождения, хотя у ряда видов,
например, у Patriella vivipara, Р. paravivipara и Asterina pseudoexigna pacifica, разви-
тие происходит в гонадах, что можно рассматривать в качестве яйцеживорождения.
У этих видов зародыш ни на одной стадии не прикреплен к стенкам гонады. Сведе-
ний об увеличении размеров зародышей в ходе развития нет.
Класс Ophiuroidea
Для многих видов офиур характерно вынашивание зародышей или яйцеживо-
рождение, однако нет убедительных доказательств наличия у них живорождения.
В то же время у Amphipholis japonica и A. squamata яйца мелкие, а развитие со-
провождается ростом зародыша. Развитие происходит в бурсах — мешкообразных
выпячиваниях эпидермиса. На ранних стадиях зародыш прикрепляется к стенке
бурсы при помощи стебелька, однако не известно выполняет ли стебелек трофи-
ческую функцию. С другой стороны, увеличение размеров зародыша может сви-
детельствовать о наличии у этих видов абсорботрофного аденотрофного живорож-
дения.
Считается, что яйцеживорождение характерно главным образом для офиур, оби-
тающих в полярных областях или на больших глубинах (Касьянов и др. 1983).
LOPHOPHORATA (TENTACULATA)
Билатерально симметричные, вторичнополостные (с трехраздельным целомом),
одиночные и колониальные, водные эпибионты-фильтраторы. Сегменты тела пред-
ставлены предротовой лопастью — эпистомом или просомой, в ряде случаев редуци-
рованной, кольцевым лофофоральным отделом — мезосомой, за счет которого раз-
97
вивается пищеулавливающий щупальцевый аппарат с ресничками, и туловищным
отделом —метасомой. Основная часть U-образного кишечника залегает в пределах
метасомы. Ротовое отверстие располагается в пределах лофофора, анальное —вне
его. Кровеносная система присутствует (Phoronida, Brachiopoda) или отсутствует
(Bryozoa). Органы выделения представлены парными метанефридиями (Phoronida,
Brachiopoda) или отсутствуют (Bryozoa). В последнем случае экскреты удаляются
за счет активного выселения клеток или образования бурых тел (периодической ре-
циклизации части тканей организма). Нервная система представлена залегающим
в мезосоме окологлоточным кольцеобразным или ганглиозным нервным скоплени-
ем и отходящими от него стволами. Раздельнополые или гермафродитные организ-
мы. Половые железы развиваются в метасоме на стенке тела и/или мезентериях
из клеток перитонеума. Половых протоков нет. Вымет гамет осуществляется че-
рез нефридиопоры, целомопоры или разрывы стенки тела. Осеменение наружное
(Brachiopoda) или внутреннее (Phoronida, Bryozoa): интрацеломическое или интра-
овариальное. Развитие с личинкой.
Тип Phoronida
Эпибионты-фильтраторы, ведущие одиночный или групповой образ жизни.
Червеобразное тело помещено в органическую трубку-домик, прикрепленную к суб-
страту (или трубкам других форонид) или погруженную в него. Исключительно
морские животные. Большинство форонид гермафродиты, однако встречаются и
раздельнополые виды.
Хотя эмбрионы, находящиеся на самых ранних стадиях развития, изредка отме-
чались в метацеле Phoronis muelleri, Р. psammophila и Phoronopsis harmeri, однако
эмбриогенез начинается, как правило, после выхода зиготы в воду. Таким образом,
живорождения у форонид нет. Тем не менее некоторые виды (Phoronis hippocrepia,
Р. ijimai, Р. australis, Р. psammophila, Р. vancouverensis, Р. ovalis) вынашивают свое
потомство. Оплодотворенные в туловищном целоме яйца выводятся через нефри-
диопоры на поверхность нидаменталъных желез, выделяющих липкий секрет. Яй-
ца склеиваются, формируя парные эмбриональные массы, длительное время удер-
живающиеся в пространстве между ветвями лофофора. У Phoronis ovalis зиготы
выводятся через разрыв стенки переднего конца тела животного и вынашиваются
в трубке форониды, которая в этот период неактивна. Трубка с эмбрионами име-
ет характерный вздутый участок с сужающимся концом, препятствующим выходу
личинки до завершения ее формирования. Предположительно, самка достраивает
расширенный участок трубки непосредственно перед нерестом.
Тип Bryozoa (Ectoprocta)
Исключительно колониальные формы, морские и пресноводные. Стенка те-
ла обызвествлена (отр. Cyclostomata, Cheilostomata) или необызвествлена (отр.
Ctenostomata, Phylactolaemata). Член колонии обозначается как зооид, состо-
ящий из полипида (лофофора, кишечника и ассоциированной с ними муску-
латуры) и цистида (метацеля и окружающей его стенки тела). Лофофор и
терминальные отделы кишечника способны к высовыванию и втягиванию, при
этом часть стенки тела (интроверт) выворачивается или вворачивается соот-
ветственно (рис. 2.23). Широко распространен зооидальный полиморфизм (кроме
Phylactolaemata), т. е. специализация части зооидов на выполнении определенной
98
Рис. 2.23. Строение аутозооида Bryozoa (по: Boardman et al., 1983):
ан — анус; г — ганглий; гл — глотка; за.к — задняя кишка; из — обызвествленный слой
стенки тела; ин — вывернутое щупальцевое влагалище (интроверт); и.ф.ц — обызвеств-
ленная фронтальная стенка цистида; кар — кардиальный отдел кишечника; к.о.м — коль-
цевой отдел мезосомы; ку— кутикула; м.р— мускул-ретрактор; по.к —поровая камера;
пил —пилорический отдел желудка; р — рот; с.о.эк: — слепой отдел желудка; ф~фупи-
кулюс (мезенхиматозный тяж, соединяющий слепой отдел желудка и стенку цистида);
щ — щупальце с ресничками; э.ф.ц — эластичная фронтальная стенка цистида; э.ц — эпи-
телии стенки тела цистида
функции, сопровождающаяся их морфологической трансформацией. Колониальные
гермафродиты с зооидальным гонохоризмом и/или гермафродитизмом. Гонады раз-
виваются из целомического эпителия. Осеменение интраовариальное. Развитие с
личинкой.
99
Класс Stenolaemata
Яйца у представителей класса мелкие, часто с небольшим количеством желт-
ка или вовсе его лишенные. Развитие осуществляется во вторичных фолликулах,
имеющих мезодермальное происхождение. Дробление яйца асинхронное, хаотиче-
ское, приводящее к формированию морулообразного зародыша. Для Cyclostomata
характерна полиэмбриония. Развитие первичного эмбриона сопровождается отщеп-
лением от него вторичных эмбрионов путем почкования. В некоторых случаях от
вторичных отщепляются третичные эмбрионы.
Отряд Cyclostomata
Исключительно морские формы с двураздель-
ным целомом. Цистиды цилиндрической формы.
Полость метасомы представлена целомом и псев-
доцелем, разделенными стенкой перитонеальной
мембранной сумки (перепончатого мешка) — ча-
стью гидростатического аппарата.
Вынашивание осуществляется интрацеломиче-
ски, в полости мембранной сумки особых зооидаль-
ных полиморф — гонозооидов, или колониальной
выводковой камеры. Оплодотворенное яйцо начи-
нает дробиться, не покидая яичника. Полипид го-
нозооида при этом дегенерирует, а цистид разрас-
тается, образуя вздутую дистальную часть. Ме-
бранная сумка за счет активного деления клеток
в ее проксимальной части формирует так называе-
мый вторичный фолликул. Он состоит из несколь-
ких клеточных слоев, окружающих разрушающий-
ся первичный фолликул яичника и заключенную
в нем зиготу. Разрастание клеток дистальной ча-
сти мембранной сумки ведет к формированию пи-
тающей ткани (рис. 2.24). Это комплекс клеток,
включающий в себя, кроме того, вторичный фол-
ликул и дегенерирующий полипид и осуществля-
ющий транспорт веществ к развивающемуся эм-
бриону. Данный процесс сопровождается постепен-
ной дезинтеграцией вторичного фолликула и ре-
организацией бластомеров, ведущей к формирова-
нию первичного эмбриона (изредка встречаются
два первичных эмбриона).
Комплекс находящихся в полости гонозооида
образований включает в себя питающую ткань, с
погруженными в нее первичным и многочисленны-
ми вторичными, а иногда и третичными эмбрио-
нами. Готовые к выходу личинки переходят в рас-
ширенную часть гонозооида и удаляются через его
отверстие (ооэциостом). Опубликованных резуль-
татов ультраструктурных исследований нет, одна-
Рис. 2.24- Гонозооид Crisiella рго-
ducta с первичным эмбрионом (эм),
окруженным питающей тканью
(n.m) (по: Borg, 1926)
100
ко значительное превышение размеров первичного эмбриона по сравнению с яйцом,
а также количество образуемых личинок (свыше 100) однозначно свидетельствуют
об экстраэмбриональном питании у Cyclostomata. На тесное взаимодействие пита-
ющей ткани и эмбриона указывают микровиллярные выросты, обнаруженные на
поверхности клеток эмбриона и соответствующие им впячивания клеток вторично-
го фолликула.
Таким образом, данный тип живорождения следует рассматривать, как вари-
ант плацентарного живорождения, при котором экстраэмбриональное питание осу-
ществляется за счет производных перитоиеума. Особенность этого варианта разви-
тия состоит в том, что транспорт веществ к эмбриону осуществляется не локально,
а через всю поверхность зародыша.
Класс Gymnolaemata
Яйца представителей класса небольшие (от 10 до 25 мкм), олиголецитальные,
полилецитальные, изолецитальные или телолецитальные. Дробление полное и по-
чти равномерное, может иметь черты билатеральности, радиальности, но чаще ха-
отическое. В результате дробления формируется плотная морулообразная бласту-
ла. Гаструляция чаще осуществляется путем полярного врастания зачатка мезэнто-
дермы.
Отряд Ctenostomata
Морские и солоноватоводные бесскелетные мшанки с двураздельным целомом.
Цистид в форме коробочки или мешочка.
Рис. 2.25. Поздний эмбрион
Mimosella cookae, занимающий
большую часть зооида (по: Banta,
1968):
д.п — дегенерирующий полипид;
ин — интроверт; эм — эмбрион
Рис. 2.26. Ранняя (а) и поздняя (б) стадии
развития эмбриона Sundanella sibogae в эмбри-
ональной сумке (по: Вгает, 1940):
мз — мезодерма; эм — эмбрион, эк — экто-
дерма
101
Большинство представителей данного отряда вынашивают своих личинок. Выве-
дение оплодотворенных яиц из полости зооида осуществляется через супраневраль-
ную целомопору полипида. Простейшая форма вынашивания — прикрепление опло-
дотворенных яиц к поверхности цистида или интроверта. В последнем случае
эмбрионы перемещаются в полость щупальцевого влагалища при втягивании по-
липида. У некоторых форм оплодотворенные яйца после вымета погружаются в
стенку полипида или интроверта и развиваются в образующемся впячивании стен-
ки тела зооида. Чаще же эмбрион(ы) развивается в щупальцевом влагалище, при-
чем полипид при этом дегенерирует. Размеры зрелых личинок лишь незначитель-
но отличаются от размеров зиготы, поэтому считается, что экстраэмбрионально-
го питания у таких мшанок нет, и данный тип развития является яйцеживорож-
дением.
Многократное увеличение размеров эмбриона по сравнению с размерами зиготы
отмечено у Valkeria uwa, Nolella dilatata, N. papuensis, Mimosella соокае и Sundanella
sibogae. У Mimosella личинка развивается в щупальцевом влагалище, увеличиваясь
от 20 до 230 мкм в диаметре и занимая большую часть объема зооида (рис. 2.25).
У Sundanella яйцо развивается во впячивании покровов (эмбриональной сумке) на
анальной стороне зооида. По мере развития эмбриональная сумка с эмбрионом за-
полняет весь зооид (рис. 2.26). Полипид в обоих случаях дегенерирует. Хотя ме-
ханизм транспорта питательных веществ к эмбриону не объяснен и специализиро-
ванные структуры, обеспечивающие питание, не описаны, нет сомнений в том, что
у обоих видов имеет место экстраэмбриональное питание за счет прилегающей к
эмбриону стенки тела зооида.
Отряд Cheilostomata
Исключительно морские формы с двураздельным целомом и известковым на-
ружным скелетом. Цистид в форме коробочки или мешочка.
Большинство представителей данного отряда характеризуется вынашиванием
личинок. У представителей трех родов эмбрионы развиваются в наружных мембран-
ных сумках, которые рассматриваются некоторыми авторами как приклеившиеся к
поверхности зооида мембраны оплодотворения (fertilization envelope). У остальных
вынашивающих Cheilostomata (свыше 1000 родов) личинки формируются в специ-
ализированных выводковых камерах — овицеллах, внутренних выводковых сумках
или в выростах щупальцевого влагалища (эмбриональных карманах), редко интра-
целомически. Овицелла представляет собой обызвествленный полусферический вы-
рост (ооэииум) стенки тела зооида с собственной целомической полостью, сообща-
ющейся с висцеральным целомом. Ооэциум окружает выводковую полость, отвер-
стие которой закрыто крышечкой (оперкулюмом) зооида или выростом его стенки
(ооэциалъным пузырьком). Зигота переходит в выводковую полость через супра-
невральную целомопору. Как правило, у мшанок с вынашиванием в овицеллах не
происходит существенного увеличения размеров эмбриона за время развития. Вкупе
с отсутствием специализированных клеточных образований это свидетельствует об
обсутствии экстраэмбрионального питания, и такой тип развития следует относить
к яйцеживорождению. Аналогичное утверждение справедливо и для вынашивания
в эмбриональных карманах интроверта и выводковых сумках.
Тем не менее у представителей семейств Flustridae (Gregarinidra serrata,
Isosecuriflustra angusta), Bugulidae (Bugula, Bicellariella ciliata), Beaniidae (Beania
102
bilaminata), Candidae (Scrupocellaria ferox, S.scruposa), Cellariidae (Cellaria),
Cribrilinidae (Figularia figularis), Catenicellidae (Costaticella, Pterocella scutella,
Paracribricellina cribraria), Hippothoidae (Celleporella hyalina), Myriaporidae (Myria-
pora truncate,), Lanceoporidae (Calyptotheca variolosa) и Urceoliporidae (Urceolipora
папа, Reciprocus regalis) в стенке материнского зооида, закрывающей вход в вывод-
ковую полость овицеллы, обнаружен гипертрофированный эпителий (эмбриофор),
обеспечивающий транспорт питательных веществ к развивающемуся эмбриону. На
это указывает многократное (от 7 до 500 раз) увеличение объема личинки по сравне-
нию с объемом зиготы, а также результаты ультраструктурных исследований этого
эпителия и личинок.
У представителей рода Bugula после перемещения зиготы в выводковую камеру
уплощенные эпидермальные клетки участка стенки зооида, закрывающего отвер-
стие овицеллы (ооэциального пузырька), преобразуются в цилиндрический эпите-
лий с большим количеством секреторных гранул и многочисленными микровилля-
ми. Напротив, клетки прилегающего к эмбриофору участка эмбриона формируют
многочисленные впячивания. Формируется плацента (рис. 2.27). Транспорт веществ
осуществляется через тончайшую кутикулу стенки зооида по схеме экзоцитоз (клет-
ки эмбриофора) — пиноцитоз (клетки эмбриона). Предполагается, что при участии
эмбриофора удаляются метаболиты личинки. По окончании вынашивания клетки
эмбриофора восстанавливают исходное строение.
Рис. 2.27. Выводковая камера (овицелла) Bugula
neritina с эмбрионом (по: Woollacott, Zimmer,
1972):
д.з — дистальный зооид; к.п — коммуникационная по-
ра; мд — мускул-депрессор ооэциального пузырька; ма.з —
материнский зооид; о.п — ооэциальный пузырёк с плацен-
той; оц — ооэциум; ф.т — фуникулярные тяжи; эм — эм-
брион; энт — энтооэциум; эт — эктооэциум
У Celleporella hyalina гипертрофированный эпителий дистальной стенки мате-
ринского зооида экзоцитирует секрет многочисленных гранул прямо в жидкость
выводковой полости, откуда их посредством пиноцитоза поглощают поверхностные
103
клетки эмбриона. На протяжении большей части развития эмбрион свободно ле-
жит в выводковой полости, и лишь к концу вынашивания участок личинки, за-
нимающей большую часть ее объема, прижимается к стенке материнского зоои-
да. В обоих случаях в целоме материнского зооида развиваются особые питающие
клетки, связанные с мезенхиматозными фуникулярными тяжами и оварием, а у
Celleporella hyalina с эмбриофором. Предполагается, что питающие клетки обеспечи-
вают запасание необходимых веществ и транспорт их к эмбриону во время вынаши-
вания.
В пределах семейства Epistomiidae (Epistomia bursaria, Synnotum aegyptiacum)
осуществляется интрацеломическое вынашивание эмбрионов. Единственное яйцо
после оплодотворения приступает к дроблению прямо в яичнике, клетки которого
обеспечивают питание эмбриона. Участок поверхности эмбриона плотно прилегает
к клеткам яичника в проксимальной его части, и этот контакт оправданно рассмат-
ривается как плацента. Полипид дегенерирует. У Epistomia bursaria объем эмбриона
по сравнению с объемом зиготы в процессе роста увеличивается почти в 1000 раз, а
зрелая личинка занимает большую часть цистида.
Таким образом, некоторые представители отряда Cheilostomata характеризуются
плацентарным живорождением. У Celleporella hyalina живорождение абсорботроф-
ного аденотрофного типа, когда специализированная структура (питающая ткань)
образуется только материнским организмом, а эмбрион в ее формировании участия
не принимает, получая вещества прямо из жидкости выводковой камеры. Экстраэм-
бриональное питание осуществляется за счет эпидермальных или мезодермальных
производных материнского организма.
Класс Phylactolaemata
Исключительно пресноводные формы с трехраздельным целомом и подковооб-
разным лофофором с парными рядами щупалец.
Яйца пресноводных мшанок мелкие (приблизительно 30 мкм), лишенные желтка
(алецитальные). Дробление полное, не вполне равномерное, асинхронное и неупоря-
доченное. В результате дробления формируется целобластула. Обособление энтоме-
зодермы может происходить путем полярного врастания, иммиграции и эпиболии.
По поводу энтодермы существуют разные мнения. Одни авторы полагают, что за-
чаток энтодермы распадается, другие считают, что закладки энтодермы вовсе не
происходит.
Вынашивание у Phylactolaemata осуществляется в эмбриональной сумке, т. е. на-
поминает вынашивание у ктеностомной мшанки Sundanella. Полипид при этом деге-
нерирует. Эмбриональная сумка развивается как впячивание покровов на абаналъ-
ной (противоположной анальной) стороне зооида, в непосредственной близости от
яичника. Способ перемещения зиготы в эмбриональную сумку неизвестен. Предпо-
лагается, что она проникает в полость сумки непосредственно через два слоя кле-
ток ее стенки. У Plumatella в процессе роста эмбриона внутренний (по происхожде-
нию эктодермальный) слой сумки по большей части дегенерирует, за исключением
кольцевого участка, клетки которого находятся в непосредственном контакте как с
клетками эмбриона, так и с мезодермальными клетками стенки эмбриональной сум-
ки (рис. 2.28). Значительное увеличение размеров эмбриона и эмбриональной сумки
свидетельствует о том, что кольцевой участок эмбриональной сумки является пла-
центой. У Fredericella зона контакта между эмбрионом и стенкой сумки имеет форму
104
Рис. 2.28. Эмбрион Plumatella fungosa с кольцевой плацентой в эмбриональной сумке (а) и
более поздняя стадия образования полипида в личинке (б) (по: Braem, 1897):
мз.о— мезодерма оэция; мз.э— мезодерма эмбриона; пл — плацента; по — полипид; по.п —
почка полипида; с.м — складки мантии; эк — эктодерма эмбриона; эм — эмбрион
диска, образующегося у будущего заднего конца личинки. Данное образование обо-
значают как плацентарный диск.
* * *
Таким образом, истинное плацентарное живорождение встречается в пределах
всех трех современных классов мшанок. Различия в строении выводковых структур,
а также органов, осуществляющих экстраэмбриональное питание, свидетельствуют
в пользу предположения, что живорождение эволюционировало неоднократно в пре-
делах различных групп Bryozoa. Важной особенностью живорождения у мшанок
является общеколониальный транспорт веществ через систему фуникулярных тя-
жей мезенхиматозной природы, позволяющий осуществлять экстраэмбриональное
питание в отсутствие функционирующего полипида в зооиде.
Тип Brachiopoda
Одиночные, исключительно морские эпибионты-фильтраторы с трехраздельным
целомом и двустворчатой обызвествленной раковиной. Большинство брахиопод раз-
дельнополы. Половые клетки развиваются из клеток целомического эпителия.
Живорождение у Brachiopoda отсутствует, однако довольно широко распростра-
нено вынашивание эмбрионов в мантийной полости или в лофофоре. В первом слу-
чае яйца либо приклеиваются к поверхности мантии (Waltornia, Frenulina), либо
развиваются в паре выводковых карманов, будучи прикрепленными к их стенке
105
тонким филаментом (Argyrotheca). Выводковые карманы являются расширенными
дистальными участками нефридиев. У Lacazella mediterranea выводковый карман
представляет собой непарную выемку в нижней створке раковины. Несколько эм-
брионов прикрепляются к концам особых выростов лофофора — циррей, погружен-
ных в полость выводкового кармана. Единственный случай внутрицеломического
вынашивания отмечен у Gwynia capsula, однако краткость описания не позволяет
понять какой выводковый карман развивается в яичниках этой брахиоподы. У дру-
гих организмов вынашивание в целоме во многих случаях является живорождением,
поэтому нельзя исключить возможность этого феномена и у Gwynia.
Тип Kamptozoa (Entoprocta)
Тип представлен билатерально симметричными, паренхиматозными, одиночны-
ми и колониальными, преимущественно морскими эпибионтами-фильтраторами. Те-
ло состоит из чашечки и стебелька, прикрепляющегося к субстрату (у одиночных
форм) или отходящего от столона (у колониальных форм). На чашечке формиру-
ется пищеулавливающий аппарат, представленный кольцевым венчиком щупалец с
Рис. 2.29. Участок колонии Kamptozoa (по: Nielesen, 1989):
ан — анус; ат — атриум; г — ганглий; го — гонады; сне — желудок; л.р — латеральные реснички; пч.з —
почкующиеся зооиды; пн — протонефридий; пщ — пищевод; р — рот; р.о.к — ректальный отдел кишечни-
ка; с.к — средняя кишка; с.с-—столониальная септа с порой; ст — стебель; сто — столон; ф.р — фрон-
тальные реснички; стрелками указано направление токов воды, создаваемых венчиком щупалец
106
ресничками. Пространство внутри венчика щупалец обозначается как атриум. Ро-
товое и анальное отверстия открываются внутри венчика щупалец. Кишечник U-
образный, залегает внутри чашечки (рис. 2.29). Единственный нервный ганглий рас-
положен над желудком. Выделительная система представлена парой протонефри-
диев. Большинство энтопрокт - гермафродиты. Яйца выводятся через гонодукты.
Осеменение интраовариальное. Развитие с личинкой.
Яйца у Kamptozoa мелкие (средний диаметр 40-60 мкм) и содержат мало желтка.
Дробление полное, не вполне равномерное, имеет черты спиральности. Закладка
энтодермы осуществляется путем инвагинации, а мезодерма формируется за счет
мезодермальных телобластов.
У представителей большинства видов эмбрионы вынашиваются в пределах атри-
ума, прикрепляясь к особому участку его дна {эмбриофору) при помощи слизистого
тяжа (Nielsen, 1989). У Loxosomella leptoclini и L. vivipara (семейство Loxosomatidae)
зигота после вымета помещается в выводковый карман — эктодермальное впячива-
ние задней части дна атриума (рис. 2.30, а). На стадии завершения формирования
личиночного кишечника между столбчатым эпителием выводкового кармана и эпи-
сферой личинки формируется плотный контакт. Значительное увеличение размеров
эмбриона, находящегося в выводковом кармане (рис. 2.30, б), позволяет предполо-
Рис. S.30. Зигота (а) и личинка (б) Loxosomella vivipara в выводковом кармане (по: Nielesen, 1966):
а.д — апикальный диск; в.к— выводковый карман; зи — зигота; л— личинка
107
жить направленный транспорт веществ от материнского организма к эмбриону и
рассматривать данное образование как плаценту. Таким образом, для двух видов
Kamptozoa характерно плацентарное живорождение.
Тип Chordata
ПОДТИП UROCHORDATA (TUNICATA)
Исключительно морские, билатерально симметричные животные. Хорда, нерв-
ная трубка и постанальный хвост (если есть) представлены только на личиночной
стадии и у одной неотенической группы (класс Appendicularia). Целомической по-
лости и экскреторных органов нет. Мышечные и другие структуры не сегменти-
рованы. Тело целиком заключено внутри секретируемой эпидермисом туники или
«домика», обычно состоящих из целлюлозы и белка и содержащих мигрировавшие
из тела клетки, а у некоторых форм — экстракорпоральные кровеносные сосуды.
Пищеварительный тракт U-образной формы с обширной глоткой, обычно занимаю-
щей большую часть объема тела. Нервная система представлена крупным ганглием,
расположенным между ртом и атриальным отверстием, и отходящими от него нерв-
ными стволами. Гермафродиты, обычно с непарными семенником и яичником.
Класс Ascidiacea
Подавляющему большинству асцидий свойствен прикрепленный образ жизни, и
лишь очень немногие из них могут медленно ползать. Тело мешковидной формы
Рис. 2.31. Продольный разрез асцидии:
а— атриум; ан — анус; г— ганглий; гл — глот-
ка; го — гонада; снс — желудок; о/с.щ — жаберные
щели; к — кишка; к.с — клоакальный сифон; р.с —
ротовой сифон; се — сердце; энд — эндостиль
с ротовым и клоакальным сифонами на
апикальном конце (рис. 2.31). Ротовой си-
фон ведет в перибранхиалъную полость,
содержающую сложный жаберный филь-
трационный аппарат в форме корзины.
Пространство между внутренними орга-
нами в виде узких синусов, в которые от-
крываются кровеносные сосуды. Половые
протоки впадают в клоаку. Осеменение
наружное или внутреннее.
Многие одиночные асцидии — яйце-
кладущие организмы, тогда как среди ко-
лониальных форм откладка яиц встреча-
ется крайне редко. При вынашивании ча-
ще имеют место различные формы яй-
цеживорождения, но зародыши практи-
чески всегда вынашиваются в перибран-
хиальной полости. У некоторых видов
развитие эмбрионов происходит в осо-
бых инкубационных сумках — выпячива-
ниях стенки тела. Полости этих образова-
ний могут терять связь с материнским ор-
ганизмом. Иногда встречается живорож-
дение, при котором зародыш получает
дополнительное питание от материнско-
го организма. У Botrylloides яйца, одетые
108
двухслойным фолликулярным эпителием, развиваются в полости тела и омываются
кровью. Из крови зародыши получают питательные вещества. При этом они уве-
личивается в размерах. Таким образом, данный тип живорождения относится к
абсорботрофному аденотрофному.
Развитие Hypsistozoa fasmeriana происходит в выводковой камере, образованной
в результате расширения яйцевода. Из мелких алецитальных яиц (диаметром при-
близительно 25 мкм) развиваются личинки до 6,8 мм длиной. На первых этапах
развития зародыш питается, переваривая фолликулярные клетки, что приводит к
исчезновению части фолликула. После этого энтодерма дорсолатерально образует
два трубкообразных выпячивания, проходящих сквозь эктодерму и открывающих-
Рис. 2.32. Приспособления к питанию эмбриона асцидии Hypsistozoa fasmeriana
(по: Brewin, 1956):
а — медианный разрез нейрулы; б — поздний зародыш; з.ч.к — задняя часть
кишки; п.т — нервная трубка; пи —пигмент личинки; п.« — передняя часть кишки;
пр — прикрепительные сосочки; хв — зачаток хвоста; экт — эктотроф; эт.т — экто-
дермальные трубки
109
ся наружу. Таким образом, гастральная полость зародыша вступает в сообщение
с полостью выводковой камеры (рис. 2.32, а). В дальнейшем дорсальная эктодер-
ма выпячивается через отверстие фолликула, формируя две латеральные складки.
Дистальные участки складок становятся зубчатыми, причем зубцы одной склад-
ки входят в выемки другой (рис. 2.32, б). Это образование, названное эктотрофом,
входит в контакт со стенкой выводковой камеры. Эпителий эктотрофа не секретиру-
ет туники. По-видимому, взаимоотношения зародыша и материнского организма у
Hypsistozoa fasmeriana можно отнести к разновидности плацентарного живорожде-
ния. Развитие представителей этого вида необычайно продолжительное — от опло-
дотворения до стадии хвостатой личинки проходит примерно пять месяцев. При
этом личинка содержит от 9 до 14 бластозооидов.
Класс Salpae
Представители класса — пелагические животные с цилиндрическим или верете-
новидным телом. Ротовой и клоакальный сифоны располагаются на противополож-
ных концах тела (рис. 2.33). Туника тонкая, прозрачная. Имеется только одна пара
жаберных щелей. Мускулатура в виде лент, опоясывающих тело сальп. Представи-
тели класса — протогинические гермафродиты. Яичник состоит из небольшого ко-
личества фолликулов. Осеменение внутреннее.
Рис. 2.33. Внешний вид сальпы (по: Жизнь животных, 1968):
«.с — клоакальный сифон; м.л— мышечные ленты; р.с — ротовой си-
фон; ст.п — брюшной столон с почками
Яйца сальп небольшие. Дробление полное, не вполне равномерное, асинхронное.
Для дробления характерно массовое вселение между бластомерами тестальных кле-
ток (test cells) из фолликулярного эпителия. Предполагается, что дробление имеет
билатеральный детерминированный характер. В результате дробления формируется
морулообразный зародыш, который приступает к морфогенезу.
Все сальпы характеризуются плацентарным живорождением. Фолликул с за-
ключенным в нем зародышем омывается кровью, из которой эмбрион получает пи-
тательные вещества, обеспечивающие его рост. По мере увеличения размеров за-
родыша он впячивается в клоакальную полость. Клоакальный эпителий на вер-
шине выпячивания разрывается, обнажая часть фолликула (рис. 2.34, а). Затем он
110
Рис. 2.34- Две стадии (а, б) морфогенеза сальпы Salpa maxima (по: Brien, 1948):
бл — бластомеры; гл — зачаток глотки; ин.с — инкубационные складки; и.п— инкубационная по-
лость; кр.п — крыша плаценты; кц — калимоциты (тестальные клетки); н.с— зачаток нервной системы;
пл — стенка плаценты; п.пл — полость плаценты; п.у — плацентарное утолщение; с.п — супраплацентар-
ная полость; су.с — супраплацентарная складка; фо — остаток фолликула; ц.п — центральная полость
бластофора
образует вокруг зародыша боковые стенки плацентарной полости, отделяющей-
ся от остальной полости тела перетяжкой. Фолликулярный эпителий деградиру-
ет со стороны клоаки, но сохраняется со стороны плацентарной полости, где фор-
мирует крышу плаценты с утолщением в центральной части (рис. 2.34). У некото-
рых сальп (Salpa maxima, S. fusiformis, Cyclosalpa pinnatd), объединенных в группу
111
Рис. 2.35. Различные стадии (а — д) развития Thalia democratica (по: Salensky, 1917, 1921):
гл — глотка; мс — зачаток желудка; к — зачаток кишечника; к.к.п—краевые клетки плаценты; кл —
клоака; кр.п— крыша плаценты; к.с.п — кровяной синус плаценты; м — мышечные ленты; мз— мезо-
дерма; н.г — нервный ганглий; об — внешняя оболочка; прк — перикард; пл — плацента; п.п — первичная
полость тела; пл.т — плацентарная ткань; се — зачаток сердца; ст — зачаток столона; эк—эктодерма;
эл — элеобласты; энд — эндостиль
112
Salpae Thecogona, стенки клоаки формируют вокруг зародыша кольцевую складку,
ограничивающую инкубационную полость. Последняя сообщается с клоакой узким
отверстием (рис.2.34, б). У других сальп —Salpae Gymnogona {Thalia democratica,
lasis zonaria), инкубационной полости не образуется.
Скопление тестальных клеток (test cells) образует бластофор. У Thecogona
между бластофором и крышей плаценты развивается супраплацентарная полость,
а в бластофоре также формируется небольшая «центральная» полость (Brien, 1948).
В дальнейшем, между обеими полостями устанавливается сообщение (рис. 2. 34, б).
В ходе органогенеза бластофор постепенно редуцируется: полость бластофо-
ра сливается с супраплацентарной полостью, на их месте формируется первич-
ная полость тела зародыша (гемоцель), в которой находятся клетки мезодермы.
У Gymnogona бластофор долгое время остается массивным, а центральной и супра-
плацентарной полостей нет.
Итак, зародыш сальп связан с матерью через плаценту, в формировании которой
принимает участие фолликулярный эпителий, образующий крышу плаценты, и кло-
акальный эпителий, ограничивающий плаценту латерально. Плацентарная полость
связана с гемоцелем матери узким горлышком (рис. 2.34) и отделена от супрапла-
центарной полости крышей плаценты. Таким образом, крыша плаценты отделяет
гемоцели матери и зародыша. В центральной части крыши плаценты развивает-
ся плотное разрастание — плацентарная шишка, частично закрывающая отверстие
плацентарной полости (рис. 2.34). Предполагается, что клетки плацентарной шишки
содержат энзимы, участвующие в превращении питательных веществ крови матери
в форму, пригодную для усвоения тестальными клетками и бластомерами, в част-
ности расщепляющие гликоген на простые углеводы.
В период органогенеза и редукции бластофора плацента достигает максимально-
го развития. Затем крыша плаценты становится рыхлым синцитием, богатым лаку-
нами. К этой синцитиальной массе присоединяются материнские кровяные клетки,
а также лимфоциты зародыша. Плацента примыкает к зародышу с брюшной сторо-
ны. В ходе развития эмбриональная эктодерма обрастает плаценту до ее горлышка.
Здесь она отрывается от клоакального эпителия матери, что связано с освобож-
дением зародыша. Между телом зародыша и плацентой формируется пережим —
пупочный стебелек, через который кровь зародыша проникает в плаценту и возвра-
щается из нее обратно (рис. 2.35). Постепенно плацента деградирует.
По мнению О. М. Ивановой-Казас (1978), плацентарное живорождение у сальп и
живорождение у некоторых асцидий, в частности у Hypsistozoa, возникло независи-
мо, на что указывают отличия в развитии, строении и функционировании.
* * *
Как видно из изложенного материала, наиболее распространенные типы живо-
рождения у беспозвоночных и низших хордовых животных — аденотрофное (особен-
но абсорботрофное) и плацентарное, а также различные переходные формы. Цито-
трофное живорождение отмечено только у известковых губок (класс Calcispongiae,
подкласс Calcaronea). У губок нет тканей, гомологичных тканям других Metazoa и
нет органов. Соответственно у животных с таким уровнем организации и не могли
возникнуть более сложные формы взаимоотношений развивающегося зародыша с
материнским организмом, чем на уровне отдельных клеток или их небольших ком-
плексов.
113
Лецитотрофное живорождение описано только для представителей нескольких
отрядов Insecta с полным превращением.
Таблица 2.2. Характеристика плаценты у некоторых беспозвоночных
и низших хордовых животных
Вид | Ткани матери
Ткани зародыша
Авторы
Тип Onychophora
Paraperipatus amboinensis Macroperipatus Внутренний эпителий матки » Эктодерма Pfliigfelder, 1948 Anderson, Manhon, 1972; Campiglia, Walker, 1995
Класс Insecta
Apiomorpha umalis (Homoptera) Фолликулярный эпителий Сероза (внезародышевая бластодерма) Buchner, 1957
Hesperoctenes fumarius (Homoptera) Фолликулярный эпителий; Стенка яйцевода Сероза; Плейроподии Hagan, 1931
Hemimerus talpoides (Dermaptera) Разрастание фолликулярного эпителия Тип Е Класс Ste Амнион и сероза ryozoa nolaemata Heymons, 1912
Cyclostomata Питающая ткань (стенка мембраной сумки) Класс Gyn Поверхностный эпителий inolaemata Harmer, 1898; Borg, 1926
Cheilostomata Эмбриофор (эпителий овицеллы) Поверхностный эпителий Vigelius, 1886; Calvet, 1900; Woollacott, Zimmer, 1972
P hylactolaemata Мезодермальный эпителий стенок эмбриональной сумки Тип Ка » Tiptozoa Braem, 1897, 1908; Brien, 1953
Loxosomatidae Эктодермальное впячивание части дна атриума Тип С1 Класс А Эктодерма эписферы предличинки iordata scidiacea Nielsen, 1966
Hypsistozoa fasmeriana Эпителий яйцевода Дорзальная эктодерма Brewin, 1956
114
Вид
Ткани матери
Ткани зародыша
Авторы
Класс Salpae
Salpae
Фолликулярный
эпителий;
Клоакальный
эпителий
Эмбриональная
эктодерма
Brien, 1948; Иванова-
Казас, 1978
Плацентарное живорождение встречается у моллюска Veloplacenta maculate.
(класс Gastropoda), у многих представителей типа Onychophora; у насекомых из
отрядов Blattoidea, Psocoptera, Homoptera и Heteroptera; у асцидии Hypsistozoa
fasmeriana; практически у всех сальп; у представителей семейства Loxosomatidae из
типа Kamptozoa, а также у мшанок из классов Stenolaemata (отряд Cyclostomata),
Gymnolaemata (отряды Ctenostomata и Cheilostomata) и Phylactolaemata. Плацен-
той (детским местом) называется орган, осуществляющий связь между организ-
мом матери и зародышем в период внутриутробного развития. Как явствует из
этого определения, оно вполне подходит к описанным нами случаям плацентар-
ного живорождения среди рассмотренных групп беспозвоночных и низших хор-
довых животных. Состав материнской фракции плаценты значительно варьиру-
ет у различных беспозвоночных, тогда как со стороны зародышей в ее построе-
нии участвуют лишь эктодермальные производные (табл. 2.2). Исключение состав-
ляют насекомые, у которых эмбриональная фракция плаценты представлена се-
розой (табл. 2.2). Разнообразие развития, строения и состава плаценты у различ-
ных беспозвоночных свидетельствует о ее неоднократном и независимом возникно-
вении.
2.3. ЭВОЛЮЦИЯ ЖИВОРОЖДЕНИЯ У БЕСПОЗВОНОЧНЫХ
И НИЗШИХ ХОРДОВЫХ животных
В эволюционной истории многих групп организмов забота о потомстве в фор-
ме вынашивания эмбрионов стала одним из важнейших приобретений, обеспечив-
ших их выживание. Живорождение рассматривается в качестве одного из важней-
ших результатов или составляющих эмбрионизации онтогенеза. Под эмбрионизаци-
ей подразумевается возникновение в процессе эволюции способности к прохождению
значительной части стадий зародышевого развития под защитой материнского тела
или специальных яйцевых оболочек. Таким образом, эмбрионизация и, следователь-
но, живорождение отражают тенденцию развития зародыша в более защищенной и
постоянной внутренней среде. Живорождение, сопровождаемое рядом изменений,
приводит к усилению роли внутренней среды в развитии зародыша и эмансипации
его от внешней среды. Следствием этого является быстрое и экономное развитие
сложного зародыша. Уменьшение сложности организации жизненного цикла зави-
сит от того, сколько стадий онтогенеза и какие из них проходят под защитой яйцевых
оболочек или материнского организма.
В эволюционном плане важнейшими функциями эмбрионизации, способствую-
щими приспособлению животных к освоению ими новых биотопов, можно считать
защищенность зародыша от внешних неблагоприятных факторов и сокращение жиз-
ненного цикла вследствие выпадения ряда стадий, характерных для анцестральных
115
видов, что, в свою очередь, направлено на рационализацию развития. Именно эм-
брионизация путем утраты провизорных адаптаций — личинки и метаморфоза, поз-
волила многим представителям беспозвоночных (как и позвоночных) выйти на су-
шу. К ним можно отнести Pulmonata (Mollusca), Chelicerata, Onychophora, Uniramia.
А. А. Захваткин (1949) называл эмбрионизацию «ведущей линией, столбовой доро-
гой прогрессивного развития».
Многие исследователи объясняли появление живорождения в различных груп-
пах беспозвоночных его адаптивным преимуществом над яйцерождением или яйце-
живорождением. Можно выделить несколько основных адаптивных свойств живо-
рождения:
1) защита зародыша от неблагоприятных факторов внешней среды;
2) укорочение сроков личиночной стадии;
3) редукция количества желтка (поскольку вителлогенез — сложный гормоноза-
висимый процесс, требующий больших энергетических затрат);
4) доступность легкоусвояемых пищевых ресурсов.
С экологических позиций переход от яйцерождения с личиночной стадией к яй-
цеживорождению связан с переходом от самостоятельного питания к иждивенче-
ству, а при живорождении — и к своеобразному паразитизму. Однако, как отме-
чал Г. А. Шмидт (1968), в отличие от настоящего паразитизма, питание зародыша
(Шмидт называл зародышей при живорождении «вторичной личинкой») при живо-
рождении осуществляется не за счет хозяина, а за счет специализированных тканей
материнского организма.
Своеобразие живорождения в ряду эмбриоадаптаций заключается прежде все-
го в питании зародыша за счет материнского организма. Живорождение следует
рассматривать как финальную стадию эволюции вынашивания, простейшая форма
которого — развитие зародышей на теле родительского организма (наружное вы-
нашивание) (например, Phoronida), а промежуточная — яйцеживорождение (многие
Demospongiae, Echinodermata и др.).
Беспозвоночные и низшие хордовые демонстрируют широкий спектр разнооб-
разных вариантов вынашивания, иллюстрирующих отдельные этапы перехода от
простого прикрепления эмбрионов к телу самки до их развития в ее половых путях,
целоме или гонадах. Очевиден тот факт, что увеличение времени пребывания заро-
дыша в непосредственном контакте с материнским организмом стало предпосылкой
формирования направленного перемещения веществ от самки к эмбриону и обратно.
С большой долей вероятности можно предположить, что на ранних этапах эво-
люции внутреннего вынашивания трофическая связь между развивающимся заро-
дышем, окруженным защитными яйцевыми оболочками, и материнским организмом
отсутствовала. Увеличение сроков пребывания эмбриона(ов) в половых путях самки
привело к тому, что зародыши, освободившись от яйцевых оболочек, могли получать
питательные вещества, заглатывая выделения половых путей матери. Дальнейшая
модификация трофических взаимоотношений системы зародыш-родительский ор-
ганизм привела к тому, что яйцевые оболочки были утрачены или сильно редуци-
рованы, а питательные вещества усваивались из окружающей жидкости как за счет
пиноцитоза и фагоцитоза (абсорботрофия), так и путем их активного заглатывания
(деглютотрофия). Прикрепление зародыша к стенке тела матери и формирование
комплексного специализированного тканевого органа—плаценты, обеспечивающей
трофику и удаление метаболитов зародыша, явилось следующим этапом эволюции
живорождения. В некоторых группах эмбриогенез (и экстраэмбриональное питание)
116
стал осуществляться непосредственно в полости тела самки или даже в гонадах.
Вкупе с защитной функцией это позволило аккумулировать в клетках развивающе-
гося организма большое количество питательных веществ и, следовательно, уско-
рить его развитие и сократить период пребывания во внешней среде. Кроме того,
оказалось возможным отказаться от личиночного питания, в значительной степени
увеличивающего сроки жизни во внешней среде и поэтому серьезно понижающего
шансы личинки на выживание.
Таким образом, главной предпосылкой возникновения живорождения у беспо-
звоночных и низших хордовых явился переход к вынашиванию — развитию дочер-
него поколения на или в родительском организме. Отметим, что причины и условия
формирования этого важнейшего эволюционного приобретения, обеспечивающего
резкое увеличение шансов на выживание, в тех или иных группах могли быть раз-
личными. Не вызывает сомнений, что вынашивание и, как следствие, живорождение
возникали неоднократно и независимо в пределах многих групп.
Так, у многих морских беспозвоночных развитие способности к вынашиванию
могло быть связано с приобретением нового личиночного типа. В свою очередь пе-
реход от планктотрофной к лецитотрофной личинке (и, как следствие, переход
от г- к К-стратегии) мог быть обусловлен изменениями в половом размножении,
выразившимися в отказе от формирования большого количества мелких алециталь-
ных или олиголецитальных яиц в пользу небольшого количества крупных макро-
лецитальных яиц. Преимущества накопления питательных веществ в яйцеклетке
очевидны: это обеспечивает ускоренное развитие эмбриона и независимость от по-
лучения питания извне. Однако данный переход, причины которого остаются неяс-
ными, имел серьезное негативное последствие — уменьшение числа потомков. В та-
кой ситуации отбором, по-видимому, были поддержаны именно те формы, которые
приблизительно в это же время обеспечили защиту потомства, перейдя к вынаши-
ванию.
Сходное предположение может быть выдвинуто и для групп насекомых с плацен-
тарным вынашиванием и клещей. В этих случаях количество откладываемых сам-
кой яиц относительно невелико, поэтому появление вынашивания и впоследствии
живорождения обеспечивало выживание большего числа потомков. Одной из воз-
можных причин могло явиться предохранение зародышей от высыхания.
У наземной немертины Geonemertes, онихофор и скорпионов (и псевдоскорпио-
нов), чьи предки были водными животными, возникновение вынашивания, очевид-
но, было связано с переходом к существованию на суше и невозможностью откладки
яиц во внешнюю среду. У Diptera (Cecidomydae) развитие следующего поколения в
организме матери обеспечило ускорение жизненного цикла, максимальную эксплу-
атацию пищевого субстрата и значительное увеличение числа потомков.
Таким образом, переход от откладки яиц к их вынашиванию, а в дальнейшем
и живорождению обеспечил эволюционный успех рассматриваемых групп организ-
мов. Для одних это выразилось в длительности существования на нашей планете,
для других - - в доминировании в современных биотопах. В любом случае эволюция
вынашивания и живорождения явилась одним из решающих факторов, позволив-
шим данным организмам успешно конкурировать и выживать в меняющихся усло-
виях среды.
117
РЕКОМЕНДУЕМАЯ ЛИТЕРАТУРА
Гиляров М. С. Закономерности приспособления членистоногих к жизни на суше. М.: Наука,
1970. 276 с.
Захваткин А. А. Сравнительная эмбриология низших беспозвоночных. М.: Советская наука,
1949. 395 с.
Иванова-Казас О. М. Эволюционная эмбриология животных. СПб.: Наука, 1995. 565 с.
Короткова Г.П. Половой эмбриогенез губок и закономерности его эволюции// Морфогенезы
у губок. Л.: Изд-во Ленингр. ун-та, 1981. С. 108-136.
Anderson D. Т. Embryology and phylogeny in Annelids and Arthropods. Oxford: Pergamon Press,
1973. 495 p.
Ankel W.E. Prosobranchia. Tierwelt Nord-Ostsee. 1936. 29. 240s.
Baba K. The early development of a Solenogaster, Epimenia verrucosa. Ann. Zool. 1940. Jap. Vol. 19.
P. 107-113.
Berrill N. J. Budding and development in Salpa. J. Morphol. 1950. Vol. 87. P. 553-605.
Boardman R. S., Cheetham A. H., Blake D. B. etal. Bryozoa (Part G, revised). P. 1-625 // Treatise
on Invertebrate Paleontology / Ed. R. A. Robinson. 1983. Vol. 1. Geological Society of America (Boulder,
Colorado) University of Kansas (Lawrence).
Chuang S. H. Brachiopoda // Reproductive Biology of Invertebrates / Eds K. G. Adiyodi,
R. G. Adiyodi. Vol. IV, Part B. New Delhi, Bombay; Calcutta: Oxford & IBH Publishing Co. Pvt. Ltd.,
1990. P. 211-254.
Emig С. C. Phoronida// Ibid. P. 165-184.
Fautin D. G., Spauling J. G., Chia F. S. Cnidaria // Reproductive Biology of Invertebrates. Vol. 4 /
Eds K.G. Adiyodi, R.G. Adiyodi. Calcutta.: Oxford and IBH Publishing, 1989. P. 43-62.
Hagan H. R. Embryology of the viviparous insects. New York, 1951. 472 p.
Hyman L. H. The invertebrates. Echinodermata. New York: McGraw-Hill, 1955. Vol. 4. 763 p.
Hyman L. H. The Invertebrates: smaller coelomate groups. New York: McGraw-Hill, 1959. Vol. 5.
VIII. 783 p.
Kaestner A. Invertebrate zoology. Vol. 2. Arachnids and Myriapods. Huntington; New York: Robert
E. Krieger Publ., 1980. 495 p.
Long J. A., Stricker S.A. Brachiopoda// Reproduction of Marine Invertebrates / Ed. A. C. Giese,
J. S. Pearse, V. B. Pearse. Vol. VI. Echinoderms and Lophophorates. Pacific Grove: Boxwood Press, 1991.
P. 47-84.
McEuen F. S. Phylum Echinodermata. Class Holoturoidea // Reproduction and development of
marine invertebrates of the Northern Pacific Coast / Ed. M. Strathmann. Seatie; London: Univ.
Washington Press, 1987. P. 574-596.
Meier R., Kotrba M., Ferrar P. Ovoviviparity and viviparity in the Diptera // Biol. Rev. 1999.
Vol. 74, N3. P. 199-258.
Nielsen C. Entoprocts. Synopses of the British Fauna / Eds D. M. Kermack, R. S. K. Barnes. 1989.
41. P.i-vii, 1-131.
Pianka H. D. Ctenophora// Reproduction of marine Invertibrates / Eds A. C. Giese, J. S. Pearse.
New York: Acad. Press, 1974. Vol. 1. P. 201—265.
Reed C.G. Bryozoa// Reproduction of Marine Invertebrates/ Eds A. C. Giese, J. S. Pearse,
V.B. Pearse. Vol. VI. Echinoderms and Lophophorates. Pacific Grove: Boxwood Press, 1991. P. 85-245.
Reuter E. Zur Morphologie und Ontogenie der Acariden. Acta Soc. sci. fenn. 1909. Bd36. S. 1-285.
Salensky W. Embryonalentwicklung der Salpen// Bull. Acad. Sci. 1921. N 3-10. P. 485-509.
Strom R. Brooding patterns of bryozoans// Biology of Bryozoans / Eds R. M. Woollacott,
R. L. Zimmer. New York: Acad. Press, 1977. P. 23-56.
Weber H. Lehrbuch der Entomologie. Jena: Gustav Fisher Verlag, 1953. 454 p.
Weygoldt P. 1964. Vegleichend — embryologische Untersuchungen an Pseudoscorpionen. I.// Z.
Morphol. Okol. Tiere. Bd54. S. 1-64.
Weygoldt P. 1965. Vegleichend — embryologische Untersuchungen an Pseudoscorpionen. I// Z.
Morphol. Okol. Tiere. Bd 55. S. 321—382.
Zimmer R. L. Phoronida // Reproduction of Marine Invertebrates / Eds A. C. Giese, J. S. Pearse,
V.B. Pearse. Vol. VI. Echinoderms and Lophophorates. Pacific Grove: Boxwood Press, 1991. P. 1-45.
СЛОВАРЬ ОСНОВНЫХ ТЕРМИНОВ
Абаксиальный — направленный от оси, внешний по отношению к оси.
Абсцизовая кислота (АБК)—гормон растений, по химической природе изопреноид.
Автономность зародыша (греч. autos — сам, nomos— закон) — свойство зародыша, харак-
теризующее его способность к саморегуляции и независимому от материнского организма раз-
витию.
Агамоспермия — образование семян с зародышем (или зародышами) без участия оплодотво-
рения.
Адаксиальный — направленный или обращенный к оси; в морфологии адаксиальная сторо-.
на — внутренняя сторона, расположенная ближе к продольной оси органа.
Адаптация (позднелат. adaptation — приспособление, прилаживание)—выработанные в про-
цессе эволюции приспособления, обеспечивающие существование индивидуумов, популяций и ви-
дов; в основе адаптаций лежит принцип целесообразности (соответствия) жизнедеятельности и
строения организмов условиям их обитания; поведение — направляющий фактор создания адапта-
ций, естественный отбор — рабочий механизм их образования.
Алейроновый слой (греч. aleuron — мука)—наружный слой (или несколько слоев) клеток
эндосперма злаков и растений других групп, который содержит алейроновые зерна и ферменты,
связанные с гидролизом запасных веществ в эндосперме.
Амнион (греч. amnion — жертвенная чаша)—одна из зародышевых оболочек у некоторых
членистоногих, рептилий, птиц и млекопитающих; формируется боковыми складками внезароды-
шевой эктодермы и мезодермы, которые приподнимаются и смыкаются над зародышем, образуя
амниотическую полость.
Амниопор — (греч. amnion — жертвенная чаша, poros — канал) — отверстие в амниотической
оболочке.
Амфибластула (греч. amphi — с обеих сторон, blastos — росток) — бластулоподобная личин-
ка известковых губок подкласса Calcaronea с резкими различиями между клетками переднего и
заднего полюсов; развивается из стомобластулы.
Антиклинальные деления — деления клеток с образованием оболочек, перпендикулярных
поверхности растущего органа.
Антоцианы — пигменты из группы флавоноидов.
Апойкогенные —скорпионы, зародыши которых развиваются вне фолликула яичника.
Апомиксис (греч. аро — без, mixis — смешение)—образование зародыша без слияния гамет.
В широком смысле слова — все способы воспроизведения и размножения, не связанные с половым
процессом, в узком — гаметофитный апомиксис.
Аппендикс (лат. ad. — к, pepdere — висеть)—длинный узкий дистальный придаток диверти-
кула овариальных трубок, который выполняет роль железы, выделяющей питательные вещества,
известен у живородящих скорпионов семейства Scorpionidae.
Атриум (лат. atrium — преддверие) — обобщенное название полости у животных; в разных
группах имеет различное происхождение и положение в теле.
Бластодерма (греч. blastos — зачаток и derma — слой, кожа)—пласт бластомеров, образу-
ющих стенку бластулы.
Бластула (греч. blastos — росток) — одна из первых стадий развития многоклеточного орга-
низма, на которой заканчиваются процессы дробления.
Бурса (лат. bursa — сумка)—впячивание или выпячивание покровов, часто использующееся в
качестве выводковой камеры.
Вайя (от греч. baton — пальмовая ветвь) —лист папоротника.
119
Велум (лат. velum — парус) — ресничный орган личинок брюхоногих и двустворчатых моллюс-
ков, служащий для плавания и обеспечивающий перемещение частичек пищи ко рту.
Водоносная система — водопроводящая система губки между остиями (порами) и оску-
люмом (устьем), состоящая из приносящей системы каналов, хоаноцитных камер и выносящей
системы каналов; различают водоносные системы асконоидного типа, когда внутренние полости
губки полностью выстланы хоаноцитами; лейконоидного типа, когда хоаноциты объединены в от-
дельные хоаноцитные камеры, разбросанные в мезохиле; сиконоидного типа, когда удлиненные
хоаноцитные камеры проходят через все тело губки от кортекса до атриума; силеибидного типа,
когда удлиненные хоаноцитные камеры располагаются радиально вокруг впячивания атриальной
полости.
Выводковая камера (сумка) — обобщенное название специальных эпителиальных образова-
ний в виде складок или глубокого кармана — впячивания покровов, служащих для вынашивания
яиц и зародышей.
Выводковая почка — специализированный орган вегетативного размножения и расселения
цветковых растений и папоротников.
Гаметофит (греч. gamete—жена, gametes — муж, phyton— растение)—половое поколение в
жизненном цикле растений; развивается из споры и продуцирует половые клетки (гаметы), содер-
жащие один набор хромосом.
Гастральная полость (греч. gastei—желудок) пищеварительная полость у книдарий, вы-
стланная энтодермой; реже — полость кишечника у личинок сальп.
Гастроваскулярная система (греч. gaster— желудок, лат. vasculum — маленький сосуд) —
пищеварительная система медуз и гребневиков; состоит из желудка и отходящих от него радиаль-
ных каналов, выполняющих трофическую и транспортно-распределительную функции.
Гаструла (греч. gaster — желудок) —зародыш животных на стадии гаструляции.
Гемицеллюлоза — один из полисахаридных компонентов матрикса клеточной оболочки рас-
тения; обычно встречается в форме ксиланов глюко- и галактоманнонов; много во вторичных обо-
лочках клеток эндосперма некоторых растений (запасное вещество).
Гемморизогенез — образование новой особи через формирование почек и корней; один из
путей морфогенеза при вегетативном размножении.
Гемолимфа (греч. haima — кровь, лат. lympha — влага) — жидкость, циркулирующая в сосудах
и межклеточных полостях многих беспозвоночных с незамкнутой кровеносной системой; содержит
клеточные элементы, часто дыхательные пигменты; выполняет те же функции, что кровь и лимфа
у животных с замкнутой кровеносной системой.
Гемоцель (греч. haima— кровь, koiljma— полость, углубление)—система кровеносных сину-
сов у некоторых беспозвоночных.
Герминативный эпителий (лат. germen — почка, бутон, греч. epi — на, thele — сосок, бугор,
пузырь)—слой клеток, выстилающих гонады и обеспечивающих формирование половых клеток.
Гиббереллины — гормоны растений из группы дитерпеноидных кислот.
Гипокотиль (греч. hypo — под, внизу, kotyle— углубление, чаша) — осевая стеблевая структура
зародыша, расположенная между радикулой (зародышевым корнем) и семядольным узлом.
Гонады (половые железы) (греч. pone —семя) —органы, в которых образуются и/или раз-
множаются половые клетки.
Деляминация (лат. delaminatio — отщепление) —один из способов гаструляции, при котором
происходит расщепление бластодермы на два слоя клеток.
Диаспора (греч. dia — приставка со значением сквозного движения, spora — сеяние, посев, по-
томок) — единица распространения, представляющая собой часть или целое растение различной
морфологической природы, естественно отделяющиеся от материнского растения.
Дробление — процесс деления зиготы на бластомеры.
Желточный мешок — орган питания, дыхания и кроветворения у зародышей многих живот-
ных; обычно формируется за счет обрастания желтка энтодермой и мезодермой.
Жировое тело—депо питательных веществ, источник метаболической воды, а также место
накопления и изоляции продуктов обмена веществ у многоножек и насекомых; основной структур-
ный компонент — жировая ткань.
Завязь —нижняя часть плодолистика в цветке растений; в ней развиваются семязачатки, из
которых после оплодотворения образуются семена.
Зародыш растений — зачаток спорофита нового поколения, образующийся в семязачатке из
зиготы (или яйцеклетки, иногда синергиды, при некоторых формах гаметофитного апомиксиса); в
120
зрелом семени з. имеет таксоноспецифическую форму, размеры и строение, адаптивные к способу
прорастания и образования проростка.
Зародышевая полоска — вытянутый слой клеток, образующийся на будущей брюшной сто-
роне зародыша в результате поверхностного дробления у многих членистоногих.
Зародышевый мешок — первый этап развития женского гаметофита у покрытосеменных
растений — от мегаспоры до образования структур яйцевого и антиподального аппаратов и цен-
тральной клетки; плоидность клеток з. м. различается и зависит от типа его развития.
Зеатин (3) — гормон растений, производный 6-аминопурина (6-(4-гидрокси-3-метил-2-
бутенил)аминопурин).
Индолилуксусная кислота (ИУК), или гетероауксин — гормон растений из группы аук-
синов, производное индола.
Интегумент (фр. in — не, tegument — оболочка) — структура семязачатка, окружающая мега-
спорангий (=нуцеллус); основные функции: защитная (участие в образование семенной кожуры
зрелого семени), образование микропиле, трофическая (снабжение зародышевого мешка питатель-
ными веществами).
Каменистая клетка=брахислереида — клетка, не обладающая прозенхимной формой и
имеющая более или менее равномерно утолщенные оболочки.
Карапакс (исп. carapacho— покрытие) — хитинизированная складка у многих ракообразных,
покрывающая заднюю часть головы, а также частично или полностью грудь.
Каротиноиды — желтые, оранжевые или красные пигменты, синтезируемые главным обра-
зом бактериями, грибами и высшими растениями; полиненасыщенные углеводороды терпенового
ряда.
Катойкогенные —скорпионы, зародыши которых развиваются в фолликуле яичника.
Клоака (лат. cloaca — труба для сброса нечистот) — расширенная задняя часть толстой кишки,
в которую открываются выделительные и половые протоки.
Клубенек — специализированный орган вегетативного размножения; представляет собой вы-
водковую почку, стебель которой, включающий одно или несколько междоузлий, сильно разраста-
ется и накапливает запасные вещества;.
Коксальные железы (лат. соха — бедро) — парные выделительные органы мечехвостов и
некоторых паукообразных, расположенные в головогруди; состоят из целомического мешочка, неф-
ростома, извитого канала (лабиринта) и выводного протока, обычно открывающегося у оснований
кокс.
Комиссура — поперечное соединение между нервными стволами или ганглиями.
Крахмал — основной резервный углевод растений, состоящий из линейной амилозы и разветв-
ленного амилопектина.
Луковичка —специализированный орган вегетативного размножения; представляет собой вы-
водковую почку, состоящую из запасающих низовых листьев, зачатков зеленых листьев и прида-
точных корней.
Максиллярные железы (лат. maxilla — челюсть) — парные выделительные железы у низших
ракообразных, мокриц и личинок высших раков; по происхождению, строению и функции подобны
антеннальным железам; выводные протоки открываются у оснований максилл.
Мальпигиевы сосуды — выделительные и осморегулирующие органы у паукообразных, мно-
гоножек и насекомых; представляют собой трубчатые слепые выросты кишечника.
Матка — полый мешковидный или каналообразный участок женской половой системы у жи-
вотных для размещения яиц или эмбриона.
Мегаспорогенез — процесс образования (в результате мейоза и цитокинеза) мегаспор в ну-
целлусе семязачатка.
Междоузлие — участок стебля между двумя соседними узлами побега.
Мезодерма (греч. mesos— средний, derma — кожа)—третий (средний) зародышевый листок,
располагающийся между эктодермой и энтодермой.
Метаморфоз (греч. metamorphosis—превращение) — у растений — видоизменения основных
органов в онтогенезе, связанные со сменой выполняемых ими функций или условий функциониро-
вания; у животных — глубокое преобразование организма, в процессе которого личинка превраща-
ется во взрослую особь.
Микропиле (греч. micros — малый, мелкий, pyle — ворота, вход) — канал, образуемый сомкну-
тым у верхушки нуцеллуса интегументом (или интегументами), через который пыльцевая трубка
растет к зародышевому мешку; часто через микропиле выходит зародышевый корень при прорас-
тании семени.
121
Микроспорогенез — формирование (в результате мейоза и цитокинеза) четырех гаплоидных
микроспор.
Миксоцель (греч. mixis — смешанный, koilos — полый) — полость тела смешанного происхож-
дения у членистоногих, в образовании которой принимают участие редуцированный целом (вто-
ричная полость тела) и кровеносная система (остатки первичной полости).
Нефридии (греч. nephros — почка) —органы выделения у беспозвоночных; представлены рес-
ничными или жгутиковыми клетками и системой ветвящихся эпителиальных канальцев; у некото-
рых животных служат также для выведения половых продуктов.
Нуцеллус— основная структура семязачатка, в которой у семенных растений происходят ме-
гаспорогенез и развитие женского гаметофита; н. часто потребляется развивающимся гаметофитом
еще до оплодотворения. В тех случаях, когда н. сохраняется, из него формируется в зрелом семени
запасающая ткань (см. перисперм).
Овариальные трубки (овариолы, яйцевые трубочки) (лат. ovum — яйцо) —трубочки, со-
бранные в два пучка и составляющие яичники у насекомых; каждая овариола подразделяется
перетяжками на ряд фолликулов.
Ооцит (греч. ооп — яйцо, kytos — пустой сосуд)—женская половая клетка в фазах роста и
созревания в период оогенеза.
Органогенез (греч. organon — орган, genesis — происхождение)—процесс формирования и
развития органов.
Осеменение — совокупность явлений, благодаря которым происходит контакт между муж-
скими и женскими половыми клетками; различают наружное и внутреннее осеменение.
Партеногенез (девственное размножение) (лат. parthenos—девственница, греч. genesis —
развитие) —одна из форм размножения, при которой зародыш развивается без оплодотворения.
Партенокарпия (греч. parthenos — девственница, karpos — плод) — образование на растении
плодов без оплодотворения, бессемянных или содержащих семена без зародышей.
Педогенез (греч. paidos — ребенок, genesis — развитие) — одна из форм партеногенеза, при
которой неоплодотворенные яйцеклетки, дающие начало новому поколению, развиваются уже в
теле личинки.
Первичная бороздка —утолщение наружного слоя зародышевой полоски у насекомых.
Перисперм (греч. реп —вокруг, около, возле, sperma — семя) —запасающая ткань семени,
образованная клетками нуцеллуса.
Планула (греч. planus — плоский) — личинка книдарий с гастральной полостью.
Плацента (греч. placus — лепешка) — у животных иначе детское место — орган, образующийся
во время беременности и осуществляющий связь зародыша с телом матери; у растений — струк-
тура, образующаяся из клеток меристемы завязи, на которой формируется семязачаток (семя);
осуществляет связь семязачатка (семени) с материнским организмом.
Плод —у растений — орган размножения цветковых растений, развивающийся из плодолисти-
ка и заключающий семена; у животных — организм млекопитающих (кроме однопроходных) в пе-
риод внутриутробного развития после закладки основных органов и систем.
Покой семени — физиологическое состояние, при котором резко снижаются скорость роста и
интенсивность обмена веществ в семени.
Полигерм (греч. polys — много, лат. дегтеп — почка) — совокупность зародышей, сформиро-
вавшихся в результате полиэмбрионии, у насекомых.
Полиэмбриония (греч. polys — много, embryon — зародыш)—у растений — развитие несколь-
ких зародышей в одном семени; у животных — развитие нескольких зародышей из одного яйца.
Провизорные органы (лат. provideo — предвижу) — временные органы у зародышей и личи-
нок животных, исчезающие к моменту рождения или в ходе метаморфоза.
Пролификация (лат. proles — отпрыск, потомство, /его — несу) — израстание цветка или пло-
да с образованием вегетативного побега или нового цветка над ним.
Пропагула (лат. ргорадо — отводок, потомок)—почка или побег, способные развиться во
взрослое растение; общий термин для обозначения органов и частей, служащих для вегетативного
размножения.
Сегментация (лат. segmentum — отрезок, часть) — процесс подразделения мезодермальной ча-
сти метамерного зародыша на ряд последовательно расположенных сегментов.
Семенная кожура — покров семени; в его образовании принимают участие один или оба
интегумента, а также ткань халазы.
122
Семя — единица диссеминации, свойственная семенным растениям; развивается на материн-
ском растении из семязачатка и содержит зачаток или зачатки (зародыши разного происхождения)
нового растения и специализированную запасающую ткань (эндосперм, перисперм), окруженные
защитным покровом — семенной кожурой.
Семядоля (греч. kotuledon — чашевидный сосуд) — первый особый лист, закладывающийся в
зародыше семенных растений; обычно у однодольных растений одна семядоля, у двудольных —
две, у хвойных — несколько.
Семязачаток — орган семенного растения, формирующийся на плаценте, в котором происхо-
дят мегаспорогенез, образование женского гаметофита и процесс оплодотворения; из с. в результате
сложных преобразований образуется семя; состоит из видоизмененного мегаспорангия (см. нуцел-
лус) и покровов (интегументов).
Сероза, серозная оболочка (лат. serum — сыворотка) — провизорный орган зародышей неко-
торых членистоногих; выполняет дыхательную и трофическую функции.
Синергида (греч. syn — вместе, ergon — работа)—клетка яйцевого аппарата (обычно две), в
которую изливается содержимое пыльцевой трубки, обычно имеет нитчатый аппарат; иногда вы-
полняет гаусториальную функцию.
Синцитий (греч. syn~ вместе, kytos— клетка) —один из типов строения тканей, при котором
нет клеточных границ и обособленных участков цитоплазмы с ядром.
Система репродукции — сочетание механизмов, участвующих в образовании инициальных
клеток нового организма, в формировании генеративных и вегетативных диаспор, которые могут
поддерживать существование популяций вида в достаточно большом ряду поколений.
Сорус (греч. soros — куча) — группа расположенных скученно спор или спорангиев либо га-
метангиев на поверхности таллома у красных и бурых водорослей, на листьях у папоротников, а
также у низших грибов.
Сперматофор (греч. sperma— семя, phoros — несущий)—заключенные в капсулу пакеты
сперматозоидов, склеенные выделениями придаточных желез самцов.
Спикула (лат. spiculum— кончик, жало)—элемент минерального скелета губок, обычно со-
стоящий из кремния или извести.
Спора (греч. spora — сеяние, посев, потомок) — специализированная клетка, образующаяся на
спорофите и служащая для расселения. У высших растений споры образуются в результате мейоза
(мейоспоры). Женские с. (мегаспоры) у семенных растений образуются в нуцеллусе семязачатка,
функцию расселения они утратили; их основная функция — развитие женского гаметофита с обра-
зованием в последнем половых клеток, или гамет. Мужские с. (микроспоры) образуются в гнезде
пыльника (эволюционно преобразованном микроспорангии). Микроспорангий семенных растений
сохранил функцию размножения микроспор, тогда как функция расселения замещена функцией
адресного переноса пыльцевых зерен (содержащих редуцированный мужской гаметофит, развив-
шийся из микроспоры) на семязачатки (у голосеменных растений) или на рыльца пестиков (у
покрытосеменных).
Спорофит (греч. spora — сеяние, посев, потомок, phyton — растение)—бесполое поколение в
жизненном цикле растений; развитие начинается с зиготы (или яйцеклетки) и завершается обра-
зованием спор в результате мейоза.
Стерробластула (греч. sterros — плотный, blastos —зачаток)—плотная бластула, лишенная
полости.
Стомобластула—(греч. stoma —рот, blastos — зачаток) — предличинка, характерная для из-
вестковых губок подкласса Calcaronea; незамкнутая бластула, жгутики которой обращены в ее
полость.
Стомодеум (греч. stoma — рот)—передняя кишка эмбриона.
Таннины — широко распространенная группа растительных веществ фенольной природы,
имеющих вяжущий вкус и дающих с солями железа зеленый до черного осадок.
Трихобласты (греч. thrix — род, падеж, tri ch os— волос, blastos — росток, зародыш, побег) —
клетки волосконосного слоя корня, способные образовывать корневые волоски.
Фиалопор (греч. phiale — сосуд, бутылка, poros — канал) — отверстие стомобластулы, через ко-
торое осуществляется экскурвация.
Фолликулл (лат. folliculus — мешочек) — полый пузырек яичника, в котором развиваются яй-
цеклетки.
Фолликулярная оболочка — оболочка, окружающая ооцит в ходе оогенеза.
Хоаноцит — клетка губок со жгутиком, окруженным воротничком из цитоплазматических
микроворсинок.
123
Хоаноцитная камера — сферическая, яйцевидная или удлиненная полость в мезохиле губ-
ки, выстланная хоаноцитами', находится между приносящим и выносящим каналами водоносной
системы.
Хорда (греч. chorde—струна)—эластичная несегментированная скелетная ось у хордовых
животных.
Хорион (греч. chorion — укрепление) — плотная оболочка яйца, выделяемая клетками яичника
у многих членистоногих, пресмыкающихся, птиц и млекопитающих.
Целом (греч. koiloma — углубление, полость)—вторичная полость тела, пространство между
стенкой тела и внутренними органами, имеющее собственную выстилку.
Целомоциты — клетки, находящиеся в целоме.
Экскурвация (лат. ех— вне, curvare— гнуть, кривить, изгибаться) —процесс выворачивания
стомобластулы через фиалопор с образованием личинки амфибластулы у известковых губок под-
класса Calcaronea.
Эктодерма (греч. ektos — вне, наружный, derma — кожа) — наружный зародышевый листок
эмбриона многоклеточных животных.
Эмбриогенез — процесс развития полового зародыша.
Эмбриоид (соматический зародыш) (греч. embryon — зародыш, oidos— вид) — зачаток инди-
видуума, образующийся асексуально in situ, in vivo, in vitro.
Эмбриоидогенез — процесс развития эмбриоида (соматического зародыша).
Эмбриоидогения (греч. embryon — зародыш, oidos — вид, genus — происхождение) —тип бес-
полой (вегетативной) репродукции цветковых растений in situ, in vivo, in vitro, элементарная струк-
турная единица — эмбриоид.
Эндосперм (греч. endon — внутри, sperma — семя) — структура, образующаяся в семени в ре-
зультате тройного слияния, многофункциональна — запасающая, защитная, трофическая ткань
для развития зародыша и проростка.
Энтодерма (греч. entos — внутри, derm — кожа) — внутренний зародышевый листок эмбриона
многоклеточных животных.
Эпидермис (эпидерма) (греч. epi — на, над, сверх, derma — кожа)—наружный слой клеток,
первичный по происхождению и специализированный в соответствии с его функциональным зна-г
чением в системе тканей того или иного органа.
Яичник —женская половая железа, в которой происходит развитие яйцеклеток.
Яйцеклетка — женская половая клетка (гамета); после оплодотворения преобразуется в зиго-
ту. При некоторых формах гаметофитного апомиксиса она развивается в зародыш без оплодотво-
рения.
Яйцо — зрелая женская половая клетка; по количеству и характеру распределения желтка в
цитоплазме выделяют следующие типы яиц: алецитальное (греч. а — без, likithos — желток)—яй-
цо, почти лишенное желтка; изолецитальное (греч. isos — равно) —желток распределен более или
менее равномерно; олиголециталъное (греч. oligos — мало) — яйцо, содержащее небольшое количе-
ство желтка; поли- или макролециталъное (греч. poly — много)—яйцо, богатое желтком; телоле-
цитальное (греч. telos — конец) — яйцо с ясно выраженной полярностью: желток у вегетативного
полюса, а ядро, окруженное свободной от желтка цитоплазмой, у анимального; центролециталъ-
ное (лат. centrum — центр) — богатое желтком яйцо с концентрическим расположением компонен-
тов: в центре ядро, окруженное свободной от желтка цитоплазмой (центроплазма), далее толстый
слой цитоплазмы с желтком, по периферии тонкий слой чистой цитоплазмы (периплазма).
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
а-Амилаза 47
а-Нафтилуксусная кислота 45
Абдомен 92
Абсцизовая кислота (АБК) 25, 26, 47, 48, 119
Автономность зародыша 48, 119
Агамоспермия 119
Адаптация 65,119
Акрон 85, 92
Акцессорные железы 90
Алейроновый слой 47, 119
Амебоидные клетки 81
Амебоциты 74
Амнион 81, 83, 87, 93, 95, 114, 119
Амниопор 79, 80, 83, 119
Амниотическая полость 79
Амфибластула 74, 76, 119
Анальное отверстие 78
Антенны 78, 92
Антоцианы 31, 119
Апойкогенные 86, 119
Апомиксис 16, 119
Аппендикс 87, 88, 119
Атриальное отверстие 108
Атриум 79, 107, 119
Базальная ламина 81
6-бензиламинопурин 45
Бластодерма 119
зародышевая 93
внезародышевая 79, 93
синцитиальная 93
Бластодермический пузырек 79
Бластомеры 81
Бластофор 111, 113
Бластула 79, 81, 119
Брюшко 92, 93
Бурса 97, 119
Вайя 28, 119
Вакуоли 79
Вакуолярные клетки 81
Вегетативный полюс 94
Велум 78, 120
Вивипария 9, 16, 47, 64, 65, 68
вегетативная 16, 17, 18, 27-47, 49, 51, 64, 65
гемморизогенная 17, 18, 29, 51, 64, 65
генеративная 16, 17, 20-26, 48, 50, 51, 64, 65
инфлоральная 17, 18, 29-37, 64-65
каулигенная 17, 18, 45, 64, 65
криптовивипария 16, 17, 25, 50, 64, 65
облигатная 16, 18, 20-26, 48, 50, 64, 65
факультативная 16, 18, 37, 49, 50, 51, 64, 65
фолиарная 17, 18, 37-45, 64, 65
эмбриоидогенная 17, 18, 41, 64, 65
фанеровивипария 17, 20-26, 64, 65
Вителлофаги 95
Внезародышевая часть бластодермы 79, 93
Внутренние выводковые сумки 102
Водоносная система губок 73, 120
асконоидная 73, 120
лейконоидная 73,120
сиконоидная 73, 120
силлеибидная 73, 120
Вторичные эмбрионы 100
Вторичный фолликул 100
Выводковая почка 9, 16, 27, 29, 32-36, 120
Выводковая сумка 90, 91, 120
Выводковые камеры 77, 78, 109, 120
Выводковые карманы 105, 107
Выделения половых путей 73, 78, 116
Вынашивание 100, 106
Гаметофит 120
Гаметы 98
Ганглии 79, 99, 107, 108
Гастральная полость ПО, 120
Гастроваскулярная система 77, 120
Гаструла 101, 120
Гемицеллюлоза 31, 120
Гемолимфа 94, 120
Гемоцель 72, 78, 83, 93, 113, 120
Гермафродитизм 98, 99, 107, 108
протогинический ПО
Герминативный эпителий 87, 88, 120
Гиббереллины 45, 120
Гидростатический скелет 78
Гипокотиль 21, 23, 24, 120
Гипоподий 32, 33
Глаза 78, 85, 92
Гликоген 79, 94, 113
Глотка 91, 108
Голова 92
Головной мозг 79
Гонады 77, 78, 97, 108, 120
125
Гонодукты 107
Гонозооид 100
Гонохоризм (раздельнополость) 99
Грудь 92
Деляминация 87, 120
Диаспора 16, 18, 27, 46, 47, 51, 120
Дивертикула 85, 88
Дробление 120
асинхронное 74, 86, 100, 104, ПО
дискоидальное 85
неравномерное 74, 91
неупорядоченное 86, 104
поверхностное 93
полное 74, 79, 86, 101, 104, 107, ПО
равномерное 86, 101
хаотическое 100, 101
Жабры 86
Жало 85
Жвалы 92
Жгутиковые клетки 75
Железистые клетки 95
Желток 72, 79, 94
Желточная оболочка 93
Желточный мешок (трофический пузырь) 79,
81, 85, 120
Желточный синцитий 94, 95
Желудок 107, 108
Живорождение 9, 10, 68, 72, 73, 85, 86
истинное живорождение 12, 68
яйцеживорождение 10, 68-71, 86
Жировое тело 92, 120
Завязь 20, 120
Заднебрюшие 86
Задняя кишка 92, 99
Запасные питательные вещества 73, 79, 83
Зародыш 18, 26, 72, 73, 81, 120
Зародышевая полоска 79, 80, 93, 94, 121
Зародышевая полость 83
Зародышевая часть плаценты 81
Зародышевый мешок 18, 121
Защитная мембрана 74
Зеатин (3) 45, 121
Зеатин рибозид (ЗР) 45
Зернистые бластомеры 75
Зигота 22, 98, 100, 102
Зооид 98
Иммиграция 104
Инвагинация 107
Индолилуксусная кислота (ИУК) 45, 121
Инкубационная камера 88
Инкубационная полость 111, 113
Инкубационная сумка 97, 108
Интегумент 22-24, 121
Интрацеломическое вынашивание 100, 102, 104
Интроверт 98, 102
Истинное живорождение 12, 68, 113
абсорботрофное 73, 77-79, 91, 104, 109
аденотрофное 73, 77, 79, 81, 87, 93, 97, 104,
109
гемоцельное 93
деглютотрофное 73, 91
лецитотрофное 72, 93
облигатное 93
переходное 113
плацентарное 73, 78, 79, 104, ПО, 115
факультативное 93
цитотрофное 73
Каменистая клетка 121
Карапакс 85, 121
Кариокинез 94
Каротиноиды 47, 121
Катойкогенные 86, 121
Кишечник 78, 85, 92
Клетки крови 113
Клоака 108, 121
Клоакальная полость 111
Клоакальный сифон 108, ПО
Клоакальный эпителий 111
Клубенек 16, 27, 32, 33, 51, 121
Кожные покровы 87
Коксальные железы 85, 121
Колониальная выводковая камера 100
Комиссура 79, 121
Конгенитальное срастание 24, 65
Копуляция 92
Крахмал 31, 121
Криптовивипария 16, 17, 25, 50, 64, 65
Крыша плаценты 111-113
Кутикула 79, 99, 103
Ларвипария 93
Легкие 86
Лимфоцит 113
Липиды 76
Личинка 85, 93, 98, 105, ПО
Лофофор 97, 98, 105
Луковичка 16, 27, 29-37, 121
Лябиум 92
Макромеры 75, 90
Максиллы 92
Максиллярные железы 92, 121
Мальпигиевы сосуды 85, 92, 121
Мангровые 16, 20, 48-50
Мангры 20
Мандибулы 92
Мантия 105
Мантийная полость 105
Матка 10, 72, 79, 121
Мегаспорогенез 35, 51, 121
Междоузлие 32, 33, 121
Мезентерии 98
Мезодерма 82, 113, 121
Мезодермальные телобласты 107
Мезосома 85, 97, 99
Мембрана оплодотворения 102
Мембранная сумка (перепончатый мешок) 100
126
Метаморфоз 121
Метанефридии 98
Метасома 85, 98
Метацель 98
Микровилли 81, 83, 103
Микроворсинки 124
Микромеры 90
Микропиле 22, 24, 121
Микроспорогенез 35, 51, 122
Миксоцель 92, 122
Мозг 79
Морулообразный зародыш 100, 110
Мультиларвипария 93
Мускулатура 78, 81
Нервная трубка 108, 109
Нервные тяжи 79, 92
Нефридии 78, 106, 122
Нефридиопоры 98
Нидаментальная железа 98
Нижняя губа 92
Нуцеллус 18, 122
Обертка 35
Овариальные трубки 87, 122
Оварий 104
Овицелла 102
Олиголарвипария 93
Ооцит 77, 93, 122
Ооэциальный пузырек 102
Ооэциостом 100
Ооэциум 102
Оперкулюм 102
Опистосома 85
Оральные папиллы 78
Органогенез 79-80, 91, 122
Осевой канал 88
Осеменение 122
наружное 98, 108
внутреннее 74, 79, 86, 89, 98, 108, НО
интрацеломическое 98
интраовариальное 98, 99, 107
Остии 78
Партогенез 93, 122
Партенокарпия 23, 122
Парус (велум) 78, 120
Паутинные железы 89
Педипальпы 85, 89, 91
Педогенез 93, 122
Первичная бороздка 79, 122
Перибранхиальная полость 108
Перисперм 18, 122
Перитонеум 89, 98
Пиноцитоз 73, 103
Пиноцитозные пузырьки 83
Питательная жидкость 88, 91
Питающая ткань 100, 104, 114
Питающие клетки 104
Планула 77, 122
Плацента 10, 73, 81-85, 95, 103, 115, 122
Плацентарная мембрана 74, 75
Плацентарная полость 111, 113
Плацентарная шишка 113
Плацентарное кольцо 82
Плацентарный диск 105
Плейроподии 95, 114
Плод 18, 20, 21, 24, 122
Покой семени 19, 122
Полигерм 95, 122
Полипид 98
Полиэмбриония 95, 100, 122
Половая камера 86, 91
Половое отверстие 91, 93
Половые железы 79
Половые протоки 77, 78, 108
Полувивипария 16, 29-32, 49
Полярное врастание 101, 104
Провизорные органы 72, 122
Пролификация 18, 122
Пропагула 37-41, 41-45, 51, 122
Просома 85, 97
Простые глазки 85
Протонефридии 107
Прямое развитие 79, 86
Псевдовивипария 16, 17
Псевдоцель 100
Пупипария 93
Пупочный канатик 81, 82
Развитие 77, 79
Раздельнополость 92, 98, 105
Раковина 105, 106
Рострум 88
Ротовое отверстие 79, 82, 83, 87
Ротовой сифон 108, 110
Сегментация 83, 122
Сегменты 85, 92
Секрет 81
Семенная кожура 18, 122
Семенник 108
Семя 18, 35, 51, 123
Семядоля 24, 45, 46, 123
Семязачаток 18, 123
Семяприемники 90
Сердце 78, 87
Сероза 87, 93-95, 114, 123
Синергида 22, 23, 123
Синцитиальная бластодерма 93
Синцитиальная эмбриональная оболочка 91
Система репродукции 50, 123
Сифон 108, ПО
Сорус 47, 123
Сосочек 88
Сперматофор 79, 89, 123
Спикула 73, 123
Спора 47, 123
Спорофит 18, 48, 123
Средняя кишка 87, 92
Стебелек 97, 106
Стебелек (пупочный канатик) 81-83
127
Стерробластула 79, 86, 123
Столон 106
Стомобластула 74, 75, 123
Стомодеальное впячивание 75, 76, 87, 88
Стомодеум 87, 123
Стрелка 34, 35
Супраплацентарная полость 113
Сфинктеры 82
Таннины 45, 123
Тельсон 85
Тестальные клетки 110, 111, 113
Торакс 92
Трахеи81, 86, 89, 92
Третичные эмбрионы 100
Трийодбензойная кислота 45
Трихобласты 123
Трофамнион 95
Трофический пузырь (желточный мешок)
79-81, 85, 120
Туника 30, 31, 108, ПО
Униларвипария 93
Униполярная иммиграция 87
Усики 92
Фагоцитоз 73, 75
Фанеровивипария 17, 20-26, 64, 65
Фиалопор 76, 123
Фолликул 86, 89, ПО, 123
Фолликулярная оболочка 88, 89, 123
Фолликулярные клетки 88, 93, 109
Фуникулярные тяжи 103, 104
Хелицеры 85, 88, 89
Хоаноцит 74, 76, 123
Хоаноцитная камера 76, 124
Ходильные ноги 85
Хорда 108, 124
Хорион 86, 90, 93, 124
Целобластула 104
Целом 77, 97, 124
Целомический эпителий 99
Целомопора 98, 102
Целомоциты 77, 124
Цилиндрический эпителий 103
Цирри 106
Цистид 98, 99, 101, 102
Чашечка 106
Челюсти 92
Щупальца 99, 106
Щупальцевое влагалище 99, 102
Экзоцитоз 103
Экскурвация 74, 124
Экстраэмбриональное питание 101, 102
Эктодерма 79, 82, 124
Эктотроф ПО
Эмбриогенез 72; 98, 116, 124
Эмбриоид 27, 45
Эмбриоидоген ия 124
Эмбрион 73, 100, 101, 104
Эмбриональная капсула 74, 76
Эмбриональная оболочка 91
Эмбриональная сумка 102, 104
Эмбриональный карман 102
Эмбриональный мешок 81-83
Эмбриональный паразитизм 94
Эмбриофор 103, 104, 107
Эндосперм 18, 24, 25, 124
Энзимы 113
Энтодерма 79, 82, 124
Эпиболия 104
Эпидермис 37, 42, 97, 124
Эпистом 97
Эписфера 107, 114
Эпителиальный мешок 81-83
Эпителий 81, 114
Яичник 10, 72, 79, 86, 92, 104, 108, 124
Яйцевод 10, 72, 78, 86, 92, 95, 109
Яйцевые оболочки 68, 72, 79, 91
Яйцекладущие животные 68
Яйцеклетка 117, 124
Яйцеживорождение 10, 68, 76, 77, 85, 86, 92, 93,
96, 102, 108
прямое 68
личиночное 68
Яйцерождение 11, 68, 85, 108
Яйцо 124
алецитальное 72, 74, 79, 86, 104, 109, 117
изолецитальное 72, 74, 79, 101
макролецитальное 117, 124
олиголецитальное 86, 101, 117
полилецитальное 79, 85, 86, 93, 94, 101
телолецитальное 101
центролецитальное 124
УКАЗАТЕЛЬ ЛАТИНСКИХ НАЗВАНИЙ РАСТЕНИЙ
Acanthus ilicifolius 49, 53
Aegialitis 25, 50, 64
annulata 26, 50
Aegiceras 25, 53, 64
comiculatum 26
Agrostis vulgaris 37, 49, 60
Allium 27, 28, 32, 35, 37, 49, 51, 54
aflatunense 51, 54
carinatum 51, 54
caeruleum 34, 51, 54
decipiens 51
fetissovii 54
fistulosum 54
oleraceum 28, 29, 51
proliferum 32, 35, 51
sativum 35, 36, 54
scorodoprasum 51, 54
senescens 28, 29, 51, 54
tulipaefolium 54
viheale 29
Alliaceae 28, 54
Amaryllidaceae 37, 56
Amphibolis 25, 58
Anagallis phoenicea 28
Arabidopsis 25, 56
Arabis pumila 27, 28, 37, 56
Araceae 37, 56
Arecaceae 25, 26, 56, 64
Ardisia escallonioides 26
A splenium
bulbiferum 28, 46, 47
celtidifolium 28
cirrhatum 28
edgeworthii 28
flagelliferum 28
flagellifolium 28
rhachirhizon 28
viviparum 9, 28, 46, 47
Atherurus tematus 37
Avicenia 10, 25, 56
marina 25, 56
Avicenniaceae 25, 56
Balanophora 18
Brassica oleraceae 37
Bromus pumpellianus 49
Bruguiera 10, 20, 24, 50, 63, 64
eriopetala 24
exariststa 26, 63
gymnorrhiza 26, 63
Bryophyllum 10, 41, 50, 51, 57
daigremontianum 27, 28, 37, 41-45, 57
fedtschenkoi 57
pinnatum 19, 28, 42-45, 57
rosei 57
tubiflorum 27, 28, 57
Brassicaceae 27, 28, 37, 56
Cardamine 10, 50, 51, 56
mathioli 27, 28, 56
pratensis 27, 28, 37, 56
silvatica 37
uliginosa 37
Caryophyllaceae 18, 56, 57
Cassipourea elliptica 26
Ceraptopteris thalictroides 28
Ceriops 10, 20, 24, 50, 63, 64
candolleana 24, 63
decandra 26, 63
tagal 26, 63
Chelidonium majus 37, 59
Chirita scinensis 37
Crassulaceae 27, 37, 57, 58
Cucurbitaceae 50,58
Curculigo 37
Cymbopogon 37, 51, 60
Cymodoceaceae 25, 58
Deschampsia 60
alpina 29, 60
flexuosa 37, 49, 60
Dentaria 28
bulbifera 28
Dioscorea bulbifera 29, 58
Drosera 58
anglica 37
intermedia 27, 28, 58
rotundifolia 27, 28, 58
Droseraceae 27, 37, 58
Echeveria 37
Episcia bicolor 37
Eriogonum viviparum 9
129
Euphorbia
helioscopia 28
peplus 28
Festuca 50, 61
ovina var. vivipara 9, 16
rubra x vivipara 50
vivipara 29, 49, 51, 61
Fritillaria 37
Gagea 58
arvensis 28, 29, 58
bulbifera 28, 29, 59
liotardi 29, 59
sinensis 37
Gesneriaceae 37
Gleichenia alpine 28
Hammarbya paludosa 27, 28, 37-41, 50, 51, 59
Haycinthaceae 27, 58
Hyacinthus 27, 37, 58
pouzolsii 27, 28, 58
Kandelia 10, 50, 63, 64
candel 26, 63
Lilium 28, 59
bulbiferum 28, 29, 59
lancifolium 28, 59
tigrinum 28, 59
Liliaceae 28, 37, 59
Limonium peregrinum 26
Linaria vulgaris 28
Myrsinaceae 25, 26, 59, 64
Nasturtium officinale 37
Nypa 25, 64
fruticans 26
Nymphaea 27, 51, 59
guineensis 27, 28, 37, 59
micrantha 27, 28, 59
Nymphaeaceae 9, 27, 37, 59
Orchidaceae 9, 27, 37-41, 59
Ornithogalaceae 27, 37, 59
Omithogalum 27, 28, 37, 59
scilloides 27, 28, 59
Papaveraceae 37, 59 '
Pelliciera 25, 59
Pellicireaceae 25, 59
Phoenix reclinata 26
Pineilia tuberifera 28
Pinguicula backeri 37
Pinguiculaceae 37
Piperaceae 18
Plumbaginaceae 25, 26, 59, 64
Poaceae 9, 59-62, 64
Poa
alpigena 50, 61
alpina 29, 62
alpina var. vivipara 32
arctica 49, 62
bulbosa 16, 29-32, 49, 50, 62
chaixii 49, 62
chaixii x longifolia 49, 64
longifolia x pratensis 49, 62
sublanata 50, 62
viviparum 9, 10
xjemtlandica 29
Polygonum viviparum 9, 10, 28, 29, 32, 33, 49, 51
63
Polygonaceae 28, 62, 63
Quercus robur 25
Ranunculaceae 9, 63
Ranunculus ficaria 28, 32
Scelevafus 45, 46
Remusafia vivipara 9
Rhizophora 10, 20, 24, 50, 63, 64
conjugata 21-23, 63
mangle 20, 22-25, 63
mucronata 21, 63
stylosa 26, 64
Rhizophoraceae 20-26, 63, 64
Rochea falcata 37
Rorippa palustris 37
Saxifraga
bulbifera 29
cemua 29
Saxifragaceae 64
Sparaxis bulbifera 29
Stellaria media 19
Theobrma cacao 25
Triticum 32, 49, 62
Viscum 18
Zea 25, 62
УКАЗАТЕЛЬ ЛАТИНСКИХ НАЗВАНИИ
БЕСПОЗВОНОЧНЫХ И НИЗШИХ ХОРДОВЫХ
Acari 70, 92
Amphipholis japonica 70, 97
Amphipholis squamat 70, 97
Annelida 69, 77
Apiomorpha umalis 95, 96, 114
Appendicularia 108
Arachnida 70, 86
Argyrotheca 106
Ascidiacea 71, 108, 114
Asterina pseudoexigna pacifica 97
Asteroidea 70, 97
Beania bilaminata 71, 102
Beaniidae 102
Bicellariells cilita 71, 102
Bivalvia 69, 77
Blattoidea 93, 95, 115
Botrylloid.es 71, 109
Brachiopoda 98, 105
Bryozoa 70, 98, 114
Bugula 71, 102
Bugulidae 71, 102
Buthidae 70, 87, 89
Calcaronea 69, 74, 113
Calcispongia 69, 73, 113
Calyptotheca variolosa 71, 103
Candidas 103
Catenicellidae 103
Cecidomydae 70, 93, 94, 117
Cellaria 71, 103
Cellariidae 103
Celleporella hyalina 71, 103, 104
Cheilostomata 71, 98, 102, 114, 115
Chelicerata 70, 85, 116
Chordata 71, 108, 114
Chriodota rotifera 97
Chrysaora hysoscella 69, 76
Cnidaria 69, 76
Coeloplana 77
Costaticella 71, 103
Cribrilinidae 103
Crisiella producta 100
Ctenophora 69, 77
Ctenostomata 70, 98, 101, 115
Cucumaria glacialis 97
Cyclosalpa pinnata 113
Cyclostomata 70, 98, 100, 101, 114, 115
Diptera 10, 93, 117
Dermaptera 93, 95, 114
Echinodermata 70, 97, 116
Ectoprocta 98
Entoprocta 106
Epiperipatus trinidadensis 79, 82, 83
Epistomia bursaria 71, 104
Epistomiidae 104
Fifularia figularis 71, 103
Flustrellidae 102
Fredericella 71, 104
Frenulina 105
Gastropoda 69, 78
Geonemertes agricola 69, 97
Grantia compressa 75
Gregarinidra serrafa 71, 102
Gwynia capsula 106
Gymnogona 113
Gymnolaemata 70, 101
Halictoxenos simplicis 94, 95
Halomenia 70, 77
Hemimerus talpoid.es 95, 114
Hemimetabola 93
Hesperoctenes fumarius 95, 114
Heterometrus scaber 87, 88
Heteronemertini 69, 77
Heteropeza pygmaea 93, 94
Heteroptera 70, 95, 115
Hippotoidae 103
Holometabola 93
Holoturoidea 70, 97
Homoptera 70, 95, 114, 115
Hoplonemertini 69, 77
Hormurus australisiae 87—89
Hymenoptera 94
Hypsistozoa fasmeriana 109, 110, 113-115
Gastropoda 69, 115
Geonemertes 69, 117
Gymnolaemata 70, 101, 114, 115
131
lasis zonaria 113
Insecta 70, 92, 114
Ischnurus ochropus 88
Isosecuriflustra angusfa 71, 102
Janthina janthina 70, 78
Kamptozoa 71, 106, 114, 115
Knemidocoptes 70, 92
Lanceoporidae 103
Lacazella mediterranean 106
Leptosynapta clarki 97
Linens viviparus 69, 77
Littorina saxatilis 69, 78
Lychas tricarinatus 70, 87
Lophophorata 97
Loxosomatidae 71, 107, 114, 115
Loxosomella leptoclini 71, 107
Loxosomella vivipara 71, 107
Macroperipatus (Peripatus) acacioi 79-83, 114
Miastor metraloas 93
Mimosella cookae 71, 101, 102
Myriapora truncata 71, 103
Myriaporidae 103
Mollusca 69, 77, 116
Nemertini 69, 77
Neobisium 91
Nereis limnicola 77
Nolella dislatata 70, 102
Nolella papuensis 71, 102
Oneirophanta mutabilis 70, 97
Onychophora 70, 78, 114-116
Ophiuroidea 70, 97
Paracribricellina cribraria 71, 103
Paraperipatus amboinensis 79, 80, 83, 114
Patriella paravivipara 97
Patriella vivipara 9, 97
Pediculopsis 70, 92
Peripatopsis 78, 79
Peripatus edwardsii 83
Peripatus torquatus 83
Peripatus trinidadensis 84
Petrobiona massiliana 76
Phoronida 98, 116
Phoronis australis 98
Phoronis hippocrepia 98
Phoronis ijimai 98
Phoronis muelleri 98
Phoronis psammophila 98
Phoronis ovalis 98
Phoronis vancouverensis 98
Phoronopsis harmeri 98
Phylactolaemata 71, 98, 104, 114, 115
Phyllophora uma 97
Platyctenida 69, 77
Plumatella 71, 101, 105
Polychaeta 69, 77
Porifera 69, 73
Prosoptera 93, 115
Prosorochmus viviparus 69, 77
Pselaphochemes 90, 91
Pseudoscorpiones 70, 89
Psocoptera 70, 93, 95
Pterocella scutella 71, 103
Raphidrillus nemasoma 77
Reciprocus regalis 71, 103
Salpa fusiformis 113
Salpa maxima 111, 113
Salpae 71, 110, 115
Scorpiones 70, 86
Scorpionidae 70, 89
Scrupocellaria ferox 71, 103
Scrupocellaria scruposa 71, 103
Scypha cf. ciliatum 74
Scyphozoa 69, 76
Solenogastres 70, 77
Sphaeridae 77
Stictococcus 96
Stenolaemata 70, 100, 114, 115
Strepsiptera 70, 93, 94
Stylops 94
Sundanella sibogae 71, 101, 102, 104
Sycon ciliatum 75
Synapta hydriformis 97
Synnotum aegyptiacum 71, 104
Taeniogyrus confortus 97
Tentaculata 97
Thalia democratica 112, 113
Thecogona 113
Tjalfiella 77
Tunicata 108
Uniramia 70, 92, 116
Urceolipora папа 71, 103
Urceoliporidae 103
Urochordata 71, 108
Urodactus abruptus 88
Valkeria uwa 70, 102
Vejovidae 70, 87, 89
Veloplacenta maculata 70, 78, 115
Viviparus viviparus 9, 78
Waltomia 105
Xenos bohlsi 94
Учебное издание
Татьяна Борисовна БАТЫГИНА, Елена Александровна БРАГИНА,
Александр Вадимович ЕРЕСКОВСКИЙ, Андрей Николаевич ОСТРОВСКИЙ
ЖИВОРОЖДЕНИЕ У РАСТЕНИЙ И ЖИВОТНЫХ:
БЕСПОЗВОНОЧНЫХ И НИЗШИХ ХОРДОВЫХ
Учебное пособие
Директор Издательства СПбГУ
проф. Р. В. Светлов
Главный редактор
Т. Н. Пескова
Редактор Е. В. Васильева
Обложка художника Е. А. Соловьевой
Верстка Е. М. Воронковой
Лицензия ИД № 05679 от 24.08.2001
Подписано в печать 21.04.2006. Формат 70x100 1/ie-
Бумага офсетная. Печать офсетная. Усл. печ. л. 10,96. Заказ № 185
Издательство СПбГУ.
199004, С.-Петербург, В.О., 6-я линия. 11/21
Тел. (812) 328-96-17: факс (812) 328-44-22
E-mail: editor@unipress.ru
www.unipress.ru
По вопросам реализации обращаться по адресу:
С.-Петербург, 6-я линия В. О., д. 11/21, к. 21
Телефоны: 328-77-63. 325-31-76
E-mail: post@unipress.ru
Типография Издательства СПбГУ.
199061, С.-Петербург, Средний пр.. 41