Author: Герасимов В.В. Монахов А.С.
Tags: общее машиностроение технология машиностроения ядерное оружие ядерные реакторы
Year: 1982
Text
В. В. Герасимов
АСМонахов
МАТЕРИАЛЫ
ЯДЕРНОЙ
ТЕХНИКИ
В. В. Герасимов,
А.СМонахов
МАТЕРИАЛЫ
ЯДЕРНОЙ
ТЕХНИКИ
Издание второе,
переработанное и дополненное
Допущено Министерством
высшего и среднего
специального образования СССР
в качестве учебника
для студентов высших
учебных заведений,
обучающихся по специальности
«Атомные электрические станции и установки»
ЕЭ
МОСКВА • ЭНЕРГОИЗДАТ 1982
УДК 621.039.53(075.8)
Герасимов В. В., Монахов А. С. Материалы ядерной техники:
Учебник для вузов. — 2-е изд., перераб. и доп. — М.: Энергоиздат,
1982, 288 с.
Изложены требования, предъявляемые к реакторным материа-
лам. Приведены характеристики теплоносителей и рассмотрены про-
цессы, происходящие в них под действием облучения. Описаны струк-
тура, свойства конструкционных и ядерно-горючих материалов и
влияние на них эксплуатационных факторов. На современном науч-
ном уровне рассмотрены вопросы прочности, совместимости, радиа-
ционной, коррозионной стойкости конструкционных и топливных ма-
териалов.
Учебник рассчитан на студентов энергетических факультетов
высших учебных заведений, а также научных работников и инже-
неров, работающих в областях науки и техники, связанных с ядер-
иой энергетикой (1-е издание вышло в 1973 г.).
Табл. 65. Ил. 63. Библиогр. 20.
Рецензент: Кафедра теплофизики и атомной энергетики ТПИ
_ 2304000000-204
1 034(О1)-82 И'81
© Энергоиздат, 1982
ПРЕДИСЛОВИЕ
Решением XXVI съезда КПСС намечено ввести в действие в 1981—
1985 гг. атомные электростанции мощностью 24—25 млн. кВт с дове-
дением выработки электроэнергии до 220—225 млрд. кВт-ч в год. На-
ряду с сооружением реакторов единичной мощности 1 тыс. МВт будут
строиться энергоблоки с реакторами 1,5 тыс. МВт. Успешно эксплуа-
тируются реакторы ВВЭР и РБМК на многих АЭС. Советские атомные
ледоколы способствуют плаванию судов по Северному морскому пути
в течение всего года.
Надежная и экономичная работа ядерных энергетических устано-
вок (ЯЭУ) невозможна без самого серьезного подхода к выбору кон-
струкционных материалов. В нашей стране в этой области имеются
значительные успехи. Правильное решение вопросов, возникающих
при конструировании, проектировании и эксплуатации АЭС, требует
также четкого понимания процессов, происходящих в теплоносителях
ЯЭУ.
Учебник написан применительно к курсу «Физико-химические про-
цессы в реакторах», читаемому на кафедре АЭС в Московском энерге-
тическом институте. Рассчитан на лиц, не специализирующихся в об-
ласти материаловедения. В связи с этим авторы стремились сочетать
доступность изложения материала с необходимой (там, где это неиз-
бежно) углубленной проработкой теории и практики материаловеде-
ния на современном уровне знаний.
Авторы считают, что специалист в области атомной энергетики толь-
ко тогда сможет успешно трудиться при конструировании, проекти-
ровании или эксплуатации ЯЭУ, когда он творчески освоит и сможет
грамотно применить на практике последние достижения в области фи-
зической химии процессов, протекающих в реакторных системах, и ма-
териаловедения. Без этих знаний нельзя успешно создавать и эксплу-
атировать новые мощные, экономичные и надежные ядерные энерге-
тические установки.
Главы 1; 2; § 1—3 главы 4; § 7 главы 8; § 3 и 4 главы 9 написаны
А. С. Монаховым, остальное—В. В. Герасимовым.
Глава 1
КОНСТРУКЦИОННАЯ СХЕМА
ЯДЕРНОЙ ЭНЕРГЕТИЧЕСКОЙ УСТАНОВКИ
Основой любой ядер ной энергетической установки (рис. 1.1) явля-
ется реактор /, в котором размещается активная зона реактора 15, где
происходит цепная реакция деления ядерного горючего с выделением
тепловой энергии. Теплоноситель 13 транспортирует выделившееся
в результате распада ядерного горючего тепло в парогенератор 3, где
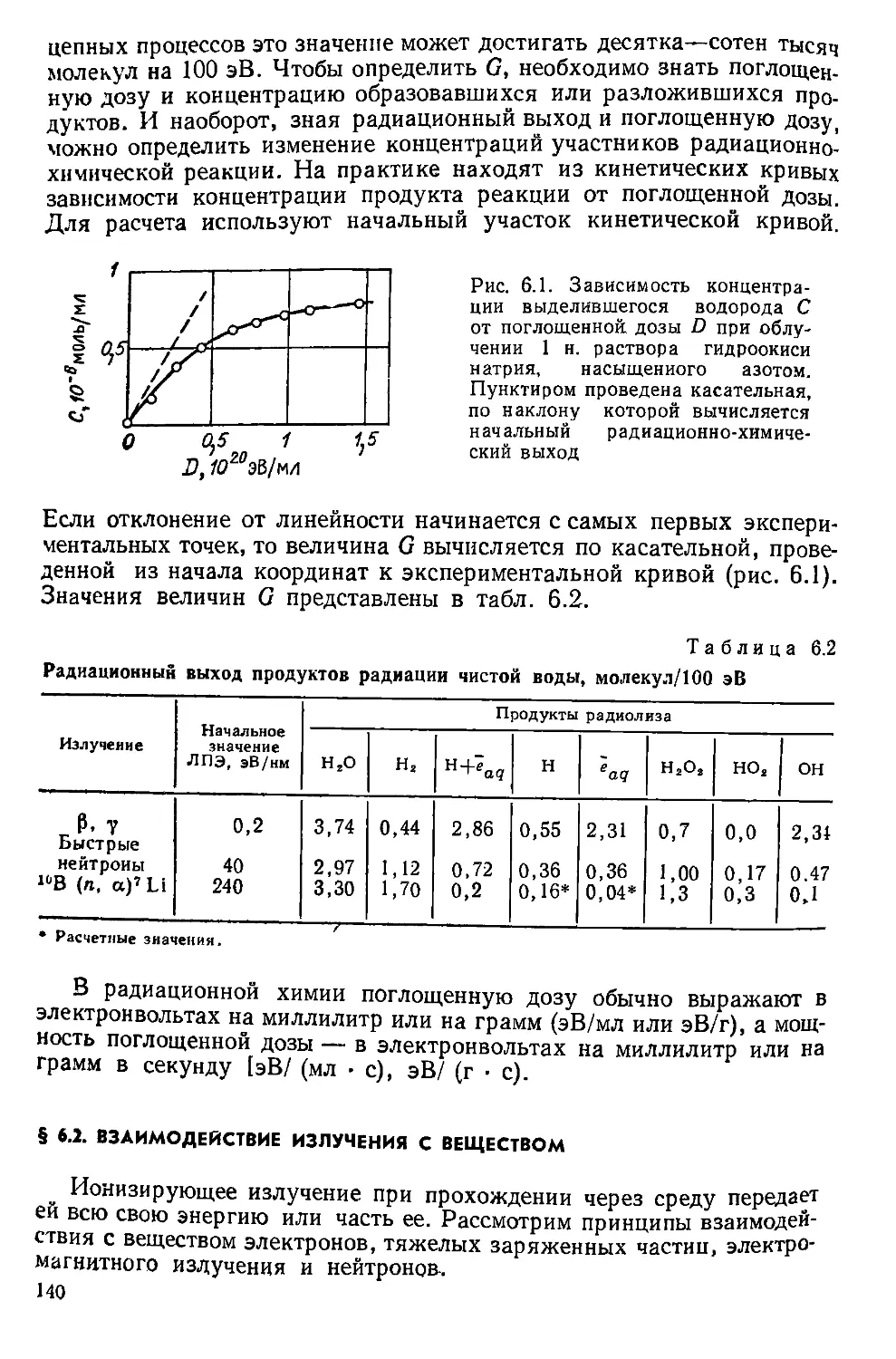
Рис. 1.1. Принципиальная тепловая схема двухконтурной ядерной энергетической
установки с реактором типа ВВЭР:
/ — реактор; 2 — стержни регулирования и аварийной защиты; 3 — парогенератор: 4 — тур-
б 1На, 5 — электрогенератор; 6 — конденсатор: 7 — конденсатный насос: 8 — регенеративные
по огреватели; 9 — деаэратор; 10 — питательный насос; 11 — главный циркуляционный насос;
12 — отражатель нейтронов; 13 — теплоноситель; 14 — биологическая защита: 15 — активная
зона, 16 — корпус реактора
ХХСяТ^АередаЧа ЭТ0Г0 тепла во внешний, II контур. Образовав-
шая схема туНпРаТОре паЯ>направляется в паровую турбину 4. Та-
виях облучим 1 К0Нтур Работает в усло-
ПяпллЛпо Я’ В0 контуре активность отсутствует.
зоне оеактлпя°АзаНИе1Мо?КеТ пРоисх°Дить и непосредственно в активной
ет и обпячХм„ » С’ в этом слУчае парогенератор ЯЭУ отсутству-
Такая1 Sa Хт” В РеаТре пар идет непосредственно в турбин?,
все обооуллвяииа1 «а^СЯ °дНоКонтУРной- В одноконтурной установке
1ЬиРи?пп НИе Работает В условиях облучения.
(например нятпиа^НИИ В Качестве теплоносителя жидких металлов
ла) во внешнийРкпнт^еДаЧа тепла от теплоносителя (жидкого метал-
этом случае тол[ькпТ/Р ПР°ИСХ°ДИТ через промежуточный контур. В
4 учае только I контур работает в условиях облучения. Проме-
суточный контур разделяет радиоактивный контур жидкого металла
и III контур рабочего тела (пароводяной контур), исключая, таким
образом, возможность их взаимодействия. Такие схемы называются
трехконтурными (рис. 1.3).
Рис. 1.2. Принципиальная тепловая схема одноконтурной ядерной энергетической
установки с уран-графитовым реактором:
I — уран-графитовый реактор; 2— технологический канал; 3 — барабан-сепаратор; 4 —турби-
на; 5 — электрогенератор; 6 — конденсатор; 7 — конденсатный насос: 3 — регенеративные по-
догреватели; 9 — деаэратор; 10 — питательный насос; 11 — циркуляционный насос
Тепловая энергия пара, расширяющегося в паровой турбине,
превращается в механическую энергию вращения турбины, а послед-
няя, в свою очередь, превращается в электрогенераторе 5 в электри-
Рис. 1.3. Принципиальная тепловая схема трехконтурной ядерной энергетической
уста ювки:
1 — реактор; 2 — промежуточный теплообменник; 3 — парогенератор: 4 — турбина; S — элек-
трогенератор; в — конденсатор; 7 — конденсатный насос; 8 — регенеративные подогреватели:
У — деаэратор; 10 — питательный насос; П— электромагнитный циркуляционный насос; 12 —
промежуточный контур с иерадиоактивиым теплоносителем: 13— первый контур е радиоак-
тивным теплоносителем
ческую энергию. Пар, проработав в турбине, конденсируется в конден-
саторе 6 за счет отвода тепла технической водой, и конденсат через
систему регенеративных подогревателей низкого и высокого давления
8 и дегазатор (деаэратор) 9 поступает в парогенератор (при двух- и трех-
контурной схемах) или в реактор (при одноконтурной схеме). По двух-
контурной схеме работают также ядерные энергетические установки
при использовании в I контуре газовых и органических теплоносителей.
5
Таблица 1.1
Классификация нейтронов
Не» троны Медленные (тепловые) Промежуточные Быстрые
Энергия, 10"» Дж <1,6 1,6-1600 >1600
В зависимости от энергии нейтронов, используемых для осуществ-
ления цепной ядерной реакции, различают реакторы на тепловых (мед-
ленных), промежуточных и быстрых нейтронах (табл. 1.1)
В настоящее время основой развития ядерной энергетики во всех
странах являются реакторы на тепловых нейтронах, хотя будущее
атомной энергетики — за реакторами на быстрых нейтронах, так как
они позволяют решить проблему горючего. По типу распределения
топлива в активной зоне реакторы подразделяют на гомогенные и гете-
рогенные. В гомогенных реакторах ядерное топливо в активной зоне
находится в виде однородной массы (раствора, смеси, суспензии или
химического соединения с замедлителем и теплоносителем). В гетеро-
генных реакторах твердое топливо в виде таблеток помещают в тепловы-
деляющие элементы (твэлы), где горючее отделено от замедлителя и
теплоносителя оболочкой твэла. На всех действующих промышлен-
ных АЭС и транспортных ЯЭУ используют только гетерогенные реак-
торы.
По виду используемого теплоносителя реакторы подразделяются
на реакторы с водой под давлением (ВВЭР — водо-водяные энергети-
ческие реакторы), кипящие, тяжеловодные, газовые реакторы, реакто-
ры с жидкометаллическими и органическими теплоносителями. По
конструктивному оформлению различают реакторы корпусного и ка-
нального типов. В реакторах корпусного типа активная зона помеща-
ется внутри корпуса, где теплоноситель выполняет одновременно и роль
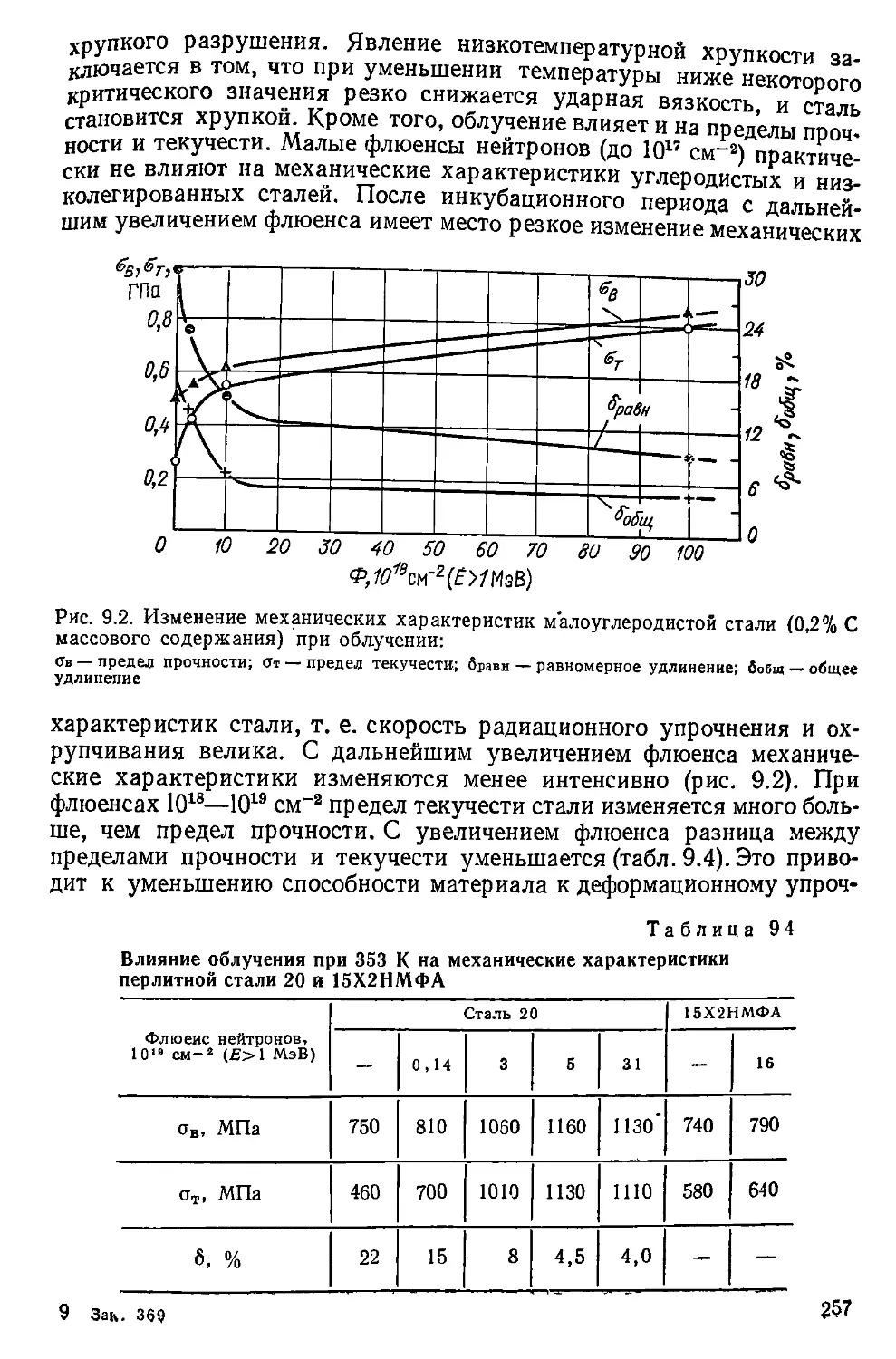
замедлителя. В реакторах канального типа теплоноситель и замедли-
тель разделены. Теплоноситель омывает твэлы в отдельных многочис-
ленных технологических каналах (рис, 1.4).
В СССР в основном используются реакторы с водным теплоносите-
лем корпусного типа с водой под давлением типа ВВЭР (Нововоро-
нежская, Кольская, Армянская АЭС и др.) и канальные кипящие ре-
акторы с графитовым замедлителем типа РБМК — реактор большой
~ Кипяш,ий (Ленинградская, Курская, Чернобыльская АЭС
Возможна также классификация реакторов по их назначению; на-
пример, реакторы для производства электроэнергии, теплофикацион-
ые, для воспроизводства горючего и др. Приведенная классификация
реакторов несколько условна. Так, о реакторе, представленном на
ляКлрйиА»°ЖН0 сказать’ что это реактор корпусного типа с водой под
давлением, гетерогенный на тепловых нейтронах.
(оис41 РЛ°® т°пливо в виде стержней (твэлов), собранных в кассеты
i.oj, загружается в активную зону реактора. В реакторах на теп-
4
5
|з
Рис. 1.4. Рабочий канал
уран-графитового реак-
тора Белоярской АЭС:
1 — верхняя головка; 2 — уп-
лотнительные кольца; 3 —
компенсатор линейного рас-
ширения; 4 — тепловыделя-
ющий элемент; 5 — нижняя
головка; 6 т- выход теплоно-
сителя; 7 вход теплоноси-
теля
Рис. 1.5. Кассета с твэлами
для реакторов ВВЭР:
кассёгы*°х теггл°носителя; 2 — верхняя головка кассеты: 3 — верхняя решетка: 4 — корпус
теплоносителя ТеПЛ°ВЫДеЛЯ10ЩИе элементы> 6 — инжняя решетка; 7 — хвостовик; 8 — вход
ловых нейтронах для поддержания цепной реакции деления необхо-
лимо снижение энергии быстрых нейтронов до уровня тепловых, ддя
чего в состав активной зоны вводят замедлитель нейтронов. В реакто-
пах работающих на быстрых нейтронах, замедлитель отсутствует.
Г В СССР работают ряд реакторов на быстрых нейтронах типа БОР
(опытные реакторы) и одна промышленная ядерная энергетическая
установка в г. Шевченко БН-350 (реактор с натриевым теплоносите-
лем). Построена еще более мощная установка с реактором на быст-
рых нейтронах БН-600 (третья очередь Белоярской АЭС).
В качестве ядерного горючего могут использоваться только три
радионуклида: ^U, 2S3U, 239Pu. В природном уране содержится 0,71%
MU, или 7,1 кг на тонну. Остальная часть приходится в основном на
’“U. Сырьем для получения делящихся нуклидов 233U и 239Ри служат
^Th и соответственно; 233U и 239Ри называют вторичным ядерным
горючим.
Для уменьшения объема активной зоны реактора (и соответствен-
но внешних его размеров) количество делящихся нуклидов (236U, ^U,
^Pu) в смеси топлива повышают, т. е. используют обогащение топли-
ва. Обогащение топлива резко повышает его стоимость.
Тепловыделяющие элементы диаметром 6—14 мм компонуют в кас-
сеты. На рис. 1.5 показана кассета с твэлами цилиндрической формы
для реактора типа ВВЭР. Твэлы представляют собой устройства, со-
держащие твердое ядерное горючее и обеспечивающие при помещении
их в активную зону реактора цепную реакцию деления, генерацию теп-
ловой энергии, а при наличии в их составе материалов воспроизвод-
ства — накопление нуклидов 233U и 239Ри. В наиболее общем случае
твэл включает в себя сердечник с ядерным горючим, оболочку, хвосто-
вики и дистанционирующие детали.
В зависимости от вида ядерного горючего различают следующие
типы твэлов: на основе металлического топлива, с керамическим топ-
ливом, дисперсные.
По форме твэлы делятся на цилиндрические, трубчатые, пластин-
чатые, шарообразные, а также более сложные по конфигурации в ви-
де блоков с отверстиями для прохода теплоносителя, в виде скручен-
ных лент и т. п.
Оболочка твэлов служит для изоляции ядерного топлива от тепло-
носителя и предотвращения загрязнения его частицами ядерного го-
рючего и продуктами деления. Хвостовики позволяют герметизи-
ровать топливо в оболочке и вместе с дистанционирующими деталями
служат, кроме того, для крепления твэлов во время работы в строго
определенном положении.
РеактоРах на тепловых нейтронах для замедления нейтронов ис-
чрс’г‘3^К>Т материалы с малой относительной атомной массой. В ка-
ве материала замедлителей служат тяжелая и обычная (легкая)
жидкости ИТ’ беРиллий и окись бериллия, некоторые органические
кп^ирЛМеНЬШения утечек нейтронов за пределы активной зоны во-
етанавливают отражатель нейтронов. В качестве отражателей
У т те же материалы, что и для замедлителей.
9
Тепло, выделяющееся при делении ядерного горючего, отводят с
помощью следующих теплоносителей: обычной воды (с кипением и
без кипения в реакторе), тяжелой воды, газов (углекислоты, азота, ге-
лия, водорода и их смесей), жидких металлов (натрия, калия, висму-
та, свинца, ртути) и органических жидкостей (например, дифинильной
смеси).
Регулирование мощности реактора осуществляется изменением вво-
димого в активную зону количества вещества, поглощающего нейтро-
ны. Эти вещества вводятся в активную зону реактора обычно в виде
стержней различного профиля, но могут вводиться и в виде поглощаю-
щих добавок в топливо или в состав конструкционных материалов ак-
тивной зоны. Используется и «мягкое» регулирование. В этом случае
поглощающее нейтроны вещество в виде раствора циркулирует либо с
теплоносителем, либо в отдельном контуре. Этим веществом могут быть
борная кислота, соли кадмия и др. «Мягкое» регулирование для сов-
временных реакторов типа ’ВВЭР обязательно. При этом возникают
проблемы радиолиза, коррозии конструкционных материалов, регу-
лирования концентрации поглощающего вещества.
Для быстрого останова реактора используют стержни аварийной
защиты. Конструктивное оформление и требования к материалам этих
стержней такие же, как к стержням регулирования. В качестве материа-
лов регулирующих стержней и системы аварийной защиты использу-
ют материалы, содержащие хорошо поглощающие нейтроны элемен-
ты: В, Cd, Hf, In, Ag, Eu, Gd и Sin.
Корпус мощных энергетических реакторов имеет внушительные
размеры (диаметр до 4 м и высота до 12 м). Изготовление корпуса, ра-
ботающего при высоких давлении и температуре теплоносителя, из
нержавеющих аустенитных сталей не представляется возможным
вследствие их низкой прочности.
Для корпуса реактора используют стали 48ТС, 1Х18Н10Т (для
корпусов малых диаметров). При выполнении корпуса реактора из
перлитной стали для уменьшения выхода продуктов коррозии в теп-
лоноситель, а также для уменьшения возможности наводороживания
корпуса, снижающего его пластичность, на его внутренней поверхности
делают наплавку из аустенитной нержавеющей стали. Вместо наплав-
ки повысить коррозионную стойкость материала корпуса можно соз-
данием на его поверхности защитной окисной пленки (например, при
обработке ее комплексонами или другими способами).
Корпус реактора работает в жестких условиях: высокие давление
и температура теплоносителя, высокий уровень облучения (а значит,
отсутствие визуального контроля за материалом корпуса в процессе
его эксплуатации), большие скорости теплоносителя, который даже
при высокой степени чистоты является коррозионно-агрессивной сре-
дой. Для уменьшения воздействия излучения на корпус реактора во-
круг активной зоны устанавливают тепловую защиту, которая пред-
ставляет собой цилиндрическую обечайку из коррозионно-стойкой
стали.
Для изготовления корпуса парогенератора и других сосудов боль-
ших диаметров ЯЭУ используют стали 22К, 15ХМ, 16ГНМ, сталь 20.
9
Количество циркулирующего через активную зону реактора теп-
лоносителя велико, так как подогрев воды в реакторе невелик (293—
308 К). Поэтому циркуляция его по I контуру обычно осуществляет-
ся по нескольким петлям (от 2 до 8). Но даже при таком количестве
петель диаметры циркуляционных трубопроводов получаются боль-
ка^ьного ТипПаа.Р°ГеЯеРаТ0Р вер™‘
устройствам заРЭ: 2 ~ сепаРационные
питательной во-
ве^'ности--? ТРУ1бКИ теплообмЯен?ойб по"
3 ®*°А*тепл'оиоситёля; 71бвТХ0Я:
Поносителя выход топ*
10
шими (до 850 мм). С целью умень-
шить поступление продуктов корро-
зии в теплоноситель трубопроводы
выполняют либо из аустенитных не-
ржавеющих сталей, либо из перлит-
ных сталей с внутренней наплавкой
из коррозионно-стойкой стали. По-
верхность нагрева парогенераторов
также представляет собой большое
количество труб из нержавеющей
стали диаметром от 10 до 24 мм. За-
мена аустенитных сталей на углеро-
дистые в реакторных контурах яв-
ляется одной из проблем атомной
энергетики.
Теплообмен в парогенераторе (как
и в реакторе) в основном конвектив-
ный и осуществляется при неболь-
ших перепадах температуры (от 288
до 293 К). Поэтому поверхность на-
грева состоит из большого количества
труб малого диаметра. Для более
компактного расположения их ком-
понуют с малым шагом. Парогенера-
торы современных мощных ЯЭУ
(атомных электростанций) являются
уникальными крупногабаритными аг-
регатами (рис. 1.6) со значительны-
ми размерами корпуса (диаметром до
4 м и длиной до 15 м). Парогенера-
тор относится к I и II контурам, поэ-
тому предъявляются повышенные тре-
бования к его плотности.
Элементы оборудования II конту-
ра выбирают почти такими же, как
и на электростанциях на органиче-
ском топливе. Паропроводы от паро-
генератора до турбины, трубопрово-
ды конденсатно-питательного тракта
от конденсатора до парогенератора
выполняют из перлитных сталей. По-
верхности нагрева конденсатора и р6"
генеративных подогревателей низкого
давления (на конденсатном тракте) вь1'
полняют из материалов с повышенной коррозионной стойкостью — ла-
п'ни нержавеющих сталей, мельхиора, никелевых сплавов, так как
они работают в наиболее коррозионно-агрессивной среде. Поверхности
нагрева подогревателей высокого давления (на питательном тракте)
выполняют из углеродистых сталей.
На одноконтурных АЭС в качестве поверхностей нагрева регенера-
тивных подогревателей исключается применение сплавов, содержащих
медь, так как медистые отложения в реакторе недопустимы.
Особенностью ядерных энергетических установок является нали-
чие радиоактивности. Для защиты от нейтронного излучения исполь-
зуют материалы, хорошо замедляющие и поглощающие нейтроны. Для
защиты от у-излучения берут материалы, содержащие тяжелые эле-
менты. Таким образом, для защиты от излучений применяют легкую
воду, бетоны с различными добавками (тяжелый бетон, колеманит,
портландцемент, бариевый цемент и др.), а также металлы (Pb, Fe и
ДР-)-
Все ныне действующие ЯЭУ используют энергию деления ядерного
горючего. Возможно также использование энергии, выделяющейся
при синтезе легких ядер. Такие установки называются термоядерны-
ми. В реакторах этих установок может протекать следующая реакция
термоядерного синтеза:
iD + ?Т -> 1Не + Jn + 17,6 МэВ, (1.1)
где JD — дейтерий и ?Т — тритий — изотопы водорода, при этом ос-
вобождаются нейтроны с энергией 14 МэВ и свободная энергия
17,6 МэВ.
Создание термоядерной энергетической установки, использующей
реакцию (1.1), весьма затруднительно. Наличие в продуктах этой ре-
акции нейтронов высокой энергии на первом этапе освоения термоядер-
ных реакторов предопределяет симбиоз: синтез плюс деление, т. е. е
помощью термоядерных нейтронов будет нарабатываться 239Ри из 238U,
являющийся искусственным делящимся изотопом для обычных ядер-
ных реакторов.
Наиболее изученными комбинированными установками в настоя-
щее время являются гибридные термоядерные установки типа тока-
мак. На их основе разрабатывается ряд проектов гибридных термо-
ядерных электростанций (ГТЭСТ) с паротурбинным циклом преобра-
зования энергии синтеза и деления ядер в электрическую. Один из ва-
риантов такой ГТЭСТ с использованием стандартной турбины пред-
ставлен на рис. 1.7. В вакуумной камере 1 осуществляются нагрев
плазмы и реакция (1.1). Образование и удержание плазмы обеспечи-
ваются сверхпроводящей электромагнитной системой с помощью вих-
ревого электрического поля. Бланкет, окружающий вакуумную каме-
ру, состоит из вакуумной стенки 2, зоны преобразования нейтронной
®”®РГИИ в тепловую и наработки плутония 14, зоны воспроизводства
тр тия 13 и радиационной защиты 12.
11
мощность такого гибридного реактора составляет
Тепловая мощность до 40 кг трития и производится д0
6650 МВт. На ^таНЦ’"1РТвэЛы зоны наработки плутония имеют шаро-
4200 кг плутония в год. ива ИСПОльзуется уран-молибденовый
°бра^Увкой из*молибдена.
сплав с обоЛ° реакторах в наиболее жестких условиях работает
маок подвергается воздействию флюенсов Кейт-
Рис. 1.7. Принципиальная тепловая схема термоядерной энергетической установ-
ки типа токамак:
I — вакуумная камера; 2 —вакуумная стенка; 3 — парогенератор; 4 — турбина: 5 — электпо-
рат р, 6 — конденсатор; 7 — конденсатный насос; 8—регенеративные подогреватели: S-
эр тор: Н> — питательный насос; 11— циркуляционный насос: 12— радиационная заши-
ы —зова воспроизводства трнтня; 14— зона преобразования Нейтронной энергии в теп-
ую и наработки плутония
такжр °К°Й энеРгие®’ флюенсов ядер гелия, водорода, трития, а
быть чияиытопТ И электР0Н0в- Ресурс работы первой стенки должен
нология сс миНЫМ’ Т^К Как замена ее крайне затруднительна и тех-
матическим ТРебуе/Т Р/3Работки и создания механизмов с авто-
против нонУ Р^НИеМ (Роботов)- Для этой цели требуются стойкие
ческие и элДс?п^еГ° излучения радиотехнические, электротехни-
ния предъявляются ОЛЯДионные материалы. Определенные требова-
нье температуо пои ппипТерИаЛаМ’ Работаклцим в области криоген-
низирующегоУизлучения°ВРеМеННОМ воздействии на них флюенсов ио-
В тдбл 1 о
В атомной\ёхникеГиеХастГЕхКппиННЫеМаТерИаЛЫ’ используемые
12 ’ и ооласти. их применения.
Таблица 1.2
Конструкционные материалы, используемые в атомной технике, и области
их применения______________________________________________________
Материал Область применения Максимальная рабочая тем- пература, К
Аустенитные нержаве- ющие стали Оболочка твэлов, технологические ка- налы, трубопроводы первого контура, по- верхность парогенераторов, насосы 973
Перлитные низколеги- рованные стали Паропроводы перегретого пара одно- контурных реакторных установок, паро- генераторов и корпуса реакторов 773
Углеродистые стали Паропроводы насыщенного пара одно- и двухконтурных реакторных установок, трубопроводы конденсатно-питательного тракта 623
Бористые нержавею- щие стали Стержни системы управления и защи- ты 873
Циркониевые сплавы Оболочки твэлов, кассеты и технологи- ческие каналы реакторов, охлаждаемых водой и жидкими металлами 673
Алюминиевые сплавы Оболочки твэлов и технологические ка- налы водоохлаждаемых реакторов 523
Магнитные сплавы Оболочки твэлов, охлаждаемые угле- кислым газом 673
Титановые сплавы Поверхность нагрева парогенераторов водоохлаждаемых реакторов 673
Никелевые сплавы Промежуточные теплообменники реак- торов с жидкометаллическими теплоно- сителями, поверхность нагрева парогене- раторов и регенеративных подогревате- лей 1073
Тугоплавкие металлы и их сплавы Оболочки твэлов и другие узлы перво- го контура 1273—1773
Медные сплавы Поверхности нагрева регенеративных подогревателей, конденсаторов и вспомо- гательных теплообменников 473
Глава 2
ТРЕБОВАНИЯ, ПРЕДЪЯВЛЯЕМЫЕ К РЕАКТОРНЫМ МАТЕРИАЛАМ
§ 2.1. ОБЩИЕ ТРЕБОВАНИЯ
Капитальные затраты на сооружение ЯЭУ более высокие по срав-
нению с затратами на сооружение станции той же мощности, работаю-
щей на органическом топливе, что объясняется использованием более
дорогостоящих материалов при сооружении первых ЯЭУ. Современ-
ная ЯЭУ представляет собой сложное инженерное сооружение. Ис-
пользуемые материалы работают в крайне тяжелых условиях. Атомная
энергетика может широко внедряться в народное хозяйство лишь при
13
_ «vneT конкурентоспособна с электростанциями, ра.
условий, ™ топливе. Для атомной энергетики хар^.
б°та™жепутиРразвития, что и для обычной тепловой энергетики, _
терны те же пути р блоков, параметров и мощности основного
Р0СТ "борения. Создание новых ЯЭУ, отвечающих
" = аым требованиям по мощности, экономичности, надежности,
«прерывно предъявляет все новые, повышенные требования к реак-
таРЯжрныГгеХев пара, впервые осуществленный в нашей стране
на Белоярской АХ им. И. В. Курчатова, потребовал создания маге-
риалов работоспособных в условиях облучения при температуре
783 К. При высокой температуре эксплуатируются материалы в реак-
торах "на быстрых нейтронах с жидкометаллическим теплоносителем,
а также в высокотемпературных газоохлаждаемых реакторах. При-
менение ядерных двигателей в космической технике, создание термо-
ядерной энергетики потребуют материалов, работоспособных при тем-
пературе до 3273 К.
Применяемые материалы должны обеспечить конструкционную
прочность элементов ЯЭУ, т. е. быть прочными, пластичными, в ряде
случаев способными работать в условиях высоких динамических нагру-
зок. Материалы должны быть технологичными, легко подвергаться
обработке давлением, резанием, прокатке, хорошо свариваться. Ме-
ханические характеристики материалов не должны изменяться в про-
цессе длительной эксплуатации при высокой температуре и в услови-
ях изменения механических напряжений, действующих на материал,
по значению и знаку. Некоторые материалы эксплуатируются в усло-
виях вибрации, поэтому они не должны разрушаться вследствие ус-
талости, в том числе и малоцикловой, и должны обладать высокой
циклической прочностью.
Элементы конструкций ЯЭУ, в первую очередь твэлы, техноло-
гические каналы, стержни системы управления и защиты, должны со-
хранять свою форму. Материалы активной зоны подвергаются интен-
сивному облучению, которое может существенно повлиять на их свой-
ства. Под действием облучения материалы охрупчиваются, изменяют
свою форму .Поэтому необходимо, чтобы реакторные материалы обла-
дали высокой радиационной стойкостью.
В процессе эксплуатации реакторные материалы соприкасаются с
теплоносителем, в котором могут присутствовать коррозионно-агрес-
сивные примеси, да и сами теплоносители, даже высокой степени чис-
тоты, являются коррозионно-активными. Поэтому материалы могут
разрушаться вследствие протекания коррозионных процессов, эрозии
твппятУ^ЦИИ' ВыделяюЩийся в процессе коррозии водород может рас-
ornf в В матеРиале и вызывать его охрупчивание. Отсюда вытекает
Щ Мят₽пНоРпеб^ВаНие ~ высокая коррозионная стойкость.
ях пи вР Л/ оболочки твэлов находится в еще более жестких услови-
длитмкппгл°Ц2ССе эксплУатаЦии при высокой температуре в течение
ствие ТМеНИ контактиРУет с ядерным топливом. Взаимодей-
Возникает «пЛлп может пРивести к разрушению оболочки твэлов.
возникает еще одно требование - совместимость.
и
Ядерная энергетика предъявляет особые требования к физическим
свойствам материалов, рдерное горючее должно обеспечивать высокое
теп ювыделение и выгорание, а также быть радиационно-стойким.
В реакторах на тепловых нейтронах конструкционные материалы
должны иметь малое сечение захвата тепловых нейтронов. В противном
случае нарушается баланс нейтронов в активной зоне, что может при-
вести к прекращению ядерной реакции. Для осуществления и поддер-
жания цепной ядерной реакции в этом случае необходимо применять
более обогащенное топливо, что приводит к его удорожанию. Указан-
ные обстоятельства выдвигают повышенные требования к чистоте ма-
териалов активной зоны. Содержание в них примесей с высоким сече-
нием захвата нейтронов должно быть минимальным.
Материалы замедлителя и отражателя должны, кроме того, эф-
фективно замедлять быстрые нейтроны. В системах управления и за-
щиты реактора применяют материалы с большим сечением захвата
нейтронов. Желательно, чтобы реакторные материалы слабо активи-
ровались в нейтронном потоке. Особенно это относится к материалам
активной зоны. Радионуклиды продуктов коррозии откладываются в
контуре реактора и существенно затрудняют его обслуживание. Осо-
бенно неприятно в этом смысле присутствие радионуклидов с большим
периодом полураспада, в частности кобальта. Кобальт в незначи-
тельных количествах содержится в никеле, которым легируют сталь.
Особые требования предъявляются к теплофизическим характерис-
тикам материалов. Коэффициент термического расширения должен
быть минимальным. Компенсация температурных напряжений, обус-
ловленных термическим расширением материалов, вызывает опреде-
ленные трудности при конструировании ЯЭУ.
Весьма важной характеристикой реакторных материалов является
коэффициент теплопроводности. Низкий коэффициент теплопроводно-
сти обусловливает большой перепад температуры по сечению материала.
В керамическом ядерном топливе это может привести к плавлению
центра сердечника твэла. Большой перепад температуры в материале
создает также термические напряжения, что угрожает целостности
конструкции. Низкая теплопроводность материала резко увеличивает
габариты теплообменников, что крайне нежелательно для транспорт-
ных установок.
В ряде случаев к реакторным материалам предъявляют требование
газоплотности. Проникновение газообразных осколков деления че-
рез оболочку твэла повышает активность теплоносителя. Проникнове-
ние газообразных осколков через стенку трубопроводов, а также с про-
течками теплоносителя ухудшает радиационную обстановку и затруд-
няет обслуживание и эксплуатацию ЯЭУ. Естественно, речь идет о
миграции газов не по дефектам сварных соединений, а по сечению ос-
новного металла.
Немаловажным обстоятельством является стоимость материалов,
используемых для изготовления оборудования АЭС. В ряде случаев
это существенно сказывается на себестоимости электроэнергии и кон-
курентной способности атомной энергетики по сравнению с тепловой
энергетикой на органическом топливе. Так, замена нержавеющей аусте-
15
. „г.» ия п колитную в реакторных контурах и конденсатно-
SSiSom тракте одноконтурных АЭС типа РБМК дает экономию
несколько десятков миллионов рублей.
^исимости от того. ДЛЯ изготовления каких узлов и деталей
конкретные реакторные материалы, к ним предъявляют
то “ной комплекс требований, рассмотренных ниже.
§ 2.2. ТРЕБОВАНИЯ, ПРЕДЪЯВЛЯЕМЫЕ К МАТЕРИАЛАМ
АКТИВНОЙ ЗОНЫ
Оболочки твэлов. В наиболее тяжелых условиях в активной зоне
ядерного реактора работают оболочки твэлов. Для меньшего погло-
щения нейтронов оболочки твэлов делают минимальной толщины. В
процессе работы материал оболочек может подвергаться деформации
из-за радиационного повреждения ядерного топлива. Вследствие боль-
шого перепада температуры в оболочке возникают термические напря-
жения. Материал оболочки должен выдерживать термические циклы,
а также быть коррозионно-стойким в теплоносителе и совместимым с
топливом при рабочих температурах. Находясь в активной зоне, ма-
териал оболочки подвергается действию излучения, что может сущест-
венно повлиять на его физико-механические свойства.
В активной зоне реактора размещаются узлы и детали крепления
твэлов, а также технологические каналы, в которых находятся твэлы.
Эти узлы и детали могут испытывать значительные механические на-
грузки, гидравлические удары, подвергаться эрозии и коррозии. Тем
не менее условия эксплуатации этих узлов и деталей более легкие, чем
у оболочек твэлов. Если какой-либо материал годен для изготовления
оболочек твэлов, то из него можно изготовить и другие конструкцион-
ные элементы активной зоны.
Среди разнообразных требований, предъявляемых к материалу
оболочек твэлов, можно выделить главные:
1) минимальное сечение захвата нейтронов;
2) механическую надежность, постоянство формы и размеров обо-
лочек и тем самым твэла в целом;
3) высокую теплопроводность, обеспечивающую длительную тепло-
передачу без чрезмерно высоких термических напряжений в оболочке;
4) высокую коррозионную и эрозионную стойкость- в теплоноси-
5) совместимость с ядерным топливом.
определении требований к материалу оболочек твэлов необхо-
в кяирД-ИТЫВатЬ °Собеиноот данного реактора. В случае применения
бовямиА в® ядеРН0Г0 горючего природного необогащенного урана тре-
чае пг>имАИАиМаЛЬ1к°Г° захвата нейтронов становится главным. В слу-
чек могут urn™ °®огащенного топлива в качестве материалов оболо-
та нейтпонпв ьзоваться материалы с более высоким сечением захва-
Сочетяим!’ яаприм„еР нержавеющие стали.
охлаждения оболоиАкЙтп1еПЛ°ПрОВОДНОСТИ с требованием надежного
16 твэлов для всех видов теплоносителей является
одним из условий безаварийной и безопасной работы реактора. Высо-
кая теплопроводность материала оболочки и контактных слоев ее с
ядерным топливом необходима для снижения разности температуры
между теплоносителем, самой оболочкой и топливом. Градиент темпе-
ратуры в оболочке может вызвать термические напряжения, дости-
гающие нескольких мегапаскалей.
Для оболочек твэлов, работающих при температурах 773 К и вы-
ше, существенными становятся прочностные характеристики матери-
ала. В этом случае материал оболочки должен быть жаропрочным.
В кипящем реакторе на поверхности твэла концентрируются при-
меси, содержащиеся в воде, что увеличивает ее коррозионную агрес-
сивность. Материал оболочек в этом случае должен быть коррозион-
но-стойким, особенно по отношению к местным видам коррозии, на-
пример язвенной и коррозии под напряжением. Вопрос о коррозион-
ной и эрозионной стойкости оболочки твэлов в теплоносителе и о ее
совместимости с ядерным топливом принадлежит к наиболее сложным
и важным проблемам эксплуатации ядерных реакторов. Коррозионные
процессы протекают при высоких температурах, больших скоростях
теплоносителя, при наличии больших тепловых потоков и механичес-
ких напряжений в металле. Изменение свойств металла и состава теп-
лоносителя под действием радиации осложняет эти условия.
Для суждения о механической надежности оболочки наиболее важ-
ны следующие характеристики материала: прочность и пластичность
при кратковременных испытаниях, длительная прочность и сопротив-
ление ползучести, предел усталости при рабочих температурах, ста-
бильность размеров оболочки при циклических изменениях темпера-
туры. Необходимо также знать изменение этих характеристик под
влиянием облучения.
Для получения необходимой информации о свойствах материалов
в условиях эксплуатации приходится проводить сложные, длительные
и дорогостоящие испытания, в том числе непосредственно в реакторе.
Безаварийная работа реактора канального типа во многом зависит
от надежности работы каналов. Разрушение стенки канала вследствие
коррозии, эрозии или кавитации приводит к попаданию теплоносите-
ля в графитовую кладку, что существенно изменяет нейтронный баланс
в реакторе и нарушает его нормальную работу. Изменение геометри-
ческой формы канала вследствие ползучести материала может приве-
сти к заклиниванию канала в графитовой кладке — что затрудняет
замену технологических каналов при перегрузках реактора.
Ползучесть сама по себе создает опасность разрушения канала. Ма-
териал каналов не должен наводороживаться, ибо это создает опас-
ность хрупкого разрушения. Материал, из которого изготавливают
технологические каналы и каналы системы управления и защиты,
должен быть прочным, противостоять ползучести, обладать высокой
коррозионной и эрозионной стойкостью, не охрупчиваться.
Замедлитель и отражатель нейтронов. Материал замедлителя и от-
ражателя должен содержать минимальное количество примесей, осо-
сенно элементов с высоким сечением захвата нейтронов. В реакторах
графитовым замедлителем изменение размеров графитовых блоков и
17
ЙПЛОК вследствие радиационного роста или усадки затрудняет замё-
В?канала Отсюда вытекает требование высокой радиационной стой-
Нпети гоаф’ита и стойкости к окислению. Весьма важны для физики ре-
я^топа плотность и чистота графита.
^Поглощающие материалы системы управления и защиты (СУЗ).
Поглошающие материалы должны иметь высокое сечение поглощения
тепловых нейтронов. Для реакторов на тепловых нейтронах использу-
ются почти «черные» стержни. Обычно тело считается «черным» ддя
тепловых нейтронов, если поперечное сечение поглощения тепловых
нейтронов много больше поперечного сечения рассеяния.
В ряде случаев необходимо поглощать надтепловые нейтроны. На-
пример, гафний считают «черным» вблизи резонансов поглощения, ко-
торые у гафния расположены при энергиях 1; 1,2; 2,38 и 7,8 эВ. По-
добно гафнию большинство надтепловых поглотителей — резонансно-
го типа. Одним из методов повышения эффективности регулирующего
стержня является изготовление его из смеси поглотителей, подобран-
ных таким образом, чтобы резонансные максимумы одного лежали
между резонансными максимумами другого. К такому типу поглоти-
телей относятся сплавы Cd, Ag, In и смеси редкоземельных элементов.
При поглощении нейтронов в результате протекания ядерных реак-
ций в стержнях выделяется энергия, приводящая к их разогреву. В
поглотителях, где протекает реакция (я, а) (к числу которых отно-
сится В), практически вся энергия ядерной реакции поглощения вы-
деляется в регулирующем стержне. В поглотителях, где идет реакция
(п, у), значительная часть энергии вместе с у-излучением уносится из
стержня. В обоих случаях в реакторах ВВЭР с высокой плотностью
энерговыделения количество тепла, генерируемого в стержнях, может
быть очень высоким. В связи с этим необходимо обеспечить охлажде-
ние стержней. При наличии защитной оболочки на стержне должен
быть создан хороший тепловой контакт между материалом поглоти-
теля и оболочкой для надежного отвода тепла через оболочку.
Эффективность стержней в работающем реакторе изменяется в те-
чение кампании. Постепенно за счет протекания ядерных реакций вы-
водится значительное количество ядер поглощающего материала. В
ряде случаев эффективность стержней мало изменяется при выгорании
поглощающего нуклида. Это происходит в том случае, когда продуктом
ядерной реакции в стержне является стабильный и долгоживущий ну-
клид с большим сечением захвата.К числу таких материалов можно
отнести диспрозий и европий.
Материалы СУЗ должны обладать большим сечением поглощения
МТНОВ и в Ряде случаев в широком спектре энергий нейтронов,
атериалы должны быть радиационно-стойкими.
ич гтплаН^НИе геометРии поглощающих материалов может вывести
выгопип встемУ управления и защиты. С экономической точки зрения
оимАппгппИЧеНЯТЬ неохлаждаемые каналы СУЗ. В связи с этим мате-
иыми и стойк^еГ» элемента и ег0 оболочка должны быть жаропроч-
МетелппиА К К°РР°ЗИИ пРи высокой температуре.
торах каиальных Реакторов. В канальных реак-
18 Ф замедлителем материалы, из которых изготовлены
конструкции, находящиеся в активной зоне, работают при высокой тем-
пературе в условиях интенсивного облучения. К этим материалам
предъявляются требования жаропрочности и радиационной стойкости.
В реакторах ВВЭР материалы конструкций под действием тепло-
носителя могут подвергаться коррозионным и эрозионным воздейст-
виям, поэтому эти материалы должны быть коррозионно- и эрозионно-
стойкими с малым сечением захвата нейтронов.
Корпус реактора. Корпус реактора и крышка в рабочих условиях
подвергаются воздействию механических напряжений вследствие из-
быточного давления в реакторе, термических нагрузок в стационарных
и особенно в нестационарных температурных режимах, вибрационных
нагрузок, а на транспортных установках, кроме того, действию удар-
ных нагрузок. Материал корпуса, находясь в условиях всех видов об-
лучения, должен иметь высокую прочность при достаточном уровне
пластичности. Облучение корпуса реактора в течение всего периода
работы (до 30 лет) не должно вызывать охрупчивания материала. В
связи с этим выдвигается требование высокой радиационной стойкости.
Материал корпуса должен иметь хорошую теплопроводность и низкий
коэффициент теплового расширения, чтобы не возникали высокие
температурные напряжения, а также должен быть стоек к малоцик-
ловой усталости.
Материал корпуса должен быть стойким к коррозии. Загрязнение
теплоносителя радиоактивными продуктами коррозии ухудшает ра-
диационную обстановку и усложняет обслуживание и ремонт оборудо-
вания. Местная коррозия может привести к возникновению концент-
раторов напряжений в металле и увеличению вероятности его разру-
шения. Наводороживание, особенно в сочетании с облучением, может
вызвать охрупчивание материала корпуса. Для уменьшения корро-
зионных процессов материала корпуса на его внутренней поверхно-
сти, соприкасающейся с теплоносителем, делается наплавка толщиной
8—12 мм из коррозионно-стойкого материала. Эта наплавка также
уменьшает возможность наводороживания корпуса реактора.
Материал корпуса должен быть технологичным и хорошо свари-
ваться в больших толщинах. Высокий уровень местных напряжений
в сварных соединениях требует последующей термической обработки.
Термическая обработка корпуса, имеющего значительные габариты,
вызывает серьезные трудности.
Заметим также, что высокая прочность материала корпуса ре-
актора позволяет снизить его массу и габариты, что в ряде случаев
крайне важно.
§ 2.3. ТРЕБОВАНИЯ К МАТЕРИАЛАМ УЗЛОВ,
НАХОДЯЩИХСЯ ВНЕ АКТИВНОЙ ЗОНЫ
Основные узлы, работающие вне активной зоны реактора ВВЭР, —
это главные циркуляционные трубопроводы, поверхность нагрева
парогенератора, арматура, главные циркуляционные насосы и вспо-
могательные реакторные системы. Для одноконтурных АЭС с кипящим
19
пеактором добавляется оборудование турбоустановки и всего конден.
гятно-питательного тракта.
К материалам трубопроводов и паропроводов предъявляют требова-
„ысокой прочности и способности противостоять хрупкому раз.
пушению Материал трубопроводов должен быть коррозионно-стойким
йовеохность их обычно значительна). Продукты коррозии, переходя,
шне в теплоноситель, ухудшают радиационную обстановку и создают
опасность образования отложений на поверхности твэлов.
Скорость потока теплоносителя в трубопроводах велика — до
10 м/с, но в циркуляционных насосах она еще выше.^ Материалы, из
которых изготовлены узлы насоса, должны быть стоики не только к
коррозии, но и к эрозии и кавитации.
Аналогичные требования предъявляют к материалам, идущим на
изготовление арматуры.
Барабаны-сепараторы (БС) мощных АЭС с кипящими канальными
реакторами имеют значительные размеры (в длину до 20 м и диаметр
до 2,5 м). В корпус БС вваривается значительное число патрубков.
Это обусловливает требование высокой прочности материалов при до-
статочном уровне пластичности, стойкости к малоцикловой усталос-
ти, технологичности, стойкости к коррозии.
§ 2.4. МАТЕРИАЛЫ, ПРИМЕНЯЕМЫЕ В РЕАКТОРОСТРОЕНИИ
В качестве конструкционных материалов в реакторостроении ис-
пользуют металлы и их сплавы. Это связано с тем, что сплавы метал-
лов обладают высокой прочностью при достаточном уровне пластично-
сти, способны упрочняться при пластической деформации.
Металлургические процессы получения и обработки материалов и
сплавов хорошо освоены. В промышленности отработана технология
обработки материалов и сплавов резанием и давлением, ковкой, штам-
повкой, прокаткой, освоены различные виды сварки.
Чистые металлы в атомной энергетике применяют ограниченно,
там, где требуются высокая пластичность и отсутствие примесей. В ка-
честве материала для прокладок используют высокочистые никель и
медь. Для оболочек твэлов исследовательских реакторов используют
алюминий высокой чистоты. В качестве материала замедлителя и от-
ражателя применяют чистый бериллий. Из алюминия технической чис-
тоты (содержание примесей не более 0,5%) изготовляют баки исследо-
вательских реакторов и ряд узлов активной зоны.
о основном в реакторостроении используют сплавы металлов. Так,
п авы на основе алюминия применяют для изготовления оболочек
пппиЛЛ технологических каналов водоохлаждаемых реакторов ДлЯ
кмпян1тЛСТВа ПЛУТОНИЯ, Для изготовления каналов СУЗ канальных
пой мп РеаКТ°ров- Максимальная рабочая температура, при кото-
523 К п использоваться сплавы алюминия с водным теплоносителем,
ния не гтпв^,Лее высокой температуре существующие сплавы алюмй'
ъ чоики к коррозии.
лочки твэпп«аиоЛДе теплоносителем является углекислый газ, обо
2Q товляют из сплавов магния (сплавы типа магнокс)-
Низкая жаропрочность и коррозионная стойкость ограничивают уро-
вень рабочих температур 673 К. При переходе на более высокие тем-
пературы необходимо использовать в качестве оболочек твэлов нержа-
веющую аустенитную сталь с применением обогащенного ядерного
топлива.
Сплавы циркония применяют для изготовления оболочек твэлов
водоохлаждаемых реакторов, технологических каналов канальных
кипящих реакторов. Максимально допустимая температура 623 К огра-
ничена коррозионной стойкостью сплавов циркония и ползучестью.
Материалы на основе Al, Mg, Zr технологичны, имеют малое сечение
захвата и поэтому находят широкое применение в активной зоне реак-
торов.
Широкое применение в реакторостроении нашли сплавы на основе
железа. В первую очередь следует отметить аустенитные нержавеющие
стали. Их применение связано с высокой общей коррозионной стойко-
стью в различных теплоносителях, жаропрочностью, технологично-
стью. При обогащенном ядерном топливе аустенитные нержавеющие
стали используют для изготовления оболочек твэлов, каналов и дру-
гих элементов активной зоны, а также для плакирования (наплавки)
корпусов реакторов, БС, циркуляционных трубопроводов больших
диаметров, выполненных из низколегированных сталей. Вне активной
зоны эти стали применяют для изготовления трубопроводов I контура
(до диаметров 550 мм), парогенераторов, теплообменников, трубопро-
водов конденсатно-питательного тракта и контура многократной при-
нудительной циркуляции кипящих реакторов, циркуляционных на-
сосов и арматуры. Максимальная рабочая температура 973 К
обусловлена уровнем жаропрочности аустенитных нержавеющих
сталей.
Перлитные низколегированные стали используют для изготовления
корпуса парогенератора ВВЭР, паропроводов перегретого пара, БС,
теплообменников. Наряду с углеродистыми сталями эти стали приме-
няют в качестве материала паропроводов насыщенного пара и трубо-
проводов конденсатно-питательного тракта.
В последнее время показана возможность изготовления из перлит-
ных низколегированных и углеродистых сталей контура многократ-
ной циркуляции и конденсатно-питательного тракта кипящих реак-
торов. Рассматриваемые стали менее коррозионно-стойки, однако при-
менение их в водоохлаждаемых реакторах связано с разработкой и
точным соблюдением соответствующего водно-технологического режи-
ма и наличием средств глубокой очистки теплоносителя от продуктов
коррозии. Из перлитных сталей изготавливают металлоконструкции
канальных реакторов. Верхний температурный предел применения
низколегированных сталей (773 К) и углеродистых сталей (623 К) ог-
раничивается их жаропрочностью. Эти стали технологичны и хорошо
освоены промышленностью, достаточно дешевы.
Сплавы на основе никеля и титана используют для изготовления
парогенераторов н теплообменников в тех случаях, где требуется ма-
териал, стойкий к общей коррозии и коррозии под напряжением. Из
икелевых сплавов изготовляют теплообменники реакторов, охлаж-
21
лаемых жидким натрием. Максимальные Рабочие температуры адя
йляюв титана 673 К, для никелевых сплавов 1073 К. Коррозионная
SSnrrb этих сплавов высока. Большое сечение поглощения нейтр0.
1^ает нежелательным использование их в активной зоне реакто-
пов на тепловых нейтронах. В ряде случаев использование сплавов ти.
тана обусловлено их низким удельным весом.
В ядерных космических двигателях, термоэлектрических и терМо.
эмиссионных преобразователях материалы работают при температу.
ре до 3273 К. В этих условиях находят применение тугоплавкие ме-
таллы (W, Mo, Nb) и их сплавы. Из них изготовляют оболочки твэлов
и элементы активной зоны. Эти материалы имеют высокую жаростой-
кость, совместимы с ядерным топливом. Однако вольфрам и молиб-
ден недостаточно технологичны и охрупчиваются при температу-
рах, сравнительно низких по отношению к температуре их плав-
ления.
Сплавы меди, обладающие хорошей теплопроводностью, исполь-
зуют для изготовления трубчатки конденсаторов и теплообменников.
Недостатком этих сплавов является низкая коррозионная стойкость
при высокой скорости среды, особенно морской воды. Кроме того, про-
дукты коррозии медных сплавов, переходя в теплоноситель, способст-
вуют его активации и образованию отложений на твэлах.
Из неметаллических конструкционных материалов следует остано-
виться на графите. Из графита делают кладку в канальных реакторах.
Для предотвращения выгорания графита кладка продувается азотом
или гелием, очищенными от кислорода. Содержание примесей с вы-
соким сечением захвата нейтронов в графите стремятся снизить до ми-
нимума. Существенным недостатком графита является изменение его
формы и размеров изделий из него под действием облучения и высокой
температуры.
В ядерных космических двигателях и высокотемпературных газо-
вых реакторах из графита изготовляют матрицы твэлов. В этих усло-
виях графит может эксплуатироваться до температуры 2273 К и выше.
В качестве ядерного горючего в большинстве случаев применя-
ются неметаллические соединения урана. Из чистого урана изготав-
плутонияНаПРИМеР’ сеРдечники твэлов реакторов для производства
меня™ На бысТРых нейтронах наряду с двуокисью урана при-
ся ниакяяЛпВЫ урана- Недостатком урана и ряда его сплавов являет-
упаня в радиационная стойкость. Низкая коррозионная стойкость
кости обплпо^«И ВЫсокой температуре в случае нарушения герметич-
л“нию блока'yxy—
ний урана^интрп^Уп3613 ялеРНое горючее используют в виде соедине-
Динения эти могут эксЛп^’ окислов> каРбидов, нитридов и т. д. Сое-
как правило пяпио, луатиР°ваться при высокой температуре. ОнИ’
них, например двуокигиН^°’стойки- К недостаткам некоторых из
водность. у иси УРана> следует отнести низкую теплопрс*
22
Главе 3
ПРОЧНОСТЬ, СОВМЕСТИМОСТЬ И РАДИАЦИОННАЯ
СТОЙКОСТЬ РЕАКТОРНЫХ МАТЕРИАЛОВ
Реакторные материалы, особенно материалы активной зоны, в про-
цессе эксплуатации подвергаются действию высоких механических
нагрузок, облучению в области температур до 800 К и выше. На-
дежная работа ядерных энергетических установок может быть обеспе-
чена лишь в том случае, когда конструкционные материалы обладают
высокой прочностью, жаропрочностью, достаточной радиационной
стойкостью. Материалы оболочек твэлов должны быть также совмес-
тимы с ядерным горючим.
Для правильного выбора материалов необходимо знать, как изме-
няются их свойства в процессе эксплуатации ядерных энергетических
установок. Решение этой задачи, а также повышение указанных выше
характеристик материалов и является одной из основных задач реак-
торного материаловедения.
Свойства металлов и сплавов существенным образом зависят от де-
фектов кристаллической решетки. Такие свойства металлов, как спо-
собность сопротивляться механическим нагрузкам, радиационная стой-
кость, совместимость, связаны со свойствами точечных и линейных де-
фектов кристаллической решетки. В работах советских ученых
Я. И. Френкеля, А. А. Бочвара, С. Т. Конобеевского, А. С. Займовс-
кого и др. показана связь между дефектами кристаллической решетки
и свойствами металлов и сплавов.
Достижения советского материаловедения дают возможность в ря-
де случаев количественно оценивать влияние эксплуатационных фак-
торов на свойства материалов и прогнозировать характеристики ма-
териалов иа основании данных об их составе и структуре. Для реали-
зации этих возможностей необходимо глубокое знание материала, ка-
сающегося характера и свойств дефектов кристаллической решетки
металлов.
§ 3.1. ДЕФЕКТЫ КРИСТАЛЛИЧЕСКОЙ РЕШЕТКИ
Совокупность свойств металлов и сплавов в значительной мере оп-
ределяется структурой и свойствами кристаллической решетки. Кри-
сталлическая решетка металлов и сплавов характеризуется правиль-
ным чередованием в пространстве атомов металла. Атом металла, на-
ходящийся в положении равновесия в узле кристаллической решетки,
имеет минимальную энергию. Он находится как бы в энергетической
яме. Для того чтобы сместить его из положения равновесия, требуется
значительное усилие. В кристаллической решетке реальных металлов
и сплавов всегда имеются те или иные дефекты, снижающие прочност-
ные характеристики металлов. Дефекты в кристаллической решетке
«одразделяются на точечные и линейные.
!/зелбнЧеЧНЫе деФекты- К точечным дефектам относятся вакансии и меж-
ые атомы. Вакансии образуются при удалении атома из узла
23
Рис. 3.1. Различные положения атома
на поверхности кристалла:
1 — заполненное ребро; 2 — заполненный
уг л; 3 — заполненная поверхность; 4 — не-
заполненное ребро; 5 — незаполненный угол;
6 — ступенька; 7 — адсорбированное; 8 —
вакантное; 9 — полукристаллическое
,„пмческой решетки. Межузельный атом представляет собой
кристаллическом Р й между ОСНоВНыми атомами кристал.
внедренный допол вание точечного дефекта ведет к искажению
лическои решетки. и шению ее периодического строения й
кристаллическом структуры металла и его свойств. Й
в Атом, находящийся в узле
кп>ет“лт«кой решетки, получив дополнительную энергию, разры.
X смзи Ггоседаими атомами и перемещается в межузлие, образуя
мХзйьный атом. Энергия связи с соседними атомами характеризу.
межузельным г ется энергиеи кристаллической ре-
шетки Екр, равной по величине и
обратной по знаку энергии, кото-
рая выделяется при образовании
кристаллической решетки из от-
дельных, не связанных друг с дру.
гом атомов. Эта энергия выражает-
ся либо в килоджоулях на моль,
либо в электронвольтах на атом.
Для технически важных металлов
энергия кристаллической решетки
близка к 420 кДж/моль. Согласно
правилу Эйринга, энергия актива-
ции процесса, т. е. величина энер-
гетического барьера, который надо
преодолеть атому в ходе какого-ли-
бо процесса, составляет 1/4 энергии
связи, которая должна быть разорвана для реализации данного про-
цесса. Энергия активации образования вакансии QB = О^б^кр
— 1 эВ ~ 100 кДж/моль.
В кристаллической решетке энергия атома в среднем близка к кТ
или RT. Однако существует конечная вероятность того, что атом в ка-
кой-то момент будет иметь энергию, равную Q. Эту энергию атом по-
лучит вследствие флуктуации энергии, называемой термофлуктуаци-
еи. Вероятность того, что при термофлуктуации атом получит энер-
гию Q составляет, согласно распределению Больцмана, W ~
ехр (— Q/RT). Вероятность образования вакансии при комнатной
температуре равна
“ ехР (QB/RT) = ехр (--Есв/4 RT)~ ЮС-*20/4• 2>3• 8,27.о,298) ~
~3-10-19,
В 1 см железа вакансий будет насчитываться
п e (d/A)/VflZ == (7,8/56) • 6,03 • 1028 • 3 • 10-19 ~ 2,5 • 104,
АвогадроПЛОТН°СТЬ’ относительная атомная масса; N — число
ся в повеохнг^тнА? образоваться и другим путем. Атом, находяший-
рое всегда имеет мА<-СЛ°е металла> может в процессе испарения, кото-
24 СТ0’ не оторваться совсем от кристалла, а перейт
на поверхность, начав таким образом постройку нового поверхностно-
го слоя. На его место может перейти один из соседних атомов того же
слоя или атом внутреннего слоя. При этом образуется вакансия без
перехода атома в межузлие (рис. 3.1). Вакансии могут мигрировать в
глубь металла. При случайном столкновении одиночных вакансий
они могут объединяться в пары (дивакансии). При этом уменьшается
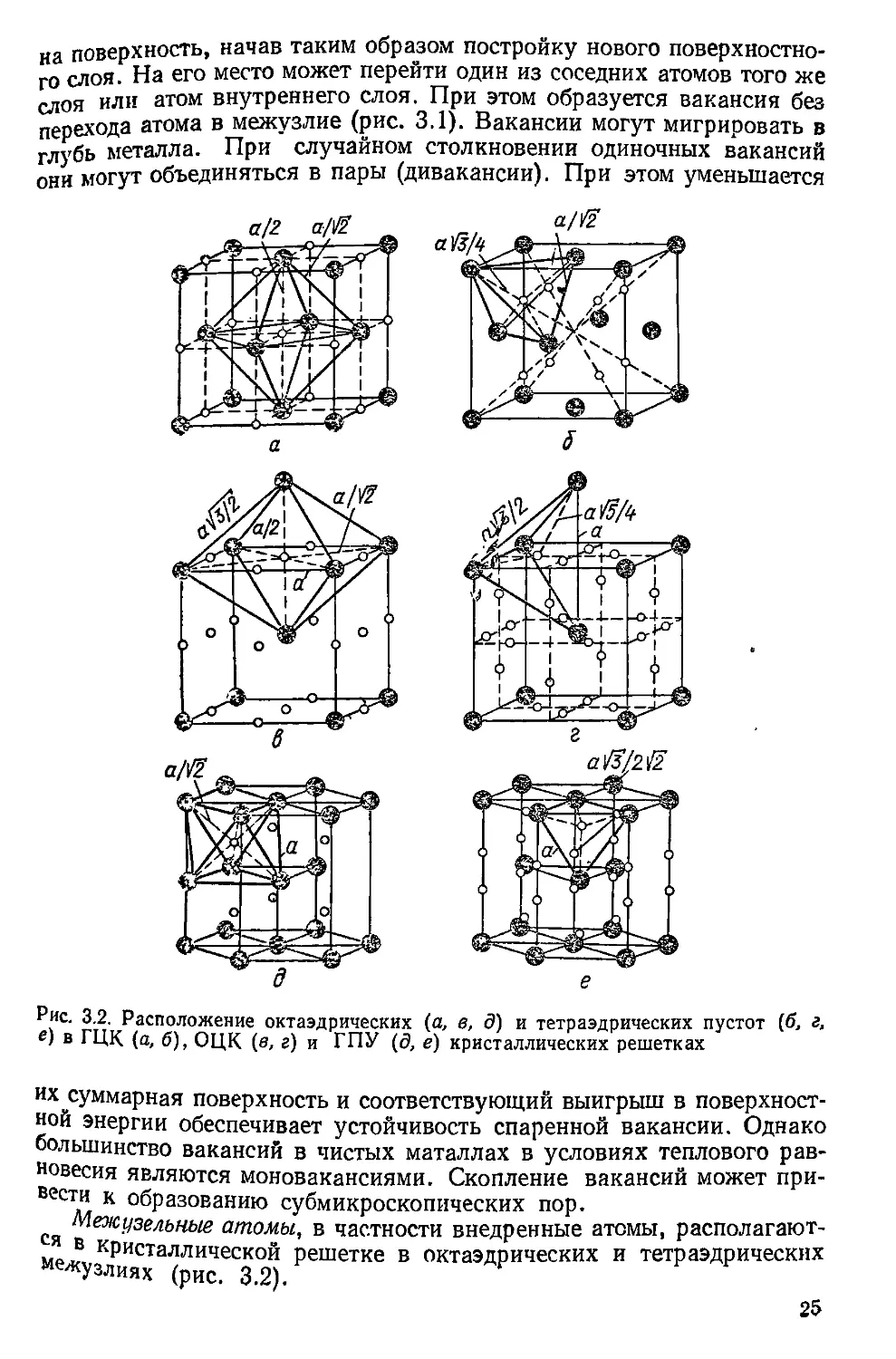
Рис. 3.2. Расположение октаэдрических (а, в, д) и тетраэдрических пустот {б, г,
е) в ГЦК (а, б), ОЦК (в, г) и ГПУ (д, е) кристаллических решетках
их суммарная поверхность и соответствующий выигрыш в Р
ной энергии обеспечивает устойчивость спаренной вака • ‘
большинство вакансий в чистых маталлах в условиях ° пПИ_
новесия являются моновакансиями. Скопление вакансии P
вести к образованию субмикроскопических пор. „„'.гтг.пягяют-
Межузельные атомы, в частности внедренные атомы, Р
ся в кристаллической решетке в октаэдрических и те р др
межузлиях (рис. 3.2).
25
от координапи-
8 6 4
0,97 0,96 0,88
3 1
0,82 0,72
Рйшусы самых больших шаров, которые могут быть размещены
в октаэдрических и тетраэдрических межузлиях без их искажения дЛя
OIIK составляют соответственно г6 == 0,1157?; г4 =• 0 2917?,где 7?
падиус металла. Аналогичные зависимости для ГЦК и ГПУ; г6
__ о 414/?* г* = 0,2257?. „
в’тотноупакованной кристаллической решетке объем октаэдра
ческих межузлий больше, чем в ОЦК-решетке. Однако общий объем
пустот в последней больше, чем в ГЦК и ГПУ, так как в этих типах
кристаллических решеток различно число самих межузлий. В ОЦ{(.
решетке на каждый атом приходится три октаэдрических и шесть тет-
раэдрических межузлий, а в плотноупакованных кристаллических
решетках на один атом приходится одно октаэдрическое и два тетра-
эдрических межузлия.
В октаэдрическом межузлии атом окружен шестью атомами, а в
тетраэдрическом — четырьмя. Радиус атома зависит
онного числа:
Координационное число ... 12
Относительная величина атом-
ного радиуса ........... 1
Ковалентные радиусы г (координационное число равно 1) для ряда
внедренных атомов имеют следующие значения:
Н С N О
г, нм 0,028 0,077 0,070 0,066
Экспериментально радиус внедренных атомов определяют по раз-
меру элементарной ячейки кристаллической решетки того или иного
металла при растворении в этом металле определенного количества
элемента, образующего внедренные атомы. Вследствие искажения
кристаллической решетки при размещении внедренных атомов в меж-
узлиях энергия кристаллической решетки возрастает, что может ска-
заться, в частности, на скорости протекания различных процессов:
диффузии, растворения и т. п.
Внедренные атомы могут образовать более сложные конфигурации,
чем одиночные межузельные атомы. В частности, стабильной может
быть конфигурация из двух межузельных атомов — гантель. Так,
вместо атома в центре двух смежных ГЦК-ячеек могут находиться два
пям^3еЛЬНЫХ атома в направлении (100]. Атом в центре грани как бы
р «ПшнЛСЯ“ Н3 два межУзельных атома и образовал гантель.
Иринин ДИИ* атом в кРисталлической решетке может создавать уплот-
ия я 4_ 1 еП0ЧКу атомов — краудион (рис. 3.3). В краудионе цепочка
жении ™°В/МеЩ5ется на а — Ь, где в нормальном поло-
рис 3 31 Кп 1 бЫли бы находиться атомы (шесть против пяти, см-
фетное пе^еМ7щХМатомов)еГКО пеРемещаться вдоль своей оси
нейным^^екДм кристаллической решетки. Дислокации. К ли-
Дислокации, смещен иТ™Т ДИслокации- Атом, находящийся в ядр
на половину межатом™™ вГ° равновесного положения не более че.
2Q го расстояния. Смещение дислоцирование
го атома от равновесного положения характеризуется вектором Бюр-
герса __ b 10'8 см. Диаметр ядра дислокации составляет 2—10 меж-
атомных расстояния.
Из теории упругости с рядом допущений следует, что энергия дис-
локации на одно межатомное расстояние равна
л = а6Ь2а = а9,8 • 10“20 Дж/ат ~ а 60 кДж/моль, где для железа
= 80 ГПа — модуль сдвига; а = 2,5 • 10“8 см ‘— межатомное рас-
стояние; а = 0,5 4- 1.
В среднем принимается ~ 41,8 кДж/моль. Количество дисло-
каций определяется их числом, приходящимся на 1 см2, — р. Между
действующим напряжением о и количест-
вом дислокаций на 1 см2 существует сле-
дующая зависимость:
р0,5 _ 2ло/бЬ.
(3.1)
Обычно в отожженном металле плотность
дислокаций 10е—108 см-2, в монокристал-
лах Ю3—104 см"2. В наклепанном метал-
ле плотность дислокаций IO10—1011 см-2 и
в сильно пластически деформированном
1012—1013 см-2.
В районе ядра дислокации кристалличе-
ская решетка значительно искажена. В свя-
зи с этим увеличивается радиус у частиц
межузлий. Внедренные атомы в такой ситуации, находясь в деформиро-
ванном межузлии, в меньшей мере деформируют кристаллическую ре-
шетку. При этом, следовательно, и в меньшей мере увеличивается энер-
гия кристаллической решетки. Отсюда следует, что внедренным ато-
мам энергетически выгодно находиться у ядра дислокации. Энергия
связи дислокации с внедренным атомом QCB представляет собой разни-
цу энергии искаженной кристаллической решетки при внедрении атома
в межузлие, находящееся у ядра дислокации, и в межузлие совер-
шенной кристаллической решетки и равна 0,5 эВ ~ 50 кДж/моль.
Группировки внедренных атомов вокруг дислокаций называют атмо-
сферами или облаками Коттрелла.
Концентрация примесных и внедренных атомов в атмосфере Кот-
трелла максимальна у ядра дислокации и убывает с удалением от нее.
Между концентрациями примесных атомов у ядра дислокации Сд и
в металле С существует следующее соотношение:
Сд = Сехр (QCB//?T). (3.2)
Вблизи линии дислокации примерно половина элементарных ячеек
растянута, половина сжата. Устойчивое «облако» примесных атомов
внедрения сохраняется на расстоянии примерно трех межатомных рас-
стояний от линии дислокации. В связи с этим можно принять, что ког-
да все межузлия вдоль линии дислокации заняты внедренными атома-
’ т- е- атмосфера Коттрелла насыщенная или конденсированная,
Мная концентрация примесных атомов в ней близка к 50%. Раство-
27
„ „ Fe при комнатной температуре близка к 2 /0 атомно-
рнмость азота в а-НИФ™ с приведенной ранее зависимостью кон-
?о содержания В соотвстс лла будет наСыщенной.
центрам азота в атмосфер атомов тормозят движение дислокаций
Атмосферы из внедре ии. Под действием приложенных
в процессе пластическо д^р <<оторватьСЯ» от окружающих ее
напряжении ДислоКаЯЯ Зашить» их за собой. В первом случае над ди.
примесных атомов, и „ рядка вектора Бюргерса должна быть
слокацией на приложенных напряжений, равная
ХЙВэ«“ргииаХей всех атомов атмосферы Коттрелла. Во второ»
Рис. 3.4. Плоскость (111) упаковки ГЦК-решетки:
а А, В, С — нижний, второй и верхний слои атомов соответственно’, б— положения атомов
в ри и ах равносторонних треугольников в трех соседних слоях А, В и С
случае движение дислокации замедляется и практически будет равно
скорости диффузии внедренных атомов.
Движению дислокации при пластической деформации мешают раз-
личные препятствия: интерметаллиды, неметаллические включения,
другие дислокации и т. д.
Поперечное скольжение и дефекты упаковки. Винтовые дислокации,
СВоем ПУТИ препятствие, могут перейти поперечным сколь-
ПЛоскость скольжения. Рассматривая этот процесс,
ном ck^xS-au,еТЬ В ВИДУ’что для того чтобы принять участие в попереч-
ниться Рясптрп’ расщепленная винтовая дислокация должна объеди-
дефектов ушывоТ™ ВИНТ0ВЫХ Дисл°каций связано с образованием
(рис.азл)°Тм«к£ВП1П Упаковки в ГЦК-решетке
т. е. имеет место пп^,, все атомы соприкасаются между собой,
ложениях А Кажпый Упаковка- Центры атомов размещаются в по-
рой слой повеох12п1гА0^ ОкрУЖен шестью атомами. Укладывая вто-
местить центры атомов втсюогп°?ранения плотной упаковки, надо раз-
атомами в первом слое и Р СЛ0я в лУнки> образованные соседними
латаются над лунками В pJ™Mep’ центРы атомов второго слоя распо-
ся в лунКах второго слоя няупЦеНТрЬ1 атомов третьего слоя разместят"
28 рого слоя, находящегося над лунками С первого слоя,
ТО Образуется плотноупакованиая ГЦК-решетка. Если в третьем слое
центры атомов разместятся над лунками второго слоя, находящегося
над центрами атомов А первого слоя, то образуется гексагональная
плотноупакованиая решетка. В этом случае размещение центров шаров
в* плотноупакованных плоскостях можно представить чередованием
АВАВАВ... В случае ГЦК чередование имеет вид АВСАВСАВС...
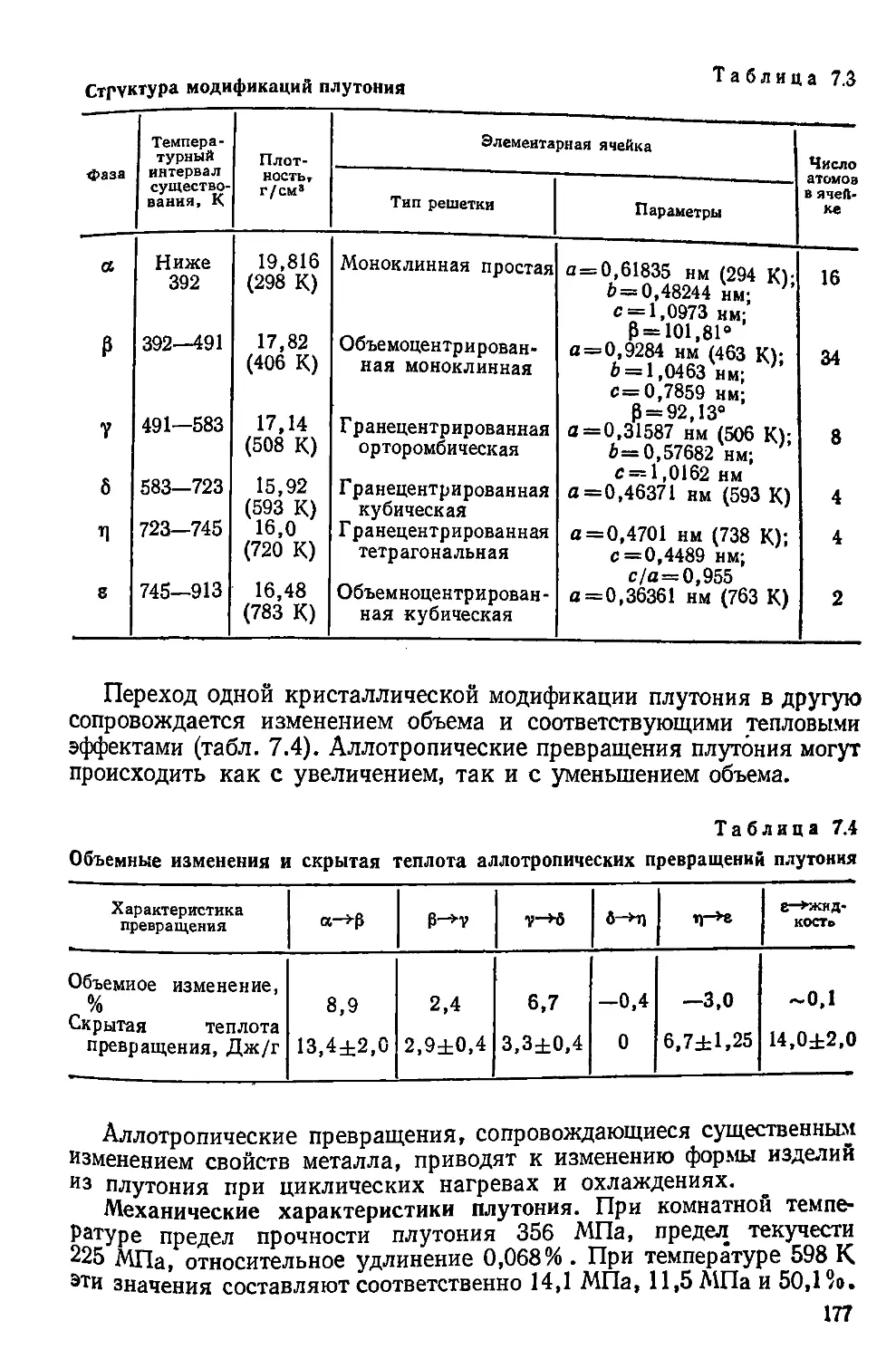
Если в ГЦК-решетке слой атомов с центрами в положении С сдвинуть
так, чтобы центры атомов заняли положение А, возникнет ситуация
описываемая чередованием слоев АВСАВСАВСАВС. При этом в
ГЦК-решетке появится слой атомов
ГПУ-решетки. Такой слой атомов
и называется дефектом упаковки.
На границе соприкосновения
атомов, размещенных в соответст-
вии со строением ГЦК- и ГПУ-ре-
шеток, происходит деформация
кристаллической решетки, атомы
приобретают некоторую дополни-
тельную энергию, т. е. становятся
дислоцированными. Однако энер-
гия, получаемая атомами в рассмат-
риваемом случае, существенно ниже
41,8 кДж/моль, характерной для
полной дислокации. Чем меньше
избыток энергии, тем вероятнее
пребывание системы в таком состо-
янии. Такая система, состоящая из
двух атомных плоскостей (границ
с упаковкой, характерной для
Рис. 3.5. Слой плотнейшей упаковки
атомов А и векторы Бюргерса еди-
ничной (bt) и частичных (Ь2> Ь3) дис-
локаций
решеток ГЦК и ГПУ), разделенных
дефектом упаковки, называется рас-
щепленной дислокацией, состоящей из двух частичных дислокаций.
При перемещении полной дислокации обеспечивается тождественная
трансляция. Так, в ГПУ-решетке в результате перемещения дислокации
атомы с центром в положении В переместятся тоже в положение В
(Рис. 3.5). При этом произойдет тождественная трансляция кристал-
лической решетки.
Однако существуют такие дислокации, перемещение которых не
приводит к тождественной трансляции кристаллической решетки в зо-
не сдвига, хотя и обеспечивается новое, механически стабильное по-
ложение атомов. При этом центр атома из положения В перейдет в по-
ложение С (см. рис. 3.5). Такие дислокации называются частичными.
ычно вектор Бюргерса этих дислокаций, и, соответственно, энергия
еньше, чем у единичной дислокации в данной решетке. В связи с этим
циничной дислокации энергетически выгодно расщепиться на две час-
тие д,нако Для того, чтобы винтовая дислокация могла принять учас-
нИт,в ПопеРечНом скольжении, частичные дислокации должны объеди-
и явл* В П0ЛНую- пР°песс этот требует затраты определенной энергии
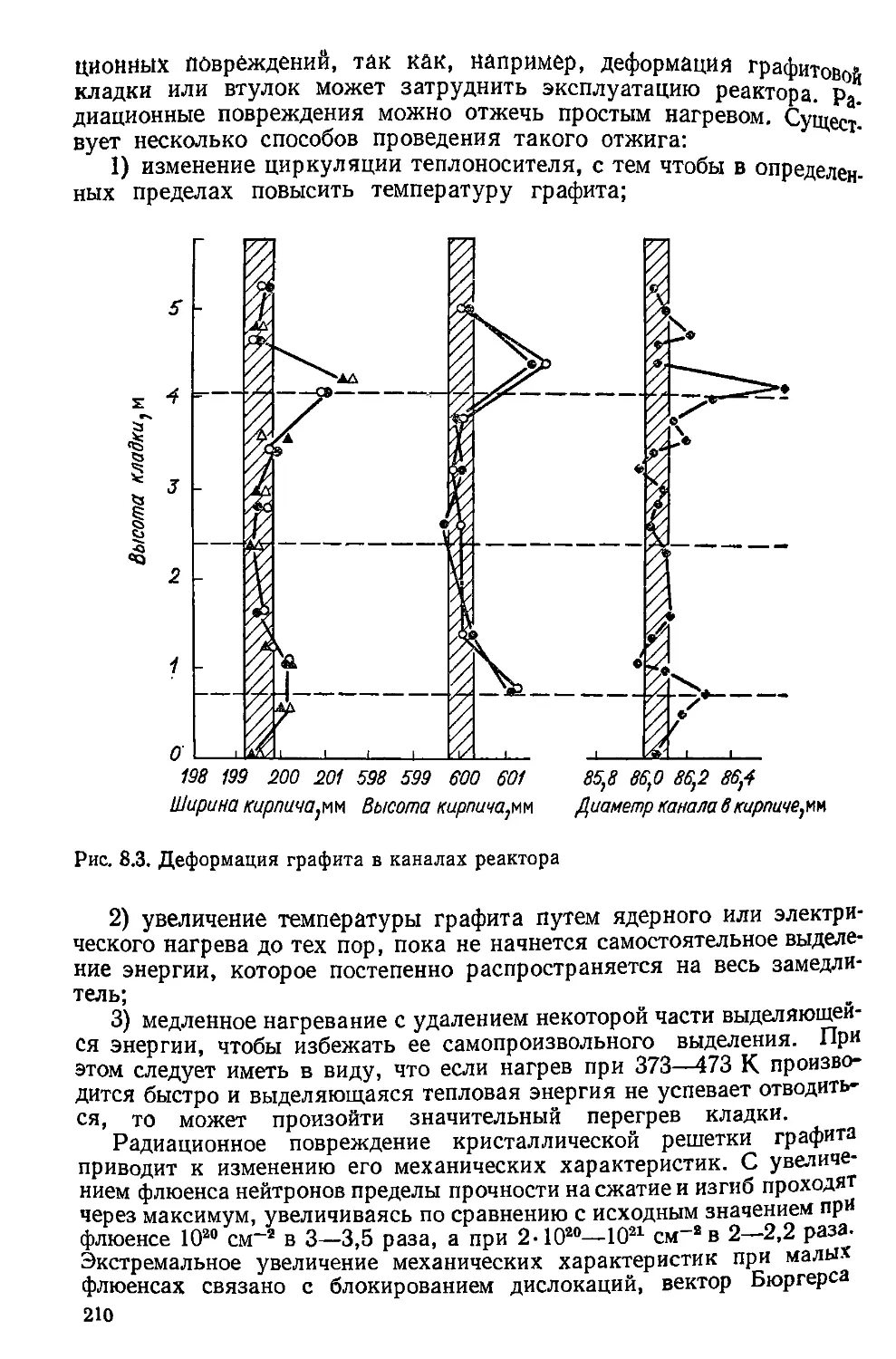
яется термически активируемым. Расстояние между частичными
29
дислокациями составляет ширину дефекта упаковки d (см), между
этой"чиной и энергией дефекта упаковки у (Дж/см2) существуй
обоатно пропорциональная зависимость, у KGb2b3/d, где /<—- по-
—я Ь, Ь3-векторы Бюргерса частичной дислокации (См.
^с 3.5).’ Значения энергии дефектов упаковки различных металлов
приведены ниже:
Металл Mg Al Ti Ag a-Fe Ni Cu Zr Сталь 08X13H10T
у, 10’ Дж СМ2 310 250 10 25 130 350 40 220 20
d Ь — 1,5 — 12 — 4 10 — 45
Слияние частичных дислокаций происходит не сразу по всей их
длине, а путем образования отдельных стяжек. Энергия активации
образования стяжек Qc Gb2d/30.
Энергия активации поперечного скольжения ниже I эЗ для металлов с
ГЦК-решеткой и высоким значением энергии дефектов упаковки, таких как
алюминий, но резко возрастает с уменьшением энергии дефектов. В металлах
с ОЦК-решеткой, где отсутствуют расщепленные дислокации, поперечное сколь-
жение осуществляется очень легко.
Легирование может существенно изменить энергию дефектов упаковки.
Так, в аустенитной стали с содержанием хрома 18% и никеля 8% дальнейшее
увеличение содержания никеля увеличивает энергию дефектов упаковки. На-
помним, что в ГЦК-решетке дефекты упаковки имеют ГПУ-структуру. Раство-
римость элементов в этих решетках в общем случае должна быть различной.
При достаточно высокой температуре атомы легирующего элемента перераспре-
деляются диффузионным путем между дефектом упаковки и ГЦК-решеткой ана-
логично перераспределению элементов между двумя фазами. Примесные атомы
или атомы легирующего элемента либо диффундируют в дефект упаковки, либо
уходят из него. При этом их средняя концентрация в основном объеме с ГЦК-
решеткой остается практически постоянной. Область с измененной концентра-
цией примесных атомов или атомов легирующего элемента в дефекте упаковки
растянутой дислокации называют атмосферой Сузуки, который считал, что в
такой ситуации имеет место химическое взаимодействие растянутой дислокации
с растворенными атомами.
Процесс перемещения дислокации под действием приложенной силы. В ис-
ходном состоянии в момент т0 дислокация состоит из No атомов. Вероятность
перескока одного дислоцированного атома W = (1/6) exp (— QJ RT). Сомножи-
указывает на то, что атом перемещается в определенном направлении,
ваомлр110 В иапРавлении действия силы. В результате перемещения рассматрИ'
Это vmo атоМа происходит локальное искажение кристаллической решетки-
шимся “вшает ®”еРгию активации перемещения атома, соседнего с переместив'
атом иа»?ВЫМ‘ „ ледовательно, после перемещения первого атома переместится
атомлп °дяи*ийся в дислокации рядом с первым. Количество дислоцированны
атомов, переместившихся в единицу времени, будет
— dN/dx = (1/6) vlV exp (— OjRT) = К TV,
---- Ю с частота тепловых колебаний. Решая это дифференциально®
1ЯАМ А/ т-— Л/ / тг > тт 1 __ гтЛПС
уравнение колеоании. пешая это дифференциал-
местнтся на ~ ехр — Кт), полагая, что вся дислокация пеР
стившнхся вРноВо/“Ие’ равное вектору Бюргерса, когда количество пере«
е положение дислоцированных атомов составит М в г
ои
Г учетом изложенного можно определить время т, за которое переместится
дислокация: N/N9 = ехр (— Кт). Отсюда
т = — 2,3 • 6 1g (0,9) ехр (QjRTj/v ~ 6 < 10-** ехр (Q^RT).
Скорость перемещения дислокации
е = Ь/т = (10-в/6-10~14) ехр ( — Qi/RT) = 1,66- 10s ехр (—Q1/RT) =
= 80 ехр (—Qi/RT). (3.3)
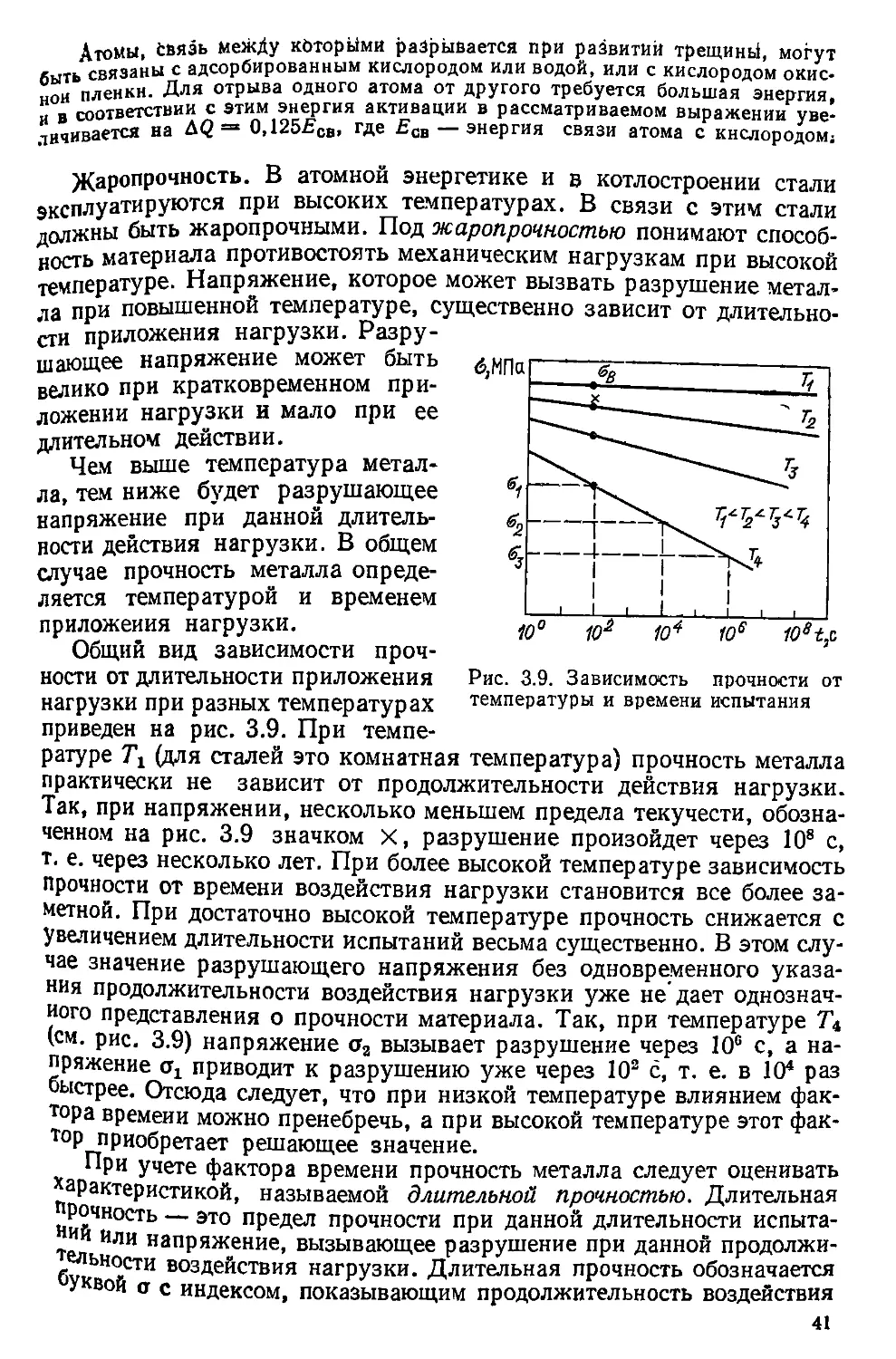
Величина ё0 = 10s см/с по порядку равна скорости звука в металлах. Под дей-
ствием приложенной силы атом смещается из своего равновесного состояния
и энергия его возрастает на величину Д<7, пропорциональную приложенной
силе а и величине смещения I: Д<7 = аД/. Заметим, что dl = ade, где 8 — дефор-
мация кристаллической решетки при перемещении атома на Д/; а= 2,5- Ю-10 м —
межатомное расстояние.
Пластическая деформация происходите зернах металла, плоскости в которых
составляют 45° с направлением приложенных сил. Последние разлагаются на
нормальную составляющую, вызывающую отрыв одной атомной плоскости от
другой, т. е. хрупкое разрушение, и тангенциальную т, обусловливающую смеще-
ние атома вдоль атомной плоскости, т. е. пластическую деформацию.
Из простых геометрических соображений с учетом связи действующей силы
с деформацией и модулем сдвига (G - 80 ГПа) т = 0,7а = eG; а = eG/0,7.
Отсюда
dq = (eGa/0,7) ds\ q = 0,7aGe2. (3.4)
На 1 см2 поверхности сплавов железа приходится п молей:
n = (AV/A)2/3 Д'-1= [(7,8/56) • 6 • 1О23]?/З(6 • 1023)-1=3,!8 • Ю"9, (3.5)
где d = 7,8 г/см3 — плотность; А = 56 — относительная атомная масса; N —
число Авогадро.
Энергия дислоцированных атомов (?д = 42 кДж/моль. Оценим величину
деформации элементарной ячейки кристаллической решетки, когда атом пере-
ходит в дислоцированное состояние:
<3Д = 4,2 • 104 = 0,7aGs2/104 • 3,18 » 10"9. (3.6)
Из данной зависимости ед = 0,30, соответственно
b = 8да = 0,31 2,5 • 10-8 = о,78 « 10-8 ю-в См. (3.7)
Оценим деформацию кристаллической решетки при отрыве одной атомной пло-
скости от другой. В этом случае Q = £кр, где Екп = 405 кДж/моль — энергия
кристаллической решетки железа; Е = 205 ГПа — модуль упругости;
£кр = 4,05 • 106 = 0,7 пЕ82/104 • 3,18 • 10"9. (3.8)
Отсюда 8 ~ 0,60, и в общем виде
82 = KQ или Q = 82/К (кДж/моль). (3-9)
О помощью последней зависимости можно оценить величину смещения атома
3 Равновесного положения I в процессе тепловых колебаний, полагая Q = RT:
1*= 0,248 (К7?Т)О,В = 0,248 (0,77 • 10~» • 827 • О,291)0,8 = 0,011 нм,
Редел’248 нм ~~ минимальное межатомное расстояние. Экспериментально оп-
еиная величина I для железа при температуре 291 К составляет 0,0107 им.
31
Ниже приведены значения величин К для различных экспериментально:
Металл А1 Ti Fe Ni Си Zr
к-ю3 1,50 1,09 0,77 0,85 1,18 0,77
w м F соеднее для 21 металла значение екр = 0>б04
С учетом величии К и сред м железа при смещении его иа рас.
Оценим энергию, пРи°°ре^йствием напряжения, равного пределу текуЧе.
стояние, отвечающее 8Д, под деи
сти от = 210 МПа.
Оценим энергию, приобретенную’
где
гяя
от = 210 МПа:
Q = OJaeaj/lO4 • 3,2 • 10-’ = сстт = 0,41 кДж/моль, /, ,
И-10)
и — 0,7а • зЮ-® • 106/104 • 3,2 • 10~8 — активационный объем. Если э
в килоджоулях на моль и а в мегапаскалях, неР-
® = 1,64 Ю-з.
(3.11)
Рнс. 3.6. Смешение атомов в кристаллической .решетке под действием механиче-
ских напряжений
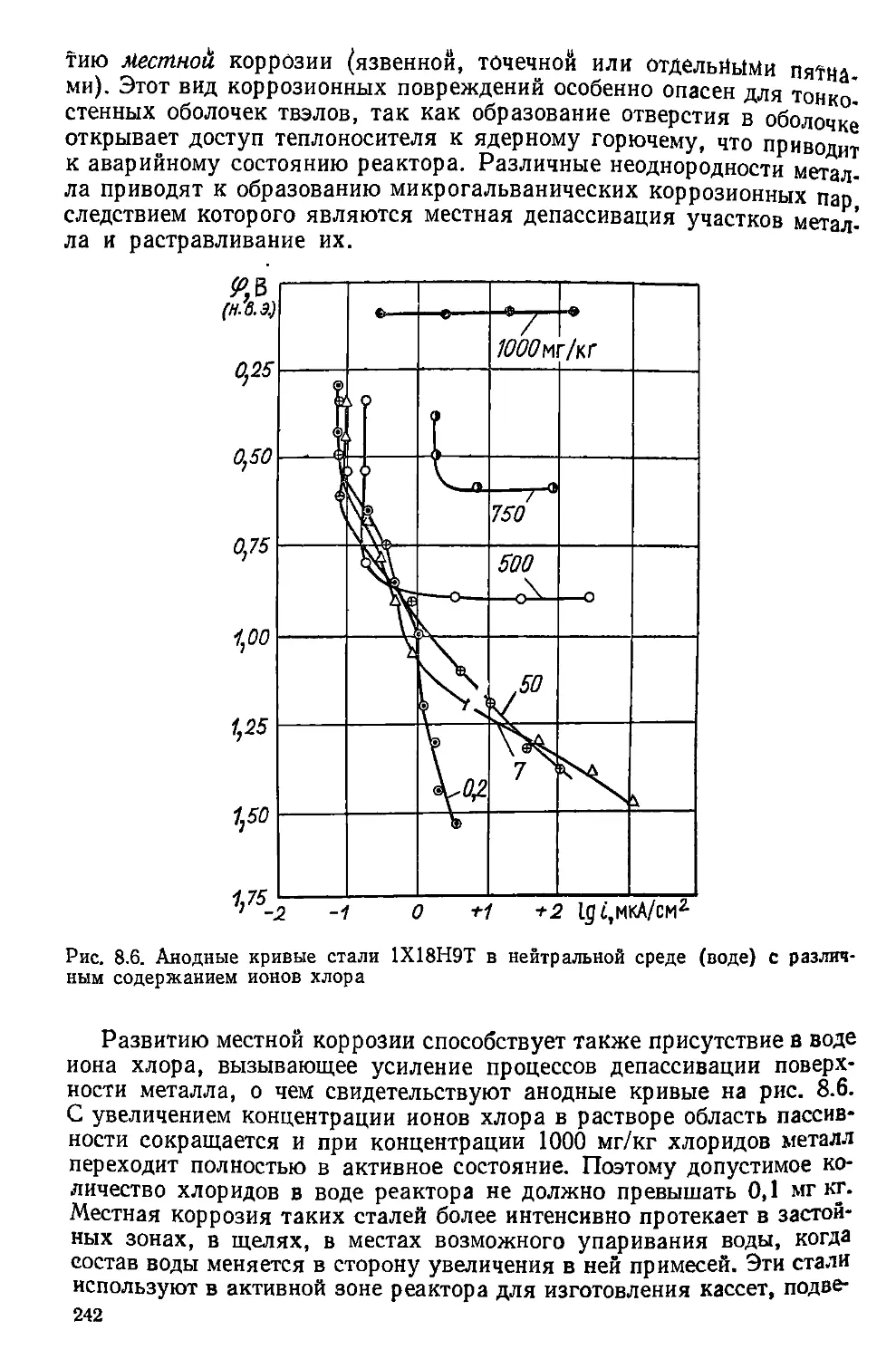
Полученное значение энергии крайне мало и не превышает даже энергии
тепловых колебаний RT. Это заставляет предположить, что в процессе нагруже-
вия кристаллической решетки происходит увеличение напряжения, действую-
щего на данный атом, иа величину у. Величина эта введена академикомС. Н. ЖУР"
ковым и названа коэффициентом перенапряжения.
Исчерпывающих методов расчета этой величины нет. Однако существуют
приближенные модели, позволяющие подойти к оценке у. Рассмотрим одну
них, Таигенцнальвая составляющая т, действующая в атомной плоскости, парад-
л ель ной экстраплоскости, вызывает смещение атомов из положения 1, 2, 3, —
п—1,п в положение 1', 2', 3', ... (п — 1)', п' (рис. 3.6). В первом приближении
ожно принять, что положение атомов в экстраплоскости не изменяется.
1 сме“?ается из своего равновесного положения на величину 4 " 6 .
/Ae_BL3?Kn3 Гука е~^Е. Смещение атома 2 L = 2еа. Смещение атома л
ИрИ Дост™ни предела текучести 8 10-3, и смещение атома
X 10-зР вектоРУ Бюргерса: ln = b = та. Тогда Ыа = е = пе^п>
IU Из этого соотношения с учетом е_ = 0,31 п = 310 = уп.
ния поевоаТПИиРЛТпНВШИЙСЯ на Рас„ст°™иа b о! своего равновесного положе
превосходящие ппОпаДИСЛ0ЦНр°ванн“й атом> хотя на него действовали сиЛ1А’ ..
нет действовать я,ЛЭ текучести- Если на рассматриваемую плоскость переем
в свое исхолнор nnnnwoT° ВСле атомы эт°й плоскости, кроме атома п, веРиут0.
ма. Д °е положеиие- Атом п останется в положении дислоцированного а
скости в^сипv^n^na^0’ иметь в ВИДУ> что некоторые атомы рассматриваемой пл
го7авновеснУого полоТеи: еЩепД° действия ™ т Могут смещены из
В межузлиях атомы Действием внедренных атомов, находяш”
* 1 кристаллической решетки смещены из своего РавН
V4
кого положения 1 в положение /' на расстояние I (рис. 3.7). При этом кристал-
лическая решетка деформирована на величину в' = Ь/а.
Под действием силы т атомы перемещаются в положение 1, отвечающее их
равновесному состоянию до искажения кристаллической решетки внедренными
атомами. Заметим, что хотя кристаллическая решетка деформирована на ве-
личину и', формально межатомное расстояние не изменилось. Соответственно,
полученная ранее величина п = 310 характерна только для идеальной, неис-
каженной кристаллической решетки, и правильнее будет обозначить ее п°.
Реальная кристаллическая решетка всегда искажена в той или иной степе-
ни. Внедренный атом, например атом углерода, находящийся в тетраэдриче-
ской пустоте, искажает кристалличе-
скую решетку на
Дг = гс — г^= 0,041 нм, (3.12)
где ге = 0,077 нм — радиус внедренно-
го атома углерода; = 0,036 нм — ра-
диус тетраэдрической пустоты в ОЦК-
решетке железа. Отсюда деформация
кристаллической решетки 8 = Дг/а =
=0,041/0,248=0,165, где а= 0,248 нм —
минимальное межатомное расстояние в
ОЦК-решетке железа.
В результате искажения кристалли-
ческой решетки энергия ее возрастает.
Если энергия, обусловленная деформа-
цией, станет равной QM = 4 R Т, то кри-
сталлической решетке энергетически выгоднее перестроиться в новую модифи-
кацию. Для нормальных условий в случае железа = К • 4RT = 0,77 X
X 10-з . 4 . 8,27 - 298 • 10~® ~ 7,6 • 10-®; 8М ~ 8,7 • 10-®.
Деформация — характеристика линейная. В железе, содержащем 0,035% С,
на один атом углерода в каком-либо кристаллографическом направлении при-
ходится
П1 = (100 • 12/56 • % С)1/3 ~ 8,5 (3.13)
Рис. 3.7. Искажение кристаллической
решетки твердого раствора внедре-
ния:
а — до деформации под действием поило-
женного напряжения: б — после деформа-
ции
атомов железа и, соответственно, 8,5 межатомных расстояний.
Сравнивая значения 8 и 8М, видим, что для сохранения исходной кристалли-
ческой решетки деформация 8, обусловленная внедрением одного атома углерода,
должна распространяться на п2 межатомных расстояний:
л2 = е/ем = 0,165/0,087 ~ 1,9. (3.14)
Тогда доля деформированных межатомных расстояний
S = n2/nx = 1,9/8,5 = 0,22. (3.15)
Доля недеформированных
1 — 5 = 1 — 0,22 = 0,78. (3.16)
Таким образом, в рассматриваемой ранее схеме могут деформироваться на
величину е = 10_® не п0 = у0 = 310 элементарных ячеек, а только
(3-17)
Vo (1 — 5) = 310 • 0,78 = 242 = у,
Где у и есть коэффициент перенапряжения или усиления.
Пп С Р°стом деформации количество дислоцированных атомов увеличивается.
когИ Этом’ естественно, искажается и кристаллическая решетка. В ситуации,
*а ВСе п° кРисталлических ячеек максимально искажены (см. рис. 3.6) и
ат0мТОМное Расстояиие не меняется под действием приложенных к каждому
сУммя СИЛ Т’ ВСе силы Ti> Tn-i> тп суммируются и на атом 1 действует
п, =аРная сила 2т = пдт, т. е. действующее напряжение увеличивается в
о раз.
Зак, 369
33
(з. 18)
алиями 1 И 0 произойдет после того, как деформацИо
Разрыв связи «е«ДУ атомам« ' ВНОЙР0,6. Из закона Гука аци*
соиа«» _ о в • •310 - °'567 гпа’
ппачности стали марки 20.
что ПлаХесйдеформация должна начаться при напряжении, равном пре-
делу текучести:* = 0д4 ГПа, (3Д9)
V ппепелу текучести железа с 0,035% С.
что близко. предаг^виси^0Стей могут быть получены значения у для матерИа.
„„.‘«„«.“зуемых в атомной технике:
Материал Сталь 20
v 173
22К 08Х18Н10Т Иодидный Zr
160 156 197
Используя зависимости, аналогичные уравнениям (3.12)—(3.19), оценим
значения <гт для ряда сталей и сплавов. Удовлетворительное согласие расчетных
значений с экспериментальными позволяет полагать, что рассматриваемая доста-
точно условная модель может быть использована для приближенных количест-
венных оценок механических характеристик сталей и сплавов (табл. 3.1).
Таблиц? 3.1
Значение сгт для сталей и сплавов, МПа
Материал Fe с 0,035 % С массового содержа- ния Сталь 20 08Х18Н10Т Си, легированная 10 % атом- ного содержания
А1 N1 Zn
Расчет 140 180 200 74 55 62
Эксперимент 147 220 200 80 75 60
Для металлов, содержащих примеси в количестве 0,01—0,001%, число эле-
ментарных ячеек, искаженных атомами внедрения, мало. В этом случае можно
принять у 300. Значения величин <гт с учетом этого обстоятельства для ряда
чистых металлов приведены в табл. 3.2.
Таблица 3.2
Значения от для чистых металлов, МПа
Металл А1 Ni Си Zn Ge А?
Расчет 39,9 115 68 54,8 58,8 43,2
Эксперимент 29—35 78 55—69 78 51 53
5 = ^ООе^гдеV—ве^чинлСТДЛЬК<’г° Удлинения 5- В первом приближения
ложеиным силам СкольжрнЛ пЛМаЦНИ В напРавлении, параллельном пря
45 к направлению приложеииь1х°сия° с?Т В ПЛоскости> находящейся под Угл°
Дня в плоскости скольжения - ТСЮда Gi “ 8 cos 45°> где в - дефор«а.
-ц я. При напряжении и? зависимости, аналогично
„ию 19)> е = 0,7yor/G. Причем в рассматриваемом случае д = вв.
Последнюю величину находим из соотношения (3.18). С учетом изложенного
получим (%): 6 = 1()2 cos 45о . Q 7 ф 0 6 , £7/0 7Суо
(3.20)
п о чтом G = Е/2 (1 + v), где v — коэффициент Пуассона для сплавов железа,
Низкий К 0,28. Тогда
6 = IO2 - 0,42£2 (1 + 0,28) у/£у0 ~ 107у/уо.
гт,я сплавов железа при у/у0 0>5 в = 53%.
Относительное удлинение^ аустенитных сталей близко к 50%. Можно пред-
ставить гипотетический случай, когда при пластической деформации скольжение
Произойдет по всем плоскостям (111) в y-Fe и по всем плоскостям (ПО) в a-Fe,
ориентированным одинаковым образом по отношению к приложенным силам.
В этом случае удлинение будет пропорционально числу таких плоскостей. По-
следнее же значение обратно пропорционально расстоянию между центрами ато-
мов лежащих в соседних плоскостях скольжения а.
Для a-Fe при а = 0,268 нм da = Д/2 а/2 = 0,202 нм. Для y-Fe при
г = 0,126 нм dy = 2r cos 60° = 2 • 0,126 • 0,5 = 0,126 нм. Отсюда 6а =
dy/da — 51 • 0,126/0,202 = 31,8. Действительно, относительное удлине-
ние Сталей с а кристаллической решеткой близко к 30%.
Таким образом, рассматриваемая приближенная модель, не являясь все-
объемлемой и исчерпывающей, позволяет в первом приближении количест-
венно оценивать ряд важных характеристик металлов, в том числе и коэффициент
усиления у при напряжениях, близких к пределу текучести.
Из рис. 3.6 следует, что величина у связана с наличием в металле экстра-
плоскости и дислокаций и определяется числом атомов, приходящихся на каком-
либо кристаллографическом направлении на один дислоцированный атом. В со-
стоянии равновесия вероятность образования дислоцированного атома
W=iG~Q/RT, (3.21)
где Q = 41,8 кДж/моль — энергия дислоцированного атома. При температуре
293 К
уо=(1О41’8/19,1.293.1О"3)]/З=зо81 (3.22)
что близко к полученному ранее значению (310).
Таким образом, можно полагать, что при действии на металл механиче-
ского напряжения о иа атом действует сила = оу. При этом энергия атома
в случае пластической деформации с учетом зависимостей (3.4)—(3.6) увели-
чится на
91= 0,7aaye-/104 • 3,18 • 10~® = 0,7 • 2,5 • Ю"10 • 0,31усг/104 • 3,18 X
X IO-® . ю-з = Цуа, (3.23)
где v — 1,64 . Ю~® — активационный объем.
□а счет внедренного атома углерода каждое из пг межатомных расстояний
стали 20 деформируется на 8= е/пг = 0,165/4,75 = 3,47 • 10~2.
Вследствие деформации каждый атом получит дополнительную энергию:
q2 = е2/К = (3,47 • 10~2)2/0,77 • 10-» = 1,56 кДж/моль.
Энергия активации перемещения дислокации соответствеиио
на сумму + ?2:
Qi= Q — 41 — <72-
С учетом изложенного скорость перемещения дислокации
(3.24)
уменьшится
(3.25)
8 = е0 exp (—Q/RT) =е0 exp [—(Q—г>уст + <7а)/ЯЛ. (3.26)
воп Q (кДж/моль) — энергия активации перемещения дислокации в недеформи-
" энном металле, равная энергии активации самодиффузии (табл. 3.3).
2* 35
Таблица
Энергмя Д""-"""11 Ni*«
Металл Si* Н<хром** Ge*
Перемещение дислокации Сам диффузия 192—213 230—240 290 286 268 290 268 276
• На ряжение 5 МПа»
•• Исходный размер зерна 100 мкм.
Энергия активации самодиффузии и энергия кристаллической решетки (£ )
в первом приближении связаны зависимостью Q 0,56 £кр.
В табл. 3.4 приведены значения энергии активации самодиффузии и вели-
чина активационных объемов для ряда технически важных металлов.
Таблица 3.4
Характеристики ряда элементов
Характеристика a-Fe y-Fe Ni Al a-Ti Cu e-Zr
Энергия активации само- диффузии, к Дж/моль 235—273 270 280 142 121 205 92
Активационный объем v, 103 кДж/(моль-МПа) 1,64 1,64 1,52 2,3 2,44 1,6 c 3,2
Количество молей на 1 см2, 10-» 3,2 3,2 3,3 2,5 2,4 3,2 2
5 ЗА ЖАРОПРОЧНОСТЬ И ДЕФОРМАЦИЯ МЕТАЛЛОВ
В процессе эксплуатации ядерных энергетических установок дета-
ли и узлы их подвергаются действию механических напряжений.
™Р^ение снизить количество конструкционных материалов в ак-
НЯппи«Д°Не ДЛЯ Умеиьшения поглощения нейтронов, облегчить вес,
НИЙР мм-яРЛ1СПОрТНЬ1Х Устан°вок> приводит к увеличению напряже-
максимал^А^«°НСТРуКЦИИ'°АН0Й из задач конструктора является
нении належнп^еНЬШ«НИе металлоемкости узлов и изделий при сохра-
нении надежности работы установки.
чтобы при всех эк™™»?* установок рассчитываются таким образом,
уиругой₽области Оп Уа3.аЦИ°ННЫХ Режимах металл работал в пределах
ла в упругопластическпй°пл^ЯЛе с^/чаев Допускается работа материа-
связано с пластичРгклЛ °^1асти- Изменение формы, например твэлов,
жений в конструкции й ^формацией. Чрезмерное увеличение напря-
лы, может привеста к n?fnHH° ПрИ °ДновРеменном воздействии сре-
ДеЛоомяпиа ! И к РазРУШению материала.
« ^сплу^тациИИ механиц^рг^и П°Д действием возникающих в процес-
металла, увеличивающаяся^ ПРОИСХ°ДИТ деформация
36 щаяся с ростом напряжений. Вначале, когда
напряжения в металле Малы, деформация обратима И Црактичбскй ли-
нейно зависит от нагрузки. При снятии нагрузки деформация исче-
зает. Такого рода деформацию называет упругой. Изменение размеров
при упругой деформации можно связать с обратимым искажением
кристаллической решетки. Упругая деформация происходит лишь при
нагрузках, не превышающих некоторой определенной величины, на-
зываемой пределом текучести (упругости).
При увеличении нагрузки выше от деформация сохраняется при
снятии нагрузки. Такая деформация называется пластической. На
диаграмме растяжения величина предела текучести отмечается почти
горизонтальным участком кривой, на котором деформация увеличи-
вается без роста нагрузки. Однако в реальных случаях такой участок
не всегда хорошо выявляется на диаграмме растяжения. В этом случае
за условный предел текучести принимают напряжения, вызывающие
пластическую деформацию на 0,1 или 0,2%. Условный предел текучес-
ти обозначается o0ii или о0>2.
Пластичные материалы до разрушения под влиянием возрастающей
нагрузки приобретают заметную пластическую или остаточную дефор-
мацию. Разрушение металла в таком случае называют пластическим.
В случае хрупкого разрушения материал с ростом нагрузки деформи-
руется упруго и затем при достижении некоторой величины нагрузки
разрушается без пластической деформации. В этом случае межатом-
ные расстояния в процессе упругой деформации становятся столь ве-
лики, что межатомные силы ослабевают и происходит отрыв одной
атомной плоскости от другой. Нагрузка (на единицу площади), при ко-
торой происходит разрушение материала, называется пределом проч-
ности (оЕ). В хрупких материалах предел прочности равен пределу
текучести. В пластичных металлах предел прочности, естественно,
выше предела текучести. Заметим, что в пластичных материалах при
напряжениях выше предела текучести одновременно развиваются и
упругая, и пластическая деформации.
Приложение нагрузки, не превышающей предела текучести, вызы-
вает искажение кристаллической решетки в результате смещения от-
дельных атомов из положений равновесия. При растягивающих на-
грузках увеличиваются межатомные расстояния вдоль оси, по которой
происходит указанное смещение. При сжимающих нагрузках рассто-
яния между атомами уменьшаются. При смещении атомов из положе-
ния равновесия силы металлической связи стремятся вернуть их в ис-
ходное состояние. Сумма сил, действующих на все смещенные атомы,
расположенные на единице площади поперечного сечения, называет-
ся напряжением и равна нагрузке, приходящейся на ту же площадь,
ока не пройден предел текучести после снятия внешней нагрузки,
каждый атом возвращается в положение равновесия. При этом упругие
Деформации и напряжения становятся равными нулю. Величина упру-
гого смещения атома даже в атомных масштабах всегда мала. Работа,
атраченная на упругое деформирование металла, сохраняется в виде
потенциальной энергии атомов искаженной кристаллической решетки.
н 'Ласгпическая деформация кристаллов может происходить в основ-
м Длумя путями: скольжением и двойникованием. При скольжении
37
имеет место движение тонких слоев кристалла наподобие смещений
капт в колоде Скольжение происходит вдоль определенной кристал-
лографической плоскости (плоскость скольжения) и кристаллогра-
фического направления (направление скольжения). В ГЦК и ГПУ
кристаллических решетках плоскостями скольжения являются обыч-
но плоскости с наиболее плотной упаковкой атомов. В ГЦК-решетке
такой плоскостью является плоскость (111), в ГПУ базисная плос-
кость (0001) При повышении температуры в скольжении могут прини-
мать участие и другие плоскости, однако и они должны иметь относи-
тельно высокую атомную плотность.
Скольжение наиболее просто установить по присутствию линий
скольжения. Последние образуются при пересечении плоскостей
скольжения с поверхностью кристал-
ла. Расстояние между плоскостями
скольжения в различных металлах
различно, в среднем это 10-4 см, т. е.
~103 атомных диаметров. Сдвиг меж-
ду соседними плоскостями скольже-
ния может достигать 102 атомных
диаметров. В большинстве металлов
с увеличением деформации при зна-
чительном растяжении расстояние
между плоскостями скольжения не
изменяется, т. е. деформация проте-
кает по уже образовавшимся плоско-
стям скольжения.
Напряжение, вызывающее сколь-
жение в данной атомной плоскости,
Рис. 3.8. Зависимость напряжения
от деформации для монокристал-
лов с ГЦК-решеткой
называется критическим скалывающим напряжением сдвига и состав-
ляет для ряда металлов 1-?2МПа, по теоретическим расчетам —3,5 ГПа.
Необходимость объяснения того факта, что наблюдаемое скольжение
в действительности происходит при относительно небольших напря-
жениях, привела к развитию теории дислокаций.
Изменение дислокационной структуры в процессе деформации. Схе-
матический вид кривой напряжение — деформация для монокристал-
лов с ГЦК-решеткой показан на рис. 3.8. Кривая отчетливо разбива-
ется на три стадии. Стадия I связана с так называемым легким сколь-
жением, когда движение дислокаций происходит в основном в одной
системе скольжения (первичной). В монокристаллах дислокации при
этом проходят большие расстояния, порядка диаметра образца. Упро-
чение, соответствующее этой стадии, мало. В металле при этом обра-
зуются длинные линии скольжения.
С увеличением степени деформации наступает стадия II. Скольже-
ние происходит во вторичных системах. Усиливается упругое взаимо-
действие дислокаций, в результате которого могут образоваться сидя-
чие дислокации Ломера—Коттрелла. Образование последних проис-
ходит, например, в металлах с ГЦК-решеткой, когда две расщепленные
дислокации с векторами Бюргерса, расположенными под углом 120',
встречаются на пересечении своих плоскостей скольжения. На ста-
38
ц„и II линии скольжения становятся короче и среднее расстояние,
проходимое дислокациями, уменьшается.
При еще больших деформациях наклон кривой напряжение — де-
формация уменьшается. Наступает стадия III, связанная с термически
активируемым процессом поперечного скольжения винтовых дислока-
ций под действием возрастающего напряжения. Поперечное скольже-
ние приводит к частичной релаксации (снятие напряжений). Дислока-
ции группируются в объемные сетки (ячеистое строение дислокаций),
внутри которых расположены менее искаженные области решетки
(блоки). Ячеистая структура образуется тем легче, чем выше энергия
дефектов упаковки, т. е. чем уже расщепленные дислокации и легче их
поперечное скольжение. Поперечное скольжение обеспечивает воз-
можность аннигиляции отдельных дислокаций противоположных зна-
ков, что также ведет к уменьшению упругих напряжений.
Движение дислокаций может быть остановлено каким-либо препят-
ствием, которое дислокации не могут обойти поперечным скольжением.
Движение дислокаций также может быть заторможено, например,
дисперсионными частицами различных фаз. Выделяющаяся в матрице
дисперсная фаза создает поле упругих напряжений за счет различия
удельного объема фаз. Эти поля, взаимодействуя с дислокациями, тор-
мозят их движение, блокируют. Критическое расстояние между дис-
персными частицами, отвечающее максимальному торможению дисло-
каций, составляет 50—250 межатомных расстояний.
Границы зерен или блоков препятствуют движению дислокации,
так как при переходе через границу ни плоскость скольжения, ни век-
тор Бюргерса не остаются неизменными. Энергия границы зависит от
угла, под которым повернуты зерна относительно друг друга.
Дислокации, движущиеся в пересекающихся плоскостях скольже-
ния, также могут блокировать друг друга. При этом образуется «си-
дячая» дислокация Ломера—Коттрелла.
Если поперечное скольжение затруднено, то перед препятствием образует-
ся плоское скопление дислокаций. Число дислокаций в скоплении может быть оп-
ределено по следующей зависимости:
п = 2nLo/Gb, (3.27)
где L — длина участка, на котором скапливаются дислокации, см. Согласно
изложенному выше, можно принять
L = уоа = 310 • 2,5 • Ю"8 = 7,75 • 10~6 см. (3.28)
Для сталей G = 80 ГПа; b = 10-в см; о = сг8 = 550 МПа. Тогда п = 2 X
X 3,14 • 7,75 • 10-е сг/8 10* • 10~8 ~ 0,06ст 33, если о выражено в мега-
паскалях.
В стали 20 на один атом углерода в каком-либо кристаллографическом на-
правлении приходится у = 186 неискаженных элементарных ячеек. Если при-
нять в среднем, что диаметр ядра дислокации имеет размер 6 межатомных рас-
стояний, то иа рассматриваемом участке в плоском скоплении должна находить-
ся 186/6 =» 31 дислокация.
Плоское скопление дислокаций представляет собой зародыш, трещины.
о сидячей дислокации Ломера—Коттрелла встречаются два плоских скопления
Дислокаций, образующих зародыш трещины. Длина зародыша трещины С 2L.
После того как дислокации перестают перемещаться вследствие того, что
0Нй блокированы, а приложенные напряжения растут, наступает хрупкое
&
яи„, — отоыв одной атомной плоскости от другой. При хрупком разру.
разрушение ^трофический рост трещины. Напряжение, при Ко^_
%м начинается катастрофический рост трещины, определяется из зависимости
Гриффитса: _ .
=1,4 ГПа, (3.29)
гтр «ля стали 22К Е = 200 ГПа — модуль упругости; р = 1,5 • 10"® Дж/см« _
по^хн^ная энергия; С =7,75-10-® см - длина трещины критических
РаЗМПр°едел прочности стали 22К равен ав = 560 МПа, относительное сужение
Ф 0,48. Отсюда истинное значение напряжения при разрушении стали соста-
ВИТ оист = 5,6 - 102/0,48 » 1,17 - 10s МПа = 1,17 ГПа,
что удовлетворительно согласуется со значением, полученным по (3.29).
Развитие трещин. Когда действующее напряжение меньше критического,
катастрофического роста трещин не наблюдается. Тем не менее трещина увели-
чивается во времени. Имеет место так называемое замедленное разрушение.
Оценим скорость распространения трещины в такой ситуации. При развитии тре-
щины происходит хрупкий разрыв между атомами в плоском скоплении дисло-
каций.
Элементарный акт развития трещины заключается в разрыве связи между
двумя соседними дислоцированными атомами. Разрыв может произойти, когда
эти атомы в процессе тепловых колебаний движутся в противоположные сторо-
ны. Вероятность движения атома в какую-либо сторону равна 1/6. Вероятность
одновремеииого движения двух атомов в противоположные стороны ТГ, = 1/6 X
X 1/6 ~ 2,8 - 10-2.
Для того чтобы связь между атомами была разорвана, они должны иметь
энергию Q"08. У поверхностных атомов «соседей» в два раза меньше, чем у ато-
мов, находящихся в середине кристалла. Отсюда и энергия кристаллической ре-
шетки поверхностных атомов £В°Е = 0,5Дкр. По правилу Эйринга энергия
активации
<2ПОВ=0,25 £™в=0,25-0,5 £кр =0,125 5кр.
Она существенно больше RТ — энергии тепловых колебаний. Отсюда и ам-
п -Удз коле°аний рассматриваемых атомов будет существенно выше амплиту-
д w вловых КОлеоаний. Смещение атома в рассматриваемой ситуации будет воз-
лр^яиий В ТОМ СлУчае' когда соседние с ним атомы в процессе тепловых ко-
X I R ~ 1 оДаляться от него. Вероятность такого события = 1/6 X
двинется на3васетояии1Й “ежду ДВУМЯ дислоцированными атомами трещина про-
зи происходит Л ’ равное вектору Бюргерса, т. е. на Ю-s см. Разрыв свя-
головиую дислокациюТКпеёйрГДп блокиРоваио скопление из п дислокаций. На
В рассматоирЯ₽мп«Д^ ТВУСТ сУММаРная сила Sa= по = 6,08 - 10-зо.
составит 0 6 а ие л 41 vf^y4ae при РазРыве связей максимальная деформация
объем о1 == ’ ак ПРИ Дислоцировании атома. Поэтому активационный
С учетом изложенного скорость развития трещины (см/с) на сталях
—(0,125 Ек_—vtno)
(-«/Rn-bvT.W.-lO W-------------------
V 10-2 о о , ^-(0.125-405 —2-1,64 - lQ-3.6.10~2g.)
Х10 2-2,8-10-2.10^ ГУ-Ь,29з ----------~~
-(50,63 — 2-1 0~*рД)
аг 78-10 19-0,293 гз 30)
Где у » Юм 1/с __ _аЛ1, 1 '
ЭД стота тепловых колебаний; <т — в МПа, Т = 293 К»
Атомы, связь межДу которыми разрывается при развитий трещинь!, могут
„связаны с адсорбированным кислородом или водой, или с кислородом окис-
и пленки. Для отрыва одного атома от другого требуется большая энергия,
в соответствии с этим энергия активации в рассматриваемом выражении уве-
шивается на 0,125£Св> где £св — энергия связи атома с кислородом;
Жаропрочность. В атомной энергетике и в котлостроении стали
эксплуатируются при высоких температурах. В связи с этим стали
должны быть жаропрочными. Под жаропрочностью понимают способ-
ность материала противостоять механическим нагрузкам при высокой
температуре. Напряжение, которое может вызвать разрушение метал-
ла при повышенной температуре, существенно зависит от длительно-
сти приложения нагрузки. Разру-
шающее напряжение может быть
велико при кратковременном при-
ложении нагрузки и мало при ее
длительном действии.
Чем выше температура метал-
ла, тем ниже будет разрушающее
напряжение при данной длитель-
ности действия нагрузки. В общем
случае прочность металла опреде-
ляется температурой и временем
приложения нагрузки.
Общий вид зависимости проч-
ности от длительности приложения
нагрузки при разных температурах
приведен на рис. 3.9. При темпе-
ратуре 7\ (для сталей это комнатная температура) прочность металла
практически не зависит от продолжительности действия нагрузки.
Так, при напряжении, несколько меньшем предела текучести, обозна-
ченном на рис. 3.9 значком X, разрушение произойдет через 108 с,
т. е. через несколько лет. При более высокой температуре зависимость
прочности от времени воздействия нагрузки становится все более за-
метной. При достаточно высокой температуре прочность снижается с
увеличением длительности испытаний весьма существенно. В этом слу-
чае значение разрушающего напряжения без одновременного указа-
ния продолжительности воздействия нагрузки уже не дает однознач-
ного представления о прочности материала. Так, при температуре 7\
(см. рис. 3.9) напряжение ста вызывает разрушение через 10° с, а на-
пряжение ох приводит к разрушению уже через 102 с, т. е. в 104 раз
быстрее. Отсюда следует, что при низкой температуре влиянием фак-
тора времени можно пренебречь, а при высокой температуре этот фак-
тор приобретает решающее значение.
При учете фактора времени прочность металла следует оценивать
характеристикой, называемой длительной прочностью. Длительная
прочность — это предел прочности при данной длительности испыта-
ний или напряжение, вызывающее разрушение при данной продолжи-
тельности воздействия нагрузки. Длительная прочность обозначается
°уквой ст с индексом, показывающим продолжительность воздействия
41
„ягях Например, запись ст1Оо обозначает напряжение,
напряжения в часах.п к ц Ниже приведены данные о жар0.
вызывающее разрушен г различных температурах:
прочности стали 08Х18Ш01 р
Л К 250 !40 100
а100, аМП 350
^ь'аллппочвость материалов характеризуется пределом mustPieami-
.JST вызывающим заданную скорость деформации при дав.
° “10Т п₽» различных
турах:
Т 1Л 823 873 923 973
„ ’ МПа 120 80 55 30
®1 /юоО> МПа
При высоких температурах способность материала сопротивляться
разрушению характеризуется длительной прочностью — значением
напряжения, при котором материал разрушается после определенной
экспозиции. Зависимость разрушающего напряжения ст (МПа) от вре-
мени т (ч) выражается соотношением
ст = а — b 1g т. (3.31)
В табл. 3.5 приведены значения а и b для сталей 08Х18Н10Т и 20
при различных температурах.
Таблица 3.5
Значения а и Ъ при различных температурах
Марка Т. К а Ь Марка Т, К а Ь
823 460 50—70 08Х18Н10Т 973 250—310 65
08Х18Н10Т 873 390-450 70—80 723 310 46
923 330—380 50—80 2U 773 240 30
Ползучесть. При высокой температуре происходит медленная плас-
тическая деформация металла под действием постоянных сравнитель-
но малых напряжений. Такое явление называется ползучестью.
Ползучесть приводит к изменению размеров и формы конструкций
и деталей и может привести к их разрушению. При температурах ни-
же температуры рекристаллизации и малых напряжениях скорость
ползучести непрерывно уменьшается до тех пор, пока деформация не
прекращается полностью. Величина пластической деформации при
низкотемпературной ползучести не превышает нескольких процентов.
Причиной снижения скорости низкотемпературной ползучести во вр6"
мени является прогрессирующее в процессе деформации торможение
{\Я,.^ения дислокаций различными препятствиями: примесными атО"
, частицами второй фазы и т. п., т. е. упрочнение металла,
пигпп вь-соких температурах облегчается поперечное скольжение
кации и переползание их вследствие интенсификации процессов
диффузии. Происходит разупрочнение металла. С ростом температу-
ры возрастает подвижность дислокаций и соответственно увеличива-
ется ползучесть. Деформация в этом случае может составлять десятки
и сотни процентов.
На кривой высокотемпературной ползучести (рис. 3.10, а) разли-
чают три стадии: участок неустановившейся ползучести (I стадия),
участок установившейся ползучести (II стадия) и участок ускоренной
ползучести (III стадия), предшествующий разрушению. При длитель-
ных сроках службы ползучесть характеризуется скоростью ее на II
Рис. 3 10. Кривые ползучести стали 20X13 после нормализации и отпуска при
993—1023 К в простых (а) и логарифмических (б) координатах при напряжении
200 (/), 188 (2) 171 МПа (3). Температура испытаний 823 К
стадии. Ползучесть возникает обычно при температурах выше
(0,34-0,4)7^, т. е. в области температур, когда в сплавах может про-
исходить изменение структуры за счет перераспределения легирующих
элементов между фазами, вследствие коагуляции и т. п.
В логарифмических координатах зависимость деформации при пол-
зучести от времени выражается прямыми линиями (см. рис. 3.10,6).
Угол наклона их к оси 1g е на участках, отвечающих I и частично II
стадии ползучести (отрезки 1Г\ 22', 33' на рис. 3.10, б), тем меньше,
чем выше напряжение. Отрезки П'-, 22', 33' при их продолжении пере-
секаются при Ig е = 1,5-=-1,6, что отвечает деформации 32—40%,
близкой к значению относительного удлинения (36,5%) стали 20X13
при 823 К, результаты испытаний которой на ползучесть при той же
температуре представлены на рис. 3.10. Аналогичное явление наблю-
дается при анализе кривых ползучести (в логарифмических коорди-
натах) и других материалов.
Образование на поверхности металла адсорбционного слоя атомов
или молекул теплоносителя снижает поверхностную энергию метал-
ла. При этом облегчаются образование трещин, выход на поверхность
Дислокации и т. д. Жидкие металлы, атомы которых проникают в мик-
ротрещины, могут снижать сопротивление материалов пластической
Деформации и интенсифицировать разрушение.
Разрушение при знакопеременных нагрузках («усталостное» раз-
рушение металла). После каждого цикла приложения знакоперемен-
43
ной нагрузки в металле накапливается определенное количество дефек-
тов. Когда суммарное число дефектов достигает определенного зна-
чения происходит разрушение металла. При напряжениях ниже пре-
дела текучести разрушение может происходить при числе циклов по-
рядка 10е—107. Экспериментально отмечено, что пульсации в трактах
ВВЭР происходят при частотах (10-Е-20) Гц. Источниками пульсаций
могут быть места возмущения потока внутри реактора и в главном цир-
куляционном насосе. Максимальное напряжение вследствие колеба-
ний достигает 0,1 МПа.
При пусках и остановах вследствие термических напряжений де-
формация'в металле ядерных энергетических установок может дости-
гать 0,596 и выше, тогда говорят о малоцикловой усталости. Разру-
шение’при температуре ~600 К может происходить через 3000—5000
циклов. Присутствие водного теплоносителя ускоряет наступление
разрушения. В частности, образование трещин на поверхности бара-
банов-сепараторов, изготовленных из высокопрочной стали, связыва-
ется с малоцикловой усталостью. Наплавка из аустенитной нержавею-
щей стали резко увеличивает стойкость оборудования АЭС к малоцик-
ловой усталости.
Если интервал изменения температуры таков, что максимальная
температура термического пика превышает температуру рекристалли-
зации материала, то происходит существенная деформация. Так, об-
разцы из алюминия при изменении температуры за цикл в интервале
300—800 К за 30 циклов изменяют свою длину на 4%. Чем выше ско-
рость охлаждения, тем больше увеличение длины материала. Для
хрупких материалов очень быстрое и большое по значению изменение
температуры (термический удар) может привести к быстрому разруше-
нию под действием внутренних напряжений.
§ 3.3. СОВМЕСТИМОСТЬ РЕАКТОРНЫХ МАТЕРИАЛОВ
Совместимость характеризует взаимодействие ядерного горючего
с оболочкой твэла. Ядерное горючее и материал оболочки считают сов-
местимыми при заданных условиях, если в течение длительного вре-
мени, находясь в контакте, они не взаимодействуют или скорость взаи-
модействия их невелика и не приводит к изменению формы или разгер-
метизции твэлов.
Совместимость материалов в ряде случаев определяет ресурс рабо-
ты твэлов, его максимальную рабочую температуру и является одним
из важных критериев при выборе материала оболочки. В результате
взаимодействия материалов топлива и оболочки могут образоваться
продукты с меньшей или большей плотностью, чем исходные материа-
лы. первом случае могут измениться размеры твэла, во втором —
НаРУшиться контакт между топливом и оболочкой. Утонение
В совокУпности с напряжениями, возникающими в твэлах,
привести к разрушению оболочки и вымыванию ядерного го-
рючего в теплоноситель.
44
Основную роль в процессе взаимодействия материалов топлива и
скорост" диффузии можно су-
Д,1ТВ твердом теле с идеальной кристаллической решеткой, все узлы
второй заполнены атомами, возможно лишь колебательное движение
ZB около положения равновесия. Для перемещения атомов из от-
яого узла решетки в другой или в межузлие необходимо хотя бы вре-
менное нарушение правильности строения решетки. Можно предпо-
лагать, что перемещение атомов происходит путем обмена местами со-
седних атомов. В момент такого взаимного перемещения кристалли-
ческая решетка должна значительно исказиться, т. е. чтобы пропус-
тить обменивающиеся атомы, соседние атомы должны раздвинуться
по крайней мере на два атомных диаметра.
Советскими учеными А. Ф. Иоффе, Я. И. Френкелем было выска-
зано другое предположение о механизме диффузии. Ими было показано,
что в реальных кристаллических решетках атом может перейти из уз-
ла решетки в межузлие. При этом атом занимает положение, аналогич-
ное положению атомов легирующего элемента в твердом растворе
внедрения. В связи с деформацией кристаллической решетки в окрест-
ностях атома, находящегося в межузлии, потенциальный барьер, ко-
торый он должен преодолеть для перехода в новое межузлие, меньше
потенциального барьера, который преодолевает атом при переходе
из равновесного положения в межузлие, т. е. атом, находящийся в меж-
узлии, становится более подвижным. При переходе атома в межуз-
лие освобождается место в узле кристаллической решетки, откуда
этот атом ушел, — вакансия. Соседний атом с малой затратой энер-
гии может перейти на вакантное место, образовав новую вакансию.
Этот процесс можно описать как миграцию ваканс
Естественно, возможен и процесс рекомбинации. Атом из межузлия
встречается с вакансией, и нарушение решетки исчезает. Я- И. Френ-
келем показано, что каждой температуре соответствует определенная
равновесная концентрация нарушений обоих типов (межузельных ато-
мов и вакансий). Чем выше температура, тем больше равновесная кон-
центрация точечных дефектов.
»ли»^оличество вещества, продиффундировавшего в единицу времени через
п п°веРхн6сти М [моль/(см2 • с)], связано с коэффициентом диффузии
‘ 'с) и градиентом концентрации dCldx (моль/см3) первым законом Фика.
М = Dac/dXt (332)
ленийв₽пый закон Фика может быть получен на основании следующих рассу*-
ОбъемиГаССМОтРим две плоскости, отстоящие друг от друга на расстоя •
и гпалй>,е концентРации диффундирующего вещества в этих плоскостях И < 2
трЕм!" КонЦентрации dCldX. Тогда С2 = С, + a dCldX, Толщина jaccMa
°ci и сс плоскостей а- Число частиц на единице поверхности в плоскости
гУ’о^ояр^?ло?<им> что частицы могут перескакивать из одной nn°c^°c™ B д.
Кова. Об ™Т0Й V’ пРичем вероятность перескоков в обоих направлениях д
будет чнсло частиц, покинувших любую плоскость в единицу р
"Доскочи о?°нзведению частоты перескоков' на'концентрацию члст"дв ле.
"Иях одии?ЛНаК0’ поскольку вероятность перескоков в обо в0РеМени
одинакова, реальное число .частиц, перешедших гв единицу времен
45
с одной плоскости на другую, равно
Мх = 0,5vaCi; М2 = 0,5vaC2 = 0,5va (Сх + adC/dX).
Разность количества частиц, перешедших в противоположных направлю
НИЯХ, и равна потоку частиц:
М = м, - м, - 0,5»«С, + 0,S«> (dCldX) - 0.5г«С, - - 0.5rf (dC/dX).
пвт'вплги пто каждый атом может участвовать в проце^
До сих пор предполаг®л > порвать связи с окружающими атомами
q Д„ИгиУ!ктйва2ниЭ^го процесса, как было показано ранее, Qx = 0,25£св.
Э““^Вероятность того” то а?ом будет иметь энергию, равную энергии активации,
yTj = exp (— Qi/RT) — ехР ( 0,25£,св/7?7’)- (3.33)
Атом, разорвав связи, перемещается в вакансию. Но вероятность образования
вакан’сии = QjRT} = ехр (_ 0>25Дсв/)?Г). (3.34)
Оба рассматриваемых события независимы, и вероятность протекания их
одновременно
~ ехр [— (Qi + = ехР (— 0,5ECB/RT). (3.35)
Отсюда М = 0,5va2 ехр (— Q/RT) dX/dC.
Сравнивая это выражение с законом Фика, получаем
D = 0,5va2 ехр (- Q/Z?T) = Го ехр (- Q/RT), (3.36)
Ав Do = 0,5va2. (3.37)
В среднем можно принять v= 1013 1/с; a = 3 • 10 8 см. Тогда Do =
= 0,5 • 1013 (3 • 10~8)2 = 4,5 • 10-3 см2/с, что близко к экспериментально на-
блюдаемым значениям.
В деформированном металле кристаллическая решетка искажена. В ядре
дислокации ион-атомы смещены из своего равновесного состояния и обладают
повышенной энергией. Вследствие этого энергия активации диффузии вдоль ли-
ний дислокаций меньше, чем при диффузии в совершенной кристаллической ре-
шетке. Естественно, что и диффузия по линиям дислокаций идет с большей ско-
ростью. В связи с указанными обстоятельствами деформация металлического
ядерного горючего и оболочки твэла интенсифицирует взаимодействие между
ними и ухудшает совместимость.
Оценим величину энергии активации диффузии вдоль линии дислокации Рд.
Атомы, находящиеся в ядре дислокации, имеют дополнительную энергию
41,8 кДж/моль. Отсюда
<?д = 2 (0,25Екр — 41,8) = О.бЕцр — 83,6 = Q — 83,6. (3.38)
Экспериментальные данные подтверждают это положение. Кристалличе-
ская решетка в металле на границах зерен искажена аналогично искажению ее
различнаИСЛ°КаЦИ“" Соответственно диффузия по границам зерен существенно
MwaV?fe*RH0CTHatl ДНФФУЗИЯ- Диффузия может происходить и по поверхности
r-nn'n,/T0M случае акт разрыва связи с кристаллической решеткой не дол-
кпистл nл° вреМен” с образованием вакансии». Атом, порвавший связи с
так как Решетк°й> может перемещаться в любое соседнее положение,
иии пов₽п¥^пД?еяИе происходит по плоскости. В связи с этим энергия актива-
диффузии* ДИФФУЗИИ Должна быть вдвое меньше, чем в случае объемной
Лишь "^Р.ниеитальные данные подтверждают это положение (табл. 3.6).
к 0,25/Q * энергия -активации поверхностной диффузии близка
ся B3rZn7/°^H0.CTHbIX атомов отличается от энергии атомов, находящих-
металлов повеп^нАгтв * Иа величинУ поверхностной энергии. Для большинства
зллов поверхностная энергия у = 1,5 . 10-« Дж/см< На 1 см» обычно на-
46
Таблица
Энергия активации объемной и поверхностной диффузии, кДж/моль
Металл w Ta Mo Nb He Ni Cu Pb Ge Si
Qu 306 231 277 200 121 90 53 34 129 189
Q 504 462 407 400 240—273 280 205 116 287 462
Qu Q 0,61 0,46 0,68 0,5 0,5—0,45 0,32 0,26 0,29 0,45 j 0,41
ходится 1015 атомов. Тогда энергия одного атома, находящегося на поверхности,
£ = 1,5 • 10-*/1016 = 1,5 • 10-« Дж/ат.
п Частота колебаний поверхностного атома может быть оценена из зависимо-
сти Еп = hv, где vn = Ea!h — 1,5 • 10—19/6,6 • Ю~3*= 2,27 • 101* 1/с. В соот-
ветствии с этим для поверхностной диффузии
Е>опов = 0,5vna2 = 0,5 • 2,27 101* (3 • 10-в)2 = 0,1 см2/с. (3.39)
В случае поверхностной диффузии предэкспоненциальный член больше, а
энергия активации меньше, чем при объемной диффузии. Следовательно, по-
верхностная диффузия протекает более интенсивно.
Для ориентировочных оценок расстояния, на которое перемещается фронт
диффундирующего вещества 6 (см), может быть использована следующая за-
висимость:
62 = 4От ~ Dr, (3.40)
где т — время, за которое фронт диффузии перемещается на расстояние 6, с.
В твердых растворах кристаллическая решетка искажена. Вследствие этого
энергия атомов возрастает, что ведет к снижению энергии активации диффузии.
Диффузия в твердых растворах протекает более эффективно, нежели самодиффу-
зия. Особенно эффективно протекает диффузия в твердых растворах вычитания
и в нестехиометрических соединениях, где велика концентрация вакансий.
При оценке совместимости ядерного горючего с оболочкой твэла необхо-
димо знать коэффициент диффузии урана в различные металлы. Энергия актива-
ции диффузии урана в металлы определяется энергией активации самодиффузии
в рассматриваемом металле. Для ряда металлов выполняется следующая зави-
симость между энергией активации диффузии урана в металл Q и энергией ак-
тивации самодиффузии Qa : Q = 0,7Qc.
Энергия активации самодиффузии алюминия 142 кДж/моль. Следовательно,
энергия активации диффузии урана в алюминий должна быть 100 кДж/моль.
При температуре 523 К коэффициент диффузии урана в алюминий составит
D — Dq . Ю 100/19 523 10 3 _ 10-1° см2/с, где Do= 1,7 для самодиффу-
зии алюминия.
Глубина проникновения урана в алюминий в за 2000 ч составит 6 = (4 X
X 1,5 . Ю-io . 2 • 103 • 3,6 . Ю3)0’6 6,6 • 10-2 см.
Экспериментально определенная величина близка к 10~а см. Энергия ак-
вации диффузии различных элементов в уран будет тем ниже, чем значитель-
е Рззличие в структуре кристаллических решеток этих элементов и урана. За
хи^ТаК0Г0 Различия можно принять разницу энергий активации самодиффузии
а ФФУндирующего элемента Qa и урана Qu. В первом приближении для диффу-
ЗИи ряда элементов в у-уране Q выражается следующей зависимостью:
Q = 158 - 0,62 (Qc - QJ.
47
Ппи контакте урана и его сплавов с материалом оболочки твэла воз-
можно образование интерметаллических соединений. Вероятность их
Х1ов7ния тем больше, чем значительнее разница металло^имических
S у входящих в него элементов: размеры атомных радиусов Ме.
таллов электроотрицательность элементов, валентность и ионизаод.
онше потенциалы атомов. Интерметаллические соединения, в частно-
«и образуются при контактке урана с оболочкой из алюминия.
Из табл. 3.7 следует, что с увеличением температуры время до по-
явления заметного количества интерметаллических соединений умень-
шается.
Таблица 3.7
Влияние температуры на взаимодействие урана и алюминия
Т. к Время до появления интерметаллидов Образующиеся фазы (в порядке уменьшения их числа)
373 Реакция не наблюдается —
473 » »
523 240 ч UA12
573 24 ч UA12; UAl4; UA13 (следы)
623 6 ч UAla; UAI4; UA1s
673 1 ч To же
773 Немедленно Э '
Совместимость урана. UA12 и UA13 образуют металлические плен-
ки, сцепленные с U, и, по-видимому, не влияют существенно на тепло-
передачу и контакт U с А1. Интерметаллид UA14 не образует фазы, хо-
рошо сцепленной с А! или UA13. UA14 рассыпается в порошок. При этом
нарушается контакт U с А1.
Для улучшения совместимости между оболочкой твэла и топливом
создают диффузионный барьер, помещая, например, никель между ура-
ном и алюминием. Интерметаллические соединения в системе U—Ni
растут значительно медленнее, чем в системе U — AL Образование на
поверхности А1 слоя А12О3 толщиной 20 мкм предотвращает взаимо-
действие с U до 823 К, Данные о совместимости ряда металлов с ураном
приведены в табл. 3.8 .
При взаимодействии материала оболочки и топлива могут образо-
ваться соединения с низкой температурой плавления. Так, Fe, Мп, Ni
реагируют с U с образованием интерметаллидов и эвтектики с темпе-
ратурой плавления 988—1013 К.
температуре немного ниже эвтектической имеет место медлен*
1Л7Ч к.?^оле^ствие- При температуре выше эвтектической (1033—
шля °Р°оТЬ взаим°Дсйствия столь высока, что Fe, Ni, нержавею-
твопяетгя 4 ПОлностью сплавляются с ураном. Вольфрам не рас-
Тантал м₽ппвВиРДОМ Уране и очень медленно растворяется в жидком.
тимХ ™ХГВОрЯетСЯ В уране ПРИ температуре 1573 К. Совмес-
рядке: WYТа Nb” С Ураном снижается в следующем по-
4»
Совместимость урана с некоторыми металлами
Таблица 3.8
Металл т. к Результаты испыта- ний продолжитель- ностью 200 ч Металл Т. К Результаты испытаний продолжительностью 200 ч
А1 573 Несс вместим Nb 873 Совместим
Be 873 » Нержавею- 773 Незначительное
Сг 873 Совместим щая сталь взаимодействие
Си 873 923 То же
Fe 773 » 973 Сильное взаимодействие
873 Несовместим Та 1173 Совместим
Мо 873 Совместим Тс 973
М 773 873 Совместим Несовместим Zr 1173 973 1073 Несовместим Совместим Несовместим
§ 3.4. РАДИАЦИОННАЯ СТОЙКОСТЬ КОНСТРУКЦИОННЫХ МАТЕРИАЛОВ
Конструкционные материалы активной зоны реакторов подверга-
ются облучению нейтронами, электронами, у-квантами и т. д.
Вопросу возникновения, природе радиационных повреждений и
влиянию их на свойства реакторных материалов посвящено в послед-
ние годы много работ. Значительный вклад в этот раздел науки внесли
советские ученые А. А. Бочвар, С. Т. Конобеевский, А. С. Займовский
и др.
Наиболее существенно облучение нейтронами, особенно быстрыми,
В результате взаимодействия с нейтронами изменяются структура и
механические свойства материалов. Нейтронное облучение увеличива-
ет разупорядочение структуры, ускоряет процесс распада твердого
раствора.
При столкновении нейтронов, обладающих энергией 2 МэВ, с крис-
таллической решеткой металла время уменьшения энергии нейтрона
до 100 эВ менее 10~13 с, т. е. энергия Торможения передается в первич-
ных столкновениях атомам решетки практически мгновенно. Атом
кристаллической решетки, получив при взаимодействии с нейтроном
значительную энергию, Может быть выбит из узла решетки и перейти
в межузлие. При этом образуется вакансия. Пара межузлий атом —
Вакансия устойчива в том случае, когда смещенный атом удаляется от
вакансии на расстояние, превышающее период решетки. Смещенный
атом, обладающий повышенной энергией, может, в свою очередь, вы-
зывать смещение других атомов. При этом происходит увеличение чис-
ла Дефектов. Число смещенных атомов, приходящихся на один первич-
но выбитый атом при облучении металла в реакторе нейтронами с энер-
та^ОО^3^’ составляет для железа 390, для бериллия 440, для графи-
в р?,??можен РЯД устойчивых конфигураций смещенных атомов,
1 ЦК-решетке атом может разместиться в, межузлии. Можно такж е
49
л смешенный атом’вместе С одним ИЗ соседних атомов
представить что смацем комби1;аци1О (гаНтель), центр которой „а.
решетки обРаауа11ПраРУ возможна комбинация, когда атомы гантели
ходится в узле решетку занимающими нормальное положение
^рХ’ке Едой тип дефектов называют краудттм (см.
рис. 3.3) - --------------
VTW комбинацию (гантель), центр которой на-
Возможна комбинация, когда атомы гантели
Последний тип’ дефектов называют краудионом (см.
- °'О> тгпигтяплической решетки быстрыми частицами мож-
Повреждение кристалличес^ частиц или как
но Рассмагриват термическим процессом. Путь быстрой_частицы
мХРразбиРть на два этапа. Первый этап (высокоэнерге.
JhhS) оставляет лишь единичные дефекты - вакансии, атомы сме-
2ия На втором этапе, когда быстрая частица уже потеряла большую
аясть своей энергии, длина ее пробега между последовательными атом-
ными столкновениями сильно уменьшается, т. е. чаще становятся ее
столкновения с атомами решетки. В этом случае преобладает хаотич-
ное движение, вносящее полный беспорядок в систему атомов. Этот
беспорядок нельзя интерпретировать как появление в решетке отдель-
ных дефектов, так как сама решетка перестает при этом существовать.
В области, окружающей место остановки быстрой частицы, темпе-
ратура и давление высоки. Вещество в этой области находится в сос-
тоянии жидкости или плотного газа. Это состояние вещества называ-
ют «атомная плазма». После охлаждения решетка восстанавливается,
но атомы занимают при этом новые позиции, происходит их новое раз-
мещение. Отсюда и название — пик смещения (клин смещения). Ок-
ружающая область пика кристаллическая решетка влияет на ориен-
тировку кристаллизующейся области, в которой первоначальная
кристаллическая структура почти полностью восстанавливается. Сохра-
няются и винтовые дислокации. Образуются дислокационные петли
диаметром 10—50 нм. Областью пика смещения, где происходит плав-
ление с последующей кристаллизацией, считают цилиндрическую об-
ласть в конце пути смещенного атома. Диаметр этой области от 2 до
4 атомных расстояний. Содержит она от 4 до 12 атомов решетки на
каждое межатомное расстояние вдоль пути.
Если энергия, переданная частицей при облучении металла, не-
достаточна, чтобы вызвать локальное расплавление металла и дать
возможность атомам обменяться местами, то локальный нагрев может
вызвать как бы местную термическую обработку. Такая область на-
зывается тепловым пиком (тепловым клином).
полим^ных материалах облучение может вызвать ионизацию,
полУпР°ВОДНИКаХ ПРИ облучении может изменяться кон-
центрация носителей.
щен™Тя™!Тм П°Д действием облучения дефекты (вакансии, сме-
X “ У перемещаться на значительное расстояние, так
попвижнлгты\ ДУ ними ослабевает. При высокой температуре (высокой
^кп^пАв?1)ТаКпеДефекТЬ1 могут свободно блуждать по кристалли-
ХЙ гепекп^мБлуЖДаЮЩИИ ДефекТ М0Жет встретить полярный ему
Йла глеР^пж£ лИр0ВаТЬ %НИМ’ Вь1йти на гРани«У зеРна поликрис-
талла, где может быть адсорбирован, если при этом снижается общий
&0
уровень поверхностной энергии границы. С повышением температу-
ры дефект может вновь переместиться в тело зерна. Возможна адсорб-
ция дефектов на дислокациях. Последние всегда присутствуют в отож-
женных и холоднодеформированных металлах.
Основная часть дефектов, образовавшихся при облучении материа-
лов, вызвана взаимодействием кристаллической решетки с «быстрыми»
нейтронами. Однако электроны и у-кванты также могут вызвать обра-
зование дефектов. При облучении электронами энергия отдается ато-
мами малыми порциями, недостаточными для того, чтобы первично
выбитый атом мог вызывать дальнейшее смещение. Таким образом,
электроны могут создавать лишь одиночные дефекты. Смещение атомов
в рассматриваемом случае обусловлено в основном упругими столкно-
вениями с электронами. Энергия, передаваемая атому «быстрым»
электроном (Е), оценивается по зависимости Е = 2Еп (Ен + 2т0С2)/МС2,
где Е„ — начальная кинетическая энергия электрона: т0 — масса
электрона; М — масса атома; С — скорость света. Если энергия
у-кванта 1 МэВ и выше, она передается электрону по механизму
комптоновского рассеяния. Комптоновское рассеяние играет основ-
ную роль в интервале энергий 0,5—1,0 МэВ для элементов с атом-
ным номером меньше 60, а в интервале от 1 до 5 МэВ оно является
главным источником «быстрых» электронов для всех элементов
периодической системы. В случае рассеяния под углом, большим 90°,
энергия, передаваемая электрону у-квантом, имеет значение порядка
энергии самого первичного у-кванта. Комптоновские электроны, об-
ладающие энергией, достаточной для передачи атомам среды энергии
выше 25 эВ, производят атомы смещения.
Адсорбция дефектов кристаллической решетки на дислокациях
приводит к закреплению последних. Дефекты создают вблизи дисло-
каций атмосферы Коттрелла и снижают их подвижность.
Энергия, получаемая кристаллической решеткой при облучении.
Тепловой импульс может распространяться в твердом теле со ско-
ростью звука или меньше. Таким образом, за время торможения час-
тицы с высокой энергией он может удалиться от места торможения на
несколько межатомных расстояний. Следовательно, можно считать,
что в области торможения возникает почти точечный тепловой источ-
ник мощностью 1—3 МэВ, который создает радиальный поток тепла,
повышающий температуру области, непосредственно окружающей мес-
то торможения. Так, при торможении осколка с энергией 2 МэВ в ура-
не в течение 0,9 • 10-11 с существует область объемом 2,44 • 10-17 см3
с радиусом 1,8 • 10“8 см, нагретая до температуры свыше 2273 К. В
пике смещения кристаллической решетки железа радиусом 0,247 нм
расходуется 20 кэВ.
При быстром охлаждении в рассматриваемой области кристалли-
с^Коа Р^етки может появиться неоднородное распределение плотно-
и от!еЖДУ наиб?льшей энергией Е (эВ), расходуемой в пике смещения,
относительной атомной массой А существует следующая эмпиричес-
ая зависимость: Е — —17900 +Г563Л.
51
Оиенпм среднюю энергию, получаемую атомами металла при облучении бы-
етпымн нейтронами (Е >10* эВ) плотностью потока <р - 10*» см-* - c-i. Се.
ченне ядра Se~ Ю"М см. Для того чтобы вероятность попадания нейтрона в
яГро равнялась единице, облучение должно длиться т с при <р = 10« см-г х
х с~‘ : т = 1 Юи • 10-а* = Юч с.
Таким образом, атом в среднем получает энергию
Е = 10e/10u = Ю-s ЭВ /(ат • с). (3.41)
При флюеисе быстрых нейтронов Ф = Ю"1 см-* число столкновений ней-
тронов с атомами в 1 см3 металла составит
р_ io"».So-1023 = 10"1-10“24- Ю23 = Ю"1"1, (3.42)
где Ю23 — число атомов в 1 см®.
Прочностные характеристики и облучение. Изменение структуры
металлов под действием облучения отражается на прочностных харак-
теристиках материалов. Предел текучести начинает увеличиваться уже
при облучении флюенсом нейтронов 1017 см-2. Для ряда металлов ве-
личина предела текучести пропорциональна корню кубическому из
флюенса. Изменение предела прочности с дозой облучения подчиняет-
ся более сложной зависимости. Предел прочности, например, в случае
меди и никеля не зависит от облучения до флюенса 1019 см-2. При
больших флюенсах предел прочности имеет ту же зависимость, что
и предел текучести.
Различие в зависимостях предела текучести и предела прочности
от облучения заключается в том, что при относительно малых дозах
действие облучения сводится к упрочнению, а при больших дозах об-
лучения предел текучести приближается к пределу прочности и запас
пластичности снижается. При этом уменьшается и максимальное удли-
нение до разрыва. Металл становится более хрупким. Так, предел те-
кучести углеродистых сталей после облучения флюенсом быстрых нейт-
ронов 1020 см-2 повышается в 2—3 раза (с 450 до 1100 МПа), а удлине-
ние падает с 22 до 4%.
В ряде случаев при отсутствии экспериментальных данных необ-
ходимо оценить изменение механических свойств сталей, например пре-
дела текучести, под действием облучения. Для этих целей могут быть
использованы развитые ниже представления, основанные на упро-
щенной модели.
В сплавах иа основе железа в результате каждого соударения с быстрым
нейтроном образуется 390 межузельных атомов. При флюенсе Ю"1 см-2 число
таких атомов будет п (см-3):
п = 390 • (3.43)
шийсВяК?Х^,И1°„КрИСТаЛЛОГр'афическом направлении на каждый атом, находя-
кристаллической решетки?"™51 ”o6a атомов’ находящихся в узлах совершенной
Лобл=[(4/А) (ЛГ/л)]’/3 = [(7,8/56) (6- 10г8/390-10т-1)]1/3гы
—1,29-Ю7/ДО"1/3. (3.44)
ближе^ной* м1АТи°МЛеЛ€3а С РадиУсом 0,126 им согласно рассматриваемой при*
ол женнои модели находится в тетраэдрической пустоте радиусом 0,036 и*'-
.„ение кристалла Л^обл ~ 0,126 0,036 = 0,09 нм, что вызовет дефор-
1,СциЮ элементарной кристаллической ячейки а-железа:
вобл = Дб об л/& — 0,09/0,286 = 0,315. (3.45)
Значение максимальной деформации элементарной ячейки, полученное ра-
нее. Равно Бм = 0,087. (3.46)
п-гсюда можно принять, что в выбранном кристаллографическом направ-
U число элементарных ячеек, претерпевших максимальную деформацию
ЛеНедствне образования при облучении межузельного атома, составит
’ Робл = вобл/вм = 0,315/0,087~3,6. (3.47)
Рис. 3.11. Зависимость стт от флю-
енса быстрых нейтронов:
--------оасчет по формуле (3.52) с
Учетом (3.58); О — эксперимент
Доля предельно деформированных за
счет образования в процессе облучения
межузельных атомов равна
$обл=робл/«обл = 3,6- 10т'3/1,29-10’ =
= 2,79-10-М0'”/3. (3.48)
По аналогии с зависимостью (3.17)
Тобл=1’о (1—S—^рбл). (3.49)
где уобл — коэффициент перенапряжения
(усиления) для облученного ма-
териала.
Из соотношений (3.48) и (3.49) по-
лучаем:
Уобл = ?-То-50бл=Т—310-2,79.10-7-10п’/3=у—8,65-10-5-10т/3. (3.50)
С учетом ранее рассмотренных зависимостей
а’обл-ат = ^= (0,3 0/0,7) [(1/Уобл)-(1/?)]= (0,3 0/0,7) [(у-?0бл)/Уобл?1^ -
-0,3-8,47-10* (у—y+8,65-10-5-10w/3)/0,7 у®= 0,3-8,47-Ю*-8,65 х
X 10-Б-10'"/3/0,7-2,25-104 = 13,9- Ю-’-Ю"*/3 (3.51)
анап! ~ ’«О' Отс1°Аа (Ао'/Ю'”/3) • 10® = 13,9. Экспериментально определенное
значение близко к 10.
’ронов^То1”** ^’19) пРеДел текучести стали 20 после облучения флюенсом ней-
%бл=°.ЗС/0,7?обл = 190/(1-4,58.10-М0т/3) МПа. (3.52)
ла тек™ЧИТаНнЫе по (3-52) и экспериментально определенные значения преде-
Слеп^ТИ стали ТИпа сталь 20 приведены на рис. 3.11.
я,ейкн иет Заметить» что при определенном флюенсе 10m все элементарные
Мальиуш каком'либо кристаллографическом направлении претерпят макси-
У Деформацию. С учетом (3.43), (3.47) получаем
п1/3 = (390- 10'я-1),/3=1/а-Робл=1/2,5-10-8-3,6,
Нейтронопел<аТомное Расстояние, т. е. т = 19,55. Таким образом, при флюенсе
^^твениы°°Л«е 3’5 ' Ю19 см~2 предел текучести не должен увеличиваться су-
Из nwM о°Раз°м, что и наблюдается экспериментально.
сУются mpw следует, что экспериментальные и расчетные данные согла-.
ЛНтных ста у»с*бой удовлетворительно. Для восьми марок упрочненных пер-
елей была определена разность 25 расчетных и экспериментальных
&Э
текучести при данном флюенсе и пределом текучеСТй
значений между пределом текУ ботка с учетом стьюдентовского распредел
до облучения. Стати""Х„ют значимые различия между расчетом и эксперт
ния показала, что отсутсшу
МеНТОценим изменение предела прочности при облучении. В соответствии с За.
висимостью Гриффитса
ов Ep/2L ,
1 ч 10_* Дж/см2 = 0,5 эВ/ат.
где ?»= „пктяте взаимодействия с нейтронами энергия атомов в металле воз-
астГетРПри флюенсе 10"* см-2 энергия каждого атома, в том числе и поверхност.
ногоГ^озрастает на pv
pi = qn . Ю"»- i/[(d/A) N] = 25 • 390 • Ю'и-^.в/бб) • 6 - 10аз] =
= 1,16 10“20 Ю"1 эВ/ат,
где в = 25 эВ — энергия межузельного атома;
ных атомов, образующихся при взаимодействии с . . .
= 7,8 г см3 — плотность железа; А = 56 — атомная масса железа; - число
Авогадро.
Поверхностная энергия при этом составит
Робл = Р + Р1= 0,51+ 1,17. 102»-
Робл/р = 1 + 2,28 . 102° • 10"».
Отношение
(3.53)
(3.54)
п = 390 — число межузель-
быстрым нейтроном; d =
10"1 эВ/ат.
(3.55)
(3.56)
Из соотношений (3.53) и (3.56) следует
%бл = (£Робл/2Г)0’5=(Яр/2£)0-5 (Робл/P)0,5 = <Тв(1 +2,28-Ю29-1О-)0'5. (3.57)
Рассчитанные по (3.57) и экспериментально определенные значения преде-
ла прочности для стали 20 приведены в табл. 3.9. В отсутствие облучения <тв =
= 500 МПа.
Таблица 3.9
Значения ов для стали 20
Флюенс (£>1 МэВ), 10*’ см“2 ов, ГПа
Расчет | Эксперимент
1 0,5 0,5
3,16 0,52 0,55
10 0,55 0,61
102 0,9 0,85
Для четырех марок упрочненных перлитных сталей было проведено срав-
нение 12 расчетных и экспериментально определенных значений предела про4'
ности прн различном флюенсе. Статистическая обработка с учетом стьюдентов-
ского распределения показала, что отсутствуют значимые различия между РаС‘
четом и экспериментом. При флюенсе 1019 см~2
От = 0,9ов. (3.58)
.в,.^едУет заметить< что рассмотренная модель, как, впрочем, и любая мо-
лишь основные черты явления и позволяет только в первом прй'
Пля пп,от,?ЦеНИТЬ влияние облучения при низких температурах на <тв и (Т'Г‘
г^,пнмГо^ТНЧеСК0Г0 Использования следует пользоваться соответствующими э«с'
пернментальными данными,
,ппи^н^ЯНИе флюенса нейтронов на механические характеристики аустенитной
хромоникелевой нержавеющей стали показано в табл. 3.10,
54
Таблица 3.10
Свойства аустенитной нержавеющей хромоникелевой
стали (17—19% Сг, 9—12% N1) при комнатной температуре
после облучения быстрыми нейтронами с различными флюенсами
флюенс, см" 2 ов. МПа ат, МПа Удлине- ние, % Флюенс, см-2 ав, МПа от, МПа Удлине- ние, %
Г= 373 К Г = 573 К
675 340 53 550 40
1017 730 380 48 3-101’ 650 27
5-Ю1’ 720 530 45,5 6-101’ 680 21
4 З-Ю18 875 710 37 Ю20 720 18
9-1018 780 680 34,5 3- ю20 750 14
10го 880 780 23 5-1020 770 18
7.10го 790 12
С возрастанием флюенса относительное удлинение сталей снижается. Оце-
ним влияние облучения на относительное удлинение аустенитной нержавеющей
стали. Их соотношения (3.20)
°обл /1 о о ~ е—Тобл /То = То (1 S—50бл) / у о = 1 — S—Зобл! (3.59)
*обл = 100 (1 — S) — ЮОЗобл = 6 — 100 - 1,68 - 10-’ • 10"1/3 =
= S — 1,68 • 10-5 . ю«/3; (3,60)
8 — 8обл = Д8 = 1,68 • 40-е . ю"1/3. (3.61)
Отсюда
(Д6 • 1,68 • 10-5/Юот/3) • 106 = 1,68. (3.62)
Экспериментально определенные значения находятся в пределах 0,4—1.
Облучение при Т = 373 К существенно меньше влияет на пластичность
аустенитных сталей. В этом случае даже при флюенсе 10м см-2 относительное
удлинение стали 347 составляет 30%.
При температуре облучения свыше 623 К происходит частичный отжиг
радиационных дефектов. Так, при флюенсе 1,6 • 1021 см-2 относительное удлине-
ние аустенитных хромоникелевых нержавеющих сталей типа 08Х18Н10Т сле-
дующим образом изменяется с температурой облучения:
Т, К 563 723—773
б, % 1 58
Отжиг радиационных дефектов, а следовательно, и восстановление механи-
ческих свойств происходит при температурах 693—923 К. Температура полного
отжига составляет 0,5—0,55 от абсолютной температуры плавления стали.
Рассмотрим более детально явление отжига радиационных дефектов и, в
частности, температуру, при которой он имеет место. В первом приближении
°жно принять, что если смещенный атом переместится на расстояние, равное
дислокационной петли, образовавшейся при взаимодействии быстрого
итрона с кристаллической решеткой (г = 2,5 10"7 см), то он займет место
с «искаженной кристаллической решетке и радиационный дефект прекратит
0т„е существование. Для большинства технически важных металлов у = 160.
.^бъемная доля искаженных элементарных кристаллических ячеек
к<Ге 0,1. Тогда число искаженных кристаллических ячеек в 1 см близ-
ния по» • °-1 = 10й. Предположим, что быстрый нейтрон смещает из положу
равновесия 400 атомов. Плотность потока нейтронов с энергией свыше 0,5МЭо
55
„ <» 1(113 (см4 d-1. С учетом (3.42) 6 секунду образуется M =,
«СЗа.МЮ« 4001 смещенных атомов. В то же время, согласно закону Ф„ч
в одну секунду 3
Мя=Р-1О-/г^(1О-в/19’1-Г-10 ) 1022/г
п смешенных из равновесного положения, переместятся в область неиска.
Хной кристаллической решетки. Заметим, что для большинства технически
важных металлов Do 1 см/с.
в состоянии равновесия М1=М8. Отсюда 3 - 10- 400 - 10^ •
v щи г Из этой зависимости Т — Q • Ю /^Уо,о, где ч энергия активации
«моткЬЛузии кДж/моль. Рассчитанные по последнему соотношению значения
ёмперйур отжига радиационных дефектов удовлетворительно согласуются с
экспериментальными (табл. 3.11).
Таблица З.Ц
Расчетные и экспериментальные значения температуры отжига
радиационных дефектов ___________________________________
Материал 0X18H10T Сталь 20 Be Al Графит (углерод) Цирка- лой-2 Си Mg
Q, кДж моль 270 240 156 142 680 92,1 205 134
Т. К Расчет 910 810 530 480 2300 604* 690 450
Экспе- римент 800—900 750-830 623—700 423 2200—2300 550—770 600 470
• С учетом D, = 3-10 8 см’/с.
Образование радиационных дефектов приводит к деформации кристалли-
ческой решетки, что, в свою очередь, увеличивает энергию атомов. Вследствие
этого уменьшается энергия активации диффузии и соответственно возрастает ко-
эффициент диффузии. В соответствии с зависимостями (3.9), (3.44) и (3.45) увели-
чение энергии кристаллической решетки в рассматриваемом случае составит
г—0,414г у / /о,586- Ю"1/3
2г Нобл / / к 2-1,29-10’
д<?
е2/К =
= 6,07-10_1з • 102 т/3,
радиус октаэдрической пустоты в плотноупакованной кристалли-
ДЛЯ температуры^ 573 К ДЛЯ В соответствин с зависимостью (3.36)
d lg D/d (102,”/3) — &.Q/RT= 6,07 . 10-i»/19,1-0,573 = 5,6-10“14.
ДИФФУЗИИ бериллия в никеле экспериментальное значение равно
ппинлпит v е л аустенитной стали при температурах выше 873 К
р шД, радиационному охрупчиванию. Это явление характеризует*
пп/гпаЬШейИеМ длительной прочности и относительного удлинения
^мпА^пВпР^МеНо^Хт?С?1ТаНИЯХ обРазЦов на растяжение'в области
тим я RJL₽J,b,IUe 873 К- Этот эффект в некоторых материалах необра*
^оах Обратим лишь частично. Так, отжиг при темпера-
материалов приводит к полному возврату свойств облученных
56
Эффект охрупчивания наблюдается и при высокотемпературных
испытаниях предварительно облученных при низкой температуре об-
разцов аустенитной нержавеющей стали. Рассматриваемый эффект ил-
люстрируется рис. 3.12, на котором представлены данные по дли-
тельной прочности облученной стали 08Х18Н9Т при температуре-
873—973 К- Наибольший эффект высокотемпературного охрупчива-
ния наблюдается у стареющих
сталей. Так, после облучения
флюенсом (1—3) • Ю20 см-2 дли-
тельная прочность у стареющей
стали с 18% Сг, 28% Ni, допол-
нительно легированной вольфра-
мом при температуре испытания
973 К и времени испытания
1000 ч, уменьшилась на 40%, а
у стали 08Х18Н9Т — только
на 15%.
Облучение нейтронами может
повлиять и на свойства погло-
щающих материалов. Так, в по-
глощающих материалах, содер-
жащих бор, в результате проте-
кания ядерных реакций накап-
ливается гелий. При высокой
Рис. 3.12. Длительная прочность стали
08Х18Н9Т при различной температуре
(флюенс 1020 см-2);
1 — 600° С, яеоблучеиная: 2— 600° С. облучен-
ная при 450° С; 3 — 700° С, необлученная; 4 —
700° С, облученная при 450° С; 5 — 700° С, об-
лученная при 550° С
температуре давление гелия в
микропорах возрастает, что мо-
жет привести к деформации из-
делия вследствие газового рас-
пухания.
Металл оболочки твэлов быст-
рых реакторов подвергается воз-
действию высокой температуры и значительных потоков нейтронов.
Облучение флюенсом более (44-8) • 102а см-2 при температурах 700—
760 К приводит к радиационному распуханию аустенитной нержавею-
щей стали на 10% и при флюенсе 3,5 • 1022 см-2 и температуре 800 К
на 20%. эп
При флюенсе (24-3) • 1023 см-2 распухание может достигать 50—
70%. Эффект этот связан с образованием скоплений вакансий. Меж-
узельные атомы, образующиеся при взаимодействии нейтронов с энер-
гией более 0,1 МэВ с кристаллической решеткой, закрепляются на
Дислокационных петлях. Изменение объема стали при 760—780 К сле-
дующим образом зависит от флюенса:
lg (Д V/V, %) = —45 + 2 1g Ф.
Радиационное распухание зависит и от температуры. Так, при
флюенсе 7 • 1022 см~2
Т, К 634 673 698 723 748 773
AV/V, % 2,7 3,0 4,3 $ 5 3
Ппи температурах 733-833 К холодная деформация до 20% в
3 паза снижает распухание. При температуре 853 К положительное Дей.
гтРЛе холмной деформации резко снижается. С увеличением содерЖа.
ния К) до 40% при флюенсе 10» см"2 и температуре 898 К отно.
шение ДУ/Vуменьшается от 50 до 1,2%. Дальнейшее увеличение содер.
жяния Ni влияет мало. Это дает основание полагать, что межузель.
ные атомы закрепляются на дефектах упаковки Ширина последних
уменьшается с ростом содержания никеля от 10 до 40/о.
7 В установках термоядерного синтеза под действием излучения тер.
моядерной плазмы происходит изменение поверхностных и объемных
свойств контрукционных материалов. Вследствие взаимодействия с
нейтронами и ионами с высокой энергией в металлах образуются поры
(рыхлоты) — блистер-эффект.
При облучении аустенитной нержавеющей стали ионами аргона с
энергией 70 кэВ и флюенсом 2 • 1017 см-2 каждый атом в кристалли-
ческой решетке испытывает 50 смещений. Часть смещенных атомов свя-
зывается дислокациями. В результате образования скопления вакан-
сий возникают поры со средним диаметром 22 нм. В 1 см3 образуется
до 3 • 1016 пор. Относительный объем пор составляет 20—40%. С уве-
личением содержания Ni в стали до 45% размер пор уменьшается до
10 нм, а пористость до 0,5%. Снижение блистер-эффекта достигается
также путем предварительного ионного легирования при создании за-
щитных покрытий.
Облучение аустенитной нержавеющей стали марки 01Х18Н40М5
ионами гелия при температуре 723—873 К вызывает появление в ме-
талле пор и трещин.
С увеличением содержания гелия в аустенитной нержавеющей
стали снижается относительное удлинение:
Удлинение в отсутствие Не
Содержание Не в стали, % Удлинение в присутствии Не
5-10~4 17
2.10-s П
действием излуЧения термоядерной плазмы происходит эро-
-Рво стенки. Интенсивность процесса эрозии зависит от матери-
шиныст^Т использовании Be, В, Ti, V, Mo, TiC, Be уменьшение гол-
шины стенки загод составляет (3-6) , i0-2 см, w, SiC-2,7 • 10~3см.
под действием пЛ?ИТН0Г° класса (углеродистые, низколегированные)
снижается удлинений” Т0ЛЬК0 Увеличивается предел текучести И
хрупкости (темпрпзт ’ Н° И П0ВЬ1Шается критическая температур^
и уменьшается ударная вяз-
составляет 29 Дж/см2nn™31™ 20 ПрИ Т > 300 Ударная вязкость
вязкость резко снижяРтЛИпУМеНЬШении темпеРатУры до 240 К ударна*
тура, при Потопай f Д° значений порядка 2,9 Дж/см2. Темпера-
т -е. наблюдается? ох^Р63К°е c™e™e Ударной вязкости.
рогом) хладноломкости стали, называется температурой
ра хладноломкости ваяпЛ $еРРитных и перлитных сталей температу
д ломкости возрастает с увеличением флюенса.
Зависимость температуры хладноломкости стали 20 от флюенса
нейтронов можно проследить по следующим данным:
Ф, см-2 0 2,7-Ю18 101® ю2*
Т, К 240 298 343 363
В результате облучения флюенсом 1020 см-2 эти стали становятся
хладноломкими уже при температуре выше комнатной. Это обстоя-
тельство необходимо принимать во внимание при оценке ресурса кор-
пуса реактора, изготовленного из стали перлитного класса.
Оценим влияние облучения на изменение температуры хладноломкости.
Полагаем, что хладноломкость наступает, когда все межатомные расстояния ис-
кажены, т. е. когда
%бл — 1- (3.63)
С учетом зависимостей (3.44), (3.45), (3.48)
$обл = 0,314-10-’- Ю'н^р-1,29; (3.64)
екр = (К.47?)°’6(Т-1О-3)0’6 = 0,16 (7- КГ8)0’6. (3.65)
Отсюда
50бл = 0,312-IO-7-10т/3/0,16-1,29 (Т-10-3)0’5 = 1,51- 10“7- 10"г/3/(Г- Ю~3)0’6.
(3.66)
В первом приближении охрупчивание стали наступает, когда S ta 1. От-
сюда
(Т-КТ3)0’5 = 1,51-10-7-10'”/3; (3.67)
7 = 22,8-10-12-102 т/3; (3.68)
ДТ/Д (10-12-102w/3)=22,8. ' (3.69)
Экспериментальное значение отношения (3.69) равно 14,3.
Связь изменения температуры хладноломкости с флюенсом можно также
представить в ином виде. Разложим в ряд последний сомножитель в правой ча-
сти уравнения (3.68):
Т=22,8- ю<2т-2-18)/3~22,8-(2-10(,”_18/3)— 2) ~45,6- 10~в- 10m/3—-45,6.
(3.70)
Тогда
ДГ/Д (10“6- 10от/3) = 45,6.
(3.71)
Экспериментальное значение отноше-
на (3.71) составляет 30—50. При уве-
ичении флюенса свыше 1020 см-2 (Е >
1,0 МэВ) температура хладноломкости
Рнктически не возрастает. При этом
ческТИЧеСК-и все элементаРные кристалли-
Фнч е ЯЧе®ки в каком-либо кристаллогра-
фу е5Л0М направлении уже деформирова-
ло' и°Разование новых межузельных ато-
ра„ иичего в такой ситуации ие меняет.
летвоИТаИные по (3-69) значения АТ удов-
Тальн'>ИТеЛЬН0 согласУ10тся с эксперимен-
та блица 3.12
Рассчитанные и экспериментальные
значения ДГ
АГ
— 2 Флюенс» см Расчет Экс пери-
мент
Ю17 5 4
1018 23 25—30
101® 106 70—100
59
Глава 4
ТЕПЛОНОСИТЕЛИ ЯДЕРНЫХ
ЭНЕРГЕТИЧЕСКИХ УСТАНОВОК
Тепло, выделяющееся при делении ядерного горючего, отводят с
помощью теплоносителей. В качестве теплоносителей используются
обычная вода (с кипением и без кипения в реакторе), тяжелая вода,
газы (азот, гелий, углекислота, водород и их смеси), жидкие металлы
(натрий, литий, калий, висмут, свинец и их сплавы, ртуть), органичес-
кие теплоносители (например, дифенильная смесь).
Ядерные энергетические установки предъявляют ряд специфичес-
ких требований к теплоносителям. К их числу относятся:
1) малая коррозионная агрессивность и малое эрозионное воздей-
ствие по отношению ко всем реакторным материалам;
2) высокие теплоемкость и теплопроводность, малая вязкость;
3) высокая температура кипения и низкая температура плавления;
4) высокая температуростойкость и. радиационная стойкость;
5) малое сечение захвата тепловых нейтронов;
6) взрывобезопасность, негорючесть, нетоксичность;
7) доступность и недефицитность;
8) слабая активация.
Малая коррозионная и эрозионная агрессивность теплоносителя
повышают надежность работы оборудования и радиационную безопас-
ность для обслуживающего персонала. При наличии больших удель-
ных тепловых потоков в реакторе требование высоких теплотехничес-
ких характеристик является одним из определяющих факторов при
выборе вида теплоносителя.
Высокая радиационная и температурная стойкость исключает по-
явление в теплоносителях различного рода примесей, изменяющих
свойства теплоносителей и вызывающих другие негативные последст-
вия.
§ 4.1. ЖИДКОМЕТАЛЛИЧЕСКИЕ ТЕПЛОНОСИТЕЛИ
Жидкие металлы могут быть использованы в реакторах на быстрых
и тепловых нейтронах. Применение в качестве теплоносителя в ядер-
ных реакторах жидких металлов вместо воды дает ряд преимуществ
о реакторах на быстрых нейтронах применение в качестве теплоноси
теля воды нецелесообразно, поскольку она замедляет нейтроны. $
жидких металлов отсутствует зависимость температуры от давления.
-1^°РаЯ На^людаеТся У обычной воды. Это позволяет создавать высоко*
г»г™еРатУРНЬ1е КОНТУРЫ теплоносителя при низких давлениях в ни^
ппп^-ЧеНИе жидких металлов, как правило, не вызывает в них явлении»
rnt,aoHb!* РадИолизУ воды. Малое давление насыщенных паров и
трпппип Рмическая и радиационная стойкость жидкометаллически
теплоносителей выгодно отличают их от других видов теплоносителей'
лив яопО°^.ее ^Щественным недостатком большинства жидких мета
ся малая п° сравнению с водой объемная теплоемкость,
ьо
ограничивает аккумуляцию тепла в Жйдкометаллическом теплоноси-
теле, Некоторые жидкие металлы (например, натрий) вступают в бур-
ную реакцию с водой, это вынуждает усложнять тепловую схему ЯЭУ
с целью обеспечения безопасности ее работы. Однако жидкометалли-
ческие теплоносители имеют более высокую теплопроводность, обес-
печивающую более интенсивный теплоотвод от твэлов, что особенно
важно для быстрых реакторов, (Некоторые свойства жидких метал-
лов приведены в табл. 4.1). В ядерных реакторах на быстрых нейтро-
нах с натриевым теплоносителем плотность теплового потока на твэ-
лах достигает 2,5 • 106 Вт/ (м2 • с).
Таблица 4.1
Некоторые физические свойства жидких металлов
Свойство Bi РЬ Li Hg К Na Na- 44 % К
Температура плав- ления, к 544 600 453,5 234,2 336,7 370,8 292
Температура кипе- ния, к Удельная массовая теплоемкость при 673 К, кДж/(кг-град) 1750 2010 1609 630 1033 J 1156 1098
0,1481 0,1473 4,3263 0,13766 0,7640 1,2782 1,0510
Плотность при тем- пературе плавле- ния, кг/см® 10 10,7 0,61 13,7 0,82 0,93 0,89
Теплопроводность прн 673 К, кДжДм-чград) 56,0656 54,3920 169,4520 45,3964 142,2560 246,2560 96,6504
Сечение захвата тепловых нейт- ронов, Ю_ 28 м2 0,034 0,17 71. 374 1,97 0,52 0,96
Недостаток жидкометаллических теплоносителей (за исключением
ртути) — твердое состояние при комнатной температуре. Это требует
сооружения системы подогрева для плавления металлов, что услож-
няет конструкцию.
Наименьшее сечение захвата нейтронов имеют Bi, Pb, Na, Ga. В
этом смысле они наиболее пригодны в качестве теплоносителей для ре-
акторов на тепловых нейтронах. Наиболее перспективными теплоно-
сителями для реакторов на быстрых нейтронах являются Hg, Li и
Na. При облучении нейтронами в жидкометаллических теплоносите-
Лях могут образовываться радионуклиды, ухудшающие радиацион-
ную обстановку в контуре. С точки зрения наведенной радиоактив-
ности наиболее неблагоприятными свойствами обладают Na и К. Пер-
'и дает нуклид 24Na со средней энергией у-излучения 3,31 • 10~* Дж,
орой — 38К со CpeAHeg энергией у-излучения 3,46 • 10 Дж-
сог ень Радиоактивности 24Na в реакторе мощностью 80 • 10 Дж
л0Давляет 10*—Ю7 ^Ц. Поскольку период полураспада 24Na невелик,
е останова реактора уровень радиоактивности быстро снижается.
61
Коррозия в жидкометаллических теплоносителях. При контакте
конструкционных материалов с жидкометаллическими теплоносите-
лями могут иметь место следующие виды коррозии: 1) растворение ме-
талла в расплаве, в том числе селективное растворение тех или иных
компонентов сплава; 2) перенос массы; 3) межкристаллитная кор.
розия.
Процесс растворения твердого металла в жидком состоит из двух
стадий. На первой стадии происходит разрыв связей атомов в кристал-
лической решетке твердого металла и образование новых связей с ато-
мами жидкого металла или с его примесями. Эта стадия происходит в
слое жидкого металла, прилегающем к твердому, — в так называемом
пограничном слое. На второй стадии растворенные атомы диффунди-
руют сквозь пограничный слой в объем жидкого металла. Любая из
этих стадий может быть замедленной и тем самым контролировать в
целом скорость растворения. В большинстве случаев контролирующей
является вторая стадия. Растворение металла сопровождается одно-
временно обратной реакцией — выделением растворенных атомов из
жидкого металла.
При равенстве скоростей обеих реакций наступает насыщение жид-
кого металла растворенными атомами. В общем виде кинетическое
уравнение растворения имеет следующий вид:
1 — exp
rt = n«
(4-1)
где п — концентрация растворенных атомов в момент времени t; пх —
концентрация насыщения; а — константа скорости растворения; 8 —
поверхность твердого металла, находящегося в контакте с жидким;
Vm — объем жидкого металла; t — время.
Зависимость концентрации насыщения от температуры выражается
уравнением
1g (п„ • 104) = 1,8266 — 558,5/Т. (4.2)
Растворимость какого-либо элемента в жидких металлах является
функцией атомного номера растворяемого металла. В жидкометалли-
ческих растворах (так же, как и в твердых) растворимость увеличива-
ется при уменьшении различия в значениях атомных радиусов компо-
нентов. В изотермических условиях скорость растворения твердого
металла уменьшается во времени по экспоненциальному закону. В
этом случае перемешивание расплава интенсифицирует процесс раство-
рения.
Деформация, изменяя энергетическое состояние атомов, увеличи-
вает скорость растворения.
Для сплавов возможно селективное растворение компонентов. В
результате преимущественного перехода более легкорастворимого
компонента сплава в жидкий металл на поверхности металла образУ'
ется слой, обедненный этим компонентом, что может привести к фаз°"
вым превращениям. Так, вследствие селективного растворения нике-
ля отмечается превращение аустенита в феррит в поверхностном слое
62
при коррозии аустенитных хромоникелевых сталей в жидких РЬ,
Bi, Li.
Перенос массы наблюдается в системах, отдельные участки которых
находятся при различной температуре. В зоне с пониженной темпера-
турой раствор вследствие уменьшения растворимости становится пе-
ресыщенным и происходит выделение кристаллов растворенного эле-
мента. Часть выпавших кристаллов остается в холодной зоне, другая
часть вместе с потоком жидкого металла вновь попадает в горячую зону.
В горячей зоне растворение металла интенсифицируется, так как кон-
центрация раствора в холодной части системы понижается. Процесс
переноса массы не замедляется, в отличие от процесса растворения, в
изотермических условиях. Перенос массы из горячей зоны в холодную
увеличивается в тех случаях, когда поверхность холодной зоны су-
щественно выше поверхности горячей зоны, и может привести к обра-
зованию пробок. Для аустенитной нержавеющей стали 1Х18Н10Т ско-
рость коррозии в литии в результате переноса массы при температуре
в горячей зоне 853 К, перепаде температуры 410 К и скорости потока
0,15 м/с составляет ~0,1 г/(м2 • ч). Для низколегированных сталей
это значение может быть на порядок больше.
Перенос массы может происходить и в изотермических усло-
виях. При растворении сплава в жидкий металл переходят и легирую-
щие элементы, которые переносятся расплавом к другому металлу.
Легирующие элементы могут образовывать со вторым металлом твер-
дые растворы или интерметаллические соединения.
Наиболее распространенным является перенос углерода со сталей,
содержащих менее сильные карбидообразующие элементы, к сталям с
более сильными карбидообразующими элементами, а также перенос
кислорода и азота от одного металла к другому и из газовой фазы че-
рез жидкий металл к твердому. Частный случай изотермического пе-
реноса — соединение находящихся в плотном контакте и погруженных
в жидкий металл двух твердых металлов (так называемое самосвари-
ваниё).
Межкристаллитная корррозия обусловлена более высоким уров-
нем потенциальной энергии атомов на границе зерен по сравнению с
атомами внутри зерн'а. Следовательно, энергия активации атомов на
границе зерен меньше, а вероятность перехода их в расплав и, следо-
вательно, скорость растворения больше. Фронт коррозии будет углуб-
ляться по границам зерен, т. е. будет протекать межкристаллитная
коррозия. Даже по достижении предельного насыщения межкристал-
литная коррозия не прекращается вследствие энергичного локального
переноса массы.
Иногда наблюдается увеличение концентрации некоторых элемен-
тов по границам зерен. Если эти элементы легко растворяются в рас-
плаве, межкристаллитная коррозия интенсифицируется. Более интен-
ивная диффузия легко растворимых атомов по границам зерен также
Ос°бствует межкристаллитной коррозии. В частности, межкристал-
щТНая коррозия хромистых сталей в висмуте связывается с преиму-
цат1Венной граничной диффузией хрома. Ионы кислорода или окись
рия могут химически взаимодействовать с компонентами сплава, в
$3
„,™пгти с атомами примесей, находящихся на границах зерен. Те,
^Лисдаод, присутствующий в расплаве, может интенсифипиро.
пптг, межкристаллитную коррозию.
£ п5гом упругих напряжений в металле скорость межкристаллит.
- nrmrwirn возрастает. Так, глубина межкристаллитной коррозии
Н0Ипи 15^54 в эвтектике Pb-Bi при температуре 823 К за 1000 ч Ис.
Хний с ростом напряжения от 1,47 до 9,8 МПа возросла с 25 До
50 ПТелочные металлы могут взаимодействовать с кислородом, раство-
пенным в твердом металле. Например, Nb, Та, Tj, Zr, свободные от
кислорода плохо растворяются в щелочных металлах. В определен-
ных условиях, когда свободная энергия образования окисла твердого
металла больше, чем энергия образования окисла щелочного металла,
щелочные металлы отбирают у твердых металлов растворенный в них
кислород. При этом щелочной металл, например литий, может прони-
кать в ниобий по границам зерен, где могут концентрироваться окис-
лы ниобия. Глубина проникновения его тем больше, чем выше содер-
жание кислорода в ниобии.
Смачивание жидким металлом твердого даже в отсутствие коррс
знойного воздействия может существенно сказаться на механических
характеристиках твердого металла. Высокопластичный исходный ма-
териал, способный удлиняться на сотни процентов, Н результате влия-
ния жидкометаллического слоя становится хрупким. Изменяются дли-
тельная прочность, сопротивление усталости. Этот эффект связывается
с адсорбционным влиянием среды. Жидкий металл проникает по ли-
ниям дислокаций, образующимся на ранних стадиях деформации. Ад-
сорбированные жидкие металлы уменьшают энергетический барьер,
препятствующий выходу дислокаций на поверхность, и разупрочняют
металл. При выходе на поверхность металла скоплений дислокаций
могут возникнуть трещины. Проникновение среды в трещины приво-
дит ^расширению их и охрупчиванию материала. Адсорбционное
воздействие жидких металлов на твердые в настоящее время интенсив-
но изучается и еще далеко не завершено. Значительный вклад в реше-
ние этого вопроса внесли советские ученые: академики П. А. Ребиндер,
С Т. Кишкин, а также Е. Д. Щукин, В. И.Лихтман, А. В. Рябченков
и др.
Способы снижения коррозии. Предложен ряд способов для сни-
жения скорости коррозии конструкционных материалов в жидких ме-
таллах. Изотермическое растворение чистого металла может быть су-
щественно снижено путем предварительного насыщения расплава этим
пи,ДЛЛ0М' ОДнако этот способ неприемлем, так как он приводит к Уве"
Cupе”и“ “ежкри£[аллитной коррозии и переноса массы. Так, введе-
на я пяиипТИКУ 1 более легко растворимого компонента спла-
стялиД1 У1ям1птЧае в количестве 0,6% снижает скорость корро31”1
И™ п°Т ПРИ темпеРатУре 873 К за 1000 ч испытаний с 1,4 Д
их раств°Рении в расплаве нескольких твердых металле»
SomВг-ряде случаев ниже- чем при разд*»-
дельную пягтпоп Введение Си, Fe или Zr в жидкую ртуть снижает пр^
дельную растворимость титана наполовину. Предварительное раство
рение в жидком металле компонентов, значительно снижающих кон-
центрацию насыщения твердого металла, уменьшает скорость корро-
зии последнего в изотермических условиях.
В тех случаях, когда жидкий металл не восстанавливает окислы
твердого металла, создание на поверхности последнего окисного слоя
замедляет растворение металла. При наличии окисной пленки атомы
растворяемого металла могут достигнуть расплава, лишь пройдя сквозь
пленку. Скорость же диффузии в твердой фазе значительно меньше, чем
в жидкой фазе. Легирование железа хромом способствует образованию
на его поверхности окисной пленки. Добавка 4,8% Сг в 7 раз снижает
скорость растворения железа в висмуте при температуре 823 К. Сни-
жение скорости коррозии высокохромистых сталей в висмуте наблю-
далось при температуре 873—1223 К при наличии кислорода в защит-
ной атмосфере аргона.
Следует отметить, что и при наличии окисных пленок на поверхно-
сти металла концентрация насыщения раствора остается неизменной.
Окисные пленки снижают и перенос массы. Так, в жидком свинце при
температурах горячей и холодной зон 1083 и 773 К соответственно вре-
мя до закупорки контура из стали 1Х18Н10Т увеличилось со 100—
140 до 500 ч после создания на поверхности металла окисного слоя тол-
щиной 100 нм. Очаги разрушения возникли в местах повреждения окис-
ной пленки. Однако защита с помощью поверхностных окисных пле-
нок носит временный характер. Пленки разрушаются из-за механи-
ческих повреждений, из-за различия коэффициентов линейного удли-
нения окисла и металла во время термических циклов, вследствие
эрозии. В щелочных металлах, восстанавливающих окислы большин-
ства конструкционных материалов, такой способ защиты, естественно,
непригоден.
Покрытие из металла, мало растворимого в расплаве, также сни-
жает скорость коррозии защищаемого металла. С помощью молибде-
нового покрытия, полученного термодиффузионным способом, защи-
щают от коррозии в литии высоконикелевые стали. Защитное поверх-
ностное покрытие может быть получено введением в поверхностный
слой металла некоторых элементов. Например, азотирование поверх-
ности титана и его сплавов снижает скорость их коррозии в ртути при
температуре 811 К.
Загрязнение щелочных металлов кислородом интенсифицирует
коррозионные процессы. Очистку расплава от кислорода можно осу-
ществить в «холодных» ловушках. С понижением температуры жидкого
металла растворимость кислорода (окислов) в нем уменьшается. Часть
металла, циркулирующего в контуре, пропускают через устройство,
находящееся на байпасе, где температура близка к температуре плав-
ления жидкого металла. Окислы осаждаются на стальной стружке,
которой заполнена холодная ловушка. При рациональной организа-
ции такого способа очистки можно снизить концентрацию кислорода
До 0,005%. Для более полной очистки жидкого металла от кислорода
(например, в случае контакта расплава с тугоплавкими металлами)
используют «горячие» ловушки с геттерами: Ti, Zr, Y, Mg. Горячие
овушки обычно ставятся на байпасе, и в них поддерживают достаточ_
3 Зак. 369 65
но высокую температуру, чтобы за время прохождения через нее жид-
кого металла кислород, растворенный в нем, успел прореагировать с
Элементы энергично взаимодействующие с кислородом, можно вво-
дить и в жидкий металл. Так, введение в ртуть натрия или магния су-
щественно снижает коррозию стали. Элементы, вводимые в расплав
лчя защиты от коррозии конструкционных материалов, называют
ингибиторами. Защитное действие ингибиторов в расплавах основа-
но на связывании ими кислорода или образовании Защитных пленок.
Ингибитор должен обладать малым сечением захвата нейтронов, хо-
рошо растворяться в жидком металле, не активироваться значительно
в поле облучения. Так как ингибитор должен связывать кислород, то
свободная энергия образования окисла ингибитора должна быть более
отрицательна, чем окисла жидкого металла. Перечисленным условиям
отвечает барий. Введение последнего в количестве 1 % в жидкий натрий
при температуре 823 К снижает перенос массы в контуре из нержаве-
ющей стали в 10—100 раз. Ингибитор следует вводить в расплав при
содержании кислорода в нем более 0,01%. Введение в жидкие Bi, Pb,
Hg небольших количеств циркония или титана (0,005%) существенно
снижает коррозию сталей. На поверхности сталей в этих условиях об-
разуются пленки нитрида и карбида циркония и титана. Эти пленки
создают дополнительный барьер для выхода атомов твердого металла
в расплав и затрудняют кристаллизацию растворенного твердого ме-
талла в холодной зоне. Таким образом, ингибиторы в данных системах
снижают и перенос массы. Для создания защитной атмосферы рекомен-
дуются гелий и аргон с содержанием кислорода 0,002—0,005% и уг-
лерода 0,003%.
Натрий. Сравнительно низкая температура плавления, удовлетво-
рительные теплопередающие свойства, умеренные затраты мощности
на перекачку металла дают натрию некоторые преимущества перед
Другими жидкометаллическими теплоносителями. Менее благоприят-
ны его ядерные и химические свойства. Выпускаемый промышленно-
стью натрий содержит не более 0,3—0,4% (по массе) примесей:
к Са Fe Mg Si Os н„ С
0,01—0,05 0,01—0,02 0,001 0,001—0,2 0,001—0,2 0,003 0,005 0,006
™тп?я°браьУ™С^НаТл Ием сплавы и смешивается с ним в любых про-
Cs’ -^8 также образуют сплавы с натрием, суммарное
содержание их в натрии не превышает 0,001%. Суммарное содержание
„ кип»’N1’ Та составляет не более 0,01%. Присутствие кислорода
сивнмм синения с натрием Na2O делает натрий коррозионно-агрес-
менкшА утоосительная удельная масса жидкого натрия несколько
Хи™ В°Д? ПРН нормальных условиях.
мый ня гпЛ^КИИ нат?ий имеет серебристо-белый цвет, хорошо види-
м разрезе, поскольку обычно натрий покрыт пленкой
окисла. Натрий является исключительно реакционно-способным эле-
ментом. Сухой кислород при комнатной температуре взаимодействует
с натрием, однако реакция быстро прекращается из-за образования
на поверхности металла пленки окисла. Присутствие в воздухе даже
следов влаги интенсифицирует процесс окисления. При температуре,
близкой к температуре плавления, натрий медленно реагирует с водо-
родом с образованием гидридов. До температуры 673 К натрий не вза-
имодействует с азотом, до 873 К — с углекислым газом. В последнем
случае углекислый газ восстанавливается до окиси углерода и даже
до элементарного углерода. Натрий восстанавливает окислы большин-
ства металлов, образуя при этом либо чистые металлы, либо сплавы с
ними. При температуре активной зоны натрий с графитом не взаимо-
действует.
Натрий весьма энергично взаимодействует с водой. В реакторных
установках соприкосновение натрия с водой может произойти при раз-
герметизации теплообменника, при заполнении натрием недостаточно
просушенного контура. В результате реакции натрия с водой выделя-
ется значительное количество теплоты и газообразного водорода. По
количеству водорода в натрии судят о разгерметизации теплообменни-
ков. В случае большой поверхности соприкосновения натрия с водой
может произойти взрыв. Взаимодействует натрий и с конструкцион-
ными материалами, вызывая их коррозию.
Для системы Fe—Na в области температур 498—773 К константа
скорости растворения равна
а = —0,007 — 2388/Г. (4.3)
Чистое железо стойко в натрии с малым содержанием кислорода до
температуры 863 К. При 773 К и концентрации кислорода 0,014% ско-
рость коррозии углеродистой стали равна 1,4 • 10-8 г/ (м2 • ч). Низ-
колегированнная сталь с 5% хрома корродирует в этих условиях с
меньшей скоростью. Дальнейшее увеличение содержания хрома до
13% не увеличивает стойкости стали.
Скорость коррозии аустенитных нержавеющих сталей при темпе-
ратурах 773—988 К ниже, чем хромистых сталей. Аустенитные нержа-
веющие стали и их сварные соединения при содержании кислорода в
натрии 0,005% сохраняют стойкость до 973 К- Натрий почти не реаги-
рует с ураном. В случае нарушения целостности покрытия твэла кор-
розия урана в жидком натрии при рабочей температуре протекает весь-
ма слабо. Коррозия графита в жидком натрии в статических условиях
происходит интенсивно лишь в том случае, когда углерод, растворен-
ный в натрии, либо осаждается на более холодных участках контура,
либо расходуется на науглероживание аустенитных нержавеющих ста-
лей. Стойкость сварных соединений сталей в натрии не уступает стой-
ости основного металла. Серебро стойко в натрии до 523 К- Нестой-
ки в натрии Sb, Bi, Cd, Au, Pb, чугун. При 473 К асбест реагирует с
трием. Фторопласт-4 (тефлон) нестоек в натрии.
Дан и эвтектика Na—К менее агрессивны, чем Li, Hg, Pb, Bi.
ВинНЫе ° сто^кости некоторых конструкционных материалов в нат-
» калии и их эвтектике приведены в табл. 4.2.
67
Таблица 4.2
Коррозионная стойкость конструкционных материалов в Na, К и сплавах Na-к
----—————— -------------------- Температура, К
Конструкционный материал 373 473 573 673 773 873 973 1073 1173
Углеродистая сталь х X X X X м м М Mj Н
х х X X X м м М Н
Низкохромистая сталь Y х х X X X X М м
Аустенитная хромоникелевая сталь Y х х X X X X X X
Никель, нихром, хастеллой Медь (электролитическая) X х X х X м н н н н н Н Н н н
Латунь „ , Молибден, тантал, ниобий, вольфрам X х X X X X X X X X X X X м X м X м
Титан х х X X X X —
Цирконий X X X X X X X X X
Хром Алюминий Бериллий Кварц, обыкновенное стекло, «пи- X X м X X X м X X X м X н м м X н м н X н м м м
реке»
Ппимечание. X —допустимая стойкость, охватывающая I—IV группы стойкости по
ГОСТ 13819—68 (табл. 4.3); М—малая стойкость, V группа стойкости; Н —отсутствие стой-
кости, VI группа стойкости.
Показатели коррозии для некоторых металлов и сплавов
Группа стойкости Глубинный показатель коррозии, 10-8 м/год Отрицательный массовый показа
железа я его сплавов никеля и его сплавов меди и его сплавов
I. Совершен- но стой- кие <0,001 <0,0009 <0,001 <0,001
II. Весьма 0,001—0,005 0,0009—0,0045 0,001—0,005 0,001—0,005
стойкие 0,005—0,01 0,0045—0,009 0,005—0,01 0,005—0,01
III. Стойкие 0,01-0,05 0,009—0,045 0,01—0,05 0,01—0,05
0,05—0,1 0,045—0,09 0,05—0,10 0,05—0,10
IV. Понижен- но стой- кие 0,1-0,5 0,09—0,45 0,1—0,5 0,01—0,5
0,5—1 0,45—0,9 0,5—1 0,5-1
V. Мало стой- 1—5 0,9—4,5 1—5 1—5
кие 5—10 4,5—9 5—10 5—Ю
VI. Нестойкие >10 >9 >10 >10 _
68
Выше уже указывалось, что загрязнение жидких металлов кисло-
родом интенсифицйрует процессы коррозии (табл. 4.3). В частности,
в присутствии кислорода в натрии на поверхности сталей образуется
бурая окалина, легко отделяющаяся от металла. Продуктом взаимо-
действия железа и окиси натрия является (Na2O)2FeO. Загрязнение
жидкого натрия кислородом увеличивает растворимость никеля. В ре-
зультате взаимодействия с содержащим кислород натрием чистого цир-
кония, ниобия, тантала последние поглощают кислород из расплава
и на поверхности их образуется слой твердого раствора кислорода,
который, в свою очередь, может взаимодействовать при определенных
условиях с щелочными металлами.
Скорость коррозии железа армко при 813 К возрастает с увеличе-
нием содержания кислорода от 0,005 до 0,16% соответственно от 0,28
до. 83,3 • 10-2 г/ (м2 • ч). При температуре 773 К увеличение содер-
жания кислорода в натрии с 0,01 до 0,1 % приводит к возрастанию ско-
рости коррозии низколегированной стали с 5% Сг от 1,4 до
38,8 • 10~2 г/ (м2 • ч), адля стали 1Х18Н10Т—до 10,83 • 10~3 г/(м2 • ч).
Предельно допустимая концентрация кислорода с точки зрения кор-
розии сталей — 0,01%.
Цирконий более чувствителен к загрязнению натрия кислородом,
чем аустенитные нержавеющие стали. Скорость коррозии циркония
возрастает уже при содержании кислорода в натрии 0,003%. Допусти-
Таблица 4.3
тель коррозии, 19-4 г/(мг-ч) Оценка коррозионное стойкости по десяти- балльной шкале. ГОСТ 13819 — 68
свинца и его сплавов алюминия и его сплавов магния и его сплавов
<0,0013 <0,0003 <0,0002 1
0,0013—0,0065 0,0003—0,0015 0,0002—0,001 2
0,0065—0,013 0,0015—0,003 0,001—0,002 3
0,013—0,065 0,003—0,015 0,002—0,01 4
0,065—0,13 0,015—0,03 0,01—0,02 5
0,13-0,65 0,03—0,15 0,02—0,1 6
0,65—1,3 0,15—0,3 0,1—0,2 7
1,3—6,5 0,3—1,5 0,2—1 8
6,5-13 1,5—3 ‘-2 | 9
>13 >3 >2 10
69
„Я концентрация кислорода И натрин составляет в случае прима,.
НИЯ циркония °,001 % за в натрии прн температуре 813 К с
от °’002 до °'04,‘ во~«
\аопячей“оЕё двоГшого окисла, например (Na20)2FeO, в диссоциаций
в ’Хной зоне "™ с непосредственным взаимодействием ново,
кислорода с атомами железа:
Fe _j- о2~ -> FeO + 2е; (4.4)
2Na++ 2е-> 2Na. (4.5)
Закись железа, попадая в поток натрия, восстанавливается. Вос-
становленное железо переносится в холодную зону, где и выпадает
вследствие перенасыщения раствора.
Присутствие углерода в натрии вызывает науглероживание поверх-
ностного слоя нержавеющих сталей подобно науглероживанию при изо-
термическом переносе углерода. Перенос углерода интенсифицируется
присутствием в расплаве кислорода. Работами советских исследовате-
лей В. С. Ляшенко и Б. А. Невзорова показано, что окись натрия час-
тично диссоциирована в расплаве натрия, т. е. в расплаве присутству-
ют ионы кислорода О2-. При температуре выше 773 К наблюдается
частичная диссоциация цементита в углеродистых сталях с образова-
нием положительно заряженных ионов углерода С2+.
На первом этапе происходит взаимодействие между ионами
(С*+ + О2’ -> СО) с последующим переносом окиси углерода в жид-
ком натрии к другим участкам контура. На втором этапе в адсорбиро-
ванной на поверхности металла окиси углерода каталитически ослаб-
ляется связь между атомами углерода и кислорода в молекуле и проис-
ходит отрыв кислорода в результате взаимодействия его с натрием-
Если на поверхности стали содержатся активные карбидообразующие
элементы, они взаимодействуют с углеродом и сталь науглероживает-
ся. На поверхности чистого железа в результате протекания описывае-
мого процесса может образоваться слой графита.
пЛ2Те кислорода в натрии при этом не уменьшается, и про-
кислопопй * УглеР0Да может протекать при малых концентрациях
нойо 2 мм ппгпАПЛаВе’ В повеРхностном слое стали 1Х18Н10Т толши;
сталью, содерж^щеГо^З»/8^11116 4°°0 4 В контакте с углеродист^
исходного зитення 0,08% до 2 м°Д9КзеЛ/ГЛерада Увеличилось J
лорода в натрии ео^^енно Ода- o ’S ^%“Це“Траи”
ирЛхаХ" Х^ХТ“циТ"СХ0Д"Т’’,,0-ВВД™0“У- В ре3уЛЬИГе
Fe3C ф- 2Li Li2C + 3Fe;
mLi2C + nCr -> CrnC,n + 2/nLi.
(4.6)
(4.7)
70
Калий. Основное преимущество калия перед натрием как теплоно-
сителя в ядерной энергетике заключается в его более низкой’темпера-
туре плавления. Другие свойства калия менее благоприятны. Тепло-
физические свойства калия и натрия весьма сходны. Характеризуя хи-
мические свойства калия, следует отметить, что он более реакционно-
способен, чем натрий. Калий энергично взаимодействует на воздухе
с кислородом, водой, а при высокой температуре с водородом и угле-
кислым газом. Азот не взаимодействует с калием и может применять-
ся для создания защитной атмосферы. С графитом калий образует твер-
дые растворы. При температуре выше 473 К калий в значительном ко-
личестве поглощается графитом. Коррозионное воздействие калия на
конструкционные материалы аналогично воздействию на них натрия
(см. табл. 4.3). Сплавы натрия с калием, содержащие 40—90% послед-
него, находятся при комнатной температуре в жидком состоянии. Это
устраняет необходимость сооружения систем подогрева для расплав-
ления жидкометаллического теплоносителя перед пуском реактора.
Минимальную температуру плавления (261,5 К) имеет эвтектический
сплав, содержащий 77,2% К. Сплавы калия с натрием можно получить
непосредственным сплавлением металлов в инертной атмосфере. Фи-
зические свойства эвтектики близки к свойствам натрия и калия.
Литий. Литий по теплопередающим свойствам, большой объемной
теплоемкости при температуре 773 К имеет преимушества перед натри-
ем. Однако в природном литии содержится 7,4% стабильного нуклида
6Li, являющегося сильным поглотителем тепловых нейтронов, а умень-
шение его содержания —процесс дорогой. Металлический литий име-
ет серебристо-белый цвет, быстро тускнеет на воздухе и покрывается
темно-коричневыми продуктами коррозии. Литий — самый легкий на
земле металл. По химическим свойствам он ближе к щелочно-земель-
ным металлам. При комнатной температуре он медленно реагирует на
воздухе с кислородом и азотом. Во влажной атмосфере быстро окис-
ляется, образуя гидроокись лития. Чистый литий воспламеняется на
воздухе при температуре 913 К. Загрязнения снижают температуру вос-
пламенения до 473 К. Литий, как и другие щелочные металлы, хранят
в осушенном керосине или минеральном масле. Твердый литий реаги-
рует с водой менее энергично, чем натрий. В жидком состоянии он взаи-
модействует с водой более энергично. Литий взаимодействует с кис-
лородом, азотом, водородом, углекислым газом. Инертные газы, при-
меняемые для предохранения от окисления лития, должны быть очи-
щены не только от кислорода и водяных паров, но и от азота.
Технический литий значительно более коррозионно-агрессивен по
отношению к конструкционным материалам, чем натрий или калий.
" литии при температуре 973 К удовлетворительной стойкостью обла-
дает нержавеющая сталь с низким содержанием углерода. При темпе-
ратуре 1173 К стойки в литии Mo, W, Nb, Та, железо армко. Стойкость
Ряда материалов в литии приведена в табл. 4.4.
р Рисутствие в литии азота увеличивает растворимость и коррозию
р ’ Ni, Nb, Ti, нержавеющих сталей. Азот делает литий более аг-
нуюИВНЫМ’ Чем КИСЛ°РОД- Азот в литии интенсифицирует селектив-
У коррозию и перенос массы аустенитных хромоникелевых нержа-
Таблица 4.4
Температура. К
- „гть конструкционных материалов в литии
Коррозионная стойкость конструкци----------------------
Конструкционный материал 473 573 673 773 873 973 1073 1173
х X X X X X X X
Железо армко X X X м м н н н
Аустенитная хромоникелевая нержавею X X X X X X X X X X X м X м м н
щая сталь Никель, нихром, хастеллой Молибден, тантал, ниобий, вольфрам 1 1 м X м X н X н X н X м н X м
Титан, цирконий, хром, оернллии м м н н н н н н
Кварц н н н н н н н н
Стекло н н н н н н н н
Графит высокой плотности
Примечание. Обозначения те же, что и в табл. 4.2
веющих сталей. Агрессивность жидкого лития при температуре ниже
723 К усиливается при наличии в нем гидроокиси лития. При более
высокой температуре гидроокись диссоциирует.
В процессе эксплуатации может возникнуть необходимость очистки
контура от щелочных металлов, применяющихся в качестве теплоно-
сителя. Перед очисткой металл из контура сливают. Когда контур охла-
дится до температуры 333—343 К, которая меньше температуры ки-
пения спирта, его продувают инертным газом. Затем в контур через
нижний дренаж малыми дозами подают этиловый или метиловый спирт.
Необходимо предусмотреть отвод кислорода, выделяющегося в ходе
взаимодействия спирта с щелочными металлами. Количество спирта,
необходимое для очистки, должно вдвое превышать вес предполагае-
мых остатков щелочного металла. Когда количество оставшегося ме-
талла неизвестно, количество спррта должно составлять 6—8% объема
системы. Перед использованием спирта необходимо проверить коли-
чество воды в нем. Спирт можно применять только в том случае, если
при растворении в нем кусочка щелочного металла не возникает вспыш-
ки, искрения или интенсивного газовыделения.
В процессе промывки контура спиртом желательно его перемеши-
вать. По окончании первой промывки спирт может быть слит и разбав-
лен на 20% водой. Этот раствор используют для второй промывки.
Окончательно контур промывают чистой водой. В последнее время
применяют также промывку контура водяным паром. Этот процесс тре-
бует тщательной отработки технологии и контроля. В частности, систе-
му заполняют инертным газом для замедления реакций, подача вна-
чале перегретого, а затем влажного пара осуществляется небольшими
порциями. При использовании в качестве теплоносителей щелочных
металлов должны быть предусмотрены системы очистки их перед за-
грузкой в контур, наличие помещения для уничтожения использован-
ных щелочных металлов.
72
Висмут. Промышленный висмут содержит 6,1—6,2% примесей.
В сухом и влажном воздухе и даже в атмосфере кислорода при комнат-
ной температуре висмут стоек к окислению. При высокой температуре
металл воспламеняется на воздухе с образованием окисла. Водород и
азот при температуре 873 К не взаимодействует с висмутом. При 873—
1073 К в контакте с висмутом водяной пар разлагается, а углекис-
лый газ восстанавливается до чистого углерода. Для защиты от окис-
ления висмута при температуре до 873 К применяют водород, азот, ге-
лий, аргон, при более высоких температурах — гелий и аргон. При
температуре 1658 К висмут растворяет в себе 0,012% углерода. Желе-
зо и углеродистая сталь стойки в висмуте до 973 К (табл. 4.5). Несколь-
ко менее стойки хромистые нержавеющие стали. Введение в висмут
магния, циркония, титана в количестве 0,005—0,05% улучшает стой-
кость сталей и уменьшает перенос масс. Цирконий, никель, сплавы и
сталь, содержащие никель, значительно взаимодействуют с висмутом.
Висмут взаимодействует с металлическим ураном, растворяя его в зна-
чительных количествах. Сплав висмута с ураном может быть исполь-
зован в жидкометаллических топливных системах.
Таблица 4.5
Коррозионная стойкость конструкционных материалов в висмуте
Конструкционный материал 573 673 Температура, К
773 873 973 1073 1173
Железо X X X X X м м
Углеродистая сталь X X X X X — —
Нержавеющие ферритные (12—27% Сг) X X X м м м н
и хромоникелевые стали Вольфрам и тантал X X X X X X - —
Молибден X X X X X X X
Ниобий X X X X X м м
Алюминий X н н
Бериллий X X X X X X X
Хром X X X X X м м
Медь м м н н н н н
Графит X X X X X X X
Стекло пирекс X X X н н н
Плавленый кварц X X X X X X X
Примечание. Обозначения те же, что и в табл. 4.2.
Свинец. Теплофизические свойства свинца невысоки. Теплоемкость
®го по массе почти в 10 раз меньше, чем у натрия. Теплопроводность
винца мала, относительная удельная масса велика. При комнатной
свине« стоек на воздухе. Расплав свинца до температу-
пеп 3 К защищается от окисления плотной пленкой окисла. При тем-
пературе 973—1173 К пленка окисла плавится, и скорость окисления
873KR в^Растает- Водород и азот не взаимодействуют со свинцом до
плав*'1’ 3111 газы’ а также аргон, гелий применяются для защиты рас-
ленного свинца от окисления. Расплавленный свинец практически
73
*мппрмствует с графитом. Стойки в расплавленном Свинце углё-
Wсталей, тантал, титан, ниобий, 6е.
^Загрязнение свинца кислородом, сурьмой, мышьяком, оловом, цин.
ком увеличивает его агрессивность.
В кач^тве жидкометаллического теплоносителя чаще применяют Не
свинец и^смут по отдельности, а их эвтектику, содержащую 44,5%
Ph И 55 5% Bi Температура плавления этого сплава 398 К- Теплофи-
,ИЧ«жиё свойства сплава, за исключением теплопроводности, близки
к сведним значениям теплофизических свойств висмута и свинца. Хи-
мические свойства близки к аналогичным свойствам его компонентов.
Аустенитные нержавеющие стали не обладают достаточной стойко-
стью в эвтектике РЬ—Bi при температуре 873 К- В процессе взаимо-
действия с эвтектикой происходит селективное растворение никеля из
аустенитной стали. Это обусловливает протекание структурного пре-
вращения аустенит—феррит; последний обнаруживают рентгенострук-
турным анализом на поверхности стали. Предварительное насыщение
эвтектики никелем в количестве 0,6% увеличивает стойкость аустенит-
ной нержавеющей стали. Создание на поверхности стали окисных сло-
ев за счет окисления компонентов стали или введения в эвтектику в
качестве ингибиторов кальция и бария снижает скорость коррозий
стали 1Х18Н10Т. В этом случае сталь можно использовать до темпера-
туры 773 К-
Железо и низколегированные стали хотя и более стойки в эвтекти-
ке РЬ—Bi, чем сталь 1Х18Н10Т, обладают низкой жаропрочностью.
В связи с этим применение их в данных условиях ограничено. Хромис-
тые нержавеющие стали стойки в эвтектике РЬ—Bi.
Галлий. Галлий — металл довольно редкий и потому дорогой.
Основным преимуществом является его низкая температура плавле-
ния (302,8 К). По химическим свойствам галлий близок к алюминию.
С водой и паром взаимодействует слабо. Галлий является весьма кор-
розионно-агрессивным металлом. Тантал и вольфрам стойки в нем до
о73 и 1073 К соответственно. Углеродистые и нержавеющие стали не-
стойки в нем уже при температуре 373—573 К.
§ 4.2. ОРГАНИЧЕСКИЕ ТЕПЛОНОСИТЕЛИ
Небплкп^лв ТКИе теплоносители имеют ряд преимуществ перед водой.
Dvkuhio и ч£гп™НИе Пар0В °Рганических жидкостей упрощает конст-
рессивности ппгГаЦИЮ К°НТура- ВслеДствие малой коррозионной аг-
ся дешекыр Р”ческих теплон°сителей в реакторе могут применять-
ность опганики тпп«СТЬ1е Стали' Невысокая наведенная радиоактив-
ным недостать™, ппгУеТ Минимальной биологической защиты. Основ-
ная и радиапионняаГиНИЧ^КИХ тевлоносителей является их термичес-
соединений ппи пмр/УеСг°ЙК0СТЬ‘ Разложение (пиролиз) органических
свойств Ппопикткт К°Й темпеРатУРе вызывает резкое изменение и*
лахи п’езко ™Ролвза могут образовывать Отложения на твэ-
У УДшать теплообмен, что может привести к разрушений
элементов. Это не позволяет использовать органические теплоносите-
ли в большой энергетике. В качестве органических теплоносителей при-
меняют дифенил, моноизопропилдифенил, дифенильную смесь. Эти ве-
щества термически стойки при температуре 593—673 К. При более
высокой температуре происходит их интенсивное разложение с обра-
зованием высокомолекулярных веществ с высокой температурой плав-
ления и газов: водорода, метана и др.
Под действием облучения молекулы органических теплоносителей
разрушаются с образованием полифенильных и водородных радика-
лов. Первые, взаимодействуя между собой, образуют высокомолеку-
лярные полимеры с высокой температурой кипения. Водородные ра-
дикалы дают водород. При взаимодействии фенильных и водородных
радикалов образуются метан и другие легкие углеводороды: Газовая
фаза, образующаяся при радиолизе углеводородов, состоит на 85—95%
из водорода и на 2—10% из метана. Наиболее устойчив к облучению
n-терфенил. Дифенил обладает наименьшей устойчивостью. При тем-
пературе ниже некоторой критической (для дифенила ~673 К) радио-
лиз органических теплоносителей не зависит от температуры. При тем-
пературе выше критической разложение органических теплоносителей
в поле облучения растет и увеличивается выход продуктов с высокой
температурой кипения. Радиационное разложение полифенилов мо-
жет быть снижено введением в них стабилизатора, например бензола.
Технический дифенил представляет собой твердое кристаллическое
вещество желтого цвета. Основными примесями в нем являются зола
(до 0,1%) и вода (до 0,5%). Дифенил—наиболее дешевый и доступный
органический теплоноситель. Температура плавления его 342,5 К, а
температура кипения — 529 К. Коэффициент теплоотдачи дифенила
меньше, чем воды, В контуре реактора дифенил всегда содержит про-
дукты распада, высококипящие вещества. Допустимым считается при-
сутствие их в количестве 30—40%. При температуре 673 К в дифениле
стойки углеродистая и нержавеющая сталь, уран. Нестойки в нем маг-
ний и сплавы циркония. Последние разрушаются вследствие гидриро-
вания при взаимодействии с водородом. Более термически и радиаци-
онно-стойки, чем дифенил, полифенильные смеси, моноизопропилди-
фенил, дифенильные смеси. Смесь 21,5% дифенила (С6Н5)2 и 73,5%
Дифенилового эфира (С„Н5)2О имеет более низкую температуру плав-
ления, чем дифенил. Однако радиационная стойкость ее невысока.
§ 4.3. ГАЗОВЫЕ ТЕПЛОНОСИТЕЛИ
Газовые теплоносители нашли достаточно широкое применение в
ядерных энергетических установках. Применение их в одноконтурном
икле упрощает схему установки. Захват тепловых нейтронов газовыми
еплоносителями невелик, что позволяет применять их в реакторах
«природном уране. Нежелательными свойствами газовых теплоно-
елей являются низкие значения плотности, объемной теплоемко-
буют КОэФФИ11Иента теплопроводности. Последние обстоятельства тре-
Уют прохождения через реактор значительных объемов газа, что ус-
75
— н
энергии на прокачку теп перекачку теплоноситель исполь-
U “SSXS Эта также усложняи
ЗУЮТ под давлением в vnHTvna
конструкцию и ’^^„„„отелях. Кислород, содержащийся в
Коррозия В газовых гячовУЮ коррозию. Взаимодействие
виде "₽'iTrasa'начинается с адсорбций последнего. В среднем на 1см1
чистой металлической поверхности приходится около 10“ атомов, па
Рис. 4.1. Изменение энергии системы при адсорбции (d — расстояние от поверх-
ности)
которых может адсорбироваться газ. При адсорбции газа свободная
энергия его уменьшается и процесс идет самопроизвольно. Различают
физическую адсорбцию и хемисорбцию. При физической адсорбции
газы удерживаются на поверхности физическими (вандерваальсовски-
ми) силами. Физическая адсорбция протекает без заметной энергии
активации и почти мгновенно, как только молекулы газа соударяются
с поверхностью. При хемисорбции реакция протекает медленнее, будучи
связана с энергией активации. Хемисорбцию называют активирован-
ной адсорбцией. Она зависит от кристаллографической ориентации
дефектов на поверхности металла. Предполагается, что хемисорбция
преобладает на «активированных» местах или участках поверхности.
Принято считать, что хемисорбция проходит только до тех пор, пока
на поверхности не образуется мономолекулярный слой адсорбата. Фи-
зическая адсорбция может проходить на всех поверхностях и приво-
дить к образованию многомолекулярных слоев. При адсорбции моле-
кулы кислорода диссоциируют.
Изменение энергии при адсорбции представлено на рис. 4.1. Точка
1 соответствует положению стабильного равновесия адсорбирован-
ного атома с энергией qlt фиксированного на расстоянии от поверх-
76
ности после распада молекулы. Точка М2 соответствует положению ста-
бильного равновесия недиссоциированной молекулы с энергией q2
на расстоянии d2 от поверхности. Для перехода из состояния молеку-
лярной адсорбции в более стабильное состояние атомной адсорбции с
разницей в энергии Е = — q2 необходимо преодолеть энергетичес-
кий барьер, высота которого Е^ — Е(, и есть энергия активации про-
цесса хемисорбции. При взаимодействии адсорбированных атомов с
поверхностью металла в ряде случаев имеет место перегруппировка
атомов в поверхностном слое металла и их ионизация.
В результате адсорбции атомов или ионов кислорода образуются
поверхностные кислородные структуры, т. е. упорядоченное располо-
жение ионов и атомов кислорода, отражающее симметрию металличес-
кой подложки и зависящее от ее кристаллографической ориентации.
Для поверхности с плотноупакованными атомами, например для плос-
кости (111) металла с ГЦК-решеткой, наиболее стабильные центры ад-
сорбции, т. е. места, где размещаются адсорбированные атомы или ио-
ны, находятся вертикально над центром тяжести группы из трех соп-
рикасающихся атомов (положения А, В, С на рис. 3.1), а не над сами-
ми атомами. Таким образом, адсорбированные атомы или ионы распо-
лагаются на поверхности металла не хаотично, а образуют двумерную
кристаллическую решетку. Для каждого типа кристаллической пло-
скости имеет место наиболее вероятная конфигурация адсорбирован-
ного слоя, соответствующая требованиям геометрии размещения ато-
мов в металле и количеству связей, которые могут быть реализованы
между металлом и кислородом. Для плоскости (100) железа с ОПК-
решеткой расположение атомов адсорбированного кислорода ведет к
образованию двумерного соединения с формулой, соответствующей
FeO. Заметим, что такое расположение атомов кислорода и железа
обусловливает структурное соответствие a-Fe и окисла FeO, образую-
щегося в ходе окисления на этой плоскости.
Связь, возникающая между кислородом и поверхностными атома-
ми металла, — ионная. Адсорбируемое вещество (кислород) обладает
большим сродством к электрону, чем металл, поэтому электроны в
результате туннельного эффекта, переходя от металла к атомам кис-
лорода, заполняют свободные уровни хемисорбированного кислорода
и ионизируют последние. Связь между адсорбированным кислородом
и подложкой сильнее связи кислорода с металлом в окисле того же
стехиометрического состава. Это связывают с тем, что при хемисорб-
пии связь имеет частично ковалентный характер.
Дальнейший рост окисной пленки идет через образование зародышей.
Предполагается, что дислокации, поверхностные дефекты, примеси
служат местами образования зародыша, где двумерная структура
адсорбированного кислорода переходит в трехмерную с правильным
чередованием атомов металла и кислорода. Такая перестройка пред-
полагает миграцию на небольшие расстояния поверхностных атомов
металла и кислорода. После образования хаотично размещающихся
ародышей окисла окисление идет путем роста отдельных кристаллитов
о тех пор, пока поверхность полностью не покроется окислом. Кроме
исла, покрывающего металл, на поверхности последнего наблюдя-
ртра ПОСТ кристаллов окисла в виде «усов» длиной около 103 нм и диа-
пх? ?0 Р 5 нм Однако количество окисла, содержащегося в ycax
илиР пластинках, представляет собой небольшую долю всего поверх-
H0CR ОпоОоц^еЛроста окисла происходит миграция через него ионов
Б "р и кислооода которая существенно зависисит от дефектов
т’отетные дефекты могут 6ыть как нейтРаль"ым".
так Заряженными. Анионные вакансии и внедренные катионы заря-
положительно, а катионные вакансии и внедренные анионы-
отрицательно ио отношению к окружающей решетке.
Зарождение точечных дефектов одного знака сопровождается воз-
никновением дефектов другого знака, чтобы сохранить электронейт-
ральность кристалла. „ о «а
Процесс окисления металлов с плотной окиснои пленкой, образо-
ванной продуктами реакции, удовлетворительно описывается теорией
Вагнера. По ней предполагается, что объемная диффузия реагирующих
ионов или соответствующих точечных дефектов либо перенос элект-
ронов через растущую окалину определяет скорость всей реакции.
Поскольку контролирующим фактором является диффузия, считает-
ся, что реакция на границах фаз протекает быстро и устанавливается
термодинамическое равновесие между окислом и газообразным кис-
лородом на поверхности раздела окисел — кислород и между метал-
лом и окислом на фазовой границе между ними.
Движущей силой реакции является изменение свободной энергии,
связанное с образованием окисла металла. В окисле возникают гра-
диенты концентрации компонентов. На границе раздела окисел—газ
(МеО/О2) парциальное давление кислорода равно давлению кислоро-
да в газовой фазе, а на границе металл —окисел (Ме/МеО) оно равно
равновесному давлению диссоциации окисла (упругости диссоциации)
в контакте с металлом. На границе Ме/МеО концентрация катионов
максимальна. На границе МеО/О2 катионы реагируют с кислородом.
Концентрация кислорода или его ионов на этой границе существенно
выше концентрации катионов, поскольку последние мигрируют к этой
границе за счет диффузии. Диффузия в данном случае является огра-
ничивающим фактором, а реакция образования окисла протекает
ыстро. В связи с недостатком катионов при образовании решетки
окисла в ней генерируются катионные вакансии. На границе Ме/МеО
п^£НТраЦИЯ анионов °2- мала и при образовании окисла генери-
руются анионные вакансии.
максима л кнп3иа3^пЖеНН°Г?/ Д°вИентРаЦия Оа~ и катионных вакансий
концентоапия ият?аНИЦе ^O/Og и минимальна на границе Ме/МеО,
це МеО/О Rrn °Н0В И анионных вакансий максимальна на грани-
к МеСЮиж^ХТВоИе гРадиента концентрации от границы Ме/МеО
МеО/О к Ме/МрП^ЗИЯ катион2в и анионных вакансий, а от границы
ХЙасчст^ГиаНИ0НД (° } и ка™°нных вакансий. Элек-
границе МЮ/Оэффекта мигрируют от границы Ме/МеО к
тами и скоростями Р°СТа пленки определяется градиен-
к окислению пл Компонент°в. Такой механизм приводит
^илиилению по параболическому закону.
Подвижности и коэффициенты диффузии катионов, анионов, их
вакансий и электронов не одинаковы. Это приводит к разделению за-
рядов в растущей окисной пленке. Результирующий пространствен-
ный заряд создает в окисной пленке электрическое поле. При описа-
нии движения ионов, электронов и вак£нсий через окисную пленку
должны учитываться диффузия, обусловленная химическим потен-
циалом, и миграция, обусловленная электрическим потенциалом, т. е.
ионная и электронная проводимости окисла. Числа переноса катио-
нов в окислах малы. Катион мигрирует в 103—106 раз медленнее, чем
кислород. Окислы могут обладать электронной проводимостью (напри-
мер, магнетит), быть изоляторами или полупроводниками п- и р-ти-
пов.
Кинетика окисления может быть рассмотрена на основе теории
Вагнера. В соответствии с этой теорией окисление контролируется
скоростью диффузии реагирующих веществ. В этом случае окисление
идет по параболическому закону
X2 = Хт, (4.8)
где X — количество окисленного металла, г/м2; т — время; К — кон-
станта скорости окисления. Константа скорости окисления К зависит
от температуры:
К = а ехр (-W/RT), (4.9)
где а — постоянная; — энергия активации.
Эта зависимость известна как уравнение Аррениуса. Если выра-
зить 1g К как функцию 1/Т, то получается прямая, наклон которой
позволяет определить энергию активации.
Окисление может описываться не только квадратической парабо-
лой (п = 2), но и кубической; имеют место случаи, когда п является
дробным числом. В тех случаях, когда окисная пленка обладает хо-
рошими защитными свойствами, окисление идет по логарифмическо-
му закону:
X = Klgr + A. (4.10)
Если окисная пленка не обладает защитными свойствами, окисление
не замедляется во времени и идет с постоянной скоростью по линей-
ному закону, описываемому уравнением
Х = Хт. (4.11)
Оценку стойкости металла к окислению следует начинать с опреде-
ления принципиальной возможности образования окисла данного ме-
талла в конкретных рассматриваемых условиях, т. е. при заданных
температуре и давлении кислорода ро2. Эта информация может быть
получена из измерения изобарного потенциала или свободной энергии
реакции образования окисла:
2Ме + О2^= 2МеО. (4.12)
Изменение термодинамического потенциала этой реакции
AZ° = _КТ In (1/ро2) =* RT In ро. (4.13)
Характеризует сродство металла к кислороду.
79
Термодинамическая возможность протекания реакции окисления/
металла характеризуется также упругостью диссоциации, окисла.. По/
слелняя величина определяется давлением кислорода в газовой фа-
зе^находящейся при данной температуре в равновесии с окислом. Ус-
ловиям равновесия химической реакции окисления металла отвеча-
ет равенство давления паров кислорода ро. и упругости диссоциации
окиДа Zo При ро. >рмео реакция протекает в сторону обра-
зования ^окисла. При рО1 < рмео окисел будет диссоциировать на
металл и кислород. Упругость диссоциации окислов растет с увеличе-
нием температуры. Однако и скорость реакции окисления такте рас-
тете температурой. Таким образом, степень термодинамической ве-
роятности окисления металла с ростом температуры падает, а реальная
скорость окисления (при условии, конечно, что термодинамически
этот процесс возможен) с повышением температуры возрастает.
Большинство металлов, представляющих интерес для реакторостро-
ения в соответствии с термодинамическими характеристиками склон-
ны к окислению. Для прогнозирования стойкости металлов к газовой
коррозии необходимо оценить защитные свойства окисной пленки.
Соотношение Пиллинга—Бедфорса дает возможность в первом при-
ближении оценить защитные свойства окисной пленки. Условие
сплошности состоит в том, что объем окисла, возникающего из ме-
талла и кислорода (Уок), должен быть больше объема, израсходован-
ного при окислении металла (Уме). При Уок/Уме <Z 1 пленка не мо-
жет быть сплошной, при Уок/Уме > 1 она может быть сплошной.
Если соотношение Пиллинга—Бедфорса меньше единицы, вопрос
о защитных свойствах пленки решается однозначно: пленка не может
быть сплошной и, следовательно, не будет обладать защитными свой-
ствами. Если это соотношение больше единицы, окисная пленка покры-
вает поверхность металла сплошным слоем. Однако этого недостаточ-
но, чтобы сделать заключение о том, что окисная пленка является за-
щитной, так как она может быть пористой, иметь плохое сцепление с
металлом и т. д. Несмотря на то, что окисная пленка покрывает всю
поверхность металла, она в этом случае не будет защитной. Таким
образом, условие Уок/Уме > 1 является необходимым, но недоста-
точным для того, чтобы пленка окисла могла считаться защитной.
ащитные свойства окисной пленки существенно зависят от сцеп-
ления ее с металлом. В этой связи необходимо рассмотреть взаимную
ZТГ10 кристаллических решеток окисла и металла. Образова-
horhX В«пяН0И СТРУКТУРЫ продукта реакции возможно при двух ос-,
поллпжкп л°виях ~ наличии плоскости монокристалла в качестве
еся соепинриы2СТаТ0ЧН° малой скорости реакции, чтобы образующе-
подложкой ПпОИМеЛ° возможность ориентироваться в соответствии с
ся и ппи'няпцИМУЩеСТВеННаЯ °Риентация окисла может наблюдать-
соответствия текстУРы в металле. При наличии структурного
(п?,ХЮ““’ реш™ “"«а как бы достраивает кри-
димо существование тЛ металла. Для реализации эпитаксии необхо-
ячеек почти олнийипп^™ решетках одной или нескольких плоских
ется, когда совпяияигЛт* П° Ф°РМе и Размерам. Это условие выполня-
8о д рехмерные ячейки двух кристаллов. Расхожде-
ние размеров элементарный ячеек этих решеток не должно превышать
15%. При эпитаксии в плоскости границы параметры решеток под-
ложки и окисла могут изменяться в сторону сближения, т. е. имеет
место как бы приспособление ячеек друг к другу. Пример структур-
ного сопротивления a-Fe и его окисла представлен на рис. 4.2. Нали-
чие эпитаксии улучшает сцепление окисной пленки с металлом и соот-
ветственно защитные свойства окисла.
Различие удельных объемов металла и окисла, изменение парамет-
ров кристаллических решеток металла и окисла при эпитаксии вы-
окисла'2' ^Рнме'} стРУктУРного соответствия кристаллических решеток a-Fe и его
появлеНие напряжений в окисной пленке. В поликристал-
.. а °М МаТеРиале большие напряжения могут возникать на грани-
цу иТ И3'за Разных скоростей окисления соседних зерен, выхода-
ми я т ПОВеРХность различными кристаллографическими плоскостя-
Наппо^КЖе из‘за преимущественного окисления по границам зерен,
пвяжеи еНИЯ В 0КИСн°й пленке увеличиваются с ростом ее. Когда на-
сплогпцИЯ пРевосх°Дят предел прочности, пленка разрушается и
Кам кояСТЬ 66 НаРУ„шается- Разрушение начинается обычно по кром-
ее защит™ 0TBePfTH® и т- Д- Разрушение пленки, естественно, снижает
ки Пви ^Ые свовства- При этом может измениться закон роста плен-
Напряжец0ЛЬШ°й пРОчности пленки и слабом сцеплении ее с металлом
окисной плеенС>КаТИЯ ПРИВОДИТ к образованию пузырей и отслаиванию
Талле адНЫе пленки толщиной до 40 нм вызывают появление на ме-
ле. В эт™ Побежалости» связанных с интерференцией света в окис-
*opOI°M СлУчае цвет пленки связан с ее толщиной. Как правило,
Шпинели Защитными свойствами обладают окислы со структурой
Большин/ апРимеР магнетит. Шпинель имеет кубическую решетку с
м числом атомов.
81
может состоять из нескблькик слоев. Так, ОКибнйЯ
Окисная плен*а/°* на> состоит из нескольких окислов железа,
пленка на металла примыкает слой Fe/0KH.
Непосредственно к пов р ^ кисЛорода, далее следует Fe£o4 и в
сел с наименьшим сод р 3аКИСЬ железа (вюстит) FeO ^меет ку-
наружном слоеплен[К хлорисТого натрия. Этот окисел устой-
бИ^Тте₽мперТтуре выше 843-848 К. При более низкой темпериту.
Je он не образуется, а при медленном охлаждении от более высокой
температуры распадается.
4FeO -> Fe + Fe3O4. (4.14)
R вюстите как правило, содержание кислорода превосходит стехио-
™ческое. Окисел Fe3O4 (магнетит) имеет кубическую решетку ти-
па шпинели. В кристаллической решетке магнетита на каждый ион
двухвалентного железа приходятся два иона трехвалентного железа.
В отличие от других окислов железа, за исключением y-Fe2O3, этот
окисел ферромагнитен. При нагреве в окислительной среде магнетит
переходит в окись железа a-Fe2O3. Гематит cz-Fe2O3 имеет структуру
ромбоэдрической системы. Чаще на сплавах образуются сложные
окислы, например Сг2О3 • NiO.
Если кислород растворяется в сплаве при его окислении, менее
благородный компонент может образовывать окисел внутри сплава.
При этом под поверхностью раздела между сплавом и окалиной могут
образовываться окисные прослойки, часто называемые субокалиной.
Для внутреннего окисления требуется, чтобы скорость диффузии кис-
лорода в сплаве была много больше скорости диффузии легирую-
щего элемента.
Выше рассматривалось образование твердых окислов. В ряде слу-
чаев в процессе окисления образуются жидкие окисные фазы, напри-
мер при окислении сплава, содержащего в качестве компонента металл,
который образует легкоплавкий окисел. Такие случаи имеют место
при окислении металлов и сплавов в присутствии МоО3 и V2O6 с тем-
пературой плавления 1068 и 947 К соответственно. Присутствие жид-
ких окисных фаз может привести к чрезвычайно быстрому разрушению
сплава, называемому катастрофическим окислением.
Одним из видов газовой коррозии является обезуглероживаний
ал и. Достаточно подвижные атомы углерода диффундируют в зоне
1!ш,йЛ«НИЯ металла и окисляются сами. При этом, естественно, лежа-
свпи vMou?XH0CTtl металла обедняется углеродом и изменяет
комипи₽нтлпЧеСКИе св°йства. Уменьшение количества окислительны*
роживания Пп^а30В°Й ^a3e (С°2’ °2) Уменьшает процесс обезугле-
происхолитк ??£ЛЯаЧительном содержании в газе СО и СН4 может
бирать если ппм науглероживание поверхности. Целесообразно поД'
ды чтобы были ЛЯеТСЯ возможность, такой состав газовой ср6"
инертны к мета "одавлены процессы окисления металла. Полностью
Хые a?MS«au ЛИШЬ благоР°Дные газы. Часто используют 3*
шом содерж^юпо0Хаа?^СНЯМИВОДОрОДа’С°’ сн- При
82 дорода, со и СН4 смесь становится взрывоопасной"
Для создания защитной атмосферы применяют также природный газ,
отходящие газы пламенных печей.
Для защиты от окисления на поверхность деталей, находящихся
в особо тяжелых условиях, наплавляют высокостойкие сплавы: стеллит,
нихром. В некоторых случаях деталь покрывают алюминием погруже-
нием в расплавленный алюминий. Широко распространено также тер-
модиффузионное покрытие. При этом металл покрытия переводится
в газовую фазу в виде какого-либо летучего соединения данного ме-
талла, а затем в результате диффузии его в защищаемый металл на
поверхности создается защитное покрытие.
Для увеличения жаростойкости железа его легируют хромом, алю-
минием, кремнием, т. е. элементами, обладающими значительным
сродством к кислороду. Естественно, что при этом должно выполнять-
ся соотношение Пиллинга—Бедфорса. Атомы легирующего компо-
нента должны иметь меньший размер, чем атомы основного металла,
чтобы легирующий элемент легче диффундировал к поверхности для
образования окисла с высоким электрическим сопротивлением. Для
того чтобы защитная окисная пленка была устойчива при высокой тем-
пературе, окисел легирующего компонента должен иметь малую уп-
ругость диссоциации и высокую температуру плавления и сублимации
(возгонки).
Углекислый газ. В настоящее время из газовых теплоносителей
наиболее широкое применение находит углекислый газ. Он представ-
ляет собой бесцветный газ, легко переходящий при охлаждении или
сжатии в жидкое состояние. При быстром испарении жидкой углекис-
лоты часть ее замерзает и переходит в снегоподобную массу. Сечение
захвата тепловых нейтронов углекислым газом невелико. Разложение
углекислого газа в поле облучения существенно зависит от парамет-
ров газа. Так, при давлении, близком к атмосферному, углекислый
газ практически не разлагается при облучении. С увеличением дав-
ления устойчивость углекислого газа снижается, и при давлении
1 МПа его разложение становится заметным. Первичными реакциями
разложения углекислого газа под действием облучения являются
СО2->СО + О; (4.15а)
СО2->С + О2. (4.156)
Преобладает разложение по первой реакции. Атомы углерода в даль-
нейшем, реагируя с окисью углерода и атомами кислорода, образуют
вновь углекислый газ. Наличие в углекислом газе примесей, взаимо-
действующих с атомами углерода или кислорода, способствует разло-
жению углекислого газа под облучением. Это обусловлено тем, что
связывание атомов углерода или кислорода примесями уменьшает
корость обратной реакции рекомбинации:
С + 2О->СОа. (4.15в)
новкМеРНЬ1^ состав углекислого газа, применяемого в ядерной уста-
го г ’ пРиведен в табл. 4.6. Наведенная радиоактивность углекисло-
аза обусловлена образованием при облучении в нем нуклидов 16N,
83
Та блица/4.6
газе используемом в качестве теплоносителя мг/кг
Объемное содержание. % Влага Аг н, о, N, С2нв сн4
СО, со
99.5 0,38 10 3 16 17 94 1 13
»»О 41Аг и 14С Первые два образуются из кислорода, последние два — собственно из аргона и примесей азота. При нагреве до темпера- туры 1273 К углекислый газ начинает диссоциировать. 2СО2 2СО + О2. (4.15г)
Реакция эта ускоряется в присутствии графита, что приводит к накоп-
лению в контуре окиси углерода в количестве до 0,37 0,65/).
В системе графит—углекислый газ возможен термический перенос
углерода из области с высокой температурой в область с более низкой
температурой. При высокой температуре взаимодействие графита с
углекислым газом по реакции
СО2 + С2СО (4.16)
приводит к образованию окиси углерода. В области пониженной тем-
пературы протекает обратная реакция
2СО-^СО2 + С, (4.17)
приводящая к образованию графита, отлагающегося на поверхности.
Однако опыт эксплуатации газовых реакторов показывает, что отло-
жение графита невелико. При повышенной температуре ряд конст-
рукционных материалов окисляется углекислым газом.
^Рассмотрим стойкость ряда конструкционных материалов к газо-
вой коррозии в углекислом газе. В сухом углекислом газе магний до-
статочно стоек. Загрязнение газа водой увеличивает скорость корро-
В 4~5раз' При температуре выше 873 К магний горит в
я wno 6 Углекислого газа. Составы ряда сплавов магния, стойких
кислом Га3е’ пРиведены в табл. 4.7. Достаточно стойки в угле-
«лавы СтойТ ТемпеРатУРе 573-773 К алюминий, цирконий и их
попадании воп«В п™ условиях и углеродистые стали. Однако при
турная копоо'чиа В, углекислый газ резко возрастает высокотемпера-
скЕх АЭС Р Углеродистых сталей, что наблюдалось на англий-
быстрых” нейтоонах я1РпяаЛТИВНЬ1Мл Теплоносителем для реакторов на
ющий запаха? Он явпя₽тгаЯ(=;ГеЛИЙ' Гелий — бесцветный газ, не име-
шении крайне инеотен г ^?агоРодным газом и в химическом отно-
мый легки послГволоппп! и, ~ легчайший из инертных газов и са-
84 после водорода из всех известных газов. По своим ядерным
Таблица 4.7
Составы магниевых сплавов, стойких в углекислом газе
Сплав Массовое содержание легирующих примесей. %
А1 Be Са Zr Мп
Магнокс 1 0,05 0,1 —
1 0,05 — —
АМ-503 — — — — 1,5
ZA (Франция) — —— — 0,6 •—’
Mg—Be — 0,01—2 — — —
Mg—Be—Zr (СССР) — 0,1 0,6 -—
и физико-химическим свойствам гелий является одним из наиболее
подходящих газовых теплоносителей. Наибольшим сечением захвата
обладает 3Не. Содержание его в природном гелии мало и составляет
10-7—10~6 %. Наведенная активность чистого гелия практически
отсутствует. В реальных условиях активность гелиевого теплоноси-
теля обусловлена примесями, в том числе продуктами деления. Чаще
всего гелий загрязнен азотом и аргоном. Но даже наличие примесей
не вызывает существенной наведенной радиоактивности гелия. Очис-
тка гелия от радиоактивных примесей может осуществляться на акти-
вированном древесном угле.
В условиях, имеющих место в реакторе с гелиевым теплоносителем,
свойства последнего близки к свойствам идеального газа. Теплоем-
кость гелия ниже, чем у углекислого газа. Для аккумуляции значитель-
ного количества тепла в гелии необходимо иметь большой перепад
температуры на входе в активную зону и выходе из нее. Это усложня-
ет применение гелия в качестве теплоносителя. Теплопроводность ге-
лия в 10 раз больше, чем углекислого газа. Это свойство облегчает
теплоотдачу, уменьшает габариты теплообменников, делает гелий
перспективным для заполнения кладки канальных реакторов. Гелий
крайне текуч. Даже при современном уровне техники создание
систем, герметичных по гелию, представляет собой трудную задачу.
При выборе гелия в качестве теплоносителя следует учитывать и
высокую его стоимость.*
Сам гелий не вызывает окисления реакторных материалов. За-
грязнение его кислородом, углекислым газом, парами воды приводит
К коррозии металлов и сплавов. Для предотвращения этого явления,
общее содержание примесей в гелии не должно превышать 0,01%.
Загрязнение гелия кислородом может привести к [переносу углерода
по контуру за счет образования углекислого газа и его диссоциации.
Воздух. Применение воздуха в качестве теплоносителя требует
тщательной его осушки. При относительной влажности воздуха выше
у/о все конструкционные материалы, за исключением нержавеющей
аустенитной хромоникелевой стали, интенсивно корродируют. При
работе с воздухом в качестве теплоносителя по разомкнутой схеме
85
возникает опасность активирования воздуха за счет присутствуйте/
го в нем аргона.
Диссоциирующие газы. Применение в качестве теплоносителя дис-
социирующих газов N2O4. А13С1в, А12Вг6 и др., а также их смесей по-
зволяет улучшить общие технико-экономические показатели ЯЭУ, в
частности за счет улучшения массовых и габаритных характеристик
основного оборудования, и в первую очередь уменьшить металлоем-
кость газовых турбин при большой их единичной мощности. Хорошие
теплофизические показатели диссоциирующих теплоносителей обеспе-
чивают высокие коэффициенты полезного действия и теплоотдачи,
что снижает габариты теплообменного оборудования. При использо-
вании диссоциирующих газов, в частности N2O4, в качестве теплоно-
сителя реакторов на быстрых нейтронах могут быть получены лучшие
показатели активных зон, чем в случае применения натрия.
Применение диссоциирующих газов в качестве теплоносителя и
рабочего тела в реакторах на быстрых нейтронах позволит снизить
давление, необходимое для достижения эффективного теплообмена, с
20—25 МПа, которое имеет место в случае применения гелия и водя-
ного пара, до 8—14 МПа в случае N2O4.
При использовании диссоциирующих газов в качестве рабочего
тела в замкнутом газотурбинном цикле газ исходного состояния с наи-
большей относительной молекулярной массой (с минимальной газо-
вой постоянной) сжимается в компрессоре, нагревается в регенерато-
ре и реакторе до максимальной температуры цикла. При этом проис-
ходит диссоциация газа с поглощением тепла на протекание химической
реакции с уменьшением массы (при увеличении числа молей и газовой
постоянной до максимального значения). При расширении в турбине
газ, охлаждаясь в регенераторе и холодильнике, рекомбинирует с вы-
делением тепла при химической реакции и изменением числа молей и
газовой постоянной до минимального значения. Далее газ поступает
в компрессор, сжимается, и цикл повторяется. Большая газовая по-
стоянная рабочего тела в турбине по сравнению с ее значением в ком-
прессоре позволяет уменьшить долю мощности, затрачиваемую на сжа-
тие газа в компрессоре, до 30—45%.
Тепловой эффект реакций диссоциации
N2O4 = 2NO2 и 2NO2 = 2NO + О2 (4.18)
составляет соответственно 57,3 и 112,9 Дж/моль. Температура плавле-
ния и кипения N2O4 равна соответственно — 383 и +294,3 К. Темпе-
200УРиЬй ”нтеРвал "Ротекания реакций диссоциации при 0,1 МПа
^УУ—-1123 К, при 10 МПа 298—1473 К.
коппп^°гт температуре 773 К и давлении 5 МПа скорость
1Х\8Н ЮТ составляет 5 • 10~3 г/ (ма • ч) Изменение
оозии о, 0 а от Ю До 25 м/ч очень мало увеличивает скорость кор-
Так с ^ЛРеМеНеМ СКОР°СТЬ коррозии стали 1Х18Н10Т уменьшается,
снизил^ ппиеЛИеМ1ААСП03ИЦЛИ со 100 А0 10 000 4 скорость коррозии
давления до 5 МПя10гРа3’ Ск°рость коРРозии растет с увеличением
аустенитной мрп+3’ Дальнейшим увеличением давления стойкость
8$ Р’ авеющеи стали практически не меняется. Преиму-
щесТвенная коррозий сварные швов нВ наблюдается. Аналогичным
образом ведут себя хромистые нержавеющие стали, упрочненные ау-
стенитные нержавеющие стали, сплавы титана.
Существенно ниже в этих условиях стойкость сталей перлитного
класса. Скорость коррозии их при температуре 773 К и давлении
5 МПа составляет 0,05 г/ (м2 • ч). При температуре 473 К и давлении
до 5 МПа скорость коррозии высокопрочных алюминиевых сплавов
составляет (1—5) • 10-2 мм/год. Повышение давления от 2 до 5 МПа
увеличивает скорость коррозии сплавов алюминия в 10 раз.
§ 4.4. ВОДНЫЙ ТЕПЛОНОСИТЕЛЬ
Особенности водного теплоносителя. В реакторах на тепловых
нейтронах в качестве теплоносителя часто используют воду, причем
она может служить не только теплоносителем, но и замедлителем. Се-
чение поглощения для воды составляет 6 10-29 м2. Теплофизические
свойства воды во всем интервале температур и давлений, представля-
ющих интерес для ядерной энергетики, хорошо изучены. Значитель-
ный вклад в исследования этого вопроса внесли советские ученые
М. А. Стырикович, М. П. Вукалович и др.
К сожалению, высокое давление насыщенных паров воды, которое
быстро растет с температурой, требует создания контуров, рассчитан-
ных на высокое давление, что, естественно, удорожает установки и
затрудняет их эксплуатацию.
Основным требованием, предъявляемым к обычной воде в ядерной
энергетике, является ее чистота. В ряде случаев, однако в воду до-
бавляют те или иные вещества, как правило, либо для уменьшения
ее коррозионной агрессивности, либо для подавления радиолиза. При
проектировании ядерных энергетических установок (ЯЭУ) с водным
теплоносителем значительное место уделяется качеству воды, т. е.
водному режиму реактора. Состав воды, количество допустимых при-
месей определяются техническими условиями или нормами на воду
заполнения, подпитки и контурную воду. При этом обычно нормиру-
ются следующие показатели: 1) солесодержание (электропроводность);
2) сухой остаток*, 3) значение pH; 4) содержание кислорода; 5) жест-
кость; 6) содержание хлоридов; 7) содержание продуктов коррозии.
pH воды зависит от характера конструкционных материалов в кон-
туре. При наличии в контуре сплавов алюминия pH воды должен быть
4—6. В контуре с перлитными сталями pH = 9-? 10. Воду для запол-
нения и подпитки ЯЭУ подготавливают методом глубокого химичес-
кого обессоливания с помощью системы ионообменных фильтров. Уда-
ление кислорода производят либо в термических деаэраторах, либо с
помощью электронно-ионообменных фильтров. Перед заполнением во-
дой I контур продувается инертным газом. Для удаления остатков
кислорода в воду контура при заполнении вводят гидразин (N2H4),
связывающий кислород. Непосредственно в I контуре воду очищают В
В настоящее время этот показатель практически не применяется.
87
ионообменными фильтрами иЛи фильтрами с высокотемпературными
LSSJXmh сорбентами, находящимися на байпасе. Конденсате-
?Р тоакт и контур многократной принудительной циркуля-
"’ /кмГЛП канального и корпус корпусного кипящих реакторов
?зполм™имически обессоленной водой, насыщенной воздухом. В
ЯЭУ просмотрены также приспособления для очистки продувочных,
"Простом^температуры электропроводность воды х возрастает:
573
2,8
сбросных и других вод;
7* к 293 333 373
к, мкСм/см 5-10-2 0,2 0,7
423 507
2,0 3,2
Указанное обстоятельство способствует, в частности, интенсифи-
кации контактной коррозии.
Из самых общих соображений очевидно, что чем чище вода, тем
меньше ее электропроводность. На практике чистоту воды, например
солесодержание, удобно оценивать по электропроводности воды. Вода,
не содержащая никаких посторонних ионов, должна иметь электро-
проводность 5 • Ю-2 мкСм/см. В промышленных масштабах после
очень тщательной и многократной очистки удается получить воду с
электропроводностью 0,1 мкСм/см. В I контуре применяется вода с
электропроводностью менее 1 мкСм/см. Присутствие кислорода, ще-
лочи, хлоридов и других солей в воде увеличивает ее электропровод-
ность и делает ее агрессивной по отношению к конструкционным мате-
риалам. Поскольку в щелях и зазорах возможно местное упаривание
воды и увеличение концентрации солей, содержание их в водедолжно
быть минимальным. Присутствие в воде солей меди, магния, кальция,
продуктов коррозии железа приводит в ряде случаев к образованию
накипи на поверхности твэлов, перегреву их и выходу из строя. В
связи с этим содержание этих веществ в воде должно строго контроли-
роваться и поддерживаться на минимальном уровне.
С увеличением температуры изменяется ионное произведение воды:
v Т,’аК, 298 366 422 474 522 555 573
Kw-10-»4 1 43 208 500 645 628 575
Насыщенная воздухом химически обессоленная вода имеет pH =
== М. Это связано с присутствием в воздухе СО2.
мятипй^а.0 В литеРатУРе приводят значения pH, измеренные при ком-
*г₽мпопо пеРатУРе. Однако следует всегда иметь в виду, что с ростом
Давление тя\<К0ИЦеНТРаЦИЯ ионов в°Дорода и гидроксила меняется.
ст« На "ОННОе "Р^^нне =°№. но в очень не-
лооола°Свнячя^аствоР“лосЛ1Ь газов в воде, в частности кис-
=ста“с пЛ^-"ЬШаеТСЯ' достигая ™нимум; при 373 К, и
дальнейшим увеличением температуры.
1) газы раствОлимпа иками газов в водном теплоносителе являются:
диолиз’* 3) кпппло В воде зап0Лнения и в подпиточной воде; 2) ра-
саторы’объема? 5)И^Ко^РделениАяеП°ЛЯРИЗаЦИеЙ; 4) газовые компен‘
88
При использовании газового компенсатора объема вода I контура
растворяет газ, находящийся в компенсаторе. Вода в газовом компен-
саторе объема растворяет газ в количествах, отвечающих закону Генри.
Из компенсатора объем газа переносится в I контур диффузией. При
363 К коэффициент диффузии кислорода близок в 10-Б см2/с. К этому
значению близок и коэффициент диффузии катионов и анионов.
При уменьшении объема воды в I контуре в него поступает вода из
компенсатора, насыщенная газом. С учетом находящегося в I конту-
ре водорода суммарное содержание газов в воде может достигать не-
скольких сотен кубических сантиметров на литр. Присутствие такого
количества растворенного газа в воде может затруднить работу цир-
куляционных насосов. Положение осложняется, когда газовый ком-
пенсатор объема по компоновочным соображениям находится при вы-
сокой температуре. Растворимость газов в воде с ростом температуры
проходит через минимум при 373 К и достаточно велика при температу-
ре 573—623 К. Соответственно велика и растворимость газов в воде
I контура на выходе из активной зоны. На циркуляционные насосы
вода попадает при температуре более низкой, чем на выходе из реак-
тора. Снижение температуры воды сопровождается уменьшением рас-
творимости газа в ней. Выделившийся из воды газ может привести к
срыву насосов.
Давление газа в компенсаторах объема достигает 15 МПа. Даже
при малом объемном содержании кислорода в газе (порядка 0,1%)
парциальное давление кислорода в газе составляет 0,015 МПа, что
приводит к высокой концентрации кислорода в воде I контура. Послед-
нее обстоятельство может влиять на коррозионную стойкость конст-
рукционных материалов.
Накопление водорода имеет место в реакторах с водой под давлением
в I контуре вследствие радиолиза и процессов коррозии. Радиолити-
ческий кислород, образовавшийся в первый период работы реактора,
расходуется на процесс коррозии, в результате чего в воде I контура,
водород присутствует в количестве 5—50 см3/л, что и обусловливает
подавление радиолиза. Для связывания кислорода в начале работы
реактора в I контур вводят гидразин. В кипящих реакторах радиоли-
тический водород и кислород уносятся с паром и выбрасываются из
системы эжектором. После конденсатора вода не содержит газов, в том
числе и водорода.
При поступлении в активную зону в воде протекает радиолиз, ве-
дущий к образованию кислорода и водорода. Следует заметить также,
что в паровой фазе, где плотность вещества существенно меньше, чем
в конденсированной фазе, реакции рекомбинации идут более вяло. Та-
ким образом, в кипящих реакторах вследствие отсутствия возмож-
ности накопления в контуре радиолитического водорода радиолиз не
подавляется и теплоноситель всегда содержит некоторое количество
Кислор°да. Так, в циркуляционной воде кипящего реактора содержит-
ся 0,03—0,3 мг/л кислорода, в пароводяной смеси 4—6 мг/л и в на-
сыщенном паре 10—30 мг/л.
Следует заметить, что если в кипящей системе пар не дросселиру-
я до атмосферного давления и водород из негр не удаляется, а оста-
89
₽тся в системе, радиолиз подавляется. Такое явление наблюдается в
замкнутых кипящих петлях, где водород не удаляется, а накаплива-
ли /Подавляет радиолиз. Механизм процесса радиолиза будет рас-
СМОСв1йс?вГводы, в частности агрессивность, могут существенно из-
меняться в тех участках контура, где существуют условия для концен-
шиоования примесей, содержащихся в теплоносителе. Такое явление
можетбыть в щелях сварных соединении технологического канала ки-
пящего реактора. Внутри канала движется вода или пароводяная смесь
в состоянии насыщения при температуре 600 К. Снаружи канал омы-
вается азотом, нагретым до 653 К. За счет теплового потока от наруж-
ной стенки канала к внутренней вода, находящаяся в щели, будет ис-
паряться. Давление пара в щели превысит давление в трубе. Пар бу-
дет выходить из щели до тех пор, пока давление в щели и трубе не
уравняется. Оставшийся в щели пар будет перегреваться. Поскольку
канал испарительный, давление в нем не останется строго постоянным,
а будет колебаться около среднего значения, временами превышая
давление в щели. При этом в щель поступают новые порции воды, и
процесс испарения воды в ней будет происходить постоянно.
В соответствии с коэффициентом распределения при рассматривае-
мых параметрах равновесная концентрация хлоридов в воде будет в
104 раз выше, чем в насыщенном паре. С парами будет уходить ничтож-
ное количество хлоридов. Практически весь хлор-ион останется в воде,
находящейся в щели. В щели будет происходить концентрирование
хлоридов и, несмотря на низкое содержание хлоридов в пароводяной
смеси (2,5 • 10-в %), образование все более концентрированного раст-
вора. В соответствии с законом Рауля температура кипения раствора
растет с увеличением его концентрации. Максимальная температура
среды в щели 653 К. При давлении 13 МПа такую температуру кипе-
ния имеет раствор, содержащий 42% хлоридов.
Концентрирование хлоридов происходит в зоне испарения прямо-
точного парогенератора давлением 4—5 МПа. При этих параметрах рас-
творимость хлоридов в паре мала. Практически все хлориды, прино-
симые водой, остаются в зоне испарения. Аналогичное явление на-
блюдается на первой ступени прямоточного подогревателя турбины
в кипящих реакторах. Концентрирование хлоридов ведет к разруше-
нию аустенитных нержавеющих сталей вследствие коррозионного
растрескивания. г
УПарИВаНИИ теплоносителя, например в местах вальцовки
что RPn₽TA°v°K’ К0НцентРаи'ИЯ NaOH возрастает до опасного предела,
Это япприио „ГТ™ щелочной хРУпкости и разрушению металла,
лоикто гиггп наблюдается при подщелачивании воды летучей ще-
гилооокись °КИСЫО аммония. При упаривании и концентрировании
дует заметить Н^Я Разлагается на воду и газообразный аммиак. Сле-
диссониапии Д У0 ГИДРООКИСЬ аммония — слабая щелочь. Константа
шается е п РаВНа ПрИ н°Рмальных Условиях 1,79 10"6 и умень-
шается с ростом температуры. ”
давлениемХКрН^ТНЫХ РеактоРах теплоносителем является вода под
9Q ' пящих же реакторах из активной зоны выходит па*
роводяная смесь. В большинстве ныне действующих кипящих реак-
торов давление на выходе из активной зоны составляет 7—8 МПа.
Растворимость хлоридов в паре при таком давлении невелика. При
кипении происходит концентрирование хлоридов в воде КМПЦ, со-
держание хлорид-иона при этом достигает 0,1 мг/кг. Наряду с хлори-
дами увеличивается концентрация продуктов коррозии, что может
привести к интенсификации роста отложений на поверхности твэлов.
В кипящих реакторах на турбину подается влажный пар. В ци-
линдре низкого давления влага, содержащаяся в паре, может вызвать
эрозию лопаток.
В Советском Союзе впервые осуществлен ядерный перегрев пара
до температуры 780 К при давлении 13 МПа. При этом давлении рас-
творимость хлоридов в паре велика и отсутствует опасность концент-
рирования их на оболочках твэлов при досыхании и перегреве пара
в пароперегревательных каналах.
Тяжелая вода D2O по сравнению с обычной водой обладает несколь-
ко худшей способностью замедлять быстрые нейтроны, однако она
почти не поглощает тепловых нейтронов. Поэтому тяжелая вода яв-
ляется лучшим замедлителем ядерных реакторов на тепловых нейтро-
нах. Естественно, тяжелая вода может применяться и как теплоноси-
тель (табл. 4.8).
Таблица 4.8
Теплофизические свойства тяжелой воды
Свойство Н2О d2o
Относительная молекулярная масса, г/моль 18,016 20,029
Плотность при 293 К, г/см3 0,998 1,106
Температура максимальной плотности, К 276,98 284,21
Температура плавления при нормальном давлении, К 273 276,82
Температура кипения при нормальном давлении, К 373 374,43
Критическая температура, К 647,15 644,5
Критическое давление, МПа 22,565 22,28
Критическая плотность, г/см3 0,308 0,340
Теплота плавлении, кДж/кг 331,9 317,1
1еплота парообразования, кДж/кг 2253 2067
Теплоемкость при 293 К, кДж/(кг-град) 4,18 4,196
Содержание тяжелой воды в природной воде составляет 0,017%,
что соответствует одной молекуле тяжелой воды на 7000 молекул
обычной воды. Для получения тяжелой воды наиболее широкое про-
мышленное применение получили три способа: электролиз, дистил-
ляция и химический обмен. Присутствие обычной воды в тяжелой
Ухудшает ее свойства как замедлителя, т. е. примесь легкой воды в тя-
желой нежелательна. Однако высокая стоимость чистой тяжелой во-
ды заставляет использовать в ядерных реакторах более дешевую тяже-
лую воду, содержащую около 10% обычной воды в качестве примеси,
астворимость солей в тяжелой воде примерно на 10% меньше, чем в
обычной.
91
В процессе эксплуатации активность водного теплоносителя ЯЭУ
повышается. Становятся радиоактивными атомы кислорода воды. В
теплоноситель переходят продукты деления. Радиоизотопы образу-
ются в конструкционных материалах, находящихся в активной зоне.
В процессе коррозии атомы этих материалов в виде продуктов корро-
зии переходят в теплоноситель. Активируются также при прохожде-
нии с теплоносителем активной зоны и продукты коррозии, образовав-
шиеся на поверхности конструкционных материалов, находящихся
вне активной зоны.
Кислородная активность. При прохождении активной зоны под
действием медленных нейтронов образуется радиоизотоп 1 О по реак-
ции 18О (л, у)19О. Этот изотоп дает жесткое у-излучение. Это излуче-
ние, или так называемая кислородная активность, и определяет уро-
вень излучения теплоносителя в трубопроводах контура работаю-
щего реактора, а также в значительной степени требования к биоло-
гической защите. Период полураспада 19О 26,9 с. В связи с этим пос-
ле останова реактора кислородная активность быстро спадает и ак-
тивность контура в этом случае определяется осколками деления и
радиоактивными продуктами коррозии. Доля изотопа 18О в естествен-
ной воде 0,002%. Под действием быстрых нейтронов протекают также
реакции 16О (n, p)16N, 17О (л, p)17N. Период полураспада 16N—7,11 с,
17N — 4,174 с. Эти нуклиды могут вступать в реакцию с кислородом,
образуя нитраты и нитриты, и с водородом, образуя аммиак. В кипя-
щих одноконтурных реакторах эти соединения могут поступать в пар
и с ним попадать на турбину, влиять на радиационную обстановку.
Коэффициент распределения ионов между паром и водой при тем-
пературе 553 К близок к 10-4. С учетом растворимости ионов во вла-
ге, содержащейся в паре, коэффициент распределения увеличивается
до 10~8. Для молекулярного 16О отношение активности в паре и во-
де составляет 0,05—0,1.
В тяжелой воде по (л, у)-реакции на дейтерии образуется значи-
тельное количество дейтерия.
При нарушении сплошности оболочек твэлов продукты деления
и само топливо могут попадать в воду, создавая так называемую оско-
лочную, активность. Часть осколков деления скапливается под обо-
лочкой твэла. Количество их зависит от коэффициента диффузии в
топливе, периода полураспада, летучести. В процессе деления и по-
следующего распада образуется более 250 радионуклидов, из них 33
являются инертными или летучими газами. Это в основном нуклиды
е- ° СИЛУ Ряда причин, например вследствие технологи-
Дефектов в металле и сварных швах, возможно возникновение
ности оболочки теплоносителя. Наиболее часто образуется га-
пЛпТ, неплотность, которая может предшествовать более серьезным
? оЛЛеНИЯМ °б°лочки’ Осколочная газовая активность в воде I конту-
зйяимтЛ^о слУчае течей и попадания газов в рабочие помещения. При
смтопоч п ЫХ повреждениях оболочки и контакте топлива с теплоно-
Nh^n мВ°ле 1 К0Н?УРа обнаруживаются нуклиды Mo, Sr, Ba, La, Zf,
Lu nLn Иб°ЛЬШИЙ вЛлад в активность теплоносителя при поврежде-
нии ободочки вносит 133Хе с периодом полураспада 5,245 сут.
92
Следует также заметить, что при заполнении твэлов горючее в том
или ином количестве попадает на наружную поверхность оболочек.
При эксплуатации осколки деления, образовавшиеся из горючего,
загрязнявшего наружную оболочку, переходят в воду I контура. Ес-
тественно, технологический процесс заполнения твэлов горючим и от-
мывку наружной поверхности оболочек нужно вести таким образом,
чтобы свести загрязнение к минимуму.
Загрязнение воды I контура может происходить и активированны-
ми продуктами коррозии. Образование активных продуктов коррозии
происходит либо при переходе в воду продуктов коррозии, облучен-
ных материалов активной зоны, либо при активации продуктов кор-
розии, образовавшихся вне активной зоны. Наибольшее количество
активных продуктов коррозии образуется первым способом. Радиоак-
тивность продуктов коррозии определяется в основном нуклидами:
5‘Сг, 64Мп, 56Мп, 58Со, ь°Со, 59Fe и др.
Со содержится в виде примеси к Ni в нержавеющей стали. Источ-
ником Со могут быть стеллитовые наплавки. В металлическом ломе,
используемом для выплавки сталей, Со может находиться в виде на-
плавок. В связи с этим содержание Со в перлитных сталях может
быть велико.
В теплоносителе кипящих реакторов при использовании в подогре-
вателях питательной воды и конденсаторах медных сплавов присут-
ствуют радионуклиды 64Cu, 65Zn.
Продукты коррозии, в том числе и активные, разносятся водой по
контуру и отлагаются на поверхностях металла, в том числе и на по-
верхностях твэлов, скапливаются в застойных зонах. Процессы эти
приводят к активации оборудования I контура, затруднению его обслу-
живания и ремонта. Уровень у-излучения у внешней поверхности
труб американского реактора СМ-1 составлял через сутки после оста-
новки (1,55—1,8) • 10~б Кл/ (кг • ч). На отдельных участках зафик-
сирована активность до 6,45 • 10-4 Кл/ (кг • ч), что связано, видимо,
с локальным накоплением продуктов коррозии. После 2 лет работы
примерно 80% долгоживущей активности (через несколько месяцев
после останова) было обусловлено нуклидами 60Со и 58Со. Сразу же
П°Мп °СТанова РеактоРа 50% активности обусловлено нуклидами Fe
Отложение продуктов коррозии. Знание кинетики этого процесса необ-
одимо для количественного прогнозирования роста активности оборудования,
работоспособности твэлов и эффективности теплообменников. В образовании
железоокисных отложений преимущественно принимают участие частицы магне-
ита размером d ~ 10-4 см. Эти частицы в процессе броуновского движения скач-
перемещаются на расстояние, соизмеримое с размерами молекулы bo-
ok Ю-8 см)- Если частица находится на расстоянии б от поверхности, то
ГИрйза од*1° перемещение достигает поверхности. Часть из них, обладающая энер-
с м нео°х°Дим°й для преодоления энергии гидратации, связывающей частицы
В °лекУлами воды, участвует в элементарном акте образования отложений.
лосп°М акте МОГУТ принимать участие только те частицы, которые находятся не-
и₽и?еАственно У поверхности в слое толщиной d ~ 10-4 см. Поверхностная кон-
центрация частиц на 1 см2
Сп= CdlO-s, (4.1)
Где £
концентрация Fe в объеме теплоносителя, г/л.
93
Из теории абсолютных скоростей реакций скорость осаждения V [г/(см*.с)1
С°СТаВИ; « vW ехр (- Q/RT) Са = vd-IO-®IF ехр (- Q/RT) С = КС, (4.2)
„„оти пгяжпения- v — частота колебания частиц, с-ь
где К - к^Хс?ийСКЛаРктор- Q, кДж/моль - энергия активации разрыва свя-
и, — геометрический фактор,
ЗН с гидратированными молекулами вод . толщиной 8
Из теории массопереноса флюенс части •> н
ф = (v6/2) ДС.
Величина Ф может быть определена из закона Фика:
ф = DECIS. (4.4)
R полных средах коэффициент диффузии обратно пропорционален размеру
дяффундирующнх^астиц г. Коэффициент диффузии ионов с г0 = Ю"® см близок
к D# = Ю“« см2/с. Отсюда
D = DorJd = 10-8-10-8/10-4= Ю-s см2/с.
(4.3)
(4.5)
Из зависимостей (4.3)—(4.5) следует:
v = 2D/62 ~ 10-9/10-16 = Ю7 с-4 (4.6)
Каждый из находящихся на поверхности частицы магнетита ионов FeH,
Fe*+, О2- связан с одной молекулой воды силами гидратации. Максимальная
энергия связи в случае Fe+3 составляет Е = 443 кДж/моль Н2О. При переходе
частицы из одной фазы в другую, в данном случае из воды на поверхность, энер-
гия активации
Q = 0,125Д = 54,9 кДж/моль. (4.7)
Отрыв Fe?+ от гидратированной молекулы воды происходит в момент, когда
в процессе тепловых колебаний ион и молекула воды двигаются в противополож-
ные стороны. Вероятность этого события
W = (1/6) (1/6) = 2,78-10-2. (4.8)
С учетом изложенного
K = vWd-Ю-зехр (—Q/7?7’) =2,78-IO-2-10~54-9/'R7’. (4.9)
Для области температур 553—573 К К = (1,53 4- 2,42)-10“7 т 2-10"’.
Это хорошо согласуется с экспериментальным значением К = 4-10-7.
Полученные зависимости могут быть полезны для оценки кинетики отложе-
нии и накопления активности на нетеплопередающих поверхностях. Константы
скорости осаждения радионуклидов приведены в табл. 4.9.
Таблица 4.9
Константы скорости осаждения
Нуклид Длительность экспозиции, 10» ч К, 10-7 см/с Нуклид Длительность ЭКСПОЗИЦИИ. 10» ч К, 10-7 см/с
««Со 1 4 1,6 0,97 ««Fe 1 2,6 0,58 1.57
осажденных прод?ктоТ ко°оСпми1НИчнПр°ДуКТОВ КОРР°ЗИИ и«ет и процесс смыв®
магнетита О == т КЛ J/maP°3 г ’ ЭнеРгия активации разрыва связи в плев*
м Ч 138 кДж/моль. Скорость перехода продуктов коррозии в тепЛ^
носитель V [г/(см4-с)1 будет пропорциональна количеству продуктов коррозии,
осевших на 1 см4 [Г, г/см4):
= vriT ехр (— <2i/Z?T) = К1Г; (4.10)
Ki=vW .1Q~q^rt = 10’-2,78-10~4-10~138/rj* . (4.11)
Для температуры 553 К Kt — 2,43-10-8. Из экспериментальных данных для
тех же условий Kt = 10~8.
Скорость коррозии конструкционных материалов уменьшается во времени.
В случае коррозии аустенитной нержавеющей стали через 104 ч скорость выно-
са продуктов коррозии в воду становится меньшей, чем скорость смыва продук-
тов коррозии, отложившихся на поверхности оборудования. В такой ситуации
через некоторое время при постоянном гидродинамическом режиме скорости
осаждения и смыва продуктов коррозии выравняются:
СК = Г Kt. (4.12)
С учетом того, что истинная поверхность в 3 раза больше геометрической,
в монослое отложившихся частиц магнетита с плотностью 3 г/см3 размером 10~4 см
на 1 см4 будет находиться
Г = 3-3-10-4 ~ 10-3 г/см4. (4.13)
Из зависимостей (4.12) и (4.13) равновесная концентрация продуктов кор-
розии в водном теплоносителе
св = Г/Ci/tf = 10-3-10-8/4-10-’ = 2,5-10-5 г/л, (4.14)
что близко к значению, наблюдаемому на АЭС, оборудование которых изготов-
лено из аустенитных нержавеющих сталей.
Во время поверхностного кипения продукты коррозии при давлении 7,0—
12,5 МПа практически не уносятся с паром и концентрация их у теплопередаю-
щей поверхности растет. Количество продуктов коррозии, подведенных к по-
верхности, где происходит кипение с кипящей водой [К2, г/(см2-с)],
V2 = (g/104-3,6- 103-<7i) Со, (4.15)
где q =4,2-10* кДж/(м2-с) — тепловой поток; = 1254 кДж/кг — теплота
парообразования при температуре 553—573 К.
Скорость отвода продуктов коррозии от поверхности за счет диффузии
V8 = DC-10-8/6; 6= 10-4 см. (4.16)
При установившихся скоростях процесса
v2 = V + v3,
где V — скорость осаждения.
Решение уравнения (4.17) дает значение для установившейся концентрации
продуктов коррозии у теплопередающей поверхности, где происходит поверх-
ностное кипение при рассмотренных условиях:
~ 102Со. (4.18)
ГОд Толщина отложений на поверхности твэла в рассматриваемых условиях за
6 = КС^т/З = 2-10-’- Ю2-2,5- 10-в-З-107/3 = 5-10~3 см.
н Экспериментальное значение равно (4—9)-10~3 см. Облучение практически
сказывается на кинетике отложения и смыва продуктов коррозии.
*еиий Н°и И3 меР борьбы с активацией оборудования I контура за счет отло-
ных И пР°ДУктов коррозии следует считать правильный подбор конструкцион-
«аееЗГ ’ Р™а’ Л контура и очистка воды на бай-
тРении Л0ЭФФективны, так как скорость отложений продуктов коррозии на вну-
них поверхностях контура и особенно на твэлах весьма значительна.
8 Качес ИЧеСКИ обессоленная вода высокой степени чистоты, применяющаяся
стве теплоносителя в громадном большинстве реакторов Советского Сою-
95
(4.17)
О, ппечставляет собой разбавленный раствор. Крайне важно прогнозировать
пезчльтаты тех или иных процессов, например таких, как описаны выше, про-
исходящих в водном теплоносителе, на поведение реакторных материалов. Рас-
смотрение химических равновесий в растворах позволит решить эту задачу.
Тимическое равновесие в растворах. Состояние термодинамического рав.
новесия характеризуется тем, что система, способная обмениваться энергией
с окружающей средой, остается сколь угодно долго неизменной (в термодина-
мичктом смысле) до тех пор, пока не изменятся внешние условия. Если про-
нес можно реализовать не только в прямом, но и в обратном направлении,
иЦТои ^м так, чтобы не только сама система, но и окружающая ее среда вер-
иулисьв первоначальное состояние, то он называется обратимым. Для того что-
бы процесс был обратимым, достаточно, чтобы он в каждой самой малой своей
сткии был бесконечно близким к равновесному состоянию. При наличии в рав-
новесной”системе компонентов А, В, D, Е соотношение величин концентрации
В мГтях на литр (Q этих компонентов определяется константой равновесия.
Так? при реакции mA + пВ pD + qE константа равновесия
кс=ср сус™спв.
В газовой фазе при расширении газа производится работа (при Т = const)
А = pAV; dA = pdV. Подставляя р = RT/V, получаем
V .
А = J (RT/V) dV= RT In (V2/Vx).
Vi
Для идеальных газов при Т = const молярные объемы обратно пропорцио-
нальны концентрациям (С = 1/7): А — RT In (Cj/C2).
Предположим, что в газовой фазе идет реакция mA -f- пВ pD 4- qE.
Введем в реакционное пространство m молей компонента Ann молей компонен-
та В. Концентрация их до введения в реакционное пространство составляла сА
и св. После введения в реакционное пространство концентрация газов А и В
обратимо изменилась до СА и Св. При этом совершилась изотермическая ра-
бота изменения концентрации m молей идеального газа А от сА до СА и «I
молей идеального газа В от св до Св. '
a^RT in (с”/С%) +RT in (с«/С£) .
л п и И3 Р£ак£ионного пространства образовавшиеся там р молей газа
и Ч молей газа Е. (В реакционном пространстве концентрации их CD и С£,
вне его cD и с£). Работа этого изотермического процесса
^2= -RT In (cfyCfy-RT In (4/C’) .
роста, с которой^оии Вобоазуютс? И3 Равновесного пространства равна ско-
работ равна максимальной работе А Не будет наРУШеН0- сУмма всеХ
ведены обратимо: раооте А реакции, так как все стадии процесса про-
А^+^цт [1п (4/С«) + 1п (4/c")_in (4/С’)-1п (4/c£)J=
^тер^
конечное состояния:
ф нк Л ~ (г2 - (4.1®
р.боте »6р>тИ»Х 'м±±‘’ «WXM. Уменьшение Z р.И»"
9g ню изотермического процесса. Поскольку
совершает работу, термодинамический потенциал конечного состояния Z2 мень-
ше термодинамического потенциала начального состояния Zt. Максимальная
работа процесса положительна. Отсюда знак минус в уравнении (4.19). Связь
между изменением свободной энергии в ходе обратимого процесса, константой
равновесия и концентрацией исходных продуктов имеет вид
AZ = — А = — RT In Кс + RT In Дс.
Это выражение часто называют изотермой Вант-Гоффа.
Изменение термодинамического потенциала при изотермических условиях
определяет направление самопроизвольных процессов в изолированных систе-
мах. Самопроизвольные изотермические процессы всегда идут при постоянном
объеме в направлении уменьшения термодинамического потенциала. Ничего
принципиально не изменится в приведенных выше рассуждениях, если реакция
будет протекать не в газах, а в разбавленных растворах. В этом случае для стро-
гости рассуждений концентрации следует заменить активностями AZ = — R Т X
X 1л Ка + R Т In Да.
Максимальная полезная работа реакции А служит мерой химического
сродства реагирующих веществ. Из уравнения изотермы следует, что в зависи-
мости от начальных и конечных концентраций реагирующих веществ А может
принимать любые значения. Поэтому величиной химического сродства принято
называть максимальную полезную работу реакции, когда начальные и конечные
концентрации всех участников реакции равны единице. При этом А = RTlg Кс =
—\Z.
Таким образом, чем больше максимальная работа реакции или чем отри-
цательнее величина свободной энергии, тем выше химическое сродство участ-
ников реакции. Если в реакции участвуют твердые тела, то их присутствие от-
ражается на величинах А и но в выражении для In Дс и концентрации
их ие входят, так как перенесение их из резервуара в равновесный ящик не
сопровождается работой.
В случае диссоциации какого-либо вещества в растворе устанавливается
некоторое равновесие между концентрациями исходного вещества и продукта-
ми его диссоциации. Если было взято Со моль/л бинарного электролита и его
степень диссоциации а (доля продиссоциированных молекул), то после диссо-
циации концентрация недиссоциированного остатка равна Со (I — а), а кон-
центрация каждого из обоих ионов равна Соа. Введя эти величины в уравнение
константы равновесия реакции диссоциации, получим Кс = С0а2/(1 —а), или,
переходя к активностям, Ка — Сяа2/(1—а).
Константа диссоциации Кс существенно зависит от температуры. Так, при
комнатной температуре добавление в воду аммиака в количестве 5—10 мг/л
обусловливает pH, равный 8—9, т. е. дает щелочную среду. Вследствие умень-
шения константы диссоциации с температурой вода с тем же количеством аммиа-
ка имеет при 573 К значение pH, соответствующее практически нейтральной
среде. Указанное обстоятельство следует иметь в виду при оценке агрессивности
водного теплоносителя по отношению к тем или иным реакторным материалам.
Изменение pH в щелях и зазорах может происходить вследствие гидроли-
за. Уксуснокислый натрий NaAc — соль сильного основания и слабой кисло-
ты— при растворении в воде диссоциирует на Na+ и Ас-. Небольшое количест-
во Н+ воды почти целиком соединяется с Ас- в уксусную кислоту, так как это
слабая малодиссоциированная кислота. Убыль Н+ пополняется за счет даль-
нейшей диссоциации воды, причем образуется эквивалентное количество ОН-.
Ионы ОН- не соединяются с ионами Na+, так как NaOH — сильное, пол-
ностью диссоциированное основание. В силу этого в растворе в результате опи-
санного выше процесса, называемого гидролизом, накапливаются недиссоцииро-
ванная уксусная кислота и ионы гидроксила, придающие раствору щелочную
реакцию. Описанные процессы можно представить следующей схемой:
NaAc = Na+-4-Ас-1
н2о=н++он- |=Na++0H“+HAc-
поли^ТеПп”ь гидР°лиза ₽ характеризует долю молекул соли, подвергшихся гид-
и зу. если в 1 л было растворено Со молей соли NaAc, то она дала Со солей
4 Зак- 369 07
ионов Ас- из которых после гидролиза осталось [Ас~] = Со (1 — 0) и обра-
зовалась кислота НАс = [ОН-] = Со0. Кислота и ОН- образуются в эквивалент-
ных количествах. Константа гидролиза в разбираемом случае по уравнению
Ас- + Н2О = НАс Ч- ОН- равна Кг = [НАс] [ОН~]/[Ас-]. Подставляя полу-
ченные ранее концентрации в это выражение, получаем
Кг = (С0₽)2/С0 (!-₽)= Со₽2/(1 - ₽).
В большинстве случаев степень гидролиза невелика и (1 — ₽) можно при-
равнять единице. Тогда Кг=Со0 = [ОН_]г/С0. Отсюда [ОН-] = "|/КГСО и 0 =
= У^7с0.
Наличие в котловой воде свободной щелочи может привести к разрушению
металлов в результате так называемой щелочной хрупкости.
Электрохимические процессы. При прохождении электрического тока через
раствор переносятся электрические заряды и, следовательно, совершается опре-
деленная работа. Электрическая работа равна произведению разности потенциа-
лов между электродами на величину перенесенного заряда. Эту разность потен-
циалов называют электродвижущей силой <р. Если в гальваническом элементе
произошло превращение одного моля ионов электролита в эквивалентное коли-
чество молей других ионов и молекул, то работа при перенесении заряда равна
nF<p, где п — валентность иона, a F = 96,5 кДж/эВ. Тогда электрическая ра-
бота А = лЕф = — AZ.
Если гальванический элемент работает термодинамически обратимо, то А
совпадает с максимальной полезной работой при постоянном давлении и, как
было показано ранее, AZ = RT (— In Ко+ In Да), где Ка — константа рав-
новесия, выраженная через активность; а — начальная активность участников
реакции. В силу сказанного
Ф = (RT/nF) (— In Ка + In Д«)-
Переходя к десятичным логарифмам для стандартной температуры 298 К,
при нормальных условиях, когда начальная активность участников
равна единице (а = 1), нормальный потенциал электрохимической
Ф° = — (0,059/n) 1g Ка. Отсюда
ф = ф° + (RT/nF) 1П Я;
того чтобы гальванический элемент был обратим, необходимо, чтобы
получим
реакции
реакции:
Для
процессы в нем происходили бесконечно медленно, ток его был бы очень мал,
т. е. был замкнут бесконечно большим сопротивлением или компенсирован рав-
ной по значению и обратной по знаку электродвижущей силой. Измерение элек-
тродвижущей силы по компенсационной схеме производится путем сравнения ее
с электродвижущей силой нормального элемента. В качестве нормального эле-
мента применяется элемент Вестона, в котором протекает реакция
Cd + Hg2SO4 + (8/3) Н2О CdSO4 (8/3) Н2О + 2Hg.
Положительный электрод — ртуть — покрыт слоем Hg2SO4, отрицательный
электрод — насыщенная амальгама кадмия (10—14% Cd). Электролитом слу-
гл на8ыщеиный раствор CdS04. Элемент Вестона работает обратимо, если от
293 ГрТиГ 171? вЭЛЫе Т0КИ- Электродвижущая сила элемента Вестона при
~в„Цри П0грУжении металла в раствор часть атомов переходит из узлов кри-
плп Решетки в электролит. При переходе одного моля металла в раст-
и ипилт? ается работа, равная разности термодинамических потенциалов моля
аллической решетке металла и моля в виде ионов в растворе. Реакция,
Мр м'2Хац_По И РДСТВ0Рении металла, может быть представлена в общем виде:
~ "г Потенциал этой реакции выразится уравнением Нернста
ф = ф° + (RT/nF) In а Ме2+.
разбавланных растворов активность может быть заменена концентра-
„“Г”: „еличина Ф представляет собой значение потенциала по отношению к не-
рому, всегда одному и тому же, электродупотенциал которого условно
93
принят за нуль, при активности, равной единице, и называется стандартным
или нормальным потенциалом данного электрода. Значение стандартного по-
тенциала определяет тенденцию металла посылать ионы в раствор. Для лития,
крайне энергично реагирующего с водой, это значение равно — 3,01 В, для
инертного золота + 1,70 В. Стандартные потенциалы технически важных ме-
таллов лежат между этими значениями, образуя известный ряд напряжений.
При взаимодействии металлов с водными средами существенную роль игра-
ют электрохимические реакции с участием ионов водорода. Водородный элек-
трод, обратимый относительно иона водорода, реализуется при погружении пла-
тины в раствор, содержащий ионы водорода и насыщенный водородом. На элек-
троде идет реакция (1/2) Н2 Н+ + е.
Потенциал водородного электрода при п = 1
Фн2 = Фн, +(%Т/р) 1пан+.
Потенциал водородного электрода при давлении водорода 0,1 МПа в растворе
с активностью Н+, равной единице, принят за эталон, к которому относят по-
тенциалы всех электродов. Этот эталон называют стандартным или нормальным
водородным электродом, значение которого принимается за нуль. Потенциал
водородного электрода зависит от активности Н+:
(pHj = (7?T//') In пн+=0,059 pH
при давлении водорода 0,1 МПа. При любом другом давлении водорода потен-
циал водородного электрода будет равен
= (RT/F) In an+~(RTiF) In .
Электрод, погруженный в раствор собственных ионов и обменивающийся
этими ионами с раствором, называют электродом первого рода. Для такого
электрода <р = <р° + (RT/nF) In а.
Примером такого электрода могут быть медь, погруженная в раствор мед-
ного купороса, и водородный электрод. Электроды, обменивающие с раствором
анионы, называют электродами второго рода. Примером такого электрода мо-
жет служить серебро, покрытое слоем труднорастворимой соли и погруженное
в раствор легкорастворимой соли с тем же анионом, — так называемый хлор-
серебряный электрод, на котором идет реакция Ag Ag+ 4- е. Потенциал
такого электрода зависит от концентрации иона серебра по уравнению Нернста
ф + ф° 4- (7?Т/nF) in aAg+.
В растворе хлоридов серебро образует труднорастворимое соединение AgCl.
Концентрация ионов серебра в таком случае связана с концентрацией хлорид-
иона через произведение растворимости L:
aAg+ = iAgCl/aCl~-
Потенциал серебряного электрода в растворе хлорида будет равен
Ф = (р°4-(7?Т/п/:') In Z.Agci — (RT/nF) In acl-,
или при
^°+{RT/nF) ln£AgC1=<p0' <p = <po' — (RT/nF) In acl-,
T. e. потенциал электрода второго рода формально обратим относительно анио-
на. В качестве вспомогательного электрода большое распространение получил
каломельный электрод, на котором протекает реакция 2Hg 4" 2С1- Hg2Cl2 4*
77Потенциал насыщенного каломельного элемента, т. е. в насыщенном
при 293 К, равен 0,245 В по нормальному водородному электроду.
В случае окислительно-восстановительного электрода реакции окисления
и восстановления протекают в растворе. Вещество инертного электрода участия
в реакции не принимает. Электрод служит лишь источником электронов. На-
пример, в растворе, содержащем ионы двух- и трехвалентного железа на инерт-
4* 99
2*
Л/е —*-Ме
a
2+
Me ^Ме2+
Ме^Ие2*
Рис. 4.3. Схема протекания реак-
ций при установлении равновес-
ного (а) и неравновесного стацио-
нарного (б) потенциалов
ном электроде, например на платине, идет электрохимическая реакция Fe2+
—> РрЗ+ _L g.
Тоехвалентное железо является окислителем, двухвалентное восстано-
вителем- реакция окислительно-восстановительная. Потенциал электрода при
протекании этой реакции связан с концентрацией участников:
ф = <рО-|-(7?Т/п/:') 1П (йре3+/аре2+)"
Элемент состоящий из двух различных электродов, в котором источником
тока является работа химической реакции, называется химическим. В элемен-
те где одинаковые электроды погружены в одинаковый электролит, но с раз-
умной концентрацией последнего, электрический ток возникает за счет работы
личнин ц F переноса электролита из одного раствора
в другой. Такой элемент называется кон-
центрационным.
Стационарный потенциал. В реальных
случаях коррозии поверхность металла
обычно покрыта окисными пленками, от-
ложениями продуктов коррозии. На по-
верхности металла могут адсорбировать-
ся кислород, молекулы воды и ионы, при-
сутствующие в среде. Все это приводит к
нарушению зависимости потенциала раст-
воряющегося металла от концентрации
его ионов, выражаемой уравнением Нерн-
ста. Для упомянутых факторов при кон-
такте металла с электролитом устанавли-
вается некоторый потенциал, называемый
стационарным. Рассмотрим отличие ста-
ционарного потенциала от потенциала ме-
талла, удовлетворяющего уравнению Нерн*
ста. (Существенный вклад в исследование
стационарных потенциалов металлов внес
советский ученый-коррозионист Г. В. Аки-
мов).
Итак, с электрода первого рода в про-
цессе анодной реакции в раствор пере-
ходят ионы металла, и они могут при-
нимать участие в катодном процессе. В ре-
зультате скорости катодного и анодного процессов выравниваются. Если и в
анодном, и в катодном процессах принимают участие только атомы и ионы од-
ного и того же элемента, устанавливается равновесный потенциал. При этом ди-
намическое равновесие сопровождается своим током обмена, т. е. величиной, ха-
рактеризующей скорость электродных процессов (рис. 4.3, а).
Потенциал рассматриваемого электрода зависит от концентрации его ионов
в среде по уравнению Нернста. Если же в анодном процессе электроны освобож-
даются за счет образования ионов металла, а в катодном процессе они связывают-
ся, например ионами водорода, т. е. в анодном и катодном процессах принимают
«.пл™6 ионы различных элементов, на границе металл—среда устанавливается
Уи стаЦионаРн>>1й потенциал (см. рис. 4.3, б). Естественнно, что и
потрн1тиаЛК^р0С1Н катодного и анодного процессов выравниваются и величина
upuuc РИнимает некоторое более или менее постоянное во времени зна-
чение, именуемое стационарным потенциалом.
оеалич«ДгаТп^,КИ важнВ1Х случаях при контакте с электролитом на металле
лов служат ли1п^И°НарНЫЙ потендиал- Поэтому нормальные потенциалы метал-
Так нопмапиичоДЛ^ °РиентиР°вочной оценки их электрохимической активности,
и __.’л 750 о п п тенциалы алюминия и цинка равны соответственно — 1,663
щнтных окисных н™»™аЛЬНЫХ Условиях в основном вследствие образования за-
неси. сХионапНХКпСТаЦИ°НарНЫЙ п°тенаиал алюминия более положителен,
ла с электролитом п₽аипоеИЦИаЛ цинка- Предположим, что при контакте метал-
случае приРсмешенииепА^3°ВаЛСЯ Равновесный потенциал первого рода. В этом
потенциала в отрицательную сторону от равновесного зна*
* vO
чения на электроде пойдет катодная реакция. При смещении потенциала я по-
ложи тельную сторону от равновесного значения на электроде пойдет анодная
реакция растворения металла.
Прохождение тока через раствор, сопровождаемое протеканием химиче-
ских процессов на электродах, называется электролизом. В электролитической
ячейке электрод, соединенный с отрицательным полюсом источника тока, явля-
ется катодом с положительным анодом. На катоде идут процессы восстановле-
ния, например Си2+ 2е -► Си, иа аноде — окисления, например Zn -► Zn2+ -f-
4- 2е. Изменение в гальванической цепи, в частности изменение потенциала элек-
тродов при электролизе, называется электрохимической поляризацией. Поля-
ризация электрода может происходить вследствие изменения концентрации элек-
тролита около электродов (концентрационная поляризация) и торможения ка-
кой-либо стадии электродного процесса (химическая поляризация). Перемеши-
вание среды, уменьшая градиент концентрации в растворе, может снижать
концентрационную поляризацию.
Если потенциал протекания какой-либо реакции отличается от термодина-
мического обратимого потенциала этой реакции, говорят о явлении перенапря-
жения. На платинированной платине в растворе с концентрацией ионов водорода
1 и. и при давлении водорода 0,1 МПа выделение водорода при небольших то-
ках имеет место при нулевом потенциале. Уже на гладком платиновом электро-
де водород выделяется при потенциале—0,2 В. Значение перенапряжения опре-
деляется по разности потенциалов электрода при протекании на нем Электродной
реакции с определенной скоростью н равновесного потенциала этой же реакции.
Значение перенапряжения реакции разрядки иона водорода зависит от скоро-
сти реакции на электроде, т. е. от плотности поляризующего тока. Зависимость
между перенапряжением водорода г] и плотностью тока i выражается уравнением
Тафеля
г] = а + b 1g i.
Постоянная b одинакова для всех металлов н составляет при комнатной тем-
пературе 0,18 В. Постоянная а зависит от природы металла. Уравнение Тафеля
выполняется в широком интервале плотностей тока — от 10-8 до 10 А/см2.
Глава 5
КОРРОЗИЯ РЕАКТОРНЫХ МАТЕРИАЛОВ
§ 5.1. КЛАССИФИКАЦИЯ КОРРОЗИОННЫХ ПРОЦЕССОВ
В процессе эксплуатации энергетического оборудования происхо-
дит разрушение металла вследствие протекания физико-химических
процессов (электрохимических или химических) на границе раздела
металл—среда, в данном случае металл—теплоноситель. Такое раз-
рушение металла называется коррозией. Ущерб, причиняемый на-
родному хозяйству коррозией, крайне велик. В отдельных случаях да-
же незначительные коррозионные повреждения могут вывести конст-
рукцию из строя. Примерно треть ежегодно добываемого металла вы-
бывает из технического употребления вследствие коррозии. Около
Двух третей этого количества металла регенерируется, например, в
роцессе переплава скрапа. Однако примерно одна десятая годовой
ооычи металла теряется безвозвратно. В США ежегодные убытки,
Ричиняемые коррозией, оцениваются в 40—45 миллиардов долларов,
р в яДеРных энергетических установках разрушение вследствие кор-
ппиИИ’ напРимеР. оболочек твэлов, теплообменников, каналов может
Р вести к останову реактора. Кроме этого, поступление продуктов
101
коопозии в I контур, активация их в активной зоне и последующее от-
ложение на элементах конструкции ухудшают обслуживание реактора
и затрудняют проведение ремонтных работ. Среди аварий, приводя-
щих к останову ЯЭУ, значительная часть обусловлена коррозией. В
связи с этим при выборе конструкционных материалов ЯЭУ серьезное
внимание уделяется обеспечению их высокой коррозионной стойкостью.
Металлическое состояние для большинства технически важных
металлов термодинамически неустойчиво. Вследствие этого большин-
ство металлов в природе встречаются в виде солей и окислов. Лишь
благородные металлы Pt, Au и отчасти Ag, Hg, Си находятся в приро-
де в чисто металлическом самородном состоянии. Изменение свободной
энергии при переходе 1 моля металла в ионное состояние для благо-
родных металлов больше нуля, а для большинства технически важных
меньше нуля. Однако термодинамика, определяя возможность проте-
кания реакций коррозии, ничего не говорит о кинетике, скорости
протекания этих реакций. Реальная устойчивость металла против кор-
розии без учета окружающих условий не может быть охарактеризо-
вана каким-либо абсолютным числом, как это может быть сделано в
отношении механических свойств металлов и сплавов.
По механизму протекания коррозионного процесса следует разли-
чать два типа коррозии: химическую и электрохимическую. Химичес-
кая коррозия подчиняется законам чисто химических гетерогенных
реакций и не сопровождается возникновением электрического тока. К
этому случаю может быть отнесена коррозия в сухих газах и неэлект-
ролитах. В процессе химической коррозии окисление металла и вос-
становление окислительного компонента среды происходят в одном
акте.
Электрохимическая коррозия протекает в присутствии электроли-
тически проводящей среды. Ионизация металла и восстановление окис-
лительного компонента среды протекают не в одном акте. Электрохи-
мическая коррозия подчиняется законам электрохимической кинетики
и сопровождается протеканием электрического тока.
По условиям протекания коррозионного процесса различают сле-
дующие виды электрохимической коррозии: 1) коррозия при пол-
ном, частичном и переменном погружении в электролит; 2) щелевая
и контактная коррозия; 3) коррозия под действием механических на-
пряжений.
В зависимости от вида коррозионного разрушения принято под-
разделять коррозию на общую и местную. В первом случае коррозии
подвергается вся поверхность металла, во втором — только часть ее.
ели поражения на отдельных участках сравнительно неглубоки и
анимают относительно большие участки коррозии, говорят о корро-
ии пятнами.„При язвенной коррозии глубокие поражения локализу-
я гтЭ малои части поверхности. Иногда говорят о точечной корро~
' межкРисталлитн°й коррозии разрушение происходит по
АтгаИ^е кРисталлитов- Коррозионное растрескивание сопровожда-
ичйипатЗНИКН°вением тРанскРисталлитн.ых трещин в металле. При
ппиагл ельнои коррозии происходит преимущественное растворение
з компонентов сплава, например цинка из латуни. Как пра-
вило, местная коррозия является более опасной, чем общая, и зачас-
тую угрожает прочности и герметичности конструкций. Общая кор-
розия в ряде случаев неприятна с точки зрения загрязнения теплоно-
сителя продуктами коррозии. Интенсивность {скорость} общей корро-
зии оценивается по потере металла [мг/ (ма • ч) или г/ (ма • сут)], а
также по глубине проникновения коррозии (мм/год), характеризую-
щей утонение металла. В тех случаях, когда продукты коррозии проч-
но сцеплены с металлом, интенсивность процесса оценивается по при-
весу металла, т. е. по количеству кислорода, связанного в окиси. В
случае местной коррозии интенсивность ее оценивается глубиной про-
никновения по язвам (мм/год).
В соответствии с интенсивностью коррозии в данной среде металлы
и сплавы разделяются по стойкости на ряд групп (ГОСТ 13819—68).
При выборе конструкционных материалов необходимым требовани-
ем является, чтобы в условиях эксплуатации ЯЭУ они относились к
группе стойких или совершенно стойких, т. е. глубина проникновения
равномерной коррозии не превосходила 0,01 мм/год, и не были подвер-
жены местной коррозии.
При электрохимической коррозии протекают два взаимосвязанных,
но в определенной степени самостоятельных процесса: 1) анодный —
переход металла в раствор в виде гидратированных ионов с оставле-
ние.м эквивалентного количества электронов в металле; 2) катодный —
ассимиляция появившихся в результате протекания анодного процес-
са избыточных электронов какими-либо деполяризаторами (атомами,
молекулами, ионами), которые могут восстанавливаться на катоде.
Если катодный и анодный процессы разделены • пространственно,
т. е. реализуются на различных электродах или на различных участ-
ках металла или сплава, коррозия протекает по гетерогенному меха-
низму. Если катодный и анодный процессы происходят на одном и
том же участке металла, чередуясь лишь во времени, коррозия проте-
кает по гомогенному механизму.
Оценить влияние водного теплоносителя на ресурс оборудования
АЭС можно лишь с учетом процессов, протекающих на границе ме-
талл—вода, где образуется двойной электрический слой.
§ S.2. ДВОЙНОЙ ЭЛЕКТРИЧЕСКИЙ СЛОЙ
Контакт с молекулами воды существенным образом влияет на свой-
ства поверхности металла. Молекула воды может случайным образом
ориентироваться относительно поверхности, как это изображено на
Рис. 5.1, а. Электроны металла, находящиеся в зоне проводимости,
вследствие кулоновского взаимодействия с положительным зарядом
молекулы воды (которая является диполем) образуют в металле отри-
цательно заряженный слой. Положительные заряды молекул воды,
ориентированные в положении а, создают положительно заряженный
слой. Оба эти слоя образуют плоский конденсатор иди двойной элект-
рический слой. На участке поверхности металла, откуда электроны
Ушли на образование отрицательно заряженного слоя, возникает недо-
103
статок электронов, и энергетически выгодным станет образование двой-
ного слоя при положении молекул воды согласно схеме рис. 5.1, б. Меж-
ду атомами металла и молекулами воды, образующими наружную об-
кладку двойного слоя, никакого вещества нет. В связи с этим куло-
новские силы между зарядами металлической поверхности и зарядами
молекулы воды не ослабляются и ди-
электрическая постоянная может быть
принята равной единице.
Емкость двойного электрического
слоя L (мкФ/см2) может быть опреде-
лена из зависимости, характерной для
плоского конденсатора при D — 1:
L = D/9 • 105 - 4 . лб =
Рис. 5.1. Ориентация молекул во-
ды в двойном электрическом слое
при отрицательном (а) и положи-
тельном (б) зарядах металла
= 8,85 • 10-8/б, (5.1)
где 6— расстояние между обкладка-
ми конденсатора (двойного слоя), см.
При отрицательном заряде метал-
ла расстояние от его поверхности до
центра положительных зарядов в мо-
лекуле воды (в соответствии с мо-
делью Роулинсона) составит
б = 64 + б3; (5.2)
б3 = б1-ба. (5.3)
Расстояние между атомом водоро-
да и центром молекулы кислорода
б2 = 0,096 нм. Расстояние между
центром молекулы воды
определения величины б4
ности:
центром положительных зарядов и
б2 = 0,059 нм. Отсюда б3 = 0,037 нм. Для
воспользуемся соотношением неопределен-
Дх = Й/ДА
(5.4)
При взаимодействии с поверхностным атомом надо учитывать энер-
гию молекулы воды, приходящуюся на одну степень свободы. Отсюда
Рн,о = (2тн2о йТ)0-6 = 1,1 • Ю-18 (г • см)/с, (5.5)
Ю 24 — 3 • 10 23 г — масса молекул воды; k =
1,60 • 10 Дж • град-1 — постоянная Больцмана.
Молекула воды в процессе тепловых колебаний сталкивается с ато-
мом металла, имеющим импульс РМе. Характеристики двойного элект-
рического слоя лучше всего изучены на ртути,
Из закона сохранения импульсов скорость молекулы вода и атома
металла после столкновения
V = (Рн,о + Png)/ (тн2о + ttlug) —
= (1,1 • 10-18 + 3,66 • 10-18)/ (3 • 10-“ + 3,34 10-22) =
= 1,31 - 104 см/с. (5.6)
После столкновения импульсы молекулы воды и атома ртути сос-
ДРн.о = /«н.о V = 3 • 10-23 • 1,31 • 104 =
= 3,93 • 10~19(г • см)/с; (5.7)
ДРнв = mug V = 3,34 • IO"22 • 1,31 • 104 =
= 4,38 • 10-18 (г • см)/с.
С учетом зависимости (5.4) по координате, перпендикулярной по-
верхности металла, получаем
64 = Дхн,о = й/ДРЙ,о = 1,05 • 10“27/3,93 • 10-19 ~
~ 0,27 • 10-8 см; (5.8)
Дхнв = Й/ДРнв = 1,05 • 10-27/4,36 • 10-18 ~0,02 • 10'8 см.
(5.9)
Для отрицательно заряженной поверхности
6_ = + 63 + ДхН8 = 0,26 • IO"8 4- 0,37 • 10~8 + 0,02 х
X 10~8 = 0,65 • 10“8, (5.10)
и с учетом зависимости (5.1)
Lt = 8,84 • 1О~8/О,65 • 10~8 ~ 14 мкФ/см2. (5.11)
При положительном заряде поверхности (см. рис. 5.1, б)
65 = 64 4- Дхнв = 0,27 • IO"8 см; (5.12)
L°+ = 8,84 • 10~8/0,27 • 10"8 ~ 33 мкФ/см2. (5.13)
Отрицательный заряд в двойном слое поверхности металла (Кл/см2)
q~ = q0S_pF, (5.14)
где q0 =z о,66 заряда электрона — величина заряда в диполе молеку-
лы воды; S_ — доля поверхности, занятая молекулами воды, находя-
щимися в положении а (см. рис. 5.1); р ~ 10_* моль/см2 — число мо-
лей воды в двойном электрическом слое на 1 см2; F сх. 105 Кл/г-экв —
число Фарадея.
Соответственно значение положительного заряда составит
<?+ = q0S+pF, (5.15)
Де„‘$+ доля поверхности, занятая молекулами воды, находящими-
я в положении б (см. рис. 5.1).
105
й определенны* условиях суммы поЛожиФеЛьныХ й отрицательны*
зарвдов^даойном слое на поверхности металла равны. В такой си-
тУациИ S_ = $4- - о,5.
R целом здесь поверхность металла электрически нейтральна и для
внешнего наблюдателя как бы не несет никакого заряда, ибо суммар-
ный заряд поверхности равен нулю. Такая ситуация отвечает потен-
циалу нулевого заряда. „
Каждая молекула воды и соответствующий ей заряд в металле об-
разуют заряженный конденсатор на молекулярном уровне. Если со-
седние молекулы воды расположены по отношению к поверхности, как
показано на рис. 5.1, то энергия этих молекул-диполей вследствие ку-
лоновского взаимодействия меньше, чем при любом другом их совмест-
ном расположении. Отсюда следует, что рассматриваемые конфигура-
ции устойчивы.
Из рис. 5.1 следует, что рассмотренные конденсаторы на молеку-
лярном уровне расположены так, что отвечают схеме последователь-
ного включения конденсаторов. На 1 см2 металла при потенциале ну-
левого заряда суммарная емкость конденсаторов на молекулярном
уровне, когда молекулы воды находятся в положении рис. 5.1, а,
£_ = 0,5£1" (5.16)
и при положении рис. 5.1,6
L+ = 0,5L°+. (5.17)
Суммарная емкость двойного слоя для потенциала нулевого заряда
Lu.a при последовательной схеме включения конденсаторов составит
l/LH.e = 1/£_ + 1/£+ = 1/0,5LL + 1/0,5L+’. (5.18)
Отсюда £н 8 = 4,9 мкФ/см2.
Величины емкости двойного электрического слоя на ртути, оце-
ненные с использованием рассматриваемой модели, удовлетворитель-
го согласуются с экспериментами (табл. 5.1)..
Таблица 5.1
Емкость двойного электрического слоя на ртути, мкФ/см2
Состояние поверхности Расчет Эксперимент
Заряжена положительно Заряжена отрицательно Потенциал нулевого заряда 33 14 4,9 37 17 5,0
дво^4пм^0тлМеТЬ В ВИДУ’ что часть молекул воды, находящихся в
мана мпжот тРическом слое, в соответствии с распределением Больн-
занные SOvMeTb 9нергию’ отличную от (3/2)7?7\ В связи с этим ука-
106НЬ1е Молекулы воды МОГУТ находиться на большем удалении от по-
верхности, чем 65. В этом случае говорят о том, что вследствие терми-
ческих флуктуаций двойной электрический слой размыт. На расстоя-
нии от поверхности металла менее 65 реализуется плотная часть двой-
ного слоя. На расстоянии большем, чем б5, реализуется так называе-
мая диффузионная часть двойного электрического слоя. Величина па-
дения потенциала в этой части двойного электрического слоя обозна-
чается как При наличии градиента потенциала в водной среде про-
исходит движение жидкости двойного электрического слоя — электро-
осмос или движение твердых частиц в растворе — электрофорез.
Таким образом, в первом приближении поверхность металла мож-
но рассматривать как одну из обкладок конденсатора, обязанных сво-
им существованием двойному электрическому слою, емкость которого
изменяется с потенциалом. При потенциале нулевого заряда емкость
такого конденсатора близка к 5 • 10-6 Ф/см2. С увеличением потен-
циала металла на 0,1 В положительный заряд металла на половине
поверхности с ориентацией воды, согласно рис. 5.1,6, увеличится
на 4-Д<?:
+Д<7 = (<р — фн.а) = 0,5 • 3,7 • 10-5 • 0,1 =
= 1,85-10—6 Кл/см2. (5.19)
Изменение заряда произошло за счет того, что часть молекул воды
из положения а рис. 5.1 перешла в положение б. В связи с этим + Д^ =
= — (—Дд), и абсолютное изменение величины заряда на 1 см2 в
первом приближении составит
2Дд = 2 • Д</ = 3,7 • 10-6 Кл/см2. (5.20)
Заряд 1 см2 поверхности 5° = 0,66 • 10-9/10_6 = 6,6 • 10-6 Кл/см2.
Отсюда изменение площади металла, отвечающего положению моле-
кул воды на рис. 5.1, а, составит
Д5 = 2Ag/S° = 3,7 • 10-6/6,6 • IO"8 = 5,6 • 10“2 см2. (5.21)
Емкость при этом изменится на
Д£ = ASLg = 5,6 • 10"2 • 3,7 • Ю”5 = 2,07 • 10“6 Ф/см2. (5.22)
Тогда емкость при увеличении потенциала на 0,1 В будет состав-
лять £0д = 5 . ю-e + 2,07 • IO"6 = 7,07 • Ю"8 Ф/см2.
Следует заметить, что поскольку речь идет о конденсаторе с емко-
ью, эквивалентной емкости двойного электрического слоя, имеется
в виду интегральная емкость.
диЛлНТеГРаЛЬная«емкость связана с непосредственно измеряемой
“Фференциальной емкостью La следующей зависимостью'
£и = (1/ф)],^д6ф.
о
меж1«И ?зменении потенциала до 0,5 В от потенциала нулевого заряда
У Ьд и £и существует линейная зависимость. В этом случае
J07
Рнс. 5.2. Зависимость емкости
двойного слоя от потенциала на
ртути в 10“* Н NaF:
О — эксперимент: X — расчет по пред-
ложенной методике:--------расчет
по Грину
в первом приближении при
Дф = ф — фн 3 ~ 0,5 В
La ~ (1/ф) [0,5 (LH — Lh.Jjp +
+ ^-н.8 ф! = 0>5-Ьд “Ь 0,5Lh-3 =
= 0,5£д + 2,5 • 10-6 Ф/см2; (5.23)
£д = 2LH — 2,5 • 10~6 Ф/см2.
(5.24)
Используя рассмотренный при-
ем, можно получить при Дф = 0,1 В
значение Ln = 1,2 • 10-6 Ф/см2,
что удовлетворительно согласуется
с экспериментальным значением
1,14- 10-6 Ф/см2. Таким же образом
была рассчитана дифференциальная емкость при изменении Дф от
+0,5 до —0,5 В. Между расчетными и экспериментальными значения-
ми емкости имеется удовлетворительное согласие (рис. 5.2). Статисти-
ческая обработка с использованием стьюдентовской постоянной пока-
зывает, что между экспериментом и расчетом значимого различия нет.
§ 5.3. КИНЕТИКА КАТОДНЫХ ПРОЦЕССОВ
Коррозия металлов, т. е. процесс перехода металлов в ионное сос-
тояние под действием среды, состоит из двух взаимосвязанных про-
цессов: анодного — ионизация металла, сопровождающаяся накоп-
лением эквивалентного количества электронов в металле, и катодно-
го — взаимодействие этих электронов с молекулами или ионами кор-
розионной среды.
Водородная деполяризация. В деаэрированных водных средах,
характерных для ядерной энергетики, и также в кислых средах катод-
ный процесс заключается в разряде ионов водорода:
Н+ + е->Н-^0,5Н2.
с образованием вначале атомарного, а затем молекулярного водорода.
В этом случае коррозия идет с водородной деполяризацией.
Равновесный потенциал водородного электрода
4h+ = V°+(.RTIF) \gC^ — (RT/F) lgPfr2B,
где ф =0 нормальный потенциал водородного электрода. С уче-
том того, что при Рн, = 0,1 МПа и pH = 0
—1g Сн+ = pH; фн+ = — (RT/F) pH = —0,059 pH.
„Тогда потенциал водородного электрода при различных значениях
рн имеет следующие значения:
pH о 7 14
Фн+ 0 —0,42 —0,84
108
Для оценки ресурса реакторных материалов в ряде случаев необхо-
димо знать абсолютную скорость реакции разряда ионов водорода. Ион
водорода из-за малого размера в водных средах ассоциируется с молеку-
лой воды и присутствует в виде гидроксония Н3О+. Энергия ионов
гидроксония, находящихся у поверхности металла, так же, как и лю-
бой другой заряженной частицы, зависит от падения потенциала в
двойном электрическом слое: dQ = ydq.
Для плоского конденсатора ф = q/L, отсюда dQ = qdq!L\
Q = (1/L) f qdq = (1/L) (g2/2) = q ф/2 = L<p2/2. (5.25)
Переходя к килоджоулям на грамм-эквивалент и обозначая число
зарядов рассматриваемой частицы через п, получаем Q = 0,5nF<p =
= anFq>, где а = 0,5.
Вне двойного электрического слоя в монослое на 1 см2 будет
находиться Сг = С 2,36 • 10~8 • 10-8 г-ионов гидроксония, где С,
г-ион/л — концентрация гидроксония в объеме; 2,36 • 10-8 см — ди-
аметр гидроксония.
Энергия этих ионов не зависит от потенциала двойного слоя. Со-
отношение между количеством ионов гидроксония в монослое на 1 см2,
находящихся непосредственно у поверхности металла (Сп), и вне
двойного слоя (Сх), моль/см2, выразится следующей зависимостью:
Са ехр {- [Q + anF (Фн,8 — <р)]/7?Т} = С. • 10-<Э/*г,
где Q — энергия гидратации; F = 96,5 кДж/эВ — коэффициент для
перехода от электронвольта на атом (эВ/атом) к килоджоулю на моль
(кДж/моль); (фн а — ф) — падение потенциала в двойном электричес-
ком слое; фН 8 — потенциал нулевого заряда.
С учетом изложенного
Са = С • 2,36 • 10-и ехр { [аГ (фн,8 — ф)]//?Т}. (5.26)
Исходя из размеров молекулы воды и количества молекул воды в
1 л, можно полагать, что в первом приближении в монослое на площа-
ди 1 см2 находится 10-9 молей воды. Тогда для не слишком кислых
сред с учетом зависимости (5.26) легко показать, что при фн,8 — Ф
С 0,5 В ионы гидроксония не образуют монослоя. В этих условиях не-
посредственно у поверхности металла присутствуют как молекулы во-
ды, так и ионы гидроксония,
В процессе катодной реакции водородной деполяризации ион гид-
роксония взаимодействует с электронами, вышедшими из металла,
электроны покидают металл посредством «туннельного» эффекта. Ве-
роятность этого события W (т), исходя из квантовомеханических пред-
ставлений, описывается следующей зависимостью:
lg W = — 0,44а£°’Б, (5.27)
’ Ю-8 см — ширина барьера, преодолеваемого электроном; Е,
твои Вр1Сота этого барьера, отождествляемая с работой выхода элект-
н а. Величина а может быть оценена с учетом значения энергии Фер-
109
ми Ел, - максимальной энергии электрона в металле Для большин-
ства технически важных металлов £ф близка к 10 эВ =1,6-10 Дж.
Из соотношения неопределенности местоположение электрона в
металле может быть определено с точностью до Ах = 0,55 • 10 см.
Выйдя из металла, электрон, чтобы принять участие в процессе
катодной деполяризации разряда иона водорода, должен пройти путь
б равный в соответствии с (5.10) 0,64 • 10 8 см. Отсюда а = Ах +
+’б_ = 0,55- 10-8 + 0,64 • 10"8= 1,19- 10-8 см.
Для большинства технически важных металлов Е — 4,2 эВ.
Тогда, согласно (5.27),
1g Гт = —0,44 ' !»19 ’ (4>2)0,6 — — !•
Количество отрицательно заряженных частиц (электронов) в ме-
таллической обкладке двойного слоя q (г-экв/см2), согласно (5.22),
q = LAq>/F.
В реальных средах всегда присутствует то или иное количество ка-
тионов и анионов. В этом случае L — 2,3 • 10“6 Ф/см2.
Для Дф = 0,5 В
q = 2,3 • Ю-6 • 0,5 • 10-6 = 1,15 • 10-6 г-экв/см2.
Вероятность выхода электрона из металла с площади 1 см2
FM = qWT = 1,15 • IO”10 • IO”1 ~ 10"11.
Как указывалось выше, ионы гидроксония в обкладке двойного
электрического слоя не образуют монослоя. Поэтому для электрона,
вышедшего из металла, вероятность встречи с ионом гидроксония не
равна единице, а пропорциональна значению Сп [см. (5.26)]. Выход
электрона из металла и взаимодействие электрона с ионом гидроксо-
ния — события независимые. Вероятность взаимодействия электрона
с гидроксонием W = FM Са.
Когда ион водорода, взаимодействуя с электроном, образует атом
водорода, освобождается энергия, равная потенциалу ионизации во-
дорода 13,59 эВ. Эта энергия превосходит энергию гидрятяттии
иона гидроксония. В ходе рассматриваемойгреакции происходит де-
гидратация иона гидроксония.
Скорость катодного процесса разряда ионов водорода, выражен-
ная в амперах на квадратный сантиметр (А/см2), равна
i = vF'WMCa = 1018 • 10Б • 10“u • • 2,36 • 10_u X
X exp { [aF (фн,8 — ф)]//?Т} = Сг 2,36 • 10“4 X
X exp { [aF(?H,8 — ф)]//?Т}, (5.28)
293 Ю 3 ° ~ Кл/г'Экв. При С\ = 1 для температуры
пГс-ь/ + '8 ‘ = Ф... - 0,47- 0,118 1g >.
1 Равновесныи потенциал водородного электрода ф° = 0 и
значение перенапряжения
но
П = Ф° — ф = 0,47 — фа,8 + 0,118 1g I.
(5.29)
В уравнении Тафеля^ связывающем перенапряжение водорода с
плотностью тока катодной поляризации
т] = а + b 1g I, (5.30)
постоянная b = 0,118,
(5.29) и (5.30)
что согласуется с зависимостью (5.29). Из
а = 0,47 — фн.а. (5.31)
Потенциал нулевого заряда связан с работой выхода электрона е<р
следующей зависимостью:
Фн.в = е<р — 4,7. (5.32)
Отсюда
а = 5,17 — е<р. (5.33)
Значения а, оцененные по (5.33) и определенные эксперименталь-
но, отличаются не более чем на 20%. Это дает основание полагать, что
для количественной оценки скорости катодного процесса водородной
деполяризации в первом приближении можно использовать следую-
щую зависимость, вытекающую из уравнения (5.28):
lg i = 1g Сн+ - 3,62 + [ (aF (фн,3 — Ф)/ЯТ].
(5.34)
Потенциалы нулевых зарядов для ряда технически важных метал-
лов приведены ниже:
Металл А1 Сг Си Fe Hg Ni Pb Ti Zr
«ф, В —0,19 —0,45 0,03 —0,37 —0,2 —0,25 —0,65 —0,7 —0,8
Кислородная деполяризация. В средах, содержащих кислород, на-
пример, на стенках или в контуре многократной циркуляции кипя-
щих реакторов, коррозия может идти с кислородной деполяризацией.
Катодная реакция ионизации кислорода может быть записана в сле-
дующем виде:
0,5О2 + Н2О + 2е = 2ОН-.
Равновесный потенциал реакции ионизации кислорода при различ-
ных значениях pH составляет:
pH 0 7 14
Фо, 1,23 0,82 0,40
Из кинетических соображений следует, что именно одноэлектрон-
Ная стадия контролирует скорость этой реакции. Элементарный акт
перехода электрона к кислороду совпадает с процессом хемисорбции.
1ри этом выделяется энергия, равная сродству кислорода к электро-
эВ/моль = 141,3 кДж/моль.
Присоединение второго электрона атомом кислорода сопровождается
оглощением энергии Qx = 6,8 эВ/моль = 656 кДж/моль. Энергия
Ш
ГИЯ Д^аточна для компенсации энергии связи молекул воды с други-
ми молекулами или с поверхностью металла.
nSSy именно одноэлектронная стадия реакции ионизации
кислородТнаиболее медленная и определяет скорость всей реакции,
концентрация кислорода, участвующего в катодном процессе, зависит
от потенциала. По аналогии с водородной деполяризацией количество
кислорода на 1 см2 состарит
Са = Со, (d/A)IO"3 • Ю-11 ехр { [aF (фн,3 — <p)]/2?T} =
= Со, 4,6 • Ю-“ ехр { [aF (фн.в — ф)1//?Т}, (5.35)
где Со, — концентрация кислорода, мг/л; a — 1,46 • 10 8 см —
атомный диаметр кислорода', А = 32 относительная молекулярная
масса кислорода.
Даже в насыщенном воздухом водном теплоносителе (Со, =
= 10 мг/л) при фн.3 Ф = 0,5; Сп ~ 10“10 г-моль/см2, т. е. кислород
не образует монослоя у поверхности металла. Отсюда вероятность вза-
имодействия электрона с кислородом 1^0 = 1^мСп-
В первом приближении можно принять = 10-11, т. е. так же,
как и в случае водородной деполяризации. Отсюда скорость катодной
реакции ионизации кислорода
i = vFWMCn = Со, Ю13 105 • 2 • 10~и • 4,6 10"16 X
X ехр { [aF (фя,3 — ф)]//?Т} =
= Со, IO”7 ехр { [aF (Фн,3 — ф)]/ЯТ), (5.36)
где п = 2 — число электронов, участвующих в реакции кислородной
деполяризации.
lg i = 1g Со, — 7 + { [aF (фн,8 — ф)]//??}. (5.37)
Рассчитанные из (5.36) значения перенапряжения реакции иони-
зации кислорода для 14 металлов в среде, насыщенной воздухом с pH =
в 9,2 при плотности тока 0,001 А!см2, отличаются от эксперименталь-
но определенных значений в среднем не более чем на 10%.
Концентрационная поляризация. При прохождении через электрод
тока состав раствора в приэлектродном слое вследствие протекания
электрохимических реакций изменяется по сравнению с составом
раствора в объеме. В случае равновесного электрода равновесие при
этом нарушается. В растворе возникают диффузионные процессы, на-
правленные в сторону выравнивания возникающих разностей концеи-
рации и обеспечивающие подачу реагирующих веществ к поверхно-
и и удаление продуктов реакции от поверхности электрода. Потен-
иппргЭЛеКТРст^а может ПРИ этом принимать значение, отличное от рав-
Явление это называется концентрационной поляризацией.
Р родныи слой, в котором происходит изменение концентраций
112
раствора вследствие протекания электрохимических реакций на по-
верхности электрода, называется диффузионным слоем. Толщина его О
в искусственно неразмешиваемых средах составляет 10-3—5 • 10-2 см.
Предположим, что наряду с ионом А, участвующим в электродной
реакции, в растворе находится избыток одноименных с ним ионов, ко-
торые в основном и переносят ток, но не участвуют в электродных ре-
акциях. Миграцией под действием тока интересующего нас иона в этих
условиях можно пренебречь. По мере прохождения электрохимичес-
кой реакции концентрация иона А на поверхности электрода будет
снижаться. Градиент концентрации иона А и подача его вследствие
диффузии к поверхности электрода при этом возрастают. Со временем
установится стационарное состояние, когда количество ионов, участ-
вующих в электродной реакции, станет равным числу ионов, подавае-
мых к электроду за счет диффузии. Количество ионов, диффундирую-
щих в единицу времени к 1 см2 поверхности электрода, равно DdC/dx.
Плотность тока, отвечающая этому количеству ионов, i = nFDdC/dx,
и в случае стационарного процесса i = nFD (С — где Са — кон-
центрация у поверхности электрода; б — толщина диффузионного
слоя.
При увеличении плотности тока величина Сп может меняться от
исходного значения С до нуля. В последнем случае плотность тока
достигает некоторого предельного значения, называемого предельным
диффузионным током:
id = nFDC/8.
Значение б может быть рассчитано лишь для случая вращающегося
дискового электрода. При этом б = l,62Z)1/3v1/6co_1/2, где v — кине-
матическая вязкость; со — угловая скорость.
Если поляризация электрода, т. е. изменение его потенциала вслед-
ствие прохождения через электрод тока, обусловливается замедленно-
стью определенной стадии электрохимической реакции, например ста-
дией выхода электрона из металла в ходе катодного процесса, то она
называется кинетической или химической. В случае ограничения до-
ступа реагента к поверхности металла также может иметь место изме-
нение потенциала металла, т. е. поляризация. Такая поляризация
называется концентрационной и обусловлена диффузионным ограниче-
нием доставки реагента к поверхности электрода.
5 М. КИНЕТИКА АНОДНЫХ ПРОЦЕССОВ
Активная область. Растворение металла, переход его в ионное сос-
ояние происходят в результате протекания анодного процесса. Если
СКоРость анодного процеса
Me Ме"+ + пе
Ухичивается с ростом потенциала, то металл растворяется в актив-
Рис с^‘1^сти анодной поляризационной кривой (участок В—С на
• &-3). При растворении металла поверхностный атом покидает кри-
113
м-^лиЧесКУЮ Решетку. Энергия активаций элементарного акта выхо-
S’Xa из оовТхно^ного слоя металла (0 составляет, согласно „ра.
Эйринга О = 0,25£,Т. £S -энеР™я кРисталической
S™ поверхногтного атома, равная половине энергии крнсталли-
S решетки для атома в трехмерной решетке, т. е.
Q = 0,125£kP- (5.38)
атома из поверхности металла
= ехр (—0,125£кр/ЯТ). (5.39)
Вероятность выхода
Гкр
ционная кривая пассивиру-
ющегося металла
Энергию кристаллической решетки характеризует переход одного
моля металла из газа, состоящего из неионизированных атомов, в кон-
гломерат атомов, связанных металличе-
ской СВЯЗЬЮ.
Получив в результате термофлуктуа-
ции энергию 0,125£кр, кристаллическую
решетку может покинуть только неиони-
зированный атом. Для двухвалентных ме-
таллов вероятность того, что в момент по-
кидания кристаллической решетки оба
электрона будут находиться в атоме, равна
Fi = 0,5 • 0,5 = 0,25; 1g = —0,6.
(5.40)
Покинуть кристаллическую решетку мо-
жет лишь тот атом, который в процессе
тепловых колебаний удаляется от поверх-
ности по направлению, нормальному к ней.
Вероятность такого состояния =
= 1/6= 1/6 • 10-1; 1g F2 = —0,78.
В плотноупакованной кристаллической
решетке в поверхностном слое у атома 6 со-
седей и в'^нижележащем слое 3 соседа. От-
рыв от кристаллической решетки атома мо-
жет произойти лишь в том случае, [когда
соседние с ним атомы, лежащие в поверхностном слое, в процессе теп-
ловых колебаний направлены не по нормали к поверхности в сторону
среды и не по направлению атома, покидающего решетку Вероятность
такой ситуации F3 = (2/3)® ~ 8 • 10~2.
Нижележащие атомы в этот момент должны’в процессе тепловых
колебаний направляться в глубь кристалла или в сторону. Вероят-
ность этой ситуации F4 = (2/3)3 = 3,7 • 10~2.
Произведение вероятностей 2,3 и 4
П^пл « 1,6 • Ю-1« 8 • 10-2 • 3,7 • 10~2 ~ 4,7 • 10“4.
Для кубической неплотноупакованной решетки ПЯ7я= 10“’. В-
среднем может быть принята величина
пг = 10“3.
(5.41)
114
Атом, покинувший кристаллическую решетку и перешедший в кор-
розионную среду, будет гидратирован только в том случае, если он
ионизируется. В процессе ионизации рассматриваемого атома электро-
ны покидают его (туннельный эффект). Вероятность этого процесса
ц/у и lg Wt = — 0,44а)/'Е.
После того как осуществилась ионизация, должен реализоваться
процесс гидратации. Только в этом случае исключается немедленное
возвращение иона в кристаллическую решетку. В случае присоедине-
ния в процессе гидратации к двухвалентному иону двух молекул воды
энергия иона снизится на = 83, 6 • 2 • 2 — 334 кДж. При возвра-
щении в кристаллическую решетку для большинства технически важ-
ных металлов энергия иона уменьшится на 280—400 кДж. Таким об-
разом, гидратация уже двух молекул воды исключает возвращение
иона в кристалл.
Для реализации элементарного акта процесса гидратации моле-
кула воды, соседствующая с ионом, должна в процессе теплового
движения столкнуться с ионом. Вероятность того, что молекула воды
переместится в заданном направлении, будет 1/6. Вероятность того,
что в таком же движении будут участвовать две молекулы, составит
Г5 = (1/6) • (1/6) = 2,8 • IO"2; lg W5 = —1,55.
Подтверждением того, что в процессе анодного растворения металла
вначале в среду переходит атом и за ним следует процесс его иониза-
ции, служит следующее наблюдение.. При взаимодействии калия с хо-
лодной водой, не содержащей даже следов кислорода, образуется ра-
створ голубого цвета. Точно такая же окраска наблюдается при облу-
чении воды электронами. На первом этапе растворения переходит в
воду атом калия, который затем ионизируется с образованием гидра-
тированного электрона.
Необходимо также иметь в виду, что поверхностные атомы металла
обмениваются электронами. При анодной поляризации (Д<р = 0,5 В)
и положении молекул Н2О , отвечающих рис. 5.1, б, число электронов
на один атом уменьшается на
Дп = Дд/1,6 10~19 • 1015 = L°+ Дф/1,6 • 10-4 =
= 3,7 • 10“5 • 0,5/1,6 • 10-4 0,12, (5.42)
где 1,6 • Ю-19 Кл — заряд электрона; 1016 — число атомов на 1 см2.
В случае двухвалентного металла при таком изменении количест-
ва электронов не компенсировано только 0,12 элементарного положи-
тельного заряда ядра атома.
’ Кулоновские силы не являются насыщенными. Поэтому энергия
электронов, экранирующих положительный заряд ядра атома, возрас-
тет вследствие взаимодействия с’отрицательным зарядом молекулы
находящейся в положении б (см. рис. 5.1). Для двухвалентного
еталла в рассматриваемой ситуации число электронов, приходящих-
ся на 1 атом, п = 2 —0,12 = 1,88 ~ 2. ЭнергияЪлектронов увели-
ивается на величину AQ — апВДср.
115
Пои комнатной температуре практически все электроны в металле
выоомены т е имеют минимальную энергию. Вследствие этого полу-
ценнуюими энергию AQ электроны передают атомам кристаллической
пеше™ На эт? величину и уменьшается энергия активации элемен-
тарного акта выхода атома из кристаллической решетки.
РС Счетом изложенного скорость анодного процесса растворения №п.
валентного металла при равновесном потенциале, т. е. ток обмена,
составит = nvp'CaYlWWtlWIt WtWs ехр { -[0,125£кр -
— anF (ср0 — Фн.ЖП, (5.43)
где п — валентность; v = Ю13 с"1; F = 96 5 кДж/эВ; F =
— 10® Кл/г-экв — число Фарадея; Сп = 3 • 10 г-экв/см — по-
верхностная концентрация растворяющегося металла; Wi„ Wit~
вероятность процесса туннельного перехода электронов, отвечающих
первому и второму потенциалам ионизации.
Рассчитанные по зависимости (5.43) значения токов обмена для Ag,
Cd, Hg, РЬ превышают 10—100 А/см2. Очевидно, в этом случае токи
обмена ограничиваются анодным диффузионным током, значение ко-
торого для комнатной температуры составит 10-2 —10-1 А/см2. Для
железа в соответствии с зависимостью (5.43) получаем
1g 1о = О,9+13+5 — 8,5— 3—0,44-1,19 ’/7^7-0,44-1,19КТбДЗ—
0,125-405—0,5-2-9,65 [—0,44 —(—0,37)]
—0,6 — 1,55 —------------------------- —
5,68
Расчетные и экспериментальные значения тока обмена приведены
в табл. 5.2.
Таблица 5.2
Расчетные и экспериментальные значения тока обмена (1g i0, А/см2)
Металл Ag Cd Со Си Fe Hg Ni Pb Zn Cr
Расчет Экспери- мент Ц|1 •„+»+ —14—2 -1,7ч- — 1,9 1 1 —3,35 —1,3ч- —4,7 -8,4 —8 — 14- —2 —0,3 —8,28 -8,7ч- —9,1 —1ч- —2 — 1 —4.65 -3,2-j- —4,7 —13,1 -12
„ анодной поляризации, т. е. при потенциалах положительнее
ц'1'®’ й °-Ичество 0ТР^цательнь1Х зарядов, т. е. электронов в металли-
№ofiHoro электрического слоя, уменьшается. В соот-
мртяпггло ИМ’ КаК ^едУ61, из основных положений зонной теории
коистялп1тПа^Н“>ШаеТСЯ ЭН^РГИЯ Ферми и, соответственно, энергия
нов на 1 смЧ2еппп^пРеШеТК?’ Последняя связана с количеством электро-
мостью (кДж/В РХЯ.0СТИ Кл/см2) следующей эмпирической зависимо-
£кР = 148,4 + 7,5 • 105<7.
(5.44)
116
С учетом зависимости (5.19)
Екр = 148,4 + 7,5 • 106£<р. (5 45^
При отклонении потенциала от срн 8 не более чем на 0,3___0,5 В
L ~ 2,5 • IO'5 F/cm2.
Отсюда
Д£Кр = 148,4 + 18,8 (ф — фн,3). . (5.46)
С учетом изложенного и зависимости (5.43) скорость анодного про-
цесса в активной области (ta, А/см2) следующим образом зависит от
потенциала:
Га = К exp { [anF (ф — фн.в) + 18,8 (ф — фн.3)]/7? Т}; (5.47)
lg = 1g К + (anF/RT) (ф - фн.з) + (18,8//?Т) (ф - фн.8),
(5.48)
где
К = nvFCJIWW/, X exp [ —(0,125£кр — 148,4)/flTL
(5.49)
Для двухвалентных металлов из зависимости (5.48) следует:
d (ф — фн.з)/^ 1g 1 = RTI (anF + 18,8) =
= 2,3 • 8,27 • 298 • 10"8/ (0,5 • 2 • 96,5 + 18,8) ~ 4,9 • 10~2.
(5.50)
Экспериментальное значение для железа (5.50) составит 0,042±
±0,008, что близко к расчетному. Без учета последнего члена правой
части уравнения (5.48) рассматриваемое значение должно составлять
0,059.
Таким образом, в полулогарифмических координатах связь потен-
циала металла и скорость его растворения в активной области выра-
жается прямой линией
lg i = а + Ьф, (5.51)
где b равно значению (5.50).
При значительной анодной поляризации в активном состоянии
скорость растворения будет зависеть от интенсивности отвода ионов
металла от поверхности в глубь раствора. Поскольку скорость диффу-
зии не зависит от потенциала, значение предельного анодного диффузи-
онного тока не зависит от потенциала и составляет при температуре
293 К 10-2—10-1 А/см2.
Пассивная область. Под пассивностью понимают резкое уменьшение
скорости анодного процесса и, соответственно, скорости коррозии ме-
талла в условиях, когда металл термодинамически неустойчив. В
развитие теории пассивности существенный вклад внесли советские
Ученые В. А. Костяковский, Г. В. Акимов, Б. В. Эршлер, Я. М. Ко-
лотыркин, Н. Д. Томашов и др.'
Пассивность связана с образованием защитного слоя на поверх-
ности металла. Часть энергии поверхностные атомы металла расходу-
117
ют на образование связи с кислородом, находящимся в защитном слое.
Вследствие этого энергия активации, необходимая для разрыва свя-
зей в процессе растворения металла, возрастает и скорость анодного
процесса и коррозии снижается. „ u
Участок анодной поляризационной кривой DB на рис. 5.3, отве-
чающий пассивному состоянию, характеризуется низкой скоростью
анодного процесса (10~8 —Ю“6 А/см2) и независимостью его от зна-
чения потенциала. Потенциал, отвечающий точке D, называют потен-
циалом полной пассивации или фляде-потенциалом (ффп). При дости-
жении этого потенциала протекает реакция
Me + Н2О = Ме+О2~ + На+дс + Н+ + е. (5.52)
Значение потенциала полной пассивации определяется по следую-
щей зависимости:
Ффл = AZ/F = 0,01 ZMe+o2—0,059 pH +а, (5.53)
где AZ — изменение термодинамического потенциала реакции (5.52);
ZMe+o«- = КДЖ^Г'ЭКВ — термодинамический потенциал
низшего окисла металла, отнесенного к грамм-эквиваленту.
Например,
Zcr+o2-=Zcr2o3/2-3= 1057/6= 176 кДж/г-экв.
Величины
а = 2,46 для Al, Zr, Ti, V, Nb, Мп, U, Be, Ta, Si, Bi;
a — 1,89 для Cr, Fe, Ni, Co, Tc, Ga, In, Ge, Zn, Mg, Sn, Cd,
a — 1,16 для Ag, Cu, Hg, Pd, Au, Ru.
Для того чтобы принять участие в образовании пассивирующего
слоя, молекула воды должна оторваться от соседних молекул. Энер-
гия активации этого процесса Qn возрастает с увеличением потенциа-
ла, так как в двойном электрическом слое энергия молекул воды с уве-
личением потенциала уменьшается по зависимости (5.25) на величи-
AQH = anFcp = aFLtp2.
Отсюда скорость образования пассивирующего слоя
ип = К ехр [—(Qn + aFL<p2)/RT].
иПри протекании анодной реакции на поверхности металла, покры-
той пассивирующим слоем, последний разрушается. В первом при-
лижении доля поверхности металла, покрытой пассивирующим слоем
с>п, пропорциональна скорости реакции его образования:
5п = Кхца = К2ехр (—aFL^/RT).
При потенциалах пассивной области большая часть поверхно-
и металла покрыта пассивирующим слоем. Отсюда скорость растворе-
ния металла в пассивном состоянии
in = K3Sn
118
Ионы металла, входящие В состав пассивирующего СлОя, являют-
ся одной из обкладок двойного электрического слоя. Энергия их за-
висит от потенциала. С учетом зависимости (5.43) можно записать
ia = К3К2ехр (—aFLcp2//?T) exp (aFL<p2/7?T) = const.
Скорость анодного процесса в пассивной области не должна за-
висеть от потенциала, что и наблюдается на практике.
Чем более отрицателен ффЛ, тем больше вероятность того, что ста-
ционарный потенциал металла или сплава будет отвечать пассивной
области и скорость коррозии их будет низка.
При длительном пребывании в водной среде на поверхности метал-
ла образуется фазовая окисная пленка, которая также способствует
снижению скорости коррозии:
2Сг+Оа“ + Н2О = Сг2О3 + 2Н+ + 4е.
При температурах 473—573 К образование окисных слоев на поверх-
ности металлов и сплавов ускоряется. В частности, на железе и сталях
перлитного класса в этих условиях образуются защитные окисные
слои магнетита Fe3O4. Увеличение окисных слоев идет по законам
твердофазной поверхностной диффузии. Толщина окисла 6 (см) в пер-
вом приближении может быть оценена по зависимости
62~D0exp (-<2п/ЯТ)т,
гдеПо~ 108; энергия активации поверхностной диффузии Qn =
= 0,35-j-0,45Q (Q — энергия активации объемной диффузии); т, с —
время.
В условиях эксплуатации ЯЭУ нержавеющие стали, сплавы алю-
миния и циркония находятся при стационарном потенциале в пассив-
ном состоянии. С этим и связана их высокая коррозионная стойкость.
Перепассивация. При увеличении потенциала до значения £(см.
рис. 5.3) становится термодинамически возможным протекание реак-
ции, ведущей к образованию хорошо растворимых ионов высшей ва-
лентности.
В нейтральной среде протекает реакция
Сг2О8 + 4НаО = Сг2ОГ + 8Н+ + бе. (5.54)
В щелочной среде
Сг2О8 + ЮОН- = 2СгОГ + 5Н2О + бе. (5.55)
Участок анодной поляризационной кривой EF на рис. 5.3 назы-
вается областью перепассивации, а потенциал, отвечающий точке Е, —
потенциалом перепассивации <рп.
Для реакции (5.55) равновесный потенциал при pH = 14 равен
~~0>07 В. Отсюда равновесный потенциал этой реакции
Ф в —0,07 + (0,059 • 10/6) pH = —0,07 + 0,098 pH ~ —0,07 +
+ 0.1 pH.
В Щелочных средах при pH = 124-13 в присутствии окислителя,
апример КМпО4, стационарный потенциал нержавеющей стали бу-
119
дет отвечать области йерейассивации. Естественно, Окисййя плёйка,
образовавшаяся в процессе эксплуатации на поверхности нержавею-
щей стали, будет растворяться. В среду будут переходить все вещест-
ва осевшие на поверхности окислов, в том числе и соединения, содер.
жащие радиоизотопы кобальта, железа, марганца и т. д. При этом бу.
дет происходить дезактивация оборудования, улучшение радиацион-
ной обстановки.
В кислых и нейтральных средах перепассивация реализуется
вследствие протекания реакции (5.54). При pH = 7 равновесный по-
тенциал этой реакции близок к 0,9 В. Именно при достижении этого
потенциала нарушается пассивное состояние на аустенитных хромо-
никелевых, нержавеющих сталях.
Псевдопассивное состояние. В средах, не содержащих активато-
ров, например хлоридов, в частности в химически обессоленной во-
де, при потенциалах отрицательные области активного растворения
скорость анодного процесса не зависит от потенциала и мала (отрезок
АВ на рис. 5.3).
Последние два обстоятельства делают эту область похожей на пас-
сивное состояние. В связи с этим она получила название псевдопассив-
ного состояния. Наступление псевдопассивного состояния при потен-
циалах положительнее фн,3 связывается с адсорбцией Н2О. В рас-
сматриваемой области потенциалов на участках, где молекулы воды
ориентированы по схеме рис. 5.1, б, металл заряжен положительно,
При адсорбции молекула Н2О отдает электрон металлу. Для реакции
Me + Н2О = (Н2О)адс, MeJ AZ — A// = —Q = —41,8 кДж/моль.
Отсюда
^н»°адс,ме = AZ + Zh2o = —41,8 — 237,0 = 278,8 кДж/моль.
На участках поверхности, где молекулы воды ориентированы по
схеме рис. 5.1, а, металл заряжен отрицательно. На этих участках
происходит адсорбция О2, в процессе которой металл отдает электрон.
В процессе адсорбции выделяется энергия. При этом энергия по-
верхностных атомов металла уменьшается, что и приводит к снижению
скорости анодного процесса до значений, близких к скорости анод-
ного процесса в пассивном состоянии, и, соответственно, к снижению
скорости коррозии. Так, в химически обессоленной воде с содержани-
ем кислорода 0,2 мг^л СК0Р0СТЬ коррозии перлитных сталей при 293
и 353 К составляет, соответственнно, 0,020—0,065 г/ (м2 • сут). Если
кислород в среде связан, например, гидразином, то адсорбция кисло-
рода, естественно, не происходит и, соответственно, скорость корро-
зии при этом в 3—4 раза выше.
При протекании реакции
(Н2О)адС( ме = Меге+ + Н2О пе
псевдопассивное состояние нарушается. Потенциал этой реакции, —-
потенциал выхода из псевдопассивного состояния
Фв = (2ме«+4-2Нго—2(нго)адС1Ме)/п-96,5 = (ZMe"+/n-96,5) +
4-41,8/п.96,5 = Фме«+ + 0,43/п. (5.56)
120
Для железа расчетное значение <рв составляет —0,22 В, экспери-
ментальное —0,25 В. При потенциалах положительнее фв железо
и другие металлы растворяются в активном сотоянии.
В присутствии хлоридов псевдопассивное состояние не реализу-
ется. В связи с этим для снижения скорости коррозии перлитной ста-
ли в условиях, например, конденсатнопитательного тракта содержа-
ние хлор-иона в конденсате не должно превышать 0,02 мг/кг, а элект-
тропроводность быть на уровне 0,1—1,0 мкСм/см.
§ 5.5. МЕСТНАЯ КОРРОЗИЯ
К местной относится язвенная или питтинговая коррозия. В местах
скопления дислокаций, при пересечении границ трех зерен поверхно-
стные атомы обладают повышенной энергией. На этих участках ско-
рость анодного процесса выше, чем на соседних. В связи с этим и на
поверхности металла образуются углубления. Диаметр основания та-
кого углубления (язвы) соизмерим с ее глубиной.
Кислород, растворенный в среде, заполняющей язву, расходует-
ся на протекание катодной реакции на стенках язвы. В связи с этим
металл на дне язвы по истечении некоторого времени контактирует с
практически деаэрированной средой. В этом случае в химически обес-
соленной воде реализуется псевдопассивное состояние и скорость кор-
розии резко замедляется. Язва перестает расти. В химически обессо-
ленной воде глубина язв не превышает 0,3—0,4 мм. В средах, содер-
жащих хлориды, последние препятствуют наступлению псевдопассив-
ного состояния. Язвы в такой ситуации продолжают расти и могут до-
стигать в глубину нескольких миллиметров.
Коррозия под напряжением. Присутствие в среде хлоридов при-
водит к нарушению не только псевдопассивного, но и пассивного сос-
тояния. При нарушении пассивного состояния на нержавеющих ста-
лях протекает реакция
Cr+ О"8 + ЗС1- = СгС13 + 0,5О2 + 4г.
Нормальный потенциал этой реакции (потенциал пробоя <рпр) близок
к 0,2—0,3 В. СгС13, взаимодействуя с водой, образует хорошо раство-
римые комплексы.
В местах выхода дислокаций на поверхность ионы, образующие
пассивирующий слой (Сг+ О2-)дисл, дислоцированы и энергия их вы-
^.е’ Чем на участках с совершенной кристаллической решеткой, на
’*»8 кДж/моль. Отсюда
Z(Cr+o2-)дисл = Z(Cr+o2-) 4-41,8
И соответственно
^Рдисл = Ч’пр— (41,8/4-96,14) ~фпр— 0,11.
к /“тационарный потенциал нержавеющей стали <рст может быть та-
’ Что Ч-'пРдщ.д < Фст < фпр-
121
В такой ситуации участки поверхности металла с совершенной
коисталлической решеткой будут находиться в пассивном состоянии, а
на участках выхода дислокаций пассивное состояние будет нарушено,
пеализуется так называемый активно-пассивныи элемент. На участ-
ках где пассивное состояние нарушено, металл будет растворяться
в активном состоянии, причем поверхностные атомы получат допол-
нительную энергию:
Сакт = anF (Тст — Фн.э)- (5.57)
Дислокации, выходя на поверхность, образуют ступеньку сколь*
жения. На ее образование тратится энергия, равная Ь2у, где b — век-
тор Бюргерса; у — поверхностная энергия. Вследствие этого поверх-
ность тормозит движение дислокаций. При образовании пассивирую-
щего слоя часть энергии поверхностных атомов расходуется на связь
с кислородом пассивирующего слоя. При этом энергия поверхностного
атома, в том числе и дислоцированного, также снижается. Когда пас-
сивное состояние в результате протекания реакции (5.56) нарушает-
ся, ступенька скольжения, образовавшаяся при выходе дислокации
на поверхности, растворяется вследствие протекания анодного процес-
са. При этом энергия поверхностных дислоцированных атомов воз-
растает на
2<3 = + anF (<рст — <рн,8).
На участках, где металл растворяется в активном состоянии, дви-
жение дислокаций не только не тормозится поверхностью, но еще уско-
ряется вследствие того, что дислоцированные атомы, находящиеся
на поверхности, получили дополнительную энергию QaKT. Энергия
активации движения дислокаций в зависимостях (3.31), (3.32) умень-
шается на это значение, и скорость движения дислокаций возрастет.
Соответственно через меньший промежуток времени образуется плос-
кое скопление дислокаций, являющееся зародышем трещины. Тре-
щины в этом случае пересекают зерна металла. В такой ситуации го-
ворят о транскристаллитной коррозии под напряжением или о корро-
зионном растрескивании.
С учетом изложенного время до появления зародыша трещин в слу-
чае коррозионного растрескивания может быть определено с учетом
зависимостей (3.32) и (5.57):
lg т = 1g т0 — [anF (Фст — фн.8)]/7?Т. (5.58)
оценки влияния содержания О2 и С1~ в среде на время т с
У ом зависимостей (5.57), (5.58) воспользуемся соотношением
d 1g т= (dQaBT/d 1g Co2)d 1g Co2 + (dQaKT/d 1g Ca-)d 1g Сщ- (5-59)
® nPaB0® час™ (5.57) от концентрации кислорода звисит cpCT- 0°'
Ределим <рст как функцию 1g СОг. Значение Ь в тафельской зависи-
и’ опис«вающей связь скорости анодного процессатрастворения
firaov В области и потенциала при комнатной "температуре.
- п пт? ° п Отсюда это значение при 573 К составит 0,04 • 573/298 =*
- и,и//. Для катодной поляризационной кривой получим, соответ-
122
ственно, —0,118 * 573/298 = —0,23. С учётом того, что скорость ка-
тодного процесса прямо пропорциональна концентрации кислорода,
зависимости скоростей катодного и анодного процессов при 573 К на
активных участках будут иметь следующий вид:
Фа = Ка + 0,077 lg i; фь = Кк — 0,23 lg i + 0,23 lg СОг.
Скорости катодного и анодного процессов при стационарном зна-
чении потенциала <рот равны. Отсюда
<рст = К + 0,06 lg COt. (5.60)
Из зависимостей (5.59) и (5.60) для 573 К
d lg x/d lg Co2 = —anF • 0,06/tfT =
= —0,5 • 2 • 96,5 • 0,06/2,3 • 8,27 • 573 • IO"3 = —0,53.
Из экспериментальных данных значение (5.60) близко к —0,5. В
правой части зависимости (5.57) в соответствии с уравнением (5.42)
п. зависит от емкости двойного электрического слоя Llt которая, в
свою очередь, зависит от концентрации:
Cci = + К lg Cci-;
Лс1 = По^с\1Ьо = п0 [ (a!L0) + (К/Со) lg Cci-1 =
= «о (ai + Ki lg Cci-). (5.61)
В химически обессоленной воде, т. е. в отсутствие Cl-, Lo =
= 5 мкФ/см2. При Cci-<10-3 Н из экспериментальных данных
К = 3 мкФ/см2 и, соответственно, Кх = 0,6, а <рн,8 = —0,41 В прак-
тически не зависит от концентрации хлоридов.
Из зависимостей (5.59) и (5.61) при Со, = 0,14-0,3 мг/л, когда
Фет — 0,1 В, и0 = 2,
d lg x/d 1g Са- = —(an0F/RT) (<pCT — ф^)^ = -1,65. (5.62)
Из экспериментальных данных значение (5.62) близко к —1,5. С
учетом уравнений (5.58) и (5.62) и других величин, входящих в зависи-
мости (3.31), (3.32), при о ~ ат для температуры 573 К
1g т = 3,3 — 0,5 1g Со, — 1,5 lg Cci- (5.63)
Эта зависимость позволяет количественно оценить влияние содер-
жания кислорода и С1~ в среде на время до появления трещин, обус-
ловленных коррозией под напряжением аустенитной хромонике-
евой нержавеющей стали марки 08Х18Н10Т при температуре 573 К.
Из зависимостей (3.31) и (3.32) для температуры 573 К, когда о да-
в мегапаскалях (МПа),
Д 1g т/До = —vy/RT = —1,64 • 10-® • 150/19 • 0,573 =
= —2,26 • 10-2, ’
:ХбЛИЗК° К экспеРиментальным значениям. Эта зависимость дает
ВЛИЯОЖНОСТЬ В пеРВ0М приближении количественно прогнозировать
ние уровня напряжений на время до появления трещин.
123
R ппппессе эксплуатации может увеличиваться концентрация хлор,
иона на поверхности, где происходит кипение. Так, в слое отложений
нХктов коррозии имеются поры, образующие систему капилляров.
К» таких капилляров теплоноситель поступает к теплопере.
дающей поверхности, где происходит испарение. Образующийся „ар
уааяяется по другим капиллярам. При температурах порядка 573 К
оХорение хлоридов в паре невелико. В связи с этим концентрация
хлооидов в зоне испарения возрастает и в зависимости от толщины
слоя отложений продуктов коррозии может увеличиваться в К раз по
сравнению с концентрацией в объеме:
Толщина отложений, мкм 22 J0 ГС ^100^
Концентрирование хлоридов может происходить в зоне испарения
прямоточного парогенератора низкого давления, в парогенераторах
низкого давления при нарушении нормальной циркуляции и тепло-
обмена, в щелях и зазорах и т. п.
Вследствие протечек вода может попадать на трубопроводы, на-
гретые до температуры свыше 373 К, и испаряться на их поверхности.
Даже в случае протечек химически обессоленной воды на поверхности
трубопроводов в такой ситуации происходит концентрирование хло-
ридов.
Для борьбы с коррозией под напряжением в такой ситуации на по-
верхность трубопроводов методом металлизации наносится покрытий
из А1 толщиной 0,1 — 0,2 мм.
В качестве других мер борьбы с коррозией под напряжением
уменьшают концентрацию в теплоносителе С1~ и кислорода до
0,02 мк/кг и продуктов коррозии для уменьшения толщины отложе-
ний. Применяются также конструктивные меры по уменьшению про-
течек, ликвидации щелей и зазоров и т. д.
Для увеличения стойкости аустенитных нержавеющих сталей к
коррозии под напряжением увеличивается содержание никеля в них.
Стали практически не подвержены транскристаллитному коррозион-
ному растрескиванию при содержании Ni 40%. С повышением содер-
жания никеля увеличивается энергия дефектов упаковки и облегча-
ются поперечное скольжение дислокаций и перемещение их в новые
плоскости скольжения. Вероятность образования плоских скоплений
дислокаций при этом, естественно, снижается. В высоконикелевых
сплавах, содержащих 50—60% Ni, поперечное скольжение дислока-
ции столь существенно облегчено, что дислокации мигрируют через
все зерно и скапливаются у границ зерен. При этом зародыш трещины
образуется на границе зерен и высоконикелевые сплавы склонны к
межкристаллитному коррозионному растрескиванию.
Велика энергия дефектов упаковки и у сплавов алюминия. В си-
лу этого у сплавов алюминия облегчено поперечное скольжение дис-
локаций. В связи с этим сплавы алюминия так же, как и сплавы с вы-
соким содержанием никеля, склонны к межкристаллитному коррози-
онному растрескиванию.
124
Рис. 5.4. Диаграмма Веллера:
1 — усталость; 2 — коооозионная уста-
лость: АА — предел усталости: В — ус-
ловный предел коррозионной усталости
При содержании в нержавеющей стали Ni в количестве 7—8%
сталь становится не чисто аустенитной, а аустенитно-ферритной. В
ферритной составляющей (a-фазе), имеющей ОЦК-структуру, попе-
речное скольжение дислокаций облегчено. В связи с этим аустенитно-
ферритные стали более стойки к коррозии под напряжением, чем сталь
08Х18Н10Т.
При совместном воздействии на металл агрессивной среды и пере-
менных напряжений разрушение металла происходит вследствие кор-
розионной усталости. Переменное напряжение, не вызывающее в от-
сутствие коррозионной среды разру-
шения металла даже при очень боль-
шем числе циклов (107—108), назы-
вается пределом усталости. С ростом
числа циклов разрушающее напря-
жение снижается асимптотически,
приближаясь к пределу усталости
(АА на рис. 5.4). В присутствии аг-
рессивной среды металл не имеет пре-
дела усталости. Даже в отсутствие
переменных напряжений образец че-
рез достаточно длительное время раз-
рушится от коррозии. Для расчетов
принимается условный предел корро-
зионной усталости (В на рис. 5.4) —
минимальное переменное напряже-
ние, вызывающее разрушение метал-
ла за определенное число циклов,
например за 107 циклов. Существен-
ный вклад в исследование процессов
коррозионной усталости внесли со-
ветские ученыеА. В. Рябченков, И. Д. Томашов, Г. В. Карпенко и др.
Борьба с коррозионной усталостью ведется созданием в поверхностном
слое металла сжимающих усилий, например, обдувкой дробью, обкат-
кой роликом (это снижает опасность циклов растягивающих перемен-
ных напряжений), нанесением защитных покрытий, применением
электрохимической защиты. При знакопеременных нагрузках, от-
ветственных за усталостное разрушение металла, деформация при каж-
дом цикле нагружения не превосходит 0,1—0,2%.
При выходе на мощность и расхолаживании, а также при измене-
нии мощности в узлах ЯЭУ, например в местах вварки трубопроводов
в барабан-сепаратор, могут создаваться напряжения, превышающие
предел текучести. При этом, естественно, и деформация превысит 0,1%
и может достигать 0,5 и даже 1%.
Число остановов и пусков, когда возникает такая ситуация, огра-
ичено. В связи с этим и разрушение металла при знакопеременных
Вгрузках с деформацией выше 0,1—0,2%, и число циклов 108—104
лУчили название малоцикловой усталости.
Ли “Ыще указывалось, что процессу образования на поверхности ста-
при контакте с водой окисных пленок предшествует растворение
125
кислорода в металле. Кислород, диффундируя со временем в тлубь
ме™ образует вокруг дислокации облака Коттрелла. ПоследНИе
roZoS движение дислокаций, затрудняют переход их в другие Пло,
екСсти скольжения и тем самым способствуют образованию плоских
скоплений дислокаций и, соответственно, зародышей трещин. В связи
с этим контакт даже с химически обессоленной водой при температурах
пооядка 573 К снижает число циклов до разрушения вследствие ма-
лоцикловой усталости в 3—5 раз. Энергии активации диффузии кис-
лорода в аустените и феррите составляют соответственно 170,54 и
99 07 кДж/моль. При температуре 573 К коэффициент диффузии кис-
лорода в аустенитных сталях в 1,7 • 108 раз меньше, чем в перлитных.
Соответственно и разрушения от малоцикловой усталости следует
ожидать в первую очередь в случае применения в ЯЭУ сталей перлит-
ного класса. Плакирование поверхности, например, барабан-сепа-
ратора или коллекторов аустенитной нержавеющей сталью практи-
чески исключает опасность появления трещин вследствие малоцикло-
вой усталости.
В процессе эксплуатации может происходить трение деталей друг
о друга, например оболочки кассеты тепловыделяющей сборки и ди-
станционирующих устройств. В процессе трения разрушается защит-
ная окисная пленка. Процесс этот называется фреттинг-коррозией.
Вследствие развития фреттинг-коррозии может происходить разру-
шение сплавов циркония.
При нагреве в процессе сварки в аустенитных нержавеющих ста-
лях могут выпадать карбиды состава, близкого к Сг4С. Содержание
Сг и С в аустените по границам зерен уменьшается. Карбиды выпада-
ют преимущественно у границ зерен.
Из центра зерна Сг и С диффундируют к границам. Однако коэф-
фициент диффузии С на неколько порядков выше, чем у Сг. Поэтому
С, продиффундировавший к границам зерен, связывает новые порции
Сг в карбиды и тем самым интенсифицирует процесс обеднения аусте-
нита хромом. Содержание Сг при этом может упасть ниже 8%, т. е.
ниже первого порога устойчивости, составляющего 12%. В ситуации,
когда при стационарном потенциале аустенит с содержанием Сг
18% будет находиться в пассивном состоянии, а обедненные хромом
границы зерен — в активном, может развиться межкристаллитная
коррозия (МКК). МКК, как правило, развивается в кислых средах.
Для борьбы с МКК в аустенитные хромоникелевые нержавеющие ста-
ли вводят Ti и Nb, которые связывают углерод в прочные карбиды.
Можно также снижать содержание углерода в сталях, но этот путь
не технологичен и дорог.
§ 5.6. ВЛИЯНИЕ РАЗЛИЧНЫХ ФАКТОРОВ
НА КОРРОЗИЮ РЕАКТОРНЫХ МАТЕРИАЛОВ
Внешние факторы. К внешним факторам коррозии относятся фаК'
торы, связанные с коррозионной средой, ее составом, pH, температУ'
Р°й, давлением, наличием контактов с другими материалами и т. Д-
126
К внутренним факторам относятся состав и структура металла, сос-
тояние поверхности, наличие механических напряжений.
Влияние pH. Общего правила, позволяющего оценить влияние pH
среды на стойкость всех материалов, не существует. В каждом конкрет-
ном случае следует рассматривать влияние pH на кинетику катодно-
го и анодного процессов и через них на скорость коррозии. В нейтраль-
ной, насыщенной воздухом среде железо корродирует в активном сос-
тоянии с кислородной деполяризацией с диффузионным ограничени-
ем.
Изменение pH от 4 до 10 практически не сказывается при прочих
равных условиях на концентрации и диффузии кислорода, т. е. на
скорости катодного процесса, и также существенно не влияет и на
анодный процесс. В связи с этим в пределах pH от 4 до 10 скорость
коррозии железа остается практически постоянной. С уменьшением
pH ниже 4 концентрация ионов водорода возрастает, равновесный по-
тенциал водородного электрода увеличивается в такой степени, что
скорость водородной деполяризации повышается и становится соиз-
меримой со скоростью кислородной деполяризации и превышает ее.
В связи с этим стационарный потенциал увеличивается, что в соответ-
ствии с анодной поляризационной кривой растворения железа в ак-
тивном состоянии приводит к увеличению скорости коррозии железа
с уменьшением pH. При pH выше 11,3 железо в растворах, насыщен-
ных воздухом, пассивируется при стационарном потенциале. Есте-
ственно, скорость коррозии при этом резко снижается. При увеличе-
нии pH выше 14 при повышенных температурах гидроокисные защит-
ные пленки растворяются. Это приводит к тому, что при значениях
pH выше 14 скорость коррозии железа увеличивается.
Более легко прогнозировать поведение при различных pH амфо-
терных металлов, например алюминия, цинка. В этом случае как при
уменьшении, так и при увеличении pH от нейтрального скорость кор-
розии возрастает. Никель, кобальт, кадмий нестойки в кислых сре-
дах. В щелочных же растворах скорость коррозии их невелика бла-
годаря образованию защитных окисных и гидроокисных пленок. Ряд
металлов, такие как тантал, молибден, вольфрам, стойки в кислых
средах, но неустойчивы в щелочных растворах. Окисли их, являю-
щиеся ангидридами соответствующих кислот, растворимы в щелочах
и не оказывают защитного действия в средах с высокими значениями
Рп. Скорость коррозии благородных металлов — золота, платины,
Серебра — практически не зависит от pH среды.
Влияние окислителей. Окислители по влиянию их на стойкость
металлов можно разбить на две группы: 1) окислители, которые уве-
личивают скорость катодного процесса и практически не влияют на
инетику анодного процесса, и 2) окислители, которые увеличивают
М^Р^ТЬ годного процесса и тормозят анодный процесс растворения
К первой группе относятся, например, ионы трехвалентного желе-
л и ионы двухвалентной меди. Присутствие в среде таких окислите-
н Увеличивает скорость катодного процесса, а соответственно и по-
Щиал металла, поэтому увеличение содержания кислорода или окис-
127
ппивппит к возрастанию скорости коррозии, если ста-
лителей Ч>"“ Д0'вечает области активного растворения метал.
ционарныи потенциал отвечу кислорода или окислителей ста-
ла. Если с Увеличением ™^™одит активной оМасти в „at
ционарныи ^епн^ЛКоррозии снижается. Если при изменении кон-
сивную, ;°2теХионарный потенциал останется в преде.
центрации °™^иТ^еи CK0D0CTb коррозии не изменится. При очень
лаХ паЯсиквХнтоации’окислителей стационарный потенциал перехо-
^Тмссивной области в область перепассивации, что сопровожда-
ется повышением скорости коррозии. Таким образом, в общем слу-
чае vSSe концентрации окислителя не влияющего на скорость
аноднюго процесса, может различным образом влиять на стойкость
пассивирующихся материалов.
^Замедлители. Ко второй группе можно отнести перманганаты,
нитриты хроматы. Взаимодействуя с поверхностью металла, эти окис-
лители тормозят скорость анодного процесса, пассивируя металл. Поэ-
тому такие окислители называют анодными пассиваторами или анод-
ными замедлителями коррозии, а часто просто замедлителями или
ингибиторами. Пассивация металла анодными замедлителями про-
исходит вследствие образования на его поверхности адсорбционных
или фазовых защитных слоев.
Обычно для существенного снижения скорости коррозии железа
или сталей при температурах до 353 К концентрация замедлителя
должна составлять 1—5 г/л. В качестве замедлителей коррозии ста-
лей применяют хроматы, нитриды, силикаты, жидкое стекло, молиб-
даты, алюминаты. При недостаточной концентрации замедлителя часть
поверхности металла не пассивируется и остается в активном состоя-
нии. При этом возникает опасность язвенной коррозии. Часто такое
явление наблюдается в щелях, куда доступ замедлителя затруднен
из-за диффузионных ограничений. Присутствие в среде активаторов,
например хлоридов, увеличивает опасность язвенной коррозии в слу-
чае недостатка замедлителя. В общем случае, чем выше концентрация
активаторов, тем больше должна быть и концентрация замедлителя.
Следует отметить, что замедлители защищают лишь металл, кон-
тактирующий с раствором. По ватерлинии и выше нее замедлители
рассматриваемого типа металл не защищают. Для защиты металла
по ватерлинии и выше нее применяют так называемые летучие инги-
Летучие ингибиТ0Ры, например нитриты, карбонаты и бензо-
^ициклогек1£иламина и моноэтаноламина, обладают высокой уп-
РУ □ Пара‘ ®следствие этого молекулы этих соединений перехо-
ются ия отельных количествах в газовую фазу и оттуда адсорбиру-
линии ЦпЛерХН0С™. металла> находящегося, например, выше ватер]
зию м₽тяппяИКп°ЩИЙ ПрИ Э10М сорбционный слой тормозит Koppo-J
для зяпшткг и»гибиторы находят применение, в частности]
консрпТятт 1 °Т корР°зии баков водяной защиты, для предмонтажно]
ко СЛРВ^ИЗДеЛИЙ И3 углеР°дистых сталей при хранении их в упа
должна ^ТВеНН°’ емкость’ где применяются летучие ингибиторы'
лий обпябя^ геРметизиР°вана- Для этих же целей поверхность изде
Р ывают водными растворами нитрита с соответствующи
128
ми загустителями. После обработки на поверхности металла созда-
ется слой нитрита, предохраняющий изделие от коррозии.
При травлении металлов с целью удаления с их поверхности про-
дуктов коррозии, окалины в кислоты для уменьшения коррозии стали
вводят высокомолекулярные органические соединения, содержащие
серу и азот. Такие соединения называются ингибиторами коррозии.
Примером ингибитора может служить присадка ЧМ, широко приме-
няющаяся при травлении металлов.
Влияние кислорода. Возвращаясь к действию окислителей, рассмот-
рим влияние кислорода, растворимого в воде, на стойкость железа и
углеродистых и низколегированных сталей.
При концентрации О2 менее 0,2 мг/кг стали перлитного класса в
химически обессоленной воде в области температур 293—353 К нахо-
дятся в псевдопассивном состоянии и скорость коррозии их низка
[0 02—0,06 г/ (м2 • сут)]. С увеличением концентрации О2 возраста-
ет’скорость катодного процесса и соответственно стационарный потен-
циал, который попадает в область активного растворения. В такой си-
туации с увеличением концентрации О2 растет и скорость коррозии.
При достаточно высокой скорости анодного процесса у поверхно-
сти металла существенно повышается концентрация продуктов кор-
розии. Скорость отвода их от поверхности металла в глубь раствора,
определяемая интенсивностью диффузии, контролирует скорость анод-
ного процесса растворения металла. В такой ситуации последняя не
зависит от потенциала и определяется величиной предельного анод-
ного диффузионного тока id. При комнатной температуре id =
= 10-2 А/см2, что соответствует растворению в 1с слоя железа тол-
щиной 3,6 • 10-7 см.
Для того чтобы в таких условиях на поверхности металла образо-
валась защитная окисная пленка, необходимо, чтобы кислород за 1 с
продиффундировал в металл на глубину больше 3,6 • 10-7 см. Заме-
тим, что при увеличении с концентрацией кислорода стационарного
потенциала металла возрастает и энергия поверхностных атомов, со-
ответственно уменьшается энергия активации диффузии. Коэффи-
циент диффузии кислорода в a-Fe при этом составит
D — 3,7-10-2- io-<"-anFzi<₽)/Rr.
Глубина перемещения фронта диффузии S (см) может быть оценена
по зависимости S2 ~ Dx.
Для того чтобы могла образоваться защитная пленка, должно вы-
полняться равенство
(3,6* 10_7)2~3,7- 10-2- 10“(99—°.5 • 2• ЭбДф)/19 • 298- ю-з
Из зависимости (5.64) Дер — фст — фн з ~
^юда Фст ~ о,ОО В.
Значительное снижение скорости коррозии стали 20 наблюдает-
-п₽и Фст = 0,1 -т- 0,11 В, что отвечает Со, = 16 -? 40 мг/кг
(табл. 5.3),
Ся В некоторых случаях присутствие в среде веществ, не являющих-
5 Числителями, может сказаться на интенсивности образования за-
Зак. 369 J29
(5.64)
Фст - (—0,37) = 0,35.
Таблица 5.3
Влияние кислорода на скорость коррозии стали 20
Концентрация О,, мг/кг гоЛ_» в к. г/(м’-сут) Концентрация О,, мг/кг Фет’ В К, Г/(мг.суг)
4 8—10 —0,34—0,4 —0,2 0,18 2,9 16 40 —0,11 0,1 0,53 0,17 — —!
щитных слоев и, следовательно, на коррозионной стойкости металлов.
Так есть вещества, способные образовывать с металлами раствори-
мые комплексные соединения. Естественно, при этом образование за-
щитных слоев исключается и металл, образующий комплексные сое-
динения, растворяется в активном состоянии. Однако при определен-
ных условиях, например при увеличении температуры, комплексные
соединения разлагаются и атомы металла образуют окислы. Послед-
ние, отлагаясь на поверхности металла, за короткое время образуют
защитную пассивирующую пленку, снижающую коррозию металла.
Влияние температуры. Скорость анодного процесса в активном
и пассивном состояниях увеличивается с ростом температуры. Скорость
катодного процесса водородной деполяризации также растет с темпе-
ратурой. Эффективность кислородной деполяризации не всегда растет
с температурой. Эффективное конвекционное размешивание горячего
раствора уменьшает толщину диффузионного слоя. Следует иметь в
виду, что с ростом температуры в системе, сообщающейся с атмосфе-
рой, растворимость кислорода падает. В связи с этим с ростом темпера-
туры значение предельного диффузионного тока и скорость коррозии в
открытой системе проходят через максимум. В закрытой системе пре-
дельный диффузионный ток и коррозия непрерывно растут с темпера-
турой. При 293 К кислородная и водородная ветви катодной поляри-
зационной кривой отстоят друг от друга на 0,5—1,0 В. С ростом тем-
пературы обе ветви сближаются и при 473 К сливаются, т. е. иониза-
ция кислорода и разряд ионов водорода происходят при практически
одинаковых потенциалах.
Коррозия всех реакторных материалов в воде и паре растет с тем-
пературой. Особенно резко увеличивается коррозия перлитных ста-
лей при температурах выше 673 К. Следует, однако, иметь в виду,
что с ростом температуры интенсифицируется диффузия кислорода
в металл, а соответственно и рост защитных окисных пленок. В насы-
щенном паре скорость коррозии такая же, как и в воде при той же тем-
пературе. В перегретом паре коррозия менее интенсивна, чем в воде
при той же температуре.
Изменение давления воды и пара не сказывается на стойкости пер-
литных и нержавеющих сталей. Скорость коррозии сплавов алюминия
растет с давлением пара.
Если один участок металла нагрет до высокой температуры, а ДР У'
гои находится при низкой температуре, между этими участками ио3'
пикает разность потенциалов и образуется термогальваническая
макропара. Анодом является более горячий участок металла. Термо-
гальваническая макропара, как правило, работает с катодным контро-
лем при диффузионном ограничении. В связи с этим при малой пло-
щади анода, большой площади катода, интенсивном перемешивании
среды термогальваническая коррозия может представлять серьезную
опасность.
Влияние движения среды. Движение воды приводит к уменьшению
толщины диффузионного слоя и к интенсификации коррозии, проте-
кающей с диффузионным ограничением.
При изменении сечения трубопроводов, в местах изгибов и при
других изменениях гидродинамических характеристик потока наблю-
дается процесс эрозии. Разрушение в процессе эрозии защитной окис-
ной пленки приводит к выходу из строя оборудования. Такие разру-
шения наблюдаются на гибах и в местах завальцовки в трубные
доски подогревателей низкого и высокого давления при температурах
403—473 К. При этих температурах интенсивность диффузии кисло-
рода в железо еще мала, соответственно невелика и скорость роста за-
щитной окисной пленки магнетита. Введение в химически обессолен-
ную воду кислорода в количестве не более 0,2 мг/кг интенсифициру-
ет рост защитной окисной пленки и существенно повышает стойкость
оборудования конденсатно-питательного тракта.
Увеличение скорости воды практически не сказывается на стойко-
сти нержавеющих сталей, находящихся при стационарном потен-
циале в пассивном состоянии. При скорости воды 5—10 м/с происхо-
дит размывание медных и латунных труб. Легирование латуней мышья-
ком увеличивает их стойкость в движущейся воде.
Контактная коррозия. В ЯЭУ практически невозможно избежать
контактов различных материалов, различающихся по электрохими-
ческим характеристикам и, в первую очередь, по стационарному по-
тенциалу. Металл, потенциал которого более отрицателен, является
в такой гальванической паре анодом и разрушается вследствие кон-
тактной коррозии. Примером такой коррозионной пары может быть
контакт алюминиевого сплава с нержавеющей сталью. При протека-
нии в гальванической паре тока потенциалы электродов изменяются.
Явление это называется поляризацией электродов.
В простейшем случае изменение потенциала электрода прямо про-
порционально плотности поляризующего тока. Рассмотрим для этого
случая эффективность работы гальванической коррозионной пары.
'-'Ценим значение тока пары и соответственно количество растворив-
шегося металла. При работе гальванической пары в ней протекает не-
который ток /. Под влиянием этого тока за счет поляризации электро-
дов потенциал их изменяется на Дф. Величина, характеризующая
связь изменения потенциала электрода с током, называется поляриза-
ционным сопротивлением Р: Д<р = PI.
Разность потенциалов катодов и анода фк — фа равна сумме па-
лений потенциалов в гальванической цепи:
фк •— фа = Дфк + Дфа + Дфме + ДфД,
5*
131
a. — омическое падение потенциала в металле, равное вслед-
где Дерме чпектоопооводности металла нулю; Деря — омическое
равное 1R (где R - сонротнв^
падение поте ц = р _ изменение потенциала катода за
^я^изаши; Дф. = Р.1 - изменение потенциала анода за счет
поляризации.
Рис. 5.5. Коррозионная диаграмма гальванической пары, частично (а) и полно-
стью (6) заполяризованной
Последнее уравнение можно переписать в виде
Ф» - Ф» = PJ + Ра/ + £/ = I (Рк + Ра + R) = ДфО,
откуда
I = ДФ°/ (Рк + Ра + R).
Графически этот случай представлен на рис. 5.5, а. Если раствор
имеет высокую электропроводность, R близко к нулю, и
/= Аф°/(РК + Ра).
В простейшем случае Рл = tg а и Рк = tg ₽ (см. рис. 5.5, б). Ес-
ли R 0, система полностью заполяризована и потенциалы обоих
электродов становятся равными ф (см. рис. 5.5, б). Изменение потен-
циала электрода при прохождении через него тока, т. е. при поляри-
зации, может быть представлено графически в виде поляризационных
кривых (см. рис. 5.5). В простейшем случае имеет место линейная за-
висимость между изменением потенциала и током или плотностью
тока. В ряде случаев линейная зависимость наблюдается в полулога-
рифмических координатах (ф — 1g /) (рис. 5.6). Поляризационное
сопротивление, пропорциональное тангенсу угла наклона поляриза-
ционной кривой, определяет скорость электродного процесса. Чем
больше угол наклона, тем более замедлен процесс, и наоборот. Следу-
ет помнить, что скорость электродных реакций следует сравнивать при
одинаковых потенциалах.
132
Совокупность катодной и анодной поляризационных кривых пред-
ставляет собой коррозионную диаграмму данного коррозионного про-
цесса. Поскольку скорости катодного и анодного процессов с необхо-
димостью равны, точка пересечения катодной и анодной кривых отве-
чает стационарному, установившемуся потенциалу системы и скоро-
сти самих электродных процессов. Если процесс характеризуют поля-
ризационные кривые ОА и (см. рис. 5.6), то коррозия идет с кис-
лородной деполяризацией, причем с кинетическим ограничением ка-
тодного процесса. При поляризационных кривых OAL и KL наблюда-
ется коррозия с кислородной де-
поляризацией при диффузионном
ограничении. В случае поляриза-
ционных кривых OALBC и ST кор-
розия идет с водородной деполяри-
зацией. Предельный диффузионный
ток по ионам водорода достигается
на практике крайне редко. Корро-
зия большинства важных для тех-
ники материалов в нейтральных
средах протекает с кислородной де-
поляризацией при диффузионном
ограничении. Толщина диффузион-
ного слоя при этом в искусственно
неразмешиваемых электролитах
принимается обычно равной 0,05 мм.
Рис. 5.6. Коррозионная диаграмма в
обычных (а) и полулогарифмических
координатах (б)
Выше указывалось, что электродвижущая сила коррозионного
элемента расходуется на преодоление омического и поляризационных
падений потенциала: Д<р° = Дфк + Д<ра + Д<Рт?- В зависимости
от соотношения этих величин коррозионный процесс может идти либо
преимущественно с каким-нибудь одним видом ограничения (омичес-
ким или поляризационным катодным, или анодным), либо со смешан-
ным. Отношение одного вида падения потенциала к первоначальной
разности потенциалов, выраженное в процентах, характеризует сте-
пень контроля:
(Д<рк/Дф°) 100 — степень катодного контроля;
(Д<ра/Дф°) • 100 — степень анодного контроля;
(Дф^/Дф°) • 100 — степень омического контроля.
В случае полностью заполяризованных систем, когда омическое
падение потенциала мало, коррозия может идти или с катодным, или
с анодным, или со смешанным ограничением (контролем). Разница
между стационарным и начальным потенциалами катода и анода (Дфк
и Афа). которую легко получить из коррозионных диаграмм, дает пол-
ное представление о характере контроля в данном коррозионном про-
цессе.
Процесс называют контролирующим, если изменение именно его
скорости отражается на эффективности коррозии. Как следует из кор-
розионной диаграммы, представленной на рис. 5.6, изменение в широ-
ких пределах наклона прямой K_L, т. е. изменение скорости анодного
133
nnortecca не скажется на скорости коррозии, поскольку в интервале
потенциалов АВ скорость катодного процесса не зависит от потен-
циала В этом случае контролирующим фактором будет скорость ка-
тодного процесса и коррозия идет с преимущественно катодным огра-
НИ<Из рассмотренных представлений следует, что для борьбы с кон-
тактной коррозией следует увеличивать удельное электрическое соп-
ротивление водного теплоносителя, т. е. уменьшать солесодержа-
ние воды и ее электропроводность, снижать содержание кислорода.
Ослабить контактную коррозию в паре сплав алюминия—нержавею-
щая сталь можно созданием на поверхности сплава алюминия окис-
ной пленки методом анодирования. Наиболее эффективна окисная
пленка толщиной 50—60 кмкм, получаемая методом толстослойного
анодирования. Полезно также разделение стальных и алюминиевых
деталей сменной алюминиевой деталью, называемой часто протекто-
ром или проставками из сплавов Zr или Ti. Как правило, для борьбы
с контактной коррозией применяется комплекс мероприятий.
В щели, образовавшейся при контакте деталей из одного и того
же материала, накапливаются продукты коррозии, чаще всего в виде
гидроокисей. Диффузионный обмен между средой в щели и объеме за-
труднен.
Гидроокиси, как правило — труднорастворимые соединения. Тем
не менее диссоциация их в щели приводит к подщелачиванию среды
до pH = 8,5-^-9,0. При указанных значениях pH коррозия интенси-
фицируется. В связи с этим при наличии щелей коррозия сплавов
алюминия интенсифицируется.
Внутренние факторы, легирование. Коррозионная стойкость реак-
торных материалов существенно зависит от их состава и структуры.
В громадном большинстве практически важных случаев сплавы с го-
могенной структурой, например твердые растворы, более коррозион-
но-стойки, чем сплавы гетерогенные. Структурные составляющие ге-
терогенных сплавов имеют различные электрохимические свойства.
Интерметаллические соединения. В алюминиевых сплавах, ис-
пользуемых в реакторостроении, при температурах до 473 К содержа-
ние re, N1, Си составляет 0,5—1 % каждого. Эти элементы образуют с
интерметаллические соединения, например FeAl3. Энергия кристал-
лической решетки его
Е АН — (ДЯреА1, — #Реат — ЗЯд1ат) = 1456кДж/моль =
= 364 кДж/моль,
где ДДреА!, 112 кДж/моль; Нре = —405 кДж/моль — энталь-
пия в атомарном состоянии; ЯА1 = —313 кДж/моль. Энергия же
кристаллической решетки Al £А1 = 313,5 кДж/моль.
Согласно эмпирической зависимости, работа выхода е<р связана с
—е<? а*6 1 кристаллической решетки (кДж/моль) зависимостью Де<р =
Из зависимостей (5.30)—(5.36) следует, что от работы выхода
зависит <рн#3 и соответственно перенапряжение и абсолютная скорость
кислородной и водородной реакций деполяризации. В частности, раз-
ность перенапряжения этих реакций Дт) на интерметаллическом сое-
динении и А1
Дт] = —2,4 • 10~8Д£ = —2,4 • 10"» (364 — 313) = —0,12 В.
Уменьшение перенапряжения, а соответственно и увеличение ско-
рости катодных реакций приводит к увеличению стационарного по-
тенциала. Если сплав при этом находится в активном состоянии, ско-
рость коррозии его возрастает. При температуре 473 К и выше, когда
коэффициент диффузии возрастает и, соответственно, интенсифици-
руется рост защитных окисных пленок, увеличение стационарного
потенциала способствует образованию защитных окисных слоев. Дей-
ствительно, легирование алюминием сплавов Fe, Ni, Си увеличивает
их коррозионную стойкость при высоких температурах и снижает при
363 К.
Твердые растворы. Энергия кристаллической решетки сплава мо-
жет уменьшиться на величину’^ [см. зависимость (3.24)] вследствие
ее деформации при образовании твердых растворов замещения и внед-
рения. Это увеличивает скорость анодного процесса при коррозии в
активной области. Присутствие атомов легирующего элемента также
изменяет энергию кристаллической решетки.
Вместе с тем введение в сплав элемента с большим сродством к
кислороду может облегчить пассивацию сплава. Радиусы ионов же-
леза и кислорода соответственно равны 0,08 и 0,14 нм. Поэтому кисло-
род может блокировать только два атома. Для того чтобы сущест-
венно изменились характеристики пассивирующего слоя, один из этих
атомов должен быть атомом легирующего элемента. В кристаллогра-
фической плоскости (100) на одну элементарную ячейку a-Fe с ОЦК-
решеткой приходится (1/8) • 4 = 0,5 атома. В рассматриваемой ситуа-
ции в плоскости (100) должно быть 0,25 атома легирующего элемента.
На одну элементарную ОЦК-ячейку приходится (1/8) -84-1=2.
Если активность атома легирующего элемента X, то должна выпол-
няться следующая зависимость: X • 2 = 0,25. Отсюда X = 0,125, и
атомное содержание легирующего элемента, при котором существен-
но повышается коррозионная стойкость сплава, должно составлять
12,5%. Действительно, так называемый первый порог устойчивости
достигается при содержании Сг в стали 13%. В нержавеющей сталях
с содержанием Сг 13—14% фляде-потенциал близок к потенциалу
чистого Сг. При содержании Сг 25% вся плоскость (100) состоит из
атомов Сг. В практике известны стали марки Х25.
В ряде случаев состояние поверхности металла может отражаться
на его стойкости. Полировка уменьшает истинную площадь поверх-
ности и тем самым снижает коррозионные потери, отнесенные к еди-
нице видимой поверхности. Этот эффект проявляется в первые часы
взаимодействия металла со средой. После образования на поверхности
металла пленки продуктов коррозии влияние предварительной обра-
ботки поверхности перестает сказываться. Следует также заметить,
что на поверхности с высокой чистотой обработки (например, электро-
полированной) легче выявляются производственные дефекты.
135
§ 5.7. ВЛИЯНИЕ ОБЛУЧЕНИЯ НА КОРРОЗИОННЫЕ ПРОЦЕССЫ
Изменение электрохимических и коррозионных характеристик ме-
таллов при облучении происходит в основном под действием радио-
лнзного, радиационно-электрохимического и деструкторующего эф-
фектов.
Радиолизный эффект обусловлен изменением состава коррозион-
ной среды вследствие радиолиза ее, радиационно-электрохимический
эффект — увеличением энергии поверхностного слоя атомов при по-
глощении энергии излучения, деструктирующий эффект — измене-
нием структуры (деструкцией, образованием микродефектов) защит-
ной окисной пленки в результате бомбардировки ее частицами с вы-
сокой энергией.
Радиолизный эффект. В насыщенной воздухом химически обессо-
ленной воде под действием ионизирующего облучения образуются кис-
лород, перекись водорода и короткоживущие радикалы. Концентра-
ция стабильных продуктов радиолиза (О2, Н2О2) достигает 0,001 М.
При комнатной температуре в насыщенной воздухом воде растворено
приблизительно 10 мг/л (3,10 • 10-4 М) О2.
Коррозия перлитных сталей в насыщенной воздухом воде протека-
ет с диффузионным контролем. За счет увеличения концентрации окис-
лителей скорость коррозии в этом случае должна увеличиться в
10~®/ (3,1 • 10~*) ~ 3,2 раза. При комнатной температуре облуче-
ние с плотностью потока нейтронов 1012 см-2 • с-1 увеличивает ско-
р сть коррозии стали 20 за счет радиолизного эффекта в 3—5 раз. В
кипящих реакторах вследствие радиолиза содержание кислорода в
контурной воде может достигать 0,3 мг/кг. Нержавеющие стали и
сплавы циркония в условиях работы активной зоны находятся в пас-
сивном состоянии и увеличение концентрации кислорода слабо сказы-
вается на их коррозионной стойкости. На сталях перлитного класса
при температурах порядка 573 К образуется фазовая защитная окис-
ная пленка. При этом увеличение содержания кислорода до 0,1—
0,3 мг/кг сказывается на их коррозионной стойкости незначительно.
Радиационно-электрохимический эффект. В активной зоне совре-
менных реакторов атомы металла, в том числе и поверхностные, полу-
чают энергию порядка 10“6 эВ/ (ат • с). В деаэрированной химически
обессоленной воде при температуре 573 К перлитная сталь на дне пор
в окисной пленке находится в активном состоянии. Энергия актива-
ции анодного процесса в активном состоянии может быть принята
о ккал/моль 0,22 эВ/ат — 20,9 кДж/моль. Если даже вся энергия,
полученная поверхностными атомами в поле облучения, пойдет на уве-
личение их энергии, то 0,22 эВ/ат атом приобретет за т = 0,22/Ю-5 =
2,2 • 104 с.
В монослое на 1 смi 2 находится 10-8 молей. В первом приближе-
нии можно принять, что с периодичностью 2,2 • 104 с все поверхност-
ные атомы принимают участие в анодном процессе, образуя двухвалент-
ные ионы. Скорость анодного процесса составит
i 10 8 • 106 2/ (2,2 104) ~ 10-7 А/см2
136
(10s Кл моль — число Фарадея), что отвечает скорости коррозии
2 8 • 10-2 г (м2 • сут). Площадь пор составляет 1—3%, т. е. прирост
коррозии за счет радиационно-электрохимического эффекта не дол-
жен превышать 10-8 г/ (м2 • сут). При длительности испытаний
Ю4 ч скорость коррозии в рассматриваемых условиях близка к
0 01 г (м2 • сут). Таким образом, скорость коррозии сталей перлит-
ного класса за счет радиационно-электрохимического эффекта может
увеличиться почти на 10%. На практике же скорость коррозии пер-
литных сталей под влиянием облучения может возрастать в несколь-
ко раз.
Деструктурирующий эффект. В процессе облучения в защитной
окисной поленке, образующейся на поверхности металла, возникают
радиационные дефекты.
При температуре 573 К коррозия реакторных материалов в водных
средах определяется переносом ионов металла и кислорода поверхно-
стной диффузией через защитную окисную пленку. В первом прибли-
жении можно принять, что в окисной пленке ионы кислорода образу-
ют плотноупакованную решетку. При этом радиус октаэдрических пор
г = 0,414го = 0,414 0,14 ~ 0,06, где г0 = 0,14 нм — радиус иона
кислорода.
В результате облучения кристаллическая решетка искажается.
Ион кислорода внедряется в октаэдрическую пустоту. С учетом зави-
симости (3.47) максимальная деформация кристаллической решетки
е = (г0 — г)/2г0п = (0,14 — 0,06)/ (2 • 0,14 • 3,6) ~ ,08.
Энергия искажения кристаллической решетки при этом составит
при К ~ 10-3
Q = е2/К = 6,4 • 10_3/10_3 = 6,4 кДж/моль.
На это значение уменьшается энергия активации диффузии. Отсю-
да отношение скорости коррозии, контролируемой диффузией через
окисиую пленку при облучении и без него,
А'обл/К^ 10(0.5-6,4/(19,1.573.10-3)^2.
При температуре, близкой к 573 К, скорость коррозии перлитных
и нержавеющих сталей, сплавов циркония, т. е. тех материалов, на
которых образуется защитная окисная пленка, при облучении возрас-
тает в 1,2—4,4 раза.
При флюенсе нейтронов 1020—1021 см-2 число радиационных дефек-
тов в нержавеющей стали, а соответственно число атомов, имеющих
повышенную энергию, значительно. Это влияет на динамику дисло-
каций и увеличивает склонность аустенитных нержавеющих сталей к
коррозионному растрескиванию.
137
Глава 6
РАДИОЛИЗ ВОДЫ
§ 6.1. ХАРАКТЕРИСТИКА ИЗЛУЧЕНИЯ ЯДЕРНОГО РЕАКТОРА
Ядерный реактор является мощным источником излучения нейтро-
нов у-квантов, р- и а-частиц, осколков деления. Эти виды излучения
при прохождении через среду вызывают ее ионизацию и называют-
ся ионизирующими.
Единицей энергии ионизирующего излучения служит внесистем-
ная единица'электронвольт (эВ). Электронвольт — это энергия, кото-
рую приобретает заряженная частица, несущая один элементарный
заряд (заряд электрона), при перемещении в электрическом поле меж-
ду точками с разностью потенциалов 1 В. В ядерной технике широко
используется в качестве единицы энергии излучения мегаэлектрон-
вольт: 1 МэВ = 106 эВ.
'у-Излучение часто характеризуют длиной волны. Связь между дли-
ной волны Л и энергией излучения Е выражается зависимостью Е =
= 12400/%.
Доза излучения характеризует поле излучения или поле радиации
и определяет его ионизационную способность.
Следует различать поглощенную и так называемую экспозицион-
ную дозы излучения. Экспозиционная доза рентгеновского и у-излу-
чений характеризует ионизирующую способность излучения. В еди-
ницах СИ единицей экспозиционной дозы рентгеновского и у-излуче-
ния является кулон на килограмм (Кл/кг).
Кулон на килограмм равен экспозиционной дозе фотонного излу-
чения, при которой сумма электрических зарядов всех ионов одного
знака, созданных электронами, освобожденными в облученном возду-
хе массой 1 кг при условии полного использования способности элек-
тронов, равна 1 Кл.
За интенсивность направленного излучения принимают энергию
излучения, проходящего за 1 с через 1 сма сечения, перпендикуляр-
ного к направлению излучения; единицы измерения: ватт на квадрат-
ный метр в секунду [Вт/ (м2 • с)]; внесистемная единица измерения —
электронвольт на квадратный сантиметр в секунду [эВ/ (см2 • с)].
Для’ характеристики нейтронного излучения обычно использу-
ют понятия плотности потока, характеризующейся количеством ней-
тронов, проходящих через 1 см2 нормально расположенной поверхно-
сти за 1 с, и интегрального (по времени) потока; единицы измерения:
нейтрон на квадратный сантиметр в секунду [нейтр./ (см2 • с)] и ней-
трон на квадратный сантиметр (нетр./см2) соответственно.
Величиной, характеризующей взаимодействие излучения с ве-
ществом, является поглощенная доза, или доза облучения. Под по-
глощенной дозой понимают энергию ионизирующего излучения, по-
глощенную единицей массы облученного вещества. Единицей погло-
щенной дозы ионизирующего излучения любого вида является джо-
уль на килограмм (Дж/кг), или грей (Гр).
138
Отметим, что понятие «ионизирующее излучение» в определении
поглощенной дозы означает, что при поглощении электронов в вещест-
ве надо учитывать только их ионизационные потери и ту часть радиа-
ционных потерь, которой соответствует тормозное излучение, погло-
щенное в самом веществе; при поглощении нейтронов надо учитывать,
что ионизация создается не только ядрами отдачи, но и у-излучением,
возникающим в результате реакции (п, -у) радиационного захвата.
Мощность поглощенной дозы — поглощенная доза излучения, от-
несенная к единице времени; единицы измерения: ватт на килограмм
(Вт/кг) и грей в секунду (Гр-с).
Соотношения между основными единицами радиоактивности и ио-
низирующих излучений приведены в табл. 6.1.
Таблица 6.1
Соотношения между различными дозиметрическими единицами
1 расп-с== 27,027-10“12 Ки—10-® Рд (резерфорд) =1 Бк (беккерель)
1 эрг=10-7 Дж=6,24-103 МэВ = 6,24-1011 эВ
1 кал=4,185-10г эрг
1 эВ= 1,602-10-12 эрг
I Кл/кг=3,87672-103 Р (рентген)
1 Р=257,976-10-® Кл/кг
1 Р=0,877 рад в воздухе=0,98 рад в мягкой ткани=0,96 рад в воде (для энер-
гии у-квантов ~1 МэВ) =2,08-109 пар ионов в 1 см3 воздуха = 1,61-1012 пар
ионов на 1 г сухого воздуха
I А/кг=3,87672-103 Р/с
1 Вт/м2=103 эрг/(см2-с) =6,24-1014 эВ/(см2-с)
1 Дж/кг=104 эрг/г=100 рад
1 Вт/кг=104 эрг/(г-с) = 100 рад/с
Радиационно-химический выход — основная количественная ха-
рактеристика любой реакции, протекающей под действием ионизирую-
щего излучения. Он обозначается буквой G и равен числу молекул,
атомов, ионов, свободных радикалов и т. п., образующихся или расхо-
дуемых при поглощении системой 100 эВ энергии ионизирующего из-
лучения. Нижним индексом служит химическая формула соответст-
вующего вещества.
Например, Gh, обозначает число молекул водорода, образовав-
шихся в начальный момент при поглощении 100 эВ энергии излуче-
ния. Этот выход радиолиза является начальным выходом, а не наблю-
даемым, так как не характеризует суммарного процесса реакции. Сум-
марный радиационный выход с учетом всех реакций, протекающих в
сРеде, обозначается G(h2> (химическая формула вещества заключена
к круглые скобки). Если перед формулой в скобках стоит минус, то
это означает, что данное вещество под действием излучения разлага-
ется. Например, G(_н2) показывает число молекул воды, разлагаю-
щихся под действием 100 эВ поглощенной энергии излучения.
Значение радиационно-химического выхода зависит в первую оче-
Редь от типа радиационной реакции. Для нецепных реакций радиа-
ционный выход невелик (до 10—15 молекул] на 100 эВ). В случае
139
цепных процессов это значение может достигать десятка—-сотен тысяч
молекул на 100 эВ. Чтобы определить G, необходимо знать поглощен-
ную дозу и концентрацию образовавшихся или разложившихся про-
дуктов. И наоборот, зная радиационный выход и поглощенную дозу,
можно определить изменение концентраций участников радиационно-
химической реакции. На практике находят из кинетических кривых
зависимости концентрации продукта реакции от поглощенной дозы.
Для расчета используют начальный участок кинетической кривой.
Рис. 6.1. Зависимость концентра-
ции выделившегося водорода С
от поглощенной, дозы D при облу-
чении 1 н. раствора гидроокиси
натрия, насыщенного азотом.
Пунктиром проведена касательная,
по наклону которой вычисляется
начальный радиационно-химиче-
ский выход
Если отклонение от линейности начинается с самых первых экспери-
ментальных точек, то величина G вычисляется по касательной, прове-
денной из начала координат к экспериментальной кривой (рис. 6.1).
Значения величин G представлены в табл. 6.2.
Таблица 6.2
Радиационный выход продуктов радиации чистой воды, молекул/100 эВ
Излучение Начальное значение ЛПЭ, эВ/нм Продукты радиолиза
Н2О н, Н+*а9 Н eaq Н2О2 НО2 ОН
Р, V Быстрые 0,2 3,74 0,44 2,86 0,55 2,31 0,7 0,0 2,34
нейтроны 40 2,97 1,12 0,72 0,36 0,36 1,00 0,17 0.47
10В (п, a)’ Li 240 3,30 / • 1,70 0,2 0,16* 0,04* 1,3 0,3 0.1
* Расчетные значения.
В радиационной химии поглощенную дозу обычно выражают в
электронвольтах на миллилитр или на грамм (эВ/мл или эВ/г), а мощ-
ность поглощенной дозы — в электронвольтах на миллилитр или на
грамм в секунду [эВ/ (мл • с), эВ/ (г • с).
§ 6.2. ВЗАИМОДЕЙСТВИЕ ИЗЛУЧЕНИЯ С ВЕЩЕСТВОМ
Ионизирующее излучение при прохождении через среду передает
ей всю свою энергию или часть ее. Рассмотрим принципы взаимодей-
ствия с веществом электронов, тяжелых заряженных частиц, электро-
магнитного излучения и нейтронов.
140
Существует несколько механизмов взаимодействия электронов с
веществом, при которых энергия электронов уменьшается. Основные
из них: эмиссия тормозного электромагнитного излучения, неупру-
гие и упругие соударения. При низкой энергии электронов сущест-
венное значение приобретает упругое рассеяние: изменение направ-
ления движения без перехода кинетической в какие-либо другие вилы
энергии.
Заряженные частицы с большой энергией, проходя вблизи ядер
атомов, могут тормозиться и испускать электромагнитное (тормозное)
излучение. Энергия частиц по мере прохождения через вещество умень-
шается (теряется). Скорость потери энергии на единицу длины про-
бега в веществе прямо пропорциональна массе частицы. Таким обра-
зом, потери энергии на излучение больше для легких частиц при взаи-
модействии с веществом с большим атомным номером. Ниже 0,1 МэВ
потери энергии на излучение незначительны, но они резко возрастают
с увеличением энергии и в интервале 10—100 МэВ становятся преоб-
ладающими. Если тормозное излучение не поглощается в материале,
облучаемом электронами, оно не производит в нем никаких существен-
ных изменений. Если энергия электронов настолько мала, что тор-
мозное излучение не возникает, энергия частицы расходуется на упру-
гие и неупругие соударения.
Упругое рассеяние преобладает при взаимодействии электронов с
малой энергией и вещества с большим атомным номером. При этом
взаимодействии электроны отталкиваются электростатическим полем
атомных ядер (кулоновское отталкивание). Процессы рассеяния будут
упругими, если в результате взаимодействия электрона с атомами или
молекулами среды происходит лишь увеличение кинетической энер-
гии последних, и неупругими, если изменится потенциальная энергия
атомов и молекул. В результате упругого рассеяния электронов при
взаимодействии с электрическим зарядом атомов среды суммарная ки-
нетическая энергия электрона и атома не меняется. Изменяется лишь
направление движения электронов. Наибольшее отклонение электро-
нов наблюдается при прохождении вблизи атомного ядра.
При неупругих соударениях энергия электрона теряется в резуль-
тате взаимодействия его с электронами атома. При этом наблюдается
возбуждение и ионизация атомов и молекул. С увеличением началь-
ной энергии электрона вероятность возбуждения атомов возрастает.
В случае передачи энергии возбужденного атома валентному электро-
ну последний может быть выбит со своего энергетического уровня и по-
кинуть атом. В этом случае выбитый электрон способен произвести ио-
низацию и образовать вторичную траекторию с более сильной иони-
зацией, чем у исходного, более быстрого электрона. Число вторичных
электронов, образующихся на единицу длины траектории, возраста-
с уменьшением энергии первичного электрона. При возбуждении
Том не теряет электронов; происходит лишь переход части его элек-
тронов на более высокие энергетические уровни. Обычно расход энер-
ии электронов на ионизацию и возбуждение атомов и молекул среды
азывают ионизационными потерями. Полный расход энергии элек-
Р°нов будет равен сумме ионизационных потерь и потерь на тормоз-
141
потерь). Постепенное тороможение элек-
?°оноГГпогаощаотей среде зависит главным образом от их взанмо.
действия с электронами^^°^лектронов зависит прежде всего от их
Проникающая ™° слоя полного поглощения электронов
“SSX® »еУ"РУ™х сот®™»- КОТОР“=
2SS элеир 'н с электронами атомов в единице объема, т. е. элек-
тывает электрон v С, Поглощение электронов описывается
/Г/»ехр(-М, где л-интев.
сиет^т в отсутствие поглотителя; Z - интенсивность после прохож-
деяияизлучения через слой поглотителя толщиной d, см; р - общий
коэффициент поглощения, см х.
Коэффициент поглощения показывает, какая часть электронов по-
глощается на единице длины пути в данной среде. Значение коэффи-
циента поглощения пропорционально плотности р поглощающей сре-
ды. Отношение р/р, называемое массовым коэффициентом поглоще-
ния почти постоянно для различных веществ. В этом случае I =
__ /п ехр (_p,Q/p), где Q — толщина поглощающего слоя, г/см3.
Интенсивность излучения уменьшается в два раза при прохожде-
нии через слой толщиной х = In 2/р. Связь между толщиной такого
слоя и максимальной энергией 0-спектра ЕПт приближенно выража-
ется эмпирической зависимостью Етах = х0,75. Тяжелые заряженные
частицы (прогоны, дейтоны, а- частицы и др.) взаимодействуют с ве-
ществом подобно электронам, т. е. теряют энергию на тормозное излу-
чение, упругие и неупругие соударения. Тормозное излучение преоб-
ладает лишь при очень высоких энергиях, порядка 1000 МэВ, а упру-
гие соударения в этом случае играют совсем малую роль. Практически
следует принимать во внимание только неупругие соударения с элек-
тронами поглотителя. На одинаковом отрезке пути в поглощающей
среде тяжелые частицы теряют значительно большую энергию, чем
легкие. Например, плотность ионов вдоль трека а-частицы в нес-
колько сотен раз больше, чем вдоль трека электронов той же энергии.
При прохождении у-излучения через среду происходит ослабление
интенсивности излучения и переход энергии излучения в другие фор-
мы энергии. При прохождении у-квантов через среду они взаимодейст-
вуют с электронами атомов, ядром, полем электрических зярядов.
При этом может произойти поглощение у-квантов средой, упругое и
неупругое их рассеяние. В первом случае энергия у-квантов полностью
преобразуется в другие виды энергии. При упругом (когерентном)
рассеянии происходит лишь изменение направления излучения без
прпм^еНИЯ энеРгии Т'Квантов. Неупругое (комптоновское) рассеяние
ведет к изменению направления у-кванта и частичному поглощению
его энергии. у-Излучение теряет свою энергию в результате трех'ос-
овных процессов: фотоэлектрического поглощения (фотоэффект),
(зЛе™он“КИОГП0о3РптТ™""Я:,КОМ"Т°НОВС'<ИЙ И °б₽а30ВаН“’ МР
с низк°й энергией поглощаются~веществом*главным1 об-
р результате фотоэффекта. В этом процессе вся энергия у-кван-
та nv передается одному из электронов атома (рис. 6.2, а). Кинетичес-
ая энергия этого электрона равна £ = hv — /, где / — потенциал
онизации того уровня, на котором первоначально находился элек-
1 н При низких энергиях у-кванта фотоэлектрон выбрасывается пре-
мущественно перпендикулярно к первоначальному направлению у-
^анта. Чем выше энергия у-кванта, тем больше совпадают направле-
ния фотоэлектрона и у-кванта. Фотоэлектрон рассеивает свою энер-
гию за счет процессов ионизации и тормозного излучения.
Если у-кванты имеют достаточную энергию, то в основном вы-
биваются наиболее прочно связанные с атомом электроны с наиболее
низких уровней, т. е. из К-обо-
лочки. Если энергия у-кванта
больше энергии связи К-элек-
тронов, то 80% фотоэлектронов
выбиваются из К-оболочки. Ос-
тальные у-кванты взаимодейст-
вуют с электронами L-оболочки.
На освободившиеся места в К-
и L-оболочках переходят элек-
троны с внешних оболочек. При
этом испускается характеристи-
ческое рентгеновское излучение.
У элементов с низким атомным
4
Фотоэлектрон е~
а
й
hv
Свободный электрон
hv
Падающий ц-квант
Ятом
Падающий квант
/hv'
Рассеянный
квант
номером энергия связи электро-
нов на внутренних оболочках
относительно мала, для воды, на-
пример, порядка 500 эВ. В связи
с этим вторичное характеристи-
ческое излучение с малой энер-
гией поглощается в непосредст-
венной близости от места перво-
начального взаимодействия. Фо-
Электрон отдачи
Рис. 6.2. Схема процессов поглощения
средой у-излучения:
а — фотоэффект: б — комитон-эффект: в —
эффект образования пап
тоэлектрическое поглощение за-
метно возрастает, если энергия
Y-кванта становится больше энергии связи электронов на К-оболочке.
Поскольку при фотоэффекте должны выполняться законы сохранения
энергии и момента количества движения, то атом, из оболочки кото-
рого вырван электрон, также получает некоторый импульс (атомы от-
дачи). Таким образом, фотоэффект невозможен для свободных элект-
При комптон-эффекте у-квант может взаимодействовать как с ор-
Тальным так и со свободным электроном. Комптон-эффект наблю-
дается при энергии у-кванта > 0 01 МэВ.
Поел'^®ант отДает часть своей энергии электрону, в результате чего
гию е;?ний выбрасывается из атома и приобретает кинетическую энер-
квант Р?ВНУЮ разности энергий первоначального и рассеянного у-
Прявл°В СМ' РИС’ S'?” ^) - Т"Квант изменяет первоначальное на-
Расс?еНИе И пРевРаш>ае,1<ся во вторичный у-квант с меньшей энергией.
Должя1^Ые V-кванты, взаимодействуя с электронами атомов, пре-
уменьшать свою энергию в< процессе прохождения через
143
среду, и в конце их поглощения происходит обычно фотоэлектри-
'“комп^вские электроны характеризуются непрерывным спеет,
пом энергии от ничтожно малых до максимальных значении, полу,
чающихся в том случае, когда вылет электронов происходит в направ.
= Первичного у-кванта. Таким образом, потеря энергии в резуль-
тате комптон-эффекта, которая происходит при прохождении у-излу.
пения через вещество, равна энергии, уносимой электронами, и рас.
сеянной энергии вторичных у-квантов. Для энергии первичных у-кван-
тов 1 6 МэВ эти значения приблизительно равны. При более высоких
уровнях энергии у-квантов потеря энергии, уносимой электронами,
больше потери энергии за счет рассеяния. В воде комптон-эффект
является наиболее важным, механизмом поглощения при энергии пер-
воначальных у-квантов 0,03—20 МэВ.
Образование пар, т. е. превращение у-излучения в позитроны и
электроны, происходит в непосредственной близости от атомного ядра
под влиянием его поля. В процессе образования пар у-квант исчеза-
ет и появляются электрон и позитрон. Энергия у-кванта частично пе-
реходит в массу покоя этих двух частиц (2т0с2) и частично в кинети-
ческую энергию позитрона и электрона. Образование пар не может
происходить при энергии у-кванта менее 2m 0с2 = 1,02 МэВ. Образо-
вавшийся позитрон замедляется, как обычный электрон, или взаи-
модействует с электроном (при этом обе частицы аннигилируют),
давая два у-кванта с энергией по 0,51 МэВ.
Взаимодействие нейтронов с веществом. Нейтроны, не имея заря-
да, непосредственно не ионизируют вещество и взаимодействуют толь-
ко с атомными ядрами. Ионизировать среду могут продукты взаимо-
действия нейтрона с ядром: протоны, тяжелые ионы, у-излучение. Ос-
новными процессами взаимодействия нейтронов с ядрами атомов яв-
ляются: упругое и неупругое рассеяние, радиационный захват, ядер-
ные реакции с испусканием заряженных частиц (протонов, а-частиц
и т- Д-), деление ядра. Характер взаимодействия в первую очередь за-
висит от энергии нейтронов. По энергии нейтроны обычно подразде-
п Но меДленные (с энергией 0—1 кэВ, в том числе тепловые —
U.U25 эВ) промежуточные (1—100 кэВ), быстрые (100 кэВ — 14 МэВ),
сверхбыстрые (>14 МэВ). Следует заметить, что классификация ней-
тронов по их энергии не является строго определенной.
и.й?"РуГОе ₽ассеяние ~ наиболее вероятный процесс для быстрых
пт, ппа°В' О*10 Также имеет значение и для взаимодействия с вещест-
н₽йтплиМеЖуТ0ЧНЫХ неитРОНов> При столкновении с ядрами энергия
РаспРеДеляется согласно законам сохранения энергии и
ми OTnauuOJM4eCTBa движения между рассеянными нейтронами и ядра-
Tnn annv ак2ямальная энергия, которая может быть передана ней-
на из соотношенияСИТеЛЬН°й атомн°й массой А, может быть опреде-
(Д£/£0)тах = 4А/(А + I)2,
где Д£ переданная энергия; Ео — начальная энергия нейтрона.
144
В случае водорода (А = 1) вся энергия нейтрона может быть пере-
дана атому водорода. Образующийся при этом протон отдачи ионизи-
рует и возбуждает молекулы рассеивающего вещества, например
воды. При неупругом рассеянии нейтрон поглощается ядром, затем
вновь испускается, но уже с более низкой энергией. Ядро находится
некоторое время в возбужденном состоянии и переходит в основное
состояние с высвечиванием одного или нескольких у-квантов. Неупру-
гое рассеяние не наблюдается, если энергия нейтронов ниже наимень-
шей энергии возбужденного состояния ядра, которая обычно порядка
100 кэВ. Вероятность этого процесса быстро возрастает с увеличением
энергии нейтронов. При энергии порядка 10 МэВ равновероятно как
упругое, так и неупругое рассеяние.
Ядерный захват характерен для медленных нейтронов. Этот про-
цесс приводит к возникновению неустойчивого ядра, претерпеваю-
щего превращение с испусканием у-квантов или заряженных час-
тиц. Примером таких реакций могут быть: Н (п, y)D, 16О (и, у) 17N,
10В (л, a)7Li. Реакции деления наблюдаются в случае тяжелых эле-
ментов. Продукты деления обладают высокой энергией и способны
вызвать ионизацию и возбуждение среды.
Ионизация и возбуждение молекул происходят вдоль пути части-
цы высокой энергии. Возбужденное состояние возникает, когда свя-
занные электроны в атомах и молекулах получают дополнительную
энергию и переходят на более высокие уровни. При ионизации атомы
и молекулы теряют электроны, получив большую энергию, чем в слу-
чае возбуждения.
В результате поглощения любого вида излучения образуются
треки возбужденных и ионизированных частиц. Продукты взаимодей-
ствия излучения с данным веществом в основном не зависят от вида
и энергии излучения. Все виды ионизирующего излучения дают ка-
чественно одинаковый химический эффект. Однако излучения различ-
ных видов и энергии с разной скоростью теряют свою энергию в веще-
стве, и плотность первичных продуктов взаимодействия излучения с ве-
ществом в треках зависит от вида излучения. Химический эффект за-
висит от плотности первичных продуктов в треках, особенно в жид-
костях, где миграция первичных продуктов из трека затруднена окру-
жающими молекулами. В газах первичные продукты могут относи-
тельно легко покидать треки, поэтому под действием различных видов
излучения в газах обычно не наблюдается большой разницы в выходах
продуктов радиационно-химических реакций.
Электроны, выбитые из атомов или молекул, в результате первич-
ных процессов ионизации могут, обладая достаточной энергией, сами
производить ионизацию и возбуждение. Если энергия таких вторич-
ных электронов менее 100 эВ, то их пробеги в жидкостях малы и про-
дукты вторичной ионизации расположены очень близко от первичных,
образуя так называемые шпоры возбужденных и ионизированных
томов и молекул. Некоторые вторичные электроны с достаточно вы-
окой энергией могут мигрировать на значительное расстояние от ме-
а своего возникновения, давая собственные треки, ответвляющиеся
первичных. Такие вторичные электроны называют р-лучами. На
145
их долю при энергии электронов более 100 эЁ приходится приблизи-
тельно половина всех продуктов ионизации.
Шпора содержит в среднем 2—3 пары ионов или молекул воды.
Если частица обладает высокой плотностью ионизации вдоль своего
пути (например, а-частица), то шпоры, перекрываясь, образуют ко-
лонны ионов и возбужденных частиц вдоль треков (колонная иониза-
ция). Для быстрых вторичных электронов, образующихся при погло-
щении водой у-излучения, расстояние между шпорами по треку элек-
трона 103 нм и первоначальный диаметр их равен ~ 2 нм. Замедленные
электроны с энергией ~ 0,025 эВ, по-видимому, непосредственно ней-
трализуют положительный ион или сначала захватываются нейтраль-
ной молекулой, давая отрицательный ион, который впоследствии ней-
трализует положительный ион.
Линейная передача энергии. Выше говорилось, что скорость поте-
ри энергии ионизирующей частицы при прохождении через вещество
на единицу длины пути характеризуется тормозной способностью сре-
ды dEfdx. В радиационной химии эта величина называется линейной
Таблица 6.3
Начальные значения ЛПЭ в воде для различных видов излучения
Вид излучения Энергия, МэВ ЛПЭ, эВ/нм
у-Излучение в0Со Электроны B-Из лучен не Рентгеновские лучи Электроны Рентгеновские лучи р-Излучение трития Дейтоны Протоны Дейтоны Протоны Гелиоиы Протоны Гелионы Протоны а-Частицы 210Ро ^(дЛ^а)1Т ядеРН0® реакции Li л-Частицы Продукты ядерной реакции «В v*, a) 7Li 146 1,25 (средняя) 1 или 2 0,48 0,1 50 0,046 (средняя) 0,25 (максимальная) 0,01 0,01 0,008 0,0055 ^средняя) 10 5 8 5,2 2 38 32 1 0,9 12 о,з „ 5,3 2,05 (а) и 2,73 (Т) , 3»4 1,50 (а) и 0,85 (Li) 0,2 0,2 0,207 0,417 0,67 0,7 1,0 2,0 2,3 2,8 3,6 4,5 4,67 8,16 Ю 13 17 22 225 30 30 50 54 88 100 120 170
передачей энергии (ЛПЭ). Единицей ее измерения является килоэлек-
тронвольт на микрометр (кэВ/мкм) или электрон на нанометр (эВ/нм).
Заряженные частицы постепенно теряют свою энергию по мере про-
хождения через среду. Поэтому значение ЛПЭ вдоль трека частицы
не одинаково. Особенно это характерно для заряженных частиц. На-
чальные значения ЛПЭ в воде для различных видов ионизирующего
излучения приведены в табл. 6.3.
§ 6.3. ТЕОРИЯ СВОБОДНЫХ РАДИКАЛОВ
Наилучшее объяснение фактам, наблюдавшимся при радиолизе
воды, дает теория свободных радикалов. Согласно этой теории, при
действии ионизирующего излучения на воду происходит образование
свободных радикалов Н- и ОН’:
Н2О->Н’ + ’ОН. (6.1)
Положительный ион
возбужденная молекула
Схема процессов, происходящих в треке ионизирующей частицы через
10“ —10-1в с после ее прохождения через воду
Возникают эти радикалы следующим путем. Частица с высокой энер-
гией ионизирует молекулу воды, находящуюся вблизи ее траектории:
Н3О-> НаО+ + е~. (6.2)
Вторичные электроны ионизируют несколько других молекул
воды. Возникшие при этом ионы образуют шпоры. Некоторые другие
молекулы воды, отстоящие дальше от трека, возбуждаются, так как
приобретают энергию, недостаточную для ионизации. Схематически
эти процессы представлены на рис. 6.3. Существуют две гипотезы о
Дальнейшем поведении вторичного электрона. Согласно гипотезе
^•амюэля и Маги, вторичный электрон теряет свою энергию при не-
Упругих соударениях с молекулами воды, затем возвращается назад
взаимодействует с материнским ионом, который образовался из
лекулы воды в результате потери электрона. Образовавшаяся ней-
ральная молекула воды сильно возбуждена (возбужденное состояние
147
отмечено звездочкой) и распадается на радикалы
Н2О* — Н- + ОН". (6.3)
По гипотезе Ли и Грея, вторичный электрон после потери энергии
не может присоединиться к иону, а на некотором расстоянии от него
сольватируется и образует радикал водорода
g-+ Н2О-> Н-+ ОН-. (6.4)
Ион Н..О+ диссоциирует, давая радикал ОН\
Н2О+->Н++ОН-. (6.5)
По гипотезе Самюэля и Маги, радикалы Н- и ОН-, которые образова-
лись из возбужденной молекулы воды, находятся близко друг к другу.
По гипотезе Ли и Грея, радикал ОН- находится вблизи трека ионизи-
рующей частицы, а радикал Н- — на некотором расстоянии от него.
В настоящее время трудно отдать предпочтение той или иной гипотезе.
При гидратации электронов, выбитых при ионизации, могут об-
разоваться гидратированные электроны е™ДР- Последние могут быть
просто представлены в виде электронов, окруженных ориентированны-
ми молекулами воды. К гидратированному электрону направлен один
из атомов водорода молекулы Н2О. Гидратированный электрон явля-
ется мощным восстановительным агентом. Энергия активации реакций
гидратированного электрона мала. Гидратированный электрон крайне
реакционноспособен. Он реагирует в ряде случаев при каждом соуда-
рении с частицей.
Процессы ионизации и образования радикалов протекают весьма
быстро. В зависимости от энергии частицы ионизация протекает за
102й-10-“ с, пРевРаЩение иона в радикал ОН-— за 10-12 —
10 11 с. Приблизительно за то же время происходит потеря энергии
вторичным электроном и его захват с последующим образованием ра-
дикала Н-.
Продукты радиолиза. Образовавшиеся радикалы Н" и ОН- в ме-
стах их высокой концентрации взаимодействуют друг с другом в реак-
циях рекомбинации:
Н- + Н- -> Н2; (6.6)
ОН- + ОН- Н2О2; (6.7)
Н- + ОН- -> Н2О. (6.8)
Иленно в результате этих реакций образуется большая часть моле-
иппи?НЫХ ТДуКиТ°Д и Однако не исключено, что некоторое
чество Н2 и Н2О2 возникает в результате прямого разложения во-
ды, например по реакции
Н2О + Н2О* Н2 + Н2О2. (6.9)
циям°Пе^еКИСНЫ^ Радикал НО2 может возникать в шпорах по реак-
Н2о2 + он- -но2 + Н2О; (6.10)
148 2ОН->-НО2 + Н-. (6.П)
Вероятность протекания реакции рекомбинации с образованием моле-
кулы воды из радикалов Н* и ОН* в жидкой фазе равна 0,1, а в газо-
вой фазе при давлении 10 МПа — лишь 10-3. Таким образом, эта ре-
акция рекомбинации в паре и пароводяной смеси протекает более вяло,
чем в воде, и радиолиз воды в кипящей системе больше, чем в кон-
денсированной. Максимальный радиационный выход разложения воды
в газовой фазе G(-H2O)max равен 12 молекулам.
Начальный выход продуктов разложения воды Gh, Goh, Gh2,
6н,о, отличается от измеренных выходов G<h2), G(h2o), так как на-
ряду с радиолизом воды идут реакции рекомбинации. Принимая ра-
диационные выходы первичных продуктов радиолиза за стехиометриче-
ские коэффициенты, можно представить реакцию разложения воды
седующим уравнением:
G -HjO) Н2О-*-СнгН2 + Gh2o2H2O2 + GHH- + GOHOH’ + GHo2HC>2. (6.12)
Выход радикала HOj очень мал, и образованием его как первичного
продукта в большинстве случаев можно пренебречь. Однако следует
заметить, что радикал этот весьма эффективно образуется в том слу-
чае, когда в воде присутствует кислород:
Н-+О2-^НО;. (6.13)
При составлении уравнения материального баланса учитывается
число молекул воды, расходуемых на образование тех или иных про-
дуктов радиолиза. На образование радикала Н* расходуется одна мо-
лекула воды, на образование молекулы Н2 — две молекулы воды.
Поэтому
G(-h2O) = Gh + 2 Gh2.
Соответственно одна молекула воды расходуется на образование ради-
кала гидроксила и две — на образование перекиси водорода:
G(-h2o) = Goh+ 2 Gh2o2-
Поскольку одна молекула воды дает и Н, и ОН, объединяя эти
Уравнения, получаем уравнение материального баланса, широко ис-
пользуемое при рассмотрении кинетических процессов радиолиза:
G—н2о— GhH- 2 Gh2 = Gqh + 2 Gh2o2- (6.14)
Сучетом реакции образования радикала НО2 из радикала Н* [см. урав-
1ение (6.13)] и из радикалов ОН* [см. уравнение (6.11)1 уравнение
’атериального баланса радиолиза воды приобретает вид
^(-н2о) = Gh + 2 Gh2 — Gho2 = Goh + 2 Gh2o2 + 2 Gho2. (6.15)
f ПродУкты радиолиза воды, за исключением Н2, и особенно сво-
д^816 короткоживущие радикалы весьма реакционноспособны. Ра-
телал — атомарный водород, как правило, является восстанови-
РНеМ- восстановительнЬ1е свойства усиливаются с увеличением
сРеды. В кислых средах радикал Н* может проявлять окислитель-
149
и„р гвойства. Радикал ОН- обладает окислительными свойствами
Ппи пН >9 он диссоциирует по реакции
Р Р ОН--*Н+ + О". (6.16)
Молекулярный водород, как правило, не реагирует непосредственно
с'растворенньпли веществами. Однако он может взаимодействовать с
радикалом ОН* по реакции
р н2 + он--*-н- + н2о.
(6.17)
Радикал НО; способен диссоциировать на ионы
•НО2->Н+ +ОГ (6.18)
Этот радикал является сильным окислителем.
Выходы продуктов радиолиза воды в случае у-излучения тоСо для
0.5 М сернокислого водного раствора равны: Он = 3,65; Сон =
= 2.95; бн, = 0,45; (7н2ог = 0,80: 0(-н,О) = 4,55.
Теория свободных радикалов применима к растворам, разбавлен-
ным настолько, что прямое действие излучения на растворенное веще-
ство пренебрежимо мало.
Взаимодействие с растворенным веществом. Предполагается, что
любой радикал, который избежал рекомбинации и продиффундировал
в толщу раствора, в конце концов прореагирует с растворенным веще-
ством, даже если концентрация его ниже 10-4 М. В отсутствие раство-
ренного вещества молекулярные продукты вступают в реакцию с ра-
дикалами:
Н2О2 + -Н ОН- + Н2О. (6.19)
Вследствие этого концентрация молекулярного продукта будет
увеличиваться лишь до некоторого стационарного значения. Присут-
ствие растворенного вещества, реагирующего с радикалами, предохра-
няет молекулярные продукты от обратных реакций. Концентрация раст-
воренного вещества, при которой полностью подавляются обратные
реакции, зависит от природы вещества и составляет 10~8—10-3 М-
Например, бромид-ион взаимодействует с радикалом ОН-.
Вг- + ОН- -> Вг + ОН" (6.20)
и тем самым подавляет реакцию (6.17). При радиолизе тщательно очи-
щенном воды концентрация образующихся Н2 и Н2О2 чрезвычайно
низка. Радикалы Н- и ОН- взаимодействуют с молекулярными про-
дуктами Н2н Н2О2, давая вновь воду [реакции (6.17) и <6.19)7- По-
этому стационарные концентрации мрлекуляпных продуктов радио-
лиза при у-облучении составляют 10~e—10~8 М. В случае тяжелых
заряженных частиц эти концентрации выше.
Рассмотрим более детально реакции с участием радикалов:
Н- + Н2 н2 4- Н; (6.21)
Н- + О2 -> ОН' + О. (6.22)
Этих реакций изучена для газовых сред. Взаимодействовать
между собой могут лишь частицы, удаленные друг от друга на расстояние, не
150
превышающее перемещения в процессе Тепловых колебаний, т. е. не более чей
на I == 10~* с*1- Если Радиусы частиц (см) г± и г2> то объем с двумя частицами,
аходящимися на расстоянии I, Vo — (га 4" гг)3.
В первом приближении можно принять + r2 = 5-Ю-8 см, тогда Vo ~
„ Ю"га см3. Концентрация частиц в среде Сх и С2, моль/ч. Б объеме Vo будет
^ходиться молекул вещества 2
Яа= К0С^А-10-3= С2.10-33-6-1023-10-з= С2.6-Ю-a, Где ЛГД _ число
Двогадро.
Вероятность того, что молекула вещества I, находящаяся в объеме Уо,
в процессе тепловых колебаний встретится с молекулой вещества 2 составит
IF = l-n2= C2-6-10-2. (6.23)
Для того чтобы произошло взаимодействие, молекула вещества 2 должна
двигаться в направлении к молекуле вещества 1. Вероятность этого события
j.. = 1/6 = 0,16.
Скорость бимолекулярной реакции [моль/(л«с)]
р = ехр (— Q/RT) = Cv 1013-С2-6-10-2-0,16 ехр (— Q/RT) =
= СдС2- 10u ехр (- Q/RT), (6.24)
где v = 10й с-1 — частота тепловых колебаний; Q — энергия активации.
Для того чтобы могла протекать реакция (6.21), молекулы водорода долж-
ны диссоциировать. Энергия активации реакции диссоциации молекулы водо-
рода
(?Н1 = 0,25£cbHj = 0,25-434,8 =* 108,7 кДж/моль,
где Eali —энергия связи в молекуле Н2.
Из закона сохранения количества движения импульс молекулы водорода
после столкновения с радикалом водорода составит
^н,= (^н- + ^н,)- (6.25)
Энергия Н" будет
£н. = 217 кДж/моль=3,6-10—12 эрг/ат=3,6-10—19 Дж/ат;
£Hj = l,5 й7' = 6,2-10-14 эрг/ат = 6,2-10~21 Дж/ат; (6.26)
Рн.=]/2 =у 2-1,6-10-24-3,6.10-12 = 3,4. 10~»в;
Рн,=|/2-2/пН1£На = ]/2-2-1,6-10“24-6,2-10_14 = 6,30-10-19. (6.27)
Из зависимостей (6.25)—(6.27) получаем:
?Н, = (2/3) • (3,4 • 10-18 + 6,3 • 10-19) = 2,7 • 10-18.
После столкновения с Н- энергия молекулы водорода возрастет на
£Н,= (Рн,)2/4т = (2,7-10~18)2/4.1,6-10~24 = 1,14-10~19 Дж/ат=68,5 Дж/моль.
На это значение уменьшится энергия активации Qh ; Эффективная эиер-
r*”i активации *
Qnt= 108,7—68,5 = 40,2 кДж/моль.
^Реакция (6.22) протекает обычно при температуре порядка 1000 К. При
£о> = 2,07-10-20 Дж/моль; РО1 = 4,6-10-18 г-см/с.
Согласно зависимости (6.26),
Р0а=8,О-1О-18 г-см/с.
151
Ы КиСЛОро,
рассматри.
Энергии, получаемая Молекулой воды после столкновения» £O?=37,6 кДж/Модь
На это значение снижается энергии активации диссоциации молекул
да, равная 123,3 кДж/моль. Отсюда эффективная энергия активации
ваёмой реакции 85,4 кДж/моль.
Скорость реакции может быть представлена в следующем виде: v = СХС, v
X А ехр (— Q/RT). Расчетные и экспериментальные значения предэкспонеи
циальиого множителя и энергии активации удовлетворительно согласуют^
между собой (табл. 6,4).
Таблица 6.4
Расчетные и экспериментальные значения предэкспоненциального множителя д
и энергии активации Q, кДж/моль
Реакция А Q
Расчет Эксперимент Расчет Эксперимент
Н- + Н2-*Н2 + Н 1011 5-Ю12 40,2 35,6
Н- + О2-»ОН- + О ЮН 2,5-1012 85,4 75,2
Кроме Н2 и Н2О2 при радиолизе чистой воды образуется в не-
больших концентрациях кислород. Его возникновение связано с об-
разованием по реакции (6.10) радикала -НО2 и дальнейшим его вза-
имодействием с радикальными и молекулярными продуктами радио-
лиза:
ОН- + -но2 -+ Н2О + О2;
Н2О2 + -НО2 Н2О + -ОН + О2;
•НО2 + -НО2 Н2О2 + О2.
Поскольку молекулярные продукты первоначально образуются
в результате рекомбинации радикалов, то, очевидно, стационарные
концентрации Н2 и Н2О2 пропорциональны корню квадратному из
мощности дозы. Присутствие в облучаемой воде кислорода влияет на
стационарную концентрацию перекиси водорода. Кислород защищает
перекись от обратной реакции с радикалом Н-. Взаимодействуя с Н'
по реакции (6.13), кислород образует гидроперекисные радикалы HOj.
Последние, взаимодействуя между собой по реакции (6.23), образу-
ют Н2О2. Так, при мощности дозы 5-Ю20 эВ/(мл-с) в деаэрирован-
ной и насыщенной кислородом воде образуется соответственно 0,5 и
9,0 мкМ перекиси водорода. Причем если в деаэрированной воде
0,5 мкМ—уже стационарная концентрация, то в насыщенной кислоро-
дом воде концентрация перекиси пропорциональна мощности дозы.
При насыщении воды водородом образования перекиси не на-
блюдается, поскольку последняя сразу же разлагается радикалам0
Н- по реакции (6.19), образовавшимися при радиолизе воды (6.1) и ®
результате реакции (6.17). Накопление в I контуре молекулярного
водорода, образовавшегося в результате радиолиза и протекани
коррозионных процессов с водородной деполяризацией, подавляе
дальнейший радиолиз воды, когда концентрация водорода достига
стационарного значения более 5 см3/л. Естественно, что вода при 3
полнении контура дожна быть деаэрирована. В противоположном слу
152
чае присутствие кислорода интенсифицирует радиолиз, образование
перекиси водорода. В результате радиационно-химических реакций
с участием азота образуется нитрат-ион, а вследствие реакций (6.5)
л диссоциации перекиси водорода
Н2О2 но- 4- Н+
происходит подкисление среды до значения pH = 3 -? 4. Это явление
носит название кислотной ямы. В связи с изложенным деаэрация воды
I контура является совершенно необходимой.
Температура влияет на реакции рекомбинации, интенсифицируя
их поэтому с ростом температуры радиолиз воды идет более медленно.
$ м. РАДИОЛИЗ В ЯДЕРНЫХ РЕАКТОРАХ
В реакторах с водой под давлением высокая температура (соот-
ветственно и значительная скорость реакций рекомбинации), а так-
же накопление водорода препятствуют радиолизу воды. Кислород в
I контуре в воде с электропроводностью 10-1 мкСм/см при концент-
рации Н2 25 см3/кг не обнаруживается. Обычно концентрация Н2 в
контуре составляет 25—50 см3/кг. Если кислород попадает в I контур
с подпиточной водой, он расходуется за счет реакции с Н2 и в ходе
коррозионных процессов. В течение 12 мин концентрация кислорода
уменьшается в два раза. Для снижения скорости коррозии сталей
в воду I контура ВВЭР дозируется аммиак. Он также является
источником водорода.
В I контуре ВВЭР для мягкого регулирования вводится борная
кислота. Образующиеся в результате реакции 10В (п, a) 7Li а-частицы
с энергией 0,49 МэВ и у-излучение с энергией 2,3 МэВ интенсифици-
руют радиолиз.
Если в I контуре создается избыток кислорода, то в присутствии
растворенных в воде N2 и Н2 образуется HNO:1. При этом pH может
снизиться до 3,5. Имеет место так называемая кислотная яма. В ряде
случаев дозированием кислорода в контурную воду снижают значение
pH Таким образом, ни воздух, ни азот не являются инертными при
наличии излучения. Заманчиво применение в компенсаторах объема
инертных газов: Не, Ne, Аг, Кг, Хе. Однако все они, кроме гелия и
неона, в поле радиации дают радиоизотопы. Ксенон имеет около 15
Радиоизотопов с периодом полураспада от 1 с до 36,4 сут, аргон имеет
радиоизотопа с периодом полураспада от 109 мин до 265 лет. Крип-
он также имеет долгоживущие изотопы. Гелий и неон их не дают,
Днако оба они дороги. Гелий, кроме того, обладает большой текуче-
ью, и удержать его в контуре при больших давлениях достаточно
ожно. Таким образом, для контуров с водой под давлением, где до-
пустимо увеличение pH воды, наиболее пригодным газом для компен-
торов объема является азот.
ИСЛ0Р°Д из воды для заполнения контура удаляется обычно
^РМической деаэрацией. Остатки кислорода связываются гидразином.
и этом в воде остается газообразный азот. Другим источником попа-
153
дания азота в воду может быть газовый компенсатор объема, зап
ненный азотом. Перенос азота из компенсаторов объема в i'koh-h?"
происходит в результате градиента концентрации посредством
фузии и, в основном, за счет переноса воды, насыщенной азотом п
высоком давлении, из компенсатора объема вследствие изменени"
объема теплоносителя при изменении температуры. Ия
Синтез аммиака происходит при работе реактора выводе из я™,
та и водорода. Скорость образования аммиака пропорциональна мош
ности реактора, концентрации азота в воде, но практически не зави
сит от концентрации водорода. В активной зоне происходит также и
разложение аммиака. При длительной эксплуатации реактора между
реакциями синтеза и разложения аммиака наступает равновесие при
pH, равном 8—9. Синтез аммиака идет в отсутствие кислорода в теп-
лоносителе.
В кипящих одноконтурных реакторах радиолиз идет более интен-
сивно, чем в реакторах с водой под давлением. Ранее указывало^
что в паровой фазе реакции рекомбинации идут более вяло, чем в кон-
денсированной фазе. Кроме этого, радиолитический водород в соот-
ветствии с коэффициентом распределения между водой и паром пер
ходит в основном в последний и удаляется из системы в эжектор
конденсатора. Накопления водорода в системе не происходит. Содер-
жание водорода в питательной воде составляет 0,02 мл/кг и на входе
в реактор 0,02 мл/кг. В результате указанных обстоятельств в актив-
ной зоне кипящего корпусного реактора идет интенсивный радиолиз
воды и концентрация кислорода составляет в циркуляционной вод
0,03—0,3 мг/кг, в’пароводяной смеси 6—10 мг/кг и в паре 30—40 мг/кг
Поскольку циркуляционная'вода не деаэрируется, присутствие в ней
кислорода интенсифицирует'радиолиз. Скорость разложения воды в
кипящем реакторе составляет’2,5—3,5 моль/(МВт*ч). Радиолитиче-
ский газ содержит 30% кислорода, 60%*водорода и до 10% инертных
газов. Выход кислорода зависит от уровня мощности реактора:
Удельная мощность, кВт/л активной зоны 7 27
Выход кислорода, л О2/(МВт-ч) 9 П
50
14
содержа
Выход кислорода близок к 30—50 л/(МВт*ч). При этом
ние водорода и кислорода в насыщенном паре составляет 36 и 18 л
пара соответственно. Следует заметить,"что интенсивность радиол
и соответственно содержание кислорода в воде зависят от типа ки
щего реактора. В’корпусном кипящем реакторе вода является и те
лоносителем, и замедлителем. Естественно, что поглощенная
энергия излучения в этом случае больше, чем в кипящем каналь
реакторе, где замедлителем является графит. лепте-18
Относительное радиационное энерговыделение в теплой
(доля полной мощности реактора) в кипящих реакторах разно р3%
изменяется в широких пределах. В кипящих корпусных _Реа • 3
в теплоносителе может выделяться 1,6—2% полной мощности Р*® сх0’
В теплоносителе, находящемся в испарительных каналах Ьел 1
АЭС им. И. В. Курчатова, выделяется 0,2% мощности испари
154
каналов, в паре, охлаждающем пароперегревательные каналы
Jg более 0,01 %_их мощности. к ые каналы,—
В реакторе канального типа с графитовым замедлителем и степ,
пеньковыми твэлами доля энерговыделения в теплоносителе составля
а_<,к<мо 0,6% мощности Скорость образования кислорода в
корпусном^ реакторе 0,4 л/(МВт-мин) для реактора ВК-50 чем н
канальном 0,1 л/(МВт-мин) для П блока Белоярской АЭС и
0,23 л/(МВт-мин) для реакторов типа РБМК.
Концентрация кислорода в паре, получаемом на АЭС с реакторами
корпусного типа, может достигать 25—35 мг/кг и в канальных реак-
торах 5 15 мг/кг. При ядерном перегреве увеличения концентрации
радиолитических газов не обнаружено. В связи с этим в канальном ки-
пящем водо-графитовом реакторе содержание кислорода в воде мень-
ге, чем в корпусном, и составляет 0,1 мг/кг. Содержание Н2О,___
30 мг/кг на мощности и 1,5 мг/кг на стоянке.
Подавление радиолиза в кипящем одноконтурном реакторе может
быть осуществлено непрерывной дозировкой в теплоноситель водоро-
да или аммиака. Так, при введении в питательную воду водорода
в количестве 160 мл/л содержание кислорода в паре уменьшается в
8—10 раз. Дальнейшее увеличение содержания водорода до 3000 мл/л
практически не сказывается на концентрации кислорода в паре. Не-
прерывная дозировка водорода требует значительного его расхода и
экономически невыгодна.
С увеличением pH реакторной воды до 8 за счет введения аммиа-
ка содержание кислорода в ларе снижается в 3—5 раз. Для каналь-
ного реактора содержание кислорода в паре составляет при этом 5—
6 мг/кг. Выход кислорода равен 6,2 л/(МВт-ч). Степень разложения
аммиака на 1 МВт мощности реактора 8,5—9%. На 1 МВт мощности
реактора образуется 0,05 г/ч нитратов и нитритов. Содержание их
в реакторной воде достигает 0,1 мг/л. Для полного подавления радио-
лиза в кипящем реакторе содержание аммиака в воде должно быть
не менее 10 мг/кг. По расчетам О. И. Мартыновой, в этом случае под-
питка аммиака для восполнения его потерь должна составлять 4%
требуемого для подавления радиолиза количества аммиака.
Следует также иметь в виду, что при введении такого количе-
। ства аммиака в воду кипящего реактора трубчатка конденсаторов и
подогревателей должна быть выполнена из нержавеющей стали. При
Изготовлении трубчатки из медных сплавов скорость коррозии их
будет велика. Кроме того, присутствие меди в воде интенсифицирует
'образование накипи, что особенно опасно для твэлов. Цинк, являю-
щийся продуктом коррозии латуни, увеличивает активность тепло-
носителя и оборудования.
В исследовательских реакторах бассейнового типа мощностью до
18 МВт содержание радиолитического водорода в воде не превышает
мл/кг, а перекиси водорода 10 мг/кг. Объемная концентрация во-
дорода в воздушных объемах реактора не превосходит 1% при взры-
Поопасней концентрации 4%. Содержание водорода в воде не зависи
мощности при высоких ее значениях. Это связывается с тем, ч
с Ростом поглощенной водой дозы увеличивается удельная плоти
радикалов, а следовательно, и интенсивность реакций рекомбиназ
С увеличением температуры на Г концентрация водорода по той -,ь
причине уменьшается на 0,03 мл/кг. Концентрация перекиси водоГ
да при повышении температуры до 323 К изменяется незнаиителЬа
а выше 323 К резко уменьшается вследствие ее разложения. Конщ£
трация растворенного водорода практически не зависит от скорОС7
потока воды в активной зоне. Опыт эксплуатации бассейновых пеакИ
торов мощностью до 18 МВт подтвердил возможность длительной Ра
боты без систем дегазации. В случае же необходимости гремучая смес
сжигается на контактных аппаратах, где в присутствии катализатор
кислород взаимодействует с водородом с образованием воды. Пред^
лы взрывоопасности гремучей смеси с воздухом составляют от 33
до 81,5%. Нижний предел объемного содержания взрывоопасной смеси
с паром зависит от давления и составляет 33 и 16% соответственно ддя
общего давления 0,005 и 0,1—3 МПа.
В случае поступления теплоносителя в активную зону при аварии
образуется радиолитический водород. Возможность образования взры-
воопасной концентрации водорода внутри помещения реактора дола
на учитываться при анализе аварийных ситуаций с потерей теплоно-
сителя.
Глава 7
ЯДЕРНО-ГОРЮЧИЕ МАТЕРИАЛЫ
§ 7.1. ФИЗИКО-МЕХАНИЧЕСКИЕ СВОЙСТВА УРАНА
Физические свойства. Уран — 92-й элемент периодической систе-
мы, Природный уран состоит из трех изотопов: 238U, 2S5U и “U. Со-
держание последних двух в природном уране составляет 0,7 и 0,005
соответственно. Все естественные изотопы урана излучают а-частины
с энергией 4,21—4,76 МэВ. Период полураспада естественных изо-
топов 234U —2,44-Ю5 года, 235U — 6,85-108 года, —4,5-108 го-
да. Известен ряд искусственных изотопов урана.
Уран имеет три аллотропические модификации; низкотемператур-
ную а-модификацию, £- и у-модификации. Кристаллическая струит)-
ра урана во всех этих модификациях, а также температура превращу
ний представлены в табл. 7.1. Расположение атомов в решетке а-урзнз
показано на рис. 7.1. Кристаллическая решетка а-урана образована
гофрированными слоями атомов, параллельными плоскости (010 •
Координационное число для а-урана равно 12, однако 4 атома нахо*
дятся на меньших расстояниях, чем остальные. Расстояние между аТ°"
мами в пределах слоев составляет 0,28539 и 0,27544 нм, а междуиат°^
мами, расположенными в разных слоях, 0,32631 и 0,33423 нм.
атомные силы убывают с увеличением межатомного расстояния. В св
зи с этим силы связи между атомами в пределах слоя выше, чем меж у
атомами соседних слоев.
156
Таблица 71
Физические свойства урана
-
Атомный номер Относительная атомная масса Плотность, г/см® Температура плавления, К Удельная теплоемкость при 298 К, кДж/(Моль-град) Температура кипения, К Удельное электрическое сопротивление при 298 К, мкОм-см Кристаллическая структура Параметр кристаллической решетки, нм Коэффициент линейного расширения в интервале температуры 293—773 К вдоль различных кристаллографиче- ских осей, Ю-6 град-1 92 238,03 19,05 1402—1403 27,6 4086 30 а-Фаза, ромбическая до 940,7 1 3 ” 0-Фаза, тетрагональная до 1047,8 ±1,6 К у-Фаза, ОЦК при температуре выше 1049 К а-Фаза: а —0,2852 b 0,5865 с = 0,4955 0-Фаза: а 1,0759 с 0,5656 у-Фаза: а = 0,3524 а = 39,2 & = —6,3 с = 27,6
Рис. 7.1. Кристаллическая решетка а-урана
157
Лирические свойства урана также представлены в табл. 7.1. Сле.
o™S что свойства урана существенно зависят от его чист0.
W ПгпА^ностью а-урана в связи с низкой симметрией ромбической
™‘ 2?и является анизотропия физических и механических свойств.
^^Механические характеристики. Чистейший монокристалл а-урана
имеет очень высокую пластичность. Техническим же уран не слишком
пластичен тверд и хрупок. Уран относительно трудно обрабатывает-
™ Ня его механические характеристики существенно влияет тексту,
ра определяемая технологией изготовления изделия и термической
^РНетначительные колебания содержания неметаллических приме-
сей в уране могут влиять на его механические свойства. Уран сильно
наклепывается, что затрудняет его обработку резанием. Механиче-
ские свойства его, особенно пластичность, существенно зависят от
температуры и термической обработки (табл. 7.2). В интервале тем-
ператур от 373 до 77 К пластичность урана резко падает с уменьше-
нием температуры испытаний (рис. 7.2). Одновременно понижается
и предел прочности. Уран из пластичного становится хрупким. Тем-
пература перехода зависит от содержания примесей, размеров зерна
и т. п. Пластичность урана при комнатной температуре может быть по-
вышена отжигом в вакууме. Наилучшие результаты дает отжиг в те-
чение одних суток при 623—673 К- С ростом температуры прочность
урана снижается, а пластичность растет (рис. 7.3). В случае больших
зерен пластичность и предел прочности меньше.
Таблица 12
Прочностные и пластические свойства урана при испытаниях на растяжение при
комнатной температуре
Обработка а012. МПа <тв, МПа в. %
Литье Горячая прокатка в 7-области с быст- 190—280 380-480 4-6
рым охлаждением Отжиг в у-области (после прокатки 250 400 55
в а-области) 180 390 5
Закалка из у-области (после литья) Закалка из p-области (после прокатки 460 600 4
в а-области) 250 580 9
Закалка из р-области (после литья) Прокатка в а-области (при 773 К с об- 460 580 4
жатием 25 %) Прокатка в а-области (при 773 К с об- 540 630 9
жатием 50 %) Прокатка при 573 К с обжатием 28 % (суммарное массовое содержание при- 600 710 7
месей <0,05 %) 980 35
Прокатка в а-области и отжиг при 823 К Прокатка в а-области при 773 К с об- 220 620 12
жатием 50 % и отжиг при 873 К 430 600 7
158
с на Р«. 7.4.
703 К) скорость ползучести урана резко во3растает™каТа ю®<7
ласти температуры ₽. и т-фаз повышает сопротевлеше “лз”адй
Рис. 7.2. Влияние малых добавок железа и алюминия на температуру перехода
из хрупкого состояния в пластичное для урана, отожженного в 0-области:
/ — 0,005% Fe, 0,006% AI, размер зерна 0,45 мм; 2 —0,05%Fe. 0,025% Al, размер зерна 0.30 им;
3 — 0,1% Fe, 0,02% Al, размер зерна 0,12 мм
при температуре ниже 673 К> но уменьшает ее при более высокой
температуре. В условиях циклического изменения температуры ско-
рость ползучести возрастает. Это связано с внутренними напряжения-
ми, возникающими из-за анизотропии термического расширения а-ура-
Рис. 7.3. Влияние температуры на механические свойства урана^
Размер зерна rf - 20 мкм, скорость Де,Й012м/мин- °4 —<7- 130 мкм, «деф
*0,1 см/Мин; 3— d — 20 мкм, одеф = 0,003 рм/мцн.
20 мкм. Т’Д<‘* “
0,1 см/чнн
159
nw Внутренние напряжения возрастай?»
„а при изменении пластическую деформацию
по предела текучести “ в“зь испытаниях на усталость зависит „
ПрЬ выносливости урана "₽ оставляет при комнатной темпера^
пигтоты металла, о Р
100-280 МПа. (периодические изменения температуры) вы.
изделий из урана. Наибольшая скорость
пывают изменение размера изд отмечена при максимальной
’оста (увеличения «л““Иче?кого никла (причем наибольлее влияя»
'разнице температур н
и высокой скпппп-гМЗНаЧеНИе темпвРатУРы), низкой скорости нагрева
в тепловоз пиЛп охлаждения- В процессе изменения температуры
кристалличеек-nrn ПРОИСХ°ДИТ некоторое распухание изделий из поли-
роховатость nnnnnv РаНа Т’ е’ Уменьшение плотности), возникает ше-
кивание р пости «жеванность» и даже происходит растрес-
смежныхУпязп1л«иИ теРмических пиклах связывается с тем, что в дв>х
ГО в опоелепрпип0 °РиентиР0Ванных зернах, имеющих вследствие это-
расшипения М напРавлении различные коэффициенты теплового
Эти наппяу«-АитлРИ нагРевании возникают внутренние напряжения
скольжением ” ПРИ достижении определенного значения снимаются
чением по гпяиИгг/В0ИНИК0Вапием прк пониженной температуре и те-
кого взаимолейгтпиаерНа При высокой температуре. В результате та-
мация накапливав МеЖДу зеРнаади возникает пластическая дефор-
мЬаниЛ пп ЩаЯСЯ С Увеличением числа циклов.
точки ФазовыхР пп^а урана ВРИ термических циклах с переходом через
ется с оачпиииА РевРаЩении иной. В этом случае рост урана связыва-
ций уоаня п Плотнос™ и прочности кристаллических модифика-
1ео ' лУчае превращений а—р и 0—у объем увеличивается
примерно на 1 %. При этом на границе двух dm fivm™
треннне напряжения, превосходящие предел текучеХ вХх Вкать.ВНу"
ПИЙ урана. Пластическая деформация менее пробных 2
приведет к изменению формы урана. F ых а- и 0-фаз
§ 7.2. РАДИАЦИОННЫЙ РОСТ УРАНА
Под действием облучения происходит изменение формы и разменов
изделии из урана. При температуре ниже 673 К эти явления обуЛгов
лены радиационным ростом урана. В мелкозернистом поликни™
лическом уране при малом выгорании поверхность изделий становится
шероховатой. Имеет место так называемый эффект апельсиновой кор
ки. В случае крупного зерна ц больших выгораний неровности на по-
верхности увеличиваются, появляются чередующиеся гребешки н впа-
дины. Этот вид изменения поверхности называют жеванностью. Од-
новременно может/происходить деформация изделий, например прут-
ков из урана.
При исследовании облученного монокристалла урана было уста-
новлено удлинение в направлении [010], сокращение длины по оси
[1001 (в направлении [ООП монокристалл не изменяется). Изменение
размеров выражается коэффициентом радиационного роста Gt — без-
размерной величиной, представляющей собой при малом изменении
длины относительное удлинение, отнесенное к выгоранию: G{ = из-
менение длины, %/выгорание, %.
В более общем случае коэффициент радиационного роста выража-
ется следующим образом:
Gt = In (///0)/(A/n//n),
где I и Za — конечная и исходная длина; Д/п — число атомов, испы-
тавших деление из общего числа атомов т. Значения коэффициента
радицапионного роста монокристалла урана в случае облучения его
при температуре 373 К для направлений [010], [1001 и [001] составля-
ют соответственно + 420 ± 20; — 420 ± 20; 0 ± 20.
Поведение поликристаллического урана под облучением существен-
но зависит от размера зерна и совершенства его структуры, от харак-
тера текстуры. С ростом степени холодной деформации коэффициент
радиационного роста увеличивается, с повышением температуры про-
катки в а-области он снижается. Закалка из 0-области в значительной
степени приближает структуру к квазиизотропной. Так, для урана,
прокатанного при температуре 573 К и облученного до выгорания
0,5%, G составляет 690, а для того же материала после закалки из р-
фазы G равен 25. Данные по изменению длины образцов урана поите
различной термической обработки в зависимости от выгорания приве-
дены на рис. 7.5. m „попста-
Изменение формы урана при радиационном росте мож_ Р .
вить как переход атомов из плоскости (100) в плоскость (Q0).
перенос должен осуществляться либо миграцией отдель - •
6 Зак. 369
либо за счет их кооперативного движения. Для объяснения явления
радиационного роста урана были предложены различные теории.
Термомеханическая теория объясняет рост урана возникновением
тепловых пиков при делении и анизотропией пластических свойств
а-урана. В делящемся уране возникают локальные области диаметром
4—8 нм, где в течение 10-10 — 10-11 с температура находится на
уровне нескольких тысяч градусов. В области термического пика
должно произойти расширение металла, которому препятствует ок-
ружающий холодный металл. В связи с этим в зоне пика создаются од-
нородные сжимающие напряжения, которые вызывают локальную пла-
Рис. 7.5. Изменение длины образцов
урана в зависимости от выгорания:
1— прокатка пои 573 К: 2 — при 773 К:
3 — при 573 К (закалка из V-Фазы): 4 —
при 573 К (закалка из (3-<Ьазы и рекри-
сталлизация)
стическую деформацию двойникова-
нием в направлении [010].
Теория радиационного роста
Коттрелла основана на представ-
лении об анизотропии коэффициен-
та расширения урана и по сущест-
ву развивает изложенную выше
термомеханическую теорию. По
этой теории при возникновении ло-
кального поля напряжений в зоне
термического пика вследствие ани-
зотропии коэффициента термнче-
ского расширения часть атомов из
плоскостей (100) и (001) переместит-
ся в плоскость (010). При этом
вдоль оси 10101 появится новый
слой атомов. Следует иметь в виду,
что объем пика не может увели-
читься, так как этому препятствует окружающая его холодная часть
кристалла. Поэтому локальная пластическая деформация должна со-
провождаться перемещением атомов.
В случае идеальной решетки при охлаждении металла в зоне пика
процессы пойдут в обратном направлении и радиационного роста не
будет. Если же пики возникнут на линии краевой дислокации, то
обратный процесс не произойдет. В этом случае в плоскости (010) об-
разуются дислокационные петли, которые приводят к росту в направ-
лении [010], а экстраплоскости, образующие дислокации с вектором
Бюргерса ь [100], уничтожаются в пике деления, что дает сокраще-
ние размеров по оси [100].
Теория коррелятивных ударных процессов основывается на том,
что благодаря закономерному расположению атомов в кристалличе-
ской решетке урана ударные процессы (передача энергии атомам ре-
шетки от быстрых нейтронов и осколков деления) происходят корре-
лятивно, т. е. в определенной зависимости от энергии и направления
удара, а также от механизма передачи энергии от атома к атому в це-
почке атомов урана. Грубой механической моделью такого процесса
может служить удар бильярдного шара по «пирамиде», т. е. по тре-
угольной, плотно сложенной группе шаров. В этом случае отлета
под углом к направлению удара не тот шар «пирамиды», по которому
нанесен удар, а дальний крайний шар Таким пл
передаваться по цепочке атомов в направления* .Удар мо;кет
правлении [100] имеет место плотная упаковка ят^ и 1010J. В ка-
ноном ударе в атомном ряду в направлении Iinni v «°В' При кажД°м
дением удара и линией атомного ряда становится ме^^47 НаПрав‘
фокусировка. При таком фокусирующем удапе ппг™ ’ настУпае»
сматриваемой цепочки передаетс^^ а™У рас-
бы выбить его из решетки. Этот смещенный атом попадает"либХ
границу соседнего зерна, либо на границу субзепня ” 6 На
Атом попадает в зову того пли иного дефекта^криталитакой
и, и покидает рассматриваемую цепочку атомов В резул
вом ряду становится одним атомом меньше и происходат сокрадевиё
длины. Расчеты показывают, что фокусировка смещенных атом™ ТХ.
ществляется в направлении плотной упаковки [100]. 3
Иная картина имеет место при ударе вдоль направления [010].
Упаковка в этом ряду неплотная. В результате вместо фокусировки
удара получается обратный эффект — краудион. Угол между на-
правлением удара и линией ряда атомов становится с каждым ударом
все больше. В конце концов столкновения атома цепочки с окружаю-
щими атомами приводят либо к выбиванию атомов из ряда за пределы
данного зерна и превращению его в промежуточный атом, либо, что
наиболее вероятно, краудионный процесс задерживается на границе
зерна, и атом не выходит за его пределы. В этом случае скопившиеся
на границе атомы образуют новый гофрированный слой в направле-
нии [010], что и приводит к радиационному росту урана в этом на-
правлении.
В третьем направлении [ООН, как вытекает из анализа кристалличе-
ской решетки а-урана, вообще отсутствуют плотноупакованные це-
почки атомов. При таких условиях частицы большой энергии не могут
передавать свою энергию путем динамических коррелятивных процес-
сов типа фокусонов или краудионов, в результате чего изменение
размеров в этом направлении отсутствует.
Диффузионная теория радиационного роста урана основана на пред-
ставлении об анизотропной диффузии вакансий и смещенных а™мов
(интерстиций). Под действием быстрых нейтронов с энергией 1 2Мэ
и осколков деления с энергией около 100 МэВ в облучаемом ура-
не в 1 с возникает до 1018—1019 точечных дефектов (вакансии и сме
Щенных атомов). При выгорании 0,07% общего числа атомов в пр
родном уране каждый атом смещается из своего положения р •
Около 98% смещенных атомов рекомбинируют с вакансиями
мают места в узлах кристаллической решетки, 1 /о смещении *
поглощается дислокациями. Оставшиеся смещенные атомы и в.
.мигрируют к границам зерен и субзерен. При анизотропно д. ФФУ
смещенные атомы создают дополнительные плоскости, р ются
к увеличению размеров в одном направлении, а аа^а направле-
из решетки, что приводит к сокращению размеро дру
Коэффициенты диффузии вакансий в нал
1001] находятся в соотношении 1:0: 0,8. Диффузия ж
атомов в этих направлениях практически изотропна (0,9 : 0,9: п
Вследствие этого потоки вакансий и смещенных атомов в рассматри!
ваемых направлениях неоднородны. В направлении [010] диффундиру.
ют только смещенные атомы, поэтому и размеры в этом направлении
будут увеличиваться. В направлении [100] диффундируют предпочти-
тельно вакансии, поэтому размеры будут уменьшаться. Следует отме-
тить, что ни одна теория не объясняет всех наблюдаемых эксперимен-
тальных фактов.
Теория Бакли дает наилучшее согласование с опытными данными.
По предположению Бакли, радиационный рост обусловлен образова-
нием в поле упругих напряжений пиков деления далеко отстоящих
друг от друга групп вакансий и смещенных атомов. Смещенные атомы
удалены от пика деления за счет фокусирующих столкновений и кра-
удионов. Возникающие в результате нагрева в термическом пике на-
пряжения создают условия, благоприятные для конденсации смещен-
ных атомов и вакансий на разных атомных плоскостях. Удлинение,
возникающее за счет плоских скоплений смещенных атомов в плоскости
(010), идет по направлению минимального термического расширения.
Сокращение длины по направлению максимального термического рас-
ширения происходит вследствие скопления вакансий на плоскости
(100). Этому способствует малое значение вектора Бюргерса в направле-
нии [100]. Вектор Бюргерса в направлении [001] больше, поэтому
плоские скопления в плоскости (001) не возникают, хотя упругие на-
пряжения благоприятствуют их образованию.
Плоские скопления смещенных атомов и вакансий ограничены дис-
локационными петлями. Количество сохранившихся смещенных ато-
мов зависит от температуры облучения и дислокационной структуры
урана. Благодаря фокусирующим ударам и краудионам атомы в на-
правлении [НО] значительно удаляются от пика деления, распростра-
няясь в других направлениях в решетке лишь на несколько межатом-
ных расстояний. В совершенной кристаллической решетке зарождение
комплексов должно быть гомогенным. На стадиях облучения вероят-
ность гомогенного зарождения мала и большинство смещенных ато-
мов аннигилируют на плоских скоплениях вакансий. Результирующий
рост при этом мал. По мере возрастания дозы облучения увеличивает-
ся вероятность гомогенного зарождения ассоциаций смещенных ато-
мов, уменьшается вероятность аннигиляции и возрастает коэффициент
роста. Поликристаллические образцы и несовершенные монокристал-
лы содержат, по-видимому, достаточно дислокаций, чтобы уловить
большинство мигрирующих смещенных атомов, поэтому скорость ро-
ста вначале очень велика до тех пор, пока не возникнет столько ком-
плексов вакансий, что они смогут экранировать дислокационные
стоки. Тогда скорость роста понижается до стационарного значения.
§ 7.3. ГАЗОВОЕ РАСПУХАНИЕ
Под газовым распуханием, или свеллингом, понимают изменение
геометрии урана с большим уменьшением плотности. В случае радиа-
ционного роста изменение плотности минимально. Скорость радиа-
164
двойного роста урана достигает максимального значения ппи 47<? v
уменьшается с дальнейшим повышением темпепатупы и Л о,?73
пявной нулю при 733—773 К. Газовое DacnvyEP становится
температуре, большей 623-773 К. Явления радиационногоТмта’и
распухания могут перекрываться, т. е. механизм роста X™ “
?а««Мраспу"“™Г Д"аПа3°Не в котором HaSSlS
Газовое распухание обусловлено образованием в уране газом,
пузырьков, наполненных осколками деления, главным образом ™
образными ксеноном и криптоном. В 1 см» урана, облученного да>
горания 1 /о, образуется 4,73 см (при нормальных условиях) инеот-
ного газа. Растворимость ксенона и криптона в а-уране ничтожна. Ато-
мы этих инертных элементов не образуют химических соединений сура-
ном, его примесями и осколками деления и выделяются из решетки,
размещаясь в тех местах кристаллической решетки, где она искажена’
Такими участками могут быть микропоры, дислокации, границы двой-
ников, зерен и субзерен, слои металла, окружающие интерметаллиды,
неметаллические включения. Атомы ксенона и криптона могут, по-
видимому, захватываться отдельными вакансиями и группами вакан-
сий, т. е. объемами, дающими начало порам. Накопившийся газ при
высокой температуре создает в порах высокое давление, под действи-
ем которого происходит пластическая деформация металла. Пузырь-
ки газа растут, объединяются и образуют крупные пузыри, в ре-
зультате чего происходит увеличение объема урана, т. е. газовое рас-
пухание.
Рост газового распухания при повышении температуры обусловлен
уменьшением'сопротивления ползучести материала с увеличением тем-
пературы. При температуре 848 К увеличение выгорания от 0,2 до
0,5% приводит практически к линейному увеличению объема урана от
1 До 7%. В первом приближении выполняется зависимость AV
= — 3,6 + 19,4 (процент выгорания). При выгорании 0,27 0,3>о
увеличение объема урана при температуре 973 и 1073 К составляет
соответственно 11,5 и 84,5%. При газовом распухании разрушение
может произойти по объему зерна или по границам зерен.
Увеличение прочностных характеристик урана при пов^®в®°”
температуре и особенно характеристик сопротивления по уч
снижает газовое распухание. Это достигается Дегиров
молибденом, ниобием, цирконием. Так, сплав с 10 Л £ £ вУуран
До температуры 873 К при выгорании до 2/о. При ввеДен”“ JP
железа и алюминия образуются мелкодисперсные Рр другом,
Образующиеся на них пузырьки мелки и не слива распу-
В сочетании с закалкой из у-фазы такое легирова У ^беспечиваю-
хание при выгорании до 0,7%. Применение констру ц ’ ьшению га-
Щих сжатие ядерного горючего, также способству У
зового распухания.
165
§ 7.4. ВЛИЯНИЕ ОБЛУЧЕНИЯ НА МЕХАНИЧЕСКИЕ
ХАРАКТЕРИСТИКИ УРАНА
Облучение металлов нейтронами вызывает радиационные повреж.
дения, влекущие за собой увеличение электросопротивления, преде.
лов текучести и прочности, уменьшение пластичности и ударной вяз-
кости, смещение порога хладноломкости в сторону высокой темпера-
туры. В уране все эти эффекты проявляются более резко, так как его
кристаллическая решетка подвергается действию не только быстрых
нейтронов, но и осколков деления с энергией до 100 МэВ. Наибольшее
практическое значение имеют изменения механических характеристик
и теплопроводности при облучении. Так, при облучении в области тем-
ператур 423—573 К и выгорании 0,08% предел текучести урана уве-
личивается от 270 до 560 МПа. Предел прочности несколько снижает-
ся с увеличением флюенса, а затем возрастает. Наиболее характерным
является резкое уменьшение удлинения (от 19 до 0,3—0,5%) при вы-
горании 0,02%. Ударная вязкость урана после облучения флюенсом
нейтронов Ю19 сма снижается с 20—30 до 6—9 Дж/сма. Охрупчивание
урана под облучением начинается при малых флюенсах (10w см2).
Облучение при температуре 573—673 К приводит к аналогичным
результатам.
Отжиг облученного урана восстанавливает в некоторой степени
пределы прочности и текучести, но не восстанавливает пластичности.
Радиационные повреждения не снимаются отжигом. Причиной этого
служит не только внедрение в кристаллическую решетку урана ино-
родных атомов, осколков деления, но и главным образом возникнове-
ние микротрещин. Микротрещины на границах и в теле зерен поли-
кристаллического урана вызываются, по-видимому, анизотропным
радиационным ростом отдельных зерен. Атомы примеси, являющиеся
продуктами деления, приводят к упрочнению металла и препятствуют
снятию внутренних напряжений пластической деформацией. В зер-
нах облученного поликристаллического урана имеется большое число
двойников и полос скольжения. Зерна деформируются. В результате
взаимного воздействия беспорядочно ориентированных зерен происхо-
дит их пластическая деформация и так называемый радиационный на-
клеп металла.
Чрезвычайно важной особенностью механического поведения урз-
на непосредственно под облучением является резко выраженная пол-
зучесть — так называемая сверхползучесть, или радиационная пол-
зучесть. В нейтронном поле ползучесть закаленного, отожженного
и текстурированного урана превосходит его ползучесть вне нейтрон-
ного поля в десятки и сотни раз. При облучении в потоке нейтронов
с плотностью 6- 101а (сма-с)_ 1 ползучесть урана при температуре
493 К наблюдается при напряжении 0,02 МПа. При той же температу-
ре испытаний без облучения в уране ползучести не отмечается. При
температуре 373 К в условиях облучения уран ползет со скоростью
10 5%/ч под действием нагрузки, составляющей 1% нормального
предела текучести урана при данной температуре. Предполагается,
что сверхползучесть связана с идущим под облучением процессом Ра‘
166
„«анионного роста, при котором зерна voawa ппп
5 доводят тем самым напряжение до предала теУучестиРй НЭ ДРуга
ловиях приложение даже ничтожной внешней нагп^Л таких Ус*
' значительной ползучести, так как по мере лесЬпг приводит
й рост в направлении [010] все время пов^Ср^н^
реННую ползучесть часто связывают с образованием дефектов J'nа СК°'
ке и с движением атомов в зоне термического пика S решет'
2жег вызвать деформацию твэлов,' что имел” ™т0 мТи “„ЗУ’К^
акторах атомной станции в Колдер-Холле. ’ априМеР« в ре-
§ 7.5. СПЛАВЫ УРАНА
Возможности использования чистого урана для изготовления ме-
таллических сердечников твэлов ограничены из-за изменения свойств
урана при облучении. Термическая и термомеханическая обработка
урана, позволяющая получить более устойчивую мелкозернистую и
квазиизотропную структуру, не решает полностью проблемы устой-
чивости металлического ядерного горючего. Повышение устойчивости
ядерного горючего в твэлах с металлическим сердечником может
быть достигнуто применением сплавов урана.
Сплавы урана должны обеспечивать минимальный паразитный за-
хват нейтронов. Для этого легирующие элементы должны иметь мини-
мальное сечение захвата нейтронов. Сплавы должны сохранять разме-
ры и форму при работе в реакторе и обладать высокими прочностью
и пластичностью. Сплав должен быть совместим с оболочкой твэла.
Диффузионное взаимодействие сплава с материалами оболочки недо-
пустимо, так как в результате диффузии могут возникнуть поврежде-
ние оболочки и разрушение твэла. В условиях длительной эксплуата-
ции возможно нарушение герметичности оболочки, вследствие чего
ядерное горючее будет контактировать с теплоносителем. Для предот-
вращения вымывания урана и его продуктов коррозии в теплоноситель
сплавы должны обладать высокой коррозионной и эрозионной стой-
костью.
Сплавы урана, предназначенные для использования в качестве
ядерного горючего, можно разделить на две группы: сплавы со струк-
турой a-фазы, в которых небольшое количество легирующих элемен-
тов способствует получению мелкозернистого металла без текстуры, и
сплавы со структурой у-фазы, в которых легирующие элементы вво-
дятся в количестве, достаточном для частичной или полной стабили
зации кубической у-фазы. Сплавы первой группы на основе природно-
го или слабообогащенного урана применяют главным образом в резк
торах на тепловых нейтронах. Примером таких сплавов могут слУ*
сплавы урана <0,4% AI, 0,5-2,0% Мо, 2,0 Zr, 0,1% Ст. Сплавыt вто-
Р°й группы более универсальны, но из-за высокого сод р _
РУющих элементов требуют значительного °^°raL?,_ ij—ZrU_____Nb
сплавов этого типа могут служить сплавы систем и , ’
" ройные сплавы системы U-Zr-Nb со
2егирующих компонентов. Значительный интерес рд и
Позиции на основе интерметаллических соединени з »
Сплавы с железом. Легирование урана небольшим количеством
(сотые доли процента) железа улучшает эксплуатационную надежность
сеодечников твэлов. После закалки у такого урана измельчается зер.
но и повышаются механические характеристики. Это ослабляет рц.
диационное огрубление поверхности сердечников твэлов. Урановый
угол диаграммы состояния U—Fe представлен на рис. 7.6. В этой си-
стеме образуется ряд интерметаллидов урана. Предельная раствори-
мость железа в а-уране близка к нулю, а в 0- и у-фазах — соответст-
венно 0,5 и 1,8%.
Рис. 7.6. Урановый угол диаграммы системы U — Fe
не алюминием. Алюминий практически нерастворим в а-ура-
саптаот™ ная растворимость алюминия в 0- и у-фазах составляет
металлических соеданения ' ” U-A1 П>» ™«1>-
В НИЯ меЛкозеРнистого металла со структурой а-фазы.
вклкЕы?ЛРе сплавов с содержанием алюминия 0,15—0,5% имеются
0 4% оекпиДя^ге^Т'аЛЛИДа UA?2- Сплав с содержанием алюминия
полиэлпииАск^тЛг3пеТСЯ очень быстро и приобретает мелкозернистую
предпочтительнойппГУРУ С РазмеР°м зеРен 10—20 мкм. Зерна с
сплав обляпает оРиентиРовкои практически отсутствуют. Такой
чительно более vrrn”KHM сопР0Тивлением термической усталости и зна-
"ри
ляют^уояи^я интеРес для использования в реакторах представ-
168 *УР алюминиевые сплавы, содержащие менее 35% U. В спла-
16% U значительное количество алюмийия находится б биде
ве с I4"* UAU- Структура сплава состоит из кристаллов первично-
соединен17 ия UAL. распределенных в матрице, состоящей из эвтек-
r° coeff_UA14
тики интерметаллических соединений наиболее важное значе-
Из тРе сперсионных твэлов имеет соединение UA14. Сфероидальная
Рис. 7.7. Диаграмма состояния U — А1
форма включений этого соединения благоприятствует сохранению фор-
мы металла матрицы и не вызывает трудностей при изготовлении твэ-
лов.
Сплавы с кремнием. Диаграмма состояния U—Si представлена на
Рис. 7.8. В а-уране кремний практически не растворяется. Раство-
римость кремния в Р- и у-уране (в атомном содержании) составляет
соответственно 2,58 и 3,75%. Легирование урана кремнием в атомном
содержании 0,5—1,5% понижает температуру у—₽- и особенно р—«-
превращений. Полная фиксация ₽-фазы наблюдается в сплавах с
0,25-1,5% Si.
Кремний более эффективен в смысле сохранения p-фазы при за-
калке, чем алюминий и железо. Легирование урана кремнием приво-
дит к уменьшению размера зерна в уране, закаленном из у- я р-фа •
„ Фаза U3Si содержит 3,78% Si. Для выдавленных и
тержней из U3Si пределы прочности и текучести соответст Р
НЫ 703 и 420 МПа. Литые образцы имеют хорошую чистую ™вер
ость и стабильны при облучении. Выдавленные обра цы
удлиняются при облучении. Вследствие накапливания Газообразна,,
продуктов деления наблюдается распухание при температуре нил
773 К. При выгорании более 600 МВт-сут/т максимальное увеличеии
объема вследствие распухания составляет 7%. Необлученный сплав
показал высокую коррозионную стойкость в воде при температуре
588 К.
Рис. 7.8. Диаграмма состояния U — Si
Сплавы с хромом. Одним из наиболее значительных эффектов, до-
стигнутых легированием урана, является измельчение зерна в спла-
вах с хромом. С увеличением содержания легирующего элемента раз-
мер зерна уменьшается. Так, при содержании хрома 0,067; 0,4; 0,9/о
размер зерна составляет соответственно 0,050; 0,035; 0,030 мм. Пре-
дельная растворимость хрома в различных модификациях урана со-
ставляет: a-U — 1,5% атомного содержания; 0- U— 1,5%; у- U
4,5%. Легирование хромом резко замедляет фазовые превращения.
Сплавы урана, содержащие менее 0,3% Сг, могут быть подвержены
изотермической обработке, в процессе которой превращение 0—а ПР°*
170
ИСХОДИТ при постоянной температуре. Малые добавки
вуют увеличению прочности урана. А аВКИ хР0Ма способст-
Сплавы с молибденом. Диаграмма состояния ТТ м
на на рис. 7.9. В этих сплавах при закалке могут быть ^JPe4CTaMe'
как так и у-фазы, а также промежуточные метастаб£.КСИР дВаНЫ
При содержании молибдена ~ 1 % закалка сохраняет р фазу пр/Х
Массовое содержание Мо, %
Рис. 7.9. Диаграмма состояния U — Мо
натной температуре. При закалке сплавов с 3% Мо у-твердый раствор
полностью превращается в а'-фазу пересыщенный -
твердый раствор на основе a-фазы урана. В сплавах, содеР
лее 3% Мо, начинается подавление у-a -превращения, которое до-
стигается полностью при атомном содержании 11 /о о.
Пределы прочности и текучести закаленных сп ₽ _
Держания молибдена проходят через максимум при атомн,ом вдер
нии 5% Мо и составляют в этом случае соответственно О '
Относительное удлинение равно 8%. Радиационная стойкость спла-
Вов возрастает с увеличением содержания молибдена.
171
Наилучшую радиационную стойкость имеет сплав с 10% Мо, облу-
ценный в у-состоянии. После закалки в воду облучение при темпера
туре 513 К до выгорания 0,09% атомного содержания не изменило гео'
метрии образцов. В холоднопрессованных и спеченных сплавах с тем
же содержанием молибдена при выгорании 0,18—1,02% размеры об-
разцов изменялись на 0,5—1,2%.
Сплавы урана с молибденом лучше, чем чистый уран, сопротив-
ляются газовому распуханию. Стабильность сплавов возрастает с уве-
личением содержания молибдена. При выгорании 2,5—3,0% атомно-
го содержания увеличение объема в сплавах с 10—13% Мо составляет
2—4%. Такое увеличение объема наблюдается в чистом уране уже при
выгорании 0,2—0,5%. Коррозионная стойкость сплавов с 10—12%
Мо в воде высокой чистоты при температуре до 573 К достаточно вы-
сока.
Сплавы с цирконием. Цирконий растворяется в значительном ко-
личестве в y-U и задерживает структурное превращение. Однако
для стабилизации у-фазы при комнатной температуре требуется зна-
чительное количество циркония. При добавке ниобия содержание цир-
кония в сплаве, необходимое для фиксирования у-твердого раствора
при комнатной температуре, снижается. Так, сплав урана с 5% Zr
и 1,5% Nb был успешно использован в экспериментальном кипящем
реакторе в США. Температура поверхности твэлов в этом случае со-
ставляла 553 К, а коррозионная стойкость сплава была удовлетвори-
тельна в воде при 573—623 К- Максимальная радиационная стойкость
сплава с коэффициентом роста 17 достигается после изотермического
превращения при 893—923 К, которое приводит к образованию сферо-
идальных частиц а-урана.
Фиссиум. В результате пирометаллургической очистки отрабо-
танного ядерного горючего достигается удовлетворительная очистка
от легколетучих редкоземельных элементов. Однако определенная
группа элементов —продуктов деления урана — не может быть вы-
ведена таким способом. Оставшиеся в топливе продукты деления —
Мо (3,42%), Ru (2,6%), Тс, Rh, Pd (каждый по 0,3—0,9%) — в сово-
купности называют фиссиумом Fs. По мере повышения концентрации
фиссиума повышается стабильность у-урана.
В сплаве с 5% Fs у-фаза легко фиксируется при комнатной темпер
ратуре. Пределы прочности и текучести для этого сплава при 813 К
составляют соответственно 22—30 и 80—100 МПа, относительное уд-
линение 8—13%. Сплав урана с 5% Fs имеет высокую радиационную
стойкость. При температуре облучения 633—863 К коэффициент ра-
диационного роста равен 1—2. При 873 К газовое распухание приво-
дит к увеличению объема на 8 % на каждый атомный процент вы-
горания. Перспективным является металлическое горючее примерно
следующего состава: U — 15%, Ри — 10%Fs.
Сплавы с большим разбавлением. В последнее время внимание
привлекают сплавы урана с большим разбавлением, содержащие ме-
нее 50% U. Такие сплавы изготовляются на основе Al, Zr, Nb — эле-
ментов с малым сечением захвата.
172
§ 7.6. СОВМЕСТИМОСТЬ УРАНА С МАТЕРИАЛОМ ОБОЛОЧКИ
И КОРРОЗИЯ УРАНА
В процессе эксплуатации твэлов уран и его сплавы длительна
время контактируют с оболочкой. Взаимодействие между оболов
и сердечником может привести к разгерметизации твэлов. чкои
Алюминий. Тепловыделяющие элементы с сердечником из метал-
лического урана и оболочкой из алюминия или его сплавов исполь"
зуют во многих реакторах на тепловых нейтронах. Скорость взаймы
действия урана с алюминием связана с температурой уравнением Ао
рениуса. С увеличением температуры от 484 и 993 К скорость реакции
возрастает в 104 раз. Диффузионный слой, образующийся между ура-
ном и алюминием, состоит в основном из интерметаллида UA13. Ин-
тенсивное взаимодействие урана с алюминием начинается уже при
температуре 523 К. При 573 К между обоими металлами возникает
слой интерметаллических соединений, достигающий толщины 0 025 мм
за 2000 ч.
Скорость диффузии зависит от давления. Предполагается, что дав-
ление нарушает целостность окисных пленок на алюминии и уране,
что способствует диффузии. При неблагоприятных условиях диффу-
зионный слой, состоящий из интерметаллида, выходит на поверхность
алюминиевой оболочки, в результате чего происходят взаимодействие
с теплоносителем и разгерметизация твэла. Для повышения стойкости
твэлов из урана с алюминиевой оболочкой применяют промежуточные
слои, чаще никелевые. Скорость взаимодействия урана с алюминием
при этом снижается и обеспечивается прочное сцепление оболочки с
сердечником. Аналогичным образом действует промежуточный слой
из алюминиево-кремниевой эвтектики.
Цирконий. Цирконий совместим с нелегированным ураном и его
сплавы с 10% Мо примерно до 773 К, а со сплавами урана, содержащи-
ми 2—80% Zr или 80—90% Nb, приблизительно до 973 К. Со сплава-
ми урана, содержащими 75—84% А1, цирконий плохо совместим; вза-
имодействие начинается уже при 773 К.
Магний. Магний совместим с ураном и его сплавами до темпера-
туры 773 К.
Сталь типа 1Х18Н10Т. Совместимость аустенитной нержавеющей
стали типа 1Х18Н10Т с ураном можно охарактеризовать следующим
образом. При температуре 773 К за 1 год в стали образуется слои уран-
содержащих интерметаллидов толщиной 0,03—0,04 мм. При о
973 К толщина слоя 0,25 и 0,5 мм соответственно. Столь быстрое во -
растание скорости взаимодействия с увеличением температуры и опас-
ность локального перегрева оболочки заставляют либо снизить н м -
нальную расчетную температуру, либо изолировать сталь от урана о
сидированием последнего, слоем натриево-калиевой эвтектики и т. д.
Твэлы с натриевым или натриево-калиевым слоем между горю
стальной оболочкой применялись в реакторе «Энрико Ферми», ид
такая изоляция ненадежна, и в современной практике избегают прим
нять твэлы с урановым сердечником и оболочкой из нержавеющей ста*
173
Электрохимическое поведение урана. Уран принадлежит к числ
металлов, пассивирующихся в нейтральных средах. В насыщенщ/
воздухом водных средах, не содержащих активаторов, при стационап
ном потенциале уран находится в пассивном состоянии. Пассиваций
урана связывают с образованием на его поверхности двуокиси уРаНд
темно-бурого цвета. Между кристаллическими решетками Двуокиси
урана и урана имеется структурное соответствие. Так, кристаллогра
фическая плоскость (110) двуокиси урана параллельна плоскости (100)
урана. В присутствии кислорода в воде образуется более плотная плен,
ка продуктов коррозии с лучшими защитными свойствами. При деаэ^
рации воды стационарный потенциал урана смещается в отрицатель-
ную сторону и соответствует активной области. Естественно, что ско-
рость коррозии при этом возрастает. Присутствие в среде сильных
окислителей в значительной концентрации, например хроматов, пер.
манганатов, смещает стационарный потенциал урана в область пере-
пассивации, что интенсифицирует коррозию. При малой концентра-
ции (0,1—1 г/л) такие окислители, как хроматы, нитриты, действуют
как пассиваторы. Стационарный потенциал урана в этом случае отве-
чает пассивной области.
Коррозия урана. В нейтральной, насыщенной воздухом среде кор-
розия урана протекает с кислородной деполяризацией, в деаэрирован-
ных средах — с водородной. В последнем случае в продуктах коррозии
урана присутствуют гидриды. Присутствие в среде нитратов, сульфа-
тов до концентрации 0,1—1 г/л не влияет на стойкость урана. Хлориды
уже в количестве 0,01—0,1 мг/л депассивируют уран и интенсифици-
руют его коррозию, вызывая образование язв.
Уменьшение pH среды интенсифицирует коррозию урана. Кислые
среды, содержащие значительные количества окислителя, применяются
для растворения урана при переработке ядерного горючего. С ростом
температуры коррозия урана интенсифицируется в соответствии с за-
коном Аррениуса. При температуре 373 К коррозия идет с водородной
деполяризацией со скоростью 2—5 мг/(сма-ч). Перекись водорода как
сильный окислитель способствует пассивации урана и снижает ско-
рость его коррозии.
Во влажном паре стойкость урана такая же, как и в воде при той
же температуре. В перегретом паре скорость коррозии урана растет
с увеличением давления. При наличии щелей доступ кислорода в них
затруднен, что приводит К интенсификации коррозии урана в щеля^
и зазорах. При наличии неплотности в оболочке вода поступает в за-
зор между урановым сердечником и оболочкой. Вследствие интенси
ного процесса коррозии происходит’накопление окислов урана и г д
рида, что приводит к распуханию оболочки, образованию так назыв
мых отдул ин.
Повышение коррозионной стойкости урана может быть досТИр^_
то легированием. Наиболее стойкими являются: 1) сплавы со cJP^r0
турой у-твердого раствора; 2) сплавы со структурой пересыще
a-твердого раствора мартенситного типа; 3) композиция на осно
терметаллических соединений.
174
к первой группе принадлежит, в частности, ряд сплавов системы
U-Mo с содержанием молибдена 13-20%. При темпеоатуое 373
473 К стойкость таких сплавов в десятки раз в£ше стойкое™ н^ег7-
рованного урана. Однако даже при самой оптимальной ?ермичТкой
обработке эти сплавы разрушаются в воде при 573 К за время от 30
до 100 сут Несколько менее стоек сплав урана с 5% Zr /1 5% Nb
закаленный из J-области на мартенсит. К третьей группе относится
композиция с 3,8 %S1, достаточно стойкая в воде при 533 К? Комп?,
зиция с 3,8 %Si может применяться при более высокой температуре
чем сплавы со структурой у-твердого раствора и а-мартенсита Г&
следние две группы сплавов при длительных выдержках при высокой
температуре испытывают структурное превращение с образованием
стабильной a-фазы с низкой коррозионной стойкостью
Атмосферная коррозия урана. Металлический уран взаимодейст-
вует с воздухом при комнатной температуре. Во влажном воздухе ме-
талл покрывается окисной пленкой темно-коричневого цвета, состоя-
щей из двуокиси урана. Состав окисла может отличаться от стехио-
метрического в сторону избытка кислорода. Скорость коррозии урана
при комнатной температуре в сухом воздухе невелика и составляет
несколько микрон в год. Увеличение влажности и температуры интен-
сифицирует окисление урана. Коррозия урана при этом идет по ли-
нейному закону. При высокой влажности или при Т > 343 К окисная
пленка не является защитной. Нагрев на воздухе до 773—973 К может
привести к загоранию урана, который более пирофорен, чем цирко-
ний. При низкой температуре уран не взаимодействует с очищенными
от влаги и кислорода гелием, азотом, углекислым газом, водородом.
'Однако при 643 К уран реагирует с сухим азотом, а при 773 К —
с углекислым газом.
Стойкость урана в жидких металлах. Уран достаточно стоек в очи-
щённых от кислорода натрии и в эвтектике Na—К. Присутствие
в щелочных металлах кислорода интенсифицирует коррозию урана.
.Уран имеет большее сродство к кислороду, чем натрий ( 1030,8 и
—751,6 кДж/моль соответственно), и в связи с этим уран восстанавли-
вает окись натрия, окисляясь до двуокиси урана. В потоке натрия с со-
держанием кислорода 0,005% при 873 К скорость коррозии урана рав-
.на0,8 мг/(см2-ч). С очищенными от кислорода щелочными металлами
Уран практически не взаимодействует до температуры 773 К. У
ние не сказывается на интенсивности взаимодействия урана щ
ми металлами до 873 К. Даже в случае нарушения
ки твэла взаимодействие уранового сердечника с щелочи
ми не приводит к серьезному загрязнению теплоносит .
Стойкость урана в органическом теплоносителе, дифенил УР
значительно более стоек, чем в воде при той же ТРплоносйтелей.
кость урана сильно зависит от чистоты органическ б мес
В очищенном дифениле уран стоек в течение по'крайней мере о
Контакт урана при нарушении целостности °бо язнен£ю по.
•Ческим теплоносителем не приводит к сущест У
следнего.
175
Защитные покрытия. Для защиты от коррозии и в качестве по
жуточного слоя между урановым сердечником и металлической пб6"
лочкой твэла на уран наносятся покрытия. Покрытия наносятся га
ваническим, химическим, диффузионным, горячим способами, разло^Ь"
нием летучих соединений из, газовой фазы либо путем создания заЦ1ие"
ной окисной или нитридной пленки. Качество покрытий существен7'
зависит от чистоты поверхности урана, в частности от наличия на нй
окислов. Поскольку уран легко окисляется на воздухе, очистка ег
поверхности представляет существенную трудность. Большинство S
крытий не защищают уран от коррозии в кипящей воде сколько
нибудь длительное время, в основном покрытия применяются в каче
стве промежуточного слоя между ураном и оболочкой.
§ 7.7. ПЛУТОНИЙ И ЕГО СПЛАВЫ
Физические свойства. Плутоний — 94-й элемент периодической
системы. Наибольшее значение имеет нуклид плутония с относитель-
ной атомной массой 239. В природе плутоний практически не встре-
чается. В урановых рудах обнаруживаются лишь следы 239Ри в коли-
честве 5-10-12 % содержания урана. Получают плутоний в процессе
ядерных превращений в ядерных реакторах. При облучении естест-
венного урана до выгорания 0,5% 235U образуется 0,28%239Ри. Для
извлечения плутония из облученного урана последний растворяют в
азотной кислоте. Уран и плутоний из раствора экстрагируют органи-
ческими растворителями. При этом основная масса продуктов деле-
ния остается в водном растворе. Далее плутоний отделяют от урана.
Металлический плутоний получают металлотермическим восстановле-
нием его соединений, например галоидных. Для использования в ка-
честве восстановителя лучше всего подходит кальций, не образую-
щий с плутонием сплавов.
В зависимости от длительности облучения урана в реакторе могут
быть получены 11 изотопов плутония с относительной атомной мас-
сой от 232 до 243 и периодами полураспада от 35 мин до 9-10® лет.
Период полураспада 239Ри составляет 24 060 лет. Распад изотопа
239Ри сопровождается а- и у-излучением.
Температура плавления металлического плутония 913 К, темпе-
ратура кипения 3500 К- В интервале температур от комнатной до
температуры плавления плутоний имеет шесть аллотропических моди-
фикаций. Температура фазовых превращений, типы кристаллической
структуры и плотность различных кристаллических модификации
плутония представлены в табл. 7.3. Следует отметить, что 6-модифи-
кация плутония е плотноупакованной решеткой имеет наименьшую
плотность. В зависимости от кристаллографической модификации
существенно меняется коэффициент теплового расширения — от
56-10-8 град-1 для «-модификации до — 57,9-10-® град-1 для ^-мо-
дификации. Отрицательный температурный коэффициент для о- и il-
фаз плутония, т. е. сокращение линейных размеров при нагревании,
необычен для металлов с простыми решетками и до сих пор не нашел
удовлетворительного объяснения.
176
Структур» модификаций плутония
Таблица 7.3
фаза Темпера- турный интервал существо- вания, К Плот- ность. г/см3 Элементарная ячейка Число атомов в ячей- ке
Тип решетки Параметры
а Ниже 392 19,816 (298 К) Моноклинная простая а = 0,61835 нм (294 К? 6 = 0,48244 нм- 16
с = 1,0973 нм;’
₽ 392—491 17,82 Объемоцентрирован- ₽ = 101,81° а = 0,9284 нм (463 К? 6 = 1,0463 нм; ’ .44
(406 К) ная моноклинная
с= 0,7859 нм;
7 491—583 17,14 Г ранецентрированная Р = 92,13° а = 0,31587 нм (506 К? 6=0,57682 нм; я
(t)U6 KJ орторомбическая
6 583—723 15,92 (593 К) 16,0 Г ранецентрированная кубическая Г ранецентрированная с = 1,0162 нм а =0,46371 нм (593 К) 4
П 723—745 а =0,4701 нм (738 К); 4
(720 К) тетрагональная с =0,4489 нм;
745—913 16,48 с/а = 0,955
г Объемноцентрирован- а=0,36361 нм (763 К) 2
(783 К) ная кубическая
Переход одной кристаллической модификации плутония в другую
сопровождается изменением объема и соответствующими тепловыми
эффектами (табл. 7.4). Аллотропические превращения плутония могут
происходить как с увеличением, так и с уменьшением объема.
Таблица 7.4
Объемные изменения и скрытая теплота аллотропических превращений плутония
Характеристика превращения а—>3 ₽->v у—>б й—>Г) К)->8 е-*жид- КОСТо
Объемное изменение, % Скрытая теплота превращения, Дж/г 8,9 13,4±2,0 2,4 2,9±0,4 6,7 3,3±0,4 —0,4 0 —3,0 6,7±1,25 ~0,1 14,0±2,0
Аллотропические превращения, сопровождающиеся существенным
изменением свойств металла, приводят к изменению формы изделий
из плутония при циклических нагревах и охлаждениях.
Механические характеристики плутония. При комнатной темпе-
ратуре предел прочности плутония 356 МПа, предел текучести
225 МПа, относительное удлинение 0,068% . При температуре 598 К
эти значения составляют соответственно 14,1 МПа, 11,5 МПа и 50,1 %.
177
При комнатной температуре плутоний имеет высокую прочность и ни
кую пластичность, т. е. является хрупким металлом. Вследствие им3"
кой пластичности a-фазы объемные изменения, происходящие пп"
охлаждении плутония, приводят к появлению внутренних напря*“
ний, микротрещин.
В результате a-активности металлический плутоний в компакт-
ном виде самор азогр евается.
Высокая химическая активность, большое число аллотропических
превращений, сопровождающихся существенным изменением объема
малая пластичность «-плутония усложняют технологию изготовления
изделий из него. Высокая реакционная способность плутония ограничи-
вает число тугоплавких металлов, пригодных для изготовления литей-
ной оснастки. Наиболее пригодными для этой цели являются тантал*
вольфрам, окислы или фториды кальция, окись магния, сульфид це-’
рия. Для предотвращения окисления процесс плавки и разливки плу-
тония необходимо проводить в условиях высокого вакуума.
В области a-фазы из-за высокой хрупкости плутоний с трудом под-
дается деформации. В области 6-фазы (583—723 К) плутоний пласти-
чен и может быть подвергнут всем видам обработки давлением: прес-
сованию, ковке, штамповке, вытяжке. При охлаждении из области тем-
пературы 6-фазы до комнатной происходят три фазовых превращения,
в связи с тем остается возможность коробления и растрескивания го-
товых изделий при охлаждении. Обработку плутония при высокой тем-
пературе, так же как плавку и_литье, следует проводить в вакууме
или в инертной атмосфере.
Коррозионная стойкость плутония. Плутоний химически более
активен, чем уран, и обладает большим сродством к кислороду, водо-
роду, азоту. С углекислым газом плутоний реагирует при сравнитель-
но низкой температуре, восстанавливая его до окиси углерода и при
избытке плутония до графита. При комнатной температуре (и особен-
но при 473 К) плутоний быстро реагирует с водородом с образованием
гидридов. С азотом плутоний взаимодействует слабо даже при темпе-
ратуре 1073—1273 К.
Совместимость плутония с щелочными металлами изучена слабо.
Литий не образует с плутонием твердых растворов и интерметалличе-
ских соединений. Плутоний восстанавливает окислы калия и натрия,
но не восстанавливает окись лития.
• В виде порошка и стружки плутоний пирофорен и легко загора-
ется на воздухе, образуя аэрозоли окиси. При выдержке на воздухе
поверхность компактного плутония покрывается легко отстающей
пленкой окисла. Во влажной атмосфере до температуры 323 К плен-
ка состоит из двуокиси плутония и имеет желтый цвет. Окисление плу-
тония на воздухе интенсифицируется с ростом температуры и проте-
кает по закону, близкому к линейному, до 478 К. При более высокой
температуре окисление идет по параболическому закону с образова-
нием черной защитной пленки, хорошо сцепленной с металлом. В воде
протекает коррозия плутония с образованием гидроокиси. Скорость
взаимодействия его с водой относительно низкая. В кипящей вод
этот процесс существенно ускоряется. Присутствие кислорода в вод
178
снижает скорость коррозии. Это свидетельствует о том, что плутоний
принадлежит к пассивирующим металлам “лутонин
Стойкость плутония близка к стойкости урана. Во многих случаях
имея данные о коррозионной стойкости урана, можно качественно
дить о стойкости плутония в аналогичных условиях. Продукта коп
розии плутония токсичны. В растворах серной кислоты плутоний паст'
воряется плохо, в растворах азотной кислоты - незначительно хстя
его двуокись и гидроокись в этих концентрированных кислотах паст
воряются хорошо. Легирование плутония элементами, стабилизирую-
щими о-фазу, приводит к существенному повышению коррозионной
стойкости аналогично сплавам урана на основе у-фазы.
Сплавы плутония. Легирование плутония алюминием, цирконием
титаном, церием, таллием и торием, с последующей закалкой сплава*
из области температуры, соответствующей б-фазе, позволяет фикси-
ровать пластичную б-фазу при комнатной температуре. Например,
структуру б-фазы имеют закаленные сплавы плутония с алюминием
при атомном содержании последнего 2—13%. При быстром охлажде-
нии в сплавах плутония с содержанием менее 5% А1 из-за ликвации
последнего присутствует нежелательная a-фаза. Отжиг в области тем-
пературы, соответствующей a-фазе, полностью восстанавливает гомо-
генность сплава. Железо, кобальт, никель значительно снижают темпе-
ратуру плавления плутония, образуя легкоплавкие эвтектики, при-
годные для использования в качестве жидкометаллического горючего.
В качестве ядерного горючего, в частности, для реакторов на быстрых
нейтронах можно применять сплавы плутония с ураном. Дополнитель-
ное легирование этих сплавов молибденом (14%) увеличивает стабиль-
ность их при 773—873 К. Структуру, стабильную до 823 К, имеет
сплав урана, легированный 15% Ри и 20% Мо.
Радиационная стойкость. Металлический плутоний имеет низкую
радиационную стойкость. Так, облучение нелегированного плутония
при 623—673 К (область б-фазы) с 44 циклами охлаждения до темпера-
туры у- и Р-фаз (423—473 К) привело к разрушению образца и пока-
зало полную непригодность этого металла для использования в чи-
стом виде в качестве ядерного горючего. Легирование плутонием раз-
личных металлов обычно используют при необходимости равномерно
распределить плутоний либо в воспроизводящем материале (уране или
тории), либо в каком-либо конструкционном материале для получе-
ния стабильного при облучении сплава. Уран-плутониевые сплавы ра-
диационно-нестойки вследствие радиационного роста и газового рас-
пухания. Термическая обработка позволяет избежать радиационного
роста, но создаваемое при этом крупное зерно приводит к появлению
излишне шероховатой поверхности металла после облучения._Радиа-
ционная стойкость уран-плутониевых сплавов (до 10—15% _Рн) по-
вышается при дополнительном легировании их молибденом в коли-
честве 28% атомного содержания. Радиационная стойкость сплавов
систем Th^-Pu выше, чем у сплавов U—Рш
Удовлетворительную радиационную стойкость показали сплавы
алюминия е 0,5—20% Ри. Эти’сплавы имеют хорошие литеиные каче-
ства и поддаются механической обработке. Структура сплавов с боль-
179
шим содержанием плутония двухфазная и представляет собой отдел
ные зерна хрупкого интерметаллида РиА14, диспергированного в пл
стачной алюминиевой матрице. Проблема радиационной стойкое?'
снимается в случае применения жидкометаллического горючего ВИ
основе плутония. Однако в этом случае появляется проблема выбоп
конструкционных материалов, совместимых с ядерным горючим. Нам
меньшую скорость растворения в жидком уране по сравнению с дру'
гими тугоплавкими металлами имеют вольфрам и тантал. Возможно
они будут совместимы с плутонием и его сплавами при высокой темпе’
ратуре и длительной экспозиции.
§ 7.8. ТОРИЙ И ЕГО СПЛАВЫ
Физические свойства. Торий — радиоактивный химический эле-
мент семейства актиноидов с атомным номером 90. В противополож-
ность урану и плутонию торий сам по себе не является делящимся
(расщепляющимся) материалом. При облучении природного тория теп-
ловыми нейтронами образуется 233U, который можно извлечь и исполь-
зовать как расщепляющийся материал.
Торий — мягкий серебристый металл. Низкотемпературная «-мо-
дификация тория с ГЦК-решеткой при температуре 1673 К переходит
в 0-модификаию с ОЦК-решеткой. Температура плавления тория
1968 К, плотность 11,71 г/см3; коэффициент теплового расширения в
интервале температуры 303—873 К составляет 12-10—6 град-1. При-
родный торий состоит из практически чистого изотопа с относитель-
ной атомной массой 232. Кроме него известны еще пять природных
и семь искусственных изотопов тория.
Механические характеристики. Чистый торий пластичен и легко
деформируется в холодном состоянии. Сравнительно небольшие за-
грязнения существенно сказываются на механических свойствах то-
рия. В зависимости от способа получения варьируются и предел проч-
ности (140—220 МПа), предел текучести (80—130 МПа), относительное
удлинение (20—50%). Примеси большинства элементов, особенно угле-
рода, заметно упрочняют торий, а примеси кислорода и азота почти
не влияют на механические характеристики тория. Прочность тория
быстро падает с ростом температуры.
Коррозионная стойкость. Торий более коррозионно-стоек, чем
уран и плутоний. Поверхность его на свежем срезе остается неокислен-
ной длительное время. С увеличением температуры скорость окисле-
ния тория на воздухе возрастает. При температуре до 1123 К окисле-
ние идет по линейному закону с образованием двуокиси тория. В ди-
стиллированной воде торий стоек до 273 К. На поверхности металл
образуется защитная пленка. С дальнейшим повышением температу-
ры скорость коррозии тория в воде резко возрастает. Легировани
титаном, цирконием, бериллием повышает стойкость тория.
Радиационная стойкость. В жидкометаллических теплоносителя
торий стоек. Загрязнение жидких металлов кислородом снижает
стойкость. Металлический торий не претерпевает аллотропических пр
180
вращений и до температуры 1673 К имеет изотропную ГЦК-пешет™
В связи с этим не следует ожидать размерной нестабильностии^^
зОТропных свойств при облучении характерных для урана. Так nSe
облучения флюенсом нейтронов см"» диаметр ториевых бло^в
увеличился на 0,02/6. Сплавы тория с ураном радиационно-стойки
хорошо сопротивляются газовому распуханию. Хорошую размеон™
стабильность при облучении показали и сплавы тория, легированное
§ 1.9. КЕРАМИЧЕСКОЕ И ДИСПЕРСИОННОЕ ЯДЕРНОЕ ГОРЮЧЕЕ
Соединения урана, плутония, тория с неметаллами (кислородом
углеродом, азотом и др.), имеющие высокую температуру плавления*
значительную плотность горючего материала, низкое сечение захва-
та, стойкость в условиях облучения, обычно объединяют в одну груп-
пу — керамическое ядерное горючее. Керамическое ядерное горючее
находит все более широкое применение, особенно для высокотемпера-
турных реакторов. Применяемые материалы можно разбить на три
основные группы. Первая группа включает керамику на основе окис-
лов урана, тория, плутония или их смеси. Применяют также смеси
окислов делящихся и неделящихся материалов. Ко второй группе
относятся неокисные керамические материалы: карбиды, нитриды,
сульфиды, фосфиды и другие соединения урана, плутония, тория, их
смеси, а также смеси их с другими соединениями, не содержащими де-
лящихся нуклидов. К третьей группе относят керамические материа-
лы, диспергированные в графитовой или иной матрице. Дисперсной
фазой (ядерным горючим) могут быть любое соединение урана, плу-
тония, тория или их смеси.
Двуокись урана. Из окисных материалов самое широкое исполь-
зование нашла двуокись урана. Двуокись урана имеет ГЦК-решетку
типа решетки фтористого кальция (флюорита). Параметры решетки
и ряд других свойств двуокиси урана приведены в табл. 7.5. Следует
отметить, что температура плавления двуокиси урана зависит от
ее стехиометрического состава. Коэффициент теплового расширения
Двуокиси урана в интервале температуры 299—1273 К составляет
10,52-IO-8 град-1.
Существенным] недостатком двуокиси урана является ее низ-
кая теплопроводность, составляющая для 873 и 1273 К 0.033 и
0.026 Дж/(см-с-град). Это обусловливает при эксплуатации высокие
температурные градиенты по сечению и может явиться причиной рас-
трескивания и даже расплавления UO2. Во избежание этого изделия из
Двуокиси урана обычно стремятся делать возможно меньшей толщины.
Механические свойства двуокиси урана зависят от метода изготов-
ления и температуры испытаний. Сопротивление разрушению пр
комнатной температуре значительно ниже, чем при высокой. Двуокись
УРана стехиометрического состава, хрупкая при 1273 К, становится
пластичнее при 1873 К. Компактная U02,oe нестехиометрического
состава пластически деформируется при 1073 К. Прочность двуокиси
Урана на сжатие составляет 420—980 МПа.
181
Таблиц.7t Сравнительные характеристики некоторых соединений ураиа, плутония и тор &
Соеди- нение Тип кристаллической решетки Параметры, им Теоретическая плотность, г/см1 Температура плав- ления, К Содержание U, (Pu, Th) Сечение. 10*»
массовое, % । г/см» деления поглощения / (включая се- / ченне деле- / ння) 1
иоа Кубическая, типа CaFa а = 0,54704 10,97 3153 88,2 9,68 1,40 2,56
uso8 Орторомбическая а = 0,67198 6 = 0,3983 8,38 2773 84,8 7,11 1,16 2,11
с= 0,41462
РпОа Кубическая, типа CaFa 0=0,539 11,46 2513 88,0 10,11 240 339
ThOa Кубическая, типа CaFa а= 0,55597 9,82 3573 87,8 8,62 — 2,31
ис Кубическая, типа NaCl а=0,49610 13,63 2643 95,2 13,00 2,10 3,85
иса a-UCa (до 2100 К) а= 0,3524 11,68 2743 90,8 10,60 1,39 2,54
тетрагональная, типа СаСа ₽-UCa (>2100 К) с =0,5999 а=0,545
кубическая, ти- па CaFa
РпС Кубическая, типа NaCl а = 0,4970 13,60 2123 95,0 12,91 358 505
ThC То же а= 0,5338 10,64 2898 95,1 10,11 3,51
1 hCg UN Моноклинная а = 0,653 а =0,424 с=0,656 а = 1040 9,3 2928 9о;в 8,45 — 2>
Кубическая, типа NaCl а=0,48891 14,32 3123 94,4 13,50 2,10 4,79
PuN US То же а= 0,4905 14,23 3123 94,5 13,92 366 517
а = 0,54905 10,87 2723 88,1 9,60 2,10 4,14
Примечание. При расчете сечеиий для соединении ураиа за основу брались соответ-
ствующие значения сечений природного урана.
Совместимость. Одной из важных характеристик ядерного горюче-
го является совместимость с материалом оболочек. Данные о совме-
—? ^ВУ0КИСИ УРана с различными материалами приведены
Двуокись урана не реагирует с водой при 573 К. При температу-
ре 773 К в воде растворяется 0,005% двуокиси урана. В соляной кис-
лоте и щелочи двуокись урана не растворяется, но реагирует с цар-
ской водкой, азотной и плавиковой кислотами. Двуокись урана при
комнатной температуре окисляется слабо. При размере зерна меньше
0,5 мкм двуокись пирофорнаЛПри нагреве на воздухе двуокись урана
поглощает кислород тем интенсивнее, чем выше температура.
182
0 Таблица 7.6
Совместимость компактной иО2 с различными материалами
Матерная Температура, К Примечание
А1 -773 Относительно медленное взанмодейст-
Be 873 вне с образованием UAla и UA1. Реакция с образованием интерметал- лида
Zr 873 Медленная реакция, цирконий ох- рупчивается Нет взаимодействия
Нержавеющая сталь 1673
Ni Si <1673 <2173 Слабо реагирует При температуре 2173—2373 К обра-
SiO2 А12О3, МоО, ВеО <1873 <2073 зуется USiB н
Нет взаимодействия То же
С (в виде порошка тонко- го помола) 1573 Медленная реакция при 1473 К, быст-
1473 рая реакция при 2073 К
Nb, Та, Мо В течение 1000 ч никакой реакции
2273 не наблюдается
W Нет взаимодействия
Н 3153 Восстанавливается до стехиометри-
ческого состава UO2 при Т>873К,
Вода (обезгаженная) с нейт- 613 других реакций не происходит Устойчива в течение 300 сут
ральным или повышенным пН
ЕР Пар 673 То же
со2 1173 Хорошая стойкость
Na, Na—К 873 Хорошая стойкость высокоплотной
UOa
Радиационная стойкость. Для ядерного горючего существенным
является изменение его свойств и размеров при облучении.
Распухание и связанное с этим изменение объема вызываются сле-
дующими процессами: 1) накоплением атомов продуктов деления,
имеющих больший объем, чем разделившиеся атомы; 2) ростом от-
дельных зерен в результате выбивания атомов из узлов кристалличе-
ской решетки и внедрения в решетку атомов продуктов деления;
3) образованием пор в результате слияния мигрирующих вакансий;
4) увеличением объема пор вследствие действия накапливающихся
в них газообразных продуктов деления; 5) увеличением размеров пор
вследствие их слияния при миграции.
В зависимости от температуры облучения относительное значение
этих процессов изменяется. Ориентировочно можно выделить три тем-
пературные области:
1. Температуры ниже 0,37пл (823—873 К). Распухание опреде-
ляется в основном накоплением атомов продуктов деления и мало
Зависит от температуры.
2. Температуры 0,3—0,5 Тпл (933—1523 К). Распухание опреде-
ляется как накоплением атомов продуктов деления, так и ббразова-
1S3
6
ниекгпор При слиянии вакансий и увеличением объема пор пол
ствием давления газообразных продуктов деления. А Ае«-
3. Температуры выше 0,5 Тил (выше 1373—1673 К). Pacnvxa
определяется увеличением объема пор под действием внутренн е
давления газообразных продуктов деления в сочетании с процесс
слияния и увеличения размеров пор вследствие их миграции в по
градиента температуры. Ле
Поры, находящиеся в поле градиента температур, перемещают
в сторону большей температуры (к центру сердечника). Вещества
в этом случае движется в противо.
положном направлении по меха*
низму: испарение — конденсация*
поверхностная и объемная ди<Ь
фузия. v
Распухание топлива приводит
к появлению в топливном сердеч-
нике напряжений, сжимающих во
внутренних зонах и растягиваю-
щих во внешних.
Увеличение диаметра топливно-
го сердечника в результате радиа-
ционного распухания приводит к
механическому контакту между
топливом и оболочкой твэла. В
процессе эксплуатации в сердеч-
нике возникают радиальные тре-
щины. Если сила сцепления (тре-
ния) между оболочкой и топливом
достаточна, то в зонах расположе-
ния трещин оболочки деформиру-
ются. При циклических измене-
ниях мощности (пуск и останов ре-
актора) возникающие напряжения
приводят к разрушению оболочки.
Для оксидного топлива при работе с нагрузкой свыше 350 Вт/см
в стационарном режиме радиальные трещины могут «залечиваться»
в результате переноса материала при испарении из центральных на-
гретых зон и конденсации его в холодных участках. Радиальный мас-
соперенос приводит к уменьшению зазора между сердечником и обо-
лочкой вплоть до полного его исчезновения. При этом улучшается
отвод тепла от наружных слоев сердечника.
Центральные зоны таблеток UO2 нагреты до более высокой тем-
пературы и подвергаются существенно большему тепловому расшире-
нию по сравнению с оболочками и наружными слоями таблеток иОг-
В силу этого могут развиваться напряжения и деформация вдоль осн
твэла (рис. 7.10). Результатом такого эффекта будет либо развитие
«жеванности» оболочки, либо удлинение твэла, либо, наконец, раз*
рушение оболочки твэла по кольцу перпендикулярно к обра-
зующей.
184
Рис. 7.10. Схема развития «жеванно-
сти» оболочки:
° — при расхолаживании; б — рабочее со-
стояние; в — до облучения (/ — оболочка;
2 — таблетка UO2)
По химическим свойствам продукты деления в окисном топливе
Могут быть разделены на несколько групп: юпливе
1) благородные газы Кг и Хе с малой растворимостью в ПО
образующие газовые пузырьки и поры; 2’
2) химически активные Rb, Cs, Те, Вт, I, которые, в частности
могут реагировать с оболочкой твэла; и’
3) Ru, Rh, Pd, Мо, Те, Sr, Ва, выделяющиеся в металлической
иЛи окиснои фазе;
4) Y, Zr, Nb, редкоземельные элементы, окислы которых могут
частично растворяться в UO2. J
Изотопы Хе и Кг образуются в количестве около 0,25 атома бла-
городного газа на один разделившийся атом 235U и составляют 12_
15% общего количества осколков деления.
Выход газообразных продуктов деления возрастает по мере вы-
горания. При температурах в центре таблеток UO2 1523 К относи-
тельное газовыделение линейно зависит от выгорания до20МВт-сут/кг
и составляет 0,075% на каждые 9 МВт-сут/кг. При более высоком вы-
горании происходит резкое увеличение газовыделения. При выгора-
нии 50 МВт-сут/кг оно составляет уже 7,9%.
При температурах ниже 1773 К распухание происходит главным
образом вследствие того, что UO2 удерживает в себе пузырьки Хе
и Кг. Их рост сильно зависит от температуры. В относительно холод-
ном топливе степень распухания повышается с ростом температуры,
приближаясь к некоторому максимуму в области 1773 К, и понижает-
ся по мере протекания диффузии и выхода газообразных продуктов
деления.
В целом двуокись урана допускает высокие степени выгорания
без заметного распухания и нарушения геометрических размеров твэ-
лов. Так, при выгорании до 15,5% атомного содержания увеличение
объема не превышало 8%. Верхняя граница распухания при выгора-
нии до 9% составляет 0,33% на 1% атомного содержания выгорания
и не зависит от температуры в интервале 1033 2253 К. При выг р
кии более 9% распухание интенсифицируется и изменение
составляет в среднем 0,7% на 1% атомного содержания вы Р •
Снижение плотности двуокиси урана до 81 /о те0Р^д’®^ невелики,
ет распухание. Однако приведенные значения распу упана,
они существенно меньше, чем в случае металлических УР
и легко могут быть учтены при конструировании т ' ления дву-
лучении температуры в центре превышает темпер УРУ При раС-
окиси урана, объемное расширение существенно Р уок^си урана,
плавлении более 70% поперечного сечения CTeP™JJ ? выГопания.
Распухание достигает 5—7% на 1 % атомного °ДР в дВуОкиси,
Часть газообразных продуктов деления УД^Р^пболоЧКОй или в спе-
а часть выделяется в зазоры между сердечник внутри твэлов. Ге-
ниально предусмотренные для сбора газов о и создает опас-
зовыделение в зазоры повышает внутреннее д ся с0СтаВ газа в за-
ность разрушения оболочки. Кроме того,~из гелием, имеющим
з°рах. Часто при изготовлении зазоры ^Х^нию с воз^ухом и ар-
лучщий коэффициент теплопроводности по сра ,0R
гоном. При газовыделении в зазоры ухудшается теплопередача
топливом и оболочкой и повышается температура горючего Э Ме>КдУ
При облучении снижается и без того малая теплопроводност
окиси урана. Низкая теплопроводность и обусловленные ею н
термические напряжения вследствие большого градиента темС0КИе
ры могут вызвать растрескивание двуокиси урана. Растрески^^'
как правило, происходит в радиальном направлении (рис 711)Ие’
Рис. 7.11. Характер растрескивания таблеток двуокиси урана
чевдТчастоТопппйп^п разрушением таблеток двуокиси урана. Обду-
ванием столбчатых лается изменением структуры двуокиси, образо-
ной плошали скристаллов, охватывающих до 70% всей попереч-
состава интенгиН™ ИЯ Та^леток- Отклонение от стехиометрии чистого
В цеетпе пи±Ц"РУеТ рост в Двуокиси Урана.
шей темпеоатепм TaftneT0K-Двуокиси урана в зоне наивно-
Пои увелипри«?Ы При °^лучении образуется полость (рис. 7J2).
разованис Пп?И темяеРатуры в центре до температуры плавления об-
или уплотненно? н °®легчаетс.я- ПРИ облучении свободно засыпанной
холит иит1еНН0И В оболочке (но неспеченной) двуокиси урана проис-
В йСИВН°е спекание час™ц при температуре ~1173 К.
останов/ по нарушения сплошности оболочек твэлов вода во время
в non J реактоРа или при работе на малой мощности попадает
р Д уокиси урана. При достижении рабочей температуры про-
4OQ
исходит испарение воды, повышение давления в
ние двуокиси. Аналогичный эффект наблюдает^ М Р И РазРУше-
таллического теплоносителя. и в случае жидкоме-
Технология изготовления изделий из двуокиси
ная двуокись урана получается либо холодным пЛ? Компакт'
следующим спеканием для повышения плотности пРе^оваНием с по-
набивкой порошка двуокиси в оболоику твэла с „осл^ующм"^
уран 12’ Столбчатые кристаллы и центральный канал в облученной двуокиси
нением. При прессовании в качестве связующего компонента исполь-
зуют парафин, полиэтиленгликоль и другие органические соединения.
Удаление связующих компонентов производится нагревом после прес-
сования перед спеканием. Спекание происходит в атмосфере водорода.
Наивысшая плотность изделия достигается при температуре спекания
1973 К. В порошкообразной двуокиси урана необходимо ограничить
содержание углерода, вредно сказывающегося на процессе производ-
Ва изделий и на их стабильности в условиях эксплуатации. Уплот-
нение порошка двуокиси в оболочке твэла осуществляют методом виб-
рации, прессованием или совместным выдавливанием с оболочкой.
Отсутствие спекания в уплотненной двуокиси снижает коэффициент
теплопередачи, сопротивление коррозии к распуханию.
187
Закись—окись урана. ЦО8 по сравнению с двуокисью VBat
ограниченное применение. Она применяется в твэлах диспеп hMeet
типа, в частности в смеси с алюминием, в контакте с котопИ°ННого
окись урана термодинамически неустойчива. рЫм ДВУ-
Двуокись плутония. В виде твердого раствора с двуокисью
двуокись плутония применяют для изготовления твэлов реактпп ЭНа
быстрых нейтронах с расширенным воспроизводством. Некотоп 8 На
зические свойства двуокиси плутония представлены в табл 7?$И'
эффициент линейного расширения двуокиси плутония сравним с
Совместимость РиО2 с различными материалами Таблица 7j
Материал Температура, К Примечание
Th 1073 Частичное восстановление до Ри20з; при 1273 К частичное восстановление до металлического Ри. образующего твердый раствор с Th
и 1073 Частичное восстановление до Ри2О3
Zr 1433 Взаимодействия нет; частичное восстановление до Ри2О3
Fe 1573 То же
Al 873 Взаимодействия нет
Mg 773 Частичное восстановление до Рн2О3; при 873 К признаки восстановления до металлического Ри
С 1273 Частичное восстановление до Ри2О3; при 1473 К медленное образование монокарбида РиС; при 2123 К образование РиС и Pu2Cs
эффициентом теплового расширения двуокиси урана. Сведения о сов-
местимости двуокиси плутония с другими материалами приведены
в табл. 7.7. Двуокись плутония трудно растворима в большинстве сред.
Наиболее эффективно растворяют двуокись плутония фосфорная, азот-
ная и плавиковая кислоты. Компактные изделия из двуокиси плуто-
ния изготавливают способами, описанными для двуокиси урана. Ра-
диационная стойкость двуокиси плутония близка к стойкости двуокиси
урана.
Двуокись тория. Во многом сходна с двуокисью урана двуокись
тория. Она имеет высокую температуру плавления (см. табл. 7.5) и я
окисляется на воздухе. Двуокись тория — хрупкий материал. Пр
дел прочности ее на сжатие при 293 К 24,5 МПа. Спеченная двуоки
тория не взаимодействует с углекислым газом и устойчива в воде Д
температуры 573 К. Теплопроводность двуокиси тория незначитель-
на и уменьшается с повышением температуры, приближаясь к теп
проводности двуокиси урана. Горючее в виде смеси двуокисей УР
и тория имеет большое значение для реакторов с уран-ториевым
лом. Спекание смеси этих окислов можно проводить на воздухе.
дение твердого раствора двуокиси тория и двуокиси урана при
чении сходно с поведением двуокиси урана. пшчего
Неокисные топливные материалы. В качестве ядерного гор
могут использоваться карбиды делящихся материалов.
188
Монокарбид урана. UC считают одним из пеоспрюпп»,^ „
материалов в связи с высоким содержанием в них горючего (н?2^
30% больше, чем в двуокиси урана) и повышенной™™ ( 25~~
стью (в 8—10 раз больше, чем у двуокиси уоана) Ис™пи ПЛОПРОВ°ДНО*
карбида урана позволяет при сохранении загрузки активной Т0*
увеличивать тепловыделение, снижать тазовылелен™ в L Й ы
в центре твэла. Изотропная кубическая структура монокаобиТой/
печивает его хорошую радиационную стойкость при высокойтемпе’
ратуре и большом выгорании. н высокой темпе-
Совместимость UC с различными материалами Таблица 78
Материал Температура, К Примечание
А1 773 Реакция с образованием UA13 и НАЦ
Be Си Zr 873 1273 1073 Реакция с образованием UBeis Нет взаимодействия в течение 24 ч Нет взаимодействия; при 1273 К быстрая реак- ция с образованием ZrC+U
Нержавеющая сталь 1173 Нет взаимодействия в течение 100 ч; при 1243 К в течение 6000 ч. Небольшое взаимо- действие с монокарбидом сверхстехиометрического состава
Nb 1373 Нет взаимодействия в течение 100 ч; при более высокой температуре (>1473 К) взаимодействие с образованием карбида ниобия и карбида ураиа
Nb+1% Zr 1273 Нет взаимодействия
Мо <1273 Совместим; при температуре >1473 К взаимо- действие с образованием Мо2С и ураиа
W 2073 Нет взаимодействия в течение 838 ч
Re 2123 Простая эвтектика; Re не образует карбидов, по- этому не должен взаимодействовать
С 1473 Взаимодействие с образованием UCj и П2Сз
Ряд свойств монокарбида урана и других карбидов делящихся
Материалов представлен в табл. 7.5. Коэффициент линейного расши-
рения монокарбида урана при температуре от 293 до 773 К равен
11,6-10-® град-1. Монокарбид стехиометрического состава медленно
растворяется в концентрированных кислотах и быстро— в раз яв-
ленных. На воздухе он пирофорен при температуре выше 573 К. о угле-
кислом газе окисляется при 773 К до закиси-окиси урана. Монокар-
бид с большой скоростью реагирует с водой при температуре
333 К; в органических теплоносителях нестоек при высокой тем ер
тУре и инертен к расплавам натрия и калия. В табл. 7. р А
Данные о совместимости монокарбида урана с различныл
Риалами.
Дикарбид урана. UC2 имеет меньшую плотность по урану, чем моно-
Карбид, и претерпевает аллотропическое превращение при темпеРатУ₽
2ЮЗ К. Стойкость дикарбида на воздухе и в углекислом газе близка
к стойкости монокарбида. Взаимодействие дикарбида с большинством
конструкционных материалов начинается при температуре боле
сокой, чем у монокарбида. Теплопроводность дикарбида близка к Вы*
лопроводности монокарбида и возрастает с увеличением тйТец'
ратуры. Мпе*
Теплопроводность монокарбида плутония значительно ниже
монокарбида урана (см. табл. 7.5). Более высокую теплопроводной
имеет твердый раствор (U, Pu) С. Этот карбид инертен к натрию и к
лию и совместим со сплавом Zr — 1 % Nb до температуры 873 К сто
при облучении. ’ Оек
Нитриды урана. Из трех соединений урана с азотом (UN, и N
UN2) наибольший интерес для использования в качестве ядерного го’
рючего представляет мононитрид урана (см. табл. 7.5). Совместимость
мононитрида урана со многими материалами выше, чем монокарбида
урана. Мононитрид имеет достаточно высокую теплопроводность. Хо-
рошо сопротивляется деформации при высокой температуре, облада-
ет высокой радиационной стойкостью. Мононитрид урана стоек в де-
аэрированной воде до 523 К, в щелочных металлах до 1073 К, в орга-
нических теплоносителях до 623 К. С алюминием, сплавами циркония
и нержавеющей сталью мононитрид урана совместим соответственно
до температуры 673, 873 и 1573 К- При нагревании до температуры вы-
ше 1973 К мононитрид разлагается. Повышение давления азота за-
медляет этот процесс. Так, при давлении азота 10-5МПа температура
разложения мононитрида урана 2353 К- Для полного предотвращения
разложения вплоть до температуры плавления давление азота должно
быть увеличено до 0,25 МПа.
Монофосфид урана и сульфиды урана и тория. Они имеют высо-
кую температуру плавления, сравнительно стабильны при высокой тем-
пературе, совместимы при высокой температуре со многими материа-
лами и достаточно стойки во многих теплоносителях. Все это делает
указанные соединения перспективными с точки зрения использования
их в качестве ядерного горючего.
Дисперсионное ядерное горючее. В дисперсионном ядерном горю-
чем топливная фаза дисперсно распределена в неактивной матрице.
Каждую частицу ядерного горючего можно рассматривать как микро-
элемент, в котором роль оболочки играет матрица. В качестве диспер-
гированного горючего могут быть использованы керамические мате-
риалы, высокая температура плавления и стойкость при облучении
которых сочетаются с прочностью, пластичностью и высокой тепло-
проводностью матрицы. Процессы деления и возникающие при этом
радиационные повреждения сосредоточиваются в топливной части*
диспергированной в матрице. Сама же матрица будет находиться в ос-
новном только под действием нейтронов, радиационные поврежден
от которых не столь велики, как от действия осколков деления.
нако часть матрицы, соприкасающаяся с ядерным горючим, та
будет повреждена осколками деления. Глубина зоны поврежденИега
зависит от размера диспергированных частиц и равна длине пр &
осколков деления в матрице. Для прочности дисперсной сис
большое значение имеет соотношение размеров поврежденной в_
поврежденной частей матрицы. При постоянном соотношении то
190
Я0Й части и матрицы размер диспергированных частиц может быть паз-
лИЧен. Чем мельче зерна топливных частиц, тем значительнее их по-
верхность и тем больше зона повреждения матрицы. В качестве мятпи
^используют Al, Be, Mg, Zr, Nb, W, нержа^ую^Гв X
стве дисперсной топливной фазы служат различные соединения урана
лнтерметаллиды его с алюминием, бериллием, окислы, карбиды ни-
триды урана и других делящихся материалов. Для увеличения радиа-
ционной стойкости дисперсионного горючего расстояние между дис-
пергированными частицами должно быть больше удвоенной длины про-
бега осколков деления. Дисперсионное ядерное горючее должно быть
совместимым с материалом матрицы в процессе изготовления и в ра-
бочих условиях, иметь достаточную прочность, равномерно распре-
деляться в матрице.
Материал матрицы должен обладать высокими прочностью и пла-
стичностью, чтобы противостоять распуханию диспергированных ча-
стиц горючего при накоплении в них твердых продуктов деления и сдер-
живать давление газообразных продуктов деления без разрушения,
хорошей теплопроводностью, не иметь структурных превращений во
всем диапазоне рабочих температур, быть коррозионно-стойким к теп-
лоносителю и совместимым с материалом оболочки твэла.
Дисперсная система с 30% UO2 в матрице из аустенитной нержа-
веющей стали при выгорании до 15% урана и температуре в центре
твэла 700—1144 К обладает высокой радиационной стойкостью.
Матрица воспринимает напряжения, возникающие под действием
облучения в полости, занятой горючим, до тех пор, пока эти напряже-
ния не превзойдут максимальную прочность материала матрицы. Сле-
дует заметить, что матрица, ослабленная хрупкими керамическими
включениями, будет иметь пониженную прочность. Определение проч-
ности такой системы — весьма сложная задача.
В дисперсной системе двуокись урана — алюминий материалы
при температуре 873 К взаимодействуют с образованием интерметал-
лических соединений урана и алюминия и окиси алюминия. При этом
происходит изменение объема на 20—30%. При замене двуокиси ура-
на на закись-окись урана изменение объема в этих же условиях со-
ставляет только 4%. В качестве дисперсной системы применяют стек-
лянное волокно, содержащее закись-окись урана; система монокар ид
Урана—алюминий применяется до 773 К (при 873 К карбид несовме-
стим с алюминием и полностью распадается). Хорошо зарекомендова-
ла себя система, состоящая из интерметаллидов урана и алюминия
в Матрице из алюминиевого сплава или порошка алюминия.
§ МО. ТЕПЛОВЫДЕЛЯЮЩИЕ ЭЛЕМЕНТЫ ЯДЕРНЫХ РЕАКТОРОВ
Тепловыделяющий элемент (твэл) — устройство, предназначенное
Для размещения в активной зоне в определенном порядке ядерного топ-
лива, генерации основной части производимой в активной зоне теп-
ловой энергии и передачи ее теплоносителю. В твэлах может также на-
капливаться вторичное ядерное горючее а39Ри и 233U.
191
Твэл состоит из сердечника, в котором находятся ядерно-гоп
материалы, оболочки, концевых и дистанционирующих деталей пе
форме различают твэлы: цилиндрические, стержневые, кольц
трубчатые, пластинчатые, ленточные, шаровые, призматические и тЫе’
Оболочка служит для изоляции ядерного горючего от теплоноситс
в целях предотвращения загрязнения последнего. Концевые детая*
герметизируют твэл и вместе с дистанционирующими фиксируют е И
в определенном положении. Для загрузки в реактор твэлы собирав
в тепловыделяющие сборки (ТВС): кассеты, пучки, пакеты, топлив
ные каналы. ТВС служат для организации потока теплоносителя в
активной зоне.
Надежная работа твэлов обеспечивается правильным выбором
материалов, теплоносителя, поддержанием в процессе эксплуатации
заданных составов теплоносителя и температурного режима, а также
выбором рациональной конструкции элемента и способов его крепле-
ния. Одними из важных требований являются простота и низкая сто-
имость твэла, возможность и простота регенерации ядерного горючего.
Контроль. После изготовления твэла необходимо проверить пра-
вильность расположения сердечника внутри оболочки, качество самой
оболочки, герметичность, связь оболочки с сердечником, правильность
размера, качество отделки поверхности.
Условно методы контроля твэлов можно разделить на две группы:
1) технологические методы контроля в процессе изготовления и сбор-
ки твэлов: 2) методы контроля при испытании твэлов на эксперимен-
тальных стендах в условиях, аналогичных условиям эксплуатации
в реакторе.
Твэлы в процессе изготовления подвергаются испытаниям без
разрушения. Такие испытания не ухудшают эксплуатационных свойств
деталей при их дальнейшем использовании. Методы испытания по фи-
зической сущности можно разделить на несколько групп: испытания
на течь под давлением, проверка смачиванием, визуальные, тепловые,
радиографические, акустические, электрические и электромагнитные
методы. Различные способы испытаний не заменяют, а дополняют
друг друга.
Дефекты, обнаружение которых является целью испытании без
разрушения, можно условно классифицировать по технологическим
причинам, их вызвавшим, на три группы:
1) первичные дефекты, возникшие в процессе производства исход-
ного материала: изменения химического состава, поверхностные и вну-
тренние трещины;
2) дефекты, обусловленные технологическими процессами изготов-
ления твэлов (получение заготовки, механическая обработка, термо-
обработка): пористость, разрывы, усадочные и газовые раковины,
3) дефекты, возникшие при сборочных операциях: пористость,
непровары в сварных швах, отсутствие сцепления между оболочкой
и топливным сердечником. В последнем случае нарушается тепло-
вой контакт.
Тепловой контакт. Местный перегрев может произойти вследствие
нарушения контакта (сцепления) между сердечником и оболочкой.
192
Создание надежного контакта между сеппецни„л
особенно в случае соединения керамики РСм₽ М И Точкой,
риалами, встречает серьезные трудности ОпНяЛ ? ИЧескими Не-
целесообразно оставить зазор между сердечна™ ^КГОрых случаях
жив его теплопроводящей прослойкой Спеп=^ осочкой, зало-
и оболочкой можно осуществить ^аллуп™ сердечником
соединение получают при нагреве конХИп™“ СВЯЗЬЮ»- Такое
Под металлургической связью понимав всеТлТ Д ПовеРхн^ей.
таллических системах, в том числе за счет Синения в ме-
ВИЯ, диффузии и т. д. Если сердечник ЛллотТ™ взаимп®йи.
материала, например дисперсионная фаза двуоки" „ да™ "3„“?"“г0
„з нержавеющей стали и оболочка из нержавеющей то ..₽Т
разования металлургической связи достаточно создало™""™
дачника и оболочки и осуществить нагрев до определенной
В Других случаях совмещаемые материалы, например уран и алю-
минии, при нагревании образуют интерметаллиды, объем продуктов
коррозии которых больше объема урана и алюминия, затраченных на
их образование. Изменение объема в промежуточном слое и образова-
ние хрупких соединений могут привести к разрушению всего элемента.
Во избежание этого создается промежуточный диффузионный барьер',
препятствующий образованию хрупких интерметаллидов. Для созда-
ния диффузионного барьера на поверхность сердечника наносят слой
Ni, Nb, Si и других металлов толщиной 8—20,мкм. При нагреве про-
слойка образует диффузионные пары со стороны сердечника и обо-
лочки. Алюминий из оболочки может продиффундировать сквозь ни-
келевую прослойку, но для этого потребуется значительное время.
При чисто механическом контакте сердечника и оболочки необходима
тщательная подгонка деталей топлива и оболочки, что требует преци-
зионной механической обработки или обжатия. Необходимо учитывать
коэффициенты теплового расширения материалов.
Как уже указывалось, в ряде случаев целесообразно создавать
зазор между сердечником и оболочкой, так как объем горючего в
время эксплуатации увеличивается. Зазор заполняется веще
с хорошей теплопроводностью. В качестве газовой проел
применяют гелий, имеющий хорошую теплопроводное • жидко-
чае не возникает проблемы смачивания металлов. ИСПОльзуют Na,
металлической теплопроводящей прослойки о ы к0^ и обо-
РЬ. сплавы Na—К, Pb-Bi. Сцепление меж»„“J’"™»?™»»»'
Дочкой создается совместной прокаткой, пресс ’ ga5KHOe значе-
Ротационной ковкой (обжатием со всех сторощ • ’ ныМ способом
пие имеет герметизация твэла. Наиболее рас: р• аТМОсфере. В по-
герметизации является дуговая сварка в Д* н0.лучевая сварка,
следнее время широко применяется эл р' . твэЛ0В в процессе
Повреждения. К числу основных поврежд^ ероВ сердечни-
ксплуатации следует отнести изменение ф Р термических циклов
а вследствие радиационного роста, Р^У ’оболочки вследствие
аллотропических превращении; разру иессов> диффузионного
^Ротекания коррозионных, и эрозионны P 193
Зак. 369
взаимодействия материала горючего и оболочки, перегрева отдель
участков оболочки из-за образования отложений. Hbl*
Оболочки могут разрушаться под действием давления в pe3v
тате как теплового расширения, так и выделения газообразных прОпуЬ’
тов деления ядерного топлива. Трещины в оболочках появляются пл
искривлении твэлов под действием температурных градиентов в ядеп
ном топливе. К вспучиванию твэлов ведет неравномерность расширеди
оболочек и ядерного топлива. Негерметичность оболочки может вОг
никнуть вследствие развития местной коррозии. В табл. 7.9 суммиро.
ваны причины выхода твэлов из строя и методы борьбы с ним. Р
Таблица 7.9
Причина выхода твэлов из строя и меры борьбы с ним
Причина Метод борьбы
Гидрирование внутренней поверх- ности оболочки, загрязнение топлива (влага) Локальные деформации при меха- ническом взаимодействии топлива и оболочки, потери пластичности при облучении Уплотнение топлива в начале кам- пании, смятие оболочки Охрупчивание сварных швов Изгиб твэлов Коррозионное растрескивание обо- лочки Локальное увеличение мощности кассет при перегрузках Циклирование нагрузки Фреттинг-коррозия Повышение плотности таблеток, ва- куумная горячая сушка твэлов, ограни- чение содержания примесей в топливе Повышение температуры отжига обо- лочки, увеличение толщины стенки, оп- тимизация геометрии таблеток и диамет- рального зазора, уменьшение допусков на зазор, применение смазок, противо- давления, понижение линейных нагру- зок Применение противодавления, повы- шение плотности таблеток, применение стабильной двуокиси урана Отработка технологии сварки Тщательный подбор материалов ком- понентов кассеты, правильный выбор осевого зазора Повышение температуры отжига обо- лочки для увеличения пластичности Оптимизация перегрузки Выбор наиболее плавного режима вы- хода на мощность и регулирование Устранение источника вибрации (в ча- стности, уменьшение скорости потока в зазоре между кассетами)
Повреждение твэлов вследствие гидрирования происходит при
сравнительно небольших выгораниях — до 11 000 МВт-сут/т. Основ-
ная мера борьбы с гидрированием внутренней поверхности твэлов —
жесткий контроль влажности таблеток UO2. Способность двуокиси
урана сорбировать влагу зависит от ее плотности. В связи с этим же-
лательно применение UO2 с высокой плотностью (10,5—10,6 г/см3).
Применяется также вакуумная горячая сушка твэлов в собранном ви-
де непосредственно перед герметизацией. Наряду с этим мероприя
тием в твэл помещают геттер для поглощения водорода. При выпол-
194
б^ее 0^)2%МтвэловЯТИ^ В пеРвУю камПанию из строя выходят не
Разрушение оболочки твэла вследствие механического взаимо-
действия металла с таблетками UO2 происходит при выгооания* колл
27 500 МВт-сут/т. Основной мерой бЕрьбы ?
считается повышение исходной пластичности материала оболочек
Для сплавов Zr это вызывает необходимость повышения темпепатуоы
отжига до температуры полной рекристаллизации. Связанное с этим
понижение предела текучести компенсируется увеличением толщины
оболочек. Считается также, что уменьшение отношения высоты к диа
метру таблеток UO2, наличие фасок, снижение линейной нагрузки
(Вт/см), уменьшение диаметра твэлов при одновременном увеличении
их числа в кассете, плавное изменение мощности существенно повы-
шают работоспособность твэлов. Скачкообразное изменение мощности
отдельных сборок при перегрузке топлива может повлечь за собой
повреждение твэлов. В особенности опасно повышение мощности для
сборок, длительное время проработавших при меньших нагрузках.
В процессе эксплуатации может происходить заклинивание табле-
ток с последующим их разрушением. В результате химического взаи-
модействия UO2 со сплавом Zr при больших выгораниях или линей-
ных нагрузках образуется диффузионный слой, содержащий Zr, U,
O,Cs. При выгораниях 22 500 МВт-сут/т диффузионный слой образует-
ся при линейных нагрузках 300 Вт/см и выше.
В случае применения пористой UO2 с пониженной плотностью мо-
жет происходить смятие оболочек твэлов. В первые (24-5)-10s ч столб
топлива уменьшается на 1—3 %. Вследствие этого при заклинивании
некоторых таблеток происходит образование промежутков между от-
дельными частями топливного столба, что приводит к локальному
всплеску энерговыделения и смятию оболочек. Применение твэлов
с внутренним противодавлением исключает возможность смятия. По-
вышение температуры спекания таблеток из UO2 одновременно с по-
вышением плотности приводит к увеличению стабильности таблеток
под действием облучения.
Осколки деления (иод) вызывают коррозию оболочек твэлов и вы-
ход твэлов из строя. Вибрация твэлов и связанная с этим коррозия
при трении (фреттинг-коррозия) также могут явиться причиной вы-
хода твэлов из строя. Снижение скорости потока воды в зазорах меж-
ду кассетами устраняет причины вибрации.
Главные направления в усовершенствовании твэлов, которы
сили надежность твэлов с UO2, представлены в табл- • •
Твэлы. На рис. 7.13 приведена схема твэла ханфордского реа -
тора с природным ураном. Урановый сердечник диа^Р°^ пп’ипаи.
и длиной 204 мм помещают в оболочку из алюминия, ко РУ Р
вают к сердечнику силуминовым припоем. Толщина о о > „
чая слой припоя 0,25 мм, составляет 1,05 мм. На торцах °б°?0
Щена до 8,9 мм (глухой торец) и 8,4 мм (торец, закрываех Р Р
ваемым диском). _ „ __, не-
Для изготовления сердечника обточенный ели Р' Р _ягото’вку,
легированного урана (динготметалл) куют на про у
7* 195
Главные направления в усовершенствовании твэлов
Усовершенствование
Таблица
Достигаемая цель
Горячая вакуумная сушка твэлов
Применение таблеток двуокиси ура-
на с повышенной плотностью
Повышение пластичности оболочки
(в результате повышения температу-
ры отжига)
Применение внутреннего противо-
давления в твэлах
Увеличение толщины оболочки
Оптимизация геометрии таблеток
на основе специальных расчетных мо-
делей
Удаление влаги из топлива, предотвра-
щение гидрирования
Уменьшение сорбции влаги при изго-
товлении, уменьшение уплотнения топли-
ва в начальный период облучения, пре-
дотвращение образования промежутков
в топливном столбе
Повышение сопротивления разруше-
нию при механическом взаимодействии
таблеток и оболочки, повышение сопро-
тивления иодной коррозии
Предотвращение смятия оболочки,
уменьшение взаимодействия топлива и
оболочки
Компенсация потери прочностных
свойств при высокотемпературном отжи-
ге оболочки, увеличение жесткости обо-
лочки и ее сдерживающего влияния на
деформацию топливных таблеток
Уменьшение локальных деформаций
оболочки при механическом взаимодей-
ствии с таблетками
При этом разбивается литая структура. Заготовка под прокатку мо-
жет быть получена также прессованием в области у-фазы. Прокатку
на прутки диаметром 37—38 мм производят в a-фазе с нагревом.
Прутки выпрямляют, обтачивают, разрезают и после закалки из 0-фазы
Рис. 7.13. Схема твэла (а) и топливной сборки (б) ханфордского реактора:
^ — крышка: 2 —сварной шов; 3 — алюминиевая оболочка; 4 — урановый блок; 5— кольце*
вая щель для теплоносителя (2,18 мм); 6 — алюминиевая труба (d 1,83 мм)
196
сердечники доводят до заданных размеров. Контролируют размер зер-
на и поверхностные дефекты: трещины, раковины, рифленость, за-
усеницы, герметичность, газовые пузыри, неспаи, проедание алю-
миниевой оболочки припоем, хрупкость слоя припоя.
В твэлах для газоохлаждаемых реакторов используют металличе-
ский уран в виде стержней диаметром 29,2 мм и длиной 1020 мм тол-
щина магноксовой оболочки 1,83 мм. Для улучшения теплоотдачи
оболочки делают с винтообразными ребрами высотой 10,4 мм. Конце-
вые детали, приваренные к оболочке, служат для центровки твэла по
оси канала. В процессе эксплуатации наблюдается небольшое увеличе-
ние длины и диаметра твэлов. В целом же эти элементы надежны в экс-
плуатации до выгорания несколько килограммов на тонну урана
Твэлы ВВЭР собирают в шестигранные кассеты (см. рис. 1.5)*
Для ВВЭР-210 и ВВЭР-440 кассеты состоят из наружного чехла и твэ-
лов, закрепленных в концевых решетках из нержавеющей стали. Между
концевыми решетками расположены дистанционирующие решетки,
препятствующие возникновению вибрационных усилий. В верхней
своей части кассеты имеют головки с устройством сцепления со штан-
гой для их извлечения из реактора и установки в него, внизу — хво-
стовики для установки и жесткой фиксации в днище корзины. Верхняя
решетка допускает возможность продольного перемещения твэлов
вследствие теплового расширения. Внутри твэлы заложены таблетка-
ми из спеченной UO2 со свободным объемом наверху, чтобы обеспе-
чить большее пространство для компенсации теплового расширения
топлива. В серийных реакторах ВВЭР-440, начиная с I блока Коль-
ской АЭС, 312 рабочих кассет. Каждая рабочая кассета содерж} т
126 цилиндрических твэлов диаметром 9,1 мм, расположенных по тре-
угольной решетке, с шагом 12,2 мм при толщине трубчатой оболочки
0,6 мм. Конструкция кассеты с твэлами представлена на рис. 1.5.
Средняя глубина выгорания в реакторах ВВЭР-440 в стационарном
режиме равна 28,6 МВт-сут/кг при трех частичных перегрузках за
кампанию. Материал оболочек сплав Zr с 1% Nb.
В реакторах ВВЭР-1000 активная зона собирается из 151 шести-
гранной кассеты с размером под ключ 238 мм. В каждой кассете раз-
мещается 317 твэлов диаметром 9,1 мм с таблетками UO2 и 12 направ-
ляющих трубок внешним диаметром 7 мм для поглотителен. Средн
значение выгорания (расчетное) в стационарном режиме состав-
27МВт-сут/кг при двух перегрузках за кампанию. Преду- JP
на возможность перехода в дальнейшем к глубине вы Р
40МВт-сут/кг при трех частичных перегрузках за кам
Твэлы канальных реакторов Белоярской АЭС. Топливные каналы
(см. рис. 1.4) содержат трубки и твэлы, размещенные Р длп-
и металлических втулках, образующих цилиндр диаме р> . * ’ ыХ
яой 13,6 м у испарительных ияалов в 12,9 м у
В канале расположено шесть твэлов. Наружный дна поноситель,
Раз®₽и внутренней трубки, по “торой второго. Мате-
нТжавеКХлш'в ~ ядерного горючего
используют сплав U с 9% Мо с магниевым заполнителем для теплово
го контакта. Среднее выгорание составляет 22,2 МВт-сут/кг.
ТВС Ленинградской АЭС состоит из 18 твэлов с длиной тепловыде-
ляющей части 3,5 м. Твэл представляет собой трубку из циркониево-
го сплава с 1 % Nb наружным диаметром 13,6 мм и толщиной 0,9 мм, за-
полненную таблетками из UO2. Выгорание составляет 18,5МВтХсут/кг
Твэлы реакторов на быстрых нейтронах. В реакторах на быстрых
нейтронах твэлы работают в очень жестких условиях. Плотность ней-
тронного потока в быстрых реакторах составляет 1016—101в (см2-с)-1
а флюенс нейтронов 1023 см~2. Плотность теплового потока при этом
достигает 1,25-107 кДж/(м2-ч) и выгорание 5—10%. Рабочими среда-
ми могут быть жидкие металлы при скорости потока 7—10 м/с и темпе-
ратуре 773—873 К.
Активная зона промышленного быстрого реактора БН-350 набра-
на из шестигранных пакетов под ключ 96 мм. В пакетах активной зоны
расположены твэлы, заполненные окисью обогащенного урана, высо-
той (по топливу) 106 см. В верхней и нижней частях пакета размеще-
ны элементы торцевых экранов, содержащие окись обедненного урана.
Общая высота пакета составляет 3,5 м. Твэлы выполнены из нержа-
веющей стали в виде труб диаметром 5 мм с толщиной стенок 0,4 мм.
Оболочка имеет достаточный запас прочности, чтобы выдержать тер-
мические и растягивающие напряжения от внутреннего давления га-
зообразных продуктов деления в конце кампании.
В реакторе на быстрых нейтронах «Энрико Ферми» в качестве топ-
ливного материала использована радиационно-стойкая у-фаза сплава
U —10% Мо. Элементы изготовлены совместным выдавливанием топ-
лива и оболочки из циркониевого сплава.
Термоэлектрические и термоэмиссионные твэлы. В последнее время
разрабатываются пути прямого преобразования тепловой энергии де-
ления в электрическую. При термоэлектрическом методе преобразо-
вания полупроводниковые термоэлектрические элементы, собранные
в батареи, встраивают непосредственно в активную зону. В реакторе
«Ромашка» термоэлементы на основе полупроводников из кремний-гер-
маниевых сплавов используют тепло оболочек твэлов. Сброс тепла с хо-
лодной стороны термобатареи осуществляется ребристым излучате-
лем. В других конструкциях термобатареи получают тепло от тепло-
носителя I контура. В реакторах с термоэмиссионным преобразова-
нием энергии катод, испускающий электроны при нагреве до темпера-
тур 1773—2473 К, является твэлом, работающим при давлении паров
цезия 0,013—0,133 Па. Материал катода должен обладать высокой элек-
тропроводностью, низкой скоростью испарения, хорошими эмиссион-
ными характеристиками, стойкостью в парах цезия, достаточной
механической прочностью. При использовании в качестве твердых ра-
створов монокарбидов урана и циркония без оболочек наблюдалось рас-
пухание и растрескивание катода, испарение карбида урана. Вольфра-
мовые и молибденовые оболочки улучшают работу установок с термо-
эмиссионными преобразователями. Существенную роль в надежности
таких установок играют выбор изоляционных материалов и стойкость
их и материала оболочек в парах цезия.
198
Серьезные проблемы при выборе материалов и конструкции твэ
лов возникают при использовании ядерного реактора для разогрева
плазмы в магнитогидродинамических генераторах. F
Твэлы ядерных ракетных двигателей работают в жестких уело
виях. В таких реакторах рабочее тело - водород - нагревается до
температуры выше 2273 К. Материал твэлов должен обладать радиа-
ционной и коррозионной скоростью, достаточной механической проч-
ностью при рабочих температурах, быть способным выдерживать рез-
кие изменения температуры, неизбежные при быстром запуске ядер -
ных ракетных двигателей. н
Наиболее тугоплавкие материалы можно разделить на три класса:
металлы, тугоплавкие (керамические) материалы и графит. К туго-
плавким металлам относятся Та, Мо, W, Re, Os и др. Металлы плати-
новой группы (Os и др.) не только дороги, но и не технологичны; Та
поглощает водород при температуре 620—920 К и охрупчивается.
Вольфрам и молибден рекристаллизуется при температуре, сравни-
тельно низкой по отношению к температуре их плавления. Рекристал-
лизация приводит к росту зерна и охрупчиванию. Максимальная ра-
бочая температура для молибдена 2073 К. Введение в вольфрам дву-
окиси урана тормозит диффузию через границы между зернами и при-
останавливает их рост. Прочность вольфрама должна резко падать при
температуре выше 2223 К.
Нитриды тугоплавких металлов хрупки при температуре ниже
1673 К. При температуре выше 2493 К. они склонны к разложению
и науглероживанию. Бориды вольфрама и циркония устойчивы до
2773 К и могут использоваться как конструкционные материалы при
работе на сжатие. Однако природный бор содержит нуклид 10В, об-
ладающий большим сечением захвата тепловых нейтронов. Карбиды
тугоплавких металлов устойчивы в восстановительной атмосфере при
высокой температуре. Температура плавления карбидов тантала и
циркония выше 3153 К. Карбид ниобия может быть использован при
температуре 3503 К.
Графит при комнатной температуре менее прочен и пластичен,
чем металлы, но его прочность сохраняется до температуры, близкой
к 2773 К, и при этой температуре приближается к прочности вольфра-
ма. Графит становится все более пластичным с ростом температуры и не
плавится вплоть до температуры сублимации, равной 4198 К, при ат-
мосферном давлении. При этой температуре прочность его падает до
нуля. Графит технологичен, обладает высокой теплопроводностью
и хорошей термостойкостью.
Твэлы для ядерного ракетного двигателя «Киви Л.» представляют
собой графитовые пластины длиной 203 мм, толщиной 6,3 мм, шириной
195—203 мм, содержащие диспергированную двуокись урана. Пла-
стины изготовлены из смеси двуокиси урана и неспеченного графита.
В других реакторах делящееся вещество в виде частиц карбида урана
размером 10—20 мкм защищено слоем пирографита и диспергирова-
но в графитовой матрице. Матрица защищена покрытием из карбида
ниобия, нанесенным методом термического разложения хлорида
ниобия.
199
Глава 8
КОНСТРУКЦИОННЫЕ МАТЕРИАЛЫ АКТИВНОЙ ЗОНЫ
§ 8.1. БЕРИЛЛИЙ
Физические свойства. По совокупности физических свойств берил-
лий является одним из наиболее интересных и перспективных реактор-
ных материалов. Он имеет малое сечение поглощения тепловых ней-
тронов (табл. 8.1). Сочетание малого сечения поглощения с высоким
рассеянием и большим числом атомов в 1 см8 делает бериллий пре-
восходным замедлителем и отражателем в реакторах; его применение
приводит к уменьшению критической загрузки горючего. Однако пер-
спектива широкого применения бериллия ограничена рядом обстоя-
тельств. Бериллий принадлежит к очень редким и дорогим металлам.
Стоимость его почти в сто раз выше стоимости алюминия, магния,
стали. Бериллий хрупок. Облучение вызывает охрупчивание и распу-
хание. Изготовление из него тонкостенных оболочек твэлов и особен-
но их герметизация крайне затруднительны. Положительными свой-
ствами бериллия являются малая плотность, относительно высокая
температура плавления, небольшой коэффициент теплового расшире-
ния (см. табл. 8.1). До температуры 1513 К бериллий не претерпевает
аллотропических превращений и кристаллизуется в ГПУ-решетке.
Отсутствие структурных превращений в широком диапазоне темпера-
туры делает бериллий нечувствительным к циклическим изменениям
температуры. Бериллий и его соединения очень токсичны. Металличе-
ский бериллий получают магниетермическим восстановлением окисла
бериллия или электролизом.
Изделия из бериллия изготовляют на основе металлокерамиче-
ской технологии. Из порошков горячим прессованием получают заго-
товки, из которых методами выдавливания, горячей прокатки, рота-
ционной ковки изготовляют прутки, трубы, листы и другие профили.
Таблица 8.1
Физические свойства бериллия
Атомный иомер
Относительная атомная масса
Сечение поглощения тепловых
нейтронов, м2
Плотность, г/см3
Температура плавления, К
Коэффициент линейного расшире-
ния, град-1
Температура кипения, К
Коэффициент теплопроводности,
Вт/(м-К)
Кристаллическая структура
Параметр кристаллической решетки
a-фазы, нм
4
~9
9-10-31
1,85
1556
11,6-Ю-®
3243
180
а-Фаза, ГПУ до 1513 К
0-Фаза, ОЦК выше 1513 К
а=0,228
с =0,358
200
Рис. 8.1. Предел прочности а, и уд-
линение 6 горячепрессованного бер i.i-
лия в зависимости от температуры.
Размер зерна 50 мкм
Механические характеристики. Механические свойства бериллий
особенно его пластичность, существенно зависят от температуоы
(рис. 8.1). Имеет место резкий спад пластичности при уменьшении тем-
пературы ниже 573—473 К — так называемый порог хладноломкости.
Температура этого порога может быть смещена на 323____373 К к бо-
лее низкой температуре в результате очистки бериллия от примесей
и главным образом измельчения зерна. Однако никакими приемами не
удается сдвинуть порог хладноломкости квазиизотропного поликри-
сталлического бериллия ниже комнатной температуры, т. е. получить
бериллий, пластичный при комнат- ’ J
ной температуре. Длительным от-
жигом при температуре 1023—
1073 К и очень медленным охлаж-
дением можно устранить падение
пластичности при 873—1073 К.
Указанная термическая обработка
приводит к выделению интерме-
таллидов бериллия по границам
зерен.
При выдавливании бериллия ба-
зисные плоскости гексагональной
решетки ориентируются параллель-
но направлению выдавливания. Та-
кая текстура вызывает резкую ани-
зотропию свойств бериллия. Вдоль
оси выдавливания пластичность бе-
риллия возрастает, а в попереч-
ном направлении падает. Ударным
выдавливанием из литых загото-
вок можно изготовить трубки из
бериллия. После рекристаллиза-
ционного отжига на мелкое зерно трубки имеют высокую продольную
и достаточную (1—2%) поперечную пластичность. Легирование бе-
риллия кальцием в количестве 0,4 % несколько улучшает свойства труб.
Вследствие низкой пластичности детали и узлы замедлителей и отра-
жателей не рассчитаны на значительные нагрузки. Снижение пластич-
ности бериллия при облучении не столь опасно.
Радиационная стойкость. В бериллии под действием облучения
протекают ядерные реакции с образованием газообразных продуктов:
®Ве + п 4Не + «Не; «Не -> «Li 4=- вЫ 4=- п ->4Не + 3Н.
Гелий и тритий могут скапливаться в порах, образовывать газо-
вые пузыри, вызывающие газовое распухание. Внедрение гелия и
трития в кристаллическую решетку бериллия снижает его пластич-
ность. Изменение свойств бериллия в результате облучения представ-
лено в табл. 8.2. Облучение увеличивает прочность и ухудшает пла-
стичность бериллия.
При флюенсе нейтронов 1020 см-2 и температуре облучения У/о
1023 К газовое распухание невелико и не превышает 1—2%. При тем-
201
Таблица 8.2
Влияние облучения при 703 К на механические свойства бериллия (флюенс
быстрых нейтронов 1021 см~2)
Температура испытания облученных и исходных образцов, К От> МПа 6. %
исходные облученные исходные облученные
298 340 670 3 0
473 300 560 35 5
573 270 440 45 26
703 190 350 40 25
873 130 190 17 5
пературе 1073—1173 К газовое распухание составляет 3—5%. При
указанном флюенсе нейтронов бериллий может применяться в отража-
телях и замедлителях до температуры 973—1073 К.
Совместимость. При наличии окисной пленки на уране и бериллии
эти металлы совместимы до 873 К. При нарушении сплошности окис-
ной пленки на бериллии он совместим с ураном до температуры 773 К.
При 773 К бериллий несовместим с Fe, Ni, Zr и совместим с Al, Mg.
Коррозионная стойкость. Нормальный потенциал бериллия равен
—1,85 В. Стационарный потенциал бериллия составляет — 0,8 В.
Это свидетельствует о способности бериллия пассивироваться. В ней-
тальных средах, не содержащих хлоридов и сульфатов, бериллий пас-
сивируется в широком интервале потенциалов. В воде высокой чис-
тоты бериллий стоек. Продукт коррозии — окись бериллия — бело-
го цвета, очень рельефно выглядят на поверхности металла, в резуль-
тате чего может создаваться впечатление, что бериллий подвергся
интенсивной коррозии. При движении воды продукт коррозии смывает-
ся с поверхности, и создается впечатление, что поток воды существен-
но увеличивает стойкость бериллия. В воде высокой чистоты бериллий
стоек до температуры 423—473 К- При этой температуре на поверх-
ности металла образуется темная окисная пленка. При 573 К стой-
кость бериллия снижается и существенно зависит от качества металла.
При этом имеет место язвенная коррозия. Легирование бериллия желе-
зом несколько повышает его стойкость. При использовании бериллия
при температуре воды 573—623 К ею очехловывают сплавами цир-
кония. Присутствие в воде хлоридов и сульфатов, а также уве-
личение pH среды до 10—12 резко снижают стойкость бериллия. Кон-
такт с алюминием практически не сказывается на стойкости бериллия,
контакт с нержавеющей сталью несколько снижает ее. При цикличе-
ском изменении температуры в воде высокой чистоты бериллий под-
вергается коррозии под напряжением. Создание на поверхности бе-
риллия окисных пленок методом анодирования увеличивает его стой-
кость.
При давлении в несколько десятков мегапаскалей бериллий стоек
в сухом кислороде до 923 К, в водяном паре и влажном кислороде до
202
873 К, в углекислом газе до 973 К. При температуре 773 К бепиллий
стоек в натрии, содержащем до 0,01 % О2. При 873 К бериллий стоек
в литии и в эвтектике РЬ—Bi.
Окись бериллия. Окись бериллия может применяться в качестве
отражателя. Температура плавления ее велика, 2823 К. Окись берил-
лия— хороший изолятор. Как и у большинства керамических мате-
риалов, предел прочности при сжатии окиси бериллия в несколько раз
больше, чем при растяжении. Относительно высокая теплопровод-
ность способствует повышению ее термостойкости. Изделия из окиси
бериллия изготовляют методом прессования, выдавливания, литья.
Распиливание необожженной окиси бериллия осуществляется*смочен-
ными абразивными кругами, спеченной окиси бериллия — алмазны-
ми кругами. Окись бериллия стойка в воде при 573—623 К, не вза-
имодействует с воздухом, углекислым газом до температуры 773____
873 К. Недостаточно плотная окись бериллия при 873 К пропитывает-
ся натрием и разрушается. Под действием нейтронного облучения мо-
жет иметь место газовое распухание и растрескивание окиси бериллия,
обусловленное накоплением гелия и трития. Окись бериллия исполь-
зуют в исследовательских реакторах в качестве замедлителя и отра-
жателя.
§ 8.2. ГРАФИТ
Графит — одна из кристаллических модификаций углерода. По-
следний существует в виде двух стабильных изотопов с массовыми чис-
лами 12 (98,892%) и 13 (1,108%). В отечественном реакторостроении
в основном используется графит марок МПГ и ГМЗ.
Физические свойства. Графит находит широкое применение в ре-
акторах на тепловых нейтронах в качестве замедлителя и отражателя.
Сечение поглощения тепловых нейтронов у графита меньше, чем у бе-
риллия и магния (табл. 8.3). Получение графита реакторной чистоты
не представляет больших технических трудностей. Графит обладает
хорошими тепловыми свойствами и достаточной прочностью, хорошо
Таблица 83
Физические свойства графита
Атомный номер Относительная атомная масса Сечение поглощения тепловых нейтро- нов, Мг Плотность, г/см® Температура плавления 6 12 4,5-Ю-з1 1,65—1,75 Возгоняется при давлении 0,1 МПа и температуре 3923 ±2э К
Коэффициент линейного расширения, град_1 Коэффициент теплопроводности, Вт/(м • К) Кристаллическая структура Параметр кристаллической решетки, нм (284-44)-10 7 263,8—523,5 Гексагональная сложная а = 0,246 с=0,670
203
поддается механической обработке. Благодаря высокой теплопровод
пости и низкому коэффициенту линейного расширения графит облд',
дает хорошим сопротивлением тепловым ударам. Однако применению
графита препятствуют его низкая стойкость к окислению и хрупкость
Кроме того, в результате облучения нейтронами кристаллическая ре1
шетка графита повреждается, что отражается на его физических свой-
ствах.
Свойства графита существенно зависят от исходного материала
и метода получения. Чистота графита в значительной степени зависит
от чистоты исходных материалов. В реакторном графите содержание
золы не выше 0,054—0,16%, со-
держание бора 4-10“®%. В случае
газовой очистки эти значения мо-
гут быть снижены до 5-10—4 и
6-10“®% соответственно. При обра-
ботке графита газообразным хло-
ром увеличивается содержание хло-
ра в графите, что может привести
к загрязнению хлором реакторно-
го пространства в процессе экс-
плуатации. При высокой темпера-
туре графит не плавится, а возго-
няется. До температуры возгонки
кристаллическая решетка графита
не изменяется.
Совершенные кристаллы графи-
та состоят из параллельных атом-
ных слоев (рис. 8.2). В каждом слое атомы графита образуют гекса-
гональную сетку. Межатомное расстояние в слое равно 0,142 нм. Рас-
стояние между слоями 0,335 нм. Слои смещены в собственной плоско-
сти так, что над центром и под центром каждого из шестиугольников
в прилегающих слоях находится атом графита. При этом любой шести-
угольник в каждом третьем слое лежит над соответствующим шести-
угольником в первом слое. Общепринятые параметры решетки графи-
та приведены в табл. 8.3. Образование слоистой структуры происходит
во время графитизирующего отжига при температуре ~ 3353 К. Кри-
сталлические слои достаточно свободно перемещаются друг относитель-
но друга. В связи с этим свойства графита существенно зависят от
кристаллографического направления.
Теоретическая плотность графита равна 2,27 г/см3, плотность ре-
акторного графита обычно лежит в пределах 1,65—1,75 г/см®. Такое
различие обусловлено пористостью реакторного графита, составляю-
щей 20—30%. Поры, как правило, сообщаются между собой, поэтому
графит пропускает газ. Теплопроводность графита мало отличается
от теплопроводности многих металлов. Распространение тепла в гра-
фите происходит главным образом вдоль базисных плоскостей, рас-
положенных преимущественно параллельно оси выдавливания.
Механические характеристики. Механические свойства графита
существенно зависят от кристаллографического напряжения. В плот-
204
неупакованных плоскостях атомы углерода связаны между собой силь-
ными ковалентными Связями, сами же плоскости связаны дпуг с anv
гом относительно слабо. J ' у
В уран-графитовых реакторах из графитовых блоков сооружают
кладку, через которую проходят каналы. Поэтому главное требование
которое предъявляется к Графиту, состоит в том, чтобы он обладал до-
статочной прочностью на сжатие и мог выдерживать массу выше рас-
положенных блоков графит^ Так, предел прочности на сжатие (а
МПа) графита, полученного по электродной технологии с мелкодисперс-
ным наполнителем, следующим образом зависит от плотности (у,
г/см3): ов = 232 + 166у. Предел прочности на растяжение при ком-
натной температуре колеблется от 7 до 21 МПа, при изгибе 7—30 МПа.
Предел прочности на сжатие обычно составляет 21—35 МПа. При по-
вышении температуры прочность графита возрастает. При температурах
до 2273 К увеличение прочности происходит приблизительно по ли-
нейному’закону. При температуре 3073 К прочность достигает мак-
симального значения и примерно в два раза превышает прочность при
комнатной температуре. Увеличение механической прочности с темпе-
ратурой связывается со снятием больших внутренних напряжений,
возникающих в графите при охлаждении от температуры графитиза-
ции. Эти напряжения появляются вследствие большого различия в ко-
эффициентах теплового расширения по направлению оси с и перпен-
дикулярно к этой оси. Чем выше плотность графита, тем значитель-
нее его прочность.
В области высоких температур изделия из графита деформируются
под действием постоянных во времени напряжений, т. е. наблюдается
явление ползучести. Скорость ползучести графита высока при темпе-
ратурах, близких к 2273 К. Однако в условиях облучения заметная
деформация наблюдается и при более низких температурах. Для крат-
ковременных испытаний при постоянной температуре скорость ползу-
чести пропорциональна квадрату приложенного напряжения. Снятие
напряжения приводит к частичному восстановлению длины образца.
Так, после снятия нагрузки восстанавливается около 30% общей де-
формации, достигнутой в процессе испытаний при 2836 К.
Среда, в которой проводятся испытания, оказывает существенное
влияние на полученные результаты. В частности, снижение Давлев1л
аргона приводит к резкому возрастанию скорости ползучести, кор.
Установившейся ползучести (и, см-1) можно оценить по следующей
висимости:
v = 40 (ст/ов)3,8 ехр (— QJRT),
где а—растягивающее напряжение; <тв предел прочности,
Q = 209 кДж/моль. „ ппгтятпч.
Окисление графита. При высоких температурах граф А
Но реакционноспособен. Однако с твердыми веществам р
Честим вплоть до высоких температур, когда наблюдается^з
Диффузия углерода и науглероживание металлов и сп ппблемы
м°жны химические реакции восстановления углеродом. р
совместимости графита сводятся к вопросам его взаимодействия ст
доносителем. Скорость взаимодействия графита с газами обычно оп
деляют по относительному изменению массы образцов. Влияние уд^'
ной поверхности, как правило, не учитывается, хотя известно ч
она изменяется при 'окислении. Наиболее распространенными и'nJ0
спективными газами для’охлаждения реакторов являются гелий, а3(£'
углекислый газ, воздух. Гелий не взаимодействует’с графитом даж’
в условиях облучения. При температуре ~ 2273 К может наблюдать^
перенос массы графита потоком гелия в результате выкрашивания чаЯ-
стиц графита. Такая эрозия обычно заканчивается после удаления ча-
стиц, имевших недостаточное сцепление с основным материалом
Примеси в гелии, например кислород, могут явиться причиной кор^
розии графита.
Коррозия графита представляет собой сложный физико-химиче-
ский процесс, который может быть условно разделен на несколько эта-
пов: 1) доставка окислителя к поверхности графита посредством моле-
кулярной, конвективной диффузии; 2) адсорбция молекул окислителя
на кристаллах графита; 3) взаимодействие адсорбированного окисли-
теля с поверхностными атомами углерода на активных центрах с об-
разованием комплекса 4) расход комплекса СЖОУ с образова-
нием СО и СО2 и удалением их в газовую среду.
При температурах ниже 773 К скорость коррозии определяется
скоростью химической реакции. При свободном доступе кислорода
к реакционной поверхности существенного влияния скорости газово-
го потока не наблюдается. При Т > 973 К скорость реакции горения
графита начинает лимитироваться диффузией окислителя к реакцион-
ной поверхности. При этом скорость окисления графита К [г/(см2-с)]
слабо зависит от температуры. Так, для графита марки ГМЗ при кон-
центрации кислорода 0,1 % и расходе газа 3,8 л/ч получены следующие
данные:
Т, К 723 823 873 973 1073
IgK —9,5 —8,5 —8,3 —8,08 —8,05
В диффузионной стадии продукты реакции (СО2, СО), накапли-
ваясь у поверхности графита, вытесняют кислород. В связи с этим уве-
личение скорости движения газовой среды интенсифицирует достав-
ку кислорода к поверхности и соответственно увеличивает скорость
окисления графита. Это положение иллюстрируется данными, полу-
ченными при 1000 К и концентрации кислорода 0,005%:
Расход газа, л/ч 0,85 1,7 2,9
IgK —9,6 -9,3 —9,1
При температуре 1073 К и расходе газа 3,8 л/ч зависимость ско-
рости окисления графита марки ГМЗ от концентрации кислорода в га-
зовой фазе (Со,, %) выражается следующим уравнением:
1g К = - 7 + 0,95 1g СОа.
Скорость окисления графита уменьшается с ростом его плотности
так же, как и с увеличением температуры термической обработки,
интенсифицируют окисление графита примеси Fe, V, Na. В присутст-
206
ВИИ примесей окисление имеет локальный характер. С увеличением
степени чистоты графита скорость его окисления снижается
Графит с молекулярным азотом практически не взаимодействует
Основным продуктом вз^модействия графита с водородом при темпе-
ратурах 573—1273 К является метан. Равновесная концентрация ме-
тана в присутствии графита снижается с ростом температуры и при
1273 К и давлении 0,1 МПа близка к нулю. Облучение ионизирует во-
дород и способствует образованию метана. Присутствие в реакторной
среде паров воды интенсифицирует окисление графита.
В ряде случаев для оценки стойкости графитовой кладки к окисле-
нию используют коэффициент вйгорания, равный доле кислорода,
взаимодействующего с углеродом при прохождении над поверхностью
графита. В гелии с 0,22% объемного содержания О2 при площади гра-
фита 0,22 м2 и скорости газового потока 1,1 л/мин коэффициент выго-
рания при температурах 673 и 973 К составляет 0,1 и 0,8 соответст-
венно.
При взаимодействии с СО2 протекает следующая реакция:
С + СО2 = 2СО.
Если концентрация СО в результате протекания какой-либо другой
реакции превысит равновесную для рассматриваемой реакции, то
вследствие интенсификации обратной реакции 2СО->С + СО2 произой-
дет отложение углерода. При 673—773 К процесс отложения графита
незначителен.
Облученный при 323 К флюенсом нейтронов 5-Ю20 см-2 графит
марки ГМЗ окисляется на воздухе при 873 К. в 7 раз интенсивнее, чем
необлученный. Облучение при 573—623 К флюенсом 1,5-1021 см-2 не
увеличивает скорости окисления. При температуре выше 1073 К
предварительное облучение графита не влияет на скорость окисления.
Это связывается с отжигом радиационных дефектов.
Облучение газовой среды вызывает ионизацию молекул, что также
влияет на кинетику окисления графита. Этот эффект наблюдается при
мощности дозы у-излучения более 154,8 Кл/(кг-с). При этом скорость
окисления возрастает в 2,6 раза.
Защита от окисления. Для защиты от окисления графитовой клад-
ки реактора, работающей при температуре 973—1073 К, необходимо
снижать объемное содержание кислорода в газовой среде до 0,05
0,10%. Содержание Н2О при этом не должно превышать 1 о. Рекомен-
дуется также периодически вводить в газ соединения, склонные
к пиролизу: СО, СН4, светильный газ. При этом в результате пироли-
за образуется защитный слой, препятствующий окислению.
В первую очередь реакция окисления протекает с участием а
мов графита, имеющих повышенную энергию. Иными словами,
чале окислению подвергаются активные места в кристаллическо р
Шетке. Если активные места будут заняты, например в результате ад-
сорбции на них атомов некоторых элементов, то эти места оудут
ключены из дальнейшего участия в реакции. В качестве веществ,
торые можно вводить с этой целью в графит, предложены различные
фосфорсодержащие соединения. Такие вещества после разложен
при нагреве до определенной температуры оставляют атомы форС(ьГ)Г1
адсорбированными на активных местах решетки, что и снижаетТк
рость окисления. Обычно для этой цели изделия из графита пропив
вают фосфорсодержащим веществом и быстро обжигают при темп
ратуре 1073—1473 К в инертной атмосфере. В качестве фосфоре!’
держащих веществ используют как органические, так и неорганиче
ские вещества, например фосфорную кислоту, триметилфосфат и др'
В результате такой обработки потери массы графита при окислений
снижаются в 2—3 раза.
Для повышения стойкости графита к окислению могут быть исполь-
зованы и смеси веществ, которые образуют сложные соединения типа
фосфатных стекол. Для получения фосфатного стекла графитовые из-
делия после пропитки раствором, содержащим необходимые компонен-
ты, обрабатывают при температуре образования стекла. Пленка из
фосфатного стекла хорошо защищает от окисления графит в интерва-
ле температур 773—1223 К- Скорость окисления при этом снижает-
ся почти на два порядка. В условиях облучения защита от окисления
фосфатными покрытиями неэффективна. По-видимому, это связано
с повышением активности га’за-окислителя при облучении, в результате
чего он может взаимодействовать с атомами углерода, находящимися
не только в активных местах. После прекращения воздействия облу-
чения фосфатные покрытия вновь предохраняют графит от окисления,
что указывает на сохранение покрытия в условиях облучения.
Графит практически не взаимодействует с эвтектикой Pb—Bi
при температуре до 973 К. При использовании жидкого натрия в ка-
честве теплоносителя с графитовым замедлителем - возникают две
проблемы: перенос массы углерода и проникновение натрия в поры
графита.
. Натрий при взаимодействии с графитом образует соединение со
слоистой структурой. Натрий, по-видимому, располагается в прост-
ранстве между плотноупакованными слоями, причем занятым оказы-
вается каждое восьмое межплоскостное пространство. Среднее расстоя-
ние между плотноупакованными плоскостями увеличивается на 5%,
что вызывает расширение и растрескивание графита. Из-за переноса
углерода натрием может происходить науглероживание аустенитной
нержавеющей стали или осаждение углерода из теплоносителя в бо-
лее холодных частях системы. Если графит не обработан соответст-
вующим образом или на его поверхности не создано покрытие, пре-
пятствующее проникновению натрия, то последний должен отделять-
ся от графита металлической оболочкой, например из сплава циркония.
При этом следует учитывать образование газов в очехлованных бло-
ках графита.
Радиационная стойкость. Облучение графита частицами высокой
энергии приводит к изменению его физико-механических характери-
стик и размеров, что связано с деформацией кристаллической решетки
графита. Под влиянием облучения происходит образование вакансии
и смещенных атомов. Смещенные атомы образуют комплексы по 3 б
атомов каждый. Образуются также дислокационные петли. Это при-
водит к увеличению размера элементарной ячейки графита в направле-
208
НИИ С и уменьшению параметра решетки а пропорционально флюенсу
облучения. Увеличение постоянной решетки по оси с при облучении
графита связано с внедрением смещенных атомов или их комплексов
в Межслоевое пространство графита. Сжатие решетки по оси а вычй.
но, вероятно, ее релаксацией на вакансиях. Повышение температуры
облучения устраняет ^радиационные дефекты - рекомбинацию пап
вакансия - смещенный а\ом, что приводит к уменьшению деформа^
дни кристаллической решетки графита. Так, при флюенсе нейтронов
2-Ю20 см-2 при увеличениистемпературы облучения с 333 до 573 К
относительное удлинение по оси с уменьшается в 50 раз При низкой
температуре относительное изменение параметра с при облучении
не превышает 15%. 1
Основным следствием деформации кристаллической решетки гра-
фита при облучении является изменение его макроразмеров. В поли-
кристаллических графитовых стержнях, полученных методом выдав-
ливания с последующим спеканием, обычно ось с преимущественно
устанавливается в радиальном направлении, ось и — в продольном.
Изменение параметров кристаллической решетки при облучении при-
водит к анизотропному изменению размеров графитовых изделий.
Макроскопическое распухание не полностью соответствует увеличе-
нию кристаллической решетки графита, так как кристаллографиче-
ское расширение частично компенсируется заполнением существую-
щих пор. С повышением температуры до 673—773 К и выше процесс
заполнения пор и дополнительного спекания превосходит рост кри-
сталлической ячейки и приводит к сжатию поликристаллического гра-
фита, Влияние температуры облучения можно наблюдать по относи-
тельному значению распухания графитовых кирпичей по высоте клад-
ки реактора (рис. 8.3). Несмотря на то, что плотность нейтронного
потока наибольшая на середине высоты кладки, распухание здесь
наименьшее вследствие более высокой температуры. Максимум роста
наблюдается на входной, более холодной стороне кладки. Другая
особенность — неравномерное накопление радиационных нарушений
в толще графита. Максимальные нарушения имеют место со стороны,
примыкающей к источнику быстрых нейтронов — делящемуся ура-
ну. В прилегающих к твэлу слоях графита коэффициент теплопровод-
ности уменьшается в 40 раз.
Облучение увеличивает ползучесть графита. В отсутствие облуче-
чения ползучесть графита не наблюдается при температуре ниже 423
473 К- При облучении флюенсом нейтронов 1020 см и т®м11еР^^)Ре
353 К ползучесть при напряжении 10 МПа составляет 0,7 и,о о.
Облучение снижает тепло- и электропроводность графита.
Энергия Вигнера. В результате нарушений кристаллическом ре-
шетки в процессе облучения в графите накапливается скрытая энер
гия — энергия Вигнера (существование этого явления было предска-
зано Вигнером). Эта энергия может выделяться в виде тепла при нагре-
ве графита до температуры, которая превышает температуру о уче-
ния. В этом случае имеет место повышение температуры в процессе
отжига графита, облученного при низкой температуре. Отжиг графита
в низкотемпературных реакторах осуществляется для снятия радиа-
209
циоиных повреждений, так как, например, деформация графит™
кладки или втулок может затруднить эксплуатацию реактора р
диационные повреждения можно отжечь простым нагревом. Суще
вует несколько способов проведения такого отжига: ’ ущест'
1) изменение циркуляции теплоносителя, с тем чтобы в определи
ных пределах повысить температуру графита; г ен’
198 199 200 201 598 599 600 601 85,8 86,0 86,2 86,4
Ширина кирпича,ш Высота кирпича, мм Диаметр канала в кирпиче, мм
Рис. 8.3. Деформация графита в каналах реактора
2) увеличение температуры графита путем ядерного или электри-
ческого нагрева до тех пор, пока не начнется самостоятельное выделе-
ЭНеРгии’ котоРое постепенно распространяется на весь замедли-
3) медленное нагревание с удалением некоторой части выделяющей-
ся энергии, чтобы избежать ее самопроизвольного выделения. При
этом следует иметь в виду, что если нагрев при 373—473 К произво-
дится быстро и выделяющаяся тепловая энергия не успевает отводить-
ся, то может произойти значительный перегрев кладки.
Радиационное повреждение кристаллической решетки графита
приводит к изменению его механических характеристик. С увеличе-
нием флюенса нейтронов пределы прочности на сжатие и изгиб проходят
через максимум, увеличиваясь по сравнению с исходным значением при
флюенсе 1020 см~2 в 3—3,5 раза, а при 2-1020—1021 см~2 в 2—2,2 раза.
Экстремальное увеличение механических характеристик при малых
флюенсах связано с блокированием дислокаций, вектор Бюргерса
210
которых расположат в плоскости базиса. Это затрудняет смещение ст
дельных частей кристаллита друг относительно друга. Прич= б™
кировки дислокаций Хвляются, вероятно деЛек™ “ °
ра. Чем выше темпер^ра обАуче’кин5Г
стает прочность графитж при равном флюенсе нейтронов Пред пол ай'
ется, что при болев выстой температуре происходит рекомбинация
части вакансии и образование комплексов атомов внедрения Оба эти
фактора снижают вероятно^ блокировки дислокации, что и поиво
дит к снижению прочности графита. нриво-
§ 8.3. МАТЕРИАЛЫ РЕГУЛИРУЮЩИХ СИСТЕМ И ЗАЩИТЫ
К элементам с высоким сечением захвата могут быть отнесены Gd
Sm, Ей, В, Cd, Dy, Ir, Hg, In, Er, Rh, Tm, Lu, Hf, Au, Re, Ag. Для
практического применения в системах регулирования энергетических
реакторов пригодны далеко не все эти элементы. Кадмий обладает
плохими механическими характеристиками; Au, Re, Rh и Ir слишком
дороги. Ртуть — жидкость, применение ее в системе регулирования
связано с рядом трудностей. Гафний может быть применен в элемен-
тарном виде, серебро для получения лучшей комбинации физических
и механических свойств используется в виде сплава с инием и кадмием.
Остальные элементы используются в виде окислов или смеси окислов,
обычно диспергированных в металлической матрице. Бор применяется
в виде карбида в металлической или керамической матрице, а также
в качестве легирующего элемента для введения в нержавеющую сталь,
цирконий, титан. В большинстве случаев материалы регулирующих
стержней могут работать в активной зоне только в оболочках. Гафний,
нержавеющая сталь, легированная бором, могут использоваться без
защитных покрытий. В настоящее время материалами для регули-
рующих стержней чаще всего служат бор в виде карбидов и сплавов,
легированная бором сталь, гафний, сплав серебра с индием и кадмием,
окислы редкоземельных элементов, диспергированных в металличе-
ских матрицах.
Соединения бора. Из соединений бора наиболее часто примен
карбид бора В4С. Это тугоплавкий материал с теоретической плот-
ностью 2,51 г/см3. Реальная плотность обычно 2,4 г/см3. Карбид бора
хрупок, но обладает высокой термостойкостью. В случае р РУ
оболочки скорость растворения карбида в воде невелик• облуче.
кристаллической решетки карбида в результате неДРк Няоушение
ния частично отжигаются при температуре 973—11 • нее
кристаллической решетки происходит также из-за Р реакциИ
атомов гелия, которые образуются в результат д р
10В + п -> 7Li + 4Не.
Скопление гелия в порах при высокой тем1^а*УРе возникновению
кальному увеличению давления в газовой п ’ ссматриваемой
местных напряжений и трещин. „Другим проду £ в боосодержа-
ядерной реакции является литий. Присутствие
щем материале ухудшает его коррозионные свойства, так как
активно реагирует с водой. °н
При введении в легированную сталь бора количество его не дол
но превышать 3%. При более высоком содержании бора стали ста'
новятся крайне хрупкими и плохо обрабатываются. Так, введе
ние в состав сталей 2% бора уменьшает относительное удлинение
в ~ 10 раз. Накопление гелия при облучении нейтронами может при-
вести к растрескиванию стали, легированной бором. До 90% выгорания
бора нержавеющая сталь имеет хорошую коррозионную и радиацион-
ную стойкость и может применяться без защитного покрытия. Не-
сколько меньшая коррозионная стойкость у сплавов титана, легиро-
ванных бором до 1,7%. Сплавы же циркония, легированные 2% бора
нестойки в воде при 573—633 К- Легирование бором снижает пластич-
ность титана и циркония. Облучение усиливает этот эффект.
Наряду со сплавами для изготовления регулирующих стержней
широко используют дисперсионные материалы. К ним относятся
бораль — карбид бора, диспергированный в алюминии, а также в не-
ржавеющей стали, титане, цирконии. Дисперсионные материалы по
сравнению со сплавами обладают лучшей радиационной стойкостью.
Гафний. Гафний и его сплавы можно применять в регулирующих
стержнях без защитных оболочек. По коррозионной стойкости гаф-
ний превосходит цирконий. Гафний более пластичен, чем цирконий,
и превосходит его по прочности. Гафний целесообразно применять для
поглощения надтепловых нейтронов. Сечение поглощения тепловых
нейтронов сравнительно невелико. Вследствие этого для поглощения
значительного количества нейтронов требуются относительно массив-
ные стержни.
Сплавы серебра. В качестве поглощающего материала можно при-
менять сплав серебра с 15% In и 5% Cd. Как нейтронный поглотитель
этот сплав сравним с гафнием и превосходит сплав Ag — 30% Cd.
При поглощении нейтронов серебро превращается в кадмий, неболь-
шая часть кадмия — в индий, а индий — в олово. Таким образом,
после длительного облучения состав сплава изменяется. Рассматри-
ваемый сплав стоек в воде с pH = 9 4- 10,5 при температуре 538 К.
Контактной коррозии этого сплава в паре с нержавеющей сталью
не наблюдается. После облучения флюенсом нейтронов 1,4-1021 см"’
изменения размеров образцов и изменения структуры не наблюдалось.
Редкоземельные элементы. Редкоземельный элемент европий це-
лесообразно применять для изготовления регулирующих стержней, эф-
фективность которых не должна меняться в течение длительного
времени. Нуклиды, образующиеся при захвате нейтронов в таком
стержне, имеют большое сечение захвата. В связи с этим стержни,
содержащие европий, будут эффективны длительное время. Однако
необходимо отметить, что европий крайне дорог.
Гадолиний может быть введен в качестве легирующего элемента
в нержавеющую сталь, сплавы титана. Такие сплавы с содержанием
гадолиния до 25% обладают высокой коррозионной стойкостью в воде
до 633 К. Трвердость и хрупкость нержавеющих сталей с гадолинием
возрастают с увеличением содержания последнего. Коррозионная стои-
212
кость сплавов титан\ снижается по мере увеличения концентрации
редкоземельных элементов. нации
Из экономических соображений целесообразно применять оелко-
земельные: элементы не в виде металлов, а в виде более дешевых окис-
лов. Наиболее низкую стоимость имеет смесь окислов ряда редко-
земельных элементов. Стержни из окислов редкоземельных элементов
изготовляют методом порошковой металлургии: прессовкой с после
дущим спеканием. Стержни йз окислов редкоземельных элементов
применяют обычно в оболочке из нержавеющей стали
Окислы редкоземельных элементов могут быть диспергированы
в матрице из нержавеющей стали. Наряду с окислами в регулирующих
стержнях можно применять бориды редкоземельных элементов. Эти
соединения инертны и имеют высокую твердость.
Выгорающие поглотители. Материалы с высоким сечением захва-
та нейтронов применяют не только для регулирования мощности, но
и в качестве выгорающих поглотителей. Последние могут вводиться
в активную зону на все время работы реактора. В процессе работы
реактора расходуется ядерное горючее и уменьшается количество ядер
поглотителя в результате ядерных реакций, идущих при поглощении
нейтронов. Одновременно протекают два процесса: снижение общего
уровня реактивности вследствие выгорания ядерного горючего и вы-
свобождение добавочной реактивности, скомпенсированной в начале
избыточным количеством поглотителя. При определенной скорости
выгорания поглотителя реактор будет критичен при длительной экс-
плуатации активной зоны. При этом меньшую долю реактивности не-
обходимо компенсировать регулирующими стержнями. В большинст-
ве случаев в качестве выгорающего поглотителя применяют 10В. Со-
единения его диспергируются в алюминии, нержавеющей стали, гра-
фите и т. п. Кроме бора в качестве выгорающих поглотителей могут
быть использованы Hf, Eu, Gd, Sm, Cd, Hg. Выгорающий поглоти-
тель гомогенно смешивается с ядерным горючим. В этом случае, однако,
может произойти нежелательное изменение ядерного топлива и будет
затруднена последующая регенерация его.
Материалы защиты. Ядерный реактор является источником ней-
тронного, а-, 0- и у-излучений. В связи с этим необходимо принимать
меры к защите от облучения обслуживающего персонала. Для осущест-
вления защиты реактор должен быть экранирован материалами, спо-
собными поглощать энергию излучения. Защита от а- и 0-излучении
нс представляет трудностей. Длины пробега этих частиц в твеРД
телах и в воздухе столь невелики, что специальной защиты от
видов излучения не требуется. Иначе обстоит дело с нейтронным £
излучениями, так как они обладают большим проникающим де
ем. Способность материалов поглощать нейтроны существенно зав,и-
сит от энергии нейтронов. Для поглощения нейтронов и Р
Должна быть снижена по сравнению с исходным значе i Р
нейтронов, освободившихся в процессе деления ядерного р •
Система защиты реактора должна удовлетворять следу Р
бованиям:
1) снижать энергию нейтронов до тепловой;
2) поглощать замедленные нейтроны (если толщина защит
слоя минимальная, то материалы защиты должны обладать 3н110г°
тельным сечением поглощения тепловых нейтронов); ачи'
3) эффективно поглощать проникающее ^-излучение.
При выборе материала для защиты необходимо учитывать не то
ко их физические характеристики, но и экономические показатели^
технологичность материалов; для эффективного поглощения у-изЛу
чения целесообразно применять тяжелые металлы. У’
Таким образом, защита реактора должна обеспечить: снижение
энергии нейтронов, поглощение нейтронного и у-излучений. Сниже-
ние энергии нейтронов — это замедление их. Характеристики мате-
риалов замедлителей были рассмотрены ранее. Любые материалы, яв-
ляющиеся эффективными замедлителями нейтронов, с теоретической
точки зрения пригодны к использованию в системе защиты реактора.
При решении конкретных вопросов необходимо учитывать не только
физические, но и другие характеристики материалов.
Благодаря высокой замедляющей способности, удобству приме-
нения в системе защиты и низкой стоимости водород следует считать
особенно подходящим компонентом материалов, используемых в си-
стеме защиты. В реакторах бассейнового типа вода выполняет одно-
временно функции замедлителя и защиты. На ряде энергетических ре-
акторов создают баки водяной защиты. Однако в ряде случаев приме-
нение воды в качестве материала для защиты реакторов ограничено,
так как толщина требуемого слоя воды должна быть значительной,
а это сказывается на общих размерах реактора. Увеличение мощности
реактора связано с повышением температуры воды в системе водяной
защиты. По этим причинам и ряду других соображений вместо воды
в системах защиты иногда целесообразно применять другие материа-
лы, содержащие водород (гидриды, углеводороды). Вопрос о приме-
нении в системе защиты этих материалов, а также бериллия, графита
должен решаться с учетом их экономических, технологических харак-
теристик и радиационной стойкости. Характеристики материал в
с высоким сечением поглощения тепловых нейтронов рассматривались
выше. Наиболее часто для этих целей в системах защиты применяют
композиции, содержащие бор, в частности стали перлитного класса,
легированные бором. При содержании бора 1—2% из таких сталей
прокаткой могут быть изготовлены листы. При более высоком содер-
жании бора стали становятся нетехнологичными. Прокатка их за-
труднена, а зачастую и невозможна.
В системе защиты от нейтронного облучения применяют бораль.
Этот материал представляет собой металлокерамическую композ ь
цию, состоящую из мелкодисперсных частиц карбида бора, распре-
деленных в основе из алюминия. Листы бораля толщиной 6 мм с каж-
дой стороны плакируют (покрывают) слоем алюминия толщиной окол
0,5 мм.
Тепловая защита предназначена в основном для уменьшения воз-
можности попадания тепловых нейтронов в биологическую защит}
Энергия, выделяемая при поглощении этих нейтронов, вызывает и -
грев материала тепловой защиты. В связи с этим необходимо подо
214
рать материалы с соответствующими свойствами и
вую защиту. Обычно тепловую защиту изготовляю'? И°_клаждать тепЛо*
ванного 14% Ni, 5% Си к 1-4% Сг для( п=вп7шеии?7На’легир°-
при нагреве. Причиной роста серого чугунаДявляетс??ып₽пСТа ЧуГуна
свободного углерода при распаде карбида железа. Для Йо ж? S
можно применять не склонную к росту малоуглеродетую St
Однако получение из нее крупных отливок сложно. Боле^целесой
разно собирать тепловую защиту из отдельных поковок, размен S
торых определяются экономической целесообразностью Обычно бт
содержащие композиции и стали применяют в защите реактооов X
существенное значение имеют размер и масса защиты Е д
Если масса и размер защиты не являются лимитирующими факто-
рами, в качестве основного материала защиты используют цемент
и бетон. Такие решения осуществлены на большинстве энергетических
и исследовательских реакторов. Стоимость бетонной защиты будет
определяться не только стоимостью цемента и заполнителей, но и спо-
собом изготовления защиты, наличием и расположением в ней отвер-
стий и т. п. Степень ° ослабления интенсивности флюенса нейтронов
системой биологической защиты в большой степени зависит от содержа-
ния воды в материале защиты, которое, в свою очередь, определяет-
ся в основном типом используемого бетона и способом его изготовле-
ния. Поглощение нейтронов бетонной защитой может быть значитель-
но увеличено введением бора в состав материала защиты. Для изготов-
ления систем защиты применяют цементы, содержащие ~ 1% В.
Стоимость бетона при этом возрастает в 2—3 раза. Способность слоя
бетонной защиты поглощать у-излучение зависит от плотности мате-
риала защиты. В зависимости от состава цемента и заполнителя плот-
ность бетона составляет 2,4—6,6 г/см3. Наименьшая плотность полу-
чается при использовании в качестве заполнителя песка и гравия, наи-
большая — при использовании стальных шариков, кусков стальной
проволоки, обрезков стального лома. В последнем случае стоимость
бетона в 40—50 раз выше, чем при применении песка и гравия.
Конструкция бетонной защиты в зависимости от назначения мо-
жет быть монолитной или же состоять из отдельных заранее изготов-
ленных блоков. Монолитные конструкции защиты применяют для
больших реакторов. Блочная конструкция целесообразна для
ших исследовательских реакторов, где необходим свободныйi д
ступ к активной зоне и которые менее опасны как источники у
я
При монолитной конструкции бетонной защиты Ре£^ора ПС„Т™’
мость ее возрастает вследствие применения каркасов. P У
бетона необходимо принимать меры для равномерного р Р
Ния заполнителя с большой плотностью, наприм р
При изготовлении защиты из отдельных блоков ц.
следует обращать на участки стыковки между бл°*а“ ’ скает при.
нить защиту от излучения. Если конструкция реактор Д У
Мнение защиты большой толщины из бетона, воды и ДРУ плНовое-
лических материалов, то эти материалы можно использо P
215
менно для защиты от нейтронного и ^-излучений. Если размеры и и
са защиты ограничены, то для поглощения у-излучения целесообп
но применять тяжелые металлы. Наиболее экономичным материал
эффективно поглощающим у-излучение с высокой энергией, являет**’
свинец. Применение свинца ограничивается его низкой температур
плавления. Если материал защиты нагревается до высокой темпер
туры, вместо свинца необходимо применять вольфрам, тантал. Эгй
металлы крайне дороги и применение их для защиты промышленных
реакторов нецелесообразно.
§ 8.4. МАГНИЙ И ЕГО СПЛАВЫ
Физические свойства. Весьма интересными материалами для обо-
лочек твэлов являются магний и его сплавы. Магний дешев и доступен.
Недостатками магния как материала оболочек и других деталей ак-
тивной зоны являются его малая коррозионная стойкость, склонность
к самовоспламенению, низкая температура плавления и низкие меха-
нические свойства при повышенной температуре. Несмотря на это,
магниевые сплавы широко применяют в качестве материала оболочек
в двухцелевых реакторах с графитовым или тяжеловодным замедли-
телем, природным ураном в качестве горючего и углекислым газом
в качестве теплоносителя, например в английских реакторах в Кол-
дер-Холле, Брадуэлле и др., а также в ряде французских реакторов
при температуре углекислого газа 623—673 К.
По сечению захвата тепловых нейтронов магний уступает лишь
бериллию. Физические свойства магния представлены в табл. 8.4,
а состав ряда магниевых сплавов для оболочек — в табл. 8.5.
Природный магний состоит из следующих изотопов: 78,8%
10,14% 25Mg; 11,06% 26Mg. При нейтронном облучении активируется
только 26Mg. В результате протекания реакции (п, у) образуется 27Mg
с периодом полураспада 9,46 мин. Магний и его сплавы используют
при изготовлении оболочек твэлов для уран-графитовых и тяжеловод-
ных реакторов, в которых топливом служит природный уран и теп-
лоносителем — углекислый газ. В Великобритании магниевые спла-
вы применены в реакторах Колдер-Холла, «Беркли» и др. Твэлы с обо-
Таблица 8.4
Физические свойства магния
Атомный номер 12
Относительная атомная масса 24,32
Сечение поглощения тепловых нейтронов, м2 5,9-10-»
Плотность, г/см8 1,74
Температура плавления, К 924
Температура кипения, К 1393
Коэффициент линейного расширения, град-1 26- Ю-*
Коэффициент теплопроводности, Вт/(м-К) 158,3
Кристаллическая структура ГПУ
Параметр кристаллической решетки, нм а = 0,32 с=0,52
216
Магниевые сплавы
Сплав
Таблица 85
Массовое содержание легирующих элементов и примесей"
Be Si Al Th Fe Mn NI Cu Mgo I Ca
%
Zr
0,001 0,005
0,2-
0,3
СССР:
ПМБ
МБ-3
МБ-4
Mg—Al— Be
Mg—Th—Be
Mg—Ca — Zr—Be
Великобритания;
Магнокс AL-80
ZA(+Be)
Магзан-2
Магзан-4
AM 503 (S)
AM 503
0,5—3,2 —
0,04 0,5
0,08—0,15 0,7
0,04 —
0,04 —
0,04 —
0,01 —
0,01 —
0,04
0,01
0,01
0,01
0,01
0,01
0,001
0,001
0,001
0,001
0,001
0,001
0,001
0,001
0,001
0,001
0,005
0,005
0,005
0,005
0,005
0,50,5
0,15
0,4
0,7
1,4
дочкой из магний-бериллиевого сплава используются в Чехословац-
кой АЭС А-1, созданной по совместному советско-чехословацкому
проекту и усилиями специалистов и промышленности обеих стран.
Температура теплоносителя СО2 в активной зоне реакторов 623—
723 К.
В твэлах с оболочкой из сплавов Mg механическую прочность
обеспечивает урановый металлический сердечник. Оболочка предо-
храняет сердечник от коррозионного воздействия теплоносителя.
Основным требованием, предъявляемым к магниевым сплавам, кроме
высокой коррозионной стойкости является не столько жаропроч-
ность (сопротивление ползучести и разрушению), сколько достаточная
пластичность, препятствующая разгерметизации оболочек твэлов при
деформации уранового сердечника.
Механические характеристики. Чистый магний малопластичен при
температуре ниже 373 К. Относительное удлинение составляет 5—
Ю% и значительно колеблется в зависимости от размера зерна и тек-
стуры. При выдержке в течение 100—200 ч при температуре 670—
720 К размер зерна в чистом магнии увеличивается в сотни и тысячи
раз. Это обусловливает дальнейшее снижение пластичности при ком-
натной температуре до относительного удлинения 2—4°6.
Измельчение и стабилизация зерна в магнии могут быть достигну-
ты легированием его Zr, Al, Мп, Th. Так, введение в магний 0,55°о
Увеличивает относительное удлинение в 2,5—3 раза. При этом про-
исходит и упрочнение магния. Механические характеристики совет-
ских магниевых сплавов представлены в табл. 8.6.
Ряд магниевых сплавов получают из порошков методами металло-
керамики. В этом случае в сплаве присутствуют окислы. Такие мате-
риалы (ПМБ-2 и ПМБ-5, см. табл. 8.6) менее пластичны, чем литые и
Реформированные, но обладают повышенной прочностью и жаропроч-
ностью.
217
Механические свойства Mg - - V и и И и сплавов Mg — Be при различной температуре 8.6 К
Материал <УВ, МПа V МПа 6. %
293 573 773 293 573 293 573 773
Магний 180 18 4 90 14 9 52 *70
МБ-4 220 38 9 150 19 6 48 /о
МБ-3 200 29 8 130 17 8 58 04 Qft
ПМБ-2 260 80 28 190 48 5 16
ПМБ-5 240 75 30 190 50 5 15 49
При деформации и пластическом течении в магнии и его сплавах
образуются крупные поры, полости по границам зерен. Это снижает
пластичность сплавов, создает опасность газового распухания. В спла-
вах, применяемых в реакторостроении, это явление практически уст-
ранено и при рабочей температуре 673—773 К оболочки из этих спла-
вов обладают достаточной устойчивостью.
Радиационная стойкость. Температура рекристаллизации магния
невелика. В связи с этим облучение не должно существенно изме-
нять механические свойства магния и его сплавов. Так, при облуче-
нии флюенсом нейтронов 1018 см-2 при температуре 318 К пределы
прочности и текучести сплава, легированного цирконием, возрастают
соответственно на 0—11 и 2—18%, а относительное удлинение умень-
шается на 10—35%. Более высокие флюенсы должны существеннее
повлиять на пластичность сплавов магния. Следует, однако, иметь
в виду, что в газоохлаждаемом реакторе детали и узлы из магниевых
сплавов будут иметь температуру не ниже 423—473 К. При этой тем-
пературе пластичность сплавов магния достаточно велика и радиа-
ционные повреждения не снижат ее до опасного предела.
Совместимость. Магний, совместимый с ураном до температуры
773 К, восстанавливает окислы почти всех металлов. В связи с этим
взаимная диффузия металлов будет зависеть от проницаемости окисла
магния. Малые количества легирующих элементов практически не
сказываются на проницаемости окиси магния и совместимости его
с другими металлами. До температуры 720—850 К магний и его
сплавы не взаимодействуют со сплавами Zr, Сг, Ti, Ni, Pt. С алю-
минием магний взаимодействует при температуре выше 673 К-
Низколегированные перлитные стали не взаимодействуют с рас-
плавленным магнием.
Коррозионная стойкость. В сухом углекислом газе при давлении
до 5 МПа и температуре 853 К устойчивы сплавы, легированные 2
Be. При температуре до 793 К стойки сплавы типа магнокс. КоррО"
зия идет по параболическому закону. Присутствие водяных паре
интенсифицирует окисление. При 773 К и давлении 1,4 МПа сплав
типа магнокс устойчивы в углекислом газе, загрязненном до 1 о
и до 0,03% водой. Увеличение содержания воды до 2°о не вызыва
катастрофической коррозии, так же как и увеличение содержания в
духа до 50%. С ростом давления углекислого газа скорость коррозии
возрастает. Облучение флюенсом нейтронов 2-Ю* * * * * 18 см~2 незначитель-
н0 влияет на скорость окисления.
При увеличении температуры сплавы магния воспламеняются
в атмосфере углекислого газа. Так, при давлении 1 МПа температура
воспламенения равна 913 К. Полное сгорание материала за счет само-
разогрева происходит при температуре не ниже 888 К. Оболочки твэ-
лов из спеченных порошковых магниевых сплавов не уступают по
коррозионной стойкости в углекислом газе оболочкам из литейных
и деформируемых сплавов.
В нейтральных средах, в том числе и в дистиллированной воде,
магний и его сплавы нестойки. Нормальный потенциал магния равен
—2,38 В, т. е. магний весьма электрооотрицателен и крайне активен
в коррозионном отношении. Облученные элементы в оболочке из спла-
вов магнокс хранятся в воде в течение времени, необходимого для сни-
жения активности короткоживущих продуктов деления. Сильная кор-
розия сплавов магния за это время может привести к контакту урана
с водой и загрязнению бассейна выдержки. Очистка воды от хлоридов
и карбонатов до содержания их 0,02 мг/л и увеличение pH среды выше
11 почти полностью подавляют коррозию магнокса. Следует отме-
тить, что в описываемых условиях контакт сплавов магния с нержа-
веющей и низколегированной сталями, графитом интенсифицирует
коррозию, вызывает образование язв. Контакт с алюминием и его
сплавами не интенсифицирует коррозию сплавов магния.
Магний и его сплавы нестойки к атмосферной коррозии. Для за-
щиты изделий из сплавов магния в этом случае применяют системы по-
крытий. При изготовлении оболочек сплавы магния сваривают аргоно-
дуговой, электронно-лучевой сваркой.'
§ 8.5. АЛЮМИНИЙ И ЕГО СПЛАВЫ
Физические свойства. Алюминий — элемент третьей группы тре-
тьего периода периодической системы. Физические свойства алюминия
отражены в табл. 8.7. Малое сечение захвата тепловых нейтронов, низ-
Таблица 8.7
Физические свойства алюминия
Атомный номер
Относительная атомная масса
Сечение поглощения тепловых нейтронов, м2
Плотность, г/см3
Температура плавления, К
Температура кипения, К
Коэффициент линейного расширения при температур
293-873 К, град-1
коэффициент теплопроводности при температуре
/73 К, Вт/(м-К)
кристаллическая структура
Параметр кристаллической решетки, нм
13
26,98
2,15-IO"2»
2,7
933
2600
28,7-10“®
210—233
ГЦК
= 0,
219
кая плотность делают алюминий весьма перспективным для реакт
строения. Температура плавления алюминия невысока. Алюми^
не претерпевает структурных превращений до температуры naaBMli
ния. * Ле’
Природный алюминий состоит из стабильного изотопа 27А1 п
взаимодействии с нейтронами по реакции (п, у) образуется ради11
изотоп 28А1 с периодом полураспада 2,24 мин. Из алюминия и его сил
вов изготовляют оболочки твэлов, канальные трубы, трубопроводЭ
обечайки баков и др. Низкое сечение поглощения тепловых нейтроно’
алюминия позволяет в случае использования его в активной зоне пя!
ботать на природном уране при значительной степени выгорания'
Наряду -с чистым алюминием (содержание всех примесей 0,0002%)
в реакторостроении широко применяются сплавы алюминия, которые
можно разбить на несколько групп:
технический алюминий марки АД (и близкий к нему по составу
алюминий производства США марки 1100) содержит ~ 0,5% приме-
сей, в основном Fe и Si;
сплавы, легированные никелем и железом (Х8001, Х8003, А288,
табл. 8.8); из этих сплавов изготавливают оболочки твэлов, эксплуа-
тирующихся при температуре до 473 К;
Таблица 8.8
Алюминиевые сплавы производства США, применяемые в реакторостроении
Сплав Массовое содержание легирую- щих элементов и примесей, % Сплав Массовое содержание легирую- щих элементов и примесей. %
Ni Fe Си 1 Si Mg Сг Ni 1Fe Си 1 Si Mg °
Х8001 1,0 0,5 0,1—0,3 А288 1 0,5 0,003
Х8 003 1,5 1,5 — 0,003 — — 6061 — — 0,25 0,6 1,0 0,25
более прочные сплавы типа 6061 (см. табл. 8.8) применяют для из-
готовления технологических каналов.
Значительное упрочнение алюминия может быть достигнуто вве-
дением в него окисла алюминия. Изделия из таких композиций полу-
чают методами порошковой металлургии, прессованием с последующий
спеканием тонкодиспергированного алюминиевого порошка. Такие
композиции типа САП содержат 8—10% окиси алюминия. Компози-
ции САП состоят из алюминиевых зерен, частично охваченных плен-
ками окисла. Керамический окисел обладает высокой твердостью и
прочностью. Охватывая мелкие зерна алюминия, окись препятствует
срастанию их в крупные и ограничивает ползучесть. Высокая проч*
ность сплавов САП получается вследствие ухудшения пластичности-
Некоторые элементы, которыми легируют алюминиевые сплавы,
значительно растворяются в алюминии в твердом состоянии при по*
вышенной температуре. Растворимость их падает с уменьшением те'
пературы. Для получения структуры алюминиевого сплава в вид
твердого раствора сплав нагревают до температуры, обеспечивают
220
полное растворение легирующего элемента с последующим быстрым
охлаждением. При такой операции — закалке — при комнатной тем-
пературе фиксируется неравновесный твердый раствор. Поскольку
твердый раствор нестабилен, в результате процесса старения проис-
ходит его распад. Процесс старения может быть ускорен нагпеванием
до 393—443 К в течение 4-12 ч. Эта обработка называется
ным старением или дисперсионным твердением. Старение увеличивает
прочностные характеристики сплавов алюминия. Для снятия наклепа
сплавы алюминия отжигают при температуре 623—673 К в тече-
ние 0,5—2 ч.
Сплавы алюминия, кроме металлокерамических, достаточно пла-
стичны и в этом смысле технологичны. Из них легко изготавливать
изделия методом прессования, выдавливания. Сварка сплавов алю-
миния встречает некоторые трудности, однако процесс этот освоен
и широко применяется при изготовлении твэлов. Изделия из сплавов
алюминия могут быть соединены пайкой или склеиванием. Благоприят-
ные физические, механические, технологические характеристики спла-
вов алюминия позволяют широко применять их для изготовления обо-
лочек твэлов и других элементов активной зоны. В первом уран-гра-
фитовом реакторе для производства плутония был использован алю-
миний марки 1100. Твэлы с оболочкой из алюминиевых сплавов при-
меняют в исследовательских реакторах, реакторах для производства
плутония в Ханфорде, Саванна-Ривере в США, в экспериментальных
кипящих реакторах.
К сплавам, идущим на изготовление оболочек, предъявляют тре-
бования высокой пластичности, От сплавов, идущих на изготовление
каналов и других конструкций активной зоны, требуется высокая
прочность.
Механические характеристики. Чистый алюминий очень пластичен
и непрочен. Предел прочности его равен 50—60 МПа. Небольшое ко-
личество примесей, присутствующих в техническом алюминии, уп-
рочняет его. Прессованные и холоднотянутые или холоднокатаные тру-
бы из технического алюминия после отжига при температуре
723 К имеют следующие механические характеристики.
Предел прочности, МПа 30=50°
Предел текучести, МПа
Относительное удлинение, %
Несколько более прочен американский сплав к со-
ветским сплавам алюминия с магнием типа АМг. В о
в готовых трубах свойства его таковы. 293К 473К
„ А _ 120-150 90-100
Предел прочности, МПа 40—60 30—40
Предел текучести, МПа 25—30 45—60
Относительное удлинение, %
С повышением температуры прочностные характеристики сплава
падают, пластические растут. vcnni выплавленных
Прочностные «Рактеристики
на основе технического алюминия, являю Р - У
характеристиками технического алюминия и сплава 6061. Скооп
ползучести технического алюминия при температуре 373 К и нап Ь
жении 100 МПа составляет 10“а %/ч. Такая же скорость ползучее*1'
имеет место при температуре 523 К и напряжении 10 МПа. У С™
Материалы оболочек должны быть совместимы с ядерным топливо
Взаимодействие между ураном и алюминием начинается при темпеоа
туре 523 К. При 573 К за 2000 ч в результате взаимодействия возни-
кает интерметаллидный слой толщиной 0,025 мм. Двуокись урана сов-
местима с алюминием до температуры 533 К, карбид и нитрид урана
до 813 К.
Радиационная стойкость. Вследствие низкой температуры рекри-
сталлизации радиационные повреждения алюминия и его сплавов
невелики. Имеет место повышение предела текучести и прочности
при сохранении пластичности (для предварительно упрочненных ма-
териалов) или снижении ее до допустимого уровня.
Флюенс нейтронов. 1021 см~2 0 2 7 27 38
ав, МПа 140 180 200 220 240
ат, МПа 125 160 170 180 200
6, % 22 25 22 22 24
В связи с этим можно заключить, что нейтронное облучение скорее
улучшает, чем ухудшает механические свойства алюминия и его
сплавов.
Коррозионная стойкость. Максимальная температура, при кото-
рой сплавы алюминия можно применять в водоохлаждаемых реакто-
рах, определяется коррозионной стойкостью сплавов. Весьма заман-
чиво с экономической и ядерно-физической точек зрения использо-
вать сплавы алюминия для изготовления оболочек твэлов и техноло-
гических каналов кипящих реакторов. Решение этой задачи затруд-
няется низкой коррозионной стойкостью сплавов алюминия при тем-
пературе 523—573 К в воде и пароводяной смеси. Длительная и надеж-
ная работа изделий из алюминия и его сплавов в водоохлаждаемых ре-
акторах при температуре ниже 523 К в значительной степени опреде-
ляется их коррозионной стойкостью, которая существенно зависит
от качества воды, конструктивных особенностей (наличие щелей и за-
зоров, контактов с другими материалами), состава сплавов, облуче-
ния и т. д. Безаварийная работа реактора, в активной зоне которого
используют алюминиевые сплавы, может быть достигнута лишь при
тщательном учете всех приведенных выше соображений.
Нормальный потенциал анодной реакции А1 -+ А13+ + Зе равен
— 1,663 В, что свидетельствует о высокой химической активности
алюминия. В первую миллисекунду после погружения в водную средУ
потенциал свежезачищенного алюминия близок к нормальному зна-
чению. С течением времени потенциал алюминия смещается в поло-
жительную сторону до значений от — 0,5 до 0,0 В, что связано с об-
разованием на его поверхности окисных пленок. В свою очередь»
нарушение сплошности окисной пленки на металле, погруженном в Ра*
створ, приводит к резкому смещению потенциала алюминия в отрица*
тельную сторону. Резкое изменение электрохимических характери-
222
стик алюминия при образовании окисной пленки наряду с другими
торами дает основание полагать, что алюминий способен ™ссЙи‘
роваться
Состав и структура окисных пленок. Рассмотрим состав и mw
туру окисных пленок, образующихся на алюминии в процессе коп'
розии. При контакте с воздухом на поверхности алюминия образует-
ся так называемая воздушно-окисная пленка толщиной 0 01 мкм Эта
пленка состоит из двух слоев. Внутренний слой, прилежащий к ме-
Рис. 8.4. Анодная поляризация
алюминия в деаэрированном
0,1 н. растворе нитрата калия
таллу (барьерный), компактный, на-
ружный состоит из более проницаемого
окисла.
В случае контакта алюминия чисто-
той 99,995% с насыщенной воздухом
дистиллированной водой при темпера-
туре до 363 К на поверхности металла
образуется аморфная пленка окисла
алюминия и поверх нее слой бемита
А12О3-Н2О сорторомбической решеткой
и слой байерита А12О3-ЗН2О с моно-
клинной решеткой. Толщина пленки со-
ставляет десятые доли миллиметра и за-
висит от конкретных условий. При тем-
пературе выше 373 К окисная пленка на
алюминии и его сплавах состоит пре-
имущественно из бемита.
Окисная пленка, образующаяся на
поверхности алюминия, неоднородна.
Толщина ее различна на разных участ-
ках, в пленке имеются поры. Именно в
порах в первую очередь протекает анод-
ный процесс. При толщине 5—10 нм пленка окиси алюминия обла-
дает достаточно малым электрическим сопротивлением, и на этих
участках может осуществляться катодный процесс. На участках зна-
чительной толщины пленка практически не пропускает электронов
и поэтому инертна. На этих участках не протекают ни катодные, ни
анодные процессы. Присутствие на поверхности алюминия фазовой
окисной пленки обусловливает его пассивацию. Анодная поляризаци-
онная кривая алюминия (рис. 8.4) свидетельствует о пассивации алю-
миния в области потенциалов от — 0,4 до — 0,75 В.
В случае нарушения сплошности пассивирующей окиснои пленки,
например при перемешивании среды, содержащей частицы корунда,
алюминий активируется и на анодной поляризационной кривой пас-
сивная область отсутствует. Образование на поверхности алюминия
окисной пленки при окислении на воздухе или при анодировании уве-
личивает пассивную область до потенциала 2,0 В. При температуре,
близкой к комнатной, коррозия алюминия и его сплавов протекает
преимущественно с кислородной деполяризацией при диффузионном
огРаничении. Значение предельного диффузионного тока на алюминии
в Ю раз меньше, чем на железе и меди, так как на большей части по-
223
верхности алюминия катодный процесс не идет. При комнатной тем,
пеоатуре AI и его сплавы при стационарном потенциале находятся
в пассивном состоянии. Скорость коррозии при этом мала и составляет
пои длительности испытаний 30 сут 0,002 г/(м *сут). С ростом темпе,
сатуры до 353 К скорость коррозии увеличивается до 0,03 г/(мг.Сут).
н С увеличением температуры интенсифицируется образование фа.
зовых защитных слоев. В связи с этим скорость коррозии замедляется
во времени. При температуре 373 К в первые 10—20 сут испытаний
толщина окисной пленки 6 (см) следующим образом зависит от вре.
мени т (с): 1g 6 = - 7 + 0,5 1g т.
При длительности испытаний свыше 10 сут коррозия алюминия
типа сплава АД при 353—373 К идет по линейному закону. Окисная
пленка на поверхности металла, достигнув определенной толщины,
растет далее крайне медленно, и толщину ее в первом приближении
можно принять постоянной. Скорость же коррозии определяется ин-
тенсивностью диффузии через окисную пленку и в рассматриваемом
случае близка к 0,03 г/(м2-сут).
При температурах, близких к 473 К, на поверхности алюминия
в результате протекания коррозионного процесса образуются пузыри.
Эти пузыри заполнены гидроокисью алюминия, частицами непрокор-
родировавшего алюминия и водородом.
3731К “пТН л°Й СРеДе (а К°РР°ЗИЯ ПРИ температурах свыше
nnlr правило, протекает в деаэрированной среде) катодный
процесс состоит в разряде иона водорода. Часть водорода при этоЛ
водополЯувелЛиМеТаЛЛе’ Молизуясь в микропорах и микрорыхлотах,
металла Упя=!аеТ ДаВЛеНИе В НИХ’ 0бразуя пузыРи на поверхности
трмгиАипмпл/Р^ШаеТ защитиУю окисную пленку и тем самым резко ин-
гпййиггаг РУе КОРР°ЗИЮ- Регулярность кристаллической решетки на
nv^-тпа зеРен нарушается. Очевидно, на этих участках концентри-
И «оплошности в окисной защитной пленке. В связи с этим
дует ожидать'более интенсивной коррозии алюминия по границам
Р ’ «то И наблюдается на практике. При легировании алюминия
Manurv И никелем последние мало растворимы в алюминии и уже при
вппппппК°НЦеНТрациях °бразуют интерметаллиды. Перенапряжение
нии PR 3 Н3 интеРМеталлидах железа, никеля меньше, чем на алюми-
6vhpt следствие этого катодная реакция разряда ионов водорода
Тут пРотекать преимущественно на поверхности интерметаллидов.
у 6 следует ожидать и молизации водорода. В результате в спла-
вах алюминия, легированных железом, никелем, медью, следует ожи-
Д меньшего растворения водорода в металле и соответственно бо-
е высоких защитных свойств окисной пленки. Так, при увеличе-
ии содержания в алюминии железа перенапряжение водорода при
температуре 473 К снижается:
Содержание Fe, % о,25 0 5 J ,0 5
перенапряжение водорода, В 1,34 1’14 0,85 0,74
водорода пооисхлпЛб?,Лее значительное уменьшение перенапряжения
До 1%, Очевидна ДНТ, лРИ введании в алюминий железа в количестве
’ аиболее эффективно скорость коррозии алюминия
а
224
гЖГсоХ» Дальней-
Шается соответственно в 1,7 и 1 5 раза РР И алЮминия умень-
В соответствии с изложенным сплавы яЛ1п
пературах, близких к 573 К, должны содержать^ЙКИе ПрИ Тем*
элементы, как железо, никель, в количестве * ^ирующие
количество никеля содержит, в частности сппЛ * 1%- Так°е
мендуемый для работы при температупе 57Ч кМагКИХ8001’Рек°-
аии ЭТОГО сплава ПРИ TeMnenaTvnciY 473 ° 14' ОКОрОСТЬ корро-
I %
। 0.050
J 0.025
I
<5 0
500 ~ 1000 1500 2000 2500
Вренн,ч
Рис. 8.5. Зависимость коррозии
алюминиевого сплава М388 от вре-
мени в воде при температуре
636 К
зии этого сплава при температурах 473
и 573 К составляет соответственно
0,1 и 0,25 г/(ма-сут) и уменьшается
во времени т (сут). При 573 К вы-
полняется следующая зависимость:
1g К = 0,58 — 0,42 1g т.
Присутствующие в теплоносителе
продукты коррозии алюминия, осаж-
даясь на поверхности окисных слоев,
затрудняют выход продуктов корро-
зии в воду. При этом снижается и
скорость коррозии. В связи с этим
чем больше площадь нержавеющей
стали в контуре, тем выше скорость
коррозии сплавов алюминия, находя-
щихся в этом же контуре.
Необходимо заметить, что при температурах ниже 373 К наиболее
коррозионно-стоек чистый А1. При температурах свыше 373 К бо-
лее стойки сплавы, легированные Fe, Ni, Си.
В начальный период коррозия алюминия и его сплавов протекает
по параболическому закону. По истечении некоторого периода, назы-
ваемого обычно инкубационным, скорость коррозии возрастает (рис. 8.5)
Коррозия при этом протекает по линейному закону.
Для алюминия чистоты 99,5% длительность инкубационного периода т
(ч) при коррозии в воде следующим образом зависит от температур •
Ig т----18,78+ (1,4- 10VT).
По этой зависимости можно в первом приближении оценю^^уще'стае^но
ность инкубационного периода при коррозии сплавов а
влияет на стойкость алюминия и его сплавов рп сред . _ проте.
Пассивное состояние на алюминии может нарушаться вследствие пр
кания следующих реакций:
А1+Оа- + 2Н+ == А13+ + Н2О + 2е;
А1+О2- + ОН- = НА1О2 + 2е.
Минимальная скорость коррозии реализуется,
Минимальным скоростям той или другой реакц • ии этому отвечает ра-
корда скорости этих реакций равны. В первом приближении это у
венство /птч
С*. ехр = С ехр (anF^/RT).
я 4 225
С Зак. 36§
С другой стороны, ионное произведение воды
W = С .С
н+ он-
• Кор.
изме-
• ско-
398—473
4,5—5,0
523—573
3,0-3,5
Решая совместно эти уравнения, получаем, что минимальная скопостк
розии алюминия должна отвечать значениям pH = — 1g w/3. F ть
Ионное произведение воды изменится с температурой. В связи с этим
няется с температурой и диапазон значений pH, отвечающий минимальной
рости коррозии сплавов алюминия: "
Т, К 333—373
pH 5,8—6,5
При температурах 473—573 К подкисление воды фосфорной кислотой сни-
жает скорость коррозии алюминиевых сплавов. Так, при температуре 588 К
и скорости потока 5,4 м/с для сплава Х8001 связь привеса образцов AG (г/м’1 и
времени т (сут) выражается следующими зависимостями:
для pH 5,5 lgAG = 0,3-|-0,8 Igr;
для pH 3,5 lgAG = — 0,6+0,71gT.
Содержание кислорода влияет на скорость катодного процесса и стационар-
ный потенциал. Алюминий и его сплавы в широком диапазоне потенциалов на-
ходятся в пассивном состоянии. В связи с этим увеличение концентрации кис-
лорода от 0,02 до 8 мг/кг практически не изменило скорости анодного процесса
на алюминии чистоты 99,99% при потенциале — 0,3 В.
Соответственно изменение концентрации кислорода не должно заметно ска-
заться на коррозионной стойкости алюминия и его сплавов. Аналогично вли-
янию кислорода и влияние перекиси водорода. Присутствие в среде хлоридов
влияет на электрохимическое и коррозионное поведение А1 и его сплавов.
Скорость анодного процесса при потенциале 0,05 В при 333 К практически
не изменяется на образце, выдержанном в химически обессоленной воде 72 ч до
концентрации хлор-иона 0,5 мг/л. При дальнейшем повышении концентрации
хлор-иона скорость коррозии увеличивается линейно с концентрацией хлор-
иона.
Если в воде присутствует сульфат-ион в количестве 5 мг/л, то хлор-иои
не увеличивает скорости анодного процесса в тех же условиях до концен-
трации 2 мг/л. Сам сульфат-ион не увеличивает скорости анодного процесса
до концентрации 5 мг/кг.
Ингибиторами коррозии А1 являются кремниевая кислота, хроматы.
Контактная коррозия. В любой конструкции всегда имеет место
контакт разнородных материалов. При контакте с нержавеющими ста-
лями стационарный потенциал сплавов алюминия смещается в область
перепассивации, и скорость коррозии алюминия возрастает. Лишь
для некоторых сплавов при строго определенном соотношении поверх-
ностей алюминия и нержавеющей стали стационарный потенциал при
контакте со сталью отвечает пассивной области. Для снижения контакт-
ной коррозии на алюминиевых изделиях методом анодирования со-
здается защитная пленка окиси алюминия. При так называемом обыч-
ном анодировании толщина окисной пленки равна 10—20 мкм, при
толстослойном—50—100 мкм. Пленка окисла имеет в последнем слу-
чае черный цвет, и этот метод анодирования называют иногда черным.
Окисная пленка при толстослойном анодировании обладает хорошими
антифрикционными свойствами. Окисные пленки после обычного ано-
дирования наполняются (пропитываются) хроматами и имеют зеленый
цвет.
226
делием из^ алюминия и ’нержавеющей сталью встаыяютМ МвКДУ ИЭ'
с’не^^авеРюще’йсталью’протектор'разруша^^д^^р^д^51 веНк*^>а^®
гих случаях изделия из алюминия и стали разделяет детыь^сй'
вов циркония или титана. F деталью из спла-
В исследовательских реакторах баки, изготовленные из сплавов
алюминия, контактируют с бетоном. В бетон обычно добавляют стаТ
НОЙ скрап, кроме того, в бетоне имеется стальная арматура Поверх-
ность бетона, соприкасающаяся с алюминиевым б^ком, покрыв^г
защитным покрытием. Обычно наносят несколько слоев кузбас-лака.
Если сплошность защитного покрытия нарушена, алюминий может
соприкасаться с бетоном и находящимися в нем арматурой или скра-
пом. Влага, содержащаяся в бетоне, может иметь pH = 13 — 14.
В месте непосредственного контакта с бетоном развивается ин-
тенсивная язвенная коррозия алюминия, которая может привести
к сквозному поражению через несколько лет эксплуатации. Наибо-
лее эффективным способом борьбы с такого рода коррозией является
нанесение на поверхность бетона высококачественного защитного
покрытия.
Существенно увеличивает скорость коррозии сплавов алюминия
контакт с графитом. Так, скорость коррозии сплава марки 6061 при
контакте с графитом в химически обессоленной и речной воде возросла
более чем в 20 раз. Анодирование повышает в этом случае стойкость
сплавов алюминия.
Щелевая коррозия. В реальных конструкциях трудно полностью
избежать образования щелей и зазоров между однородными материа-
лами. При контакте двух изделий из сплавов алюминия протекает
щелевая коррозия.
Ширина зазора или щели при плотном прилегании двух металли-
ческих поверхностей составляет обычно 0,005 см.
Кислород из среды, находящейся в щели, расходуется в ходе^кор-
розионного процесса. Поступление новых порций кислорода и
ма в щель возможно только за счет диффузии. Ионы алюми и ,
пающие вследствие протекания коррозионного процесса РР
ную среду, в щели гидролизуются:
Моа = DSC/1 = 10-5-5-10-М0-в/1 = 5-Ю-14 моль/с,
где D = 10-5см2/с- коэффициент Д^ФФУ3™ в^Тдонц^а^я
х 10-8 см2 — сечение щели; С = Ю г-экв/см
кислорода в объеме. гтпг™пление кислорода
Даже на расстоянии 0,1 см от края щ
составит лишь 5-Ю-13 г-экв/с. НЯГЫшенной воздухом хи-
Стационарный потенциал алюмини у состоянию. При
мически обессоленной воде отвечает скооость анодного про-
УМеньшении концентрации кислорода V* и СКОрость коррозии
Десса в пассивном состоянии, а соотв с /(-л.Сут\ что составляет
остаются постоянными, близкими к <3 227
Clu.
1,85-IO-11 г-экв/(см=*-с). Очевидно, что Поступающий вследствие hui
фузии в щель кислород не может обеспечить протекание коррози
В результате реакции гидролиза ии-
А13+ + ЗН2О = А1(ОН)3 + ЗН+
образуется ион водорода, который принимает участие в катодном пол
цессе. Коэффициент диффузии Н+ приблизительно на два порядка
выше, чем коэффициент диффузии кислорода. В связи с этим можно
полагать, что значительная часть водорода, образовавшегося в ре.
зультате гидролиза, будет удалена из щели вследствие диффузии Н*
В соответствии с этим среда в щели может стать практически ней-
тральной.
Следует иметь в виду, что при попадании нейтральной коррози-
онной среды в щель может протекать анодная реакция с образованием
алюминатов. Протекание этой реакции уменьшает количество А1*+
в щели. Реакция гидролиза и образование Н+ при этом подавляются.
В рассматриваемой ситуации продукты коррозии алюминия в ще-
ли будут присутствовать в виде Н2А10з и А1(ОН)3. Концентрация
А13+ может быть принята 10-6 моль/л. В этом случае, исходя из про-
изведения растворимости А1(ОН)3 — 2-Ю-32, pH в щели должен
быть 5,4, т. е. близок к нейтральной.
Вследствие ограничения поступления кислорода в щель среда
в щели будет деаэрирована. В деаэрированной химически обессоленной
воде стационарный потенциал алюминия равен — 0,7 В. При этом
потенциале в нейтральной среде скорость разряда иона водорода рав-
на 10-9 А/см2, или 10-14 моль/(см2-с), что в 1000 раз меньше скорости
поступления алюминия в щель. Таким образом, можно полагать, что
анодный процесс в щели компенсируется протеканием катодного про-
цесса в объеме.
Ионы водорода в щели расходуются на протекание катодного про-
цесса. Так как концентрация ионов Н+ и ОН“ связана значением ион-
ного произведения воды, то вследствие диссоциации молекул воды
в коррозионную среду в щели поступают гидроксил-ионы. В связи
с этим pH среды в щели повышается до 8.
Подщелачивание среды в щели приводит к резкому увеличению
скорости коррозии. Особенно сильно развивается щелевая коррозия,
когда щель образуется в результате контакта алюминия и нержавею-
щей стали. В таком случае говорят о контактно-щелевой коррозии.
В связи с изложенным следует избегать образования щелей и за-
зоров в конструкциях атомных установок, где используются алюми-
ний и его сплавы. В этой связи соединение листов и труб алюминия
следует производить не внахлестку, а встык и методом сварки. При на-
греве во время сварки на поверхности сплавов алюминия и нержавею-
щей стали образуются окисные пленки, которые снижают ток при ра-
боте гальванической пары алюминий — нержавеющая сталь.
Переход продуктов коррозии алюминия в теплоноситель. При кор-
розии алюминия часть продуктов коррозии остается на поверхности
металла в виде защитной окисной пленки или в виде отложений,
а часть переходит в теплоноситель. В статических условиях в тепло-
228
носитель переходит меньше продуктов коппо^, 4*
При скорости теплоносителя 3—6 м/с и теЯЛлят^ 6 Аи11амических.
переходит до 50% продуктов коррозии Р уРе Д° 423 К в среду
При линейной зависимости изменения массы
розии от времени в раствор должна переходить осноХТмГГ К°Р'
дуктов коррозии. F д основная масса про-
Влияние облучения. Рассмотрим влияние облучения на коплп,
ную стойкость сплавов алюминия. Выше указывать коРРозион-
алюминия и его сплавов ковтролируХ
Элементарные ячейки кристаллической решетки, выхХщ*Тп^
верхность окисла, в общем случае значительно искажены ™ свя^Х
во с тем, что сама поверхность раздела является весьма серьезным де-
фектом кристаллической решетки. В связи с этим трудно ожадЛь
что дефекты кристаллической решетки, образовавший в результате
облучения, сколько-нибудь существенно скажутся на эффективности
поверхностной диффузии и соответственно на стойкости сплавов алю-
миния.
В деаэрированной среде коррозия идет с водородной деполяриза-
цией и облучение не влияет существенно на кинетику катодного про-
цесса. В среде, содержащей кислород, облучение увеличивает скорость
катодного процесса, но стационарный потенциал алюминия остается
в пассивном состоянии. При этом скорость анодного процесса не изме-
няется. Отсюда следует вывод о том, что облучение не должно заметно
изменить коррозионную стойкость алюминия и его сплавов.
Так, коррозия сплавов алюминия, легированных 0,5—2% Ni и
0,5% Fe, испытывавшихся при температуре 533 К в течение 700 ч,
уменьшилась при воздействии реакторного облучения в среднем на
11,9% по сравнению с испытаниями в тех же условиях, но без облу-
чения. Погрешность в такого рода коррозионных исследованиях близ-
ка к 10%. Возможно, что в начальный период коррозионных испытаний
облучение интенсифицирует рост окисной пленки. Принтом путь диф-
фузии удлиняется и на последующих этапах испытаний скорость кор-
розии несколько снижается. Некоторое снижение скорости коррозии
при облучении зафиксировано при испытании сплава М288 при темпе-
ратуре 493—523 К- При температуре 463 К зафиксировано увеличе-
ние скорости коррозии сплава Х8001 при облучении. При Tj*IJIBPa уР
473 К и длительности испытаний в химически обессоле«н°й ‘ВА
2000 ч скорость коррозии сплавов Х8001,
0,3 г/(ма-сут). Такого же порядка была скорость РР
Увеличение скорости катодного процесса под^еиствием^облуче-
ния в кислородсодержащих средах приведет У очередь,
ла на границе алюминий-нержавеющая сталь Это^^
может интенсифицировать контактную к рр
Движение теплоносителя интенсифицирует «жор^т^^РР^^^
алюминиевых сплавов. Особенно заметен 2 5% Ni и 0,4% Fe, при
553 К и выше. Так, для сплавов, скорость коррозии уве-
испытаниях со скоростью теплоносителя 2 м/с скорость рр
дичилась от 0,37 до 0,93 г/(ма-сут). 11ри скорости воды 6—6 м/с на
алюминиевых образцах фиксируются коррозионно-эрозионные по-
вреждения. На отдельных образцах на входе и выходе из испытатель'
ного участка глубина коррозионно-эрозионных повреждений за 2000 ч
испытаний достигает 0,5—1,0 мм. Этот эффект связан, по-видимому
со смыванием с поверхности металла продуктов коррозии. В специаль-
ных экспериментах образцы сплавов алюминия выдерживали при тем-
пературе 623—673 К в воде, насыщенной продуктами коррозии алю-
миния, в течение недели и суток соответственно. При этом, очевидно
происходил процесс, сходный со спеканием. После этого испытание
при циркуляции теплоносителя не вызвало увеличения скорости
коррозии.
Увеличение скорости потока перегретого пара также снижает стой-
кость алюминиевых сплавов. С увеличением давления перегретого пара
растет его плотность, что, видимо, приводит к увеличению скорости
коррозии сплавов алюминия. Вибрация существенно снижает кор-
розионную стойкость сплавов алюминия.
Подводя некоторые итоги изложенному, следует заметить, что для
обеспечения надежной эксплуатации сплавов алюминия (высокой кор-
розионной стойкости) необходимо уделять серьезное внимание соста-
ву водного теплоносителя, гидродинамическим факторам. Имеющи-
еся в настоящее время данные подтверждают, что сплавы алюминия
могут длительно и надежно эксплуатироваться до температуры
473 К.
В исследовательских реакторах для оболочек твэлов и элементов
конструкций применяют алюминий высокой чистоты, поскольку тем-
пература воды, насыщенной воздухом, не превышает 313—343 К.
Качество воды должно соответствовать следующим нормам:
Удельная электропроводность, мкСм/см 1
Жесткость, мкг-экв/л 1—2
Содержание, мг/л:
хлоридов <0,02
сульфатов <0,05
меди <0,02
pH 5—7
Алюминий высокой чистоты и сплавы типа 6061 могут применять-
ся в реакторах, охлаждаемых речной или озерной водой, при темпе-
ратуре до 353—363 К.
Для работы при 443—473 К используют сплавы типа А288, Х8001
(см. табл. 8.8). Нормы по качеству воды в этом случае отличаются от
принятых для исследовательских реакторов по содержанию кислорода
и значению pH. Вода должна содержать не более 0,02 мг/л кислорода
и pH должен быть 5,5—6,5.
§ 8.6. ЦИРКОНИЙ И ЕГО СПЛАВЫ
Физические свойства. Сплавы алюминия в настоящее время не
применяют при температуре выше 473 К, так как при такой темпера*
туре коррозионная стойкость и прочность их недостаточно высоки.
230
Из материалов с малым сечением захвятя и <
менение получили сплавы циркония Физико ШиРокое при-
и коррозионные их характеристики делают°‘^Ханические (™бл. 8.9)
перспективными для изготовления оболочек твэловИРКОНИЯ В6СЬМа
Физико-механические свойства циркония
Таблица 8,9
Атомный номер Относительная атомная масса Сечение поглощения тепловых нейтронов м2 Плотность, Т/см3 ’ Температура плавления, К Температура кипения, К Коэффициент линейного расширения, град~1 Коэффициент теплопроводности, Вт/(м-К) Кристаллическая структура Параметр кристаллической решетки, нм 40 91 1,8-10 « 6,5 2118 3873-3973 5,8-10-е 23,7 а-Фаза, ГПУ до 1135 К p-Фаза, ОЦК выше 1135 К а-Фаза: а=0,3232 с=0,5147 Р-Фаза: а = 0,316
В реакторах канального типа сплавы циркония незаменимы для
изготовления канальных труб. Применение каналов из сплавов цир-
кония существенно снижает поглощение нейтронов по сравнению с ка-
налами, изготовленными из аустенитных нержавеющих сталей.
В соответствии с Директивами XXV съезда КПСС возведены Ле-
нинградская, Курская, Чернобыльская АЭС. В канальных реакто-
рах этих АЭС технологические каналы изготавливают из сплавов
Zr + 2,5% Nb, а оболочки твэлов—из сплава Zr-f-1% Nb. Из этого
сплава иготавливают и оболочки твэлов ВВЭР. Максимальная темпе-
ратура (573—623 К), при которой сплавы циркония применяются
в водоохлаждаемых реакторах, определяется их коррозионной стой-
костью.
Для работы в перегретом паре при температуре свыше 623 К в ка-
честве перспективного рассматривается сплав валой (1,2% Сг, 0,1/о
Fe).
При облучении циркония нейтронами образуются три изотопа.
83Zr, период полураспада 1,5-10® лет, энергия 0-излучения
0,06 МэВ; п пл MaR-
85Zr, период полураспада 64,05 сут, энергия у-излучения , >
87Zr, период полураспада 17 ч. апрк-
Металлический цирконий получают в основном иод Д металл
тролитным и магнийтермическим методами. В первом у
наиболее чистый. _л^„лт,пгиирских ка-
Из сплавов циркония изготовляют участки возникает не-
малое, находящиеся в активной зоне. В связв ими сталями.
обходимость соединения сплавов циркония с н Р Обусловленных
На соединения стцль—цирконий кроме напря »
действием давления теплоносителя, действуют также значительные
циклически изменяющиеся напряжения, обусловленные различием
коэффициентов теплового расширения циркония (5,8-10~® град-ь
и нержавеющей стали (17,5-10-® град-1). '
Соединение методом сварки в данном случае приводит к образова-
нию в зоне сварки хрупких фаз (эвтектики и интерметаллидов), приво-
дящих к растрескиванию соединений уже при охлаждении после свар-
ки. Для получения соединения сталь — цирконий более перспективны
такие методы, как механические, диффузионная сварка, пайка, совме-
стное прессование, развальцовка, сварка взрывом и т. п. Наиболь-
шее практическое использование получил метод развальцовки.
Механические характеристики. Чистый цирконий имеет невысокую
прочность (табл. 8.10) и высокую коррозионную стойкость. Загряз-
нение циркония, особенно азотом, снижает стойкость металла. Для
нивелирования вредного действия азота цирконий легируют оловом.
(Из этих соображений легируют оловом и сплав оженит, который со-
держит по 0,1—0,3% Sn, Nb, Fe и Ni). Повышение прочностных ха-
рактеристик циркония достигается легированием его Nb, Fe, Ni, Си
и др. Сплавы, легированные 2,5% Nb, и сплавы типа циркалой-2
(1,2—1,7% Sn, 0,07—0,2% Fe, 0,05—0,15% Сг, 0,03—0,08% Ni) по
механическим свойствам (см. табл. 8.10) приближаются к нержавею-
щим сталям. Возможность их применения в реакторах при температу-
ре 750—900 К в среде газовых, жидкометаллических или органиче-
ских теплоносителей определяется не прочностными свойствами, а
коррозионной стойкостью в условиях движения теплоносителя и при
облучении.
Механические свойства циркония и его сплавов.
Материал ав, МПа ат. МПа
293К 473К 573К 673К 293К 473К | 573К I 673К
Цирковнй иодидной ра- финировки, дуговой переплавки 220 140 120 110 80 50 45 40
Циркалой-2 (США) 480 250 200 170 310 150 100 70
Zr-j-0,5% Та (СССР) 300 200 160 140 130 80 60 50
Zr+ l%NJt> (СССР) 350 260 200 180 200 160 120 90
Zr+2,5%Nb (СССР) Сплав оженит (СССР) 450 320 300 270 280 220 200 180
290 200 160 130 120 80 70 70
Zr-|-5%Nb (СССР) 650 570 530 480 — — —- —
Валой 560 — 360 270* 400 — ЗЮ 240*
* Температура 773К,
ЗЭД
Термическая обработка влияет на механические характеристики
сплавов циркония. Закалкой из 0-фазы с последующим старением при
отпуске можно получить высокие механические характеристики на
сплавах, легированных 2,5% Nb. Оптимальный режим термической
обработки должен обеспечить высокие прочностные и коррозионные
характеристики сплавов циркония. Влияние термической обработки
на Прочностные характеристики сплава, легированного 2,5%Nb, при-
ведено в табл. 8.11.
Из данных табл. 8.11 следует, что для сплава с 2,5% Nb в зяии
симости от режима термической обработки ст = 04-^78 МП
При заданном режиме термообработки свойства отдельных загстговок
труб и т. п. могут варьироваться в широких пределах. В табл. 8 16
приведены значения, близкие к минимальным значениям механиче-
ских характеристик.
Для длительной эксплуатации диаметр канальных труб из сплавов
циркония увеличивается вследствие ползучести. После отжига в те-
чение 4—5 ч при 738—823 К скорость ползучести сплава с 2,5 % Nb
при напряжении 1 МПа и температуре 623 К составляет (1,7—4,3) X
X 10-7 ч-1. Высокотемпературный отжиг (при 973 К в течение 30 мин)
увеличивает скорость ползучести почти в 10 раз.
При температуре 573 К между скоростью ползучести сплава
с 2,5% Nb (s, ч-1) и напряжением (ст, МПа) в первом приближении
существует следующая зависимость:
lg s — —• 8 + 0,1ст.
Таблица 8 10
СкороСтЬ установившейся ползучести
6. % Скорость установившейся ползучести Р. %/ч, при напряжении 0. МПа
263К | 47 ЗК । 573К | 673К
45 22 40 55 34 42 В5 35 42 60 36 45 Ь0= —246,954-90(Г, 189,8<а«тв R04K (Т^50 и ==0,4-1° 623К’^60 1,9.10-» 2=80 0=4.10"»
30 25 33 20 31 24 42 17 33 23 46 17 38 22 50 16 623К, <7=80 623К, О =150 623К, о = 60 673К, о=45 0 = 10-4 и= 10-1 0=0,3-10- * 0 = 0,7-10-*
13 — 11 13* 1
233
Т а Механические свойства сплава fcr+2,5% Nb (облучение нейтронами, блица 8.Ц с>0,5 МэВ)
Темпера- в, %
Обработка Флюенс нейтронов, см 2 тура испытаний, %, 2, МПа V МПа (на длине %
К 2.54 см)
Закалка с 1153К и Необлученные 293 780 870 13 63
старение при 773К, 1020 при 523К 293 960 1000 10
в течение 24 ч 1021 при 543К 293 1080 1100 8 45
Необлученные 573 530 580 14 75
Ю20 при 523К 573 680 720 13
Закалка с 1233— Ю21 при 543 К 573 780 810 9 65
Необлученные 573 480 580 13 70
1273К и старение при 102» при 573К 573 770 810 8 50
773К в течение 24 ч 1021 при 543К 573 860 860 4 5
Медленное охлаж- Необлученные 293 410 530 27 53
дение с 1073К 573 210 310 27 67
Быстрое охлаж де- » 293 630 730 13 51
ние с 973К и холод- ная обработка на 20% 573 410 480 15 55
При напряжении 0,9 МПа скорость ползучести и температура
в первом приближении связаны следующей зависимостью:
1g ё = — 12,6 + l,8-10-2t
Длительная прочность существенно зависит от температуры.
Сплав циркалой-2 при напряжении 2,4—2,55 МПа разрушается при
температурах 561 и 616 К за 10 882 и 140 ч соответственно. При
561 К увеличение напряжения с 2,55 до 2,72 МПа приводит к умень-
шению времени до разрушения в 6 раз.
Трубы технологических каналов, оболочки твэлов, переходные со-
единения, связывающие трубы из нержавеющей стали и из сплава
циркония, и другие элементы, изготовленные из циркониевых сплавов,
в процессе эксплуатации подвергаются действию переменных напря-
жений, обусловленных изменением температуры теплоносителя, вну-
треннего давления, внешних сил или вызываемых потоком теплоноси-
теля. В первом приближении число циклов до разрушения N для спла-
вов Zr с 1 и до 2,5% Nb при температуре 573 К связано следующей за-
висимостью со значением деформации за каждый цикл (%): 1g М=
= 5,32 — 2,32 1g 8.
Влияние облучения. В табл. 8.11 представлены данные о влиянии
облучения на свойства сплава. После закалки с 1150 К и старения
сплав обладает высокими механическими свойствами, в том числе и
при температуре 573 К. Облучение флюенсом нейтронов 1021 см-2 не-
сколько снижает пластичность. После закалки из 0-фазы и старения
облучение с тем же флюенсом снижает относительное удлинение с 13
до 4%.
При флюенсе нейтронов 1021 см-2 стт и ств при 293 К сплава с 1 %
Nb уменьшаются на 180 и 60 МПа соответственно. Для сплава с 2,5%
234
Nb эти значения уменьшаются ня .400 u oan хлп
230 МПа при 573 К. Облучение пло™ОстьЮ ± "PV93 К и на
тронов (2—3)-1013 см-2-с""1 (Е >» 1 МэВ! hp vmpu °Ка быстрых ней-
тельной прочности циркалоя-2. У ньшает предела дли-
Технологические каналы из сплавов циркония в процессе эксп™
атации изменяют свои размеры вследствие радиальной нп„Лу'
радиационного роста. При температурах, близких к 573 К, ES
нейтронов менее 10» см-“ (В>1 МэВ) теория дает
зависимость для оценки ползучести сплавов циркония:
1g е (%) = —7,83 — (4,38/Т-Ю 3) +
+ (8- 10-Зо/Т. 10-3) + 0,585 1g ср +
+ 1,085 1g т,
где 8 — деформация, %; о — приложенное напряжение, МПа; ср —
плотность потока нейтронов с£>1 МэВ, см~2-с_1; т — время, ч.
Значения радиальной деформации, рассчитанные по этой зависи-
мости для технологических каналов реактора типа CANDU, удов-
летворительно согласуются с экспериментальными данными:
1g-с 3,08
1g е: расчет —1,96
эксперимент —1,70
При флюенсе нейтронов свыше 1020 см-2 и о 140 МПа деформация
может быть оценена по следующей зависимости:
1g 8 (%) = 3- (3,96/Т-10-3) +
+ (8- 10-Зо/Т-10-3) + 0,5 1g т.
Удлинение технологических каналов за счет радиационного роста
I (%) может быть оценено следующим образом:
lg I = — 21,7 4- 1g <р + 1,7 1g т.
Значения радиационного роста, рассчитанные по этой‘зависимо-
сти для технологических каналов реактора Pickering, удов р
но согласуются с экспериментальными данными.
IgT 4,26
Igl: расчет —1,2
экспер имент — 1,1 о
3,5
— 1,5
—1,25
3,8
— 1,2
—0,94
3,9
—1,1
-0,9
4,0
—1
-0,8
4,66
—0,5
—0,5
4,6
—0,62
—0,62
4,4
—0,9
—0,9
4,48
—0,72
—0,73
Совместимость. Растворимость урана в a-Zr и циркония в ₽-
ограничена. В соответствии с этим при температурах ниж
взаимодействие циркония с металлическим ураном протека Р
тельно медленно. ₽-Zr и y-U обладают полной взаимной Ра^В0Р”н^
стью. В'результате преимущественной диффузии урана р
при Т> 1073 К в зоне урана, примыкающей к поверхн°^™ Р
возникает повышенная концентрация вакансий,.Х°™Р ’а ТВЭЛУ с
образуют микропоры. Это ухудшает сцепление^ циркония совместимы
Дочкой и теплопередачу между ними. Сплавы ц р
с нелегированным ураном до 873 К- $
При температуре 873 К U02 медленно взаимодействует со сплава,
ми циркония с образованием ZrO2. Происходит охрупчивание цирк0'
ния. Цирконий и его сплавы могут быть использованы в качестве ма-
трицы для диспергирования соединений урана в сердечниках диспер-
сионных твэлов, а также в качестве оболочек твэлов с компактным
керамическим сердечником, работающих при температуре 873 К.
Коррозионная стойкость. Количество электричества, пропущенное
при постоянном потенциале через образец сплава циркония с 2,5%
Nb при температуре 573 К, эквивалентно количеству металлического
циркония, перешедшего в ионное состояние. Это количество опреде-
лялось по привесу, т. е. по количеству кислорода, израсходованного
в процессе образования окисной пленки на ионизацию циркония.
Указанное обстоятельство свидетельствует о том, что коррозия цир^
кония и его сплавов в воде при температуре 573 К — процесс электро-
химический.
Цирконий — металл пассивирующийся. С течением времени кис-
лород, диффундируя через пассивирующий слой, растворяется в ме-
талле. При этом образуется твердый раствор внедрения и кристалличе-
ская решетка Zr искажается. При некоторой концентрации растворен-
ного кислорода искажение кристаллической решетки будет столь зна-
чительным, что энергетически выгоднее образоваться твердому раст-
вору циркония в двуокиси циркония. При этом будет иметь место не-
достаток кислорода против стехиометрческого количества в ZrO2.
Образующаяся черная защитная окисная пленка нестехиометрическо-
го состава может быть представлена в виде ZrOl g98. В окисной пленке
на поверхности циркония и его сплавов всегда имеются поры.
При коррозии циркония основным источником кислорода являет-
ся вода. Если через окисную пленку в металл будет диффундировать
атомарный кислород, то коррозия в водной среде не должна отличаться
от коррозии в газообразном кислороде, т. е. она должна идти по хи-
мическому механизму.
При электрохимическом механизме из воды должен образоваться
ион кислорода, например по следующей реакции:
Н2О =₽* 2Н+ + О2".
Ионы кислорода диффундируют через окисную пленку к поверхности
металла.
Ионизация циркония в ходе анодного процесса, как электрохими-
ческая реакция, может протекать только в том случае, когда кислород,
взаимодействующий с металлом, не может принять электрон.
В защитной окисной пленке нестехиометрического состава при-
сутствуют анионные вакансии. Вследствие этого миграция кислорода
через окисную пленку облегчена и протекает с энергией активации
120 кДж/моль. В воде при температуре 573 К увеличение массы образ-
цов из сплава с 2,5% Nb (AG, мг/дм2) и длительность испытаний т(ч)
связаны следующей зависимостью:
lg AG= 0,12 + 0,5 1g т.
236
Коррозия протекает по параболическому закону
лорода, диффундирующего через окисную пленкуу' *оличество кис-
щины и градиента концентраций. В насыщенном’naSS ” ** Тол’
под слем окисла, концентрация кислорода постояннИ РЛ.Лежащем
некоторой толщине окисной пленки, отвечающей привру^Т^/Пр2и
ДЛЯ ТОГО чтобы диффундирующий кислород обеспечил протеканийЙ
розионного процесса, содержание кислорода в наружных S р"
ной пленки должно отвечать стехиоме?рическому ОкисХ” плХ'
стехиометрического состава ZrOa белого цвета и не обладаетзащитны
ми свойствами. Эта пленка осыпается с поверхности находящейся™^
ней черной защитной окисной пленки, толщина которой в ходе лаль
нейшего коррозионного процесса остается постоянной. Коррозия пп и
этом протекает по линейному закону. F
В процессе коррозии сплавов циркония с Nb скорость перехода про-
дуктов коррозии в теплоноситель близка к 10'2 г/(м2-сут). F
С ростом температуры коррозия сплавов циркония интенсифици-
руется. Сплавы с 1 и 2,5% Nb применимы до температур не свыше
623 К- При более высоких температурах применяют сплавы типа ва-
лой, легированные железом. При температуре 673 К в среде с содер-
жанием кислорода 0,1 мг/кг для этого сплава выполняется зависимость
1g ДО = 0,1 + 0,55 1g т.
При загрязнении циркония азотом последний внедряется в межуз-
лие и деформирует кристаллическую решетку. Кислород, растворяю-
щийся в процессе коррозии в металле, дополнительно деформирует
кристаллическую решетку. При этом твердый раствор превращается
сразу в окись циркония стехиометрического состава, не обладающую
защитными свойствами. В такой ситуации коррозия идет по линейному
закону с высокой скоростью. Для нивелирования вредного действия
азота цирконий легируют оловом. Аналогично азоту действует и угле-
род.
Молекулы растворенного в воде кислорода при адсорбции на по-
верхности окисной пленки диссоциируют в поток кислорода через
окисную пленку, а соответственно и скорость коррозии Zr возрастает.
При совместном присутствии в среде О2 и NH4OH может образо-
ваться NOr В ходе этой реакции в качестве промежуточного-продукта
образуется атомарный азот, который растворяется в цирконии иен
жает его стойкость. В связи с этим в теплоносителе при с в-
присутствии этих реагентов концентрация кислорода не д ______
восходить 0,1 мг/кг при'концентрации аммиака, отвечающ Р *
При температуре 573'К 70% выделяющегося ® "Р ~ Содержа-
водорода диффундирует сквозь толщу изделия из образования
»ня ктавпгегося в металле водорода недостаточно
Придав при 573 К. С уменьшением температурь, растворимое
«Рода падает, я при 293 К в сплавМ Д*"теплоносятеля. а со-
Однако при низких температурах мало и да с этим присут-
Петственно и рабочее напряжение в металл • оаботы оборудова-
ние гидридов не должно сказаться на р ур Р
йия, изготовленного из сплавов циркония.
Присутствие в среде хлоридов и особенно фторидов в количег
более 0,05 мг/кг снижает стойкость сплавов циркония. Коррозион 6
стойкость сварных соединений на сплавах циркония увеличивает"1
термомеханической обработкой. Стойкость изделий из сплавов пиСЯ
кония возрастает после травления их в смеси азотной и фтористов^'
дородной кислот. °‘
В процессе облучения в кристаллической решетке циркония и ег
сплавов образуются радиационные дефекты. Последнее обстоятель
ство приводит к увеличению энергии кристаллической решетки и ин-
тенсификации диффузии кислорода, что увеличивает скорость коп',
розии. Тепловой поток 4,18-10® кДж/(м2-ч) интенсифицирует корро^
зию сплавов циркония.
В ряде случаев детали из сплавов циркония в процессе эксплуата-
ции в результате вибрации периодически контактируют друг с другом
или с изделиями из нержавеющей стали. При этом может нарушать-
ся целостность защитной окисной пленки на поверхности сплавов
циркония. Периодический контакт с нержавеющей сталью может пре-
пятствовать восстановлению окисной пленки. Коррозия (фреттинг-
коррозия} при этом интенсифицируется.
Требования к теплоносителю кипящих реакторов при изготовлении
оболочек твэлов и технологических каналов из циркония. Питательная
вода должна деаэрироваться. Снижение концентрации кислорода в пи-
тательной воде уменьшает интенсивность радиолиза и, следовательно,
концентрацию кислорода в воде циркуляционного контура, что повы-
шает стойкость оболочек твэлов технологических каналов и других
элементов активной зоны, изготовленных из сплавов циркония.
Необходимо исключить попадание аммиака в циркуляционный
контур и генерацию его в активной зоне. Поэтому следует крайне ос-
торожно использовать гидразин в системах кипящих реакторов для
деаэрации воды.
В кипящих реакторах концентрация хлорид-иона нормируется
на уровне 0,1 мг/кг. Значение это не является оптимальным с точки
зрения стойкости материалов активной зоны и обусловлено специфи-
кой работы кипящего одноконтурного реактора. Вследствие капилляр-
ного эффекта в отложениях продуктов коррозии концентрация хло-
рид-иона на поверхности оболочки твэла может быть и выше 0,1 мг/кг.
Поэтому содержание хлорид-иона в воде циркуляционного контура
должно поддерживаться на минимально возможном уровне и, конечно,
не превышать его. Концентрация фторид-иона должна быть не выше
0,02 мг/кг. Категорически недопустимы одновременное повышение
содержания фторид-иона и подкисление среды.
По изложенным причинам весьма желательна очистка циркуля-
ционной воды на ионообменных фильтрах. Крайне нежелательно
даже кратковременное увеличение содержания продуктов коррозии
в циркуляционной воде, например при пуске, переменах режима и т. Д-
Образование отложений на поверхности твэла, ведущее к увеличе-
нию температуры оболочки и концентрированию примесей воды, сни-
жает стойкость сплавов циркония, используемых для изготовления
оболочек твэлов.
238
| a.7. АУСТЕНИТНЫЕ НЕРЖАВЕЮЩИЕ ХРОМОНИКЕЛЕВЫЕ СТАЛИ
к конструкционным материалам пеактппы^
энергетических установок (ЯЭУ) предъявляют ве™ТУ₽а йде₽ныХ
бования в отношении их коррозионной стойкости Тре‘
но для контуров, в которых в качествеtShS^c бенно важ’
кую воду или жидкие металлы. Вода д!же выТоЗ «и^Му,ОТ лег‘
коррозионно-агрессивной средой. В жидких исталли^ХХто’е
выше 773 К наблюдается перенос массы Р ‘емпературе
В первые годы строительства ЯЭУ с водным и жидкомегаллическим
теплоносителями было мало данных о коррозионной стойкости паз
личных материалов в воде высокой чистоты и в жидких металлах'
так как обычная теплоэнергетика не ставила своей задачей изучение
этих проблем. Поэтому исследовались в основном материалы обла-
дающие самой высокой коррозионной стойкостью, освоенные в смеж-
ных отраслях промышленности. Основным конструкционным материа-
лом была выбрана аустенитная хромоникелевая нержавеющая сталь
(советские марки Х18Н9 и Х18Н10Т и американские стали типа 304
и 347). Стали этого класса коррозионно-стойки в воде до температуры
633 К, в газовом теплоносителе (например, в углекислоте до 873 К)
и в водяном перегретом паре — до температуры 923 К. Наряду с вы-
сокой коррозионной стойкостью эти стали имеют необходимые техно-
логические характеристики.
Аустенитные нержавеющие стали успешно применяют в качестве
оболочек твэлов и других элементов активной зоны в реакторах на
тепловых и быстрых нейтронах. Несмотря на более высокие значения
сечения поглощения тепловых нейтронов [(2,7—2,9)- 10-28м2по сравне-
нию с 0,19* 10-28 ма у циркония], что приводит к необходимости
использования более обогащенного топлива, хромоникелевые нержа-
веющие стали имеют ряд важных преимуществ перед другими материа-
лами. Они в несколько раз дешевле, чем цирконий, обладают высокой
жаропрочностью и жаростойкостью, вплоть до 823—^73 К, имеют
хорошую свариваемость, технологичны. Оболочки из стали Х18Н101
предпочтительны для реакторов на быстрых нейтронах, так как в та
ких реакторах в основном в качестве теплоносителя используют
жидкие металлы. а п „пппрпрн
Состав некоторых хромоникелевых сталей и их сплавов; приведен
в табл. 8.12. Нержавеющие аустенитные стали обладают Д
высокими механическими характеристиками вплоть до РУ.аХ
873-923 К (табл. 8.13), поэтому их можно пРиХГ^о™очн(£ти
С высоким давлением теплоносителя. Для повышения Р деги_
аустенитных нержавеющих сталей необходимо доп
рование молибденом или вольфрамом. гтялей для оболо-
При использовании аустенитных нержавеющих стали
твэлов необходимо обР™|™10вт"“В™о совместима с двуокисью
с ядерным топливом. Сталь л 18Ши 1 хорош ппи ИСпользова-
урана ДО температуры 1023 К. Это особенно важко при нс
кии жидкометаллических теплоносителей, не взаимодействует
Нии герметичности оболочки твэла двуокис ур
Й Химический состав некоторых хромоникелевых нержавеющих сталей Таблица 8.12
Марка стали или сплава Массовое содержание, %
с 1 Si Mg | Cr | Ni Ti Mo W 1 В Nb Ce S 1 p
Х18Н10Т 0,08 0,8 1—2 17—19 9-11 5% C — — 0,02 0,035 0 035
Х18Н10Т (ЭЯ1Т) 0,12 0,8 1-2 17—19 9—11 (% C—0,03) 5 — —- — — O'02
Х18Н12Т 0,08 0,8 1—2 17—19 11—13 5 (% G—0,03) ' .— 0'02 O'035
1Х14Ш6Б 0,07— 0,6 1—2 14—17 14—17 — «— —. 0,9—1,3 — 0,02 0^35
(ЭИ-694) 0,12 18—20
Х14Н18В2Б 0,07— 0,6 1-2 13—15 — —— 2—2,75 0,9—1,3 •— 0,02 0,035
(ЭИ-695) 0,12
ТР304 (4301-ФРГ) 0,07 1,0 2 18—19 9—10,5 — — — - 0,03 0,045
Х12Н20ТЗР (ЭИ-696) 0,10 1,0 1 10—12,5 18—21 2,6—3,2 1,1—1,4 — — — 0,02 0,035
ХН35ВТЮ (ЭИ-787) 0,10 0,6 1 14—16 35—38 1,1-1,5 — 4—5 0,005 0,025 0,02 0,035
304* 0,8 1,0 2 18—20 8—10 — - - -
316* 0,8 0,75 2 16—18 11—14 2—3
321* 0,8 1,0 2 17—19 9—12 __ - - .
347* 0,8 1,0 2 17—19 9—13 0,8
Х16Н16МЗБ 0,05— 0,8 0,8 14—17 14—16 — 2,5—3,5 2,0— 0,45— - 0,02 0,030
0Х18Н9 (ЭЯО) 0,1 2,7 0,85
0,06 0,8 1—2 17—19 8—10 0 02 0,035
0Х18Н9Т 0,06 0,8 1—2 17—19 9—11 0,3—0,6 J _ 0,02 0,02 0,035
1Х18Н9Т (ЭЯ1Т) 0,12 0,8 1—2 17—19 9—11 (% C—0,03) 5— — — — — 0,035
Х17Н13М2Т (ЭИ-448) 0,10 0,8 1—2 16—18 12—14 0to 0,3—0t6 1,8—2,5 — — — — 0,02 0,035
Х17Н16МЗТ 0Х23Н28М2Т (ЭИ-628) 0,08 0,06 0,8 0,8 1—2 0,8 16—18 22—25 15—17 26—29 0,3—0,6 0,4—0,7 2,8—3,5 1,8—2,5 ’—• — — — 0,02 0,02 0,035 0,035
0Х18Н12Б 0X21Н5Т 0,06 0,08 0,8 0,8 1—2 0,8 17—19 20—22 11—13 4,8— 0,3—0,6 — — 0,5—0,8 -- 0,02 0,025 0,035 0,035
0X21HGM2T 0,08 0,8 0,8 20—22 5,8 5,5— 0,2-0,4 1,8—2,5 — J, 025 0,035
6,5
• Сплавы производства США.
Механические свойства
Ф- %
75,5
76,5
70,5
66,0
64,0
хин,от разаи<ны> - 413
К
S
. С
т. к
С
s
to
С
г
/я
«' % Ч>. %
е
s
ь
2,50
3,70
3,17
2,02
1,98
1,93
1,85
1,77
773
823
873
923
973
170
180
160
160
180
430
455
360
355
275
30,0
40,5
28,5
30,0
29,5
64,5
61,0
64,5
68,3
57,5
3,05
3,65
3,60
3,40
. с
[ц £
1,69
1,64
1,60
1,55
1,50
с жидким металлом (натрием). С металлическим vnaun
вступают во взаимодействие в пределах температур ТТ^ЭТзТ X”
доЯ0^аш°даРЖаЩ”е интеРме™™’“Х"® соединшия , ”ое
Хорошо совместим с аустенитными нержавеющими сталями до
температуры 873 К монокарбид урана, при более высокой темпепату-
ре он обычно взаимодействует со сталью и несовместим с водой и па-
ром при высоких параметрах последнего. Эти стали в воде высокой
чистоты и ”В паре достаточно коррозионно-стойки. Высокая коррози-
онная стойкость этих сталей обусловлена их способностью пассиви-
роваться.
В зависимости от состава сталей, их структуры, значения pH и
наличия примесей среды нержавеющие аустенитные стали могут под-
вергаться нескольким видам коррозии: общей (охватывающей всю
поверхность равномерно), местной (точечные, язвенные поражения),
межкристаллитной (поражения по границам зерен) и коррозии под
напряжением.
Общая коррозия этих сталей в дистиллированной воде при комнат-
ной температуре протекает с кислородной деполяризацией. С ростом
Температуры возрастает скорость разряда ионов водорода, и при тем-
пературе 573—633 К в деаэрированной воде коррозия протекает с во-
дородной деполяризацией. При наличии в воде кислорода эта
может корродировать с кислородной деполяризацией и при высоко~
температуре. Скорость коррозии аустенитных нержавеющих сталей
в насыщенном паре практически равна скорости коррозии ее в вод
при той же температуре. -
Скорость общей коррозии в воде в статических уело»иях iври 55*-
623 К составляет 0,8—4 мкм/год, а в пароводяной Р .
Кислорода при температуре до 873 К и давлении д , „ радиа-
на 5-10 мкм/год. В промышленных установка. £
НИИ и при циркуляции воды И пара^ск°Р^ть ^Точно коррозионно-
Выщается, но до температуры 8731\ эти стал д
УСТНа™ е в стали шлаковых включений тредин раковин, ра^ич-
«ых загрязнений и других неоднородностей может привести р
тию местной коррозии (язвенной, точечной или отдельными пятна
ми). Этот вид коррозионных повреждений особенно опасен для тонко-
стенных оболочек твэлов, так как образование отверстия в оболочке
открывает доступ теплоносителя к ядерному горючему, что приводит
к аварийному состоянию реактора. Различные неоднородности метал-
ла приводят к образованию микрогальванических коррозионных пар
следствием которого являются местная депассивация участков метал-
ла и растравливание их.
Рис. 8.6. Анодные кривые стали 1Х18Н9Т в нейтральной среде (воде) с различ-
ным содержанием ионов хлора
Развитию местной коррозии способствует также присутствие в воде
иона хлора, вызывающее усиление процессов депассивации поверх-
ности металла, о чем свидетельствуют анодные кривые на рис. 8.6.
С увеличением концентрации ионов хлора в растворе область пассив-
ности сокращается и при концентрации 1000 мг/кг хлоридов металл
переходит полностью в активное состояние. Поэтому допустимое ко-
личество хлоридов в воде реактора не должно превышать 0,1 мг кг.
Местная коррозия таких сталей более интенсивно протекает в застой-
ных зонах, в щелях, в местах возможного упаривания воды, когда
состав воды меняется в сторону увеличения в ней примесей. Эти стали
используют в активной зоне реактора для изготовления кассет, подве-
242
сок, дистанционирующих и других элементов, тепловых «naun п
изготовлении деталей из разнородных метя™™ экранов. При
щая сталь—алюминий, возможно увеличение обадйРХТпНеРЖаВеЮ'
зии алюминия за счет образования макрогальванических naTJ°PP0'
вие разности их потенциалов. ических пар вследст-
Аустенитная нержавеющая сталь подвергается еше
местной коррозии—межкристаллитной. Сущность ее сосХ Ув ВДДУ
что выдержка этих сталей при температуре 823—92? k L ’
к выпадению карбидов хрома по гранитам зерен. Граничные Ети
зерен обедняются хромом, что уменьшает электрохимическую^^^
этих областей. Отмечается, что сталь с повышенным содержанием ™
рода более чувствительна к межкристаллитной коррозии так как ппи
этой температуре углерод интенсивно диффундирует к границам зерен
Увеличение содержания никеля в аустенитной нержавеющей стали
не влияет на склонность ее к этому виду разрушения; повышение со-
держания хрома или дополнительное легирование ее молибденом в не-
которых случаях способствует пассивации обедненных границ и тем
самым увеличивает стойкость сталей к межкристаллитной коррозии.
Однако такой способ борьбы с этим видом разрушения не является ра-
дикальным. Наилучшие результаты получают при легировании или,
как принято говорить, при стабилизации аустенитных нержавеющих
сталей титаном или ниобием. Титан и ниобий дают с углеродом весьма
стойкие карбиды, не диссоциирующие даже в случае аустенизации
сталей при температуре 1323—1373 К. В стабилизированных сталях
содержание свободного углерода, т. е. не связанного в карбиды титана
и ниобия, мало и не превышает растворимости углерода в аустените
при комнатной температуре. В связи с этим образования карбидов
хрома и обеднения хромом границ зерен не происходит.
Количество титана и ниобия, вводимого в сталь, зависит от содер-
жания углерода в ней и определяется по следующим зависимостям:
o/oTi = 5 (%С — 0,03); °%Nb = 10 (%С — 0,03).
Если сталь легирована азотом, то стабилизировать ее следует ни-
обием, так как титан расходуется на образование нитридов. Для из-
готовления особо тонких труб с толщиной стенки 0,5 мм и менее также
следует применять стали, легированные ниобием. Титан .
карбиды, размеры которых могут быть почти соизмеримы
СТеСтойХ“ аустенитных нержавеющих сталей к
коррозии существенным образом за®ХлиТ склонной к межкрвстал-
Стойкость деталей, изготовленных из стали’ й если их ра-
литной коррозии, может быть пов™е«а pL аустенизации карбиды
бочая температура не превышает 873 К. с?ойкой к межкристаллит-
хрома диссоциируют, и сталь CTaH0B“L неожавеющую сталь пеле-
ной коррозии. В ряде случаев аУс^ввУ отжигу при температуре
сообразно подвергать стабилизи^юЩ му максимальное количество
1073-1143 К в течение 1-3 ч. Пр и 3 е области зерен при этом
углерода связывается в карбиды, погра 1073—1143 К скорость
обедняются хромом. Однако при '[емп р слРдСТВие диффузии его из
Диффузии хрома достаточно велика, 243
середины зерен к границам концентрация хрома у границ увеличи
вается и сталь становится стойкой к межкристаллитной коррозии*
Аустенитные нержавеющие стали, стабилизированные титаном
и ниобием, после длительной эксплуатации при температуре 773_
873 К становятся склонными к межкристаллитной коррозии. Для уст-
ранения этого явления следует увеличивать отношение титана к угле-
роду в стали и подвергать сталь аустенизации с последующей стабили-
зацией. Для обеспечения стойкости аустенитной нержавеющей стали
к межкристаллитной коррозии при длительной эксплуатации при тем-
пературе 773—923 К отношение титана к углероду должно быть 10—17.
Выпадение карбидов и обеднение границ зерен хромом происходят
при нагреве стали в процессе сварки. Нагрев стали до 823—923 К
происходит в пришовной зоне, которая чаще всего и становится склон-
ной к межкристаллитной коррозии.
Следует отметить, что на стали, склонной к межкристаллитной
коррозии, последняя развивается не во всех средах. Наиболее интен-
сивно межкристаллитная коррозия развивается в кислых средах при
повышенной температуре. При температуре выше 373 К и высоком
давлении межкристаллитная коррозия развивается при наличии
в водей паре кислорода более 0,1—0,3 мг/кг. В деаэрированной воде
и паре межкристаллитная коррозия не развивается на сталях, склон-
ных к ней, при испытаниях по стандартному методу, так же как и
в аэрированной воде при температуре ниже 373 К.
Испытания сталей на склонность их к межкристаллитной корро-
зии производятся в соответствии с ГОСТ 6032—75. Склонность к меж-
кристаллитной коррозии проверяют также на сварных образцах.
Для контроля межкристаллитной коррозии на готовых изделиях в ря-
,де случаев испытания также проводят в соответствии с ГОСТ 6032—75.
При изготовлении наиболее ответственных узлов проверке на
межкристаллитную коррозию подвергают каждую поковку, трубу и т. п.,
для менее ответственных узлов достаточно произвести проверку ме-
талла данной партии плавки.
Аустенитные нержавеющие стали при совместном воздействии на
них механических напряжений и коррозионно-агрессивной среды под-
вергаются особому виду разрушений — коррозионному растрескива-
нию. Напряжение может быть приложенным или остаточным, но, как
правило, всегда растягивающим. Коррозионное растрескивание про-
является в виде трещин, скорость распространения которых зависит
от состава и параметров коррозионной среды. Трещины могут разви-
ваться от поверхности в глубь металла, проходя по телу зерен (транс-
кристаллитное разрушение) и по границам зерен (межкристаллитное
разрушение). Коррозионное растрескивание—опасный вид корро-
зионного разрушения и может привести к выходу из строя оборудова-
ния. Оно зависит от многих факторов — напряжения, состава среды,
температуры, длительности воздействия среды, структуры и состава
металла, степени пластической деформации (наклепа), характера за-
щитных пленок на металле и др.
Для снижения склонности аустенитной стали к коррозионному
растрескиванию необходимо обеспечить полное снятие наклепа. Рас-
244
гягивающие напряжения от наклепа скляпЫпястл
(РавИИМ”’ “"РЯ-ИЯМК,\XXZTp™.
никеля, а также уменьшений содержания эл^енто?”^ ТержаНии
образованию аустенита (углерода, азота), до О О ™ О 0Х/ лСТВующих
сталь более стойкой к коррозионному^^
Рис. 8.7. Микроструктура образцов стали 1Х18Н9Т с наклепом после испытания
их в нейтральной воде с различным содержанием хлоридов, мг/кг:
® 0«05; б — 0,1; 9 — 1,0; г — 10; 5 — 100; е— 1000; да? — 10 000 (шлифы протравлены)
содержания аустенитообразующего элемента — никеля — более 10—
12% делает аустенит более стабильным, а сталь более стойкой к кор-
розионному растрескиванию. Сплавы типа инконель, инкалой и др.
с повышенным содержанием никеля более стойки к коррозионному рас-
трескиванию, чем сталь Х18Н10Т.
Большую роль в коррозионном растрескивании аустенитных не-
ржавеющих сталей играет состав коррозионной среды. Коррозионное
Растрескивание аустенитной нержавеющей стали наблюдается в раст-
ворах, содержащих хлориды и кислород. С увеличением содержания
в растворе хлоридов уменьшается область пассивности таких сталей
(см. рис. 8.6). Из рис. 8.6 видно,’что при содержании в растворе
1000 мг/кг хлоридов стали полностью переходят в активное состояние.
С ростом количества хлоридов увеличивается коррозионное растрес-
кивание аустенитной нержавеющей стали. На рис. 8.7 представлены
Данные по коррозионному растрескиванию одной из таких сталей с на-
клепом 30% в нейтральных растворах при различном содержании
Длорид-ионов при температуре 583 К без начальной деаэрации раст-
вора. С ростом содержания хлоридов в растворе коррозионное растрес-
245
кнлание стали редко возрастает, и при концентрации хлорид
mno мг/кг образцы полностью разрушаются.
Копоозионное растрескивание аустенитных нержавеющих стаад
впоисходит также в паровой фазе. Но наиболее опасными с т0ЧКи
априия коррозионного растрескивания являются участки металла,
РпЛпженные попеременному увлажнению и высушиванию, т, е.
XS упариванию. Ядерные энергетические реакторы используй
Рис. 8.8. Микроструктура стали 1Х18Н9Т на конце ввальцовки трубы в труб у
доску парогенератора
в качестве теплоносителя воду высокой чистоты. Реакторная и под-
питочная вода строго нормируется по содержанию хлорид-иона. Но,
несмотря на малые нормируемые значения содержания хлорид в
в реакторной воде (от 0,1 до 0,5 мг/кг) и в воде парогенератора (0,5—
1 мг/кг), в некоторых местах (места заделки труб парогенератора в
трубные доски, участки с вялой циркуляцией и т. п.) может возникнуть
упаривание и повышение содержания хлоридов до опасных с точки зре-
ния коррозионного растрескивания концентраций. На рис. 8.8 пред-
ставлена микрофотография трубки парогенератора, подверженной
коррозии в результате упаривания воды с содержанием хлоридов
0,5 мг/кг.
В прямоточных парогенераторах с давлением 3—5 МПа раствори-
мость солей в паре мала. В связи с этим происходит накопление хло-
ридов в воде в зоне испарения. Это исключает создание прямоточного
246
парогенератора со средними Параметрами haba ♦
асавеющих сталей. н р и Пара из аустенитных Нер.
Для давлений 18 МПа и выше вследствие
растворимости хлоридов в паре их концентпип « 6тр°Г0 Увеличения
допустимых значений. Следовательно, прямоточной/6 прев“шает
в которых трубы теплообменника выполнены из Хг/ Р°ГеиераторьЬ
целесообразно создавать только на высокие давлений пНЫХ Сталей.
5-5 МПа эти стали следует применять для изгоХеНияРп/аВЛеИИИ
гора с многократной циркуляцией. вления парогенера-
Коррозионное растрескивание может возникнуть как при высокий
так и при относительно низкой температуре (358-363 К 5
дании воды (например, вследствие протечек) на наружную повеох'
кость трубопровода, нагретую до 353-373 К, происходит упаривХё
ее и увеличение концентрации хлоридов на поверхности трубопровода
В этом случае коррозионное растрескивание может происходить пол
влиянием внутренних напряжений в металле, которые могут возник-
нуть в процессе холодной прокатки труб, а также в результате накле-
па от случайных ударов и царапин. При температуре 293—313 К, как
правило, коррозионного растрескивания аустенитных нержавеющих
сталей не происходит, что позволяет использовать их даже в конден-
саторах, охлаждаемых морской водой. Хлориды могут проникать в
сталь из изоляционных материалов, вызывая коррозию под напряже-
нием. Коррозионное растрескивание сталей протекает и в паровой
фазе при загрязнении пара хлоридами и кислородом. Отмечалось раз-
рушение оболочек твэлов при ядерном перегреве пара вследствие раз-
вития коррозионного растрескивания.
. Аустенитные нержавеющие стали имеют высокую коррозионную
стойкость в широком интервале значений pH воды как в отношении
общей скорости коррозии, так и в отношении коррозионного растрес-
кивания. Кислород существенным образом влияет на коррозионное
растрескивание стали, усиливая его. Так, при концентрации кислоро-
да 1 мг/кг в присутствии в воде хлоридов наблюдается коррозионное
растрескивание. Увеличение концентрации кислорода до 1200 мг кг
не приводит к резкому усилению процессов коррозионного растрес-
кивания, т. е. в данном случае важна не концентрация кислорода,
а сам факт его присутствия. Процессы коррозионного растрескивания
сталей могут происходить и в отсутствие кислорода, если в,в д
ются другие легко восстанавливающиеся элементы (на р- Р> ТР
уловках в результ^ Р=
в воде реактора всегда присутствует радиол . тя в кипя-
Процессы радиолиза воды в большей степе р У в паре м0_
Щих реакторах, и количество радиолитическиго р°д ованиР хл0.
*ет достигать 40 мг/кг. Поэтому принят р бежаНИР КОррозион-
Рид-иона в реакторной воде. Следователь о, д ого и перегретого
кого растрескивания стали составi вод , чистоты> Склонность
пара должен поддерживаться на выси Ур ОЗИОННому растрескнва-
хРомоникелевых аустенитных сталей рр ниХ НИКеля.
Нию уменьшается с увеличением сод р
Несовершенство решетки металлов й сплавов играет существен^
роль в процессах их коррозионного растрескивания. Образовани
особое распределение дефектов могут вызвать хрупкое состоя»Й
в обычно пластичном материале. Ие
Образцы не
разрушились
Рис. 8.9. Влияние содержания нике-
ля в аустенитной нержавеющей ста-
ли (17—18% Сг) на склонность ее к
коррозионному растрескиванию в ки-
пящем растворе MgCU при напряже-
нии 2,8 МПа
Никель оказывает заметное влияние на распределение дислокаций
в аустенитных нержавеющих сталях. Эти дислокации связаны с пдо.
скостями скольжения. При увели
чении содержания никеля повьь
шается энергия дефектов упаков-
ки и облегчается поперечное сколь»
жение.
Основываясь йа зависимости
распределения дислокаций дефор.
мированных аустенитных нержа-
веющих сталей от содержания ни-
келя, следует ожидать значитель-
ного повышения стойкости нержа-
веющих сталей с 18% Сг против
коррозионного растрескивания при
содержании никеля более 18—20%
(рис. 8.9).
При высокой концентрации ще-
лочи и наличии напряжений в ме-
талле аустенитная нержавеющая
сталь подвержена особому виду
разрушений — щелочной хрупко-
сти. Она может развиваться и в от-
сутствие кислорода. Природа это-
го разрушения еще не выявлена.
Щелочная хрупкость может наблю-
даться, например, в местах упари-
вания, где происходит увеличение
содержания щелочи в 10 и более
раз. Предупреждение коррозион-
ного растрескивания аустенитной
нержавеющей стали в ЯЭУ должно проводиться как применением сов-
ременных средств водоочистки и водообработки, так и улучшением
условий службы металла, его качества, сварки, термообработки.
Существенное значение также приобретает правильный выбор тепло-
вой схемы АЭУ и правильных конструктивных решений ее элементов.
Как уже отмечалось*, аустенитные нержавеющие стали широко ис-
пользуют в системах с жидкометаллическим теплоносителем (эвтек-
тика Pb—Bi, Na, К, эвтектика Na—К, Li). Коррозионное воздействие
жидкого металла на сталь отличается своеобразными особенностями;
эти воздействия имеют иную природу, чем химическая или электро-
химическая коррозия. Это воздействие наиболее ощутимо при темпе-
ратуре большинства теплоносителей выше 773 К.
Для аустенитной нержавеющей стали при сложном составе жидко-
металлического теплоносителя (например, эвтектика Na—К) и при
248
наличии различных примесей (С, О, N, Н и др.) процессы взаимодейст-
вия значительно усложняются. В этом случае возможно избирательное
взаимодействие отдельных компонентов жидкого металла с твердь™
й его компонентами. .В системах из аустенитных нержавеющих с?мей
с щелочными жидкометаллическими теплоносителями термический
перенос массы становится заметным при температуре 773—873 К с раз-
ностью температуры в системе порядка нескольких десятков градусов*
Коррозионные поражения в этом случае локализуются в местах с маю
симальной температурой.
С увеличением скорости движения жидкометаллического теплоно-
сителя скорость растворения стали увеличивается. Скорость раство-
рения пропорциональна скорости движения жидкого металла в степе-
ни ~ 0,8. При больших скоростях к коррозионному воздействию добав-
ляется эще эрозионное и механическое повреждение, особенно для тя-
желых жидких металлов. Главной причиной переноса массы являет-
ся значительное различие растворимости данного вещества при раз-
ной температуре (табл. 8.14). Так, в эвтектике Pb—Bi в активной зоне,
где более высокая температура, возможно растворение из стали нике-
ля или железа, а в менее нагретой части контура — осаждение их
в виде интерметаллических соединений или чистого металла.
Таблица 814
Примерная растворимость твердых металлов
в жидких щелочных металлах
Жидкий металл Темпера- тура, К Массовое содержание твердого металла, %
Ni Сг Fe Nb Мо
Li 873 1073 1273 1473 о,1 1,8 4 0,01 0,02 4 0,002 0,005 0,025 0,065 <0,0001 <0,0001 0,03-0,1
Na 873 - 0,00001 0,001 0,002 0,008 0,06
1073 — 0,0007 —»
1273 0,004 0,003 **
1473 —
Большое значение в переносе массы имеет разница кипм,^...г—.....
8 жидком металле того или иного компонента, в результате которой
Может происходить, например, науглероживание аустенитной стали
Следствие обезуглероживания перлитной, если такая присутствует
8 контуре. Это приводит к изменению механических свойств стали,
‘эк, в эвтектике РЬ—Bi происходит выщелачивание никеля и хрома
йз стали, в результате чего сильно снижаются прочность и пластич-
”ость сталей, а в зоне взаимодействия аустенит частично переходит
8 феррит.
В жидком натрии также возможны растворение компонентов стали
5 Зрячей части и осаждениеих в холодной части контура. Аустенитные
нержавеющие стали весьма устойчивы в жидком натрии и в эр.
тике Na—К- Так, при 873 К в контуре е движущимся потоком натп К'
при содержании в нем 0,002% кислорода глубина коррозионной}
ражения стали Х18Н8Б составляет 2—3 мкм/год. Следователе!0'
необходимо в первую очередь очищать жидкий металл от кислооо
Кроме того, очень легко происходят выщелачивание и перенос угл^
рода. Поэтому при конструировании реакторных контуров из таки*
сталей необходимо брать стали с минимальным содержанием углевп
да, а также систематически очищать жидкий металл от углерода
По сравнению с другими жидкометаллическими теплоносителями
щелочные металлы наименее агрессивны и аустенитные нержавеющие
стали наиболее пригодны для длительной работы в них до температуры
873 К. При более высокой температуре наблюдается заметное наугле-
роживание поверхности нержавеющих сталей, особенно сталей, легиро-
ванных сильными карбидообразующими элементами, например ти-
таном. Науглероживание усиливается при наличии углеродсодержа-
щих материалов в системе и может сопровождаться переносом углеро-
да в ней. Перенос массы усиливается также в случае значительного пе-
репада температуры в системе (423—473 К).
Перенос массы характерен и для компонентов стали (Ni, Fe, Сг)
при одновременной межкристаллитной коррозии стали. Скорость
межкристаллитной коррозии аустенитных хромоникелевых сталей
в движущемся натрии составляет 0,05—0,25 мм/год при температуре
873—973 К и зависит в основном от содержания кислорода в натрии,
резко повышаясь при содержании кислорода более 0,005%. В этом
случае на поверхности стали образуются продукты коррозии в виде
сложных окислов железа и натрия, которые могут также растворяться
в потоке и осаждаться затем на холодных участках контура. При тем-
пературе более 973 К можно применять жаропрочные и жаростойкие
металлы и их сплавы, например на основе никеля (60—75% Ni, 16—
20% Сг, до 5 % Мо, 1—2,5% Ti, до 10% W). Улучшения коррозион-
ной стойкости жаропрочных сталей можно достигнуть добавкой до
30% А1.
При высокой температуре натрия (более 1073 К) целесообразно
применять тугоплавкие металлы (Та, Mo, Nb, W) и их сплавы. При-
сутствие в жидком металле кислорода и азота снижает коррозионную
стойкость тугоплавких металлов.' т
Коррозионная стойкость аустенитных сталей в эвтектике Na—К
ниже, чем в натрии, и понижается с увеличением содержания калия
в смеси. В литии скорость коррозии значительна, кроме того, не ре-
комендуется сочетать с ним стали с высоким содержанием никеля,
так как никель хорошо выщелачивается. На увеличение скорост
коррозии в литии существенным образом влияют примеси, в первую
очередь азот и кислород. Хромоникелевые стали с литиевым теплоно-
сителем можно применять до 773—873 К, при более высокой температу-
ре (973—1073 К) предпочтение следует отдать ферритным нержавею
щим сталям (например, 0X13, 1X13, 1Х12М2БФ и др.), не содержащим
никеля. Изменение температуры вызывают те или иные термически
напряжения в конструкционном материале, зависящие от скорое
S5Q
вменений температуры. Термические напряжений зависят от физиче-
ских И механических свойств материала. В аустенитных нержавею-
щих сталях с относительно низкой теплопроводностью термические
напряжения могут быть значительны и привести к разрушению стали.
Конструкционные материалы активной зоны подвергаются облу-
4ению нейтронами, у-квантами и электронами.
Рис. 8.10. Изменение механических свойств стали, содержащей Сг__Ni
под облучением ,
Облучение приводит к изменению механических свойств материа-
лов: возрастают предел текучести и предел прочности (в меньшей сте-
пени), а относительное удлинение и относительное сужение умень-
шаются. Таким образом, облучение
вызывает радиационное охрупчи-
вание металлов и сплавов. Это ох-
рупчивание в сочетании с терми-
ческими и другими напряжениями,
вибрациями, термическими цикла-
ми и коррозионным воздействием
теплоносителя может привести к
разрушению оболочек твэлов. Низ-
котемпературное облучение сталей
IX18Н10Т флюенсом нейтронов до
4-Ю22 см~2 вызывает повышение
прочности и снижение пластично-
сти (рис. 8.10).
С увеличением температуры об-
лучения выше 773 К механические
свойства значительно ухудшаются,
высокотемпературное охрупчива-
ние свойственно не только нержа-
веющим аустенитным сплавам-ста-
лям, но и сплавам на никелевой ос-
нове. На рис. 8.11 приведено изме-
нение механических свойств жаро-
прочного сплава ХН77ТЮР, облу-
Рис. 8.11. Механические свойства не-
облученного (1—3) и облученно-
го флюенсом нейтронов (1—3)Х
ХЮ20 см-2 при 423—473 К (1*—3 )
жаропрочного никелевого сплава
ХН77ТЮР (20% Сг, 2,5 /G Ti, 0,8 Al,
остальное никель) в зависимости от
температуры испытания;
1, 2. 2* — 3, 3* — 6
251
Цёйного при 423—473 К и испытанйого п£й температуре до 107о ь
При температуре выше 873 К происходит быстрое снижение относ *
тельного удлинения и предела прочности. Образование интермет
лических фаз, а также накопление гелия в результате некого^4'
ядерных реакций способствуют охрупчиванию стали и резкому он*
жению ее пластичности. и'
Глава 9
МАТЕРИАЛЫ КОРПУСА РЕАКТОРА И ДРУГИХ ЭЛЕМЕНТОВ
ЯДЕРНЫХ ЭНЕРГЕТИЧЕСКИХ УСТАНОВОК
§ 9.1. ПЕРЛИТНЫЕ СТАЛИ
Состав и структура. Стали-сплавы на основе железа широко при-
меняются в машиностроении, в том числе и в ядерной энергетике.
Чистое железо в качестве конструкционного материала из-за малой
прочности (ов ~ 280 МПа) практически не используется. Железо —
элемент VIII группы таблицы Д. И. Менделеева с атомным номером
26 — является переходным металлом. Природное железо состоит из
изотопов: 64Fe—5,84%; 66Fe—91,68%; 67Fe— 2,17%; 58Fe— 0,31%.
При облучении нейтронами в основном образуется радионуклид 59Fe
с периодом полураспада 45,1 сут и энергией 0-излучения 0,475—
1,57 МэВ и у-излучения 0,199—1,095 МэВ. Физические свойства желе-
за представлены в табл. 9.1.
Таблица 91
Физические свойства железа
Атомный номер
Относительная атомная масса
Сечение поглощения тепловых нейтронов, м®
Плотность, г/см®
Температура плавления, К
Температура кипения, К
Теплота сублимации (энергия кристаллической ре-
шетки) при 293 К, кДж/моль
Коэффициент линейного расширения, град-1:
363—576 К
576—1406 К
Коэффициент теплопроводности, Вт/(м-К)
Кристаллическая структура
Параметр кристаллической решетки, нм
Модуль упругости, ГПа
Модуль сдвига, ГПа
26
55,847
2,43.10-и
7,86
1811
3145
405
1,07-10-5
1,67-10-«
74
а-Фаза, ОЦК до ЧЮ К
у-Фаза, ГЦК до 1665 К
а-Фаза, а—0,286
у-Фаза, а — 0,361
217
84,7
В последнее время в реакторостроении находят широкое применен
стали перлитного класса, содержащие 0,08—0,4%С. Суммарное
держание легирующих элементов в них не превосходит 5 о о. Р
252
проектировании и строительстве пеьвы* аыс,„ь .
в качестве основного конструкционного м™РГ ИчеСКИХ Ректоров
стенитяую хромоникелевую‘ вержазеюХ^^’ “с"°ль“ва-™ ay
ее высокой коррозионной стойкостью гпппатЛ Объяснялось это
нение продуктами коррозии воды I контур f По м^пМ«НИМуМу Загряз‘
та реакторостроения выяснилось, что в ряде слу^™“акопления олы-
моникелевая нержавеющая сталь не BBVLMy4aeB аустенитная хро-
лом для изготовления некоторых узлов I контура* Материа’
ность аустенитной хромоникелевой нержавеющей ет4 ности’ Г,Р°4'
для изготовления из нее корпуса реактора достаточна
Аустенитная хромоникелевая нержавеющая сталь, стойкая вооб
ще говоря, к коррозии, подвержена таким видам разрушения ^к
коррозионное растрескивание и межкристаллитная корразияГНикХ
которым легируют нержавеющую сталь, всегда содержит примТи
кобальта. В связи с этим кобальт можно обнаружить, хотя и в незна-
чительных количествах, в продуктах коррозии нержавеющих аусте-
нитных хромоникелевых сталей, переходящих в воду I контура. Этих
незначительных количеств кобальта оказывается достаточно для серь-
езного ухудшения радиационной обстановки. Через месяц после ос-
танова основной вклад в активность оборудования I контура вносят
радиоизотопы кобальта.
Следует также заметить, что стоимость аустенитных хромоникеле-
вых нержавеющих сталей высока,что существенно отражается на сто-
имости электроэнергии, вырабатываемой на атомных электростанциях.
Замена нержавеющих сталей на стали перлитного класса существен-
но снижает стоимость атомных электростанций. Продукты коррозии
перлитных сталей не содержат кобальта. Следует также отметить, что
большинство перлитных сталей технологичны, освоены промышлен-
ностью. В случае применения перлитных сталей в ядерную энергети-
ку может быть перенесен опыт, накопленный обычной энергетикой,
в которой перлитные стали нашли широкое применение. Коррозион-
ная стойкость перлитных сталей ниже, чем стойкость нержавеющих
сталей. В случае применения перлитных сталей в I контуре атомных
энергетических установок необходимо принимать меры к увеличению
их стойкости, в частности с помощью поддержания соответствующего
водного режима, использования защитных покрытий и т. д.
Для изготовления корпусов реакторов с водным теплоносителем
используют стали, легированные для повышения механически
рактеристик Cr, Мо, V, Мп. Эти стали относятся к перлитному мае
су. Они хорошо прокатываются. Обычно корпус реактор Р доч
обечаек и днища. Обечайки, днище и крышку изготав
штамповки и ковки. ппоизоити
В процессе сварки корпуса в пришовной зоне Р
местная закалка низколегированной стали, что о' У"1 ® ически обра-
ние местных напряжений. Для снятия их прих д Р происХодить
батывать сваренный корпус. Аналогичное яв Жланнев трубо-
при вварке в корпус реактора п ос-
проводов и т. п. В местах сварки возникаютзначительные №с _
таточные напряжения. Суммарные (рабочие
. иЫЧмть разрушение металла в рёзульта-te образования
жения могут вызь изделий из высокопрочных сталей
трещЖгнМ¥ которых предел текучести близок к пределу прочности,
типа 16ГпМ, у ко р превышающие предел текучести, могут
в этом СЛУ4^ “айпрХм Низкое качество металла-наличие в ста-
“3Хаета«ических включений .1.1- увеличивает опасность воз.
тоещин в зоне сварки.
никновения тран тепЛоносителем корпус и крышку, изготов-
^иТХлитЗ стали, для уменьшения загрязнения воды 1 кон-
лет nnnnvKTaMH коррозии и предотвращения наводороживания кор-
тура пРадУкта“ нР^авеющей сталью методом наплавки. В послед-
пуса покрыг1ВпаиЮеоблюдении соответствующего водного режима приме-
”П.ВРнТп«а нз^еХной стали без’плакировки нержавеющей ста-
льюУ Состав ряда сталей перлитного класса приведен в табл. 9.2.
Перлитные стали
Таблица 9.2
Массовое содержание легирующих элементов и примесей. %
Марка С Мп Si Ni Мо Сг Прочие компо- ненты
22К 0,18— 0,7—1,0 0,17—
0,23 0,57
16ГНМ 0,13— 0,8—1,1 0,17— 1,0—1,3 0,40— — —
0,18 0,37 0,55
12ХМФ 0,08— 0,4—0,7 0,17— 0,3 0,25— 0,9—1,2 0,85—
0,15 0,37 0,35 0,30 V
SA302B <0,31 1,1 0,15- 0,4—0,6 — —
0,30
Сталь 20 0,17— 0,35— 0,17— <0,25 — <0,25 —
0,24 —0,65 0,37
12МХ 0,09— 0,4—0,7 0,15— <0,3 0,4—0,6 0,4—0,6 —
0,16 0,30 0,7-
38Х2МЮА 0,35— 0,3—0,6 0,17— <0,2 0,15— 1,35—
0,42 0,30 0,25 1,65 1,1 М
10ХСНД <0,12 0,5—0,8 0,8—1,1 0,5—0,8 — 0,6—0,9 0,4— 0,65 Си
25Х2НМФ 0,22— 0,3—0,6 0,17— 0,4 0,6—0,8 2,5—3,0 0,25—
0,27 0,37 2,0—3,0 0,35 V
15Х2НМФ 0,11— 0,3—0,6 0,17— 0,4 0,6—0,8 0,25—
0,21 0,37 0,35 V
Стали, состав которых приведен в табл. 9.2, содержат менее О,
С. Согласно диаграмме состояния Fe—С (рис. 9.1) стали, содерж Щ
менее 0,8% С, доэвтектоидные. При снижении температуры ниж
нии GS начинается превращение аустенита с выделением ФеРР '
Аустенит — структурная составляющая, представляющая собой и
дый раствор углерода в у-железе. у-Железо кристаллизуется в
решетке. Феррит — структурная составляющая, представляющ
бой a-железо, которое в незначительном количестве растворяе у
254
род. а-Железо кристаллизуется в ОЦК-оешм-кр п „х
структура доэвтектоидной стали состоит из феоои™ «б И GSP
При Г <996 К (горизонталь РК} прота!“
аустенит -> феррит + цементит, видная реакция,
В сталях с содержанием углерода < 0,8% продуктом поевоашениа
является эвтектоидная смесь феррита и цементита - перлит П^ле
окончательного превращения структура стали будет состоять ич
феррита и перлита Такую структуру перлитные стали с содержа-
нием углерода < 0,8% имеют после отжига. И
$ к
£
1273\
1073
873
I# Феррит
Аустенит
< Аустенит*"-^
\Р феррит
I Феррит-t-перлит
/ Аустенит+иаментигг)
-------—------ЛР/т/оричныи}
п Феррит+цементит
**, ।____,(третичный)_______
°)2 0.4 0,6 0,8 1,0 1,2 1,4 1,6 1,8 2,0
Массовое содержание 0, %
Перлит+цементит
Л
3
Рис. 9.1. Стальной участок диаграммы железо — углерод
Отжиг — фазовая перекристаллизация, заключающаяся в нагре-
ве выше температуры Ас3 (см, линию Д3 на рис. 9.1) с последующим
медленным охлаждением. Перлитные стали обычно применяют в нор-
мализованном состоянии. Нормализация представляет собой разно-
видность отжига. При нормализации охлаждение производят на воз-
духе, что обеспечивает несколько более высокую скорость охлаждения,
чем при обычном отжиге. При охлаждении с достаточной скоростью
от температуры выше критической точки Ас3 происходит закалка. С
увеличением скорости охлаждения температура эвтектоидного превра-
щения Агг снижается. Феррито-цементная смесь по мере снижения
Агг становится все более мелкодисперсной и твердой. Если скорость
охлаждения столь велика и переохлаждение так значительно, что рас-
пада твердого раствора не происходит, аустенит превращается в мар-
тенсит (твердый раствор углерода в a-железе). Если быстрое охлажде-
ние производят от температуры выше А(\ и ниже Ас3, происходит
неполная закалка.
Повышение содержания легирующих элементов приводит к уве-
личению устойчивости переохлажденного аустенита. В сталях,, леги-
рованных несколькими элементами, например в сталях Сг—Ni—Мо,
перлитное превращение настолько’ задерживается, что при охлажде-
?55
нии на воздухе происходит переохлаждение аустенита до температу
мартенситного превращения. При сварке корпуса в зоне шва мо-
происходить закалка низколегированной стали, что приводит к обо^
зованию внутренних напряжений. Для снятия этих напряжений коп"
пус после сварки подвергают термической обработке. ***
Физические и механические свойства. Механические свойства ста
лей (табл. 9.3) зависят не только от их химического состава и режима
термической обработки, но и от толщины и габаритов заготовки. ДЛя
низколегированных сталей при толщине 161—400 мм может быть полу-
чен предел текучести 300—550 МПа или категория прочности (К'П
25-70.
Таблица 93
Физические и механические свойства перлитных сталей
Марка ав, МПа (293 К) <ТТ, МПа (293 К) 6, % (293 К) °н’ Дж/см2 (293 К) <тт. МПа (573 К) н - в ~ 1 V К 1 к р = 5 at х я х о £ 2. 1=11” Коэффи- циент теплопро. водности. Вт/(м-К)
(573 К)
22 К 440—560 220—350 20—23 90—150 200—270 12,4— 13,4 46
16ГНМ 530—680 280—500 17—28 76—190 260—500 _—
12ХМФ 510—670 290—530 23—39 150—230 250—400 12,35 36
SA302B 350 • — — 300 — «***
Сталь 20 510 320 32 50 210 13 44
12МХ 450 280 31 190 270 12,7 50
38Х2МЮА 855 665 16,5 16(5 580 13,3 мм
10ХСНД 540 400 16 — — —
25Х2НМФ ***** 600—630 17—20 ** 600—630 *— •—
15Х2НМФ — 480—500 17—20 480—500 — *«*
15Х2НМФА 620 500 15 248 450 11,3 31
10ГН2МФА 550 350 16 —‘ 300 *—
Прочность сталей при Т >673 4- 753 К характеризуется преде-
лом длительной прочности. Для сталей 12ХМ и 12ХЛ1Ф предел дли-
тельной прочности при температуре 783 К и длительности испытаний
105 ч равен 130 и 180 МПа соответственно. Скорость ползучести при
температуре 783 К и напряжении 120 МПа составляет 10-6 %/ч. Стали
25Х2НМФ, 15Х2НМФА, SA302B (см. табл. 9.2) используют для из-
готовления корпусов и крышек реактора, стали 16ГНМ, 22К — для
изготовления барабанов-сепараторов, стали 12ХМФ, 12ХМ, стали 20,
ЮГН2МФА — для изготовления трубопроводов, сталь 10ХСНД
для изготовления элементов конструкий канальных реакторов и сталь
38Х2МЮА — для крепежа.
Радиационная стойкость. Корпус реактора в процессе эксплуата-
ции подвергается интенсивному нейтронному облучению, что ведет
к изменению механических характеристик перлитных сталей. Плот-
ность сталей, теплопроводность изменяются при этом незначительно.
Под влиянием нейтронного облучения изменяются критическая
температура хрупкости и ударная вязкость, что создает опасность
256
хрупкого разрушения. Явление низкотемпературной хрупкости за-
ключается в том, что при уменьшении температуры ниже некоторого
критического значения резко снижается ударная вязкость, и сталь
становится хрупкой. Кроме того, облучение влияет и на пределы проч-
ности и текучести. Малые флюенсы нейтронов (до 1017 см-2) практиче-
ски не влияют на механические характеристики углеродистых и низ-
колегированных сталей. После инкубационного периода с дальней-
шим увеличением флюенса имеет место резкое изменение механических
Рис. 9.2. Изменение механических характеристик малоуглеродистой стали (0,2% С
массового содержания) при облучении:
Св — предел прочности; От — предел текучести; бравн — равномерное удлинение; бобщ — общее
удлинение
характеристик стали, т. е. скорость радиационного упрочнения и ох-
рупчивания велика. С дальнейшим увеличением флюенса механиче-
ские характеристики изменяются менее интенсивно (рис. 9.2). При
флюенсах 1018—1019 см"2 предел текучести стали изменяется много боль-
ше, чем предел прочности. С увеличением флюенса разница между
пределами прочности и текучести уменьшается (табл. 9.4). Это приво-
дит к уменьшению способности материала к деформационному упроч-
Таблица 94
Влияние облучения при 353 К на механические характеристики
перлитной стали 20 и 15Х2НМФА
Флюенс нейтронов, 10‘» см—4 (£>1 МэВ) Сталь 20 15Х2НМФА
— 0,14 3 5 31 — 16
ав, МПа 750 810 1060 1160 ИЗО* 740 790
от, МПа 460 700 1010 ИЗО 1110 580 640
6, % 22 15 8 4,5 4,0 — —
9 Зак. 369
257
нению. В результате облучения флюенсом нейтронов 1020 см~2 предел
текучести сталей увеличивается на 100—150%, а предел прочности-^
лишь на 30—50%. Пластичность при этом’’уменьшается до'4%; При
облучении флюенсом от 1017 до Ю10 см-3 предел текучести низк0
углеродистой стали увеличивается в соответствии с зависимостью
Дстт = ЛФ*/3,
Рис. 9.3. Зависимость ударной вязкости ав малоуглеродистой стали (0,2% С мас-
сового содержания) от температуры испытаний после облучения:
1 — без облучения; 2—4 — облучение флюенсом 2,7 . 101в. 10*’ и 10“ см-* соответствен о
(1 кгм/см2 = 9,81 Дж/см2)
Упрочнение низколегированных сталей под действием облучения
сопровождается охрупчиванием, что характеризуется повышением
температуры перехода материала из пластичного в хрупкое состояние
и уменьшением ударной вязкости в области пластического разрушения.
Заметное изменение критической температуры хрупкости у боль-
шинства низколегированных сталей с мелкозернистой структурой на-
чинается при облучении флюенсом порядка 1018 см-2. При флюенсах,
превосходящих 1018 см-2, повышение критической температуры хруп-
кости малоуглеродистых и низколегированных сталей тем существен-
нее, чем выше флюенс (рис. 9.3, табл. 9.5). После облучения флюенсом
порядка 1020 см-2 критическая температура хрупкости сталей возра-
стает на 393—403 К, а ударная вязкость при температуре выше кри-
тической снижается на 30—50%. У некоторых, более чувствительных
к облучению сталей и их сварных соединений прирост критической
температуры хрупкости в результате облучения флюенсом (1 ~~ 3) X
X 1020 см-2 достигает 493—523 К. Связь между приростом критиче-
ской температуры хрупкости и флюенсом тепловых нейтронов выра-
жается следующей полуэмпирической зависимостью:
ДТкрит = 17,5Ф>/3,
где Ф — флюенс (отношение тепловых нейтронов к быстрым 10:1)
в единицах 1018 см-2,
Таблица 9.5
вя1Тос?ГпоиРТ>Т СК0Йн1е^’"еРг11', РЬ' ХрУПК0СТИ Гирит и ударной вязкости при />Гирит В зависимости от флюенса нейтронов^
Марка Флюенс нейтронов, 10*« см-* (Е>1 МэВ) т КРИТ* К д т, град д ё"
О Е(
SA302B — 298 82,7
1 313 15 82,7 0
4 323 25 77,3 7,0
7 378 80 69,0 17,0
Сталь 20 17 428 313 130 59,3 52 30,0
5 288 25 45 13,5
15Х2НМФА 12 0 363 353 130 33 36^5
70 343 150 — —
Следует отметить, что плотность нейтронного потока, а следова-
тельно и время достижения заданного флюенса не оказывают заметно-
го влияния на изменения механических свойств стали.
Механические характеристики облученного материала зависят от
температуры, при которой облучаются стали (табл. 9.6).
Таблица 96
Механические свойства перлитных сталей при 293 К
после облучения нейтронами
Марка Условия облучения °в- МПа ат- МПа б,
Флюенс нейтронов, 1О‘« см—2 (£>1 МэВ) Темпера- тура облуче- ния, К
Сталь 20 . . 530 280 25
2 566 720 535 9
2 678 590 390 14
12Х2МФ — — 860 740 12,9
4,3 508—538 970 880 и,о
Облучение нейтронами при температуре 403—413 К низколегиро-
ванной стали приводит к более сильному охрупчиванию, чем облуче-
ние при 323—333 К- Это обусловлено, вероятно, либо движением и ко-
агуляцией точечных дефектов, либо выделением дисперсных карбидов
и нитридов. Начиная с температуры 503—533 К эффект облучения
уменьшается, что обусловлено подвижностью и отжигом образовав-
шихся дефектов. При более высокой температуре изменение свойств
стали тем меньше, чем выше температура облучения. Облучение стали
при 688 К ведет лишь к небольшому изменению ее свойств. В резуль-
тате облучения при температуре 723—773 К даже довольно большими
259
флюенсами свойства низкоуглеродистых й Низколегированных сталей
практически не изменяются. и
Изменение свойств низкоуглеродистых и низколегированных ста-
лей в процессе облучения нейтронами обусловлено образованием ком-
плексов дефектов. Эти дефекты нестабильны и при повышенной темпе-
ратуре отжигаются. В случае облучения при температуре ниже 473—
493 К отжиг дефектов, а следовательно, и возврат механических свойств
облученных сталей начинаются при Т ~ 523 К и завершаются пол-
ностью при 723—753 К- Поэтому облучение при температуре 723 К
даже большими флюенсами не приводит к заметному изменению меха-
нических характеристик низкоуглеродистых и низколегированных
сталей.
Радиационная стойкость сталей зависит от их структуры. Стали
с мелкозернистой структурой менее чувствительны, чем средне- и
крупнозернистые. При одинаковом размере зерна изменение свойств
стали при облучении зависит от формы карбидной фазы и микрострук-
туры до облучения. В случае примерно одинакового количества кар-
бидной фазы наименьшее изменение свойств наблюдается у стали с зер-
нистым цементитом, полученным при высокотемпературном отпуске
закаленной стали. Влияют на свойства облученной стали также форма
и распределение участков перлитной фазы. При одинаковом размере
зерен феррита сталь с равномерно распределенными участками перли-
та менее чувствительна к облучению, чем сталь с неравномерно распре-
деленными крупными участками перлита. При одинаковых условиях
облучения изменения критической температуры хрупкости у различ-
ных плавок даже одной марки стали значительно различаются.
Коррозионная стойкость. При решении вопроса об использовании
перлитных сталей в реакторостроении, особенно в кипящих реакто-
рах, в первую очередь необходимо принимать во внимание их корро-
зионную стойкость. Более низкая по сравнению с нержавеющими ста-
лями коррозионная стойкость перлитных сталей вызывает опасение
с точки зрения загрязнения водного теплоносителя продуктами кор-
розии, разрушения оборудования вследствие местной коррозии или
охрупчивания при наводороживании.
Кинетика электродных процессов. Нормальный потенциал реак-
ции ионизации железа
Fe-> Fe2+ + 2е
равен — 0,44 В и не зависит от pH среды. С учетом реальной концен*
трации двухвалентного иона железа в среде, ограниченной произве-
дением растворимости гидрата окиси двухвалентного железа^ потен-
циал этой реакции в нейтральной среде равен — 0,52 В. В нейтраль-
ных средах в качестве катодных реакций при коррозии железа, низ-
коуглеродистых и низколегированных сталей термодинамически воз-
можно протекание процессов ионизации кислорода и разряда иона
водорода. В нейтральной среде нормальные потенциалы этих катод-
ных реакций равны соответственно + 0,8 и — 0,42 В. В деаэрирован-
ных средах коррозия железа и перлитных сталей идет с водородном
деполяризацией. В средах, содержащих кислород, например в воде,
260
потенциалу перехода железа в среду
Рис. 9.4. Анодная и катодная поляриза-
ция перлитной стали в нейтральной сре-
де (1 н. раствор нитрата натрия):
1 — анодная кривая в деаэрированной среде:
2 — катодная кривая в деаэрированн й среде.
3 — катодная кривая в насыщенной воздух и
среде. Пояснения в тексте
Насыщенной воздухом, коррозий железа протекает и с кислооолной
и с водородной деполяризацией. В нейтральных, насыщенных возду-
хом средах концентрация ионов водорода мала по сравнению с кон-
центрацией растворенного кислорода. Стационарный потенциал жХ
за в воде близок к равновесному----
с образованием двухвалентных
ионов. Следовательно, и катод-
ные реакции протекают при
этом потенциале.
В общем, скорость катодно-
го процесса тем выше, чем бо-
лее отрицателен потенциал, при
котором он протекает, по срав-
нению с равновесным потенци-
алом. Учитывая концентрации
ионов водорода и кислорода, а
также потенциал, при котором
протекают рассматриваемые ка-
тодные процессы, можно заклю-
чить, что в нейтральной среде
коррозия железа и низколегиро-
ванных сталей будет протекать
преимущественно с кислородной
деполяризацией. При снижении
pH среды концентрация ионов
водорода возрастает, и в кислых
средах коррозия железа и пер-
литных сталей протекает пре-
имущественно с водородной де-
поляризацией. Естественно, что
в щелочных средах, где концен-
трация иона водорода меньше,
чем в нейтральных, коррозия
железа протекает в основном с
кислородной деполяризацией.
Из данных, представленных
на рис. 9.4, следует, что в ней-
тральной, насыщенной воздухом
среде коррозия железа протекает
с кислородной деполяризацией
при диффузионном ограничении.
Рассмотрим анодные процессы на железе и перлитной стали в де-
аэрированной нейтральной среде. При потенциалах более отрицатель-
ных, чем <рх (см. рис. 9.4), скорость анодного процесса не зависит от
потенциала и крайне мала. Учитывая это, можно предположить, что
в рассматриваемых условиях железо находится в псевдопассивном
состоянии. При стационарном состоянии псевдопассивное состояние
на стали 20 в области температур 293—353 К сохраняется при кон-
центрации кислорода не более 0,2 мг/кг.
261
При потенциалах положительнее фг псевдопассивное состояние
нарушается и сталь переходит в область активного растворения. Ско-
рость анодного процесса при этом возрастает (ток ia при потенция'
ле ф3).
При потенциале ф8 достигается максимальный ток растворения
железа в активном состоянии. С дальнейшим увеличением потенциала
начинается пассивация железа, заканчивающаяся при достижении
фляде-потенциала, ффЛ. Пассивация железа при низкой температуре
связывается с образованием защитных слоев, как адсорбционных
так и фазовых. Фазовый защитный пассивирующий слой содержит
y-Fe2O8.
При потенциале положительнее ср4 протекают анодные процессы
выделения кислорода и растворения железа в области перепассива-
ции с образованием ионов высшей валентности. При комнатной темпе-
ратуре в деаэрированной воде высокой чистоты (с удельной электро-
проводностью 0,1 мкСм/см) стационарный потенциал более отрицате-
лен, чем фь т. е. отвечает области псевдопассивности. Скорость кор-
розии в этих условиях мала.
Рассмотрим коррозионное поведение сталей перлитного класса,
эксплуатирующихся в различных участках контура кипящего каналь-
ного ядерного реактора. В конденсатно-питательном тракте химически
обессоленная вода с электропроводностью 0,1—1,0 мкСм/см содер-
жит кислород в количестве 0,02 мг/кг. В конденсатно-питательном
тракте при всех температурах теплоносителя (293—423 К) сталь 20
находится при стационарном потенциале в псевдопассивном состоянии
и скорость общей коррозии ее мала.
Следует заметить, что в рассматриваемом диапазоне температур
скорость образования фазовой защитной пленки магнетита мала. За-
щитная окисная пленка в местах завальцовки в трубные доски может
разрушаться вследствие трения, обусловленного вибрацией. При этом
в местах разрушения окисной пленки интенсифицируется коррозион-
ный процесс.
Влияние кислорода. Присутствие в среде кислорода увеличивает
стационарный потенциал и соответственно энергию поверхностных ато-
мов и в конечном счете интенсифицирует поверхностную диффузию и
соответственно скорость восстановления защитной окисной пленки.
Кроме того, в присутствии кислорода Fe2-*’ окисляется до Fe3+. Про-
изведение растворимости Fe (ОН)3 существенно ниже, чем у Fe (ОН)2.
В силу этого в присутствии кислорода более значительная часть про-
дуктов коррозии откладывается в застойных зонах.
Увеличение содержания кислорода с 0,02 до 0,3 мг/кг приводит
к некоторому возрастанию скорости коррозии [кг/(м2-сут)] стали 20:
Со, мг/кг 293 К 353 К 423 К
0,02 0,02 0,05 0,3
0,2 0,03 0,06
0,3 0,07 0,26 0,6
Однако эффект интенсификации роста защитной окисной пленки в при-
сутствии кислорода и уменьшения растворимости продуктов коррозии
262
превалирует. В связи с этим в кондексатно-питательный тпаэт
случаев вводится кислород в концентрации 0,2 мг/Йили Н О
центрацин, обеспечивающей • то же mnenwoJ. Л Н’
В конденсате греющего пара кипящего канал“отоРрй,'
держание кислорода не превышает 0,2 мг/кг. В связи с этим и
коррозии стали 20 при температуре 420 К И С ЭТ М И
и снижается во времени.
тракт в ряде
”2О2 в кон-
реактора со-
..................I скорость
не превышает 0,6 г/(м2-сут)
В контуре многократной принуди-
тельной циркуляции (КМПЦ) кипящих
канальных реакторов вследствие радио-
лиза концентрации кислорода близки к
0,01—0,05 мг/кг. При рабочей темпера-
туре 550 К защитная окисная пленка из
магнетита (рис. 9.5) формируется за ко-
роткое время. При стационарном потен-
циале перлитная сталь в этих усло-
виях находится в пассивном состоянии
(рис. 9.6). Скорость коррозии К [г/(м2Х
Хсут)] вследствие образования защит-
ной окисной пленки уменьшается во вре-
мени (т4): 1g К, = 1,2 — 0,6 1g т.
Скорость перехода продуктов кор-
розии в теплоноситель Ка [г/(м2-сут)]
также уменьшается во времени: 1g Кп=
= 0,6 — 0,5 1g т.
При длительных стоянках КМПЦ не
обезвоживается, так как необходимо от-
водить от активной зоны тепло, образу-
ющееся вследствие остаточного тепловы-
деления. На стоянках вода в КМПЦ на-
сыщается воздухом. Температура ее
близка к 350 К. Скорость коррозии
Рис. 9.5. Анодная (1) и т -
ная (2) поляризации а о\
роднстой стали в деаэрир
ном 10-‘ н. растворе NaNO
при температуре 573 К
стали 20 в этих условиях близка к 2—
Зг/(м2-сут) и практически не изменяется
во времени. 80% продуктов коррозии переходят в теплоноситель.
Образовавшаяся при рабочих температурах окисная пленка магнети-
та при длительных стоянках не защищает перлитную сталь от к рро-
зии.
В условиях стояночной коррозии на перлитной стали образуются
язвы глубиной до 0,03 см. Транспорт кислорода к дну язв осущест-
вляется диффузией. При миграции в среде, заполняющей язву, кисло-
род расходуется на протекание коррозионных процессов на бок вых
поверхностях язвы. Легко показать, что в рассматриваемых устов ях
концентрация кислорода на дне язвы не превышает 0,2 мг кг. таким
образом, на дне язвы металл находится в псевдопассивном состоянии.
Скорость коррозии при этом мала, и рост язвы прекращается. 1акая
ситуация реализуется только в химически обессоленной воде. При
концентрации в воде хлор-иона свыше 0,5 мг/кг псевдопассивное
состояние не реализуется, и язва продолжает расти.
263
В свете изложенного в КМПЦ из сталей перлитного класса слеп
изготовлять толстостенные изделия, например корпуса заяви
Если в КМПЦ трубопроводы изготовляются из сталей перлити^'
класса, то для предотвращения образования железоокисных отло°Г°
ний на твэлах в период выхода на мощность необходимо применять
по снижению скорости коррозии на стоянках. Для этой цели в к
тур можно вводить ингибитор, например NaNO2, в концентоапи’
0,1 г/кг. Однако перед выходом на мощность ингибированная сред
Рнс. 9.6. Пленка магнетита на поверхности перлитной стали после испытания в
деаэрированной воде при температуре 573 К
должна быть заменена на химически обессоленную воду. Эта операция
занимает несколько суток, что связано с дополнительным простоем
реактора и не всегда экономически целесообразно.
В местах вварки трубопроводов КМПЦ в барабан-сепаратор или
коллектор при пусках и остановах возникают знакопеременные на-
пряжения, превосходящие предел текучести. При этом местная дефор-
мация может достигать 0,3—0,5%. Возникает опасность образования
трещин вследствие малоцикловой усталости. В присутствии коррозион-
ной среды число циклов до разрушения существенно уменьшается.
Образованию окисной пленки в процессе коррозии предшествует раст-
ворение кислорода в металле. Растворенный кислород образует обла-
ка Коттрелла, тормозит движение дислокаций и тем самым способ-
ствует образованию их плоских скоплений и соответственно зароды-
шей трещин.
В связи с изложенным для предотвращения образования трещин
вследствие малоцикловой усталости поверхности барабанов-сепара-
торов и коллекторов покрывают наплавкой из аустенитной нержавею
264
щей стали. Стойкость нержавеющей ста™ „ __ .
усталости существенно выше, чем у перлитам cT“AeaM™°Um°Boli
Поверхность паропроводов контактирует с Haoum»uu„„ „
нагретым до 550 К. В этих условиях £тро образуется “JS
окисная пленка. Скорость коррозии при этом такая V"ак в S X
такте с химически обессоленной водой и пля™™™ при ко
концентрации кислорода. Д И’ И пРактически не зависит от
Из сталей перлитного класса изготовляют баки водяной защиты
Температура обессоленной воды в них близка к 350 К. Эти баки™:
но соединяются с атмосферой ды-
дательными трубами диаметром
~ 100 мм и длиной до 10—15 м.
Массоперенос кислорода через ды-
хательные трубы мал. Кислород,
растворенный в воде при заполне-
нии бака, расходуется в ходе кор-
розионных процессов. В связи с
этим содержание кислорода в среде
со временем снижается. Сталь пе-
реходит в псевдопассивное состо-
яние, и скорость коррозии ее рез-
ко снижается.. В такой ситуации
каких-либо специальных мер по
защите перлитных сталей от кор-
розии не требуется.
В ряде случаев конструкция
баков водяной защиты такова, что
среда в них насыщена воздухом.
В такой ситуации в воду вводят ле-
рН среды
Рис, 9.7. Влияние pH среды на ско-
рость коррозии перлитной стали в
деаэрированной воде при температу-
ре 573 К
тучий замедлитель коррозии, на-
пример ИФХАН-12, в концентра-
ции 1 %. При этом снижается кор-
розия стали и по ватерлинии, и
выше нее.
В I контуре ВВЭР радиолиз подавлен за счет накопления На. При
этом Со2 < 0,05 мг/л. Для «мягкого» регулирования в контур вво-
дят борную кислоту. Подкисление водного теплоносителя приводит
к интенсификации коррозии сталей перлитного класса (рис. 9.7).
В окисной пленке, состоящей из магнетита, всегда имеются поры.
Стационарный потенциал металла на дне пор в деаэрированных средах
при температуре 550—570 К при pH < 10 отвечает области актив-
ного растворения. При pH = 10-4- 11,7 перлитная сталь находится
в пассивном состоянии. Для уменьшения коррозионных потерь в воду
I контура добавляют аммиак и КОН до pH = 7,3. Подщелачивание
среды снижает скорость коррозии перлитных сталей и на стоянках.
При длительных стоянках необходимо консервировать контур, обо-
рудование которого изготовлено из перлитных сталей. При «мокрой»
Консервации контур заполняется деаэрированной водой с pH = 9,5 4-
10,5. Деаэрацию осуществляют введением в среду гидразина.
265
Для поддержания заданного значения pH вводят аммиак Пои
хой» консервации контур заполняют инертным газом, напримео а?'
шейным азотом. Консервация предохраняет перлитную сталь от к
розии и снижает содержание продуктов коррозии в теплоносителе п°Р'
пуске реактора. ЛРИ
В деаэрированной среде I контура ВВЭР коррозия идет с водовод
ной деполяризацией. Часть выделяющегося водорода растворяете"
в стали. При температурах 550—570 К скорость диффузии водорода
перлитной стали столь велика, что водород не образует облаков Кот
трелла. В связи с этим нет опасности возникновения обратимой водо-
родной хрупкости. В порах, микрорыхлотах и другпих дефектах
атомы водорода соединяются в молекулы. Со времением давление мо-
лекулярного водорода в поре растет, что может вызвать разрушение
металла вследствие необратимой водородной хрупкости. Если поры
расположены близко к поверхности, то при наводороживании на по-
верхности металла образуются пузыри.
При температуре 290 К давление Н2 в поре может достигать
103 МПа, при 570 К —2,5 МПа. При Т = 570 К напряжение 2,5 МПа
не может повлиять на работоспособность корпуса ВВЭР. При резком
охлаждении в металле вокруг поры могут возникнуть напряжения,
превышающие предел прочности. При медленном охлаждении водород
будет успевать выйти из пор, и необратимая водородная хрупкость-не
наступит. Тем не менее возможность резкого увеличения давления во-
дорода в порах при быстром охлаждении необходимо учитывать при
оценке прочности корпуса и выборе скорости расхолаживания.
Облучение существенно не влияет на скорость коррозии сталей пер-
литного класса и соответственно на поступление водорода в металл
и развитие необратимой водородной хрупкости.
Во II контуре ВВЭР условия эксплуатации перлитных сталей близ-
ки к условиям, отвечающим кипящим реакторам. В нижней части
вертикальных парогенераторов могут скапливаться продукты корро-
зии. Это приводит к образованию на теплопередающих поверхностях
слоя железоокисных отложений. В порах этого слоя вследствие
«фитильного» эффекта возможно концентрирование щелочи до
pH = 11 ~ 12.
Гидроксил-ион может взаимодействовать с магнетитом, образуя
растворимые соединения — ферриты. При этом нарушается пассивное
состояние и может происходить разрушение сталей вследствие щелоч-
ной хрупкости.
Комплексонная обработка. Для создания защитной пленки приме-
няется обработка комплексонами — веществами, способными давать
комплексные растворимые соединения с железом, в частности трило-
ном. При наличии в среде комплексонов последние при температуре
360—390 К взаимодействуют с продуктами коррозии железа с обра-
зованием растворимых соединений. Поверхность перлитной стали при
этом очищается от продуктов коррозии, и условия для образования на
ней в дальнейшем защитных пленок улучшаются. При температуре
550 К комплексные соединения железа разлагаются с образованием на
поверхности стали слоя магнетита. Поскольку зерна магнетита обра-
266
зуются из материала, находящегося в воде, в защитной пленке не воз-
никает механических напряжений, нарушающих ее сплошность В тех
случаях, когда кристаллы магнетита образуются при взаимодействии
стали с водой, зерна магнетита как бы мешают росту друг друга что
приводит к возникновению напряжений в металле. 3 '
Вынос и отложение продуктов коррозии. Развитие корро онннх
процессов двояко отражается на надежности работы ядерных реакто-
ров. Вследствие общей и местной коррозии происходит у геньшение
толщины изделий из перлитной стали. Кроме того, часть продуктов
коррозии переходит в теплоноситель. Отложение продуктов коррозии
на твэлах может привести к их перегреву и выходу из строя. Отложе-
ние продуктов коррозии на теплопроводящих поверхностях, например
теплообменников и парогенераторов, снижает мощность установки.
Отложение продуктов коррозии в контуре ухушает радиационную об-
становку. Наиболее активными являются продукты коррозии, обра-
зовавшиеся из материалов, подвергающихся нейтронному облучению.
Меньший вклад в активность вносят продукты коррозии, образовав-
шиеся вне активной зоны и активирующиеся во время прохождения
теплоносителя через поле облучения. В случае перлитной стали можно
принять, что 50% всего прокорродировавшего металла переводит в во-
ду, а 50% остается на поверхности стали в виде окисной защитной
пленки. С увеличением скорости движения среды и концентрации ю с-
лорода, а также при снижении pH доля продуктов коррозии, пер хо-
дящих в воду, возрастает. Соответственно деаэрация и увеличение
pH снижают выход продуктов коррозии. Продукты коррозии в воде
могут находиться в истинно растворенной — ионной — форме, в виде
коллоидных частиц размером <0,1 мкм и в виде взвешенных частиц
размером >0,1 мкм. Подавляющая часть продуктов коррозии на-
ходится в воде в виде частиц размером > 1 мкм. При температуре
520—570 К в деаэрированной воде продукты коррозии присутствуют
в виде магнетита. При наличии в воде кислорода в продуктах коррози f
присутствует гематит. Продукты низкотемпературной коррозии в сре-
де, содержащей кислород, состоят из окислов и гидроокислов.
При использовании в ядерных энергетических установках статей
перлитного класса необходимо предъявлять определенные требования
к качеству теплоносителя.
Требования к качеству воды I контура ВВР при аммиачном вод-
ном режиме. Для уменьшения скорости коррозии и выноса продуктов
коррозии перлитных сталей концентрация в воде хлорид-, сульфат-,
фторид-ионов должна быть не более 0,02 мг/кг каждого. Концентра-
ция кислорода должна быть менее 0,02 мг/кг. В контуре, заполненном
водой, содержащей гидроокись аммония, за счет радиационного разло-
жения последнего накапливается водород в количестве 5 50 н. см кг.
Этого количества водорода достаточно для того, чтобы подавить ра-
диолиз и тем самым предотвратить поступление кислорода в контур.
Радиолиз может быть интенсифицирован кислородом, пр сугст-
вующим в воде заполнения. Поэтому I контур должен заполняться
Деаэрированной водой. Часть кислорода, который может попасть в
267
воду при транспортировании ее или из оставшегося в контуре Boanv
необходимо связать гидразином. духа,
Для снижения скорости коррозии и выноса продуктов корпоз
перлитных сталей значение pH в I контуре должно поддерживаться и”
уровне 10—10,5 введением в воду гидроокиси аммония, которая я/
ляется донором водорода, необходимого для подавления радиолиза'
В ряде случаев в I контур ВВР для «мягкого» регулирования
вводят борную кислоту. При этом добавление в воду только гидро-
окиси аммония не дает возможности поддерживать значение pH, обес-
печивающее высокую стойкость сталей перлитного класса. Для уве-
личения pH среды в воду I контура добавляют гидроокись лития или
гидроокись калия.
Концентрация нелетучей щелочи зависит от содержания в воде
борной кислоты, но она не должна превышать 10“4—10-8 н. При бо-
лее высоких концентрациях нелетучей щелочи создается опасность
разрушения изделий, изготовленных из перлитных и нержавеющих
сталей, вследствие щелочной хрупкости.
Нелетучую щелочь можно ввести лишь в том случае, когда в I кон-
туре исключены условия для концентрирования примесей теплоноси-
теля. В случае введения в воду борной кислоты для изготовления
узлов I контура следует применять не углеродистые, а низколегиро-
ванные стали. В этих условиях вынос продуктов коррозии С низколе-
гированных сталей существенно ниже, чем с углеродистых сталей.
Требования к качеству воды П контура ВВР. Концентрация кис-
лорода в воде II контура не должна превышать 0,02 мг/кг. При бес-
коррекционном водном режиме электропроводность питательной воды
должна быть не выше 0,1 мкСм/см. При аммиачном водном режиме и на-
личии в контуре сплавов меди pH должен быть равен 9,3—9,6. При-
сутствие нелетучей щелочи исключается. Допустимое содержание хло-
ридов, сульфатов, фторидов, нитратов в циркуляционной воде зависит
от конструкции парогенератора и, в частности, от давления. Содержа-
ние этих веществ в воде, контактирующей с изготовленными из пер-
литных сталей узлами, на поверхности которых примеси не концентри-
руются, не должно превышать 0,1 мг/кг для’каждого иона.
Требования к качеству воды кипящих реакторов. Высокая корро-
зионная стойкость перлитных сталей в конденсатно-питательном трак-
те обеспечивается при следующем качестве воды:
Удельная электропроводность, мкСм/см <0,1
Концентрация хлоридов, фторидов, сульфат-иона (каждо- -<0,02
го), мг/кг
Концентрация кислорода, мг/кг -<0.02
Контур многократной принудительной циркуляции. Парообразова-
ние увеличивает содержание примесей в воде КМПЦ. Поэтому в цир-
куляционной воде содержание хлорид-, фторид-, сульфатов-ионов
выше, чем в конденсатно-питательном тракте. Снижение концентрации
их до 0,02 мг/кг увеличением продувки и интенсификацией внутрикон-
турной очистки экономически нецелесообразно. В связи с этим при-
ходится идти на некоторое увеличение содержания примесей в вод >
268
а следовательно и на определенное повышение скорости коррозии
перлитных сталей. При этом концентрация хлорид-, фторид- сулыЬат
ионов не должна превышать 0,1 мг/кг каждого ’ у
Содержание кислорода в циркуляционной воде должно нормиоо-
ваться в периоды пуска, останова и, естественно, на стоянках Еше паз
следует отметить, что высокая коррозионная стойкость перлитньГх ста-
лей в условиях работы КМПЦ может быть обеспечена лишь при ctdo
гом соблюдении водно-технологического режима выхода на мощность
расхолаживания, а также в результате принятия мер по консервации
оборудования на стоянках. н
Стойкость перлитных сталей в КМПЦ может быть увеличена при-
менением различных способов пассивации (обработка комплексонами
и т. д.), в результате чего на поверхности стали создается защитная
окисная пленка.
Изделия из перлитных сталей при хранении их до монтажа также
необходимо консервировать для предотвращения развития атмосфер-
ной коррозии. Методика консервации должна быть максимально про-
стой, экономичной и позволять быстро и надежно проводить раскон-
сервацию изделий перед их монтажом. Наиболее целесообразно ис-
пользовать при консервации летучие ингибиторы (дициклогексиламин
и др.), бумагу, пропитанную летучими ингибиторами. Законсервиро-
ванные летучими ингибиторами или ингибированной бумагой изделия
упаковывают в чехлы из полиэтилена для предотвращения испарения
ингибитора и помещают в деревянные ящики. Естественно, что перед
консервацией поверхность изделий из перлитной стали тщательно
очищают от продуктов коррозии и загрязнений.
Для консервации перлитных сталей в период хранения можно
применять легко снимаемые покрытия (ЛСП). Такие покрытия предо-
храняют металл от атмосферной коррозии и легко удаляются механи-
чески перед монтажом. ЛСП состоят из хлорвиниловой эмали ХВ-114
с 10% присадки акор.
В ряде случаев для защиты от коррозии перлитных сталей приме-
няют металлические и неметаллические покрытия. Металлические по-
крытия наносят методом металлизации, химическим и электрохими-
ческим способами. Толщина металлических покрытий 0,1 0,2 мм.
Максимально допустимая температура воды для разных металлических
покрытий различна:
Zn—313ЧК
Cd—353 К
Си—Ni—Сг—603 К
(комбинированное)
А1—373в К
Ni (химический) — 473 К
Для защиты перлитных сталей от газовой коррозии в каналь ы-
реакторах применяют алюминиевые покрытия, нанесенные горя
способом или металлизацией. В случае применения лакокрасочны п
крытий следует иметь в виду, что эти покрытия необходимо в
лять через 3—5 лет. Для защиты перлитных сталей в воде при темпе-
ратуре до 343 К применяют эпоксидные эмали, при температур д
377 К — эмаль ВЛ-515. В паровоздушной среде при атмосферном дав-
269
лении до температуры 573 К может быть применена эмаль на маслин
глифталевой основе АЛ-70, до температуры 623 К — органосиликэт
ное покрытие АС-8А. Все упомянутые покрытия стойки под облуче
нием флюенсом нейтронов, не превышающем 1020 см-2. Защитные свой
ства лакокрасочных покрытий улучшаются, если их наносить не по
стали, а по алюминиевому металлизационному покрытию. Следует за-
метить, что высокое качество всех покрытий достигается при хорошей
очистке защищаемой поверхности, а лакокрасочных покрытий —- еще
и при правильном режиме сушки.
Одной из причин внедрения в реакторостроение перлитных сталей
является их более низкая стоимость по сравнению с нержавеющими ста-
лями и освоенность промышленностью.
При этом, однако, следует заметить, что перлитные стали должны
быть газоплотными, т. е. не иметь микропор и быть непроницаемыми
для газов. В обычной энергетике такие требования к стали не предъяв-
ляют, так как утечки пара в микроколичествах не отражаются на
эксплуатации обычного энергетического оборудования. В ядерной
энергетике даже микроскопические утечки активного газа и пара мо-
гут серьезно ухудшить радиационную обстановку и затруднить экс-
плуатацию оборудования. Получение газоплотной перлитной стали
и особенно контроль на плотность существенно удорожают сталь.
В связи с этим применение перлитной стали в ядерной энергетике,
когда это не вызвано особыми обстоятельствами, должно сопровож-
даться детальным экономическим анализом. В настоящее время стои-
мость перлитных сталей в 3—7 раз ниже стоимости аустенитных хромо-
никелевых нержавеющих сталей.
§ 9.2. ХРОМИСТЫЕ НЕРЖАВЕЮЩИЕ СТАЛИ
В ряде узлов ЯЭУ от материалов требуется не только высокая
коррозионная стойкость, но и повышенные прочностные характери-
стики. Так, валы насосов, выполненных в комплексе с закрытыми элек-
тродвигателями, изготовляют из стали 14XI7H2. В местах подшип-
никовых опор на вал обычно надевают втулку, которая должна обла-
дать высокой твердостью (HRC45—HRC60). Втулки изготовляют из
закаленных хромистых сталей 95X18, 14Х17Н2. В механизмах управле-
ния, работающих в воде, для таких деталей, как шестерни, валы, на-
правляющие штоки и др., используют нержавеющие стали типа 12X13,
14Х17Н2. Хромистые стали используют также для изготовления кре-
пежа, пружинных элементов.
Состав и структура. Высокая коррозионная стойкость сталей до-
стигается легированием хромом. Диаграмма состояния системы Fe—Cr
представлена на рис. 9.8. Железо с хромом образует ряд непрерывных
твердых растворов. В области замкнутой петли аустенит устойчив,
в промежуточной области сосуществуют аустенит и феррит. За преде-
лами петли устойчив только феррит. Форма и границы петли в значи-
тельной степени зависят от присутствия в стали еще и других элемен-
тов, например углерода, никеля. Если содержание Хрома не превиша
270
значений, соответствующих границе аустенитной петли, то сталь пои-
надлежит к мартенситному классу и может быть закалена. Пои бы-
стром охлаждении от температуры, отвечающей аустенитной области
происходит фазовое превращение и при комнатной температуре Фик-
сируется мартенсит. Если содержание хрома выше, чем это соответст-
вует границе петли аустенита, то сталь не претерпевает у-а-превоа-
щения и принадлежит к ферритному классу. При содержании хрома
отвечающем промежуточной области (аустенит + феррит) сталь при-
надлежит к ферритно-мартенситному классу. ’ F
Рис. 9.8. Диаграмма состояния Fe —Сг
Применяют три типа хромистых нержавеющих сталей: с 12, 17 и
27% Сг. Стали с 12%Сг в зависимости от требуемых механических ха-
рактеристик имеют различное содержание углерода (от 0,1 до 0,4%).
Стали с 17—18 и 25—28%Сг имеют иногда небольшие добавки титана
и никеля, которые вводятся для измельчения зерна, а никель еще и для
улучшения механических характеристик. Состав хромистых нержавею-
щих сталей, применяемых в промышленности, приведен в табл. 9.7.
В зависимости от содержания углерода хромистые стали с 12—14 о
Могут относиться к разным структурным -классам (см. табл. 9.7). Сталь
08X13 может являться чисто ферритной (при содержании углерода ме-
нее 0,08% и хрома на верхнем пределе) и ферритно-мартенситнои (при
среднем содержании хрома и углерода).Углерод является аустенито-
образующим элементом, расширяющим у-область, а хром феррито-
образующим, уменьшающим у-область. При минимальном содержании
Углерода и максимальном содержании хрома у-область уменьшается,
н в этом случае сталь марки 08X13 отвечает составу, лежащему вне
аустенитной области, т. е. является чисто ферритной сталью и не испы-
271
Состав хромистых нержавеющих сталей (ГОСТ 5632—72)
а б л и ц а g 7
Класс Тип Марка Массовое содержание легИрующих“^еМе^Г~Г
С Сг Ni Ti * /о
Мп Si
Ф 13% Сг 08X13 <0,08 11—13 <0,6 <0,6 <0,6 <0,6 <0,6 <0,6 <0,7 <0,7 <0,6
М —ф 12X13 0,09—0,15 12—14
м 20X13 0,16—0,24 12—14 <0,6
м 30X13 0,25—0,34 12—14 <0,6
м 40X13 0,35—0,44 12-14 <0,6
Ф—м ф 17% Сг 12X14 12X17 <0,15 <0,1 13—; 5 16—18 — <0,6 <0,6 <0,8 <0,8
ф 08Х17Т <0,08 16—18 — 50/0 с-
14Х17Н2 0,8
м 0,11-0,17 16—18 1,5—2,5 <0,8 <0,8 <1,0
ф 254- 15Х25Т <0,15 24-27 —— 5% C- <0^8
28% Сг 0,8
ф 15X28 <0,15 27—30 — <0,8 <1,0
Примечание. Ф — феррит, М— мартенсит.
тывает фазового превращения. При средних содержаниях углерода
и хрома состав стали отвечает области у—a-диаграммы, приведенной
на рис. 9.8. В этом случае зерна аустенита будут претерпевать фазовое
превращение, а феррита — естественно, нет, т. е. превращение будет
осуществляться не полностью.
Состав стали 12X13 при минимальном содержании хрома (12%) и
максимальном содержании углерода (0,15%) будет лежать в пределах
у-области и сталь будет испытывать протекающее полностью превраще-
ние у -> а, а при охлаждении из у-области на воздухе будет закаливать-
ся на мартенсит. Указанные факторы делают сталь марки 12X13 весь-
ма нестабильной по свойствам.Небольшие отклонения в пределах ма-
рочного состава резко изменяют структуру стали от мартенситной до
ферритной. Сталь 12X14 ферритная, но при максимальном содержании
углерода она становится ферритно-мартенситной. Стали 20X13,30X13,
40X13 принадлежат к мартенситному классу, а стали 12X17 и 15Х
(25—28) — к ферритному.
В соответствии с изложенным выше после закалки или охлаждения
на воздухе от температуры 1173—1373 К стали имеют следующую
структуру: 08X13 и 12X13 — феррит и мартенсит в разных соотноше-
ниях; 20X13, 30X13, 40X13 —мартенсит;' 12X17, 15Х25Т, 15X28-
феррит.
Физические и механические свойства. Твердость и прочность ста-
лей после закалки зависят от содержания в них углерода. При содер-
жании 13% Сг сталь с 0,01% С не упрочняется при закалке,так как
в ней невозможно фазовое превращение. Стали с промежуточным со-
держанием углерода упрочняются при закалке в меньшей степени,
чем сталь с 0,35% С.
172
„ . „ Таблица 9.8
Режимы термической обработки и механические свойства хромистых
нержавеющих сталей риминых
Марка Температура, К Механшеские свойства
закал- ки отпус- ка HRC ств- МПа %,2- МПа в. % % ак* Дж/сма
12X13 1273 973 600 400 20 60 50 90 60
20X13 1323 973 — 850 650 10
30X13 1323 523 40 1600 1300
40X13 1323 473 50
12X17, 08Х17Т 1323 1023 — 450 300 15-25 40—50 ап
14Х17Н2 1323 573 1100 900 10 35 СП
15Х25Т, 15X28 1323 1023 — 450 300 20 45 DU
25Х17Н2 1323 — 45 1540 1300 10
25Х17Н2 1323 573 28 740 630 20 — —
После закалки стали становятся менее пластичными. Чтобы полу-
чить оптимальные прочностные и пластические свойства, после закал-
ки стали подвергают отпуску. Чем ниже температура отпуска, тем
тверже и прочнее сталь. Режимы термической обработки хромистых
нержавеющих сталей и получаемые при этом механические характери-
стики приведены в табл. 9.8.
Стали типа Х13 являются распространенными и наиболее дешевы-
ми нержавеющими сталями. Стали с низким содержанием углерода
08X13, 12X13, 20X13 пластичны, из них хорошо штампуются детали.
Стали ЗОХ13, 40Х13 обладают высокой твердостью и повышенной проч-
ностью. Из них изготовляют детали, от которых требуются повышен-
ная прочность и износоустойчивость.
Стали с 17% Сг обладают более высокой коррозионной стойкостью.
Их можно применять и как жаростойкие (окалиностойкие), так же как
и стали с 25—28% Сг. Большим недостатком этих сталей ферритного
класса является то, что возникающая при перегреве, например при
сварке, крупнозернистость не может быть устранена термической обра-
боткой, так как в этих сталях отсутствуют фазовые превращения. Круп-
нозернистость обусловливает повышенную хрупкость сталей. Рост зер-
на несколько сдерживается при добавке в них титана и азота. Карби-
ды и нитриды титана, находящиеся по границам зерен, препятствуют
росту зерна.
Явление охрупчивания наблюдается в сталях с 17% Сг и при мелко-
зернистой структуре .после длительных выдержек при температуре
723—973 К (т. е. ниже температурного порога роста зерна) в резуль-
тате значительного выделения карбидов по границам зерен при 773 К
или образования хрупкой 6-фазы при 973 К- Присадка никеля к ста-
лям с 17% Сг и повышение в них содержания углерода расширяют
Y-область и приводят к фазовому превращению у —> а. Однако подоб-
ное превращение в этой стали проходит не до конца, но тем не менее
273
это дает заметное упрочнение. В группе сталей с 17% Сг сталь 14X1 тил
является высокопрочной (см. табл. 9.8) и применяется там гле 2
буется повышенная прочность при коррозионных свойствах пп *
щих сталям с 17% Сг. Еще более высокой прочностью облапает ™ ‘
25X17Н2. задает сталь
Физические свойства хромистых нержавеющих сталей, содержащих
13—28 % Сг.
Плотность, г/см3 7 7_- g
Коэффициент теплового расширения при 293—673 К, ’ ’
гРад-1 ’(11—11 8Ь10-в
Теплопроводность при 373—573 К, Вт/(м-К) 26—30
Сечение поглощения тепловых нейтронов, м2 2 7-Ю-28
Мартенситные и ферритно-мартенситные хромистые стали, в ко-
торых происходит фазовое превращение аустенита в феррит, склонны
к воздушной закалке при нагревах во время производственных опера-
ций и при сварке, что резко снижает их пластичность. Хромистые ста-
ли свариваются труднее, чем низколегированные или хромоникеле-
вые стали. Лучше свариваются хромистые стали с более низким содер-
жанием углерода и хрома, т. е. стали типа Х13 и, в частности, сталь
12X13. Сталь 12X17 с более низким содержанием углерода по сравне-
нию со сталью 95X18 сваривается лучше. Не рекомендуется сваривать
хромистые стали с содержанием углерода более 0,12%.
Сварочная проволока применяется из того же материала или из
аустенитной хромоникелевой нержавеющей стали. Вследствие за-
калки при охлаждении на воздухе сталей мартенситного или ферритно-
мартенситного класса имеет место охрупчивание в сварном шве и
в смежных зонах. Поэтому рекомендуется отпуск сварного изделия
при температуре 1023—1073 К в течение 1 ч с последующим мед-
ленным охлаждением.
В высокохромистых сталях ферритного класса при сварке может
иметь место рост зерна, а также появление высокотемпературной хруп-
кости вследствие образования о-фазы.
Для сталей типа Х13, имеющих несколько повышенную вязкость,
наблюдается наволакивание металла на режущий инструмент. При-
садки серы и молибдена улучшают резание этих сталей.
Хромистые стали в отожженном состоянии удовлетворительно
подвергаются обработке давлением: прокатке, штамповке. Мелкозер-
нистые стали с содержанием хрома 17—27% хорошо обрабатываются
давлением. Особенно хорошо обрабатываются хромистые стали давле-
нием при подогреве до 423—473 К.
Радиационная стойкость. Облучение увеличивает прочность и сни-
жает пластичность хромистых нержавеющих сталей. Так, механические
свойства отожженной стали 12Х12МС (12% Сг, 1% Мо и 1% Si)
облучения флюенсом нейтронов 1021 см-2 при температуре 723—773 К
изменились следующим образом: предел прочности с 665 до 800 МПа,
предел текучести с 435 до 620 МПа и относительное удлинение с 2»
До 16%. Аналогично изменяются при облучении в области температу-
ры 773—873 К свойства сталей 20X13 и 14Х17Н2. В то же время свои-
274
ства стали 1X17 с ниобием, не претерпевающей структурных превра-
щений, после облучения остаются практически неизменными
Коррозионная стойкость. Коррозионная стойкость хромистых ста-
лей непосредственно связана со способностью их пассивироваться.
Хром, находящийся в твердом растворе, облегчает пассивацию железа.
Так, при pH, равном нулю, фляде-потенциал железа равен 0 58 В
Легирование железа хромом в количестве 17% сдвигает фляде-потенци-
ал в отрицательную сторону до 0,06 В, т. е. пассивация облегчается
так как происходит при более отрицательных потенциалах. Хромистые
нержавеющие стали пассивируются при стационарном потенциале
в окислительных средах.
В сталях с содержанием хрома 11,8%, 1/8 всех атомов в кристал-
лической решетке приходится на долю хрома. Тамманом был сформу-
лирован закон «1/8», который определяет первую границу устойчиво-
сти. Действительно, резкое снижение скорости коррозии сплавов Fe—Сг
в ряде сред наступает при концентрации хрома 12%. При содержании
хрома 24%, что соответствует 2/8 атомным долям хрома в сплаве, по-
является вторая граница устойчивости, при 36% Сг, т. е. приблизи-
тельно при 3/8 атомных долях, появляется граница устойчивости да-
же к таким активным средам, как смесь серной и соляной кислот.
При наличии углерода в стали часть хрома связывается в карбиды
и содержание его в твердом растворе снижается. В связи с этим умень-
шается и коррозионная стойкость стали. В закаленном состоянии,
когда весь хром находится в твердом растворе, высокохромистые ста-
ли с повышенным содержанием углерода более стойки, чем в отожжен-
ном состоянии, когда часть хрома связана в карбиды.
В деаэрированной воде с содержанием хлоридов менее 0,1 мг/л
хромистые нержавеющие стали при стационарном потенциале находят-
ся в пассивном состоянии и близки по стойкости к аустенитным хромо-
никелевым нержавеющим сталям. В присутствии кислорода и хлоридов
стойкость хромистых нержавеющих сталей существенно снижается.
Коррозия становится язвенной. Хлориды существенно уменьшают
пассивную область хромистых нержавеющих сталей. Последнее об-
стоятельство связано с тем, что при наличии кислорода стационарный
потенциал хромистых сталей в среде, содержащей хлориды, более
положителен, чем потенциал пробоя.
С увеличением содержания хрома в стали потенциал пробоя сме-
щается в область положительных значений. В связи с^этим стали с со-
держанием хрома 25—28% менее склонны к язвенной коррозии. Вы-
сокое содержание углерода, например 1%, в стали 95X18«интенсифи-
цирует язвенную коррозию. В речной воде, насыщенной воздухом,
хромистые стали подвержены щелевой коррозии. Высокое качество
обработки поверхности повышает стойкость хромистых сталей. Кон-
такт со сталью 08Х18Н10Т, наличие щелей увеличивают коррозию
хромистых сталей. В этом случае продукты коррозии могут затруднить
Движение сопряженных деталей.
Ферритные хромистые стали подвержены межкристаллитной кор-
розии. При температуре 1373—1473 К карбиды растворяются в Ф®Р*
Рите. При охлаждении карбиды выпадают по границам зерен. При
275
этом границы зерен обедняются хромом и становятся менее устойчи
ми. Медленное охлаждение или длительный нагрев при темпепят?''
823—973 К способствует коагуляции карбидов и выравниванию ко?
центрации хрома по границам зерен вследствие диффузии его из гл”'
бины зерна. Для предотвращения межкристаллитной коррозии не*
ржавеющие хромистые стали либо подвергают стабилизирующему от
жигу, либо стабилизируют титаном. Отношение титана к углероду
должно составлять 8:1. и
В паровоздушной среде хромистые стали, особенно мартенситного
класса, подвержены коррозии под напряжением. В отличие от аусте-
нитных нержавеющих сталей катодная поляризация интенсифицирует
коррозионное растрескивание хромистых сталей. Это связывают с на-
водороживанием сталей.
Рассмотрим, как указанное обстоятельство может влиять на кор-
розию под напряжением. В хромистых сталях с ОЦК-решеткой попе-
речное скольжение дислокаций облегчено по сравнению с ГЦК-решет-
кой. В связи с этим в хромистых сталях менее вероятно скопление
дислокаций и зарождение трещин. Водород способствует образованию
вблизи дислокаций облаков Коттрелла, которые тормозят движение
дислокаций и приводят к их скоплению и зарождению трещин. Кро-
ме того, водород, внедряясь в кристаллическую решетку, деформирует
ее, вызывая локальные напряжения. В сумме с остаточными напряже-
ниями в закаленной стали эти напряжения являются причиной разви-
тия трещин. Снятие внутренних напряжений при отпуске увеличи-
вает стойкость хромистых сталей к коррозионному растрескиванию.
Лучше всего снимает напряжения отпуск с высокой температуры,
в меньшей степени напряжения снимает низкотемпературный отпуск.
§ 9.3. МЕДНЫЕ СПЛАВЫ
Состав и структура. В теплообменной аппаратуре, в конденсаторах
турбин, подогревателях низкого давления применяют трубы из мед-
ных сплавов. Существенное значение имеет их высокая теплопровод-
ность. При охлаждении конденсаторов морской водой медные сплавы
не подвергаются обрастанию морскими организмами, поскольку со-
единения меди токсичны для них. Наибольшее распространение в ка-
честве материалов для конденсаторов имеют латуни и медноникелевые
сплавы. К отрицательным последствиям применения медных сплавов
следует отнести опасность образования медьсодержащих накипей на
теплопередающих поверхностях с высокими удельными тепловыми по-
токами, например на поверхностях твэлов, и загрязнения теплоноси-
теля и оборудования радионуклидами цинка, являющимися продук-
тами коррозии латуней. Состав ряда медных сплавов представлен
в табл. 9.9 и 9.10. Медь можно применять также в качестве мате-
риала для прокладок.
Цинк образует с медью ряд твердых растворов. Богатая медью
a-фаза (с содержанием цинка <30%) представляет собой твердый
раствор с ГЦК-решеткой. Параметры решетки зависят от концент-
276
Химический состав материалов конденсаторных труб
Таблица 9.9
Массовое содержание. %
Материал Си РЬ Fe Sb Bi р Zn Sn Мт с Si Ni + Co
Латунь Л 68 67—70 <0,03 <0,1 <0,005 <0,002 <0,01 Осталь-
Латунь Л070-1 ное
69—71 ’ <0,07 <0,1 <0,005 <0,002 <0,01 1—1,5
Мельхиор <0,005 0,6—1
МН70-30 Осталь- ное — — — 0,8—1,3 <0,05 -'0,15 29—33
МНЖ5-1 <0,005 1—1,4 — — — 0,5 — 0,3—0,8 <3,03 — 5->,5
Таблица 9.10
Химический состав и механические свойства труб из латуни с добавкой мышьяка
Материал Массовое содержание, % Механические свойства
Си Sn Al As РЬ ав . ' Bm1n МПа ®mtn’ %
Л68 + А 67—70 0,04—0,08 0,03 3,0 38
Л070-1 + А 69—71 1—1,5 — 0,04—0,08 0,07 3,0 38
ЛА77-2+А 76—79 — 1,75—2,5 0,04—0,08 0,07 3,8 23
Примечания: 1. Во всех марках латуни содержится 0,1% Fe; 0,02 % Bi? 0,005 %
Sb —всего 0,3 %.
2. Термическая обработка — отжиг.
рации цинка. Латуни, приведенные в табл 9.8, имеют структуру
a-твердого раствора. В пределах a-твердого раствора пластичность
сплавов возрастает с увеличением содержания цинка.
Структуру a-твердого раствора имеют также медноникелевоцин-
Ковые сплавы с 5—35% Ni и 13—45% Zn, известные под названием ней-
зильбера, мельхиора. Мельхиором часто называют и сплав, не содержа-
щий цинка, а именно сплав 80% Си — 20% Ni. Теплопроводность
латуни высока— 1,09 Дж/(см2*с-град); коэффициент теплового рас-
ширения равен 18-10-6 град-1; плотность 8,4 г/см3.
Коррозионная стойкость. Общая коррозия медных сплавов приво-
дит к загрязнению теплоносителя продуктами коррозии меди, а мест-
ная — к нарушению плотности теплообменных аппаратов. В первом
случае возникает опасность образования медистых накипей на твэ-
лах (на одноконтурных АЭС), во втором случае — попадание воды,
охлаждающей конденсатор, в конденсатно-питательный тракт и за-
грязнения его.
Коррозия медных сплавов протекает по электрохимическому меха-
низму. Нормальный потенциал анодной реакции с образованием одно-
иалентного и двухвалентного ионов равен 0,526 и 0,356 В соответствен-
но. Стационарный потенциал меди имеет положительное значение с
довательно, процесс катодного выделения водорода на меди термоди "
мически невозможен. В связи с этим коррозия меди идет с килородн^
деполяризацией. Увеличение содержания кислорода и окислителей
интенсифицирует коррозию меди и медных сплавов. В деаэрированной
воде скорость общей коррозии латуни при температуре до 393 К. не
велика. При более высокой температуре медь в качестве прокладок
можно применять лишь в уплотнении типа «замок», чтобы ограничить
доступ к ней теплоносителя и вынос продуктов коррозии в контур.
В кипящих реакторах пар содержит значительное количество кис-
лорода. Контакт с кислородсодержащим паром вызывает общую кор-
розию трубчатки конденсатора, выполненной из медных сплавов.
Струи пара могут вызывать эрозию конденсаторных труб. В связи
с этим первые по ходу пара пучки конденсаторных труб изготовляют
из аустенитной нержавеющей стали.
В случае введения в контур аммиака для защиты от коррозии пер-
литных сталей или подавления радиолиза в кипящем реакторе разру-
шение медных сплавов интенсифицируется. Аммиак образует с медью
растворимые комплексы и препятствует образованию защитных сло-
ев. Если трубчатка конденсатора и подогреватели низкого давления
выполнены из медных сплавов, максимальное значение pH при введе-
нии аммиака не должно превышать 9,6. При более высоких значениях
pH’трубчатку теплообменной поверхности следует делать из аустенит-
ных нержавеющих сталей.
При охлаждении конденсатора пресной водой трубчатку делают из
латуней типа Л68, а при охлаждении морской водой более предпочти-
тельны коррозионно-стойкие сплавы типа МНЖ.
При скорости потока пара в конденсаторе более 2 м/с трубчатка
конденсатора подвергается струйной коррозии, связанной с эрозией
под действием струй пара. Борьба со струйной коррозией ведется пу-
тем создания оптимальных гидродинамических условий и легирова-
ния латуней максимально возможным количеством железа и никеля.
Более стойки к струйной коррозии «адмиралтейские» латуни, содержа-
щие 29% Zn и 1% Sn.
При охлаждении конденсаторов морской водой происходит разру-
шение латуней вследствие избирательного растворения цинка (обес-
цинкования). Атомы меди и цинка из твердого раствора в результате
анодного процесса переходят в коррозионную среду. Однако ионы ме-
ди высаживаются на поверхности латуни в виде рыхлых образований,
а ионы цинка остаются в растворе. При обесцинковании на поверх-
ности латунных труб может образоваться сплошной слой высадившей-
ся меди. В других случаях образуются язвы, заполненные рыхлой
медью. Этот вид коррозии приводит к сквозному разрушению трубок
конденсатора и крайне опасен. Введение в латунь 0,001—0,08% As
снижает обесцинкование. Предполагается, что мышьяк увеличивает
перенапряжение катодного процесса восстановлением меди. Латуни,
содержашие не менее 85% Си (томпак), не подвержены обесцинкова-
нию. Более стойки в морской воде мельхиор и купроникель (60 в
Си и 40% Ni).
278
§ <)Л. ТИТАН И ЕГО СПЛАВЫ
Многие благоприятные свойства титана прпаюл*
материалом для изготовления теплообменник"^ перспективным
торов и других узлов ЯЭУ. Он имеетмал^ю пп РХН°СТИ паР°генера-
ность и коррозионную стойкость. Физические Высокие ПР04'
дены в табл. 9.11. Теплопроводность титяня пп а ТИТана пРиве'
ниже, чем стали. С повышением темпеоатупыкпХМерН° 3 1’5~~2 Раза
ности не снижается, как у сталей a эФ$Ициенттеплопровод-
эффициент линейного расширения титана мрнК°ЛЬК° В03Растает» Ко-
тан - плохой проводник Хктрич ySSS ЧеМ У стали- Т«’
противление ел/в 5.5 раза бол?" К™
чем у меди. J п, и в ои раз больше,
Таблица 911
Физические свойства титана
Атомный номер
Относительная атомная масса
Сечение поглощения тепловых нейтронов, м2
Плотность, г/см3
Температура плавления, К
Температура кипения, К
Теплоемкость, Дж/(г-град)
Коэффициент линейного расширения, Град-1
Коэффициент теплопроводности, Дж/(с-см2-град)
Кристаллическая структура
Параметры кристаллической решетки, нм
22
47,9
5,6>10-гв'
4,5
1963
3908
0,5799
8,5-10-«
1,7154
а-Фаза, ГПУ до 1155 К
0-Фаза,
ОЦК при Т> 1155 К
а-Фаза, a = 0,29504,
с =0,46833
0-Фаза, а = 0,33065
Примеси кислорода, азота, углерода повышают прочностные ха-
рактеристики титана и уменьшают его пластичность. Водород сущест-
венно снижает ударную вязкость титана. Из-за высокого коэффициента
трения титан не рекомендуют для резьбовых соединений.
Технический титан при комнатной температуре обладает заметной
ползучестью. Для уменьшения ползучести сплавы титана легируют
Al, V, Zr, Мо в количестве нескольких процентов. По удельной проч-
ности (отношение предела прочности к плотности) сплавы титана пре-
восходят все известные технические сплавы. Поэтому сплавы титана
применяют для изготовления изделий, работающих при значительных
нагрузках и высокой температуре.
Сплавы титана технологичны. Они хорошо куются, штампуются,
прокатываются (только в горячем состоянии). Большинство сплавов
титана хорошо свариваются ар гонно-дуговой сваркой. Сварные шв
пластичны. При толщине металла более 3 мм сварные швы для снят
внутренних напряжений отжигают. Сплавы титана хорошо обрабаты-
ваются резанием. При длительном нагреве на воздухе при температур
выше 923 К на поверхности сплавов титана образуется тонкий хруп-
279
кии слой, снижающий пластичность. Наряду с процессом Окисление
идет процесс диффузии кислорода и азота в глубь металла. При это
под окалиной образуется хрупкий слой. Он снимается механической
обработкой или травлением, если механическая обработка изделий
из сплавов титана не предусмотрена. и
По стойкости в воде высокой чистоты при высокой температуре
сплавы титана превосходят аустенитные нержавеющие стали. Вынос
продуктов коррозии титана в теплоноситель пренебрежимо мал.
Сплавы титана не подвержены контактной, язвенной коррозии
и, что особенно существенно, коррозии под напряжением.
Исследования сплавов титана показывают, что длительная эксплу-
атация их в ядерных энергетических установках не вызывает насыще-
ния их водородом и охрупчивания. Благодаря этим свойствам сплавы
титана получают все более широкое применение для изготовления теп-
лообменного оборудования ЯЭУ.
ПРИЛОЖЕНИЕ /
Физические характеристики некоторых элементов
Физические константы различных элементов
Эле- мент гшг °c ГКИП’ °c p, г/см’ CP’ Дж/(кг-град) (Дж/(см-сХ Хград) a. IO-*, град-1 в* ем2 /с
н —259,4 —252,7 9- 10~s 14,435 18,200-Ю-4 ___ 1,40
О —218,8 — 183 1,43-10-3 0,921 25,94-IO-? —— 0,197
N —210 —195,8 1,25-10-3 1,046 25,52-Ю-6 — 0,195
Hg —38,7 357 13,55 0,138 0,105 261 0,056
к 64 760 0,86 0,745 1,339 83 2,09
Na 98 882 0,97 1,230 1,381 71 1,16
Li 180,5 1327 0,53 3,284 0,711 56 0,408
Sn 232 2270 7,3 0,230 0,669 23 0,398
Bi 271 1430 9,8 1,272 0,100 13,4 0,081
Cd 321 765 8,65 0,234 0,920 31,8 0,454
Pb 327,5 1750 11,34 0,126 0,347 29,3 0,244
Pu 639 3230 19,8 0,134 0,050 46,8 0,019
Mg 650 1120 1,73 1,046 1,715 27,0 0,948
Al * 660 2320 2,7 0,849 2,301 22,5 0,912
Cu 1083 2590 8,93 0,381 3,933 16,7 1,156
U 1133 3862 19,0 0,117 0,268 14,6 0,120
Mn 1245 2150 7,4 0,481 — 22,0 —
Be 1315 2450 1,8 1,883 1,883 11,4 0,555
Si 1410 2480 2,4 0,690 0,837 2,8—7,3 0,505
Ni 1452 2800 8,9 0,456 0,669 13,3 0,165
Co 1490 3330 8,9 0,435 0,711 12,2 0,184
Fe 1537 3030 7,86 0,446 0,962 12,3 0,276
Ti 1727 3530 4,5 0,565 0,155 8,4 0,061
Th 1730 4200 11,6 0,113 0,356 11,0 0,272
Zr 1850 4330 6,5 0,289 0,213 6,4 0,114
Cr 1880 2580 7,19 0,448 0,369 6,2 0,208
V 1900 2800 6,1 0,502 0,330 8,7 0,108
В 2030 2550 2,3 0,996 15,06.10-3 8,3 0,007
Hi 2230 5200 13,1 0,145 0,226 5,9 0.Н8
Mo 2590 5230 10,2 0,251 1,632 5,1 0,637
Nb 2480 4770 8,57 0,264 0,527 7,1 U, 233
Ta 2987 5530 16,6 0,138 0,628 6,3 0,274
W 3397 5930 19,3 0,134 1,674 4,4 0,649
C 3500 3900 2,3 0,690 0,251 0,6—4,3 0,158
(графит)
Примечание. Тщ—температура плавления; Гкип температура кипения, р плот
ность; Ср—удельная массовая теплоемкость; Л,—коэффициент теплопроводности, сс коэфф
ВДент линейного расширения; а—коэффициент температуропроводности.
Эффективные сечения поглощения тепловых (£±0,023 эВ) и быстрых
(£=65±20 кэВ) нейтронов
Элемент g, 10~28 м» Элемент a, lO-23^
Тепловые нейтроны Быстрые нейтроны Т епловые нейтроны Быстрые нейтроны
О с (графит) 2-10-5 4-Ю"3 0_,0±0,3 Сг и 2,9 3,51 3,5±1 о 302
Be 0,01 — Си 3,62 25 6,5±2,0 3,0±1,0 5,0± 1,0
Bi 0,032 4,0±3,0 Ni 4,6
Mg 0,063 2,1±0,7 V 4,98
Si Pb 0,13 0,17 2,0±0,7 1,0±2,0 Ti Th 5,6 7,45-
Zr 0,18 Ю,3±2,0 Мп 13,4 9,0±1,0 190
Al 0,23 2,8±0,7 W 19,2
H 0,332 —• Та 21,3 440
Na 0,53 0,7±0,3 Со 37 18
Sn 0,65 51 ±10 Li 71
Nb 1,1 135 Ри (М9Ри) 287
N 1,88 — Hf 105 330
К 1,97 4,0±1,0 Hg 380 103
Mo 2,5 69 В 755 —-
Fe 2,53 6,3±2,0 Cd 2550 183
ПРИЛОЖЕНИЕ II
Физические свойства некоторых сталей
Коэффициент теплопроводности А, Вт/(м-град)
Марка
Т, °C 10 1 20 | 22 К | 12ХМф| 15ХМФ 12Х1МФ 2оХ2МФА XI8H10T
100 57,0 50,7 49,5 50,2 44,5 41,3 42,0 16,3
200 52,9 48,6 47,7 50,2 41,3 40,8 41,5 17,5
300 — 46,1 45,5 50,2 40,2 40,3 41,1 18,8
400 44,8 42,4 43,5 48,6 39,0 39,7 38,5 21,4
500 — 39,0 41,5 47,0 36,1 39,0 —- 23,0
600 37,6 35,6 39,3 46,0 33,7 38,2 24,6
700 — — — 44,0 — 37,4 — 26,8
Модуль продольной упругости (Модуль Юнга) Е, 10s МПа
Т, °C Марка Т, °C Марка _
10; 20; 25 2 2К 12ХМ V 15ХМ Х18Н10Т 10; 20; 25 22К 12ХМ 15ХМ X18H10T
20 2,01 2,07 2,07 2,04 1,98 500 1,76 1,78 1,78 1.66 1 АГ
100 1,92 2,04 2,06 1,94 550 1,71 —- — 1 ,о> 1 £7
200 1,84 2,01 2,0 1,89 600 —. 1,62 1,7 1,69 J ,0/ 1 42
300 1,72 1,96 1,95 1,82 650 11 —— —- 1 47
400 1,63 1,87 1,89 1,89 ' 1,74 700 • —
282
Коэффициент линейного расширения а, 10~в град-1
Т, °C Марка " " 1
10 20 22К 12ХМ- 15ХМ 12Х1МФ 25Х2МФА Х18Н10Т
100 П,6 11,6 11,2 11,9 10,8 11 3 1А А
200 12,6 12,6 12,2 12,5 12,6 11,8 12 ,7 17 А
300 —— — 12,9 12,7 13,2 12,3 17 9
400 13,0 13,0 13,3 12,9 13,7 12,8 13,9 17 5
500 —‘ 14,0 13,2 14,0 13,2 17 0
600 14,6 14,6 13,8 13,5 14,3 13,6 14,4 18 2
700 — — — 13,8 — 13,8 18,6
Нормальное допускаемое, напряжение (Гдоп для некоторых сталей, применяемых
для изготовления змеевиков, корпусов, трубных досок и других деталей, МПа
Марка
Т, °C 10 20К 25 22К 15ГС 16НГМ
20 127,5 144,2 161,8 166,7 181,4 196,1
250 109,8 129,4 144,1 147,1 161,8 181,4
275 103,9 123,5 137,3 143,2 157,9 180,4
300 98,1 116,7 129,4 137,3 150,0 178,5
320 93,2 111,8 122,6 133,4 142,2 177,5
340 88,3 106,9 116,7 127,5 134,3 176,5
380 79,4 95,1 103,9 — 118,7
400 75,5 90,2 98,1 — 110,8 ч —
410 75,0 87,3 94,1 — 104,9 —
420 70,6 84,3 91,2 100,0 —
430 66,7 81,4 84,3 — 95,1 —
440 58,8 71,6 75,5 88,3
450 52,0 62,8 66,7 «а —. 81,4 —
470 41,2 48,0 51,0 — — ——
490 31,4 37,3 38,2 — —
500 29,4 33,3 33,3 — — •—
Продолжение
Т, °C Марка
12ХМ 15ХМ 12Х1МФ | 12Х2МФБ | Х17Н10Т
20 144,2 150,0 169,7 137,3 143,2
250 142 2 149,0 162,8 126,5 122,6
300 138,3 144,2 155,9 124,5 117,7
350 134,3 139,2 149,0 120,6 113,8
400 129,4 134,3 142,2 117,7 108,8
420 126,5 132,4 138,3 116,7 107,9
440 123,6 129,4 136,3 114,7 105,9
460 120,6 127,5 133,4 113,8 103,9
480 118,7 123,6 130,4 93,2 103,0
500 94,1 101,0 123,6 78,5 102,0
510 81,4 87,3 115,7 71,6 101,0
520 67,7 77,7 104,9 65,7 101,0
530 55,9 67,7 91,2 59,8 100,0
540 46,1 58,8 81,4 55,9 100,0
283
Продолжение
Г, °C - - Марка
12ХМ 15ХМ 12Х1МФ 12Х2МФБ Х17Н10Т
550 (33,3) 49,0 72,6 50,0 99,0
560 — 41,2 65,7 46,1 99,0
570 — (33,3) 58,8 42,2 95,1
580 —-* — 52,0 38,1 88,3
590 — (45,1) 35,3 79,4
600 — — (39,2) (32,3) 72,6
610 —. — — (29,4) 66,7
620 — — (26,5) 60,8
630 — — — (24,5) 55,9
640 — — — (20,6) 51,0
650 — — — (15,7) 47,1
660 — — — 44,1
670 — — — 40,2
680 —— „ • —- — 33,3
700 — — — — 29,4
СПИСОК ЛИТЕРАТУРЫ
К. главе I
1. Атомной энергетике — XX лет. М., Атомиздат, 1974.
К главе 3
1. Физическое металловедение. Пер. с англ. Под ред. Р. Кана. Т. 1—3 М
Мир, 1967. ‘ ‘ '*
2. Конобеевский С. Т. Действие облучения на материалы М., Атомиздат
1967. ’
3. Хоникомб Р. Пластическая деформация металлов. Пер. с англ М Мио
1972.
К главе 4
L Улыбин С. А. Теплоносители энергетических ядерных установок. М.—Л.,
Энергия, 1966.
2. Канаев А. Л., Копп И. 3. Судовые и стационарные жидкометаллические
энергетические установки. Л., Судостроение, 1968.
3. Никитин В. И. Физико-химические явления при воздействии жидких
металлов на твердые. М., Атомиздат, 1967.
4. Герасимов В. В., Касперович А. И., Мартынова О. И. Водный режим
атомных электростанций. М., Атомиздат, 1976.
К главе 5
1. Жук И. А. Курс коррозии и защиты металлов. М., Металлургия, 1976.
2. Бялобжесский А. В. Радиационная коррозия. М., Наука, 1967.
3. Дамаскин Б. Б., Петрий О. А. Введение в электрохимическую кинетику.
М., Высшая школа, 1975.
4. Герасимов В. В. Коррозия реакторных материалов. М., Атомиздат,
1980.
К главе 6
1. Своллоу А. Радиационная химия. Пер. с англ. М., Атомиздат, 1976.
К. главе 7
1. Займовский А. С., Калашников В. В., Головнин И. С. Тепловыделяющие
элементы атомных реакторов. Изд. 2-е. М., Атомиздат, 1967.
2. Котельников Р. Б., Башлыков С. Н., Каштанов А. И. и ДР-
пературное ядерное топливо. Под ред. Ю. Н. Сокурского н др. изд. - . ••
АТ° 3ИЗцаыканов8В. А., Давыдов Е. Ф. Радиационная стойкость тепловыделяю-
щих элементов ядерных реакторов. М., Атомиздат, 1972.
285
4. Сокурский Ю- Н., Стерлин Я. М., Федорченко В. А. Уран и его сплавы.
М.» Атомиздат, 1971.
5. Самойлов А. Г., Каштанов А. И., Волков В. С. Дисперсионные тепло-
выделяющие элементы ядерных реакторов. Изд. 2-е. М., Атомиздат, 1969.
К главам 8, 9
1. Конструкционные материалы ядерных реакторов. Т. 1. М., Атомиздат,
1972.
2. Гончаров В. В., Бурдаков Н. С., Виргильев Ю. С. и др. Действие об-
лучения на графит ядерных реакторов. М., Атомиздат, 1978.
3. Скорое Д. М., Бычков К). Ф., Дашковский А. И. Реакторное материало-
ведение. Изд. 2-е. М., Атомиздат, 1979.
ОГЛАВЛЕНИЕ
Предисловие ................................................... 3
Глава 1. Конструкционная схема ядерной энергетической установки 4
Глава 2. Требования, предъявляемые к реакторным материалам 13
§ 2.1. Общие требования........................................
§ 2.2. Требования, предъявляемые к материалам активной зоны 16
§ 2.3. Требования к материалам узлов, находящихся вне активной
зоны................................................. . ... . 19
§ 2.4. Материалы, применяемые в реакторостроении..............20
Глава 3. Прочность, совместимость и радиационная стойкость ре-
акторных материалов...............................................23
Гл
Г л
§3.1. Дефекты кристаллической решетки...................
§ 3.2. Жаропрочность и деформация металлов...............
§ 3.3. Совместимость реакторных материалов...............
§ 3.4. Радиационная стойкость конструкционных материалов
а в а 4. Теплоносители ядерных энергетических установок . .
§4.1. Жидкометаллические теплоносители..................
§ 4.2. Органические теплоносители .......................
§ 4.3. “
§ 4.4.
а в а
5.1.
5.2.
5.3.
5.4.
5.5.
§ 5.6.
§
Г л
Газовые теплоносители ..................................
Водный теплоноситель....................................
5. Коррозия реакторных материалов ......................
Классификация коррозионных процессов...................
Двойной электрический слой .............................
Кинетика катодных процессов ...........................
Кинетика анодных процессов ............................
Местная коррозия .......................................
Влияние различных факторов на коррозию реакторных мате-
риалов .................................................
Влияние облучения на коррозионные процессы..............
6. Радиолиз воды........................................
23
36
44
49
60
60
74
75
87
101
101
103
108
113
121
Г л
§ 5.7.
а в а
§6.1. Характеристика излучения ядерного реактора . .
§ 6.2. Взаимодействие излучения с веществом.............
§ 6.3. Теория свободных радикалов ......................
§ 6.4. Радиолиз в ядерных реакторах.....................
а в а 7. Ядерно-горючие материалы.......................
7.1.
7.2.
7.3.
7.4.
7.5.
7.6.
7.7.
„ 7.8.
§ 7.9. Керамическое и дисперсионное ядер ное горючее . . .
§ 7.10. Тепловыделяющие элементы ядерных реакторов . .
I
§
§
§
§
§
§
Физико-механические свойства урана ....................
Радиационный рост урана ... ...........................
Газовое распухание................................’ ‘ ‘
Влияние облучения на механические характеристики ура
Сплавы урана . . *............................... ‘ ’
Совместимость урана с материалом оболочки и коррозия урана
Плутоний и его сплавы...................................
Торий и его сплавы ....................................
. 126
. 136
. 138
. 138
. 140
. 147
. 153
. 156
. 156
. 161
. 164
1 166
, 167
। 173
. 176
. 18J
181
191
2§7
Глава 8. Конструкционные материалы активной зоны . . .
§ 8.1. Бериллий...................................
§ 8.2. Графит.....................................
§ 8.3. Материалы регулирующих систем и защиты . . . .
? 8.4. Магний и его сплавы........................
8.5. Алюминий и его сплавы .....................
8.6. Цирконий и его сплавы......................
8.7. Аустенитные нержавеющие хромоникелевые стали .
§
200
200
203
211
216
219
230
239
энергетических установок........
§ 9.1. Перлитные стали...........
§ 9.2. Хромистые нержавеющие стали
§ 9.3. Медные сплавы ............
§ 9.4. Титан и его сплавы........
Приложения.........................»
Список литературы ...................
§
§
§
§ . . -------Vie..'!/! • . • ,
Глава 9. Материалы корпуса реактора и других элементов ядерных
эн<>Пгетич1*гки5с vrTfliinnnv
. 252
- 270
. 276
. 279
. 281
- 285
Валентин Владимирович Герасимов
Александр Семенович Монахов
МАТЕРИАЛЫ ЯДЕРНОЙ ТЕХНИКИ
Редактор Н. А. Петрунина
Переплет художника С. Н. Голубева
Технический редактор В. В. Хапаева
Корректор Г. А. Полонская
ИБ № 871
Сдано в набор 17.07.81. Подписано в печать 27.01.82. Т-05503. Формат 60X90' s.
Бумага типографская № 1. Гарнитура литературная. Печать высокая. Усл. печ. л. 18,0.
Уч.-изд. л. 21,24. Тираж 3800 экз. Заказ 369. Цена 95 коп.
Энергоиздат, 113114, Москва, М-114, Шлюзовая наб., 10 ______
Московская типография № 4 Союзполиграфпрома при Государственном комитете СССР о®**
лам издательств, полиграфии и книжной торговли, 129041, Москва, Б. Переяславская ул •