Author: Степин Б.Д. Цветков А.А.
Tags: неорганическая химия общая и неорганическая химия химия учебник для вузов издательство высшая школа
ISBN: 5-06-001740-0
Year: 1994
Similar
Text
Б.Д. СТЕПИН А. А. ЦВЕТКОВ
НЕОРГАНИЧЕСКАЯ
ХИМИЯ
ПОД РЕДАКЦИЕЙ ПРОФ. Б. Д. СТЕПИНА
Рекомендовано Государственным комитетом Российской Федерации по высшему образованию в качестве учебника для студентов химических и химико-технологических специальностей высших учебных заведений
МОСКВА
«ВЫСШАЯ ШКОЛА» 1994
ББК 24.1
С 79
УДК 546
Федеральная целевая программа книгоиздания России
Рецензенты: кафедра Пермского государственного технического университета (зав. кафедрой д-р хим. наук, проф. В. В. Вольхин); д-р хим. наук, проф. С. И. Дракин (Российский химико-технологический университет)
Степин Б. Д., Цветков А. А.
С 79 Неорганическая химия: Учеб, для хим. и химико-технол. спец, вузов. — М.: Высш, шк., 1994. — 608 с.: ил.
ISBN 5-06-001740-0
В книге изложены современные представления о строении вещества, природе химической связи, межмолекулярного взаимодействия. Рассмотрены общие закономерности протекания химических реакций. Дано описание методов получения и основных свойств простых веществ и их соединений в соответствии с положением в периодической системе Д. И. Менделеева и с привлечением структурных и термодинамических представлений.
(704000000—100
С 001(01)—94
119—94
ББК 24.1
540
ISBN 5-06-001740-0
© Б. Д. Степин, А. А. Цветков, 1994
ПРЕДИСЛОВИЕ
В настоящем, учебнике дано краткое изложение основ современной неорганической химии, позволяющее осветить разные аспекты предмета, а не рассмотреть его исчерпывающе.
Предлагаемый учебник является главным звеном учебного комплекса по курсу неорганической химии химико-технологических вузов и факультетов, подготовленного преподавателями кафедры неорганической химии Московской государственной академией тонкой химической технологии. В учебный комплекс входят: «Основы номенклатуры неорганических веществ» (Р. А. Лцдин, В. А. Молочко, Л. Л. Андреева, А. А. Цветков. М., Химия, 1983); «Применение международной системы физических величин в химии» (Б. Д. Степин. М., Высшая школа, 1990); «Задачи по неорганической химии» (Р. А. Лидин, В. А. Молочко, Л. Л. Андреева. М., Высшая школа, 1990); «Справочник по неорганической химии» (Р. А. Лидин, Л. Л. Андреева, В. А. Молочко. М., Химия, 1987). Поэтому в учебнике отсутствуют задачи, а упражнения приведены в ограниченном объеме, справочные данные и сведения о номенклатуре неорганических веществ также сокращены.
Учебный комплекс позволит студентам с точки зрения авторов более углубленно освоить основные законы химии, даст им возможность понять, что в основе химии лежат не только интуитивные обобщения, но и строгие расчеты, разовьет у студентов навыки работы со справочной литературой.
Теоретическим фундаментом современной неорганической химии является физическая химия, предварительное изучение которой в вузах позволяет наиболее полно разобраться в сущности неорганических реакций и свойствах получаемых веществ. Однако традиционно в вузах вначале изучают неорганическую химию или общую химию, а затем — физическую. Эта система временного расположения общехимических дисциплин сложилась в прошлом столетии в период их формирования, когда каждая фундаментальная дисциплина изучалась практически изолированно. Поэтому во всех учебниках по неорганической химии, изданных у нас в стране, первая и довольно значительная теоретическая часть представляет, по существу, изложение элементарной физической химии, дополненное некоторыми разделами из курса физики. Более того, из-за отсутствия у студентов 1-го курса нужной физико-математической подготовки некоторые важные закономерности неорганической химии подаются в учебниках в виде готовых положений и формул, без их вывода и строгого обоснования, что не должно вообще иметь места в высшей школе.
Естественно, авторы не могли избежать при написании учебника дублирования физической химии и физики, сохранилась и некоторая схематичность в изложении отдельных разделов учебника (часть I). Тем не менее были коренным образом пересмотрены содержание и методика рассмотрения таких важных разделов, как строение атомов, гидролиз, кислоты и основания, окислительно-восстановительные реакции, энергетика химических реакций.
В учебнике не рассматривается химия элементов всех групп периодической системы Д. И. Менделеева. Авторы считают, что с позиций про
3
блемного метода обучения более целесообразным является изложение только общей характеристики физико-химических свойств элементов некоторых групп, к которым были отнесены группы ШБ, VIIIA, лантаноиды и актиноиды.
Введена глава по международной системе единиц, применяемых в неорганической химии, где по-новому рассмотрены понятия эквивалента и эквивалентной концентрации. Можно надеяться, что эта глава позволит студентам прочно усвоить основные термины и единицы физических величин и правильно использовать их при решении задач.
В связи с бурным развитием химии неорганических веществ переменного состава, эволюцией наших представлений о дискретной форме химической организации вещества в учебник введена глава «Нестехиометрические соединения».
Неорганическая химия представляет собой неотъемлемую часть общечеловеческой культуры. В последние годы яснее стали осознавать, что появление все большего числа неорганических веществ в различных сферах народного хозяйства оказывает глубокое и опасное влияние на окружающую среду. Сейчас нельзя обойти вниманием характер и степень воздействия неорганических веществ на окружающий нас мир, на человека. Настало время научить себя и студентов раздумывать над принимаемыми инженерными и научными решениями. Поэтому появилась еще одна самостоятельная глава «Неорганическая химия и окружающая среда». Эти главы помещены в конце II части учебника и преподаватели могут сами решить вопрос о их включении в рабочую программу курса.
Часть III учебника служит для более глубокого самостоятельного изучения студентами отдельных глав учебника. Эта часть предназначена для студентов, проявляющих серьезный интерес к неорганической химии и стремящихся полнее раскрыть для себя связи химических реакций и свойств веществ с теоретическими принципами химии; при этом авторы учебника исходили из того, что студенты уже владеют основными знаниями по высшей математике и физике.
Для более глубокого и детального знакомства с рассматриваемыми вопросами приведены литературные источники. В частности, для получения сведений об индивидуальных химических соединениях, о химической терминологии рекомендуем чаще обращаться к «Химическому энциклопедическому словарю» (М., Советская энциклопедия, 1983) и «Химической энциклопедии», т. 1—5 (М., Советская энциклопедия, 1988—1992).
Авторы признательны д-ру хим. наук, проф. В. А. Михайлову и проф., канд. хим. наук Р. А. Лидину за советы по изложению отдельных разделов курса неорганической химии. В качестве приятного долга авторы выражают благодарность д-ру хим. наук, проф. В. В. Вольхину, д-ру хим. наук, проф. С. И. Дракину и коллективу кафедры общей и неорганической химии Пермского государственного технического университета за обстоятельный анализ материала рукописи, ценные замечания и методические рекомендации.
Авторы будут признательны за предложения и советы, направленные на улучшение учебника в отношении фактического материала, его объяснения и способа изложения.
Авторы
Часть первая
Все перемены, в натуре случающиеся, такого суть состояния, что сколько чего у одного тела отнимется, столько присовокупится к другому, так, ежели где убудет несколько материи, то умножится в другом месте.
М. В. Ломоносов, 1748 г.
ТЕОРЕТИЧЕСКИЕ основы НЕОРГАНИЧЕСКОЙ ХИМИИ
Михаил Васильевич Ломоносов (1711— 1765) — учеиый-эи-циклопедист, первооткрыватель закона сохранения материи и движения, концепции атомно-кинетического строения вещества. Он создал первую в России научную химическую лабораторию и основал новую науку — физическую химию. По его инициативе в 1755 г. был открыт Московский университет. Академия наук России получила свой смысл и бытие только благодаря Ломоносову. Он многое сделал дпя того, чтобы Академия стала действительно русским учреждением, а академики — природными россиянами. Ломоносов вдохнул также новую жизнь в русский язык, грамматику и поэзию. Он был женат на дочери немецкого пивовара Елизавете Цильх, семейная его жизнь протекала счастливо. Он имел двух дочерей и сына.
ГЛАВА 1. МЕЖДУНАРОДНАЯ СИСТЕМА ЕДИНИЦ ФИЗИЧЕСКИХ ВЕЛИЧИН, ПРИМЕНЯЕМАЯ В НЕОРГАНИЧЕСКОЙ ХИМИИ
Химическая форма движения материи исследуется и познается измерением физических свойств и физических величин, присущих каждому веществу. Физической величиной является, например, масса вещества, его плотность, температура плавления.
Физическая величина — свойство, индивидуальное в количест-I венном отношении для конкретного вещества, но и в то же время “ общее свойство для многих веществ.
Так, той или иной плотностью обладают разные вещества, но каждое из них имеет вполне определенную плотность, в частности, при 20 °C плотности таких металлов, как калий и золото, равны соответственно 0,86 и 19,3 г/см .
Из приведенного примера следует, что одна и та же физическая величина, как вполне определенное свойство, будет для разных веществ отличаться от себе подобной своим размером. Измерение любой величины связано с определением опытным путем отношения значения данной величины к соответствующей единице измерения.
Совокупность единиц физических величин принято называть системой единиц. Единицы физических величин, входящие в систему и условно принятые в качестве независимых друг от друга единиц, носят название основных единиц системы.
Все физические величины обозначают, как правило, с помощью одной буквы греческого или латинского алфавита, которая при необходимости может быть дополнена надстрочным и подстрочным индексами определенного значения. Например, Еа — потенциальная энергия, Ек — кинетическая энергия, S °(Т) — стандартное значение (индекс «о») энтропии при температуре Т.
Обозначения единиц, происходящих от имен собственных, начинаются с прописной буквы. Например, А — ампер, К — кельвин, Дж — джоуль. Единицы измерения, выражающие произведение двух других единиц, представляют знаком умножения, например Н»м, Дж«с. Единицы измерения, как частное от деления двух других единиц, могут быть представлены любым из способов: м/с, — или м»с \ Однако в одном выражении не должно быть более одного знака наклонной черты (/). Например, нельзя писать Дж/(моль/К), следует Дж/(моль*К) или Дж»К г<>моль *. В знаменателе произведение двух и более величин заключают в скобки.
Заряд иона указывают справа вверху у символа элемента или иона арабской цифрой: А13+, СО
Объединение в названии единицы двух и более приставок не допускается. Например, для обозначения 10-9 секунды, следует применять название наносекунда (нс), но не миллимикросекунда (ммкс),
6
или названием 10 3 г будет миллиграмм (мг), но не микрокилограмм (мккг), так как в названии единицы массы «килограмм» уже содержится приставка «кило». Поэтому для образования названий дольных единиц массы приставки следует присоединять только к слову грамм (табл. 1): микрограмм (мкг), миллиграмм (мг), пикограмм (пг).
Таблица 1. Приставки к единицам СИ для образования кратных и дольных единиц
Множитель Приставка Обозначение Множитель Приставка Обозначение
10-1 деци д 10 дека да
ю-2 санти С 102 гекто Г
10-3 милли м 103 кило к
10~ 6 микро мк 106 мега м
10“ 9 нано н 169 гига г
10“12 ПИКО п 1012 тера т
Приставки пишут слитно с наименованием основной единицы, к которой они присоединяются.
Слова «удельный» и «молярный» перед названием физической величины всегда означают соответственно «деленная на массу» и «деленная на количество вещества». Например, Vm “ V/m в — удельный объем, Vn (В) = V/n в — молярный объем вещества В, где т в и п в — соответственно масса и количество вещества В. Возбужденное электронное состояние обозначают верхним индексом * справа у символа элемента или молекулы: Be*, СО*, Р*.
Подробнее см.: Степин Б. Д Применение Международной системы единиц физических величин в химии. — М.: Высшая школа, 1990.
1.1. ДЛИНА
При определении размеров атомов, ионов, молекул, межатомных и межионных расстояний применяют доли метра: нанометр (нм), пикометр (пм) и внесистемную единицу ангстрем А, соотношения между которыми: 1нм » 10 У м, 1 пм = 10 12 м и 1 А - 10 1 м.
Соотношение 1 А - 100 пм является простым и поэтому легко переходить от одной единицы измерения длины к другой, подобно тому как переходят от метров к сантиметрам. Межатомные расстояния измеряются в пикометрах.
Перечень единиц физических величин, применяемых в химии, приведен в табл. 2.
Таблица 2. Основные единицы системы СИ, используемые в химии
Величина Название Символ Обозначение
Длина метр 1 м
Количество вещества МОЛЬ п моль
7
Продолжение табл. 2
Величина Название Символ Обозначение
Масса килограмм т КГ
Время секунда т с
Термодинамическая темпера- кельвин Т к
тура
Сила электрического тока ампер 1 А
Примечание. Называть п «числом молей» или Z «числом метров» неправильно, поскольку и, I и другие символы представляют собой обозначение величин, а не чисел.
1.2. КОЛИЧЕСТВО ВЕЩЕСТВА'
Любое вещество состоит из формульных (структурных или условных) единиц (ФЕ). Формульные единицы в химии — это реально существующие частицы, такие, как атомы (К, С, О), молекулы (НгО,. СОг), катионы (К+, Са2+), анионы (Г, СоЗ~), радикалы (ОН, NO2), условные молекулы (КОН, BeSO4) и любые
другие частицы вещества или определенные группы таких частиц.
Количество вещества ив — физическая величина, пропорциональная числу формульных единиц этого вещества (Афе); ив=
А^
-jy— , где Na — постоянная Авогадро. Единица количества ве-
щества — моль.
[- Моль — это количество вещества, содержащее столько же фор-| мульных единиц, сколько атомов содержится в 0,012 кг изотопа углерода £2С.
Единица «моль» после числа не склоняется. Понятие «моль» распространяется на любые формульные единицы. Поэтому можно говорить о количестве радикалов (пЬн- = 5 ммоль), количестве электронов (пе = 0,5 моль) и т, д.
Кроме формульных единиц в химии применяют такое понятие, как «эквиваленты». Эквиваленты —- условные частицы в z н раз меньше, чем соответствующие им формульные единицы: 1/гСа2+, */5КМ11О4, /6К2СГ2О7, —, 1/z в (ФЕ). В одной формульной единице вещества В может содержаться z в эквивалентов этого вещества. Число z в называют эквивалентным числом, z н г 1. Эквивалентное число z в показывает, сколько эквивалентов содержится в одной формульной единице вещества. Число z в является безразмерным и определяется химической реакцией, в которой данное вещество участвует.
Определение эквивалентных чисел веществ неодинаково для обменных и окислительно-восстановительных реакций.
В обменных реакциях эквивалентное число вещества определяется стехиометрией реакции. Если в рекции
VaA + vbB-VcC+vdD
на 1 ФЕ вещества А требуется vB/vA ФЕ вещества В, то zB= Ев/гл. Например, для реакции
H2SO4 + 2КОН - K2SO4 + 2Н2О
эквивалентное число z Н2 = 2, так как на 1 ФЕ H2SO4 требуется 2 ФЕ КОН, a zKOH = l. В реакции
H2SO4 + Са(ОН)2 = CaSO4 + 2Н2О
эквивалентное число z Н2 = 1, так как на 1 ФЕ H2SO4 расходуется 1 ФЕ Са(ОН)2, a zCa(on)2= 1- в реакции
AJ2(SO4)3 + 12К0Н = 2Кз[А1(ОН)б ] + 3K2SO4
на 1 ФЕ A12(SO4)3 затрачивается 12 ФЕ КОН, следовательно, эквивалентное число zAi2(SO4)3 равно 12, a zKOH=l.
В окислительно-восстановительных реакциях эквивалентные числа для окислителя и восстановителя определяют по числу электронов, которое принимает одна формульная единица окислителя или отдает одна формульная единица восстановителя. Например, в полурсакции
МпО 4 + 8Н+ + 5е = Мп2+ + 4Н2О
2мпо4“ = 5, и значение zKMn.Q4 = 5.
Количество вещества эквивалентов В, символ Пэк (В) — величина, пропорциональная числу эквивалентов этого вещества АГЭк (В): пЭк (В) = —Единица измерения количества ве-Аа
щества эквивалентов — моль. Так как в одной формульной единице вещества В может содержаться zB эквивалентов этого вещества, то Л'Эк (В) = zB N<j>e. Отсюда Пэк (В) = zB п в. Например, если в реакции
2CuSO4 + 4KI = 2CuI + h + 2K2SO4
участвует 2 моль формульных единиц C11SO4, a zCuSO4 = 1, так как в полуреакции
Cu2+ + r + <?~=CuI
1 ФЕ катионов Си2+ или 1 ФЕ C11SO4 получает один электрон, то количество вещества эквивалентов CuSO4 для приведенной реакции равно «3k(CuS04) = 2 моль.
1.3. МАССА
Относительная атомная масса Аг элемента — это средняя масса атомов элемента при его природном изотопном составе, отнесенная к ’/12 массе атома углерода 12С. Относительная атомная масса — величина безразмерная, например: Ar (I) = 126,904; Аг (Мп) = 54,938.
Относительная молекулярная масса Мт — средняя масса «формульного» состава соединения, включающего атомы отдельных элементов в их природном изотопном составе, отнесенная к 1 /12 массе
9
атома углерода i2C. Относительная молекулярная масса — величина безразмерная. Например: Л/НКгЗОд) = 174,26 = 2АГ(К) + A(S) + + 4А-СО); Мг = (KA1(SO4)2*12H2O) =474,39.
Молярная масса вещества В, символ Л/в — это масса одного его моля или масса вещества В (символ тв), деленная на количество вещества, п в : Мв = т в/п в. Единица измерения молярной массы — грамм на моль (г/моль). Термин «молярная масса» относится не только к массе моля молекул, но и к массе моля атомов, ионов и радикалов. Например: Мса = 40,08 г/моль; М Ва2+ - 137,36 г/моль.
Молярная масса — одна из констант данного вещества, она определяется только составом формульной единицы и не зависит от реакции, в которой данное вещество принимает участие.
Молярная масса вещества В численно равна относительной молекулярной массе этого вещества: МГ(В) = М(В) г/моль.
Молярная масса эквивалентов вещества В, символ Мэк. (В) — это масса вещества В (т в), деленная на количество вещества
эквивалентов В: Мж (В) = —. Единица измерения молярной массы «эк (В)
эквивалентов — грамм на моль (г/моль). Так как иЭк(В) — zBnB, то Мэк (В) = —. Молярная масса эквивалентов вещества В в конкретной реакции всегда в z в раз меньше молярной массы этого вещества.
Молярная масса электрохимических эквивалентов вещества В, символ Л/Эх (В) — это масса вещества В, деленная на количество электричества Q: Мж (В) = т B/Q. Единица измерения молярной массы электрохимических эквивалентов вещества — г/Кл. Молярная масса электрохимических эквивалентов вещества представляет собой ту массу вещества В, которая выделяется на электроде при прохождении через электролит количества электричества, равного одному кулону. Например, значение Л/эх(Си) и Мж (Ag) равно соответственно 0,3294* 10 3 и 1,113*10~3г/Кл. Молярная масса эквивалентов вещества В пропорциональна молярной массе электрохимических эквивалентов того же вещества: МЭкВ = РМЖ (В). Например, если через электролит, содержащий катионы Си , прошло F Кл/моль, то выделится 96 485*0,3294* 10 3 = 31,78 г/моль молярной массы эквивалентов меди. Коэффициент пропорциональности F — постоянная Фарадея.
Фарадей Майкл (1791—1867) — английский физик и химик, заложивший основы электрохимии, впервые получил жидкий хлор, открыл явление диамагнетизма и парамагнетизма.
Один фарадей — это заряд одного моля электронов, равный 96484,5 Кл/моль, т. е. 1С = 96484,5 Кл*моль-1. Массу элементарных частиц (протона, нейтрона, электрона и др.) выражают во внесистемных атомных единицах массы (а.е.м.). 1 а.е.м. = 1/12 массы атома углерода к2С. Так как в 12 г углерода }>2С содержится 2/д атомов углерода или (по определению а.е.м.) 12Na частиц с массой, равной 1 а.е.м., то 1 а.е.м. равна 12/1277а, или 1,6606* 10-24 г.
10
Массовое число А — целое число, равное общему числу нуклонов, т. е. протонов и нейтронов, в ядре: А = Z + °, где Z —
атомный (или порядковый) номер элемента, равный числу протонов в ядре, a In ° — число нейтронов в ядре.
Масса вещества — физическая величина, являющаяся мерой его инерционных и гравитационных свойств. Понятия и термины «масса» и «вес» разделены. Понятие массы как скалярной (ненаправленной) величины следует использовать во всех тех случаях, когда имеется в виду свойство вещества, характеризующее его инерционность и способность создавать гравитационное поле. Масса не зависит от ускорения свободного падения g. Массу вещества определяют его взвешиванием на весах. Результат взвешивания следует называть массой, а не весом. Недопустимо применять термин «вес вещества» в качестве физической величины, характеризующей вещество.
Понятие веса, которое раньше отождествляли с понятием массы, теперь используют только в тех случаях, когда имеется в виду сила, возникающая при взаимодействии вещества с гравитационным полем. Вес пропорционален ускорению свободного падения (mg) и представляет собой векторную величину. Как и любая другая сила, вес выражается в ньютонах и определяется специальными силоиз-мерительными машинами и динамометрами. Поэтому термин «вес» исключают из всех понятий, связанных с массой вещества.
1.4. ТЕРМОДИНАМИЧЕСКАЯ ТЕМПЕРАТУРА
Один кельвин (1 К) равен 1/273,160 части термодинамической температуры тройной точки особо чистой воды (см. раздел 6.3). Координаты тройной точки воды: 0,0100 °C и 607,95 Па. За абсолютный нуль температуры принят 0 К, который является температурой на 273,160 °C ниже температуры тройной точки воды. Значение градуса в шкалах Кельвина (Т) и Цельсия (Z) одинакова: изменение температуры на 1 К эквивалентно изменению температуры на 1 °C. Однако нулевыеточкиэтихшкалотличаютсяна273,15градуса:0К - 273,15°С и t= (Т — 273,15) °C. Температура плавления льда, равная 0 °C, на 0,0100 °C ниже температуры тройной точки воды и в температурной шкале Кельвина отвечает 273,1500 К.
Принято ниже 0 °C пользоваться температурной шкалой Кельвина, а выше 0 °C — температурной шкалой Цельсия. Это позволяет избежать применения в тексте знака минус в обозначениях отрицательных значений температур.
Символ °C составляет единое целое и отделяется от числа интервалом: 100 °C, 25 °C. Допускается использование для обозначения температуры по шкале Цельсия одного надстрочного индекса ...°. В этом случае индекс от числа интервалом не отделяется: 45°.
Томсон Вильям лорд Кельвин (1824-1907) - английский физик, известный своими работами в области термодинамики.
Цельсий Андерс (1701-1744) - шведский профессор астроно* Мии, предложил термометр для измерения температур.
11
1.5. ОБЪЕМ И ПЛОТНОСТЬ ВЕЩЕСТВА
Объем принято обозначать латинской буквой V (м3), а плотность — греческой буквой «ро» р (кг/м3). Плотностью вещества В (/)в) называют величину, равную отношению массы вещества тв к его объему: ръ*= тв/Ув.
Допускают применение таких единиц измерения объема, как литр (л) и миллилитр (мл). Слово «литр» рассматривают, как специальное название кубического дециметра (дм3), равно как и слово «миллилитр» является специальным названием кубического сантиметра (см3). При очень точных измерениях учитывают, что 1 л = 1,000028 дм3.
Единицей измерения плотности твердых и жидких веществ поэтому может быть г/мл, а газов — г/л.
Объем эквивалентов газообразного вещества В, символ Уэк (В) — это объем данного газа (Ув), деленный на эквивалентное количество вещества пЭк (В) : УЭк (В) = —° . Единица измерения эк-'t эк(в;
Бивалентного объема л/моль. Поскольку для газов, принимаемых условно за идеальные газы, nB= VB/Vn (Vn = 22,414 л/моль при нормальных условиях), то Уэк (В) = 22,414/zB. Таким образом, объем эквивалентов газообразного вещества В, принимаемого за идеальный газ в конкретной реакции, которая протекает в нормальных условиях, всегда в zB раз меньше объема одного моля идеального газа.
Относительную плотность (безразмерная величина, символ d) определяют, как отношение плотности данного вещества В (рв) к плотности вещества, взятого за эталон (р0У. рв/р0.
Таким эталонным, стандартным, веществом чаще всего является либо вода (4 °C, 1 атм), либо сухой воздух (0 °C, 1 атм).
Плотность воды при 4 °C и 1 атм равна 1,00000 г/мл, а плотность сухого атмосферного воздуха при ОТ и 1 атм равна 1,2928 кг/м3 при составе (в массовых долях): 0,7547 N2, 0,2310 Ог, 0,0129 Аг и 0,00046 СО2.
В обозначение относительной плотности вводят два индекса: верхний, указывающий температуру вещества, при которой производят определение, и нижний, означающий температуру эталонного вещества. Например, запись d° (N2O) - 1,5300 говорит о том, что относительная плотность оксида диазота измерена при 0 °C по отношению к плотности воздуха, температура которого была также 0 °C.
1.6. ДАВЛЕНИЕ
В СИ единицей измерения давления является паскаль (Па), равный давлению, вызываемому силой в 1 Н (ньютон), равномерно распределенной по нормальной к ней поверхности площадью в 1 м2; 1 Па= 1 Н/м2. В паскалях выражают все виды давления.
В термодинамике допускается применение внесистемной единицы давления — атмосферы (атм) с соотношением 1 атм=101325 Па <= 0,1 МПа.
12
массе раствора: (mp)'wB
Внесистемную единицу давления «бар» (обозначение — бар) применяют только как единицу, равную 105 Па; 1 бар -= 105 Па.
1.7. КОНЦЕНТРАЦИЯ
Концентрация — это величина (размерная или безразмерная), определяющая количественный состав раствора, смеси или сплава. Способы выражения концентрации не учитывают, что происходит с данным веществом при растворении, для этой цели существуют другие константы.
Молярная концентрация растворенного вещества В, символ св, определяют как отношение количества этого вещества (п в) к объему раствора: с в = Единица измерения молярной кон-центрации — моль/л, сокращенное обозначение М. Например, записи 0,1 М КС1, 0,02 М CuSO4 означают соответственно децимолярный раствор хлорида калия и двусантимолярный раствор сульфата меди.
Молярная концентрация эквивалентов растворенного вещества В, символ Сэк (В), представляет собой отношение количества вещества эквивалентов пэк (В) к объему раствора Vp: Сэк (В) = Пэк (В) / Vp. Единица измерения молярной концентрации эквивалентов — моль/л, а обозначение этой единицы измерения — «н.» (допускается употребление и буквы «N»). Запись 0,01 н. КМпОд означает сантинормальный раствор перманганата калия.
Из приведенных выше соотношений (см. раздел 1.1) следует, что сэк (B) = zbcb, т. е. молярная концентрация эквивалентов растворенного вещества В в конкретной реакции всегда в z в раз больше его молярной концентрации.
Моляльность растворенного вещества В, символ ст (В), определяют из отношения количества вещества (n1s) к массе растворителя (ms), выраженной в килограммах (кг): сщ “ п в/ms. Единица измерения моляльности раствора — моль/кг. Запись 2ст (НС!) означает, что в растворе на каждый килограмм растворителя приходится 2 моль хлороводорода, такой раствор называют двумоляльным.
Молярная доля вещества В, символ хв, равна отношению количества вещества (пв) к суммарному количеству всех веществ, образующих раствор: х в = тг5-, где ,Snz=nB+ni + n2 + ...+ nt. i
Величина х в — величина безразмерная.
Массовая доля растворенного вещества В, символ wB, представляет собой отношение массы растворенного вещества т в к
Ш В _ в
V ррр
Массовая доля (wB) показывает, какую часть массы раствора составляет масса растворенного вещества. Массовая доля — величина безразмерная. Если значение wB умножить на 100, то получим массовую долю, выраженную в процентах. Запись w (HCl,
13
С2Н5ОН) = 0,01 читается: массовая доля хлороводорода в этаноле равна 1%.
1.8. ЭНЕРГЕТИЧЕСКИЕ ВЕЛИЧИНЫ
Для различных видов энергии приняты символы: U — внутренняя энергия, Е — полная энергия, Еп — потенциальная энергия, Ек — кинетическая энергия, Ей — энергия ионизации атомов, Ее — энергия сродства атомов к электрону, G — энергия Гиббса, Н — энтальпия, W — работа и ее виды: WM — механическая работа, Иэ — электрическая работа. Теплота Q и ее виды: QP*=&H — теплота при постоянном давлении, Qv= А17 — теплота при постоянном объеме и при отсутствии других видов работ.
Теплота и работа — две формы обмена внутренней энергией системы с внешней средой.
Единица измерения энергии джоуль (Дж) и килоджоуль (кДж). Не рекомендуется употреблять такую внесистемную единицу энергии, как термохимическая калория (кал, ккал). Определением калории в настоящее время является только ее соотношение с джоулем: 1 кал “4,1840 Дж.
Единица механической работы расширения литр «атмосфера (л«атм), причем 1 л*атм* 101,3 Дж. Допускается применение такой единицы энергии ионизации, Еи, как электрон-вольт (эВ); 1 эВ = 96,495 кДж.
Введена единая термодинамическая система знаков: изменение энтальпии в экзотермических реакциях отрицательно (система выделяет часть своей энергии в окружающую среду), изменение энтальпии в эндотермических реакциях положительно (система приобретает энергию от окружающей среды). Аналогичную систему знаков имеет и тепловой эффект химической реакции.
В табл. 3 приведены значения наиболее часто используемых фундаментальных постоянных.
Таблица 3. Значения фундаментальных постоянных
Величина Обозначение Значение
Атомная единица массы а.е.м. l,6606»10~27 кг
Газовая постоянная R 8,3144 Дж/(моль«К)
Масса покоя электрона те 9,1095.10“31 кг
Масса покоя нейтрона «л 1,6749* Ю“27 кг
Масса покоя протона ГПр 1,6726*10-27 кг
Молярный объем идеального'газа го-?* ₽0 22,4138 л/моль
Нормальная атмосфера Ро 101 325 Па
Постоянная Авогадро Na 6,0220* 1023 моль -1
Постоянная Больцмана Jc-R/Ma 1,3807.10-23 Дж/К
Постоянная -Планка h 6,6262.10“34 Дж*с
Постоянная Фарадея F 96484,56 Кл/моль
Скорость света в вакууме t c 2,9979» 108 м/с ,
Элементарный заряд e 1,6022*10“19 Кл
14
Упражнения к главе 1
1. Какие из перечисленных ниже названий единиц массы являются неправильными: микрограмм, микрокилограмм, ли-копрам/^, миллинанограмм, сантиграмм?
2. Кдгда количество вещества эквивалентов равно количеству этого вещества?
3. Как определить число нейтронов в ядре данного элемента, если известен его порядковый номер и массовое число?
4. Может ли эквивалент быть больше соответствующей ему формульной единицы?
5. Можно ли отнести атомы Ni и Си, а также радикал ОН к категории формульных единиц? Правильной ли будет следующая запись: "В реакции участвовало 0,5 ммоль радикалов ОН"?
6. В чем вы видите различие в определении понятий: "относительная молекулярная масса" и "молярная масса" одного и того же вещества? Зависит ли значение молярной массы вещества от реакции, в которой данное вещество принимает участие?
ГЛАВА 2. НОМЕНКЛАТУРА НЕОРГАНИЧЕСКИХ ВЕЩЕСТВ
Номенклатура неорганических веществ является важнейшей информационной областью неорганической химии. Название любого вещества должно однозначно указывать на его состав и, наоборот, каждое вещество должно иметь только одно правильное название, принятое во всем мире.
Впервые идею о химической номенклатуре выдвинул де Морво, а затем им совместно с Лавуазье, Бертолле и Фуркруа была опубликована в 1787 г. книга «Метод химической номенклатуры». Основной вклад в создание первой химической номенклатуры внес Лавуазье. В их книге впервые все вещества были разделены на элементы и соединения.
Гитом Де Морво Луи Бернар (1737—1816) — французский химик, юрист по образованию, поэт.
Лавуазье Антуан Лоран (1743—1794) — гениальный французский химик, превративший химию в количественную науку, основатель новой науки — термохимии, член Парижской АН.
Бертолле Клод Луи (174В—1822) — французский химик, основатель учения о химическом равновесии и химическом сродстве, предсказал существование нестехиометрических соединений, научный консультант Наполеона, член Парижской АН.
Фуркруа Антуан Франсуа (1755—1809) - французский химик, врач по образованию, член Парижской АН, иностранный член Петербургской АН.
В настоящее время составление формул и названий подчиняется одним и тем же номенклатурным правилам Международного союза теоретической и прикладной химии (ИЮПАК).
15
Подробнее см Лидин Р. А., Молочко В. А., Андреева Л. Л., Цветков А А Основы номенклатуры неорганических веществ. — М.: Химия, 1983
Степин Б. Д. Ж. неорг. химии, 1987. Т. 32. С. 843.
2.1. ХИМИЧЕСКИЕ ЭЛЕМЕНТЫ
Символы и названия химических элементов приведены в периодической системе Д. И. Менделеева. Перед символом химического элемента слева вверху ставится массовое число, а слева внизу — порядковый номер элемента. Например: К, |$7Au, ^2 С. Изотопы водорода имеют специальные символы и названия: {Н^Н, протий; ?Н = D, дейтерий; ?Н=Т, тритий.
За некоторыми группами химических элементов сохраняются их традиционные названия: IA — щелочные элементы; Са, Sr, Ва и Ra — щелочно-земельные элементы; VIA — халькогены; VIIA — галогены; VIIIA — благородные газы; La и 41-элементы (от Се до Yb) — лантаноиды, общее обозначение Ln, Ас и 51-элементы (от Th до Л) — актиноиды, общее обозначение Ап.
2.2. ПРОСТЫЕ ВЕЩЕСТВА
к Простым веществом называют вещество, состоящее из химически ’ связанных атомов одного химического элемента
Простые вещества в зависимости от типа химической связи условно делят на металлы и неметаллы.
Простые вещества имеют формулы и названия такие же, как и у соответствующих им элементах: РЬ — свинец, Хе — ксенон, К — калий. В названиях же аллотропных форм простых веществ указывают число атомов в молекуле: Se — октасера, ₽4 — тетрафосфор, Оз — трикислород (озон).
2.3. ИОНЫ
Составление названий одноэлементных одноатомных и многоатомных катионов и анионов подчиняется следующим правилам: у одноатомных катионов указывают степень окисления, если их у элемента несколько (Си — катион меди (II), Fe3 — катион железа (III) и т. д.); у многоатомных катионов указывают заряд [Hg^+ — катион диртути (2+); 12+ — катион дииода (1+); S«+ — катион октасеры (2+) ]. Латинские названия одноэлементных анионов получают окончание -ид: Н — гидрид-ион; S2~ — суль-фид-ион; С1 — хлорид-ион. Некоторые анионы сохраняют традиционные названия: N з — азид-ион; Оз — озонид-ион; О г — надпероксид-ион; О — пероксид-ион; С№ — цианид-ион; HS — гидросульфид-ион; ОН — гидроксид-ион; НОг— гидропероксидион.
16
2.4. ПРОСТЫЕ СОЕДИНЕНИЯ
При написании формул простых соединений существует давняя традиция помещать вначале элементы-металлы или катионы, а затем элементы-неметаллы или анионы (KI, СаСг, CuSCU).
В формулах соединений, состоящих из неметаллов, на первом месте ставят всегда элемент, находящийся левее в условном ряду неметаллов, построенном по их возрастающей электроотрицательности: Хе, В, Si, С, As, Р, Н, Те, Se, S, I, Br, Cl, N, О, F. Например: CI3N — нитрид трихлора; CCI2O — оксид-дихлорид углерода, 1Вг — бромид иода, BiCIO — оксид-хлорид висмута.
Если соединение имеет в своем составе разные элементы-металлы, то первым слева в формуле всегда указывают более электроположительный элемент, либо элемент, находящийся ниже в группе периодической системы, либо стоящий левее в периодической системе, например: KA1(SO4>2 — сульфат алюминия-калия, CaMg(CO3)2 — карбонат магния-кальция, Rb?Hgs — октартуть-гептарубидий.
Из приведенных примеров видно, что число атомов в молекуле указывают при помощи числовых приставок, имеющих следующие названия: 1 — моно, 2 — ди, 3 — три, 4 — тетра, 5 — пента, 6 — гекса, 7 — гепта, 8 — окта, 9 — нона, 10 — дека, 11 — ундека, 12 — додека. Выше 12 уже применяют в названиях вместо слов цифры: W20O58 — 58-оксид 20-вольфрама.
В галогенидах, оксидах, сульфидах, нитридах и карбидах металлов и неметаллов более электроположительный элемент всегда стоит в формуле левее: O2F2 — дифторид дикислорода; Hg2Ch — дихлорид диртути, NbBrs — пентабромвд ниобия, AS2I4 — тетраиодид димышьяка, Р4О10 — декаоксид тетрафосфора, CS2 — дисульфид углерода, Mg3N2 — динитрид тримагния, S4N4 — тетранитрид тетрасеры, СаСг — дикарбид кальция, AI4C3 — трикарбцд тетраалюминия, СггзСб гексакарбид 23-хрома.
Многочисленные гидриды бора и кремния получили групповое название соответственно боранов и силанов. В названиях этих соединений число атомов водорода указывают в круглых скобках: В4Н10 — тетраборан (10); S13H8 — трисилан (8). Гидриды серы, содержащие всегда два атома водорода, носят название сульфанов: H2S3 — трисульфан, H2S5 — пентасульфан.
Оксиды, в состав которых входят два разных элемента металла, причем ни один из них не образует оксоанионы, называют двойными оксидами (термин «смешанные оксиды» применять не рекомендуется). Например: (Са, ТДОз — триоксид титана-кальция, (Be, А1?)О4 — тетраоксид диалюминия-бериллия.
Двойные оксиды составов (М', М2Ю4 и (М2, МЮ4, где М' — элемент в степени окисления +11, имеют групповое название «шпинели». Например: (Mg, А12Ю4 — тетраоксид диалюминия-магния; РЬзО4= (РЬг,РЬ)04 — тетраоксид свинца (IV) — дисвинца (II).
Все оксиды состава МзСММ “ Pb, Fe, Со, Мп, Ей и др.) являются двойными оксидами, содержащими металл в разных степенях окисления: ЕезС)4=(Ее', Fe2)O4, E113O4MEU', Еиг)О4.
17
Известны и более сложные двойные оксиды, например Мп5О8= (М 2, Мпз)О8—октаоксид тримарганца (IV)-димарганца (II). В кристаллах двойных оксидов каждый атом металла находится внутри многогранника (полиэдра), образованного атомами кислорода.
2.5. КИСЛОТЫ И ИХ СОЛИ
Номенклатура кислот прошла долгий путь развития и складывалась постепенно. Так появились традиционные названия кислот, сохранившиеся до наших дней (табл. 4). Для кислот необычных, менее распространенных, содержащих кислотообразующие элементы с переменной степенью окисления, рекомендуются только систематические названия (табл. 5).
Таблица 4. Традиционные названия некоторых кислот и их солей
Кислоты Соли
формула название название
НзАзСМ Мышьяковая Арсенаты
В(ОН)з Борная Бораты
Н2СОз Угольная Карбонаты
Н2СгО4 Хромовая Хроматы
НМпО4 Марганцовая Перманганаты
HNO3 Азотная Нитраты
hno2 Азотистая Нитриты
Н2О2 Пероксид водорода Пероксиды
Н3РО4 Фосфорная Ортофосфаты
H2SO4 Серная Сульфаты
H4S1O4 Ортокремниевая Ортосиликаты
H2S Сероводородная Сульфиды
HF Фтороводородная Фториды
НС1 Хлороводородная Хлориды
HBr Бромводородная Бромиды
HI Иодоводородная Йодиды
Таблица 5. Систематические названия некоторых кислот
Формула Название
систематическое традиционное
НзАаОз Триоксоарсенат (Ш) водорода Ортомышьяковистая
HCIO4 Тетраоксохлорат (VII) водорода Хлорная
НСЮз Триоксохлорат(У) водорода Хлорноватая
НС1О2 Диоксохлорат (III) водорода Хлористая
НС1О Оксохлорат(Х) водорода Хлорноватистая
Н5Юб Гексаоксоиодат(УП) водорода Ортоиодная
Продолжение табл. 5
Формула Название
систематическое традиционное
НЮ4 Тетраоксоиодат(УП) водорода Метаиодная
НЮз Триоксоиодат(У) водорода Йодноватая
H2N2O2 Диоксодинитрат (I) водорода Азотноватистая
Н4Р2О7 Гептаоксодифосфат (V) водорода Дифосфорная
Н2(РНОз) Триоксогидрофосфат (Ш) водорода Фосфористая
H2S2O7 Гептаоксодисульфат(У1) водорода Дисерная
H2S2O6(O2) Пероксогексаоксодисульфат(УТ) водо- Пероксодисерная
рода
HSO3F Фторотриоксосульфат (VI) водорода Фторосульфоновая
H2S4O6 Гексаоксотетрасульфат диводорода Тетратионовая
H2S2O4 Тетраоксодисульфат (Ш) водорода Дитионистая
Примечание. Указанные в табл. 5 традиционные названия кислот применять не рекомендуется.
Из табл. 5 следует, что в систематических названиях кислот к корню латинского названия кислотообразующего элемента добавляют суффикс-ат, а названия остальных элементов или их групп в анионе приобретают соединительную гласную -о: H[Sb(OH)6] — гексагидроксостибат(У) водорода. В скобках указывают степень окисления кислотообразующего элемента, если она имеет целочисленное значение. В противном случае в название включают и число атомов водорода: H2S4O6 — гексаоксотетрасульфат диводорода, Н2В4О6 — гексаоксотетраборат диводорода.
Ниже приведены корни латинских названий кислотообразующих элементов, не совпадающие с корнями русских названий тех же элементов: Ag — аргент(ат), As — арсен (ат), Au — аур(ат), Си — купр(ат), Fe — ферр(ат), Hg — меркур(ат), РЬ — плюмб(ат), Sb — стиб(ат), Si — силик(ат), Sn — станн(ат), S — сульф (ат).
В формулах тиокислот, образованных из оксикислот замещением атомов кислорода на атомы серы, последние помещают в конце: H3PO3S — тиофосфорная кислота, H2SO3S — тиосерная кислота. Применение формулы H2S2O3 — для тиосерной кислоты не рекомендуется.
Систематические названия солей строят по аналогичному принципу: ZnS2O4 — тетраоксодисульфат цинка, КгЗгОбЮг) — перок-согексаоксодисульфат(У1) калия, Na2SOaS — тиотриоксосульфат(УТ) натрия (традиционное — тиосульфат натрия). Используемые традиционные названия кислых и основных солей: КНСОз — гидрокарбонат калия, Са(НгРО4)2 — дигидрофосфат кальция, (СиОЮгСОз — карбонат гидроксомеди(П), (РеОН)ЬЮз — нитрат гидроксожелеза(П).
Характер построения названий кристаллогидратов солей иллюстрируют следующие примеры: Си8О4‘5НгО — пентагидрат суль
фата меди(П); Na3[Fe(CN)6]»H2O — моногидрат гексацианоферрата (III) натрия.
Составление систематических названий гидроксидов металлов не требует особых пояснений: Fe(OH)2 — гидроксид железа(II), ВКОН)з — гидроксид висмута(III). Если в составе гидроксида металла помимо гидроксид-иона ОН появляется еще и оксид-ион 0z—, то названия их будут: АЮ(ОН) — гидроксид-оксид алюминия (или традиционное метагидроксид алюминия), TiO(OH)2 — дигид-роксид-оксид титана.
2.6. КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
Основные положения номенклатурных правил, рассмотренные выше для простых соединений, в полной мере относятся и к комплексным соединениям. Молекулярная формула комплекса может быть изображена в общем виде (без указания заряда) как набор лигандов, положительно заряженных (L ) нейтральных (Lu) и отрицательно заряженных (L ), присоединенных к комплексообразо-вателю (М):
[M(L+)(L°)(L) ].
В формуле комплекса нейтральные лиганды располагают между положительно и отрицательно заряженными лигандами, например [Ru(NO ) (Н2О) (NO 3 ) J. Постоянное местоположение лигандов с разным знаком заряда в формулах комплексов помогает составлению правильного названия любого комплекса, особенно в тех случаях, когда он содержит лиганды, имеющие одинаковый состав, но разный по знаку заряд, как у NO+, NO0 и NO .
Лиганды, одинаковые по знаку заряда, располагают друг за другом по порядку появления их первых элементов в условном ряду неметаллов (см. раздел 2.4) вне зависимости от сложности лиганда. Так, в комплексе [Co(C5H5N) (Н2О) (NH3)2](NO3)3 нейтральные лиганды расположены так, как расположены элементы С, Н и N в условном ряду неметаллов. При буквенном обозначении лиганда порядок его расположения в формуле комплекса также определяется химической формулой этого лиганда, например, лиганд ру = C5H5N предшествует лиганду NH3 в комплексе [Co(py)2(NH3)4]C13.
Названия лигандов. Названия отрицательно заряженных лигандов, анионов различных кислот, состоят из полного названия (или корня названия) аниона и окончания с гласной буквой -о. Например: I — иодо, Н — гидридо, СО — карбонато, СГ — хлоро, СгО — оксалата, S2O — тиосульфате, СНзСОО- — ацетато, О2-— оксо, О — пероксо. Некоторые анионы, выполняющие функции лигандов, имеют специальные названия: S2 — тио, ОН~ — гидроксо, CN~ — циано, NCS — тиоцианато, NO- — нитрозо, NO 2 — нитро (координация через атом О).
20
В названиях нейтральных лигандов специальных приставок или окончаний не применяют: N2 — диазот, N2H4 — гидразин, С2Н4 — этилен, C5H5N — пиридин. По традиции оставляют специальные названия только у небольшого числа лигандов: Н2О — аква, NH3 — аммин, СО — карбонил, NO — нитрозил.
Названия положительно заряженных лигандов имеют окончания -ий: NO+ — нитрозилий, NO * — нитроилий, N 2 Н * — гидразиний. Катион водорода Н+, выступающий в качестве лиганда, называют гидро.
Число лигандов. В названиях комплексов число одинаковых лигандов указывают числовыми приставками, которые пишут слитно с названиями лигандов (см. раздел 2.4). Конечные гласные приставок сохраняются в названиях: Li[AlH4] — тетрагидридоалюминат лития, [Fe(CO)5] — пентакарбонилжелезо.
Если в названии сложного лиганда уже имеется числовая приставка, например этилендиамин NH2CH2CH2NH2, то для указания числа таких лигандов применяют умножающие числовые приставки: 2-бис, 3-трис, 4-тетракис и т. д., а название самого лиганда заключают в скобки. Например, (1г)2 — бис(дииод), два лиганда I2; [Co(en)2(NO2>2]0 — динитритобис (этилендиамин) кобальт (II); [Fe(C5H5)2]° — бис (циклопентадиенил) железо. Когда во внутренней сфере число лигандов больше 12, то их количество указывают в названиях цифрой: [M06CI14] — 14-хлорогексамолибден;
Кг[Ке4Вп5] — 15-бромотетраренат дикалия.
Сокращенное обозначение лигандов. Многие лиганды органической природы имеют сложный состав. Поэтому при составлении формул комплексов с их участием возникают различные неудобства. В этом случае применяют вместо химических формул таких лигандов буквенные сокращения. Например: СгО^~ — оксалато — ox; C5H5N — пиридин — ру; (NH2)2CO — карбамид — ur; NH2CH2CH2NH2 — этилендиамин — en; С5Н 5 — циклопентадиенил — ср.
Название комплексообразователей. Если элемент, являющийся комплексообразователем, входит в состав комплексного аниона, то к корню названия (русского или латинского) элемента добавляют суффикс -ат и степень окисления элемента. Корни латинских названий элементов, не совпадающие с корнями русских названий, приведены в разделе «Кислоты и их соли». Например: Кз[Со(НОг)б1 — гексанитрокобальтат(Ш) калия, Na2[Ni(CN)41 — тетрацианоникколат(П) натрия, Cs[I(BrCl) ] — хлоробромоиодат(I) цезия; Кг[СиВг4] — тетрабромокупрат(II) калия.
Если элемент, являющийся комплексообразователем, входит в состав комплексного катиона или нейтрального комплекса, комплекса без внешней сферы, то комплексообразователь получает русское название химического элемента с указанием его степени окисления. Например: [Ni(CO)41 — тетракарбонилникель(О),
[Cu(NH3)4](OH)2 — гидроксид тетраамминмеди(П),
[А1(Н2О)5ОН]2+ — катион гидроксопентаакваалюминия.
Соединения, содержащие комплексный катион и анион. Назва
21
ния таких соединений составляют по указанным выше правилам, как это следует из приводимых примеров: [Pt(NH3)4][PtC14] — тетрахлороплатинат (II) тетраамминплатины(П), [CIFiHSbFfi] — гексафторостибат(У) дифторохлора (III), [Со(Т\'Нз)б ][Сг(С1\')б] — гексацианохромат(Ш) гексаамминкобальта (III).
Двуядерные комплексы с мостиковыми лигандами. Названия комплексов, содержащих два комплексообразователя, связанных мостиковыми лигандами, представляют развернутыми молекулярными формулами, в которых мостиковые лиганды L' помещают между комплексообразователями: [(DM(L')M(D ].
Название мостикового лиганда отличают предшествующей греческой буквой «мю» Д через дефис и заключают в скобки. Например, [(NH3)5Cr(OH)Cr(NH3>4OH]Br4 — бромид (и-гидроксо)-гидроксо-тетраамминхрома(Ш)-пентаамминхрома(Ш). При симметричном расположении мостиковых лигандов название комплекса укорачивают за счет использования умножающей числовой приставки бис-: К4[(ох)2Со(ОН)гСо(ох)2] — ди(«-гидроксо)-бис [диоксалатокобаль-тат(Ш)] калия, [(NH3)4Co(NH2)(NO2)Co(NH3)4](NO3)4 — нит-рат(«-нитро)-(«-амидо)-бис [тетраамминкобальта (III) ]. Названия неразвернутых молекулярных формул двуядерных комплексов строят аналогично названиям одноядерных комплексов: (Co2(NH3)8(NH2)(NO2) ](NO3)4 — нитрат нитроамидооктааммин-дикобальтаШП, К4[Сог(ох)4(ОН)2] — дигидроксотетраоксалатоди-кобальтат(Ш) калия.
Кластеры. Кластерами называют многоядерные комплексы, в которых комплексообразователя непосредственно связаны между собой. В формулах наиболее простых, двуядерных, кластеров связь между комплексообразователями показывают одним валентным штрихом независимо от кратности связи: [(DM—M(D ]. В названиях таких кластеров наличие связи М—М указывают в круглых скобках после названия комплексного иона или молекулы.
Кластеры называют в соответствии с общими правилами: [(СО)5Йе—Мп(СО)5] — пентакарбонилмарганец-пентакарбонил-рений (Мп—Re); K2[CURe—ReC14] — бис [тетрахлороренат (III) ] калия.
Упражнения к главе 2
1. Правильно ли расположены символы элементов в следующих формулах: C13N, NF3 и Br3N? Назовите эти соединения.
2. Как вы назовете катионы S в+, I Т и анионы НО 7 , HS~ и О г-?
3. Назовите соединения Rb7Hge, Mg3N2, АЦ С3, Н51О6, H2SO3S и H2S2O6(O2).
4. Напишите химические формулы и назовите лиганды, которым присвоили следующие буквенные сокращения: ох, ру, ел,
ГЛАВА 3. ЭЛЕКТРОННОЕ СТРОЕНИЕ АТОМА
физические исследования, выполненные в конце прошлого и начале настоящего столетия, выявили исключительное своеобразие законов, управляющих поведением микрообъектов (электронов, протонов, нейтронов и других микрочастиц).
На основе этих исследований была создана новая наука — квантовая механика, описывающая свойства материи и законы ее движения в силовых полях на уровне микрообъектов и микроявлений. Применение законов квантовой механики к химическим явлениям, к превращениям веществ, их образованию с появлением конкретных структур привело к созданию такой науки, как квантовая химия.
Квантовая химия является в наши дни теоретической основой учения о строении и свойствах веществ.
Зарождение квантовой механики относят к 1911 г., когда появилась гипотеза Резерфорда о ядерном строении атома. По модели Резерфорда атом состоял из ядра и расположенных вокруг него электронов.
Резерфорд Эрнест (1871-1937) - английский физик, важнейшие открытия которого относятся к явлениям радиоактивности, лауреат Нобелевской премии.
Опыты Резерфорда показали, что ядро занимает в атоме лишь незначительную часть всего объема. Если размеры атомов имеют порядок 100 пм, то размеры ядра около 0,001 пм. Основная масса атома (более 99,9%) сосредоточена в ядре, плотность которого колоссальна, она равна 10Г4 г/см .
Подробнее см.: Вихман Э. Квантовая физика. — M.: Наука, 1986.
Теперь известно, что ядро атома имеет сложную структуру. Основные ядерные частицы — это протоны р+ и нейтроны п°. Протон и нейтрон очень похожи по свойствам, их отличают только заряд и масса. Масса нейтрона равна 1,00813 nip. Считают, что протон и нейтрон являются двумя состояниями одной и той же частицы — нуклона. Взаимодействие между нуклонами осуществляется путем обмена Л-мезонами (Л+, Л°, л- или пионами), находящимися в постоянном окружении протонов и нейтронов. В последнее время было доказано, что нуклоны состоят из особых частиц — кварков, экспериментально пока не обнаруженных. Взаимодействие между кварками вызвано обменом глюонами — частицами, не имеющими массы.
Число протонов в ядре определяет величину положительного заряда ядра, количество электронов в атоме и соответствует порядковому или атомному номеру элемента (Z). Число нейтронов в ядре равно разности между массовым числом (А) и числом протонов: А—Z.
Заряд ядра равен Ze, где е — элементарный заряд. Химические свойства атома определяются почти исключительно зарядом ядра, а следовательно, числом электронов в атоме, их энергией и распределением вокруг ядра атома.
23
3.1. ТРИ ОСНОВОПОЛАГАЮЩИЕ ИДЕИ КВАНТОВОЙ МЕХАНИКИ
В квантовой механике есть три основополагающие идеи, отличающие ее от классической механики: 1) дискретность, или квантование, 2) корпускулярно-волновой дуализм, или двойственная природа электрона, и 3) вероятностный характер законов микромира. Общими для квантовой и классической механик являются законы сохранения энергии, массы, заряда и импульса.
Квантование энергии электронов в атоме. Некоторые физические величины, относящиеся к микроявлениям и к микрообъектам, могут изменяться в соответствующих условиях не непрерывно, а скачкообразно, т. е. могут принимать только вполне определенные, дискретные значения. О таких величинах говорят, что они квантуются.
В 1900 г. М. Планк пришел к выводу, что тепловое излучение абсолютно черного тела не является непрерывным, а состоит из дискретных порций энергии, квантов энергии.
i Излучением абсолютно черного тела называют излучение из не-I большого отверстия в стенке шарообразной полости, внутренняя $ поверхность которой зачернена.
Значение одного кванта энергии равно
ДЕ = ЛР, (3.1)
где ДЕ — энергия кванта, Дж; V — частота, с— , h — постоянная Планка, равная 6,626» 10~ 4 Дж»с; v-c/Л, где Л — длина волны излучения, ас — скорость света. Постоянная Планка является мерой дискретности. Она как бы определяет границу между микро-и макромирами. Постоянная Планка — одна из фундаментальных
Рис. 1. Кванты энергии:
а — фотоэлектрический эффект: hv + т»^/2), где Еи— энергия ионизации металла, Ек = mv^/2 — кинетическая энергия вылетающего электрона; б — испускание фотона атомом при переходе электрона с одного энергетического уровня на другой, более низкой энергии
24
постоянных природы. Она входит во все квантово-механические соотношения.
Планк Макс (1858-1947) — немецкий физик, основные труды которого посвящены тепловому излучению и термодинамике, лауреат Нобелевской премии.
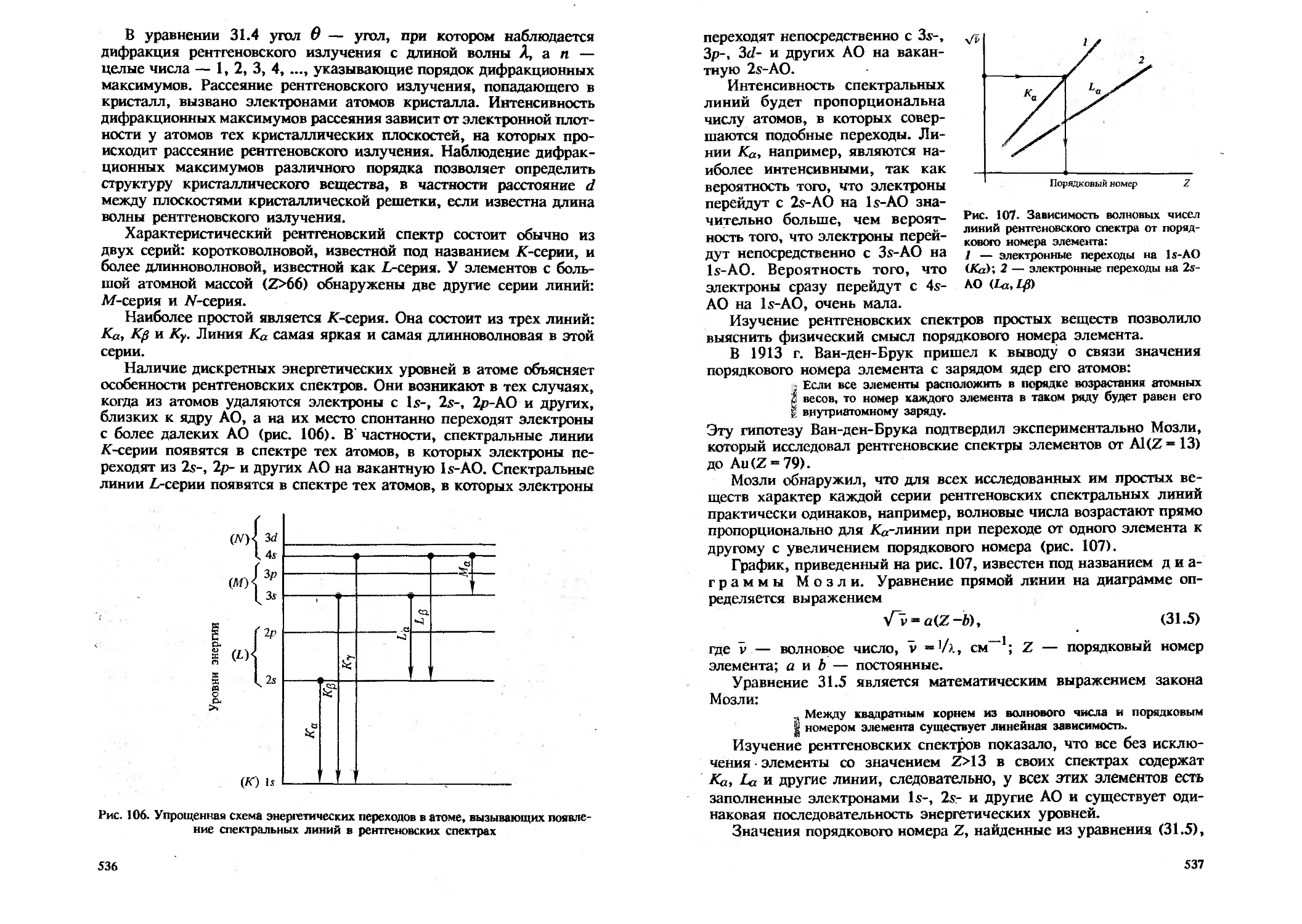
Из формулы (3.1) следует, что свет с большей частотой электромагнитных колебаний (с более короткими длинами волн) состоит из больших квантов энергии (рис. 1).
Кванты энергии впоследствии назвали фотонами. Фотоны являются в полном смысле частицами, только особенными, так как масса покоя их равна нулю и движутся они со скоростью, равной скорости света в вакууме. При малых частотах V у фотонов преобладающую роль играют волновые свойства, при больших V — корпускулярные свойства света.
Идею о квантовании энергии использовал Эйнштейн для объяснения фотоэлектрического эффекта (см. рис. 1). Идея о квантовании энергии позволила также объяснить происхождение линейчатых атомных спектров, состоящих из набора линий, объединенных в серии (см. гл. 31).
Эйнштейн Альберт (1879-1955) — немецкий физик, автор общей теории относительности, квантовой теории света, лауреат Нобелевской премии.
Фотоэлектрическим эффектом называют испускание электронов металлами под действием ультрафиолетового света или рентгеновских лучей.
Подробнее см.: Дикерсон Р., Грей Г, Хейт Дж. Основные законы химии. — М.: Мир, 1982. Т. 1. С. 338.
В 1913 г. Бор предложил первую квантовую теорию строения атома.
Бор Нильс (1885—1962) — датский физик, один из создателей квантовой теории строения атома, лауреат Нобелевской премии.
Теория строения атома Бора была основана на следующих двух постулатах: 1) в изолированном атоме электрон движется по круговым стационарным орбитам, находясь на которых он не излучает и не поглощает энергии. Каждой такой орбите отвечает дискретное, вполне определенное значение энергии (Ei, Ei, Ез ... ..., Еп, где п — целое число, отвечающее возможным стационарным состояниям электрона); 2) переход электрона из одного стационарного состояния (Ег) в другое (Ei) сопровождается испусканием кванта монохроматического (Л = const) излучения, частота
—.Ei
которого V = — —- (см. рис. 1). h
Таким образом, теория Бора ввела представление о дискретном наборе энергий связанного электрона (электрона в атоме). В теории Бора для процесса излучения было совершенно несущественно, как часто облетает электрон ядро атома, важна была лишь разность энергий стационарных состояний, между которыми происходит квантовый скачок.
ОС
Подробнее см.: Храмов Ю. А. Укр. физ. журнал, 1985. Т. 30. С. 1585.
Переход электрона с одной орбиты на другую, связанный с поглощением или испусканием фотонов, квантов энергии, получил название квантового перехода (см. раздел 31.1).
Фотон возникает в процессах перехода электрона из возбужденного состояния в состояние с меньшей энергией; фотон исчезает, когда электрон после взаимодействия с ним переходит в состояние с большей энергией.
Для одноэлектронного атома (атома водорода) Бор показал, что потенциальная энергия электрона (Е«) на стационарных орбитах равна:
Еп —(3.2) п
тде Еп — потенциальная энергия, кДж/моль; п — целые числа, равные 1, 2, 3, ..., «>. По мере возрастания величины п энергетические уровни сближаются и при п -» » , Еп -» 0. Электрон в этом случае оказывается не связанным с ядром и удален от него на бесконечно большое расстояние. Энергия свободного электрона может иметь как положительное, так и нулевое значение.
Двойственная природа электрона. В классической механике для макрообъектов известно два вида движения: движение частицы по определенной траектории (например, полет ракеты или снаряда) с локализацией перемещающегося объекта в каждой точке траектории в определенный момент времени и движение волн, делокализованной в пространстве среды, а не объекта.
Для микрообъекта, в частности для электрона, в квантовой механике такое разграничение невозможно, его миграция характеризуется одновременно и волновыми, и корпускулярными свойствами. Эту особенность движения микрообъектов и принято называть корпускулярно-волновым дуализмом.
Подробно см.: Фейнман Р. Характер физических законов. — М.: Мир, 1968. С. 137.
Корпускулярно-волновой дуализм понимают как потенциальную способность микрообъекта проявлять различные свойства в зависимости от тех или иных внешних условий. В одних условиях на первый план выступают волновые свойства, в других — корпускулярные, в-третьих — те и другие одновременно. Свободный или связанный электрон не является в действительности ни волной, ни частицей, ни даже симбиозом волны и частицы. Электрон — это частица, если речь идет о дискретности, но это и волна, если обсуждается характер его движения. Создать наглядную модель микрообъекта принципиально невозможно.
Автором идеи корпускулярно-волнового дуализма можно считать Эйнштейна, предложившего еще в 1917 г. рассматривать фотоны как частицы определенного импульса.
Впоследствии де Бройль (1924) получил простую зависимость,
26
в которой между собой связаны как корпускулярные (£, т, у), так и волновые (Л, v) свойства:
Е => тс2 = kV’* h^~, Л = —, (3.3)
z mv
где h — постоянная Планка; с — скорость света в вакууме, равная 2,9979»108 м/с; т — масса частицы, г; у — скорость частицы, м/с. Величина А получила название длины волны де Бройля. Она может относиться и к электрону, и к фотону, тогда т и v — соответственно масса и скорость движения электрона или фотона (уфот = с).
Луи де Бройль (1892—1987) - французский физик, один из основоположников квантовой механики, лауреат Нобелевской премии.
Постоянная Планка h связывает воедино корпускулярный и волновой аспекты движения материи.
Из уравнения (3.3) следует, что электрон, находящийся в состоянии покоя (у = 0), имеет значение Л = «о . Чем меньше скорость движения электрона в атоме (у), тем больше величина волны де Бройля и тем ближе электрон по свойствам к частице. Длина волны электрона уменьшается с увеличением скорости его движения. Поэтому чем больше значение у, тем характернее для электрона волновые свойства.
У макрообъектов, обладающих сравнительно большой массой, волновые свойства не поддаются измерению. Так, при массе дробинки в 1 г, летящей со скоростью 1000 м/с, длина волны де Бройля равна около 7»10-1 пм. Это значение Л мало даже по сравнению с размерами ядер атомов (0,001 пм). Построить прибор, позволяющий измерить такое значение длины волны, невозможно, а следовательно, невозможно обнаружить волновую природу макрообъектов.
Принцип неопределенности. Характерная для электронов двойственность поведения отражена в соотношении неопределенности, предложенном Гейзенбергом (1927):
Дрх^х > ~ , (3.4)
где 2^?х=/пДух — неопределенность (ошибка в определении) импульса микрообъекта по координате х; Дх — неопределенность (ошибка в определении) положения микрообъекта по этой координате.
Гейзенберг Вернер (1901-1976) — немецкий физик, один из создателей квантовой механики, лауреат Нобелевской премии.
Согласно принципу неопределенности, математическим выражением которого является неравенство (3.4), невозможно одновременно определить положение и импульс любого микрообъекта с одинаково высокой точностью. Чем меньше значение Дх, т. е. чем точнее мы определяем положение микрообъекта, в частности электрона, тем больше неопределенность в определении значения его импульса или
27
энергии. Если микрообъект имеет конкретное значение энергии, то его координаты (местонахождение) будут иметь очень большую неопределенность.
Физический смысл соотношения (3.4) заключается не в ограничении точности измерений той или иной динамической характеристики микрообьекта, не в невысоком качестве имеющихся приборов или несовершенной технике эксперимента, а в том, что оно отражает корпускулярно-волновую двойственность микрообъектов.
Соотношение (3.4) нельзя вывести или строго доказать, но его справедливость экспериментально установлена для любых систем с динамическими переменными.
Рассмотрим два следствия, вытекающих из принципа неопределенности.
Первое следствие: движение электрона в атоме — движение без траектории. Понятие траектории связано с конкретными координатами и импульсом (mv) электрона, но электрон не может, как уже выяснили, иметь одновременно эти две характеристики достаточно точного значения. Если электрон имеет более или менее конкретное значение энергии, то о местонахождении его можно говорить только предположительно.
Отказ в квантовой механике от такого понятия, как траектория движения электронов и других микрообъектов, связан с наличием у последних волновых свойств, которые не позволяют рассматривать электроны как классические локализованные частицы. Поэтому понятие «орбита движения» электрона, введенное Бором, оказалось неприемлемым в квантовой механике. Появилось другое понятие — вероятность пребывания электрона в определенной части объема атома.
Второе следствие: электрон в атоме не может упасть на ядро. Теория Бора не объясняла, почему электрон, двигаясь по стационарной орбите, не излучает энергию и не падает в конечном итоге на ядро. Падение электрона на ядро существенно уменьшило бы неопределенность его координат с 100 пм (размеры атома) до 0,001 пм (размеры ядра). Уменьшение же неопределенности в значениях координат вызвало бы резкое возрастание неопределенности значения энергии электрона, возрастание разброса его энергетических состояний, с включением и очень больших значений энергии. В частности, энергия электрона в этом случае может возрасти до 10 кДж/моль и больше. Это означает, что минимальная энергия электрона оказывается в 100 раз больше энергии связи нейтрона и протона в ядре и в 10у раз больше энергии электрона в невозбужденном атоме водорода. Электрон с такой энергией вместо падения на ядро должен будет покинуть атом. Отсюда следует, что усилие необходимо не для того, чтобы удержать электрон от падения на ядро, а для того, чтобы «заставить» электрон находиться в пределах атома.
Вероятностный характер законов микромира. Если понятие траектории для электрона в атоме оказалось несостоятельным, то как определить его местонахождение? В квантовой механике о
28
местонахождении электрона судят только с вероятностной точки зрения. Электрон может находиться в любом элементе объема атома, однако вероятность его пребывания в различных элементах объема атома в данный момент времени неодинакова. Он чаще бывает в одних местах, реже в других, и полностью избегает третьи участки объема атома, вероятность пребывания электрона в которых равна нулю. Можно только предсказать, с какой вероятностью электрон может быть обнаружен в различных частях объема атома.
3.2. ВОЛНОВОЕ УРАВНЕНИЕ
Движение электрона в атоме под действием электростатического поля ядра описывается волновой функцией^ (х, у, z) («подфункцией, функцией пространственных координат электрона).
Для этой функции, не зависящей от времени, Шредингер в 1926 г. предложил уравнение, названное впоследствии его именем (уравнение Шредингера):
V 2 у + (Е— Еп )Чр = 0, (3.5)
h
Шредингер Эрвин (1887-1961) - австрийский физик, один из создателей квантовой механики, лауреат Нобелевской премии.
где Е, Еп — соответственно полная и потенциальная энергии электрона; т — масса движущегося электрона, а V — оператор «набла», а2 а2 а2
V 2 - —- + —- + —равный сумме вторых частных производных по дх ay2 dz2
независимым переменным координатам х, у и z электрона. Выражение V читается «набла квадрат пси».
Подробнее см.: Заградник Р, Полак Р. Основы квантовой химии. — М.: Мир, 1979; см. также гл. 32 данного учебника.
Уравнение Шредингера строго не выводится, скорее постулируется. Тем не менее уравнение (3.5) описывает реальное поведение электрона в атоме, так как значения величин, вычисленных при помощи этого уравнения, удовлетворительно согласуются с их значениями, найденными экспериментально. В этом уравнении отражена двойственная природа электрона. Шредингер получил уравнение (3.5), использовав математические выражения для некоторых колебательных процессов и уравнение де Бройля (см. раздел 32.1).
Волновая функция Чр при решении уравнения (3.5) может принимать различные значения, в частности быть величиной мнимой и отрицательной. Но вероятность нахождения электрона в данном элементарном объеме атома должна быть величиной действительной и положительной. Поэтому все наблюдаемые свойства электрона выражают через произведение Ч/Лр* = \чр I2, где Чр* — комплексно-
29
Рис. 2. Схема перехода от декартовых координат к сферическим
ка, и будет местом наиболее
сопряженная волновая функция. Борн предложил рассматривать квадрат модуля ^-функции \1р\2 как плотность вероятнос-т и обнаружения электрона в тех или иных точках объема атома. Ес-
2
ли умножить 1^1 на элементарный объем dv, взятый в точке с координатами х, у и z: dv = dxdydz, то получим lip l2dv — вероятность того, что электрон будет обнаружен в пределах элементарного объема dv. Вероятность же нахождения электрона в объеме атома должна быть равна единице: f I у I2 dv= 1. Та часть пространства атома, где
2 плотность вероятности lip I вели-вероятного пребывания электрона.
Борн Макс.(1882—1970) - немецкий физик, один из создателей квантовой механики, лауреат Нобелевской премии. Подробнее см.: М. Борн. Размышления и воспоминания физика. — М.: Наука, 1977. С. 229.
3.3. КВАНТОВЫЕ ЧИСЛА
Атом водорода с его единственным электроном — наиболее удобная модель для применения уравнения Шредиргера к описанию свойств электрона в атоме. Чтобы решить уравнение, надо разделить его переменные. Такая математическая операция оказывается возможной при замене декартовых координат на сферические (рис. 2).
Так как масса протона много больше массы электрона, то протон считают центром тяжести системы р+—ё~ или началом координат. Уравнение Шредингера, содержащее сферические координаты г, в и в качестве переменных величин, определяющих положение электрона, можно уже представить в виде произведения трех функций, каждая из которых содержит только одну переменную:
0, р)-Я(г)0(в>Ф(р). (3.6)
Функцию А (г) называют радиальной частью волновой функции, а 0(0) и Фф) — ее угловой частью (0 и Ф — заглавные буквы «тэта» и «фи» греческого алфавита).
Подставляя уравнение (3.6) в уравнение Шредингера (3.5), выраженное через новые переменные, можно получить три независимых дифференциальных уравнения, каждое из которых содержит только одну переменную координату: ^n,/(r), lpi,mPfh и ipmSp)- Из решения этих уравнений находят целочисленные параметры п, I и mi, получившие название квантовых чисел. Таким образом,
30
появление квантовых чисел автоматически вытекает из решения уравнения Шредингера для атома водорода (см. раздел 32.2).
Принято называть число п — главным, I — орбитальным, а z — магнитным квантовым числом.
Главное квантовое число п может принимать любые целые положительные значения от 1 до 00 (л = 1, 2, 3, 4, ...,°°).
Значение орбитального квантового числа I связано со значением главного квантового числа л: для данного значения п значение I изменяется в интервале Os / s (л—1), отвечающем значениям I = 0, 1, 2, ..., (л—1). Когда п = 1, то Z = 0, при п = 2 значения I = 0 и I = 1.
Каждое значение орбитального квантового числа принято обозначать буквенными символами, широко используемыми в неорганической химии:
I 0 1 2 3 4...
Символы s р d f g...
Значение магнитного квантового числа mi изменяется от -I до +1, а всего это число может принимать (2/ + 1) значений для данного /, включая нулевое. Например, для 1=2, mi = 2, 1, 0, —1, —2.
Детальное изучение свойств атома водорода показало, что описание состояния электрона в атоме с помощью трех квантовых чисел является недостаточным. Электрон имеет еще собственный магнитный и механический моменты, которые объединили общим названием «спин» и ввели в связи с этим четвертое квантовое число т s — магнитное спиновое число, принимающее всего два значения: +'/2 И —(/2.
Наличие спина у электрона было подтверждено экспериментально. Спин у электрона не зависит от внешних условий и не связан с движением электрона в трехмерном пространстве, спин не может быть уничтожен или изменен.
3.4. АТОМНЫЕ ОРБИТАЛИ. ФИЗИЧЕСКИЙ СМЫСЛ КВАНТОВЫХ ЧИСЕЛ
Атомная орбиталь (АО) — геометрический образ одноэлектронной волновой функции ip, зависящей от трех квантовых чисел п, I и щ, представляющий собой область наиболее вероятного пребывания электрона в атоме.
Понятие «АО» как бы связывает представления Бора об орбитах-траекториях с квантово-механическими представлениями о вероятностном характере движения электрона в атоме.
Атомную орбиталь иногда рассматривают как электронное облако, представляющее собой наглядное изображение электрона, делокализованного в объеме атома.
Атомные орбитали принято обозначать при помощи двух квантовых чисел л и I. Например, Зх-АО(л = 3, / = 0); 2р-АО(л = 2,1 = 1); 4с?-АО(л = 4, 1=2).
Форма и размеры АО зависят от квантовых чисел п, I и mi и, следовательно, изменяются от одного состояния электрона в атоме к другому его состоянию.
31
Р-АО(/=1)
d-A0(Z=2)
Рис. 3. Конфигурации АО и их ориентация в пространстве
Главное квантовое число и определяет размеры АО: чем больше значение п, тем больше область наиболее вероятного пребывания электрона около ядра атома. Так, Зх-АО > 2s-AO > ls-AO, 4р-АО > Зр-АО.
Орбитальное квантовое число I определяет конфигурацию АО, которая от значения п не зависит. При I = 0 (для всех значений главного квантового числа) АО будет иметь сферическую форму, при 1= 1 — форму гантели, при 1-2 — более сложную пространственную форму (рис. 3).
Магнитное квантовое число mi связано с ориентацией АО в пространстве. Если ns-АО (Z = 0, m/ = 0) — сферически симметричны, то р- и J-АО имеют характерную направленность в трехмерном, пространстве (рис. 3).
Для условного изображения каждой АО вне зависимости от ее пространственной конфигурации принят символ квадрата ,
называемый квантовой или электронной ячейкой. Так как каждой АО отвечает только одно значение магнитного квантового числа mi, то число АО или квантовых ячеек для данной величины орбитального квантового числа будет следующим:
ns - АО
пр
- АО(п>2)
, для которых
nij = 1,0, -1; nd - АО (п > 3)
для которых
пц = 2, 1, 0, —1, —2.
32
Рис. 4. Графики функции радиального распределения вероятности: ЭП — распределение электронной плотности для 2s-AO (разрез 2$-АО>; УП — узловая поверхность (сфера), где W(r) - О
3.5. ФУНКЦИЯ РАДИАЛЬНОГО РАСПРЕДЕЛЕНИЯ ВЕРОЯТНОСТИ
Выше было установлено, что вероятность нахождения электрона в элементарном объеме атома равна I ip 12 dv. Если за элементарный объем принять объем шарового слоя толщиной dr, где г — расстояние от ядра атома до шарового слоя, то dv = 4л г2 dr. Тогда
Ж(г) = 4Лг2 l^l2dr. (3.7)
_ Функция W(r) получила название функции радиального распре-
деления вероятности нахождения электрона в атоме или вероят-
поста электронной плотности.
Она представляет собой вероятность обнаружения электрона в сферическом слое толщиной dr при различных расстояниях слоя от ядра атома. Графики функции W(r) представлены на рис. 4, из которого видно, что для ls-AO вероятность обнаружения электрона наибольшая в слое, находящемся на расстоянии 52,9 пм от ядра (слой заштрихован). По мере удаления от ядра атома вероятность обнаружения электрона асимптотически приближается к нулю.
Отсюда следует,, что у атома нет четких границ, он не имеет жесткой поверхности и при сближении атомов их АО могут проникать друг в друга.
У 2s-AO появляется два максимума (см. рис. 4) на кривой Ж(г) =
2—125Х
33
= /(г), между которыми находится узловая точка (в АО — узловая поверхность), где вероятность обнаружения электрона равна нулю. Высоты максимумов у функции Ж(г) убывают по мере приближения их к ядру атома. Атомные орбитали, имеющие более одного максимума, называют проникающими АО. Число максимумов на кривых И'Сг) =/(г) равно п-1. Поэтому наиболее проникающими к ядру всегда являются s-AO (/ = 0). Атомные орбитали 2р, 3d и 4/, как ls-АО, не имеют узловых поверхностей, для них функция 1У(Г) имеет только один максимум, так как п- l~ 1.
3.6. ЭНЕРГЕТИЧЕСКИЕ УРОВНИ И ПОДУРОВНИ В АТОМАХ
Решение уравнения Шредингера (3.5) для атома водорода, содержащего всего один электрон, приводит к соотношению
~ 2 4
£п = -^ту-, (3.8)
ил
где ЕП — потенциальная энергия электрона в атоме; т — масса электрона; е — его заряд, Л — постоянная Планка; п — главное квантовое число.
Для 1 моль электронов уравнение (3.8) преобразуется в уравнение
= (3.9)
п
где ЕП — потенциальная энергия 1 моль электронов (в кДж), отвечающая определенному значению главного квантового числа.
Знак минус в правой части уравнений (3.8) и (3.9) означает понижение энергии относительно начала отсчета — состояния атома водорода, в котором протон и электрон удалены друг от друга на бесконечно большое расстояние. При п -» » ЕП -» 0.
Из уравнений (3.8) и (3.9) и рис. 5 следует, что в одноэлектронном атоме энергия квантуется, принимает дискретные значения, пропорциональные п.
Для п=1 существует только одна ls-АО с энергией -1312,1 кДж/моль электронов. Когда п = 2, появляется уже четыре АО с одним значением энергии (-328,8 кДж/моль): 2s- и три 2р-АО. Если п = 3, то одинаковую энергию (- 45,8 кДж/моль электронов) уже будет иметь п2 АО или девять АО: 3s-АО, Зр-АО и пять 3J-AO.
Таким образом, энергетический уровень — это совокупность энергетических состояний электрона в атоме, характеризующихся одним и тем же значением главного квантового числа п. Каждому энергетическому уровню одноэлектронного атома отвечает определенный набор АО, равный пг.
,, Энергетическим подуровнем называют совокупность энергетиче-§ ских состояний электрона в атоме, характеризующихся одним и
тем же значением орбитального квантового числа L
У одноэлектронного атома для любого значения главного квантового числа значения энергий уровня и подуровней совпадают.
34
Е = 0 п- --•т.тта
Е4 = -82,0 п = 4
£3 = -145,8 и=3
Е2=- 328 п=2
Ej =-1312,1 и = 1
Рис. 5. Схема дискретных энергетических уровней в атоме водорода:
А — область континуума энергии (бесконечно большое удаление электрона от ядра)
У многоэлектронных атомов основные закономерности, характерные для атома водорода, сохраняются. Каждой ^-функции электрона отвечает своя АО, состояние каждого электрона определяется теми же четырьмя квантовыми числами: п, I, mi и rns. Энергия электрона в многоэлектронном атоме также изменяется дискретно.
Существенное отличие одноэлектронного атома от многоэлектронного заключается в том, что в последнем в результате взаимодействия электронов, их взаимного отталкивания, эффекта экранирования внешних электронов от воздействия ядра электронами, ближе расположенными к ядру атома, происходит расщепление энергетического уровня на подуровни. Энергия электронов уже зависит не только от и, но и от I:
В многоэлектронных атомах s-AO находятся всегда ближе к ядру вследствие их большей проникающей способности через внутренние АО, т. е. через АО с меньшим значением главного квантового числа.
2*
35
Поэтому s-AO оказываются более стабильными, их энергия имеет большее отрицательное значение, чем у p-АО или d-AO. В свою очередь, p-АО более стабильны, чем d-AO.
Энергии s - и p-АО с увеличением заряда ядра монотонно уменьшаются для всех значений главного квантового числа. Зависимость же энергии d- и /-АО от заряда ядра является более сложной функцией. Порядок расположения АО по возрастанию их энергии следующий: Is < 2s < 2р < 3s < Зр < 4s < 3d < 4р < 5s < 4d < 5р < 6s < 4/... Объяснение такому расположению АО будет дано в следующей главе при изложении правила Клечковского.
В многоэлектронных атомах заселение электронами уровней и подуровней осуществляется не произвольно, а в строгом соответствии с тремя основными принципами квантовой механики: принципом минимума энергии, принципом Паули, правилом Гунда.
Паули Вольфганг (1900—1958 — швейцарский физик, автор многих работ по квантовой механике, лауреат Нобелевской премии.
Гунд (Хунд) Фридрих (р. 1896) — немецкий физик, автор ряда работ по квантовой механике, спектроскопии и магне
тизму.
Принцип минимума энергии отражает стремление любого атома находиться в основном (невозбужденном) состоянии. В связи с этим электрон в атоме всегда старается занять наиболее низкий энергетический подуровень, т. е. подуровень с наименьшим значением энергии. Например, в приведенной выше схеме трех энергетических подуровней 3s, Зр и 3d электрон займет низший 3s подуровень (электрон изображен стрелкой t ).
В соответствии с принципом Паули в каждой атомной орбитали число электронов не может быть больше двух: никакие два электрона в одном и том же атоме не могут иметь четыре одинаковых квантовых числа (n, I, mi и ms), т. е. не могут находиться в одинаковом квантовом состоянии. Поэтому если в одной АО (квантовой ячейке) появляется второй электрон, то он будет иметь спиновое квантовое число противоположного знака: || например, для р-ао(^Х^) или • В этом слу-
чае говорят, что на АО находятся спаренные электроны.
Правило Гунда требует, чтобы в пределах совокупности атомных орбиталей одной и той же энергии (энергетический подуровень) число электронов с одинаковыми спинами было максимальным. Такая особенность распределения электронов по атомным орбиталям с одним и тем же значением I объясняется межэлектронным отталкиванием. Например, заселение вакантных d-AO пятью электронами возможно в соответствии с правилом Гунда только одним способом, отвечающим наименьшей энергии основного состо-
яния | | | | | . Другие варианты
It It t
1 t 1 t 1
It t t 1
противоречат правилу Гунда и относятся к возбужденным состоя-
36
ниям атома. Из правила Гунда следует, что наполовину заполненные электронами АО (в каждой квантовой ячейке по одному электрону) являются наиболее устойчивыми:
t t t
t t t t t
t t t t t t t
Распределение электронов по различным. АО называется электронной конфигурацией атома (табл. 6). Например, электронная конфигурация атома кислорода Is 2.v 2р , а натрия — .
Таблица 6. Распределение электронов по атомным орбиталям
ЗаселениеАО
энергетические подуровни
2
1
О
2р 2s
3d Зр 3s
1,0,- 1 0
2,1,0,- 1,-2 1,0,- 1 0
Максимальное число электронов на энергетическом уровне
18
2
8
3.7. МАГНИТНЫЕ И ЭНЕРГЕТИЧЕСКИЕ ХАРАКТЕРИСТИКИ АТОМОВ
Магнитные свойства атомов характеризуют их поведение во внешнем магнитном поле. Если вещество выталкивается из внешнего неоднородного магнитного поля, то атомы этого вещества называют диамагнитными, если же вещество втягивается во внешнее неоднородное магнитное поле и ориентируются вдоль его силовых линий, то атомы этого вещества получают название п а р а м а г-н и т н ы х.
Диамагнитные свойства вызваны движением спаренных элект-
37
ронов, а парамагнитные — движением неспаренных электронов (орбитальным движением и спином). Чем больше у атома неспаренных электронов, тем в большей степени проявляется парамагнетизм у атомов вещества.
Особенности электронной структуры атомов различных элементов находят отражение в таких энергетических характеристиках атомов, как энергия ионизации Ец и сродство к электрону Ее. Их значения, отнесенные к молю атомов, принято измерять в килоджоулях на моль (кДж/моль).
Энергия ионизации — энергия, необходимая для полного удаления электрона из нейтрального газообразного атома в его основном состоянии без сообщения электрону кинетической энергии. Значение Ек всегда является положительным. Например, энергия ионизации атома водорода Н(Г) = Н(г) + ё~, равная + 1312,1 кДж/моль, представляет собой переход электрона с Is-AO (Е\) на АО с п =~, которой отвечает величина Е<» = 0(см. рис. 4).
У многоэлектронных атомов различают первую (Е1И), вторую (Е2и) , третью (£зи) и т. д. энергии ионизации по последовательному удалению электронов из атома. При этом всегда для одного и того же атома £1И < £2и < £зи, поскольку второй, третий и т. д. электроны приходится уже отрывать от положительно заряженного иона, заряд которого возрастает после удаления каждого электрона. Например, для лития Е1и = 521,1 кДж/моль, £'2и = 7295,4 кДж/моль, а Ези~ 11811,6 кДж/моль.
Наибольшим значением энергии ионизации обладают атомы благородных газов, имеющие полностью заселенный электронами энергетический уровень ns^np . Наименьшее значение энергии ионизации обнаружено у атомов щелочных элементов, у которых на внешней ns-AO находится всего один электрон, надежно экранированный от воздействия ядра 8-электронной оболочкой предыдущего благородного газа (кроме 1л).
Сродство к электрону — энергия, выделяемая или поглощаемая при присоединении электрона к нейтральному атому, находящемуся в газообразном состоянии, с образованием отрицательно заряженного иона. Например: F(r) + е = F~(r), Ее = = —345,7 кДж/моль.
Наибольшим сродством к электрону обладают галогены.
Каждый возбужденный атом может в результате квантового перехода излучать энергию только прерывно, т. е. порциями или квантами, причем энергия одного кванта (фотона) равна hV. Квантовые переходы электрона в атоме — это скачкообразные изменения его энергии. (Подробнее см. раздел 32.3.)
Фотоны (кванты электромагнитного излучения) движутся со скоростью света, масса покоя их равна нулю. Фотон в состоянии покоя — понятие, лишенное смысла. Лишь некоторые свойства фотона, например эффект Комптона (аннигиляция электрон-позитрон-ной пары), напоминают свойства частицы.
38
Комптон Артур (1892—1962) — американский физик, изучавший рассеяние и поглощение рентгеновского излучения.
Все микрообъекты (фотоны, электрогы, протоны и др.) обладают некоторыми свойствами волн и некоторыми свойствами частиц, корпускул. Двойственность их природы можно понять с позиций принципа дополнительности Бора. В соответствии с этим принципом данные об электроне, фотоне или другой микрочастице могут быть «наглядно» объяснены лишь на основе взаимно исключающих друг друга представлений. Взаимно исключающие образы микрообъектоь, частица — волна, как бы дополняют возникающую в нашем сознании картину об этих микрообъектах, адекватно отражают разные стороны объективной реальности.
С двойственной природой электрона связано соотношение неопределенностей, в соответствии с которым невозможно одновременно точно измерить и координаты, и импульс (mv) этой частицы. Если электрон локализован в небольшой области около ядра, неопределенность его положения мала, но в этом случае велика неопределенность импульса, что означает большую кинетическую энергию электрона.
В одноэлектронном атоме для одного и того же главного квантового числа энергия уровня (слоя электронов) и подуровней (электронных оболочек) одна и та же. В многоэлектронных атомах происходит расщепление энергетического уровня на подуровни различной энергии.
Распределение электронов по подуровням или атомным орбиталям происходит в соответствии с принципом минимума энергии, принципом Паули и правилом Гунда. Каждому допустимому энергетическому состоянию электрона в атоме отвечает конкретный набор значений квантовых чисел. Правила квантования ограничивают возможные комбинации квантовых чисел, например Ip-, 2d-и 3/- состояний электронов не существует.
Волновая функция — функция координат электрона в атоме — имеет вероятностный характер. Геометрическим образом волновой функции является атомная орбиталь — область наиболее вероятного пребывания электрона в атоме. Главное квантовое число п определяет размеры АО, орбитальное квантовое число I — форму АО, а магнитное квантовое число mi — пространственную ориентацию АО.
Электрон имеет собственный момент количества движения, т. е. спин. Спин — основное первичное свойство электрона, такое же, как заряд и масса. Наглядно представить это свойство невозможно.
Положение электрона в атоме определяет функция радиального распределения вероятности. Она показывает, что в атоме существуют зоны, где электрон бывает чаще, и узловые поверхности, которые он избегает, где вероятность пребывания электрона равна нулю.
39
Упражнения к главе 3
1. Сколько, типов АО, указанных ниже, имеется в атоме* 2s, 4d!H, 3d, 5рх>.
2. Какая из перечисленных ниже величин пропорциональна энергии электромагнитного излучения: длина волны, скорость, частота?
3. Какой энергии нужен фотон, чтобы его соударение с электроном в атоме водорода вызвало бы переход электрона с ls-АО на 2s-AO?
4. Почему первая энергия ионизации у атома серы меньше, чем у атома фосфора?
5. Какому из перечисленных ниже переходов в атоме водорода соответствует фотон с наименьшей энергией: 1 s -• 2р; 2р -» 3s; 1 s -» 4d; 4р -» Ss?
Ь. Сродство к электрону атома углерода намного больше, чем у атома азота. Объясните причину этого, основываясь на сопоставлении электронных конфигураций.
ГЛАВА 4. ПЕРИОДИЧЕСКИЙ ЗАКОН
Периодический закон — фундаментальный закон природы — был открыт Д. И. Менделеевым в 1869 г.
Закон устанавливал определенную зависимость между свойствами элемента и его важнейшей характеристикой — порядковым номером. Первоначально периодический закон имел следующую формулировку:
„ свойства простых веществ, также формы и свойства соединений Р элементов находятся в периодической зависимости от величины 1 атомных масс элементов.
С развитием квантовой химии периодический закон получил строгое теоретическое обоснование, а с ним и новую формулировку:
Г свойства простых веществ, а также формы и свойства соединений элементов находятся в периодической зависимости от величины зарядов ядер их атомов.
Эта формулировка не изменяет содержание закона, она только углубляет наше понимание его. Следует заметить, что атомные массы связаны со значением зарядов атомных ядер прямой пропорциональностью. Как показал еще Ридберг, при переходе от одного элемента к соседнему в периодической системе атомная масса увеличивается в среднем на 2—3 единицы.
Ридберг Юханнес (1854—1919) — шведский физик, занимался изучением атомных спектров.
4.1. ДОМЕНДЕЛЕЕВСКАЯ СИСТЕМАТИЗАЦИЯ ЭЛЕМЕНТОВ
Первая попытка систематизации элементов принадлежит Дёбе-рейнеру, установившему в 1816 г. правило триад. Он объединил близкие по свойствам элементы в триады: Li, Na, К; S, Se, Те; Cl, Br, I и др. — и обнаружил, что средний элемент каждой
40
триады имеет атомную массу, близкую к среднеарифметическому значению из атомных масс двух крайних элементов.
Деберейнер Иоганн (1780—1849) - профессор химии, фармации и технологии, друг Гёте, обнаружил каталитическое действие платины.
Многие химики после Дёберейнера пытались разработать систематизацию элементов, но только Бегье де Шанкуртуа удалось несколько продвинуться вперед. Он в 1862 г. в своем сочинении «Земная спираль» предложил располагать элементы по спирали или образующей цилиндра в порядке возрастания их атомных масс и указал, что в этом случае можно обнаружить некоторое сходство элементов в физико-химических свойствах, если они попадают на одну и ту же вертикальную линию цилиндра, располагаясь один под другим. Так впервые появилась мысль о периодичности свойств элементов, но на нее не обратили внимания и вскоре она оказалась забытой.
Бегье де Шанкуртуа Александр (1819-1886) — профессор геологии Парижской высшей горной школы.
В 1866 г. Ньюленде снова пытался расположить известные элементы в порядке возрастания их атомных масс и обнаружил поразительное сходство между каждым 8-м элементом.
Ньюленде Джон (1837-1898) — английский химик-аналитик, основные работы которого посвящены изучению периодических свойств химических злементов.
Он назвал свою закономерность законом октав:
H Li Be В C N 0
F Na Mg Al Si P s
Cl К Ca Cr Ti Mn Fe
Co Cu Zn Y In As Se
Однако ему не удалось удовлетворительно объяснить найденную закономерность, более того, в его таблице не нашлось места новым элементам, а в некоторые вертикальные столбцы попали элементы, различающиеся по своим свойствам. Лондонское химическое общество встретило его закон октав равнодушно и предложило Ньюлендсу располагать элементы по алфавиту. В 1864 г. Мейер в своей книге «Современные теории химии» привел таблицу, в которой элементы были также расположены в порядке увеличения их атомных масс:
- - - - Li Ве
С N О F Na Mg
Si Р S Cl К Са
- As Se Br Rb S
Sn Sb Те I Cs
Pb Bi
Ba
41
Но в эту таблицу Мейер поместил всего 27 элементов, меньше половины известных в то время. Расположение остальных элементов (В, Al, Си, Ag и др.) оставалось неясным, а структура таблицы была неопределенной. Одновременно Одлинг опубликовал свою таблицу элементов, в которой последние были без каких-либо пояснений просто расположены по возрастанию их атомных масс.
Майер Лотар (1830—1895) — немецкий химик, основные работы которого связаны с неорганической и органической химией. Одлинг Уильям (1829—1921) - английский химик, занимался различными вопросами неорганической и органической химии. Предложенная Д. И. Менделеевым периодическая система элементов имела четкую структуру в виде групп и периодов (рядов). В этой структуре нашлись места не только для всех известных в то время элементов, но были оставлены пустые места для еще не открытых элементов. Система элементов Д. И. Менделеева позволила не только предсказать существование неизвестных элементов, но и предугадать их свойства, исправить атомные массы уже известных элементов. В частности, используя свою систему, Д. И. Менделеев в 1871 г. предсказал существование трех неизвестных элементов: экабора Sc, экаалюминия Ga и экасилиция Ge.
Первым был открыт галлий. В 1875 г. Лекок де Буабодран обнаружил этот элемент в минерале сфалерите ZnS, а затем выделил его в виде металла. Свойства галлия оказались тождественными свойствами неизвестного экаалюминия, предсказанным Менделеевым.
Лекок де Буабодран Поль (1838—1912) — французский химик-экспериментатор, первооткрыватель новых химических элементов: Ga (1875), Sm (1879), Gd (1886), Dy (1886) и Eu (1892). Подробнее см.: Михеева Л. М., Григорьев А. Н. Ж. неорг. химии, 1984. Т. 29. С. 421.
В 1879 г. Нильсон выделил из некоторых минералов триоксид дииттербия УЬгОз и оксид нового элемента SC2O3, названного им скандием в честь Скандинавии. Этот элемент по своим свойствам, атомной массе соответствовал экабору.
Нильсон Ларс (1840—1899) — шведский профессор аналитической химии, изучал соединения мышьяка и торня.
В 1886 г. Винклер обнаружил в редком минерале аргиродите AgxGcSe новый элемент германий, свойства которого поразительно совпали со свойствами экасилиция. С согласия Менделеева Винклер назвал открытый им элемент в честь своей родины германием.
Винклер Клемеит (1838—1904) - немецкий профессор аналитической химии, предложил промышленный метод получения серной кислоты контактным методом. Подробнее см.: Лавут Е. А. Ж. неорг. химии, 1984, Т. 29. С. 460.
4.2. СТРУКТУРА ПЕРИОДИЧЕСКОЙ СИСТЕМЫ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ
Своеобразие периодического закона заключается в том, что он в отличие от других фундаментальных законов природы не может быть выражен в виде какого-либо математического уравнения. На
42
иболее удобным для изображения периодического закона оказался графический способ, в частности табличный.
Периодическая система химических элементов — это строго упорядоченное множество химических элементов, их естественная классификация, являющаяся табличным или другим графическим выражением периодического закона химических элементов.
Были предложены сотни различных вариантов таблиц периодической системы. Однако широкое распространение получили только те из них, которые оказались весьма близкими к таблице, составленной Д. И. Менделеевым. В настоящее время применяют преимущественно две формы периодической системы: длиннопе-риодную и короткопериодную (см. первый и второй форзацы книги).
Вертикальные графы периодической системы называют группами, а горизонтальные — периодами. Таким образом, координатами каждого элемента периодической системы являются номера группы и периода.
Короткопериодная форма (см. второй форзац книги) состоит из восьми групп и семи периодов. Семейства лантаноидов и актиноидов вынесены под таблицу. Группы I—VII состоят из двух подгрупп: А и Б, а VIII группа — из четырех подгрупп: VIIIA, VIIIB, VIIIB1 и VIIIB2. Буквы указывают АО, заселяемые электронами: А - $- и p-АО; Б — s- и d-AO. Римские цифры соответствуют числу валентных электронов и максимально возможной степени окисления элемента в его соединениях. Например, у элементов VnjV-группы семь валентных электронов, находятся на s- и p-АО: ns ирэ* у элементов IVB-группы четыре валентных электрона: nsl(n - \)а.
Длиннопериодная форма периодической системы (см. первый форзац книги) содержит при том же числе периодов 32 группы. Такое число групп соответствует полному заполнению электронами $р6-, d1 - и / 4-АО. Группы, включающие лантаноиды и актиноиды, состоят всего из двух элементов и не имеют специальных названий. Остальные группы сохраняют обозначения короткопери-одной формы, например IB, VILA, IVB и т. д.
4.3. ПОРЯДКОВЫЙ НОМЕР ЭЛЕМЕНТА
В основе систематизации химических элементов Д. И. Менделеев использовал два фактора: значение их атомной массы и сходство в свойствах элементов, стоящих по вертикали. В отдельных случаях, опираясь на химическую аналогию, ему приходилось нарушать принцип распределения элементов в порядке увеличения атомных масс. Так, не по возрастанию атомных масс в периодической системе Д. И. Менделеева размещены элементы: ieAr(39, 94) и 19К(39, 10); 27Со(58, 94) и 28NK58, 71); 52Те(127, 61) и 53I (126, 91) (в скобках указана атомная масса элемента).
Понятие порядкового или атомного номера элемента (Z) долгое бремя не имело определенного физического смысла, хотя еще в 1897 г. Ридберг пришел к заключению, что для закона периодичности
43
элементов значение Z имеет больше преимуществ, чем значения атомных масс.
Впервые физический смысл порядкового номера раскрыл Ван-ден-Брук. Он теоретически доказал, что порядковый номер элемента равен заряду ядер его атомов. Гипотеза Ван-ден-Брука была экспериментально подтверждена впоследствии Мозли при изучении спектров рентгеновского излучения, испускаемого простыми веществами при их бомбардировке электронным пучком высокой энергии (см. раздел 31.2).
Ван-ден-Брук Антониус (1870—1926) - голландский юрист, затем физик, член Голландской академии.
Подробнее см.: Лисневский Ю. И. Учение о периодичности. — М.: Наука, 1981. С. 134.
Мозли Генри Джефрис (1887-1915) - английский физик, убит под Дарданеллами в первую мировую империалистическую войну.
Работы Ван-ден-Брука и Мозли оказали наиболее существенное влияние на завершение построения периодической системы, дали возможность установить правильность расположения элементов в периодической системе, определить общее число элементов в каждом периоде.
Эти работы показали, что порядковый номер, а не атомная масса, является важнейшим свойством элемента, определяющим электронную структуру атомов и связанное с нею химическое поведение соединений элемента.
Подробнее см.: Сб. Учение о периодичности. — М.: Наука, 1981.
С. 117, 134; см. также раздел 31.2.
Периодическая система элементов к началу 1988 г. включала ПО элементов, из них в природных объектах было обнаружено 89 элементов. Элементы технеций Тс (Z = 43), прометий Pm (Z = 61), астат At (Z = 85), а также элементы с порядковыми номерами Z = 93 — ПО были искусственно синтезированы с помощью различных ядерных реакций. Элементы с Z=102—107, ПО открыты учеными Объединенного института ядерных исследований в Дубне, a cZ = 108,109 — немецкими физиками. Элементы с Z = 102—105 получили названия, данные им их первооткрывателями, соответственно: жолиотий Л, резерфордий Rf, курчатовий Ku, нильсборий Ns. Остальные элементы пока названий не имеют.
Подробнее см.: Флеров Г. Н., Ильинов А. С. На пути к сверхэлементам. — М.: Педагогика, 1982.
4.4. ПЕРИОД, ЧИСЛО ЭЛЕМЕНТОВ В ПЕРИОДЕ
I Периодом называют горизонтальную последовательность элементов, начинающуюся с щелочного элемента и заканчивающуюся элементом VIHA-группы (благородным газом) с тем же максимальным значением главного квантового числа, равного номеру периода.
В современной периодической системе вне зависимости от ее форм имеется семь периодов. Все известные химические элементы распределяются по периодам следующим образом: в первом — 2,
44
во втором и третьем — по 8, в четвертом и пятом — по 18 элементов, в шестом и седьмом — по 32. Седьмой период является незаконченным, он обрывается пока на 110-м элементе. Таким образом, начиная со второго периода, существует повторяемость числа элементов в периодах, образуется как бы «парная» группировка периодов. Периоды с одинаковым числом элементов получили название диад или циклов. В пределах каждого периода осуществляется постепенный переход от типичного металла (щелочные металлы) к типичному неметаллу (благородные газы), завершающему каждый период.
Порядок формирования периодов связан с постепенным заполнением энергетических подуровней или АО электронами.
Сначала заполняется электронами энергетический уровень, расположенный ближе всего к ядру атома с п = 1. Если пк1, то 1= = 0 и mi = 0, a zns= ± 1/2. Таким образом, в первом периоде, которому соответствует значение и = 1, может находиться только два элемента: водород с одним электроном на 1s-АО и гелий с двумя электронами на 1s-АО. Количество элементов в периоде совпадает с максимально возможным числом электронов на энергетическом уровне с п ==1.
Второй период начинается с щелочного элемента лития Li (Z = 3). У лития три электрона, два из них занимают ls-АО, а третий уже вынужден заселять более высокий энергетический уровень с и = 2. Этот уровень содержит два подуровня: s и р (1 = 0 и 1=1). Число подуровней в многоэлектронном атоме совпадает со значением главного квантового числа. Минимальным значением энергии для уровня с и = 2 обладает 2s-AO, которую и занимает третий электрон. Электронная конфигурация атома лития для основного состояния: Iszs1 или [He]2s! (см. ниже энергетические диаграммы). Для сокращения формы записи электронной конфигурации все АО предыдущих периодов заменяют символом благородного газа (в квадратных скобках), завершающего предшествующий период.
Энергетические уровни атомов элемента, следующего за литием, бериллия содержат четыре электрона (Z = 4). Четвертый электрон в соответствии с принципом минимума энергии и принципом Паули займет также 2s-AO, но знак спинового квантового числа ms у этого электрона будет иной, чем у третьего электрона атома Li.
Li
Be
45
Квантовые числа электронов, занимающих 2s-AO: и = 2, / = 0, ли/ = О, т$ = +/2 и ms = -1/2. У Be, как и у Не, на s-AO находятся два спаренных электрона. Однако Be не похож по своим физико-химическим свойствам на Не. Это происходит потому, что пара электронов, размещенная на ls-АО гелия, обладает повышенной устойчивостью из-за близости к ядру атома. Пара же электронов, находящаяся на 2s-AO у бериллия, значительно удалена от ядра и, кроме того, экранирована от его воздействия электронами ls-АО. Поэтому пара 25-электронов активна и при внешнем воздействии может быть разъединена с переходом одного из электронов на 2р-АО: 2s2- 2sx2px‘
Бор (Z = 5) является первым элементом, у которого начинает заполняться электронами 2р-АО (см. энергетические диаграммы). Его электронная конфигурация: [He]2s22p1. Подобно атому Be у атома бора сравнительно легко происходит разъединение пары электронов на 2s-AO с переходом одного из них на 2р-АО. Поэтому атомы бора в возбужденном состоянии имеют три неспаренных электрона и одну вакантную 2р-АО.
Дальнейшее заполнение электронами АО у атома элементов второго периода с увеличением их порядкового номера представлено в табл. 7.
Таблица 7. Электронные конфигурации атомов элементов второго периода (от углерода до иеона) для их основного состояния
Элемент
Порядковый номер
Заселение электронами АО
Ne
6
7
8
9
10
Электронная конфигурация
[Не]2?2р2
[He]2s22p3
[Не]2?2р4
[Не]2?2р5
[Не]2?2р6
С
N
О
F
У атомов неона полностью заполнены электронами все три 2р-АО. Этот элемент завершает второй период, емкость которого в соответствии с электронной емкостью s- и p-АО равна восьми элементам:
46
от лития [Не 12s1 до неона [He]2s22p6, Электронная конфигурация У неона очень устойчива. Неон и гелий принадлежат к самым инертным в. химическом отношении веществам.
Следующий по порядку элемент натрий (Z = 11) открывает уже новый, третий период периодической системы. Электронная конфигурация натрия [Ne]3s* повторяет электронную конфигурацию лития, но с другим значением главного квантового числа. Заканчивается третий период также благородным газом — аргоном с полностью заселенными электронами 3s- и Зр-АО, [Ne]3s23p . Емкость третьего периода, как и второго, равна восьми элементам.
Формирование четвертого и последующих периодов не является столь простым, как первых трех. Уже в третьем периоде (и = 3, I = 0, 1 и 2) должны заполняться электронами пять 3d-АО (1 = 2), но эти АО остаются в основном состоянии атомов вакантными и принимают электроны с 2s- и 2р-АО только при возбуждении атомов. Заселяются же электронами 3J-AO только в четвертом периоде.
Объяснение последовательности заполнения электронами АО периодов сиг 4 дает правило Клечковского (табл. 8) или правило «и + /»:
Заполнение электронами уровней и подуровней энергии в нейтральных атомах, находящихся в основном состоянии, происходит с увеличением порядкового номера элементов последовательно от групп уровней с меньшим значением п+1 к группам с большим значением п+1. В пределах каждой группы п+1 заполнение происходит от АО с меньшим значением квантового числа и к АО с большим его значением.
Правило Клечковского, основанное на принципе минимума энергии и принципе Паули, отражает усиление зависимости энергии внешних электронов от значения орбитального квантового числа
Клечковский Всеволод Маврикиевич (1900-1972) - русский агрохимик, академик ВАСХНИЛ, лауреат Государственно»* премии.
Таблица 8. Порядок заполнения электронами АО в соответствии с правилом Клечковского
п+1 п 1 АО Хена АО Периоды - Число элементов в периоде Элементы, начинающие и заканчивающие период
1 1 0 Is 2 1 2 Н-*Не
2 2 0 2s 2 2 Li
3 2 1 2р 6 8 Ne
4 3 0 3s 2 3 Na
3 1 Зр 6 8 Аг
5 4 0 4s 2 4 К
3 2 3d 10
4 1 4р 6 18 Кг
6 5 0 5s 2 5 Rb
4 2 4d 10
5 1 5р 6 18 Хе
47
Продолжение табл. 8
п+1 Л 1 АО Sena AO Периоды Число элементов в периоде Элементы, начинающие и заканчивающие период
7 6 0 6s 2 6 Cs
4 3 4/ 14
5 2 Sd 10
6 1 f>p 6 32 Rn
8 7 0 7s 2 7 Fr
5 3 5f 14 I
6 2 6d 10 32*
* Период не завершен.
I по мере увеличения порядкового номера элемента.
К сожалению, пока не найдено удовлетворительного объяснения роли орбитального квантового числа в определении порядка заполнения электронами АО. В конечном итоге в зависимости от заряда ядра, взаимного отталкивания электронов и степени экранирования одних электронов другими распределение электронов по энергетическим подуровням или АО, характеризуемым данным значением I, становится таким, чтобы свободный атом имел минимально возможную полную энергию.
Из табл. 8 следует, что d-элементы впервые появляются в четвертом периоде, а 4/-элементы (и = 4, Z = 3) — в шестом периоде. Элементы с семью 4/-АО, заселяемыми электронами от лантана La до иттербия Yb, называют лантаноидами, что означает — подобные лантану. В седьмом периоде появляются 5/-элементы от актиния до жолиотия Л, известные под общим названием актиноиды — подобные актинию.
Подробнее см.: Клечковский В. М. Распределение атомных электронов и правило последовательного заполнения п+1 групп. — М.: Атомиздат, 1968.
Седьмой период еще не завершен, он должен заканчиваться элементом с Z“118, экарадоном.
Что касается восьмого перйода, то в нем должно содержаться уже 50 элементов, среди которых будет находиться новая группа химически близких элементов, состоящая из 18 элементов, называемых пока октадеканоидами (Z=121—138, Z = 4, g-AO).
Из табл. 8 следует также, что порядок энергетических подуровней следующий: 4s < 3d; 5s < 4d', 6s < 4/< 5d; 7s < 5f < 6d. Правило Клечковского имеет и исключения. В отдельных случаях электроны, не закончив полное заселение s-AO, могут появиться на d-AO или вместо 4/-АО заселять 5d-AO. Например, у хрома и молибдена (VIB-группа) на 4s- и 5s-AO появляется только один электрон, а остальные пять заполняют наполовину 3d- и 4d-AO, так как nd5-АО имеет высокую энергетическую устойчивость и электронная конфи
48
гурация n(^(n+l)sl оказывается у Сг и Мо более энергетически выгодной, чем (n+l)s2ncT. Особенно устойчива с?1 °-АО, поэтому электронной конфигурации валентных электронов атомов меди, серебра и золота (1Б-группа) — nd^In+Ds1 будет соответствовать более низкая энергия, чем (n+l)s па. Последняя конфигурация отвечает возбужденному состоянию атомов элементов ТБ-группы. В УП1Б2-группе также наблюдается различие в электронных конфигурациях атомов: Ni—[Ar]4s23cr, Pd—[Kr]4d105s°, Pt— [Xe]5d96s . Считают, что появление у этих атомов различной заселенности АО электронами связано с реализацией минимума полной энергии атомов, а не только минимума энергии их внешних электронов. Следует заметить, что в пятом периоде у d-элементов от ниобия Nb до палладия Pd, за исключением технеция Тс, пара s электронов крайне неустойчива и s-AO занимает только один электрон, который у палладия Pd переходит на d-AO, обладающую более низкой энергией.
Правило Клечковского отвечает основному, невозбужденному состоянию свободных атомов. У атомов d-элементов в процессе их ионизации, связанной с возбуждением и отрывом электронов, s- и d-подуровни энергии меняются местами. В возбужденном атоме внешними электронами становятся электроны, находящиеся на s-AO, которые и удаляются из атомов первыми. Энергия отрыва ns-электронов от атомов оказывается меньше, чем (и—Dd-электронов. Например. Ре°(г=26)4523<Г -* Fe*3tT4s2 - FetlDSd^s0; Ti(Z=22)4s23d2 - Ti*3d24s2 - Ti(ni)3dl4s®
4.5. ГРУППЫ ЭЛЕМЕНТОВ
Й Группой элементов называют вертикальную совокупность элемен-К тов, обладающую однотипной электронной конфигурацией и оп-в ределенным химическим сходством.
Число и структура групп зависят от формы периодической системы. В короткопериодной форме — восемь групп, от I до VIII, каждая из которых делится еще на две подгруппы: А и Б. В длин-нопериодном варианте периодической системы 32 группы. В группах VIIIB (Fe, Ru, Os), VIIIBl (Co, Rh, Ir) и VIIIB2 (Ni, Pd, Pt) мало сходства у элементов не только в электронных конфигурациях, но и в химических свойствах. Гораздо большее химическое подобие обнаруживают эти элементы по горизонтали, в периодах; поэтому их объединяют в семейство железа (Fe, Со, Ni) и семейство платиновых металлов (Ru, Rh, Pd, Os, Ir, Pt).
В длиннопериодном варианте периодической системы группы элементов объединяют в секции s-, р-, d- и /-элементов. Такое объединение не является системой классификации элементов по их физико-химическим свойствам. Секции состоят из групп, имеющих сходство в распределении электронов по АО.
Секция s-элементов содержит всего две группы (IA и ПА), каждая из которых состоит из шести элементов с общей электронной конфигурацией ns1 * 2‘
49
Секция p-элементов включает шесть групп (от ГПА до VIIIA), каждая из которых содержит по пять элементов (в VIIIA-rpynne — шесть элементов). Общая электронная конфигурация р-элементов 2 1-6
ns пр
Секция d-элементов состоит из десяти групп (от 1Б до VIIIB2), каждая из которых содержит от трех до четырех элементов с общей электронной конфигурацией ns°~*2(zi- l)^1-*10.
Наконец, секция f -элементов состоит из безымянных четырнадцати групп, каждая из которых включает только два элемента с общей электронной конфигурацией ns2(n—2)/°"* 14(п - l)d0”* *. В группах секции /-элементов уже мало физико-химического подобия, особенно в первых семи группах:
La, Се, Рг, Nd, Pm, Sm, Eu, Gd„...
Ac, Th, Pa, U, Np, Pu, Am, Cm,,...
Если Се и Th можно еще считать химически сходными элементами, то, например, уран U больше напоминает по своему химическому поведению вольфрам W, чем неодим Nd. Одной из причин подобного явления считают наблюдаемый у актиноидов ^/-элементов) так называемый размыв периодичности из-за отсутствия заметного различия в энергии 6d- и 5/-электронов.
4.6. ПЕРИОДИЧЕСКОЕ ИЗМЕНЕНИЕ СВОЙСТВ ЭЛЕМЕНТОВ
I Периодичность — это повторяемость сходства химических и некоторых физических свойств у простых веществ и их соединений при изменении порядкового номера элемента (Z), а также появление у ряда свойств, как функций Z, максимумов и минимумов количественного или качественного характера.
Периодической (дискретной) функцией является прежде всего электронная периодичность, т. е. повторяемость по мере увеличения Z сходства типов электронной конфигурации газообразных атомов с минимальным и максимальным числом неспаренных электронов.
С электронной периодичностью связана химическая периодичность простых веществ: аналогия химического поведения, однотипность химических реакций и т. п., хотя в этом случае нет сходства формул соединений, равенства числа валентных электронов, идентичности набора степеней окисления и ряда других характеристик веществ. При химической периодичности также наблюдается максимальное и минимальное различие в химических характеристиках простого вещества.
В последние годы накопился большой экспериментальный материал, представляющий собой результаты систематического изучения химических и физических свойств простых веществ и их соединений. Оказалось, что не только для простых веществ, но и для более сложных соединений многие физико-химические свойства являются четко выраженными периодическими функциями.
Различают три основных вида периодичности: вертикальную, горизонтальную и диагональную.
Рис. 6. Периодичность изменения атомных объемов
Вертикальная периодичность. Вертикальная периодичность заключается в повторяемости сходства химических и некоторых физических свойств простых веществ и их соединений в вертикальных столбцах периодической системы.
Это основной вид периодичности, в соответствии с которым все элементы объединяются в группы. Химия элементов и их соединений рассматривается на основе этого вида периодичности.
Вертикальной периодичностью обладает изменение атомных объемов простых веществ. Атомный объем Уа (смл/моль) — мера пространства, занимаемая 1 моль атомов простого вещества:
Уа = А/р,
где А — атомная масса; р — плотность вещества, г/см3.
В 1870 г. Мейер установил, что атомные объемы являются периодической функцией порядкового номера элемента (рис. 6). Например, атомные объемы всех щелочных металлов (элементы IA-группы) лежат в точках максимумов кривой Va=/(Z). Элементы VIIIA-группы (благородные газы) после щелочных металлов имеют наибольшие атомные объемы. Первый минимум кривой Va=/(Z) занимают Be, В и С, второй минимум — элементы третьего периода Mg, Al и Si. Остальные минимумы при больших значениях Z занимают элементы-аналоги VIIIE—У1ПБ2-групп.
В изменениях значений энергии ионизации атомов также наблюдается вертикальная периодичность (табл. 9). Щелочные металлы имеют наименьшее значение первой энергии ионизации, а благородные газы — максимальное. У элементов ША-группы (В и А1) значение Еи наименьшее по сравнению с соседними элементами
51
из-за наличия на p-АО всего одного электрона, экранированного от воздействия ядра слоем электронов, соответственно ls22s2 и lx 2х2р ах.
Вертикальная периодичность просматривается и в орбитальных атомных радиусах (табл. 10). В кристаллах простых веществ атомы условно представляют в виде сфер. Тогда атомный радиус — половина кратчайшего расстояния между ядрами двух атомов, сферы которых соприкасаются. Если исходить из квантово-механических представлений, то радиус атома не что иное, как расстояние от ядра до максимума радиальной функции распределения вероятности
Таблица 9. Первые энергии ионизации атомов, МДж/моль
Z Элемент E„ Z Элемент Еи
1 Н 1,31 20 Ca 0,59
2 Не 2,37 21 Sc 0,63
3 Li 0,52 22 Ti 0,66
4 Be 0,90 23 V 0,65
5 В 0,80 24 Cr 0,65
6 С 1,09 25 Mn 0,72
7 N 1,40 26 Fe 0,76
8 О 1,31 27 Co 0,76
9 F 1,68 28 Ni 0,74
10 Ne 2,08 29 Cu 0,74
11 Na 0,49 30 Zn 0,91
12 Mg 0,74 31 Ga 0.58
13 Al 0,58 32 Ge 0.76
14 Si 0,79 33 As 0,94
15 P 1,01 34 Se 0.94
16 S 1,00 35 Br 1,14
17 Cl 1,25 36 Kr 1,35
18 Ar 1,52 37 Rb 0,40
19 К 0,42 38 Sr 0,55
Таблица 10. Орбитальные радиусы атомов
Z Элемент Радиус, пм Z Элемент Радиус, пм
1 H 52,9 9 F 39,0
2 He 29,0 10 Ne 35,0,
3 Li 158,6 11 Na 171,3
4 Be 104,0 12 Mg 127,9
5 В 77,6 13 Al 131,2
6 C 59,6 14 Si 106,8
7 N 48,8 15 P 91,9
8 0 41,4 16 S 81,0
52
Продолжение табл. 10
Z Элемент Радиус, пм Z Элемент Радиус, пм
17 С1 72,5 28 N1 113,9
18 Аг 66,0 29 Си 119,1
19 К_ 216,2 30 Zn 106,5
20 Са 169,0 31 Ga 125,4
21 Sc 157,0 32 Ge 109,0
22 Ti 147,7 33 As 99,1
23 V 140,1 34 Se 90,9
24 Сг 145,3 35 Br 84,2
25 Мп 127,8 36 Kr —
26 Fe 122,7 37 Rb 228,7
27 Со 118,1 38 Sr 183,6
Примечание. Подробнее см.: Урусов В. С. Энергетическая кристаллохимия. М., Наука, 1975. С. 92.
И'(г). Атомный радиус зависит от числа ближайших соседних атомов. Из табл. 10 следует, что повторяемость больших значений радиусов наблюдается у щелочных металлов, а малых — у галогенов (см. подчеркнутые символы).
Изменение значений энергии атомизации (Еат) многих двухатомных молекул простых веществ отвечает также вертикальной периодичности (см. рис. 7). Энергия атомизации — это энергия разрыва химической связи для реакции диссоциации молекул на нейтральные атомы. Из рис. 7 следует, что максимумы на кривых £ат = /(Z) повторяются у элементов VA-группы, а минимумы — у галогенов и щелочных металлов.
Горизонтальная периодичность. Горизонтальная периодичность заключается в появлении
максимальных и минимальных значений физико-химических свойств
простых веществ и их соединений в пределах каждого периода с изменением
порядкового номера эле-
мента.
Энергия металлической связи Есв является функцией порядкового номера элемента: Е№ = /(Z). Ме
Рис. 7. Энергии атомизации двухатомных молекул простых веществ, образованных элементами второго и третьего периодов
таллы с электронной конфигурацией ns2 (и—1)а и nsl(n—1)а и отличаются
пониженным значением £св по сравнению с анало
53
гичным значением энергии их соседей по периоду. В четвертом периоде минимум энергии связи наблюдается у атомов Мп и Zn, в шестом периоде — у атомов Re и Hg.
В соответствии с горизонтальной периодичностью происходит изменение степеней окисления элементов в периодах. Например, во втором периоде:
Li(+I) -» Ве(+П) -» В(+Ш) -» C(+IV) N(+m,—III) -» О(—II) -* F(—I)
[He] 2s1 2s2 2s22pl 2s22p2 2s22p3 2s22pA 2s22p5
Повторяемость степеней окисления наблюдается и в ряду лантаноидов:
(+IV)
(+П1)
(+11)
— Се
6s
Периодическое изменение степеней окисления элементов связано со строением их внешней электронной оболочки. Например, у лития на 2s - АО один электрон, а у фтора не хватает одного электрона до устойчивой 2s^2pb электронной конфигурации. Отсюда одинаковые по абсолютному значению степени окисления. Степень окисления (+IV), известная у церия Се, повторяется у тербия ТЬ, отдающего, как и Се, два электрона с 6s-AO и два электдона с 4/-АО, после чего последняя у ТЬ приобретает устойчивую 4/-кон-фигурацию.
В изменении значений энергии ионизации (см. табл. 9) наблюдается не только вертикальная, но и горизонтальная периодичность. Например, увеличение первой энергии ионизации у бериллия Be по сравнению с литием Li и бором В повторяется у азота N и связано с существованием устойчивых электронных конфигураций: Be; [He]2s , N; [Не]2?2р3.
Горизонтальная периодичность обнаруживается в изменении сродства атомов элементов к электрону. В каждом периоде оно является наименьшим у элементов ПА- и VA-групп, так как в этих группах атомы элементов имеют устойчивые электронные конфигурации.
Распространенность лантаноидов в земной коре определенно обладает горизонтальной периодичностью: элементы с четным значением Z более распространены, чем элементы с нечетными порядковыми номерами, так как ядра атомов при четном числе протонов и нейтронов более стабильны.
На основе горизонтальной периодичности можно предсказывать Молекулярные формулы и химические свойства соединений металлов и неметаллов с водородом. Например, со второго по четвертый
54
период число атомов водорода, приходящееся на один атом металла или неметалла, закономерно сначала увеличивается от 1 до 4, а затем уменьшается до 1, в частности, во втором периоде:
LiH-» ВеН2- ВН3(В2Н6) - СН4-» NH3- ОН2-» FH
В группе VIIIB горизонтальная периодичность преобладает над вертикальной. Элементы Fe, Со и Ni имеют между собой больше физико-химического сходства, чем с элементами, расположенными вместе с ними в группах; например, химия железа Fe в очень небольшой степени напоминает химию рутения Ru и осмия Os.
Диагональная периодичность. Под диагональной периодичностью понимают повторяемость сходства химических свойств простых веществ и их соединений по диагоналям периодической системы.
Сходство в химических свойствах между элементами в диагональных направлениях периодической системы вызвано тем, что нарастание неметаллических свойств в периодах слева направо приблизительно уравновешивается эффектом увеличения металлических свойств в вертикальном направлении, сверху вниз.
Например, литий Li похож на магний Mg во всем, что отличает его от натрия Na, бор В по химическому поведению больше напоминает кремний Si, чем алюминий А1, который является аналогом бора по ША-группе:
Период IA ПА ША IVA VA
2 Li Be В С N
3 Na Mg А1 51 Р
К числу общих химических свойств у лития и магния следует отнести термическую неустойчивость их нитратов и карбонатов, образование нитридов при взаимодействии с азотом, малую растворимость в воде гидроксидов, фторидов, фосфатов и карбонатов, склонность к образованию кристаллогидратов.
Диагональная периодичность Be-» Al (см. фрагмент периодической системы) выражается в том, что оба металла одинаково реагируют с кислотами и гидроксидами щелочных элементов, их оксиды и гидроксиды амфотерны:
Ве+2КОН+2Н2О=К2 [Be (ОН) 4+Н21 А1+ЗКОН+ЗН2О=К3 [А1 (ОН)6 ]+3/гН21
Ве(ОН)2+КОН=К2[Ве(ОН)4]; А1(ОН)3+ЗКОН=К3[А1(ОН)6 ]
Галогениды бериллия Be, как и галогениды алюминия А1, подвергаются значительному гидролизу, а сульфаты образуют с сульфатом калия двойные соли состава К2Ве (SO4) 2 и KAI (SO4) 2. Оксиды бериллия и алюминия отличаются высокими температурами плавления.
55
Бор и кремний также очень сходны между собой по химическому поведению. Простые вещества инертны и тугоплавки, оксиды обладают кислотными свойствами:
В2О3+2КОН-2КВО2+Н2О; SiO2+4KOH=K4SiO4+2H2O
Галогениды подвергаются необратимому гидролизу:
ВС1з+ЗН2О=В (ОН) з+ЗНС1; SiC14+4H2O=H4Si04+4HCl
Кислоты В(ОН)з, H4SiO4 принадлежат к числу очень слабых кислот, а их соли имеют цепочечную или циклическую структуру. Оба элемента при взаимодействии их фторидов с фтороводородом образуют сильные кислоты:
BF3+HF=H [BF41; SiF4+2HF=H2 !SiF6 ]
Для неметаллов диагональная периодичность охватывает значительное число элементов. Так, диагональ С * Р * Se -» I пересекает четыре элемента. Все они входят в состав кислотных оксидов (СО2, Р4О10, БеОз, I2O7) и соответствующих кислот (Н2СО3, Н3РО4, H2SeO4, H5IO6). Простые вещества относятся к неметаллам-диэлектрикам, а элементы в низших степенях окисления проявляют восстановительные свойства.
Две диагонали Al - Ge * Sb и Zn * In * Pb включают элементы, оксиды и гидроксиды которых обладают амфотерными свойствами. Диагональ Ni * Ag -» Hg содержит элементы с повторяемостью устойчивости низших степеней окисления: Ni(+II); Ag(+I); Hg(+I).
В каждой диагональной серии элементов нет, конечно, сходства химических формул и тождества электронных конфигураций, но зато есть качественное химическое сходство, которое проявляется то в большей, то в меньшей степени.
Объединение вертикальной, горизонтальной и диагональной периодичности называют «звездной периодичностью».
Звездная периодичность (или «геохимическая звезда») помогает геохимикам в прогнозировании поисков тех или иных соединений элементов в различных минералах и рудах. Звездная периодичность для индия In и германия Ge представлена на прилагаемой схеме:
Период ПБ ША 1VA VA
3 Si *
4 Zn *- -Ga ♦ Т — Ge — I ►As
5 1 Sn
Период ПБ ША IVA
4 Zn Ga L I Ge
5 Cd*- \ b' — In — | -►Sn
6 1 T1 Pb
5б
В рудах цинка Zn и олова Sn, в меньшей мере в рудах свинца РЬ, почти всегда встречается индий In. Он находится вместе с Ga и Т1 в таких минералах, как галенит PbS и сфалерит ZnS, в котором содержание In доходит до 0,1%. Вместе с галлием Ga индий содержится в бокситах, важнейшей алюминиевой руде, а вместе с Ge — в некоторых ископаемых углях.
Подробнее см.: Федоров П. И. Ж. неорг. химии. 1984. Т. 29. С. 535.
Германий является спутником углерода и кремния, он постоянно присутствует в природных силикатах и алюмосиликатах. Каменные угли, антрациты — важнейший источник германия. Германий в основном связан с органической частью угля. Присутствует Ge и в сульфидных цинковых рудах. Постоянным спутником Ge является мышьяк As, поэтому разделение Ge и As относится к сложным технологическим задачам.
Кроме рассмотренных видов периодичности существуют и другие более сложные виды периодичности, среди которых следует выделить вторичную периодичность, открытую Бироном в 1915 г.
Бирон Евгений Владиславович (1874-1919) - русский физи-кохимик, профессор Петербургского лесного института и Томского технологического института.
Подробнее см.: Мельников В. П., Дмитриев И. С. Дополнительные виды периодичности в периодической системе Д. И. Менделеева.— М.: Наука, 1988.
♦ * *
Периодический закон и периодическая система являются основой современной неорганической химии. Они относятся к числу таких общих научных закономерностей, которые реально существуют в природе и поэтому в процессе эволюции наших знаний никогда не потеряют своего значения. Однако говорить о законченности периодической системы нельзя. Она непрерывно совершенствуется и развивается. Д. И. Менделеев 10 июля 1905 г. записал в своем дневнике: «Будущее не грозит периодическому закону разрушением, а только надстройки и развитие обещает».
Среди всех элементов периодической системы только один элемент — водород — не может быть закреплен за какой-либо группой. От элементов IA-группы (щелочных элементов) водород отличается неметаллическими свойствами, возможностью появления его в соединениях в степени окисления (—I); от элементов VIIA-группы (галогенов) его отличают строения электронной оболочки и восстановительные свойства. Водород по химическому поведению похож на бор (элемент ША-группы) и элементы IVA-группы, особенно на углерод.
Элементы второго периода характеризуются сильным взаимодействием ядра и электронов, наименьшими размерами атомов (см. табл. 10). Поэтому они отличаются по свойствам от своих более тяжелых аналогов, в частности, Li менее реакционноспособен, чем
57
другие щелочные металлы, a F - более реакционноспособен, чем остальные галогены.
В силу диагональной периодичности первый элемент каждой группы второго периода (кроме Не) обнаруживает свойства, близкие по отношению к элементу, стоящему от него в следующей группе справа и ниже. Элементы третьего периода обнаруживают другую особенность: из всех элементов nA-группы они оказываются наиболее близкими по химическим свойствам к первым элементам иБ-групп.
Для атомов элементов всех групп, кроме фтора и кислорода, максимальная положительная степень окисления равна номеру группы, а максимальная отрицательная степень окисления для атомов элементов IVА—VIIA-групп равна номеру группы минус восемь. Например, для азота и фосфора в некоторых соединениях (NH3, РН3) такая степень окисления равна (—III), а в соединениях кислорода и серы (Н2О, H2S) — (—И).
Заполнение электронами энергетических подуровней или атомных орбиталей газообразных атомов в их основном состоянии подчиняется правилу « п+1» или правилу Клечковского. Исключения из этого правила связаны с появлением электронов на tZ-AO. В свободном атоме cZ-АО являются большими по размерам и размытыми в пространстве. Когда они заселены электронами наполовину или полностью, то размеры их меньше, орбитали сжаты в пространстве, уменьшена и их энергия. Поэтому у хрома (элемент VIB-группы) электронная конфигурация [Аг]3гг4х1, а не [Ar^sorZ4, так же как у меди (элемент 1Б-группы) электронная конфигурация [Ar ]3cZ104sl, а ре [Ar]4s 3cZy. Квантово-механические расчеты показывают, что 4s -подуровень лежит здесь выше З^-подуровня.
У атомов в возбужденном состоянии, у ионов и химически связанных атомов расположение энергетических подуровней становится иным, такие атомы не подчиняются правилу « п+1».
Остается пока без конкретного ответа вопрос о пределе построения периодической системы, о конце естественного ряда химических элементов. Квантово-механические расчеты показали, что обрыв ряда элементов ожидается в области значений Z = 150—168. Для атомов элементов, завершающих периодическую систему, с ростом Z сильно увеличиваются размеры ядер. При этом электроны, занимающие подуровни, характеризующиеся значениями п - 1 и Z = 0; п = 2 и Z = 0, начнут сливаться с ядром, превращая протоны в нейтроны. Вместо синтеза новых ядер появятся изотопы известных тяжелых химических элементов.
Упражнения к главе 4
1. Начиная с какого значения главного квантового числа п возможно появление у атома электронов, у которых / = 4? Атомы какого элемента с / = 4 вам известны?
2. О чем говорят буквы А, Б и Б2 после номера группы?
3. В каких периодах впервые появляются d- и f-элементы?
4. Объясните, почему элемент Н нельзя помещать ни в IA-, ни в VIIA-группы?
58
5. Какие вы знаете исключения из правила Клечковского и чем они вызваны?
6. Расположите в каждой из трех групп АО в порядке возрастания их энергии: 4d, 4s, 5р; 5d, 4f, 6s, 6p; 3d, 4p, As- и укажите, к какому периоду относятся элементы, имеющие электроны на этих АО.
7. 8 проявлении каких химических свойств вы усматриваете существование диагональной периодичности у бора и кремния, углерода и фосфора?
8. Какие из указанных ниже электронных конфигураций соответствуют основным состояниям атомов, а какие — возбужденным: [Heps' 2р2; [Ne]3s'3p3; [Ne]3s23p5; [Arps'3d5?
9. Составьте электронные конфигурации следующих атомов: 24^г, 50$п, 46 Pd, 5з I, 2gCu.
Глава 5. ХИМИЧЕСКАЯ СВЯЗЬ И СТРОЕНИЕ МОЛЕКУЛ
Учение о природе химической связи является основой всей химии. Исследователей всегда интересовало, почему одни атомы соединяются в молекулы, а другие такой способностью не обладают. Почему у молекулы появляются свойства, отличающиеся от свойств образующих ее атомов? Почему одни молекулы очень устойчивы, а другие распадаются на атомы уже в обычных условиях? Почему некоторые вещества состоят из ионов, а другие — из молекул? Ответы на эти и подобные им вопросы уже можно получить после знакомства с излагаемой ниже элементарной теорией химической связи. Элементарное изложение теории химической связи может создать иллюзию ее окончательной разработанности. На самом деле наши познания в области химической связи только начали приобретать контуры бесконечно разнообразной реальности.
Подробнее см.: Хьюи Дж. Неорганическая химия. — М.: Химия, 1987; Пиментел Г., Спратли Р. Как квантовая механика объясняет химическую связь. — М-: Мир, 1973.
По современным представлениям химическая связь имеет электрическое происхождение. В ее образовании участвуют преимущественно внешние электроны атомов. Между электронами и ядрами атомов возникают электростатические силы притяжения, удерживающие атомы или ионы друг около друга в виде достаточно стабильного агрегата атомов или ионов.
Обычно выделяют три типа химической связи: ковалентную, ионную и металлическую. Эта классификация является условной. Ковалентная связь по своей природе представляет универсальный тип химической связи. Ионную же связь можно рассматривать как предельный случай ковалентной связи между атомами, резко отличающимися по электроотрицательности. Металлическая связь характерна только для металлов и их сплавов и
59
имеет ту же природу, что и ковалентная связь, отличаясь от последней только некоторыми особенностями.
Для объяснения природы ковалентной связи и механизма ее образования используют преимущественно две основные теории, известные под названием метода валентных связей (метода ВС) и метода молекулярных орбиталей (метода МО). В настоящее время в теоретической химии доминирует метод МО. Тем не менее элементарное знакомство с теорией ковалентной химической связи полезно начать с метода ВС—метода, дающего более наглядное представление об образовании и строении молекул.
5.1. ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ
Понятие об электроотрицательных и электроположительных элементах является одним из наиболее старых понятий неорганической химии.
После экспериментального открытия электрона в 1898 г. химики стали задумываться над тем, какую роль он играет в образовании химической связи. Высказывались предположения о том, что электроотрицательные атомы, получая электроны от электроположительных атомов, приобретают отрицательный заряд и взаимодействуют с последними как отрицательные и положительные ионы.
Полинг предложил использовать понятие электроотрицательности (ЭО) элемента для оценки различных свойств химической связи. По определению Полинга ЭО — это способность атома в молекуле или сложном ионе притягивать к себе электроны, участвующие в образовании связи. Однако ЭО не является сродством атома к электрону, поскольку она относится не к изолированным, а к химически связанным атомам в молекуле. ЭО атома в молекуле представляет собой его способность конкурировать с друтм, с ним связанным атомом, в притяжении общих электронов, участвующих в образовании между ними химической связи.
Полинг Лайнус (р. 1901) — американский физик и химик, дважды лауреат Нобелевской премии. Основные его работы — природа химической связи и строения молекул.
Электроотрицательность элементов связана, с одной стороны, со склонностью свободного атома удерживать свои внешние электроны (энергия ионизации атома), а с другой стороны, со склонностью атома притягивать дополнительные электроны (сродство атома к электрону). Поэтому ЭО часто рассматривается как функция этих двух видов энергии.
Очевидно, чем больше химических связей у атома, тем большей способностью он обладает к передаче электронов, и ЭО должна изменяться с изменением степени окисления элементов. Так, сера в SCh, несомненно, должна иметь большую ЭО, чем сера в SFb, в котором она теряет значительное число электронов. Тем не менее
60
допускают, и в этом слабость концепции ЭО, что значение ЭО для i-ro атома в молекуле не зависит от числа его химических связей с другими атомами. За ЭО i-ro элемента принимают некоторую эмпирическую, усредненную безразмерную величину %,. Наиболее часто используемой шкалой ЭО является шкала Полинга, рассчитанная из термохимических данных. За начало отсчета в этой шкале произвольно принята величина ЭО наиболее электроотрицательного элемента фтора, xf“4,0 (табл. 11).
Таблица И. Электроотрицательности s- и p-элементов в их стабильных степенях окисления
IA НА IIIA IVA VA VIA VIIA
Li Be В -Н-» 2,1 C N 0 F
1,0 1,5 2,0 2,5 3,0 3,5 4,0
Na Mg Al Si P S Cl
0,9 1,2 1,5 1,8 2,1 2,5 3,0
К Ca Ga Ge As Se Br
0,8 1.0 1,6 1,8 2,0 2,4 2,8
Rb Sr In Sn Sb Те I
0,8 1,0 1,7 1,8 1.9 2,1 2,5
Cs Ba Tl(III) Pb(II) Bi Po At
0,7 0,9 1,8 1,6 1,9 2,0 2,2
Примечание. Значения х, взяты из кн. Л. Полинга «Общая химия» (М., Мир, 1974. С. 168.).
Подробнее см.: Бацанов С. С. Электроотрицательность элементов и химическая связь. — Новосибирск: Изд-во СО АН СССР, 1962.
В шкале ЭО каждому элементу приписывается вполне определенное значение величины х< (табл. 11), не зависящее от партнера, с которым данный элемент вступает в связь.
Электроотрицательность d-элементов изменяется в пределах от 1,3 до 2,4. Наиболее электроотрицательными среди них являются золото Au (х Au “2,4) и платиновые металлы (х,=2,2).
Из табл. 11 следует, что в каждом периоде периодической системы элементов ЭО возрастает слева направо, т. е. с увеличением атомного номера элемента, а в каждой группе убывает, как правило, сверху вниз. Таким образом, с увеличением ЭО элементов их металлические свойства ослабевают. Чем дальше отстоят два элемента один от другого по шкале ЭО, тем большую склонность они обнаруживают к образованию ионной связи.
При составлении формул соединений из неметаллических элементов более электроотрицательные из них всегда указываются правее: OF2, SiBnFa, SChO, BnN и т. д. (см. раздел 2.4).
61
5.2. ПРИРОДА КОВАЛЕНТНОЙ СВЯЗИ И МЕХАНИЗМ ЕЕ ОБРАЗОВАНИЯ
Первую гипотезу о природе ковалентной химической связи выдвинул Льюис (1916). Он предположил, что связь между двумя атомами образуется вследствие появления между ними общей пары электронов, для образования которой каждый атом выделяет по одному неспаренному электрону. Например, образование молекулы F2, по мнению Льюиса, вызвано обобществлением неспаренных электронов и образованием вокруг каждого из связанных атомов стабильного электронного октета, восьмиэлектронной оболочки благородного газа:
if/T4 *f: = :fj f:
Льюис Гильберт (1875—1946) - американский физико-химик, разработал современные представления о валентности, автор новой теории кислот и оснований и многих работ по химической термодинамике.
Пару электронов между атомами впоследствии стали изображать соединительной чертой, валентным штрихом (например, F—F, Н—Н, I—Вг), широко использованным еще Бутлеровым для обозначения связи.
Бутлеров Александр Михайлович (1828-1886) - русский химик-органик, создатель теории химического строения органических веществ, действительный член Петербургской АН.
На основе идеи Льюиса была разработана теория химической связи, получившая название метода валентных связей (метод ВС). Теория охватывала все молекулы, простые и сложные, а также и твердые вещества.
Метод ВС позволяет резличать три механизма образования ковалентной связи: обменный, донорно-акцепторный и дативный.
Обменный механизм образования ковалентной связи. К обменному механизму относят те случаи образования химической связи, когда каждый из двух связываемых атомов выделяет для обобществленной пары по электрону, как бы обмениваясь ими. Рассмотрим силы, действующие в молекуле АВ, имеющей в пространстве между ядрами пару электронов еГ и ei, каждый из которых ранее принадлежал одному из атомов (рис. 8). Так как ядерные движения происходят гораздо медленнее электронных, то ядра молекулы АВ считают неподвижными; в электростатическом поле их происходит перемещение неразличимых электронов е\ и ег . Вследствие электростатического взаимодействия электрона е\ с ядрами А и В появляются силы /1а и fib, причем вектор силы направлен от положительного заряда к eZ
отрицательному. По закону Кулона /- —|, где Ze — заряд ядра атома, еог
г — расстояние между электроном и ядром, а £о — электрическая постоянная. Аналогично силы/2а и fib появляются при взаимодействии
62
Рис. 8. Взаимодействие электронов с ядрами двух атомов: а — образование химической связи; б — отсутствие взаимодействия у двух атомов
электрона ег с теми же ядрами А и В. Полная сила Fa, приложенная к ядру А, будет равна векторной сумме сил/10 и/2а, a Fb — векторной сумме сил /ль и fib (рис. 8, а). В этом и состоит наиболее важное свойство электрических сил, заключающееся в том, что сила взаимодействия протона и электрона не изменяется при наличии второго, третьего и т. д. электронов. Из рис. 8, а следует, что полные силы Fa и Fb стремятся сблизить ядра А и В. Однако по мере сближения ядер увеличиваются силы их отталкивания For. Сближение ядер прекращается, как только наступит равновесие сил отталкивания и сил их сближения: Гд-Fot; Fb“FOr. Если обобществленная пара электронов окажется по той или иной причине слева от ядра А или справа от ядра В, то образование связи не произойдет. Например, при расположении электронов еГ и е2 правее ядра В на последнее будет действовать полная сила Fb, совпадающая по направлению с силой отталкивания FOT (рис. 8, б). Суммарная сила F=Fb+Fm будет стремительно удалять ядро В от ядра А. Полная же сила Fa окажется небольшой из-за значительного удаления электронов е\ и ei от ядра А. Ее стремление приблизить ядро А к ядру В будет в значительной степени нейтрализовано силой Fm ядра А.
Отсюда следует, что для связывания ядер двух атомов необходимо, чтобы электроны большую часть своего времени находились в пространстве между ядрами. Поэтому эта область в молекуле получила название области связывания. Вне этой области равнодействующая всех сил будет способствовать разъединению атомов, будет препятствовать образованию связи. Такую область стали называть разрыхляющей.
Не следует понимать пару электронов в виде каких-то материализованных точечных зарядов, расположенных в центре между ядрами. Маловероятно, что оба электрона с противоположными спинами окажутся очень близко друг к другу, их взаимное отталкивание сохраняется и в этом случае, только движение приобретает
63
более скоррелированный характер в области связывания (области наиболее вероятного их пребывания).
Чтобы произошел обмен неспаренными электронами у атомов А и В (их объединение), необходимо проникновение одной АО в другую, т. е. их перекрывание. Только тогда электронная пара становится общей для двух ядер связываемых атомов. В этом и заключается действие обменного механизма образования ковалентной химической связи.
Чтобы перекрывание АО произошло, необходимо сближение ядер А и В на небольшое расстояние, порядка 100—200 пм. Тогда между ядрами образуется зона повышенной электронной плотности, иначе своеобразный электронный мостик. Чем больше перекрывание АО, тем выше электронная плотность между ядрами, тем прочнее химическая связь. При образовании сильной химической связи АО как бы втягиваются друг в друга и центрируются в пространстве между ядрами (рис. 9). После перекрывания двух АО пара электронов уже принадлежит каждой из них, а в соответствии с принципом Паули на одной АО не могут находиться два электрона с одинаковым значением спинового квантового числа. Когда пара электронов с
Рис. 9. Перекрывание атомных орбиталей:
а — перекрывание АО с образованием химической связи; б — перекрывание АО, не приводящее к образованию химической связи
64
Рис. 10. Донорно-акцепторный (а) и дативный (б) механизмы образования химической связи.
противоположными спинами находится в области связывания, то вероятность того, что другие электроны будут находиться поблизости, очень мала. Отсюда и возникает представление о паре электронов как об облаке заряда, занимающем определенный объем.
Атомные орбитали могут перекрываться только в том случае, если они обладают одинаковыми свойствами симметрии относительно межъядерной оси. Перекрывание возможно s- и pz-AO, р- и р-АО, если они ориентированы одинаковым образом относительно осей координат, например в случае, представленном на рис. 9, а. Симметрия s- и pz-AO относительно межъядерной оси будет одна и та же. Если же симметрия перекрывающихся АО относительно оси А—В различна (рис. 9, б), химическая связь не образуется. Например, при перекрывании s- и ру-АО или ру- и рх-АО возникнут две области перекрывания, равные по величине, но противоположные по знаку волновой функции. Суммарное перекрывание окажется равным нулю.
Донорно-акцепторный и дативный механизмы образования связи. Помимо обменного механизма образования ковалентной связи метод ВС допускает существование еще двух других механизмов. Один из них связан с передачей неподеленной пары электронов от атома А на вакантную АО атома В (рис. 10, а).
Передача неподеленной электронной пары сопровождается также перекрыванием двух АО и образованием области повышенной элек-
3—1258
65
тронной плотности между ядрами. Этот механизм образования связи получил название донорно-акцепторного (рис. 10, а). В этом случае нет проявления каких-либо новых сил, приводящих к образованию нового ^гипа химической связи. Например, присоединение фторид-иона F в реакции Dbi 3 + F~ * [bf4] происходит по донорно-4.________________________!
акцепторному механизму. Вакантная p-АО бора в молекуле BF3 акцептирует пару электронов от фторид-иона F- с его p-АО путем перекрывания с этой АО. В образовавшемся анионе [BF4]- все четыре ковалентные связи В—F равноценны по длине и энергии, несмотря на различие в механизме их образования. Напомним, что в исходной молекуле BF3 все три связи В—F появились по обменному механизму.
Атомы, внешняя электронная оболочка которых состоит только из s- и p-АО, могут быть либо донорами, либо акцепторами непо-деленной пары электронов. Атомы, у которых внешняя электронная оболочка включает еще и d-AO, уже могут выступать одновременно в роли и донора, и акцептора неподеленных пар электронов. Чтобы отличить эти два механизма образования связи, приводящие к про
тивоположным электронным смещениям, ввели понятие дативного механизма образования связи, или da — рл-взаимодействия.
Простейшим примером проявления дативного механизма при образовании связи служит взаимодействие двух атомов хлора (рис. 10, б).
Два атома хлора в молекуле С1г образуют ковалентную связь по обменному механизму, объединяя свои неспаренные Зр-элект-роны. Кроме того, атом С1-1 передает неподеленную пару электронов с Зр-АО атому С1-2 на вакантную 3d-AO, а атом 0-2 — такую же пару электронов на вакантную 3d-АО атома 0-1. Каждый атом хлора выполняет одновременно функции и акцеп-
Рис. 11. Схема образования AliCU: длины связей: 1 —206 пм; 2 — 206 пм;
3 и 4 — по 221 пм
тора, и донора. В этом и заключается дативный механизм образования ковалентной связи. Действие дативного механизма связи приводит к увеличению прочности связи. Поэтому молекула С1г является более прочной, чем молекула F2, ковалентные связи в которой образовались только по обменному механизму. Энергии разрыва связей в молекулах F2 и С12 равны соответственно 159 и 243 кДж/моль.
Ковалентные связи, образованные по донорно-акцепторному механизму, имеют широкое распространение.
66
Они являются причиной полимеризации неорганических соединений, гидратации ионов, появления в растворе комплексных соединений. Например, молекулы А1С1з и FeCb в парообразном состоянии (вблизи температуры кипения) образуют димеры состава AI2CI6 и FeiCle, структура которых содержит два мостиковых атома хлора (рис. 11). В димерах ковалентные связи 7, 2 и 3 образованы по обменному механизму, а связи 4 — по донорно-акцепторному. Каждый мостиковый атом хлора удален от атомов А1 на одинаковое расстояние й химические связи 3 и 4 полностью равноценны, несмотря на различие в механизме их образования. При донорно-акцепторном механизме образования связи 4 (Cl* -» А1*) не происходит полного переноса пары электронов от хлора к алюминию, электронная плотность равномерно распределяется между связями 3 и 4.
С позиций донорно-акцепторного механизма образования связи можно объяснить число кислородных кислот хлора НС1О, НСЮг, НСЮз и НСЮ4. В молекуле оксохлората (I) водорода Н—О—С1: у атома хлора остается три неподеленных пары электронов. К атому хлора поэтому возможно присоединение максимум трех атомов кислорода по донорно-акцепторному механизму. Допускают, что каждый присоединяемый атом кислорода перед образованием связи С1—О объединяет свои неспаренные электроны, освобождая одну из p-АО для приема пары электронов от атома хлора:
О, 2/-А0 f| f f
При таком расположении электронов в возбужденном атоме кислорода нельзя утверждать о нарушении правила Гунда (см. раздел 3.6), так как последнее относится к атому, находящемуся в основном состоянии. Можно предположить, что подобная рекомбинация электронов в атоме кислорода снимает вырождение с трех p-АО и одна из них, уже вакантная, приобретает другое значение энергии, становится активной для участия в образовании химической связи.
Характерные особенности ковалентной связи. К характерным особенностям ковалентной связи относят ее направленность и насыщаемость, а следовательно, и целочисленность связей.
Если два атома водорода образовали связь путем объединения своих неспаренных электронов, то присоединение третьего атома водорода уже невозможно:
В случае присоединения трех атомов водорода в области связывания окажутся три электрона, а так как область связывания (область перекрывания) принадлежит каждой из трех АО водорода, то называется, что на каждой АО будет находиться три электрона, а 67
Рис. 12. Образование химических связей по обменному механизму в молекулах Р4 (а) и H2S (6)
это противоречит принципу Паули. В области связывания двух атомов может находиться только два электрона с противоположными спинами. Если удалить один электрон, то образуется реально существующий ион H^, в котором в области перекрывания будет только два электрона с противоположными спинами.
Принцип Паули запрещает использование одной и той же АО дважды в образовании химических связей. В этом и заключается насыщаемость ковалентной связи.
Если же у атома есть несколько АО с неспаренными электронами, то, естественно, возможно образование таких молекул, как Оз, Ss, Р4 и др. Например, существование тетраэдрической молекулы Рд обязано перекрыванию трех p-АО каждого атома фосфора по обменному механизму е p-АО трех других атомов фосфора, каждая из которых содержит по одному неспаренному электрону (рис. 12). Любая p-АО только один раз используется в образовании ковалентной связи. Таким образом, взаимодействие двух атомов, приводящее к образованию ковалентных связей, своей насыщаемостью отличается от взаимодействия электрических зарядов и больших масс (силы тяготения). Последние два вида взаимодействия не знают насыщения. Если положительный заряд притягивается к одному отрицательному, то это не мешает ему притягиваться и к другим отрицательным зарядам. Вследствие насыщаемости ковалентной связи молекулы имеют определенный химический состав.
Перекрывание АО вдоль прямой линии, проведенной через ядра взаимодействующих атомов, придает ковалентной связи определенную направленность. Направленные ковалентные связи получили
68
Рис. 13. Различные виды «связи
специальное название ординарных или «сигма» O'-связей. Между двумя атомами в молекуле возможна только одна O'-связь. Все о-связи обладают осевой симметрией относительно межъядерной оси (рис. 13). Фрагменты молекулы могут вращаться вокруг межъядерной оси без нарушения степени перекрывания АО, без деформации O'-связи.
Рис. 14. Кратные связи, образующиеся при перекрывании р-АО . атомов азота в молекуле Nj:
а — образование а- и лг-связей; б —образование лг-связи
69
Рис. 15. Различные виды л-связи между атомами А и В
Химические связи, образованные с участием s-AO, всегда являются О-связями. Так как О-связи строго ориентированы в пространстве, в зависимости от состава молекулы они могут находиться под определенным углом друг к другу. Углы между О-связями получили название валентных углов. Например, в молекуле H2S две 0-связи S—Н, образованные по обменному механизму перекрыванием s-AO атомов водорода и p-АО атома серы, находятся под углом 92° (см. рис. 12, б). Совокупность направленных, строго ориентированных в пространстве о-связей создает структуру молекулы.
Если два взаимодействующих атома имеют по нескольку неспаренных электронов и связь между ними осуществляется более чем одной парой электронов, то между этими атомами появляются кратные связи (двойные, тройные и т. д.). Например, атом азота с электронной конфигурацией [He|2s 2/> образует одну O'-связь при перекрывании pz-AO и две другие связи при перекрывании рх- и Ру-АО (рис. 14), получившие название «пи-связей» (Л-связей). Образование Л-связей происходит при перекрывании АО, расположенных перпендикулярно или под иными углами к О-связи и параллельно друг к другу (рис. 15). С появлением л-связи, не имеющей осевой симметрии, свободное вращение фрагментов молекулы вокруг О-связи прекращается. Любой поворот одного из связанных л-связью атомов вокруг межъядерной оси (вокруг О-связи) приведет к разрыву Л-связи. Если электроны, образующие Л-связь, имеют равную нулю вероятность нахождения в плоскости молекулы, то такую плоскость называют узловой. Электроны Л-связей составляют делокализованную систему в области скелета O'-связей молекулы.
Перекрывание АО при Л-связывании меньше, чем при о-связы-вании. Поэтому Л-связи, как правило, слабее О -связей. Электроны, образующие Л-связь, легче вырываются из молекулы и, следовательно, придают ей большую реакционную способность. Для отличия Л-связей от O'-связей их обозначают штрихами; например, в молекуле
70
Рис. 16. Схема образования «дельта» связи(Л-связи) между flU-AO
jq2 (:bfeN:). Сравнительно небольшое число электроотрицательных элементов, прежде всего таких, как С, N, О, образует двойные и тройные связи. Эти элементы имеют необходимое число неспаренных электронов, которые могут участвовать в образовании двух и более связей. Примерами соединений с двойными и тройными связями являются: диоксид углерода О—С—О, монооксид углерода :С—О:, азот :jfeN:, оксид диазота :N?hN *
>0:: циановодород Н—C^N:
Помимо О- и Л-связей возможно образование еще одного вида связи — (5-связи («дельта-связи») (рис. 16). Обычно (5-связь появляется после образования атомами О- и Л-связей при наличии у атомов d- и /-АО. «Дельта-связь» образуется при перекрывании J-AO (dXy, dxz или dyz) в четырех местах, т. е. всех четырех «лепестков». Для образования O'-связи соответствующие d-AO должны быть точно расположены друг под другом. Смещение «лепестков» одной из d-AO в ту или другую сторону вызовет ослабление d-связи, а при шахматном их расположении — полный разрыв d-связи. С появлением d-связи кратность связи увеличивается до четырех-пяти. Связи располагаются по возрастанию их энергий в следующий ряд: д «Л< О.
Химические связи, образованные более чем одной парой электронов, получили название кратных связей. Кратность связи (или порядок связи, символ (D) между двумя атомами определяется числом пар электронов, участвующих в ее образовании. В молекулах ?2, N2, СО и СОг значение (О равно соответственно 1, 3, 3 и 2.
Высокая кратность связи, участие в образовании связей между Двумя атомами четырех или пяти пар электронов приводят к усилению связи и уменьшению ее длины.
Примером соединений, содержащих четырехкратные связи, являются соединения с октахлородиренатными (III) анионами (рис. 17). Каждый атом рения образует по донорно-акцепторному механизму 4<7-связи с четырьмя атомами хлора с использованием своих вакантных s-, d- и p-АО. Между атомами Re (Т-связь образуется перекрыванием JZ2-AO, а две тт-связи появляются после перекрывания двух dxz- и двух dyz -AO. Одна д связь образуется при перекрывании двух dxy-AQ.
Валентность элемента. В настоящее время под валентностью химического элемента понимают способность свободных его атомов к образованию определенного числа ковалентных химических связей, невидно, если в атоме имеется п неспаренных электронов и т неподеленных электронных пар, то этот атом может образовать п+т
71
Re, 6s2 5d5
ковалентных связей с другими атомами. Валентность такого атома будет равна п+т.
Перед образованием химических связей атомы некоторых элементов переходят в возбужденное состояние называемое валентным’ состоянием, с увеличением числа неспаренных электронов. Возбужденное состояние экспериментально наблюдать невозможно, состояние является гипотетическим.
Например, бериллий Be в основном состоянии (l.s 2<г) имеет
Рис. 17. Четырехкратные связи в анио- только неподеленные пары элек-не [RejClg] 2~: ... — <5-связь;- тронов. Однако известно, что Be
я-связь; а-связь образует многочисленные соеди-
нения, в которых имеются две обычные ковалентные связи (ВеРг, BeCh, ВеНг и др.). Допускают, что перед образованием химической связи атомы Be переходят из обычного (или основного) состояния Ве° в возбужденное (Be*) с разъединением пары электронов, находящихся на 2s-AO, и переходом одного из электронов на 2р-АО:
t
В возбужденном состоянии атом Be имеет уже два неспаренных электрона (их называют валентными электронами) и может образовать две ковалентные связи по обменному механизму. Валентность Be равна двум. Квантово-механические расчеты показывают, что энергия, необходимая для перехода атома Be в возбужденное состояние, с избытком компенсируется энергией, выделяющейся при образовании двух связей. Бериллий, располагая еще двумя вакантными 2р-АО, может образовать дополнительно две ковалентные связи по донорно-акцепторному механизму, например в анионах [BeF4]2' или [Ве(ОН)4Г. Валентность Be в этом случае будет равна четырем, но его степень окисления остается равной (+11).
Бор в основном состоянии —- [Не]!®2!/) — имеет только один неспаренный электрон. Соединения бора с одной ковалентной связью (BF, ВВг, ВО и др.) неустойчивы и в обычных условиях не существуют. Полагают, что атомы В0 перед образованием связей переходят в возбужденное состояние В* с разъединением пары электронов
72
№ 2fA° “ 2f>'i2px‘2py
“2 1
перемещением одного из них на 2р-АО: 2s 2рх-
Такое распределение электронов требует затраты определенной •анергии, которая с избытком компенсируется энергией, выделяющейся при образовании трех связей (молекулы типа ВС1з, BF3 или В(ОН)з)- Валентность и степень окисления бора в таких соединениях равны 3 и (+III). Однако у бора остается еще не заполненной одна 2р-АО, которая может быть акцептором неподеленной пары электронов других атомов. Присоединяя эту пару электронов, бор об- разует четыре ковалентные связи, например в анионах [ВН4Г и [BF4 ]—• Валентность В становится равной четырем, а степень окисления не изменяется.
Углерод в основном состоянии — [He]2szp имеет только два неспаренных электрона. Поэтому следовало бы ожидать, что с атомами, имеющими один неспаренный электрон (Н, F, С1 и др.), углерод должен образовать устойчивые молекулы типа СН2 или СС12. Но это противоречит экспериментальным данным. Наиболее устойчивыми соединениями углерода являются СН4, CCI4 и им подобные, содержащие четыре равноценные ковалентные связи. Чтобы объяснить это, следует также предположить возможность перехода атомов углерода в возбужденное состояние: 2sl2.pl -- 2?2р3
Энергия перехода 2s"2p * 2s 2^ с избытком компенсируется энергией, выделяющейся при образовании двух дополнительных ковалентных связей. В возбужденном состоянии углерод не имеет Ни вакантных АО, ни неподеленных пар электронов. Естественно, Чт° в своем возбужденном состоянии углерод не может быть ни Донором электронных пар, ни их акцептором. Валентность углерода в° многих его соединениях равна четырем, хотя степень окисления м°жет быть (+11) и (+IV). В частности, в молекуле :С^О: валентность Углерода равна трем, а степень окисления (+11).
Атомы азота в основном и возбужденном состояниях имеют одну
73
и ту же электронную конфигурацию: [He]2s22p3. Разъединить пару электронов 2s-АО невозможно, так как в пределах квантового числа п-2 нет свободных АО. Переходы же 2s22p3 - 2s12p33s1 или 2s22p3 -» 2s22p23s‘ мало вероятны из-за необходимости затрат настолько большой энергии, что последняя не может быть компенсирована энергией, выделяющейся при образовании новых связей.
Поэтому атом азота может образовать только четыре ковалентные связи, одна из которых будет иметь донорно-акцепторное происхождение. Максимальная валентность азота равна четырем. Например, в одиночной молекуле HNO3 азот образует с тремя атомами +V кислорода только четыре ковалентные связи: Н—О—N
Три связи у азота появились по обменному и одна П-связь по донорно-акцепторному механизмам. Так как длины и энергии связей N—О и N - О одинаковы, то считают, что эти связи делокализованы и кратность каждой из них равна 1,5. По этой же причине у азота неизвестно соединение состава CI5N, для образования которого необходимо пять неспаренных электронов. Валентность, равная пяти, наблюдается только у атомов p-элементов, имеющих вакантные d-AO низкой энергии с тем же самым главным квантовым числом (элементы третьего и последующих периодов). Так, аналоги азота (фосфор и мышьяк) уже могут образовывать соединения с пятью ковалентными связями (PCI5, AsFs).
Атом кислорода, имеющий электронную конфигурацию [Не ]2s22px2py2p%, образует обычно только две ковалентные связи. Атомы кислорода, как и азота, не могут разъединить пару электронов 2р2-АО из-за отсутствия близлежащего энергетического подуровня, на который можно было бы перевести неспаренный электрон. Валентность кислорода в большинстве его соединений равна двум. В оксониевых ионах, например НзО+, кислород трехвалентен (имеет три связи): две связи в молекуле НгО и третью связь с ионом Н+ по донорно-акцепторному механизму при перекрывании 2р2-АО с вакантной ls-АО протона.
Фтор с электронной конфигурацией [Не ]2s22p5 может быть только акцептором одного электрона с образованием O’-ковалентной связи по обменному механизму. Его валентность и степень окисления равны 1 и (-1).
5.3. СТРУКТУРА КОВАЛЕНТНЫХ МОЛЕКУЛ ТИПА АВ„
В методе ВС для предсказания геометрического строения молекул типа АВИ, где и > 1, и значений валентных углов применяют предложенную Полингом идею гибридизации АО.
Г и б р идизация — это выравнивание (усреднение) энергии у атома А различных АО в результате смешения (гибридизации) перед химическим взаимодействием (или в его процессе), что приводит к образованию гибридных орбиталей, направленных в сторону образующейся связи.
74
Гибридизация не является реальным физическим явлением. Она представляет собой условный прием, позволяющий предсказать структуру молекулы при помощи комбинации АО.
В гибридизации могут участвовать только те АО, энергии которых достаточно близки; например, 1 s-атомные орбитали не участвуют в гибридизации 2s- и 2р-атомных орбиталей. В результате гибридизации энергии атомных орбиталей с разным значением орбитального квантового числа I выравниваются, становятся одинаковыми, что приводит к образованию равноценных O’-связей. Длина и энергия всех связей в молекуле А—В становятся равными.
В гибридизации могут участвовать вакантные АО, орбитали с неспаренными электронами и неподеленными электронными парами. Атомные орбитали, не имевшие электронов в основном состоянии атома либо ставшие вакантными при перераспределении электронов в процессе образования молекулы, могут не участвовать в гибридизации, если для них не хватает О-активных электронных пар. Такие АО приобретают другое значение энергии и частично или полностью включаются в образование делокализованных тг-связей.
В результате гибридизации появляются новые гибридные орбитали, которые ориентируются в пространстве таким образом, чтобы после их перекрывания с орбиталями других атомов электронные пары оказались максимально" удаленными друг от друга. Такое состояние молекулы будет отвечать минимуму энергии межэлектронного отталкивания.
Каждому виду гибридизации АО соответствует определенная геометрическая форм молекулы, образованная O’-связями, создающими жесткий скелет частицы, в электростатическом поле которого в случае кратных связей движутся делокализованные пары 7Г-элект-ронов (табл. 12).
Таблица 12. Пространственная ориентация гибридных орбита-лей молекул и ионов состава АВп
Вид гибридизации Конфигурация орбиталей Число связей Валентный угол а, ° Структура частицы
sp dp Линейная 2 180 В-у-Ау-В а
sp22 dP. sd2 Плоская, треугольная 3 120 W
75
Продолжение табл. 12
Ниже приведены примеры определения структур одиночных молекул с использованием нескольких простых правил, в основе которых лежат идея гибридизации АО, условный донорно-акцепторный механизм образования связей и понятие о степени окисления центрального атома А молекулы АВи.
• Структура молекулы BeCh. Атом бериллия в этой молекуле имеет степень окисления (+ II). Поэтому можно допустить, что он лишен двух электронов, перешедших условно к атомам хлора. Вакантные S- и p-АО атома Be подвергаются гибридизации, причем sp-гибридные орбитали располагаются линейно (см. табл. 12) и затем перекрываются по донорно-акцепторному механизму с p-АО двух атомов хлора с образованием двух о-связей:
Схематично этот гипотетический процесс трансформации и перекрывания АО можно представить следующим образом:
76
• Структура молекулы NO2. Структура молекулы определяется при помощи аналогичных правил:
В соответствии со своей степенью окисления в молекуле NO2 азот теряет 4е , переходящих на p-АО двух атомов кислорода. Поэтому -в гибридизации участвуют 2s-AO с одним неспаренным электроном и две вакантные 2р-АО атома азота, число которых равно числу атомов кислорода. Это будет sp -гибридизация с расположением трех гибридных орбиталей в одной плоскости (см. табл. 12). Одну из гибридных орбиталей занимает оставшийся неспаренный электрон, а две другие перекрываются с двумя p-АО атомов кислорода с образованием двух a-связей. Одновременно появляются и две делокализованные л-связи за счет вторых активных пар электронов атомов кислорода. Более сильное отталкивание друг от друга электронов кратных связей, чем неспаренного электрона, увеличивает валентный угол в молекуле NO2 до 134°.
Можно полагать, что две электронные пары, образующие две делокализованные л-связи, находящиеся вне плоскости молекулы, так коррелируют свое движение, что они поочередно занимают одну вакантную p-АО атома азота, не участвующую в гибридизации, и поэтому не могут быть «приписаны» к определенному атому кислорода. Делокализация л-электронов — обычное их состояние.
Кратность связи N — О равна <о-1,0+0,5“1,5, где единица отвечает одной о-связи, а второе слагаемое равно отношению числа АО, не участвующих в гибридизации, к числу оставшихся активных пар электронов у двух атомов кислорода, образующих делокализованные л-связи.
Сумма кратностей связей определяет валентность атома азота, равную трем.
После того как установлена структура молекулы, можно определить механизм образования той илн иной связи.
Так, электроны 2s2-AO атома азота, разъединение которых энергетически затруднено, участвуют в донорно-акцепторном механизме образования о-связи N -► О, ' а остальные два неспаренных электрона в обменном механизме образования 1а- и 1л-связей. Один из трех неспаренных р-электронов остается неиспользованным.
• Структура молекулы SF4. У атома серы в этой молекуле в степени окисления (+ IV) остаются электроны на 3s2-AO. Поэтому для образования четырех a-связей S—F необходимо участие одной из 3d-AO:
77
Гибридизация приводит к появлению пяти гибридных $р3«/-орбиталей. пространственное расположение которых носит название тригональной бипирамиды (см. табл. 12). Неподеленная пара s-электронов занимает, как это следует из экспериментальных данных, гибридную орбиталь в экваториальной плоскости полиэдра. Структура же молекулы, отвечающая расположению всех ее ядер, носит название «качели» (бисфеноид). Вследствие отталкивания неподеленной пары электронов от двух а-связей S—F две аксиальные a-связи S—F слегка согнуты в направлении к двум экваториальным связям.
Все четыре связи в молекуле SF< являются ординарными to—1), поэтому валентность атома серы, равная четырем, совпадает со значением степени окисления (+ IV).
• Структура молекулы ХеОРг. Атом ксенона после условной передачи атому кислорода и двум атомам фтора четырех электронов остается с двумя АО, заселенными полностью электронами:
Поэтому для образования трех a-связей привлекается одна из 5rf-AO ксенона. Гибридизации sp3d отвечает тригональная бипирамида, в экваториальной плоскости которой на двух гибридных орбиталях располагаются две оставшиеся у ксенона пары электронов. Одна гибридная экваториальная орбиталь перекрывается с p-АО атома кислорода, образуя a-связь. Вторая активная пара электронов атома кислорода вместе с вакантной 5d-AO атома ксенона, не участвовавшей в гибридизации, образует делокализованную л-связь, расположенную вне экваториальной плоскости (условно эта связь показана в плоскости треугольника). Кратность связи Хе—-О ш — 2, а связи Хе—F ш — 1. Валентность атома Хе, следовательно, равна 4, а степень окисления (+ IV).
• Структура молекулы NH3. Атом азота, как более электроотрицательный, условно забирает три электрона у трех атомов водорода, полностью заселяя свои p-АО н образуя четыре sp-гибридные орбитали, вытянутые к углам тетраэдра (см. табл. 12):
It It It
Три гибридные орбитали, содержащие каждая по паре электронов, перекрываются по донорно-акцепторному механизму с тремя вакантными ls-АО атомов водорода с образованием трех a-связей. Структура молекулы NH3 — треугольная пирамида, валентные углы Н—N—Н равны 107,3 , меньше идеального тетраэдрического, равного 109,5°, из-за отталкивания неподеленной пары электронов от электронных пар a-связей. Валентность азота в молекуле NH3 равна трем. Степень окисления (— III).
Из приведенных примеров следует, что при определении структур простых молекул нет необходимости в выяснении деталей механизма образования a-связей и появления л-связей. Кроме того, из примеров видно, что между структурой молекулы
78
(пространственное расположение ее атомов) и расположением гибридных орбиталей существует различие. В частности, пространственное расположение гибридных орбиталей в молекуле SF« — тригональная бипирамида, а структура молекулы — «качели» или бисфеноид.
Предложенный метод прогнозирования структур ковалентных молекул типа АВИ, где п > 2, можно использовать н для определения структур одиночных ионов (гипотетических частиц), находящихся в полной изоляции от своей среды (раствора, расплава, кристаллов, газовой фазы).
Например, структуру катиона ннтрогенила NO2 определяют, используя схему:
Азот, потеряв один электрон при ионизации молекулы, передает условно остальные 4г— двум атомам кислорода, каждый из которых полностью заселяет свои р-АО, образуя две активные электронные пары. Две вакантные гибридные орбитали зр-типа перекрываются с двумя p-АО атомов кислорода с образованием двух о-связей. Две оставшиеся активные пары электронов атомов кислорода и две вакантные р-АО атома азота, не участвовавшие в гибридизации, дают систему двух делокализованных л-связей.
Кратность каждой N—О связи равна двум, а валентность — четырем [степень окисления атома азота (+ V)].
Механизм образования связей можно представить в виде схем: (О—N -* О) или (O«-N—О), которые равновероятны.
5.4. ПОЛЯРНОСТЬ КОВАЛЕНТНОЙ ХИМИЧЕСКОЙ СВЯЗИ
Когда взаимодействующие атомы отличаются по своей электроотрицательности, то обобществленная пара электронов смещается к более электроотрицательному атому, вызывая появление на последнем отрицательного заряда. Более электроположительный атом, лишившись частично своего электрона, приобретает некоторый положительный заряд, равный по величине отрицательному. Такие заряды получили название эффективных.
Например, в молекуле HF связывающая пара электронов смещена к атому фтора, вследствие чего на последнем появляется заряд, равный —0,43 доли заряда электрона. Эффективные заряды атомов в молекуле принято изображать надстрочной цифрой: Н*0, 3—F-1 14 , Н*0,0 —I ’ . Эффективный заряд — безразмерная величина, определяемая отношением фактического заряда к заряду электрона.
Понятие эффективного заряда не является строгим, так как разделить область перекрывания АО, т. е. область пространственного распределения заряда между атомами, можно только условно.
79
!1 Явление смещения пары электронов химической связи к более электроотрицательному атому получило название поляризации химической связи.
Ковалентные химические связи со смещенной связывающей парой электронов принято называть полярными ковалентными химическими связями. Наиболее часто встречается в соединениях полярная ковалентная связь.
Из приведенных выше значений эффективных зарядов в молекулах галогеноводородов следует, что по мере выравнивания электроотрицательностей галогена и водорода связь становится все менее полярной, и в молекуле HI ее можно считать чисто ковалентной. В молекуле HF атом фтора полностью не отрывает электрон от атома водорода, обобществленная электронная пара оказывается лишь частично смещенной к наиболее электроотрицательному элементу.
Характеристикой полярности связи служит ее электрический дипольный момент. Диполем называют систему, состоящую из двух равных по величине, но противоположных по знаку зарядов, расположенных на некотором расстоянии друг от друга.
Дипольный момент связи [I (в Кл»м) определяют из соотношения Д - ql, где q — абсолютная величина заряда в кулонах, а 1 — длина диполя (вектор, направленный из центра положительного заряда к центру отрицательного заряда), пм. Величина 1 является межатомным расстоянием или длиной химической связи.
Внесистемной единицей измерения величины дипольного момента служит Дебай (1 D- 3,33» 10~ Кл»м).
Дипольный момент сложной молекулы равен векторной сумме дипольных моментов ее химических связей и неподеленных пар электронов. Если в молекуле центры тяжести положительных и отрицательных зарядов совпадают, то21я0,/<ж0, и молекула будет неполярной (ССЦ, ВгС1з, SiBr4, СН4 и др.). Поэтому все молекулы с симметричным расположением атомов являются неполярными из-за совпадения центров тяжести положительных и отрицательных эффективных зарядов, хотя каждая химическая связь может быть в этом случае полярной. Двухатомные молекулы, состоящие из одинаковых атомов, также являются неполярными.
Примером полярных молекул могут служить молекулы НзО, NH3 и Н2О2, дипольные моменты которых равны соответственно 1,86; 1,46 и 2,26 D. Значения дипольных моментов этих молекул свидетельствуют о смещении электронных пар химических связей к атомам кислорода и азота. Чем больше дипольный момент двухатомной молекулы, тем более ионный характер приобретает связь.
Следует заметить, что определение дипольного момента связи — сложная и не всегда решаемая задача (взаимодействие связей, неизвестность направления Дит. д.).
5.5. ИОННАЯ ХИМИЧЕСКАЯ СВЯЗЬ
Ионной химической связью называют связь, которая образуется между катионом и анионом в результате их электростатического взаимодействия.
Ионная химическая связь — предельный случай полярности химической ковалентной связи, которому отвечает значительное смещение пары электронов связи к наиболее электроотрицательному атому. Этот атом приобретает отрицательный заряд и превращается в анион. Другой атом, лишившись своего электрона, образует катион. Иногда механизм ионной химической связи называют «гарпунным» механизмом. Более электроположительный атом как бы «забрасывает» свой электрон на более электроотрицательный атом и «подтягивает» его к себе за счет электрического взаимодействия образовавшихся ионов.
Ионная химическая связь не обладает насыщаемостью, не имеет направленности и повышенной электронной плотности в области связывания. Каждый ион окружен сферическим электрическим полем, действующим на любой другой ион вне зависимости от места его расположения. Сила взаимодействия будет определяться только величиной заряда и расстоянием между ионами в соответствии с законом Кулона.
В газах, жидкостях и кристаллах каждый ион стремится окружить себя наибольшим числом ионов противоположного заряда. Если представить ионы в виде несжимаемых сфер, то они располагаются в кристаллах друг около друга в определенном порядке, позволяющем занять минимально возможный объем с минимальной потенциальной энергией.
Отсутствие у ионной химической связи такого свойства, как насыщаемость и направленность, приводит к образованию ионных кристаллов, представляющих собой, по существу, гигантские полимерные молекулы. Каждый ионный кристалл, как гигантская молекула, может и дальше увеличиваться в размерах путем присоединения к поверхности кристалла в процессе кристаллизации новых положительных и отрицательных ионов.
Понятие валентности к ионной связи неприменимо. Каждый ион имеет неограниченное число связей с другими ионами, находящимися относительно этого иона в ближнем и дальнем порядке.
Как показывают экспериментальные исследования и квантово-механические расчеты, иде-
Рис. 18. Радиальная электронная плотность W в одиночной молекуле NaCl.
А — зона небольшой электронной плотности в пространстве между ионами; В — зона увеличенной электронной плотности вблизи хлоридного аниона
81
альной ионной связи не существует. Даже при взаимодействии щелочных металлов с галогенами не происходит полного удаления электрона у щелочного металла и присоединения его к атому галогена. Электрон только смещается к галогену, образуя около последнего область повышенной электронной плотности (рис. 18). Из рис. 18 видно, что в области между ионами Na+ и СГ сохраняется незначительное перекрывание АО (зона А), остается небольшой электронный мостик между ядрами атомов.
5.6. ЭНЕРГИЯ КОВАЛЕНТНОЙ ХИМИЧЕСКОЙ СВЯЗИ
Энергия ковалентной химической связи — важнейшая характеристика молекулы, определяющая особенности ее строения и свойств.
Энергия ковалентной химической связи — это изменение энергии в процессе образования связи между двумя одиночными атомами в стандартных условиях:
А<г) + В<г) = АВ(г), Д£°(298К)
Энергия некоторых ковалентных связей приведена ниже:
Молекула F—F Cl—Cl Вг—Br I—I Н—F Н—Cl Н—Br Н—I
Энергия, —159 —243 —194 —153 —566 —432 —366 —298
кДж/моль
Монотонный характер уменьшения энергии связи в галогеново-дородах вызван монотонным увеличением длины связи Н—Hal.
Изменение энергии при образовании связи принимают за среднее значение полной энергии Е двух взаимодействующих ядер и их электронов. Вероятностный характер волновой функции не позволяет некоторые величины определять точно (принцип неопределенности). Поэтому полную, кинетическую и потенциальную энергии связи рассматривают лишь как средние величины.
Среднее значение полной энергии Е взаимодействующих ядер и электронов равно сумме средних_значений кинетической Е* и потенциальной Еп энергий: Е - Ек + ЕП. В квантовой механике известна теорема в и р и а л а, из которой следует, что среднее значение полной энергиисистемы равно половине значения средней потенциальной энергии: Е = 0,5Еп. Это равенство выполняется для любых многоэлектронных систем.
Таким образом, изменение средней полной энергии взаимодействующих атомов всегда должно иметь тот же знак, что и изменение средней потенциальной энергии. На рис. 19 приведена зависимость средней потенциальной энергии от межъядерного расстояния при образовании молекулы водорода.
Если поместить атом Щ в начале координат и сближать с ним атом Нл, находившийся в начале движения на значительном расстоянии от атома Но, то потенциальная энергия системы, состоящей из этих двух атомов, начнет уменьшаться (кривая 2), находясь все _ 2
время ниже оси абсцисс: Еп = —у.
Рис. 19. Зависимость средней потенциальной энергии от межъядерного расстояния:
1 — изменение Е п двух атомов Н, не способных к образованию химической связи; 2 — изменение ЕП взаимодействующих атомов водорода; 4)— равновесное межъядерное расстояние; Еа — энергия разрыва связи Н—Н; Ео —нулевая энергия
области между ядрами, увеличивается
Уменьшение величины £п будет продолжаться до тех пор, пока расстояние между атомами водорода не станет равным равновесному, межъядерному расстоянию к) “ 74,14 пм. Это будет длина химической связи Н—Н, образованию которой отвечает минимум на кривой Еп равный — 872 кДж/моль. Отсюда полная средняя энергия связи Н—Н равна —436 кДж/моль.
Минимуму на кривой Еп - /(Z) отвечает наиболее полное перекрывание 1s-АО с образованием повышенной электронной плотности между двумя протонами.
Если межъядерное расстояние становится меньше /о, происходит выталкивание электронной пары из
взаимное отталкивание ядер и электронов, вследствие чего величина Еп начинает резко возрастать (рис. 19). Пересечение оси абсцисс кривой Еп = /(/) означает разрыв химической связи Н—Н, разъединение пары электронов и появление их в разрыхляющей области.
Таким образом, ковалентная химическая связь может образоваться только в том случае, если при сближении атомов средняя потенциальная энергия ядер и электронов понижается.
В положении равновесия (/о) атомы водорода не являются неподвижно связанными. Они всегда колеблются друг относительно друга. Даже при температуре Т = 0 наблюдается колебание атомов в интервале Д/ (рис. 19) около положения равновесия. Энергия их колебания при Г = 0 получила название нулевой энергии Ео. Появление Ео вытекает из принципа неопределенности. Если бы не было нулевой энергии, то точка минимума кривой Еп точно определяла бы координаты атомов в молекуле и их энергию, а это противоречит принципу неопределенности. _ _ _
Энергия разрыва химической связи Н—Н Ея = Еп — Ео (рис. 19).
В многоатомной молекуле, содержащей одинаковые связи, энергия одиночной химической связи определяется как средняя арифметическая величина от суммарной энергии всех связей. Например, Для реакции С<Т) + 4С1<г> = CCU(r) ДЕо(298К) в —1384 кДж. Отсюда средняя энергия связи С—С1 равна —1384:4 « 350 кДж/моль. В случае многоатомных молекул, содержащих более двух неодина-
83
ковых атомов, а следовательно, различное число неодинаковых связей, понятие об энергии связи становится условным.
Следует при этом заметить, что в многоатомной молекуле энергия разрыва связи не равна средней энергии связи. Например, при реакции ЗО(Г) “ Оз(г) выделяется энергия, равная 605 кДж. Отсюда средняя энергия каждой связи О—О в молекуле озона будет равна —605:2 *= —302,5 кДж. Между тем энергия разрыва первой связи Оз(г) = О2(г) + О составляет всего 108,8 кДж, а второй связи О2(г) = О(г) + О(г) около 496 кДж. Несовпадение энергии разрыва первой и второй связей со средней энергией связи обусловлено тем, что при разрыве уже первой связи происходит изменение электронной и ядерной конфигурации молекулы озона, в результате чего изменяется и энергия взаимодействия оставшихся атомов.
5.7. ОСНОВНЫЕ ПОНЯТИЯ О МЕТОДЕ МОЛЕКУЛЯРНЫХ ОРБИТАЛЕЙ
Метод валентных связей, или локализованных пар электронов, достаточно хорошо объясняет образование и структуру многих молекул. К сожалению, этот метод не универсален. В самом деле, как объяснить химическую связь в молекулярном ионе водорода н£, где всего один электрон, а ион довольно устойчив. Почему при образовании молекулы Ог остаются два неспаренных электрона? Существуют ли ионы состава H^HeJ, Н2? Как образуется анион [1з Г в реакции 1г + Г- — [1з ]~, если у иона Г и молекулы 1г нет неспаренных электронов и вакантных АО, a s р электронные конфигурации частиц не способствуют перекрыванию АО? Получить ответы на эти и многие им подобные вопросы стало возможным только после разработки теории молекулярных орбиталей (сокращенно теории МО).
Подробнее см.: Грей Г. Электроны и химическая связь. — М.: Мир, 1967.
Теория МО возникла из идеи рассмотрения молекулы (с точки зрения возможных энергетических состояний) как атома.
Основные положения теории МО можно свести к следующему: а) образование химических связей является результатом перехода электронов с АО на новые энергетические уровни, называемые молекулярными орбиталями и обладающие энергией, определяемой всеми атомами молекулы;
б) после образования молекулы АО теряют свою индивидуальность, превращаясь в МО;
в) каждой МО соответствует определенная энергия, приближенно характеризуемая энергией удаления электрона с данной МО, энергией ионизации молекулы;
г) электроны в молекуле не локализованы в межъядерных пространствах, они могут в ряде случаев перемещаться в электрическом поле нескольких ее ядер;
д) состояние каждого электрона описывается одноэлектронной
84
молекулярной волновой функцией (р, характеризуемой определенным набором квантовых чисел. Эта функция, определяющая размеры области наиболее вероятного пребывания рассматриваемого электрона конкретной энергии в поле действия всех ядер молекулы, и является МО;
е) распределение электронов по новым энергетическим уровням или МО производится в соответствии с принципом минимума энергии, правилами Паули и Гунда;
ж) если переход электронов на МО энергетически выгоден, т. е. приводит к понижению полной энергии молекулы по сравнению с
Рис. 20. Энергетическая диаграмма МО, образующихся при перекрывании ns-AO
суммарной полной энергией
взаимодействующих атомов, то возникает химическая связь. Если же переход электронов на МО связан с затратой энергии, то молекула не образуется;
з) совокупность МО, занятых электронами, называется элект-
ронной конфигурацией.
Таким образом, многие положения метода МО совпадают с положениями метода ВС. Основное отличие этих методов друг от друга состоит в том, что МО являются многоцентровыми волновыми функциями, описывающими поведение электрона в электрическом
поле всех ядер молекулы.
Ниже рассматривается использование приведенных выше положений метода МО для объяснения образования химических связей в двухъядерных (двухцентровых) молекулах.
Энергетическая диаграмма МО. Соотношение между энергиями исходных АО и образующимися МО удобно представлять на энергетической диаграмме (рис. 20). _
Диаграмма разделена ординатами Еп на три части. В средней части диаграммы изображают кружками МО, а по краям располагают АО в соответствии с их энергиями. Атомные орбитали более электроотрицательных элементов всегда находятся ниже АО менее электроотрицательных. Число МО равно числу исходных АО. Наиболее устойчивые МО находятся ниже исходных АО.
Химическая связь между двумя атомами появляется при соблюдении следующих условий: а) комбинируемые АО должны быть близкими по энергии. Если электрон у одного из атомов находится на АО очень низкой энергии по сравнению с энергией АО другого атома, то он не перейдет в область связывания, так как это будет энергетически невыгодно; б) атомные орбитали, образующие МО, должны перекрываться. Если перекрывания не будет, то электрон одного из атомов не попадет в область притяжения ядра другого атома; в) МО образуется только тогда, когда обе перекрываемые
85
Рис. 21. Условия образования молекулярных орбиталей: а, б и в — Осв-молекулярные орбитали; г — лсв-молекулярные орбитали
АО расположены симметрично относительно межъядерной оси (рис. 21).
Двухцентровые МО. Двухцентровой МО называют молекулярную волновую функцию характеризующую поведение электрона в электрическом поле двух ядер, или двух центров.
Молекулярная волновая функция <р в одном из простейших приближений теории МО рассматривается как линейная комбинация двух исходных одноэлектронных ^-функций взаимодействующих атомов.
Например, волновую функцию <р молекулы АВ можно представить следующим образом:
Когда атомы А и В находятся на большом расстоянии друг от друга, то состояние их электронов, участвующих в образовании связи, характеризуется атомной волновой функцией 1рл. и тръ. При сближении атомов до равновесного расстояния /о происходит перекрывание АО и образование молекулы, в которой состояние электрона уже будет описываться молекулярной волновой функцией <р. Если электрон в молекуле будет вблизи атома А, то а если окажется около атома В, то <р~1ръ. В общем же случае: = ci ± где о и с2 — некоторые постоянные коэффициен ты, учитывающие долю участия АО атомов А и В в образовании МО и зависящие от электроотрицательности этих атомов. При а > > С2 вероятность пребывания электрона у атома А, как более электроотрицательного, больше, чем у атома В. В том случае, когда
86
Рис. 22. Энергетическая диаграмма МО, образующихся при перекрывании р-АО
атомы А и В принадлежат одному элементу, а - с2. Знак «+» в уравнении функции отвечает нахождению электрона в области связывания (на связывающей МО), а знак «—» — пребыванию электрона в области разрыхления связи (на разрыхляющей МО).
Такой метод вычисления одноэлектронной волновой функции, разработанный Малликеном, называют «молекулярные орбитали в приближении линейной
комбинации атомных орбиталей» (МО ЛКАО).
Малликен Роберт (1896-1985) - американский химик, лауреат Нобелевской премии.
Подразделение МО на связывающие (рсв= CiV'a + с^)в и разрыхляющие = СуТрл — с2грц вызвано характером движения электрона. Попадая в область связывания, электрон оказывается на МО более низкой энергии, чем исходные АО. Тем самым достигается выигрыш энергии, возникает химическая связь. Попадая в область разрыхления связи, электрон оказывается на МО более высокой энергии, чем исходные АО, поэтому связь не образуется.
Молекулярные орбитали по аналогии с s-, р- и d-AO обозначают соответственно буквами греческого алфавита О, л и <5. При выборе системы координат линия, связывающая ядра двухатомной молекулы, принимается за разуется при перекрывании при перекрывании рх~, ру,
Рис. 23. Энергетическая
диаграмма молекулы водорода
ось z. Молекулярная орбиталь О об-s-, Pz~ и dz2-AO, а Л-МО появляется dxz~, dyz~, dxy, dx2 - у2 “ АО.
Если перекрываются две ns-AO, то образуется две МО (<р св и , которые называют <7СВ- и о*-МО.
Если перекрываются по три p-АО двух атомов, то уже образуется шесть МО: (7СВ и О*, две Лсв и две Л* (рис. 22).
Взаимодействие атомов водорода и гелия. Распределение электронов по МО молекулы водорода представлено на ее энергетической диаграмме (рис. 23).
87
Два электрона размещаются в соответствии с принципом минимума энергии и правилом Паули на асв-МО, имеющей низкую энергию, О*-МО остается вакантной. Таким образом, представление о характере химической связи в молекуле Нг, полученное с использованием метода МО ЛКАО, оказывается аналогичным представлению метода ВС — связь образуется при помощи пары электронов, имеющих разные спиновые квантовые числа.
Ниже представлено распределение электронов по МО при образовании молекулярных ионов Н Г, Не 2 , Н t и Нег •’
Электронные конфигурации МО
| (освУ (с*)1 | | (ас„)2 «т»)1 | (асв)2 (с*)2 | (О„)2 (о*) |
Из диаграммы следует, что химическая связь может быть образована не только парой электронов, но и единственным электроном, если последний занимает <7СВ-МО. Конечно, связь, в которой участвует всего один электрон, слабее двухэлектронной связи. Достаточно сравнить энергию связи в ионе Не* с энергией связи в молекуле Нг и их межъядерные расстояния, равные соответственно 106 и 74,14 пм.
Электрон в ионе Н % (Н+ * е *- Н+), находясь между ядрами, не только притягивает их к себе, но и экранирует их друг от друга, уменьшая взаимное отталкивание. В результате происходит заметное понижение энергии такой системы.
Когда электроны заселяют полностью все МО ( <рсв и <р*), то химическая связь не образуется из-за равенства количеств связывающих и разрыхляющих электронов. В этом случае не существует нескомпенсированных связывающих электронов, нет и выигрыша энергии по сравнению с энергией исходных АО.
88
Рис. 24. Энергетические диаграммы МО молекул Ог (в) и Nz (б)
Взаимодействие атомов кислорода и азота. Распределение электронов по МО молекул кислорода и азота представлено на рис. 24. Уровень энергии 2s-АО атома кислорода (—2819 кДж/моль) расположен много ниже уровня энергии 2р-АО (—1314 кДж/моль) и поэтому 2s-AO практически в образовании связей не участвует. Размещение всех 8е” следует производить с заселения (7СВ-МО, обладающей наименьшей энергией. Затем заселяется ?ГСВ-МО. Оставшиеся 2е~ в соответствии с правилом Гуида займут л*-МО по одному на каждой из них.
Отсюда следует, что молекула Ог будет парамагнитной, с двумя неспаренными электронами. Такое простое объяснение магнитных свойств молекулы 62 с помощью несложных соображений было первым большим достижением теории МО.
Кратность, или порядок связи, (D в молекуле Ог и других молекулах определяют половиной разности между числом электронов на связывающих МО (пев) и числом электронов на разрыхляющих МО (и*): (D = 0,5(исв — и*). В частности, для молекулы О2 W = “ 2. В этом определении допускают, как и в методе ВС,
что любая связь между двумя атомами осуществляется с помощью Двух электронов.
Итак, ковалентная связь в молекуле О2 двойная 0—0, энергия связи —498 кДж/моль, длина связи 121 пм.
Ниже приведено распределение электронов по МО в молекулярных ионах кислорода:
89
Соединения с катионом О1+ пока не получены, а соединения с катионом Ot, называемом катионом диоксигенила, широко известны <О2[Р1Рб], ChlAsFe] и др.). Анион ОГ существует в кристаллах надпероксидов щелочных и щелочно-земельных элементов (КО2, Ва(О1)2 и др.).Связи в таком анионе неустойчивы, легко разрываются. Надпероксиды принадлежат к сильным окислителям, в процессе окисления они переходят в обычные кислородные соединения с другим набором МО. Анион 01 существует в кристаллах пероксида цинка ZnO2 и пероксидах щелочных и щелочно-земельных металлов (Na2O2, ВаОг и др.).
В молекуле азота (рис. 24, б) в отличие от молекулы Ог наиболее устойчивыми являются л^в-МО, с них и начинается заселение МО электронами p-АО. В молекулах от Иг до N2 Л^В-МО лежат ниже асв-М0. В этих молекулах нет электрона на л*-М0, связи более прочные и более короткие. В случае коротких межъядерных расстояний происходит более полное перекрывание рхг и ру-АО и образующиеся ?4В-МО становятся более сильными, чем <7СВ-МО. К тому же увеличение энергии (7СВ-МО вызвано усилением межъядерного отталкивания.
90
Рис. 25. Энергетические диаграммы образования молекул HF (а) и СО (б)
Энергия связи :N^N: в молекуле азота равна —945 кДж/моль, кратность связи О) “ (6—0)/2 - 3, а ее длина — ПО пм.
Из энергетической диаграммы следует, что удаление одного электрона с осв-МО приведет к образованию катиона N 2 с меньшей энергией связи (—846 кДж/моль) и, естественно, с большей длиной (112 пм). Присоединение электрона к молекуле N2 также приводит к ослаблению связи, так как электрон займет л*-МО (анион N7)-
Двухатомные гетероядерные молекулы. Несвязывающие МО. Перекрывание АО двух разных атомов с образованием молекулы возможно только при близости их энергий, при этом АО атома большей электроотрицательности всегда на энергетической диаграмме располагаются ниже. В связывающую МО больший вклад вносит АО более электроотрицательного атома (эти орбитали ближе по энергии), а разрыхляющую МО — атомная орбиталь менее электроотрицательного атома (эти орбитали также ближе по энергии).
В качестве примера рассмотрим образование молекулы HF с позиций теории МО (рис. 25). Так как энергии ls-АО атомов водорода и ls-АО атомов фтора сильно отличаются по энергии, то перекрывание этих орбиталей не происходит. Слишком низкой энергией обладает и 2$-А0 атомов фтора. Только ls-АО атомов водорода и 2р-АО атомов фтора достаточно близки по энергии (различие в энергиях 479 кДж/моль). Эти АО образуют связь в молекуле Н—F:
91
Перекрывание этих орбиталей вызывает появление двух МО: (7СВ и О*. Оставшиеся у атомов фтора рх~ и ру-АО уже перекрываться с 1s-АО атомов водорода не могут не только в силу своей антисимметричности относительно межъядерной оси (см. рис. 9, б), но и в соответствии с правилом Паули. Орбитали 2рх и 2ру образуют несвязывающие №-МО, имеющие ту же энергию, что и 2рх- и 2ру-АО. Несвязывающие CJ°-MO образуют также 1s- и 2s-AO атомов фтора.
Несвязывающие МО не помогают и не препятствуют образованию связи в молекуле HF. Заселение электронами О°- и гг°-МО не влияет на энергию связи молекулы, так как их энергетические уровни и энергетические уровни соответствующих АО (рис. 25, а) одни и те же. На энергетических диаграммах несвязывающие МО соединяют линией с той АО, энергия которой равна этой МО.
Таким образом, в молекуле HF одна ковалентная связь, й>=(2— —0)/2=1, и три неподеленные пары электронов, что согласуется с методом валентных связей. Ковалентная асв-МО полярна, пара электронов связи находится в области, близкой к атому фтора как более электроотрицательному.
Метод МО позволяет разобраться в характере химических связей и в молекуле СО (рис. 25, б). Молекулы N2 и СО являются изоэлек-тронными, содержат по 10 валентных электронов, связи однотипны и поэтому сходны и их физические свойства: оба газа плохо растворяются в воде, плотности и температуры кипения газов близки (0,796 и 0,793 г/см3; —196 и —192 °C у N2 и СО соответственно).
Энергетическая диаграмма МО молекулы СО (рис. 25, б) свидетельствует о том, что связи в молекуле тройные (ft>=6/2“3); (^>с ~о; Энергия связи равна —1076 кДж/моль, длина связи 113 пм. В молекуле СО есть две несвязывающие пары электронов: одна на (7?-МО, близкой по энергии к энергии 2s2-AO кислорода, нереакционноспособная, а другая на <7°-МО с ярко выраженным р-характером и высокой энергией. Электроны, заселяющие эту <7г-МО, являются реакционноспособными, участвуют в образовании химических связей молекулы СО со многими металлами (см. раздел 19.2).
Двухэлектронные трехцентровые МО. В многоатомных молекулах
92
Рис. 26. Энергетические диаграммы МО иона Н + (а) и HF 2 (б)
МО являются многоцентровыми (трех-, четырех- и п-центровыми), так как они представляют собой линейную комбинацию АО всех атомов, участвующих в образовании связей. Рассмотренные выше двухцентровые МО являются частным, наиболее простым случаем многоцентровых МО. Такие МО легче всего описываются математически, и поэтому все многообразие связей в молекулах стараются свести путем различных приближений к двухцентровым МО. Однако в некоторых случаях, когда имеется недостаток или избыток валентных электронов, прибегают к использованию трехцентровых МО.
В качестве простого примера применения трехцентровых МО для объяснения причин образования молекулярного иона Н з рассмотрим энергетическую диаграмму МО этого иона (рис. 26, а). Ион может быть получен в реакции Нг + Н+ = Н з ; —293 кДж/моль с выделением большого количества энергии. Из трех s-АО атомов водорода образуется три МО: <7СВ, <7° и о*. Пара электронов на (ТСВ-МО, удерживающая вместе три протона, является делокализованной. Несвязывающая <7П-МО отвечает взаимодействию только концевых протонов. Таким взаимодействием из-за значительного расстояния между концевыми протонами можно пренебречь, поэтому энергия СГ°-МО мало отличается от энергии АО концевых атомов водорода. Заполнение электронами <7°-МО или, наоборот, удаление с нее электронов почти не влияет на энергию связи. Из приведенной энергетической диаграммы иона Н з следует, что достаточно прочная связь может образоваться уже при использовании двух электронов, поскольку они полностью заселяют стсв-МО. Вторая пара электронов уже не оказала бы влияния на
93
прочность связи, так как она заняла бы несвязывающую МО. Поэтому использование идеи о двухэлектронных трехцентровых МО особенно полезно при рассмотрении молекул и ионов, содержащих три ядра и только пару валентных электронов.
Другим примером двухэлектронных трехцентровых МО являются связи в линейном, устойчивом гидродифторидном анионе, HFi, легко образующемся в реакции HF + F « HFf.
Из энергетической диаграммы МО этого иона (рис. 26, б) следует, что в образовании связи между тремя атомами участвует только пара электронов, находящаяся на С7св-МО. На двух атомах фтора остаются 8е , не участвующих в образовании связей в соответствии с правилом Паули и асимметричностью их АО относительно межъядерной оси. В образовании связи не участвует также пара электронов на <J°-MO. Все эти 10е~ находятся на концевых атомах фтора.
♦ ♦ ♦
Одним из подходов к объяснению химических связей в молекуле является метод валентных связей. Этот метод основан на допущении, что единичную, ординарную, ковалентную связь образуют два электрона с противоположными спинами, создающие между атомами зону с повышенной электронной плотностью, своеобразный электронный мостик. Обобществление электронной пары происходит при перекрывании АО взаимодействующих атомов. Одна и та же АО может только один раз участвовать в образовании химической связи (насыщаемость ковалентной связи). Ковалентные связи, образовавшиеся при перекрывании АО вдоль межъядерной оси, обладают направленностью и носят название Освязей. Обобществление электронных пар взаимодействующими атомами происходит при помощи трех механизмов: обменного, донорно-акцепторного и дативного. Если атом располагает несколькими неспаренными электронами и электронными парами, то он может образовать кратные связи (двойные, тройные и т. д.).
Число обобществленных электронных пар тем или иным атомом определяет его валентность.
Ионная связь является предельным случаем ковалентной связи. Чем больше разность электроотрицательностей атомов в молекуле, тем больше степень ионности химической связи. Между ковалентной и ионной связями нет четкой границы. Главным отличием твердых ионных соединений от ковалентных является то, что у ионных кристаллов в узлах кристаллической решетки находятся положительные и отрицательные ионы, а у ковалентных кристаллов — атомы или молекулы.
Возбуждение атомов при затрате энергии, переход их в валентное состояние — реальный физический процесс. Например, для атомов Be переход в валентное состояние связан с разъединением 2$-электронов и переходом одного из них на 2р~АО: ls22s2 •* ls22sl2pi.
Возбужденные состояния имеют конечное время жизни, так как
94
атом стремится перейти в состояние с меньшей энергией, при этом он испускает фотон, энергия которого равна Af= hv (см. раздел 31.1). Для свободных атомов время жизни в возбужденном состоянии равно ~ 10-в с.
Гибридизация же АО — только наглядный способ изображения результата появления той или иной структуры у ковалентносвязанной молекулы. Поэтому гибридизация валентных орбиталей атома перед образованием его связей не является следствием возбуждения атома. Гипотетический механизм гибридизации нужен только для объяснения эквивалентности образующихся связей (равная энергия связей и их длина). В частности, атом бора образует три одинаковые по геометрии и энергии связи В—F в молекуле BF3 не потому, что он проходит стадию sp-гибридизации своих АО перед их перекрыванием с 2р-АО атомов F, но потому, что образование одинаковых связей В—F энергетически более выгодно, чем различных связей (двух за счет 2р-АО и одной за счет 2s-АО).
Каждому виду гибридизации отвечает строго определенная геометрическая форма, подтвержденная экспериментом.
Метод молекулярных орбиталей основан на допущении, что связывающие электроны в молекуле находятся на молекулярных орбиталях подобно тому, как в атомах — на атомных орбиталях. Молекулярная орбиталь — область наиболее вероятного пребывания электронов определенной энергии в молекуле, область, включающая все ядра молекулы. Молекулярная орбиталь — это волновая функция электрона в молекуле.
Различают три вида МО: связывающую, разрыхляющую и несвязывающую. Связывающая МО, образуемая из волновых функций ^-АО, характеризует усиление взаимодействия атомов, а разрыхляющая у7*-АО, состоящая из тех же волновых функций, отражает ослабляющее взаимодействие атомов. При полном заселении электронами всех ^*-МО химическая связь не образуется. Все разрыхляющие МО имеют узловую плоскость, перпендикулярную к межъядерной оси и лежащую между атомными ядрами. В точках этой плоскости ^9* = 0. Несвязывающие МО, О°- или Л°-М0, не участвуют в образовании связи. Заполнение электронами О°- или Л°~М0, так же как и удаление с них электронов, почти не влияет на энергию связей в молекуле.
Молекулярные волновые функции, симметричные относительно межъядерной оси, называют «сигма» (О)-орбиталями, а молекулярные волновые функции, изменяющие знак при вращении на 180° вокруг межъядерной оси, называют «пи» (л)-орбиталями. Как О-, так и Л-МО могут быть как связывающими (<7СВ или л^„), так и разрыхляющими (О* или Л*).
В рамках данного учебника и его объема в изложенной выше главе можно было дать лишь самое общее, чисто качественное представление о химической связи и строении молекул. Материал этой главы следует принять как основу для дальнейшего углубления и расширения, насколько это будет возможно.
95
Упражнения к главе 5
1. Какая из следующих связей более полярна: Вг-Вг, В—F, N—F или I—Вг?
2. Что происходит с третьей p-АО при зр2-гибридизации?
3. Объясните, почему молекула Не2 не существует, хотя существуют молекулы Нг, N2 и О 2 •
4. Почему молекула F2, содержащая 18 электронов, обладает большей химической активностью, чем атом Аг, содержащий также 18 электронов?
5. Укажите пространственное расположение связей для каждого из следующих наборов гибридных орбиталей: sp7d; sp3d; sp3d2. Уточните, какие из d-AO используются для каждого случая.
6. Какой из следующих атомов или иоиов имеет 8-элек-тронную внешнюю оболочку: Cl , S2 , К0, Cs + или Sn?
7. Сопоставьте свойства CsCI и CI2 и объясните, почему CsCI следует рассматривать как ионное вещество, а С12 — как ковалентное.
8. 8 каком случае длина химической связи будет больше: у N2 или nJ, О2 или Of?
9. Почему реакция образования HF из F2 и Н2 экзотер-мична, а реакция образования NO из N2 и О2 — эндотермична?
10. Составьте энергетические диаграммы МО частиц: NO, NO* и NO и определите порядок связи в этих частицах. Укажите, будут пи эти частицы диамагнитными или парамагнитными.
11. Предскажите тип гибридизации АО центрального атома и геометрическую форму следующих молекул: SFg, SF4, CS2, СО2, NO2,COF2 и О3.
12. Строение димера A^CIg показано на рис. 11. Обсудите строение молекулы Fe2Clg. Почему существует димер?
13. Какие три важнейших типа гибридных орбиталей могут образовать атомы, имеющие только s- и p-АО в валентных оболочках? Опишите геометрию молекул, соответствующую каждому типу гибридизации s- и р-АО.
14. Какое из перечисленных ниже веществ будет иметь бопее ионный, а какое — более ковалентный характер химической связи: NOCI2, NaCI, SrF2, СО2, CS2, BaO, Fr2O?
13. Почему молекула CCIq неполярна, а молекула CH3CI — полярна?
18. Какая из молекул: CS2 или H2S; NH3 ипи РН3 — должна иметь больший дипольный момент? Объясните ответ.
17. В какой из частиц: Ог или Oj; НJ ипи Н2 — химическая связь прочнее и почему?
ГЛАВА 6. МЕЖМОЛЕКУЛЯРНОЕ ВЗАИМОДЕЙСТВИЕ. АГРЕГАТНОЕ СОСТОЯНИЕ ВЕЩЕСТВА
Уравнение состояния идеального газа pV = nRT не всегда применимо к реальным газам, так как в реальных газах наблюдается взаимодействие молекул и происходит отклонение их свойств от
96
Рис. 27. Ориентационное (а), индук-ционное (б) и дисперсионное (в) взаимодействие молекул (М — неполярная молекула)
свойств идеального газа. При повышении давления или понижении температуры происходит уменьшение расстояния между молекулами газа, в результате чего возрастают отклонения свойств реальных газов от свойств идеального газа. При понижении температуры и увеличении давления все газообразные вещества, даже такие, как водород и гелий, сначала образуют агрегаты молекул, превращаются в молекулярные жидкости, а затем в молекулярные кристаллические вещества. Например, при давлении 30 кПа и температуре около —243 °C молекулы водорода соединяются в димерные молекулы (Нг)2, а азот и кислород образуют димеры (Ni)2 и (Ог>2 при —193 °C. Многие молекулярные жидкие и кристаллические вещества состоят из тех же молекул, что и их газы.
Силы сцепления, действующие между одиночными молекулами и приводящие вначале к образованию молекулярной жидкости, а затем молекулярных кристаллов, получили название м е ж м о л е-кулярных сил или сил Ван-дер-Ваальса. Межмолекулярное взаимодействие имеет электрическую природу и отличается от химического взаимодействия тем, что проявляется на значительно больших расстояниях, порядка 500—600 пм, и не имеет часто, как ионная химическая связь, насыщаемости.
Ван-дер-Ваальс Ян Дидерик (1837—1923) — голландский фи-зикохимик, вывел уравнение состояния реального газа. Лауреат Нобелевской премии.
К межмолекулярному взаимодействию относятся также и ион-Дипольное взаимодействие.
О значении энергии межмолекулярного взаимодействия можно судить по изменению энергии при сублимации молекулярных кристаллов и испарении молекулярных жидкостей. Например, значение (298 К) при испарении Н1(Ж) равно 21 кДж/моль, а энергия химической связи Н—I равна 298 кДж/моль. Значение ° (298 К) при сублимации кристаллов иода соответствует 62 кДж/моль, а энергия химической связи I—I равна 153 кДж/моль. Отсюда следует, что межмолекулярное взаимодействие относится к слабым взаимодействиям.
4—1258
97
6.1. ПРИРОДА МЕЖМОЛЕКУЛЯРНЫХ СИЛ. ЭНЕРГИЯ МЕЖ МОЛЕКУЛЯРНОГО ВЗАИМОДЕЙСТВИЯ
Энергия межмолекулярного взаимодействия (£м) — сложная функция многих переменных. Ее можно представить в виде алгеб раической суммы энергий, характеризующих различные виды взаимодействия молекул: Ем =ЕК+ Ел + Ел+ Ет, где Ек, Ел,е и Еот — соответственно энергии взаимодействия Кеезома, Дебая, Лондона и энергия отталкивания молекул.
Энергия Кеезома — это энергия, выделяющаяся при взаимодействии полярных молекул. Ее еще называют энергией ориентационного взаимодействия. Полярные молекулы ориентируются, поворачиваясь противоположными полюсами (рис. 27, й), и противодействуют тепловому перемешиванию. Для двух однородных взаимодействующих полярных молекул
3/ 6кТ ’
(6.1)
где /z — постоянный дипольный момент молекулы; I — расстояние между центрами диполей; Т — абсолютная температура; к — постоянная Больцмана, равная 1,381*10~ Дж/(молекула*К).
Кеезом Виллем Хендрик (1876-1956) — нидерландский физик, директор криогенной лаборатории, впервые получил Не в твердом виде.
Больцман Людвиг (1844—1906) — австрийский физик, один из основоположников статистической физики и физической кинетики, иностранный член-корреспондент Петербургской АН.
Из уравнения (6.1) следует, что межмолекулярные связи у полярных молекул тем сильнее, чем больше значение //, чем ближе молекулы находятся друг к другу и чем меньше температура.
Энергия Дебая, или энергия индукционного взаимодействия, выделяется при образовании межмолекулярных связей между полярными и неполярными молекулами. Например, ниже 0 °C атомы Хе и неполярные молекулы хлора, брома при взаимодействии с полярными молекулами воды Щ = 1,86 £>) образуют кристаллы примерного состава Хе*8Н2О, С12*7НгО и Вгг*8Н2О. Кристаллы образованы многогранниками, состоящими из молекул воды, а в полостях многогранников находятся атомы Хе или молекулы С12, Вг2. Такие соединения называют клатратами или клеточными соединениями (подробнее см. раздел 29.4).
Дебай Петер (1884—1966) — голландский физико-химик, создатель теории взаимодействия диполей. Лауреат Нобелевской премии, иностранный член-корреспондент АН СССР.
При сближении полярных и неполярных молекул последние под воздействием электрических полей полярных молекул деформируют свои внешние электронные оболочки и превращаются в индуцированные дипольные молекулы (рис. 27, б), которые и взаимодействуют с полярными молекулами чисто электростатически.
98
Значение Еа определяется для молекул соотношением Ед--2а^, (6.2)
Д f
м у и 2 — соответственно постоянный и наведенный (ивдуци-^анный) дипольные моменты молекул; а — электронная поляри-емость (деформируемость) неполярной молекулы.
3У Когда неполярная молекула (или атом) попадает во внешнее леКтрическое поле полярной молекулы с напряженностью Е, происходит смещение внешних электронных оболочек относительно «дер- Это явление называется электронной поляриза-ц и е й Р: P=«b« Е, гае а — коэффициент пропорциональности, получивший название электронн ой поляризуемости, выражает степень смещения электронов электрическим полем, Ео — электрическая постоянная ( £Ь = 8,85«10“12 ф/м).
Электронная поляризуемость а возрастает с увеличением размеров молекулы или атома и их молярной массы. Например, для Аг Кг и Хе значения а равны соответственно 1,66» 10“ , 2,54* 10“ 4 и 4,15*10“24 см3.
Поэтому молекулы с большой молярной массой образуют более прочные межмолекулярные связи с полярными молекулами.
Энергия Лондона (Ед), или энергия дисперсионного взаимодействия, характеризует прочность межмолекулярных (межатомных) связей у бездипольных, неполярных молекул или атомов (образование, например, жидкого ксенона, водорода, жидкого ССЦ или жидкого CF4).
Лондон Фриц (1900-1954) — немецкий физик.
У сблизившихся неполярных молекул могут возникнуть из-за быстрого перемещения электронов в молекулярных орбиталях мгновенные диполи (рис. 27, в), которые и индуцируют диполи в других неполярных молекулах. Мгновенные диполи появляются и исчезают с частотой 10,э циклов/с, что приводит к какому-то постоянному межмолекулярному взаимодействию, энергия которого равна:
Е л = — Ей т , (6.3)
416
где Еи — энергия ионизации молекулы или атома.
Образование неполярных молекулярных жидкостей и кристаллов обязано исключительно дисперсионному взаимодействию. Особенностью дисперсионного взаимодействия является его всеобщность. Оно в°зникает не только у неполярных молекул, но и у любых молекул, независимо от их строения. Именно дисперсионное взаимодействие Ридает межмолекулярным взаимодействиям универсальность.
Сравнение всех видов межмолекулярного взаимодействия при-Дено в табл. 13, из которой следует, что взаимодействие полярных олекул обусловлено в основном ориентационным взаимодействием *°ЛеКул (молекулы Н2О). У полярных молекул, имеющих доста-Чно высокую электронную поляризуемость, значения Ек и Ел н°вятся соизмеримыми (молекулы NH3).
4*
99
Таблица 13. Значения Ем при расстоянии между молекулами 500 пм и температуре 298 К
Молекулы Я. D «•1024, см3 Ек Ед, кДж/моль Ел
Хе 0 4,0 0 0 1.1
СС14 0 10,5 0 0 7,5
. Н2О 1,86 1,5 0,8 0,04 0,2
HI 0,38 5,4 1«10~3 6«10-3 2,1
NH3 1,46 2,2 0,3 0,04 0,3
Помимо сил межмолекулярного взаимодействия существуют еще исилы взаимного отталкивания электронов и ядер молекул, проявляющиеся при сближении последних. Не будь этих сил, молекулы при сближении сливались бы в одно целое и плотность вещества возрастала бы неограниченно. Энергия отталкивания молекул друг от друга равна:
Вот = + 4, (6.4)
где b — постоянная отталкивания; п = 5—15.
В результате уравновешивания сил притяжения и отталкивания
Рис. 28. Зависимость энергии межмолекулярного взаимодействия двух молекул от расстояния между ними;
fo — равновесное расстояние между молекулами: / — энергия отталкивания; 2 — энергия межмолекулярного взаимодействия; 3 — энергия притяжения молекул
молекулы в жидком и твердом агрегатном состояниях остаются на конечном (равновесном) расстоянии друг от друга.
Потенциальная кривая взаимодействия двух молекул имеет тот же вид, что и потенциальная кривая взаимодействия двух атомов (рис. 28). Различаются потенциальные кривые только количественно: глубина потенциальной ямы при межмолекулярном взаимодействии меньше, а равновесное расстояние центров тяжести двух молекул больше. Различие между химическими и межмолекулярными силами в первую очередь количественное, природа же сил в обоих случаях одна и та же — электрическая.
Общее уравнение межмолекулярного взаимодействия при Т = const
100
Ем
а , b
—7 +---
I6 Г
(6.5)
где а и b — постоянные. Это уравнение называют уравнением Леннарда-Джонса, а при и=12 — «потенциалом 6—12».
Лайнард-Джонс Джон (1894—1954) — английский химик-тео-ретнк.
К ион-дипольному взаимодействию относят взаимодействие ионов с полярными и неполярными молекулами. В электрическом поле иона полярная молекула стремится ориентироваться той своей частью, где сконцентрирован заряд противоположного знака. Энергия ион-дипольного взаимодействия определяется из соотношения
Вид = (6.6)
4лео/
где z — заряд иона; £ о — электрическая постоянная.
Ион-дипольное взаимодействие проявляется при образовании гидратов ионов в процессе растворения ионных кристаллов в воде. Например, при растворении KI в воде в растворе появляются гидраты К+«(Н2О)х и Г«(Н2О)У.
6.2. ВОДОРОДНАЯ СВЯЗЬ
Существует особый вид межмолекулярного и внутримолекулярного взаимодействия с участием атома водорода, который получил название водородной связи. Атом водорода, уже связанный одной ковалентной (7-связыо в одной молекуле, не может быть связан второй такой же связью с другой молекулой, поскольку у него имеется лишь одна ls-АО. Водородную связь двух молекул изображают тремя точками, подчеркивая тем самым, что возникновение новой связи не затрагивает уже существующие внутримолекулярные ковалентные связи:
R1-A-H ••• fl-R2
где Ri и R2 — остатки взаимодействующих молекул; А — акцептор электронов; Д — донор электронов. Атомы А и Д — электроотрицательные атомы, F, О, N, С1 и Вг. При меньшей электроотрицательности атомов А и Д водородная связь становится очень слабой.
Образование водородной связи сопровождается смещением электронной плотности от молекулы донора к молекуле акцептора:
-6 = 0,0064
пирокатехин
+S = 0,0064 о-салициловая кислота о-нитрофенол
101
У любой водородной связи угол —А—Н • • • Д— всегда близок к 180°, а ее длина, определяемая как расстояние между атомами А и Д, составляет 228—350 пм. Энергия водородной связи в зависимости от электроотрицательности атомов А и Д изменяется в пределах 4—60 кДж/моль. Водородная связь образуется в результате диполь-дипольного и ион-дипольного взаимодействия, которое требует линейного расположения атомов —А—Н • • • Д—, так как в этом случае силы притяжения максимальны, а силы отталкивания минимальны.
Наиболее прочными являются водородные связи при ион-диполь-ном взаимодействии —А—Н + Д~. Изменение энергии Д£ (298 К) при образовании водородных связей в ионах HFi, HCI2 и НВгг равно соответственно -155, -59 и -54 кДж/моль. По мере уменьшения электроотрицательности атомов галогенов падает и энергия образующихся водородных связей. Энергия водородной связи в ионе HF2 не отличается по своему значению от энергии обычных химических связей. В таких случаях прибегают для объяснения природы водородных связей к методу молекулярных орбиталей в трехцентровом приближении (см. раздел 5.7).
Различают симметричную и асимметричную водородные связи. В первом случае атомы А и Д принадлежат одному и тому же элементу (связи Н—О—Н ••• ОНг или F—Н ••• F ), во втором случае атомы А и Д принадлежат разным элементам (связи Й—О—Н ••• NH3 или И—О—Н ••• F").
Водородная связь образуется не только между молекулами, но и внутри молекулы. Внутримолекулярная водородная связь объединяет части одной и той же молекулы. Для образования внутримолекулярной водородной связи необходимо, чтобы функциональные группы молекулы, содержащие атомы А и Д, находились рядом, на сравнительно небольшом расстоянии. При значительном удалении этих групп друг от друга образуется не внутримолекулярная, а межмолекулярная водородная связь. Для внутримолекулярной водородной связи не наблюдается линейность в расположении атомов А, Н и Д.
Соединения с внутримолекулярной водородной связью, как правило, менее растворимы, чем их изомеры, обладают более низкими температурами плавления и кипения, так как такие молекулы мало связаны с соседними молекулами, имеют меньшую вязкость в жидком состоянии. Органические кислоты, у которых кислород карбоксильной группы участвует в образовании внутримолекулярной водородной связи, являются более сильными кислотами, чемфих изомеры. Водородная связь облегчает отрыв протона Н из-за перераспределения электронной плотности.
При образовании сильных межмолекулярных водородных связей вещество приобретает более высокие температуры плавления и кипения по сравнению со своими аналогами, имеющими очень слабые водородные связи (порядка 0,5—4,0 кДж/моль).
Межмолекулярные водородные связи приводят к образованию
102
Рис. 29. Межмолекулярные водородные связи: а — фрагмент структуры жидкого фтороводорода; 6 — димерные молекулы муравьиной кислоты; в — фрагмент структуры льда
димерных молекул, циклических и цепочечных структур (рис. 29, а, б). В частности, жидкий фтороводород содержит циклические структуры, а в газообразном состоянии — цепочечные (HF)n, где п = 4—6.
Кристаллы борной кислоты В(ОН)з состоят из слоев молекул, объединенных водородными связями. Водородная связь приводит к образованию в водном растворе ионов оксония: Н + иНгО «—~ . ' Н2м+1О^, где и=1—5 (см. раздел 10.2). Водородные связи создают ажурную структуру льда, состоящую из тетраэдрических фрагментов (рис. 29, в). Поэтому лед имеет небольшую плотность по сравнению с водой. При плавлении водородные связи частично разрушаются, молекулы воды сближаются и плотность ее возрастает. Структуру обычного льда имеют кристаллы фторида аммония NH4F, в которых каждый атом азота образует связи N—Н • • • F длиной 271 пм.
Водородные связи являются причиной образования полигидрофторидов калия: KH2F3, KH3F4, KH4F5, K2H5F7. В кристаллах гидрокарбоната натрия ЫаНСОз анионы связаны водородной связью в бесконечные цепи (НСОз)п, удерживаемые друг относительно друга электростатическим взаимодействием с катионами Na .
В водных растворах аммиака часть молекул NH3 связана водородными связями с молекулами растворителя (Н—О—Н ••• NH3).
6.3. АГРЕГАТНЫЕ СОСТОЯНИЯ ВЕЩЕСТВА
Любое вещество может находиться в обычных условиях в зависимости от давления и температуры в одном из четырех агрегатных состояний: твердом, жидком, газообразном илц в виде плазмы. При низких температурах и высоких давлениях все вещества находятся в твердом (кристаллическом или аморфном) состоянии. Твердое и
юз
Рис. 30. Фазовые р-7-диаграммы состояния веществ: а — COi; б — Н2О; Тс, Ттг, Тшл, Ткр — температуры соответственно сублимации, тройной точки, кипения и критического состояния; К — критическая точка; Ф — тройная точка
жидкое состояния вещества называют конденсированным состоянием. Вещества, не разлагающиеся при плавлении и кипении, могут иметь все четыре агрегатных состояния.
Состояние вещества, зависящее от температуры и давления, можно изобразить при помощи фазовой р-Т-д иаграммы (рис. 30). Такие диаграммы характерны для всех веществ, существующих в твердой, жидкой и газообразной фазах.
Кривые ОФ (рис. 30) — кривые сублимации (возгонки) твердой фазы, кривые двухфазных равновесий «твердая фаза ♦ - ' газообразная фаза». Из диаграммы (рис. 30, а) следует, что сублимация СОг происходит уже при атмосферном давлении (точка С), а лед переходит в пар, минуя жидкое состояние, только при очень низких давлениях^ меньше 6*10—4 МПа (0,006 атм). Кривые ФП — кривые плавления, т. е. кривые двухфазных равновесий «твердая фаза у-—» жидкая фаза». Из диаграммы следует, что СО2 можно превратить в жидкость только при давлении больше 0,5 МПа (5,1 атм). Наклон кривых ФП связан с принципом Ле Шателье. У подавляющего большинства веществ, к которым относится и СОг, молярный объем жидкой фазы больше, чем твердой. Поэтому сповышением давления фазовое равновесие «твердая фаза • жидкая фаза» будет смещаться влево, в сторону уменьшения
объема жидкой фазы, а более позднее появление жидкой фазы связано с повышением температуры, с отклонением кривой ФП вправо. У таких веществ, как Н2О, Bi и Ga, молярный объем жидкой фазы меньше, чем твердой, поэтому повышение давления будет смещать фазовое равновесие вправо, в сторону образования жидкой фазы, что связано с понижением температуры плавления. В этом случае с увеличением давления кривая ФП, поднимаясь вверх, начнет отклоняться
1ПЛ
Рнс. 31. Межмолекулярные силы в объеме жидкое™ и на ее поверхнос™: кружком обозначены молекулы; стрелками указаны силы межмолекулярного взаимодействия
Жидкости имеют много общего с
влево. Кривые ФК — кривые испарения, обрывающиеся в критической точке, в которой различие в свойствах жидкой и газообразной фаз исчезает, исчезает и граница раздела фаз. Такое состояние вещества называют флюидным (подробнее см. разделы 36.6 и 36.7).
Все три кривые сходятся в точке Ф, которую называют тройной точкой. В тройной точке в фазовом равновесии находятся все три фазы. При изменении либо давления, либо температуры исчезнет по крайней мере одна из трех фаз. Координаты тройной точки (р, Г) — физические константы вещества.
Жидкое состояние вещества.
твердыми веществами по компактному расположению частиц, что вызывает малую их сжимаемость по сравнению с газами. Частицы в жидкости образуют лабильные упорядоченные агрегаты (ближний порядок), разделенные областями беспорядочного расположения частиц. Агрегаты или ассоциаты частиц не имеют резких границ; перемещаясь в жидкости, они теряют одни частицы и приобретают другие, а также могут полностью разрушаться и возникать вновь. При понижении температуры агрегаты частиц увеличиваются в размерах, приобретают большую стабильность и упорядоченность в расположении частиц. Вблизи температуры кристаллизации агрегаты превращаются в зародыши и центры кристаллизации твердой фазы (см. раздел 9.4). Отличают жидкости от твердой фазы и сближают их с газами большая подвижность частиц, текучесть и изотропность (одинаковость физических свойств по различным направлениям). Между частицами жидкости существуют равномерно распределенные по объему и перемещающиеся пустоты с размерами, примерно равными размерам частиц.
Жидкости присущ определенный объем, в свободном состоянии она стремится принять такую форму, которая соответствовала бы минимальной площади ее поверхности. Энергия, необходимая для увеличения поверхности жидкости, называется поверхностным натяжением. Измеряется эта энергия в джоулях на квадратный метр (Дж/м2). Минимального значения поверхностное натяжение достигает, когда жидкость принимает сферическую форму (например, в эмульсиях). Поверхностное натяжение возникает из-за неуравновешенности межмолекулярных сил, действующих у поверхности жидкости. Если в объеме жидкости на каждую ее молекулу Действуют одинаковые во всех направлениях межмолекулярные силы. то на поверхности силы, втягивающие молекулы в объем, не
105
уравновешены силами, отрывающими молекулы от поверхности, так как в газовой фазе очень мало тех же молекул (рис. 31).
Твердые фазы. Твердые фазы могут находиться как в кристаллическом, так и в аморфном состояниях. В аморфном состоянии вещество сохраняет неупорядоченное расположение частиц жидкой фазы, т. е. существует только ближний порядок Поэтому в аморфном состоянии вещество является бес-
твердых кристаллов
Рис. 32.
(а)
Плавление и аморфного вещества (б)
частиц.
форменным. Аморфные вещества отличает от кристаллов два признака: изотропность свойств и отсутствие фиксированной температуры плавления (рис. 32). Переход аморфного вещества из твердого состояния в жидкое не сопровождается скачкообразным изменением свойств; например, плавление происходит в некотором температурном интервале. По сравнению с твердыми кристаллами того же вещества аморфное вещество обладает большим удельным объемом, энтропией и энтальпией. Аморфное состояние вещества — метастабильное состояние. С течением времени аморфное вещество превращается в кристаллическое с выделением I' энергии.
Стеклообразное состояние вещества также является аморфным состоянием. Образование аморфных (стеклообразных) веществ происходит при быстрой кристаллизации, значительном переохлаждении расплавов, когда частицы вещества не успевают занять свои места в узлах кристаллической решетки. В стеклообразном состоянии могут находиться простые вещества (С, Р, As, S, Se и др.), оксиды (В2О3, SiO?, Р4О10 и др.), галогениды (ВеРг), халькогениды (AsSa, SbiSea и др.) и многие органические полимеры.
в Твердые кристаллы — трехмерные образования, характеризующи-| еся строгой повторяемостью одного и того же элемента структуры i (элементарной ячейки) во всех направлениях.
Элементарная ячейка — наименьший объем кристалла в виде параллелепипеда, повторяющегося в кристалле бесконечное число раз (рис. 33). Элементарные ячейки соприкасаются целыми гранями, каждая из них содержит определенное число частиц вещества (атомов, ионов или молекул) и характеризуется длиной своих ребер (а, Ь, с) и значениями углов (a, ft, у) между ними. Длины ребер и углы между ними элементарной ячейки называют параметрами кристаллической решетки. Любой частице (отмечена *, рис. 33) в данной элементарной ячейке соответствует пространственно Эквивалентная частица в другой такой же элементарной ячейке того же кристалла.
Геометрически правильная форма кристаллов обусловлена преж-
106
Рис. 33. Кристаллическая решетка (а) и элементарная ячейка кристаллической решетки CsCl (б): жирными линиями выделена элементарная ячейка; черными кружками выделены узлы кристаллической решетки
де всего их строго закономерным внутренним строением. Если вместо атомов, ионов или молекул в кристалле изобразить точки как центры тяжести этих частиц, то получим трехмерное регулярное распределение таких точек, называемое кристаллической решеткой (рис. 33). Сами точки называют узлами кристаллической решетки. Прямая линия, проведенная через любые два узла, пройдет и через другие подобные узлы, расположенные на одинаковом расстоянии друг от друга.
Кристаллическая решетка — это абстрактный математический образ, позволяющий фиксировать расположение узлов, а следовательно, и частиц вещества в пространстве. Решетка состоит из совершенно идентичных элементарных ячеек. Кристалл же — реальное химическое вещество с правильным внутренним строением, физически и химически однородное. Каждое кристаллическое вещество характеризуется своими параметрами кристаллической решетки, своей кристаллической структурой, строго определенным расположением частиц вещества в трехмерном пространстве.
Все кристаллы по параметрам их элементарных ячеек можно разделить на семь кристаллических систем, или сингоний (табл. 14).
Таблица 14. Сингонии твердых кристаллов
Сингония
Параметры элементарной ячейки
Примеры
Кубическая Ромбоэдрическая или тригональная
Тетрагональна^
a-b-с, а- р - у - 90° a —b~ С, а- р --у * 90°
а - b с; а-р^у~ 90°
NaCl, CaF2, СО2, CaO, FeS2, ZnS
А12Оз, Сг2Оз, СаСОз, SiO2, HgS, графит
5>пО2, MnO2, CilFeS2, tiO2
107
Продолжение табл- 14
Сингония Параметры элементарной ячейки Примеры
Ромбическая или ортогональная с; а — р —у — 90° S8, 12. PbSCM, BeCh, Na2SO4, KNO3, КМ11О4
Гексагональная а-b* с; а-р-90°; у- 120° NaNO3, Н2О, CdS, Agl
Моноклинная b с\ а ~ 90° * у NallCOj, AICI3, K2SO3, CaSO4«2H2O
Триклинная а*Ь*с, а * р * у В(ОН)з, CuSO4«5H2O, K2Cr2O7
Помимо симметрии у кристаллического вещества есть еще два основных признака: анизотропия и способность к самоогране-нию. >
Анизотропия, или векториальность свойств кристалла, — это зависимость свойств (механических, оптических, электрических, тепловых и др.) от направления в кристалле. Например, в кристалле хлорида натрия NaCl прочность на разрыв по диагонали составляет 2150 г/мм2, а по любому направлению, перпендикулярному к граням, — только 570 г/мм2. Анизотропия в скорости роста отдельных граней кристалла вызывает многообразие кристаллических форм. У оптически анизотропных кристаллов окраска зависит от того, под каким углом наблюдается проходящий свет. Изменение окраски кристалла при врашении получило название плеохроизма.
Одно и то же кристаллическое вещество при разных способах его получения может иметь разную структуру, образовывать разные по форме и симметрии кристаллы. Это явление называют полиморфизмом.
Полиморфизм — способность кристаллов существовать без изменения химического состава в нескольких кристаллических формах с различной структурой и свойствами. Такие формы называют полиморфными модификациями, а взаимные превращения модификаций называют полиморфными переходами.
Переход из одной полиморфной модификации в другую происходит при нагревании или увеличении давления или при одновременном воздействии этих двух факторов и связан со скачкообразным изменением свойств. Процесс перехода одной модификации в другую бывает обратимым (или энантиотропным) и необратимым (или монотропным). Примером энантиотропного перехода одной модификации в другую может служить переход: G-SiO2 (ромбоэдрический) . /?-SiO2 (гексагональный), протекающий при
575 °C (см. табл. 14).
К монотропному переходу принадлежит превращение нитрида бора BN — мягкого белого вещества гексагональной сингонии, в нитрид бора кубической сингонии, боразон с твердостью, равной твердости алмаза, но с большей стойкостью к окислению. Этот монотропный переход происходит при 1500—1800 °C и давлении 6,5—8,5 ГПа. При снижении температуры и давления до значений,
108
отвечающих обычным условиям, боразон сохраняет свою кубическую структУРУ и отвечающие ей свойства.
Полиморфизм кристаллов простых веществ называют аллотропией.
g Аллотропия — способность химических элементов существовать в « виде двух и более простых веществ, различных по строению и | свойствам.
У аллотропных модификаций простых веществ также существуют энантиотропные и монотропные переходы. Примером энантиотропного перехода может служить превращение: ct-Se (ромб.). * /З-Ss (мо-
нок.) (см. табл. 14). К монотропному переходу принадлежит превращение белого фосфора Р4 под давлением 1,25 ГПа и температуре 200 °C в наиболее стабильную модификацию, черный фосфор. После снятия давления и температуры черный фосфор обратно не превращается в белый. Давление способствует монотропному переходу, так как плотность белого и черного фосфора равна соответственно 1,8 и 2,6 г/см3 (принцип Ле Шателье). К монотропному переходу принадлежит и превращение графита (гексагональная сингония) в алмаз (кубическая сингония) при давлении 6 ГПа и температуре 1500 °C в присутствии катализаторов (расплавленные никель, хром и другие металлы). Алмаз имеет более высокую плотность (3,5 г/смл), чем графит (2,2 г/см3), и поэтому давление благоприятствует его образованию. Алмаз является неустойчивой в обычных условиях аллотропной модификацией углерода, но его обратный переход в графит не протекает из-за ничтожно малой скорости превращения. Графитизация алмаза начинается только выше 1500 °C в среде аргона или гелия, так как на воздухе алмаз сгорает при 870 °C.
Некоторые соединения и простые вещества имеют по нескольку полиморфных модификаций. Например, диоксид кремния SiOi имеет десять модификаций, фторид кальция CaF2 — шесть, нитрат аммония NH4NO3 — четыре, диоксид титана ТЮг — три и т. д. Полиморфные и аллотропные модификации принято обозначать греческими буквами а, /3, у, д, Е, ..., начиная с низкотемпературных модификаций. Например, энантиотррпные полиморфные переходы NH4NОз будут иметь обозначение: Ct/-—/3 У —► (5 (над знаком обратимости указана
температура перехода, °C). Последняя модификация д-МЩМОз уже не испытывает превращения до т. пл. 170 °C. Энантиотропные полиморфные переходы СаРг протекают при следующих температурах (°C): а ^/3 Ж У <5 е при 1419 °C CaF2 плавится.
Образование вещества, имеющего несколько полиморфных модификаций, протекает при кристаллизации из пара, раствора, расплава, при термическом разложении двух веществ ступенчато, причем сначала образуется менее устойчивая в данных условиях модификация, которая затем превращается в более устойчивую (правило ступеней Оствальда). Например, при конденсации пара Фосфора вначале образуется белая неустойчивая модификация, которая в обычных условиях медленно, а при нагревании быстрее переходит в красную модификацию.
109
Оствальд Вильгельм Фридрих (1853—1932) — немецкий фи-зикохимик, изучал поведение веществ в растворах при Электролитической диссоциации. Лауреат Нобелевской премии, иностранный член-корреспондент Петербургской АН.
У оксида свинца РЬО существует две модификации: а-РЬО красного цвета (гексагональная сингония) и /3-РЬО желтого цвета (ромбическая сингония). Полиморфный переход первой модификации во вторую протекает при 540 °C. Если нагревать [РЬб(ОН)4О4], то вначале, около 70 °C, образуется желтая модификация, более высокотемпературная, которая переходит в красную около 100 °C, а при 540 °C — снова в желтую, стабильную, высокотемпературную модификацию.
Жидкие кристаллы. При охлаждении некоторых жидких веществ появляется новое их состояние, похожее и на жидкое, и на твердое. В этом состоянии вещество полупрозрачно или непрозрачно, сохраняет текучесть, но уже имеет анизотропные свойства и обладает определенной упорядоченностью структуры.
Такое состояние вещества называют ж и д к о-к ристалли-ч е с к и м. По степени молекулярной упорядоченности жидкие кристаллы занимают промежуточное положение между твердыми кристаллами, в которых существует трехмерный дальний порядок, и жидкостями, имеющими только ближний порядок в расположении частиц. Поэтому жидко-кристаллическое состояние часто называют мезоморфным, а само вещество — мезофазой.
Наиболее часто жидко-кристаллическое состояние встречается у органических веществ, молекулы которых имеют удлиненную форму.
Жидко-кристаллическое состояние вещества было открыто в результате наблюдений за процессами плавления. При плавлении некоторых веществ (рис. 34, а) образуется мутная жидкость, обладающая интенсивным светорассеянием и двойным лучепреломлением (рис. 34, б). Образование жидко-кристаллического состояния при плавлении кристаллов сопровождается лишь частичным разрушением дальнего порядка. При дальнейшем нагревании (рис. 34, в)
Рис. 34. Фазовые переходы у жидких кристаллов при их плавлении:
а — твердые кристаллы; б — жидкие кристаллы; В — расплав; АТ — температурный интервал существования мезофазы
110
мудаый расплав переходит в прозрачную жидкость, обладающую изотропными свойствами. Ширина температурного интервала А Г существования жидкокристаллического состояния или мезофазы тем больше, чем сильнее различие в энергиях межмолекулярного взаимодействия вдоль длинных осей молекул и перпендикулярно к ним.
Типы твердых кристаллов. Все многообразие кристаллических веществ можно свести к нескольким типам, если принять во внимание только вид частиц и характер химической связи между ними. Различают ионные, атомные, молекулярные и металлические кристаллы.
Ионные кристаллы образованы противоположно заряженными ионами (простыми или сложными), объединяемыми вместе ионной химической связью. Ионы не являются, как правило, сферическими и в зависимости от числа окружающих их противоионов могут сжиматься и расширяться. Так как чисто электростатическое взаимодействие ионов не имеет направленности, каждый ион стремится окружить себя как можно большим числом ионов противоположного знака. Поэтому в ионных кристаллах нельзя выделить дискретные обособленные молекулы, каждый ионный кристалл следует рассматривать как одну гигантскую молекулу. Ионные кристаллы отличают большая твердость, высокие температуры плавления, малая летучесть, слабая деформируемость, а следовательно, высокая хрупкость. Твердые кристаллы в чистом виде и бездефектном состоянии обладают плохой электрической проводимостью, но в расплавленном состоянии проводят электрический ток (ионная проводимость).
Наиболее яркими представителями ионных кристаллов являются галогениды s-элементов.
Атомные кристаллы состоят из нейтральных атомов, объединенных вместе ковалентными химическими связями. В структуре атомного кристалла также невозможно выделить дискретные обособленные молекулы, каждый кристалл следует рассматривать как одну гигантскую молекулу.
Атомные кристаллы, как правило, плохие проводники теплоты и электричества. Их отличают химическая инертность, высокая твердость, тугоплавкость, практическая нерастворимость в каких-либо растворителях. Атомные кристаллы образуют алмаз, кремний, карбиды, силициды, бориды, нитриды, фосфиды, некоторые оксиды и сульфиды.
Молекулярные кристаллы состоят из геометрически обособленных молекул, связанных межмолекулярными силами. Молекулярные кристаллы в большинстве случаев обладают низкими температурами плавления и кипения с небольшим температурным интервалом между ними, \Они имеют высокую летучесть, небольшую твердость, не обладают электрической проводимостью, их растворы и расплавы также не проводят электрического тока. Молекулярные кристаллы принадлежат к типичным диэлектрикам.
Молекулярные кристаллы образуют все газы (Нг, Ог, N2, СОг,
ш
SFe и др.), некоторые галогениды и оксиды. Молекулярные кристаллы могут состоять из молекул бесконечной протяженности (Se, Те, SiSi, PdCh, SeOz, MgSiOs и др.).
Металлические кристаллы состоят из атомов, (атомные орбитали которых, перекрываясь, создают совокупность близко расположенных по энергии МО или энергетическую зону. Зоны соприкасаются или даже перекрываются. Нижняя зона занята электронами, а верхняя состоит из свободных энергетических уровней (зона проводимости). В тепловом и электрическом поле электроны легко переходят с одного энергетического уровня на другой, легко перемещаются по близко расположенным энергетическим уровням, при этом не происходит разделения электронов и положительных ионов.
Металлические кристаллы обладают высокой электрической проводимостью и теплопроводностью, металлическим блеском и непрозрачностью, легкой деформируемостью (ковкостью и пластичностью).
Приведенная выше классификация твердых кристаллов отвечает предельным случаям. Большинство кристаллов неорганических веществ принадлежит к промежуточным типам — ковалентно-ионным, молекулярно-ковалентным и т. д. Например, в кристаллах графита внутри каждого слоя связи ковалентно-металлические, а между слоями — межмолекулярные.
♦ ♦ »
Межмолекулярные силы, удерживающие вместе частицы жидко-/ сти и молекулы твердого вещества, имеют электрическую природу. Межмолекулярные силы вызваны дисперсионным взаимодействием, взаимодействиями типа диполь-диполь, диполь-индуцированный диполь, ион-диполь, ион-индуцированный диполь. Дисперсионные силы действуют между ионами, атомами и молекулами независимо от наличия у них зарядов или постоянных дипольных моментов. Относительный вклад остальных типов взаимодействия в межмолекулярное притяжение зависит от ряда физических свойств конкретного вещества: дипольного момента, энергии ионизации, поляризуемости, структурных особенностей, молярной массы. Межмолекулярные силы принадлежат к дальнодействующим силам и изменяются по закону / , где I — расстояние между центрами тяжести взаимодействующих частиц.
Водородная связь является разновидностью межмолекулярной связи. Она возможна в тех случаях, когда взаимодействующие молекулы содержат связи Н—F, Н—О, Н—N, Н—С1. При образовании водородной связи происходит существенное перераспределение электронной плотности между атомами взаимодействующих молекул, при этом на протоне, участвующем в образовании связи, всегда имеет место уменьшение электронной плотности.
Любое вещество, если оно не испытывает химических превращений при нагревании и давлении, может существовать в трех агрегатных состояниях: твердом, жидком и газообразном. Переход
112
из одного агрегатного состояния в другое называют фазовым п е^еходом. Фазовые переходы твердого вещества в жидкое, твердого вещества — в газообразное, жидкого вещества — в газообразное являются эндотермическими процессами. Все три фазы — твердая, жидкая и газообразная — могут находиться одновременно в равноресии только при строго определенных для каждого вещества температуре и давлении (тройная точка, см. разделы 36.1 и 36.7).
Жидкие кристаллы — термодинамически устойчивое жидкое состояние рещества, обладающее свойствами твердых кристаллов (анизотропия |свойств).
Жидкое вещество не может существовать в жидком состоянии выше критической температуры независимо от того, как велико давление. Минимальное давление, достаточное для появления жидкой фазы при критической температуре, называют критическим давлением.
У твердых и жидких кристаллов одного и того же химического состава может быть несколько отличающихся друг от друга структур или кристаллических форм, называемых в случае соединений полиморфными модификациями, а в случае простых веществ — аллотропными модификациями. Аллотропия, как разновидность полиморфизма, существует только у твердых кристаллов простых веществ. Переходы кристаллов из одной модификации в другую с изменением температуры или давления могут быть обратимыми и необратимыми (см. раздел 36.6).
Твердые кристаллы подразделяют по типу связи между образующими их частицами на ионные, атомные, молекулярные и металлические.
Упражнения к главе 6
1. Чем отличаются атомные кристаллы от металлических и ионных?
2. Почему молекулы галогенов образуют молекулярные, а не ионные кристаллы?
3. При плавлении некоторого вещества образовался мутный расплав, обладающий интенсивным светорассеянием. Дальнейшее нагревание привело к тому, что расплав стал прозрачным. Можно пи назвать мутный расплав жидкокристаллическим состоянием вещества?
4. Как влияет внутримолекулярная водородная связь вещества на его растворимость, температуры плавления и кипения, вязкость вещества в жидком состоянии?
5. Чем отличается симметричная водородная связь от асимметричной?
6. Может ли образоваться водородная связь между молекулами R, — А—Н и D—R2, если электроотрицательность атомов А и D менее 2?
’ В чем структурное отличие графита от алмаза, стекла от кварца?
8. Могут ли кривые плавления, сублимации и испарения одного вещества пересекаться на р— 7-диаграмме?
9. Может ли вещество при давлении несколько выше критического находиться в жидком состоянии, если температура вещества равна критической температуре?
ГЛАВА 7. ЭНЕРГЕТИКА ХИМИЧЕСКИХ РЕАКЦИЙ
Любые химические реакции всегда сопровождаются теь^и или иными энергетическими эффектами: выделением или поглощением теплоты, света, совершением электрической или механической работы. Энергетические эффекты в виде теплоты и работы,' будучи легко измеримыми, позволяют количественно охарактеризовать конкретную химическую реакцию, поведение в ней того или иного вещества — его реакционную способность, термическую устойчивость, кислотно-основные и окислительно-восстановительные свойства. ’
Изучением энергетических эффектов химических реакций, химических и физико-химических явлений занимается наука, называемая химической термодинамикой. Собственно термодинамика — это наука о температуре, теплоте и работе (от греч. терме — теплота и динамис — сила, работа). С появлением и развитием энергетического подхода к химическим реакциям стало возможным предсказывать их направление, математически оценивать различия в химических свойствах веществ. Знание термодинамических закономерностей позволяет избежать постановки химических экспериментов, заранее обреченных на неудачу.
Особенностью химической термодинамики как науки является рассмотрение химических реакций в состоянии равновесия, когда реакция либо еще не началась, либо уже закончилась, и изменения во внешней среде отсутствуют.
7.1. ВНУТРЕННЯЯ ЭНЕРГИЯ, ТЕПЛОТА И РАБОТА
В химической термодинамике широко используют понятие система. Под системой понимают произвольно выбранную часть пространства, содержащую одно или несколько веществ. Между отдельными частями системы возможно химическое взаимодействие или перераспределение массы и энергии.
Часть объема системы, обладающая во всех своих точках одинаковыми физическими и химическими свойствами и отделенная от других частей системы поверхностью раздела, называется ф а-з ой (подробнее см. раздел 36.1).
По количеству фаз системы делят на гомогенные и гетерогенные. Гомогенной называется однофазная система, в которой все вещества находятся в одинаковом агрегатном состоянии, как правило, либо в газообразном, либо в жидком. Например, гомогенной будет система, в которой протекает реакция
Н2(г) + С12(г) = 2НС1(г)
(Индексы (к), (ж) и (г) означают, что вещество находится в кристаллическом, жидком или газообразном состояниях.)
Гетерогенной называется многофазная система. В такой системе могут содержаться вещества или одно вещество в различных агре
гатных состояниях. Система, где вдет реакция окисления железа на воздухе
4Fe<K) + 2Н2О(ж) + ЗО2(г) = 4FeO(OH)(K)
является примером гетерогенной системы (см. раздел 36.7).
Любая система отделена от внешней среды оболочкой, реальной или воображаемой.
Полная энергия системы состоит из трех видов энергии: кинетической энергии движения системы как целого объекта, потенциальной энергии, обусловленной положением системы в каком-либо внешнем поле, и внутренней энергии. Обычно химические реакции протекают в стационарных установках при отсутствии электрических и магнитных полей, а воздействие гравитационного поля Земли на химические реакции является столь малым, что не может быть экспериментально установлено. В этом случае изменения кинетической и потенциальной энергии можно не учитывать и считать, что изменение полной энергий системы определяется лишь изменением ее внутренней энергии.
Внутренняя энергия U представляет собой сумму четырех слагаемых, каждое из которых характеризует определенный вид движения в системе: кинетическую энергию движения (поступательного, вращательного, колебательного) структурных частиц (Як), потенциальную энергию межмолекулярного взаимодействия (Яп), химическую энергию внутримолекулярной химической связи (Ях), атомную энергию взаимодействия нуклонов в ядрах (Яа):
U = Як + Яп + Ях + Яа.
Поскольку в химических реакциях ядерные перестройки не происходят, Яа системы постоянна, а изменяются кинетическая, потенциальная и химическая энергии. Поэтому при переходе из начального состояния системы (1), от исходных веществ (реагентов) в конечное (2), к продуктам реакции изменение внутренней энергии будет равно:
Дя = U2 - U\ = Дяк + ДЕП + Дях. (7.1)
Абсолютные значения U\ и Ui неизвестны, поэтому можно судить только о суммарном изменении внутренней энергии системы Дя, по обмену внутренней энергии системы с внешней средой и таким формам обмена энергией, как теплота и работа.
Теплота — результат изменения внутренней энергии, характеризующий передачу хаотического поступательного, колебательного и вращательного движения от структурных частиц системы к частицам внешней среды (или наоборот) путем теплопроводности, излучения или конвекции. Такую передачу энергии называют теплопередачей. Количественно изменение внутренней энергии в процессе теплопередачи оценивают количеством переданной теплоты Q.
Теплопередача возможна только при наличии разности температур системы и внешней среды. Для экзотермических реакций, идущих с выделением теплоты, когда температура системы больше.
115
чем внешней среды, система теряет энергию и Q < 0. Для эндотермических реакций, идущих с поглощением теплоты извне, от внешней среды, значение теплоты положительное и Q > 0. Если внешняя среда представляет собой вакуум, то теплообмен не происходит и 0 = 0, внутренняя энергия системы остается без изменения, т. е. A U = 0. При равенстве температур системы и внешней среды А Т = 0 и Q = 0. Однако это не говорит об отсутствии теплопередачи, она будет происходить, но так, что количество поглощенной теплоты в единицу времени равно количеству выделенной. В этом случае говорят о состоянии теплового равновесия между системой и внешней средой.
С понятием «теплота» тесно связано другое понятие — «температура» (см. раздел 1.1). Температура представляет собой термодинамический параметр, характеризующий энергетическое состояние частиц вещества или системы. В отличие от объема, экстенсивного свойства системы, температура относится к интенсивным свойствам, она не следует закону аддитивности. Нельзя, слив в один стакан несколько пробирок воды с одинаковой температурой, получить воду с более высокой температурой. Число, которым характеризуют температуру, надо рассматривать как единое целое: 100 °C не является суммой ста единичных градусов Цельсия.
Работа — результат изменения внутренней энергии, характеризующий передачу упорядоченного поступательного движения от организованного потока частиц системы к частицам внешней среды (или наоборот) с созданием в ней такого же организованного, поступательно движущегося потока частиц. Количество совершенной в этом процессе работы W определяет изменение внутренней энергии. В химических реакциях обычно изменяется объем газообразных реагентов и продуктов реакции и совершается работа расширения или сжатия системы.
Окислительно-восстановительные реакции также могут служить источником работы, но электрической, заключающейся в передаче поступательного движения ионов системы электронам внешней цепи (внешней среды) с созданием в ней их направленного потока. И в том и в другом случае работа совершается только при наличии внешнего сопротивления (давления внешней среды, электрического сопротивления) и при физическом контакте частиц системы и внешней среды.
Работа расширения или сжатия при постоянном внешнем давлении окружающей среды р = const равна WM = р (Vz — —Vi) = pAv , где — механическая работа; Vz и V\ — объемы системы соответственно после окончания и до начала химической реакции.
Единицей такой работы будет 1 л*атм = 101,3 Дж. Если Vz > V1, система расширяется, работа будет положительной (Им > 0) и тем больше, чем выше внешнее постоянное давление р. Если система расширяется в вакуум, работа отсутствует, р = 0 и = p&V = 0. Если Nz < Pl, система в результате химической реакции сжимается, работа Жм < 0, это означает, что система «вынуждает» внешнюю среду произвести над собой работу сжатия.
116
Электрическая работа постоянного тока, которую совершает система, где идет окислительно-восстановительная реакция, равна WS = A 8, где q — заряд, перемещаемый во внешней цепи между ее двумя точками, А 8 — разность потенциалов между ними, в вольтах. Единицей W3 будет 1 Кл»В = = 1 Дж. Если по внешней цепи переносится n-электронов (моль), переходящих от восстановителя к окислителю, а заряд 1 моль электронов равен F кулонов, то q = nF электронов, отсюда W3 = = nFt\ 8, где F — постоянная Фарадея; F = 96 486 Кл/моль; 1F= “Nkc = 6,02» IO23» 1,60.10“ 9 — 96500 Кл/моль; A’А — постоянная Авогадро; е — заряд электрона, Кл.
Разность потенциалов А 8 представляет собой электродвижущую силу (э.д.с.) гальванического элемента, на электродах которого происходит окислительно-восстановительная реакция. Электрическая работа, совершаемая системой, всегда считается положительной.
В целом если система одновременно участвует в двух процессах — теплопередаче и работе — для расчета изменения внутренней энергии А//, необходимо измерить значения обеих величин: Q и W.
Теплота и работа есть следствие обмена движением микрочастиц системы и внешней среды. Теплота и работа характеризуют не систему, а временные процессы передачи движения, его преобразования. Как только закончилась химическая реакция и внутренняя энергия системы приобрела свое новое значение, процессы теплопередачи и совершения работы заканчиваются. Значения Q и W нужны лишь для того, чтобы определить изменения внутренней энергии системы. Поэтому такие выражения, как «тепловая энергия», «теплосодержание», «передача энергии», не имеют физического смысла. Веществу присуще только движение, энергия же — математическая характеристика этого движения, его мера. Конечно, не мера запасена в веществе и не мера передается от системы к системе. Движение — общее свойство материи, и только само движение может передаваться или превращаться в другие свои виды.
О теплоте и работе можно говорить только в момент передачи движения от системы или к системе, но не в связи с ее состоянием. Теплота, как и работа, не являются свойствами системы, их значение 1ависит от пути перехода системы из начального состояния в конечное. Внутри системы нет ни «теплоты», ни «работы».
Существует три типа систем по характеру их обмена движением : внешней средой: изолированные, закрытые (или замкнутые) и открытые.
Изолированной системой называют систему, масса и энергия которой неизменны. Это означает, что передача вещества и движения через оболочку такой системы исключена. Практически абсолютно изолированных систем не существует. В первом приближении к таким системам можно отнести запаянную ампулу с хорошей теплоизоляцией.
Закрытой называют систему, масса которой постоянна, а энергия может меняться. Такая система не препятствует процессам теплопередачи и работы, но через ее оболочку не происходит перенос
117
вещества. Разновидностью закрытой системы является адиабатическая система, у которой через гибкую оболочку теплопередачи не происходит, но изменение внутренней энергии системы возможно за счет совершения работы.
Открытые системы способны изменять как свою массу, так и энергию.
7.2. ПЕРВЫЙ ЗАКОН ТЕРМОДИНАМИКИ
Химическая термодинамика базируется на двух основных законах, называемых также первым и вторым началами термодинамики. Первый закон термодинамики обычно известен как закон сохранения энергии. Первый закон термодинамики не может быть выведен математически, его содержание вытекает из обобщения многолетнего опыта человечества. Первые идеи о законе сохранения материи и ее движения были высказаны в 1748 г. Ломоносовым. Уже тогда он считал, что причиной теплоты является движение молекул вещества. Идеи Ломоносова получили подтверждение в работах Майера, Гельмгольца и Джоуля, которые установили, что теплота и работа являются энергетически эквивалентными эффектами, свидетельствующими об изменении внутренней энергии системы.
Майер Юлиус (1814—1878) - выдающийся немецкий физик, врач по образованию.
Гельмгольц Герман (1821 — 1894) — крупнейший немецкий ес-тествоиспытатепь, врач по образованию, иностранный член Петербургской АН.
Джоуль Джеймс (1818—1889) — английский физик, впервые доказавший энергетическую эквивалентность теплоты и работы.
Первый закон термодинамики формулируется следующим образом:
изменение внутренней энергии закрытой системы определяется si количеством переданной теплоты и совершенной работы.
Математическая форма первого закона:
At/= Q- Ж. (7.2)
В уравнении (7.2) W представляет сумму всех работ, но чаще всего это либо работа расширения (или сжатия) 1Ум = рАУ (при р = const), либо электрическая работа И-э = п^Л
Знак А (дельта), стоящий перед символом U, означает, что U — функция состояния системы, изменение которой (A (/ = Uz - Di) не зависит от способа, пути перехода системы из исходного состоянш в конечное. Теплота же и работа функциями состояния системы н< являются. Они возникают только в процессе перехода системы и: одного состояния в другое и зависят от пути процесса, условий еп проведения. Однако в своей совокупности (Q- W) они будут дават: значения A U независимо от способа перехода системы из одноп состояния в другое.
В изолированной системе A U -= 0, Значение внутренней энерги не изменяется, так как Q-Ои ИМ.
118
Состояние системы можно описать рядом свойств, но для однозначной его характеристики достаточно знать четыре свойства, наиболее легко определяемых экспериментально: давление р, объем V, температуру Т и концентрацию св. Эти свойства называют термодинамическими параметрами системы. От их значений в начальном и конечном состояниях системы зависит изменение внутренней энергии и остальных термодинамических функций.
Для закрытой системы, в которой совершается обратимый (круговой) равновесный процесс, теплота и работа взаимопревращаю-щиеся, строго пропорциональные в количественном отношении формы передачи внутренней энергии. Когда работа является только механической работой расширения или сжатия системы, Им/(2 = = 9,869» Ю--5 л»атм/Дж. Это значение является механическим эквивалентом работы. Если значения Им и Q выразить в джоулях, то IVm/Q~ 1 или Q- Wm = 0.
Внекруговом (необратимом) процессе разность Q—Им * 0 зависит только от начального (171) и конечного (t/г) состояний системы: i/2-t7i = Ai/= Q- жм.
Таким образом, после перехода закрытой системы из начального состояния в конечное приращение движения во всех его формах (bU) в системе равно движению, полученному системой через ее границы в форме теплоты, минус движение, отданное системой через ее границы в форме работы расширения.
Разность Q—W в общем случае определяет только приращение внутренней энергии системы, но не значение этой энергии в данном состоянии системы.
Независимость значения разности Q—W от пути процесса является следствием сохранения и превращения движения, следствием эквивалентности между теплотой и работой.
Для адиабатической (от грсч. adi^batos — непереходимый) си-системы, системы без обмена движением в форме теплоты с окружающей средой (Q = 0) внутренняя энергия может изменяться только за счет работы, совершаемой системой (или над ней). Простым примером адиабатической системы является сжатие или расширение газа в теплоизолированном цилиндре: Д/7 = - W.
7.3. ТЕПЛОВОЙ ЭФФЕКТ ХИМИЧЕСКОЙ РЕАКЦИИ. ЭНТАЛЬПИЯ
| Количество выделившейся или поглощенной теплоты в конкретной в химической реакции называется ее тепловым эффектом.
Тепловой эффект относят либо ко всей реакции (единица — кДж), либо к 1 моль одного из реагентов или продуктов реакции (единица — кДж/моль), а значение Q записывают со знаком минус для экзотермической реакции и со знаком плюс для эндотермической реакции. Например:
С(к)+О2(г)=СО2(г), Q = —394 кДж или —394 кДж/моль СОг
ЗО2(г)“2Оз(г>, (2 =+288 кДж или +144 кДж/моль Оз
119
Так как тепловой эффект зависит от агрегатного состояния вещества, его обозначают нижними индексами справа у химических формул.
Согласно первому закону термодинамики при поддержании в системе неизменным ее объема (АУ-О) и при отсутствии других видов работы И'м “ 0 и, следовательно, Ди = Qv- Например:
Н2(г)+С12(г)-2НС1(г), Qv”—185 кДж/моль или
А1/ = Qv- — 185 кДж
При поддержании постоянства давления в системе и отсутствии других видов работ, кроме работы расширения “ рАУ, тепловой эффект реакции будет равен Qp - Ди + рДУ. Для перехода системы из начального (1) в конечное (2) состояние можно записать:
QP- (t/2—Ui)+p(V2— V\)-(U2+pV2)-(Ui+pVi). (7.3)
Сумма U + pV является функцией состояния системы и называется энтальпией Н: Hs и + pV. С учетом этого обозначения выражение (7.3) можно привести к виду
Qp = Н2 - Hi = ДН; Qp = Ди + рАУ = АН. (7.4)
Таким образом, тепловой эффект реакции, проведенной при постоянном давлении, есть изменение энтальпии.
Уравнения химических реакций, записанные с указанием значения АН и агрегатного состояния участников реакции, называют тер-' мохимическими.
Поскольку значение ДН зависит от термохимических параметров, систему приводят к стандартному состоянию. Таким стандартным состоянием являются обязательное равенство температур исходных веществ и продуктов реакции и поддержание постоянного давления каждого газообразного участка реакции, равного 1 атм (101 325 Па) или внешнего атмосферного давления в 1 атм, если все участники реакции находятся в твердом или жидком состоянии. Изменение энтальпии в стандартном состоянии системы отмечают верхним индексом «о»: Ая°(Т). Температуру, при которой определена стандартная энтальпия реакции, указывают особо, но чаще всего берут 298 К. В этом случае стандартная энтальпия реакции обозначается символом ДН ° (298 К). Например, термохимическое уравнение
СО(г) + Н2О(г) = СО2(Г) + Н2<г>; Дн° (298 К) - 41 кДж
показывает, что при поддержании давления каждого участника реакции в 1 атм, а общего их давления в 4 атм и температуры 298 К будет выделяться 41 кДж теплоты.
В растворах в качестве стандартного состояния для растворителя всегда выбирают состояние чистой жидкости. Для растворенных веществ за стандартное состояние принимают гипотетическое состояние раствора, который обладает свойствами предельно разбавленного раствора с концентрацией вещества В, равной 1 моль/л.
120
7.4. ЭНТАЛЬПИЯ ОБРАЗОВАНИЯ ВЕЩЕСТВ
Изменение энтальпии может характеризовать с энергетической стороны не только реакцию, но и химическое соединение, полученное в этой реакции. Поскольку синтезировать один и тот же продукт можно различными способами, для однозначной характеристики его термодинамических свойств применяют только такую реакцию, где в качестве исходных веществ участвуют простые вещества в своих термодинамически устойчивых (или стандартных) состояниях.
Термодинамически устойчивым состоянием простого вещества, существующего при Т = 298 К в твердом виде, считают его чистый кристалл под давлением 1 атм = 101 325 Па. Если простое вещество может существовать при 298 К в двух и более аллотропных формах, термодинамически стабильным состоянием будет его наиболее устойчивая форма. Так, термодинамически устойчивым состоянием углерода будет графит, а не алмаз, у серы — ромбическая сера, а не моноклинная. Исключение составляют только фосфор и олово: их термодинамически устойчивым состоянием считают белый фосфор и белое олово, а не черный фосфор и серое олово, труднодоступные стабильные модификации.
Если простое вещество при 298 К представляет собой жидкость, как, например, бром или ртуть, его термодинамически устойчивым состоянием считают чистую жидкость под давлением 1 атм.
Если простое вещество при 298 К представляет собой газ (Нг, Ог, Не и т. д.), то его термодинамически устойчивым состоянием будет газ с собственным давлением 1 атм.
За стандартную энтальпию образования вещества принимают стандартную энтальпию такой реакции, в которой 1 моль этого вещества образуется из простых веществ, каждое из которых находится в термодинамически устойчивом состоянии; символ (Т).
Например, из четырех реакций:
С(графит) + О1(г) = СО2<г)5 АЯ° (298 К) — — 393 кДж
СО(г) + 0,5О2(г) = СО2(г); Ая° (298 К) =-281 кДж
СаСОз(к) = СаО(к) + СО2(г>; А//° (298 К) = + 178 кДж
С(К) + Оз(г) - СО2(г) + о,502(e); А//0 (298 К) = - 536 кДж
только стандартная энтальпия первой реакции будет представлять одновременно и стандартную энтальпию образования диоксида углерода: (298 К) = -393 кДж/моль.
Согласно определению стандартной энтальпии образования вещества стандартная энтальпия образования простого вещества будет равна нулю. Это отправная точка отсчета, от которой отсчитывается Энтальпия образования сложных веществ и термодинамически неустойчивых простых веществ. Например, у серы известны аллотропные модификации Ss, So, S2 и др., а у углерода — графит, алмаз и карбин. Значение А/Я ° (298 К) = 0 будут иметь только стабильные модификации: Ss (ромб) и графит.
121
7.5. ЗАКОН ГЕССА И ЕГО СЛЕДСТВИЯ
Гесс в 1836 г. экспериментально установил:
_ тепловой эффект реакции, протекающей при р, Т- const или V, 8 Т - const, зависит только от вида и состояния начальных веществ в и продуктов реакции, но не зависит от пути реакции, ее механизма.
В этом и заключается содержание закона Гесса. Закон Гесса является констатацией того факта, что внутренняя энергия (при V, Т = const, Qv= &U) и энтальпия (при р,Т- const, Qp = А//) являются функциями состояния системы.
Гесс Герман Иванович (1802—1850) — русский химик, академик Петербургской АН, врач по образованию, основоположник термохимии.
Большое практическое значение имеют следствия из закона Гесса: а) изменение энтальпии химической реакции не зависит от числа ее промежуточных стадий (рис. 35);
б) энтальпия прямой химической реакции равна взятой с противоположным знаком энтальпии обратной химической реакции, например, для реакций
СаСОз(К)=СаО(к)+СО2(г) и СаО(к)+СО2<г)=СаСОз(к)
значение АТ7°(298 К) равно соответственно +178 и -178 кДж;
в) энтальпия реакции равна сумме энтальпий образования продуктов реакции минус сумма энтальпий образования исходных веществ:
АГЯ° (298 K)=S(AZH°(298 К) прод.) -2(AZH°(298 К) pear)
Например, А,Я°(298 К) реакции
РЬБ(к) + 4НгО2<ж) = PbSO4<K) + 4НгО<ж)
Рис. 35. Изменение энтальпии в одностадийной и многостадийных реакциях:
ПП — промежуточный продукт реакции:
А Я1 = АЯ2 + ДЯ3 = ДЯ4 + ДЯ5 + АЯб
122
равна с учетом стехиометрических коэффициентов [—918 + 4 х х (—286)] — [—94+4 (—187)]»—1220 кДж. Стандартные энтальпии образования PbS(K), ЩОгСж), PbS04(K) и НгО(ж) равны соответственно —94, —187,—918 и —286 кДж/моль. Следовательно, данная реакция экзотермическая, выделение теплоты целиком связано с убылью внутренней энергии Д(7, поскольку практически объем системы не меняется (РРм-О; Дя = А(/).
7.6. ЭНТРОПИЯ. ТЕРМОДИНАМИЧЕСКОЕ РАВНОВЕСИЕ
Для оценки принципиальной осуществимости конкретной химической реакции необходимы специальные количественные критерии. В качестве такого критерия Клаузиусом была предложена функция, названная им энтропией S (что означает в переводе с греч. превращение). Эта функция равна:
AS = S2 - Si = Q/T. (7.5)
В этом выражении энтропии конечного Sz и исходного состояний 51 системы относятся к одной и той же абсолютной (термодинамической) температуре Т, которую нельзя заменить другими температурными шкалами, например t, °C; Q — энергия, которой система в форме теплоты обменивается с внешней средой при температуре Т источника теплоты (системы или внешней среды). Когда наступает тепловое равновесие, значение Т будет равным у системы и внешней среды.
Клаузиус Рудольф (1822—1888) — немецкий физик-термоди-
намик, иностранный член Петербургской АН.
Уравнение (7.5) не взято Клаузиусом произвольно, оно вытекает из анализа работы идеальной тепловой машины, из так называемого цикла Карно.
Подробнее см.: Смородинский Я. А. Температура. — М.: Наука, 1987.
Эффективность работы идеальной тепловой машины не зависит от природы нагреваемого и охлажденного рабочего вещества (идеального газа) и определяется только равенством:
W <21 ~Сг Тг-Т^ Ci Сг м
где 7] — коэффициент полезного действия машины; Qi — теплота переданная рабочему веществу от нагревателя, температура которого Ti; Q1 — теплота, принятая холодильником от рабочего вещества, температура которого Тг. Уравнение (7.6) показывает, что доля внутренней энергии, которая может быть превращена в работу, зависит только от двух температур: нагревателя и холодильника.
Энтропия — свойство, присущее любой системе, любому веществу, такое же, как р, Т, V, U и другие свойства. Выражение (7.5) определяет это свойство.
При термодинамически обратимых процессах в изолированных и адиабатических системах Q = 0, $2 “ 51 и AS - 0, т. е. энтропия
123
Реагенты
Продукты реакции
Рис. 36. Изменение энтропии в изолированной системе при термодинамически обратимом (равновесном) 1 и при необратимом (самопроизвольном) процессе 2
их не изменяется (рис. 36, система /). Процесс называется термодинамически обратимым, если в любое время химическая реакция может пойти в обратном направлении при бесконечно малом внешнем воздействии, повторяя те же изменения состояния веществ, что и в прямом направлении, не изменяя в итоге внутренней энергии системы. В окружающей нас природе термодинамически обратимых процессов нет. Обратимые реакции можно провести в условиях, максимально приближенных к термодинамическому равновесию, и тогда можно считать их термодинамически обратимыми (см. раздел 7.10).
Энтропия в термодинамически необратимом процессе, протекающем в изолированной системе, возрастает, AS > 0. Это возрастание энтропии можно продемонстрировать на примере теплообмена путем теплопроводности между двумя соприкасающимися веществами А и В, обладающими различной температурой 7'а>Тв (рис. 36, система 2). Между этими веществами будет происходить необратимый процесс самопроизвольной передачи теплоты от более нагретого вещества А к менее нагретому веществу В. Предположим, что перешедшее количество теплоты Q очень мало, и, следовательно, температуры Та и Тв изменяются незначительно. Тогда для вещества А изменение энтропии составит Л5а = —(Q/Ta), а для вещества В ЛХв = Q/Тв. Общее изменение энтропии в системе будет отвечать алгебраической сумме этих изменений: AS = ASa + ASb = Q Так
как по условию Та>Тв, то AS X).
124
Процесс теплообмена не может быть связан с потерей или получением энергии (система изолирована). Возможность самопроизвольного, необратимого процесса передачи теплоты объясняется только увеличением энтропии системы.
Для любой химической реакции, протекающей в изолированной системе самопроизвольно и необратимо, энтропия продуктов реакции всегда больше энтропии исходных веществ.
Возрастание энтропии будет происходить до тех пор, пока она не достигнет максимально возможного значения, характерного для данной системы (рис. 36, система 2), пока не наступит термодинамическое равновесие. Из этого состояния изолированная система самостоятельно выйти не может, требуется нарушение ее изолированности.
Для закрытых систем, находящихся в тепловом равновесии с внешней средой,
TAS = Q. (7.7)
Для необратимых, самопроизвольных химических реакций, протекающих в закрытых системах, AS > QlT. Как показывает эксперимент, значение AS возрастает сильнее, чем Q/ Т, из-за потерь энергии в форме теплоты. Отношение Q/ Т представляет собой минимальное увеличение энтропии, соответствующее только термодинамически обратимому процессу. Чем медленнее и в меньших количествах будет осуществляться перенос энергии в форме теплоты, тем меньше будут потери и меньше будет разница между AS wQ/T.
В общем случае для изолированных систем Д$ > О, а для закрытых TAS Q.
7.7. ВТОРОЙ ЗАКОН ТЕРМОДИНАМИКИ
Второй закон термодинамики является, по существу, законом возрастания энтропии в необратимых химических реакциях. Как и первый, второй закон установлен экспериментально, в частности, путем наблюдений за работой тепловых машин.
Для систем, состоящих из очень большого числа частиц, какими являются системы с протекающими химическими реакциями и физическими процессами, применяют понятие вероятности состояния системы. В системах самопроизвольно могут протекать с изменением термодинамических параметров только такие реакции и физические процессы, которые приводят системы в наиболее вероятное состояние, а следовательно, в наиболее стабильное состояние. Обычное состояние системы, характеризуемое термодинамическими параметрами (р, Т, V, св) называется макросостоянием. Но система состоит из огромного числа частиц, каждой из которых отвечают непрерывно изменяющиеся энергия, координаты в пространстве, масса и скорость движения. Совокупность таких мгновенных характеристик каждой частицы получила название микросостояния. Каждому макросостоянию системы отвечает колоссальное число различных микросо
125
стояний. Если система находится в термодинамическом равновесии, то ее макросостояние не изменяется во времени, а микросостояния изменяются непрерывно, но так, чтобы макросостояние оставалось неизменным.
Число микросостояний, с помощью которых осуществляется данное макросостояние системы, называют термодинамической вероятностью.
Величайшей заслугой Больцмана является то, что он связал энтропию с термодинамической вероятностью уравнением, получившим его имя:
S = klnM’, (7.8)
где w — термодинамическая вероятность. Коэффициентом пропорциональности в этом уравнении служит универсальная газовая постоянная в расчете на одну молекулу k = R/Nk в 1,38*10 Дж/ (молекула* К). Единица энтропии — 1 Дж/(моль*К).
Уравнение (7.8) придало энтропии физический смысл:
энтропия — это мера термодинамической вероятности состояния веществ и систем.
Уравнение (7.8) относится к числу важнейших соотношений, рожденных научной мыслью, и является другой формой математической формулировки второго закона термодинамики:
любая изолированная система, предоставленная самой себе, изменяется в направлении состояния, обладающего максимальной вероятностью.
Докажем, применяя уравнение (7.8), что при термодинамическом равновесии в изолированной системе AS = 0. При таком состоянии системы термодинамическая вероятность состояния оставшихся после завершения реакции исходных веществ fwi) равна термодинамической вероятности состояния полученных продуктов реакции (wi). Оба эти состояния являются равновероятными. Поэтому
AS = 5г - Si = klmv2 - klnwi = kin — ,
но так как w2==m,i , то AS = 0.
Можно показать также, что любой необратимый самопроизвольный процесс в изолированной системе всегда связан с увеличением энтропии. Пусть два благородных газа Не и Ne находятся в двух частях изолированной системы:
126
Если удалить перегородку так, чтобы не изменить внутреннюю энергию системы, то, несмотря на равенство давлений и температур двух газов, начнется необратимый процесс их смешения, который приведет через некоторое время к полному смешению газов, к равномерному распределению их молекул по всему объему системы. В этом процессе происходит переход системы из менее вероятного состояния (мч), когда молекулы газов находятся в разных частях системы, в более вероятное (м>2), когда молекулы равномерно распределены по всему объему системы. Ясно, что обратный процесс самопроизвольного разделения молекул Не и Ne является маловероятным, практически невозможным. Процесс смешения двух газов не может быть объяснен обменом энергией системы и внешней среды. Необратимый процесс смешения связан с увеличением энтропии системы
AS = S2 - Si = klmv2 - klnwi = kin — , wi
но W2> m, поэтому AS > 0. Уменьшение потенциальной энергии за счет разбавления каждого газа практически равно нулю, если допустить, что исходные концентрации каждого газа малы.
7.8. ЭНТРОПИЯ — МЕРА НЕУПОРЯДОЧЕННОГО СОСТОЯНИЯ СИСТЕМ И ВЕЩЕСТВ НА МОЛЕКУЛЯРНОМ УРОВНЕ
Энтропия является мерой хаотичности движения в системе, мерой молекулярного беспорядка. Наиболее беспорядочное, статистическое распределение частиц в системе отвечает наиболее вероятному ее состоянию. Молекулярный беспорядок в системе обусловлен хаотичным (поступательным, колебательным и вращательным) движением структурных частиц веществ, образующих систему. Так, энтропия возрастает в ряду 0<02<0з (рис. 37), что связано с увеличением от атомарного кислорода до озона числа поступательных, колебательных и вращательных движений частиц вещества.
Рис. 37. Возможные виды движения атомов и молекул (показаны стрелками): поступательное; вращательное; колебательное движение; а — атом кислорода, 5° (298 Ю=16Г, б — молекула кислорода, 5° (298 К)=205; в — молекула озона, 5° (298 К)= =239 Дж/(моль«К)
127
Энтропия возрастает во всех процессах, сопровождающихся усилением беспорядочного движения частиц вещества: при нагревании, диссоциации, дроблении, увеличении объема, плавлении, испарении, сублимации, растворения и т. д. Энтропия кристаллических веществ тем больше, чем слабее их частицы связаны между собой, чем больше у них возможностей для колебательных и вращательных движений. Энтропия аморфных (стеклообразных) веществ всегда больше, чем кристаллических. Твердые вещества обладают меньшей энтропией, чем мягкие. Наименьшей энтропией среди всех простых веществ обладает алмаз как самое твердое вещество.
В отличие от энтальпии и внутренней энергии можно определить абсолютное значение энтропий всех веществ, в том числе и простых, так как для энтропии есть нулевая точка отсчета: энтропия вещества при Т=0 К равна нулю. Энтропии всех веществ всегда больше нуля и поэтому перед символом энтропии нет необходимости ставить знак дельта А При Т-0 К в совершенно чистом, бездефектном монокристалле вещества существует абсолютный порядок в расположении частиц и термодинамическая вероятность достигает минимального значения: w-l. Отсюда следует, что S=kln, м’Ч). Данное макросостояние достигается единственным микросостоянием.
По мере увеличения температуры увеличивается тепловое движение частиц в кристалле, а следовательно, увеличивается молекулярный беспорядок, а вместе с ним и энтропия. При фазовых переходах (плавлении, кипении и др.) энтропия растет скачкообразно.
Стандартная энтропия вещества обозначается символом S°(T). Для газа стандартным считается то значение энтропии, которое он имеет при собственном давлении в 1 атм (101 325 Па). Для вещества в твердом или жидком состоянии стандартным является значение его энтропии при внешнем (атмосферном) давлении в 1 атм. Для удобства сравнения между собой стандартных энтропий различных веществ их относят к одной температуре, чаше всего 298 К и обозначают символом 5° (298 К).
Изменение стандартной энтропии в химической реакции Д.Х° (298 К) определяется, как и изменение энтальпии, разностью суммарной энтропии продуктов реакции и суммарной энтропии исходных веществ:
A, S (298 К) - S[S° (298 К)прод]-2[5° (298 К)реаг]. (7.9)
Второй закон термодинамики часто используют для различных идеалистических спекуляций. Распространяя на всю Вселенную закон увеличения энтропии, метафизики приходят к выводу о неизбежности ее «тепловой смерти». Они принимают Вселенную за изолированную систему, в которой рост энтропии в конце концов приведет к равновесию, выравниванию температур, к прекращению самопроизвольных процессов. Несостоятельность этой позиции заключается в том, что нельзя считать Вселенную изолированной системой, она безгранична как во времени, так и в пространстве.
128
Та часть Вселенной, где находится наша Солнечная система, является пульсирующей открытой системой. В настоящее время она расширяется после очередного взрыва, идет удаление Галактик друг от друга. Расширение должно достичь максимума через 3»101и лет, после чего начнется сжатие этой части Вселенной, затем опять последует взрыв и вновь начнется расширение.
7.9. ЭНЕРГИЯ ГИББСА — КРИТЕРИЙ НАПРАВЛЕННОСТИ ХИМИЧЕСКИХ РЕАКЦИЙ В ЗАКРЫТЫХ СИСТЕМАХ
Изолированные системы, где осуществимость процесса легко определяется по росту энтропии, редко встречаются в практике. В лабораториях и промышленности большинство химических реакций проводят в закрытых системах, где их самопроизвольное течение может идти согласно второму закону термодинамики как с увеличением, так и с уменьшением энтропии, лишь бы произведение TAS алгебраически было больше количества переданной теплоты Q:
T&S > Q. (7.10)
У закрытых систем при р, Т = const Qp-AH, поэтому ГД$ г Д// или Д// - TAS s 0. Используя начальные и конечные значения энтальпии и энтропии, получим: (Нг — Hi) — T(Si — —Si) - (Н2 — TSt) — (Hi — TSi) £ 0. Поскольку энтальпия и энтропия являются функциями состояния системы, разность Н — TS также представляет функцию состояния. Она названа энергией Гиббса и обозначается буквой G, G = Н—TS.
Гиббс Джозайя Уиллард (1839-1903) - американский физик-теоретик, один из основоположников термодинамики..
Ее изменение равно G2 — Gi = =Дв = ДН - TAS. Таким образом, для закрытых систем, при р, Т = const AG < 0. Для самопроизвольных, необратимых реакций AG < 0. Когда AG = 0, химическая реакция закончилась и система пришла к термодинамическому равновесию с внешней средой (рис. 38). Необратимая реакция идет с постоянным уменьшением энергии Гиббса (рис. 38, кривая 1) и любая точка кривой отвечает неравновесному состоянию системы.
Стандартное значе-н ие энергии Гиббса имеет обозначение AG0 (298 К) при температуре 298 К, а при любой температуре AG °(Т).
Рис. 38. Изменение энергии Гиббса в закрытой системе р, '/'-const, в необратимой (У) и обратимой (2) химической реакции: х — равновесный состав смеси исходных веществ и продуктов реакции
s—125S
129
Стандартная энергия Гиббса образования простых веществ, находящихся в термодинамически устойчивом состоянии (см. раздел 7.4), равна нулю. Например, AZG° (298 К) -0 для Н2(г). Ог<г) и графита. Стандартное значение энергии Гиббса образования сложных веществ при 298 К: A/G0 (298 К) — это изменение энергии Гиббса в реакции образования 1 моль вещества из простых веществ, каждое из которых находится в термодинамически устойчивом состоянии:
AZG° (298 К) -2 [А/? ° (298 К)пред] - S [A,G (298 Юреаг].
В случае отсутствия в справочных таблицах значений t±fG° (Т) какого-либо сложного вещества ее можно определить по уравнению
AZG°(T> Д,Я °(298 К)—TAzS° (298К). (7.11)
Из уравнения AG = &Н - ТД$, объединяющего два закона термодинамики, следует, что осуществление химических реакций зависит от двух движущих сил: стремления системы перейти в состояние с наименьшей внутренней энергией, с выделением ее части в форме теплоты или работы (Ая < 0) и стремления системы приобрести наиболее вероятное состояние с максимально возможным молекулярным беспорядком, с максимумом энтропии (AS > 0). Первое стремление (значение АЯ) отражает склонность атомов к взаимодействию с образованием наиболее прочных молекул с минимальной энергией, объемом, с небольшими межатомными расстояниями, склонность молекул к межмолекулярному взаимодействию с образованием возможно более крупных и в то же время компактных агрегатов молекул. Значение же AS характеризует противоположную тенденцию: стремление молекул и атомов (вследствие теплового движения, действия сил отталкивания и других сил) к наиболее беспорядочному расположению, к дезорганизации. Повышение температуры, как правило, препятствует силам межатомного и межмолекулярного взаимодействия и способствует распространению частиц в возможно большем объеме.
Для химических реакций, протекающих в закрытой системе при р, Т- const с совершением только работы расширения, связь внутренней энергии с энтальпией и энергией Гиббса представлена на схеме:
По значению энтальпии можно безошибочно определить направление только таких реакций, в которых энтропия практически не
130
Д5^0(Д//>0)
Рис. 39. Температурная зависимость энергии Гиббса различных реакций: Tj и Тг — температуры начала изменения направления реакций; tg а - AS
меняется. В этом случае А(7~ -tsH и, следовательно, экзотермические реакции (АН < 0) идут самопроизвольно, а эндотермические (АН > 0) невозможны и самопроизвольно могут протекать только в обратном направлении.
При Аб = 0 или АЯ = TAS в системе устанавливается очень подвижное равновесие между ее стремлением к упорядочению (AS < 0 и тогда АН < 0) и стремлением к дезагрегации, разупо-рядочению (AS >0 и тогда ДН > 0). При малейшем воздействии равновесие в системе будет смещаться в любую сторону. Например, в фазовом равновесии «кристаллы ;.— расплав» малей-
шее понижение температуры вы
зовет появление новых кристаллов с их упорядоченной структурой; наоборот^ малейшее повышение температуры приведет к расплавлению имеющихся кристаллов. О такой системе говорят, что она находится в состоянии термодинамического равновесия (подробнее см. раздел 35.1).
Зависимость изменения энергии Гиббса от температуры дается соотношением АС = АН - 7AS, которое в первом приближении можно считать уравнением прямой линии при условии незначительного влияния температуры на значение АН и As, а также неизменности агрегатного состояния веществ. Наклон этой прямой зависит от знака и значения AS реакции (рис. 39), из которого видно, что возможно изменение знака энергии Гиббса с изменением температуры, а следовательно, и изменение направления химической реакции. При AS = 0 реакция от температуры практически не зависит, она либо возможна (АЯ <0; 2, рис. 39), либо невозможна (А//>0; 1, рис. 39). Чем больше значение AS, тем сильнее проявляется зависимость от температуры Дб-.
7.10. НАПРАВЛЕНИЕ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЙ
Математическое выражение первого закона термодинамики, включающее электрическую работу, имеет вид
Д1/ = Q- W= Q - (рДУ + W9). (7.12)
Заменяя в этом выражении Q на 7AS (Q = TAS), получим
Al/= TAS-(рДУ + W9). (7.13)
5*
131
Преобразуем уравнение AG = А(7 + pAv - ТА$, используя соотношение (7.13): AG= TAS- (pAV + №’;l) + pAV- TAS = - Жэ. Следовательно,
AG= - ТУэ- <7.14)
Таким образом, стандартная энергия Гиббса AGO(77 связана со значением электрической работы соотношением
AG°(3n)= - Жэ= - пАА Е°, (7.15)
где А 8° — стандартное значение электродвижущей силы (э.д.с.) гальванического элемента (см. раздел 7.1).
Окислительно-восстановительную реакцию можно записать в виде
нгОк (1) + «1Вс (2) т? _ игВс (1) + щОк (2), (7.16)
где Ок — окислитель; Вс — восстановитель, п — стехиометрические коэффициенты. Под символами Ок и Вс понимают одну или несколько частиц окислителя и восстановителя. Реакцию (7.16) представляют как сумму двух полуреакций, полуреакции (1) и (2):
Ок (1) + ще~ 7-- Вс (1); Вс (2) — пге - т=± Ок (2)
Если полуреакции осуществить около электродов гальванического элемента, то его э.д.с. AS позволит определить значение AG(T) реакции (7.16), а следовательно, и возможность ее осуществления (подробнее см. раздел 33.4).
Электродвижущей силой гальванического элемента А 8 (вольт) называют предельное значение разности электрических потенциалов его электродов: Д$ = <рп - (рп при токе, стремящемся к нулю. В этом выражении <рп и (рл — электрические потенциалы правого и левого электродов, у которых протекают окислительно-восстановительные полуреакции. Значение э.д.с. считают положительным, если электрический ток течет во внешней цепи от левого электрода к правому (рис. 40). В этом случае у левого электрода протекает реакция окисления (потеря электронов), а у правого — реакция восстановления (приобретение электронов).
Абсолютное значение электрического потенциала отдельного электрода экспериментально не может быть определено. За его электрический потенциал условно принимают э.д.с. гальванического элемента, в котором слева расположен стандартный водородный электрод со значением условно равным нулю, а справа — электрод, потенциал которого определяют (рис. 40).
Стандартный водородный электрод состоит из платиновой пластинки, покрытой тончайшим платиновым порошком, хорошо абсорбирующим водород, и погруженной в водный раствор кислоты с концентрацией ионов НзО+ 1 моль/л. Электрод омывают газообразным Нг с давлением 1 атм (101 325 Па) при температуре 298 К. На водородном электроде протекает обратимая реакция
132
Рис. 40. Схема измерения стандартного окислительно-восстановительного потенциала полуреакции:
1 — стандартный водородный электрод; 2 — электрод с изучаемой полуреакцией; 3 — токопроводящий электролитный мостик; схематическое изображение этого гальванического элемента: РПГЫНзО*! IFe2+. Fe3+IPt
Н2 + 2Н2О= 2Н3О+
+2е-
В зависимости от электрического потенциала правого электрода это равновесие смещается либо вправо (окисление водорода), либо влево (восстановление ионов оксония НзО ).
Например, э.д.с. гальванического элемента, приведенного на рис. 40, равна +0,77 В. Это значение принимают за электрический потенциал правого электрода и стандартный окислительно-восстановительный потенциал полуреакции
Fe3+ + e“ = Fe2+
протекающей у правого электрода. Значения стандартного электрического потенциала всегда относят к полуреакциям восстановления. Правый электрод должен находиться в таком растворе, где концентрации каждой частицы, участвующей в полуреакции, равны 1 моль/л при внешнем давлении 1 атм и температуре 298 К.
Чем больше положительное значение <р„ у конкретной полуреакции, тем более сильный окислитель она содержит.
Стандартные электрические потенциалы измерены для очень большого круга окислительно-восстановительных полуреакций и сведены в справочные таблицы. Табличные значения <р° всегда рассчитаны на перенос только одного электрона в окислительно-восстановительных полуреакциях.
См.: Лидин Р. А, Андреева Л. Л., Молочко В. А. Справочник по неорганической химии. — М.: Химия, 1987. С. 206.
133
Ниже приведен электрохимический ряд напряжений металлов, в котором металлы расположены в порядке увеличения их стандартных
электрических потенциалов <р°, отвечающих полуреакции восстановления: КГ+ + Ve~= М°. Металлы, стоящие в этом ряду левее, являются
Li Са Mg Al Мп Zn Fe Cd Ni Sn Pb (H) Cu Hg Ag Au
_____I-----1----1-----1----1-----1---J------L----1-----1----------1----1-----1----
у>° <0 <р°>0
более сильными восстановителями, чем металлы, расположенные правее, они вытесняют из растворов и расплавов солей металлы, находящиеся в ряду правее. Металлы, стоящие в ряду левее водорода, реагируют с кислотами-неокислителями с выделением водорода. Металлы, стоящие в ряду правее водорода, с кислотами-не-окислителями в обычных условиях не взаимодействуют.
Для определения возможности протекания окислительно-восстановительной реакции надо прежде всего определить, используя табличные значения у>°, какое вещество является окислителем, а какое — восстановителем. Например, какие га-логенидные ионы будут участвовать в реакции
2НаГ + 2Fe3+ - (Hal)2 + 2Fe2+
где Hal “ Cl, Br, I, если эту реакцию проводить в стандартных условиях? Известны значения стандартных электрических потенциалов следующих полуреакций:
1) Fe3+ + е~ - Fe2*, <р ° - 0,77 В;
2) Вг2 + 2е~ - 2Вг~ , у> ° = 1.06 В;
3) С12 + 2е—= 2С1~ ; у,0-!,36В;
4) 12 + 2е--21, у> °-0,54 В.
Из сравнения значений <р° полуреакций следует, что только иод 12 будет более слабым окислителем, чем иои Fe , поэтому возможна только одна реакция:
2I~ + 2Fe3+ - 1г + 2Fe2+
для которой AG° <298 К) - — пГД8° 2-96,5(0,77 — 0,54) - — 44 кДж. Значение AG(298 К) свидетельствует о самопроизвольности реакции. Гальванический элемент, в котором правым электродом будет электрод с первой полуреакцией, а левым — с четвертой полуреакцией, даст э.д.с., равную Af> ° = 0,77 - 0,54 - 0,23 В.
Если ионы имеют промежуточную степень окисления, то значения у> ° позволяют определить их склонность к диспропорционированию. В любом случае, когда значение <р ° для полуреакции, содержащей иои (1) в более низкой степени окисления, больше, чем у>2 Для полуреакции, содержащей тот же ион (1) вместе с ионом (2), имеющим более высокую степень окисления, неравенство у> ° > <р % указывает на термодинамическую неустойчивость иона (1) и возможность его диспропорционирования.
Так, сравнение значений у> ° для полу реакций
Cu2+ + е~ - Си+ , <р °- 0,15 В и Cu+ + е~ - Си°, <р ° - 0,52 В
показывает, что значение у> ° для второй полу реакции на 0,37 В больше, чем значение у>° полуреакции с участием Си* и Си2+- Это означает, что в водном растворе ион
134
Cu+ будет подвергаться реакции самоокисления — самовосстановления или реакции диспропорционирования: 2Си+ - Си0 + Си - Поэтому при растворении CU2SO4 в воде выпадает осадок металлической меди и образуется C11SO4.
Сравним значение <р° еще для двух полуреакций:
1) МпоГ + 4Н+ + 2е~ - МпОг + 2НгО, <р ° - 2,26 В;
2) МпОГ + е~ - МпО2-; <р 2 “ 0,56 В.
Так как <р ° > <f> %, ион МпО будет подвергаться диспропорционированию с выделением в осадок практически не растворимою в воде МпО? и образованием аниона МпО4 , окрашивающего раствор в фиолетовый цвет:
ЗМпО2- + 2Н2О - 2МпОГ + МпО21 + 4ОН~
Стандартные электрические потенциалы известных полуреакций позволяют рассчитать значение ° для более сложных систем, отсутствующих в справочных таблицах. Например, значение <р ° для полуреакции Мп3+ + Зе - Мп° находят следующим образом:
Мп3+ + е~ - Мп2+, <р ° - 1,50 В;
Мп2++ 2е— -Мп', 2 "—1,19 В.
? + 2у> °
Искомое значение <р — ——--= [ 1,50 + 2 (— 1,19) ] :3 - — 0,29 В.
7.11. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ СВОЙСТВА КИСЛОТ
Кислоты как вещества, образующие ионы оксония НзО , условно делят по их окислительным свойствам в водном растворе на «кислоты-окислители» и «кислоты-неокислители».
Кислоты-неокислители, к которым относятся водные растворы галогеноводородов, фосфорная кислота Н3РО4, муравьиная НСООН и уксусная кислоты СНзСООН, гексафторосиликат водорода Н2 [Si F6 ], разбавленные водные растворы серной кислоты H2SO4 и тетраоксохлората водорода НСЮ4, взаимодействуют с металлами, находящимися в электрохимическом ряду напряжений левее водорода, с выделением водорода и образованием, как правило, аквакатионов:
M + nH2O+vH3O+= [М(НгО) v + n]v + +0,5vH2t
Окислительные свойства у таких кислот проявляет ион оксония, а анионы не подвергаются воздействию восстановителя и остаются без изменения. Некоторые кислоты-неокислители (НС1, HBr, Н1, НСООН, SO2 • хНгО) проявляют восстановительные свойства при воздействии достаточно сильных окислителей (КМпО4, РЬОг, К2СГ2О7, K2S2O8).
У кислот-окислителей (HNO3, H2SeO4, концентрированных H2SO4, НСЮ4 и существующих только в водном растворе НМпО4, Н2СГ2О7) функции окислителя выполняют оксоанионы, кислотообразующий элемент которых в окислительно-восстановительной реакции уменьшает свою степень окисления, превращаясь в другую по составу частицу. Катионы оксония в этих реакциях дают молекулы воды. Например:
135
Zn + 2N0 з + 4H3O+ = [Zn(H2O)6]2+ + 2N0t
2A1 + SeOl" + 8H3O+ = 2 [Al (H2O) 6 ]3+ + Se f
Оксоанионы кислот, образованные металлами (МПО4, Cr2O^). как правило, восстанавливаются в кислой среде до акватионов, как. например, это происходит в реакции
Сг2О?“ + 6СГ + 14Н3О+ = 2 [Сг(Н2О)б ]3+ + ЗС12 f + 9Н2О
Механизм превращений оксоанионов довольно сложен и зависим от их конкретной природы. В частности, восстановление азотной кислоты HNO3 идет, как показывают некоторые экспериментальные данные, через промежуточные состояния окисления: HNO3- NO2-> NO-» N2O-» NHt. Образование N2 в водном растворе в качестве самостоятельной стадии маловероятно и происходит только при повышенных температурах. Поведение HNO3 как окислителя в большей степени зависит от кинетических эффектов, чем термодинамических (см. раздел 34.4).
Некоторые кислоты, как H2SO4, НСЮ4, могут быть в разбавленных водных растворах кислотами-неокислителями, а в концентрированных нагретых водных растворах — «кислотами-окислителями». Например:
Мп + Н28О4(разб.) “ MnSO4 + H2f t
Мп + H2SO4(kohu.) = MnSO4 + SO2f + 2H2O
P4 + 4HC1O4(kohu.) = (HPO3)4 + 2Ch + 2O2f
У таких кислот в их концентрированных водных растворах присутствуют преимущественно молекулы кислот, которые легче образуют аддукты с частицами восстановителя для переноса от последнего электронов к кислоте (см. раздел 33.4). Чем меньше склонность кислоты к электролитической диссоциации, тем выше окислительная способность оксоанионов. Например, в ряду от НСЮ до НСЮ4 возрастает степень электролитической диссоциации кислот, возрастает степень их протолиза и в этом же направлении уменьшается окислительная способность оксоанионов:
Такие диаграммы изменения степени окисления кислотообразующего элемента и стандартных электродных потенциалов называют диаграммами Латимера.
136
Латимер Венделл Митчелл (1893—1955) — профессор химии Калифорнийского университета (США).
Значение <р° для полуреакции
2С10 4 + 16Н+ + 14е— = C12t + 8Н2О
из приведенной диаграммы Латимера находят следующим образом: 14у?° = 4 • 1,189 + 4 • 1,215 + 4 • 1,645 + 2 • 1,630 = 19,456 В. Отсюда ip° = 1,3897 В или 1,39 В. Множителями при значениях <р° являются числа электронов, участвующих в каждой полуреакции.
Кислоты не проявляют окислительных и восстановительных свойств в протолитических реакциях (подробнее см. раздел 10.2) и реакциях обмена. В реакциях обмена более сильные кислоты вытесняют более слабые кислоты из их солей:
CaF2 + H2SO4 = CaSO4l + 2HF
ф ф ф
Вселенная состоит из материи, обладающей различными видами движения. Различают две формы существования материи: вещество и излучение (или поле). Вещество — это такая форма существования материи, дискретные частицы которой имеют конечную массу покоя, характеристикой количества вещества является моль. Характеристикой количества излучения, мерой перехода одного вида движения в другой является энергия.
Внутренняя энергия U любой системы состоит из кинетической, потенциальной, химической и атомной энергий, каждая из которых (кроме атомной) может изменяться в химических реакциях. Внешним признаком изменения внутренней энергии служит ее теплообмен с внешней средой и совершение работы. Сама теплота и работа в системе не содержатся, формами энергии они не являются, а появляются лишь в процессе обмена энергией, точнее движением, структурных частиц системы и внешней среды. По характеру обмена энергией с внешней средой системы подразделяют на изолированные, закрытые и открытые.
В соответствии с первым законом термодинамики теплота и работа могут возникнуть только за счет изменения внутренней энергии закрытой системы: AU - Q- W.
Изменение энтальпии, как функции состояния системы, представляет собой тепловой эффект реакции, измеренный при постоянном давлении, Qp = Лн = &U + р Ду. Поскольку значение изменения энтальпии зависит от условий проведения химической реакции, вводится понятие стандартного состояния. Значение изменения энтальпии реакции, определенное при стандартном состоянии, называется стандартной. Стандартное состояние—это равенство температур реагентов и продуктов реакции, поддержание постоянного давления в 1 атм каждого газообразного участника реакции и постоянного атмосферного давления в 1 атм для жидких и твердых веществ. Стандартная эн
137
тальпия образования вещества — изменение стандартной энтальпии в химической реакции образования единицы количества этого вещества из простых веществ, каждое из которых находится в термодинамически устойчивом (стандартном) состоянии.
Тепловой эффект реакции, протекающей при р,Т- const или VT = = const, зависит только от вида и состояния начальных веществ и продуктов реакции, но не зависит от ее механизма (закон Гесса).
Согласно второму закону термодинамики в изолированной системе самопроизвольно может протекать только такая реакция, которая сопровождается увеличением энтропии. Для любой химической реакции, протекающей в изолированной системе, энтропия конечного состояния никогда не может быть меньше энтропии начального состояния.
Когда изолированная система находится в состоянии с максимальной энтропией, то в ней не могут протекать никакие последующие химические реакции, так как они привели бы к уменьшению энтропии. Состояние с максимальной энтропией является наиболее устойчивым состоянием изолированной системы.
Энтропия по своему физическому смыслу является мерой неупорядоченности системы, ее молекулярного хаоса. Энтропия возрастает во всех процессах, сопровождающихся усилением беспорядочного движения молекул (сублимация, испарение, плавление и т. д.), во всех химических реакциях, в которых образуются газообразные продукты или увеличивается их количество.
Для закрытых систем критерием направленности химических реакций является изменение энергии Гиббса, с убылью которой связана осуществимость реакции при р, Т- const.
Для химических реакций, характеризующихся отрицательным значением изменения энтальпии и положительным значением энтропии, изменение энергии Гиббса всегда отрицательно, поэтому такие реакции протекают самопроизвольно и необратимо. Увеличение температуры повышает вероятность самопроизвольного протекания реакций только при положительном значении AS. При одинаковых знаках изменения энтальпии и энтропии (оба больше нуля или оба меньше нуля) в системе возможно установление равновесия (см. раздел 35.1) между продуктами и реагентами при температуре 7 = &Н/AS.
Направление окислительно-восстановительных реакций определяют по разности стандартных электрических потенциалов окислительно-восстановительных полуреакций, А#° = - (р°с- Когда А&°
больше нуля, то изменение энергии Гиббса будет иметь отрицательное значение: AG° (298 К) = — nF А 8 °. Поэтому окислитель всегда находится в полуреакции, обладающей большим стандартным электрическим потенциалом, а восстановитель — в полуреакции, имеющей меньшее значение стандартного электрического потенциала,
Следует иметь в виду, что значения <р° не позволяют судить о направлении окислительно-восстановительных реакций, осуществля-
138
емых при температурах, давлениях и концентрациях, сильно отличающихся от стандартных значений, а также в неводных растворах.
Упражнения к главе 7
1. Содержатся ли теплота и работа в системе?
2. Может ли в системе без теплообмена с внешней средой изменяться энтропия?
3. Положительное значение стандартного электродного потенциала дпя первой попуреакции больше, чем для второй. В какой попуреакции будет находиться бопее сильный окислитель?
4. Как изменяется внутренняя энергия системы в процессе теплопередачи и совершения работы?
5. Что представляет собой тепловой эффект реакции, проведенной: а) при постоянном объеме? б) при постоянном давлении?
6. Зависит пи стандартная энтальпия образования сложного вещества от его агрегатного состояния?
7. Каков знак изменения энтальпии реакции 2NHs(r) = = ЗН2(г) + М2(г), если внутренняя энергия в ходе реакции увеличивается? Экзо- или эндотермической является эта реакция?
8. В каком направлении будет протекать химическая реакция, если изменение энтальпии и энтропии в этой реакции равно нулю?
9. Какое значение AG связано с самопроизвольным характером реакции?
10. Объясните, почему табличные значения 5° для всех чистых веществ являются положительными.
11. Почему энтропия' 1 моль кристаллического вещества меньше, чем энтропия 1 моль того же вещества в жидком состоянии?
12. Будет ли в указанном направлении протекать полуреакция на водородном электроде: Н2 + 2Н2О — 2е = 2НзО , если на втором электроде гальванического элемента протекает реакция Fe3 + +е = Fe2+?
13. Почему растворение твердого ипи жидкого вещества в воде, как правило, приводит к увеличению энтропии, тогда как растворение газа вызывает уменьшение энтропии?
14. Согласно второму закону термодинамики любая самопроизвольная реакция, протекающая в изолированной системе, приводит к увеличению энтропии. Однако энтропия при Замерзании воды уменьшается. Объясните, почему оба утверждения не противоречат друг Другу.
I 15. Может ли протекать в закрытой системе реакция с Увеличением энтальпии, если не происходит изменения энтропии?
16. Будет ли в указанном направлении протекать реакция в водном растворе в стандартных условиях: Sn(IV) + + 2Fe*+ -► Sn(ll) + 2F3+. Для ответа используйте значения
стандартных электродных потенциалов соответствующих полуреакций.
17. Изменение энтальпии в реакции CsI(k) + 1г(к) = = С*[1(1)2](к) равно А Н (298К) = — 3,6 кДж/моль. Чему будет равно изменение энтальпии в реакции Сз[1(|)2](к) = CsI(k)4’ ♦ 12(к)?
18. Может ли иод в водном растворе перевести в стандартных условиях Fe(l<) в Fe(lll)?
139
19. Возможно пи взаимодействие в водном растворе ионов МпОд и [Fe(H2O)6]3+ ?
20. Какой из ионов в стандартных условиях: МпОд ипи Сг2О у — более сильный окислитель?
ГЛАВА 8. ХИМИЧЕСКОЕ РАВНОВЕСИЕ
Понятие «равновесие», означающее в различных областях человеческих знаний состояние покоя объекта, устойчивое соотношение между действующими силами, отсутствие значительных колебаний в составе и структуре систем, имеет в химии конкретный смысл.
ч Химическим равновесием называют не изменяющееся во времени I при постоянных давлении, объеме и температуре состояние смете-й мы, содержащей вещества, способные к химическому взаимодей-$ ствию.
Различают два вида химического равновесия: истинное и мета-стабильное.
Истинное химическое равновесие характеризуется тремя признаками: в системе не происходит видимых во времени изменений при отсутствии внешнего воздействия; равновесие достигается как при прямой, так и при обратной реакции (рис. 41), самое малое внешнее воздействие легко и незначительно смещает равновесие в ту или другую сторону.
В некоторых случаях химическая реакция не доходит до состояния истинного равновесия из-за возникновения на ее пути раз
Гис. 41. Достижение химического равновесия при прямой 1 и обратной 2 реакции: A + B^yC + D
К — момент наступления истинного равновесия
личных по своему характеру «препятствий», тормозящих взаимодействие веществ. Торможение химической реакции может наблюдаться и в самом начале ее пути. Например, смесь азота и водорода можно нагревать до высоких температур и сжимать до высоких давлений, но образования аммиака происходить не будет. Азотно-водородная смесь находится в состоянии заторможенного химического равновесия, называемого чаще м е-т а стабильным состоянием. Если устранить торможение введением в эту смесь катализатора, то на-
140
чнется обратимая химическая реакция:
' N2 + 3H2- ‘ 2NH3,
AG°(298K) =-33 кДж
При метастабильном равновесии в системе также не происходит видимых изменений. В этом отношении метастабильное равновесие
Рис. 42. Механические равновесия:
1 — исходное положение шарика; 2 и 3 — метастабильное равновесие; 4 и 5 — истинное, стабильное равновесие
не отличается от истинного. Важно отметить другое. Метастабильное равновесие является только кажущимся равновесием. Если
устранить причины тормо-
жения реакции, то она придет к истинному равновесию.
Механической аналогией двух видов химического равновесия
является положение шарика на склонах горы и у ее равнинного основания (рис. 42). Достаточно срыть уступы перед шариками 2 и 3, чтобы последние продолжили свое движение и скатились к горизонтальному подножию горы, где и оказались бы в состоянии истинного механического равновесия.
Химически обратимый процесс отличается от термодинамически обратимого тем, что в первом процессе при достижении и при смещении равновесия вправо или влево система может терять или приобретать энергию, что исключено для второго. Поэтому любой химически обратимый процесс является термодинамически необратимым, реальным процессом. Химическое равновесие можно превратить в термодинамическое, если поддерживать в системе постоянство ее внутренней энергии. В этом случае химическое равновесие рассматривается как частный случай термодинамического равновесия системы, в которой протекает обратимая химическая реакция. Тогда условия термодинамического (и химического) равновесия системы выражают следующими равенствами: At?”= О, ДГ”= О, ДИ«= 0 и Дсв ”= 0.
8.1. ОБРАТИМЫЕ И НЕОБРАТИМЫЕ ХИМИЧЕСКИЕ РЕАКЦИИ
Все известные самопроизвольно протекающие реакции можно разделить на две группы: необратимые и обратимые. Необратимые реакции протекают только в одном направлении, при этом происходит практически полное взаимодействие взятых в стехиометрическом соотношении исходных веществ. Необратимости реакции способствуют такие условия, при которых один из продуктов реакции (или большее их число) является малорастворимым и выделяется в виде осадка, либо образуется в виде газообразного вещества, удаляемого из сферы реакции, или представляет собой малодиссоциирующее в реакционной среде вещество.
141
Примером необратимой реакции может служить взаимодействий водных растворов нитрата ртути и сульфида калия:
Hg(NO3)2 + K2S - HgS| + 2KNO3
Чем менее растворимым или более слабым электролитом является один из продуктов реакции, тем полнее протекает необратимая реакция, тем меньше остается после ее окончания исходных веществ. После окончания необратимой реакции нельзя снова получить исходные вещества, не вводя новых реагентов и не затрачивая энергии. Не следует, однако, полагать, что направление химической реакции может быть только необратимым: «исходные вещества ш продукты». Известно множество реакций, которые прекращаются прежде, чем исходные вещества прореагируют полностью. В реакционной смеси у таких реакций сосуществуют и исходные вещества, и продукты их взаимодействия. Изменяя незначительно внешние условия (концентрацию реагентов, температуру и др.), можно заставить реакцию протекать по ее уравнению не только слева направо, но и справа налево. Такие реакции получили название обратимых. В общем виде уравнение обратимых реакций можно записать: «исходные вещества продукты», где 1 — прямая реакция, 2 — обратная реакция.
В ходе обратимой химической реакции концентрации исходных веществ уменьшаются, но как только появляются продукты реакции, между ними также начинается взаимодействие, вначале мало заметное, но по мере их накопления все более энергичное, а затем снова замедляющееся. Наконец, наступает момент, когда при тех же температуре и давлении видимое течение реакции прекращается, наступает химическое равновесие. При химическом равновесии образуется ровно столько продуктов реакции, сколько их снова превращается в исходные вещества. Концентрации исходных веществ и продуктов реакции перестают изменяться и для всех частей объема системы, для всех участников реакции, становятся постоянными (подробнее см. раздел 34.1).
Примером обратимых реакций служат реакции:
Н2 +122HI; 2SO2 + O2s=^ 2SO3; N2 + ЗН2. - 2NH3
Первая химическая реакция при 444 °C и давлении в 0,1 МПа прекращается после образования 78% HI. Эта концентрация HI отвечает состоянию химического равновесия. Не изменяя температуры и давления, нельзя получить больше чем 78% HI. Если в реактор Двести при указанных выше температуре и давлении чистый иодоводород, он распадается на Н2 и 12 до тех пор, пока не останется 78% HI (см. раздел 34.2).
Тем не менее при химическом равновесии взаимодействие веществ продолжается на атомно-молекулярном уровне. Частицы продолжают двигаться, соударяться, образовывать новые частицы, которые от соударений снова распадаются на исходные составные части. Сколько новых частиц образуется, столько же их и распадается.
142
Если развитие, течение обратимой химической реакции уподобить ее жизни, то химическое равновесие станет как бы ее летаргическим состоянием.
\ Состояние химического равновесия сохраняется до тех пор, пока ! остаются неизменными давление, температура и в систему не вводятся извне новые количества исходных веществ или продуктов реакции, а также не выводятся из реакционного объема участники реакции.
8.2. КОНСТАНТА ХИМИЧЕСКОГО РАВНОВЕСИЯ. ЗАКОН ДЕЙСТВУЮЩИХ МАСС
Допустим, что в закрытой системе при постоянных температуре й давлении протекает обратимая химическая реакция, которая заканчивается установлением равновесия: оА + йВ - сС + dD, где а, Ь, с и d — стехиометрические коэффициенты. Количественной характеристикой химического равновесия является его константа, представляющая отношение произведения молярных концентраций продуктов реакции к произведению молярных концентраций оставшихся неизрасходованными исходных веществ, взятых в степенях, равных стехиометрическим коэффициентам:
Кс = lCT[Dll.const (8J)
IA] ° [В] ь
Квадратными скобками [А], [В] и т. д. принято выражать равновесные молярные концентрации веществ (см. раздел 1.4), не изменяющиеся во времени.
Выражение (8.1) представляет собой математическую формулировку основного закона химического равновесия — закона действующих масс, который читается следующим образом:
в изотермических условиях химического равновесия отношение произведения молярных концентраций продуктов реакции, взятых в степенях, равных их стехиометрическим коэффициентам, к произведению молярных концентраций, остающихся неизрасходован-' ными исходных веществ, также взятых в степенях, равных их стехиометрическим коэффициентам, является величиной постоянной.
Закон действующих масс был открыт в 1864 г. Гульдбергом и Вааге. Они назвали молярные концентрации взаимодействующих веществ «действующими массами» или «активными массами». Через год Бекетов, не зная о их работах, также обратил внимание на независимость константы равновесия от концентраций взаимодействующих веществ.
Гульдборг Като Максимилиан (1836-1902) - норвежский профессор прикпадиой математики в университете г. Осло.
Вааге Потер (1833—1900) — норвежский профессор химии в университете г. Осло.
Бекетов Николай Николаевич (1В26—1911) — русский физи-
ко-химик, академик Петербургской АН, создал основы алю-
. мотермии.
143
Константа химического равновесия связывает концентрации всех' веществ, участвующих в обратимой химической реакции. Поэтому нельзя изменить концентрацию ни одного из них, чтобы это не повлекло за собой соответствующие изменения концентраций всех остальных участников обратимой химической реакции. Если изменить концентрации исходных веществ, то тотчас же изменяйся концентрации и продуктов реакции, но так, что значение константы равновесия останется неизменным (см. раздел 35.2).
Значение Кс изменяется от 0 (исходные вещества не взаимодействуют) до бесконечности (исходные вещества полностью прореагируют [А] - [В] -0). В последнем случае реакция является необратимой и к ней закон действующих масс неприменим.
Закон действующих масс справедлив только для разбавленных (менее 0,01 М) жидких и газообразных растворов. С увеличением концентрации или давления (для газообразных веществ) возрастают отклонения от закона. Особенно резкие отклонения наблюдаются для водных растворов электролитов, содержащих многозарядные ионы.
При определении Кс следует обращать внимание на то, как записано уравнение обратимой химической реакции. Для одной и той же реакции, в зависимости от ее записи, Кс может иметь совершенно различные числовые значения.
Например, для реакции
Я'гНг + IZ2N2 «—-NH3 при некоторых давлении и температуре константа равновесия
Ai = —-*?- V, “ М * 10-3 (моль/л)"1.
[Н2] 2[N2J 2
Для той же реакции, но с целочисленными стехиометрическими коэффициентами при прежних давлении и температуре значение константы равновесия Кг будет уже иной:
2
Кг = ----(Х1)2 = 4,2 • 10~5(моль/л)-2.
[Н2 ]3[N2]
Для гомогенных химических равновесий, устанавливающихся в газовых смесях, константа равновесия может быть выражена как через молярные концентрации, так и через парциальные давления р/. В последнем случае константу обозначают Кр.
Парциальным давлением газа в газовой смеси называют давление, которое оказывал бы этот газ, если бы из смеси были удалены все остальные газы при условии сохранения первоначальных объема и температуры. Общее давление газовой смеси, состоящей из идеальных газов, равно сумме парциальных давлений каждого газа смеси (закон Дальтона):
р - Spi. ' (8.2)
Даяьтон Джок (1766—1844) — английский физико-хнмик, автор атомистической теории.
144
Еля каждого газа такой смеси справедливо уравнение Клапейрона — 'нделеева:
piV^mRT. (8.3)
Клапейрон Бенуа Поль Эмиль (1799—1864) — французский инженер, член-корреспондент Петербургской АН, автор ряда работ по термодинамике и теории паровых машин.
'Объединяя соотношения (8.3) и (8.2), получим уравнение состояний смеси идеальных газов:
Р “ (pi + Р2 + рз+ ...) “ (п\ + П2 + пз + ...)^. (8.4)
Из выражений (8.4) и (8.3) следует, что pi= pxi, где Xi — молярная щля i-ro газа.
Между значениями Кс и Кр существует определенное соотношение. Если химическое равновесие для взаимодействующих газов записать в виде: аК + bR«-- сС + dD, то константа этого равнове-
сия, выраженная через парциальные давления, будет равна:
кр== K(^RT} А п (8 5) (Ж)о(Рв)д [А]° [V]\RTf(RT?
где (pi) — равновесные парциальные давления; Ап — изменение количества (моль) газообразных веществ в реакции, Ап - (с + d) — — (а + Ь).
Если в реакции не происходит изменения количества (моль) взаимодействующих веществ (Дп = О), как в реакции Нг(г)+ * 12(г) HI (г>, то Кр - Кс.
Большинство химических равновесий являются гетерогенными, г. е. равновесиями в системах, содержащих две и более фаз.
Опыт показывает, что конденсированные фазы (жидкие и твердое), не улетучивающиеся в реакции и не переходящие полностью в раствор, не оказывают влияние на константу равновесия. Изменение их массы, связанное с расходом или образованием веществ в исследуемой реакции, не влечет за собой изменение состава и, зледовательно, не нарушает равновесия. Например, в реакции
t
MgCO3(K) . MgO(K) +СО2(г>; Kc= [CO2]
i так как Дп= 1, то Кр = Kc(RT). В этой реакции, протекающей в закрытой системе (только в данном случае можно говорить о равновесии), молярная концентрация самостоятельных твердых фаз <MgCO3(K) и MgO(K)) в объеме их кристаллов является молекулярной константой, равной отношению их плотности (г/см3) к молярной массе (г/моль). Это следует из приводимых ниже соотношений. Для гвердой фазы АВ [АВ ] = пав/К, где FK — объем кристаллов твердой $>азы АВ. Так как количество твердого вещества АВ равно пав = ° тдв/Л/дв, а Ук = тАв/рий, то
гав 1 -
J м(АЕ^<АВ) мА в’
145
где /пав — масса кристаллов АВ; Л/ав — молярная масса, а р лв —? плотность вещества АВ.
Поэтому значения [MgCO3(K) ] и [MgOoo ] как молекулярных констант входят в неявной форме в значения константы равновесия Кс и последняя определяется только значением равновесной концентрации диоксида углерода.
Если увеличить объем системы, то равновесие сместится вправо, часть MgCO3(K) разложится, но равновесная концентрация СОг останется неизменной (п СОг/ У СОг) • При уменьшении объема, увеличении давления, часть СОг провзаимодействует с MgOx с образованием MgCO3(K).
8.3. ИЗОТЕРМА ХИМИЧЕСКОЙ РЕАКЦИИ. УРАВНЕНИЕ ВАНТ-ГОФФА
Из первого и второго законов термодинамики следует, что для протекающей химической реакции AG(T) = AGo(T) + RT\nx, где
С CD 4
х = а ь. Значение х является переменной величиной для процесса протекания реакции как в прямом, так и в обратном направлениях.
Вант-Гофф Якоб (1852—1911) — выдающийся нидерландский физико-химик, один из основателей современной физической химии.
Как только система, например, с газообразными веществами приходит к состоянию химического равновесия, величина х становится равной константе химического равновесия (х = Кр), при этом AGo(T) = 0.
AG°(T)—ЛЛпХр (8.6)
или AG°(T) = —19,145 TlgXp Дж/моль. Уравнение (8.6) называют уравнением изотермы химической реакции. Значение &G°(T) представляет собой разность стандартных значений энергии Гиббса образования (pi « 1 атм для Кр) продуктов реакции и исходных веществ в обратимой химической реакции аК + 5В сС + rfD при температуре Т химического равновесия: &G°(T) = (cG с + + dG р) - (aG а + bG в). В течение обратимой химической реакции все ее участники, вещества А, В, С и D, должны Находиться в стандартном состоянии: рл - р в = р с = Р d = 1 атм (подробнее см. раздел 35.1). Это означает, что количество исходных веществ и продуктов реакции предполагается настолько большим, что убыль первых и соответственное увеличение вторых не сказывается на величине стандартной концентрации веществ, участвующих в реакции (см. раздел 35.1).
Поэтому Ago(T) является характерной для данной обратимой реакции постоянной величиной при температуре Т. Общее изменение энергии Гиббса AG в обратимой химической реакции будет определяться переходом веществ от исходного стандартного состояния к
конечному, равновесному состоянию. Например, для вещества В Ав(Л- ЬСЪ - bGl.
\ Возможны следующие случаи изменения величины Аб °(Г) в различных химических равновесиях: AG °(Т) > О, Ag °(7) ,- О, AG °(Т) <0. Поскольку выбор стандартного состояния уже определяет давление и агрегатное состояние всех веществ, значение AG °(Т) и, следовательно, Кр зависит только от температуры. Для реакций в разбавленных жидких растворах AG °(Т) = ~RT\nKc, так как в этом случае Ag °(Т) ~ Ал °(Т) (см. раздел 35.2).
Когда AG °(Т) « 0, в равновесной смеси будут преобладать продукты реакции, Кр» 1. Если А Л °(Т) = 0, то для равновесной смеси веществ [C]c[D]rf“ [А]а[В и Кс= 1. При AG °(Г) »0 в равновесной смеси веществ окажется больше исходных веществ, химическое равновесие будет сдвинуто влево, выход продуктов реакции окажется незначительным (см. раздел 35.1).
Из уравнения (8.6) следует, что RTlnKp = - &Н °(Т) + + Т AS °(Т) = —AG °(Т) или
1ПХ, —
(8.7)
Уравнение (8.7) называют интегральной формой уравнения Ван т-Г о ф ф а. Оно дает зависимость константы равновесия от температуры при постоянном давлении.
Слагаемое AS°(T)/R можно считать при небольших изменениях температуры величиной постоянной, тогда
1пКр = - + const.
(8.8)
Изменение энтальпии Ая °(Т) — это энтальпия реакции, проведенной в стандартных условиях с участием веществ, находящихся в чистом виде. Уравнение (8.8) отвечает любым типам равновесий: протолитическим, гетерогенным, фазовым, так как переход от стандартных условий к реальным практически не отражается на значении Ая °(Г).
Из уравнения (8.8) следует, что величина Кр возрастает с повышением температуры в обратимых реакциях, сопровождающихся поглощением энергии (Ая (Т)>0). Если же обратимая реакция является экзотермической (Ая °(3Р) <0), то величина Кр увеличивается при понижении температуры. Наконец, при Ая °(71) ~ О константа равновесия от температуры не зависит.
Если известны константы равновесия при температурах Ti и Тг, т° можно из уравнения (8.8) получить соотношение
147
In , позволяющее рассчитать величину Дя7
л р2 Л * 2 ‘ I '
для интервала (Т2 - Т\).
8.4. ПРИНЦИП ЛЕ ШАТЕЛЬЕ
На константу равновесия не влияет изменение концентраций реагентов и продуктов реакции. Однако если выводить непрерывно образующиеся вещества из реакционной смеси (удаление выделяющихся газов, образующихся осадков малорастворимых веществ), то система все время будет находиться в неравновесном состоянии, в ней будет происходить образование все новых и новых количеств продуктов. Выход продуктов в обратимой реакции Можно повысить и другим путем: либо увеличением константы равновесия (изменяя температуру реакции), либо (при постоянной константе) смещением равновесия вправо, повышая давления и концентрации реагентов.
В 1884 г. Ле Шателье сформулировал общий принцип смещения химического равновесия, получивший его имя:
если на систему, находящуюся в истинном химическом равновесии, воздействовать извне путем изменения какого-либо параметра, влияющего на равновесие, то равновесие смещается в том направлении, которое способствует восстановлению первоначального состояния системы.
Ле Шателье Анри Луи (1850-1936) — французский химик-технолог и металловед, одним из первых применил термодинамику к химии.
Влияние температуры. Повышение температуры вызывает смещение равновесия в том направлении, в котором обратимая химическая реакция идет с поглощением энергии в форме теплоты, т. е. в направлении эндотермической реакции. Понижение температуры смещает химическое равновесие в таком направлении, в котором реакция протекает с выделением энергии, является экзотермической. Этот вывод Вант-Гоффа является частным случаем принципа Ле Шателье.
Так, в обратимой реакции
N2(r) + ЗН2(г) - 2NH3(r), Ая°(298К) - — 91 кДж
происходит выделение энергии. Следовательно, повышение температуры будет смещать равновесие влево, в сторону разложения аммиака на N2 и Н2. Например, выход аммиака по этой реакции при 300 °C и 20,0 МПа составляет 64%, а при 600 °C и том же давлении — всего 8%.
Влияние давления. Повышение давления в соответствии с принципом Ле Шателье смещает равновесие в направлении той реакции, которая связана с уменьшением объема системы. При использовании приведенной выше реакции для йолучения аммиака увеличение давления способствует увеличению выхода продукта. В частности, при 300 °C и давлении 100,0 МПа выход аммиака достигает 92%.
Чем меньше изменение объема системы в обратимой химической
148
реакции, тем меньше влияние давления на сдвиг равновесия. Когда объем системы в реакции не изменяется, давление не оказывает Никакого воздействия на смещение химического равновесия. Например, в реакции
Н2(г) + 12(г) 2Н1(г), А/У ° (298К) - - 9,25 кДж
изменение объема системы равно нулю {Ап = 2п(Н1) - [п(Н2) + + п(12)]в0}. Поэтому ни увеличение, ни уменьшение давления не смещает это равновесие.
Влияние концентрации. Введение в равновесную систему дополнительных количеств какого-либо реагента вызывает смещение равновесия в том направлении, при котором концентрация введенного реагента будет уменьшаться. Так, добавление KNCS в равновесную систему
3KNCS + FeCh = Fe (NCS) 3 + ЗКС1
к_ [Fe(NCS) 3 ] [KCl]3 [KNCS]3 [FeCI3 ]
вызовет образование новых количеств тиоцианата железа и хлорида калия. Степень смещения равновесия при данном количестве введенного реагента зависит от его стехиометрического коэффициента: чем он больше, тем больше и степень смещения равновесия. В частности, добавление KNCS смещает равновесие в большей степени, чем добавление того же количества FeCh.
Влияние катализатора. Катализатор не влияет на значение Кс, не смещает химическое равновесие, так как он изменяет скорости прямой и обратной реакции в одинаковой степени. Катализатор только увеличивает скорость достижения равновесия. Он приводит реакцию к тому же состоянию равновесия за меньший промежуток времени, чем могла это сделать сама система без катализатора. Катализатор не является ни реагентом, ни продуктом обратимой химической реакции (подробнее см. раздел 34.3).
Влияние инертного газа. При введении в равновесную систему, находящуюся при постоянном внешнем давлении, инертного газа (газа, не участвующего в реакции) все парциальные давления газообразных веществ уменьшаются. Например, если в равновесную систему
N2 + 3H2.-:- 2NH3,
(pn2)(₽h2)
добавить аргон, то общее давление по условию не изменится:
Р “Рм2 + Рн2 + Рьшз и Р ~РП2 + Рн2 + Ргчнз + Рах-
Но так как в ходе прямой реакции происходит уменьшение количеств газообразных веществ и объема, равновесие после добавления аргона сместится влево; произведение (р n2) (Р н2)3 умень
149
шится сильнее, чем (р Nh3 )2, а это потребует при Кр - const дополнительного уменьшения р Nh3 за счет разложения аммиака. Поэтому разбавление инертным газом реакционной смеси полезно только тогда, когда реакция протекает с увеличением объема и с увеличением количеств газообразных веществ, т. е. действие инертного газа равносильно уменьшению давления.
Если же Ап = 0, то система будет нечувствительна к присутствию инертного газа.
Принцип Ле Шателье имеет огромное Практическое значение. Он позволяет качественно определить условия, при которых можно получить максимально возможный выход продуктов от данной реакции.
* * *
Реакции, называемые самопроизвольными, протекают сами по себе, без какого-либо воздействия извне. Одни из них заканчиваются быстро, другие требуют для своего завершения определенного времени. Реакция может быть сколько угодно медленной, но тем не менее самопроизвольной.
Если самопроизвольно протекающая реакция завершается прежде, чем будут полностью израсходованы исходные реагенты (если они взяты в стехиометрических количествах), то это будет обратимая химическая реакция, прекращение которой связано с наступлением химического равновесия.
Химическое равновесие — такое состояние химического взаимодействия, (химической реакции), при котором скорость образования продуктов реакции становится равной скорости получения из этих продуктов исходных веществ.
Количественной характеристикой химического равновесия является константа равновесия (Кс или Кр), величина которой зависит только от температуры.
Химическое равновесие при изменении внешних условий (р, Т, св) может Смещаться вправо или влево. Принцип смещения равновесия, или принцип Ле Шателье, утверждает, что всякая система, находящаяся в равновесии, стремится при внешнем воздействии измениться так, чтобы ослабить это воздействие. Для эндотермической реакции значение Кс или Кр увеличивается при повышении температуры, то же самое происходит при охлаждении в случае экзотермической реакции.
Константа равновесия не зависит от пути реакции, ее механизма, а определяется только значением равновесных концентраций исходных веществ и продуктов реакции. Поэтому изменение исходных концентраций реагирующих веществ или внешнего давления не изменяет значения Кс или Кр, но приводит к смещению равновесия в соответствии с принципом Ле Шателье.
150
В гетерогенных равновесиях концентрации чистых твердых и кИх реагентов не входят в выражение для константы равновесия. * Большое значение константы равновесия указывает на то, что оавновесной смеси содержится больше продуктов реакции, чем родных веществ.
Если при каких-то условиях продуктов реакции оказалось больше х равновесных значений, то реакция самопроизвольно будет проткать справо налево (в обратном направлении) до тех пор, пока е установится снова химическое равновесие.
Упражнения к главе 8
I. В чем сходство и в чем различие химического и термодинамического равновесий?
2. Чему равно соотношение констант Кр и Кс для химического равновесия: 25О2(г) + О2(г) ^=г2$О3(г)?
3. Как изменяется при повышении давления значение Кр для эндотермической реакции?
4. Перечислите признаки истинного химического равновесия.
5. При каких условиях константа химического равновесия становится зависимой от исходных концентраций взаимодействующих веществ?
6. Объясните, почему для химического равновесия Cs[ICI2](k) . -CsCI(h) + 1С1(г), установившегося в закрытой системе, Кр = [1С1(г)].
7. В каком направлении произойдет смещение химического равновесия в обратимой реакции Н2(г) + 12 (г) *-~г2Н1(г) с
увеличением давления?
ГЛАВА 9. РАСТВОРЫ
Учение о растворах является важнейшим разделом неорганиче-ской химии. Вся история химии свидетельствует о чрезвычайной важности явлений, связанных с растворимостью веществ. Процессы Растворения и кристаллизации интересовали философов еще в глубокой древности.
Средневековые алхимики усиленно занимались поисками универсального растворителя, «алькагеста», интерес к которому уступал ишь интересу к золоту и вечной жизни.
В наши дни без знания процессов, протекающих в газообразных, ^мдких и твердых растворах, невозможно инженерное осуществле-щ химической технологии и количественного ее контроля. Боль-весьСТв° известных химических реакций протекает в растворах, а смес.ОкРУжаюЩий нас мир представляет собой либо механические и веществ, либо их растворы.
151
9.1. ОБЩИЕ ПОНЯТИЯ
При смешении веществ в твердом, жидком или газообразном состоянии могут Происходить либо химические реакции, либо образование смеси веществ, либо то и другое одновременно или в любой последовательности.
Смеси веществ по степени дисперсности (дисперсность — характеристика размеров частиц данного вещества) условно разделяют на грубо дисперсные или механические смеси (размер частиц 1000 нм), коллоидные растворы (размер частиц 1—100 нм) и истинные растворы, размер частиц которых определяется размером ионов, молекул, ионных пар и различных ассоциатов.
Механические смеси и коллоидные растворы являются многофазными гетерогенными системами, в которых одна или несколько фаз диспергированы в какой-либо другой фазе (подробнее см. раздел 36.1).
Механические смеси в зависимости от агрегатного состояния среды и распределенных в ней других веществ имеют специальные названия: суспензия, эмульсия, аэрозоль, пена.
-Суспензия — взвесь частиц одного или нескольких твердых веществ в жидкой среде. Обычно твердые частицы настолько велики (» 1000 нм), что они постепенно оседают под действием силы тяжести. Устойчивые суспензии образуются в тех случаях, когда либо плотности твердой и жидкой фаз почти не различаются, либо на твердых частицах адсорбируются полярные молекулы жидкой фазы или ионы растворенных веществ. Одноименно заряженные твердые частицы при своем движении уже не сталкиваются и не слипаются.
Эмульсия —- взвесь капель одной или нескольких жидких фаз в среде другой по составу жидкой фазы. Все эмульсии со временем разрушаются, капли при соприкосновении друг с другом сливаются и система постепенно расслаивается снова на несмеши-вающиеся жидкости.
Аэрозоли — взвесь жидких и твердых частиц в. газообразной среде. К аэрозолям относятся туман, дым и пыль. Наиболее мелкие частицы (<100 нм) содержатся в дыме. Частицы твердых веществ в аэрозолях часто несут определенный заряд: основные вещества (РегОз, MgO, ZnO, СггОз и др.) образуют отрицательно заряженную пыль, а кислотные (SiOz, С, Ss, TeOz и др.) — положительно заряженную.
Коллоидные растворы (или золи) —микрогетеро-генные, метастабильные системы с жидкой средой, содержащей очень мелкие частицы, участвующие в интенсивном броуновском движении. Поэтому они равномерно распределены по объему и очень медленно осаждаются (коагулируют). Золи кажутся однородными и прозрачными.
| Истинным раствором называют однофазную систему переменного | состава, содержащую атомы, ионы или молекулы и различные g ассоциаты последних.
152
Вещество, присутствующее в растворе в большем количестве, обычно называют растворителем, а другие вещества — растворенными веществами. Если одно из веществ раствора является жидкостью» а ДРУ™е — твердыми или газообразными веществами, то растворителем принято называть жидкость даже тогда, когда остальные вещества присутствуют в растворе в большем количестве, растворителем также считают то вещество, агрегатное состояние которого не изменяется при образовании раствора. Однако такие определения произвольны и носят условный характер.
Состояние раствора определяется тремя основными параметрами: температурой, давлением и концентрацией растворенных веществ. При растворении данного вещества — твердого, жидкого или газообразного — в выбранном растворителе при р, Т* const концентрация раствора увеличивается не беспредельно. Рано или поздно вещество перестает растворяться, достигается определенная его концентрация, которая при дальнейшем, даже самом длительном контакте растворяемого вещества и растворителя в условиях интенсивного перемешивания, уже более не изменяется и остается величиной постоянной. Это признак наступления фазового равновесия: растворяемое вещество раствор (рис. 43).
й Предельно возможная концентрация растворенного вещества, orfe вечающая этому фазовому равновесию, называется растворимостью е вещества при данных температуре и давлении.
Раствор, находящийся в фазовом равновесии с растворяемым веществом, называется насыщенным.
Насыщенный раствор может существовать только в контакте (через поверхность раздела) с растворяемым веществом неизменного химического состава.
ис- 43. Фазовое равновесие: жидкий раствор растворяемое вещество (а — твердое, б — жидкое, в — газообразное) при р, Т-const:
чеРными точками обозначены частицы растворяемого вещества, а кружками — частицы жидкого растворителя
153
Фазовое равновесие «растворяемое вещество . ~ » раствор» по своему характеру является равновесием динамическим: непрерывно какая-то часть вещества переходит в раствор, растворяется, и одновременно такая же часть этого вещества выделяется из раствора. При этом агрегатное состояние вещества, растворяемого и выделяющегося, является одним и тем же (подробнее см. раздел 36.6).
Насыщенные растворы могут быть как концентрированными, так и разбавленными в зависимости от значения растворимости веществ. Например, насыщенный раствор AgNO3 содержит 216 г соли в 100 г воды (20 °C), а насыщенный раствор бромида серебра — только 1,2* 10-5 г AgBr в 100 г воды (20 °C). В насыщенном концентрированном растворе количество растворенного вещества и растворителя сравнимы между собой, а в насыщенном разбавленном растворе количество растворенного вещества во много раз меньше присутствующего растворителя.
Вещества любого агрегатного состояния могут образовывать в определенных условиях пересыщенные растворы, т. е. такие, в которых содержание растворенного вещества больше, чем в насыщенном растворе этого же вещества при тех же значениях температуры и-давления. Такие растворы являются неустойчивыми и при контакте с растворенным веществом переходят в насыщенные растворы, выделяя избыток растворенного вещества.
Наконец, существует еще одно состояние растворов — ненасыщенные растворы. Раствор, в котором при данных температуре и давлении возможно дальнейшее растворение уже содержащегося в нем вещества, называют ненасыщенным раствором. Такие растворы всегда представляют собой однофазную систему.
9.2. РАСТВОРИМОСТЬ ГАЗОВ В ЖИДКОСТЯХ
Растворимость газа в жидкости зависит от природы газа, растворителя, температуры и прямо пропорциональна парциальному давлению рв газа В над поверхностью его раствора: рв = Агхв. В этом уравнении Аг — константа пропорциональности или константа Генри, Па, а хв — молярная доля растворенного газа В. Приведенное уравнение является математической формой закона Генри:
I растворимость газа в жидкости при постоянной температуре пропорциональна его парциальному давлению в газовой фазе.
Генри Уильям (1774—1836) — английский химик, -изучавший физико-химические свойства газов.
Закон Генри справедлив только для небольших давлений (не более 0,1 МПа) и для газов, химически не взаимодействующих с растворителем. Например, для систем NH3—НгО и СО2—НгО закон Генри неприменим, так как состав газа в водном растворе изменяется, вместо молекул газа появляются ионы:
NH3(r) + Н2О . * NH3«H2O.- ' NHt + ОН-
СО2(г) + Н2О Н2СОз---*НСО Г + н+
154
Для большинства газов изменение энтальпии процесса их раство-ния в воде с получением насыщенного раствора отрицательно (ДЯо<0). Например, для О2, Hz, N2 и СО значение Ая°(298 К) ' получении их насыщенного водного раствора равно соответственно -12 1, “3,8, -10,5 и -121,3 кДж/моль. Но есть газы, растворение которых в воде является эндотермическим процессом. В частности, значения АЯ ° (298 К) для С2Н4, С2Н2 и N2O равны соответственно +36,5, +210,9 и +59,0 кДж/моль. Растворение азота в СН3СООН также процесс эндотермический, Ая° (298 К) - + 6,7 кДж/моль.
Поэтому увеличение температуры вызывает уменьшение раство-
римости только тех газов в жидкости, для которых процесс растворения связан со значением &Н°(Т) <0 (принцип Ле Шателье, см. раздел 8.3). В большинстве случаев газы растворяются в органических растворителях лучше, чем в воде. Известно также общее правило: в жидкости лучше растворяется тот газ, который имеет более высокую температуру кипения.
Растворимость газов в воде уменьшается при добавлении к раствору солей, ионы которых более прочно связываются с молекулами воды, чем молекулы газа, понижая тем самым его растворимость.
9.3. ВЗАИМНАЯ РАСТВОРИМОСТЬ ЖИДКОСТЕЙ
При смешении двух жидкостей можно наблюдать самую различную взаимную их растворимость: от практически полной нерастворимости друг в друге (ртуть — вода) до неограниченной смешива
Рис. 44. Фазовое равновесие: раствор ССЦ в воде -------»
раствор НгО в тетрахлориде углерода.
Рис. 45. Фазовое равновесие Вг2(ж)^=^ВгРз(жу: К — критическая температура растворения
155
емости (бензол — толуол). Неограниченно растворяются в воде все жидкие неорганические вещества, являющиеся кислотами (HCN, HNCS, НСЮ4 и др.), простейшие органические кислоты (НСООН, СНзСООН и др.), простейшие спирты и кетоны (СН3ОН, С2Н5ОН, СН3СОСН3 и др.).
Если жидкости растворяются друг в друге ограниченно, то происходит их расслаивание с образованием двух жидких фаз, причем фаза с большей плотностью будет находиться в нижнем слое (рис. 44).
Соприкасающиеся слои жидкостей находятся в фазовом равновесии и каждый слой — насыщенный раствор одной жидкости в другой (для данной температуры).
С увеличением температуры взаимная растворимость жидкостей чаще всего возрастает и может наступить такой момент, когда граница раздела двух жидких фаз исчезнет, образуется одна жидкая фаза. Температура, выше которой двухфазная система превращается в однофазную, называется верхней критической температурой растворения (рис. 45).
На рис. 45 кривая АК — кривая растворимости брома в ВгЕз. Кривая ВК — кривая растворимости ВгЕз в броме. Обе кривые растворимости сливаются в критической точке К (55,5 °C). Выше этой точки верхний и нижний слои жидкостей полностью смешиваются и граница раздела двух жидких фаз исчезает. При критической температуре растворения (в точке К) оба слоя жидкости имеют один и тот же состав, а именно х = 0,70.
Кривая АКБ называется кривой расслаивания или бинодальной кривой. Она ограничивает область равновесного существования двух жидких фаз. Вне этой области находится однофазная область ненасыщенных растворов одной жидкости в другой.
Реже встречаются системы с нижней критической температурой растворения и системы с замкнутой бинодальной кривой, с двумя критическими температурами растворения.
Если жидкий раствор какого-то вещества перемешать с другой жидкостью, не смешивающейся с раствором, то это вещество будет распределяться между двумя жидкими фазами и концентрироваться в той из них, в которой оно больше растворимо. Например, при смешении раствора иода в н-гептане СНз—(СН2)5—СНз с этанолом образуется двухфазная система 1г(н-гептан) .л 1г (эта-
нол). Верхний слой н-гептана окажется почти бесцветным, а в нижнем слое этанола будет находиться основная часть иода, так как растворимость иода в этих растворителях различна: в этаноле 21,3%, а в н-гептане 1,7% при 25 °C (подробнее см. раздел 36.5).
Растворитель, концентрирующий в своей фазе вещество В, называют экстрагентом. Жидкостную экстракцию широко используют для извлечения и разделения растворенных веществ путем их перевода из одной жидкой фазы в другую при перемешивании обеих фаз.
156
9.4. РАСТВОРИМОСТЬ ТВЕРДЫХ ВЕЩЕСТВ
Все твердые вещества обладают способностью в той или иной степени растворяться в различных жидкостях. Различие в растворимости твердых веществ может быть очень большим. Например, растворимость AgNOa в воде при 25 °C равна 15,1 моль/л, a HgS — всего 1*Ю 21 моль/л.
Существует условное деление веществ по их растворимости в конкретном растворителе при определенной температуре на нерастворимые, малорастворимые и растворимые вещества. Концентрационные границы подобного деления весьма ориентировочны и, естественно, лишены какого-либо физико-химического смысла. К нерастворимым относят вещества, растворимость которых меньше 0,001 моль/л, к малорастворимым — вещества с растворимостью 0,001—0,1 моль/л, а к растворимым — вещества с растворимостью более 0,1 моль/л.
В группу растворимых в воде веществ входят, в частности, почти все ацетаты, нитраты и тиоцианаты металлов и аммония, хлориды,
Рис. 46. Диаграмма растворимости:
кривая ДДВ — кривая растворимости, Д G°(T) - 0; кривая БЕГ — граница метастабильной области; I — область лабильных пересыщенных растворов, Д G°(T) » 0; 2 — область метастабильных пересыщенных растворов, Д G°(7) > 0; 3 — область стабильных ненасыщенных растворов, Д С°(7) < 0
157
бромиды и иодиды металлов и аммония, кроме галогенидов РЬ, Cu(I), Hg(I) и Ag; сульфаты металлов, за исключением PbSC>4, Hg2SO4, Ag2SC>4 и сульфатов щелочно-земельных металлов.
Группу нерастворимых в воде веществ образуют сульфиды, гидроксиды, сульфиты, хроматы, средние карбонаты и фосфаты металлов, кроме щелочных и аммония. Карбонат, фторид и фосфат лития относят к малорастворимым в воде солям.
Подробнее см.: Лидин Р. А.; Андреева Л. Л., Молочко В. А. Справочник по неорганической химии. — М.: Химия, 1987. С. 243.
Растворимость большинства веществ возрастает с увеличением температуры. Зависимость растворимости твердого вещества от температуры можно изобразить в виде диаграммы растворимости (рис. 46). Кривая растворимости ДЛВ на такой диаграмме отвечает фазовому равновесию: кристаллы насыщенный раствор.
Ниже кривой растворимости находится область ненасыщенных растворов. Растворы, состав которых отвечает этой области, способны и дальше растворять данное вещество. В частности, при добавлении кристаллов вещества к его раствору, состав которого отвечает точке А (рис. 46), будет происходить растворение кристаллов при постоянной температуре Т2 с увеличением концентрации раствора от точки К до точки В. Если же кристаллы того же вещества будем добавлять к насыщенному раствору состава, например, отвечающего точке В на кривой растворимости, не изменяя температуру 7'2, то концентрация вещества в растворе останется прежней. Все добавленное количество вещества осядет на дно сосуда, в котором находится насыщенный раствор с осадком кристаллов растворяемого вещества.
При нагревании насыщенного раствора от температуры Тг до температуры Тз кристаллы, находящиеся в равновесии с раствором, начнут растворяться и точка В станет передвигаться вверх по кривой растворимости до тех пор, пока не начнется кипение насыщенного раствора. С этого момента точка В перестает перемещаться по кривой растворимости, так как концентрация вещества в растворе не изменяется, растворитель переходит из раствора в парообразную, а растворенное вещество — в твердую фазу. В точке 0 (см. рис. 46), отвечающей температуре кипения насыщенного раствора, кривая растворимости обрывается. Значения температуры кипения насыщенных растворов зависят от состава растворителя и растворенного вещества, внешнего давления. Например, температура кипения насыщенного раствора NaCl (39,7 г в 100 г НгО) равна 109 °C, а температура кипения насыщенного раствора KI (221 г в 100 г НгО) равна 118 °C.
При осторожном, без встряхивания и перемешивания, охлаждении раствора состава, отвечающего точке А (от Тз до Ti, рис. 46), концентрация вещества в растворе не изменяется до тех пор, пока не будет достигнута точка Е, лежащая на границе метастабильно й области пересыщенных растворов. В этой точке вне-
158
пно начинается кристаллизация вещества. Она будет продолжаться 3 же в том случае, если прекратить понижение температуры, при ^ом уменьшение концентрации вещества в растворе будет происходить по кривой ЕЛ. В точке Л кристаллизация прекращается, так как раствор становится насыщенным.
Пересыщенные растворы — очень неустойчивые однофазные системы. Появление в таких растворах небольшого кристалла рас-
творенного вещества тотчас же вызывает массовую кристаллизацию, которая представляет собой одновременное появление в объеме раствора многих кристаллов вещества. Граница области метастабильных растворов (кривая БЕГ, рис. 46) для одного и того же вещества не является постоянной, она может быть и ближе и дальше от кривой растворимости. Положение кривой БЕГ зависит от многих факторов: наличия в растворе механических примесей, шероховатости стенок сосуда, скорости перемешивания раствора и т. п. Поэтому при интенсивном перемешивании охлаждаемого раствора кристаллизация вещества наблюдается сразу же за точкой В. Кривая БЕГ в этом случае почти сливается с кривой
растворимости.
Кристаллизация любого вещества из пересыщенных растворов начинается со стадии образования зародышей твердой фазы, которые, достигнув своего критического размера в точке Е (рис. 46), становятся центрами кристаллизации вещества. Центрами кристаллизации вещества могут быть примесные частицы коллоидного размера, существующие в любых растворах. Форма, размер и состав как зародышей, так и центров кристаллизации до сих пор неизвестны. Считают, что зародыш критического размера представляет собой блок или ассоциат из 50—150 иногда и большего числа ионов или молекул. Такие зародыши можно рассматривать как неупорядоченные микрокристаллы. Вероятность образования зародышей критического размера возрастает с увеличением пересыщения раствора.
Центры кристаллизации в пересыщенном растворе постепенно увеличиваются в размерах, превращаясь в мельчайшие кристаллы. Эти кристаллы продолжают дальше расти, уменьшая пересыщение раствора.
Чем больше абсолютное пересыщение раствора, тем больше вероятность превращения зародышей в центры кристаллизации вещества, тем интенсивнее будет проходить кристаллизация.
Растворимость твердых веществ в жидкостях не всегда увеличивается при нагревании раствора. Известны вещества, растворимость которых, например, в воде при увеличении температуры либо почти не изменяется, либо падает (рис. 47).
Кривые растворимости кристаллогидратов в воде имеют сложную форму (рис. 48). Экстремальные точки (точки перегиба) на кривых Растворимости кристаллогидратов в воде отвечают изменениям состава твердых фаз, находящихся в равновесии с раствором.
Кристаллизация является одним из наиболее распространенных Методов получения вещества в чистом виде. Однако при помощи
159
Рис. 48. Кривые растворимости кристаллогидратов в воде
Рис. 47. Кривые растворимости различных твердых веществ в воде: 1 — большинство веществ; 2 — NaCl, UOH, K2SO3; 3 — MnSO-», U2SO4, СаСгО4
однократной кристаллизации удалить большинство примесей, находящихся в веществе, удается редко (см. раздел 36.5).
Примеси могут попасть в образующиеся кристаллы различными путями. Во-первых, пример может образовать в процессе кристаллизации самостоятельную твердую фазу, если концентрация этой примеси достигнет значения, отвечающего насыщенному раствору (малорастворимые примеси). Примесь может соосаждаться вместе с кристаллами также тогда, когда она находится в растворе в виде мельчайших, взвешенных твердых частиц. Во-вторых, примесь может быть включена внутрь кристалла вследствие ее адсорбции на поверхности с последующим зарастанием при росте кристалла. В-третьих, примесь может быть механически захвачена с частью жидкого раствора, окружающего растущий кристалл (зарастание пор, трещин и других дефектов кристалла). Наконец, примесь попадает в кристалл в результате образования твердого раствора.
Твердый раствор (изоморфная смесь) представляет собой однородную кристаллическую фазу переменного состава. Например, при охлаждении концентрированного водного раствора хлорида калия, содержащего примесь хлорида рубидия, выделяются не кристаллы чистого КС1, как менее растворимого вещества, а кристаллы твердого раствора (К, Rb)Cl, в структуре которого равномерно распределены катионы и К+, и Rb+. Катионы Rb+ замещают в узлах кристаллической решетки КС1 катионы калия.
Явление замещения ионов (атомов или молекул) кристаллизующегося вещества на частицы другого вещества, находящегося в жидком или газообразном растворе, приводящее к образованию твердого-раствора, называется изоморфизмом.
Вещества, участвующие в образовании твердого раствора, стали называть изоморфными. Изоморфные вещества имеют близкую при-
160
У химической связи, кристаллическую структуру и размеры за-^щаювдих друг друга частиц (подробнее см. раздел 36.5).
Изоморфизм как физическое явление был открыт в 1819 г. рДитчерлихом.
Митчерлнх Эйльхард (1794-1863) — профессор химии Берлинского университета. Занимался изучением химии селена, марганца, способов искусственного получения минералов.
При образовании твердого раствора изоморфными веществами А и В устанавливается фазовое равновесие: А<р> +В(Р>;=^ (А, В) <тр). Константа этого фазового равновесия называется коэффициентом сокристаллизации D. Если между жидким и твердым растворами распределяется вещество В, то D в = В этом
уравнении хв и ха — молярные доли веществ В и А в кристаллах твердого раствора, а Сщ(В) и cm(A) — моляльности тех же веществ в жидком растворе, находящемся в равновесии с кристаллами твердого раствора.
Когда Db < 1, то вещество В накапливается в жидкой фазе и при кристаллизации вещества А кристаллы последнего будут освобождаться от вещества В. Если Пв > 1, то вещество В накапливается в кристаллах твердого раствора и кристаллизация вещества А будет только способствовать его загрязнению веществом В. При Db - 1 в полученных кристаллах будет столько же примеси, сколько ее было до кристаллизации.
Подробнее см.: Степин Б. Д, Горштейн И. Г. и др. Методы получения особо чистых неорганических веществ. — М.: Химия, 1969. С. 63.
9.5. ЭНЕРГЕТИКА ОБРАЗОВАНИЯ РАСТВОРОВ
Образование ненасыщенных растворов — самопроизвольный физико-химический процесс, сопровождающийся уменьшением энергии Гиббса: AGM < О (верхний индекс м обозначает процесс смешения, растворения, от англ, mixture — смешение, смесь).
В исходном состоянии каждая отдельно взятая фаза — растворяемое вещество и растворитель — являются термодинамически устойчивыми. Сумма энергий Гиббса исходных фаз до смешения отмечена точкой Ghcx (рис. 49).
Внесение первой же порции растворяемого вещества в растворитель приводит к образованию новой фазы — ненасыщенного раствора, появление которой сопровождается убылью энергии Гиббса системы (AGM<0).
Растворение одного вещества в другом продолжается до тех пор, пока энергия Гиббса системы не примет наименьшее значение в данных условиях (G нас). С этого момента уменьшение энергии Гиббса прекратится: AG м = 0. Такое состояние раствора, при котором Ag м *= 0, отвечает насыщению.
Для пересыщенных растворов AGM>0 (рис. 49), такие растворы
б—1258
161
Рис. 49. Изменение значения G при образовании насыщенного раствора:
О — исходное состояние системы (растворяемое вещество В и чистый растворитель); си — концентрация насыщенного раствора, сп — концентрация пересыщенного раствора на границе метастабильной области
термодинамически неустойчивы, они легко выделяют избыточное количество растворенного вещества, при этом происходит уменьшение энергии Гиббса системы вплоть до состояния насыщения (ДОнас)-
Процесс растворения твердого вещества связан с разрывом межмолекулярных или внутримолекулярных его связей, что требует затраты определенного количества энергии. Частичному или полному разрушению подвергаются связи между молекулами растворителя. Одновременно протекает процесс образования новых связей между ионами (или молекулами) растворенного вещества и молекулами растворителя, называемый процессом сольватации или гидратации, когда растворителем является вода. Процесс сольватации сопровождается выделением энергии.
В результате процесса сольватации в растворе появляются молекулярно-ионные группы постоянного или переменного состава — сольваты или гидраты.
Суммарное изменение энергии в процессе растворения твердого вещества или изменение энтальпии растворения можно представить в виде алгебраической суммы изменений энтальпий для трех указанных выше стадий
= ( АЯК + дЯр) + ДЯС, где ДЯк— изменение энтальпии при разрушении кристаллической решетки растворяемого вещества; Днр — изменение энтальпии при разрыве межмолекулярных связей у растворителя; АЯс — изменение энтальпии при сольватации образовавшихся частиц.
162
Это уравнение получило название уравнения Фаянса. Если I Дяк + Аяр I > I АЯс I, то растворение будет происходить с поглощением энергии, т. е. АЯм>0. Когда I Аяк + Аяр I < < I АЯс I. растворение станет экзотермическим, АЯм<0.
Фаянс Казимир (1887—1975) — профессор физической химии в университете г. Мюнхена, а затем США. Занимался исследованиями растворов сильных электролитов, адсорбции и радиоактивных изотопов.
Большинство солей растворяется в воде с поглощением энергии. Экзотермическое растворение наблюдается у безводных солей, образующих в водном растворе аквакатионы (CaCh, C11SO4, Zn(NO3)2, LiCl и др.), у гидроксидов щелочных металлов и сильных кислот (сольватация протонов и гидроксид ионов).
Изменение энтальпии АЯ м при растворении единицы количества вещества в некотором количестве чистого растворителя называется интегральной энтальпией растворения. Она зависит не только от температуры, но и от концентрации вещества в растворе (рис. 50).
Из рис. 50 следует, что максимальное значение Ая м достигается при растворении вещества в бесконечно большом количестве чистого растворителя (св-» 0). Если количество растворителя будет уменьшаться по отношению к количеству растворяемого вещества (увеличение св), абсолютное значение АЯ м также начнет уменьшаться до обрыва в точке, отвечающей получению насыщенного раствора. В большинстве случаев изменение Ая м с изменением концентрации вещества в растворе не превышает 1—2 кДж/моль.
Процесс растворения с позиций затраты энергии представляют в виде термохимических уравнений, например:
ЯЬС1(К)+590Н2О(ж)” =(RbCl, 590Н2О),
АЩ298 К)=16,62 кДж/моль;
RbCl(K)+oo Н2О(ж)=(КЬС1, о» Н2О), АЖ298 К)”16,99 кДж/моль.
Значение Ая° измеренной в стандартном состоянии, системы всегда записывают с указанием количества вещества растворителя. Например, значение Дя°для процесса растворения определенного количества вещества КОН в бесконечно большом количестве вещества чистой воды Ая° (КОН, *Н2О, 298 К)—57,62
кДж/моль.
Рис. 50. Зависимость АЯМ от концентрации растворенного вещества при T=const:
1 — эндотермическое растворение, А Я“ > 0; 2 — экзотермическое растворение, А Я” < 0; ci и С2 — концентрации насыщенных растворов
6*
163
Рис. 51. Влияние температуры на растворимость солей:
1 — KNO3, РЬ(ЫОз>2; 2 — NaCI, YC13; 3 — NajSOr, 4 — MnSO«, CaCrO«; AB — кривая растворимости NajSCU’lOHsO; ВС — кривая растворимости NajSCU
Из уравнения AGm = = zX/7 м - Т AS м следует, что для самопроизвольного эндотермического (Дям > 0) процесса растворения необходимо, чтобы значение ASM > 0. Увеличение энтропии в процессе растворения кристаллических веществ вызвано переходом частиц растворяемого вещества из упорядоченного состояния в кристаллах в хаотическое, т. е. менее упорядоченное состояние в образовавшемся растворе. Чем больше положительное значение Д$м, тем выше растворимость. Так как повышение темпера
туры вызывает увеличение хаотического движения частиц вещества в растворе, а следовательно, и увеличение ASM, то при нагревании растворимость твердых (и жидких) веществ, как правило, увеличивается. В наиболее общем случае знак функции Л$м зависит от соотношения эффектов упорядочения растворов (сольватация частиц вещества) и разрушения структуры твердого вещества — ассоциатов жидкого вещества и растворителя.
Самопроизвольность экзотермического процесса растворения веществ вызвана существенным влиянием на значение взаимодействия частиц растворенного вещества с молекулами растворителя (Д//м<0). В этом случае в растворе происходит образование упорядоченных структурных единиц, что, естественно, вызывает уменьшение энтропии, а следовательно, и уменьшение растворимости веществ при нагревании. К такому выводу приводит и применение принципа Ле Шателье.
Влияние температуры на растворимость солей в зависимости от знака функции Аны приведена на рис. 51.
При растворении газов в жидкостях не нужно затрачивать энергию на разрушение межмолекулярных связей в газах, их практически нет. В уравнении Фаянса остаются только величины АНр и Анс. Сольватация или гидратация молекул газа всегда связана с большим выделением энергии, чем затраты энергии на разрушение межмолекулярных, связей в растворителе, I АНС I > I Анр I. Поэтому растворение газов в жидкостях является экзотермическим процессом, для которого характерным буд₽т уменьшение растворимости с увеличением температуры. Энтропия в процессе растворения газов в жидкостях уменьшается, так
164
как неупорядоченность движения молекул газа после растворения в жидкости снижается.
Приведенные выше чисто качественные закономерности носят самый обший характер. На растворимость веществ влияет так много факторов, что связать их в количественные закономерности до сих пор не удается.
* * *
Раствор представляет собой гомогенную систему переменного состава. Растворы могут быть газообразными, жидкими и твердыми. По концентрации растворенного вещества растворы подразделяют на ненасыщенные, насыщенные и пересыщенные. Ненасыщенные и пересыщенные растворы всегда состоят из одной фазы. Растворением называют процесс самопроизвольного равномерного распределения частиц одного вещества между частицами другого вещества, сопровождающийся уменьшением энергии Гиббса (ЛС?м<0). Мера растворимости вещества — концентрация его насыщенного раствора. Растворы, концентрация вещества в которых выше растворимости его при данной температуре, называются пересыщенными.
В ненасыщенных растворах вещество может растворяться, в насыщенных вероятность растворения и выделения (кристаллизации) вещества одинакова (Лбм = 0), а в пересыщенных растворах возможно только выделение (кристаллизация) избыточного количества вещества (ДСм>0). Самопроизвольная кристаллизация растворенного вещества наступает тогда, когда пересыщение раствора превышает концентрацию, отвечающую границе метастабильной области. Кристаллизация вещества проходит через две стадии: образование в растворе центров кристаллизации и рост микрокристаллов.
Если количество растворенного вещества невелико, то раствор называют разбавленным, если же количество растворенного вещества в растворе приближается к количеству растворителя и даже превышает его, то раствор называют концентрированным.
Количественной характеристикой состава раствора является концентрация растворенного вещества: массовая доля, молярная, мо-ляльная концентрации и др. (см. гл. 1).
При растворении вещества происходит взаимодействие частиц вещества с молекулами растворителя или сольватация (гидратация) частиц вещества. В результате сольватации в растворе появляются сольваты, ионно-молекулярные группы постоянного или переменного состава, например К+«хН2О; [Си(Н2О)4] , 1А1(Н2О)б] ,
*хН2О и др.
Растворимость разных веществ в том или ином растворителе °~разному зависит от температуры: она может возрастать, умень-аться или оставаться практически постоянной. Растворимость веществ, связанная с поглощением энергии в форме теплоты, обус-влена увеличением энтропии при образовании раствора. В этом
165
случае повышение температуры вызывает увеличение растворимости вещества.
В общем случае изменение энергии Гиббса при растворении зависит от изменения энтальпии Д//м, так как изменение энтропии в большинстве случаев всегда способствует растворению.
Упражнения к главе 9
1. Объясните, почему растворимость газов в жидкостях является экзотермическим процессом.
2. Можно ли получить пересыщенный раствор охлаждением насыщенного раствора?
3. Является ли граница метастабильной области пересыщенных растворов данного вещества характеристикой фазового равновесия: растворяемое вещество «—* пересыщенный раствор.
4. Перечислите возможные пути попадания примесей из раствора в образующиеся кристаллы.
5. Укажите, какой тип межмолекулярного взаимодействия между частицами растворенного вещества и растворителя имеет наибольшее значение в растворах: а) нитрата бария в воде; 6) фтороводорода в воде; 'в) бензола в тетрахпориде углерода.
6. Как будет изменяться концентрация насыщенного водного раствора при увеличении его температуры до 200°С и выше?
7. Можно ли удалить примесь В из вещества методом кристаллизации, если коэффициент сокристаллизации этой примеси DB > 1?
8. Зависит ли значение интегральной энтальпии растворения 1 моль вещества от количества растворителя?
9. Будет пи происходить эндотермический процесс растворения вещества, если при этом происходит уменьшение энтропии?
ГЛАВА 10. ИОННЫЕ РАВНОВЕСИЯ В РАСТВОРАХ
Большинство известных химических реакций с участием неорганических веществ протекает в растворах между ионами или между ионами и атомами или молекулами. Ионы появляются в растворе либо при электролитической диссоциации ионных соединений, либо образуются при взаимодействии полярного растворителя с веществами, имеющими ковалентные и полярные ковалентные химические связи.
Жидкие и твердые вещества условно разделяют по их поведению в том или ином растворителе на сильные и слабые электролиты и неэлектролиты. Сильные электролиты подвергаются практически полной электролитической диссоциации на ионы, слабые электролиты только частично диссоциируют на ионы, а неэлектролиты
166
присутствуют в растворе в виде молекул и их различных ассоциатов. Одно и то же вещество в зависимости от растворителя может быть и сильным, и слабым электролитом и неэлектролитом. Например, pqaI в водном растворе проявляет свойства сильного электролита: NaI“Na++I . Однако в ацетоне (СНз)гСО иодид натрия подвергается только частичной электролитической диссоциации и в основном находится в растворе в виде молекул: Nal(p>^==* Na++I-.
Полагают, что при растворении ионных соединений в жидких растворителях, особенно с небольшой диэлектрической проницаемостью, вначале образуются ионные пары (АВ. А+ «В ), а затем происходит разрыв электростатических связей с образованием сольватированных ионов:
А+«В“(х+у)Н2О. * А+»хН2О+В«уН2О
В газах ионы образуются при фотоионизации, действии ионизирующего излучения или сильных электрических полей, при столкновении атомов и молекул с частицами большой энергии.
Ионы принадлежат к химически активным частицам. В частности, появление кислотно-основных свойств у растворенных веществ вызвано обратимым взаимодействием катионов или анионов с протон-содержащими молекулами растворителя.
Ионные равновесия в растворах можно разделить на две большие группы равновесий: гомогенные и гетерогенные. В последнем случае в равновесии участвуют различные фазы.
Например, гомогенные ионно-молекулярные обратимые реакции протекают в газовой фазе при столкновении ионов с нейтральными частицами, при этом ионы переходят в более энергетически выгодную химическую форму, как это наблюдается при ионизации Н2 быстрыми электронами:
Н2+^ . т-Н2++2^; Н2++Н2 .- 'Н3++Н; Н 3++Н2+Н2 5++Н2
(третья частица Н2 отнимает часть энергии экзотермической реакции и стабилизирует тем самым тяжелый ион Н*).
10.1. ГЕТЕРОГЕННЫЕ ИОННЫЕ РАВНОВЕСИЯ
К гетерогенным ионным равновесиям относят те фазовые равновесия, при которых в одной из равновесных жидких фаз находятся ионы. Например, в водной фазе, содержащей FeCh и НС1 и находящейся в равновесии с диэтиловым эфиром (С2Н5)гО, присутствуют ионы тетрахлородиакважелеза (III) [Fe(H2O)2CU] , а также ионы НзО и^С1 , а в органической фазе — диэтиловом эфире, ионные пары Н «[Fe(C2H5)2OC14] , причем Fe (III) концентрируется преимущественно в органической фазе и поэтому из солянокислого водного раствора FeC13 можно количественно (почти на 99%) из-Лечь Fe (Ш) диэтиловым эфиром.
Другим примером гетерогенного ионного равновесия является вновесие кристаллов малорастворимого в воде сильного электро
167
лита с его ионами в растворе. Этот вид равновесия ниже рассмотрен подробнее.
Произведение растворимости. В насыщенном водном растворе малорастворимого сильного электролита устанавливается равновесие между жидкой фазой и кристаллами электролита:
МА(к) _ М++А , T=const.
Так как сильный электролит МА малорастворим в воде, то раствор будет очень разбавленным, содержащим поэтому только гидратированные ионы М+ и А . Константа равновесия
Кс=
(М+][А ] [МАф]
= const,
(10.1)
где [МАск) ] — молекулярная константа растворенного электролита, моль/см3 (см. раздел 8.2). Она представляет собой равновесную молярную концентрацию электролита МА в объеме его собственных кристаллов, [МА(к) Нэ/А/ (р — плотность, а М — молярная масса).
Из уравнения (16.1) следует, что Кс [МА(К)}“[М ][А ]. Произведение двух констант Кс [МА(к) ] обозначают символом ПР и называют произведением растворимости вещества МА. Таким образом, произведение растворимости — произведение молярных концентраций катионов и анионов малорастворимого сильного электролита в его насыщенном растворе. Для каждого малорастворимого сильного электролита и взятого растворителя величина ПР при р, T=const постоянна и от концентрации ионов не зависит. Произведение растворимости — константа фазового равновесия кристаллы -—-- раствор.
Независимость от концентрации величины ПР сохраняется только при выполнении двух условий: а) в гетерогенном ионном равновесии участвует малорастворимый электролит, концентрация которого в растворе не превышает 0,01 моль/л; б) ионы электролита не участвуют (в заметных количествах) в каких-либо других равновесиях, например протолитических (см. раздел 10.2). Практически большинство малорастворимых электролитов находится в растворе не только в виде ионов, но и их ассоциатов, комплексных и коллоидных частиц и даже недиссоциированных молекул. Однако концентрации таких частиц невелики и ими обычно пренебрегают. В частности, в водных растворах галогенидов серебра количество недиссоциированных молекул достигает приблизительно 0,1—1,0% от общей растворимости вещества.
В общем случае
(MnAw)(K) nMV1++mA"2 и ПР (МпАт) » |MV1^ flA*'2 ]m, где пит — стехиометрические коэффициенты, a Vi и V? —• заряды ионов (у} = nVj/m). Так, ПР [Саз(РО4>2] “ [Са2+I3 [РО1 ]Д“ =2«10"2’ моль5*л~, а ПР (PbF2)=[Pb2+][F“]2»2,7«10 8 моль3«л •
Значение ПР изменяется с температурой по кривой растворимости малорастворимого электролита (рис. 52). В ненасыщенных растворах
168
произведение молярных концентраций ионов вещества МА может иметь любое значение, меньшее равновесного значения (< ПР), а в метастабильной области пересыщенных растворов произведение (М+) (А-) будет несколько больше равновесного значения (> ПР). Если(М+)(А ) < ПР, то кристаллы малорастворимого электролита растворяются до тех пор, пока [М+][А~1“ПР(МА).
Кристаллизация малораство-рнмого электролита МА из его раствора возможна тогда, когда (М+) (А ) > ПР, при этом образование и рост кристаллов будет про-должаться до тех пор, пока [М+][А~1=ПР(МА).
Рис. 52. Зависимость ПР от температуры раствора:
(М+) и (А-)— неравновесные концентрации ионов; 1 — область пересыщенных растворов; 2 — кривая растворимости;
3 —область ненасыщенных растворов
Если увеличивается по каким-либо причинам (T=const) концентрация катионов М , то тотчас же происходит уменьшение концентрации анионов А ровно настолько, чтобы значение ПР (МА) осталось без изменения. Уменьшение концентрации анионов А достигается переходом части электролита МА из раствора в осадок в виде кристаллов. Аналогичное изменение концентрации катионов М происходит при увеличении количества в растворе анионов А .
Значения ПР малорастворимых гидроксидов металлов со степенью окисления (+11) и выше всегда являются ориентировочными и для количественных расчетов не применяются. Формулы М(ОН)П, где и г 2, не отражают состава гидроксидов. Осадки последних представляют собой сложные полиядерные аквагидрок-сокомплексы, подвергающиеся старению (изменению состава с течением времени), сопровождающемуся, как правило, уменьшением растворимости.
Значения ПР являются весьма малыми числами, например: nP(AgI)=2,3»10 1 , nPcaSO4=3,78«10-5 (298 К). Было найдено более Удобным выражать значения ПР через его отрицательный десятичный логарифм. Это число получило название показател я произведения растворимости рПР= -1g (ПР). Значение рПР (Agl)=15,64, рПР (CaSO4)=4,43.
Между значениями ПР как константы гетерогенного ионного равновесия и изменением энергии Гиббса AG °(Т) существует зависимость, ОпРеделяемая уравнением hG0(T)“-RT In (ПР) (см. раздел 8.2).
Для всех гетерогенных ионных равновесий типа МА(К) М+ + + А малорастворимых электролитов 0. Изменения энталь-«ии А// °(Т) и энтропии AS °(7) могут быть больше и меньше нуля в
169
зависимости от растворенного вещества и растворителя. Например, значению pnP(Agl) = 15,64(298 К) отвечают Лб°=92 кДж/моль, ДН°“105 кДж/моль, Д5°” 45 Дж/(моль«К). Значению рПР (CaSO4> ”4,43(298 К) отвечают ДС° = 25 кДж/моль, Дн° = = —24 кДж/моль, AS=—163 Дж/(моль*К).
Эффект общего иона. При появлении в насыщенном водном растворе малорастворимого электролита МА другого, но хорошо растворимого электролита ВА количество общих анионов А резко возрастет, что вызовет, как было отмечено выше, переход части электролита МА из раствора в осадок, т. е. вызовет уменьшение растворимости электролита МА.
Аналогичное явление наблюдается при появлении в растворе вещества МА другого, хорошо растворимого вещества МБ с тем же катионом. Эффект общего иона нельзя использовать для предсказания растворимости, если в растворе или в твердой фазе будут протекать те или иные химические реакции. В этих случаях вместо ожидаемого уменьшения растворимости может произойти ее увеличение.
10.2. ГОМОГЕННЫЕ ИОННЫЕ РАВНОВЕСИЯ. ПРОТОЛИТИЧЕСКИЕ РАВНОВЕСИЯ
К гомогенным ионным равновесиям относятся многочисленные кислотно-основные или протолитические равновесия, связанные с переносом протонов от одних частиц (молекул или ионов) к другим.
Протон Н — ядро атома водорода, имеет очень небольшие размеры (около 0,001 пм) по сравнению с размерами других ионов, радиус которых может достигать 100 пм и больше. Поэтому протон — высокоподвижная частица в различных средах, обладающая уникальной способностью внедряться в электронные оболочки других атомов. В любых растворах протон никогда не появляется в свободном виде. Протон, например, обладает большим сродством к молекулам воды: пН2О(Ж)+Н ”Н2п+1Оп.
Появление протонов в воде приводит к образованию целого ряда ионов: НзО+, H5OJ, Н?О^, HgOj, среди которых преобладают ионы НдО^. Продолжительность жизни этих ионов в воде очень мала, так как все протоны постоянно мигрируют от одной молекулы воды к другой (подробнее см. раздел 34.4). Обычно во всех реакциях ради упрощения их записи используют вместо катиона HgOt только катион оксония состава НзО .
Подробнее см.: Белл Р. Протон в химии. — М.: Мир, 1977.
Протонная теория кислот и оснований. Начало протонной теории кислот и оснований положили исследования, проведенные в 1923 г. Бренстедом, а затем Лоури. В соответствии с их теорией кислота — любая водородсодержащая частица (молекула или ион), способная при взаимодействии с растворителем отдавать протон, быть донором протонов, а основание — любая частица (молекула или ион), спо-
170
обная при аналогичном взаимодействии присоединять протон, акцептировать его.
u Бренстед Йоханес Николаус (1879-1947) - датский физико-
химик, автор работ в области химии растворов кислот и оснований.
Лоури Томас Мартин (1874—1936) — английский химик. Первым ввел протонную теорию в учебный курс неорганической химии.
Например, при взаимодействии HNO2 с НгО
11 1 _ HNO2+H2Oi=i НзО++ЫО2
HNO2 — донор протонов, т. е. кислота, а вода — основание, т. е. акцептор протонов, превращающаяся в кислоту.
Процесс передачи протона от кислоты к основанию называется протолизом, а ионно-молекулярное равновесие, устанавливающееся после передачи протона, — протолитическим или кислотно-основным. Кислоты и основания, соответственно теряющие и приобретающие протоны, называют протолитами.
В протолитическом равновесии всегда принимают участие две сопряженные кислотно-основные пары «кислота — основание», как в приведенном выше примере HNO2—NO2 и НзО+—НгО. Кислота HNO2, передав свой протон основанию НгО, превращается в сопряженное с ней основание NO2, а основание НгО, получив протон, образует сопряженную кислоту НзО+. Таким образом, кислотами и основаниями могут быть не только молекулы, но и ионы. В частности, помимо нитритного аниона NO2 анионными основаниями могут быть сульфидный карбонатный и фосфатный анионы: S2 , СО? , POi и др. Так, в протолитическом равновесии
СО? +П2О. - - НСОз+ОН"
t-—1 L_____1
н+ н+
основаниями являются ионы СО?- и ОН- — акцепторы протонов, а кислотами НгО и НСОз — доноры протонов.
Основной идеей протонной теории кислот и оснований является представление о том, что кислота не выделяет протон самопроизвольно, а участвует в его переносе совместно с основанием, в качестве которого могут быть и молекулы растворителя. Конкуренция за обладание протоном между двумя сопряженными кислотноосновными парами и приводит к установлению протолитического Равновесия. Так, равновесие
s2 +h2o.- - HS"+OH-
t___J L_J
й* й+
1Я
сильно смещено вправо из-за большего сродства к протону сульфидных анионов, чем образующихся в этой реакции гидроксидных ионов. Кислотные или основные свойства у протолита появляются только в реакциях протолиза, при взаимодействии его с другим протолитом. Например, HNO3 является кислотой в водном растворе, но в среде тетраоксохлората водорода НСЮ4 азотная кислота превращается в основание, гидроксид нитроила NO2OH: NO2OH + + НСЮ4 .=^NO2C1O4+H2O и взаимодействует с НСЮ4 как основание, образуя тетраоксохлорат нитроила NO2CIO4.
Амфолиты. Протолиты, способные к присоединению и отдаче протона, называются амфолитами или амфипротонными веществами. К числу амфолитов принадлежат вода, почти все гидроанионы (НСОз, НРО|~, HS-, НС2О4, HSO3, Н2РО4 и др.) и соли, образованные слабой кислотой и слабым основанием (CH3COONH4, NH4CN, (МН4)гСОз и др.). В частности, гидрокарбонатный анион может участвовать в двух реакциях протолиза:
н+ н+
НСО5+Н2О. - НзО++СОЗ ; НСО3+Н2О. ' Н2СО3+ОН
Однако амфолиту НСОз более свойственны функции основания. Водный раствор ацетата аммония содержит ионы NHt и СНзСОО . Ион NH t является донором протонов, а ион СНзСОО их акцептором:
NH4++2H2O.- ЬГНз«Н2О+НзО+
L. I
н+
н+
I ;
СНзСОО +Н2О. - СНзСООН+ОН
Автопротолиз протонных растворителей. Все растворители условно можно разделить на две большие группы: апротонные и протолиты (или протонные растворители). Первые не обладают кислотно-основными свойствами (углеводороды, бензол, CS2, CCI4 и др.), а вторые (Н2О, С2Н5ОН, СН3СООН, HF, NH3, H2SO4 и др.) — участники реакций протолиза.
Каждый протонный растворитель (условно HL) является амфолитом, способным самопроизвольно подвергаться слабой электролитической диссоциации или реакции автопротолиза:
н+
Г””: + _
HL+HL.* H2L +L
J н+
Константа этого протолитического равновесия в соответствии с [Ho L+ ] [L- I , _ _ законом действующих масс равна Кс=--------;--= /(7). гавно-
[HL]2
172
веская концентрация растворителя [HL ] практически является величиной постоянной, так как концентрация молекул HL, распавшихся на ионы, по сравнению с концентрацией недиссоциированных молекул, как правило, очень мала. Поэтому две константы Кс и [HL] объединяют в одну константу KsHMHL]2. Отсюда 7Cs=[H2L+][L- ]. (Индекс s — первая буква англ, слова solvent — растворитель, для воды принят индекс в — первая буква слова «вода»).
| Величину называют ионным произведением растворителя или в константой автопротолиза растворителя.
В частности, для воды Кб=Кв=[НзО+ПОН}=1*1014 (25 °C).
Величина Ка является функцией температуры и для разбавленных растворов не зависит от концентраций ионов [НзО+] и [ОН ].
Автопротолиз воды — процесс эндотермический. Изменение энтальпии в реакции
н+
Н2О+Н2О. ’ Н3О++ОН"
равно +55,90 кДж/моль. Поэтому, если при 0°С Хв=0,115»10-14, то при 60 °C Кв=9,5*10 (моль/л)2. В обычных условиях (25 °C) Кв“1*10-14 (моль/л)2, а так как в чистой воде [НзО^ХОН"], то концентрация каждого из ионов для 25 °C будет равна/7^ = V 1*10“14 = = 1 • 10-'моль/л.
Поскольку степенные выражения неудобны в количественных расчетах, их заменяют логарифмическими функциями, имеющими специальное обозначение: —IgfHsO+] = рН; —1g [ОН-] = рОН; —lgKB=pA?B=14,0 (25 °C). Символы pH и рОН называются водородным и гидроксидным показателями, а символ рКв — показателем ионного произведения воды. Для чистой воды рН+рОН=р/Св=14,0 (25 °C) или рН=рОН=7,0. В кислых растворах [НзО ]>10 ' и рН<7,0, а в щелочных растворах [НзО ,|<10 ' и рН>7,0.
Например, 1 М водный раствор НС1 имеет рНО; наш желудочный сок достаточно кислый, его pH 1,4, а кровь имеет почти нейтральную реакцию (pH 7,4). У1 М водного раствора КОН pH 14,0, следовательно, в таком растворе будет находиться 10-14 моль/л ионов НзО+.
Точное определение значения pH производят с помощью специальных приборов — pH-метров, а для грубого определения применяют индикаторы — органические вещества из класса красителей, которые изменяют свою окраску при переходе из кислотной формы в основную и наоборот. Такой сложный органический краситель, как метиловый оранжевый (н-диметиламиназобензолсульфат натрия) в кислой форме, условно обозначаемой Hind, имеет красную окраску. В интервале pH 3,1—4,4 у этого индикатора происходит Удаление протона и окраска становится желто-оранжевой:
н+
HInd+H2(X=r H3O++Ind-
____J
н+
173
При добавлении кислоты желтая окраска раствора сменяется снова красной из-за смещения равновесия влево. Метиловый оранжевый принадлежит к двуцветным индикаторам. К ним относятся также лакмус, изменяющий свою синюю окраску на красную при уменьшении pH с 8,0 до 5,0, и бромтимоловый синий, синяя окраска которого переходит в желтую в интервале pH 7,6—6,2. Существуют и одноцветные индикаторы, например фенолфталеин, бесцветный в кислой среде (pH 8,0) и розово-фиолетовый в щелочной среде (pH 9,6).
В табл. 15 приведены значения Ks автопротолиза наиболее часто используемых протонных растворителей — амфолитов.
Таблица 15. Значение рК, некоторых амфолитов
Уравнение автопротолиза Температура, °C t>Ks
0 14,9
2Н2О . » НзО+ + ОН" 25 14,0
60 13,0
2СН3ОН . ► СНзОН* + СНзО" 25 16,7
2С2Н5ОН j=± С2Н5ОН2+ + C2HsO- 25 19,5
2СНзСООН^=±СНзСООН^+СНзСОО- 25 12,6
2КН3(ж) NHZ + NHf ' —50 32,3
—33,4 21,0
Сила кислот и оснований. Сила кислот и оснований оценивается по способности сопряженных кислотно-основных пар конкурировать между собой за обладание протоном.
Для протолитического равновесия с участием кислоты НА и воды как растворителя НА + Н?О - НзО* + А значение константы
I____J L______________J
н+ н*
-г [НзО+1 [А ] гр ГТТ А1
равновесия находят из уравнения Кс - ГЦА1 гц . Так как [Н201 *
[НА] IH2UJ
=const, то КС[Н2О| = Кк = [Нз.<ц.',[А1 . Константа Кк называется [НА]
константой кислотности, а рКк = —lgKK — показателем кислотности.
Чем больше значение Кк и соответственно меньше рКк, тем более сильной кислотой считается протолит НА в воде и тем слабее сопряженное с ним основание А-.
Рассмотрим три примера протолиза кислот в водном растворе при 25 °C:
Н2СОз + Н2О . __ * Н3О+ +НСО5, К* - 4«10"7
NH<+ + 2Н2О г > Н3о+ + МНз*Н2О, К,. - б*1О'10
(АКНйО)*]а+ + Й20 с=ЦА1(Н2О)5ОЙ]2+ + НзсЛк* * 9*16’*
1М
Из приведенных значений К« следует, что в водном растворе наиболее сильной кислотой будет аквакатион алюминия.
Как и любая другая константа химического равновесия, константа кислотности является функцией температуры. С увеличением температуры она сначала возрастает, а затем убывает. Для каждой слабой кислоты существует характерная температура, при которой значение Кк достигает максимума. Установлена эмпирическая закономерность: чем меньше значение Кк, тем при большей температуре константа кислотности достигает своего максимума.
Сильные кислоты подвергаются в разбавленном водном растворе практически полной электролитической диссоциации, иначе говоря, протолиз таких кислот практически необратим, значение [НА] -» 0, поэтому и Кк -» оо. Например, экспериментальное значение для разбавленных водных растворов HCIO4 и HI равно около 101и или рКк = —10. Из-за почти полной передачи протона сильной кислотой молекулам воды в растворе остаются только ионы Н3О и очень слабое анионное основание, в приве
денном выше примере анионы СЮ4 и Г.
К сильным кислотам принадлежит и ион НзО+, не связанный с каким-либо анионным основанием. Протолитическое равновесие н+ н+
1 ;- -1
НзО+ + НгО . - • * НгО + НзО характеризуется константой Кс= [Н2О] [Н3О+] -
=-----т------, следовательно, константа кислотности будет равна
[Н3О+] [И2О]
=КС[Н2О] - [Н2°].[Н?О. J . [Н2О]. Как известно, для 25 °C [Н3О+]
[НгО] = п(Н2О)/1л = 1000»0,9971/18,015 = 55,35 моль/л. В этом
выражении плотность и молярная масса воды равны соответственно 0,9971 г/мл и 18,015 г/моль. Отсюда Кк = 55,35 моль/л, а рКк(НзО+)-----lg(55,35)---1,74.
К сильным кислотам принадлежат галогеноводородные кислоты (Hl, HBr, НС1), триоксохлорат водорода НСЮз, тстраоксохлорат водорода НСЮ4, тетраоксоманганат (VII) водорода НМпО4, селе-
новая кислота Нг8еО4, серная кислота H2SO4, катион оксония НзО , азотная кислота HNO3, гексафторосиликат водорода H2[SiF6], тетрафтороборат водорода H[BF4] и гексафторосфосфат
водорода Н[РРб]. Эти кислоты, сильные в водных растворах, могут быть слабыми в других растворителях, не обладающих большим сродством к протону. Например, в 100%-ной уксусной кислоте С'НзСООН все сильные кислоты становятся слабыми. Значение Р*к таких кислот, как НСЮ4, HBr, H2SO4, НС1 и HNO3, в безводной СН3СООН равны соответственно 5,8; 6,4; 8,2; 8,8; 9,4 <25 °C).
Если передача протона от кислоты к молекулам воды будет из-за сильной конкуренции между двумя основаниями 20 и А ), то значение Кк « 1, и кислота будет слабой. Например,
175
___н*
Л „
в реакции протолиза HCN + НгО 7 -
НзО* + CN цианид во- t
।। н+
дорода передает воде очень небольшое число протонов и поэтому в растворе присутствует преимущественно в виде молекул. Анион CN-оказывается более сильным акцептором протонов, чем вода. Поэтому KK(HCN) = 4,93» 10~‘, р/Ск “ 9,31.
Таблица 16. Единая шкала кислотности для водных растворов (25 °C)
Сопряженная пара Константа кислот к* Показатель кислотности рК
кислота основание
Сильны е кислоты
Н3О+ H2O 55,35 —1,74
SO2«nH2O HSO3+ 1,66«10-2 1,78
nsor SO?- 1,20«10-2 1,92
H3PO4 н2роГ 7,24» 10-3 2,14
Fe3+«H2O FeOH2+ 6,76«10-3 2,17
hnq2 NOf 5,10«10-4 3,29
HF- 1“ 6,67» 10—4 3,18
CH3COOH CH3COO- 1,74«10—5 4,76
A13+«H2O A1OH2+ 9,55’1О-'5 5,02
H2CO3 нсог 4,27» 10—7 6,37
H2S HS- 1,05«10—7 6,97
н2роГ hpo4 6,17’Ю-8 7,21
HSO3" so?- 6,30* 10-8 7,20
nhZ nh3«h2o 5,75« 10-1° 9,24
. B(OH)3«H2O [B(OH)4]- 5,75«1О-10 9,24
HCN CN- 4,93» Ю-10 9,31
нсог co?- 4,68’10—11 10,33
H2O2 ноГ 2,40* 10-12 11,62
нроГ PoF' 4,57’10—13 12,34
HS- s2- 1,23» 10“13 12,91
H2O OH- 1,81«10—16 15,74
Сильные основания
Примечание М,,+»Н2О — условная формула аквакатионов [М(Н2О)л]*’+ МОН*'4' — условная формула частиц состава [М(Н2О) B-i(OH)](v-1)+ .
176
В табл. 16 приведена единая шкала кислотности для^ водных пастворов. Константа кислотности Н2СО3, равная 4,27*10 7, определена для равновесия с участием СОг:
СОг + 2Н2О Н2СО3 + Н2О НзО+ + НСОз
[Н3О+ПНСОз 1
[СО2 + Н2СО3] ’
Равновесие
СО2 + Н2О. ‘ Н2СО3
устанавливается медленно, и только небольшая доля растворенного СОг взаимодействует с водой с образованием Н2СО3 (отношение
21 = 0,0037). Если при расчете значения Кк использовать только
концентрацию Н2СО3, то значение Кк - 1,2*10 4(25 °C).
Протолиз оснований характеризуется константой основности:
А- + Н2О НА + ОН-, Ко “ 1НАПОН] [А"]
или показателем основности рК0. Чем больше значение Ко и соответственно меньше значение рК0, тем сильнее данное основание А-, тем более сильным акцептором протонов оно является.
К сильным основаниям относятся гидроксиды щелочных металлов и таллия (I), Ва(ОН>2 и Ra(OH)2. Все они хорошо растворимы в воде и полностью распадаются в растворе на ионы. К сильным основаниям принадлежат также ионы: гидроксид-ион ОН-, амид-ион NH2 и оксид ион О2-.
н+ н+____
I I I----- I
*_ 1 1 *
Для протолитического равновесия ОН + Н2О ^=^НгО + ОН
константа равновесия Кс - ^1гОН°н . Следовательно, константа [он-] [Н2О]
основности Ко = Кс|Н2О] - 55,35 моль/л, а рК0------1,74.
Ионы NH2 и О2 , особенно последний, подвергаются в водном растворе почти мгновенному протолизу:
О2- + Н2О - ОН + ОН ; NH2 + Н2О - NH3 + ОН t I t
Например, значение рХ0 доя иона О2- равно, примерно, —10. 1оэтому обнаружить ион О2 в водном растворе очень трудно, его уродство к протону в реакции О^) + Н(г) = ОН(Г) равно Дя °(298 К) “ ~~~2318 ^ж/моль.
Ион О — реально существующая частица. Он обнаружен в азовой фазе в реакциях захвата двух электронов атомарным кис-Родом, ион О2- может существовать в расплавах нитратов в
177
результате равновесия NO3 *--NOj + О2 , но в очень небольшой
концентрации из-за реакции О2 + NO3 - + NO2. Можно
полагать, что ион О2 появляется в водном растворе на очень короткое время при необратимом гидролизе монооксидов щелочных элементов: К2О = 2К+ + О2-; О2- + Н2О - 2ОН-.
Ион ОН сильно гидратирован и в водном растворе существует в виде стабильной частицы ОН «ЗНгО = Н7О4. Значение энергии отрыва от иона ОН- трех молекул воды очень близко к значению энергии удаления четырех молекул воды из иона HgOj = Н+ + 4Н2О.
В табл. 16 сверху вниз уменьшается сила кислот и одновременно увеличивается сила сопряженных с ними оснований. В частности, очень высокой акцептирующей способностью по отношению к протону обладают такие анионные основания, как S2 и Poi , которые в водных растворах немедленно отрывают протон от воды:
S2" + Н2О. - HS + ОН-; РО|- + Н2О7- НРО^ + ОН-
Поэтому концентрация анионов S2 и РО| в водных растворах незначительна.
К слабым основаниям в водных растворах относятся, помимо ЫНз^НгО и катионов типа MOHv+ (см. табл. 16), некоторые органические азотсодержащие соединения — гидразин и гидроксиламин (табл. 17).
Таблица 17. Константы основности слабых оснований для их водных растворов
Основание Кислота Ko (298 K) pA'c
Метиламин CH3NH2 CH3NH3+ 3,70» 10—4 3,43
Аммиак ИНз’НгО NH«+ l,79«10—5 4,75
Гидразин N2H4 n2h5+ 9.8И0-7 6,01
Гидроксиламин NH2OH NH3OH+ 2,00» 10" 8 7,70
Пиридин C5H5N CSHSNH+ l,80«10-9 8,75
Анилин C6H5NH2 CeHjNH? 4,30» 10—10 9,37
Их протолиз протекает в соответствии с реакциями:
NH3 + Нг(Х=^ NH3*H20i=t NHt + ОН-N2H4 + НгО N2H| + ОН~
Малорастворимые в воде гидроксиды металлов (А1(ОН)з, FeO(OH), CrO(OH), Ni(OH)2, Cu(OH)2 и др.) к слабым основаниям не относятся. Их водные растворы из-за малой растворимости гидроксидов являются очень разбавленными, и поэтому гидроксиды подвергаются полной электролитической диссоциации. К сильным
нованиям указанные выше гидроксиды тоже не относятся, так их растворы содержат ничтожно малое количество ОН -ионов. К Катионы малорастворимых в воде гирдоксидов металлов уже при оннентрациях порядка 10 5—10 3 моль/л образуют в водном растворе сложные аквагидроксокомплексы и коллоидные частицы. Например, установлено, что в водном растворе гидроксида алюминия молекул состава А1(ОН)з не обнаружено, в растворе присутствуют катионы составов . [А1(Н2О)5ОН], [А17(Н2О)ю(ОН)14О2Г ,
[А12(Н2О)8(ОН)2]4+ и другие более сложные частицы.
Степень протолиза слабых кислот и оснований. Степень протолиза CL представляет собой отношение равновесной концентрации образовавшихся в протолитической реакции частиц к исходной концентрации протолита:
Со Со Со Со
Например, в протолитическом равновесии п+ н+_
т-----1 г ; л
НА + НгО. * НзО + А
равновесные концентрации ионов [НзО+] = [А ] - Ct со, где со — исходная концентрация слабой кислоты НА, моль/л. Равновесная концентрация этой кислоты [НА] “ со — Ct со “ (1 — Ct) со. Отсюда 4- — 2
„ „ ...» v [НзО ИА ] а со а со а о л
следует, что Ак ----—-----= (1 _с)со = <Ч) Это уравнение
известно как математическое выражение закона разбавления Оствальда. Если значение Ct <0,01, то можно использовать приближенное соотношение К* - С?со.
Аналогичное соотношение известно и для протолиза слабого основания. Из закона разбавления Оствальда следует, что с уменьшением концентрации слабой кислоты или слабого основания значение степени протолиза увеличивается.
Уменьшение степени протолиза слабой кислоты можно достигнуть увеличением концентрации ионов НзО+ (введением в раствор сильной кислоты), а уменьшение степени протолиза слабого основания — Увеличением концентрации 0Н~-ионов (введением в раствор сильного основания).
Связь констант основности и констант кислотности. Для сопряженных кислотно-основных пар соотношение констант определяется из рассмотрения протолитических равновесий:
НА + Н2О. ' Н3О+ + А", Ак =
И
А~ + Н2О*=^ НА + ОН", Ко - ..]
(А ]
179
Из этих равновесий следует, что произведение КкКо = Кв = = [НзО+][ОН~ ]. Это уравнение справедливо для любой сопряженной кислотно-основной пары. Очевидно, что чем меньше значение Кк, тем больше значение Ко, тем слабее кислота и сильнее сопряженное с ней основание. Поэтому нет необходимости в создании специальной таблицы констант основности, достаточно единой шкалы кислотности, представленной в табл. 16. Константы основности, приведенные в табл. 17, дополняют табл. 16.
Роль растворителя в реакциях протолиза. Влияние растворителя на протолитические равновесия наиболее значительно тогда, когда сам растворитель активно участвует в процессе переноса протона. Чем сильнее основные свойства растворителя, чем сильнее он акцептирует протон, тем больше значение Кк протолита. Так, очень слабая в воде кислота HCN в таком растворителе, как жидкий аммиак, становится сильной кислотой: HCN + NH3<«) = NH? + CN-. В жидком NH3 сильными кислотами будут H2S, СНзСООН и другие слабые кислоты. Кислоты, сильные в водном растворе, останутся сильными и в жидком аммиаке. В его среде различия в силе кислот исчезают из-за большого сродства к протону молекул NH3. Такое влияние на протолиз растворителей получило название выравнивающего или нивелирующего действия растворителя.
Растворители, обладающие слабым сродством к протону, проявляют в ряде случаев дифференцирующее воздействие на протолиз кислот и оснований. Выше уже отмечалось появление различия в силе сильных кислот в среде безводной уксусной кислоты СН3СООН. Некоторые органические растворители также обладают дифференцирующим действием на сильные кислоты. Например, в ацетонитриле CH3CN тетраоксохлорат водорода НСЮ4 остается сильной кислотой, а бромоводород НВг, хлороводород НС1 и серная кислота H2SO4 становятся слабыми кислотами, значения их рКк равны соответственно 5,5; 8,9 и 7,3.
В растворителях с еще меньшим сродством к протону, чем у уксусной кислоты СНзСООН, например в безводном тетраоксохлорате водорода HCIO4 и серной кислоте H2SO4, вообще не может быть кислот. В этих растворителях почти все протолиты будут основаниями. В частности, уксусная кислота СНзСООН в серной кислоте проявляет свойства сильного основания, образуя катион ацетатдиводорода:
н+ !] СНзСООН + H2SO4 = CH3COOHJ + HSO4
Азотная кислота, растворенная в безводной серной кислоте, также превращается в основание — гидроксид нитроила HNO3 = NO2OH:
NO2OH + H2SO4. - * NO? + HSO4 + Н2О
Влияние температуры на протолиз. Большинство протолитических реакций является эндотермическими, протекающими с погло-
180
еНйем энергии из окружающей среды. Затраты энергии на пролиз тем больше, чем меньше значение констант кислотности и L-новности. Например, протолиз в водном растворе двух анионных оснований S2 и СНзСОО связан с изменением энтальпии д//(298 К), равным соответственно 5,9 и 144.8 кДж/моль. Константы основности этих оснований: AO(S2 ) - 8,1*10 2 и до(СНзС00 ) - 5,7»10-1 моль/л. Поэтому протолитические равновесия в соответствии с принципом Ле Шателье будут при нагревании растворов смещаться вправо, образуя в большем количестве продукты протолиза.
Кислотные свойства аквакатионов. Многие катионы металлов в водном растворе гидратированы, содержат вокруг себя оболочку из того или иного количества молекул воды.
Однозарядные крупные катионы металлов образуют слабые ион-дипольные связи с молекулами воды, их аквакатионы [Ag(H2O2) Г, [К(НгО)81+, [Ка(НгО)бГ и др.) очень неустойчивы. Число связанных молекул воды в подобных аквакатионах зависит от многих факторов и заметных кислотных свойств лабильные аквакатионы не проявляют.
По мере увеличения степени окисления металла устойчивость аквакатионов возрастает из-за увеличения прочности связи М—О, образующейся по донорно-акцепторному механизму, и уменьшения прочности связи О—Н в молекулах воды, входящих в состав аква-катиона (сильное отталкивание между протонами связанной воды и ионами металла, несущими большой заряд). Поэтому аквакатионы металлов в степени окисления (+11) и больше уже проявляют кислотные свойства.
Например, аквакатион [Ре(НгО)б]2+ в 10~5—10~3 моль/л водных растворах имеет рАк = 6,74 (25 °C).
Аквакатионы металлов, имеющих степень окисления (+III), — еще более активные доноры протонов. Протолизу
[Fe(H2O)6]3+ + Н2О_ - НзО+.+ [Fe(H2O)5OH]2+
отвечает рАк = 2,17. Следовательно, аквакатион [Ре(НгО)б]3+ — более сильная кислота, чем HNO2 или HF. Такой аквакатион, как [Се (НгО) б Г , по своим кислотным свойствам (Кк - 6,61 и рА\ = 0,82) принадлежит уже к сильным кислотам.
Продукты протолиза аквакатионов могут в дальнейшем подвергаться димеризации, например:
2[Fe(H2O)5OH|2+_ - [Fe2(H2O)8(OH)414+ + 2Н2О
При протолизе аквакатионов РЬ(П), [№(НгО)б]2+ и IZn (НгО) б г в растворе обнаружены ионы составов соответственно I О4(ОН)4] , [Ni4(OH)4]4+ и [Zn2(H20)io(OH) J . Первые два катиона, видимо, как и последний, являются гидроксоакваком-Плексами.
181
10.3. ГИДРОЛИЗ
| Гидролиз представляет собой взаимодействие вещества с водой без $ изменения степеней окисления элементов, образующих данную я систему.
Встречаются два вида гидролиза: гидролиз солей и гидролиз солеобразных бинарных соединений (карбиды, нитриды, фосфиды, сульфиды и др.), а также ковалентных галогенидов некоторых металлов и неметаллов, таких, как TiCU, SnCU, РС1з, SiCU, ВС1з и др.
Гидролиз солей включает две основные стадии: полную электролитическую диссоциацию соли на ионы и последующий протолиз либо анионного основания, либо аквакатионов (или катионов аммония), протекание которого связано с рассмотренными выше закономерностями.
Например, гидролиз KNO2. включает стадию KNO2-K+ + + NO2 и протолиз аниона NO2 + НгО «_-t?HNO2 + ОН-. Для второй стадии константа равновесия, иногда называемая константой гидролиза, является не чем иным, как константой основности, равной „ [HNOj] [ОН- ] , „
Ко “-------—----- или Ко “ -Jr. Константа кислотности относится
[NO2 ] **
к образовавшейся кислоте HNO2.
Степень протолиза (или степень гидролиза) определяют из закона разбавления Оствальда или из соотношения а - [ОН- ]/со, где со — исходная концентрация соли. Водородный показатель раствора соли, подвергшейся гидролизу, находят из приведенного выше уравнения, считая, что [HNO2] - [ОН- ], Ко = [ОН- ]2/ [NO2 ] и pH — 14,0 — рОН, при этом допускают, что [NO2 ]~со.
Аналогичные зависимости получают и при гидролизе солей, содержащих аквакатионы металлов.
Гидролиз солеобразных бинарных соединений протекает, как правило, необратимо. Карбиды, нитриды, фосфиды, сульфиды металлов при взаимодействии с водой образуют гидроксиды металлов и соответственно углеводороды, аммиак, фосфин и сероводород. Например:
СаСг + НгО - Са(ОН)2 + Н2С2Т
MgsN2 + 6Н2О == 3Mg(OH)2| + 2NH3f
AI2S3 + 6Н2О - 2А1(ОН)з| + 3H2Sf
Гидролиз галогенидов неметаллов и металлов протекает различным образом. Галогениды неметаллов образуют при гидролизе смесь двух кислот: галогеноводородной и оксокислоты неметалла. Например:
РС1з + ЗН2О - Н2(РНОз) + ЗНС1
SiCl4 + 4Н2О - H4S1O4 + 4НС1 AsF5 + 4НгО - H3ASO4 + 5HF
Ковалентные галогениды металлов при гидролизе образуют галогеноводородные кислоты и оксиды или гидроксоаквайбмплексы. Например:
182
TiCl4 + 2НгО - TiO2l + 4HC1
PbF4 + 2НгО - PbO2l + 4HF
SnCU + 6H2O. > H2[Sn(OH)6]+ 4HC1
В ряде случаев такой гидролиз сопровождается побочными реакция*®1
SnCl4 + 2Н2О. ' H2[SnC16]
Механизм гидролиза таких соединений сложен. Полагают, что вначале ковалентносвязанная молекула присоединяет молекулу воды и выделяет протон и анион. Этот процесс «присоединений — выделения» повторяется до полного завершения гидролиза. В частности, гидролиз BF3 начинается со стадии
BF3 + НгО == ВРз’НгО == B(OH)F2 + Н+ + F
затем этот процесс повторяется
B(OH)F2 + Н2О - B(OH)F2«H2O - B(OH)2F + Н+ + F~
и т. д. до образования В(ОН)з. Аналогично протекает гидролиз TiCl4, но конечным продуктом гидролиза является не гидроксид Ti(OH)4, а фазы переменного состава ТЮг’хНгО, появляющиеся в результате реакций полимеризации (оляции и оксоляции).
В реакции оляции происходит образование цепей, в которых атомы титана связаны между собой ОН-группами. В реакциях оксоляции ОН-группы превращаются в оксогруппы с выделением молекул воды:
>Ti(OH)2Ti< - ^Ti—О—Ti« + Н2О
Протеканию реакции оксоляции способствует повышение температуры раствора и длительность выдерживания осадка в среде раствора (старение осадка).
Если молекула воды не сможет подойти к центральному атому гидролизуемой молекулы на такое расстояние, когда возможно образование химической связи, то гидролиз не протекает, хотя он термодинамически возможен. Например, гидролиз СС14
ССЦ + ЗН2О = Н2СО3 + 4НС1; ДО ° (298 К) = —595 кДж
термодинамически возможен, однако в обычных условиях (и даже в присутствии КОН) гидролиз CCI4 в заметной степени не протекает. Молекулы воды не могут приблизиться к атому углерода на такое расстояние, при котором было бы возможным образование связи С О- Атом углерода практически полностью закрыт для воды большими атомами хлора. Аналогичное явление наблюдается и для SFe:
SF6 + 4Н2О = H2SO4 + 6HF; Дб'°(298 К) - —460 кДж
Гексафторид серы не взаимодействует даже с расплавленным КОН.
Усиление и подавление гидролиза. Гидролиз — неприятное осложнение, возникающее при синтезе неорганических веществ в водных Растворах. В получаемом веществе появляются примеси продуктов
183
гидролиза. Для подавления гидролиза солей, при растворении которых образуются аквакатионы, в раствор вводят избыточное количество соответствующей сильной кислоты. Например, при получении сульфата меди [Cu(H2O)4]SO4«H2O в его кристаллы попадает примесь сульфата гидроксомеди (CuOH)2SO4, продукта протолиза:
Си2+*Н2О + Н2О. ‘ СиОН+ + Н3О+
Поэтому кристаллизацию сульфата меди производят из растворов, содержащих некоторое количество серной кислоты H2SO4.
Если вещество подвергается необратимому гидролизу, то его синтез осуществляют в неводных средах или в условиях, исключающих присутствие растворителей. В частности, получение сульфида алюминия AI2S3 или сульфида хрома (III) СггБз производят только методом непосредственного взаимодействия металлов с серой. В водном же растворе синтез этих сульфидов невозможен из-за необратимого их гидролиза:
AI2S3 + 6Н2О = 2А1(ОН)з| + 3H2Sf
Когда гидролиз применяют как метод получения нужного вещества, то его, наоборот, усиливают, превращая в необратимый. Для этой цели продукты гидролиза удаляют из сферы реакции путем выделения осадков или газообразного вещества, образования мало-диссоциирующего на ионы соединения.
Так, для синтеза триоксргидрофосфата (III) водорода Нг(РНОз) применяют гидролиз трихлорида фосфора РС1з:
РС1з + ЗНгО - Н2(РНОз) + 3HC1I
Реакцию осуществляют при нагревании, при этом хлороводород выделяется из раствора вместе с парами воды.
Получение чистого диоксида кремния SiO2 основано на использовании гидролиза тетраэтоксисилана — этилового эфира ортокрем-ниевой кислоты:
Si(OC2H5)4 + 2НгО = SiO2l+ 4C2H5OHt
При нагревании этанол испаряется из смеси, способствуя течению реакции слева направо.
♦ ♦ ♦
Вещества при растворении в том или ином растворителе могут подвергаться либо полностью, либо частично электролитической диссоциации. В первом случае их называют сильными электролитами, а во втором — слабыми. Будет ли вещество сильным или слабым электролитом, зависит от характера взаимодействия его с расворителем.
Допускают, что почти все соли являются сильными электролитами.
Ионы сильных электролитов образуют с молекулами растворителя сольваты, а при взаимодействии между собой — ионные пары.
184
Кристаллы малорастворимого сильного электролита в его насы-тенном растворе находятся в равновесии с образовавшимися ионами. Поэтому произведение молярных концентраций катионов и анионов, зятых в степенях, равных количеству вещества каждого иона, является величиной постоянной, не зависящей от концентрации ионов. Это произведение называют произведением растворимости (ПР): ПР(МпАт) - [NT ]и [А*'2]'”.
Вещества, способные отдавать либо присоединять протоны, подучили название протолитов, а реакции с их участием стали называть протолитическими или реакциями протолиза. Протолиты — ЭТО либо кислоты, либо основания.
Протолиты (молекулы или ионы), которые могут быть и кислотами, и основаниями, называют амфолитами. Молекулярный амфолит может взаимодействовать сам с собой (реакция автопролиза). Например, в жидком аммиаке
Г|Н3 + N^3-- * NH4+ + NH2
происходит незначительный перенос протонов от одних молекул к другим с образованием катионов аммония NH t и амид-ионов NHi.
Константа автопротолиза жидкого аммиака приведена в табл. 15. Произведение равновесных концентраций ионов амфолита в реакции автопротолиза называют ионным произведением растворителя или константой автопротолиза. В приведенном выше примере эта константа равна произведению равновесных концентраций катионов аммония и амидных анионов: As(NHs) = [NH % ] [NH2].
Протолиты проявляют свои кислотные или основные функции только в реакциях протолиза — реакциях взаимодействия с другим протолитом, являющимся растворителем. Например, безводный жидкий НС1 — ковалентное соединение, не обладающее кислотными свойствами. В водном же растворе НС1 — сильная кислота, а в среде безводной HCIO4 хлороводород ведет себя как основание, присоединяет протон, превращаясь в катион НгСГ.
Силу кислот и оснований в конкретном растворителе определяют по значению константы кислотности Kt. Чем больше значение Кк, тем сильнее кислота, и тем слабее сопряженное с кислотой основание.
К сильным кислотам относят частицы (молекулы или ионы), Для которых значение Кк » 1, в частности, ион НзО+ — сильная кислота (Кк = 55,3 моль/л). К кислотам относят все аквакатионы металлов, например [А1(НгО)б] , [Сг(НгО)б] , [Си(Н2О)4] и др.
Малорастворимые в воде гидроксиды металлов, такие, как ьеО(ОН), А1(ОН)з, Со(ОН)2 и им подобные, слабыми основаниями Не являются. В своих крайне разбавленных водных растворах они присутствуют только в виде ионов, как правило, .очень сложных.
К слабым основаниям в водных растворах относятся NH3, N2H4,
185
NH2OH, органические амины и некоторые другие вещества, молекулы которых находятся в равновесии с продуктами их протолиза например:
NH2OH + Н2О-^ NH3OH+ + ОН'
Взаимодействие веществ с водой, не сопровождающееся окислительно-восстановительными реакциями, называют гидролизом. Гидролиз солей всегда включает стадию протолиза образовавшихс ионов.
Гидролиз солей при данной температуре протекает тем полнее, чем больше константа основности анионного основания или чем больше константа кислотности аквакатионов металлов.
Необратимому гидролизу подвергаются солеобразные бинарные соединения металлов (карбиды, нитриды и др.), а также некоторые галогениды металлов и неметаллов.
Упражнения к главе 10
1. Напишите ионное уравнение реакции, протекающей при смешении водных растворов нитрата свинца и сульфата капия и приведите выражение дпя произведения растворимости образовавшегося осадка.
2. Как усилить гидролиз РС13 и Cr2S3?
3. Напишите выражения дпя произведения растворимости таких малорастворимых сопей, как Cu2S, Pb3(PO4)2, Agl, MgF2.
4. Почему не протекает гидролиз СС14 даже в водных растворах КОН, хотя дпя реакции гидролиза этого вещества AG <5 О?
5. В каком из нижеперечисленных водных растворов pH > 7: ЫаС1О4, Na2S, [Cu(H2O)4]s+, Na2CO3?
6. Усиливается или уменьшается степень протолиза аквакатионов с увеличением степени окисления металла, входящего в состав этого катиона?
7. Почему большинство протолитических реакций относят к эндотермическим реакциям?
8. Объясните, почему водородный показатель 110 мопь/п водного раствора HI не равен 10,0.
9. В каком из растворителей — Н2О, ЫНэ(ж), СН3СООН -протолиз H2S и НО будет протекать в большей степени?
10. Не проводя вычислений, предскажите, pH какого разбавленного раствора меньше: водного раствора HF или эквимолярного водного раствора HI. Объясните свой ответ.
11. Укажите, какие вещества из нижеперечисленных будут в водном растворе слабыми основаниями: AI(OH)3, FeO(OH), NH2OH, Cu(OH)2, TIOH.
12. Укажите киспотно-основиые сопряженные пары в водном растворе NH4CN.
13. Укажите, какие вещества из нижеперечисленных будут в водном растворе сильными основаниями: NH4OH, ОН- , NH7, TIOH, Ы2Н4.
14. Как вычислить Ко по известному значению Кк Для кислотно-основной сопряженной пары?
15. Какое из оснований будет бопее сильным в водном растворе: CN или S2 ; СО3 или СН3СОО ?
Часть вторая
Ближайший предмет химии составляет изучение однородных веществ, из сложения которых составлены все тела мира, превращений их ДРУГ в друга и явлений, сопровождающих такие превращения.
Д. И. Менделеев, 1903 г.
ХИМИЯ
ПРОСТЫХ
ВЕЩЕСТВ
И СОЕДИНЕНИЙ
ЭЛЕМЕНТОВ
Дмитрий Иванович Менделеев (1834— 1907) — русский ученый-энциклопедист. Им открыт и разработан периодический закон химических элементов. Менделеев умеп «химически мыслить» и ясно представлял конечные- цели своей творческой работы: предвидение и пользу. Он был философом в химии и естествоиспытателем в проблемах философии, политической экономии и социологии. Д. И. Менделеев — последний 17-й ребенок в семье Менделеевых. Он был дважды женат и имеп троих дочерей и трех сыновей. Его дочь Любовь от второго брака вышла замуж за поэта А. Блока, а старшая сестра Ольга за декабриста Н. В. Басаргина, Менделеев принадлежит к таким выдающимся деятелям науки и культуры, о которых говорят, что они создали свою жизнь как произведение искусства.
Химия неорганических соединений многообразна и сложна. Последнее время происходит процесс ее дифференциации с выделением в самостоятельные научные направления химии отдельных элементов (бора, кремния, фтора и т. д.). Одновременно наблюдается все большее слияние органической и неорганической химии, в частности, в комплексных соединениях многочисленные органические молекулы и анионы органических кислот образуют химические связи с металлами и неметаллами.
Быстро развивается новый раздел неорганической и органической химии — бионеорганическая химия, рассматривающая роль металлов как комплексообразователей в жизнедеятельности различных организмов, в фотосинтезе и дыхании. В частности, такие вещества, как хлорофилл и гемоглобин, являются комплексными соединениями магния и железа со сложными циклическими органическими соединениями — молекулами порфирина.
Подробнее см.: Хьюи Дж. Неорганическая химия. — М.: Химия, 1987. С. 405. 465 и 569.
Самостоятельной наукой стала химия металлорганических или элементорганических соединений — веществ, в которых атомы углерода органических групп или их Л-электронных систем непосредственно связаны с атомами металлов (Ni, Сг, Fe, Pt и др.) или атомами неметаллов (Р, Se, As, Si и др.). Например, [(СНз)зА1]г — димер триметилалюминия, (C2Hs)2Zn — диэтилцинк, [Ni(C0)4J — тетракарбонил никеля, [Fe(C5H5)2] — бис-циклопентадиенил железа или ферроцен, К[Р1(СгН4)С1з] — трихлороэтиленплатинат (II) калия. Химия металлорганических соединений изучается как в курсах неорганической химии, так и в курсах органической химии.
При замещении в бороводородах фрагмента ВН изоструктурным и изоэлектронным СН-аналогом образуются многочисленные соединения состава BmCnHm+n (т - 3 — 10, п = 1 — 6), получившие название карборанов. Молекулы карборанов могут быть либо замкнутые, т. е. закрытые многогранники (клеточные или клозо-сое-динения), либо многогранники с одной открытой вершиной (гнездовые или нидо-соединения). Получены карбораны, в которых атомы бора заменены на атомы Al, Zn, Sn, Pb, N, Р и другие элементы.
Металлы и неметаллы могут образовывать наряду с простыми ионами одноэлементные полиионы линейной или циклической структуры: В&-, Н|, О|, Pb$", Sb$“, S3+ , S?£, I?, lg“, I3 и др.
Неорганическая химия — это не только химия малых молекул, т. е. веществ с небольшой относительной молекулярной массой, но и химия макромолекулярных веществ (неорганических полимеров).
188
К ним принадлежат алмаз и графит, некоторые аллотропные мо-ификации серы, нитриды бора и серы, состава (BN)x и (SN)x, полисиликаты и полифосфаты, циклополифосфины (RP)x, где R= = CF3, Ph, Me, Et, фосфазены типа (PChN)*, циклоборазаны и др.
Методы синтеза неорганических веществ включают сегодня, помимо традиционны^, методы, осуществляемые в экстремальных условиях: при высоких давлениях, создаваемых взрывом, при очень низких (криохимия) и очень высоких (плазмохимия) температурах, при воздействии сильнейших окислителей — типа фторидов галогенов, дифторида криптона KrF2 и фторидов кислорода. Большое распространение при синтезе новых неорганических материалов, например керамики, обладающей высокой электрической проводимостью и сверхпроводимостью, получили твердофазные реакции.
Подробнее см.: Третьяков Ю. /?. Твердофазные реакции. — М.: Химия, 1978.
С помощью методов криохимии удалось получить многие вещества, существование которых ставилось под сомнение, например трифториды рубидия RbFs и цезия CSF3, триоксид углерода СОз, озонид аммония NH4O3, тетраоксид диводорода Н2О4. Применение одного из сильнейших окислителей дифторида криптона KrF2 позволило синтезировать соединения с катионами [C1F6J и [BrFgf.
Подробнее см.: Степин Б. Д. Успехи химии, 1987. Т. 56. С. 1273.
Химия некоторых из приведенных соединений будет рассмотрена в соответствующих разделах, посвященных химии элементов многих групп периодической системы.
ГЛАВА 11. ХИМИЯ ВОДОРОДА
Водород не принадлежит ни к одной из групп периодической системы. Он обнаруживает те или иные физико-химические свой-
ства, сходные с элементами почти всех A-групп (см. раздел 4.2). Атом водорода по сравнению со всеми остальными элементами имеет самую простую электронную конфигурацию lx1 — один электрон
и одну s-AO, доступную для образования химической связи. Водород как горючий газ, получающийся при действии кислот на металлы, был известен уже в XVI в. Ломоносов называл водород «горючим паром» и считал его флогистоном (так называли в XVIII в. мифическую составную часть всех горючих тел, выделяющуюся из них при горении). Природу водорода как особого газа впервые установил Кавендиш в 1766 г.
Кавендиш Генри (1731 — 1810) — английский физик и химик.
обнаруживший, что атмосферный воздух есть смесь кислорода и азота, а вода образуется из воздуха и водорода.
189
11.1. РАСПРОСТРАНЕННОСТЬ В ПРИРОДЕ
Водород принадлежит к распространенным в природе элементам. Его кларк равен примерно 1%.
! Кларк — относительная распространенность (в массовых долях, выраженных в процентах) элемента в таких составных частях Земли. как ее каменная кора глубиной до 16 км от уровня моря, воды океанов, морей, озер и рек, воздушная оболочка высотой до 50 км (граница стратосферы).
Водород, встречающийся в природе, является смесью двух стабильных изотопов: }Н — протия (99,984 %) и ?Н — дейтерия (0,016 %). Радиоактивный изотоп водорода тритий ?Н s Т постоянно образуется в верхних слоях атмосферы под действием нейтронов космических лучей на атомы азота и некоторых других газов. В природных водах содержание трития не превышает 1—150 атомов на 1018 атомов протия.
Подробнее см.: Ленский Л. А. Физика и химия трития. — М.: Наука, 1981.
В виде простого вещества (молекул Нг) водород встречается только на очень больших высотах, где он находится частично в атомарном, частично в ионизированном состоянии (Н+, HJ). Среднее содержание Нг вблизи земной поверхности составляет всего 5«10“5%.
Наиболее важные соединения водорода, встречающиеся в природе, — вода, углеводороды (нефть, природный газ) и другие различные органические вещества.
11.2. ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА
Водород — бесцветный газ, без вкуса и запаха. Во всех трех агрегатных состояниях водород находится в виде молекул Нг. Из-за слабого межмолекулярного взаимодействия водород имеет очень низкие температуры плавления (—259,2°С) и кипения (—252,8°С). Растворимость в 1 л воды при 25°С составляет 0,0175 л (при 0 °C — 0,1 МПа). Плотность водорода по отношению к плотности воздуха, принятой за единицу, равна 0,06952. В обычных условиях водород ведет себя почти как идеальный газ.
Водород является смесью двух модификаций: 25% параводорода и 75% ортоводорода, незначительно отличающихся друг от друга своими температурами плавления и кипения.
Водород способен давать соединения с большинством химических элементов, за исключением благородных газов.
Водород горит на воздухе, но его смеси с воздухом или кислородом взрываются от искры, пламени или платинированного асбеста:
2Нг + Ог - 2НгО
Смеси Нг и F2 взрываются даже в темноте:
Нг + F2 = 2HF
190
В атмосфере водорода горит хлор:
Н2(г) + С12(г) - 2НС1(г>; Ля°(298 К)-----182 кДж
Реакции водорода с бромом и иодом протекают обратимо.
С серой и селеном водород взаимодействует только при нагревании с образованием H2S и HiSe.
Непосредственно, без применения катализаторов, водород не взаимодействует с азотом, углеродом и кремнием.
В обычных условиях молекулярный водород проявляет восстановительные свойства только по отношению к металлам, имеющим стандартный электродный потенциал более +0,7 В (Hg, Ag, Pd, Au). Например:
2AgNC>3(p) + Н2(г) ” 2Ag(K) t + 2НЫОз(р)
PdO(K) +H2(r) - Pd(K) + НгО(ж); Лн°(298 K)-----170,3 кДж
причем в последней экзотермической реакции оксид палладия раскаляется за счет выделяющейся энергии. При высоких температурах водород является активным восстановителем, широко применяемым в промышленности:
GeO2 + 2Нг - Ge + 2НгО
WO3 + ЗН2 = W + ЗНгО
SiHCI3 + Н2 - Si + ЗНС1
При высоких температурах происходит ослабление химических связей, возрастает положительное значение AS°(T) реакций и, следовательно, значение Дг<7°(7') становится более отрицательным, что свидетельствует о возрастании химической активности участников реакций.
Водород особенно активен как восстановитель в момент выделения из своих соединений, когда он находится в виде атомарного водорода. Атомарный водород уже при температуре 18—25 °C восстанавливает до металлов многие оксиды: Ag2O, В12О3, CuO, HgO, РЬО и др.
Некоторые металлы <Ni, Pd, Pt) хорошо растворяют водород, а щелочные, щелочно-земельные металлы, титан, цирконий, уран взаимодействуют с ним с образованием гидридов (КН, СаНг, UH3, TiHi и др.).
Водород вызывает физическую коррозию железа и некоторых сортов стали: металлы становятся хрупкими, под нагрузкой расслаиваются.
11.3. ПОЛУЧЕНИЕ
Основным промышленным методом получения водорода является переработка природного газа. Такой газ, содержащий до 90 % метана, пропускают вместе с парами воды над никелевым ката-850”СОР°М ^СМ* Раздел 34.3), нагретым до температуры 700—
191
СН4(Г) + 2НгО(г) - 4Нг1 + СОг! ; Лн°(298 К) = —161 кДж
Затем из полученной смеси газов удаляют СОг, сначала поглощая его водой под давлением, а затем — водным раствором этанол-амина H2NCH2CH2OH.
Наиболее чистый водород получают электрохимическим разложением воды, содержащей для увеличения ее электрической проводимости NaOH или КОН:
на катоде Fe(—): 2НгО + 2е - Нг1 + 2ОН
на аноде С(+): 2ОН — 2е 0,5021+ НгО
В меньших количествах водород получают при помощи реакции 2НгО + С - 2Н21 + СОг!
В качестве побочного продукта водород образуется также при электрохимическом получении хлора и гидроксида натрия. Считают, что в недалеком будущем водород начнут получать методом фотохимического разложения воды с использованием солнечной энергии.
Подробнее см.: Замараев К. И., Пармон В. Н. Усп. химии, 1983. Т. 52. С. 1433.
Реже используют реакцию
СаНг + 2Н1О - 2Нг! + Са(ОН)г
В лабораторных условиях водород выделяют либо из кислот:
Zn + 2НС1 - Нг! + ZnC12
либо из гидрида титана при термическом его разложении: Т1Н2 == Нг! + Ti
11.4. ГИДРИДЫ
Гидридами называют бинарные соединения водорода с более электроположительными элементами. Соединения водорода с углеродом, азотом, элементами VI- и VIIA-групп периодической системы к гидридам не относят.
По характеру химической связи все гидриды делят на ионные (солеобразные), ковалентные и металлообразные.
Ионные гидриды — бесцветные кристаллические вещества высокой реакционной способности. Все они сильные восстановители. Ионные гидриды в кристаллической решетке содержат катион металла и гидридный анион Н , который и определяет восстановительные свойства ионных гидридов.
Стандартный электродный потенциал полуреакции 0,5Нг + е = = Н- <р° = —2,24 В. Поэтому анион Н проявляет восстановительные свойства по отношению ко многим веществам, содержащим даже небольшое число ионов Н :
Н~ + Н+ - Нг; ВаНг + 2НгО - 2Нг 1 + Ва(ОН)г
Ионные гидриды образуют все щелочные, щелочно-земельные
192
лементы и лантаноиды в степени окисления (+11), например ЕиНг,
YbH2. .
Химическая активность ионных гидридов возрастает от L1H к £§Н и от СаНг к RaH2. Гидриды рубидия и цезия воспламеняются в Сухом воздухе
2RbH + О2 - Rb2O + Н2О
(образуется смесь Rb2O, RbO2, Rb2O2). С H2S, сухим НС1 и влажным £02 гидриды щелочных металлов вступают в реакции:
2КН + H2S « K2S + 2Нг
КН + НС1 == КС1 + Н2Т
КН + СОг - Н—COOK
При нагревании ионных гидридов до температур, превышающих температуры их синтеза, происходит разложение веществ на металл и водород:
2CsH= H2T+2Cs
Температуры разложения гидридов уменьшаются с увеличением относительной атомной массы металла.
Все ионные гидриды получают при прямом взаимодействии металла с водородом.
Ковалентные гидриды некоторых р-элементов — газообразные бесцветные вещества со своеобразным запахом, взаимодействующие с водой и водными растворами гидроксидов щелочных металлов:
SiH4 + 4Н2О = H4SiO4 + 4Н2Т
Исключением являются РНз и АзНз, на которые ни вода, ни водные растворы КОН не действуют.
Силан и диборан воспламеняются на воздухе:
ВгНб + ЗО2 = В2О3 + ЗН2О
SiH4 + 202 = SiO2 + 2НгО
Другие гидриды сгорают с образованием кислот:
РНз + 20г = Н3РО4
При нагревании ковалентные гидриды, как и ионные, распадаются:
2AsH3 = 2As + 3H2t ; SiH4 = 2НгТ + Si
Кроме простых гидридов, бор и кремний образуют сложные гидриды цепочечного строения, которые могут включать до 20 атомов бора (В20Н16) и до 6 атомов кремния (Si6Hi4).
Ковалентные гидриды получают различными способами. Например, в среде органического растворителя
7—1258
193
2Na[BH4] + I2 - B2H6T + 2NaI + H2f
или в водном растворе
Mg2Si + 4НС1 == SiH4f + 2MgCl2
Подробнее см.: Жигач А. Ф., Стасиневич Д. С. Химия гидридов. — Л.: Химия, 1969.
Металлообразные гидриды образуют некоторые d-элементы. Они представляют собой металлоподобные темные порошки, обладающие электрической проводимостью, теплопроводностью и магнитными свойствами, характерными для металлов. В большинстве случаев металлообразные гидриды — нестехиометрические соединения.
Химическая связь в металлообразных гидридах — полярная ковалентная с участием ионов Н+ или Н в зависимости от вида металла и количества связанного водорода. Присутствие связанного водорода в виде протонов Н+ подтверждается перемещением его при электролизе расплавов гидридов к катоду.
Металлические свойства рассматриваемых гидридов возникают в результате свободно перемещающихся в кристаллической решетке электронов, оставшихся после образования связи. Например, если в гидриде состава МНИ у металла т валентных электронов, а участвует в связях только нН -ионов, то разность (т — п) даст число электронов, вызывающих металлические свойства. Когда т = = и, то металлические свойства исчезают и гидриды будут ионными.
При нагревании в инертной атмосфере гидриды состава МН2 разлагаются с выделением водорода, а на воздухе сгорают; с кислотами взаимодействуют, выделяя водород:
TiH2 + ЗНС1 - TiCl3 + 2,5Н2
ZrH2 - H2f + Zr
TiH2 + l,5O2 - TiO2 + H2O
Элементы IVB-группы образуют дигидриды состава МН2 при непосредственном взаимодействии порошкообразных металлов с водородом при 400—500 °C, а металлы V Б-группы образуют нестехиометрические гидриды состава МН*.
Подробнее см.: Маккей К. Водородные соединения металлов. — М.: Мир, 1968.
11.5. ПРИМЕНЕНИЕ
В настоящее время все большее внимание начинают уделять использованию водорода в качестве топлива. Водород — превосходный энергоноситель: среди всех веществ он имеет самую высокую плотность энергии, равную 33 кВт/кг, в то время как у углерода она равна только 9,1 кВт/кг. Теплотворная способность водорода 142 кДж/г, а у нефти и природного газа 45—50 кДж/т. Большие количества водорода используются в промышленном синтезе NH3 и НС1 для получения метанола, синтетического жидкого топлива,
194
в гидрогенизации жиров, при гидрокрекинге нефтяных фракций. Изотопы водорода — дейтерий и тритий — применяют как термоядерное горючее. Водород необходим для получения Ge, W, Мо и Re из их оксидов и фторидов, для производства капрона, найлона, высших жирных спиртов. Гидриды металлов — компоненты ракетных топлив, восстановители в металлургической промышленности, реагенты в неорганическом и органическом синтезах.
11.6. токсикология
Водород не ядовит, но при высоких концентрациях вызывает удушье и наркотическое действие. Газообразные гидриды неметаллов — токсические вещества. Особенно ядовитыми газами являются AsH3, РНз и SnH4, хроническое отравление которыми приводит к расстройству зрения, анемии и язве желудка. Попадание на кожу порошкообразных ионных гидридов вызывает химические ожоги, а попадание этих веществ в глаза приводит к тяжелому их поражению, вплоть до полной потери зрения. Высокой токсичностью обладают гидриды бора. Диборан ВгНб близок по токсичности к фосгену CCI2O, а пентаборан В5Н9 и декаборан В10Н14 поражают центральную нервную систему почти так же, как и HCN, причем они способны проникать даже через поврежденную кожу.
Упражнения к главе 11
I. Чем отличаются ковалентные гидриды от металлообразных?
2. Можно ли приготовить смеси водорода и фтора, водорода и хлора?
3. Что происходит с ковалентными и ионными гидридами при нагревании или их контакте с водой?
4. При помощи какого метода получают наиболее чистый водород?
5. Что произойдет, если в атмосфере водорода слегка нагреть Ag2O, СиО или РЬО?
ГЛАВА 12. ХИМИЯ S-ЭЛЕМЕНТОВ
К s-элементам относят элементы IA- и ПА-групп периодической Сисгемы. Элементы 1А-группы — литий Li , натрий Na, калий К, Рубидий Rb, цезий Cs и франций Fr — называют щелочными элементами, а у элементов ПА-группы — берилия Be, магния Mg, кальция Са, стронция Sr, бария Ва, радия Ra — последние четыре элемента называют щелочно-земельными.
и Атомы щелочных элементов для образования химических связей еют всего один электрон, находящийся на /is1-АО. Сравнительно
7*
195
небольшое значение первой энергии ионизации, уменьшающееся от Li (£и “ 520 кДж/моль) к Cs (£и == 342 кДж/моль), облегчает удаление электронов с АО. Поэтому атомы щелочных элементов в различных химических реакциях легко превращаются в однозарядные катионы с устойчивой восьмиэлектронной (п — 1)«2(и — 1)р6 конфигурацией соответствующего благородного газа. Например, K([Ar]4s* — ё~ == К+([Аг]). Естественно, что в многочисленных своих ионных соединениях щелочные элементы имеют только одну степень окисления (+ I).
Элементы ПА-группы содержат на внешнем энергетическом уровне уже два электрона, способных перед образованием ионных химических связей к разъединению с переходом одного из них на пр-АО: ns2 -* ns1 пр1. Степень окисления элементов ПА-группы в их различных соединениях равна (+ II).
Бериллий по своим физико-химическим свойствам резко выделяется среди элементов ПА-группы. У атомов этого элемента наиболее высокое среди всех «-элементов значение первой энергии ионизации (£и == 901 кДж/моль) и наибольшее различие в энергиях ns- и пр-АО. Поэтому бериллий образует преимущественно ковалентные химические связи с другими элементами, которые рассматриваются обычно с позиций метода валентных связей. Атомные орбитали бериллия подвергаются sp-гибридизации, отвечающей образованию линейных молекул ВеС12, Ве1г и др. Возможна также и sp-гибридизация, с которой связана тетраэдрическая структура образующихся ионов и молекул:
Ве(ОН)2 + гОН-. - [Ве(ОН)4]2~
ВеС1г + 2СГ^=г [BeCU]2
Ионы бериллия не обнаружены ни в кристаллах его соединений, ни в растворах и расплавах последних. Образующиеся при растворении BeS04 или Ве(МОз)2 аквакатионы [Ве(НгО)4Г тотчас же подвергаются кислотно-основному взаимодействию с водой (см. раздел 12.4).
Электроотрицательность бериллия, равная 1,5 по шкале Полинга, является самой высокой среди s-элементов (/ = 1,2 у Mg, а у Li, Са и Sr % - 1,0).
Химическое поведение Li и Mg, а также Be и А1 в силу диагональной периодичности во многом аналогично. В частности, при нагревании нитрат и карбонат лития разлагаются до 1лгО, в то время как нитраты других щелочных элементов превращаются в нитриты с выделением кислорода, а карбонаты плавятся без разложения. Литий, как и магний, образует нитрид U3N. Нитриды других
196
щелочных элементов неизвестны. Карбонаты, фториды и фосфаты как лития, так и магния малорастворимы в воде.
Среди всех s-элементов только Be, а также его оксид и гидроксид проявляют амфотерные свойства.
Соли s-элементов известны практически для всех кислот. Обычно это бесцветные кристаллические вещества с ионной химической связью (кроме ряда соединений бериллия), обладающие высокими температурами плавления, электрической проводимостью своих растворов в воде и расплавов. Малорастворимыми солями элементов IA-группы являются LiF, U2CO3, U3PO4, Na[Sb(OH)6], КСЮ4, RbC104, а у элементов ПА-группы — карбонаты и фосфаты, фториды Mg, Са, Sr, Ва и Ra, сульфаты Са, Sr, Ва и Ra.
Среди элементов IA- и ПА-групп только К, Rb. Ra и Fr обладают естественной радиоактивностью (изотопы WK, 'Rb и все изотопы Ra и Fr).
12.1. РАСПРОСТРАНЕННОСТЬ В ПРИРОДЕ. ОСНОВНЫЕ МИНЕРАЛЫ
Из-за чрезвычайно высокой химической активности s-элементы в виде металлов в природе не встречаются. По содержанию (кларки) на Земле Са(3,38), Na(2,63), К (2,41) и Mg(l,95) принадлежат к наиболее распространенным элементам.
Основными минералами элементов IA-группы, имеющими промышленное значение, являются: галит (каменная или поваренная соль NaCl), сильвин КС1, сильвинит (КС1 с примесью NaCl), карналлит KCl*MgC12*6H2O, мирабилит Na2SO4»10H2O и поллуцит Cs2O*A12O3*4SiO2*nH2O. Природные источники карбоната натрия: трона Na2CO3*NaHCO3 *21120 (США) и содовые озера (озера Кулундинской степи).
Рубидий принадлежит к рассеянным элементам, своих минералов он не образует, почти всегда в виде примеси встречается в минералах калия. Источником для получения Rb и Cs могут быть природные минерализованные воды.
скопления (мел, мра-
Подробнее см.: Плющев В. Е., Степин Б. Д. Химия и технология соединений лития, рубидия и цезия. — М.: Химия, 1970. С. 174.
Элементы ПА-группы образуют в природе большие таких минералов, как флюорит СаРг, кальцит М°Р, известняк) СаСОз, магнезит MgCOs, доломит МвСОз»СаСОз, гипс CaSC>4*2H2O, кизерит MgSO4*H2O, ба-Р и т BaSC>4 и целестин SrSC>4. Кальцит и доломит составляют % общей массы всех породообразующих карбонатов.
В морской воде и воде различных соляных озер растворены значительные количества NaCl, MgCh, MgSCU, CaSCM, Na2SO4 и гиДрокарбонатов кальция и магния. Соли кальция и магния придают воде жесткость и выделяются в виде накипи в котлах и отопительных приборах.
История открытия элементов. Литий был открыт в 1817 г. Арф-Дсоном в минерале паталите, а затем в минералах сподумене и
197
лепидолите. Натрий и калий в виде металлов впервые получил в 1807 г. Дэви электролизом их гидроксидов. Рубидий и цезий открыли в 1860—1861 гг. Бунзен и Кирхгоф при помощи спектрального анализа в воде одного минерального источника (рубидий по красным линиям, а цезий по ярко-голубой линии в спектре), франций обнаружила в 1939 г. Перей в продуктах радиоактивного распада актиния.
Арфведсен Юхаи Август (1792—1841) — шведский химик и минеропог.
Дэви Гемфри (1778—1829) — выдающийся английский химик, основатель электрохимии как науки, создатель первой безопасной пампы для шахтеров. Президент Лондонского Королевского общества.
Бунзен Роберт (1811 — 1899) - немецкий химик, вместе с Кирхгофом разработал методы спектрального анализа, иностранный член Петербургской АН.
Кирхгоф Густав (1824—1887) — немецкий профессор физики, иностранный член Петербургской АН.
Перей Маргерит (1909—1975) — французский радиохимик, член Парижской АН.
Бериллий был открыт в 1798 г. Вокленом. Магний, кальций и барий получил в виде металлов Дэви в 1808 г. электролизом их соединений. Стронций в виде оксида обнаружил в 1790 г. Крофорд, а радий был открыт в 1898 г. супругами Кюри.
Воклен Луи (1763—1829) - французский профессор химии, открыл хром, занимался исследованиями платиновых металлов.
Крофорд Адер (1748—1795) — английский химик.
Склодовская-Кюри Мария (1867—1934) — польский химик, открыла вместе с мужем явление радиоактивности. Лауреат Нобелевской премии по физике и по химии.
Кюри Пьер (1859—1906) — французский радиохимик, лауреат Нобелевской премии.
12.2. ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА ПРОСТЫХ ВЕЩЕСТВ
В чистом виде щелочные металлы, бериллий, магний и щелочно-земельные металлы имеют серебристо-белый цвет, только цезий обладает золотисто-желтым цветом. Все металлы, кроме бериллия, очень мягкие. Температуры плавления уменьшаются от Li к Cs и от Be к Mg, а затем от Са к Ва (табл. 18).
Стандартные электродные потенциалы <р° для полуреакций, протекающих в кислых водных растворах:
М+ + е == М(к>;. М2+ + 2е == М(к)
являются наиболее отрицательными среди всех известных металлов (табл. 18). Поэтому почти все рассматриваемые металлы принадлежат к сильнейшим восстановителям. На воздухе они (кроме Be и Mg) тотчас же окисляются, образуя различные оксиды, a Rb и Cs — самовоспламеняются. Барий загорается на воздухе уже при простом раздавливании (по твердости он близок к свинцу). Все щелочные металлы, а также Са, Sr, Ва и Ra хранят под обезвоженным минеральным маслом или керосином.
7.27 1857 3,63 —2,90 206
СО 768 1390 2,63 —2,89 184
Са 04 Ю ОС О' 3 $ n о> 5 - ~ 1
Mg О V} тГ ОС О' - 04 чО О - 04 - - 1
Be О- 04 ОС ОС о ОС * О 04 ТГ - м - 04 - |
Cs 04 ОС 04 О О' сч 04 О' г; ОС Ю _ । 04
Rb 04 О' О £ °! О' СС О' psi 04 । 04
to tn Jg \о Ю VO 00 „ - r~ о | м
Na ос ч© О' ос О' |> ©0 О |
3 S § 3 °- $ 2 о 7 2
Свойство Ж и о Р - 0 я. О Е ° м § з а “ * НН Ct С
198
Бериллий и магний обладают меньшей активностью. При контакте с воздухом они окисляются, покрываясь тонкой пленкой оксида и гидроксида, приобретают матовый оттенок, но глубокому разрушению не подвергаются. Бериллий окисляется кислородом воздуха полностью только выше 800 °C, а магний в виде порошка или ленты загорается на воздухе ослепительно ярким пламенем при температуре выше 400 °C.
Щелочные и щелочно-земельные металлы энергично взаимодействуют с водой (К," Rb и Cs с воспламенением и взрывом):
Ва + 2Н2О - Ва(ОН)2 + Н2|
Бериллий с водой не взаимодействует, а магний разлагает воду только при нагревании, амальгамировании его поверхности или введении в раствор хлорида аммония:
Mg + 2Н2О + 2NH4C1 - MgCl2 + 2NH3«H2O + H2f
Mg(OH)2 + 2NH4CI - MgCl2 + 2NH3«H2O
Щелочные и щелочно-земельные металлы растворяются в жидком аммиаке с образованием темно-синих растворов, содержащих сольватированные катионы и электроны:
М(к) + xNH3(jK) - [M(NH3)>]r+ + Ve (NH3)*-y
Такие растворы являются удобным источником электронов и очень сильными гомогенными восстановителями.
В концентрированных холодных азотной HNO3 и серной H2SO4 кислотах бериллий, как и алюминий, подвергается пассивированию. Остальные металлы реагируют со всеми кислотами с образованием солей. Например,
Са + 2НС1 - СаС12 + Н2 f
Исключение представляют HF и Н3РО4 и те металлы, фториды и фосфаты которых малорастворимы в воде (LiF, MgF2, CaF2, 1л3РС>4, Са3(РО4)2 и др.). С кислотами-окислителями реакции частично протекают с образованием продуктов их полного восстановления:
NO3 + 10Н+ + &е~ - NHJ + ЗН2О
SO3~ + ЮН+ + 8<Г- H2St + 4Н2О
Бериллий как амфотерный металл взаимодействует не только с кислотами, но и с основаниями:
Be + 2ОН" + 2Н2О - [Ве(ОН)4]2- + H2f
Be + 2Н3О+ + 2Н2О = |Ве(Н2О)4]2+ + Н2 f
в том числе и с расплавами гидроксидов с образованием диоксобериллатов:
Be + 2КОН - К2ВеО2 + H2f
Последние в воде превращаются в тетрагидроксобериллаты: "
200
К2ВеО2 + 2Н2О - К2[Ве(ОН)4]
в Амфотерность — способность металлов, оксидов и гидроксидов К взаимодействовать как с кислотами с образованием аквакомплексов 1 или аквакзтионов, так и с основаниями с образованием гидроксо-И комплексов или оксоанионов.
У щелочных металлов только литий может взаимодействовать с азотом в обычных условиях:
6Li + N2 ” 2L13N
покрываясь коркой зеленовато-черного нитрида. Бериллий, магний и щелочно-земельные металлы вступают в реакцию с азотом лишь при нагревании. Полученные нитриды очень чувствительны к влаге и легко разлагаются уже во влажном воздухе:
Ca3N2 + 6Н2О - 2Са(ОН)2 + 2NH3T
С водородом бериллий и магний непосредственно не взаимодействуют даже при нагревании. Остальные металлы образуют солеобразные гидриды составов МН и МН2 (подробнее см. раздел 11.4).
С углеродом при нагревании вступают в реакцию литий, расплавленный бериллий и щелочно-земельные металлы с образованием солеобразных карбидов состава М2С2, Ве2С и МС2 (подробнее см. раздел 14.7).
Подробнее см.: Полуэктов Е. Н. Аналитическая химия лития. —
М.: Наука, 1975; Коренман И. М. Аналитическая химия калия. —
М.: Наука, 1964; Иванов В. М., Семененко К. А. Натрий. — М.:
Наука, 1986; Плющев В. Е., Степин Б. Д. Аналитическая химия
рубидия и цезия. — М.: Наука, 1975.
12.3. МЕТАЛЛУРГИЯ ЩЕЛОЧНЫХ, ЩЕЛОЧНО-ЗЕМЕЛЬНЫХ МЕТАЛЛОВ, БЕРИЛЛИЯ И МАГНИЯ
Из многочисленных методов, предложенных для получения металлов, серьезную экспериментальную и технологическую проверку прошли очень немногие. В промышленности применяются преимущественно методы электрохимического и вакуумтермического восстановления и вакуумтермического разложения солей.
Литий, натрий, магний и кальций получают в большинстве случаев электролизом расплавов их хлоридов, вводя для понижения температуры плавления электролита другие соли. Например, при производстве лития к расплаву LiCl добавляют КС1. Электролиз протекает следующим образом:
катод (сталь) (—): Li+ + е~ - 1д<Ж)
анод (графит) (+): 2СГ - 2е - Chf
Метод вакуумтермического восстановления является основным Для получения бериллия, калия, рубидия и цезия:
1000°С
BeF2 + Mg « Вс + MgF2; 2КС1 + СаС2 = 2К + СаС12 + 2С
201
В лабораторной практике проводят разложение азидов:
2RbN3 ” 2Rb + 3N2t ; Ва(Нз)2 = Ba + 3N2t
12.4. ХИМИЯ ВОДНЫХ РАСТВОРОВ
Катионы s-элементов в водных растворах присутствуют в виде неустойчивых аквакатионов, содержащих чаще всего четыре или шесть молекул воды: [П(НгО)4]+, [Ве(НгО)4] , [К(НгО)б]+, [Mg (НгО) 6 Г и др. По мере увеличения радиуса катиона и уменьшения его заряда устойчивость аквакатионов падает. Она уменьшается в каждой группе сверху вниз и при переходе от ПА- к IA-группе. Очень большие и однозарядные катионы не в состоянии удержать молекулы воды в насыщенном растворе и поэтому соли с такими катионами кристаллизуются безводными (соли калия, рубидия и цезия). У остальных элементов аквакатионы входят в состав кристаллов: [Mg(H2O)6]C12, [Ве(НгО)4](МОз)2 и др. Гидролизу (см. раздел 10.3) соли «-элементов (кроме бериллия) не подвергаются. В водном растворе катионы [Ве(НгО)4] почти полностью превращаются _в сложные полимерные гидроксоаквакатионы [Bex(H2O)y(HO)z]2x z. Первой стадией такого превращения является стадия протолиза:
[Ве(Н2О)4]2+ + Н2О [Ве(Н2О)з(ОН)]+ + Н3О+
12.5. ОКСИДЫ И ГИДРОКСИДЫ
Оксиды и гидроксиды «-элементов — бесцветные кристаллические вещества, только озониды имеют оранжево-красную окраску. У всех оксидов и гидроксидов, кроме ПОН, обнаружены полиморфные модификации. Например, у КОг известно 6 модификаций.
Рассматриваемые вещества расплываются на воздухе и легко поглощают СОг, превращаясь при этом в карбонаты:
М2О + СО2 = М2СО3
М(ОН)2 + СО2 = МСОз + Н2О
М2О2 + СО2 = М2СО3 + 0,50г
Известны следующие наиболее устойчивые оксиды и гидроксиды s-элементов. У лития ПгО и ПОН, у остальных щелочных элементов оксиды составов М2О, М2О2, МОг, МОз; гидроксиды имеют один и тот же состав МОН. Бериллий образует ВеО, [Ве(ОН)г]х и [Ве(ОН)4]2 ! магний — MgO и Mg(OH)2, а щелочно-земельные элементы — оксиды составов МО, МОг, М(Ог)2 и гидроксиды одного и того же состава М(ОН)г (см. табл. 14).
Оксиды дилития ПгО и динатрия ИагО — термически устойчивые соединения с температурой плавления 1453 и 1132 °C соответственно. Остальные оксиды щелочных элементов состава МгО — более легкоплавкие вещества с температурой плавления, от .740 (КгО) до 495 °C (СзгО). В вакууме КгО, ИЬгО и CS2O возгоняются без разложения, если температура не превышает 450 °C.
202
Подробнее см.: Вольнов И. И. Перекисные соединения щелочных металлов. - М.: Наука. 1980.
Пероксиды щелочных элементов, магния и щелочно-земельных элементов разлагаются при нагревании до плавления:
М20з - М2О + 0,502
МОг - МО + 0,502
В процессе разложения происходит образование надпероксидов, например ЗМ2О2 - 2M0z + 2МгО. При более высоких температурах надпероксиды превращаются в МгО и О2. Например, у CsO2 давление диссоциации при 400 °C достигает 931 Па.
Все озониды разлагаются до плавления на МгО и Ог. Наиболее термически устойчивым из них является СзОз (температура разложения 82 °C).
Рубидий и цезий кроме перечисленных выше оксидов образуют еще оксиды составов: RbeO, RbgOz, Cs?O, CS4O, СззО, СзиОз-Диоксид нонарубидия имеет медно-красный цвет и металлический блеск. Оксиды цезия, начиная с Cs?O, имеют соответственно бронзовый, фиолетовый, темно-зеленый и фиолетово-голубой цвета.
Оксиды Be, Mg и щелочно-земельных элементов — термически устойчивые соединения с очень высокими и сравнительно близкими по величине температурами плавления: 2825 у MgO и 2650 °C у SrO.
Гидроксиды щелочных элементов плавятся без разложения в интервале температур 473 (LiOH) — 322 °C (NaOH), а гидроксиды Be, Mg и щелочно-земельных элементов разлагаются при нагревании: М(ОН>2 - МО + Н2О.
Подробнее см.: Иткина Л. С. Гидроксиды лития, рубидия и цезия. — М.: Наука, 1973.
Все монооксиды s-элементов (за исключением ВеО) взаимодействуют с водой с образованием гидроксидов:
U2O + Н2О = 21Л0Н; ВаО + Н2О - Ва(ОН)2
Изменение значения ДО (298 К) в реакции
МО(к> + НгОсж) - М(ОН>2(к)
в ряду MgO, CaO, SrO и ВаО равно соответственно —27,2, —62,3, 54,3, —63,9 кДж. Таким образом, оксиды щелочно-земельных металлов обладают практически равным химическим сродством к воде.
Пероксиды металлов подвергаются в водном растворе гидролизу как соли пероксида водорода Н2О2 — очень слабой кислоты:
Na2Oz + Н2О NaOH + NaHO2
Надпероксиды и озониды при действии воды выделяют кислород:
«ГС
2К0г + 2Н2О = 2КОН + Н2О2 + Ost, ДА/0 (298 К) * -11 ОК Дж
203
При 20 °C и выше пероксид водорода не образуется:
2КО2 + Н2О - 2К0Н + 1,5О2, ДЯ° (298 К)-------100 кДж
Озониды при взаимодействии с водой выделяют наибольшее количество кислорода:
2RbO3 + Н2О - 2RbOH + 2,5O2f
Все оксиды, вне зависимости от их состава, взаимодействуют с СО2:
ВаО + СО2 - ВаСОз; 2СзОз + СО2 *= Сз2СОз + 2,5O2f
Пероксиды, надпероксиды и озониды могут связывать и монооксид углерода СО:
Na2O2 + СО = Ка2СОз
2КО2 + СО - К2СО3 + O2f
2RbO3 + СО = Rb2CO3 + 2O2f
Слабые кислоты и разбавленные растворы сильных кислот при температурах ниже О °C выделяют из пероксидов Н2О2:
ВаО2 + СО2 + Н2О = ВаСОз I + Н2О2
Пероксиды, надпероксиды и озониды принадлежат к сильным окислителям; с органическими веществами, некоторыми порошкообразными металлами (Mg, Al, Мп и др.) они взаимодействуют со взрывом. Ниже приведены примеры окислительно-восстановительных реакций:
2Na2O2 + S« Na2SO3 + Na2O 2KO2 + S - K2SO4
3Na2O2 + 2A1 - 2NaA102 + 2Na2O 2KO2 + SO2 = K2SO4 + O21
2KO2 + 2NO2 = 2KNO3 + O2f
Получение оксидов некоторых s-элементов основано на использовании реакции непосредственного взаимодействия металлов с кислородом:
2Li + 0,5О2 = Ы2О
Ва + 0,502 = ВаО
ВаО + 0,5О2 = ВаО2
Однако не все оксиды можно получить таким простым путем. В частности, при синтезе оксидов щелочных металлов (кроме лития) необходимо строго соблюдать условия осуществления конкретной реакции: 2Na + О2 = Na2O2 (избыток кислорода, 270—370 °C); Na2O2 + О2 - 2NaO2 (12,2 МПа, 400 °C). В противном случае образуется смесь различных оксидов (Na2O, Na2O2 и NaO2). Для получения озонидов калия, рубидия и цезия используют реакцию
2КОН + 20з - 2КОз + Н2О + 0,5O2f
204
pj3 смеси КОз и КОН озонид извлекают жидким аммиаком. Озонид натрия неустойчив, а озониды элементов ПА-группы и Li неизвестны.
Оксиды элементов ПА-группы получают разложением при нагревании гидроксидов, карбонатов и нитратов, например:
ВаСОз “ ВаО + CO2f
В основе синтеза гидроксидов щелочных элементов лежит электролиз водных растворов солей. Например, для производства NaOH применяют диафрагменный электролиз концентрированного водного раствора NaCl:
катод Fe(—): 2Н2О + 2е “ H2f + 2ОН
анод Ti (+): 2СГ — 2е~ - Cl2f
Суммарная электрохимическая реакция:
2NaCl + 2Н2О - 2NaOH + Cl2f + H2f
Гидроксид натрия образуется в катодной части электролизера, отделенной от анода диафрагмой. Диафрагма уменьшает возможность протекания побочных реакций:
С12 + 2NaOH = NaCl + NaClO + Н2О
NaClO + 2Н2О — 4е" - NaClCh + 4Н+ (у анода)
Гидроксиды щелочно-земельных элементов выпадают в осадок при действии на концентрированные водные растворы солей концентрированных водных растворов КОН или NaOH в условиях, исключающих доступ к реагентам СО2:
SrCl2 + 2КОН - Sr(OH)2i + 2КС1
Возможно также использование реакций типа
СаО + Н2О = Са(ОН)2
В некоторых случаях применяют обменные реакции:
Cs2SO4 + Ва(ОН)2 - 2CsOH + BaSO4 I
12.6. СОЛИ
Соли элементов IA- и ПА-групп периодической системы имеют ионную кристаллическую решетку. Общим, чисто качественным, признаком всех ионных кристаллических решеток является такая упаковка ионов, при которой ближайшим соседом любого иона всегда будет ион противоположного знака. В этом случае отталкивание между ионами одинакового знака сводится к минимуму, а число контактов между ионами противоположного знака максимально.
Если максимальный контакт между катионами и анионами в кристаллической решетке не достигается, например, катион очень мал по сравнению с анионом, то соль становится неустойчивой. В частности, соли, содержащие катионы Li+, Be , Mg , щелочноземельных элементов и такие большие анионы, как СО| , NO3,
205
неустойчивы к нагреванию; разлагаются при нагревании и перманганаты щелочных элементов. Например:
L12CO3 = U2O + СО2 t
2КМпС>4 = К2МПО4 + МпОг + ОгТ
4Be(NO3>2 ” Ве4О(ЬЮз)б + 2NO2T+ 0,50г!
Галогениды, ортофосфаты, сульфиты и хроматы щелочных металлов, галогениды элеметов ПА-группы плавятся без разложения. Расплавы таких солей являются хорошими электролитами. Расплавы галогенидов щелочных металлов растворяют значительные количества вещества соответствующего щелочного металла. В системе Cs(Hal)—-—Cs, где Hal-F, Cl, Вг или I, наблюдается неограниченная взаимная растворимость при всех температурах выше температуры плавления.
Ниже рассматриваются наиболее технически важные соли: карбонаты, сульфаты, нитраты и галогениды.
Карбонаты. Карбонаты s-электронов — бесцветные кристаллические вещества, в ионных кристаллических решетках которых находятся треугольные плоские ионы СО?-. Карбонаты лития и элементов ПА-группы известны только в безводном состоянии, а карбонаты Be и элементов 1А-группы — гигроскопичные вещества, образующие кристаллогидраты с различным содержанием молекул воды. Карбонаты элементов IA-группы, кроме Ы2СО3, плавятся без разложения при 800—900 °C и хорошо растворяются в воде, а карбонаты лития и элементов ПА-группы при нагревании разлагаются до плавления и малорастворимы в воде. Разложение карбонатов протекает по уравнению
МСОз(к)-МО(К)+СО2Г
Изменение величины (298 К) в реакции
МО(к)+СО2(г)“МСОз<к)
для ВеО, MgO, CaO, SrO и ВаО равно соответственно (кДж): +16, —66, —130, —183 и —218. Отсюда следует, что ВаО является более основным оксидом, чем ВеО, поэтому и устойчивость ВаСОз к нагреванию выше, чем у остальных карбонатов. Если ВеСОз разлагается ниже 100 °C, то у ВаСОз полная диссоциация наблюдается выше 1300 °C.
Водные растворы карбонатов и их суспензии в воде взаимодействуют с СОг с образованием гидрокарбонатов, среди которых наименее растворимым является NaHCOs:
Na2CO3+CO2+H2O“2NaHCO3
а малорастворимые карбонаты магния и щелочно-земельных элементов переходят в водный раствор:
СаСОз+СО2+Н2О=Са (НСОз) 2
Гидрокарбонаты элементов 1А-(1дНС0з в кристаллическом состо-* янии неизвестен) и ПА-групй — бесцветные, безводные кристалли
206
ческие вещества (см. табл. 14), в которых анионы НСОз связаны между собой водородными связями в бесконечные цепи —Н ... СОз— Н ... СОз—Н ...._ Все гидрокарбонаты хорошо растворимы в воде, кроме NaHCOs. С кислотами карбонаты и гидрокарбонаты взаимодействуют с образованием солей:
SrCO3+2HNO3=Sr(NO3)2+CO2t +Н2О
Карбонаты и гидрокарбонаты щелочных металлов подвергаются гидролизу:
СО^+Н2О. — НСОз+ОН"; НСО3+Н2О Н2СО3+ОН"
Синтез большинства карбонатов элементов IA- и ПА-групп основан на использовании либо обменных реакций:
U2SO4 + Na2CO3 = 1л2СОз I + Na2SO4
Ва(ЬЮз)2 + К2СОз ” ВаСОз I + 2KNO3
либо реакций нейтрализации:
КОН + СО2 - КНСОз; 2КНСОз - К2СО3 + СО21 + Н2О
Более сложным является промышленный синтез карбоната натрия (соды). Современное производство Na2CO3, достигающее нескольких миллионов тонн в год, применяет старый аммиачный способ Сольве, разработанный еще в 1863 г., но не потерявший до сих пор своего значения.
Сольве Эрнст (1838—1922) — бельгийский химик и инженер, организатор первой В мире фабрики по производству соды аммиачным методом.
По этому способу вначале получают гидрокарбонат аммония:
NH3 + СО2 + Н26 - NH4HCO3 (12.1)
необходимый для этой реакции СО2 образуется при термическом разложении известняка (или мела):
СаСОз = СаО + СО2 г (12.2)
затем осуществляют обменную реакцию:
NaCl + NH4HCO3 - NaHCO31 + NH4CI (12.3)
Осадок гидрокарбоната натрия отфильтровывают и нагревают до полного его разложения:
160”С
2NaHCO3 = Na2CO3 + CO2f + Н2О (12.4)
выделяющийся СО2 используют в реакции (12.1). Аммиак непрерывно регенерируется и также используется в реакции (12.1):
2NH4C1 + Са(ОН)2 - 2NH31 + СаС12 + 2Н2О (12.5)
207
Таким образом, сырьем для производства Na?CO3 служат только NaCl, СаСОз и НгО, а отходом производства является СаС1г, используемый в дорожном строительстве.
Вместо NaCl можно использовать большие природные запасы м и рабилита Na2SO4»10H2O (залив Кара-Богаз-Гол):
Na2SO4 + 2NH3 + 2СО? + 2Н2О 2ЫаНСОз4 + (NH4)2SO4
Побочный продукт (NH4)2SO4 найдет применение в сельском хозяйстве в качестве удобрения.
Последнее время для производства Na^COa у нас во все возрастающих масштабах начинают использовать богатейшие залежи нефелина (Na, К) [AIS1O4]. Сначала нефелиновую руду спекают при 1300 ° С с известняком или мелом:
(Na, К) [AlSiO4 J + СаСОз = (Na, К)АЮг + CaSiO3 + СОг t
Затем образовавшийся спек обрабатывают водой, при этом алюминаты натрия и калия переходят в раствор, а метасиликат кальция остается в осадке. После удаления осадка через фильтрат пропускают СОг:
2NaA102 + ЗН2О + СОг - 2А1(ОН)з I + Na2CO3
2КА10г + ЗН2О + СОг = 2А1(ОН)з1 + К2СО3
Осадок гидроксида алюминия отделяют, а фильтрат, содержащий Na2CO3 и К2СО3, упаривают. Первым в осадок при этом выпадает менее растворимый №гСОз*НгО.
При наличии дешевых источников энергии и такого природного сырья, как мирабилит Na2SO4»10H2O, рентабельным может быть старый сульфатный способ Леблана (1791):
Na2SO4<K) + СаСОз(к) + 2С(К) = НагСОз(ж) + СаБ(ж) + 2СОг1
Леблан Никола (1742—1806) — французский врач и химик. Для извлечения Na?CO3 полученный сплав обрабатывают водой. Отходы CaS можно применять в технологии производства серы:
-п +IV 1000°С
2CaS + SO2 = 3S(r) + 2СаО(К) Lj_ 4 е
Сульфаты. Сульфаты s-элементов — бесцветные, кристаллические вещества, в ионных кристаллических решетках которых находятся тетраэдрические (хр3-гибридизация) анионы SO^ . Сульфаты наиболее тяжелых s-элементов кристаллизуются из водных растворов безводными, а сульфаты остальных s-элементов образуют кристаллогидраты. Почти все сульфаты s-элементов (кроме щелочно-земельных) хорошо растворимы в воде.
При нагревании сульфаты щелочных элементов и магния плавятся без разложения, а у сульфатов бериллия и щелочно-земельных элементов плавление сопровождается частичным разложением:
208
I450-C
CaSC>4 = CaO + SO31
Сульфаты щелочных металлов образуют с сульфатами металлов (II) и (Ш) двойные сульфаты с общей формулой соответственно М^М11 (SO4 )2*6Н2О и MrMm(SO4)2*12H2O, имеющих групповое название в первом случае шёниты, а во втором — квасцы. В этих соединениях М =Mg, Fe, Мп, Си, Ni, Со и др., М1П=А1, Cr, Fe, Мп и др. Например, KA1(SO4)2* 12НгО — додекагидрат сульфата алюминия-калия, Rb2Cu(SO4)2’6H2O — гексагидрат сульфата меди (II)-дирубидия.
Наиболее простой метод получения сульфатов щелочных металлов, Be и Mg заключается во взаимодействии водных растворов H2SO4 и карбонатов (или гидроксидов) металлов. Сульфаты щелочно-земельных металлов осаждаются в обменных реакциях типа:
СаС12 + (NH4)2SO4 + 2НгО = CaSO4*2H2O; + 2NH4C1
BaCh + K2SO4 = BaSO4; + 2КС1
Нитраты. Нитраты «-элементов —- бесцветные, хорошо растворимые в воде кристаллические вещества, в ионных кристаллических решетках которых (см. табл. 14) находятся треугольные плоские анионы NO3 («//-гибридизация). Среди нитратов щелочных элементов только нитрат лития образует кристаллогидрат ЕЖОз’ЗНгО, а среди нитратов элементов ПА-группы — только Ва(НОз)2 кристаллизуется в безводном состоянии. При нагревании нитраты s-элементов сначала плавятся (Ве(МОз)2 и Mg(NO3>2 разлагаются до плавления), а затем, при более высокой температуре, разлагаются:
MNO3 - MNO2 + 0,5021
M(NO3)2 = M(NO2)2 + ОгТ
2M(NO2)2 - 2МО +2NO2t + 2N0f
Расплавленные нитраты s-элементов — сильные окислители: они разрушающе действуют на платину и многие металлы.
Обычный метод получения нитратов s-элементов состоит во взаимодействии их карбонатов или гидроксидов с азотной кислотой.
Галогениды. Галогениды s-элементов — бесцветные ионные кристаллические вещества. Безводные галогениды плавятся и кипят без разложения, их температуры плавления и кипения понижаются от фторидов к иодидам. Наиболее высокие температуры плавления и кипения имеют фториды магния и щелочно-земельных элементов, например, у СаРг т. пл. = 1419 °C, а т. кип. = 2530°С.
Фториды лития, магния и щелочно-земельных элементов мало-растворимы в воде и не образуют кристаллогидратов. В безводном состоянии кристаллизуются также NaF, RbCl, CsCl бромиды и нодиды калия, рубидия и цезия. В водных растворах фтороводорода HF фториды щелочных элементов образуют гидродифториды MHF2, которые и кристаллизуются из пересыщенных растворов вместо Фторидов.
209
Фторид бериллия — ионное соединение. Остальные галогениды: BeClz, ВеВгз и Bel? — ковалентные соединения, возгоняющиеся в виде димеров при нагревании их расплавов (см. раздел 5.3). В водном растворе BeF? находится в виде частиц состава [ВеСНгО)???]а при избытке фторид-анионов F образует анионы [BeF4] . Остальные галогениды бериллия подвергаются сильному гидролизу с образованием сложных продуктов (см. раздел 10. 3).
Бромиды и иодиды калия, рубидия и цезия способны к взаимодействию в водном растворе и особенно в растворах неполярных органических растворителей с бромом и иодом и межгалогенными соединениями:
CsI + I?-- Cs[1(1)21 RbCl + 1С1з = Rb[lCl4] CsBr + Be? j= Cs{Br(Br)2]
При действии на раствор иодида цезия CsI в хлороводородной кислоте избытка газообразного хлора происходит не выделение иода, а образование желтоватых кристаллов тетрахлороиодата цезия:
CsI + 2CI2.7 - Cs[ICl4]
Синтез галогенидов «-элементов основан на использовании реакций типа:
МОН + НС1 - MCI + Н2О
МСОз + 2НВг - МВг2 + СОг Г + 2Н?О
МС12 + KF = MF?! + 2КС1
Иодиды щелочных металлов получают при помощи окислительно-восстановительных реакций:
6КОН + 31? = 5KI + КЮз + ЗН2О
КЮз + ЗН2О2 •= KI + ЗОгГ + ЗН2О
12.7. ПРИМЕНЕНИЕ
Рассмотренные выше элементы и их соединения играют колоссальную роль в народном хозяйстве, составляя арсенал современной и грядущей техники. Такие элементы, как Li, Mg, Be, Са, Na, Sr, К, Cs, являются стратегически важными.
Подробнее см.: Коган Б. И. Редкие металлы. — М.: Наука. 1978.
Литий (6LiD и $1лТ) используется в термоядерной энергетике; Cs — в МГД-генераторах и ионных двигателях ракет; Be, Mg и И — при производстве специальных сплавов для авиаракетной и космической промышленности. Некоторые щелочные и щелочно-земельные металлы применяют в радиоэлектронике (фотоэлементы, фотоэлектронные умножители и др.), используют для изготовления пьезоэлектрических, акустооптических устройств, оптических мо
дуляторов, пироэлектриков, оптических волноводов, химических ИСТОЧНИКОВ тока с литиевым анодом, в жидкометаллических теплоносителях (Li, Na, К и их сплавы).
Калий, магний и кальций необходимы для питания растений наряду с азотом и фосфором. Они не могут быть заменены никакими другими элементами.
По своему значению в жизни человека хлориды натрия и калия превосходят все другие соединения. Хлорид натрия не только один из важнейших пищевых продуктов человека и животных, но и основное сырье для производства соды, гидроксида и пероксида натрия, хлороводородной кислоты и хлора. Хлорид калия и карналлит идут на производство калийных удобрений, карбоната и гидроксида калия. Кальцит необходим в производстве строительных материалов, извести и цемента, стекла и бумаги. Магнезит и доломит применяют для изготовления огнеупорных кирпичей, облицовочного камня, минеральной ваты и фарфора. Гипс широко используют в строительном деле, цементной и бумажной промышленности. Мирабилит — основное сырье для производства высококачественного стекла, бумаги, необходим он и для текстильной и нефтеперерабатывающей промышленности.
Пероксиды, надпероксиды и озониды широко используют для регенерации воздуха в подводных лодках, кабинах космических кораблей, танках-амфибиях, убежищах, подводных домах. Применяют их в дыхательных аппаратах пожарных и горноспасательных команд.
12.8. ТОКСИКОЛОГИЯ
Ионы Na+ и К+ — активные участники биохимических процессов в живых организмах. Ионы 1л являются биологическим антагонистом ионов Na , они особенно токсичны при недостатке ионов N а+ в рационе. Большинство солей бария, кроме BaSO4, относится к сильно токсичным веществам, нервным и мышечным ядам. Очень токсичны соединения бериллия, обладающие канцерогенным действием.
Щелочные и щелочно-земельные металлы относят к взрыве- и пожароопасным веществам. Попадание на кожу даже крупинок этих металлов, их оксидов и гидроксидов вызывает сильные ожоги, а при сильном поражении глаз — полную потерю зрения. Утилизацию щелочных и щелочно-земельных металлов осуществляют обработкой их остатков этанолом, полученные алкоголяты затем разрушают водой.
Упражнения к главе 12
. '• ^ак ПОПУЧИТЬ иодид капия без примеси триоксоиодата (*) капия, используя в качестве реагентов водный раствор КОН и. 12?
^^Почему ВаСОз бопее устойчив к нагреванию, чем
3- Какое соединение образуется при длительном пропу
211
скании СО2 через водный раствор RbOH? Выпадет пи это соединение в осадок?
4. Какие отходы производства образуются при получении карбоната натрия аммиачным методом? Какое природное сырье для этого производства необходимо?
5. Можно пи получить карбонат натрия, применяя кокс и такое природное сырье, как мирабилит и известняк?
6. Какие соединения будут кристаллизоваться из водного раствора, содержащего K2SO4 и Cr2(SO4)3; Rb2SO4 и CuSO4?
7. Можно пи при помощи обменных реакций получить CsOH? Какие реагенты для этого необходимы?
8. Какие реакции будут протекать при нагревании пероксида натрия и озонида цезия в атмосфере диоксида углерода, а надпероксида калия в атмосфере диоксида серы?
9. Может пи нитрид кальция в обычных условиях взаимодействовать с водой?
10. Какой из щелочных металлов взаимодействует с азотом в обычных условиях?
11. Где у нас встречаются основные запасы карналлита и мирабилита и для чего используется в промышленности это природное сырье?
ГЛАВА 13. ХИМИЯ ЭЛЕМЕНТОВ ША-ГРУППЫ
В группу ША периодической системы входят пять элементов: бор В, алюминий А1, галлий Ga, индий In, таллий Т1. Внешняя электронная конфигурация их атомов ns^npin - 2—6). Основная степень окисления элементов в их соединениях (+Ш). При переходе от А1 к Т1 возрастает устойчивость соединений со степенью окисления (+1). Например, Т1 легко окисляется на воздухе с образованием Т1?О, известны устойчивые соединения ТЮН, Т1С1, TI2SO4 и др. Таллий (I) может быть окислен в растворе до Т1(Ш) только сильными окислителями. Электронная конфигурация атомов таллия: [Xe]6s24/I45a и6р . Считают, что при возбуждении атомов Т1 вследствие релятивистского эффекта (зависимость массы электронов от их скорости, а следовательно, и зависимость от скорости электронов размеров АО) происходит сильное сжатие 6s-АО и ее энергетическая стабилизация. Соединения Т1(1) имеют преимущественно ионный характер.
Ковалентные соединения элементов ША-группы могут иметь треугольную плоскую структуру (sp-гибридизация), тетраэдрическую (sp-гибридизация) и октаэдрическую (sp^d -гибридизация).
В случае sp-гибридизации (галогениды бора и алюминия, борная кислота В(ОН)з, галогениды галлия) у атомов элементов ША-группы остается вакантной одна p-АО, которая может участвовать в образовании делокализованной дополнительной Л-связи, образуемой при перекрывании вакантной p-АО, например, с Зр-АО атома хлора (рис. 53). Такая Л-связь или рЛ- рЛ-связь уже не принадлежит
212
о—н
Рис. 53. Структуры молекулы ВС1з и аниона [B4Os(OH)4]2 в Na2[B4Os(OH>4] «8Н2О
определенному атому хлора. Поэтому при сублимации хлоридов, бромидов и иодидов Al, Ga и In в степени окисления (+Ш) образуются /Димерные молекулы Мг(На1)б с мостиковой структурой, состоящие из двух тетраэдров с общим ребром (см. рис. 15).
Тетраэдрические структуры встречаются преимущественно в анионах [BF4 Г, [A1CU]-, [В(ОН>4] , [ВН4] . В таких ионах атомы В и А1 образуют четыре О-связи с окружающими их атомами (координационное число В и А1 равно четырем). Оба вида гибридизации могут быть реализованы в одном соединении. Например, в анионе гептаоксотетрабората натрия (буры) Na2[B4O7»10H2O nNa2[B4O5(OH)41*8H2O половина атомов бора образует с окружающими их атомами кислорода плоскую структуру, а другая половина — тетраэдрическую (рис. 53).
Октаэдрическую структуру имеют [А1(ОН)б1 , [Т1(Н2О)зС1з]°, [А1(Н2О)2(ОН)4Г, [A1F6] .
При переходе от бора к таллию наблюдается усиление основных свойств. Бор — единственный неметалл в IIIA-группе. Его гидроксид В(ОН)з — слабая кислота. Гидроксиды А1(ОН)з и Ga(OH)3 проявляют уже амфотерные свойства, S 1п(ОН)з и Т1(ОН) являются основаниями.
Различие в свойствах бора и алюминия очень резкое: неметалл — типичный металл. Соединения бора имеют преимущественно ковалентные химические связи, соединения алюминия — ионные. Бор не образует катионов, его первая энергия ионизации больше соответствующей энергии ионизации алюминия на 223 кДж.
Бор по своим химическим свойствам стоит гораздо ближе к кремнию, чем к адюминию (диагональная периодичность). Бор и кремний — кислотообразующие элементы (В(ОН)з и EUSiCM, их гиДРиды (ВгНб и SiH4) отличаются летучестью и склонностью к самопроизвольному воспламенению на воздухе; хлориды (ВС1з и *С14) — жидкости, легко подвергающиеся необратимому гидролизу; °°раты, как и силикаты металлов, образуют циклические и линейные структуры; бориды, как и силициды металлов, при взаимодействии кислотами, образуют гидриды.
213
В электрохимическом ряду напряжений Al, Ga, In и TI находятся левее водорода (Mg... Al..., Мп... Ga... Cd, In..., Tl... H...) среди активных металлов. Поэтому все металлы IIIA-группы энергично взаимодействуют с кислотами, не являющимися окислителями, с выделением водорода:
М + ЗН3О+ + ЗН2О = [М(Н2О)б]3+ + l,5H2f
У оксидов металлов состава М20з наблюдается заметное различие свойств при переходе от А120з к Т120з. Так, А120з и Са20з трудно восстанавливаются водородом и аммиаком до металлов, а 1п20з и Т120з при действии водорода и аммиака легко превращаются в металлы:
Т120з + ЗН2 - 2Т1 + 3H20f
1п20з + 2NH3 = 2In + N?f + 3H20f
13.1. РАСПРОСТРАНЕННОСТЬ В ПРИРОДЕ. ОСНОВНЫЕ МИНЕРАЛЫ
В свободном состоянии элементы ША-группы в природе не встречаются. Наиболее распространенным из них является алюминий, его кларк равен 7,6 % — третье место по распространенности после кислорода и кремния и первое среди металлов. Кларк бора — 2«10 3%; в своих минералах бор всегда связан с кислородом, впрочем как и остальные элементы ША-группы.
Алюминий образует в природе многочисленные алюмосиликаты, часто очень сложного состава, наиболее распространенными среди которых являются полевые шпаты, например ортоклаз K(AlSi30g). При выветривании алюмосиликатов (действие воды и СО2, перепада температур) образуется каолин A14(OH)8(Si40io), который затем распадается на бокситы и SiO2. Бокситы содержат различные формы гидратированного А12Оз[А1(ОН)з, А1О(ОН) и др. ]. Около 50 % мировых запасов бокситов сосредоточено в Австралии, 26 % —в Гане и Марокко (Африка). Важнейшим промышленным сырьем для производства А1 помимо бокситов являются нефелин (Na, К) (AlSiO4) и а л у н и т К[А1з(ОН)б(БО4)2] (см. раздел 2.6).
У нас отсутствуют высококачественные бокситы. Поэтому алюминиевая промышленность стала использовать нефелины и алуниты. При использовании нефелинов получают не только гидроксиды алюминия, но и карбонаты калия и натрия (см. раздел 12.6), портландцемент, соли рубидия и цезия, металлический галлий.
Бор находится в природе в виде боратов, очень небольшая часть которых используется для извлечения этого элемента. К ним прежде всего относятся бура Na2lB4O7]»10H2O и кернит Na2 [В4О7 ]»4Н2О. Основное количество бора добывается из различных соляных озер и отчасти и? морских вод.
Галлий, индий и таллий рассеянные элементы. Для них характерна крайняя редкость собственных минералов. Наиболее^ас-пространеннымй среди них является галлий (кларк 1,4*10
214
Галлий в качестве примеси (до 0,1 %) встречается в сфалерите ZnS. Вместе с германием он концентрируется в золе некоторых ,,гЛсй и сопровождает алюминий в его рудах — боксите и нефелине. J История открытия элементов. Соединения бора были известны с раннего средневековья. Еще в те времена буру называли «тинкал» и употребляли ее для пайки золота и серебра. Свободный бор впервые выделили Гей-Люссак и Тенар в 1808 г. по реакции
В2О3 + 6К = 2В + ЗК2О
Металлический алюминий был получен в 1825 г. Эрстедом при восстановлении безводного А1С1з амальгамой калия:
А1С1з + 3K(Hg) = Al + ЗКС1 + Hg
Существование галлия было предсказано Менделеевым, а открыт элемент в 1875 г. де Буабодраном. Существование в природе индия было доказано в 1863 г. Рейхом и Рихтером по двум синим линиям в спектре некоторых полиметаллических руд. Наконец, таллий был открыт в 1861 г. Круксом по ярко-зеленой линии в спектре отходов сернокислотного производства.
В связи с тем, что химия бора и химия алюминия резко отличаются, они рассматриваются раздельно.
Гей-Лк>ссак Жозеф Луи (1778—1850) — профессор химии, член Парижской АН, занимался изучением свойств газов, щелочных металлов, галогенов и фосфорных кислот.
Тенар Луи Жак (1777—1857) — французский профессор химии, открыл пероксид водорода, амид натрия, изучал свойства галогенов и щелочных металлов.
Эрстед Ханс (1777—1851) — датский физик, иностранный член Петербургской АН.
Рейх Фердинанд (1799—1882) — немецкий физик, металлург и менерапог.
Рихтер Иероним (1824—1898) — немецкий химик-аналитик.
Крукс Уильям (1832—1919) — английский физик и химик, активный защитник идеи единства материи.
13.2. ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА БОРА
Бор известен в виде простого вещества в двух формах: кристаллической (т. пл. 2175 °C) и аморфной. Кристаллический бор имеет несколько полиморфных модификаций черного цвета, не уступающих по твердости алмазу. Структура кристаллов бора состоит из Двадцатигранников В]2, называемых икосаэдрами.
Кристаллический бор — химически инертное вещество. Он не взаимодействует с кипящими галогеноводородными кислотами, да-с фтороводородной кислотой HF. Только нагретые концентрированные HNO3, H2SO4 и смесь (HNO3 + ЗНС1) медленно дей-СТвУЮт на бор:
В + 3HNO3 - В(ОН)з + 3NO2f
2В + 3H2SO4 - 2В(ОН)з + 3SO2f
215
В расплавах гидроксидов щелочных металлов, содержащих окислители, бор превращается в диоксобораты:
4В + 4КОН(Ж) + ЗО2 = 4КВО2 + 2Н2О|
Из галогенов только F2 реагирует с бором в обычных условиях: 2В + 3F? - 2BF3
С остальными галогенами реакции протекает при высоких температурах;
2В + 31? = 2В1з f
При нагревании выше 700 °C бор вступает в реакцию с О2, Sg и даже с водой:
2В + ЗН2О = В2О3 + 3H2f
4В + 30г = 2В20з; 2В + 3S = B2S3
Выше 1200 °C бор взаимодействует с азотом, фосфором и углеродом:
2В + N2 - 2BN; 2В + С = В4С; В + Р = ВР
восстанавливает Si и Р4 из их оксидов:
3SiO2 + 4В = 3Si + 2В2О3; ЗР4ОЮ + 20В = IOB2O3 + ЗР4
С водородом бор непосредственно не реагирует.
13.3. ПОЛУЧЕНИЕ БОРА
Аморфный бор образуется по реакциям:
г
В2О3 + 3Mg = 3MgO + 2В
K[BF41 + 3Na = KF + 3NaF + В
Для отделения бора от продуктов первой реакции полученную смесь нагревают с разбавленной хлороводородной кислотой, переводящей в раствор В2О3 в виде В(ОН)з, a Mg и MgO в виде MgC12- Бор отфильтровывают и подвергают дальнейшей очистке. Продукты второй реакции обрабатывают при нагревании водой, растворяющей все реагенты, кроме бора.
Кристаллический бор в виде мелких кристаллов выделяется на танталовой проволоке, раскаленной до 1200 °C, находящейся в газообразной среде:
2ВВгз + ЗНг ~ 2В(К) + 6HBrt
216
13.4. ХИМИЯ ВОДНЫХ РАСТВОРОВ
В водном растворе бор может присутствовать либо в виде оксо-[В4О7 1 и гидроксоанионов [В(ОН>4] , либо в виде молекул В (ОН) з, либо в виде галогеноборатных анионов [BF4 ] и др. В водном растворе при pH 4—10, кроме анионов [В (ОН) 4 Г, обнаружены чаСтицы составов 1ВзОз(ОН)4]~, [В4О5(ОН)4]~, причем анион [В (ОН) 4] присутствует преимущественно при pH < 4 и концентрации В(ОН)з меньше 1 моль/л (см. также табл. 16).
Подробнее см.: Тарасевич Б. П., Кузнецов Е. В. Усп. химии, 1987.
Т. 56. С. 353.
Катионы в водном растворе бор не образует.
Большинство соединений бора подвергается гидролизу:
ВС1з + ЗН2О - В (ОН) з1 + ЗНС1
или окислительно-восстановительным реакциям:
В2Н6 + 6Н2О - 2В(ОН)з1 + 6H2f
Соединения бора с оксоанионами немногочисленны. Гидросульфат B(HSO4)3, ацетат В(СНзСОО)з, перхлораты В(С1О4)з, В(СЮ4)гС1 и В(С1О4)С12 принадлежат к ковалентным соединениям, очень чувствительным к влаге. Их гидролиз протекает необратимо (см. раздел 10.3).
13.5. ГИДРИДЫ БОРА (БОРАНЫ)
К боранам относят соединения составов BnHn+4, ВпНп+6, где па 2. Низшие бораны В2Нб и В4Н8 и др. — газообразные вещества, воспламеняющиеся при контакте с воздухом и мгновенно реагирующие с водой. Бораны с большим числом атомов водорода — жидкие или твердые вещества, более устойчивые на воздухе. Например, декаборан (14) В10Н14 — летучее, твердое, бесцветное вещество с т. пл. 98,8 °C. Большинство боранов имеет отвратительный запах и принадлежит к ядовитым веществам.
Подробнее см.: Хьюи Дж. Неорганическая химия. — М.: Химия, 1987. С. 495; Жиган А. Ф., Стасиневич Д С. Химия гидридов. Л.: Химия, 1969. С. 138.
Бораны относят к электронодефицитным соединениям. Для образования нужного числа двухэлектронных ковалентных связей в боранах не хватает электронов. Например, в молекуле диборана В?Нб после образования трех (7-связей каждым атомом бора все валентные электроны оказываются израсходованными. В молекуле Не хватает пары электронов на образование связи В—В, в то же время молекула ВНз неизвестна (рис. 54).
Исследование структуры В2Нб показало, что связи между атомами бора осуществляются через атомы водорода, получившие название мостиковых. Четыре атома водорода, лежащих вместе с томами бора в одной плоскости (рис. 54), связаны с последними вухэлектронными Освязями, а атомы водорода, находящиеся вне
217
Рис. 54. Образование химических связей в ВгНв
плоскости, образуют с атомами бора трехцентровые двухэлектронные связи (см. раздел 5.7).
Основные химические свойства боранов отражают реакции:
В2Н6 + ЗО2 “ В2О3 +ЗН2О; В2Н6 + 6С12 = 2ВС1з + 6НС1
Бораны легко вступают в реакции замещения атомов водорода на галогены, органические радикалы, ионы CN , например
BioHu + I2 ” B10H13I + HI
Диборан получают по реакции
2Na[BH4] + H2SO4 = B2H6f + Na2SO4 + 2H2f
Реакция протекает бурно, выделяющийся диборан содержит примесь SO2. Более простой метод синтеза В2Нб передает реакция, протекающая в среде органического растворителя:
2Na[BH4] + 12 = В2НбТ + H2f +2NaI
13.6. ОКСИД И ГИДРОКСИД БОРА
Среди оксидов бора наиболее известен В20з, являющийся ангидридом борной кислоты В(ОН)з. Оксид — бесцветное кристаллическое вещество с т. пл. 450 °C и т. кип. около 2100 °C, легко переходящее при охлаждении расплава в стеклообразное состояние. В газообразном состоянии триоксид дибора состоит из одиночных молекул, имеющих V-образную структуру с линейными фрагментами —О—В—О и расстояниями О—В и В^ О, равными соответственно 136 и 120 пм.
С водой и водными растворами гидроксидов щелочных элементов оксид бора взаимодействует с выделением энергии:
В2О3(к) + ЗН2О(ж) = 2В(ОН)з(к), ДЯ°(298 К)-----58 кДж
2В20з + 2КОН + Н2О = К2[В4О5(ОН)4]
При сплавлении с КОН и оксидами металлов В20з образует диоксобораты:
В20з + 2КОН = 2КВО2 + Н2О
По окраске получаемых стеклообразных диоксоборатов («перлы
218
буры») геологи качественно определяют присутствие в минералах тех или иных оксидов металлов. Например, диоксоборат меди Си (ВО?) 2 представляет собой синее стекло.
Борная кислота В(ОН)з — бесцветное кристаллическое вещество со слоистой структурой (см. табл. 14). В каждом слое молекулы кислоты связаны между собой водородными связями, а между слоями действуют слабые межмолекулярные силы. При нагревании В(ОН)з вначале превращается в полимерный диоксоборат водорода, а затем в ВгОз:
«1 «2
В(ОН)з -» (НВОг)х -» В2О3, t2 > t\
Б воде В(ОН)з малорастворима и в разбавленном растворе является слабой одноосновной кислотой (Кк=5,8*10 1 , 298 К, см. табл. 16). В процессе протолиза происходит присоединение молекулы воды к растворенной молекуле В(ОН)з, а затем быстрое удаление из присоединившейся молекулы воды протона:
н+
!B(HiO)(OH)3] + Н2О. ' [В(ОН)4] + н3о+
С увеличением концентрации В(ОН)з (>0,03 М) в растворе анионы [В(ОН)4] превращаются в более сложные частицы, например, состава [ВзОз(ОН)4] .
Атомы водорода В(ОН)з не подвергаются ступенчатому замещению на атомы металлов. Например, неизвестны анионы Н2ВО3 и НВО|~. Мономерный анион ВО^~ у подавляющего числа боратов металлов не обнаружен. Он легко подвергается полимеризации из-за наличия у бора вакантной p-АО и значительного заряда на атомах кислорода. Пока установлено, что триоксобораты образуются при сплавлении В2О3 с Ы2СО3 и нагревании В2О3 в автоклаве с Са(ОН)2:
ЗЫгСОз + В2О3 - 21лзВОз + 3CO2f
ЗСа(ОН)г + В2О3 ” Саз(ВОз)г + ЗНгО
Известны также бораты составов Мз(ВОз)г, где М = Mg, Ba, Cd, Со, и МВОз, где М = Al, Sc, In, Y, Fe, La.
Действие водных растворов КОН или NaOH на В(ОН)з отражают две реакции:
В(ОН)з + КОН. ' К[В(ОН)4] 4В(ОН)з + 2КОН. ' К2[В4О5(ОН)4] + 5Н2О
При сплавлении КОН и В(ОН)з образуются полимерные диоксобо-Раты, содержащие циклические анионы (ВзОбГ или бесконечные Чепи (ВО2)Г:
хВ(ОН)з + хКОН = (КВО2)х + 2хН2О
Со спиртами В(ОН)з дает в присутствии H2SO4 легко летучие
219
эфиры, сгорающие бледно-зеленым пламенем (качественная реакция обнаружения бора):
В(ОН)з + ЗСНзОН = В(ОСНз)зГ+ЗН2О 2В(ОСНз)з + 90г = В2О3 + 6С0г! + 9Н2О
Получают В(ОН)з по реакциям:
ВС1з + ЗН2О = В(0Н)з1 + 4НС1
Na2(B4O7] + H2SO4 + 5Н2О = 4В(ОН)з + Na2SO4
Образующаяся при дегидратации В(ОН)з метаборная кислота НВО2 существует в трех кристаллических модификациях: кубической, моноклинной и ромбической (см. раздел 6.3). Наиболее устойчивая кубическая модификация имеет каркасную структуру, состоящую из тетраэдров В04, связанных водородными связями (см. раздел 6.2). Моноклинная модификация состоит из цепей состава [ВзО4(ОН)з], а ромбическая построена из молекул [ВзОз(ОН)з], объединенных в слои водородными связями (см. раздел 6.2). В газообразном состоянии одиночная молекула НВО2 почти линейна: Н—О—В^О.
13.7. БОРАТЫ МЕТАЛЛОВ
Соли борной кислоты — бораты металлов образуют, как и силикаты, сложные цепные и плоские циклические структуры (рис. 55, см. также рис. 53). Тример (КВО2)з имеет плоскую циклическую конфигурацию, в которой атомы объединены как О- так и Л-связями (рис. 55). Однако при такой двоесвязанности полного перехода отрицательного заряда от атомов кислорода к атомам бора не происходит. Электроны связей внутри тримерного аниона равномерно распределяются между всеми его атомами.
Кристаллы диоксоборатов могут состоять и из бесконечных линейных цепей, например у Са(ВО2)2 (рис. 55).
Тетрабораты и полимерные диоксобораты щелочных металлов подвергаются сильному гидролизу. Механизм гидролиза является
Са(ВО2)2
Рис. SS. Структуры тримера диоксобората калия и диоксобората кальция
220
сложным ввиду полимерного характера боратов. Предполагают, что полимерные диоксобораты вначале распадаются на мономерные анионы ВОг, которые затем участвуют в протолизе:
ВО2 + Н2О. ' НВО2 + ОН-
причем образующаяся метаборная кислота НВОг тотчас же присоединяет молекулу воды и превращается в борную кислоту В(ОН)з.
Анион [В4О5(ОН)4]2 (см. рис. 53) при гидролизе вначале распадается на В(ОН)з и мономерные бораты, после чего анионы В02 подвергаются протолизу, как было указано выше:
[В4О5(ОН)4]2- + Н20 = 2В(ОН)з + 2ВОг
Тетраборат, метаборат натрия и В(ОН)з взаимодействуют с Н2О2 с образованием гексагидрата бис-(«-пероксодигидроксобората) натрия:
2NaBO2 + 2НгОг + 6Н2О w Na2[(OH)2B(O2)2B(OH)2]’6H2O, Ля° (298 К)---------------------107 кДж
Это вещество — бесцветные кристаллы триклинной сингонии с т. пл. 65 °C, малорастворимое в воде и частично в водном растворе распадающееся:
[(ОН)2В(О2)2В(ОН)212\ ' 2[В(ОН)4]- + 2Н2О2
Подробнее см.: Вольнов И. И. Пероксобораты. — М.: Наука, 1984.
13.8. ГАЛОГЕНИДЫ БОРА
Известны газообразные BF3 и ВС1з, жидкий ВВгз и кристаллический BI3. Молекулы этих соединений имеют плоское строение.
Получены галогениды B2CI9, Вг(На1)4, В4(На1)4 и Bg(Hal)8, где Hals F, Cl, Вг или I.
Галогениды бора подвергаются полному гидролизу, например:
ВВгз + ЗН2О - В(ОН)з1 +ЗНВг
причем на В1з вода действует со взрывом. Гидролиз BF3 осложняется образованием H[BF4] — сильной одноосновной кислоты:
BF3 + ЗН2О = В(ОН)з + HF; BF3 + HF. ’ H[BF4]
Последняя реакция протекает только в водном растворе, ВРз<г) и ”Г(ж) не взаимодействуют из-за отсутствия фторид-ионов, необходимых для образования о-связей с бором по донорно-акцепторному механизму. Получение H[BF4] возможно и при помощи Реакции
В(ОН)з + 4HF = НзО+ + [BF4]- + 2Н2О
УуТРзфторобораты калия, рубидия и цезия, как и тетраоксохлораты И) тех же элементов, малорастворимы в воде.
221
13.9. БОРИДЫ МЕТАЛЛОВ
Продукты взаимодействия бора с металлами — бориды металлов, как правило, нестехиометрические соединения сложного строения, не отвечающего обычным представлениям о двухэлектронной связи.
Состав и структура боридов могут быть самыми разнообразными: включать, например, изолированные атомы бора, полностью окруженные атомами металла (ВедВ, ЬПзВ, RhiB); простые цепи из атомов бора (CrB, NbB, TiB); двойные цепи (СгзВд, ЫЬзВд, ТазВ4); слои (AIB2, CrB2, MgB2) и трехмерную систему связей В—В (СаВб, ZrBu, ЬаВд).
Подробнее см.: Уэллс А. Структурная неорганическая химия. — М.: Мир, 1988. Т. 3. С. 174.
Бориды различаются по физико-химическим свойствам. Бориды ^-элементов с небольшим содержанием бора (MgB2> разлагаются не только кислотами, но и водой с образованием боранов. Бориды р-и d-элементов — химически инертные соединения, например, на А1Вг кислоты не действуют. У ряда боридов значения электрической проводимости и теплопроводности больше, чем у самих металлов. Некоторые бориды d-элементов имеют очень высокие температуры плавления. Так, у HfB2 т. пл. 3250 °C, а у ТаВг т. пл. 3200 °C.
13.10. ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА АЛЮМИНИЯ
Алюминий — серебристо-белый металл с т. пл. 660 °C и т. кип. 2520 °C, обладающий пластичностью, ковкостью и тягучестью. После серебра и меди алюминий — лучший проводник теплоты и электричества. На воздухе алюминий устойчив из-за способности поверхности металла подвергаться пассивированию. В обычных условиях в концентрированных H2SO4 и HNO3 поверхность А1 также становится химически инертной, что позволяет производить транспортировку и хранение HNO3 в алюминиевых цистернах и баках.
Пассивирование — изменение состояния поверхности металла, связанное как с внедрением атомов кислорода в приповерхностный слой металла, так и с образованием мономолекулярного слоя Ог или различных твердых фаз на поверхности.
Если предотвратить процесс пассивирования, то А1 приобретает свою естественную высокую химическую активность. В частности, амальгамированная поверхность А1 не подвергается пассивированию и легко взаимодействует с Ог и НгО воздуха, постепенно разрушаясь с образованием белой, очень пушистой волокнистой массы, состоящей из А1(ОН)з и АЮ(ОН):
4(А1, Hg)+3O2+6H2O=4Al(OH)3+(Hg)
Алюминий взаимодействует со всеми галогеноводородными кислотами, а с HF(r) даже в отсутствие воды:
2A1+6HF (г) =2A1F3+3H2 f
Общий вид ионного уравнения реакции взаимодействия А1 с разбавленными кислотами, кроме HNO3:
222
2А1+6Нз0++6Н2О2 [Al (Н20) 6 ]3++ЗН21
С разбавленной (2—3 М) HNO3 при нагревании А1 реагирует с образованием А1(ЫОз)з и NH4NO3:
8А1+30 HNO3=8A1(NO3)3+3NH4NO3+9H2O
В этих условиях N(V) может восстанавливаться не только до N но и до NO, NO2 и N2O. Последние три газа всегда в виде примесей выделяются из раствора в ходе реакции.
С водными растворами КОН алюминий взаимодействует с образованием гидроксоалюминатов:
2А1+6КОН+6Н2О= 2Кз [А1(0Н)6 J+3H2f
Порошкообразный А1 загорается на воздухе при внесении его в пламя с выделением большого количества энергии:
4А1(К)+ЗО2(г)=2А12Оз(к), Д//° (298 К)=—3351 кДж
Смесь из 75% алюминиевого порошка и 25% РезОд называют термитом и применяли раньше для сварки рельсов (температура горения такой смеси около 2400 °C).
Алюминий горит в среде галогенов с образованием соответствующих галогенидов (А1С1з, АИз и др.), взаимодействует при нагревании с серой (AI2S3), азотом (A1N) и углеродом (AI4C3).
Алюминий восстанавливает многие металлы из их оксидов, например:
t t
Сг20з+ 2А1= 2Сг+А1гОз; 3ZrO2+4Al= 32г+2А1гОз
Со многими металлами А1 образует сплавы.
13.11. ПОЛУЧЕНИЕ АЛЮМИНИЯ
Промышленный метод получения алюминия — электролиз расплава Na3[AlF6], содержащего растворенный AI2O3. Гексафтороалюминат натрия понижает температуру расплава до 950—990 °C и обеспечивает его электрическую проводимость. Сложные реакции, протекающие на электродах, условно можно передать уравнениями:
анод (уголь) (+): AI2Q3—6<Г=2А13++1,50г t
катод (уголь) (—): Аг +6е =2А1(Ж)
Выделяющийся кислород окисляет угольный анод до СО и СОг. Анод постепенно выгорает и поэтому в процессе электролиза непрерывно восстанавливается добавлением специальной анодной массы. Сила тока в электролизере достигает 80—150 кА при напряжении В. Производство А1 — энергетически емкий процесс. Добавление к электролиту LiF, LiCl позволяет повысить производительность электролизеров, снизить расход электроэнергии, анодной массы, понизить температуру расплава электролита, что равнозначно сгро-тельству новых цехов.
223
13.12. ХИМИЯ ВОДНЫХ РАСТВОРОВ
В водном растворе ионы алюминия находятся только в виде аквакатионов [А1(НгО)б] , проявляющих свойства катионной кислоты:
[А1(Н2О)б]3++Н2О^=^ НзО++[А1(Н2О)5ОН ]2+
Для этого протолитического равновесия константа кислотности Кк = 1,1*10 5 моль/л. Образующиеся при протолизе катионы гид-роксопентаакваалюминия [А1(НгО)5(ОН) ]2+ подвергаются полимеризации с образованием более сложных ионов состава: [А12(Н2О)8(ОН)2] , [А18(ОН)20Г и др. В присутствии гидроксидионов ОН аквакатионы превращаются в анионы [А1(ОН)б]3 .
13.13. ОКСИДЫ И ГИДРОКСИДЫ
Алюминий образует оксид состава AI2O3 и два гидроксида: гид-роксид-оксид алюминия или метагидроксид АЮ(ОЙ) и гидроксид А1(ОН)з (см. табл. 14).
Аморфный триоксид диалюминия AI2O3 образуется при горении в атмосфере кислорода металла, при нагревании А1(ОН)з, АЮ(ОН) или влажного А1(СНзСОО)з:
2А1(СН3СОО)з+ЗН2О=А12Оз+бСНзСООНт
Аморфный AI2O3 обладает амфотерным характером, взаимодействует с кислотами и основаниями:
А12Оз+бН3О++ЗН2О=21А1 (Н2О) 6 ]3+ А12Оз+бОН“+ЗН2О=2 [А1 (ОН) 6 ]3~
При прокаливании А1(ОН)з, АЮ(ОН) или аморфного AI2O3 выше 400—600 °C образуется кристаллическая у-модификация А120з, которая выше 1000 °C переходит в «-AI2O3 (корунд); т. пл. (Z-AI2O3 равна 2050 °C. Эта же модификация может быть получена при прокаливании сульфата алюминия-аммония до 1200 °C:
2NH4Al(SO4)2=A12O3+2NH3t +4SO3t +Н2О
Всего у AI2O3 известно пять полиморфных модификаций a, fl, у, <5 и Е) (см. раздел 6.3).
Кристаллический AI2O3 (табл. 14) уже не способен взаимодействовать ни с кислотами, ни с основаниями. Видимо, при переходе аморфной модификации в кристаллическую на поверхности частиц AI2O3 исчезают химически активные центры или очаги реакции, которыми могут быть места с дефектами структуры, места со слабыми химическими связями А1—О. С C-AI2O3 взаимодействует только HF(r) и BF3(r), превращая оксид при 200—400 °C в AIF3.
Гидроксид А1(ОН)з и метагидроксид А1О(ОН), как и AI2O3, — малорастворимые в воде, бесцветные, мелкокристаллические вещества амфотерного характера:
224
А1(ОН)з+ЗОН‘.-- - [АКОЮб!3-
Al (ОН)з+ЗНМОз=А1 (NO3) 3+ЗНгО
Условия получения гидроксидов различны. Гидроксид состава д|(ОН)з выделяется в виде мелкокристаллического осадка только при разложении гидроксоалюмината в обычных условиях:
[А1(ОН)6]3~+ЗСО2=А1(ОН)з; +ЗНСО5
При добавлении к растворам солей алюминия водного раствора аммиака выпадают белые гелеобразные осадки переменного состава АЬОз^-хНгО. Если же осаждение гидроксида производить водным раствором аммиака при нагревании, то образуется кристаллический метагидроксид:
А1С1з+ЗМНз+2Н2О= АЮ(ОН) 4 +3NH4C1
Метагидроксид осаждается также при взаимодействии солей алюминия с К2СО3 или КагСОз при нагревании:
2А1(МОз)з+ЗК2СОз+Н2О= 2А10(0Н) | +6KNC>3+3CO2t
При использовании КОН или NaOH вначале наблюдается осаждение АЬОз^хНгО, а затем происходит его превращение в растворимые гидроксоалюминаты:
А1С1з+ЗКОН=А1(ОН)з1 +ЗКС1; А1(ОН)з+ЗКОН=Кз(А1(ОН)б]
13.14. ГАЛОГЕНИДЫ АЛЮМИНИЯ
Известны все галогениды: AIF3, А1С1з, А1Вгз и АПз в виде бесцветных кристаллических веществ, возгоняющихся при нагревании, например, т. субл. AIF3 1279 °C; т. субл. AICI3 181 °C. Структура одиночных молекул — плоская, треугольная (sp -гибридизация) (см. раздел 5.3), как у галогенидов бора. В парообразном состоянии хлориды, бромиды и иодиды алюминия образуют димеры, имеющие конфигурацию сдвоенных по ребру тетраэдров (см. рис. 10). Образование димеров можно объяснить стремлением атомов AL имеющих вакантную p-АО, к завершению октета электронов: ns пр . Галогениды алюминия подвергаются обратимому протолизу
1А1(Н2О)б]3++Н2О = НзО++1А1(Н2О)5ОН |2+
продуктами которого могут быть в зависимости от концентрации аквакатионов и температуры частицы различной сложности (см. Раздел 13.12).
Галогениды получают по следующим уравнениям реакций:
ссц
2А1(К)+312(к) = 2А11з(р)
А1(ОН)з+ЗНВг=А1Вгз+ЗН2О
2А1+6НС1=2А1С1з+ЗН21
8.
«258
225
Фторид алюминия AIF3, полученный в реакциях без участия воды
А1гОз+6НР(г)= 2А1Рз(к)+ЗН2О 2Al(K)+6HF(r)“2AlF3(K)+3H2 f
не растворяется в воде, гидролизу не подвергается, с кислотами и основаниями не взаимодействует.
13.15. ПРИМЕНЕНИЕ
Элементы ША-группы и их соединения — компоненты многих современных материалов, крайне необходимых народному хозяйству и оборонной технике. Алюминий — основа легких сплавов, его применяют для производства различных емкостей и аппаратов, фольги и проволоки, используют в качестве раскислителя стали, восстановителя в алюмотермии, для производства кабелей. Бор — компонент жаропрочных и коррозионностойких сплавов, боропластиков, полупроводниковых материалов.
Оксиды боры и алюминия применяют в электроизоляционных огнеупорах, диэлектриках и конденсаторах, материалах высокочастотной техники, в производстве специальных стекол, керамики, эмали, глазурей, огнестойких покрытий. Корунд и /J-BN служат абразивными материалами, а /З-BN идет еще на изготовление резцов, свёрл для скоростной обработки стали и чугуна.
Перборат натрия НаВОг^НгОг’ЗНгО находит широкое применение в производстве моющих средств, в текстильной промышленности для отбеливания шерсти, шелка, в косметике — для обесцвечивания волос, в медицине — в качестве дезинфицирующего средства.
Нитрид и оксид алюминия — основа огнеупорных материалов для тиглей, футеровки ванн электролизеров, для металлургических и электрических печей. Оба вещества используют в качестве коррозионностойких и износостойких покрытий стали и чугуна. Корунд — термостойкий материал, применяемый в производстве специальной керамики, тиглей и лодочек. Монокристалл корунда, содержащий примесь хрома, называют рубином. Примеси Fe и Ti придают корунду синий цвет. Такой материал называют сапфиром. Рубиновые и сапфировые монокристаллы являются рабочими телами твердотельных лазерных установок, опорными камнями часовых механизмов, ювелирными изделиями, их нитевидные кристаллы применяют для армирования А1 и Ag. Оксид алюминия — адсорбент, основа катализаторов, а оксид бора и борная кислота — антисептики и фунгициды.
Карбид бора — материал, который используют для изготовления шлифовальных порошков, a -BN — компонент термостойких волокон и сухих смазок для подшипников.
Нитриды алюминия и бора применяют в качестве армирующих волокон при изготовлении композиционных материалов (композитов) с полимерной (боропластики) и металлической матрицами.
226
Галогениды алюминия — катализаторы хлорирования, бромирования и иодирования, алкилирования и изомеризации в органическом синтезе. Гидрид алюминия — компонент твердого ракетного топлива.
Сульфат алюминия — реагент для осветления и обесцвечивания воды, протрава при крашении тканей.
13.16. токсикология
Бораны являются нервно-паралитическими ядами. При попадании на кожу или при вдыхании самых незначительных их количеств они вызывают головную боль, тошноту, слабость и судороги. Таллий и его соединения по характеру действия напоминают мышьяк. Они поражают нервную систему, пищеварительный тракт и почки. В медицине солями таллия пользуются для удаления волос.
Газообразные галогениды бора, пыль алюминия и его оксида поражают главным образом легкие и слизистые оболочки глаз, носа и рта.
Смертельная доза при отравлении тетраборатом натрия Na2(B4O7)’10H2O и борной кислотой В(ОН)з для взрослого человека 15—20 г. Действие аэрозоля этих веществ приводит к снижению половой активности.
Аэрозоли боридов металлов поражают органы дыхания, вызывают нарушение координации движений.
Соединения индия, попадая в человеческий организм, разрушают зубы, вызывают желудочно-кишечные расстройства.
Упражнения к главе 13
1. Объясните образование димера А12С|6; чем его структура отличается от структуры мономера?
2. Можно ли получить АП3 взаимодействием алюминия с иодом?
3- Какое природное сырье применяют для промышленного производства бора и его соединений?
4. По каким химическим свойствам бор напоминает кремнии, а алюминий бериллий?
3- Можно ли ожидать выделение водорода, если в водный Раствор КОН ввести металлический алюминий?
6- Предложите методы получения кристаллических А1(ОН)3
7- Как протекает гидролиз галогенидов бора? При гидролизе какого галогенида бора образуется побочный продукт?
"• С помощью каких реакций получают аморфный бор?
’•В каких условиях бор будет взаимодействовать с расплавом КОН?
г Как протекают реакции нейтрализации борной кислоты Ароксидами щелочных металлов?
' \ Опишите структуру диборана и
"ij* ® его молекуле.
«. • Можно ли смешать диборан с воздухом
“ с°суде с водой?
Опишите промышленный метод получения алюминия.
характер
химических
его в 13.
и хранить
8*
ГЛАВА 14. ХИМИЯ ЭЛЕМЕНТОВ IVA-ГРУППЫ
В IVA-группу входят углерод С, кремний Si, германий Ge, олово Sn и свинец РЬ. Электронная конфигурация невозбужденных атомов элементов: ns пр* (валентные электроны), причем на p-АО находятся два неспаренных электрона (правило Гунда):
В своих соединениях элементы IVA-группы имеют, как правило, две степени окисления: (+11) или (+IV). Устойчивость соединений со степенью окисления (+11) увеличивается от С к РЬ, что подтверждается, в частности, изменением энергии Гиббса в реакциях восстановления диоксидов:
GeO2(K)+Ge(K)=2GeO(K); AG0 (298 К) =+41 кДж
SnO2(K)+Sn(K)=2SnO(K); AG0 (298 К) =+6 кДж
РЬО2(к)+РЬ(к)«2РЬО(к>; AG0 (298 К) = —158 кДж
Из значений А(7О (298 К) следует, что соединения Ge(II) должны быть сильными восстановителями, а соединения Pb(IV) — сильными окислителями (РЬОг, РЬСЦ и др.).
Углерод образует, как правило, ковалентные связи, по-разному ориентированные в пространстве: к вершинам тетраэдра или треугольника ~С ' (COF2, (НгЮгСО, CCI2O, НСООН) или линейно С (СО2, CS2, С3О2), =sC— (Н2С2, HCN).
При переходе от соединений углерода к соединениям свинца возрастает полярность связей, и в кристаллах солей типа Pb(NO3)2, PbCh и других уже присутствуют ионы РЬ2 . Однако почти все вещества, содержащие Sn(IV) и Pb(IV), являются ковалентными. Ионы С4+ в соединениях углерода не обнаружены, но ионы (с условным зарядом) с обнаружены в кристаллах метанидов (АЦСз), а ионы С$~ — в кристаллах ацетиленидов (СаСг, Ag2C2 и др.).
Углерод проявляет ярко выраженную способность к образованию цепей из атомов, а также кратных рЛ—рД-связсй (НС^СН, О—С—О, С-^О). Склонность к образованию цепей из атомов уменьшается в ряду: C»Si>Ge~Sn»Pb. Для свинца соединения со связями —РЬ—РЬ— неизвестны. Энергия связей —С—С— равна 347 кДж/моль, а связей —Si—Si— значительно меньше: 226 кДж/моль. Связи —Si—Si— обнаружены в гидридах (силанах) SinH2n+2 и галогенидах SinHal2n+2(Hal=F, Cl, Вг и I), где число п достигает 10. Соединения кремния с цепями —Si—Si— неустойчивы при нагревании, воздействии Ог и НгО. Силаны SinH2n+2 разлагаются уже в присутствии следов влаги;
SiH4+2H2O=SiO2l + 4Н21
228
Образующиеся новые связи —Si—О—Si— являются более прочными: энергия связи Si—О равна 466 кДж/моль. У кремния в дополнение
I а а
к срсвязям с О и N появляются еще и dn—рп-сьязя: —Si—О—Si—.
Связи Ge—Ge обнаружены только у гидридов. Цепи —Sn—Sn— известны у многочисленных полимерных металлорганических соединений состава (R2Sn)n, где R — алкилы (СНз, С2Н5 и др.), значение и=10—20.
Структуры ковалентных соединений элементов IVA-группы являются преимущественно тетраэдрическими и октаэдрическим (см. также табл. 14), но могут быть и линейными (СОг) и плоскими треугольными (СО i-, CCI2O). Элементы IVA-группы в степени окисления (+IV) образуют слабые кислоты (Н2СО3, H4SiO4, Нг[Се(ОН)б], Нг[8п(ОН)б1 и Нг[РЬ(ОН)б]), а в степени окисления (+11) — малорастворимые основания составов Sn6O4(OH)4, РЬбО4(ОН)4, проявляющие амфотерные свойства.
Устойчивость гидридов резко падает от метана СН4 (AjG° (298 К) =—51 кДж/моль) к плюмбану РЬЩ. Уже моносилан SiH4 является эндотермическим соединением (А/7° (298 К) = = + 57 кДж/моль). Гидролиз всех тетрагалогенидов термодинамически возможен:
СС14+2Н2О(ж)=СО2Г +4НС1<р); АС° (298 К)—380 кДж
SiC14(«)+2H2O(«)=SiO2l +4HCl(pj; Аб° (298 К)—287 кДж
Однако ССЦ не взаимодействует с водой из-за стерических затруднений (см. раздел 10.3).
14.1. РАСПРОСТРАНЕННОСТЬ В ПРИРОДЕ. ОСНОВНЫЕ МИНЕРАЛЫ
Кремний после кислорода — самый распространенный элемент (кларк 27,6%), углерод менее распространен (кларк 0,14%). Основные запасы углерода сосредоточены в карбонатах: кальците СаСОз, доломите MgCOa’CaCOa, магнезите MgCOs- Разновидность кальцита — мел, мрамор и известняк всем хорошо известны. Кремний входит в состав многочисленных горных пород (силикаты, алюмосиликаты), в больших количествах находится в земной коре в виде SiO2 (горный хрусталь, опал, агат, яшма, халцедон и др.). Запасы олова и свинца в земной коре довольно ограничены. Важнейшей и почти единственной РУДой для получения олова является касситерит (оловянный кДмень) БпОг. Наиболее распространенным минералом свинца является галенит PbS. Галенит содержит до 0,1 % Ag. Значитель-я Доля мировой добычи серебра связана с переработкой этого НеРала. Для получения свинца наибольшее практическое значение
229
имеют полиметаллические сульфидные и смешанные руды, содержащие помимо РЬ еще и Zn, Си и Fe.
Германий — рассеянный элемент (кларк 6» 10 4%), своих минералов он не образует, всегда , сопровождает кремний в его минералах (радиусы атомов Si и Ge очень близки) и концентрируется в каменных углях (до 0,01%).
В свободном виде в природе встречается только углерод (а л-мазы, графит, карбины) и олово в виде серебристо-желтых кристаллов, включающих Au, Pt, Os, Ir и Сц. Углерод является составной частью ископаемых углей (антрациты, каменные и бурые угли, торф), нефти, озокерита (горного воска) и асфальта.
История открытия элементов. Углерод в виде угля и сажи, алмазов и графита известен человечеству с незапамятных времен. Название «углерод» впервые появилось в книге де Морво, Лавуазье, Бертолле и Фуркруа «Метод химической номенклатуры». Природные соединения кремния (кварц, горный хрусталь и др.) также давно известны, но кремний удалось получить только в 1823 г. Берцелиусу при взаимодействии паров SiF4 и калия: SiF4+4K“Si+4KF. Существование германия было предсказано Менделеевым в 1871 г. (экасилиций), а в виде простого вещества он получен в 1886 г. Винклером. Олово и свинец были известны за 3000—2000 лет до н. э., но вплоть до XVII в. олово и свинец почти не отличали друг от друга.
Берцмиус Йене Якоб (1779—1848) — шведский профессор химии, член Шведской АН, врач по образованию, ввел символы элементов, открыл Се, Se, Th, выделил в свободном состоянии Ti, Та и Zr, внес большой вклад в развитие химической атомистики Дальтона.
14.2. ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА УГЛЕРОДА, КРЕМНИЯ И ГЕРМАНИЯ
Углерод, кремний и германий имеют несколько аллотропных модификаций, одной из которых является модификация с атомной кристаллической решеткой типа алмаза. Алмаз — метастабильная модификация углерода. В его кристаллах каждый атом углерода окружен четырьмя точно такими же атомами, располагающимися в вершинах правильного тетраэдра. Кристаллическая решетка другой стабильной в обычных условиях аллотропной модификации углерода — графита, является слоистой, составленной из шестйчленных бесконечных колец (рис. 56, см. также табл. 14). Кристаллическую решетку графита можно считать переходной между молекулярной и металлической решетками. Кристаллическая решетка третьей аллотропной модификации углерода — карбина состоит из линейных цепей Н—(С.^С—С=гС)иН (а-карбин) или На (С—С—ОиНг Ф~ карбин)', расстояние между которыми меньше, чем между слоями графита, за счет более сильного межмолекулярного взаимодействия.
Подробнее см.: СтанкевичИ. В., НикеровМ. В., Бочвар Д. А. Усп. химии, 1984, Т. 53. С. 101.
Карбин образует белого цвета кристаллы. У углерода допускают существование еще двух, мало изученных модификаций: металли-
230
Рис. 56. Фрагмент кристаллической решетки графита (а) и схема роста алмазов на границе жидкой и твердой фаз (б)
ческого углерода (углерод III) и углерода Се. При очень больших давлениях (~ 10 ГПА) Si и Ge переходят в металлическое состояние, образуя кристаллы такого же типа, как у белого олова.
Графит под давлением 12 МПа плавится при 3750 °C, образуя вязкую полимерную жидкость. Кремний имеет т. пл. 1415 °C, а германий плавится при 937 °C.
Химическая активность возрастает от углерода (графит) к германию, а среди аллотропных модификаций углерода наименее химически активен алмаз. При пропускании водяного пара через сильно нагретые С, Si или Ge можно наблюдать реакции:
С+Н2ОСО t +Нг t ; Si+2H2O=SiO2+2H21
В кислороде при высоких температурах С, Si и Ge сгорают с образованием оксидов: СО, СОг, SiO2 и СеОг.
С водородом С, Si и Ge непосредственно не взаимодействуют, а с N2 вступает в реакцию только Si с образованием выше 1300 °C белого вещества состава тетранитрида трикремния S13N4. Кремний в отличие от германия может взаимодействовать с углеродом около *000 С с образованием карбида кремния SiC — химически инертного вещества, по твердости уступающего только алмазу.
На углерод и кремний азотная, серная, хлорная и галогенводо-Родные кислоты в обычных условиях не действуют. Смеси HNO3+KCIO3, HNO3+K2Cr2O7 превращают углерод при нагревании бензолгексакарбоновую кислоту Сб(СООН)ь; продуктом взаимодействия смеси HNO3+HF с Si является гексафторосиликат водорода:
231
Si+4HNO3“SiO2+4NO2t +2H2O
SiO2+4HF-=SiF4 f +2НгО
SiF4+2HF. * H2[SiF6]
В присутствии порошка меди кремний взаимодействует с безводным НС1:
250"С
Si+3HCl(r) = SiHCl31 +Н21
Эта реакция используется для промышленного получения трихлорсилана.
Аморфный углерод (например, древесный или активированный уголь) более химически активен. Азотная кислота HNO3 (конц.) окисляет его до СО2:
C+4HNO3=CO2f +4NO2f +2Н2О
В HNO3 (9—11 М) Ge подвергается пассированию, но при нагревании медленно взаимодействует:
Ge+4HNO3“H2GeO3+4NO2t+Н2О
Аналогично протекает реакция при нагревании и с H2SO4 (конц.):
Ge+2H2SO4=H2GeO3+2SO2t +Н2О
Более энергично действуют на Ge водные растворы Н2О2 и HF:
Ge+2H2O2=H2GeO3+H2O; Ge+6HF=H2 [GeFe ]+2Н21
Расплавы и водные растворы КОН и NaOH взаимодействуют только с Si:
Si + 4КОН = K4SiO4 + 2Н21
В отличие от Р4, Sg и Ch кремний в щелочной среде не подвергается реакции диспропорционирования. На Ge растворы и расплавы КОН и NaOH действуют только в присутствии окислителя:
Ge + 2КОН + 2Н2О2 = КгСеОз + ЗН2О
При высокой концентрации ОН~-ионов (pH > 11) в растворе появляются анионы [Ge (ОН) 6 Г .
Реакции углерода с галогенами протекают только при нагревании. С фтором углерод образует продукты состава CFn, где и г 1 (CF, C2F6, CF4 и др.), с другими галогенами — тетрагалогениды, устойчивость которых уменьшается от CF4 к С14.
Фториды углерода — инертные вещества с очень слабым межмолекулярным взаимодействием, что делает их похожими на благородные газы. Твердый (CF)n близок по строению к графиту, а политетрафторэтилен содержит цепи —CF2—CF2—CF2— спиральной конфигурации (фторопласт, тефлон) и также химически инертен, как и мономерные фторуглероды.
232
Ha Si и Ge фтор действует уже в обычных условиях: Si + 2F2 = = SiF4 f (или GeF4>. Рассматриваемые простые вещества образуют с Sb и ее парами дисульфиды:
4С + S8 = 4CS2; 4Ge + S8 = 4GeS2
а при нагревании с металлами — многочисленные карбиды, силициды и германиды.
14.3. ПОЛУЧЕНИЕ АЛМАЗОВ, КРЕМНИЯ И ГЕРМАНИЯ
Искусственное получение алмазов основано на использовании главным образом двух методов: превращении графита в алмаз в системе металл — графит и выращивание алмазов на затравках из газовой фазы. В первом методе при давлении порядка 4,0 ГПа и 1200 °C графит растворяется в жидком металле-катализаторе (Ni, Мп, Fe, Rh и др.), а затем кристаллизуется из последнего на границе раздела твердой и жидкой фаз в виде алмаза, который менее растворим в жидком металле, чем графит (см. рис. 56). Кристаллизации алмаза способствуют находящиеся в расплаве коллоидные частицы графита. Таким способом получены алмазы с линейным размером около 1 мм и массой не более 0,1 г.
Подробнее см.: Федосеев Д В., Дерягин Б. ^.//Природа, 3, 80. 1983; Калашников Я. А.//Природа, 3, 1980.
Для увеличения размеров алмазов прибегают к разложению углеводородов на поверхности небольшого затравочного кристалла алмаза: СН4г-С + 2Н2|. Выделяющийся углерод достраивает кристаллическую решетку алмаза-затравки, увеличивая его размеры. Образование кристаллов графита на поверхности алмаза в этом случае затруднено, так как атомы углерода должны расположиться в ином порядке, не согласующемся с расположением атомов в кристалле алмаза. Параметры реакции: 13—133 Па, 1000—1200 °C.
Мелкокристаллический кремний, загрязненный различными примесями, получают из диоксида восстановлением его Mg, Al • или С. Например, SiCh + 2Mg “ Si + 2MgO. Реакция протекает очень бурно, избытка Mg избегают из-за возможного образования Mg2Si: Для выделения Si из реакционной смеси последнюю сначала обрабатывают хлороводородной кислотой, извлекающей в раствор MgO и Mg в виде MgCh, а затем фтороводородной HF, взаимодействующей с остатком SiOa:
SiO2 + 4HF = SiF4 f + 2H2O
Часто получают не кремний, а твердый раствор (сплав) железа в кремнии, ферросилиций FexSiy, необходимый для получения железа и стали определенных марок:
SiO2 + Fe + С = (Fe, Si) + СО21
Почти все количество особо чистого кремния, применяемого в
233
полупроводниковой технике, производят с использованием следующих реакций:
1000" С 700°С
Sil4 = Si + 2l2t;SiH4 = Si + 2H2t
SiCl4 + 2Zn 95= ° Si + 2ZnCh t; SiHCl3 + Нг' Si + 3HC11 1000°C
SiCl4 + 2H2 = Si + 4HClf
Разложение Sil4 происходит на танталовой спирали. Восстановление SiCl4 цинком интересно в том отношении, что цинк не образует с Si соединений и почти нерастворим в нем. Кроме того, Zn и ZnCh в условиях реакции находятся в газообразном состоянии и легко удаляются из реактора, в котором остается только чистый кремний. Металлический Ge получают восстановлением диоксида:
650°С
GeO2 + 2Нг = Ge + 2Н2О
14.4. ОКСИДЫ
Известно несколько оксидов углерода (СО, СОг, С3О2) и по два оксида у кремния и германия (SiO, GeO, SiO2 и GeO2).
Монооксид углерода СО — газообразное вещество, более легкое, чем воздух. Молекула :СнеО: содержит активную пару электронов у атома углерода (см. раздел 5.7). Энергия разрыва химических связей в молекуле СО больше, чем у всех других известных бинарных соединений; больше, например, чем у молекулы азота, она равна 1070 кДж/моль. В воде СО мало растворим и с водой в обычных условиях не взаимодействует. На воздухе СО воспламеняется только выше 700 °C: 2СО + Ог - 2С0г. Реакция диспропорционирования (см. раздел 33.3): 2СО^='С + СОг заметно протекает выше 500 °C, при температуре выше 1100 °C ее равновесие смещается влево. Поэтому нельзя пропускать газы, содержащие СО, через трубопроводы, нагретые до 500 °C, так как может произойти их закупорка выделяющимся на стенках графитом.
Восстановительные свойства СО в обычных условиях сильнее, чем у водорода. В реакции
h
СО + Н2О СО2 + Н2 , где ti < t2 (14.1)
t2
до 830 °C восстановителем является СО. При 830 °C в реакционной смеси содержатся равные количества всех четырех веществ.
Для СО характерны не только реакции восстановления, но и присоединения. Не являясь ангидридом муравьиной кислоты Н— —СООН, СО тем не менее взаимодействует с КОН или NaOH с образованием ее солей — формиатов:
120°С
СО + КОН = НСООК
0,5МПа
234
Монооксид углерода соединяется при нагревании со многими металлами с образованием комплексных соединений, называемых карбонилами:
Ni + 4С0 [Ni(CO)4 1
С галогенами СО вступает в реакцию при нагревании и в присутствии платины (катализатор); так, получены CChO, COF2 и СВггО. Мно-гйе оксиды металлов восстанавливаются до металла при нагревании в атмосфере СО:
SnOi + 2СО = Sn + 2COi а некоторые соли — уже в обычных условиях:
PdCh + СО + Н2О - Pd; + CO2t + 2НС1
При нагревании выше 400 °C монооксид углерода вместе с парами воды действует как СОг (см. реакцию 14.1):
СО + Н2О + СаО - СаСОз + H2f
Реакция получения метанола
СО +2Нг = СНзОН
широко используется в промышленности.
Для синтеза СО применяют главным образом следующие реакции:
2С + Ог = 2СО (14.2)
НСООН = COt + НгО (14.3)
H2SO4
Н2С2О4 = СОг+СОгТ+НгО (14.4)
H2SO4
Реакция (14.2) используется в промышленности, а реакции (14.3) и (14.4) — в лабораторной практике. Для удаления из СО примеси СОг смесь газов пропускают через водный раствор КОН или NaOH:
КОН + СО2“КНСОз
Диоксид углерода СОг — газ без цвета и запаха, значительно тяжелее воздуха. Твердый СОг, имеющий молекулярную кристаллическую решетку (см. табл. 14), возгоняется без плавления при - 78 °C. В жидком состоянии СОг может находиться только под а а
Давлением. Молекула О — С — О линейна, длина связи С—О равна л л
116 пм (см. раздел 5.3).
В воде СОг растворяется: 1 л НгО при 25 °C и 0,1 МПа поглощает ",'6 л СОг. Только небольшая часть растворенного СОг взаимодей-^вует с водой (менее 1%) с образованием угольной кислоты (см. табл. 16);
СО2 + Н2О.—' Н2СО3
235
Диоксид углерода превращает водные растворы гидроксидов щелочных, щелочно-земельных элементов и магния в гидрокарбонаты (при избытке СО2). Например,
Ва(ОН)2 + 2СОг = Ва(НСОз)2
Твердые гидроксиды и оксиды щелочных и щелочно-земельных металлов поглощают СОг из воздуха:
2КОН(К) + СОг = К2СО3(к) + Н2О
О взаимодействии СОг с пероксидами, надпероксидами и озонидами металлов см. раздел 12.6.
Диоксид углерода и водород взаимодействуют (400 °C, 30 МПа) в присутствии катализатора (смесь ZnO и СггОз) с образованием метанола:
СОг + ЗНг = СНзОН + Н2О
Образующаяся вода вступает в реакцию: СО + Н2О СО2 + Нг. Крупнотоннажный синтез метанола из диоксида углерода может стать одним из регуляторов содержания СОг в атмосфере (см. гл. 30).
Получение СОг в промышленности основано на разложении известняка:
СаСО2= СаО + СОгт
В лабораторной практике применяют реакции:
СаСОз + 2НС1 = CaCh + СОгГ + Н2О
2NaHCO = КагСОз + СОг! + Н2О
Диоксид триуглерода С3О2 — бесцветный ядовитый газ с удушливым запахом, т. кип. - 43 °C, легко полимеризующийся в обычных условиях с образованием нерастворимого в воде продукта желтого, красного или фиолетового цвета. Красноватый цвет Марса объясняют присутствием в его атмосфере полимеров (СзОг)х.
Подробнее см.: Кривошей И. В., Скоробогатов В. М. Усп. химии, 1981. Т. 50. С. 746.
Молекула С3О2 имеет линейную структуру О—С—С—С—О с длиной связи С—С 130 пм и С—О 120 пм. С водой С3О2 взаимодействует с образованием малоновой кислоты НгС(СООН)2, а с основаниями — ее солей — малонатов:
С3О2 + 2КОН - Н2С(СООК)2
Получают С3О2 дегидратацией малоновой кислоты:
Н2С(СООН)2 = С3О2 + 2Н2О Рл Ош
Монооксиды кремния SiO и германия GeO — аморфные, коричневато-черные порошкообразные или стеклообраз
236
ные вещества, легко возгоняющиеся при нагревании в вакууме. Одиночные молекулы оксидов имеют кратные связи Эн^О, но менее прочные, чем у СО.
При температурах, превышающих температуры их синтеза, монооксиды диспропорционируют:
2SiO = Si + SiOi
Монооксиды разлагаются перегретым водяным паром:
GeO + Н2О = СеОг + H2t взаимодействуют с галогенами: t
2SiO + 2Ch= SiCU + SiOz
и основаниями:
SiO + 4КОН = K4SiO4 + Н2О + Н2 f
Синтез SiO и GeO осуществляют преимущественно при помощи реакций, требующих вакуума и высоких температур:
t t
Si + SiO2 = 2SiO<r) f; Ge + CO2 = GeO + COf
Диоксиды кремния SiO2 и германия GeQ2 — прозрачные бесцветные кристаллические вещества, имеющие много полиморфных модификаций (см. табл. 14). Т. пл. SiO2 и СеОг равны соответственно 1728 и 1116 °C. При медленном охлаждении расплава SiO2 образуется кварцевое стекло, содержащее беспорядочно расположенные полимерные цепи из кремнекислородных тетраэдров. Кристаллы SiO2 и СеОг состоят из цепочек тетраэдров, связанных между собой через атомы кислорода. Все полиморфные модификации SiO2 (см. раздел 6.3) относятся к мало реакционноспособным веществам, не взаимодействующим ни с водой, ни с кислотами, кроме фтороводородной HF, ни с галогенами: ‘
SiO2 + 6HF = Н2 [SiF6 ] + 2Н2О
Аналогично ведет себя и тетрагональная («нерастворимая») модификация СеОг. Гексагональная же модификация СеОг растворяется в воде (4,5 г/л при 25 °C), но с водой не взаимодействует, реагирует с HF и НС1:
СеОгсгексаг.) + 4НС1 = GeCl4 + 2НгО
Оба диоксида вступают в реакцию с водными растворами и Расплавами гидроксидов щелочных элементов, а при нагревании й с их карбонатами с образованием цепочечных и циклических полимерных метасиликатов и метагерманатов:
SiOi + 2КОН(Ж) = K2SiO3 + Н2О
t
СеОг + ИагСОз = Na?GeO3 + СОг t
237
Получение чистого Si02 основано на использовании гидролиза либо тетраэтоксисилана, этилового эфира ортокремниевой кислоты, либо SiCh.’
SiCU + 2Н2О = SiOil + 4НС1
Si(OC2H5>4 + 2НгО = SiO21 + 4C2H5OH
В начале процесса гидролиза образуются поликремниевые кислоты, которые затем подвергают прокаливанию. Если прокаливание проводить при 1000—1500 °C, то получается кристобалит — полиморфная модификация S1O2.
14.5. КИСЛОРОДНЫЕ КИСЛОТЫ УГЛЕРОДА, КРЕМНИЯ И ГЕРМАНИЯ
В свободном виде мономерные кислородные кислоты углерода, кремния и германия (Н2СО3, FUSiCU и ЩСеО4) не получены. При подкислении водных растворов силикатов и германатов появляю
Рис. 57. Продукты полимеризации кремниевых кислот;
а — полимеризация H4S1O4; б — цепочечные и циклические структуры кремниевых кислот
238
щиеся вначале мономерные формы кислот подвергаются полимеризации, а образующиеся дикислоты переходят в три-, тетра- и по-ликислоты (рис. 57). В процессе полимеризации раствор постепенно превращается в желатинообразную студенистую массу — силикагель состава S1O2 • аН2О (х>300). Силикагель может содержать поли-кислоты различной сложности: цепочечной или циклической структуры (рис. 57). При нагревании силикагель (или германогель) теряет воду и переходит в S1O2 (или GeOi).
Карбонаты при действии кислот выделяют СОг:
К2СО3 + 2НС1 - 2КС1 + СОгГ + НгО
а в растворе остается небольшое количество НгСОз. Протолиз этой слабой кислоты протекает в основном до образования гидрокарбо-натных анионов:
Н2СО3 + Н2О. ' Н3О+ + НСОз, ХК1 - 4,45 • 10~7 (25 °C)
Анионная кислота НСО з является еще более слабой:
НСО з + Н2О - - * НзО+ + СО з2, КК2 = 5,6 • 10"’1 (25 °C)
поэтому раствор карбонатов из-за протолиза всегда содержит гид-рокарбонатные анионы:
СО 1" + НгО = НСО з + ОН", Ко = ~ = 1,78 • 10‘4. Ай
Кремниевые и германиевые кислоты слабее угольной, они выпадают в осадок при пропускании СОг через водные растворы силикатов и германатов.
Производными угольной кислоты О—С (ОН) 2 можно считать карбамид О—C(CN2)2 и к арбаминат аммония О— —С Последнее соединение образуется по реакции
2NH3<r) + CO2(D - OC(ONH4)NH2
Карбаминовая кислота О=С nh2 в св°бодном виде неизвестна. В присутствии воды NH3 и СОг взаимодействуют иначе:
2NH3 + СО2 + Н2О « (NH4)2CO3
При растворении в воде карбаминат аммония обратимо превращается в карбонат:
OC(ONH4)NH2 + H2O^=r (NH4)2CO3
П|эи высоком давлении (10 МПа) и повышенной температуре (130 С) СО2 и NH3 образуют карбамид:
2NH3 + СО2 = OC(NH2)2 + Н2О
239
Карбамид CO(NH2)2 — бесцветное кристаллическое вещество, образующее с сильными кислотами аддукты за счет водородной связи-(ЫН2)2СО»••HNO3, (NH2)2CO«««H2SO4.
14.6. КАРБОНАТЫ, СИЛИКАТЫ И ГЕРМАНАТЫ
Среди карбонатов, силикатов и германатов металлов только соли щелочных металлов (кроме Li) растворимы в воде. Водные растворы этих соединений имеют сильную щелочную реакцию вследствие протолиза:
SiO4“ + H2O-i - HSiOt’ + OH"
Анион HSiOt" содержит в действительности ОН -ион, (5Юз(ОН) ]3~ и способен к димеризации:
2 [SiO3(OH> j3” - [Si2O716" + H2O
Земная кора почти полностью состоит из диоксида кремния Si02, силикатов, алюмосиликатов. Алюмосиликаты представляют собой силикаты, в которых часть атомов Si заменена на атомы А1 с включением катионов других металлов для компенсации зарядов кремнекислородного аниона.
Силикаты подразделяют на ортосиликаты, содержащие изолированные анионы SiOi~; метасиликаты с циклическим анионом (SiO3)n” (например, минерал берилл или изумруд ВезА1251бО18); дисиликаты с анионом Si2O^~ (например, минерал тортвейтит Sc2Si2O7>; силикаты с цепочечными и слоистыми структурами и силикаты с трехмерной структурой (цеолиты, полевые шпаты). Некоторые типы структур представлены на рис. 57.
В структурах ортосиликатов катионы занимают пустоты (ZrSiO4, Be2SiO45 гранаты M^n(SiO4)3, где М(П) = Mg, Са, Fe, а М(Ш) = А1, Сг, Fe). В портландцементе важнейшей составной частью также являются ортосиликаты. Следует отметить, что портландцемент — основная разновидность цемента — вяжущего материала гидравлического твердения.
При нагревании карбонаты всех металлов, кроме щелочных, разлагаются до плавления:
ВаСОз = ВаО + СО21
Силикаты и германиты металлов при высоких температурах плавятся без разложения. Нерастворимые в воде силикаты и германаты, как правило, взаимодействуют только с фтороводородной кислотой:
Ca2Sip4 + 8HF = SiF41 + 2CaF2 + 4H2O
240
Силикаты и германаты щелочных металлов получают сплавлением SiO2 (или 6с02) с карбонатами и гидроксидами:
GeO2 + 4КОН(Ж) - K4GeO4 + 2Н2О
SiO2 + 2ИЬ2СОз = Rb4SiO4 + 2СОг f
14.7. КАРБИДЫ, СИЛИЦИДЫ И ГЕРМАНИДЫ
Карбидами, силицидами и германидами называют бинарные соединения металлов соответственно с углеродом, кремнием и германием. В эту группу соединений включают также карбиды бора и кремния. Наиболее разнообразные соединения с металлами образует углерод. Принято все карбиды подразделять на солеобразные (карбиды металлов IA, Б — ША, Б-групп), ковалентные (SiC, В4С) и карбиды внедрения, образованные большинством «/-металлов.
Солеобразные карбиды — бесцветные, прозрачные кристаллические вещества с ионной химической связью, взаимодействующие с водой и кислотами. Если такие карбиды содержат в своем составе анионы С^ (—С^С—), то их называют ацетиленидами. Они при взаимодействии с водой выделяют ацетилен:
СаС2 + 2Н2О - H2C2f + Са(ОН)2
К ацетиленидам принадлежат: К2С2, Ag2C2, СаС2, Cu2C2, ZnC2, La2(C2)3. Образуются ацетилениды в обменных реакциях, протекающих в растворе и твердой фазе:
2[Ag(NH3)2]NO3(p> + Н2С2°= Ag2C2| + 2NH4NO3
Если карбиды содержат в своем составе анионы С4 , то их называют метанидами (Ве2С, А14Сз). Метаниды при взаимодействии с водой образуют метан:
А14Сз + 12Н2О = 3CH4f + 4А1(ОН)з1
Метаниды принадлежат к тугоплавким веществам, например, т. пл. У Ве2С равна 2152 °C, а у А14Сз т. пл. 2797 °C.
Ковалентные карбиды образуют элементы, близкие к углероду по своей электроотрицательности. Ковалентные карбиды — твердые, тугоплавкие и химически устойчивые вещества.
Карбиды внедрения — преимущественно металлические, нестехиометрические соединения с высокой электрической проводимостью, твердостью и жаропрочностью (т. пл. 3100— 4800 °C). В таких карбидах атомы углерода занимают межузельные пустоты (см. раздел 29.1) в кристаллических решетках металлов, размеры атомов которых больше 130 пм. Между структурой карбидов “элементов и склонностью последних к гидролизу нет прямой связи. Например, карбид титана TiC не взаимодействует с водой и хлороводородной кислотой даже при температуре 600 °C; карбид железа неС уже разрушается разбавленными водными растворами кислот, а карбИд марганца МпзС — даже водой. Продукты гидролиза таких карбидов содержат помимо водорода сложные смеси углеводородов.
241
Силициды и германиды относят также к нестехиометрическим соединениям (см. гл. 29). При большом содержании металла в силицидах связи М—Si имеют металлический характер, а в силицидах с преобладанием кремния появляются ковалентные связи Si—Si. Некоторые металлы (Al, Ag) с кремнием не взаимодействуют, а растворяют его в своем расплаве. При охлаждении жидкого раствора Si выделяется в виде кристаллов. Другие металлы образуют с Si и Ge твердые растворы (сплавы). Например, сплав железа с кремнием (ферросилиций) может содержать от 9 до 95% Si.
Силициды и германиды металлов IA- и ПА-групп разлагаются водой и кислотами:
Ca2Si + 4Н2О = SiH4t + 2Са(ОН)2
Силициды d-элементов отличаются тугоплавкостью (т. пл. WSi2 2165 °C), высокой твердостью и химической инертностью, например, MoSi2 не взаимодействует со всеми известными кислотами, включая HF и смесь HNO3 + НС1.
Получение силицидов и германидов основано на непосредственном взаимодействии металлов с Si или Ge при определенных температурах:
t
2Mg + Si = Mg2Si; Ba + Ge = BaGe (или BaGe2)
14.8. ГИДРИДЫ
Гидриды углерода (углеводороды) подробно рассматриваются в курсах органической химии. Настоящий раздел посвящен только химии гидридов кремния и германия.
Моносилан S1H4 и моногерман СеНд — бесцветные газообразные вещества с т. кип. соответственно -112 и -88 °C, образующие с воздухом взрывчатые смеси, причем SiH4 может окисляться со вспышкой даже в жидком состоянии при -180 °C. Моносилан и моногерман — термодинамически неустойчивые соединения, у SiH4 AfG°(298 К)-+ 57, а у GeH4 &fG°(298 К) =+113 кДж/моль. Молекулы гидридов имеют тетраэдрическую структуру (s/r -гибридизация). Моносилан устойчив в нейтральной и кислых средах, но легко вступает в реакцию с водой в присутствии ничтожно малых следов ОН -ионов:
он-
SiH4 + 4Н2О = H4SiO4 + 4Н21
Следует отметить, что реакционная способность связи Si—Н по отношению к водным растворам КОН и к кислороду остается постоянной во всех соединениях, где эта связь содержится. Моногерман более устойчив к действию воды, он не реагирует даже с 30%-ным растворами КОН и NaOH.
Гидриды Si и Ge — сильные восстановители, их взаимодействие
с Ог и галогенами происходит со взрывом и выделением большого количества теплоты:
SiH4(r) + 20г(г) “ SiO2(K) I + 2Н2О(ж), Дн°(298 К) - - 1515 кДж
SiH4(r) + 4С1г(г)“ SiCUtoc)» Л//°(298 К) — — 1058 кДж
Для синтеза SiFU применяют реакцию
Li [Д1Н4 ] + SiCl4 - SiH41 + LiCl l + AICI3
либо используют разложение триэтоксисилана в присутствии Na:
80°С
4SiH(OC2H5)3 = SiH4t + 3Si(OC2H5>4
Последняя реакция имеет важное промышленное значение, так как она позволяет получать чистый силан. Герман с примесью других германоводородов, как и силан, можно выделить кислотным разложением германидов:
Mg2Ge + 4НС1 - GeH41 + 2MgCl2
У многоатомных силанов SinH2n+2 термическая устойчивость понижается с ростом их молекулярной массы. Все силаны очень легко окисляются.
14.9. ГАЛОГЕНИДЫ
Углерод, кремний и германий образуют галогениды состава Э(На1)4 со всеми галогенами (Hal=F, Cl, Br или I). В обычных условиях 3F4 — газы, ЭСЦ — жидкости, а ЭВг4 и ЭЦ — кристаллические вещества (SiBr4 — жидкость). В ряду тетрагалогенидов прочность химической связи Э—Hal уменьшается от фтора к иоду.
Галогениды рассматриваемых элементов — ковалентные соединения, молекулы которых имеют тетраэдрическую структуру с валентным углом, близким к 109°.
Отличительной особенностью тетрагалогенидов кремния и германия является их высокая склонность к гидролизу:
SiBr4 + 2Н2О - SiO21 + 4НВг
SiF4 + 8ОН~ - S1O4” + 4F- + 4Н2О
Тетрафторид кремния в значительных количествах образуется при переработке апатитов и фосфоритов сернокислотным методом:
CaF2 + Нг8О4 - CaSO41 + 2HF t ; SiO2 + 4HF - SiF41 + 2H2O
При абсорбции SiF4 водой протекает (помимо приведенной выше) Реакция образования гексафторосиликата водорода:
SiF4 + 2HFr= H2[SiF6]
Этот продукт применяют для производства фторидов металлов (см. Разд. 17.3).
243
Наиболее важными в практическом отношении галогенидами являются ССЦ, SiCU и SiHCh-
Тетрахлорид углерода ССЦ — негорючая, бесцветная жидкость, т. кип. 77 °C, в воде малорастворим и в обычных условиях не взаимодействует ни с кислотами (включая концентрированную H2SO4), ни с основаниями; хорошо растворяет иод и многие органические вещества.
Синтез ССЦ основан на использовании реакции (катализатор 12, MnCh):
CS2 + 3C12 = CC14 + S2C12
Отделяют ССЦ от S2C12 дистилляцией, отбирая фракцию, кипящую при 75—80 °C. Если через кипящий трихлорметан (хлороформ) пропускать сухой С12 до прекращения выделения НС1, то также можно получить ССЦ:
СНС1з + С12 = ССЦ + НС1
Тетрахлорид кремния SiCH — бесцветная, летучая (т. кип. 57 °C), дымящая на воздухе жидкость с удушливым запахом. В отличие от ССЦ тетрахлорид кремния — химически активное вещество. Помимо воды SiC14 энергично взаимодействует с основаниями и некоторыми оксидами металлов и неметаллов:
3SiC14 + 2А120з = 3SiO2l + 4А1С1з
SiCl4 + 6КОН = КгБЮз + 4КС1 + ЗН2О
Для получения SiCH нагревают Si или смесь SiO2 + С в токе С12:
SiO2 + С + 2С12 “ SiC141 + СОг t
Используют также метод хлорирования ферросилиция (90—98% Si):
2FeSi + 7С12 = 2SiCl4 t + 2FeCl3
Трихлорсилан SiHCh — бесцветная, подвижная, летучая жидкость с т. кип. 32 °C, сильно дымящая на воздухе, легко воспламеняющаяся уже при небольшом нагревании или соприкосновении с активированным углем:
SiHCh + О2 = SiO21 + НСЦ + Cht
Охлажденная до 0 °C вода превращает SiHCh в полисилоксан — белое, объемистое полимерное соединение состава (H2Si2O3)x:
2SiHCl3 + ЗН2О - H2Si2O3 + 6НС1
В обычных условиях реакция SiHC13 с Н2О протекает в соответствии с уравнением
SiHCh + 2Н2О = SiO2l + ЗНС1 + H2f
В щелочной среде SiHCh переходит в полисиликаты:
244
SiHCh + 50H~ = SiOi +3CI +2H2O + H2t
В инертной среде при нагревании
4SiHCh = SiH41 + 3SiC141
Получение SiHCh основано на использовании реакции гидрохлорирования кремния в присутствии порошкообразной меди:
Si + ЗНС1 С SiHCh t + H2f Си
Полученный продукт содержит до 10% SiCl4. Чистый кремний превращается при гидрохлорировании в SiHCh только выше 400°С.
14.10. СУЛЬФИДЫ
Углерод образует сульфиды составов CSO, CgS2 и CS2, а кремний и германий — SiS2, GeS и GeS2. Первые три сульфида являются аналогами СО2 и СзО2 (см. раздел 14.3). Кристаллы SiS2 и GeS2 состоят из бесконечных цепей тетраэдров, связанных между собой ребрами, через два атома серы. Наиболее важным в практическом отношении является дисульфид углерода CS2.
Дисульфид углерода (сероуглерод) CS2 — бесцветная, ядовитая жидкость с неприятным запахом, т. кип. 46 °C. Молекула CS2 линейна S=C—S (sp-гибридизация AG атома углерода (см. раздел 5.3), длина связи С—S 155 пм. Дисульфид углерода — эндотермическое соединение, Д/G0 (298 К) = + 64 кДж/моль. Пары CS2 легко воспламеняются:
CS2 + ЗО2 = СО2 + 2SO2
В воде CS2 малорастворим, но является прекрасным растворителем для I2, Ss и Р4. Гидролиз CS2 наблюдается выше 160 °C:
CS2 + 2Н2О = СО2 т + 2H2S t
С сульфидами щелочных металлов CS2 образует тиокарбонаты:
CS2 + KiS - K2CS3
Получают CS2 либо при взаимодействии СН4 с парами серы, либо прямым действием паров серы на углерод:
CH4 + 4S = CS2 t + 2H2Sf; C + 2S^CS2f
14.11. СОЕДИНЕНИЯ УГЛЕРОДА, КРЕМНИЯ И ГЕРМАНИЯ С АЗОТОМ. ПСЕВДОГАЛОГЕНЫ И ПСЕВДОГАЛОГЕНИДЫ
Рассматриваемые элементы образуют нитриды одного и того состава ЭзМ4 (Э —С, Si, Ge). Более обширным является класс соединений со связями С—N, важнейшие из которых — цианиды, ™оцианаты и цианаты. Анионы CN~, NCS- и NCO получили
245
название псевдогалогенидных по сходству в их химических свойствах с галогенидными анионами. Псевдогалогениды щелочных металлов, как и галогениды, хорошо растворяются в воде. Подобно галогеноводородам существуют псевдогалогеноводороды: циановодород HCN, тиоцианат водорода HNCS, цианат водорода HNCO, водные растворы которых являются кислотами различной силы.. Псевдогалогенидные анионы под воздействием окислителей превращаются в псевдогалогены: 2CN -2е - (CN)2; 2NCS" - 2е - (NCS>2 — неустойчивые ковалентные соединения, которые могут окислять металлы с образованием псевдогалогенидов: Са + (NCS)2"* Ca(NCS>2. Псевдогалогены, как и галогены, в растворах КОН или NaOH подвергаются разложению:
(CN)2 + 2К0Н = KCN + KNCO + Н2О
Наиболее хорошо изученными являются такие псевдогалогениды, как цианиды и тиоцианаты металлов. Основным свойством, объединяющим псевдогалогены с галогенами по их химическим способностям, является свойство псевдогалогенов образовывать комплексные анионы, состоящие либо только из псевдогалогенов, либо из галогенов и псевдогалогенов, причем галогены чаще всего являются комплексообразователями. В частности, синтезированы K[(CN)(CN)2] = К[(СЫ)з], Cs[I(NCS)2] и другие им подобные.
Циановодород HCN — бесцветная, легколетучая жидкость (т. кип. 26 °C) с запахом горького миндаля, смешивающаяся с водой в любых отношениях. В водных растворах HCN ведет себя как очень слабая кислота, К* - 4,93* 1О~10 (25 °C).
Молекула Н—fc=N: линейная (sp-гибридизация АО углерода), длина связи C===N равна 115 пм. В кристаллическом циановодороде молекулы HCN образуют за счет слабых водородных связей бесконечные цепи •••N==zC—Полимеризация HCN приводит к образованию бесцветных кристаллов тетрамера (HCN)4= (H2N)2C=--C(CN)2.
Водные растворы HCN взаимодействуют с оксидами и гидроксидами щелочных и щелочно-земельных металлов с образованием цианидов:
Ва(ОН)2 + 2HCN = Ba(CN)2 + Н2О
Li2O + 2HCN = 2UCN + Н2О
С карбонатами тех же металлов HCN не реагирует, так как является более слабой кислотой, чем угольная. Растворимые в воде цианиды металлов подвергаются протолизу:
CN" + НгО. " HCN + ОН"
В промышленности HCN получают каталитическим окислением смеси СН4 и ЫНз воздухом при 800 °C:
2СН4 + 2NH3 + ЗО2 - 2HCN + 6Н2О
В лабораторной практике применяют реакции:
246
2KCN + H2SO4(p> = 2HCNf +K2SO4
K4[Fe(CN)61 + 3H2SO4 = 6HCNf + 2K2SO4 + FeSO4
Д ициан (CN)2 — легко воспламеняющийся бесцветный газ, обладающий высокой токсичностью, относится к эндотермическим соединениям: 2\G° (298 К) - + 298 кДж/моль. Молекула (СЫ)г симметрична и линейна, :N?~C—Cf“N:. В присутствии влаги, цианида калия и на свету дициан полимеризуется. В воде (CN)2 хорошо растворяется, но в растворах быстро разлагается:
(CN)2 + Н2О = HCN + HNCO
Выше 1100 °C дициан диссоциирует, образующийся моноциан термически очень устойчив.
Синтез (CN)2 возможен при нагревании смеси концентрированных водных растворов KCN и C11SO4:
t
4KCN + 2CuSO4= (CN)2t + 2CuCN I + 2K2SO4
или при разложении цианидов ртути и серебра:
Hg(CN)2= Hg + (CN)2t
Тиоцианат водорода HNCS — бесцветная, очень неустойчивая, маслянистая жидкость, смешивающаяся с водой в любых соотношениях и образующая при этом сильную кислоту. Водные растворы HNCS устойчивы только при концентрации, не превышающей 5%.
Получение водных растворов кислоты производят с использованием реакций обмена:
Ba(NCS)2 + H2SO4 = 2HNCS + BaSO4l
Соли HNCS носят название тиоцианатов. По химическим свойствам они напоминают хлориды металлов; большинство солей HNCS хорошо растворяется в воде. Тиоцианаты щелочных металлов термически неустойчивы:
2KNCS = K2S + (CN)2t + S
При нагревании и плавлении NH4NCS происходит частичная изомеризация тиоцианата в тиокарбамид NH4NCS jz=j:SC(NH2)2-Константа этого равновесия для раствора NH4NCS в н-бутаноле пРи 160 °C равна 0,37.
Синтез тиоцианатов возможен с использованием реакций обмена и сплавления цианидов с серой:
KCN + S = KNCS; Hg(NO3>2 + 2KNCS - Hg(SCN)2l + 2KNO3
247
14.12. ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА ОЛОВА И СВИНЦА
Олово и свинец — металлы серебристо-белого цвета с незначительной твердостью и большой ковкостью, легкоплавкие, т. пл. 232 и 334 °C соответственно.
Олово имеет три полиморфные модификации (см. раздел 6.3): a-Sn /З-Sn y-Sn расплав
Обычно (белое) Д-Sn очень пластично, мягче Au, но тверже РЬ и может прокатываться до тончайших листов толщиной 0,003 мм (станиоль или оловянная бумага). Выше 173 °C /?-Sn энантиотропно превращается в хрупкую модификацию y-Sn. Ниже 14 °C /З-Sn переходит монотропно в порошкообразное серое олово. Этот полиморфный переход совершается с очень малой скоростью, но стоит только на fl-Sn попасть крупинкам G -Sn, как плотные куски белого олова рассыпаются в пыль. Поэтому полиморфный переход /?-* а иногда называют «оловянной чумой». Обратно G -Sn может быть переведено в /З-Sn только путем переплавки, уничтожающей кристаллики a -Sn. У свинца полиморфных модификаций не обнаружено.
В электрохимическом ряду напряжений Sn и РЬ находятся непосредственно перед водородом (<р° = - 0,141 и -0,126 В). Поэтому их химическая активность по отношению к воде и разбавленным кислотам незначительна.
Чистая вода в обычных условиях не действует на Sn и РЬ. Если же вода содержит СОг, то при небольшой его концентрации на поверхности свинца образуется пленка РЬСОз, препятствующая дальнейшей коррозии:
РЬ + СОг + НгО - РЬСОз + Нг!
При большом содержании СОг происходит переход свинца в воду в виде растворимого гидрокарбоната:
РЬСОз + СОг + Н2О = РЬ(НСОз)г
что и служило причиной свинцового отравления людей в древнем Риме, имевшем свинцовые водопроводы.
При нагревании Sn и РЬ энергично взаимодействуют с кислородом, галогенами, серой, селеном и теллуром:
2РЬ + Ог = 2РЬО; Sn + 2С1г = SnCU
Pb + S-PbS; Sn + S = SnS
Свинец в отличие от олова практически не взаимодействует с галогенами из-за образования на поверхности плотной пленки галогенида свинца, защищающей металл от дальнейшей коррозии. В частности, свинец устойчив к действию хлора до 300 °C, из свинца можно изготовлять испарители жидкого брома. Олово и свинец не вступают в химические реакции даже при нагревании с Нг, В, С, Si, Nz, As4 и Рд.
248
Характер взаимодействия Sn и РЬ с кислотами различен. Все галогеноводородные кислоты на свинец не действуют в обычных условиях из-за малой растворимости его галогенидов. Раньше, например, растворы фтороводородной кислоты хранили в свинцовых сосудах. Олово же реагирует со всеми концентрированными галогеноводородными кислотами при нагревании, в частности
Sn + 2НС1 = SnCl2 + H2f
С разбавленной серной кислотой Sn взаимодействует очень медленно:
t
Sn + H2SO4 ** SnSO4 + H2f
а свинец воздействию кислоты не подвергается из-за образования плотной пленки малорастворимого PbSC>4- Поэтому свинец был основным конструкционным материалом в сернокислотной промышленности. Реакции олова и свинца с концентрированной H2SO4 протекают медленно даже при нагревании:
t
Sn + 2H2SC>4 = S11SO4 + SO21 + 2H2O
Pb + 3H2SO4 “ Pb(HSO4)2 + SO2? + 2H2O
Разбавленная HNO3 является хорошим реагентом для получения Sn(NC>3)2 и РЬ(ЫОз)г:
ЗРЬ + 8HNO3 = ЗРЬ(ЫОз>2 + 2NOt + 4Н2О
В концентрированной HNO3 (20 М) олово и свинец в обычных условиях подвергаются пассивированию, а при нагревании с кислотой реагирует только олово в соответствии с реакцией
Sn + 4HNO3 + 2Н2О = Н2 [Sn (ОН)6 ] + 4NO21
Свинец с нагретой концентрированной HNO3 не взаимодействует, так как образующийся на поверхности Pb(NO3>2 нерастворим в концентрированной HNO3 и поэтому предохраняет металл от дальнейшего ее действия.
В присутствии окислителей (даже кислорода воздуха) Sn и РЬ могут очень медленно взаимодействовать со слабыми кислотами:
2РЬ + О2 - 2РЬ0; РЬО + 2СН3СООН 1 РЬ (СНзСОО) 2 + Н2О
Водные растворы гидроксидов щелочных металлов и их расплавы слабо реагируют и с Sn, и с РЬ:
t
РЬ + 2КОН(Ж)= К2РЬО2 + Н2|
Sn + 4КОН(Р) + 2Н2О = K4[Sn(OH)6] + H2j
249
14.13. ПОЛУЧЕНИЕ ОЛОВА И СВИНЦА
Получение Sn и РЬ из их руд является простым металлургическим процессом — восстановлением оксидов углем при нагревании:
t
SnO2 + 2C= Sn()K)+2COt
2PbS + ЗО2 = 2РЬО + 2SO2t
PbO + C= Pb(x)+COt
Металлы можно выделить и из водных растворов их солей в виде дендритов черного цвета:
SnCh + Zn = Sn | + ZnCh
14.14. ХИМИЯ ВОДНЫХ РАСТВОРОВ
П^сле растворения в воде солей Sn(II) и РЬ(П) ни катионы РЬ2+ и Sn , ни аквакатионы в растворе не появляются. Происходят довольно сложные превращения частиц, которые можно изобразить схематично в виде следующих реакций:
Pb(NO3)2-Pb2+ + 2NO3
Pb2+ + Н2О Pb2+ • Н2О
РЬ2+ • Н2О + Н2О < * Н3О+ + РЬОН+
РЬОН+ ----. (РЬ2ОН)3+---. [РЬ4(ОН)4 14+
Sn2+ • Н20 + НгО^:-* Н3О+ + SnOH+
SnOH+-----• [Sn3(OH)4]2+ или SnOH+---♦ [Sh2(OH)2]2+
При pH 1—4 из солянокислых растворов кристаллизуется не SnCl • 2НгО, a [Sn4(OH)6]C12 или [ЗпШгОЮгг • НгО.
Наиболее используемыми малорастворимыми солями являются у олова Snl2, SnS, SnS2, а у свинца галогениды, PbSO4, РЬСгО4, PbS и PbCO3.
14.15. ОКСИДЫ, ГИДРОКСИД-ОКСИДЫ и кислоты
В табл. 19 приведены наиболее изученные оксиды, гидроксид-оксиды и кислоты олова и свинца.
Монооксиды SnO и РЬО представляют собой кристаллические вещества. Их цвет зависит от метода получения: у SnO синечерный или красновато-коричневый, у РЬО — желтый или красный. Монооксид свинца известен в виде двух полиморфных модификаций, красной и желтой. Стабильная в обычных условиях красная «-модификация при 540 °C переходит в желтую: «-РЬО /3-РЬО.
250
Таблица 19. Оксиды, гидроксид-оксиды и кислоты олова и свинца
Соединения Олово Свинец
Оксиды SnO, SnO? РЬО, РЬОг
Гидроксид-оксиды $ПбО4(0Н>4 РЬбО4(ОН>4
Двойные оксиды — (Pb₽,Pb1V)O4
Кислоты H<SnO4; (НгБпОз)» —
Монооксид олова при нагревании на воздухе выше 200 °C переходит в диоксид, а РЬО испытывает превращения: РЬО -* РЬОг -* -»(РЬ2, РЬ)О4 -» РЬО, сначала связывая кислород, а затем его выделяя. При 886 °C РЬО плавится без разложения.
В воде монооксиды не растворяются и с водой не взаимодействуют. Оба монооксида амфотерны:
SnO + 2НС1 - SnCh + Н2О
Sn + 4КОН(Р) + Н2О L K4[Sn(OH)6]
Суспензию SnO и РЬО в воде хлор окисляет до диоксидов:
РЬО + С1г + НгО = РЬОг + 2НС1
Для получения SnO применяют реакции:
Sn6O4(OH)4 = 6SnO + 2НгО; SnCh + 2КОН = SnO l + 2KC1 + H2O t
SnC2O4 = SnO + CO2I + CO t
SnCh + K2CO3 = SnO l + CCht + 2KC1
Во всех этих реакциях температура (во избежание окисления SnO) не должна превышать 200 °C. Монооксид свинца образуется при прокаливании нитрата и карбоната, при действии водного раствора аммиака на ацетат свинца:
РЬСОз = РЬО + СОгТ
Pb(NO3)2 = РЬО + 2NCht + О,50гт
РЬ(СНзСОО)г + 2NH3 = Н20 = PbOl + 2CH3C00NH4
Гидроксиды состава8п(ОН)гиРЬ(ОН)2неизвестны. Вместо них в реакциях растворимых солей олова и свинца (II) с гидроксидами щелочных металлов выделяются белые, малорастворимые в воде студенистые осадки состава МбО4(ОН)4, где M = Sn(II) или РЬ(П). Появление тетрагидроксид-тетраоксид гексаолова или гекса
251
свинца вызвано полимеризацией мономерных гидроксидов с одновременным выделением части воды:
6РЬ(ОН)2 = РЬбО4(ОН)4 + 4Н2О
Гидроксид-оксиды олова и свинца обладают амфотерными свойствами, сильнее проявляющимися у тетрагидроксид-тетраоксид гексаолова:
Sn6O4(OH)4 + 24КОН + 4Н2О = 6K4[Sn(OH>6]
Гексагидроксокомплексы Sn(II) и РЬ(П) образуются при действии на оксиды и соли олова и свинца (II) избытка КОН или NaOH:
РЬО + 4КОН(р) + Н2О - К4[РЬ(ОН)б]
Олово и свинец всегда содержат в гидроксоанионах шесть ОН~ -групп вне зависимости от степени окисления металла. При уменьшении этого числа место ОН -групп занимают молекулы воды, например K2[Sn+II(H2O)2(OH)4].
В отличие от соединений свинца K4[Sn(OH)6] является сильным восстановителем. Например, из солей ртути (II) выделяет ртуть:
HgCl2 + [Sn(OH)6]4~ = Hgi + [Sn(OH)6]2~ + 2СГ
Гексагидроксостаннаты и гексагидроксоплюмбаты (II) щелочных металлов растворимы в воде, кислоты разрушают гидроксоанионы:
К4[РЬ(ОН)б] + 6HNO3 = Pb(NO3)2 + 4KNO3 + 6Н2О
При длительном стоянии водные растворы K4[Sn(OH)6] разлагаются:
К4 [Sn(OH)6 = SnO l + 4КОН + Н2О
а при их нагревании до 70—100 °C выделяется олово:
2K4[Sn(OH)6] = Sni + SnO2| + 8КОН + 2Н2О
Диоксиды SnO2 и РЬО2 — твердые кристаллические вещества, соответственно белого и коричневого цвета, обладающие разной химической активностью. Диоксид олова — химически инертное соединение, на которое не действуют водные растворы кислот и оснований даже при нагревании. Диоксид свинца — сильный окислитель; в частности, при растирании РЬО2 с серой последняя воспламеняется:
РЬО2 + 2S - PbS + SO2f
сероводород вспыхивает в соприкосновении с РЬО2:
4H2S + ЗРЬО2 - 3PbS + SO2 f + 4Н2О
а из хлороводородной кислоты диоксид выделяет хлор:
РЬО2 + 4НС1 = РЬС12 + Ci21 + 2Н2О
При нагревании SnO2 плавится около 2000 °C, а РЬО2 выше 300 °C разлагается:
2РЬО2 = 2РЬ0 + O2f
252
Оба оксида взаимодействуют с расплавами гидроксидов щелочных металлов:
SnO2 + 2КОН(Ж) = K2S11O3 + Н20
РЬО2 + 4К0Н(Ж) = К4РЬО4 + 2Н2О
Затвердевший расплав водой разлагается:
К4РЬО4 + 2Н2О = PbOn + 4КОН
а в концентрированном водном растворе КОН оксоанион превращается в гидроксоанион:
SnO + ЗН2О. ' [Sn(OH)6 ]2~
Синтез диоксидов основан на использовании реакций сжигания распыленного жидкого олова в кислороде:
8п(ж) + О2 “ SnO2
окисления оксидов и гидроксид-оксидов:
РЬО + КСЮ = РЬО2 + КС1
кон
РЬбО4(ОН)4 + 6С12 + 4Н2О = 6РЬО2 + 12НС1
гидролиза:
SnCU + 2Н2О = SnO2| + 4НС1
и разложения тетраоксида свинца (IV)-дисвинца (II):
(Pb2, Pb)O4 + 4HNO3 = РЬО2 + 2Pb(NO3)2 + 2Н2О
Двойной оксид (РЬг, РЬ)О4 — мелкокристаллический порошок светло-оранжевого или красного цвета, образуется в реакциях:
ЗРЬО + 0,5О2 = (РЬ2, РЬ)О4
ЗРЬСОз + 0,5О2 = (Pb2, Pb)O4 + 3CO2f
Двойной оксид не является механической смесью двух оксидов, ни их твердым раствором. Он имеет кристаллическую решетку, в которой атомы Pb(IV) и РЬ(П) находятся внутри различных по геометрии полиэдров, образованных атомами кислорода и связанных между собой в цепи. При нагревании на воздухе двойной оксид < разлагается без плавления:
(РЬ2, РЬ)О4 = ЗРЬО + 0,5О2 f
Его взаимодействие с HNO3 приведено выше, а с концентрированной НС1 он реагирует с выделением хлора:
(Pb2, Pb)O4 + 8НС1 - ЗРЬС12 + Cl2f + 4Н2О
Ги дроксокисл оты H2[Sn(OH)6] и Н2[РЬ(ОН)б] в индивидуальном состоянии не получены. При действии разбавленных
253
кислот и даже СОг на К2[РЬ(ОН)б] сразу же выделяется коричневый осадок РЬОг:
К2[РЬ(ОН)б1(р> + СОг = РЬОг! + К2СО3 + ЗНгО
Иначе протекают реакции при добавлении тех же реагентов к водному раствору K2[Sn(OH)61. В первый момент, видимо, выделяется кислота Нг[8п(ОН)б], которая тотчас же распадается на орто- и метакислоты, образующие аморфные студенистые осадки, причем ортокислота имеет амфотерный характер:
H2|Sn(OH)6]
H4SnO4
(H2SnO3)4; п = 0-5
SnOj-xHjO
Свежеосажденная ортооловянная кислота H4SnO4 взаимодействует и с КОН и НС1:
H4SnO4 + 2КОН + K2[Sn(OH)6]
H4SnO4 + 4НС1 - SnCl4 + 4H2O
С течением времени она становится менее активной, постепенно превращаясь в метаоловянную кислоту (Н25пОз)п, на которую почти не действуют ни кислоты, ни основания. Обе кислоты, теряя воду, переходят в нестехиометрический гидратированный диоксид олова (см. раздел 29.4). Ортооловянная кислота получена также при низкотемпературном гидролизе SnCl4 и действии на него водных растворов КОН и NH3. Метаоловянная кислота образуется при высокотемпературном гидролизе SnCl4 и по реакции Sn + HNO3.
14.16. СОЛИ
Олово и свинец образуют соли только в степени окисления +11. Соединения олова и свинца (IV) являются, как правило, ковалентными, подвергающимися полному гидролизу (кроме SnS2). Известны тетраацетаты, дисульфаты, тетраазиды олова и свинца, тетрагалогениды олова, тетрафторид PbF4 и тетрахлорид свинца РЬС14, Sn(NO3)4, Sn(NCS)4, SnS2. Среди этих соединений только РЬС14 и SnCl4 — жидкости, остальные — кристаллические вещества. Соединения свинца (IV) обладают сильными окислительными свойствами и, как правило, менее термически устойчивы, чем соединения олова (IV); например, Pb(Na)4 относится к взрывчатым соединениям, а РЬС14 в обычных условиях легко разлагается на РЬС12 и С12-Соединения олова (IV) и свинца (IV) обладают большой склонностью к комплексообразованию.
В отличие от солей олова (II) соли свинца (II) (галогениды, хромат, карбонат, фосфат, сульфат, тиоцианат, азид и сульфид)
254
малорастворимы в воде. К очень небольшому числу растворимых в воде солей следует отнести прежде всего нитрат и ацетат свинца.
Молекулы дигалогенидов олова и свинца в газообразном состоянии имеют угловую структуру (sp-гибридизация с неподеленной парой электронов), а молекулы тетрагалогенидов олова имеют тетраэдрическую структуру (sp-гибридизация). Ниже рассмотрены некоторые свойства галогенидов, сульфидов, нитратов, сульфатов и карбонатов олова и свинца.
Галогениды. Дигалогениды олова (II) и свинца (II) — бесцветные (MFz и МС12, где М « Sn, Pb), окрашенные в желтый (МВг2) и оранжево-красный цвета (М1г) кристаллические вещества, плавящиеся без разложения. Наиболее легкоплавким из них является SnF2 (т. пл. 215 °C), а тугоплавким РЬРг (т. пл. 822 °C). Дигалогениды олова в отличие от дигалогенидов свинца хорошо растворимы в воде (кроме Snl2). Растворимость всех дигалогенидов уменьшается от фторидов к иодидам.
Хлорид олова (II) SnCh • 2НгО образует молекулярные кристаллы (см. раздел 6.3), состоящие из пирамидальных молекул [Sn(H2O)Cl2]° и обособленных молекул воды. Видимо, такими же соединениями являются бромиды и иодиды Sn(II).
Известно много галогенидов Sn(II) и РЬ(П), содержащих разные галогены: SnCIF, PbCIF, БпгОРз, SnjBrFs и др. В последнем галогениде присутствует плоский катион (Sn3F5) .
Гидролиз дигалогенидов протекает с образованием сложных ионов (см. раздел 14.15), причем дигалогениды олова подвергаются гидролизу в большей степени, чем дигалогениды свинца. Дигалогениды олова проявляют в водном растворе восстановительные свойства:
SnC12 + HgCh = Hg 1 + SnCU SnCh + 2FeCl3 - SnCl4 + 2FeCh
Получение дигалогенидов олова и свинца основано на использовании реакций:
Sn + 2НС1 = SnCl2 + Hzt Pb(CH3COO)2 + 2KI = РЫ21 + 2CH3COOK Pb(NO3)2 + 2KF = PbF2l + 2KNO3
Тетрагалогениды олова и свинца — ковалентные соединения: тетрахлориды — жидкие вещества, а остальные тетрагалогениды — кристаллические соединения. Из-за восстановительных свойств анионов В г и Г и сильной окислительной способности Pb(+IV) тетрабромиды и тетраиодиды свинца не образуются, а РЬРд и РЬСЦ проявляют окислительные свойства. Тетрагалогениды крайне чувствительны к влаге. Их гидролиз протекает в соответствии с уравнениями:
PbF4 + 2Н2О - РЬО21 + 4HF
SnCl4 + 6Н?О. - H2[Sn(OH)61 + 4НС1
255
Методы синтеза тетрагалогенидов включают реакции, осуществляемые либо в неводных средах, либо между твердыми и газообразными реагентами:
Sn + 2С12 “ SnCl4
SnCU + 4KI = Snl4 + 4KC1
o°c
РЬОг + 4HC1 = PbC14 + 2H2O
Pb(CH3COO)4 + 4HF - PbF4l + 4CH3COOH
Сульфиды. Олово образует два сульфида: SnS коричневого цвета с т. пл. 880 °C, и SnS2 желто-золотистого цвета, разлагающегося выше 630 °C на SnS и S. У свинца известен один сульфид PbS черного цвета с т. пл. 1077 °C. При нагревании на воздухе сульфиды превращаются либо в оксиды, либо окисляются до сульфатов:
2PbS + ЗО2 = 2РЬ0 + 2SO21
PbS + 2О2 = PbSO4
SnS + 2O2 = SnO2 + SO2 f
В последней реакции SnO не образуется из-за легкого его окисления, a SnSO4 легко разлагается на SnO2 и SO2.
Сульфиды SnS и PbS взаимодействуют с кислотами при нагревании:
3SnS + 8HNO3OM) = 3Sn(NO3)2 + 2N0f + 3Si + 4H2O PbS + 2H2SO4(18M) = PbSO4 I + SO2? + Si + 2H2O При реставрации потемневших картин применяют реакцию окисления S(—II) до S(+VI), которая приводит к образованию PbS04 белого цвета:
PbS + 4Н2О2 = PbSO4 + 4Н2О
Дисульфид олова, полученный взаимодействием Sn и S, — химически инертное вещество по отношению к кислотам, кроме смеси HNO3 и НС1, но активное при действии водных растворов КОН и сульфидов щелочных металлов и аммония:
SnS2 + 2K2S К4 [SnS4 ]
3SnS2 + 6ОН- г^пЗз]2- + [Sn(OH>6]2-
Сульфиды SnS и PbS отличаются друг от друга по взаимодействию с полисульфидами:
SnS + KiS2«—- K2[SnS3 ]
На PbS ни сульфиды, ни полисульфиды не действуют. Дисульфид олова может образовывать в зависимости от условий тритио- и тетратиостаннаты:
SnS2 + K2S K2[SnS3 ]
256
Соляная кислота выделяет из тиостаннатов золотисто-желтые пластинки SnSi («сусальное золото»):
[SnS312- + 2Н3О+ - SnS21 + H2S t + 2НгО
Сульфиды получают при помощи простых реакций:
SnC12(P> + H2S = SnS l + 2НС1
SnCl4 + 2H2S - SnS2l + 4HC1
Pb(NO3)2 + K2S = PbS 1 + 2KNO3
Дитраты, сульфаты и карбонаты. Нитрат свинца РЬ(ЬЮз)2 относится к наиболее широко используемым в промышленности и лабораторной практике соединениям свинца. Он выделяется из водных растворов в виде бесцветных и безводных кристаллов. При 380 °C сухой Pb(N0a)2 плавится с разложением:
2РЬ(Ь10з)2 - 2РЬО + 4NO2T + Ог!
Сульфаты SnSO4 и РЬ80д (см. табл. 14) резко отличаются друг от друга по своей растворимости в воде и термической устойчивости. Сульфат олова хорошо растворим в воде, подвергается гидролизу и разлагается при нагревании:
SnSO4“ SnO2 + SO2 Т
a PbSC>4 — малорастворим в воде и плавится без разложения при 1170 °C. Сульфаты Sn(SC>4)2 • 2НгО и Pb(SC>4)2 кристаллизуются только из концентрированной H2SO4 и при действии воды подвергаются полному гидролизу:
Sn(SO4)2 + 4НгО = H2SnC>4| + 2H2SO4
Pb(SO4)2 + 2НгО = РЬОг! + 2H2SO4
Карбонат олова — малоустойчивое соединение, а РЬСОз выделяется из водных растворов в виде мелкокристаллического осадка в реакциях, где концентрация ОН~-ионов ничтожно мала:
Pb(NO3)2 + (NH4)2CO3 = РЬСОз; + 2NH4NO3
Pb (СНзСОО) 2 + СО2 + Н2О = РЬСОз I + 2СН3СООН
Карбонаты щелочных металлов, образующие при гидролизе слабощелочную среду, осаждают только основный карбонат свинца нестехиометрического состава хРЬ(ОН)г • уРЬСОз.
14.17. ПРИМЕНЕНИЕ
Народнохозяйственное значение соединений элементов IVA-rpyn-пы неоценимо. Углерод — это не только горючее в различных энергетических устройствах, но и важнейший конструкционный материал (реакторы, электроды электрохимических производств, нагревательных элементов). Из углерода готовят твердые смазки, отражатели нейтронов в ядерных реакторах, стержни для карандашей.
9 -1258
Технический углерод (или сажу) применяют в производстве резин, пластмасс, типографских красок, копировальной бумаги, сухих электрических батарей. Алмаз ценится не столько как драгоценный камень, сколько как вещество, без которого невозможно современное развитие нефтяной и машиностроительной промышленности (буровые долота, резцы, сверла, шлифовальные порошки и др.).
Полупроводниковые Si, Ge и SiC применяют в электротехнике и электронике (диоды, транзисторы, высоковольтные тиристоры, фотопреобразователи, термо- и фоторезисторы и т. п,). Технический кремний — легирующая добавка в производстве сталей и сплавов цветных металлов. Диоксид кремния разной чистоты в больших количествах идет на производство кварцевого стекла, а кремний-органические соединения находят широкое применение в производстве термически и химически стойких полимерных материалов.
Жидкий СОг применяют для транспортировки угля по трубопроводам (12 МПа, температура от - 24 до - 4 °C). Твердый СОг — хладоагент («сухой лед»), а газообразный — сырье для производства соды, карбамида и других веществ. Монооксид углерода — высококалорийное топливо, восстановитель в черной и цветной металлургии, сырье для органического синтеза. Монооксид кремния — первоклассный диэлектрик, используемый для пленочных защитных покрытий в микроэлектронике.
Углеродное волокно применяют как армирующий наполнитель композиционных материалов, для изготовления теплоизоляции, защитной одежды; волокно обладает исключительно высокой теплостойкостью (до 2000 °C в отсутствие кислорода).
Углеграфитовые материалы нашли широкое применение в химии для изготовления различной арматуры и насосрв для перекачки фтороводородной, хлороводородной и серной кислот, травильных и электролизных ванн, абсорберов и ректификационных колонн.
Около 60% выплавляемого олова идет на производство сплавов с Си (бронза), с Zn (латунь), с Sb (баббит), с Zr (для атомных реакторов), с Ti (для турбин), с Nb (для сверхпроводников).
Свинец применяют для изготовления электродов аккумуляторов, контейнеров для перевозки и хранения радиоактивных веществ. Большие количества свинца идут на изготовление разнообразных сплавов.
Тетраметил- и тетраэтилсвинец — антидетонационные присадки к бензину и компоненты катализаторов полимеризации олефинов. Оксид, сульфат, хромат и карбонат свинца нужны для производства специальных стекол, красок и эмалей. Диоксид свинца используют как окислитель, а дифторид — в качестве твердого электролита и материала катодов в химических источниках тока; стеарат и фталат свинца — термо- и светостабилизаторы пластмасс.
Диоксид олова — белый пигмент для высококачественных эмалей и глазурей, материал для пленочных резисторов и прозрачных токопроводящих покрытий. Дихлорид олова — восстановитель в органическом синтезе, протрава при крашении тканей, компонент флюса при сварке металлов.
258
Дисульфид углерода необходим для получения вискозы, ксанто-генатов целлюлозы, растворителей смол, жиров, каучуков, серы и других веществ. Карбамид — ценное азотное удобрение.
14.18. ТОКСИКОЛОГИЯ
Соединения С, Si и Ge с галогенами, азотом и серой относятся к категории токсичных веществ. Циановодород, дициан, цианиды металлов принадлежат к сильнодействующим ядам. Уже 50 мг HCN достаточно, чтобы убить человека. Смерть наступает в течение нескольких секунд из-за паралича дыхания. Оксид-дихлорид углерода ССЦО обладает удушающим действием. Смертельная концентрация 0,1—0,3 мг/л. Это вещество применяли под названием фосген как боевое отравляющее вещество в первую мировую войну. Гало-генпроизводные циана CNC1, CNBr и CNI принадлежат к категории слезоточивых отравляющих веществ. Монооксид углерода — ядовитый газ. Сродство гемоглобина крови к СО гораздо больше, чем к кислороду воздуха. При концентрации (мае. долях) СО в воздухе около 0,06% наступает потеря сознания. Вредным для человека является воздух с повышенным содержанием СОг. Вдыхание воздуха с 10%-ным содержанием СОг вызывает потерю сознания и смерть вследствие остановки дыхания.
Высокой токсичностью обладают тетраметил- и тетраэтилолово и свинец. Свинец и его неорганические соединения — яды, действующие на все живое, вызывающие изменения в нервной системе, крови и сосудах.
Упражнения к главе 14
1. Как получают в промышленности алмазы?
2. Какие реакции следует использовать дпя получения РЬСОЗ?
3. Как взаимодействует в обычных условиях кремний с серой, хлороводородной и азотной кислотами?
4. Можно пи разделить химическим способом смесь порошкообразных алмазов и кремния?
5. Как протекает гидролиз соединений олова (IV) и свинца (IV)? Приведите примеры реакций.
б. Какие реакции применяют дпя получения особо чистых поликристаппических кремния и германия?
7. Какие вещества образуются при нагревании на воздухе SnS и PbS?
8. В водном растворе присутствуют сопи опова (II) и свинца (II). При помощи каких реакций можно обнаружить их присутствие и произвести разделение?
9- Как взаимодействует двойной оксид (Pb ", Pb'^)O4 с азотной кислотой и что с ним происходит при нагревании на воздухе?
10.
Рьо?
Что
происходит
при нагревании на
воздухе SnO и
.. В водном растворе находятся ионы Ва2* и свинца ' )> Мд2 и опова (II). Как обнаружить их присутствие?
9*
259
12. Приведите реакции присоедииеиия и восстаиовпеиия для моиооксида углерода.
13. Как можно получить чистый диоксид кремния?
14. Как протекают реакции взаимодействия ЫНз(г) и СО2(г); NH3(r); СО2(Г) и Н2О(ж)?
15. У вас имеется два карбида неизвестного состава. При взаимодействии с водой у одного из них наблюдалось выделение ацетилена и образование осадка Zn(OH)2, а у другого — выделение метана и образование осадка А1(ОН)3-Определите состав этих карбидов.
16. Можно пи выделить свинец из сплава олова со свинцом в виде одного из его соединений, действуя иа сплав газообразным хлором?
17. В оловянный сосуд, содержащий кусочки свинца, запили разбавленную серную кислоту. Что можно обнаружить на следующий день?
18. Какие вещества относят к псевдогапогеиам и лсев-догапогенидам?
19. Можно пи разделить диоксиды опова и свинца без изменения химического состава SnO2?
20. С помощью каких реакций можно выделить из смеси SnS2 и SnS дисульфид опова?
21. Можно ли хранить водные растворы HF в свинцовых сосудах?
22. Отличаются пи по своей структуре молекулы диоксида и дисульфида углерода?
ГЛАВА 15. ХИМИЯ ЭЛЕМЕНТОВ VA-ГРУППЫ
В VA-группу периодической системы элементов входят азот N, фосфор Р, мышьяк As, сурьма Sb и висмут Bi. Если первые два элемента являются типичными неметаллами, то висмут принадлежит уже к металлам.
Общая электронная конфигурация невозбужденных атомов элементов VA-группы (валентные электроны) — ns пр3 с тремя неспаренными электронами на p-АО. Присоединение электрона к этой довольно устойчивой электронной конфигурации энергетически невыгодно, как и удаление одного из электронов с p-АО. Поэтому степени окисления (+1) и (-1) в соединениях рассматриваемых элементов встречаются редко, а сами соединения отличаются неустойчивостью.
Степень окисления (+ III) реализуется в соединениях с более электроотрицательными элементами — фтором, кислородом и хлором, например NF3, HNO2, В12О3, PCI3, AsC13. Степень окисления (-III) имеют элементы в гидридах (NH3, РНз), нитридах (L13N, Mg3N2, CI3N), фосфидах (СазРг), арсенидах (KjAs), стибидах (Mg3Sb2) и висмутидах (LisBi).
260
15.1. ОБЩАЯ ХАРАКТЕРИСТИКА СОЕДИНЕНИЙ ЭЛЕМЕНТОВ VA-ГРУППЫ
В соответствии с практическим рядом электроотрицательностей (см. раздел 2.4) соединения азота с галогенами NF3 и CI3N называют трифторидом азота и нитридом трихлора. Соединения отличаются по характеру необратимого гидролиза:
NF3 + 2Н2О = HNO2 + 3HF; CI3N + ЗН2О - NH3 + ЗНСЮ
При переходе от азота к фосфору и другим элементам VA-группы степень окисления (+ III) становится все более устойчивой, усиливается основный характер соединений. Если HNO2 и Н2(РНОз) — кислоты, НзАзОз — амфотерное соединение с преобладанием кислотных свойств, БЬгОз • хН2О — амфотерное соединение с преобладанием основных свойств, то Bi(OH)3 — типичный гидроксид металла.
В атоме азота различие в .энергиях 2s- и 2р-АО составляет 420 кДж/моль электронов, а различие в энергиях 2р- и 3s-AO возрастает до 1250 кДж/моль. Поэтому разъединение пары s-электронов при образовании химической связи и переход одного из них на 3s-AO энергетически невыгоден. Следовательно, максимально возможное число ковалентных химических связей у атома азота с атомами других элементов равно четырем и, естественно, валентность азота не может быть больше четырех: три связи образуются по обменному механизму, а одна связь — по донорно-акцепторному.
Например, F3N -» О, Н—О—N .
Азот является единственным элементом VA-группы, который существует в обычных условиях в виде двухатомной молекулы с тройной связью :N^Nl и сохраняет эту форму в твердом и жидком состояниях. Азид-ион N з с кратными связями также характерен только для азота.
У фосфора различие в энергиях Зр- и 4s-AO уменьшается и составляет 720 кДж/моль электронов. Появляется возможность для электронного перехода 3s23p3 -» 3sI3p34sI (или 3«) с появлением пяти неспаренных электронов и образования пяти ординарных о -связей или ординарных и кратных связей. Это объясняет, почему у фосфора существуют соединения состава PF5 или PCI5, а у азота такие соединения неизвестны. В соединениях POF3 или PCI3O у фосфора появляется двойная связь с кислородом F3P—О, валентность фосфора равна пяти.
Подробнее см.: Бочвар Д. А., Гамбарян Н. П., Эпштейн Л. М. Усп. химии, 1976. Т. 45. С. 1316.
Кроме того, в кислородных соединениях фосфора наблюдается
Дополнительное dn - Рл-связывание Р — О в результате перекрывания вакантных J-АО фосфора с p-АО кислорода. Образование
261
дополнительных связей подтверждают стабильность и многообразие кислородных соединений фосфора.
Устойчивость степени окисления (+ V) в соединениях элементов VA-группы понижается с увеличением порядкового номера элемента, и соединения Sb(V) и Bi(V) легко разлагаются и проявляют сильные окислительные свойства:
Sb2O5 + ЮНС1 - 2SbC13 + 2Chf + 5Н2О
2Mn2+ + 5ВЮз + 14Н+ - 2МпО4 + 5Bi3+ + 7Н2О
Оксиды As(V), Sb(V) и Bi(V) в отличие от оксида Р(У) мономерны (AS2O5, Sb2O5 и Bi2O5) и не могут быть получены подобно Р4О10 прямым окислением As, Sb или Bi, так как при высоких температурах они разлагаются до оксидов элементов (III) с потерей кислорода. Их кристаллические структуры различны: кристаллы AS2O5 состоят из тетраэдров AsO4 и октаэдров АзОб! кристаллы Sb2O5 построены из октаэдров SbOe, соединенных вершинами и ребрами, а структура кристаллов Bi2O5 пока не изучена.
Оксоанионы Sb(V) составов SbOi , 8ЬОз или Sb2O^ не существуют, в кристаллах и растворах обнаружены только гидроксоком-плексы состава [Sb (ОН) б Г-
У висмута, как и у других «тяжелых элементов» шестого периода (Pb, Hg, Т1), наблюдается эффект «инертной па р ы» s-электронов. Эта пара не участвует в ряде случаев в образовании химических связей, несмотря на близость энергий ns-, пр- и nd-АО. Благодаря высокой проникающей способности s-AO и большому Заряду ядра атома, s-AO сжимаются и теряют способность к перекрыванию с АО других атомов. Участие s-AO в sp-гибридизации с увеличением атомного номера элемента также уменьшается, ослабевают и электронно-донорные свойства молекул гидридов. Так, ион PHj в водных растворах распадается на РНз и Н3О+, ион AsHj обнаружен только в следовых количествах в смеси АзНз и HI при низких температурах, а ионы SbHt И BiHt — неизвестны.
Усиление металлических признаков у простых веществ при переходе от азота к висмуту хорошо иллюстрирует их взаимодействие с HNO3:
3As + 5HNO3 + 2Н2О - 3H3ASO4 + 5NO f
3Sb + 5HNO3 + 8Н2О - 3H[Sb(OH)6] + 5NOf
Bi + 4HNO3 “ ВЦЬЮз)з + NO т + 2H2O
Среди кислородных соединений рассматриваемых элементов наиболее сильные восстановительные свойства проявляет фосфор (+1) и (+111):
РН2О2 + 2Ni2+ + 2Н2О - POi~ + 2Ni i + 6H+
В сильнокислой среде Нг(РНОз) восстанавливает НзАзОз до As:
262
ЗН2 (РНОз) + 2H3ASO3 - ЗН3РО4 + 2As I + 3H2O
Соединения элементов VA-группы с серой различаются по своей природе. Азот образует циклические нитриды серы S2NJ, S3N2, S4N4, S4N3 и др.; полимеры (SN)n; катионы (S2N) ; (S3N2) ; анионы (S4N5) . У фосфора известны сульфиды — желтые кристаллические вещества общей формулы ₽4SX: P4S3, P4S4, P4S5, P4S7, P4S9 и P4S10. Однако эти сульфиды не содержат группу Р4 в качестве общей структурной единицы. Сульфиды мышьяка, сурьмы и висмута не столь разнообразны: AS2S5, AS4S3, AS4S4, As4S5, AS4S6, Sb2S3, Sb2S5, Bi2S3.
Химия катионов элементов VA-группы обширна. Она включает химию таких катионов, как NHj, NO+, NOj, [Bi6<OH) 12 J6* (pH ~ 7); [В1бОб(ОН)з ]3+ (pH > 8), а в неводных средах полиатомных катионов состава Bi§+, Bi§+. Одноядерные аквакатионы висмут не образует.
15.2. РАСПРОСТРАНЕННОСТЬ В ПРИРОДЕ. ОСНОВНЫЕ МИНЕРАЛЫ
Наиболее распространенным элементом VA-группы является фосфор (0,09%), важнейшие руды которого апатит ЗСаз(РО4>2 • • Са(С1, ОН, F)2 и фосфориты, состоящие главным образом из фторид-гидроксид-карбонат-апатита CaioPsC023(OH, F)3. В апатитовой руде основной минерал, содержащий фосфор, — фторапатит ЗСаз(РО4)2 • СаРг.
Крупнейшие залежи апатитовых руд сосредоточены на Кольском полуострове, а фосфоритов — в районе горного хребта Каратау. По общим запасам фосфатного сырья Россия занимает одно из ведущих мест в мире.
Азота на Земле всего 0,03%. Основные запасы его сконцентрированы в атмосфере (4 • 1015 т или 75,6%). В земной коре азот встречается в виде нитратов натрия и калия, промышленные месторождения которых почти полностью выработаны. Ежегодно каждый гектар Земли получает с дождями и снегом до 7—8 кг связанного азота в виде HNO3, HNO2 и NH4NO3, образование которых происходит в атмосфере во время гроз и электрических разрядов. Содержание азота в живых организмах достигает 1—10%, но животный мир не сам усваивает азот, а потребляет его в виде белков растительного мира. Таким образом, биосфера является накопителем связанного азота (~1О10 т).
14 Азо^ природных объектов состоит из двух стабильных изотопов N и ЭМ, концентрация которых в атмосфере равна соответственно 99,63 и 0,37%. Азот — единственный элемент на Земле с наиболее Распространенными ядрами нечетно-нечетного типа (7 протонов + 7 нейтронов).
Содержание As, Sb и Bi в земной коре относительно невелико: 1 • Ю э—5 • Ю-4%. Встречаются эти элементы в природе в виде сульфидов: реальгара AS4S4, аурипигмента AS2S3, ар-сенопирита Fe(As, S)2, антимонита БЬгБз и висму-
263
то ₽ о го блеска BiiSa- В небольших количествах As, Sb и Bi найдены в самородном состоянии.
Среди всех элементов VA-группы наиболее рассеянным является As. Многие металлы, полученные из сульфидных руд, почти всегда содержат примесь As, удаление которого представляет сложную технологическую задачу. Висмут имеет единственный природный изотоп 209 с самым высоким атомным номером среди изотопов всех элементов, устойчивых к радиоактивному распаду.
История открытия элементов. Сурьма была известна за 1000 лет до н. э. как в виде соединений, так и в виде простого вещества. Открытие мышьяка приписывают’ Альберту. История открытия висмута не выяснена до конца, так как даже в XVII в. этот металл путали с Sb, Sn и РЬ. Получение висмута описано Агриколой. Фосфор впервые выделил Бранд в 1669 г. нагреванием без доступа воздуха остатка от выпаривания мочи. Азот был открыт в 1772 г. Резерфордом, давшим ему название «зловредный воздух». Затем азот получили почти одновременно Кавендиш, Шееле, Пристли и Лавуазье, который в 1775 г. предложил для элемента название азот.
Альберт фон Болыштедг Великий (1193—1280) — немецкий монах-алхимик, епископ.
Агрикола Георгий (1494 — 1555) — немецкий алхимик, металлург, врач и филолог.
Бранд Хенниг (1630—1710) — немецкий купец-алхимик. Резерфорд Даниэль (1749—1819) — шотландский химик. Шееле Карл Вильгельм (1742—1786) — шведский химик, фармацевт по самообразованию, открыл кислород, хлор и марганец; впервые получил SOg, WO3, МоО3, H2S, HF и многие другие вещества, член Шведской АН.
Пристли Джозеф (1733—1804) — английский химик, священник по образованию, профессор лингвистики, открыл кислород; впервые получил в чистом виде N О, HCI, NH3, S1F4, SO2„ СО, член Лондонского Королевского общества, иностранный член Петербургской АН.
15.3. ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА АЗОТА
В обычном состоянии азот — бесцветный газ, без запаха и вкуса, состоящий из двухатомных молекул N2 с энергией связи в 945 кДж/моль и длиной связи :N—N:, равной НО пм. Диссоциация молекулы азота заметно не наступает даже при 3000 °C, молекула практически не подвергается поляризации и не взаимодействует с себе подобными, поэтому азот имеет очень низкие т. пл. (-210 °C) и т. кип. (- 196 °C) малорастворим в воде и органических растворителях.
С прочностью молекулы азота связана и его относительная химическая инертность. В обычных условиях азот взаимодействует только с литием, образуя нитрид L13N. При высоких температурах азот окисляет многие металлы и неметаллы, особенно с малой атомной массой, переводя их в нитриды:
3Mg + N2 = MgjN2; 2В + N2 = 2BN
264
Азот способен растворяться во многих металлах, образуя твердые растворы внедрения.
№ Твердый раствор внедрения — фаза переменного состава, в которой К атомы примеси расположены неупорядоченно в межузельном про-I странстве.
С галогенами азот непосредственно не соединяется, а оксиды азот образует только в искровом разряде. Молекулярный азот способен взаимодействовать с соединениями металлов "УШБ-группы, находящихся в низшей степени окисления (+11) или (+ III). Например, связывание N2 в водном растворе при атмосферном давлении [Ru(H2O)(NH3)5]2+ + N2^=? [Ru(NH3)5N2]2+ + Н2О
протекает за счет с?л - Рл -взаимодействия. Связь Ru—N—N: является линейной с участием неподеленной электронной пары, находящейся на J-AO Ru (II) и вакантной л*-МО молекулы азота без нарушения ее тройной связи (азот выступает как л-акцепторный лиганд).
Получены бесцветные кристаллы [M(NH3)5N2]X2, где M = Ru, Os, а X — СГ, Вг~, Г, [BF4]-. В частности, комплекс [Os(NH3)5N2]Cl2 устойчив, разлагается только при температуре выше 200 °C. Известные в настоящее время соединения с молекулярным азотом (нитрогенильные комплексы) диамагнитны. Очевидно, такие соединения образуются атомами металлов, находящимися в низкоспиновом состоянии (подробнее см. раздел 27.7).
В промышленных масштабах азот получают только из жидкого воздуха при его фракционированной перегонке: жидкая фаза будет состоять из жидкого кислорода (т. кип. — 183 °C). В лабораторной практике применяют для получения азота следующие реакции:
2NH3 + 3Br2 = N2f + 6НВг
NH4CI + NaNO2 = N?T + NaCl + 2Н2О
60”С
NH4NO2(p> = N2t + 2H2O
(сухая соль NH4NO2 при этой температуре взрывается, способна к детонации).
15.4. НИТРИДЫ
Нитридами называют бинарные соединения азота с более электроположительными элементами. С литием (остальные щелочные металлы не образуют нитридов, устойчивых в обычных условиях), Щелочно-земельными металлами, магнием, металлами 1Б- и ПБ-гРупп периодической системы азот образует ионные нитриды, твердые вещества, кристаллы которых содержат анионы N ’ .
Подробнее см.: Самсонов Г. В. Неметаллические нитриды. — М.: Металлургиздат, 1969.
Ионные нитриды подвергаются необратимому гидролизу и разлагаются разбавленными растворами кислот:
265
Cu3N + 4HC1 - ЗСиСЦ + NH4C1
Mg3N2 + 6H2O - 2NH3f + 3Mg(OH)2
С неметаллами (В, Si, P, S) и металлами, принадлежащими к секции p-элементов (Al, Ge и др.), азот образует ковалентные, в ряде случаев нестехиометрические нитриды (BN, AIN, S4N4, Si3N4 и др.), отличающиеся большим разнообразием свойств. Например, /?-BN (эльбор, боразон) выдерживает нагревание на воздухе до 2000 °C, поддается воздействию хлора только выше 700 °C, близок по твердости к алмазу, но разлагается кипящей водой и разбавленными растворами кислот:
BN + 3H2O= B(OH)3i + NH3f
Нитрид серы S4N4 при нагревании распадается со взрывом, а Si3N4 обладает исключительно высокой химической стойкостью; вода и кислоты, кроме HF, на это вещество не действуют даже при нагревании, его разрушают только расплавы гидроксидов щелочных элементов.
Большинство d-элементов образуют с азотом нестехиометрические продукты внедрения, в которых атомы азота занимают полости в кристаллической решетке металлов. Поэтому такие нитриды по внешнему виду, электрической проводимости и теплопроводности напоминают металлы, но отличаются от последних своей высокой химической инертностью, твердостью и тугоплавкостью. В частности, Ta3N5-x и TiNj плавятся при 3360 и 3220 °C соответственно, а их твердость составляет 8—9 единиц по шкале Мооса.
в Шкала твердости Мооса — цифровая шкала от 1 (тальк) до 10 | (алмаз), оценивающая твердость веществ по их способности ца-нрапать друг друга.
Для получения нитридов используют реакции непосредственного взаимодействия простых веществ при высокой температуре, например ЗМп + N2 = Mn3N2 (горение Мп в атмосфере азота). Применяют также реакции:
СгС13 + NH3 = CrN + ЗНС1
ЗСиО + 2NH3 = Cu3N + 0,5N2t + ЗН2О
3Zn(NH2)2 = Zn3N2 + 4NH3f
15.5. СОЕДИНЕНИЯ АЗОТА С ВОДОРОДОМ
Азот образует с водородом аммиак NH3, гидразин N2H4, азидоводород ЙКэ, гидроксиламин NH2OH и некоторые другие соединения. Среди этих веществ только NH3 и NH2OH являются экзотермическими соединениями. Гидразин и азидоводород — термодинамически неустойчивые соединения, их Д/7° (298 К) равно соответственно 149 и 327 кДж/моль.
266
Гидразин, гидроксиламин и азидоводород склонны при нагревании, введении катализаторов или при облучении подвергаться реакциям диспропорционирования с образованием азота и аммиака (см. раздел 33.3):
3№Н4= N2f + 4NH3
3NH2OH - Nit + NH3f + ЗН2О
hv
3HN3 = 4Nit + NHat
А м м и а к — полярная Ui - 2,46D) молекула, имеет пирамидальное строение, связанное с sp-гибридизацией АО азота. Одна из вершин тетраэдра занята орбиталью с неподеленной парой электронов. Расстояние N—Н около 100 пм, валентный угол равен 108,2 , а энергия связи N—Н составляет 389 кДж/моль (см. раздел 5.3).
Ниже — 33 °C аммиак образует бесцветную жидкость. Константа автопротолиза:
2NH3 = NH| + NH2, Ks = 2- IO"33 (— 50 °C)
Жидкий аммиак — сильный ионизирующий растворитель. Слабые кислоты (H2S, HCN и др.) в его среде превращаются в сильные, а некоторые соли ведут себя как кислоты и основания (см. раздел 10.2). Например, соли аммония становятся сильными кислотами, а амиды металлов — сильными основаниями. Поэтому в среде ИНз(Ж) соли аммония и амиды металлов взаимодействуют как кислоты и основания:
NH4Cl(p) + NaNH2(p) - NaCl| + 2ННз(Ж>
Жидкий аммиак растворяет Sg, Р4, соли аммония, амиды металлов, иодид серебра, иодиды и нитраты щелочных металлов.
Аммиак хорошо растворим в воде (при 0 °C 1 л Н2О растворяет 1176 л NH3), с которой частично взаимодействует:
NH3 + H2O^=t NH3’H2O.- -- NHj+OH-
Для этой реакции константа основности Ко (25 °C) = 1,8»10-5. При температурах ниже — 80 °C удалось выделить два гидрата аммиака ИНз^НгО и 2NH3»H2O в виде бесцветных кристаллов, не содержащих ни ионов NHJ и ОН-, ни молекул NH4OH.
Аммиак принадлежит к сильным восстановителям. Он воспламеняется в атмосфере F2 и С12:
2NH3 + ЗС12 - N2 + 6НС1
Аммиак воздействует с Вг2 (см. получение N2), горит в чистом Ог:
2NH3 +1,50г = N2 + 3H2O
а при участии катализаторов (Pt) окисляется до NO:
4NH3 + 50г - 4NO + 6Н2О; АН0 (298 К) “ — 1170 кДж/моль
267
Аммиак при нагревании (а также жидкий аммиак) взаимодействует с щелочными и щелочно-земельными металлами, бериллием Be и магнием Mg, образуя амиды металлов, например NaNHi, Be(NH2)2, Ca(NH2>2. Структуры амидов, содержащих анион NH2, имеют большое сходство со структурами галогенидов s-элементов.
Аммиак образует соли аммония почти со всеми известными кислотами. Ионы NHJ в кристаллических солях, как правило, способны вращаться либо проявлять ориентационную неупорядоченность. Вращению препятствует образование водородных связей. Так, в кристаллическом NH4F ионы NHJ не вращаются из-за связей N—H—F.
Все соли аммония, за небольшим исключением, хорошо растворимы в воде. Соли аммония, содержащие анионы нелетучих кислот, разлагаются при нагревании подобно сульфату аммония:
(NH4)2SO4 - NH31 + NH4HSO4
Другие примеры:
NH4C1(K) = NH3(r) + НС1(г) (NH4)2CO3(k) - 2NH3T + CO2f + Н2О
NH4NO3(m) - N2Ot + 2НгО
Для синтеза аммиака в промышленных условиях применяют реакцию
N2(r) + ЗН2(г) - ' 2NH3(rt; ДЯ° (298 К) - — 92 кДж
Выход NH3 увеличивается с увеличением давления и понижением температуры, но ниже 200—300 °C скорость взаимодействия N2 и Нг невелика. Увеличение скорости реакции достигается при использовании катализаторов (см. раздел 33.3). У нас до 90% аммиака производят на установках, работающих под давлением 20—30 МПа и температурах около 450 °C с применением плавленых катализаторов на основе (Fe11, Fe5’)O4 с добавками AI2O3 и SiOi, увеличивающими активность катализаторов. В лабораторных условиях часто применяют реакцию
2NH4C1 + Са(ОН)2 = 2NH3 Т + СаС12 + 2Н2О
Гидразин N2H4 — бесцветная, сильно дымящая на воздухе жидкость с т. пл. 1,5 °C и т. кип. ИЗ °C, смешивающаяся с водой во всех отношениях. Молекула гидразина имеет изогнутую форму (рис. 58). Наличие неподеленных пар электронов у атома азота сообщает молекуле N2H4 донорные свойства.
В водном растворе N2H4, образует гидраты ИгЩ’НгО и НгН4»2НгО, которые ведут себя как слабые основания, с образованием катионов гидразиния (1) NiH^ и гидразиния (2) НгН?+:
268
Рис. 58. Структуры молекул N2H4 (a), NHjOH (б), HN3 (в) (межатомные расстояния даны в пм)
N2H4 + Н2От=? N2H4«H2O n2h? + ОН , Ко = 8 И (Г7 (25 °C)
N2H4 + 2Н2О - ’ N2H4«2H2O N2H?+ + 2ОН-,
Л'о = 9»Ю16'(25 °C)
Полагают, что в катионах гидразиния образуются непрочные ковалентные (7-связи N—Н по донорно-акцепторному механизму. Из водного раствора кристаллизуется только моногидрат ЫгЬЦ’НзО, плавящийся при — 51 °C и кипящий при + 119 °C.
Подробнее см: Брикун И. К, Козловский М. Т., Никитина Л. В. Гидразин и гидроксиламин и их применение в аналитической химии. — Алма-Ата: Наука, 1967.
Гидразин и его гидраты взаимодействуют с кислотами как слабые основания с образованием солей гидразиния: N2H5CI, (N2H5)HSO4. Почти все соли гидразиния, подобно солям аммония, хорошо растворимы в воде и малорастворимы в органических растворителях. Соли гидразиния подвергаются сильному гидролизу:
N2H5CI = N2Hj" + СГ
N2h£ + Н2О ;---Н3О+ + N2H4
Гидразин и его гидраты, подобно аммиаку, осаждают малорастворимые гидроксиды металлов из растворов их солей:
А1С13 + 3N2H4*H2O - А1(ОН)з1 + 3N2H5CI
Гидразин является сильным восстановителем в щелочных растворах:
N2 + 4Н2О + 4ё~ » N2H4 + 4ОН", ^ = — 1,12 В
N2 + 5H+ + 4e-”N2H?, ^ = — 0,23 В
269
Поэтому гидразин осаждает в щелочной среде из раствора CuSO< не Си (ОН) 2, а Си (при нагревании) или СигО (в обычных условиях):
2Cu2+ + N2H4 + 4ОН"= 2Cul + N2T + 4Н2О
Другие примеры окислительно-восстановительных реакций с участием гидразина:
N2H4 + 21г = N2 f + 4HI; N2H4 + 2Н2О2 = N2 Т + 4Н2О
Гидразин и его водные растворы легко окисляются кислородом воздуха:
N2H4 + О2 = N2f + 2Н2О, ДЯ ° (298 К) - — 622 ”Дж
Окисление катализируется солями некоторых (/-элементов.
Гидразин образует взрывоопасные смеси с воздухом, способен к самовоспламенению при контакте с углем, оксидами меди, никеля, хрома и других металлов.
Для получения гидразина применяют два метода; в одном — к щелочному раствору карбамида, содержащему катализатор (MnCh или MnS04), при 25 °C добавляют водный раствор оксохлората натрия:
(NH4)2CO + NaClO + NaOH = N2H4 + NaCl + NaHCO3|
В другом — в водный раствор, содержащий окислитель и желатину, пропускают аммиак:
2NH3 + NaClO = N2H4 + NaCl + Н2О
Гидроксиламин NH2OH — бесцветное, очень гигроскопичное кристаллическое вещество, которое в закрытом стеклянном сосуде может сохраняться многие месяцы. При нагревании уже выше 15 °C NH2OH распадается на N2, NH3 и НгО. В вакууме (3000 Па) гидроксиламин плавится при 32 °C и кипит при 57 °C.
Структура молекулы NH2OH искаженная тетраэдрическая (см. рис. 58, б). Энергия связи N—О равна 263 кДж, а связи N—Н равна 418 кДж. Гидроксиламин растворяется в воде, метаноле и этаноле в неограниченных количествах. В водном растворе он образует моногидрат, проявляющий свойства слабого основания:
NH2OH + Н2О . - * NH2OH«H2O. ' NH3OH++ ОН-;
Яо-2«10~8 (25 °C)
Из водных растворов NH2OH кристаллизуется безводным. С кислотами гидроксиламин образует соли гидроксиламиния:
NH2OH + НС1 = (NH3OH)C1
Протолиз катионов гидроксиламиния протекает в небольшой степени (см. раздел 10.2):
270
NH3OH+ + H20 r=* H30+ + NH2OH, Кк = 2» 10 7 (25 °C)
!______t
н+
Гидроксиламин и соли гидроксиламиния обладают как восстановительными (щелочная среда), так и окислительными (кислая среда) свойствами:
N2O + 5Н2О + 4е~ = 2NH2OH + 4ОН", — 1,05 В
NH3OH+ + 2Н+ + 2е~ = NHf + Н2О, = 1,35 В
Под действием кислорода воздуха NH2OH в водном растворе медленно превращается в HNO2:
NH2OH + О2 - HNO2 + Н2О
Окисление NH2OH в щелочной среде иллюстрирует реакция, в которой наряду с N2O образуется и N2, при этом азота выделяется тем больше, чем более разбавленным будет раствор NaClO:
2NH2OH + NaClO = N2O| + NaCl + ЗН2О
Другой пример:
2NH2OH + 2Ag2O = 4Agj + N2O f + ЗН2О
Характер взаимодействия NH2OH с восстановителями передают реакции:
NH2OH + SO2 + 2НгО - NH| + Н3О+ + SOl"
NH2OH + H2S » NH31 + S * + Н2О
Гидроксиламин производят пропусканием смеси NO и Нг через суспензию платины (катализатор) в разбавленной хлороводородной кислоте:
2NO + ЗН2 - 2NH2OH
Применяют также электролитическое восстановление HNO3 на ртутном катоде или катоде из амальгированного свинца.
Катод (—): HNO3 + 6Н+ + бе- = NH2OH + 2Н2О
Азидоводород HN3 — бесцветная, летучая (т. пл.
80 °C, т. кип. + 36 °C) жидкость, легко взрывающаяся при сотрясении и соприкосновении с нагретыми предметами;
2HN3(r) = 3N2 + Н2, ДЯ ° (298 К) - — 600 кДж
Молекула HN3 содержит линейный анион, состоящий из трех связанных атомов азота (см. рис. 58, в). Допускают существование у молекулы таутомерной формы: Н—N *---N^jN:.
I Таутомерия — подвижное равновесие между взаимно превращающимися структурными изомерами, таутомерами.
271
Разбавленные (3%) водные растворы HN3 устойчивы, растворы же при большей концентрации HN3 могут детонировать. В разбавленных водных растворах HN3 проявляет свойства слабой кислоты:
HN3 + Н2О Н3О+ + N3, Кк - 1,2-10-5 (20 °C)
В водных растворах HN3 медленно разлагается:
HN3 + Н2О - N2f + NH2OH
Азидоводород может быть и окислителем и восстановителем. При его действии на металлы (Zn, Мп, Fe и др.) свободный водород не выделяется:
3HN3 + Zn = Zn(Ns)2 + N2f + NHsf
Смесь HN3 с НС1 является сильным окислителем, она взаимодействует с Pt и Au:
Pt + 2HN3 + 6НС1 - PtCl4 + 2N2 f + 2NH4C1
Азидоводород окисляет иодоводород:
HN3 + 2HI = I2j + N2f + NH3
Восстановительные свойства NH3 иллюстрирует реакция, используемая для количественного определения азидов:
HN3 + HNO2 = N2f + N2O Т + Н2О
Подробнее см.: Химия псевдогалогенидов/Под ред. А. М. Голуба. — Киев: Вища школа, 1981.
Соли азидоводорода называют азидами. Азиды металлов и неметаллов относят к группе «псевдогалогенидов», так как эти соединения по химическому поведению напоминают галогениды (см. раздел 14.11). Азиды, как и хлориды, образуют малорастворимые в воде соли: AgNs, TIN3, Hg2(Ns)2 и РЬ(Йз)2. Подобно галогенидам, азиды могут существовать в виде ионных (KN3) и ковалентных (ВШз)з) азидов, образовывать комплексы (сравните [CuChr и [Си(Кз)41 ). Аналогично межгалбгенным соединениям, таким, как IC1, существуют соединения типа CIN3 (азид хлора).
Азиды щелочных и щелочно-земельных металлов хорошо растворимы в воде и малорастворимы в органических растворителях. При нагревании они спокойно разлагаются:
2RbN3 - 2Rb + 3N2f
Азиды других металлов при ударе или нагревании взрываются:
Cu(Ns)2 - Си + 3N2f; РЬ(Кз)2 = Pb + 3N2f
Для получения азидоводорода обычно применяют реакции:
NaN3 + Н3РО4 - HN3 Г + NaH2PO4; N2H4 + HNO2 = HN3 + 2Н2О
272
15.6. КИСЛОРОДНЫЕ СОЕДИНЕНИЯ АЗОТА
Отличительной чертой оксидов азота является их термодинамическая нестабильность:
AfG° (298К) = + 104 + 87 +139 +51 +115
2S: мс . N2°(r) NO(r) N2°3(r) N02(r) n2o5
+н,о ль 2 ' H2N2 °2(р) HN( =>2(.) HNO +н2° 3(ж) " H3NO4(>k)
AfG°(298K) = +46 -45 -81 -328
Тем не менее они ведут себя как устойчивые соединения и в обычных условиях могут существовать сколь угодно долго из-за ничтожно малой скорости разложения. Только при контакте с раскаленной медью все оксиды азота разлагаются, образуя СиО и N2.
Оксиды азота, кроме N2O5, — газообразные вещества. Оксиды N2O3 и NO2 — красно-бурые газы, a N2O5 — бесцветные кристаллы. С водой и водными растворами оснований взаимодействуют только N2O3, NO2 и N2O5. Оксиды NO, NO2, N2O4, N2O3 легко превращаются друг в друга:
2NO2.r 'N2O4; 2NO+ О2. : ’2NO2; NO2 + NON2O3
Ниже рассмотрены наиболее широко используемые в промышленности кислородные соединения азота.
Монооксид диазота N2O — бесцветный газ со слабым приятным запахом. Газ обладает наркотическим действием («веселящий газ»), при вдыхании N2O у человека появляется состояние легкого опьянения, судорожный смех, а затем потеря сознания. Температуры плавления (- 91 °C) и кипения (- 88 °C) N2O почти совпадают, образуя очень узкую область жидкого состояния.
Малополярная (и - 0,17D), диамагнитная молекула N2O является линейной :N—-?N (sp-гибридизация АО центрального атома
азота). В воде N2O растворим примерно в тех же количествах, что и СО2, но с водой и водными растворами КОН или NaOH не взаимодействует.
В обычных условиях N2O — химически инертное вещество: не взаимодействует с озоном, галогенами и щелочными металлами, хотя в водном растворе окисляет SO2:
N2O + SO2 + Н2О = N2f + H2SO4
273
Монооксид диазота не может быть окислен непосредственно до других оксидов: NO2, N2O3, N2O5, хотя сам легко, получается восстановлением влажного NO и кислот HNO2 и HNO3. При нагревании монооксид диазота разлагается:
2N2O = 2N2 + Ог
и поэтому в атмосфере N2O тлеющая лучина вспыхивает, как и в кислороде. Смесь N2O и Нг при соприкосновении с пламенем дает сильную вспышку, а смесь N2O и NH3 при воспламенении взрывает:
N2O + Н2 = N2 + Н2О; АН ° (298 К) = - 322 кДж
2NH3 + 3N2O - 4N2 + ЗН2О; ДЯ ° (298 К) - - 878 кДж
Получение N2O основано на использовании реакций:
170 °C
NH4NO3 = N20t+2H20
ЫагКгОгср) + СОг = N2OT + КагСОз(Р)
Диоксодинитрат (I) водорода H2N2O2 — двухосновная кислота, образует бесцветные, очень неустойчивые кристаллы, разлагающиеся со взрывом даже при простом трении:
H2N2O2(k) - N2O(r> f + Н20(ж>; ДН° (298 К) — 117 кДж
Аналогично кислота постепенно разлагается при хранении как в виде кристаллов, так и в виде своего водного раствора с выделением N2O. Строение молекулы H2N2O2 почти линейное: Н—О—N—N—О—Н.
Водные растворы H2N2O2 представляют собой очень слабую кислоту:
H2N2O2 + Н2О НзО+ + HN2O2, Ак1 - 6-10-8 (25 °C)
HN2O2 + НгО. — НзО+ + N2O5“, Кк2 = 3-1012 (25 °C)
Диоксодинитраты (I) щелочных металлов хорошо растворимы в воде, малорастворим Ag2N2O2.
Кислота получается с использованием реакций:
Ag2N2O2 + 2НС1= H2N2O2 + 2AgCl |
NH2OH<k) + HNO2(r) = НгКгОгоо + НгО(ж);
Д#° (298 К) =-178 кДж
Монооксид азота NO — бесцветный газ, с низкими температурами плавления (-163 °C) и кипения (-151 °C), узкой областью жидкого состояния. Твердый и жидкий монооксид азота имеет синий цвет. Парамагнитйая молекула NO содержит на Л*-МО один электрон и имеет электронную конфигурацию (Осв)2^)2!^)4!^)2^)1 (см. раздел 5.7). Длина связи N—О 115 пм, энергия связи 623 кДж/моль. Удаление электрона с Х*-М0 приводит к образованию более устойчивого диамагнитного катиона нит-
розила: NO—е = NO+ с длиной связи 106 пм и энергией связи 1051 кДж/моль. Наоборот, присоединение к молекуле NO электрона превращает ее в нитрозид-ион NO-, у которого на Л*-М0 будет находиться два неспаренных электрона. Поэтому нитрозид-ион NO менее устойчив, чем молекула NO.
Катион нитрозила образует со многими анионами соли: NOCI, NOBr, (NO)HSO4, (NO)C1O4, <NO)[BF4] и др. Соли нитрозила подвергаются необратимому гидролизу:
NOC1 = NO+ + C1-; NO+ + 2H2O»H3O+ + HNO2
Нитрозид-ион NO- входит в состав некоторых комплексных соединений.
Димеризация NO в обычных условиях не наблюдается. С водой и растворами КОН монооксид азота не взаимодействует. Растворимость NO в воде незначительна: 1 л Н2О (0°С; 0,1 МПа) растворяет 74 см3 NO.
Основные реакции NO — это реакции присоединения и окислительно-восстановительные реакции. Например, хлорид и сульфат Fe (II) могут поглощать до 22 л NO на 1 л своего насыщенного раствора с образованием в растворе хлорида (или сульфата) нит-розилпентаакважелеза (II):
FeCl2 + NO + 5Н2О [Fe(H2O)sNO ]С12
Под высоким давлением и небольшом нагревании монооксид азота диспропорционирует: 3NO = N2O + NO2 (действие принципа Ле Шателье). Монооксид азота взаимодействует как окислитель с H2S и SO2:
2NO + 2H2S » N2 + 2S1 + 2H2O; 2NO + SO2 + H2O - N2O f + H2SO4 и мгновенно реагирует с кислородом воздуха:
2NO + О2 = 2NO2
а с галогенами, кроме иода, образует галогениды нитрозилия:
2NO + С12 - 2NOC1; 2NO + F2 » 2NOF
Получение NO производят при помощи реакций:
3Cu + 8HNO3 (30%) “ 3Cu(NO3)2 + 2N0f + 4Н2О
2KNO2(p) + 2KI (р) + 2H2SO4 - 2NO т + 2K2SO4 + Ы + 2Н2О
Триоксид диазота N2O3 — красно-бурый газ, конденсирующийся ниже -40 °C в зеленовато-синюю жидкость, которая затвердевает при - 101 °C. Строение молекулы N2O3 передается двумя ее изомерными формами (рис. 59). В жидком и газообразном состоянии молекула легко распадается: N2O3 :i===z NO + NO2. В обычных условиях газообразный N2O3 состоит на 90% из смеси NO и NO2.
С водой и водными растворами оснований N2O3 взаимодействует с образованием азотистой кислоты и нитритов:
N2O3 + Н2О = 2HNO2; N2O3 + Са(ОН)2 = Ca(NO2)2 + Н2О
275
б)
Рис. 59. Структуры изомерных молекул N2O3 to) и таутомерных форм HNO2 (6) (межатомные расстояния приведены в пм)
кислота постепенно разлагается:
Получение N2O3 основано на конденсации ниже - 101°С стехиометрической смеси NO и NO2 до образования голубоватых кристаллов. Применяют также реакцию раз-ложения водой гидросульфата нитрозила:
2(NO)HSO4 + Н2О = - N2O3T+2H2SO4
В этой реакции N2O3 выделяется в виде, стехиометрической смеси NO и NO2.
Азотистая кислота HNO2 известна только в виде растворов, устойчивых ниже О °C, при более высоких температурах
3HNO2 - HNO3 + 2NO f + Н2О
. Азотистая кислота в водных растворах проявляет свойства слабой кислоты:
HNO2 + Н2О ;=? Н3О+ + NO5; Кк - 5,1 • 10-4 (25 °C)
Кислота имеет две таутомерные формы (см. рис. 59), которым отвечают и два вида солей — нитритов металлов. Нитриты щелочных и щелочно-земельных металлов, хорошо растворимые в воде, содержат анионы транс-формы, а нитриты Ag и других металлов, малорастворимые в воде, — анионы цис-формы.
Водные растворы HNO2 взаимодействуют с химически активными металлами с образованием нитритов:
4HNO2 + Ва - Ba(NO2)2 + 2NOf + 2Н2О
Азотистая кислота и ее соли (нитриты) проявляют как окислительные, так и восстановительные свойства:
HNO2 + H+ + e" = NOf + Н2О; <р°- 1,0 В
\ NO3 + ЗН++ 2е- = HNO2 + Н2О; р°-0,93 В
Например:
HNO2 + 0,50г - HNO3
(NH2) 2СО + 2HNO2 “ N2 Т + СО2 f + ЗН2О
2HNO2 + 2HI - 2NO f +121 + 2Н2О
276
В сильнощелочной среде нитриты восстанавливаются Zn, Al до аммиака:
KNO2 + 3Zn + 5КОН + 5НгО = NH3 f + ЗК2 [Zn(OH)4 J
Подробнее CM-: AfuHuoeu« М. А., Миниович В. М. Соли азотистой кислоты. — М.: Химия, 1979.
Для получения водных растворов кислоты применяют реакции:
NO2 + NO + Н2О = 2HNO2
о°с
Ba(NO2>2(p) + H2SO4 = 2HNO2(p) + BaSO4|
Нитриты. Почти все нитриты — бесцветные, хорошо растворимые в воде кристаллические вещества. Нитриты щелочных металлов появятся без разложения, а остальные нитриты при нагревании разлагаются:
Ca(NO2>2 = CaO + NO2T + NOf ; AgNO2 = Agj + NO21
Нитриты лантаноидов, железа, кобальта, никеля, висмута, меди, родия и иридия легко образуют при взаимодействии с нитритами щелочных металлов комплексные соединения: Cs3[Bi(NO2)6], Na3[Co(NO2)61, Rb3[Pr(NO2)61.
Получение наиболее широко используемых нитритов проводят при помощи реакций:
Na2CO3(p) + NO + NO2 - 2NaNO2 + СОг!
Са(ОН)2 + NO + NO2 - Ca(NO2)2 + Н2О
Диоксид азота NO2 — красно-бурый, ядовитый газ, переходящий ниже + 21 °C в желтого цвета жидкость, содержащую димеры N2O4. Тетраоксид диазота NiO4 образует бесцветные кристаллы ниже — 11 °C. Димеризация NO2 происходит уже в газообразном состоянии, только выше 140 °C NiO4 полностью распадается на молекулы NO2. Нагревание NO2 выше 600 °C приводит к разрушению молекулы на NO и Ог. Структура парамагнитной молекулы NO2 угловая с sp -гибридизацией АО азота (см. раздел 5.3) (рис. 60). При потере электрона молекула NO2 превращается в к а-
Рис- 60. Структуры молекул NO2 (а) и N2O4 (б) (межатомные расстояния приведены в пм)
277
тион нитроила NOj. Известны соли нитроила, на-, пример (NO2)C1O4 — тетраоксохлорат (VII) нитроила, (NOiJlSiO? — дисульфат нитроила и др.
Димер N2O4 имеет плоское строение (рис. 60). В молекулярных кристаллах димера при - 269 °C происходит изменение структуры молекул с появлением связи N—ON. В безводной HNO3 и разбавленных растворах H2SO4 димер полностью распадается на ионы: N2O4 - NO+ + NO3. Поэтому димер можно рассматривать как нитрат нитрозила NO+ • NO3, образующийся из низкотемпературного изомера ON—ONO2 с непрочными связями N—ON.
Диоксид азота взаимодействует с водой и водными растворами КОН и NaOH:
2NO2 + Н2О - HNO2 + HNO3
2NO2 + 2КОН = KNO2 + KNO3 + Н2О
Механизм образования эквимолярной смеси двух кислот (или двух солей) такой же, как и у СЮг (см. раздел 17.6).
Диоксид азота принадлежит к сильным окислителям. При смешении газообразных NO2 и HI возникает фиолетовое пламя:
2NO2 + 8HI = N2 + 41г + 4Н2О
В атмосфере NO2 горят С, Р4 и Ss:
2NO2 + 2С = N2 + 2СОг
В водном растворе из-за взаимодействия NO2 с водой (с образованием HNO2 и HNO3) трудно выделить реакции, принадлежащие исключительно действию NO2 или N2O4. Тем не менее окислительные свойства NO2 проявляются сильнее, чем у HNO2 и HNO3, благодаря высокой склонности NO2 к акцептированию электрона:
NO2 + Н+ + е - HNO2, <р° - 1,09 В
Примеры окислительной способности диоксида азота:
NO2(p) + HI - HNO2 + 0,51г
2NO2 + SO2 + 2НгО - 2HNO2 + H2SO4
Промышленное производство NO2 связано с каталитическим окислением NH3 сначала до NO, а затем до NO2 кислородом воздуха.
В лабораторных условиях получение NO2 основано на использовании реакций: t
Pb (NO3) 2 = РЬО + 2NO2 f + 0,502 Т
H2SO4
2HNO3 = 2NO2 Т + 0,50г Т + Н2О f
Пентаоксид диазота N2O5 — бесцветные игольчатые кристаллы, расплывающиеся на воздухе, взрывающиеся часто при
278
хранении и при нагревании: 2N2O5“ 4NO2 + Ог. Если же N2O5 нагревать в атмосфере озонированного кислорода, то он возгоняется около 33 °C без разложения и плавится при 41 °C под давлением 0,14 МПа.
Структура ковалентной молекулы O2N—О—NO2 изучена слабо. Кристаллы N2O5 имеют солеобразную ионную структуру NOJNO3, нитрата нитроила, линейного и симметричного катиона NOJ.
С водой N2O5 взаимодействует с выделением энергии в форме теплоты:
N2O5(k) + Н2О(Ж) - 2HNO3(p), ДЯ ° (298 К) — 20 кДж
Пентаоксид диазота — сильный окислитель. Многие органические вещества при соприкосновении с N2O5 воспламеняются, металлы превращаются в оксиды; сильные восстановители, такие, как H2S или SO2, разлагают N2O5 до азота:
N2O5 + H2S = N2T + H2SO4 + 0,50г Т
N2O5 + SO2 =“ N2f + SO3t + 20гТ
Получают N2O5 в промышленных условиях обработкой жидкого N2O4 озонированным кислородом:
КгО4(ж) + Оз = КгО5(ж) +Огг
В лабораторных условиях для синтеза N2O5 применяют реакции: 4HNO3 + Р4О10 - (НРОз)4 +2N2O5
2AgNO3(K) + CI2 = N2O5 + 2AgCl + 0,50г f
Азотная кислота HNO3 в чистом состоянии без примеси воды — бесцветная, дымящая на воздухе жидкость (т. пл. - 41 °С,‘ т. кип. +83 °C). В твердом состоянии HNO3 — гидроксид нитроила NOjOH-. В среде безводной НСЮ4 азотная кислота ведет себя как основание (см. раздел 10.2):
NO2OH + НСЮ4 = NO2CIO4 + Н2О
В газообразном состоянии HNO3 имеет плоское строение (рис. 61, а). В концентрированных водных растворах (> 14 М) азотная кислота присутствует в виде малодиссоциированной о р т о-азотной кислоты H3NO4:
H3NO4 + H2O. * H3O+ + H2NO4, а» 0,05-0,06
Полагают, что H3NO4 является моногидратом азотной кислоты H3NO4^HNO3 • Н2(Ь (НзОЖОз, содержащим ионы оксония. При разбавлении раствора H3NO4 превращается в HNO3.
Нагревание и длительное хранение 100%-ной HNO3 приводят к ее постепенному разложению:
hv
2HNO3 = 2NO21 + 0,502 Т + Н2О
279
a)
Рис. 61. Структура одиночной молекулы HNO3 (в) и зависимость (6) состава продуктов взаимодействия IINO3 и железа от концентрации кислоты в водном растворе (межатомные расстояния даны в им)
Выделяющийся NO1 растворяется в кислоте и придает ей желтый цвет,
С водой HNO3 смешивается в любых отношениях. Азеотропная смесь содержит 68,4% HNO3 и кипит при 122 сС (0,1 МПа). Концентрированная HNO3 — сильный окислитель. Образование тех или иных продуктов окисления зависит от концентрации кислоты, ее чистоты, температуры и типа восстановителя. Чем разбавленнее кислота и чем левее находится металл в электрохимическом ряду напряжений, тем больше появляется в продуктах восстановления HNO3 таких веществ, как N2, N2O и NH^ (рис. 61,6).
Такие металлы, как А1, Сг и Fe, в концентрированной HNO3 (>68%) подвергаются пассивированию. Поэтому такую HNO3 хранят и перевозят в алюминиевых цистернах. Другие металлы (Zn, Cd, Mg) HNO3 (конц.) восстана'вливают до NO2:
2HNO3 + е - NO2 + NO3 + НгО
Разбавленная HNO3 восстанавливается преимущественно до NO:
NO3 + 4Н+ + Зе~ = NO + 2НгО, (Р° = 0,96 В
Механизм окислительного действия HNO3 изучен слабо. Было установлено, что чистая, прозрачная HNO3 проявляет окислительные свойства только при нагревании. Желтые или красно-бурые водные растворы HNO3 действуют как окислители уже в обычных условиях. Считают, что реакции с участием HNO3 являются аутокаталитическими, самоускоряющимися в результате образования продуктов реакции, прежде всего HNO2 и NO2. Аутокаталитический окислительный механизм действия HNO3 включает следующие стадии:
NO2 + е = NO2
NO? + Н+ HNO2
HNO2 + HNO3 = 2NO21 + Н2О
280
С появлением двух молекул NO? реакция окисления ускоряется. Особенно сильным окислителем является смесь концентрированных 1 л HNO3 и 3 л НС1 (см. раздел 17.5).
Нитраты. Соли азотной кислоты — нитраты — бесцветные кристаллические вещества, хорошо растворимые в воде. Нитраты лития, магния, щелочно-земельных металлов и металлов третьего и четвертого периодов, полученные из водных растворов, всегда содержат аквакатионы, например [Ре(Н2О)б](НОз)2, [8г(НгО)4](МОз)2.
Нитраты металлов по характеру термического разложения делятся на три группы. К первой группе относят нитраты щелочных металлов, разложение которых происходит только после плавления:
t
KNO3 = KNO2 + 0,5O2t
При более высоких температурах (выше 500 °C) нитриты в расплаве также начинают разлагаться:
2KNO2 = К2О + N21 + 1,5021
Ко второй группе относят нитраты металлов, стоящих в электрохимическом ряду напряжений левее меди. Такие нитраты плавятся с разложением:
2Pb(NO3)2 = 2РЬ0 + 4NO2t + Ог!
К третьей группе принадлежат нитраты металлов, находящихся в электрохимическом ряду напряжений правее меди. При нагревании они разлагаются с выделением металла:
2AgNO3 = 2Ag + 2NO2t + O2t
Безводные нитраты Be, Mg, Zn, Hg (II), Си (II), Sn (IV), Ti (IV), Co (III) при нагревании возгоняются без разложения, а безводные Sn(NO3)4 и Т1(ЬЮз)4 являются энергичными окислителями (при соприкосновении с органическими веществами воспламеняются или взрываются).
Особое положение занимают нитраты аммония и гидразиния. При нагревании NH4NO3 до температуры плавления происходит частичная возгонка соли с разложением ее пара:
NH4NO3(r) = NH3(r) + HNO3(r)
Расплав NH4NO3 (т. пл. 170 °C) разлагается:
NH4NO3(«) = N2O? + 2H20t
Выше 200 °C состав газообразных продуктов сильно изменяется:
8МН4ЫОз(ж) = 5N2t + 4NO1 + 2NO2t + I6H2O
Нитрат гидразиния N2H5NO3 претерпевает при нагревании также сложные превращения, которые сводятся к реакции:
2N2H5NO3 = 3N2T + 0,5021 + 5Н2О Выше 270 °C N2H5NO3 воспламеняется.
281
Расплавы нитратов — сильные окислители. В частности, расплавы нитратов щелочных металлов разрушающе действуют на платину и многие металлы.
15.7. ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА ФОСФОРА
Фосфор существует в виде нескольких модификаций: белого, черного и красного фосфора, природа которого до сих пор не раскрыта.
Белый фосфор имеет две аллотропные модификации: а и Д Ниже - 78 °C Д-модификация переходит в «-модификацию. Высокотемпературная Д-модификация представляет собой бесцветные, идеально прозрачные кристаллы, сильно преломляющие свет и поэтому играющие на солнце всеми цветами радуги. На свету эти кристаллы быстро желтеют, теряют свою прозрачность и превращаются в воскообразную массу из-за появления примесей оксидов и красного фосфора.
Подробнее см,.: Корбридж Д. Фосфор. — М.: Мир, 1982.
Белый а- и Д-Л о с ф о р в твердом, жидком и газообразном состояниях (до 800 °C) содержит тетраэдрические молекулы Р4 (рис. 62, а). Твердый фосфор имеет молекулярную кристаллличе-скую решетку (см. раздел 6.3). Его т. пл. 44 °C, т. кип. 257 °C. Уже при обычной температуре белый фосфор легко испаряется и в газообразном состоянии окисляется сначала до Р4О6, а затем до Р4О10. Освобождающаяся в результате окисления энергия выделяется
Рис. 62. Структуры молекул белого фосфора (д), Н(РН2О2) (б); Нг(РНОз) (в) и Н3РО4 (г)
282 .
не в форме теплоты, а в виде света, что и является причиной свечения белого фосфора на воздухе. Медленное окисление Р4 очень легко переходит на воздухе в бурное горение. Выше 800 °C Д-модификация диссоциирует (Р4 = 2Рз), а при 1200 °C начинается распад молекул на атомы (Р2 = 2Р). Молекулы Р2, как и молекулы азота, имеют кратные связи :Р—Р: с длиной 188 пм.
В воде белый фосфор практически нерастворим (2*10 4 моль/л) и с ней не взаимодействует. Лучшими растворителями для него являются CS2, PCI3, CCI4 и СбНб. Белый фосЗюр обладает среди всех полиморфных модификаций наибольшей химической активностью.
Красный фосфор (т. пл. 585—610°C) образуется при нагревании белого фосфора до 300—400 °C без доступа воздуха. Эта модификация значительно менее химически активна. (Красный фосфор — термин, используемый для описания многих различных аллотропных модификаций красного цвета.) Она нерастворима ни в воде, ни в других растворителях. При конденсации пара красного фосфора опять образуется белый фосфор.
Черный фосфор (т. пл. 587 °C) получают либо длительным нагреванием белого при 400 °C в присутствии катализатора — мельчайших капель ртути, либо нагреванием Р4 при 200 °C и давлении 12 000 МПа. Черный фосфор очень напоминает по свойствам графит: он электро- и теплопроводен и среди остальных модификаций наиболее химически инертен, практически негорюч.
Если пар белого фосфора, нагретый до 1000 °C, конденсировать при -196 °C, то происходит образование коричневой модификации, состоящей, видимо, из молекул Рг.
Белый фосфор в атмосфере кислорода воспламеняется:
Р4 + 5Ог = Р4О10
горит в среде галогенов:
Р4 + 10С12 = 4РС15
диоксида азота:
Р4 + 5NO2 = Р4О10 + 2.5N2
и диоксида углерода:
Р4 + ЮСО2 = Р4О10 + ЮСО
При нагревании выше 100 °C фосфор бурно взаимодействует с серой с образованием смеси сульфидов состава P4SX, где х ** 3 + 10. С водородом и азотом фосфор практически не взаимодействует. При 700 °C в присутствии порошка меди как катализатора фосфор разлагает воду:
Р4 + I6H2O - 4НзРО4 + 10Н21
Эта реакция может быть использована для промышленного получения чистой фосфорной кислоты. Концентрированные азотная и серная кислоты окисляют Р4 до Н3РО4:
283
Р4 + 20HNO3 - 4НзРО4 + 20NO2t + 4Н2О
Р4 + 8H2SO4 - 4НзРО4 + 7SO21 + S | + 2Н2О
С другими кислотами (НСЮ4, галогеноводороды, Н3РО4) белый фосфор не взаимодействует.
При нагревании с водными растворами гидроксидов щелочных металлов фосфор подвергается диспропорционированию (см. раздел 33.3):
Р4 + ЗКОН + ЗН2О - РНз t + ЗК(РН2О2)
Со многими металлами фосфор образует фосфиды.
15.8. ПОЛУЧЕНИЕ ФОСФОРА
Реакция промышленного получения фосфора:
Саз(РО4)2 + 3SiO2 + 5С* Р2] + 5COt + 3CaSiO3
была предложена Вёлером в 1829 г. и осталась без изменений до наших дней. Реакция включает следующие предполагаемые стадии:
2Саз(РО4)2 = бСаО + Р4О10
Р4О10 + ЮС = 2P2t + lOCOt
CaO + SiO2 - CaSiO3
Влияние SiO2 на процесс восстановления Саз(РО4>2 заключается в связывании СаО, что и вызывает ускорение разложения фосфата. Основная реакция всегда сопровождается рядом побочных, вызванных присутствием примесей. Например,
t
2CaF2 + 3SiO2 = SiF4 f + 2CaSiO3
Подробнее см. сб.: Технология фосфора. — Л.: Химия, 1979.
еВёлер Фридрих (1800—1882) — немецкий профессор химии, врач по образованию, впервые синтезировал карбамид, по-пучип чистый алюминий, кристаллический бор и кремний, иностранный член Петербургской АН.
15.9. КИСЛОРОДНЫЕ СОЕДИНЕНИЯ ФОСФОРА
Оксиды и кислородные кислоты фосфора — бесцветные кристаллические вещества, либо разлагающиеся при нагревании до плавления, либо легко возгоняющиеся, либо подвергающиеся диспропорционированию выше их температур плавления. Большинство их проявляет склонность при нагревании к димеризации и полимеризации. В окислительно-восстановительных реакциях диспропорционирования кислородных кислот фосфора при повышенных температурах одним из продуктов реакции всегда является фосфин:
»i
ЗЩРН2О2) = 2Нг(РНОз) +РНз1
284
t2
4Н2(РНОз) = ЗН3РО4 + РНз
причем /1 < t2, Н(РН2О2) разлагается в две стадии, а Н2(РНОз) — в одну.
Окисление Р4 кислородом воздуха — типичная многоступенчатая цепная реакция, протекающая иногда со взрывом. Однако в некоторых условиях она не заканчивается образованием Р40ю. Так, фосфор, не горит на воздухе, если нет следов влаги, горение прекращается при уменьшении давления кислорода ниже 10 Па (предел зависит от давления паров Р4 и ряда других причин). Вследствие этого в продуктах реакции при недостаточном количестве кислорода могут присутствовать наряду с Р4О10 оксиды фосфора низших степеней окисления.
Кислородные кислоты фосфора и их соли имеют тетраэдрическую конфигурацию (см. рис. 62), в которой фосфор образует три ординарные СГ-связи и одну двойную связь. Тетраэдрическое расположение ковалентных связей обнаружено и у ряда оксидов (Р4О6, Р4О10).
Получены следующие оксиды и соответствующие им кислоты: Р4О; Р4О2 - Н(РН2О2); Р4О6 - Н2(РНОз); Р4О10 - Н3РО4; Р4О8 * Н2(РНОз) и Н3РО4; Р4О7; Р4О9; Н4Р2О6.
Первые два оксида (Р4О и Р4О2) — соответственно красноватобурые и желтовато-красные кристаллы, не взаимодействуют с водой. Структура и свойства их так же, как и оксидов Р4О7 и Р4О9, изучены недостаточно.
Диоксодигидрофосфат (I) водорода Н(РН2О2) — бесцветное кристаллическое вещество тетраэдрической структуры с т. пл. 26 °C (см. рис. 62, б). Кислота хорошо растворяется в воде, проявляя свойства кислоты умеренной силы:
Н (РН2О) + Н2О . - Н3О+ + (РН2О2)“, Кк - 0,08 (25 °C)
Соли Н(РН2О2) называют диоксодигидрофосфатами (I). Диоксодигидрофосфаты щелочных и щелочно-земельных металлов получают нагреванием белого фосфора в водных растворах или суспензиях гидроксидов металлов:
2Р4 + ЗВа(ОН)2 + 6Н2О - ЗВа(РН2О2)2 + 2РН31
Все они хорошо растворяются в воде.
Кислота и ее соли являются сильными восстановителями, особенно при нагревании. В водных растворах, содержащих анион <РН2О2)' , катионы многих металлов (Au, Ag, Hg, Ni и др.) восстанавливаются до свободного металла. Например,
4AgNO3 + Н(РН2О2) + 2Н2О - 4Agi + Н3РО4 + 4HNO3
Подобные реакции применяют для покрытия тем или иным металлом стекла, пластмассы или керамики (химическое металлирование).
Получение Н(РН2О2) основано на реакциях типа
Ва(РН2О2)2 + H2SO4 = 2Н(РН2О2) + BaSCUl
285
Hg
РН3 + S02 = ЩРН2О2) + S1
H20
Гексаоксид тетрафосфора P4O6 — белая кристаллическая масса неприятного запаха с т. пл. 23,5 °C. При нагревании на воздухе Р4О6 загорается:
Р4Об + 2О2 = Р4О10
но в среде водорода возгоняется при 177 °C, а при 200 °C диспро-порционирует:
н2
5Р40б= 2Р4 + ЗР4О10
Оксид взаимодействует с водой:
Р4О6 + 6Н2О = 4Н2(РНОз)
Триоксогидрофосфат (III) водорода Нг(РНОз) — бесцветные кристаллы с т. пл. 74 °C, хорошо растворимые в воде. Структура молекул — искаженная тетраэдрическая (см. рис. 62, в). В водных растворах кислота выступает как слабая, двухосновная:
Н2(РНОз) + Н2О Н3О+ + Н(РНОз)", Кк1 = 1 • Ю"2 (25 °C)
Н(РНОз)" + Н2О НзО+ + (РНОз)2-, Кк2 - 3* 10-7 (25 °C)
Известны одно- и двухзамещенные триоксогидрофосфаты (или фосфиты), например К2(РНОз) и КН(РНОз). Большинство солей Н2(РНОз) малораствопимо в воде, хорошо растворяются только триоксогидрофосфаты (III) щелочных металлов и кальция.
Кислота и ее соли обладают сильными восстановительными свойствами. Они осаждают Au, Ag, Pt, Pd из растворов их солей:
Нг(РНОз) + 2AgNO3 + Н2О - Н3РО4 + 2Agl + 2HNO3
восстанавливают H2SO4 до SO2:
Н2(РНОз) + H2SO4 - Н3РО4 + SO2 f + Н2О
а из водного раствора К2СГ2О7 выделяют зеленый осадок Сг20з:
З(РНОз)2- + Сг2О?~ - ЗРОГ + Сг20з I + Н3О+
Азотная кислота без примеси NO2 не окисляет Н2(РНОз) даже при нагревании.
Для получения Нг(РНОз) чаще всего применяют реакцию
РС1з + ЗН2О - Н2(РНОз) + ЗНС1
Реакция является экзотермической, протекает бурно. Удаление НО из смеси двух кислот производят ее нагреванием до 60 °C под вакуумом. Кислоту можно получить и при окислении белого фосфора хлором под водой:
Р4 + 6О2 + 12Н2О - 4Н2(РНОз) + 12НО
286
Октаоксид тетрафосфора Р4О8 мало изучен, может образовывать димеры и тримеры, а при растворении в воде дает смесь равных количеств Нг(РНОз) и Н3РО4.
Гексаоксодифосфат (IV) водорода Н4Р2О6 кристаллизуется из водного раствора в виде дигидрата ШРзО^НгО с т. пл. 62 °C. Кислота в присутствии избытка ионов НзО дисп-ропорционирует:
Н4Р2О6 + НгО - Нг(РНОз) + Н3РО4
Получают кислоту при помощи реакции
РЬРгОб + 2H2S - Н4Р2О6 + 2PbS 1
Декаоксид тетрафосфора Р4О10 — бесцветные кристаллы, существующие в виде нескольких модификаций, число которых окончательно не установлено. При нагревании Р4О10 выше 360 °C возгоняется и плавится около 420 °C.
Оксид фосфора (V) отличается исключительно большим сродством к воде, поглощая влагу, он превращается в полиметафосфорную кислоту (НРОз)х. Поэтому Р4О10 часто используют как самое эффективное осушающее средство; связывая воду, он может разрушать другие кислоты с выделением их оксидов:
4HNO3 + Р4О10 = 2N2O5 + (НРОз)4
4НС1О4 + Р4О10 = 2CI2O7 + (НРОз)4
При растворении Р4О10 в воде образуется смесь разных кислот фосфора (V) общего состава Нги+гРиОзи+ь Так, при концентрации (мае. доли) Р4О10 от 72 до 89% в водном растворе присутствуют Н3РО4, Н4Р2О7, Н5Р3О10. При более высокой концентрации Р4О10 появляются еще полиметафосфорные кислоты (НРОз)х-
Оксид фосфора (V) взаимодействует с HF и НС1 с образованием в первом случае гексафторофосфата (V) водорода, а во втором — оксидтрихлорида фосфора (V):
Р4О10 + 6HF = H[PF6] + (НРОз)з + Н2О
Р4О10 + ЗНС1 - РС13О + (НРОз)з
При высоких температурах Р4О10 разрушает кварцевое стекло и многие кремнийсодержащие керамические материалы.
Получают Р4О10 сжиганием Р4 в избытке сухого воздуха или кислорода. От примесей других оксидов фосфора Р4О10 очищают при помощи метода сублимации в атмосфере кислорода.
Ортофосфорная кислота Н3РО4 в безводном состоянии образует прозрачные, гигроскопичные кристаллы с т. пл. 42 °C. Расплав легко переохлаждается и представляет собой густую маслянистую жидкость. В расплавленном состоянии 100%-ная кислота подвергается частичному автопротолизу:
2Н3РО4 [Р(ОН)4 ]+ + Н2РО4
287
Катион тетрагидроксофосфора (V) обнаружен в кристаллах [Р(ОН)4]СЮ4.
Структура молекулы Н3РО4 — искаженная тетраэдрическая (см. рис. 62, г). В кристаллах те же тетраэдры связаны между собой водородными связями, сохраняющимися и в концентрированных водных растворах, чем объясняется их высокая вязкость.
В парообразном состоянии Н3РО4 распадается на Р4О10 и Н2О. С водой Н3РО4 смешивается во всех отношениях и из насыщенных водных растворов выделяется в виде кристаллогидрата 2НзРО4*Н2О с т. пл. 29 °C. В водном растворе Н3РО4 подвергается протолизу:
Н3РО4 + Н2О 7=^ НзО+ + Н2РО4; Кк1 “ 7,2* 10~3 моль/л
Н2РО4 + Н2О - Н30+ + НРОГ; Кк2 - 6,2» 10~8 моль/л
НРОГ + Н20-~ Н30+ + РОГ; Ккз ” 4,6*10-13 моль/л
Из сопоставления констант кислотности следует, что протолиз Н3РО4 протекает преимущественно по первой ступени, а анион Р0|~ является сильным акцептором протонов, т. е. сильным анионным основанием.
При нагревании водных растворов Н3РО4 вначале удаляется вода, затем (по мере увеличения концентрации раствора) начинается процесс полимеризации (конденсации). Вначале появляется дифос-форная кислота:
260 °C
2НзРО4 = Н4Р2О7 + Н2О
а потом — полимерные формы метафосфорной кислоты:
300 °C
ЗН4Р2О7 = 2(НРОз)з + ЗН2О
В промышленности Н3РО4 получают сжиганием Р4 в атмосфере воздуха до Р4О10 с последующим поглощением оксида нагретой до 200 °C разбавленной ортофосфорной кислотой Н3РО4.
Ортофосфорную кислоту производят также разложением фторапатита Саз(РО4)2 • СаРг концентрированной серной кислотой при нагревании:
Саз(РО4)2 + 3H2SO4 = 2Н3РО4 + 3CaSO4l
Одновременно с этой реакцией протекают и побочные, так как природный фторапатит всегда содержит примеси песка SiO2 и нефелина:
CaF2 + H2SO4 = 2HF f + CaSO41; SiO2 + 6HF H2 [SiF6 ] + 2Н2О
2(Na, К) (AlSiO4) + 4H2SO4 - (Na, K)2SO4 +
+ A12(SO4)3 + 2SiO2l +4НгО
Выделяющийся фтороводород наряду с ортофосфорной кислотой является промышленным продуктом такого производства.
288
Рис. 63. Структуры дифосфорной кислоты (а), цепочечных и циклических фосфатов (б)
Дифосфорная кислота (гептаоксодифосфат (V) водорода) Н4Р2О7 — бесцветные кристаллы двух модификаций, смесь которых имеет т. пл. 61 °C. Дифосфорная кислота принадлежит к числу конденсированных фосфорных кислот, к которым относят кислоты, получаемые дегидратацией (удалением одной и более молекул воды) ортофосфорной кислоты (реакции конденсации кислот). В реакциях конденсации кислот тетраэдрические анионы ортофосфорной кислоты образуют цепочечные, циклические и смешанные структуры, в которых тетраэдрические анионы имеют только один общий атом кислорода и поэтому никогда не связаны ни гранями, ни ребрами (рис. 63, а).
Подробнее см.: Кубасова Л. В. Усп. химии, 1971. Т. 40. С. 3.
Кислота хорошо растворима в воде и в растворе постепенно (а при нагревании — быстрее) превращается в ортофосфорную кислоту (разрыв связей Р—О—Р):
Н4Р2О7 + Н2О - 2НзРО4
Дифосфорная кислота является более сильной, чем ортофосфорная, в соответствии с общим правилом увеличения силы кислот при их конденсации. При протолизе Н4Р2О7 особенно легко удаляются пер-Вые два протона:
Н4Р2О7 + НгО' ’ НзО+ + Н3Р2О7; Кк1 —0,14 моль/л
Н3Р2О7 + Н2О > НзО+ + Н2Р2О?“; Кк2 = 3* 10-2 моль/л
,0—1258
289
Остальные константы кислотности равны: /Скз~2»106 и Кк4 ~ 6«10 9 моль/л. Все константы определены приближенно из-за неустойчивости кислоты в водном растворе.
Известны два рада солей Н4Р2О7: дигидродифосфаты, например К2Н2Р2О7, хорошо растворимые в воде, и дифосфаты, например К4Р2О7, среди которых хорошей растворимостью в воде обладают только дифосфаты щелочных металлов.
Метафосфорные кислоты (НРОз)х, где х = 3, 4, 6, представляют собой бесцветные стекловидные массы, хорошо растворимые в воде. В водном растворе метафосфорные кислоты постепенно (при нагревании — быстрее) разлагаются, превращаясь в Н3РО4. Кислотные свойства (НРОз)х выражены очень сильно. Например, у (НРОз)з= Н3Р3О9 Кк2 ~ 0,02 (25 °C). Соли метафосфор-ных кислот называют три-, тетра- и гексаметафосфатами.
Фосфаты. 'Фосфаты конденсированных фосфорных кислот могут иметь, как и кислоты, цепную, циклическую и смешанную структуры (рис. 63, б). Цепные полифосфаты состоят из связанных через атом кислорода тетраэдров, располагающихся различным образом друг за другом. Длина повторяющегося фрагмента цепи колеблется от 520 до 700 пм. Общая формула цепных фосфатов: Ми+2РпОзи+1 и МпН2РиОзи+1, где и — степень конденсации, а степень окисления М равна (+1).
Циклические фосфаты образуют чаще всего метафосфаты. Они имеют сложную пространственную конфигурацию, состоящую также из тетраэдров. Например, тетраметафосфат калия (КРОз)4 в своих ионных кристаллах содержит анионы состава Р40^г" (рис. 63, б). Общая формула циклических полиметафосфатов МиРиОзп или (МРОз)и.
Гидроортофосфаты по-разному относятся к нагреванию:
хКН2РО4 = (КРОз)х + хН2От.
2К2НРО4 - К4Р2О7 + H20t
Ортофосфаты металлов плавятся при нагревании без разложения при очень высоких температурах, в частности, температура плавления К3РО4 равна 1640 “С. Дигидроортофосфат аммония разлагается при нагревании выше 140 °C ступенчато, с выделением NH3 и образованием сложных фосфатов, выше 300°С от исходного вещества остается только (НРОзЦ. При сильном нагревании наблю-’ дается деконденсация полифосфатов: метафосфаты переходят в дифосфаты, а последние — в ортофосфаты.
Большинство известных способов получения ортофосфатов основано на взаимодействии оксидов, гидроксидов и карбонатов металлов с водным раствором Н3РО4. Для синтеза дигидроортофосфатов берут избыток Н3РО4, остаток кислоты удаляют промыванием полученного фосфата этанолом или изобутанолом:
К2СОз<к) + 2НзРО4(Р) = 2КН2РО4(р) + CO2f + Н2О
290
15.10. ФОСФИДЫ
Фосфидами называют соединения фосфора с более электроположительными элементами (As, Bi, Si и металлы). При нагревании фосфор окисляет почти все металлы, лишь Sb, Bi, Pb и Hg не дают устойчивых в обычных условиях фосфидов. Многие фосфиды являются нестехиометрическими соединениями (см. гл. 29). Фосфиды ^-элементов (кроме Be) и лантаноидов имеют ионную кристаллическую решетку. Они легко подвергаются необратимому гидролизу:
Ваз₽2 + 6Н2О = 2РНз! + ЗВа(ОН)2
Фосфиды ^/-элементов представляют собой вещества серого или черного цвета с высокими температурами плавления. Они часто являются проводниками электричества, могут обладать ферромагнитными свойствами, многие из них устойчивы к действию воды и кислот.
15.11. ГИДРИДЫ ФОСФОРА
Основные гидриды фосфора: фосфин РНз (т. пл. -134 °C, т. кип. -88 °C) и жидкий дифэсфин Р2Н4 (т. пл. -99 °C, т. кип. +65 °C), самовоспламеняющийся на воздухе.
Фосфин РНз — аналог аммиака, бесцветный крайне ядовитый газ, обладающий чесночным запахом. Он хорошо растворим в дисульфиде углерода CS2, бензоле СбНб, этиловом эфире (СгЩ^О и других органических растворителях. Молекула РНз имеет такое же пирамидальное строение, как и молекула аммиака, но со смещением атома фосфора к вершине тригональной пирамиды и углом между связями в 94°, много меньшим тетраэдрического (109°). Связи Р—Н (длина связи 142 пм) являются чисто ковалентными типа so - Ра- Гибридизация АО фосфора, видимо, не происходит, а электронная плотность распределяется по трем связям Р—Н. Поэтому атом фосфора по сравнению с атомом азота в значительной мере теряет свои донорные свойства (см. раздел 5.3).
В жидком фосфине очень слабы водородные связи РНз»• «РНз, отсюда и низкие температуры плавления и кипения. Фосфин в отличие от аммиака малорастворим в воде и образует с последней неустойчивый гидрат:
РНз + Н2О РНз»Н2О . ' • РН| + ОН-, Ко = 4» 10-29 (25 °C) Подробнее см.: Осадченко И. М., Томилов А. П. Усп. химии. 1969.
Т- 38. С. 1089.
Донорные свойства РНз проявляет только при взаимодействии с сильными акцепторами электронных пар, сильными безводными
РНз + HI - РН41
PH3 + H[BF4]-PH4[BF4]
РНз + НСЮд » РН4(СЮ4)
291
кислотами:
10*
В воде соли фосфония полностью гидролизуются:
РНД + Н2О = НзО+ + РНз f + Г
Фосфин в чистом виде на воздухе в обычных условиях не воспламеняется. Самовозгорание (иногда со взрывом) происходит при температуре выше 150 °C и сопровождается реакцией
РНз + 202 - Н3РО4
Первой стадией процесса является образование Р4О10: 4РНз + 8O2 = Р4О10 + 6Н2О
Высокая температура (больше 450 °C) и отсутствие Ог способствуют разложению:
4РНз = Р4 + 6Н2
Фосфин более сильный восстановитель, чем аммиак. Сравните, например, реакцию
РНз + 6AgNO3 + ЗН2О = 6Agi + Нг(РНОз) + 6HNO3 с реакцией
2NH3 + AgN03(p)i=^ [Ag(NH3>2]NO3(p)
или
РНз + 312 + ЗН2О = Нз(РНОз) + 6HI
и 4NH3 + 3I2 I3N + 3NH4I
В последней реакции атомы азота не меняют своей степени окисления, а атомы молекул иода приобретают разные по знаку степени окисления (см. раздел 33.3).
Для получения фосфина применяют реакции Р4 с КОН при нагревании или PH4I с водой. Возможно использование и фосфидов металлов:
Zn3P2 + 6HCI = 2РНз t + 3ZnCh
(с водой ZnsP2 не взаимодействует). Гидролиз некоторых фосфидов является сложным процессом. Так, в реакции СазРг + Н2О помимо РНз и Са(ОН)2 образуется до 30% дифосфина и водорода.
15.12. ГАЛОГЕНИДЫ И ОКСИД-ГАЛОГЕНИДЫ ФОСФОРА
Известны почти все галогениды фосфора (табл. 19). Молекулы галогенидов состава РНа1з (Hal= F, С1, Вг или I) имеют пирамидальное строение, а молекулы пентагалогенидов обладают триго-нально-бипирамидальной структурой (см. раздел 5.3, табл. 12)-В кристаллах PCI5 и РВг5 обнаружены ионы: 2РС15= [РСЦ ]+[РС1б L РВг5^ [РВг4]+Вг .
292
Таблица 19. Физические характеристики галогенидов фосфора
Свойства Галогениды фосфора
PF3 PFs РС1з PCI5 РВгз PBrs Р1з
Т. пл., °C -151 -94 -90 +160 -40 +105 +61
Т. кип., °C -101 -84 +75 (+) +173 Разлагаются
-BfG° (298 К), кДж/моль 956 1593 312 436 177 229 46
Примечание. (+) — возгоняется при плавлении; Pls — неизвестен.
В полярных органических растворителях (CH3NO2, CH3CN, C6H5NO2 и др.) пентахлорид и пентабромид фосфора диссоциируют на ионы, а в воде подвергаются полному гидролизу:
РВгз + ЗН2О = Н2 (РНОз) + ЗНВг; РСЬ + 4НгО = Н3РО4 + 5НС1
Трихлорид фосфора медленно окисляется на воздухе:
РС1з + 0,502 “РС1зО
присоединяет серу:
РС1з + S - PSCI3
восстанавливает оксиды хрома (VI) и серы (VI):
РС1з + 2СгОз - PCI3O + СггОз 1 + 021
Оксид-тригалогениды фосфора подвергаются полному гидролизу:
PCI3O + ЗН2О = Н3РО4 + ЗНС1
Подробнее см.: Дрозд Г. И. Успехи химии, 1970. Т. 39. С. 3;
Наумова Т. Н., Введенская Т. С., Степин Б. Д. Усп. химии, 1972.
Т. 41. С. 977.
Синтез тригалогенидов фосфора (кроме PF3) основан на прямом галогенировании белого фосфора при его избытке:
Р4 + бВгг = 4РВгз
либо используют реакцию
PCI3 + ASF3 = PF3t + AsCh
Пентагалогениды фосфора можно получить непосредственным взаимодействием исходных простых веществ при избытке галогенов либо воздействием галогенов на тригалогениды фосфора:
Р4 + ЮС12 - 4РС15; РВгз + Вг2 = РВг5
15.13. ПРИМЕНЕНИЕ
Основная часть связанного азота идет на производство азотных Удобрений (аммиачная вода, карбамид, нитрат аммония и др.) и Рунических азотсодержащих соединений (красителей и лекарсг-
293
венных средств). В частности, производство аммиака во всем мире достигло в 1985 г. 120 млн. т. Жидкий азот применяют в криохимии, а газообразный — при проведении синтезов в инертной атмосфере. Почти все взрывчатые вещества и детонаторы — азотсодержащие соединения или их смеси. Нитраты щелочных металлов, аммония, оксиды азота (IV, V), азотная кислота — окислители в жидком и твердом ракетных топливах, в газогенерирующих смесях (для пироклапанов, для катапультирования и др.), в зажигательных и трассирующих смесях. Нитрит натрия применяют в производстве азокрасителей и при консервировании мясных изделий.
Монооксид диазота — анестезирующее средство, диоксид азота — реагент для очистки нефтепродуктов от сероорганических соединений и катализатор реакций окисления бензола до фенола и метана до формальдегида. Аммиак применяют в производстве соды по методу Сольве, азотной кислоты, нитратов, карбамида, циановодорода и удобрений.
Фосфаты входят в состав различных удобрений: суперфосфата Са(НзРО4)2*Н2О + CaSO4, двойного суперфосфата Са(Н2РО4)2 • • 2НзО, преципитата СаНРО4*2Н2О, аммофоса (NH4)H2₽O4 + + (NH4)2HPO4 и нитрофоски (смесь NH4NO3, КС1 и (ЫН4)зРО4).
Подробнее см.: Технология фосфорных и комплексных удобрений. М.: Химия, 1987.
Ортофосфорная кислота расходуется прежде всего на производство триполифосфата натрия NasPaOiO, применяемого для получения синтетических моющих средств, для выпуска кормовых фосфатов, необходимых для животноводства, и производства гексаметафосфата натрия (КаРОз)б, нужного для умягчения воды и для удаления накипи из паровых котлов. Фосфаты применяют в металлургии, в процессах фосфатирования металлов. Красный фосфор используют в спичечной промышленности; сульфиды фосфора необходимы для выпуска пластификаторов, присадок к маслам, фармацевтических средств; трихлорид фосфора — для синтеза инсектофунгицидов, поверхностно-активных веществ и фосфорорганических соединений.
15.14. ТОКСИКОЛОГИЯ
Большинство соединений азота (оксиды, гидриды, кислоты) обладают токсичностью, оказывают поражающее действие на кожу, верхние дыхательные пути и глаза. Монооксид диазота в смесях с кислородом — слабый наркотик, в высоких концентрациях вызывает удушье. Диоксид азота, пары азотной кислоты и хлорида нитрозила NOCI раздражают легкие, вызывая их отек. Монооксид азота, гид-роксиламин и азидоводород разрушают красные кровяные тельца. Нитриты сильно расширяют сосуды, снижают кровяное давление, а азиды щелочных металлов действуют на человека почти1 так же, как цианиды.
Аммиак образует с воздухом взрывчатые смеси, а производство нитратов и нитритов относят к числу пожаро- и взрывоопасных.
294
В частности, нитрат и нитрит аммония способны самопроизвольно взрываться с особенно большой силой.
Белый фосфор — сильнодействующий яд, смертельная доза для человека 50—100 мг. Он опасен и в меньших дозах, так как аккумулируется в организме и вызывает некроз (омертвление) костных тканей, разрушение челюстей и выпадение зубов. Фосфин — ядовитый газ, с характерным запахом чеснока и гниющей рыбы. Он действует преимущественно на нервную систему и систему, регулирующую обмен веществ. При концентрации более 0,1 мг/м3 вызывает рвоту, обморок и смерть. Хроническое отравление этим веществом приводит к расстройству зрения и язве желудка. Оксиды фосфора, особенно Р4О10, а также РС1з вызывают ожоги кожи и поражения слизистых оболочек.
Фосфаты металлов — одни из наиболее безопасных для человека соединений. Они необходимы для питания, добавляются в тонизирующие и лекарственные препараты, зубные пасты.
За последние 10—20 лет создано очень много токсичных фосфорсодержащих нервнопаралитических газов: зарин, табун, зоман и др. Табун, в частности, имеет состав (CH3)2NPO(C2H5>OCN. Нервнопаралитические газы всасываются через кожу, глаза, органы дыхания и блокируют деятельность нервной системы, чем и вызывают смерть. Для человека однократное вдыхание этих газов уже является смертельным.
Упражнения к главе 15
1. Может ли фосфор разлагать воду?
2. Какие металлы взаимодействуют с азотом уже в обычных условиях?
3. Отличается ли термическое разложение нитрита и нитрата аммония?
4. Приведите примеры, когда Н3РО4 проявляет свойства основания.
S. Зачем в реакцию промышленного получения Р4 вводят диоксид кремния?
6. Какая из частиц NO + или NO более устойчива?
7. Какие реакции N2O с галогенами вы знаете?
8. Возможен ли протолиз в воде ковалентных молекул
гидразина и гидроксиламина?
9. Может ли взаимодействовать Р4 с азотной кислотой и
гидроксидом калия?
Ю. Как протекает гидролиз РС13О, РС16 и РС13?
11- Кристаллы РС15 и РВг5 содержат молекулы или ионы?
12- Как разлагаются при нагревании нитраты металлов?
13. Напишите уравнение реакции взаимодействия водного раствора азидоводорода с марганцем.
14. Через воду пропускают сначала диоксид азота, а затем кислород. Можно ли ожидать появления в растворе новых веществ?
и । ,1?' Какие реакции *2НРО4 и К3РО4? NH1!6’ В Двух п°РЧиях Г4' а во второй
° наружИть в первой
протекают при прокаливании КН2РО4, воды растворили кристаллы: в перврй — РН41. Какие ионы можно будет и второй порциях раствора?
295
ГЛАВА 16. ХИМИЯ ЭЛЕМЕНТОВ VIA-ГРУППЫ
В VIA-группу периодической системы входят пять элементов: кислород О, сера S, селен Se, теллур Те и полоний Ро. Первые четыре элемента получили еще в прошлом столетии групповое название — «халькогены», что означает «образующие руды» или «относящиеся к медным рудам». Отсюда и название некоторых минералов, содержащих эти элементы: халькозин C112S, халькопирит CuFeS?.
Электронная конфигурация невозбужденных атомов элементов VIA-группы — ns пр* (валентные электроны). Наиболее стабильная степень окисления элементов в их соединениях (-II) характерна только для кислорода. Эта степень окисления связана с присоединением двух электронов и образованием устойчивой 8-электронной конфигурации ns1 пр . У Те и Ро, отчасти и у Se, обладающих меньшей электроотрицательностью, стабильной является степень окисления (+IV), которую имеют эти элементы в соединениях с фтором, кислородом и хлором (ТеОг, P0CI4 и др.).
Кислород, сера и селен — типичные неметаллы, у теллура появляются металлические свойства, а полоний относят к металлам. Полоний — радиоактивный, мягкий, серебристо-белый металл с т. пл. 254 °C. Он окисляется на воздухе до Р0О2 и осаждается из растворов сероводородом в виде PoS. С концентрированными HNO3 и H2SO4 полоний взаимодействует с образованием Ро(Г*Юз)4 и Po(SO4)2-
Сера и селен в твердом, жидком и газообразном состояниях образуют циклические молекулы: Sg, See, S6, Se6 и др. Двухатомные газообразные молекулы халькогенов содержат на л* - МО два неспаренных электрона, что объясняет появление у молекул парамагнитных свойств (см. раздел 5.7).
В VIA-группе с увеличением атомного номера элемента все заметнее начинает играть роль в образовании химических связей - Рл взаимодействие из-за сближения энергий р- и J-АО. В частности, кристаллы SeO2 имеют цепную пирамидальную структуру
X <7 2 О
с мостиковыми связями Se — О — Se, вызванными перекрыванием
p-АО кислорода с вакантными J-АО селена. В газообразном состоянии мономерные молекулы SeCh и ТеОг имеют, как и SO?, угловое строение («//-гибридизация с неподеленной парой электронов).
У молекул воды угол между связями О—Н равен 104,5° (^-гибридизация АО кислорода), а в остальных халькогеноводородах этот угол близок к 90°, что свидетельствует об отсутствии гибридизации s- и p-АО атомов халькогенов и участии в образовании связей «чистых» р-АО-
При переходе от H2S к НзТе с уменьшением термодинамической устойчивости соединений возрастает их восстановительная способность, что находит отражение в изменении значений (298 К) реакции: Нг/г) + Э(Г) = НгЭр-)
296
Н2Э-»............... Н2О H2S H2Se Н2Те
bG° (298 К) кДж/моль . . -228 -21 +33 +10°
Склонность к гидролизу солей М2Э (М — щелочные элементы) уменьшается от MiS к МгТе.
Реакция диспропорционирования
3S + ОКОН = 2K2S + K2SO3 + ЗН2О
характерна только для серы и селена (см. раздел 33.3). С теллуром такая реакция протекает при нагревании. Охлаждение раствора смещает равновесие реакции влево с выделением почти всего Те. Реакции типов
K2SO3 + S = K2SO3(S) и K2S + nS. -K2S„+i для селена и теллура неизвестны.
В ряду слабых кислот: БОг’хНзО, НгЗеОз, НзТеОз наибольшей восстановительной способностью обладают водные растворы SO2:
НгЗеОз + 2SO2 + Н2О = Se; + 2H2SO4
ТеО2 + 2SO2 + 2НгО » Те| + 2H2SO4
Полное выделение Se и Те происходит только из сильнокислых (НС1) растворов. С увеличением металлических свойств халькогенов возрастает ионность химических связей в их диоксидах: SO2 < SeO2 < ТеОг. В этом же направлении уменьшаются летучесть, кислотные свойства и взаимодействие их с водой.
Среди триоксидов халькогенов сильными окислителями являются только триоксиды серы SO3 и селена SeOs, которые к тому же энергично взаимодействуют с водой с образованием сильных кислот: H2SO4 и H2SeO4. В отличие от них триоксид теллура ТеОз окислительными свойствами не обладает, с водой практически не взаимодействует и только в водных растворах КОН и NaOH при нагревании превращается в тетраоксотеллураты (VI):
ТеОз + 2КОН = К2ТеО4 + Н2О
Слабая кислота НбТеОб (КК]“2*10 , 25 °C) может быть получена только косвенным путем:
Те + ЗН2О2 = НбТеОб
16.1. РАСПРОСТРАНЕННОСТЬ В ПРИРОДЕ. ОСНОВНЫЕ МИНЕРАЛЫ
Кислород — самый распространенный элемент в природе, его кларк равен '49,5%. Природный кислород является смесью трех стабильных изотопов: 160 (99,759%), 170 (0,0370%) и 19О (0,204%). Кислород входит в состав воды (85,8%), воздуха (23,1%), многочисленных минералов земной коры (47,3%). С увеличением атомного номера халькогенов распространенность в природе резко падает: S - 0,048%; Se — 8*10 5%; Те — Ы0“6%; Ро - 2»10~14%.
297
Сера встречается в природе в различном состоянии. Самородная сера находится в недрах Земли в виде самостоятельных пластов. Полагают, что на глубине 20 км под алюмосиликатной оболочкой земной коры находится зона, состоящая из расплавленной серы и сульфидов металлов. Большие запасы серы сосредоточены в сульфидах и сульфатах металлов: пирите FeSz, халькопири-т е CuFeSz (на долю которых приходится 80% всех сульфидов, или 0,15% от массы земной коры), галените PbS, в юр т ц и-т е ZnS, мирабилите NazSO^lOHzO, кизерите MgSO^HzO, г и п с е CaSO^lHzO, барите BaSO4, целестине SrS04 и других минералах.
Второе место среди сырьевых источников серы после самородной серы, сульфидных руд и сульфатов занимают сероводородсодержащие газы природного и промышленного происхождения.
Селен и теллур найдены в природе только в виде селенидов и теллуридов серебра, золота, меди и висмута. Главными сырьевыми источниками Se и Те служат анодные шламы, остающиеся после электродного рафинирования меди, и шламы сернокислотного производства. Анодный шлам — глинистый осадок, выпадающий на дно электролитных ванн при рафинировании меди, содержит 3—14% Se и 0,3—3,0% Те. Шлам сернокислотного производства накапливается в нижней части влажных электрофильтров и состоит на 45—55% из элементарного селена.
История открытия элементов. Сера в самородном состоянии была известна за пять тысячелетий до н. э. Кислород был открыт четыре раза. Вначале Шееле в 1772 г. получил Ог «огненный газ» при прокаливании HgO, затем в 1774 г. кислород выделил таким же путем Байен, не зная об опытах Шееле. В этом же году кислород получил сначала Пристли, используя реакцию
(Pb2, РЬ)О4= ЗРЬО + 0,50? f
и одновременно Лавуазье, который дал кислороду его название и установил, что он входит в состав воздуха.
Байен Пьер (1725—1798) — французский химик.
В 1798 г. Клапрот, исследуя присланный ему «металл», нашел, что последний является новым элементом. Он назвал этот элемент в честь Земли — теллуром (от греч. Земля, планета).
Крапрот Мартин Генрих (1743-1817) - немецкий профессор химии, открыл уран, титан и церий.
Селен был открыт в 1817 г. Берцелиусом в шламе красного цвета, накапливавшегося на дне свинцовых камер сернокислотного производства. Так как Se по своим химическим свойствам был похож на теллур, то Берцелиус назвал его в честь Луны, спутника Земли (селена — греч. название Луны).
Последним был открыт Ро. Он был обнаружен в 1898 г. в урановой руде Кюри-Склодовской, которая дала название элементу в честь своей родины Польши.
298
16.2. КИСЛОРОД. ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА
Кислород в обычных условиях — газ без цвета, запаха и вкуса, г. пл. -219 °C, т. кип. -183 °C. Жидкий кислород — подвижная, слегка голубоватая жидкость. Твердый, жидкий и газообразный кислород обладает парамагнитными свойствами. Аллотропные модификации кислорода: Оз — озон и крайне неустойчивая молекула 04. Твердый кислород имеет еще три энантиотропные модификации:
«-02= Р~Ог= У-О2
Заметная диссоциация Ог на атомы наблюдается выше 2000 °C.
В воде кислород лучше растворим, чем азот и водород. Значительные количества кислорода растворяют фторуглеродные соединения, например CioFie — перфтордекалин. Их эмульсии применяют в качестве искусственной крови.
Кислород способен при высоких температурах растворяться в металлах, с которыми он непосредственно не взаимодействует. В частности, при 450 °C 1 см3 Pt и Au растворяет соответственно 77 и 48 см3 кислорода.
Подобно фтору, кислород образует соединения почти со всеми элементами, кроме Не, Ne и Аг. Однако непосредственно он взаимодействует в обычных условиях только с белым фосфором, щелочными и щелочно-земельными металлами, причем Р4, Ва, Rb и Cs самовоспламеняются в среде кислорода.
Галогены даже при нагревании с Ог не взаимодействуют, азот вступает в реакцию с Ог выше 3000 °C, а сера, селен и теллур сгорают в атмосфере кислорода выше 260 °C с образованием диоксидов.
Подробнее см.: Разумовский С. Д Кислород — элементарные формы и свойства. — М.: Химин, 1979.
В некоторых соединениях кислород присутствует в виде молекулярных ионов: 0$ — катиона диоксигенила, Ог — н адпероксидного аниона, О%~ — пероксидного аниона, Оз — озонидного аниона. При низких температурах возможно существование соединений с ионами и О4.
Основное количество кислорода получают из воздуха методами низкотемпературной ректификации, в результате которого жидкий воздух разделяется на кислород (им обогащается жидкая фаза) и азот, температура кипения которого -196 сС. Во многих странах Европы функционируют магистральные кислородопроводы, связывающие промышленные центры. Химические методы получения О? Утратили свое техническое значение и применяются сейчас только в лабораторных масштабах. К их числу относят методы термического Разложения некоторых солей:
ВаОг - ВаО + 0,50г t
2КМпО4 = К2МПО4 + МпОг + 021
( М11О2
КСЮз = КС1 + i,5O-2t
299
каталитическое разложение пероксида водорода:
2Н2О2 - 2НгО + Ог!
и электролиз воды (см. гл. 11).
Озон Оз — газообразное вещество синего цвета, с резким запахом, т. пл. -192 °C, т. кип. -112 °C. Молекула озона диамагнитна, малополярна (u = 0,53D) и имеет угловое строение:
Жидкий озон — вещество темно-синего, почти черного цвета. Озон взрывоопасен во всех агрегатных состояниях. Вследствие самопроизвольного распада хранить озон нельзя:
20з(г) - ЗО2(г); АС 0 (298 К) — 326 кДж
Озон принадлежит к сильным окислителям. В газовой фазе озон окисляет NO2 до N2O5; SO2 до SO3; С1г до CI2O7. В щелочном растворе с участием озона протекают реакции:
2Мп2+ + 20з + 6ОН- - 2МпО4 + ЗНгО + 0,50г Г
PbS + 20з — PbS04 + О21
Pb2+ + Оз + H2O - РЬОг! + 021 + 2Н+
Бесцветные гидроксиды калия, рубидия и цезия МОН (М= К, Rb, Cs) под воздействием озона превращаются в оранжево-красные озониды:
2М0Н(К) + 20з - 2МОз(к) + НгО + О,50г|
Качественно и количественно озон определяют при помощи реакции Оз + 2К1<р) + Н20= 1г! + 2К0Н + Ог!
Получение озона производят в озонаторах — приборах барьерного разряда (два электрода из А1 или Си, разделенных диэлектриком — стеклом или керамикой). Через зазор между электродами пропускают воздух или кислород, а на электроды подают переменный электрический ток высокого напряжения порядка 6—15 кВ. В зоне разряда протекают следующие реакции:
Ог- 0 + 0; О + Ог. Оз; О + Оз-—- 20г
Последняя реакция ограничивает возможность повышения концентрации Оз в газе свыше 10%. Присутствие влаги также сильно снижает выход озона.
300
16.3. ПЕРОКСИД ВОДОРОДА
Пероксид водорода Н2О2 является первым членом в гомологическом ряду полипероксидов водорода НгОц, молекулы которых образованы цепями из атомов кислорода (и = 2—4).
Пероксид водорода — бледно-голубая, сиропообразная жидкость, т. пл. -0,3 °C; т. кип. +152 °C, смешивающаяся с водой в любых отношениях из-за образования водородных связей. Молекула Н2О2 имеет сложную пространственную конфигурацию (рис. 64).
Пероксид водорода неустойчив при хранении, легко подвергается реакции диспропорционирования, протекающей часто со взрывом:
2Н2О2 - 2НгО + Ог!
В водных растворах Н2О2 — очень слабая кислота:
Н2О2***Н2О.- НзО+ + НОг, Кк-1,5-10"12 (20 °C)
Гидропероксидный анион в водном растворе кислотных свойств не обнаруживает. Соли Н2О2 называют пероксидами, а кислые — гидропероксидами. Пероксиды состава М2О2 образуют все щелочные элементы, а состава МОг — щелочно-земельные, цинк и кадмий (М — соответствующий элемент). Кристаллические пероксиды содержат О^ -ионы с длиной СРсвязи О—О, равной 149 пм.
В водных растворах соли Н2О2 разлагаются, например
К2О2 + Н2О - 2КОН + 0,50г f
Пероксид водорода проявляет как окислительные, так и восстановительные свойства, но первые выражены сильнее. Механизм окислительно-восстановительных реакций с участием Н2О2 в значительной степени определяется кислотностью среды (см. раздел 33.4).
Окислительные свойства. В кислой среде протолиз Н2О2 почти полностью подавлен, и в полуреакциях восстановления пероксид водорода участвует в виде молекул:
Н2О2 + 2Н+ + 2е~ - 2Н2О, <р ° - 1,77 В
В этой полуреакции пероксидная группировка —О — О— после при-
соединения 2е разрушается из-за полного заполнения электронами л*- и о*-МО (см. раздел 5.7):
2е
Г’П
Н—O-i-O—Н - 2ОН“;
ОН- + Н3О+ = 2Н2О
Удаление ОН -ионов из зоны ре-акции способствует усилению окислительных свойств Н2О2.
В щелочной среде:
Рис. 64. Структура молекулы пероксида водорода
301
НО2 + НгО + 2е~ - ЗОН , $р°-0,88 В
или
_2«Г__
Г'1 !
Н—О-рО*««Н4-О—Н * ЗОН-
ОН~-ионы остаются в зоне реакции, уменьшая тем самым окислительную способность Н2О2, о чем свидетельствует значение <р°. Окислительные свойства Н2О2 иллюстрируют реакции:
KI + ЗН2О2 - КЮз + ЗН2О
2 [Сг(ОН)б I3- + ЗНОг - 2СгО4 + 5ОН- + 5Н2О
Восстановительные свойства. Пероксид водорода является восстановителем только в присутствии сильных окислителей (КМпО4,НЬЮз, С1г, РЬОг, К2СГ2О7 и др.). В кислой среде:
Н2О2 - le = О2Г + 2Н+; <р° - 0,69 В
В этой полуреакции пероксидная группировка, потеряв 2е , разрывает свои связи с атомами водорода, превращаясь в молекулярный кислород. В щелочной среде:
НО2 — 2e"-O2t + H+; (р° = —0,08 В
Освобождающиеся в этой полуреакции протоны будут связываться в воду, что, естественно, способствует восстановительной способности Н2О2.
Восстановительные свойства Н2О2 иллюстрируют реакции:
2МпО4 + 5Н2О2 + 6Н+ - 2Мп2+ + 8Н2О + 50г Г
РЬОг + Н2О2 + 2Н+ - РЬ2+ + 2Н2О + Ог t
Получение. Промышленным способом получения пероксида водорода является электролиз раствора (NH4)2SO4 в серной кислоте:
катод (графит) (-): 2НзО+ + 2е =Н2(+2НгО
анод (платина) (+): 2HSO4-2e- = НгЗгОбЮг)
Пероксодисульфат водорода образует с ионами NHJ малорастворимую в серной кислоте соль (NH4>2S2O6(O2), которую отфильтровывают и обрабатывают нагретой водой:
8гОб(О2)2- + 2Н2О = Н2О2 + 2HSO4
Выделяющиеся пары Н2О2 и НгО конденсируют.
В лабораторной практике применяют некоторые химические способы:
0°С
ВаОг + H2SO4 = Н2О2 + BaS041
ВаОг + СОг + Н2О ** Н2О2 + ВаСОз I
302
16.4. ФТОРИДЫ КИСЛОРОДА
фториды кислорода — бесцветные или окрашенные газообразные токсичные вещества с неприятным запахом, члены гомологического ряда OnFz, где п ~ 1—6. Фториды кислорода — эндотермические, диамагнитные соединения, термическая устойчивость которых резко падает с увеличением числа кислородных атомов. При термическом распаде фторидов кислорода образуются фтор и кислород.
Дифторид кислорода OFz — наиболее стабильное соединение, устойчивое до 250 °C (т. пл. -224 °C, т. кип. -145 °C). Дифторид дикислорода O2F2 уже разлагается на F2 и Ог при температуре выше -100 °C. Фториды кислорода с л г 2 имеют зигзагообразную структуру (рис. 65), в которой концевые позиции занимают атомы фтора, причем химические связи неравноценны. Например, в молекуле O2F2 связи О—О прочные, в то время как связи О—F слабые, так как образованы за счет электронов, находящихся на Л*-М0 молекулы Ог. Дифторид кислорода OF2 имеет, как и молекула НгО, угловое строение (103°, связь О—F равна 141 пм), объясняемое с позиций sp-гибридизации АО атома кислорода (см. раздел 5.3).
Фториды кислорода — сильнейшие окислители. Они, кроме OF2, энергично взаимодействуют с водой и водными растворами КОН (NaOH):
O2F2 + 2КОН - 2KF + Н2О + 1,502 Т
O3F2 + Н2О = 2HF + 20гг
Со многими веществами фториды кислорода вступают в бурные реакции, сопровождающиеся воспламенением и взрывом. Реакции заканчиваются образованием фторидов элементов в их высших степенях окисления.
Например:
СаО + OF2 = CaF2 + 02t
2Р + 4(OF2) = PF5 + POF3 + 1,50г t
S + 3(O2F2) =SF6 + 3O2t
Дифторид кислорода может быть получен при пропускании F2 через водный раствор NaOH:
2NaOH + 2F2 = OF2f + 2NaF + H2O
Остальные фториды кислорода образуются при облучении охлажденной до -180 °C смеси Ог и F2 ультрафиолетовым светом или при действии тлеющего электрического Разряда.
Подробнее см.: Никитин И. В., Росоловский • и. усп. химии, 1971 т 40 с 1913
Рис. 65. Структуры дифторидов поликислорода:
а — O2F2; б — предполагаемая структура O4F2
303
16.5. ДИОКСИГЕНИЛЬНЫЕ СОЕДИНЕНИЯ
К диоксигенильным соединениям относят ионные кристаллы, содержащие катион Oj: Ог[ЭРб], где 3 = Pt, Sb, As, V, Nb, Bi, Ta, P, Cr, Au и др.; Ог[ЭР5], где Э = Ti, Мп, Ge; (ЫЭгРи ], где Э = V, Nb, Та, Sb и Bi.
Термическая устойчивость таких веществ различна. Так, O2[SbF61 разлагается при нагревании только выше 240 °C; О2 [PtFb 1 возгоняется около 90 °C в вакууме без разложения; ChlGeFs] разлагается уже в обычных условиях, а Ог[РРб] распадается на PF5, Ог и F2 при -80 °C.
Диоксигенильные соединения принадлежат к сильнейшим окислителям. Они легко взаимодействуют с водой, ксеноном:
3O2[PtF6 J + ЗН2О = 3H2[PtF6] + 3O2t + Оз f
Хе + 2O2[SbF6i - (XeF) [Sb2Fu ] + 20г t и многими другими веществами.
Общий метод синтеза диоксигенильных соединений — взаимодействие фторидов кислорода с фторидами элементов в их высших степенях окисления, например
O2F2 + BF3 = Ог(Вр4 ] + 0,5F2f
Возможно применение способа непосредственного окисления молекулярного кислорода сильнейшими окислителями:
О2 + PtF6 - O2[PtF61
16.6. СЕРА. ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА
В виде простого вещества сера имеет большое число аллотропных модификаций, содержащих циклические и линейные молекулы состава Sx, где х - 3—20, а по некоторым данным х = 3—33.
В обычных условиях сера существует в виде циклооктасеры Se, кристаллы которой содержат молекулы, имеющие вид короны (рис. 66, а). Известны три кристаллические аллотропные модифи
Рис. 66. Строение молекулы Se (а) и катиона S$+ (б)
304
кации циклооктасеры. Наиболее устойчивой среди них является a-Se (ромбическая модификация), обладающая хорошо известным желтым цветом, очень малой электро- и теплопроводностью. В воде эта модификация практически нерастворима, но хорошо растворима (мае. доли) в CS2 (34%, 25 °C) и ацетоне (2,65%, 25 °C). Из растворов сера кристаллизуется снова в «-модификации. Природная сера почти полностью состоит из Ct-Ss (см. раздел 6.3).
При 95 °C Ct-Sg энантиотропно переходит в Д-Ss (моноклинная модификация), а при 101 °C Д-Ss превращается в y-Ss, которая плавится при 115 °C и кипит при 445 °C.
Расплавы серы содержат почти все ее аллотропные модификации. Во всех твердых и жидких состояниях сера диамагнитна. Парообразная сера содержит молекулы составов Se, S6, S4 и S2. Выше 800 °C сера состоит преимущественно из двуатомных парамагнитных молекул, придающих пару голубоватую окраску. Выше 1000 °C молекулы S2 распадаются на атомы.
Сера — химически активное вещество. Известны ее соединения почти со всеми элементами, кроме благородных газов, Au, Pt, I2 и At2- Сера горит на воздухе голубоватым пламенем: S8 + 8O2 = 8SO2. Фтор способен воспламенять серу уже в обычных условиях с образованием SF6, а хлор и бром реагируют с Ss при небольшом нагревании, превращая серу в галогениды различного состава: SCI2, S2Br2, S2CI2. (Во всех последующих реакциях для их упрощения вместо символа Ss будет использован символ S.)
С водородом сера взаимодействует обратимо выше 150 °C, образуя H2S, начиная с 400 °C сероводород разлагается на исходные вещества. В реакции с углеродом парообразная сера превращается в дисульфид углерода CS2, а при сплавлении с фосфором Р4 образует нестехиометрические сульфиды состава ₽4Sx, х ~ 3 или =7 (см. раздел 28.4).
С концентрированными растворами H2SO4 и HNO3 сера взаимодействует только при повышенных температурах:
2H2SO4+S=3SO21 + 2H20t
6HNO3+S=H2SO4+6NO2f + 2Н2О
Взаимодействие избытка серы с водными растворами гидроксидов щелочных и щелочно-земельных элементов при температуре до 100 С приводит к образованию полисульфидов и тиосульфатов:
(2x+2)S(k)+6KOH=2K2Sx+K2SO3(S)+3H2O
где л=2—5, с преобладанием сульфидов состава K2S5 и CaSs.
Сильными окислителями (SbFs, AsFs) в среде НР(ж) сера превращается в циклические катионы Si+ и S?<t (рис. 66, б):
Ss+3AsF5=Ss [AsF6 ]2+AsF3
2S8+3SbF5=S 16 [SbF6 ]2+SbF3
При сплавлении или нагревании сера взаимодействует почти со всеми металлами с образованием сульфидов, являющихся в основном нестехиометрическими соединениями.
305
Получение серы производят в промышленности либо извлечением самородной серы из недр Земли, либо переработкой природных сероводородсодержащих газов (окисление при недостатке кислорода):
2H2S+O2 = 2S1 + 2Н2О
В ближайшем будущем «газовая» сера займет основное место в общем ее выпуске.
Подробнее см.: Менковский М. А., Яворский В. Т. Технология серы. — М.: Химия, 1985.
16.7. СУЛЬФАНЫ
Соединения серы с водородом состава НгБх, где х=1—23 называют сульфанами. Все сульфаны, кроме H2S, — жидкости желтого цвета с удушливым запахом. Анион у сульфанов S2 — изогнутая цепь связанных (7-связями атомов серы. При длительном хранении сульфаны превращаются в гомологи, более богатые серой, при нагревании сульфаны разлагаются на сульфаны с меньшим числом атомов серы и сероводород.
Сероводород (моносульфан) H2S — бесцветный, сильно ядовитый газ, с неприятным запахом, т. пл. —85 °C, т. кип. —60 °C. Диамагнитная, малополярная (Д = 0,9—1,1 D) молекула H2S имеет угловое строение (угол 92,2°) с sa- р<х-связями, длиной 134 пм (см. рис. 11).
Растворимость H2S в воде невелика. При 25 °C и давлении 101 кПа насыщенный бесцветный раствор H2S является 0,1 М. В водных растворах H2S проявляет свойства очень слабой двухосновной кислоты:
H2S + Н2О Н3О++ HS"; рХк=7,05
HS" + НгО НзО++ S2-; рАк=12,89
В смеси с воздухом H2S постепенно окисляется:
2H2S+O2=2S| +2Н2О
Особенно легко эта реакция протекает в водных растворах H2S, которые при стоянии на воздухе мутнеют. Сероводород воспламеняется на воздухе выше 250 °C и сгорает:
2H2S+3O2 - 250г + 2НгО
Сероводород принадлежит к числу сильных восстановителей:
S+2H+ + 2е~ = H2S; ^°=0,14 В
В водном растворе его окиОляют SO2, 1г, конц. H2SO4 и HNO3:
2H2S + SO2=3Sl + 2Н2О
H2S + I2“S I + 2HI
H2S + H2SO4 - S l + S02t + 2НгО
а РЬОг вызывает даже воспламенение:
4H2S + ЗРЬОг - 3PbS+SO2f + 4Н2О
Для получения H2S в лабораторных условиях применяют реакцию
FeS + 2НС1 - H2S f + FeCl2
Более чистый газ образуется при разложении сульфида кальция:
CaS + 2НС1 = H2S t + СаС1г
Сульфиды. Сульфидами называют бинарные соединения серы с более электроположительными элементами, в том числе с некоторыми неметаллами (В, С, Si, Ge, Р, As, Sb). Сульфиды металлов и аммония относят к категории солей сульфанов, в частности сероводородной кислоты. Щелочные, щелочно-земельные металлы образуют ионные сульфиды — гигроскопичные вещества стехиометрического состава. Сульфиды других металлов — ковалентные соединения, как правило, нестехиометрического состава.
Сульфиды щелочных металлов и аммония (М) хорошо растворимы в воде, но в водном растворе они подвергаются сильному гидролизу:
M2S - 2М+ + S2"; S2" + НгО • HS" + ОН", Ко - 0,08 (25 °C)
вызывающему появление у раствора сильнощелочной реакции (в 0,1 М растворе M2S при 25 °C pH 13,0). Водные растворы сульфидов щелочных металлов на воздухе постепенно окисляются до тиосульфатов:
2Na2S + 20г + Н2О - Na2SO3(S) + 2NaOH
а при нагревании их кристаллов образуются сульфаты:
Na2S + 20г = NazSCM
Концентрированные водные растворы и расплавы сульфидов щелочных и щелочно-земельных металлов и аммония (М) взаимодействуют с серой с образованием полисульфидов составов M2Sx и MS*, где л = 2—9.
Сульфиды остальных элементов — малорастворимые в воде вещества, некоторые из них подвергаются медленному необратимому гидролизу:
SiS2 + 4НгО - H4SiO41 + 2Нг8 г
A12S3 + 6Н2О - 2А1(ОН)з I + 3H2S f
Сульфиды р- и d-элементов превращаются при нагревании на воздухе в оксиды:
2ZnS+3O2=2ZnO+2SO21
Окислительный обжиг является одной из стадий переработки при-Р°ДНого сульфидного сырья. Все сульфиды разлагаются кислотами, особенно быстро кислотами-окислителями, в частности
307
Bi2S3 + 8HNO3 - 2Bi(NO3)3 + 2N0f + 3Sl + 4H2O
Разложение сульфидов металлов (II) кислотами, не являющимися окислителями (см. раздел 7.11), отвечает равновесию
MS(K) + 2Н3О+ 5= М2+ + H2S(P) + 2Н2О где ион М2+ — это аквакатион [М(Н2О)х]2+. Константа равновесия этой реакции равна:
Ко (25 °C)
ПР (MS) [м2+ ] [H2S]
Кк2 [н3о+ ]2
Отсюда, допустив [H2S]“0,l К1, получим [М2+]« 1023ПР (MS) [Н3О+]2.
Зная произведение растворимости сульфида ПР (MS) и концентрацию ионов оксония, можно определить концентрацию катионов металла в разбавленном растворе кислоты после установления равновесия.
Помимо сульфидов известны и гидросульфиды (KHS, Ca(HS)2 и др.) — хорошо растворимые в воде вещества, подвергающиеся в растворе гидролизу.
Среди многочисленных методов получения сульфидов наиболее часто меняют непосредственное взаимодействие с серой или H2S простых веществ, их оксидов и солей:
t
Fe + S — FeS; Zn + HtS = ZnS + H2f
BaO + H2S = BaS + H2O
CuSC>4(p) + H2S(r> = CuSl + H2SO4<p)
Наибольшее техническое значение среди сульфидов имеет Na2S, получаемый при помощи реакции
Na2SO4 + 4С= Na2S + 4СО f
Подробнее см.: Самсонов Г. В., Дроздова С. В. Сульфиды. — М.: Металлургия, 1972.
16.8. КИСЛОРОДНЫЕ СОЕДИНЕНИЯ СЕРЫ
Все оксиды и кислородные кислоты серы принадлежат к экзотермическим соединениям. Оксиды в низших, нечетных степенях окисления серы неустойчивы и легко подвергаются реакциям диспропорционирования:
2S2O = 3S + SO2 f; 2S2O3 = S + 3SO2 f
Наиболее изученными кислородными соединениями серы являются оксиды SO2 и SO3, сульфиты металлов; серная кислота и ее соли, тиосульфаты, в частности тетраоксодисульфаты (III) щелочных ме
308
таллов, политионовые кислоты НгБхОб и их соли, дисерная кислота H2S2O7 и ее соли, пероксомоносерная Н25Оз(Ог), пероксодисерная Нг82Об(О2) кислоты и их соли.
Тетраоксоди сульфат (III) водорода H2S2O4 существует только в водном растворе в виде двухосновной кислоты (Хк1 - 0,5 и Кк2 = 4»10 л), разлагающейся при упаривании раствора:
2S2O1" + Н2О - 2HSO3 + SChCS)2-
В анионе S2O1~ атомы серы слабо связаны между собой, длина связи S—S равна 240 пм. Тем не менее соли H2S2O4 обладают большей стабильностью, хотя в сврих водных растворах постепенно распадаются даже без доступа воздуха по приведенному выше уравнению. Сухие соли при нагревании образуют смесь тиосульфата и сульфита:
2K2S2O4 = K2SO3 + K2SO3(S) + SO2f
Тетраоксодисульфаты (III) щелочных металлов — сильные в щелочной среде восстановители:
S2oi" +12 + 4ОН“ - 2SOi~ + 2Г + Н2О
Получают тетраоксодисульфаты (III) по реакции
2NaHSO3 + SO2 + Zn - ZnSO3I + Na2S2O4 + H2O
Диоксид серы SO2 — бесцветный газ с резким запахом, т. пл. — 75 °C, т. кип. — 10 °C, термически очень устойчив, диссоциация газа на S и Ог наблюдается выше 2800 °C.
Строение сильно полярной = 1,6 D) молекулы SO2 — угловое, (sp -гибридизация АО серы), угол 119,5°, длина двойной связи S—О равна 143 пм. Большая устойчивость молекулы указывает на возможность - рл-связывания (см. раздел 5.3).
При взаимодействии SO2 с водой образуются нестехиометрические гидраты SO2»xH2O, обладающие свойствами умеренно сильной кислоты:
SO2»xH2O + Н2О^=? НзО+ + HSO3 + (х — 1)НгО; Ак=1,54»10-2 (25 °C)
Гидрат состава SO2»7H2O выделен из его водных растворов при температуре ниже 0 °C в виде бесцветных кристаллов, полностью разлагающихся выше 7 °C.
Абсолютно сухой SO2 в обычных условиях не взаимодействует с галогенами, H2S, СО, Нг и Ог. Реакция
2Б0г + Ог 2SO3
протекает только при высоких температурах в присутствии катализатора (см. раздел 34.3). Присоединение молекулы С1г к молекуле оОг также требует участие катализаторов (влага, активированный
309
S02 + Cl2 = SCI2O2
Диоксид серы в водном растворе взаимодействует с HNO2 и N2O3 (ИгОз^ NO + NO2):
SO2 + N2O3 + Н2О - H2SO4 + 2NO t 2HNO2 + SO2«xH2O = H2SO4 + 2NOf + хНгО
Эти реакции лежали в основе «н и т р о з н о г о» метода получения H2SO4, теперь почти не используемого («нитрозой» называли водный раствор H2SO4, содержащий NO, NO2, N2O3 и (NO)HSO4).
Диоксид серы в большинстве своих реакций проявляет свойства восстановителя. Например:
SO2 + Н2О2 - H2SO4; SO2 + NO2 - SO3 + NO
SO2 + 2HNO3 - H2SO4 + 2NO25 SO2 + Оз = SO3 + Ог
Известно небольшое число реакций, где SO2 выполняет функции окислителя в соответствии с полуреакцией:
SO2(p) + 4Н+ + 4е~ = S 4 + 2Н2О, <р° - 0,45В
Например,
н2о
SO2 + 2H2S = 3Si +2НгО
или
SO2 + 2СО - SI + 2С0г (500 °C; AI2O3)
Получение SO2 в промышленности производят сжиганием серы и обжигом сульфидов металлов:
4FeS2 + 1Ю2 = 2РегОз + 8SO2J
В лабораторных условиях применяют реакции:
Na2SO3 + H2SO4 - Na2SO4 + S02t + Н2О
Си + 2H2SO4 - CuSO4 + SO2 f + 2НгО
Диоксид серы взаимодействует в присутствии воды с активными металлами, оксидами, гидроксидами, карбонатами, гидрокарбонатами металлов с образованием сульфитов и гидросульфитов:
Zn + SO2 + Н2О = ZnSO3 + Н21; КОН + SO2 = KHSO3
Сульфиты и гидросульфиты. Гидросульфиты металлов хорошо растворимы в воде, некоторые из них . известны только в растворе, например Са(Н80з)г. Сульфиты же металлов, кроме сульфитов щелочных металлов и аммония, малорастворимы в воде.
Сульфиты и гидросульфиты принадлежат к соединениям, которые, как и SO2, могут быть и восстановителями, и окислителями. В водном растворе онй восстанавливаются Цинковой Пылью до тет-
Й10
раоксодисульфатов (III), а при нагревании сухих солей с такими восстановителями, как С, Mg, Al, Zn, они переходят в сульфиды:
ЫагБОз + ЗС - NaiS + 3COt
В водном растворе сульфиты и гидросульфиты легко окисляются до сульфатов:
NaHSO3 + Ch + Н2О = NaHSO4 + 2НС1
Окислителем растворенных сульфитов при нагревании может быть и сера:
SOi" + S = SO3(S)2"
L_..J
2г
Нагревание сухих сульфитов и гидросульфитов вызывает реакции соответственно диспропорционирования и конденсации:
4K2SO3 - 3K2SO4 + K2S; 2KHSO3 - K2S2O5 + Н2О
Политионовые кислоты. Оксокислоты состава Нг(Оз5—S*—SO3), где х = 0—16, называют политионовыми кислотами. Кислоты, у которых х = 0,1 и 2, называют соответственно дитионовой, тритионовой и тетратионовой кислотами. Политионовые анионы состоят из зигзагообразных цепей атомов серы.
Политионовые кислоты существуют только в виде желтовато-зеленых растворов, медленно разлагающихся при хранении:
H2S2 + хОб - H2SO4 + SO21 + xS )
Нагревание до 40—60 °C изменяет характер разложения растворов:
НгБг+хОб = НгЗдуОб + (2 + y)S 1
Многочисленные соли политионовых кислот выделяются из водных растворов в виде бесцветных кристаллов, содержащих различное число молекул воды. Комплексные катионы стабилизируют цепочечные анионы S2+xO?~ В частности, удалось получить [Co(NH3)6]2(S37O6)3*6H2O.
Политионаты щелочных металлов хорошо растворимы в воде. В сухом состоянии политионаты металлов устойчивы. При нагревании они разлагаются, причем дйтионаты — без выделения серы:
ВаБгОб’ЗНгО = BaSO4 + S02t + 2НгО
а политионаты — с ее выделением:
K2S4O6 - K2SO4 + SO2f + 2S1
Растворы политионовых кислот получают методами криохимии при взаимодействии сульфанов НгБ* с SO3 в среде этилового эфира:
H2Sx + 2SO3-H2S2+xO6
Применяют также реакции:
311
о
о
о
о
Рис. 67. Структуры одиночных молекул тиосерной (а), серной (6) и дисерной кислот (в)
BaSiOfi + H2SO4 - H2S2O6 + BaSO41
МпОг + 2SO2 “ МпБгОб
Тиосерная кислота Нг80з(8) в виде бесцветной маслянистой жидкости получена только при температурах ниже —83 °C в среде этилового эфира при помощи реакции присоединения:
H2S + SO3 - H2SO3(S)
когда окислительно-восстановительные процессы сильно заторможены. В этих условиях возможно получение Нг80з(8) и в реакции сероводорода с триоксохлоросульфатом (VI) водорода:
H2S + HSCIO3 = H2SO3(S) + HClf
Структура одиночной молекулы НгБОзСБ) — искаженная тетраэдрическая (рис. 67, а). Связь S—S является слабой, легко разрываемой, а действительный заряд на S(VI) равен +0,12е.
Попытки выделения Нг80з(8) из ее растворов упариванием последних в вакууме приводят к внутримолекулярной окислительно-восстановительной реакции:
H2SO3(S) = SO2t + SI + H2O
В водных растворах Н250з(8) проявляет свойства сильной кислоты. Соли тиосерной кислоты — тиосульфаты более устойчивы, чем сама кислота. Они образуют бесцветные кристаллы, хорошо растворимые в воде. Малорастворимы в воде тиосульфаты Ag, T1(I), РЬ и Ва.
Подробнее см.: Волынский Н. П. Тиосерная кислота. Политионаты.
Реакция Вакенродера. — М.: Наука, 1971.
При нагревании тиосульфаты щелочных металлов сначала плавятся, а затем, при более высоких температурах, разлагаются:
4K2SO3(S) = 3K2SO4 + K2S + 4SI
Гидротиосульфаты неизвестны, так как в кислой среде тиосульфаты распадаются:
SO3(S)2“ + 2Н3О+ = SO21 + S | + ЗН2О
312
Присутствие в тиосульфатах серы (-II) определяет их восстановительные свойства в водных растворах:
SO3(S)2“ + Н2О — 2е - SO1“+ SI + 2Н+ (тякиые окислители типа С1г, KMnCh) 2SO3(S)2- — 2е = S4Og
(слабые окислители типа Fe(III), I2, Cu(II)).
Для получения тиосульфатов применяют несколько реакций: окисление водного раствора Na2S кислородом воздуха:
2Na2S + 20г + Н2О - Na2SO3(S) + 2NaOH взаимодействие при нагревании водного раствора сульфита с серой: Na2SO3 + S = Na2SO3(S)
нейтрализацию водного раствора основания смесью H2S и SO2: 6КОН + 2H2S + 4SO2 - 3K2SO3(S) + 5Н2О
Триоксид серы SO3 кристаллизуется в трех полиморфных модификациях — а, р и у, температуры плавления которых равны соответственно 17°С(р = 0,02 МПа), 32°С(р = 0,05 МПа) и 62 °C (р = 0,23 МПа). Все три модификации легко возгоняются при нагревании (рис. 68).
Структура одиночной молекулы SO3 — плоская, треугольная (хр2-гибридизация АО серы) с длиной связи S—О, равной 142 пм. Полагают, что между атомами S и О существует еще - рл-вза-имодействие.
Наиболее легкоплавкая (Z-модификация состоит из циклических тримеров S3O9 (рис. 68) и в твердом состоянии напоминает лед. Следующая, Д-модификация, похожа по внешнему виду на асбест и образована зигзагообразными цепями тетраэдров SO4, связанных
Рис. 68. Структуры полиморфных модификаций триоксида серы: а —а -- SO3; б — /?-8Оз; в — y-SCh
313
между собой общим атомом кислорода. Наконец, у-модификация состоит из цепей тетраэдров SO4, объединенных в слои плоских сеток. Твердый триоксид серы, выпускаемый промышленностью или получаемый в лабораториях, представляет собой смесь этих полиморфных модификаций.
Триоксид серы энергично взаимодействует с водой:
SO3(r> + Н2О(Ж) “ H2SO4(p), ЛН°(298К) - — 130 кДж
Он поглощается серной кислотой, образуя с последней смесь поли-серных кислот (H2S2O7, H2S3O10 и др.), называемую «олеумом». Пропускание высушенных HF или НС1 над SO3 приводит к их присоединению к молекуле SO3 с образованием бесцветных жидких веществ состава HSO3F (т. кип. 163°С) и HSCIO3 (т. кип. 151 °C), разлагающихся водой, например:
HSCIO3 + Н2О - H2SO4 + НС1
Серная кислота H2SO4 — бесцветная маслянистая жидкость, т. пл. 10 °C; т. кип. 280 °C, константа автопротолиза
2H2SO4-=- НзБО| + HSO4; Ks - 3« Ю"4 (25 °C)
Одиночная молекула H2SO4 имеет тетраэдрическую структуру (см. рис. 67, б). В молекулярных кристаллах кислоты тетраэдрические молекулы связаны между собой водородными связями.
В водных растворах H2SO4 — сильная двухосновная кислота, образующая в разбавленных растворах ионы оксония от НзО+ до Н21ОЦ). Из насыщенных водных растворов серной кислоты могут быть выделены сульфаты оксония:
(H3O)2SO4= H2SO4«2H2O; (H5O2)2SO4= H2SO4’4H2O
Концентрированная серная кислота принадлежит к сильным окислителям. В зависимости от вида восстановителя полуреакции могут заканчиваться образованием SO2, S или H2S:
H2SO4 + 2Н+ + 2₽~ - SO21 + 2Н2О
H2SO4 + 6Н+ + бе" - S | + 4Н2О
H2SO4 + 8Н+ + 8е" - H2S f + 4НгО
Последние две полуреакции протекают при участии сильных восстановителей. Выделяющиеся S и H2S могут также взаимодействовать с H2SO4:
S + H2SO4 - 3SO21 + 2НгО; H2S + H2SO4 - SO21 + S1 + 2НгО
Таким образом, основной продукт восстановления серной кислоты — SO2.
Серная кислота способна взаимодействовать с NO2 и N2O3 (смесью NO и NO2):
314
H2SO4 + 2NO2 = (N0JHS04 + HNO3; AH °(298 K) - — 24 кДж
2H2SO4 + N2O3 - 2 (NO) HSO4 + H2O; AH 0 (298 K) - — 86 кДж
Гидросульфат нитрозила (NO)HSO4 — бесцветное гигроскопичное кристаллическое вещество с т. пл. 73 °C. В водном растворе он подвергается гидролизу:
(NO)HSO4 + Н2О 5=1 H2SO4 + HNO2
а при повышенных температурах HNO2 разлагается:
2(NO)HSO4 + Н2О = 2H2SO4 + NO f + NO2f
Концентрированная (96—98 %-ная) H2SO4 в обычных условиях пассивирует Fe, Сг, Со и Ni. Поэтому ее хранят и транспортируют в стальных цистернах.
Основным промышленным методом получения H2SO4 является каталитическое окисление SO2 кислородом воздуха до SO3 с последующей абсорбцией триоксида серы серной кислотой во избежание образования тумана. Катализатором в таком процессе служит V2O5 с добавками K2SO4 или Rb2SC>4 в качестве активаторов, а окисление SO2 проводят при температуре около 500 °C.
Сульфаты, гидросульфаты, дисульфаты. Соли серной кислоты — сульфаты и гидросульфаты — образуют многие металлы. Малорастворимыми в воде является ограниченное число сульфатов: CaSC>4, SrS04, BaSO4, PbS04. Сульфаты металлов разлагаются при прокаливаний на оксид металла и SO3, который затем диссоциирует на SO2 и О2. Чем более отрицательно значение <р° металла, тем устойчивее к нагреванию будет его сульфат. Например, CaSC>4 плавится при 1460‘’С без разложения. Сульфаты металлов с большим положительным значением <р° разлагаются при прокаливании подобно сульфату ртути:
HgSC>4 = Hg + SO21 + О21
Нагреванце гидросульфатов щелочных металлов до 150—200 °C приводит к образованию дисульфатов:
2KHSO4 - K2S2O7 + Н2О
Выше 300 °C дисульфаты переходят в сульфаты:
K2S2O7 “ K2SO4 + SO31
Дисульфаты — соли дисерной кислоты H2S2O7, существующей в обычных условиях в виде бесцветных прозрачных кристаллов (т. пл. 35 °C), дымящих на воздухе. При растворении в воде H2S2O7 и ее соли разрушаются:
H2S2O7 + Н2О - 2H2SO4; K2S2O7 + Н2О = 2KHSO4
Поэтому химия водных растворов H2S2O7 и ее солей является, по существу, химией H2SO4 и сульфатов.
315
Рис. 69. Структуры одиночных молекул пероксокислот: а—НаБОзЮг); б—HjSzOeCCh)
Структура молекулы H2S2O7 представлена на рис. 67, в. Получают дисерную кислоту смешением 100 %-ной H2SO4 с расчетным количеством SO3, отвечающим реакции
H2SO4 + SO3 - H2S2O7
Пероксомоносерная и пероксодисерная кислоты — бесцветные, гигроскопичные кристаллы, плавящиеся с разложением около 47 °C (Нг8Оз(Ог)) и 65 °C (НгБгОбСОг)). Структуры одиночных молекул кислот представлены на рис. 69.
Водород, связанный с пероксогруппой в Нг5Оз(Ог), на металл не замещается, поэтому известны только гидропероксомоносульфа-ты, например КНБОз(Ог). Обе кислоты подвергаются необратимому протолизу при нагревании их растворов:
H2S2O6(O2) + 2Н2О = 2H2SO4 + Н2О2
Ниже 0 °C водные растворы кислот устойчивы. Все соли пероксо-серных кислот растворимы в воде.
Пероксосерные кислоты и их соли принадлежат к сильным окислителям. Они способны, например, окислить Мп (II) до МПО4, Сг(1П) до СггО$ . В кислой среде полуреакции протекают следующим образом:
НБОзФгГ + Н+ + 2е = So3"+ Н2О
БгОбЮг)2- + 2е~ = 2SOi~; <р° = 1,96 В
Для синтеза Нг$20б(02) применяют электрохимический метод — электролиз концентрированных водных растворов H2SO4:
катод (—): 2НзО+ + 2е~ = Нг t + 2НгО
анод (+): 2SO3- — 2ё~ = 8гОб(О2>2
В лабораторных условиях используют реакции:
HSCIO3 + Н2О2 = H2SO3 (О2) + НС1
Нг8гОб(Ог) + НгО “ Нг8Оз(Ог) + H2SO4
316
16.9. ГАЛОГЕНИДЫ СЕРЫ
Сера образует соединения с фтором (SF6, SF4, SF2, S2F2 и S2F10), хлором (SCI4, SC12 и SxCh, где х = 2—100) и бромом (БхВгг, где х = 2 — 24). С уменьшением электроотрицательности галогенов уменьшается и склонность серы к взаимодействию с ними. С бромом, например, сера образует только цепочечные бромиды ^полисер^. Мало известно о иодидах серы, хотя катионы состава (S7I) и (S2I4)2 обнаружены в некоторых соединениях.
Все фториды серы, кроме жидкого S2F10, — бесцветные газообразные вещества. Гексафторид серы SF6 — неполярное, устойчивое к воздействию воды и расплава КОН вещество. Малореакционноспособным является в обычных условиях и S2F10. Остальные фториды серы (см. раздел 5.3) — химически активные вещества:
SF4 + 2Н2О = S02f + 4HF
При высоких температурах SF6, SF4 и S2F10 — сильные фторирующие агенты. Например, SF6 при 600—700 °C превращает W и Мо в гексафториды.
Подробнее см.: Опаловский А. А., Лобков Е. У. Усп. химии, 1975. Т. 44. С. 193.
Хлориды и бромиды серы — жидкие, оранжево-желтые вещества, неустойчивые в водной среде:
SC14 + 2Н2О = S02t + 4НС1
2SxBr2 + 2НгО = SO2f + (2х — 1)S I + 4HBr
При 18—25 °C SCI4 полностью диссоциирует на SCh и С1г, а ниже —30 °C представляет собой твердое желтое вещество.
Известны оксид-галогениды серы (IV) S0F2<r>, 8С1гО(ж) и др. и серы (VI) S0F4(r), 8С1гО2(ж) и др., молекулы которых имеют тетраэдрическую структуру (см. раздел 5.3). У оксид-галогенидов серы (IV) одна из sp3-гибридных орбиталей занята неподеленной парой электронов. Фторид-оксиды серы — газообразные вещества, устойчивые к воздействию воды. Например, дифторид-диоксид серы SO2F2 не реагирует с водой до 150 °C, a SOF2 в обычных условиях очень медленно разрушается в водной среде. Остальные оксид-галогениды серы — жидкие вещества, дымящие во влажном воздухе, подвергающиеся полному гидролизу:
SC12 + Н2О = SO21 + 2НС1; SCI2O2 + 2Н2О - H2SO4 + 2НС1
Получение галогенидов серы производят в большинстве случаев методом прямого взаимодействия серы и галогенов: S + 3F2 = SF6 ^8 потоке F2 сера сгорает синеватым пламенем); S + C12 = SC12; 6U2 + C12 = SC14; S + 2F2 = SF4 (в среде CCI3F при —78 °C).
317
16.10. ПРИМЕНЕНИЕ
Газообразный кислород используют в металлургии для интенсификации доменных и сталеплавильных процессов, при выплавке цветных металлов в шахтных печах (кислородное дутье). Кислород применяют в качестве окислителя во многих химических производствах, для сварки и резки металлов, жизнеобеспечения на подводных судах и космических кораблях. Жидкий кислород, озон, пероксид водорода — окислители ракетных топлив.
Основная часть производимого озона идет на обработку питьевой воды. Озонирование оказывает сильное бактерицидное действие, устраняет неприятный запах и привкус воды. Применяют озон и для стерилизации воздуха на мясокомбинатах и пивоваренных заводах, обезвреживания сточных вод, содержащих фенолы.
Пероксид водорода используют для отбеливания текстильных материалов и бумаги, в качестве реагента его применяют в производстве глицерина, органических и неорганических пероксидов, как дезинфицирующее средство. Порошкообразная сера — эффективный фунгицид в борьбе с вредителями хлопчатника, винограда и картофеля, компонент в производстве спичек и вулканизирующих средств для резиновой промышленности. Часть серы идет на получение CS2, хлоридов серы, красителей и коррозионностойких сортов бетона, кирпича, кровельной черепицы и теплоизоляционного материала.
Почти все количество (92 %) получаемой серы расходуется сернокислотной промышленностью, потеснив другие виды сырья, в том числе и пирит. Основным потребителем H2SO4 является производство фосфорных удобрений, кроме того, серная кислота используется в производстве синтетических волокон, моющих средств, полимерных материалов, сахара, растительных масел и жиров. Большое количество ее идет на очистку нефти и травление черных металлов.
Водные растворы SO2 применяют для отбеливания шерсти, шелка, сахара и кукурузной муки. Гексафторид серы используют в качестве газообразного изолятора в генераторах высокого напряжения и кабелях.
Сульфит натрия применяют главным образом в производстве вискозного шелка, органических красителей, для отбеливания тканей и дубления кож. Он является также реагентом при флотации руд цветных металлов.
Сульфиды натрия, кальция и бария применяют в кожевенной промышленности для удаления волосяного покрова с кожи, сульфиды цинка и кадмия — в производстве люминофоров и фотоэлектрических устройств. Селен нужен для производства выпрямителей переменного тока, фотоэлементов, окрашенного стекла, резины повышенной эластичности и стойкости к износу, полупроводников. Теллур применяют в качестве добавок к свинцу с целью улучшения его антикоррозийных и механических свойств.
318
16.11. токсикология
Озон ядовит для животного и растительного мира. Вдыхание воздуха с содержанием озона 0,002 мг/л уже вызывает кашель, рвоту, головокружение. При постоянной работе с пероксидом водорода наблюдается воспалительное заболевание кожи. При попадании Н2О2 в желудок появляются боли в животе, задержка дыхания, головные боли. Предельно допустимая концентрация пероксида водорода в воздухе 1,4 мг/м, при более высоком содержании возможны ожоги слизистых оболочек и дыхательных путей.
Сероводород — токсичное вещество, при его вдыхании наступает обморочное состояние и смерть от паралича дыхательных органов. В присутствии паров органических веществ токсичность H2S резко возрастает. Такими же ядовитыми являются и пары CS2, высокие концентрации CS2 действуют наркотически. К токсичным веществам относятся оксид-галогениды серы и S2F10, последний по физиологическому воздействию на человека напоминает фосген. Селен и теллур, попадая в виде различных соединений в организм человека, действуют аналогично мышьяку. Уже в ничтожных концентрациях газообразные производные селена и теллура вызывают головную боль и раздражение верхних дыхательных путей. В случае отравления селеном и теллуром появляется неприятный запах от всего тела и из полости рта.
Диоксид серы раздражает верхние дыхательные пути, вызывает спазм бронхов, рвоту и одышку. Аэрозоль H2SO4 (SO3 + НгО) более токсичен, чем H2SO4, его раздражающее действие проявляется уже при 1 мг/м . Серная кислота при попадании на кожу вызывает тяжелые ожоги и глубокие язвы. Пероксодисульфаты щелочных металлов способствуют появлению аллергических заболеваний.
Упражнения в главе 16
1. Какие реакции, в которых диоксид серы является окислителем, вам известны?
2. Как взаимодействует сера с K2SO3 и K2S? Может ли аналогичным образом взаимодействовать селен с триоксо-селенатом (IV) калия и селенидом калия?
3. Как протекает протолиз пероксида водорода?
4. Какие вещества образуются при подкислении водного раствора тиосульфата калия?
3. Возможен пи гидролиз SCU, SF6, SF< и SCI2O?
6. Объясните, почему структура молекулы озона является угловой, а не линейной.
2. Какие вещества образуются при взаимодействии О2 F2 и О4 F 2 с водой?
8* Чем отличается взаимодействие с водой триоксидов сеРы, селена и теппура?
Как протекает окислительно-восстановительная реакция участием сульфата марганца и пероксомоносерной кислоты? О. Чем отличаются водные растворы дисерной и серной кислот?
319
11. Какое строение имеют молекулы диоксида и триоксида серы?
12. Как получают в лабораторных условиях пероксид водорода?
13. Образованием каких веществ заканчивается термическое разложение гидросульфатов щелочных металлов?
14. Какое природное сырье применяют в настоящее время для производства серной кислоты?
ГЛАВА 17. ХИМИЯ ЭЛЕМЕНТОВ УПА-ГРУППЫ
Элементы VIIA-группы имеют групповое название «галогены», иначе «солеобразователи». В VIIA-группу входят фтор F, хлор С1, бром Вг, иод I и астат At. Электронная конфигурация невозбужденных атомов галогенов — nsinp:> (валентные электроны). Наличие пяти электронов на p-АО, в том числе одного неспаренного, является причиной высокого сродства галогенов к электрону (см. раздел 3.6). Присоединение электрона приводит к образованию галогенидных ионов (F-, СГ, Вг-, Г и At ) с устойчивой 8-электронной оболочкой следующего за галогеном благородного газа.
У галогенов в их соединениях встречаются степени окисления от (-1) до (+VII), равной номеру группы. Только фтор имеет одну степень окисления (-1), так как является всегда акцептором электрона.
Химическая активность галогенов уменьшается от фтора к астату, одновременно наблюдается усиление металлических свойств. Например, у иода известны соединения lJ(SO3F)-, it (Sb2Fn) , a At, как Bi и другие металлы, осаждается H2S из солянокислых растворов некоторых своих соединений.
Наиболее сильной окислительной способностью среди галогенов обладают фтор, хлор и бром. Иод может проявлять как окислительные (например, по отношению к H2S и S02), так и восстановительные (при взаимодействии с HNO3 и Н2О2) свойства.
Более электроотрицательный галоген всегда вытесняет электроположительный из его соединений с металлами. Так, F2 вытесняет все другие галогены из их галогенидов, а бром — только йод из иодидов металлов 21 + Вг2 = 12+ 2Вг . Такое хичическое поведение галогенов связано со значениями их стандартных электродных потенциалов (<р°, В), равных для F2, С12, Вг2 и 12 соответственно 2,87; 1,36; 1,09; 0,54 (кислые водные растворы).
Все галогены, кроме фтора, подвергаются в водных растворах в обычных условиях диспропорционированию, хотя оно и протекает в небольшой степени, уменьшающейся к тому же от хлора к астату, в частности,
Вг2 + Н2О НВгО + НВг
320
В твердом состоянии F2, С1г, Вгг и 1г образуют молекулярные кристаллы за счет дисперсионного взаимодействия, увеличивающегося от хлора к иоду с ростом поляризуемости молекул (см. раздел 6.1).
Характерной особенностью галогенов является устойчивость двухатомных ковалентных молекул галогеноводородов, превращающихся в водных и спиртовых растворах в сильные кислоты. У кислородных кислот галогенов наблюдается усиление кислотных свойств с увеличением степени окисления галогена, что вызвано увеличением числа электронов, участвующих в образовании ковалентных связей галоген — кислород, делокализацией электронов, уменьшением длины связи и возрастанием ее кратности. Перераспределение электронной плотности ослабляет связь Н—О, облегчает отрыв протона.
Галогены могут взаимодействовать между собой, образуя полярные ковалентные молекулы, состоящие из атомов двух разных галогенов. Межгалогенные соединения делят на фториды, хлориды и бромиды галогенов, например CIF3, BrFs, IF7, BrCl, ICI3, 1Вг и др. Межгалогенные соединения являются сильными окислителями по отношению к разнообразным неорганическим и органическим веществам.
Подробнее см.: Фиалков Я. А. Межгалоидные соединения. — Киев;
Академиздат УССР, 1958; Николаев Н. С., Суховерхое В. Ф., Шишков Ю. Д., Аленчикова И. Ф. Химия галоидных соединений фтора. — М.: Наука, 1968.
С галогенидами калия, рубидия и цезия межгалогенные соединения образуют кристаллические вещества — анионгалогенаты, а с некоторыми фторидами металлов и неметаллов в сильнокислых средах — катионгалогены. Например:
CsCl + lCl3.- Cs[IC141
BrF3 + SbF5 J BrF2 ] |SbF6 ]
Подробнее см. Степин Б. Д. Усп. химии, 1987. Т. 56. С. 1273.
Среди галогенов естественной радиоактивностью обладает только At, самым устойчивым природным изотопом которого является 219А1 с периодом полураспада, равным всего 54 с.
17.1. РАСПРОСТРАНЕННОСТЬ В ПРИРОДЕ. ОСНОВНЫЕ МИНЕРАЛЫ
Среди галогенов наиболее распространенными в природе являются хлор (0,19 %) и фтор (0,03 %). Хлор и бром концентрируются в водах океанов, морей и соляных озер. Бром, иод и астат — Рассеянные элементы, своих минералов они не образуют. Иода в природе меньше, чем урана, германия, лютеция и других элементов.
свободном виде галогены в природе не встречаются. Основные минералы, содержащие фтор: флюорит СаРг (плавиковый криолит Йаз[А1Рб] и фторапатит
аз(РО4>2»Са(Р, С1)2. Хлор входит в состав таких важных мине-как галит NaCl, сильвин КС1, карналлит KCl.MgCl2.6H2O.
Ч—1258
321
Флюорит — ценнейшее для современной промышленности сырье, но природа обеспечила нас им не более чем на одно поколение. Сейчас главным источником фтора становятся фторапатиты. Криолит («ледяной камень») богаче фтором, чем флюорит, но единственное на Земле месторождение криолита в Гренландии почти полностью исчерпано.
Основным промышленным источником получения иода и брома являются буровые воды нефтяных месторождений, в которых содержание брома достигает 0,01%, а иода 0,003%. Неисчерпаемый источник получения хлора и брома — морская вода.
Астат — один из самых редких на Земле элементов: в поверхностном слое земной коры толщиной 1,6 км содержится около 70 мг At.
История открытия элементов. Первым среди галогенов был открыт хлор. Шееле в 1774 г. обнаружил, что в реакции МпОг с НС1 выделяется химически активное газообразное вещество, получившее название хлора.
Иод был получен в 1811 г. Куртуа из золы морских водорослей. Бром в 1826 г. открыл Балар. Фтор в свободном виде удалось выделить в 1866 г. Муассану электрохимическим методом. Астат, предсказанный Д. И. Менделеевым, давшим ему название экаиода, был получен только в 1940 г. группой физиков под руководством Сегре. Сегре использовал для получения астата ядерную реакцию:
239Bi(«, 2л) IV At
Куртуа Бернар (1777—1838) — французский химик, владелец заводов по лроизводству мыла, соды и селитры.
Балар Антуан (1802-1876) - французский профессор химии. Муассан Анри (1852-1907) — французский профессор токсикологии и неорганической химии, выдающийся экспериментатор, лауреат Нобелевской премии, иностранный член Петербургской АН.
Сегре Эмилио (р. 1905) — американский физик-экспернмен-татор, лауреат Нобелевской премии.
17.2. ФТОР. ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА
Фтор — светло-желтый газ с резким запахом (т. пл.- 220 °C, т. кип. -188 °C), является наиболее активным простым веществом. Он взаимодействует практически со всеми другими простыми веществами, кроме Не, Ne, Аг, проявляя свойства сильнейшего окислителя. С кислородом и азотом Р'г в обычных условиях непосредственно не взаимодействует. Устойчивый NF3 (т. кип. 129 °C) получают по реакции: NH3 + 3Fi = NF3 + 3HF при избытке фтора, в присутствии азота. Известны фториды кислорода состава OxF2 (Xs - 1—6, см. раздел 16.4).
С водородом и щелочными металлами фтор реагирует со взрывом, образуя соответственно фтороводород HF и фториды металлов. Такие вещества, как Al, Zn, Р4, Mg, В, Sb и некоторые другие, в атмосфере фтора воспламеняются:
322
2А1 + 3F2 - 2A1F3; 2B + 3F2 = 2BF3
2P + 5F2 = 2PF5; Zn + F2 = ZnF2
При нагревании фтор окисляет Au до AuF3, Pt до PtF6, Хе до ХеРд. фтор взаимодействует с другими галогенами с образованием фторидов галогенов: CIF3, CIF5, BrFg, IF5, IF? и др.
С водой фтор взаимодействует в зависимости от температуры по-разному. Ниже О °C:
Н2О<к) + F2<r) = HOF(r> + НР(ж>
с образованием очень неустойчивого фторооксигената (0) водорода. Молекула HOF имеет угловое строение: угол HOF равен 97°, а межатомное расстояние О—F 144 пм.
При 0—90 °C:
Н20(ж> + 2F2<r) - OF2f + 2HF
С повышением температуры количество дифторида кислорода уменьшается, увеличивается содержание кислорода и частично озона в продуктах реакции. Водяной пар взаимодействует со фтором со взрывом:
Н2О<г) + F2 “ 2HF t + 0,5O2f
Фтор может вступать в весьма разнообразные реакции, которые не поддаются какой-либо классификации. В частности, реакция
2КОН + 2F2 - 2KF + OF2 f + Н2О протекает только в разбавленном (2—5 %-ном) водном растворе, а реакция
4КОН + 2F2 - 4KF + О2| + 2Н2О
в концентрированном водном растворе КОН.
Фтор взаимодействует с простым и кварцевым стеклом в присутствии следов воды (катализатор реакции, см. раздел 34.3):
SiO2 + 2F2 = SiF4t + O2f
Хранение и транспортировка фтора возможна только в сосудах из монель-металла (сплав Ni с Fe и Мп), меди или никеля. На поверхности этих металлов образуется при воздействии фтора тонкий плотный слой фторидов никеля или меди, защищающий металл от дальнейшей коррозии.
Во всех своих соединениях фтор, как правило, образует одну "'Связь и поэтому всегда располагается на периферии молекулы, 113 ее концах. Однако известны случаи, когда атомы фтора образуют Две связи (фторидные мостики). Например, SbFs в обычном состоянии — полимерная жидкость из-за появления между молекулами язей Sb—F—Sb (трехцентровые двухэлектронные связи).
химических методах получения F2 используют склонность к ложению при нагревании фторидов некоторых металлов (C0F3,
н*
323
TIF3, PtFb, МпРз и др.) и полифторометаллатов (К2[МпРб], K2|NiF6l, Ог[АиРб] и др.) Известны реакции:
2C0F3 = 2C0F2 + F2t Не
К2 [NiF6 ] = 2KF + NiF2 + F21
K2(NiF6] + 2HF(») “ 2KHF2 + NiF2 + F2t
K2(MnF6] + TiF4 = K2(TiF6] + MnF2 + F2f
Промышленным и основным лабораторным методами получения F? является метод электролиза расплавов KHF2 (т. пл. 239 °C) или KH2F3 (т. пл. 70 °C), так как безводный жидкий HF тока не проводит. Процесс электролиза сводится к разложению HF:
катод (никелевая сетка) (—):_2HF + 2е~ = Н2Т + 2F
анод (угольный) (+): 2F--2e -F2f с примесью 5—15% HF
17.3. ФТОРИД ВОДОРОДА
Фторид водорода — бесцветная легко кипящая жидкость (т. пл. -83 °C, т. кип. +20 °C) с резким запахом, сильно дымящая на воздухе. Безводный, жидкий HF — неэлектролит (см. рис. 22). Константа автопротолиза:
3HF.- H2F+ + HF5; Ks = 2,1»10-11 (25 °C).
В жидком состоянии молекулы HF при помощи водородной связи образуют цепочечные и циклические полимерные молекулы состава (HF)8, (HF)6. Даже газообразный HF содержит молекулы (HF)4, (HF) 2. Только выше 90 °C происходит полный распад полимерных молекул на одиночные. Твердый HF состоит из бесконечных зигзагообразных цепей (см. раздел 6.2).
Фторид водорода неограниченно растворяется в воде, и его водные растворы носят название фтороводородной кислоты (техническое название — плавиковая кислота). Величина Кк для равновесия:
HF + Н2О +=• Н3О+ + F" (1)
равна 6,7»10-4 (25 °C). При увеличении концентрации HF до 5—15 М происходит образование более сложных ионов:
F" + HF* * HF2; HF2 + HF H2F3 и т. д.
В результате кислотно-основное равновесие (1) смещается вправо и значение Кк увеличивается (см. рис. 23).
Химические свойства фтороводорода HF во многом зависят от присутствия воды. Безводный фтороводород не действует ни на металлы, ни на их оксиды и гидроксиды, водные же растворы HF можно хранить только в платиновых сосудах или сосудах из фторопласта и полиэтилена.
324
фтороводородная кислота взаимодействует со многими металлами, их оксидами, гидроксидами и карбонатами:
А10(0Н) + 3HF = A1F3 + 2Н2О
Zn + 2HF - ZnF2 + Н21
В реакциях
КОН + 2HF = KHF2 + Н20; NH3 + 2HF = (NH4)HF2
протекающих в водных растворах, содержащих избыток фтороводорода, образуются гидродифториды. Кристаллы этих соединений при нагревании выделяют HF:
KH2F3 - KF + 2HF t
От остальных кислот фтороводородную кислоту отличает ее способность взаимодействовать с SiO2:
SiO2 + 4HF = SiF4t + 2H2O
SiF4 + 2HF;=r H2[SiF6]
C SO3 фтороводород образует фторотриоксосульфат (VI) водорода:
HF + SO3 - HSO3F
очень сильную кислоту (т. кип. 169 °C), образующую много солей. Промышленное производство HF основано на взаимодействии флюорита с H2SO4 (конц.) при 150—300 °C:
CaF2 + H2SO4 - 2HFf + CaSO4l
Фтороводород вместе с парами воды отводят в медный сосуд, охлаждаемый до -10 °C, где и конденсируется 70—75% HF, содержащей значительное число примесей. Для получения чистой фтороводородной кислоты технический продукт подвергают дистилляции во фторопластовой аппаратуре.
Гексафторосиликат водорода H2[SiF6] — основной продукт, образующийся в виде 20 %-него водного раствора при улавливании HF и SiF4, выделяющихся в громадных количествах при переработке апатитов и фосфоритов сернокислотным и азотнокислотным методами (см. раздел 15.8):
3SiF4 + 4Н2О = 2Нг [SiF6 ] + H4SiO4; SiF4 + 2HF H2 [SiF6 ]
Из концентрированных водных растворов при температурах, близких к 0 °C, кристаллизуется H2[SiF6]*2H2O в виде бесцветных кристаллов, которые в обычных условиях неустойчивы и распадаются на SiF4, HF и Н2О. В водных растворах H2[SiF6] — устойчивая сильная кислота, существующая в виде ионов Н3О+ и [SiFb ] .
отличие от HF она не действует на SiO2. В виде своего 13,3%-ного водного раствора она перегоняется без разложения.
Фториды. Большинство фторидов металлов малорастворимо в Де. к растворимым фторидам принадлежат фториды щелочных еталлов, кроме LiF и NaF, фториды аммония и серебра. Раство
325
римые в воде фториды подвергаются гидролизу в соответствии с реакцией: 2F" + НгО ^==± HF2+ ОН~. Фториды щелочных и щелочно-земельных металлов имеют ионную кристаллическую решетку и являются твердыми веществами, плавящимися й кипящими без разложения. Фториды бериллия и алюминия возгоняются также без разложения. Фториды неметаллов в высшей степени окисления (ВРз(г), PF5(rt, SF6(r), SiF4(r) и др.) — газы или летучие жидкости с ковалентной химической связью. Их летучесть вызвана слабым межмолекулярным взаимодействием преимущественно ориентационным и диполь-дипольным.
Подробнее см.: ИсикаваН., Кобаяси Е. Фтор. — М.: Мир, 1982.
17.4. ХЛОР, БРОМ И ИОД. ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА
Хлор, бром и иод отличаются друг от друга по своему агрегатному состоянию: хлор — желто-зеленый газ (см. рис. 9), более чем в два раза тяжелее воздуха (т. пл. -101 °C, т. кип. -34°C), бром — тяжелая буровато-коричневая жидкость, затвердевающая при -7 °C и кипящая при +59 °C, а иод — твердые черно-фиолетового цвета кристаллы (см. табл. 14), плавящиеся с частичной возгонкой при 114 °C (т. кип. расплава 186 °C).
Среди рассматриваемых элементов наибольшей растворимостью в воде обладает бром (0°С, 4,22 г в 100 г НгО), а наименьшей — иод (0°С, 0,01 г в 100 г НгО). Растворы хлора и брома в воде получили название хлорной и бромной воды. При охлаждении таких растворов ниже 0 °C кристаллизуются нестехиометрические гидраты С1г*5,75 НгО и Вгг*7,67 НгО, называемые клатратами или соединениями включения. В полости кристаллического каркаса, образованного молекулами воды, включены молекулы хлора или брома (см. раздел 29.4). В водном растворе часть молекул галогенов взаимодействует с растворителем (реакции диспропорционирования) :
(Hal) 2 + Н2О - ' ННаЮ + Н+ + НаГ (2)
где Hals Cl и Вг. Константы этого окислительно-восстановительного равновесия для 25 °C равны: С1г — 3,9*10 4, а Вгг — 5,8*10 • Образование в реакции (2) НЮ термодинамически маловероятно. Для этой реакции: &G ° (298 К) = +70 кДж/моль, a AS ° (298 К) в - -3 Дж/(моль*К). Полагают, что 1г в водных растворах образует не НЮ, а гидрат иода:
1г + НгО 1+*Н2О + Г; Кс - 1,2* 10"11 (25 °C)
Появление 1+*НгО обнаружено и в обратимой реакции:
НЮ + Н+. _ - Г^НгО; Кс-22 (25 °C)
Природа гидрата иода исследована мало. Появление ионов I в приведенных выше реакциях вызывает образование дигалогеногалогенатных анионов:
326
(Hal)2 + Hal , [На1зГ устойчивость которых возрастает от хлора к иоду.
Подробнее см.: Степин Б. Д, Плющев В. Е., ФакеевА.А. Усп. химии, 1965. Т. 34. С. 1881; Степин Б. Д. Координац. химия, 1986.
Т. 12. С. 1587.
Водные растворы гидроксидов щелочных металлов превращают в обычных условиях Ch и Вег в оксохлораты или оксоброматы:
2К0Н + Ch - КСЮ + КС1 + НгО
Нагревание растворов вызывает реакцию диспропорционирования: ЗКСЮ - КСЮз + KCI
Анион 10 в водных растворах не обнаружен, в присутствии ОН -ионов иод немедленно превращается в иодид и триоксоиодат:
312 + 6К0Н - КЮз + 5KI + ЗН2О
В полисерных кислотах (H2S2O7 и др.), фторосерной кислоте HSO3F и S2O6F2 иод образует катионы ij, I3 и 1^:
2I2 + S2O6F2 = 2lJ +2SO3F
С HNO3 хлор и бром не взаимодействуют, а иод окисляется до триоксоиодата водорода:
12 + IOHNO3 “ 2Н10з + 10NO2f + 4Н2О
Растворы Ch в хлороводородной кислоте могут взаимодействовать с Au и Pt:
2Au + ЗС12 = 2АиС1з; A11CI3 + НС1 i=? Н [A11CI4 ]
Допускают, что при низких температурах возможно образование дихлорохлората (+1) водорода, сильного окислителя:
НС1 + С12 = Н |С1з > Н [С1(С1)2]
Аналогичные обратимые реакции наблюдаются и при взаимодействии галогенов с другими галогеноводородными кислотами, например:
HI + I2 Н [1з ]; HI + Ch Н [IC12 ]
НВг + 12.— ' H[I(IBr)J
Выделить из растворов пока удалось только тетрахлороиодат (+III) тетраоксония (Н9О4) [ICI4 ].
С водородом в обычных условиях хлор, бром и иод не взаимодействуют. Но при нагревании и освещении ультрафиолетовым светом смеси Нг и С1г последние взаимодействуют с воспламенением по типу неразветвленной цепной реакции:
CJ2. -2C1 (3)
С1 + Н2 ^=t НС14- Н (4)
327
Н + Ch z=t HC1 + ci (5)
Cl + H2 . -HC1 + H и т. Д. (6)
В реакции (3) цепь зарождается, а 6-я реакция уже повторяет 4-ю. С Вг2 водород может взаимодействовать около 600 °C со взрывом, а с иодом — только обратимо:
H2 + l2. -2HI; ЛС° (298 К) =+1,75 кДж/моль
С О2 и N2 галогены непосредственно не взаимодействуют, а озон превращает галогены в оксиды разного состава в зависимости от условий осуществления реакций. Аммиак окисляется хлором и бромом до свободного азота:
2NH3 + ЗВг2 = N2 + бНВг
а иод образует аддукт состава I3N«ЫНз. Оксид углерода при действии Ch и Вг2 превращается в СС12О и СВг2О. С иодом СО не реагирует.
Сероводород и сульфиды окисляются хлором, бромом и иодом до серы, например
H2S + I2 = Sl +2HI
Диоксид серы и сульфиты превращаются под действием хлора, брома и иода в сульфаты:
SOi- + Вг2 + Н2О - SOF + 2Вг“ + 2Н+
Хлор и бром окисляют тиосульфаты до сульфатов:
S2Oi~+ 4Ch + 5Н2О - 2SO^ + 10Н+ + 8СГ
а иод — до тетратионатов:
2S20i"+ I2-S4O^+2F
В атмосфере хлора и жидком броме горят Р4 (PCI3, РС15, РВгз и РВг5) и Se (S2C12, S2Br2 и SC12), воспламеняются многие металлы (Al, Zn, Sb, Си, Fe, Sn и др.), при этом образуются галогениды металлов в их высшей степени окисления.
С галогенидами щелочных металлов и аммония хлор, бром и иод взаимодействуют по-разному. Более электроотрицательный галоген вытесняет электроположительный из галогенидов лития и натрия:
2NaI + Ch - h + 2NaCl
Если в такой реакции участвуют галогениды калия, рубидия и цезия, то возможно образование анионгалогенатов (см. раздел 19.2):
CsI + Ch Cs [ICh ]; KBr + Ch К [BrCh J
В водном растворе галогенидов аммония также может происходить обмен галогенами и образование анионгалогенатов:
328
2NH4Br + Ch - 2NH4C1 + Br2
NH4I + 2Ch (NH4) (ICI4 ]
При взаимодействии водного раствора NH4C1 с Ch или NH4Br с Вг2 в среде СС14 образуются жидкие взрывоопасные нитриды хлора и брома:
2NH4C1 + 7Ch = 2C13N + 8НС1
Нитриды относятся к эндотермическим соединениям, \tHo (298 К) у С1зМ(ж) и ВгзЫ(ж) равны соответственно +228,9 и +272,0 кДж/моль. Твердый ВгзИ взрывается даже в виде суспензии в вазелиновом масле уже при -103 °C.
Хлор и, особенно, бром и иод хорошо растворяются в неполярных органических растворителях. Например, иод образует либо фиолетового цвета (CHCI3, CS2, СбНб, п-ксилол), либо красно-коричневого цвета (С2Н5ОН, (СгН5)гО и др.) растворы. В фиолетовых растворах иод находится в виде слабо сольватированных молекул, а в красно-коричневых — в составе комплексов с переносом заряда:
C2H5OH*l2. - C2H5OH+»l2
Органические растворители применяют для извлечения иода и брома из водных растворов различного состава.
17.5. ПОЛУЧЕНИЕ ГАЛОГЕНОВ
Хлор в промышленных масштабах получают при электролизе водных растворов NaCl:
катод (Fe) (—): 2НгО + 2е~ “Jh f + 2ОН
анод (графит) (+): 2С1 —2е “Chf
Продукты электролиза: Ch, Н2 и NaOH. В лабораторных условиях используют реакции:
МпОг + 4НС1 - Chf + MnCh + 2Н2О
КСЮз + 6НС1 = 3Chf + КС1 + ЗН2О
Бром и иод в больших количествах извлекают из подземных рассолов и буровых вод путем обработки последних хлоро-воздушной смесью:
2NaI + Ch “ I21 + 2NaCl
2NaBr + Ch - Bnt + 2NaCl
Для избирательного извлечения иода рекомендуется применение нитрита натрия:
Nal + NaNO2 + HiSO4 = 0,5h I + NO f + Na2SO4 + H2O
В этой реакции окисляется только I-, а Вг~ остается в растворе; кР°ме того, в отличие от реакции с участием хлора 1~-ионы не °кисляются до Юз. В лабораторных условиях для получения брома
329
и иода применяют методы воздействия на бромиды и иодиды щелочных металлов различных окислителей:
2NaBr + МпОг + 2Нг8О4 = Вгг! + MnSO4 + Na2SO4 + 2Н2О
Выделение чистого иода возможно при взаимодействии:
2KI + CuSO4 - Cui + 0,5h + K2SO4
Если есть избыток KI, то осаждающийся иод перейдет в раствор: KI +12 К [1з ]. Осадок Cui отфильтровывают, а из фильтрата
ирд выделяют нагреванием вместе с парами воды: К[1з] = KI + 1г|.
17.6. ГАЛОГЕНОВОДОРОДЫ
В обычных условиях НС1 (т. пл. — 114 °C, т. кип. — 85 °C), НВг (т. пл. — 87 °C, т. кип. — 67 °C) и HI (т. пл. — 51 °C, т. кип. — 35 °C) — бесцветные газы с резким запахом, хорошо растворимые в воде. Твердые галогеноводороды имеют молекулярную кристаллическую решетку, а в жидком состоянии являются неэлектролитами, химически инертными веществами по отношению к металлам, их оксидам, гидроксидам и карбонатам.
При растворении в воде галогеноводороды полностью распадаются на ионы:
Н(На1) + Н2О - Н3О+ + НаГ
Hal s Cl, F или I вследствие сильной поляризации ковалентной связи Н—Hal под действием дипольных молекул воды:
Водные растворы НО, НВг и HI принадлежат к сильным кислотам. Устойчивость их водных растворов к воздействию кислорода воздуха падает от НС1 к HI, в этом же направлении усиливается восстановительная способность галогеноводородов. Уже при хранении на воздухе концентрированных растворов иодоводорода происходит окисление последнего:
2HI + 0,5О2 = 12 + Н2О
При этом растворы буреют:
HI +12 = Н[1з]
В тех же условиях водные растворы НС1 и НВг не изменяются. Галогеноводороды способны в растворе взаимодействовать с га-логенидными ионами:
Н(На1) + НаЬ + Н(На1)2
ззо
Анионы HCh, НВг2 и НИ имеют линейное строение, а прочность водородных связей —Hal—Н...На1 уменьшается от хлора к иоду.
Анионы НС12 и НВг2 обнаружены лишь в солях с очень крупными катионами, например в кристаллах [Аз(СбН5)4]НС12.
Галогеноводородные кислоты взаимодействуют со многими металлами, их оксидами, гидроксидами и карбонатами с образованием солей — галогенидов металлов. Газообразные НВг и HI восстанавливают H2SO4 (конц.) до серы:
6НВг(г) + H2SO4 - ЗВГ21 + S| + 4Н2О
6HI (Г) + H2SO4 “ 3121 + S | + 4Н2О
При уменьшении концентрации H2SO4 возможно выделение SO2:
2Н1(г) + H2SO4 = I2I + SO2t + 2НгО
Азотная кислота переводит НВг и Н1 в НВгОз и НЮз'.
HI + 6HNO3 - НЮз + 6NO21 + ЗН2О
Газообразный НС1 и хлороводородная кислота с H2SO4 не взаимодействуют, а смесь концентрированных хлороводородной и азотной кислот является сильным окислителем:
HNO3 + ЗНС1 NOC1 + С12(р) + 2НгО
Водные растворы рассматриваемых галогеноводородов образуют азеотропные смеси (мае. доли; 0,1 МПа): HCI—НгО при ПО °C и 20,2% НС1; НВг—Н2О при 126 °C и 47,5% НВг и HI—Н2О при 127 "С и 57,0% HI.
Азеотропными смесями называют такие растворы, которые при перегонке образуют конденсат того же состава, что и кипящий раствор.
Синтез НС1 в промышленных масштабах осуществляют сжиганием С1г в избытке Нг. В лабораторных условиях применяют реакцию
2NaCl + H2SO4 = 2НС1 f + Na2SO4
Необратимому ее протеканию способствует летучесть НС1 и незначительная растворимость его в H2SO4 (конц.).
Промышленные и лабораторные методы получения НВг и HI почти не отличаются:
РВгз + ЗН2О - ЗНВгг + Нг(РНОз) SO2 + Вгг + 2Н2О = 2HBrt + H2SO4
BaS + 4Вг2 + 4Н2О = 8HBr f + BaSO41
Галогеноводороды выделяют из продуктов реакции нагреванием и абсорбируют их затем водой в поглотительных сосудах (склянки 1 ищенко, Дрекселя и др.). Получаемые таким образом кислоты могут иметь любую нужную концентрацию. Упариванием же раз-аьленных водных растворов галогеноводородных кислот нельзя по
331
высить их концентрацию выше тех величин, которые отвечают азеотропным смесям (см. выше).
17.7. ОКСИДЫ ХЛОРА, БРОМА И ИОДА
Оксиды хлора, брома и иода (кроме I2O5) — эндотермические соединения с изменением A fG ° (298 К) от + 80 до 400 кДж/моль. Они легко взрываются, окисляют другие вещества, и их химия является химией взрывчатых веществ. Работать с оксидами хлора и брома можно только ниже 0°С, избегая механических ударов и детонации, способствующих их взрывному разложению. Все оксиды брома разлагаются выше 0 °C и в обычных условиях не существуют.
К экзотермическим соединениям относится только I2O5, для которого (298 К) - — 183 кДж/моль.
Ниже приведены достаточно изученные оксиды хлора, брома и иода и образуемые ими кислородные кислоты:
(+1) (+п)
(+Ш) (+IV) (+V)
(+VI) (+VII)
С12О
(0)
Вг90
нею
С12о2 сю
Вг2О2 *
НВг
НВгО
сио5?
CLO, ?
Вг02 *
С17О, Z о
нею.
Вг2О3? *
НВгО2?
120? *
10 *
HI I 1+ Н2О; НЮ?
ню2?
12О.
Вг2О5
нсю3
ВгО
ВгО
НВгО
НЮ3
С12о7
нсю4
I I
I
I I
Вг2°7? *
I
I НВгО4 !
I
I
I о ’ 12и7.
* I
Н5Ю6
ь
W *
Знаки вопроса стоят у соединений, существование которых пока проблематично. Звездочки означают, что данные оксиды при смешении с водой не дают кислот. Две стрелки показывают, что оксид взаимодействует с водой с образованием смеси двух кислот.
Большинство оксидов хлора, брома и иода при взаимодействии с водой образует кислоты, причем оксиды с нечетной степенью окисления образуют одну кислоту, а оксиды с четной степенью
окисления — две кислоты. Так, радикал диоксид хлора СЮг медленно взаимодействует с водой, быстрее с водными растворами гидроксидов щелочных металлов:
332
2С10г + 2К0Н = КСЮг + КСЮз + НгО
Образование двух кислот или двух солей вызвано присутствием в •
молекуле СЮг неспаренного электрона. Радикал-оксиды либо теряют электрон, либо присоединяют его:
СЮг + е - СЮг; СЮг — е “ ClOj
Эти процессы равновероятны и приводят к появлению в водном растворе двух кислот:
НзО+ + СЮг - НСЮг + НгО; ClOj + ОН" = НСЮз
При взаимодействии С1гО, CI2O7, ВГ2О5 и I2O5 с водными растворами fCOH и Са(ОН)г образуются соли соответствующих кислородных кислот галогенов, например:
ChO + Са(ОН)2 = Са(СЮ)2 + НгО
или
I2O5 + 2КОН = 2КЮз + НгО
При нагревании все оксиды галогенов разлагаются на галоген и Ог.
Молекулы типа С1гО и СЮг угловые (рис. 70), структура которых может быть объяснена с позиций метода гибридизации АО (см. раздел 5.3). У С1гО валентный угол а меньше, чем у СЮг, из-за более сильного отталкивания двух неподеленных электронных пар
(рис. 70, а). Неспаренный электрон СЮг из-за сильного отталкивания
неподеленных пар электронов на большом расстоянии от ядра О и поэтому не способен к образованию пары с таким же электроном другой молекулы
•
СЮг. Димер CI2O4 в обычных условиях неустойчив:
2С1гО4 = С1гО6 + Cl2f + Ог!
Гексаоксид дихлора С1гО6 — парамагнитное вещество светло-красного цвета, плавящееся с разложением при “ С. В твердом состоянии С1гОб имеет ионную кристаллическую решетку тетраоксохлората (+VII) диоксохлора (+V) СЮ J (С1О4) . С оксидами азота
U и NO2 это солеобразное соединение образует тетраоксох-лораты нитрозила и нитроила:
атомов хлора и кислорода находится
Рис. 70. Структуры молекул ОгО (а)-, СЮг (б) и I2O5 (в)
333
Рис. 71. Структуры молекул CI2O7 (а) и НСЮ4 (б)
NO + СЮ2(СЮ4) - NO(C1O4) + C102f
NO2 + С1О2(СЮ4) - NO2(C1O4) + С1О21
Приведенные реакции подтверждают солеобразную природу С120б.
Считают, что кристаллы I20s образованы молекулами, состоящими из двух искаженных тетраэдров, связанных между собой через атом кислорода (рис. 70, в). Химические свойства 12О5 изучены довольно поверхностно.
Существование Вг2О? и 12О? подвергается до сих пор сомнению.
Относительно устойчив только гептаоксид дихлора O2O7 — бесцветная, маслообразная жидкость с т. пл. — 90 °C и т. кип. + 80 °C. Структура молекулы представлена на рис. 71. Соединение очень чувствительно к ударам и нагреванию (A/G°(298 К) = + 408 кДж/моль). При термическом распаде С12О? вначале разрываются
ординарные О-связи и появляются два радикала СЮз и СЮ4, а уравнение реакции имеет вид
2С12О? “ 4C102f + ЗОгТ
В отличие от других оксидов галогенов С12О? обладает низкой химической активностью. Например, капли его, попадая на бумагу, испаряются без взрыва, он не взаимодействует в обычных условиях с Р4, Se и Вг2.
Для получения оксидов хлора и иода применяют различные методы:
2НЮз(ю = 12О5(к) + Н2О
ЗКСЮз + 3H2SO4 - 2СЮ2| + НСЮ4 + 3KHSO4 + Н2О
В водном растворе
2NaC102 + С12 - 2С1О21 + 2NaCl
В реакции
2СЮ2 + 20з = С120б(ж) + 2O2f
334
сначала образуется СЮз, который затем легко димеризуется. Выделение CI2O7 обычно производят действием на НСЮ4 водоотнимающих оксидов:
4НС1О4 + Р4О10 - 2CI2O7 + (НРОз)4 при этом появляются два жидких слоя, один из которых будет содержать CI2O7.
17.8. КИСЛОРОДНЫЕ КИСЛОТЫ ХЛОРА, БРОМА И ИОДА
Кислородные кислоты галогенов — соединения состава Н (Hal) Ох, где х = 1 - 4, a Hal = Cl, Br или I (см. раздел 17.7). Их устойчивость увеличивается с увеличением степени окисления галогена. В индивидуальном состоянии получены HIO3, HCIO4, Н5Юб(НЮ4, H7I3O14).
Остальные кислоты известны только в виде своих водных растворов, причем существование кислот составов НЮ, НЮг и НВгОг подвергается сомнению. Чем меньше степень окисления галогена, тем при меньшей концентрации кислоты начинается ее разложение под тем или иным внешним воздействием (нагревание, освещение и т. п.). Так, водные растворы НСЮ можно концентрировать в вакууме только до содержания 25% кислоты, а растворы НСЮз — уже до 40%. При дальнейшем концентрировании растворы кислот разлагаются, например 4НС10з = 2С1г^+ 5Ог1 +2НгО (со взрывом). В водном растворе НВгО4 устойчива только до концентрации 6 моль/л.
Подробнее см.: Гаврилов В. В., Исупов В. К. Уел. химии. 1980. Т. 49. С. 2118.
Водные растворы НСЮ, НВгО и НСЮг постепенно разлагаются при хранении, разложение усиливается с повышением концентрации кислоты; например, 25%-ный раствор НСЮ даже при 0°С быстро разлагается.
Термическое разложение НСЮ, НСЮг, НВгО и НСЮз в их разбавленных водных растворах относится к реакциям диспропорционирования:
ЗНСЮ - НСЮз + 2НС1; 4НСЮ3 = ЗНСЮ4 + НО
В присутствии примесей состав продуктов реакции изменяется:
4НС1О2 - 2С10г Т + 2Н+ + СЮз + СГ + НгО 5НС10г - 4С10г f + Н+ + СГ + 2Н2О
Кислоты состава Н(На1)О4 при нагревании подвергаются полной диссоциации:
4Н(На1)О4 - 2 (Hal) 2 + 70г + 2НгО
Триоксоиодат (V) водорода НЮз и гексаоксоиодат (VII) водорода 5Юб, образующие бесцветные кристаллы, при нагревании либо выделяют воду, либо подвергаются полимеризации:
335
6HIO3 - 3I2O5 + ЗН20 H5IO6 - HI04 + 2Н2О
ЗН5Ю6 = H7I3O14 + 4НгО 2Н5Ю6 = I2O5 + 5НгО + О21
Окислительные свойства кислот убывают как с увеличением констант кислотности (чем больше в водном растворе недиссоциированных молекул, тем выше окислительная способность кислот), так и с увеличением атомного номера галогена при одной и той же его степени окисления. Поэтому среди рассматриваемых кислот наиболее сильным окислительным действием обладают НСЮ, НСЮг, НВгО и H5IO6.
К сильным кислотам относят НСЮ4, НСЮз, НВгСМ, НВгОз и НЮз- К слабым — все остальные.
Одна из важнейших, широко используемых кислот тетраоксохлорат водорода (хлорная кислота) НСЮ4, весьма подвижная, сильно дымящая на воздухе жидкость. Одиночная молекула ее имеет тетраэдрическую структуру (рис. 71, б). Полагают, что в жидкой фазе существует равновесие (Кс ~ 10 4):
ЗНСЮ4. :- CI2O7 + НзО+ + СЮ4
в котором участвуют димерные молекулы. При хранении и нагревании до 92 °C кислота сначала окрашивается в коричнево-красный цвет, а затем взрывается:
4НС1О4 = 4СЮ21 + ЗО2 Г + 2Н2О
Без разложения HCIO4 можно перегонять только в вакууме. С водой кислота смешивается во всех отношениях, и ее концентрированные растворы в отличие от чистой кислоты являются вязкими жидкостями, напоминающими H2SO4 (конц.) из-за образования водородных связей НСЮ4 ... НгО. Водные растворы НСЮ4 устойчивы при хранении и безопасны в обращении. Азеотропный раствор, содержащий 72,4% НСЮ4, кипит при 203 °C (101,325 кПа). Перегонка такого раствора является одним из методов очистки НСЮ4 (см. раздел 17.6).
Разбавленные до 6 моль/л растворы содержат только ионы НзО и CIO4, а в концентрированных растворах образуются ионы диок-сония H50j.
Подробнее см.: Росоловский В. Я. Химия безводной хлорной кислоты. — М.: Наука, 1966.
Иодных кислот известно несколько: гексаоксоиодат (VII) водорода Н5Ю6, тетраоксоиодат (VII) водорода HIO4, и 14-оксотрииодат (VII) водорода H7I3O14. Все кислоты образуют бесцветные кристаллы, хорошо растворимые в воде. Водные их растворы на воздухе желтеют и сильно пахнут озоном. В водном расворе HIO4 и H7I3O14 быстро превращаются в H5IO6. Структура и химические свойства этих кислот изучены слабо. Молекула H5IO6 имеет октаэдрическую структуру (рис. 72), появление которой связано с sp3d-гибридизацией АО иода (+VII). Одиночный атом кислорода, образующий с атомом иода О- и Л-связи, расположен в аксиальной позиции. Каждый октаэдр Юб в кристаллах H5IO6 связан с соседними октаэдрами водородными связями.
336
Получают кислоты разными методами. Водные растворы оксохлората и оксобромата водорода образуются в реакциях типа:
2Ch(r) + HgO + Н2О =
- 2НС10 + HgCh
2С12(г) + СаСОз + НгО -= = 2НС1О + CaCh + СО21
Оксид ртути и СаСОз вводятся в реакцию для связывания хлороводорода (или бромоводорода), обра
Рис. 72. Структуры молекулы H5IO6
зующегося при пропуска-
нии С12(Вг2) через воду. Из продуктов реакции НСЮ (НВгО) выделяют перегонкой в вакууме при температуре ниже О °C. Водные растворы НСЮз, НВгОз и H5IO6 получают в лабораториях при помощи обменных 'реакций:
Ва(ВгОз)г + H2SO4 “ 2НВгОз + BaSO4l
Ва(СЮ3)2 + H2SO4 = 2НС10з + BaSO4 J
Для синтеза НЮз применяют окисление иода азотной кислотой или пероксидом водорода:
I2 + IOHNO3 “ 2НЮз + IONO2I + 4НгО
12 + 5Н2О2 - 2Н10з + 4Н2О
Такие кислоты, как НСЮ4 и H5IO6, предпочитают получать из их солей действием концентрированных HNO3, H2SO4 или НО при нагревании:
КСЮ4(к) + H2SO4 = НС1О4 + KHSO4
NaClO4(K) + НО = HCIO4 + NaCl
При использовании серной кислоты НСЮ4 выделяют из продуктов реакции перегонкой в вакууме, а в последней реакции фильтрат упаривают для удаления примеси НС1. Взаимодействие дигидрогек-саоксоиодата бария с HNO3
Ваз(НгЮб)2 + 6HNO3 “ 2H5IO6 + ЗВа(НОз)2|
основано на хорошо известном способе вытеснения слабой кислоты б°лее сильной и на малой растворимости Ba(NO3>2 в азотной кислоте.
17.9. СОЛИ КИСЛОРОДНЫХ КИСЛОТ ГАЛОГЕНОВ
Соли всех кислородных кислот галогенов, кроме НЮ, более устойчивы, чем соответствующие кислоты, и представляют собой есцветные кристаллические вещества. Растворимость в воде солей
337
щелочных и щелочно-земельных металлов наименьшая у тетраоксохлоратов и тетраоксоиодатов, а в ряду от К+ до Cs+ при одном и том же анионе — у ЯЬСЮз, RbClO4, RbICU, RbBrOa и RbBrC>4. В водном растворе анионы солей щелочных и щелочно-земельных металлов и слабых кислородных кислот галогенов участвуют в протолизе, например:
ю!- + Н20 = НЮ2~ + ОН-; HIO&* + НгО Н2Ю?> + ОН-а СЮ-- и ВгО-- ионы подвержены также диспропорционированию, особенно легко протекающему в присутствии ОН -ионов:
ЗНаЮ-= 2НаГ + НаЮз
Большинство рассматриваемых солей при нагревании разлагается еще до плавления. Даже те соли (КСЮ4, КСЮз, КЮз, KIO4 и др.), которые в чистом виде сначала плавятся, а затем разлагаются, в присутствии различных примесей подвергаются внутримолекулярному окислению и восстановлению до плавления. Например, чистый КСЮз имеет т. пл. 370 °C и при медленном нагревании разлагается после плавления выше 400 °C
4КСЮз = ЗКСЮ4 + КС1
частично:
4КСЮз = КСЮ4 + ЗКС1 + 40г Т
Примеси оксидов Сг20з, СиО, МпОг, БегОз и других резко снижают температуру разложения этой соли, она распадается уже до плавления без образования КСЮ4:
2КСЮз = 2КС1 + 30г t
Безводные соли с более крупными и малозарядными катионами (К , Rb+ или Cs+) более устойчивы к нагреванию. Так, NaIO4 • • ЗН2О и NaIO4 разлагаются соответственно при 175 и 300 °C, а чистый KIO4 плавится при 582 °C.
Термическое разложение даже чистых солей не подчиняется какой-либо простой закономерности и зависит от многих факторов (скорость нагрева, влажность, присутствие примесей, дисперсность и т. п.). Например, возможны реакции:
NaIO4 “ Nal + 2Ог t
5NaIO4 - NasIOfi + 21г t + 70г t
2NaIO4“2NaIO3 + O2f
Встречается и ступенчатое разложение:
2КВгО4 » 2КВгОз + Ог Т; 2КВгОз “ 2КВг + 30г 1
Промышленное производство наиболее важных для народного хозяйства солей (NaClO, ЫаСЮз и NaC104) основано на использо
вании электрохимических методов. Например, при электролизе водного раствора NaCl без диафрагмы у анода образуется NaClO:
катод (Fe) (—): 2НгО + 2е “_Нг t + 2ОН
анод (графит) (+); Cl +2ОН -2е =С1О +НгО
Другим распространенным способом получения NaClO является взаимодействие водного раствора гидроксида натрия с хлором:
2NaOH + С12 - NaClO + NaCl + Н2О
Для разделения NaClO и NaCl охлаждают раствор до О °C, при этом кристаллизуется менее растворимый в воде NaClO. Пропуская хлор в нагретые растворы гидроксидов щелочных и щелочно-земельных металлов можно получить триоксохлораты:
ЗС12 + 6ОН" = СЮз + 5СГ + ЗН2О
которые с понижением температуры выпадают в осадок как менее растворимые вещества.
Тетраоксохлораты синтезируют в лабораториях действием HCIO4 на металлы, их оксиды, гидроксиды и карбонаты.
17.10. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНАЯ СПОСОБНОСТЬ КИСЛОРОДНЫХ КИСЛОТ ГАЛОГЕНОВ И ИХ СОЛЕЙ
Кислоты являются более сильными окислителями, чем их соли.
В частности, НСЮ окисляет свою соль NaClO:
2НСЮ + NaClO = NaCKh + 2НС1
Окислительная способность оксохлоратов и оксоброматов обусловлена либо их гидролизом, либо кислой средой, приводящих к образованию НСЮ и НВгО:
2NaC10 + 4НС1» С12 Т + 2NaCl + 2Н2О
Окислительная способность триоксогалогенатных анионов
НаЮз + 6Н+ + 6е~ -НаГ + ЗНгО
проявляется только в кислой среде и уменьшается от СЮз к Юз. Например:
HIO3 + 5HI “312| + ЗН2О
КСЮз + 6НС1 - ЗС12 т + КС1 + ЗН2О
КЮз + 5KI + 3H2SO4 - 3121 + 3K2SO4 + ЗН2О п м
нейтральных водных растворах триоксо- и тетраоксогалогенаты металлов окислителями не являются. Их окислительная способность проявляется лишь при нагревании твердых солей с восстановителями:
2КС10з(к) + 3S - 3SO21 + 2КС1
КС1О4(к) + K2S(K) * K2SO4 + ко
339
У кислот НСЮдШВгОд) и H5IO6 склонность к акцептированию электронов, к разрыву связей Hal—О различна: слабая кислота H5IO6 является более сильным окислителем, она превращает аква-катионы [Мп(Н2О)б]2+ в анионы МпО^:
5Н$Юб + 2MnSO4 = 2HMnC>4(p) + 5Н10з + 2H2SO4 + 7НгО
Безводная, а также нагретая концентрированная НСЮ4 и 12 М НВгОд принадлежат к сильным окислителям. В частности:
4НС1О4 + ₽4 - (НРОз)4 + 2С12Т + 20г f
Если же НСЮ4 является чистым продуктом, то она не взаимодействует с HBr, НС1, 12 и Вг2.
Тетраоксобромат (VII) водорода НВгО4 (12 М) окисляет Мп(П) до МпОг; Сг(Ш) до СггО?-; СГ до С10з, взрывается при контакте с бумагой.
Разбавленные же водные растворы НСЮ4 и НВгО4 в обычных условиях теряют окислительную способность: HCIO4 не взаимодействует в этом случае даже с такими сильными восстановителями, как H2S, SO2 и HI, а НВгО4 медленно окисляет Г- и Вг--ионы, но не изменяет состояния хлорид-ионов (сравните с взаимодействием КСЮз и НС1). Устойчивость у атома хлора в анионе CIO4 в степени окисления (+VII) — признак большой прочности четырех связей (О- и Л-) центрального атома с атомами кислорода (см. раздел 7.11).
Все реально существующие оксиды хлора, брома и иода являются окислителями в гетерогенных реакциях. Оксиды галогенов в водном растворе вряд ли принимают непосредственное участие в окислительно-восстановительных реакциях. Вначале они взаимодействуют с водой с образованием соответствующих кислот, которые затем и выполняют функции окислителя. Оксид I2O5 применяют для обнаружения и количественного определения монооксида углерода в воздухе:
12О5(к> + 5СО(г) «= 12(к) + 5С0г
Диоксид хлора — хороший реагент для получения диоксохлоратов:
2С10г + Na202(K> = 2NaC102(K) + О2Т
17.11. ПРИМЕНЕНИЕ
Фтор, хлор, иод и бром, их производные — важнейшие народнохозяйственные продукты. По промышленному применению хлор намного превосходит все остальные галогены. Хлор особенно широко используют в органическом синтезе (производство поливинилхлорида, хлоропренового каучука, хлорбензола, дихлорэтана, полихлорвиниловой смолы, некоторых пестицидов, фреонов и других веществ) и в промышленности редких и цветных металлов для извлечения их из минерального сырья (хлорный способ переработки концентратов титана, циркония, ниобия, тантала и др.), разделения и очистки.
340
В большом количестве выпускаются NaClO и Са(С1О)2 как дезинфицирующие и отбеливающие средства для бумажной пульпы и текстильных волокон; А1С1з, используемый как катализатор; SiCU, SiHCh — вещества, необходимые для производства полупроводникового кремния; ССЦ — как растворитель масел, смол и жиров.
Триоксохлораты КСЮз и NaOOs применяют в производстве спичек, взрывчатых веществ, в пиротехнике; Mg(ClC>3)2 используют для выпуска дефолиантов (механическая уборка хлопчатника), гербицидов для борьбы с сорняками, диоксид хлора — отбеливающее средсгво в целлюлозно-бумажной и текстильной промышленности, реагент для обесфеноливания сточных вод. Соли НСЮд и сама кислота используются в гальваностегии, аналитической химии, пиротехнике и для производства ракетных топлив.
Бром и иод находят применение в органическом синтезе, медицине, в технологии рафинирования иодным методом титана, циркония, ванадия и других металлов, в производстве фотоматериалов и дибромэтана (добавки к бензину, содержащему тетраэтилсвинец).
Фториды хлора и брома — сильнейшие окислители, энергичные фторирующие агенты, компоненты реактивных топлив и зажигательных средств в военной технике, реагенты в технологии производства гексафторида урана и регенерации использованного ядерного горючего.
Основные потребители фтора — ядерная промышленность (UFe) до 56% и электротехника до 40% (SFe). Значительные количества фтора используют в органическом синтезе для производства различных фторорганических соединений, среди которых видное место занимают полимерные материалы типа фторопластов. Фторопласт, или политетрафторэтилен, состоит из цепей — CF2—CF2—CF2—CF2, в которых атомы фтора как бы экранируют атомы углерода от химического воздействия реагентов. Атом углерода, связанный с атомами фтора, можно рассматривать как полностью окисленный, и поэтому на фторопласт совершенно не действуют любые окислители, кислоты и гидроксиды щелочных металлов. Фторопласты выдерживают нагревание только до 200—250 °C и реагируют с расплавами щелочных металлов.
Фтор используют также для производства хладагентов, фреонов (фторхлорметанов) составов CCI3F, CCI2F2 и др. Фторхлорметаны не принадлежат к огнеопасным веществам, не гидролизуются, не взаимодействуют с металлами и поэтому широко применяются в промышленности, выпускающей домашние холодильники и кондиционеры.
Фтор в виде AIF3 и криолита необходим для производства алю-Ми»ия: на 1 т А1 кроме А1О(ОН) расходуется в среднем 31 кг AIF3 и л2 кг криолита. Фториды галогенов и кислорода — компоненты Ракетных топлив; HF, F2, CIF3 — основные реагенты в технологии ядерного горючего.
Особо чистая фтороводородная кислота применяется в полупроводниковой технике для очистки, травления различных изделий.
341
17.12. ТОКСИКОЛОГИЯ
Галогены (кроме иода) принадлежат к токсичным веществам, а фтор является еще и легковоспламеняющимся и взрывчатым продуктом. Жидкие галогены обладают сильным кожепоражающим действием, а газообразные — вызывают даже в очень небольших концентрациях воспаление органов дыхания.
Галогеноводороды оказывают сильное раздражающее воздействие на слизистые оболочки и органы дыхания, разрушают зубную эмаль. Фториды металлов — протоплазматические яды, действующие в основном на ферменты. Избыток фторид-ионов в питьевой воде вреден для зубов, а также для развития костей, как и недостаток этих ионов. При избытке фторид-ионов (более 2 мг/л) в питьевой воде зубы чернеют и легко выпадают.
Появились исследования, свидетельствующие об опасном влиянии фреонов на сердечно-сосудистую систему.
Оксиды галогенов и межгалогенные соединения — высокотоксичные вещества. Триоксохлораты щелочных металлов относят к кровяным ядам, вызывающим распад эритроцитов, кроме того, они взрывоопасны, пропитывая текстильные и кожаные изделия, придают им способность к самовозгоранию. Тетраоксохлорат (VII) аммония NH4CIO4 способен к самовоспламенению уже при 40 °C. Особенно опасны смеси КСЮз и фосфора.
Высокая химическая активность безводной НСЮ4, токсичность и способность к взрывному разложению превращают эту кислоту в очень опасное в обращении вещество. Если хранить безводную НСЮ4 в обычных условиях в закрытом сосуде, то через несколько дней она сначала желтеет, затем становится коричнево-красной и, наконец, взрывается. Поэтому окрашенная уже в желтый цвет кислота должна быть немедленно уничтожена.
Упражнения к главе 17
1. Как протекает термическое разложение оксидов галогенов?
2. Можно пи получить фторооксогенат (0) водорода?
3. Какое природное сырье является основным источником получения фтора?
4. Будут ли взаимодействовать сероводород и молекулярный иод?
5. Содержит пи газообразный фтороводород полимерные молекулы?
6. Что происходит при хранении безводного тетраоксохлората водорода в обычных условиях в закрытых сосудах?
7. Чем опасны смеси триоксохлората калия и тетрафосфора?
8. Какую структуру имеют молекулы гексаоксоиодата (+ VII) водорода?
9. Как протекает термическое разложение оксохлората и диоксохлората водорода?
10. Кристаллы гексаоксида дихлора являются ионными или молекулярными?
11. Какие вещества образуются При Взаимодействии С
водным раствором КОН диоксида хлора и монооксида дихлора?
1J. Для получения оксохлората водорода через водную суспензию карбоната кальция пропускают хлор. Зачем нужен в этом синтезе СаСОз?
13. Чем отличается взаимодействие тиосульфата натрия и хлора от взаимодействия тиосульфата натрия и иода?
14. К водному раствору сульфата меди добавили водный раствор иодида калия. Как разделить смесь двух продуктов этой реакции, выпавших в осадок?
1S. Как объяснить высокую устойчивость фторопласта к воздействию любых окислителей, кислот и оснований?
ГЛАВА 18. ОБЩАЯ ХАРАКТЕРИСТИКА ФИЗИКО-ХИМИЧЕСКИХ СВОЙСТВ БЛАГОРОДНЫХ ГАЗОВ И ИХ СОЕДИНЕНИЙ
Группа благородных газов, или VIIIA-группа, включает шесть элементов: гелий Не, неон Ne, аргон Аг, криптон Кг, ксенон Хе и радиоактивный радон Rn.
Атомы всех благородных газов имеют на последнем энергетическом уровне завершенную высокостабильную восьмиэлектронную конфигурацию ns2npb (гелий — lsz), в связи с чем энергии их ионизации очень высоки (табл. 20). Поэтому, чтобы получить соответствующее соединение благородного газа, нужно иметь сильного партнера-окислителя, способного вырвать электрон из стабильной электронной конфигурации и главное — удержать его около себя.
В 1962 г. Бартлетту удалось получить первое соединение ксенона с сильнейшим окислителем — гексафторидом платины XelPtFe].
Бертлетт Нил (р. 1932) — американский химик-неорганик.
По своему составу это соединение аналогично ранее открытому гексафтороплатинату (V) диоксигенила Ог[Р1Еб]. К выводу о возможности синтеза соединений благородных газов Бартлетт пришел после сравнения энергий ионизации атомов Хе (Еи1 = = И68 кДж/моль) и молекул Ог (Еи1 = П66 кДж/моль).
Таблица 20. Некоторые свойства благородных газов
Свойства Не Ne Аг Кг Хе Rn
Первая энергия ионизации ^и1, кДж/моль 2374 2084 1525 1351 1168 1042
Температура кипения, °C -269 -246 - 186 - 153 - 108 -62
Температура плавления, °C Растворимость при 0 °C и -272* -249 - 189 -157 - 112 -71
__01,3z5 кПа (1л/100л воды) 1,0 1,2 5,8 6,0 24,2 50,0
* Под давлением 2,6 МПа.
343
Начало 60-х годов отмечено бурным развитием химии благородных газов: очень скоро были синтезированы фториды, оксофториды и оксиды криптона, ксенона и радона. Однако первые элементы VIIIA-группы — гелий и неон — остаются пока, действительно, инертными, так как их истинно химических соединений до настоящего времени не получено. Правда, известны соединения включения (клатраты) примерного состава Э • 6Н2О или Э • ЗСбН4(ОН)г, где Э — атомы гелия, неона, аргона и других благородных газов располагаются в пустотах кристаллической решетки воды или гидрохинона, удерживаясь там за счет межмолекулярного взаимодействия. Некоторые такие соединения термически нестойки и существуют только под большим давлением благородного газа (102— 10* кПа) и при низких температурах (см. раздел 29.4).
При столкновении возбужденных и нейтральных атомов благородных газов возможно образование димерных ионов, например
Ne + Ne* = NeJ + е
От гелия к радону закономерно увеличиваются температуры кипения и плавления, а также растворимость в воде, что подтверждает рост по группе сверху вниз межмолекулярного взаимодействия (см. табл. 20).
На значительной разнице в температурах кипения основан способ получения благородных газов перегонкой жидкого воздуха: после отделения его более высококипящих составных частей — кислорода и азота — начинают отгоняться последовательно благородные газы. Радон образуется в природе (или в ядерных реакциях) при радиоактивном распаде урана-238, урана-235 или тория-232.
18.1. ФТОРИДЫ БЛАГОРОДНЫХ ГАЗОВ
Вся химия благородных газов так или иначе связана с самым электроотрицательным элементом — фтором. Только с фтором могут взаимодействовать криптон, ксенон и радон, причем от криптона к радону химическая активность элементов возрастает. Так, для получения дифторида криптона KrFi используют газоразрядную трубку, куда при температурах — 200 °C помещают смесь криптона и фтора в соотношении 1:5. Дифторид криптона — эндотермическое соединение (A fH0 (298 К) = + 22 кДж/моль), при 0 °C оно уже разлагается и по своей окислительной активности превосходит даже молекулярный фтор, приближаясь к атомарному фтору. Эту особенность KrFi используют для синтеза фторидов с необычными степенями окисления, например PrF4 или AuFj.
Легче всего с фтором взаимодействует радон; считается, что в этом случае образуется нелетучий продукт RnFi с ионным типом связи. Наиболее изученными являются фториды ксенона (XeFz» XeF4 и XeFe), которые все одновременно образуются при обработке ксенона фтором. В чистом виде легко выделить дифторид ксенона (при недостатке фтора) и XeFe (при избытке фтора). Некоторые свойства этих фторидов приведены в табл. 21. Фториды ксенона
344
Рис. 73. Структура фторидов ксенона: а — XeF?; б — XeF4; в — XeFe
бесцветные, кристаллические вещества, окислительные свойства которых уменьшаются от KrF2 к ХеРб в ряду: KrF2 > XeF2 > XeF4 > > ХеРб. Структуры их молекул в целом отвечают предсказанию метода валентных связей (табл. 21, рис. 73).
Молекулы фторидов ксенона при взаимодействии с сильными акцепторами фторидных ионов (AsFs, PtFe, Sb?5 и др.) превращаются в катионы, например:
ХеРб + PtF5 = (ХеР5)+[Р1РбГ
XeF2 + 2SbF5 = (XeF)+ISb2Fi! Г
Гексафторид ксенона существует в четырех кристаллических модификациях, но ни одна из них не содержит собственно молекул ХеРб- В частности, в одной из модификаций ХеРб обнаружены катионы (XeF5)+. При взаимодействии ХеРб с MF (М = К, Rb или Cs) образуются кристаллы MfXeF?], превращающиеся при нагревании в октофтороксенаты:
2М [XeF7 ] = M2[XeFs ] + ХеРб
Тетрафторид ксенона (сам по себе невзрывоопасный) гидролизуется очень бурно, поэтому его гидролиз ведут при пониженных температурах. Так, при - 80 °C образуется кристаллический светло-желтый продукт — дифторид-оксид ксенона:
XeF4 + Н2О = XeOF2 + 2HF
Параллельно этой реакции идет медленное образование гидроксида ксенона (IV):
2XeF4 + 6Н2О = Хе t + Xe(OH)4j + О21 + 8HF
При более высоких температурах взаимодействие тетрафторида ксе-н°на с водой сопровождается диспропорционированием:
6XeF4 + 12Н2О = 2ХеО3 + 4Хе f + ЗО2 т + 24HF
345
Гексафторид ксенона при сильном охлаждении (до -183 °C) гидролизуется спокойно с образованием сначала фторидов-оксидов ксенона:
XeF6 + Н2О = XeOF4 + 2HF
XeOF4 + Н2О = XeO2F2 + 2HF
а затем — оксида ксенона (VI):
XeO2F2 + Н2О = ХеОз + 2HF
Таблица 21. Свойства фторидов ксенона
Свойства Фториды ксенона
XeFj XeF4 XeF6
Температура плавления, °C 129 114 50
Температура кипения, °C 600* — 76
bfG° (298 К), кДж/моль -86 - 145 - 169
Структура молекулы Линейная Квадрат Искаженный
октаэдр
Тип гибридизации АО Хе sp3d sp3d2 sp3d2
Приведена температура разложения соединения.
18.2. ОКСИДЫ БЛАГОРОДНЫХ ГАЗОВ
С кислородом ни один из благородных газов не взаимодействует, и все известные оксиды и фторид-оксиды ксенона получаются гидролизом соответствующих фторидов. Наиболее спокойно идет гидролиз дифторида ксенона; получаемый при этом в качестве промежуточного продукта оксид ксенона (II) в чистом виде не выделен:
XeF2 + Н2О = ХеО + 2HF; ХеО + Н2О - Хе t + Н2О2
XeF2 + Н2О2 = Xet + 2HF + О2Г
Окислительно-восстановительный потенциал суммарной реакции
XeF2 + 2е~ = Хе + 2F”
составляет +2,64 В и говорит о том, что по окислительной способности дифторид ксенона превосходит озон.
Оксид ксенона (+ VI) — бесцветное, кристаллическое высокогигроскопичное вещество, термодинамически нестабильное: при длительном хранении медленно разлагается до простых веществ, масса более 20 мг взрывоопасна. При нагревании выше 70 °C возгоняется с разложением. В воде триоксид ксенона хорошо растворяется с образованием слабой ксеноновой кислоты НгХеО4. Из шс" лочных растворов можно выделить ее соли — ксенаты МНХеО4 (М — щелочные элементы) или ВаХеО4.
В сильнощелочных растворах ксенаты неустойчивы и постепенно диспропорционируют с образованием малорастворимых перксенатов,
346
где ксенон имеет максимально возможную для него степень окисления (+VIII):
2НХеО4 + 2ОН" - ХеО£~ + Хе f + О21 + 2Н2О
Перксенаты получают также окислением ксенатов озоном:
3LiHXeC>4 + 9LiOH + Оз = ЗЦ4ХеОб + 6Н2О
Перксенаты и некоторые ксенаты являются, пожалуй, наиболее устойчивыми соединениями ксенона с кислородом: они разлагаются только в интервале температур 200—250 °C. Анион XeOi, имеет октаэдрическое строение в точном соответствии с предсказанием метода валентных связей.
Выделен газообразный тетраоксид ксенона ХеО4 — самое летучее соединение ксенона. Это эндотермическое, нестойкое к нагреванию соединение (Д /Я0 (298 К) = + 640 кДж/моль) с температурой возгонки, равной 77 К. Изолированные молекулы ХеО4 имеют тетраэдрическое строение, соответствующее sp-гибридизации АО ксенона. Получают тетраоксид по реакции
-5 °C
ВагХеОб + 2H2SO4 = ХеО41 + 2BaSO41 + 2НгО
Сравнивая свойства оксидов ксенона, можно сделать традиционные выводы: а) с ростом степени окисления ксенона кислотные свойства его оксидов возрастают. Так, если гипотетический оксид ксенона (+11) и малорастворимый гидроксид ксенона (+IV) имеют явно выраженный основный характер, то ХеОз — амфотерен, а у ХеС>4 преобладают кислотные свойства; б) в том же направлении от Хе(+П) к Xe(+VIII) растут окислительные свойства соединений: ХеО4 И ХеО<Г’, по-видимому, — одни из сильнейших в настоящее время окислителей.
Подробнее см.: Нейдинг А. Б., Соколов В. Б. Усп. химии. 1974. Т.
43. С. 2146;. Хьюи Дж. Неорганическая химия. — М.: Химия, 1987.
l"98^^' ^ЭЛЛС Структурная неорганическая химия. — М.: Мир,
18.3. РАСПРОСТРАНЕННОСТЬ В ПРИРОДЕ
Кл^эки благородных газов очень невелики: от 10-4% у аргона ДО 10 для радона. Сырье: минеральные природные воды; гелий находят также в природных газах, например в метане (США и Канада). Однако больше всего содержится благородных газов в воздухе, среди которых основная доля приходится на аргон (93%). 1аким образом, и в VIIIA-группе действует общее геохимическое правило — наиболее распространенным является элемент третьего периода периодической системы.
История открытия элементов. Одним из первых среди благородных газов был открыт гелий по желтой линии в солнечном спектре (1868 г., Локьер). Затем в 1898 г. Рэлей и Рамзай выделили
347
поочередно все благородные газы из воздуха его фракционной перегонкой. Позднее в 1899 г. при радиоактивном распаде тория был обнаружен Резерфордом последний инертный газ — радон.
Локьер Норман (1836—1920) — английский астрофизик.
Релей Джон Уильям (1842-1919) — английский физик, лауреат Нобелевской премии, иностранный член Петербургской АН. Рамзай Уильлм (1852—1916) — английский химик и физик, лауреат Нобелевской премии, иностранный член Петербурской АН.
18.4. ПРИМЕНЕНИЕ
Первое практическое применение нашел в начале этого века гелий — он использовался для заполнения дирижаблей, воздушных шаров и атмосферных метеозондов вместо более легкого, но взрывоопасного водорода. Вторая область использования гелия — в смесях для дыхания при работе человека под избыточным давлением (в барокамерах и под водой) как разбавитель кислорода с целью предупреждения азотного отравления. Велика роль жидкого гелия для создания особо низких температур — при изучении низкотемпературной теплоемкости веществ, их сверхпроводимости и сверхтекучести.
Вследствие химической инертности и низкой теплопроводности аргон, криптон и ксенон используют в качестве наполнителей электроламп и в других областях электроники, включая неоновые лампы, выпрямители и пр. Широко применяют самый дешевый из благородных газов — аргон в электросварочных работах для предохранения свариваемых металлов, в первую очередь алюминия, магния, титана, от нежелательного контакта с кислородом воздуха.
Фториды криптона и ксенона используют в качестве жесткого фторирующего средства, превосходящего по силе воздействия (KrF2) даже фтор. Фториды ксенона благодаря своему твердому агрегатному состоянию удобны в дозировке и применяются при мягком фторировании органических веществ без загрязнения посторонними примесями продукта реакции. В зарубежной литературе серьезно дискутируется возможность использования кристаллического гексафторида ксенона в качестве окислителя ракетного топлива.
18.5. ТОКСИКОЛОГИЯ
Из благородных газов наибольшую опасность для человека представляют радиоактивный радон и радиоактивные изотопы ксенона, образующиеся при работе атомных электростанций и на урановых рудниках. Поэтому здесь предусмотрена очистка воздуха, основанная на образовании радоном и ксеноном твердых, нелетучих продуктов с такими сильными окислителями, как O2[SbF6], например
Хе + 2O2[SbF6]= (XeF) [Sb2Fn ] + 2O2f
О токсичности других благородных газов сведений нет, хотя отмечено интересное анестезирующее действие ксенона на биологические объекты.
348
Вдыхание благородных газов, особенно Кг и Хе, под давлением вызывает наркотическое действие. В частности, пребывание в атмосфере, содержащей 70% Хе и кислород, приводит к потере сознания через 2—4 мин. Вдыхание гелиево-кислородной смеси позволяет водолазам спускаться на большие глубины, чем при вдыхании воздуха.
При атмосферном давлении все благородные газы вредны лишь в той мере, в какой они понижают парциальное давление кислорода. Так, наблюдались случаи гибели людей, проводивших сварочные работы с применением аргона при отсутствии вытяжной вентиляции.
♦ ♦ ♦
Элементы от ША- до VIIIA-группы периодической системы принадлежат к p-элементам, т. е. элементам, у которых происходит заполнение электронами p-АО (Z=l; Sm/ = 2/ + 1 =3). Общая электронная конфигурация невозбужденных атомов р-элементов ns2пр1 (валентные электроны).
Среди p-элементов находятся как металлы, так и неметаллы; в пограничной области между ними располагаются элементы, проявляющие амфотерные свойства (Al, Ga, Sb, Pb, Sn, Po). В каждой из A-групп p-элементов наблюдается усиление сверху вниз металлических свойств, причем с увеличением номера группы число элементов-неметаллов в группе возрастает. Если в ША-группе неметаллом является только бор, то в VIIIA-группе все элементы (благородные газы) принадлежат к неметаллам. Необходимо отметить, что все неметаллы находятся среди р-элементов.
Деление р-элементов на металлы и неметаллы имеет условный характер. В принципе все неметаллы при очень высоких давлениях можно перевести в металлическое состояние. В частности, гелий-1 при —271 °C и давлении 5050 Па переходит в гелий-П, у которого обнаружена теплопроводность более высокая, чем у Ag. Алмаз при давлении 60 ГПа и 1000 °C также приобретает металлические свойства. Некоторые полиморфные модификации таких неметаллов, как С. Р, As, Sb и Se, обладают высокой теплопроводностью, электрической проводимостью, металлическим блеском. В свою очередь, у металлов также встречаются полиморфные модификации, обладающие свойствами неметаллов, например cz-Sn. Часть р-элементов в виде простых веществ обнаруживает склонность к образованию полимерных цепочечных и циклических трехмерных и двумерных молекул. Особенно это заметно проявляется у элементов второго и третьего периодов: В, С, Si, Р и S. Так, алмаз представляет одну гигантскую молекулу Сх, в которой каждый атом углерода окружен тетраэдрически четырьмя другими атомами углерода. Тетраэдрическая молекула Р4 и циклическая Ss существуют не только в кристаллах, где они связаны между собой межмолекулярными силами, но и в растворах, расплавах и газообразном состоянии, арбин — линейная модификация углерода — состоит из цепей,
349
включающих ацетиленовые и этиленовые фрагменты — С==гС—C=i, —С—С—. Кристаллический бор — плотно упакованная совокупность многогранников Bi2, называемых икосаэдрами.
При взаимодействии с другими элементами p-элементы способны к образованию цепочечных и циклических молекул. С водородом и фтором р-элементы могут быть связаны в открытые цепи: сульфаны H2SX (х “ I—23), полипероксиды водорода Н2ОХ (х = 2—5), силаны SixH2x+2 (х - 1—8), фториды поликислорода OXF2 (х - 1—6). Наибольшую склонность к образованию цепей обнаруживают углерод и кремний. Атомы разных p-элементов характеризует высокая способность к взаимодействию между собой с образованием гетеро-атомных молекул и ионов с полярным характером ковалентной химической связи. Это взаимодействие может быть внутригрупповым, например, элементы VIIA-группы дают многочисленные межгалогенные соединения 12С1б, ВгРб, IF5 и др., и межгрупповым. В последнем случае образуются многочисленные оксоанионы, как дискретные (NO3 , SO^- , CIO4 и др.), так и полимерные (силикатные, боратные, фосфатные и др.).
У p-элементов второго периода максимально возможное число ковалентных связей (валентность) равно четырем, так как к участию в гибридизации нельзя привлечь d-AO, относящиеся к другому энергетическому уровню и обладающие поэтому высокой энергией. Четыре ковалентные связи реализуются в следующих молекулярных и ионных структурах: линейной с 2(7- и 2 л-связями (СО2, NOJ и др.), угловой с 2d- и 2л-связями и одним или двумя неподеленными электронами (NO2 ; :О(О)2 = Оз и др.), плоской треугольной с 3(7- и ^-связями (СС12О и др.) и тетраэдрической с 4(7-связями (CCI4, SiF4, СН4). Прочные Л-связи образуются только между р-элементами второго периода. Для p-элементов третьего и других периодов л-связи несвойственны и энергетически невыгодны из-за больших размеров р-АО.
В третьем и последующих периодах число ковалентных связей в соединениях p-элементов увеличивается до семи, так как появляется возможность использования d-AO низкой энергии, орбиталей того же энергетического уровня с разъединением всех пар электронов, находящихся на х- и p-АО (по другим данным, из-за больших размеров d-AO их перекрывание с валентными АО других атомов незначительно и энергетически невыгодно).
Подробнее см.: Бочвар Д. Л., Гамбарян Н. П., Эпштейн Л. М. Усп. кимин, 1976. Т. 45. С. 1316.
В связи с этим увеличивается и число молекулярных и ионных структур. Помимо указанных выше появляются структуры триго-нально-бипирамидальные с 5(7-связями (PCI5, AsF5), бисфеноидные («качели») с 4Освязями и неподеленной парой электронов (SF4. XeO2F2), плоского квадрата с 4<т-связями и двумя неподеленными парами электронов (XeF4, [ICI4] ) и октаэдрические с 6(7-связями (SF6, [A1F6F и др.).
Почти все p-элементы, являющиеся неметаллами, имеют высокие
350
значения энергии ионизации и сродства к электрону, обладают способностью к образованию ковалентных и ковалентно-полярных связей с другими неметаллами и ионных и ионно-ковалентных связей с металлами. В виде простых веществ p-элементы (неметаллы) не имеют металлического блеска, хрупки в кристаллическом состоянии, многие интенсивно окрашены, электрическая проводимость и теплопроводность их (кроме углерода-графита) незначительна, температуры плавления и кипения охватывают необычайно широкий диапазон значений (гелий Не, т. пл. —271 °C, давление 3 МПа; графит С, т. пл. +3750 °C, давление 12 МПа).
Среди p-элементов встречаются весьма инертнее вещества — благородные газы (элементы VIIIA-группы) с полностью заселенными s- и p-АО (nsnp), не образующие поэтому молекул и существующие в обычных условиях в виде газа, состоящего из атомов.
Только с такими сильными окислителями, как хлор, кислород и фтор, благородные газы (кроме Не, Ne и Аг) образуют фториды (KrF2, XeFs и др.), хлориды (ХеОг), оксиды (ХеОз и др.), кислоты (НдХеОб и др.) и соли (Rb2[XeFe], Na4XeO6*xH2O и др.). Способность к химическим реакциям с хлором, кислородом и фтором проявляют, в первую очередь, тяжелые благородные газы, обладающие более низкой энергией ионизации (Rn, Хе и Кг).
Упражнения к главе 18
1. Почему ксенон образует целый ряд фторидов, а гелий аналогичной реакционной способностью не обладает?
2. Как протекает гидролиз дифторида и тетрафторида ксенона?
3. Какие виды природного сырья применяют для получения благородных газов?
4. Какое геометрическое строение должен иметь анион ХеО$— ?
5. Какой вывод следует сделать из того факта, что изменение энтальпии при образовании оксидов ксенона положительно?
6. Как изменяется окислительная способность оксидов ксенона с увеличением его степени окисления?
ГЛАВА 19. КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
В различных окислительно-восстановительных реакциях, реакциях обмена, присоединения, протекающих либо в растворе, либо между твердыми и газообразными веществами, участвуют неизменные группы атомов элементов, способные к независимому существованию в обычных условиях в той или иной фазе (СО, ОН , N°2 , NH3 и др.). Неизменные группы атомов и одноатомные ионы
351
способны к взаимодействию с нейтральными атомами и ионами металлов с образованием более сложных молекул или ионов.
Так, при смешении водных растворов нитрата серебра и аммиака протекает обратимая реакция образования катионов диамминсеребра:
Ag+ + 2NH3i=^ [Ag(NH3)2]+
Порошкообразное железо при нагревании взаимодействует с монооксидом углерода:
Fe + 5СО. * [Fe(CO)5]
Если к мелкокристаллическому красному осадку Hgli в водном растворе прибавить раствор KI, то осадок начнет переходить в раствор, который через некоторое время станет бесцветным и прозрачным, содержащим более сложное соединение — тетраиодомер-кураТный анион:
Hgh + 2Г. - |HgI412
Малорастворимый в воде А1(ОН)з под воздействием ОН-ионов переходит в раствор в виде иона [А1(ОН)б]3~:
А1(ОН)з + ЗОН . ' [А1(ОН)б]3-
Во всех приведенных выше реакциях, проходили ли они с твердыми, газообразными или растворенными веществами, неизменные группы атомов элементов, сохраняя свой состав и формальный заряд, присоединяясь к атомам, ионам или молекулам, образовывали сложные соединения, являясь как бы их «строительным материалом».
В сложных соединениях такие неизменные группы атомов или одноатомные ионы располагаются (координируются) в том или ином количестве вокруг нейтральных атомов или положительно заряженных одноатомных ионов, образуя с последними либо молекулы ([Fe(CO)5]), либо ионы ([Ag(NH3)2]+, [Hgl4]2-).
Подобные сложные частицы, построенные из более простых, неизменных групп атомов элементов или одноатомных ионов, получили название комплексных или координационных соединений, комплексных или координационных ионов. Термины «комплексное соединение» и «координационное соединение» или просто «комплекс» являются синонимами. (О номенклатуре комплексных соединений см. раздел 2.6.)
Последнее время к комплексным соединениям формально стали относить все или почти все химические соединения. Понятие «комплексное соединение» стало неопределенным и расплывчатым.
Однако, как это будет видно из содержания раздела 19.2, комплексным соединениям присущи вполне определенные, хотя и многочисленные, признаки, которые не позволяют относить к комплексным соединениям такие вещества, как СгОз, H2SO4, Н2СГ2О7, Cu(OH)2, К2СО3, NaNOs и многие другие им подобные, относящиеся традиционно к категории простых соединений.
Химия комплексных соединений является частью неорганической химии. Она охватывает как чисто неорганические комплексные
352
соединения, так и комплексные соединения, включающие в качестве неизменных групп ионы и молекулы многочисленных органических соединений.
Среди комплексных соединений встречаются соли, например [Cu(NH3)4]SO4, молекулярные соединения, как [Fe(CO)s] и др., основания, подобные [Ag(NH3)2]OH, и кислоты, аналогичные HIAuCkl.
Объяснение природы комплексных соединений и их строения дает координационная теория, основные положения которой были разработаны Вернером.
Вернер Альфред (1866—1919) — швейцарский профессор химии, первый химйк-неорганик, удостоенный Нобелевской премии.
19.1. РЕАКЦИИ КОМПЛЕКСООБРАЗОВАНИЯ
J Реакции, в результате которых образуются комплексные молекулы ’ или ионы, называют реакциями комплексообразования.
Комплексообразование оказывает существенное влияние на изменение свойств простых веществ и соединений элементов.
Значения стандартных электродных потенциалов металлов обычно становятся при комплексообразовании ионов металлов более отрицательными, что приводит к изменению характера окислительно-восстановительных реакций. Например, в кислой среде (анионы СЮд ) значение <р° для полуреакции: Си+ + е = Си равно +0,52 В, а в присутствии ионов I для той же реакции <р° = -0,18 В. Такое различие в значениях <р° вызвано комплексообразованием:
Си+ + 21 [Cuh]
Поэтому взаимодействие меди с HI протекает с выделением водорода:
Си + 2HI = H[Cuh] + 0,5H2t
хотя с разбавленными водными растворами кислот-неокислителей (HCIO4, H2SO4, Н3РО4 и др.) медь, как известно, не взаимодействует (см. раздел 7.11).
Для дицианокупратного аниона значение <р° полуреакции ICu(CN>2] + е = Си + 2CN равно —0,43 В. Эта реакция комплексообразования приводит к тому, что медь по отношению к водороду оказывается восстановителем и реакция
Си + 2CN ' + Н2О = [Cu(CN)2]~ + ОН + 0,5Нг!
протекает в щелочной среде с выделением водорода (см. разделы 7.10 и 20.2).
Для золота значение <р° полуреакции: Au+ + е = Аи° равно *.69 В и поэтому металл имеет малую реакционную способность и не может реагировать с кислородом:
О2 + 4Н+ + 4е = 2НгО; <р° = +1,23 В
*2—1258
353
Однако при комплексообразовании кислород воздуха уже может окислять золото:
4Au + 8CN” + О2 + 2НгО^=г 4[Au(CN)2]- + 4ОН-в связи с малым значением <р° для полуреакции:
[Au(CN)2]“ + е - Au° + 2CN-; <р° = -0,76 В.
Комплексообразование создает условия для перехода в раствор осадков малорастворимых соединений. Например, хорошо известны реакции:
АКОН)з(к) + ЗОН- [А1(ОН)бГ
Zn(OH)2<K) + 2ОН“._- [Zn(OH)4]2-
SnS2(K) + 2K2S(p). " K4[SnS4](p)
SnS(к) + K2S2(p). ^ K2[SnS31(p)
Образование комплекса может стабилизировать неустойчивую в обычных условиях степень окисления элемента. В частности, Сг (II) — сильный восстановитель
Сг2+ + 2е~ - Сг; <р° - -0,85 В
а его акваацётатный комплекс [Сг2(Н2О)г(СНзСОО)4]0 не окисляется на воздухе даже при нагревании до 300 °C (см. раздел 25.7).
Комплексообразование может привести к плавлению двух взаимодействующих солей при комнатной температуре. Например, при смешении кристаллов NHEtsCl и CuCl протекает эндотермическая реакция с образованием светло-зеленого маслообразного продукта:
NHE13C1 + CuCl. v (NHEt3)[CuC121
где Et = С2Н5.
Координация молекул воды ионами некоторых металлов способствует увеличению подвижности протонов, превращает образующиеся аквакатионы в катионные кислоты:
[Fe(H2O)613+ + H2Oi= НзО+ + IFe(H2O)5OH ]2+ :______________t
н+
Реакция образования гидроксокомплексов
А1(ОН)з + ЗОН» * [АКОЮб]3-
превращает малорастворимые амфотерные основания в хорошо растворимые сильные анионные основания:
[А1(ОН)б]3“ + Н2О [А1(Н2О)(ОН)512“ + ОН-
При взаимодействии слабой фтороводородной кислоты с тетрафторидом кремния
2HF + SiF4i=? H2[SiF6]
в растворе появляется сильная кислота, гексафторосиликат водорода-
354
19.2. ОСНОВНЫЕ ПОНЯТИЯ КООРДИНАЦИОННОЙ ТЕОРИИ
Реакцию комплексообразования в общем виде можно представить следующим образом:
NT1+ + nV2 [MLn р “ т2 ,
где М — комплексообразователь; L — лиганды; п — координационное число; V — заряд соответствующих частиц. Равенства Vi = nV2 или Vl = v2 = 0 отвечают молекулярным комплексным соединениям, а неравенства Vj > nV2 и < nV2 — соответственно комплексным катионам и анионам.
Комплексообразователь — частица (атом, ион или молекула), координирующая (располагающая) вокруг себя другие ионы или молекулы.
Обычно комплексообразователем является электроположительный одноатомный ион металла или неметалла, например [Fe(CN)6j , [IC14]-.
Если комплексообразователь не имеет заряда, то его называют центральным атомом. Так, в тетракарбониле никеля [Ni°(CO)4] беззарядный центральный атом никеля координирует
четыре ^яолекулы монооксида углерода, а в дииодоиодатном анионе [1°(1)2] центральный атом иода координирует два иона иода с эффективным зарядом на каждом из них, равным —0,5 е~.
Комплексообразователи с отрицательным зарядом встречаются
сравнительно редко.
Последнее время обнаружено, что в комплексных соединениях с большим числом атомов иода комплексообразователями могут быть молекулы иода и даже трехатомные анионы: [Is Г = [(12) (1з>2 ] , [I? Г а [(1з) (12)2 ]“.
Подробнее см.: Степин Б. Д, Степина С. Б. Усп. химии. 1986. Т.
55. С. 1434. Степин Б. Д. Координац. химия. 1987. Т. 13. С. 859.
Комплексообразователями могут быть почти все элементы периодической системы, даже элементы VIIIA-группы. В частности, получен октафтороксенат (+ VI) цезия Cs2[XeFs] в виде желтых кристаллов, устойчивых при нагревании до 400 °C. Реже встречаются комплексные соединения, в которых комплексообразователями являются щелочные и щелочно-земельные элементы.
Самую большую группу комплексообразователей образуют d-элементы (отчасти /-элементы) в разнообразных степенях окисления.
Комплексообразователь может участвовать в реакциях комплексообразования, протекающих в растворе как в виде иона, так и в составе молекулы:
[А1(Н2О)б]3+ + 60Ю - [АКОЮб]3- + 6Н2О Cu(OH)2 + 4NH3i=^ [Cu(NH3)412+ + 2ОН~
В одном комплексном ионе или молекуле может быть два и Дплее комплексообразователей, связанных либо непосредственно РУг с другом, либо посредством лигандов. Комплексные соединения рвого типа получили название кластеров.
12*
355
В кластерах роль комплексообразователя выполняет трехмерный скелет (полиэдр) из связанных между собой атомов металла. С увеличением числа атомов металла-комплексообразователя в полиэдре увеличиваются размеры его внутренней полости. Если в кластере всего два-три комплексообразователя, то функции координационного центра выполняет линейная и плоская (треугольная) группы атомов металла. Большинство известных в настоящее время кластеров состоит из одинаковых комплексообразователей-[Rh6(CO)i6]°, [Re3Cli2] .
Лиганды — частицы (ионы или молекулы), координируемые ком-£ плексообразователем и имеющие с ним непосредственные хими-5 ческие связи.
Лиганды, как правило, не связаны друг с другом, так как между ними действуют силы отталкивания. В отдельных случаях, когда лигандами являются молекулы, между ними возможно межмолекулярное взаимодействие, чаще всего в виде водородной связи.
Подробнее см.: Кукушкин Ю. Н. Химия координационных соединений. — М.: Высшая школа, 1985. С. 134.
Лигандами могут быть анионы различных кислот, неорганических и органических (CN~, Г, СгО^-, СН3СОО-, NO5 и др.), гидро-ксидный ион, полярные молекулы (NH3, НгО, СО и др.) и сложные органические молекулы. Например, в молекуле [Cr(NH3)3(NCS)3r лигандами являются анионы NCS и молекулы NH3.
Обычно с комплексообразователем лиганды связаны через один из своих атомов. Такие лиганды получили название м о н о дентатных.
« Дентатность — число химических связей у лиганда с комплексо-* образователен.
К числу монодентатных лигандов принадлежат все галогенид-ионы, ионы Н-, СН3СОО~, NO2, CN~, NCS- и др., молекулы Н2О, СО, NH3 и др. Когда с комплексообразователем лиганд связан через несколько своих атомов, то его называют п о л и д е н-татным (би-, три-, тетрадентатным). К числу бидентатных лигандов относятся, например, двухзарядные анионы: С2ОЗ , S2O1 , СО? и др.
Некоторые многоатомные лиганды могут образовывать химические связи с комплексообразователем через разные свои атомы. Такие лиганды получили название амбидентатных. К их числу принадлежат, например, анионы NCS-, CN- и NO2. Так, тиоцианатный анион в зависимости от природы комплексообразователя может быть связан с последним либо через атом азота М *- NCS, либо через атом серы М *- SCN.
Лиганды, связывающие комплексообразователи между собой, получили название мостиковых лигандов. Мостиковым лигандом может быть только такая частица, которая имеет либо несколько атомов-доноров, либо несколько донорных электронных пар в одном атоме: NCS-, Г, ОН-, NH2 , СГ и др. Например, р
356
комплексном катионе |(NH3)3Co— ОН —Со(МНз)з] комплексооб-пазователи (ионы Со) связаны через три мостиковых лиганда (ОН и NH2). Свойства лигандов изменяются, если они становятся мостиковыми. Так, лиганды ОН в анионе [А1(ОН)бГ способны к взаимодействию с протонами:
[АКОЮб]3- + H+^=t [А1(Н2О)(ОН)512-
Мостиковый же лиганд ОН- с протоном не взаимодействует. Этим и объясняется нейтральная реакция водных растворов, содержащих, например, анионы [(С2О4)2Сг(ОН)2Сг(С2О4)2Г , и щелочная — у гидроксокомплексов, таких, как [А1(ОН)бГ •
Координационное число — это число химических связей, которое комплексообразователь образует с лигандами.
Когда комплексообразователь связан с монодентатными лигандами, то координационное число равно числу лигандов. Количество присоединяемых к комплексообразователю полидентатных лигандов равно частному от деления координационного числа на дентатность лиганда.
Значение координационного числа комплексообразователя зависит от его природы, степени окисления, природы лигандов и условий (температура, природа растворителя, концентрация лигандов и комплексообразователя и т. п.), при которых протекает реакция комплексообразования.
Координационное число может изменяться в различных комплексных соединениях от 2 до 12. Однако координационные числа 3, 7, 8 и больше встречаются редко. Наиболее распространенными координационными числами являются 4 и 6.
Для координационного числа 4 структуры комплексных частиц могут быть тетраэдрическими и плоскоквадратными, но последние менее предпочтительны и не образуются, если лиганды являются крупными, а комплексообразователь имеет небольшие размеры. Плоскоквадратные комплексы характерны для ионов металлов с конфигурацией сГ: Ni2+, Pd , Pt , Au3*.
Шестикоординационные комплексы известны у многих комплек-сообразователей (металлов и неметаллов) и имеют преимущественно октаэдрическую структуру, хотя встречается у таких комплексов и структура тригональной призмы.
Для комплексов с координационным числом 5 существуют даа основных вида структур: тригональная бипирамида [CuChj , Ше(СО)5], [CdC15] , [Fe(N3)53l и др. и встречающаяся реже КваДратная пирамида [Ni(CN)5r и др.
Между значением координационного числа и степенью окисления элемента-комплексообразователя существует определенная корреляция- Так, для элементов-комплексообразователей, имеющих степень окисления (+ I) (Ag, Au, Си, I и др.), наиболее характерно координационное число 2: [1Вг2] , [Ag(NH3)2j+.
-^лементы-комплексообразователи, имеющие степень окисления
357
(+ II) (Zn, Cu, Pt, Pd и др.), образуют часто комплексные ионы с координационным числом 4, например [Zn(NH3)4] , [PtCl4] .
Элементы-комплексообразователи, имеющие степень окисления (+ III) или (+ IV) (Pt, Si, Со, Fe, Сг), имеют, как правило, координационное число 6: [Сг(НгО)бГ , [SiFer и др.
Из приведенных примеров видно, что координационное число комплексообразователя всегда больше его степени окисления.
Известны комплексообразователи, которые обладают почти постоянным координационным числом. Так, Со(Ш), Сг(Ш), Pt(IV), Al(III) в различных своих комплексных соединениях имеют координационное число 6, а В(+ III), Au(III), Pt(II), Pd(II) образуют преимущественно комплексные соединения с координационным числом 4.
Однако большинство комплексообразователей имеет переменные координационные числа.
Внутренняя сфера комплексного соединения — совокупность комплексообразователя и лигандов, имеющих между собой ординарные химические связи.
Внешняя сфера комплексного соединения — совокупность ионов, имеющих с внутренней сферой ионные химические связи.
Например, в комплексном соединении [Cu(NH3)4]SO4 внутренняя сфера образована ионом Си2 и молекулами ЬШз, непосредственно связанными с катионом меди. Обозначается внутренняя сфера квадратными скобками.
Внутренняя сфера комплекса может содержать в качестве лигандов одновременно ионы и молекулы, например [Pt(H2O)(NH3)2(OH) ]NO3. Молекулы, как правило, входят во внутреннюю сферу комплекса.
Ионы, не образующие непосредственной химической связи с комплексообразователем, но нейтрализующие заряд комплексного иона, образуют внешнюю сферу комплекса. В приведенных выше примерах такими внешнесферными ионами являются ионы SOi и NO3. При написании формулы комплексного соединения внешне-сферные ионы располагаются за квадратными скобками.
Различие между внешнесферными ионами и лигандами внутренней сферы существенно. Если ионы внешней сферы образуют с комплексным ионом преимущественно ионные химические связи, то химические связи лигандов с комплексообразователем являются ковалентными связями с различной долей полярности. Поэтому комплексные соединения, содержащие внешнесферные ионы, в разбавленных водных растворах ведут себя как сильные электролиты, они полностью распадаются на внешнесферные и комплексные ионы, например
K2[Hgl4] = 2К+ + [Hgl4]2"
Если химическая связь М—L во внутренней сфере близка к ионной, то комплексные ионы очень неустойчивы и в полярном растворителе практически полностью распадаются на ионы, например
[ZnCl4]2 = Zn2+ + 4СГ
358
Комплексное соединение может состоять из двух комплексных ионов, каждый из которых можно считать внешнесферным, например [Cu(NH3)4][PtC14]. При растворении такого соединения в воде в растворе появляются два иона:
[Cu(NH3)4][PtC141 = [Cu(NH3)4]2+ + [PtCl4]2~
19.3. ОСНОВНЫЕ ТИПЫ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ
Большое многообразие комплексных соединений и их свойств не позволяет создать единую их классификацию.
Наиболее распространенной в настоящее время является классификация комплексных соединений по типу координируемых лигандов. Однако и эта классификация применима только для тех комплексных соединений, внутренняя сфера которых состоит из одинаковых лигандов (гомолигандные комплексы). Тем не менее такая классификация позволяет объединить комплексные соединения в определенные типы по общности методов синтеза и некоторых физико-химических свойств.
Аквакомплексы. К аквакомплексам относят комплексные катионы, в которых лигандами являются молекулы воды.
В кристаллах некоторые аквакатионы могут образовывать парные ассоциаты. Например, в аквакомплексе [Na(H2Q)5j2CO3 аквакатионы [Na(H2O)5]+ связаны в пару [Na2(H20)ior •
Аквакомплексы образуют только катионы металлов со степенью окисления (II) и больше, причем способность к образованию аквакомплексов у металлов уменьшается в группах периодической системы сверху вниз.
Все аквакатионы в большей или меньшей степени являются катионными кислотами:
[Сг(Н2О)б]3+ + Н2О. *Н3О + [Сг(Н2О)5ОН]2+
Протоногенными группами служат координированные молекулы воды. По мере удаления из внутренней сферы протонов кислотные свойства аквакатионов ослабевают.
Кислотные свойства аквакатионов выражены тем сильнее, чем больше заряд иона и степень окисления комплексообразователя. В частности, у аквакатиона [Ре(НгО)б]3+ константа кислотности
== 10 (25 °C), что свидетельствует о более сильных его кислотных свойствах, чем у HNO2 и СНзСООН (см. раздел 10.2, табл. 16).
Гидроксокомплексы. К гидроксокомплексам относят комплексные ионы и молекулы, в которых лигандами являются преимущественно ионы ОН :[Zn(OH)4] , [Sn3(OH)4], [Ве(Н2О)2(ОН)2Г и др.
Комплексообразователями в гидроксокомплексах являются метал-Лы, склонные к проявлению амфотерных свойств. К их числу относятся: М(Ц) _ Be, Zn, Cd, Sn, Pb, Mn, Fe, Co, Cu; M(III) — Al, Cr, a’ Sc> Bi, Fe; M(IV) — Sn, Pb, Pt, Ti, Zr; M(V) — Sb, As, V.
M . идР°кс°комплексы в водных растворах неустойчивы из-за об-гидроксогрупп на молекулы воды:
359
[Zn(OH)4]2 + H20.~* [Zn(H2O)(OH)3f + ОН"
Обмен ОН -ионов на молекулы Н2О обычно заканчивается осаждением малорастворимых гидроксоаквакомплексов, таких, как [Zn(H2O)2(OH)2]°. К устойчивым в воде гидроксокомплексам (последние два — малорастворимы) принадлежат: Na2[Sn(OH)6] Na2[Pb(OH)6L Na[Sb(OH)6], Ag2[Pt(OH)6].
Кристаллические осадки гидроксокомплексов и их водные растворы энергично взаимодействуют с СО2, SO2, H2S и другими веществами, обладающими кислотными свойствами. Например:
[А1(ОН)613- + ЗСО2 = А1(ОН)з1 + ЗНСО5
При действии кислот гидроксокомплексы металлов-комплексооб-разователей, находящихся в стабильных степенях окисления, превращаются в аквакомплексы:
[Сг(ОН)б]3- + 6Н3О+ = [Сг(Н2О)б]3+ + 6Н2О
Если же комплексообразователь имеет нестабильную высокую степень окисления, то реакция взаимодействия гидроксокомплексов с кислотами становится окислительно-восстановительной:
Na[Sb(OH)6] + 6НС1 - SbCl3 + Cl2f + NaCl + 6H2O
В разбавленных растворах при низкой концентрации ОН"-ионов гидроксокомплексы превращаются в гидроксоаквакомплексы, которые затем подвергаются полимеризации с появлением между комплексообразователями мостиковых ОН -лигандов (процесс о л я ц и и):
|А1(ОН)б13' - [А1(Н2О)4(ОН)2]+- [А12(Н2О)8(ОН)2]4+ ► - [А17(Н2О)юО2(ОН)1413+
С течением времени многоядерные гидроксоаквакомплексы изменяют свой состав, происходит так называемое старение осадков. Мостиковые лиганды ОН превращаются в оксогруппы (процесс оксоляции), одновременно комплекс теряет молекулы вода:
> Ti(OH)2Ti < О—TiC+ Н2О
При нагревании (300—500. °C) гидроксокомплексы разлагаются с выделением воды и образованием двойных оксидов:
Саз[Сг(ОН)б]2 = (Саз, Сг2)Об + 6Н2О
Получение гидроксокомплексов основано на использовании ре-акций типа:
Zn(OH)2 + 2ОН- ' [Zn(OH)412~ Сг20з + 6ОН + ЗН2О - 2[Сг(ОН)б]3’ А1 + ЗОН" + ЗН2О = [А1(ОН)б]3" + l,5H2f
Аммиакаты. Комплексные соединения, в которых лигандами являются молекулы аммиака, называют аммиакатами. Аммиакаты
360
образуют преимущественно d-элементы. Устойчивость аммиакатов увеличивается с увеличением степени окисления комплексообразо-вателя и уменьшения размеров его атомов. Например, hqh [Ве(ЫНз)4Г “ 34 пм) более устойчив, чем ион [Mg(NH3)6J (гмв = пм)’ а ион [Со(ЬШз)бГ более устойчив, чем ион [Со(МНз)б ]2+. Наиболее устойчивыми аммиакатами являются соединения, включающие катионы: (Со(МНз)бГ, [Си(Т4Нз)4Г > [Zn(NH3)4F+-
При действии кислот на большинство аммиакатов молекулы аммиака во внутренней сфере превращаются в катионы аммония и тотчас же замещаются молекулами воды:
[Cu(NH3)412+ + 4Н3О+ - [Cu(H2O)412+ + 4NH|
Нагревание всех аммиакатов приводит к их разложению: [Мп(ЫНз)б]С12 = MnCh + 6NH3t [Zn(NH3)4](OH)2 = Zn(OH)2 + 4NH3t
Для получения аммиакатов действуют аммиаком на оксиды, гидроксиды, безводные соли или их водные растворы:
ZnO + 4NH3 + Н2О =: [Zn(NH3)4]2+ + 2ОН
CoS04(K) + 6NH3(r) [Co(NH3)6]SO4(k>
Cu(OH)2 + 4NH3.-- - [Cu(NH3)4]2+ + 2OH-
Ацидокомплексы. Ацидокомплексы представляют наиболее обширную группу комплексных соединений, в которых лигандами являются анионы неорганических и органических кислот.
Широко распространенными являются, например,_ ацидокомплексы с галогенидными лигандами, подобные [BF4 ] , [SnClc ]Z , [Hgl4]2".
Многие ацидокомплексы придают растворам характерную окраску и поэтому могут служить для открытия тех или иных ионов металлов в растворе. Например, Fe(II) образует с тиоцианатными анионами NCS- комплексные анионы состава [Fe(NCS)6] , придающие раствору зеленоватый цвет, а ионы Fe(III) с теми же анионами — анионы состава [Fe(NCS)6i, окрашивающие раствор в кроваво-красный цвет. Эту весьма чувствительную реакцию применяют для обнаружения примеси солей Fe(III) в солях Fe(II):
[Fe(H2O)6]3+ + 6NCS~. ‘ [Fe(NCS)6f~ + 6Н2О
Однако анион [Fe(NCS)6]3 очень неустойчив. Например, ионы F , Н2РО4 легко заменяют во внутренней сфере ионы NCS и раствор становится бесцветным:
lFe(NCS)6]3- + 6F- * [FeF6]3" + 6NCS
рх,РОЧТи все d-элементы образуют ацидокомплексы с анионами • Химическая связь комплексообразователя и лигандов CN” осуществляется либо через атом углерода, либо через атом азота.
361
Наиболее изучены гексацианоферраты металлов, например K4[Fen(CN)61 и Кз[РеШ(СН)б]. Если к водным растворам этих комплексов добавить соответствующие растворы солей Fe(III) и Fe(II), то выделяются осадки синего цвета, содержащие железо с различной степенью окисления:
[Fe(H2O)613+ + [Fe(CN)614- = FeUI[Fen(CN)6]~ + 6Н2О
[Fe(H2O)612+ + [Fe(CN)613~ = Feu[FeUI(CN)6F + 6H2O
Считают, что образовавшиеся анионы находятся в окислительно-восстановительном равновесии: Fein[Fen(CN)61 ^=^Fen[Fem(CN)6F.
Подробнее см.: Тананаев И. В., Сейфер Г. Б. и др. Химия ферроцианидов. — М.: Наука, 1971.
В разбавленных кислотах анионы устойчивы, но в водных растворах КОН выделяют FeO(OH):
Fen[Fem(CN)6r + ЗОН' = FeO(OH)i + [Fen(CN)6]4' + Н2О
FenI[Feu(CN)6r + ЗОН' - FeO(OH)j + [Feu(CN)6]4' + НгО
Медь, серебро и золото взаимодействуют в присутствии окислителя с анионами С№, например
2Au + 4CN' + 0,502 = 2[Au(CN)2]~ + 2ОН~
Известно много ацидокомплексов с лигандом NO2. В частности, для обнаружения малых количеств кобальта в солях никеля используют реакцию образования Кз[Со(НО2)б], малорастворимого в воде и спирте. Мелкие, желтого цвета кристаллы выпадают в осадок при добавлении к водным растворам солей Со(П) растворов СНзСООН и KNO2:
[Со(Н2О)б]2+ + NO2 + 2Н3О+ - [Со(Н2О)б]3+ + NO f + ЗН2О
[Со(Н2О)б]3+ + 6NO2 [Co(NO2)6]3- + 6Н2О
В основе синтеза Кз[СоШО2)б1 лежат окислительно-восстановительная реакция и реакция комплексообразования, стабилизирующая у кобальта степень окисления (III).
Среди ацидокомплексов особое место занимают п е р о к с о-комплексы — комплексные соединения, содержащие во внутренней сфере анионы 0% (условное обозначение ). Пероксокомплексы образуют преимущественно элементы IVB-, VB-, VIB- и VIIIB-rpyrm периодической системы, бор и уран. Увеличение кислотности среды приводит, как правило, к уменьшению числа пероксогрупп во внутренней сфере. Например, в реакции:
[Nb(O2)4 ]3~ + 4НзО+ + 2Н2О [Nb(H2O)4(OH)2(OS) f + ЗН2О
Пероксокомплексы составов Na3 [ V (02) 4 ], Кз [Сг(О§) 4 L Cs [Nb (02) 41 существуют только в сильнощелочных средах.
362
Пероксокомплексы могут содержать во внутренней сфере наряду с анионами О^- молекулы воды, ионы О2- и другие лиганды: K|V(H2O)O(O5)2l, Na2|B2(OH)2(HO2)2(05)21, K2|VO(O2)2F1.
В комплексах состава [М(ОЗ>4 Г” только три лиганда способны обмениваться на другие частицы. Последний ион очень прочно удерживается комплексообразователем и сохраняется во внутренней сфере при воздействии ионов НзО и ОН в широком интервале их концентраций.
Пероксокомплексы сравнительно легко разлагаются при нагревании с выделением кислорода:
2(NH4)3[Ta(O5)4] = Та2О5 + 6NH3f+ 02f + ЗН2О
K3[V(C2O4)O(O2)2] - KVO3 + К2С2О4 + 02f
Общий метод синтеза пероксокомплексов состоит во взаимодействии оксидов, галогенидов или солей J-элементов с Н2О2 (конц.) (в ряде случаев в присутствии КОН) при температурах не выше 25 °C:
ТаС15+ 4Н2О2 + 8NH3 = (NH4)3[Ta(O5)41 + 5ЫН4С1
Комплексные соединения галогенов. К комплексным соединениям галогенов принадлежат соединения, в которых либо анион, либо катион состоит целиком из атомов галогенов, являющихся и комплексообразователями, и лигандами. Комплексные соединения галогенов делят на две группы: анионгалогенаты и катион-галогенаты.
Анионгалогенаты. К анионгалогенатам относят комплексные соединения галогенов, в которых в анионе функции комплексообразователя выполняет наиболее электроположительный галоген, а лигандами являются галогены равной или большей электроотрицательности.
В этих комплексах координационное число комплексообразова-тедя на единицу больше, чем его степень окисления. Например, у [I (BrCl) ] , [1+ТПС14 ] , [C1+VF6 ] , [I+VI г 8 ] координационные числа равны соответственно 2, 4, 6 и 8.
Комплексообразователями у анионгалогенатов в большинстве случаев являются положительно заряженные ионы галогенов, но могут быть и беззарядные_ атомы ([I°(I)2]), отрицательно заряженные_ одноатомные ([I (1г) 2] ) и даже трехатомные ионы П(1з) (12)2] ) и молекулы ([(12) (1з)2 ]2 ).
Анионгалогенаты, содержащие в анионе четыре различных галогена, неизвестны. Устойчивость анионгалогенатов в растворах увеличивается при переходе от более электроотрицательных к более электроположительным комплексообразователям и при замене воды как растворителя на апротонные полярные растворители (CH3CN, СН3*Ю2, C6H5NO2 и др.).
Анионгалогенаты, у которых комплексообразователями являются атомы или ионы брома или хлора, разлагаются водой:
363
5[ВгСЬГ + ЗН2О - ВгОз + 10СГ + 2Вг2 + 6Н+
Анионгалогенаты — термически неустойчивые соединения. При нагревании они выделяют галоген или межгалогенное соединение, превращаясь в галогенид с наиболее электроотрицательным галогеном:
Cs[I(BrCl)] - CsCl + IBr; RblKChF)] - RbF + ICht
Образуются анионгалогенаты при взаимодействии галогенидов малозарядных крупных катионов (К+, Rb+, Cs+, NHj, катионов алкиламмония, фосфония, арсония и др.) с галогенами и межгалогенными соединениями:
CsCl + IBr. -Cs[I(BrCl)j; RbCl + 1С1з . _RblICl4|
[N(CH3)41I + ' [N(СНз)4][Kb)2]
Подробнее см.: Степин Б. Д., Плющев В. Е., Факеев А. А. Усп. химии, 1965. Т. 34. С. 1881; Степин Б. Д, Степина С. Б. Усп. химии, 1986. Т. 55. С. 1434; Степин Б. Д Координац. химия. 1986. Т. 12. С. 1587; Опдловский А. А. Усп. химии. 1967. Т. 36. С. 1673.
Катионгалогены. К катионгалогенам относят ацйдокомплексы с катионом, содержащим три и более галогена, один из которых является комплексообразователем (I, Вг, С1) в нечетной степени окисления от (+ I) до (+ VII). Лигандами в таком катионе могут быть все галогены и межгалогенные соединения. Например, [Cl+vF4][SbF6]; [I+I(IBr)2]+; [I+VIIF6][BF41; [Cl+r(Cl)2][AsF6].
Все катионгалогены — сильнейшие окислители. Они бурно реагируют с водой и органическими растворителями.
Синтез катионгалогенов возможен только с участием сильных акцепторов галогенидных ионов в средах, не содержащих восстановителей:
Юз + SbCl5. - [ICl2][SbC16]; BrF3 + AsFs [BrF2][AsF61
В среде межгалогенных соединений анионгалогены и катионгалогены взаимодействуют как кислоты и основания. Например, в среде ВгРз
Ag[BrF4] + [BrF2 ][SbF61 - Ag[SbF6] + 2BrF3
Подробнее см.: Степин Б. Д Усп. химии. 1987. Т. 56. С. 1273.
Карбонилы металлов. Комплексные соединения, у которых лигандами являются молекулы монооксида углерода, а комплексооб-разователями — атомы металлов со степенью окисления, равной нулю, получили название карбонилов металлов.
Карбонилы металлов диамагнитны, состоят из одной внутренней сферы и относятся к категории неэлектролитов. Они могут быть жидкими, как! [Ni(CO)4[Fe(CO)5], и твердыми веществами, как [Сг(СО)б], [Со2(СО)8].
При образовании связей в карбонилах происходит перекрывание гибридных орбиталей центрального атома с (Т°-МО молекулы СО
364
Рис. 74. Образование карбонилов металлов (а) и структуры л-комплексов (6 и в)
(рис. 74, а). Одновременно заполненные электронами d-AO центрального атома перекрываются с вакантными Л*-МО монооксида углерода. Вследствие этого происходит смещение электронов к лигандам, упрочнение связи М—СО и ослабление связи внутри молекул СО. Молекула СО может быть в карбонилах не только моноден-татным, но и мостиковым лигандом, например в [Сог(СО)8].
Значение координационных чисел центральных атомов в карбонилах определяют при помощи правила Сиджвика.
Сиджвик Невил Винсент (1873—1952) - английский профессор химии.
В соответствии с этим правилом при образовании большинства карбонилов вокруг центрального атома создается устойчивая 18-электронная оболочка из валентных электронов лигандов и центрального атома. Например, атом Fe° с электронной конфигурацией 1Аг]4х 3d” имеет восемь валентных электронов, для образования «электронной оболочки ему не хватает десяти е . Эти десять электронов Fe получают от пяти молекул СО, каждая из которых
365
является донором одной пары электронов. Следовательно, состав карбонила железа будет отвечать формуле [Fe(CO)5]°.
Химические свойства карбонилов очень разнообразны. Растворы карбонилов в CCI4 энергично взаимодействуют с галогенами:
2[Fe(CO)5] + ЗС12 = 2FeCl3 + lOCOf
Серная кислота при нагревании разрушает карбонилы:
[Ni(CO)4] + H2SO4 = NiSO4 + 4COt + H2f
Растворы гидроксидов щелочных металлов превращают карбонилы в карбонилат-анионы со связями М—Н:
[Fe(CO)5] + ЗКОН = K[Fe(CO)4H] + К2СО3 + Н2О
Получение карбонилов основано либо на непосредственном взаимодействии металла и монооксида углерода, либо на использовании реакций карбонилирования безводных галогенидов металлов под давлением в присутствии металлов, связывающих галогены:
t
СгС1з + 6СО + А1 = [Сг(СО)б] + А1С1з
WC16 + 6СО + 3Cu = [W(CO)6] + ЗСиС12
Гидридные комплексы. Гидридными комплексами называют соединения, содержащие в анионе в качестве лигандов гидридные ионы Н~.
Комплексообразователями у гидридных комплексов являются в основном элементы ША-группы, хотя известны комплексные анионы, образованные и другими элементами, например [ReFk) ] . Получены и многоядерные гидридные комплексы, например KIAI2H7].
В ряду [ВН4] > [AIH4] > [GaH4! устойчивость анионов резко уменьшается. Если Na[BH41 взаимодействует при 25 °C с водой медленно, то Na[AlH41 бурно разлагается, часто со взрывом:
Na[BH4] + 4Н2О - В(ОН)з1+ NaOH + 4H2t
Na[AlH4] + 4Н2О - А1(ОН)з| + NaOH + 4H2t
Получение гидридных комплексов возможно только в неводных средах: в среде диэтилового эфира
4UH + AICI3 - Li [А1Н4 ] + LiCl
или в среде тетрагидрофурана
Na + Al + 2H2= Na[AlH4]
Подробнее см.: Жигач А. Ф., Стасиневич Д. С. Химия гидридов. — Л.: Химия, 1969.
Особые группы комплексных соединений. В приведенную выше классификацию не укладываются некоторые очень важные группы комплексных соединений, которые объединяют комплексы не по
366
виду лигандов, а по типу химической связи и характеру координации лигандов.
Пи-комплексы. Непредельные углеводороды, такие, как этилен, бензол, циклопентадиен и др., могут выполнять функции лигандов, не изменяя кратности своих связей. У таких лигандов нет непосредственной связи с комплексообразователем, последний образует связи со всей делокализованной Л-электронной системой лиганда. Отсюда и название Л-комплексы металлов.
Первый 71-комплекс — трихлороэтиленплатинат (И) калия К [Р1(С2Н4)С1з ] был получен в 1830 г. Цейзе по реакции
K2[PtC141 + С2Н4 - К[Р1(С2Н4)С1з 1 + КС1
Цейзе Вильям (1789-1847) - датский химик-органик.
Строение же этого комплекса было установлено лишь к 1953 г. Оказалось, что молекула этилена лежит в плоскости, перпендикулярной химической связи платина — двойная связь этилена. Перекрывание происходит между Л-МО этилена и вакантной гибридной орбиталью sp2dx2 - у2 платины. Структура этилена после образования комплекса остается, по существу, неизменной, только прочность связи С—С ослабевает из-за смещения электронной плотности от металла на Л*-МО этилена (рис. 74, б).
Другим широко известным .^-комплексом является бис-Л-пикло-пентадиенилжелезо (другое название ферроцен) [Fe(C5H5>2]. Лиганд С5Н5 является анионом очень слабой {Кк~ 1О-20, 25 °C) циклической кислоты — циклопентадиена. Отщепление водорода от группы СН2 этой кислоты происходит только в среде сильных оснований:
С5Н6 + КОН « К(С5Н5) + Н2О
Образующийся циклопентадиенил калия может взаимодействовать с галогенидами металлов:
FeCh + 2К(С5Н5) = [Fe(C5H5)2]0 + 2КС1
Известно большое число соединений состава [М(С5Н5)2]°, получивших название металлоценов. Металлоцены образуют элементы четвертого периода от Ti до Си, а также Os и Ru. Все металлоцены растворяются в органических растворителях и имеют почти одинаковую температуру плавления, равную 173—174 °C.
Структура металлоценов получила название «сэвдвичевой»: катион металла (II) размещается между двумя циклопентадиениль-ными анионами и находится на равном расстоянии от всех атомов углерода. Выделить в комплексе [М(С5Н5)2]° отдельные ковалентные связи между металлом и атомами углерода двух лигандов невозможно (рис. 74, в).
Циклические комплексные соединения, или хелаты. К циклическим комплексным соединениям, или хелатам, относят соединения, содержащие во внутренней сфере полидентатные лиганды, заключающие комплексообразователь в замкнутые циклы (один или
367
одновременно несколько). Обычно встречаются четырех-, пяти-, шестичленные циклы и циклы с большим числом членов.
Например, оксалатный анион СгОЗ- образует пятичленный цикл, а тиосульфатный анион 8г0|~ — четырехчленный цикл:
0-с-о^ /О\ Л)
I М ; М
О—С—0^ '^S
Как показывает большой экспериментальный материал, наибольшей устойчивостью обладают пяти- и шестичленные циклические комплексы (правило циклов Чугаева). Соединения, содержащие семи- и восьмичленные циклы, неустойчивы и встречаются редко.
Чугаев Лев Александрович (1873-1922) - профессор Петербургского университета, основатель и первый директор Института платиновых и благородных металлов. Его работы посвящены многим вопросам координационной теории.
Как правило, полидентатный лиганд занимает во внутренней сфере циклического комплекса соседние координационные места. Например, в анионе [Со(ох)з г три пятичленных цикла, в каждом из которых анионы СгОЗ- = ох занимают соседние координационные места.
Большинство циклических комплексных соединений содержит полидентатные лиганды органического происхождения (этилендиамин NH2CH2CH2NH2; а-аминоуксусная кислота CH2NH2COOH, диметилглиоксим (СНз)гС2(МОН)2 и многие другие). Например, в реакции
Cu(0H)2 + 2CH2NH2COOH = [Cu(gly)2]° + 2НгО
образуется комплекс диглицинатомедь (II) (лиганд CH2NH2COO называют «глицинато», условное обозначение gly), придающий раствору сине-фиолетовую окраску:
Н2 I
h2c-n4 х0-С-0
0-=С—QCU'4 N—СН2
I Н2
[Си (gly) 21°
Внутренняя сфера комплекса содержит два замкнутых пятичленных цикла. В аналитической практике для обнаружения примеси никеля в солях кобальта применяют реакцию Чугаева:
2H2dmg + Ni2+ + 2NH3 = [Ni(Hdmg)2 [° + 2NHJ
/0 ...H—Ox
H3C-C=N< Pn=C-CH3
>NiCT I
Н3С-С=Г^ ^~N—C—CH3
O-H-./O'
([Ni(Hdmg)2]0)
368
с участием диметилглиоксима, являющегося очень слабой Одноосновной кислотой (Кк = 2,2»10-1 , 25 °C). Бидентатный лиганд (CH3)2^2(NOH)2, после потери протонаобозначают — Hdmg .
В приведенной выше реакции Hdmg образует с Ni (II), присутствующем в виде аммиаката [Ni(NH3)61 , циклический комплекс, бмс(диметилглиоксимато) никель (II), окрашивающий раствор в алый цвет. Молекула комплекса плоская и содержит четыре пятичленных цикла, два из которых образованы с участием водородной связи.
Многоядерные комплексы. Многоядерными комплексами называют самые разнообразные типы комплексных соединений, отличительным признаком которых является наличие во внутренней сфере двух и более комплексообразователей. Комплексообразователи в таких комплексах могут быть связаны либо непосредственно, либо при помощи мостиковых лигандов.
Образование многоядерных комплексов объясняют тем, что лиганды, связанные с одним комплексообразователем, сохраняют способность к дальнейшему взаимодействию, если они имеют еще по одной неподеленной паре электронов. Когда лиганд содержит больше донорных атомов, чем максимальное координационное число, то он так же может через эти атомы образовать связи с другими комп-лексообразователями. Наконец, объединение одноядерных комплексов в многоядерные может произойти в тех случаях, когда пространственные затруднения не позволяют всем донорным атомам полидентатного лиганда установить химические связи с одним и тем же комплексообразователем.
Примерами двуядерных комплексов могут быть сульфат ди-^и-гидроксо)-бис(тетраакважелеза) (III) [(HzO)4Fe(OH)2Fe(H2O)4]SO4; бмс(пентакарбонилмарганец) (Мп—Мп) [(СО)5Мп—Мп(СО)5Г; ди (w-бромо)-бис (дибромоалюминий) [ВггА! ВггАШг? ].
Большинство изученных многоядерных комплексов с мостиковыми лигандами являются дву- и трехъядерными. Многоядерныс комплексы с шестью и более центрами координации встречаются реже. Они, например, образуются при гидролизе одноядерных аквакомплексов металлов.
19.4. ИЗОМЕРИЯ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ
Среди комплексных соединений широко распространено явление изомерии, под которым понимают способность веществ образовывать соединения, одинаковые по составу и молекулярной массе, но различающиеся по строению или расположению атомов в пространстве, а следовательно, и по свойствам.
Изомерия комплексных соединений является одной из причин их многообразия.
У комплексных соединений явление изомерии обусловлено как Различным расположением лигандов во внутренней сфере (внутри-сферная изомерия), так и различным распределением ионов и молекул между внутренней и внешней сферами (междусферная изомерия).
369
Внутрисферная изомерия. Основными видами внутрисферной изомерии являются геометрическая, оптическая и связевая изомерии.
Геометрическая изомерия. Этот вид изомерии вызван различным размещением лигандов во внутренней сфере относительно друг друга. При геометрической изомерии лиганды не меняют атомы, через которые они связаны с комплексообразователем, и структуры (тетраэдрическая конфигурация, например, не может превратиться в квадратную).
Геометрическая изомерия проявляется преимущественно у комплексных соединений, имеющих октаэдрическое строение, строение плоского квадрата или квадратной пирамиды.
Линейные и тетраэдрически построенные комплексы геометрических изомеров не имеют:
Из линейной и тетраэдрической структур следует, что все координационные места у рассматриваемых комплексов являются равноценными. Линейные структуры легко совмещаются друг с другом поворотом одной из них на 180°. Тетраэдрический комплекс [M(Li, L2, L3, L4) ] также невозможно преобразовать в неэквивалентную форму перестановкой лигандов, поскольку все комбинации, возникающие от перестановок, идентичны, и каждому лиганду соответствуют одинаковые наборы ближайших соседей. Так, у левого тетраэдра соседями лиганда Li в основании будут лиганды L3 и L4. Эти же соседи остаются у лиганда Li в правом тетраэдре у задней боковой грани, равноценной основанию левого тетраэдра.
Комплексные соединения, имеющие структуру в виде плоского квадрата, уже могут иметь два изомера при наличии двух различных лигандов. Например, комплекс состава [Pt(NH3)2C12] имеет два изомера, содержащих лиганды, расположенные двумя неэквивалентными способами (рис. 75, а). У цис-изомера одинаковые лиганды расположены рядом, а у транс- — по диагонали, напротив друг
друга.
Большое число геометрических изомеров образуют октаэдрические комплексы. Появление во внутренней сфере двух лигандов, отличающихся по составу от остальных, уже вызывает образование цис- и транс-изомеров. Например, у катиона [Pt(NH3)4C12F из" вестно два изомера (рис. 75, б). Для октаэдрических комплексов состава [М(ЬзЬз) ] также возможно два изомера. В гран-изомерах, например у [Сг(МНз)зС1з]°, три одинаковых лиганда занимают
Рис. 75. Геометрические изомеры: а — [PKNHOjCh]0; б — [Pt(NH3)4C12r+; в — [Cr(NH3)3Cl3]°
вершины одной и той же грани октаэдра, а у ос-изомеров три одинаковых лиганда занимают вершины в экваториальной плоскости октаэдра (рис. 75, в).
С увеличением числа различных лигандов во внутренней сфере растет и число геометрических изомеров. У октаэдрического комплекса с шестью различными лигандами существует 15 геометрических изомеров.
Оптическая изомерия. Если одинаковые структуры двух внутренних сфер одного и того же состава и молекулярной массы не совмещаются в трехмерном пространстве и оказываются зеркальным отображением друг друга, то они являются оптическими изомерами. Оптическую изомерию называют иногда еще зеркальной изомерией, а сами изомеры — оптическими антиподами или энантиомерами.
Ниже представлены структуры двух оптических изомеров тетраэдрических комплексов. Эти комплексы не имеют геометрических изомеров, но их нельзя совместить друг с другом никакими пово-
371
ротами, как наши правую и левую руки (ладони должны быть ориентированы в одном направлении). Совмещаются только зеркальные отображения комплексов.
Оптическая изомерия возможна только тогда, когда комплексная частица не имеет внутренней плоскости симметрии, является асимметричной. Тетраэдры нельзя разделить никакой плоскостью на две симметричные части, поскольку по обе стороны любой плоскости, проходящей через комплексообразователь М, всегда окажутся разные лиганды.
Например, темно-зеленые кристаллы (КН4)з[Со(ох)з]»ЗН2О существуют в виде двух оптических изомеров (рис. 76). Октаэдрический анион [Со (ох) з Г не имеет плоскости симметрии, его оптические антиподы соотносятся между собой как предмет к его зеркальному изображению.
II
б)
I I I
—Fe (III)—CN—Fe (II)—NC—Fe (III)—
—Fe (II)—NC—Fe (III)—CN—Fe (II)—
Рис. 76. Изомеры оптические (о) и связевые (б): б — фрагмент кристаллической решетки гексацианоферрата (II, III) железа (III, II); 0xsQ>O?_
372
Рис. 77. Вращение плоскости поляризации света растворрм оптических изомеров:
у — обычный световой-луч; 2 — оптические призмы; 3 — плоскополярй-зованный луч; 4 — кювета с раствором комплекса
Важнейшим физическим свойством оптических изомеров, по которому они отличаются друг от друга, является способность их растворов вращать плоскость поляризации проходящего светового луча либо вправо, либо влево.
В обычном световом луче электромагнитные колебания совершаются в различных плоскостях. Если такой луч пропустить через систему специальных оптических призм, то он станет плоскополя-ризованным, электромагнитные колебания будут происходить в одной плоскости.
Плоскополяризованный луч, проходя через раствор оптического изомера, может отклоняться либо влево (Z-изомер, от лат. laevus — левый), либо вправо (J-изомер, от лат. dexter — правый) йа некоторый угол а (рис. 77). Приборы, с помощью которых определяют угол вращения плоскости поляризации света, называют поляриметрами.
Подробнее см.: Хьюи Дж. Неорганическая химия. — М.: Химия, 1987. С. 338.
Механические смеси и растворы эквимолярных количеств оптических антиподов оптической активностью не обладают, их называют рацематами.
По многим своим физико-химическим свойствам оптические изомеры практически друг от друга не отличаются, и их разделение («расщепление» рацематов) представляет очень трудную технологическую задачу.
Связевая изомерия. Комплексные соединения, различающиеся только видом атома амбидентатного лиганда, через который осуществляется связь этого лиганда с комплексообразователем, получили название связевых изомеров.
Например, розовые кристаллы [Со(МНз)5ОЫО](ЫОз)2 со связью ''° ONO приобретают со временем желто-коричневую окраску, характерную для связевого изомера [Co(NH3)sNO2 ](МОз)2 со связью Co-no2. Связевые изомеры образуют катионы [Cr(H2O)5NCSj и lCr(H2O)5SCN ]2+ изтза различия в связях М—NCS и М—SCN.
373
У связевых изомеров, содержащих амбидентатные лиганды, связь с комплексообразователем осуществляется только через один атом. Лиганды у связевых изомеров являются монодентатными.
Гексацианоферраты KFen[Feni(CN)6] и KFein[Fen(CN)61 рассматривают как связевые изомеры, имеющие одну и ту же кри-.сталлическую решетку (см. рис. 76), содержащую в кубических полостях ионы К+.
Междусферная изомерия. Основными видами междусферной изомерии являются: сольватная (или гидратная), координационная и ионизационная.
Сольватная, или гидратная, изомерия. К сольватным, или гидратным, изомерам относят комплексные соединения, одинаковые по составу, молекулярной массе и строению, но различающиеся по распределению молекул растворителя между внутренней и внешней сферами.
Классическим примером гидратной изомерии служит существование трех изомеров хлорида гексааквахрома (III).
Первый изомер состава (СгШзОб) ]С1з известен в виде кристаллов серо-сиреневого цвета, окрашивающих водный раствор в фиолетовый цвет, из которого раствор AgNOa осаждает все три хло-ридных иона:
3CF + 3Ag+ = 3AgCh
Второй изомер состава [Сг(Н2О)5С1]С12*Н2О существует в виде кристаллов светло-зеленого цвета, окрашивающих водный раствор в голубовато-зеленый цвет. Такой раствор содержит ионы [Сг(НгО)5С1_Г и 2С1 , поэтому раствор AgNOa осаждает только два иона С1 :
2СГ +2Ag+ = 2AgCl|
Наконец, третий изомер состава [Сг(Н2О)4С12]С1«2Н2О кристаллизуется из темно-зеленых водных растворов в виде кристаллов изумрудно-зеленого цвета. В его растворе присутствуют ионы [Сг(Н2О)4С121+ и С1 . Раствор AgNOa осаждает только "/з содержащегося в веществе хлора:
Cr + Ag+ = AgCU
Четвертый изомер состава [Сг(Н2О)зС1з1*ЗН2О пока не получен.
При высушивании в эксикаторе над H2SO4 (конц.) гидраты [Сг(Н2О)5С1]С12«Н2О и [Сг(Н2О)4С12]С1»2Н2О теряют только те молекулы воды, которые находятся во внешней сфере.
Координационная изомерия. Координационные изомеры обнаружены у комплексов, состоящих из двух внутренних сфер с различными комплексообразователями или комплексообразователями, находящимися в различных степенях окисления. Изсмерия вызвана различным распределением лигандов между сферами. Например: [Pt(NH3)4] [PdCl4] и [Pd(NH3)4] [PtCUl; [Co(NH3)6] [Cr(CN)61 и (Cr(NH3)6] [Co(CN)6].
374
Ионизационная изомерия. Этот вид изомерии связан с различным распределением ионов между внутренней и внешней сферами комплекса без изменения его состава и молекулярной массы.
Например, ионизационными изомерами являются комплексы [Co(NH3)5Br]SO4 и [Co(NH3)5SO4]Br; [Pt(NH3)4Br2]Ch и [Pt(NH3)4C12]Br2. Первые два изомера отличаются еще и координационными числами (6 и 7). Кристаллы ионизационных изомеров имеют различную окраску, а их водные растворы в отдельных случаях могут отличаться и по химическим свойствам. В частности, изомер [Pt(NH3)4SO4](OH)2 является основанием и его водные растворы имеют щелочную реакцию, а изомер [Pt(NH3)4(OH)2]SO4 принадлежит уже к солеобразным комплексам, водные растворы его имеют нейтральную реакцию (pH = 7).
19.5. ПРИРОДА ХИМИЧЕСКОЙ СВЯЗИ В КОМПЛЕКСНЫХ СОЕДИНЕНИЯХ
Теоретические представления о природе сил комплексообразования возникли из попыток дать объяснение химическому взаимодействию устойчивых молекул с ионами и атомами различных элементов. Одновременно шли поиски ответов на вопрос о причинах заметной неспецифичности таких взаимодействий, в результате которых с комплексообразователем оказываются прочно связанными различные по своему характеру ионы и молекулы. Химические связи в комплексных соединениях отличаются большим разнообразием, порождаемым сочетанием ковалентных связей различной полярности и степени делокализации электронных пар.
Было предложено много различных теорий координационной связи, значительная часть которых уже стала достоянием истории. В настоящем разделе рассматриваются основы только двух теорий: теории валентных связей (локализованных пар электронов) и теории кристаллического поля.
Теория валентных связей. Теория валентных связей была первой приближенной квантово-механической теорией, использованной для объяснения природы химических связей в комплексных соединениях. В основе ее применения лежала идея о донорно-акцепторном механизме образования ковалентной связи между комплексообразователем и лигандом.
Процесс образования ковалентных связей между комплексооб-разователем и лигандами с позиции теории валентных связей рассматривают следующим образом.
У комплексообразователя перед гибридизацией изменяется энергия отдельных АО, вакантные АО приобретают большую энергию, а энергия заселенных электронами d-AO понижается и в гибридизации эти орбитали не участвуют. Затем перед взаимодействием с лигандами происходит гибридизация вакантных АО, появление ор-италей одной энергии. Вакантные гибридные орбитали, число которых соответствует координационному числу комплексообразова-теля, располагаются вокруг последнего таким образом, чтобы за
375
нявшие их электронные пары лигандов находились как можно дальше друг от друга. Каждому виду гибридизации отвечает своя структура комплекса.
Допускают, что в отдельных случаях неспаренные электроны комплексообразователя могут объединяться в пары, освобождая АО для электронных пар лигандов. Гибридные орбитали комплексообразователя перекрываются с орбиталями лигандов, содержащими электронную пару. Пара электронов, принадлежащая до образования связи лиганду, начинает двигаться в поле двух ядер, перенося на акцептор-комплексообразователь избыточный отрицательный заряд.
Таким образом, координационная связь является обычной двухэлектронной ковалентной О-связью с большей, может быть, полярностью (см. раздел 5.4).
Однако на комплексообразователе, несмотря на акцептирование им электронных пар лигандов, практически никогда не появляется отрицательный заряд, электронные пары распределяются по всем химическим связям внутренней сферы. Их распределению способствует образование .U-связей при переносе электронов с d-AO комплексообразователя на вакантные p-АО или Л*-МО лиганда, либо на вакантную d-AO лиганда.
Перемещение электронов от комплексообразователя к лигандам увеличивает положительный заряд и акцепторную способность комплексообразователя, усиливает прочность О -связи М—L.
Структуру комплексных ионов и молекул определяют по виду гибридизации АО комплексообразователя (см. табл. 12, раздел 5.3).
Ниже приведены примеры предсказания структур некоторых комплексов с позиций метода валентных связей.
Структура аниона [AgCCNJj]~. Электронная конфигурация комплексообразователя иона Ag4: [Kr]4d. Заселенная 4d -АО в гибридизации не участвует. Гибридизации подвергаются одна 5s- и одна 5р-АО. Такой гибридизации отвечает линейная структура аниона. Образовавшиеся две sp-гибридные орбитали одинаковой энергии заселяются электронными парами атомов углерода анионов (*- :C~N:) Так как все электроны образуют пары, то линейный анион [Ag(CN)j]~ является диамагнитным. Изменение электронного состояния атома Ag° при образовании аниона [Ag(CN>2]~ можно передать схемой, приведенной на рис. 78.
Структура катиона [NUNHaH] . Основное состояние комплексро^-разователя иона Nr4: [Аг]3(Г4$°. В соответствии с числом лигандов произойдет sp -гибридизация вакантных АО иона Ni24. Этому виду гибридизации отвечает тетраэдрическая структура парамагнитного катиона [NUNHjM. Электронные пары атомов азота молекул аммиака хотя и заселяют четыре гибридные орбитали иона никеля, вытянутых к вершинам тетраэдра, но смещены к Ni24 незначительно (рис. 78).
Аналогичным образом можно предсказать тетраэдрические структуры диамагнитного катиона [ZrUNHsh]24, парамагнитного аниона [МпСЦ]2-.
Структура аниона [Ni(CN>4]2—. В тетрацианоникколатном (II) анионе в отличие от катиона тетраамминникеля (II) перед гибридизацией происходит спаривание двух d-электронов комплексообразователя. Анион оказывается диамагнитным. Энергия вакантной 3d-AO становится равной энергиям вакантных 4s- и 4р-АО.
Поэтому и гибридизация будет иной — dsp1, которой отвечает квадратная структура аниона (рис. 78).
Метод валентных связей не объясняет, почему катион [Ni (NHah)2 4 является тетраэдрическим, парамагнитным, а не плоским, квадратным, диамагнитным, как анион [Ni(CN)4]2~.
376
[Ag(CN)2r
Ag°
|Kr]5s’4d)0
5P° | i i I__^Ag+ 5s°
5f’EI
Рис. 78. Гибридизация атомных орбиталей при образовании комплексных ионов Ag(I) и Ni(II)
Структура катиона [Со(МНз)в]3+. Комплексообраз^ватель Со (Ш) в основном состоянии имеет электронную конфигурацию: [Ar]3o ’4s . У иона Со (III) в этом комплексном катионе происходит, как показывает изучение магнитных свойств, объединение неспареиных электронов в пйры с освобождением двух d-AO, энергия
Рис- 79. Гибридизация атомных орбиталей при образовании комплексных ионов
Со (III) 4
377
которых становится равной энергиям 4s- и 4р-АО. Последующая spV-гибридизация отвечает октаэдрической структуре катиона (рис. 79).
Структура аниона [CoFe]3. В этом анионе не происходит объединение неспаренных электронов комплексообразователя, анион является парамагнитным (рис. 79).
К участию в гибридизации в таких случаях привлекают 4J-AO, орбитали более высокой энергии. Комплексы, в которых в образовании химических связей участвуют вместе с ns- и пр-АО вакантные nd-AO, называют внешнеорбитальными. Комплексы, в которых в гибридизации АО участвуют вместе с ns- и пр-АО вакантные (n-l)d-AO, называют внутриорбитальными комплексами.
Квантово-механические расчеты не подтверждают участие в образовании химических связей в комплексах d-AO высокой энергии. К сожалению, при всей своей простоте и наглядности теория валентных связей не всегда может объяснить пространственное строение комплексов и их магнитные свойства. В частности, теория валентных связей не объясняет причин, вызывающих спаривание электронов в ионах [Ni(CN)4r и [Со(МНз)б] , не дает она и разъяснений по поводу причин неучастия в гибридизации заселенных электронами (и - DJ-AO.
Теория кристаллического поля. Теория кристаллического поля была предложена в 1929 г. для объяснения влияния на энергию ионов J-элементов в кристаллах их окружения, ионов других элементов, создающих кристаллическое или, иначе, электростатическое поле. В 1950 г. эта теория была применена к комплексным соединениям. Основные положения теории кристаллического поля сводятся к следующему:
— химическая связь М—L во внутренней сфере комплекса является либо ионной (как в ионе [СоС14Г ), либо ион-дипольной (как в ионе [А1(Н2О)б] );
— лиганды располагаются вокруг комплексообразователя в вершинах правильных многогранников (полиэдров) в виде точечных, неподвижно закрепленных зарядов; реальный объем лигандов, их структура и электронная конфигурация во внимание не принимаются;
— лиганды, как точечные отрицательные заряды, создают вокруг комплексообразователя электростатическое поле, в котором (/-подуровни энергии комплексообразователя расщепляются, их энергия изменяется, р-подуровни энергии расщеплению не подвергаются;
— энергия новых подуровней, их число и взаимное расположение зависят от симметрии полиэдра, от симметрии расположения лигандов (октаэдрическое, тетраэдрическое и т. д., рис. 80).
Таким образом, теория кристаллического поля была простейшей моделью химических связей в комплексах и не имела поэтому серьезной физической ценности. Этой теорией не учитывалось истинное состояние лигандов и все многообразие химических связей. Однако простота этой теории и ее пригодность для объяснения магнитных и оптических свойств комплексов предоставили ей прочное место среди теорий координационной химии.
378
^XZ’ dyz
Рис. 80. Расщепление d-AO в различных электростатических полях лигандов
Рис. 81. Октаэдрическое поле лигандов:
а — расположение d2- и dx2 — у2-АО; б — расположение d^-AO комплексообразователя
Ниже рассматривается влияние на энергию электронов, находящихся на d-AO только октаэдрического электростатического поля лигандов.
При октаэдрическом расположении лигандов d-AO комплексообразователя попадают в неравноценное положение. Атомные орбитали dz2 и dx2 - у2, вытянутые вдоль осей координат, ближе всего подходят к лигандам и подвергаются сильному воздействию электростатического поля этих лигандов (рис. 81, а). Поэтому между электронами, заселяющими эти АО, и отрицательным^ зарядами лигандов возникают значительные силы отталкивания, приводящие к увеличению энергии dz2- и dx2-y2-AO. Взаимодействие между dz2-, dx2 - у2-АО и близко расположенными к ним лигандами можно представить в виде сильно сжатой пружины.
Другие три d-AO (dxy, dxz и dyz), расположенные между осями координат, между лигандами, в меньшей степени подвергаются воздействию последних, поэтому энергия dxy-, dxz- и dyZ-AO понижается (рис. 81, б).
Таким образом, пятикратно вырожденные d-AO комплексообразователя, расположенного в октаэдрическом поле лигандов, подвергаются расщеплению на две группы новых орбиталей: на группу трехкратно вырожденных (см. раздел 3.6) орбиталей с более низкой энергией (.dxy, dxz и dyz), получивших обозначение d£ или tig, и группу двукратно вырожденных орбиталей с более высокой энергией (dz2 и dx - у2), получивших обозначение dy или eg.
Разность энергий новых подуровней Ei - Ei = А 0 называют п а-раметром расщепления (рис. 82).
Расположение двух новых энергетических подуровней Ei(dy) и Е\ (de) по отношению к исходному подуровню Ео неодинаково: Е1 1~ - Eq>Eq-Ei (рис. 82).
380
Рис. 82. Расщепление d-AO в октаэдрическом поле лигандов: До — параметр расщепления
Квантово-механическая теория требует, чтобы при полном заполнении электронами новых энергетических подуровней общая энергия комплексообразователя осталась без изменений
|Ло (4) — jAo (6)=0.
Размещение каждого электрона (из шести возможных) на de-орбитали вызывает уменьшение энергии на величину, равную /5А0. Наоборот, размещение каждого электрона (из четырех возможных) на dy-орбитали вызывает увеличение энергии на величину, равную 3/5Ао- Когда шесть электронов с исходной d-AO размещаются на de-орбитали, то выделяется энергия, равная - 6(/5А0) = = - 12/5Ао, комплекс становится более стабильным.
Выигрыш энергии за счет преимущественного заселения электронами de-орбитали называют энергией стабилизации комплекса полем лигандов.
Параметр расщепления А измеряют, как правило, в волновых числах V, см-1. Так как то A=6v=A^ = hcv или 1 см * 12 Дж/моль. Чем сильнее октаэдрическое поле лигандов, тем больше размер Ао. Большинство экспериментальных значений А различных комплексов лежит в области от 5000 до 35 000 см 1 или От 60 до 420 кДж/моль.
Значение А зависит от природы и степени окисления комплексообразователя, природы лигандов. С увеличением степени окисле-Ния комплексообразователя А возрастает. Например, у ионов [Мп (Н2О)6]2+ и [Ре+п(НгО)б]2+ значения Ао равны соответст-гпНН1? 7800 и 10 400 см-1, а у ионов [Мп+Ш(Н2О)б]3+ и ice (Н2О)б]3+ значение Ао возрастает до 21 000 и 13 700 см-1 соответственно. При увеличении заряда ядра комплексообразователя параметр расщепления также возрастает. Так, у катионов l27Co(NH3)6] , [45Rh(NH3)6]3+H [771г(МНз)б]3+значение Ао равно соответственно 22 900, 34 100 и 41 000 см-1.
381
Зависимость Л от природы лигандов более разнообразна. В результате изучения многочисленных комплексов было установлено, что по способности увеличивать параметр расщепления металлов-комплексообразователей, находящихся в обычных состояниях окисления [Fe (II), Со (II), Мп (II) и т. д. ], лиганды можно расположить в следующий спектрохимический ряд, вдоль которого, слева направо, размер До монотонно возрастает:
Г < Вг” < СГ^ SCN~ < NO3 < F" < ОН" < Н2О < NCS' < Н~ < NH3 <
< NO2 < СК ~ СО
(подчеркнут атом, непосредственно связанный с комплексообразо-вателем). Такие лиганды, как NO2, CN” и СО, создают наиболее сильное электростатическое поле вокруг комплексообразователя и тем самым вызывают сильное расщепление d-AO.
Магнитные свойства октаэдрических комплексов связаны с характером размещения электронов на dy- и de-орбиталях. Если исходные d-AO содержат I, 2, 3 или 8, 9, 10 электронов, то заселение ими dy— и de-орбиталей возможно только одним способом:
ei
-ОО~ -ОО -ОО -GXD- -CgXD- 4SXg>
d‘ d2 d’ d*dj dfd^ d^d*
Заселение орбиталей электронами происходит в соответствии с принципом минимума энергий, правилами Паули и Гунда.
Если комплексообразователи имеют электронную конфигурацию d4, d5, а или d", то уже появляются две возможности заселения электронами новых орбиталей. Например, для d4 nd6:
Электронные конфигурации dy- и de-орбиталей с максимально возможным числом неспаренных электронов (didy, d£ и dy и ДР-> получили название высокоспиновых конфигурации
382
высокоспиновых состояний электронов. Минимальное число неспаренных электронов на de- и dy-орбиталях называют низко-с п иновой или спин-спаренной конфигурацией.
Диамагнитным комплексам отвечают электронные конфигурации de и cfc d$. Теория кристаллического поля следующим образом объясняет возможность образования двух электронных конфигураций для одного и того же числа d-электронов комплексообразователя.
В случае слабого поля лигандов параметр расщепления является небольшой величиной и различие в энергиях dy- и de-орбйталей ДЕ = Ег ~ Е1 = А будет минимальным, мало отличающимся от исходного энергетического уровня. Поэтому электроны из-за межэлектронного отталкивания будут распределяться по dy- и de-орбиталям с максимально возможным полным спиновым числом S = При этом достигается понижение энергии межэлектронного Отталкивания в большей степени, чем незначительный выигрыш энергии при размещении всех электронов на de-орбитали.
Следует отметить, что спаривание электронов — энергетически невыгодный процесс.
На примере распределения пяти электронов между de- и dy-орбиталями выясним условия появления высокоспиновой и низкоспиновой конфигураций:
Для конфигурации (& dy полная энергия пяти электронов будет равна:
Е = ЗЕ1 + (2£1 + 2До) = 5Е\ (de) + 2До-
Для конфигурации df полная энергия пяти электронов равна:
Е = ЗЕ1 + (2£1 + 2£сп) = 5£] (de) + 2ЕСп,
где ЕСГ| — энергия спаривания электронов, равная, примерно, ‘О ООО см *. Из соотношения следует, что при Есп > До будет реализована высокоспиновая конфигурация как более энергетически выгодная.
Для сильного поля лигандов параметр расщепления уже будет значительно больше энергии спаривания электронов, До > Есп. Поэтому электроны разместятся на de-орбитали в соответствии с принципом минимума энергии.
383
Рис. 83. Распределение электронов по энергетическим подуровням в высокоспиновом (й) и низкоспиновом
(6) комплексах кобальта (ПО
На рис. 83 приведена схема_энергетическйх уровней в гексафто-рокобальтатном анионе [СоРб г и катионе гексаамминкобальта (III) [Со(МНз)бг . Лиганды F- по сравнению с молекулами NH3 создают слабое электростатическое поле вокруг Со (III). Поэтому обмен электронами между dy- и de-орбиталями не вызывает затруднений, анион [CoFe ]3 является высокоспиновым, парамагнитным, так как До < £сп- Лиганды NH3 вызывают более значительное расщепление d-AO, До > £сп- Поэтому катион [Со(МНз)б ]3+ является диамагнитным, низкоспиновым.
Теория кристаллического поля позволяет объяснить появление окраски у кристаллов комплексов и их растворов. Если пропускать через раствор или кристаллы комплекса свет с изменяющейся длиной волны и регистрировать при этом интенсивность поглощения света (рис. 84), то можно получить кривую зависимости внутренней оптической плотности от длины волны светового потока:
Z) = lg/0/7 = £cBZ = /d),
где 1о и / — интенсивности падающего и прошедшего светового потока; £ — молярный показатель поглощения, л«моль-1,см , св малярная концентрация раствора, через который проходит световой поток, моль/л; / — ширина кюветы, см.
Фотоны проходящего через раствор света взаимодействуют с комплексами, точнее — с электронами комплексообразователя, находящимися на низших энергетических уровнях, передают им свою энергию, заставляя электроны переходить на более высокий энер' гетический уровень, например с de- на dy-орбиталь. Поэтому часть
384
Рис. 84. Схема установки для получения оптических спектров <а) и спектр поглощения (6):
I — источник света с переменной длиной волны; 2 — кювета с раствором комплекса; 3 — фотоэлемент; 4 — потенциометр, записывающий спектр поглощения; D — внутренняя оптическая плотность
энергии светового потока, проходящего через раствор, поглощается, а оставшаяся часть энергии вызывает появление дополнительного цвета (табл. 22).
Таблица 22. Соотношение дополнительного и поглощенного цвета
Поглощенная часть спектра, нм
Зеленовато-жел- Желтая Оранжевая Пурпурная Красная
тая
495-575 575—590 590—625 625—650 650—760
Окраска раствора = Дополнительный цвет, нм
Фиолетовая Синяя Голубая Зеленая Сине-зеленая
400—440 440—460 460—495 495—580 490-520
Например, фотоны, проходя через раствор, содержащий катионы [Ti(H2O)6r, вызывают переход электрона комплексообразователя, иона Ti (III) с de- на dy-орбиталь и при этом теряют энергию, равную До (рис. 85, а). В спектре поглощения водных
13.
1258
385
J Рис. 85. Энергетический переход у комплексообразователя Т1(Ш) в ионе [TUHjOej при поглощении квантов энергии видимого света (а) и полоса поглощения в видимой части спектра (б)
3+ растворов, содержащих ионы [TifHzOjfi] , проявляется полоса поглощения с максимумом при 20 300 см или около 500 нм (рис. 85, б). Поглощается зеленовато-желтая часть спектра и раствор приобретает фиолетовую окраску, являющуюся дополнительным цветом.
Если электронная конфигурация комплексообразователя Sc (III) а или Zn (II) d , то раствор, содержащий такие ионы, будет бесцветным. Свет проходит через раствор без поглощения, так как при расщеплении, например, 3d -АО комплексообразователя переходы электронов между dE- и dy-уровнями энергии невозможны из-за их полной заселенности.
Избирательность поглощения света зависит не только от комплексообразователя, но и от природы лигандов. При замене во внутренней сфере лигандов, находящихся в левой части спектрохимического ряда, на лиганды, создающие сильное электростатическое поле, увеличивается доля энергии, поглощаемой электронами комплексообразователя из проходящего света и, как следствие, уменьшается длина волны, соответствующей полосы поглощения и yeej личивается интенсивность окраски или ее изменение. Так, водный раствор, содержащий катионы [Си (НгО) 4] , окрашен в светло-голубой цвет, а содержащий катионы [Си(Ь1Нз)4] , — в интенсивно синий цвет.
Различные типы расщепления d-AO в зависимости от расположения лигандов вокруг комплексообразователя приведены на рис, 80.
386
19.6. ИОННЫЕ РАВНОВЕСИЯ В РАСТВОРАХ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ
В своих растворах комплексы могут подвергаться самым различным превращениям, определяемым их природой, природой растворителя и внешними условиями: электролитической диссоциации на комплексные и внешнесферные ионы, реакциям замещения одних лигандов на другие, реакциям протолиза, окислительно-восстановительным реакциям и т. д. (см. разделы 33.3 и 33.4).
Комплексы, как и другие соединения, можно условно разделить на три группы: электролиты, неэлектролиты и слабые электролиты. К неэлектролитам принадлежат комплексы, состоящие из одной внутренней сферы (карбонилы металлов, JT-комплексы, хелаты, циклические комплексы).
При растворении в воде комплексов с внешнесферными ионами прежде всего происходит их полная электролитическая диссоциация на внешнесферные и комплексные ионы, например:
Кз [Fe(CN)6 ]» ЗК+ + [Fe(CN)6 ]3"
Комплексные ионы уже принадлежат в большинстве случаев к категории слабых электролитов (для водных растворов), в которых они подвергаются обратимой электролитической диссоциации постепенно, ступенчато замещая свои лиганды на молекулы воды:
[Cu(NH3)4]2+ + Н2О [Cu(H2O)(NH3)3]2+ + NH3 [Cu(H2O)(NH3)3]2+ + Н2О =• [Cu(H2O)2(NH3)2]2+ + NH3
В упрощенной схеме (опуская молекулы растворителя и заряды частиц) ступенчатая электролитическая диссоциация комплексного иона [ML« ] (заряд не указан) может быть представлена в виде ряда равновесий:
[ML„]= [MLn-i]tL
ГМЬ,г-1 I. zz=- [ML«-2] + L
[MLn-г]^^ [MLn-3] + L и т. д.
С разбавлением раствора из внутренней сферы удаляется все большее число лигандов и в предельном случае в растворе остаются только ионы комплексообразователя и лиганды.
Аналогично протекают и реакции комплексообразования. По мере увеличения концентрации лигандов в растворе происходит постепенное их увеличение и во внутренней сфере:
M + L.T— [ML]; [ML] + L^=t [ML2]
[ML2] + Lj=: [ML3]; ... [MLft-i ] + L [MLn]
Процесс комплексообразования заканчивается, как только число присоединившихся монодентатных лигандов станет равным координационному числу п комплексообразователя.
L-остояние равновесия для каждой ступени реакции комплексо-
13*
387
образования можно охарактеризовать в соответствии с законом действующих масс ступенчатой константой образования комплекса (К/):
1 IM] [L]
tML2]
Z [ML] [L]
и т. д.
и для n-й ступени
„ - tML,]
" [ML„ —i][L]
Применяется и другой способ количественного описания равновесий в реакциях комплексообразования:
M + L==tMLl;
М + 2L i==? [ML2]; в2 —И т. д.
[M][L]2
В общем случае
M + nLr— [МЫ; = (MJ [L]
Константа называется обшей константой образования.
Ступенчатые константы Kt и общие константы образования /?„, как и любые другие константы равновесия, являются только функциями температуры и для разбавленных растворов от концентраций взаимодействующих частиц не зависят.
Нетрудно заметить, что значение связано со ступенчатыми константами соотношением
i = п
Р„~К1К2Кз...Кп = П Ki, i = 1
где П — знак произведения. При i-1, как это следует из приведенных выше равновесий для первой ступени, /?i = Ki.
Чем больше значение для данного координационного числа одного и того же комплексообразователя при постоянной степени его окисления, тем более устойчивым является комплексный ион. Например, для [Ag(NH3>2]+ и [Ag(CN)2] значения/? 2 соответст^ венно равны 2,5*10° и 1,2* 1021 (25 °C). Ясно, что ион [Ag(CN)2] более устойчив, чем его аммиачный аналог. Поэтому при добавлении к водному раствору, содержащему катионы [Ag(NH3>2] , цианид-ионов CN будет протекать реакцияЗамещения во внутренней сфере молекул NH3 на цианид-ионы CN-:
[Ag(NH3)2]+ + 2CN~^=r [Ag(CN)2Г + 2NH3
Ступенчатые константы образования дают нам ориентировочное представление о склонности комплексообразователя к последователь'
388
ному присоединению лигандов. Например, после присоединения бромид-иона к катиону [Си(НгО)4 ]2+ с образованием иона [Си(Н2О)зВг]+ положительный заряд комплексного иона_ уменьшается. Второй ион Вг будет уже взаимодействовать с ионом [Си(НгО)зВг]+ слабее, при этом в растворе появляются молекулы [Си(Н2О)2Вг2]°. Поэтому Значения Ki и Кг сильно различаются и равны соответственно 4,5* 1(Г и 37 л/моль. Присоединение третьего иона Вг- с образованием иона
Рис. 86. Схематическое распределение комплексных ионов в растворе в зависимости от концентрации лигандов:
1 — [Ml; 2 — [ML]; 3 — [ML2]; 4 — [МЬз1; 5 — [ML4]
[Си(НгО)Вгз ] возможно, но еще более затруднено: Кз - 4,5 г/моль.
Последовательное взаимодействие полярных молекул NH3 с ионом [Си(НгО)4Г+ не приводит к столь резкому изменению значения Ki, так как размер заряда иона сохраняется: Ki = 1,4«104; ^2 = 3,2«1О3; А'з = 7,7«102 л/моль. Уменьшение значения Ki в этом
случае вызвано постепенным увеличением размеров комплексного иона и изменениями конфигурации внутренней сферы.
Доля того или иного комплексного иона в растворе (а„) опре-
деляется отношением а„ - где [MLn] — равновесная концен-см
трация иона, а См — сумма равновесных концентраций всех ком-плексных ионов, включая и свободные ионы комплексообразователя:
см = [МТ+ [ML] + [ML2] + ... + [ML,,]
На рис. 86 представлена зависимость величины а„ от равновесной концентрации лигандов в растворе. Из рис. 86 видно, что по мере увеличения концентрации лиганда в растворе одна комплексная частица сменяет другую. Доля промежуточных комплексов не всегда Достигает единицы и проходит через максимум. При достаточно высокой концентрации лиганда в растворе остается одна комплексная частица [ML«], состав которой отвечает максимально возможному координационному числу для данного комплексообразователя при Данной температуре.
Хелатный эффект. Хелатным эффектом называют повышение Устойчивости комплексов за счет образования полидентатными лигандами в его внутренней сфере циклов. Например, для lo<i(NH3)6]z и [Ni(en)3j значения 6 (25 °C) равны соответственно 8,6 и 18,3. Бидентатный лиганд этилендиамин еп образует ^комплексе три пятичленных цикла. В реакции замещения ли-
[Ni(NH3)6 ]2+ + Зеп =—♦ [Ni(en)3 ]2+ + 6NH3
389
изменение энтальпии и энтропии равны соответственно -12 и TAS = + 55 кДж. Значительное увеличение энтропии вызвано увеличением числа частиц в растворе.
Данные, полученные для большинства реакций комплексообразования, показывают, что хелатный эффект вызван увеличением энтропии, но в ряде случаев он обусловлен и уменьшением энтальпии.
По мере увеличения размеров цикла хелатный эффект снижается. При больших размерах цикла очень трудно его замкнуть на один и тот же комплексообразователь, возрастает вероятность образования многоядерных комплексов. Хелатный эффект обнаружен почти у всех металлов-комплексообразователей.
Реакции замещения лигандов. В реакциях комплексообразования, протекающих в растворе:
КР + п I?2 [Mb Р " Ю2
+
никогда не участвуют простые катионы металлов MV1 . В зависимости от вида растворителя и концентрации раствора они находятся либо в виде сольватов, либо в виде акваионов, либо в виде гидроксоак-вакомплексов. При появлении в водном растворе, содержащем ак-вакатионы, других ионов или молекул, способных к взаимодействию с комплексообразователем, происходит либо их включение во внутреннюю сферу комплекса с изменением координационного числа, либо замещение ими части или всех лигандов:
[Cu(H2O)4 ]2+ + 4NH3 [Cu(NH3)4 ]2+ + 4Н2О [А1(Н2О)з(ОН)з 1° + ЗОН" — [АКОЮб]3- + ЗН2О
Эти реакции и получили название реакций замещения лигандов.
Естественно, что полное замещение одних лигандов другими происходит только при большом избытке замещающих частиц и образовании ими более прочных химических связей с комплексообразователем.
В реакциях замещения лигандов у комплексов с квадратной или октаэдрической структурой Черняев обнаружил интересное явление.
Черняев Илья Ильич (1893—1966) — академик, основные труды которого посвящены химии комплексных соединений семейства платиновых элементов. Лауреат Государственных премии. Оказалось, что лиганды, находящиеся в транс-положении, оказывают друг на друга больше влияния по вступлению в реакции замещения лигандов, чем лиганды, расположенные рядом, в цнс-положении.
Например, такой лиганд, как С1 , в квадратном комплексе Pt(II) в большей степени дестабилизирует положение лиганда, расположенного по диагонали, чем лиганда, находящегося в цнс-положении:
Cl<—-X^-NH3
+ NH*
390
В результате такой дестабилизации молекула NH3*, находящаяся в щрамс-положении к атому хлора, легче замещается хлорид-ионом, чем соседняя молекула NH3. Оставшиеся молекулы NH3 замещению хлорид-ионами уже не подвергаются.
По той же причине при нагревании кристаллов [Pt(NH3)3NO2]<NO2> образуется только транс-динитродиаммин-лдатина:
J<NH, t _
/Pt< N02 - ~
+ NH3
Если пропускать аммиак в водный раствор Кг [РЮЦ], то вначале происходит замещение любого лиганда во внутренней сфере [PtC14J, но затем уже проявляется транс-влияние. Лиганд С1* имеет более сильное транс-влияние, чем лиганд NH3, и поэтому его замещение на молекулу аммиака маловероятно. Следовательно, в этой реакции можно получить только чнс-изомер:
2-
+ NH3
Cl'xp.z'NHs р|—
СГ --ci + С
— о
аХ™3] *NHj = [£1хЖ] •сг
Таким образом, транс-влияние можно определить как увеличение подвижности лиганда, находящегося в транс-положении к другому лиганду.
Лиганды по величине производимого ими транс-влияния в квадратных комплексах Pt(II) располагают в ряд, получивший название ряда лигандов по тран с-в л и я н и ю:
СО ~ CN- > NO2 ~ Г > Вг- > СГ > NH3 > ОН" > Н2О
В левой части ряда находятся лиганды, оказывающие наибольшее wpaHc-влияние. К ним принадлежат либо лиганды с большими размерами, либо лиганды с кратными связями (СО, CN-, NO2).
Для каждого комплексообразователя в определенной степени окисления существует свой ряд лигандов по транс-влиянию. Однако порядок расположения лигандов в ряду за некоторым исключением почти такой же, как и для платины (II).
Явление транс-влияния обнаружено в реакциях стереоспецифического замещения только в плоскоквадратных и октаэдрических комплексах с такими комплексообразователями, как Pt(II, IV), F /тт’ Rh(III)’ Co(III), Cd(II), Hg(II), Mo(VI), W(VI), е<Ш) и некоторыми другими.
ТГ±,Р°бнее см" ^УкУЧ1кин Ю. Н„ Бобоходжаев Р. П. Закономерность whc-вдияния и. И. Черняева. — М.: Наука, 1977.
391
19.7. ПРИМЕНЕНИЕ
Комплексные соединения широко используют в различных отраслях промышленности для синтеза, выделения, разделения и очистки веществ. Они являются реагентами в аналитической химии для избирательного определения одних элементов в присутствии большого числа других. Комплексы d-элементов катализируют самые различные реакции: окисления олефинов, получения уксусной кислоты из метанола, гидрирование этилена, полимеризации, образования эфиров.
Комплексные соединения необходимы для таких электрохимических производств, как получение алюминия, золочение, серебрение, хромирование, никелирование, лужение, омеднение. В основе обработки фотоматериалов лежит процесс комплексообразования.
Большую роль играют комплексные соединения в биохимических процессах в медицине. Такие вещества, как хлорофил, гемоглобин, витамин В12, являются комплексными соединениями магния, железа и кобальта.
Подробнее см.: Кукушкин Ю. Н. Химия координационных соединений. — М.: Высшая школа, 1985. С. 420; Кукушкин Ю. Н. Реакционная способность координационных соединений. — Л.: Химия, 1987.
19.8. ТОКСИКОЛОГИЯ .
Среди всех типов комплексных соединений наибольшей токсичностью обладают карбонилы металлов и катионгалогены. Газообразные карбонилы металлов, особенно карбонилы никеля и железа, вызывают воспаление и отек легких независимо от пути поступления в организм. Больше всего при отравлении страдает центральная нервная система. Катионгалогены уже в небольших концентрациях вызывают раздражение глаз, верхних дыхательных путей, воспаление легких. Гидридные комплексы при соприкосновении с кислотами выделяют очень токсичные газы, а во влажном воздухе могут воспламеняться.
Упражнения к главе 19
1. Чем вызван хелатный эффект?
2. Как изменяется значение параметра расщепления с увеличением степени окисления и заряда ядра комплексообразователя?
3. Есть ли различие между понятиями «комплексообразователь» и «центральный атом»?
4. Сколько геометрических изомеров имеют тетраэдрически построенные комплексы?
5. Определите состав карбонилов хрома и марганца, используя правило Сиджвика.
6. Какие комплексы называют кластерами?
7. Могут ли быть комплексообразователями отрицательно заряженные ионы, молекулы или даже трехатомные анионы?
8. К водному раствору, содержащему аквакатиои железа
392
(Ill) м фторидный анион, добавили тиоцианат калия. Какие 'еакции комплексообразования будут протекать в растворе? Р 9. В чем заключается явление транс-влияния? Приведите
примеры.
10. Как объясняет теория кристаллического поля появление фиолетовой окраски у водного раствора, содержащего катионы ГТ|(НгО)б] *? ,2 +
Ц. Какой будет структура ионов [Zn(NH3)4] и [MnCl4 12~ ?
1J. Какие координационные числа чаще всего имеют Со(1П)< Сг(Ш) и PI(IV) в своих комплексах?
13. К водному раствору хлорида гексаамминмарганца (II) добавили соляную кислоту. Изменится ли после добавления кислоты состав комплекса?
14. Являются ли изомерами комплексы [Co(NH3)5Br]SO4 и [Co(NH3)5SO4]Br?
15. Сколько изомеров будет иметь дихлородиамминплатина
(II) и к какому виду их следует отнести?
16. Какие продукты образуются в результате термического разложения Cs[l(BrCI)], Rb[IBr2] и K[lCI4J?
17. Комплексы с каким координационным числом и структурой образуют соединения Си(1) и 1( +1)?
18. На водный раствор, содержащий ионы Fe'"[Fel'(CN)6 и Fe,,[Fe*"(CN)6] , подействовали КОН. Изменится ли после растворения состав раствора?
ГЛАВА 20. ХИМИЯ ЭЛЕМЕНТОВ 1Б-ГРУППЫ
Медь, серебро и золото, образующие 1Б-груПпу периодической системы, имеют общую электронную конфигурацию невозбужденных атомов: (n-l)d ns* (валентные электроны). Являясь девятыми по счету d-элементами соответственно четвертого, пятого и шестого периодов, они вместо ожидаемых девяти внешних d-электронов имеют на один больше в связи с энергетической выгодностью полностью заполненного (и-1) d-подуровня. Общей степенью окисления элементов 1Б-группы является (I), связанная с потерей одного s-электрона. Однако устойчива эта степень окисления только у серебра (Ag2O, AgNOa, AgCl) за счет особой прочности 4d -конфигурации, сформировавшейся еще у предшественника серебра по периодической таблице — палладия Pd, элемента VIIIB-группы: [Kr]5s°4d10. Конфигурации 3d10 (у Си) и 5d10 (у Au) в гораздо большей степени подвержены возбуждению и распариванию d-электронов, в связи с этим У меди появляется устойчивая степень окисления (II) (CuO, CuSC>4, '“U(OH)2), ay золота, где сказывается дополнительное отталкивающее электронов 4/ -экрана, степень окисления (III): АиС1з, (АиСЦ ]. в степени окисления (II) атомы имеют один неспаренный электрон на d-AO, и поэтому соединения с этой степенью окисления •называются, как правило, парамагнитными и окрашенными.
393
Медь и серебро можно окислить до Си (III) и Си (IV), Ag(II) и Ag(III), а золото — до Au(V). Известны, например, комплексы (ХегРн) [AuFe], Cs2[CuF6], K[AgF4] (см. раздел 20.7).
В соединениях с кислородом и галогенами у элементов 1Б-группы ковалентный характер связи проявляется гораздо отчетливее, чем у элементов LA-группы; тем более это заметно в комплексных соединениях. Для степени окисления (I) характерна хр-гибридизацня АО с линейной структурой комплексов: [Ag(NH3)2] , [Au(CN)2]~. Медь со степенью окисления (II) может образовывать два основных вида координационных многогранников: тетраэдр, (sp-гибридизация), например [СиВг4]2 , [CuChj , [Cu(OH)4]Z , и тригондльную бипирамиду (хр’тЛгибридизация), например [СиСЬг и [Cu(NH3)2(NCS)3]~.
У Cu(II), имеющей электронную конфигурацию а , в ряде случаев наблюдается значительное удаление лигандов от комплексообразователя в аксиальном направлении (вдоль оси z), приводящее к превращению октаэдрического комплекса в плоскоквадратный. Например, катион (Си(ЫНз)4(Н2О)2) не является октаэдрическим. Молекулы воды хотя и занимают две октаэдрические позиции выше и ниже плоскости квадрата, но межатомные расстояния Си—ОНг, равные 259 и 337 пм, много больше, чем длины четырех связей Си—NH3 (205 нм). Поэтому структура комплекса — плоскоквадратная и состав его [Си(1ЧНз)4Г (молекулы воды в таких случаях во внутреннюю сферу не включаются).
Для степени окисления (III) характерны dsp- и sp3(^-гибридизации, что^ает плоскоквадратное расположение лигандов [AuCU Г, [Au(CN)4] , [Au(OH)4] и октаэдрическое [AuBr^]3 , [СиРбГ -
Изменение кислотно-основных свойств оксидов и гидроксидов элементов 1Б-группы подчиняется общему правилу: с ростом степени окисления кислотный характер возрастает, а при движении-по группе сверху вниз уменьшается. Так, кислотный характер амфотерных СигО и Ag2O у первого оксида выражен очень слабо, а у второго — практически не проявляется, поэтому их часто относят к основным оксидам. Кислотный характер у СиО и Си (ОН) 2 Уже вполне отчетлив, хотя и не превалирует над основным; в оксиде золота (III) АигОз и гидроксиде АиО(ОН) кислотные свойства выражены наиболее отчетливо, последнее соединение носит даже название «золотой кислоты» за ее способность образовывать комплексные анионы — гидроксоаураты (III) [Au(ОН)4]“.
Характерно, что в степени окисления (I) ни один из элементов 1Б-группы не образует аквакатионов, а известные для них простые соли, как правило, малорастворимы: CuCi, Cui, CuCN, AgCI, Agl-
20.1. РАСПРОСТРАНЕННОСТЬ В ПРИРОДЕ. ОСНОВНЫЕ МИНЕРАЛЫ
Наибольшей распространенностью среди других элементов 1Б" группы выделяется медь (1«10-2%). Скромнее представлены на Земле серебро (1*10 5%) и золото (5*10 '%). Все они хотя и редк°>
394
но встречаются в природе в виде простых веществ: найденные самородки меди имеют максимальную массу несколько сотен килограммов, золота — несколько десятков килограммов. Основной источник промышленной добычи золота — золотоносный песок (самородные вкрапления золота в кварц) или рассыпное и жильное золото. В чистом виде золото в природе не встречается. Оно всегда содержит различные примеси, прежде всего серебро и медь, придающие ему различную окраску от зеленоватой до желто-красной. Примесь палладия окрашивает золото в белый цвет.
Медь и серебро добыйают в основном из сульфидных руд: халькозина Cu2S, ковелина CuS, аргентита AgzS. Большое промышленное значение имеет также халькопирит CuFeS2. Серебро и, отчасти, золото извлекают попутно при переработке полиметаллических руд, содержащих медь, свинец, цинк и другие металлы.
Самые богатые месторождения меди в виде халькопирита находятся в Центральном Казахстане (Джезгазган), на оз. Балхаш (месторождение Коунрад) и в Башкирии.
Серебро в составе полиметаллических руд добывается на Северном Кавказе (Орджоникидзе), Рудном Алтае (Салаир), в Средней Азии. Золотоносные пески найдены в Восточной Сибири (бассейны рек Алдана, Колымы, Зеи, Амура) и в Казахстане (г. Степняк). Около 60% мировой добычи золота приходится на долю ЮАР.
История открытия элементов. Медь, серебро и золото настолько давно используются человеком, что имена их первооткрывателей не сохранились. Медь, серебро и золото относятся к семи металлам древности, к которым, помимо рассматриваемых, относят Pb, Sn, Ре и Hg. Эти семь металлов были известны еще за 4000 лет до н. э. Золото и медь, видимо, были первыми металлами, с которыми познакомился человек.
Подробнее см.: Потемкин С. В. Благородный 79-й. — М.: Недра, 1988.
20.2. ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА ПРОСТЫХ ВЕЩЕСТВ
В виде простых веществ медь, серебро и золото — очень пластичные, вязкие, хорошо тянущиеся в проволоку блестящие металлы, соответственно красного, белого и желтого цветов. Медь и серебро обладают наивысшей среди металлов и теплопроводностью, и электрической проводимостью. Некоторые их физико-химические свойства приведены в табл. 23. Металлы кристаллизуются в однотипной кубической решетке. За счет участия в связях s- и d-электронов температуры плавления меди и золота несколько выше серебра и значительно выше (включая и серебро), чем у щелочных металлов.
В электрохимическом ряду эти металлы стоят за водородом, их андартные электродные потенциалы положительны (табл. 23), оэтому ни с водой, ни с кислотами-неокислителями они не взаи-Действуют. Исключение составляет несколько более активная
395
медь, которая реагирует с концентрированными галогеноводородными кислотами (кроме фтороводородной) за счет связывания ионов Си+ в прочные анионные комплексы:
2Cu + 4НС1 = 2Н (CuCU ] + Н21
Таблица 23. Физико-химические свойства металлов 1Б-группы
Металл Лт» °C Мип» °C Плотность, г/см3, 25 °C Стандартный электродный потенциал, В
Си 1084 2540 8,9 0,34 Cu2+ + 2е~ - Си+
962 2170 10,5 0,80 Ag+ + е~ - Ag°
Аи 1064 2947 19,3 1,50 Au3+ + Зе - Au°
Медь и серебро взаимодействуют с азотной и концентрированной серной кислотами, золото — только с концентрированной селеновой. Эта особенность химического поведения золота используется для отделения его от серебра:
2Au + 6H2SeC>4 » Au2(SeO4>3 + ЗНгБеОз + ЗН2О
3Ag + 4HNO3 = 3AgNO3 + NOf + 2H2O
Си + 2H2SC>4 = CuSO4 + SO2f + 2H2O
2Ag + 2H2SC>4 = Ag2SO4 + SO2 f + 2H2O
Более дешевым и менее токсичным растворителем для золота является смесь НО + HNO3, в которой активным действующим началом выступает атомарный хлор:
HNO3 + ЗНС1 NOO + 2С1 + 2Н2О
Au + ЗС1 + НО - Н [АиСЦ ]
Металлы 1Б-группы устойчивы к действию растворов и расплавов гидроксидов щелочных элементов, однако благодаря комплексообразованию они могут реагировать с цианидами щелочных металлов и раствором аммиака:
4Au + 8KCN + 2Н2О + О2 = 4К [Au(CN)2] + 4КОН
Медь при этом проявляет закономерную особенность: располагаясь в ряду напряжений левее серебра и золота, она способна к реакциям, не свойственным Ag и Au, например, она взаимодействует с раствором цианида калия в отсутствие окислителя, с аммиаком в присутствии О2:
2Cu + 4KCN + 2Н2О - 2K[Cu(CN)2] + 2КОН + H2f
2 Си + 8NH3 + О2 + 2Н2О = 2[Cu(NH3)4](OH)2
396
В реакциюс кислородом вступаеттол ько медь, давая при нагревании до 400 °C преимущественно оксид меди (II), а при более высокой температуре — СигО. С азотом, водородом и углеродом металлы 1Б-группы не взаимодействуют, но активно окисляются всеми галогенами. Медь при низких температурах не взаимодействует с фтором из-за образования плотной фторидной пленки СиГг. Галогены по силе агрессивного воздействия на металлическое золото можно расположить в следующем порядке: Вгг(ж) > 11(г) > Ch(r) > Fl(r). С парами брома золото реагирует уже при комнатной температуре:
2Аи + 2Вгг = AuBr + АиВгз
а с иодом — при 60—ПО °C с образованием Aul, с газообразным хлором и фтором — выше 200 °C и 300 °C, образуя тригалогениды АиС1з, АиРз. При обработке мелкодисперсного золота водным раствором, содержащим дииодоиодат калия и иодид калия, образуется водорастворимый комплекс золота (+1) дииодоаурат калия:
2Аи + [1(1)2]"+ Г= 2[Аи1гГ
Эту реакцию применяют при переработке золотосодержащих отходов. В расплавленной сере медь и серебро превращаются в сульфиды Cu2S и Ag2S. Способность серебряных предметов темнеть на воздухе в присутствии сероводорода объясняется появлением поверхностной пленки сульфида:
4Ag + H2S + Ог = 2Ag2S + 2НгО
20.3. ПОЛУЧЕНИЕ ПРОСТЫХ ВЕЩЕСТВ
Металлическую медь получают главным образом из сульфидных руд частичным их окислением при высокой температуре кислородом и восстановлением образовавшегося оксида меди (I) избытком сульфида меди (I). Реакция проходит в расплаве, получаемую жидкую медь собирают на дне реактора:
1300°С
CU2S(>K) + 2СигО(ж) = 6Cu(jk) + SO2T
Дальнейшая очистка меди связана с электролитическим рафинированием, при котором листы черновой меди (анод) помещают в раствор электролита (C11SO4 + H2SO4), в котором анодная медь окисляется до ионов [Си(НгО)4]2+ и осаждается затем в чистом виде на катоде из предварительно очищенной меди (рис. 87). Содержащиеся в черновой меди примеси более активных металлов при Рафинировании остаются в растворе, а менее активные металлы — Сребро, золото, платина — в раствор не переходят и остаются в виде анодного шлама на дне электролизера. Этот шлам является важным источником получения металлического серебра, извлекаемого обработкой шлама ртутью или цианидным выщелачиванием (см. ниже).
Ртуть с Ag и Au образует жидкий сплав, амальгаму, содержащую
397
Рис. 87. Электролитическое рафинирование меди: 1 — анод из черновой меди; 2 — раствор электролита CuSOa + H2SO4; 3 — источник постоянного тока (0,3 В; 1 кА); 4 — катод, где осаждается чистая медь; 5 — анодный шлам (серебро, золото, платина и платиновые металлы и другие металлы)
также и соединения этих металлов с ртутью (AuHg2, AuaHg, AgaHg, Ag3Hg4 и др.).
Для выделения частиц самородного золота из золотоносного песка издавна использовался способ отмывки водой более легкой части пустой породы. Позднее во избежание потерь очень мелких частиц золота промывку стали сочетать с обработкой золотоносного песка жидкой ртутью и отгонкой последней (т. кип. ртути, равная 357 °C, гораздо ниже т. кип. золота). Современным способом добычи золота, исключающим потери даже микроскопических включений, является цианидное выщелачивание, основанное на обработке золотоносного песка 0,1—0,2%-ным раствором цианида калия или натрия в присутствии кислорода воздуха. Золото при этом связывается в растворимый анионный комплекс [Au(CN)2] , из которого оно легко восстанавливается цинком:
2[Au(CN)2]“ + Zn = [Zn(CN)4]2~ + 2Au|
Этот способ, предложенный Багратионом, может быть использован и для выделения серебра.
Багратион Петр Романович (1818—1876) - русский химик, заложивший основы гидрометаллургического процесса переработки золотосодержащих руд.
20.4. ХИМИЯ ВОДНЫХ РАСТВОРОВ
Растворимые в воде соли меди (I) и золота (I) крайне нестойки в растворе, поскольку идет их диспропорционирование:
2Cu+ Cu(K)l + Си2+; Ас~106
398
3Au+^= 2Au(K)l + Au3+; Kc ~ IO10
H2O
CU2SO4 = Cuj + C11SO4
3AuCl + H2O » 2Au l + H[AuCl3(OH) ]
Ионы Си существуют в водном растворе в виде аквакатионов состава [Си(НгО)4] , придающих раствору голубую окраску и обладающих слабыми кислотными свойствами:
[Си(Н2О)4 ]2+ + Н2О Н3О+ + (Си(НгО)з(ОН) ]+;
Ак = 4,6«10-8 (25 °C)
Поэтому все растворимые соли Cu(II) в водном растворе подвергаются гидролизу (см. раздел 10.3).
Полагают, что ионы Ag+ также присутствуют в водном растворе в виде очень неустойчивых аквакатионов состава [Ag(HzO)2] . Известен, например, фторид серебра состава |Ag(H2())2]F«2H2O.
20.5. ОКСИДЫ И ГИДРОКСИДЫ
Физико-химические свойства известных оксидов и гидроксидов меди, серебра и золота приведены в табл. 24. Это твердые, амфотерные, не взаимодействующие с водой вещества. Наибольшей термической устойчивостью обладает оксид меди (I). Остальные оксиды (а также все гидроксиды) при нагревании разлагаются:
2Ag2O •• 4Ag + О21 4CuO = 2СигО + Ог f
Си (ОН) 2 = СиО + НгО 2АиО (ОН) = АигОз + НгО
Из табл. 24 следует, что с ростом степени окисления и при переходе от Си к Ag термическая устойчивость оксидов падает.
Амфотерность СигО и Ag2O проявляется в их способности образовывать при сплавлении с оксидами щлочных элементов купраты (I) и аргентаты (I) состава NaCuO, KAgO. Кроме того, СигО и Ag2O легко взаимодействуют с водным раствором аммиака с образованием бесцветных комплексных соединений:
Cu2O + 4NH3(P) + Н2О = 2[Cu(NH3)2](OH)
AgzO + 4NH3(P) + H2O = 2lAg(NH3)2](OH)
С кислотами оксид серебра (I) взаимодействует с образованием простых солей (AgNO3, AgCl, Ag2SO4), а оксид меди (I), если не образует комплексы, подобно оксиду золота (I), диспропорционирует:
СигО + 4НС1 = 2Н [СиС1г ] + Н2О
СигО + H2SO4 = Си | + CuSO4 + НгО
ЗАигО + 8НС1 = 2Н [АиС14] + 4Ащ + ЗНгО
Оксид серебра (I) получают по обменным реакциям из растворимых солей:
2Ag+ + 2ОН = AgzO I + НгО
399
При низких температурах (-50 °C) из спиртовых растворов нитрата серебра (I) осаждением гидроксид-ионами удается получить темный осадок крайне неустойчивого гидроксида серебра AgOH, который при достижении комнатной температуры полностью разлагается:
2AgOH = Ag2O + Н2О
Таблица 24. Физико-химические свойства оксидов и гидроксидов меди, серебра и золота
Соединение Цвет Температура плавления, °C Температура разложения, °C ZyG° (298К), кДж/моль
CuiO(n) Красный 1242 1800 -148
Ag2O(R) Коричневый 815* >160 -11
CuO(K) Черный 1336* 1026 -128
Си (ОН) w Синий — -100 -359
(А/л/’)О2(к) Черный — -100 —
Си2Оз(к) Красный — -400 —
Аи20з(к) Коричневый — >160 +77
AuO(OH)W Оранжевый — 150 -350**
* Плавится под давлением О2.
*• Для АиО(ОН)»Н2О.
В лабораторных условиях оксид меди (I) выделяют из щелочных растворов Си(П) действием восстановителей (гидразином или гидроксиламином) :
2CuSO4 + 2NH2OH + 4NaOH = С112О ; + N2t + 2Na2SO4 + 5Н2О
Промышленный способ получения С112О основан на использовании электролиза водного раствора хлорида натрия с медным анодом:
на катоде (-): 2Н2О + 2е” =_H2t + 2OH2
на аноде (+): Си +2С1 -е = [CuCh]
в электролите: 2 [CuCh ] + 2ОН = СигО | + 4СГ + НгО
Хотя основные свойства у СиО и Си (ОН) 2 преобладают, их кислотные свойства выражены более отчетливо, чем у Си2О и Ag2O. Так, гидроксид меди (II), реагируя с концентрированными растворами сильных оснований, образует в растворе темно-синие гидро-ксокомплексы, некоторые из которых выделены в твердом состоянии: Na2[Cu(OH)4], Sr[Cu(OH)4], Ва[Си(ОН)4]. При нагревании выше 200 °C они теряют воду и превращаются в диоксокупраты (П>: ИагСиОг, ВаСиОг.
Подобно оксидам меди (I) и серебра (I), оксид и гидроксид меди (II) реагируют с раствором аммиака с образованием темно-синего раствора гидроксида тетраамминмеди (II) [Си(МНз)4](ОН)2 хорошо растворимого в воде сильного верования, а также с кислотами:
СиО + 2Н3О+ + Н2О = [Си (Н2О) 4 ]2+
400
Cu(0H)2 + 2H3O+ = [Cu(H2O)4 ]2+
Кислотно-основные свойства двойного оксида серебра (Ag1, Ag“bO2 продемонстрировать невозможно ввиду большой окислительной способности входящего в него серебра (III). Например, этот оксид взаимодействует с серной кислотой с выделением кислорода: 2(Ag’, Agni)O2 + 2H2SO4 = 2Ag2SO4 + O2t+ 2Н2О
Получают (Ag1, Agul)02 либо действием озона на металлическое серебро или Ag20, либо окислением Ag2O пероксодисульфатом калия в щелочной среде:
Ag2O + 2К0Н + K2S2O6(O2) = (Ag1, Agn)O2 + 2K2SO4 + H20
Оксид меди (И) в промышленном масштабе получают окислением медной стружки кислородом воздуха ( < 400 °C), а в лабораторных условиях — термическим разложением гидроксида, нитрата или основного карбоната меди (II) (СиОН)гСОз:
Cu(NO3)2 = CuO + 2NO2t + О,50г1
(Cu(OH) ]гСОз = 2CuO + СОг! + Н2О
Гидроксид меди (II) выпадает в виде объемистого голубого осадка при обработке растворов солей меди (И) гидроксидами щелочных металлов:
CuSO4 + 2КОН = Си (ОН) 2! + K2SO4
У кислородных соединений меди и золота (III) явно преобладает кислотный характер. Так, метагидроксид золота (III) АиО(ОН) («золотая кислота») практически не реагирует с разбавленными кислотами, но зато легко взаимодействует с разбавленными растворами сильных оснований с образованием желтых гидроксокомплексов:
АиО(ОН) + КОН + Н2О = K[Au(OH)4]
а в НС1(конц) переходит в тетрахлороаурат водорода:
AuO(OH) + 4НС1 = Н [AuCU ] + 2Н2О
Оксид СигОз обладает большой окислительной активностью:
СигОз + 6НС1 - 2CuC12 + Chf + ЗН2О
С гидроксидами щелочных металлов СигОз образует нестойкие гид-роксокупраты (III) красного цвета:
СигОз + 2NaOH + ЗН2О - 2Na [Си (ОН) 4 ]
Получают СигОз окислением Си (ОН) г пероксодисульфатом калия, а метагидроксид золота АиО(ОН) — обменными реакциями солей Au (III) с гидроксидами щелочных металлов:
2Cu(OH)2 + 2КОН + K2S2O6(O2) - СигОз 4 + 2K2SO4 + ЗН2О
К[АиС141 + ЗКОН = АиО(ОН) 4 + 4КС1 + Н2О
401
20.6. СОЛИ
Для элементов 1Б-группы известно большое число самых разнообразных солей, причем если соли со степенью окисления металла (+1), как правило, нерастворимы (редкое исключение — AgNOa, AgC104 и AgClOs), то соли меди (И) и золота (III), наоборот, в своем большинстве хорошо растворяются в воде и подвержены гидролизу, необратимому для таких солей, как АиРз, Аи2(БО4)з, Аи(ЬЮз)з. Например,
AuF3 + 2Н2О - АиО(ОН); + 3HF
Для водорастворимых солей меди и золота с неустойчивой степенью окисления (+1) возможны реакции диспропорционирования, а для меди (II) и золота (III) — проявление окислительных свойств. Так, попытка получить в растворе иодид меди (II) или золота (III) будет обречена на неудачу, поскольку пойдет окислительно-восстановительный процесс с выпадением малорастворимых иодидов меди (I) и золота (I):
2 [Си(Н2О)4]2+ + 4Г = 2CuI 4 + I2l + 8Н2О
[АиСЦ Г + ЗГ = Aul 4 +12 j + 4СГ
Безводные галогениды элементов 1Б-группы в их устойчивых степенях окисления можно получить прямым синтезом из элементов, однако более удобным является их выделение по обменным реакциям из водных растворов с последующей сушкой (и обезвоживанием кристаллогидратов, если они образуются). Некоторые физико-химические свойства галогенидов меди (И), серебра (I) и золота (III) приведены в табл. 25. Термодинамическая устойчивость всех галогенидов падает от фторидов к иодидам и от меди к золоту. В этом же направлении падает и термическая устойчивость солей, что соответствует, очевидно, уменьшению ионной составляющей связи и нарастанию ковалентной (особенно у галогенидов золота). В ионных кристаллических решетках CuF2 и галогенидов серебра. (I) каждый катион окружен шестью анионами.
Таблица 25. Свойства некоторых галогенидов меди, серебра и золота
Галогениды (кристаллы) Цвет Температура плавления, °C Температура разложения, °C ZyG° (298 К), кДж/моль
CuFj Бесцветный 770 — -488
CuCl2 Желтый 596 1000 -172
CuBrj Черный 498. — / -131
AgF Бесцветный 435 ~ 1000 -188
Aga « 455 - 1550 -ПО
AgBr Бледно-желтый 424 1505 -97
Agl Желтый 554 ~ 1500 -66
Продолжение тпабл. 25
Галогениды (кристаллы) Цвет Температура плавления, °C Температура разложения, °C AfG° (298 К), кДж/моль
АиРз Оранжевый — >500 -297
АиС1з Красный 288* >254 -49
АиВгз Коричневый — >200 -18
Аи1з Темно-зеленый — >20 —
* Под давлением Ch.
Хлориды и бромиды Си (II), хлорид Au(I) обладают полимерной структурой с ковалентными химическими связями (см. ниже). Структуры молекул Аиг(На1)б (Hal-Cl, Вг или I) аналогичны структурам молекул Ah(Hal)6 и РегС1б (см. рис. 10). В парообразном состоянии хлорид, бромид и иодид Cu(I) образуют тримеры:
(СиС12)„
(Au С1)х
(АиС13)и
Хлорид, бромид и иодид серебра (I) в воде малорастворимы. В отличие от них фторид серебра хорошо растворим (при 20 °C й> = 63%) и в воде не гидролизуется, чего нельзя сказать об остальных галогенидах. Фторид меди (II) горячей водой необратимо гидролизуется до CuOHF, хлорид и бромид меди (II) гидролизуются обратимо с образованием катионов (Си(НгО)з(ОН) ] ; гидролиз галогенидов золота (III) приводит к появлению в растворе комплексных анионов типа [АиС1з(ОН)Г.
Важным в практическом отношении свойством галогенидов серебра (I) является их светочувствительность. Под действием света AgCl, AgBr и Agl способны разлагаться с выделением галогена и металлического серебра, причем это разложение пропорционально Длительности облучения.
Кристаллы a-Agl обладают высокой ионной проводимостью, обусловленной движением ионов Ag+ сквозь довольно рыхлую подре
403
шетку анионов I . Еще большей ионной проводимостью обладают соединения состава Rb[Ag4l51 и Rb [C114I2CI3 ]. Эти два ацидоком-плекса превосходят по уровню ионной проводимости (у первого комплекса она достигает 0,25 Ом ‘«см 1 при 25 °C) все известные кристаллические вещества.
Известно два нитрата элементов 1Б-группы: AgNOa и Си(КОз)2, получаемые растворением металлов в азотной кислоте. Оба нитрата хорошо растворимы в воде, легко плавятся при нагревании выше 230 °C, а их расплавы при дальнейшем повышении температуры разлагаются:
2AgNO3 “ 2Ag + 2NO2t + Ог!
2Cu(NO3)2 = 2CuO + 4NO2T + Ог!
Нитраты отличаются друг от друга по своему поведению в водном растворе: AgNOa не гидролизуется, а Си (N Оз) 2 подвергается обратимому гидролизу (см. раздел 20.4). Из водных растворов AgNOa кристаллизуется в безводном состоянии, а Си(ЙОз)2 — в виде [Cu(H2O)4](NO3)2«2H2O. Безводный Си(МОз)2 можно выделить только из неводных сред, например, в реакции:
Си + 2НгО4(ж) = Си (ИОз)2 + 2N0f
Известны сульфаты составов: CuSO4, [Cu(H2O)41SO4»H2O, Ag2SO4. Сульфат меди (I) подвергается в водном растворе диспропорционированию, а хорошо растворимый в воде [Cu(H2O)4]SO4«H2O — обратимому гидролизу. Сульфат серебра малорастворим в воде и с водой не взаимодействует. Все три сульфата при нагревании разлагаются:
4CuSO4 = 2СигО + 4Б0г Т + 30г!
1000 °C
Ag2SO4 = 2Ag + SO2f + O2t
650 ”С
2CuSO4 = 2CuO + 2SO21 + О2! (после обезвоживания)
Наибольшее народнохозяйственное значение имеет сульфат меди («медный купорос»), промышленное производство которого основано на взаимодействии непрерывно окисляющихся с поверхности медных гранул с разбавленной серной кислотой. Поверхностное окисление медных гранул осуществляют непрерывной продувкой через их слой паровоздушной смеси:
2Cu + О2 = 2CuO; CuO + H2SO4 - CuSO4 + Н2О
Ортофосфаты меди (II) и серебра (И) Сиз(РО4)2, Ag3(PO4)2, а также мета-, орто- и дифосфат серебра (I) AgPOa, AgaP04, Ag4?2O7 получают по обменным реакциям из других более растворимых солей или растворением соответствующих оксидов в фосфорных кислотах.
У меди (II) известны как средние, так и основные карбонаты,
404
причем из водных растворов осаждается менее растворимый основной карбонат:
2 [Си(Н2О)4 ]2+ + 2СО1" = [Си(Н2О)з(ОН> ]2СОз I + CO2f + Н2О
При нагревании он обезвоживается и дает зеленое кристаллическое вещество (СиОН)2СОз, аналогичное по составу природному малахиту.
Средний карбонат СиСОз получают искусственным путем, действуя на гидроксокарбонат меди избытком диоксида углерода под давлением и при небольшом нагревании:
(СиОН)2СОз<к) + СО2(Г) = 2СиСОз(к) + Н2О<Г)
В связи с отсутствием протолитической активности у иона Ag средний карбонат серебра может быть в отличие от СиСОз получен из водного раствора по обменным реакциям типа
2AgNO3 + К2СО3 = Ag2CO31 + 2KNO3
Характерно, что простые нитраты, сульфаты и карбонаты золота (III) неизвестны; в водном растворе они нацело гидролизуются, а в сильнокислотной среде образуют комплексные кислоты.
В свойствах сульфидов меди, серебра и золота наблюдается явная аналогия со свойствами их оксидов. Все сульфиды — кристаллические вещества темной окраски, термодинамическая стабильность которых падает с ростом степени окисления элемента и при переходе от меди к золоту. Наибольшей термической устойчивостью обладают Cu2S и Ag2S; минералы с таким составом образовались при геохимических процессах и тысячелетиями остаются неизменными. Сульфиды золота при относительно низких температурах разлагаются до простых веществ, а сульфид меди (III) выше 1000 °C, выделяя серу, превращается в устойчивый СигБ.
Для получения сульфидов меди (I) и серебра (I) используют сплавление металлов с серой, остальные сульфиды (как, впрочем, и Ag^) можно получить по обменным реакциям соответствующих солей с НгБ или Na2S.
Особый характер сульфидов проявляется в их способности образовывать тиокомплексы и двойные соединения. Так, для CuiS и в особенности для Ag2S, у которых основные свойства преобладают над кислотными, характерно взаимодействие с сульфидами кислотного характера, прежде всего с Аз28з, Sb2Ss и As^s, приводящее к образованию тиокомплексов состава Ag[SbS2], Cu[AsS2], Ag3[SbS3], Cu3[AsS4]. Более кислотные CuS и АигБз, наоборот, легче реагируют с сульфидами основного характера Na2S, FeS, Давая при этом двойные сульфиды (Fe2Cu)S3 или тиокомплексы Na3 [AuS3 ], Na [^iS2 ]._^e практически нерастворимые в воде сульфиды (ПР = 10 3 - 10 > не подвергаются гидролизу, но взаимодействуют с концентрированной НС1, при нагревании — с разбавленной HNO3:
3CuS + 8HNO3 = 3Cu(NO3)2 + 2N0f + 3S | + 4H2O
405
20.7. КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
Медь, серебро и золото во всех своих степенях окисления являются эффективными комплексообразователями. В степени окисления (+1) они проявляют высокую склонность к образованию комплексов с линейной структурой L—М—L (координационное число 2) в результате sp-гибридизации близких по энергии АО. К числу таких комплексов относятся [Ag(NH3>2]+, [CuCh] , [Auli] , [Ag(CN)2]~ и др. Среди цианидных комплексов только [Cu(CN)2] обладает полимерной структурой с необычным координационным числом 3:
। * *
—CN—Си—CN--------CN—Си—CN--------CN—Си—
Вследствие высокой устойчивости цианидных и тиосульфатных комплексов малорастворимые галогениды меди, серебра и золота взаимодействуют с KCN и NaaSOaCS):
CuI(k) + 2KCN(P) = K[Cu(CN)2](p) + KI<p)
AgBr(K) + 2Na2SO3(S)(P) - Na3[Ag(S2O3)2](p) + NaBr<P)
Комплексы Cu(III), Ag(III) и Au (III) имеют плоскоквадратную структуру, примером таких коьйыексов^ могут служить анионы [AgF4r, [AuF4r, [AuCkl и [Au(CN)4] .
Тетраэдрическая структура обнаружена у анионов [Cu*(CN)4r , [Ag(SCN)4]3 , искаженной тетраэдрической структурой (сплющенный тетраэдр) обладают анионы в соединениях Cs2[CuCl4] и Cs2[CuBr4], содержащих катионы большого размера. Те же анионы становятся плоскоквадратными, когда вместе с ними в кристаллах находятся катионы небольших размеров, как у (NH4)2[CuCl4].
Фактически вся химия Au (III) является химией комплексных соединений. Лигандами здесь могут выступать даже нитратные и сульфатные анионы. Так, при взаимодействии гидроксида золота (III) с концентрированной HNO3 или H^SO4 образуются комплексные кислоты: Н[Аи(ЫОз)4] и H[Au(SO4)2].
Тригрнальнопирамидальная структура обнаружена у анионов [СиС151 . Октаэдрическую структуру имеют комплексы Au(V), например [AuFfi], и некоторые комплексы Си (И): [Си(КОг)бГ ’> [Си(Н2О)2(КНз)4Г+.
У комплексов Си (II) может быть искаженная октаэдрическая структура, в которой два аксиальных (транс-) расстояния Си—L увеличены по сравнению с четырьмя другими, лежащими в плоскости квадрата октаэдра. Поэтому такие комплексы принимаются за пд^о-скоквадратные, как, например, [Си(НгО)4] , [Cu(NH3)41 > [Си(КНз)2(СНзСОО)г] (катион [Си(КНз)бГ+ существует только в жидком аммиаке).
Комплексообразование стабилизирует такие неустойчивые и нехарактерные степени окисления, как (II) и (III) для серебра, (III) и (IV) — для меди и (V) — для золота. С этими степенями окисления получены комплексные фториды М [AgFs ], М [AgF4 ] (М » К, Rb, Cs),
406
Кз[СиРб], Cs2[CuF6], CsfAuFfi], проявляющие окислительные свойства.
Медь (II) способна образовывать диамагнитные двуядерные ацетатные кластеры с расстоянием Си—Си, большим, чем в металлической меди (256 пм), поэтому CZ-связь в кластере ([Си2(НгО)2(СНзСОО)4Г слабая:
У золота известны кластеры с шестью, девятью и одиннадцатью атомами золота, например [Aun(PPh3)7(CN)3 ]° (т. пл. с разлож. 173°С), [Au9(PPh3)8]X3 (т. пл. с разлож. 230—240 °C), где Ph = = С6Н5, а Х = ЫОз, [BF4]~ и СЮ4.
Медь (I), (II), серебро (I) и золото (I), (III) образуют аммиакаты состава [М(Ь1Нз)п]Х, где и = 2 или 4, а X — различные анионы. Образование катиона [Си(КНз)г]+ стабилизирует у меди степень окисления (+1). В частности, [Си (ЬШз) 2 ]2SO4 кристаллизуется из водных растворов в виде бесцветных гексагональных пластинок, а CU2SO4 в тех же условиях подвергается реакции диспропорционирования. Водные растворы аммиакатов [Cu(NH3)2J^ бесцветны, так как у Cu(I) электронная конфигурация содержит d-AO.
Серебро (I) образует аналогичный по составу аммиакат [Ag(NH3)2]+. Золото (I) содержит во внутренней сфере вместе с молекулами аммиака галогенидные ионы: [Аи(КНз)С1]°, [Аи(ЫНз)зВг]°.
Аммиакаты меди (II) содержат в своем составе четыре молекулы аммиака, их кристаллы имеют синий цвет, как и водные растворы. Получают аммиакаты Си (II) при помощи реакций:
[Си(Н2О)4 ]2+ + 4NH3. ' [Cu(NH3)412+ + 4Н2О
Си + 4NH3 + 0,50г + Н2О » [Cu(NH3)4]2+ + 2ОН~
При пропускании NH3 через водный раствор HfAuCh] в присутствии нитрата аммония образуется [Аиш(ЬШз)4](ЫОз)з с плоскоквадратной структурой катиона. Эти катионы ведут себя как слабые кислоты:
407
[Au(NH3)413+ + H2o ;=r [Au(NH3)3NH2]2+ + H30+ ; t
,________j
н
Молекулы аммиака связаны c Au (III) настолько прочно, что концентрированные кислоты не действуют на катионы тетрааммин-золота (III).
20.8. ПРИМЕНЕНИЕ
Основное использование меди — изготовление проводов, малое электрическое сопротивление которых позволяет снизить потери электроэнергии при ее передаче на дальние расстояния. Медь — неотъемлемая часть бронз (сплавов меди с оловом в массовом соотношении 9:1), сочетающих ковкость с твердостью. Сплав меди с цинком в соотношении 1:1, называемый латунью, отличается легкостью вальцевания и протяжки. Мельхиор — сплав меди с никелем (в соотношении 7:3), по красоте и полируемости Напоминающий серебро, идет на изготовление украшений и столовой посуды. Из сплавов меди с никелем штампуются «серебряные», а из меди с добавкой 5% алюминия — «медные» разменные монеты.
Количество денежных знаков, выпускаемых в обращение каждым государством, обеспечивается его золотым запасом. Непосредственно золотом идет расчет во многих международных торговых операциях. В большом количестве металлическое серебро и золото идет на изготовление украшений, стоматологических протезов. Серебро и золото применяют в электронной технике (неокисляющиеся контакты, токоотводы). Коллоидные растворы металлического серебра (под названием колларгол, протаргол) используют в медицине благодаря их антибактериальному действию.
Сульфат меди (II) — составная часть многих препаратов для борьбы с вредителями и болезнями сельскохозяйственных культур. Оксиды меди (I) и (II) служат окрашивающими добавками к стеклам и эмалям. Хлорид меди (II) используют как катализатор в производстве органических красителей и в пиротехнике. Нитрат серебра применяют в медицине («ляпис») как прижигающее (сворачивающее белок) средство. Галогениды серебра, в первую очередь бромид серебра (I), идут на изготовление светочувствительных фотопластинок, фотобумаг и пленок.
20.9. ТОКСИКОЛОГИЯ
Медь в виде микропримесей входит в комплексные органические соединения, играющие важную роль в кроветворении у человека-Избыток ионов Си2+ связывает гидросульфидные группы ферментов и действует на организм угнетающе. Соединения меди вызывают резкое раздражение слизистых оболочек верхних дыхательных путей и желудочно-кишечного тракта. При систематическом действии солей меди на организм человека отмечается поражение зубов и слизистой оболочки рта, язвенная болезнь желудка, конъюнктива
408
глаз приобретает зеленовато-желтый цвет, а на деснах появляется темно-красная полоса.
Серебро в виде пыли более 0,01 мг/мл в воздухе опасно своим накоплением на стенках капилляров, особенно печени, костном мозге, селезенке. У работающих постоянно с золотой пылью отмечаются дерматиты и экземы на коже.
Упражнения к главе 20
1. Возможны пи реакции
CujO + NH3 + Н2О =...
Ag2O + NH3 + Н2О = ...
2. Почему все соли меди (I) являются малорастворимыми?
3. Можно ли выделить кристаллы [Cu(NH3)2]2SO4 и Cu2SO4 из водного раствора?
4. Напишите уравнения реакции получения Cu2O, СиО и Cu2Og.
5. Как разделить при помощи химических реакций золото и серебро, медь и серебро?
6. Есть ли различие во взаимодействии меди и золота с водным раствором цианида калия?
7. Как взаимодействуют разбавленные растворы серной кислоты с водным раствором, содержащим катион тетраам-минмеди (II) или катион тетраамминзолота (III)?
8. Напишите уравнения реакций:
(Ад1, Ад")О2 + H2SO4 = ...
Ад+ + ОН" =...
9. Какой химический метод применяют для извлечения золота из золотоносного песка?
10. Объясните, почему медь, находясь в электрохимическом ряду напряжений правее водорода, взаимодействует с водным раствором иодоводорода с выделением водорода?
11. Как протекает в водном растворе протолиз аммиакатов: [Ag(NH3)2]+ и [Au(NH3)4]3 + ?
12. Можно пи выделить СиСОз из водного раствора?
ГЛАВА 21. ХИМИЯ ЭЛЕМЕНТОВ ПБ-ГРУППЫ
Цинк, кадмий и ртуть — последние d-элементы соответственно четвертого, пятого и шестого периодов, и поэтому имеют полностью заполненную (п -l)d- и ns- АО; Zn - [Аг 14s23dia; Cd - [Kr]5s24d10;
- [Xe |6s’24/l45d . Такое электронное строение определяет общую к практически единственную характерную для них в соединениях степень окисления (+11), например ZnSO4, CdCh, HgS, Hg(NOa)2. “туть, кроме того, способна образовывать соединения кластерного типа (Hg2C12, Hg2<NO3)2 и др.), в которых она имеет степень
409
окисления (+1). Катион диртути Hg5+ в таких соединениях образован по донорно-акцепторному механизму
Hg°:yVnHg2+= [Hg-2* Hg]2+; D6s-ao
Водорастворимые соединения цинка, кадмия ZnCh, Cd(NOs)2 и других являются сильными электролитами, демонстрируя тем самым ионный характер связи. Относительно хорошо растворимые в воде HgCh, Hg(CN)2, наоборот, проявляют свойства слабых электролитов. В этих соединениях изолированные молекулы с двумя ОЧвязями имеют линейную структуру (sp-гибридизация АО ртути).
Металлические свойства элементов ИБ-гру ппы и основные свойства
их оксидов и гидроксидов усиливаются от цинка к ртути: если оксид цинка ZnO обладает ярко выраженной амфотерностью, то у CdO она практически отсутствует, a HgO проявляет только основные свойства.
Как и все d-элементы, Zn, Cd и Hg — хорошие комплексооб-
разователи. Характерное для них значение координационного числа 4 отвечает sp-гибридизации АО и связдно с тетраэдрической структурой комплексных ионов: [Zn(OH>4] , [Zn(NHa)4] , [HgU] . Для кадмия (И) более характерно координационное число 6 за счет вовлечения в химическую связь вакантных 5d-AO с образованием октаэдрических структур {sp^a -гибридизация): [Cd(H2O)6] , [Cd(NH3)6F и др. Все комплексные соединения цинка, кадмия и
ртути не окрашены ввиду отсутствия для электронов возможности de -» dy-переходов.
21.1. РАСПРОСТРАНЕННОСТЬ В ПРИРОДЕ. ОСНОВНЫЕ МИНЕРАЛЫ
Цинк занимает 23-е место по распространенности (кларк 10-2%). Кадмий и ртуть представлены в земной коре более скромно (кларк 10 5 %).В самородном виде обнаружена только ртуть. Минералами промышленного использования являются главным образом сульфидные руды: сфалерит и вюртцит (ZnS кубической и гексагональной кристаллической структуры), киноварь (HgS гексагональной структуры), а также карбонаты, например смитсонит ZnCOa, изоструктурный с СаСОз. Киноварь является почти единственным источником промышленного получения ртути. Наиболее перспективными районами добычи киновари являются Донбасс (Никитовское месторождение) и Закарпатье (Боркут).
Месторождения цинка в виде сфалерита находятся на Северном Кавказе (Садонское), в Центральном Казахстане и Западном Забайкалье (Озерное), а также в Таджикистане (Алтын-Топкан).
История открытия элементов. Цинк и в особенности ртуть известны с глубокой древности. Кадмий открыт в 1817 г. Штромейером.
Штромейер Фридрих (1776-1835) - немецкий профессор химии, генеральный инспектор аптек Ганновера.
410
21.2. ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ
Цинк, кадмий и ртуть — белые, блестящие металлы с относительно низкими температурами плавления и кипения, снижающимися от цинка к ртути (табл. 26). Ртуть — единственный из известных металлов, находящийся при стандартных условиях в жидком состоянии. Как и в 1Б-группе, химическая активность металлов сверху вниз падает: если Zn и Cd стоят в электрохимическом ряду напряжений до водорода, то ртуть располагается далеко за ним (см. раздел 7.10).
Цинк и кадмий не взаимодействуют с водой ввиду образования на их поверхности прочной оксидной пленки, но активно реагируют с кислотами-неокислителями:
Zn + 2Н3О+ + 2Н2О = [Zn(H2O)4]2+ + H2f
Cd + 2Н3О+ + 4Н2О = [Cd(H2O)6 ]2+ + H2t
Ртуть в силу своего положения в электрохимическом ряду напряжений металлов не реагирует с хлороводородной и разбавленной серной кислотами, однако взаимодействует со всеми кислотами-окислителями (аналогично ей реагируют цинк и кадмий):
Hg + 2H2S04(koh4) = HgSO4 + SO2 f + 2H2O
Hg + 2HN03(koh4) = Hg(NO3)2 + 2NO2f + 2H2O
При недостатке азотной кислоты (избытке ртути) процесс сопровождается образованием нитрата диртути:
6Hg + 8HNO3 = 3Hg2(NO3)2 + 2NO t + 4Н2О
С сильными основаниями в силу своей явной амфотерности реагирует только цинк:
Zn + 2ОН" + 2Н2О = [Zn (ОН) 4 ]2~ + Н2f
Подобно алюминию, цинк способен восстанавливать в щелочной среде нитрат-ион до аммиака:
4Zn + NO3 + 7ОН" + 6Н2О = 4 [Zn (ОН)4 ]2" + NH31
Таблица 26. Физико-химические свойства металлов ПБ-группы
Свойства •» Металлы
ЦИНК кадмий ртуть
Температура плавления, °C 420 321 -39
Температура кипения, °C 906 766 357
Плотность р, г/см3 (25 °C) 7,13 8,65 13,55
Стандартный электродный потенциал <р°, Э2+/Э°, В -0,76 -0,40 +0,85
При нагревании цин к, кадмий и ртуть CI юрают в кислороде с
^оразованием оксидов ZnO, CdO, I [gO, активно взаимодействуют с
411
расплавленной серой (ртуть — даже при комнатной температуре), давая сульфиды ZnS, CdS, HgS, а при реакции со всеми галогенами образуют галогениды цинка, кадмия и ртути.
Установлено образование не только ртутью, но и цинком, и кадмием катионов состава М^+. Такие катионы обнаружены в некоторых солях, например CditAICU]?. Получены доказательства существования у ртути многоатомных линейных катионов Hg^+ и Hgi+. В частности, при помощи реакции
3Hg + 3AsF5 = Hg3 [AsF612 + AsFa
был синтезирован гексафтороарсенат (V) триртути.
21.3. ПОЛУЧЕНИЕ ЦИНКА, КАДМИЯ И РТУТИ
В настоящее время получение цинка в промышленных условиях осуществляют преимущественно двумя способами: пирометаллургическим и электрохимическим. Пирометаллургический способ состоит из окислительного обжига сульфидного концентрата, восстановления цинка и его возгонки:
2ZnS + ЗО2 = 2ZnO + 2SO2t ; 2ZnO + С - 2Zn t + CO21
В электрохимическом способе ZnO, полученный при окислительном обжиге, обрабатывают H2SO4 и из полученного раствора выделяют кадмий восстановлением его избытком цинковой пыли:
CdSO4 + Zn = Cd 1 + ZnSO4
а фильтрат направляют на электролитическое получение цинка:
катод (А1) (—): Zn2+ + le- = Zn°;
анод (РЬ) (+): 2НгО - 4е =O2t + 4Н+
Выделенный из раствора кадмий вместе с остатком цинка обрабатывают теплым и влажным воздухом для превращения кадмия в оксид, который затем переводят при помощи H2SO4 в сульфат. Из полученного раствора кадмий выделяют электрохимически, как и цинк, на катоде.
Обжиг сульфида ртути позволяет сразу получить металл:
500 °C ’
HgS+ 02 = Hgt+S02t
21.4. ХИМИЯ ВОДНЫХ РАСТВОРОВ
Катионы цинка и кадмия присутствуют в водном растворе в виде аквакомплексов, являющихся катионными кислотами:
[Cd(H2O)612+ + Н2О ;--> [Cd(H2O)5OH]+ + Н3О+
В водных растворах с содержанием Zn(II) и Cd (II) более 1 моль/л происходит образование двуядерных гидроксоаквакомплексов состава [Zn2(H20)io(OH)]3+и |Cd2(H20)io(OH) ]3<
412
Ионы Hg(II) при значительной их концентрации существуют^ водном растворе в виде неустойчивых аквакатионов [Hg(H2O)2F , подвергающихся протолизу:
[Hg(H2O)2]2+ + Н2О -z=± НзО+ + HgOH+ + Н2О
Катион HgOH+ может в зависимости от состава раствора либо образовывать малорастворимые основные соли, например (HgOH)NOa, либо распадаться:
HgOH+ + Н2О = HgO I + НзО+
Хорошо растворимые HgCh и Hg(CN)2, как уже указывалось, к ионным соединениям (солям) не относятся. В водном растворе хлорид ртути (II) диссоциирует очень слабо:
HgCl2(p) — HgCf + СГ
а цианид ртути (II) вообще электролитом не является.
Для ртути (I) известен аквакатион [(FhOHg—Hg(H2O) ] , образующийся, например, при растворении в воде нитрата диртути Hg2(NO3)2- Разложение последнего в водном растворе проходит необратимо с выделением осадка HgO и металлической ртути. Подобно золоту (I), ртуть (I) проявляет в водных растворах большую склонность к диспропорционированию: Hgl(p) 5=tHg^c) + Hg2 \ поэтому для длительного сохранения рабочих растворов ртути (I) необходимо присутствие в растворе некоторого количества жидкой ртути.
21.5. ОКСИДЫ И ГИДРОКСИДЫ
Оксиды цинка, кадмия и ртути — твердые вещества, не взаимодействующие с водой. Окраска оксидов различна: ZnO — белого, CdO — коричневого и HgO — желтого цвета.
Все три оксида возгоняются, не плавясь, и в парообразном состоянии разлагаются на металл и кислород. Летучесть оксидов возрастает в ряду ZnO < CdO < HgO. Под повышенным давлением кислорода ZnO плавится при 1970 °C. Оксид ртути (II) обладает наименьшей термической стойкостью: с повышением температуры он меняет свой цвет с красного на желтый, а выше 400 °C разлагается до простых веществ.
Амфотерность проявляет только оксид цинка, взаимодействующий как с растворами сильных оснований, так и кислот:
ZnO + 2ОН" + Н2О - [Zn(OH)4 J2-
ZnO + 2Н3О+ + ЗН2О = [Zn(H2O)6 ]2+ [Zn(H2O)612'. - lZn(H2O)4]2+ + 2H2O
Оксиды кадмия и ртути проявляют основный характер, их взаимодействие с кислотами приводит к образованию солей.
Гидроксиды цинка и кадмия выпадают в виде бесцветных гелеобразных осадков при обработке водных растворов солей разбавленными Растворами гидроксидов щелочных металлов. Осаждение гидроксида
413
цинка следует вести осторожно, избегая избытка осадителя, с которым легко идет образование растворимого гидроксокомплекса цинка:
Zn(OH)2 + 2NaOH = Na2[Zn(OH)4]
Амфотерность гидроксида кадмия проявляется в более жестких условиях (концентрированный водный раствор NaOH и нагревание):
Cd(OH)2 + 4NaOH = Na4[Cd(OH)6]
При подкислении гидроксокомплексы разлагаются с образованием в конечном счете аквакатионов [Zn(H2O)6F и [Cd(H2O)61 , однако при действии слабых кислот могут быть выделены из гидроксокомплексов и гидроксиды:
[Cd (ОН) 6 ]4" + 4NH| = Cd (ОН) 21 + 4(NH3 • Н2О)
[Zn(OH)4]2+ + 2SO2 = Zn(OH)21 +2HSO3
Гидроксиды цинка и кадмия взаимодействуют также с растворами аммиака с образованием хорошо растворимых бесцветных аммиакатов:
Zn(OH)2 + 4NH3(p) = [Zn(NH3)4](OH)2
Cd(OH)2 + 6NH3(P) = [Cd(NH3)6](OH)2
При попытке выделить гидроксиды ртути (I) или (II) из ее солей образуется либо осадок оксида, либо смесь оксида с ртутью (реакция диспропорционирования):
Hg(NO3)2 + 2NaOH = HgO | + 2NaNO3 + Н2О
Hg2(NO3)2 + 2NaOH = HgO l + Hg i + 2NaNO3 + H2O
Общим способом получения оксидов элементов ПБ-группы является окисление металлов кислородом, а для цинка и кадмия, кроме того, — разложение их карбонатов, гидроксидов и нитратов:
2Hg + Ог= 2HgO; Zn(OH)2 = ZnO + H20
t t
CdCO3 = CdO + COlt ; 2Cd(NO3)2 = 2CdO + 4NO2t + 02t
. 21.6. СОЛИ
Нитраты, сульфаты, хлораты и перхлораты цинка, кадмия и ртути (II) относятся к хорошо растворимым в воде соединениям. Растворимы большинство галогенидов цинка и кадмия (кроме их фторидов). Сульфиды, карбонаты, ортофосфаты элементов ПБ-груп-пы, а также большая часть галогенидов ртути (I) являются малорастворимыми соединениями.
Нитраты ртути (I) и (II) существуют только в кислых растворах, при разбавлении они необратимо гидролизуются с осаждением в конечном счете оксида ртути (II). Нитрат диртути в присутствии достаточно сильного окислителя проявляет восстановительные свойства, например:
414
Hg2(NO3>2 + 4HNO3 = 2Hg(NO3)2 + 2NO2t + 2НгО
Все нитраты, включая и соединения ртути, — сильные электролиты.
Нитраты цинка, кадмия и ртути получают взаимодействием металлов с азотной кислотой любой концентрации. Для синтеза нитрата ртути (I) требуется, как указывалось выше, избыток металлической ртути; другой способ синтеза описывается уравнением
Hg(M) + Hg(NO3)2 Hg2(NO3>2
Галогениды цинка и кадмия, а также фториды ртути — ионные соединения. Фториды ртути, растворяясь в воде, нацело гидролизуются. Газообразные фторид, бромид и иодид ртути (П) — ковалентные соединения с линейной структурой. В твердом виде эти соединения имеют молекулярную решетку, их растворимость в воде от хлорида к иодиду ртути резко падает. Подобно большинству ковалентно связанных соединений HgCh, HgBr2 и Hgh растворяются в органических растворителях (этаноле, диэтиловом эфире, бензоле).
С достаточно сильными восстановителями HgCh проявляет окислительные свойства, восстанавливаясь сначала до ртути (I), а затем до металлической ртути. Например:
2HgCl2 + [SnCI412" = Hg2C12 + [SnCle ]2~
Hg2C12 + [SnC1412= 2Hg* + [SnCU]2-
Безводные галогениды элементов ПБ-групп синтезируют из элементов; малорастворимые в воде галогениды ртути — по обменным реакциям из водных растворов:
Zn + Ch = ZnCh; Hg + F2 “ HgF2
CdO + 2HI = Cdl2 + H2O
Hg2(NO3)2 + 2KC1 = Hg2C12l + 2KNO3I
Hg2(NO3)2 + 2KI = Hg2h + 2KNO3
Известны три средних карбоната цинка, кадмия и ртути (I): ZnCO3, CdCO3, Hg2CO3. Это кристаллические, малорастворимые в воде соединения, устойчивость которых от цинка к ртути резко падает: если первые два карбоната разлагаются до оксидов и диоксида углерода при температурах около 200—300 °C, то карбонат диртути нестоек и при длительном хранении подвергается реакции диспропорционирования:
Hg2CO3 = Hgj + HgO + CO2f
Карбонаты кадмия и диртути получают обменными реакциями из водных растворов:
Cd(NO3)2 + К2СО3 = CdCOs I + 2KNO3
Hg2(NOa)2 + КагСОз = Hg2CO3l + 2NaNO3 g
случае же солей цинка аналогичной реакции не происходит, так
415
как выпадает менее растворимый, чем Z11CO3 и Zn(OH)2, основной карбонат цинка:
2ZnCh + INazCOa + Н2О = (ZnOH)2CC>34 + CO2f + 4NaCl
Осаждение карбоната гидроксоцинка происходит вследствие протолиза карбонатных анионов: COI+H2O НСОз + ОН-. Ионы ОН способствуют образованию в растворе катионов ZnOH+ и осаждению малорастворимого (ZnOH)2CO3. Большой избыток НСОз-ионов в растворе и пропускание через него СОг приводят к реакциям:
ZnOH+ + НСОз - ZnCOs I + Н2О
н2О
СО2 + Н2О’=: * Н2СО3 = НзО + НСОз
результатом которых является осаждение только ZnCOs. Выделения Zn(HCOs)2 из раствора не происходит из-за хорошей его растворимости в воде. Общая реакция имеет вид
[Zn(H2O)6 ]2+ + 2НСОз = ZnCO3 4 + СО24 + 7Н2О
Сул ь ф и д ы цинка, кадмия и ртути (II) осаждаются по обменным реакциям из водных растворов:
HgCh + H2S = HgS 4 + 2НС1
CdSO4 + Na2S = CdS 4 + Na2SO4
Zn (NO3) 2 + K2S - ZnS 4 + 2KNO3
При попытке выделить сульфид диртути последний диспропорцио-нирует:
Hg2(NO3)2 + Na2S = Hg4 + HgS4 + 2NaNO3
Кристаллические сульфиды ртути (II) существуют в виде двух модификаций, отличающихся типом кристаллической решетки и своим цветом. Например, черная модификация сульфида ртути (II) осаждается по обменным реакциям из водных растворов. При нагревании выше 345 °C она превращается в красную модификацию. Минерал киноварь окрашен в ярко-красный цвет как раз за счет высокотемпературной модификации /З-HgS (см. табл. 14).
Все сульфиды элементов ПБ-группы малорастворимы в воде, от цинка к ртути их растворимость и термодинамическая устойчивость падают.
21.7. КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
У октаэдрических и тетраэдрических комплексных соединений элементов ПБ-групп отсутствует эффект стабилизации кристаллическим полем лигандов из-за полной заселенности электронами dy и d£ энергетических подуровней. По этой же причине большинство комплексных соединений цинка и кадмия бесцветны.
416
Комплексообразование объясняет ряд важных свойств цинка, кадмия и ртути. Так, в отличие от всех других d-элементов металлический цинк способен взаимодействовать с водным раствором аммиака, выделяя при этом водород:
Zn + 4NH3(P) + 2Н2О = [Zn(NH3)4](OH)2 + Hit
Кадмий образует малорастворимый в воде аммиакат {Cd(NH3)6]C12, превращающийся при хранении в [CdCNH^piChi — соединение цепочечной структуры, в которой ионы Cd2 расположены в центрах октаэдров, связанных между собой ребрами экваториального квадрата, содержащего в углах атомы хлора.
Устойчивость аммиакатов падает от цинка к ртути. Если пропускать аммиак через раствор соединений ртути, не подвергающихся в воде заметной электролитической диссоциации, то в присутствии значительных количеств солей аммония образуется белый кристаллический осадок аммиаката ртути, например:
NH4C1
HgC12 + 2NH3 = [Hg(NH3)2 JC12
Аммиакат взаимодействует с разбавленными кислотами:
[Hg(NH3)2]C12 + 2НС1 =HgC12 + 2NH4Cl
и разлагается водой с выделением аммиака:
Н2О
[Hg(NH3)2]C12 = HgC12 + 2NH3t
Когда в растворе нет солей аммония, то аммиакат не образуется, вместо него выделяется малорастворимый белый осадок соединений амидортути:
HgCh + 2NH3 = Hg(NH2)CU + NH4CI
Все соли ртути, подвергающиеся в воде электролитической диссоциации, взаимодействуют с аммиаком с образованием соединений нитриддиртути:
2[Hg(H2O)2]2+ + NO3 + 4NH3(p) = (Hg2N)NO3«H2O + ЗН2О + 3NHJ Аналогичные соединения образуются при действии водных растворов NH3 и КОН на некоторые ацидокомплексы ртути:
2 (Hgl4 ]2- + NH3<p) + ЗОН- - (Hg2N)I • Н2О + 7Г + 2Н2О
Уже небольшие количества (Hg2N)I • Н2О придают раствору желтоватый цвет, а при Значительном содержании — бурый с выделением осадка бурого цвета. Последнюю реакцию используют в аналитической практике для обнаружения следов аммиака и солей аммония в растворах. Водный раствор, содержащий KiIHgU] и КОН, получил название реактива Несслера.
Несслер Юлиус (1827 — 1905) — немецкий химик-аналитик.
Ртуть может образовывать комплексные соединения, аналоги аммиакатов, и с другими азотсодержащими лигандами, например гидразином (бидентатный лиганд) состава [Hg(N2H4) ]С1г и пиридином состава {Hg(py)2]C12.
14—1258 417
Цинк, кадмий и ртуть образуют многочисленные ацидокомплек-сы, преимущественно тетраэдрической структуры.
Для одного и того же комплексообразователя устойчивость тет-рагалогенидных комплексных соединений растет с переходом от хлора к иоду: [HgCUJ2 < [HgBr4]2 < [HgU] . Этот ряд соответствует росту донорной активности галогенид-ионов.
В частности, взаимодействие металлической ртути с водным раствором иодоводородной кислоты вызвано сильным комплексообразованием: оно настолько смещает равновесие вправо, что ртуть, стоящая в электрохимическом ряду напряжений за водородом, в этих условиях способна вытеснять его из кислоты:
HgOK)+4HI = H2[Hgl4] + H2t
Тетраиодомеркуратный анион, имея очень большое значение константы устойчивости /?4 = 5,6 • 10 29(25 °C), не разрушается даже в сильнощелочных средах. Лишь при добавлении к нему сульфид-ионов выпадает черный сульфид ртути:
[Hgl4 ]2' + S2" = HgS! + 4Г
Аквакатионы цинка, кадмия и ртути легко заменяют свои молекулы воды на анионы CN , превращаясь в устойчивые цианоме-таллатные анионы составов: [Zn(CN)4F , [Cd(CN)4]2 ,
[Cd(CN)6]2 , [Hg(CN)4]2 . Например:
[Zn(H2O)612+ + 4CN“ . [Zn(CN)4 ]2- + 6H2O
Известны также тиоцианатные комплексы составов [M(NCS)4]2_ и [M(NCS)6j , где M = Zn, Cd и Hg. Амбидентатный лиганд NCS связан с комплексообразователем М по-разному: Zn—NCS; Cd—SCN (за исключением Cs4[Cd(NCS)6]) и Hg—SCN. Устойчивость комплексов также возрастает от цинка к ртути.
Устойчивые гидроксокомплексы образует цинк и очень неустойчивые — кадмий. Ртуть гидроксокомплексов не образует. Получены комплексы состава M2[Zn(OH)4] и M2[Zn(OH)61, где М = К, Rb, Cs, а М' = Sr и Ва. При действии кислот гидроксокомплексы превращаются в аквакомплексы:
[Zn (ОН) 4 ]2- + 4НзО+ = [Zn (Н2О) 6 ]2+ + 2Н2О
а при нагревании — полностью разлагаются:
K2[Zn(OH)4] = K2(ZnO2) + 2Н2О
21.8. ПРИМЕНЕНИЕ
Цинк и кадмий в силу своей химической активности широко используют для поверхностной защиты металлов (и в первую очередь железа) от коррозии. Сульфиды цинка и кадмия (реже — ртути) —' пигменты минеральных красок, а также составные части люминофоров и полупроводниковых материалов (кинескопы цветных телевизоров, изделия электронной техники).
418
Высокая электрическая проводимость жидкой ртути обусловливает ее широкое применение в качестве электродного материала в электрохимических производствах (получение хлора, чистых металлов с помощью ртутных амальгам), а также в научно-исследовательских приборах (полярография и др.).
Цинк и кадмий — компоненты различных сплавов (цинк — латуни, нейзильбера, томпака и др., кадмий — сплав для припоев, подшипников, стержней ядерных реакторов и др.). Теллуриды кадмия CdTe и ртути HgTe — компоненты для изготовления приемников инфракрасного излучения, термоэлектрических генераторов и детекторов ядерного излучения. Некоторые соли ртути и цинка используют в качестве антисептиков, для консервирования древесины; сульфат цинка является одним из видов микроудобрений.
21.9. ТОКСИКОЛОГИЯ
Наибольшую опасность для человека представляет ртуть и ее соединения, поскольку они плохо выводятся из организма. Характерные признаки отравления: головная боль, набухание и кровоточивость десен, появление черной каймы на зубах (отложение HgS), воспаление слюнных и лимфатических узлов. Токсичны также соединения кадмия: при хронических отравлениях появляются желудочно-кишечные расстройства, быстрая утомляемость, шум в ушах. Наименее токсичен цинк, однако попадание паров металлического цинка или его солей вызывает у человека кашель, катары верхних дыхательных путей, одышку. Для детоксикации применяют яичный белок, молоко. В качестве профилактических мероприятий — работа с солями ртути и кадмия в резиновых перчатках, периодическое полоскание рта, тщательное мытье рук по окончании работы. Не допускается слив растворов солей кадмия и ртути в канализацию. Для сбора пролитой металлической ртути используют амальгамированные медные и жестяные пластины и кисточки, дезактивация проводится обработкой порошкообразной серой или раствором РеС1з.
Производство цинка и кадмия представляет экологическую опасность ввиду повышенной токсичности кадмия. Не менее опасно с точки зрения охраны природы и производство ртути, особенно бесконтрольное использование ее препаратов в сельском хозяйстве.
Упражнения к главе 21
1. Существуют пи гидроксокомплексы цинка и кадмия в воДных растворах при pH < 5?
2. Могут ли взаимодействовать металлические цинк и кадмий с водным раствором аммиака?
2- Что произойдет при длительном хранении водного раствора нитрата диртути?
Закончите уравнение реакции Zn + NOjj” + ОН” +
•НгО = ...
J. Какой минерал является основным источником про-мышпеиного получения ртути?
4- 8 каких условиях образуется аммиакат ртути (II)?
14*
419
7. Как протекает электролитическая диссоциация в водном .растворе HgCI2, Hg(NO3)2 и Hg(CN)2?
8. Закончите уравнение реакции HgCI2 + NHg = ...
9. Какие координационные числа наиболее часто встречаются у ацидокомплексов элементов ЦБ-группы?
10. Отличается пи взаимодействие с аммиаком нитрата ртути (II) от хлорида ртути (II)?
11. Закончите уравнения реакций:
НдС12 + СОз~ = ...
[Zn(H2O)6]2+ + СОз“ = ...
12. Почему пролитую металлическую ртуть обрабатывают порошкообразной серой ипи концентрированным водным раствором трихлорида железа?
ГЛАВА 22. ОБЩАЯ ХАРАКТЕРИСТИКА СВОЙСТВ ЭЛЕМЕНТОВ ШБ-ГРУППЫ
Первыми d-элементами с четвертого по седьмой периодической системы в соответствии с правилом Клечковского (см. раздел 4.4) являются скандий Sc, иттрий Y, лютеций Lu и резерфордий Rf.
Электронные конфигурации атомов Sc. Y, Lu и Rf равны соответственно [Аг]4х2ЗсГ; [Кг]5?4«Г; [Xe]6s24/145d1 и [Rn]7s25/146d’.
Начиная со скандия, иттрия, лютеция и резерфордия происходит систематическое заселение электронами nd-АО. Например, Lu: [Xe]6s24/*45a ; Hf: |Хе |6?4/145d ; Та: [Xe]6s24/145d3 и т. д.
Единая и устойчивая для элементов ШБ-группы степень окисления (III) связана с отдачей трех валентных электронов и с переходом к электронной конфигурации атомов предшествующих им благородных газов.
22.1. ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА ПРОСТЫХ ВЕЩЕСТВ
В виде простых веществ элементы ШБ-группы представляют собой пластичные металлы с серебристо-белой окраской (у скандия — с желтоватым оттенком) и высокой электрической проводимостью. Некоторые физико-химические свойства металлов приведены в табл. 27. Судя по изменению их температур плавления, можно сказать, что прочность химических связей в металлах возрастает при переходе от скандия к лютецию. Увеличение же температур кипения металлов в том же направлении свидетельствует об упрО' чении межатомных связей в жидком состоянии.
Посвоей химической активности металлы ШБ-группы превосходят алюминий, цинк и сопоставимы с магнием (у>мв/м/+ = —2,4 В).
420
На воздухе скандий и иттрий устойчивы, а лютеций покрывается белой оксидной пленкой. При нагревании металлы М активно взаимодействуют с кислородом, образуя оксиды состава М2О3, с азотом их реакция заканчивается превращением металлов в нестехиометрические нитриды MN*, при нагревании в атмосфере галогенов металлы переходят в тригалогениды М(На1)з, где Hal = F, Cl, Вг или I. С водородом металлы ШБ-группы образуют два вида солеподобных гидридов с ионной связью состава МНг и МНз и ряд твердых растворов. Насыщение металлов водородом при 25 °C приводит, как правило, к получению тригидридов МНз часто нестехиометрического состава.
Таблица 27. Некоторые свойства металлов ШБ-группы
Свойства Металлы
скандий иттрий лютеций
Температура плавления, °C 1541 1528 1663
Температура кипения, °C 2850 3322 3412
Плотность, г/см3 3,0 4,5 9.8
Стандартный электродный потенциал <р°, М/М3+, В —2,4 —2,4 —2,3
С водой металлы ШБ-группы медленно реагируют с выделением водорода:
2М + 6Н2О - 2М(ОН)з + 3H2f
Исключение — скандий, покрывающийся в воде малорастворимой оксид-гидроксидной пленкой.
Все металлы взаимодействуют с кислотами-неокислителями с выделением водорода:
М + ЗНзО+ + ЗН2О = [М(НгО)б]3+ + 1,5Нг!
Реакции с азотной и концентрированной серной кислотами протекают в соответствии с уравнениями:
Sc + 4HNO3 = Sc(NO3)3 + NOf + 2НгО
2Y + 6H2SO4 = Y2(SO4)3 + 3SO2t + 6H2O
С растворами и расплавами гидроксидов щелочных элементов скандий, иттрий и лютеций не взаимодействуют.
22.2. ОКСИДЫ И ГИДРОКСИДЫ
Оксиды элементов ШБ-группы состава М2О3 — бесцветные кристаллические вещества с высокими температурами плавления, равными 2280—2450 °C. Основность оксидов и гидроксидов растет от скандия к лютецию. Если SC2O3 с водой практически не взаимодействует, то реакция
LU2O3(k> + ЗНгО(ж) - 2Lu(OH)3(K>; &н° (298 К) = —41 кДж
421
является экзотермической. Оксид и гидроксид Sc(III) проявляют признаки амфотерности: при сплавлении их с гидроксидами щелочных элементов в расплаве появляются диоксоскандиаты:
SC2O3 + 2КОН = 2KScO2 + H2Of
Оксиды и гидроксиды иттрия и лютеция реагируют только с кислотами. Гидроксиды иттрия и лютеция поглощают из воздуха СОг, превращаясь в карбонаты МзСОз^иНгО, малорастворимые в воде. Все гидроксиды М(ОН)з выпадают в виде белых слизистых осадков при добавлении .к водным растворам солей скандия, иттрия и лютеция водных растворов гидроксидов щелочных элементов. Термическим разложением гидроксидов при умеренных температурах можно получить гидроксид-оксиды МО (ОН), после прокаливания которых остаются оксиды М2О3.
22.3. СОЛИ И КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
В водных растворах нитратов, хлоридов, бромидов и иодидов элементов П1Б-группы присутствуют аквакатионы состава [М(НгО)п]3+ с различным содержанием молекул воды во внутренней сфере (п = 4—9). Аквакатионы ведут себя как слабые катионные кислоты:
[Y(H2O)913+ + H2O=^ Н3О++ [Y(H2O)8(OH) ]2+;
Ак = 8,3*1О-10 (25 °C)
При переходе от скандия к лютеццю сила катионных кислот ослабевает, в связи с чем соли скандия подвергаются гидролизу в большей степени, чем соли лютеция.
К малорастворимым солям элементов ШБ-группы относятся карбонаты, оксалаты, фосфаты и фториды. Эти соли — бесцветные кристаллические вещества, способные к образованию ацидокомплексов в присутствии избытка своих анионов, например, (NH3)3[ScF6], Кз[У(СОз)2 1, K3[Sc(C2O4)3] и др. Большинство таких ацидокомплексов растворимо в воде. Среди сульфатов M2(SO4)3*nH2O наименее растворимым в воде является сульфат иттрия Y2(SO4)3*6H2O, Растворимость сульфатов уменьшается с увеличением температуры.
В избытке сульфат-ионов сульфаты образуют также ацидокомп-лексы, среди которых растворимыми в воде являются только сульфа-тоскандиаты, например Na[Sc(SO4)2] и Кз[8с(8О4)з]. В водном растворе сульфата калия растворимость сульфатоскандиатов в отличие от растворимости Кз[У(5О4)з] и Кз[Ьи(8О4)з] резко уменьшается.
22.4. РАСПРОСТРАНЕННОСТЬ В ПРИРОДЕ. ОСНОВНЫЕ МИНЕРАЛЫ
Элементы ШБ-группы относятся к малораспространенным^ Их кларки равны: Sc — 5«10 4 %, Y — 3*10~3 %, Lu — 1*10 % (резерфордий получен искусственно). Собственные минералы обра
422
зуют скандий и иттрий: тортвейтит Sc[Si2O?] и ксенотим YPO4. Лютеций входит в состав многих сложных по составу минералов, таких, как монацит (Се, La, Y, Th)PO4, лопарит (Na, Са, Ln, Ti, Nb, ...)дОз. Скандий и его аналоги добываются также при попутной переработке титаномагнетитовых, цирконий-и урансодержащих руд и касситерита SnO2. Крупным сырьевым источником скандия могут оказаться бокситы, содержащие до 0,01 % SC2O3.
История открытия элементов. Исторически первым, в виде металла, был выделен иттрий при восстановлении его хлорида натрием (1828 г. Велер). В 1871 г. Д. И. Менделеев, опираясь на только что открытый им периодический закон, достаточно точно описал свойства нового, еще не открытого элемента ШБ-группы, эка-бора. В 1879 г. Нильсон выделил этот элемент из минерала гадолинита Be2(Y, Sc)2Fe(Si04>202 и назвал его скандием в честь своей родины Скандинавии. Лютеций открыл в 1907 г. Урбэн. Первые атомы резерфордия были получены Флеровым в 1965 г. при помощи ядерной реакции
i?Am+J8O=i^Rf+5in
Урбэн Жорж (1872—1938) — французский химик, физик и музыкант, профессор Парижского университета.
Флеров Георгий Николаевич (1913 — 1990) — русский физик, открыл спонтанное деление ядер урана-238 и элементы с Z= 102-107.
22.5. ПРИМЕНЕНИЕ
Трудности извлечения, концентрирования и разделения скандия, иттрия и лютеция сдерживают их широкое использование, однако существует ряд узких, но важных областей их применения, где затраты на добычу окупаются. Так, металлический иттрий, благодаря своему малому сечению захвата нейтронов, используется при строительстве ядерных реакторов. Незначительные добавки иттрия к легированным сталям и другим сплавам существенно улучшают их эксплуатационные качества, особенно в области высоких температур.
Из оксидов скандия и иттрия изготавливаются лазерные, а также ферромагнитные материалы и люминофоры, необходимые современной электронной технике. Тугоплавкость оксида иттрия Делает его незаменимым компонентом огнеупорной прозрачной керамики.
22.6. ТОКСИКОЛОГИЯ
Воздействие Sc, Y, Lu на человека наблюдается в основном при добыче, обогащении и переработке руд, при получении оксидов и солей из-за радиационного воздействия примесей Ac, Th и U.
423
Упражнения к главе 22
I. Как протекает протолиз аквакатиона [У(Н2О)8]3+?
2. Взаимодействуют пи с водой металлические скандий и лютеций?
3. Что происходит со Sc2O3 и LuO(OH) при нагревании выше 1000 ”С?
4. Через спой У2О3 пропустили воду. Какое вещество можно обнаружить в фильтрате?
S. Допишите уравнение реакции Sc(NO3)3 + К2$ + Н2О =
6. Гидроксид лютеция оставили в открытом сосуде. Какое вещество обнаружили в нем по истечении недели?
ГЛАВА 23. ХИМИЯ ЭЛЕМЕНТОВ 1УБ-ГРУППЫ
В IVB-группу входят четыре элемента, три из которых — титан Ti, цирконий Zr, гафний Hf — обнаружены в природных минералах, а четвертый — курчатовий Ku — синтезирован искусственно путем ядерных реакций. Общая электронная конфигурация невозбужденных атомов: ns2(и — \)ст (валентные электроны) предопределяет устойчивую степень окисления (IV) в типичных соединениях МОг, MF4, МСЦ, М(8О4)2*4НгО (М = Zr, Hf); (Кг, Ti)O3. Для титана (и в меньшей степени для циркония) существуют также неустойчивые степени окисления II и III: TiF2, TiCh, ZrFz, Z1CI2, TiFa, TiCla, ZrC13, связанные с отдачей металлов двух s- (II) или двух s- и одного J-электрона (III). Приведенные соединения проявляют сильные восстановительные свойства, возрастающие от титана к цирконию. Соединений гафния со степенью окисления (II) и (III) известно очень мало. Для соединений в степени окисления (IV) возможно проявление окислительных свойств, действительно встречающихся у Ti (IV) и не характерных для циркония и гафния. В целом можно сказать, что в IVB-группе проявляется общее свойство всех J-элементов: по группе сверху вниз стабилизируется высшая степень окисления [в данном случае (IV) ] и падает устойчивость низших степеней окисления.
С ростом степени окисления увеличивается ковалентная составляющая химической связи. Если тетрахлориды МСЦ — ковалентно связанные соединения, газообразные молекулы которых имеют тетраэдрическое строение вследствие sa-гибридизации АО центрального атома, то низшие хлориды, и особенно фториды TiF2, TiC12, ZrF2, ZrCh, представляют собой ионные, солеподобные соединения.
Лантаноидное сжатие, отсутствовавшее у элементов предшествующей ШБ-группы, существенно сказывается на близости размеров радиусов циркония и гафния — атомных: Zr —- 160 пм, Hf 159 пм; и ионных (координационное число 6): Zr (IV) — 86 пм и Hf (IV) — 85 пм. Это приводит к необычайному сходству всех
424
свойств этих элементов и их соединений, что создает большие трудности для разделения Zr и Hf.
Титан (IV), цирконий (IV) и гафний (IV) не образуют кислот, например типов Н4МО4, Н2МО3, ни гидроксидов, ни даже стехиометрических гидратов их диоксидов. Отличительной особенностью рассматриваемых элементов является образование ими в водных растворах сложных аквагидроксокомплексов, а в расплавах — двойных оксидов типа (К2, ТООз (см. раздел 2.4).
Элементы IVB-группы не образуют в водных растворах нитратов, сульфатов, карбонатов и фосфатов из-за необратимого гидролиза этих солей и высокой склонности Ti, Zr и Hf к образованию одно-и полиядерных комплексов с анионами SO2', СОГ, РОГ, NO3 в качестве лигандов, например [Ti(SO4)3]2 , [Т1(НгО)з(Н5О4)(ОН)г]+ и др.
Нитраты, сульфаты и другие подобные соединения получают либо в безводных средах, либо при сплавлении с реагентами, служащими источником нужных анионов:
t
Т1О2 + 2K2S2O7 = Ti(SO4)2 + 2K2SO4
ZrCl4 + 4N2O5 = Zr(NO3)4 + 4NO2C1
В силу диагональной периодичности Ti (III) проявляет сходство с Al (III), a Ti (IV), Zr (IV), Hf (IV) — с Ge (IV), Sn (IV) и Pb (IV). Например, сходен состав аквакатионов [Т1(НгО)бГ и [А1(НгО)б1 или двойных солей (квасцов) КТ1(8О4)2-12НгО и KA1(SO4)2,12H2O, одинаково высока склонность к гидролизу у галогенидов элементов IVB- и IVA-групп, заметна аналогия в составах комплексных анионов [TiCU]2- и [SnC16j и т. д.
Характерные координационные числа, проявляемые элементами IVB-группы, в своей высшей степени окисления растут от 4 и 6 у титана, до 6, 7 и 8 у циркония, 7 и 8 — гафния (IV): [TiF6j -» - [ZrF7r- [HfFs]4.
23.1. РАСПРОСТРАНЕННОСТЬ В ПРИРОДЕ. ОСНОВНЫЕ МИНЕРАЛЫ
Титан, цирконий, гафний обычно относят к редким элементам, хотя по распространенности среди элементов титан, например, занимает 10-е место. Кларки Ti, Zr и Hf равны соответственно 0,41, 2,Ы0 2 и 4,2-10~4 %.
Важнейшие минералы титана: .рутил Т1О2, ильменит (Fe, ТЬОз, перовскит (Са, ТООз, титаномагнетит (Fe, Ti)O3-«(Fe, Fe2)O4- Основные месторождения титана находятся На Урале (Ильменские горы), в Хибинах и в районе Ловозерской тундры (ильменит). Цирконий представлен в природе минералом Мделеитом ZrO2 и цирконом ZrSiO4. Последний най-Ден в Приднепровье. Гафний собственных минералов не образует, Но присутствует как примесь во всех минералах циркония. Кроме
425
того, титан, цирконий и гафний всегда присутствуют в минералах, образуемых их ближайшими соседями по периодической таблице — элементами П1Б-, VB-групп. Так, налажено извлечение титана из минерала лопарита (Na, Са, Sr, La, Nb, Ti)i±xO3, добываемого на Кольском полуострове.
История открытия элементов. Титан был открыт в 1791 г. Грегором в минерале рутиле. Цирконий был обнаружен в 1789 г. Клапротом в минерале цирконе. Существование гафния было предсказано в 1895 г. Томсеном, но открыт этот элемент был только в 1922 г. Хевеши и Костером при анализе рентгеновских спектров циркония. Оказалось, что цирконий постоянно сопровождает еще один элемент с порядковым номером 72, который и назвали гафнием по имени старинного названия столицы Дании — Копенгагена (Hafnia).
Курчатовий был открыт в 1964 г. группой физиков, руководимых академиком Флеровым, в продуктах адерной реакции
942Pu + wNe - imKu + 4и°
и назван в честь выдающегося физика Курчатова.
Грегор Уильям (1761 — 1817) - английский священник, минералог.
Томсен Юрген (1826—1909) — датский профессор химии, один из основоположников термохимии.
Хевеши Дьердь (1885—1966) — венгерский профессор физической химии, лауреат Нобелевской премии.
Костер Дирк (1889—1950) — нидерландский физик.
Курчатов Игорь Васильевич (1902—1960) — крупнейший русский исследователь в области ядерной физики, академик.
23.2. ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ
Чистые, беспримесные Ti, Zr и Hf — серебристо-белые, пластичные металлы, обладающие высокими температурами плавления, равными соответственно 1668, 1855 и 2227 °C. Если металлы содержат примеси N, О и С, то их механические свойства резко меняются: они становятся хрупкими.
В электрохимическом ряду напряжений (см. раздел 7.10) титан, цирконий и гафний находятся где-то рядом с алюминием (^>ai/ai3+ ® “ ~1,70 В), однако точное определение их Стандартных электродных потенциалов затруднительно, поскольку поверхность металлов быстро покрывается при контакте с воздухом пленкой оксида и нитрида, придающей металлам высокую коррозийную стойкость. Поэтому в отличие от алюминия титан, цирконий и гафний не реагируют при комнатной температуре с кислотами-неокислителями и не взаимодействуют с водой. Лишь фтороводородная кислота способна перевести эти металлы в водорастворимые комплексные кислоты:
2Ti + 12HF = 2Нз[Т1ШЕб] + 6H2t
Zr + 6HF = H2[ZrF6] + 2H2f
426
Цирконий и гафний в отличие от титана образуют при этом соединения, в которых они имеют степень окисления (+ IV).
Нагревание способствует проявлению химической активности металлов. Титан, например, взаимодействует с водяным паром с выделением водорода:
Ti(K) + 2НгО(Г) = TiO2(K) + 2НгГ
Он же реагирует с нагретыми соляной и разбавленной серной кислотами с образованием фиолетовых растворов Ti (III), состав катионов в которых зависит от кислотности и концентрации раствора, вида аниона. В фиолетовых растворах Ti (III) обнаружены, в частности, катионы составов [Ti(H2O)61 , [Ti(H2O)4SO4]+ и др. В слабокислых растворах аквакатион [ТЦНгСОбГ довольно устойчив, окислению и протолизу подвергается медленно. Поэтому взаимодействие Ti с разбавленными галогеноводородными и серной кислотами можно передать реакцией
2Ti + 6НзО+ - 2[Ti(H2O)6 ]3+ + 3H2t
В азотной кислоте любой концентрации Ti, Zr и Hf пассивируются (см. раздел 13.10), а с серной кислотой титан дает оксид-сульфат титана (IV):
Ti + 3H2SO4 = Ti(SO4)O + 2SO2T + ЗН2О
цирконий и гафний — комплексные кислоты:
Hf + 5H2SO4 = H2[Hf(SO4)3] + 2SO2t + 4НгО
Оксид-сульфат титана (IV) Ti(SO4)O содержит не катион тита-нила TIO , а зигзагообразные полимерные цепочечные катионы
(TiO)n” + 1 (с повторяющимся фрагментом —Ti—О—Ti—), объеди-I I
няемые анионами soi-.
Цирконий и гафний не взаимодействуют с растворами и расплавами МОН даже в присутствии окислителя, отличаясь тем самым от титана, который с такими реагентами вступает в реакцию, приводящую к образованию двойных оксидов:
Ti + 6КОН + ЗО2 - 3(Кг,Т1)Оз + ЗН2О
Все три металла пирофорны — в тонкодисперсном состоянии возгораются на воздухе от искры, при 200 °C пыль Ti и Zr способна взрываться. При температуре более 600 °C компактные металлы сгорают в кислороде с образованием диоксидов ТЮг, ZrOz, НЮ2, при нагревании выше 800 °C взаимодействуют с азотом, образуя нитриды ~ TiN, ~ ZrN, нагревание Металлов в атмосфере галогенов приводит к получению тетрагалогенидов TiCU, TiF4, ZrBr4, НАЦ. При нагревании выше 800 °C титан и его аналоги реагируют практически со всеми неметаллами, образуя сульфиды ~ MS2, карбиды
МС, бориды ~ мВ, фосфиды ~ МР и т. д.
Порошкообразный титан поглощает водород уже при комнатной
427
температуре. Гидриды титана, циркония и гафния обладают металлической проводимостью и являются нестехиометрическими соединениями МН2-х (х = 05).
23.3. ПОЛУЧЕНИЕ МЕТАЛЛОВ
Металлические титан, цирконий и гафний в виде губчатой массы получают высокотемпературным восстановлением в инертной атмосфере тетрахлоридов или комплексных фторидов расплавленным металлическим натрием или магнием:
TiCh(r) + 2Mg<>K) - Ti(K) + 2MgC12(>K)
Кг[НГРб](ж) + 4Na<>K) = Hf(K) + 2КГ(ж) ? 4NaF<»)
Металлическую губку затем переплавляют в электродуговых печах в компактные слитки.
Металлы особой чистоты получают при помощи метода иодидного рафинирования. Метод основан на взаимодействии металлов при нагревании с газообразным иодом, переносе MI4 в высокотемпературную зону, термической диссоциации тетраиодидов, кристаллизации металлов на накаленной металлической нити и возвращении иода в низкотемпературную реакционную зону:
М + 212(г) Ml4(r) М + 21г<г>; ti < /2
Реакция протекает в вакууме (0,01 Па), до 200 °C образуется MI4, выше 200 °C — MI2.
23.4. ХИМИЯ ВОДНЫХ РАСТВОРОВ
Титан (III) в подкисленных водных растворах существует в виде окрашенного в фиолетовый цвет аквакатиона [Ti(H2O)6] . В избытке хлоридных и сульфатных ионов может быть получен его гидратный изомер [Т1(НгО)4С12]+ с зеленой или [Ti(H2O)4SO41 с голубой окраской. Под действием кислорода воздуха Ti (III) в водных растворах постепенно окисляется:
4[Т1(НгО)б]3+ + 2Н2О + Ог = 4[Ti(H2O)4(OH)2]2+ + 4Н3О+
Поведение Ti(IV), Zr(IV) и Hf(IV) в водных растворах осложняется прохождением полного гидролиза их соединений. В зависимости от значения pH в водном растворе могут присутствовать частицы различных составов:
[Ti(H2O)4(OH)2]2+.~ - |Т1(Н2О)з(ОН)зГ. ' [Ti(H2O)2(OH)4]°
рН< 1 рН>1 рН>3
С дальнейшим ростом pH содержание гидроксогрупп все больше возрастает и приводит к выпадению осадка гидроксоаквакомплексов. Однако и в кислых растворах (при рН<3) при нагревании или длительном их хранении идут процессы полимеризации с образованием многоядерных комплексных частиц вида [Ti4(H2O)i6(OH)8T с мо
428
стиковыми гидроксогруппами (процессы оляции). Подобные катионы найдены также в солях циркония (IV) и гафния (IV).
Гидролиз солей титана (IV) не заканчивается процессом оляции, а протекает дальше, переходит в процесс оксоляции —- образования
I I
цепочечных оксоструктур (—Ti—О—Ti—)п: । I
>TiC TiC- ^Ti—О—Ti^ + НгО
ин i t.
Связь Ti О в этих цепях упрочняется за счет дополнительного dK—рл-взаимодействия. Таким образом, используемая для простоты запись состава солей в виде мономеров ZrOC12*8H2O, ZrO(NO3)2«2H2O, HfOF2, TiOCl2*2H2O, TiOSO4 *21120 и т. д. является условной и не отражает реального сложного их состава и структуры.
23.5. ОКСИДЫ И ГИДРОКСИДЫ
Все оксиды титана, циркония и гафния — нестехиометрические соединения. Титан образует оксиды гомологического ряда TinO2n-i, число которых может доходить до 40 и более (TiO, Ti2O3, TisOs, Т14О7 и т. д.). Оксиды этого ряда имеют слоистую структуру, образованную цепями октаэдров, сочлененных по общим граням, ребрам или углам.
Золотисто-желтый TiO(i ± Х) скорее представляет собой твердый раствор кислорода в титане, чем оксид, так как у него преобладают металлические свойства: высокая электрическая проводимость и способность взаимодействовать с кислотами с выделением водорода:
2ТЮ + 6НзО+ + 4Н2О = 2[Ti(H2O)613+ + H2t
Фиолетовый оксид состава ИгОз, как и TiO, при нагревании на воздухе окисляется до TiO2, с водой не взаимодействует, а в разбавленных серной и соляной кислотах превращается в сульфаты и хлориды Ti(III).
Диоксиды TiO(2 ± х), ZrO(2 ± Х) и HfO(2 ± х) являются белыми кристаллическими диамагнитными веществами, способными образовывать несколько полиморфных модификаций. Так, у диоксида титана известны три полиморфные модификации: рутил, анатаз и брукит.
Гидроксиды у рассматриваемых элементов неизвестны. При добавлении оснований к растворам соединений М (IV) выпадают бесцветные, гелеобразные осадки, содержащие переменное число молекул воды МО2*хН2О (M=Ti, Zr, Hf). Свежеосажденные гидратированные Диоксиды — химически активные соединения, они могут взаимодействовать с водными растворами сильных оснований и их расплавами, образуя либо гидроксокомплексы, либо различные двойные оксиды:
TiO2«xH2O + 2КОН(Р) - K2[Ti(OH)61 + (х—2)НгО
ZrO2«xH2O + 4КОН(Ж) - (K4,Zr)O4 + (х+2)НгО
429
Прокаленные диоксиды, практически полностью потерявшие воду, — тугоплавкие, химически инертные вещества. Они не взаимодействуют ни с водой, ни с кислотами (кроме HF), ни с расплавами гидроксидов щелочных элементов. С такими оксидами возможны только реакции:
ZrO2 + 6HF = Н2 [ZrF6 ] + 2НгО
ТЮг + КгЗгОтсж) = Ti(SO4)O + K2SO4
ZrO2 + 2К28гО7(ж) = К2 [Zr(SO4)2O ] + K2SO4 + SO3(r) t
23.6. КОВАЛЕНТНЫЕ СОЕДИНЕНИЯ
Элементы IVB-группы не образуют, за небольшим исключением, солей, если под солью понимать вещества, содержащие катионы и анионы, переходящие в раствор при полной или частичной электролитической диссоциации этого вещества. Рассмотренные выше сульфаты Ti(SO4>2, Ti(SO4)O, нитраты Ti(NO3)4, а также все тетрагалогениды, кроме фторидов, являются ковалентными соединениями.
Молекулы тетрагалогенидов в газообразном состоянии имеют тетраэдрическое строение, обусловленное sd-гибридизацией АО центрального атома. Наличие еще двух вакантных d-AO объясняет возможность дополнительного d-л—р^-взаимодействия в молекуле в виде делокализованных Л-связей (эффективный заряд Ti (IV) равен +0,25 е ):
При комнатной температуре все тетрагалогениды представляют собой твердые вещества, за исключением жидкого TiCU (т.кип. 136 °C). Хлориды, бромиды и иодиды М (IV) имеют молекулярные кристаллические решетки, фториды — ионные, поэтому первые обладают высокой летучестью. При переходе от MCI4 к MI4 температуры плавления и кипения галогенидов растут.
Все галогениды с молекулярной кристаллической решеткой подвергаются полному гидролизу, но в разной степени:
TiCl4 + (х+2)НгО - ТЮг’хНгО + 4НС1
ZrCk + Н2О = ZrChO + 2НС1
Оксид-дихлорид циркония (IV) кристаллизуется из водных растворов в виде тетрамера:
430
(ZrC12O-8H2O)4 • [Zr4(H2O)i6(OH)8]C18«12H2O
Гидролиз TiCl4 протекает даже в 36 %-ной хлороводородной кислоте: TiCl4 + 6Н2О = [Ti(H2O)4(OH)2]Cl2 + 2НС1
Продукт гидролиза может быть выделен в виде бесцветных кристаллов состава [Ti(H2O)4(OH)2]Cl2e2H2O.
23.7. КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
Элементы IVB-группы образуют многочисленные ацидокомплек-сы и полиядерные гидроксооксоаквакомплексы. Устойчивость аци-докомплексов с галогенидными лигандами падает от F к Г и растет при переходе от титана к гафнию. Известны комплексы составов H2[TiC16], K3[ZrF7], Na4[HfFs] и др. Прочные комплексы, не подвергающиеся гидролизу, образуют титан и цирконий с оксалатными анионами, например H2[Ti(ox)20] и H4[Zr(ox)3OJ.
Цирконий и гафний в водных растворах H2SO4 находятся в виде комплексных анионов полимерной природы разного состава, в частности [Zr(SO4)3O ]n”~, [Zr(SO4)3OH |?” и другие, которые в присутствии сульфатов щелочных металлов могут быть выделены в виде кристаллических осадков переменного состава: M4[Zr4(S04)4-6(OH)8-ioOi-2]*xH20. При добавлении Н2О2 к кислым водным растворам соединений Ti (IV) или к суспензии све-жеосажденного ТЮг’хНгО образуются устойчивые пероксокомп-лекСы, придающие раствору интенсивную оранжевую Окраску. Состав пероксокомплексов зависит от состава раствора. Свежеосаж-денный ТЮг’хНгО взаимодействует с Н2О2 с образованием [Ti(H2O)O(O2) 1°, из кислых растворов могут быть получены пероксокомплексы составов: [Ti(SO4)O§]°, K2[Ti(SO4)2(O5) рЗНгО, 1П(Н2О)з(ОН) (О§) ]С1 и другие (пероксогруппу в комплексах обозначают 05 для отличия от молекулярного кислорода как лиганда).
Для связывания в мягких условиях атмосферного азота применяют алкоголяты титана (II) Ti(0R)2, где R—СНз, С2Н5, С4Н9 и другие радикалы: Ti(OR)2+N2=[Ti(N2) (0R)2j. Полученные соединения, точный состав которых неизвестен, называют нитрогенилами (по аналогии с карбонилами).
Нитрогенилы титана позволяют при их восстановлении превратить молекулы связанного азота в аммиак или гидразин:
[Ti (N2) (OR) 2] + 4НзО+ + 4е~ - N2H4 + Ti(0R)2 + 4НгО
Однако такие реакции не способны пока конкурировать с промышленными процессами синтеза аммиака.
При сплавлении в вакууме при температуре около 800 °C MgCl2 и очищенной титановой «губки» (очень пористого титана, получаемого восстановлением TiCl4 магнием или натрием) образуется сплав, который в измельченном состоянии способен также поглощать
431
азот из воздуха. После обработки в среде толуола суспензии насыщенного азотом сплава такими реагентами, как Li[AlH4], НС1 и КОН, наблюдается восстановление N2 до NH3 с выделением последнего из реакционной смеси. Состав продуктов всех реакций пока до конца не установлен (см. также разделы 15.2 и 27.7).
23.8. ПРИМЕНЕНИЕ
Металлические титан и цирконий широко используют в качестве легирующих добавок к сталям для повышения их прочности, коррозионной стойкости (особенно титан), вязкости и твердости, в частности для бронебойных сталей. Металлический титан ввиду своей легкости и термостойкости незаменим для ракете- и самолетостроения. Малое сечение захвата нейтронов у циркония позволяет использовать его как конструкционный материал ядерных реакторов; у гафния же, наоборот, сечение захвата велико, и из него изготавливают регулировочные стержни тех же реакторов для замедления нейтронов.
Из карбидов и нитридов титана и циркония, обладающих высокой твердостью, изготавливают резцы, сверла, шлифовальные материалы. Оксид и хлорид титана катализирует ряд органических реакций. В больших масштабах используют оксид титана для приготовления белил, как наполнитель пластмасс и в качестве добавок к фарфору и керамике.
23.9. ТОКСИКОЛОГИЯ
Мелкодисперсные титан и оксид титана (IV) при их содержании в воздухе выше 10 мг/м-5 вызывают отек легких, эмфизему. Отравление соединениями циркония проявляется болями в сердце, потливостью, головными болями. При хронических отравлениях отмечается снижение содержания гемоглобина в крови. Оксид и карбид гафния относят к малотоксичным соединениям.
Рабочие, занятые в производстве губчатого титана, подвергаются воздействию паров титана, его тетрахлорида, хлора и хлорида магния, что приводит к почти 90 %-ной заболеваемости дыхательных путей, носа, глотки и гортани. Попадание на кожу брызг нагретого T1CI4 вызывает ожоги.
Гексафтороцирконаты относят к промышленным ядам токсического действия.
Упражнения к главе 23
1. Чем отличается характер взаимодействия фтороводородной кислоты с титаном и цирконием?
2. Диоксид титана нагрели вместе с дисульфатом калия до образования расплава. Какие продукты реакции обнаружили в застывшем расплаве?
432
3. Что произойдет с Ti(NO3)4 при попытке его растворения в воде?
4. Какие комппексные соединения титана называют нит-рогениЛами?
5. Какие частицы Ti(IV) присутствуют в водном растворе при pH К в
6. Будет пи взаимодействовать метаппический титан с расплавом, содержащим гидроксид и нитрат капия?
7. Какие катионы содержат кристаллы Ti(S04)0?
ГЛАВА 24. ХИМИЯ ЭЛЕМЕНТОВ УБ-ГРУППЫ
В УБ-группу входят ванадий V, ниобий Nb, тантал Та и нильсборий Ns. Электронная конфигурация невозбужденных атомов V, Та и Ns:ns2(n—1)</3 (валентные электроны); в атоме ниобия энергетически более выгодной является конфигурация [КгМА1.
Степень окисления (V) является общей, характерной для всех элементов группы, у Nb, Та и Ns она же и самая устойчивая в их соединениях, например Nb20s, NbFs, TaCls, NsCb. Степень окисления (V) у ванадия стабильна только в соединениях с фтором и кислородом: VF5, V2O5, VOF3. В обычных условиях наиболее устойчива для ванадия степень окисления (IV), связанная с отдачей двух s- и двух rf-электронов и реализуемая в соединениях УОг, УСЦ, [V(H2O)5O]SO4. Соединения V(V) проявляют окислительные свойства, a Nb и Та в степени окисления (IV) — восстановительные.
Среди элементов УБ-группы низшие степени окисления (И) и (Ш) обнаружены только в соединениях ванадия. В степени окисления (III) ванадий напоминает своих соседей по периоду Ti и Сг (III). В степенях окисления (II) и (III) ванадий проявляет сильнейшие восстановительные свойства.
С увеличением степени окисления растут кислотные свойства оксидов и гидроксидов. Если VO и V(OH)2 обнаруживают основные свойства, то V2O3 и VO2 — амфотерные с преобладанием основных свойств, а у V2O5 и У2О5*хНгО явно преобладает кислотный характер.
Переход от ванадия к ниобию сопровождается весьма существенным изменением в химических свойствах соединений этих элементов. Так, в ряду амфотерных оксидов V2O5—Nb20s—ТагОз кислотные свойства резко уменьшаются от ванадия к ниобию. Как и Следовало ожидать, кислотные свойства оксидов VB-группы выражены сильнее, чем у элементов IVB-группы: если ТЮг взаимодействует с гидроксидами щелочных металлов только в расплавах, то V(J2 и V2O5 реагируют и с их растворами.
433
Ниобий и тантал не образуют простых солей* типа нитрате и сульфатов. Ванадий, ниобий и тантал — активные комйлексообра-зователи. В низших степенях окисления они оказываются в/катионной части комплекса [У(НгО)б] , [У(НгО)б1 , [УСНгОУзО] , а в высшей (V) — в анионной: [VF& ] , [NbOFei , [TaF?]2-, [TaFs]3^, [VO (0§) з I3-. Координационное число ванадия равно, как правило, 6, ниобия и тантала — 7 и 8.
24.1. РАСПРОСТРАНЕННОСТЬ В ПРИРОДЕ. ОСНОВНЫЕ МИНЕРАЛЫ
Содержание ванадия в земной коре больше, чем меди, свинца и цинка, его кларк равен 1,5*1(Г2%. Тем не менее ванадий относят к рассеянным элементам, так как он не имеет крупных месторождений собственных минералов, а чаще всего встречается в свинцовых, титановых, железных и урановых рудах, в каменных углях и нефти. Ванадий принадлежит к самым распространенным рассеянным элементам. Во многих странах основная доля ванадия вырабатывается из различного рода железных руд, содержащих до 1% ванадия, например из титаномагнетита (Fe, Ti)03»n(Fe, Fe2)O4. Другой источник получения ванадия — комплексная переработка урансодержащих руд, в частности тюямунита Ca(UO2)2(VO4)2«8H2O.
Минералы ванадия: патронит V(S2>2 и ванадинит Pb5(VO4)3CI — встречаются редко.
Распространенность ниобия (10~3%) и тантала (2*104 %) меньше, чем ванадия. Их основные минералы — к,о л у м б и т (Fe, Мп, Nb2)O6, танталит (Fe, Мп, ТагЮб, часто встречающиеся в виде твердых растворов. Крупным сырьевым источником получения ниобия и тантала служат пирохлор (Са, Na, Nb2)O6F и лопари т (Na, Са, Sr, Ln, Nb, Т1)<1±Л)0з — двойной оксид сложного нестехиометрического состава. В лопарите содержатся La, Се, Рг, Nd и другие лантаноиды (Ln).
История открытия элементов. Первым из элементов УБ-группы был открыт тантал (1802 г., Экеберг). Ванадий был открыт дважды: вначале в мексиканской свинцовой руде (1801 г., Дель-Рио), а затем в чугуне, полученном из шведской железной руды (1831 г., Сефстрем). Ниобий был обнаружен как примесь во всех минералах тантала (1844 г., Розе). Нильсборий был синтезирован при помощи реакции (1970 г., Флеров):
9s3Am + ioNe -» io5Ns+4n°
Экеберг Андрес (1767—1813) — шведский учитель химии и минералог.
Дель-Рио Андрес Мануэль (1764—1849) - мексиканский профессор минералогии и химии.
Сефстрем Нильс (1787—1845) — шведский химик, сотрудник Берцелиуса, известен своими работами в геохимии.
Розе Генрих (1795—1864) — немецкий профессор химии, иностранный чпеи-корреслондент Петербургской АН.
24.2. ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ
Ванадий, ниобий и тантал в виде простых веществ представляют собой тугоплавкие металлы (т.пл.: V 1917 °C, Та 3014 °C) серебристо-белого цвета. Ковкость металлов возрастает от V к Та.
Физико-химические свойства металлов зависят от их чистоты. Чистые металлы достаточно пластичны и относятся к химически активным веществам. Присутствие же в их поверхностном слое незначительных примесей оксидов, нитридов и карбидов превращает металлы в твердые и хрупкие вещества с возрастанием их пассивности к воздействию кислот от V к Та. Поэтому технические металлы ни с водой, ни с кислотами-неокислителями не взаимодействуют (см. раздел 7.11). Исключение составляет более реакционноспособный ванадий, реагирующий за счет комплексообразования с фтороводородной кислотой:
2V + 12HF = 2Нз [VInF6 ] + ЗНг Г
Подобные реакции у ниобия и тантала идут крайне медленно, в кислотах-окислителях они пассивируются и взаимодействуют только со смесью фтороводородной и азотной кислот:
ЗТа + 5HNO3 + 21HF = ЗН2 [TaF7 ] + 5NO f + 10Н20
Ванадий в отличие от ниобия и тантала реагирует с концентрированной азотной кислотой, а при нагревании — и с концентрированной серной:
V + 3H2SO4 + 2НгО = [V(H2O)5O ]SO4 + 2SO21
V + 6HNO3 = (VO2)NO3 + 5NO2 f + ЗН2О
Ванадий, ниобий и тантал не взаимодействуют с растворами гидроксидов щелочных металлов, но в присутствии кислорода воздуха или других окислителей (KNO3, КСЮз) вступают в реакции с расплавами, например
4Nb + 12К0Н(ж) + 502 = 4K3NbO4(«) + 6Н2О
При нагревании ванадий, ниобий и тантал сгорают в кислороде с образованием пентаоксидов М2О5, реагируют с азотом с образованием очень твердых, химически инертных нестехиометрических нитридов VNX, NbNj, TaNx. Гидриды состава МНХ (х<1) образуются при непосредственном воздействии на металлы водорода. Продукты Реакции наряду с нестехиометрическим гидридом содержат и твердые растворы водорода в металле.
С фтором металлы (М) вступают в реакцию при комнатной температуре, образуя MF5, при нагревании — с хлором и другими - галогенами с образованием VCI4, NbCb, TaCls, УВгз, VI3. В расплавах серы металлы дают нестехиометрические сульфиды ~ V2S3, ~ ТагВз; большую твердость и термостойкость имеют образующиеся при высокотемпературном синтезе из элементов нестехиометриче-Ские карбиды ~ VC; ~ NbC; ~ ТаС (см. раздел 29.4).
435
24.3. ХИМИЯ ВОДНЫХ РАСТВОРОВ
Водорастворимые соли ниобия и тантала в низших степенях окисления крайне неустойчивы, водой быстро окисляются до устойчивой степени окисления (V):
2ТаС1з+(х+5) H2O=Ta2Os*xH2O+6HCl+2H2 f
Соли ванадия (II) VCI2, VSO4 образуют аквакатиоъы [V(H2O)e) ]2+, придающие раствору фиолетовую окраску. Они быстро окисляются даже водой с образованием аквакатиона V(III):
2 [V(H2O)6 J2++2H2O=2 [V(H2O)6 ]3++2ОН'+Н2 f
Ион [У(НгО)б]3+ придает водному раствору характерную зеленую окраску. Для V(III) свойственно образование двойных солей типа квасцов KVin(SO4)3*12H2O, подобных тем, которые образуют Ti(III), АЦШ), Сг(Ш), Мп (III).
Выступая в роли сильных восстановителей, соли V(III) взаимодействуют с кислородом воздуха и с течением времени переходят в окрашенные в водном растворе в голубой цвет соединения, содержащие катионы оксопентаакваванадия (IV):
4 [У(НгО)б ]3+ + Ог = 4 [У(НгО)5О ]2+ + 4Н+ + 2Н2О
Катион [V(H2O)sO]2+ очень устойчив; он не разрушается ни при действии сильных оснований, ни при действии сильных кислот: [V(H2O)5O]2+ + 20Н~- [V(H2O)5O](0Н)2| [V(H2O)sO ](0Н)2 + 2НзО+ - [V(H2O)sO ]2+ + 4Н2О
У Nb(IV) и Та (IV) подобных катионов не обнаружено. Хлорид тантала (IV), например, в водном растворе диспропорционирует:
4ТаС14+(х+5)Н2О=2ТаС1з+Та2О5«хН2О+ЮНС1
Для V(V), Nb(V) и Ta(V) химия водных растворов особенно сложна. В частности, поведение водорастворимых солей ванадия (V) определяется их концентрацией и значением pH (рис. 88). В сильнокислых растворах (рН<4) и при малых концентрациях ванадия (<0,01 моль/л) присутствуют светло-желтые катионы ванадила (V) VOJ, обладающие окислительной способностью:
2V0J+2Cr=2VO2+Cl2 f
С увеличением pH в растворе появляются бесцветные ванадатные анионы: или метаванадатные VO3, в области, близкой к нейтральной, или ортованадатные HVO?-, VO|~ (при рН>13). Рост концентрации ванадия приводит к полимеризации и образованию темно-оранжевых ди-(У2С$~), три-(УзО^) и 28-оксодекаванадатных анионов (V10O28) • С дальнейшим повышением концентрации ванадия (>1 моль/л) из водных растворов выпадают кристаллические вана-
436
Рис. 88. Схема влияния концентрации ванадия (V) и pH на смещение ионных равновесий в водных растворах (концентрационные границы проведены условно)
даты (при рН>6) или нестехиометрические гидраты оксида ванадия (V) V2O5«xH2O (рН<6).
Подробнее см.: Ивакин А. А. и др. Ж.неорг. химии. 1986. Т. 31.
С. 388 и 510.
Для ниобия (V) и тантала (V) также установлено существование подобных равновесий в водных растворах. В отличие от VOJ катионы NbOj и TaOj окислительной способностью не обладают.
24.4. ОКСИДЫ И ГИДРОКСИДЫ
Все оксиды и гидроксиды элементов VB-группы — твердые вещества с температурой плавления, изменяющейся от 680 °C (V2O5) до 2080 °C (NbO2).
Монооксиды VO и NbO с водой не взаимодействуют, а с разбавленными кислотами реагирует только VO с образованием солей, водные растворы которых имеют фиолетовую окраску:
VO+H2SO4+5H2O= [V (Н2О) 6 ]SO4
На воздухе монооксиды окисляются до М2О5. Коричневого цвета гидроксид V(OH)2 осаждается из растворов в обменных реакциях типа
437
[V(H2O)6]2++2OH~=V(OH)2 +6H2O
Он так же, как и монооксиды, окисляется во влажном воздухе:
V (ОН) 2+0,5О2+5Н2О- [V (Н2О) 5О ] (ОН) 2
Известны V2O3 и У(ОН)з, взаимодействующие с кислотами с образованием солей V(III):
2V(OH)3+3H2SO4+6H2O-[V(H2O)612(SO4)3
водные растворы которых имеют зеленую окраску.
Зеленая суспензия У(ОН)з постепенно окисляется на воздухе и раствор приобретает голубой цвет:
2У(ОН)з+02+8Н2О“2 [V(H2O)5O ](ОН)2
Темно-синие, почти черные диоксиды VO2, NbO2 и ТаО2 не взаимодействуют с водой. Диоксиды ниобия и тантала — химически инертные вещества, на них не оказывают никакого действия даже при нагревании ни сильные кислоты, ни фтороводородная кислота, ни смесь азотной и хлороводородной кислот. Диоксид ванадия же проявляет амфотерные свойства:
4VO2+2OH=V4O£~+H2O
VO2+2H3O++2H2O-[V(H2O)5O ]2+
Образующийся в последней реакции катион оксопентааквавана-дия (IV) — наиболее стабильный аквакатион ванадия [V(H2O)5O].
Он имеет октаэдрическую структуру, в которой молекулы_ воды могут частично замещаться на внешнесферные ионы (С1 или Sol ) с образованием гидратных изомеров (см. раздел 19.3).
Взаимодействие [V(H2O)5O]2+ с ОН~ в водном растворе приводит к выпадению в осадок малорастворимого гидроксида желтого цвета:
[V(H2O)5O ]2++2Oir-[V(H2O)5O ](ОН)21
438
Пентаоксиды рассматриваемых элементов различаются по своему химическому поведению. Пентаоксид диванадия взаимодействует с водой в незначительной степени, образуя сильную кислоту состава Нд [V10H2O28 L водные растворы которой неустойчивы:
Нд [V10H2O28 ] - ' 5V2O5+3H2O
а сама кислота малорастворима в воде. Состав продуктов, получаемых в реакциях с участием V2O5, и водных растворов гидроксидов щелочных металлов определяется концентрацией и значением pH (рис. 88). В сильных кислотах V2O5 образует соли диоксованадия:
V2O5+H2SO4=(VO2) 2SO4+H2O
В отличие от Nb20s и ТагО5 оксид ванадия (V) проявляет окислительные свойства:
V2O5+6HCI+2H2O2 [V (НгО) 5О JC12+C12 f
Оксиды Nb20s и ТагО5 с водой и кислотами не реагируют, а гидроксиды и карбонаты щелочных элементов действуют на них лишь в расплавах, превращая в ортониобаты и ортотанталаты:
Nb2O5+3Na2CO3(>K)=2Na3NbO4+3CO21
Та2О5+6КОН(ж)=2КзТаО4+ЗН2О f
Гидраты пентаоксидов М2О5«хНгО выпадают в виде малорастворимых в воде студенистых осадков белого (у ниобия и тантала) и оранжевого цвета (у ванадия) при гидролизе пентагалогенидов и оксогалогенидов, при взаимодействии ниобатов и танталитов с кислотами:
2ТаС15+хН2О=Та2О5«(х—5)Н2О+ЮНС1
2NbC13O.+xH2O=Nb2O5« (х—3)Н2О+6НС1
Содержание воды в осадках переменное. По своему химическому поведению МгС^’хНгО — очень слабые кислоты, склонность к протолизу которых ослабевает при переходе от ванадия к танталу. Пентаоксиды диниобия и дитантала взаимодействуют с водными растворами гидроксидов щелочных элементов с образованием полимерных ниобатов и танталатов, например К8(МЬбО19), и фтороводородной кислотой:
Ta2O5«xH2O+14HF=2H2 [TaF7 ]+(5+х)НгО
24.5. ГАЛОГЕНИДЫ
Известны все галогениды ванадия (II) и (III), получаемые либо взаимодействием простых веществ, как в случае синтеза УВгз и VI3, либо по обменным реакциям (VF2 и VF3), либо восстановлением или диспропорционированием галогенидов (III) и (IV):
V2O3+6HF=2VF3+3H2O
439
Рис. 89. Структуры тетрамера (TaFsh (о) и димера (NbClsh (6)
t
2VC14(r)=2УС1з(к)+С12(г)
2VC13(k)=VC12(k)+VC14(D
Хлориды и фториды ванадия (II) и (III) хорошо растворимы в воде; проявляя сильные восстановительные свойства, способны окисляться водой и кислородом воздуха с образованием устойчивых солей V (IV):
2VC13+12H2O=2 [V(H2O)5O ]С12+2НС1+Н21
В своей устойчивой степени окисления (IV) ванадий образует бинарные VF4, VCI4 и солеподобные соединения [V(H2O)5O j(Hal)2 (Hal=F, Cl, Br, I). Тетрагалогениды в водном растворе гидролизуются:
VF4+6H2O [V (Н2О)5О ]F2+2HF
Ниобий и тантал образуют ковалентные пентагалогениды со всеми галогенами, а ванадий — только с фтором VF5. Одиночные молекулы пентагалогенидов имеют структуру тригональной бипирамиды. Наличие у рассматриваемых элементов вакантных d-AO способствует образованию галогенидами димерных и тетрамерных молекул с га-логенидными мостиками (рис. 89). Бесцветные кристаллы пентафторидов, дымящиеся на воздухе из-за гидролиза, образованы тетрамерами, связанными между собой фторидными мостиками, а кристаллы пентахлоридов содержат димерные молекулы.
Известны все оксидгалогениды ванадия, ниобия и тантала М(На1)зО (Hal=F, Cl, Br, I), за исключением оксидиодида ванадия (V) VI3O. По своему агрегатному состоянию это твердые вещества, VCI3O — жидкость желтого цвета с т.кип. 127 °C. Структура молекулы VCI3O приведена на рис. 90. В кристаллических оксидга-логенидах ниобия и тантала найдены слои из сдвоенных октаэдр°в с мостиковыми межслойными атомами кислорода. Водой все оксидгалогениды быстро и необратимо гидролизуются с образованием соответствующих гидратов пентаоксидов МгО5*хН2О.
440
Рис. 90. Структуры VChO (а) и фрагмента кристаллов ТаОзС! (б)
Общим методом синтеза оксидгалогенидов ванадия, ниобия и тантала (V) является обработка их пентаоксидов безводными гало-геноводородами в присутствии водоотнимающих средств:
V2O5+6HF=2VOF3+3H2O
Nb2O5+6HCl=2NbCl3O+3H2O
24.6. КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
Кроме уже упоминавшихся аквакатионов [Уп(Н2О)б]2+> [V,n(H2O)6> ] , [ VIV (Н2О)$О г для элементов УБ-группы в высшей степени окисления характерно образование ацидокомплексов, в которых ванадий, ниобий и тантал находятся в анионной части. Это, в первую очередь, галогенидные и оксид-галогенидные комплексы с координационным числом ванадия . равным 6, а для ниобия и тантала — 6, 7 и 8: [VF6f, [NbCU]", [VQF4] , [NbCkOf, [TaOF4J , [NbF7] , [TaF7] , [TaF8] , [NbCl5O] , lNbOF6]3 , [TaOFeF .
Для синтеза галогенидных комплексов применяют пентагалогениды (V), галогениды щелочных металлов и неводные растворители, а оксидгалогенидные комплексы получают таким же путем, но из водных растворов:
VF5+NaF=NafVF61
NbCl3O+KCl=K [NbCl4O ]
TaF5+2KF=K2[TaF7]
Последняя реакция имеет практическое использование для отделения методом кристаллизации из 10—15%-ной HF тантала от ниобия, который образует такое же, но более растворимое соединение К2 lNbF7 ], которое, подобно другим фторидным комплексам ванадия и ниобия, к тому же легко гидролизуется в водных растворах:
К2 [NbF7 ]+Н2О=К2 [NbOF51+2HF
Ванадий, ниобий и тантал образуют различные по составу и струк
441
туре пероксокомплексы. Число пероксоанионов О? как бидентатных лигандов (условное обозначение О?), приходящихся на атом металла (V), повышается с увеличением pH среды и концентрации Н2О2, максимальное их число равно четырем (координационное число 8). Получены пероксокомплексы с ионами (М(Н2О)4О(О2) ]+, [М(Н2О)2О(О2)2Г, [МО(О2)з]3^ и [М(О2)4]3“, где M(V) = V, Nb или Та.
Подробнее см.: Вольнов И. И. Пероксокомплексы ванадия, ниобия и тантала. — М.: Наука, 1987.
Молекулы воды в пероксоионах могут замещаться на другие лиганды. Образующиеся в слабокислых растворах ионы [V(H2O)4O(O2) ]+ придают раствору красный цвет. В сильнокислой среде они превращаются в катионы VOJ, а при избытке Н2О2 теряют все молекулы воды и приобретают состав [У0(02)гГ, при этом цвет раствора становится желтым. Между первым и вторым ионами существует равновесие:
[V(H2O)4O(O2)]++H2O2^=^ IVO(O2)2 Г+2Н3О++2Н2О
При добавлении большого количества Н2О2 к концентрированному водному раствору M3VO4, содержащему некоторое количество МОН (М=К, Rb, Cs), раствор приобретает синюю окраску, связанную с появлением ионов [V(O2)4]3-.
Ниобий (III) и тантал (III) способны образовывать двуядерные кластеры, например Cs3[Nb2X9], где Х-Cl, Вг или I. В таких кластерах между атомами ниобия существует двойная связь Nb—Nb, длина которой в зависимости от вида галогена изменяется в интервале 270—296 пм.
24.7. ПРИМЕНЕНИЕ
Основная область использования металлического ванадия — производство сталей и сплавов. Присадки ванадия в количестве 0,1— 0,2% придают сталям вязкость и ударопрочность, что используется для изготовления авиационных и автомобильных двигателей. Сплав ниобия с танталом (1:9) используют в ракетостроении и космической технике, поскольку он сохраняет свою работоспособность при температурах вплоть до 2500 °C. Высокая химическая стойкость тантала позволяет изготовлять из него изделия медицинского назначения — иглы шприцев, зажимы для кровеносных сосудов, нити для сшивания тканей.
Пентаоксид диванадия остается незаменимым катализатором в производстве серной кислоты, фталевого ангидрида, анилиновых красителей; металлический тантал — катализатор синтеза искусственных алмазов.
442
Тантал применяют также для изготовления электролитических конденсаторов, электродов электронных ламп, аппаратуры в химическом машиностроении и ядерной энергетике, нагревателей высокотемпературных печей. Германид ниобия NbaGe — сверхпроводник — нужен для изготовления обмоток сверхпроводящих соленоидов.
Пентаоксиды элементов УБ-группы применяют в производстве изделий квантовой и радиоэлектроники, оптических волноводов, сегнетоэлектриков.
24.8. ТОКСИКОЛОГИЯ
Микроколичества ванадия необходимы для жизнедеятельности животных: при его дефиците замедляется рост и воспроизводство молодняка. Считают, что ванадий ограничивает синтез холестерина у всех теплокровных.
Однако при большом содержании (более 0,1 мг/м3) ванадий опасен для человека: его присутствие в воздухе вызывает сухой кашель, насморк, одышку, аэрозоль металлического ванадия при хроническом отравлении снижает содержание эритроцитов и гемоглобина в крови; V2O5 поражает конъюнктиву глаз, приводит к расстройству зрения.
Металлические ниобий и тантал, а также их соединения относят к малотоксичным веществам.
Экологическая опасность производства ванадия связана с возможностью выбросов его в атмосферу. Поскольку промышленный выпуск ванадия связан с комплексной переработкой цинк-, медь-и свинецсодержащих материалов, то экологические проблемы у них одинаковы.
Упражнения к главе 24
1. Какой катион образуется при взаимодействии V2O5 с сильными кислотами?
2. Как протекает реакция Та2Об + КОН(ж)?
3. Возможна пи реакция МЬ + КОН(ж)?
4. Какой состав имеет пероксокомплекс ванадия (V), образовавшийся в растворе, содержащем ортованадат капия, гидроксид калия и большой избыток пероксида водорода?
5. Определите структуру молекулы VCI3O, используя идею гибридизации АО.
6. Как протекают реакции:
V2O5 + HF=...
v2o3 + hf = ...
Какую структуру имеет катион оксопентаакваванадия
8. Какой из металлов — ванадий, ниобий или тантал — может взаимодействовать с азотной кислотой?
9. Закончите уравнения реакций:
443
V(OH)2+O2 + H2O = ...
VO2 + H3O* =...
[V(H2O)6]2+ + h2o = ...
10. Приведите пример использования ацидо|$омппексов ниобия и тантала для разделения последних методом кристаллизации.
11. Какие продукты образуются при гидролизе трихлорида и тетрафторида ванадия?
ГЛАВА 25. ХИМИЯ ЭЛЕМЕНТОВ VIB-ГРУППЫ
Четыре элемента образуют VIB-группу: хром Сг, молибден Мо, вольфрам W и 106-й элемент (пока без названия). Первые два элемента имеют сходную электронную конфигурацию невозбужденных атомов, связанную с созданием устойчивой, наполовину заполненной d-AO за счет заимствования одного s-электрона: ns1 (и—l)d5 у вольфрама и, по-видимому, 106-го элемента, имеющих полностью заполненные /-АО, конфигурация полностью соответствует правилу Клечковского: ns2(n—2)/1<г(и—1)а (электроны внешних энергетических подуровней).
У хрома устойчивая степень окисления (III) реализуется во многих соединениях, например СггОз, Сг2(8О4)з*18НгО, СгО(ОН), СгС1з*бН2О. Степень окисления (VI), крайне неустойчивая у хрома в его оксиде СгОз, хромовых кислотах и соответствующих им солях К2С1О4 и К2СГ2О7, характерна, напротив, для всех остальных элементов VIB-группы: МоОз, WO3, CaWO4 и др. Здесь проявляется общая закономерность, присущая всем d-элементам: по группе сверху вниз с проявлением экранирующего влияния /-электронов растет устойчивость высшей степени окисления, соответствующей номеру группы.
Стабильность степени окисления (III) у хрома в водных растворах его солей вызвана тем, что в аквакатионе [Сгш(Н2О)б]3+ посл| расщепления d-AO ₽ октаэдрическом поле лигандов электроны d атома хрома занимают de-орбиталь низкой энергии, наполовину ее заполняя и тем самым придавая ей особую устойчивость.
Химические реакции Сг(Ш) во многом напоминают реакции А1(Ш) и Fe(III): образование аквакатионов, метагидроксидов, квасцов, невозможность выделения M2S3 из водных растворов. Хром (III) и алюминий (III) имеют оксиды и гидроксиды, обладающие амфотерностью.
Сверху вниз по группе падают, как обычно, кислотные свойства оксидов и гидроксидов: кислотный оксид хрома (VI) СгОз, взаимодействуя с водой, дает сильную хромовую кислоту Н2СГО4, оксиды молибдена МоОз и вольфрама WO3 с водой не реагируют»
444
кислотный характер их малорастворимых кристаллогидратов МоОз^НгО и WO3-H2O выражен слабо. С увеличением степени окисления кислотные свойства оксидов и гидроксидов также закономерно растут: СгО — основный, СггОз — амфотерный, СгОз — кислотный оксид.
В водных растворах хром (11) входит только в катионную часть комплексов в виде (Сг(НгО)бГ или fCr(H2O)sCl]+, хром (III) — либо в катионную часть при рН<7 — [Сг(НгО)б] , либо в анионную [Сг(ОН)б]3 — в щелочных растворах; в высшей степени окисления (VI) хром, молибден и вольфрам в водных растворах находятся только в виде оксоанионов СгО^ , МоО^ , WO^ . Последние все имеют тетраэдрическое строение за счет str-гибридизации АО центрального атома.
Для элементов IVB-группы как в высших, так и в низших степенях окисления характерны сильные комплексообразующие свойства. Наиболее распространенным является координационное число 6, встречающееся в аква-, гидроксо- и ацидокомплексах. Обычным явлением для хрома, молибдена и вольфрама является образование кластерных и многоядерных комплексных соединений.
25.1. РАСПРОСТРАНЕННОСТЬ В ПРИРОДЕ. ОСНОВНЫЕ МИНЕРАЛЫ
Хром занимает 21-е место по распространенности в земной коре (его кларк 0,02%), молибден стоит на 39-м месте (0,001 %), вольфрам — на 27-м (0,01%). Наиболее важные руды — хромит (Fe,Cr2)O4 (добываемый на Урале близ г. Екатеринбурга), шеелит CaWO4 и повеллит СаМоСЦ (г. Тырныауз), молибденит M0S2 и вольфрамит (Mn,Fe)WO4. Перспективные месторождения элементов VIB-группы обнаружены в Забайкалье.
Хромит является двойным оксидом из группы сложных оксидов состава (М',Мг)О4, называемых шпинелями. В шпинелях атом М'(П) — Mg, Fe, Zn, Мп, а М(Ш) — Al, Fe, Сг, Мп (см. раздел 2.4).
Богатыми запасами хромита, этого важнейшего природного сырья для цветной металлургии, обладают Зимбабве, ЮАР и Новая Каледония. Крупными запасами вольфрамовых руд располагают Китай и Южная Корея.
Минерал молибденит был известен задолго до открытия Мо и отождествлялся с графитом. В самородном состоянии Сг, Мо и W в природе не встречаются.
История открытия элементов. Первым был открыт молибден <1778 г.), затем — вольфрам (1781 г.). Честь открытия этих элементов принадлежит Шееле, его имя увековечено в названии минерала шеелита CaWCU. Вольфрам в переводе с немецкого означает «волчья пена», поскольку его присутствие затрудняет выплавку олова (с которым он часто встречается в природе),
445
образуя пену шлаков, содержащих кроме вольфрама много и олова.
Хром был открыт в 1797 г. Вокленом в свинцовой руде PbCrCU, найденной в Сибири. Ярко-желтая окраска этой руды дала Воклену повод назвать элемент № 24 хромом, что в переводе с греч. означает «цвет».
Элемент 106-й синтезирован в Объединенном институте ядерных исследований (г. Дубна) группой акад. Г. Н. Флерова в 1974 г. при помощи ядерной реакции
SCr+iTPb- ^3 + 2in
25.2. ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ
Металлические хром, молибден и вольфрам — бесцветные, блестящие металлы с высокими температурами плавления. Вольфрам — самый тугоплавкий из известных металлов (табл. 28). Хром, лишенный микропримесей углерода, азота и кремния, становится очень пластичным.
Таблица 28. Физико-химические свойства хрома, молибдена и вольфрама
Свойства Металлы
хром молибден вольфрам
Температура плавления, °C 1890 2620 3387
Температура кипения, °C 2680 4630 5680
Плотность р, г/см3 (25 °C) 7,19 10,22 19,35
Стандартный электродный потенциал —0,70* —0,20*
<р °, В —0.85** ?
♦ Для пары Э°/Э3+.
** Для пары Ст°/Сг+.
Металлическая решетка вольфрама настолько прочна, что точное определение его стандартного электродного потенциала не представляется возможным; по ориентировочным расчетам вольфрам в электрохимическом ряду напряжений металлов должен был бы предшествовать водороду. Ни один из металлов VIB-группы не взаимодействует с водой, и лишь хром способен реагировать с кислотами-неокислителями:
Сг+2НзО++4Н2О- [Сг(Н2О) 6 ]2++Н2 f
Образующийся аквакатион хрома (II) придает раствору ярко-голубую окраску.
Молибден медленно взаимодействует с водным раствором фтороводорода:
Mo + 4HF + Н2О = MoOF4 + 3H2f
446
В кислотах-окислителях (концентрированная H2SO4, азотная всех концентраций, НСЮ4) хром, молибден и вольфрам пассивируются за счет образования на их поверхности химически неактивных оксидов (см. раздел 13.10). Значительное нагревание снимает пассивацию лишь у хрома, который с кипящими концентрированными кислотами начинает взаимодействовать с образованием соответствующих солей хрома (III) и диоксидов азота или серы. В частности,
Сг + 6HNO3 = Cr(NO3)3 + 3NO21 + ЗН2О
Для перевода металлических молибдена и вольфрама в раствор пользуются смесью азотной и фтороводородной кислот:
W + 8HF + 2HNO3 = Нг [WF8 ] + 2NO f + 4Н2О
или щелочными расплавами с добавлением окислителей:
Мо + 3№КЮз(ж) + 2NaOH(«) = ИагМоОд + 3NaNO2 + НгОт
Аналогично ведет себя в этих условиях металлический хром:
t
2Сг +2КагСОз(ж) + ЗО2 = 2Na2CrO4 + 2C0zt
В атмосфере кислорода хром, молибден и вольфрам при повышенных температурах сгорают с образованием оксидов в устойчивых степенях окисления: СггОз, МоОз и WO3; при взаимодействии с расплавленной серой образуются сульфиды: ~ CrS — черного цвета, ~ M0S2 и ~ WS2 — термически устойчивые (до 1000—1700 °C) соединения серого цвета.
Сульфид хрома СггВз в водных растворах не образуется из-за необратимого гидролиза (см. раздел 10.3). Его получают, пропуская сероводород над нагретым трихлоридом хрома:
2СгС13(к) + 3H2S = Cr2S3(K) + 6HClf
Прй пропускании H2S через водные растворы молибдатов и вольфраматов щелочных металлов образуются растворимые в воде тиокомплексы:
K2WO4 + 4H2S = Кг [WS4 ] + 4НгО
Добавление к растворам тиокомплексов молибдена и вольфрама кислот вызывает выделение осадков трисульфидов, практически нерастворимых в воде и водных растворах кислот:
Кг [WS4 ] + 2НС1 = WS31 + H2S t + 2КС1
Трисульфиды термически нестабильны (без доступа воздуха):
t
MoS3(k) = MoS2(K) +Sf
Взаимодействие Cr, Мо и W с фтором, хлором и бромом дает высшие галогениды молибдена и вольфрама Mo(HaI)6, W(Hal)6, хром окисляется фтором лишь до степени окисления (IV) — CrF4.
447
С остальными галогенами получаются тригалогениды хрома СгС1з, СгВгз. Иодид хрома (III) получен только в виде кристаллогидрата Сг1з*9НзО. При нагревании он разлагается с образованием иодида хрома (II).
При температурах выше 1000 °C металлические хром, молибден и вольфрам реагируют с азотом и углеродом с образованием нестехиометрических, химически инертных нитридов и карбидов ~ CrN, ~ СггЫ, ~ MoN, -- WN и ~ СгС, ~ М02С, ~ WC. Карбиды — очень прочные,-тугоплавкие вещества, по своей твердости приближающиеся к алмазу.
25.3. ПОЛУЧЕНИЕ ХРОМА, МОЛИБДЕНА И ВОЛЬФРАМА
Достаточно чистый металлический хром получают восстановлением оксида хрома (III) активными металлами:
СггОз + 2А1 = 2Сг + AI2O3
Для нужд металлургии (легирование сталей) хром в сплаве с железом (феррохром) получают восстановлением непосредственно из руд (хромита) углеродом:
(Fe11, Сг^)О4 + 4С = (Fe + 2Сг) + 4C0f
Чистые молибден и вольфрам готовят восстановлением их оксидов водородом, например
МоОз + ЗНг = Мо + ЗН2О f
Образующийся порошок металлического вольфрама или молибдена спекают затем в компактный металл методами порошковой металлургии или в вакууме с помощью электронной пушки.
25.4. ХИМИЯ ВОДНЫХ РАСТВОРОВ
Хром (II) и (IID образует аквакатионы состава [М(НгО)бГ^> причем [Сг(НгО)бГ обладает сильными восстановительными свойствами и в отсутствие кислорода выделяет из воды водород:
2 [Сг(Н2О)б ]2+ + 2Н3О+ - 2 [Сг(Н2О)б ]3+ + 2Н3О + Н2 Г 5
р°— 0,41 В.
На воздухе эта реакция протекает иначе:
4 [Сг(Н2О)б ]2+ + 4Н3О+ + 02-4 [Сг(Н2О)б ]3+ + 6Н2О
Аквакатион Сг (III) подвергается частично протолизу: [Сг(Н2О)б ]3+ + Н2О [Сг(Н2О)5ОН ]2+ + Н3О+
Молибден и вольфрам аквакатионов не образуют.
Хром, молибден и вольфрам в степени окисления (VI) присутствуют в водном растворе в виде моно- и полиоксоанионов (или
448
изополисоединений). Образование трх или иных полиоксоанионов зависит от значений pH и концентрации в растворе монооксоанионов.
В щелочной среде (pH > 8) существуют только монооксоанионы: CrOi , MoOl" и WO?“.
В области pH 1—8 происходят реакции конденсации и полимеризации. Если для Сг (VI) они практически заканчиваются образованием частиц состава (СлчСИз)2 , то у Mo (VI) и W (VI) реакции конденсации протекают до появления в растворе частиц с содержанием 7—12 атомов металла. Например:
7МоО?“ + 8НзО+ (МО7О24)6" + 12НзО
2О¥бНО21)5~ + 4НзО+ - * (W12H2O40)6' + 6Н2О
Полагают, что реакции конденсации следуют за стадией протолиза монооксоанионов:
МоО|~ + НзО+ . '|Мо(ОН)Оз Г + НгО
Полиоксоанионы состоят из октаэдров МоОб (или WO6), связанных между собой общей вершиной или общим ребром.
В состав полиоксоанионов могут входить протоны и молекулы воды, которые расширяют возможности частиц к дальнейшей конденсации. Коща содержание ионов НзО+ достигает примерно 1 моль/л, в растворе появляются катионы МоО^+ или WO?+:
(МО7О24Л + 2ОНзО+ ;=? 7МоО$+ + ЗОН2О
При дальнейшем повышении кислотности наблюдается образование осадка МоОз*НгО или ХУОз^НгО:
3WO$+ + (W12H2O40)6- + 14Н2О - 15(WO3*H2O) |
25.5. ОКСИДЫ И ГИДРОКСИДЫ
Все оксиды и гидроксиды хрома, молибдена и вольфрама — твердые, термодинамически устойчивые вещества с различной окраской (табл. 29). Наибольшей термостойкостью обладает оксид хрома (III): его кристаллическая решетка настолько прочна, что он не взаимодействует с растворами кислот и сильных оснований.
Наименьшей устойчивостью обладают кислородные соединения хрома в степени окисления (II). Желтый гидроксид хрома (II), полученный по обменным реакциям из его солей, на воздухе быстро окисляется с образованием зеленого метагидроксида хрома (III):
4Сг(ОН)2 + Ог = 4СгО(ОН) + 2НгО
Оксид и гидроксид хрома (II) проявляют только основные свойства. Они способны взаимодействовать с кислотами-неокислителями с образованием аквакатионов, придающих растворам голубую окраску:
*5—1258
449
Сг(0Н)2 + 2НзО+ + 2Н2О - [Сг(Н2О)6]2+
Оксид хрома (II) образуется при медленном окислении хрома, растворенного в ртути. Выше 700 °C этот оксид диспропорционирует с образованием хрома и Сг20з.
Амфотерность метагидроксида хрома (III) экспериментально легко доказывается двумя традиционными реакциями:
СгО(ОН) + ЗОН + Н2О = [Сг(ОН)б J3"
СгО(ОН) + ЗН3О+ + Н2О = [Сг(Н2О)б 13+
Таблица 29. Физико-химические свойства кислородных соединений элементов У1Б-группы
Степень окисления Соединение Цвет Температура плавления, °C —\fG° (298 К), кДж/моль
(II) СгО Черный Разлагается —
Сг(ОН)2 Желтый — 576
(III) Сг20з Темно-зеленый 2340 1059
СгО (ОН) Зеленый — —
(IV) СгОз Черный Разлагается —
МоОз Коричневый 534
WO2 1500 534
(VI) СгОз Темно-красный 198 505
МоОз Светло-зеленый 795 668
МоОз*Н2О Желтый 115* 950
WO3 Возгоняется 764
WO3«H2O Белый 100* 1036
* Температура обезвоживания.
Гидроксокомплекс окрашивает водные растворы в зеленый цвет, аквакатион — в фиолетовый. Осторожным подкислением гидроксокомплекс можно разрушить и получить аморфный ортогидроксид хрома (III) (по аналогии с гидроксидом алюминия):
[Сг(ОН)б]3- + ЗСО2 = Сг(ОН)з1 + ЗНСОз
Ортогидроксид быстро теряет воду, переходя в метагидроксид. Во всех остальных реакциях обмена солей хрома (III) с сильными основаниями сразу получается СгО(ОН).
При мягком разложении (~ 150 °C) метагидроксида хрома может быть выделен амфотерный достаточно активный оксид хрома (Ш), взаимодействующий как с кислотами, так и с сильными основаниями. Однако высокотемпературная обработка делает Сг20з химически инертным. Для превращения его в водорастворимое соединение используют обычно предварительное сплавление с дисульфатом калия, карбонатом натрия или с гидроксидами:
Сг20з(к> + 3K2S2O7(«) = Cr2(SO4)3 + 3K2SO4
450
Сг20з<х> + 2NaOH(x) = 2 NaCrO2 + HzO t
NaCrOz(T) + 2HzO + 2NaOH<P) = Na3[Cr(OH)6]
По кристаллической структуре Сг20з подобен оксиду алюминия (корунду). Получают оксид хрома (III) синтезом из простых веществ, а также термическим разложением гидроксида, дихромата аммония или восстановлением дихроматов щелочных элементов углеродом, серой:
г (NH4)2Cr2O7 = Сг20з + N2t + 4H20j
KzCr2O7 + S = СпОз + KzSO4
Диоксиды хрома и молибдена термически нестойки: при нагревании они диспропорционируют с образованием разных по составу продуктов:
ЗСгОг = Сг2О3 + СгОз; ЗМоОг = 2МоО3 + Мо
Оксид вольфрама (IV) — одно из самых его термостойких соединений (табл. 29). Он плавится и возгоняется без разложения. Все диоксиды элементов VIB-группы — химически инертные вещества, что объясняется прочностью их кристаллической решетки; последняя у них однотипная (структура рутила TiO2).
Оксиды молибдена и вольфрама (IV) синтезируют восстановлением их триоксидов:
t
МоОз + Н2 = МоО2 + Н2О t
Получение оксида хрома (IV) проводят осторожным окислением Сг20з под давлением кислорода. Диоксид хрома проявляет способность сохранять однажды сообщенную ему намагниченность (ферромагнитные свойства).
Пентаоксиды молибдена (черно-фиолетового цвета) и вольфрама (красно-фиолетового цвета) относятся к нестехиометрическим соединениям. В качестве синих осадков переменного состава они выпадают из водных растворов при частичном восстановлении цинком в кислой среде вольфраматов и молибдатов (VI), например
2(NH4)zMoO4 + Zn + 6НС1 - MozOs + ZnClz + 4NH4C1 + ЗН2О
Образующаяся молибденовая или вольфрамовая «синь» служит качественной реакцией на присутствие молибдена и вольфрама в растворе (подробнее см. раздел 29.4).
Известны двойные оксиды, содержащие хром в двух степенях окисления: CrsOiz = (Сг2, Сгз)О12, где 2Сг (+III) и ЗСг (+VI); Сг2О5 или (Сг', Сг)О5, где Сг' (+IV) и Сг (+VI), и СгзОв или (Cr2, Cr)Og, где 2Сг (+V) и Сг (+VI), см. раздел 2.4.
Устойчивость триоксидов хрома, молибдена и вольфрама различная: если СгОз разлагается с отщеплением кислорода уже при температуре плавления
15*
451
Рис. 91. Структурный фрагмент (СгОз)л
4СгОз = 2СггОз + ЗОзт
то МоОз и WO3 плавятся и кипят без разложения при высоких температурах (см. табл. 29).
В парообразном состоянии МоОз и WO3 состоят преимущественно из тримеров с кольцеобразной структурой. Длина связи Мо—О в фрагменте О—Мо—О равна 189 пм.
В твердом состоянии все триоксиды состоят из изогнутых цепочек тетраэдров, связанных че
рез мостиковые атомы кислорода (рис. 91). Между цепями (в случае СгОз) осуществляется только слабое межмолекулярное взаимодействие, согласующееся с относительно низкой температурой плавления этого оксида.
Ярко выраженная кислотность триоксида хрома проявляется в его активном взаимодействии с водой, приводящем к образованию сильной хромовой кислоты:
СгОз + НзО = НзСгО4
Последняя подвергается двухступенчатому протолизу, в котором лишь вторая ступень является обратимой:
Н2СгО4 + Н2О = НзО+ + НСгО4
НС1О4 + НзО • ' НзО+ + СгОЗ"; Кк - 3,16* КГ7 (25 °C)
Уравнения показывают, что гидрохроматным анионам обязательно сопутствуют ионы оксония; хроматные же анионы могут находиться в водных растворах (в достаточном количестве) только в щелочных среде х. Сама хромовая кислота в индивидуальном виде не выделена — получены лишь ее водные растворы с максимальной концентрацией — 75%. В концентрированных растворах хромовой кислоты начинают идти реакции конденсации (см. раздел 25.4):
2НзСгО4 НзСгзО? ~н?® и т. д. до Н3СГ4О13
Образующиеся полихроматные анионы имеют то же цепочечное строение, что и триоксид хрома, где несколько тетраэдров СгО4 связаны между собой атомами кислорода (рис. 91).
В кислотной среде (pH 2—6) хроматные анионы, придающие раствору желтую окраску, неустойчивы: подкисление, как и концентрирование, приводит к их димеризации, и раствор окрашивается в ярко-оранжевый цвет, присущий дихроматным анионам:
2СгОГ + 2Н3О+ Сг2О?~ + ЗНзО; Кс ~ 1014
При pH > 6 представленное равновесие смещается влево, а при pH > > 13 в растворе обнаруживают только хроматные анионы:
452
CnO?" + 2ОН" 2СгОГ + Н2О
Практически все дихроматы хорошо растворимы в воде, хроматы же, наоборот, как правило, малорастворимы, за исключением хроматов щелочных металлов и аммония.
Кислотные свойства высших оксидов молибдена и вольфрама выражены гораздо слабее, чем у СгОз: с водой они не взаимодействуют, но могут реагировать с водными растворами сильных оснований с образованием бесцветных, растворимых молибдатов и вольфраматов:
МоОз(т) + 2КОН(Р) - К2М0О4 + НзО
WO3(t) + 2NaOH(p> = Na3WO4 + НзО
Малорастворимые гидраты МоОз*НзО и WO3*H2O образуются из соответствующих солей по обменным реакциям типа
K3WO4 + 2HNO3 - WO3*H2O | + 2KNO3
В серной и соляной кислотах за счет комплексообразования реакции идут по-другому, например:
Na2WO4 + H2SO4 - Na2 [W(SO4)O3 ] + НзО
Na2WO4 + 2HC1 - Na [W(H2O)C1O3 ] + NaCl
Если оксиды молибдена и вольфрама (VI) получают прямым синтезом из простых веществ, то для получения СгОз необходимо использовать косвенные методы:
КзСг2О7(к) + H3SO4 - 2СгОз1 + K3SO4 + НзО
Оксид хрома (VI) в концентрированной серной кислоте малорастворим и может быть отделен от раствора.
Кислородные соединения хрома (VI) отличаются от своих аналогов по группе явными окислительными свойствами, проявляющимися особенно заметно в кислотной среде, и в меньшей степени — в щелочной:
СгзО?" + 14Н+ + 6е~ - 2Crj$ + 7НзО; <р° - + 1,33 В
СгО?' + 4Н2О + Зе' - [Сг(ОН)б J3- + 2ОН"; <р° — 0,16 В
Так, для окисления нитрит-иона в нитрат (у?° = 0,01 В) или бро-мид-иона в бром (^° = 1,09 В) следует использовать только дихро-мат-ион, так как окислительной силы хроматного аниона для таких партнеров оказывается недостаточно.
25.6. СОЛИ И КОВАЛЕНТНЫЕ СОЕДИНЕНИЯ
Хром, молибден и вольфрам образуют соли только в низших степенях окисления (II) и (III). У молибдена и вольфрама эти степени окисления крайне неустойчивы и стабилизируются отчасти лишь в их комплексных соединениях (см. раздел 25.7). Большая
453
часть солей хрома (II) и (III) хорошо растворима в воде, при кристаллизации таких солей часто образуются кристаллогидраты.
Сульфаты. Известен сульфат хрома (II) [Cr(H2O)6]SO4»H2O, тождественный по своей кристаллической структуре [Fe(H2O)6]SO4*H2O. В присутствии кислорода сульфат хрома (II) легко окисляется, меняя окраску водного раствора с голубой нд фиолетовую:
4 [Сг(Н2О) 6]2+ + О2 + 2Н2О = 4 [Сг(Н2О)б ]3+ + 4ОН;
<р° — 0,41 В
В отсутствие кислорода соли хрома (II) способны окисляться даже водой:
ГСг(Н2О)6 ]2+ + 2НгО - 2 [Сг(Н2О)б I3* + Н2f + 2ОН
Сульфат хрома (III) кристаллизуется из водных растворов в виде фиолетового кристаллогидрата [Cr(H2O)6]2(SC>4)3»6H2O. Как и сульфат алюминия, Сг2 (864)3 участвует в образовании двойных солей — квасцов состава 1М(НгО)бИСг(Н2О)б](8О4)2 (М = щелочной металл или аммоний-катион). При растворении в воде квасцы полностью диссоциируют на ионы, например
[К(Н2О)б][Сг(Н2О)б](8О4)2“ 1К(Н2О)бГ+ [Cr(H2O)6]3+ + 2SOl“
За счет протолиза катиона гексааквахрома (III) pH таких растворов меньше 7:
[Сг(Н2О)б ]3+ + Н2О — [Сг(Н2О)5ОН ]2+ + НзО+
Поэтому общим способом получения квасцов является их кристаллизация из подкисленных насыщенных растворов.
Галогениды. Существуют все галогениды хрома (II) и (III). Их синтезируют либо взаимодействием металлического хрома с газообразным галогеноводородом:
Сг + 2Н(На!) = 2Сг(На1)г + НгТ
либо из простых веществ (СгС1з, СгВгз, Сг1з) или (СгРз) по реакциям нейтрализации типа:
СгО(ОН) + 3HF - СгРз + 2Н2О
Безводные галогениды, особенно фториды, малорастворимы в воде, зато остальные галогениды хрома (II) и (III) — [Сг(Н2О)б1Вг2, [Сг(Н2О)б]С1з, [Сг(НгО)9]1з и др. — хорошо растворимы.
Обнаружено, что в водных растворах галогенидов хрома (II) присутствуют в основном комплексные частицы, содержащие во внутренней сфере помимо воды галогенид-ионы, например [Сг(НгО)4С12] • Хлориды и бромиды гексааквахрома (III) [Сг(Н2О)б]С1з и [Сг(Н2О)б ]Вгз существуют в виде двух довольно устойчивых гидратных изомеров— [Сг(Н2О)б]С1з, [Сг(НгО)б]Вгз (серо-голубого и фиолетового цвета) и [Сг(Н2О)4С12]С1»2Н2О, [Сг(Н2О)4Вг2]Вг*2Н2О
454
(темно-зеленого цвета). В водных растворах между этими двумя формами существует равновесие:
[Сг(Н2О)б 13+ + 2СГ = [Сг(Н2О)4С12 Г + 2Н2О
При повышении температуры и увеличении концентрации галоге-нидных ионов равновесие смещается вправо (раствор приобретает зеленую окраску), при охлаждении и разбавлении раствора — влево (окраска фиолетовая).
Трихлорид хрома является конечным продуктом многих окислительно-восстановительных реакций, связанных как с восстановлением Сг (VI), так и с окислением Сг (II), например:
К2Сг2О7 + 14НС1 + Н2О = 2[Сг(Н2О)4С12]С1 + 4С121 + 2КС1
2 [Сг(Н2О)4С12 ] + Н2 [SnCl4 ] - 2 [Сг(Н2О)4С12 ]С1 + Sn | + 2НС1
Из высших галогенидов получены в индивидуальном виде Сг1б, MoFe и W(Hal)6 (Hal = F, Cl и Вг). Все это — легколетучие, ковалентносвязанные соединения с однотипным октаэдрическим строением молекул, определяемым sp а-гибридизацией АО центрального атома. Некоторые физико-химические свойства этих галогенидов приведены в табл. 30. Все высшие галогениды синтезируют из простых веществ при избытке галогена.
В воде галогениды необратимо гидролизуются с образованием в конечном счете либо кислот, например
CrF6 + 4Н2О = H2CrO4 + 6HF
либо оксид-галогенидов и гидратов триоксидов:
MoF6 + Н2О - MoOF4 + 2HF
MoOF4 + Н2О = MoO2F2 + 2HF
MoO2F2 + 2Н2О = МоО3»Н2О + 2HF
Таблица 30. Некоторые физико-химические свойства высших галогенидов элементов ¥П5-группы
Соединение Цвет Температура плавления, °C Температура кипения, °C -Дл6° (298 К), кДж/моль
СгРб(к) Желтый -100 (с разлож.) —
МоРб(ж) Бесцветный 18 34 1473
WF6(r) Черный 2 17 1633
wci6W Черно-фиолетовый 295 392 501
WBr6(K) Черный 309 400 (с раз-лож.) 329
Оксид-галогениды хрома (VI) СгС12О2 и CrO2F2 образуются при обработке оксида хрома (VI) газообразным галогеноводородом так:
455
Рис. 92. Образование связей в молекуле
CrCljOa и ее структура
СгОз(к) + 2НС1(г) == СгОзОгсж) + НзО
(тот же продукт получается при взаимодействии концентрированной H2SO4 со смесью кристаллических КзСгзО? и NaCl).
Связь во всех оксид-галогенидах — ковалентная полярная, изолированные молекулы имеют строение искаженного тетраэдра (рис. 92).
25.7. КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
Карбонилы хрома, молибдена и вольфрама — [М(СО)б] являются примерами комплексов, где центральный атом имеет степень окисления (0). Карбонилы — диамагнитные, бесцветные кристаллические вещества, синтезируемые, как и большинство карбонилов, обработкой металлов газообразным (под давлением) монооксидом углерода. Все карбонилы хрома, молибдена и вольфрама имеют относительно низкую температуру кипения (1/2—175 °C) и возгонки. Структура их молекул октаэдрическая (spa-гибридизация АО центрального атома).
Экспериментально установлено, что на атоме хрома в его карбонильном комплексе сосредоточен заметный положительный заряд д = + 0,4.
Для объяснения этого полагают, что помимо шести обычных (^связей, полученных при перекрывании шести spa -гибридных орбиталей металла с шестью <7°-МО молекулы СО, несущими пары электронов, в молекуле существует дополнительное (1Л - рл-взаи-модействие. Три пары J-электронов хрома дают три делокализованные Л-связи с л*-МО молекул СО.
Для хрома (0) известны также смешанные аминокарбонильные комплексы — [Сг(СО)зШНз)з]° и [Сг(СО)5КНзГ — желтые кристаллические вещества, устойчивые на воздухе.
456
Сг(И)
ООО
связи С г ДЯГ Сг :
Я 1 О " <2*2 -<2*2 — ^=“уг-ауг
••••• b=d ~d ху ху
Рис. 93. Образование химических связей в молекуле [СггСНгОЫСНзСООЬ]0 и ее структура
Крайне неустойчивая степень окисления (+11) заметно стабилизируется за счет комплексообразования. Так, кластерные ацетатные комплексы хрома и молибдена (II) — [Сг2(НгО)2(СНзСОО)4] и [Мо2(СНзСОО)4] не окисляются на воздухе при нагревании до 300 °C. В виде малорастворимых осадков (соответственно красного и желтого цветов) они получаются по обменным реакциям в присутствии избытка ацетатных ионов:
2[Сг(НгО)4С12] + 4СНзСОО~ - [(Н2О)Сг(СН3СОО)4Сг(Н2О) ] + + 4СГ + 6Н2О
Координационное число в двухъядерном комплексе Д-тетраацета-то[диаквахром (II) (Сг—Сг)] у каждого комплексообразователя Сг (II) равно 6: помимо четырех (^связей с мостиковыми ацетатными лигандами и одной СРсвязи с молекулой воды каждый атом хрома связан одной (^связью со вторым атомом хрома. Дополнительно связь Сг—Сг упрочняется образованием двух л,- и одной д-связей (рис. 93).
Бидентатность ацетатного иона определяется донорными свойствами двух атомов кислорода:
/О:-
СИз—с^о
Среди тг-комплексов хрома (II) необходимо отметить хромоцен — (Сг(С5Н5)г] — кристаллическое вещество красного цвета, с температурой плавления, близкой к ферроцену, и по молекулярной структуре аналогичное последнему.
Галогениды молибдена и вольфрама в степенях окисления (II)
457
являются типичными кластерами: [МобЯв ]С14»6Н2О или [W6C18 ]С14. Комплексный катион в них состоит из связанных между собой О-связями шести атомов Мо или W, расположенных по вершинам октаэдра, и восьми мостиковых атомов хлора, дополнительно связывающих комплексообразователи друг с другом.
Помимо уже упоминавшихся выше (разделы 25.4—25.5) аква-и гидроксокомплексов хрома (III), заслуживает внимания оксалатный комплекс Кз[Сг(С2О4)з]*ЗН2О, существующий в виде двух зеркальных изомеров (энантиомеров), по-разному вращающих плоскость поляризации светового потока. В зависимости от направления освещения окраска комплекса представляется наблюдателю либо красной, либо зеленой.
Как указывалось в разделе 25.4, хром, молибден и вольфрам в степени окисления (VI) способны образовывать полимерные анионы типа Cr2O?~, Мо?О^4, Wi2Oi?~ и др. Такие многоядерные комплексы, содержащие только один вид лигандов (в данном случае — кислород) , называются изополисоединениями. Молибден и вольфрам (VI) могут участвовать в образовании также гетерополисоединений, где в комплексный анион помимо кислорода входят атомы других элементов — кремния (IV), фосфора (V), мышьяка (V), бора (III), титана (IV), циркония (IV), иода (VII) и др., например: K4[Si(Wi2O40) 1; Na3(P(Moi204o) ], K5[B(Wi204o) ]. По своей структуре они напоминают изополисоединения, поскольку так же, как и последние, содержат октаэдрические группы МоОь или WOe, располагающиеся вокруг центрального атома — кремния, фосфора, бора и др. Состав гетерополимолибдатов и вольфраматов можно рассматривать в качестве производного от состава ортокремниевой или ортофосфорной кислот, в которых четыре кислородных атома замещены группами МзО?о: H4[Si(W301o)41 или Нз [Р (М03О10) 41-Общий способ получения гетерополисоединений — смешение в кислотной среде двух солей, например:
12(NH4)2MoO4 + Na3PO4 + 24HNO3 -(NH4)3[P(Moi2O40) П + I2H2O + 2INH4NO3 + 3NaNO3
Эту реакцию применяют в аналитической химии — выпадающий малорастворимый 40-оксододекамолибдатофосфат (V) аммония благодаря своей ярко-желтой окраске служит хорошей качественной реакцией на присутствие фосфатного иона.
Пероксидный комплекс Сг (VI) окрашен в синий цвет (аналитическая реакция):
СггО? + 4Н2О2 + 2Н3О+ = 2[СгО(О5)2] + 7Н2О
В водном растворе дипероксооксохром (VI) неустойчив, однако при его экстракции в органический растворитель L (L — диэтиловыи эфир, пиридин) образуется устойчивое комплексное соединение, включающее во внутреннюю сферу в качестве лиганда молекулу растворителя: [Cr(L)O(O5)2].
458
Существуют и другйе менее устойчивые пероксокомплексы хрома, например К[Сг(ОН)О(02)2], Кз[Сгу(О2)4]. Аналогичные пероксокомплексы известны у молибдена и вольфрама: К[Мо(ОН)О(ОЗ)2 ], Na2[W(OS)4]‘хН20.
25.8, ПРИМЕНЕНИЕ
Значительная часть хрома, молибдена и вольфрама идет в производство легированных сталей: хром придает им коррозионную и термическую стойкость, молибден и вольфрам — механическую прочность. Высокотвердые карбиды молибдена и вольфрама служат для изготовления режущих инструментов. В 1929 г. у нас разработан сплав «победит», включающий 90% WC и 10% Со. Победитовые сверла незаменимы при выборке отверстий в твердых сплавах, железобетоне. Из металлического вольфрама изготавливают нити накаливания электроламп, где нить должна выдерживать нагрев до температур в несколько тысяч градусов.
Широкое применение получили хромат свинца и оксид хрома (III) в качестве пигментов минеральных красок; Сг20з используют также как полирующее средство для металлов. Издавна известно дубильное действие хромокалиевых квасцов (отсюда — «хромовая кожа»). Дихроматный анион — распространенный окислитель в органических синтезах. Для мытья лабораторной посуды применяют «хромпик» — раствор дихромата калия в концентрированной серной кислоте. Ферромагнитные свойства СгО2 используют при изготовлении высококачественных магнитных лент видео- и стереомагнитофонов.
25.9. ТОКСИКОЛОГИЯ
Наибольшей токсичностью обладают соединения хрома (VI): ту-'ман хромовой кислоты служит причиной плеврита; при хронических отравлениях отмечается сухой кашель, поражения печени (вплоть до цирроза). Отмечено, что избыток молибдена в организме вызывает подагру — повышенное отложение в суставах мочевой кислоты. Оксид вольфрама (VI) вызывает раздражение верхних дыхательных путей, кожные дерматиты.
Промышленное производство хрома и молибдена при недостаточном контроле за газовыбросами может привести к загрязнению окружающей среды, что грозит человеку появлением легочных заболеваний.
Упражнения к главе 25
1. Какие два элемента VIE-груплы особенно близки ло своим физико-химическим свойствам? С чем это связано?
2. Имеется смесь порошкообразных металлических хрома й молибдена. Предложите способ выделения из Нее метай- • лического молибдена.
459
3. Сопоставьте кислотно-основные свойства оксидов хрома СгО -» Сг2Оз -» СгО2 -» СгОз. Почему экспериментальным путем трудно доказать амфотерность оксида хрома (III)? Имеет пи оксид хрома (VI) признаки амфотерности?
4. Рассчитайте значение дпя реакции взаимодействия дихромата капия с соляной кислотой, приведенной в разделе 25.5. Подтверждает пи ваш расчет возможность ее протекания? Если нет — поясните, почему написанная реакция осуществима.
5. При добавлении к нейтральному раствору дихромата капия раствора хлорида бария наблюдается легкое помутнение раствора. С чем это связано? Как повлияет добавление к полученной суспензии хлорида аммония? Ацетата натрия?
6. С чем связано падение устойчивости кластерных ацетатных комплексов от Сг (II) к W (II)?
7. Возможно пи существование изомеров дпя комплексов [Cr(CO)5NH3] и [Сг(СО)3 (NH3 )3 ]?
ГЛАВА 26. ХИМИЯ ЭЛЕМЕНТОВ УПБ-ГРУППЫ
В VIIB группу входят марганец Мп, технеций Тс, рений Re и не имеющий пока собственного названия 107-й элемент. Электронная конфигурация их атомов однотипна: Мп — [Ar]4s23a ; Тс — [Kr]5s!4a ; Re — [Хе ]6s24/ 45d . Так как электронная конфигурация а обладает большой устойчивостью, степень окисления (II) для марганца — одна из самых характерных, например, в соединениях MnSO4, MnCh, МпСОз и др. Сверху вниз по группе по мере заполнения d- и /-АО растет экранирующее действие внутренних электронов, и высшая степень окисления (VII) становится для остальных элементов все более устойчивой: Re2O7, HReO4, НТсО4.
У марганца широк набор промежуточных степеней окисления: (III) — Мп20з, МпО(ОН); (IV) — МпОг, MnF4; (V) и (VI) — КазМпО4, К2МпО4, а также (VII) — МодО?, КМпО4- Во всех этих соединениях марганец проявляет окислительные свойства, растущие по мере роста степени окисления; соединения рения, наоборот, в степени окисления от (II) до (VI) крайне неустойчивы и проявляют восстановительные свойства, усиливающиеся с уменьшением степени окисления.
Ионные, солеподобные соединения образуют лишь марганец в своих низших степенях окисления: (II), (III) и, отчасти, (IV):
Mn(Hal)2(Hal - F, Cl Вг, I), MnF3, Мп(СН3СОО)з, МпРф
В соединениях с более высокими степенями окисления связи, как правило, ковалентные.
Для оксидов и гидроксидов с ростом степени окисления закономерно растут в водных растворах кислотные свойства: от практически
460
основных МпО и Мп (ОН) 2 через амфотерные МпгОз, МпО (ОН) и МпО2*хНгО к типичным кислотам Н2МПО4 и НМпОд.
В водных растворах кислотные свойства таких соединений, как НМпО4, НТсО4 и HReO4, уменьшаются от НМпОд к HReO4: рКк равны соответственно 2,25; 1,5 и 1,25. Для всех трех кислот характерно образование малорастворимых солей с катионами изоморфны между собой. Соли манганатов бесцветны.
Рис. 94. Структура трихлорида рения (ReCh>3 = ResClg
Т1+ и Cs+. Соли всех трех кислот
НТсО4 и HReOx в отличие от пер-
Соединения Тс (VI) и Re (VI) менее устойчивы, чем соединения Мп (VI), на воздухе в присутствии влаги они медленно, а в водных растворах быстро диспропорционируют, например
ЗК2ТСО4 + 2НгО = 2КТсО4 + ТсОг! + 4КОН
Комплексообразующие свойства у элементов VIIE-группы очень своеобразны. Марганец (II) в комплексных соединениях характеризуется чаще всего координационным числом 6, например [Мп(ЫНз)б1 , [Мп(Н2О)б], [Mn(NCS)614 , ГМп(СЫ)б]4 . Все они имеют октаэдрическое строение за счет spa-гибридизации АО марганца. Лишь в галогенидных комплексах марганец (II) проявляет координационное число 4: [МпСЦ]2 , [МпВг4Г , что связано с sp-гибридизацией его АО (тетраэдрическое строение).
Марганец образует преимущественно высокоспиновые комплексы, а рений — низкоспиновые. Характерной особенностью галогенидов рения (III) является образование ими кластеров (рис. 94, см. также рис. 15).
Все три элемента в степени окисления (II) и (III) образуют аквакомплексы. Соединения Тс (IV) с октаэдрической структурой и с d -электронной конфигурацией отличаются особой устойчивостью, так как три электрона наполовину заполняют de-энергетический подуровень.
26.1. РАСПРОСТРАНЕННОСТЬ В ПРИРОДЕ. ОСНОВНЫЕ МИНЕРАЛЫ
Марганец занимает 14-е место по распространенности на Земле (кларк 0,08%), его наиболее известная руда — пиролюзит МпОг, добываемая на Кавказе (г. Чиатура), Украине (г. Никополь), в Казахстане (Байконур). Основная доля запасов марганцевых руд приходится на карбонатные руды (около 61%), из которых более 40% в виде родохрозита МпСОз сосредоточено в Болыпе-Токмакском месторождении на Украине.
461
Кроме пиролюзита и родохрозита в природе в значительных количествах встречается псиломелан МпОг^хНгО; как примесь марганец встречается во многих других минералах и является постоянным спутником железа.
Рений — рассеянный элемент, собственных месторождений не имеет и обычно сопутствует рудам молибдена, меди, платины.
Первичный Тс, существовавший в природе несколько миллиардов лет тому назад при формировании Земли, исчез в результате радиоактивного распада. Обнаруживаемые в некоторых минералах следы Тс порядка 10"^ г/кг — результат спонтанного деления урана (минералы, содержащие уран) и воздействия космических нейтронов (минералы, содержащие Mo, Nb и Re).
Сырьем для получения Тс служат облученный тепловыми нейтронами молибден и продукты деления урана. На атомных элект-^станциях п^550%-ном выгорании 235U образуется около 600 мг Тс на 1 кг U.
Подробнее см.:Спицын В. И., Кузина А Ф. Технеций. — М.: Наука, 1981.
История открытия элементов. Марганец открыт в 1774 г. Шееле. Существование технеция (экамарганец) и рения (димарганец) предсказал еще в 1870 г. Д. И. Менделеев. Первым был обнаружен в продуктах переработки минералов колумбита и танталита рений (1928 г., Ноддак и Такке). Это был последний стабильный элемент, найденный в природе.
Ноддак Вальтер (1893—1960) — немецкий физнкохнмик.
Такке-Ноддак Ида (1896—1978) — немецкий физик-неорганик.
Сообщение об открытии нового 75-го элемента — рения в платиновых рудах было сделано еще в 1877 г. русским химиком С. Керном, о работах которого Ноддак и Такке, по-видимому, ничего не знали.
Подробнее см.: Друце И. Рений. — М.: Издатинлит, 1951.
Технеций — первый элемент, полученный в 1937 г. искусственным путем в ядерной реакции: «Мо (?H, п) «Тс. Из молибденовой мишени Тс был выделен Сегре и Перье. Элемент под номером 107 получен в 1976 г. группой физиков под руководством акад. Г. Н. Флерова в ядерной реакции: ®оэВ1 («Сг, 2п) гмЭ.
Перье Карло (1886—1948) — итальянский химик.
26.2. ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ
В виде простых веществ Мп, Тс и Re представляют собой блестящие металлы с высокой температурой плавления, увеличивающейся от марганца к рению (табл. 31). В этом направлении падает химическая активность металлов. С кислотами-неокислителями реагирует только марганец:
Мп + 2Н30+ + 4НгО •* [Мп(Н2О)б]2+ + Нг!
462
Таблица 31. Физико-химические свойства простых веществ
Свойства Металлы
марганец технеций рений
Температура плавления, °C 1245 -2200 3190
Температура кипения, °C 2080 -4600 -5900
Плотность р, г/см3 (25 °C) 7,4 11,5 21,0
Температура перехода в сверхпроводящее состояние, К — 8,2 1,7
Стандартный электродный потенциал у>°, В -1,19* +0,47** +0,37**
* Для пары Мп°/Мп2+.
** Для пары Э°/ЭО4 .
В холодных концентрированных азотной и серной кислотах металлические марганец, технеций и рений пассивируются (см. раздел 13.10). Но при нагревании марганец начинает с ними медленно взаимодействовать:
Мп + 2H2SO4 = MnSO4 + SO21 + 2Н2О
Мп + 4HNO3 = Mn(NO3)2 + 2NO21 + 2НгО
В разбавленной азотной кислоте реакции проходят более энергично с образованием устойчивых соединений со степенями окисления Mn(II), Tc(VII) и Re(VII):
ЗМп + 8HNO3 = 3Mn(NO3>2 + 2NO f + 2Н2О
3Re + 7HNO3 = 3HReO4 + 7NO f + 2H2O
Чистые рениевую и технециевую кислоты можно получить в реакциях металлов с раствором пероксида водорода, в частности:
2Re + 7Н2О2 = 2HReO4 + 6Н2О
С растворами сильных оснований не реагирует ни один из металлов, в щелочных расплавах взаимодействие идет только в присутствии окислителей:
t
Мп + ЗККОз(ж) + 2КОН<ж) = К2МПО4 + 3KNO2 + НгО
t
4Re + 4КОН<ж) + 70г = 4KReO4 + 2НгО
В атмосфере кислорода металлический марганец сгорает с образованием МпгОз («900 °C), при более высокой температуре получают двойной оксид (Мп, Мп2)О4; технеций и рений образуют при этом сразу свои гептаоксиды: ТС2О7, Re2O7- С серой расплавленной марганец образует сульфид (II) MnS, технеций и рений — дисульфиды TcS2 и ReS2.
463
Из 2—4 М растворов НС1, содержащих пертехнаты и перренаты, сероводород осаждает малорастворимые сульфиды, например
2(NH4)TcO4 + 8H2S = TC2S71 + (NH4)2S + 8Н2О
Аналогичная реакция с участием КМ11О4 приводит не к осаждению сульфида марганца, а выделению серы:
Мп04 + 8Н+ + 5е~-Мп2+ + 4НгО; H2S — 2<Г» S| + 2Н+
С водородом металлические марганец и рений не реагируют; с азотом и углеродом при высоких температурах (>1200 °C) марганец способен давать нестехиометрические нитриды ~ МпгИз и карбиды ~ МпзС.
С галогенами марганец реагирует очень энергично с образованием дигалогенидов — МпС1г, МпВгг, Мп!г, с фтором — MnF4; технеций и рений с галогенами дают соединения с более высокими степенями окисления: ReF?, TcFe, ReCb, ReBrs и др.
Порошкообразный марганец вследствие высокой химической активности (он более активен, чем цинк) разлагает при нагревании воду:
Мп + 2Н2О = Mn(OH)2 + H2t
26.3. ПОЛУЧЕНИЕ МЕТАЛЛОВ
Металлический марганец получают при помощи электролиза раствора MnSO4. Электролиз проводят при pH 6—8, когда еще не происходит осаждение Мп (ОН) 2:
катод (-) [Мп(Н2О)б]2++ 2е~ = Мп| + 6НгО
анод (+) 2НгО - 4е~ = Ог! + 4Н+
На аноде протекает также окисление Мп (II) до МпОг.
Если восстанавливать пиролюзит коксом, то образуется не чистый марганец, а его сплав с железом (MnFe) — ферромарганец (~ 70% Мп, ~ 20% Fe, примеси С, Р, Si и др.), так как пиролюзит всегда содержит оксид железа:
t
МпО2(РегОз) + С = (Мп, Fe) + СОг!
Технеций и рений выделяют из тетраоксометаллатов восстановлением водородом:
2NH4ReO4 + 4Н2 = 2Re + Nit + 8HiOt
Для получения технеция применяют также реакцию
Tc2S? + 7H2= 2Tc + 7HiSt
464
26.4. ХИМИЯ ВОДНЫХ РАСТВОРОВ
Технеций, рений и марганец в степени окисления (VII) в водном растворе входят в состав оксоанионов ТсО4, ReO4, Мп04- Эти анионы имеют тетраэдрическое строение за счет sd3-гибридизации АО центрального атома (аналогичное строение имеют и ионы МпО^ , МпО|~). В водных растворах оксоанионы в промежуточных степенях окисления (V) и (VI) чрезвычайно нестойки и легко диспропорционируют, например:
ЗКсОз + Н2О ** ReO4 + 2ReO? I + 2ОН
ЗМпО|“ + 4Н2О = МпО4 + 2МпО2| + 8ОН"
Особенно легко эти реакции проходят в кислой среде, способствующей выводу гидроксидных ионов.
Аквакатионы элементов в степени окисления (II) и (III) имеют состав: [Re(H2O)612+, [Тс(Н2О)б]3+, [Мп(Н2О)б]2+и [Мп(Н2О)б]3+-Наиболее устойчив аквакатион Мп(II), он образуется при растворении солей Мп(II) в воде, входит в состав солей Мп(II), например [Мп(Н2О)б]ШОз)2. Водные растворы марганца (II) дают кислую реакцию за счет обратимого протолиза:
[Mn(H2O)6 ]2+ + Н2О [Мп(Н2О)5ОН ]+ + Н3О+
Аквакатион марганца (III) крайне неустойчив. В водных растворах идет необратимый протолиз:
[Мп(Н2О)б ]3+ + Н2О = МпО (ОН) | + ЗН3О+ + 2Н2О
а в кислотных средах — диспропорционирование (см. раздел 33.3): 2 [Мп(Н2О)б ]3+ = [Мп(Н2О)б ]2+ + Мп021 + 4Н3О+
Крайне неустойчивы и аквакатионы Тс и Re, поэтому число солей Мп (III) ограничено: МпРз«2Н2О; MnPO4, Mn2(SO4)3, Мп(СНзСОО)з*2Н2О. Две известные соли Mn(IV) — MnF4 и Mn(SO4)2 в водном растворе подвергаются необратимому гидролизу:
Mn(SO4)2 + 2Н2О “ МпО2| + 2НгБО4
26.5. ОКСИДЫ И ГИДРОКСИДЫ
За исключением Мп2О?, все оксиды — твердые, окрашенные, нестехиометрические соединения с полупроводниковыми свойствами. Наименьшей термодинамической устойчивостью отличается МпО, в ряду Мп -• Тс -» Re устойчивость гептаоксидов явно возрастает (табл. 32).
У МпО и Мп(ОН)2 преобладают основные свойства: Мп(ОН)2(к) + 2Н3О+ + 2Н2О - [Мп(Н2О)б12+
С концентрированными водными растворами КОН гидроксид марганца взаимодействует только при нагревании, образуя гидроксо-манганаты красного цвета:
465
Таблица 32. Некоторые свойства оксидов и гидроксидов марганца, технеция и рения
Соединение Цвет Температура плавления, °C (298 К), кДж/моль
МпО Зеленый 1842 363
Мп(ОН)г Белый Разлагается 617
МпгОз Бурый 940* 880
МпО (ОН) Разлагается 578
МпОг Черно-бурый » 465
ТсО2 Черный Возг. 1000 381
ReOz Разлагается 396
ТсОз Красный 160 461
ИеОз 620 514
МпгО7(ж) Темно-зеленый 6 544
TC2O7 Светло-желтый 120 938
ReiOz 301 1098
* Переход в (Мп, МпгЮч.
Мп(ОН)2(к) + 4КОН - К4[Мп(ОН)б]
Оксид марганца (II) удобнее всего получать разложением его карбоната или гидроксида в отсутствие кислорода:
t t
Мп(0Н)2(к> = МпО + НгО; МпСОз(к) = МпО + СОгТ
Нерастворимый в воде гидроксид марганца (II) можно выделить в виде бело-розового осадка по обменным реакциям из его солей в среде инертного газа или азота для предотвращения окисления:
4Мп(ОН)2(к) +Ог“ 4Мп0(0Н) (К) + 2НгО
Оксид и гидроксид марганца (III) при взаимодействии с разбавленными кислотами диспропорционируют:
МпгОз + H2SO4 = MnSO4 + МпОг1 + НгО
2MnO(OH) + 2HNO3 = Мп(МОз)2 + МпОг! + 2Н2О
а при нагревании с концентрированными кислотами выделяют кислород:
t
2МпгОз + 8HNO3 = 4Мп(ЫОз)2 + 4НгО + ОгТ
t
4Мп0(0Н) + 4Нг5О4 = 4MnSO4 + 6Н2О + Ог!
С галогеноводородными кислотами реакции идет иначе, например Мп20з + 6НС1 = 2МпС1г + Cht + ЗН2О
Для получения МпгОз используют низкотемпературное окисле
ние металлического марганца кислородом или высокотемпературное разложение диоксида марганца; метагидроксид получается по обменным реакциям из немногочисленных солей Мп(Ш), а также при окислении на воздухе Мп (ОН) 2 (см. выше).
Оксид марганца (IV), обладая очень прочной кристаллической решеткой (см. табл. 14), с гидроксидами щелочных металлов и с разбавленными кислотами вообще не взаимодействует. С концентрированными кислотами при нагревании протекают процессы, характерные для МпгОз:
г
2МпОг + 4НЫОз = 2Мп(МОз)г + Ог! + 2НгО
t
2МпОг + 2HzSO4 = 2MnSO4 + Ог! + 2НгО
МпОг + 4НС1 = МпС1г + С1г! + 2Н2О
Диоксид технеция отличается по свойствам от МпОг и ReOz. При нагревании до 900—1000 °C в вакууме он сублимирует без разложения, в то время как ReOz в тех же условиях диспропорционирует:
7ReOz = 3Re + 2RezO?
а МпОг разлагается:
2МпОг = 2МпО + Ог!
В отличие от МпОг и ReOz диоксид технеция взаимодействует с разбавленными водными растворами кислот с образованием аниона ТСО4:
2ТсОг + 3H2SO4 “ 2НзО+ + 2ТсО4 + 3S0z!
Важной особенностью оксида марганца (IV) является его каталитическая активность в различных окислительно-восстановительных процессах, например:
МпОг
2НгОг = 2НгО + Ог!
МпО2
2КС10з = 2КС1 + 30г!
Оксид марганца (IV), имея промежуточную степень окисления марганца, способен проявлять и восстановительные свойства при наличии достаточно активных партнеров. Так, в щелочном расплаве нитрата калия оксид марганца (IV) переходит в зеленый расплав манганата (VI) калия, являющийся солью несуществующей кислоты Н2МПО4:
МпОг(к) + КЫОз(ж) + 2КОН(Ж) = К2МпО4 + КЫОг + НгО
При растворении полученного плава в воде и при последующем даже слабом подкислении манганаты (VI) диспропорционируют:
ЗМпО1~ + 2НгО -= 2МпО4 + МпОг! + 4ОН~
467
3MnOi + 4С0г<г) + 2НгО =» 2MnO4 + МпОг! + 4НСОз
Манганаты (VI) проявляют сильные окислительные свойства:
К2М11О4 + С2Н5ОН = МпОг! + СНзСОН + 2КОН
а с такими сильными окислителями, как хлор, и слабые восстановительные свойства, например
2КгМпО4 + С12(р> = 2КМпО4 + 2КС1
Оксид марганца (IV) является продуктом многих реакций диспропорционирования, в лаборатории его синтезируют по реакции
t
ЗМпСОз(к) + КС1Оз(ж) = ЗМпОг(к) + КС1(к> + ЗСОгТ
с последующей отмывкой от хлорида калия водой.
Высшие оксиды МП2О7, ТС2О7 и ЫегО? обладают ярко выраженными кислотными свойствами. Растворяясь в воде, они дают сильные кислоты: ЙМ11О4, НТсС>4, HReCU; например
НМпО4 + НгО =» НзО+ + Мп04
В свободном состоянии эти кислоты не выделены и существуют только в виде водных растворов с максимальной концентрацией 20—25%. При сильном упаривании их растворов кислоты разлагаются:
4НМпО4 = 4МпОг! + 2НгО + ЗОгТ ; 2HReO4 = RC2O7 + Н2О
Оксиды технеция и рения (VII) — вполне устойчивые, кристаллические соединения, плавящиеся без разложения (см. табл. 32).
Структура МП2О7 не изучена, а структуры ТС2О7 и R егО? различны: если структура РегО? имеет полимерный характер, то структура ТС2О7 подобна слоистой структуре СгОз, R11O4 и OsO4 (рис. 95).
Оксид марганца (VII) разлагается уже при 55 °C, а от удара взрывается:
t
2МпгО7(ж) = 4MnO2 + 3O2t
Для лабораторного получения гептаоксида димарганца пользуются реакцией
2КМпО4(к> + H2SO4 •“ Мпг07(ж> + Н2О + K2SO4
В водных растворах перманганат-ион проявляет сильнейшие окислительные свойства, несколько ослабевающие с ростом pH раствора (см. раздел 33.4):
в сильнокислотных растворах
МпОд + 8Н+ + 5е~ = Мп2+ + 4Н2О; <р° = + 1,53 В
в слабокислотных и слабощелочных (pH 6—8)
МпО4 + 2НгО + Зе = МпО2| + 4ОН ; ^р°и + 0,62 В
468
Рис. 95. Структуры ТС2О7 (а) и ReiO? (б)
в сильнощелочных средах
МпОд + е~ = МпО^ ; <р ° = + 0,56 В
В сильнощелочных средах при значительном избытке восстановителя и достаточном охлаждении (до ~ 0 °C) могут быть выделены манганаты (V), окрашивающие водные растворы в синий цвет:
МпОд + 2е~ = MnOi"
Промышленный способ получения важного химического соединения — перманганата калия заключается в двухстадийном окислении природного продукта — пиролюзита: на первой стадии его переводят в щелочных расплавах (КОН или К2СО3) в зеленый манганат калия:
469
2МпОг(к> + 4К0Н(Ж) + Ог = 2КгМпО4 + 2НгО
который во второй стадии процесса электрохимически окисляют в водном растворе до перманганата (раньше эту операцию выполняли с помощью элементарного хлора):
анод (+) МпОЗ - = Мп04
катод (-) 2НгО + 1е - Нг t + 2ОН”
Известен также электрохимический метод получения КМпО4 в одну стадию путем анодного окисления железомарганцевых сплавов в щелочной среде:
анод (+) Мп + 8ОН” - Те’ = МпС>4 + 4НгО
катод (-) 2НгО + 2е~ = Нг! + 2ОН~
Для лабораторного получения перманганатов используют достаточно мощные окислители типа NaBiOa, РЬОг, (Pb£, PbIV)Oz:
lONaBiOs + 4MnSO4 + 28HNO3 = 4NaMnC>4 + 8Bi(NO3>3 +
+ Biz(SO4>3 + NazSCM + 4NaNO3 + 14НгО
При этих процессах следует избегать избытка восстановителя, так как образующийся перманганат может вступать с ним в реакцию конмутации:
ЗМп2+ + 2МпО4 + 2НгО = 5МпОг| + 4Н+
Перманганаты относятся к термически неустойчивым соединениям: при нагревании идут внутримолекулярные окислительно-восстановительные реакции с образованием твердых манганатов (VI), оксида марганца (IV) и выделением кислорода (см. лабораторный способ получения чистого О?). Перренаты щелочных металлов, наоборот, термически стойкие, высокоплавкие (>540 °C) бесцветные кристаллические соединения.
26.6. СОЛИ
Многочисленные соли образует только Мп (II). У Тс и Re нет солеобразных соединений, в которых они были бы представлены в виде простых катионов, за исключением, может быть, сульфидов с полярной ковалентной связью.
С увеличением степени окисления марганца число образуемых им солей резко убывает. Так, у Мп(Ш) известны МпРО4*НгО, МпРз«2НгО, Mnz(SO4)3, МпС1з (при температуре -40 °C и выше разлагается на МпС1г и С1г) и Мп(СНзСОО)з*2НгО. Марганец (IV) образует всего две соли: МнЕц и Mn(SO4)2, являющиеся скорее полярными ковалентными соединениями. Получен МпСЫ, существующий ниже -10 °C.
Все соли Мп(Ш) и (IV) малоустойчивы. Они легко восстанавливаются в кислых растворах до солей Мп(Ш« в нейтральных и
470
Щелочных водных растворах подвергаются гидролизу и диспропорционированию. Например:
2MnF3 + 2Н2О = МпОг| + MnF2 + 4HF
Марганец (II) образует соли почти со всеми анионами. Кристаллы его водорастворимых солей содержат, как правило, в виде структурной единицы аквакатионы, например [Mn(H2O)61(NO3)2, [Mn(H2O)4]SO4«H2O, [Мп(Н2О)4]С12. Большинство солей Мп(II) хорошо растворяется в воде. К малорастворимым солям принадлежат карбонат, фосфат и сульфид. Марганец образует в водном растворе только один сульфид MnS, взаимодействующий с разбавленными кислотами-неокислителями (ПРмпЗ = 1,1*10 * , 25 °C). Сульфиды марганца, имеющего степень окисления (III), неизвестны из-за окислительных свойств последнего:
2MnF3 + H2S = 2MnF2 + SI + 2HF
Известен термически неустойчивый MnS2, аналог пирита FeS2 — солей дисульфида водорода.
Технеций и рений образуют сульфиды составов MS2 и M2S7. Первые получают при сплавлении металлов с серой, а вторые осаждаются из водных растворов НТсО4 или NH4TCO4, HReO4 или NH4ReO4 при действии K2S или H2S:
2HReO4 + 7H2S = Re2S7 + 8Н2О
С концентрированной азотной кислотой гептасульфид дирения взаимодействует, давая вновь рениевую кислоту:
Re2S7 + 56HNO3 - 2HReO4 + 56NO2t + 7H2SO4 + 20Н2О
26.7. КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
Комплексные соединения Мп, Тс и Re очень разнообразны по составу и свойствам. Все три элемента обладают склонностью к образованию ацидокомплексов и карбонилов.
Основная масса ацидокомплексов содержит Мп, Тс и Re в низших степенях окисления, которые при комплексообразовании стабилизируются, как, например, в цианидных комплексах рения: [ReI(CN)6]5-, [Reni(CN)6]3 , [ReIV(CN)8]4 . Неустойчивый МпС14 при взаимодействии с КС1 превращается в стабильный К2[Мп1уС1б], выделяющийся из раствора в виде темно-красных кристаллов. Цианид марганца (III) неизвестен, но темно-красные кристаллы Rb3[Mn n(CN)6] устойчивы. Фторид Мп(Ш) в водном растворе подвергается гидролизу и диспропорционированию, а комплексы K[MninF4] и Кг[Мпшр5] кристаллизуются без изменения их состава.
Все аква- и большинство ацидокомплексов Мп (II) малоустойчивы и парамагнитны. Высокоспиновые комплексы [Мп(Н2О)бГ , [Мп(ох)3Г , [Mn(NCS)6]4~ содержат 5 неспаренных электронов, равномерно распределенных по d£- и dy-подуровням (значение До аквакомплекса равно 7800 см-1).
471
Лишь цианидный комплекс [Мп(СЫ)б]4 обладает относительно большей устойчивостью: за счет сильного электростатического поля цианидных лигандов все d-электроны оказываются на более энергетически выгодной de-AO с одним неспаренным электроном (большое значение До):
Мп (II) 3ds
Аммиакат Мп (II) очень неустойчив, а Тс и Re аммиакаты не образуют.
Карбонилы Мп, Тс и Re являются двухъядерными кластерами состава [Мг(СО)ю], где М-Мп, Тс или Re. Они представляют собой диамагнитные, изоморфные кристаллические вещества, устойчивые на воздухе, легко сублимирующие в вакууме и имеющие т. пл. ~ 150—180 ЬС. Структура карбонилов представлена на рис. 96.
Одинарная о-связь М—М в карбонилах образована перекрыванием dz2-AO металлов, а связи М—СО имеют дативный 7Г-характер.
Карбонилы Мп, Тс и Re не могут быть получены непосредственным взаимодействием металла и монооксида углерода, в частности, при нагревании Мп и СО протекает экзотермическая реакция
Рис. 96. Структуры карбонилов (М=Мп, Тс или Re) Мп—Мп = 292 пм; Re—Re = 302 пм; Мп—СО = » 185 пм
Рис. 97. Структура комплекса [ReHg] 2~. Трехшапочная тригональная призма
472
Мп + СО = МпО + С
Карбонил марганца образуется при взаимодействии МпС1г, Мп1г или Мп(СНзСОО)2 с СО в присутствии катализатора и при повышенном давлении:
2Мп1г + 10СО - [Мп2(СО)1о] + 21г f
Карбонилы Тс и Re получают с использованием реакций типа
ТС2О7 + 17СО = [Тс2(СО)ю1 + 7СО2Т
Гидридные комплексы состава [TcHq]2- и [ReH9]2~ образуют только технеций и рений. Соединения, содержащие нонагидридотехнат- и нонагидридоренат-ионы устойчивы лишь в сильнощелочных средах. На воздухе кристаллы гидридных комплексов неустойчивы, постепенно разлагаются с образованием перренатов или пертехнатов и карбонатов внешнесферных катионов.
Связи в гидридных комплексах образованы цо лонорно-акцеп-торному механизму перекрыванием вакантных sp3cr-гидридных орбиталей металла (VII) с s-AO гидридных анионов Н , несущих пару электронов. Поэтому гидридные комплексы Тс и Re диамагнитны, а структура их анионов — трехшапочная тригональная призма. Лиганды в такой структуре расположены в вершинах призмы и над каждой прямоугольной ее гранью (рис. 97).
Получение гидридных комплексов производят в среде 100%-ного этанола, без доступа влаги и кислорода воздуха воздействием на пертехнаты и перренаты водородом в момент его выделения:
NaReO4 + 18Na + 1ЗС2Н5ОН = Na2[ReH<j] + 4NaOH + 13C2H5ONa
Рений и в меньшей мере Тс обладают удивительной способностью к образованию полиядерных комплексных соединений — кластеров. Известны двухъядерные кластеры [ТсгОвГ , [Re2(NCS)ior > [РегОвГ » в которых связи М===М четверные (6А, две Л-связи и 'одна d-связь); двухъядерные, например тетрахлоротетракис(три-этилфосфин) дирения [Re2(PEta)4C14], в котором связь Rer-^Re тройная; трехъядерные, например [ReaCln]3-, [ReaCl<>] , в которых связи Re—Re двойные.
Четверные связи очень короткие. Так, в комплексе [ТсгОвГ длина связи Тс—Тс равна 214 пм, она много меньше, чем в металлическом Тс (273 цм). Степень окисления Тс в таком комплексе дробная, равная 2,5.
В структуре нонахлорида трирения [ReaClg] три атома рения связаны между собой непосредственно О- и Л-связями и, кроме того, тремя мостиковыми атомами хлора; остальные шесть атомов хлора являются концевыми (см. рис. 94). В таком кластере степень окисления (III) у рения оказывается очень устойчивой: [ReaCto ] плавится без окисления и разложения выше 250 °C.
473
26.8. ПРИМЕНЕНИЕ
Вследствие активного взаимодействия марганца с серой его в широком масштабе используют для удаления из железных сплавов серы, поскольку примесь сульфида железа придает им повышенную хрупкость:
FeS + Мп = Мп5(ж) + Ре(ж); AG0 (298 К)--117 кДж
В металлургических процессах марганец в виде своего сульфида уходит в шлаки и поэтому, к сожалению, безвозвратно и в большом количестве теряется: выплавка 1 т стали требует в среднем затраты 1 кг марганца. Замена мартеновского способа выплавки стали на конвертерный (см. раздел 27.3) позволяет снизить содержание марганца в чугуне с 0,4—0,6 до 0,2% и уменьшить его потери и расход в металлургии стали. Значительная доля марганца идет на выплавку ударопрочных марганецсодержащих (12—15%) сталей.
Диоксид марганца находит широкое применение в качестве компонента активной массы электродов гальванических элементов, как окислитель, абсорбент и катализатор. Перманганат калия используют как окислитель в органическом синтезе, а антисептическое действие его находит применение в медицине.
Хлорид марганца (II) и МпОг — составная часть сиккативов (ускорителей полимеризации олиф и масел), МпСОз и МпОг — пигменты минеральных красок.
Более 80% рения используют в производстве биметаллических платино-рениевых катализаторов для получения высокооктановых сортов бензина из низкосортных методов риформинга. Ограниченное применение находит рений при изготовлении высокотемпературных платино-рениевых термопар, его механическая и коррозионная стойкость позволяет использовать рений для неокисляющихся контактов в радиоэлектронике.
26.9. ТОКСИКОЛОГИЯ
Необходимо отметить, что микроколичества марганца играют важную роль в жизнедеятельности животных, растений и человека. Соединения марганца активируют работу многих ферментов, дефицит марганца в почве приводит к снижению плодородия, а в живых организмах — замедляет рост костных тканей.
С опасностью отравления соединениями марганца сталкиваются горные рабочие при добыче пиролюзита и работники химических производств, где производится (или используется) перманганат калия. В сталеплавильном деле также возможна интоксикация соединениями марганца. Общие признаки отравления — жалобы на головную боль, быструю утомляемость, вялость. При хронических отравлениях — изменение кровяного давления, при действии на кожу — дерматит и экзема, разбухание лимфатических желез-Попадание перманганата калия через рот и дыхательные пути в
474
организм человека приводит к пневмонии, воспалениям желудочно-кишечного тракта. По-видимому, таким же действием, но в меньшей степени, обладают соединения рения (VII) — ЕегО? и рениевая кислота.
Упражнения к главе 26
1. К какому элементу Vllb-группы ближе всего по свойствам технеций? С чем это связано?
2. Предложите способ отделения металлического рения от марганца из нх смеси.
3. Можно пн в посуде из металлического марганца проводить упаривание водных растворов сильных оснований? Устойчива ли такая посуда к щелочным расплавам?
4. Почему получаются разные продукты прн взаимодействии с разбавленной азотной кислотой металлических марганца и рения? Как будет вести себя в тех же условиях металлический технеций?
5. Объясните устойчивость в водных растворах солей Мп(П) и быструю окиспяемость Мп(ОН)2.
6. Имеется смесь оксида марганца (II) и диоксида. Как выделить диоксид марганца в чистом виде?
7. Составьте уравнение реакции окисления нитрата марганца тетраоксидом свинца (IV) — дисвинца (II) в азотнокислой среде. Используя значения стандартных окислительно-восстановительных потенциалов, определите, возможно ли ее протекание в стандартных условиях.
8. Предскажите тип гибридизации центрального атома в карбонилах марганца, технеция н рения. Какую структуру имеют молекулы этих карбонилов?
ГЛАВА 27. ХИМИЯ ЭЛЕМЕНТОВ УШБ-ГРУППЫ
УШБ-группа содержит наибольшее число элементов — 9, не считая открытых, но еще не названных пока элементов 108—ПО. Отличительным свойством элементов семейства железа (Fe, Со и Ni) является преобладание горизонтальной повторяемости свойств (периодичности) над периодичностью в вертикальных столбцах соответствующих групп, куда входят еще шесть элементов семейства платины (Ru, Rh, Pd, Os, Ir и Pt). В частности, электроотрицательности % железа, кобальта и никеля гораздо ближе между собой, чем с электроотрицательностями элементов семейства платины:
Fe 1,64; Ср 1,70; Ni 1,75 Xcp-1.70
Ru 1,42; Rh 1,45; Pd 1,3?) %cP=l,46
Os 1,52; Ir 1,55; Pt 1.44J
475
Если сравнить изменение энергии Гиббса образования любых однотипных соединений элементов УШБ-группы, например хлоридов, то и здесь скажется подмеченная выше закономерность: близость значений Д/G0 (298 К), кДж/моль по горизонтали:
I eCh(K) -303 СоСЬ(к) -270 NiCizfn) -259
RuC12(k) -146 RhChw -Ш PdC12(x) -150
OsCh(K) - IrCh(K) -149 Р1С1зд -93
Учитывая эту особенность УШБ-группы, свойства элементов семейства железа обычно рассматривают отдельно от свойств платиновых металлов.
Кажущаяся «перенаселенность» УШБ-группы находит свое логичное объяснение в строгой последовательности заполнения электронами внешних атомных орбиталей: 8 валентных электронов у железа, рутения и осмия, 9 электронов — у кобальта, родия и иридия, 10 электронов — у никеля, палладия и платины, в связи с чем эти вертикальные столбцы называют группами и обозначают УШБ, УШБ1 и УП1Б2, отражая тем самым общее число валентных электронов:
УШБ VIIIBl VIIIB2
Fe 4s23d6 Co 4?3d7 Ni 4s23rf8
Ru 5?4г/7 Rh 5sl4<f Pd 5s°4</1D
Os bifsd6 Ir 6s25d7 pt esW
Некоторая аномальность в распределении электронов у элементов пятого периода связана с необычайной устойчивостью 4d -АО. В меньшей степени стремление к полному заполнению 5</ -АО про
является также у платины — ппедшественника в периодической таблице золота Au — [Xejbs^d . В целом, общую электронную конфигурацию элементов всех трех групп от УШБ до УШБ2 можно
записать: ns0"*2 (и - 1) t/6”*10.
Набор степеней окисления у рассматриваемых элементов в их соединениях необычайно богат: от (0) до (VIII); наиболее устойчивые
из них указаны ниже:
Fe(III) Co(II) Ni(II)
Ru(IV) Rh(II) Pd(II)
Os(VIII); (VI) Ir(IV) Pt (ID; (IV)
Как во всех d-группах, сверху вниз по каждой группе растет устойчивость более высоких степеней окисления. Необходимо отметить, что высшую степень окисления (VIII) проявляют лишь элементы УШБ-группы: рутений (ИиОд), осмий (OsC>4, OsFg, OSO3F2)» для последнего она самая характерная, и железо (ЕеОд).
В частности, получены растворы FeCU в ССЦ путем извлечения тетраоксида экстракцией ССЦ из щелочных водных растворов, образующихся при анодном окислении железа:
476
Fe + 801Г - 8г = FeO4 + 4H2O
Растворы FeO4 в ССЦ в обычных условиях неустойчивы:
4FeO4 = 2Бе20з 4 + 50г f
Подробнее см.: Киселев Ю. М., Копелев II. С., Спицын В. И., Мартыненко Л. И. ДАН СССР, 1987. Т. 292. С. 628.
При сплавлении ЬезОз с КОН и KNO3 образуются темно-красные ферраты (VI):
Ре20з + 4К0Н + 3KNO3 - 2K2FeO4 + 3KNO2 + 2Н2О
По своей окислительной способности они превосходят такой окислитель, какКМПО4: ^°Fe3+/FeOi" =+1,90В;^°Мп2+/МпО4 = +1,53 В.
Окислительные свойства в VIIIB-группе от Fe(VI) к Os(VIII) резко ослабевают. Тетраоксид осмия уже проявляет свойства мягкого окислителя. В частности, водный раствор аммиака на OsO4 не действует, а при низких температурах (-33 °C) выделен продукт присоединения OsO4*NH3-
В степени окисления (II) Fe, Со и Ni образуют соли практически со всеми устойчивыми анионами. Число простых соединений у тех же элементов со степенью окисления (III) резко уменьшается при переходе от Fe к Ni. У кобальта известны C0F3, Co(NO3)3, СоО(ОН), Co2(SO4)3« 18Н2О, а у никеля (III) существование солей не доказано, получен только NiO(OH).
Железо (III) не образует соли с анионами-восстановителями (I , S2-, SO^ и др.). Поэтому невозможно получение в водных растворах Feb или Ре28з:
2Fe3+-+ 2Г = 2Fe2+ +121 ; 2Fe3+ + HS~ = 2Fe2+ + S | + H+
В отличие от металлов семейства железа платиновые металлы представляют собой химически инертные вещества, не взаимодействующие с кислотами-неокислителями. Более или менее реакционноспособным является Pd. Палладий в порошкообразном состоянии реагирует с концентрированной HNO3 (особенно хорошо, если кислота содержит диоксид азота), с хлороводородной кислотой, в которой растворен хлор:
Pd + 4HNO3 = [Pd(NO2)2(NO3)2]° + 2Н2О
Pd + 2НС1 + 2С12 = Н2 [PdCIe 1
Платина не взаимодействует ниже 100 °C ни с одной отдельно взятой кислотой, на нее действует только смесь ЗНС1 + HNO3:
ЗНС1 + HNO3 NOC1 + С12 + 2Н2О;
Pt + 2НС1 + 2С12 = Н2 [PtCl6 ]
Все металлы УШБ-группы, кроме Ni, разрушаются при действии расплавов гидроксидов щелочных элементов в присутствии окислителей (KNO3, Na2O2, КСЮз и др.); например, железо превращается в ферраты (VI), рутений — в рутенаты (VI):
477
2Ru + 4K0H + ЗО2 = 2KzRuO4 + 2НгО
Гидроксиды образуют только элементы семейства железа. В чистом виде большинство гидроксидов платиновых металлов пока не выделено и поэтому мало изучено.
Амфотерные свойства для гидроксидов и оксидов элементов VIIIB-групп не характерны.
Химия платиновых металлов — это прежде всего химия комплексных соединений, число которых очень велико, а состав крайне разнообразен.
27.1. РАСПРОСТРАНЕННОСТЬ В ПРИРОДЕ. ОСНОВНЫЕ МИНЕРАЛЫ
Элементы семейства железа имеют значительно большие кларки по сравнению с платиновыми металлами. После кислорода, кремния и алюминия железо занимает 4-е место по распространенности в Земной коре — 4,7%. Кларки кобальта и никеля равны соответственно 4*10 d и 0,02%. Все платиновые металлы относят к числу редких, их кларки 10 7 - 10~”%. Наиболее распространенными среди них являются рутений и палладий.
Из железосодержащих минералов самым ценным является магнетит (магнитный железняк), по своей природе являющийся двойным оксидом (Fe, Fe2)O4, однако промышленные залежи магнитного железняка практически все уже выработаны. Основным сырьем для производства железа сейчас являются гематит РегОз (красный железняк) и гетит, или лимонит, FeO(OH) (бурый железняк).
В металлургии железа применяют в качестве сырья также с и-д е р и т РеСОз и даже пирит FeS2 (см. табл. 14). Железных руд становится все меньше и меньше. По расчетам в 2000 г. потребуется для народного хозяйства 3»1О10 т железа, а разведанные запасы железных руд не превышают 7»1011 т железа.
Полагают, что твердое ядро Земли, начиная с глубины 2900 км (экваториальный радиус Земли 6377 км), состоит из сплава железа (91—92%) и никеля (8—9%).
Кобальт и никель чаще всего встречаются в виде сульфидных минералов: кобальтин CoAsS (промышленного значения не имеет), петландит (Fe, Ni)S, никелин NiS(As). Никель добывается под Норильском совместно с платиновыми металлами, залежи полиметаллических руд с достаточно высоким содержанием кобальта находятся на Среднем Урале (Пышма).
На долю медно-никелевых руд, содержащих петландит, приходится 90% мировой выплавки никеля. Из этих руд добывается также значительное количество меди, кобальта, платиновых металлов, селена и теллура.
Платиновые металлы встречаются в природе в самородном состоянии и в виде сплавов друг с другом: осмиридий (17—80% осмия), ферроплатина (до 20% железа). В мексиканском золоте содержится до 43% родия.
478
История открытия элементов. Железо используется человеком с III—II тысячелетия до н. э. Соединения кобальта применялись уже в XV в. до н. э., а металл впервые был получен в 1736 г. Брандтом. Никель открыт в 1751 г. Кронстедтом.
Бранд Георг (4694—1768) — шведский химик и минералог.
Кронстедт Аксель (1722—1765) — шведский химик и минералог.
Платина известна, по-видимому, как золото, серебро и ртуть, с древних времен. Первое описание платины как металла относят к 1557 г. Другие платиновые металлы были открыты в течение 1803— 1804 гт.: родий и палладий — Вулластоном, осмий — Теннантом. Позднее всех, в 1844 г., был открыт Клаусом рутений (от лат. Ruthenia — Россия) в платиновых отходах Петербургского монетного двора.
Вулластон Уильям (1766—1828) — выдающийся английский химик, врач и фнэик, один из первых защитников основ атомистической теории.
Теннант Смитсон (1761 — 1815) — английский профессор химии, доктор медицины, ботаник, математик, член Лондонского Королевского общества.
Клаус Карл Карлович (1796-1864) - профессор химии Казанского университета, директор института фармации, член-корреспондент Петербургской АН.
27.2. ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА ЖЕЛЕЗА, КОБАЛЬТА И НИКЕЛЯ
Элементы семейства железа в виде простых веществ представляют собой твердые, серебристо-белые, тугоплавкие металлы (табл. 33).
Таблица 33. Некоторые физико-химические свойства железа, -кобальта и никеля
Свойства Металлы
железо кобальт никель
Температура плавления, °C 1539 1494 1455
Температура кипения, °C 2872 2957 2897
Плотность р, г/см3 (25 °C) 7,91 8,90 8,90
Стандартный электродный потенциал °, В, для полурс-акции М2+ + 2е~ = М° -0,44 -0,28 -0,23
Химическая активность в ряду Fe -* Со -» Ni падает: если металлическое железо на холоду быстро реагирует с кислотами-неокис-лителями, то кобальт и никель взаимодействуют уже при нагревании. Все рассматриваемые металлы образуют при этом аквакатионы:
Fe + 2Н3О+ + 4Н2О = [Fe(H2O)612+ + H2f
В холодных концентрированных серной и азотной кислотах металлы (см. раздел 13.10) пассивируются (что позволяет концентрированную НгБОд транспортировать в железных цистернах); в разбавленной
479
азотной кислоте образуются нитраты металлов в своих устойчивых степенях окисления (см. раздел 7.11):
Fe + 4HNO3 - Fe(NO3)3 + NO t + 2H2O
ЗСо + 8HNO3 = 3Co(NO3)2 + 2NOt + 4Н2О
Активность железа проявляется в его взаимодействии с водой: в отличие от кобальта и никеля оно окисляется до 600 °C:
Fe + Н2О j=z FeO + H2f
При повышении температуры выше 600 °C равновесие этой реакции сдвигается влево. Уникальна способность железа к атмосферной коррозии: под действием влаги и воздуха ежегодно теряется - 10% всего производимого металлического железа:
4Fe + 2Н2О + ЗО2 = 4FeO(OH)
Однако очень чистое железо, содержащее менее 0,01 % примесей углерода, серы и фосфора, оказывается коррозионно-устойчивым.
Металлические железо и кобальт взаимодействуют при нагревании с концентрированными ~ 50%-ными растворами гидроксидов щелочных элементов:
Fe + 2ОН~ + 2Н2О = lFe(OH)4 ]2 + Н2 г
Никель устойчив к действию щелочных растворов и расплавов.
Все три металла горят в атмосфере кислорода, образуя оксиды Fe2O3, СоО, NiO. В мелкораздробленном состоянии (частицы < 5 мкм) все металлы пирофорны, д. е. способны самовозгораться на воздухе. Элементы семейства железа реагируют с расплавленной серой, образуя нестехиометрические сульфиды (~ FeS, - CoS, ~ NiS, — FeS2), активно взаимодействуют с галогенами с образованием тригалогенидов железа, кроме Fel3, дигалогенидов кобальта и никеля и СоРз. С фтором металлы реагируют в обычных условиях слабо, особенно никель, из-за образования на поверхности плотной, малолетучей пленки фторидов. Никель не разрушается фтором даже при 500—600 °C. При высоких температурах металлы взаимодействуют с азотом, фосфором, образуя соответственно нитриды и фосфиды нестехиометрического состава: ~ Ni3N2 и ~ Fe3P, ~ C03N2 и т. д. (см. раздел 29.4).
При температурах более 500 °C металлы взаимодействуют обратимо с углеродом: ЗМ + С ^=?МзС. Карбид железа такого состава называют цементитом. Углерод может растворяться до 1,7% в y-Fe-полиморфной модификации, существующей между 912 и 1394 °C. Такой твердый раствор (фаза внедрения) называют аустенитом. В CZ-Fe полиморфной модификации, устойчивой до 770 °C, углерод практически нерастворим. Если y-Fe превращается в Ct-Fe, то углерод выделяется. Но при быстром охлаждении аустенита переход в CZ-Fe происходит без выделения углерода-Такое железо называется мартенситом, оно обладает высокой твердостью, но в то же время и хрупкостью.
480
Мелкораздробленные металлы (Fe, Со, Ni), особенно никель, поглощают в значительных количествах водород. Поглощение водорода резко возрастает после образования металлами интерметаллических соединений типа пентаникель-лантана LaNis. Если металлы гидридов не образуют, то LaM5(M - Ni, Со, Fe), поглощая водород, превращается в нестехиометрический гидрид состава LaMsHx, где - 5—6 при содержании в водороде не более 1 % кислорода.
27.3. ПОЛУЧЕНИЕ МЕТАЛЛОВ
Развитие промышленности немыслимо без производства чугуна (2—4% углерода в железе) и стали (менее 2% углерода в железе). Объем производства этих железосодержащих сплавов характеризует технический прогресс страны. Химической основой получения металлического железа и его сплавов является восстановление оксидов железа:
Fe2O3 + 3CO^2Fe + 3CO2t
Вначале в доменных печах с применением кокса выплавляют чугун. Затем чугун превращают в сталь двумя способами: конвертерным и мартеновским. В конвертерном способе через расплавленный чугун, налитый в грушевидный сосуд-конвертер, продувают воздух, который окисляет часть углерода до СО, примесь FeS превращается при этом в РегОз и SO2. В мартеновском процессе над расплавленным чугуном продувают воздух вместе с горящим газом, при этом также происходит частичное окисление углерода до СО и серы до SO2. Дефицит кокса из-за уменьшения природных запасов коксующихся углей заставил искать другие пути получения стали. Новым металлургическим процессом стал процесс предварительного превращения железной руды при ее обогащении в «окатыши», которые затем обрабатывают во вращающихся печах при 1100 °C смесью Нг и СО до перехода их в губчатое железо. Переплавляя губчатое железо в электропечах, получают сталь, минуя стадию выплавки чугуна.
Выделение из руд кобальта и никеля — сложный металлургический процесс, который в этом учебнике не рассматривается.
Железо, кобальт и никель особой степени чистоты (менее 0,01 % примесей) получают через их карбонилы, для чего исходные технические металлы обрабатывают при 150—200 °C под давлением монооксидом углерода. Образующиеся при этом жидкие карбонилы затем разлагают при более высокой температуре (/? > ft) до металла. Например:
Д <2
Ni<K> + 4СО(г) = [№(С0)4]<ж> = Ni<K) + 4СО(г)
Очистка в этом процессе основана на том, что сопутствующие примеси если и образуют карбонилы, то с резко отличными от исходного вещества температурами кипения и поэтому легко отделяются от него перегонкой.
16—1258
481
27.4. ХИМИЯ ВОДНЫХ РАСТВОРОВ
Соли Fe(II), Со(П) и Ni(II), будучи растворенными в воде, образуют аквакатионы [Fe(H2O)6] , [СоШгСОбГ и [№(НгО)б] , придающие раствору соответственно бледно-зеленую, розовую и зеленую окраску. Катион гексаакважелеза (II) легко подвергается окислению кислородом воздуха, переходя в аквакатион железа (III): [Fe(H2O)6]2+-e~= [Fe(H2O)6]3+; <р° — 0,76 В
У кобальта (III) и никеля (III) аналогичных аквакатионов нет. Все перечисленные аквакатионы являются в водном растворе катионными кислотами, сила которых уменьшается в ряду
IFe(H2O)6]3+ > [Fe(H2O)6]2+ > [Со(Н2О)б)2+ > [Ni(H2O)6]2+
Протолиз иона [Ре(НгО)б]3+ при pH >2 проходит с последовательным образованием ионов [Ре(НгО)5ОН]2 , [Fe(H2Q)4(OH)2]+, [(H2O)4Fe(OH)2Fe(H2O)4] , [(H2O)4Fe(O)2Fe(H2O)4] , а при pH > 3 из раствора выпадает в конечном итоге метагидроксид железа FeO (ОН). Водные растворы хлоридов содержат смешанные хлороаквакомплексные частицы: [FedbOUCh] , [Со(Н2О)4С1г] , [Ni(H2O)4C12]°, [Fe(H2O)4C12]+. Из насыщенных водных растворов галогенидов, нитратов, сульфатов и других солей железа, кобальта и никеля кристаллизуются соли, содержащие в своем составе высокоспиновые, парамагнитные аквакатионы: [Fe(H2O)6]SO4*H2O; [№(НгО)б]СОз; [Со(НгО)б]С12; [Ni(H2O)6](NOs)2. В аквакатионах все молекулы воды или их часть легко замещаются на другие лиганды. Например:
[Fe(H2O)6]2+ + 2Cr ^=± [Fe(H2O)4C12]0 + 2H2O [Ni(H2O)6]2+ + 6NH3 = [Ni(NH3)6]2+ + 6H2O
27.5. ОКСИДЫ И ГИДРОКСИДЫ ЖЕЛЕЗА, КОБАЛЬТА И НИКЕЛЯ
Рассматриваемые элементы в степени окисления (II) образуют нестехиометрические оксиды состава МХО и гидроксиды состава М (ОН) 2. Монооксиды — твердые, тугоплавкие вещества (т. пл. 1400— 1960 °C) черного (~ FeO) или темно-зеленого (~ СоО, ~ NiO) цвета. С водой они не взаимодействуют, но легко реагируют с кислотами:
МО + 2НзО+ + ЗН2О = [М(Н2О)б]2+
При нагревании выше 500 °C на воздухе или в атмосфере кислорода монооксиды железа и кобальта испытывают превращения:
4FeO = Fe + (Fe, Fe2) O4; 6C0O + O2 = 2(Co, C02)O4
Монооксиды получают прокаливанием в инертной атмосфере гидроксидов, карбонатов, нитратов и оксалатов:
СоСОз = СоО + СО21 ; Fe(C2O4) “ FeO + СО21 + СО t
Гидроксиды M(OH)2, образующиеся при действии на водные
482
растворы солей железа, кобальта и никеля, гидроксидов щелочных элементов, представляют собой гелеобразные осадки белого (М = = Fe), розового (М = Со) и яблочно-зеленого (М = Ni) цвета, легко разлагающиеся при нагревании на МО и Н2О.
Если гидроксиды кобальта и никеля на воздухе устойчивы, то Fe(OH)2 легко окисляется:
2Fe(OH)2 + 0,502 = 2FeO(OH) + Н2О
при этом образуются промежуточные соединения переменного состава xFe(OH)2*yFeO(OH) черного цвета, вызванного присутствием в соединении железа в разных степенях окисления.
Окисление Ni(0H)2 требует введения в раствор сильного окислителя:
2Ni(OH)2 + NaClO = 2Ni0(0H) + NaCl + H2O
Все гидроксиды взаимодействуют с кислотами:
М(0Н)2 + 2НзО+ + 2НгО = [М(НгО)б J2+
а гидроксиды кобальта и никеля — с водными растворами аммиака: Со(ОН)2 + 6NH3<p) ~ ‘ [Со(КНз)б]2+ + 2ОН"
Образование гидроксидов в реакциях [М(НгО)б]2+ + 2ОН протекает ступенчато. Например, в процессе получения Со(ОН)г при недостатке ОН -ионов сначала выпадает синий осадок малорастворимой основной соли:
[Со(Н20)б ]2+ + ОН" + СГ = ICo(H2O)4Cl(OH) J | + 2НгО
которая уже в избытке ОН-ионов превращается в розовый Со(ОН)г: [Со(Н2О)4С1(ОН) ] = Со(ОН)2; + 4Н2О + СГ
У элементов семейства железа в степени окисления (+III) известен только один оксид — РегОз и метагидроксиды — МО (ОН). Гидроксиды состава М(ОН)з как индивидуальные фазы неизвестны, скорее всего это фазы переменного состава МгОз*хНгО.
Триоксид дижелеза РегОз — твердое вещество бурокрасного цвета, разлагающееся при плавлении (т. пл. 1560 °C) на FeO и Ог, не взаимодействующее с водой и водными растворами КОН или NaOH, но реагирующее с кислотами:
РегОз + 6Н3О+ + ЗН2О = 2[Ре(НгО)6]^
После сильного прокаливания РегОз становится, как и AI2O3, СггОз, химически инертным оксидом и с кислотами уже не взаимодействует.
Получают РегОз при термическом разложении FeO(OH) или Ре(ИОз)з:
4Ре(ИОз)з = 2РегОз + 12N0zt + 30г!
Метагидроксид железа — конечный продукт многих обменных реакций, в которых участвуют соли Fe(III). Например:
16*
483
FeCl3 + 3(NH3«H2O) - FeO(OH) i + 3NH4CI + H2O
Fe2(SO4)3 + 6NaOH - 2FeO(OH) * + 3Na2SO4 + 2H2O
Метагидроксиды никеля и кобальта NiO(OH), СоО(ОН) принадлежат к сильнейшим окислителям:
4СоО(ОН) + 2НгО - 4Со(ОН)2 + O2f
2NiO(OH) + 6НС1 = 2NiCh + Cht + 4H2O
4Ni0(0H) + 4H2SO4 = 4NiSO4 + O2t + 6H2O
Среди всех метагидроксидов только СоО(ОН) взаимодействует с водным раствором аммиака:
СоО(ОН) + 6NH3(P) + Н2О = [Co(NH3)6]3+ + ЗОН-
Образование аммиаката стабилизирует у кобальта степень окисления (III) и тем самым резко уменьшает возможность проявления комплексными соединениями кобальта (III) окислительных свойств.
Для получения метагидроксидов кобальта и никеля применяют некоторые окислительно-восстановительные реакции, например:
2Со(ОН)г + Н2О2 = 2СоО(ОН) + 2Н2О
2Ni(OH)2 + Вг2 + 2КОН » 2Ni0(0H) + 2КВг + НгО
27.6. СОЛИ ЖЕЛЕЗА, КОБАЛЬТА И НИКЕЛЯ
В степени окисления (+11) рассматриваемые элементы образуют простые соли почти со всеми известными анионами. Растворимыми в воде солями являются нитраты, сульфаты, галогениды (кроме FeF2), тиоцианаты, ацетаты и тетраоксохлораты.
При кристаллизации или осаждении из водных растворов солей Fe, Со и Ni аквакатионы, как правило, состава [М(НгО)бГ входят в образующуюся кристаллическую решетку соли.
Соли подвергаются гидролизу, причем первой ступенью протолиза является в большинстве случаев реакция
[М(НгО)б]2+ + Н2О [М(НгО)5(ОН) ]+ + Н3О+
Водные растворы солей железа (II) и его твердые соли окисляются на воздухе до метагидроксида, например:
2FeCO3 + Н20 + 0,502 = 2FeO(OH) + 2CO2t
4FeS + 6H2O + O2 = 4FeO(OH) + 4H2Sf
Более устойчив на воздухе сульфат железа (II)-аммония (NH4)2[Fe(H2O)6] SO4.
К нагреванию соли Fe(II), Со(П) и Ni(II) относятся по-разному: почти все хлориды плавятся и кипят без разложения, а сульфаты, нитраты, карбонаты и оксалаты разлагаются, например
2FeSO4 = Fe2O3 + SO3 т + SO2 Т
Получение солей основано либо на взаимодействии металлов,
484
их оксидов, гидроксидов и карбонатов с кислотами, либо на применении обменных реакций:
Fe + H2SO4 = FeSO4 + Н2Т
NiSO4 + Ba(NCS)2 = Ni(NCS)2 + BaSO4!
CoO + 2HNO3 = Co(NO3>3 + H2O
Среди элементов семейства железа в степени окисления (+III) сравнительно большое число солей образует только железо. Немногочисленные простые соли кобальта (III) при действии воды полностью разлагаются (см. ниже), а никель (III) простых солей не образует.
Соли железа (III) подвергаются сильному гидролизу с образованием на стадии протолиза FeO(OH) в коллоидной форме:
[Ре(Н2О)б]Э+ FeO(OH) + ЗН3О+ + Н2О
Поэтому водные растворы солей железа (III) окрашены в цвета от желто-бурого до темно-коричневого и имеют сильнокислую реакцию.
Аквакатионы железа (III) проявляют’ достаточно сильные окислительные свойства, поэтому попытка получить РегБз, Ре1з, Рег(80з)з по обменным реакциям из водных растворов соли обречена на неудачу: андоны-восстановители переводят железо в степень окисления (II), сами при этом окисляясь, например
2FeC13 + 3H2S = 2FeS + S * + 6НС1
Соли Со (III) — сильнейшие окислители. При растворении в воде они разлагаются с образованием солей Со (И) и выделением (за счет окисления воды) газообразного кислорода:
4C0F3 + 2Н2О = 4CoF2 + О2Т + 4HF
Получение солей железа (III) основано на следующих реакциях: 2Fe + ЗС12 = 2FeCh
Fe + 4HNO3 = Fe(NO3)3 + NOt + 2H2O 2FeO(OH) + 3H2SO4 = Fe2(SO4)3 + 4H2O
Железо в степени окисления (+VI) образует тетраоксоферратные анионы FeO4 , с которыми многие катионы металлов образуют соли — ферраты. По кристаллической структуре и растворимости в воде ферраты подобны сульфатам и хроматам. Так, BaFeCU и SrFeO4 малорастворимы в воде, а ферраты щелочных элементов образуют растворы малиново-красного цвета. При pH > 10 анион FeO^ довольно устойчив, но при меньших значениях pH он вступает во взаимодействие с водой:
4FeO3' + 6Н2О = 4FeO(OH) | + 8ОН" + ЗО2Г
которое в кислой среде заканчивается образованием аквакатиона железа (Ш):
4РеОГ + 20Н3О+ = 4 [Fe(H2O)6 ]3+ + ЗО21 + 6Н2О
485
Термическое разложение ферратов протекает при сравнительно низких температурах:
2BaFeO4 “ РегОз + 2ВаО + 1,5021
Для синтеза ферратов применяют реакции:
2FeO(OH) + ЗС12 + ЮКОН = 2K2FeO4 + 6КС1 + 6Н2О
Fe2O3 + КСЮз + 4К0Н = 2K2FeO4 + КС1 + 2Н2О
27.7. КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
Железо, кобальт и никель являются хорошими комплексообразователями. Железо и кобальт в степени окисления (III) образуют в большинстве случаев октаэдрические комплексы, а кобальт в степени окисления (II, а ) — тетраэдрические и октаэдрические. Ввиду небольшого различия в устойчивости тетраэдрических и октаэдрических комплексов кобальта (II) возможны случаи равновесия этих форм в растворах:
|СоЬб12+ = [CoL4]2+ + 2L
Комплексные соединения никеля (II, d8) могут иметь октаэдрическую, тетраэдрическую и квадратную структуры.
Ниже рассматриваются наиболее известные типы комплексных соединений железа, кобальта и никеля.
Ацидокомплексы. В ацидокомплексах состава [MLe] и [ML4] лигандами могут быть самые разнообразные анионы, прежде всего галогенидные, CN-, NCS-, NO2, Сго|-, СНзСОО-, Р0|~ и др.
Анион CN- создает сильное кристаллическое поле вокруг комплексообразователя и поэтому цианометаллатные комплексы являются низкоспиновыми и диамагнитными. Связан этот лиганд с комплексообразователем через атом углерода (g>c==£N; , несущим пару электронов на О'°-МО, как и в молекуле СО. Известны октаэдрические комплексы [M(CN)6]4- и [M(CN)6] , где M-Fe или Со, и плоскоквадратные, например [Ni(CN)4]z (см. разделы 19.2 и 19.4).
Анионы CN~, NO2 и NCS- являются амбидентатными лигандами, но кобальт (III) имеет особое сродство к азоту и лиганды NO2, NCS- (кроме CN-) связаны с ним через атом азота Со—N. Полагают, что анионы [Со(МО2)б1 в растворе имеют равное число связевых изомеров (Со(ОКО)б]3- со связями Со—0N0. Анион N02 во внутренней сфере ацидокомплексов может обратимо превращаться в катион нитрозилия N0+ в зависимости от pH раствора:
[Fe(CN)5NO2]4“ + Н20 г=± [Fe(NO) (CN)5]2~ + 20Н~
Аммиакаты. Железо (И) и (III) обладает низким сродством к азоту молекулы аммиака. При добавлении водного раствора аммиака к солям железа выпадает Fe(0H)2 или FeO(OH):
486
FeC13 + 3NH3(P) + 2H2O » FeO(OH) 4 + 3NH4C1
Кобальт (II) и никель (III) образуют уже более устойчивые аммиакаты:
[Со(Н2О)612+ + 6NH3 [Co(NH3)6]2+ + 6Н2О
Константы образования 1Со(ЫНз)б]2+ и [№(ЫНз)б]2+ равны соответственно 1-105 и 5*10° (25 °C). Тем не менее эти катионы разлагаются водой:
[Ni(NH3)6 ]2+ + 2Н2О = Ni(OH)2 4 + 4NH3 + 2NHJ
Поэтому их образование в водном растворе происходит при избытке ионов NH| и аммиака.
Наибольшим сродством к азоту молекулы аммиака обладает кобальт (III). Общий метод получения катионов [Со(КНз)бГ состоит в добавлении окислителя (О2, Н2О2 и др.) к растворам солей кобальта (II), содержащим аммиак и активированный уголь:
[Со(Н2О)6]2+ + 0,5О2 + 6NH3(P) - [Co(NH3)6]3+ + 2ОН' + 5Н2О
Карбонилы. Железо, кобальт и никель образуют диамагнитные карбонилы составов [Fe(CO)5], [Со2(СО)в] и [Ni(CO)4]. Состав карбонилов определяют по правилу Сиджвика (см. раздел 19.2).
Пентакарбонил железо и тетракарбонилникель — жидкости с температурами кипения 103 и 42 °C соответственно. Октакарбонилдикобальт представляет собой кристаллическое вещество оранжевого цвета (т. пл. 51 °C). При нагревании все карбонилы легко разрушаются, выделяя мелкодисперсные пирофорные металлы. Например:
[Ni(CO)4] = Ni + 4C0j ; [Co2(CO)e] “ 2Со + 8C0f
Диамагнитность карбонилов связана с отсутствием у центрального атома неспаренных электронов. Геометрия молекулы [Fe(CO)5] определяется хр3б?-гибридизацией атомных орбиталей атома железа, молекулы [Ni(CO)4] — sp-гибридизацией АО атома никеля:
It It It It
It It It It It
487
Рис. 98. Структуры карбонилов железа, кобальта и никеля: а — пентакарбонил железа; б — тетракарбонил никеля; в, г — октакарбонил дикобальта
Этим видам гибридизации АО отвечают, как известно, структуры, называемые тригональной бипирамидой (рис. 98, а) и тетраэдром (рис. 98, б). Молекулы октакарбонилдикобальта [Со2(СО)8] в газовой фазе представляют собой двухъядерный комплекс с двумя мостиковыми карбонильными лигандами (рис. 98, в,г), а в растворе они превращаются в кластеры. Карбонилы металлов образуют молекулярные кристаллы.
Реакции, в которых участвуют карбонилы, можно разделить на две группы: обменные реакции и окислительно-восстановительные (см. раздел 19.2). Например:
[Со2(СО)8] + 2Na - 2Na[Co(CO)4]
[Fe(CO)5] + 2ND 4=С [Fe(CO)2(NO)2] + 3COf
СН3ОН
I—0—I
Первая реакция протекает в тетрагидрофуране (НгС—(СНг)2—СНг, т. кип. 65 °C) в присутствии ртути. Способ превращения карбонила в карбонилат-анион основан на восстановлении металла самим лигандом:
lFe(CO)5 ] + 4ОН~ = [Fe(CO)4 ]2" + СО^- + 2Н2О
! 2е~ :
488
или действии на карбонилы металлическим натрием (см. выше).
Карбонилат-анионы [Fe(CO)4] , [Со(СО)41~ и [Ni(CO)41° — изоэлектронны и изоструктурны.
При подкислении растворов, содержащих карбонилат-анионы, образуются либо кислоты, либо гидрокарбонилатные анионы:
[Со(СО)4 Г + НзО+ = Н [Со(СО)4 ] + Н2О [Fe(CO)4 ]2- + НзО+ = [FeH(CO)4 Г + Н2О
Тетракарбонилкобальтат (-1) водорода Н[Со(СО)4] — неустойчивая сильная кислота, самовоспламеняющаяся на воздухе. Карбонилы горят на воздухе:
2[Ni(CO>4] + 502 = 2NiO + 8CO2f
Если через пентакарбонил железа пропускать кислород, то карбонил самовоспламеняется и детонирует.
Карбонилы получают непосредственным взаимодействием порошкообразных металлов и монооксида углерода. Тетракарбонил никеля образуется уже в обычных условиях, для синтеза других необходимы повышенные температура и давление:
Fe + 5CO= [Fe(CO)5]
Применяют для синтеза карбонилов и другие реакции:
2СоСОз + 2Н2 + 8СО ™ С [Со2(СО)8 ] + 2CO2f + 2Н2О
25МПа
Подробнее см.: Баев А. К. Структура и энергетика карбонилов металлов. — Минск: Вышэйшая школа, 1986.
Металлоцены. Железо, кобальт и никель в степени окисления (II) могут присоединять ненасыщенные углеводороды, заполняя свои вакантные АО л'-электронами кратных связей (см. раздел 19.2). В частности, циклопентадиенил-ион С5Н5 (сокращенно ср) входит в состав [М(ср)2]° металлоценов, где М(П) = Fe, Со и Ni. Металлоцены железа, кобальта и никеля — кристаллические вещества с температурами плавления, близкими 173 °C. Они имеют оранжевую (М = Fe), пурпурную (М = Со) и зеленую (М = Ni) окраску.
Ферроцен [Fe(cp) г термически устойчив (не разлагается до 500 °C) и не окисляется кислородом воздуха; кобальтоцен и ник-колатоцен легко окисляются до ионов [Со(ср)2]+ и [Ni(cp)2]+.
Катионы металлоценов напоминают по своим свойствам катионы Rb+ и Cs+. Они образуют мало^астворимые соли [Ni(cp)2 ] [PtCle ], [Co(cp)2][B(Ph)4], a [Co(ср)2Г — устойчивое сильное основание [Со(ср)2]ОН, поглощающее СО2 из воздуха.
Металлоцены способны возгоняться, хорошо растворимы в органических жидкостях.
Лиганды-циклы (ср) в металлоценах параллельны и легко поворачиваются относительно друг друга во внутренней сфере. Если в кристаллах [Fe(cp)2]° имеет структуру, приведенную на рис. 74, в, то в газообразном состоянии циклы у ферроцена повернуты на
489
оборот. В кристаллах свободное вращение лигандов ограничено, они могут двигаться только одновременно.
Общий метод синтеза металлоценов основан на использовании реакции типа
ТГФ п
2Na(CsH5) + NiCh = [Ni(C5H5)21 + 2NaCl
(ТГФ — тетрагидрофуран). Применяют также, метод депротонирования циклопентадиена с помощью сильного основания диэтиламина:
2С5Н6 + 2(C2H5)2NH + C0CI2 = [Со(С5Н5)2]° + 2(C2H5)2NH2C1
_________„..J
н
Нитрогенилы. Нитрогенилами называют комплексы, содержащие молекулярный азот во внутренней сфере в качестве одного из лигандов. Нитрогенилы образуют преимущественно элементы УШБ-группы. Существуют нитрогенилы следующих типов: аммиакаты состава [M(NH3)5(N2) ]Х2, М = Ru, Os, X = Cl, Вг, I; фосфинаты состава [М(РРЬз)з(К2)С1], М = Rh, Ir, Os; фосфинаты состава [M(PPh3)3(N2)Hr, М = Fe, Со, Ni, Ru, Os и цианометаллаты состава [Fe(N2)(CN)5] . К фосфинатам относят комплексы, содержащие в качестве лигандов группы трифенилфосфина Р(СбН5)з, образованные замещением в фосфине РНз атомов водорода на фенильные группы СбНз (сокращенно Ph). Фосфины и их производные обладают способностью к стабилизации низших степеней окисления комплек-сообразователей.
При нагревании выше 200 °C нитрогенилы разлагаются с выделением молекулярного азота. Наиболее термически устойчивыми являются нитрогенилы состава [M(NH3)5(N2) ]Х2, где М = Os, Ru и X — галогснидные ионы.
Азот в нитрогенилах слабо связан с комплексообразователем и легко замещается на другие лиганды, например, ру = C5H5N [Ru(NH3)5(N2) ]2+ + ру - N2f + [Ru(py) (NHsJs]2*
Реакции взаимодействия фосфинатов с газообразным азотом можно представить уравнением
[М(РРЛз)зНи] + N2 = [М(РРЛ)зН п- 2(N2) ] + Н2Т
Так были синтезированы нитрогенилы кобальта [Со(РРЛз)зН(К2) ] и железа [Ре(РРЛз)зН2(Н2) J.
Возможно получение нитрогенилов при помощи реакции восстановления нитрозил-группы гидразином или аммиаком:
2[Ru(NH3)5NO ]2+ + N2H4 - 2[Ru(NH3)5(N2) ]2+ + 2Н2О
Полагают, что координация молекулы азота происходит путем замены некоторых лигандов (Н, Н2О) на азот:
[Ru(H2O) (NH3)5 ]2+ + N2 = [Ru(NH3)5(N2) ]2+ + Н2О
Существуют и другие довольно многочисленные реакции получения нитрогенилов (см. также разделы 15.2 и 23.7).
490
Оксигенилы. К оксигенилам относят комплексные соединения, содержащие во внутренней сфере молекулярный кислород в качестве лиганда. Большой склонностью к образованию оксигенилов обладают фосфинаты элементов УШБ-группы. Реакции комплексов, приводящие к включению молекулярного кислорода во внутреннюю сферу, без распада молекулы Ог на атомы, называют реакциями оксиге-нирования. Например, реакция
[1г+1(СО)(РРЛз)2Си0 + О2 = [1гш(СО)(РРЛз)2(О5)С1]°
в обычных условиях протекает в растворе обратимо. Комплекс можно выделить из раствора в виде кристаллов. При подкислении раствора [1гП1(СО)(РРЛз)2(О§)С1 ]° образуется Н2О2. Поэтому считают, что молекула Ог выступает как бидентатный лиганд, превращаясь во внутренней сфере в пероксидный ион Ы . Длина связи О—О изменяется в зависимости от состава комплекса в диапазоне 130— 163 пм (длина связи О—О в молекулах Ог и Н2О2 равна соответственно 121 и 149 пм). Обнаружено, что реакция образования оксигенилов с длиной связи О—О более 150 пм протекает необратимо.
Известны оксигенилы, в которых молекула Ог координируется по двойной связи, как молекула этилена.
При повышении температуры или уменьшении парциального давления кислорода диоксигенилы разрушаются с выделением мо-* лекулярного кислорода.
Образование оксигенилов играет большую роль в биологических процессах, например в процессах дыхания с участием молекул гемоглобина и миоглобина, сложных комплексов Fe(II) с белковой цепью. В таких случаях присоединение Ог к Fe(II) сопровождается спариванием электронов у последнего. После освобождения кислорода в клетках тканей живого организма Fe(II) снова становится высокоспиновым.
27.8. ПРИМЕНЕНИЕ
Железо и его сплавы — основа современной индустрии. Никель и кобальт придают сталям твердость, коррозионную стойкость, высокие магнитные свойства, жаропрочность, вязкость; широко применяют никель и кобальт для поверхностной защиты других металлов от коррозии. Платиновые металлы благодаря своей высокой термостойкости и химической пассивности используют для изготовления лабораторной химической посуды и ответственных деталей промышленных установок; термопары на основе платиновых металлов позволяют измерять температуру до 2400 °C.
Все металлы УШБ-группы применяют в качестве эффективных катализаторов органического и неорганического синтеза (см. раздел 34.3): железо с активаторами (К2О, AI2O3) используют в синтезе аммиака, а никель — для гидрирования жИрой. Сплав платины И родия в виде сеток применяют в процессе окисления аммиака до
491
монооксида азота. Железо — основной материал для сердечников, электромагнитов и якорей электромашин. Соединение LaNis — аккумулятор водорода в водородной энергетике. Оксид железа (III) — эффективный материал для изготовления магнитофонных пленок. Ферроцен предложено использовать в качестве термостойкого теплоносителя и присадки к минеральным маслам и топливу.
27.9. ТОКСИКОЛОГИЯ
Железо, кобальт и никель — жизненно важные микроэлементы: железо (II) — составная часть гемоглобина крови, являющегося переносчиком кислорода в живом организме; кобальт активирует ряд ферментов, входит в состав витамина В12; дефицит никеля приводит к заболеваниям печени. Однако в больших дозах соединения никеля и особенно кобальта ядовиты. Образуя комплексы с гидросульфидными группами ферментов, кобальт (II) вызывает у человека удушье, отравление его солями проявляется в приступах тошноты, рвоты, болями в сердце, возможны кожные дерматиты. Соединения никеля относят к канцерогенным препаратам, хронические отравления сопровождаются головной болью, головокружением, снижением аппетита.
Токсичность платиновых металлов, в частности родия и палладия, незначительна, соли рутения и осмия вызывают кашель, раздражение верхних дыхательных путей; отравление осмием вызывает слезотечение, появление металлического привкуса во рту. Аналогично действуют соединения платины. Например, попадание внутрь организма (ЫН4)2[Р1С1б] вызывает у человека светобоязнь, приступы астмы; Р10г действует прижигающе на кожу, вызывает дерматиты.
Упражнения к главе 27
1. Какой вид периодичности преобладает в VIIIE-rpynne? В чем это проявляется?
2. Согласуется ли нарастание основных свойств у оксидов и гидроксидов элементов семейства железа от железа к никелю с изменением тех же свойств в периоде?
3. Какой тигель более пригоден для проведения реакций в расплавах гидроксидов щелочных металлов — платиновый или никелевый?
4. Диа- или парамагнитными являются рутеноцен и родо-цен?
5. Предскажите состав, магнитные свойства и пространственную структуру простейших карбонилов осмия и иридия.
6. Что произойдет, если внести в воду C0F3, K;>FeO4?
7. Через водную суспензию FeCOa пропускают поток воздуха. Что будет происходить в этом случае?
8. К водному раствору FeCIs добавили водный раствор K2S. Определите состав осадка.
9. Какую структуру и магнитные свойства будут иметь комплексные анионы, образующиеся в реакциях [М(Н2О)6]2+ + xCN = ..., где М = Fe, Со и Ni?
492
10. Какие реакции позволяют превратить карбонилы в карбонилаты?
11. Объясните характер химических связей в металлоценах и карбонилах с позиций метода валентных связей.
12. Как перевести гидроксиды М(ОН)2 в метагидроксиды, если М = Fe, Со и Ni?
13. К водному раствору М$Од(М - Fe, Со, Ni) добавили избыток водного раствора аммиака. Образование каких веществ следует при этом ожидать?
* * *
Начиная с четвертого периода между s- и p-секциями в длинно-периодном варианте периодической системы появляются элементы, характеризующиеся заселением электронами d-атомных орбиталей и имеющие общую электронную конфигурацию (n-l)d1 '* 10 ns° 2 (валентные электроны). Значение орбитального квантового числа I для электронов, заполняющих d-AO, равно 2, сумма магнитных квантовых чисел т t равна 2Z + 1 = 5, а поскольку в каждой квантовой ячейке может находиться по два электрона с противоположными спинами, то общее число d-электронов с одинаковым значением главного квантового числа п, а следовательно, и число d-элементов в одном длинном периоде будет равно 2(2*2 + 1) = 10.
Все d-элементы расположены в Б-группах периодической системы. Поэтому можно дать и другое определение d-элементам: все элементы, находящиеся в Б-группах периодической системы, назы-1 вают d-элементами.
Близость энергетических s- и d-подуровней приводит к тому, что s-электроны могут переходить в отдельных случаях на d-AO, комплектуя ее до энергетически устойчивых состояний: сГ и d . Так, в четвертом и пятом периодах у четвертых по порядку d-элементов Сг и Мо (VIB-группа) вместо ожидаемых ns2(n— l)d4 электронные конфигурации имеют вид (n-l)dns1, а в четвертом — шестом периодах у девятых по счету d-элементов Си, Ag и Au (1Б-группа) вместо электронной конфигурации ns2(n-l)d9 появятся конфигурации (n-l)d1 ns . У восьмого по порядку 4d-aaeMeHTa — палладия стремление создать полностью заполненный d-подуровень настолько велико, что 5я-атомная орбиталь оказывается полностью лишенной своих электронов: Pd—[Kr]4d105s° (см. раздел 4.4).
Общим свойством всех d-элементов в свободном состоянии является несомненная принадлежность к металлам; по периоду слева направо их металличность ослабевает, правда, не так заметно, как у s- и p-элементов. Подобно остальным металлам, они обладают, как правило, высокой теплопроводностью и электрической проводимостью, а также высокими температурами плавления, растущими в большинстве случаев по группам сверху вниз. Среди металлов наиболее тугоплавкими являются W (3387 °C) и Re (3190 °C).
В образовании химических связей d-элементов с другими эле
493
ментами в первую очередь участвуют s-электроны благодаря своей способности давать наибольшие области перекрывания с другими атомными орбиталями. Уже затем в образование связей вовлекаются по мере необходимости и электроны d-AO. Степени окисления rf-элементов в их соединениях изменяются в очень широких пределах: от (0) до (VIII) (в OsO4, R11O4).
При взаимодействии с кислородом rf-элементы образуют тугоплавкие, не взаимодействующие с водой и мало в ней растворимые оксиды, за исключением СгОз, МП2О7, RezO?, R11O4 и OsO4. Оксиды и гидроксиды rf-элементов со степенями окисления (I)—(III) проявляют преимущественно основные свойства (AgiO, МпО, Fe(OH)2, L112O3 и др.), а в высших степенях окисления — кислотные (СгОз, Re2O7, МП2О7). Среди оксидов и гидроксидов рассматриваемых элементов (особенно четвертого периода) много амфотерных, например Sc(OH)3, CrO(OH), Cu(OH)2, Zn(OH)2.
Рассматриваемые элементы, находящиеся в низших степенях окисления, являются восстановителями и в водном растворе оказываются, как правило, в составе аквакатионов — [Zn(H2O)6] , [ТЦНгСОб] , [Со(НгО)б] , проявляющих свойства слабых катионных кислот (см. раздел 10.2). Протолиз аквакатионов rf-элементов приводит к образованию основных солей (гидроксосолей), в которых ОН’-ионы связаны с катионом металла, например (CuOH)2SO4, (ZnOH)2CO3. Катионы типа МОН+, как правило, координируют вокруг себя молекулы воды, например [Си(НгО)зОН]+, [Fe(H2O)5OH] , а в кристаллах образуют цепи, состоящие из октаэдров или тетраэдров, сочлененных по противоположным ребрам. Соотношение М:ОН может быть весьма разнообразным. Известны, например, |Хп5(ОН)б ]СОз, [Zr4(H2O>i6(OH)8]C18. Оксоанионы, содержащие rf-элементы в высших степенях окисления, могут проявлять в той или иной мере окислительные свойства (Сг2О?-, MnOl", FeOl-).
Характерной особенностью всех без исключения элементов Б-групп является повышение устойчивости их высших степеней окисления в соединениях с увеличением порядкового номера элемента (в отличие от p-элементов, для которых эта зависимость обратная). Такое поведение rf-элементов связано с легкостью отдачи валентных rf-электронов ввиду уменьшенной йх проникающей способности к ядру по сравнению с валентными s-электронами р-эле-ментов. Так, высшая степень окисления (VII) устойчива у Re, а не у Мп (VIIB-rpynna), (VI) — у W, а не у Сг (VIB-группа) и т. д.
Все rf-элементы являются хорошими комплексообразователями, поэтому их химия — это, в основном, химия комплексных соединений. Благодаря тому, что d-AO простираются к периферии атома, они испытывают особо сильное влияние электростатического поля лигандов и, согласно теории кристаллического поля, расщепляются на различные подуровни (см. раздел 19.4). Причем это расщепление сказывается тем больше, чем выше порядковый номер элемента (или главное квантовое число электронов и). Следовательно» d-эле
494
менты пятого — седьмого периодов будут образовывать преимущественно низкоспиновые комплексы за счет стремления электронов занять нижнюю энергетически выгодную, например, de-орбиталь (октаэдрическое поле лигандов).
Та же теория кристаллического поля объясняет способность d-элементов образовывать богатый набор окрашенных соединений: атому достаточно иметь хотя бы один электрон, например, на de-орбитали, который мог бы поглотить квант света и перейти на незанятую dy-орбиталь. В результате такого выборочного поглощения определенной части видимого спектра комплекс оказывается окрашенным в дополнительный к поглощенному цвет. Отсюда становится понятным, почему комплексы с атомами, вообще лишенными d-электронов [Sc(III), Ti(IV) ] или имеющими полностью заполненный d-подуровень [Cu(I), Ag(I), Zn(II), Cd(II) ], оказываются бесцветными (см. раздел 19.4).
Для d-элементов в низших степенях окисления характерно образование кластеров со связями металл — металл. К ним относятся, например, анион октахлородирената (III) [Re2C18F и катион ок-тахлорогексамолибдена (II) [МобОв]4 .
Каждую Б-группу периодической системы характеризует еще одна интересная особенность: последние (более тяжелые) элементы образуют соединения со свойствами, чрезвычайно близкими между собой и значительно отличающимися от свойств аналогичных соединений, образованных первыми (легкими) членами той же группы. Так, соединения циркония почти тождественны по свойствам соединениям гафния и курчатовия, но резко отличны от соединений титана; соединения молибдена больше напоминают соединения вольфрама, чем своего легкого аналога — хрома и т. д. Объяснение этому феномену кроется в эффекте лантаноидного (/-) сжатия (см. гл. 28), сближающего атомные радиусы более тяжелых d-элементов: r(Ti) = 146 пм, r(Zr) = 160 пм, a r(Hf) = 159 пм; г(Сг) = = 127 пм, г(Мо) = 139 пм, a r(W) = 140 пм и т. д.
Совместное действие d- и /-(лантаноидного) сжатия приводит к тому, что в УШБ-группе, состоящей из девяти стабильных элементов, сходство в горизонтальных рядах делается больше, чем в вертикальных: элементы четвертого периода Fe, Со, Ni тесно сближаются по свойствам между собой, образуя семейство железа, а элементы пятого и шестого периодов Ru, Rh, Pd, Os, Ir и Pt — группу платиновых металлов.
Очень многие бинарные соединения d-элементов относятся к нестехиометрическим соединениям (бертоллидам). Это оксиды и сульфиды с дефицитом металла (Си (2 - х)О, МпО (i + х), Fe (i - х)О, VS (2 + х), карбиды и нитриды, обладающие очень высокой твердостью и химической инертностью (TaC(i—х), ZrC(i—х), ~ TiN, ZrN(2—х)), а также гидриды с ионной (ЬаН<з+х)) или ковалентной (VH(i-x), TaH(i-x)) химической связью. Металлы VIB—УШБ-групп способны растворять при обычной температуре газообразный водород, располагая протоны в пустотах кристаллической решетки; электроны
495
атома водорода при этом смешиваются с электронами металла, что дает основание говорить о металлическом типе связи водорода в этих соединениях внедрения. Поэтому металлы Ni, Pd, Pt, благодаря большой растворимости в них водорода, оказываются прекрасными катализаторами гидрирования монооксида углерода и непредельных углеводородов.
Активную роль играют d-элементы в биологических системах. Железо, например, в составе гемоглобина крови служит переносчиком кислорода, кобальт в виде витамина В12 участвует в кроветворении, цинк необходим для полового созревания и воспроизведения потомства, Ti, V, Сг, Мп, Ni, Си, Мо выполняют другие важные биологические функции. Интересно отметить, что из перечисленных биологически важных d-элементов только железо и титан относительно широко представлены на Земле; массовый кларк остальных элементов не превышает 10 z%.
Седьмой период является незаконченным. В нем пока находятся семь d-элементов: актиний 89Ас, курчатовий 104KU, нильсборий 105NS и четыре элемента 106—109 без названия. По своим свойствам они близки к элементам соответствующих III—VIIIB-групп.
Подробнее см.: Флеров Г. Н., Ильинов А. С. На пути к сверхэлементам. 2-е изд. — М.: Педагогика, 1982.
Ожидается, что 110-й элемент (эка-платина) будет значительно стабильнее своих радиоактивных собратьев.
ГЛАВА 28. ОБЩАЯ ХАРАКТЕРИСТИКА СВОЙСТВ f-ЭЛЕМЕНТОВ
В шестом и седьмом периодах периодической системы Д. И. Менделеева появляются элементы, атомы которых содержат электроны на энергетическом подуровне (4/- и 5/-), характеризуемом значением орбитального квантового числа I = 3. Этому значению I отвечает семь /-АО одной энергии с общим числом электронов, равным 2(2/ + 1) = = 14. Элементы, у которых 7=3, получили название /-элементов.
Секция /-элементов состоит из двух семейств: семейства лантаноидов (4/-элементы, общее обозначение Ln) — лантан La, церий Се, празеодим Рг, неодим Nd, прометий Рш, самарий Sm, европий Ей, гадолиний Gd, тербий ТЬ, диспрозий Dy, гольмий Но, эрбий Ег, тулий Тт, иттербий Yb и семейства акти-н о и д о в (5/-элементы, общее обозначение Ап) — актиний Ас, торий Th, протактиний Ра, уран U, нептуний Np, плутоний Ри, америций Am, кюрий Ст, берклий Вк, калифорний Cf, эйнштейний Es, фермий Fm, менделевий Md и жолиотий Л.
496
28.1. ЭЛЕКТРОННАЯ КОНФИГУРАЦИЯ АТОМОВ f-ЭЛЕМЕНТОВ
Общая электронная конфигурация/-элементов ns2 (п-2) 14(л-1)
2. В соответствии с правилом Клечковского в шестом и седьмом периодах после 6s- и 7s-AO происходит систематическое заполнение электронами /-АО. Только у лантана, актиния и тория (табл. 34) из-за более высокой энергии /-АО электроны занимают d-AO. Начиная же с церия и протактиния, уже идет с увеличением атомного номера элемента заполнение /-АО.
Поэтому /-элементы расположены в шестом и седьмом периодах между барием и лютецием, радием и резерфордием, т. е. элементами ПА- и ШБ-групп.
Вертикальная периодичность в безымянных 14 группах элементов, содержащих всего по два элемента, почти не проявляется, происходит как бы «размывание периодичности». Из-за этого /-элементы объединяют не в группы, а в семейства, хотя в семействе актиноидов не проявляется горизонтальная периодичность (см. раздел 4.6). Видимо, семейство актиноидов целесообразно разделить на подсемейства ураноидов (от Ас до Am) и кюроидов (от Ст до Л), в которых горизонтальная периодичность передает в большей степени действительный характер изменения свойств элементов.
Обращает внимание то, что элементы подсемейства кюроидов в .значительной мере, чем ураноидов, по своим физико-химическим свойствам напоминают элементы лантаноидов от гадолиния до иттербия.
Размыв вертикальной периодичности между 4/- и 5/-элементами объясняется тем, что 5/-АО простирается за пределы 6s- и бр-АО. Энергии 7s-, 5/- и 6d-AO у актиноидова примерно одинаковы, к тому же эти АО перекрываются в пространстве. Поэтому электронные конфигурации 5/-элементов в одном и том же состоянии окисления могут меняться от соединения к соединению, а в растворе даже зависеть от природы присутствующих ионов.
У элементов, расположенных в середине и в конце семейств, в связи с энергетической устойчивостью наполовину и полностью заполненной /-АО валентный электрон расподагается на d-AO, например, у гадолиния 6s24/75d* и кюрия 7sz5/'6d1.
Степень окисления (III) присуща всем /-элементам, она же является наиболее устойчивой для всех лантаноидов и большинства актиноидов (табл. 34). Ее появление связано с отдачей двух s- и одного /-электрона у большинства /-элементов или двух s- и одного d-электрона. Эту степень окисления /-элементы имеют в оксидах, гидроксидах, многочисленных солях: ЬпгОз, Ьп(ОН)з, РигОз, Ат(ОН)з, LnC13, Ln(NO3)3, РиБз, UCI3, Ln2(SO4>3 и т. д.
Степень окисления (И) является нехарактерной для /-элементов и проявляется только у Sm, Eu, Yb и кюроидов от Es до Л. Соединения в этой степени окисления являются сильнейшими восстановителями.
497
Степень окисления (IV) наиболее устойчива у тория и плутония, но может проявляться также у лантаноидов — церия и тербия (за счет образования стабильных г~ и /7-электронных конфигураций), а также у ураноидов. Соединения Ce(IV), Tb(IV), Am (IV), Bk(IV) — сильные окислители. Типичные примеры соединений /-элементов, имеющих степень окисления (IV): СеОг, CeF4, ThOz, UO2, NpOz, Th(OH)4, UF4, Th(NO3)4«12HzO, Pu(SO4)2«4HzO.
Таблица 34. Электронные конфигурации и степени окисления лантаноидов и актиноидов
Лантаноиды Электронная конфигурация валентных электронов Степень окисления Актиноиды Электронная конфигурация вален-, тных электронов Степени окисления
La 6s25dl III Ac 7s26rf' IV
Се III, IV Th 7s2&f2 IV
Рг 6s24/3 III, IV Pa 7s25/W IV, V
Nd 6s24/4 III U III, IV, V, VI
Pm 6s24/s III Np Ш, IV, V, VI, VII
Sm 6s24/6 II, III Pu 7s25/6 III, IV, V, VI, VII
Eu 6s24/ 7 II, III Am 7sz5/7 II, III, IV, V, VI, VII
Gd 6s24/ 75d' III Cm 7s25/W1 III, IV
Tb 6s24/9 III. IV Bk 7s25/9 III, IV
Dy 6?4/10 III Cf 7s25/10 III, IV
Ho 6s24/n III Es 7s25/n II, III
Er . 6s24/12 III Fm. 7s25f12 II, III
Tm 6s24/ 13 III Md 7?5/13 II, III
Yb 6s24/ 14 11, III Л 7s25/14 III
Примечание. Устойчивые степени окисления выделены шрифтом.
Степень окисления (V) характерна для ураноидов, но уже при переходе от нептуния к америцию устойчивость соединений в степени окисления (V) падает (пимеры соединений: PazOs, PaCIs, UOzCl, UCI5, NpOz(OH)).
Степень окисления (VI) встречается у ураноидов: UO3, NpFe, PuF6, UO2(NO3)2*6HzO, NpO2(NO3)2*6HzO.
Степень окисления (VII) также найдена только в соединениях ураноидов. Эти соединения проявляют сильнейшие окислительные свойства.
Лантаноиды по многим своим свойствам напоминают элементы ШБ-группы, поэтому их часто вместе со скандием, иттрием и лютецием объединяют под общим названием редкоземельные элементы.
28.2. ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА ПРОСТЫХ ВЕЩЕСТВ
В виде простых веществ все /-элементы представляют собой серебристо-белые металлы (Рг и Nd — с желтоватой нацветкой) с т. пл. от 737 до 1750 °C (Th), быстро тускнеющие в воздухе за счет образования оксидной (а актиноиды — еще и нитридной) пленки. Среди актиновдов находятся вещества, плотность которых равна 19,0—20,4 г/см3 (уран, нептуний, плутоний).
Все актиноиды радиоактивны. Период их полураспада уменьшается от тория к жолиотию с Ю1и лет до нескольких минут. Сложность синтеза и неустойчивость актиноидов, начиная с эйнштейния, не позволяют всесторонне изучить их физико-химические свойства. За счет незначительного содержания неустойчивых изотопов слабой радиоактивностью обладают неодим, самарий и гадолиний. У не найденного в природе прометия самый долгоживущий изотоп 145Рш имеет период полураспада около 30 лет.
В ряду /-элементов наблюдается немонотонное изменение свойств. Все /-элементы можно разделить на две группы: / —/' и /7 —/ . В пределах каждой группы происходит плавное изменение свойств, прежде всего структурнозависимых, с минимумом на середине (при Г —Г и /10 —/ ), что позволяет весь ряд /-элементов представить в виде четырех частей или тетрад, состоящих каждая из четырех элементов («тетрадный эффект»).
Химическая активность простых веществ /-элементов очень высока. В порошкообразном состоянии они быстро взаимодействуют с водой, особенно при нагревании, и с кислотами-неокислителями с выделением водорода:
Th + 2Н2О = ThO2 + 2Н21; 2Се + 6НС1 - 2СеС1з + ЗН21
2Pr + 3H2SO4 = Pr2(SO4)3 + 3H2f
Действие кислот-окислителей на металлы приводит к получению соединений с устойчивыми степенями окисления, например
U + 4HNO3 - UO2(NO3)2 + 2NO t + 2Н2О t
С сильными основаниями лантаноиды и актиноиды не взаимодействуют. Металлы тускнеют на воздухе и легко сгорают при нагревании с образованием оксидов СеО2, Рг20з, ThO2. Активно идут также реакции с галогенами, с расплавленной серой, фосфором, углеродом, азотом и водородом, при этом образуются, как правило, нестехиометрические соединения — LnH(2±x>; LnSx; LnNx; LnCx; ThH(2±x).
28.3. ОКСИДЫ И ГИДРОКСИДЫ
В связи с заполнением внутреннего /-подуровня уменьшение атомных радиусов /-элементов внутри семейств происходит в малой степени (найример, от 198 пм — у церия до 166 пм — у иттербия), поэтому различия в химическом поведении соединений одного се
499
мейства крайне незначительны (отсюда — сложность их разделения). Однако определенные закономерности и здесь удается подметить. Так, оксиды и гидроксиды /-элементов в степени окисления (II) обладают ярко выраженным основным характером. В ряду Sm(0H)2 > > Еи(ОН)г > Yb(OH)2 сила оснований и их растворимость в воде уменьшается, с повышением степени окисления основный характер оксидов и гидроксидов несколько ослабевает, хотя преимущественно основные свойства Ьп(ОН)з и в особенности Ап(ОН)з, не вызывают сомнений.
Актиноиды (IV) образуют оксиды состава ТЬОг, UO2, NpCh, Р11О2. Гидроксиды общей формулы М(0Н)4 для лантаноидов и актиноидов неизвестны. Вместо них из растворов осаждаются желатинообразные нестехиометрические многоядерные гидроксоаквакомплексы. В частности, при действии гидроксида калия КОН на водные растворы соединений Се, Th и U в степени окисления (IV) образуются катионы различной сложности: [М(НгО)б(ОН)2] , [М2(Н2О)12(ОН)2 ]6+, [М4(НгО)х(ОН>8Г+и др. Конечные продукты реакции содержат катионы состава [Мб(НгО)х(ОН)15] .
Актиноиды, имеющие более высокие степени окисления, образуют еще более сложные комплексы. Например, Pa(V) уже в 1— 3 моль/л водных растворах галогеноводородных кислот присутствует в виде частиц состава [Ра(Н2О)х(ОН)уХгГ—у~z, переходящих в осадок с изменением значений х, у и z при понижении кислотности раствора (X = С1, Вг).
При сплавлении или спекании оксидов актиноидов с карбонатами щелочных и щелочно-земельных элементов образуются уранаты, диуранаты, нептунаты и другие им подобные соединения:
2UO3 + К2СО3 - K2U2O7 + CO2t
K2U2O7 + К2СО3 - 2K2UO4 + СО2Г
Для /-элементов, как и для d-элементов, способных иметь различные степени окисления, очень характерно образование нестехиометрических соединений — оксидов UO<2+x), (ПУ, Uvl)Oe, гидроксидов указанных выше составов, нитридов UN2—х, гидридов ThH(2±x), UH(3-x), РиН(2—х). Двойные оксиды, аналогичные урану, найдены у нептуния (NpJv, Np+vi)O8.
28.4. СОЛИ И КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
В водных растворах хлоридов, нитратов, сульфатов лантаноидов и актиноидов (III) (ЬпС1з, Ln(NO3)3, АпС1з, Ап2(8О4)з) присутствуют аквакатионы [Ьп(Н2О)и]3+и [Ап(Н2О)пГ+ с координационным числом п, равным чаще всего 8. Аквакатионы — слабые катионные кислоты, степень протолиза которых повышается от La к Yb и от Ас к Л. Аквакатионы лантаноидов, кроме Се, Gd и Yb, придают водным растворам ту или иную окраску.
В степени окисления (VI) актиноиды присутствуют в водных
500
растворах в виде катионов МО2+. При понижении кислотности раствора гидраты диоксокатионов подвергаются протолизу:
н+
иоЗ+«Н2О + НгО = иОг(ОН)+ + Н3О+
В комплексах /-элементов лиганды почти не влияют на расщепление /-подуровней и поэтому параметр расщепления _в кристаллическом поле невелик, составляет всего 100—250 см-1 (для d-элементов он много больше, например, у Мп в аквакатионе [Мп(Н2О)б]3+ Ло = 21 000 см’) и энергия стабилизации полем лигандов незначительна. У лантаноидов, находящихся в конце ряда, /-АО вообще не принимают участия в комплексообразовании.
Считают, что 4/-АО лантаноидов, входящих в состав соединения, подвергаются, хотя и неполному, экранированию электронами, занимающими 5s- и 5р-подуровни энергии. Следует отметить, что по сравнению с одиночными атомами порядок подуровней энергии у лантаноидов в комплексах иной: 4/3 * 1415s25p615«/° * 16s2. Эффект экранирования сильно уменьшает перекрывание 6/-АО с атомными орбиталями лигандов и связи Ln—L имеют преимущественно ионный характер, связанный с ион-дипольным электростатическим взаимодействием.
, Изменение энтальпии (&ГН °) в реакциях комплексообразования лантаноидов с монодентатными лигандами невелико и лежит в области от -20 до +20 кДж/моль. Значение возрастает до 80—90 кДж/моль при образовании связей лантаноидами с полиден-татными лигандами.
Основное различие между комплексами лантаноидов и актиноидов состоит в том, что многие актиноиды в своих комплексах имеют высокие степени окисления и поэтому связи Ап—L ковалентны, а лиганды создают эффективное кристаллическое поле.
Координационное число в комплексах лантаноидов может изменяться в интервале 6—12. В бромидных и хлоридных комплексах координационное число, как правило, равно шести ([РгС1бГ , [NdBrer , [ОуВгб] , [иС1бГ ); в сульфатных, тиоцианатных, оксалатных и хроматных комплексах — восьми _[Pu(SO4>2] , [U(NCS)8]4-, [Th(ox)4]4 , [Sm(CrO4)2] , |Рг(СгО4)2| ); в иодидных и броматных — девяти ([Ndl9] , [Gd(BrO3>9] , [Prig]6-). Комплексы лантаноидов и актиноидов с координационным числом 10 с монодентатными лигандами неизвестны.
Синтезировано очень небольшое число комплексов с координационным числом 11, например биядерный комплекс [Th(H2O)3(NO3)3OH]2, где анион NO3 является бидентатным лигандом. Больше известно комплексов с координационным числом 12: M[Ce(NO3)6J, M[Th(NO3)6]*8H2O, где M = Mg, Mn(II), Co(II),
501
Ni(II) и Zn, a NO3 — бидентатные лиганды. Высокие и переменные координационные числа в комплексах лантаноидов вызваны ионным характером связей.
В водной среде молекулы воды и другие кислородсодержащие лиганды образуют связи с лантаноидами через атом кислорода Ln—О.
С сильноосновными N-донорными лигандами (этилендиамин и др.) комплексы образуются только при взаимодействии с безводными солями лантаноидов (галогениды, нитраты, тетраоксохлораты и др.) в среде ацетонитрила. Все комплексы лантаноидов, где есть связи Ln—N, легко гидролизуются.
28.5. РАСПРОСТРАНЕННОСТЬ В ПРИРОДЕ. ОСНОВНЫЕ МИНЕРАЛЫ
Лантаноиды более распространены на Земле, чем Со, Sn, Pb и В. Среди лантаноидов больше всего л литосфере содержится церия (кларк 0,004 %), а среди актиноидов — тория (кларк 0,001 %). Известно очень много минералов, содержащих в небольших количествах лантаноиды и актиноиды. Минералов, в которых содержание БпгОз или АпгОз превышало бы 10 %, немного. К числу последних принадлежат монацит (Се, La, Th...) РО4, гадолинит (Y, Ce...)2FeBe2(SiO4)O2, лопарит (Na, Са, Sr, Ln, Nb, Т1)(1±х)Оз, урановая смоляная руда (U, Th, Се, Рг...)зС>8, э в к с е-н и т (Y, Ег, Се, U, Th...) (Nb, Та, Ti)2(O, ОН)б и др. Помимо приведенных выше сырьевых источников лантаноидов используют и другие, в частности апатиты.
История открытия элементов. Первые сведения о лантаноидах были получены в 1794 г. Гадолиным, обнаружившим в гадолините группы новых элементов. В течение последующих 100 лет в этой группе были обнаружены: эрбий и тербий (1843 г., Мосандер), иттербий (1858 г., Мариньяк), гольмий и тулий (1879 г., Клеве), диспрозий (1886 г., Лекок де Буабодран).
Гадолин Юхан (1760—1852) — финский химик, профессор университета в г. Або.
Мариньяк Жан Шарль (1817—1894) — швейцарский химик. Клеве Пер Теодор (1840—1905) — шведский химик, профессор Упсальского университета.
В других минералах были открыты: церий (1839 г., Мосандер), самарий (1879 г., Лекок де Буабодран), гадолиний (1880 г., Мариньяк), неодим и празеодим (1885 г., Ауэр фон Вельсбах), европий (1901 г., Демарсе). Не обнаруженный в природе элемент прометий был получен искусственным путем и выделен из продуктов деления урана (1947 г., Маринский, Гленденин).
Ауэр фон Вельсбах Карл (1858—1929) — австрийский химик, открыл пирофорные сплавы и явление свечения раскаленных оксидов лантаноидов.
Демарсе Эжен (1852—1903) — французский химик.
Маринский Джейкоб (р. 1918 г.) — американский Химик.
Гленденин Лоренс (р. 1918 г.) — американский радиохимик.
502
Торий был впервые обнаружен в минерале торите ThSiO4 в 1828 г. Берцелиусом, уран — в урановой смоляной руде в 1789 г. Клапротом, протактиний открыт в 1918 г. (Ган, Мейтнер).
Ган Отто (1879—1968) — немецкий физико-химик, лауреат Нобелевской премии, открыл расщепление атомного ядра. Мейтнер Лизе (1878—1968) — австрийский физик и радиохимик, сотрудница Гана, профессор Стокгольмского университета.
Открытие следующих за ураном (трансурановых) элементов было связано с осуществлением ядерных реакций. В природе трансурановые элементы присутствуют (кроме Ри) в урановых рудах в очень малых количествах. Нептуний был открыт в 1940 г. Макмилланом и Эйбельсоном. В последующие годы Сиборгом. Гиорсо и их сотрудниками были синтезированы плутоний (1940), америций (1945), берклий и калифорний (1949), эйнштейний и фермий (1953), менделевий (1955). Первые атомы элемента жо-лиотия были получены акад. Г. Н. Флеровым и его сотрудниками (1963) в ядерной реакции
^2Pu+ ?gJl + 4^
Макмиллан Эдвин (р. 1907) — американский физик, лауреат Нобелевской премии.
Эйбельсон Филип (р. 1913) — американский физикохимик.
Сиборг Гленн (р. 1912) — американский химик и физик, лауреат Нобелевской премии.
Гиорсо Альберт (р. 1915) — американский физик и химик.
28.6. ПРИМЕНЕНИЕ
Лантаноиды и актиноиды широко используют в технике, промышленности, медицине. Металлический церий, например, служит легирующей добавкой к стали, идущей на изготовление хирургических инструментов. Сплав церия с железом благодаря своей пирофорности применяют для изготовления кремней зажигалок. Прочные и легкие сплавы лантаноидов с магнием используют в самолете- и ракетостроении.
Оксиды лантаноидов и тория, а также карбид урана — прекрасные катализаторы или активаторы каталитических процессов. Оксиды и соли церия, празеодима, неодима и диуранат натрия NaiUiO? применяют для придания стеклам и эмалям различной окраски. Широко используют лантаноиды для изготовления лазерных материалов. Нитраты и фториды лантаноидов и тория применяют для пропитки углей дуговых ламп.
Присадки церия к чугуну в количестве до 0,15 % повышают его жидкотекучесть, улучшают обрабатываемость. Особенно сильно сказываются добавки лантаноидов к сталям на их пластичности (стали меньше растрескиваются при отливках и горячей формовке).
Тугоплавкие сульфиды CeS и ThS — ценные материалы для изготовления тиглей, выдерживающих в восстановительной атмосфере температуры до 2450 °C.
503
Некоторые лантаноиды — компоненты новых сверхпроводящих материалов с критической температурой около -180 °C.
Область основного использования урана и плутония — ядерная энергетика. В качестве перспективного источника ядерного горючего, в частности и, рассматривается также торий. Применение остальных актиноидов сдерживается их малой стабильностью и дороговизной получения.
Подробнее см.: Коган Б. И. Редкие металлы. — М.: Наука, 1978.
28.7. ТОКСИКОЛОГИЯ
Токсические свойства лантаноидов проявляются в замедлении свертываемости крови, хронических фарингитах и ринитах — заболеваниях верхних дыхательных путей. У работающих с оксидом церия (IV) на производстве полирующего состава — поляри-та наблюдаются при непосредственном контакте кожные дерматиты.
Соединения тория, урана и плутония ядовиты. Кроме того, опасность работы с актиноидами заключается в радиоактивном воздействии на человека, интенсивность которого с ростом порядкового номера элемента возрастает. Поэтому все работы с актиноидами ведутся в изолированных боксах, в толстых резиновых перчатках, защищающих от /3-излучения, а при необходимости (О- и /-источники) — с использованием дистанционного управления.
Упражнения к главе 28
1. Почему 47-элементы называют лантаноидами, а 57-элементы — актиноидами?
2. В чем проявляется горизонтальная периодичность 7-элементов и почему нарушается в этой секции вертикальная периодичность?
3. Какая степень окисления лантаноидов наиболее устойчива и у каких элементов появляется степень окисления (IV)?
4. Как изменяется основный характер гидроксидов лантаноидов по периоду. В каких степенях окисления оксиды и гидроксиды лантаноидов проявляют амфотерность?
5. Какое практическое значение находит самое летучее соединение урана — его гексафторид?
6. Какие координационные числа характерны для лантаноидов? Приведите примеры.
7. Какое значение имеет параметр расщепления 7-АО в кристаллическом поле лигандов? Отличается ли он от параметра расщепления d-AO?
8. Какие связи у лантаноидов с лигандами: ионные или ковалентные?
ГЛАВА 29. НЕСТЕХИОМЕТРИЧЕСКИЕ СОЕДИНЕНИЯ
В начале нашего столетия незыблемой основой для химии были три основных стехиометрических закона: закон эквивалентов, закон постоянства состава и закон простых и кратных отношений.
Закон эквивалентов был открыт в 1792 г. Рихтером, который установил, что кислоты и основания соединяются в определенных, эквивалентных отношениях независимо от своей природы, и эквивалентные отношения являются физическими постоянными. В начале XIX столетия на работы Рихтера никто не обратил внимания. Рихтером был также введен и термин «стехиометрия», прочно укоренившийся в химии. Буквально термин «стехиометрия» означал измерение основных начал всех веществ (от греч. стехион — элемент, метрон — мера).
Рихтер Иеремия (1762—1807) — немецкий химик-технолог, написал книгу «Начальные основания стехиометрии или искусства измерения химических элементов».
Закон постоянства состава был открыт в 1799 г. Прустом.
Пруст Жозеф (1754—1826) - французский профессор химии, член Парижской АН, преподавал химию в Испании и Франции.
Этот закон утверждал, что состав данного соединения не зависит от способа и условий его получения, что соотношения между массами атомов элементов, входящих в состав данного соединения, постоянны. Как писал Пруст, японская киноварь HgS имеет такой же состав, как и испанская, оксиды серебра, полученные в Перу или в России, ничем не отличаются друг от друга.
Закон простых и кратных отношений сформулировал Дальтон на основе своей атомистической теории. Дальтон считал, что если два элемента взаимодействуют друг с другом с образованием соединения, то их количества соотносятся между собой как простые целые числа. Например, в НгО или КОН отношения Н:О = 2:1 и К:О:Н= 1:1:1.
С открытием трех стехиометрических законов химия превратилась в науку и полностью освободилась от алхимических наслоений, превратилась в химию стехиометрических соединений.
Подробнее см.: Кузнецов В. И. Эволюция представлений об основных законах химии. — М.: Наука, 1967. С. 7—23.
В 1803 г. Бертолле пришел к выводу, что элементы могут соединяться друг с другом в любых пропорциях в зависимости от массы реагирующих вешеств. Этот вывод противоречил закону постоянства состава Пруста и в споре с Прустом Бертолле потерпел поражение. Почти все химики того времени признали закон постоянства состава в качестве всеобщего закона природы.
Однако в начале нашего столетия стали накапливаться факты, не подчиняющиеся стехиометрическим законам химии.
Стехиометрические законы химии были действительны только для молекулярных соединений, соединений с ковалентной связью,
505
газообразных и жидких веществ (концепция насыщаемости связей, см. раздел 5.2).
К твердым веществам с ионной химической связью, к бесконечным трехмерным кристаллам законы постоянства состава и простых кратных отношений неприменимы. Любой, даже чистый стехиометрический кристалл выше О К всегда станет нестехиометрическим из-за теплового движения атомов или ионов, часть которых может покинуть поверхность вещества. Кроме того, любой идеальный кристалл стехиометрического соединения AnBm не отвечает закону постоянства состава, так как он может содержать переменное число молекул (АпВт)х в зависимости от своего размера.
Развитие химии твердого тела заставило пересмотреть наши прежние представления о дискретности химической организации вещества. Стало очевидным, что стехиометрические законы химии являются не всеобщими, а частными законами природы.
29.1. КРИСТАЛЛИЧЕСКАЯ РЕШЕТКА И ЕЕ ДЕФЕКТЫ
Большинство твердых веществ является поликристаллическими телами, состоящими из массы небольших монокристаллов — однородных образований, ограниченных плоскими гранями.
Геометрически правильная наружная форма монокристаллов, ее симметричность связаны с упорядоченным расположением атомов, молекул и ионов в кристалле, с его кристаллической структурой. Каждый монокристалл представляет собой закономерную последовательность в повторяющемся расположении частиц в трехмерном пространстве. Частицы занимают определенный объем в пространстве, поэтому для упрощения математического описания кристалла и наглядности частицы заменяют системой точек (см. раздел 6.3). Эту систему называют кристаллической решеткой.
Реальные монокристаллы содержат в огромном количестве разнообразные дефекты кристаллической решетки. На стехиометрию влияют прежде всего точечные и линейные дефекты. Точечные дефекты — нарушения решетки, в изолированных друг от друга ее узлах и межузельных пространствах (рис. 99). К точечным дефектам принадлежат вакансии (или дефекты по Шоттки) и ионы внедрения (или дефекты по Френкелю). Вакансии представляют собой отсутствие тех или иных ионов в узлах решетки.
Появление вакансии вызывает нарушение стехиометрического соотношения между катионами и анионами вещества. Отклонение от стехиометрии связано также с внедрением избытка того или иного собственного иона извне при синтезе соединения. В том и другом случае соблюдается закон постоянства зарядов, электронейтральности кристалла. Поэтому, когда нет, например, в узле катиона, то один из катионов решетки изменяет свою степень окисления на более высокую. Появление вакансии вместо аниона вызывает увеличение в кристалле свободных электронов.
506
Рис. 99. Точечные дефекты в ионном кристалле: а — дефект Шоттки; б — дефект Френкеля
Точечные дефекты, расположенные близко друг к другу, способны к взаимодействию с образованием ассоциатов, вызывающих появление новых фаз. Так, при нагревании нестехиометрического CrSx(l <х< 1,5) образуются фазы СггБз, СггЗд, CrsSc и CrS.
При образовании и росте монокристаллов под действием механических и термических факторов могут появиться линейные дефекты (дислокации). Они соответствуют смещению в решетке целых рядов ионов, нарушению ориентации слоев у края незавершенной плоскости кристаллической решетки. В этом случае также происходит нарушение стехиометрического соотношения катионов и анионов.
Образование дефектов в реальных кристаллах — самопроизвольный процесс, вызванный уменьшением значения АС, который происходит до тех пор, пока не образуется равновесная концентрация дефектов. Причем определяющим фактором в увеличении дефектности кристаллов является увеличение энтропии, вызванное существованием в кристалле большого числа позиций, которые могут быть заняты точечными дефектами. При повышении температуры значение Тб S возрастает и минимум значения ЛС? сдвигается в сторону еще большей концентрации дефектов.
Подробнее см.: Вест А. Химия твердого тела. — М.: Мир, 1988.
Ч. 1. С. 388.
29.2. ДАЛЬТОНИДЫ И БЕРТОЛЛИДЫ
Образованию стехиометрических соединений дискретного, определенного, состава отвечает дискретная стехиометрическая реакция: nA + znB » АдВ/и. Числа пит (количество веществ А и В в молях, участвующих в реакции) называют стехиометрическими коэффициентами. Это постоянные для данной реакции величины, не зависящие от количества взятых веществ и условий осуществления реакции.
При образовании соединения АиВт с целочисленными стехио-
507
метрическими коэффициентами п и т в кристаллической решетке соединения ионы А занимают свои все узлы, а ионы В — свою правильную систему узлов.
На диаграмме состав — свойство (температура плавления, электрическая проводимость, вязкость и т. д.) стехиометрическому соединению отвечает с и н-
Рис. 100. Зависимость свойства образующегося гулярная (или даль-вещества от состава: тоновская) точка D
а — стехиометрические; б — нестехиометриче- . 1 пл \
ские соединения (рис. 1W, а).
Стехиометрические соединения названы Курниковым дальтонидами.
Курнакав Николай Семенович (1860—1941) — русский физи-кохимик, создавший основы физико-химического анализа.
В точке D дальтониды представляют собой чистые, индивидуальные соединения АпВщ. В точках, близких к точке D, будут находиться уже твердые растворы реагентов А и В в соединении АлВт.
К стехиометрическим соединениям, или дальтонидам, относятся вещества, находящиеся в газообразном состоянии, жидкости и молекулярные кристаллы. Получение же кристаллических соединений с ионной или атомной кристаллической решеткой строго стехиометрического состава, без дефектов и частичной диссоциации невозможно.
Образованию нестехиометрических соединений с непрерывным характером изменения состава отвечает нестехиометрическая химическая реакция: хА + уВ==АхВу, где х и у уже являются переменными числами в определенных пределах, ограничивающих область однородности (гомогенности) кристалла. На диаграмме состав — свойство в этом случае отсутствует резкий максимум — сингулярная точка, нет стехиометрической ординаты соединения АлВу (рис. 100, б).
Состав соединения в области однородности (гомогенности) кристаллической структуры (рис. 100, заштрихованная область) оказывается неопределенным. Такие соединения Курнаков назвал бертоллидами. Все составы, входящие в область однородности бертоллида, равноправны и каждый представляет химическое соединение. Весь бертоллид в целом есть непрерывный набор химических соединений, обладающих одной и той же структурой.
Подробнее см.: Макаров Е. С. Изоморфизм атомов в кристаллах. — М.: Атомиздат, 1973.
В бертоллидах часть узлов кристаллической решетки является либо вакантной, либо в межузельном пространстве находится нестехиометрическое число ионов А+ или В-.
508
Выделяют четыре основных типа нестехиометрических соединений: соединения с избытком катионов вследствие анионных вакансий, соединения с избытком катионов в межузельных пространствах, соединения с избытком анионов вследствие катионных вакансий и соединения с избытком анионов в межузельных пространствах.
Таким образом, нестехиометрическим соединением или бертоллидом называют кристаллические фазы переменного состава, в которых отношение чисел разнородных ионов не может быть выражено малыми целыми числами.
Когда бертоллид переходит в парообразное состояние в виде молекул, то он превращается в дальтонид, в стехиометрическое соединение.
К нестехиометрическим соединениям не относятся твердые растворы, вещества, содержащие различные примеси, продукты сорбции кристаллами посторонних молекул или ионов.
Принципиальное отличие твердого раствора от нестехиометрического соединения, бертоллида, заключается в том, что в твердом растворе все ионы структурно эквивалентны, узлы кристаллической решетки статистически заняты ионами разных элементов. У бертоллида же каждая совокупность кристаллографически эквивалентных узлов либо занята только ионами определенного химического элемента, либо остается вакантной.
По Курнакову, бертоллиды занимают промежуточное положение между стехиометрическими соединениями и твердыми растворами.
29.3. НОМЕНКЛАТУРА НЕСТЕХИОМЕТРИЧЕСКИХ СОЕДИНЕНИЙ
Общим обозначением бертоллидов, когда размер отклонения от стехиометрического состава неизвестен, является математический знак = (приблизительно), например = FeO, -> TiO и т. д. Если известны колебания в составе, например в катионной части соединения, то вводят в формулу после катиона переменный коэффициент х: FexO, NaxW()3, Fea-xjS (при х = О FeS имеет стехиометрический состав). Если надо показать, что переменный коэффициент х имеет небольшое значение, то вместо лат. буквы х применяют греч. букву (5: KCl(i-<5);PbS(i-^); Zn(i+<5)0.
Когда конкретный состав бертоллида известен, то он указывается либо непосредственно, например Feo,877$, либо в виде пределов из-мененияпеременныхкоэффип,иентовхили<5:NajcWO3(0,3 < х< 0,9); PbS(i-^) (0 < (5 < 0,005).
Существование вакансий отмечают символом □. Например, хлорид натрия с анионными вакансиями будет иметь обозначение Na(ci; 5, □ ), а катионные вакансии в монооксиде железа (Fex, □ ) о.
Для ионов внедрения, т. е. ионов, находящихся между узлами кристаллической решетки, применяют символ А, который заключают в круглые скобки с символами атомов внедрения. Например, Та(Нх, А) или Zr(Co,8, А).
509
29.4. НЕСТЕХИОМЕТРИЧЕСКИЕ СОЕДИНЕНИЯ
К нестехиометрическим соединениям относятся, как это было сказано выше, практически все твердые вещества с ионной и атомной кристаллической решетками. Ниже рассматриваются только отдельные примеры бертоллидов, химия которых была изложена в предыдущих главах учебника.
Оксиды, гидроксиды и кислоты. Оксиды многих металлов имеют вакансии в узлах решетки либо кислорода, либо металла. Так, у Fe^O (х « 0,84 - 0,96) появление каждой катионной вакансии на месте иона Fe2+ сопровождается образование двух ионов FeJ в двух других узлах для компенсации зарядов.
Оксид титана Ti(Ox, Д) (х = 0,0 - 0,5) образован вхождением атомов кислорода в межузельное пространство CZ-Ti. У оксида TiOx с х = 0,64- 1,26 существуют вакансии как в катионной, так и в анионной частях кристаллической решетки. Точному составу монооксида титана отвечает формула Tio,850o,85- Это означает, что примерно из каждых семи узлов решетки один узел, предназначенный для титана или кислорода, всегда пустует. Поскольку вакансии распределены по кристаллу статистически, кубическая структура. TiO (типа NaCl) не изменяется во всем интервале составов. Диоксид титана также имеет нестехиометрический состав Ti (Ох, □), х = 1,98 -- 2,00. Вследствие избытка атомов титана оксид имеет электронную проводимость и полупроводниковые свойства.
В оксидах TiO(2-x), WO(3-X), МоО(з-х) с дефицитом кислорода обнаружены области с идеальной стехиометрией (TiOi, WO3, МоОз), разделенные нестехиометрическими фазами, близкими по структуре и составу. В частности, в диоксиде титана найдены нестехиометрические фазы с общей формулой TinO2n-i (и - 4, 5, 6, ..., 10), каждая из которых, например, Т48О15 или TiOi,875, имеет достаточно упорядоченную структуру.
У молибдена и вольфрама известны синие аквагидроксиды состава МОг.о- 2,9(Н2О)х(ОН)у. Существуют и безводные синие оксиды-гид-роксиды, например Мо02,5(ОН)о,5; W02,67(OH)o,33- В синих окси-дах-гидроксидах атомы Мо и W находятся в разных степенях окисления: (V) и (VI).
Получают синие оксиды-гидроксиды мягким восстановлением слабо подкисленных водных растворов Na2WO4, К2МОО4 или водных суспензий МоОз и WO3 такими восстановителями, как SnCh, SO2, H2S, Zn и HI. Влажная WO3 приобретает голубую окраску уже на свету или при облучении ультрафиолетовым светом (см. раздел 25.5).
К нестехиометрическим соединениям относятся и так называемые оловянные кислоты, образующиеся при взаимодействии NH3 с SnC14 или Sn с концентрированной HNO3. При их хранении в результате самопроизвольной дегидратации они постепенно меняют свой состав, как полагают, по схеме: H2[Sn(OH)6] - H4SnO4*H2O - (НгБпОз)*-- (H2Sn2O5)x -» SnO2*xH2O. В этом ряду (Нг8пОз)х — цепной полимер, a (H2Sn2O5)x — сетчатый полимер. Сухие осадки SnO2*xH2O
510
представляют уже частицы диоксида олова, покрытые слоем, состоящим из ОН-групп и молекул воды.
При действии кислот на K[Sb(OH)61 и при гидролизе SbCls образуются осадки переменного состава, включающие и нестехиометрические соединения, в частности Н(4-х)(НзО)(х-2)5Ь2Об*хН2О.
Гелеобразные осадки, выделяющиеся из раствора при гидролизе галогенидов титана, также принадлежат к нестехиометрическим соединениям, полиядерным аквагидроксокомплексам, состава |liA(H2O)/OH)z|(jc^ с оловыми ^Ti(OH)2Ti^ и оксомостиками —О—Ti . В этом отношении такие осадки похожи на осадки поликремниевых кислот, силикагелей. В процессе самопроизвольной дегидратации («старение осадка») происходит формирование слоистой структуры, переходящей постепенно в структуру анатаза — полиморфной модификации ТЮг.
Двойные оксиды. Некоторые двойные оксиды (см. раздел 2.4) можно представить в виде соединений включения атомов одного металла в кристаллическую решетку оксида другого металла. Таковыми являются, например, «вольфрамовые бронзы» состава (Мх, W)O3, где М38 щелочные металлы, Си, Ag, Т1. В частности, у (NaxW)03 х = 0,3-1,0, причем состав, отвечающий х = 1,0, никогда не достигается. При х = 0,9 соединение имеет желтый цвет, по которому это соединение получило название «бронзы». Когда х = = 0,8, соединение окрашено в оранжевый цвет, а при хш 0,6-0,7 — в красный.
«Вольфрамовые бронзы» имеют металлический блеск, электрическую проводимость металлов, инертны к воздействию кислот, не являющихся окислителями. Степень окисления у вольфрама сохраняется, но атомы металлов, внедряясь в межузельное пространство WO3, теряют свои s-электроны, вызывая тем самым появление у «бронз» металлической проводимости.
К двойным оксидам типа «вольфрамовых бронз» относятся и такие соединения, как (Lax, Т1)0з (х = 0,67 - 1,0); (SrxNb)O3 (х = = 0,7-0,95).
Гидриды. Твердые гидриды элементов IVA—VIIA-групп периодической системы имеют молекулярную кристаллическую решетку и являются стехиометрическими соединениями. Нсстехиометриче-ские гидриды образуют преимущественно d- и /-элементы. У солеобразных гидридов s-элементов часто также наблюдается отклонение от стехиометрии при высоких температурах (400—800 °C), например NaHo,7-l,o, ВаН],8-2,0. Тип дефектов, вызывающих появление нестехиометрического состава у таких гидридов, пока не установлен. В остальных случаях атомы водорода внедряются в неэквивалентных количествах в межузельное пространство металла, забирают у последнего электроны (Н + е =Н ), образуя ионную химическую связь, например, у лантаноидов LaH(3+x).
Если же водород, попадая в межузельное пространство, отдает свой электрон металлу (Н - е = Н ), то образуются не гидриды, а нестехнометрические гидрометаллы со смешанной металло-ковалентной химической связью, например УНо,45, ТаНо,з-О,5 и др. Поэтому
511
гидрометаллы обладают металлическим блеском и высокой электрической проводимостью.
Карбиды. В нестехиометрических карбидах атомы углерода либо занимают межузельное пространство в структуре металлов, либо образуют вакансии, которые распределяются в решетке упорядоченно^ В первом случае электронная структура металла не изменяется, в то же время атомы углерода стабилизируют решетку металла, увеличивая ее твердость до 9—10 ед. по шкале Мооса и т. пл. до 3000—4800 °C. Для проникновения атомов углерода в структуру металла необходимо, чтобы атомы металлов были относительно большими (130 пм и больше). Поэтому первые d-элементы четвертого периода — Сг, Мп, Fe, Со и Ni не образуют обычных карбидов внедрения, атомы углерода образуют цепи, проходящие через искаженные кристаллические решетки этих металлов. Такие карбиды легко взаимодействуют с водой и разбавленными кислотами с образованием различных углеводородов. Примеры карбидов внедрения: MoC(i-x), х-0,0-0,4; УСХ, х = 0,66-0,88.
Нитриды. Нитриды металлов Б-групп периодической системы часто имеют дефицит по азоту и представляют собой продукты внедрения атомов азота в полости кристаллической решетки металла. Поэтому они по внешнему виду, электрической проводимости напоминают металлы, отличаясь от последних химической инертностью, твердостью и высокими температурами плавления. Например, VNx (х - 1,00-1,33); TiNx (х = 0,38-1,20); тантал образует несколько нитридов различной структуры: TaaNx (х = 4,67 - 5,00); TaNx (х = - 0,8-0,9) и TaaNx (х-0,4-0,5).
Соединения включения. К этой группе нестехиометрических соединений относят соединения, в которых молекулы и ионы размещаются в полостях, каналах и между слоями кристалла соединения основы или «соединения-хозяина». Полости и каналы могут существовать у «соединения-хозяина», но могут и возникать при образовании его кристаллической решетки.
Гидраты газов. Если через охлажденную до 0 °C воду пропускать некоторые газы (Аг, Кг, Хе, Оз, Вгз, НгО, РНз, SO2, H2S, СН4 и др.), то выделяются кристаллы гидратов газов, состоящие из полиэдров, включающих до 20 и больше молекул воды, связанных между собой водородными связями и занимающих вершины полиэдра. Внутри полости таких полиэдров находятся молекулы газов. Размер полости (клетки) колеблется от 400 до 750 пм. Получены зеленовато-желтые кристаллы С1г*(7+ х)НгО, устойчивые на воздухе ниже 9 °C; желтоватые кристаллы СЮг*(6 ± х)НгО, с температурой разложения 15 °C; бесцветные кристаллы SO2*(6 + х)НгО, устойчивые ниже 7 °C.
Полярные молекулы (аммиак, галогеноводороды и др.) гидратов газов не образуют.
Полииодоиодаты полиацетилена и углеводов. При добавлении иода к полимеризующему ацетилену в органическом растворителе или при нагревании полиацетилена в парах иода образуются пленки черного цвета с металлической проводимостью и блеском состава:
512
цис- (CHIo,Об)х и транс- (СН1о,22)х- Атомы иода отрывают электроны от углеродных атомов полимера и в его каналах создают цепи, состоящие из анионов [1з] и [I5] .
Углеводы (крахмал, амилоза, декстрины и др.), твердые и растворенные в воде, при контакте с иодом и KI приобретают синюю окраску, вызванную образованием нестехиометрических полииодо-иодатов. В спиралевидной, циклической структуре некоторых углеводов существуют каналы, заполняемые цепочечными полииодат-ными анионами, состоящими из связанных между собой ионов [I5 ] .
Подробнее см.: Степин Б. Д, Степина С. Б. Усп. химии, 1986. Т. 55. С. 1434.
Слоистые соединения графита. Слоистая структура графита позволяет многим веществам проникать в пространство между слоями с образованием нестехиометрических слоистых соединений графита. Слоистые соединения образуют щелочные металлы, галогены, галогениды металлов и сильные кислоты. Например, при нагревании Подробнее см.: Новиков Ю. Н., Вольпин М. Е. Усп. химии, 1971. Т.
40. С. 1568.
щелочных металлов с графитом в ампуле при 300—400 °C получены KC<2frbx) (х = 0,2-3,3); КС<зо+х) (х = 0,4-2,7); RbC(34+X) (х = 0,8-3,4) и др. При действии на графит растворов щелочных металлов в жидком аммиаке или пиридине в графит включается и часть растворителя.
Слоистые соединения щелочных металлов с графитом сохраняют многие свойства щелочных металлов: взаимодействуют с водой с выделением водорода, поглощают водород уже при 18—25 °C с образованием нестехиометрических продуктов, например состава КНхСв (х = 0,0-0,67), взаимодействуют с галогенами, превращаясь в смесь графита и галогенида металла.
Графит может включать молекулы галогенидов (FeCh, AICI3 и др.) и оксидгалогенидов (СгСЬОг и др.) металлов. Например, известно соединение состава С»(9± х)А1С1з, имеющее интенсивную голубую окраску. В подобных соединениях происходит перенос электронов от графита к галогениду металла: С^»(х[А1С14 Г + уА1С1з).
При обработке графита концентрированной H2SO4 в присутствии окислителя (HNO3, СгОз, KMnCU) образуется слоистое соединение состава: C(*24+x)*HSO4*H2SO4.
29.5. НЕСТЕХИОМЕТРИЧЕСКИЕ ФАЗЫ, ОБЛАДАЮЩИЕ СВЕРХПРОВОДИМОСТЬЮ
У некоторых нестехиометрических соединений обнаружено явление сверхпроводимости, заключающееся в том, что ниже некоторой температуры (7с) электрическое сопротивление этих веществ становится близким к нулю. Полагают, что сверхпроводящее состояние вещества вызвано возможностью коллективного движения валентных электронов.
Явление сверхпроводимости обнаружено у самых разнообразных по составу веществ: NbNx (Тс~ -258 °C), NbaSn* (Тс “-255 °C),
17—1258
513
Nb3Gex (Tc» — 250 °C), NbC, (Tc « — 262 °C), Nb.<Zn, (T<« « —263 °C) Nb3Alo.75Geo.2s (Tc « —252 °C), V3SiA. (Tc « —256 °C), МоТСл (Tc « —259 °C).
Резкое увеличение значений температуры Тс было получено в последнее время после синтеза купратов лантаноидов и щелочноземельных элементов: Ьаг[СиО(4-<5)] (Те- - 238 °C), Вао,34Уо,зСи (Тс - - 188 °C). Спеканием смеси различных соединений бария, иттрия и меди при 900—950 °C в токе кислорода получено нестехи-ометрнческое по кислороду соединение состава ВагУСизОп-х), проявляющее сверхпроводимость ниже — 185 °C. Идеальная стехиометрия по кислороду ВагУСизОу никогда не достигается. Максимальное содержание кислорода (350 °C, р = 0,1 МПа) соответствует стехиометрии Ва2УСизОб,93±0,03. В этом случае Тс~ - 183 °C. При повышении температуры и понижении парциального давления кислорода происходит уменьшение содержания кислорода в этой твердой фазе и понижение значения Тс, в частности при х~0,4 значение Тс~ - - 213 °C. Рассматриваемое соединение неустойчиво к воздействию СОг и влаги воздуха:
2Ва2УСизО7 + ЗНгО = ВаУгСиО5 + СиО + ЗВа(ОН)2 + О,50г!
Фазы со стехиометрией ВагЬпСизО(7-х) образуют все лантаноиды без исключения, а барий может быть замещен на Sr и Са, при этом значение Тс существенно не изменяется. Введение в соединения фтора или хлора не увеличивает значение Тс.
Получены и другие нестехиометрические фазы -с высоким значением Тс. Например, у фаз состава (Са, Sr)6Bi4CuO(i&^x) <х - 0,3) и Cai 5ВаТ12СнзО<8,5+х) значение Тс равно соответственно - 163 и - 167 6С.
Считают, что в структуре купратов, аналогичной, структуре K2[NiF4], катионы Ва2* и разделены плоскими слоями купратных анионов, содержащих медь в различных степенях окисления от (I) до (III). Атомы меди находятся либо в квадратной пирамиде С11О5, либо в центре плоских квадратов С11О4, образующих чередующиеся слои.
Получение сверхпроводящих нестехиометрических многоядерных оксокупратов бария и лантаноидов резко увеличило экономическую эффективность ряда электротехнических устройств и расширило области их практического применения, например, для изготовления кабелей сверхпроводящих линий электропередачи, так как теперь достаточно для получения явления сверхпроводимости использовать жидкий азот.
Упражнения к главе 29
1. Объясните природу дефектов по Шоттке и Френкелю.
2. Какова природа «синих оксидов вольфрама» и молибдена?
3. Что означают формулы: = FeO, KCI(1—<J), (Na*, W)O3?
4. Какие соединения получили название дальтонидов и бертоллидов?
514
5. Что вы знаете о соединениях включения?
6. Могут ли быть нестехиометрическими газообразные вещества?
7. Какие физико-химические свойства «вольфрамовых бронз» вам известны? Что собой представляют эти вещества?
8. Какие места в кристаллической решетке нестехиометрических гидридов металлов занимают атомы водорода?
9. Что собой представляют слоистые соединения графита? Какими химическими свойствами они обладают?
ГЛАВА 30. НЕОРГАНИЧЕСКАЯ ХИМИЯ И ОКРУЖАЮЩАЯ СРЕДА
Еще в начале нашего века считали, что развитие неорганической химии и химических производств несет человечеству новые материалы и изделия, увеличение плодородия почв, комфорт, а природа будет вечно ласкать наш взор, открывая людям все новые и новые свои кладовые, ничего не требуя взамен.
Взрывы атомных бомб над Хиросимой и Нагасаки вызвали первые ростки беспокойства за судьбу окружающей среды. Появились сразу и экологические проблемы: природные ресурсы оказались не бесконечными, а отходы химических производств и энергетических установок стали угрожать существованию человечества. Оказалось, что реки, моря и воздух давно уже превратились в резервуары любых отходов химических, металлургических и других производств, нашего быта. Загрязнение воды и воздуха, носившее ранее локальный характер, теперь стало глобальным, охватывая всю атмосферу, литосферу и гидросферу Земли.
г- Экология — наука, изучающая взаимоотношения организмов и окружающей среды.
Многие страны приближаются к ощутимой нехватке сырья, пресной воды и энергетических ресурсов. Дело дошло до разработки проектов по транспортировке айсбергов из Антарктиды к некоторым азиатским и европейским странам, извлечения сырья из вод океанов и их донных отложений.
Почти все виды химических загрязнений активно взаимодействуют с биосферой и между собой, превращая Землю в сложную химическую систему. Теперь производство практически всех неорганических веществ оказалось тесно связанным с решением таких проблем, как замкнутые технологические циклы, комплексная переработка сырья, вторичное использование материалов, полная утилизация отходов.
$ Биосфера — часть Земли, в которой возникают и проводят свои i жизненные циклы все живые организмы.
Выяснению влияния отдельных неорганических веществ на биосферу посвящены последующие разделы главы.
17*
515
ЗОЛ. АТМОСФЕРА
Атмосфера представляет собой чрезвычайно сложную физико-химическую систему. До 10 км атмосфера носит название тропосфера, в которой мы проводим всю свою жизнь. От 10 до 50 км простирается стратосфера, от 50 до 85 км — мезосфера и выше 85 км — термосфера.
Приблизительно 99% всего состава воздуха тропосферы приходится на долю двух газов — азота и кислорода, третьим по распространенности газом является аргон.
Подробнее см.: Бримблкумб П. Состав и химия атмосферы. — М.: Мир, 1988.
В стратосфере на высоте 20—30 км находится слой озона, защищающий Землю от мощного ультрафиолетового излучения Солнца. На больших высотах солнечное излучение вызывает диссоциацию молекул Ог на атомы (на высоте 130 км 50% молекул кислорода диссоциировано на атомы). Столкновение атомов и молекул кислорода приводит к образованию озона: Ог + О —- Оз (см. раздел 16.2).
Молекулы озона сильнее всего поглощают фотоны с длиной волны от 200 до 310 нм:
hv
Оз.=г Ог+О; О+О=Ог; Оз+О=2Ог
Если бы не слой озона в стратосфере, то фотоны с такой большой энергией достигли бы поверхности Земли и уничтожили на ней все живое. Последние годы над Антарктидой в озоновом слое образовалось окно, то расширяющееся, то сужающееся.
Кроме приведенных выше в атмосфере протекают и другие реакции с участием кислорода и озона. Среди них наиболее важная: НгО+О=2ОН. Своим появлением гидроксил-радикал вызывает образование целого набора атомов, радикалов и молекул:
6н+СО=СОг+Н; дн+О=Ог+Н; ОН+Оз=НОг+Ог;
ЗОг+НОг^Оз+ОН; СН4+ОН-СН3+Н2О;
OH+HzS-HS+HzO; OH+NO2=HNO3
С каждым десятилетием в тропосферу поступает все более значительное количество вредных для биосферы выбросов от переработки сульфидных и других руд, выплавки чугуна и стали, производства суперфосфата, от сгорания различных видов топлива и др.: СОг, SO2, СО, HF, Pb, H2S, ЫОг, Hg, аэрозоли и т. п.
Каждая такая составная часть атмосферы, достигая определенной концентрации, начинает изменять условия существования живых организмов, подавляя одни и убивая другие их виды.
Диоксид углерода. За сохранение благоприятных температурных условий у поверхности Земли ответственны главным образом два компонента атмосферы: СОг и НгО. Приблизительно 71 % солнечного излучения (450—850 нм), попадающего в атмосферу, поглощается
516
земной поверхностью. В свою очередь, земная поверхность также излучает энергию, приходящуюся на инфракрасную часть спектра (14—16) «КГ нм. Поэтому находящиеся в атмосфере НгО и СОг помогают поддерживать более или менее равномерную температуру у поверхности Земли (от —40 до +40 °C).
Все возрастающее колоссальное количество сжигаемого топлива приводит к тому, что содержание СОг_в атмосфере неуклонно увеличивается и достигает сейчас 0,6 г/м3 воздуха при скорости роста 2 мг/м3 в год. Считают, что к 2000 г. содержание СОг в атмосфере удвоится, а это приведет к повышению средней температуры поверхности Земли на 4—8 °C (появление «парникового эффекта»). Такое повышение температуры вызовет неизбежно глобальное изменение климата планеты, что приведет, в частности, к усилению засух, массовому размножению вредных насекомых, увеличит скорость таяния льдов Антарктиды и Гренландии. Уже сейчас отмечается повышение уровня Мирового океана в среднем на 13 мм в год.
Возрастающая вырубка лесов (особенно в бассейне реки Амазонки), считающихся «легкими» планеты, также способствует увеличению СОг в атмосфере.
С увеличением температуры поверхности Земли возрастет температура гидросферы, что приведет к уменьшению растворимости СОг в морской воде, выходу глубинных вод океана и выделению СОг в атмосферу (см. раздел 9.2).
Есть сторонники и другой теории, в соответствии с которой на Земле может наступить новая ледниковая эпоха. В атмосферу заводами выбрасывается все возрастающее количество пыли, достигшее за последние годы 1 млрд, т в год. Пыль поглощает солнечную радиацию в большей степени, чем СОг задерживает излучение Земли. Установлено, что увеличение непрозрачности атмосферы в четыре раза вызовет уменьшение температуры поверхности Земли, примерно наЗ °C. Такое понижение температуры будет достаточным для наступления льдов с Северного полюса и Антарктиды на средние широты.
Монооксид углерода. Монооксид углерода является опасным загрязнителем атмосферы. Он снижает способность гемоглобина крови к переносу кислорода, вызывает появление и развитие сердечных недугов, уменьшает активность работы мозга. Особенно чувствительны к отравлению СО молодые люди и беременные женщины.
Из-за неполного сжигания природного топлива образуется ежегодно 5» 10° т СО. Автотранспорт с выхлопными газами также выбрасывает в атмосферу ежегодно около 2» 10е т этого газа. Существенным источником СО может быть окисление метана СН4 биологического происхождения в тропосфере. Поверхность океанов выделяет в год (60—220) «10б т СО, образовавшегося при фоторазложении продуктов жизнедеятельности планктона, красных, сине-зеленых и других водорослей. Окисление СО в СОг в атмосфере протекает крайне медленно и поэтому содержание СО неуклонно возрастает. Основные реакции СО в атмосфере:
2СО+Ог=2СОг; 4CO+2NOy=N2+4CO2
517
СО+Оз-СОгЮг; СО+2ОН=НгСО+О2
2HNO3+CO2NO2+CO2+H2O
Естественный уровень содержания в атмосфере СО составляет 0,01— 1,0 мг/м. Действие СО на человека начинается уже при концентрации 6 мг/м . Среднесуточная предельно допустимая концентрация СО равна 3 мг/м3.
Диоксид серы. Сера относится к элементам, необходимым для органического мира как составная часть белков, в которых ее содержание колеблется в пределах 0,8—2,4%.
Но есть соединения серы — отходы безграмотных технологических процессов, нарушающие экологическое равновесие в природе. К таким соединениям относится прежде всего диоксид серы — самый распространенный загрязнитель воздуха. Диоксид серы опасен для здоровья людей, особенно страдающих заболеваниями дыхательных путей. Диоксид серы снижает продуктивность сельскохозяйственных культур, замедляет рост леса.
Плотная дымка, окутывающая крупные промышленные районы, состоит главным образом из SO2 и аэрозоля сульфата аммония.
Было обнаружено, что растения, поглотив из атмосферы SO2, затем выделяют обратно H2S и CS2, относящиеся к канцерогенным веществам. Пагубно действует SO2 на строительные материалы, содержащие карбонат кальция:
CaCO3+SO2+0,5O2a=C^SO4+CO21
Такие материалы из-за большого объема продуктов коррозии постепенно разрушаются.
Диоксид серы попадает в атмосферу в немыслимых количествах: во всем мире порядка 140—150 млн. т ежегодно. Приблизительно 80% выделяемого в атмосферу SO2 связано с сжиганием угля и нефти, производством меди, свинца и цинка.
В атмосфере SO2 окисляется до БОз (роль катализатора играет находящаяся в воздухе пыль оксидов металлов). Капли влаги превращают SO3 в серную кислоту, которая вместе с дождями выпадает на землю («кислотные дожди»).
Из-за выпадения «кислотных дождей» во многих пресноводных озерах и реках уменьшается количество обитающей там рыбы (уже при pH < 5,5 гибнут лосось, форель, хариус, сиговые рыбы, плотва).
Диоксид серы и «кислотные дожди» увеличивают из года в год коррозию металлов, вызывают нарушения целостности лакокрасочных покрытий.
Озон. Атмосферные загрязнения постепенно уничтожают защитный озоновый слой Земли. Озон, образующийся в тропосфере, сейчас уже не компенсирует общие его потери в стратосфере. Озон уничтожают поступающие в атмосферу фторированные и хлорированные углеводороды (фреоны) и оксиды азота.
Фреоны (CCI3F, CCI2F2, CCIF3 и др.), химически стабильные в тропосфере, разрушаются в стратосфере под действием ультрафио-
518
лотового солнечного излучения, выделяя атомарный хлор, взаимодействующий с озоном:
О3+С1=СЮ+О2; CIO+OCI+O2
В реакциях разложения озона участвуют многие газы, но прежде всего оксиды азота:
O3+NONO2+O2; O+NO2”O2+NO
В этих реакциях NO играет роль катализатора распада озона. Поставщиком оксидов азота является реактивная авиация. По некоторым данным, за один трансконтинентальный перелет реактивного самолета сгорает около 35 т атмосферного кислорода, содержащего значительную долю драгоценного озона.
Оксиды азота. Оксиды азота, в основном NO, NO2, поступают в атмосферу с выбросами заводов, автотранспорта и авиации. Считают, что каждый автомобиль выбрасывает около 4 г NO2 на 1 км пробега. Оксиды азота являются сильными окислителями и вызывают уже при концентрации 0,002 мг/л воздуха воспаление слизистых оболочек верхних дыхательных путей, хронические бронхиты. Накопление в атмосфере оксидов азота приводит к подавлению роста лесов, заболеванию листьев у деревьев и некоторых сельскохозяйственных культур.
Сероводород. Сероводород попадает в атмосферу при подземной выплавке серы, при использовании флотационно-автоклавного метода производства серы (на 1 т серы выделяется около 3 кг H2S), при получении CS2 и очистке серы от органических примесей и при ее хранении. Значительные количества сероводорода образуются при газификации углей и очистке природных газов. Постоянными источниками сероводорода все еще являются заводы по производству бумаги и целлюлозы (восстановление сульфидов лигнином древесины), коксогазовые и сланцеперерабатывающие заводы, фабрики искусственного шелка.
Сероводород принадлежит к сильным ядам нервно-паралитического действия.
Аэрозоли. Свинец. Кадмий. Ртуть. Прн существующей технологии производства многих неорганических веществ в атмосферу выбрасываются миллионы тонн отходов в виде аэрозолей, содержащих соединения ряда металлов, губящих растительный и животный мир. Среди соединений металлов особую опасность для живых организмов представляют соединения свинца, кадмия и ртути, относящиеся к ядам кумулятивного действия.
В 1923 г. для улучшения качества бензина в него стали вводить тетраэтилсвинец РЬ(СгН5)4, примерно 80 мг на 1 л бензина. С этого года началось резкое увеличение содержания свинца в атмосфере. Свинец стал одним из основных отравителей внешней среды. Заводы и автотранспорт выбрасывают ежегодно во всем мире почти 50 млн. т свинца, и более половины этого количества попадает в атмосферу при сжигании бензина с антидетонационными добавками.
Из атмосферы свинец вместе с дождями и снегом попадает в
519
почву (ежегодно до 300 г на гектар) и постепенно в ней накапливается, переходя в некоторые сельскохозяйственные культуры. Неорганические соединения свинца способны заменять соединения кальция в костях, превращаясь тем самым в постоянный источник отравления организма.
Подробнее см.: Затонская В. М., Лобанов Ф. И., Макаров Н. В.
Успехи химии, 1981. Т. 50. С. 693.
В атмосфере ртуть присутствует в меньшем количестве, чем в гидросфере. Основной источник поступления ртути в воздушную среду — сжигание углей й нефти, содержание ртути в которых достигает 2*10 4%. Подсчитано, что ежегодно свыше 1000 т ртути выбрасывается в атмосферу с аэрозолями только угольных электростанций. Ртуть попадает в воздушную среду также с заводов, производящих хлор электрохимическим методом с применением ртутных электродов.
Кадмий, как и ртуть, обладает относительно высокой летучестью, поэтому он легко проникает в атмосферу при выплавке металла, сжигании и переработке изделий, содержащих кадмий, при химической обработке цинковых, свинцовых и медных руд.
Соединения кадмйя очень ядовиты. Они легко накапливаются в почках и печени, вызывают появление камней в почках.
Считают, что свинец, ртуть и кадмий образуют «тройку металлов», представляющих наибольшую потенциальную опасность для человека и окружающей среды.
30.2. ГИДРОСФЕРА
Водой покрыто 70,8% поверхности Земли. Воды на Земле 1,4 млрд, км3, из этого количества только 35 млн. км3 (или 2,5%) приходится на долю пресной воды. Однако значительная часть пресной воды (24 млн. км3) находится в форме ледников и снежного покрова Антарктиды, Гренландии и Арктики и в подземных запасах. В реках и озерах сосредоточено всего 0,007% от общих запасов воды на Земле (95 тыс. км3).
Между тем реки и озера — основные источники пресной воды, во все большей степени подвергаются загрязнению отходами многочисленных заводов и фабрик. Без потребления пресной воды не может работать ни одно производство. Например, для выплавки 1 т стали нужно 150—200 м3 воды, для выпуска 1 т капронового волокца необходимо 5600 м3 чистой воды, а 1 т бумаги — почти 20 000 м.
В реки и озера попадают огромные массы высокоминерализованных вод, выливающихся на поверхность земли при разработке нефтяных и газоконденсатных месторождений. В производстве соды образуются в виде отходов большие количества СаС1г, которые либо сбрасываются в реки, либо спускают в выработанные шахты или в специальные водоемы, расположенные около заводов.
Одним из наиболее стойких загрязнителей гидросферы является ртуть. В результате деятельности промышленных предприятий, вымывания из почв атмосферными осадками вынос растворимых сое
520
динений ртути в Мировой океан достигает 3000—5000 т в год. В морской воде ионы ртути, взаимодействуя с содержащимися в ней анионами, образуют суспензии малорастворимых соединений HgS, Hg2C12, Hg3<PO4>2, которые постепенно оседают на морское дно вместе с глинистыми шлаками. Донные осадки под воздействием микроорганизмов вновь частично превращаются в ионы Hg(I) и Hg(II), например HgS+2O2=HgSO4. Катионы Hg?+ диспропорциони-руют: HgF < 'HgUHg2+, а некоторые виды бактерий превращают катионы Hg2+ в высокотоксичные соединения Hg(CHa)+ и Hg(CH3)2.
Диметилртуть способна накапливаться в флоре и фауне океана. В рыбе концентрация ртути часто оказывается в 1000 раз выше, чем в водах, из которых она выловлена. При употреблении такой рыбы в пищу ртуть попадает в человеческий организм и накапливается в нем, повреждая центральную нервную систему (см. раздел 21.9).
В последнее десятилетие в ряде стран приостановлен лов рыбы в некоторых местах океана, где она оказалась отравленной ртутью.
Общее количество меди, весьма токсичной для всех представителей водной фауны и флоры, достигает в гидросфере 5*1О9 т. Из рек в океаны поступает ежегодно ~3’1(г т и за это время осаждается с донным илом ~ 4*104 т меди. В гидросфере медь входит в состав суспензий и присутствует в виде частиц составов Си(ОН)С1, СиСОз, СиС1+ и (СиОН) .
Воды Мирового океана содержат «41 млн.т соединений свинца, а годовой их вынос с речным стоком в океан составляет 37 тыс.т. В морской воде свинец присутствует в виде суспензий, содержащих PbS04, PbCIF, (РЬОН)гСОз и другие малорастворимые в воде соединения.
К наиболее распространенным токсичным компонентам крупномасштабного загрязнения гидросферы принадлежат соединения одн-ка. Их содержание в водах Мирового океана достигает 6,8*109 т. Годовой вынос соединений цинка с речными водами составляет 740 тыс.т.
Вместе с медью и свинцом цинк занимает первое место среди токсичных элементов по интенсивности поглощения биомассой океана (планктон, водные растения, моллюски, рыбы). Соединения цинка сильно повреждают жабры рыб. Концентрация 15 мг Zn/л смертельна для всех рыб. Токсичность соединений цинка усиливают ионы меди и никеля.
В гидросфере содержится 2«109 т урана при средней концентрации 3,2* 10~3 мг/л. Общий вынос урана с речным стоком оценивается в 19 000 т в год. Основные химические формы нахождения этого элемента в морской воде: [иОг(СОз)з ]4-, UO?+, UO2OH+ и коллоидные частицы, содержащие [UO2(OH)2]x.
Большую опасность для водоемов пресной воды представляет попадание в них с дождевыми стоками азотных и фосфорных удобрений. В таких водоемах начинается бурный рост синезеленых водорослей и цветение воды. Эти процессы вызывают снижение количества растворенного в воде кислорода, гибель рыб, накапли
521
вание органических отложений. Водоем мельчает, превращается в болото и зарастает лесом.
С развитием ядерной энергетики выросло количество радиоактивных отходов. Ежегодно около 7000 т таких отходов погружают в специальных контейнерах в глубины океанов.
С увеличением различных загрязнений в океанах возникают новые биохимические и биологические процессы, уследить за которыми пока наука не в состоянии.
30.3. ЛИТОСФЕРА
Земная кора или литосфера (7 км под океаном и 40 км под континентами) в результате производственной деятельности человека также подвергается необратимым изменениям.
Из земельных кладовых извлекается во все возрастающих количествах минеральное сырье, уголь, нефть, газ и пресная вода. Остаются большие пустоты, полости, частично заполняемые подземными водами и легко подвижным грунтом. Эти полости пролегают в ряде случаев под населенными пунктами и даже городами, представляя для последних потенциальную опасность (обвалы, образование трещин на поверхности земли и т. п.). Иногда образовавшиеся пустоты заполняют отходами производства. Например, в районе г. Соликамска после извлечения карналлита — ценного сырья для производства магния и хлорида калия, отходы производства, в основном хлорид натрия, направляют в пустующие шахты, между тем NaCl может быть использован для выпуска соды и пищевой соли (см. раздел 12.6).
Пока остается неясным: как образовавшиеся пустоты будут влиять на водный режим рек.
Интенсивное развитие промышленности фосфорных удобрений приводит к накоплению больших количеств гипса СаВО4«2НгО, в котором связана вся серная кислота, затраченная на разложение фосфоритов (из 1 т фосфорита образуется 1,4—1,6 т гипса). Гипс разносится подпочвенными водами на большие расстояния, загрязняя почву и воду. Поэтому использование гипса как сырья для производства серной кислоты стало острой необходимостью.
В частности, в Казахстане к 1986 г. отходы фосфорной промышленности, металлургии и тепловых электростанций достигли 5 млрд, т и продолжают расти, превращаясь в источник истощения земель, загрязнения вод и воздуха.
Это только один (среди большого числа других) пример экологического несовершенства существующих химических производств, нерационального использования природного сырья.
В почвах постепенно накапливаются соединения таких токсичных элементов, как ртуть, медь, свинец и цинк, продукты многотоннажных производств цветной металлургии.
С дождями на Землю выпадает за год более 100 000 т соединений ртути, что в 15—20 раз больше ее ежегодной добычи, так как значительная часть соединений ртути попадает в атмосферу при
522
сжигании любого органического топлива и при коксовании угля (см. раздел 30.1). Ртуть прочно фиксируется почвой, образуя комплексы с гуминовыми кислотами, представляющими собой сложную смесь природных высокомолекулярных ароматических соединений, образующихся при разложении отмерших растений. Из почвы ртуть может переходить в растения, а затем и в пищевые продукты (зерно, хлеб, овощи, фрукты). Предельно допустимая концентрация ртути в пищевых продуктах не должна превышать 0,01 мг/кг.
В результате работы металлургических и химических предприятий на поверхность Земли ежегодно поступает до 155 тыс. т различных соединений меди. Содержание меди в почвах составляет в среднем 15—20 мг/кг. Медь является одним из биокатализаторов, необходимых для жизни растений, но при повышенных ее концентрациях (более 60 мг/кг) она становится весьма токсичным веществом для почвенной микрофлоры, вызывает хлороз растений.
С атмосферными осадками ежегодно выпадает на 1 км2 поверхности Земли около 72 кг соединений цинка, гораздо больше, чем соединений свинца и меди. Значительные количества цинка поступают в почву с твердыми отходами тепловых электростанций, работающих на буром угле. В 1981 г. в Японии наблюдалось массовое заболевание населения (поражение костно-мышечной системы), потреблявшего в пищу рис, выращенный на полях, орошаемых водой с повышенным содержанием цинка и кадмия.
Продолжается интенсивное накопление свинца в почвах. В результате работы предприятий цветной металлургии на поверхность Земли ежегодно поступает около 89 тыс.т соединений свинца, а с выхлопными газами до 260 тыс. т свинца в виде аэрозоля (РЬО, PbCh, PbFi, PbS04), 20% которого оседает в непосредственной близости от дорог. Общее поступление соединений свинца в почву достигло в ряде мест 150—350 мг/кг, что вызвало заболевание населения и повреждения ландшафта.
30.4. КРУГОВОРОТЫ АЗОТА, КИСЛОРОДА, УГЛЕРОДА, СЕРЫ И ФОСФОРА В ПРИРОДЕ
Почти все известные элементы не находятся в природе в какой-либо одной химической форме. Они непрерывно циркулируют в больших или меньших масштабах, либо в замкнутых стабильных циклах, либо открытых циклах, например «литосфера — гидросфера — атмосфера — литосфера»; «гидросфера — литосфера», с участием на каждом этапе биосферы. В таких циклах происходит переход элемента из одной химической формы в другую в ряде случаев в результате сложных биохимических процессов.
Стабильность циклического круговорота ряда элементов сейчас нарушена человеческой деятельностью. Наблюдается накопление тех или иных соединений элементов на отдельных этапах циклов с неблагоприятным воздействием их на биосферу.
Биосфера обменивается химическими элементами в виде их различных соединений с окружающей средой и прежде всего с лито
523
сферой (земной корой). С развитием промышленности из недр Земли извлекаются и переносятся в биосферу все возрастающие количества различных неорганических соединений с большим разнообразием элементов. Поток химических элементов в виде их соединений, проходящий в связи с этим через биосферу, крайне велик, порядка 5»108 т в год.
Нынешний химический состав биосферы содержит одних элементов (С, Н, N, Р, Cl, S) значительно больше, чем литосфера, по другим элементам состав биосферы и литосферы почти одинаков (Ru, Ag, Au, Zn и Cd). Остальные элементы содержатся в биосфере
в незначительных количествах.
Для нормального функционирования биосферы необходимо, чтобы концентрация некоторых элементов в воде и продуктах питания была почти постоянной, в пределах 10"6—10'4%, в частности В, I, Си, V, Ni. За этим пределом, при большем или меньшем содержании
некоторых элементов, наблюдаются функциональные расстройства, различные заболевания, появляются уроды в потомстве и возрастает возможность гибели отдельных видов фауны и флоры.
Ниже рассматривается круговорот наиболее важных для биосферы
элементов.
Круговорот азота. Атмосфера служит основным резервом для круговорота азота. В гидросфере содержание азота составляет примерно 5*1 О*5 моль/л, а в литосфере — исчезающе малые количества. Азот исключительно важен для биосферы. Белки животных организмов содержат до 17% азота. Постоянная смена химических форм азота является источником жизни многих организмов.
Из атмосферы вместе с осадками азот попадает в почву в виде NH4NO3 и HNO3 в результате реакций: N2+O2=2NO (действие атмосферных электрических разрядов); N0+0,502=N02; 2NO2+H2O-K),5O2=2HNO3; HNO3+NH3»NH4NO3. Таким путем в почву ежегодно вносится около 15 кг/га азота. Кроме того, азот захватывается азотфиксирующими бактериями (от 10 до 350 кг/га в год).
Накопленные в почве запасы связанного азота служат источником питания высших растений, с которыми связанный азот поступает в организмы животных. Растения и животные, отмирая, дают начало органическим соединениям азота, в основном аминокислотам. Эти
соединения затем превращаются в соли аммония, а последние — в нитраты, реже в нитриты, снова усваиваемые растениями. Так, цикл движения азота в биосфере замыкается.
Часть азота в почвах может восстанавливаться до молекулярного, с переходом последнего в атмосферу. Часть растворимых соединений азота вымывается из почв дождями и грунтовыми водами и попадает в водоемы, ускоряя рост водорослей и цветение воды.
Деятельность человека нарушила установившееся равновесие в распределении азота на Земле. В балансе фиксируемого азота все большее значение приобретает искусственно синтезируемый аммиак, количество которого удваивается каждые 5—6 лет. Значительные количества аммиака выделяются также из почв сельскохозяйственных угодий из-за широкого использования азотных удобрений (до
524
200 млн. т в год). В атмосфере аммиак окисляется, превращаясь в оксиды азота. Такое же количество оксидов азота образуется при полетах самолетов.
Круговорот азота в природе определяется скоростями процессов фиксации и денитрофиксации (выделение азота в атмосферу). При разбалансе этих скоростей азотная атмосфера Земли может исчезнуть всего за несколько десятков миллионов лет.
Круговорот кислорода. Кислород — важнейший компонент жизненных и энергетических процессов. Основной потребитель кислорода в природе — флора и фауна. Подсчитано, что весь кислород атмосферы проходит через земные живые организмы, включая человека, примерно за 10 лет. В настоящее время потребление кислорода на Земле приблизилось к уровню его воспроизводства в естественных биохимических циклах.
Важнейшими источниками кислорода в неживой природе являются СОг и НгО. Часть кислорода образуется в стратосфере в результате диссоциации НгО(Г) под действием солнечного излучения:
НгО(г) = 2Н+0,5Ог; Н2О = Н+ОН; 2ОН=Ог+2Н
Другая часть кислорода выделяется зелеными растениями и фитопланктоном океанов и морей в процессе фотосинтеза из НгО и СОх Например, один гектар леса ежегодно производит около 45 000 м кислорода.
Атмосферный кислород расходуется в громадных количествах в реакциях горения разных видов топлива, в процессе дыхания живых организмов, в окислительных процессах выветривания горных пород: 2CuFeS2+6O2=Cu2O+Fe2O3+4SO2 f Sb2S3+4,5O2=Sb2O3+3SO2t и др.
Без кислорода невозможно осуществление металлургических процессов:
2С+Ог=2СО1 ; Fe2O3+3CO=2Fe+3CO2t; ZnS+l,5O2=ZnO+SO2 и др.
Расходуется кислород и на непрерывное пополнение озона в стратосфере, на окисление в озоновом слое СО и SO2:
СО+0,5О2=СО2; SO2+B,5O2=SO3
Подсчитано, что автомобильный транспорт Земли сжигает ежегодно около 1 млрд, т кислорода, выбрасывая в атмосферу до 115 млн. т СО, более 1 млн. т SO2. Эти цифры с каждым годом растут. В воздухе больших городов в часы «пик» содержание кислорода уменьшается настолько, что оно соответствует высоте 5000 м над уровнем моря.
Значительные количества кислорода растворяются в гидросфере до концентрации примерно 1«10~5% и расходуются на различные окислительные процессы. Когда концентрация растворенного кислорода и нитратов сильно снижается, некоторые виды бактерий начинают получать необходимый им кислород за счет восстановления
525
sol'ионов до HzS и тем самым создают в водоемах безжизненные зоны.
Круговорот углерода. В круговороте углерода основную роль играет СОг. Основными хранилищами этого вещества являются: гидросфера (~1,3»1014 т), атмосфера (~2,3»1012 т) и биосфера (~ 2,0* 1012 т углерода). Ежегодное атмосферу поступает ~5,6в101Г>т СОг, а в гидросферу — примерно 2»1016 т.
Брожение и минерализация органических веществ, а также дыхание наземных и водных растительных организмов дают около .56% поступающего в атмосферу СОг, жизнедеятельность почвенных микроорганизмов — около 38%, а дыхание животных и людей — всего 1,6%. Промышленные выбросы СОг в атмосферу составляют ~ 5«109 т в год, из них 50% остается в атмосфере, а остальная часть попадает в процессе фотосинтеза в биосферу и поглощается гидросферой.
Из атмосферы СОг (-30%) адсорбируется гидросферой, причем в больших количествах в холодных частях Мирового океана. Гидросфера действует как насос, перекачивающий СОг из холодных регионов в теплые, где СОг частично вновь выделяется в атмосферу. Примерно 1011 т СОг находится в непрерывном круговороте между атмосферой и океаном.
Диоксид углерода участвует в реакциях, протекающих в гидросфере:
СОг+НгО-- - * НгСОзН++НСОз
В обычных условиях pH океанов не выходит из пределов 7,0*8,5. Для этой области значений pH более 80% углерода будет находиться в виде НСОз-ионов. В такой форме углерод легко усваивается организмами, живущими в водной среде. Если концентрация ОН--ионов возрастает (рН>10), то протекает реакция
НСОз+ОН' HzO+COi"
вызывающая осаждение карбонатов и основных карбонатов. С этого момента наблюдается массовый уход свободно плавающих организмов, прекращение жизни в воде данного района. Понижение pH ниже 6,0 в водах океанов пока не наблюдалось. В кислой среде начались бы реакции
НСОз+Н+ г=± НгСОз НгО+СОг t
приводящие к выделению СОг в атмосферу, к изменению климата на всей планете.
Диоксид углерода атмосферы расходуется также на процесс выветривания горных пород, превращая последние сначала в средние, а затем в гидрокарбонаты, которые вымываются водой и накапливаются в океане. Например, при выветривании полевых шпатов, в частности анортита, образуется гидрокарбонат кальция:
Са (AlzSizOe) +CO2“CaCO3+A12O3+2SiO2
526
СаСОз+СО2+Н2О=Са(НСОз)2
Общее количество СОг, связываемое ежегодно при выветривании горных пород, достигает 2 млрд, т углерода.
В процессах дыхания из атмосферы постоянно извлекается кислород, а возвращается СОг. Растения извлекают в процессе фотосинтеза из атмосферы и гидросферы около 150 млрд, т углерода в год в виде СОг и выделяют одновременно 110 млрд, т кислорода.
Вырубка лесных массивов, сжигание топлив, обжиг кальцита и других карбонатов приводят к накоплению в атмосфере СОг в больших количествах, чем поглощается это вещество в процессе фотосинтеза.
Таким образом, замкнутого цикла в круговороте СОг в наше время не наблюдается.
Круговорот фосфора в природе. Круговорот фосфора проще, чем круговорот азота, кислорода и углерода. Он ограничен лишь гидросферой и литосферой. Циркуляция фосфора зависит от его запасов в горных породах и донных отложениях океанов. Гидросфера — конечный пункт одностороннего движения фосфора: из почв в воды океанов и их донные отложения.
Естественные химические формы фосфора в гидросфере: РО|~, НРОд- , Н2РО4. Среди этих форм преобладают ионы НРО1 (90%), лучше всего усваиваемые растительным и животным миром. В живых организмах растворимые фосфаты превращаются в аденозинтрифосфат: С5К5Н4»С5О(ОН)2вН4»НгРО4в(НРОз)2, при помощи которого запасается энергия в биологических клетках. (Аденозинтрифосфат — универсальный аккумулятор энергии, ее источник для самых различных процессов в живой природе.)
После отмирания живых организмов и растений органические соединения, содержащие фосфор, попадают обратно в почву, где они распадаются с образованием в конечном счете фосфатов, возвращающихся в гидросферу, в придонные осадки, где и заканчивается миграция фосфора.
С увеличением производства и применения удобрений круговорот фосфора ускоряется. Ежегодно урожаи всего мира и неполное усвоение удобрений уносят с полей свыше 10 млн. т фосфора, который затем попадает в гидросферу. Поэтому многие водные системы быстро становятся насыщенными по фосфатам, выделяя их избыток в донные отложения.
Круговорот серы. В круговороте серы в природе участвуют несколько ее соединений: SO2, H2SO4, H2S, сульфаты и, отчасти, свободная сера.
В атмосферу сера попадает в виде SO2 и H2S, которые окисляются до H2SO4. Серная кислота частично выпадает на землю с осадками («кислотные дожди»), частично взаимодействует с аммиаком с образованием аэрозоля (NH4)2SO4. В почвах кислота тотчас же вступает во взаимодействие с карбонатами:
СаСОз + H2SO4 = CaSO4 + СО21 + Н2О
527
Значительная часть образовавшихся сульфатов уносится почвенными водами в реки, затем в океаны и накапливается в донных отложениях в виде гипса.
Часть сульфатов извлекается из почвы растениями и превращается в белки, содержащие серу, которые усваиваются затем животными. После отмирания растений и животных их белковые вещества разлагаются, и сера выделяется в виде сероводорода, включающегося снова в круговорот. Главную роль в поступлении серы из биосферы играет диметилсульфид (СНз)2$.
Сера появляется в почвах и гидросфере под воздействием серобактерий, получающих необходимую для их жизни энергию за счет экзотермической реакции:
2H2S + Ог “ 2НгО + 2S| ; ДЯ°(298 К) — 530 кДж
Выделяемая сера откладывается в телах серобактерий, достигая 95% от их общей массы. Сера погибших бактерий окисляется кислородом воздуха до серной кислоты:
2S + ЗОг + 2НгО = H2SO4; АЯ °(298 К) — 1050 кДж
Серобактерии играют положительную роль в жизни живой природы, снижая концентрацию H2S в почвах и гидросфере.
Цикл серы в окружающей среде лишь частично балансируется выделением H2S из океанов в атмосферу (около 15 млн. т в год). Основная часть серы, как и фосфора, накапливается постепенно в донных отложениях океанов в виде малорастворимых сульфатов металлов.
В заключение следует заметить, что в связи с резко возросшей химической нагрузкой на биосферу химик-неорганик, инженер или исследователь не может в своей творческой деятельности оставлять без внимания окружающую среду. Новые технологические процессы не должны разрушать биосферу.
Упражнения к главе 30
1. Как влияет на биосферу содержание СО в атмосфере?
2. Как протекает круговорот серы в природе?
3. Какие наиболее опасные загрязнения гидросферы вы знаете? Перечислите источники этих загрязнений.
4. Как происходит круговорот кислорода в природе?
5. Какова роль озона в атмосфере?
6. Как происходит круговорот азота в природе?
7. Как влияет развитие химической промышленности иа состояние литосферы?
8. Много ли на Земле пресной воды? Где находятся основные ее источники?
9. Как влияет на биосферу увеличивающееся содержание СО2 в атмосфере?
10. Какое значение для биосферы имеет оз. Байкал?
11. Как происходит круговорот углерода в природе?
12. Какие наиболее опасные загрязнения атмосферы вам известны? Основные источники поступлений этих загрязнений в атмосферу.
13. Как протекает круговорот фосфора в природе?
Часть третья ПОСЛЕСЛОВИЕ
Химик без знания физики подобен человеку, который всего искать должен ощупом. И сии две науки так соединены между собой, что одна без другой в совершенстве быть не могут.
М В. Ломоносов
В первых двух частях книги рассматривалась неорганическая химия без излишних подробностей, наряду с явлениями простыми и ясными мы встречали и такие, которые для восприятия требуют дополнительных знаний.
Классическое изложение неорганической химии дает лишь узкое представление о богатом ее содержании. Имеется огромное число экспериментальных данных, множество химических реакций, требующих для их объяснения самые различные теории. В этой части отобраны и кратко изложены теории, с помощью которых студенты могут полнее представить себе все многообразие химических явлений и найти причины, их вызывающие.
ГЛАВА 31. АТОМНЫЕ СПЕКТРЫ
Атомным спектром называют совокупность спектральных линий или полос, интенсивность которых зависит от длины волны электромагнитного излучения свободных или слабо взаимодействующих атомов.
Атомные спектры можно поделить на две большие группы: о п-тические спектры и рентгеновские спектры.
Рентген Вильгельм (1845—1923) — немецкий профессор физики. Известен своими работами в области кристаллофизики, открыл в 1895 г. особый вид электромагнитного излучения, названного впоследствии его именем, лауреат Нобелевской премии.
31.1. ОПТИЧЕСКИЕ СПЕКТРЫ
Оптические спектры связаны с излучением свободных атомов вещества, находящегося в газообразном состоянии. Атомы испускают электромагнитное излучение только тогда, когда они возбуждены, т. е. когда »их электроны перешли с уровней меньших значений энергии на свободные уровни более высоких значений энергии. В возбужденном состоянии атомы существуют в течение очень короткого времени, порядка 10'°—10'7 с, после чего их электроны снова возвращаются в основное исходное состояние, излучая поглощенную энергию в виде квантов энергии, фотонов. Излучение, проходя преломляющую среду, дает линейчатый оптический спектр (рис. 101). Были измерены длины волн спектральных линий в спектрах атомов многих элементов. В 1885 г. Бальмер установил, что длины волн, соответствующие определенным линиям в спектре атомов водорода, можно выразить через ряд целых чисел.
Бальмер Иоганн Якоб (1825—1898) — швейцарский физик и математик.
Предложенное им уравнение было впоследствии модифицировано Ридбергом и известно сейчас как уравнение Бальмера — Ридберга:
Голубая
Красная
nt = 3
Граница серии
Рис. 101. Спектр атомарного водорода. Серия линий Бальмера
i i
2 nt nj
(31.1)
где v — волновое число, см *; Л — длина волны, см; 7?н — постоянная Ридберга для атома водорода» равная 109677,6 см-1; щ и иу — целые числа, причем во всех случаях иу > щ. Если, например, п/ж 2, то пу=3, 4, 5, 6, ...»
Каждой спектральной линии отвечает своя разность - -у, т. е.
•и Щ положение каждой спектральной линии (соответствующая длина
волны или волновое число) в спектре можно определить йз уравнения 31.1. Из этого уравнения видно, что по мере увеличения иу разность между значения v соседних линий уменьшается и при иу - оо мы получаем постоянное значение v = 7?н -4*. Спектральные линии по-
степенно сближаются (см. рис. 101), стремясь к пределу серии v = /?н Л, ультрафиолетовой ее границе. За ультрафиолетовой гра-и,
ницей серии наблюдается уже непрерывное излучение, сплошной оптический спектр, отвечающий свободным электронам, покинув
шим свои атомы.
Оптический спектр излучения атомарного водорода в соответствий с уравнением 31.1 можно разделить на несколько серий спектральных линий: серию Лаймана (л,= 1) — ультрафиолетовая область спектра, серию Бальмера (л/ = 2) — видимая область спектра, серию Пашена (и/ “ 3), серию Брэккетта (и/ “ 4), серию Пфунда (л; =5) и серию Хэмфри (щ = 6). Последние четыре серии спектральных линий лежат в инфракрасной области спектра.
Для каждой серии спектральных линий щ имеет строго постоянное значение, a nj принимает ряд целых чисел, начинающихся с числа на единицу большего, чем число щ. Например, для серии Пашена и/ = 3, а иу=4, 5, 6, ..., Каждая серия имеет свою границу, в частности, границей серии Пашена будет значение v = АнЛ.
з
Вводя обозначения 7'(л/) = ~ и Г(лу) = можно уравнение п, nf
(31.1) записать в виде разности двух функций целых чисел:
v= Т(щ) - T(nj).
(31.2)
Функции Т(и/) и Т(лу) получили название спектральных т е р м о в или просто термов. Таким образом, волновое число для любой спектральной линии оптического спектра может быть представлено в виде разности двух термов.
Энергия квантов излучения при переходе электронов с более высокого Ег энергетического уровня на низкий Е1 равна
ДЕ - Ег - Ei - hv ~ hj = hcv или
”i)
(31.3)
531
Серия Бальмера
Ех = -1312
£2=-328
Серия Пашена _J_LI__^3=-146
Рис. 102. Переходы между энергетическими уровнями атомарного водорода
Серия Лаймана
Следовательно, каждый терм характеризует определенный энергетический уровень: Т{щ) Переход электронов с одного
уровня энергии на другой и вызывает появление в оптическом спектре соответствующей спектральной линии (рис. 102). Спектральные термы отвечают определенному набору уровней энергии, характеризующих данный атом.
Анализ оптических спектров показывает, что электрон в атоме не может иметь какую-либо «промежуточную» энергию между энергетическими уровнями Е2 и Ei. Все значения энергии между Е2 и Ei для электрона запрещены. Электрон может только переходить с уровня Е2 на Ei или наоборот, испуская или поглощая квант энергии hv строго определенного значения, отвечающего разности Е2 - Ei “ Де.
Из рис. 102 видно, что относительно небольшому числу уровней энергии отвечает значительное число переходов электронов (отмечены стрелками) и равное им число спектральных линий в сериях. Число таких переходов в атоме водорода равно 0,5п(п -- 1), где п — число энерегетических уровней (и — главное квантовое число). В многоэлектронных атомах не все переходы электронов разрешены. Например, в атоме лития нет переходов между уровнями 3s и 2s, Зр и 2р и т. п. Существуют специальные правила отбора разрешенных переходов, которые в этом учебнике не рассматриваются.
Если энергия, сообщенная атому, меньше значения Ег ~ Е\ = = hV, то излучение не происходит, соответствующая спектральная линия в спектре не появляется. Когда энергия, полученная атомом, равна или больше энергии его ионизации, то из атома выделяется
532
свободный электрон и образуется однократно ионизованный атом, появляются две частицы, полностью изолированные друг от друга.
Возникновение оптических спектров не только подтвердило дискретную природу энергетических состояний электронов в атомах, но и позволило разработать спектральные методы качественного и количественного определения примесей одних веществ в других веществах: атомно-абсорбционный, пламенно-фотометрический, лазерный атомно-ионизационный, оптический эмиссионный спектральный анализ. Качественный спектральный анализ основан на обнаружении в оптическом спектре характерных для данного элемента спектральных линий при помощи точного определения длин волн этих линий.
У каждого элемента есть свои наиболее интенсивные спектральные линии, которые по мере уменьшения концентрации соединения, содержащего этот элемент, исчезают из спектра последними.
Например, у натрия это линия с длиной волны 588,9 нм, окрашивающая пламя газовой горелки в желтый цвет, у лития — линия с длиной волны 670,8 нм малиново-красного цвета, у бария — линия 535,5 нм зеленого цвета.
Подробнее см.: Петерс Д., Хайес Дж, Хифтье Г. Химическое разделение и измерение. — М.: Химия, 1978. Кн. 2. С. 677.
31.2. РЕНТГЕНОВСКИЕ СПЕКТРЫ
По своей природе рентгеновское излучение тождественно со светом и отличается от него только тем, что имеет меньшие длины волн, порядка 10—100 пм.
Рентгеновское излучение возникает в результате столкновения электронов, летящих с большими скоростями, с веществом анода рентгеновской трубки (рис. 103). При ударе о вещество анода электроны тормозятся, часть их энергии Ео расходуется на взаимодействие с веществом анода, а остальная часть кинетической энергии
Рис. 103. Схема установки по получению рентгеновских спектров: а — рентгеновская трубка: 1 — система охлаждения анода; 2 — анод; 3 — исследуемое вещество; 4 — бериллиевая фольга или литий-бериллиевое стекло; 5 — катод; б — схема установки: 1 — рентгеновская трубка; 2 — устройство для создания пучка параллельных рентгеновских лучей (коллиматор); 3 — кристалл; 4 — лучевой канал; 5 — фильтр (никелевая фольга); 6 — приемник рентгеновских лучей
533
Рис. 104. Типичный рентгеновский спектр молибденового анода:
1 — сплошной спектр; 2 — характеристи-
ческий спектр Мо
Превращается в фотоны, в энергию рентгеновского электромагнит-2
ного излучения Е = hcv “ + Ео. Полученный в приемнике рент-
геновского излучения рентгеновский спектр бывает двух видов: сплошной и линейчатый или характеристический (рис. 104). Сплошной спектр не зависит от природы вещества анода и определяется только напряжением на электродах рентгеновской трубки. Этот вид спектра -возникает, когда энергия электронов, падающих на вещество анода, недостаточна, чтобы выбить из последнего электроны.
При высоком напряжении на электродах рентгеновской трубки (порядка 25—40 кВ) на сплошной спектр накладывается линейчатый (рис. 104). Его появление вызвано удалением из вещества анода электронов с низких энергетических уровней атомов вещества за их пределы. Такие атомы находятся в возбужденном1 состоянии очень непродолжительное время и через 10 ' с возвращаются в исходное состояние, при этом электроны с более высоких уровней энергии переходят на освободившиеся уровни с испусканием квантов энергии.
Линейчатый рентгеновский спектр характеризует вещество анода в такой же степени, в какой оптический спектр испускания характерен для газообразного состояния любого вещества. Каждый элемент дает только присущий ему рентгеновский спектр независимо от того, находится этот элемент в виде простого вещества или входит в состав сложного химического соединения. Этим рентгеновские спектры существенно отличаются от оптических, состав которых различен для атомарного и молекулярного состояния вещества.
Рентгеновские спектры более просты, чем оптические, содержат небольшое число спектральных линий, в то время как оптические состоят из сотен и даже тысяч спектральных линий, например спектр железа.
534
Рис. 105. Рассеивание рентгеновских лучей от плоскости кристаллической решетки
Различие оптических и рентгеновских спектров вызвано тем, что появление оптических спектров связано с перемещением между энергетическими уровнями периферических, в том числе и валентных, электронов атомов, а рентгеновские — с движением электронов между разрешенными дискретными энергетическими уровнями во внутренних частях атомов, вблизи их ядер. Поэтому для любого элемента значение v линий рентгеновского спектра больше значений v линий оптического спектра.
По рассеиванию узкого пучка рентгеновских лучей, падающих на небольшой монокристалл NaCl, CaFi или SiOi (см. рис. 103), можно вычислить длину волны каждой линии рентгеновского спектра и, наоборот, используя рентгеновское излучение известной длины волны, определить расстояния между плоскостями кристаллической решетки (см. раздел б.З) и тип кристаллической структуры вещества.
Пусть узкий пучок рентгеновского излучения падает на плоскость кристаллической решетки под углом 0 (рис. 105) и два луча I и 2 рассеиваются двумя частицами кристалла А и В. Луч 2 совершает более длинный путь, чем луч 1. Разность хода двух лучей равна СВ + BD. Когда разность хода окажется равной длине волны л или целому числу длин волн пЛ, то волны будут в результате интерференции усиливать друг друга и на фотопластинке приемника излучения (см. рис. 103) появятся яркие дифракционные пятна. Иначе СВ + BD = нА, СВ = dsind, BD = cZsinfi Откуда
пА= 2cZsin0, (31.4)
где d — расстояние между плоскостями кристаллической решетки. Уравнение 31.4 известно как уравнение Брэгга — Вульфа.
Брэгг Уильям Лоуренс (1890—1971) — английский профессор физики, один из основоположников рентгеноструктурного анализа, лауреат Нобелевской премии.
Вульф Георгий Викторович (1863 — 1925) — русский кристап-лограф-физик, чпен-корреспондент Российской АН.
535
В уравнении 31.4 угол 0 — угол, при котором наблюдается дифракция рентгеновского излучения с длиной волны Л, а и — целые числа — 1, 2, 3, 4, указывающие порядок дифракционных максимумов. Рассеяние рентгеновского излучения, попадающего в кристалл, вызвано электронами атомов кристалла. Интенсивность дифракционных максимумов рассеяния зависит от электронной плотности у атомов тех кристаллических плоскостей, на которых происходит рассеяние рентгеновского излучения. Наблюдение дифракционных максимумов различного порядка позволяет определить структуру кристаллического вещества, в частности расстояние d между плоскостями кристаллической решетки, если известна длина волны рентгеновского излучения.
Характеристический рентгеновский спектр состоит обычно из двух серий: коротковолновой, известной под названием Х-серии, и более длинноволновой, известной как L-серия. У элементов с большой атомной массой (Z>66) обнаружены две другие серии линий: Af-серия и /V-серия.
Наиболее простой является Х-серия. Она состоит из трех линий: Ка, Кр и Ку. Линия Ка самая яркая и самая длинноволновая в этой серии.
Наличие дискретных энергетических уровней в атоме объясняет особенности рентгеновских спектров. Они возникают в тех случаях, когда из атомов удаляются электроны с Is-, 2s-, 2р-АО и других, близких к ядру АО, а на их место спонтанно переходят электроны с более далеких АО (рис. 106). В частности, спектральные линии К-серии появятся в спектре тех атомов, в которых электроны переходят из 2s-, 2р- и других АО на вакантную 1s-АО. Спектральные линии /,-серии появятся в спектре тех атомов, в которых электроны
(X)
(ДО
2р
я
3d
4s
Зр
3s
К
Е
2s
(X) Is
Рис. 106. Упрощенная схема энергетических переходов в атоме, вызывающих появление спектральных линий в рентгеновских спектрах
536
Рис. 107. Зависимость волновых чисел линий рентгеновского спектра от порядкового номера элемента:
/ — электронные переходы на Is-AO (Ка); 2 — электронные переходы на Is-AO (La, LB)
переходят непосредственно с 3 s-, Зр-, 3cZ- и других АО на вакантную 2s-AO.
Интенсивность спектральных линий будет пропорциональна числу атомов, в которых совершаются подобные переходы. Линии Ка, например, являются наиболее интенсивными, так как вероятность того, что электроны перейдут с 2s-АО на 1s-АО значительно больше, чем вероятность того, что электроны перейдут непосредственно с 3s-AO на Is-AO. Вероятность того, что электроны сразу перейдут с 4s-АО на Is-AO, очень мала.
Изучение рентгеновских спектров простых веществ позволило выяснить физический смысл порядкового номера элемента.
В 1913 г. Ван-ден-Брук пришел к выводу о связи значения порядкового номера элемента с зарядом ядер его атомов:
; Если все элементы расположить в порядке возрастания атомных весов, то номер каждого элемента в таком ряду будет равен его § внутриатомному заряду.
Эту гипотезу Ван-ден-Брука подтвердил экспериментально Мозли, который исследовал рентгеновские спектры элементов от A1(Z= 13) до Au(Z = 79).
Мозли обнаружил, что для всех исследованных им простых веществ характер каждой серии рентгеновских спектральных линий практически одинаков, например, волновые числа возрастают прямо пропорционально для Ад-линии при переходе от одного элемента к другому с увеличением порядкового номера (рис. 107).
График, приведенный на рис. 107, известен под названием диаграммы Мозли. Уравнение прямой линии на диаграмме определяется выражением
V~v = a(Z-/>), (31.5)
где v — волновое число, v =1А, см-"1; Z — порядковый номер элемента; а и b — постоянные.
Уравнение 31.5 является математическим выражением закона Мозли:
ч Между квадратным корнем из волнового числа и порядковым | номером элемента существует линейная зависимость.
Изучение рентгеновских спектров показало, что все без исключения элементы со значением Z>13 в своих спектрах содержат Ка, La и другие линии, следовательно, у всех этих элементов есть заполненные электронами Is-, 2s- и другие АО и существует одинаковая последовательность энергетических уровней.
Значения порядкового номера Z, найденные из уравнения (31.5),
537
позволяют однозначно расположить химические элементы в периодической системе Д. И. Менделеева, совершенно бесспорно указать положение также и таких элементов, для которых этого прежде сделать не удавалось.
После работ Ван-ден-Брука и Мозли порядковые номера или заряды ядер стали атомными константами, не обладающими периодическим характером.
ГЛАВА 32. СТАЦИОНАРНОЕ, НЕ ЗАВИСЯЩЕЕ ОТ ВРЕМЕНИ УРАВНЕНИЕ ШРЕДИНГЕРА
Уравнение Шредингера, как и основные законы термодинамики, нельзя вывести из каких-либо общих физических принципов. Ниже рассмотрен один из приемов подхода к получению этого уравнения.
32.1. ВОЛНОВАЯ ФУНКЦИЯ
Электрон обладает двойственной природой. Ему присущи как волновые, так и корпускулярные свойства. Если электрон считать частицей с массой т, движущейся в постоянном, не зависящем от времени внешнем поле вдоль оси х, то такая система поле — частица удовлетворяет закону сохранения энергии:
Е = Еп + Ек,
где Е — полная энергия электрона, Еп и Ек — его потенциальная-и кинетическая энергии соответственно.
Импульс электрона р = mv связан с его кинетической энергией 1 2 о2
Ек соотношением: Ек - = 2m ’ Отсюда значение импульса
вдоль оси х:
р? = 2т(Е-Еп). (32.1)
Шредингер предположил, что волновые свойства электрона в атоме можно описать уравнением стоячих волн или плоских колебаний струны, закрепленной на ее концах (рис. 108). Длина волны колебаний струны связана с длиной I самой струны целым числом п: А - ^1, где и = 1, 2, 3, ... Это уравнение говорит о том, что при заданном расстоянии между точками закрепления струны возможны стоячие волны лишь со строго определенными длинами волн. Известно, что колебания закрепленной на концах струны вызывают
538
стоячие волны, одна волна накладывается на другую, бегущую в противоположном направлении, в результате мы наблюдаем неподвижную волну, хотя смещение суммарной волны будет происходить непрерывно.
Граничными условиями, накладываемыми на колебания струны, являются закрепленные ее концы. В этих точках (узлах) смещение струны равно нулю. Таким образом, из-за наличия граничных условий колебания струны квантуются, т. е. могут происходить только определенные колебания.
Значения амплитуды чр откло
Рис. 108. Колебания струны, закрепленной на ее концах (у — амплитуда колебаний)
нения точек струны от координаты
х (см. рис. 108) колеблющейся струны описываются уравнением
фх - A sin -j-jc,
(32.2)
где х — координата точки на оси, вдоль которой происходит волновое движение с длиной волны Л
В уравнении (32.2) начало отсчета по оси х выбрано так, что оно совпадает с одним из узлов волны. Относительная амплитуда волны чрх в точке х определяется уравнением (32.2). Величина, обозначенная греческой буквой «пси» Чрх, получила название волновой функции. Так как максимальное положительное значение величины sin ^-х « 1 (тригонометрическая функция синус изменяется от 0 до 1), то при sin^-x = 1 фх’-А, где А — максимальное значение амплитуды колебаний.
Подробнее см.: Купер Л. Физика для всех. — М.: Мир, 1973. Т. 1.
С. 234; Суорц Кл Э. Необыкновенная физика обыкновенных явлений. — М.: Наука, 1987. Т. 2. С. 42; а также учебники физики для средней школы.
Взяв вторую производную по х от обеих частей уравнения (32.2), получим дифференциальное уравнение для одномерной волновой функции:
d2tf 4л2 Л .2л d2 у 4л2 I, /ЯЭ Я)
—Т’-------л-sm или -Д - - V'-
d х л ах А
Чтобы получить уравнение, объединяющее и волновые, и корпускулярные свойства электрона, в уравнение (32.3) подставим уравнение де Бройля: —= —
ZW рх
539
2 2
(32.4) dx2 ft2
Чтобы это уравнение определяло энергетические характеристики электрона, вместо импульса рх введем соотношение 32.1:
2 2 2
- ^2т (JE-Еп)1р = - ^(Е-Еп)1р. (32.5) dx Л Л
Уравнение (32.5) и есть уравнение Шредингера для одномерного (по одной координате) движения электрона в потенциальном поле.
Для трехмерного пространства функции 1р будет функцией трех декартовых координат и в этом случае полные производные заменяют частными производными:
2 2 2 2
+ _ ьт Е у (32.6)
dx2 ду dz п
Уравнение (32.6) можно упростить введением оператора Лапласа Д или векторного оператора «набла» V2:
„ а2 а2 а2 Д = \72= Д.+ Д-.
дх2 ду2 dz2
Тогда уравнение Шредингера можно представить следующим образом:
V2 V» + ~ " £n)V* = °- <32-7>
й
Операторы — символы математических операций, которые должны быть выполнены над некоторой функцией для того, чтобы получить новую функцию. Запись Ырх = <рх означает, что оператор L действует на функцию трх, превращая последнюю в функцию d а2
<рх. Простыми операторами являются sin, 1g, £-, —- — тригономет-dx2
ричсские и логарифмические операторы, дифференцирование по х, вторая частная производная. Например, (х2) = 2х, sin 30° = 0,5; IglOO = 2.
л Оператор Ьназывдют л^ейным,£сли он удовлетворяет условиям: Ц1р1 + fpi) = Llfti + Llp2; Hdty) = гДе а — некоторое число. Теория линейных операторов является одной из основных частей математического аппарата квантовой механики.
Подробнее см.: Цюлике Л. Квантовая химия. — М.: Мир, 1976. Т. 1.
С. 119; Тарасов Л. В. Основы квантовой механики. — М.: Высшая школа, 1978. С. 179.
Основное уравнение теории линейных операторов имеет вид: ^1лр = fap. Числа Л, при которых это уравнение имеет конечные {решения, образуют спектр собственных значений оператора L, а сгами числа Л, которые могут быть и комплексными, т. е. включать
:540
мнимую^единицу iz - - 1, называют собственными значениями оператора L, функция же Ар будет собственной функцией оператора.
С использованием" оператора энергии (гамильтониана) Н уравнение (32.7) можно записать в более компактном виде:
Еф, (32.8)
2 2 2 2 \
z+4+4 + £п.
8л т [дГ. dy dz J
Поскольку Н является оператором, сокращать 1р в обеих частях уравнения 32.8 бессмысленно.
Так как все сведения о поведении электрона в атоме передает функция 1р, то на нее накладываются математические ограничения: в бесконечности значение 1р равно нулю, она должна быть непрерывной и однозначной в любой точке пространства.
Уравнение Шредингера основано на нескольких допущениях. Во-первых, электроны не рождаются и не исчезают (электроны имеют конечную массу покоя), число электронов в любом физическом процессе остается постоянным. Однако испускание и поглощение фотонов возможно, фотон может возникать и исчезать. Во-вторых, электроны, как частицы с массой покоя, движутся с сравнительно малыми скоростями и поэтому их можно описывать нерелятивистским образом.
32.2. РЕШЕНИЕ УРАВНЕНИЯ ШРЕДИНГЕРА ДЛЯ
АТОМА ВОДОРОДА
Решение уравнения Шредингера даже для атома водорода, содержащего всего один электрон, является довольно сложной задачей.
Ниже изложен лишь подход к решению этого уравнения для одноэлектронной системы, позволяющий понять появление квантовых чисел и дискретных уровней энергии электрона в атоме водорода.
Подробнее см.: Фок В. А. Начала квантовой механики. — М.: Наука, 1976; Ландау Л. Д, Лифшиц Е. М. Квантовая механика. — М.: Наука, 1975; Блохинцев А. И. Основы квантовой механики. — М.: Наукам 1976.
2
В связи с тем, что значение Еп = - — зависит только от
’ 4л«о г
расстояния г между взаимодействующими частицами (потенциальная энергия сферически симметрична), целесообразно перейти от декартовых координат к сферическим (см. рис. 2). Можно ожидать, что при фиксированном положении протона в начале координат, на расстоянии г от него, т. е. на поверхности сферы радиусом г, электронная плотность однородна. Кроме того, переход к сферическим координатам позволяет при решении уравнения (32.7) разделить переменные.
Сферические координаты связаны с декартовыми следующими соотношениями:
541
х - r sin 6 • cos <р\ у - r sin 6 • sin <pi z — r cos &, r2 - x2 + y2 + z2; dx*dy*dz - r2dr sin ftifidy?и dv,
(32.9)
где dv — элемент объема.
Заменяя x, у и z в уравнении (32.7) их значениями из уравнений (32.9), получим волновое уравнение для атома водорода в сферических координатах:
I . +
r2sin20 5у>2
I гsing
2
+ ~\Е- £п)^= 0.
(32.10)
Это уравнение разделяется на три более простых, если представить функцию как произведение трех функций, каждая из которых зависит только от одной переменной:
tyj-Qp) = R(r) »Q0) -CtyT). (32.11)
Ради простоты функции Л (г), <Э{0) и обозначим R, 0 и Ф. Дифференцирование уравнения (32.11) дает:
^=-^ОФ, 1=^лфи ^=-^R0
дГ дГ w ои о<р о<р
После подстановки этих значений частных производных в уравнение (32.10) получим:
_ 1 а2Ф г2 sin2 6 д<рг
rQ+
-Т2—— (sine г s\nf) д0 '
.^7?Ф)
+ £п)Я0Ф= 0.
й
2 2q
Умножение этого уравнения на г ~— - приведет к уравнению ДвФ
sin2 е а / 2 ад \ sing а д дг v вг) + е аб
sing-^
8л2 nv sin2 в , с „ 1 а2 Ф
------2-----(Е - Еп) = - ф , П-----------др
(32.12)
Левая часть равенства содержит величины, зависящие от переменных г и 6, а правая — только от <р. Но обе части уравнения (32.12), зависящие от разных переменных, могут быть равны друг другу только в том случае, если значения этих частей равны некоторому постоянному числу т}. Тогда
1 а2Ф 2 а2Ф
----r-= - mt или —т-= - тгФ.
Ф dtp
(32.13)
542
Решением уравнения (32.13) будет: Фу?) = Ле±1Л1/$₽, где i — мнимая единица, а А — константа.
Из рис. 2 видно, что-угол <р может изменяться только от 0 до 2Л. Значениям <р и <р + 2тГ отвечает одна и та же точка. Следовательно, чтобы функция ф<Д) была однозначной, она должна быть периодической с периодом, равным 1Л, т. е. фО) = ф2л). Это возможно, если т( = 0, ±1, ±2, ... Таким образом, из решения уравнения (32.7) автоматически получаем значения магнитного квантового числа. Каждому значению пи соответствует определенная функция ф^Т).
Значение константы А определяют из условий нормировки. Для этого необходимо проинтегрировать от 0 до 2л произведение ф^9)Ф*(у7), где Ф*(<р) = Ae~im,,f> — комплексосопряженная функция: 2л 2л , ,
/фу?) •Ф*((р)й<р*в 1. Отсюда A2 f eimiV>*e~im‘ = А2 *2л= 1, сле-0 о
довательно, А =
Таким образом, нормированная функция Ф($») имеет вид
Ф97) = (32.14)
причем пц = 0,± 1;± 2;± 3,...
Функцию Ф(<р) можно представить также в виде комплексной: фу?) = VSF е±^п‘'р = Y27 (cosmi<р± zsinm,^). (32.15)
Приравнивая левую часть уравнения (32.12) также к величине mJ, получим
sin2# д / 2 dR\ sin# д , • a йвч 8л2 т? sin2# „ „ 2
-даГ V "аг) + бЖ (sin* +------------~г--(£- ^n)=mf. (32.16)
Разделим это уравнение на sin2 ft
1 й ( 2 dR\ д , -п й0.
R дГ 'Г йг) + Osin# a# (S,n^ а#) +
л2
2 (Е-ЕП)=-^-sin #
Произведем разделение переменных:
± А
R дг
( 2 dR\
V дг)
-^-{Е- Еп)=-^~
(32.17)
. да (sin# ^г). ©sin# a# \ ov >
В левой части уравнения (32.17) все члены зависят только от одной переменной г, а в правой — только от ft. Следовательно, обе части уравнения должны быть равны какой-либо постоянной величине, например С. Тогда:
2
= <32Л8)
543
2 2
I тг if) + (F " En) ° c' <32л9)
Решение уравнения (32.18) хорошо известно в теории дифференциальных уравнений. Оно приводит к соотношению
ЭД = 1/2 • l<cos^>- <32.20)
Функции типа pjm''(cos0) называют присоединенным многочленом Лежандра, которые определяют из:
рJm/'(cos0) = — [1 - (cos#)2 ] 2---rq— (cos2#- 1)*. (32.21)
27! d (cos®) m‘
Подробнее см.: Корн Г., Корн Т. Справочник по математике. — М.: Наука, 1973. С. 767.
В этих уравнениях 1 = 0, 1, 2, 3, .... В нормированном множителе (I- 1ш/1)! значение mz не может быть больше значения I, иначе получится факториал отрицательного числа. Поскольку отрицательного факториала не может быть, максимальное значение mt должно равняться значению I или -I s mz s +1.
Таким образом, решение уравнения (32.18) зависит от двух целых чисел: I и mz. Число I получило название орбитального квантового числа.
Уравнение (32.19) называют радиальной функцией атома водорода. Его решение подробно исследовано в математической физике и может быть приведено к виду
з 1
Л(Г) = Ш 2 Ч (n ~f ~ н>1 iV+VfP). (32.22)
W I2n[(n+/)!fj
2
В этом уравнении р=—г, ао =—г—- = 52,9 пм, a I^++z 1(/7) — ,,а° 4л тс
присоединенный многочлен Лягерра, равный
+' 0°) = -Чти \еР ^7+7 <<е~рРп )] • <32-23>
dp L dp J
Вид уравнения (32.22) довольно Сложен, но выводы из него можно сделать. В этом уравнении появляется новый параметр п, который принимает только целочисленные положительные значения от 1 до Так как у факториала (л -1— 1)! отрицательного числа не бывает, то максимальное значение I должно быть равно п - 1. Итак, решение уравнения (32.19) привело к появлению главного квантового числа п и ограничению значений орбитального квантового числа рядом 1=0, 1, 2, 3, ... (и-1).
Из приведенных выше рассуждений следует, что полная волновая функция водородоподобного атома зависит от трех квантовых чисел (л, I и mz), целочисленные значения и взаимозависимость
544
которых обусловлены требованиями конечности и непрерывности волновой функции
Для атома водорода п=1, 1 = 0 и т( = 0, поэтому уравнение
(32.11) может быть записано как и
равно:
f 4л2 me2 )
I ft2 J
•еЛ
причем Q0) = Q/,mz) = -y R(f) = R(n,t) =
I 2 2 \ 3/2
_ 4л me e 2e~&'2
Л2 I /
32.3. КВАНТОВАНИЕ ЭНЕРГИИ ЭЛЕКТРОНА В АТОМЕ ВОДОРОДА
Из уравнения Шредингера следует, как это будет показано ниже, что энергия электрона квантуется, принимает только дискретные значения. Рассмотрим поведение электрона в одномерной потенциальной яме (рис. 109), условном аналоге атома водорода. Предположим, что электрон имеет в любом месте внутри ямы постоянную потенциальную энергию, равную нулю, а вне ямы его потенциальная энергия бесконечно велика. Это означает, что электрон не существует вне ямы, не выходит за пределы области 0 s х <, г.
Уравнение Шредингера для одномерного движения электрона параллельно оси х при Еп = 0:
,2 , „2
^4 + Е1рх = о. (32.24)
dx2 ft2
Потенциальная энергия электрона в нашей задаче должна удовлетворять требованиям: Еп = 0 при Os xs гм Ел = 00 при х = 0 и х = = г. Вероятность нахождения электрона за пределами потенциальной
ямы равна нулю, так как для удаления его необходимо сообщить бесконечно большую энергию. Поэтому вне ямы должно выполняться условие ipx = 0.
Представим уравнение (32.24) в виде
2 £•„ = *»
^4 + eV* = 0. <32-25)
d?
из ямы электрону
£„ = 0
2 где с2= ~-~-Е.
h
Из теории линейных дифференциальных уравнений второго порядка известно, что общее решение уравнения (32.25) будет равно:
---*-----------Ж-----
х = 0 х=г
Рис. 109. Микрочастица с массой т в одномерном потенциальном ящике
18—1258
545
1рх = Asin (ex) + Boos (ex). (32.26)
Это можно проверить, проведя два последовательных дифференцирования уравнения (32.26):
c[Acos(cx) - Bsin(cx)];
- с2 [Z sin (ex) + Bcos(cx)]= - c^lpx. dx
Из граничных условий следует, что в уравнении (32.26) 1рх = 0 в точке х = 0: 0 = Asin(c»0) + Bcos(c»0) или 0 = А(0) + В(1). Чтобы последнее равенство соблюдалось, постоянная В также должна быть равна нулю. В этом случае уравнение (32.26) превращается в функцию: ipx - -Asin (сх).
Для точки х = г(В = 0) уравнение (32.26) превращается в 0 = = Asin(сг). Это равенство имеет два решения: А = 0 или sin(сг) = 0. Известно, что синус угла равен нулю при угле, кратном Л: с = и у. В этих граничных условиях = Asinу^х, где п — целое число.
2
Приравнивая с2 = —- и с = п получим
2 2 2 \
^^Е=п2^ или £= и2 -Ц . (32.27)
Уравнение (32.27) означает, что электрон, «запертый» в потенциальной яме, может иметь только дискретные, квантованные значения энергии. Чем шире потенциальная яма (больше значение г), тем ближе располагаются друг к другу уровни энергии, тем меньше энергии электрона.
Таким образом, дискретность энергетических состояний электрона вытекает из решения уравнения Шредингера, а не из гипотетических предположений.
ГЛАВА 33. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ
Окислительно-восстановительные реакции — реакции, сопровождающиеся изменением степени окисления атомов, входящих в состав реагирующих веществ, в результате перемещения электронов от атома восстановителя к атому окислителя. Например, в реакции
546
Ок(1) + В<5(2) Вс(1) + Ок(2) (33.1)
L I
ne
участвуют две сопряженные окислительно-восстановительные пары. Одна состоит из исходного окислителя, Ок(1) и его восстановительной формы Вс(1), другая — из исходного восстановителя Вс(2) и его окислительной формы Ок (2).
33.1. СОСТАВЛЕНИЕ УРАВНЕНИЙ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЙ
Если реакции протекают в растворах, то для составления уравнений применяют метод электронно-ионных полуреакций. В соответствии с этим методом реакцию (33.1) делят на две полуреакции:
Вс(2) - пе~»Ок(2) и Ок(1) + пе~“Вс(1).
Первая полуреакция представляет окисление восстановителя, сопряженная пара Ок(2)/Вс(2), а вторая — восстановление окислителя, сопряженная пара Вс(1)/Ок(1).
Слабые электролиты и неэлектролиты записывают в полуреакциях в виде молекул, а соли — в виде ионов, включая в случае необходимости молекулы воды, ионы НзО+ и ОН , соблюдая законы сохранения зарядов и массы.
Например, для составления уравнения окислительно-восстановительной реакции взаимодействия сероводородной кислоты H2S(p> с перманганатом калия КМпО4 в кислой среде сначала выписывают из таблиц стандартных электродных потенциалов значения <р°, отвечающие двум полуреакциям восстановления:
S + 2e~ -» H2S(P); ^° = 0,144 В; MnO^ + 5e"- Мп2+; <р° = 1,531 В.
Из этих данных следует, что анион МпС>4 будет в реакции окислителем, a H2S — восстановителем (см. раздел 7.10). Затем составляют в ионно-молекулярной форме уравнения двух полуреакций:
МпО4 + 8Н+ + 5е~ ~ Mn2+ + 4Н2О12 H2S - 2е~ = S + 2Н+ 15
В первую полуреакцию включены восемь ионов Н+, необходимых для связывания четырех атомов кислорода аниона МпО7 в молекулы воды. Во второй полуреакции сероводород указан в молекулярной форме, так как его протолиз подавлен избытком ионов НзО+ (кислая среда).
После этих операций уравнивают число электронов в полуреакциях, умножая первую на 2, а вторую — на 5, и складывают полуреакции:
2МпО4 + 16Н+ + 10е~ + 5H2S - 10е“ ~ 2Mn2+ + 8Н2О + 5S + 10Н+
18*
547
Сокращая отдельные слагаемые, получают уравнение в краткой ионно-молекулярной форме:
2МпО4 + 6Н+ + 5H2S “ 2Мп2+ + 5S + 8Н2О
В реакции участвуют, естественно, не ионы Н+, а ио^ы НзО+ и не условные катионы Мп , а аквакатионы [Мп(Н2О)бГ •
Для составления материального баланса ионно-молекулярное уравнение (33.2) преобразуют в молекулярное, включая в него ионы, не участвующие в полуреакциях (К+, S03 ), но присутствующие в растворе:
2КМпО4 + 5H2S + 3H2SO4 = 2MnSO4 + 5SI + K2SO4 + 8H2O
При составлении уравнений окислительно-восстановительных реакций, протекающих в твердых и газообразных фазах и расплавах, расчет стехиометрических коэффициентов производят, применяя метод электронного баланса. Например, следует составить уравнение реакции взаимодействия MnQz с кислородом в расплаве КОН:
МпО2(к) + О2(г) + КОН(ж) — *К2МпО4 +...
После того как был определен продукт реакции — тетраоксоманганат (+VI) калия, составляют две полуреакции
Mn(+VI) - 2е~- Мп(+ VII) I 2 О2 + 4е--» 2О(~П) 11
и уравнивают число принятых и отданных электронов. Затем составляют уравнение
2МпО2 + О2 + 4КОН » 2К2МпО4 + 2Н2О
Стехиометрический коэффициент перед КОН определяют по числу атомов калия в правой части уравнения, а атомы водорода связывают в воду.
При одновременном окислении (или восстановлении) атомов нескольких элементов, входящих в состав одной молекулы, подбор стехиометрических коэффициентов ведут, применяя также метод электронного баланса. Например, в реакции
FeS2 + О2 -• Ре20з + SO2
Fe(+II) - le~ »Fe(+III)
2S(-I)-10e~“2S(+IV) О3 + 4е~ = 2O(-II)
Всего: -Не Всего: +4е~
Следовательно, стехиометрические коэффициенты у FeS2 и О2 будут равны соответственно 4 и 11:
4FeS2 + 11О2 “ 2Fe2O3 + 8SO2
Стехиометрические коэффициенты продуктов реакции (Ре20з и SO2) определяют по материальному балансу всей реакции.
В ряде случаев подбор стехиометрических коэффициентов в урав
548
нениях реакций окисления — восстановления, протекающих при термическом разложении вещества, производят, используя метод баланса атомов, не участвующих в приеме или отдаче электронов, при условии, что эти атомы входят в состав исходного вещества и одного из продуктов реакции. Например, в реакции
5Ва(10з)2 = Ва5(Юб>2 + 41г + 902
по атомам бария (подчеркнуты). В реакции
4Na2SO3 - 3NaSO4 + Na2S
по атомам кислорода, а в реакции
(NH4)2Cr2O7 = СггОз + N2 + 4НгО
по атомам водорода.
Нет необходимости во всех случаях производить подобного рода расчеты. Некоторые оказываются настолько простыми, что стехиометрические коэффициенты можно определить сразу, например, для реакции
t
Си + 2Н28О4(конц.) = CuSO4 + SO2t + 2НгО
33.2. ТИПЫ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЙ
В окислительно-восстановительных реакциях протекает процесс переноса электронов от атома восстановителя к атому окислителя. Одновременный перенос одного или двух электронов часто является одностадийным процессом. Перенос более двух электронов — процесс многостадийный и очень сложный. Если в окислительно-восстановительной реакции, протекающей в растворе, участвуют сольватированные электроны е «пНгО, то фактическое столкновение реагирующих частиц может и не происходить.
Более быстро протекают реакции при взаимодействии разноименно заряженных частиц или молекул и ионов. Из двух реакций:
Hg2(I) + Sn(II) ~ 2Hg(«) + Sn(IV);
2Fe (III) + Sn(II) = 2Fe(II) + Sn(IV)
первая протекает быстрее, так как частота столкновений катионов Sn(II) с катионами Hg2(I) выше, чем с катионами Fe(III) (катионы Hg2(I) имеют меньший одноименный заряд). В первой реакции в
Г ;
образовавшемся активированном комплексе (Hg2(+I) • Sh(II) ] происходит двухэлектронный перенос, в результате чего появляются устойчивые продукты реакции, Hg(O) и Sn(IV).
К приведенному выше обозначению частиц в виде Hg2(I), Sn(IV), Sn(II) и т. п. прибегают в тех случаях, когда состав частицы либо достаточно сложен, либо пока не установлен окончательно. Напри
549
мер, Sn(II)= lSri4<OH)6 ]2+, а не Sn2+ или Fe(II)s [Ре(НгО)б]2+, a не Fez и т. д.
Перенос электронов может быть связан с переносом атомов. Например, в реакции
NOz + НСЮ(р) + Н2О - ЬЮз + Н3О+ + СГ
сначала образуется активированный комплекс NOz^HClO, в котором кратковременная неустойчивая связь N-—О превращается в стабильную с одновременным разрывом связей О—Н и О—О:
гп +111 2е~ .... +1-| ~ ifx +v »-
~>N-—О-ГС1 + Н2О- q>N—О + Н3О+ + СГ
н J
В активированном комплексе присоединение атома кислорода вызывает перенос двух электронов от атома азота по мостику N—О—С1 к атому хлора.
Различают реакции межмолекулярного окисления — восстановления, внутримолекулярного окисления — восстановления, диспропорционирования (дисмутации или самоокисления — самовосстановления) и конмутации.
К реакциям межмолекулярного окисления — восстановления относят реакции, в которых атом-окислитель и атом-восстановитель принадлежат разным веществам. Например:
+UI —П +в о
2HNOz + H2S = 2NO f + S | + 2Н2О
+v -I О
КЮз + 5KI + 3H2SO4 = 312 + 3K2SO4 + ЗН2О
К реакциям внутримолекулярного окисления — восстановления относят реакции, в которых атом-окислитель и атом-восстановитель входят в состав одной и той же молекулы или одного и того же иона. Например:
-ш +vi t III
(NH4)2Cr2O7 = Nzt +СГ2О3 + 4Н2О
+П -II t 0 +V-II t -I 0
2Hg 0 = 2Нё(ж) + O21 ; 2KC1 Оз = 2KC1 + 30zt
Внутримолекулярные реакции окисления — восстановления могут быть вызваны действием потока фотонов определенной энергии. В частности, азид меди Си(Нз>2 и ацетиленид серебра AgzCz взрываются при облучении светом определенной длины волны:
hv hf
2Cu(N3)z = 2Cu + 3Nzt; AgzCz = 2Ag + 2C
Воздействие y-излучения на КСЮз вызывает реакцию
2КС10з - KCIO4 + КС! + 021
550
а аммиакат нитрида трииода взрывается при бомбардировке «-частицами:
2(l3N-NH3)=2NH3t + N2f +312Г
К реакциям диспропорционирования относят реакции, в которых функции окислителя и восстановителя выполняет один и тот же атом молекулы или иона, находящийся в промежуточной степени окисления. Например:
+ш +п +IV
2fMn(H2O)6]3+ = [Мп(Н2О)б1+МпО21 +4Н3О+
+iv +ш +v О -I +i
2NO2 + Н2О :—> HNO2 + HNO3; С12 + Н2О;—> НС1 + нею
Реакции конмутации — реакции внутримолекулярного окисления — восстановления, в результате которых происходит выравнивание степеней окисления атомов одного и того же элемента. Например:
-ш +v t +1 —Ш +1п t О
NH4NO3 = N2O + 2Н2О; NH4NO2 = N2 + 2Н2О
Перечисленные выше виды окислительно-восстановительных реакций могут находиться в различном сочетании друг с другом. Например, реакция термического разложения Ва(Юз)2> приведенная выше, состоит из реакции диспропорционирования и реакции внутримолекулярного окисления — восстановления одного и того же аниона.
33.3. УРАВНЕНИЕ НЕРНСТА
Направление самопроизвольных окислительно-восстановительных реакций, протекающих в стандартных условиях, оценивают по значениям <р° соответствующих полуреакЦий. Если же начальные концентрации взаимодействующих веществ отличаются от 1 моль/л, то прибегают к использованию уравнения Нернста.
Нернст Вальтер Фридрих (1864—1941) — немецкий профессор, занимавшийся вопросами электрохимии и термодинамики, директор института физики в Берлине. Лауреат Нобелевской премии.
Для окислительно-восстановительной реакции, записанной с учетом стехиометрических коэффициентов
Vi0k(1) +V2Bc(2) ^=:у3Вс(1) +У40к(2)
как и ко всякой другой химической реакции применимо уравнение изотермы химической реакции (см. разделы 8.2 и 35.2):
Дб7(Т) = At?°(T) + /?Лп (33.2)
IOk(I)!1- 1Вс(2)1 2
где I Bed) 1, 10к(1) I, I Вс(2) I и 10к(2) I — неравновесные (началь
551
ные) концентрации окислительно-восстановительных сопряженных пар. Подставим в уравнение (33.2) полученные ранее (см. раздел 7.10) соотношения
Лб’(7) = - лРАй и Д(70(Т) = - пМ 8 °,
в которых Ай = <рп- и А Й 0 = <Рп~ $ представляют соответственно разности электродных потенциалов для нестандартных и стандартных состояний частиц, находящихся в растворе, а и <ря являются значениями электродных потенциалов правого (для полуреакции с участием окислителя) и левого (для полуреакции с участием восстановителя) электродов гальванического элемента, п — число переданных от восстановителя к окислителю электронов после их уравнивания, F — постоянная Фарадея. Окончательное уравнение
nF Юк(1)1 1 IBc(2)|V2
(33.3)
получило название уравнения Нернста. Значение AS отвечает разности потенциалов электродов или напряжению гальванического элемента, в котором протекает окислитльно-восстановительная реакция при начальных молярнх концентрациях окислителя и восстановителя, отличающихся от 1 моль/л и составляющих менее 0,001 моль/л. Уравнение Нернста в виде уравнения (33.3) применимо только для очень разбавленных растворов. Из этого уравнения следует, что начальные концентрации окислителя и восстановителя влияют на напряжение гальванического элемента. Когда все концентрации равны 1 моль/л, то член, содержащий в уравнении (33.3) логарифм, обращается в нуль и Ай = Ай °.
Заменяя натуральные логарифмы на десятичные и подставляя значения R = 8,314 Дж/(моль*К), 7 = 298 К и 7=96 485 Кл/моль, можно привести уравнение (33.3) к виду
(33.4)
Д£ = Дй° — Р-0591.!,..IBc(11i2iOk£2Ji2, ” 1Ок(1)1Г1 1Вс(2)1Г2
Размерность множителя 0,0591/л вольт.
Когда окислительно-восстановительная реакция находится в состоянии термодинамического равновесия (см. гл. 8), то
Аб\Т) =0, А й 0 = lgATc и Кс = IQ.*®1*4.
п Юк(1)]п [Bc(2)f2
В этом случае по значению А й ° можно определить концентрационную константу равновесия Кс данной окислительно-восстановительной реакции, так как Ай = Ай°=^Р° [Вс(1)/Ок(1) — - ^>°[Вс(2)/Ок(2) ].
К полуреакциям также применимо уравнение Нернста. Для каждой окислительно-восстановительной сопряженной пары можно записать:
552
<р=<ро_ 005911 BcQ. 00591! BC(®L
г V п '“Ок(1) V V п °Ок(2)'
Потенциал электрода (<р), погруженного в раствор, содержащий окислительно-восстановительную пару, отражает способность окисленной формы пары присоединять электроны и стремление восстановленной формы отдавать их. Эта способность и оценивается уравнением Нернста. При термодинамическом равновесии разность потенциалов электродов в гальваническом элементе равна нулю.
Например, для полуреакции
МпО$ + 8Н+ + Se Mn2+ + 4Н2О
значение <р°~ 1,531 В, а в общем случае
О
<f> = V>
0,0591 [ IMn2+ I
5 8 IMnOi" I IH+ I8
= 1,531 -0,01181g
IMn2+ I 1МпО4“ I
- 0,0946рН.
Отсюда следует, что значения у> полуреакций и реакций зависят от концентрации ионов оксония. Вертикальными линиями I...I обозначены начальные, неравновесные, концентрации реагентов.
Если 1Мп2Э = IMnO? I = 1 моль/л, а значения pH-5, 3 и 1, то значения для приведенной выше полуреакции соответственно равны: — 1,531 - 0,0946*5 — - 1,058 В; 1,247 В и 1,436 В. Таким образом, с увеличением концентрации ионов оксония увеличивается окислительная способность перманганатных анионов. Если сопоставить полученные значения <р со значениями стандартных электродных потенциалов полуреакций:
С12 + 2е~ - 2С1~; ° = 1,396 В
ВГ2 + 2е~ = 2Вг“; <р ° - 1,087 В
12 + 2е“-21“; ^' =0,535 В
то очевидно, что при pH 5 перманганат калия б$дет окислять только иодид-ионы I- до h, не действуя на ионы Вг~ и С1“. При pH 3 окислению будут уже подвергаться не только иодид-ионы I , но и бромид-ионы Вг , а при pH 1 — все три галогенидных иона.
Другой пример. Надо определить константу равновесия реакции, протекающей при 25°С в кислом растворе:
2Fe3+ + 21^- 2Fe2+ +I2
когда начальные концентрации каждого из реагентов равны 1 моль/л. Для этой кРо 0,0591, IFe2+ I2 ._ ’ ,
реакции АО = Ао-----------1g-------------- (1г как твердая фаза в подлогариф-
« IFe3+I2 II Г' мическое выражение не входит). Из полуреакций
Fe3++ е~-Fe2+; ° “0,771 В
12 + 2е~ - 21“; ° = 0,535 В
следует, что А £ ° “ 0,771 —0,535-0,236 В, а п “2. В состоянии термодинамического равновесия ДС(Т) • — nF&&=0 и поэтому Д£° = 9^^ IgKc, где Кс =---—
п [Fe3 I2 П ]2
Следовательно, IgKc-о,2 = 7,986 или Кс“ 9,68*107 (моль/л)"2
В щелочной среде направление той же реакции изменяется на> обратное:
2Fe(OII)2 + 12 + 2011“ s=t 2FeO(OH) + 21“ + 2H2O
553
Правда, атомы Fe(II) и Fe(III) сохраняют свои степени окисления, но входят они уже не в состав аквакатионов, а в состав гидроксидов. Поэтому полуреакция с участием атомов железа будет другой:
FeO (ОН) + Н2О + е~ - Fe(OH)2 + ОН ; <р 0 = — 0,666 В
Если допустить, что полуреакция I2 + 2e- “2I- остается в щелочной среде без изменения, то из сравнения значений <р ° следует, что в этой среде уже иод способен окислить Fe(II) до Fe(III).
Константа равновесия реакции будет равна
1g Хс = — 535 ~ = 40,643 или Кс - 4,395*1040.
Из приведенных выше примеров следует, что значение pH может определять, будет ли данное вещество окислителем или восстановителем.
Щелочная среда (рН>> 7,0) усиливает восстановительные свойства вещества в тех случаях, когда в результате реакции увеличивается число атомов кислорода, связанных с атомом-восстановителем (sol- - sob, когда анион бескислородной кислоты или простое вещество превращаются в оксоанион (Г -» Юз), когда аквакатион переходит в оксоанион. Во всех этих случаях поставщиками атомов кислорода являются гидроксид-ионы или молекулы воды. Например: MnOz + 4ОН" - Зе = MnO4 + 2Н2О; S2" + 8ОН~ - 8е“ - SO3~ + 4Н2О
В кислой среде (pH«7,0) окислительные свойства вещества усиливаются в тех случаях, когда в результате реакции уменьшается число атомов кислорода в оксоанионе (CIO4 -» СЮз), когда оксоанион превращается в аквакатион (CrzO? - [Cr(HzO)6 ]3+),
so; + 2Н3О+ 4- 1е = soF + ЗН2О
МпО; + 8Н3О+ + 5е~ - [Mn(HzO)6 ]2+ + 6Н2О
Полагают, что влияние ионов НзО+ на окислительные свойства вещества вызвано способностью протонов входить в состав активированного комплекса, ослабляя связи между атомом окислителя и кислородом путем связывания кислорода в молекулу воды.
Итак, восстановительные свойства вещества-восстановителя усиливаются в щелочной среде, а окислительные свойства вещества-окислителя — в кислой среде.
Выбирая среду для окислительно-восстановительной реакции, следует учитывать ее влияние и на окислитель, и на восстановитель. Если расход ОН -ионов меньше для процесса окисления, чем расход ионов Н3О+ для процесса восстановления, то такая реакция пойдет легче в кислой среде. Например:
2Мп2+ + 16ОН~ - Юе" = 2МпО4 + 8Н2О
5В10з + ЗОН30+ + 10е~ - 5Bi3i + 45НгО_________
2Мп2+ + 5ВЮ5 + 14Н3О+ - 2MnO; + 5Bi3+ + 21Н2О
554
Для создания кислой среды чаще всего используют разбавленный водный раствор H2SO4. Азотную и хлороводородную кислоты применяют реже, так как HNO3 проявляет окислительные, а НС1 — восстановительные свойства. Для создания щелочной среды применяют водные растворы гидроксидов натрия или калия. Роль среды может выполнять сам окислитель или восстановитель, как, например, в случае реакции
Мп02 + 4НС1(конц.) “ МпС12 + CI21 + 2НгО
Возможность осуществления конкретной окислительно-восстановительной реакции зависит не только от среды (растворитель, концентрация ионов НзО или ОН ), но и от внешнего воздействия (температура, освещенность, введение катализаторов, радиоактивное облучение).
Влияние температуры на направление реакций определяется термодинамическими (см. разделы 7.9 и 8.3), а на скорость — кинетическими факторами (см. раздел 34.1 и 34.2). Эти факторы никак не следуют один из другого. Поэтому всегда надо помнить о различии между термодинамической и кинетической возможностями осуществления реакции.
Внутримолекулярные реакции и реакции диспропорционирования для веществ, содержащих элементы в разных и неустойчивых степенях окисления, стимулируются повышением температуры или введением локального теплового импульса, например, разложение дихромата аммония введением в его порошок нагретой стеклянной палочки:
(NH4)2Cr2O? = N2I + СггОз + 4НгОг
Тетраоксохлорат (VII) аммония при нагревании выше 200°С участвует в двух параллельно протекающих реакциях:
4NH4CIO4 = 2N20t + 2С121 + ЗО21 + 8Н2ОГ
2NH4CIO4 “ N2t + CI2I + 20г1 + 4Н2О
Эндотермические реакции при низких температурах, как правило, либо прекращаются, либо превращаются в реакции присоединения или обмена ионов без изменения степени окисления элементов. Так, при смешении газообразных SO3 и H2S или их растворов в этиловом эфире в обычных условиях протекает реакция
SO3 + H2S = S021 + S1 + Н2О
Ниже -83°С эта реакция в среде этилового эфира превращается в реакцию присоединения
SO3 + H2S = H2SO3(S)
с образованием тиосерной кислоты (см. раздел 16.8).
Смешение Нг и F2 в обычных условиях приводит к взрыву:
H2 + F2-2HF
а ниже -183 °C смесь этих газов устойчива, образование фтороводорода не наблюдается (действие кинетическйх факторов).
555
При низких температурах создаются благоприятные условия для стабилизации реакционноспособных эндотермических соединений. В частности, ниже -196 °C устойчив SiFz, который в обычных условиях диспропорционирует:
2SiF2 “ Si + SiF4 f
Ниже -77°C можно хранить месяцами KrF4 без разложения, а когда температура достигает 0°С, то это вещество полностью распадается на криптон и фтор.
ГЛАВА 34. СКОРОСТЬ И МЕХАНИЗМ ХИМИЧЕСКОЙ
РЕАКЦИИ
Любая химическая реакция протекает во времени. Одни реакции идут чрезвычайно быстро, почти мгновенно, другие — крайне медленно. Некоторые реакции начинаются медленно, а затем ускоряются, другие вначале развиваются бурно, а через определенное время затухают. Например, метан реагирует с хлором в соответствии с реакцией СН4 + ЗС12 = CHCI3 + ЗНС1. Эта реакция протекает на свету мгновенно, а в темноте — медленно. Быстро протекают ионные обменные реакции в растворе (реакции нейтрализации, осаждения, вытеснения и др.).
34.1. СКОРОСТЬ И ПОРЯДОК ХИМИЧЕСКОЙ РЕАКЦИИ
Скорость реакции зависит от многих факторов: от состава исходных веществ (реагентов), их состояния (агрегатного, дисперсности, степени диссоциации в растворе и т. п.), интенсивности перемешивания, давления, температуры, концентрации, воздействия различных видов излучения, присутствия других веществ.
В химических реакциях не происходит, как правило, непосредственного превращения реагентов в продукты реакции, реакции протекают в несколько стадий — последовательных или параллельных. Уравнения химических реакций, приводимые в настоящем учебнике, — конечный результат химического превращения реагентов. Действительный путь реакции много сложнее.
I Скоростью гомогенной химической реакции (и) по реагенту В называют изменение молярной концентрации этого реагента св при постоянном объеме в единицу времени (т):
dr '
Знак минус свидетельствует об уменьшении скорости реакции с уменьшением концентрации реагента В. Скорость реакции по ее продукту равна:
556
dr
Если скорость реакции не зависит от концентрации реагентов, то реакцию называют реакцией нулевого порядка:
йсв > v = - —= к, dr
(34.1)
где к — константа скорости реакции нулевого порядка. После интегрирования уравнения (34.1) при условии, что св= св(Т = 0), где св — исходная концентрация реагента В, получим
Св-Св =-*(*-Го). (34.2)
Большинство известных реакций нулевого порядка относится к гетерогенным, протекающим на поверхности. Например, реакции разложения N2O и NH3 на поверхности платины
2N2O(r) = 2N2(r) + О2(г>; 2NH3(r) “ N2(r) + ЗН2(г)
При распаде молекул вещества В на продукты реакции (Т, V = const) В -* Продукты реакции
скорость уменьшения молярной концентрации вещества В определяют как
v—$=*св, (34.3)
где к — константа скорости реакции первого порядка, с , а св — концентрация вещества В, моль/л.
Реакции, описываемые уравнением скорости реакции или кинетическим уравнением (34.3), называют реакциями первого порядка. Порядок реакции — это показатель степени концентрации
св в правой части уравнения (34.3). Чтобы найти зависимость концентрации вещества В от времени г, следует проинтегрировать уравнение (34.3) при условии, что св“ = св(Г= 0), св — начальная концентрация вещества В:
- кг, 1п^= - ЛТ;
св
Св = Св ехр (- кГ). (34.4)
Кинетическая кривая, отвечающая уравнению (34.4), приведена на рис. ПО. Наклон касательной к кинетической
Время х
Рис. ПО. Кинетические кривые реакции первого порядка. Изменение концентрации реагентов (2) и продуктов реакции (2) в зависимости от времени
557
кривой в некоторой точке и определяет собой скорость реакции в данный момент времени (моль»л *«с ).
Известно небольшое число химических реакций первого порядка: разложение N2O5, растворенного в CCI4, разложение гидразина и тетраоксида диазота:
2N2O5 = 4NO2 + О2; N2H4“2NH2; N2O4“2NO2
Если химическая реакция протекает в результате взаимодействия двух молекул А и В или двух одинаковых молекул В:
А + В - Продукты; В + В - Продукты
то скорости реакций будут пропорциональны числу столкновений молекул или пропорциональны произведению концентраций взаимодействующих молекул (сА св, Св). Следовательно, уравнение для
скорости таких химических реакций будет иметь вид:
(34.5)
v -
(34.6)
где к — константа скорости реакции второго порядка, л»моль 1»с *. Зависимость изменения концентраций сд и св от времени находят интегрированием уравнений (34.5 и 34.6) после разделения переменных:
св св
или
<34.7> св/ Ъ св
Уравнение (34.7) — линейное, в координатах — = f(T). При св
графическом решении этого уравнения константа скорости реакции к равна тангенсу угла наклона прямой.
Кинетические уравнения (34.1), (34.3), (34.5) и (34.6) — дифференциальные уравнения, представляющие зависимость скорости химической реакции от концентраций влияющих на нее веществ и включающие коэффициент пропорциональности к, называемый константой скорости конкретной реакции.
Реакция
2NO(r) + О2(г) - 2ЫО2(г>
является реакцией второго порядка по NO и первого порядка по кислороду, а в целом вся реакция третьего порядка. Уравнение для скорости реакции получения NO2: = к&о *£<>2 — совпадает
случайно со стехиометрией реакции, что является признаком ее одностадийности, одновременного Столкновения трек молекул, приводящего к появлению диоксида азота.
558
К реакциям второго порядка относятся также реакции:
2NOC1 . ’2N0 + С12 20з - ЗО2
NHj + NO2 = N2 + 2НгО 2HI + Н2О2 -12 + 2НгО
В последней двухстадийной реакции наиболее медленной стадией будет первая: Г + Н2О2 “ ЮН + OFT, скорость которой можно измерить. Вторая стадия: ЮН + HI = I2 + Н2О — протекает очень быстро. Поэтому порядок реакции определяют по скорости наиболее медленной стадии.
В реакции взаимодействия ионов NHj и NO2 скорость равна: v- _ dCNH4+ _ dCNO2~ _ кс +с -
V- dj " Л “ *CNH4 CNO2
и константа скорости к “2,7* 10 4 л»моль ^с"1.
К реакциям второго порядка принадлежат также реакции:
2NO2- ' N2O4; Нг(г) +12(г)^= 2Н1(Г>;
S20g~ + 2r-2S03~ + l2
Последняя реакция состоит из трех стадий:
S2O§- + SO4 + sol- + I; SO4 + Г— SO?- + I; I +1 -12
Первая стадия — реакция второго порядка, самая медленная, две последующие — быстрые. Первая стадия определяет общую скорость и порядок реакции.
Уравнению реакции более высокого порядка:
аА + ЬВ + сС -» Продукты
de
отвечают скорость: v = и порядок реакции, равный ш + иг + пз- Показатели степени не являются в общем случае стехиометрическими коэффициентами уравнения химической реакции. Они могут быть как целыми, так и дробными числами. Порядок реакции определяют из экспериментальных измерений скорости реакции.
К реакциям дробного порядка принадлежат, например, газофазное образование оксида-дихлорида углерода и разложение озона в присутствии хлора: СО + CI2 - CCI2O; 20з “ 30г. В первой реакции порядок по хлору 3/г и первый т> монооксиду углерода СО, во второй реакции порядок по озону /2.
Все химические реакции по их скорости грубо делят на медленные и быстрые. К медленным относят реакции, у которых значения констант скорости первого и второго порядка лежат в интервале 10-8—1,0 с 1 (или л*моль *»с Ь. Все реакции, константы скорости которых находятся в интервале 10*—10*1 с 1 (или л«моль *»с ), принадлежат к быстрым реакциям.
Например, к быстрым реакциям относятся реакции нейтрализации
559
НзО+ + ОН" - 2Н2О
Кинетическое уравнение этой реакции имеет вид:— = “ кс н3о+ сон"> а значение к - 2» 1011 л»моль 1 «с1 настолько велико, что всего лишь за 7»10~12 с расходуется половина небольшого количества ионов НзО+, добавленного к раствору, содержащему 1 моль/л ОН~-ионов. В подобных реакциях происходит перемещение протонов вдоль системы мостиковых межмолекулярных водородных связей без удаления гидратных оболочек протона. Если водородная связь внутримолекулярного типа, то скорость перемещения протона резко падает до значения к- 10° - 107 л «моль"1 «с \ _
Реакции, у которых значения Л= 101 - 1012 л «моль ^с1 контролируются диффузией, которая определяется частотой столкновений ионов друг с другом в растворе, причем каждое столкновение приводит к взаимодействию ионов. Таких быстрых реакций немного. К ним принадлежат реакции второго порядка переноса протона между молекулами воды, переноса протона между молекулами воды н+
и гидроксид-ионами: НзО+ + Н2О g *1- Н2О + НзО+; Н2О + ОН" . кг • ; ♦ it
н+ н+ н+
s=s ОН" + Н2О. Константы скорости приведенных реакций равны: ki ~ 1»1О10 л*моль~1*с" , &2-5«1(г л * моль"1 • с" *.
34.2. ЭНЕРГИЯ АКТИВАЦИИ
Не все столкновения молекул и ионов реагентов приводят к образованию продуктов реакции. Реакция начинается только между теми частицами, которые обладают повышенной энергией. Такие частицы при столкновении сначала образуют активированный комплекс, что-то вроде промежуточного соединения, существующего в течение очень короткого времени. Затем активированный комплекс разрушается с образованием продуктов реакции. Активированный комплекс не является химическим соединением в обычном смысле слова. Его образование энергетически более выгодно, чем предварительный полный распад молекул, вступающих в реакцию (разрушение старых связей перед образованием новых).
Для обратимых химических реакций активированный комплекс является одним и тем же для прямой и обратной реакций. Например, в эндотермической реакции
/
Н2(Г) + 12(Г)г= 2Н1(г); ДН°(Т) = 54 кДж
2
таким активированным комплексом будет плоский аддукт (Н2*12), отличающийся большим значением энергии образования, чем реа-
560
(H2-I2)
£•„^71 (реакция 2)
I Продукты (HI)
Гдн£. = +27
Направление прямой реакции
Рис. 111. Д иаграмма потенциальной энергии эндотермической реакции образования иодоводорода:
х — область существования активированного комплекса; Ел — энергия активации
генты: водород и иод (рис. 111). Так как энергия образовавшегося иодоводорода больше, чем энергия реагентов, то на осуществление реакции следует затратить энергию; энергия является эндотермической.
Энергия образования активированного комплекса называется энер-| гией активации.
Реакция начинается только тогда, когда столкнувшиеся частицы будут обладать необходимой энергией активации, сумеют преодолеть энергетический барьер, ограничивающий их химическую активность.
Разность энергий активации прямой и обратной реакций равна изменению энтальпии.
Константа скорости реакции зависит от числового значения энергии активации. Чем меньше энергия активации, тем больше значение константы скорости реакции. Экспериментально установлено, что зависимость к=f(E&) достаточно точно передается уравнением Вант-Гоффа — Аррениуса:
k = pZ exp (- EjRT), (34.8)
где р — стерический множитель, представляющий собой долю столкновений, при которых реагирующие частицы ориентируются в пространстве так, что они могут объединиться с образованием активированного комплекса; Z — частотный множитель, учитывающий как число соударений, заканчивающихся образованием продуктов реакции, так и вероятность распада активированного комплекса на исходные вещества без образования продуктов реакции; Еа — энергия активации, Дж; R — универсальная газовая постоянная, равная 8,3143 Дж/(моль»К); Т — температура, К.
Значения р лежат между 0 и 1 и зависят от структуры реагирующих частиц. Если они очень просты (НзО+, ОН , I и т. п.),
561
то р ~ 1, для сложных частиц значение р« 1 и может достигать значений, равных 10 .
Ниже приведена зависимость константы скорости реакций второго порядка от энергии активации при 25 °C и р-1, вычисленные по уравнению (34.8) для Z=10.
£», кДж/моль... 100 60 40 20 10 ~0
к, л^моль'^с'1... 3«10'7 10 104 3»107 2«109 10й
Значение Z“ 1011 л’моль"1 «с'1 характерно для многих реакций, протекающих между молекулами и ионами, за исключением реакций между многозарядными ионами. Реакции с Л-1011 без заметного энергетического барьера Еа ~ 0 происходят, очевидно, практически при каждом соприкосновении реагирующих частиц.
Скорость химических реакций очень чувствительна к изменению температуры. Поскольку процесс образования активированного комплекса — процесс эндотермический, то константа скорости реакции увеличивается с повышением температуры. Существует эмпирическое правило Вант-Гоффа, согласно которому возрастание температуры на 10° вызывает увеличение константы скорости в 2—4 раза.
Для большинства реакций значения р, Z и Еа почти не зависят от температуры, поэтому функция 1пЛ”/(7’~1), как правило, линейна:
Injt - In(pZ) — EalRT. (34.9)
Поэтому значение Еа можно оценить графически или алгебраически. В последнем случае должны быть известны значения к для двух температур: Into - In(pZ) -E&/RTt, Into =ln(pZ) - EalRT\, после преобразования получим
\nk2 - Into - 4 fe- - Т-1 • (34.10)
« \T2 Til
34.3. КАТАЛИЗ
Скорость медленно протекающей реакции можно увеличить введением в систему катализатора. Катализатор — это вещество (твердое, жидкое или газообразное, ионы, молекулы или радикалы), изменяющее скорость термодинамически возможной реакции. В процессе катализа катализатор может вступать в реакцию на ее различных стадиях, но в конце реакции он остается химически неизменным.
При гомогенном катализе катализатор и реагенты находятся в одной и той же фазе. Катализаторы, образующие самостоятельную фазу, составляют вместе с реагентами и продуктами реакции гетерогенную систему (гетерогенный катализ). Катализатор может многократно участвовать в промежуточных химических взаимодействиях, но обычно его количество значительно меньше, чем реагентов.
Рис. 112. Энергетические профили каталитической (/) и некаталитической (2) экзотермической реакции
Реакции в присутствии катализаторов называют каталитическими.
Катализатор снижает значение Ея из-за сильного взаимодействия с активированным комплексом и слабого взаимодействия с реагентами и продуктами реакции. Уменьшение энергии активации приводит к увеличению скорости реакции (рис. 112). В частности, платина снижает значение Ея в реакции Нг<г) + 12(г) до 109 кДж/моль, но одновременно снижает и энергию активации обратной реакции.
Следует заметить, что катализатор не может сместить химическое равновесие, он может способствовать более быстрому его достижению, причем катализатор в равной степени ускоряет прямую и обратную реакции.
Добавляемые к катализатору вещества, не обладающие каталитической активностью, но повышающие его способность к снижению энергии активации, называют промоторами или активаторами. Например, ванадиевый катализатор синтеза 80з из смеси SO2 и Ог содержит в качестве активаторов сульфаты калия или рубидия.
Реакция диспропорционирования Н2О2 в водном растворе в обычных условиях протекает довольно медленно: 2НгОг “ 2НгО + Ог. Увеличение скорости реакции происходит под воздействием различных катализаторов. В гомогенном катализе катализаторами являются ионы (Г, СггО?- и др.), в гетерогенном — оксиды МпОг, РегОз; металлы Pt, Си и др. В частности, действие катализатора МпОг в кислой среде можно передать следующей схемой:
МпОг + Н2О2 + 2Н3О+ + 2НгО - [Мп(НгО)б ]2+ + Огt [Мп(Н2О)б12+ + НгО ;= [Мп(Н2О)5ОН ]+ + Н3О+ [Мп (Н2О)5ОН ]+ + НгОг - МпОг I + НзО+ + 5НгО
563
34.4. МЕХАНИЗМ ХИМИЧЕСКИХ РЕАКЦИЙ
Химические реакции в большинстве случаев являются многостадийными. Путь реакции (совокупность стадий), через которые протекает химическая реакция, носит названия механизма химической реакции. Механизм химической реакции включает также последовательность разрыва старых и образования новых химических связей, последовательность изменения структур взаимодействующих частиц и всех промежуточных образований. Например, окисление катионов [Fe(H2O)6j кислородом воздуха в водном растворе при pH < 5 состоит из семи стадий (точкой обозначены радикалы):
[Fe(H2O)6]2+ + О2 - [Fe(H2O)6]3+ + Oi; Ог + Н3О+ = НО2 + Н2О
[Fe(H2O)6]2+ + НО2- [Fe(H2O)6]3+ + НО2
НО2 + Н3О+ » Н2О2 + Н2О
[Fe(H2O)6 ]2+ + Н2О2 = [Fe(H2O)6 J3+ + ОН' + ОН
[Fe(H2O)612+ + ОН = [Fe(H2O)6]3+ + ОН'; ОН' + Н3О+ - 2Н2О
На этом сложном пути реакции, на каждой из семи стадий, сталкивается не более двух частиц и отсутствуют соударения одноименно заряженных частиц.
Суммарное стехиометрическое уравнение рассмотренной реакции:
4 [Fe(H2O)6 ]2+ + 4НзО+ + О2 ” 4 [Fe(H2O)6|3+ + 6Н2О
Если судить только по этому уравнению, то для осуществления реакции необходимо одновременное соударение (соприкосновение) девяти частиц, восемь из которых имеют одноименные заряды. Такие групповые соударения, да еще одноименно заряженных частиц, — маловероятное событие. Поэтому стехиометрическое уравнение реакции не определяет ее механизма: характер ее протекания во времени, число стадий.
Простые реакции, имеющие одностадийный механизм реакции, в которых участвует одна реагирующая молекула, называют м о-номолекулярными. Одностадийные реакции с участием двух взаимодействующих частиц, называют бимолекулярными, а трех частиц — тримолекулярными. Уже три-молекулярная одностадийная реакция, протекающая при одновременном столкновении трех частиц, — маловероятна.
Примером двухстадийной тримолекулярной реакции может служить взаимодействие водорода и иода в газообразной фазе (см. раздел 34.2). После образования активированного комплекса (Н2»12) происходит его распад на Н2 и 21, за которым следует тримолеку-лярная реакция атомарного иода с водородом:
Н2 + 21. >2Н1
Допускают, что эта тримолекулярная реакция может быть представлена двумя бимолекулярными стадиями:
564
н2 + i H2i и H2i +1 2Hi
Ниже рассмотрен механизм некоторых реакций, изложенных в общем виде в разделах настоящего учебника.
Почти все прямые реакции протолиза являются реакциями первого порядка, а обратные — реакциями второго порядка. Например:
к1 +
СНзСООН + НгО.-* Н3О+ + СНзСОО
кг
где Л1=9,1*105 с-1, Л2 = 5,2*1О10 л*моль-1*с-1. Константа кислотности СНзСООН представляет собой отношение констант скоростей прямой и обратной реакций:
Кц-с~-= 1,7*10 5 моль/л.
*2
’*1 .
Другой пример: В(ОН)з*Н2О + Н2О ^=?НзО+ + [В(ОН>41
кг
где £1 = 1*103 с-1, Л2“1,75*1012 л*моль **с *, Кк = ^= 5,7*10 10
*2 моль/л.
В реакциях обратимого перемещения молекул воды из раствора во внутреннюю сферу аквакатиона и наоборот: константа скорости реакции зависит от комплексообразователя и в ряду M(II> Ni < Mg < < Со < Fe < Zn < Cd < Си < Hg возрастает от никеля к ртути:
[М(Н2О*)б)2+ + Н2О [М(Н2О*)5(Н2О) ]2+ + Н2О*
Наиболее быстрый обмен молекулами воды наблюдается у Hg(II) и Cu(II). амедленный — у Ni(II). У Cu(II) к = 7*109 с , ay Ni(II) Л = 3*104 с *. Считают, что квадратноплоская конфигурация аквакатиона [Си(Н2О)4Г приводит к большой подвижности аксиально расположенных молекул воды по сравнению с октаэдрической кон-фшурацией аквакатионов других комплексообразователей.
У аквакатионов А1(Ш), Сг(Ш), Rh(III) и Fe(III) обмен молекулами воды происходит медленно. Например, у [Сг(Н2О)б1 и [Rh(H2O>6r значения к равны соответственно 5*10”' и 4*10”в с’1. С понижением степени окисления комплексообразователя скорость реакции обмена молекул воды резко возрастает и у [Сг(Н2О)бГ значение к достигает 8,3* 1Сг с \
Значения констант скорости реакций замещения одних лигандов другими позволяют приближенно оценить прочность связей М—L. Например, в реакции
[M(nh3)5C1]2++h2o [мшнзжнгои^ + а
константа скорости убывает от Сг(Ш)(Л - 7,3* 108 с-1) к Ir(III)U-= 104 с Ь в ряду: Сг > Со > Ru > Rh > Ir.
565
Скорость замещения в значительной степени зависит от вида уходящего лиганда. В частности, для комплекса [Со(МНз)5Х]г+ константы скорости замещения лиганда X на молекулу воды в водном
растворе (25 °C) равны: НСОз(£ = 2*10 3 с Ь, I U = 8»10-6c Ь, СГа-2-10"6 с-1), NCS"a-8-10~7 с-1) и NCS_a = 5-lO“10 с'1). Из
сравнения двух последних констант следует, что связи тиоцианатного аниона с комплексообразователем через атом азота (Со—NCS) оказываются более прочными, чем через атом серы.
Механизм окислительно-восстановительных реакций, связанный с переносом одного электрона, можно представить в виде ряда последовательных стадий:
образование мостиковой связи
Вс(1) + X—Ок(2) - Вс(1)— X—Ок(2)
перенос электрона
е е ---( ,-п
Bc(i)—X—6к(2) - Ок(1)—X—Вс(2)
разрыв мостиковой связи
Ок(1)—X—Вс(2)
_ Ок(1)—X + Вс(2)
_ Ок(1) + X—Вс(2)
. Ок(1)+Вс(2)+Х
Перенос электрона может происходить в два этапа:
Bc(D—X—Ок(2) - Ок(1)—X—Ок(2)
Ок(1)—X—6к(2) - Ок(1)—X—Вс(2)
Любая из указанных выше стадий может определить скорость окислительно-восстановительной реакции.
Энергия активации на первой стадии затрачивается на перестройку электронных структур Вс(1) и Ок(2), образовавших мостик.
Значение энергии активации будет более низкой для ионов с подобными координационными сферами, как, например, в реакции
[Fe(CN)6]3 + [Fe*(CN)6]4 s=r [Fe(CN)£"]+ [Fe*(CN)6l3"
Электрон за время переноса не успевает гидратироваться. Механизм реакции, в которой гидратированный электрон е"*хН2О, переходит от растворителя к окислителю Ок (2), не имеет большого значения из-за взаимодействия е"»хНгО с молекулами воды:
е ‘хНгО + НгО = Н + ОН +хНгО, Л* 16 л»моль ^*с Ч
566
Примером окислительно-восстановительной реакции с образованием временной мостиковой связи может служить реакция [Co(NH3)5C12]+ + [Сг(Н2О)б]2+ + 5Н2О - .[Со(Н2О)6]2+ +
С1° f
+5NH3+ [СгШгО^СЦ^ + СГ
Константа скорости реакции образования мостиковой связи Со—С1—Сг равна к “7,6 л*моль *«с *. Перенос электрона через мостиковую связь от Сг(П) к Со (III) происходит много быстрее, = 6* 105 л*моль- «с-1. Следовательно, скорость определяющей стадии будет стадия образования мостиковой связи. Интересно отметить, что электронная проводимость мостиковых абидентатных лигандов различна в зависимости от связи окислителя с тем или иным атомом лиганда. Так, константа скорости переноса электрона в системе (H2O)sFe—SCN—Co(NH3>5 ^“3*1(ГЛ а в системе (H2O)sFe— NCS—Co(NH3)5 к = 0,12 л»моль *»с \ Видимо, атом серы мостикового лиганда как бы блокирует перенос электрона от Fe(II) к Со (III).
В окислительно-восстановительных реакциях может переноситься не только один, но и два и более электронов от восстановителя к окислителю. Если мостиковая связь может сохраняться достаточно долго, то вполне возможен последовательный перенос более чем одного электрона. Например, при действии С12 или Вг2 на катион [Co(NH3)5(C2O4) Г последний теряет в одну стадию два электрона: [Co(NH3)5(C2O4) ]+ - 2е- = [Co(NH3)5(C2O4) ]3+
при этом лиганд С2ОЗ~ сначала становится нейтральным и тотчас же расщепляется на две молекулы СО2, а его место занимает молекула воды:
[Co(NH3)5(C2O4) J3* + Н2О - [Co(NH3)5(H2O) ]3+ + 2СО2
Двухэлектронный перенос наблюдается в некоторых окислительно-восстановительных реакциях присоединения:
[PtCl4]2- + Cl2= [PtCk]2-; [Au(CN)2r + Cl2- [Au(CN)2C12]-
В большинстве же случаев, когда степени окисления реагентов изменяются более чем на две единицы, окислительно-восстановительная реакция является многостадийной, с образованием на одной или нескольких стадиях неустойчивых окисленных промежуточных веществ. В частности, через такие стадии проходят реакции Mn(VII) + Fe(II); Fe(III) + Sn(II), Cr(VI) + НгБ и др.
Допускают, что вместо переноса электронов может происходить перенос атома или группы атомов. Например:
[Fe*(H2O)613+ + СГ-— [Fe*(H2O)5Cl]2+ + Н2О [Fe*(H2O)5C,l]2+ + |Fe(H2O)6j2+' [Fe*(H2O)6J2++ [Fe(H2O)5Cl]2+
ci°
[Fe(H2O)5CI]2+ + H2O - [Fe(H2O)6]3+ + СГ
567
В этих реакциях вследствие перемещения атома С1° и образования мостика Fe*—Cl—Fe(II) понижается степень окисления Fe* и происходит окисление Fe(II).
Почти такой же механизм имеют реакции восстановительного элиминирования (от лат. eliminare — исключать, устранять). Например, в реакции
EPtCle 12~ + Г - [PtCU-1 ]3- - [PtCU ]2- + IC1 + СГ ♦
иодид-ион Г кратковременно включается во внутреннюю сферу, передает пару электронов комплексообразователю и исключается из внутренней сферы с одним из лигандов в виде монохлорида иода; одновременно исключается еще один лиганд.
ГЛАВА 35. КОНСТАНТА РАВНОВЕСИЯ И ЕЕ СВЯЗЬ С ЭНЕРГИЯМИ ГИББСА И ГЕЛЬМГОЛЬЦА. ИЗОТЕРМА ХИМИЧЕСКОЙ РЕАКЦИИ
Термодинамический вывод уравнения химического равновесия основан на следующих рассуждениях. Энергия Гиббса равна:
(7»Я — TS или G^U + pV— TS.
Изменение этой функции состояния системы в зависимости от изменения входящих в нее параметров можно записать в дифференциальной форме следующим образом:
dG = dU + pdV + Vdp — TdS — SdT, (35.1)
где dG, dU и т. д. — дифференциалы термодинамических функций
Рис. 113. Дифференциал функции и энергия Гиббса:
х — изменение состояния системы
или их бесконечно малое изменение. Если, например, изменение функции G по кривой от точки / до точки 2 (рис. 113) заменить на изменение ее по касательной, проведенной в точке 1 к кривой, то новое приращение dG называют дифференциалом. Из рис. 113 следует, что dG=tgfX«dx, где tga=^|.
Замена приращения функции AG на ее дифференциал dG приводит к большим упро
568
щениям в вычислениях, но при этом совершается ошибка, которая будет тем меньше, чем меньше значение приращения независимого переменного dx. Производную функции G, можно рассматривать как отношение дифференциала функции к дифференциалу независимого переменного.
35.1. ИЗОТЕРМА ХИМИЧЕСКОЙ РЕАКЦИИ
В случае равновесия в обратимой химической реакции
dH - TdS = dU + pdV. (35.2)
Подставив уравнение (35.2) в уравнение (35.1):
dG-Pdp-SdT. (35.3)
Уравнение (35.3) связывает изменение энергии Гиббса с изменениями давления и температуры. Значение Vdp — это не то же самое, что pdV. Если pdV — механическая работа расширения или сжатия системы, то Vdp не имеет простого физического смысла.
Из уравнения (35.3) следует, что в закрытой системе при р, Т-“ const в случае равновесия действительно dG “ 0.
Для изотермического процесса (dT- O) уравнение (35.3) становится более простым:
dG “ Vdp. (35.4)
Применяя это равенство к 1 моль идеального газа, для которого pV = RT или V=S~-, получим соотношение
dG~RT& (35.5)
Р
Чтобы найти теперь изменение энергии Гиббса между двумя состояниями системы, отвечающими давлениям р i и р 2, прибегают к интегрированию зависимости (35.5):
₽,2 ..
J dG = G2-Gi-Z?rJ ^-ЛГ1п^. (35.6)
pi pi р Р1
Уравнение (35.6) дает нам изменение энергии Гиббса при изотермическом обратимом изменении состояния 1 моль идеального газа.
Хотя уравнение (35.6) выведено для обратимого перехода от состояния системы с давлением pt к состоянию системы с давлением р2, оно в равной степени применимо и к необратимым реакциям, поскольку энергия Гиббса является функцией состояния системы и ее изменения не зависят от способа перехода системы из состояния 1 в состояние 2.
Чтобы узнать, как изменилось состояние равновесия в изотермической обратимой химической реакции, необходимо выбрать исходное стандартное состояние системы — исходную шкалу отсчета. В качестве исходного стандартного состояния для газов выбирают состояние чистого газа при температуре опыта Т и давлении pi «
569
= 1 атм. Такое стандартное состояние энергии Гиббса Gi изображают символом G°(T) : Gi - G°(T). Отсюда
dG = Gi - G\ = RT In p2,
Gi -‘G°(T)+RT In pi. (35.7)
Для n моль газа получим: nGi = nG°( T) + nRT In p2. Под знаком логарифма в уравнении стоит безразмерное число ~ = рг, по-
казывающее, во сколько раз конечное давление р2 больше или меньше давления pi, принятого за единицу (1 атм.).
В качестве G°(T) вещества в стандартном состоянии при 7-- 298 К можно использовать значения AZG°(298 К), изменения свободной энергии Гиббса образования вещества, так как в любой химической реакции выполняется закон сохранения массы, а реагенты и продукты реакции должны быть получены из одинаковых по виду и количеству простых веществ в их стандартных состояниях.
Если применить уравнение (35.7) к изменению свободной энергии Гиббса AG реакций, то вклады простых веществ в их стандартном состоянии в левой и правой частях уравнения реакции для исходных веществ и продуктов реакции взаимно скомпенсируются.
Когда в системе присутствует смесь газов, то под знаком логарифма вместо р2 будет находиться величина, называемая парциальным давлением р2 (см. раздел 8.1).
Например, значение AGso3 — свободной энергии Гиббса образования триоксида серы БОз из простых веществ в их стандартных состояниях для реакции 2S(K) + ЗО2 ;—* 2SO3 — зависит от его парциального давления. Если для SO3 AfG°(298 К)= “ —370,4 кДж/моль, то AGso3 “ — 370,4 + RT In 7^--— 370,4 + + 5,706 lg pso3 (7? = 8,314 Дж/(моль-К), 7-298 К).
Пусть в закрытой системе при 7-const протекает обратимая химическая реакция между идеальными газообразными веществами:
ак + ЬВ сС + еЕ
Чтобы найти изменение AG( Г), примем в качестве исходного стандартного состояния системы такое ее состояние, при котором каждое вещество имеет парциальное давление pi = 1 атм или Ра= Рв= Рс= Ре = 1 атм, а количество каждого вещества (в молях) в системе равно его стехиометрическому коэффициенту в реакции. Конечное (равновесное) состояние системы будет отвечать уже равновесным парциальным давлениям: (рА), (рв), (рс) и т. д., не равным 1 атм.
Изменение энергии Гиббса AG(T') такого перехода от исходного стандартного состояния к конечному (равновесному) составит:
AG(T) = (eGe + cGe) — (qGa + йвв), (35.8)
570
при этом безразлично каким путем придем к состоянию равновесия: в результате прямой или обратной реакции.
Изменения энергии Гиббса для одного моль всех участников реакции в соответствии с уравнением (35.7) будет равно:
aGa = aG а + clRT In Ра» bGn — bG в + bRT In p^, cGc — cG c + cRT In pd cGe = eG e + eRT In pp,
где pt — текущие (изменяющиеся) парциальные давления.
Подставим эти соотношения в уравнение (35.8) и сгруппируем вместе все слагаемые G?:
Асет) - [c(G£ + RT In pc) + e(Gg + RT In pE) ] — [a(.G\ + RT in pA) +
+ *(Gb + RT In pB) ] = [(eGe + eGg) — (aGX + bG в) ] + RT In
Pa Pb
Алгебраическую сумму всех стандартных значений энергии Гиббса [(eGe + eGе)—(oGa + bG&) ] обозначим AG°(T), тогда последнее уравнение примет вид
&G(T) - AG °(Т) + RT In (35.9)
Ра“₽в
Значение AG°(7) является при данной температуре характерной для реакции постоянной величиной, поскольку она отражает изменение энергии Гиббса, когда исходные вещества и продукты реакции имеют начальное (стандартное) состояние (р<“1 атм). Сохранение постоянства парциального давления в 1 атм в обратимой химической реакции возможно только при условии постоянства свойств газообразной смеси, несмотря на взаимодействие исходных веществ. Постоянство же свойств газообразной смеси может быть достигнуто только тогда, когда количество исходных веществ бесконечно велико по сравнению с прореагировавшими и образовавшимися количествами веществ.
При равновесии AG(7^=0, а текущие парциальные давления pi становятся равновесными парциальными давлениями рр
&G °(Т) “ — RT In IMXpeL. (35.10)
(Ра)“(рв)й
Отношение равновесных парциальных давлений всех участников реакции получило название константы равновесия:
Кр- (^Z(pe)' const или Ag°(7^ = —ЛЛпКр (р, Т = const).(35.11) (РаЛрв)
Уравнение (35.11) является математическим выражением закона действующих масс. Приведенный выше вывод этого уравнения яв
571
ляется общим. Он не основан на каких-либо представлениях о механизме химической реакции.
Таким образом, изменение энергии Гиббса в химической реакции зависит от двух факторов: от изменения стандартной энергии Гиббса реакции ДС?°(7), которое связано со стандартной энергией Гиббса образования веществ, участников реакции и от парциальных давлений исходных веществ и продуктов реакции.
Уравнение (35.11) получило название изотермы химической реакции.
35.2. КОНЦЕНТРАЦИОННАЯ КОНСТАНТА РАВНОВЕСИЯ
Если константу равновесия выразить через молярные концентрации взаимодействующих веществ обратимой химической реакции, то она будет связана уже со свободной энергией Гельмгольца, Д А°(7).
Для реакций, протекающих при V, Т - const, термодинамической функцией состояния системы, свойством системы, будет свободная энергия Гельмгольца А, равная А - U — TS.
Эта термодинамическая функция появляется, когда к закрытым равновесным системам, находящимся при V, Т = const, применяют первый и второй законы термодинамики. Из Q = dU + pdV при V -- const следует, что Qv = dU, а> так как при равновесии Q » TdS, то dU — TdS = 0 или 172 — 1/1 — TS2 + TS\ = (t/2 — TS2) — (171 — — TSi) = 0. Функция U — TS получила название свободной энергии Гельмгольца. Дифференциал этой функции равен:
dA - dU — TdS — SdT. (35.12)
Если объединить уравнения dU » Q- pdV и Q= TdS, то дифференциал внутренней энергии будет равен: dU = TdS - pdV. Подставляя это соотношение в уравнение (35.12) и сокращая некоторые слагаемые, получим
dA» — pdV— SdT. (35.13)
Таким образом, равновесие в обратимой химической реакции характеризуется равенством dA»0 ( У, 7» const). Энергия Гельмгольца, как и энергия Гиббса, равновесной системы минимальна, но при других параметрах состояния системы.
Когда 7 = const, то уравнение (35.13) принимает вид
dA = — pdV. (35.14)
В этом случае изменение энергии Гельмгольца становится равным изменению работы расширения или сжатия системы.
Применяя уравнение (35.14) к 1 моль идеального газа, для которого р » получим: dA = — RT
Изменение энергии Гельмгольца между двумя состояниями системы, отвечающими объемам У1 и V2, будет равно:
572
Кг Кг
fdA~A2 — Ai - — RT J ^- — RTlng;
Ki Ki v n
Л2 - Л1 — RT In (35.15)
Ki
В качестве исходного стандартного состояния системы выбирают состояние чистого газа при температуре опыта Т и концентрации газа ci - 1 моль/л. Такое стандартное состояние значения Ai изображают символом Л°(Т) или Л1=Л°(7). Для замены объемов равновесными или текущими концентрациями а = у = где п = - 1 моль/л, вводят в уравнение (35.15) значения Vt = —:
Л2 = Л°(Т) - ЯТ1п^-= А°(Т) + ЯЛп^= Л°(7) + RTlnc?. (35.16)
Под знаком логарифма стоит безразмерное число, так как ci = = 1 моль/л. Уравнение (35.16) применимо не только к смесям газообразных веществ, но и к разбавленным растворам, если значение молярной концентрации каждого вещества не превышает 0,01 моль/л. Для обратимой химической реакции, находящейся в состоянии равновесия:
еЕ + r/Q ЛК + rR, ДЛ(7), принимают такое ее исходное, стандартное состояние, когда при Т = const концентрации всех веществ равны 1 моль/л: Се = cq = ск = Ск, а количество каждого вещества в системе равно их стехиометрическим коэффициентам е, q, к, г.
Изменение энергии Гельмгольца ДЛ(7) при переходе системы от исходного стандартного состояния к конечному равновесному состоянию равно:
Л-1(7') = (ЛЛК+ гЛк) - (еЛЕ + qAQ). (35.17)
Уравнения (35.16) для каждого вещества, участвующего в реакции, будут следующими:
кА к = кА к + £R71n ск; rA R = г А к + rR ТТпсц;
еА е = сАе+ eRT\n сь; qA Q = qA q + ^R7ln cq,
где сд, Cr, се и Cq — текущие концентрации веществ в их смеси.
Если подставить эти соотношения в уравнение (35.17) и отдельно сгруппировать стандартные значения Л?, то изменение энергии Гельмгольца в обратимой химической реакции будет равно:
ДА(^= 1(*Лк+ гА°Е}-(еА°Е+ <M&)]+ ЯЛп ^4 сЬсе
573
Алгебраическую сумму всех стандартных значений энергии Гельмгольца А? обозначают символом ДА°(Т), тогда
ДА(Г) = ДЛ°(Т) + ЯЛп
СЕ
Значение ДА°(7) при Т-const является характерной для данной реакции постоянной величиной, поскольку она отражает изменение энергии Гельмгольца в результате превращения исходных веществ в продукты реакции с концентрацией каждого вещества, равной 1 моль/л.
Когда система находится в равновесном состоянии ДЛ(7) =0, а текущие концентрации а становятся равновесными [с/], то
Да°(Т) = - ЛЛп _ RT\nKc.
Отношение равновесных концентраций всех реагентов под знаком логарифма носит название концентрационной константы равновесия и обозначается символом Кс. Итак,
„ [Cr]' [СК)* _
Kc =---------“ const.
[Cq]’ [СеГ
Таким образом, уравнение изотермы обратимой химической реакции может иметь два вида в зависимости от термодинамических параметров, определяющих равновесие:
ДС°(Г) = - /?71пКр (р, Т” const);
ДЛ°(Т) = - ЯПпКс (Г, Т = const).
Сравнивая значения Дб°(Г) или ДА°(7) различных веществ, участников конкретной химической реакции, получаем характеристику степени ее удаленности от состояния равновесия при парциальном давлении каждого реагента в 1 атм или при концентрации каждого реагента, равной 1 моль/л. Для реакций, протекающих в предельно разбавленных растворах, /SG°(T) = ДЛ°(Т) = - RT\nKc.
ГЛАВА 36. ПРАВИЛО ФАЗ ГИББСА
Правило фаз — важнейший закон гетерогенного химического и, прежде всего, фазового равновесия. Это правило позволяет априорно характеризовать фазовый состав какой угодно сложной многокомпонентной системы при заданном числе независимых переменных,
574
определяющих равновесие, предсказывать варианты фазовых превращений в различных системах с изменением определенных параметров состояния системы.
Понятие компонента и фазы введено в науку Гиббсом, им же выведена простая формула, связывающая число фаз, находящихся в равновесии, с числом компонентов, получившая название правила фаз Гиббса.
36.1. ФАЗА СИСТЕМЫ
Фазой (от греч. phasis — появление) называют часть объема равновесной системы, однородную во всех своих тачках по хими-3 ческому составу и физическим свойствам и отделенную от других частей того же объема поверхностью раздела.
Понятие фазы не относится к очень малым объемам, к системам с очень развитой поверхностью. Свойства таких систем зависят от свойств и размеров входящих в нее поверхностей раздела.
Смесь газов (раствор газов) состоит из одной фазы, полностью смешивающиеся жидкости также образуют одну фазу. Фазы могут существовать в любом из трех агрегатных состояний вещества. Если в системе находится (р несмешивающихся между собой жидких веществ, то она будет состоять из <р жидких фаз. Другим примером многофазной системы может служить трехфазная система, все фазы которой (пар воды, водный раствор соли и твердая соль) представляют собой различные агрегатные состояния веществ. Совокупность кристаллов какой-либо соли составляет одну фазу, так как каждый из кристаллов однороден по химическому составу и физическим свойствам и подобен любому другому кристаллу из их совокупности, хотя и отделен от других кристаллов поверхностью раздела. Отсюда следует, что наличие поверхности раздела является только одним из признаков фазы.
Механическая смесь кристаллов CsNO3, КС1, C11SO4, PbS будет состоять из четырех твердых фаз. Неустойчивая смесь кристаллов Na2SO4, Na2SO4*H2O и Na2SO4*5H2O — из трех фаз, так как каждое вещество не только отличается от остальных по содержанию воды, но и имеет определенную кристаллическую структуру, а следовательно, отличается и по физическим свойствам.
Напомним, что системы, содержащие одну фазу, называются гомогенными, а системы, состоящие из двух и более фаз, относятся к гетерогенным.
36.2. КОМПОНЕНТ СИСТЕМЫ
f Компонент — независимая составная часть системы, способная к £ существованию в изолированном состоянии в виде индивидуаль-k ного химического вещества.
К индивидуальным химическим веществам не могут быть причислены ионы, хотя они и существуют в растворах в виде самостоятельно перемещающихся кинетически независимых частиц.
575
В системе, образованной солью и водой (например, раствор КС1 в воде), обе ее составные части, вода и соль, являются компонентами, так как они могут существовать в виде индивидуальных химических соединений и их количества можно изменять независимо друг от друга, пока раствор является ненасыщенным.
Если в системе не протекают химические реакции, то все вещества, образующие систему, являются компонентами. Например, механическая смесь Zn, С2Н5ОН и KNO3 представляет собой трехкомпонентную систему. Каждое вещество такой системы является компонентом, независимой ее составной частью. Например, можно произвольно изменять количество цинка, но при этом количество этанола и нитрата калия не изменится.
Если в системе протекает необратимая реакция, то число компонентов будет определяться состоянием системы в момент прекращения реакции. Например, если в закрытой системе прореагировали стехиометрические количества цинка и разбавленного водного раствора серной кислоты, то после окончания реакции в системе останутся только сульфат цинка, вода и водород. Число компонентов будет равно трем (к = 3). Если же взять избыток цинка, то число компонентов станет равным четырем, так как в системе после окончания реакции останется часть цинка.
В случае химического равновесия между веществами появляются дополнительные количественные связи, определяемые законом действующих масс и другими независимыми уравнениями. В таком состоянии системы число компонентов всегда будет меньше числа всех реально присутствующих веществ, ибо для реализации обратимой химической реакции вовсе не обязательно брать все вещества (ойно или несколько веществ может появиться в результате реакции). Например, однофазное равновесие при некоторой температуре 2Н1<г> Нг(г) + 1г<г> может быть реализовано, если взять смеси HI + Н2, Н2 +12, HI +12. В любом из этих трех случаев протекание прямой или обратной реакции приведет к появлению третьего вещества. Это третье вещество не будет уже компонентом системы, поскольку его концентрация предопределяется законом действующих масс:
Кс= = Д7).
[HI]2
Число компонентов к в данной системе равно двум:
к “ 3(HI, Н2,12) — 1 (независимое уравнение) “ 2.
Таким образом, понятие компонента является химическим аналогом математического понятия независимой переменной. Понятие компонента родственно, но не тождественно понятию вещества.
Если в предыдущем примере можно осуществить нагревание HI, то Н2 и 1г получатся в результате реакции разложения HI. В этом случае соотношение молярных концентраций водорода и иода определяется уравнением реакции: [Нг ] = [12 ]. Появляется еще одно дополнительное независимое уравнение, и тогда
576
A = 3(HI, H2,I2) — 2 (независимые уравнения) = 1.
Рассмотрим такой пример. Если в равновесии находятся С(т>, Ог(г), СО (Г) и СОг(г), то между этими веществами возможны четыре реакции:
С + О2 = СО2; С + СОг- ' 2С0; 2С + 02 = 2С0;
2СО + О2- ‘ 2С0г
но одна (любая) из этих реакций может быть получена алгебраическим сложением двух других. Следовательно, число независимых уравнений (выражений закона действующих масс) равно трем.
Число компонентов этой системы:
£ = 4(С, Ог, СО, СОг) — 3 (независимые уравнения) = 1.
Число компонентов в системе зависит от характера взаимодействия веществ и условий, в которые поставлена система. Например, при нагревании достаточного количества карбоната аммония в закрытой системе при некоторой постоянной температуре устанавливается равновесие:
(NH4)2CO3(k> 2NH3(r) + СОг(г) + НгО(г)
Число независимых уравнений, связывающих концентрации образующихся веществ, будет равно двум: уравнение закона действующих масс и молярное соотношение газообразных продуктов реакции 2:1:1. Поэтому число компонентов равно:
к = 4(МНз, СО2, Н2О, (ЬПЗДгСОз) - 2 (независимые уравнения) - 2.
Если же эти четыре вещества смешать при очень низкой температуре, когда все они будут в кристаллическом состоянии и взаимодействие между ними практически прекратится, то система окажется четырехкомпонентной.
Другой пример, реакция СаСОз(к) -—-СаО(к) + СОг(г) протекает в закрытой системе при некоторой температуре. При равновесии Кс= [СОг]. Это уравнение сокращает число компонентов до двух. Система может быть построена из СаСОз и СаО, СаО и СОг, СаСОз и СОг. Но она не может стать однокомпонентной, если число молей СаО (к) окажется равным числу молей СОг. Равенство количества этих веществ не означает равенства их молярных концентраций, фазы различны по своим объемам, а молярные концентрации СаСОз (к) и СаО (к) постоянны и равны отношению плотности вещества к его молярной массе.
Приведенные примеры показывают, что для ряда систем не всегда можно ответить на вопрос, из каких компонентов состоит данная система, а можно только определить число компонентов, образующих ту или иную систему, а оно всегда равно тому наименьшему числу химически индивидуальных веществ, которое достаточно для образования всех фаз данной системы.
19—1258
577
36.3. ВАРИАНТНОСТЬ (СТЕПЕНЬ СВОБОДЫ) РАВНОВЕСНОЙ СИСТЕМЫ
В некоторой равновесной системе, состоящей из <р фаз и к компонентов, распределенных между всеми фазами, равновесие установилось при некоторых общих для всех фаз температуре Т, давлении р и концентрациях каждого компонента в каждой фазе, например массовой или молярной х доле.
Произвольно можно менять только то число параметров, которое будет определяться разностью между общим числом неизвестных параметров и числом независимых уравнений, связывающих все неизвестные параметры системы.
Общее число неизвестных параметров будет равно сумме неизвестных концентраций компонентов во всех фазах системы и двух общих для каждой из фаз системы таких параметров, как температура и давление. Для каждой фазы число неизвестных концентраций равно (к-l), так как концентрация одного из компонентов может быть определена по разности. Так как число фаз в системе равно <р, то общее число неизвестных концентраций будет <p(k-V), а общее число неизвестных параметров у>(£-1) + + 2(р, Т).
Число независимых уравнений, связывающих все параметры данной равновесной системы для любого компонента, распределенного между ^-фазами, равно (<р- 1). Каждые две фазы связывает одно уравнение — константа равновесного распределения компонента (см. ниже закон распределения). Общее число таких уравнений распределения для всех компонентов рассматриваемой системы будет равно к(<р~ 1).
Разность между общим числом параметров системы и числом возможных независимых уравнений даст нам число v независимых параметров, для определения которых не хватает уравнений и которые поэтому можно изменять произвольно, по своему усмотрению, не изменяя числа фаз системы:
v — [<р(к- 1) + 2]-к((р- 1) = к-(р+2. (36.1)
Величина v получила название вариантности или степени свободы системы. Вариантность равновесной системы всегда больше нуля или равна нулю, v > 0.
Уравнение (36.1) представляет собой математическое выражение правила фаз Гиббса.
36.4. ПРАВИЛО ФАЗ ГИББСА
Правило фаз Гиббса можно сформулировать следующим образом: вариантность равновесной системы равна числу ее компонентов минус число фаз плюс два: v = к - <р + 2.
Когда один из термодинамических параметров не является параметром состояния системы, т. е. не оказывает влияния на равновесие, его не учитывают в правиле фаз. Например, если в соответ
578
ствии с принципом Ле Шателье давление не влияет на смещение равновесия в системе, как в случае 2Н1<Г) —-Hitr) + 12(г), и это равновесие не нарушается при любом р = const, правило фаз Гиббса записывают в виде
v = k-(p+l. (36.2)
Обычно уравнение (36.2) применяют также и в тех случаях, когда изучаемые системы находятся под атмосферным внешним давлением и не содержат летучих веществ.
Рассмотрим несколько примеров применения правила фаз Гиббса по определению вариантности конкретных систем.
Так, в системе КС1<к> КС1(Ж) при некотором внешнем давлении в фазовом равновесии находятся кристаллы хлорида калия и их расплав (летучесть хлорида калия невелика). Число компонентов к = 1, число фаз <р = 2, следовательно, вариантность системы будет: 27=1-2 + 1=0. Давняя равновесная система называется инвариантной (или нонвариантной). Отсутствие степени свободы означает, что плавление KCI происходит только при одной температуре, характерной для данного вещества, изменить которую по своему усмотрению нельзя. Такие характеристики вещества называют его физическими константами. В другой равновесной системе: РС1з(Ж) +=*РС1з(г) число компонентов тоже равно единице, а число фаз (р = 2. Но в отличие от первой системы внешнее давление оказывает большое влияние на равновесие в этой системе из-за наличия пара РС1з. Система будет моновариант-ной (.V =1-2 + 2= 1): каждой температуре кипения трихлорида фосфора отвечает единственное значение давления насыщенного пара.
Разложение MgCO3 при некоторой постоянной температуре в закрытой системе оканчивается установлением равновесия
MgCO3(K) MgO<K) + СОг(г)
Число компонентов в такой системе к = 3 - 1 = 2 (одно независимое уравнение, закон действующих масс), число фаз (р = 3, поэтому вариантность системы г?=2-3 + 2 = 1. Система моновариантна и равновесие при термической диссоциации MgCO3 зависит от одного параметра — температуры. Каждому значению температуры отвечает определенное значение давления СОг в системе. Например, при температурах 400 и 500°С давление в системе будет равно соответственно 13 и 1,3*104 Па.
Таким образом, при с’=0 система будет инвариантной (или нонвариантной) и изменение любого параметра состояния системы приведёт к изменению числа фаз. Когда п=1, система называется моновариантной, один из параметров системы может быть изменен без изменения числа фаз, находящихся в равновесии. При v = 2 система называется дивариантной, оба параметра (р, Т) можно изменять в определенных пределах без изменения числа фаз, находящихся в равновесии.
19*
579
36.5. ЗАКОН РАСПРЕДЕЛЕНИЯ
Распределение растворяемого вещества В между двумя фазами (1 и 2) для данной равновесной системы подчиняется закону распределения:
*»<в> - 3^' <36-3>
где хв(1) — молярная доля вещества В в фазе 1, а хв(2) — молярная доля этого же вещества в фазе 2; Хд(В) — константа распределения вещества В между двумя фазами в состоянии равновесия. Например, в закрытой системе (при р и Т = const), состоящей из двух жидких растворителей — воды и бензола, которые будем считать индифферентными друг другу, находится небольшое количество HgBr2. Дибромид ртути растворен как в воде, так и в бензоле. После установления фазового равновесия содержание HgBn в воде и бензоле окажется вполне определенным, зависящим от растворимости дибромида ртути в этих растворителях при данной температуре. Отношение молярных долей HgBr2 в бензольной фазе и в водной фазе будет величиной постоянной и равной при 25°С Хо(Н^Вг2)/(СбНб/Н20) = 1,13. Это отношение не зависит от общего количества HgBr2.
Если в системе имеется три фазы (1, 2 и 3), то распределение вещества В между ними будет определяться двумя различными константами распределения:
*d(B) и Хр(В) = ^g,
*в(1) *в(2)’
где хв(1), *в(2) и хв(3) — молярные доли вещества В в фазах 1, 2 и 3 в состоянии фазового равновесия между ними.
Таким образом, для <р фаз вещества В всегда можно составить (^)-1) уравнений закона распределения.
Для жидких растворителей уравнение (36.3) можно использовать также в виде
Хр(В)=^, св(1)
где св(1) и св(2) — молярные концентрации вещества В в фазах 1 и 2, или в виде
V- /Т>\ _ (2)
где м>в(1) и wв(2) — массовые доли вещества В в фазах 1 и 2.
Закон распределения оказывается действительным для любых веществ (твердых, жидких и газообразных), распределенных между любыми (пр агрегатному состоянию) фазами.
Константа распределения данного вещества В между двумя определенными фазами всегда остается постоянной (при р, Т = const), если растворенное вещество В образует разбавленные растворы и не изменяет своего формульного состава при переходе из одной фазы в другую.
580
Частными случаями закона распределения являются закон Генри (см. раздел 9.2) и закон сокристаллизации примеси при очистки вещества методом кристаллизации из растворов (см. раздел 9.4).
36.6. ФАЗОВЫЕ РАВНОВЕСИЯ
Любое вещество в зависимости от температуры и давления может находиться в трех агрегатных состояниях: твердом, жидком и газообразном (см. раздел 6.3), каждое из которых представляет одну фазу.
При изменении параметров состояния системы (р, Т) одна фаза может переходить в другую, подвергаясь различным фазовым превращениям.
Переход жидкой фазы в газообразную (парообразную) называют испарением, а обратный процесс — конденсацией. Если испарение происходит в равновесных условиях, то его называют кипением, а обратный процесс — равновесной конденсацией. Поэтому температуру, при которой жидкая и парообразная фазы находятся в равновесии, называют температурой кипения Тк или температурой равновесной конденсации ТКОнд.: 7k = Тконд.
Газообразной фазой вещества В (газом) называют фазу, находящуюся в состоянии, достаточно далеком от ее равновесия с жидкой фазой этого же вещества. Паром вещества В (паровой фазой) называют газ, находящийся в состояниях, близких к его равновесию с жидкостью, переходу его в жидкость.
При равновесии скорость выкипания определенного количества вещества всегда равна скорости равновесной конденсации такого же количества вещества. Такая система моновариантна (v= 1 - 2 + 2 = = 1), и Тк и Тконд. будут зависеть от давления. Например, вода под давлением, равным 0,1 МПа, кипит при 100°С. Если давление понижается до 0,05 МПа, то понижается и температура кипения до 81°С. Повышение внешнего давления до 2,5 МПа увеличивает температуру кипения до 223°С.
Переход твердой фазы в жидкую называют плавлением, а обратный фазовый переход — кристаллизацией из расплава. Температура, при которой кристаллы и их расплав находятся в равновесии друг с другом, называют температурой плавления, Тпл, или температурой кристаллизации из расплава, Ткр: 7’пл = Tkp. В такой однокомпонентной, инвариантной (и= 1 — 2+1=0) равновесие наступает только при одной температуре, характерной для данного вещества.
Переход твердой фазы в парообразную называют сублимацией или возгонкой, а обратный процесс — десубли-м а ц и е й. Температура, при которой кристаллы вещества и его пар находятся в равновесии друг с другом, называют температурой сублимации Тс или температурой десублимации Тдс: Тс = Тдс. Такая система является моновариантной (у =1 —2 + 2 = 1) и каждой температуре в состоянии равновесия будет отвечать единственное значение давления насыщенного пара. Например, для равновесия
581
I2(K> г=±12(г) температурам 140 и 170°С отвечают давления насыщенного пара иода, равные соответственно 2,9* 104 и 7,0* 104 Па.
К фазовым равновесиям относят также равновесия типа «кристаллы растворенного вещества насыщенный раствор». Моно-вариантному равновесию (и =2-2+1 = 1) отвечает зависимость растворимости вещества от температуры (см. раздел 9.4).
Все эти равновесия называют фазовыми равновесиями. Под фазовыми равновесиями понимают не изменяемое во времени сосуществование различных фаз, находящихся при постоянных температуре и давлении. К фазовым равновесиям относят также равновесия, связанные с сосуществованием различных полиморфных модификаций одного твердого вещества. Например, для олова установив 16ГС
лены фазовые равновесия типа: Ct-Sn;==^8-Sn;==? y-Sn (см. раздел 6.3).
Кристаллическая структура у этих полиморфных модификаций олова различна и потому каждая модификация предсавляет собой самостоятельную фазу с особыми физико-химическими свойствами.
36.7. ЗАКРЫТЫЕ ГЕТЕРОГЕННЫЕ ОДНОКОМПОНЕНТНЫЕ СИСТЕМЫ
В однокомпонентной системе отдельные фазы представляют собой
одно и то же вещество в различных агрегатных состояниях.
Из правила фаз следует (о= 1 — <р+2 = 3 — <р), что ни одно индивидуальное вещество не может образовать равновесную систему, состоящую более чем из трех фаз.
Обычно состояние однокомпонентной гетерогенной системы изо-
Рис. 114. Диаграмма состояния однокомпонентной гетерогенной системы
бражают в координатах р -Т (рис. 114).
Линии, образующие диаграмму состояния в координатах р — Т, являются границами однофазных областей (и = 2). В пределах каждой области можно изменять р и Т, например, из точки 1 в точки 2 или 3 без изменения числа фаз (см. также раздел 6.3).
Линии на диаграмме отвечают моновариантным фазовым равновесиям (v = » 1). Кривая ФК — кривая давления насыщенного
пара над жидкостью, кривая кипения и конденсации, кривая фазового рав
582
новесия «жидкость ;—► пар». Кривая ФК отражает зависимость давления насыщенного пара от температуры и зависимость температуры кипения жидкости от давления пара над ней. Кривая ФК заканчивается в критической точке К, характеризующей исчезновение различий между жидкостью и паром. Состояние системы в этой точке инвариантно (v=0), температуру и давление в результате обрыва кривой ФК изменять произвольно нельзя, их значение зафиксировано точкой К (р и Т — физические характеристики критического состояния данного вещества). На всех р — Т диаграммах однокомпонентных систем кривая ФК обрывается в критической точке К.
Линия ОФ изображает моновариантное фазовое равновесие «кристаллы ...пар» и определяет влияние температуры на давление
пара сублимирующего вещества.
Линия ФП — кривая плавления или кристаллизации из расплава, кривая фазового равновесия «кристаллы ——расплав». На рис. 114 представлен наиболее общий случай, когда температура плавления с ростом давления увеличивается (молярный объем жидкой фазы больше молярного объема твердой фазы, кривая ФП). Кривая ФП' — кривая плавления очень немногих веществ, у которых молярный объем жидкой фазы меньше молярного объема твердой фазы (вода, галлий, висмут, германий, кремний, чугун).
Экспериментально кривую ФП можно продлить до очень высоких давлений без какой-то критической точки ее обрыва.
Влияние давления на температуру плавления невелико и поэтому линии ФП и ФП* мало отклоняются от оси ординат.
Тройная точка Ф, где сходятся линии моновариантных равновесий, отвечает инвариантному равновесию всех трех фаз (и= 1 -- 3 +2 = 0). Координаты тройной точки (р и Т) — физические константы любого индивидуального вещества.
Пунктирная кривая ФМ отображает метастабильное равновесие переохлажденной жидкости и насыщенного пара. Переохлажденная жидкая фаза менее устойчива, чем твердая фаза при той же температуре, что и вызывает повышение давления пара над ней по сравнению с давлением пара над твердой фазой.
Подробнее см.: Глазов В. М., Лазарев В. Б., Жаров В. В. Фазовые диаграммы простых веществ. — М.: Наука, 1980.
Линии двухфазовых равновесий на р — Т-диаграмме аналитически описываются уравнением Клапейрона — Клаузиуса, вывод которого вытекает из следующих рассуждений.
Уравнение свободной энергии Гиббса G = H~TS = U + pV- TS после дифференцирования приобретает следующий вид: dG = dU + + pdV + Vdp - TdS - SdT. Так как dU=Q-pdV (см. раздел 7.2) и Q = TdS (см. раздел 7.6), то dG= Vdp-SdT.
Когда система находится в фазовом равновесии dG = 0 и dGi = = dG2, где 1 и 2 — исходное и конечное состояния системы. Следовательно, Kidp - SdT = Vzdp - SzdT, откуда (Уг - Vi)dp = (Sr~ - Si)dT или Разности (Уз - Pi) и (5з - Si) обозначают
аГ V2 — Vi
583
изменение молярных объемов и энтропии при переходе вещества из 1-й фазы во 2-ю.
При фазовом равновесии S2- Si=AS = ^, поэтому
d£= дн . ат TAV
(36.4)
Уравнение (36.4) получило название уравнения Клапейрона — Клаузиуса. Производная описывает изменение давления пара над жидким или твердым веществом при его испарении, плавления или возгонке (сублимации). В этом уравнении ЛЯ — изменение энтальпии при фазовом переходе, а ДУ — изменение объема. Знак производной зависит от знака Ду.
Плавление, кипение и возгонка вещества являются процессами эндотермическими (Дя > 0) и в подавляющем большинстве случаев сопровождаются увеличением объема (ДУ>0). Поэтому все три кривые ОФ, ФП и ФК диаграммы наклонены вправо.
В соответствии с уравнением (36.4) наклон кривой плавления ФП влево относительно ординаты (кривая ФП*, рис. 114) будет наблюдаться в тех редких случаях, когда молярный объем жидкой фазы (Уз) меньше молярного объема твердой фазы (У1): ДУ= Уз -- У1 < 0.
ГЛАВА 37. ФИЗИКО-ХИМИЧЕСКИЕ ОСНОВЫ СИНТЕЗА
ВЕЩЕСТВА В ВОДНЫХ РАСТВОРАХ С ИСПОЛЬЗОВАНИЕМ РЕАКЦИЙ ПРИСОЕДИНЕНИЯ И ОБМЕНА
Неорганический синтез часто осуществляют в водных растворах либо путем смешения растворов исходных реагентов, либо путем введения одного или нескольких реагентов в раствор других реагентов. Физико-химическое изучение водно-солевых систем, систем, содержащих взаимодействующие соли и воду, позволяет получить ответ на вопросы: будут ли взятые сода взаимодействовать в воде при данной температуре с образованием нужного соединения, в какой области концентраций исходных солей это соединение образуется, будет ли оно устойчиво в водном растворе.
Ниже рассматриваются самые простые системы, содержащие две соли с общим анионом и воду, т. е. системы состава АХ - ВХ - НзО. Такие системы называют тройными.
Диаграммы состояния тройных водно-солевых систем строят по экспериментальным данным, полученным при изучении раствори-584
Рис. 115. Построение диаграммы состояния системы АХ — — ВХ — НгО при постоянной температуре (в); б — сосуд для определения растворимости:
1 — соленоид; 2 — раствор; 3 — мешалка; 4 — твердый остаток; Ф, — фигуративные точки жидкой фазы; К, — фигуративные точки составов твердых остатков; С — состав новой твердой фазы
мости соли АХ в растворе соли ВХ и, наоборот, при постоянной температуре. С этой целью в специальный сосуд (рис. 115, б), содержащий воду, загружают соли АХ и ВХ в определенном соотношении и погружают его в термостат. Смесь солей интенсивно перемешивают до установления фазового равновесия между твердой фазой и раствором. Соотношение твердых солей и воды каждый раз должно быть таким, чтобы после достижения фазового равновесия на дне сосуда оставался твердый остаток. Затем из сосуда, где установилось равновесие, отбирают для анализа часть жидкой фазы и часть твердого остатка. Данные анализа наносят на равносторонний треугольник составов (рис. 115, а).
В треугольнике составов каждая вершина отвечает исходным реагентам и растворителю. Стороны треугольника делят на 100 частей, каждая из которых отвечает 1%. Предположим, что в одной из проб равновесного раствора содержится 25% соли АХ и 50% соли ВХ. Проводя линии через точки 25% на стороне НзО-АХ и 50% на стороне НзО - ВХ, параллельные соответствующим сторонам треугольника (рис. 115, а), получим точку Ф1, отвечающую найденному составу раствора. Такую точку называют фигуративной. Аналогичным образом, по данным анализа пробы раствора из другого сосуда, содержащей 50% соли АХ и 25% соли ВХ, наносят на диаграмму точку Фз. Эти точки соединяют кривой линией Ф1Фз, которая и является кривой растворимости либо одной из солей, либо кривой растворимости полученного соединения.
Все точки линии НФ\ отвечают составам раствора с одним и тем же содержанием (25%) соли АХ, а все точки линии
585
отвечают составам раствора с одним и тем же содержанием (50%) соли ВХ.
Точки Н и D, находящиеся на сторонах треугольника составов, характеризуют растворимость в воде соответственно солей АХ и ВХ для данной температуры. Точки стороны треугольника АХ—ВХ отвечают различным соотношениям твердых солей.
Содержание солей в твердом остатке также наносят на диаграмму в виде точек Ку и К2. Твердый остаток содержит твердую фазу (кристаллы солей) и находящуюся между ними и на их поверхности жидкую фазу. Полученные точки Ф] и Ку, Ф2 и К2 соединяют прямой линией, называемой лучом Схрейнемакерса. Пересечение лучей Схрейнемакерса дает точку, определяющую состав твердой фазы.
Схрвйнвмакврс Франциеиус Антониус Губерту с (1864—1945) — голландский физикохимик, изучавший гетерогенные равновесия с применением правила фаз; см. его кн.: Нонвариантные, моновариантные и дивариантные равновесия. — М.: Издат-инлит, 1948.
Из положения кривой Ф1Ф2 следует, что перемещение точки Фз к точке Ф1 в сторону, противоположную вершине треугольника АХ, свидетельствует об уменьшении растворимости соли АХ и увеличении растворимости соли ВХ. Точки прямой линии НзО—Ф1 отвечают постоянному отношению концентраций солей в растворе, ВХ: АХ = const, или в приведенном на рис. 115 примере 50:25 = 2. Таким образом, линии внутри треугольника составов обладают следующими свойствами: прямая, проходящая через водный угол и любую фигуративную точку, отвечает постоянному отношению концентраций солей, прямая, проходящая параллельно одной из сторон треугольника, характеризует постоянную концентрацию в растворе той соли или воды, которым соответствует вершина треугольника, лежащая против проведенной прямой.
Подробнее см.: Аносов В. Я., Озерова М. И., Фиалков Ю. Я. Основы физико-химического анализа. — М.: Наука, 1976. С. 149, 277 и 418; Михеева В. И. Метод физико-химического анализа в неорганическом синтезе. — М.: Наука, 1975. С. 26, 145 и 220.
37.1. ДИАГРАММА СОСТОЯНИЯ СИСТЕМЫ, КОГДА СОЛИ НЕ ВЗАИМОДЕЙСТВУЮТ ДРУГ С ДРУГОМ И НЕ ОБРАЗУЮТ ТВЕРДЫХ РАСТВОРОВ
Вид диаграммы состояния системы, в которой соли не взаимодействуют между собой и не образуют твердых растворов, приведен на рис. 116. Поле на диаграмме (Нг0)Я£О — поле ненасыщенных растворов, кривые НЕ и ED — кривые растворимости соответственно соли АХ в присутствии соли ВХ и соли ВХ в присутствии соли АХ. Из положения кривых видно, что прибавление одной соли к насыщенному раствору другой приводит к уменьшению растворимости последней, к выделению ее части из раствора в виде кристаллов.
Если бы соли взаимно не влияли на растворимость, то кривые их растворимости НМ и MD были бы параллельны соответствующим сторонам треугольника составов, пока такие случаи не обнаружены.
586
Рис. 116. Диаграмма состояния системы с одной эвтонической точкой при постоянной температуре:
прямые НМ и DM отвечают случаю, когда соли АХ и ВХ ие влияют на растворимость друг друга
Когда обе соли увеличивают растворимость друг друга, то кривые их растворимости (или изотермы растворимости) лежат вне параллелограмма (Н2О)//Л/£>.
Точка Е — точка пересечения кривых НЕ и ED характеризует состав раствора, насыщенного при данной температуре двумя солями. Эту точку называют эвтонической. В эвтонической точке суммарная концентрация двух солей в воде при данной температуре максимальна, точка отвечает равновесию трех фаз: двух кристаллических (соли АХ и ВХ) и жидкой, раствора солей АХ и ВХ.
Поле Н—АХ—Е является полем, в котором в равновесии находятся кристаллы соли АХ и раствор, а поле D—ВХ—Е — полем, в котором в равновесии находятся кристаллы соли ВХ и раствор. Поле АХ—Е—ВХ поле трехфазного равновесия, аналогичного равновесию в эвтонической точке, но с различным соотношением твердых фаз, солей АХ и ВХ (рис. 116).
При добавлении порциями кристаллов соли ВХ к насыщенному раствору соли АХ (точка Н) точка Н начнет смещаться по мере добавления кристаллов соли ВХ по кривой растворимости НЕ соли АХ к эвтонической точке Е. Добавляемая соль ВХ будет растворяться в насыщенном водном растворе соли АХ, а из раствора будет выделяться в виде кристаллов соль АХ, так как ее растворимость в присутствии соли ВХ понижается.
В эвтонической точке раствор станет насыщенным не только по соли АХ, но и по соли ВХ, что вызовет одновременную кристаллизацию двух солей в виде механической их смеси. Дальнейшее добавление к раствору, имеющему состав точки Е соли ВХ, не вызовет смещения точки Е на кривую растворимости ED. Все добавляемое количество соли ВХ перейдет в осадок.
587
37.2. ДИАГРАММА СОСТОЯНИЯ СИСТЕМЫ, ДВЕ СОЛИ КОТОРОЙ ВЗАИМОДЕЙСТВУЮТ С ОБРАЗОВАНИЕМ КОНГРУЭНТНО РАСТВОРИМОГО БЕЗВОДНОГО СОЕДИНЕНИЯ
Диаграмма состояния системы, в которой происходит образование соединения, не разлагающегося при растворении в воде, имеет вид, представленный на рис. 117.
В этом случае на диаграмме появляется область Е1СЕ2 кристаллизации образовавшегося соединения С. Состав соединения определяется отношением отрезков АХ—С : С—ВХ, образующихся при пересечении лучей Схрейнемакерса Е\К\ и Е2К2 в точке С, лежащей на стороне АХ—ВХ треугольника составов.
Соединение С имеет свою кривую растворимости (или изотерму растворимости) Е1Е2. Диаграмма состояния в этом случае как бы разбивается лучом соединения Н2О—С на дне ранее рассмотренные диаграммы с одной эвтонической точкой. Так как луч соединения пересекает кривую растворимости соединения Е1Е2, то соединение
при растворении в воде не разлагается, является конгруэнтно р а с т в о*р и м ы м.
На диаграмме состояния системы (рис. 117) кроме поля Е1СЕ2 — поля кристаллизации соединения, находятся поле (Н2О)ЯЕ1Е2^> ненасыщенных растворов, поле HEi—АХ — поле кристализации соли АХ, поле Е2—ВХ—D — поле кристаллизации соли ВХ, поле АХ—EiC — поле кристаллизации соли АХ и соединения С и поле СЕ2—ВХ — поле кристаллизации соединения С и соли ВХ.
Если к ненасыщенному раствору соединения С, концентрация которого отвечает точке Ф1, лежащей на луче соединения НгО—С (все точки луча соединения отвечают постоянному отношению
Рис. 117. Диаграмма состояния системы с образованием безводного конгруэнтного растворимого соединения
АХ—С:С—ВХ), добавлять постепенно кристаллы соединения С, то раствор его станет все более концентрированным и точка Ф1 будет перемещаться по лучу соединения к его кривой растворимости. Когда точка Ф1 достигнет точки М, лежащей на кривой растворимости, образуется насыщенный водный раствор соединения С и новые порции кристаллов перестанут растворяться, наступит фазовое равновесие «кристаллы соединения С <—’ раствор». Состав солевой части раствора и твердой фазы в точке М будет один и тот же. Такое
588
растворение соединения С называют конгруэнтным, растворением без разложения, без образования новой твердой фазы.
Добавление новых порций кристаллов соединения С к раствору, имеющему состав, определяемый координатами точки М, не изменит ее положения, не изменит концентрации раствора при неизменной температуре. Добавляемые кристаллы будут оседать на дно сосуда, увеличивая количество твердой фазы.
Когда для синтеза применяют метод высаливания, то образование соединения происходит следующим образом. При добавлении к насыщенному раствору соли АХ (Г = const) небольшими порциями кристаллов соли ВХ при интенсивном перемешивании раствора будет происходить растворение соли ВХ и выделение кристаллов соли АХ. Точка Н начнет перемещаться по кривой растворимости соли АХ к эвтонической точке Е\. В растворе будет протекать реакция образования соединения С: АХ + ВХ = С и его ненасыщенного раствора. По мере добавления все новых количеств соли ВХ в растворе образуются все большие количества соединения С, увеличивающие его концентрацию в растворе. Одновременно из раствора будет выделяться часть соли АХ, не вступившей в реакцию с солью ВХ. Когда состав раствора достигнет эвтонической точки Е\, он окажется насыщенным по соединению С и поэтому дальнейшее добавление соли ВХ вызовет одновременное выделение кристаллов соединения С и кристаллов соли АХ. Последующее добавление соли ВХ к раствору вызовет уже растворение кристаллов соли АХ и выделение новых количеств кристаллов соединения С. Состав раствора, отвечающий координатам точки Е\, не будет изменяться до тех пор, пока в результате непрерывного добавления соли ВХ все кристаллы соли АХ из осадка не перейдут в раствор с образованием соединения С. Дальнейшее прибавление соли ВХ к раствору приведет к образованию новых количеств соединения С уже за счет уменьшения концентрации соли АХ в растворе, поэтому состав раствора начнет изменяться по кривой растворимости Е\—Ег соединения С, вызывая дальнейшую кристаллизацию соединения. Выделение кристаллов соединения С прекратится, как только состав раствора станет отвечать составу, определяемому эвтонической точкой Ег. С этого момента все добавляемое количество соли ВХ будет переходить в осадок, загрязняя выделившиеся прежде кристаллы соединения С.
Таким образом, синтез соединения С методом высаливания следует производить с использованием раствора состава точки Ф1 (рис. 117) и соли ВХ, добавление которой к этому раствору надо заканчивать после получения раствора состава, отвечающего точке <Т>4, лежащей вблизи эвтонической точки Ег.
Синтез соединения С возможен также и с использованием насыщенного раствора соли АХ (точка Н) путем добавления к последнему соли ВХ, как это было описано выше. Однако в этом случае возрастет длительность операций растворения кристаллов соли АХ и кристаллизации соединения С, увеличится и вероятность захвата выделяющимися кристаллами соединения С кристаллов выпадающей в осадок соли АХ и раствора.
589
Синтез соединения можно осуществить и обратным путем, добавлением к насыщенному раствору соли ВХ (точка D) кристаллов соли АХ.
Наконец, синтез соединения С возможен при помощи метода изотермического испарения, удалением при постоянной температуре растворителя (воды). В этом случае используют растворы, близкие по составу к точкам, лежащим между точками Ф1 и М. С уменьшением количества воды в системе точка Ф1 сначала совпадает с точкой М, и раствор станет насыщенным по соединению С, и начнется кристаллизация соединения. Кристаллизация будет продолжаться до полного удаления воды, при этом состав раствора не изменяется, точка М перемещается по лучу соединения до точки С.
Если же подвергнуть изотермическому упариванию раствор состава точки Фз, то вначале раствор станет насыщенным (точка Ф?) и соединение С станет выделяться в виде кристаллов. Кристаллизация будет продолжаться до тех пор, пока раствор не станет эвтоническим (точка Ег). В эвтонической точке будет выделяться механическая смесь кристаллов соединения С и кристаллов соли ВХ. Состав раствора останется неизменным до полного удаления воды.
Поэтому удаление растворителя следует прекратить еще до достижения эвтонической точки Е1 (рис. 117).
37.3. ДИАГРАММА СОСТОЯНИЯ СИСТЕМЫ, ДВЕ СОЛИ КОТОРОЙ ВЗАИМОДЕЙСТВУЮТ С ОБРАЗОВАНИЕМ ИНКОНГРУЭНТНО РАСТВОРИМОГО БЕЗВОДНОГО СОЕДИНЕНИЯ
Рис. 118. Диаграмма состояния системы с образованием безводного инконгруэнтно растворимого соедииения
Признаком разложения соединения при его растворении в воде является пересечение на диаграмме (рис. 118) лучом соединения (НгО)ФМС не его кривой растворимости, а кривых растворимости либо соли АХ, либо соли ВХ. Если соединение разлагается при его растворении в чистом растворителе, то оно называется и н-конгруэнтно растворимым. В приведенном на рис. 118 случае соединение С будет разлагаться также и в насыщенных растворах соли АХ. В ненасыщенном водном растворе соединения С (точка Ф) видимого разложения не
590
наблюдается. Соединение диссоциирует на две соли АХ и ВХ, концентрации которых определяются соотношением АХ—С:С—ВХ. При добавлении кристаллов соединения С к этому раствору концентрация соединения начнет увеличиваться и точка Ф станет двигаться к точке М. Движение фигуративной точки Ф по лучу соединения показывает изменение состава ненасыщенного раствора по мере увеличения концентрации соединения С. По достижении точки М раствор окажется насыщенным по соли АХ, но ненасыщенным по соединению С, так как точка М лежит на кривой растворимости соли АХ. Поэтому при дальнейшем добавлении кристаллов соединения к раствору соединение будет разлагаться, причем соль ВХ перейдет в раствор, а соль АХ выделится в осадок. В точке М в фазовом равновесии находятся кристаллы соли АХ и раствор. При дальнейшем добавлении кристаллов соединения к раствору состава точки М состав раствора начнет - изменяться по кривой растворимости от точки М к точке Р. Точка
Р называется переходной точкой. В растворе состава точки Р соединение уже не разлагается, так как эта точка принадлежит к кривой растворимости соединения. Добавление новых порций кристаллов соединения к раствору, имеющему состав точки Р, приведет к их осаждению на дно сосуда, где уже находится осадок кристаллов соли АХ. В точке Р в фазовом равновесии будут находиться две твердые фазы (АХ и С) и жидкая фаза, раствор состава точки Р (рис. 118).
Поэтому перекристаллизовывать из воды инконгруэнтно растворимые соединения нельзя, так как при перекристаллизации образуется механическая смесь кристаллов двух веществ, а не очищенные кристаллы соединения С.
Для синтеза инконгруэнтно растворимого соединения к насыщенному раствору соли АХ (точка М) добавляют при интенсивном перемешивании соль ВХ. Вначале соль ВХ будет переходить в раствор, а соответствующее количество соли АХ — выделяться вследствие уменьшения ее растворимости. Состав раствора будет изменяться по кривой растворимости соли АХ от точки М к точке Р, в нем будет повышаться концентрация соединения С. В переходной точке Р начнется кристаллизация соединения С, образуется механическая смесь кристаллов соединения и соли АХ (рис. 118).
Дальнейшее добавление соли ВХ вызовет растворение кристаллов АХ, которое будет продолжаться до тех пор, пока все они не перейдут в раствор, состав которого до этого момента остается постоянным, отвечающим координатам точки Р. После растворения последнего кристалла состав насыщенного раствора начнет с добавлением соли ВХ изменяться по кривой растворимости соединения С от точки Р к точке Е, раствор будет становиться все беднее и беднее по содержанию соли АХ и богаче по содержанию соединения С, непрерывно выделяющегося из раствора в виде кристаллов. Когда состав раствора достигнет точки Е, дальнейшее прибавление соли ВХ уже не вызовет кристаллизации соединения
591
Рис. 119. Диаграмма состояния системы, в которой образуется конгруэнтно растворимое соединение, содержащее в своем составе молекулы растворителя:
1 — поле ненасыщенных растворов; 2 — поле кристаллизации безводной соли АХ; 3 — поле кристаллизации соединения ОпНзО; 4 — поле кристаллизации соли ВХ, содержащей в своем составе молекулы растворителя; 5 — поле кристаллизации солей АХ и С’пНгО; б — поле кристаллизации C«nHjO и^ВХ^гиНгО; 7 — поле, содержащее смесь кристаллов ОпНгО, ВХ»тНгО и ВХ; 8 — поле, содержащее смесь кристаллов АХ, ВХ и ОпНгО
Рис. 120. Диаграмма состояния водно-солевой системы, в которой соли образуют твердые растворы: С — лучи Схрейнемакерса
С, так как все находившееся в растворе количество соли АХ окажется израсходованным на образование соединения. В точке Е в равновесии будут находиться три фазы: кристаллы соли ВХ, соединения С и раствор состава точки Е.
Поэтому добавление соли ВХ прекращают до достижения точки Е. На рис. 119 представлена диаграмма состояния системы, две соли которой при взаимодействии образуют конгруэнтно растворимое соединение СиНгО, содержащее в своем составе молекулы растворителя. Синтез таких соединений проводят, руководствуясь диаграммой состояния системы (рис. 119) и рекомендациями, изложенными выше.
Если две соли в водном растворе при данной температуре образуют непрерывный ряд твердых растворов (см. разделы 6.3 и 9.4), то диаграмма состояния такой системы будет иметь одну кривую растворимости твердого раствора (рис. 120) с веером равномерно расходящихся лучей Схрейнемакерса, оканчивающихся на стороне АХ—ВХ треугольника составов.
При добавлении к насыщенному раствору соли АХ (точка Н) небольшого количества соли ВХ из раствора выделится небольшое количество твердого раствора двух солей АХ и ВХ с небольшим содержанием соли ВХ, часть катионов А будет замещена на катионы В без изменения формы кристаллов и их
592
структуры. Изменение состава твердого раствора происходит от менее растворимой соли АХ к более растворимой соли ВХ (показано стрелкой, рис. 120).
По мере добавления новых порций кристаллов соли ВХ к раствору из последнего будут выделяться новые порции кристаллов твердого раствора, все более обогащенного катионами В. Фигуративная точка Ф, характеризующая состав раствора, будет перемещаться по кривой HD к точке D, а состав твердого раствора — изменяться по стороне треугольника от АХ к ВХ. В точке D кристаллизоваться будет уже соль ВХ (рис. 120).
ИМЕННОЙ УКАЗАТЕЛЬ
Агрикола Г. 264 Альберт фон Больштедт 264 АрфедСен Ю. 198 Ауэр фон Вельсбах К. 502 Гольдберг К. 143 Гунд Ф. 36 Дальтон Дж. 144, 505
Багратион П. 398 Байен П. 298 БаларА. 322 Бальмер И. 530 Бартлетт Н. 343 Бекетов Н. 143 Бертолле К. 15, 505 Берцелиус Й. 230, 298, 503 Бирон Е. 57 Больцман Л. 98, 126 БорН. 25 Борн М. 30 Бранд X. 264 Брандт Г. 479 БрёнстедЙ. 171 Брэгг У. 535 Бунзен Р. 198 Бутлеров А. 62 . Дебай П. 98 ДеберейнерИ. 41 Де Бройль Л. 27 Дель Рио А. 434 Демарсе Э. 502 Де МорвоЛ. 15 Де Фуркуа А. 15 Де Шанкуртуа Б. 41 Д жоуль Дж. 118 Дэви Г. 198 Кавендиш Г. 189, 264 Кеезом В. 98 Керн С. 462 Кирхгоф Г. 198 Клапейрон Б. 145 Клапрот М. 298, 426, 503 Клаузиус Р. 123 Клаус К. 479
Вааге П. 143 Ван-ден-Брук А. 44, 537 Ван-дер-Ваальс Я. 97 Вант-Гофф Я. 146 Вёлер Ф. 284, 423 Вернер А. 353 ВиклерК. 42 ВокленЛ. 198, 446 Вулластон У. 479 Вульф Г. 535 Клечковский В. 47 Клеве П. 502 Костер Д. 426 Кронстедт А. 479 КрофордА. 198 Крукс У. 215 Курнаков Н. 508 Куртуа Б. 322 Курчатов И. 426 Кюри П. 198
Гадолин Ю. 502 Ган О. 503 Гейзенберг В. 27 Гей-Люссак Ж. 215 Гельмгольц Г. 118, 572 Генри У. 154 Гесс Г. 122 Гиббс Дж. 129, 568, 578 ГиорсоА. 503 Гленденин Л. 502 Грегор У. 426 Лавуазье А. 15, 264, 298 Латимер В. 137 Леблан Н. 208 Лекок де Буабодран П. 42,. 215, 502 Ленард-Джонс Д. 101 Ле Шателье А. 148 Локьер Н. 348 Ломоносов М. 5 Лондон Ф. 99 Лоури Т. 171 Льюис Г. 62
Майер Ю. 118
Малликен Р. 87
Макмиллан Э. 503
МаринскийДж. 502
Мариньяк Ж. 502
Мейер Л. 42, 51
Мейтнер Л. 503
Менделеев Д. 40, 187, 215, 322, 423,
462
Митчерлих Э. 161
Мозли Г. 44, 537
Мосацдер К. 502
Муассан А. 322
Нернст В. 551
Несслер Ю. 417
Нильсон Л. 42, 423
Ноддак В. 462
Ньюленде Дж. 41
Одлинг У. 42
Оствальд В. ПО, 179
Серге Э. 322, 462
Сёфстрем Н. 434
СиборгГ. 503
Сиджвик Н. 365
Склодовская-Кюри М. 198, 298
Сольве Э. 207
Схрейнемакерс Ф. 586
Такке И. 462
Тенар Л. 215
Теннант С. 479
Томсон В. 11
Томсен Ю. 426
УрбенГ. 423
Фарадей М. 10
Фаянс К. 163
Флёров Г. 423, 434, 446, 462. 503
Френкель 506
Паули В. 36
Перей М. 198
Перье К. 462
Планк М. 25
Полинг Л. 60
Пристли Дж. 264, 298
Пруст Ж. 505
Рамзай У. 348
Резерфорд Д. 264
Резерфорд Э. 23
Рейх Ф. 215
Рентген В. 530
Ридберг Ю. 40, 530
Рихтер И. 215, 505
Розе Г. 434
Рэлей Дж. 348
Хевеши Д. 426
Цейзе В. 367
Цельсий А. 11
Черняев И. 390
Чугаев Л. 368
Шееле К. 264, 298, 322, 445, 462
Шоттки 506
Шредингер Э. 29, 538
Штромейер Ф. 410
Эйбелсон Ф. 503
Эйнштейн А. 25
ЭкебергА. 434
Эрстед X. 215
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
Автопротолиз 172
Азеотропные смеси 331
Азиды 271
Азот 46, 73, 260
— гидриды 266
— кислородные кислоты 274, 276
— круговорот в природе 524
— молекула 69, 90, 264
— — лиганд 265
— оксиды 77, 79, 273, 277 , 329, 519
— получение 265, 328
Азотная кислота 136, 172, 279
Актиний 498
Актиноиды 16, 496
Аллотропия 109
Алмаз 109, 230, 233, 349
Алунит 214
Алюминий 213
— галогениды 66, 222, 225
— гидроксокомплексы 225, 352, 360
— гидроксид 224
— соли 182, 184, 241, 341, 366
Алюмосиликаты 214
Америций 498
Амиды 177, 268
Аммиак 78, 144, 267, 328
595
— получение 144, 148, 268
Аммиакаты 360
Аммония соли 109, 189, 207, 239, 268
Амфолиты 172, 174
Анизотропия 108
Анионгалогенаты 321, 328, 355, 363
Апатит 263, 502
Аргон 343
Арсенопирит 263
Атмосфера, состав 516
Атом 23, 52
— возбужденное состояние 72
— магнитные свойства 37
— сродство к электрону 38
— уровни энергии 34
— центральный 355
— энергия ионизации 38, 52
Атомная орбиталь 31, 64, 380
— гибридизация 74, 375
Аурипигмент 263
Аустенит 480
Ацетилениды 241
Ацидокомплексы 361
Аэрозоли 152, 519
Бадделеит 425
Барит 197
Барий и его соли 192, 200, 205, 337, 514
Бериллий и его соли 45, 72, 196, 200, 210, 361
Берклий 498
Бертоллиды 507
Биосфера 515
Благородные газы 343, 346, 351
Бокситы 214, 423
Бор 46, 72, 350
— галогениды 183, 221
— комплексы 66, 183, 194, 217, 363,366
— нитрид 108, 226
— оксид 218
Бораны 193, 217
Бориды 222
Борная кислота 103, 183, 215, 219
Бром 326, 329, 332
— бромоводород 330
— кислородные кислоты 332, 335
— свойства 155, 326, 328, 340
Бронза 258
— вольфрамовая 511
<;Бура 214
Валентность 71
Ванадий 435, 442
— аквакатионы 433, 436, 438
— галогениды 433, 439
— гидроксид 437
— катион диоксованадия 435
— — окоспентаакваванадия 438
— оксиды 433, 437
— пероксокомплексы 362, 442
Ванадинит 434
Вещество 8, 16, 105
— агрегатные состояния 103, 106, 110
— изоморфное 160, 265
— магнитные свойства 37
— полиморфизм 109
Висмут 260, 262, 308
Вода 11. 104
— ионное произведение 173
— экологические проблемы 520
Водород 16, 88, 167, 189
— ионы оксоння 171
— полипероксиды 301, 337, 350
— получение 191, 329, 339
Водородная связь 101, 103
Водородный показатель 173
Водородный электрод 133
Вольфрам 191, 366, 446, 449, 510
Вольфрамит 445
Вюрцит 298, 410
Гадолиний 498
Гадолинит 423, 502
Газовая постоянная 126
Газы
— благородные 16, 88, 343
— гидраты 309
— расторимость 154
Галенит 229, 298
Галит 197, 321
Галогеноводороды 330
Галогены 320
— комплексные соединения 363
Гафний 424
Гелий 88, 348
Гематит 478
Германий 191, 228, 230, 236, 242
Гидразин 268
Гидратация 162, 512
Гидриды 192, 194, 511
Гидроксиламин 270
Гидроксокомплексы 225, 359
Гидроксид-ион 178
Гидролиз 182
Гидросфера 520
Гипс 197, 298
Графит 230, 513
Давление 12
— парциональное 144,- 154, 570
Дальтониды 507
Дентатность 356
Дислокации 507
Джоуль, единица 14
Диады 45
Диаграмма
— Мозли 537
— Латимера 136
596
— растворимости 157
— фазовая 104, 156, 582
— энергетическая 85
Диполь 98
Дипольный момент электрический 80
Дисперсность 152
Диссоциация
— термическая 268, 281, 290, 315
— электролитическая 166, 168
Доломит 197, 229
Дициан 247
Европий 498
Единицы формульные 8
Железо 167, 479, 481, 484, 491
— аквакатионы 181, 354, 381, 485
— ацидокомплексы 361, 486
— гексацианоферраты 362, 372, 374
— гидроксиды 480, 482
— карбонилы 364, 366, 487
— нитрогенилы 490
— оксиды 477, 480, 482, 510
— пи-комплексы 489 '
Жолиотий 498
Закон (ы)
— Генри 154
— Гесса 122
— действующих масс 143
— Мозли 537
— периодический 40
— постоянства состава 505
— простых и кратных отношений 505
— разбавления Оствальда 179
— распределения 580
— термодинамики 118, 126
— эквивалентов 505
Заряд эффективный 79
Золото 327, 395, 399, 408
— аммиакат 407
— ацидокомплексы 354
— дицианоаураты 354, 362, 396, 398
Известняк 229
Изоморфизм 160
Ильменит 425
Ицдий 213
Иод 320, 326, 328, 331, 340
— иодоводород 142, 149, 328, 330
— комплексы 327, 363
— кислородные кислоты 332, 335, 337
Ионы 16, 167
— полиионы 188
Ионные пары 167
Иридий 381
Иттрий 420, 423, 514
Кадмий 414, 415, 418
— аквакомплексы 411, 412
— аммиакат 414, 417
— гидроксид 413
— экологические проблемы 519
Калий 201, 205, 210
— аквакатион 202
— гидрид 193
— гидроксид 202
— оксиды 202, 204
— Кальций 109, 137, 192, 200, 210
— гидроксид 205
— карбид 182, 241
— карбонат 207
— оксид 202, 206
Кальцит 197, 229
Каолин 214
Карбамид 239
Карбаминовая кислота 239
Карбиды 241, 511
Карбин 230, 349
Карбонаты 240
Карбонилы 352, 355, 364
Карбораны 188
Карналлит 197, 321
Касситерит 229, 423
Катализатор 149, 562
Катионгалогены 321, 364
Квантовая ячейка 32
Квантовые числа 30, 544
Кварцевое стекло 237
Квасцы 209
Кизерит 197, 298
Киноварь 410
Кислород 46, 74, 89, 127, 299, 343
— круговорот в природе 516, 525
— надпероксид-ион 299
— озонид-ион 299
— оксония-ион 170
— свойства 299, 515
— фториды 303, 350
Кислоты 18, 135, 171, 174
Кислотно-основные сопряженные
пары 171
Кислотность, шкала 176
Кларк 190
Кластеры 22, 355
Кобальт 362
— аммиакаты 361, 377, 381
— ацидокомплексы 362, 372, 378
— комплексы разные 364, 373, 378, 384
Кобальтин 478
Ковелин 395
Колумбит 434
Комплексные соединения 20, 351
— аквакомплексы 359
— активированные 561
— внешнеорбитальные 378
— внешняя сфера 358
— внутренняя сфера 358
— внутриорбитальные 378
597
— высокоспиновые 382
— галогенов 363
— гидридные 366
— изомерия 369, 371, 375
— магнитные свойства 382
— многоядерные 22, 369
— названия 20
— низкоспиновые 383
— нитрогенилы 265
— окраска 384
— с переносом заряда 329
— пи-комплексы 367
— пероксокомплексы 362
— реакции 353
— тиокомплексы 405, 447
— хелаты 367, 389
Комплексообразователь 355, 357, 376
— названия 21
Константа
— автопротолиза 172, 174
— кислотности 174, 179, 182
— образования комплекса 388
— основности 177, 179, 182
— скорости реакции 557
— химического равновесия 143
Кремний 230, 233, 257
— галогениды 182, 191, 243
— гидрид 184, 193, 242, 350
— кислородные кислоты 238
— нитрид 231, 266
— оксиды 108, 184, 236, 325
— сульфид 245
— фторид 325
Кривая расслаивания 156
Криолит 321
Криптон 189, 348
Кристаллизация 159, 161
Кристаллическая решетка 107, 111, 506
Кристаллическое поле 378
Кристаллы, зародыши 159
Ксенон 78, 348
Ксенотим 423
Курчатовий 426
Кюрий 498
Магний 200, 202, 210
— гидроксид и оксид 202
— карбонат 206
— нитрид 182
— силицид 194
— соли 205
Марганец 136, 462
— аквакатионы 381, 462, 465
— гидроксиды 465
— комплексы 461, 471
— оксиды 329, 465
— соли 463, 470
Мартенсит 480
Масса 10
Массовое число И, 23
Медь 395, 398, 408
— аквакатионы 389, 399, 401
— аммиакаты 355, 361, 396, 399, 407
— ацидокомплексы 353, 389
— галогениды 330, 402
— диглицинатомедь (II) 368
— дицианокупраты 353, 396
— гидроксид 399, 401
— карбонаты 405
— оксиды 397, 399, 401, 514
— соли 184, 396, 402, 404
— токсикология 408, 521
Межгалогенные соединения 321, 350
Менделевий 498
Мирабилит 197, 298
Молекула 74, 83, 97
— виды взаимодействия 98, 101, 164
Молекулярные орбитали 84
— двухцентровые 86
— несвязывающие 92, 95
— разрыхляющие 87, 95
— связывающие 87, 95
— трехцентровые 92
— энергетичская диаграмма 85
Молибдеи 444, 446, 449, 451
Молибденовая «синь» 510
Молибденит 445
Моль 8
Монацит 432, 502
Мышьяк 182, 193, 262, 412
Лантаи 498, 514
Лантаноиды 16, 496
Лиганд 20, 356, 380
Литий 45, 198, 201, 210
— гидрид 201
— гидроксид и оксид 202
— нитрид 201
— соли 205
Литосфера 522
Лопарит 423, 426, 434, 502
Лютеций 420
Магнезит 197, 229
Магнетит 478
Натрий 196, 198, 210
— гцдроксид 202, 205, 329
— карбонат 206
— оксиды 202, 204
—• СОЛИ 205, 329
Неодим 498
Неон 46, 348
Нептуний 498
Несслера реактив 417
Нефелин 208, 214
Неэлектролиты 166
Никелин 478
Никель 181, 364, 368
— аммиакаты 376, 389
598
— карбонил 364, 366 Нильсборий 435 Ниобий 435, 437, 442 — галогениды 440 — кластеры 442
— комплексы 362, 441
Нитраты 281
Нитриды 265, 511 Нитриты 277 Нитрогенилы 265
Озон 300, 516, 518
Окисления степень 54
Оксид-ион 177
Оксиды двойные 17, 511
Оксокислоты 135
Оксоляция 183, 360, 429
Олово 248, 250, 257
— галогениды 183, 255
— гидроксиды и оксиды 250
— гидроксокислоты 253, 510
— комплексы 250, 252, 354
— соли 254, 256
Оляция 183, 360, 429
Осмий 476
Основания 170, 176, 178
Палладий 191, 235, 393
Параметр расщепления 380
Пассивирование 222, 280, 315
Патронит 434
Переходная точка 591
Периодичность 50, 53, 56, 196, 213
Периоды 43
Пероксокислоты 316
Перовскит 425
Петландит 478
Пирит 298, 478
Пиролюзит 461
Пирохлор 434
Планка постоянная 27
Платина 327, 343, 367, 370
Плеохроизм 108
Плотность вещества 12
— оптическая 384
Плутоний 498
Повеллит 445
Полвые шпаты 214, 240
Полииодоиодаты 512
Полиморфизм 108
Полиморфные переходы 108, 233, 248
Полисульфиды 305, 350
Политионовые кислоты 311
Пол л пит 197
Поляризация света 373
— электронная 99
Потенциал электронный 117, 132
Порядковый номер элемента 11, 23, 43
Празеодим 498
Правило
— Клечковского 47
— Сиджвика 365
— фаз Гиббса 574, 578
Принцип
— дополнительности Бора 39
— Ле Шателье 148
— минимума энергии 36
— неопределенности Гейзенберга 27
— Паулн 36
Произведение растворимости 168
Прометий 498
Протактиний 498
Протолиз 171
— влияние температуры 180 •
Протолиты 171
Протон 23, 170
Псевдогалогены 246
Псиломелан 462
Работа 14, 116, 132
Равновесие
— гетерогенное 167, 582
— гомогенное 167, 170
— ионное 166, 387
— истинное 140
— констата 572
— метастабильное 140, 158
— протолитическое 170, 560, 565
— термодинамическое 124, 129, 141
— фазовое 131, 155, 168, 581
— химическое 140
Растворы 152, 155, 158, 161
— концентрации 13
— твердые 160, 265
Растворение
— инконгруэитиое 590
— интегральная энтальпия 163
— конгруэнтное 588
Растворители 153
— апротонные 172
— дифференцирующие 180
— нивелирующие 180
— протонные 172
Рацемат 373
Реакции
— внутримолекулярные 550, 555
— диспропорционирования 134, 551, 555
— замещения лигандов 387, 390, 565
— комплексообразования 353, 355, 387, 390
— конмутации 551
— константа скорости 557
— межмолекулярные 550
— механизм 564
— молекулярность 564
— необратимые 129, 141
— обратимые 124, 142
599
— окислительно-восстановительные 131, 135, 546, 565
— полуреакции 132, 134, 547
— порядок 556
— скорость 556
— термохимические 120, 555
— химические, изотерма 146, 569
— цепные 327
Реальгар 263
Резерфордий 420
Рений 462, 465, 468, 471
Родий 381
Родохрозит 462
Ртуть 410, 413, 418
— галогениды 413, 415
— карбонат 415
— комплексы 352, 416, 418
— нитрид 417
— оксид 337, 413
— соли 411, 414
— токсикология 419, 519, 521
Рубидий 189, 198, 203, 205, 338
Рутил 425
Ряд
— лигандов по траис-влиянию 391
— напряжений электрохимический 134
— спектрохимический 382
Самарий 498
Свинец 181, 248, 250, 257
— гидроксид и оксид 250
— гцдроксокислрты 253
— комплексы 252, 254
— соли 122, 183, 254, 256
— экологические проблемы 519,521,523
Селен 296, 298
Сера 109, 304, 306, 331, 349
— галогениды 77, 183, 317
— кислородные кислоты 309
— круговорот в природе 527
— оксиды 309, 313, 518
Сериая кислота 136, 314, 331
Серебро 191, 395, 397, 399
— аммиакаты 352, 407
— галогениды 402
— дицианоаргентаты 376, 388
— оксиды 399, 401
— соли 191, 396, 402, 404
Сероводород 68, 306, 328, 519
Сидерит 478
Силаны 184, 193, 244, 350
Силикаты 240
Силициды 241
Сильвии 197, 321
Сингония 107
Сингулярная точка 508
Системы 14
— вариантность
— гетерогенные 114, 582
— гомогенные 114
— закрытые 117, 125.
— изолированные 117, 125
— компонент 573
— кристаллические 107
— открытые 117
— тройные 584
Скандий 420
Смитсонит 410
Сольватация 162
Спектры, классификация 385, 530, 533
Стехиометрия реакции 507
Стронций 196, 205
Сульфаны 315
Сульфиды 307 .
Сульфиты 310, 328
Сурьма 260, 360, 364
Суспензия 152
Сфалерит 410
Таллий 212, 214
Тантал 363, 436, 439, 441
Таутомерия 271
Теллур 296, 298
Температура критическая 104, 113, 155
Теплота 115, 119
Тербий 498
Термы спектральные 531
Технеций 462, 466, 471
Тиокарбамид 247
Тиосфульматы 312, 328, 368
Тиоцианаты 149, 247
Титан 385, 425, 427
— галогениды 183, 427, 430
— гидрид 192, 194, 428
— комплексы 360, 425, 429, 431
— нитрогенилы 431
— оксиды 183, 427, 510
— сульфаты 425, 427, 430
Титаномагнетит 425, 434
Торий 498
Тортвейтит 240, 423
Тритий 190
Тулий 498
Углерод 46, 73, 109, 228, 349
— галогениды 183, 243
— дисульфид 245
— круговорот в природе 526
— оксиды 92, 121, 189, 234, 328, 516
Угольная кислота 238
Уравнения
— Бальмера — Ридберга 530
— Брэгга — Вульфа 535
— Ваит-Гоффа 147
— Вант-Гофф^ — Аррениуса 561
— волновое 29
— де Бройля 27
— изотермы химической реакции 146, 569
600
— кинетическое 557
— Калпейрона — Клаузиуса 145
— Нернста 551
— Планка 24
— термохимическое 120, 163
— Шредингера 29, 540
— Фаянса 163
Уран 498, 500
Урановая смоляная руда 502
Фаза 106, 114, 575
Фарадея постоянная 10, 117
Ферроцен 367, 489
Фигуративная точка 585
Флюорит 197, 321
Фосфаты 290
Фосфиды 291
Фосфор 68, 109, 136, 282, 349
— галогениды 182, 184, 292
— гидриды 193, 291
— круговорот в природе 527
— кислоты 184, 285, 287, 289
— оксиды 284, 286
— получение 284
Фотон 24, 384
Фтор 46, 74, 322, 324
Фториды 94, 103, 325
Фтороводород 91, 324
Фторопласт 341
Халькогены 16
Халькозин 395
Халькопирит 298, 395
Химическая связь 59, 69, 71, 79
— длина 83
— ионная 59, 81
— ковалентная 67
— кратная 71, 89
— механизм 62, 65
— энергия 82
Хлор 66, 326, 328
— кислородные кислоты 67, 333, 335
— оксиды 332, 334
— соли кислот 327, 329, 337
Хлороводород 327, 330
Хром 374, 444, 446, 448
— галогениды 448, 454
— гетерополисоединения 458
— гидроксиды и оксид 449, 451
— изополисоединения 449, 458
— комплексы 354, 360, 366, 373, 456
— соли 447, 453
Хромит 445
Цезий 189, 197, 205, 210, 364
Целестин 197
Цементит 480
Цеолиты 240
Церий 181, 498
Циаиоводород 246
Цинк 181, 411
— амфотерность 414
— карбонат 415
— комплексы 361, 410, 413, 416
— соли 413
— токсикология 419, 521
Циркон 425
Цирконий 426, 428, 430
— оксид 427, 429
Шеелит 445
Шёниты 209
Шпинель 445
Эвксенит 502
Эвтоническая точка 587
Ъйнштейний 498
Эквивалент 8
Электроотрицательность 60
Электрон гидратированный 566
Эмульсия 152
Энергия 14, 34, 48
— активации 560
— атомизации 53
— внутренняя 114
— Гельмгольца 568
— Гиббса 129, 568
— квантование 24
— нулевая 83
— стабилизации кристаллическим по-
лем лигандов 381
Энтальпия 119, 121, 163
Энтропия 123, 126, 164, 390
Эрбий 498
Эффект
— «инертной пары» 262
— общего иона 170
— транс-влияния 390
— желатный 389
Оглавление
Предисловие ............................................... 3
ЧАСТЬ I ТЕОРЕТИЧЕСКИЕ ОСНОВЫ НЕОРГАНИЧЕСКОЙ ХИМИИ ............................ 5
Глава 1. Международная система единиц физических величин, применяемая в неорганической химии..................................... 6
1.1. Длина................................................... 7
1.2. Количество вещества .................................... 8
1.3. Масса .................................................. 9
1.4. Термодинамическая температура.......................... 11
1.5. Объем и плотность вещества ............................ 12
1.6. Давление .............................................. 12
1.7. Концентрация .......................................... 13
1.8. Энергетические величины................................ 14
Упражнения к главе 1........................................ 15
Глава 2. Номенклатура неорганических веществ........................... 15
2.1. Химические элементы ................................... 16
2.2. Простые вещества....................................... 16
2.3. Ионы................................................... 16
2.4. Простые соединения .................................... 17
2.5. Кислоты и их соли...................................... 18
2.6. Комплексные соединения ................................ 20
Упражнения к главе 2........................................ 22
Глава 3. Электронное строение атома.................................... 23
3.1. Три основополагающие идеи квантовой механики ........ 24
3.2. Волновое уравнение..................................... 29
3.3. Квантовые числа........................................ 30
3.4. Атомные орбитали. Физический смысл квантовых чисел 31
3.5. Функция радиального распределения вероятности ........ 33
3.6. Энергетические уровни и подуровни в атомах............. 34
3.7. Магнитные и энергетические характеристики атомов .... 37
Упражнения к главе 3........................................ 40
Глава 4. Периодический закон........................................... 40
4.1. Доменделеевская систематизация элементов ............. 40
4.2. Структура периодической системы химических элементов 42 4.3. Порядковый номер элемента ........................< 43
4.4. Период, число элементов в периоде...................... 44
4.5. Группы элементов...................................... 49
4.6. Периодическое изменение свойств элементов . ........... 50
Упражнения к главе 4................................•. . . 58
Глава 5. Химическая связь и строение молекул .......................... 59
5.1. Электроотрицательность ................................ 60
5.2. Природа ковалентной связи и механизм ее образования . . 62
5.3. Структура ковалентных молекул типа АВ„............, 74
5.4. Полярность ковалентной химической связи........ 79
5.5. Ионная химическая связь .............................. 81
5-6. Энергия ковалентной химической связи........... 82
602
5.7. Основные понятия о методе молекулярных орбиталей . . 84
Упражнения к главе 5 ...................................... 96
Глава 6. Межмолекулярное взаимодействие. Агрегатное состояние вещества ............................................................. 96
6.1. Природа межмолекулярных сил. Энергия межмолекулярного взаимодействия............................................. 98
6.2. Водородная связь...................................... 101
6.3. Агрегатные состояния вещества........................ 103
Упражнения к главе 6 ...................................... 113
Глава 7. Энергетика химических реакций .............................. 114
7.1. Внутренняя энергия, теплота и работа.................. 114
7.2. Первый закон термодинамики............................ 118
7.3. Тепловой эффект химической реакции. Энтальпия .... 119
7.4. Энтальпия образования веществ......................... 121
7.5. Закон Гесса и его следствия......................... 122
7.6. Энтропия. Термодинамическое равновесие ............... 123
7.7. Второй закон термодинамики .......................... 125
7.8. Энтропия — мера упорядоченного состояния систем и веществ на молекулярном уровне......................... 127
7.9. Энергия Гиббса — критерий направленности химических реакций в закрытых системах ............................. 229
7.10. Направление окислительно-восстановительных реакций . 231
7.11. Окислительно-восстановительные свойства кислот .... 135
Упражнения к главе 7 ..................................... 139
Глава 8. Химическое равновесие....................................... 140
8.1. Обратимые и необратимые химические реакции....... 141
8.2. Константа химического равновесия. Закон действующих масс 143
8.3. Изотерма химической реакции. Уравнение Вант-Гоффа . 146
8.4. Принцип Ле Шателье................................... 148
Упражнения к главе 8 ............................ . . . 151
Глава 9. Растворы ................................................... 151
9.1. Общие понятия........................................ 152
9.2. Растворимость газов в жидкостях...................... 154
9.3. Взаимная растворимость жидкостей ................... 155
9.4. Растворимость твердых веществ ....'.................. 157
9.5. Энергетика образования растворов ................... 161
Упражнения к главе 9 ..................................... 166
Глава 10. Ионные равновесия в растворах 166
10.1. Гетерогенные иоииые равновесия .................... 167
10.2. Гомогенные ионные равновесия. Протолитические равновесия ..................................................... 170
10.3. Гидролиз............................................ 182
Упражнения к главе 10.................................... 186
ЧАСТЬ П ХИМИЯ ПРОСТЫХ
ВЕЩЕСТВ И
СОЕДИНЕНИЙ ЭЛЕМЕНТОВ.............. 187
Глава 11. Химия водорода............................................ 189
11.1. Распространенность в природе...................... 190
11.2. Физико-химические свойства..................; . . . 190
11.3. Получение......................................... 191
11.4. Гидриды ........................................... 192
11.5. Применение......................................... 194
11.6. Токсикология ...................................... 195
603
Упражнения к главе 11 ........................................ 195
Глава 12. Химия s-элементов.............................................. 195
12.1. Распространность в природе. Основные минералы .... 197
12.2. Физико-химические свойства простых веществ...... 198
12.3. Металлургия щелочных, щелочно-земельных металлов, бериллия и магния . .•.................................... 201
12.4. Химия водных растворов ................................. 202
12.5. Оксиды и гидроксиды .................................... 202
12.6. Соли ................................................... 205
12.7. Применение.............................................. 210
12.8. Токсикология ........................................... 211
Упражнения к главе 12 ................................. 211
Гл а в а 13. Химия элементов ША-группы................................... 212
13.1. Распространенность в природе. Основные минералы . . . 214
13.2. Физико-химические свойства бора ........................ 215
13.3. Получение бора.......................................... 216
13.4. Химия водных растворов ................................. 217
13.5. Гидриды бора (бораны) .................................. 217
13.6. Оксид и гидроксид бора.................................. 218
13.7. Бораты металлов ........................................ 220
13.8. Галогениды бора ........................................ 221
13.9. Бориды металлов......................................... 222
13.10. Физико-химические свойства алюминия ................... 222
13.11. Получение алюминия . . .^............................ 223
13.12. Химия водных растворов................................ 224
13.13. Оксиды и гидроксиды .................................. 224
13.14. Галогениды алюминия ..................:............... 225
13.15. Применение ........................................... 226
13.16. Токсикология.......................................... 227
Упражнения к главе 13 ........................................ 227
Глава 14. Химия элементов IVA-группы .................................... 228
14.1. Распространенность в природе. Основные минералы . . . 229
14.2. Физико-химические свойства углерода, кремния и германия 230
14.3. Получение алмазов, кремния и германия .......... 233
14.4. Оксиды........................................... 234
14.5. Кислородные кислоты углерода, кремния и германия . . 238
14.6. Карбонаты, силикаты и германаты ....................... 240
14.7. Карбиды, силициды и германиды.................... 241
14.8. Гидриды ............................................... 242
14.9. Галогениды....................................... 243
14.10. Сульфиды.............................................. 245
14.11. Соединения углерода, кремния и германия с азотом. Псевдогалогены и .псевдогалогениды........................... 245
14.12. Физико-химические свойства олова и свинца .. 250
14.13. Получение олова и свинца ............................. 250
14.14. Химия водных растворов................................ 250
14.15. Оксиды, гидроксид-оксиды и кислоты ........... 250
14.16. Соли.................................................. 254
14.17. Применение ........................................... 257
14.18. Токсикология.......................................... 259
Упражнения к главе 14 .............................'. . . 259
Глава 15. Химия элементов VA-группы...................................... 260
15.1. Общая характеристика соединений элементов УА-группы 261
15.2. Распространенность в природе. Основные минералы . . . 263
15.3. Физико-химические свойства азота................. 264
15.4. Нитриды.......................................... 265
15.5. Соединения азота с водородом..................... 266
15.6. Кислородные соединения азота..................... 273
15.7. Физико-химические свойства фосфора............... 282
15.8. Получение фосфора ..................................... 284
15.9. Кислородные соединения фосфора ....................... 284
604
15.10. Фосфиды . . . :........................................... 291
15.11. Гидриды фосфора............................................ 291
15.12. Галогениды и оксид-галогениды фосфора ..................... 292
15.13. Применение ............................................... 293
15.14. Токсикология............................................... 294
Упражнения к главе 15 ............................................ 295
Глава 16. Химия элементов VIA-группы ........................................ 296
16.1. Распространенность в природе. Основные минералы . . . 297
16.2. Кислород. Физико-химические свойства................ 299
16.3. Пероксид водорода........................................... 301
16.4. Фториды кислорода .......................................... 303
16.5. Диоксигенильные соединения ................... 304
16.6. Сера. Физико-химические свойства............................ 304
16.7. Сульфаны ................................................... 306
16.8. Кислородные соединения серы................................. 308
16.9. Галогениды серы ............................................ 317
16.10. Применение ............................................... 318
16.11. Токсикология.............................................. 319
Упражнения к главе 16 ............................................ 319
Глава 17. Химия элементов VIIA-группы........................................ 320
17.1. Распространенность в природе. Основные минералы ... 321
17.2. Фтор. Физико-химические свойства ........................... 322
17.3. Фторид водорода............................................. 322
17.4. Хлор, бром и иод. Физико-химические свойства..... 326
17.5. Получение галогенов......................................... 329
17.6. Галогеноводороды............................................ 330
17.7. Оксиды хлора, брома и иода............,..................... 332
17.8. Кислородные кислоты хлора, брома и иода..................... 335
17.9. Соли кислородных кислот галогенов .......................... 337
17.10. Окислительно-восстановительная способность кислородных кислот галогенов и их солей ..........................339 ;
17.11. Применение ................................................ 340
17.12. Токсикология............................................... 342
Упражнения к главе 17 .......................................... 342
Глава 18. Общая характеристика физико-химических свойств благородных газов и их соединений .......................................... 343
18.1. Фториды благородных газов .................................. 344
18.2. Оксиды благородных газов ................................... 346
18.3. Распространенность в природе................................ 347
18.4. Применение ................................................. 348
18.5. Токсикология ............................................... 348
Упражнения к главе 18 ............................................ 351
Глава 19. Комплексные соединения............................................. 351
19.1. Реакции комплексообразования .............................. 353
19.2. Основные понятия координационной теории ................... 355
19.3. Основные типы комплексных соединений....................... 359
19.4. Изомерия комплексных соединений............................ 369
19.5. Природа химической связи в комплексных соединениях 375
19.6. Ионные равновесия в растворах комплексных соединений 387 19-7- Применение ................................................ 392
19.8. Токсикология .............................................. 392
Упражнения к главе 19 ........................................... 392
Глава 20. Химия элементов IB-группы ......................................... 393
20.1. Распространенность в природе. Основные минералы . . - 394"
20.2. Физико-химические свойства простых веществ.......... 395
20.3. Получение простых веществ ........................ 397
20.4. Химия водных растворов ............................ 398
20.5. Оксиды и гидроксиды................................. 399
20.6. Соли ............................................... 402
20.7. Комплексные соединения............................. 406
20.8. Применение ........................................ 408
605
20.9. Токсикология ........................................ 408
Упражнения к главе 20 ..................................... 409
Глава 21. Химия элементов ПБ-группы................................ 409
21.1. Распространенность в природе. Основные минералы ... 410
21.2. Физико-химические свойства металлов.................. 411
21.3. Получение цинка, кадмия и ртути ..................... 412
21.4. Химия водных растворов .............................. 412
21.5. Оксиды и гидроксиды.................................. 413
21.6. Соли ................................................ 414
21.7. Комплексные соединения .............................. 416
21.8. Применение........................................... 418
21.9. Токсикология ........................................ 419
Упражнения к главе 21 419
Глава 22. Общая характеристика свойств элементов ШБ-группы .... 420
22.1. Физико-химические свойства простых веществ....... 420
22.2. Оксиды и гидроксиды.................................. 421
22.3. Соли и комплексные соединения ....................... 422
22.4. Распространенность в природе. Основные минералы . . . 422
22.5. Применение........................................... 423
22.6. Токсикология ........................................ 423
Упражнения к главе 22 ..................................... 424
Глава 23. Химия элементов 1УБ-группы .................................. 424
23.1. Распространенность в природе. Основные минералы . . . 425
23.2. Физико-химические свойства металлов........ 426
23.3. Получение металлов................................... 428
23.4. Химия водных растворов .............................. 428
23.5. Оксиды и гидроксиды.................................. 429
23.6. Ковалентные соединения .............................. 430
23.7. Комплексные соединения .............................. 431
23.8. Применение .......................................... 432
23.9. Токсикология ........................................ 432
Упражнения к главе 23 ..................................... 432
Глава 24. Химия элементов УБ-группы.................................... 433
24.1. Распространенность в природе. Основные минералы . . . 434
24.2. Физико-химические свойства металлов........ 435
24.3. Химия водных растворов .............................. 436
24.4. Оксиды и гидроксиды.................................. 437
24.5. Галогениды........................................... 439
24.6. Комплексные соединения .............................. 441
24.7. Применение........................................... 442
24.8. Токсикология ........................................ 443
Упражнения к главе 24 ..................................... 443
Глава 25. Химия элементов У1Б-группы .................................. 444
25.1. Распространенность в природе. Основные минералы . . . 445
25.2. Физико-химические свойства металлов........ 446
25.3. Получение хрома, молибдеиа и вольфрама...... 448
25.4. Химия водных растворов .............................. 448
25.5. Оксиды и гидроксиды.................................. 449
25.6. Соли и ковалентные соединения........................ 453
25.7. Комплексные соединения .............................. 456
25.8. Применение .......................................... 459
25.9. Токсикология ........................................ 459
Упражнения к главе 15 ..................................... 459
Глава 26. Химия элементов УПБ-группы.................................. 460
26.1. Распространенность в природе. Основные минералы . . . 461
26.2. Физико-химические свойства металлов ................. 462
26.3. Получение металлов................................... 464
26.4. Химия водных растворов .............................. 465
26.5. Оксиды и гидроксиды.................................. 465
26.6. Соли ................................................ 470
26.7. Комплексные соединения .............................. 471
606
26.8. Применение........................................... 474
26.9. Токсикология ........................................ 474
Упражнения к главе 26 .............................. . 475
Глава 27. Химия элементов УШБ-группы .............................. 475
27.1. Распространенность в природе. Основные минералы . . . 478
27.2. Физико-химические свойства железа, кобальта и никеля 479
27.3. Получение металлов................................... 481
27.4. Химия водных растворов .............................. 482
27.5. Оксиды и гидроксиды железа, кобальта и никеля .... 482
27.6. Соли железа, кобальта и никеля ...................... 484
27-7. Комплексные соединения ............................. 486
27.8. Применение........................................... 491
27.9. Токсикология ........................................ 492
Упражнения к главе 27 ..................................... 492
Глава 28. Общая характеристика свойств /-элементов................. 496
28.1. Электронная конфигурация атомов /-элементов...... 497
28.2. Физико-химические свойства простых веществ....... 499
28.3. Оксиды и гидроксиды.................................. 499
28.4. Соли и комплексные соединения ....................... 500
28.5. Распространенность в природе. Основные минералы . . . 502
28.6. Применение........................................... 503
28.7. Токсикология ........................................ 504
Упражнения к главе 28 ..................................... 504
Глава 29. Нестехиометрические соединения............................... 505
29.1. Кристаллическая решетка и ее дефекты................. 506
29.2. Дальтониды и бертоллиды ............................. 507
29.3. Номенклатура нестехиометрических соединений...... 509
29.4. Нестехиометрические соединения ...................... 510
29.5. Нестехиометрические фазы, обладающие сверхпроводимостью ...................4................................ 513
Упражнения к главе 29 ..................................... 514
Глава 30. Неорганическая химия и окружающая среда..................... 515
30.1. Атмосфера............................................ 516
30.2. Гидросфера .......................................... 520
30.3. Литосфера............................................ 522
30.4. Круговороты азота, кислорода, углерода, серы и фосфора в природе ............................................. 523
Упражнения к главе 30 ..................................... 528
ЧАСТЬ ш ПОСЛЕСЛОВИЕ............. 529
Глава 31. Атомные спектры...........................................530
31.1. Оптические спектры................................. 530
31.2. Рентгеновские спектры.............................. 533
Глава 32. Стационарное, не зависящее от времени уравнение Шредингера 538
32.1. Волновая функция .................................. 538
32.2. Решение уравнения Шредингера для атома водорода . . 541
32.3. Квантование энергии электрона в атоме водорода .... 545
Глава 33. Окислительно-восстановительные реакции .................... 546
33.1. Составление уравнений окислительно-восстановительных реакций .................................................. 547
33.2. Типы окислительно-восстановительных реакций ....... 549
33.3. Уравнение Нернста.................................. 551
Глава 34. Скорость и механизм химической реакции...................... 556
34.1. Скорость и порядок химической реакции.............. 556
34.2. Энергия активации.................................. 560
34.3. Катализ............................................ 562
34.4. Механизм химических реакций .................. 564
607
Глава 35. Константа равновесия и ее связь с энергиями Гиббса и Гельмгольца. Изотерма химической реакции................................ 568
35.1. Изотерма химической реакции......................... 569
35.2. Концентрационная константа равновесия.............. 572
Глава 36. Правило фаз Гиббса.......................................... 574
36.1. Фаза системы........................................ 575
36.2. Компонент системы................................... 575
36.3. Вариантность (степень свободы) равновесной системы 578
36.4. Правило фаз Гиббса.................................. 578
36.5. Закон распределения................................. 580
36.6. Фазовые равновесия.................................. 581
36.7. Закрытые гетерогенные однокомпонентные системы . . . 582
Глава 37. Физико-химические основы синтеза вещества в водных растворах с использованием реакций присоединения и обмена.................... 584
37.1. Диаграмма состояния системы, когда соли не взаимодействуют друг с другом и не образуют твердых растворов 586 37.2. Диаграмма состояния системы, две соли которой взаимодействуют с образованием конгруэнтно растворимого безводного соединения........................................ 588
37.3. Диаграмма состояния системы, две соли которой взаимодействуют с образованием инконгруэитно растворимого безводного соединения.................................. 590
Именной указатель .................................................... 594
Предметный указатель.................................................. 595
Учебное издание
Степин Борис Дмитриевич, Цветков Андрей Александрович
НлОРГАНЧЧЕСА АЯ Ш
Редактор В. Н. Бораненкова. Мл. редакторы Л. С. М а к а р к и н а, Т. С. Костян. Художник Н. Ю. Бабикова. Художественный редактор Т. А-Коленкова.
Технические редакторы Т. Д. Г а р и н а, С. В. С в е т и к о в а. Корректор С. К. Завьялова
ИБ № 8786
ЛР Ne 010146 от 25.12.91. Изд. № Х/Е-8. Сдано в набор 11.01.91. Подп. в печать 16.03.93. Формат 60Х 901 /|6. Бум. тип. Ne 2. Гарнитура Тип Таймс. Печать офсетная. Объем 38,0 усл. печ. л. + 0,25 усл. печ. л. форзац. 76,25 усл. кр.-отт. 39,93 уч.-изд. л. + + 0,36 уч.-изд. л. форзац. Тираж 15 000 экз. Заказ Ne 1258.
Издательство «Высшая школа», 101430, Москва, ГСП-4, Неглинная ул., д. 29/14.
АООТ «Ярославский полиграфкомбинат». 150049, Ярославль, ул. Свободы, 97.
Периодическая система элементов Д.И. Менделеева
(норотнопериодный вариант)
Периоды Гр у п п ы элементов
I И III IV V VI VII VIII
А Б А Б A Б A Б A Б A Б А Б А Б Б1 Б2
1 1 H l_ (Is1) 2 Не (1S2) 4,003 ГЕЛИЙ
1,0079 ВОДОРОД
2 3 Li (2s1) 6,941 литий 4 Be <2s2) 9.012 БЕРИЛЛИЙ 5 В (2s22p>) 10.811 БОР 6 c (2s22?) 12.011 УГЛЕРОД 7 N (2s22p3) 14,007 АЗОТ 8 О (2s22p4) 15,999 НИСЛОРОД 9 F (2s22p5) 18,998 ФТОР 10 Ne (2s22p6) 20,179 НЕОН
3 11 Na (3?) 22,9898 НАТРИЙ 12 Мд (3s2) 24,305 МАГНИЙ 13 Al (3s23/>') 26,982 АЛЮМИНИЙ 14 Si (3s23p2) 28,086 КРЕМНИЙ 15 p (3s23p3) 30,974 ФОСФОР 16 s (3s2 3p4) 32,066 СЕРА 17 CI (3s2 Зр5) 35,453 ХЛОР 18 Аг (3s2Зр6) 39,948 АРГОН
4 19 к (4?) 39,098 КАЛИЙ 20 Са (4?) 40.078 КАЛЬЦИЙ 21 Sc (4s23J1) 44,956 СКАНДИЙ 22 Ti (4s23d2) 47,88 ТИТАН 23 у (4s23 ’) 50,942 ВАНАДИЙ 24 Сг (3Js4sb 51,996 ХРОМ 25 Мп (4s23J5) 54,938 МАРГАНЕЦ 28 Fe (4s23J6) 55,841 ЖЕЛЕЗО 27 Co (4 s2 3d7) 58,933 КОБАЛЬТ 28 Ni (4s23d8) 58,69 НИКЕЛЬ
29 Си (3d'°4s1) 63,546 медь 30 Zn (3d*°4s2) 65,39 ЦИНК 31 Ga (4s24p*) 69,723 ГАЛЛИЙ 32 Ge (4s24p2) 72,61 ГЕРМАНИЙ 33 As (4s24p3) 74,922 МЫШЬЯК 34 Se (4s24p4) 78,96 СЕЛЕН 38 Вг (4s24p5) 79,904 БРОМ 36 Кг (4s24p6) 83,80 КРИПТОН
5 37 Rb (5?) 85,4678 РУБИДИЙ 38 Sr (5s2) 87,62 СТРОНЦИЙ 39 Y (5s24d‘) 88,906 ИТТРИЙ 40 Zr (5s24d2) 91,224 ЦИРКОНИЙ 41 Nb (4tf45sl) 92,906 НИОБИЙ 42 Мо (4J55sl) 95,94 МОЛИБДЕН 43 Тс (5s24d5) 97,907. ТЕХНЕЦИЙ 44 Ru (4d75s‘) 101,07 РУТЕНИЙ 45 Rh 4d85sl) 102,906 РОДИЙ Pd (4d*°) 106,42 ПАЛЛАДИЙ
47 Ад uAs1) 107.868 СЕРЕБРО 48 Cd (4d*°5s2) 112,41 КАДМИЙ 49 In (5s25pl) 114,82 ИНДИЙ 50 Sn (5s25p2) 118,71 олово 51 Sb (5s25p3) 121,75 СУРЬМА 52 Те (5s25p4) 127,6 теллур 53 | (5$25р5) 126,904 ИОД 54 Хе (5s25p6) 131,29 КСЕНОН
6 55 Cs 6s1) 132,905 ЦЕЗИЙ 58 Ва (6s2) 137,33 БАРИЙ О i ♦° 71 Lu (6s25dl) 174,967 ЛЮТЕЦИЙ 72 Ht (6s25J2) 178,49 ГАФНИЙ 73 Ta (6s25d5) 180,948 ТАНТАЛ 74 W (6s25J4) 183,85 ВОЛЬФРАМ 75 Re (6s25d5) 186,207 РЕНИЙ 76 Os (6s25d6) 190,2 ОСМИЙ 77 Ir (6s25d7) 192,22 ИРИДИЙ 78 Pt (5d96sl) 195,08 ПЛАТИНА
79 Аи (5</10б№) 196,966 ЗОЛОТО 80 Hg (5J106s2) 200,59 РТУТЬ 81 TI (6s26p*) 204,383 ТАЛЛИЙ 82 Pb (6S26p2) 207,2 СВИНЕЦ 83 Bi (6s25d2) 208,980 ВИСМУТ 84 Ро (6s26p4) 208,98 ПОЛОНИЙ 85 At (6s26ps) 209,987 АСТАТ 86 Rn (6s26p6) 222,018 РАДОН
7 87 рГ (7s1) 223,02 ФРАНЦИЙ 88 Ra (7s2) 226,025 РАДИЙ **89-102 103 Rf (7s26J*) 260,1051 РЕЗЕРФОРДИЙ 104 Ku (7s26J2) 261,108 КУРЧАТОВИЙ 105 (7s26d3) 262,113 НИЛЬСБОРИЙ 106 (7s26d4) 263,118 107 108 109 110
‘ЛАНТАНОИДЫ
57 La (6s25j!) 138,906 ЛАНТАН 58 Ce (6s24/15d1) 140,12 ЦЕРИЙ 59 Pr (6s24/3) 140,908 ПРАЗЕОДИМ 80 Nd (6s24/4) 144,24 НЕОДИМ 81 Pm (6s24/5) 144,913 ПРОМЕТИЙ 82 Sm (6s24/6) 150,36 САМАРИЙ 63 Eu (6s24/7) 151,96 ЕВРОПИЙ 84 Gd (6s24/75d1) 157,25 ГАДОЛИНИЙ 65 Tb (6s24/9) 158,925 ТЕРБИЙ 66 0y (6s24/10) 162,50 ДИСПРОЗИЙ 87 Ho (6s24/“) 164,93 ГОЛЬМИЙ 88 Er (6s24/12) 167,26 ЭРБИЙ 89 Tm (6s24/13) 168,934 ТУЛИЙ 70 Yb (6s24/14) 173,04 ИТТЕРБИЙ
“АКТИНОИДЫ
89 Ac (7s26rf') 227,028 АКТИНИЙ 90 Th (7s26d2) 232,038 ТОРИЙ 91 Pa (7s25/26d1) 231,036 ПРОТАКТИНИЙ 92 J (7s25/36d‘) 238,029 УРАН 93 (7s25/46d') 237.048 НЕПТУНИЙ 94 Pu (7s25/6) 244,064 ПЛУТОНИЙ 85 Am (7s25/7) 243,061 АМЕРИЦИЙ 98 Cm (7s25/76d’> 747,07 КЮРИЙ 87 Bk (7s25/86d1) 247,07 БЕРКЛИЙ 98 Cl (7s25/“ 251,08 КАЛИФОРНИЙ f ’) 89 Es (7s25/u) 252,083 ЭЙНШТЕЙНИЙ 100 Fm (7s25/12) 257,095 ФЕРМИЙ Md (7s25/13) 258,099 МЕНДЕЛЕВИЙ 102 JI (7s25/14) 259,101 ЖОЛИОТИЙ