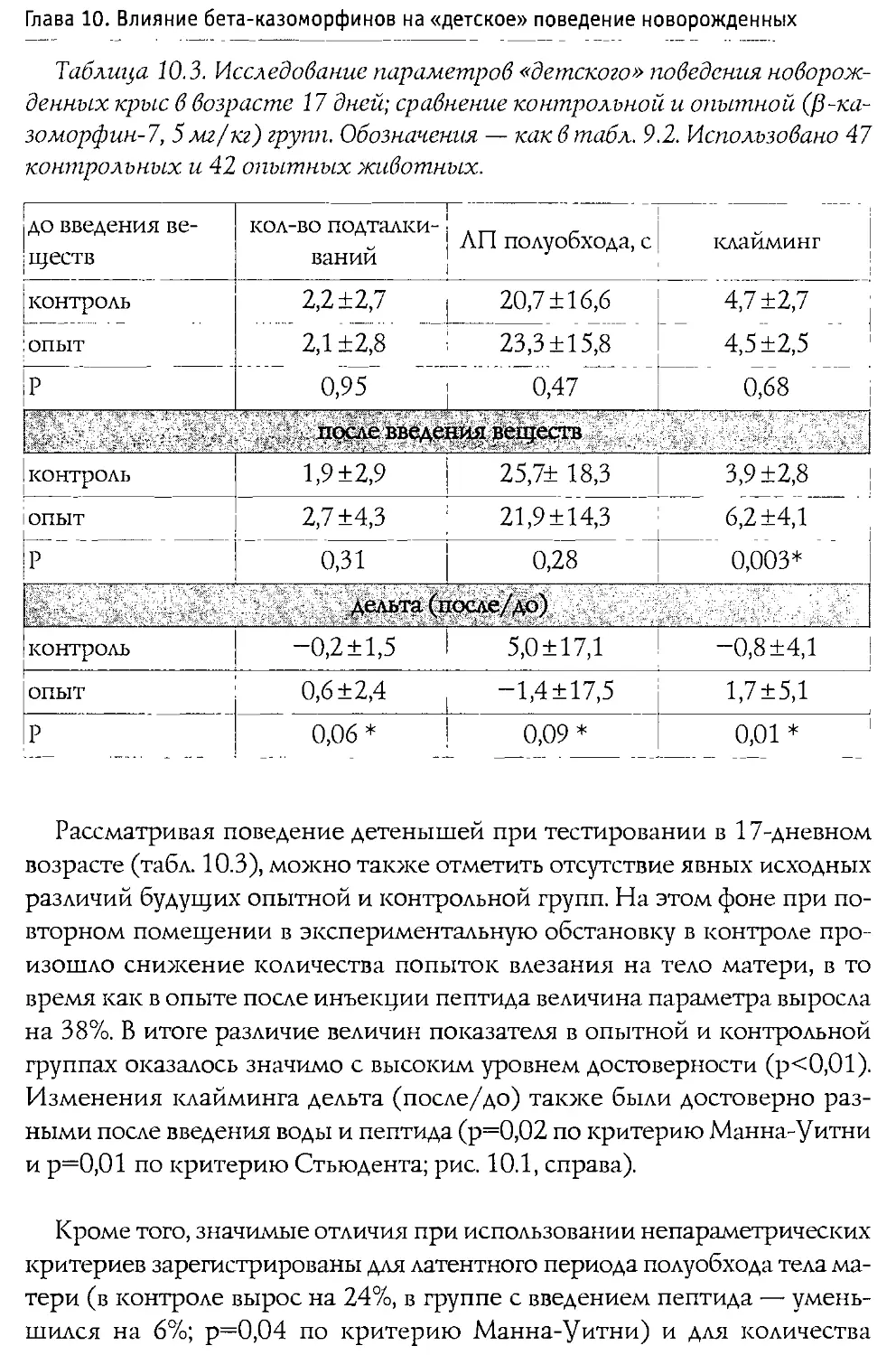
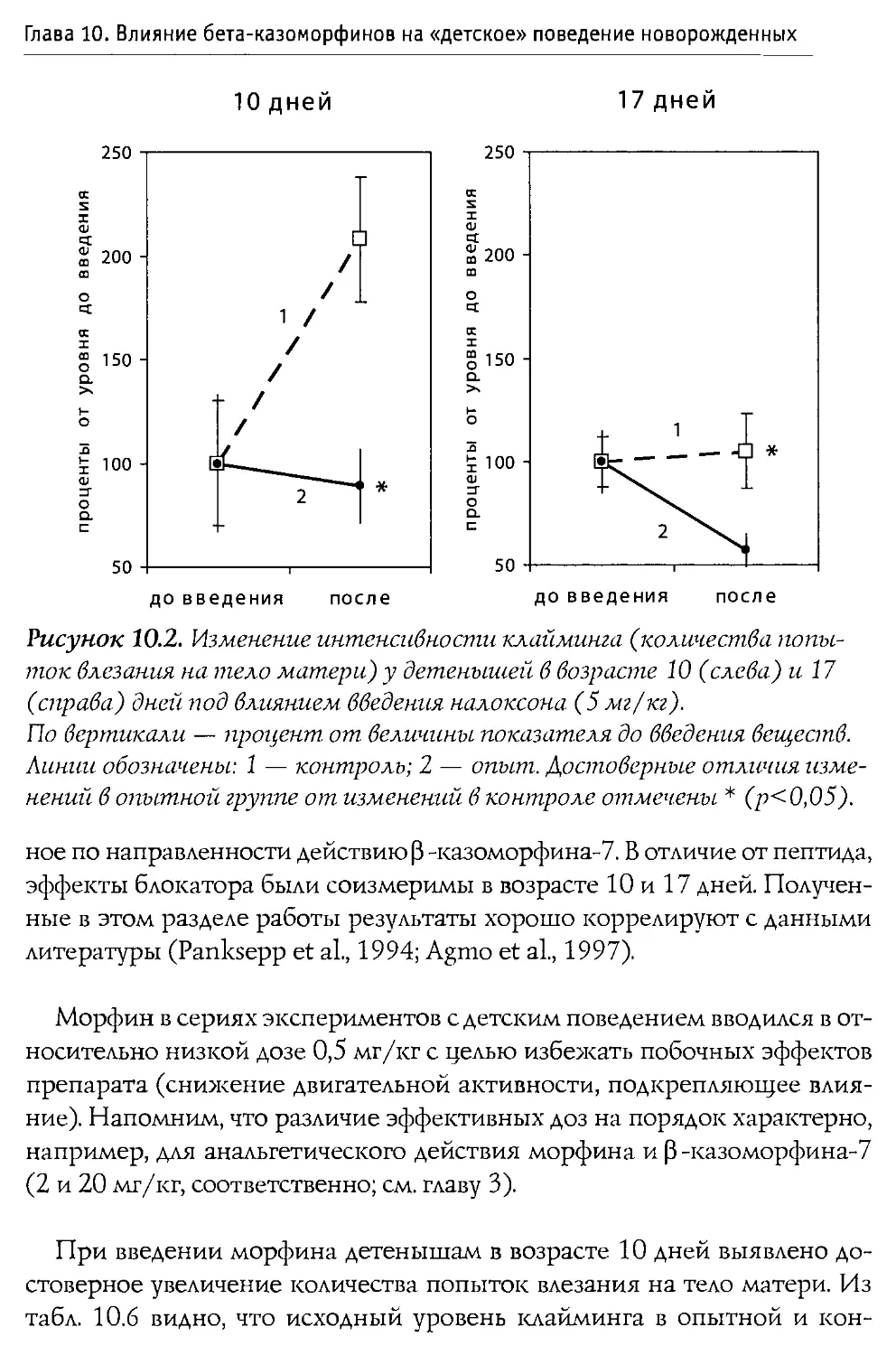
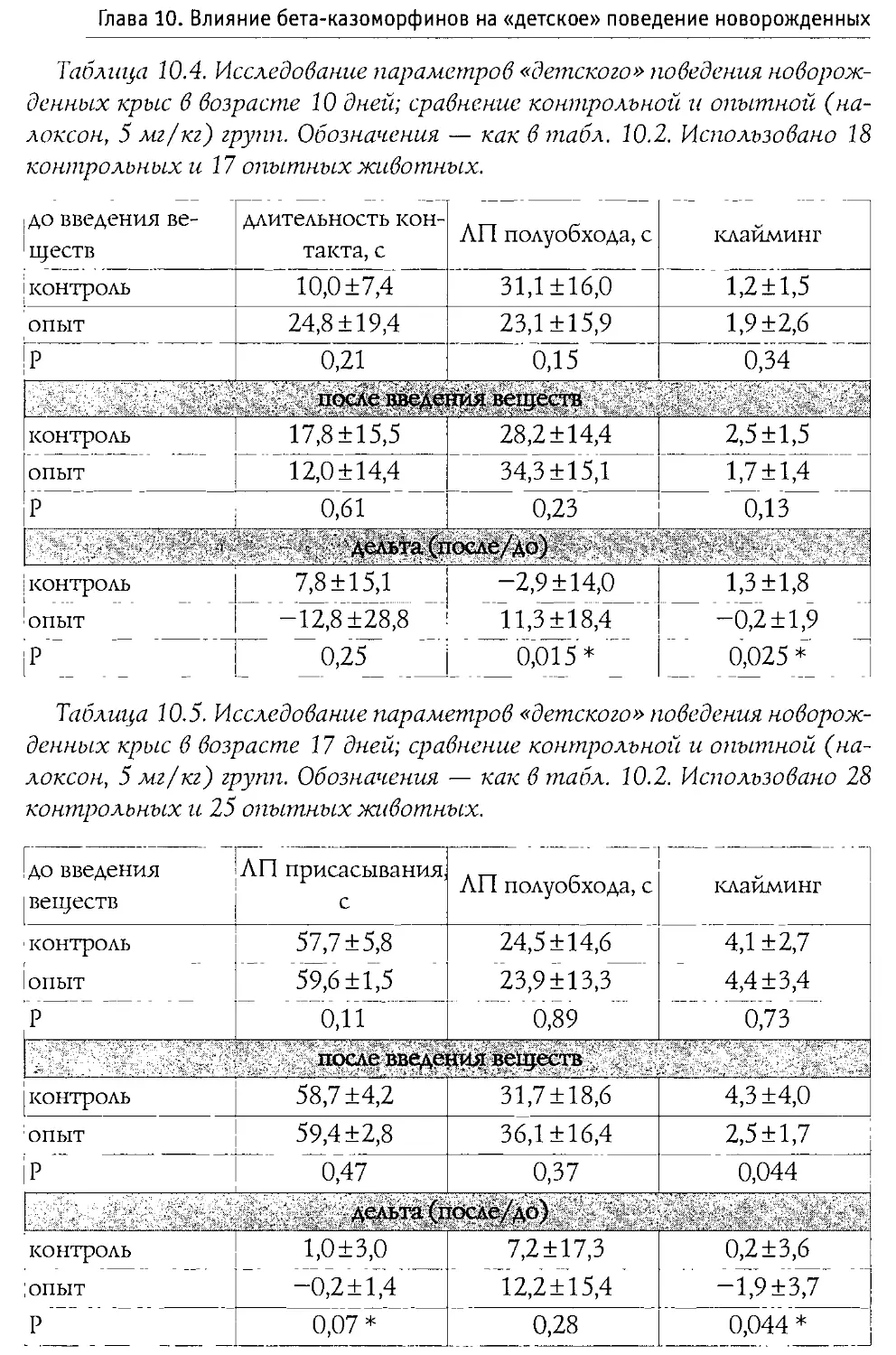
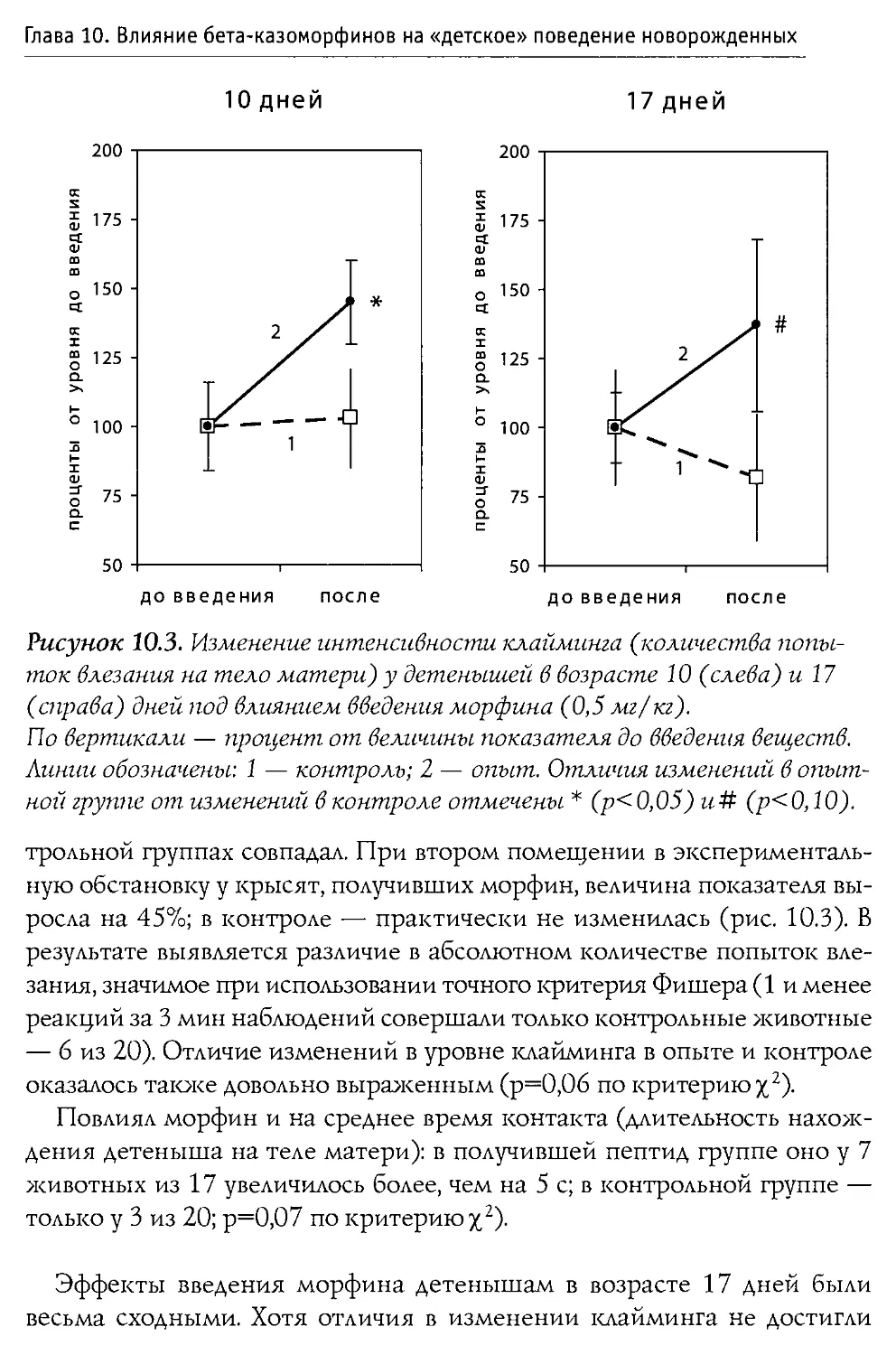
Author: Каменский А.А. Дубынин В.А.
Tags: химия биология биохимия монография молекулярная химия гормоны бета-казоморфины
Year: 2010
Text
В.А. Дубынии, А.А. Каменский
БЕТА-КАЗОМОРФИНЫ
и их роль в регуляции поведения
В.А. Дубыиин, А.А. Каменский
БЕТА-КАЗОМОРФИНЫ
и их роль в регуляции поведения
Введение
Пептидные регуляторы — это, как правило, вещества эндогенного происхождения. Возникая из белков-предшественников в различных тканях, они действуют непосредственно в месте образования, модулируя множество процессов (в том числе, протекающих в нервной системе). Кроме того, пептиды могут переноситься кровью и другими жидкими средами, выполняя гормональную функцию (Ашмарин, Каразеева, 1999; Mains, Eipper, 2006). Однако есть и другой путь появления регуляторных пептидов в организме — проникновение через желудочно-кишечный тракт. Показано, что даже в норме ди- и трипептиды способны проходить из полости кишечника в кровь. При повреждениях слизистой в результате заболеваний либо стресса в плазму попадают и гораздо более длинные молекулы (Гмошинский, 1997). Но особенно характерно проникновение внутрь организма пептидов и даже белков пищевого происхождения для новорожденных млекопитающих (Зуфаров, 1998; Van de Регге, 200З1).
Для каждой из таких молекул существует вероятность проявления регуляторных свойств — то есть способности влиять на физиологическое состояние различных клеток и органов. Особенно важно учитывать подобную возможность в тех случаях, когда речь идет о белках, которые самой природой предназначены для питания, а именно, о казеинах молока. Показано, что в результате ферментативной деградации молекула-, Р - и к -казеинов могут образовываться десятки фрагментов, проявляющих иммуномодулирующую, нейротропную, антитромботическую, антигипертензивную и другие виды физиологической активности (Lemieux, Amiot, 1990; Meisel, 1997). Наиболее известными из них являются опиоидные пептиды — так называемые казоморфины (Teschemacher et al., 1997), а среди казоморфинов — Р-казоморфины (фрагменты Р-казеина). Последние отличаются высокой устойчивостью к протеолизу и наибольшим среди пептидов пищевого происхождения сродством к опиоидным рецепторам (в первую очередь, ц-типа). 1
1 В качестве одного из наиболее ярких примеров можно указать на проникновение через кишечный барьер иммуноглобулинов молозива
В последние годы сформировалось представление о том, что аминокислотная последовательность 0 -казоморфинов не просто случайно совпадает с первичной структурой эндорфинов, но является результатом определенного эволюционного процесса. Происходит постепенное накопление данных о способности 0 -казоморфинов регулировать деятельность и созревание различных систем организма новорожденного, питающегося материнским молоком (Meisel, 1997; Sun et al., 2003; Kaminski et al., 2007). Вместе с тем, данные о функциональных характеристиках 0 -казоморфинов остаются весьма отрывочными и фрагментарными. Большинство исследований выполнено на взрослых животных, причем основная часть публикаций посвящена анальгетическим свойствам пептидов данной группы, а также их способности влиять на моторику кишечника. Целью наших работ явилось систематическое изучение нейротропных свойств 0 -казоморфинов в экспериментах на взрослых животных (белые крысы), а также анализ острого и отставленного действия, которое пептиды данной группы оказывают на поведение детенышей. В соответствии с этим нами были поставлены следующие конкретные задачи:
1. Изучить действие системно вводимых 0-казоморфинов на болевую чувствительность, двигательную активность и тревожность экспериментальных животных, а также их способность к обучению.
2. Изучить развитие в онтогенезе (при введении детенышам разного возраста) поведенческих последствий однократного применения 0 -казоморфинов.
3. Изучить отставленные нейротропные эффекты 0-казоморфинов, хронически вводимых новорожденным белым крысам.
4. Изучить влияние 0 -казоморфинов на характеристики материнско-детского взаимодействия.
Несмотря на обнаружение 0-казоморфинов в плазме крови и мозге новорожденных (llmbach et al., 1985; Pasi et al., 1993), вопрос об их влиянии на состояние и развитие детенышей млекопитающих до наших исследований был практически не изучен. То же справедливо и по отношению к возможному действию 0-казоморфинов на организм кормящих матерей (Renlund et al., 1993). В этом случае опиоидные пептиды проникают в кровь самки непосредственно из молочной железы.
В ходе выполнения работы нами проанализированы механизмы действия 0 -казоморфинов с применением их аналогов, укороченных с С- и 14-концов (в последнем случае происходит резкое ослабление опиоидных
свойств), а также на фоне введения блокатора опиоидных рецепторов налоксона. В особых сериях экспериментов активность р -казоморфинов сравнивалась с последствиями введения классического ц-агониста морфина (эксперименты проводились совместно с ННЦ наркологии Росздрава).
Решение поставленных задач позволило достаточно полно охарактеризовать нейротропную активность Р-казоморфинов, а также оценить их роль в развитии и становлении функций ЦНС в ходе постнатального развития. Полученные сведения представляют не только фундаментальный научный интерес; их учет полезен (и даже необходим) при подборе оптимального состава питательных смесей, ориентированных на кормление младенцев.
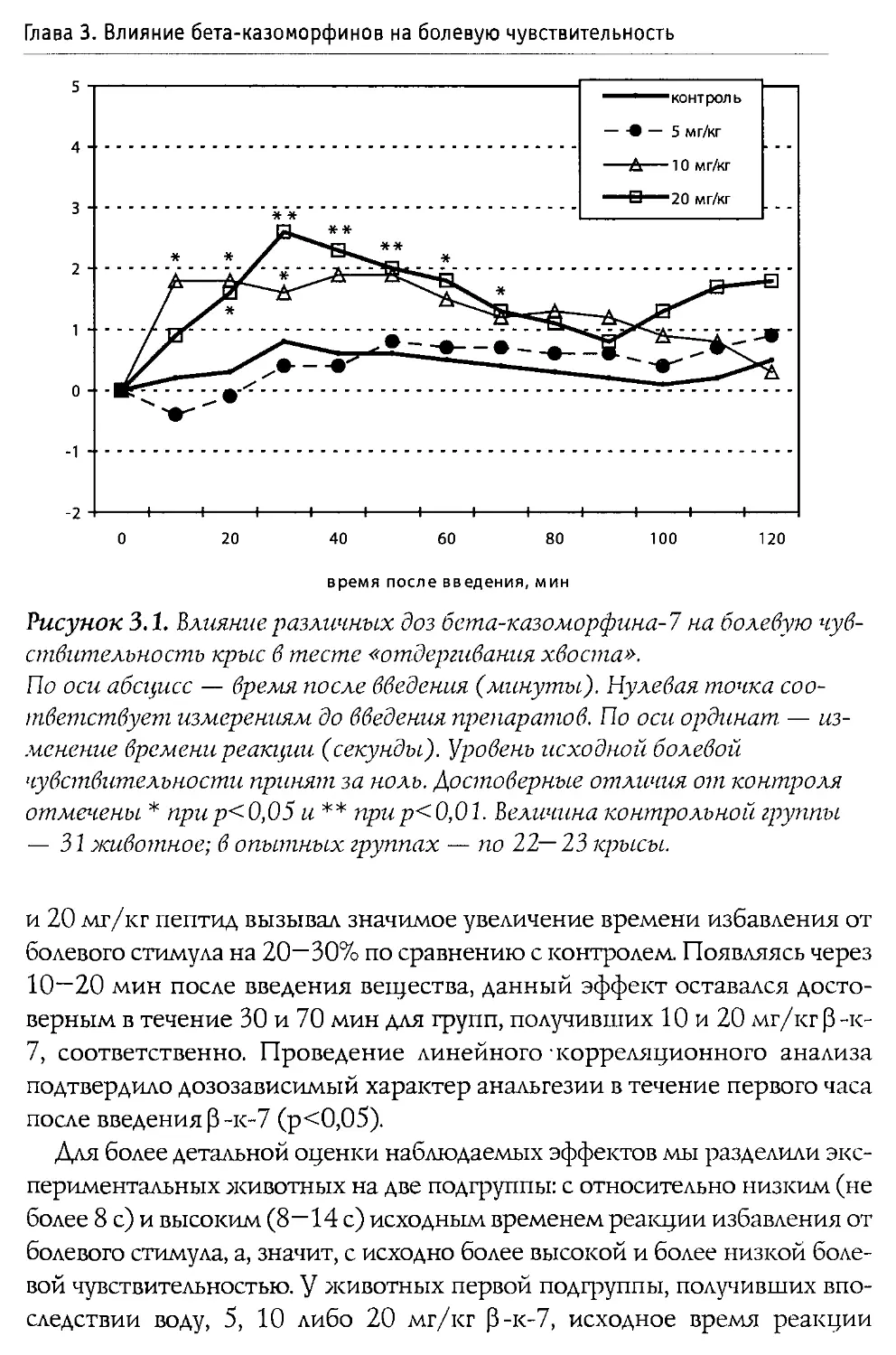
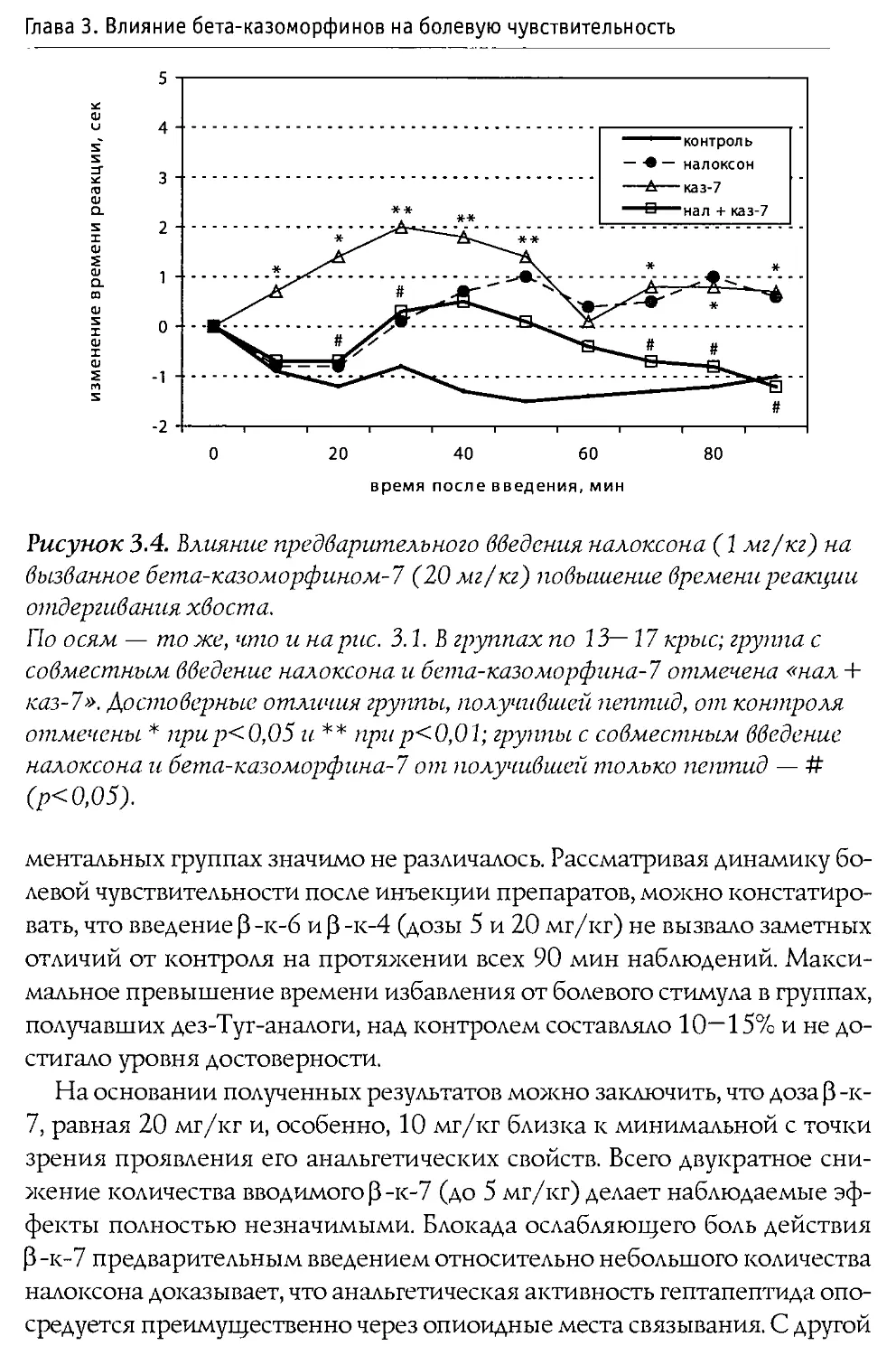
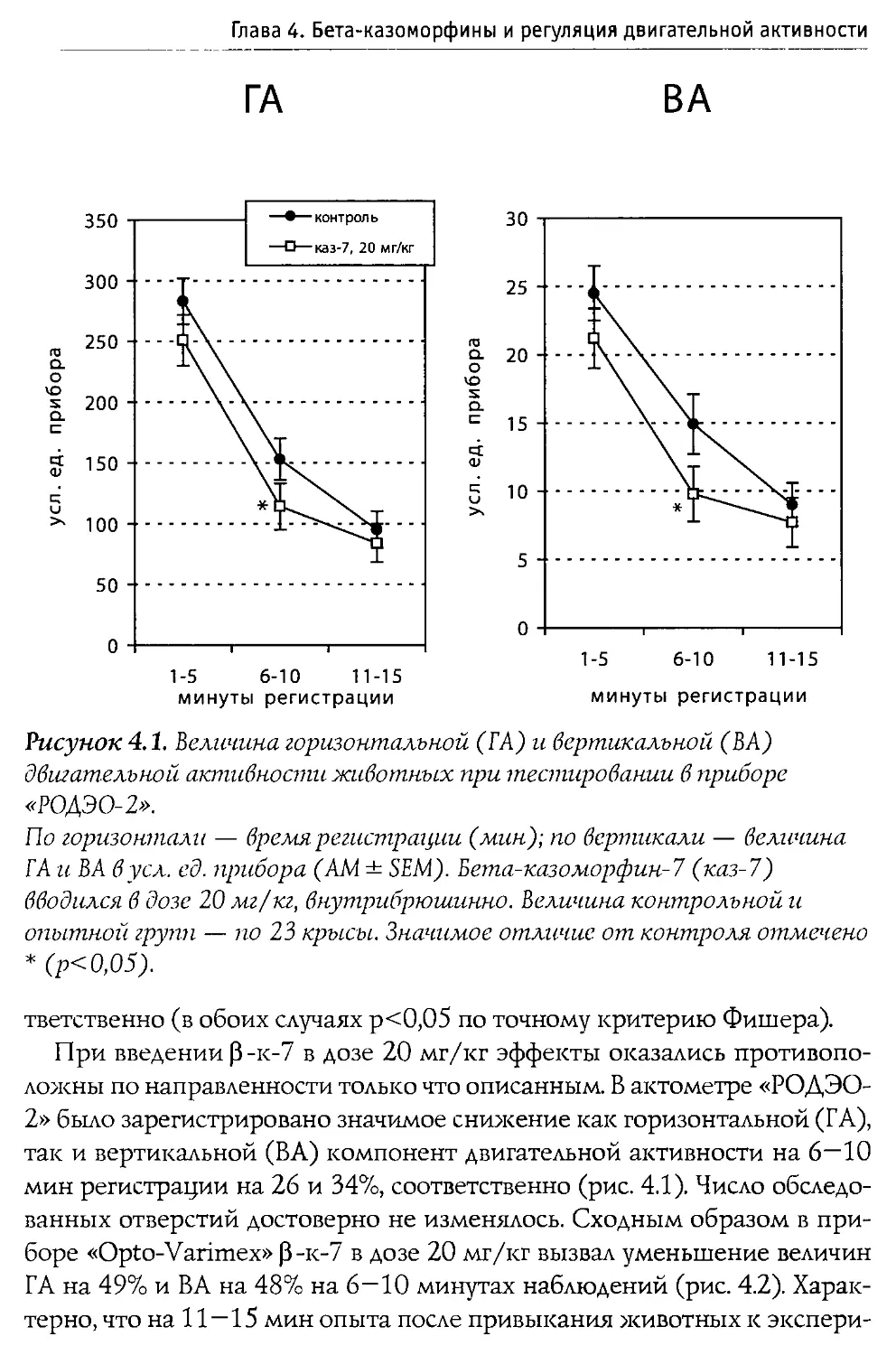
Монография состоит из 10 основных разделов, первые два из которых посвящены характеристике опиоидной системы мозга, а также истории открытия и наиболее общим свойствам Р-казоморфинов. Следующие четыре главы содержат информацию о влиянии пептидов этой группы на болевую чувствительность и двигательную активность, проявления тревожности и депрессивности, способность к обучению и формирование памяти. В заключительных четырех главах проанализированы последствия хронического введения Р-казоморфинов новорожденным и их влияние на материнско-детское взаимодействие.
Помимо результатов собственных экспериментов и данных литературы, характеризующих нейротропную активность Р -казоморфинов и родственных им пептидов, текст монографии включает значительный объем информации, относящийся к опиоидной системе в целом. Достаточно подробно анализируется ее рецепторная составляющая, разнообразие эндо- и экзогенных лигандов, онтогенез, причины и следствия формирования зависимости. Особое внимание уделено вкладу опиоидной системы мозга в регуляцию болевой чувствительности, тревожности, способности к обучению и др. Авторы искренне надеются, что все это окажется интересным и полезным для читателей.
Кроме того, хотелось бы выразить искреннюю признательность нашим постоянным коллегам-химикам, синтезировавшим Р-казоморфины (Л.А. Андреева, Л.А. Алфеева, В.Н. Незавибатько; руководитель работ академик РАН Н.Ф. Мясоедов), а также А.С. Маклаковой, И.В. Малиновской, Ю.А. Ивлевой, Ю.А. Беляевой
С глубочайшей благодарностью укажем также на то, что исходным инициатором и вдохновителем работ cP -казоморфинами
явился академик РАМН Игорь Петрович Ашмарин (1925—2007), светлой памяти которого посвящают свой труд авторы.
В течение многих лет работы по исследованию 0 -казоморфинов поддерживались Российским фондом фундаментальных исследований (гранты № 94-04-11351, № 97-04-48166,№ 99-04-48410, Т 02-04-48561, 05-04-49761), за что авторы выражают РФФИ искреннюю признательность.
Список основных сокращений
Р -к — Р -казоморфины
Р-к-7 —Р -казоморфин-7 (Tyr-Pro-Phe-Pro-Gly-Pro-Ile)
Р -к-5 — Р -казоморфин-5 (Tyr-Pro-Phe-Pro-Gly)
Р-к-6 —Р-казоморфин-6 (Pro-Phe-Pro-Gly-Pro-Ile)
Р-к-4 —р-казоморфин-4 (Pro-Phe-Pro-Gly)
ВА — вертикальная двигательная активность
ВР — время реакции (в лабиринте с пищевым подкреплением)
ГА — горизонтальная двигательная активность
ГЭВ — гемато-энцефалический барьер
ЖКТ — желудочно-кишечный тракт
КИ — кардиоинтервал
КАР — коротколатентные реакции
АП — латентный период
МСР — межсигнальные реакции ткф — точный критерий Фишера УЗВ — ультразвуковая вокализация УРАИ — условная реакция активного избегания УРПИ — условная реакция пассивного избегания ЧВР — число выполненных реакций ЧО — число ошибок
ЧОО — число обследованных отверстий
ЦНС — центральная нервная система
ЦСВ — центральное серое вещество
ЭКГ — электрокардиограмма
ЭЭГ - электроэнцефалограмма
D0R-1 —ген 8-опиоидного рецептора
K0R-1 —ген к-опиоидного рецептора
M0R-1 — ген ц-опиоидного рецептора
0RL-1 — ген орфанового рецептора
PTS — peptide transport system (пептидная транспортная система) VTA — ventral tegmental area (вентральная тегментальная область)
Глава 1. Бета-казоморфины — экзогенные лиганды опиоидных рецепторов
Эндогенные и синтетические лиганды опиоидных рецепторов
Препараты опиумного мака Papaver somniferum использовались человечеством для облегчения боли с давних времен (Соломзес с соавт., 1998). Как известно, в 1803 г. был выделен кристаллический образец их основного алкалоида — морфина; позже открыт и описан кодеин. Эти соединения и их производные в настоящее время относят группе наркотических анальгетиков. Они характеризуются, с одной стороны, мощной антиноцицептивной активностью, с другой — способностью вызывать эйфорическое состояние, а при повторном применении — физическую и психическую зависимость (Харкевич, 2004). Другими эффектами опиоидов являются снотворное действие, угнетение дыхательного и кашлевого центров, изменение тонуса гладкой мускулатуры внутренних органов (в т.ч. тонкого и толстого кишечника, что ведет к ослаблению перистальтики). Основной обмен и температура тела, как правило, понижаются.
Исторически сложилось так, что вначале было открыто и изучено большое количество непептидных лигандов опиоидных рецепторов, и лишь затем обнаружены эндорфины и энкефалины. При этом уже в 1970-е гг. был определен набор критериев (Аничков, 1982), которым должно было удовлетворять вещество для того, чтобы вызывать анальгетические и наркотические эффекты. Приведем его: (1) молекула содержит четвертичный атом углерода, т.е. атом, ни одна из валентностей которого не замещена водородом; (2) к этому атому присоединено фенильное кольцо; (3) молекула содержит третичный атом азота, связанный с четвертичным углеродом цепочкой, состоящей из двух углеродных атомов; (4) по меньшей мере одна из присоединенных к азоту групп должна быть коротким алкильным радикалом (предпочтительно метильным). Всем перечисленным критериям удовлетворяют не только морфин, кодеин и их произ
водные (метилморфин, оксиморфин и т.п.), но и синтетические препараты, такие как промедол, лидол и тд.
С другой стороны, перечисленные структурные особенности в весьма слабой мере присущи эндогенным пептидным лигандам опиоидных рецепторов. Для них отмечается необходимость наличия: (1) N-концевого тирозина; (2) расположенного в 3-м или 4-м положении фенилаланина; (3) некоторого оптимального расстояния между ароматическими кольцами данных аминокислот (Mosberg et al., 1994а; Brandt et al., 1996). Существенные расхождения между свойствами синтетических и эндогенных опиоидов говорят о сложности процесса лиганд-рецептор-ного взаимодействия в опиоидной системе, а также о наличии у соответствующих рецепторов значительного количества мест связывания, «срабатывание» даже части которых может приводить к активации рецептора в целом (Spivak et al., 1997; подробнее см. в следующей главе).
Специфичность присоединения пептидов к различным подтипам опиоидных рецепторов определяется широким кругом их химических и конформационных особенностей, в частности наличием Р -поворота, образованного взаимодействием остатков Туг1 и Phe3 (Tancredi et al., 1991) и повышающего сродство лиганда к р-рецепторам. Также следует учитывать пространственную ориентацию радикала фенилаланина, которая, в свою очередь, может зависеть от свойств следующих за ним аминокислот (Mosberg et al., 1994b; Fiori et al., 1999; Riand et al., 1999). Показано, что N-конец пептидов наобходим для активации любого из опиоидных рецепторов, различия же в С-концевой части обуславливают избирательное сродство к р-, 8- и к-подтипам (Naim et al., 1996; Сергеев с соавт., 1999).
У млекопитающих эндогенные опиоидные пептиды главным образом происходят от четырех предшественников: проопиомеланокортина, проэнкефалина, продинорфина и проноцицептина/орфанина FQ (Naka-nishi et al., 1979; Kakidani et al., 1982; Noda et al., 1982; Meunier et al., 1995). Производные первых трех из них содержат на N-конце последовательность Tyr-Gly-Gly-Phe-Met/Leu. Такие пептиды отличаются сродством к р-, 8- и к-рецепторам, но имеют незначительное сродство к ORLi-рецепторам (Eppler et al., 1993). Однако каждый из них способен связываться с более, чем одним подтипом опиоидных рецепторов.
Показано, что Р -эндорфин имеет примерно одинаковое сродство к ц -и 8-местам связывания, но гораздо менее эффективно взаимодействует с к-рецепторами (Akil et al., 1981; Kosterlitz, Paterson, 1985). Met- и Leu-энкефалины высокоаффинны к 8-рецепторам, в 10 раз менее эффективно
Глава 1. Бета-казоморфины — экзогенные лиганды опиоидных рецепторов взаимодействуют ср-рецепторами и практически не связываются ск-подтипом. Другие продукты процессинга проэнкефалинов, которые имеют N-концевые вставки Met-энкефалина, менее предпочтительно связываются с 8-рецепторами и обнаруживают наибольшее сродство к ц-рецепторам. Опиоидные фрагменты продинорфина, в частности, динорфин А и динорфин В, имеют высокое сродство к к-рецепторам, но также обладают значительной аффинностью к ц- и 8-сайтам (Corbett et al., 1984).
Амидированные природные тетрапептиды эндоморфин-1 (Туг-Рго-Trp-Phe-NHz) и эндоморфин-2 (Tyr-Pro-Phe-Phe-NHz), по-видимому, функционируют в мозге как специфические эндогенные лиганды для ц -рецепторов, к которым они высокоселективны (Zadina et al., 1997). Эн-доморфины являются производными до сих пор не идентифицированных предшественников и структурно не связаны с другими эндогенными опиоидными пептидами.
Ноцицептин/орфанин FQ происходит от проноцицептин/орфанина FQ, обладает низким сродством к Ц-, к-, и8-рецепторам и является эндогенным лигандом для ORLi рецептора (Meunier et al., 1995; Remscheid et al., 1995). Его аминокислотная последовательность (Phe-Gly-Gly-Phe-Thr-Gly-Ala-Arg-Lys-Ser-Ala-Arg-Lys-Leu-Ala-Asn-Gln) имеет гомологию с другими опиоидными пептидами, особенно с динорфином А. Предположительно, существует тесная эволюционная связь между этими соединениями. Ноцицептин/орфанин FQ ха-рактеризуется, однако, наличием N-концевого фенилаланина, сохраняя при этом анальгетическую активность (по крайней мере, в случае крыс: Rossi et al., 1997).
Большая часть эндогенных опиоидов образуется из своих предшественников в результате деятельности, во-первых, трипсин-подобного фермента, который гидролизует связи основных аминокислот, и, во-вторых, карбоксипептидазы В, которая отщепляет остатки основных аминокислот с С-конца пептидной молекулы. Пары Lys-Lys и Lys-Arg являются наиболее специфическими мишенями для действия таких ферментов.
Экзорфины — опиоидные пептиды пищевого происхождения
Кроме опиоидных пептидов, синтезируемых внутри нервных, нейроэндокринных и некоторых других клеток, существует целый класс опиоидов, являющихся фрагментами белков пищевого происхождения. Они поступают в организм извне, за что и названы экзорфинами. К этой
Глава 1. Бета-казоморфины — экзогенные лиганды опиоидных рецепторов группе относят пептиды, выделенные из гидролизата пшеничного глютена — экзорфины А, В и С (Zioudrou et al., 1979) и гидролизатов казеинов молока — казоморфины (Brantl et al., 1979). Сюда же примыкают фрагменты, образующиеся в ходе энзиматической деградации гемоглобина — геморфины (Brantl, Neubert, 1986), цитохрома b — цитохрофины (Liebmann et al., 1989; Freeman, Young, 2000), рибулозо-бисфосфат кар-боксилазы/оксигеназы — рубисколины (Yang et al., 2001) и ряд других.
Геморфины и цитохрофины имеют первичную структуру, весьма сходную с эндоморфинами: например, геморфин-4 (Tyr-Pro-Trp-Thr) и цитохрофин-4 (Tyr-Pro-Phe-Thr). Геморфин-4 был идентифицирован при теоретическом анализе первичной последовательности аминокислот в Р-цепи гемоглобина быка в положении (34-37), а также в Р-цепи гемоглобина человека в положении (35—38) (Brantl, Neubert, 1986). В дальнейшем он и его удлиненные с С- и N-концов аналоги были обнаружены в плазме крови человека, экстрактах мозга быка, спинномозговой жидкости больных цереброваскулярным кровотечением (Glamsta et al., 1992; Karelin et al., 1994). Чаще всего описывается присутствие в различных тканях и органах фрагментов (31-40) и (32—40), названных ЬУУ-геморфин-7 и УУ-геморфин-7 (соответственно, Leu-Val-Val-Tyr-Pro-Trp-Thr-Gln-Arg-Phe и Val-Val-Tyr-Pro-Trp-Thr-Gln-Arg-Phe) (Yat-skin et al., 1998). Все эти пептиды обладают опиоидной активностью. Для фрагментов с N-концевым тирозином показано сродство к ц-, слабее — к 8-; еще слабее (но все же в довольно заметной степени) — к к-рецепто-рам (Liebmann et al., 1989). Для W-геморфина-? выявлено несколько иное соотношение аффинностей: р>к>8 (Szikra et al., 2001). Образование геморфинов в организме происходит во многом, видимо, за счет активности макрофагов (Zhao et al., 1997).
Из известных в настоящее время свойств геморфинов наибольшее внимание привлекает их способностью инактивировать ангиотензин-пре-вращающий фермент (Lantz et al., 1991; Zhao, Piot, 1997) — один из важнейших элементов в патогенезе артериальной гипертензии. Кроме того, физиологическую роль геморфинов связывают с их ингибирующим влиянием на воспалительные процессы. В работе Sanderson с соавторами (1998) показано, что геморфин-7 значимым образом ослабляет острый воспалительный ответ, вызываемый электростимуляцией периферических нервов либо введением вещества Р. Геморфины могут потенцировать активность брадикинина in vivo (lanzer et al., 2006). Описана также чрезвычайно интересная способность LW-геморфина-7 взаимодейство-
вать с рецепторами ангиотензина IV в ЦНС (Moeller et al., 1998; Lee et al., 2001).
Некоторое число экзорфинов было выделено в 1979 г. из гидролизата глютена пшеницы. Обнаруженные пептиды обладали налоксон-зависимой опиоидной активностью и ослабляли вызванные электрической стимуляцией сокращения семявыносящего протока мыши (Zioudrou et al., 1979). Кроме того, под их влиянием происходило ингибирование аденилатциклазы в гомогенате клеток нейробластомы. Пероральное введение гидролизата пшеничного глютена увеличивало время прохождения пищи через кишечник и налоксон-зависимо повышало уровень инсулина в плазме крови (Schusdziarra et al., 19 81). При идентификации продуктов гидролиза с опиоидной активностью были найдены четыре пептидных последовательности Gly-Tyr-Tyr-Pro-Thr, Gly-Tyr-Tyr-Pro, Tyr-Gly-Gly-Trp и Tyr-Gly-Gly-Trp-Leu, названные экзорфинами Аа, Аз, В4 и Bs, соответственно (Fukudome, Yos-hikawa, 1992). Оценка связывания с рецепторами показала, что глютеновые экзорфины являются 5-селективными лигандами, слабее взаимодействуют ср-рецепторами и не проявляют аффинности к к-рецепторам.
Экзорфины А и В, полученные пепсиновым перевариванием, не найдены при действии на глютен других гастро-интестинальных ферментов. Вместе с тем эти пептиды обнаружены в продуктах гидролиза глютена протеазами, выделенными из Aspergillus orysae и Bacillus subtilis. Соответственно, in vivo высвобождение экзорфинов А и В, вероятно, происходит благодаря совместным действиям пепсина и энтеробактериальных протеаз (Fukudome, Yoshikawa, 1992; Fukudome et al., 1997).
Еще один опиоидный фрагмент Tyr-Pro-Ile-Ser-Leu был получен пеп-син-трипсин-химотрипсиновым расщеплением пшеничного глютена и назван экзорфином С. Оценка аффинности к опиоидным рецепторам показала, что этот пептид является 5-селективным лигандом; отмечается также связывание ср-рецепторами (Fukudome, Yoshikawa, 1993). Были синтезированы аналоги экзорфина С со структурой Tyr-Pro-X-Ser-Leu (где X — замены аминокислот в третьем положении), у которых оценивались рецепторное связывание и опиоидная активность. Показано, что пептид имеет опиоидные свойства, если только X представлен алифатическим гидрофобным или ароматическим аминокислотным остатком. Соответственно, гидрофобность Не3 играет важную роль в реализации опиоидной активности глютенового экзорфина С.
Интересно, что диетологи уже довольно давно обращают внимание на возможность развития при избытке глютенов в пище неблагоприятных
психических и неврологических изменений. Однако такая точка зрения пока что не подкреплена данными убедительных клинических и экспериментальных исследований. Ниже мы еще вернемся к более подробному ее обсуждению.
Цитохрофины, свойства которых, судя по первичной структуре и оценке аффинности к опиоидным рецепторам, весьма близки к свойствам геморфинов (Liebmann et al., 1989; Freeman, Young, 2000), пока что практически не исследованы.
Еще один интересный опиоидный пептид рецепторфин (Tyr-Ile-Phe-Asn-Leu) был выделен из второго трансмембранного домена опиоидного рецептора (Kampa et al., 2001). Его последовательность консервативна для всех типов опиоидных рецепторов и для всех видов животных; она не найдена в других семидоменных рецепторах. При этом участок Phe-Asn-Leu важен для формирования активного центра и во многом определяет взаимодействие рецептора с агонистами и антагонистами. Рецепторфин связывается преимущественно с к-рецепторами, а также в одинаково слабой степени с 5- и р-рецепторами и сайтом связывания соматостатина. Рецепторфин дозозависимо и обратимо ингибирует клеточную пролиферацию в культурах клеток человеческих опухолей. По-видимому, рецепторфин, как опиоидный пептид, может вызывать реальные физиологические эффекты, выделяясь после клеточной смерти (Kampa et al., 2001).
Наиболее интересной из недавно открытых групп экзорфинов являются, по нашему мнению, рубисколины (рубисколин-5 и рубиско-лин-6: Tyr-Pro-Leu-Asp-Leu и Tyr-Pro-Leu-Asp-Leu-Phe; Yang et al., 2001). Руби ско (5-рибулозо-1,5-бисфосфат карбоксилаза/оксигеназа) — ключевой фермент в фиксации диоксида углерода и фотореспирации. Поскольку его содержание в зеленых листьях составляет ЗО_5О% от общего белка, Рубиско в значимых количествах может попадать в организм вместе с пищей (салат, шпинат, и др.). В большой субъединице Рубиско, степень гомологии которой у разных видов растений очень велика, последовательность рубисколина-6 образуют 103—108-й остатки.
Показано, что рубисколины-5 и -6 обладают подавляющим сократимость действием на препараты семявыносящего протока мыши и, слабее, подвздошной кишки морской свинки. Эффект блокируется налоксоном, что подтверждает действие пептидов через опиоидные рецепторы. Оба рубисколина являются селективными агонистами 5-рецепторов (выраженное влияние на семявыносящий проток мыши —
Глава 1. Бета-казоморфины — экзогенные лиганды опиоидных рецепторов mouse vas deferens) и относительно слабыми ц -агонистами (незначительное воздействие на подвздошную кишку морской свинки — guinea pig ileum) (Yang et al., 2001).
Фрагменты Рубиско обладают антиноцицептивным действием, типичным для опиоидов. Рубисколин-5 и рубисколин-6 индуцировали снижение болевой чувствительности при пероральном введении (первый — в дозе 300 мг/кг, второй — в дозе 100 мг/кг) в тесте сдавливания хвоста у мыши. Как отмечают авторы (Yang et al., 2001), подобное действие при пероральном введении не характерно для эндогенных опиоидных пептидов. Его наличие в случае рубисколинов, очевидно, обуславливается присутствием в первичной структуре последовательности Туг-Pro, что делает молекулы фрагментов Рубиско (благодаря пролину) более устойчивыми к расщеплению в ЖКТ.
Обнаружено (Yang et al., 2003), что рубисколин-6 улучшает выработку условной реакции пассивного избегания у мышей в дозе 3 нмоль/мышь при внутримозговом введении и в дозе 100 мг/кг при пероральном введении. Выявленный эффект блокируется предварительным введением на-лтриндола, что предполагает действие гексапептида через 8-тип опиоидных рецепторов.
В работе Hirata с соавт. (2007) показано, что внутрибрюшинное (10 мг/кг) и пероральное (100 мг/кг) введение рубисколина-6 оказывает анксиолитическое действие при тестировании в крестообразном приподнятом лабиринте у мышей. Эти эффекты блокируются введением налтриндола. Следовательно, снижающая тревожность активность руби-сколина-6 также опосредована через 8-тип опиоидных рецепторов.
Наиболее недавно открытая группа экзорфинов — фрагменты 0 -субъединицы 0 -конглицинина сои (Ohinata et al., 2007). Для них характерен N-концевой участок Тут-Pro-Phe-Val-... Сойморфины обладают анксиолитическим действием. Показано, что при внутрибрюшинном введении в дозе 3 мг/кг они увеличивают время, проведенное на открытых рукавах (тест крестообразный приподнятый лабиринт). То же наблюдалось и при пероральном введении; минимальные эффективные дозы в этом случае составляли 10—30 мг/кг.
Наличие в растительных белках опиоидных последовательностей, возможно, является попыткой защиты от поедания насекомыми. Конечно, в случае непептидных алкалоидов (морфин, кодеин) это оказывается более эффективно. Однако наличие экзорфинов в составе «обычных» белков также может иметь определенный адаптивный смысл и быть проявле-
нием аллелопатии. Наиболее вероятной такая гипотеза выглядит в случае фрагментов глютенов и, особенно, рубисколинов. Не исключено, что ру-бисколины возникли на Земле даже раньше, чем опиоидная система позвоночных. Интересно, что в опытах на насекомых показана более высокая чувствительность к введению рубисколинов, по сравнению не только с экзо- и эндорфинами, но и даже с морфином (Грицай с соавт., 2008).
Некоторые исследователи также полагают, что экзорфины сыграли определенную роль в становлении человеческого общества (Wadley, Martin, 1993). Действительно, экзорфины молочного и пшеничного происхождения буквально «ворвались» в жизнь человека в эпоху неолита, когда происходило становление сельского хозяйства. Около 10 тыс. лет назад люди в разных уголках планеты начали сажать семена зерновых культур и одомашнивать скот, в том числе для получения молока. Сейчас около 2/3 потребляемого человечеством белка приходится на зерновые культуры.
Wadley и Martin предполагают, что экзорфины сыграли и продолжают играть роль подкрепляющих факторов, стимулирующих потребление глютенов, казеинов, Рубиско и т.п. По нашему мнению, эту гипотезу вряд ли стоит принимать всерьёз. Однако, возможно, доля истины в ней есть. Мы, безусловно, должны учитывать влияние экзорфинов в случае новорожденных (как при питании материнским молоком, так и при искусственном вскармливании), в ходе развития ряда патологий, а также в некоторых случаях генетической предрасположенности.
Казоморфины — фрагменты казеинов молока
Наиболее активно изучаемая группа экзорфинов — фрагменты казеинов молока. Как известно, содержание белка в коровьем молоке колеблется в пределах 2,8—3,2 г/100 мл; в женском молоке — 0,9—1,3 г/100 мл (Конь, 1999). Казеины, являющиеся по своей природе фосфопротеинами, составляют 80% белков молока коровы и около 30% белков женского молока (в случае человека более «весомой» группой являются лактальбумины сыворотки). При этом а-, 0- и к-казеины представлены в соотношении примерно 5:4:1.
Показано, что в результате гидролиза молочных протеинов может образовываться более двухсот различных пептидов (Lemieux, Amiot, 1990). Некоторые из них при системном (имитирующем питание) введении
Глава 1. Бета-казоморфины — экзогенные лиганды опиоидных рецепторов способны проявлять физиологическую активность. Например, дипептид (23—24), образующийся при гидролизе а-казеина, обладает антигипертензивным действием, олигопептид (106—119) выступает в качестве переносчика минеральных веществ. Фрагменты к-казеина (106—116), (106—112), (ИЗ-116) обладают антитромбо-тическими свойствами; фрагменты 0-казеина (49—68), (59—68) и (191—193) являются модуляторами деятельности иллмунной системы. Фрагмент 0 -казеина (177—183) способен активировать синтез ДНК (Hagaune et al., 1989).
Исследование фракций гидролизатов казеина, имеющих опиоидную активность, показало, что активным началом в них являются пептиды, отвечающие следующим требованиям: 1) наличие N-концевого тирозина; 2) присутствие гидрофобного «хвоста» из 3-10 аминокислот; 3) устойчивость к действию протеолитических ферментов. Последний критерий имеет особую важность, поскольку лишь при его выполнении пептид может существовать в организме в течение времени, достаточного для переноса от места введения к рецептору. Работами многих авторов показано, что в наибольшей степени всем перечисленным условиям удовлетворяют некоторые фрагменты 0 -казеина — так называемые 0 -казоморфины.
Впервые выделение 0 -казоморфинов было произведено из казеинового пептона (Brantl et al., 1979; Henschen et al., 1979; Lottspeich et al., 1980). Для этого осуществлялась многоэтапная очистка активной фракции с тестированием опиоидного действия на каждом шаге (оценивалось ингибирующее влияние на сократимость подвздошной кишки морской свинки при электростимуляции). Если в исходном пептоне было около 50 веществ, то после жидкостной хромотографии под высоким давлением получили практически однокомпонентную фракцию. Ее анализ показал наличие одного большого пика с выраженной опиоидной активностью. При структурном исследовании установлено, что этот пик соответствует гептапептиду Tyr-Pro-Phe-Pro-Gly-Pro-Ile, названному затем 0-казомор-фином-7 (0-к-7, bovine 0-casomorphine). Его опиоидная активность подавлялась налоксоном; эффективно действующие концентрации составляли 5—30 мкМ/мл (при разовой аппликации на препарат подвздошной кишки). В дальнейшем 0 -к-7 был идентифицирован как фрагмент (60—66) 0 -казеина молока коровы.
Несколько позже из гидролизатов а-казеина коровы также была выделена фракция, обладающая опиоидной активностью. Данный экзорфин представлял собой смесь двух пептидов — Arg-Tyr-Leu-Gly-Tyr-Leu-Glu и Arg-Tyr-Leu-Gly-Tyr-Leu, фрагментов а-казеина (90—96) и (90—95), соо-
R Ё L Ё Ё L N V Р Ё G I V Ё S L S
SSEESI TRI N К К I EKFQ
SEEQQQTEDELQDKI HP FAQTQSLVYPFPGPI PN (60—66)
SLPQNI PPLTQTPVVVP PF LQP EVMGVS KVKEAM
АР KHKE MP F P KYP VE PF
TES QS LTLTDVENLHLP
L P L L QS WMHQP HQP L PP
TVMF P PQS VLS LS QS К V
L P V P Q К A V P Y P Q R D M P I
Q A F L L Y QE P VL GP VRGP
F P I I V
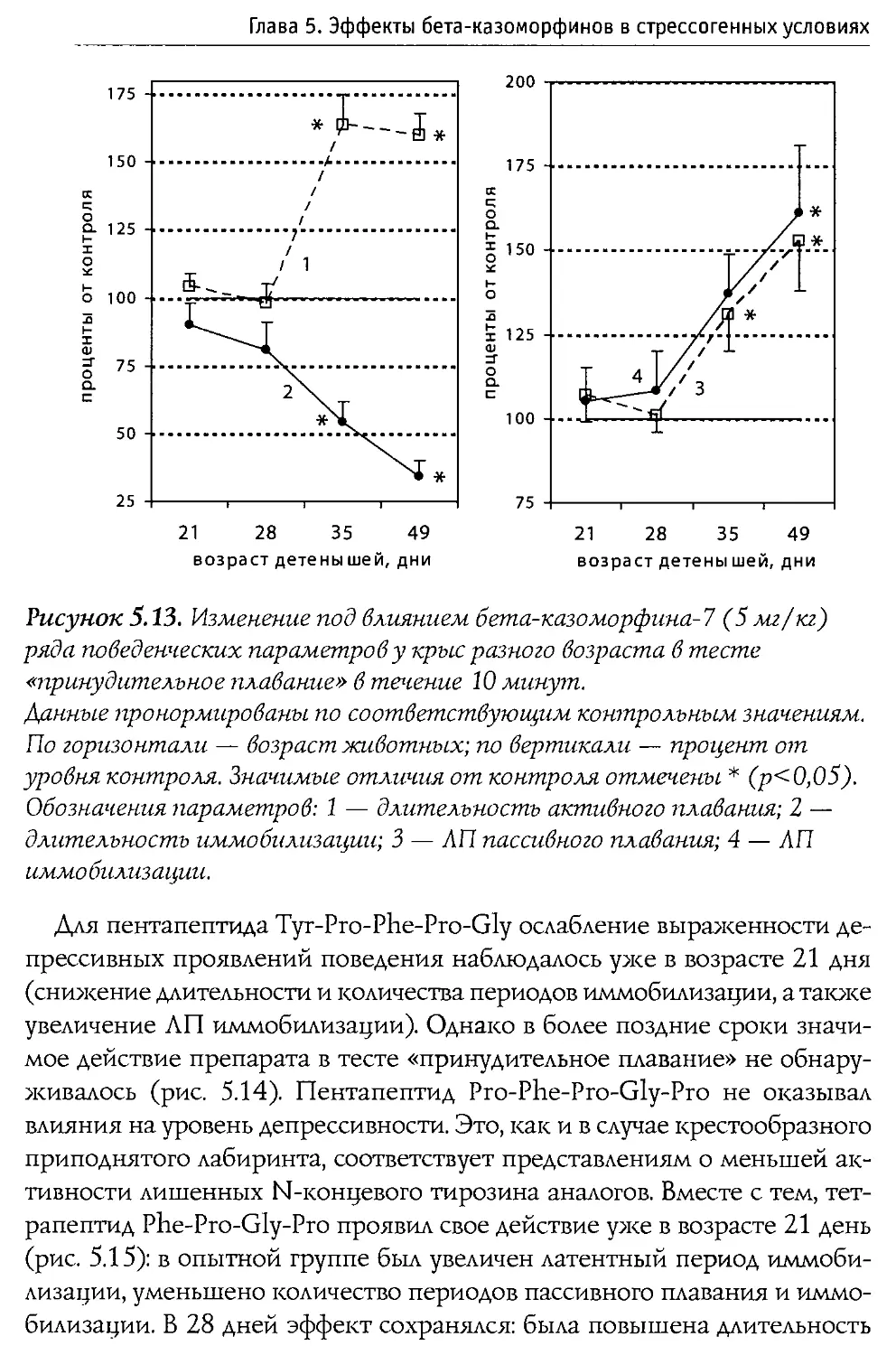
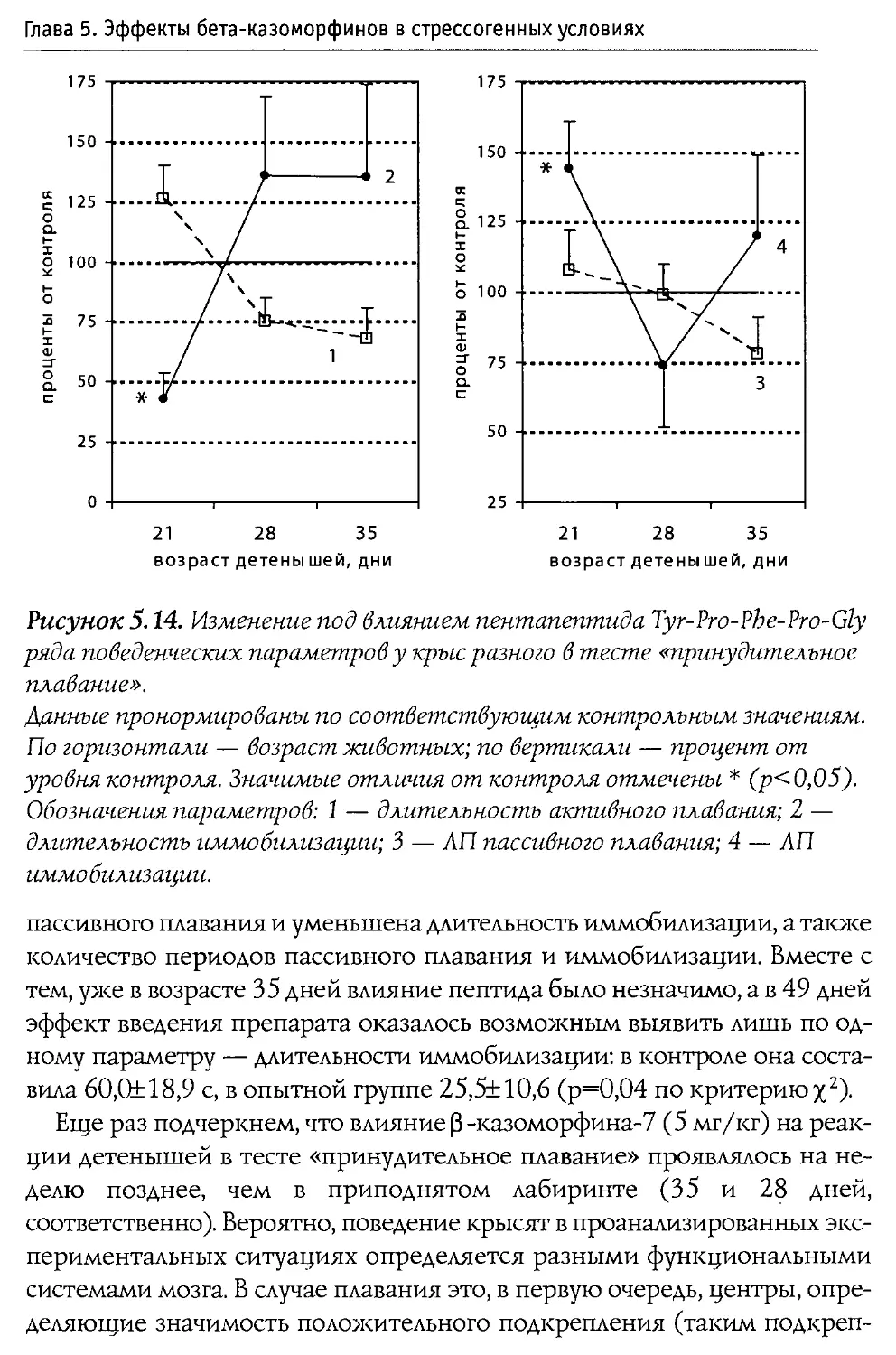
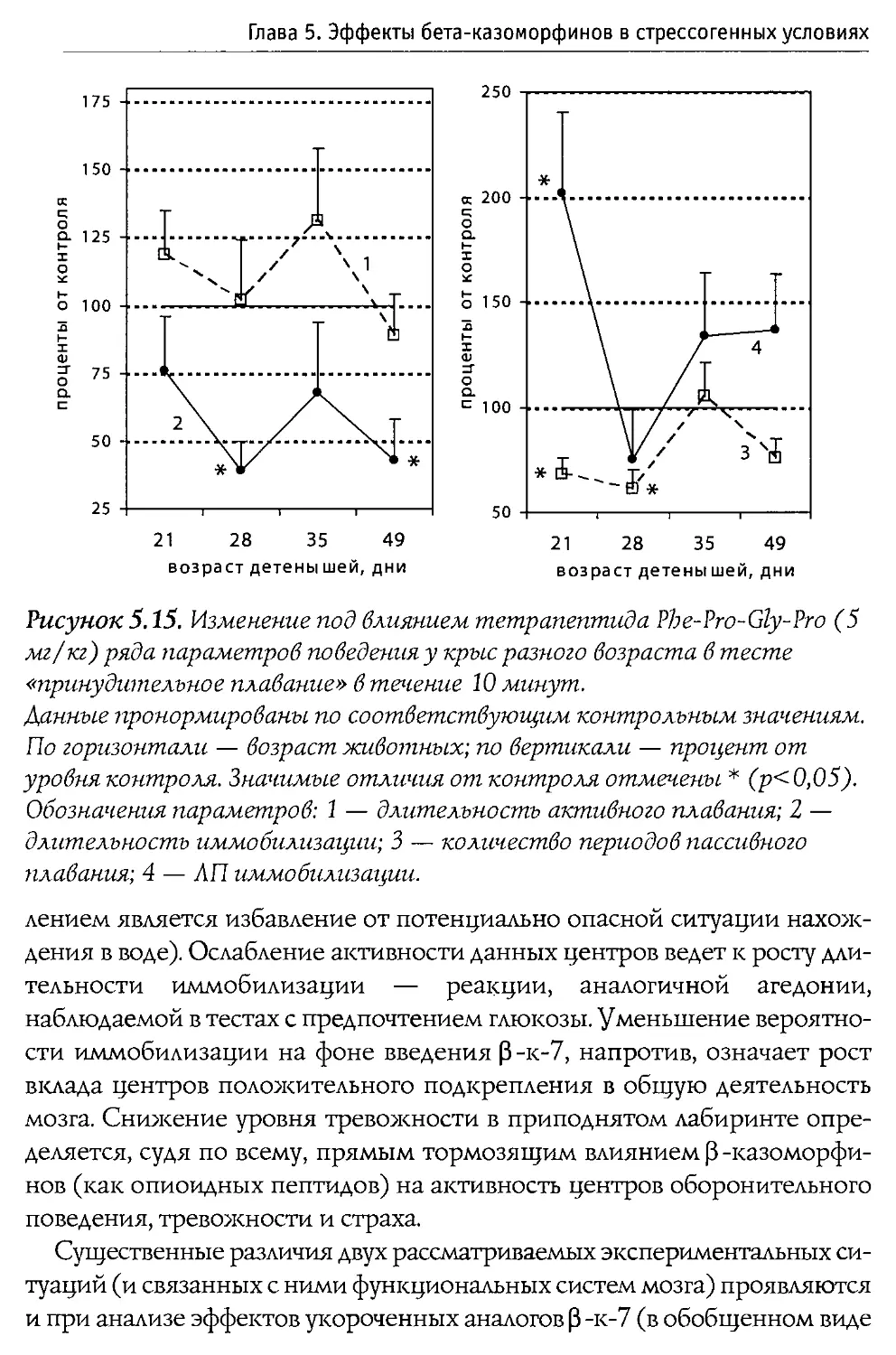
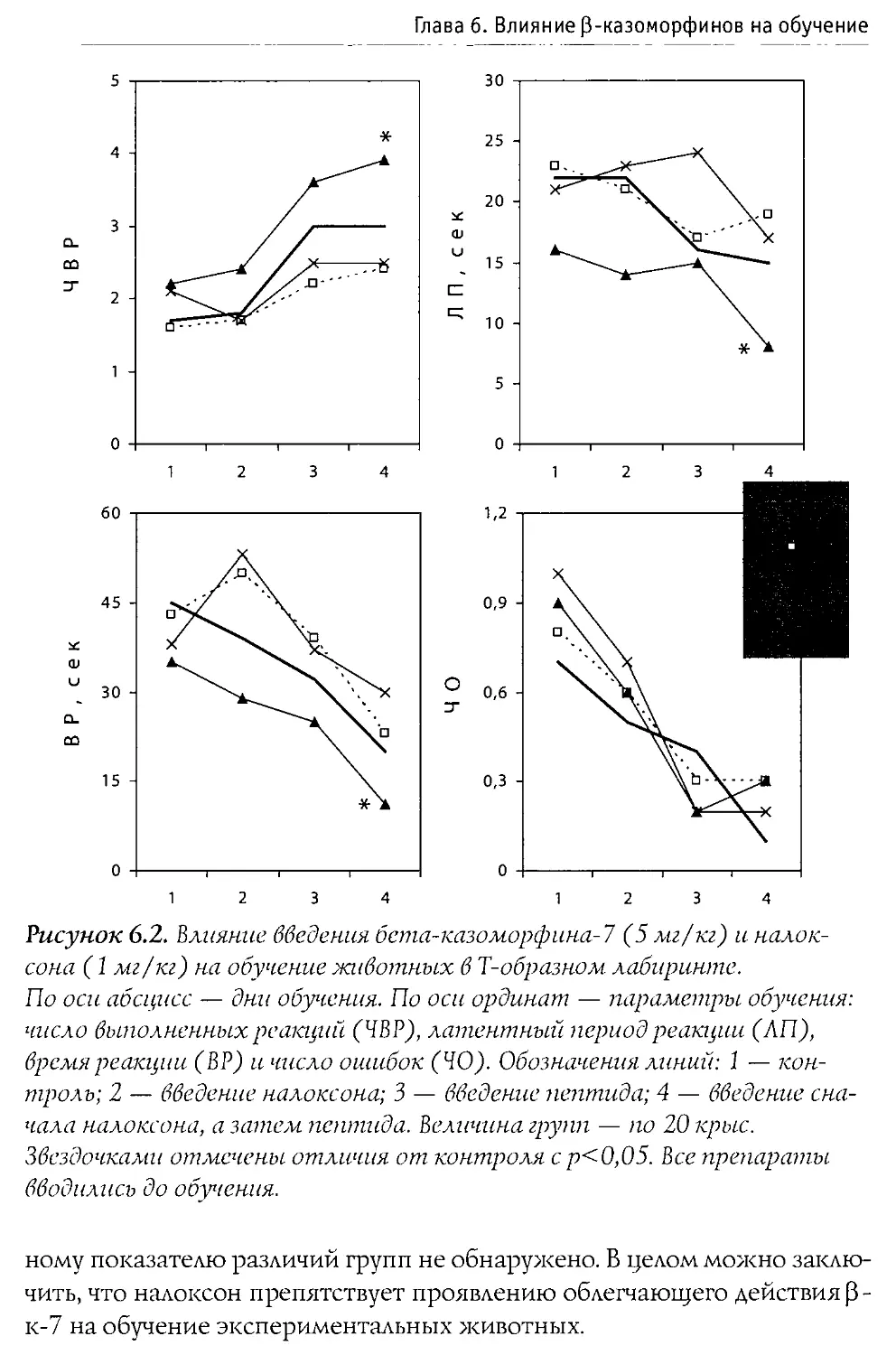
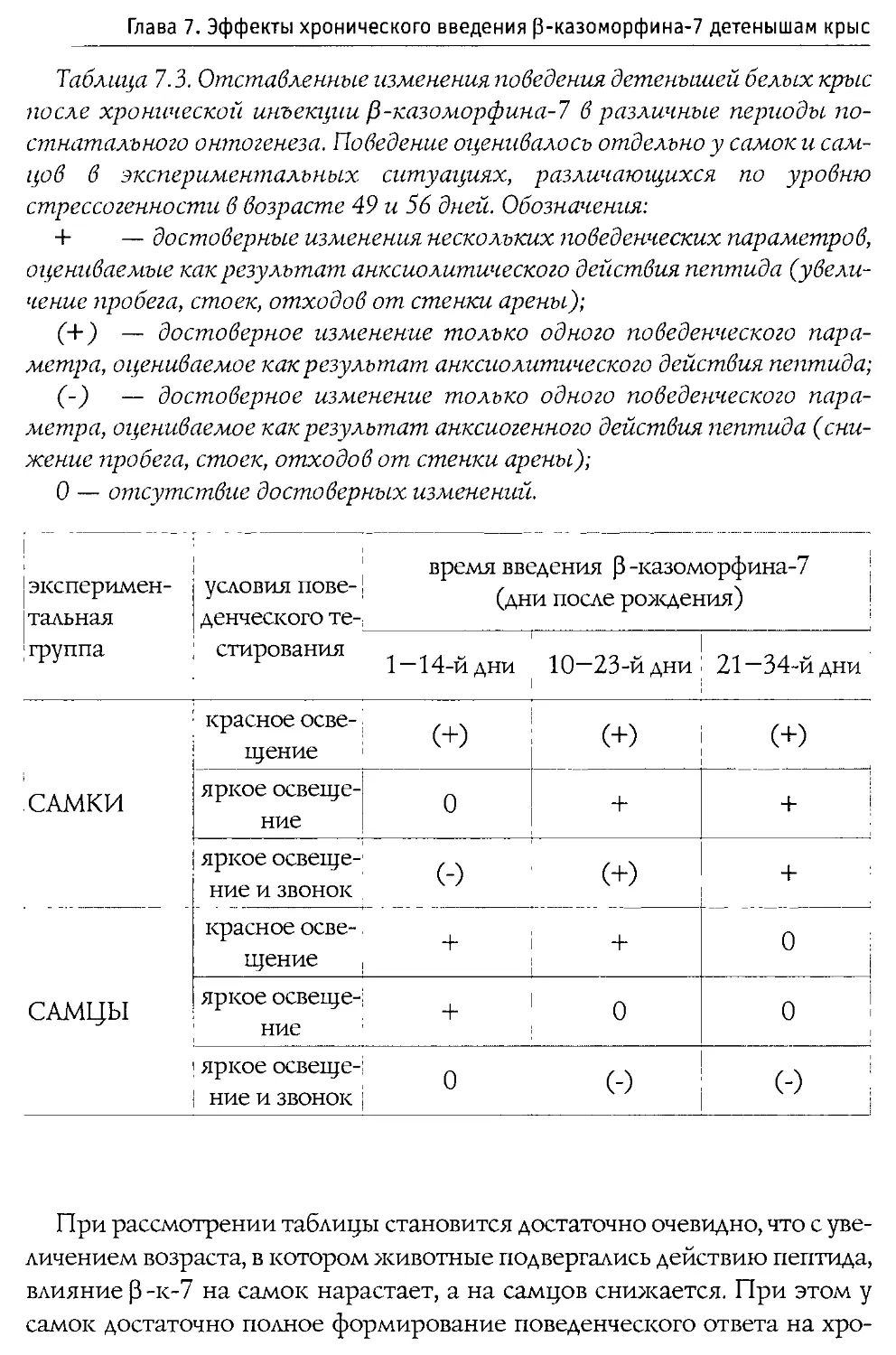
Puc. 1.1. Первичная структура p-казеина коровьего молока и некоторые входящие в его состав физиологически активные пептиды.
60—66 —р-казо морфин-7
177—183 — активатор синтеза ДНК
191—193 — стимулятор деятельности иммунной системы
тветственно (Loukas et al., 1983). Препарат ингибировал вызванные электростимуляцией сокращения семявыносящего протока мыши. Это ингибирующее действие снималось при добавлении налоксона; инкубация с проназой полностью лишала пептид активности. Параллельно было проведено определение первичных аминокислотных последовательностей Р -казеинов овец (Richardson, Mercier, 1979) и буйволов (Petrilli et al., 1983). Оказалось, что они содержат аналогичные Р -к-7 участки в том же положении, что и Р-казеин молока коровы. В 1984 г. Greenberg с соавторами опубликовали структуру р -казеина человека, в котором в положении (51 — 57) располагается аминокислотная последовательность Tyr-Pro-Phe-Val-Glu-Pro-Ile, близкая по структуре к коровьему Р -к-7 (т.н. человеческий Р-казоморфин-7). Дальнейшие эксперименты на препаратах подвздошной кишки подтвердили наличие опиоидной активности у данного соединения (Brantl, 1984; Yoshikawa et al., 1984). Фрагмент а-казеина с опиоидными свойствами находится у человека в положении (158—162) — Tyr-Val-Pro-Phe-Pro (Kampa et al., 1996).
Начинающиеся с Tyr-Pro-Phe- и обогащенные пролином последова-тель-ности аминокислот присутствуют также в казеинах верблюда, ан-
Глава 1. Бета-казоморфины — экзогенные лиганды опиоидных рецепторов тилопы, свиньи, тапира, кенгуру (Alexander et al., 1992; Kappeler et al., 1998). В составе белков молока многих грызунов (крысы, мыши) таких фрагментов не обнаружено. Вместе с тем, Р-казеин морских свинок содержит последовательность Tyr-Pro-Phe-Arg-Arg-Trp-Tyr-Tyr-Gly-Pro (Hall et al., 1984).
Интерес к изучению опиоидных фрагментов казеинов и, в частности, Р -казоморфинов (Р -к) относительно невелик, но стабилен; в год выходит в среднем 10—15 публикаций. Следовательно, литература по пептидам этой группы вполне обозрима — по данным PubMed на лето 2008 г. около 350 работ, которые можно подразделить на ряд основных исследовательских тематик:
1) анализ классических опиоидных свойств Р-к (в т.ч. синтетических аналогов Р -к), то есть способности соединяться со специфическими рецепторами и вызывать анальгезию;
2) переваривание Р -казеинов в ЖКТ, приводящее к появлению Р -к; деградация Р -к; описание деятельности соответствующих пептидаз;
3) возможность всасывания Р -к из полости ЖКТ в кровь у взрослых и новорожденных млекопитающих; проникновение Р-к через гематоэнцефалический барьер;
4) эффекты Р -к на уровне клеток и клеточных культур (лимфоциты, клетки нейробластомы и др.);
5) влияние Р -к на различные системы организма (пищеварительную, эндокринную, сердечно-сосудистую);
6) работы на поведенческом уровне (действие Р -к в условиях стресса; влияние на обучение; активность на фоне экспериментально вызванных дисфункций ЦНС); действие на ЭЭГ и нейронную активность мозга;
7) возможная роль р -к в генезе патологических состояний (постродовой психоз и постродовая депрессия; нарушения деятельности ЦНС новорожденных);
8) развитие прямо противоположных представлений о том, что Р-к являются регуляторными соединениями, которые необходимы для нормального функционирования и созревания различных систем организма детенышей (пищеварительной, нервной и др.).
Опиоидные свойства р-казоморфинов
Для анализа зависимости между структурой соединения и опиоидной активностью авторы первых работ ср-к использовали Y-карбоксипепти
дазу, которая осуществляет С-концевое отщепление аминокислот. Опыты на содержащих ц-рецепторы препаратах подвздошной кишки морской свинки дали следующие результаты: пентапептид Tyr-Pro-Phe-Pro-Gly (0-казоморфин-5 — 0 -к-5) обладает наиболее выраженными опиоидными свойствами, далее в порядке убывания следуют 0-к-4 (Tyr-Pro-Phe-Pro), 0 -к-6 (Tyr-Pro-Phe-Pro-Gly-Pro) и 0 -к-7. Трипептид Tyr-Pro-Phe и дипептид Туг-Pro практически не активны. Не обладают анальгетическими свойствами и лишенные N-концевого тирозина 0-казоморфины (дез-Тут-0-к-5 — Pro-Phe-Pro-Gly, и дез-Тут-0 -к-7 — Pro-Phe-Pro-Gly-Pro-Ile) (Henschen et al., 1979; Brand et al., 1981).
Амидирование (замена С-концевой ОН-группы на аминогруппу) и введение в состав пептидных молекул d-аминокислот приводят к резкому усилению опиоидных свойств 0 -казоморфинов. Среди амидированных аналогов наибольшую активность проявил тетрапептид Tyr-Pro-Phe-Pro-NH2, получивший собственное название «морфицептин». По сравнению с0-к-4 и0-к-5 вызываемые морфицептином эффекты оказались в 10—20 раз выраженнее (Chang et al, 1981; Day et al., 1981; Chang et al., 1982).
Основная часть работ с d-замещенными 0 -к выполнена на крысах. Пептиды вводили внутрижелудочково и в дальнейшем оценивали уровень болевой чувствительности в тестах отдергивания хвоста, сдавливания лапы и др. Было показано (Grecksch et al., 1981; Matthies et al., 1982; Matthies et al., 1984), что при введении крысам 0-к-5 значимое анальгетическое действие вызывает 100—200 нмоль вещества; эффект остается постоянным в течение 50—90 мин. Замена 1-аминокислот на 5-стереоизомеры резко повышает ноцицептивную активность: для dPhe3-0 -к-5 — в 60 раз, для dPro2-0-i<-5 — в 160 раз, для dPro4-0-i<-5 — в 250 раз. Последнее соединение также получило собственное название — «депролор-фин» (Reymann etal, 1983). Замена Phe3 на 0-гомофенилаланин приводит к увеличению опиоидной активности 0 -к-5 в 2 раза; 0 -к-7 — в 5 раз (Lon-gobardo et al., 2000).
Более детальное изучение опиоидных свойств 0 -к позволило выяснить, что они взаимодействуют, прежде всего, с рецепторами ц -типа (Brand et al., 1982). Ингибирующие (по отношению к вызванным электростимуляцией сокращениям) свойства 0-к ослабевали в 5—10 раз при использовании семявыносящего протока мыши (mouse vas deferens) — классического объекта, содержащего 8-опиоидные рецепторы (Chang et al., 1981). Сходные результаты получены и при использовании тканей головного мозга (Brand et al., 1982; Chang et al., 1982). Оценка связывания
Р-к-7, Р-к-5 и Р-к-4 молока человека также выявила максимальную аффинность к р -рецепторам, меньшую — к 5-рецепторам, низкую — в случае к-рецепторов (Koch et al., 1985).
Наиболее специфическими р -агонистами являются относительно короткие Р -казоморфины — пента- и тетрапептиды, их амидированные и содержащие d-аминокислоты аналоги (Matthies et al., 1984). По этой причине некоторые из них и, в первую очередь, морфицептин используются как вещества сравнения (р-селективные лиганды) в разнообразных фармакологических эксперментах (например, Yang et al., 1999; Hosea et al., 2000).
Замена Pro2 на dPip позволила повысить аффинность к 5-рецепторам (эксперименты на mouse vas deferens, но не в случае ЦНС) (Liebmann et al., 1986). Те же авторы, модифицируя 2-4 аминокислоты вр-к-5, осуществили тонкий анализ его связывания с pi и pz-подтипами рецепторов (Liebmann et al., 1991).
Синтез циклических аналогов 0-к-4 и 0-к-5 открыл новые возможности в получении соединений с высокой опиоидной активностью. При этом производилась замена Pro2 на основную d-аминокислоту (d-орнитин, d-лизин) с последующим замыканием цепи между дополнительной аминогруппой 2-го остатка и -СООН группой концевой аминокислоты (Schiller et al., 1987). Было показано, что в результате происходит резкое повышение аффинности к р-рецепторам; анальгетическая активность циклических [dLys2]-p -к-5 и, особенно, [dOrn2]-{3-к-5 оказывается в 100—1000 раз выше, чем у морфина (Ruthrich et al., 1992b). Дополнительная замена на d-стереоизомеры в 3-4 положениях повышала сродство как кр-, так и к8-рецепторам (Schmidt et al., 1991). Антиноцицептивное действие циклических аналогов Р -к-5 сохранялось и было сравнимо с активностью морфина даже при замене Туг1 на фенилаланин. При этом природа эффекта оставалась опиоидной, поскольку анальгезия устранялась предварительным введением налоксона (Ruthrich et al., 1994b).
В ходе дальнейших работ удалось создать циклические аналоги Р -к-5, сохраняющие свойства р-агонистов и одновременно являющиеся высоко селективными 8-антагонистами (Schmidt et al., 1994; Schmidt et al., 1996; Schiller et al., 2000). Полученные данные активно используются авторами для теоретического анализа конформации р- и 8-опиоидных рецепторов, исследования присущих им мест связывания и т.п. (обзор: Schiller, 2005).
Образование 0-казоморфинов в ЖКТ; возможности проникновения через кишечный и гемато-энцефалический барьеры
Высокая устойчивость 0 -казоморфинов к действию пептидаз обусловлена наличием в их молекулах большого количества пролиновых остатков. В результате переваривание 0-казеинов может приводить к «вырезанию» фрагментов различной длины, содержащих 0-к. Первые данные о такой возможности опубликованы Petrilli с соавторами (1984), которые показали, что инкубация in vitro 0-казеина с комплексом протеолитических ферментов приводит к появлению пептидов — предшественников 0-к-7. В последующие годы появилась целая серия работ, подтверждающих этот факт. Так, Chang с соавторами (1985) обнаружили, что после энзиматической деградации казеинов можно идентифицировать не только 0 -к-7 и его предшественники, но и морфицептин. Svedberg с соавторами (1985) продемонстрировали наличие 0-к-7 в кишечнике взрослых людей после употребления молока. Meisel (1986) нашел в кишечнике свиньи при поедании казеина т.н. 0-к-11, обладающий опиоидной активностью, сходной С0-К-5. Еще более длинный предшественник 0-казоморфинов, соответствующий 58—93 фрагменту 0-казеина, был обнаружен в желудке телят после питания молоком (Scanff et al., 1992). С помощью гидролиза панкреатическими ферментами из него были получены фрагменты, устойчивые к действию кишечных пептидаз. Это подтвердило гипотезу авторов о возможности присутствия в ЖКТ активных пептидов даже после действия ферментов поджелудочной железы. Интересно, что вероятность высвобождения 0 -к в кишечнике, помимо всего прочего, зависит от генетических вариаций молекулы 0-казеина, в частности, присутствия в 67-м положении гистидина (Jinsmaa, Yoshikawa, 1999).
К перечисленным работам примыкают исследования, в которых анализируется возникновение 0 -к (в том числе 0 -к-7) в результате бактериального «переваривания» казеинов. Это происходит, помимо экспериментальных условий, в случае образования кисломолочных продуктов и сыра (Hamel et al., 1985; Muehlenkamp, Watthesen, 1996; Haile-selassie et al., 1999). Авторы подобных публикаций делают заключение о самопроизвольном появлении в продуктах питания регуляторных пептидов, способных оказывать существенное влияние на организм человека
Обладая значительной энзиматической стабильностью, 0-казоморфины, относительно медленно распадаются во внутренней среде орга
низма. Помимо уже упоминавшейся Y-декарбоксипептидазы, определенное гидролизующее влияние на них оказывает действующая с N-конца лейцин-аминопептидаза. При этом пепсин, трипсин, химотрипсин практически не активны. В серии работ, посвященных изучению метаболизма 0 -к, было установлено, что в процессах их деградации ключевую роль играют три фермента: внеклеточная экзопептидаза — дипептидил пептидаза IV (DP-IV), пост-пролин-разрезающий фермент (РРСЕ) и пролин-специфическая эндопептидаза (РСЕ) (Hartrodt et al., 1982; Kreil et al., 1983; Petrilli et al., 1984; Caporale et al., 1985). Места приложения активности названных ферментов таковы:
j i у Tyr-Pro-Phe-Pro-Gly-Pro-Ile DP-IV
РРСЕ/РСЕ
Кроме того, отщепление пролин-содержащих дипептидов с Ы-конца молекулы так же, как и DP-IV, может катализировать лизосомальная дипептидил пептидаза II (DP-П). Однако, оптимум pH для DP-П равен 4,5— 5,0 в отличие от DP-IV, для которой эта величина составляет 7,3. Так как среда кишечника слабощелочная, то, по общему мнению, основной вклад в процесс деградации 0 -казоморфинов вносит DP-IV. Велика активность этого фермента и в клетках почечного эпителия (Miyamoto et al., 1987; Ti-ruppathi et al., 1990). Отметим также, что РРСЕ — фермент внутриклеточный, следовательно, он принимает участие в деградации 0-казоморфинов только в гомогенатах in vitro.
Механизмы распада 0 -казоморфина-5 и его производных в гомогенатах мозга, печени, в нативном мозге были детально изучены Stark с соавторами (1986, 1987, 1988). По их данным, время полураспада 0-к-5 в мозге составляет 5 мин, в печени — менее одной мин. Замена природных 1-аминокислот на их d-стереоизомеры повышает стабильность пептидов, причем устойчивость к деградации зависит от положения d-аминокис-лоты в молекуле. Наиболее устойчивыми оказались 0 -к с d-остатками во втором и третьем положениях (dPhe3-0 -к-5 и, особенно, dPro2-0 -к-5). Для первого из них время полураспада в гомогенате мозга составило 70 мин, для второго — более 600 мин. По-видимому, d-стереоизомеры так изменяют конфигурацию пептидной связи между вторым и третьим амино
кислотными остатками, что затрудняют доступ DP-IV Кинетика деградации р -к в мозге и печени различна. Она указывает на то, что активность DP-IV в печени существенно выше; здесь, кроме того, в процессах превращения пролин-содержащих пептидов может принимать участие РРСЕ.
Еще более стабильны d-производные Р -к-5, лишенные N-концевого тирозина (Ae3-Tyr-dPhe3-P -к-5 и Ae3-Tyr-dProz-P -к-5). Активность как DP-IV, так и РРСЕ в этом случае оказывается резко сниженной из-за «крайнего» расположения d-аминокислотных остатков. Это справедливо и по отношению к действию других пептидаз (Stark et al., 1987; Stark et al., 1988).
В настоящее время P -казоморфины и их производные нередко используются как стандартные субстраты при анализе свойств различных пептидаз (прежде всего, пролил-дипептидил пептидаз; см., например, Вап-bula et al., 2000; Sanz, Toldra, 2001).
Имеется также несколько работ, касающихся свойств р -к (например, Р-к-7 женского молока) как ингибиторов эластаз (Wilmouth et al., 1997; Wright et al., 2001). Учитывая важную роль эластаз в генезе целого ряда патологий (например, легочной гипертензии), полученные авторами результаты открывают перспективы для нового направления в исследовании функций р -казоморфинов.
Таким образом, пептиды с опиоидными свойствами могут образовываться в ЖКТ в результате переваривания белков-предшественников. Однако для развития физиологических эффектов р -казоморфинов должно произойти их проникновение через кишечный эпителий в кровь.
Для морфицептина Mahe с соавторами (1990) не обнаружили транспорта интактных молекул через стенку тонкой кишки взрослого кролика. Показано, что пептид слишком быстро подвергается деградации в просвете кишечника. С другой стороны, dAla2,‘*-Tyr5-P-K-5-NH2 (синтетический аналог р-к-5, названный «казокефамид») способен к транспорту сквозь кишечную стенку в кровь в неповрежденном состоянии (Tome et al., 1987). Эффект переноса проявлялся через 2 мин после того, как пептид в концентрации 10-3М добавляли со стороны мукозы кишечника; концентрация казокефамида с противоположной (серозной) стороны составляла 10-7 М. Транспорт морфицептина и р-к-5 через стенку кишечника в неповрежденном состоянии наблюдали только при добавлении в его просвет ингибиторов протеаз (в частности, веществ, блокирующих DP-IV).
На здоровых добровольцах, показано, что про пероральном приеме в количестве 8—16 мг казокефамид затем определяется в плазме крови в концентрации до 0,35 рМ/л. Данное исследование реализовано с целью изучения свойств 0 -к как регуляторов перистальтической активности ЖКТ (Schulte-Frohlinde et al., 2000; подробнее см. ниже).
Существенно дополняет перечисленные публикации работа Read с соавторами (1990), которые использовали в качестве объекта кишечник новорожденных (7 дней) ягнят и поросят. В опытах наблюдался интенсивный перенос 0 -к-7 и морфицептина в кровь в течение 10—15 мин после инфузии. Вместе с тем, происходила быстрая деградация пептидов, в результате чего их концентрация в крови оставалась низкой. Авторы сделали заключение о недостаточности такой концентрации для запуска значимых физиологических эффектов. Однако они же указали на возможность проникновения в кровь более длинных и стабильных пептидов, например, Val-0 -к-7 — фрагмента (59—66) 0-казеина, дополнительно защищенного с N-конца валином
Принципиально важно, что в случае новорожденных мы имеем дело со значительной слабостью кишечного барьера (обзор: Зуфаров, 1998). Для ЖКТ новорожденных характерен захват и перенос в кровь пептидов и белков молока, способных участвовать в регуляции различных функций организма (см., например, обзор Clare et al., 2003). На этом механизме основано, в частности, становление пассивного иммунитета (поступление материнских иммуноглобулинов молозива сначала в клетки кишечного эпителия, а затем в кровь детеныша). Заключение о возможности проникновения 0 -казоморфинов через стенку кишечника подкрепляется и тем, что 0 -к-подобные соединения обнаруживаются в крови после поедания казеина. Это, как правило, довольно длинные пептидные молекулы, которые деградируют до активных форм уже в крови. Данное представление исходно сформулировано в работе Umbach с соавторами (1985), которые нашли 0-к-7-иммунореактивные предшественники в плазме новорожденных телят после первого приема молока. К этой точке зрения присоединились затем многие авторы (Caporale et al., 1985; Brantl, Neubert, 1986), заключив, что крупные неактивные фрагменты казеинов (т.н. проказоморфины) могут распадаться до активных составляющих прямо в мозге.
Наиболее детальное исследование в этой области выполнено Singh с соавторами, которые показали, что базовый уровень 0-K-7-иммунореактивных соединений в крови щенков собаки (возраст 2 и 4 не
дели) составляет 0,08—0,12 рМ/мл и возрастает примерно в 2 раза через 2—4 ч после питания молоком (в разных сериях использовалось молоко собаки и коровы). Употребление соевых заменителей молока не приводило к таким эффектам. Не определялись 0 -к-подобные пептиды и у взрослых собак после питания коровьим молоком Характерно, что также не обнаружено какого-либо присутствия 0 -казоморфинов в крови взрослых людей после переваривания коровьего молока и молочных продуктов (Teschemacher et al., 1986). Это в очередной раз свидетельствует о принципиальной разнице свойств кишечного барьера у новорожденных и зрелых млекопитающих.
Способность к транспорту через эпителий ЖКТ во внутреннюю среду организма подтверждается развитием разнообразных физиологических эффектов после перорального или интрагастрального введения 0 -казоморфинов (например, Schusdziarra et al., 198 3ab; White et al., 2000). Подробнее эти работы будут рассмотрены немного ниже.
Следующим препятствием на пути 0 -казоморфинов, проникших из полости ЖКТ в кровь, является гемато-энцефалический барьер (ГЭБ) — в том случае, если мы акцентируем внимание на нейротропных эффектах пептидов этой группы. Принципиальная возможность прохождения 0 -к через ГЭБ может быть допущена, исходя из гидрофобной природы С-конца молекул 0 -казоморфинов и общих соображений по относительной проницаемости этого барьера для пролин-содержащих пептидов (Poto-man et al., 1991).
Имеются и более прямые данные. В 1983 г. Ermisch с соавторами провели опыты с меченным тритием 0-к-5. После его введения в сонную артерию крысы метка была обнаружена в 18 зонах головного мозга. Накопление метки составляло десятые и сотые доли процента от введенного количества, однако было вполне достоверным. Количество 3Н в областях со слабым ГЭБ (гипоталамус, дно IV желудочка) было примерно в 15 раз больше, чем в остальных зонах. Накопление метки не зависело прямо от количества введенного вещества, что позволило авторам предположить существование особой транспортной (легко насыщаемой) системы, переносящей 0 -к через ГЭБ.
В качестве таковой (видимо, одной из возможных) Banks и Kastin (1987, 1990) предложили рассматривать исходно описанную для Туг-MIF-1 (Tyr-Pro-Leu-Gly-NHz) пептидную транспортную систему — т.н. PTS1. Ее функции, по мере проведения исследований, авторы «распространили» на все содержащие N-концевой тирозин короткие пептиды, в
т.ч. энкефалины и 0-казоморфины. PTS-1 противопоставляется система, переносящая через ГЭБ вазопрессин-подобные пептиды. Повторное периферическое введение агонистов опиоидных рецепторов детенышам крыс усиливает деятельность PTS-1 (Banks et al., 1996).
К настоящему времени показано (обзор: Ganapathy, Miyauchi, 2005), что PTS-1 распознает не все опиоидные пептиды. Ее субстратами являются Туг-MIF-l, энкефалины, 0-казоморфины, динорфины. Другие опиоидные пептиды (киоторфин,0-эндорфин) не переносятся этой транспортной системой. PTS-1 присуща преимущественно эндотелиальным клеткам капилляров мозга, где она создает условия для облегченной диффузии субстратов (протекает без привлечения трансмембранных градиентов ионов и метаболической энергии). Молекулярная природа этой транспортной системы еще не установлена.
Вместе с тем, для целого ряда опиоидных пептидов длиной 4—13 аминокислот описан и Ыа+-зависил<1ый активный транспорт. Субстратом этой транспортной системы являются энкефалины, динорфины, 0-эндорфины, 0 -казоморфины. Кинетика транспорта предполагает вовлечение минимум трех ионов Na+ на один цикл.
Данные о проникновении через ГЭБ лишенного тирозина аналога 0 -к-5 — Ae3-Tyr-dPhe3-0 -к-5 получены in vitro на культуре бычьих цереброваскулярных эндотелиальных клеток. Оказалось, что пептид проходит через монослой этих клеток без существенных преобразований, причем проницаемость эндотелия не изменяется в зависимости от концентрации пептида (1 нМ либо 1 мкМ) и не зависит от того, с какой стороны апплицировали вещество (Stark et al., 1992).
Как и в случае кишечного барьера, ГЭБ новорожденных отличается от такового у взрослых млекопитающих большей проницаемостью по отношению к широкому кругу соединений, в т.ч. опиоидам. Landymore с соавторами (1990) специально исследовали изменение способности опиоидов проникать в ЦНС крыс. Показано, что связывание центрально вводимого селективного ц -агониста [3H]DAGO (Tyr-dAla-Gly-MePhe-Gly-ol) остается низким до 10-дневного возраста. К 15-му дню жизни происходит быстрой рост включения метки до взрослого уровня (показатель созревания ц-рецепторов). Если животным предварительно системно вводили синтетический аналог энкефалина FK 33—824 (Tyr-dAla-Gly-MePhe-Met-(O)-ol), то регистрировалось снижение связывания DAGO в медиобазальном гипоталамусе. Однако такая конкуренция двух опиоидных агонистов наблюдалась лишь до 15-дневного возраста. FK 33—824 у
Глава 1. Бета-казоморфины — экзогенные лиганды опиоидных рецепторов более взрослых крыс не влиял на включение DAGO (признак завершения формирования ГЭБ). Сходным образом FK 33—824 снижал связывание DAGO в срединном возвышении и области аркуатного ядра до 30 дня после рождения.
Продемонстрировано также относительно легкое проникновение через ГЭБ упоминавшегося выше тетрапептида Туг-MIF-l по крайней мере до 21 дня жизни новорожденных крыс (Harrison et al., 1993).
К этим исследованиям примыкает работа, в которой 0-к-8-иммунореактивность была обнаружена в 19 различных зонах среднего мозга, моста и продолговатого мозга новорожденных детей, что дало авторам право высказать предположение о возможном попадании 0-казоморфинов из крови в мозг и их участии в центральной регуляции физиологических процессов (Pasi et al., 1993).
Физиологические эффекты 0-казоморфинов
При изучении влияния 0 -казоморфинов на различные функции организма наиболее частыми объектами исследования выступают пищеварительная и эндокринная системы, которые подвержены значительным регуляторным воздействиям со стороны эндогенных и экзогенных опиоидов.
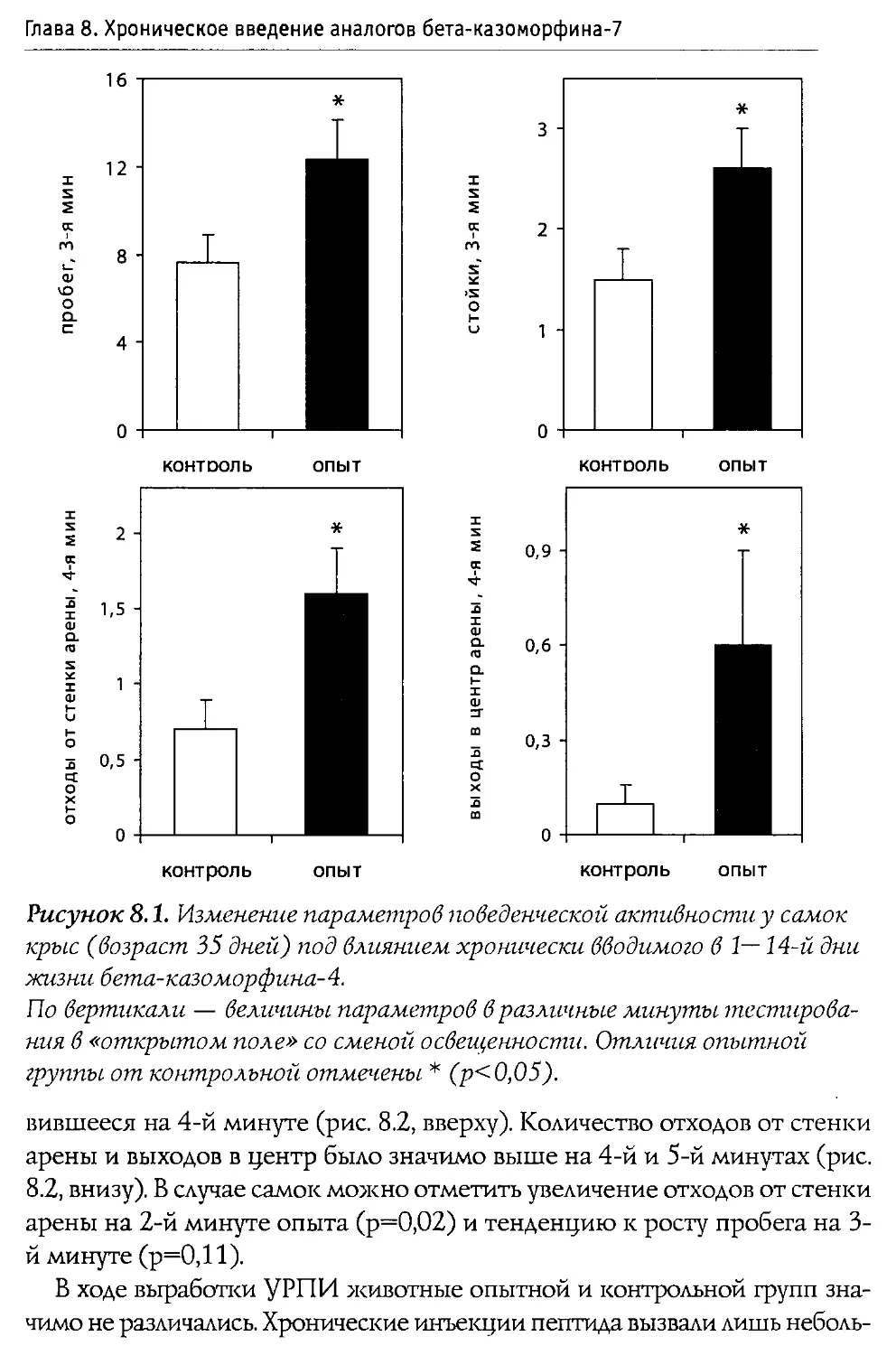
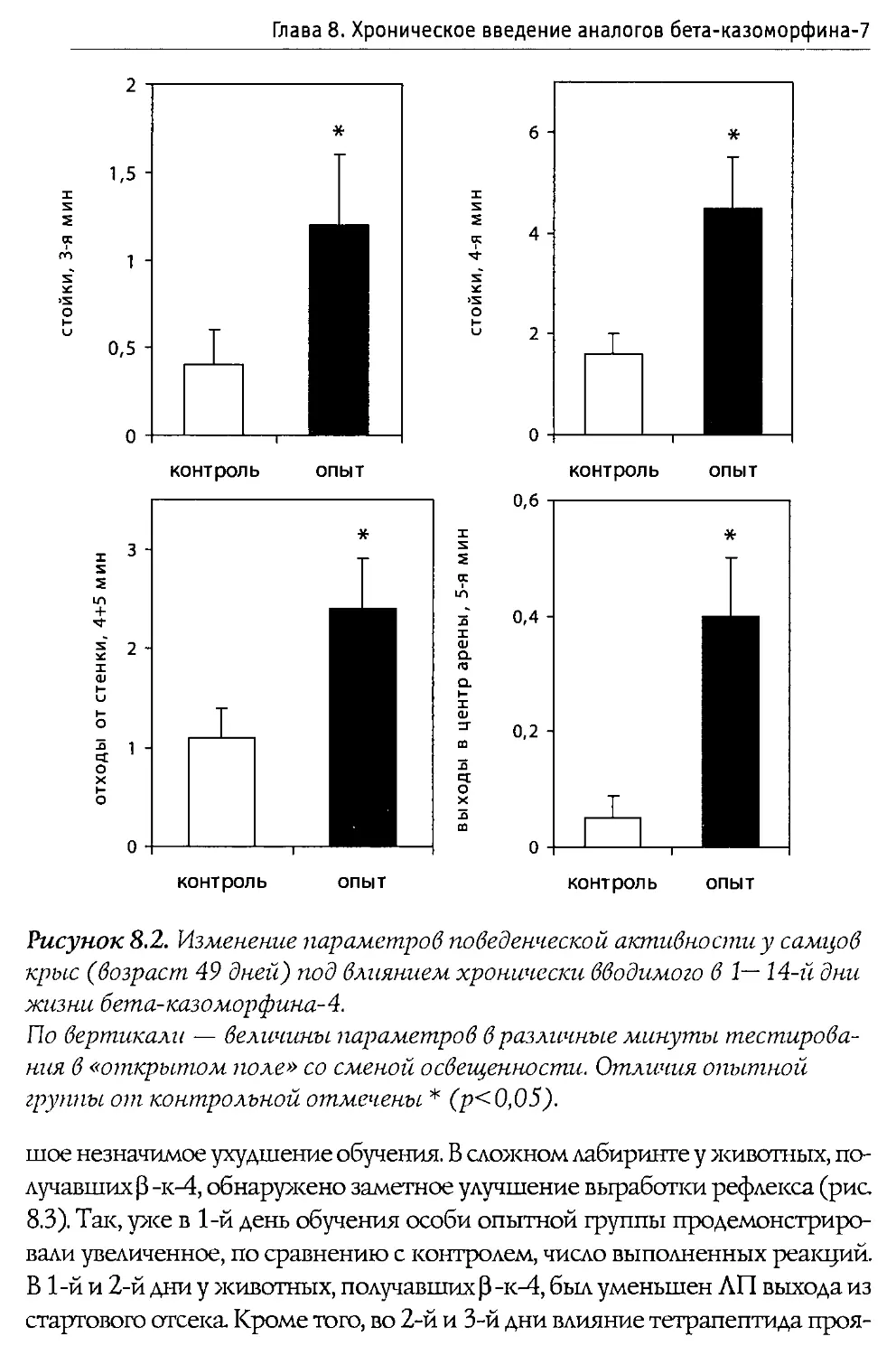
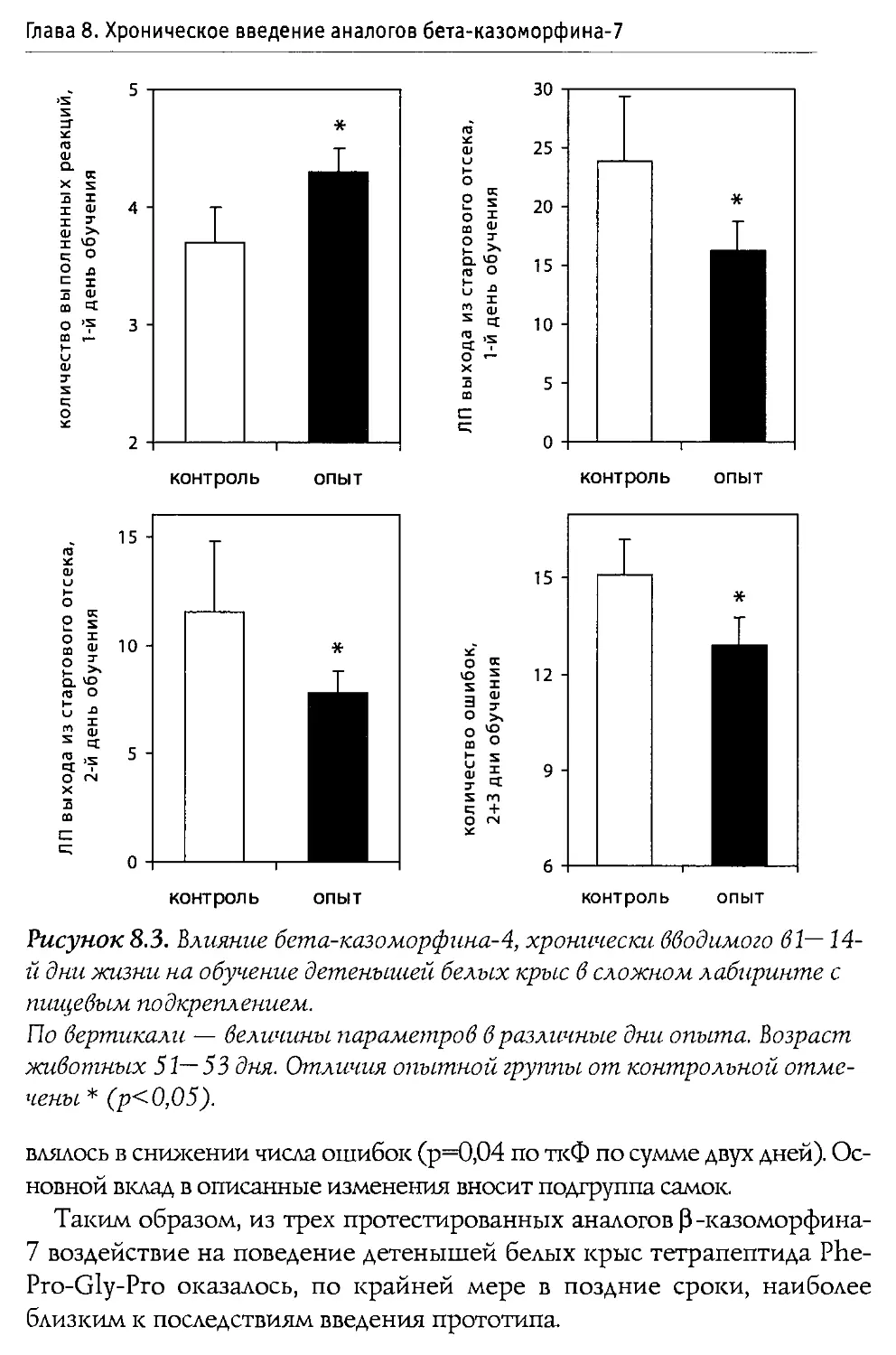
Первое детальное исследование влияния 0 -казоморфинов на сократительную способность желудочно-кишечного тракта (ЖКТ) было выполнено Daniel с соавторами (1990). В ходе экспериментов одна группа крыс получала в качестве пищи суспензию белков без казеинов, другая — суспензию казеинов. Среднее время прохождения содержимого через ЖКТ у животных первой группы оказалось равным 6,5 часа; у животных второй группы — 10,8 часа (значимое замедление перистальтики). Налоксон не оказал заметного влияния на время прохождения в первой группе; для второй группы время прохождения снизилось, составив 5,9 часа. Аналогичные данные были получены и для скорости опорожнения ЖКТ.
В следующей серии опытов к суспензии белков, лишенной казеина, авторы добавляли 0 -к-4-NHz (морфицептин), dAla2-0 -к-4-NHz либо dAla2,4-Туг5-0 -к-5 (доза до 5 мг на животное). Обнаружено, что морфицептин не изменяет показатели активности ЖКТ; Tyr-dAla-Phe-Pro-NTh и Tyr-dAla-Phe-dAla-Tyr, напротив, значительно увеличивают время прохождения. Разница во влиянии 0 -к-4-NHz и dAla-производных достаточно ожидаема и может быть объяснена более высокой устойчивостью последних к протеолизу.
Ослабление перистальтики кишечника морской свинки под действием 0-к-5 зафиксировано De Ponti с соавторами (1989). Активность пептида находилась на уровне, выявленном для морфина. Эффекты 0-к-5 подавлялись налоксоном. Введение 0 -к-4 не приводило к изменением перистальтики.
Способность снижать сократительную активность ЖКТ привела к появлению идеи о том, что 0 -казоморфины можно использовать для лечения диареи (Schusdziarra et al., 1990). Как известно, диарея представляет серьезную проблему для новорожденных млекопитающих (в том числе человека). Она, в частности, является основной причиной смерти детенышей крупного рогатого скота. Если же больным новорожденным телятам в течение трех дней дважды в день в молоко добавлять по 500 мг 0 -к-4-NHz, то к концу курса в 90% случаев симптомы болезни исчезают (Mansfeld et al., 1990). Сходные результаты были получены и на взрослых людях, которые излечивались после 10-дневного приема богатой казеином пищи (Charlin et al., 1992).
Хорошо известно, что морфин и подобные ему соединения ингибируют сократительную активность ЖКТ. Механизмы этого эффекта связаны, в первую очередь, с активацией пресинаптических опиоидных рецепторов, снижающих интенсивность холинергической передачи. Аналогичным образом действуют, видимо, и 0-казоморфины (De Ponti et al., 1989).
В настоящее время продолжается поиск новых препаратов, эффективно ингибирующих перистальтику. Результатом проводимых работ стало появление, например, лоперамида — синтетического ц -агониста, сходного по структуре с фентанилом, но не проходящего ГЭБ и не влияющего на ЦНС. Синтетические производные 0 -казоморфинов оказались весьма перспективны с этой точки зрения. В итоге проведенных исследований (Allescher et al., 2000) был разработан т.н. 0 -к-4027. Этот препарат оказался способен ингибировать перистальтику изолированной подвздошной кишки крысы при использовании в количестве 0,14 мкМ. Для лоперамида и 0 -к-4 дозы, вызывающие аналогичный эффект, были существенно выше: 4,1 и 4,5 мкМ, соответственно. Результаты этих исследований использованы при разработке лечебного детского питания фирмы “Humana” (Германия). Предлагаемая питательная смесь ориентирована на детей разного возраста (начиная с грудных) и предназначена для лечения диарейных заболеваний и расстройств пищеварения различной этиологии. При этом 0-казоморфины рассматриваются как «успокаивающий кишечник» компонент.
Кроме влияния на моторику и тонус гладких мышечных волокон, 0 -к способны управлять и другими аспектами деятельности ЖКТ. Имеется ввиду, в первую очередь, изменение после введения пептидов этой группы транспортной функции кишечного эпителия. Показано (Hautefeuille et al, 1986; Tome et al, 1988), что dAla2,4-Tyr5-0 -к-5-NHz способен усиливать абсорбцию электролитов (Na+, Cl") в подвздошной кишке кролика. Этот эффект ингибировало введение налоксона, тетродотоксина и адреналина. Другие dAla-содержащие аналоги 0 -к-5 действовали сходным образом: природные 0 -к-5 и 0 -к-4 были неэффективны.
Для аналога dAla2,4-Tyr5-0-K-5-NH2 продемонстрировано, кроме того, влияние на водный обмен (Ben Mansour et al., 1988). Эффекты пептида состояли в стимуляции всасывания воды в случае интактной подвздошной кишки кролика и торможении секреции воды на фоне действия холерного токсина.
Наиболее ранние работы по изучению действия 0 -казоморфинов на эндокринную систему были выполнены Schusdziarra с соавторами (1983аЬ). Они посвящены оценке влияния природных 0 -к на выделение инсулина и соматостатина. В первом случае опыты проводили на собаках. Введение пептидов осуществляли внутривенно со скоростью 1 нМ/кг в час. Показано, что 0 -к не влияют на базальный уровень инсулина. Однако на фоне инфузии раствора глюкозы и аминокислот обнаружено, что 0 -к-5 и, слабее, 0-к-7 повышают выделение инсулина в кровь. Эффекты 0-к-5 и0-к-7 совпадали по направленности с действием морфина. Тетрапептид 0-к-4 был неэффективен даже при увеличении скорости введения до 100 нМ/кг в час. Все последствия применения 0 -к-5 и 0 -к-7 блокировались налоксоном Показано также, что 5-агонист лей-энкефалин вызывает определенное ослабление выделения инсулина, а к-антагонист этил-кетоциклазоцин не влияет на него. Это позволило авторам сделать заключение о разной (часто — противоположной) роли опиоидных рецепторов ц-,5- и к-типов в регуляции деятельности эндокринных клеток поджелудочной железы.
Определение уровня соматостатина в крови производилось в методически аналогичном эксперименте. Среди исследованных 0 -казоморфинов в этом случае единственной активной (повышающей выделение гормона) формой оказался 0 -к-5. Содержание соматостатина возрастало и после вливания в желудок раствора глюкозы, аминокислот и 0 -к-5. То же происходило при использовании раствора глюкозы и аминокислот в коровьем молоке. Водный раствор глюкозы и аминокислот изменения уровня соматостатина в крови не вызывал
В работе Mitsuma с соавторами (1984) показано, что внутривенно вводимый крысам Р-к-7 (0,3 мг/кг) вызывает кратковременное (в пределах 1 ч) снижение содержания в плазме тиролиберина (TRH) и тиреотропного гормона (TSH). Уровень тироксина при этом значимо не менялся. Пептид блокировал увеличение выброса TRH и TSH в ответ на холод. Вместе с тем, рост уровня TSH после введения TRH на фоне Р -к-7 сохранялся. Эффекты пептида частично устранялись налоксоном. Nedvidkova с соавторами (1985) продемонстрировали рост содержания пролактина в сыворотке крови после внутрибрюшинного введения не только Р -к-7, но и его аналога с замещенным фенилаланином — Tyr-Pro-Gly-Pro-Gly-Pro-Пе. Действие аналога было даже более выражено. Эффекты изученных пептидов блокировались предварительным введением налоксона. Sha-coori с соавторами (1992) изучено изменения выброса лютеинизирующего гормона (LH) и его гипоталамического рилизинг-фактора (LHRH) в ходе воздействий на опиоидную систему. Показано, что Р -к-7 и не изменяет базальный уровень названных гормонов. Однако он способен примерно на 1/2 ослабить вызванный налоксоном выброс LH, а также на 1/4 уменьшить рост концентрации LH, возникающий после введения LHRH.
В 1988 г. Mentz с соавторами провели изучение влияния р-к-5 на изолированный препарат сердца морской свинки. Показано, что пептид в малых концентрациях (10-9—10~7 М/л) вызывает положительный инотропный эффект (увеличение силы сокращений). При использовании больших количеств Р-к-5 (10~5~ 10-6 М/л) наблюдались кардиодепре-ссивные изменения. Доза 10-8 М/л вызывала учащение ритмической активности препарата, доза 10-6 М/л — урежение. Обнаруженные эффекты не изменялись на фоне введения налоксона.
Возможные механизмы кардиотропного действия Р-к-5 проанализированы в следующей статье тех же авторов (Liebmann et al., 1990). Работа посвящена исследованию влияния р-к-5 на Р-адренорецепторы клеток сердца морской свинки. Показано, что пептид приводит к налоксон-не-зависимому увеличению связывания Р -агониста изопротеренола. Однако при этом вызываемое изопротеренолом увеличение сократимости сердца на фоне Р-к-5 ослабевает; снижается и присоединение ГТФ к мембранам клеток сердца. Следовательно, в целом влияние пептида на Р-адренорецептор и его комплекс с G-белком можно охарактеризовать как десен-ситизирующее.
Небольшая модификация первичной структуры Р -к привела к тому, что полученный гексапептид Tyr-Pro-Phe-Pro-Pro-Leu приобрел способ
ность к взаимодействию с нейрокининовыми NKi рецепторами (Fujita et al., 1996). В соответствующей публикации показано его вазорелаксирующее влияние на стенку брыжеечной артерии собаки. При использовании перорального введения пептида (3 мг/кг) наблюдалось снижение артериального давления.
Elitsur и Luk (1991) первыми продемонстрировали антипролифера-тивное действие 0 -к на лимфоциты человека. Эффект пептидов был на-локсон-зависимым Позже Kayser и Meisel (1996) исследовали действие 0 -к-7 на деление лимфоцитов более подробно и показали его дозозависимый характер: в количествах менее 10‘7 М/л пептид ослаблял пролиферацию; в более высоких дозах — усиливал её. Rabgaoui с соавторами (1994) обнаружили, что 0 -к-4 ослабляет продукцию свободных радикалов кислорода нейтрофилами человека. Другой пептид пищевого происхождения Arg-Tyr-Ley-Gly-Tyr-Leu (фрагмент 90—95 а-казеина) оказывает противоположное по направленности действие.
В целом можно сказать, что под действием 0 -к наблюдается определенная иммуносупрессия, характерная также, например, для морфина. Однако этот вывод вряд ли можно считать окончательным, поскольку многие опиоидные пептиды, в том числе эндогенные, могут проявлять иммуностимулирующие свойства (при определенных условиях либо в определенных дозах).
Показано, что 0 -к-7,0 -к-5 и морфицептин дозозависимо снижают пролиферацию раковых клеток молочной железы (Hatzoglou et al., 1996). Аналогичные результаты получены в случае использования культуры раковых клеток предстательной железы человека (Kampa et al., 1997).
Sakagushi с соавторами (1998) показано, что 0 -к-5 способен усиливать рост нейритов в культуре клеток нейробластомы мыши. Эффект пептида был налоксон-зависимым и наблюдался при его использовании в пикомолярных концентрациях. При этом синтетические 5- и к-агонисты, а также энкефалины и динорфин А на рост нейритов не влияли. К рассмотрению этой работы мы еще вернемся, поскольку она имеет прямое отношение к возможным нейротропным функциям, выполняемымй0-к в ранний постнатальный период.
Представления о функциональном значении 0-казоморфинов
В литературе сосуществуют две противоположные точки зрения на физиологическое значение 0 -казоморфинов. Ряд исследователей рассматри
вают их как патогенетический фактор, способный привести к серьезным нарушениям в работе организма кормящих матерей и новорожденных (в первую очередь, к сбоям в деятельности ЦНС). Другими учеными развивается представление о необходимости (желательности) присутствия Р-к в пище. В этом случае пептиды данной группы рассматриваются как «пищевые гормоны», регулирующие текущую деятельность некоторых систем органов (например, перистальтику ЖКТ) и создающие определенный нейромодуляторный фон, на котором происходит окончательное созревание ЦНС детенышей.
Материнский организм может подвергнуться действию р -к во время беременности и выкармливания новорожденного. В этом случае Р -казеины, образовавшись в молочной железе, способны здесь же деградировать на составляющие пептиды (Renlund et al., 1993), которые затем переносятся в кровоток матери. Действительно, в плазме 26 из 35 женщин на разных сроках беременности и 100 из 138 женщин в период кормления были обнаружены Р -к-иммунореактивные вещества (Koch et al., 1988). У мужчин и небеременных некормящих женщин они отсутствовали.
В дальнейшем Р -к могут проникать в ЦНС. Подтверждением служат сообщения о присутствии р -казоморфин-подобных пептидов в спинномозговой жидкости у здоровых беременных и кормящих женщин, а также, в особенно высокой концентрации, у женщин, страдающих послеродовым психозом и депрессией. Впервые такие измерения были проведены Lindstrom с соавторами (1984).
Описание послеродового психоза как отдельной патологии принадлежит Матсе (1858), который обследовал несколько десятков пациенток и обратил внимание на связь психического расстройства и начала лактации. В большинстве случаев психоз развивается в течение первых двух недель после рождения ребенка. Для ранних стадий характерны бессонница, беспокойство, депрессия и раздражимость. Далее тяжесть проявлений обычно нарастает. Больная начинает высказывать бредовые идеи, испытывает эмоциональные отклонения, восприятие нарушается вплоть до дезориентации во времени и пространстве, иногда — до галлюцинаций.
У матерей, страдающих этой болезнью, уровень р-к-8-иммунореактивных веществ в плазме и спинно-мозговой жидкости значительно выше, а уровень р -казеинов в молоке ниже, чем у здоровых женщин (Nyberg et al., 1988). Авторы предполагают, что причина этого во многом связана с анормальной протеолитической активностью, когда образуется
Глава 1. Бета-казоморфины — экзогенные лиганды опиоидных рецепторов большое количество фрагментов Р -казеина с опиоидными свойствами. Проникая через ГЭБ, они в итоге и вызывают психическое расстройство. Вторым фактором риска, по-видимому, является индивидуально повышенная чувствительность рецепторной составляющей опиоидной системы мозга.
Широкое распространение в прессе и медицинской литературе имеют также представления о потенциально вредном действии Р -казоморфинов на организм новорожденных. Это касается, в первую очередь, связи р -к и аутизма. Кроме этого Р -к «подозревают» в негативном влиянии на дыхание. Однако при ближайшем рассмотрении оказывается, что какие-либо серьезные данные, подкрепляющие эти представления, пока что отсутствуют.
Опиатная гипотеза детского аутизма (Leboyer et al., 1993) предполагает, что данная патология может быть результатом чрезмерной активности опиатной системы мозга в течение неонатального периода. Это, в свою очередь, способно ингибировать социальную мотивацию, порождая аутистическую изоляцию и отчужденность. Гипотеза основана на трех группах фактов: 1) подобие между аутистическими симптомами и ненормальным поведением, вызываемым у молодых животных инъекциями опиоидов (в т.ч. увеличение социальной отчужденности и уменьшение социальной вокализации); 2) прямое биохимическое свидетельство ненормальности периферической эндогенной опиоидной системы при аутизме; 3) терапевтические эффекты блокады опиоидных рецепторов налоксоном и налтрексоном при аутизме.
Однако представление о том, что именно Р-казоморфины могут быть фактором, запускающим патогенез аутизма (например, при хронических нарушениях в работе ЖКТ, плохом функционировании пептидаз и т.п.), еще не подкреплено реальными клиническими и экспериментальными данными. Кроме того, опиатная гипотеза аутизма «конкурирует» с большим числом аналогичных (и значительно более популярных) гипотез о роли моноаминергических систем в генезе той же патологии (см., например: Trottier et al., 1999).
Угнетающее дыхание действие морфицептина и р -к продемонстрировано лишь в одной работе на новорожденных кроликах (Hedner, Hedner, 1987). Для развития эффектов природных пептидов требовалось внутримозговое введение; при системном применении сохранялись лишь эффекты морфицептина. У взрослых крыс респираторные эффекты даже морфицептина были очень слабы. Тем не менее, вскоре после публикации этой работы Ramabadran и Bansinath (1988) высказали гипотезу о
Глава 1. Бета-казоморфины — экзогенные лиганды опиоидных рецепторов возможной роли опиоидных фрагментов казеина в развитии т.н. «синдрома внезапной смерти новорожденных».
Данный синдром является третьей по встречаемости причиной смерти новорожденных в развитых странах (США — около 6 тыс. в год). Смерть ребенка наступает без предварительной явной патологии обычно во время ночного сна. В качестве причины рассматривается, прежде всего, незрелость дыхательных центров заднего мозга. Поскольку опиоиды оказывают тормозящее действие на эти центры (Morin-Surun et al., 1992), их рассматривают как один из патогенетических факторов синдрома внезапной смерти.
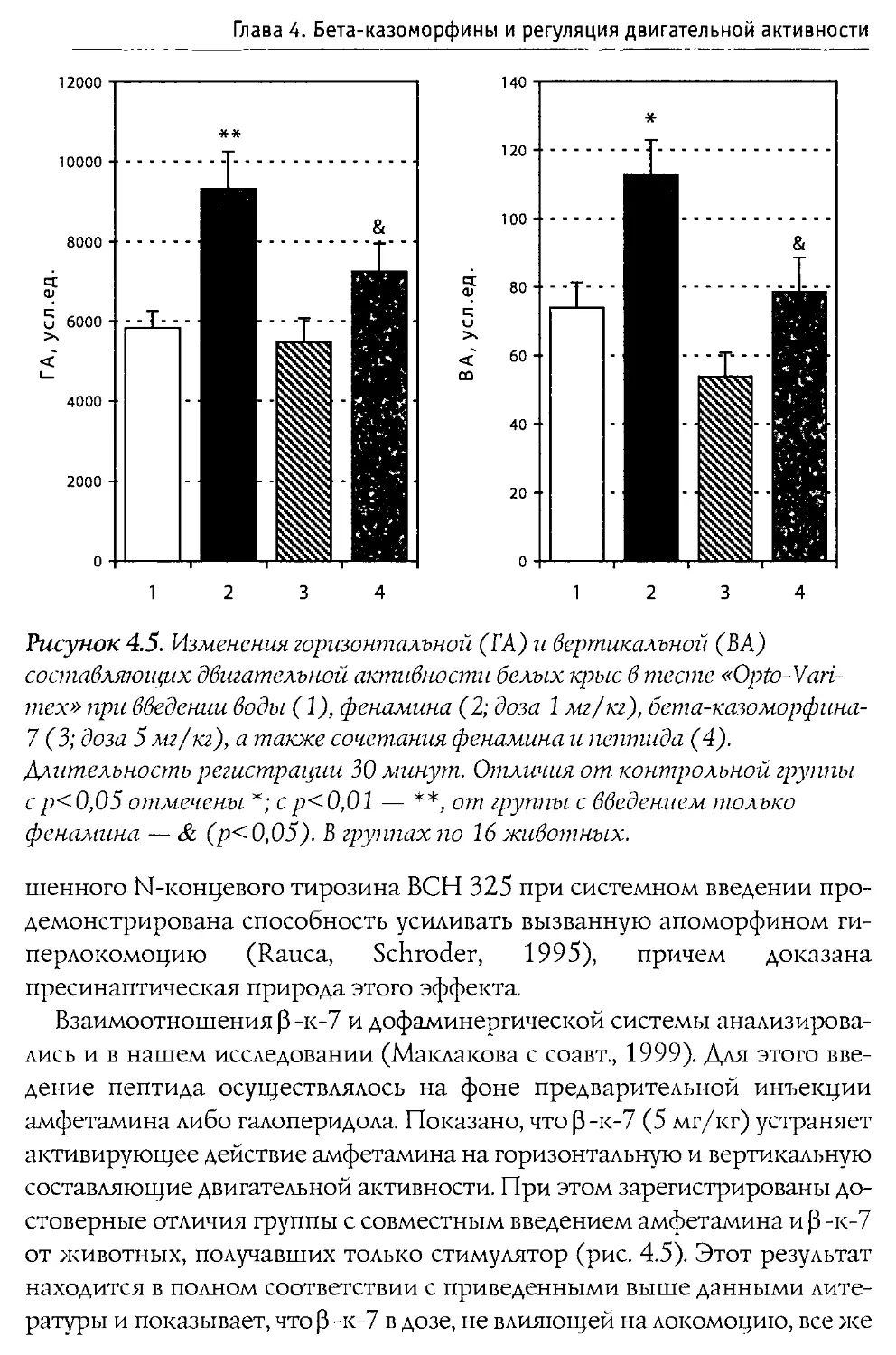
Положение дел таково, что подавляющее большинство исследований по изучению активности р -казоморфинов проводились и проводятся на взрослых животных. Но обратимся к ситуации, существующей в природе. Совершенно ясно, что если у р -казоморфинов имеется реальная физиологическая функция, то она должна проявляться в раннем постнатальном периоде, когда детеныши млекопитающих потребляют в качестве пищи исключительно молоко. Еще Volterra с соавторами (1986аЬ) было сформулировано представление о том, что Р -казоморфины, вероятно, оказывают положительное влияние на становление и развитие ЦНС и играют определенную роль в процессах индивидуального развития. Это представление было поддержано в дальнейшем немецкими учеными, которым принадлежит наибольшее количество исследований активности Р-казоморфинов (Teschemaher et al., 1997; Meisel, FitzGerald, 2000).
Те не менее специфика положительного действия р -к на организм новорожденных пока изучена очень мало. До наших исследований сам факт его существования оставался столь же недоказанным, как и представления о вреде, наносимом этими пептидами развивающейся ЦНС. В литературе имелись лишь три работы, посвященные исследованию действия Р -казоморфинов на новорожденных крысят. В наиболее ранней из них (Cuomo et al., 1989) авторы пытались обнаружить влияние пептидов этой группы на частоту и интенсивность ультразвуковой вокализации, вызванной удалением детеныша из гнезда. Однако каких-либо изменений зарегистрировано не было. Не было их и при использовании налоксона. В то же время морфин снижал частоту и громкость вокализаций, хотя и увеличивал продолжительность каждого «призыва».
В 1990 г. Taira с соавторами предприняли попытку оценить, как системно вводимый в дозах 1—100 мг/кгР-к-7 влияет на сон новорожден-
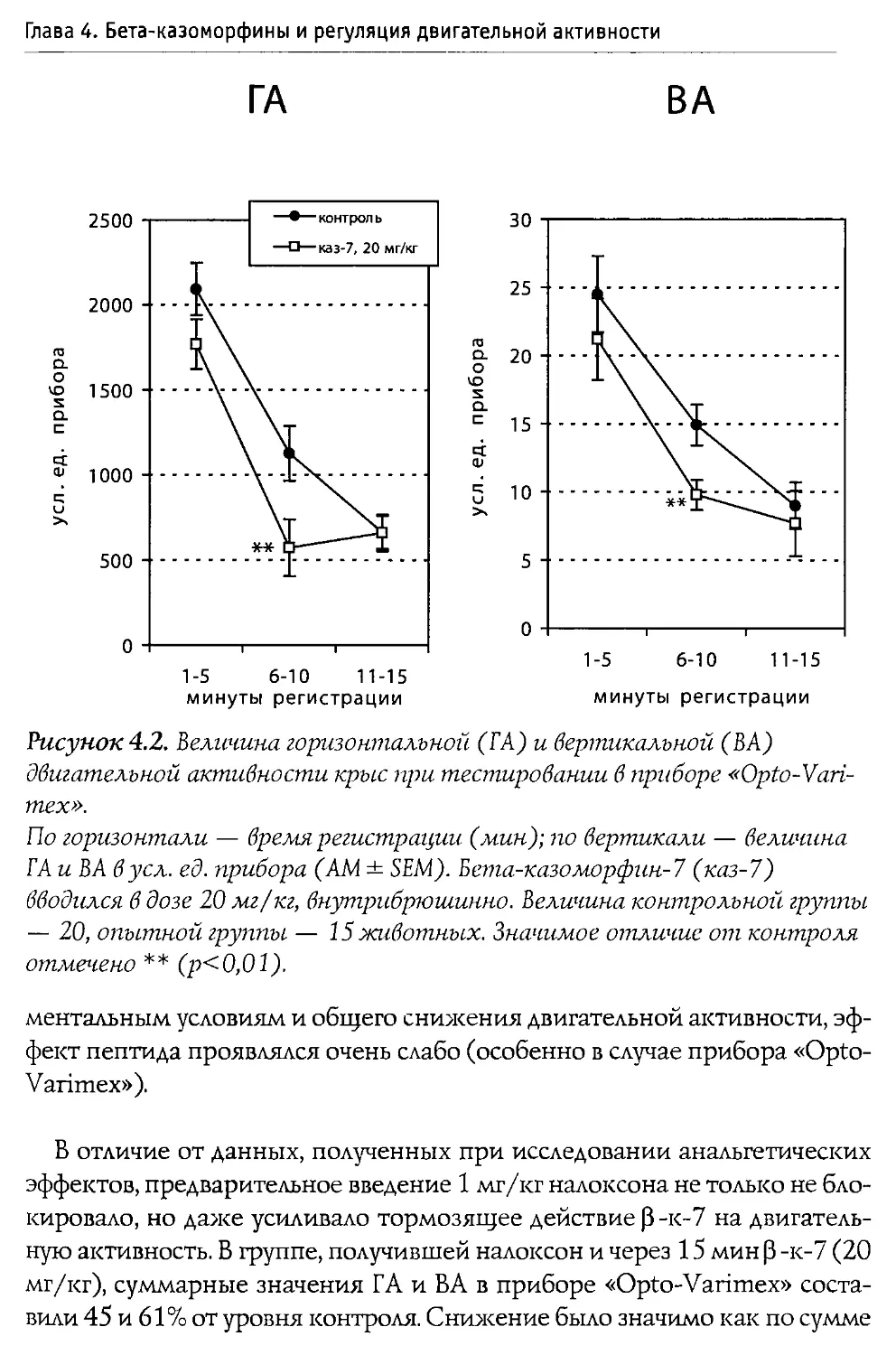
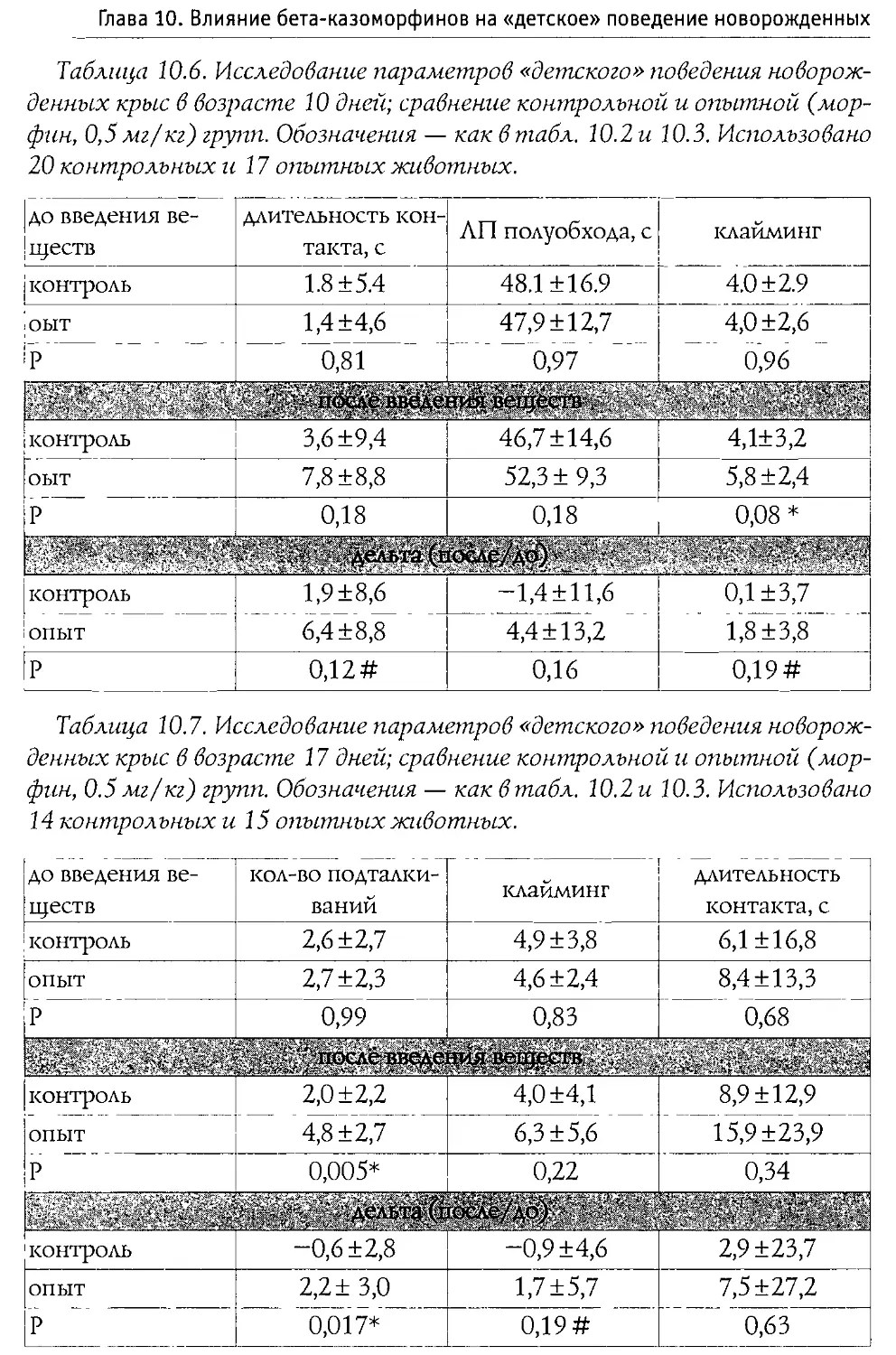
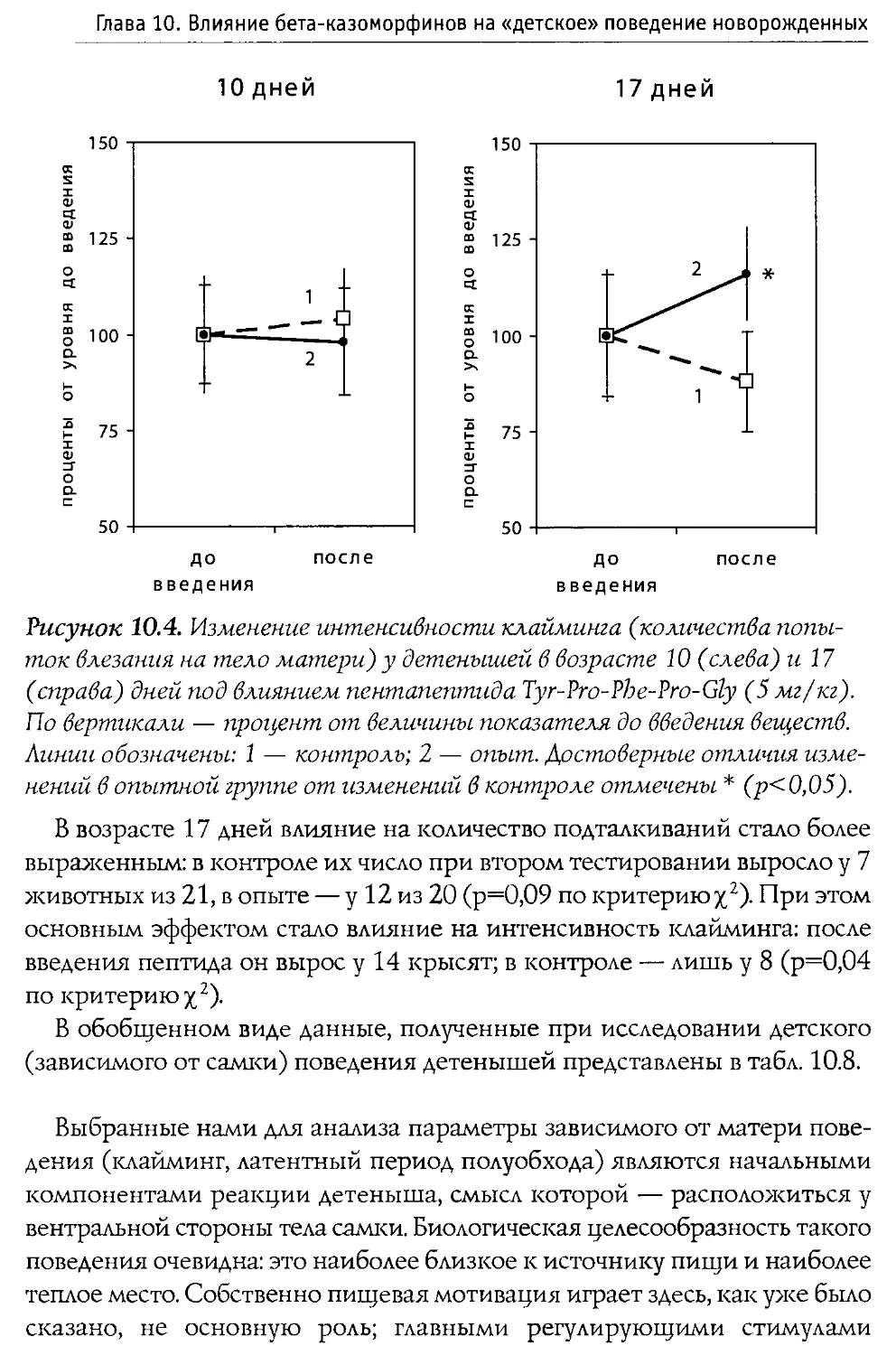
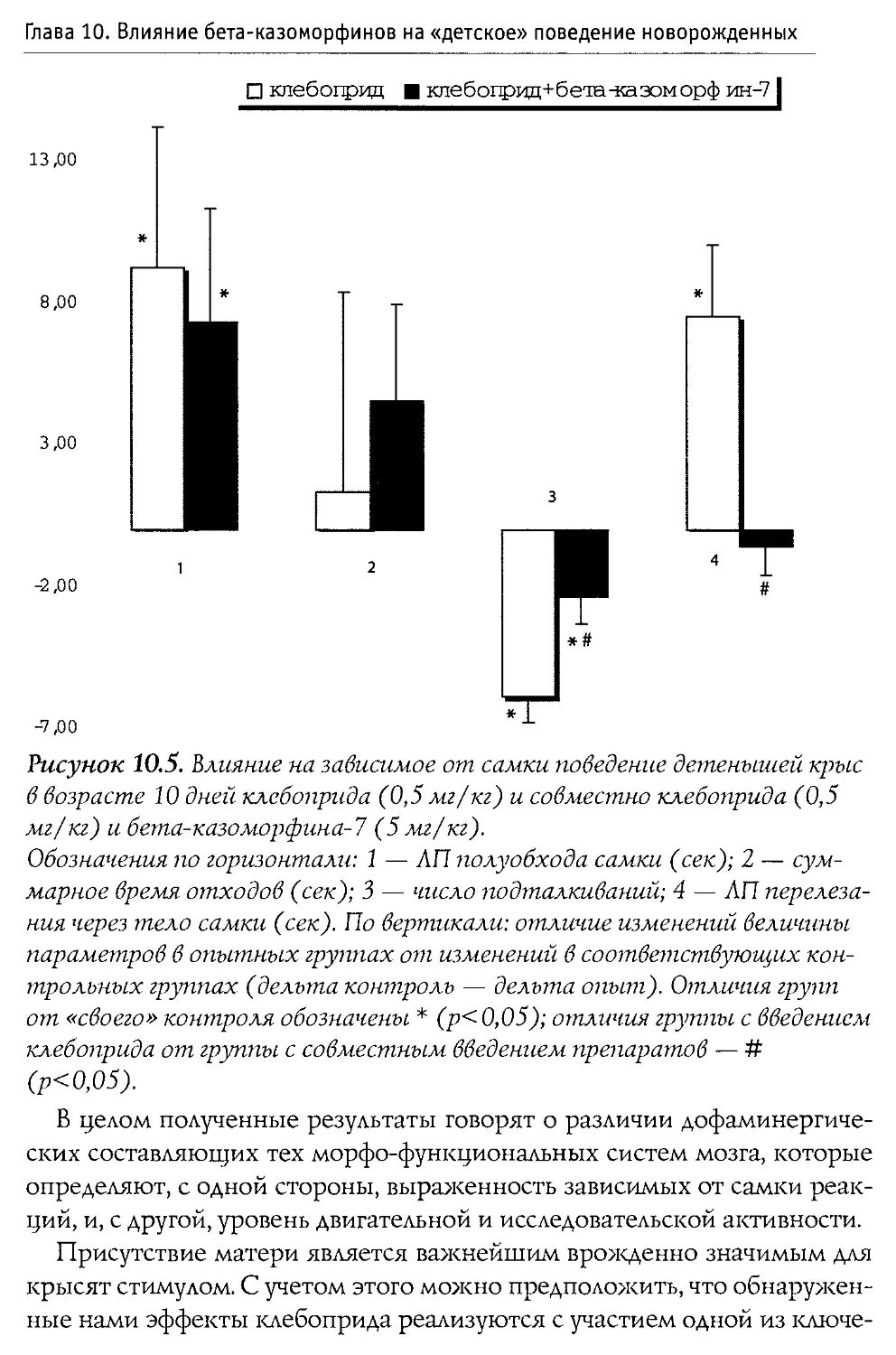
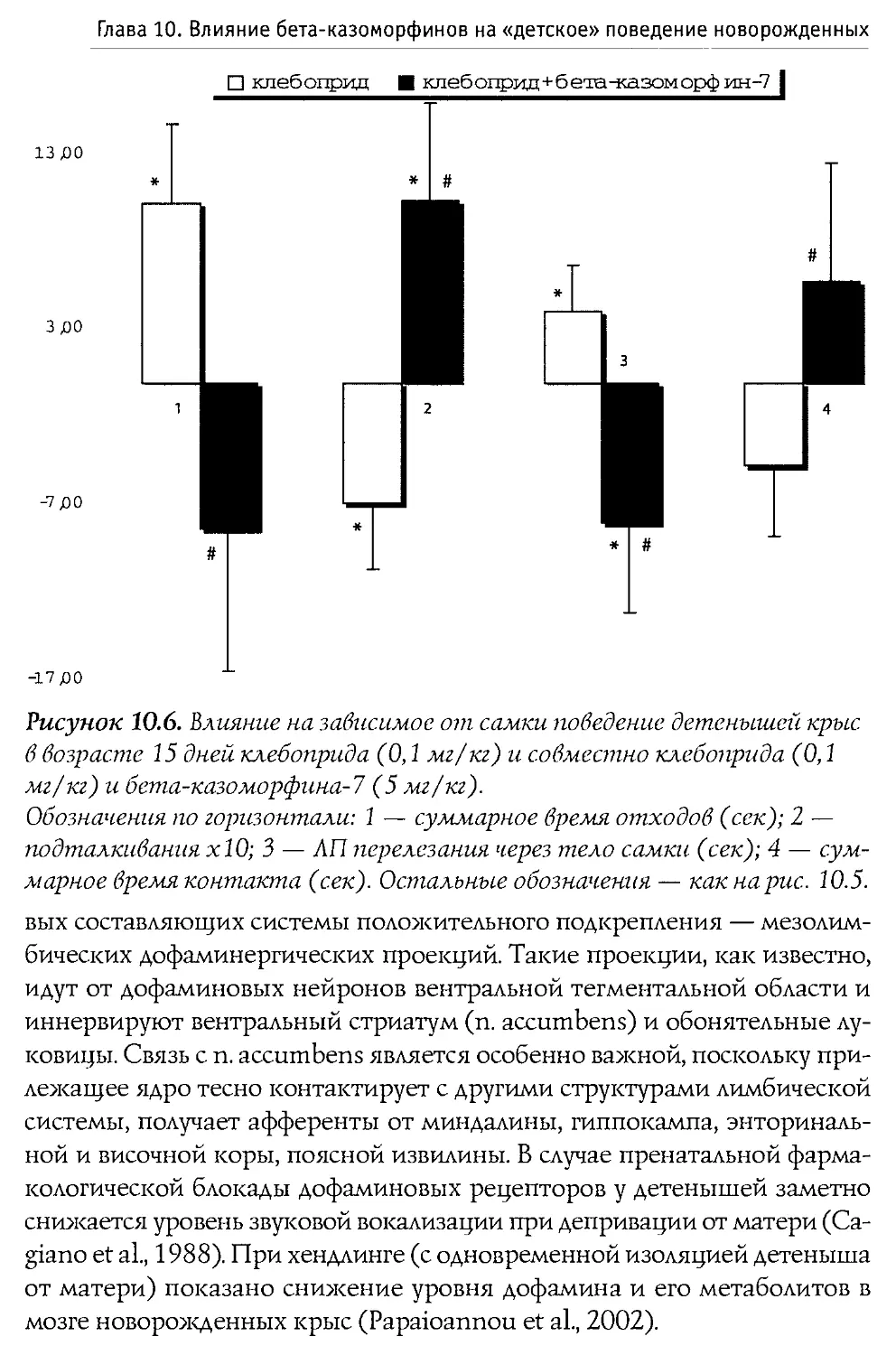
ных крыс (первая неделя жизни). Выяснилось, что во всех использованных дозах пептид не воздействует на процесс пробуждения, и лишь его введение в дозе 100 мг/кг вызвало значимые налоксон-зависимые изменения в структуре сна: увеличилась длительность пассивной (спокойной) стадии и снизился процент активного (парадоксального) сна В той же работе показано, что р -к-7 не вызывает достоверной депрессии дыхания.
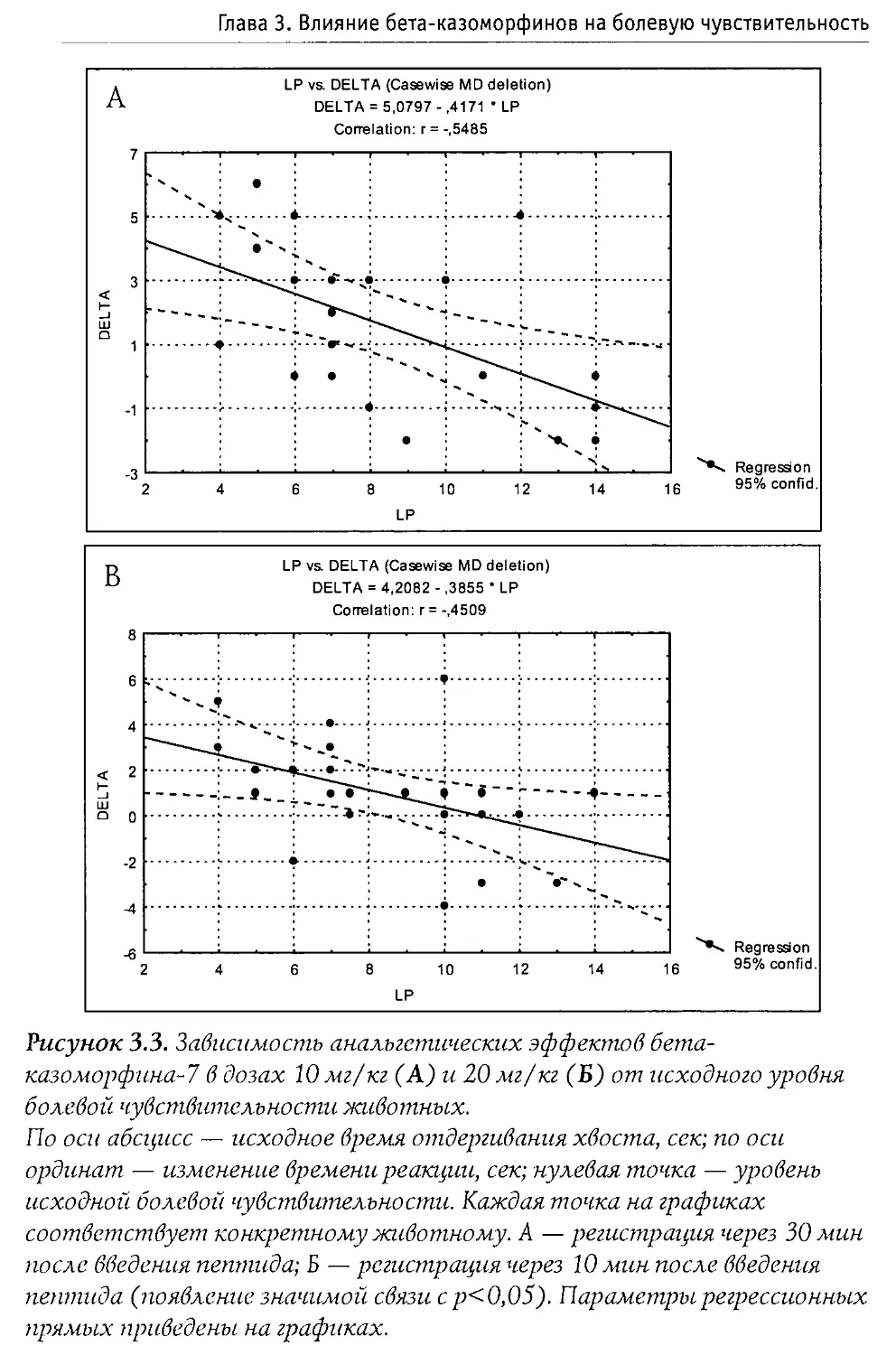
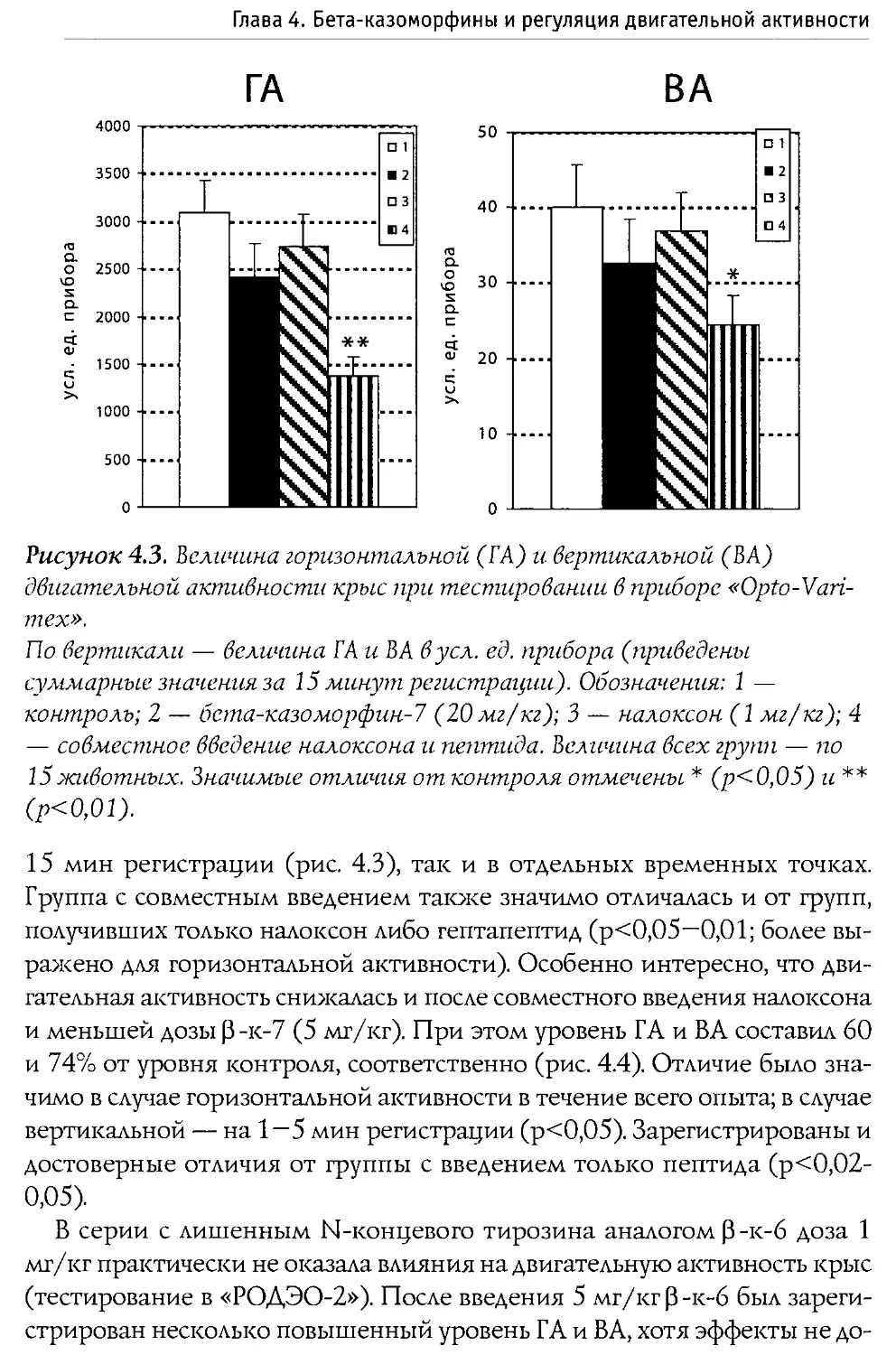
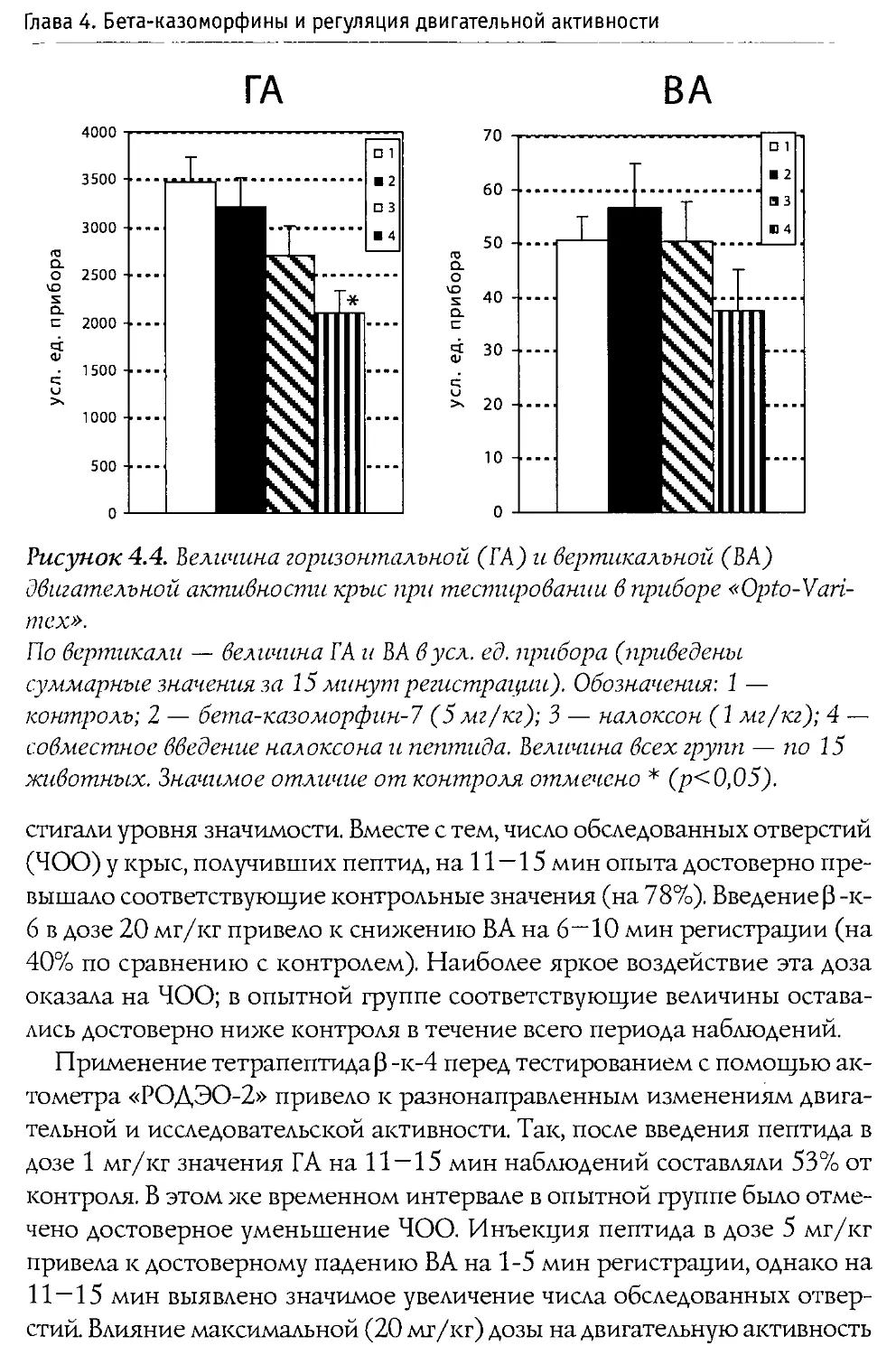
Blass и Blom в 1996 г. исследовали воздействие р-казоморфинов на болевую чувствительность 10-дневных крыс. Ими оценивался латентный период избавления от высокой температуры (48°С, приложенных к передней лапе). Крысам системно вводился Р -к-7, Р -к-5 и р -к-4 в диапазоне доз 0,1—2,5 мг/кг. Показано, что только Р-к-5 и только в максимальной дозе вызывал анальгетические изменения. Налоксон, введенный в боковые желудочки мозга, блокировал эффекты р -к-5, что доказывает центральную природу антиноцицептивного действия Р -казоморфинов.
Итак, история изучения Р -казоморфинов насчитывает уже почти 30 лет. Однако, хотя в каталоги различных фирм входит нередко до 20—30 аналогов и производных Р -казоморфинов, большинство исследований в этом направлении ограничиваются либо вопросами лиганд-рецепторных взаимодействий, либо выяснением влияния на желудочно-кишечный тракт и систему болевой чувствительности. Другие аспекты физиологической активности р -к (в том числе воздействие на ЦНС и поведение) изучены гораздо слабее. Это и позволило сделать исследование нейротропных функций пептидов данной группы основным содержанием нашей работы. При этом нас интересовал не столько скрининг поведения взрослых крыс, сколько последствия острого и хронического введения Р -казоморфинов детенышам.
Расчет показывает, что казеины молока содержат в «скрытом виде» 1— 3% фрагментов с опиоидными свойствами. Следовательно, при поедании 10—15 г молочных белков (необходимое ежедневное количество) в организме грудного ребенка могут образовываться десятки миллиграммов проказоморфинов и казоморфинов. Все это обуславливает актуальность исследования эффектов системного введения р -казоморфинов, которые, судя по всему, могут играть немаловажную роль в деятельности нервной системы в неонатальный период при питании исключительно молоком, а также в некоторых других случаях (например, у женщин в период беременности и лактации).
Глава 2. Опиоидная система: свойства, разнообразие и онтогенез рецепторов
Основные типы опиоидных рецепторов
Как известно, что все классические типы опиоидных рецепторов (ц 8-, к-) имеют одинаковую базовую структуру. Они состоят из N-конце-вой и С-концевой областей, 7 трансмембранных доменов и соединяющих их экстра- и внутриклеточных петель. За связывание с лигандом отвечают как трансмембранные домены, так и экстраклеточные петли. Для первых показана высокая степень консервативности. Связывания с трансмембранными участками (в первую очередь, III и VII) достаточно для проявления активности неселективных лигандов (Сергеев с соавт., 1999; Lavecchia et al., 2000).
Зона захвата лиганда опиоидного рецептора условно делится на участки селективности и карман связывания. Первые расположены преимущественно выше наружной поверхности мембраны и сформированы аминокислотными остатками внеклеточных петель и верхушек трансмембранных доменов (Befort et al., 1996ab; Mansour et al., 1997). Карман находится ниже наружной поверхности мембраны и ограничен спиральными петлями трансмембранных доменов. В присоединение относительно крупных лигандов пептидной природы вовлечены как участки селективности, так и карман связывания. Алкалоиды и их дериваты контактируют с рецептором преимущественно в области кармана. При этом заряженный азот молекулы лиганда (имеются в виду, прежде всего, морфин и его производные) вступает во взаимодействие с остатками ароматических аминокислот полипептидной цепи рецептора.
Углублению теоретических представлений о механизмах связывания лигандов опиоидных рецепторов способствовало внедрение методов клонирования. В частности, значительное количество информации получено посредством создания химерных конструкций. В этом случае полипептид формировался из фрагментов, принадлежащих рецепторам различных типов: ц /8,8 /ц, 8 /к и тд. (Chaturvedi et al., 2000). Подобный подход дал возможность определить конкретное участие внеклеточных петель и
Глава 2. Опиоидная система: свойства, разнообразие и онтогенез рецепторов трансмембранных доменов в связывании тех или иных агонистов и антагонистов (Jordan, Devi, 1998). Иными словами, исследования химерных рецепторов позволили выявить участки, ответственные за формирование селективности к различным лигандам.
Однако путем изучения химерных рецепторов невозможно определить ключевые аминокислоты, отвечающие за связывание. Поэтому следующим шагом стало изучение вклада отдельных аминокислотных остатков. Для этого проводилось клонирование мутантных рецепторов, в которых направленно заменяли одну или несколько аминокислот. Оценивались функциональные характеристики рецептора (по параметрам связывания радиолигандов и по активности систем трансдукции); кроме того, осуществлялось компьютерное моделирование участка рецептиро-вания (Pepin et al., 1997).
Было показано, что ключевыми аминокислотами кармана связывания служат гистидин, глутаминовая и аспарагиновая кислоты (Surratt et al., 1994; Spivak et al., 1997). Li с соавт. (1999) установили, что в связывании налтрексона важную роль играет отрицательно заряженная карбоксильная группа аспартата-147 (трансмембранный домен III) ц-рецептора. Взаимодействие происходит, между карбоксилом аспартата-147 и протонированным азотом-17 налтрексона. Замена аспартата-147 на аспарагин или аланин, которые не имеют карбоксильной группы, резко понижала аффинитет рецептора к антагонисту. С другой стороны, мутанты с глутаматом-147 (имеется карбоксил) мало отличались от рецепторов «дикого» типа. При этом аналог налтрексона, не обладающий протонированным азотом, характеризовался очень низким сродством к рецептору, а его антагонистическая активность в сравнении с прототипом была слабее в 100 раз.
Для 8-рецепторов показана важность наличия в 3-й экстраклеточной петле гидрофобной области, заканчивающейся лейцином-300, а также аргинина в позиции 291. Замена любой из этих аминокислот приводит к практически полной блокаде присоединения 8-селективных лигандов (Pepin et al., 1997).
Структура кармана связывания опиоидного рецептора способна модулироваться аминокислотными остатками, расположенными на некотором удалении от него. К примеру, замена лизина-108 в первой внеклеточной петле на аспарагин сопровождалась многократным снижением аффинитета 8-рецептора к налоксону. Первая экстрацеллюлярная петля не участвует в формировании кармана связывания, с которым
Глава 2. Опиоидная система: свойства, разнообразие и онтогенез рецепторов взаимодействует антагонист. Следовательно, в этом случае замена лизина-108 ведет к каскаду определенных (весьма серьёзных) внутримолекулярных перестроек рецептора (Minami et al., 1996).
Основная функция опиоидных рецепторов связана с пресинаптиче-ским торможением передачи сигнала в различных нейромедиаторных системах. Соответственно, опиоиды, как правило, оказывают ингибирующее действие на высвобождение нейротрансмиттеров. Снижается выброс как медиаторов-аминокислот глутамата и ГАМК (Kavaliers et al., 1997; Napier, Mitrovic, 1999; Waldmeier et al., 2000), так и моноаминов — дофамина, норадреналина, серотонина (Heijna et al., 1992; Speciale et al., 1993; Tao et al., 1998; Yilmaz, Gilmore, 1999), а также ацетилхолина (Sandor et al., 1992).
Известно, что большинство клонированных типов опиоидных рецепторов сопряжены с Gi/o-белками, чувствительными к пертуссин-токсину (Беспалов, Звартау, 2000). В свою очередь, G-белки реализуют свое действие через подавление активности аденилатциклазы, что приводит к уменьшению количества цАМФ и изменению состояния протеинкиназ. В результате снижается Са2+-проводимость пресинаптической мембраны и уменьшается количество высвобождаемого медиатора.
Именно этот механизм был описан первым в качестве способа, с помощью которого опиоиды влияют на работу синапсов в нейронах, передающих боль, и ингибируют выброс вещества Р (Gale et al., 1978). В дальнейшем была показана способность Gi/o-белков влиять на ^-проводимость (как пре-, так и постсинаптическую). В пресинаптических окончаниях дополнительное открывание К+-каналов повышает скорость реполяризации, ограничивая, таким образом, Са2+-ток и высвобождение нейротрансмиттеров (Simmons, Chavkin, 1996).
Как известно, G-белок — гетеромерный протеин, ассоциированный с мембраной. Он включает а-, р - и у-субъединицы. В покое три субъединицы сцеплены между собой, а а-субъединица взаимодействует с гуанозиндифосфатом (ГДФ). После присоединения агониста облегчается связывание опиоидного рецептора с G-белком. Это является сигналом для замены ГДФ на гуанозинтрифосфат (ГТФ) в а-субъединице, а весь комплекс G-белка диссоциирует на два фрагмента: а и р -у. Именно свободные субъединичные комплексы способны взаимодействовать с эффекторами — аденилатциклазой, фосфолипазой С, калиевыми и кальциевыми каналами. Для возврата системы в исходное состояние после взаимодействия с эффектором а-субъединица, обладающая внутренней ГТФ-азной ак-
тивностью, гидролизует ГТф до ГДФ. При этом каталитическая активность субъединицы теряется, и она диссоциирует из комплекса с эффектором. На заключительной стадии происходит реассоциация всех субъединиц G-белка
G-белки отличаются гетерогенностью, что, в свою очередь, определяется множественностью изоформ субъединиц, входящих в их состав. Например, идентифицированы 16 типов а-субъединицы, 7 — р субъединицы и 5 —у-субъединицы (Harrison et al., 1998; Jordan, Devi, 1998). Эффекторы, с которыми взаимодействуют G-белки, также неоднородны. В частности, существует не менее десяти разновидностей аде-нилатциклазы. Все это предопределяет множественность путей трансдукции, опосредуемых G-белками.
Вторым по значимости после аденилатциклазного путем передачи внутриклеточного сигнала при активации опиоидных рецепторов следует считать фосфатидилинозитидный или инозитолфосфатный цикл. В этом случае стимуляция опиоидных рецепторов приводит (через G-белок) к активации фосфолипазы С, которая индуцирует гидролиз фосфатидил-4,5-дифосфата (трифосфоинозитид). В результате образуется 2 вторичных мессенджера — диацилглицерол и инозитол-1,4,5-трифосфат. Диацилг-лицерол является мощным эндогенным активатором протеинкиназы С. Этот фермент, как и циклонуклеотидзависимые протеинкиназы, фосфорилирует регуляторные белки и тем самым изменяет физиологическую активность клетки. Инозитол-1,4,5-трифосфат стимулирует выброс ионов кальция из внутриклеточных депо. Кальций, также являющийся вторичным посредником, в свою очередь, воздействует на активность клетки через систему Са2+-кальмодулин-зависимых протеинкиназ.
Особое место в деятельности опиоидной системы занимают, кроме того, белковые регуляторы сигналов G-белков (RGS). Они ослабляют эффекты связанных с G-белками рецепторов путем увеличения ГТф-азной активности а-субъединицы (Hollinger, Hepler, 2002; Clark et al., 2008). Для некоторых членов семейства белков RGS выявлена способность негативно регулировать сигналы от ц-рецептора in vitro и in vivo (Potenza et al., 1999; Zachariou et al., 2003). Интересно, что экспрессия RGS в стриатуме крыс очень высока в раннем постнатальном периоде (2-й и 10-й дни жизни). Однако между 10-м и 18-м днями происходит резкое падение экспрессии, и именно в этот период наблюдается наибольший рост вызванного ц -рецепторами связывания ГТф в стриатуме (Ingi, Aoki, 2002).
Длительное воздействие опиоидных агонистов снижает чувствительность соответствующих рецепторов (десенситизация). В основе данного явления лежит фосфорилирование аминокислотных остатков серина и/или треонина третьей внутриклеточной петли, и, особенно, внутриклеточной карбоксильной терминали (С-терминаль). Фосфорилирование катализируют протеинкиназы, регулируемые вторичными мессенджерами (Са2+-кальмодулинзависимая протеинкиназа, протеинкиназы А и С), тирозинкиназа, а так же киназы, связанные с G-белок-рецепторным комплексом (GRKs — G-protein—receptor kinases) (Hasbi et al., 1998; Wolf et al., 1999). Существует избирательность протеинкиназ в отношении фосфорилируемых аминокислотных остатков. Например, остаток серина-266 в третьей внутриклеточной петле ц-рецептора крысы является мишенью для Са2+-кальмодулинзависимой протеинкиназы II (в ц-рецепторе человека соответствующий серин находится в положении 268) (Koch et al., 1997). Треонин-353 С-терминали 8-рецептора и серин-375 ц-рецептора представляют собой мишени для GRKs (Cvejic et al., 1996).
В 8-рецепторе мыши внутриклеточный С-конец содержит семь остатков серина и треонина: серин-344 и 363; треонин-335,352,353,358 и 361. При активации рецепторов, экспрессированных в клетках НЕК-293 (human embryonic kidney) агонистом DPDPE ([8-Pen2,Pen5]enkephalin), быстрее всего фосфорилировались серин-363 и треонин-358. Треонин-361, по-видимому, выполняет роль места связывания киназ и сам не подвергается фосфорилированию (Hasbi et al., 1998). С-терминаль ц-рецептора крысы на участке [треонин-354 - треонин-394] содержит 12 остатков треонина и серина, рассматриваемых в качестве возможных мест фосфорилирования. Наиболее «активная» зона — от серина-363 до серина-375 (El Kouhen et al., 2001).
Показано, что фосфорилированный рецептор связывается с белком ар-рестином. Затем он отщепляется от G-белка и подвергается интернализации, то есть погружению в особые ямки клеточной мембраны, покрытые белком клатрином (Kramer, Simon, 2000). Из таких ямок-уг-лублений формируются первичные (ранние) эндосомы. В их кислой среде осуществляется восстановление исходного состояния опиоидного рецептора посредством дефосфорилирования и отщепления лиганда. Завершается этот процесс повторным встраиванием рецептора в клеточную мембрану (рециклизация) и восстановлением его функциональной активности (ресенситизация). Вместе с тем, часть иммобилизованных в первичных эндосомах рецепторов может транспортироваться в лизосомы для конечной деградации (Segredo et al., 1997).
Доказательство существования трех классических типов опиоидных рецепторов (ц-,к- и8-) является результатом большого количества работ, выполненных в 70_80-х годах прошлого века.
Опиоидные рецепторы широко распространены в мозге и периферических тканях всех животных, хотя встречаемость конкретных типов различна у разных видов и в разных анатомических регионах. Этот вопрос довольно подробно рассмотрен в обзоре Девойно и Ильюченок (1993). Авторы отмечают, что особенно большое количество ц -рецепторов имеется в стриатуме, бледном шаре, поводке, таламусе, спинном мозге, фронтальных и цингулярных областях коры. Меньше рецепторов этого типа обнаруживается в миндалине, гиппокампе, мамиллярных телах, моторной и первичной сенсорной коре, центральном сером веществе среднего мозга, голубом пятне. Наличие 8-рецепторов выявлено в неостриатуме, обонятельных бугорках и обонятельных луковицах, миндалине, таламусе, спинном мозге. В коре больших полушарий 8-рецепторы также хорошо представлены и распределены более равномерно, чем ц -рецепторы. В целом распределение мест связывания опиоидных пептидов подчиняется следующим отношениям: в коре — к >8 > ц; в стриатуме — 8 > к > ц; в стволе мозга и спинном мозге —ц > 8 > к.
В работе Eide с соавт. (1995) при использовании антител к выделенным аминокислотным последовательностям, входящим в состав 8-, ц-и к - опиоидных рецепторов, удалось визуализировать последние в ряде структур нервной ткани. Показано, что 8-опиоидные рецепторы распределяются преимущественно в аксонах и функционируют, прежде всего, на пресинаптическом уровне, ц- и к - опиоидные рецепторы чаще связаны с мембранами дендритов и тел нейронов, и, соответственно, в большей мере причастны к постсинаптическим процессам. Энкефалинсодержащие терминали обнаруживаются в основном по соседству с мембранами, где присутствуют 8- или ц- опиоидные рецепторы; ди-норфин-содержащие терминали находятся чаще вблизи к-мест связывания.
В 1990-е гг. были определены и клонированы гены, кодирующиец- ,к-и8- типы рецепторов — MOR-1, KOR-1 и DOR-1, соответственно (Evans et al., 1992, Kieffer et al., 1992; Minami et al., 1993). Позже на основе данных о структурном сходстве к ним была присоединена последовательность ДНК, несущая информацию о так называемых «орфановых» рецепторах (ген ORL-1) (Mollereau et al., 1994). Степень гомологии MOR-1, KOR-1, DOR-1 и ORL-1 составляет не менее 50%.
Эндогенными агонистами ц-рецепторов являются эндорфины, которые образуются путем протеолитической деградации предшественника проопиомеланокортина, а также эндоморфины-1 и -2. Кроме того, в ткани мозга обнаружен эндогенный морфин. Наряду с морфином, селективными не-пептидными агонистами ц-рецепторов являются фентанил, суфентанил, оментанил. Такими же свойствами обладают аналог мет-энкефалина FK 33.824, а также синтетические пептиды DAMGO, DAGO, DAGOL. К антагонистам ц-рецепторов относят налоксон, налтрексон, налоксазон, налоксоназин и др. Выяснено, что у MOR-1 но-каутных мышей морфин не индуцирует антиноцицепцию и физическую зависимость (Matthes et al, 1996). У MOR-1 нокаутных детенышей снижен уровень зависимых от матери реакций (Moles et al., 2004).
В 1981 г. Wolozin и Pasternak предложили дополнительное разделение ц-рецепторов нащ ирг подтипы на основе двухфазного связывания меченых ц-радиолигандов. In vivo исследования показали, что налоксоназин (в дальнейшем был определен как селективный блокатор ц i -рецепторов) устраняет морфин-индуцированную антиноцицепцию, но не ингибирует вызванную морфином депрессию дыхания, а также развитие морфиновой зависимости (Ling et al., 1985). Среди пептидов селективностью относительно подтипов ц-рецепторов обладает Тут-W-MIF (Tyr-Pro-Trp-Gly-NH2). Показано, что он является агонистом ц 2- и антагонистом щ -мест связывания (Gergen et al., 1996). Более высоким сродством кц2-рецепторами обладает, видимо, сходный с этим пептидом эндоморфин-1 (Тут-Рго-Тгр-РЬе-ЫНг). Во всяком случае, антиноцицептивное действие эндоморфина-1 не блокировалось налоксоназином (Sakurada et al., 1999).
Вместе с тем, хотя фармакологически выделено несколько подтипов ц-рецептора, в настоящее время известен всего один ген MOR-1 (Pan et al., 2005). У мышей, крыс и человека его продукты проходят альтернативный сплайсинг. Например, открыто 10 сплайсинговых вариантов человеческого гена MOR-1. Все они содержат экзоны 1,2 и 3, но отличаются друг от друга сплайсингом после 3 экзона, что в итоге приводит к разным аминокислотным последовательностям. Полученные белки принадлежат к семейству ц-рецепторов, однако изучение связывания ГТФ и активности аденилатциклазы выявило значительную разницу между ними. По-видимому, подобные различия аффинности и эффективности обнаруженных вариантов по отношению к конкретным агонистам и антагонистам лежат в основе выделения в более ранних исследованиях подтипов опиоидных рецепторов.
Эндогенными лигандами этого типа мест связывания являются лей- и метэнкефалины, предшественником которых служит проэнкефалин А. Синтетические лиганды 5-рецепторов представлены такими соединениями как DADLE и DPDPE (агонисты), а также налтриндол, налтрибен, BNTX, DALCE (антагонисты). Рецепторы 5-типа участвуют в регуляции многих физиологических процессов: болевой чувствительности (в том числе на спинальном уровне), когнитивных функций, настроения, дыхания, двигательной активности. Показано вовлечение 5-рецепторов в ингибирование эвакуаторной функции кишечника.
Для 5-рецепторов на сегодняшний день также клонирован единственный ген — DOR-1. Тем не менее, на основе in vivo и in vitro фармакологических экспериментов предполагается существование, по меньшей мере, двух соответствующих подтипов —51 и 5 2. Показано, что у грызунов супраспинальная антиноцицептивная активность DPDPE (dPen2-dPen5-энкефалин) может селективно отменяться BNTX (7-бензилиденналтрек-сон) или DALCE (ТА1а2-ТЕеи5-энкефалил-Су5) (Jiang et al., 1991; Sofuoglu et al., 1993). С другой стороны, антиноцицептивное действие [<1А1а]-дель-торфина II может быть обращено только налтрибеном или налтриндо-лом (Sofuoglu et al., 1991). Доказательством существования подтипов 5-мест связывания в in vitro экспериментах является также ингибирование аденилатциклазной активности мембраны мозга крыс (Buzas et al., 1994; Noble, Сох, 1995) и повышение уровня внеклеточного Са2+ в ND8-47 клеточной линии, опосредованные 5-опиоидными рецепторами (Tang et al., 1995). И в этих случаях BNTX служит селективным антагонистом DPDPE, а налтрибен — селективным антагонистом дельторфина II. фармакологические свойства клонированного DOR-1 опиоидного рецептора распределяются «между» двумя подтипами 5 -рецепторов. Нокаут гена DOR-1 приводит к исчезновению связывания агонистов как51-, так ибг-рецепторов (Zhu et al., 1999).
Фармакологические эксперименты показали, что существует не менее трех подтипов к-рецепторов: ki-, 1<2- и 1<з. Использование этилкетоцикла-зоцина (ЕКС) указало на существование в спинном мозге морских свинок негомогенной популяции высокоаффинных связывающих сайтов (предположительно, ki- и la-), отличающихся по чувствительности к DADLE ^А1а2^Ьеи5-энкефалин) (Kosterlitz et al., 1981; Attali et al., 1982). Позднее применение селективного агонистак-опиоидных рецепторов LI-50,488 и его аналогов (U-69,593, и др.) сделало более решаемой задачу определения предполагаемых подтипов. Так, прямое сравнение связыва
ния [3Н]-ЕКС у различных видов грызунов (на фоне подавления связывания ц- и 5 -сайтами) указало на существование высокоаффинного ki -сайта, преобладающего в мозге морских свинок и имеющего селективную чувствительность к И-69,593; а также низкоаффинного, нечувствительного к U-6 9,593 kz-сайта, более характерного для мозга крыс (Zukin et al., 1988). В качестве веществ — относительно селективных kz-агонистов, в настоящее время рассматриваются бремазоцин (Su et al., 1997) и гептапептид Аг§6-Р1ге7-энкефалин (Benyhe et al., 1999). Отдельными авторами описывается наличие в мозге также кз-рецепторов (Brooks et al., 1996). Впрочем, как и в предыдущих случаях, весьма вероятно, что имеется лишь один тип этих рецепторов, меняющий свою аффинность в зависимости от особенностей взаимодействия с G-белками, вариантов сплайсинга и т.п.
Предшественником эндогенных агонистов к-рецепторов динорфинов А и В является продинорфин. К агонистам относятся также кетоцикла-зоцин, этилкетоциклазоцин, бремазоцин, бензодиазепин тифлуадом; среди антагонистов наибольшее сродство проявляет норбиналторфимин. к-рецепторы вовлечены в регуляцию нейроэндокринной секреции, диуреза, ноцицепции, потребления пищи. Они обнаружены также на иммунокомпетентных клетках (Sharp et al., 1998; Hiramatsu et al., 1998). Показано, что к-рецепторы тормозят экзоцитоз дофамина в прилежащем ядре (пресинаптическое торможение). Соответственно, к-агонисты вызывают подавление выброса дофамина в прилежащем ядре (nucleus accumbens), что сопровождается развитием синдрома отмены, агедонией, дисфорией, ростом тревожности (Narita et al., 2002).
Особо следует отметить, что опиоидные рецепторы способны к димеризации (Jordan, Devi, 1998). Два полностью функционально зрелых белка (например, 5 - и к-) объединяются, образуя новый рецептор с отличной от предшественников способностью связывания лигандов и измененными функциональными свойствами, к-5 гетеродимер, синергично связывающий высокоселективные лиганды и потенцирующий передачу сигнала, фармакологически оказался очень близок к kz-подтипу. В присутствии 5-селективного агониста (ПРПРЕ)к-агонист (U69593) связывается с гетеродимером с большей селективностью. Такая синергичность связывания агонистов приводит к усилению эффекторной функции.
В работе Wang с соавт. (2005) выявлена способность к гетеродимеризации ц и 5 рецепторов. Обнаружено, что в таком случае малые дозы 5 -селективных агонистов вызывают многократное увеличение связывания ц-агонистов, и наоборот. Кроме того, показана возможность гетеродиме
ризации между ц и ORL-рецепторами. В целом можно заключить, что гетеродимеризация рецепторов, сопряженных с G-белками, представляет собой ранее неизвестный механизм модулирования их функций.
Рецептор ORL-1 причислен к семейству опиоидных рецепторов на основе структурного сходства с классическими типами. Фармакологическая гомология ORL-1 рецепторов с ц-, 5-, к-местами связывания не наблюдается. Даже неселективные лиганды, которые обладают единообразно высоким сродством кц-,к- и 5-рецепторам, связываются с ORL-1 сайтами с низкой аффинностью. Кроме того, имеются участки около вершины каждого трансмембранного региона, консервативные в равной мере для ц-, к- и 5-рецепторов, но измененные у ORL-1.
Орфановые рецепторы были идентифицированы у крыс, мышей и человека со степенью взаимного сходства более 90% (Meunier et al., 1995; Henderson, McKnight, 1997). В ЦНС млекопитающих ORL-1-рецепторы расположены во многих структурах: в миндалине, гиппокампе, ножке эпифиза, перегородке, гипоталамусе, стволе головного мозга (голубое пятно, парабрахиальные ядра, дорсальные ядра шва), в стриатуме, мозжечке, в дорсальных и вентральных рогах спинного мозга. Обнаружены ORL-1-рецепторы и в периферических тканях, в том числе на клетках иммунной системы (Lleda et al, 1997; Taylor et al., 1998).
Эндогенный лиганд ORL-1-рецепторов ноцицептин/орфанин FQ состоит из 17 аминокислотных остатков, что соответствует длине лиганда к-рецеп-торов динорфина Д Ноцицептин значительно короче 0 -эндорфина, но длиннее мет- и лей-энкефалинов. Передача сигнала рецепторами ORL-1 осуществляется с участием сопряженных G-белков посредством модуляции активности аденилатциклазы, калиевых и кальциевых каналов. Агонисты этих рецепторов вызывают, прежде всего, стимуляцию кальциевых каналов N-типа (усиливают экзоцитоз нейротрансмиттеров). Введение орфанина приводит к гиперальгезии, снижению двигательной активности, и увеличивает депрессивные составляющие поведения (Rady et al., 2001). Напротив, антагонисты ORL-1 обладают антидепрессантным действием (Jenck et al., 2000). Доказано участие рецепторов ORL-1 в регуляции процессов памяти и обучения, внимания, эмоций, нейроэндокринной секреции, зрения, вкуса, потребления пищи, сокращения гладкой мускулатуры, иммуногенеза.
Определенное число работ связано с так называемым е-типом опиоидных рецепторов. В соответствии с данными Narita и Tseng (1998), агонистами е-рецепторов являются 0-эндорфин, бремазоцин, эторфин. В 1995 г. O’Dowd и соавт. клонировали и описали два гена GPR7 и GPR8,
Глава 2. Опиоидная система: свойства, разнообразие и онтогенез рецепторов которые кодируют рецепторы со структурой, схожей с рецепторами опиоидов и соматостатина. Фармакологические исследования показали, что с рецептором, кодируемым GPR7, с высокой аффинностью связываются Р -эндорфин, бремазоцин и бензоморфан. Вместе с тем, низкая аффинность выявлена для селективных ц- (DAMGO), 5- (DPDPE), к-(1150,488) агонистов. Соответственно, в случае фармакологической блокады ц -, 8 - и к-рецепторов, действие Р -эндорфина, как предположили авторы, опосредуется £-типом опиоидных рецепторов.
Однако в более поздней работе Contet с соавт. (2004) на мышах, но-каутных по генам трех опиоидных рецепторов, выявлено, что Р -эндорфин стимулирует связывание ГТФ в мембранах контрольных мышей дикого типа и не вызывает такого связывания у нокаутных животных. Таким образом, вероятное-рецептор представляет собой ц-, 8-и/илик-рецептор, сопряженный с неклассическими G белками.
Влияние опиоидной системы на функционирование других нейромедиаторых систем
Воздействие опиоидов на различные медиаторные системы продемонстрировано многими исследователями, однако большинство накопленного материала касается лишь описательных, фармакологических аспектов этой проблемы. В последние годы с появлением новых методов молекулярной и клеточной физиологии был достигнут значительный прогресс в понимании механизмов взаимодействия опиоидной и других медиаторных систем. Кратко рассмотрим эти механизмы, ограничиваясь лишь наиболее распространенными из медиаторов.
Глутамат является основным возбуждающим медиатором мозга. Его эффекты осуществляются через специфические рецепторы, которые классифицируют на основе способности взаимодействия с избирательными агонистами Ы-метил-с1-аспартатом (NMDA), каиновой кислотой и др. (Беспалов, Звартау, 2000). Взаимодействие опиоидной и глутаматергиче-ской систем, осуществляется, вероятно, на нескольких уровнях.
Во-первых, возможно прямое пресинаптическое торможение выброса глутамата. Оно наблюдается, например, при введении морфина (Martin et al., 1999). Способны осуществлять регуляцию Са2+-зависимого уровня глутамата также и агонисты 8- и к-рецепторов (Waldmeier et al., 1995).
Во-вторых, показана возможность солокализации опиоидных и глутаматных рецепторов и их совместное участие в регуляции пресинаптиче-
Глава 2. Опиоидная система: свойства, разнообразие и онтогенез рецепторов скоро высвобождения нейротрансмиттеров (Kavaliers et al., 1997). При этом в случае метаботропных рецепторов могут происходить внутриклеточные изменения в системе вторичных посредников — фосфотидили-нозитола и/или цАМФ, с которыми эти подтипы рецепторов связаны (Fundytus, Coderre, 1994).
В случае ионотропных (NMDA, АМРА, каинатных) рецепторов, кроме того, не исключен вариант прямого рецепторного взаимодействия. Действительно, недавно (Tang et al., 1999) были получены данные о связывании дез-тирозинового аналога динорфина А (2—17) с NMDA рецепторами. Эффекты пептида носили неопиоидную природу и блокировались Мк-801. Связывание дез-Тут-аналога динорфина А предпочтительно происходило с NMDA рецепторами, находящимися в инактивированном (наличие иона Mg2+) состоянии.
Гораздо большее число работ посвящено обратной проблеме: влиянию глутаматергической системы на функционирование опиоидных рецепторов, ноцицептивные/антиноцицептивные процессы и развитие опиоидной толерантности. Было показано (Fundytus, Coderre, 1994), что активация синтеза фосфатидилинозитола и цАМФ, вызванная метаботропными рецепторами к глутаминовой кислоте, вовлечена в формирование опиоидной зависимости. NMDA рецепторы, индуцируя синтез оксида азота через активацию NO-синтазы, также могут способствовать развитию опиоидной толерантности. Напротив, антагонисты NMDA-рецепторов предотвращают развитие морфиновой зависимости, что, возможно, опосредуется активацией протеинкиназы С (Liaw et al., 1996; Popik, Skolnick, 1996).
ГАМК — основной тормозный медиатор в ЦНС, широко распространенный во многих нервных окончаниях. Высокие концентрации ГАМК найдены в коре больших полушарий, нейронах стриатума, мозжечка, задних рогов спинного мозга. Известно, что опиоидные пептиды могут осу-ществять модуляцию ГАМК-ергической трансмиссии. Показано, что они гиперполяризуют нейроны вентрального бледного шара и подавляют их спонтанную активность, регулируя передачу информации от базальных ганглиев к структурам-мишеням. Следствием опиоидных влияний на ГАМК-нейроны nucleus accumbens является потенциация активности глутамата в коре и миндалине (Napier, Mitrovic, 1999).
Другим примером может служить деятельность опиоидных пептидов в центральном сером веществе среднего мозга, которое является одним из центров регуляции болевой чувствительности (Jolas et al., 2000). Пока-
Глава 2. Опиоидная система: свойства, разнообразие и онтогенез рецепторов зано, что анальгетические эффекты опиоидов в этом случае реализуются путем подавления ингибирующего влияния ГАМК на нейроны (в т.ч. серотонинергические), формирующие часть нисходящего антиноцицеп-тивного потока. Опиоиды ослабляют тормозную синаптическую передачу и уменьшают возможность выделения ГАМК, контролируя пресинапти-ческую потенциал-зависимую К+-проводимость. Показано, что в процесс передачи сигнала от опиоидных рецепторов на К+-каналы вовлечены фосфолипаза А2, арахидоновая кислота и 12-липоксигеназа (Vaughan et al., 1997). Ингибирование нейронов, содержащих ГАМК, видимо, лежит в основе некоторых возбуждающих эффектов морфина в ЦНС (подробнее см. раздел «Обсуждение результатов»).
Указывается также на возможность прямого взаимодействия между опиоидными пептидами и ГАМКл-рецептором и роль этого явления в процессах пал4яти (Dubrovina, Ilyutchenok, 1995).
Методами электронной микроскопии показано, что в одних аксонных терминалях могут сосуществовать энкефалины и ГАМК (либо глутамат). Так, в locus coeruleus мозга крыс ГАМК и энкефалины могут действовать сообща, высвобождаясь из общего окончания либо через различные участки афферентов, сходясь на близких областях плазмалеммы нейрона-мишени (Van Bockstaele, Chan, 1997). Производные продинорфина и препроэнкефалина обнаружены в ГАМК-ергических проекциях нейронов стриатума. И с другой стороны, показано, что ГАМК способна оказывать ингибиторное влияние на экспрессию генов опиоидных пептидов (Reimer, Hullt, 1991).
Известно, что активность мозговых моноаминергических систем в значительной степени регулируется эндогенными опиоидами. Вопрос этот интересует исследователей давно, и накопилось множество работ, касающихся обсуждения данного взаимодействия. Агонисты опиоидных рецепторов, как правило, налоксончувствительным образом снижают катехоламиновую трансмиссию (Versteeg et al., 1991, Simmons et al., 1992), тогда как в случае серотонина чаще регистрируются противоположные эффекты.
Высокий уровень связывания 5-, к- и, особенно, ц-лигандов показан в различных областях черной субстанции, вентральной тегментальной области и других зонах, содержащих терминали дофаминергических нейронов (Speciale et al., 1993). Однако окончательные представления, через какой из подтипов рецепторов осуществляется взаимодействие опиоидов с дофаминегической системой, еще не сформированы. Разными ис-
следователями сообщается о модулирующем действии опиодов, которое может происходить только через определенный тип (типы) рецепторов.
Так, Heijna с соавторами (1992) показали, что активация ц -, 5 -, но не к-опиоидных рецепторов в nucleus accumbens и обонятельных бугорках ингибирует стимулированную дофамином продукцию цАМФ. При этом не найдено влияние опиоидов на дофамин-чувствительную аденилатци-клазу во фронтальной коре и медиобазальном гипоталамусе. По данным Manzanares с соавторами (1991) применение к-агонистов тормозит все дофаминовые нейрональные системы мозга, хотя эффект обычно проявляется только после активации соответствующих нейронов. Сообщается также (Schlosser et al., 1995), что все три классических подтипа опиоидных рецепторов могут осуществлять ингибирующий контроль высвобождения дофамина в стриатуме.
Хроническое введение опиоидов приводит к уменьшению внеклеточного уровня дофамина и его метаболитов по Са2+-зависимым механизмам. Эффекты наиболее выражены в тех областях мозга, которые вовлечены в экспрессию синдрома отмены (Tokuyama et al., 1996). Хроническая экспозиция морфина, не меняя чувствительность ц-опиоидных рецепторов, вызывала увеличение Di-стимулированной продукции цАМФ (De Vries et al., 1993). Напротив, снижение этой продукции наблюдалось после повторного введения налтрексона (De Vries et al., 1991).
Как известно, уровень активности норадренергических синапсов в значительной мере регулируется пресинаптическими ауторецепторами. Соответственно, высвобождение норадреналина эффективно модулируется опиоидами через норадреналин-чувствительную аценилатциклазу (Van Vliet et al., 1991). Как острое, так и хроническое действие морфина изменяет активность норадреналин-индуцированной цАМФ; при этом эффект обращается налоксоном (Mehta, Strada, 1994). В более поздних работах показано, что подавление норадренергической трансмиссии происходит при активации ц- и к-типов опиоидных рецепторов (Yilmaz, Gilmore 1999). Однократное введение морфина снижает межклеточный уровень норадреналина, тогда как хроническое его применение приводит к увеличению высвобождения данного медиатора в различных областях мозга При хроническом введении морфина наблюдаются, кроме того, изменения чувствительности и плотности аг- и р -адренорецепторов (Maldonado, 1997). Для эндогенного лиганда орфановых рецепторов ноцицептина (ор-фанина FQ) также показано ингибирование выхода норадреналина (Schlicker et al., 1998). Эффект этот опосредуется через локализованные
пресинаптически на норадреналинергических терминалях ORLi-рецеп-торы и является налоксон- и бензоилгидразон-чувствительным (Werth-wein et al., 1999).
Еще в 1985 г. Niwa с соавторами было установлено, что морфин и пентазоцин существенно увеличивают оборот серотонина в стриатуме. Позже Но и Takemori (1990) показали то же для высокоселективногок-агониста U-50488. Используя метод микродиализа Matos с соавторами (1992) установили, что анальгетический эффект опиоидов может опосредоваться через повышение выхода серотонина в дорзальных рогах спинного мозга Морфин дозозависимо и налтрексон-зависимо увеличивал внеклеточный уровень серотонина в промежуточном мозге (Grauer et al., 1992). Трамадол способен ингибировать обратный захват норадреналина и индуцировать синаптический выброс серотонина (Bono, Cuffari, 1997).
Регуляция выхода серотонина является, видимо, важным компонентом развития опиоидной толерантности/зависимости (Tao et al., 1998). При хроническом введении крысам морфина на фоне выраженной анальгезии уже в первые сутки эксперимента обнаружено значительное (около 50%) увеличение уровня серотонина в дорзальном ядре шва Введение налтрексона крысам, хронически получавшим морфин, индуцировало признаки абстинентного синдрома и вызывало снижение уровня серотонина
Воздействие опиоидов на холинергическую систему также состоит в угнетении высвобождения ацетилхолина из пресинаптических окончаний. Управление осуществляется опиоидами через стимуляцию соответствующих рецепторов, локализованных на холинергических аксонных терминалях, и в ЦНС дополняет тонический дофаминовый контроль (Sandor et al., 1992). По-видимому, в различных мозговых структурах опиоиды влияют на холинергическую трансмиссию через различные подтипы рецепторов. По данным Arenas с соавторами (1990) ц - и 5 -, но не к-опиоидные агонисты подавляют активность холинергических интернейронов. Однако по мнению Kojima с соавторами (1994) к-ре-цепторы вполне способны модулировать выход ацетилхолина, ингибируя потенциал-зависимые Са2+-каналы. В неокортексе этот процесс опосредуется, видимо, 5- и к-, но не ц-опиоидными рецепторами (Feuerstein et al., 1996). В стриатуме к снижению выхода ацетилхолина приводит активация 5-рецепторов (Ruzicka et al., 1988).
Кроме того, может происходить взаимодействие эффектов пресинаптически локализованных опиоидных и никотиновых рецепторов, что продемонстрировано для таламо-кортикальных волокон (Sahin et al.,
1992). Взаимодействие с эффектами связанных с G-белками мускариновых холинорецепторов, по-видимому, распространено значительно шире и показано для нейронов базальных ганглиев, коры, обонятельной луковицы (Olianas, Onali, 1988, Olianas, Onali, 1994).
Наконец, в одной из работ сообщается (Itoh et al., 2000), что динорфин А (1-17), эндогенный агонист к-опиоидных рецепторов, может изменять активность нейрональных никотиновых рецепторов ацетилхолина, не связываясь с опиоидными рецепторами и не влияя на G-белки. Угнетающее действие динорфина А на никотиновые рецепторы было неконкурентным и потенциал-независимым. Авторами сделан вывод о том, что данный пептид прямо действует на никотиновый рецептор, приводя к уменьшению времени открытия его ионного канала.
Онтогенез опиоидной системы мозга
Поскольку значительная часть экспериментов с0-казоморфинами выполнена на детенышах белых крыс, завершим данный раздел небольшим обзором онтогенеза опиоидной системы мозга.
Показано (Georges et al., 1998), что еще в пренатальный период в различных областях головного мозга крыс определяются мРНК опиоидных рецепторов. На 14-й день эмбрионального развития мРНК опиоидныхц-и к-рецепторов присутствуют в промежуточном мозге, стриатуме, коре. На 20-й день впервые обнаруживается мРНКЗ-рецепторов во многих областях, включая nucleus accumbens и дорзальный стриатум. Однако общее число рецепторов остается пока очень небольшим. В результате на начальной стадии жизни детеныша только ц-рецепторы являются уже относительно созревшими. Связывание DAGO (избирательного ц-агониста) обнаружено в мозгу в первые же дни после рождения крысят, затем в течение двух недель оно быстро нарастает, достигая взрослого уровня к 14-му дню постнатального развития (Spain et al., 1985).
В работе Talbot с соавт. (2005) показано, что плотность стриосомаль-ных ц-рецепторов в постнатальном периоде после 5 дня жизни практически является постоянной величиной. В то же время, вызываемое активацией опиоидного ц-рецептора (MOR) связывание ГТФ увеличивается более, чем в 20 раз. Во многих участках мозга экспрессия MOR находится на взрослом уровне уже в раннем постнатальном периоде. Однако связывание MOR с Gi/о (и вероятными путями передачи сигнала) не достигает максимума до возраста 2—3 месяца Изменения активности
опиоидной системы, таким образом, происходят в результате повышения активации G-белков р-рецепторами, а не являются следствием роста плотности рецепторов или аффиности агонистов. По мнению авторов, возможно, что опосредованная MOR передача сигнала зависит от специфичности G-белков и временной динамики экспрессии их субъединиц.
В работе Ihnatovych с соавт. (2002) измерялась экспрессия G -субъединицы в различных участках мозга, включая гиппокамп, таламус и кору. Показано, что в ходе постнатального развития уровни G ii, G й, G 01 увеличиваются, G az не изменяется, Gis снижается. О функциональном значении подобных изменений можно пока только догадываться. Однако факт того, что плотность рецепторов еще не свидетельствует об активности соостветствующей медиаторной системы, очень показателен.
Кроме G-белков, в ходе онтогенеза регуляторами связывания MOR/G-белок могут служить другие факторы. Как уже отмечалось выше, белковые регуляторы RGS негативно влияют на сигналы рецепторов, связанных с G-белками, путем увеличения ГТф-азной активности G субъединицы (Hollinger, Hepler, 2002).
Связывание агонистов 8-рецепторов DADL и DPDPE в головном мозге практически не регистрируется вплоть до 10-го дня постнатального развития, однако затем увеличивается приблизительно в три раза, достигая наивысших значений к 25—28 дню жизни (Spain et al., 1985; McDowell, Kitchen, 1986). Такое заключение подтверждается также данными Wohltmann с соавт. (1982), полученными при изучении конкурентного связывания DADL и налоксона. До 12-го постнатального дня связывание DADL было ниже, чем у налоксона, но увеличивалось пропорционально последнему. Позже связывание DADL заметно возросло, и к 26-му дню соотношение связывания налоксона и DADL было равно таковому у взрослых особей. Авторы заключили, что в первые две недели после рождения налоксон и DADL взаимодействуют с одними и теми же ц-участками связывания, а затем DADL «переключается» на 8-тип рецепторов.
Наиболее противоречивая информация имеется пока относительно ic-рецепторов: по одной информации (Hill et al., 1984; Spain et al., 1985) сразу после рождения наблюдается очень слабое связывание этилкето-циклазоцина, которое увеличивается в течение 4—5 недель. С другой стороны, по данным Багг с соавт. (1986) пик связывания селективных к-агонистов регистрируется уже на 16-й день постнатального развития. Использование высокоселективного к-лиганда [3HJU69593 показало резкое увеличение его связывания в период между 5-м и 10-м днями.
Наконец, в работе Zhu с соавт. (1999) показано, что в эмбриональном периоде крыс к-рецепторы экспрессируются, начиная с 9,5-го дня развития, достигая уже к 17-му дню уровня экспрессии, характерного для взрослых особей.
У мышей связывание DAGO постепенно нарастает с 3-го по 15-й дни после рождения и имеет еще более высокий уровень у десятинедельных животных. Присоединение DADL к 8-рецепторам фиксируется лишь на 15-й день (Tavani et al., 1985).
Хотя общий уровень морфологической и нейрохимической незрелости мозга человека в момент рождения очень велик, его опиоидная система находится в более сформированном состоянии, чем у крысы. Об этом свидетельствуют немногочисленные, но весьма убедительные работы.
Sales с соавт. (1989) изучали распределение в спинном мозгу человека энкефалиназы, а также ц- и 8-опиоидных рецепторов в течение всего периода эмбриогенеза. Все три соединения обнаружены на ранней стадии развития ЦНС (14 недель) по большей части в сером веществе (особенно в поверхностных слоях дорсальных рогов).
Panigrahy с соавт. (1998) исследовали средний мозг пяти эмбрионов в течение 19—26 недель беременности, шести детей (38—74 недели), ребенка четырех лет и трех взрослых в возрасте 20—68 лет. Во всех случаях в медиальном межножковом ядре наблюдалось высокое связывание опиатов с соответствующими рецепторами.
Работа Kinney с соавт. (1990) дает информацию о количественном распределении опиатных рецепторов в стволе мозга детей и эмбрионов. Показано, что высокое связывание налоксона происходит в сенсорных и лимбических ядрах, а также некоторых ядрах ствола (тригеминальном, ядре одиночного тракта, респираторных центрах, голубом пятне). Опиатные рецепторы оказались редки в черной субстанции эмбрионов, детей и взрослых, тогда как у приматов и грызунов здесь регистрируется умеренное, но весьма заметное их количество. Наконец, было обнаружено высокое связывание налоксона в нижней оливе эмбрионов и детей, что контрастирует со слабым связыванием в этой области у взрослых людей, приматов и грызунов. Последний факт, по мнению авторов, отражает программируемую гибель нейронов в онтогенезе моторных систем мозга.
Приведенные данные показывают, что прямой перенос на человека выводов, сделанных в экспериментах с грызунами, не всегда корректен. Вместе с тем, если эффекты тех или иных опиоидов (например, экзорфинов)
Глава 2. Опиоидная система: свойства, разнообразие и онтогенез рецепторов выявляются в случае детенышей крыс, то для человека с его относительно сформированной к моменту рождения опиоидной системой мы вправе ожидать аналогичных и даже более выраженных изменений.
Глава 3. Влияние бета-казоморфинов на болевую чувствительность
Общая характеристика системы болевой чувствительности
Система болевой чувствительности служит, как известно, для детекции стимулов, повреждающих организм, его ткани и клетки. Помимо центров, обеспечивающих восходящее проведение ноцицептивной информации (задние рога спинного мозга, ядра тройничного нерва, различные таламические зоны, передняя часть теменной доли коры больших полушарий), в ее состав входит значительное число структур, осуществляющих нисходящий (в первую очередь, тормозный) контроль болевой чувствительности. К последним относят желатинозную спинного мозга, центральное серое вещество и ядра шва, ряд ретикулярных и гипоталамических ядер, голубое пятно и уже упомянутую теменную кору (Ноз-драчев с соавт., 2001).
Механизмы тормозного контроля ноцицепции очень разнообразны и включают в себя как пре-, так и постсинаптические процессы; а на уровне нейронных сетей — различные варианты последовательного и параллельного торможения. Наиболее изучены нейрофизиологические и нейрохимические принципы работы задних рогов спинного мозга и центрального серого вещества (ЦСВ).
В первом случае суть происходящих процессов состоит в регуляции активности релейных нейронов, принимающих сигналы от сенсорных клеток спинномозговых ганглиев (медиаторы — глутаминовая кислота и вещество Р) и формирующих спинноталамический тракт. Передача ноцицептивной информации от спинномозговых ганглиев находится под контролем опиоидергических интернейронов желатинозной субстанции, осуществляющих пресинаптическое торможение соответствующих сенсорных входов. Кроме этого, состояние релейных клеток задних рогов во многом определяется постсинаптическим торможением, формируемым ГАМК-ергическими интернейронами. В свою очередь, активность опиоид- и ГАМК-ергических интернейронов зависит от сигналов, поступающих по системе кожной чувствительности (от тех же точек рецеп
тивной поверхности, что и боль; концепция «воротного контроля», предложенная Р. Мелзаком) и нисходящих сигналов из головного мозга.
Основу нисходящего тормозного контроля составляют серотонин- и норадренергические аксоны, принадлежащие, соответственно, нейронам ядер шва и голубого пятна. В свою очередь, эти структуры находятся под управлением ЦСВ, гипоталамуса, коры больших полушарий. В ЦСВ осуществляющие супраспинальное влияние области функционируют под контролем ГАМК-содержащих нервных клеток, которые при развитии анальгезии тормозятся за счет срабатывания опиоидергических интернейронов. В случае гипоталамуса принципиально важна роль латеральных и аркуатных ядер, а также значение входных активационных влияний дофаминергической области вентральной покрышки (последние также усиливаются на фоне экзоцитоза опиоидных пептидов). Данные вопросы детально анализируются в большом количестве экспериментальных работ и обзоров (Bach, Yaksh, 1995; Dafny et al., 1996; Беспалов, Звартау, 2000).
Опиоидная система и контроль ноцицепции
Опиоидная система играет очень существенную роль на конечных этапах реализации ноцицептивных эффектов, запускаемых более рострально расположенными структурами ЦНС. Примером может служить стресс-индуцированная анальгезия, источником которой способны быть самые разные (не обязательно болевые) сенсорные сигналы, уровень возбуждения центров оборонительного поведения (в ситуациях принудительного плавания, иммобилизации) и т.п. На гормональном и нейрохимическом уровнях стресс-индуцированная анальгезия обуславливается активацией гипоталамо-гипофизарной системы, надпочечников и, в числе прочего, выбросом энкефалинов и эндорфинов (Филаретов с соавт., 1995; Yamada, Nabeshima, 1995).
В нестрессогенных условиях активность антиноцицептивной составляющей опиоидной системы достаточно мала. У животных с нокаутированными MOR-1, DOR-1 и KOR-1 генами значимых изменений фоновой болевой чувствительности не зарегистрировано (Matthes et al., 1996), а введение опиоидных антагонистов даже в значительных дозах обычно не вызывает гиперальгезии (либо вызывает ее в слабой форме).
Что касается рецепторной специфичности антиноцицептивных эффектов опиоидов, то здесь достаточно устоявшейся точкой зрения явля
ется относительно равный вклад ц 8 - и к-мест связывания в спинальную анальгезию, и несколько более важная роль ц-типа в супраспинальных механизмах (в т.ч. в случае ЦСВ). При этом все три рецепторные подсистемы сосуществуют достаточно независимо. Аддитивность (иногда с дополнительным усилением) анальгетических изменений, вызываемых совместно вводимыми ц-, 8- и к-агонистами, многократно продемонстрирована на уровне как спинного, так и различных областей головного мозга. Более того, сложение эффектов препаратов обнаружено при параллельном спинальном (интратекальном) и супраспинальном введении, при параллельной инъекции в голубое пятно и ЦСВ и тд. (Sutters et al., 1990; Bodnar et al., 1991). В исследованиях на животных с нокаутированными генами опиоидных рецепторов показано, что «выбивание» MOR-1 участка ДНК не приводит к изменению реакции на81-,8г- и к-агонисты; выбивание гена DOR-1 не влияет нац- и к-анальгезию, а выбивание гена KOR-1 не ослабляет эффекты ц- и 8-агонистов (Matthes et al., 1996).
Вместе с тем, существует довольно много данных о том, что для более методически «узких» ситуаций (определенный тип боли — термическая, механическая, висцеральная, связанная с воспалением; определенный вид экспериментальных животных; определенная группа спинно-таламических проекций) некоторая рецепторная специфичность все же существует, и тогда сообщается от отсутствии эффектов р 2-агонистов, Si-агонистов, к-агонистов и т.п. (например, Rossi et al., 1994; Hirata et al., 2000).
Обратимся теперь к (3 -казоморфинам. Будучи достаточно выраженными ц- и, отчасти, 8-селективными лигандами, они проявляют четкое анальгетическое действие при центральном и периферическом введении. Активность р-к-5 (Tyr-Pro-Phe-Pro-Gly) в случае внутрижелудочкового применения составляет 1 /25 от активности морфина: ED200 морфина равно 5—6 нМ; для пентапептида оно составляет 130—150 нМ (около 70— 80 мкг) (Neubert et al., 1990).
Соотношение анальгетически активных доз при внутрижелудочковом и внутривенном введении морфина равно примерно 1/1000. ЕВгоодля системно применяемого морфина оценивается как 4,5—5 мкМ (1,5—2 мг на животное). Для менее выраженной, но регистрируемой как значимая 20—30%-ной анальгезии, доза, соответственно, ниже — 1—2 мг/кг. В случае Р -к-5 вызывающее аналогичные эффекты количество оказывается (с поправкой на более высокую молекулярную массу пептида) практически таким же — 2,5 мг/кг (Blass, Blom, 1996). Следовательно, при системном
введении антиноцицептивная активность (3 -к-5 приближается к уровню морфина.
Анальгетические свойства системно вводимых 0-казоморфинов
В наших опытах для измерения болевой чувствительности использовался тест «отдергивание хвоста». Во время эксперимента животное постоянно находилось в специальной прозрачной пластиковой камере. Болевое раздражение наносили погружением хвоста в воду, нагретую до телшературы 56°С. Время реакции (латентный период отдергивания хвоста) определяли в течение 30~50 мин до и 2—2,5 часов после введения препарата (в контрольной группе — воды) с интервалами 10—30 мин (в разных сериях экспериментов). Измерения до введения веществ позволяли (после усреднения) оценить уровень исходной ноцицепции, с которым затем сравнивалась величина приобретенной болевой чувствительности (Дубынин с соавт., 1992).
Основной исследуемый препарат (3-к-7 вводили в трех дозах — 5,10 и 20 мг/кг внутрибрюшинно (объем раствора — 1 мл/кг веса). В опытах было использовано 98 животных. Кроме того, изучалось влияние предварительного введения налоксона (1 мг/кг) на анальгетические эффекты (3 -к-7, а также возможное действие на ноцицепцию лишенных N-концевого тирозина (3 -к-6 (Pro-Phe-Pro-Gly-Pro-Ile) и (3 -к-4 (Phe-Pro-Gly-Pro) в дозах 5 и 20 мг/кг. В каждой из этих серий экспериментов было использовано примерно по 80 крыс.
Исходное время реакции отдергивания хвоста у экспериментальных животных колебалось от 5 до 14 с. Его величина составила 9,3±0,4 с (среднее ± ошибка среднего; AMtSEM) в контроле; 9,О±О,5, 8,4±0,7 и 8,4±0,6 с в трех опытных группах, получивших впоследствии 5,10 и 20 мг/кг (3-к-7, соответственно. Поскольку исходное время реакции избавления от болевого стимула в группах несколько различалось, действие препаратов мы оценивали по изменению величины времени реакции в ходе эксперимента. Соответственно, в каждой временной точке сравнивались не только абсолютные значения параметра, но и изменения («дельта от исходной величины») в опытных группах и изменения в контроле.
В графическом виде результаты оценки болевой чувствительности после введения различных доз |3 -к-7 (в контроле — воды) представлены на рисунке 3.1. Как можно заметить, 0 -к-7 в дозе 5 мг/кг практически не влиял на болевую чувствительность животных. В более высоких дозах 10
Рисунок 3.1. Влияние различных доз бета-казоморфина-7 на болевую чувствительность крыс в тесте «отдергивания хвоста».
По оси абсцисс — время после введения (минуты.). Нулевая точка соответствует измерениям до введения препаратов. По оси ординат — изменение времени реакции (секунды). Уровень исходной болевой чувствительности принят за ноль. Достоверные отличия от контроля отмечены * при р< 0,0 5 и** при р< 0,01. Величина контрольной, группы — 31 животное; в опытных группах — по 22—23 крысы.
и 20 мг/кг пептид вызывал значимое увеличение времени избавления от болевого стимула на 20—30% по сравнению с контролем. Появляясь через 10-20 мин после введения вещества, данный эффект оставался достоверным в течение 30 и 70 мин для групп, получивших 10 и 20 мг/кг Р-к-7, соответственно. Проведение линейного корреляционного анализа подтвердило дозозависимый характер анальгезии в течение первого часа после введения Р-к-7 (р<0,05).
Для более детальной оценки наблюдаемых эффектов мы разделили экспериментальных животных на две подгруппы: с относительно низким (не более 8 с) и высоким (8—14 с) исходным временем реакции избавления от болевого стимула, а, значит, с исходно более высокой и более низкой болевой чувствительностью. У животных первой подгруппы, получивших впоследствии воду, 5, 10 либо 20 мг/кг Р-к-7, исходное время реакции
5
Рисунок 3.2. Влияние различных доз бета-казоморфина-7 на болевую чувствительность крыс в тесте «отдергивания хвоста».
Вверху — для животных с исходно более низким временем реакции (до 8 сек); в группах по 10—13 крыс. Внизу — для животных с исходно более высоким временем реакции (8—14 сек); в контроле 18 крыс; в опытных группах по 10—13 крыс. Обозначения как на рис. 3.1.
отдергивания хвоста составило 6,4±0,2; 6,3±0,4; 5,9±0,3 и 6,1 ±0,3 с. Во второй подгруппе соответствующие величины были равны 11,4±0,3; 10,3±0,4; 11,3±О,8 и 11,0±0,4 с. Полученные результаты представлены на рисунке 3.2.
Показано, что анальгетические эффекты 0 -к-7 в основном обусловлены вкладом животных с исходно более высокой болевой чувствительностью. Действительно, в этой подгруппе 0 -к-7 в дозе 20 мг/кг увеличивал время
отдергивания хвоста на 30—40% (рис. 3.2А) по сравнению с 10—20% для животных с более низкой болевой чувствительностью (рис. 3.2Б). Кроме того, в первом случае эффект появлялся раньше и был более длительным. Аналогичная зависимость выявлена и для меньшей действующей дозы 0 -к-7 — 10 мг/кг. Если в подгруппе с исходно более высокой болевой чувствительностью введение такого количества пептида приводило длительному увеличению времени реакции отдергивания хвоста на 20— 40%, то в подгруппе с исходно более низкой болевой чувствительностью 0 -к-7 оказался вообще неэффективным.
При проведении линейного корреляционного анализа было подтверждено наличие положительной связи между выраженностью анальгезии и исходной болевой чувствительностью животных. Эта связь регистрируется в группе, получившей 10 мг/кг пептида, через 30 мин после инъекции (рис. 3.3 А); в группе, получившей 20 мг/кг — уже через 10 мин (рис. З.ЗБ). Выявленное корреляционное отношение характеризуется высоким уровнем значимости (р<0,05—0,001) и сохраняется в течение двух часов регистрации. В случае дозы 5 мг/кг подобная зависимость отсутствовала.
Показано, что анальгетическое действие 0-к-7 (20 мг/кг) может быть заблокировано предварительным (за 15 мин) внутрибрюшинным введением налоксона. Использованная доза налоксона 1 мг/кг, как известно, является минимальной для реализации его антагонистических (по отношению к соединениям с опиоидной активностью) эффектов.
Исходное время отдергивания хвоста составило 7,8±0,6, 7,5±0,6, 7,4±0,7 и 8,4+0,5 с в контроле и группах, получавших налоксон, пептид и оба препарата, соответственно. Время избавления от болевого стимула в группе с совместным введением налоксона и пептида хотя и превышало контрольные значения на протяжении всего периода наблюдений, однако отличие оставалось незначимым (рис. 3.4). Кроме того, изменения болевой чувствительности в группе с совместным введением достоверно отличались от таковых для группы, получившей только пептид (точки 20, 30, 70 и 90 мин). Несколько осложняет интерпретацию результатов тот факт, что сам по себе налоксон к концу первого часа наблюдений начинал оказывать обезболивающее действие. Однако, по нашему мнению, общая динамика наблюдавшихся зависимостей явно свидетельствует о конкуренции (но не суммации) эффектов налоксона и 0 -к-7.
При тестировании лишенных тирозина аналогов 0 -казоморфина-7 (0 -к-4 и 0 -к-6) исходное время реакции отдергивания хвоста в экспери-
Рисунок 3.3. Зависимость анальгетических эффектов бета-казоморфина-7 в дозах 10 мг/кг (А) и 20 мг/кг (Б) от исходного уровня болевой чувствительности животных.
По оси абсцисс — исходное время отдергивания хвоста, сек; по оси ординат — изменение времени реакции, сек; нулевая точка — уровень исходной болевой чувствительности. Каждая точка на графиках соответствует конкретному животному. А — регистрация через 30 мин после введения пептида; Б — регистрация через 10 мин после введения пептида (появление значимой связи с р<0,05). Параметры регрессионных прямых приведены на графиках.
Рисунок 3.4. Влияние предварительного введения налоксона (1 мг/кг) на вызванное бета-казоморфином-7 (20 мг/кг) повышение времени реакции отдергивания хвоста.
По осям — то же, что и на рис. 3.1. В группах по 13—17 крыс; группа с совместным введение налоксона, и бета-казоморфина-7 отмечена «нал + каз-7». Достоверные отличия группы, получившей пептид, от контроля отмечены * прир<0,05 и ** прир<0,01; группы с совместным введение налоксона и бета-казоморфина-7 от получившей только пептид — # (р<0,05).
ментальных группах значимо не различалось. Рассматривая динамику болевой чувствительности после инъекции препаратов, можно констатировать, что введение Р -к-6 и Р -к-4 (дозы 5 и 20 мг/кг) не вызвало заметных отличий от контроля на протяжении всех 90 мин наблюдений. Максимальное превышение времени избавления от болевого стимула в группах, получавших дез-Туг-аналоги, над контролем составляло 10—15% и не достигало уровня достоверности.
На основании полученных результатов можно заключить, что доза Р -к-7, равная 20 мг/кг и, особенно, 10 мг/кг близка к минимальной с точки зрения проявления его анальгетических свойств. Всего двукратное снижение количества вводимого Р -к-7 (до 5 мг/кг) делает наблюдаемые эффекты полностью незначимыми. Блокада ослабляющего боль действия Р-к-7 предварительным введением относительно небольшого количества налоксона доказывает, что анальгетическая активность гептапептида опосредуется преимущественно через опиоидные места связывания. С другой
стороны, дез-Туг-аналоги не влияли на болевую чувствительность, что согласуется с представлением о необходимости N-концевого тирозина для присоединения к классическим подтипам опиоидных рецепторов.
Таким образом, в наших экспериментах увеличение времени реакции отдергивания хвоста на 20—30% вызывалр -к-7, внутрибрюшинно вводимый в дозе 20 мг/кг (у всех крыс) и 10 мг/кг (в случае животных с высокой болевой чувствительностью). Следовательно, соотношение с анальгетически активным количеством Р -к-5 составляет с учетом более низкой молекулярной массы пентапептида (см. уже упоминавшуюся работу Blass и Blom, 1996) примерно 1/3-1/5. Эти расчеты хорошо соответствуют факту несколько разного сродства данных соединений к ц -рецепторам: К, на фоне DAGO оценивается для Р -к-5 в 1 000 нМ, для Р -к-7 — в 5000 нМ. Кроме того, учтем, что аффинность р -к-5 и р -к-7 к 8 -рецепторам практически одинакова: К на фоне DADL равняется для них около 20000 нМ (Koch, Brantl, 1990).
По данным литературы в случае внутрижелудочкового введения синтетических аналогов Р-казоморфинов значимое анальгетическое действие наблюдается в дозах, более низких, чем при использовании морфина (в 28 раз для dPro4-P -к-5 и в 8 раз для ЗРго4-морфицептина). Однако при системной инъекции соотношение «выравнивается» и dPro4-P-K-5 оказывается лишь в два раза эффективнее морфина, а dPro4-мopфицeптин — в 2 раза слабее (Neubert et al., 1990). Можно предположить, что наличие d-аминокислоты затрудняет для пептидов проникновение через ГЭБ (при условии, что переносом занимаются особые транспортные системы, близкие к уже упоминавшейся PTS1).
Сходная картина наблюдается при тестировании природного 8-аланин содержащего опиоидного пептида дерморфина (Батурина, 1989). В этом случае достоверное увеличение времени реакции отдергивания вызывало введение внутрь желудочков мозга 0,5 мкг/кг и внутрибрюшинное введение 5 мг/кг препарата (соотношение 1/10000). Для синтетического тетрапептида Tyr-dAla-Gly-Phe также сообщается, что при внутривенном введении его анальгетическая активность несколько уступает характерной для морфина, при интратекальном — значительно превышает ее (Silbert et al., 1991). С другой стороны, в связи с низкой стабильностью энкефалины при периферической инъекции в дозах 20—30 мг/кг на болевую чувствительность практически не влияют.
Наблюдавшиеся нами эффекты Р -казоморфина-7 характеризовались четкой зависимостью от дозы: пептид в количестве 5 мг/кг (0,04 мкМ/кг)
не приводил к изменениям болевой чувствительности крыс; в дозе 10 мг/кг (0,08 мкМ/кг) вызывал небольшую по амплитуде и длительности (до 30 мин) анальгезию; в количестве 20 мг/кг (0,16 мкМ/кг) действовал на животных вне зависимости от фоновой болевой чувствительности, а время реакции отдергивания хвоста оставалось увеличено в течение 70 мин.
Кроме того, в группе с введением Р -к-7 в максимальной дозе уже через 10 мин после инъекции регистрировалась достоверная корреляция анальгетических изменений и исходной величины латентного периода отдергивания хвоста. Данная корреляция, наблюдавшаяся также при использовании 10 мг/кг пептида (но несколько позже), свидетельствует о значимости для проявления эффектов Р -к-7 индивидуального уровня болевой чувствительности животных. Этот уровень, в свою очередь, является результатом взаимодействия ноцицептивной и антиноцицептивной систем. При высокой активности последней Р -к-7, очевидно, находит меньше возможностей для проявления своего снижающего болевую чувствительность действия.
Интересно, что незначительная часть экспериментальных животных (около 10%) характеризовалась особо высоким фоновым латентным периодом отдергивания хвоста — более 14 с, из-за чего не включалась в общую статистику. Введение Р -к-7 почти вне зависимости от дозы приводило у них к парадоксальному эффекту: время реакции, по сравнению с контрольной группой, снижалось. По всей вероятности, в этом случае мы имели дело с анальгезией, вызываемой у крыс длительным нахождением в пластиковых домиках, что являлось значимым стрессогенным воздействием. Характерно, что эти же животные при тестировании в «открытом поле» и «приподнятом лабиринте» продемонстрировали меньший уровень исследовательской активности и более высокую степень тревожности. Можно предположить, что в описанной ситуации Р -к-7 выступал как конкурент эндогенной опиоидной системы: занимал соответствующие места связывания, но, активируя их в меньшей степени, приводил к росту болевой чувствительности.
Опиоидная природа анальгетического действия Р -к-7 доказывается почти полным исчезновением антиноцицептивных изменений на фоне введения налоксона. Аналогичный результат получен и в экспериментах сР-к-5 (Blass, Blom, 1996). Интересно, что в работе этих авторов блокатор вводился внутрь желудочков мозга для доказательства центральной природы влияния Р -казоморфинов на болевую чувствительность.
Как известно, лишенные тирозина аналоги опиоидных пептидов не способны эффективно связываться с соответствующими рецепторами. Следовательно, отсутствие анальгетического действия у дез-Тут-производных тетрапептида Phe-Pro-Gly-Pro и максимально близкого к прототипу гексапептида Pro-Phe-Pro-Gly-Pro-lle даже при использовании дозы 20 мг/кг также подтверждает опиоидную природу антиноци-цептивных эффектов 0 -к-7.
Подавляющее большинство выполненных в рамках данной работы экспериментов проведено с использованием внутрибрюшинной инъекции пептидов. Это связано со стремлением по возможности повторить ситуацию системного проникновения 0 -казоморфинов в организм, которая наблюдается при питании молочными белками. Соответственно, при оценке нейротропных эффектов нас интересовали не столько тонкие механизмы действия тестируемых соединений (для чего используются локальные внутричерепные или внутримозговые инъекции), сколько реакции целостной нервной системы. Тем не менее, в отдельной серии опытов был испытан также интраназальный способ введения 0-к-7. Идея этих экспериментов связана со способностью многих соединений проникать через слизистую носовой полости в кровь и далее — в мозг (преимущественно в передние его отделы). Данный путь является неинвазивным (что очень важно с точки зрения возможного практического применения); при его использовании некоторые опиоиды (в т.ч. пептиды) проявляют более высокую активность, в сравнении с внутрибрюшинными и внутривенными инъекциями.
Так, для морфина показано, что его интраназально вводимая доза может быть в два раза меньше, чем при внутривенном применении (Kendall et al., 2001; клиническое исследование на детях); при этом действие анальгетика развивается значительно быстрее. В случае пептидов, содержащих d-аминокислоты, пропорция еще «благоприятнее»: 1/1 000-2000 для дермор-фина (Батурина, 1989; анальгезия фиксируется при интраназальном введении 2,5—5 мкг/кг); 1/100-1000 для синтетического аналога арги-нилвазопрессина [6—9] N-Ac-dMet-Pro-Arg-Gly-NHz (Пономарева с соавт., 1998; оценивалось влияние на исследовательскую деятельность и обучение). Вместе с тем, пептиды, легко распадающиеся под действием протеаз (например, энкефалины), при интраназальном применении вообще не проходят в кровь, задерживаясь в слизистой носовой полости.
Исходя из всего изложенного, для первых опытов с данным способом введения 0-к-7 нами была выбрана доза 20 мкг/кг; в дальнейшем тести
ровалась также доза 100 мкг/кг. Однако в обоих случаях какие-либо изменения болевой чувствительности отсутствовали. Дальнейшее наращивание количества вводимого 0 -к-7 было ограничено его растворимостью (для интраназального введения используются малые объемы жидкости, составляющие до 100 мкл/животное), а также приближением к диапазону доз, эффективных при внутрибрюшинном применении.
Вместе с тем, отсутствие антиноцицептивных эффектов интраназального введения вовсе не означает, что пептид не воздействовал на мозг, и при обработке результатов экспериментов обнаружено значительное количество поведенческих изменений, хорошо коррелирующих с зарегистрированными при внутрибрюшинных инъекциях (см. ниже). Следовательно, в случае интраназального применения пептид проникал в ЦНС, но распределялся, скорее всего, более локально, не затрагивая центров регуляции болевой чувствительности. Действительно, ответвляющиеся от сонных артерий сосуды, осуществляющие основное кровоснабжение головы, обслуживают лишь промежуточный и конечный мозг; остальные отделы головного мозга снабжаются кровью через позвоночные артерии. В результате действие 0 -к-7, видимо, не затрагивало центры регуляции ноцицепции в среднем и заднем мозгу, а сосредотачивалось на более ростральных областях. При этом влияния 0-к-7 на гипоталамические и корковые области, управляющие антиноцицепцией, видимо, оказалось недостаточно для развития анальгезии (в отличие от, например, дерморфина).
Онтогенез антиноцицептивного действия 0-казоморфинов
Еще одна группа результатов, которую следует рассмотреть в связи с болевой чувствительностью — онтогенез изменяющих ее эффектов опиоидов (в т.ч. 0 -к-7). В литературе по этому поводу можно обнаружить весьма разнородный набор фактов. Так, по данным Fanselow и Cramer (1988) морфиновая анальгезия наблюдается у крысят (сгибание задней лапы при действии t=52°C) уже с 1-го дня жизни. О том же сообщают Abbott и Guy (1995), использовавшие для провокации боли инъекцию формалина в одну из лап. В обоих случаях применялись стандартные дозы системно вводимого морфина (1—5 мг/кг). Вместе с тем, в работе Tseng с соавторами (1995) найдено, что 2—4-дневные крысята еще не реагируют на внутрижелудочковое введение морфина и 0 -эндорфина (термическая боль). Антиноцицептивные реакции развивались только у 7—14-дневных крысят и увеличивались до 21—28-го дня.
В исследовании Barr с соавторами (1992) морфин в разных сериях инъецировался внутрижелудочково и интратекально. Анальгетическое действие измерялось у детенышей крыс в возрасте 3, 10 и 14 дней (термически и механически вызываемая боль, приложенная к передней лапе, задней лапе или хвосту). Показано, что у 3-дневных животных морфин, введенный в желудочки мозга, вызывает анальгезию по отношению только к передним лапам (термический и механический тесты); у 10-дневных — по отношению ко всем частям тела в случае механически вызванной боли и только для передних лап в случае использования нагревания. У 14-дневных детенышей регистрируется снижение болевой чувствительности всех частей тела в обоих тестах. При интратекальном введении в возрасте 3 дня отмечена анальгезия только передних лап и только для термической боли; с возраста 10 дней — все варианты обезболивания. Авторы заключают, что становление антиноцицептивных систем во многом зависит от формирования нисходящих проекций, контролирующих боль.
Marsh с соавторами (1999) сконцентрировали свое внимание на становлении различных компонентов опиоидной системы в спинном мозге, вводя эпидуральноц- (морфин),5- (DPDPE) ик- (П-69593) агонисты животным разного возраста. Полученные результаты выглядят на общем фоне весьма пародоксально, поскольку в случае механически провоцируемой боли показано, что EDso всех трех агонистов минимальны в 3-дневном возрасте, имеют средний уровень в 10-дневном возрасте и максимальны на 21-й день жизни. При использовании термического теста выявлена более сложная картина: эффективность П-69593 понижалась с возрастом, морфина — повышалась, DPDPE — оставалась относительно неизменной. Кроме того, найдено, что распределение и концентрация меченного 3Н-морфина в спинном мозге при эпидуральном введении мало отличаеся у животных на 3,10 и 21-й дни жизни. Авторы делают заключение, что созревание собственно опиоидной системы не является единственным фактором, определяющим развитие антиноцицептивных функций.
Действительно, параллельно происходит становление и других тормозных компонентов нейросетей спинного мозга, в результате чего способность контролировать проведение сенсорных (в том числе болевых) и моторных сигналов нарастает. Принято считать, что новорожденные крысята по степени зрелости нервной системы примерно соответствуют 25-недельному плоду человека (Abbott, Guy, 1995). Соответственно, в
последнем случае антиноцицептивная система также еще недостаточно сформирована. Об этом свидетельствует наличие у недоношенных детей повышенной болевой чувствительности и возникновение после болевой стимуляции длительных периодов гиперальгезии (Anand, 1998).
Таким образом, у нас нет особых оснований заключить, что данные поведенческих экспериментов удовлетворительно совпадают с результатами работ по определению концентрации опиоидных рецепторов в созревающем мозге крыс (подробнее см. главу 2). Анальгетические эффекты опиоидов зависят не только от возраста, но и от места (способа) введения, дозы и метода тестирования. Вместе с тем, если антиноцицепция выявляется, она возникает при использовании доз, сравнимых с эффективными в случае половозрелых животных (и даже меньших). Соответственно, в собственных опытах по определению влияния Р -казоморфина-7 на болевую чувствительность детенышей крыс мы остановились на наиболее часто применяемом термическом способе стимуляции и использовали дозы 5 и 20 мг/кг, последняя из которых доказала свое действие на взрослых особях (Дубынин с соавт., 2001).
У еще незрячих детенышей в возрасте 7 дней тестирование проводилось с применением установки «горячая пластина» (производство «Ugo Basile», Италия). Животных вначале помещали на поверхность с температурой 28°С (условия гнезда) и для оценки общего уровня двигательной активности регистрировали латентный период выползания из круга диаметром 5 см. После этого детеныш переносился на поверхность с температурой 48°С (слабое термическое болевое воздействие). В ходе наблюдений отмечался момент выхода за пределы круга диаметром 5 см хотя бы одной конечности (оценка уровня ноцицепции). Регистрацию проводили через 15, 30 и 75 мин после инъекции пептида (в контроле — воды).
Показано, что при помещении детенышей на «горячую пластину» с температурой 48°С через 5—7 с возникают резкие боковые (в горизонтальной плоскости) сгибательно-разгибательные движения туловища. В результате одна из конечностей (обычно — правая или левая передняя) достаточно быстро оказывается за пределами круга, что служит сигналом к немедленному прекращению теста.
При оценке болевой чувствительности латентный период реакции характеризовался значительным индивидуальным разбросом, составляя в контрольной группе в среднем 25—40 сив ходе трех последовательных измерений достоверно не менялся. Аналогичная картина наблюдалась
при введении обеих доз пептида; значимые отличия от контроля отсутствовали. Использование относительно низкой температуры 48°С было вызвано необходимостью избежать травмирующего действия теста. В результате, хотя некоторые животные находились на «горячей пластине» в течение 1 мин, признаки повреждения кожных покровов отсутствовали как по ходу тестирования, так и в следующие за ним дни.
В целом можно заключить, что введение 0 -казоморфина-7 в этот период онтогенеза неэффективно, что, вероятнее всего, связано с функциональной незрелостью опиоидной системы мозга и отсутствием (малым количеством) в ЦНС крыс соответствующих мест связывания.
Тестирование в возрасте 14 дней проводилось по той же методике, что и в предыдущем случае. Разница состояла в том, что для оценки болевой чувствительности использовался латентный период выхода одной конечности за пределы круга диаметром 10 см.
В конце второй недели жизни движения детенышей стали более скоординированными и, несмотря на еще не открытые глаза, они оказались способны к гораздо более эффективным перемещениям по горизонтальной поверхности. В результате латентный период реакции избавления от термического раздражителя в контроле составил около 20 с. В группе, получившей более высокую дозу 0-казоморфина-7 (20 мг/кг), происходило снижение чувствительности к болевому стимулу, через 15 и 30 мин после введения латентный период реакции был значимо больше, чем в контроле. Животные с инъекцией пептида в дозе 5 мг/кг, занимали промежуточное положение, достоверно не отличаясь ни от той, ни от другой группы (рис. 3.5).
На 15—17-й день жизни у крысят происходило открытие глаз, что привело к резкому возрастанию их двигательной активности и позволило в ходе дальнейшего тестирования использовать стандартную методику, применяемую в случае экспериментов со взрослыми животными. При этом крысят помещали поверхность «горячей пластины», нагретой до температуры 56°С. Латентный период лизания задних лап (время реакции) определяли в течение 30—50 мин до и 2—2,5 ч после введения препаратов с интервалами 10—30 мин. Обработка результатов проводилась так же, как и в случае теста «отдергивание хвоста».
Выявлено, что латентный период первого лизания задней лапы в контроле относительно стабилен и составляет 12—14 с. В группе с введением 0 -казоморфина-7 (20 мг/кг) через 15 и 45 мин после инъекции время реакции оказалось значимо больше контрольного уровня, что свидетель-
Рисунок 3.5. Изменение латентного периода реакции избавления от термического воздействия у детенышей крыс различного возраста после внутрибрюшинного введения бета-казоморфина-7 (дозы 5 и 20 мг/кг). Данные во всех точках пронормированы по контролю. По горизонтали — время после введения веществ; по вертикали — проценты от контрольного уровня. Отличия от контроля ср<0,05 отмечены *.
ствует о развитии анальгетического эффекта. В группе, получившей меньшую дозу Р-к-7, подобные изменения отсутствовали (рис. 3.5).
В целом можно заключить, что развитие той составляющей антиноци-цептивной системы, на которую способен влиять Р-казоморфин-7, происходит в ходе онтогенезе детенышей крысы достаточно рано — на второй неделе постнатального периода. Введение Р -к-7 в возрасте 7 дней не влияет на латентный период реакции избавления. Однако такое влияние было зарегистрировано в возрасте 14 дней и 21 день. Величина анальгетических изменений при применении 20 мг/кг пептида составляла 30—40%; длительность присутствия значимых отличий от контроля — не менее 45 мин. Доза 5 мг/кг, как и у взрослых животных, была неэффективна.
Обратим внимание на хорошее соответствие сделанного заключения с уже упоминавшейся работой Blass и Blom (1996), выполненной на 10-дневных крысятах. Из рассмотренных выше экспериментальных исследований наши данные в наибольшей мере совпадают с результатами, полученным Tseng с соавторами (1995а). Они показали, что анальгетическое действие опиоидов в первую неделю жизни крыс если и регистрируется, то его эффективность значительно снижена. Сходное утверждение по отношению к повреждающим термическим и механическим стимулам (но не химически вызванной и воспалительной боли) высказано также Abbott и Guy (1995).
Полученная нами в экспериментах на новорожденных информация позволила установить «точку отсчета» в смысле доз и сроков введения, от-
Глава 3. Влияние бета-казоморфинов на болевую чувствительность носительно которой в дальнейшем проводилось исследование влияния 0 -к-7 на двигательную активность, тревожность и некоторые другие характеристики поведения детенышей. Сходное заключение можно сделать и в случае взрослых животных. Весь комплекс экспериментов по анализу антиноцицептивного действия 0 -казоморфинов принес, по сути, достаточно ожидаемые результаты. Однако это позволило охарактеризовать наиболее «очевидную» черту опиоидной активности 0-казоморфинов, доказать ее связь с соответствующими рецепторами и стало основой для планирования следующих серий опытов. Очевидно, что 0 -к-7 не является высоко активным в смысле снижения ноцицепции пептидом, и его аналь-гетически эффективная доза, составляющая 20 мг/кг, весьма высока. Мы вряд ли можем ожидать наличия сходных по интенсивности воздействий на эндогенную опиоидную систему организма детенышей в естественных условиях питания молоком Однако дозы 5 и, особенно, 1 мг/кг представляются уже вполне приближенными к реальной ситуации (Singh et al., 1989). Последствия введения таких анальгетически неактивных количеств и стали основным объектом анализа в ходе проведения дальнейших работ (в том числе — при хронических инъекциях новорожденным).
Влияние 0-казоморфинов на защитную реакцию реакцию Periplaneta americana
Завершим раздел, посвященный влиянию 0-казоморфинов на болевую чувствительность, описанием исследования, выполненного благодаря усилиям коллег-зоологов и посвященного действию 0 -к-7 за защитную локомоторную реакцию таракана Periplaneta. americana (Грицай с соавт., 2000). Такая реакция возникает при прямой электростимуляции через вживленные в переднегрудь электроды, а соответствующая экспериментальная модель позволяет изучать эффекты различных фармакологических препаратов. Использование насекомых в качестве объекта экспериментальных исследований оправдано чисто научными (в т.ч. связанными с эволюционной физиологией) задачами и активно приветствуется с позиций биоэтики.
В цикле работ, выполненных О.Б. Грицай с соавторами (1998—2004), тестировались такие стандартные наркотические и ненаркотические анальгетики как морфин, промедол, метамизол, ацетилсалициловая кислота. Исходя из того, что активность большинства физиологически активных веществ при действии на беспозвоночных оказывается заметно
ниже в связи с их пойкилотермностью и особенностями обмена веществ, для исследования влияния 0 -к-7 на Р. americana исходно была выбрана заведомо завышенная доза пептида 200 мкг/г.
Показано, что введение такого количества препарата ослабляет локомоторную защитную реакцию более, чем на 50%, причем достоверное отличие от контроля сохраняется в течение всех 75 мин наблюдений. Снижение дозы пептида до 100 мкг/г привело к ослаблению его действия (изменения выраженности реакции в пределах 20—30%). Вместе с тем, значимое отличие от контроля продолжало наблюдаться в течение всего эксперимента. Пептид в количестве 50 мкг/г вызывал достоверное снижение защитной реакции лишь в первые 30 мин после инъекции. Таким образом, наблюдалась явная зависимость эффектов 0-к-7 от дозы, а также примерно 5-кратное снижение его эффективности (по сравнению с реакцией крыс).
В дальнейшем было проанализировано влияние 0 -к-7 на защитную реакцию Р. americana на фоне введения налоксона. При этом вначале оценивалось действие собственно блокатора. Показано, что инъекция высокой дозы налоксона (50 мкг/г) вызывает снижение защитной реакции в течение всего периода наблюдений — то есть антагонист опиоидных рецепторов действует, как их агонист. Подобное «обращение» влияний налоксона при использовании его больших количеств показано не только для других беспозвоночных, но и для позвоночных. Снижение дозы до 5 мкг/г заметно ослабило, но не устранило обнаруженный эффект. Еще меньшая доза 1 мкг/г не оказала значимого влияния на локомоторную защитную реакцию, в результате чего и была использована для дальнейших экспериментов.
Установлено, что в условиях совместного введения налоксона (1 мкг/г) и0-к-7 (через 15 мин, 100 мкг/г) тормозящее действие пептида на проявления защитной реакции практически полностью устраняется; выраженность реакции не отличалась от контрольного уровня в течение всего времени наблюдений. Очевидно, что результаты этих опытов могут рассматриваться как типичный случай функционирования налоксона в роли опиоидного антагониста.
В последней серии экспериментов доза налоксона была понижена до 0,1 мкг/г, а 0-к-7 — до 50 мкг/г. При этом были получены существенно иные результаты: при совместном введении блокатор значимо усиливал ингибирующее действие пептида на локомоторную защитную реакцию. В соответствующей группе животных отличие от контроля появлялось
через 30 мин после инъекции 0 -к-7 и достигало максимальной выраженности еще через 45—60 мин. Одновременно наблюдались достоверные отличия от группы с ведением только пептида.
Характерно, что сходные эффекты наблюдались нами также при исследовании (на фоне предварительной инъекции налоксона) действия 0 -к-7 на двигательную активность белых крыс; возможные механизмы данного явления будут рассмотрены в следующей главе.
Опиоидная система насекомых изучена достаточно подробно, охарактеризованы эндогенные лиганды, подтипы рецепторов и т.п. Следовательно, полученные в экспериментах на Р. americana результаты являются дополнительным доказательством опиоидных и антиноцицептивных свойств 0 -к-7, позволяют сопоставить его активность с действием стандартных анальгетиков.
Глава 4. Бета-казоморфины и регуляция двигательной активности
Краткая характеристика центров, определяющих общий уровень двигательной активности
Перейдем к анализу влияния 0 -казорморфинов на двигательную активность эксприментальных животных. Понятие двигательной активности даже в рамках используемых в лабораторных условиях методик подразумевает большое число поведенческих компонентов, обусловленных общей степенью активации моторных центров, уровнем исследовательской деятельности, способностью к запуску новых двигательных актов (программ) и тд. При этом множественность и сложные взаимоотношения связанных с перечисленными явлениями областей ЦНС существенно затрудняют анализ полученных результатов. Один из способов сделать подобную задачу относительно решаемой — максимальное упрощение экспериментальных условий и сведение к минимуму вклада центров различных мотиваций в формирование текущего «спонтанного» поведения животного.
В связи с этим, видимо, наиболее адекватным является использование для тестирования двигательной активности различных автоматизированных установок, обеспечивающих изоляцию от внешних сенсорных воздействий. Причем животное должно находиться в камере прибора не менее 10—15 мин для угашения первичного всплеска исследовательской деятельности.
Общепризнанно, что регистрируемый в ходе такого тестирования уровень горизонтальной активности (ГА) является (особенно после 3_5 мин наблюдений) валидной характеристикой уровня возбуждения локомоторных центров. Соответствующие исполнительные области располагаются в спинном мозге; управление ими осуществляется из головного мозга путем фазического контроля (усиление отдельных фаз локомоции — сгибания или разгибания конечностей, движений туловища) и тонического контроля (запуск локомоции и управление общей ее скоростью, в т.ч. переходом с шага на различные типы бега).
Фазические влияния поступают в спинной мозг в основном из ретикулярных ядер моста и продолговатого мозга, латеральных вестибулярных ядер, крупноклеточных областей красных ядер. Все эти структуры, в свою очередь, находятся под управлением старых областей мозжечка, который «помнит» оптимальные параметры отдельных моторных элементов, составляющих целостное движение. Источником тонических влияний служит, во-первых, т.н. мезенцефальная локомоторная область (центральное серое вещество, голубое пятно и расположенная ростральнее от него в среднем мозге аналогичная по функции зона, ядра шва, некоторые ретикулярные ядра). Формируемые здесь серотонин- и норадренергические проекции опускаются в промежуточные ядра серого вещества спинного мозга. Вторая область, запускающая и ускоряющая перемещения организма в пространстве — субталамические ядра (содержат глутаматерги-ческие нейроны). Субталамус в значительной мере управляет мезенцефальной локомоторной областью и сам находится под контролем премоторной и моторной коры больших полушарий (см., например, Баев, 1983).
С точки зрения решаемых нами задач важно, что во многих из перечисленных структур обнаружены опиоидергические нервные клетки либо такие клетки имеются в зонах, которые направляют проекции к управляющим локомоцией центрам (Uhl et al., 1979; Pego-Reigosa et al., 2000).
Вертикальная активность традиционно оценивается как, прежде всего, компонент направленного на сбор новой информации исследовательского поведения животного. Действительно, при переходе от занимающей основное время горизонтальной активности к выполнению стойки (нескольких стоек) происходит торможение чисто локомоторных проявлений и смена двигательной программы. Это само по себе представляет весьма сложную задачу, решаемую такими высшими центрами головного мозга как лобная кора больших полушарий и базальные ганглии (вернее, значительная часть входящих в их состав структур — хвостатое ядро, скорлупа, бледный шар и др.).
Как известно, базальные ганглии являются вторым, наряду с мозжечком, подкорковым центром двигательного обучения и памяти (Черкес, 1983; Graybiel, 1990). Присутствие опиоидных пептидов в этой области весьма значительно. В частности, они функционируют как ко-медиаторы (вместе с ГАМК) во многих клетках стриатума. Существенную роль играют опиоиды и в деятельности компактной части черной субстанции, направляющей дофаминергические проекции в полосатое тело.
Повреждение (фармакологически вызванное изменение состояния) базальных ганглиев может приводить, с одной стороны, к развитию гиперкинезов, с другой — к появлению симптомов акинезии. Часто наблюдаются двигательные стереотипии, в том числе значительное увеличение пробега с параллельным падением числа стоек, что является хорошей иллюстрацией различий в генезе данных компонентов двигательной активности. Так, для к-агониста П-50488 при системном введении в дозе 3 мг/кг показано значимое подавление только стоек, в дозе 10 мг/кг — как стоек, так и пробега (Ukai, Kameyama, 1985). Вместе с тем, в относительно нормальных условиях конкуренции вертикальной и горизонтальной активности не наблюдается; величины данных параметров внутри экспериментальных групп характеризуются высоко достоверной положительной корреляцией (животное, имеющее высокую ГА, совершает много стоек, и наоборот).
То же можно сказать о показателе, позволяющем оценить видоспецифичное исследовательское поведение грызунов — количестве обследованных отверстий-норок (различные модификации теста «норковая камера»). Хотя при фармакологической нагрузке и этот параметр может приобретать определенную «самостоятельность», изменяясь (либо не изменяясь) относительно независимо от остальных показателей двигательной активности (Jackson et al., 1993).
Опиоиды и двигательная активность
Влияние опиоидов на локомоцию анализировать несколько сложнее, чем их антиноцицептивные эффекты. Проблема заключается, прежде всего, в том, что хотя системное введение морфина и родственных ему соединений обычно вызывает тормозные и даже каталептические последствия, на уровне отдельных нервных структур нередко описываются возбуждающие эффекты опиоидных агонистов. Так, системное введение морфина крысам в минимальной анальгетически активной дозе 1 мг/кг по данным Koks с соавторами (1999) не приводит к изменению локомоторной активности. Однако уже при использовании дозы 2,5 мг/кг наблюдается значимое снижение подвижности. Сходный эффект описан в работе Sudakov с соавторами (1993) при введении морфина в количестве 3 мг/кг. Вместе с тем, Loggi с соавторами (1991) не наблюдали изменений активности животных в приборе «Opto-Varimex» после инъекции 10 мг/кг морфина; депрессия локомоции выявлялась только при использо
вании 33 мг/кг. Каталептические симптомы описываются разными исследователями, начиная с 10—15 мг/кг морфина (Wolgin, 1985; Nomikos et al., 1987), хотя для изучения этого феномена обычно используют введение более высоких доз — 25—50 мг/кг (Llkponmwan et al., 1986; Scotti de Carolis et al., 1991). В случае, например, фентанила аналогичные эффекты вызывает доза 0,5 мг/кг (Vuckovic et al., 1998).
Каталепсия в ее максимальном проявлении определяется как двигательное расстройство, заключающееся в длительном сохранении приданной извне позы (в т.ч. неудобной). Хорошо известна каталепсия, вызываемая нейролептиками (например, галоперидолом). Она характеризуется тем, что, несмотря на снижение двигательной активности и исследовательской деятельности, крысы сохраняют способность реализовать рефлексы, направленные на поддержание позы. Они успешно сопротивляются изменению устойчивого положения тела, удерживаются на опоре, цепляются за неё (Wolgin, 1985; Pellis et al, 1986). На уровне электромиограммы (ЭМГ) этому соответствует одновременная ригидность мышц-антагонистов конечностей (De Ryck, Teitelbaum, 1983). В результате идет усиление статических двигательных компонентов, происходящее за счет торможения на фоне галоперидола собственно локомоторных проявлений.
В случае морфиновой каталепсии сохранения позных рефлексов не наблюдается. На ЭМГ мышц конечностей регистрируется реципрокная ригидность сгибателей и разгибателей, которая представляет собой как бы «застывшие» фазы локомоторных шагательных циклов. Это означает, что, несмотря на хорошо известное взаимодействие с дофаминергической системой и влияние на содержащие соответствующие клетки области головного мозга, связанные с каталепсией эффекты опиоидов в ЦНС более широки; они захватывают многие (связанные не только с дофамином) сети нейронов и двигательные центры.
Интересно также, что в последействии (через 3—4 ч) от введения больших доз морфина у крыс обычно наблюдается гиперактивность (Magnus-Ellen-broek, Havemann-Reinecke, 1993). Она длится еще 1,5—2 ч и рассматривается как эффект «отдачи» после морфинового торможения большого числа синапсов. В этом состоянии у животных отмечается снижение выраженности социальных компонентов поведения (Sieber et al., 1982).
Из пептидных соединений отметим развитие каталепсии у крыс при введении дерморфина (Negri et al., 1995) и р-эндорфина (Rondeau et al., 1982).
Каталептическое действие как морфина, так и других опиоидов эффективно снимается системной инъекцией налоксона (1— 5 мг/кг), а также более специфических ц-агонистов. Фаза поздней гиперактивности мало чувствительна к налоксону, но значимо ослабляется галоперидолом.
Для мышей, второго главного объекта нейрофармакологических исследований, более характерна реакция усиления двигательной активности при введении морфина. Предваряющая ее депрессия локомоции регистрируется не всегда (Kamei, Saitoh, 1996; Kuzmin et al., 2000). При этом на фазе гиперактивности отмечается преимущественное увеличение ГА, но не числа стоек. Вместе с тем, такой специфический компонент двигательной активности, как влезание на решетчатую стенку экспериментальной камеры, при введении морфина подавляется (Marcais-Collado et al., 1983).
Влияние на уровень двигательной активности 0-казоморфина-7 и его аналогов
В наших экспериментах для изучения двигательной активности использовались приборы «Opto-Varimex» («Columbus Instruments», США) и актометр «РОДЭО-2» (Экспериментальные мастерские РАМН). Их конструкция позволяет с помощью встроенных фотодатчиков раздельно регистрировать горизонтальную и вертикальную компоненты двигательной активности, а в случае «РОДЭО-2» — еще и число обследованных отверстий в полу камеры. Размер камер составляет 40x40x25 см и 47x47x27 см, соответственно, число круглых отверстий в полу камеры «РОДЭО-2» равняется 16. Регистрацию осуществляли в тишине и темноте в течение 15—30 мин. Оценку двигательной активности производили в условных единицах приборов (Маклакова с соавт., 1993).
Выявлено, что введение 0 -к-7 в дозе 1 мг/кг не оказывает какого-либо значительного воздействия на поведение экспериментальных животных в приборах «Opto-Varimex» и «РОДЭО-2». При использовании дозы 5 мг/кг ситуация была сходной. Вместе с тем, наблюдались некоторые активационные изменения, выявляемые после суммирования данных за 6~ 15 мин регистрации и лишь при использовании непараметрических критериев. В приборе «Opto-Varimex» в этот интервал времени отмечено повышение вертикальной активности от 17,9±2,2 стоек в контроле до 25,2±5,4 в группе, получавшей пептид; в «РОДЭО-2» — увеличение горизонтальной активности: 132,2±14,1 и 166,8=5=22,9 усл.ед. прибора, соо-
ГА
ВА
Рисунок 4.1. Величина горизонтальной (ГА) и вертикальной (ВА) двигательной активности животных при тестировании в приборе «РОДЭО-2».
По горизонтали — время регистрации (мин); по вертикали — величина ГА и ВА в усл. ед. прибора (AM ± SEM). Бета-казолюрфин-7 (каз-7) вводился в дозе 20 мг/кг, внутрибрюшинно. Величина контрольной и опытной групп — по 23 крысы. Значимое отличие от контроля отмечено * (р<0,05).
тветственно (в обоих случаях р<0,05 по точному критерию Фишера).
При введении Р-к-7 в дозе 20 мг/кг эффекты оказались противоположны по направленности только что описанным. В актометре «РОДЭО-2» было зарегистрировано значимое снижение как горизонтальной (ГА), так и вертикальной (ВА) компонент двигательной активности на 6—10 мин регистрации на 26 и 34%, соответственно (рис. 4.1). Число обследованных отверстий достоверно не изменялось. Сходным образом в приборе «Opto-Varimex» Р-к-7 в дозе 20 мг/кг вызвал уменьшение величин ГА на 49% и ВА на 48% на 6—10 минутах наблюдений (рис. 4.2). Характерно, что на 11—15 мин опыта после привыкания животных к экспери-
ГА
ВА
Рисунок 4.2. Величина горизонтальной (ГА) и вертикальной (ВА) двигательной активности крыс при тестировании в приборе «Opto-Vari-тех».
По горизонтали — время регистрации (мин); по вертикали — величина ГА и ВА вусл. ед. прибора (AM ± SEM). Бета-казоморфин-7 (каз-7) вводился в дозе 20 мг/кг, внутрибрюшинно. Величина контрольной группы — 20, опытной группы — 15 животных. Значимое отличие от контроля отмечено ** (р<0,01).
ментальным условиям и общего снижения двигательной активности, эффект пептида проявлялся очень слабо (особенно в случае прибора «Opto-Varimex»).
В отличие от данных, полученных при исследовании анальгетических эффектов, предварительное введение 1 мг/кг налоксона не только не блокировало, но даже усиливало тормозящее действие 0 -к-7 на двигательную активность. В группе, получившей налоксон и через 15 мин 0 -к-7 (20 мг/кг), суммарные значения ГА и ВА в приборе «Opto-Varimex» составили 45 и 61% от уровня контроля. Снижение было значимо как по сумме
Рисунок 4.3. Величина горизонтальной (ГА) и вертикальной (ВА) двигательной активности крыс при тестировании в приборе «Opto-Varimex».
По вертикали — величина ГАиВАв усл. ед. прибора (приведены суммарные значения за 15 минут регистрации). Обозначения: 1 — контроль; 2 — бета-казоморфин-7 (20мг/кг); 3 — налоксон (1 мг/кг); 4 — совместное введение налоксона и пептида. Величина всех групп — по 15 животных. Значимые отличия от контроля отмечены * (р<0,05) и** (р<0,01).
15 мин регистрации (рис. 4.3), так и в отдельных временных точках. Группа с совместным введением также значимо отличалась и от групп, получивших только налоксон либо гептапептид (р<0,05~0,01; более выражено для горизонтальной активности). Особенно интересно, что двигательная активность снижалась и после совместного введения налоксона и меньшей дозы Р-к-7 (5 мг/кг). При этом уровень ГА и ВА составил 60 и 74% от уровня контроля, соответственно (рис. 4.4). Отличие было значимо в случае горизонтальной активности в течение всего опыта; в случае вертикальной — на 1_ 5 мин регистрации (р<0,05). Зарегистрированы и достоверные отличия от группы с введением только пептида (р<0,02-0,05).
В серии с лишенным N-концевого тирозина аналогом Р-к-6 доза 1 мг/кг практически не оказала влияния на двигательную активность крыс (тестирование в «РОДЭО-2»), После введения 5 мг/кг Р-к-6 был зарегистрирован несколько повышенный уровень ГА и ВА, хотя эффекты не до-
ГА
ВА
Рисунок 4.4. Величина горизонтальной (ГА) и вертикальной (ВА) двигательной активности крыс при тестировании в приборе «Opto-Vari-тех».
По вертикали — величина ГА и ВА вусл. ед. прибора (приведены, суммарные значения за 15 минут регистрации). Обозначения: 1 — контроль; 2 — бета-казоморфин-7 (5 мг/кг); 3 — налоксон (1 мг/кг); 4 — совместное введение налоксона и пептида. Величина всех групп — по 15 животных. Значимое отличие от контроля отмечено * (р<0,05).
стигали уровня значимости. Вместе с тем, число обследованных отверстий (ЧОО) у крыс, получивших пептид, на 11 — 15 мин опыта достоверно превышало соответствующие контрольные значения (на 78%). Введение Р -к-6 в дозе 20 мг/кг привело к снижению В А на 6~ 10 мин регистрации (на 40% по сравнению с контролем). Наиболее яркое воздействие эта доза оказала на ЧОО; в опытной группе соответствующие величины оставались достоверно ниже контроля в течение всего периода наблюдений.
Применение тетрапептида Р -к-4 перед тестированием с помощью ак-тометра «РОДЭО-2» привело к разнонаправленным изменениям двигательной и исследовательской активности. Так, после введения пептида в дозе 1 мг/кг значения ГА на 11 — 15 мин наблюдений составляли 53% от контроля. В этом же временном интервале в опытной группе было отмечено достоверное уменьшение ЧОО. Инъекция пептида в дозе 5 мг/кг привела к достоверному падению ВА на 1-5 мин регистрации, однако на 11—15 мин выявлено значимое увеличение числа обследованных отверстий. Влияние максимальной (20 мг/кг) дозы на двигательную активность
было наиболее определенным и проявлялось на 6—10и11—15 мин наблюдений. Значения ГА при этом составили 80 и 60%, а ВА — 55 и 36% от контрольных величин. ЧОО, как и в случае р -к-6, было значимо ниже, чем в контроле, в течение всего периода регистрации.
Таким образом, можно констатировать, что в условиях свободного поведения инъекция р-к-7 в дозах 1 и 5 мг/кг не влияет на двигательную (локомоторную) активность животных либо слабо активирует её. Лишь в дозе 20 мг/кг гептапептид вызывает заметное снижение как горизонтальной, так и вертикальной компонент двигательной активности. Однако это снижение не может рассматриваться как значительное нарушение деятельности моторных систем. В специальной серии экспериментов показано, что введение Р-к-7 в дозе 20 мг/кг не приводит к достоверным изменениям времени удержания на вертикальной сетке и вращающемся стержне. В первом случае латентный период падения составил 87,0± 12,3 с и 7б,6± 10,8 с в контроле и опыте, соответственно; во втором — 26,9+6,9 с и 25,0±4,5 с (размер экспериментальных групп — по 16 животных).
Как и в случае морфина, ингибирующее действие на локомоцию оказало количество Р -казоморфина-7, близкое к минимально анальгетически активному. В сравнении с ним каталепсию вызывали примерно 5-кратные дозы морфина. Это значит, что для обнаружения аналогичных эффектов р -к-7 нам, видимо, следовало ввести пептид в дозе порядка 100 мг/кг. Пока существует единственная работа, в которой гептапептид вводился в таких больших количествах: Taira с соавторами (1990) показали тормозящее влияние р -к-7 на REM-сон новорожденных крысят.
Отметим также, что ситуация, когда дозы опиоида, вызывающие значительное снижение двигательной активности, выше анальгетически эффективных — не единственный возможный вариант. В случае дерморфинов показана обратная зависимость, и приводящее к падению ГА и числа стоек количество пептида оказалось на порядок ниже, чем необходимо для уменьшения болевой чувствительности (Уранова, 2000).
В дозе 20 мг/кг снижение локомоции, близкое к выявленному для р -к-7, вызывали и его дез-Тут-аналоги. Их влияние оказалось даже шире, нежели у гептапептида, и помимо угнетения двигательной (преимущественно верти-кальной) активности, р -к-6 и р -к-4 вызывали снижение видоспецифического исследовательского поведения (обследование отверстий-норок). В сравнении с прототипом, дез-Тут-аналоги в относительно низких дозах (1 и 5 мг/кг) воздействовали на поведение крыс
более выражено. При этом р -к-6 оказывал в основном активирующее влияние, а эффекты р-к-4 имели разную направленность. Все эти изменения зарегистрированы на 1—5 либо 11—15 мин тестирования. По нашему мнению, они являются следствием воздействия пептидов не столько на локомоцию, сколько на мотивационные составляющие поведения (исследовательские проявления, тревожность и т.п.; подробнее этот вопрос будет рассмотрен ниже).
Можно лишь догадываться, какой центральный механизм обеспечивает изменение поведения экспериментальных животных под действием дез-Туг-Р -казоморфинов. Судя по классическим представлениям, маловероятно, что при этом активируется какой-либо из подтипов опиоидных рецепторов. Участие же других мест связывания остается пока гипотетическим (сошлемся, например, на данные по прямому действию лишенного тирозина аналога динорфина А на NMDA-рецепторы: Tang et al., 1999). Тем не менее, эффекты дез-Туг-Р-казоморфинов обнаружены нами не только при оценке двигательной активности, но и в других поведенческих тестах, а также после хронического введения детенышам крыс. Описаны они и в литературе (например, в случае ВСН 325: Becker et al., 1991ab и др.). Можно вспомнить также данные работ по введению аналогов Р -к-5 в различные отделы базальных ганглиев на фоне фармакологических воздействий. В этих исследованиях показано, что содержащие N-концевой тирозин и лишенные его пептиды в одних условиях действуют разнонаправленно (Rauca, Matthies, 1986ab), в других — сходным образом (Ruthrich et al., 1992а; Ruthrich et al., 1993a).
He исключено, что предполагаемые места связывания, чувствительные к дез-Туг-аналогам р -к-7, взаимодействуют и с самим прототипом. Подобный вариант трактовки данных позволяет объяснить то, что мы не обнаружили блокирующего влияния налоксона на снижающие двигательную активность эффекты р -к-7. Действительно, в этом случае налоксон, конкурируя с пептидом за соединение с опиоидными рецепторами, мог вытеснить его на другие места связывания. В результате эффекты р -к-7, введенного в дозе 20 мг/кг, не только не ослабевали, но и (в отличие от серий с измерением ноцицепции) становились ярче выражены. Более того, ранее не эффективная доза 5 мг/кг на фоне налоксона также приобрела способность значимо снижать двигательную активность.
Впрочем, возможно и другое (не исключающее только что приведенное) объяснение. Дело в том, что налоксон лишь в довольно условной мере
можно считать неспецифическим антагонистом опиоидных рецепторов. Строго говоря, он в весьма заметной степени специфичен по отношению кц-сайтам: значения Ki для ц-, 5-, к-мест связывания составляют 0,93,17 и 2,3 нМ, соответственно (Raynor et al., 1994). Следовательно, мы могли наблюдать эффект вытеснения р -к-7 лишь с ц -рецепторов. Этого оказалось достаточно для снятия анальгетического действия пептида (а также, как показано в соответствующих главах, его влияния на обучение и тревожность), но привело в потенциации уменьшающих двигательную активность эффектов. Если следовать этой логике, то основное влияние р -казоморфина-7 на локомоцию реализуется через 5 -рецепторы, к которым пептид имеет достаточно высокое сродство.
И все же более предпочтительным представляется первый вариант объяснения полученных результатов — отличные от классических опиоидных механизмы влияния р-к-7 на двигательную активность. В его пользу свидетельствуют, в числе прочего, данные экспериментов на детенышах. Они получены при попытке выявить момент появления уменьшающего ГА и количество стоек действия р -к-7 в онтогенезе. Показано, что даже в возрасте 45 дней у животных при введении пептида в дозе 20 мг/кг регистрируется только тенденция к ослаблению локомоции. Следовательно, соответствующие центральные механизмы еще не сформированы и, значит, не основаны на известных подтипах опиоидных рецепторов (содержание последних в мозге детенышей к 4~5 неделям жизни достигает уровня взрослых особей).
Для других опиоидных агонистов и антагонистов влияние на локомоторные поведенческие проявления детенышей описано достаточно хорошо. Показано, например, что морфин и DAGO (10 мг/кг, внутрибрюшинно) снижают двигательную активность и вызывают симптомы каталепсии у крысят в возрасте 5,10 и 20 дней (Jackson, Kitchen, 1989). При этом к-агонист U-5O488 в той же дозе провоцирует гиперактивность. Об аналогичном (а также повышающем тревожность) действии U-50488 в дозе 7,5 мг/кг сообщает Nazarian с соавторами (1999). По данным Alieva с соавторами (1987) у 14-дневных мышей морфин в наименьшей из использованных доз (1 мг/кг) приводит к депрессии двигательной активности, а у 28-дневных — в максимальной дозе (10 мг/кг) вызывает гиперлокомоцию.
На какие же области ЦНС мог действовать Р -к-7, вызывая снижение двигательной активности? Круг этих структур очень широк и включает в себя подавляющее большинство двигательных центров, а также зоны, вы
полняющие более интегративные функции — например, вентральный тегментум (VTA) и вентральный стриатум (прилежащее ядро прозрачной перегородки — n. accumbens); существование в них опиоидергиче-ских проекций и опиоидных рецепторов является хорошо известным фактом
Если вернуться к системе управления локомоцией, то можно обнаружить, в первую очередь, данные по влиянию опиоидов на активность нейронов мозжечка. Показано (Suzuki, Taguchi, 1983), что морфин при системном введении (2 мг/кг) вызывает депрессию спонтанной и вызванной активности клеток Пуркинье кошки. Сходное (хотя и более слабое в сравнении с нембуталом) действие фентанила описали Аршавский с соавторами (1979). Депрессия активности клеток Пуркинье, как известно, означает высвобождение из-под их тормозного ГАМК-ергического контроля ядер мозжечка. На поведенческом уровне это может проявиться в виде ригидности, усиления отдельных сгибаний и/или разгибаний и др.
Для красного ядра показан рост утилизации глюкозы после введения р -эндорфина и синтетических пептидных р -агонистов (Ableitner, Schulz, 1992; Fabian, Ableitner, 1995). В случае вестибулярных ядер также чаще регистрируется возбуждение нервных клеток (Яснецов, Правдивцев, 1986; Lin, Carpenter, 1994). При введении в педункулопонтинные ядра (компонент мезенцефальной локомоторной области) р -агонист DAGO вызывал налоксон- и галоперидол-зависимую активацию локомоции (Kli-tenick, Kalivas, 1994). Билатеральное разрушение этих ядер устраняло снижающее двигательную активность действие морфина (Olmstead, Franklin, 1994).
В коре больших полушарий (прежде всего, фронтальной) опиоиды вызывают частичное ингибирование активности аденилатциклазы (Duman et al., 1988), уменьшение выделения дофамина и ацетилхолина (Heijna et al., 1990), торможение таламо-кортикальных входов (Abdulla, Aneja, 1993) и, наконец, ослабление активности собственно нервных клеток (Ja-niri et al., 1988; Giacchino, Henriksen, 1996). Как и в случае мозжечка, подобное торможение может означать высвобождение из-под контроля коры различных подкорковых структур, развитие ригидности, стереотипий и т.п.
Наибольшее число работ по выяснению механизмов влияния опиоидов на двигательную активность выполнено на базальных ганглиях и непосредственно связанных с ними структурах (VTA, черная субстанция).
Приведем несколько примеров. Vezina с соавторами (1987) показали, что морфин и DAGO при инъекциях в VTA и n. accumbens вызывают возрастание локомоторной активности; в покрышке эффекты оказались дофа-мин-зависимыми, в прилежащем ядре — нет. По данным Matsumoto с соавторами (1988) введение ц- (DAGO), 8- (DPDPE) и к- (U-50488) агонистов в S. nigra вызывает контролатеральные ротации, которые подавляются налоксоном. Calenco-Choukroun с соавторами (1991) обнаружили, что при введении в VTA ц -агонист DAGO налоксон-зави-симо активирует локомоцию в установке «Opto-Varimex», но снижает её в более стрессогенных условиях. Вместе с тем, разрушение VTA не снимает каталепсию, вызванную однократной инъекцией морфина (Hand, Franklin, 1985).
Hoffman с соавторами (1991) показано, что одностороннее введение в вентральный паллидум DAGO провоцирует контралатеральные ротации, двустороннее — рост локомоции; DPDPE вызывает более слабые изменения; U-50488 почти не эффективен. Аналогичное DAGO действие оказал и морфин в количестве 5—10 мкг (Anagnostakis et al., 1992). Ингибирование в n. accumbens ферментов, разрушающих энкефалины, приводит к росту двигательной активности (ГА и количества стоек) (Churchill et al., 1995). Те же авторы показали, что введение в вентральный паллидум ц-агониста DAMGO вызывает усиление моторики, но только на фоне функционирующих таламических проекций (в отличие от эффектов агониста глутамата АМРА). Введение прокаина в стволовую (мезенцефальную) локомоторную область устраняло эффекты как DAMGO, так и АМРА (Churchill, Kalivas, 1999).
Таким образом, локальные инъекции агонистов опиоидных рецепторов в базальные ганглии, VTA и черную субстанцию обычно вызывают рост двигательной активности экспериментальных животных. Напротив, блокаторы ц -, 8 - и к-рецепторов приводят к ее снижению (Leventhal et al., 1996). При системном введении опиоидных агонистов данные эффекты, видимо, достаточно сложным образом интерферируют с параллельно развивающимся тормозящим действием на мозжечок, кору больших полушарий и др. В результате наблюдается формирование описанной выше конкурентной ригидности мышц сгибателей и разгибателей конечностей, более или менее выраженное «зависание» двигательных систем на отдельных фазах локомоторного цикла.
Способность вызывать налоксон-зависимые контролатеральные ротации при введении в черную субстанцию и стриатум показана и для р -ка-
зоморфинов (Rauca, Matthies, 1986а; Herrera-Marschitz et al., 1989). Вместе с тем, при внутрижелудочковом введении, более «системном», чем локальные инъекции в определенные структуры, синтетические аналоги р-к-5 привели к снижению исследовательской активности крыс (Ruthrich et al., 1993а). Данный факт хорошо соотносится с наблюдавшимися нами последствиями внутрибрюшинного введения Р -казоморфина-7.
Влияние р-каэоморфина-7 на изменения двигательной активности, вызванные воздействием на дофаминергическую систему мозга
В начальный период исследования центральной активности опиоидов анализировались механизмы, связанные, прежде всего, с ацетилхолином (Kaakkola, Ahtee, 1977), норадреналином (Roberts et al., 1978), серотонином (Malec, Langwinski, 1980). Однако в дальнейшем доминирующим направлением стало изучение взаимодействия опиоидов и дофаминергической системы (в частности, модуляции влияния VTA и S. nigra compacta на кору и базальные ганглии). При этом в более «простых» по постановке задачи исследованиях изучается изменение эффектов опиоидных и дофаминовых агонистов/антагонистов при совместном введении. Как пример более сложно спланированной работы приведем исследование Churchill с соавторами (1998). В нем проанализировано функционирование ГАМК-ергических проекций n. accumbens к вентральному паллидуму и VTA. Показано, что включение этих проекций (введением ГАМКа и ГАМКб агонистов в бледный шар и покрышку, соответственно) подавляет активирующее действие DAMGO на моторную активность (ц-агонист вводился в прилежащее ядро). Обнаружено также, что поведенческий ответ на DAMGO возрастает в случае истощения в n. accumbens запасов дофамина. Последний факт является иллюстрацией определенного антагонизма, существующего между дофамином и опиоидами в базальных ганглиях; точнее — тормозного регулирующего влияния опиоидов на триаду, обеспечивающую основные функции стриатума и паллидума: ГАМК, глутаминовую кислоту и дофамин (Беспалов, Звартау, 2000).
Во многих случаях показано, что фармакологически вызванная активация дофаминергической системы ослабляется опиоидами. Особенно это характерно для ц-агонистов, способных ослаблять стимулирующие эффекты амфетаминов, апоморфина, кокаина (например, Jackson et al., 1993; Ukai et al., 1993). Показаны подобные свойства и для Р-казоморфинов (Ruthrich et al., 1992а; Ruthrich et al., 1993a). Вместе с тем, для ли-
Рисунок 4.5. Изменения горизонтальной (ГА) и вертикальной (ВА) составляющих двигательной активности белых крыс в тесте «Opto-Vari-тех» при введении воды (1), фенамина (2; доза 1 мг/кг), бета-казоморфина-7 (3; доза 5 мг/кг), а также сочетания фенамина и пептида (4).
Армтелъность регистрации 30 минут. Отличия от. контрольной группы с р<0,05 отмечены *; с р<0,01 — **, от группы с введением только фенамина — & (р<0,05). В группах по 16 животных.
шейного N-концевого тирозина ВСН 325 при системном введении продемонстрирована способность усиливать вызванную апоморфином гиперлокомоцию (Rauca, Schroder, 1995), причем доказана пресинаптическая природа этого эффекта.
Взаимоотношения 0 -к-7 и дофаминергической системы анализировались и в нашем исследовании (Маклакова с соавт., 1999). Для этого введение пептида осуществлялось на фоне предварительной инъекции амфетамина либо галоперидола. Показано, что р-к-7 (5 мг/кг) устраняет активирующее действие амфетамина на горизонтальную и вертикальную составляющие двигательной активности. При этом зарегистрированы достоверные отличия группы с совместным введением амфетамина и Р -к-7 от животных, получавших только стимулятор (рис. 4.5). Этот результат находится в полном соответствии с приведенными выше данными литературы и показывает, что Р -к-7 в дозе, не влияющей на локомоцию, все же
Рисунок 4.6. Изменения горизонтальной (ГА) и вертикальной (ВА) составляющих двигательной активности белых крыс в тесте «Opto-Varimex» при введении воды (1), галоперидола (2; доза 0,1 мг/кг), бста-казоморфина-7 (3; доза 5мг/кг), а также сочетания галоперидола и пептида (4).
Алительность регистрации 15 минут. Отличия от контрольного группы ср<0,05 отмечены *; ср<0,01 — **. Отличия от группы с введение только пептида — # (р<0,05). В группах по 16животных.
способен регулировать состояние дофаминергической системы, по сути защищая ее от перевозбуждения и истощения.
Снижающие двигательную активность эффекты галоперидола 0 -к-7 не изменял (рис. 4.6). Следовательно, ингибирование той составляющей дофаминергической системы, которая связана с локомоцией, введение пептида не компенсировало. Вместе с тем, ухудшающее действие нейролептика на обучение 0-к-7 устранял достаточно эффективно (см. ниже). Не исключено, впрочем, что при другом соотношении доз взаимный антагонизм локомоторных эффектов 0 -казоморфина-7 и галоперидола может быть обнаружен (как показано в работах на других опиоидах: например, Scotti de Carolis et al., 1991; Brent, 1993).
Реализуют ли исследованные нами пептиды действие на дофаминергическую систему через опиоидные рецепторы либо какие-то другие
места связывания, остается пока неизвестным. Но принципиально важно то, что влияние (ингибирующее по направленности) на спонтанное поведение Р-к-7 осуществляет в весьма высоких дозах, сопоставимых с анальгетически активными. Описание этих эффектов, конечно, дополняет общую характеристику Р-казоморфинов как нейротропно активных соединений. Однако, как и в случае антиноцицепции, вводя пептиды в столь большой концентрации, мы остаемся в диапазоне доз, с трудом сопоставимых с реально присутствующими в организме новорожденных количествами экзогенных опиоидов.
Отметим еще одно сходство с анальгетическими эффектами: влияние Р -казоморфина-7 на двигательную активность почти не проявилось при интраназальном способе применения (см. также главу 6). Соответственно, если следовать представлениям о более локальном проникновении препаратов в мозг при введении через носовую полость, можно предположить, что действие Р -к-7 на локомоцию опосредуют в большей мере средне- и заднемозговые структуры (но не передний мозг).
Глава 5. Эффекты бета-казоморфинов в стрессогенных условиях
Нейроанатомическая основа реакций на стрессогенные стимулы
Как известно, в стрессогенной ситуации на организм действуют повреждающие факторы либо стимулы, сигнализирующие о вероятном появлении таких факторов. За соответствующий анализ сенсорной информации отвечают весьма многочисленные отделы ЦНС: подкорковые оборонительные центры; области, оценивающие уровень новизны поступающих сигналов; структуры, учитывающие индивидуальный опыт особи. На выходе данной системы может происходить запуск эндокринных, вегетативных и поведенческих реакций. Последние способны развиваться по типу пассивно-оборонительных (затаивание, бегство), активно-оборонительных (агрессия), а также замещающих (например, груминг) проявлений. Для описания подобных поведенческих комплексов часто используются такие термины, как «тревожность», «страх», «ярость», «эмоциональность».
В наиболее простом варианте стрессогенное воздействие представляет собой болевой стимул либо сильный и неожиданный зрительный, слуховой, обонятельный и т.п. сигнал. При этом развитие ответных реакций обеспечивается безусловнорефлекторными нейронными дугами, проходящим во многих случаях через пассивно- и активно-оборонительные центры заднего гипоталамуса и среднего мозга
Более сложным для наблюдений является случай, когда у особи развивается конкуренция между защитной и какой-либо другой мотивацией. В качестве последней может выступать заинтересованность в получении пищи и питья (при использовании «конфликтных методик», когда некая двигательная реакция подкрепляется одновременно с умеренной элек-троболевой стимуляцией) либо новой информации («неконфликтные методики» — различные варианты «открытого поля», приподнятый крестообразный лабиринт) и др. Соответственно, для развития стрессогенной поведенческой реакции необходимо хотя бы временное преобладание оборонительной мотивации. Это, в свою очередь, определяется как
уровнем активации центров основных биологических потребностей, так и функционированием особого «блока сравнения», который обеспечивает собственно механизм формирования доминанты. В качестве ключевого элемента этого блока наиболее часто рассматривается миндалина (Симонов, 1997).
Наиболее трудная для анализа ситуация возникает тогда, когда ЦНС при обработке поступающих сигналов и принятии решения о дальнейшем поведении учитывает информацию, накопленную в ходе индивидуального онтогенеза. Иными словами, происходит подключение условнорефлекторных нейронных дуг, активируемых (не обязательно до уровня запуска явной поведенческой реакции) исходно незначимыми стимулами из внешней среды. Как известно, оборонительные рефлексы, основанные на избегании различных повреждающих и вызывающих боль стимулов, вырабатываются быстрее и сохраняются дольше, чем условные реакции, сформированные на базе положительного подкрепления. Это приводит, в числе прочего, к нарастанию тревожности по мере взросления (Frussa-Filho et al., 1992). Нейрофизиологический субстрат данных процессов — нервные клетки коры больших полушарий, в т.ч. старой (гиппокамп), префронтальной и фронтальной.
Список областей мозга, участвующих в обеспечении реакции на стрессогенные стимулы, можно продолжить. Помимо уже перечисленных центров, пассивно-оборонительные и агрессивные реакции оказываются связаны с септумом, прилежащим ядром, ЦСВ, VTA, голубым пятном (например, Charney, Deutch, 1996; Balaban, Thayer, 2001). Следовательно, круг задействованных структур оказывается довольно широк. Их характерной особенностью является наличие большого числа обратных связей, позволяющих проводить коррекцию реализуемого поведения.
Нейромедиаторы и регуляция уровня тревожности
На нейрохимическом уровне системы, обеспечивающие реакцию на стрессогенные воздействия, не менее разнообразны. Наибольшее число работ характеризуют значимость норадренергической составляющей. При этом имеются ввиду многочисленные проекции голубого пятна в новую кору, миндалину, таламус, гипоталамус (Bremner et al., 1996; Tanaka et al., 2000). В условиях стресса регистрируется усиление импульсной активности нейронов голубого пятна и увеличение оборота норадреналина в структурах, получающих соответствующую иннервацию.
Одновременно на поведенческом уровне наблюдаются реакции страха и тревожности. Хронический стресс приводит к длительным нарушениям активности нейронов locus coeruleus и норадренергической системы в целом. Препараты, повышающие выделение норадреналина в ЦНС, часто обладают анксиогенными свойствами (Tanaka et al., 2000).
В последнее время особое внимание привлекает изучение взаимодействия норадреналина и кортиколиберина (CRF). Последний, помимо участия в обеспечении эндокринной реакции на стресс, действует на специфические рецепторы в ЦНС, повышая двигательную активность и тревожность (Holsboer, 1999; Boyer, 2000). Норадренергические проекции из голубого пятна стимулируют выделение CRF в гипоталамусе и миндалине; кортиколиберин, в свою очередь, способен активировать нейроны locus coeruleus.
Для развития стрессогенных реакций очень велико значение ГАМК. Агонисты данного медиатора являются классическими анксиолитическими препаратами (например, Nestoros, 1984). Показано, что диазепам ослабляет стресс-индуцированное выделение норадреналина в гипоталамусе, миндалине и голубом пятне (Tanaka et al., 2000). Агонисты бензодиазепиновых мест связывания на ГАМКл рецепторах (эндозепины, 0 -карболины и др.) обладают выраженными анксиогенными свойствами (Ашмарин с соавт., 1996). Под их влиянием отмечается рост активности миндалины, усиление ее воздействия на ядра гипоталамуса и ЦСВ (Ada-mec, 1994).
Восходящие проекции ядер шва также играют значительную роль в обеспечении поведенческих защитных реакций. По клиническим данным при значительном (например, приводящем к суициду) повышении тревожности и депрессивности регистрируется снижение оборота серотонина в ЦНС. Препараты, блокирующие обратный захват данного медиатора, обладают анксиолитическими свойствами, сравнимыми с показанными для традиционных транквилизаторов (Fawcett et al., 1997; Kent et al., 1998). Вместе с тем, на экспериментальных животных показано, что направленность действия серотонинергической системы на уровень тревожности может быть разной и зависит от места приложения стимуляции (дорзальные или медиальные ядра шва), области окончания проекций (гипоталамус, гиппокамп, миндалина, фронтальная кора), типа используемого теста (Graeff et al., 1996; Cheeta et al., 2000). Так, в случае провоцирующей тревожность ситуации социального взаимодействия введение в дорзальный гиппокалш 5HTia агонистов вызывало анксиогенный эффект.
В случае ацетилхолиновой синаптической передачи также отмечаются как анксиолитические, так и анксиогенные изменения (File et al., 2000; Wall et al., 2001). Антагонисты глутаминовой кислоты (в том числе NMDA-рецепторов) часто вызывают снижение тревожности, по-видимому, за счет ослабления влияния миндалины на различные области ЦНС (Беспалов, Звартау, 2000). Для пептидных регуляторов способность уменьшать поведенческие проявления стресса показана, например, в экспериментах с вазопрессином и Na-уретическим гормоном (Engelmann et al., 2000; Wiedemann et al., 2000). Противоположные по направленности изменения вызывают холецистокинин-4 и его агонисты (Koks et al., 1998; Koks et al., 1999).
Опиоиды, благодаря своей способности управлять пресинаптическим высвобождением медиаторов, могут взаимодействовать со всеми перечисленными нейрохимическими механизмами. Показано ингибирование под влиянием морфина, мет-эн кефали на и 0 -эндорфина стресс-индуцированного выброса норадреналина в гипоталамусе, миндалине и голубом пятне (Tanaka et al., 2000). Морфин способен ослаблять эффекты агонистов холецистокинина-4 (Koks et al., 1999). Налоксон, напротив, усиливает их действие (Koks et al., 1998). Для налоксона показано ослабление анксиолитического влияния агонистов ГАМК (Agmo, Belzung, 1998). Вместе с тем, большие дозы налоксона (10 мг/кг, внутрибрюшинно) приводят к усилению эффектов барбитуратов и бензодиазепинов (Belzung et al., 2000).
Системное введение морфина в дозах, не влияющих на болевую чувствительность (0,1 и 0,3 мг/кг) приводило к росту исследовательской активности и понижению тревожности животных в крестообразном приподнятом лабиринте (Anseloni et al., 1999). По данным Koks с соавторами (1999) анксиолитическое налоксонзависимое действие в приподнятом лабиринте оказала доза 1 мг/кг; морфин в количестве 2,5 мг/кг подавлял двигательную активность, воздействуя уже на локомоторную сферу. О снижающем тревожность эффекте сообщается и в более ранней работе Motta и Brandao (1993), использовавших дозы морфина 0,1 и 1 мг/кг. Для пептидных ц-агонистов эндоморфинов анксиолитическое действие обнаружено при внутрижелудочковой инъекции (Asakawa et al., 1998).
Внутрибрюшинно вводимый в дозах до 1 мг/кг к-агонист U-50488 активирует поведение крыс в крестообразном приподнятом лабиринте (Pri-vette, Terrian, 1995). Действие 5-агонистов на оборонительные реакции
взрослых животных, как правило, не регистрируется (Calenco-Choukroun et al., 1991; Ukai et al., 1997). Однако у мышей с нокаутом гена соответствующего рецептора изменение (повышение) уровня тревожности все же обнаружено (Filliol et al., 2000).
Зависимость эффектов 0-казоморфинов от выраженности стрессогенных воздействий
В наших экспериментах для создания стрессогенной ситуации использовались стандартные методы «открытое поле» и «крестообразный приподнятый лабиринт» (КПЛ). «Открытое поле» представляет собой круглую арену диаметром 80 см с полом, расчерченным восемью диаметрами и двумя концентрическими окружностями, находящимися на равном расстоянии друг от друга. Арена окружена стенкой высотой 40 см. При тестировании животное помещали в центр арены и поминутно визуально регистрировали следующие показатели: горизонтальную двигательную активность (по числу пройденных сегментов); вертикальную двигательную активность; число умываний (груминг); переходы I и II (отходы от стенки арены и выходы в центр — по числу радиальных перемещений с пересечением внешней и внутренней окружностей, соответственно). Над ареной на высоте 80 см находились лампа накаливания мощностью 200 Вт, электрический звонок и красная лампа (15 Вт). Исследования проводили в трех различающихся по уровню сенсорной нагрузки модификациях: «минимально стрессогенной» — 2 мин в тишине при свете только красной лампы, «максимально стрессогенной» — 2 мин при включенных мощной лампе и звонке, а также со сменой освещенности. В последнем случае за основу был взят метод, предложенный Родиной с соавторами (1993) и предполагающий оценку поведения в течение 5 мин. При этом первые 3 мин был включен яркий свет; затем вместо яркой лампы на 1 мин с включали красную, после чего восстанавливали исходный уровень освещенности.
Метод КПЛ отличается от «открытого поля» тем, что у животного есть выбор между более и менее стрессогенными участками лабиринта. Длина каждого из четырех рукавов КПЛ составляет 35 см, ширина 10 см, высота стенок 20 см. Два противоположных рукава затемнены и закрыты с боков и торцов стенками; два других — освещены и открыты (не имеют стенок). Лабиринт устанавливали на высоте 50 см от пола. Крысу помещали в центр лабиринта, после чего в течение 3 мин регистрировали: ла
тентный период захода в закрытый отсек; общее время нахождения на свету; количество стоек, выполненных в темных и светлых отсеках; гру-минг; количество выглядываний из темных отсеков камеры; количество переходов из темных отсеков в темные и из светлых в светлые; количество свешиваний со светлых рукавов лабиринта; количество выходов на светлые рукава и на концы светлых рукавов.
Выявлено, что в минимально стрессогенных условиях (2 мин в поле при красном свете) влияние 0 -казоморфина-7 на поведение крыс практически не регистрируется. Несмотря на значительный объем экспериментальных групп (25—30 животных) достоверные изменения поведения после инъекции гептапептида в дозах 0,1, 1, 5 и 10 мг/кг отсутствовали (Маклакова с соавт., 1993; Дубынин с соавт., 20046).
В максимально стрессогенных условиях (2 мин в поле при ярком свете и звонке) влияние пептида на поведение было более выражено. В отдельных экспериментах на фоне инъекции 0 -к-7 регистрировалось значимое увеличение пробега, числа стоек и отходов от стенки арены (в случае, если контрольные животные демонстрировали реакцию затаивания). Однако при суммировании всех данных подобные отличия от контроля не достигли уровня достоверности. Тем не менее, действие пептида на поведение все же удалось обнаружить при анализе форм распределения регистрируемых показателей (в первую очередь, пробега). Показано, что введение 0 -к-7 приводит к снижению разброса величины индивидуальной горизонтальной активности крыс. В случае дозы 1 мг/кг стандартное отклонение (SD) оказывается уменьшено на 30%; в случае дозы 5 мг/кг — на 23% (р<0,01 ~0,02 по параметрическому критерию Фишера). Применение наибольшей и наименьшей из использованных доз пептида подобных эффектов не вызывает.
Полученные результаты иллюстрируют рис. 5.1 и 5.2. На первом из них показана зависимость нормированных по контролю средних и стандартных отклонений от дозы вводимого пептида. На рисунке 5.2 в качестве примера приведены формы распределений величин пробега в двух экспериментальных группах — контрольной и получавшей 1 мг/кг 0-к-7. Видно, что снижение разброса данных происходит за счет симметричного «сжатия» распределения и повышения его моды. Реально это означает, что в опытной группе выявляется меньше крыс, демонстрирующих минимальную (реакции затаивания) и максимальную (реакции панического бега) двигательную активность при помещении в стрессогенные условия. Оба эти поведенческих паттерна являются яркими проявлениями пас-
—<э—am
—SD
доза бета-казоморфина-7, мг/кг
Рисунок 5.1. Зависимость зарегистрированной у опытных животных средней величины пробега (AM) и ее разброса (SD — стандартное отклонение) от дозы внутрибрюшинно введенного бета-казоморфина-7. Тестирование проводилось в «открытом поле» при ярком свете и звонке. По горизонтали — доза пептида (мг/кг). Нулевая точка соответствует уровню контроля. По вертикали — процент от соответствующих контрольных значений. /Достоверные отличия от контроля отмечены * (р<0,05) и** (р<0,01).
сивно-оборонительной мотивации. Следовательно, снижение их встречаемости свидетельствует об уменьшении вклада последней в управление поведением животных и определенном антистрессорном (анксиолитическом) действии 0-К-7. Пользуясь несколько иной терминологией, можно говорить о снижении уровня тревожности (тревожно-фобических поведенческих проявлений).
Протестированный в тех же условиях лишенный тирозина аналог Р -к-4 (Phe-Pro-Gly-Pro) не вызвал никаких поведенческих изменений (величины контрольной и опытной групп составили 31 и 27 животных, пептид вводился внутрибрюшинно в дозе 5 мг/кг).
Третьей использованной нами модификацией открытого поля стала методика, предложенная Родиной с соавторами (1993); как уже было сказано, животные сначала 3 мин находились в условиях ярко освещенного
Рисунок 5.2. Распределение величины пробега животных контрольной (вверху) и опытной (внизу; введение бета-казоморфина-7 в дозе 1 мг/кг) групп при тестировании в «открытом поле» (яркий свет и звонок).
По горизонтали — величина пробега (вусл.ед.); по вертикали — процент крыс, продемонстрировавших соответствующий пробег. Ъолее подробное описание см. в тексте.
поля, а затем на 1 мин включался красный свет. Падение освещенности, как правило, заметно смещает соотношение между оборонительной и исследовательской мотивациями в сторону последней. В результате регистрируется значительный рост пробега, числа стоек и др. Показано, что введение Р-казоморфина-7 в дозе 5 мг/кг вызывает усиление данного
время, мин
Рисунок 5.3. Влияние введения бета-казоморфина-7 (5мг/кг) на горизонтальную двигательную активность (вверху) и число выходов в центр открытого поля (внизу).
По горизонтали — время регистрации (минуты). Тестирование проводилось со сменой освещенности на 4-й минуте. По вертикали — величина параметров. Достоверные отличия от контроля отмечены * (р<0,05). Количество животных в контрольной и опытной группах — 16 и 15, соответственно.
«всплеска» поведенческой активности. При этом пробег и число выходов в центр арены у животных опытной группы оказываются значимо выше, чем в контроле (на 24 и 126%, соответственно; рис. 5.3).
В приподнятом крестообразном лабиринте время пребывания на свету в течение трех мин опыта и демонстрируемые поведенческие паттерны также позволяют оценить уровень тревожности крыс. Показано, что вве-
Рисунок 5.4. Величина различных параметров двигательной активности крыс при тестировании в крестообразном приподнятом лабиринте.
По вертикали — величина параметров. Обозначения: 1 — контроль; 2 — бета-казоморфин-7 (5мг/кг); 3 — налоксон (1 мг/кг); 4 — совместное введение налоксона и пептида. Величина групп — по 19— 23 животных.
Значимые отличия от конроля отмечены * (р<0,05).
дение Р -казоморфина-7 в дозе 5 мг/кг приводит в значительному снижению различных проявлений оборонительной мотивации. Величины практически всех соответствующих показателей (латентный период первого захода в темный отсек, время на свету, количество выходов на светлые рукава) в опытной группе оказались достоверно выше, чем в контрольной. Была увеличена также исследовательская активность — при нахождении
как в темных отсеках (количество стоек), так и на светлых рукавах лабиринта. Особенно характерен рост проявлений т.н. поведения риска — количества выходов в концы светлых рукавов и свешиваний с них (р<0,05-0,001). В отдельном эксперименте было продемонстрировано, что анксиолитическое действие 0 -к-7 снимается предварительным (за 15 мин) введением налоксона в дозе 1 мг/кг (рис. 5.4).
В целом можно утверждать, что зарегистрированное нами влияние системно вводимого 0 -казоморфина-7 на взрослых крыс носит анксиолитическую направленность, типичную для преимущественных ц-агонистов. Действительно, использование различных модификаций теста «открытое поле», а также крестообразного приподнятого лабиринта показало, что пептид смещает соотношение пассивно-оборонительных и исследовательских компонентов поведения в сторону большей выраженности последних. При этом активны дозы 1 и 5 мг/кг, не вызывающие анальгезии и снижения двигательной активности (обратим внимание на аналогичное соотношение доз в случае морфина).
Важно также, что в минимально стрессогенных условиях (помещение в «открытое поле» при красном свете) действие пептида не проявлялось. Вместе с тем, на фоне яркого света и последующей смены освещенности у опытных животных зарегистрировано возрастание пробега и числа выходов в центр арены. В максимально стрессогенных условиях (яркий свет и звонок) влияние 0 -к-7 на средний по группе уровень горизонтальной активности не было значимо. Вместе с тем, хорошо известно, что в такой ситуации у животных возрастает вероятность крайних поведенческих проявлений — длительного затаивания либо панического бега (Вальдман с соавт., 1976). Оба эти феномена, встречаясь примерно в равной мере, не приводят к смещению средних значений пробега, но заметно повышают разброс данных. Именно этот эффект и ослаблял 0-к-7 (рис. 5.1 и 5.2). Дозы 0,1 и 10 мг/кг были неэффективны: первая, очевидно, в связи с малой интенсивностью оказываемого воздействия; вторая, видимо, из-за приближения к уровню, снижающему двигательную активность.
На фоне налоксона анксиолитический эффект 0-к-7 практически полностью исчезал, что свидетельствует об опиоидной природе наблюдавшихся изменений. Подтверждается это и серией с инъекцией лишенного N-концевого тирозина 0-к-4 (Phe-Pro-Gly-Pro): при тестировании в «открытом поле» (яркий свет и звонок) каких-либо отличий среднего значения и разброса в опытной группе, по сравнению с контролем, не обнаружено.
Рисунок 5.5. Влияние интраназального введения различных доз бета-казоморфина-7 на вертикальную активность (В А) животных в «открытом поле» (тестирование со сменой освещенности).
По оси абсцисс — время регистрации (минуты); по оси ординат — величина ВА (число стоек). Отличия от контроля ср<0,05 отмечены *.
Интересно, что результаты опытов сР-к-4 находятся в определенном противоречии с данными других авторов: дез-Туг-аналог ВСН 325 оказывал защитное действие при хроническом стрессе, вызванном неизбегае-мой болевой стимуляцией (КоЫег, Rauca, 1992). Сходный с ним тетрапептид Pro-Phe-dPro-Gly проявил протекторные свойства у крыс с удаленными надпочечниками (Ruthrich et al., 1993b). Однако оба эти примера имеют отношение не к тревожности, вызываемой разовым стрессогенным воздействием, а, скорее, к развитию депрессивных состояний, имеющих существенно иную нейрофизиологическую и нейрохимическую природу (см. ниже). В случае содержащих Ы-концевой тирозин Р -казоморфинов антистрессорное действие выявлено в форме снижения вызванной изоляцией вокализации у цыплят (Panksepp et al., 1984), а также ослабления поведенческих нарушений после иммобилизации у обезьян (Динсбург с соавт., 1995).
Рисунок 5.6. Влияние интраназального введения различных доз бета-казо морф ина-7 на горизонтальную активность (ГА) животных в «открытом поле» (стрессогенная модификация).
Гистограммы для 1-й и 2-й минут тестирования приведены отдельно. Отличия от контроля ср<0,05 отмечены *.
Некоторые предположения о месте действия 0 -к-7 в ЦНС при развитии анксиолитических эффектов позволяют сделать результаты серии с интраназальным введением (Дубынин с соавт., 2004а). Показано, что при данном способе применения пептида в случае доз 0,001,0,005 и 0,1 мг/кг происходит увеличение числа стоек в «открытом поле» со сменой осве
щенности (рис. 5.5). В стрессогенных условиях (яркий свет и звонок) крысы, получившие 0 -к-7, снижали пробег, если контрольная группа характеризовалась повышенной активностью (рис. 5.6, внизу), и увеличивали пробег, если контрольные животные часто затаивались (рис. 5.6, вверху). Следовательно, как и в случае внутрибрюшинного введения, происходила определенная нормализация поведения, не зависевшая прямо от дозы препарата. Более того, в приборе «Opto-Varimex» интра-назально применяемый 0 -к-7 вызвал хотя и кратковременное, но значимое повышение ГА и числа стоек, что не отмечалось после внутрибрюшинной инъекции. Таким образом, при введении в носовую полость пептид, не влияя на болевую чувствительность и двигательную активность, смог изменить состояние центров, регулирующих уровень тревожности и исследовательской активности. Местом приложения такого анксиолитического действия служат, видимо, структуры переднего мозга, более доступные для интраназально вводимых препаратов.
Действительно, прямая инъекция опиоидов в n. accumbens (Anseloni et al., 1999), префронтальную кору (Wall, Messier, 2000), повышение концентрации проэнкефалина в миндалине (Kang et al., 2000) вызывают на поведенческом уровне снижение тревожности. В случае же более кау-дально расположенных структур эффекты могут быть анксиогенными (введение DAGO в VTA; Calenco-Choukroun, 1991) либо разнонаправленными (в зависимости от дозы). Так, при инъекции в дорзальную часть ЦСВ 10 нМ морфина происходила активация поведения крыс в крестообразном приподнятом лабиринте; доза 30 нМ, напротив, вызывала снижение выраженности поведения риска и времени нахождения на открытых рукавах (Motta, Brandao, 1993; Anseloni et al., 1999). Вместе с тем, введение морфина в вентролатеральную часть ЦСВ (в значительно большей дозе — 1—3 мкМ) приводило к ослаблению стресса, вызванного контактом с резидентом (Vivian, Miczek, 1999).
Регистрация ЭКГ на фоне стрессогенного стимула и введения 0-казоморфинов
Помимо поведенческих проявлений, нами была предпринята попытка оценить вегетативные составляющие реакции животных на внешнее стрессогенное воздействие (Соханенкова с соавт., 1998). С этой целью после введения 0 -к-7 проводилась регистрация ЭКГ у крыс в комфортных условиях и при действии яркого света и звонка (рис. 5.7). Показано,
Рисунок 5.7. Изменение длительности кардиоинтервалов (КИ) в фоне и при стрессогенном воздействии относительно средних значений до введения препаратов (нулевая точка на оси абсцисс').
Приведены данные серий с инъекцией бета-казоморфина-7 (бета-к-7). По горизонтали — время после инъекции; по вертикали — изменение КИ. В каждой временной точки кривые проходят через два значения: первое — регистрация до подачи стрессогенных стимулов («фон»), второе — регистрация во время стимулягуш (указано стрелками). Достоверные отличия отмечены * (р<0,05) и** (р<0,01).
что инъекция пептида в дозе 5 и, слабее, 1 мг/кг вызывает урежение фоновой ЭКГ (повышение длительности кардиоинтервалов — КИ). Такая реакция достаточно типична для опиоидов и включает в себя как центральный, так и периферический компоненты (в обоих случаях речь обычно идет об ингибирующем влиянии на активность норадренергической системы: см., например, Liebmann et al., 1990).
При действии яркого света и звонка происходило учащение ЭКГ (снижение длительности КИ) как в контроле, так и, в несколько большей степени, у крыс опытных групп. Однако величина КИ у животных, получавших пептид, оставалась выше контрольного уровня (значимо — только при введении Р-к-7 в дозе 5 мг/кг; моменты стимуляции отмечены на рис. 5.7 стрелками).
Можно трактовать полученные данные двояким образом. Если учитывать только изменения длительности КИ при переходе от нестрессогенных условий к стрессогенным, то явно, что анксиолитическое действие 0 -к-7 в случае ЭКГ-реакции на сильные сенсорные стимулы не проявляется. Вместе с тем, рассматривая абсолютные значения КИ, мы вправе говорить о менее «стрессированном» режиме, в котором функционируют вегетативная нервная и сердечно-сосудистая системы в группе с введением пептида (частота сердечных сокращений остается значимо ниже контрольной даже на фоне яркого света и звонка). Следовательно, протекторное, ослабляющее рост тревожности действие 0 -к-7 все же имеет место, причем пептид оказывает стабильное (тоническое) влияние, хотя и не снижает быструю (фазическую) реакцию на предъявление стрессогенных стимулов.
Данная точка зрения в определенной мере подтверждается результатами тестирования кардиотропной активности укороченных с С- и 14-концов аналогов 0 -казоморфина-7 — 0 -к-5 (Tyr-Pro-Phe-Pro-Gly) и 0 -к-4 (Phe-Pro-Gly-Pro). Показано, что в случае 0 -к-5 пептид вызывает фоновый рост длительности КИ (в одной временной точке). Однако при включении яркого света и звонка частота ЭКГ в опытных группах оказывается даже больше, чем в контроле. Можно заключить, что, во-первых, влияние на фоновую длительность К И и ее изменения в стрессогенных условиях являются относительно независимыми компонентами действия 0 -казоморфинов; во-вторых, 0 -к-5, несмотря на значительную анальгетическую активность (Blass, Blom, 1996), оказывает на сердечно-сосудистую систему влияние, лишь в слабой степени сходное с действием прототипа
Лишенный тирозина 0 -к-4 значимо длительность КИ не изменил; отличия от контроля отсутствовали как в фоне, так и при действии яркого света и звонка.
Таким образом, присутствие N-концевого тирозина в молекуле 0-ка-зоморфина является, видимо, необходимым условием для изменения фоновой длительности КИ; наличие полной молекулы, состоящей их 7-ми аминокислот — предпосылкой для сохранения сниженной частоты сердечных сокращений в стрессогенных условиях.
Нарастание анксиолитической активности 0-казоморфинов в онтогенезе белых крыс
Отдельной задачей являлось выяснение момента, когда анксиолитическое действие 0 -к-7 начинает проявляться в онтогенезе детенышей крыс.
Для этого животные в возрасте 10 и 15—16 дней тестировались в условиях изоляции из гнезда (измерялась интенсивность ультразвуковой вокализации — УЗВ), а в возрасте 21, 28 и 35 дней — в крестообразном приподнятом лабиринте (Дубынин с соавт., 2001; Дубынин с соавт., 20046).
Показано, что введение пептида в анальгетически неактивном количестве 5 мг/кг не приводит к изменению интенсивности У ЗВ как в младшем возрасте, так и непосредственно перед открытием глаз. Характерно, что влияние Р -казоморфинов на уровень УЗВ детенышей в первую неделю жизни не было зарегистрировано также Cuomo с соавторами (1989).
В качестве вещества сравнения в этой серии экспериментов нами использовался морфин, инъекция которого в дозе 0,5 мг/кг вызвала достоверное снижение интенсивности УЗВ по сравнению с контрольной группой на 15—16-й (но не на 10-й) день жизни. Полученный результат свидетельствует о том, что соответствующая (регулирующая уровень тревожности) составляющая опиоидной системы находится в этом возрасте в лишь в относительно зрелом состоянии; отсутствие же эффекта Р -к-7 — следствие, скорее всего, использования недостаточной высокой дозы.
Сравнение с данными литературы подтверждает справедливость сделанного вывода; протестированные в работах разных авторов детеныши линейных животных часто оказывались более чувствительны к введению морфина и ц -агонистов, чем в нашем случае. Так, Carden с соавторами (1996) показали, что уже у 3- и 7-дневных крысят морфин в дозе 0,125 мг/кг понижает количество УЗВ на 40%. Та же доза морфина в возрасте 10 дней вызывает снижение У ЗВ на 65%, в возрасте 14 дней — на 90%. Все эффекты были налтрексон-зависимыми; их нарастание в онтогенезе, очевидно, отражает процесс созревания ц -составляющей опиоидной системы мозга детенышей крысы. Сходное налоксон-зависимое снижение интенсивности УЗВ выявлено Winslow и Insel (1991) при использовании 0,4 мг/кг морфина (возраст детенышей 7—10 дней). Внутрижелудочково вводимый ц-агонист DAMGO снижал количество У ЗВ при тестировании крысят на 3-й, 10-й и 18-й дни жизни; анксиолитические изменения вызвал также б-агонист DPDPE; напротив, к-агонист U-50488 повышал частоту УЗВ не только при изоляции, но даже во время нахождения в гнезде (Carden et al., 1994). Для U-50488 анксиогенное действие показано и при системном введении (Kehoe, Boylan, 1994; Nazarian et al., 2001), что отличает его влияние на детенышей от анксиолитических эффектов в случае взрослых животных (например, Privette, Terrian, 1995).
800
600
400
возраст детены шей, дни
Рисунок 5.8. Изменение ряда параметров поведения в приподнятом лабиринте у крыс разного возраста под влиянием бета-казоморфина-7, вводимого в дозах 20 мг/кг (сплошная линия) и 5 мг/кг (прерывистая линия).
Данные пронормированы по соответствующим контрольным значениям. По горизонтали — возраст животных; по вертикали — процент от уровня контроля. Отличия от контроля отмечены * прир<0,05.
200
о
возраст детены шей, дни
Влияние опиоидных антагонистов на интенсивность УЗВ детенышей, как правило, незначимо (Winslow, Insel, 1991; Carden et al., 1993).
В наших экспериментах 0 -казоморфин-7 в дозе 5 мг/кг оказался неэффективен (с точки зрения влияния на уровень тревожности) не только у еще незрячих детенышей, но и в возрасте 21 день. Вместе с тем, увеличение количества вводимого пептида до 20 мг/кг показало, что воздействие 0 -к-7 на поведение в приподнятом лабиринте все же может быть обнаружено (наблюдалось повышение количества стоек в темных отсеках и на светлых рукавах).
В возрасте 28 дней анксиолитические по направленности эффекты 0 -к-7 были уже вполне очевидны; поведение в приподнятом лабиринте значимо изменяли обе дозы пептида. Та же картина наблюдалась и через неделю. Более того, в случае многих показателей (рис. 5.8 и 5.9) влияние 0 -к-7, вводимого в количестве 5 мг/кг, оказалось более выраженным. Ви-
Рисунок 5.9. Изменение ряда параметров поведения в приподнятом лабиринте у крыс разного возраста под влиянием бета-казоморфина-7, вводимого в дозах 20 мг/кг (сплошная линия) и 5 мг/кг (прерывистая линия).
Данные пронормированы по соответствующим контрольным значениям. Обозначения как на рис. 5.8.
димо, это означает, что охарактеризованные в предыдущей главе снижающие локомоцию эффекты дозы 20 мг/кг, не проявляясь у 35-днев-ных крыс в «чистом виде», уже могут ослаблять их активность в условиях выбора между исследовательским и пассивно-оборонительным типами поведения.
В целом можно заключить, что нейрофизиологические субстраты, через которые способно реализоваться снижающее тревожность действие 0 -казо-морфинов, достигают достаточно зрелого уровня к возрасту 4 недели (позже, чем подсистемы, связанные с антиноцицепцией, но раньше, чем структуры, через которые опосредуется ингибирующее двигательную активность влияние). При этом эффективная доза совпадает с найденной для взрослых животных и меньше анальгетически активной.
Серия экспериментов по изучению влияния фрагментов 0 -казоморфина-7 на поведение детенышей в приподнятом лабиринте была начата с пентапептида Tyr-Pro-Phe-Pro-Gly (также использовались дозы
Рисунок 5.10. Изменение ряда параметров поведения в приподнятом лабиринте у крыс разного возраста под влиянием пентапептида Туг-Рго-Phe-Pro-Gly, вводимого в дозах 20 мг/кг (сплошная линия) и 5 мг/кг (прерывистая линия).
/ушные пронормированы по соответствующим контрольным значениям. Обозначения как на рис. 5.8.
5 и 20 мг/кг). Показано, что в возрасте 21 день укороченный с С-конца аналог не эффективен (рис. 5.10). В 28 дней под влиянием дозы 20 мг/кг увеличивались ЛП первого захода в темный отсек, а также время, проведенное на свету и количество свешиваний со светлых рукавов лабиринта. Для дозы 5 мг/кг появления значимых отличий не наблюдалось. В 35 дней эффекты пептида проявлялись после введения доз 5 и 20 мг/кг. При этом после инъекции меньшего количества препарата изменилось большее число показателей: по сравнению с контролем увеличилось общее время, проведенное на свету, выходы на светлые лучи и выходы в концы светлых лучей. После введения 20 мг/кг пептида у животных увеличилось время на свету и количество стоек на свету. Полученные данные свидетельствуют об общей анксиолитической направленности действия укороченного с С-конца тирозин-содержащего аналога. Динамика развития его эффектов в онтогенезе сходна с выявленной для Р -казоморфина-7, но с отставанием в неделю. Причина по-
возраст детены шей, дни
возраст детены шей, дни
Рисунок 5.11. Изменение под влиянием пентапептида Pro-Phe-Pro-Gly-Pro (5 мг/кг/ ряда поведенческих параметров у крыс разного возраста при тестировании в приподнятом лабиринте.
/ушные пронормированы по соответствующим контрольным значениям. По горизонтали — возраст животных; по вертикали — процент от уровня контроля. Значимые отличия от контроля отмечены * (р<0,05). Обозначения параметров: 1 — ЛП захода в темный отсек; 2 — время на свету; 3 — стойки в светлых лучах; 4 — количество выходов на светлые лучи.
добного отличия состоит, видимо, в более быстрой ферментативной деградации пентапептида (в сравнении с прототипом).
Для укороченного с С- и N-концов аналога Pro-Phe-Pro-Gly-Pro (вводился в дозе 5 мг/кг) влияние на поведение к приподнятом лабиринте можно было наблюдать только в возрасте 35 дней (рис. 5.11): увеличивалось время, проведенное на свету и количество выходов на светлые лучи лабиринта. Это согласуется с более общим заключением о том, что лишенные тирозина фрагменты Р-казеина малоактивны и слабо связываются с классическими типами опиоидных рецепторов. Соответственно, их эффект развивается, скорее всего, через неопиоидные пути и механизмы.
В случае лишенного тирозина тетрапептида Phe-Pro-Gly-Pro (вводился только в дозе 5 мг/кг) получен наиболее неожиданный результат (рис.
Рисунок 5.12. Изменение под влиянием тетрапептида Phe-Pro-Gly-Pro (5 мг/кг) ряда поведенческих параметров у крыс разного возраста при тестировании в приподнятом лабиринте.
Данные пронормированы по соответствующим контрольным значениям. По горизонтали — возраст животных; по вертикали — процент от уровня контроля. Значимые отличия от контроля отмечены * (р<0,05). Обозначения параметров: 1 — ЛП захода в темный отсек; 2 — время на свету; 3 — стойки в светлых лучах; 4 — количество свешиваний со светлых лучей.
5.12). Анксиолитическое влияние пептида регистрировалось уже в 21 день (увеличивалось количество свешиваний со светлых рукавов лабиринта) и усиливалось к 28-му дню (значимо изменялись два показателя — время, проведенное на свету и количество стоек в темных отсеках). Вместе с тем, в возрасте 35 дней достоверных отличий опыта от контроля зарегистрировано не было.
Влияние 0-казоморфинов на поведение в тесте «принудительное плавание»
Следующий вопрос, который следует затронуть, анализируя влияние0-кказоморфинов на животных, помещенных в стрессогенные условия, — действие 0 -к-7 на депрессивные проявления поведения. Для оценки по
следних нами использовалась методика принудительного плавания. Данный тест, как известно, является одним из стандартных способов оценки состояния животных с вызванной депрессией (провоцируется неизбе-гаемой болевой стимуляцией, введением некоторых гормонов, стрессогенными условиями содержания и т.п.). Вместе с тем, его можно применять и для описания поведения грызунов, не подвергавшихся воздействиям, вызывающим агедонию. В этом случае (по аналогии с психологическими исследованиями) можно говорить не о депрессии, а о депрессивных проявлениях (как правило, достаточно кратковременных — например, развитие иммобилизации). Ту же специфику мы старались учитывать, обсуждая данные по тревожности: необходимо разделять тревожность, как типологическую черту поведения, и тревожность, как состояние, вызванное разовым стрессогенным воздействием (см, например, также Netter et al., 1997).
Оценка депрессивных проявлений поведения проводилась в тесте «принудительное плавание». Использовалась цилиндрическая емкость объемом 25 л, которая была на 2/3 заполнена водой с температурой 27— 28°С. Животное на срок 10 мин помещалось в воду; регистрировалась общая длительность активного плавания (крыса совершает энергичные плавательные движения, перемещаясь внутри емкости), пассивного плавания (крыса производит редкие одиночные движения конечностями и хвостом с целью удержания головы над поверхностью воды), а также иммобилизации (животное полностью неподвижно, над поверхностью воды выступает только нос). В отдельных сериях регистрировался ряд дополнительных поведенческих показателей: число периодов активного плавания, пассивного плавания и иммобилизации; латентный период первого периода пассивного плавания и первого периода иммобилизации; длительность первого периода иммобилизации.
В экспериментах на взрослых крысах показано, что внутрибрюшинное введение 0 -к-7 в дозе 5 мг/кг приводит к значимым изменениям поведения животных в данном тесте (табл. 5.1): возрастает длительность и количество периодов активного плавания; снижается длительность и количество периодов иммобилизации; растет латентный период первой иммобилизации. Следовательно, выраженность депрессивных составляющих поведения падает, и крысы опытной группы более активно пытаются реализовать реакцию избавления.
Проблема соотношения депрессивности и тревожности весьма сложна, и ее рассмотрение выходит за рамки данной работы. Однако от
метим, что, несмотря на длительное время существовавшее (в том числе в клинике) разграничение этих феноменов, начиная с 1990-х гг. все чаще говорится о родственности генеза тревожности и депрессии (Gulley, Ne-meroff, 1993; Fancett et al., 1997; Boyer, 2000).
Действие «стандартных» антидепрессантов направлено, как известно, на увеличение активности моноаминергических систем мозга (прежде всего, серотонинергической). Вместе с тем, повреждение опиоидной системы (в т.ч. при развитии привыкания и зависимости) также приводит к депрессивным изменениям поведения. Напротив, введение малых доз морфина (0,25, 0,75, 1,5 мг/кг) вызывает снижение проявлений депрессии у животных с выученной беспомощностью (Molina et al., 1994; Besson et al., 1996). Сходный эффект отмечен для энкефалинов (Tejedor-Real et al., 1995) и синтетического8-агониста BUBU (Tejedor-Real et al., 1998). Аналогично антидепрессантам действуют также ингибиторы энкефалиназ. С другой стороны, введение налоксона приводит к росту проявлений депрессии, сходному с эффектами блокаторов рецепторов серотонина (Panksepp et al., 1980b; Tejedor-Real et al, 1993).
Таким образом, обнаружение элементов антидепрессантной активности при введении 0-к-7 представляется весьма закономерным. Вместе с тем, мы понимаем, что исследование этого вопроса находится лишь в начальной стадии и должно быть со временем дополнено, во-первых, другими методами тестирования (например, оценкой степени предпочтения глюкозы); во-вторых, моделями длительно существующего депрессивного состояния. Важность продолжения работ в этом направлении обуславливается и тем, что как однократное, так и хроническое введение 0 -к-7 детенышам привело к ослаблению депрессивных составляющих поведения.
В сериях с однократным введением детенышам крыс разного возраста использовались 0 -казоморфин-7 и те же аналоги, что и в экспериментах с крестообразным приподнятым лабиринтом (пентапептиды Туг-Рго-Phe-Pro-Gly и Pro-Phe-Pro-Gly-Pro, а также тетрапептид Phe-Pro-Gly-Pro). Применялась только доза 5 мг/кг (внутрибрюшинное введение).
В случае 0 -казоморфина-7 показано, что его инъекция детенышам в возрасте 21 и 28 дней не ведет к значимым изменениям поведения в тесте «принудительное плавание»; все основные показатели в опытных и контрольных группах были близки по абсолютному значению (рис. 5.13). Однако уже в возрасте 35 дней поведение крыс, получивших гептапептид,
Таблица 5.1. Влияние/3-казоморфина-7 (5 мг/кг, внутрибрюшинно) на поведение крыс в тесте «принудительное плавание» (AM±SD). /улитель-ность тестирования 10 минут.
В колонке, обозначенной «Р», приведены вероятности, рассчитанные по критерию Стьюдента. «АП» — латентный период различных реакций (с).
Параметр Контроль п=20 Опыт п=19 Р
Длительность активного плавания, с 196,7±66,3 316,6±71,5 0,001
Длительность пассивного плавания, с 246,6 ±54,7 229,3 ±50,1 0,31
Длительность иммобилизации, с 156,8+58,9 54,3 ±37,5 0,001
Число периодов активного плавания 5,5 ±2,0 7,0 ±2,3 0,044
Число периодов пассивного плавания 9,3 ±1,8 8,6 ±2,2 0,34
Число периодов иммобилизации 5,4 ±1,7 3,1 ±1,7 0,01
ЛП первого периода пассивного плавания, с 76,7 ±37,6 117,5±50,1 0,02
АП первой иммобилизации, с 165,9±66,7 268,2±144,1 0,02
Длительность первого периода иммобилизации 24,0 ±17,1 16,5±8,6 0,10
характеризовалось сниженной выраженностью депрессивных проявлений: было увеличено время и количество периодов активного плавания, снижена длительность и количество периодов иммобилизации, увеличен АП пассивного плавания и уменьшена длительность первой иммобилизации. В 49 дней, когда развитие большинства структур и систем ЦНС соответствует взрослым животным, наблюдалась аналогичная картина.
Таким образом, антидепрессантное действие 0 -казоморфина-7 (5 мг/кг) с достоверностью обнаруживается в возрасте 35 дней. Это на неделю позже, чем в случае влияния на уровень тревожности. Именно в связи с таким «замедленным» (по сравнению с крестообразным приподнятым лабиринтом) проявлением эффектов пептида, период тестирования поведения детенышей в данном разделе работы был расширен до возраста 49 дней.
возраст детены шей, дни
возраст детены шей, дни
Рисунок 5.13. Изменение под влиянием бета-казоморфина-7 (5 мг/кг) ряда поведенческих параметров у крыс разного возраста в тесте «принудительное плавание» в течение 10 минут.
/уанные пронормированы по соответствующим контрольным значениям. По горизонтали — возраст животных; по вертикали — процент от уровня контроля. Значимые отличия от контроля отмечены * (р<0,05). Обозначения параметров: 1 — длительность активного плавания; 2 — длительность иммобилизации; 3 — ЛП пассивного плавания; 4 — ЛП иммобилизации.
Для пентапептида Tyr-Pro-Phe-Pro-Gly ослабление выраженности депрессивных проявлений поведения наблюдалось уже в возрасте 21 дня (снижение длительности и количества периодов иммобилизации, а также увеличение ЛП иммобилизации). Однако в более поздние сроки значимое действие препарата в тесте «принудительное плавание» не обнаруживалось (рис. 5.14). Пентапептид Pro-Phe-Pro-Gly-Pro не оказывал влияния на уровень депрессивности. Это, как и в случае крестообразного приподнятого лабиринта, соответствует представлениям о меньшей активности лишенных N-концевого тирозина аналогов. Вместе с тем, тетрапептид Phe-Pro-Gly-Pro проявил свое действие уже в возрасте 21 день (рис. 5.15): в опытной группе был увеличен латентный период иммобилизации, уменьшено количество периодов пассивного плавания и иммобилизации. В 28 дней эффект сохранялся: была повышена длительность
Рисунок 5.14. Изменение под влиянием пентапептида Tyr-Pro-Phe-Pro-Gly ряда поведенческих параметров у крыс разного в тесте «принудительное плавание».
Данные пронормированы по соответствующим контрольным значениям. По горизонтали — возраст животных; по вертикали — процент от уровня контроля. Значимые отличия от контроля отмечены * (р<0,05). Обозначения параметров: 1 — длительность активного плавания; 2 — длительность иммобилизации; 3 — ЛП пассивного плавания; 4 — ЛП иммобилизации.
пассивного плавания и уменьшена длительность иммобилизации, а также количество периодов пассивного плавания и иммобилизации. Вместе с тем, уже в возрасте 35 дней влияние пептида было незначимо, а в 49 дней эффект введения препарата оказалось возможным выявить лишь по одному параметру — длительности иммобилизации: в контроле она составила 60,0+18,9 с, в опытной группе 25,5± 10,6 (р=0,04 по критерию %2).
Еще раз подчеркнем, что влияние 0 -казоморфина-7 (5 мг/кг) на реакции детенышей в тесте «принудительное плавание» проявлялось на неделю позднее, чем в приподнятом лабиринте (35 и 28 дней, соответственно). Вероятно, поведение крысят в проанализированных экспериментальных ситуациях определяется разными функциональными системами мозга. В случае плавания это, в первую очередь, центры, определяющие значимость положительного подкрепления (таким подкреп-
Рисунок 5.15. Изменение под влиянием тетрапептида Phe-Pro-Gly-Pro (5 мл/кг) ряда параметров поведения у крыс разного возраста в тесте «принудительное плавание» в течение 10 минут.
/Данные пронормированы по соответствующим контрольным значениям. По горизонтали — возраст животных; по вертикали — процент от уровня контроля. Значимые отличия от контроля отмечены * (р<0,05). Обозначения параметров: 1 — длительность активного плавания; 2 — длительность иммобилизации; 3 — количество периодов пассивного плавания; 4 — ЛП иммобилизации.
лением является избавление от потенциально опасной ситуации нахождения в воде). Ослабление активности данных центров ведет к росту длительности иммобилизации — реакции, аналогичной агедонии, наблюдаемой в тестах с предпочтением глюкозы. Уменьшение вероятности иммобилизации на фоне введения 0 -к-7, напротив, означает рост вклада центров положительного подкрепления в общую деятельность мозга. Снижение уровня тревожности в приподнятом лабиринте определяется, судя по всему, прямым тормозящим влиянием 0 -казоморфинов (как опиоидных пептидов) на активность центров оборонительного поведения, тревожности и страха.
Существенные различия двух рассматриваемых экспериментальных ситуаций (и связанных с ними функциональных систем мозга) проявляются и при анализе эффектов укороченных аналогов 0 -к-7 (в обобщенном виде
см. в табл. 5.2). Действительно, пептапептид Tyr-Pro-Phe-Pro-Gly в приподнятом лабиринте действовал подобно прототипу, но с отставанием в неделю. В то же время, его антидепрессантные свойства выявлены только в самом раннем возрасте; начиная с 28-го дня жизни введение препарата было неэффективно. Пентапептид Pro-Phe-Pro-Gly-Pro понижал только тревожность (причем при применении в наиболее старшем возрасте). И лишь в случае тетрапептида Phe-Pro-Gly-Pro обнаруживается достаточно полное сходство: влияние на уровень оборонительной мотивации и депрессивности регистрировалось в возрасте 21 и 28 дней (но не позже).
Результаты наших опытов находятся в определенном соответствии с данными других авторов. Так, дез-Тут-аналог фрагмента 0 -казеина ВСН 325 оказывал защитное действие при хроническом стрессе, вызванном неизбегаемой болевой стимуляцией (Kohler, Rauca, 1992). Сходный с ним тетрапептид Pro-Phe-dPro-Gly проявил протекторные свойства у крыс с удаленными надпочечниками (Ruthrich et al., 1993b). Антидепрессантное действие показано и для лишенных тирозина аналогов 0-эндорфина (Hatta et al., 1995).
Полученные результаты позволили выявить весьма индивидуальный паттерн нейротропной активности, присущий каждому из четырех исследованных пептидов — самому 0 -казоморфину-7 и его укороченных аналогам. Это, в свою очередь, свидетельствует о том, что:
проанализированные соединения имеют существенно разную рецепторную специфичность, устойчивость к ферментативной деградации, способность преодолевать ГЭБ; сказанное касается не только наиболее очевидного отличия (присутствует либо нет N-концевой тирозин), но и более тонких особенностей первичной структуры;
подвергшиеся изучению функциональные системы мозга (обеспечивающие проявления тревожности, депрессивности и др.) реагируют на введение 0 -казоморфинов в явной связи с их первичной структурой; наличие «классического» опиоидного компонента действия (связанного с N-концевым тирозином) часто не является обязательным;
созревание этих функциональных систем у детенышей крыс идет с разной скоростью, и по ходу онтогенеза чувствительность в тому или иному 0 -казоморфину может меняться весьма сложным образом (например, проявиться на ранней стадии постнатального развития и исчезнуть через некоторое время).
Тем не менее, хотя лишенные N-концевого тирозина аналоги проявили способность влиять на уровень тревожности и депрессивности, дей
ствие самого 0 -казоморфина-7 на эти составляющие поведения имело, прежде всего, опиоидную природу. Об этом свидетельствуют специальные серии экспериментов, в которых показано, что при введении на фоне налоксона (1 мг/кг) гептапептид утрачивает свою активность (опыты проводились в крестообразном приподнятом лабиринте и тесте «принудительное плавание» в возрасте 49 дней).
Таблица 5.2. Обобщение данных, полученных при оценке влияния /3-казоморфинов на поведение детенышей в крестообразном приподнятом лабиринте и тесте «принудительное плавание». Представлены результаты, полученные в 21, 28 и 35-й дни жизни. Цифра в ячейке таблицы означает наличие достоверного анксиолитического либо антидепрессантного действия пептида в соответствующем возрасте. Все пептиды вводились внутрибрюшинно за 10 минут до тестирования в дозе 5 мг/ кг.
вводимый препарат Крестообразный приподнятый лабиринт «принудительное плавание»
Tyr-Pro-Phe-Pro-Gly-Pro-Ile 28, 35 35
Pro-Phe-Pro-Gly-Pro 35 нет эффекта
Phe-Pro-Gly-Pro 21,28 21,28
Tyr-Pro-Phe-Pro-Gly 35 21
Б целом можно заключить, что однократное применение 0 -казомор-фина-7 в анальгетически неэффективных дозах вело к смещению баланса пассивно-оборонительной и исследовательской мотиваций в сторону последней, возрастанию активности животных в умеренно стрессогенных условиях и ее нормализации при сильном стрессе. Наблюдавшиеся эффекты накладывали отпечаток на весь паттерн поведенческой активности животных, в том числе изменяли их способность к обучению, чему посвящена следующая глава
Глава б. Влияние 0-казоморфинов на обучение
Многообразие структур и механизмов, обеспечивающих процессы обучения
Процессы обучения входят в круг наиболее сложных задач, решаемых высокоорганизованной нервной системой, а их реализация позволяет резко повысить индивидуальную приспособленность особи к условиям окружающей среды. При этом для эффективного обучения требуется совместная деятельность большого количества нервных структур — как корковых, так и находящихся в более каудально расположенных областях ЦНС. Данные структуры:
- осуществляют анализ поступающей сенсорной информации (часто очень тонкий и требующий дополнительного предварительного обучения для качественного распознавания образов и дифференцирования раздражителей);
- организуют ответную вегетативную или двигательную реакцию; во втором случае отдельной задачей является моторное обучение, субстратом которого служат стриатум и кора мозжечка;
- обеспечивают сопряжение афферентных и эфферентных компонентов рефлекторных дуг (т.е. процессы замыкания временных связей); основной вклад здесь вносят ассоциативные области коры, высшие сенсорные зоны, премоторная кора;
- создают необходимый потребностно-мотивационный фон, который можно уподобить источнику энергии, «питающему» процессы обучения.
Б последнем случае имеются ввиду не только подкорковые ядра, отвечающие за конкретные потребности (гипоталамус, средний мозг), но и т.н. центры положительного и отрицательного подкрепления (положительных и отрицательных эмоций, награды и наказания и т.п.), история изучения которых была начата еще экспериментами по самостимуляции мозга (Милнер, 1973). По современным представлениям каждый из этих центров не является чем-то локальным, а представляет собой сложную
совокупность нервных структур. Так, система награды включает в себя ЦСВ, вентральную покрышку среднего мозга (VTA), латеральные зоны гипоталамуса, вентральный стриатум и паллидум, дорзомедиальную миндалину, а также гиппокамп, префронтальную кору (по крайней мере, отдельные их области) и ряд других структур (см., например, Беспалов, Звартау, 2000).
Анатомическая сложность системы награды дополняется сложностью нейрохимической. При этом в качестве главного нейромедиаторного компонента, обеспечивающего наиболее широкую реализацию положительного подкрепления, рассматривается дофаминергическая система (и, соответственно, VTA). Большое внимание уделяется ГАМК, глутаминовой кислоте, серотонину, норадреналину, опиоидам, а также пуринам, кортикостероидам, вазопрессину. Препараты, воздействующие на соответствующие системы, проявляют подкрепляющие свойства, что может быть выявлено при регистрации реакций самовведения, в ходе выработки условнорефлекторного предпочтения места и в ряде других экспериментальных ситуаций. Подкрепляющие свойства являются характерной чертой наркотических препаратов (кокаина, амфетаминов, морфина, героина, каннабиноидов), транквилизаторов, кофеина, этанола и др.
Влияние системы награды на функционирование различных структур мозга реализуется при достижении биологически благоприятного результата той или иной деятельности (получение пищи, избавление от повреждающего стимула и т.п.). При этом на обучающихся нейронах конвергируют сенсорные и подкрепляющие сигналы, вызывая глубокие изменения не только пресинаптических структур, рецепторного аппарата, систем вторичных посредников, но и состояния ядерной ДНК. Молекулярные механизмы этого феномена, лежащего в основе процессов консолидации памяти, в настоящее время активно исследуются (Анохин, 1997; Okano et al., 2000; Hasselmo, Stem, 2006).
Величина (интенсивность) подкрепляющего действия и определяемая ею скорость обучения зависят от степени «редукции драйва» — т.е. от исходной силы потребности и того, в какой степени она оказалась удовлетворена. Так, удовлетворение потребности в безопасности может оказать настолько мощное влияние, что обучение (например, выработка обстановочного навыка пассивного избегания) произойдет после однократной болевой стимуляции.
К системе наказания относят (с анатомической точки зрения) септальную область, латеральную миндалину, вентромедиальный гипотала
мус (см., например, Laborit, 1975). Их влияние на функционирование ЦНС реализуется при получении биологически неблагоприятного результата и обеспечивает различные варианты условного торможения (уга-сательное, условный тормоз, дифференцировочное, запаздывательное: Павлов, 1973).
Система отрицательного подкрепления изучена в существенно меньшей степени, чем система награды, и сам факт ее существования продолжает подвергаться сомнению. Вместе с тем, на поведенческом уровне достаточно очевидно, что последствия деятельности центров наказания весьма специфичны. Они заключаются в том, что обеспечивающие уже сформированные условные рефлексы нейронные дуги переводятся в «скрытое», заторможенное состояние. В результате вероятность реализации соответствующих навыков резко снижается. Однако они могут быть легко восстановлены при изменении условий внешней среды и, например, однократном подкреплении.
Изучая процессы обучения в ЦНС, мы сталкиваемся с чрезвычайно широким кругом явлений. В результате объектами исследований оказываются не только ассоциативные (условнорефлекторные), но и неассоциативные феномены, связанные с различными по механизмам типами памяти. В представленной работе внимание сконцентрировано лишь на одном из аспектов обучения — выработке пищедобывательных и оборонительных навыков. Основной целью при этом стала попытка определить, на какое звено (компонент) обучающихся систем 0 -казоморфины воздействуют в наибольшей степени.
Опиоидная система и обучение
В большом количестве экспериментов продемонстрировано (хотя существуют исключения из этого правила) ухудшающее действие морфина, энкефалинов и подобных им препаратов на выработку двигательных навыков. Причиной является, видимо, конкуренция подкрепляющего влияния опиоидов с собственно обучающим действием экспериментальной ситуации (электроболевых стимулов, получения пищи и т.п.). Кроме того, часто оказывается значимым прямое ингибирующее действие опиоидов на функционирование структур, связанных с обучением и памятью (например, гиппокампа или VTA: Platt et al., 1999; Sandin et al., 2000).
В экспериментах на мышах (Castellano et al., 1984) показано, что системно вводимый сразу после сеанса обучения морфин (1 и 2,5, но не 0,5
мг/кг) нарушает воспроизведение навыка пассивного избегания. По данным Saha с соавторами (1990,1991) морфин (1, 3 и 10 мг/кг) дозозависимо и налоксон-зависимо ухудшает выработку реакции активного избегания. Дозы порядка 6—12 мг/кг использовались и в других аналогичных работах (Aguilar et al., 1998; Galeotti et al., 2001). Примерно те же (и большие) количества морфина вызывают формирование условной реакции предпочтения места (Coudereau et al., 1997). Вместе с тем, для этого препарата, вводимого в дозах 40 и 100 мг/кг, показано облегчающее действие на процесс выработки УРПИ (Mondadori, Waser, 1979). Аналогичный результат получен Shiigi с соавторами (1990) при введение до сеанса обучения 10 мг/кг морфина.
В случае опиоидных пептидов ухудшение формирования навыка пассивного избегания показано при системном и внутрижелудочковом введении сразу после сеанса обучения дерморфина, мет- и лей-энкефалинов, 5-агонистов DADLE и DPDE (Tilson et al., 1986; Martinez, 1992). В работе Martinez с соавторами (1985) лей-энкефалин, вводимый внутрибрюшинно в дозе 0,1 мг/кг до опыта, вызвал уменьшение числа реакций активного избегания. Применение антисыворотки лей-энкефалину привело к развитию противоположного, улучшающего обучение эффекта. Ухудшали выработку УРАИ, несмотря на пониженные опиоидные свойства, и укороченные аналоги энкефалинов Tyr-Gly-Gly-Phe и Tyr-Gly-Gly (Janak, Martinez, 1990). Аналогичные свойства продемонстрированы для ноцицептина (Noda et al., 2000). У ноцицептин-нокаутных мышей обнаружено улучшение способности к выработке навыка пассивного избегания.
Влияние динорфинов на ассоциативное обучение обычно не регистрируется (McDaniel et al., 1990; Pakarinen et al., 1995). Данное отличие связывают с тем, что, в противоположность ц - и 5-селективным опиоидам, динорфины и синтетические к-агонисты вызывают условнорефлекторную аверсию; их подкрепляющие свойства очень слабы (Marinelli et al., 1998; Morales et al., 2001).
Улучшающее обучение действие опиоидных пептидов описывается гораздо реже. Например, его выявили Schulteis и Martinez (1992) при инъекции р-агониста DAGO до начала выработки У РАИ; Janak с соавторами (1994) при системном введении лей-энкефалина в дозе 0,03 мг/кг (как до, так и после сеанса обучения); Hiramatsu и Inoue (2000) при использовании динорфина А и его аналогов на фоне ухудшающего формирование УРПИ влияния угарного газа.
Как можно заметить, пока что мы рассматривали лишь работы, выполненные с использованием электроболевой стимуляции. Причина состоит в том, что методики с положительным подкреплением для изучения влияния опиоидов на обучение применяются заметно реже. Тем не менее, общая картина остается той же: применение опиоидов чаще затрудняет, чем облегчает процессы обучения, а также реализацию уже сформированных навыков.
Так, морфин, вводимый внутрибрюшинно в количествах от 0,1 до 10 мг/кг, дозозависимо ухудшал оперантные реакции крыс и мышей (нажатия на рычаг для получения пищевого подкрепления: Solomon et al., 1988; Hasenohrl et al., 1994). Adams и Holtzman (1991) получили аналогичные результаты при внутрижелудочковом введении морфина и DAGO; эффекты 5-агониста DPDPE и динорфина были значительно слабее. Пи-щедобывательные рефлексы обезьян ухудшались на фоне введения морфина (0,1—3,2 мг/кг), а также синтетического 5 -агониста, но не U-50488 (Pakarinen et al., 1995).
По данным Власовой с соавторами (1983) морфин и мет-энкефалин (0,15 мг/кг, внутрибрюшинно) не влияют на обучение в Т-образном лабиринте с пищевым подкреплением. Однако лей-энкефалин и его dAla2-аналог в том же количестве замедляют выработку навыка при введении перед помещением в лабиринт, а ТА1а2-аналог — еще и при введении после сеанса обучения. Linden и Martinez (1986) описали сходное действие лей-энкефалина, применяемого в дозе 0,3 мг/кг. Вместе с тем, Суворов и Якимовский (1982) обнаружили, что вводимый в стриатум с!А1а2-лей-энкефалин облегчает проявления классического условного рефлекса слюноотделения у собак.
Следует упомянуть еще одну область, нередко являющуюся объектом исследования в экспериментах по обучению. Имеются ввиду работы с т.н. «рабочей памятью», в которых используются радиальные лабиринты. В этом случае также обычно описывается ухудшающее действие разнообразных опиоидных агонистов (например, McDaniel et al., 1990; Kalivas et al., 2001).
Влияние 0-казоморфинов на обучение с положительным подкреплением
В наших экспериментах обучение взрослых крыс проводили в Т-образном лабиринте (размер рукавов — 30x10 см, стартовой камеры —
20x10 см; высота стенок 20 см). Б нулевой день крыс переносили в лабиринт на 30 мин с целью адаптации, утешения исследовательской реакции и формирования первичной ассоциации с пищевым подкреплением (во всех рукавах лабиринта был рассыпан корм). Б последующие четыре дня животное помещали в лабиринт по 5 раз подряд ежедневно; длительность каждой из 5 посадок не превышала 3 мин. Б качестве пищевого подкрепления использовали хлебные шарики.
Б опытах визуально регистрировали: число выполненных реакций (количество случаев, когда животное находит подкрепление в течение 3 мин пребывания в лабиринте); латентный период выхода из стартовой камеры; время реакции (время, понадобившееся крысе для достижения требуемого отсека лабиринта и взятия пищи); число ошибок (количество заходов в противоположный «верному» отсек лабиринта). Б дни опыта животных кормили один раз в сутки непосредственно после эксперимента.
Условный рефлекс пассивного избегания болевого раздражителя (УРПИ) вырабатывали в камере размером 50x22x35 см, разделенной перегородкой на два неравных отсека: меньший ярко освещался, второй был затемнен. Камеру устанавливали на решетчатый пол, соединенный со электростимулятором. Б первый день эксперимента (день обучения) животное помещали в освещенный отсек камеры и регистрировали время (латентный период — ЛП) перехода в темноту. После перехода отверстие в перегородке закрывали и на пол в течение 3 с подавали прямоугольные импульсы тока напряжением 90 Б и длительностью 10 мс (частота 50 Гц). После отключения тока крысу оставляли в затемненном отсеке на 20 с. Через 7 дней проводили воспроизведение навыка. Для этого животное вновь помещали в светлую часть камеры и регистрировали ЛП перехода в затемненный отсек, а также общее время нахождения в темноте в течение 3 мин наблюдений.
Условный рефлекс активного избегания болевого раздражителя (УРАИ) вырабатывали в камере размером 30x22x35 см, с угловой полкой на высоте 25 см и решетчатым полом, на который мог подаваться электрический ток со стимулятора. Условным сигналом служил звук звонка длительностью 3 с; безусловным раздражителем (отрицательным подкреплением) — удар током (напряжение подбирали индивидуально в диапазоне 40—60 Б). Б ходе обучения животное помещали в камеру и адаптировали к условиям эксперимента в течение 3 мин, после чего следовало первое предъявление условного сигнала. Интервал между условным сигналом и подкреплением составлял 2 с, условной реакцией являлся
прыжок на полку. Если избавление не наступало в течение 30 с, то напряжение отключали. Длительность паузы между сочетаниями условного и безусловного стимулов колебалась случайным образом в пределах 30_ 60 с.
В работе использовали две схемы выработки УРАИ. В одном случае обучение проводили в течение 4 дней, предъявляя каждому животному по 10 сочетаний ежедневно; в другом — в течение 2 дней, предъявляя по 15 сочетаний ежедневно. Регистрировали число выполненных реакций (прыжков на полку в ответ на условный сигнал), число коротколатентных реакций (прыжков на полку через 1 —2 с после включения тока) и число межсигнальных реакций (прыжков на полку в интервале между сочетаниями).
Таким образом, влияние 0-казоморфина-7 на обучение белых крыс изучали с помощью методик с положительным и отрицательным подкреплением (Маклакова с соавт., 1995). В ходе выработки пищедобывательного навыка в Т-образном лабиринте было использовано 240 животных; при формировании условных рефлексов пассивного и активного избегания — 138 и 120 крыс, соответственно. Кроме того, оценивали действие дез-Тут аналогов 0 -к-6 и 0 -к-4 на обучение белых крыс в лабиринте, а также влияние предварительного введения налоксона на эффекты 0-к-7 (использовано 93 и 80 животных). Гептапептид вводили в четырех дозах — 0,1,1, 5 и 20 мг/кг за 5 мин до начала обучения и в трех дозах — 1, 5 и 20 мг/кг сразу после обучения; 0 -к-6 и 0 -к-4 — дозе 5 мг/кг за 5 мин до начала выработки навыка.
В графическом виде часть данных, полученных при обучении с положительным подкреплением, представлена на рисунке 6.1. Анализируя результаты, можно заключить, что 0-к-7, вводимый до помещения в лабиринт в количествах, не влияющих на болевую чувствительность и двигательную активность, увеличивает скорость обучения. Число выполненных реакций (ЧВР) в группах, получавших 1 и 5 мг/кг пептида, в 1-й день обучения совпадало с контрольным уровнем Однако уже во 2-й день введение этих доз увеличивало число выполненных реакций (ЧВР) на 35 и 39%, соответственно, по сравнению с контролем (значимо в обоих случаях). На 3-й день ЧВР в опытных группах, получивших 1 и 5 мг/кг пептида, также превышало контрольные значения на 15 и 23% (достоверно только во втором случае). В последний день обучения крысы всех рассматриваемых групп по показателю ЧВР не различались (контроль доучивался до уровня опытных животных).
Рисунок 6.1. Влияние различных доз бета-казоморфина-7 на обучение экспериментальных животных в Т-образном лабиринте (введение пептида до обучения).
По оси абсцисс — дни обучения. По оси ординат — параметры обучения: число выполненных реакций (ЧВР), латентный период реакции (ЛП), время реакции (ВР) и число ошибок (40). Обозначения линий: 1 — контроль; 2, 3, 4 — введение пептида в дозах 1, 5 и 20 мг/кг, соответственно. Величина опытных групп по 20—22 крысы; в контроле 45 животных. Отличия от контроля отмечены * (р<0,05) и ** (р<0,01).
Что касается других параметров, характеризующих выработку навыка, то латентный период выхода из стартовой камеры (ЛП), время реакции (БР) и число ошибок (ЧО) менее выражено изменились под влиянием р-
к-7. В этом случае достоверное действие оказала лишь доза 1 мг/кг, снизившая ЛП во 2-й день и ВР во 2-й и 3-й дни (р<0,05 по точному критерию Фишера).
Доза 0,1 мг/кг не вызвала значимых изменений процесса обучения, хотя ЧВР в этой группе во 2-й день обучения превышало контрольный уровень на 16% (недостоверно), а параметры ЛП и ВР были снижены по отношению к контрольному уровню на 4-й день с р<0,10.
Совершенно иной характер воздействия на обучение в Т-образном лабиринте был зарегистрирован после введения 20 мг/кг р -к-7. В этом случае в опытной группе ЧВР было достоверно ниже контроля на протяжении всей процедуры обучения. Разница составила 46, 52, 53 и 45% в случае каждого из четырех дней опыта (р<0,01). Кроме того, ЛП и ВР были выше соответствующих контрольных значений в течение всего эксперимента, хотя эти изменения были менее выражены, чем изменения ЧВР (р<0,05-0,10). По ЧО группы значимо не различались.
Введение Р-к-7 во всех исследованных дозах (1, 5 и 20 мг/кг) сразу после сеансов обучения не оказало какого-либо достоверного воздействия на выработку пищедобывательного навыка
С целью анализа механизмов, лежащих в основе облегчающего влияния Р -к-7 на обучение животных в лабиринте, изучали эффекты гептапептида в дозе 5 мг/кг на фоне предварительного введения налоксона (за 15 мин, 1 мг/кг). В графическом виде результаты представлены на рисунке 6.2. Как можно заметить, в этом случае обучение всех экспериментальных групп шло с меньшего уровня ЧВР и медленнее, чем в предыдущей серии опытов. В таких условиях инъекция Р -к-7 приводила к увеличению ЧВР относительно контроля в течение всего периода обучения, хотя уровня значимости отличия достигали только к 4-му дню. Сходные результаты получены и при оценке величин ЛП и ВР.
В группе с введением только налоксона не обнаружено достоверных отличий от контроля ни по абсолютным величинам регистрируемых показателей, ни по динамике их изменений за все время обучения. То же наблюдалось и в группе с введением р -к-7 и налоксона. Более того, совместная инъекция блокатора опиоидных рецепторов и гептапептида приводила к снижению ЧВР в течение 2-го, 3-го и 4-го дней обучения по отношению к группе с введением только Р -к-7 на 29, 30 и 36%, соответственно (достоверно только в последнем случае). Также у животных, получивших комбинацию веществ, ЛП и ВР на 2-й и 4-й дни обучения были достоверно выше, чем в «пептидной» группе. Что касается ЧО, то по дан-
Рисунок 6.2. Влияние введения бета-казоморфина-7 (5 мг/кг) и налоксона (1мг/кг) на обучение животных в Т-образном, лабиринте.
По оси абсцисс — дни обучения. По оси ординат — параметры обучения: число выполненных реакций (ЧВР), латентный период реакции (ЛП), время реакции (ВР) и число ошибок (40). Обозначения линий: 1 — контроль; 2 — введение налоксона; 3 — введение пептида; 4 — введение сначала налоксона, а затем пептида. Величина групп — по 20 крыс.
Звездочками отмечены отличия от контроля с р<0,05. Все препараты вводились до обучения.
ному показателю различий групп не обнаружено. В целом можно заключить, что налоксон препятствует проявлению облегчающего действия Р -к-7 на обучение экспериментальных животных.
При изучении влияния дез-Туг-аналогов Р-казоморфина-7 на выработку пищедобывательного навыка в Т-образномлабиринте пептиды вводили в дозе 5 мг/кг. Применение Р-к-6 привело к достоверному повышению ЧВР в первый же день обучения на 120% относительно контроля. В последующие дни ЧВР в контрольной и опытной группах практически не различались. С начала обучения ЛП в группе, получившей Р-к-6, был выше контрольных значений на 23, 21, 86 и 44%, хотя уровня достоверности отличия достигли лишь на 3-й день. На ВР и ЧО использованная доза р -к-6 не повлияла.
Инъекция Р-к-4 не изменила ЧВР, ЛП и ВР в опытной группе по сравнению с контролем Единственным показателем, на который оказал воздействие тетрапептид, было число ошибок: на 4-й день обучения ЧО оказалось достоверно (на 75%) ниже, чем у контрольных животных. Таким образом, дез-Туг-аналоги Р-казоморфина-7 характеризуются относительно слабым влиянием на обучение белых крыс в лабиринте с пищевым подкреплением, имеющим, впрочем, ту же направленность, что и у прототипа.
Бета-казоморфины и выработка реакций избегания
При формировании у экспериментальных животных условной реакции пассивного избегания (УРПИ) за критерий плохой обученности был принят переход из светлого отсека камеры в темный менее, чем за 30 с (в день воспроизведения навыка). Показано, что инъекция р -к-7 в дозе 1 мг/кг за 5 мин до начала обучения приводит к появлению значимого отличия от контроля в доле плохо обучившихся крыс (Маклакова с соавт., 1995). Если в опытной группе из 23 животных таковых оказалось 5, то в равном по численности контроле их не было ни одной (р<0,05 по точному критерию Фишера). Кроме того, латентный период входа в темный отсек в день воспроизведения у опытных животных был достоверно ниже, чем у контрольных. В группе, получившей Р -к-7 в дозе 5 мг/кг, наблюдались те же тенденции: повышенное число плохо обучившихся животных и снижение ЛП входа в темный отсек (эффекты не достигли уровня значимости). Введение обеих доз гептапептида сразу после сеанса обучения было неэффективно (табл. 6.1).
Результаты, полученные при изучении влияния Р -к-7 на выработку условной реакции активного избегания (УРАИ) по четырехдневной методике представлены на рисунке 6.3. Инъекция 1 мг/кг гептапептида за
Рисунок 6.3. Влияние различных доз бета-казоморфина-7 на обучение экспериментальных животных в тесте УРАИ (введение пептида до обучения).
По оси абсцисс — дни обучения. По оси ординат — параметры обучения: число выполненных реакций (ЧВР), число коротколатентных реакций (КАР) и межсигнальных реакций (МСР). Обозначения линий: 1 — контроль; 2, 3, 4 — введение пептида в дозах 1, 5 и 20 мг/кг, соответственно. Звездочками отмечены отличия от контроля ср<0,05. В экспериментальных группах по 12 животных.
5 мин до начала эксперимента приводила к ухудшению обучения: наблюдалось снижение ЧВР по сравнению с контролем во 2-й, 3-й и 4-й дни
на 27, 20 и 22%, соответственно (во всех случаях р<0,05). Также в опытной группе было обнаружено достоверное увеличение числа коротколатентных реакций (КАР) на 68% и уменьшение числа межсигнальных реакций (МСР) на 76% в 4-й день обучения. Эффекты дозы 5 мг/кг, как и в случае УРПИ, имели ту же направленность, но были менее выражены (значимое изменение по отношению к контролю показано только для ЧВР в 3-й день). Доза 20 мг/кг, в отличие от обучения в лабиринте, оказалась практически неэффективной; отмечено лишь снижение числа МСР в последний день эксперимента.
Что касается Р -к-6 и Р -к-4, то введение обоих аналогов в дозах 5 и 20 мг/кг не выявило достоверных отличий опытных групп от контрольных ни в первый, ни в последующие дни выработки УРАН.
Представляется маловероятным, что воздействие Р-казоморфина-7 на обучение происходит через процессы консолидации памяти. В литературе имеются сведения об облегчающем влиянии опиоидов на эту стадию запоминания (Martinez, 1992). Однако нами показано, что введение Р-к-7 сразу после сеансов обучения неэффективно.
Когда опиоид вводят до начала выработки навыка, он может изменять восприятие экспериментальной обстановки (Campo, 1992). Однако в нашем случае этого, видимо, также не происходило, поскольку одновременно с улучшением формирования условного рефлекса в лабиринте, р -к-7 ухудшал обучение на фоне болевой стимуляции. Воздействие же на процессы восприятия и внимания подразумевает независимость последствий введения препарата от знака подкрепления.
Третьим (и наиболее хорошо соотносящимся с полученными данными) вариантом является воздействие Р-казоморфина-7 на мотивационные составляющие поведения. Как известно, скорость выработки навыка в Т-образном лабиринте определяется соотношением двух основных мотиваций: пищедобывательной и пассивно-оборонительной. В случае ослабления первой либо значительных проявлений второй наблюдается снижение активности животных и замедление обучения. Напротив, устойчивое доминирование пищевой мотивации либо ослабление оборонительных компонентов поведения вызывают ускорение выработки навыка.
Поскольку прямая оценка уровня оборонительной мотивации весьма затруднительна, нами было проведено исследование влияния Р -казомор-
Таблица 6.1. Влияние различных доз [З-казоморфина-7 на выработку у экспериментальных животных условного рефлекса пассивного избегания при различных сроках введения (AM+SD). Обозначения: ЛП: — латентный период перехода в темный отсек при первом помещении в камеру (обучение); ЛПг — латентный период перехода в темный отсек при повторном помещении в камеру (воспроизведение через 7 дней после обучения'). Во всех экспериментальных группах по 23 крысы. Достоверное отличие от контроля отмечено * (р<0,05).
ГРУППА введение пептида до обучения введение пептида после обучения
ЛП1, с i ЛПз, с ЛП1, с ЛПг, с
контроль 13,4 ±12,0 151,1 ±51,9 25,8 ±18,8 94,4 ± 76,2
Р-к-7,1 мг/кг 14,2 ±13,5 135,6 ±71,2* 22,9 ± 24,3 107,5 ± 73,0
Р -к-7, 5 мг/кг 15,0 ±12,4 140,1 ±65,1 18,4 ±17,2 109,7 ± 74,8
фина-7 на потребление пищи. Измерения проводились после суточной депривации. Показано, что количество съеденного за 10 мин корма не различается в контроле и группах, получивших 5 и 20 мг/кгР-к-7:1,6±0,2 г, 1,4±0,2 г и 1,8±0,3 г, соответственно (величина групп — по 12 крыс). Следовательно, наиболее вероятной причиной улучшения обучения в Т-образном лабиринте после введения 5 мг/кг пептида можно считать снижение уровня оборонительной мотивации животных.
При выработке навыков с болевым подкреплением обучение идет на ином потребностно-мотивационном фоне. В отличие от пищедобыва-тельного рефлекса, в случае УРПИ и УРАИ пассивно-оборонительная мотивация является доминирующей, и именно она запускает программу соответствующего поведенческого акта. Ослабление либо подавление данной мотивации должно приводить к замедлению (ухудшению) обучения, что и наблюдалось в наших экспериментах.
Эффекты пептида при выработке УРАИ и УРПИ не связаны с понижением болевой чувствительности животных. Действительно, с одной стороны, как показано выше, минимальной для проявления анальгетических свойств Р -к-7 является доза 10 мг/кг, с другой — влияние пептида в количестве 20 мг/кг на обучение с отрицательным подкреплением отсутствовало. Отметим также, что при исследовании процессов обучения
выявлена довольно сложная зависимость эффектов [3 -к-7 от дозы. Пептид в количестве 5 мг/кг оказался более эффективен при обучении с положительным подкреплением, 1 мг/кг — с отрицательным подкреплением. Доза 20 мг/кг ухудшала выработку навыка в Т-образном лабиринте, что, очевидно, обусловлено его угнетающим действием на двигательную активность. Однако в более стрессогенных условиях (УРАИ) это влияние не проявилось.
Наконец, в Т-образном лабиринте было зафиксировано значимое ухудшение выработки навыка у животных, которым перед инъекцией р -к-7 вводили налоксон, по сравнению с теми, которым инъецировали только пептид. Логично предположить, что по крайней мере при обучении с положительным подкреплением (как и в случае, например, анальгезии) эффекты Р -к-7 реализуются через опиоидные рецепторы. Характерно, что при этом влияние плохо взаимодействующих с подобными местами связывания дез-Туг-аналогов на процессы обучения, болевую чувствительность и уровень тревожности проявляется очень слабо.
Если бы в нашем распоряжении имелись только данные по УРАИ и УРПИ, можно было бы с уверенностью заключить, что влияние р-к-7 на обучение носит стандартный для опиоидов характер. Действительно, в процессе выработки условной реакции активного избегания введение пептида до сеанса обучения вызывало снижение числа выполненных реакций. При выработке условного рефлекса пассивного избегания направленность изменений оказалась той же. В группе, получившей гептапептид перед первым помещением в экспериментальную камеру, был достоверно уменьшен ЛП повторного (при воспроизведении) входа в темный отсек. Вместе с тем, при введении препарата после сеансов обучения его влияние на формирование навыка не обнаруживалось.
В противоположность УРАИ и УРПИ, в экспериментах с использованием пищевого подкрепления выявлено ускорение процесса обучения у животных, получавших инъекции пептида. Увеличение ЧВР под влиянием Р-к-7 в количестве 5 мг/кг происходило на 2-й и 3-й дни опыта; после введения дозы 1 мг/кг — только на 2-й день. Важно, что, как и в случае использования отрицательного подкрепления, применение пептида после сеансов обучения было неэффективно.
Специфика полученного экспериментального материала оставляет довольно мало возможностей для непротиворечивой трактовки. Как уже отмечено выше, если бы Р-к-7 влиял на восприятие сигналов и/или кон
солидацию памяти, то его воздействие на обучение с положительным и отрицательным подкреплением оказалось однонаправленным. То же наблюдалось бы в случае изменения на фоне Р -к-7 активности центров награды (что характерно для многих опиоидов).
Однако в проведенных экспериментах пептид улучшал обучение с пищевым подкреплением и ухудшал — при применении электроболевой стимуляции. Кроме того, из литературы известно, что р -казоморфины, вводимые системно, не вызывают выработки реакции предпочтения места (Reid, Hubbell, 1994). Следовательно, должен существовать еще какой-то путь действия Р-к-7 на процессы обучения. По нашему мнению, он совпадает с обсуждавшимся в предыдущей главе: пептид влияет на выработку различных навыков путем снижения уровня тревожности (оборонительной мотивации).
При обучении с отрицательным подкреплением формирование временной связи с участием специфического условного сигнала (звонка) либо обстановочных стимулов (УРПИ) идет на базе потребности в безопасности. Ее снижение при реализации адекватного поведения (прыжок на полку либо торможение реакции перехода в темный отсек) служит источником активации для центров награды, запускающих процесс консолидации памяти. Если же исходный уровень потребности в безопасности (оборонительной мотивации) будет понижен — интенсивность итогового подкрепления также окажется меньше. В результате обучение ухудшится, что наблюдалось при введении р -к-7 перед сеансом обучения (но не после него).
В случае Т-образного лабиринта скорость выработки навыка зависит от соотношения пищевой и оборонительной мотиваций. Выраженность последней, несмотря на предварительную адаптацию к условиям эксперимента, часто оказывается достаточно высока. В результате происходит затаивание животного в стартовом отсеке, что замедляет процесс обучения. Анксиолитическое действие Р-к-7, по-видимому, повышает вероятность доминирования пищевой мотивации, что сказывается на числе выполненных реакций, а также времени реакции и ЛП выхода из стартовой камеры. Наибольшие изменения наблюдались в наших экспериментах на «средней» стадии процесса обучения, когда ЧВР в контроле составляло 3—3,5 из пяти возможных, в то время как у животных, получавших 1 или 5 мг/кг р-к-7 достигало 4—4,5.
Характерно, что число ошибок при этом остается на контрольном уровне. Данный факт, видимо, свидетельствует об отсутствии влияния Р -
к-7 на пространственную память. Важно и то, что на выраженность пищевой мотивации 0 -казоморфины, скорее всего, не действуют (по нашим данным — при использовании стандартного корма) либо влияют только в случае обогащенной жирами диеты (Lin et al., 1998; White et al., 2000). Следовательно, ускорение обучения крыс в Т-образном лабиринте при введении Р-к-7 с большой вероятностью обеспечивается именно путем снижения тревожности.
Параллелизм между действием р -к-7 на обучение и уровень тревожности проявился и в других проведенных в сериях экспериментов. Так, показано, что влияние пептида на обучение в Т-образном лабиринте является налоксон-зависимым (рис. 6.2). Как и в случае тестирования в стрессогенных условиях (открытое поле при ярком свете и звонке), тетрапептид Phe-Pro-Gly-Pro (Р -к-4) практически не повлиял на выработку пищедобывательного навыка. То же можно сказать и о другом лишенном N-концевого тирозина аналогер-к-6, под действием которого в 1-й день опыта отмечены признаки улучшения обучения, в 3-й день — его ухудшения. Не обнаружено влияния р-к-4 иР-к-6 и на процесс формирования условной реакции активного избегания.
Попытаемся (в качестве гипотезы) перенести полученные результаты на новорожденных млекопитающих (копытные, приматы, морские свинки). Можно предположить, что пока детеныши находятся под опекой матери и питаются ее молоком, Р -казоморфины облегчают обучение с положительным подкреплением (например, в ответ стимулы, исходящие от родителей), одновременно тормозя выработку оборонительных навыков. Необходимость последних в этот период онтогенеза вряд ли велика. При переходе к самостоятельному образу жизни прекращение притока казеинов и Р -казоморфинов в организм детеныша будет вести к росту тревожности и более активному формированию защитных рефлексов, что обеспечит выживание в сложных, потенциально опасных условиях окружающей среды.
Воздействие р-каэоморфинов на обучение детенышей белых крыс
Эксперименты по обучению детенышей (возраст 35—40 дней) проводились в т.н. «сложном лабиринте» с пищевым подкреплением. Он представляет собой квадратную камеру (60x60x25 см), разделенную 5 прозрачными перегородками на 6 параллельных отсеков-коридоров. В
каждой перегородке имеется прямоугольное отверстие (в разных местах). В нулевой день эксперимента детенышей адаптировали к условиям лабиринта (см. выше описание аналогичной методики в случае взрослых крыс). Выработку навыка проводили в течение следующих 4 дней. Для этого животное помещали в лабиринт по 5 раз ежедневно на срок до 3 мин. Крысу переносили в стартовый отсек (ближайший к экспериментатору коридор), после чего визуально регистрировали: число выполненных реакций; латентный период выхода из стартового отсека (ЛП перехода во второй коридор); время реакции (взятия хлебного шарика, который располагался в самом удаленном коридоре); количество ошибок (число отклонений от оптимальной траектории движения, когда крыса после прохода очередного отверстия сворачивала в «неверную» сторону). В 5-й и 6-й дни эксперимента животных переучивали в зеркально отраженном варианте лабиринта. Гептапептид Р-к-7 вводился только в дни обучения (но не переучивания). Введение производилось за 10 мин перед помещением в лабиринт 5 мг/кг, внутрибрюшинно).
Показано, что в течение 4 дней выработки навыка параметры поведения крыс, которым вводился пептид, достоверно не отличались от данных по контрольным животным (Беляева с соавт., 2008). Вместе с тем, во 2-й день переучивания (6-й день эксперимента) животные, получавшие Р -к-7, достоверно меньше ошибались и в среднем за 5 посадок совершали по 0,8±0,1 ошибку. Аналогичная величина в контрольной группе составила 1,1 ±0,1 (р<0,02 по точному критерию Фишера). Следовательно, определенное положительное влияние р -казоморфина-7 на обучение с положительным подкреплением все же присутствовало.
Анализ изменения количества ошибок внутри серии из 5 посадок показывает, что максимальное отличие между группами на 6-й день наблюдалось при первой посадке (опытная группа 0,9±0,2; контрольная 1,6±О,3; р<0,04 по точному критерию Фишера). При второй посадке различия уже не достигали уровня достоверности, хотя и были близки к нему (р=0,06 по критерию %2). При последующих (3—5) посадках количество ошибок в обеих группах оказалось почти одинаковым. Это позволяет предположить, что животные, получавшие инъекции Р-к-7, лучше помнят первый день переучивания в зеркальном варианте лабиринта, чем контрольные, и быстрее ориентируются в измененной среде.
В то же время на 6-й день эксперимента время реакции и ЛП выхода из стартовой камеры у контрольной и опытной групп достоверно не от
личались. Интересно и то, что обнаруженный эффект (снижение числа ошибок при переучивании) является отставленным, т.к. инъекции пептида проводились только в 1—4-й дни опыта. С учетом этого можно было бы предположить, что эффекты Р -казоморфина-7 имеют пролонгированный характер (сутки и более). Однако подобное свойство не типично для опиоидных пептидов. Вторую гипотезу можно сформулировать так: на фоне введения пептида детёныши обучаются иначе, чем в контроле, и это различие проявляется при переучивании. По-видимому, получавшие Р -казоморфин-7 крысята запоминали не столько конкретную траекторию движения, сколько сам принцип прохождения через отверстия в перегородках лабиринта.
Сравнение полученных результатов с данными по острому введению Р-казоморфина-7 взрослым животным показывает, что в нашем случае эффекты пептида менее выражены. Это, скорее всего, обусловлено относительной незрелостью соответствующих морфо-функциональных блоков ЦНС.
Влияние р-казоморфина-7 на выработку УРАИ при изменении активности дофаминергической системы мозга
Способность Р -казоморфинов влиять на процессы обучения проявляется, кроме того, на фоне тех или иных нарушений деятельности ЦНС. Так, в работе Ruthrich с соавторами (1993) показано, что тетрапептид Pro-Phe-dPro-Gly восстанавливает способность крыс к выработке навыков после адреналэктомии. В наших экспериментах подобное корректирующее влияние оказал р -к-7, вводимый совместно с галоперидолом (Маклакова с соавт., 1999). Использовалась двухдневная методика выработки У РАИ; нейролептик и Р-к-7 инъецировались только в 1-й день перед помещением животных в экспериментальную камеру.
Галоперидол (0,1 мг/кг) сам по себе значимо снижал способность крыс к обучению в оба дня опыта (табл. 6.2). На этом фоне дополнительное введение Р -к-7 почти не изменило эффекты нейролептика в 1 -й день, но значимо их уменьшило во 2-й день. В итоге животные с совместной инъекцией галоперидола и Р-к-7 (5 мг/кг) достоверно отличались от группы, получившей только нейролептик по числу выполненных реакций (ЧВР), количеству коротколатентных и межсигнальных реакций.
Полученные данные, по нашему мнению, свидетельствуют об относительно независимом (если говорить о механизмах) влиянии галоперидола
и Р -казоморфина-7 на локомоцию и способность к обучению. Действительно, ингибирование процесса выработки УРАИ сразу после введения нейролептика, очевидно, связано с его каталептическими эффектами, которые р -к-7 не устранял не только в опытах по обучению, но и при тестировании в приборе «Opto-Varimex» (см. также главу 4). Через сутки действие галоперидола на двигательную сферу практически исчезало; однако его влияние на процесс обучения сохранялось, и соответствующие животные еще больше отставали от контрольных по ЧВР. Данный компонент активности антагониста О2-рецепторов успешно компенсировал Р-казоморфин-7; у крыс с совместным введением пептида и нейролептика показатели обученности совпадали с измеренными в группе, получавшей только пептид.
Можно предположить, что влияя на процессы обучения, Р -казомор-фин-7 в определенной степени ингибирует деятельность дофаминергической системы, переводит ее активность на хотя и более низкий, но стабильный уровень (по крайней мере, в случае выработки навыков с отрицательным подкреплением). В результате тормозящее действие нейролептиков на когнитивную сферу ослабляется. Однако в случае воздействий, повышающих активность дофаминергической системы, этот эффектР-к-7 оказывается скомпенсированным. Соответственно, в наших экспериментах фенамин, сам не влияя на способность к обучению, смог устранить уменьшающее ЧВР действие пептида в первый день опыта (табл. 6.2).
Работы, в которых рассматриваются последствия совместного применения агонистов (антагонистов) дофаминовых рецепторов и опиоидов на фоне различных видов обучения, можно встретить и в литературе (например, Corrigall, Coen, 1990; Phillips et al., 1994; Duvauchelle et al., 1997). Судя по приведенным в них данным, конкуренция опиоидов и блокаторов D2 и Dl-мест связывания является хорошо воспроизводимым феноменом. Еще не выясненной проблемой остается изменение подкрепляющего действия морфина у животных с нокаутом дофаминовых рецепторов. На эту тему имеются очень немногочисленные публикации: по сообщению Matthes с соавторами (1996) у лишенных О2-рецепторов мышей способность вырабатывать реакцию предпочтения места при введении морфина подавляется; по данным Dockstader с соавторами (2001) — остается на том же уровне. При этом в обеих работах показана способность нокаутированных животных к формированию зависимости от опиоидов.
Таблица 6.2. Изменение параметров выработки условной реакции активного избегания (2-хдневное обучение) при введенииР-казоморфина-7 (/}-к-7), фармакологических препаратов и их комбинации. Приведены AM ± SEM.
Обозначения: * и ** — отличие от. контроля с р<0,05 ир<0,01, соответственно; & — отличие от группы с введением фармакологического агента с р<0,05; # — отличие от группы с введением пептида. Аозы препаратов и сроки их введения см. в тексте.
ГРУППА ЖИВОТНЫХ ЧИСЛО ВЫПОЛНЕННЫХ РЕАКЦИЙ ЧИСЛО ЧИСЛО КОРОТКОЛАТЕН- МЕЖСИГНАЛЬ- ТНЫХ РЕАКЦИЙ; HBIX РЕАКЦИЙ
ДНИ ОБУЧЕНИЯ
1-й 2-й 1-й 2-й 1-й 2-й
Контроль, п=15 2,9 ±0,7 6,5 ±1,0 2,4 ±0,6 2,9 ±0,6 6,8 ±2,3 7,7 ±2,5
0-к-7, п=13 1,7 ±0,7 4,9 ±1,1 1,6 ±0,5 2,4±0,4 3,9±1,4 3,1 ±1,2
Галоперидол, п=16 0,7 ±0,3 ** 1,7 ±0,7 ** 0,8 ±0,3* 1,2 ±0,4* 1,5 ±0,4* 2,3 ±1,4*
Галоперидол + 0-к-7, п=15 1,3 ±0,3 4,7 ±0,8 & 1,5 ±0,4 2,1 ±0,4 4,1 ±1,0 & & 4,1 ±0,8
Контроль, п=18 5,6 ±1,0 8,0±1,3 3,1 ±0,6 2,5 ±0,5 i 17,6 ±4,7 7,6 ±4,9
0-к-7, п=17 3,4 ±0,9* 5,1 ±1,5* 2,8 ±0,8 . 2,8 ±0,5 9,3±2,7 1 1 5,0±5,9
Фенамин, п=18 5,0±1,1 7,7± 1,2 1,7±0,4*' 2,0±0,4 21,2±6,2,21,8±9,4
Фенамин + 0 -к-7, п=17 5,6±1,2# 6,7 ±1,3 ! 220 + 12 2,5±0,4 | 3,4 ±0,8 i ’„7 ’ L 1 8# 15,5 ±9,8 #
Интраназальное введение 0-казоморфина-7 и обучение
Последний вопрос, который хотелось бы затронуть в данной главе — влияние на обучение интраназально применяемого 0 -казоморфина-7 (Дубынин с соавт., 2004а). Не раз обращаясь к результатам соответ
ствующих серий экспериментов, мы обсуждали степень сходства эффектов, развивающихся при использовании разных способов введения пептида в организм. В обобщенной форме они представлены в таблице 6.3. Под малыми дозами в ней понимаются количества 1 и 5 мг/кг (внутрибрюшинно), 0,001 и 0,005 мг/кг (интраназально); под большими — 20 мг/кг (внутрибрюшинно), а также 0,02 и 0,1 мг/кг (интраназально).
Если рассматривать малые дозы, то очевидно, что в целом их эффекты довольно сходны: вне зависимости от способа введения наблюдается снижение тревожности (оборонительной мотивации), а воздействие на двигательную активность и болевую чувствительность отсутствует. В результате происходит (при внутрибрюшинном применении) улучшение обучения с положительным подкреплением и ухудшение — с отрицательным. При интраназальном введении влияние на выработку навыков проявляется гораздо слабее. Показано лишь, что пептид в количестве 0,001 мг/кг значимо уменьшает время пищедобывательной реакции в 3-й день опыта (тенденция к улучшению обучения).
Высокая степень сходства эффектов малых доз Р-к-7 при разным способах введения подтверждается с помощью непараметрических корреляционных методов. Так, анализ левой части табл. 6.3 с использованием критерия Спирмана дает значение коэффициента г=0,81 (р=0,004). Соответственно, если интраназально применяемые пептиды более активно действуют на структуры переднего мозга, то можно заключить, что и малые дозы Р -к-7 при внутрибрюшинном введении влияют на те же области.
В случае больших количеств Р -к-7 картина абсолютно иная: эффекты пептида при разных путях поступления в организм не сходны как друг с другом (коэффициент г=—0,23; р=0,52), так и с действием малых доз. Внутрибрюшинно вводимый Р -к-7 понижает болевую чувствительность, двигательную активность и ухудшает способность к обучению в Т-образном лабиринте. Для интраназально применяемого в дозе 0,1 мг/кг пептида показано снижение тревожности, небольшой рост двигательной активности (например, пробега на отдельных минутах тестирования в приборе «Opto-Varimex») и отсутствие анальгетических проявлений. Однако самое интересное заключается в том, что введениеР-к-7 в количествах 0,1 и 0,02 мг/кг вызвало ускорение обучения в тесте выработки УРАИ: число выполненных реакций было увеличено в опытных группах в 3-й и 4-й дни формирования навыка (рис. 6.4).
Рис. 6.4. Влияние интраназального введения различных доз бета-казомор-фина-7 на число выполненных реакций (ЧВР) при обучении
По оси абсцисс — дни обучения.животных в тесте УРАИ.
Отличия от контроля ср<0,05 отмечены *.
Подобный эффект не наблюдался ни в одной из других серий экспериментов с Р -казоморфинами. Он не может быть объяснен снижением уровня тревожности и свидетельствует о том, что Р -к-7 все же способен воздействовать непосредственно на процессы формирования памяти. Расхождение с направленностью последствий внутрибрюшинного применения доказывает, что набор нервных структур, через которые опосредуются эффекты больших доз пептида, существенно различается в зависимости от способа введения. При интраназальном пути использования это, видимо, вновь области переднего мозга; при внутрибрюшинном введении, прежде всего, более каудально расположенные структуры (например, центры регуляции болевой чувствительности и двигательной активности в среднем мозге). Кроме того, очевидно, что действие больших доз Р -к-7 при интраназальном применении затрагивает в переднем мозге иные области (или более широкий их круг), чем влияние малых доз. В результате регистрируются новые эффекты (ускорение выработки УРАИ и повышение двигательной активности), а некоторые из уже имевшихся (влияние на обучение с пищевым подкреплением) исчезают.
Таблица 6.3. Изменения поведенческой активности животных после внутрибрюшинного (в/ б) и интраназального (и/н) введения различных доз fl -казоморфина-7. Обозначения: уменьшение поведенческих проявлений; + — увеличение поведенческих проявлений; (+) — слабое увеличение (в один из дней обучения либо на отдельных минутах оценки двигательной активности'); 0 — отсутствие изменений; 0* — использовалась доза 10 мг/кг. Остальные пояснения см. в тексте.
поведенческие проявления эффекты малых доз эффекты больших Доз в/бвведе- и/нвве-
1 в/б введе-| ние и/н введение
ние дение
тревожность - - 0*
двигательная активность 0 0 - (+)
обучение с отрицательным подкреплением i - 0 0 +
обучение с положительным подкреплением + (+) - 0
болевая чувствительность ! 0 0 - 0
Глава 7. Эффекты хронического введения р-казоморфина-7 детенышам крыс
Несмотря на то, что физиологическая роль р -казоморфинов остается до конца не ясной, существует представление о важности этих соединений в раннем постнатальном периоде, когда молоко является основой питания новорожденных млекопитающих. После попадания в кровь мишенью для действия р -казоморфинов могут быть любые ткани и органы, в том числе клетки и синапсы нервной системы. Предполагается, что взаимодействуя с различными структурами мозга, Р-казоморфины в состоянии оказывать модулирующее влияние на его развитие (Volterra et al., 1986b) и, таким образом, играть важную роль в процессах индивидуального онтогенеза.
Для проверки и анализа такой возможности нами было проведено несколько экспериментальных серий с использованием повторных инъекций Р -казоморфинов детенышам крыс. Полученные при этом данные составляют содержание этой и следующей глав. Отметим, что для хронического применения была выбрана несколько сниженная (по сравнению с экспериментами по разовому введению) доза пептидов — 1 мг/кг, заведомо не влияющая на болевую чувствительность и двигательную активность животных. Сделано это было, во-первых, в целях приближения к реально действующим на мозг новорожденных концентрациям экзорфинов, во-вторых, чтобы избежать возможного привыкания, возникновения зависимости и т.п.
Наиболее подробно в трех независимых сериях экспериментов изучены последствия хронического введения Р -казоморфина-7 новорожденным крысам в возрасте 1—14 дней (Маклакова с соавт., 1996; Дубынин с соавт., 1999).
Влияние р-казоморфина-7, вводимого в 1—14-й дни жизни, на исследовательскую активность и тревожность детенышей крыс
Первая из серий проводилась на детенышах обоих полов; всего было использовано 81 животное, из них 41 контрольное; количество самок и
Б
2,5 -|
1 -
i 0,5 Н------------1-----------1
1 2
время, мин
Рисунок 7.1. Изменение параметров поведенческой активности детенышей белых крыс в «открытом поле» (возраст 21 день) в результате хронического введения бета-казоморфина-7 (1 мг/кг) в 1~14-й дни жизни.
По горизонтали — минуты, регистрации; по вертикали — величина показателя. А — горизонтальная активность (пробег, усл. ед.); Б — вертикальная активность (число стоек). Контроль — прерывистая линия; опыт — сплошная линия. Отличие от контроля с р< 0,05 отмечено * для суммарных групп и# для подгрупп самцов.
самцов было примерно равным. Инъекции пептида либо воды начинали через сутки после рождения, и далее осуществляли ежедневно в течение 13 дней. Поведенческое тестирование проводилось в «открытом поле» в трех модификациях: 2 мин при свете красной лампы (возраст 21 день), 5 мин со сменой освещенности (возраст 35 и 49 дней) и 2 мин в максимально стрессогенных условиях (яркий свет и звонок; возраст 56 дней).
Через 21 день после рождения обнаружено, что у животных опытной группы уровень горизонтальной двигательной активности (ГА) в «открытом поле» стабильно выше, чем в контроле. Отличие достоверно на 2-й минуте наблюдений (рис. 7.1А), а также по сумме двух минут регистрации, и в равной мере выражено у самцов и самок. Кроме того, в группе, получавшей р -к-7, на 2-й минуте увеличена вертикальная активность (ос-
время, мин
контроль опыт
Рисунок 7.2. Изменение величины горизонтальной двигательной активности (А) и количество отходов от стенки арены (Б; яркий свет, подгруппы самок) детенышей белых крыс в возрасте 35 дней в тесте «открытое поле со сменой освещенности».
Опытной группе в 1— 14-й дни жизни вводился бета-казоморфин-7 (1 мг/кг в сутки). По вертикали — значения показателей. На графике А: контроль — прерывистая, линия; опыт — сплошная линия. Отличия от контроля ср<0,05 отмечены *.
новной вклад в это изменение вносит подгруппа самцов, рис. 7.1 Б) и количество отходов от стенки арены. Эти факты свидетельствуют о смещении баланса мотиваций, определяющих поведение животных, в сторону большей выраженности исследовательской составляющей и меньшей — пассивно-оборонительного компонента.
Тестирование в «открытом поле» на 35-й и 49-й дни жизни позволило доказать существование стабильных изменений поведения животных, получавших в раннем постнатальном периоде р-к-7. В возрасте 35 дней у крыс опытной группы отмечен повышенный уровень ГА. Эффект наиболее выражен на 4-й минуте регистрации (рис. 7.2А), когда смена яркого света на красный стимулирует исследовательскую деятельность. Повышение ГА было значимо и по сумме 3—5 мин тестирования. Основной вклад в наблюдаемые изменения вновь внесла подгруппа самцов. Однако
Рисунок 7.3. Изменение величины горизонтальной двигательной активности (А) и количество отходов от стенки арены (Б; на 3-й минуте') детенышей белых крыс в возрасте 49 дней в тесте «открытое поле со сменой освещенности».
Обозначения — как на рис. 7.2.
количество отходов от стенки арены было увеличено, напротив, только у самок (по сумме всех минут регистрации при ярком свете: рис. 7.2Б). Рост числа стоек в группе, получавшей Р -к-7, оказался незначим, но близок к уровню достоверности (р=0,08 за 4—5 мин теста).
В возрасте 49 дней повышенный уровень ГА выявлен на всем интервале тестирования (р<0,05). Эффект наиболее отчетлив на 3-й минуте (рис. 7.3А) за счет вклада подгруппы самцов. Количество отходов от стенки арены у крыс, получавших пептид, в это время выше контрольного уровня более, чем вдвое (рис 7.ЗБ). Животные опытной группы также чаще выходили в центр арены (в большей мере самки) и имели повышенную вертикальную активность (в большей мере самцы).
Отметим, что многие поведенческие параметры (в частности, выходы в центр арены и вертикальная активность) характеризуются формой распределения, значительно отличающейся от нормальной. Это делает некорректным применение параметрических статистических методов и,
напротив, позволяет эффективно использовать различные непараметрические критерии, в том числе точный критерий Фишера (далее — ткФ) и критерий %2. Так, например, число стоек на 4-й мин теста в подгруппе самцов равнялось 2,9±0,9 в контроле и 4,1±0,7 в опыте (недостоверно по критерию Стьюдента). Однако число крыс, совершивших за это время 2 и более стойки в опыте составило 13 из 16, в контроле — только 8 из 18 (р=О,ОЗ по ткФ).
Таким образом, в результате проведенных исследований показано, что Р -казоморфин-7, хронически вводимый новорожденным крысам в 1—14-й дни жизни, вызывает у них сохраняющиеся длительное время изменения поведения. Эти изменения проявляются преимущественно в форме усиления исследовательской деятельности и снижения уровня оборонительной мотивации. Отставленные последствия введения Р -к-7 различаются у самцов и самок. Самцам более свойственно увеличение горизонтальной и вертикальной двигательной активности, самкам — числа отходов от стенки арены и выходов в ее центр.
Характерно, что все обнаруженные эффекты Р -к-7 наблюдались только при тестировании крыс в относительно комфортных условиях. При использовании максимально стрессогенной модификации «открытого поля» (56-й день жизни) у животных, получавших пептид, величина ГА не отличалась от контрольного уровня. Более того, у крыс опытной группы отмечено уменьшение отходов от стенки арены (р<0,05 по сумме двух мин). Основной вклад в эти изменения внесла подгруппа самок, в которой зарегистрировано также некоторое снижение вертикальной активности (р=0,04 по ткФ на 1-й минуте опыта).
Влияние гептапептида, вводимого в 1—14-й дни жизни, на способность к обучению
Во второй серии экспериментов ставилась задача оценки влияния хронического введения Р -казоморфина-7 на способность крыс к обучению с положительным и отрицательным подкреплением. Всего было использовано 86 животных обоих полов, из них 42 контрольных. Введение веществ осуществлялось по той же схеме — первая инъекция через сутки после рождения, и далее ежедневно в течение 13 дней. Поведенческое тестирование проводилось в возрасте 43—47 дней (выработка условной реакции пассивного избегания — УРПИ) и в возрасте 51—53 дня (обучение в сложном лабиринте с пищевым подкреплением).
опыт
контрол ь
контрол ь
опыт
Рисунок 7.4. Влияние хронического введения бета-казоморфина-7 (1—14-й дни жизни) на поведение белых крыс при воспроизведении условной реакции пассивного избегания (УРПИ).
Возраст животных — 47 дней. А — латентный период перехода в темный отсек (сек); Б — общее время нахождения в темном отсеке (сек). Остальные обозначения как на рис. 7.2.
Отметим, что детеныши белых крыс, по сравнению со взрослыми животными, характеризуются более низким уровнем оборонительной мотивации и тревожности. Это приводит к ухудшению выработки рефлексов, основанных на болевом подкреплении. Следовательно, для получения более высокой доли обученных животных оказалось полезным уменьшить интервал между первой посадкой в камеру (выработка УРПИ) и воспроизведением до 4 дней (вместо 7 у взрослых особей).
Показано, что уже при проведении обучающей части экспериментальной процедуры выявляются определенные отличия в поведении животных разных групп. При помещении в светлый отсек получавшие пептид крысы затаиваются на меньшее время, чем контрольные, быстрее оценивают обстановку и входят в темную камеру (где подвергаются удару электрического тока). Латентный период такого перехода составил, соответственно, 16,54:3,5 с в контроле и 11,54:1,4 с в опыте (р<0,05).
Через 4 дня при воспроизведении навыка детеныши, получавшие 0 -к-7, хуже помнили факт отрицательного подкрепления. Хотя латентный период перехода в темный отсек в результате обучения вырос у них примерно в 6 раз (до 68,1± 10,9 с), его величина оказалась значимо меньше контрольного уровня (рис. 7.4А). В опытной группе отмечено также достоверное повышение времени нахождения в темном отсеке за 3 мин тестирования (рис. 7.4 Б). Все эти изменения являются признаками ухудшения обучения в тесте выработки УРПИ.
С другой стороны, благодаря более низкому уровню оборонительной мотивации и тревожности, детеныши крыс заметно быстрее, чем половозрелые особи, вырабатывают рефлексы с пищевым подкреплением. В связи с этим, вместо использования, как в случае взрослых животных, Т-образного лабиринта, в этой части исследований мы применяли уже упоминавшийся сложный лабиринт, состоящий из 6 взаимосвязанных параллельных коридоров (такая конфигурация усложняет задачу формирования пищедобывательного навыка, увеличивая время реакции и повышая количество ошибок).
При 3-дневном тестировании в сложном лабиринте выявлено, что у животных, которым хронически вводился 0 -казоморфин-7, происходит достоверное ускорение выработки условного рефлекса. В 1-й день обучения крысы, получавшие пептид, значимо быстрее, чем контрольные, выходят из стартового отсека и совершают меньшее количество ошибок (табл. 7.1). Во 2-й день сокращен не только ЛП выхода из стартового отсека, но и время реакции. Уменьшение количества ошибок, по сравнению с контролем, достигает наибольшего уровня достоверности (р=0,004 по критерию Стьюдента). На 3-й день отличия между контрольной и опытной группами почти исчезают, поскольку большинство контрольных животных доучиваются до максимально возможного уровня.
Значение ЛП выхода из стартового отсека во 2-й день обучения по абсолютным значениям весьма близки (табл. 7.1). Однако доля животных, у которых величина данного параметра составила не более Зев опытной группе равнялась 41%, в контроле — 18% (р=0,02 по ткФ). В 3-й день обучения 6 крыс из опытной группы не сделали ни одной ошибки; в контроле такой уровень обученности продемонстрировало только одно животное (р=0,048 по ткФ).
В отличие от предыдущей серии (поведение в «открытом поле»), в данном случае каких-либо заметных отличий между самцами и самками не зарегистрировано. Животные обоих полов, получавшие 0 -казоморфин-7, вносили примерно равный вклад во все выявленные эффекты пептида
Как уже отмечалось, в случае обучения с пищевым подкреплением избыточная тревожность крыс препятствует выработке навыка. Можно предположить, что, улучшение обучения у животных, получавших Р -ка-зоморфин-7, происходит за счет увеличенной исследовательской активности и сниженной пассивно-оборонительной компоненты. Те же эффекты, по-видимому, являются и причиной ухудшения обучения при выработке УРПИ. Напомним, что при однократном введении аналогичное разнонаправленное действие р -казоморфина-7 на различные (с точки зрения знака подкрепления) виды обучения выявлено нами и в опытах на взрослых животных.
Таблица 7.1. Влияние хронического введенияР-казоморфина-7 (1—14-й дни после рождения) на обучение белых крыс в сложном лабиринте с пищевым подкреплением в возрасте 51—53 дня. Представлены: AM ± SEM. достоверные отличия от контроля (по точному критерию Фишера) отмечены * прир<0,05 и ** прир<0,01. Подробные комментарии см. в тексте.
параметр ЛП выхода из стартового отсека (с, по дням обучения) в (с, п< эемя реакции э дням обучения)
группа живот- ных 1-й день 2-й день ; 3-й день 1-й день 2-й день 3-й день
контроль 24,5 ±6,0 14,3 ±4,8 9,6+3,8 85,1 ±8,7 42,9 ±7,7 23,5 ±6,8
опыт 16,8* ±4,4 13,4* ±4,8 8,8 ±3,0 80,5+8,5 36,7* ±7,4 25,6 ±6,8
__ ___ число выполненных реакций количество ошибок
1-й день 2-й день 3-й день 1-й день 2-й день 3-й день
контроль 3,4 ±0,3 4,3 ±0,2 । 4,5 ±0,2 9,1 ±0,5 8,3 ±0,6 5,8 ±0,6
опыт 3,6 ±0,3 4,5 ±0,2 4,7 ±0,2 8,2*±0,6 5,9** ±0,6 5,5* ±0,7
Влияние р-казоморфина-7 на поведение в тестах «приподнятый крестообразный лабиринт» и «принудительное плавание»
Третья серия экспериментов проводились на самцах белых крыс; всего было использовано 30 животных, из них 13 контрольных. В отличие от
предыдущих серий, когда опыты заканчивались к моменту полового созревания, в данном случае поведенческое тестирование происходило в возрасте 85—90 дней. Это позволило нам получить дополнительную оценку длительности влияния хронических инъекций 0-казоморфина-7 на поведение. Использовались тесты «приподнятый крестообразный лабиринт» и «принудительное плавание».
В результате проведенных измерений было выявлено, что даже через 2,5 месяца после последней инъекции пептида у крыс регистрируются изменения поведения, имеющие анксиолитическую направленность и позволяющие говорить об усилении ориентировочно-исследовательской активности.
В «приподнятом лабиринте» в наиболее значимой форме эффекты пептида проявились в виде увеличения количества выходов из темных отсеков в светлые. Животные, получавшие 0-к-7, также достоверно чаще переходили в конец светлых рукавов и свешивались с них (табл. 7.2). Кроме того, применение точного критерия Фишера позволило выявить значимые отличия от контроля в случае таких показателей как ЛП первого захода в темный отсек и количество выглядываний из темных отсеков. Общее время пребывания на свету за 3 мин наблюдений в опытной группе также было увеличено, однако отличие от контроля не достигло уровня достоверности.
Через 5 дней после тестирования в «приподнятом лабиринте» сведение животных оценивалось в ситуации «принудительное плавание». При этом в течение 10 мин регистрировалось суммарное время активного и пассивного плавания, а также иммобилизации. Выявлено, что поведение крыс, получавших [3 -казоморфин-7, в этой ситуации характеризуется ослаблением депрессивных проявлений. Время активного плавания у опытных животных было значимо больше, по сравнению с контролем, и напротив, время иммобилизации (полной неподвижности) — достоверно сокращено (рис. 7.5).
Проведенные еще через неделю тесты на болевую чувствительность («горячая пластина» при t=56°C; оценка латентного периода первого лизания задней лапы) и физическую выносливость (помещение на «вертикальную сетку»; оценка времени удержания) не выявили каких-либо отличий между контрольной группой и животными, получавшими в раннем постнатальном периоде 0 -казоморфин-7.
Таблица 7.2. Влияние хронического введения fi-казоморфина-7 (1—14-й дни после рождения) на поведение в крестообразном приподнятом лабиринте (возраст 85 дней). В колонке, обозначенной «Р», приведены вероятности, рассчитанные по критерию Стьюдента; в скобках — достоверные отличия по точному критерию Фишера.
Параметр Контроль Опыт Р
ЛП захода в темный отсек, с 19,7±5,7 34,1 ±6,8 0,17(0,04)*
Общее время на свету, с 33,2±6,3 49,8 ±7,5 0,15
Количество стоек в темноте 6,2 ±0,6 6,8 ±0,5 0,46
Количество стоек на свету 0,1 ±0,1 0,3 ±0,14 0,28
Выглядывания из темных отсеков 3,4 ±0,5 5,2±0,6 0,06 (0,02)*
Переходы из темных отсеков в темные 0,9 ±0,2 1,3 ±0,2 0,28
Переходы из светлых рукавов в светлые 0,3± 0,15 0,6 ±0,2 0,21
Свешивания со светлых рукавов 3,5 ±0,6 6,6 ±0,5 0,01*
Количество выходов на светлые рукава 0,6 ±0,2 1,7±0,3 0,01*
Количество выходов в конец светлых рукавов 0,15 ±0,1 1,1 ± 0,2 0,01*
Влияние |3-казоморфина-7, вводимого в 10-23-й и 21-34-й дни жизни, на поведение детенышей крыс
Целью следующего раздела работы стало выяснение того, как изменение сроков введения Р -казоморфина-7 скажется на его отставленных поведенческих эффектах. Были выбраны частично перекрывающиеся интервалы инъекций — 10—23-й и 21 — 34-й дни жизни. Длительность введения осталась той же — 14 дней. Поведенческое тестирование проводилось в «открытом поле» в возрасте 35 и 49 дней в течение 5 мин со сменой освещенности и в возрасте 56 дней (2 мин при ярком свете и звонке).
В первой серии (введение пептида либо воды с 10 по 23-й дни после рождения) было использовано 100 детенышей нелинейных белых крыс обоих полов. Величина контрольной группы составила 51 животное.
Тестирование в возрасте 35 дней выявило незначительные по сравнению с контролем изменения в поведении животных, получавших Р -казо-
Рисунок 7.5. Влияние хронического введения бета-казоморфина-7 (1—14-й дни жизни) на поведение белых крыс в тесте «принудительное плавание».
Возраст животных — 90 дней. А — время активного плавания (сек); Б — время, пассивного плавания (сек); В — время иммобилизации (сек). Заштрихованные столбики — контроль, светлые — опытная группа. Отличия от контроля ср<0,01 отмечены **.
морфин-7. При этом влияние пептида на самцов и самок имело разную направленность. Так, самцы обнаруживали тенденции к увеличению пробега на 1-й минуте опыта и повышению количества стоек на 1-й и 3-й минуте. Напротив, самки демонстрировали пониженное число отходов от стенки арены на 1-й и 2-й минуте (р=0,045). У самок наблюдалось также уменьшение количества выходов в центр на 2-й минуте (р=О,ОЗ) и некоторое снижение горизонтальной активности. В последнем случае отличие от самцов, получавших пептид, достигало высокого уровня достоверности (р=0,007).
При тестировании тех же животных на 49-й день жизни обнаружена более высокая однородность эффектов 0 -казоморфина-7, которые проявлялись, прежде всего, в увеличении вертикальной активности (по сумме 5 мин регистрации; р=0,02). Наибольшие изменения наблюдались на 4-й минуте в минимально стрессогенных условиях (рис. 7.6); на 2-й и 5-й минуте отличия приобретали форму тенденций (р=0,08—0,09). Отмечено общее увеличение пробега опытных крыс, значимое в случае самок на 1-
Рисунок 7.6. Изменение вертикальной активности детенышей белых крыс в «открытом тле» со сменой освещенности (возраст 49 дней) в результате хронического введения бета-казоморфина-7 (1 мг/кг) в 10—23-й дни жизни.
/уанные представлены отдельно для самцов (слева) и самок (справа). По вертикали — число стоек; по горизонтали — минуты тестирования.
Контроль — прерывистая линия; опыт — сплошная линия. Отличия от контроля ср<0,05 отмечены *.
й мин опыта, а в случае самцов — на 4-й минуте (рис. 7.7, вверху). Кроме того, у самок наблюдалось возрастание числа отходов от стенки арены, достоверное на 1-й минуте наблюдений (рис. 7.7, внизу).
При тестировании на 56-й день жизни («открытое поле» при включении яркого света и звонка) самки опытной группы характеризовались несколько повышенной величиной двигательной активности; частота появления реакций затаивания оказалась у них достоверно ниже, чем в контроле (рис. 7.8, вверху слева). Отличия в количестве стоек были незначимы, однако также достаточно выражены (р=0,11; рис. 7.8, вверху справа). Наблюдалось, кроме того, достоверное повышение количества умываний.
У самцов, в отличие от самок, в стрессогенных условиях пробег в группе, получавшей 0 -к-7, снижался. Животные, при красном свете демонстрировавшие повышение уровня исследовательского поведения,
Рисунок 7.7. Изменение пробега (вверху) и числа отходов от стенки арены, (внизу) детенышей белых крыс в «открытом поле» со сменой освещенности (возраст 49 дней) в результате хронического введения бета-казоморфина-7 (1 мг/кг) в 10—23-й дни жизни.
Результаты представлены отдельно для самцов (слева) и самок (справа). По вертикали — величина параметра; по горизонтали — минута тестирования. Контроль — светлые столбики; опыт — темные. Отличия от. контроля с р< 0,05 отмечены *.
вели себя как более тревожные при использовании максимальной сенсорной нагрузки. Одновременно резко возросли половые различия: будучи незначимыми в контроле, они достигли уровня достоверности в опыте (рис. 7.8, отмечено#).
Рисунок 7.8. Изменение различных параметров поведения детенышей белых крыс при тестировании в течение 2 минут при ярком свете и звонке (возраст 56 дней) в результате отставленного влияния хронического введения бета-казоморфина-7 (10—23-й дни жизни).
По вертикали — величина параметров; по горизонтали — экспериментальные группы (самки либо самцы). Светлые столбики — контроль; темные — опыт. Отличия опытной группы от контрольной отмечены * (р<0,05); отличия самцов от самок отмечены# (р<0,05).
В экспериментах следующей серии было использовано 89 животных обоих полов, из них 42 контрольных. Первую инъекциюР-к-7 в дозе 1 мг/кг проводили в 21 день, и далее продолжали введение до 34 дня включительно. Поведение в «открытом поле» оценивалось по той же схеме, что и выше.
Рисунок 7.9. Изменение в зависимости от возраста различных параметров поведения самцов белых крыс при тестировании в «открытом поле» со сменой освещенности.
Светлые столбики — контроль-темные — опыт (введение бета-казо-морфина-7 в 21—34-й дни жизни). По горизонтали — возраст детенышей, по вертикали — величина параметров. А — выходы в центр арены (по сумме пяти минут регистрации). Б — горизонтальная активность (пробег) на 2-й минуте опыта. В — латентный период реакции в тесте «спуск с высоты», сек. Отличия опытной группы, от контрольной отмечены * (р<0,05).
Тестирование в возрасте 35 дней выявило заметное падение уровня исследовательской активности и повышение тревожности у самцов, получавших Р-к-7 (рис. 7.9). В «открытом поле» наиболее значимо было снижено общее число отходов от стенки арены и выходов в центр (р<0,01-0,02 за весь интервал наблюдений). Кроме того, был несколько уменьшен пробег: р=0,11 по сумме 5 мин опыта и р=0,046 по ткф на 2-й минуте.
У самок, получавших инъекции пептида, в возрасте 35 дней при тестировании в «открытом поле» отличия от контроля не выявлялись. Можно отметить лишь тенденцию к повышению на 2-й минуте числа стоек (р=0,09).
В возрасте 49 дней у самцов, подвергшихся действию Р -к-7, значимые отличия от контроля отсутствовали, т.е. произошло угасание эффектов пептида (рис. 7.9). В то же время у самок расхождения в поведении опытной и контрольной групп заметно усилились. У животных, получавших Р -к-7, отмечено увеличение стоек на 4-й минуте и по сумме всего времени регистрации, значимый рост выходов в центр арены и пробега (в последнем случае — на 3-й минуте опыта; рис. 7.10).
Рисунок 7.10. Изменение в зависимости от возраста различных параметров поведения самок белых крыс при тестировании в «открытом поле» со сменой освещенности.
Светлые столбики — контроль; темные — опыт (введение бета-казо-морфина-7 в 21—34-й дни жизни). По горизонтали — возраст детенышей; по вертикали — величина параметров. А — вертикальная активность (по сумме пяти минут регистрации). Б — горизонтальная активность (пробег) на 3-й минуте опыта. В — выходы в центр арены (по сумме пяти минут регистрации). Отличия опытной группы от контрольной отмечены * (р<0,05).
Результаты тестирования животных в стрессогенных условиях в возрасте 56 дней представлены на рис. 7.11. Можно отметить, что у самцов после хронического введения р -к-7 обнаруживается достоверное снижение суммарного (за 2 мин) пробега. Остальные регистрируемые в «открытом поле» показатели значимо не отличались от контрольного уровня. У самок, которые получали пептид, не только горизонтальная, но и вертикальная двигательная активность были достоверно увеличены. Кроме того, отмечено значимое уменьшение груминга.
При сравнении самцов с самками оказалось, что контрольные животные разных полов практически не отличаются друг от друга по поведению в «открытом поле» в стрессогенных условиях. Напротив, между самцами и самками, которым в течение двух недель вводили р -к-7, выявлены достоверные отличия в случае суммарной горизонтальной и вертикальной двигательной активности (рис. 7.10, отмечено #), а также количества отходов от стенки арены (1,3±0,4 и 2,2±0,45. соответственно; р=0,03).
Таким образом, в нашем распоряжении оказался материал, относящийся к отставленным эффектамр -казоморфина-7, вводимого в трех воз-
Рисунок 7.11. Изменение различных параметров поведения детенышей белых крыс при тестировании в течение 2 минут при ярком свете и звонке (возраст 56 дней) в результате отставленного влияния хронического введения бета-казоморфина-7 (21—34-й дни жизни).
По вертикали — величина параметров; по горизонтали — экспериментальные группы (самки либо самцы). Светлые столбики — контроль; темные — опыт. Отличия опытной группы от контрольной отмечены * (р<0,05); отличия самцов от самок отмечены# (р<0,05).
растных интервалах: 1 — 14, 10—23 и 21—34-й дни после рождения (Ду-бынин с соавт., 2000). Результаты его обобщения представлены в табл. 7.2 на качественном уровне. Количественный их анализ потребовал применения ANOVA-методов (после нормирования по соответствующим значениям контроля).
Таблица 7.3. Отставленные изменения поведения детенышей белых крыс после хронической инъекции fl-казоморфина-7 в различные периоды по-стнаталъного онтогенеза. Поведение оценивалось отдельно у самок и самцов в экспериментальных ситуациях, различающихся по уровню стрессогенности в возрасте 49 и 56 дней. Обозначения:
+ — достоверные изменения нескольких поведенческих параметров,
оцениваемые как результат анксиолитического действия пептида (увеличение пробега, стоек, отходов от стенки арены);
(+) — достоверное изменение только одного поведенческого параметра, оцениваемое как результат анксиолитического действия пептида;
(-) — достоверное изменение только одного поведенческого параметра, оцениваемое как результат анксиогенного действия пептида (снижение пробега, стоек, отходов от стенки арены);
О — отсутствие достоверных изменений.
экспериментальная группа условия поведенческого тестирования время введения Р -казоморфина-7 (дни после рождения)
1 — 14-й дни 10—23-й дни 21—34-й дни
красное освещение (+) (+) (+)
САМКИ яркое освещение 0 + 4-
яркое освещение и звонок (-) (+) +
красное освещение + + 0
САМЦЫ яркое освещение + 0 0
яркое освещение и звонок 0 (-) (-)
При рассмотрении таблицы становится достаточно очевидно, что с увеличением возраста, в котором животные подвергались действию пептида, влияние р -к-7 на самок нарастает, а на самцов снижается. При этом у самок достаточно полное формирование поведенческого ответа на хро
ническое введение пептида происходит уже, видимо, в возрасте 10—23 дня. Отличия данной возрастной группы от группы с введением пептида на 1—14-й дни достоверны по многим показателям, зарегистрированным при ярком свете, а также ярком свете и звонке с р=0,01_0,05. У самцов наблюдается обратная динамика, и животные, получавшие р-к-7 на 10— 23-й день жизни, значимо отличаются как от группы с введением пептида в более старшем возрасте (в сторону снижения тревожности), так и от группы с введением в 1—14-й дни (в сторону роста тревожности).
Характер имеющихся данных позволил также использовать трехфакторную ANOVA-обработку (факторы: введение препарата, пол, срок введения). Показано, что лишь первый из них оказывает стабильное достоверное влияние на абсолютные и нормированные значения различных поведенческих показателей (р=0,01—0,05), в большинстве случаев более выраженное у самок. Вероятность принятия гипотезы об отсутствии влияния колебалась для фактора «срок введения» на уровне р=0,10—0,30, для фактора «пол» — на еще более высоком уровне.
Обнаруженные закономерности, по всей вероятности, являются следствием наложения эффектов пептида на два процесса: постепенное созревание опиоидной системы мозга, занимающее не менее 20—30 дней жизни, и одну из стадий половой дифференцировки, протекающую у самцов крыс во вторую неделю жизни (см. ниже).
В целом на основе приведенных выше данных можно заключить, что после инъекций р-казоморфина-7 в возрасте 1—14,10—23 и 21—34 дня: регистрируются отставленные изменения поведения детенышей белых крыс в «открытом поле», проявляющиеся в большинстве случаев в форме усиления исследовательской активности и снижения тревожности;
- происходят имеющие ту же направленность изменения реакций животных в тестах «приподнятый лабиринт», «принудительное плавание» и в ходе выработки навыков с положительным и отрицательным подкреплением;
- эффекты пептида не ослабевают в течение длительного (до 2,5 месяца после последней инъекции) периода наблюдений, что может служить доказательством влияния р-к-7 на процессы созревания нервной системы новорожденных крыс.
Наиболее вероятные механизмы данного влияния, по-видимому, носят нейротрофический характер. При этом можно допустить прямое действие р -к-7 (как фактора роста) на созревание различных нейромедиа-
Глава 7. Эффекты хронического введения р-казоморфина-7 детенышам крыс торных систем либо принять, что пептид изменяет эффекты «истинных» факторов роста нервов (ФРН), управляющих развитием мозга.
Оба предположения могут быть подкреплены данными литературы. Так, в работе Zagon с соавторами (2000) показано существование особых рецепторов, воспринимающих мет-энкефалин именно как фактор роста, причем структура этих мест связывания не имеет гомологии с классическими опиоидными рецепторами. Влияние энкефалинов на пролиферацию клеток нейробластомы чаще описывается как тормозящее, налоксона и налтрексона — как активирующее (Zagon, 1988; Lee, Wurst er, 1994). Что касается роста нейритов и дифференцировки нейронов, то здесь данные более противоречивы. Под действием опиоидных пептидов отмечается как замедление этого процесса (Davila-Garsia, Azmitia, 1990; Miller, Azmitia, 1999), так и его ускорение, сопровождаемое более интенсивной агрегацией нейронов (Kozlova, Kalentchuk, 1994) и формированием слоистых структур (Lindner et al., 1988).
В единственной подобной работе, проведенной с использованием Р -казоморфинов (конкретно — Tyr-Pro-Phe-Pro-Gly; Sakaguchi et al., 1998), выявлено стимулирующее действие пептида на рост нейритов клеток нейробластомы мыши. Эффект наблюдался при использовании пикомолярных концентраций и был налоксон-зависимым. При этом синтетические р -агонисты были активны только в микромолярных концентрациях, aS- и к-агонисты — вообще неэффективны.
Взаимодействие опиоидов и факторов роста основано на общности систем вторичных посредников, опосредующих их эффекты. В результате, например, для мет- и лей-энкефалинов, вводимых на фоне ФРН, показана способность усиливать выживание клеток нейрональных культур (Saka-guchi et al., 1999). Tenconi с соавторами (1996) продемонстрировано, что морфин, вводимый на фоне ФРН, в больших дозах подавляет, а в малых — активирует нейритогенез.
Приведенные данные подтверждают принципиальную способность Р-казоморфина-7 и его производных влиять на процессы созревания мозга новорожденных белых крыс. Какие конкретно структуры и нейрохимические процессы при этом затрагиваются — остается пока неизвестным. Судя по литературе, наиболее чувствительным хроническому действию опиоидов является онтогенез моноаминерги-ческих систем мозга (Vathy et al., 1995; Robinson et al., 1997). Как будет показано в конце этой главы, имеющиеся в наличии факты позволяют говорить об изменениях при повторных инъекциях р -казоморфина-7,
по крайней мере, серотонинергических проекций в мозжечок и кору больших полушарий.
Возможен еще один путь развития нейротрофических влияний р -казоморфинов. Это ситуация, когда пептид воздействует на медиаторную систему X, в свою очередь влияющую на некоторый механизм, который собственно и вызывает устойчивые изменения нервных структур. Рассматривая такой вариант, мы оказываемся в рамках представлений о каскадных эффектах регуляторных пептидов, отражающих реальную сложность нейрохимических взаимодействий (Ашмарин, Каразеева, 1999; Королева, Ашмарин, 2000). Возможность подобных (скорее всего, множественных) последствий введения р -казоморфинов более чем вероятна, что подтверждается существованием рассмотренных в главе 2 путей влияния опиоидов на другие нейромедиаторные системы.
Переходим к следующей проблеме — половым различиям в наблюдавшихся эффектах. Речь идет не просто о тонких расхождениях, но о явно прослеживающейся возрастной динамике, итоговая оценка которой представлена в табл. 7.2.
Как уже отмечалось, комплекс полученных данных свидетельствует о том, что с увеличением возраста, в котором животные подвергались действию пептида, влияние р -к-7 на самок нарастает, а на самцов снижается. Выявленные феномены, по нашему мнению, являются следствием наложения действия пептида на процесс половой дифференцировки, одна из стадий которой протекает у самцов крыс во вторую неделю жизни. Происходящее в это время увеличение синтеза андрогенов способно вызвать значительное подавление активности опиоидной системы.
Действительно, постнатальное развитие многих мозговых структур находится под контролем андрогенов, секретируемых семенниками (Maggi et al., 1991; Mateo et al., 1992). В эндокринологии это явление определяется как «гормональный импринтинг» (Розен, 1994) — процесс, устанавливающий базальный уровень активности нервных центров, запускающих широкий круг врожденных поведенческих реакций.
Известно, что нейроэндокринная система, как и эндогенная опиоидная система мозга, к моменту рождения созревает не полностью. Однако половые стероиды очень рано получают возможность влиять на экспрессию и плотность опиоидных рецепторов. Специфические андроген- и эстро-ген-связывающие сайты присутствуют в преоптической области гипоталамуса крыс в продолжении всего критического периода половой дифференцировки мозга (Vito, Fox, 1981). Концентрация эстрогеновых
Глава 7. Эффекты хронического введения р-казоморфина-7 детенышам крыс рецепторов увеличивается приблизительно в 6 раз в течение последней недели внутриутробного развития, достигая взрослого уровня к моменту рождения. Концентрация андрогеновых рецепторов растет в поздние сроки эмбрионального развития незначительно; ее уровень постепенно повышается до взрослого в течение нескольких недель после рождения.
Сенситивный период, во время которого под влиянием половых гормонов происходит необратимая дифференцировка мозговых структур, у крыс начинается через несколько дней после рождения и в основном заканчивается к 10—12-му дню жизни (Becu-Villalobos et al., 1997). Самки, получающие в это время андрогены, в значительной мере утрачивают способность к секреции гонадотропин-рилизинг-гормона в ответ на эстрогеновую стимуляцию. Тестостерон способен воздействовать на нервные субстраты и позже данного периода, маскулинизируя эндокринные и поведенческие функции (его введение эффективно в 15—ЗО-й дни после рождения).
Maggi с соавторами (1991) было исследовано, как наличие либо отсутствие тестостерона в ранний постнатальный период влияет на гипоталамические опиоидные рецепторы ц-типа. Показано, что на 16-й день жизни у крыс всех групп число ц-рецепторов примерно одинаково. На 26-й день оно значительно увеличилось у нормальных самок. На 60-й день количество ц-рецепторов продолжало расти у нормальных самок, но параллельно увеличилось, достигнув того же уровня, у неонатально кастрированных самцов. У нормальных самцов и андрогенизированных (получавших тестостерон) самок какие-либо изменения отсутствовали. Следовательно, можно говорить о существовании андроген-зависимого полового диморфизма гипоталамических ц -рецепторов.
Обнаружено также, что в медиальной преоптической области на 6-й день после рождения у самок (но не у самцов) наблюдается значительное увеличение связывания налоксона (Hammer, 1985). Неонатально кастрированные самцы демонстрируют аналогичное увеличение связывания. С другой стороны, инъекции тестостерона самкам в 1—6-й дни жизни приводят к сохранению низкой плотности опиоидных рецепторов.
Таким образом, неоднородность отставленных эффектов Р-к-7, является, видимо, вполне закономерным проявлением полового диморфизма В результате можно наблюдать, как развивающаяся опиоидная система самок во все более явной форме реагирует на вводимый пептид. У самцов активность опиоидной системы подавляется андрогенами, что постепенно ослабляет реакцию на Р-к-7.
Хорошо известно, что даже в случае животных, не подвергавшихся каким-либо фармакологическим, стресирующим и прочим воздействиям, мозг взрослых самок и самцов различен. Помимо морфологических и нейрохимических показателей, это проявляется на уровне поведенческих реакций. По данным Hamad (1995) самки, по сравнению с самцами, при тестировании в «открытом поле» проявляют меньшую тревожность и более высокую исследовательскую активность. Они совершают меньше ошибок в лабиринтах с пищевым подкреплением и хуже обучаются условным реакциям пассивного и активного избегания. Половой диморфизм распространяется также на агрессивность, структуру сна, мышечный тонус (Розен, 1994).
В нашем случае половые различия контрольных животных оказались не слишком велики и почти не достигали уровня достоверности. Это, видимо, связано с относительно небольшим возрастом тестированных после хронического введения препаратов крыс — в большинстве случаев до двух месяцев. Анализируя полученные данные, можно заключить, что на подобном фонер-казоморфин-7 нередко действует на поведение животных в направлении увеличения половых различий.
С определенной долей осторожности сделанные выводы могут быть распространены и на человека, поскольку в женском молоке присутствуют р -казоморфины, обнаруживаемые после кормления в организме новорожденных (Pasi et al., 1993). При этом опиоидная система младенца, в отличие от детеныша крысы, уже практически сформирована (см. главу 2) и, следовательно, у Р -казоморфинов есть значительные возможности для реализации регуляторного и модулирующего действия.
Характерно, что отставленные последствия хронического введения р -казоморфина-7 детенышам крыс очень близки к эффектам его однократных инъекций (в т.ч. взрослым животным): усиление исследовательской деятельности и уменьшение тревожности, снижение депрессивных проявлений, улучшение обучения с положительным подкреплением и ухудшение — с отрицательным. Следовательно, мы имеем дело с ситуацией, когда вводимый в раннем постнатальном периоде пептид «подталкивает» развитие нервной системы в том же направлении, в котором действует на взрослых крыс. Подобная же специфика изменений описана для других групп регуляторных пептидов, известных своим влиянием на обучение и память — вазопрессина, АКТЕ и их фрагментов (Воскресенская, Каменский, 2007; Виленский с соавт., 2007; Левицкая, 2007).
Отметим также, что отставленные эффекты Р-казоморфина-7 в значительной мере зависят от той экспериментальной ситуации, в которой проводится тестирование. Наибольшее количество значимых отличий от контроля зарегистрировано в минимально стрессогенных условиях (красное освещение). При «средней» нагрузке (яркий свет на 1—3 мин тестирования в «открытом поле») их количество также остается значительным Однако при ярком свете и звонке у тех же животных часто наблюдалось ослабление, а в ряде случаев — обращение эффекта пептида. Следовательно, хотя зарегистрированные нами отставленные изменения поведения под действием хронически вводимого Р -к-7 являются стабильными и воспроизводимыми, их выраженность существенно меняется при изменении условий среды. Это позволяет поведению животных в целом сохранять необходимый уровень пластичности.
Завершим данную главу описанием работы, выполненной благодаря участию сотрудников кафедры биофизики Биологического факультета МГУ Е.Н. Гончаренко и С.В. Шестаковой. С использованием методов спек-трофлюориметрии ими определялось содержание серотонина в различных отделах головного мозга крыс, получавших в раннем постнатальном периоде инъекции р -к-7 и налоксона (Дубынин с соавт., 1999). В первой серии экспериментов оценивалось влияние на содержание серотонина Р-к-7, хронически вводимого в 1—14-й дни после рождения (доза 1 мг/кг). Декапитация животных проводилась в возрасте 63 дня. Показано, что в стволе (продолговатый и средний мозг, мост) и промежуточном мозге концентрация медиатора в группе с введением пептида значимо от контроля не отличалась. Вместе с тем, в мозжечке было выявлено достоверное понижение уровня серотонина по сравнению с контролем (с О,53±О,О5 до 0,42±0,03 мкг/г). Одновременно наблюдалось незначимое, но достаточно выраженное (р=0,09 по ткФ) повышение содержания медиатора в коре (с О,57±О,ОЗ до О,65±О,О5 мкг/г). В целом же происходило достоверное изменение баланса в содержании серотонина между конечным и задним мозгом.
Во второй серии экспериментов оценивалось содержание в ЦНС серотонина после хронических инъекций р-казоморфина-7 в 10—23-й постнатальные дни (доза 1 мг/кг). Показано, что пептид, вводимый в эти сроки, не оказывает влияния на содержание серотонина в мозжечке крыс; в коре было отмечено недостоверное увеличение уровня медиатора (р=0,07 по ткФ).
В третьей серии оценивались изменения содержания серотонина после хронического введения налоксона (доза 1 мг/кг) в 21—34-й дни после рождения — т.е. в сроки, когда были обнаружены его отставленные поведенческие эффекты (см следующую главу). Показано, что налоксон снижает уровень медиатора в коре, мозжечке и стволе, но не изменяет его в промежуточном мозге. Однако большинство эффектов не достигало уровня достоверности (р=0,10—0,15); и лишь в коре больших полушарий уменьшение содержания серотонина было значимым: 0,44±0,09 мкг/г по сравнению с 0,64±0,09 мкг/г в контроле.
В целом можно заключить, что хроническое введение р -казоморфина-7 вызывает не только отставленные поведенческие, но и отставленные нейрохимические изменения. Вместе с тем, обращает на себя внимание их относительно небольшая выраженность, что указывает на «мягкий» характер воздействия гептапептида на процессы созревания серотонинергической системы мозга.
Можно констатировать определенное соответствие между полученными результатами и данными других исследователей. Так, в работе Robinson с соавторами (1997) детеныши получали метадон в 7—21-й дни жизни. Показано, что в результате происходит рост содержания серотонина и его метаболитов в теменной коре больших полушарий. Lesage с соавторами (1996) исследовали уровень обмена целого ряда медиаторов в гипоталамусе новорожденных крыс после хронических пренатальных инъекций морфина. Найдено, что в случае норадреналина и нейропептида Y этот уровень остается неизменных; в случае серотонина — возрастает, причем эффекты более выражены у самок.
По данным Suzuki с соавторами (1988) системное введение налоксона в первые три недели жизни вызывает снижение концентрации серотонина в коре и повышение его содержания в таких зонах, как мост и стриатум В сходной работе De Cabo с соавторами (1994) показано, что системное хроническое введение налтрексона в 1—14-й (но не в 1—7-й) дни жизни вызывает снижение обмена серотонина в среднем мозге, гипоталамусе и стриатуме.
Выше мы обсуждали результаты оценки поведения детенышей крыс, получавших р-казоморфин-7 в первые недели жизни. Достаточно очевидным шагом было предположить, что зарегистрированные изменения уровня тревожности и исследовательской активности имеют гипоталамическую природу, поскольку именно с этой областью ЦНС связано функционирование центров большинства биологически значимых
Глава 7. Эффекты хронического введения Р-казоморфина-7 детенышам крыс потребностей. Для гипоталамуса, кроме того, наиболее легко допустима возможность взаимодействия эффектов опиоидных фрагментов пищевых белков с влиянием половых гормонов (т.е. с процессами гормонального импринтинга).
Продолжим наши рассуждения с учетом данных по изменению под действием хронически вводимого 0 -казоморфина-7 содержания в ЦНС серотонина. Как показано выше, основные отличия от контроля обнаружены в коре больших полушарий и мозжечке. Первые, скорее всего, связаны с перестройкой таламо-кортикальных проекций, поскольку показано значение серотониновых терминалей для нормального созревания различных зон коры (Bennett-Clarke et al., 1995; Turlejski et al., 1997). Интересно, что Wegerer с соавторами (1999) зарегистрировали аналогичные эффекты антидепрессанта флуоксетина, который при хроническом введении детенышам крыс вызвал повышение уровня серотонина в коре. Оно было наиболее выражено в лобной доле и явилось следствием стимуляции роста стволовых серотонинергических проекций. Сходные результаты именно для лобной коры получены на взрослых животных (Hatanaka et al., 2000) и при исследовании синаптосом мозга человека (Jagadeesh, Subhash, 1998).
Лобная кора, как известно, является ключевой зоной, осуществляющей процесс «принятия решений» (по терминологии П.К. Анохина) и запускающей наиболее сложные (в том числе, сформированные в результате обучения) поведенческие программы. Следовательно, нейротропный эффект, внешне проявляющийся как результат смещения баланса мотиваций, может основываться на изменениях в деятельности не только гипоталамуса и систем подкрепления, но и лобной коры. В последнем случае оказывается изменен собственно процесс выбора оптимального поведенческого акта. Если такое предположение справедливо — мы может ожидать, что в случае человека последствия постнатального влияния 0-казоморфинов будут затрагивать всю структуру формирующейся личности ребенка.
Что касается изменений в результате хронического введения опиоидов уровня серотонина в мозжечке, то, к сожалению, в литературе мы не встретили подобной информации. Известно, что кора и ядра мозжечка находятся в сложном взаимодействии, и активность ГАМК-ергических клеток Пуркинье тормозит запуск и реализацию двигательных реакций, вовлекающих клетки зубчатого, промежуточного и фастигиального ядер. Следовательно, снижение тормозного действия серотонина на кору моз
жечка способно ослабить различные моторные реакции, на ядра — усилить их. Но если изменения содержания серотонина распределены по мозжечку равномерно, то, скорее всего, заметные отклонения в характере двигательной активности будут отсутствовать (что и наблюдалось в реальных экспериментах).
Завершая обсуждение данного вопроса, еще раз подчеркнем, что хронически вводимый в раннем постнатальном периоде Р -казоморфин-7 вызывает перераспределение серотонинергических проекций между различными зонами конечного и заднего мозга. При этом состояние образующих эти проекции нейронов, судя по стабильному содержанию серотонина в стволе, практически не затрагивается. Следовательно, процесс перераспределения, вероятно, идет за счет изменения прорастания соответствующих нейронных терминалей. Это, в свою очередь, может означать, что клетки-мишени коры больших полушарий и мозжечка в критический период синаптогенеза под действием Р -казоморфинов изменяют выделение соответствующих факторов роста, «привлекающих» серотонинергические проекции.
Глава 8. Хроническое введение аналогов бета-казоморфина-7
Данная глава посвящена описанию зависимости эффектов хронически вводимых аналогов Р -казоморфина-7 от их первичной структуры (Дубинин с соавт., 2007). Нами протестированы укороченные как с N-, так и с С-конца фрагменты: Р -казоморфин-5 (Tyr-Pro-Phe-Pro-Gly), Р -казомор-фин-6 (Рго-РИе-Рго-С1у-Рго-Пе),Р-казоморфин^4 (Phe-Pro-Gly-Pro). В отдельных сериях были исследованы последствия хронического введения малых доз налоксона и морфина (работы проводились совместно с ННЦ наркологии Росздрава), а также гептапептид семакс (Met-Glu-His-Phe-Pro-Gly-Pro), четыре последних аминокислоты которого совпадают с (3— 6) частью молекулы Р -казоморфина-7.
Эффекты хронического введения пентапептида Tyr-Pro-Phe-Pro-Gly
В опытах по изучению влияния Р -казоморфина-5 на поведение детенышей белых крыс было использовано 83 животных, из них 42 контрольных. Пептид вводился в 1—14-й дни после рождения в дозе 1 мг/кг. Тестирование проводилось в «открытом поле» в двух модификациях: в течение 2 мин при свете красной лампы (возраст 21 день) и в течение 5-ти мин со сменой освещенности (возраст 35 и 49 дней).
В возрасте 21 день в группе, получавшей Р -казоморфин-5 (р -к-5), пробег практически не отличался от контроля. Однако, если рассматривать только самок, то обнаруживается повышение пробега на 1-й мин теста (26,1±2,4 по сравнению с 21,8±2,3 в контроле; р=0,04 по ткФ); в подгруппе самцов — напротив, наблюдается снижение горизонтальной активности (16,9± 1,5 и 22,6±2,2, соответственно; р=0,03); отличие между самцами и самками, получавшими пептид, значимо с р=0,002. Кроме того, в подгруппе самцов зарегистрирована тенденция к уменьшению числа отходов от стенки арены в течение всего времени регистрации (р=0.09).
На 35-й день жизни у животных, получавших Р-к-5, наблюдалось некоторое повышение числа отходов от стенки арены на 1-й минуте опыта (р=0,07). Отличия пробега и количества стоек в опытных и контрольных
группах были слабо выражены. Лишь в подгруппе самок, получавших пептид, вертикальная активность на 4-й минуте (красный свет) была снижена и составила 1,8±0,4 по сравнению с 3,4+0,8 в контроле (р=0,06). В возрасте 49 дней какие-либо различия опытных и контрольных групп отсутствовали.
При выработке УРПИ (43—47-й дни жизни) латентный период перехода в темный отсек при воспроизведении навыка составил 91,0+11,5 с и 102,5111,9 с в получавшей р-к-5 и контрольной группах, соответственно (р=0,48); время нахождения в темном отсеке — 68,4+9,8 с и 63,7± 10,9 с (р=0,74).
Таким образом, отличия от контроля, которые могли бы свидетельствовать об изменении баланса оборонительной и исследовательской мотиваций, обнаруживались в этой серии только в возрасте 21 день, причем их направленность зависела от пола животных. Подобный эффект не наблюдался в случае Р -казоморфина-7, вводимого в возрасте 1—14 дней. Однако, как показано ниже, сходные изменения выявлены при повторных инъекциях Л4алой дозы морфина.
Эффекты хронического введения гексапептида Pro-Phe-Pro-Gly-Pro-Ile
В опытах по изучению влияния Р -казоморфина-6 на поведение детенышей белых крыс было использовано 91 животное, из них 48 контрольных. Введение препарата и тестирование проводились так же, как в случае р-к-5 (доза 1 мг/кг).
Обнаружено, что лишенный тирозина аналог Р -к-6 оказывает на животных весьма незначительное влияние, имеющее, тем не менее, характер увеличения исследовательской деятельности и снижения тревожности. При тестировании на 21-й постнатальный день отмечено увеличение горизонтальной активности с 41,8±2,3 в контроле до 47,512,5 в опыте (по сумме двух минут наблюдений; р=0,02 по ткФ; более выражено у самцов). В подгруппе самок было также повышено количество отходов от стенки арены (р=0,03). Помещение в «открытое поле» на 35-й день жизни показало, что эффекты пептида сохраняются лишь у самцов. В соответствующей опытной группе был повышен пробег на 2-й минуте (10,7±1,4 по сравнению с 7,511,1 в контроле; р=0,02 по ткФ); на 5-й минуте проявилась тенденция к увеличению вертикальной активности, числа отходов от стенки арены и выходов в центр (р=0,06—0,09).
Вместе с тем, на 49-й постнатальный день эффекты 0 -к-6 приобрели противоположную направленность: наблюдалось уменьшение числа стоек на 2—3-й минуте опыта (1,1±0,2 по сравнению с 2,1±0,3 в контроле; р=0,01; более выражено у самок), а также тенденция к снижению пробега в 1 —2 мин (более выражена у самцов).
При обучении крыс в тесте с отрицательным подкреплением (УРПИ) не выявлено каких-либо различий между животными, получавшими 0 -к-6 и контролем, а также между самцами и самками. Обучение с положительным (пищевым) подкреплением в сложном лабиринте позволило обнаружить незначительные отличия от контроля лишь в подгруппе самцов. Они проявились на 3-й день опыта и выразились в росте числа выполненных реакций и уменьшении ЛП выхода из стартового отсека. Однако, изменения данных параметров не достигали уровня достоверности (р=0,10—0,15).
Таким образом, можно заключить, что действие 0 -казоморфина-6 характеризуется той же направленностью, что и у 0 -к-7, только при первых двух тестированиях в «открытом поле». В дальнейшем изменения, наблюдавшиеся в группе, получавшей 0 -к-6, приобретали характер некоторого увеличения тревожности.
Эффекты хронического введения тетрапептида Phe-Pro-Gly-Pro
В опытах по изучению влияния 0-казоморфина-4 использовано 75 животных, из них 36 контрольных. Инъекции и тестирование осуществлялись так же, как в случае 0-к-6 (доза 1 мг/кг).
При помещении в «открытое поле» на 21 день жизни у крыс, получавших пептид, зарегистрирована лишь тенденция к повышению количества отходов от стенки арены на 1-й мин и выходов в центр на 2-й минуте (р=0,06_0,11). В возрасте 35 дней изменения поведения под влиянием пептида выражались в усилении исследовательской деятельности и наблюдались в основном у самок. В наиболее яркой форме они зарегистрированы на 3-й минуте опыта (достоверное увеличение горизонтальной и вертикальной активности; рис. 8.1, вверху). Количество отходов от стенки арены и выходов в центр оказалось значимо выше на 4-й минуте при смене яркого света на красный; рис. 8.1, внизу).
При тестировании на 49-й день жизни подобные изменения поведения оказались более выражены у самцов, получавших 0-к-4: наблюдалось устойчивое повышение вертикальной активности, максимально проя-
Рисунок 8.1. Изменение параметров поведенческой активности у самок крыс (возраст 35 дней) под влиянием хронически вводимого в 1— 14-й дни жизни бета-казоморфина-4.
По вертикали — величины, параметров в различные минуты тестирования в «открытом поле» со сменой освещенности. Отличия опытной группы от контрольной отмечены * (р<0,05).
вившееся на 4-й минуте (рис. 8.2, вверху). Количество отходов от стенки арены и выходов в центр было значимо выше на 4-й и 5-й минутах (рис. 8.2, внизу). В случае самок можно отметить увеличение отходов от стенки арены на 2-й минуте опыта (р=0,02) и тенденцию к росту пробега на 3-й минуте (р=0,11).
В ходе выработки УРПИ животные опытной и контрольной групп значимо не различались. Хронические инъекции пептида вызвали лишь неболь-
контроль опыт
Рисунок 8.2. Изменение параметров поведенческой активности у самцов крыс (возраст 49 дней) под влиянием хронически вводимого в 1— 14-й дни жизни бета-казоморфина-4.
По вертикали — величины параметров в различные минуты тестирования в «открытом поле» со сменой освещенности. Отличия опытной группы от контрольной отмечены * (р<0,05).
шое незначимое ухудшение обучения. В сложном лабиринте у животных, получавших Р -к-4, обнаружено заметное улучшение выработки рефлекса (рис.
8.3). Так, уже в 1-й день обучения особи опытной группы продемонстрировали увеличенное, по сравнению с контролем, число выполненных реакций. В 1 -й и 2-й дни у животных, получавших Р -к-4, был уменьшен ЛП выхода из стартового отсека. Кроме того, во 2-й и 3-й дни влияние тетрапептида проя-
контроль опыт
Рисунок 8.3. Влияние бета-казоморфина-4, хронически вводимого 61—14-й дни жизни на обучение детенышей белых крыс в сложном лабиринте с пищевым подкреплением.
По вертикали — величины параметров в различные дни опыта. Возраст животных 51—53 дня. Отличия опытной группы от контрольной отмечены * (р<0,05).
ваялось в снижении числа ошибок (р=0,04 по ткФ по сумме двух дней). Основной вклад в описанные изменения вносит подгруппа самок.
Таким образом, из трех протестированных аналогов 0-казоморфина-7 воздействие на поведение детенышей белых крыс тетрапептида Phe-Pro-Gly-Pro оказалось, по крайней мере в поздние сроки, наиболее близким к последствиям введения прототипа.
Эффекты хронического введения семакса
В опытах по изучению влияния семакса (Met-Glu-His-Phe-Pro-Gly-Pro) на поведение детенышей белых крыс было использовано 77 животных, из них 37 контрольных Инъекции и тестирование осуществлялись так же, как в случае 0 -казоморфинов; ежедневно вводимая доза составляла 0,05 мг/кг.
В возрасте 21 день для животных, получавших семакс, показан рост количества выходов в центр «открытого поля» по сумме двух минут тестирования (0,4+0,1 по сравнению с 0,1±0,05 в контроле; р=0,04). Основной вклад в данный эффект внесли самцы опытной группы, которые совершили также несколько большее число отходов от стенки арены (р=0,06). Тестирование со сменой освещенности на 35 день жизни не выявило существенного влияния семакса на поведение самцов. В случае самок, получавших пептид, зарегистрировано повышение горизонтальной активности на 2—3-й минуте опыта (34,1±4,1 по сравнению с 23,5+2,8 в контроле; р=0,04). В возрасте 49 дней данный эффект в подгруппе самок сохранился; величина пробега по сумме 1—3 мин составила 24,9±4,2 в опыте по сравнению с 14,3+3,2 в контроле (р=0,02 по ткФ).
При выработке УРПИ в подгруппе самок, получавших семакс, обнаружено ухудшение обучения по сравнению с контролем. Как и в серии с введением 0 -казоморфина-7, при повторном помещении в светлую часть экспериментальной камеры они быстрее переходили в темный отсек (106,4+11,8 с по сравнению с 123,6± 16,3 с в контроле; р=0,01 по ткФ). В подгруппе самцов таких изменений отмечено не было.
Обучение в сложном лабиринте не выявило четкой картины воздействия семакса на выработку пищедобывательного навыка Число выполненных реакций и количество ошибок оказались практически равными у животных разных групп. Отмечено лишь снижение ЛП выхода из стартового отсека у крыс, получавших семакс: в 1-й день обучения его величина составила 50,0+8,2 с по сравнению с 60,9±10,4 с в контроле (р=0,049 по ткФ); во 2-й день обучения — 35,7+7,9 с и 42,3+10,1 с, соответственно (р=0,06 по ткФ). Данный эффект можно расценить как не приводящий к более успешному получению подкрепления рост исследовательской активности животных, подвергшихся инъекциям семакса.
В обобщенном виде результаты, полученные при тестировании в «открытом поле» представлены в таблице 8.1; в ней же для наглядности приведены данные по 0 -казоморфину-7. Анализ данных таблицы см. в заключительной части главы.
Эффекты хронического введения непептидных лигандов опиоидных рецепторов
Использованные в следующем разделе работы препараты являются очень хорошо изученными (в смысле различных составляющих физиологической активности) соединениями. Морфин, наиболее известный ц-агонист, и налоксон, неспецифический антагонист классических опиоидных рецепторов, уже многие годы служат веществами сравнения в различных (в том числе, поведенческих) экспериментах. Наиболее частый способ их применения •— разовые системные либо внутримозговые инъекции, изменяющие уровень различных мотиваций, болевой чувствительности, двигательной активности и др. Хроническое введение данных препаратов используется для исследования различных аспектов развития наркотической зависимости; в этом случае, как правило, применяются весьма высокие дозы (10 и более мг/кг). В наших экспериментах в задачу исследования входил анализ отставленных последствий хронического введения налоксона и морфина, как некой «точки отсчета», позволяющей оценить специфику эффектов 0 -казоморфинов. Следовательно, были выбраны заниженные дозы веществ сравнения, которые (как ожидалось) по своему действию будут сопоставимы с влиянием 0 -казоморфинов и не вызовут появления зависимости.
Таблица 8.1. Сводная таблица эффектов[3-казоморфина-7его аналогов и гептапептида семакс, вводимых в 1— 14-й дни жизни детенышей белых крыс. Составлена на основе данных, полученных при тестировании в «открытом поле». Обозначения — как в табл. 7.3.
возраст при тестирования ПОЛ 0-казо-морфин-7 0-казоморфин-5 0-казо-морфин-6 0-казо-морфин-4 семакс
21 день самцы + (-) (+) 0 (+)
самки (+) (+) (+) 0 0
35 дней самцы (+) 0 (+) 0 0
самки (+) 0 0 + (+)
49 дней самцы самки + 0 (-) + 0
(+) 0 (-) (+) (+)
Как известно, системно вводимый морфин проявляет анальгетическую активность, начиная с 1 —2 мг/кг. Для Р -казоморфина-7 аналогичные по эффектам количества — 10—20 мг/кг, т.е. на порядок больше. Исходя из этого соотношения, для хронического применения был использован морфин в дозе 0,1 мг/кг, что также на порядок отличается от использованного в аналогичных целях количества Р -к-7. Что касается налоксона, то для его хронического введения была выбрана доза 1 мг/кг — наименьшая из стандартно применяемых для проверки опиоидных свойств различных физиологически активных соединений. Было проведено по две серии экспериментов как с морфином, так и с налоксоном; препараты вводились в 1—14-й и 21—34-й дни жизни.
В первой серии было использовано 82 животных, из них половина контрольных. Инъекции морфина либо воды начинали через сутки после рождения, и продолжали в течение 13 дней. Поведенческое тестирование проводилось по той же схеме, что и в случае Р -казоморфинов.
В возрасте 21 день выявлено разнонаправленное влияние препарата, вводимого в первые две недели жизни, на самок и самцов. В подгруппе самцов на 2-й мин теста количество отходов от стенки арены и выходов в центр было понижено (0,3±0,1 и 0,1±0,05 по сравнению с 0,8±0.2 и 0,5+0.2 в контроле; р=0,02 и 0,048, соответственно). Также наблюдалось некоторое снижение горизонтальной активности (р=0,06 по ткФ). Напротив, у самок, получавших морфин, количество отходов от стенки арены и выходов в центр было повышено (хотя отличия от контроля не достигали уровня достоверности: р=0,10—0.15).
К 35 дню жизни указанные изменения становились более выраженными. У самцов снижение пробега проявлялось в течение всего периода наблюдений (55,5±6,5 по сравнению с 79,4+9,1 в контроле; р=0,01). Также за 5 мин тестирования было значимо уменьшено количество отходов от стенки арены, снижена вертикальная активность (р=0,06 по ткФ). У самок, получавших морфин, напротив, обнаружена тенденция к росту величины всех параметров двигательной и исследовательской активности в «открытом поле». При этом различия между самками и самцами экспериментальных групп оказались высоко достоверны (особенно на 3—5-й минуте тестирования; рис. 8.4).
В возрасте 49 дней отличия от контроля ослабевали, однако общая направленность эффектов сохранилась. У самцов, получавших морфин, оставалась сниженной горизонтальная активность (р=0,08 по ткФ); у самок
Рисунок 8.4. Зависимое от пола изменение параметров поведенческой активности под влиянием морфина (0,1 мг/кг), хронически вводимого в 1— 14-й дни жизни детенышей крыс.
Возраст животных — 35 дней. Тестирование в «открытом поле» со сменой освещенности. Отличие самцов от самок опытной группы с достоверностью р<0,05 отмечено *, ср<0,01 — **. Обозначения: белые столбики — контрольные группы, темные — опытные группы.
опытной группы на 3-й минуте наблюдался рост числа стоек (0,5± 0,2 по сравнению с 0,1±0,1 в контроле; р=0,04).
В процессе выработки УРПИ в подгруппах самцов не найдено заметных отличий. У самок, получавших морфин, обнаружена незначимая тен
денция к улучшению обучения: при повторном помещении в экспериментальную камеру был увеличен латентный период перехода в темный отсек (148,5±13,8 с по сравнению с 114,7±16,2 с в контроле, р=0,14), а также уменьшено общее время нахождения в темноте (20,7±9,8 с в опыте по сравнению с 61,2±15,5 св контроле, р=0,052). В сложном лабиринте в подгруппе самцов наблюдалась тенденция к улучшению обучения в 1-й день эксперимента: число выполненных реакций было несколько увеличено, латентные периоды выхода из стартового отсека и выполнения реакции — снижены (р=0,10—0,16). В следующий день заметных отличий между опытной и контрольной группами не выявлено. На 3-й день опыта зарегистрировано снижение ошибок у всех животных, получавших морфин. В подгруппе самок величина параметра составила 3,4±0,8 в опыте по сравнению с 5,2±1,0 в контроле (р=0,11). В подгруппе самцов это отличие достигло уровня значимости: 3,5±О,8 в опыте по сравнению с 5,7±1,3 в контроле (р=0.045 по ткФ).
В следующей серии было использовано 73 животных, из них 36 контрольных. Инъекции морфина начинали в возрасте 21 день и осуществляли в течение еще 13 дней. Исследование особенностей поведения проводилось так же, как описано выше.
При тестировании на 35 день жизни, проводимом через сутки после последней инъекции морфина, зарегистрированы значительные различия между самками и самцами опытной группы (рис. 8.5). Для самок показано повышение вертикальной активности, достоверное на 1-й и 5-й минуте эксперимента (р=0,02_0,04); их пробег был значимо выше контроля по сумме 4—5 мин (р=0,02); число отходов от стенки арены и выходов в центр также было увеличено (р=0,08—0,15). У самцов, получавших морфин, можно отметить тенденцию к уменьшению пробега и стоек на 1-й минуте опыта. При этом выявлены достоверные отличия от соответствующей подгруппы самок (рис. 8.5, вверху). На 5-й минуте число отходов от стенки арены и выходов в центр у самцов опытной группы, в сравнении с самками, было снижено (рис. 8.5, внизу).
В 49 постнатальный день различий в двигательной активности опытной и контрольной групп не обнаружено. Значимо отличался только уровень груминга, причем у самок и самцов эффекты имели противоположную направленность. Так, у самцов число умываний на 1-й и 3-й минуте было достоверно повышено (р=0,02), а у самок — снижено на 1-й минуте теста (р=0,01).
Рисунок 8.5. Зависимые от пола изменение параметров поведенческой активности под влиянием морфина (0,1 мг/кг), хронически вводимого в 21— 34-й дни жизни детенышей крыс.
Возраст животных — 35 дней. Тестирование в «открытом поле» со сменой освещенности. Отличие самцов от самок опытной группы с достоверностью р<0,05 отмечено *, ср<0,01 — **. Обозначения: белые столбики — контрольные группы, темные — опытные группы.
В процессе выработки УРПИ у самцов, получавших морфин, обнаружена тенденция к ухудшению обучения (ЛП повторного перехода в темный отсек составил 116,4+17,9 с по сравнению с 142,9±17,1 с в контроле; р=0,17). В подгруппе опытных самок зарегистрированы противополож
ные изменения: 120,3± 14,9 с и 92.8±14,2 с, соответственно (р=0,09). При этом половые различия в группе, получавшей морфин, оказались достоверны (р=0,03).
При выработке пищедобывательного навыка в сложном лабиринте некоторое улучшение обучения обнаружено только в случае самок. На 3-й день у них оказалось увеличено число выполненных реакций, уменьшены латентный период выхода из стартового отсека и латентный период взятия подкрепления. Однако все эти изменения не достигали уровня значимости (р=0,11—0,14).
В первой серии с введением налоксона в 1—14-й дни жизни детенышей крыс было использовано 79 животных, из них 40 контрольных. Поведенческое тестирование проводилось в «открытом поле» по стандартной схеме.
Показано, что в возрасте 21 день поведение животных, получавших налоксон, практически не отличалось от контрольной группы по всем измеренным параметрам. Только в случае самок выявлено увеличение числа отходов от стенки арены на 1-й минуте наблюдений (0,8±0,3 по сравнению с 0,3±0,2 в контроле; р=О,О55), которое на 2-й минуте сменялось снижением величины показателя. В возрасте 35 дней у животных опытной группы наблюдалась тенденция к уменьшению пробега (на 3-й минуте; р=0,12), а также отходов от стенки арены и выходов в центр (на 4-й минуте; р=0,12-0,14). Отмеченные эффекты были выражены в основном за счет вклада подгруппы самцов: число выходов в центр на 4-й мин у них равнялось О,О5±О,О5 по сравнению 0,4+0,15 в контроле (р=0,03), а пробег на 3-й мин состави 4,0+1,2 и 8,5±2,3, соответственно (р=0.054).
В возрасте 49 дней зарегистрирован значимый рост груминга у всех опытных животных на 1-й минуте тестирования, когда эмоциональное напряжение максимально (р=0,03). Однако по другим поведенческим параметрам между самцами и самками, получавшими налоксон, существовали заметные различия. Эффекты в группе самок свидетельствуют скорее об увеличении исследовательской активности. Так, у них было значимо повышено количество стоек по сумме 2—4 мин регистрации (р=0,03), а также несколько возросло число выходов в центр арены (на 3-й минуте; р=0,13). У самцов же количество стоек проявило тенденцию к снижению на 1-й минуте (р=0,14), отходы от стенки арены в 1—2-й минуте опыта отсутствовали (по сравнению с 0,4+0,2 в контроле; р=0,02).
Рисунок 8.6. Изменение параметров поведенческой активности под влиянием хронически вводимого (21— 34-й дни жизни) налоксона в дозе 1 мг/кг.
Возраст животных 35 дней. По вертикали — величины параметров в различные минуты тестирования в «открытом поле» со сменой освещенности. Отличия опытных групп от контрольных отмечены * (р<0,05).
В заключительной серии было использовано 78 животных, из них 40 контрольных. Инъекции налоксона начинали в возрасте 21 день и осуществляли в течение следующих 13 дней.
Выявлено, что на 35-й день жизни, т.е. через сутки после последнего введения, препарат оказывает влияние на все показатели двигательной активности и исследовательской деятельности, регистрируемые в «от-
контроль опыт
контроль опыт
контроль опыт
Рисунок 8.7. Изменение параметров поведенческой активности под влиянием хронически вводимого (21—34-й дни жизни) налоксона в дозе 1 мг/кг.
Возраст животных 49 дней. По вертикали — величины параметров в различные минуты тестирования в «открытом поле» со сменой освещенности. Отличия опытных групп от контрольных отмечены * (р<0,05).
крытом поле». Наиболее значимым оказалось снижение пробега и количества стоек по сумме 1—3 мин наблюдений и собственно на 3-й минуте (рис. 8.6, вверху). Кроме того, выявлено уменьшение числа отходов от стенки арены и выходов в центр (1-я минута; рис. 8.6, внизу). Перечисленные изменения были наиболее выражены на начальной стадии опыта; в ходе дальнейшей регистрации (в том числе при смене освещенности)
они проявлялись слабо. Все отмеченные эффекты в более яркой форме наблюдались в подгруппе самок, достигая у них уровня достоверности (р=0,01—0,05). У самцов же отмечены только тенденции, имевшие, однако, аналогичную направленность (р=0,06—0,30).
Поведенческое тестирование в возрасте 49 дней доказало стабильность эффектов хронически вводимого налоксона. Вновь зарегистрировано снижение пробега, выходов в центр арены, а также вертикальной активности. Все изменения наблюдались на начальном этапе тестирования и для пробега были значимы на 2—3-й минуте; для выходов в центр арены и стоек — на 3-й минуте (рис. 8.7). Как и в возрасте 35 дней, более выраженный вклад в эти изменения вносила подгруппа самок. В подгруппе самцов наблюдалась лишь тенденция к снижению количества стоек (р=0,09 по ткФ).
В обобщенном виде полученные в ходе экспериментов результаты представлены в таблице 8.2; здесь же для наглядности приводятся данные по введению в соответствующие сроки Р -казоморфина-7. При рассмотрении таблицы привлекает внимание изменение характера действия всех препаратов в зависимости от времени инъекций. При этом введение в более позднем возрасте приводит к последствиям, которые могут быть оценены как относительно легко трактуемые. Действительно, эффекты ц-агониста морфина оказываются сходны с эффектами Р -к-7 (понижение тревожности у самок и повышение у самцов), а эффекты опиоидного антагониста налоксона — в значительной степени противоположны им (повышение тревожности у самок и слабые изменения у самцов).
Таблица 8.2. Сводная (по результатам тестирования в «открытом поле») таблица эффектов морфина и налоксона, вводимых в различные периоды постнатального развития в сравнении с эффектами Р-казо морфина-
7 (Р-к-7). Возраст Обозначе Пол ния — л введ в 1- р к 7 ак в табл. 7.3. ение препаратов 14-й дни жизни морфин | налоксон введ( в 21 р-к-7 ;ние препаратов -34 дни жизни морфин | налоксон
21 день самцы самки + (•) (-)_ (+) 0_ ° — —-
35 дней самцы (+) - (-) (-) (-) 0
самки (+) (+) 0 + + Z
49 дней самцы + (-) (-) 0 0 0
самки (+) (+) (+) + 0 -
Нами была предпринята попытка формализовать процедуру сравнения результатов, полученных в разных сериях опытов, для чего осуществлен (на полуколичественном уровне) непараметрический корреляционный анализ с применением критериев Спирмана (ранговый) и Кендалла. При этом данные таблицы 8.2 были переведены в балльную форму, где уровень контроля оценивался как нулевой; значительное и незначительное понижение тревожности — как 2 и 1 балл, соответственно; значительное и незначительное повышение тревожности — как -2 и -1 балл. В результате проведенных вычислений было показано наличие значимой положительной корреляции между эффектами вводимых в 21—34-й дни жизниР-к-7 и морфина (р=0,01 по Спирману и р=0,005 по Кендаллу), а также отрицательная корреляция между эффектами пептида и налоксона (р=0,005 по Спирману и р=0,004 по Кендаллу). Отрицательная корреляция между последствиями введения морфина и налоксона была близка к достоверной (р=0,13 по Спирману и р=0,052 по Кендаллу). Понимая некоторую условность такого статистического подхода, мы, тем не менее, считаем полезным применение подобных методов на заключительном этапе анализа данных, в частности — для сравнения результатов, полученных в разных сериях экспериментов и даже разными исследователями. Отметим также определенную степень сходства использованного нами преобразования с методами формализации физиологической информации при построении компьютерных баз данных (Королева, Ашмарин, 2000).
Рассмотрим теперь результаты, полученные при введении морфина и налоксона в возрасте 1—14 дней. По сравнению с инъекцией в 21—34-й дни, налоксон в этом случае действует слабее, а морфин — сильнее. Эффекты последнего по выраженности сравнимы с обнаруженными для Р -к-7. Однако, если влияние пептида на самцов и самок не различается, то в случае морфина и налоксона наблюдалась явная зависимость от пола. При этом эффекты морфина по направленности были аналогичны описанным в случае введения в возрасте 21—34 дня. Последствия же применения налоксона оказались сходны скорее с действием морфина, но не налоксона, вводимого в более поздний период постнатального развития.
Корреляционный непараметрический анализ показал, с одной стороны, наличие значимой положительной связи между эффектами морфина и налоксона (р=0,01 по Спирману и р=0,002 по Кендаллу); с другой — отсутствие такой связи в парах р -к-7 и морфин] и р -к-7 и налоксон] (в обоих случаях наблюдается слабая отрицательная корреляция с р=0,25—
0,55). Следовательно, при введении в 1 — 2-й недели жизни налоксон действует, скорее, как слабый агонист опиоидных рецепторов, что обычно характерно для его гораздо более высоких доз (10 и более мг/кг). Причину этого представить весьма сложно; не исключено, что она состоит в малом количестве опиоидных рецепторов, имеющихся у детенышей в этом возрасте, что вызывает очень плотную «оккупацию» налоксоном имеющихся мест связывания.
Дополнительную информацию дает корреляционный анализ, в котором учтены данные табл. 8.1. При этом выявляется, прежде всего, значительное сходство эффектов морфина и Р-казоморфина-5 — наиболее избирательного среди использованных нами аналогов Р-к-7 агониста ц-рецепторов. Эта связь оценивается как достоверная при использовании критерия Кендалла (р=0,02) и как близкая к значимой — при использовании критерия Спирмана (р=0,07). Если же говорить о сравнении с собственно Р -к-7, то в этом случае наибольшее совпадение с эффектами прототипа проявляет Р -казоморфин-4 (р=0,02 по Кендаллу и р=0,07 по Спирману); для Р -к-5 и Р -к-6 соответствующие значения вероятности ошибки не опускаются ниже 0,30.
Из всего сказанного можно заключить, что для проявления отставленных влиянийР-к-7, вводимого в 1—14-й дни жизни новорожденных крысят, очень важны опиоидные рецепторы не-ц-типов, а возможно даже — не-опиоидные рецепторы. Именно этим можно объяснить расхождение эффектов Р -к-7 с последствиями введения морфина и Р -к-5, а также сложный набор соответствий и несоответствий («противофазности») по отношению к эффектам налоксона. Особенно усложняют ситуацию изменения, отмеченные в подгруппе самцов.
Действительно, при объединении самок, получавших препараты как в 1 — 14-й, так и в 21—34-й дни жизни, наблюдается высокий уровень положительной связанности эффектов Р -к-7 и морфина (р=0,03 по Спирману и р=0,01 по Кендаллу), отрицательная корреляция в паре [р-к-7 и налоксон] (р=0,10 по Кендаллу) и отсутствие связи эффектов в паре [морфин и налоксон] (р=0,90—1,00). В случае самцов первая из перечисленных корреляций отрицательна, но незначима (р=0,11 по Кендаллу), вторая — отрицательна и значима (р=0,02—0,05), а третья — положительна и достоверна (р=0,01~ 0,03). Причину этого, видимо, как уже отмечалось, следует искать «интерференции» зарегистрированные нами поведенческих изменений и процессов полового созревания, имеющих чрезвычайную для созревания нервной системы детенышей-самцов.
Подведем краткие итоги. Как было показано, в случае 0-казоморфина-5 (Tyr-Pro-Phe-Pro-Gly) отличия от контроля, свидетельствующие об изменении уровня тревожности, обнаружены только в течение небольшого срока после окончания инъекций (в основном в возрасте 21 день). Они имели разную направленность у самцов и самок: в первом случае анксио-генную, во втором — анксиолитическую. Характер наблюдаемых изменений в большей степени оказался сходен с эффектами не Р-к-7, а морфина, вводимого в те же сроки. Причиной этого, видимо, служит то, что Р-к-5 является более избирательным лигандом ц -рецепторов (в сравнении с прототипом).
Напомним, что из природных эндогенных пептидов самым активным взаимодействием ср-рецепторами характеризуются эндоморфины, чья первичная структура довольно близка к строению Р-к-5. Впервые описанные относительно недавно (Zadina et el., 1997), эти пептиды обладают высокой анальгетической активностью (Zadina et al., 1999; Kamei et al., 2000; Tseng et al., 2000). В работе Asakawa с соавторами (1998), кроме того, продемонстрирована их способность при центральном введении увеличивать потребление пищи и снижать тревожность у мышей (тестирование в приподнятом лабиринте). В случае новорожденных крыс показано ингибирующее действие эндоморфинов на проведение болевых сигналов в спинном мозге (Sugimoto-Watanabe et al., 1999). Однако при этом иммуннореактивность к эндоморфинам отсутствует в 1—3-й дни жизни, появляется на 2-й неделе и окончательно формируется только в возрасте 21 день. Следовательно, становление «лигандной» части синаптической передачи в данном случае отстает от развития ее рецепторной составляющей. Сведения по последствиям хронического введения эндоморфинов экспериментальным животным в настоящее время отсутствуют.
Обратимся теперь к лишенным тирозина фрагментам Р -казоморфина-7. Как было обнаружено, влияние р-к-6 на поведение детенышей крыс нестабильно и сохраняет направленность прототипа лишь небольшое время. Этот факт можно объяснить тем, что именно N-концевой тирозин обеспечивает основное взаимодействие с опиоидными рецепторами. Тем не менее, после его удаления физиологическая активность пептида все же имеет место — как правило, в ослабленном и несколько измененном виде.
Вместе с тем, именно эффекты Р -казоморфина-4 оказались наиболее близки к влиянию прототипа (табл. 8.1). Подобное сходство, по нашему
мнению, говорит о способности фрагментов Р-казеина, содержащих N-концевой фенилаланин и минимальный гидрофобный С-концевой участок, влиять на опиоидные (и, возможно, не-опиоидные) места связывания, регулирующие процессы созревания мозга новорожденных. В поддержку этой идеи свидетельствуют данные статьи Ruthrich с соавторами (1994), проведших замену N-концевого тирозина вР-к-5 на фенилаланин. Показано, что полученный аналог и его производные сохраняют высокую анальгетическую активность. Особый интерес полученные факты представляют в свете открытия эндогенного регуляторного пептида, содержащего N-концевой фенилаланин — ноцицептина и специфических ORL1-рецепторов (см. главу 2).
Можно заключить, что в обеспечение описанного нами отставленного нейротропного действия Р -казоморфинов вносят свой вклад, по-крайней мере, два фактора: характеристики N-концевой аминокислоты и свойства С-хвоста. В первом случае наиболее предпочтительным является наличие тирозина, менее «эффективным» — присутствие фенилаланина (изменения ослаблены и для их развития требуется срок в 2—3 недели; вариант р-к-4), еще менее эффективным — присутствие пролина (в случае Р -к-6). Свойства остального участка пептидной молекулы труднее поддаются анализу. Тем не менее, очевидно благоприятным является наличие фенилаланина в 3-м (но не во 2-м, как у Р-к-6) положении.
Формирование более четких представлений о структурно-функциональных (с точки зрения отставленных эффектов) зависимостях в ряду Р -казоморфинов требует прямого анализа особенностей лиганд-рецепторных взаимодействий, что выходит за рамки данной работы. Тем не менее, еще раз подчеркнем, что даже классические опиоидные рецепторы характеризуются наличием множественных мест связывания и, видимо, способны взаимодействовать с несколькими лигандами одновременно. Кроме того, не исключено, что существует некоторое количество не-опиоидных рецепторов, на которые способны действовать Р-казоморфины и сходные с ними пептиды (Robertson et al., 1987; Zadina et al, 1990; Tang et al., 1999).
Исследование активности тетрапептида Phe-Pro-Gly-Pro актуально и по еще одной причине. Дело в том, что данная последовательность аминокислот используется для защиты от действия протеаз. Идея такой защиты принадлежит В.Н. Незавибатько, под руководством которого была осуществлена разработка и синтез гептапептида Met-Glu-His-Phe-Pro-Gly-Pro, первые четыре остатка которого являются фрагментом АКТГ(4~
7). В дальнейшем данный пептид стал основой для создания лекарственного препарата «Семаке».
Показано (Ашмарин с соавт., 1997), что семакс существенно стимулирует обучение животных в различных тестах, ослабляет амнезию, вызванную электрическим шоком, улучшает память и др. Удалось выявить значительное повышение под его влиянием выживаемости культур нервных клеток. Одной из областей применения семакса является терапия синдрома дефицита внимания и гиперактивности — наиболее распространенного отклонения психического развития у детей. Таким образом, выявление отставленных последствий воздействия данного гептапептида на развивающийся мозг представляет собой отдельную важную задачу.
Нами обнаружено, что введение семакса в 1—14-й дни после рождения вызывает достаточно слабые изменения поведения, распространяющиеся в основном на подгруппу самок. Общая картина этих изменений не сходна с эффектами ни одного из протестированных Р -казоморфинов (табл. 8.1). Малая выраженность наблюдавшихся изменений, по-види-мому, объясняется относительной неразвитостью системы меланокорти-новых (МС) рецепторов в ранний постнатальный период. Действительно, показано, что во врелш эмбриогенеза основную роль играют МС4-места связывания. Однако в дальнейшем на первое место выходят МСЗ-рецепторы, появляющиеся только в после рождения (Gantz et al., 1993; Kistler-Heer et al., 1998).
Выполненная с семаксом серия стала первым шагом в изучении последствий его хронического введения. В настоящее время в экспериментах, проводимых под руководством Н.Г. Левицкой, показано, что при более позднем сроке применения отставленные эффекты семакса значительно усиливаются. (Виленский с соавт., 2007), В целом можно заключить, что, несмотря на высокую степень гомологии (совпадение 4 аминокислот из 7), сходство в действии хронически вводимых р -казо-морфина-7 и семакса весьма невелико. Для более яркого проявления эффектов последнего требуются относительно поздние сроки введения, наблюдается иной характер зависимости изменений от пола животных, активны существенно меньшие дозы препарата.
Отдельным вопросом является сопоставление полученных нами данных с последствиями хронического введения опиоидов вообще. Как известно, в литературе можно найти значительное число работ по анализу наркотической зависимости, развивающейся в результате пре- и постнатальных инъекций морфина и сходных соединений. Однако в больший-
стве таких исследований опиоиды используются в количествах порядка 10-100 мг/кг, что существенно выше даже анальгетически активных доз, не говоря уже о дозах, способных воздействовать на тревожность, обучение и т.д.
Именно такие количества морфина и других наркотических анальгетиков вызывают обращение эффектов опиоидной системы (например, рост активности аденилатциклазы) и формирование зависимости. Если же мы остаемся в рамках «естественного» диапазона доз, сравнимого с реально присутствующими в организме количествами эндогенных опиоидов, то оказывается возможной модуляция состояния развивающейся опиоидной системы (и мозга в целом) без появления признаков зависимости.
Для изучения этого вопроса нами были проведены серии с повторным введением относительно низких доз морфина и налоксона Анализ полученных результатов показал, что после применения морфина в количестве 0,1 мг/кг никаких поведенческих нарушений, характерных для ситуации изъятия опиатов, не отмечается. В качестве подобных нарушений обычно описывают диарею, прыжки, клацанье зубами, встряхивания по типу «мокрой собаки». Все эти эффекты зарегистрированы, например, Jones и Вагг (1995) через сутки после последней из 6-ти ежедневных инъекций морфина в дозе 10 мг/кг. В качестве еще одного характерного примера можно привести работу Kirby и Holtzmann (1982), которые вводили морфин самкам крыс во второй половине беременности (20 мг/кг/день), после чего регистрировали изменения поведения детенышей.
Однако, несмотря на отсутствие признаков зависимости, отставленные последствия хронического применения морфина (и налоксона) в наших экспериментах были достаточно выражены. Показано, что при инъекциях в относительно позднем возрасте (21—34-й дни жизни — после завершения одной из стадий полового созревания и в момент окончания основного этапа формирования рецепторной части опиоидной системы) морфин и налоксон влияют на поведение детенышей крыс разнонаправленно — снижая и увеличивая тревожность, соответственно. Вместе с тем, эта разнонаггравленность в четком виде проявляется только у самок, опиоидная система которых, как уже обсуждалось, обладает в этот период большей чувствительностью.
Выраженность отставленных эффектов морфина, вводимого в 21—34-й дни жизни, оказалась относительно невелика, и через две недели после
последней инъекции они обнаруживались лишь при использовании УРПИ (но не в «открытом поле»). При инъекциях в 1—14-й дни после рождения влияние опиоида было существенно более сильным и длительным, сохраняясь в течение всего интервала наблюдений. Следовательно, в более раннем возрастном периоде ц-опиоидные рецепторы достаточно активно опосредуют нейротрофическое действие морфина, однако в дальнейшем такая способность ослабевает.
Налоксон, вводимый в I-14-й дни жизни, напротив, вызывал значительно менее выраженные изменения, чем при применении в 21 — 34-й дни. Можно предположить, что причиной этого является незрелость систем синтеза эндогенных опиоидов. В таком случае даже при наличии соответствующих рецепторов (на которые могут эффективно влиять вводимые извне агонисты), антагонист не проявляет свое действие, поскольку еще отсутствуют лиганды, с которыми он конкурирует.
В литературе можно найти примеры исследований, достаточно близких к нашей работе по использованным методам и характеру полученных результатов. Так, Najam и Panksepp (1989) сообщили, что хроническое введение налоксона (3—26-й дни, 5 мг/кг/день) не блокирует и не тормозит социальное развитие; соответствующие животные показали даже более быстрое приобретение homing-поведения, чем контроль. При этом в группе, которой в те же сроки вводился морфин (до 10 мг/кг), наблюдались задержки в физическом развитии (масса тела и время открытия глаз), становлении координации движений и социального поведения. Хроническое введение налтрексона усиливает вокализацию (тревожность) крысят, а в более позднем возрасте — снижает контакты с матерью и усиливает социальное взаимодействие (Meyerson, Berg, 1988). Антагонист в этих опытах применялся в 1—10-й дни после рождения (по 0,1 мк/кг). De Cabo с соавторами (1995) показали, что повторные инъекции налтрексона (1—30-й дни жизни, по 1 мг/кг) увеличивают у взрослых крыс уровень тревожности и эмоциональности, снижают исследовательское поведение.
Вернемся к результатам, полученным нами при введении морфина и налоксона в возрасте 1—14 дней. Как уже отмечено, по сравнению с введением в 21—34-й дни, налоксон в этом случае действует слабее, а морфин — сильнее. Эффекты последнего по выраженности сравнимы с обнаруженными для Р -к-7. Однако, если влияние пептида на самцов и самок было примерно одинаковым, то в случае морфина и налоксона на
блюдались заметные половые различия. При этом эффекты морфина по направленности оказались аналогичны выявленным в серии с введением в возрасте 21—34 дня. В отличие от этого, последствия применения налоксона были сходны скорее с эффектами морфина, но не налоксона, вводимого в более поздний период постнатального развития. Все сказанное подкрепляется результатами приведенного выше корреляционного анализа.
Сравнение обнаруженных изменений с эффектамиР-к-7 позволяет заключить, что отставленное влияние Р-казоморфина-7 на детенышей крыс реализуется не только через опиоидные ц -рецепторы. При введении в возрасте 21—34 дня, несмотря на достаточно четкое соответствие эффектам морфина, действие пептида имеет гораздо большую выраженность и длительность. После инъекций в 1—14-й дни жизни влияниер-к-7 на поведение отличается от выявленного для морфина по направленности. В этом случае оно, скорее всего, опосредуется через более широкий круг рецепторных структур, которые способны, кроме того, «воспринимать» действие тетрапептида Phe-Pro-Gly-Pro.
Возможные пути реализации отставленного действия Р-казоморфинов
В результате наших работ показано, что повторное поступление в организм опиоидных пептидов пищевого происхождения способно вызвать отставленные изменения поведения новорожденных. Очевидно, что острое (однократное) и хроническое применениеp-казоморфинов активируют разные молекулярно-клеточные механизмы, вопрос о конкретной сути которых во многом остается открытым. Исходя из данных литературы, существуют следующие наиболее вероятные пути воздействия хронически вводимых опиоидов на мозг:
влияние на рецепторы и внутриклеточные эффекторы;
влияние на системы факторов роста нервной ткани;
опиоиды могут функционировать как особые факторы нейритогенеза На клеточных моделях показано, что постоянное присутствие в среде ц- и 5-агонистов приводит к нескольким хорошо описанным адаптивным ответам, включая десенситизацию рецепторов (Kovoor et al., 1997), снижение рецепторной регуляции (Chakrabarti et al., 1997), интернализацию рецепторов (Keith, et al., 1996) и суперсенситизацию аденилатциклазы (Vachon et al., 1987).
Подробно перечисленные изменения описаны, в частности, в обзоре Jordan и Devi (1998). Десенситизация рецепторов определяет при этом как потеря функции при длительном воздействии агониста. Она может регулироваться многими факторами, вовлеченными в биологический ответ (эффекторами, рецепторами, вторичными посредниками).
Наиболее изучены в их ряду изменения активности аденилатциклазы. Показано, что хроническое воздействие морфина вызывает сначала падение концентрации цАМФ, за которым следует ее постепенное нарастание. Эффект опосредуется рецепторами, т.к. добавление антагонистов возвращает уровень цАМФ к начальному значению. В случае удаления морфина или добавления антагониста более, чем через 12 ч, концентрация цАМФ увеличивается даже выше исходного уровня («цАМФ-овершут»),
Показано, что хроническое воздействие агонистов снижает связывание рецептора с лигандом и «отделяет» систему от аденилатциклазы. Такое отделение наблюдали для ц- и 8-подтипов. Для к-сайтов хроническое воздействие агониста ведет к отсоединению рецептора от К+-канала задержанного выпрямления. Конкретные механизмы десёнситизации до сих пор остаются неясными. Большинство сигнальных каскадов может иметь отношение к десенситизации любого опиоидного рецептора, что не объясняет гетерогенность эффектов ц- и 8-агонистов. В качестве наиболее показательных ситуаций рассмотрим механизмы интернализации, негативной регуляции (down-regulation) и возможности модификации рецепторов.
Опиоидные рецепторы ц- и 8-типов, экспрессированные в разных клетках, подвергаются быстрой (в течение нескольких минут) интернализации при воздействии агониста. Этому процессу обязательно предшествует мономеризация. Показано, например, что 8-рецепторы существуют на наружной клеточной мембране в форме димера и моно-меризуются под влиянием агониста Для димеризации и интернализации важен С-конец молекулы рецептора; удаление нескольких аминокислот приводит к потере способности рецептора участвовать в этих событиях..
Для негативной регуляции характерна генерализованная потеря рецепторов на поверхности и внутри клетки. Предполагается, что ее причиной служит модуляция синтеза мРНК. Так, показано, что введение морфина вызывает значительное снижение мРНК ц -опиоидного рецептора в базальном гипоталамусе. Хроническое воздействие эторфина (неселективного ц- и 8-агониста) негативно регулирует 8-опиоидные рецепторы и мРНК.
Как известно, многие рецепторы, ассоциированные с G-белками (GPCRs), обеспечивают спонтанную фоновую активность G-белков и эффекторов даже в отсутствии агонистов (Lefkowitz et al., 2003). КакЗ- (Mer-kouris et al., 1997), так иц-(Burford et al., 2000; Liuet al., 2001) опиоидные рецепторы обладают такими свойствами, и изменения их конститутивной активности в ответ на длительное воздействие опиоидов может вносить вклад в развитие зависимости и/или толерантности (Wang et al., 2005; Liu, Prather, 2001). Как уже было сказано, хроническое воздействие опиоидных агонистов может отсоединять GPCRs от G-белков и последующих сигнальных каскадов (Tao et al., 1993).
Интерес представляет и тот факт, что опиоидные лиганды способны работать как фармакологические шапероны, увеличивая эффективность созревания «своих» рецепторов. Дело в том, что экспрессия последних на поверхности клетки частично регулируется эндоплазматическим ретикулумом (ЭПР), который является частью секреторных путей и местом процессинга рецепторов. ЭПР создает условия для правильной сборки и сворачивания белковых молекул; при нарушениях этого процесса белок перемещается в цитозоль, где разрушается в протеосомах.
Показано, что в ходе процессинга, например, ИЗ OR (человеческого 3-опиоидного рецептора) наблюдается очень много ошибок, ведущих к деградации неправильно собранного белка. В результате только около 40% синтезированных рецепторов достигают поверхности клетки. Petaja-Repo с соавторами (2002) обнаружено, что лиганды, обладающие способностью проникать через мембрану клетки, взаимодействуют с расположенными на поверхности ЭПР предшественниками hSOR. Это взаимодействие «спасает» рецепторы от деградации и приводит к росту их числа на поверхности клетки. Способны «спасать» hSOR из ЭПР как агонисты, так и антагонисты. Так, введение налтрексона приводит к двухкратному увеличению количества созревших h3OR.
Перейдем к влиянию опиоидов на факторы роста нервной ткани.
В работе Torregrossa с соавторами (2004) показано, что хроническое введение селективного 3-агониста BW373U86 не приводит (в отличие от морфина) к потере веса и физической зависимости. Однократное введение препарата вызывало клонические судороги у большинства животных и антидепрессантный эффект в тесте «принудительное плавание». В случае введения BW373U86 последовательно в течение двух дней ни у одного из животных судорог не наблюдалось, при этом антидепрессантный эффект сохранялся. При хроническом введении (8 дней либо 21 день) ан-
тидепрессантное действие уже не проявлялось, что доказывает развитие толерантности. Одновременно обнаружено, что однократное и 2-хднев-ное введение BW373U86 повышает уровень экспрессии мРНК BDNF в различных регионах мозга. При хроническом применении (8 дней) увеличение экспрессии мРНК BDNF сохранялось; в случае введения в течение 21 дня эффект исчезал Доказано, что 8-рецепторы могут включать MAP-киназный путь (Kramer et al., 2000; Persson et al., 2003), активация которого ведет к up-регуляции экспрессии мРНК BDNF.
Центральное введение пептидных агонистов 8 -рецепторов (лей- и мет-энкефалинов), как и применение BW373U86, оказывает антиде-прессантное действие и увеличивает экспрессию мРНК BDNF (Zhang et al., 2006). Введение 0 -эндорфина и эндоморфинов также значительно усиливает экспрессию мРНК BDNF во фронтальной коре, гиппокампе и миндалине. По-видимому, эти соединения увеличивают образование BDNF через активацию центральных ц-рецепторов, причем антиде-прессантных эффектов в тесте «принудительное плавание» в данном случае не наблюдается.
Известно, что BDNF участвует в механизмах синаптической пластичности, таких, как долговременная потенциация, обучение и память (Huang, Reichardt, 2001; Malcangio, Lessmann, 2003). В качестве важного фундаментального механизма действия BDNF отмечается его способность влиять на количественные характеристики выброса медиаторов путем модуляции распределения синаптических везикул в пресинапти-ческих терминалях (Гомазков, 2002). Также действие BDNF опосредуется через активацию рецепторов тирозинкиназы В (TrkB); известна фундаментальная роль BDNF-TrkB сигнального каскада в регуляции синаптической трансмиссии, важной для реализации функций обучения и памяти (Tyler, Pozzo-Miller, 2001).
Взаимодействие опиоидов и факторов роста основано на общности систем вторичных посредников, опосредующих их эффекты. В результате, например, для мет- и лей-энкефалинов, вводимых на фоне NGF, показана способность усиливать выживание клеток нейрональных культур (Saka-guchi et al., 1999). Особый интерес представляет работа Tenconi с соавторами (1996), в которой продемонстрировано, что морфин, вводимый на фоне NGF, в больших дозах подавляет, а в малых — активирует ней-ритогенез.
Имеются сведения и о прямом нейротрофическом действии опиоидов.
Известно, что эндорфины, а также морфиноподобные соединения, могут оказывать воздействие на развитие нервной системы, включая деление нейробластов, выживание и дифференцировку нервных клеток. В уже упоминавшейся работе Zagon с соавторами (2000) показано существование особых рецепторов (OGFr), воспринимающих мет-энкефалин именно как фактор роста, причем структура этих рецепторов не имеет гомологии с классическими опиоидными местами связывания. Влияние энкефалинов на пролиферацию клеток нейробластомы чаще описывается как тормозящее, налоксона и налтрексона — как активирующее (Zagon, 1988; Lee, Wurster, 1994). Что же касается роста нейритов и дифференцировки нейронов, то здесь данные более противоречивы. Под действием опиоидных пептидов отмечается как замедление этого процесса (Davila-Garsia, Azmitia, 1990; Miller, Azmitia, 1999), так и ускорение, сопровождающееся более интенсивной агрегацией нейронов (Kozlova, Kalentchuk, 1994) и формированием слоистых структур (Lindner et al., 1988).
В работе Sakaguchi с соавт. (2003) исследовалось действие ряда Р -казоморфинов и их аналогов на рост нейритов в культуре клеток нейробластомы. Фрагменты, начиная с Р-казоморфина-5 и заканчивая Р -казоморфином-9, а также р -казоморфин-5-амид стимулировали рост нейритов. Более короткие фрагменты (р-казоморфин-3, -4, -4-амид), а также более длинные (Р-казоморфин-13, -21) не оказывали подобного действия. При этом активность р-казоморфинов, увеличивающая рост нейритов, не коррелировала с их опиоидными свойствами (оценка производилась с использованием препарата подвздошной кишки морской свинки). Эффект наиболее активного Р -казоморфина-5 блокировался селективным ц -антагонистом СТОР или предварительным введением пер-туссин-токсина Таким образом, в этом случае стимулирующее влияние Р -казоморфинов на рост нейритов, скорее всего, опосредовано ц -типом опиоидных рецепторов.
В другой работе тех же авторов (Sakaguchi et al., 2001) исследовалось влияние Р -казоморфинов на выживание культуры эмбриональных нейронов дорзальных корешков цыпленка в присутствии NGF. Выявлено, что Р-к-5 и р-к-7 в пикомолярных концентрациях оказывают значимое стимулирующее действие на выживание нейронов. Предварительное введение налоксона или пертуссин-токсина снимало эффект Р -казоморфина-5, подтверждая тем самым его действие через опиоидные рецепторы, связанные с G-белками. С другой стороны, влияния р -казоморфин-4-амида (морфицептина) и des-Tyr-P-казоморфина-7 было очень слабым. В боль
ших концентрациях (микромолярный уровень) влияниеР-к-5 и Р-к-7 на выживание нейронов было намного более выражено, чем в случае мор-фицептина, хотя аффиность последнего к ц-рецепторам превосходит связывание пента- и гептапептида в 25 и 100 раз, соответственно.
Приведенные данные подтверждают принципиальную способность Р-казоморфинов влиять на процессы созревания мозга новорожденных белых крыс. Какие конкретно структуры и нейрохимические процессы при этом затрагиваются — остается пока неизвестным. Судя по литературе, наиболее чувствительным к хроническому действию опиоидов является онтогенез моноаминергических систем мозга (Vathy et al., 1995; Robinson et al., 1997). Имеющиеся в наличии факты позволяют говорить об изменениях при повторных инъекцияхР-казоморфина-7, по крайней мере, серотонинергических проекций в мозжечок и кору больших полушарий (см. главу 7).
В целом можно заключить, что разнообразие путей влияния хронически вводимых опиоидов на рецепторы и внутриклеточные эффекторы, а также системы факторов роста нервной ткани велико и мало изучено. Кроме того, опиоиды сами по себе способны функционировать в качестве стимуляторов либо ингибиторов нейритогенеза Все это объясняет обнаруженную нами способность Р-казоморфинов вызывать длительные отставленные изменения поведения детенышей крыс при применении в раннем постнатальном периоде. Не исключено, что подобные процессы наблюдаются и в реальных ситуациях — тогда, когда опиоидные пептиды проникают в организм новорожденного в составе пищевых белков (прежде всего, казеинов).
Глава 9. Бета-казоморфины и материнское поведение белых крыс
Нейроанатомическая основа материнского поведения
У большинства взрослых самок млекопитающих материнское поведение возникает немедленно после родов. Вместе с тем, ряд исследований показал, что истинная инициация материнской заботы происходит еще за 24 часа до них. Включение материнского поведения до родов опосредуется эндокринной системой; главную роль, по мнению Rosenblatt (1975), играет гормон яичников эстрадиол. Запуск материнского поведения после родов в меньшей мере зависит от гормональных факторов и регулируется, в первую очередь, стимулами, исходящими от крысят.
Комплекс материнских реакций у крыс состоит из четырех основных компонентов: ухаживание и приседание около детенышей, перенос крысят, облизывание их тела и гениталий, строительство гнезда Начало материнского поведения требует предотвращения (торможения) стремления матери опасаться (избегать) своих крысят. Такое торможение основывается на обонятельных характеристиках детенышей, а также ряде других присущих новорожденным сенсорных свойствах (вокализация, внешний вид) (Rosenblatt, 1975).
У самок с развитым материнским поведением мозг изменен в результате накопления опыта взаимодействия с крысятами. Морфологические изменения зарегистрированы, в первую очередь, в супраоптическом ядре гипоталамуса, которое содержит окситоцинергические нейроны, важные для лактации. Модификации наблюдаются не только у рожавших и кормящих самок, но и у сенситизированных крыс-девственниц, которым предъявлялись крысята (Modney et al., 1994). В супраоптических ядрах кормящих самок и сенситизированных девственниц отмечено увеличение количества дендритов, по сравнению с контрольными крысами-девственницами.
В результате повторных родов зарегистрирован также ряд нейрохимических изменений в мозге крыс. В частности, чувствительность самок к влиянию опиоидов изменяется как функция количества беременностей
и лактаций. Крысы, рожавшие и лактировавшие два и более раз, слабее реагируют на системное введение морфина, чем рожавшие один раз самки того же возраста (по параметрам материнского поведения и ноцицепции). Увеличение репродуктивного опыта с одного до двух выкормленных выводков приводит к тому, что медиальная преоптическая область (МПО) становится менее чувствительной к опиоидам. Причиной служит, по-видимому, зависимость плотности ц-рецепторов в МПО от количества беременностей и лактаций (Mann, Bridges, 1992).
За инициацию материнского поведения у крыс ответственны, в первую очередь, МПО и n. accumbens. Микроинфузия кокаина в эти структуры достоверно ослабляет его проявления (в качестве контроля использовалось введение в зоны, не участвующие в управлении родительской мотивацией — дорзальный стриатум и дорзо-медиальный гиппокамп) (Vemotica et al., 1999). Длительность облизывания детенышей дозозависимо снижал антагонист дофамина cis-flupenthixol, инъецируемый в прилежащее ядро и (в меньшей степени) в дорзомедиальный стриатум (Кеег, Stem, 1999). Li и Fleming (2003) было проведено электрическое разрушение скорлупы и сердцевины n. accumbens до родов либо непосредственно в послеродовой период. Материнское поведение тестировалось на 1-й и 9-й дни после родов с помощью предъявления детенышей. Полученные результаты показали, что именно разрушение скорлупы прилежащего ядра достоверно ухудшает поиск детенышей самкой.
Имеются данные о причастности связанного с вомероназальным органом bed nucleus дополнительного обонятельного тракта к регуляции материнского поведения. Такая регуляция, судя по всему, осуществляется путем воздействия на МПО. Показано, что послеродовом периоде у самок изменяется ГАМК-ергическая активность bed nucleus: повышается плотность ГАМКа рецепторов и уровень глутаматдекарбоксилазы (Rodriguez et al., 2004).
Ядра боковой уздечки необходимы, судя по всему, для включения материнского поведения негормональным путем. Для доказательства этого использовалась модель сенситизации (длительное предъявление крысят). Обнаружено, что у самок с удаленными яичниками и цитотоксическим повреждением нейронов боковой уздечки возникают значительные дефекты в переносе детенышей и строительстве гнезда. При этом обнюхивание и облизывание (показатели, характеризующие послеродовое поддержание уровня родительской мотивации) оставались неизменными (Felton et al., 1998).
Список структур, связанных с активацией материнского поведения, может быть дополнен некоторыми ядрами гипоталамуса (передние вентромедиальные, паравентрикулярные), VTA, орбитофронтальной корой, bed nucleus of stria terminalis и рядом структур ствола. Большинство из них будут упомянуты ниже при рассмотрении механизмов эндокринологической и нейрохимической регуляции родительской мотивации (Leckman, Herman, 2002).
Кроме этого, в головном мозге крыс обнаружены зоны, отвечающие за снижение выраженности материнских реакций. Такими свойствами обладают вомероназальный орган и первичная обонятельная система, регулирующие избегание детенышей самками-девственницами. Со снижением уровня родительской мотивации связана также миндалина. Обонятельные стимулы от крысят активируют в ней механизмы страха и тревоги, ингибируя материнское поведение у нерожавших самок (Leckman, Herman, 2002).
Гормоны и выраженность материнского поведения
Как уже было сказано, включение материнских реакций опосредуется, в первую очередь, эндокринной системой. Так, введение эстрогена, прогестерона и пролактина крысам с удаленными яичниками стимулирует запуск родительского поведения. Более того, такое поведение может быть запущено одним лишь эстрогеном, введенным периферически либо непосредственно в ЦНС (Felton et al., 1999). Структурой-мишенью является при этом боковая уздечка, которая содержит нейроны с эстрогеновыми рецепторами.
Широко исследуется влияние пролактина на уровень материнского поведения. В качестве примера можно привести работу, в которой изучались нерожавшие овариэктомированные самки. Опытным животным с 1-го по 11-й день инъецировали прогестерон, затем с 11-го по 17-й день — эстрадиол (имитация беременности). Затем крысам в боковой желудочек вводили различные дозы пролактина, что способствовало быстрому началу материнского поведения. Подкожно вводимый пролактин не оказывал такого действия. У самок, не получавших прогестерон и эстрадиол, внутрижелудочковая инфузия пролактина также не вызывала инициацию родительских реакций. Инъекция пролактина непосредственно в МПО крыс, подвергшихся предварительному введению стероидных гормонов, привела к резко выраженной стимуляции материнского поведе
ния (Bridges et al., 1990). Антагонисты пролактина (например, S1795-PRL, в котором остаток серин-179 заменен на аспартат) значимо затрудняют инициацию родительского поведения (Bridges et al., 2001).
Важную роль в запуске материнских реакций играет окситоцин, который синтезируется нейронами паравентрикулярного и супраоптического ядер гипоталамуса. Основная часть их аксонов направляется в гипофиз. Попадая далее в кровь, окситоцин влияет на выброс молока и сокращения матки при родах. Окситоциновые волокна нейронов крупноклеточной части паравентрикулярного ядра идут также в лимбическую систему, включая миндалину, bed nucleus of stria terminalis и латеральный стриатум (Leckman, Herman, 2002).
В ряде работ продемонстрировано облегчающее действие внутримозговых инъекций окситоцина на материнские реакции нерожавших крыс, подвергшихся предварительному влиянию эстрогена. Напротив, использование антагонистов окситоцина либо лизис продуцирующих его клеток подавляют начало родительского поведения (Leckman, Herman, 2002). Pedersen (1994) показал, что введение антагониста окситоцина в МПО и VTA вызывает блокаду переносов детенышей и нарушение позы, принимаемой самкой при кормлении.
Lin с соавторами (2003) исследовали вопрос о влиянии родов на экспрессию генов Fos и FosB в нейронах, содержащих рецепторы окситоцина у крыс. Активация Fos и FosB была обнаружена в МПО, bed nucleus stria terminalis и пириформной коре рожавших самок. Показано также, что роды вызывают активацию рассматриваемых генов в окситоцинер-гических нейронах.
Роль опиоидов в регуляции материнского поведения
Важную роль в регуляции состояния беременных и кормящих самок играет опиоидная система мозга. Высокая плотность опиоидных рецепторов обнаружена в преоптической области гипоталамуса; она значительно увеличивается в период беременности и подает при лактации (Mann, Bridges, 1992).
Опиоиды выступают в качестве регуляторов ряда процессов, связанных с родами, лактацией и выраженностью материнских реакций. В одной из первых работ на эту тему исследовалось влияние центрально вводимого морфина на изменение родительской мотивации у крыс (Rubin et al., 1984). Тестирование проводилось на нерожавших самках с
удаленными яичниками после предъявления донорских детенышей. Регистрировались переносы, собирание крысят и приседания около них. Было выявлено, что у 13 из 14 самок введение морфина в МПО достоверно снизило уровень материнского поведения, в отличие от введения морфина в вентромедиальный гипоталамус (снижение наблюдалось у 25% животных).
Центральное введение морфина перворожавшим крысам значимо подавляет послеродовую агрессию, а инъекции налоксона оказывают противоположное действие (Kinsley et al., 1986). Морфин в дозах 5 и 10 мг/кг эффективно снижает выраженность материнских реакций у самок-пер-вородков, однако его введение несколько раз рожавшим крысам ослабляет родительскую мотивацию лишь в малой степени (Kinsley et al., 1988). Инфузии Р -эндорфина в желудочки мозга кормящих крыс показали, что пептид блокирует нормальное материнское поведение (Felicio et al., 1991).
Селективный антагонист ц-опиоидных рецепторов налоксоназин уменьшает влияние морфина на материнскую мотивацию, и введение морфина (10 мг/кг, подкожно) на 3-й день после родов сразу после налоксоназина не снижает уровень родительских реакций (Mann et al., 1991). Косенкова и Пошивалов (1989) показали, что ц-агонист бупренорфин ослабляет материнскую агрессию, ак-агонисты бремазоцин или тифлюадом повышают уровень пассивных защитных реакций у кормящих самок. Использование антагонистов опиоидных рецепторов, напротив, приводит к активации материнского поведения. Byrnes (2000) показала, что системное введение налоксона достоверно увеличивает время кормления и нахождения в гнезде в раннюю фазу лактации (подробнее см. ниже).
Результаты, полученные Soaje с соавторами (2002), доказывают участие опиоидной системы в регуляции секреции пролактина: ингибиторное действие во время беременности и стимулирующее — в период лактации. Модулирующее влияние опиоидов зависит от падения концентрации прогестерона в конце беременности и последующего ее увеличения после овуляции.
Известно, что материнское поведение ассоциировано с экспрессией гена c-fos в МПО. С помощью иммуногистохимического анализа показано, что у самок, которым на 5-й день после родов вводили морфин, а затем предъявляли детенышей, количество c-fos позитивных клеток меньше, чем в контроле. В случае, когда детеныши не предъявлялись, до-
Глава 9. Бета-казоморфины и материнское поведение белых крыс стоверных отличий от контроля после применения морфина не наблюдалось (Stafisso-Sandoz et al., 1998).
Материнское поведение и другие нейромедиаторные системы
Показано, что дофаминергическая система, опосредующая пути положительного подкрепления, играет важную роль в усилении родительской мотивации. Микроинфузия 6-гидроксидофамина в VTA разрушает кате-холаминергические нейроны и нарушает процесс поиска детенышей, не влияя на такие параметры материнского поведения, как кормление и строительство гнезда (Leckman, Herman, 2002).
На ранней стадии беременности и во время лактации у крыс наблюдается высокая концентрация дофамина в преоптической области. Во время родов уровень дофамина существенно ниже (Lonstein et al., 2003). Вторая исследованная авторами область — дорсолатеральный стриатум Уровень дофамина здесь был высок в последние дни беременности и во время родов. Падение активности системы дофамина в МПО и активация дофаминовых проекций в стриатуме коррелирует с инициацией материнского поведения.
В статье Byrnes с соавторами (2002) для изучения роли дофаминергической системы в регуляции уровня родительских реакций использовались антагонисты D1 и 02-рецепторов (CSH 23390 и клебоприд). На 21-й день беременности животным имплантировали осмотические капсулы с разными дозами одного из препаратов либо физраствором. Первые три часа от рождения детенышей самки проводили с потомством, после чего крысят удаляли на 15 мин. По прошествии этого периода крысе предъявляли шесть новорожденных из ее выводка и регистрировали латентные периоды нахождения 1-го и 6-го детенышей, латентные периоды собирания крысят в одно место и приседания над ними.
В первый день после родов снижение уровня материнской активности обнаружено в группах, подвергшихся влиянию как клебоприда, так и SCH 23390 (достоверный рост средней латентности нахождения детенышей и приседания). На 7-й день после родов у самок, получивших SCH 23390, каких-либо нарушений родительских реакций замечено не было. В отличие от этого, клебоприд продолжал увеличивать среднюю латентность всех показателей, по сравнению с контролем Можно заключить, что D1 и D2-рецепторы участвуют в исходной экспрессии материнского поведения, однако лишь вторые из них вовлечены в поддержание родительской мотивации.
Роль дофаминергической системы в инициации и регуляции материнского поведения также показана с помощью микроинъекций пимозида (DZ-антагонист) (Silva et al., 2003) в n. accumbens. На 5—6-й дни после родов измерялся уровень двигательной активности самок в «открытом поле». Показано, что высокая доза пимозида (5 мкг) вызывает достоверное снижение горизонтальной и вертикальной активности, увеличивает время иммобилизации. Доза 3 мкг ослабляет лишь вертикальную активность; доза 1,5 мкг к значимым изменениям не приводит. На основе полученных результатов для регистрации материнских реакций были выбраны дозы 3 и 1,5 мкг.
Перед началом тестирования выводок удалялся из клетки. Через час самке предъявляли три детеныша и регистрировали латентные периоды их поиска, группировки и время кормления. Показано, что пимозид (3 мкг) вызывает достоверное увеличение латентных периодов всех поведенческих реакций по сравнению с контролем; более низкая доза не проводила к значимым изменениям.
Введение апоморфина (агонист D1 и D2 рецепторов) в низких дозах (0,1 и 0,25 мг/кг) вызывало замедление таких реакций, как облизывание детенышей, их кормление, поиск и собирание в одно место. Однако количество переносов и время удержания детеныша самкой возрастало. Это свидетельствует о том, что апоморфин, подавляя одни параметры материнского поведения, активизирует другие (Stem, Protomastro, 2002).
Кроме опиоидной и дофаминергической, в регуляцию родительского поведения вовлечена также серотонинергическая система, специфически связанная с материнской агрессией. Показано, что внутрижелудочковые инъекции агонистов 5-НТ1 5-НТ2-рецепторов могут (на короткое время) ингибировать материнскую агрессию, не влияя при этом на родительскую мотивацию в целом (De Almeida, Lucion, 1994).
Ferreira с соавторами (2000) выполнили работу по изучению влияния агонистов ГАМК (транквилизаторы диазепам и буспирон) на материнское поведение и агрессию. Оба препарата дозозависимо тормозили материнскую агрессию и такие компоненты родительского поведения, как поиск детенышей и строительство гнезда
В обзоре Leckman и Herman (2002) охарактеризованы гены, необходимость которых для экспрессии материнского поведения доказана три транскрипционных фактора (FosB, Peg3 и Fkh5), три фермента (Mest/Pegl, дофамин-Р-гидроксилаза и нейрональная NO-синтаза), два рецептора (пролактина и ER) и ген предшественника окситоцина
Состояние постродовой депрессии
Причиной большинства нарушений материнского поведения является, по мнению клиницистов, т.н. постродовая депрессия (postpartum depression). В случае человека она отмечается приблизительно у 15% женщин (состояние тревожности, озабоченности, страха).
Развитие постродовой депрессии связано, прежде всего, с падением уровня гормонов беременности, происходящим сразу после родов. Для подтверждения этой гипотезы Stoffel и Craft (2004) использовали овари-эктомированных самок крыс линии Sprague-Dawley. Животные подвергались гормональной имитации беременности, и в период последующей абстиненции была исследована их поведенческая активность. Моделирование беременности заключалось в инъекциях прогестерона и увеличивающихся доз эстрадиолбензоата в течение 22 дней. Тестирование проводилось на 1, 2,4 или 7-й день после прекращения инъекций. На 2 и 4-й дни самки, которым вводили гормоны, показали достоверное увеличение периода иммобилизации по сравнению с контролем в тесте «принудительное плавание». В крестообразном приподнятом лабиринте достоверных отличий между контролем и опытом не было; не зарегистрированы и отличия по уровню спонтанной двигательной активности.
Smith с соавторами (2004) анализировали, может ли гестационный (во время беременности) стресс влиять на материнскую мотивацию, а также оценивали поведенческие проявления депрессии («принудительное плавание»). Самки крыс подвергались ежедневным стрессорным воздействиям (10—20-й дни беременности). Через 3 дня после родов показано, что время иммобилизации у опытных животных на 25% выше, по сравнению с контролем. Кроме того, у стрессированных самок нарушались такие параметры материнского поведения, как врелля кормления и строительство гнезда. У взрослого потомства также обнаружен рост времени иммобилизации в тесте «принудительное плавание» и гиперсекреция АКТГ.
Таким образом, гестационный стресс является важным фактором, провоцирующим развитие материнской постродовой депрессии. Он может изменять уровень материнской заботы, что, в свою очередь, способствует изменению состояния детенышей.
Еще в 1981 г. Halbreich и Endicott выдвинули гипотезу о том, что в основе пременструальных и постродовых дисфорических изменений могут лежать колебания уровня эндорфинов. В ряде исследований показано ос
лабление симптомов материнской депрессии с помощью налоксона и налтрексона. Отметим также, что в клинике встречаются случаи не только патологического ослабления материнской мотивации, но и ее чрезмерной активации (постродовые психозы). Следовательно, поиск путей фармакологической коррекции уровня родительского поведения является важной и актуальной задачей.
Методика оценки уровня материнской мотивации
Характеризуя в главе 1 общий спектр физиологической активности Р -казоморфинов, мы указывали, что материнский организм может подвергаться их воздействию во время беременности и выкармливания новорожденного. В этом случае Р-казеины, образовавшись в молочной железе, способны здесь же деградировать на составляющие пептиды (Ren-lund et al., 1993), которые затем переносятся в кровоток и проникают в ЦНС. Подтверждением служат сообщения о присутствии Р-казоморфин-подобных соединений в спинно-мозговой жидкости у здоровых беременных и кормящих женщин, а также, в особенно высокой концентрации, у женщин, страдающих послеродовой депрессией.
Для проверки справедливости этих представлений, нами были проведены серии экспериментов по оценке влияния Р -казоморфина-7 и его аналогов на материнское поведение белых крыс (Ивлева с соавт., 2003).
В большинстве серий экспериментов наблюдение за материнским поведением осуществляли повторно ежесуточно на 4—7-й дни после родов. За 10 мин до тестирования самкам внутрибрюшинно вводилась дистиллированная вода либо исследуемое вещество. Использовались Р-казомор-фин-7 (5 мг/кг), его дез-Тут-аналоги пентапептид Pro-Phe-Pro-Gly-Pro (5 мг/кг) и тетрапептид Phe-Pro-Gly-Pro (5 мг/кг); в качестве веществ сравнения применялись морфин (1 мг/кг) и налоксон (1 и 5 мг/кг). Введение веществ проводилось в опытных группах только во 2-й либо 3-й (у разных крыс) дни тестирования. В остальные дни животные получали инъекцию растворителя.
Для наблюдений за материнским поведением использовалось описанное ранее «открытое поле» со сменой освещенности. При тестировании на первом этапе самку помещали в центр арены. Далее при красном свете поминутно визуально регистрировали стандартные поведенческие показатели (пробег, стойки и тд,.). Длительность наблюдений составляла 2 мин. Затем самка на 1 мин отсаживалась, после чего еще раз помещалась в
поле, где теперь находилась чашка Петри с 3 детенышами (красное освещение). Далее в течение 2 мин оценивали латентный период первого подхода к чашке, количество таких подходов, число переносов детенышей, латентный период переноса последнего детеныша из чашки (латентный период трех переносов). На заключительном этапе тестирования после паузы в 1 мин самка еще раз помещалась в поле, где находилась чашка с 3 детенышами. Арена при этом ярко освещалась. Регистрировались те же поведенческие показатели, что и в предыдущей экспериментальной ситуации.
Поскольку использованная нами методика нуждалась в предварительной стандартизации, в первой серии экспериментов была исследована группа животных с ежедневным введением только воды. Результаты четырехдневного опыта представлены в табл. 9.1. Для всех самок, использовавшихся в данной серии и большинстве последующих серий, это были повторные (2—3) роды.
Из таблицы видно, что в ходе последовательных тестирований пробег самок в отсутствии детенышей изменялся мало. На относительно стабильном уровне оставались также вертикальная активность и число отходов от стенки арены. Значимое уменьшение исследовательской активности отмечено лишь во 2-й день: количество стоек было снижено на 1-й и 2-й мин наблюдений, число отходов от стенки арены — на 2-й мин.
В ситуации помещения в поле детенышей (красный свет) при четырехдневном наблюдении отмечено заметное, но незначимое снижение латентных периодов (ЛП) подхода к чашке и трех переносов (р=0,10_ 0,15). Этот эффект, по-видимому, является следствием некоторого обучения самок (выработка реакции на место). Количество подходов к чашке и число переносов детенышей заметно на протяжении эксперимента не изменялись.
Все сказанное справедливо и для тестирования поведения самок при ярком свете: также оставалось стабильным количество подходов; отмечено лишь незначимое уменьшение ЛП первого подхода и трех переносов. Вместе с тем, число переносов детенышей во 2-й день было несколько снижено по отношению к предыдущему дню (р=0,08). Характерно, что по сравнению с поведением при красном свете количество переносов крысят при ярком освещении выше на протяжении всего тестирования (значимые отличия отмечены в таблице знаком @). При ярком свете, кроме того, заметно снижался ЛП трех переносов (р=0,08 по сравнению со значениями при красном свете).
Таблица 9.1. Четырехдневное тестирование материнского поведения крыс в «открытом поле» на фоне введения растворителя (вода, 0,5 мл). Приведены AM±SD. Значимые (р<0,05) отличия от первого дня тестирования обозначены * (критерий Манна-Уитни), от тестирования поведения в условиях красного света — @. В эксперименте использовано 15 животных.
Параметры 1 -й день 2-й день 3-й день 4-й день
Без детенышей:
Пробег, 1 мин 28,8 ±11,8 25,0± 10,1 22,1 ±10,6 26,1 ±11,9
Стойки, 1 мин 3,0 ±2,4 1,4±1,5* 1,9 ±2,3 _ 2,7 ±2,9
Отходы, 1 мин 1,7±1,1 1,9±1,1 1,8±1,5 2,2 ±1,7
Пробег, 2 мин 17,1 ± 8 1б,5±11,8 12,7±8,5 12,1 ±8,3
Стойки, 2 мин 3,1 ± 2,9 1,8± 2,2* 1,9 ±1,7 2,3 ±2,6
Отходы, 2 мин 1,8±1,4 1,3± 1,3* 1,3+ 1,3 1,3±1,3
С детенышами, красный свет:
ЛП подхода, с 12,5±32,3 6,1 ±11,9 6,5 ±12,0 7,9 ±19,0
Количество подходов 4,8 ±2,9 5,5±1,9 5,3 ±2,5 5,1 ±1,8
Количество переносов 2,8 ±2,8 2,6 ±2,5 2,6 ± 3,3 2,7 ±2,5
ЛП трёх переносов, с 89,0 ±44,2 78,9±51,5 78,5±53,2 71,3 ±48,3
С детенышами, яркий свет:
ЛП подхода, с Количество подходов 10,1 ±30,1 4,9 ±2,8 5,5 ± 6,1 5,3±1,б 6,1 ± 9,2 6,0 ±2,2 7,5±19,1 5,5 ±2,7
Количество переносов 4,7 ±4,0 @ 3,7 ± 3,8 4,9 ± 3,8 @ 4,4 ±3,9 @
ЛП трёх переносов, с 78,3 ±46,4 76,8 ±49,2 63,3 ±45,3 59,7 ±45,5
Следовательно, включение яркого света, обычно вызывающее реакцию затаивания крыс, у кормящих самок активирует материнское поведение. В данном случае, видимо, проявляет себя сформулированный еще А.А. Ухтомским принцип доминанты. Действительно, у кормящих самок поведение подчинено материнской мотивации, и любой не вызывающей
явной оборонительной реакции сенсорный стимул (в том числе яркий свет в «открытом поле») способен еще в большей степени активировать её проявления.
В целом в ходе повторного тестирования в «открытом поле» наблюдался относительно стабильный уровень материнского поведения. Эффекты выработки реакции на место были невелики. Тем не менее, считая поведение крыс относительно неизменным, мы стремились учесть последствия обучения самок. Для этого по ходу анализа результатов, полученных на фоне введения препаратов, осуществляли дополнительную статистическую обработку. Ее суть состоит в сравнении данных, полученных в день введения препарата, с усредненными значениями, зарегистрированными в предыдущий и последующий дни тестирования (когда осуществлялось введение воды). Такие усредненные значения рассматривались в дальнейшем как «контроль». Для оценки достоверности изменений использовались различные парные статистические критерии.
Введение кормящим самкам белых крыс не-пептидных лигандов опиоидных рецепторов
В первой из серий с введением препаратов анализировалось влияние на поведение кормящих самок избирательного ц -агониста морфина. Использовалась анальгетически неэффективная доза 1 мг/кг (внутрибрюшинно). Полученные результаты представлены в таблице 9.2 (кроме средних и разбросов, в ней приведены значения достоверностей по парному критерию Стьюдента). При оценке двигательной активности самок крыс в отсутствии детенышей оказалось, что инъекция морфина достоверно влияет на поведение животных, уменьшая их пробег, а также количество отходов от стенки арены и выходов в ее центр в течение 1-й минуты наблюдений. На 2-й минуте данное влияние было незначимым, что свидетельствует о воздействии морфина не столько на интенсивность локомоции, сколько на уровень исследовательской деятельности (которая заметно выше на 1-й мин тестирования).
При предъявлении детенышей (красный свет) морфин достоверно снижал количество подходов к чашке Петри, а также увеличивал ЛП переноса последнего детеныша Использование непараметрического критерия Вилкоксона позволило выявить также достоверное увеличение ЛП подхода к детенышам (р=0,02). При яркой освещенности морфин вызывал
Рисунок 9.1. Изменение количества переносов детенышей и количества подходов к чашке Петри у самок крыс, получивших инъекции морфина (1 мг/кг), налоксона (5 мг/кг), бета-казоморфина-7 (5 мг/кг) и его лишенных тирозина аналогов FPGP (каз-4; 5 мг/кг) и PFPGP (каз-5; 5 мг/кг). По оси ординат — процент от. контрольного уровня (введение воды), /уанные представляют собой сумму измерений при красном и ярком свете. Отличия от контрольного уровня с р<0,05 отмечены *, ср<0,01 — **; тенденция ср<0,10 — # (использовались критерии для попарно связанных массивов данных — Стьюдента, Вилкоксона, критерий знаков). В группах по 15—17 животных.
значимое уменьшение количества подходов к детенышам; увеличение ЛП трех переносов было близко к достоверному (р=0,06), Латентный период подхода к детенышам также оказался увеличен (р=0,04 по критерию Вилкоксона); количество переносов — уменьшено по сумме периодов регистрации при красном и ярком свете: с 8,4+3,6 до 6,4+3,8 (р=О,ОЗ; рис. 9.1). Для числа подходов аналогичные значения составили 13,4+2,2 и 9,6± 3,9 (р=0,002). Данные по латентным периодам первого подхода и переноса всех детенышей из чашки Петри представлены на рис. 9.2 и 9.3.
Следовательно, выявляется явное угнетающее действие морфина на все характеристики родительского поведения.
морфин налоксон каз-7 каз-4 каз-5
Рисунок 9.2. Изменение латентного периода подхода к детенышам при красном и ярком свете у кормящих самок крыс, получивших инъекции морфина (1 мг/кг), налоксона (5 мг/кг), бета-казоморфина-7 (5мг/кг) и его лишенных тирозина аналогов FPGP (каз-4; 5 мг/кг) и PFPGP (каз-5; 5 мг/кг).
По оси ординат — процент от контрольного уровня (тестирования с введением воды). Разброс данных показывает ошибку среднего изменения показателя. Отличия от контрольного уровня ср<0,05 отмечены * (использовались критерии для попарно связанных массивов данных). В группах по 15—17 животных.
Результаты оценки влияния неселективного антагониста опиоидных рецепторов налоксона в дозе 5 мг/кг (внутрибрюшинно) на поведение кормящих самок представлены в таблице 9.3. Показано, что на 2-й минуте эксперимента налоксон не оказал выраженного действия на поведение крыс в «открытом поле»; в 1-ю минуту на его фоне было зарегистрировано значимое увеличение числа отходов от стенки арены.
При наличии детенышей в условиях красной освещенности наблюдалось достоверное увеличение числа подходов к чашке и снижение ЛП пе-
Рисунок 9.3. Изменение латентного периода переноса всех детенышей из чашки Петри при красном и ярком свете у кормящих самок крыс, получивших инъекции морфина (1 мг/кг), налоксона (5 мг/кг), бета-казомор-фина-7 (5 мг/кг) и его лишенных тирозина аналогов FPGP (каз-4; 5 мг/кг) и PFPGP (каз-5; 5 мг/кг).
По оси ординат — процент от контрольного уровня /тестирования с введением воды). Разброс данных показывает ошибку сродного изменения показателя. Отличия от контрольного уровня ср<0,05 отмечены * (использовались критерии для попарно связанных массивов данных). В группах по 15—17 животных.
реноса последнего детеныша. Кроме того, отмечено уменьшение латентного периода первого подхода (р=0,02 по критерию Вилкоксона) и близкое к значимому возрастание числа переносов детенышей. При ярком свете обнаружены аналогичные, но более слабые изменения, достигшие уровня достоверности только в случае количества подходов к детенышам. В результате при суммировании показателей поведения при красном и ярком свете у крыс, получавших налоксон, обнаружено высоко достоверное (р=0,001) повышение числа подходов (с 7,9±2,2 до 11,9+4,0). Общее количество переносов также возросло достаточно выражено (с 4,8± 3,5 до 6,5±4,8; р=0,09).
Полученные факты позволяют сделать вывод о положительном действии налоксона (5 мг/кг) на параметры материнского поведения кормящих крыс.
Таблица 9.2. Сравнение усредненного контроля с опытом (введение морфина, 1 мг/кг). Приведены значения AM±SD, а также значения вероятности ошибки по парному критерию Стьюдента (строка «Р»), Отличие от контроля (тестирований с введением воды, а не препарата) с р<0,05 отмечено *; п=15.
Без детенышей:
1-я минута пробег СТОЙКИ ОТХОДЫ от стенки ВЫХОДЫ в центр груминг
контроль 29,9± 7,6 3,03± 1,91 3,0 ±1,0 2,5 ±1,0 7,4 ±5,5
опыт 20,7 ±8,9 2,5± 3,7 2,4 ±1,2 1,8± 0,9 8,6 ±7,0
р 0,003 * 0,49 0,01 * 0,004 * 0,48
2-я минута пробег СТОЙКИ ОТХОДЫ от стенки ВЫХОДЫ в центр груминг
контроль 15,1 ±4,6 3,4 ±2,8 1,7± 0,8 1,3± 0,9 5,4 ±3,6
опыт 12,5± 5,8 2,5± 3,4 1,4+0,9 1,2± 1,0 4,3 ±3,7
р 0,18 0,4 0,33 0,78 0,43
С детенышами, красный свет:
ЛП подхода, с количество | количество ЛП трёх переносов
подходов переносов
контроль 6,2± 8,5 7,1± 1,2 4,0± 1,8 42,1± 31,7
опыт 14,9± 29,4 4,9 ±2,2 3,1± 2,1 62,0± 42,7
р 0,21 0,003 * 0,08 0,04*
С детенышами, яркий свет:
ЛП подхода, с количество подходов количество переносов ЛП трёх переносов
контроль 6,8± 6,7 6,3± 1,5 4,4 ±2,0 37,3± 29,5
опыт 17,0± 29,4 4,7 ±1,8 3,3 ±1,9 50,3± 39,4
р 0,15 0,006 * 0,06 0,055
В следующей серии экспериментов была протестирована более низкая доза антагониста — 1 мг/кг. Выявлено, что какие-либо заметные изменения двигательной и исследовательской активности у самок после введения налоксона в таком количестве отсутствуют. Основной отмеченный выше эффект — увеличение количества подходов к чашке с детенышами, в данном случае также не проявился; значительно не изменилось под дей-
Таблица 9.3. Сравнение усредненного контроля с опытом (введение налоксона, 5 мг/кг). Обозначения, как в табл. 9.2; п=15.
Без детенышей:
1-я минута пробег СТОЙКИ ОТХОДЫ от стенки 1,9 ±1,3 2,8±2,0~ ВЫХОДЫ в центр 3,6 ±6,5 2,4 ±2,0 груминг 3,6 ±6,5 2,4 ±2,0
контроль опыт 33,0±16,3 32,5.115,1 4,2 ±2,7 3,7 ±2,5
р 0,88 0,33 0,03* 0,45 0,45
2-я минута пробег стойки отходы от стенки ВЫХОДЫ в центр груминг
контроль 20,2 ±10,3 4,4 ±3,4 1,8+ 1,5 1,2±1,1 2,8 ±2,5
опыт 22,7 ±13,6 4,3 ±3,5 2,1 ±1,1 1,4±1,1 3,7±3,5
Р 0,11 0,87 0,29 0,38 0,44
С детенышами, красный свет:
красный свет ЛП подхода, с количество подходов количество переносов ЛП трёх переносов
Контроль 11,6±14,9 4,1 ±1,4 1,7 ±1,4 96,О±32,6
Опыт 3,2 ±2,1 6,4 ±2,4 3,1 ±2,7 69,7 ±47,8
Р 0,052 0,001 * 0,06 0,02*
С детенышами, яркий свет:
ЛП подхода, с количество подходов количество переносов ЛП трёх переносов
Контроль 1О,5±9,6 , 3,7±1,2 2,9 ±2,3 82,6 ±38,4
Опыт 8,1 ±10,9 5,4 ±2,1 0,01 * 3,3 ±2,6 71,2 ±48,7
р 0,46 0,38 0,14
ствием малой дозы препарата число переносов. ЛП трех переносов сохранил лишь слабую тенденцию к снижению (р=0,17— 0,21), что по направленности совпадает с данными табл. 9.3.
В целом можно заключить, что в случае введения налоксона в дозе 1 мг/кг наблюдается лишь незначимый рост материнской мотивации.
Последствия введения 0-казоморфинов кормящим самкам белых крыс
Результаты изучения влияния 0 -к-7 (доза 5 мг/кг) на поведение кормящих самок представлены в табл. 9.4. Показано, что инъекция пептида практически не оказывает воздействия на параметры спонтанной двига
тельной активности и исследовательского поведения. Различия опытного (после введения препарата) и контрольных (после введения воды) тестирований могут быть оценены как минимальные. Этот факт совпадает с данными, полученными в экспериментах по инъекции Р -казоморфинов взрослым самцам белых крыс (см. главы 4—5).
В случае компонентов материнского поведения выявлено небольшое (на 16%), но достоверное снижение количества переносов крысят у самок, получавших Р-казоморфин-7, по сумме измерений при красном и ярком свете (4,3±4,0 по сравнению с 5,1± 3,6 в контроле; р=0,04). Кроме того, на фоне пептида оказалось заметно уменьшено общее количество подходов к чашке (10,9±3,5 по сравнению с 12,5±2,6; р=0,06). Изменение (увеличение) латентных периодов реакций было более выражено при ярком свете, но не достигло достоверного уровня (р=0,11—0,14 по критерию Вилкоксона). Однако в совокупности выявленные эффекты дают основание оценить влияние р-к-7 в дозе 5 мг/кг на параметры материнского поведения как негативное.
Наиболее показательные результаты, полученные при введении гептапептида, налоксона и морфина, в нормированном виде представлены на рис. 9.1—9.3. Отметим, что, несмотря на меньшую выраженность, эффекты р -казоморфина-7 в значительной мере совпадают с последствиями введения морфина (уменьшение числа переносов и подходов к чашке с детенышами). Действие налоксона имеет противоположную направленность (активация проявлений материнского поведения).
В отдельной серии экспериментов нами было проанализировано воздействие на поведение кормящих самок совместного введения малой дозы налоксона (1 мг/кг) и Р -казоморфина-7 (через 15 мин после налоксона, 5 мг/кг). В этом случае мы пытались определить, сохранятся ли изменения поведения кормящих самок, развивающиеся под влиянием пептида, на фоне блокады опиоидных рецепторов. Показано, что основной описанный выше эффект р-к-7 (снижение количества переносов) в таких условиях полностью исчезает. Не проявляется также тенденция к уменьшению числа подходов к детенышам. В графическом виде полученные результаты, свидетельствующие о преимущественно опиоидной природе влияния Р-казоморфина-7 на параметры материнского поведения, представлены на рис. 9.4.
Проведение дополнительного анализа с использованием долевых критериев доказывает существование достоверных различий между реакциями кормящих самок на введениер-казоморфина-7, с одной стороны,
Таблица 9.4. Сравнение усредненного контроля с опытом (введение р-ка-зоморфина-7, 5 мг/кг). Отличие от контроля по сумме наблюдений при красномиярком свете ср<0,05 отмечено#. Остальные обозначения, как в табл. 9.2; п=17.
1 -я минута пробег Без детенышей: ВЫХОДЫ в центр груминг
Стойки ОТХОДЫ от стенки
контроль 29,0 ±10,8 4,8 ±2,6 2,6 ±1,2 1,6±1,3 2,8 ±4,8
опыт 30,6 ±13,2 4,4 ±3,3 3,1 ±1,8 1,6±1,5 3,9 ±7,5
р 0,46 0,63 0,31 ь. 1)00 0,19
2-я минута Пробег Стойки ОТХОДЫ от стенки ВЫХОДЫ в центр груминг
контроль 16,4 ±7,7 4,4 ±2,4 1,9±1,2 0,9 ±0,9 3,2±3,8
опыт 16,4 ±7,3 4,5 ±2,5 1,8±1,4 1,3±1,0 3,4 ±5,2
р 0,99 0,90 0,94 0,16 0,88
С детенышами, красный свет:
ЛП подхода, с количество подходов количество переносов ЛП трёх переносов
Контроль 4,9 ±5,4 6,8±1,8 2,4 ±2,2 82,6 ±36,2
Опыт 5,4±7,1 6,0 ±2,1 2,1 ±2,2 74,9 ±46,0
Р 0,81 0,25 0,19 i 0,32
С детенышами, яркий свет:
ЛП подхода, с количество подходов количество переносов , ЛП трёх переносов
Контроль Опыт 4,6 ±2/7 9,0.112,3 5,7 ±1,3 4,9 ±2,4 2,7±1,6 2,3.12,1 70,6 ±37,7 80,9.147,1
Р 0,13 0,12 0,32# 0,14
и налоксона, а также налоксона с 0 -казоморфином-7, с другой. В первом случае после инъекции препарата количество переносов увеличилось только у 2 самок из 17, во втором и третьем — у 8 из 15 (р=0,02 по точному критерию Фишера и р=0,01 по критерию ~/2) (рис. 9.4, внизу).
При исследовании действия лишенных N-концевого тирозина тетрапептида Phe-Pro-Gly-Pro и пентапептида Pro-Phe-Pro-Gly-Pro на поведение кормящих самок крыс обнаружено, что введение первого из них
р=О,О2 поточному критерию Фишера
Рисунок 9.4. Изменение количества переносов детенышей и количества подходов к чашке Петри у самок крыс после введения бета-казоморфина-7 (5 мг/кг), налоксона (1 мг/кг) либо совместного введения налоксона и бета-казоморфина-7.
По оси ординат — процент от контрольного уровня (введение воды).
/ушные представляют собой сумму измерений, сделанных при красном и ярком свете. Разброс данных показывает ошибку среднего изменения показателя. Отличия от контрольного уровня с р<0,05 отмечены *, тенденция с р<0,10 — #. (использовались критерии для попарно связанных массивов данных). В группах по 15—17 животных.
практически не приводит к каким-либо последствиям (вне зависимости от наличия либо отсутствия детенышей). После инъекции пентапептида, напротив, значимо увеличивается количество отходов от стенки арены и выходов в центр (2-я минута наблюдений), а при предъявлении детенышей в условиях яркой освещенности — растет ЛП первого подхода к чашке Петри. На фоне пентапептида наблюдается также заметное снижение числа переносов детенышей: с 6,8+3,2 до 5,6+ 3,3 (р=0,07).
Таким образом, влияние укороченного с N-конца на одну аминокислоту аналога Р -казоморфина-7 сохраняет ту же направленность, что и в случае прототипа (ослабление материнского поведения). Однако его кон-
Глава 9. Бета-казоморфины и материнское поведение белых крыс кретные проявления оказываются несколько иными, и пентапептид изменяет не столько количество переносов, сколько латентный период первой реакции на детенышей. Механизм развития наблюдавшихся эффектов остается неясным, поскольку, теряя тирозин, аналоги опиоидных пептидов резко снижают способность к взаимодействию со специфическими рецепторами. С учетом этого результаты, полученные при тестировании действия тетрапептида (отсутствие каких-либо значимых эффектов), легче поддаются объяснению. Тем не менее, в экспериментах по хроническому введению р -казоморфинов новорожденным крысам выявлены последствия применения как аналога, укороченного с N-конца на одну аминокислоту (Pro-Phe-Pro-Gly-Pro-Ile), так и аналога, укороченного на две аминокислоты (Phe-Pro-Gly-Pro) (см главу 8).
Влияние р-казоморфина-7 на поведение кормящих самок белых крыс при однократном введении было явно слабее, чем действие морфина. Из этого можно заключить, что участие р -казоморфинов в развитии серьезных патологий материнского поведения является маловероятным (подробнее см ниже). Для дополнительной проверки такого предположения нами были проведены две серии экспериментов с хроническим введением р -казоморфина-7 в дозе 1 мг/кг. В первой из них пептид инъецировался детенышам-самкам в возрасте 21—34 дня ежедневно (в контроле 15 животных, в экспериментальной группе — 16). Средний срок первых родов составлял 90 дней, вторых родов — 150 дней. Тестирование в обоих случаях осуществлялось трижды на 4—6-й дни после родов (Дубынин с соавт., 2005).
Показано, что хроническое постнатальное введение р -казоморфина-7 в возрасте 21—34 дня в определенной мере ослабляет проявления материнского поведения. При его оценке на 4-й день после первых родов был значимо изменен ЛП переноса всех детенышей из чашки Петри при красном свете: в опытной группе 14 самок из 16 затратили на это более 100 с; в контрольной — только 8 из 16 (р=0,02 по критерию х2)- На следующий день достоверно различалось количество подходов при красном свете: в контрольной группе более 4 подходов совершили 15 самок; в группе, получавшей пептид — только 8 (р=0,04 по критерию х2)- Кроме того, выявлено увеличение ЛП трех переносов при ярком свете: менее 50 с затратили на это в контроле 11 крыс, в опытной группе — 4 (р=0,03 по ткФ). На 6-й день после родов более 4 переносов при ярком свете в контроле совершили 11 самок, в опыте — 5 (р=0,03 по критерию х2)-
Данные по суммарному количеству переносов при красном и ярком свете (наиболее информативный показатель) представлены на рис. 9.5. Достоверные различия выявлены при первом тестировании (в контроле 5 самок совершили 10 и более переносов, в опытной группе — ни одна; р=0,02 по ткФ) и при третьем тестировании (в контроле 8 самок совершили 10 и более переносов, в опытной группе — 2; р=0,03 по ткФ).
Анализ поведения тех же животных после вторых родов выявил некоторое ослабление различий между контролем и группой, получавшей пептид. Значимого уровня они достигли только при первом предъявлении экспериментальной ситуации. На 4-й день после родов было изменено количество подходов к детенышам при ярком свете: 5 и более реакций совершили в контроле 12 самок, в опыте — только 4 (р=0,01 по ткФ).
В целом можно заключить, что хроническое постнатальное введение р-казоморфина-7 (21—34-й дни жизни) несколько снижает уровень материнской мотивации. Вместе с тем, обнаруженные изменения носят весьма нестабильный характер. В каждый из дней тестирования достоверные отличия опыта и контроля отмечались для разных параметров и только при использовании непараметрических долевых критериев. Определенное вклад в неустойчивость наблюдавшихся эффектов вносят, видимо, и процессы обучения. Они отчасти компенсируют исходный дефицит материнских реакций, и если после первых родов в ходе трехдневного тестирования выявлено 4 значимых отличия опыта от контроля, то после вторых родов — только 2. Отметим также отсутствие после вторых родов достоверных различий по числу переносов детенышей — наиболее информативному показателю в большинстве проведенных нами экспериментов.
Во второй серии опытов с использованием хронического введения р-казоморфин-7 инъецировался детенышам-самкам в 1—14-й дни жизни. Дальнейшее тестирование осуществлялось так же, как и в предыдущем случае. Показано, что после первых родов различия между опытной и контрольной группами минимальны. Значимого уровня они достигли только на 4-й день после родов и только для количества подходов к детенышам при красном свете: в контроле более 7 реакций совершили 6 крыс из 14; в группе, получавшей пептид, — 1 из 14 (р=0,03 по критерию х2)- При тестировании после вторых родов достоверных отличий опыта от контроля не обнаружено (рис. 9.6).
Следовательно, как и в случае уровня тревожности, исследовательской активности, способности к обучению, хроническое введение р -казомор-
дни после дни после
первых родов вторых родов
Рисунок 9.5. Изменение количества переносов детенышей у кормящих самок крыс в 4— 6-й дни после первых и вторых родов.
Контроль — прерывистая линия; группа, получавшая в возрасте 21— 34 дня хронические инъекции бета-казоморфина-7 — сплошная линия. Данные представляют собой сумму измерений при красном и ярком свете. Отличия от контрольного уровня с р<0,05 отмечены *, ср<0,02 — **; тенденция ср<0,10 — # (использовался точный критерий Фишера и критерий хи-квадрат). В контрольной группе 15, в опытной — 16 животных.
фина-7 способно приводить к отставленному изменению (снижению) родительской мотивации белых крыс. Вместе с тем, это снижение проявляется, во-первых, в весьма мягкой форме, во-вторых, преимущественно при введении пептида в более поздние сроки (21—34-й дни жизни). Напомним, что отставленное влияние Р -казоморфина-7 на уровень тревожности также зависит от возраста самок: при инъекциях в 1 — 14-й дни жизни параметры поведения животных почти не изменяются, в 21—34-й дни —• наблюдаются наиболее значимые анксиолитические эффекты (см. также главу 7).
Полученные результаты свидетельствуют о возможности «гормонального импринтинга» нервных центров, определяющих проявления родительской мотивации. Кроме того, они указывают на нарастание с возрастом чувствительности этих центров к воздействиям, опосредуемым
дни после первых родов
дни после вторых родов
Рисунок 9.6. Изменение количества переносов детенышей у кормящих самок крыс в 4—6-й дни после первых и вторых родов.
Контроль — прерывистая линия; группа, получавшая в возрасте 1—14-го дня хронические инъекции бета-казоморфина-7 — сплошная линия, /ушные представляют собой сумму измереншс при красном и ярком свете. Значимые различия между опытом и контролем отсутствуют (в группах по 14 животных).
через опиоидную систему мозга. Наконец, следует еще раз указать на компенсаторную роль процессов обучения по отношению к ослабляющим материнское поведение эффектамр-казоморфина-7: при вторых родах достоверные отличия опыта от контроля менее выражены (введение в возрасте 21—34 дня) либо вообще отсутствуют (введение в возрасте 1— 14 дней).
Подведем некоторые итоги. Как можно видеть, на первом этапе нашего исследования методический подход, разработанный для тестирования материнского поведения крыс, был апробирован с использованием блокатора опиоидных рецепторов налоксона и ц -агониста морфина. Для уменьшения вероятности побочных эффектов морфин вводился в дозе 1 мг/кг (более низкой, чем обычно используемые в подобных исследованиях). Тем не менее, инъекция препарата вызвала значительное ослабление всех параметров материнского поведения: снизилось число переносов
Глава 9. Бета-казоморфины и материнское поведение белых крыс детенышей и, особенно, подходов к ним; при красном свете увеличился латентный период трех переносов, при ярком и красном — ЛП первого подхода к детенышам. Полученные результаты хорошо совпадают с рассмотренными выше данными литературы.
В отличие от морфина налоксон, вводимый в дозе 5 мг/кг, вызывает у самок крыс достоверное повышение числа подходов к детенышам и близкий к значимому рост количества их переносов; при красном свете снижены латентные периоды всех реакций. Следовательно, на фоне действия блокатора происходит активация материнского поведения. Снижение дозы налоксона до 1 мг/кг привело к тому, что отмеченные изменения оказались незначимы; наблюдалось лишь некоторое укорочение латентного периода трех переносов.
Полученные в этой серии данные полностью соответствуют результатам Byrnes с соавторами (2000), которые выявили у самок крыс после центрального и периферического введения налоксона рост общей продолжительности кормления и нахождения в гнезде. По нашему мнению, является перспективным клиническое апробирование налоксона, как стимулятора материнского поведения. В проведенных Добряковой Ю.В. с соавторами (2005) экспериментах показана его способность усиливать родительскую мотивацию крыс при интраназальном введении, причем в дозе 1 мг/кг (более низкой, чем в случае внутрибрюшинной инъекции).
Главной целью наших исследований материнского поведения стал анализ влияния на его параметры р -казоморфинов и, в первую очередь, их основного представителя Р -к-7. Постановка подобной задачи основывается на факте обнаружения Р -казоморфинов в молоке, крови и спинномозговой жидкости женщин, страдающих послеродовой депрессией (см. главу 1). Предполагалось, что системная инъекцияР-к-7 кормящим крысам будет в значительной мере подавлять материнские реакции.
Результаты проведенных опытов в целом подтвердили эту гипотезу. Направленность эффектов р -казоморфина-7 была той же, что и в случае введения морфина. Вместе с тем, наблюдаемые изменения материнского поведения оказались не столь «драматичны», как ожидалось, и пептид в дозе 5 мг/кг значимо изменял (снижал) лишь число переносов детенышей. Уменьшение количества подходов не достигло уровня достоверности (р=0,06); рост латентных периодов реакций был еще менее выражен. Таким образом, представление о том, что р-казоморфины могут быть ответственны за развитие такой серьезной патологии, как послеродовая депрессия, пока что не нашло убедительного подтверждения.
Вместе с тем, мы осознаем, что до окончательного ответа на поставленный вопрос еще далеко, поскольку использовали в опытах крыс, рожавших 2 и более раз (что, по данным литературы, ослабляет реакцию на эндогенные и экзогенные опиоиды). С учетом сказанного, уже после завершения основной части экспериментов нами была проведена дополнительная серия опытов на крысах-первородках. Как можно видеть из табл. 9.5, в этом случае действительно зарегистрировано больше значимых отличий от контрольного уровня, а снижение под действием пептида количества переносов составило 30% (а не 16%, как в случае табл. 9.4). Данная проблема, несомненно, заслуживает дальнейшего пристального изучения.
Таблица 9.5. Сравнение усредненного контроля с опытом (введение (5-ка-зоморфина-7, 5 мг/кг) в случае впервые рождающих самок крыс. Обозначения, как в табл. 9.2; п=15.
Без детенышей:
1-я минута пробег Стойки ОТХОДЫ от стенки ВЫХОДЫ в центр груминг
контроль 43,7 ± 8,6 3,8 ±2,1 3,9±1,3 2,5 ±1,5 10,0 ±7,0
ОПЫТ 39,6±11,7 3,6 ±1,9 4,2 ±1,6 3,1 ±1,0 8,7 ±10,3
р 0,21 0,76 0,37 0,10 0,64
2-я минута Пробег Стойки ОТХОДЫ от стенки выходы в центр груминг
контроль 24,0 ±8,4 3,7±1,8 2,8 ±1,2 1,8±1,1 9,6 ±4,9
опыт 23,4 ±9,0 1 4,0 ±2,0 3,О±1,5 1,9 ±0,9 10,5±11,1
р 0,76 1 0,50 0,62 0,80 0,77
С детенышами, красный свет:
ЛП подхода^ количество с ' подходов количество переносов ЛП трёх переносов
Контроль 7,2 ±6,2 , 5,6 ±1,2 1,3 ±2,1 105,7 ±21,4
Опыт 8,0 ±4,9 ; 4,5 ±1,4 1,1 ±1,6 109,7 ±29,2
Р 0,66 I 0,04* 0,55 0,48
С детенышами, яркий свет:
ЛП подхода с количество подходов количество переносов ЛП трёх переносов
Контроль 8,4 ±3,6 6,5±1,7 1,7 ±2,0 99,0 ±29,2
Опыт 9,3 ±6,4 6,3 ±10,6 1,1 ±1,8 109,2 ±27,4
Р 0,64 0,95 0,03* 0,16
Кроме того, весьма вероятно, что женщины, предрасположенные к развитию послеродовой депрессии, исходно имеют повышенную чувствительность опиоидной системы, высокую проницаемость ГЭБ и т.п. В таком случае для нарушения их материнского поведения может оказаться достаточно даже эндорфинов (не говоря уже о поступающих в кровь из молочных желез р -казоморфинах).
Основные обнаруженные нами эффекты Р -к-7, видимо, опосредовались через классические опиоидные рецепторы, поскольку на фоне налоксона пептид не смог оказать практически никакого влияния на параметры материнского поведения. Вместе с тем, после введения лишенного тирозина пентапептида Pro-Phe-Pro-Gly-Pro наблюдалось достоверное увеличение латентного периода первого подхода к детенышам — параметра, на который прототип не действовал. Следовательно, с большой долей вероятности можно утверждать, что существуют дополнительные пути и возможности влияния р -казоморфинов на деятельность центров материнской мотивации. Данные, свидетельствующие о наличии нейротропной активности у дез-Туг-аналогов р -казоморфина-7 зарегистрированы нами и во многих других поведенческих тестах (см. главы 4— 6 и 8).
Наконец, особым разделом работы стал анализ воздействия хронических инъекций р -казоморфина-7 в постнатальном периоде на материнское поведение крыс. Показано, что пептид вызывает определенное ослабление родительских реакций — по крайней мере, при введении в 21—34-й дни жизни, т.е. на фоне более зрелой опиоидной системы мозга детенышей. После первых родов (возраст 90 дней) отличия опытной группы от контрольной были более выражены, чем после вторых родов (150 дней). Это может свидетельствовать как об ослаблении эффекта пептида, так и о компенсирующем действии процессов обучения (выработка у самок навыков по уходу за детенышами).
Обнаруженные нами факты, относящиеся к материнскому поведению, еще раз подтверждают способность р-казоморфинов влиять на процессы созревания мозга новорожденных млекопитающих. Наиболее вероятные механизмы отставленного действия р-казоморфина-7, по-видимому, носят нейротрофическую природу и подробно рассмотрены в главах 7~ 8.
Глава 10. Влияние бета-казоморфинов на «детское» (зависимое от матери) поведение новорожденных
Большинство грызунов, используемых в научных исследованиях (крысы, мыши, хомяки), относятся к незрело рождающимся животным: в момент появления на свет их нервная система не до конца сформирована, отсутствует зрительная ориентация; они не способны самостоятельно поддерживать температуру тела, эффективно передвигаться, питаться. Эти характеристики до периода созревания находятся в сильной зависимости от материнской заботы. Поведенческий репертуар новорожденного вращается вокруг решения проблем незрелого организма, а именно — поддержания контакта с телом матери (источник пищи и тепла) и нахождения материнского соска по тепловым, тактильным и обонятельным признакам (Henning, 1980). Несмотря на, казалось бы, низкую степень развития, новорожденный детеныш получает и запоминает внешние сигналы, касающиеся его выживания (прежде всего, обонятельной природы).
В первые две недели жизни большая часть активности детеныша связана с питанием, и новорожденный практически все время находится в гнезде под телом матери. По мере развития зрения, слуха и способности к самостоятельной терморегуляции поведенческий репертуар детеныша быстро растет. В конце 2-й недели жизни новорожденные начинают постепенно исследовать окружающую обстановку. В этом возрасте наблюдается гиперактивность, продолжающаяся вплоть до периода полного созревания (Thiels et al., 1990).
Хорошо известна важнейшая роль обонятельных стимулов в неврологическом и поведенческом развитии грызунов. Память о раннем обонятельном опыте сохраняется у них в течение всей жизни и принимает важное участие в формировании социального, сексуального и родительского поведения. На первой неделе жизни у детенышей развивается четкое предпочтение запахов, ассоциированных с гнездом или тактильной стимуляцией, получаемой от матери. Одновременно происходят пожиз-
ненные изменения в гломерулярном слое обонятельной луковицы (Wilson et al., 1994). Нарушение естественных запахов гнезда может оказать не только значительное действие на новорожденного, но и привести к устойчивым изменениям поведения во взрослом состоянии.
Мозговые структуры, вовлеченные в реализацию зависимого от матери поведения детенышей до сих пор четко не идентифицированы. В соответствующих обзорах указывается лишь на особую роль обонятельной системы и вомероназального органа, а также переднего гипоталамуса. Нейрохимическую основу реакции детенышей на мать обеспечивают окситоцин, вазопрессин, катехоламины, эндогенные опиоидные пептиды. Все они являются «ключевыми субстратами в нейробиологии зоосоци-альной привязанности детенышей к тем, кто проявляет о них заботу» (Leon, 1992; Nelson, Panksepp, 1998).
Особенности постнатального развития детенышей крыс
Как известно, в первые 14 дней жизни большая часть физиологических функций крысят (терморегуляторная, пищевая и даже выделительная) поддерживается матерью. Интенсивность и частота прикрепления к соскам в этот период регулируется стимулами, исходящими от матери, и лишь позднее устанавливается зависимость от пищевой мотивации (Henning, 1980). Подвижность детенышей пока что ограничена пределами гнезда и, следовательно, самка является для них основным источником информации об окружающей среде.
Thiels с соавторами (1990) показали, что до начала потребления твердой пищи (18-й день) крысята проводят большую часть активного периода за сосанием матери. С 18-го по 26-й дни жизни самостоятельное кормление, питье, груминг и игровые схватки быстро становятся их наиболее частыми действиями, в то время как сосание постепенно уменьшается. На 28-й день потребление крысятами воды и пищи относительно массы тела достигает стабильного уровня, но они продолжают сосать до 34-го дня.
Предъявление связанных с матерью стимулов изолированному крысенку обычно завершается так называемыми «комфортными» реакциями, что выражается в поведенческом затихании (Wilson, 1994). Это уменьшение подвижности в присутствии матери, в числе прочего, помогает ей при переносе детенышей назад в гнездо. Особое значение в управлении поведением детеныша имеют запаховые сигналы (феромоны)
Глава 10. Влияние бета-казоморфинов на «детское» поведение новорожденных матери (Пошивалов, Косенкова, 1989). Обнаружено, что детенышей в возрасте 4-5 дней и 9—10 дней привлекает запах матери; изоляция на 12 часов усиливает этот эффект. По данным Polan и Hofer (1998) у однодневных крысят предпочтение запаха матери отсутствует, в отличие от двухдневных. Следовательно, наиболее вероятный период приобретения предпочтения — интервал между 1-ми 2-м днями жизни. Однако полностью этот процесс завершается только к 10-му дню жизни (Roth, Sullivan, 2003).
Детенышей млекопитающих привлекает запах матери, поскольку этот фактор способствуют их выживанию. Со своей стороны крысята индуцируют у матери эмиссию запаха (Leon, 1992). Они увеличивают у самки уровень пролактина, что ведет к возрастанию приема ею пищи и выделению т.н. кекотрофа, который входит в запах матери. Данное вещество синтезируется микроорганизмами и изменяется в зависимости от питания самки. Это, в свою очередь, требует, чтобы крысята формировали реакцию на обонятельные характеристики матери постнатально. Запечатление (импринтинг) происходит, когда запах самки сочетается с осуществляемой ею же тактильной стимуляцией.
Различными авторами охарактеризованы нарушения в развитии ЦНС крысят в результате изоляции от самки. В частности, искусственное (без матери) выращивание детенышей приводит к уменьшению проекций вибрисс в соматосенсорной коре и падению уровня исследовательской активности (Auestad et al., 1990). Суточная изоляция новорожденных от матери вызывает снижение темпов прироста массы головного мозга и изменение болевых порогов; наблюдается падение горизонтальной и вертикальной активности в «открытом поле» (Дмитриева, Кассиль, 1994). Ежедневная 15-минутная изоляция (1 —21-й дни жизни) приводит к сохраняющемуся у взрослых крыс повышению тревожности, депрессивноподобному поведению и росту влечения к наркотическим веществам (Dauge, 2003).
Нейромедиаторная основа «детского» поведения
Показано, что эндорфины являются важнейшим фактором, вовлеченным в становление внутривидового общения. По данным Panksepp с соавторами (1994) блокада опиоидных рецепторов ведет к усилению взаимодействия крысят друг с другом и снижению подкрепляющих свойств контактов с матерью. Сходные результаты получены Agmo с со-
авторами (1997). Тест «открытое поле» использовался ими для оценки стремления уже зрячих детенышей оставаться в контакте с наркотизированной матерью. Показано, что предварительная изоляция от самки увеличивает проводимое около нее время и сокращает период, проведенный около «незнакомых» крыс. Морфин усиливал этот эффект, в то время как налоксон оказывал противоположное действие. Авторы заключают, что ценность матери для крысят изменяется с изменением состояния опиоидной системы мозга.
По данным Roth и Sullivan (2003) формирование предпочтения детенышем запаха матери нарушается при введении налтрексона (до 10-го дня жизни). При этом препарат не влияет на выработку реакции обонятельной аверсии у более зрелых детенышей. Не исключено, что некоторые нарушения детского поведения (в т.ч. в клинике) могут быть скорректированы путем манипуляций с опиоидной системой (Panksepp et al., 1994).
Весьма скудны сведения об участии в формировании зависимого от самки поведения других нейромедиаторных систем. Так, по данным Ri-stine и Spear (1984), системное введение антагонистов серотонина (в частности, метерголина) оказывает угнетающее влияние на сосательное поведение детенышей крыс на 3—4-й и 7—8-й дни жизни, однако в остальные дни не было выявлено каких-либо эффектов. Холинергический антагонист скополамин оказывал угнетающее действие на сосательное поведение крысят только в 3~4-й дни жизни.
Исходя из представлений о важной подкрепляющей роли для детеныша контактов с матерью, можно предположить непосредственное участие в формировании детского поведения дофаминергической системы. Однако данные об этом в литературе почти отсутствуют. Можно сослаться лишь на работу Becker и Smotherman (1996), где показано, что введение агониста дофаминовых рецепторов квинпирола увеличивает зависимое от самки поведение (оценка проводилась по количеству попыток присасывания к искусственному соску). Авторы рассматривают результаты исследования как подтверждение участия дофаминергической системы в захватывании соска новорожденными.
Реципрокность взаимоотношений матери и детеныша
Среди всего комплекса социальных контактов, характерных для незрело рождающихся млекопитающих, взаимоотношения матери и детеныша являются наиболее значимым фактором, необходимым для
создания оптимальных условий постнатального развития. Еще в работе Ader и Grota (1969) показано, что в внешние воздействия (например, хен-длинг) могут приводить у детенышей крыс к долгосрочным изменениям поведения. Хорошо известно, что различные нарушения в поведении и питании матери способны усиливать реакцию детенышей на стресс, вызывать изменения в их гипоталамо-гипофизарно-адреналовой оси (НРА).
Показано, что у новорожденных крысят вылизывание матерью является базовым фактором, определяющим стабильность НРА в течение первых двух недель жизни, а также вызывающим снижение нейроэндокринной и поведенческой реакции на стресс в более позднем возрасте. Напротив, повторяющаяся депривация от матери либо ее стрес-сирование в ранний постродовой период вызывает у детенышей значительное ухудшение различных поведенческих параметров. Развивается, кроме того, повышенная уязвимость к заболеваниям во взрослом состоянии (Kaufman et al., 2000).
С другой стороны, материнское поведение также находится под сильным влиянием со стороны детеныша. После родов в организме самок происходит множество морфологических и физиологических изменений (включая пониженную реакцию на стресс), и основным стимулятором служит сосание. Такая ситуация отнюдь не является уникальной для грызунов; у кормящих грудью женщин в плазме наблюдается пониженный уровень АКТЕ, кортизола, вазопрессина, норадреналина (Altemus et al., 1995).
У всех млекопитающих активация НРА является центральным компонентом интегрированного физиологического ответа на стрессогенные стимулы. Синтез и секреция глюкокортикоидов представляет при этом лишь финальное звено нейроэндокринного каскада, берущего начало в ЦНС. Соматические и физиологические стрессоры, циркадные ритмы и гуморальные воздействия инициируют этот каскад путем выброса рели-зеров АКТЕ. В числе их кортикотропин-релизинг фактор (CRF), вырабатывающийся в мелкоклеточной части паравентрикулярного ядра гипоталамуса. Он является сильнейшим стимулятором секреции АКТЕ из аденогипофиза и экспрессии гена проопиомеланокортина (РОМС). У грызунов более слабым релизером служит аргинин-вазопрессин, однако его эффекты зависимы от присутствия CRF. На активность НРА влияют также процессы элиминирования и обратного захвата глюкокортикоидов, компенсирующие их избыточную секрецию. Работая согласованно, все эти механизмы обеспечивают быструю настройку НРА при изменении условий внешней среды (Walker et al., 2004).
Поздний гестационный, перинатальный и постнатальный периоды у большинства видов млекопитающих характеризуются интенсивной синаптической реорганизацией ЦНС. В основе этих процессов лежит функциональное созревание основных нейротрансмиттерных и нейромодуляторных систем. На поздних стадиях созревания и во взрослом состоянии часть из них испытывает регуляторное влияние глюкокортикоидов, выделение которых является результатом активности НРА. Избыточная продукция глюкокортикоидов наносит вред процессам созревания мозга, в то время как низкий уровень кортикостерона надпочечников в неонатальном периоде способствует полноценному развитию мозга.
Процессы развития центральной нервной системы отличаются у разных видов. Например, у крыс постнатальный период является критическим для развития и интеграции центральных и периферических систем, участвующих в поддержании гомеостаза. У более высокоорганизованных млекопитающих, включая приматов и человека, большинство этих систем при рождении уже находится на высшем (или близком к высшему) уровне созревания и развития (Walker et al., 2004).
Методика оценки параметров «детского» поведения
Как показано выше, зависимые от матери реакции новорожденных обеспечиваются особой мотивационно-потребностной системой, которая функционирует вне зависимости от пищевых и оборонительных центров мозга. Из литературы известно, что активность этой системы находится под контролем эндогенных опиоидных факторов, способных усиливать зависимые от матери реакции (Panksepp et al., 1994). Исследованию этого компонента действия Р -казоморфинов посвящен завершающий раздел нашей работы (Дубынин с соавт., 2007).
Тестирование поведения детенышей проводилось на арене (80x80 см) с деревянным полом при комнатной освещенности и температуре. До начала эксперимента детеныши, принадлежащие к одному выводку, поочередно переносились в отсадку, разделенную на изолированные отсеки. В отсадке поддерживалась температура, соответствующая температуре гнезда (около 28°С). Далее производилась наркотизация самки (хлоралгидрат в дозе 50 мг/кг), после чего она помещалась в центр арены. Конкретная последовательность этапов экспериментальной процедуры приведена в табл. 10.1.
Таблица 10.1. Протокол экспериментальной процедуры при тестировании выраженности зависимых от матери реакций новорожденных на примере выводка из 10 крысят. Нулевое время — момент переноса первого детеныша в отсадку.
№ детеныша контроль или опыт (К/О) перенос в отсадку, мин время 1-го тестирования введение препарата детенышу время 2-го тестирования
1 к 0 55 1.40 1.50
2 О 5 60 1.45 ' 1.55
3 К 10 1.05 1.50 2.00
i. о 15 1.10 1.55 2.05
5 к 20 1.15 2.00 2.10
6 О 25 1.20 2.05 2.15
7 к 30 1.25 2.10 2.20
8 о 35 1.30 2.15 2.25
9 к 40 1.35 2.20 2.30
45 + нарко-
10 о тизация 1.40 2.25 2.35
самки
_________________________________________________________________________________________________________________________________________________________I________________________________________________________________________________
Как видно из таблицы, зависимое от матери поведение крысят тестировалось дважды: до использования препаратов и через 10 мин после их введения (контрольным животным инъецировалась вода).
При тестировании детеныша 3 раза («3 попытки») помещали на 1 мин к спине лежащей в центре арены на боку самки на равном расстоянии от ее хвоста и головы и визуально оценивали: латентный период (ЛП) полуобхода (доползания до уха или хвоста самки); ЛП присасывания к соску самки; груминг, количество подталкиваний самки детенышем, клайминг (число попыток влезания на тело матери). Если влезание завершалось успехом, то детеныш мог некоторое время находиться сверху на теле самки (в этом случае измерялась длительность контакта). Результаты трех попыток усредняли (в случае параметров, характеризующих время реакции либо ее длительность) или суммировали (в остальных случаях).
Эксперименты (в разных сериях) производились на 10, 15 либо 17-й дни жизни детенышей. Использовались 0 -казоморфин-7 и его укорочен-
10 дней
до введения после
10 дней
до введения после
Рисунок 10.1. Изменение интенсивности клайминга (количества попыток влезания на тело матери) у детенышей в возрасте 10 (слева) и 17 (справа) дней под влиянием введения бета-казоморфина-7 (5 мг/кг). По вертикали — процент от величины показателя до введения веществ. Линии обозначены: 1 — контроль; 2 — опыт, /хостоверные отличия изменений в опытной группе от изменений в контроле отмечены * (р<0,05) и ** (р=0,01).
ные с С- и N-концов аналоги Tyr-Pro-Phe-Pro-Gly, Pro-Phe-Pro-Gly-Pro и Phe-Pro-Gly-Pro. Все пептиды вводились внутрибрюшинно в дозе 5 мг/кг. В качестве веществ сравнения использовались морфин (0,5 мг/кг) и налоксон (5 мг/кг).
Показано, что при помещении детеныша к спине матери он, как правило, через достаточно небольшой промежуток времени начинает двигаться в направлении хвоста, либо, реже, головы самки, огибая её тело. Одной минуты тестирования обычно было достаточно для перемещения крысенка к брюшной стороне матери. В течение этого времени регистрировались различные двигательные компоненты детского поведения. В их числе наиболее информативным оказалось количество попыток влезания на тело самки — клайминг. Первое тестирование проводилось примерно через час после удаления детенышей от матери, второе — через 2 часа. При этом изменения поведения детенышей кон
трольных групп были относительно невелики и имели разную направленность у разных выводков. Дополнительный час изоляции мог приводить как к усилению, так и к ослаблению зависимого от матери поведения.
Влияние р-казоморфина-7 на «детское» поведение новорожденных
Как видно из табл. 10.2, введение 0-казоморфина-7 в дозе 5 мг/кг 10-дневным детенышам крыс оказало определенное влияние на их поведение. В ситуации до инъекции препарата отличия будущих опытной и контрольной групп были минимальны. После введения появление наиболее заметных различий зарегистрировано при оценке числа попыток влезания на тело матери. Если в контроле клайминг остался практически неизменным, то в опыте произошло его усиление в 2 раза: р=0,04 по критерию Стьюдента при сравнении изменений в группах; в таблице — дельта (после/до) (рис. 10.1, слева).
Таблица 10.2. Исследование параметров «детского» поведения новорожденных крыс в возрасте 10 дней; сравнение контрольной и опытной (/3-ка-зоморфин-7, 5 мг/кг) групп. Представлены значения AM±SD, а также значения вероятности ошибки по критерию Стьюдента (строка «Р»), Использовано 40 контрольных и 37 опытных животных. Отличия от контроля с р<0,05 отмечены *.
до введения веществ кол-во подталкиваний ЛП полуобхода, с । клайминг
контроль 5,7 ±6,0 31,5±15,0 2,0 ±1,9
Опыт 5,7 ±6,2 34,3 ±13,8 1,5+1,5
Р 0,99 0,41 0,22
после введения веществ
контроль 4,6 ±4,2 34,8 ±14,5 । 2,2 ±2,7
Опыт 5,4 ±5,2 33,3 ±17,2 3,1 ±3,0
Р 0,49 0,67 ! 0,18
дельта (после/до)
контроль -1,12± 4,8 3,31 ±18,0 1 0,25 ±3,1
Опыт -0,36 ± 5,1 - 0,99± 18,1 ; 1,62±2,7
Р 0,51 о,зо i 1 0,04*
Таблица 10.3. Исследование параметров «детского» поведения новорожденных крыс в возрасте 17 дней; сравнение контрольной и опытной (/3-ка-зоморфин-7, 5 ла/кг) групп. Обозначения — как в табл. 9.2. Использовано 47 контрольных и 42 опытных животных.
до введения веществ кол-во подталкиваний ЛП полуобхода, с клайминг
контроль 2,2 ±2,7 20,7 ±16,6 4,7 ±2,7
опыт 2,1 ±2,8 23,3 ±15,8 4,5 ±2,5
р 0,95 0,47 0,68
. . . . . ... после введения веществ
контроль 1,9 ±2,9 25,7± 18,3 3,9 ±2,8
опыт 2,7 ±4,3 21,9±14,3 6,2 ±4,1
р 0,31 0,28 0,003*
дельта (г юсле/до)
контроль -0,2 ±1,5 5,0 ±17,1 -0,8 ±4,1
опыт 0,6 ±2,4 -1,4 ±17,5 1,7±5,1
р 0,06* 0,09* 0,01 *
Рассматривая поведение детенышей при тестировании в 17-дневном возрасте (табл. 10.3), можно также отметить отсутствие явных исходных различий будущих опытной и контрольной групп. На этом фоне при повторном помещении в экспериментальную обстановку в контроле произошло снижение количества попыток влезания на тело матери, в то время как в опыте после инъекции пептида величина параметра выросла на 38%. В итоге различие величин показателя в опытной и контрольной группах оказалось значимо с высоким уровнем достоверности (р<0,01). Изменения клайминга дельта (после/до) также были достоверно разными после введения воды и пептида (р=0,02 по критерию Манна-Уитни и р=0,01 по критерию Стьюдента; рис. 10.1, справа).
Кроме того, значимые отличия при использовании непараметрических критериев зарегистрированы для латентного периода полуобхода тела матери (в контроле вырос на 24%, в группе с введением пептида — уменьшился на 6%; р=0,04 по критерию Манна-Уитни) и для количества
Глава 10. Влияние бета-казоморфинов на «детское» поведение новорожденных подталкиваний (в контроле уменьшилось на 9%, в опытной группе выросло на 29%; р=0,02 по точному критерию Фишера). Заметно, но незначимо после инъекции препарата снизился латентный период присасывания (р=0,06).
В целом можно заключить, что введение 0 -казоморфина-7 приводит к росту стремления детеныша находиться в контакте с самкой. Эффект нарастает с возрастом, распространяясь не только на клайминг, но и другие поведенческие показатели. Важно и то, что в этот возрастной период0-ка-зоморфин-7 еще не влияет на уровень оборонительной мотивации и двигательной активности (см. главу 5). Следовательно, нервные центры, регулирующий уровень «детского», зависимого от самки поведения, наиболее рано проявляют чувствительность к действию экзогенных опиоидов.
Введение новорожденным не-пептидных лигандов опиоидных рецепторов
В табл 10.4 и на рис. 10.2 представлена реакция детенышей крыс в возрасте 10 дней на внутрибрюшинное введение налоксона (5 мг/кг). Можно заметить, что после инъекции препарата произошло резкое возрастание латентного периода полуобхода (на 49%). Такое изменение значимо отличается от слабого снижения величины показателя в контроле (на 9%; р=0,02 по критерию Стьюдента). Число реакций клайминга в контрольной группе при втором тестировании выросло в 2,1 раза; в опытной — снизилось на 11%. В результате отличие изменений в группами также оказалось достоверным (р=0,03 по критериям Стьюдента и Манна-Уитни).
Последствия инъекции налоксона в возрасте 17 дней (табл 10.5) оказались сходными с только что описанными. Введение антагониста опиоидных рецепторов привело к снижению клайминга на 43% (что само по себе значимо по критерию Вилкоксона с р=0,01). В контроле клайминг, напротив, немного вырос (на 5%), в результате чего отличие изменений дельта (после/до) в группах достигло достоверного уровня (р=0,03 по критерию Стьюдента). В ряду показателей, связанных с измерением латентных периодов реакции, налоксон повлиял на ЛП присасывания к матери: в контроле у 5 животных он уменьшился более, чем на 3 сек; в опытной группе таких детенышей не оказалось (р=0,03 по критерию %2).
В целом влияние налоксона на стремление детеныша находиться в контакте с самкой можно охарактеризовать как негативное, противополож-
10 дней
Рисунок 10.2. Изменение интенсивности клайминга (количества попыток влезания на тело матери) у детенышей в возрасте 10 (слева) и 17 (справа) дней под влиянием введения налоксона (5 мг/кг).
По вертикали — процент от величины показателя до введения веществ.
Линии обозначены: 1 — контроль; 2 — опыт. Достоверные отличия изменений в опытной группе от изменений в контроле отмечены * (р<0,05).
17 дней
ное по направленности действию 0 -казоморфина-7. В отличие от пептида, эффекты блокатора были соизмеримы в возрасте 10 и 17 дней. Полученные в этом разделе работы результаты хорошо коррелируют с данными литературы (Panksepp et al., 1994; Agmo et al., 1997).
Морфин в сериях экспериментов с детским поведением вводился в относительно низкой дозе 0,5 мг/кг с целью избежать побочных эффектов препарата (снижение двигательной активности, подкрепляющее влияние). Напомним, что различие эффективных доз на порядок характерно, например, для анальгетического действия морфина и 0 -казоморфина-7 (2 и 20 мг/кг, соответственно; см. главу 3).
При введении морфина детенышам в возрасте 10 дней выявлено достоверное увеличение количества попыток влезания на тело матери. Из табл. 10.6 видно, что исходный уровень клайминга в опытной и кон-
Таблица 10.4. Исследование параметров «детского» поведения новорожденных крыс в возрасте 10 дней; сравнение контрольной и опытной (налоксон, 5 мг/кг) групп. Обозначения — как в табл. 10.2. Использовано 18 контрольных и 17 опытных животных.
до введения ве-ществ длительность контакта, с ЛП полуобхода, с клайминг
контроль 10,0 ±7,4 31,1 ±16,0 1,2±1,5
опыт 24,8 ±19,4 23,1 ±15,9 1,9 ±2,6
р 0,21 0,15 0,34
. > после введе Е1ИЯ веществ 1 ' '
контроль 17,8 ±15,5 28,2 ±14,4 2,5 ±1,5
опыт 12,0 ±14,4 34,3 ±15,1 1,7+1,4
р 0,61 0,23 0,13
дельта (после/до)
контроль опыт р ”_ /7 Т 7,8 ±15,1 -12,8 ±28,8 ~ 0,25 -2,9 ±14,0 11,3 + 18,4 ’ ~ 0,015 * ’ 1,3 ±1,8 -0,2 ±1,9 0,025 *
Таблица 10.5. Исследование параметров «детского» поведения новорожденных крыс в возрасте 17 дней; сравнение контрольной и опытной (налоксон, 5 мг/кг) групп. Обозначения — как в табл. 10.2. Использовано 28 контрольных и 25 опытных животных.
до введения веществ !ЛП присасывания с ЛП полуобхода, с клайминг
контроль 57,7 ±5,8 24,5 ±14,6 4,1 ±2,7
опыт 59,6 ±1,5 23,9+13,3 4,4 ±3,4
р 0,11 0,89 0,73
> после введе ния веществ
контроль 58,7 ±4,2 31,7±18,б 4,3 ±4,0
опыт 59,4 ±2,8 36,1 ±16,4 2,5+1,7
р 0,47 0,37 0,044
дельта (после/до)
контроль 1,0±3,0 7,2 ±17,3 0,2±3,б
опыт -0,2 ±1,4 12,2 ±15,4 -1,9+3,7
р 0,07* 0,28 0,044 *
10 дней
17 дней
Рисунок 10.3. Изменение интенсивности клайминга (количества попыток влезания на тело матери) у детенышей в возрасте 10 (слева) и 17 (справа) дней под влиянием введения морфина (0,5 мг/кг).
По вертикали — процент от величины показателя до введения веществ. Аинии обозначены: 1 — контроль; 2 — опыт. Отличия изменений в опытной группе от изменений в контроле отмечены * (р<0,05) и# (р<0,10).
трольной группах совпадал. При втором помещении в экспериментальную обстановку у крысят, получивших морфин, величина показателя выросла на 45%; в контроле — практически не изменилась (рис. 10.3). В результате выявляется различие в абсолютном количестве попыток влезания, значимое при использовании точного критерия Фишера (1 и менее реакций за 3 мин наблюдений совершали только контрольные животные — 6 из 20). Отличие изменений в уровне клайминга в опыте и контроле оказалось также довольно выраженным (р=0,06 по критерию %2).
Повлиял морфин и на среднее время контакта (длительность нахождения детеныша на теле матери): в получившей пептид группе оно у 7 животных из 17 увеличилось более, чем на 5 с; в контрольной группе — только у 3 из 20; р=0,07 по критерию %2).
Эффекты введения морфина детенышам в возрасте 17 дней были весьма сходными. Хотя отличия в изменении клайминга не достигли
Таблица 10.6. Исследование параметров «детского» поведения новорожденных крыс в возрасте 10 дней; сравнение контрольной и опытной (морфин, 0,5 мг/кг) групп. Обозначения — каквтабл. 10.2 и 10.3. Использовано 20 контрольных и 17 опытных животных.
до введения веществ длительность контакта, с ЛП полуобхода, с клайминг
контроль 1.8 ±5.4 48.1 ±16.9 4.0 ±2.9
оыт р 1,4 ±4,6 0,81 47,9 ±12,7 0,97 4,0 ±2,6 0,96
контроль 3,6 ±9,4 46,7 ±14,6 4,1±3,2
оыт 7,8 ±8,8 52,3 ±9,3 5,8 ±2,4
р 0,18 0,18 0,08*
дел ы.1 (после дп;
контроль опыт 1,9±8,6 6,4 ±8,8 —1,4±11,6 4,4 ±13,2 0,1 ±3,7 1,8+3,8
р 0,12# 0,16 0,19#
Таблица 10.7. Исследование параметров «детского» поведения новорожденных крыс в возрасте 17 дней; сравнение контрольной и опытной (морфин, 0.5 мг/кг) групп. Обозначения — каквтабл. 10.2и 10.3. Использовано 14 контрольных и 15 опытных животных.
до введения веществ кол-во подталкиваний клайминг длительность контакта, с
контроль 2,6 ±2,7 4,9 ±3,8 6,1 ±16,8
опыт 2,7 ±2,3 4,6 ±2,4 8,4±13,3
р 0,99 0,83 0,68
после ввехе ТИЯ Ш IJJcl ’ В
контроль 2,0 ±2,2 4,0 ±4,1 8,9 ±12,9
опыт 4,8 ±2,7 6,3 ±5,6 15,9 ±23,9
р 0,005* 0,22 0,34
ACWUftllX.'U V'J
контроль -0,6 ±2,8 -0,9 ±4,6 2,9 ±23,7
опыт 2,2 ± 3,0 1,7 ±5,7 7,5 ±27,2
р 0,017* 0,19# 0,63
уровня значимости (р=0,08 по критерию %2), на этот раз наблюдалось достоверное увеличение числа подталкиваний детенышем матери. Как видно из табл. 10.7, исходное количество таких реакций практически не отличалось в обеих экспериментальных группах. Однако при повторном тестировании контрольные животные на 26% снизили величину показателя; у детенышей, получивших морфин, число подталкиваний, напротив, выросло в 1,8 раза (достоверно различие как абсолютных значений, так и изменений; р=0,01 —0,02).
Эффекты укороченных аналогов р-казоморфина-7
Значительное внимание в ходе проведения исследований уделялось анализу активности укороченных аналоговР-казоморфина-7. Тестировались те же соединения, что и в серии опытов по изучению материнского поведения: пентапептид Pro-Phe-Pro-Gly-Pro и тетрапептид Phe-Pro-Gly-Рго. Выявлено практически полное отсутствие действия этих лишенных N-концевого тирозина соединений на параметры детского поведения как в возрасте 10, так и в возрасте 17 дней. Отличия изменений величин таких показателей, как клайминг, количество подталкиваний, латентный период полуобхода в контрольных и опытных группах были выражены крайне слабо (р=0,40~0,90). Даже в тех случаях, когда при повторном тестировании в опытной группе наблюдались значимые изменения (например, рост количества подталкиваний после введения пентапептида в возрасте 10 дней), в контроле происходили аналогичные сдвиги.
Для получения дополнительной информации о связи первичной структуры Р -казоморфинов с их способностью влиять на параметры детского поведения нами проведена серия экспериментов с введением укороченного с С-конца аналога Р -к-7 — пентапептида Tyr-Pro-Phe-Pro-Gly. Это соединение сохраняет опиоидные свойства и в условиях центрального применения является даже более активным, чем прототип (Brantl et al., 1981; см также главу 1). Вместе с тем, при системном введении оно оказывается менее устойчиво к ферментативной деградации (Stark et al., 1988). Действительно, введение пентапептида в возрасте 10 дней было неэффективно (рис. 10.4); уровень значимости выявленных различий опытной и контрольной групп даже в случае наиболее информативного параметра (количества подталкиваний) достиг лишь р=0,17 по критерию %2: величина показателя выросла после введения пептида у 16 детенышей из 23; в контроле — у 12 из 24.
10 дней
125
100
после
до введения
17 дней
Рисунок 10.4. Изменение интенсивности клайминга (количества попыток влезания на тело матери) у детенышей в возрасте 10 (слева) и 17 (справа) дней под влиянием пентапептида Tyr-Pro-Phe-Pro-Gly (5 мг/кг). По вертикали — процент от величины показателя до введения веществ. Кинии обозначены: 1 — контроль; 2 — опыт. /Достоверные отличия изменений в опытной группе от изменений в контроле отмечены * (р<0,05).
В возрасте 17 дней влияние на количество подталкиваний стало более выраженным: в контроле их число при втором тестировании выросло у 7 животных из 21, в опыте — у 12 из 20 (р=0,09 по критерию^2). При этом основным эффектом стало влияние на интенсивность клайминга: после введения пептида он вырос у 14 крысят; в контроле — лишь у 8 (р=0,04 по критерию %2).
В обобщенном виде данные, полученные при исследовании детского (зависимого от самки) поведения детенышей представлены в табл. 10.8.
Выбранные нами для анализа параметры зависимого от матери поведения (клайминг, латентный период полуобхода) являются начальными компонентами реакции детеныша, смысл которой — расположиться у вентральной стороны тела самки. Биологическая целесообразность такого поведения очевидна: это наиболее близкое к источнику пищи и наиболее теплое место. Собственно пищевая мотивация играет здесь, как уже было сказано, не основную роль; главными регулирующими стимулами
Таблица 10.8. Обобщение данных, полученных при тестировании влияния Р-казоморфинов, морфина и налоксона на параметры «детского» (зависимого от самки) поведения детенышей белых крыс в возрасте 10 и 17 дней. Количество значимых изменений различных показателей, свидетельствующих об усилении либо ослаблении детского поведения, показано соответствующим числом плюсов (+) либо минусов (-); отсутствие изменений отмечено знаком равенства. Все препараты вводились внутрибрюшинно за 10 мин до тестирования; пептиды вводились в дозе 5 мг/кг.
вводимый препарат возраст 10 дней возраст 17 дней
Tyr-Pro-Phe-Pro-Gly-Pro-Ile + +++
Pro-Phe-Pro-Gly-Pro = =
Phe-Pro-Gly-Pro = =
Tyr-Pro-Phe-Pro-Gly морфин (0.5 мг/кг) + + +
налоксон (5 мг/кг) --
являются запах матери и физический контакт с ней. Поэтому, видимо, в наших экспериментах такая «очевидная» характеристика детского поведения, как латентный период присасывания, оказалась малоинформативна.
Влияние Р-казоморфина-7 на зависимое от самки поведение крысят оценивалось с использованием дозы 5 мг/кг. При этом зарегистрированы достоверные отличия в изменении выраженности клайминга у детенышей контрольной и опытной групп. В контроле количество попыток влезания на тело матери изменялось незначительно или даже несколько уменьшалось; у крысят, получивших инъекцию Р -к-7, оно, напротив, увеличивалось (по сравнению с «фоновым» тестированием до введения воды либо пептида). Отличия в изменении уровня клайминга в опытной и контрольной группах были значимы уже в возрасте 10 дней; в 17 дней к ним присоединились различия в латентном периоде полуобхода тела матери и количестве подталкиваний ее детенышем.
Это означает, что совокупность нервных структур, регулирующих детское поведение крысят, оказалась наиболее чувствительной к р -казомор-фину-7 среди всех исследованных нами систем мозга. Действительно, анальгетическое действие пептида на детенышей реализуется только при
Глава 10. Влияние бета-казоморфинов на «детское» поведение новорожденных введении в дозе 20 мг/кг (см. главу 3), а снижение уровня тревожности — хотя и при использовании дозы 5 мг/кг, но начиная с возраста 4 недели (см. главу 5). Адаптивный смысл обнаруженного эффектаР-к-7 состоит, очевидно, в повышении значимости самки для детенышей и их удержании в гнезде в ранний постнатальный период.
Параметр клайминга доказал свою информативность и в серии с введением налоксона (5 мг/кг). В этом случае эффекты блокатора опиоидных рецепторов были противоположны действию Р -к-7, и число влезаний на тело матери оказалось значимо меньшим, чем в контроле. Кроме того, после применения налоксона наблюдалось достоверное увеличение (по сравнению с инъекцией воды) латентных периодов связанных с матерью реакций. Влияние препарата на детенышей в возрасте 10 и 17 дней было сравнимо по выраженности. Полученные в этом разделе работы результаты хорошо соответствуют данным литературы (Panksepp et al., 1994; Agmo et al., 1997).
Использование морфина даже в низкой дозе (0,5 мг/кг) привело к усилению зависимого от матери поведения детенышей, сходному с наблюдавшимся на фоне р-казоморфина-7. Вместе с тем, как и в случае налоксона (и в отличие от гептапептида), какая-либо отчетливая возрастная динамика отсутствовала. Эффекты морфина в возрасте 10 и 17 дней были примерно одинаковы по выраженности: достоверное изменение одного из поведенческих показателей (клайминга либо числа подталкиваний, соответственно). Причина выявленных расхождений состоит, вероятно, в разной рецепторной специфичности исследуемых соединений: морфин является селективным ц-агонистом, а пептид проявляет сродство еще и к рецепторам 6-типа, созревание которых в мозге крыс идет относительно медленными темпами.
Лишенные тирозина аналоги Pro-Phe-Pro-Gly-Pro и Phe-Pro-Gly-Pro на параметры зависимого от матери поведения практически не влияли. В этом специфика результатов, полученных в данном (посвященном «детским» реакциям) разделе работы. Действительно, пентапептид Pro-Phe-Pro-Gly-Pro весьма выражено изменял материнское поведение самок (см главу 9); тетрапептид Phe-Pro-Gly-Pro — выраженность депрессивных проявлений (см. главу 5); оба эти препарата — уровень тревожности (также глава 5). Следовательно, из всех исследованных нами компонентов поведения именно сфера детских реакций наиболее подвержена тому влиянию Р -казоморфинов, которое реализуется через «классические» опиоидные рецепторы (см. также раздел «Заключение»), Впрочем, этот
Глава 10. Влияние бета-казоморфинов на «детское» поведение новорожденных вывод вполне справедлив только для мозга крыс (и, видимо, других сле-порождающихся млекопитающих). В случае нейрохимически более зрелого мозга человека исключить возможность взаимодействия дез-Туг-аналогов с некими относительно специфическими местами связывания уже в раннем постнатальном периоде было бы неверно.
Анализируя воздействие 0 -казоморфинов на детенышей, мы оказываемся в самой «приближенной к реальности» области наших работ. Действительно, существует некоторая обобщающая идея, лежащей в основе изучения физиологической активности опиоидных фрагментов казеинов. Она состоит в том, что пептиды данной группы, вполне вероятно, являются не сформировавшейся в ходе мутационных процессов бессмысленной совокупностью аминокислот, а играют вполне значимую роль экзогенных физиологических регуляторов.
При этом можно выделить 2 аспекта проблемы. Первый из них — отставленные последствия ежедневного (хронического) проникновения 0 -казоморфинов в организм (см. главы 7—8). Вторая составляющая нейротропной активности опиоидных фрагментов 0-казеинов — «острые» влияния, развивающие сразу после введения. Интересно, что исходно (в 1980-е гг.) предполагалось, что они имеют седативную и даже снотворную направленность. Однако прямая проверка (Taira et al., 1990) не подтвердила наличия изменений сна, и показала, что 0 -к-7 в дозах 5,10 и даже 50 мг/кг не влияет на пробуждение. Рассмотренные выше результаты позволяют утверждать, что основной колшонент «острого» действия 0-казоморфинов на детенышей состоит в увеличении привязанности к матери и зависимости от нее. Все остальные поведенческие эффекты этих пептидов (в том числе, анксиолитическое действие) имеют в реальных условиях, видимо, меньшую значимость.
Влияние клебоприда на поведение детенышей крыс
В отдельных сериях опытов проанализированы нарушения детского поведения при воздействии на дофаминергическую систему (введение клебоприда) и способность 0 -казоморфина-7 компенсировать эти нарушения.
Клебоприд является селективным антагонистом D2 рецепторов. В настоящее время он используется в клинической практике в качестве средства, обладающего противорвотным эффектом, а в экспериментах на животных — как нейролептик и транквилизатор. Большие дозы клебо-
Глава 10. Влияние бета-казоморфинов на «детское» поведение новорожденных прида (10 и 20 мг/кг) вызывают каталепсию и паралич задней части тела у детенышей крыс всех возрастов (Byrnes et al., 1996).
На первом этапе исследований проводился подбор пороговой дозы кле-боприда, не изменяющей или минимально изменяющей двигательную активность крысят (но, возможно, оказывающей влияние на мозговые центры, участвующие в формировании детского поведения). Диапазон использованных доз был выбран, исходя из данных Добряковой с соавторами (2006) о влиянии клебоприда на кормящих самок. В работе было показано, что инъекция препарата в дозах 0,1 и 0,2 мг/кг достоверно ослабляет материнское поведение крыс, не оказывая влияния на их двигательную активность. Напомним, что зоны, управляющие материнским и детским поведением, анатомически близки и находятся в переднем гипоталамусе.
Введение 10-дневным детенышам клебоприда в дозе 0,2 мг/кг не оказало воздействия на их двигательную активность. При увеличении дозы до 0,5 мг/кг наблюдались слабые изменения подвижности крысят. Дальнейшее двукратное увеличение количества клебоприда (1,0 мг/кг) вызвало достоверное падение двигательной активности. В результате пороговой для проявления действия на локомоторные проявления была выбрана доза 0,5 мг/кг, и именно она использовалась в дальнейшем при изучении детского поведения.
Введение 15-дневным детенышам клебоприда в дозе 0,5 мг/кг (пороговой для 10-дневных животных) вызвало явное и достоверное падение их подвижности. Использование пятикратно сниженной дозы привело лишь к незначительным отличиям опытной группы от контрольной. В связи с этим в качестве пороговой была выбрана доза препарата 0,1 мг/кг.
Исследование последствий введения избранных доз клебоприда на зависимое от самки поведение позволило выявить негативное влияние, оказываемое О2-антагонистом. При этом у 10-дневных животных (доза 0,5 мг/кг) наблюдался рост латентных периодов полуобхода и перелезания через тело самки, снижение количества подталкиваний (рис. 10.5). В возрасте 15 дней (доза 0,1 мг/кг) также происходило увеличение ЛП перелезания и числа подталкиваний. Однако, в первую очередь, наблюдался рост суммарного времени отходов детенышей от матери (рис. 10.6). Действительно, в старшем возрасте животные менее зависил4ы от матери. Их подвижность значительно повышается, и у крысят начинают проявляться реакции, связанные с ориентировочно-исследовательским поведением, которые конкурируют с «детским» поведением.
□ клебоприд клебогрид+бета-каэоморф ин-7
13,00
Рисунок 10.5. Влияние на зависимое от самки поведение детенышей крыс в возрасте 10 дней клебоприда (0,5 мг/кг) и совместно клебоприда (0,5 мг/кг) и бета-казоморфина-7 (5мг/кг).
Обозначения по горизонтали: 1 — ЛП полуобхода самки (сек); 2 — суммарное время отходов (сек); 3 — число подталкиваний; 4 — ЛП перелезания через тело самки (сек). По вертикали: отличие изменений величины параметров в опытных группах от изменений в соответствующих контрольных группах (дельта контроль — дельта опыт). Отличия групп от «своего» контроля обозначены * (р<0,05); отличия группы с введением клебоприда от группы с совместным введением препаратов — # (р<0,05).
В целом полученные результаты говорят о различии дофаминергических составляющих тех морфо-функциональных систем мозга, которые определяют, с одной стороны, выраженность зависимых от самки реакций, и, с другой, уровень двигательной и исследовательской активности.
Присутствие матери является важнейшим врожденно значимым для крысят стимулом. С учетом этого можно предположить, что обнаруженные нами эффекты клебоприда реализуются с участием одной из ключе-
Рисунок 10.6. Влияние на зависимое от самки поведение детенышей крыс в возрасте 15 дней клебоприда (0,1 мг/кг) и совместно клебоприда (0,1 мг/кг) и бета-казоморфина-7 (5 мг/кг).
Обозначения по горизонтали: 1 — суммарное время отходов (сек); 2 — подталкивания х10; 3 — ЛП перелезания через тело самки (сек); 4 — суммарное время контакта (сек). Остальные обозначения — как на рис. 10.5.
вых составляющих системы положительного подкрепления — мезолим-бических дофаминергических проекций. Такие проекции, как известно, идут от дофаминовых нейронов вентральной тегментальной области и иннервируют вентральный стриатум (n. accumbens) и обонятельные луковицы. Связь с n. accumbens является особенно важной, поскольку прилежащее ядро тесно контактирует с другими структурами лимбической системы, получает афференты от миндалины, гиппокампа, энториналь-ной и височной коры, поясной извилины. В случае пренатальной фармакологической блокады дофаминовых рецепторов у детенышей заметно снижается уровень звуковой вокализации при депривации от матери (Са-giano et al., 1988). При хендлинге (с одновременной изоляцией детеныша от матери) показано снижение уровня дофамина и его метаболитов в мозге новорожденных крыс (Papaioannou et al., 2002).
Влияние совместного введения клебоприда и р-казоморфина-7 на зависимое от самки поведение детенышей крыс
В заключительном разделе исследований мы попытались с помощью Р-казоморфина-7 устранить (ослабить) негативные последствия введения клебоприда. О2-антагонист инъецировался при этом за 20 мин до второго тестирования детеныша, аР -казоморфин-7 — за 10 мин. Животным контрольной группы производилось двукратное (за 20 и за 10 мин до второго тестирования) введение эквивалентных объемов дистиллированной воды.
В серии, выполненной на 10-дневных животных, будущая опытная группа отличалась от контроля еще до введения препаратов по одному из параметров (значимо большее число подталкиваний). Это различие исчезло при повторном тестировании: у контрольных крысят количество подталкиваний возросло на 43% (р<0,01), у опытных — осталось практически без изменений. В результате дельта (после/до) в экспериментальных группах оказалась достоверно разной (рис. 10.5). Кроме того, при повторном тестировании в опытной группе по сравнению с контролем обнаружен значимо больший ЛП полуобхода матери, а также рост суммарного времени отходов.
Сравним полученные результаты с данными опытов, в которых животным вводился только клебоприд. Как можно видеть на рис. 10.5, различия групп наиболее четко проявляются при сравнении числа подталкиваний и ЛП перелезания через тело самки. В случае ЛП перелезания Р-к-7 явно блокировал эффект клебоприда (р<0,01). Изменение числа подталкиваний после совместного введения препаратов направлено в ту же сторону, что и при действии только клебоприда, однако значимо меньше выражено (р<0,05). Таким образом, в возрасте 10 дней Р-казо-морфин-7 оказался способен устранить часть последствий введения D2-антагониста. Однако такое действие пептида распространялось не на все параметры поведения детенышей, а в случае, например, суммарного времени отходов полностью отсутствовало.
В возрасте 15 дней при первом тестировании не обнаружено значимых отличий будущих опытной и контрольной групп. После инъекций в контроле произошло падение количества подталкиваний на 50% (р<0,05); в опытной группе наблюдалась аналогичная тенденция, составившая лишь 5%. В результате дельта (после/до) в контроле и опыте оказалась достоверно разной (рис. 10.6). Кроме того, при повторном тестировании в
Глава 10. Влияние бета-казоморфинов на «детское» поведение новорожденных опытной группе значимо снизился ЛП перелезания через тело самки по сравнению с контролем. Различия, близкие к достоверным, выявлены в случае суммарного времени отходов и суммарного времени контакта: у животных с совместным введением препаратов значение первого из названных параметров уменьшилось, а второго — увеличилось (р<0,1).
В целом полученные данные свидетельствуют о росте выраженности зависимых от матери реакций в опытной группе. Следовательно, в возрасте 15 дней р-казоморфин-7 не только компенсирует последствия введения клебоприда, но и приводит к усилению детского поведения. На рис. 10.6 можно видеть, что пептид, вводимый после О2-антагониста, вызывает противоположно направленные изменения по всем представленным показателям по сравнению с группой, которой вводился только клебоприд.
Большая значимость эффектов Р -казоморфина-7, вводимого в возрасте 15 дней, по сравнению с его действием в возрасте 10 дней, очевидно, связана с процессом постнатального созревания опиоидной системы мозга крыс (Spain et al., 1985). Снятие гептапептидом негативного влияния клебоприда может быть объяснено конкуренцией их активности на системном, поведенческом уровне. С другой стороны, нельзя не учитывать возможности непосредственного взаимодействия дофаминергической и опиоидной систем мозга (в частности, то, что подкрепляющие эффекты опиоидов могут опосредоваться через выброс дофамина).
Дофаминергическая и опиоидная системы тесно связаны как анатомически, так и на нейрохимическом уровне. Опиоиды сложным образом влияют на выброс дофамина (см. главу 2). В свою очередь, хроническое введение галоперидола приводит к повышению уровня энкефалинов, а агонисты дофаминовых рецепторов усиливают экспрессию мРНК ц-опиоидных рецепторов (Azaryan et al., 1996). В работе Hirose с соавторами (2005) высказывается предположение, что выброс дофамина нейронами под действием ц-опиоидных агонистов является результатом каскада, в котором происходит стимуляция 5-опиоидных рецепторов. Mathon с соавторами (2005) показано, что у мышей, нокаутных по гену ц-опиоидных рецепторов, наблюдается пониженная импульсная активность дофаминовых нейронов. Авторы указывают также на падение подкрепляющего действия «дофаминергических» наркотических препаратов у MOR-1 нокаутов.
В наших экспериментах при использовании клебоприда наблюдалось снижение значимости для детенышей подкрепляющих стимулов, исхо-
Глава 10. Влияние бета-казоморфинов на «детское» поведение новорожденных дящих от матери. Можно предположить, что введение Р-казоморфина-7, связывающегося преимущественно с ц-опиоидными рецепторами, вызывает выброс дофамина, компенсирующий влияние 02-антагониста. Впрочем, Р -казоморфин-7 с большой вероятностью может обладать и собственным подкрепляющими свойствами, поскольку не все типы подкрепления задействуют дофаминергическую систему.
Таким образом, полученные нами результаты еще раз подтверждают гипотезу о важной биологической роли р-казоморфинов. Несмотря на разнообразие поведенческих эффектов этих пептидов (анальгезия, снижение тревожности и проявлений депрессивности, улучшение обучения), основной составляющей действия Р-казоморфинов на детенышей является, судя по всему, увеличение привязанности к матери и зависимости от нее. Именно этим можно объяснить тот факт, что Р-казоморфины более присущи молоку выводковых млекопитающих, рождающих относительно зрелых и самостоятельных детенышей (копытные, морские свинки, человек). В случае гнездового типа новорожденных (хищники, большинство грызунов, кролики) потребность в экзогенной опиоидной «поддержке» детской привязанности, очевидно, не столь актуальна.
ЗАКЛЮЧЕНИЕ
Первые эксперименты по изучению нейротропной активности р-казоморфинов были проведены на кафедре физиологии человека и животных Биологического факультета МГУ летом 1990 г. При этом на начальной стадии работ осуществлялся достаточно стандартный поведенческий скрининг Р -казоморфина-7 и его аналогов. В результате была доказана способность опиоидных фрагментов пищевых белков в случае системного введения белым крысам влиять на болевую чувствительность, двигательную активность, тревожность, способность к обучению. Детальное исследование нейротропных свойств, в первую очередь, Р-казоморфина-7 позволило выявить дозы, в которых данный пептид вызывает анальгезию, тормозит локомоцию, снижает уровень оборонительной мотивации взрослых животных. Доказана опиоидная природа наблюдаемых эффектов, а также связь некоторых из них с уровнем активности дофаминергической системы.
Следует отметить, что как опиоидное соединение Р-казоморфин-7 трудно назвать высокоактивным. Его анальгетически эффективная при внутрибрю-шинной инъекции доза (20 мг/кг) на порядок выше, чем в случае морфина или, например, дерморфина. Однако проявляющие анксиолитическое действие (и при этом не снижающие уровень двигательной активности) дозы Р-казоморфина-7 оказались ниже — 1—5 мг/кг. Такие количества уже вполне сопоставимы с «порциями» Р-казоморфинов, потребляемыми, например, новорожденным ребенком, который, съедая в сутки около 2 г казеинов (500—700 мл молока), тем самым вводит в организм не менее 20—25 мг потенциальных опиоидных пептидов.
Игнорировать этот факт, считая, что наличие Р -казоморфинов в составе молока — лишь игра случая, и для организма это только набор незаменимых аминокислот, было бы достаточно странно. Следовательно, возникла необходимость попытаться исследовать эффекты Р -казоморфинов, вводимых в раннем постнатальном периоде, причем оценить как острые, так и отставленные изменения поведения.
В результате проведенных экспериментов были впервые систематически исследованы последствия хронического и острого введения Р -казо-
морфинов детенышам на различных этапах постнатального развития. Удалось подтвердить и проанализировать способность р-к-7 вызывать длительные изменения состояния ЦНС новорожденных млекопитающих. Данные изменения проявлялись как на поведенческом (повышение исследовательской активности, снижение тревожности, изменение способности к обучению), так и на биохимическом уровне (изменение содержание серотонина в ряде отделов головного мозга). Выявлена зависимость эффектов Р -казоморфина-7 от возраста и пола животных. Высокий уровень новизны полученных результатов подтвержден Российским агенством по патентам и товарным знакам, выдавшим 10 января 2001 г. патент на изобретение № 2161500 «Гептапептид с адаптогенной и анксиолитической активностью».
В случае однократного введения Р -к-7 детенышам крыс обнаружены возрастные интервалы, на которых начинают проявлять себя различные компоненты его нейротропного действия: снижающие болевую чувствительность — в возрасте 14 дней, анксиолитические эффекты — в возрасте 28 дней, активирующие зависимое от матери поведение — в возрасте 10 дней. Подобная динамика, очевидно, связана с процессом постепенного созревания рецепторной составляющей опиоидной системы. Важно, что, по сравнению с крысой, опиоидная система ребенка к моменту рождения уже практически полностью сформирована. Следовательно, можно ожидать, что Р-казоморфины находят в этом случае заметно больше возможностей для проявления своей активности.
Почему Р-казоморфины есть в коровьем и человеческом молоке и их нет в явном виде1 в молоке крысы, мыши, кролика? По нашему мнению, пептиды этой группы, как опиоиды экзогенного происхождения, необходимы для «поддержки» деятельности тех систем мозга, которые отвечают за процесс взаимодействия с внешней средой, регулируют уровень исследовательской активности и тревожности. Действительно, складывается впечатление, что казоморфины более присущи молоку, выводковых млекопитающих, рождающих детенышей с открытыми глазами, развитым слухом, относительно зрелыми двигательными системами (среди грызунов — морские свинки). В этом случае полезность «смягчения» стрессогенного влияния окружающей среды и настройки нервной системы на более экстравертный уровень функционирования оказывается достаточно
1 Имеются в виду фрагменты казеинов, не только обладающие N-концевым тирозином, но и защищенные от деградации некоторым, числом остатков пролина.
очевидной. Чрезвычайно важна и способность Р -казоморфинов усиливать зависимое от матери («детское») поведение новорожденных.
Использование онтогенетического подхода оказалось очень информативным и, дополнив данные, полученные на взрослых животных, позволило затронуть ряд чрезвычайно интересных проблем. Назовем лишь некоторые из них.
1) . Возможность программирующего (вероятно, нейротрофического) влияния Р -казоморфинов на деятельность различных систем мозга. Для описания данного явления в литературе используется такое понятие, как «гормональный импринтинг». Этот термин, хотя и не употребляется обычно по отношению к опиоидам, в данном случае достаточно точно характеризует специфику наблюдаемых эффектов — длительно сохраняющихся последствий введения пептидов в раннем постнатальном периоде. Явление это дополняет классический сенсорный импринтинг и вместе с ним обеспечивает адаптацию мозга детеныша к жизненно важным факторам среды.
2) . Наложение наблюдаемых эффектов на онтогенез опиоидной системы и процессы половой дифференцировки. Следует отметить очень малую изученность данного вопроса и небольшое количество соответствующих публикаций. Так, совершенно не исследована возможность полового диморфизма опиоидной системы человека Без этих данных достаточно очевидное предположение о большей значимости Р-казоморфинов для формирующегося женского организма остается непод-крепленным.
3) . Структурно-функциональный анализ активности Р-казоморфинов. Действительно, уникальное сочетание опиоидного N-конца и энзиматической стабильности еще не исчерпывает всех особенностей, приобретенных Р -казоморфинами в ходе эволюции. Пептиды этой группы (и различные фрагменты их молекул), по всей видимости, способны взаимодействовать с достаточно широким кругом мест связывания, отличных от классических опиоидных рецепторов (орфановые рецепторы, рецепторы к Tyr-MIF, соответствующие транспортные пептидные системы, «нейротрофические» опиоидные рецепторы). В нашем случае чрезвычайно характерным оказалось наличие отставленных эффектов у тетрапептида Phe-Pro-Gly-Pro, не обладающего какой-либо выраженной способностью присоединяться кц-,5- ик-рецепторам.
Полученные в работе данные конкурируют с представлениями о неблагоприятном действии Р-казоморфинов на организм детенышей и ма
терей, в т.ч. с гипотезой о роди данных пептидов в развитии материнской депрессии. Нами показано, что действие р -к-7 на материнское поведение, хотя и имеет ингибирующую направленность, но является достаточно слабым. Не исключено, что р-казоморфины действительно являются регуляторами поведения лактирующих самок, но регуляторами, предотвращающими избыточную выраженность материнских реакций и полезными для выживания потомства в целом Исследование подобных возможностей является одним из главных направлений продолжающихся в настоящее время работ с Р -казоморфинами. Проводится, кроме того, изучение действия Р -к-7 на детенышей, подвергаемых вызывающим депрессию воздействиям (длительное изъятие из гнезда и др.).
Очень важно подчеркнуть, что наше исследование направлено на описание и анализ стандартного положения, в котором оказывается нервная система каждого новорожденного, питающегося молоком с опиоид-со-держащими казеинами, либо, напротив, не получающая такого молока (хотя ее онтогенез может быть рассчитан на поступление экзогенной опиоидной «поддержки»). Последняя ситуация возникает при питании детей, например, соевыми заменителями молока. Конечно, было бы наивно предлагать добавление необходимой порции опиоидов в пищу не получающих р-казоморфины новорожденных. Но уже само знание о возможных последствиях такой ситуации полезно и позволяет внести важные штрихи в общую картину процессов, протекающих в ЦНС в раннем постнатальном периоде.
Обратим также внимание на интересные перспективы клинического применения опиодных агонистов и антагонистов (в том числе Р -казоморфинов) в качестве препаратов, регулирующих уровень материнской мотивации и «детского» (ориентированного на родителей) поведения.
СПИСОК ЛИТЕРАТУРЫ
Аничков С.В. 1982. Нейрофармакология. А.: Медицина. 384 с.
Анохин К.В. 1997. Молекулярные сценарии консолидации долговременной памяти // Журнал ВНД им. Павлова. Т. 47. № 2. С. 261—279.
Аршавский И.И., Беркенблит М.Б., Попова Л.Б., Фуксон О.И., Якобсон В.С. 1979. Возможность использования анальгетиков (фентанил) для электро-физиологического исследования коры мозжечка // Нейрофизиология. Т. 11. № 6. С. 585-592.
Ашмарин И.П., Незавибатысо В.Н., Мясоедов Н.Ф., Каменский АА., Гривенников И.А., Пономарева-Степная МА., Андреева Л.А., Каплан АЛ., Кошелев В.Б., Ря-сина Т.В. 1997. Ноотропный аналог адренокортикотропина 4—10 - семакс // Журнал ВНД им. Павлова. Т. 47. Вып. 2. С. 420—430.
Ашмарин И.П., Каразеева Е.П. 1999. Нейропептиды // И.П. Ашмарин, П.В. Сту-калов, НД. Ещенко (ред.). Биохимия мозга. СПб.: Изд-во СПб. ун-та. С. 232— 266.
Ашмарин И.П., Каразеева Е.П., Стукалов П.В. 1996. Биохимические исследования механизмов психических и нервных болезней // И.П. Ашмарин, П.В. Стукалов (ред.). Нейрохимия. М.: Изд-во Ин-та биомед. химии РАМН. С. 415—438.
Баев К.В. 1983. Механизмы локомоции // Частная физиология нервной системы. А: Наука. С. 171-217
Батурина Е.Ю. 1989. Физиологические эффекты дерморфина. Дисс. на соиск. уч. степ. канд. биол наук. М. 180 с.
Беляева Ю.А., Дубынин В. А., Стоволосов И.С., Беспалова Ж.Д., Каменский А А. 2008. Нейротропная активность экзорфинов, обладающих различным сродством к опиоидным рецепторам мю- и дельта-типов // Нейрохимия. Т. 25. № 1-2. С. 57-63.
Беспалов А.Ю., Звартау Э.Э. 2000. Нейропсихофармакология антагонистов NMDA-рецепторов. СПб.: Невский диалект. 297 с.
Вальдман А.В., Козловская М.М., Медведев ОС. 1976. Фармакологическая регуляция эмоционального стресса. М.: Медицина. 360 с.
Виленский Д.А., Левицкая Н.Г., Андреева Л.А., Алфеева Л.Ю., Каменский А.А, Мясоедов Н.Ф. 2007. Влияние хронического введения семакса на исследовательскую активность и эмоциональное состояние белых крыс // Росс. Физиол. журнал им. Сеченова. Т. 93. № 6.С. 661—669.
Воскресенская О.Г., Каменский А.А. 2007. Влияние хронического пренатального введения аргинин-вазопрессина на уровень тревожности белых крыс // Тез. докл. XX съезда физиол. о-ва им. Павлова. М. С. 186.
Власова Т.И., Каменский А.А., Ашмарин И.П. 1983. Влияние лей-энкефалинов на обучение белых крыс в Т-образном лабиринте // Журнал ВНД им Павлова. Т. 33. № 5. С. 870-876.
Гмошинский И.В. 1997. Проницаемость кишечного барьера для макромолекул при некоторых патологических состояниях и воздействии различных алиментарных факторов. Автореф. дисс. на соиск. уч. степ. д. биол. наук. М. 40 с.
Гомазков О.А. 2002. Нейропептиды и ростовые факторы мозга. М. 240 с.
Грицай О.Б., Дубынин ВА., Пилипенко В.Э., Петров О.П., Андреева ЛА., Мясоедов Н.Ф. 2000. Влияние 0 -казоморфина-7 и налоксона на защитное поведение таракана Periplaneta americana при электростимуляции // Докл РАН. Т. 375. № 2. С. 245-247.
Грицай О.Б., Дубынин В А., Пилипенко В.Э., Беспалова ЖД. 2008. Роль опиоидных пептидов пищевого происхождения в регуляции термочувствительности таракана Periplaneta americana // Вести. МГУ. Сер. 16. Биол. Вып. 3. С. 7—12.
Девойно Л.В., Ильюченок Р.Ю. 1993. Нейромедиаторные системы в психонейро-иммуномодуляции. Новосибирск: ЦЭРИС. 240 с.
Динзбург АЛ., Чирков А.М., Чиркова С.К. 1995. Стресс-протекторное действие нейропептидов на обезьян // Патол физиол. эксперим терапия. № 1. С.. 19— 21.
Дмитриева Н.И., Кассиль В.Г. 1994. Вляние неонатальной изоляции от матери на общее развитие, формирование мозга и поведение // физиол. журнал им. Сеченова. Т. 80. № 8. С. 63—71.
Добрякова ЮА., Дубынин ВА., Ивлева ЮЛ., Беляева Ю.А., Каменский А.А. 2005. Влияние опиоидного антагониста налоксона на материнскую мотивацию белых крыс // Бюлл эксперим. биол. и медицины. Т. 137. № 7. С. 14—17.
Добрякова ЮА., Дубынин В.А., Беляева Ю.А., Стоволосов И.С., Каменский А.А. 2006. Активация материнского поведения белых крыс после совместного введения малых доз антагонистов дофаминовых и опиоидных рецепторов // Бюлл эксперим. биол и медицины. Т. 142. № 8. С. 124—127.
Дубынин ВА., Ашмарин И.П., Каменский АЛ., Малиновская И.В., Алфеева Л.Ю., Андреева Л.А., Мясоедов Н.Ф. 2001. Гептапептид с адаптогенной и анксиолитической активностью. Патент на изобретение N 2161500, выдан Российским агенством по патентам и товарным знакам 10.01.2001 г.
Дубынин В.А., Земская Н.Ю., Ивлева ЮА., Каменский А.А., Андреева Л.А., Мясоедов Н.Ф. 2004а. Поведенческие эффекты бета-казоморфина-7 при интраназальном введении // Журнал ВНД им. Павлова. Т. 54. № 3. С. 373—381.
Дубынин В.А., Земская Н.Ю., Ивлева Ю.В, Каменский А.А., Шестакова С.В., Малиновская И.В., Гончаренко Е.Н., Андреева Л.А., Мясоедов Н.Ф. 1999. Отставленные нейротропные эффекты бета-казоморфина-7, хронически вводимого новорожденным белым крысам // Докл РАН. Т. 364. № 6. С. 839—842.
Дубынин В.А., Ивлева Ю.А., Беляева Ю.А., Добрякова Ю.В., Андреева Л.А., Каменский А.А. 2005. Воздействие однократного и хронического введения бета-ка-
зоморфинов на материнскую мотивацию белых крыс // Физиол. журнал им. Сеченова. Т. 95. № 1. С. 80—88.
Дубинин В.А., Ивлева Ю.А., Каменский А.А. 20046. Нейротропная активность опиоидных пептидов пищевого происхождения бета-казоморфинов // Успехи физиол. наук. Т. 35. № 1. С. 83—100.
Дубынин В.А., Ивлева Ю.А., Малиновская И.В., Каменский АА, Андреева Л.А., Алфеева Л.Ю., Мясоедов Н.Ф. 2001. Изменение поведенческих эффектов бета-ка-зоморфина-7 в ходе постнатального развития детенышей белых крыс // Журнал ВНД им. Павлова. Т. 51. Вып. 3. С. 386—389.
Дубынин ВА., Ивлева ЮА., Стоволосов И.С., Беляева Ю.А., Добрякова Ю.В., Андреева Л.А., Алфеева Л.Ю., Каменский А.А., Мясоедов Н.Ф. 2007. Влияние бета-казоморфинов на зависимое от матери («детское») поведение белых крыс // Докл. РАН. Т. 412. № 2.С. 279-282.
Дубынин В.А., Маклакова А.С., Незавибатько В.Н., Алфеева Л.Ю., Каменский А.А., Ашмарин И.П. 1992. Действие бета-казоморфина-7 на ноцицепцию крыс при системном введении // Бюлл эксперим. биол и медицины. Т. 114. № 9.С. 284— 286.
Дубынин В.А., Малиновская И.В., Ивлева Ю.А., Андреева Л.А., Каменский А.А., Ашмарин И.П. 2000. Зависимость отставленных поведенческих эффектов бета-казоморфина-7 от возраста и пола детенышей белых крыс // Бюлл. эксперим. биол. и медицины. Т. 130. № 11. С. 488—492.
Дубынин В.А., Малиновская И.В., Беляева Ю.А., Стоволосов И.С., Беспалова Ж.Д., Андреева ЛА., Каменский АА., Мясоедов Н.Ф. 2007. Отставленное влияние экзорфинов на обучение детенышей белых крыс // Изв. РАН, сер. Биол. № 6. С. 1-8.
Зуфаров КА. 1998. Новые данные о пищеварительно-всасывательных функциях тонкой кишки и почек новорожденных // Бюлл. эксперим. биол. и медицины. Т. 125. №1. С. 4-11.
Ивлева ЮА., Дубынин В.А., Дмитриева ТА., Андреева ЛА., Каменский АА. 2003. Влияние бета-казоморфина-7 на материнско-детское взаимодействие белых крыс // Вести. МГУ, сер. 16. Биол № 4. С. 11—16.
Конь И31.1999. Рациональное вскармливание и здоровье детей: современные аспекты // Росс, педиатр, журнал. № 2. С. 45—48.
Королева С.В., Ашмарин И.П. 2000. Нейропептид Y: многообразие и кажущаяся противоречивость функций. Анализ возможных опосредованных эффектов // Успехи физиологических наук. Т. 31. № 1. С. 31—46.
Косенкова Н.С., Пошивалов В.П. 1989. Влияние агонистов и антагонистов опиатных рецепторов на материнскую агрессию крыс // Бюлл эксперим. биол и медицины. Т. 107. № 2. С. 207—209.
Левицкая Н.Г. 2007. Физиологические эффекты синтетических аналогов мелано-кортинов: структурно-функциональное исследование. Автореф. дисс. на соиск. уч. степ. д. биол. наук. М. 44 с.
Маклакова А.С., Дубынин В.А., Андреева ЛА., Алфеева Л.Ю., Каменский А.А. 1999. Нейротропное действие бета-казоморфина-7 на фоне фармакологического изменения состояния мозга крыс // Вести. Моск, ун-та. Сер. 16. Биол. №1.С.З-9.
Маклакова А.С., Дубынин В.А., Левицкая Н.Г., Незавибатысо В.Н., Каменский А.А., Ашмарин И.П. 1993. Поведенческие эффекты бета-казоморфина-7 и его дез-Туг-аналогов // Бюлл. эксперим. биол. и медицины. Т. 116. № 8. С. 155-158.
Маклакова А.С., Дубынин В.А., Сарычева Н.Ю., Незавибатысо В.Н., Каменский АА. 1996. Зависимые от пола различия в действии хронически вводимого бета-ка-зоморфина-7 на поведение детенышей белых крыс // Журнал ВНД им. Павлова. Т. 46. Вып. 3. С. 610—613.
Маклакова А.С., Назаренко И.В., Дубынин В.А., Незавибатысо В.Н., Алфеева Л.Ю., Каменский АА 1995. Влияние бета-казоморфина-7 на уровень пищевой и оборонительной мотиваций при различных видах обучения // Журнал ВНД им. Павлова. Т. 45. Вып. 6. С. 1143—1150.
Мелзак Р. 1981. Загадка боли. М.: Медицина. 160 с.
Милнер П. 1973. Физиологическая психология. М.: Мир. 647 с.
Ноздрачев АД., Баженов Ю.И., Баранникова И.А., Батуев А.С. 2001. Начала физиологии. СПб.: Лань. 1088 с.
Павлов И.П. 1973. Двадцатилетний опыт объективного изучения высшей нервной деятельности (поведения) животных. М.: Наука. 659 с.
Пономарева Н.С., Воскресенская О.Г., Каменский А.А., Голубович В.П., Ашмарин И.П. 1998. Влияние оригинального аналога С-концевого фрагмента вазопрессина на поведение белых крыс // Журнал ВНД им. Павлова. Т. 48. Вып. 3. С. 471-477.
Пошивалов В.П., Косенкова НС. 1989. Этологическое исследование последствий пренатального введения психотропных препаратов // Фармакол. токсикол. Т. 52. № 5. С. 99-107.
Родина В.И., Крупина Н.А., Крыжановский Г.Н., Окнина Н.В. 1993. Мульти-параметрический метод комплексной оценки тревожно-фобического состояния крыс // Журнал ВНД им. Павлова. Т. 43. Вып. 5. С. 1006—1017.
Розен В.Б. 1994. Основы эндокринологии. М.: Высш. шк. 336 с.
Сергеев П.В., Шимановский НА., Петров В.И. 1999. Рецепторы физиологически активных веществ. Волгоград: Семь ветров. 640 с.
Симонов П.В. 1997. Психофизиология эмоций // Основы психофизиологии. М.: Инфра-М. С. 143-167.
Соломзес Д.А., Чеурсон В. Соколовский Г. 1998. Наркотики и общество. М.: «Ил-лойн». 192 с.
Соханенкова Н.Ю., Дубынин В.А., Андреева Л.А., Каменский А.А., Мясоедов Н.Ф. 1998. Влияние опиоидных пептидов пищевого происхождения на кардио-тропные компоненты стресса // Докл. РАН. Т. 363. № 6.С. 839—842.
Суворов Н.Ф., Якимовский А.Ф. 1982. Роль энкефалин-реактивной системы хвостатого ядра в формировании пищевого условного рефлеекса у собак // Журнал ВНД им. Павлова. Т. 32. Вып. 5. С. 840—844.
Уранова М.Г. 2000. Структурно-функциональные особенности в ряду природных и синтетических дерморфинов. Дисс. на соиск. уч. степ. канд. биол. наук. М. 213 с.
Филаретов А.А., Богданов А.И., Ярушкина Н.И. 1995. Стресс-индуцированная анальгезия. Роль гормонов гипофизарно-адреналовой системы // Физиологический журнал им. ИМ. Сеченова. Т. 81. № 2. С. 40“46.
Харкевич ДА. 2004. Фармакология. М.: Гэотар-Мед. 736 с.
Черкес В.А. 1983. Базальные ганглии // Частная физиология нервной системы. Л.: Наука. С. 383-411.
Яснецов В.В., Правдивцев В.А. 1986. Химическая чувствительность нейронов медиального вестибулярного ядра к энкефалинам, ацетилхолину, ГАМК и L-глу-тамату // Косм. биол. авиакосм, медицина. Т. 20. № 5. С. 53—57.
Abbott F.V., Guy E.R. 1995. Effects of morphine, pentobarbital and amphetamine on formalin-induced behaviours in infant rats: sedation versus specific suppression of pain // Pain. Vol. 62. No. 3. P. 303—312.
Abdulla F.A., Aneja I.S. 1993. Morphine inhibits the thalamic component of the subcortical somatosensory evoked potentials in rats // Funct. Neurol. Vol. 8. No. 3. P. 197-203.
Ableitner A., Schulz R.J. 1992. Neuroanatomical sites mediating the central actions of beta-endorphin as mapped by changes in glucose utilization: involvement of mu opioid receptors // Pharmacol. Exp. Then Vol. 262. No. 1. P. 415—423.
Adamec R. 1994. Modelling anxiety disorders following chemical exposures // Toxicol. Ind. Health. Vol. 10. No. 4-5. P. 391-420.
Adams J.U., Holtzman S.G. 1991. Naltrexone-sensitizing effects of centrally administered morphine and opioid peptides // Eur. J. Pharmacol. Vol. 193. No. 1. P. 67— 73.
Ader R., Grota L.J. 1969. Effects of early experience on adrenocortical reactivity // Physiol. Behav. Vol. 4. P. 303—305.
Agmo A., Barreau S., Lemaire V. 1997. Social motivation in recently weaned rats is modified by opiates // Dev. Neurosci. Vol. 19. No. 6. P. 505—520.
Agmo A., Belzung C. 1998. The role of subtypes of the opioid receptor in the anxiolytic action of chlordiazepoxide // Neuropharmacology. Vol. 37. No. 2. P. 223— 232.
Aguilar M.A., Minarro J., Simon V.M. 1998. Dose-dependent impairing effects of morphine on avoidance acquisition and performance in male mice // Neurobiol. Learn. Mem. Vol. 69. No. 2. P. 92—105.
Akil H., Young E., Watson S.J., Coy D.H. 1981. Opiate binding properties of naturally occurring N- and C-terminus modified beta-endorphins // Peptides. Vol. 2. No. 3. P. 289-292.
Alexander L.J., Das Gupta NA., Beattie C.W. 1992. The sequence of porcine alpha s2-casein cDNA // Anim. Genet. Vol. 23. P. 365—367.
Allescher H.D., Storr M., Piller C., Brantl V., Schusdziarra V 2000. Effect of opioid active therapeutics on the ascending reflex pathway in the rat ileum // Neuropeptides. Vol. 34. No. 3—4. P. 181—186.
Alieva E., Laviola G., Bignami G. 1987. Morphine effects on activity and pain reactivity of developing mice with or without late prenatal oxazepam exposure // Psychopharmacology (Berl). Vol. 92. No. 4. P. 438—440.
Altemus M., Deuster P.A., Galliven E., Carter C.S., Gold P.W. 1995. Suppression of hypothalamic-pituitary-adrenal axis responses to stress in lactating women //J. Clin. Endocrinol. Metab. Vol. 80. P. 2954—2959.
Anagnostakis Y., Krikos Y., Spyraki C. 1992. Pallidal substrate of morphine-induced locomotion // Eur. Neuropsychopharmacol. Vol. 2. No. 1. P. 65—72.
Anand K.J. 1998. Clinical importance of pain and stress in preterm neonates // Biol. Neonate. Vol. 73. No. 1. P. 1-9.
Anseloni V.C., Coimbra N.C., Morato S., Brandao M.L. 1999. A comparative study of the effects of morphine in the dorsal periaqueductal gray and nucleus accumbens of rats submitted to the elevated plus-maze test // Exp. Brain. Res. Vol. 129. No. 2. P. 260-268.
Arenas E., Alberch J., Sanchez Arroyos R., Marsal J. 1990. Effect of opioids on acetylcholine release evoked by K+or glutamic acid from rat neostriatal slices. Participation of noradrenergic pathways in the expression of opiate withdrawal: biochemical and pharmacological evidence // Brain Res. Vol. 523. No. 1. P. 51 — 56.
Asakawa A., Inui A., Momose K., Ueno N., Fujino M.A., Kasuga M. 1998. Endomorphins have orexigenic and anxiolytic activities in mice // Neuroreport. Vol. 13. P. 2265-2267.
Attali B, Gouarderes C, Mazarguil H, Audigier Y, Cros J. 1982. Evidence for multiple «Карра» binding sites by use of opioid peptides in the guinea-pig lumbo-sacral spinal cord // Neuropeptides. Vol. 3. No. 1. P. 53—64.
Auestad N., Fisher R., Chiappelli F., Korsak R.A., Edmond J. 1990. Growth and development of brain of artificially reared hypoketonemic rat pups // Proc. Soc. Exp. Biol. Med. Vol. 195. No. 3. P. 335-344.
Azaryan A.V., Clock B.J., Сох B.M. 1996. Mu opioid receptor mRNA in nucleus accumbens is elevated following dopamine receptor activation // Neurochem. Res. Vol. 21. No. 11. P. 1411-1415.
Bach F.W., Y aksh T.L. 1995. Release of beta-endorphin immunoreactivity from brain by activation of a hypothalamic N-methyl-d-aspartate receptor // Neuroscience. Vol. 65. No. 3. P.775-783.
Balaban C.D., Thayer J.F. 2001. Neurological bases for balance-anxiety links //J. Anxiety Disord. Vol. 15. No. 1—2. P. 53—79.
Bals-Kubik R., Herz A., Shippen berg T.S. 1989. Evidence that the aversive effects of
opioid antagonists and kappa-agonists are centrally mediated // Psychopharmacology (Berk). Vol. 98. No. 2. P. 203—206.
Banbula A., Bugno M., Goldstein J., Yen J., Nelson D., Travis J., Potempa J. 2000. Emerging family of proline-specific peptidases of Porphyromonas gingivalis: purification and characterization of serine dipeptidyl peptidase, a structural and functional homologue of mammalian prolyl dipeptidyl peptidase IV // Infect. Immun. Vol. 68. No. 3. P. 1176-1182.
Banks W.A., Kastin A.J. 1987. Saturable transport of peptides across the blood-brain barrier // Life Sci. Vol. 41. No. 11. P. 1319—1338.
Banks W.A., Kastin A.J. 1990. Peptide transport systems for opiates across the bloodbrain barrier // Am. J. Physiol. Vol. 259. P. 1—10.
Banks WA, Kastin A.J., Harrison LM., Zadina J.E. 1996. Perinatal treatment of rats with opiates affects the development of the blood-brain barrier transport system PTS-1 // Neurotoxicol. Teratol. Vol. 18. No. 6. P. 711-715.
Barr G.A., Miya D.Y., Paredes W. 1992. Analgesic effects of intraventricular and intrathecal injection of morphine and ketocyclazocine in the infant rat // Brain Res. Vol. 584. No. 1-2. P. 83-91.
Barr G.A., Paredes W., Erickson K.L., Zukin R.S. 1986. Kappa opioid receptor-mediated analgesia in the developing rat // Brain Res. Vol. 394. No. 2. P. 145—152.
Becker A, Grecksch G., Matthies H. 1991a. Influence of beta-casomorphin derivatives on chemically and electrically induced seizures // Peptides. Vol. 12. No. 1. P. 43—45.
Becker A., Grecksch G., Matthies H. 1991b. The effect of acutely administered beta-casomorphin derivatives on pentylenetetrazol-kindled mice // Peptides. Vol. 12. No. 3. P. 483-485.
Becker L.A., Smotherman W.P. 1996. Manipulation of the dopamine system affects fetal and neonatal responses to an artificial nipple // Dev. Psychobiol. Vol. 29. No. 2. P. 139-156.
Becu-Villalobos D., Gonzalez Iglesias A., Diaz-Torga G., Hockl P., Libertun C. 1997. Brain sexual differentiation and gonadotropins secretion in the rat // Cell Mol. Neurobiol. Vol. 17. No. 6. P. 699-715.
Befort K., Tabbara L, Bausch S., Chavkin C., Evans C., Kieffer B. 1996. The conserved aspartate residue in the third putative transmembrane domain of the delta-opioid receptor is not the anionic counterpart for cationic opiate binding but is a constituent of the receptor binding site // Mol. Pharmacol. Vol. 49. No. 2. P. 216—223.
Befort K., Tabbara L, Kling D., Maigret B., Kieffer B.L. 1996. Role of aromatic transmembrane residues of the delta-opioid receptor in ligand recognition //J. Biol. Chem. Vol. 271. No. 17. P. 10161-10168.
Behavioural Neuroscience. A practical approach. 1993. / Ed. by A. Saghal. Oxford Univ. Press. Vol. 1. 218 p.; Vol. 2. 217 p.
Belzung C, Barreau S., Agmo A. 2000. Naloxone potentiates anxiolytic-like actions of diazepam, pentobarbital and meprobamate but not those of Ro19-8022 in the rat // Eur. J. Pharmacol. Vol. 394. No. 2-3. P. 289-294.
Ben Mansour A., Tome D., Rautureau M., Bisalli A., Desjeux J.F. 1988. Luminal anti-secretory effects of a beta-casomorphin analogue on rabbit ileum treated with cholera toxin // Pediatr. Res. Vol. 24. No. 6. P. 751—755.
Bennett-Clarke C.A., Lane R.D., Rhoades R.W. 1995. Fenfluramine depletes serotonin from the developing cortex and alters thalamocortical organization // Brain Res. Vol. 702. No. 1-2. P. 255-260.
Benyhe S., Farkas J., Toth G., Wollemann M. 1999. Characterization of [3HJMet-en-kephalin-Arg6-Phe7 binding to multiple sites in rat and guinea pig cerebellum // Life Sci. Vol. 64. No. 14. P. 1189-1196.
Besson A., Privat A.M., Eschalier A., Fialip J. 1996. Effects of morphine, naloxone and their interaction in the learned -helplessness paradigm in rats // Psychopharmacology (Berk). Vol. 123. No. 1. P. 71-78.
Blass EM., Blom J. 1996. Betata-casomorphin causes hypoalgesia in 10-day-old rats: evidence for central mediation. // Pediatr. Res. Vol. 39. No. 2. P. 199—203.
Bodnar R., Paul D., Pasternak G.W. 1991. Synergistic analgesic interactions between the peri-aqueductal gray and the locus coeruleus // Brain Res. Vol. 558. No. 2. P. 224-230.
Bono A.V., Cuffari S. 1997. Effectiveness and tolerance of tramadol in cancer pain. A comparative study with respect to buprenorphine // Drugs. Vol. 53. Suppl. 2. P. 40-49.
Boyer P. 2000. Do anxiety and depression have a common pathophysiological mechanism? // Acta Psychiatr. Scand. Suppl. No. 406. P. 24—29.
Brandt W., Stoldt M., Schinke H. 1996. The mu- and delta-opioid pharmacophore conformations of cyclic beta-casomorphin analogues indicate docking of the Phe3 residue to different domains of the opioid receptors //J. Comput. Aided Mol. Des. Vol. 10. No. 3. P. 201-212.
Brantl V. 1984. Novel opioid peptides derived from human beta-casein: human beta-casomorphins // Eur. J. Pharmacol. Vol. 106. No. 1. P. 213—214.
Brantl V., Neubert К. 1986. Opioid peprides derived from food proteins // TJPS. Vol. 7. P. 6-7.
Brantl V., Pfeiffer A., Herz A., Henschen A., Lottspeich F. 1982. Antinociceptive potencies of beta-casomorphin analogs as compared to their affinities towards mu and delta opiate receptor sites in brain and periphery // Peptides. Vol. 3. No. 5. P.793-797.
Brantl V., Teschemacher H., Blasig J., Henschen A., Lottspeich F. 1981. Opioid activities of beta-casomorphins // Life Sci. Vol. 28. No. 17. P. 1903—1909.
Brantl V., Teschemacher H., Henschen A., Lottspeich F. 1979. Novel opioid peptides derived from casein (beta-casomorphins). I. Isolation from bovine casein peptone // Hoppe Seylers. Z. Physiol. Chem. Vol. 360. No. 9. P. 1211—1216.
Bremner J.D., Krystal J.H., Southwick S.M., Charney D.S. 1996. Noradrenergic mechanisms in stress and anxiety: I. Preclinical studies // Synapse. Vol. 23. No. 1. P. 28-38.
Brent P.J. 1993. Behavioural effect of pretreatment with opioid antagonists and sigma binding site ligands on the abnormal motor response produced by the kappa opioid agonist U50.488H in guinea pigs // Neuropharmacology. Vol. 32. No. 8. P. 751-760.
Bridges R.S., Numan M., Ronsheim P.M., Mann P.E., Lupini C.E. 1990. Central prolactin infusions stimulate maternal behaviour in steroid-treated, nulliparous female rats // Neurobiology. Vol. 87. P. 8003—8007.
Bridges R.S., Rigero B.A., Byrnes E.M., Yang L., Walker AJvt. 2001. Central infusion of the recombinant human prolactin receptor antagonis, S179-PRL, delay the onset of maternal behaviour in steroid-primed, nulliparous female rats // Endocrinology. Vol. 142. No. 2. P. 730-739.
Brooks A.I., Standifer K.M., Rossi G.C., Mathis J.P., Pasternak G.W. 1996. Characterizing карраЗ opioid receptors with a selective monoclonal antibody // Synapse. Vol. 22. No. 3. P. 247-252.
Burford N., Wang D., Sadee W. 2000. G-protein coupling of mu-opioid receptors (OP3): elevated basal signalling activity // Biochem. J. Vol. 348. No. 3. P. 531 — 537.
Buzas B., Izenwasser S., Portoghese P.S., Cox B.M. 1994. Evidence for delta opioid receptor subtypes regulating adenylyl cyclase activity in rat brain // Life Sci. Vol. 54. No. 7. P. 101-106.
Byrnes EJvt., Rigero B.A., Bridges R.S. 2002. Dopamine antagonists during parturition disrupt maternal care and the retention of maternal behavior in rats // Pharmacol. Biochem. Benav. Vol. 73. P. 869—875.
Byrnes E.M., Rigero B.A., Bridges R.S. 2000. Opioid receptor antagonism during early lactation results in the increased duration of nursing bouts // Physiol. Behav. Vol. 70. P. 211-216.
Byrnes EM., Ughrin Y., Bruno J.P. 1995. Independent mediation of unconditioned motor behavior by striatal DI and D2 receptors in rats depleted of dopamine as neonates // Psychopharmacology. Vol. 122. No. 1. P. 85—94.
Cagiano R., Barfield R.J., White N.R., Pleim E.T., Weinstein M., Cuomo V. 1988. Subtle behavioural changes produced in rat pups by in utero exposure to haloperidol // Eur. J. Pharmacol. Vol. 157. No. 1. P. 45—50.
Calenco-Choukroun G., Dauge V., Gacel G., Feger J., Roques B.P. 1991. Opioid delta agonists and endogenous enkephalins induce different emotional reactivity than mu agonists after injection in the rat ventral tegmental area // Psychopharmacology (Berk). Vol. 103. No. 4. P. 493—502.
Campo M. 1992. Effect of 12-hour infusion of naloxone on mood and cognition in normal male volunteers // Biol. Psychiatry. Vol. 32. P. 344—353.
Caporale C., Fontanella A., Petrilli P., Pucci P., Molinaro M.F., Picone D., Auricchio S. 1985. Isolation and characterization of dipeptidyl peptidase IV from human meconium. Functional role of beta-casomorphins // FEBS Lett. Vol. 184. No. 2. P. 273-277.
Carden S.E., Bortot А.Т., Hofer M.A. 1993. Ultrasonic vocalizations are elicited from rat pups in the home cage by pentylenetetrazol and U50.488, but not naltrexone // Behav. Neurosci. Vol. 107. No. 5. P. 851—859.
Carden S.E., Davachi L., Hofer MA. 1994. U50,488 increases ultrasonic vocalizations in 3-, 10-, and 18-day-old rat pups in isolation and the home cage // Dev. Psyc-hobiol. Vol. 27. No. 1. P. 65-83.
Carden S.E., Hernandez N., Hofer M.A. 1996. The isolation and companion comfort responses of 7- and 3-day-old rat pups are modulated by drugs active at the opioid receptor // Behav. Neurosci. Vol. 110. No. 2. P. 324—330.
Castellano C., Ammassari-Teule M. 1984. Prenatal exposure to morphine in mice: enhanced responsiveness to morphine and stress // Pharmacol. Biochem. Behav. Vol. 21. No. 1. P. 103-108.
Chakrabarti S., Yang W., Law P., Loh H. 1997. The mu-opioid receptor down-regula-tes differently from the delta-opioid receptor: requirement of a high affinity re-ceptor/G protein complex formation // Mol. Pharmacol. Vol. 52. No. 1. P. 105-113.
Chang K.J., Cuatrecasas P., Wei E.T., Chang J.K. 1982. Analgesic activity of intrace-rebroventricular administration of morphiceptin and beta-casomorphins: correlation with the morphine (mu) receptor binding affinity // Life Sci. Vol. 30. No. 18. P. 1547-1551.
Chang K.J., Lillian A., Hazum E., Cuatrecasas P., Chang J.K. 1981. Morphiceptin (NH4-tyr-pro-phe-pro-COHN2): a potent and specific agonist for morphine (mu) receptors // Science. Vol. 212. No. 4490. P. 75—77.
Chang KJ., Su Y.F., Brent D.A., Chang J.K. 1985. Isolation of a specific mu-opiate receptor peptide, morphiceptin, from an enzymatic digest of milk proteins //J. Biol. Chem. Vol. 260. No. 17. P. 9706-9712.
Charlin V, Defilippi C, Vargas V., Borghesi L., Gomez E. 1992. Treatment of acute secretory diarrhea with casein: an effect of beta-casomorphins? // Rev. Med. Chil. Vol. 120. No. 6. P. 666—669.
Charney D.S., Deutch A. 1996. A functional neuroanatomy of anxiety and fear: implications for the pathophysiology and treatment of anxiety disorders. // Crit. Rev. Neurobiol. Vol. 10. No. 3—4. P. 419—446.
Chaturvedi K., Shahrestanifar M., Howells R.D. 2000. Mu-opioid receptor: role for the amino terminus as a determinant of ligand binding affinity // Brain Res. Mol. Brain Res. Vol. 76. No. 1. P. 64—72.
Cheeta S., Kenny P.J., File S.E. 2000. Hippocampal and septal injections of nicotine and 8-OH-DP AT distinguish among different animal tests of anxiety // Prog. Ne-uropsychopharmacol. Biol. Psychiatry. Vol. 24. No. 7. P. 1053—1067.
Churchill L., Kalivas P.W. 1999. The involvement of the mediodorsal nucleus of the thalamus and the midbrain extrapyramidal area in locomotion elicited from the ventral pallidum // Behav. Brain Res. Vol. 104. No. 1—2. P. 63—71.
Churchill L, Klitenick M.A., Kalivas P.W. 1998. Dopamine depletion reorganizes
projections from the nucleus accumbens and ventral pallidum that mediate opioid-induced motor activity //J. Neurosci. Vol. 18. No. 19. P. 8074—8085.
Churchill L, Roques B.P., Kalivas P.W. 1995. Dopamine depletion augments endogenous opioid-induced locomotion in the nucleus accumbens using both mul and delta opioid receptors // Psychopharmacology (Berk). Vol. 120. No. 3. P. 347— 355.
Clare D.A., Catignani G.E., Swaisgood H.E. 2003. Biodefence properties of milk: the role of antimicrobial proteins and peptides // Curr. Pharm. Des. Vol. 9. No. 16. P. 1239-1255.
Clark M.J., Linderman J.J., Traynor J.R. 2008. Endogenous regulators of G protein signaling differentially modulate full and partial mu-opioid agonists of adenylyl cyclase as predicted by a collisian coupling model // Mol. Pharmacol. Vol. 73. No. 5. P. 1538-1548.
Contet C., Matifas A., Kieffer B. 2004. No evidence for G-protein-coupled epsilon receptor in the brain of triple opioid receptor knockout mouse // Eur. J. Pharmacol. Vol. 492. No. 2-3. P. 131-136.
Corbett A.D., Gillan M.G., Kosterlitz H.W., McKnight A.T., Paterson S.J., Robson L.E. 1984. Selectivities of opioid peptide analogues as agonists and antagonists at the delta-receptor // Br. J. Pharmacol. Vol. 83. No. 1. P. 271—279.
Corrigall W.A., Coen КЛ4.1990. Selective DI and D2 dopamine antagonists decrease response rates of food-maintained behavior and reduce the discriminative stimulus produced by heroin // Pharmacol. Biochem. Behav. Vol. 35. No. 2. P. 351—355.
Coudereau J.P., Debray M., Monier C., Bourre J.M., Frances H. 1997. Isolation impairs place preference conditioning to morphine but not aversive learning in mice // Psychopharmacology (Berl.). Vol. 130. No. 2. P. 117—123.
Cuomo V., Cagiano R., De Salvia M.A., Restani P., Galimberti R., Colonna S., Racagni G., Galli C.L. 1988. Ultrasonic vocalization in rat pups as a marker of behavioral development: an investigation of the effects of drugs influencing brain opioid system // Neurotoxicol. Teratol. Vol. 10. No. 5. P. 465—469.
Cvejic S., Trapaidze N., Cyr C., Devi LA. 1996. Thr353, located within the COOH-ter-minal tail of the delta opiate receptor, is involved in receptor down-regulation / / J. Biol. Chem. Vol. 271. No. 8. P. 4073-4076.
Dafny N., Dong W.Q., Prieto-Gomez C., Reyes-Vazquez C., Stanford J, Qiao J.T. 1996. Lateral hypothalamus: site involved in pain modulation // Neuroscience. Vol. 70. No. 2. P. 449-460.
Daniel H., Vohwinkel M., Rehner G. 1990. Effect of casein and beta-casomorphins on gastrointestinal motility in rats //J. Nutr. Vol. 120. No. 3. P. 252—257.
Dauge V. 2003. Neurobiological impact of separating mothers from newborns in rodents // Med. Sci. (Paris). Vol.19. No. 5. P. 607—611.
Davila-Garcia M.I., Azmitia EC. 1990. Neuropeptides as positive or negative neuronal growth regulatory factors: effects of ACTH and leu-enkephalin on cultured serotonergic neurons // Adv. Exp. Med. Biol. Vol. 265. P. 75—92.
Day A.R., Freer R.J., Liao C.S. 1981. Morphiceptin (beta-casomorphin[l-4] amide): a peptide opioid antagonist in the field stimulated rat vas deferens // Res. Com-mun. Chem. Pathol. Pharmacol. Vol. 34. No. 3. P.543—546.
De Almeida R.M., Lucion A.B. 1994. Effects of intracerebroventricular administration of 5-HT receptors agonists on the maternal agression of rats // Eur. J. Pharmacol. Vol. 264. No. 3. P. 445-448.
De Cabo C., Colado M.I., Pujol A., Martin M.I., Viveros M.P. 1994. Naltrexone administration effects on regional brain monoamines in developing rats // Brain Res. Bull. Vol. 34. No. 4. P. 395-406.
De Cabo C., Pujol A., Paz Viveros M. 1995. Neonatally administered naltrexone affects several behavioural responses in adult rats of both genders // Pharmacol. Biochem. Behav. Vol. 50. No. 2. P. 277-286.
De Ponti F., Marcoli M., Lecchini S., Manzo L, Frigo GM., Crema A. 1989. Effect of beta-casomorphins on intestinal propulsion in the guinea-pig colon. //J. Pharm. Pharmacol. Vol. 41. No. 5. P. 302-305.
De Ryck M., Teitelbaum P. 1983. Morphine versus haloperidol catalepsy in the rat: an electromyographic analysis of postural support mechanisms // Exp. Neurol. Vol. 79. No. 1. P 54-76.
De Vries T.J., Tjon Tien Ril G.H., Van der Laan J.W., Mulder A.H., Schoffelmeer A.N. 1993. Chronic exposure to morphine and naltrexone induces changes in catec-holaminergic neurotransmission in rat brain without altering mu-opioid receptor sensitivity // Life Sci. Vol. 52. No. 21. P. 1685—1693.
De Vries T.J., Van Vliet B.J., Hogenboom F., Wardeh G., Van der Laan J.W., Mulder A.H. Schoffelmeer A.N. 1991. Effect of chronic prenatal morphine treatment of mu-opioid receptor-regulated adenylate cyclase activity and neurotransmitter release in rat brain slices // Eur. J. Pharmacol. Vol. 208. No. 2. P. 97—104.
Dockstader C.L., Rubinstein M., Grandy D.K., Low MJ., van der Kooy D. 2001. The D2 receptor is critical in mediating opiate motivation only in opiate-dependent and withdrawn mice // Eur. J. Neurosci. Vol. 13. No. 5. P. 995—1001.
Dubrovina N.I., Ilyutchenok R.Yu. 1995. Effect of Leu-enkephalin on the memory reactivation produced by blockade of the benzodiazepine/GABA-chloride ionophore receptor complex // Brain Res. Vol. 670. No. 2. P. 347—350.
Duman R.S., Tailman J.F., Nestler E.J. 1988. Acute and chronic opiate-regulation of adenylate cyclase in brain: specific effects in locus coeruleus //J. Pharmacol. Exp. Then Vol. 246. No. 3. P. 1033-1039.
Duvauchelle C.L., Fleming SM., Kometsky C. 1997. DAMGO and DPDPE facilitation of brain stimulation reward thresholds is blocked by the dopamine antagonist cis-flupenthixol // Neuropharmacology. Vol. 36. No. 8. P. 1109—1114.
El Kouhen R., Burd A.L., Erickson-Herbrandson L.J., Chang C.Y., Law P.Y., Loh H.H. 2001. Phosphorylation of Ser363,Thr37O, and Ser375 residues within the carboxyl tail differentially regulates mu-opioid receptor internalization //J. Biol. Chem. Vol. 276. No. 16. P. 12774-12780.
Eide R., Arvidsson U., Riedl M., Vulchanova L., Lee J.H., Dado R., Nakano A., Chakrabarti S., Zhang X., Loh H.H. 1995. Distribution of neuropeptide receptors. New views of peptidergic neurotransmission made possible by antibodies to opioid receptors // Ann. NY Acad. Sci. Vol. 757. P.. 390—404.
Elitsur Y., Luk G.D. 1991. Beta-casomorphin (BCM) and human colonic lamina propria lymphocyte proliferation // Clin. Exp. Immunol. Vol. 85. No. 3. P. 493—497.
Engelmann M., Wotjak C.T., Ebner K., Landgraf R. 2000. Behavioural impact of in-traseptally released vasopressin and oxytocin in rats // Exp. Physiol. Vol. 85. P. 125S-130S.
Eppler CM, Hulmes J.D., Wang J.B., Johnson B., Corbett M., Luthin D.R., Uhl G.R., Linden J. 1993. Purification and partial amino acid sequence of a mu opioid receptor from rat brain //J. Biol. Chem. Vol. 268. No. 35. P. 26447—26451.
Ermisch A., Ruhle H.J., Neubert K., Hartrodt B., Landgraf R. 1983. On the blood-brain barrier to peptides: [3HJbeta-casomorphin-5 uptake by eighteen brain regions in vivo // J. Neurochem. Vol. 41. No. 5. P. 1229—1233.
Evans C.J., Keith D.E. Jr., Morrison H., Magendzo K., Edwards R.H. 1992. Cloning of a delta opioid receptor by functional expression // Science. Vol. 18. P. 1952—1955.
Fabian I., Ableitner A. 1995. Brain sites involved in mu-opioid receptor-mediated actions: a 2-deoxyglucose study // Brain Res. Vol. 697. No. 1—2. P. 205—215.
Fanselow M.S., Cramer CP. 1988. The ontogeny of opiate tolerance and withdrawal in infant rats // Pharmacol. Biochem. Behav. Vol. 31. No. 2. P. 431—438.
Fanselow M.S., Kim J.J., Young S.L, Calcagnetti D.J., DeCola J.P., Helmstetter F.J., Lan-deira-Fernandez J. 1991. Differential effects of selective opioid peptide antagonists on the acquisition of pavlovian fear conditioning // Peptides. Vol. 12. No. 5. P. 1033-1037.
Fawcett J., Busch K.A., Jacobs D., Kravitz H.M., Fogg L. 1997. Suicide: a four-pathway clinical-biochemical model // Ann. N. Y. Acad. Sci. Vol. 836. P. 288—301.
Felicio L.F., Mann P.E., Bridges R.S. 1991. Intracerebroventricular cholecystokinin in the induction and maintenance of maternal behaviour in rats // Pharmacol. Biochem. Behav. Vol. 39. No. 1. P. 201-204.
Felton T., Linton L.N., Rosenblatt J., Morrell J. 1999. Estrogen implants in the lateral habenular nucleus do not stemulate the onset of maternal behaviour in female rats // Horm. Behav. Vol. 35. No. 1. P. 71—80.
Felton T., Linton L, Rosenblatt J., Morrell J. 1998. Intact neurous of the lateral habenular nacleus are nacessary for the nonhormonal, pup-mediated display of maternal behaviour in sensitized virgin femail rats // Behav. Neurosci. Vol. 112. No. 6. P. 1458-1465.
Ferreira A., Picazo O., Uriarte N., Pereira M., Fernandez-Guasti A. 2000. Inhibitory effect of buspirone and diazepam, but not of 8-OH-DPAT, on maternal behavior and aggression // Pharmacol. Biochem. Behav. Vol. 66. No. 2. P. 389~396.
Feuerstein T.J., Gleichauf O., Peckys D. Landwehrmeyer G.B., Scheremet R., Jackisch. 1996. Opioid receptor-mediated control of acetylcholine release in human neo
cortex tissue // Naunyn Schmiedebergs Arch. Pharmacol. Vol. 354. No. 5. P. 586— 592.
File S.E., Cheeta S., Kenny P.J. 2000. Neurobiological mechanisms by which nicotine mediates different types of anxiety // Eur.J. Pharmacol. Vol. 393. No. 1—3. P. 231— 236.
Filliol D., Ghozland S., Chluba J., Martin M., Matthes H.W., Simonin F., Befort K., Ga-veriaux-Ruff C., Dierich A., LeMeur M., Valverde O., Maldonado R., Kieffer B.L. 2000. Mice deficient for delta- and mu-opioid receptors exhibit opposing alterations of emotional responses // Nat. Genet. Vol. 25. No. 2. P. 195—200.
Fiori S., Renner C., Cramer J., Pegoraro S., Moroder L. 1999. Preferred conformation of endomorphin-1 in aqueous and membrane-mimetic environments //J. Mol. Biol. Vol. 291. No. 1. P. 163-1675.
Freeman F.M., Young I.G. 2000. Inhibition of passive-avoidance memory formation in the day-old chick by the opioid cytochrophin-4 // Learn. Mem. Vol. 7. No. 4. P. 213-219.
Frussa-Filho R., Otoboni J.R., Giannotti A.D., Amaral A.C., Conceicao I.M. 1992. Effect of age on antinociceptive effects of elevated plus-maze exposure // Braz. J. Med. Biol. Res. Vol. 25. No. 8. P. 827-829.
Fujita H., Suganuma H., Usui H., Kurahashi K., Nakagiri R., Sasaki R., Yoshikawa M. 1996. Vasorelaxation by casomokinin L, a derivative of beta-casomorphin and ca-soxin D, is mediated by NK1 receptor // Peptides. Vol. 17. No. 4. P. 635—639.
Fukudome S., Jinsmaa Y., Matsukawa T., Sasaki R., Yoshikawa M. 1997. Release of opioid peptides, gluten exorphins by the action of pancreatic elastase // FEBS Lett. Vol. 412. No. 3. P. 475-479.
Fukudome S., Yoshikawa M. 1992. Opioid peptides derived from wheat gluten: their isolation and characterization // FEBS Lett. Vol. 296. No. 1. P. 107—111.
Fukudome S., Yoshikawa M. 1993. Gluten exorphin C. A novel opioid peptide derived from wheat gluten // FEBS Lett. Vol. 316. No. 1. P. 17—19.
Fundytus M.E., Coderre T.J. 1994. Effect of activity at metabotropic, as well as ionotropic (NMDA), glutamate receptors on morphine dependence // Br. J. Pharmacol. Vol. 113. No. 4. P. 1215-1220.
Gale J.S., Bird E.D., Spoke E.G., Ivejsen L.L., Jessel T. 1978. Human brain substance P: distribution in controls and Huntington’s chorea //J. Neurochem. Vol. 30. No. 3. P. 633-634.
Galeotti N., Ghelardini C., Bartolini A. 2001. Differential prevention of morphine amnesia by antisense oligodeoxynucleotides directed against various Gi-protein alpha subunits // Br. J. Pharmacol. Vol. 133. No. 2. P. 267—274.
Ganapathy V, Miyauchi S. 2005. Transport systems for opioid peptides in mammalian tissues // AAPS J. Vol. 7. No. 4. P. 852—856.
Gantz I., Miwa H., Konda Y., Shimoto Y., Tashiro T., Watson S.J., DelValle J., Yamada T. 1993. Molecular cloning, expression, and gene localization of a fourth mela-nocortin receptor //J. Biol. Chem. Vol. 268. No. 20. P. 15174—15179.
Gayet G., Dupont В., Atfi A., Samperez S., Jouan P. 1992. Stimulation of the prostate growth in rats by milk casomorphins // C.R. Seances Soc. Biol. Fil. Vol. 186. No. 1-2. P. 107-111.
Georges F., Normand E., Bloch B., Le Moine C. 1998. Opioid receptor gene expression in the rat brain during ontogeny, with special reference to the mesostriatal system: an in situ hybridization study // Brain Res. Dev. Vol. 109. No. 2. P. 187-199.
Gergen K.A., Zadina J.E., Paul D. 1996. Analgesic effects of Tyr-W-MIF-1: a mixed mu2-opioid receptor agonist/mul-opioid receptor antagonist // Eur. J. Pharmacol. Vol. 316. No. 1. P. 33-38.
Giacchino J.L., Henriksen S.J. 1996. Systemic morphine and local opioid effects on neuronal activity in the medial prefrontal cortex // Neuroscience. Vol. 70. No. 4. P. 941-949.
Glamsta E.L., Meyerson B., Silberring J., Terenius L., Nyberg F. 1992. Isolation of a hemoglobin-derived opioid peptide from cerebrospinal fluid of patients with cerebrovascular bleedings // Biochem. Biophys. Res. Commun. Vol. 184. No. 2. P. 1060-1066.
Graeff F.G., Guimaraes F.S., De Andrade T.G., Deakin J.F. 1996. Role of 5-HT in stress, anxiety, and depression // Pharmacol. Biochem. Behav. Vol. 54. No. 1. P. 129—141.
Grauer S.M., Tao R., Auerbach S.B. 1992. Morphine induces an increase in extracellular serotonin in the rat diencephalon // Brain Res. Vol. 599. No. 2. P. 277—282.
Graybiel A.M. 1990. Neurotransmitters and neuromodulators in the basal ganglia // TINS. Vol. 13. No. 7. P. 244-254.
Grecksch G., Schweigert C., Matthies H. 1981. Evidence for analgesic activity of beta-casomorphin in rats // Neurosci. Lett. Vol. 27. No. 3. P. 325—328.
Greenberg R., Groves M.L., Dower H.J. 1984. Human beta-casein. Amino acid sequence and identification of phosphorylation sites // J. Biol. Chem. Vol. 259. No. 8. P. 5132-5138.
Gulley L.R., Nemeroff C.B. 1993. The neurobiological basis of mixed depression-anxiety states //J. Clin. Psychiatry. Vol. 54. Suppl. P. 16—19.
Hagaune S., Azuma N., Ishino J., Mori H., Kaminogawa S., Yamanchi K. 1989. DNA-synthesis stimulating peptide from bovine beta-casein // Agricult. Biolog. Chem. Vol. 53. P. 3275-3278.
Haileselassie S.S., Lee B.H., Gibbs B.F. 1999. Purification and identification of potentially bioactive peptides from enzyme-modified cheese //J. Dairy Sci. Vol. 82. No. 8. P. 1612-1617.
Halbreich LI., Endicott J. 1981. Possible involvement of endorphin withdrawal or imbalance in specific premenstrual syndromes and postpartum depression // Med. Hypotheses. Vol. 7. No. 8. P. 1045—1058.
Hall L., Laird J.E., Craig R.K. 1984. Nucleotide sequence determination of guinea-pig casein В mRNA reveals homology with bovine and rat alpha si caseins and conservation of the non-coding regions of the mRNA // Biochem. J. Vol. 222. P. 561—570.
Hamel U, Kielwein G., Teschemacher H. 1985. Beta-casomorphin immunoreactive materials in cows’ milk incubated with various bacterial species //J. Dairy Res. Vol. 52. No. l.P. 139-148.
Hammer R. 1985. The sex hormone-dependent development of opiate receptors in the rat medial preoptic area // Brain Res. Vol. 360. No. 1—2. P. 65—74.
Hand Т.Н., Franklin K.B. 1985. Lesions of ventral tegmental dopamine neurons delay the development of tolerance to morphine catalepsy // Neurosci. Lett. Vol. 55. No. 3. P. 367-370.
Haney M., Miczek K.A. 1989. Morphine effects on maternal aggression, pup care and analgesia in mice // Psychopharmacology (Berk). Vol. 98. No. 1. P. 68—74.
Hamad S. 1995. A role for ovarian hormones in sexual differentiation of the brain // Psycoloquy. Vol. 6. (in http://www.ai.univie.ac.at/archives/ /0014.html.)
Harrison L.M., Kastin A.J., Zadina J.E. 1998. Opiate tolerance and dependence: receptors, G-proteins and antiopiates // Peptides. Vol. 19. No. 9. P. 1603—1630.
Harrison LM, Zadina J.E., Banks W.A., Kastin A.J. 1993. Effects of neonatal treatment with Tyr-MIF-1, morphiceptin, and morphine on development, tail flick, and blood-brain barrier transport // Brain Res. Dev. Brain Res. Vol. 75. No. 2. P. 207— 212.
Hartrodt B., Neubert K., Fischer G., Demuth LL, Yoshimoto T., Barth A. 1982. Degradation of beta-casomorphin-5 by proline-specific-endopeptidase (PSE) and post-proline-cleaving-enzyme (PPCE). Comparative studies of the beta-casomorphin-5 cleavage by dipeptidyl-peptidase IV // Pharmazie. Vol. 37. No. 1. P. 72—73.
Hasbi A., Polastron J., Allouche S. Stanasila L, Massotte D, Jauzac P. 1998. Desensitization of the delta-opioid receptor correlates with its phosphorylation in Sk-N-BE cells: involvement of a G protein-coupled receptor kinase // J. Neurochem. Vol. 70. No. 5. P. 2129-2138.
Hasenohrl R.U., Schwarting R.K., Gerhardt P., Privou C., Huston J.P. 1994. Comparison of neurokinin substance P with morphine in effects on food-reinforced operant behavior and feeding // Physiol. Behav. Vol. 55. No. 3. P. 541—546.
Hasselmo M.E., Stem C.E. 2006. Mechanisms, underlying working memory for novel information // Trends Cogn. Sci. Vol. 10. No. 11. P. 487—493.
Hatanaka K., Yatsugi S., Yamaguchi T. 2000. Effect of acute treatment with YM992 on extracellular norepinephrine levels in the rat frontal cortex // Eur. J. Pharmacol. Vol. 395. No. 1. P. 31—36.
Hatta K., Wolterink G., Van Ree J.M. 1995. Prolyl-leucyl-glycinamide, thyrotropin-releasing hormone and beta-endorphin-(10—16), like antidepressants, antagonize melatonin-induced behavioural changes in rats // Eur. J. Pharmacol. Vol. 284. No. 3. P. 327-330.
Hatzoglou A., Bakogeorgou E., Hatzoglou C., Martin PM., Castanas E. 1996. Antiproliferative and receptor binding properties of alpha- and beta-casomorphins in the T47D human breast cancer cell line // Eur. J. Pharmacol. Vol. 310. No. 2—3. P. 217-223.
Hautefeuille М., Brantl V., Dumontier А.М., Desjeux J.F. 1986. In vitro effects of beta-casomorphins on ion transport in rabbit ileum // Am. J. Physiol. Vol. 250. No. 1. Pt. l.P G92-G97.
Hedner J., Hedner T. 1987. Beta-Casomorphins induce apnea and irregular breathing in adult rats and newborn rabbits // Life Sci. Vol. 41. No. 20. P. 2303—2312.
Heijna M.H., Bakker J.M., Hogenboom F., Mulder A.H., Schoffelmeer A.N. 1992. Opioid receptors and inhibition of dopamine-sensitive adenylate cyclase in slices of rat brain regions receiving a dense dopaminergic input // Eur. J. Pharmacol. Vol. 229. No. 2-3. P. 197-202.
Heijna M.H., Padt M., Hogenboom F., Portoghese P.S., Mulder A.H., Schoffelmeer A.N. 1990. Opioid receptor-mediated inhibition of dopamine and acetylcholine release from slices of rat nucleus accumbens, olfactory tubercle and frontal cortex // Eur. J. Pharmacol. Vol. 181. No. 3. P. 267-278.
Henderson G., McKnight A.T. 1997. The orphan opioid receptor and its endogenous ligand nociceptin/orphanin FQ // Trends Pharmacol. Sci. Vol. 18. No. 8. P. 293— 300.
Henning S.J. 1980. Maternal factors as determinants of food intake during the suckling period // Int. J. Obes. Vol. 4. No. 4. P. 329—332.
Henschen A., Lottspeich F., Brantl V, Teschemacher H. 1979. Novel opioid peptides derived from casein (beta-casomorphins). II. Structure of active components from bovine casein peptone // Hoppe Seylers Z. Physiol. Chem. Vol. 360. No. 9. P. 1217-1224.
Herrera-Marschitz M., Terenius L., Grehn L., Ungerstedt LI. 1989. Rotational behaviour produced by intranigral injections of bovine and human beta-casomorphins in rats // Psychopharmacology (Berl). Vol. 99. No. 3. P. 357—361.
Hill LM., Kleinberg F. 1984. Effects of drugs and chemicals on the fetus and newborn // Mayo Clin. Proc. Vol. 59. No. 11. P. 755-765.
Hiramatsu M., Inoue K. 2000. Des-tyrosine(l) dynorphin A-(2-l 3) improves carbon monoxide-induced impairment of learning and memory in mice // Brain Res. Vol. 859. No. 2. P. 303-310.
Hirata H., Sonoda S., Agui S., Yoshida M., Ohinata K., Yoshikawa M. 2007. Rubisco-lin-6, a delta opioid peptide derived from spinach Rubisco, has anxiolytic effect via activating sigma(l) and dopamine D(l) receptors // Peptides. Vol. 28. No. 10. P. 1998-2003.
Hirata H., Takeshita S., Hu J.W., Bereiter D.A. 2000. Comea-responsive medullary dorsal horn neurons: modulation by local opioids and projections to thalamus and brain stem //J. Neurophysiol. Vol. 84. No. 2. P. 1050—1061.
Hirose N., Murakawa K., Takada K., Oi Y., Suzuki T, Nagase H., Cools A.R., Koshi-kawa N. 2005. Interactions among mu- and delta-opioid receptors, especially putative deltal- and delta2-opioid receptors, promote dopamine release in the nucleus accumbens // Neuroscience. Vol. 135. No. 1. P. 213—225.
Ho B.Y., Takemori A.E. 1990. Release by U-50488H of [3H]serotonin from brain sli
ces and spinal cord synaptosomes of U-50488H-tolerant and nontolerant mice // J. Pharmacol. Exp. Then Vol. 254. No. 1. P. 8—12.
Hoffman D.C., West T.E., Wise R.A. 1991. Ventral pallidal microinjections of receptor-selective opioid agonists produce differential effects on circling and locomotor activity in rats // Brain Res. Vol. 550. No. 2. P. 205—212.
Hollinger S., Hepler J.R. 2002. Cellular regulation of RGS proteins: modulators and integrators of G protein signaling // Pharmacol. Rev. Vol. 54. No. 3. P. 527—559.
Holsboer F. 1999. The rationale for corticotropin-releasing hormone receptor (CRH-R) antagonists to treat depression and anxiety // J. Psychiatr. Res. Vol. 33. No. 3. P. 181-214.
Hosea N.A., Miller G.P., Guengerich EP. 2000. Elucidation of distinct ligand binding sites for cytochrome P450 // Biochemistry. Vol. 39. No. 20. P. 5929—5939.
Huang E.J., Reichardt L.F. 2001. Neurotrophins: roles in neuronal development and function // Annu. Rev. Neurosci. Vol. 24. P. 677—736.
lanzer D., Konno K., Xavier C.H., Stgcklin R., Santos R.A., de Camargo A.C., Pimenta D.C 2006. Hemorphin and hemorphin-like peptides isolated from dog pancreas and sheep brain are able to potentiate bradykinin activity in vivo // Peptides. Vol. 27. No. 11. P. 2957-2966.
Ihnatovych I., Novotny J., Haugvicova R., Bourova L., Mares P., Svoboda P. 2002. Ontogenetic development of the G protein-mediated adenylyl cyclase signalling in rat brain // Brain Res. Dev. Brain Res. Vol. 133. No. 1. P. 69_75.
Ingi T., Aoki Y. 2002. Expression of RGS2, RGS4 and RGS7 in the developing postnatal brain // Eur. J. Neurosci. Vol. 15. No. 5. P. 929—936.
Itoh A., Shiotani T., Nakayama S., Mamiya T., Hasegawa T., Noda Y., Nabeshima T. 2000. Attenuation of the development of morphine dependence/tolerance by ne-firacetam: involvement of adenosine 3’,5’-cyclic monophosphate system // Behav. Brain Res. Vol. 115. No. 1. P. 65-74.
Jackson H.C., Griffin I.J., Nutt D.J. 1993. Buprenorphine-cocaine interactions in mice: effect on locomotor activity and hole-dipping behaviour // J. Pharm. Pharmacol. Vol. 45. No. 7. P. 636-640.
Jackson H.C., Kitchen 1.1989. Behavioural effects of selective mu-, kappa-, and deltaopioid agonists in neonatal rats // Psychopharmacology (Berk). Vol. 97. No. 3. P. 404-409.
Jagadeesh S.P., Subhash M.N. 1998. Effect of antidepressants on intracellular Ca++ mobili-zation in human frontal cortex // Biol. Psychiatry. Vol. 44. No. 7. P. 617— 621.
Janak P.H., Manly J.J., Martinez J.L., Jr. 1994. [Leu]enkephalin enhances active avoidance conditioning in rats and mice // Neuropsychopharmacology. Vol. 10. No. l.P. 53-60.
Janak P.H., Martinez J.L., Jr. 1990. Only tyrosine-containing metabolites of[Leu]en-kephalin impair active avoidance conditioning in mice // Pharmacol. Biochem. Behav. Vol. 37. No. 4. P. 655—659.
Janiri L., d’Amato R., Zieglgansberger W. 1988. Dynorphin(l-17) reduces the inhibitory actions of mu- and delta-selective opioid agonists in cortical neurons of the rat in vivo // Neurosci. Lett. Vol. 84. No. 1. P. 79—83.
Jenck F., Wichmann J., Dautzenberg FM., Moreau J.L., Ouagazzal AM, Martin JR, Lun-dstrom K., Cesura A.M., Poli S.M., Roever S., Kolczewski S., Adam G., Kilpatrick G. 2000. A synthetic agonist at the orphanin FQ/nociceptin receptor ORL1: anxiolytic profile in the rat // Proc. Natl. Acad. Sci. USA. Vol. 97. No. 9. P. 4938—4943.
Jiang Q., Takemori A.E., Sultana M., Portoghese P.S., Bowen W.D., Mosberg H.I., Por-reca F. 1991. Differential antagonism of opioid delta antinociception by [d-Ala2,Leu5,Cys6]enkephalin and naltrindole 5’-isothiocyanate: evidence for delta receptor subtypes //J. Pharmacol. Exp. Ther. Vol. 257. No. 3. P. 1069—1075.
Jinsmaa Y, Yoshikawa M. 1999. Enzymatic release of neocasomorphin and beta-casomorphin from bovine beta-casein // Peptides. Vol. 20. No. 8. P. 957—962.
Jolas T., Nestler E.J., Aghajanian G.K. 2000. Chronic morphine increases GABA tone on serotonergic neurons of the dorsal raphe nucleus: association with an up-regulation of the cyclic AMP pathway / / Neuroscience. Vol. 95. No. 2. P. 433—443.
Jones K.L., Barr G.A. 1995. Ontogeny of morphine withdrawal in the rat // Behav. Neurosci. Vol. 109. No. 6. P. 1189-1198.
Jordan B., Devi L.A. 1998. Molecular mechanisms of opioid receptor transduction // Br. J. Anaesth. Vol. 81. No. 1. P. 12-19.
Kaakkola S., Ahtee L. 1977. Effect of muscarinic cholinergic drugs on morphine-induced catalepsy, antinociception and changes in brain dopamine metabolism // Psychopharmacology (Berk). Vol. 52. No. 1. P. 7—15.
Kakidani H., Furutani Y. Takahashi H., Noda M., Morimoto Y, Hirose T., Asai M., Inayama S., Nakanishi S., Numa S. 1982. Cloning and sequence analysis of cDNA for porcine beta-neo-endorphin/dynorphin precursor // Nature. Vol. 298. No. 5871. P. 245-249.
Kalivas P.W., Jackson D., Romanidies A., Wyndham L., Duffy P. 2001. Involvement of pallidothalamic circuitry in working memory // Neuroscience. Vol. 104. No. 1. P. 129-136.
Kamei J., Saitoh A. 1996. Role of spleen or spleen products in the reduced locomotor-enhancing effect of morphine in diabetic mice // Neurosci. Lett. Vol. 210. No. 1. P. 57-60.
Kamei J., Zushida K., Ohsawa M., Nagase H. 2000. The antinociceptive effects of endomorphin-1 and endomorphin-2 in diabetic mice // Eur. J. Pharmacol. Vol. 391. No. 1-2. P. 91-96.
Kaminski S., Cieslinska A., Kostyra E. 2007. Polymorphism of bovine beta-casein and its potential effect on human health //J. Appl. Genet. Vol. 48. No. 3. P. 189—198.
Kampa M., Bakogeorgou E., Hatzoglou A., Damianaki A., Martin P.M., Castanas E. 1997. Opioid alkaloids and casomorphin peptides decrease the proliferation of prostatic cancer cell lines (LNCaP, PC3 and DU 145) through a partial interaction with opioid receptors // Eur. J. Pharmacol. Vol. 335. No. 2—3. P. 255—265.
Kampa М., Loukas S., Hatzoglou A., Martin P., Martin P.M., Castanas E. 1996. Identification of a novel opioid peptide (Tyr-Val-Pro-Phe-Pro) derived from human alpha SI casein (alpha Sl-casomorphin, and alpha Sl-casomorphin amide) // Biochem. J. Vol. 319. Pt. 3. P. 903-908.
Kampa M, Loukas S., Tsapis A., Castanas E. 2001. Receptorphin: a conserved peptide derived from the sequence of the opioid receptor, with opioid displacement activity and potent antiproliferative actions in tumor cells // BMC Pharmacol. P. 1—9.
Kang W., Wilson S.P., Wilson M.A. 2000. Overexpression of proenkephalin in the amygdala potentiates the anxiolytic effects of benzodiazepines // Neuropsychopharmacology. Vol. 22. No. 1. P. 77—88.
Kappeler S., Farah Z., Puhan Z. 1998. Sequence analysis of Camelus dromedarius milk casein //J. Dairy Res. Vol. 65. P. 209—222.
Karelin A.A., Philippova MM., Karelina E.V., Ivanov V.T. 1994. Isolation of endogenous hemorphin-related hemoglobin fragments from bovine brain // Biochem. Biophys. Res. Commun. Vol. 202. No. 1. P. 410—415.
Kaufman J, Plotsky PM, Nemeroff C.B, Charney D.S. 2000. Effects ofearly adverse experiences on brain structure and function: clinical implications // Biol. Psychiatry. Vol. 48. No. 8. P. 778-790.
Kavaliers M., Choleris E., Saucier D.M. 1997. The NMDA receptor antagonist, NPC 12626, reduces the pronociceptive effects of orphanin FQ and kappa opiate antinociception in the land snail, Cepaea nemoralis // Peptides. Vol. 18. No. 7. P. 943— 947.
Kayser H., Meisel H. 1996. Stimulation of human peripheral blood lymphocytes by bioactive peptides derived from bovine milk proteins. // FEBS Lett. Vol. 383. No. 1-2. P. 18-20.
Keer S.E., Stern JM. 1999. Dopamine receptor blockade in the nucleus accumbens inhibits maternal retrieval and licking, but enhances nursing behavior in lactating rats // Physiol. Behav. Vol. 67. No. 5. P. 659—669.
Kehoe P., Boylan C.B. 1994. Behavioral effects of kappa-opioid-receptor stimulation on neonatal rats // Behav. Neurosci. Vol. 108. No. 2. P. 418—423.
Keith D.E., Murray S.R., Zaki P.A., Chu P.C., Lissin D.V., Kang L, Evans C.J., von Zastrow M 1996. Morphine activates opioid receptors without causing their rapid internalization // J. Biol. Chem. Vol. 271. No. 32. P. 19021—19024.
Kendall J.M., Reeves B.C., Latter V.S. 2001. Multicentre randomised controlled trial of nasal diamorphine for analgesia in children and teenagers with clinical fractures // BMJ. Vol. 322. No. 7281. P. 261-265.
Kent J.M., Coplan J.D., Gorman J.M. 1998. Clinical utility of the selective serotonin reuptake inhibitors in the spectrum of anxiety // Biol. Psychiatry. Vol. 44. No. 9. P. 812-824.
Kieffer B.L., Befort K., Gaveriaux Ruff C., Hirth C.G. 1992. The delta-opioid receptor: isolation of a cDNA by expression cloning and pharmacological characterization // Proc. Natl. Acad. Sci. USA. Vol. 89. No. 24. P. 12048-12052.
Kinney Н.С., Ottoson С.К., White W.F. 1990. Three-dimensional distribution of 3H-naloxone binding to opiate receptors in the human fetal and infant brainstem // J. Comp. Neurol. Vol. 291. No. 1. P. 55—78.
Kinsley C.H., Bridges R.S. 1986. Opiate involvement in postpartum aggression in rats // Pharmacol. Biochem. Behav. Vol. 25. No. 5. P. 1007—1011.
Kinsley C.H., Bridges R.S. 1988. Parity-associated reductions in behavioral sensitivity to opiates // Biol. Reprod. Vol. 39. No. 2. P. 270—278.
Kirby M.L., Holtzmann S.G. 1982. Effects of chronic opiate administration of spontaneous activity of fetal rats // Pharmacol. Biochem. Behav. Vol. 16. No. 2. P. 263— 269.
Kistler-Heer V, Lauber M.E., Lichtensteiger W. 1998. Different developmental patterns of melanocortin MC3 and MC4 receptor mRNA: predominance of Mc4 in fetal rat nervous system //J. Neuroendocrinol. Vol. 10. No. 2. P. 133—146.
Klitenick MA, Kalivas P.W. 1994. Behavioral and neurochemical studies of opioid effects in the pedunculopontine nucleus and mediodorsal thalamus //J. Pharmacol. Exp. Then Vol. 269. No. 1. P. 437-448.
Koch G., BrantI V. 1990. Binging of beta-casomorphins to opioid receptors // F. Nyberg, V BrantI (eds.). Beta-casomorphins and related reptides. Uppsala: Furis-Tryck AB. P. 43-52.
Koch G.; Wiedemann K; Drebes E.; Zimmermann W.; Link G.; Teschemacher H. 1988. Human beta-casomorphin-8 immunoreactive material in the plasma of women during pregnancy and after delivery // Regul. Pept. Vol. 20. No. 2. P. 107—117.
Koch G., Wiedemann K., Teschemacher H. 1985. Opioid activities of human beta-casomorphins // Naunyn Schmiedebergs Arch. Pharmacol. Vol. 331. No. 4. P. 351 — 354.
Koch T., Kroslak T., Mayer P., Raulf E., Hollt V 1997. Site mutation in the rat mu-opioid receptor demonstrates the involvement of calcium/calmodulin-dependent protein kinase II in agonist-mediated desensitization // J. Neurochem. Vol. 69. No. 4. P. 1767-1770.
Kohler U., Rauca C. 1992. Effects of BCH 325 (Pro-d-Phe-Pro-Gly) on open field behavior after chronic stress procedure // Peptides. Vol. 13. No. 1. P. 141—144.
Kojima Y., Takahashi T., Fujina M., Owyang C. 1994. Inhibition of cholinergic transmission by opiates in ileal myenteric plexus is mediated by kappa receptor. Involvement of regulatory inhibitory G protein and calcium N-channels // J. Pharmacol. Exp. Then Vol. 268. No. 2. P. 965—970.
Koks S., Soosaar A., Voikar V., Bourin M., Vasar E. 1999. BOC-CCK-4, CCK(B)recep-tor agonist, antagonizes anxiolytic-like action of morphine in elevated plus-maze // Neuropeptides. Vol. 33. No. 1. P. 63—69.
Koks S., Soosaar A., Voikar V. Volke V, Ustav M., Mannisto P.T., Bourin M., Vasar E. 1998. Opioid antagonist naloxone potentiates anxiogenic-like action of cholecystokinin agonists in elevated plus-maze // Neuropeptides. Vol. 32. No. 3. P. 235— 240.
Kosterlitz H.W., Paterson S.J. 1985. Types of opioid receptors: relation to antinociception // Philos. Trans. R. Soc, bond. Ser. B. Biol. Sci. Vol. 19. Suppl. No. 308(1136). P. 291-297.
Kosterlitz H.W., Paterson S.J., Robson L.E. 1981. Characterization of the kappa-subtype of the opiate receptor in the guinea-pig brain // Br. J. Pharmacol. Vol. 73. No. 4. P. 939-949.
Kovoor A., Nappey V, Kieffer B.L., Chavkin C. 1997. Mu and delta opioid receptors are differentially desensitized by the coexpression of beta-adrenergic receptor kinase 2 and beta-arrestin 2 in xenopus oocytes //J. Biol. Chem. Vol. 272. No. 44. P. 27605-27611.
Kozlova M., Kalentchuk V 1994. Stimulatory effect of opioid peptides and naloxone on rat spinal cord cells in primary dissociated culture // Int. J. Dev. Neurosci. Vol. 12. No. 5. P. 507-515.
Kramer H.K, Simon E.J. 2000. Mu and delta-opioid receptor agonists induce mitogen-activated protein kinase (МАРК) activation in the absence of receptor internalization // Neuropharmacology. Vol. 39. No. 10. P. 1707—1719.
Kreil G., Umbach M., Brantl V., Teschemacher H. 1983. Studies on the enzymatic degradation of beta-casomorphins // Life Sci. Vol. 33. Suppl. 1. P. 137—140.
Kuzmin A., Sandin J., Terenius L., Ogren S.O. 2000. Dose- and time-dependent bi-modal effects of kappa-opioid agonists on locomotor activity in mice //J. Pharmacol. Exp. Ther. Vol. 295. No. 3. P. 1031-1042.
Laborit H. 1975. Neurophysiological and biological bases of active and passive avoidance behaviors. Somatic consequences. Behavioral level. Semantic problems // Ann. Med. Psychol. (Paris). Vol. 1. No. 5. P. 573—603.
Landymore K.M., Wilkinson M. 1990. Ontogenesis of cell surface mu-opioid ([3H]DAGO) binding sites in rat hypothalamus and ex vivo determination of blood-brain barrier penetration by opioid peptide FK 33-824 // Brain Res. Dev. Brain. Res. Vol. 54. No. 2. P. 169-176.
Lantz L, Glamsta E.L., Talback L., Nyberg F. 1991. Hemorphins derived from hemoglobin have an inhibitory action on angiotensin converting enzyme activity // FEBS Lett. Vol. 287. No. 1-2. P. 39-41.
Lavecchia A., Greco G., Novellino E., Vittorio F., Ronsisvalle G. 2000. Modeling of kappa-opioid receptor/agonists interactions using pharmacophore-based and docking simulations //J. Med. Chem. Vol. 43. No. 11. P. 2124—2134.
Leboyer M., Bouvard M.P., Launay J.M., Recasens C., Plumet M.H., Waller-Perotte D., Tabuteau F., Bondoux D., Dugas M. 1993. Opiate hypothesis in infantile autism? Therapeutic trials with naltrexone // Encephale. Vol. 19. No. 2. P. 95—102.
Leckman J.F., Herman A.E. 2002. Maternal behavior and developmental psyhopat-hology // Biol. Psychiatry. Vol. 51. P. 27—43.
Lee J., Chai S.Y., Mendelsohn F.A., Morris M.J., Allen A.M. 2001. Potentiation of cholinergic transmission in the rat hippocampus by angiotensin IV and LW-he-morphin-7 // Neuropharmacology. Vol. 40. No. 4. P. 618—623.
Lee Y.S., Wurster R.D. 1994. Differential effects of methionine enkephalin on the growth of brain tumor cells //J. Neurooncol. Vol. 19. No. 1. P. 11—15.
Lefkowitz R.J., Shenoy S.K. 2003. Multifaceted roles of beta-arrestins in the regulation of seven-membrane-spanning receptor trafficking and signalling // Biochem. J. Vol. 375. No. 3. P. 503-515.
Lemieux L., Amiot J. 1990. High-performance liquid chromatography of casein hydrolysates phosphorylated and dephosphorylated. I. Peptide mapping //J. Chro-matogr. Vol. 2. P. 299-321.
Leon M. 1992. Neuroethology of olfactory preference development //J. Neurobiol. Vol. 23. No. 10. P. 1557-1573.
Lesage J., Bernet F., Montel V., Dupouy J.P. 1996. Effects of prenatal morphine on hypothalamic metabolism of neurotransmitters and gonadal and adrenal activities, during the early postnatal period in the rat // Neurochem. Res. Vol. 21. No. 6. P. 723-732.
Leventhal L., Cole J.L., Bodnar RJ. 1996. Reductions in locomotor activity following central opioid receptor subtype antagonists in rats // Physiol. Behav. Vol. 60. No. 3. P. 833-836.
LiJ.G., Chen C., Yin J., Rice K., Zhang Y., Matecka D., de Riel J.K., DesJar lais R.L., Liu-Chen L.Y. 1999. ASP147 in the third transmembrane helix of the rat mu opioid receptor forms ion-pairing with morphine and naltrexone // Life Sci. Vol. 65. No. 2.P 175-185.
Li M., Fleming A.S. 2003. The nucleus accumbens shell is critical for normal expression of pup-retrieval in postpartum female rats // Behav. Brain Res. Vol. 145. No. 1-2. P. 99-111.
Liaw W.J., Ho S.T., Wang J.J., Wong C.S., Lee H.K. 1996. Cellular mechanism of opioid tolerance // Acta Anaesthesiol. Sin. Vol. 34. No. 4. P. 221—234.
Liebmann C., Schnittler M., Hartrodt B., Born I., Neubert K. 1991. Structure-activity studies of novel casomorphin analogues: binding profiles towards mul-, mu2-and delta-opioid receptors // Pharmazie. Vol. 46. No. 5. P. 345—348.
Liebmann C., Mentz P., Schnittler M., Schrader LL, Neubert K., Barth A. 1990. Nonopioid effects of beta-casomorphin-5 in guinea-pig heart // F. Nyberg, V. Brantl (eds.). Beta-casomorphins and related reptides. Uppsala: Furis-Tryck AB. P. 53— 59.
Liebmann C., Schrader U., Brantl V. 1989. Opioid receptor affinities of the blood-derived tetrapeptides hemorphin and cytochrophin // Eur. J. Pharmacol. Vol. 166. No. 3. P. 523-526.
Liebmann C., Szucs M., Neubert K., Hartrodt B., Arold H., Barth A. 1986. Opiate receptor binding affinities of some d-amino acid substituted beta-casomorphin analogs // Peptides. Vol. 7. No. 2. P. 195-199.
Lin Y., Carpenter D.0.1994. Direct excitatory opiate effects mediated by non-syna-ptic actions on rat medial vestibular neurons // Eur. J. Pharmacol. Vol. 262. No. 1-2. P. 99-106.
Lin S.H., Kiyohara Т., Sun В. 2003. Maternal behavior activation of the central oxytocin receptor system in parturien rats? // Neuroreport. Vol. 14. No. 1. P. 113— 144.
Lin L, Umahara M., York D.A., Bray G.A. 1998. Beta-casomorphins stimulate and enterostatin inhibits the intake of dietary fat in rats // Peptides. Vol. 19. No. 2. P. 325-331.
Linden D., Martinez J.L., Jr. 1986. Leu-enkephalin impairs memory of an appetitive maze response in mice // Behav. Neurosci. Vol. 100. No. 1. P. 33—38.
Lindner G., Grosse G., Wenzel M., Jentzsch K.D., Fomer K., Oehme P. 1988. The effect of methionine enkephalin, leucine enkephalin and the hexapeptide, dalargin on the morphology of cultured neurons // Himforsch. Vol. 29. No. 5. P. 547—556.
Lindstrom L.H., Nyberg F., Terenius L., Bauer K., Besev G., Gunne L.M., Lyrenas S., WilldecK-Lund G., Lindberg B. 1984. CSF and plasma beta-casomorphin-like opioid peptides in postpartum psychosis // Am. J. Psychiatry. Vol. 141. No. 9. P. 1059-1066.
Ling G.S., Spiegel K., Lockhart S.H., Pasternak G.W. 1985. Separation of opioid analgesia from respiratory depression: evidence for different receptor mechanisms // J. Pharmacol. Exp. Ther. Vol. 232. No. 1. P. 149—155.
Liu J.G., Prather P.L. 2001. Chronic exposure to mu-opioid agonists produces constitutive activation of mu-opioid receptors in direct proportion to the efficacy of the agonist used for pretreatment // Mol. Pharmacol. Vol. 60. No. 1. P. 53—62.
Liu J.G., Ruckle M.B., Prather P.L. 2001. Constitutively active mu-opioid receptors inhibit adenylyl cyclase activity in intact cells and activate G-proteins differently than the agonist [d-Ala2,N-MePhe4,Gly-ol5]enkephalin //J. Biol. Chem. Vol. 276. No. 41. P. 37779-37786.
Loggi G., Laviola G., Alieva E., Chiarotti F. 1991. Morphine effects on mouse loco-motor/exploratory activity: test dependency, test reliability, uni- and multi-variate analyses // Pharmacol. Biochem. Behav. Vol. 38. No. 4. P.. 817—822.
Longobardo L, Melck D., Siciliano R., Santini A, Di Marzo V., Cammarota G. 2000. Beta-casomorphins: substitution of phenylalanine with beta-homo phenylalanine increases the mu-type opioid receptor affinity // Bioorg. Med. Chem. Lett. Vol. 10. No. 11. P. 1185-1188.
Lonstein J.S., Dominguez J.M., Putnam S.K., De Vries GJ., Hull E.M. 2003. Intracellular preoptic and striatal monoamines in pregnant and lactating rats: possible role in maternal behavior // Brain Res. Vol. 970. No. 1—2. P. 149—158.
Lottspeich F., Henschen A., BrantI V., Teschemacher H. 1980. Novel opioid peptides derived from casein (beta-casomorphins). III. Synthetic peptides corresponding to components from bovine casein peptone // Hoppe Seylers. Z. Physiol. Chem. Vol. 361. No. 12. P. 1835-1839.
Loukas S., Varoucha D., Zioudrou C, Streaty R.A., Klee W.A. 1983. Opioid activities and structures of alpha-casein-derived exorphins // Biochemistry. Vol. 22. No. 19. P. 4567-4573.
Maggi R., Limonta P., Dondi D., Piva F. 1991. Modulation of the binding characteristics og hypotalamic mu opioid receptors in the rats by gonadal steroids //J. Steroid Biochem. Mol. Biol. Vol. 1—3. P. 113-121.
Magnus-Ellenbroek B., Havemann-Reinecke U. 1993. Morphine-induced hyperactivity in rats — a rebound effect? // Naunyn Schmiedebergs Arch. Pharmacol. Vol. 347. No. 6. P. 635-642.
Mahe S., Dumontier A.-M., Tome D. 1990. Intestinal action and absorbtion of beta-casomorphins // F. Nyberg, V. Brand (eds.). Beta-Casomorphins and Related Peptides. Uppsala, Sweden: Furis-Tryck AB. P. 79—85.
Mains R.E., Eipper B.A. 2006. Peptides // GJ. Siegel et al. (eds.). Basic Neurochemistry: Molecular, Cellular and Medical Aspects. Elsevier. P. 317—332.
Malcangio M., Lessmann V. 2003. A common thread for pain and memory synapses? Brain-derived neurotrophic factor and trkB receptors // Trends Pharmacol. Sci. Vol. 24. No. 3.P. 116-121.
Maldonado R. 1997. Participation of noradrenergic pathways in the expression of opiate withdrawal: biochemical and pharmacological evidence // Neurosci. Bi-obehav. Rev. Vol. 21. No. 1. P. 91—104.
Malec D., Langwinski R. 1980. The influence of 5-HT receptor blocking agents on the behavioral effects of analgesics in rats // Psychopharmacology (Berk). Vol. 69. No. l.P. 79-83.
Mann P.E., Kinsley C.H., Bridges R.S. 1991. Opioid receptor subtype involvement in maternal behavior in lactating rats // Neuroendocrinology. Vol. 53. No. 5. P. 487— 492.
Mann P.E., Bridges R.S. 1992. Neural and endocrine sensitivities to opioids decline as a function of multiparity in the rat // Brain Res. Vol. 580. No. 1—2. P. 241—248.
Mansfeld R., Kautni J., Grunert E., Brantl V., Jochle W. 1990. Clinical application of beta-casomorphins for treatment of calf diarrhea // F. Nyberg, V. Brantl (eds.). Beta-Casomorphins and Related Peptides. Uppsala, Sweden: Furis-Tryck AB. P. 105-108.
Mansour A., Watson S.J., Akil H. 1995. Opioid receptors: past, present and future // Trends Neurosci. Vol. 18. No. 2. P 69—70.
Manzanares J., Lookingland K.J., LaVigne S.D., Moore K.E. 1991. Activation oftube-rohypophysial dopamine neurons following intracerebroventricular administration of the selective kappa opioid receptor antagonist NOR-binaltorphimine // J. Pharmacol. Exp. Then Vol. 256. No. 2. P. 500—505.
Marcais-Collado H., Chaillet P., Costentin J. 1983. Inhibition of the spontaneous climbing behavior elicited in mice by opiates //J. Pharmacol. Exp. Then Vol. 227. No. 2. P. 466-471.
Marinelli M., Barrot M., Simon H., Oberlander C., Dekeyne A., Le Moal M., Piazza P.V. 1998. Pharmacological stimuli decreasing nucleus accumbens dopamine can act as positive reinforcers but have a low addictive potential // Eur. J. Neurosci. Vol. 10. No. 10. P. 3269-3275.
Marsh D., Dickenson A., Hatch D., Fitzgerald M. 1999. Epidural opioid analgesia in infant rats: responses to carrageenan and capsaicin // Pain. Vol. 82. No. 1. P. 33— 38.
Martin G., Przewlocki R., Siggins G.R. 1999. Chronic morphine treatment selectively augments metabotropic glutamate receptor-induced inhibition of N-methyl-d-aspartate receptor-mediated neurotransmission in nucleus accumbens //J. Pharmacol. Exp. Then Vol. 288. No. 1. P. 30—35.
Martinez J. 1992. d-Phe2-[d-Phe5}-enkephalin impairs acquisition and enhances retention of a ne-way active avoidance response in rats // Peptides. Vol. 13. P. 885— 889.
Martinez J.L., Jr., de Graaf J.S., Chavkin C., Dana R.C. 1985. Leu-enkephalin actions on avoidance conditioning are mediated by a peripheral opioid mechanism // Life Sci. Vol. 37. No. 25. P. 2345-2353.
Mateo A.R., Hijazi M., Hammer R.P. 1992. Dynamic patterns of medial preoptic mu-opiate receptor regulation by gonadal steroid hormons // Neuroendocrinology. Vol. 55. No. l.P. 51-58.
Mathon D.S., Ramakers G.M., Pintar J.E., Marinelli M. 2005. Decreased firing frequency of midbrain dopamine neurons in mice lacking mu opioid receptors // Eur. J. Neurosci. Vol. 21. No. 10. P. 2883-2886.
Matos F.F., Rollema H., Basbaum A.1.1992. Simultaneous measurement of extracellular morphine and serotonin in brain tissue and CSF by microdialysis in awake rats // J. Neurochem. Vol. 58. No. 5. P. 1773—1781.
Matsumoto R.R., Brinsfield K.H., Patrick R.L, Walker J.M. 1988. Rotational behavior mediated by dopaminergic and nondopaminergic mechanisms after intranigral microinjection of specific mu, delta and kappa opioid agonists //J. Pharmacol. Exp. Ther. Vol. 246. No. 1. P. 196—203.
Matthes H.W., Maldonado R., Simonin F., Valverde O., Slowe S., Kitchen I., Befort K., Dierich A., Le Meur M., Dolle P., Tzavara E., Hanoune J., Roques B.P., Kieffer B.L. 1996. Loss of morphine-induced analgesia, reward effect and withdrawal symptoms in mice lacking the mu-opioid-receptor gene // Nature. Vol. 31. P. 819—823.
Matthies H., Ruthrich H.L., Stark H., Barth A., Neubert K., Hartrodt B. 1982. Depro-ceptin, Tyr-Pro-Phe-d-Pro-NH2, another casomorphin with remarkable analgesic action // Acta Biol. Med. Ger. Vol. 41. No. 9. P. K39~42.
Matthies H., Stark H., Hartrodt B., Ruethrich H.L., Spieler H.T., Barth A., Neubert K. 1984. Derivatives of beta-casomorphins with high analgesic potency // Peptides. Vol. 5. No. 3. P. 463-470.
McDaniel K.L, Mundy W.R., Tilson HA. 1990. Microinjection of dynorphin into the hippocampus impairs spatial learning in rats // Pharmacol. Biochem. Behav. Vol. 35. No. 2. P. 429-435.
McDowell J., Kitchen 1.1986. Ontogenesis of delta-opioid receptors in rat brain using [3H][d-Pen2,d-Pen5]enkephalin as a binding ligand // Eur. J. Pharmacol. Vol. 128. No. 3. P. 287-289.
Mehta C.S., Strada S. 1994. Effects of acute and continuous administration of morphine on the cyclic AMP response induced by norepinephrine in rat brain slices // Life Sci. Vol. 55. No. 1. P. 35-42.
Meisel H. 1997. Biochemical properties of regulatory peptides derived from milk proteins // Biopolymers. Vol. 43. No. 2. P. 119—128.
Meisel H. 1986. Chemical characterization and opioid activity of an exorphin isolated from in vivo digests of casein // FEBS Lett. Vol. 196. No. 2. P. 223—227.
Meisel H., FitzGerald RJ. 2000. Opioid peptides encrypted in intact milk protein sequences // Br. J. Nutr. Suppl. 1. P. S27—S31.
Mentz P., Neubert K., Hoffmann S., Liebmann C, Barth A. 1988. Effects of beta-caso-morphin in isolated heart preparations // Pharmazie. Vol. 43. No. 4. P. 271—273.
Merkouris M., Mullaney I., Georgoussi Z., Milligan G. 1997. Regulation of spontaneous activity of the delta-opioid receptor: studies of inverse agonism in intact cells // J. Neurochem. Vol. 69. No. 5. P. 2115—2122.
Meunier J.C., Mollereau C, Toll L., Suaudeau C., Moisand C., Alvinerie P., Butour J.L., Guillemot J.C., Ferrara P., Monsarrat B. 1995. Isolation and structure of the endogenous agonist of opioid receptor-like ORL1 receptor / / Nature. Vol. 12. P. 532— 535.
Meyerson B.J., Berg M., Johansson B. 1988. Neonatal naltrexone treatment: effects on sexual and exploratory behavior in male and female rats // Pharmacol. Biochem. Behav. Vol. 31. No. 1. P. 63-67.
Miller J.H., Azmitia E.C. 1999. Growth inhibitory effects of a mu opioid on cultured cholinergic neurons from fetal rat ventral forebrain, brainstem, and spinal cord // Brain Res. Dev. Brain Res. Vol. 114. No. 1. P. 69—77.
Minami M., Hosoi Y., Toya T., Katao Y., Maekawa K., Katsumata S., Yabuuchi K., Onogi T., Satoh M. 1993. In situ hybridization study of kappa-opioid receptor mRNA in the rat brain // Neurosci. Lett. Vol. 12. P. 161—164.
Mitsuma T., Nogimori T., Chaya M. 1984. Beta-casomorphin inhibits thyrotropin secretion in rats // Exp. Clin. Endocrinol. Vol. 84. No. 3. P. 324—330.
Miyamoto Y., Ganapathy V., Barias A., Neubert K., Barth A., Leibach F.H. 1987. Role of dipeptidyl peptidase IV in uptake of peptide nitrogen from beta-casomorphin in rabbit renal BBMV // Am. J. Physiol. Vol. 252. No. 4. Pt. 2. P. F670—677.
Modney B.K., Hatton G.1.1994. Maternal behaviour: evidence that they feed back to alter brain morfology and function // Acta Peadiatr.Vol. 397 P. 29—32.
Moeller I., Chai S.Y., Smith I., Lew R., Mendelsohn F.A. 1998. Haemorphin peptides may be endogenous ligands for brain angiotensin AT4 receptors // Clin. Exp. Pharmacol. Physiol. Suppl. P. S68—71.
Moffat S.D., Suh E.J., Fleming A.S. 1993. Noradrenergic involvement in the consolidation of maternal experience in postpartum rats // Physiol. Behav. Vol. 53. No. 4. P. 805-811.
Moles A., Kieffer B.L, D’Amato F.R. 2004. Deficit in attachment behavior in mice lacking the mu-opioid receptor gene // Science. Vol. 304. No. 5679. P. 1983—1986.
Molina VA., Heyser C.J., Spear L.P 1994. Chronic variable stress enhances the stimulatory action of a low dose of morphine: reversal by desipramine // Eur. J. Pharmacol. Vol. 260. No. 1. P. 57—64.
Mollereau C., Parmentier M., Mailleux P., Butour J.L, Moisand C., Chalon P., Caput D., Vassart G., Meunier J.C. 1994. ORL1, a novel member of the opioid receptor family. Cloning, functional expression and localization // FEBS Lett. Vol. 14. P. 33—38.
Mondadori C., Waser P.G. 1979. Facilitation of memory processing by posttrial morphine: possible involvement of reinforcement mechanisms? // Psychopharmacology (Berl.). Vol. 63. No. 3. P. 297—300.
Moore C.L., Power K.L. 1986. Prenatal stress affects mother-infant interaction in Norway rats // Dev. Psychobiol. Vol. 19. No. 3. P. 235—245
Moore C.L., Wong L., Daum M.C., Leclair O.U. 1997. Mother-infant interactions in two strains of rats: implications for dissociating mechanism and function of a maternal pattern // Dev. Psychobiol. Vol. 30. No. 4. P. 301—312.
Morales L., Perez-Garcia C., Alguacil L.F. 2001. Effects of yohimbine on the antinociceptive and place conditioning effects of opioid agonists in rodents // Br. J. Pharmacol. Vol. 133. No. 1. P. 172-178.
Morin-Surun M.P., Boudinot E., Fournie-Zaluski M.C., Champagnat J., Roques B.P., Denavit-Saubie M. 1992. Control of breathing by endogenous opioid peptides: possible involvement in sudden infant death syndrome // Neurochem. Int. Vol. 20. No. 1. P. 103-107.
Mosberg H.I., Lomize A.L., Wang C., Kroona H., Heyl D.L., Sobczyk-Kojiro K., Ma W., Mousigian C., Porreca F. 1994a. Development of a model for the delta opioid receptor pharmacophore. 1. Conformationally restricted Tyrl replacements in the cyclic delta receptor selective tetrapeptide Tyr-c[d-Cys-Phe-d-Pen]OH (JOM-13) //J. Med. Chem. Vol. 37. No. 25. P. 4371-4383.
Mosberg H.I., Omnaas J.R., Lomize A, Heyl D.L., Nordan L, Mousigian C., Davis P., Porreca F. 1994b. Development of a model for the delta opioid receptor pharmacophore. 2. Conformationally restricted Phe3 replacements in the cyclic delta receptor selective tetrapeptide Tyr-c[d-Cys-Phe-d-Pen]OH (JOM-13) // J. Med. Chem. Vol. 37. No. 25. P. 4384-4391.
Motta V, Brandao M.L. 1993. Aversive and antiaversive effects of morphine in the dorsal periaqueductal gray of rats submitted to the elevated plus-maze test // Pharmacol. Biochem. Behav. Vol. 44. No. 1. P. 119—125.
Muehlenkamp M.R., Warthesen J.J. 1996. Beta-casomorphins: analysis in cheese and susceptibility to proteolytic enzymes from Lactococcus lactis ssp. cremoris //J. Dairy Sci. Vol. 79. No. 1. P. 20—26.
Naim M., Nicolas P., Baron D. 1996. Folded conformations of the delta-selective opioid dermenkephalin with head-to-tail interactions. A stimulated annealing stugy through NMR restraints // Int. J. Pept. Protein Res. Vol. 47. No. 5. P. 27— 31.
Najam N., Panksepp J. 1989. Effects of chronic neonatal morphine and naloxone on
sensorimotor and social development of young rats / / Pharmacol. Biochem. Behav. Vol. 33. No. 3. P. 539-544.
Nakanishi S., Inoue A., Kita T., Nakamura M., Chang A.C., Cohen S.N., Numa S. 1979. Nucleotide sequence of cloned cDNA for bovine corticotropin-beta-lipotropin precursor // Nature. Vol. 278. No. 5703. P. 423—427.
Napier T.C., Mitrovic 1.1999. Opioid modulation of ventral pallidal inputs // Ann. N. Y. Acad. Sci. Vol. 877 P. 176-201.
Narita M., Ozaki S., Suzuki T. 2002. Endomorphin-induced motivational effect: differential mechanism of endomorphin-1 and endomorphin-2 // Jpn. J. Pharmacol. Vol. 89. No. 3. P. 224-228.
Narita M., Tseng L.F. 1998. Evidence for the existence of the beta-endorphinsensitive «epsilon-opioid receptor» in the brain: the mechanisms of epsilon-mediated antinociception // Jpn. J. Pharmacol. Vol. 76. No. 3. P. 233—253.
Nazarian A., Krall CM., Osburn J.R., McDougall S.A. 2001. Ultrasonic vocalizations of preweanling rats: involvement of both alpha(2)-adrenoceptor and kappa-opioid receptor systems // Eur. J. Pharmacol. Vol. 415. No. 2—3. P. 165—171.
Nazarian A., Rodarte-Freeman A.L., McDougall S.A. 1999. Dopaminergic modulation of kappa opioid-mediated ultrasonic vocalization, antinociception, and locomotor activity in the preweanling rat // Behav. Neurosci. Vol. 113. No. 4. P. 816—825.
Nedvidkova J., Kasafirek E., Dlabac A., Felt V 1985. Effect of beta-casomorphin and its analogue on serum prolactin in the rat // Exp. Clin. Endocrinol. Vol. 85. No. 2. P. 249-252.
Negri L., Lattanzi R., Melchiorri P. 1995. Production of antinociception by peripheral administration of [Lys7]dermorphin, a naturally occurring peptide with high affinity for mu-opioid receptors // Br. J. Pharmacol. Vol. 114. No. 1. P. 57—66.
Nelson E.E., Panksepp J. 1998. Brain substrates of infant-mother attachment: contributions of opioids, oxytocin, and norepinephrine // Neurosci. Biobehav. Rev. Vol. 22. No. 3. P. 437-452.
Nestoros J.N. 1984. Gabaergic mechanisms and anxiety: an overview and a new neurophysiological model // Can. J. Psychiatry. Vol. 29. No. 6. P. 520—529.
Netter P., Hennig J., Huwe S. 1997. Explanatory models of anxiety from the viewpoint of biopsychology and pharmacopsychology // Anasthesiol. Intensivmed. Notfallmed. Schmerzther. Vol. 32. No. 3, Suppl. P. S325—S329.
Neubert K., Hartrodt B., Born I., Barth A., Ruethrich H.-L., Grecksch G., Schrader U., Liebmann C. 1990. Structural modifications of beta-casomorphin-5 and related peptides // F. Nyberg, V Brantl (eds.). Beta-casomorphins and related reptides. Uppsala: Furis-Tryck AB. P. 15—20.
Niwa M., Nose T., Nozaki M., Tzurumi K., Fujimura H. 1985. Effects of butorphanol and its metabolites on the levels of monoamines and their metabolites in the rat brain // Jpn. J. Pharmacol. Vol. 39. No. 4. P. 515—528.
Noble F., Cox BM. 1995. Differential regulation of DI dopamine receptor- and of A2a adenosine receptor-stimulated adenylyl cyclase by mu-, delta 1-, and delta 2-
opioid agonists in rat caudate putamen // J. Neurochem. Vol. 65. No. 1. P. 125— 133.
Noda M., Teranishi Y, Takahashi H., Toyosato M., Notake M., Nakanishi S., Numa S. 1982. Isolation and structural organization of the human preproenkephalin gene // Nature. Vol. 297. No. 5865. P. 431-434.
Noda Y., Mamiya T., Manabe T., Nishi M., Takeshima H., Nabeshima T. 2000. Role of nociceptin systems in learning and memory // Peptides. Vol. 21. No. 7. P. 1063— 1069.
Nomikos G., Spyraki C., Kazandjian A., Sfikakis A. 1987. Estrogen treatment to ova-riectomized rats modifies morphine-induced behavior // Pharmacol. Biochem. Behav. Vol. 27. No. 4. P. 611-617.
Nyberg F., Lieberman H., Lindstrom L.H.; Lyrenas S., Koch G., Terenius L. 1989. Immunoreactive beta-casomorphin-8 in cerebrospinal fluid from pregnant and lactating women: corellation with plasma levels //J. Clin. Endocrinol. Metab. Vol. 68. No. 2. P. 283-289.
Nyberg F., Lindstrom L.H., Terenius L. 1988. Reduced beta-casein levels in milk samples from patients with postpartum psychosis // Psychiatry. Vol. 23. No. 2. P. 115—122.
O’Dowd B.F., Scheideler MA., Nguyen T., Cheng R., Rasmussen J.S., Marchese A., Za-stawny R., Heng H.H., Tsui L.C., Shi X. 1995. The cloning and chromosomal mapping of two novel human opioid-somatostatin-like receptor genes, GPR7 and GPR8, expressed in discrete areas of the brain // Genomics. Vol. 28. No. 1. P. 84— 91.
Ohinata K., Agui S., Yoshikawa M. 2007. Soymorphins, novel mu opioid peptides derived from soy beta-conglycinin beta-subunit, have anxiolytic activities // Biosci Biotechnol Biochem. Vol. 71. No. 10. P. 2618—2621.
Okano H., Hirano T., Balaban E. 2000. Learning and memory // Proc Natl. Acad. Sci. USA. Vol. 97. No. 23. P. 12403-12404.
Olianas M.C., Onali P. 1988. Synergistic interaction of muscarinic and opioid receptors with GS-linked neurotransmitter receptors to stimulate adenylyl cyclase activity of rat olfactory bulb // Can. J. Physiol. Pharmacol. Vol. 66. No. 12. P. 1487-1492.
Olianas M.C, Onali P. 1994. Activation of opioid and muscarinic receptors stimulates basal adenylyl cyclase but inhibits Ca2+/calmodulin- and forskolin-stimulated enzyme activities in rat olfactory bulb //J. Neurochem. Vol. 63. No. 1. P. 161—168.
Olmstead M.C., Franklin K.B. 1994. Lesions of the pedunculopontine tegmental nucleus abolish catalepsy and locomotor depression induced by morphine // Brain Res. Vol. 662. No. 1-2. P. 134-140.
Olson GA., Olson R.D., Kastin A.J. 1997. Endogenous opiates: 1996 // Peptides. Vol. 18. No. 10. P. 1651-1688.
Pakarinen E.D., Woods J.H., Moerschbaecher JM. 1995. Repeated acquisition of behavioral chains in squirrel monkeys: comparisons of a mu, kappa and delta opioid agonist // J. Pharmacol. Exp. Ther. Vol. 272. No. 2. P. 552—559.
Pan L, Xu J., Yu R., Xu M.M., Pan YX., Pasternak G.W. 2005. Identification and characterization of six new alternatively spliced variants of the human mu opioid receptor gene, Oprm // Neuroscience. Vol. 133. No. 1. P. 209—220.
Panigrahy A., Sleeper LA, Assmann S., Rava L.A., White W.F., Kinney H.C. 1998. Developmental changes in heterogeneous patterns of neurotransmitter receptor binding in the human interpeduncular nucleus //J. Comp. Neurol. Vol. 390. No. 3. P. 322-332.
Panksepp J., Bean NJ., Bishop P., Vilberg T., Sahley T.L. 1980b. Opioid blockade and social comfort in chicks // Pharmacol. Biochem. Behav. Vol. 13. No. 5. P. 673— 683.
Panksepp J., Herman B.H., Vilberg T., Bishop P., DeEskinazi F.G. 1980a. Endogenous opioids and social behavior // Neurosci. Biobehav. Rev. Vol. 4. No. 4. P. 473—487.
Panksepp J., Nelson E., Siviy S. 1994. Brain opioids and mother-infant social motivation // Acta Paediatr. Vol. 397. No. 1. P. 40—46.
Panksepp J., Normansell L., Siviy S., Rossi J. 3rd, Zolovick AJ. 1984. Casomorphins reduce separation distress in chicks // Peptides. Vol. 5. No. 4. P. 829—831.
Papaioannou A., Dafni U., Alikaridis F., Bolaris S., Stylianopoulou F. 2002. Effects of neonatal handling on basal and stress-induced monoamine levels in the male and female rat brain // Neuroscience. Vol. 114. No. 1. P. 195—206.
Pasi A., Mahler H., Lansel N., Bemasconi C., Messiha F.S. 1993. beta-Casomorphin-immunoreactivity in the brain stem of the human infant // Res. Commun. Chem. Pathol. Pharmacol. Vol. 80. No. 3. P. 305—322.
Pedersen GA, Caldwell J.D., Walker C., Ayers G., Mason GA. 1994. Oxytocin activates the postpartum onset of rat maternal behavior in the ventral tegmental and medial preoptic areas // Behav. Neurosci. Vol. 108. No. 6. P. 1163—1171.
Pego-Reigosa R., Covenas R., Tramu G., Pesini P. 2000. Distribution of met-enkep-halin immunoreactivity in the diencephalon and the brainstem of the dog //J. Chem. Neuroanat. Vol. 19. No. 4. P. 243—258.
Pellis SM., de la Cruz F., Pellis V.C, Teitelbaum P. 1986. Morphine subtracts subcomponents of haloperidol-isolated postural support reflexes to reveal gradients of their integration // Behav. Neurosci. Vol. 100. No. 5. P. 631—646.
Pepin M.C., Yue S.Y., Roberts E., Wahlestedt C., Walker P. 1997. Novel «restoration of function» mutagenesis strategy to identify amino acids of the delta-opioid receptor involved in ligand binding // J. Biol. Chem. Vol. 272. No. 14. P. 9260— 9267.
Peppard J.V., Jackson L.E., Hall J.G., Robertson D. 1984. The transfer of immune complexes from the lumen of the small intestine to the bloodstream in sucking rats // Immunology. Vol. 53. No. 2. P. 385—393.
Persson AL, Thorlin T., Bull C, Eriksson P.S. 2003. Opioid-induced proliferation through the МАРК pathway in cultures of adult hippocampal progenitors // Mol. Cell Neurosci. Vol. 23. No. 3. P. 360—372.
Petaja-Repo U.E., Hogue M., Bhalla S., Laperriere A., Morello J.P., Bouvier M. 2002. Li
gands act as pharmacological chaperones and increase the efficiency of delta opioid receptor maturation // EMBO J. Vol. 21. No. 7. P. 1628—1637.
Petrilli P., Addeo F., Chianese L. 1983. Primary structure of water buffalo beta-casein tryptic and CNBr peptides // Ital. J. Biochem. Vol. 32. No. 5. P. 336—344.
Petrilli P., Picone D., Caporale C, Addeo F., Auricchio S., Marino G. 1984. Does caso-morphin have a functional role? // FEBS Lett. Vol. 169. No. 1. P. 53—56.
Petrillo P., Tavani A., Verotta D., Robson L.E., Kosterlitz H.W. 1987. Differential postnatal development of mu-, delta- and kappa-opioid binding sites in rat brain // Brain Res. Vol. 428. No. 1. P. 53-58.
Phillips G.D., Robbins T.W., Everitt BJ. 1994. Mesoaccumbens dopamine-opiate interactions in the control over behaviour by a conditioned reinforcer // Psychopharmacology (Berl.). Vol. 114. No. 2. P. 345—359.
Platt DM., Grech DM., Rowlett J.K., Spealman R.D. 1999. Discriminative stimulus effects of morphine in squirrel monkeys: stimulants, opioids, and stimulant-opioid combinations. //J. Pharmacol. Exp. Ther. Vol. 290. No. 3. P. 1092—1100.
Polan H.J., Hofer MA. 1998. Olfactory preference for mother over home nest shavings by newborn rats // Dev. Psychobiol. Vol. 33. No. 1. P. 5—20.
Popik P., Skolnick P. 1996. The NMDA antagonist memantine blocks the expression and maintenance of morphine dependence // Pharmacol. Biochem. Behav. Vol. 53. No. 4. P. 791-797.
Potaman V. N., Antonova L.V., Dubynin V.A., Zaitzev DA., Kamensky AA., Myasoe-dov N.F., Nezavibatko V.N. 1991. Entry of the synthesic ACTH (4-10) analogue into the rat brain following intravenous injection // Neurosci. Lett. Vol. 127. P. 133-136.
Potenza M.N., Gold S.J., Roby-Shemkowitz A, Lerner M.R., Nestler EJ. 1999. Effects of regulators of G protein-signaling proteins on the functional response of the mu-opioid receptor in a melanophore-based assay //J. Pharmacol. Exp. Ther. Vol. 291. No. 2. P. 482-491.
Privette Т.Н., Terrian D.M. 1995. Kappa opioid agonists produce anxiolytic-like behavior on the elevated plus-maze // Psychopharmacology (Berk). Vol. 118. No. 4. P. 444-450.
Rabgaoui N., Guerin M.C., Torreilles J. 1994. Casein-derived peptides can modulate the production of 5-hydroxyeicosatetraenoic acid in human neutrophils // Biochem. Cell Biol. Vol. 72. No. 7-8. P. 305-311.
Rady J.J., Campbell W.B., Fujimoto JM. 2001. Antianalgesic action of nociceptin originating in the brain is mediated by spinal prostaglandin E(2) in mice //J. Pharmacol. Exp. Ther. Vol. 296. No. 1. P. 7—14.
Rahman W., Dashwood M.R., Fitzgerald M., Aynsley-Green A., Dickenson A.H. 1998. Postnatal development of multiple opioid receptors in the spinal cord and development of spinal morphine analgesia // Brain Res. Dev. Brain Res. Vol. 108. No. 1-2. P. 239-254.
Ramabadran K., Bansinath M. 1988. Opioid peptides from milk as a possible cause of
sudden infant death syndrome // Med. Hypotheses. Vol. 27. Ыо. 3. P. 181—187.
Rauca C., Matthies H. 1986a. Effects of intrastriatal microinjection of beta-casomorphins and its des-tyrosine derivatives on rat motor behaviour // Biomed. Bioc-him. Acta. Vol. 45. Ho. 8. P. 1083—1091.
Rauca C., Matthies H. 1986b. The effect of beta-casomorphins on the apomorphine-and amphetamine-induced turning after nigral lesions in rats // Heuropharma-cology. Vol. 25. Ho. 10. P 1137-1140.
Rauca C., Schroder H. 1995. Effect of BCH 325 (Pro-d-Phe-Pro-Gly) on central dopaminergic functions // Peptides. Vol. 16. Ho. 4. P. 635—640.
Raynor K., Kong H., Chen Y., Yasuda K., Yu L, Bell G.I., Reisine T. 1994. Pharmacological characterization of the cloned kappa-, delta-, and mu-opioid receptors / / Mol. Pharmacol. Vol. 45. Ho. 2. P. 330—334.
Read L.C., Lord AP., BrantI V., Koch G. 1990. Absorption of beta-casomorphins from autoperfused lamb and piglet small intestine // Am. J. Physiol. Vol. 259. P. 443—452.
Reid L.D., Hubbell C.L. 1994. An assessment of the addiction potential of the opioid associated with milk //J. Dairy Sci. Vol. 77. Ho. 3. P. 672—675.
ReimerS., Hollt V 1991. GABAergic regulation of striatal opioid gene expression // Brain Res. Mol. Brain Res. Vol. 10. Ho. 1. P. 49—54.
Reinscheid R.K., Hothacker H.P., Bourson A., Ardati A., Henningsen R.A., Bunzow J.R., Grandy D.K., Lan gen H., Monsma F.J., Civelli 0.1995. Orphanin FQ: a neuropeptide that activates an opioidlike G protein-coupled receptor // Science. Ho. 3. P. 792-794.
Renlund S., Erlandsson I., Hellman LL, Silberring J., Wernstedt C., Lindstrom L, Hy-berg F. 1993. Micropurification and amino acid sequence of beta-casomorphin-8 in milk from a woman with postpartum psychosis // Peptides. Vol. 14. Ho. 6. P. 1125-1132.
Reymann K.G., Chepkova A.H., Matthies H. 1985. Effects of deprolorphin, a caso-morphin analog, on hippocampal CAI field potentials in vitro // Peptides. Vol. 4. Ho. 3. P. 283-286.
Riand J., Baron D., Hicolas P., Benajiba A., Teng Y, Haim M. 1999. The delta-selective opioid peptide dermenkephalin and the mu-selective hybrid peptide dermen-kephalin-[l—4]-dermophin-[5-7] display strikingly different conformations despite identical tetrapeptide H-termini. A quantitative 2-D HMR and molecular modeling analysis //J. Biomol. Struct. Dyn. Vol. 17. Ho. 3. P. 445—460.
Richardson B.C., Mercier J.C. 1979. The primary structure of the ovine beta-caseins // Eur. J. Biochem. Vol. 99. Ho. 2. P. 285-297.
Ristine LA., Spear L.P. 1984. Effects of serotonergic and cholinergic antagonists on suckling behavior of neonatal, infant, and weanling rat pups // Behav. Heural. Biol. Vol. 41. Ho. 2. P. 99-126.
Roberts DC., Mason S.T., Fibiger H.C. 1978. 6-OHDA lesion to the dorsal noradrenergic bundle alters morphine-induced locomotor activity and catalepsy // Eur. J. Pharmacol. Vol. 52. Ho. 2. P. 209-214.
Robertson В.С., Hommer D.W., Skirboll L.R. 1987. Electrophysiological evidence for a non-opioid interaction between dynorphin and GABA in the substantia nigra of the rat // Neuroscience. Vol. 23. No. 2. P. 483—490.
Robinson S.E., Maher J.R., Wallace M.J., Kunko P.M. 1997. Perinatal methadone exposure affects dopamine, norepinephrine, and serotonin in the weanling rat // Neurotoxicol. Teratol. Vol. 19. No. 4. P. 295—303.
Rodriguez C., Guillamon A., Pinos H., Collado P. 2004. Postpartum changes in the GABAergic system in the bed nucleus of the accessory olfactory tract // Neuro-chem. Int. Vol. 44. No. 3. P. 179—183.
Rondeau D.B., Turcotte M., Young L., Hebert D. 1982. Similarities of the cataleptic state induced by beta-endorphin and morphine // Pharmacol. Biochem. Behav. Vol. 17. No. 4. P. 703-707.
Rosenblatt J.S. 1975. Selective retrieving by maternal and nonmatemal female rats// J. Comp. Physiol. Psychol. Vol. 88. No. 2. P. 678—686.
Rosenblatt J.S. 1994. Psychobiology of maternal behavior: contribution to the clinical understanding of maternal behavior among humans // Acta Paediatr. Suppl. Vol. 39. P. 3-8.
Rosenblatt J.S., Mayer A.D., Giordano AL. 1988. Hormonal basis during pregnancy for the onset of maternal behavior in the rat // Psychoneuroendocrinology. Vol. 13. No. 1-2. P. 29-46.
Rossi G.C., Leventhal L., Bolan E., Pasternak G.W 1997. Pharmacological characterization of orphanin FQ/nociceptin and its fragments //J. Pharmacol. Exp. Ther. Vol. 282. No. 2. P. 858-865.
Rossi G.C., Pasternak G.W., Bodnar R.J. 1994. Mu and delta opioid synergy between the periaqueductal gray and the rostro-ventral medulla // Brain Res. Vol. 665. No. 1. P. 85-93.
Roth T.L., Sullivan RM.. 2003. Consolidation and expression of a shoac -induced odor preference in rat pups is facilitated by opioids // Physiol. Behav. Vol. 78. No. 1. P. 135-142.
Rubin B.S., Bridges R.S. 1984. Disruption of ongoing maternal responsiveness in rats by central administration of morphine sulfate // Brain Res. Vol. 307. No. 1—2. P. 91-97.
Ruthrich H.L., Grecksch G., Matthies H. 1993a Influence of beta-casomorphins on apomorphine-induced hyperlocomotion // Pharmacol. Biochem. Behav. Vol. 44. No.l.P. 227-231.
Ruthrich H.L, Grecksch G., Matthies H. 1993b. Adrenalectomy attenuates the improvement of memory in rats by peripheral application of Des-Tyr-d-Pro4-casomorphin // Behav. Neural. Biol. Vol. 59. No. 1. P. 25—28.
Ruthrich H.L., Grecksch G., Matthies H. 1992a Influence of modified casomorphins on yawning behavior of rats / / Peptides. Vol. 13. No. 1. P. 69—72.
Ruthrich H.L., Grecksch G., Schmidt R. 1994. Phel-substituted beta-casomorphin-5 analogues with analgesic activity // Peptides. Vol. 15. No. 3. P. 457—460.
Ruthrich H.L, Grecksch G., Schmidt R., Neubert K. 1992b. Linear and cyclic beta-casomorphin analogues with high analgesic activity // Peptides. Vol. 13. No. 3. P. 483-485.
Ruzicka B.B., Jhamandas. 1988. Depression of potassium-evoked striatal acetylcholine release by delta-receptor activation: inhibition by cholinoactive agents // Can J. Physiol. Pharmacol. Vol. 66. No. 12. P. 1487—1492.
Saha N., Datta H., Sharma P.L. 1990. Effects of morphine, buprenorphine, pentazocine and nalorphine on acquisition and extinction of active avoidance responses in rats // Indian J. Physiol. Pharmacol. Vol. 34. No. 3. P. 179—182.
Saha N., Datta H., Sharma P.L. 1991. Effects of morphine on memory: interactions with naloxone, propranolol and haloperidol // Pharmacology. Vol. 42. No. 1. P. 10-14.
Sahin M., Bowen W.D., Donoghue J.P. 1992. Location of nicotinic and muscarinic cholinergic and mu-opiate receptors in rat cerebral neocortex: evidence from thalamic and cortical lesions // Brain Res. Vol. 579. No. 1. P. 1345—1347.
Sakaguchi M., Fujimori T., Satoh T., Matsumura E. 2001. Effects of beta-casomorphins on neuronal survival in culture of embryonic chick dorsal root ganglion neurons // Jpn. J. Pharmacol. Vol. 86. No. 3. P. 363—365.
Sakaguchi M., Fujimori T., Satoh T., Satoh M., Takeuchi M, Matsumura E. 1999. Effects of opioids on neuronal survival in culture of embryonic chick dorsal root ganglion neurons // Neurosci. Lett. Vol. 262. No. 1. P. 17—20.
Sakaguchi M., Murayama K, Jinsmaa Y., Yoshikawa M., Matsumura E. 2003. Neurite outgrowth-stimulating activities of beta-casomorphins in Neuro-2a mouse neuroblastoma cells // Biosci. Biotechnol. Biochem. Vol. 67. No. 12. P. 2541—2547.
Sakaguchi M., Murayama K., Yabe K., Satoh M., Takeuchi M., Matsumura E. 1998. Beta-casomorphin-5 stimulates neurite outgrowth in a mouse neuroblastoma cell line (Neuro-2a) // Neurosci Lett. Vol. 251. No. 2. P. 97—100.
Sakurada S., Zadina J.E., Kastin A.J., Katsuyama S., Fujimura T., Murayama K., Yuki M., Ueda H., Sakurada T. 1999. Differential involvement of mu-opioid receptor subtypes in endomorphin-1- and -2-induced antinociception // Eur. J. Pharmacol. Vol. 372. No. 1. P. 25-30.
Sales N., Charnay Y., Zajac J.M, Dubois PM., Roques B.P. 1989. Ontogeny of mu and delta opioid receptors and of neutral endopeptidase in human spinal cord: an autoradiographic study // J. Chem. Neuroanat. Vol. 2. No. 4. P. 179—188.
Sanderson K., Nyberg F., Khalil Z. 1998. Modulation of peripheral inflammation by locally administered hemorphin-7 // Inflamm. Res. Vol. 47. No. 2. P. 49—55.
Sandin J., Ogren S.O., Terenius L. 2000. Endomorphin-2 but not Leu-enkephalin modulates spatial learning when microinjected in the CA3 region of the rat hippocampus // Neuroreport. Vol. 11. No. 17. P. 3659—3662.
Sandor N.T., Lendvai B., Vizi E.S. 1992. Effect of selective opiate antagonists on striatal acetylcholine and dopamine release // Brain Res. Bull. Vol. 29. No. 3—4. P. 369-373.
Sanz Y., Toldra F. 2001. Purification and characterization of an X-prolyl-dipeptidyl peptidase from Lactobacillus sakei // Appl. Environ. Microbiol. Vol. 67. No. 4. P. 1815-1820.
Scanff., Yvon M., Thirouin S., Pelissier J.P. 1992. Characterization and kinetics of gastric emptying of peptides derived from milk proteins in the preruminant calf // J. Dairy Res. Vol. 59. No. 4. P. 437—447.
Schiller P.W. 2005. Opioid peptide-derived analgetics // AAPS J. Vol. 7. No. 3. P. 560— 565.
Schiller P.W., Berezowska I., Nguyen T.M., Schmidt R., Lemieux C., Chung N.N., Fal-cone-Hindley ML, Yao W., Liu J., Iwama S., Smith A.B. 3rd, Hirschmann R. 2000. Novel ligands lacking a positive charge for the delta- and mu-opioid receptors // J. Med. Chem. Vol. 43. No. 4. P. 551—559.
Schiller P.W., Nguyen ТЛ4., Maziak L.A., Wilkes B.C., Lemieux C. 1987. Structure-activity relationships of cyclic opioid peptide analogues containing a phenylalanine residue in the 3-position //J. Med. Chem. Vol. 30. No. 11. P. 2094—2099.
Schlicker E., Werthwein S., Kathmann M, Bauer U. 1998. Nociceptin inhibits noradrenaline release in the mouse brain cortex via presynaptic ORL1 receptors // Naunyn Schmiedebergs Arch. Pharmacol. Vol. 358. No. 4. P. 418—422.
Schlosser B., Kudematsch MB., Sutor B., Bruggencate GA 1995. Delta, mu and kappa opioid receptor agonists inhibit dopamine overflow in rat neostriatal slices // Neurosci Lett. Vol. 191. No. 1-2. P. 126-130.
Schmidt R., Neubert K., Barth A., Liebmann C., Schnittler M, Chung N.N., Schiller P.W. 1991. Structure-activity relationships of cyclic beta-casomorphin-5 analogues // Peptides. Vol. 12. No. 6. P. 1175—1180.
Schmidt R., Vogel D., Mrestani-Klaus C., Brandt W., Neubert K, Chung N.N., Lemieux C., Schiller P.W. 1994. Cyclic beta-casomorphin analogues with mixed mu agonist/delta antagonist properties: synthesis, pharmacological characterization, and conformational aspects //J. Med. Chem. Vol. 37. No. 8. P. 1136—1144.
Schmidt R., Wilkes B.C., Chung N.N., Lemieux C., Schiller P.W. 1996. Effect of aromatic amino acid substitutions in the 3-position of cyclic beta-casomorphin analogues on mu-opioid agonist/delta-opioid antagonist properties // Int. J. Pept. Protein Res. Vol. 48. No. 5. P. 411—419.
Schulte-Frohlinde E., Reindl W., Bierling D., Lersch C., BrantI V, Teschemacher H., Schusdziarra V. 2000. Effects of oral casokefamide on plasma levels, tolerance, and intestinal transit in man // Peptides. Vol. 21. No. 3. P. 439—442.
Schulteis G., Martinez J.L., Jr. 1992. [Leu]enkephalin and its metabolite, Tyr-Gly-Gly, impair active avoidance retention // Pharmacol. Biochem. Behav. Vol. 42. No. 3. P. 523-527.
Schusdziarra V., Henrichs I., Holland A., Klier M., Pfeiffer E.F. 1981. Evidence for an effect of exorphins on plasma insulin and glucagon levels in dogs // Diabetes. Vol. 30. No. 4. P. 362-364.
Schusdziarra V., Schick A., de la Fuente A., Specht J., Klier M, BrantI V, Pfeiffer E.F.
1983а. Effect of beta-casomorphins and analogs on insulin release in dogs // Endocrinology. Vol. 112. No. 3. P. 885—889.
Schusdziarra V., Schick R., de la Fuente A., Holland A., Brantl V., Pfeiffer E.F. 1983b. Effect of beta-casomorphins on somatostatin release in dogs // Endocrinology. Vol. 112. No. 6. P. 1948-1951.
Schusdziarra V., Schmid R., Schulte-Frohlinde E., Reiser S., Brantl V. 1990. Effect of beta-casomorphins on gastrointestinal motitity and pancreatic endocrine function // F. Nyberg, V Brantl (eds.). Beta-Casomorphins and Related Peptides. Uppsala, Sweden: Furis-Tryck AB. P. 109—110.
Scotti de Carolis A., Popoli P., Pezzola A., Sagratella S. 1991. Differential effects of morphinan drugs on haloperidol-induced catalepsy in rats: a comparative study with an N-methyl-d-aspartate antagonist // Arch. Int. Pharmacodyn. Ther. Vol. 310. P. 132-141.
Segredo V., Burford N.T., Lameh J., Sadee W.A. 1997. A constitutively internalizing and recycling mutant of the mu-opioid receptor //J. Neurochem. Vol. 68. No. 6. P. 2395-2404.
Shacoori V., Guerin J., Girre A., Saiag B., Rault B. 1992. Effect of naloxone and beta-casomorphin on the hypothalamic-pituitary-luteinizing hormone axis in vitro // Life Sci. Vol. 51. No. 12. P. 899-907.
Sharp BM, Roy S., Bidlack JJvL 1998. Evidence for opioid receptors on cells involved in host defense and the immune system // J. Neuroimmunol. Vol. 83. No. 1 —2. P. 45—56.
Shiigi Y., Kaneto H. 1990. Facilitation of memory retrieval by pre-test morphine and its state dependency in the step-through type passive avoidance learning test in mice // Jpn. J. Pharmacol. Vol. 54. No. 1. P. 79—81.
Sieber B., Frischknecht H.R., Waser P.G. 1982. Behavioural effects of hashish in mice in comparison with other psychoactive drugs // Gen. Pharmacol. Vol. 13. No. 4. P. 315-320.
Silbert B.S., Lipkowski A.W., Cepeda M.S., Szyfelbein S.K., Osgood P.F., Carr D.B. 1991. Analgesic activity of a novel bivalent opioid peptide compared to morphine via different routes of administration // Agents Actions. Vol. 33. No. 3—4. P. 382—387.
Silva M.R., Bernardi M.M., Cruz-Casallas P.E., Felicio L.F. 2003. Pimozide injections into the Nucleus accumbens disrupt maternal behaviour in lactating rats // Pharmacol. Toxicol. Vol. 93. No. 1. P. 42—47
Simmons M.L. Wagner J.J., Caudle R.M., Chavkin C. 1992. Endogenous opioid regulation of norepinephrine release in guinea pig hippocampus // Neurosci. Lett. Vol. 141. No. 1. P. 84-88.
Simmons M.L., Chavkin С. 1996. Kappa-opioid receptor activation of a dendrotoxinsensitive potassium channel mediates presynaptic inhibition of mossy fiber neurotransmitter release //Mol. Pharmacol. Vol. 50. No. 1. P. 80—85.
Singh M., Rosen C.L., Chang K.J., Haddad G.G. 1989. Plasma beta-casomorphin-7 immunoreactive peptide increases after milk intake in newborn but not in adult dogs // Pediatr. Res. Vol. 26. No. 1. P. 34—38.
Smith J.W., Seckl J.R., Evans A.T., Costall В., Smythe J.W 2004. Gestational stress induces post-partum depression-like behaviour and alters maternal care in rats // Psychoneuroendocrinology. Vol. 29. No. 2. P. 227—244.
Soaje M., de Di Nasso E.G., Deis R.P. 2002. Regulation by endogenous opioids of suckling-induced prolactin secretion in pregnant and lactating rats: role of ovarian steroids //J. Endocrinol. Vol. 172. No. 2. P. 255—261.
Sofuoglu M., Portoghese P.S., Takemori A.E. 1993.7-Benzylidenenaltrexone (BNTX): a selective delta 1 opioid receptor antagonist in the mouse spinal cord // Life Sci. Vol. 52. No. 8. P. 769-775.
Sofuoglu M., Portoghese P.S., Takemori A.E. 1991. Differential antagonism of delta opioid agonists by naltrindole and its benzofuran analog (NTB) in mice: evidence for delta opioid receptor subtypes //J. Pharmacol. Exp. Ther. Vol. 257. No. 2. P. 676-680.
Solomon R.E., Goodrich J.E., Katz J.L. 1988. Opioid receptor subtype-specific cross-tolerance to the effects of morphine on schedule-controlled behavior in mice // Psycho-pharmacology (Berk). Vol. 96. No. 2. P. 218—222.
Spain J.W., Roth B.L., Coscia C.J. 1985. Differential ontogeny of multiple opioid receptors (mu, delta, and kappa) // J. Neurosci. Vol. 5. No. 3. P. 584—588.
Speciale S.G., Manaye K.F., Sadeq M., German D.C. 1993. Opioid receptors in midbrain dopaminergic regions of the rat. II. Kappa and delta receptor autoradiography // J. Neural. Transm. Gen. Sect. Vol. 91. No. 1. P. 53—66.
Spivak C.E., Beglan C.L., Seidleck B.K., Hirshbein L.D., Blaschak C.J., Uhl G.R., Surratt C.K. 1997. Naloxone activation of mu-opioid receptors mutated at a histidine residue lining the opioid binding cavity // Mol. Pharmacol. Vol. 52. No. 6. P. 983—992.
Stafisso-Sandoz G., Polley D., Holt E., Lambert K.G., Kinsley C.H. 1998. Opiate disruption of maternal behavior: morphine reduces, and naloxone restores, c-fos activity in the medial preoptic area of lactating rats // Brain Res. Bull. Vol. 45. No. 3. P. 307-313.
Stark H., Lossner B., Matthies H. 1986. Degradation of beta-casomorphin in the rat brain in vivo // Biomed. Biochim. Acta. Vol. 45. No. 4. P. 557—563.
Stark H., Lossner B., Matthies H. 1987. Metabolism of beta-casomorphin and its derivatives in rat brain and liver homogenates // Biomed. Biochim. Acta. Vol. 46. No. 10. P. 687-694.
Stark H., Lossner B., Matthies H., Hartrodt В., Bom 1.1988. Metabolism of8-proline beta-casomorphin derivatives in the rat brain // Biomed. Biochim. Acta. Vol. 47. No. 9. P. 865-869.
Stark H., Van Bree J.B., de Boer A.G., Jaehde U., Breimer D.D. 1992. In vitro penetration of des-tyrosinel-d-phenylalanine3-beta-casomorphin across the blood-brain barrier // Peptides. Vol. 13. No. 1. P. 47—51.
Stern JM., Protomastro M. 2002. Effects of low dosages of apomorphine on maternal responsiveness in lactating rats // Pharmacol. Biochem. Behav. Vol. 66. No. 2. P. 353-359.
Stoffel Е.С., Craft R.M. 2004. Ovarian hormone withdrawal-induced «depression» in female rats // Physiol. Behav. Vol. 83. No. 3. P. 505—513.
Su X., Sengupta J.N., Gebhart G.F. 1997. Effects of kappa opioid receptor-selective agonists on responses of pelvic nerve afferents to noxious colorectal distension //J. Neurophysiol. Vol. 78. No. 2. P. 1003—1012.
Sudakov S.K., Goldberg S.R., Borisova E.V, Surkova L.A., Turina I.V., Rusakov DJu., Elmer G.1.1993. Differences in morphine reinforcement property in two inbred rat strains: associations with cortical receptors, behavioral activity, analgesia and the cataleptic effects of morphine // Psychopharmacology (Berk). Vol. 112. No. 2— 3. P. 183-188.
Sugimoto-Watanabe A., Kubota K., Fujibayashi K., Saito К. 1999. Antinociceptive effect and enzymatic degradation of endomorphin-1 in newborn rat spinal cord / / Jpn. J. Pharmacol. Vol. 81. No. 3. P. 264-270.
Sun Z., Zhang Z., Wang X., Cade R., Elmir Z., Fregly M. 2003. Relation of beta-casomorphin to apnea in sudden infant death syndrome // Peptides. Vol. 24. No. 6. P. 937-943.
Surratt C.K., Johnson P.S., Moriwaki A., Seidleck B.K., Blaschak C.J., Wang J.B., Uhl G.R. 1994. Mu opiate receptor. Charged transmembrane domain amino acids are critical for agonist recognition and intrinsic activity //J. Biol. Chem. Vol. 269. No. 32. P. 20548-20553.
Sutters K.A., Miaskowski C., Taiwo Y.O., Levine J.D. 1990. Analgesic synergy and improved motor function produced by combinations of mu-delta- and mu-kappa-opioids // Brain Res. Vol. 530. No. 2. P. 290—294.
Suzuki T., Fukagawa Y., Yoshii T., Yanaura S. 1988. Effect of opioid agonist-antagonist inter-action on morphine dependence in rats // Life Sci. Vol. 42. No. 26. P. 2729-2737.
Suzuki Y., Taguchi K. 1983. Influence of drugs on evoked potentials in the cat cerebellum; III. Effects of morphine hydrochloride / / Jpn. J. Pharmacol. Vol. 33. No. 3. P. 681-689.
Svedberg A., de Haas J., Leimenstoll G., Paul F., Teschemacher H. 1985. Demonstration of beta-casomorphin immunoreactive materials in in vitro digests of bovine milk and in small intestine contents after bovine milk ingestion in adult humans // Peptides. Vol. 6. No. 5. P. 825-830.
Szikra J., Benyhe S., Orosz G., Darula Z., Piot JM, Fruitier I., Monory K., Hanoune J., Borsodi A. 2001. Radioligand binding properties ofW-hemorphin 7, an atypical opioid peptide // Biochem. Biophys. Res. Commun. Vol. 281. No. 3. P. 670—677.
Taira T., Hilakivi LA., Aalto J., Hilakivi 1.1990. Effect of beta-casomorphin on neonatal sleep in rats // Peptides. Vol. 11. No. 1. P. 1—4.
Talbot J.N., Happe H.K., Murrin LC. 2005. Mu opioid receptor coupling to Gi/o proteins increases during postnatal development in rat brain //J. Pharmacol. Exp. Then Vol. 314. No. 2. P. 596-602.
Tanaka M., Yoshida M., Emoto H., Ishii H. 2000. Noradrenaline systems in the hy
pothalamus, amygdala and locus coeruleus are involved in the provocation of anxiety: basic studies // Eur. J. Pharmacol. Vol. 405. No. 1—3. P. 397—406.
Tancredi T., Temussi P.A., Picone D., Amodeo P., Tomatis R., Salvador! S., Marastoni M., Santagada V., Balboni G., Tancredi T. 1991. New insights on mu/delta selectivity of opioid peptides: conformational analysis of deltorphin analogues // Biopolymers. Vol. 31. No. 6. P. 751—760.
Tang Q., Gandhoke R., Burritt A., Hruby V.J., Porreca F., Lai J. 1999. High-affinity interaction of(des-Tyrosyl)dynorphin A(2—17) with NMDA receptors //J. Pharmacol. Exp Then Vol. 291. No. 2. P. 760—765.
Tang T., Kiang J.G., Cote T., Сох B.M. 1995. Opioid-induced increase in [Ca2+]i in ND8^47 neuroblastoma x dorsal root ganglion hybrid cells is mediated through G protein-coupled delta-opioid receptors and desensitized by chronic exposure to opioid //J. Neurochem. Vol. 65. No. 4. P. 1612—1621.
Tao P.L., Chang L.R., Chou Y.P., Law P.Y., Loh H.H. 1993. Chronic opioid treatment may uncouple opioid receptors and G-proteins: evidence from radiation inactivation analysis // Eur. J. Pharmacol. Vol. 246. No. 3. P. 233—238.
Tao R., Ma Z., Auerbach S.B. 1998. Alteration in regulation of serotonin release in rat dorsal raphe nucleus after prolonged exposure to morphine // J. Pharmacol. Exp. Ther. Vol. 286. No. 1. P. 481-488.
Tavani A., Robson L.E., Kosterlitz H.W. 1985. Differential postnatal development of mu-, delta-and kappa-opioid binding sites in mouse brain // Brain Res. Vol. 355. No. 2. P. 306-309.
Taylor F., Dickenson A. 1998. Nociceptin/orphanin FQ. A new opioid, a new analgesic? // Neuroreport. Vol. 9. No. 12. P. 65—70.
Tejedor-Real P., Mico J A, Maldonado R., Roques B.P., Gibert-Rahola J. 1993. Effect of mixed (RB 38A) and selective (RB 38B) inhibitors of enkephalin degrading enzymes on a model of depression in the rat // Biol. Psychiatry. Vol. 34. No. 1 —2. P. 100-107.
Tejedor-Real P., Mico J.A., Maldonado R., Roques B.P., Gibert-Rahola J. 1995. Implication of endogenous opioid system in the learned helplessness model of depression // Pharmacol. Biochem. Behav. Vol. 52. No. 1. P. 145—152.
Tejedor-Real P., Mico J A., Smadja C., Maldonado R., Roques B.P., Gilbert-Rahola J. 1998. Involvement of delta-opioid receptors in the effects induced by endogenous enkephalins on learned helplessness model // Eur. J. Pharmacol. Vol. 354. No. 1. P. 1-7.
Tenconi B., Lesma E., DiGiulio A.M., Gorio A. 1996. High opioid doses inhibit whereas low doses enhance neuritogenesis in PCI 2 cells // Brain Res. Dev. Brain Res. Vol. 94. No. 2. P. 175-181.
Teschemacher H., Koch G., Brantl V. 1997. Milk protein-derived opioid receptor ligands // Biopolymers. Vol. 43. No. 2. P. 99—117.
Teschemacher H., Umbach M., Hamel U., Praetorius K, Ahnert-Hilger G., Brantl V Lottspeich F., Henschen A. 1986. No evidence for the presence ofbeta-casomorp-
hins in human plasma after ingestion of cows’ milk or milk products //J. Dairy Res. Vol. 53. No. l.P. 135-138.
Thiels E., Alberts J.R., Cramer C.P. 1990. Weaning in rats: II. Pup behavior patterns // Dev. Psychobiol. Vol. 23. No. 6. P. 495—510.
Tilson H., McLamb R., Hong J. 1986. Behavioral effects of centrally administered dy-norphin and [D-ala2-D-leu] enkephalin (DADLE) in rats // Neuropeptides. Vol. 8. No. 3. P. 193-206.
Tiruppathi C., Miyamoto Y., Ganapathy V., Roesel RA., Whitford G.M., Leibach F.H. 1990. Hydrolysis and transport of proline-containing peptides in renal brushborder membrane vesicles from dipeptidyl peptidase IV-positive and dipeptidyl peptidase IV-negative rat strains //J. Biol. Chem. Vol. 265. No. 3. P. 1476—1483.
Tokuyama S., Ho I.K. 1996. Effects of diltiazem, a Ca2+ channel blocker, on naloxone- precipitated changes in dopamine and its metabolites in the brains of opioid-dependent rats // Psychopharmacology (Berk). Vol. 125. No. 2. P. 135— 140.
Tome D., Ben Mansour A., Hautefeuille M., Dumontier AJvL, Desjeux J.F. 1988. Neuromediated action of beta-casomorphins on ion transport in rabbit ileum // Reprod. Nutr. Dev. Vol. 28. No. 4A. P. 909-918.
Tome D., Dumontier A.M., Hautefeuille M., Desjeux J.F. 1987. Opiate activity and transepithelial passage of intact beta-casomorphins in rabbit ileum / / Am. J. Physiol. Vol. 253. No. 6. Pt 1. P. 737-744.
Torregrossa MM., Isgor C, Folk J.E., Rice K.C., Watson S.J., Woods J.H. 2004. The deltaopioid receptor agonist (+)BW373U86 regulates BDNF mRNA expression in rats // Neuropsychopharmacology. Vol. 29. No. 4. P. 649—653.
Trottier G., Srivastava L, Walker C.D. 1999. Etiology of infantile autism: a review of recent advances in genetic and neurobiological research //J. Psychiat. Neurosci. Vol. 24. No. 2. P. 103-115.
Tseng L.F., Collins K.A., Wang Q. 1995. Differential ontogenesis of thermal and mechanical antinociception induced by morphine and beta-endorphin // Eur. J. Pharmacol. Vol. 277. No. 1. P. 71-76.
Tseng L.F., Narita M., Suganuma C, Mizoguchi H., Ohsawa M., Nagase H., Kampine J.P. 2000. Differential antinociceptive effects of endomorphin-1 and endomorphin-2 in the mouse //J. Pharmacol. Exp. Ther. Vol. 292. No. 2. P. 576—583.
Turlejski K., Djavadian R.L., Kossut M. 1997. Neonatal serotonin depletion modifies development but not plasticity in rat barrel cortex // Neuroreport. Vol. 8. No. 8. P. 1823-1828.
Tyler W.J., Pozzo-Miller L.D. 2001. BDNF enhances quantal neurotransmitter release and increases the number of docked vesicles at the active zones of hippocampal excitatory synapses //J. Neurosci. Vol. 21. No. 12. P. 4249—4258.
Lleda H., Yamaguchi T, Tokuyama S., Inoue M., Nishi M., Takeshima H. 1997. Partial loss of tolerance liability to morphine analgesia in mice lacking the nociceptin receptor gene // Neurosci Lett. Vol. 237. No. 2—3. P. 136—138.
Llhl G.R., Goodman R.R., Kuhar M.J., Childers S.R., Snyder S.H. 1979. Immunohistochemical mapping of enkephalin containing cell bodies, fibers and nerve terminals in the brain stem of the rat // Brain Res. Vol. 166. No. 1. P. 75—94.
Ukai M., Kameyama T. 198 5. Multi-dimensional analyses of behavior in mice treated with U-50.488H, a purported kappa (non-mu) opioid agonist // Brain Res. Vol. 337. No. 2. P. 352-356.
Ukai M, Takada A, Sasaki Y, Kameyama T. 1997. Stimulation of deltal- and delta2-opioid receptors produces amnesia in mice // Eur. J. Pharmacol. Vol. 338. No. 1. P. 1-6.
Ukai M., Toyoshi T., Kameyama T. 1993. Receptor-selective opioid peptides fail to affect behavioral responses induced by a low dose of apomorphine in the mouse / / Pharmacol. Biochem. Behav. Vol. 46. No. 3. P. 587—591.
Ukponmwan O.E., Murugaiah K.D. 1990. Functional reactivity of different central opioid receptor systems following clomipramine treatments // Pharmacol. Res. Vol. 22. No. 6. P. 691-699.
Umbach M., Teschemacher H., Praetorius K., Hirschhauser R., Bostedt H. 1985. Demonstration of a beta-casomorphin immunoreactive material in the plasma of newborn calves after milk intake // Regul. Pept. Vol. 7 P. 223—230.
Vachon L, Costa T., Herz A. 1987. GTPase and adenylate cyclase desensitize at different rates in NG108-15 cells // Mol. Pharmacol. Vol. 31. No. 2. P. 159—168.
Van Bockstaele E.J., Chan J. 1997. Electron microscopic evidence for coexistence of leu-cine5-enkephalin and gamma-aminobutyric acid in a subpopulation of axon terminals in the rat locus coeruleus region // Brain Res. Vol. 746. No. 1 —2. P. 171—182.
Van de Perre P. 2003. Transfer of antibody via motherr’s milk / / Vaccine. Vol. 21. No. 24. P. 3374-3376.
Van Ree J M., de Wied D. 1985.Behavioral effects of non-opioid fragments of beta-endorphin // Prog. Clin. Biol. Res. Vol. 192. P. 277—284.
Van Vliet B.J., Ruuls S.R., Drukarch B., Mulder A.H., Schoffelmeer A.N. 1991. Betaadrenoceptor-sensitive adenylate cyclase is inhibited by activation of mu-opioid receptors in rat striatal neurons // Eur. J. Pharmacol. Vol. 195. No. 2. P. 295—300.
Vathy I., Rimanoczy A., Eaton R.C., Katay L. 1995. Sex dimorphic alterations in postnatal brain catecholamines after gestational morphine // Brain Res. Bull. Vol. 36. No. 2. P. 185-193.
Vaughan C.W., Ingram S.L, Connor M., Christie MJ. 1997. How opioids inhibit GABA-mediated neurotransmission // Nature. Vol. 390. P. 611—614.
Vernotica EM., Rosenblatt J.S., Morrell J.I. 1999. Microinfusion of cocaine into the medial preoptic area or nucleus accumbens transiently impairs maternal behavior in the rat // Behav. Neurosci. Vol. 113. No. 2. P. 377—390.
Versteeg D.H., Csikys T, Spierenburg H. 1991. Stimulus-evoked release of tritiated monoamines from rat periaqueductal gray slices in vitro and its receptor-mediated modulation // Naunyn Schmiedebergs Arch. Pharmacol. Vol. 343. No. 6. P. 595-602.
Vezina Р., Kalivas P.W., Stewart J. 1987. Sensitization occurs to the locomotor effects of morphine and the specific mu opioid receptor agonist, DAGO, administered repeatedly to the ventral tegmental area but not to the nucleus accumbens // Brain Res. Vol. 417. No. 1. P. 51-58.
Vivian J A., Miczek KA. 1999. Interactions between social stress and morphine in the periaqueductal gray: effects on affective vocal and reflexive pain responses in rats // Psychopharmacology (Berk). Vol. 146. No. 2. P. 153—161.
Vito C.C., Fox T.O. 1981. Androgen and estrogen receptors in embryonic and neonatal rat brain // Brain Res. Vol. 254. No. 1. P. 97—110.
Volterra A., Brunello N., Restani P., Galli C.L., Racagni G. 1986a. Ontogenetic studies on mu, delta and kappa opioid receptors in rat brain // Pharmacol. Res. Com-mun. Vol. 18. No. 10. P. 979—990.
Volterra A., Restani P., Brunello N., Galli C.L., Racagni G. 1986b. Interaction of beta-casomorphins with multiple opioid receptors: in vitro and in vivo studies in the newborn rat brain // Brain Res. Vol. 395. No. 1. P. 25—30.
Vuckovic S., Ivanovic M., Prostran M., Todorovic Z., Ristovic Z., Micovic I., Beleslin D. 1998. Higher environmental temperature potentiates cataleptic effect of fentanyl in rats // Jpn. J. Pharmacol. Vol. 78. No. 4. P. 523—527.
Wadley G., Martin A. 1993. The origins of agriculture: a biological perspective and a new hypothesis // Australian Biologist. Vol. 6. No. 96. P. 105.
Waldmeier P.C., Wicki P., Frustl W., Bittiger H., Feldtrauer J.J., Baumann P.A. 1995. Effects of the putative P-type calcium channel blocker, R,R-(-)-daurisoline on neurotransmitter release // Naunyn Schmiedebergs Arch. Pharmacol. Vol. 352. No. 6. P. 670-678.
Walker C., Deschamps S., Proulx K, Tu M., Salzman C., Woodside B., Lupien S., Gallo-Payet N., Richard D. 2004. Mother to infant or infant to mother? Reciprocal regulation of responsiveness to stress in rodents and the implications for humans // Rev. Psychiatr. Neurosci. Vol. 29. No. 5. P. 364—382.
Wall P.M., Flinn J., Messier C. 2001. Infralimbic muscarinic Ml receptors modulate anxiety-like behaviour and spontaneous working memory in mice // Psychopharmacology (Berk). Vol. 155. No. 1. P. 58—68.
Wall PM., Messier C. 2000. U-69,593 microinjection in the infralimbic cortex reduces anxiety and enhances spontaneous alternation memory in mice // Brain Res. Vol. 856. No. 1-2. P. 259-280.
Walsh C.J., Fleming A.S., Lee A., Magnusson J.E. 1996. The effects of olfactory and somatosensory desensitization on Fos-like immunoreactivity in the brains of pup-exposed postpartum rats // Behav. Neurosci. Vol. 110. No. 1. P. 134—153.
Wang H.L, Hsu C.Y., Huang P.C., Kuo Y.L, Li A.H., Yeh Т.Н., Tso AS., Chen Y.L. 2005. Heterodimerization of opioid receptor-like 1 and mu-opioid receptors impairs the potency of micro receptor agonist //J. Neurochem. Vol. 92. No. 6. P. 1285— 1294.
Wegerer V, Moll GH., Bagli M., Rothenberger A., Ruther E., Huether G. 1999. Persi
stently increased density of serotonin transporters in the frontal cortex of rats treated with fluoxetine during early juvenile life //J. Child. Adolesc. Psychop-harmacol. Vol. 9. No. 1. P. 13—24.
Werthwein S., Bauer LI., Nakazi M., Kathmann M., Schlicker E. 1999. Further characterization of the ORL1 receptor-mediated inhibition of noradrenaline release in the mouse brain in vitro // Br. J. Pharm. Vol. 127. No. 1. P. 300—308.
Wiedemann K., Jahn H., Kellner M. 2000. Effects of natriuretic peptides upon hypo-thalamo-pituitary-adrenocortical system activity and anxiety behaviour // Exp. Clin. Endocrinol. Diabetes. Vol. 108. No. 1. P. 5—13.
Wilmouth R.C., Clifton I.J., Robinson C.V., Roach P.L., Aplin R.T., Westwood N.J., Hajdu J., Schofield C.J. 1997. Structure of a specific acyl-enzyme complex formed between beta-casomorphin-7 and porcine pancreatic elastase // Nat. Struct. Biol. Vol. 4. No. 6. P. 456-462.
Wilson C, Kaspar A. 1994. Changes in immobility responses in rat pups with maternal stimuli //J. Gen. Psychol. Vol. 121. No. 2. P. 111—120.
Winslow J.T., Insel T.R. 1991. Endogenous opioids: do they modulate the rat pup’s response to social isolation? // Behav. Neurosci. Vol. 105. No. 2. P. 253—263.
White C.L., Bray G.A., York DA. 2000. Intragastric beta-casomorphin(l —7) attenuates the suppression of fat intake by enterostatin // Peptides. Vol. 21. No. 9. P. 1377-1381.
Wohltmann M., Roth B.L., Coscia C.J. 1982. Differential postnatal development of mu and delta opiate receptors // Brain Res. Vol. 255. No. 4. P. 679—684.
Wolf R., Koch T., Schulz S., Klutzny M., Schryder H., Raulf E., Bbhling F., Hyllt V. 1999. Replacement of threonine 394 by alanine facilitates internalization and resensitization of the rat mu opioid receptor // Mol. Pharmacol. Vol. 55. No. 2. P. 263-268.
Wolgin D.L. 1985. Forelimb placing and hopping reflexes in haloperidol- and morp-hine-treated cataleptic rats // Behav. Neurosci. Vol. 99. No. 3. P. 423—435.
Wolozin B.L., Pasternak G.W. 1981. Classification of multiple morphine and enkephalin binding sites in the central nervous system // Proc. Natl. Acad. Sci. USA. Vol. 78. No. 10. P. 6181-6185.
Wright P.A., Wilmouth R.C., Clifton I.J., Schofield C.J. 2001. Kinetic and crystallographic analysis of complexes formed between elastase and peptides from beta-ca-sein // Eur. J. Biochem. Vol. 268. No. 10. P. 2969—2974.
Yang Y.R., Chiu Т.Н., Chen C.L. 1999. Structure-activity relationships of naturally occurring and synthetic opioid tetrapeptides acting on locus coeruleus neurons // Eur. J. Pharmacol. Vol. 372. No. 3. P. 229—236.
Yang S., Sonoda S., Chen L., Yoshikawa M. 2003. Structure-activity relationship of rubiscolins as delta opioid peptides // Peptides. Vol. 24. No. 4. P. 503—508.
Yang S., Yunden J., Sonoda S., Doyama N., Lipkowski A.W., Kawamura Y., Yoshikawa M. 2001. Rubiscolin, a delta selective opioid peptide derived from plant Rubisco // FEBS Lett. Vol. 509. No. 2. P. 213-217.
Yamada К., Nabeshima Т. 1995. Stress-induced behavioral responses and multiple opioid systems in the brain // Behav. Brain Res. Vol. 67. No. 2. P. 133—145.
Yatskin O.N., Philippova M.M., Blishchenko E.Yu., Karelin A.A., Ivanov V.T. 1998. LW- and W-hemorphins: comparative levels in rat tissues // FEBS Lett. Vol. 428. No. 3. P 286-90.
Yilmaz B., Gilmore D.P. 1999. Effects of mu, kappa, and delta opioid receptor agonists and antagonists on rat hypothalamic noradrenergic neurotransmission // Brain Res. Bull. Vol. 48. No. 5. P. 491—495.
Yoshikawa M., Yoshimura T., Chiba H. 1984. Opioid peptides from human p -casein // Agric. Biol. Chem. Vol. 48. P. 3185-3187.
Zachariou V., Georgescu D., Sanchez N., Rahman Z., DiLeone R., Berton O., Neve R.L, Sim-Selley L.J., Selley D.E., Gold S.J., Nestler E.J. 2003. Essential role for RGS9 in opiate action // Proc. Natl. Acad. Sci. LISA. Vol. 100. No. 23. P. 13656—13661.
Zadina J.E., Hackler L., Ge L.J., Kastin AJ. 1997. A potent and selective endogenous agonist for the mu-opiate receptor // Nature. Vol. 386. No. 6624. P. 499—502.
Zadina J.E., Kastin A.J., Ge L.J., BrantI V. 1990. Hemorphins, cytochrophins, and human beta-casomorphins bind to antiopiate (Tyr-MIF-1) as well as opiate binding sites in rat brain // Life Sci. Vol. 47. No. 8. P. PL25—PL30.
Zadina J.E., Martin-Schild S., Gerall AA., Kastin AJ., Hackler L., Ge L.J., Zhang X. 1999. Endomorphins: novel endogenous mu-opiate receptor agonists in regions of high mu-opiate receptor density // Ann. N. Y. Acad. Sci. Vol. 897. P. 136—144.
Zagon I.S. 1988. Endogenous opioid systems and neural cancer: transmission and scanning electron microscopic studies of murine neuroblastoma in tissue culture // Brain Res. Bull. Vol. 21. No. 5. P. 777—784.
Zagon I.S., Verderame M.F., Allen S.S., McLaughlin PJ. 2000. Cloning, sequencing, chromosomal location, and function of cDNAs encoding an opioid growth factor receptor (OGFr) in humans // Brain Res. Vol. 856. No. 1—2. P. 75—83.
Zhang H., Torregrossa MM, Jutkiewicz EM., Yong-Gong Shi, Kenner C. 2006. Endogenous opioids upregulate brain-derived neurotrophic factor mRNA through 8 - and p-opioid receptors independent of antidepressant-like effects // Eur. J. Neurosci. Vol. 23. No. 4. P. 984-994.
Zhao Q., Garreau L, Sannier F., Piot JM. 1997. Opioid peptides derived from hemoglobin: hemorphins // Biopolymers. Vol. 43. No. 2. P. 75—98.
Zhao Q., Piot JM. 1997. Investigation of inhibition angiotensin-converting enzyme (ACE) activity and opioid activity of two hemorphins, LW-hemorphin-5 and W-hemorphin-5, isolated from a defined peptic hydrolysate of bovine hemoglobin / / Neuropeptides. Vol. 31. No. 2. P. 147—153.
Zhu Y., King MA., Schuller A.G., Nitsche J.F., Reidl M., Eide R.P., Unterwald E., Pasternak G.W., Pintar J.E. 1999. Retention of supraspinal delta-like analgesia and loss of morphine tolerance in delta opioid receptor knockout mice // Neuron. Vol. 24. No. l.P. 243-252.
Zioudrou C., Streaty RA., Klee WA. 1979. Opioid peptides derived from food pro-
teins.The exorphins //J. Biol. Chem. Vol. 254. No. 7. P. 2446—2449.
Zukin R.S., Eghbali M, Olive D., Unterwald EM, Tempel A. 1988. Characterization and visualization of rat and guinea pig brain kappa opioid receptors: evidence for kappa 1 and kappa 2 opioid receptors // Proc. Natl. Acad. USA. Vol. 85. No. 11. P. 4061-4065.