Author: Рич В.
Tags: неорганическая химия химические элементы издательство химия открытие химические элементов история химиии
Year: 1985
Text
1
I
В.Рт
В поисках
элементов
В.Рич
В поисках
элементов
МОСКВА
«ХИМИЯ»
1985
54(09)
Р 56
УДК 546 (023.11)
Рич В.
В поисках элементов.— М.: Химия, 1985, 168 с,
ил.
Эта книга — естественное продолжение и завершение книги того
же автора «Охота за элементами» (1982 г.), в которой рассказывается
о том, как были открыты первые 63 элемента.
В новой книге рассказывается о новом этапе истории поиска хи-
мических элементов, начавшемся с открытия Д. И. Менделеевым Перио-
дического закона, о том, как зачастую бессистемная «охота за элемен-
тами» превратилась в целенаправленный научный поиск. Книга знакомит
читателя с конкретными обстоятельствами открытия каждого элемента,
с авторами этих открытий и методами, с помощью которых были обнару-
жены в природе и искусственно созданы все известные на сегодня хи-
мические элементы, а также с некоторыми закономерностями процесса
открытия химических элементов.
Адресована широкому кругу читателей, интересующихся химией и
историей химии, и в первую очередь школьникам старших классов.
168 с, 8 рис.
Рецензенты: докт. хим. наук, проф. \А. С. ПОГОДИН]
канд. техн. наук. В. И. КУЗНЕЦОВ
1801000000-002 85
050(01)-85
© Издательство «Химия», 1985 г.
Содержание
Атом обзаводится весом 5
Элементы обзаводятся системой 17
Экаалюминий превращается в галлий 33
Экабор превращается в скандий 38
Раздвоение дидима (гольмий, тулий, гадолиний, пра-
зеодим, неодим) 41
Экасилиций превращается в германий 45
По образцу учителя нашего (аргон, гелий) 49
Скрытный, новый, странный (криптон, неон, ксенон) 59
Лучеиспускатели (полоний) 61
Грамм — добыча, год — труды (радий) 66
Четвертый из смолки (актиний) 67
Последний газ (радон) 69
Самый легкий лантаноид (лютеций) 71
Самый тяжелый лантаноид (европий) 73
Система обзаводится фундаментом 76
Актиний обретает родителя (протактиний) 81
Вооруженные теорией Бора (гафний) 85
Поимка двимарганца (рений) 88
Первый искусственный (технеций) 92
Поимка экацезия (франций)
Второй искусственный (астат) 101
Раздвигая границы (нептуний) 104
Новое ядерное горючее (плутоний) 111
Семейство актиноидов 113
Кони и всадники (кюрий, америций) 115
Девять миллиардных (прометий) 117
Скромный триумф (берклий) 121
Уроженец сверхновой (калифорний) 124
В термоядерной колыбели (эйнштейний, фермий) 126
Расчетам вопреки (менделевий) 129
Снаряды становятся тяжелыми (элемент № 102) 133
Граница актиноидного царства (курчатовий, эле-
мент № 103) 138
Синтез экатантала (элемент № 105) 141
Магическая мишень (элемент № 106) 143
Синтез тримарганца (элемент № 107) 147
Область стабильности 147
Последние наблюдения 150
Таинственные острова 152
Приглашение к анализу: правила открытий 158
Если не считать короткого периода в начале
XIX века, когда Гемфри Дэви, Гей-Люссак и дру-
гие химики открыли несколько простых веществ, су-
ществование которых было предсказано Антуаном
Лораном Лавуазье в «Элементарном курсе химии»
(1789 г.), то все остальное время — и раньше, и
позже — элементы обнаруживали случайно. В том,
конечно, смысле, что исследователи находили новый
элемент более или менее неожиданно для себя и для
других химиков и не имели никакого представления
о том, сколько еще существует элементов и какими
свойствами они обладают
Так продолжалось до 1869 года, когда великий
русский химик Дмитрий Иванович Менделеев открыл
периодический закон. Опираясь на него, можно уже
было представить себе естественную систему хи-
мических элементов, теоретически обосновать на-
личие в природе еще не обнаруженных ее сочленов,
наметить четкую программу поисков.
(Н)
и
N3
к
Си
НЬ
Ад
С$
Аи
Ве
Мд
Са
2п
5г
СИ
Ва
Нд
В
А1
У
1п
й
Т1
♦♦
С
$1
и
2г
Зп
РЬ
N
Р
V
А$
№
$Ь
Та
В1
0
$
Сг
5е
Мо
Те
Ж
Н
Р
С!
Мп
Вг
1
Ре
Со
N1
Ви
НИ
РЙ
0$
1г
Р1
*Ё*
ть[
$|ТИ|
И
Ег]
Химические элементы, обнаруженные до открытия перио
дического закона
АТОМ ОБЗАВОДИТСЯ
ВЕСОМ
Открытие периодического закона увенчало собою за-
мечательные достижения химии конца XVIII и первой
половины XIX века, благодаря которым из науки
во многом чисто качественной она превратилась в
науку количественную, оперирующую математическими
расчетами.
Если физика, особенно механика, стала такой наукой
еще в древности (достаточно вспомнить законы Архи-
меда), то первый количественный закон мира хими-
ческих превращений — закон эквивалентов — был от-
крыт лишь в самом конце XVIII столетия. Открыли
его не лабораторные затворники, не любители-натура-
листы, не университетские профессора, а люди, за-
нимавшиеся химическим производством.
В лабораториях имели дело, как правило, с гранами
и унциями химических веществ, а в мастерских и на
фабриках оперировали сотнями и тысячами фунтов и
пудов. И то, с чем можно было не считаться в лабора-
тории (например, затраты тех или иных исходных
веществ для изготовления того или иного продукта),
для фабриканта могло стать причиной краха. Поэтому,
естественно, количественная сторона химических ре-
акций была предметом пристального внимания всех
химиков-практиков.
Наблюдения накапливались постепенно и поначалу
касались отдельных веществ, отдельных реакций. Но
в конце концов они привели к обобщениям, охватываю-
щим многие химические явления.
Первым химиком, который сформулировал первое
химическое количественное обобщение, был Карл Фрид-
рих Венцель. Он жил во второй половине XVIII века
в Саксонии, славившейся многими химическими про-
изводствами, и считал само собой разумеющимся, что
кислоты и щелочи соединяются не в произвольных,
а в постоянных, одних и тех же, соотношениях. Он
написал об этом в своем труде «Учение о сродстве
тел», утверждая, что одним и тем же количеством од-
ной и той же кислоты можно нейтрализовать одно и то
же количество разных щелочей, и наоборот, одним и тем
же количеством одной и той же щелочи можно нейтра-
лизовать одно и то же количество разных кислот.
Это наблюдение Венцеля подтвердил другой не-
мецкий химик — технолог Шарлоттенбургской фарфо-
ровой фабрики в Силезии Иеремия Вениамин Рихтер.
Рихтер знал, что при образовании солей кислоты
и основания соединяются в определенных количествах,
независимо от своей природы. И сформулировал закон:
если одно и то же количество какой-либо кислоты
нейтрализуется различными количествами двух или
большего числа оснований, то количества последних
эквивалентны и нейтрализуются одним и тем же коли-
чеством другой кислоты. Рихтер написал об этом в
книге «Начала стехиометрии, или способ измерения
химических элементов», вышедшей в 1793 году.
6
Таким образом было выяснено, ч^о разные вещества,
обладающие, конечно, разной массой, могут было экви-
валентными, равновеликими по своему химическому
действию.
Сначала это правило было найдено для наиболее
контрастных веществ — оснований и кислот. Но бук-
вально через несколько лет оказалось, что подобная
закономерность наблюдается и для других химических
веществ.
К тому времени был открыт и второй важнейший
количественный закон мира химических веществ. В 1779
году французский химик Жозеф Луи Пруст установил,
что в природном карбонате меди, где бы он ни был
найден, и в искусственном карбонате меди, каким бы
способом и из каких бы веществ он ни был получен,
весовое соотношение между составляющими его эле-
ментами — углеродом, кислородом и медью — всегда
одно и то же. И что так же постоянны отношения
между количеством одного и того же химического
элемента в закиси железа и в окиси железа, в закиси
сурьмы и окиси сурьмы, в закиси олова и окиси олова.
И еще одно интересное наблюдение сделал Пруст:
количество кислорода в окислах разной степени окисле-
ния никогда не изменяется постепенно, но всегда
скачком.
Все эти факты свидетельствовали о некоем скрытом
от поверхностного взгляда, сокровенном свойстве хи-
мических элементов, об их природной подразделен-
ности на какие-то порции. Однако далеко не сразу хими-
ки догадались, что у них в руках прямые улики,
подтверждающие давние представления о подразделен-
ное™ вещества на неделимые частицы — атомы.
Первым это понял гениальный английский естество-
испытатель Джон Дальтон.
Он был сыном рабочего-ткача. Уже в двенадцати-
летнем возрасте он знал столько, что мог заменить
учителя в деревенской школе. С пятнадцати лет стал
профессиональным учителем в маленьком городке
Кендаль. Там он учительствовал двенадцать лет, а за-
тем переехал в Манчестер, где преподавал математику
и начал серьезную научную работу.
В наблюдениях, обобщенных Прустом, Венцелем,
Рихтером, Дальтон сумел разглядеть явные результаты
невидимой работы мельчайших частиц вещества. Он
7
понял, что закон постоянства состава и закон эквива-
лентов подтверждают атомную гипотезу, впервые про-
возглашенную еще мыслителями Древней Греции и
Древней Индии. Зыбкая гипотеза превращалась в
строгую теорию: каждое простое химическое веще-
ство состоит из одинаковых атомов; разные атомы,
соединяясь между собой, образуют сложные хими-
ческие вещества. Свойства макромира объясняются
свойствами микромира. Подразделенность химических
веществ на атомы при постоянстве состава каждого
вещества должна проявляться в кратности отношений
между массами химических элементов при переходе
от одного сложного вещества к другому — таков был
вывод, сделанный Дальтоном из только что возник-
шей теории.
И он, не теряя времени, приступил к опытам, которые
должны были подтвердить этот вывод. В 1803 году
Дальтон исследовал маслородный газ (так тогда назы-
вали этилен) и углеродистый водород (так называли
метан) и убедился в том, что оба они состоят из угле-
рода и водорода, причем первый содержит ровно вдвое
меньше водорода, чем второй. Такую же кратность отно-
шений между массами элементов он обнаружил и в дру-
гих соединениях. Например, в углекислом газе оказа-
лось ровно в два раза больше кислорода, чем в угарном.
Так был открыт закон кратных отношений. Первый
случай в химии, когда некое свойство природы вещей
было найдено в специально для этой цели поставленном
эксперименте, исходя из чисто теоретических со-
ображений.
Соединив учение об элементах с учением об атомах,
Дальтон подвел под здание химии прочный фундамент.
Присущую атомам каждого химического элемента
о инаковую массу Дальтон назвал атомным весом.
Поскольку для определения абсолютной массы атома
не было тогда никаких возможностей и как взвесить
атом, никто не знал, под атомным весом он понимал
не абсолютную массу атома, а относительную: Дальтон
определял атомные веса по отношению к самому легко-
му атому — водорода. Кстати, и теперь, когда атомы
научились взвешивать, абсолютной массой атомов
химики не пользуются — она неудобна для расчета
взаимодействий между элементами и их соедине-
ниями.
8
В том же 1803 году Джон Дальтон опубликовал
первую таблицу атомных весов. У него не было еще
экспериментальных оснований для суждения о том,
сколько именно атомов содержится в наименьшей части-
це сложного вещества. И он принял самое простое до-
пущение: если два элемента могут образовать только
одно соединение, то его частица содержит по одному
атому каждого из них. Если же соединений может быть
два, то во втором соединении атомов одного элемента
будет два, а другого — один. Дальтон считал, например,
что вода состоит из одного атома водорода и одного
атома кислорода, аммиак—из одного атома азота и
одного атома водорода, этилен — из одного атома во-
дорода и одного атома углерода. Поэтому все атомные
веса были им вычислены неправильно, кроме, разве
что, атомного веса водорода, поскольку водород был
принят за единицу.
Чтобы определить отношение веса атома кислорода
к весу атома водорода, Дальтон исходил из состава
воды, считая, как мы уже знаем, воду двухатомной
(один атом водорода и один атом кислорода). Так как,
согласно анализам Лавуазье, вода состояла по весу
из 85 % кислорода и 15 % водорода, Дальтон разделил
85 на 15 и получил 5,5. Это число и значится в его
таблице как атомный вес кислорода.
Атомный вес серы он определил по серной кислоте,
считая, что в ней содержится опять-таки по одному ато-
му каждого из элементов. Получилось 14,4.
Чтобы правильно определять атомные веса, надо
было найти способ определения числа атомов
в молекулах.
Далее события развивались следующим образом.
В 1805 году французский исследователь Гей-Люссак
обнаружил, что два объема водорода, соединяясь
с одним объемом кислорода, дают ровно два объема
водяного пара. Не три, а два! И главное, опять возникли
точные порции! Точная кратность объемов заинтере-
совала Гей-Люссака. Он обратился к литературе.
Так и есть — и другие реагирующие газы соединялись
в простых объемных отношениях.
Оставался один шаг до правильного понимания
этих фактов. Но Гей-Люссак этого шага не сделал.
Он был принципиальным противником непроверенных
предположений — в том числе и атомной гипотезы,
9
и поэтому не связал открытый им закон кратных
объемных отношений реагирующих газов с атомной
гипотезой.
Впрочем, установить такую связь не мог и Дальтон.
В опытах француза два объема водорода плюс один
объем кислорода давали два объема водяного пара,
а Дальтон был убежден, что пара должен получаться
один объем. Он рассуждал примерно так. Все газовые
законы — зависимость объема газа от температуры
и другие — справедливы для всех газов. Следовательно,
частицы всех газов находятся на равном расстоянии
друг от друга. Следовательно, в равных объемах нахо-
дится равное число частиц. А так как под частицами
газов Дальтон понимал атомы, то двум объемам воды
просто неоткуда было взяться при одном объеме
кислорода.
Не сумев увязать результаты опытов Гей-Люссака
с другими известными ему фактами, Дальтон поступил
решительно и просто: он отверг эти опыты. Этот случай
можно считать классическим. Как правило, ученые
предпочитают до поры считать несуществующими фак-
ты, которые не удается связать с другими фактами,
установленными прочно. Как тонко подметили авторы
«Козьмы Пруткова», иные вещи нам непонятны не по-
тому, что наши понятия слабы, а потому, что сии вещи
не входят в круг наших понятий.
То, чего не сумел сделать Дальтон и не захотел
сделать Гей-Люссак, сделал генуэзский профессор фи-
зики Амедео Авогадро в 1811 — 1814 годах. Он понял,
что обнаруженные Гей-Люссаком простые объемные
отношения между соединяющимися газами отнюдь
не противоречат суждению Дальтона о равном числе
частиц, содержащихся в равных объемах газов при оди-
наковых температуре и давлении. Только частицы эти —
не атомы, но состоящие из атомов молекулы. Отношения
объемов при соединении газов — это отношения между
числом простых (т.е. состоящих из атомов одного эле-
мента) молекул, соединяющихся между собой при обра-
зовании сложной (состоящей из атомов двух или более
элементов) молекулы.
Тогда все становится на свои места. Все факты полу-
чают простое объяснение. Все противоречия устра-
няются.
10
Чтобы определить соотношение атомов водорода
и кислорода в молекуле воды, надо исходить из соотно-
шения объемов газов при ее образовании. И если два
объема водорода и один объем кислорода дают воду,
значит молекула воды состоит из двух атомов водорода
и одного атома кислорода.
Почему же тогда получается два объема водяного
пара, а не один? Да потому, объяснял профессор Аво-
гадро своим студентам, что водород в нашей колбе
находится не в виде одиночных атомов, а в виде двух-
атомных частиц, двухатомных молекул. И кислород —
в виде таких же двухатомных молекул. И два объема
двухатомных молекул водорода плюс один объем двух-
атомных молекул кислорода, естественно, дают два
объема молекул водяного пара, состоящих каждая
из двух атомов водорода и одного атома кислорода.
Все сходится!
Теперь появилось твердое основание для определе-
ния состава молекул газообразных тел. И так как в пар
можно превратить многие простые вещества, то, в прин-
ципе, можно было бы определить атомный вес многих
элементов.
Этому, к сожалению, помешало одно непредвиден-
ное обстоятельство. Некоторые простые вещества в виде
пара не образуют двухатомных молекул: в молекуле
фосфора, например, четыре атома, а у ртути один
атом. Подобные исключения на некоторое время
дискредитировали идеи Авогадро.
Первым авторитетным ученым, признавшим откры-
тый малоизвестным провинциальным учителем закон
кратных отношений, был знаменитый Уильям Вол-
ластон, первооткрыватель палладия и родия. Он не
только подтвердил открытие Джона Дальтона, но и
объявил себя решительным сторонником его атомной
теории.
Волластон как раз работал с карбонатами щелочных
металлов и тоже обнаружил кратные отношения он
собирался продолжить исследования, чтобы выяснить
причины удивительного явления. Но в это время по-
явилось подробное описание теории Дальтона в книге
«Система химии» шотландского химика Томаса Томсо-
на. И Волластон объявил: «Намеченные исследования
становятся излишними, так как наблюдавшиеся мною
и
факты являются лишь частными примерами более
общих наблюдений Дальтона».
Эксперименты и суждения известного во всем ученом
мире Волластона послужили Дальтону существенной
поддержкой и обратили на его работы внимание
многих ученых, и прежде всего Йенса Якоба Берцелиу-
са, тогда еще молодого, только начинавшего свой
бли-стательный путь в науке.
Тщательно, на огромном экспериментальном мате-
риале проверив закон кратных отношений, Берцелиус
пришел к выводу, что этот закон действителен
и для солей. В опубликованной в 1818 году статье
«Исследования по теории химических пропорций и хи-
мического действия электричества» он указал, что в мо-
лекулах многих солей существуют простые и постоянные
отношения между атомами кислорода основания и
атомами кислорода кислоты.
Подобные отношения были замечены и между метал-
лами при вытеснении ими водорода из кислот* в любой
кислоте на место одной весовой части водорода стано-
вятся 23 весовые части натрия, 39 весовых частей
калия, 12 частей магния, 20 — кальция, 23 — железа,
33 — цинка. И так далее, и так далее.
Все это позволяло привлечь для определения атом-
ных весов элементов окислы, кислоты, соли — т. е.
гораздо более широкий круг веществ, чем тот, которым
оперировал Джон Дальтон.
В это же примерно время был открыт еще один
количественный закон, который можно было использо-
вать для определения атомного веса некоторых элемен-
тов. Его открыл ученик Берцелиуса Эйльгарт Митчер-
лих- Изучая фосфаты и арсенаты разных металлов, он
нашел, что одинаковое число атомов, соединенных
одним и тем же способом, дает одну и ту же кристал-
лическую форму.
Берцелиус занялся определением атомных весов хи-
мических элементов и в 1818 году опубликовал свою
первую таблицу атомных весов. Он определял атомные
веса по отношению к атомному весу кислорода, а не во-
дорода, как это делал Дальтон. За единицу отсчета
Берцелиус принял атомный вес кислорода, произвольно
обозначив его числом 100. Так было гораздо удобнее —
ведь круг веществ, в состав которых входит кислород,
исключительно широк, и атомный вес элемента можно
12
было перепроверить по нескольким соединениям. Это
позволило Берцелиусу получить гораздо более надеж-
ные данные, чем те, что имелись в таблице Дальтона.
Работу по определению и уточнению атомных весов
известных в то время элементов Берцелиус не пре-
кращал до самой своей смерти, публикуя все более
полные, все более точные таблицы.
В таблице 1826 года были приведены атомные веса
уже 53 химических элементов. И 41 из них Берцелиус
определил более или менее верно. Неверными были
атомные веса бора, калия, натрия, лития, бериллия,
тория, циркония, кремния, ванадия, урана, висмута,
серебра.
Причины ошибок были разными. Берцелиус опре-
делял атомные веса, принимая во внимание различные
аналогии в поведении тех или иных химических веществ
И это нередко приводило его к неверным выводам
Так, например, из-за некоторого химического сходства
щелочных металлов с магнием он приписал оксидам
(тогда говорили — окислам) калия, натрия и лития
формулы КО, ЫаО и УО вместо правильных, с двумя
атомами металлов. Такую же формулу он приписал
и оксиду серебра — из-за сходства этого металла с
ртутью, «жидким серебром». И рассчитанный по этим
ошибочным формулам атомный вес металлов оказался,
естественно, вдвое больше истинного.
Из-за аналогичных ошибок были вдвое завышены
также проставленные в таблице Берцелиуса атомные
веса бора, кремния, ванадия, урана, атомный вес
бериллия завышен в шесть раз, а тория вдвое занижен.
Многие из этих ошибок можно было бы устранить,
использовав закономерность, найденную в 1819 году
профессорами парижской Политехнической школы
Пьером Луи Делонгом и Алексисом Терезом Пти.
Они сделали свое открытие благодаря Берцелиусу.
Как только появилась первая его таблица атомных ве-
сов, в которой было уже немало верных чисел, Дюлонг
и Пти заметили удивительное соответствие между не-
которыми опубликованными в таблице числами атомных
весов и удельными теплоемкостями тех же элементов.
Произведение удельной теплоемкости (число калорий,
необходимое для нагрева грамма вещества на градус
Цельсия) на атомный вес элемента было почти одина-
ковым для многих элементов и приблизительно равня-
13
лось одному и тому же числу — 6,25. Объяснение тут
могло существовать только одно: атомы разных элемен-
тов обладают одинаковой теплоемкостью.
Теперь достаточно было измерить удельную тепло-
емкость любого простого вещества и разделить
на нее постоянную величину 6,25 (атомную тепло-
емкость), чтобы, не прибегая к другим опытам,
узнать атомный вес элемента. Дюлонг и Пти проверили
свой способ на двенадцати разных металлах и получили
значения атомных весов, совпадающие с табличными.
Как уже было сказано, Дюлонг и Пти открыли
свой закон в 1819 году. И все же далекие от истин-
ных атомные веса многих элементов остались не только
в таблице Берцелиуса, опубликованной в 1826 году;
ошибочные значения атомных весов публиковались и
через десять лет, и даже через тридцать. Тому
было несколько причин, одни должны быть признаны
объективными, другие же, несомненно, относились
к разряду субъективных.
Собственно, объективная причина была только одна.
Многие редкие и рассеянные элементы, особенно из
числа вновь открываемых, удавалось выделить в чистом
виде лишь в таких ничтожных количествах, что не
представлялось возможным с достаточной точностью
определить ни их удельную теплоемкость, ни плотность
их паров. Так что ни закон Авогадро, ни закон Дюлон-
га — Пти тут помочь не могли. А разные косвенные
физические и химические аналогии часто приводили
к выводам, весьма далеким от истины.
Но тут рано или поздно порядок был бы наведен —
постепенно редкие элементы становились все более зна-
комыми, накапливались все в больших количествах.
Хуже было другое: в силу тех или иных обстоятельств
многие химические авторитеты не признавали ни закона
Авогадро, ни закона Дюлонга — Пти.
Более всего признанию закона Авогадро мешали...
успехи в изучении электричества, связанные с именами
Вольта, Ампера, Эрстеда и особенно Дэви и Фарадея.
Подвергая электролизу самые разные химические
вещества, химики убедились, что одни вещества всегда
выделяются на аноде, а другие на катоде. И Берце-
лиус, обобщив эти факты, выдвинул следующее
объяснение: все элементы делятся на электроположи-
тельные и электроотрицательные. Это означало, на-
14
пример, что атомы водорода заряжены положительно
(раз они притягиваются к отрицательному электроду),
а все атомы кислорода заряжены отрицательно (раз
они притягиваются к положительному электроду).
Такое объяснение общеизвестных фактов большинству
химиков казалось безупречным.
Правда, признав теорию Берцелиуса, приходилось
одновременно признать невозможным существование
молекул, состоящих из одноименных атомов: ведь
одноименно заряженные тела, как известно, не притя-
гиваются, а отталкиваются. А значит, предусмотренные
Авогадро двухатомные молекулы газов следовало счи-
тать выдумкой.
О том, как мешали пониманию закона Авогадро
сера, ртуть и некоторые другие элементы с аномальным
числом атомов в парообразном состоянии, читатель
уже знает. По такого же рода причине не получил едино-
душного признания закон, открытый французами. Дело
заключалось в том, что многие хорошо изученные
элементы правилу удельных теплоемкостей не под-
чинялись. Например, атомная теплоемкость бора в
интервале температур от нуля до 100 градусов
по Цельсию оказалась вовсе не 6,25, а 2,7. Атомная
теплоемкость кремния оказалась равной 4,8. Подобные
исключения подрывали доверие к методу определения
атомных весов по теплоемкости.
Берцелиус, например, который, кстати, первым сумел
выделить в свободном виде кремний, никогда не пользо-
вался удельными теплоемкостями ни для вычисления
атомных весов, ни даже для проверок.
В 1840 году, через два десятка лет после открытия
правила удельных теплоемкостей, ученик Дюлонга и
Пти Анри Виктор Реньо, точнейшим образом определив
удельную теплоемкость щелочных металлов, получил
в результате нехитрых вычислений атомные веса этих
элементов ровно в два раза меньшие чем в таблицах
Берцелиуса. И дал правильную формулу их оксидов.
Такая же работа была проделана и с серебром. Таким
образом ему удалось исправить атомные веса несколь-
ких широко распространенных металлов и, что не менее
важно, более правильно определить их химическое
родство с другими элементами. Однако большинство
химиков продолжали придерживаться взглядов Берце-
лиуса.
15
Возможно, что в недостаточном внимании химиков к
закону Авогадро и к правилу Дюлонга — Пти нашло
свое отражение различие между тогдашней химией (она
была еще в гораздо большей степени эмпирической
наукой, чем физика) и физикой. Физики уже при-
выкли использовать в своих исследованиях теорети-
ческие обобщения, а химики больше доверяли своим
собственным экспериментам, чем правилам и законам,
особенно тем, которые были найдены физиками, пред-
почитали обходиться без теоретических мудрствований.
Влияние алхимии продолжало сказываться. Как и во
времена Роберта Бойля, химики продолжали быть скеп-
тиками. Для того чтобы осмыслить и усвоить полностью
великие открытия Джона Дальтона и Амедео Авогадро,
им понадобилось почти полвека.
В 1858 году тридцатидвухлетний профессор химии
Генуэзского университета Станислао Канниццаро
опубликовал «Очерк курса химической философии»,
в котором, обобщив полувековой опыт химических
исследований, объединил открытие Дальтона с откры-
тием Авогадро. Убедительно, на огромном количестве
фактов Канниццаро показал, что разные массы одного
и того же элемента, содержащиеся в разных молекулах,
являются целыми кратными одной и той же массы,
которая, выступая всегда нераздельно, должна с
полным основанием соответствовать атому.
Канниццаро разъяснил ошибку Дальтона, считав-
шего, что газообразные простые вещества существуют
в виде атомов, и доказал, что на самом деле они
существуют, как правило, в виде двухатомных молекул.
Атомные веса металлов итальянский химик рекомендо-
вал определять в основном по правилу Дюлонга — Пти,
а газов и паров — по закону Авогадро.
Обширный и очень убедительный доклад Канницца-
ро на первом международном химическом конгрессе,
который собрался в 1860 году в немецком городе
Карлсруэ, произвел огромное впечатление. На конгресс
приехали виднейшие представители химической науки
из разных стран, и в большинстве своем они признали
взгляды Канниццаро правильными.
С 1860 года на пути к более или менее точному
определению атомных весов химических элементов не
осталось никаких препятствий принципиального ха-
рактера. Дело оставалось теперь только за... делом.
16
ЭЛЕМЕНТЫ ОБЗАВОДЯТСЯ
СИСТЕМОЙ
Несмотря на то, что в течение всей первой поло-
вины XIX столетия химики в большинстве своем
продолжали оставаться скептиками и предпочитали
опираться только на непреложные истины эксперимен-
тальных фактов, некоторые из них не могли пройти
мимо поразительных сопоставлений, на которые сами
собой наталкивали мыслящего естествоиспытателя
уже первые правильно определенные атомные веса.
И прежде всего трудно было не заметить некоторых
примеров связи между атомными весами химических
элементов и их физическими и химическими свойствами.
Первым обратил на это внимание лондонский врач
Уильям Праут. Он увидел, что, согласно опубликован-
ным данным, всем трем магнитным металлам присущи
одинаковые атомные веса. Теперь мы знаем, что на
самом деле у железа, кобальта и никеля атомные
веса хотя и близкие, но все же разные. Однако
все три металла, несомненно, образуют родственную
во многих отношениях
семью элементов. И под-
мечено это было сразу
же, как только началась
работа по определению
атомных весов.
Праут опубликовал
свои наблюдения в
1815—1816 годах. А в
1817 году с еще более
интересным наблюдени-
ем выступил Иоганн
Вольфганг Дёберей-
нер — тезка и друг вели-
кого немецкого поэта
Иоганна Вольфганга
Гёте. Дёберейнер сопо-
ставил атомные веса
трех щелочноземельных
металлов: кальция,
стронция, бария — и об-
Дмитрий Иванович Менделеев
(с фотографии 1869 г.); в этом
году он открыл периодический
закон
17
наружил, что атомный вес стронция (87,7) есть сред-
нее арифметическое атомных весов кальция (40,1) и
бария (137,4). Впоследствии Дёберейнер заметил,
что точно так же соотносятся атомные веса химически
близких элементов семейства, в которое входят сера,
селен, теллур; и семейства щелочных металлов (литий,
натрий, калий), и еще одного семейства — галогенов
(хлор, бром, иод).
Средний из трех элементов каждого семейства
обладал средним атомным весом, и он же имел про-
межуточные химические свойства. Природа еще раз
недвусмысленно намекнула на зависимость, существую-
щую между свойствами элементов и их атомными ве-
сами.
Но выявить ее более четко, и не для отдельных групп,
а для всех химических элементов, мешало многое.
Два объективных препятствия были определяющими.
Во-первых, атомные веса некоторых элементов были
установлены с большими ошибками. И, во-вторых,
далеко не все элементы, существующие в природе,
удалось к тому времени обнаружить.
Продолжавшиеся на протяжении двадцатых —
пятидесятых годов XIX века открытия новых элементов
значительно расширили химические горизонты исследо-
вателей. Исправление неправильно определенных атом-
ных весов, в том числе таких важнейших элементов,
как щелочные металлы, позволило продолжить
работу, начатую Праутом и Дёберейнером,— поиск
универсальных зависимостей, связывающих атомный
вес элементов с их физическими и химическими свой-
ствами.
Открытие таких универсальных зависимостей позво-
лило бы превратить аморфную совокупность химических
элементов в стройную и строгую, как кристалл, систему.
И тогда можно было бы понять, сколько есть еще
в природе неоткрытых элементов, какие у них свойства,
где и какими способами можно эти элементы
отыскать.
Поисками естественной системы элементов занялись
химики разных стран, раньше всех — англичане.
Оксфордский профессор химии Уильям Одлинг
начал с того, что попытался распространить открытый
Дёберейнером закон триад на все химические элементы.
Для этого надо было для каждого элемента подобрать
18
свою тройку. Для каждого — не удалось. Три элемента
у Одлинга остались в одиночестве: водород, бор и золо-
то. Зато из остальных он сумел образовать не только
тройки, но иногда четверки, пятерки и даже шестерки.
Первую такую табличку — из 49 элементов — он со-
ставил еще до конгресса в Карлсруэ, вторую — уже
из 57 элементов — через год после конгресса.
Внутри групп, как и у Дёберейнера, элементы
выстраивались по порядку атомных весов. Но друг
за другом эти группы Одлинг выстраивал, не
обращая на атомные веса никакого внимания, так что
общего закона построения элементов ему выявить не
удалось.
В первый раз такой закон проглянул в работах
лондонского химика Джона Ньюлендса в 1863 году,
когда многие из неверно определенных ранее атомных
весов были уже исправлены. Ньюлендс расположил все
известные ему химические элементы в порядке воз-
растания их атомного веса и заметил то, чего в таблицах
Одлинга еще не было видно: во-первых, наличие
большого числа пар элементов с одинаковой разницей
в атомных весах— 16; во-вторых, во многих случаях
через каждые восемь элементов в таблице стояли
химические родственники: фтор и хлор, натрий и калий,
магний и цинк... Так вели себя добрых три десятка
элементов. Они, как ноты, собирались в октавы. До-ре-
ми-фа-соль-ля-си-до. Натрий-магний-алюминий-крем-
ний-фосфор-сера-хлор-калий! Гармония природы!
Но ученые коллеги Ньюлендса не разделяли его
воодушевления. На заседании Лондонского химическо-
го общества, на котором он доложил о «законе октав»,
его наблюдение не было принято всерьез. Один
из участников заседания позволил себе даже осведо-
миться, не пробовал ли почтенный докладчик располо-
жить элементы в алфавитном порядке и выявить
при этом еще какую-нибудь закономерность.
Почему утверждения Джона Ньюлендса, вполне
справедливые, не получили своевременного признания?
Прежде всего потому, что в представленных им таб-
лицах подмеченному закону подчинялось не боль-
шинство, а меньшинство элементов. Но надо принять
во внимание еще и такое обстоятельство: в отличие
от музыки или поэзии, гармония природы, уловлен-
ная наукой, важна не столько сама по себе, сколько
19
в качестве рабочего инструмента. Законы тяготения,
например, позволяли рассчитывать движение небесных
тел и полет снарядов. А что давал «закон октав»?
Никаких предложений на этот счет Ньюлендс не сделал.
Примечательная деталь: в первой своей таблице
Ньюлендс оставил пустые места—там, где впослед-
ствии появились некоторые из новых, в то время еще не
открытых элементов. Однако он ни словом не обмолвил-
ся по поводу этих пустых мест. Почему? Быть может,
эти места были оставлены из чисто арифметических
соображений? Об этом можно только гадать.
То, что оказалось не по плечу Джону Ньюлендсу,
сумел совершить несколькими годами позже наш
соотечественник Дмитрий Иванович Менделеев.
В отличие от своих предшественников, для которых
составление таблиц элементов было лишь одним из
эпизодов их научной биографии, Менделеев с самых
первых шагов в науке сделал поиски связи между атом-
ным весом и свойствами химических элементов главной
своей задачей. При этом он руководствовался
идеей Ньютона о том, что все химические свойства
веществ определяются массой их частиц, т. е. атомов
и молекул.
Еще будучи студентом, Менделеев попытался найти
взаимосвязь между атомными весами элементов и
кристаллическими формами их соединений. Затем, уже
в магистерской диссертации, он сопоставил с атомными
весами удельные объемы веществ. Это было в 1858 году,
когда для многих элементов правильный атомный вес
не был еще известен, и поэтому общей закономерности
выявить не удалось. Но для некоторых родственных
по химическим свойствам элементов закономерный ход
изменения удельных объемов с ростом атомного веса
проступал с очевидностью. Это убеждало Менделеева
в правильности избранного пути. И когда на конгрессе
в Карлсруэ он узнал об исправленных Канниццаро
атомных весах, уверенность в существовании взаимо-
связи между атомными весами и прочими свойствами
элементов окрепла в нем еще больше
К сожалению, в первые несколько лет после конгрес
са у Менделеева не было возможности заниматься
научной работой. Такая возможность появилась только
в 1867 году, когда он получил в Петербургском
университете кафедру общей химии. И не только воз-
20
можность, но и необходимость: логика построения но-
вого курса должна была соответствовать логике
самой природы, а эта логика еще не была познана
Однако еще до того, как Менделееву удалось
завершить свои пятнадцатилетние поиски созданием
периодической системы ^элементов, ему пришлось
приступить к чтению лекций по новому курсу. Он начал
с общеизвестных, обыденных, широко распространен
ных в природе веществ — с воды, с поваренной соли.
Рассказал о водороде, кислороде, хлоре и других гало-
генах, о натрии и других щелочных металлах А далее
дело застопорилось.
Согласно химической логике, нужно было бы от
щелочных металлов перейти к щелочноземельным. Но
щелочноземельные металлы двухвалентные, между
тем он еще не рассказал о меди и серебре, которые,
могут быть одновалентными, как натрий с калием.
Не лучше ли сначала познакомить слушателей со всеми
элементами, обладающими наименьшей валентностью
а уж потом переходить к двухвалентным?
Необходимость в правильной систематизации мате
риала усугублялась еще и тем, что параллельно
с чтением лекций Менделеев предпринял издание
учебника «Основы химии». Первый выпуск был уже
отпечатан, второй — печатался. А как построить третий
автор еще не знал
По поводу всех великих открытий (во всяком
случае, по поводу многих) сочинены легенды. В этом
нет ничего удивительного, поскольку само по себе
открытие чего-то кардинально нового, не вытекающего
с логической необходимостью из ранее известного
представляется чудом. Но чудо, явленное в великом
открытии, требует общепонятного объяснения— пусть
оно даже будет лишь видимостью объяснения Кто не
знает легенды об Архимеде и ванне или о Ньютоне
и яблоке... Есть легенда и о Менделееве Но поскольку
Менделеев жил во времена не столь отдаленные от нас
как Ньютон и тем более Архимед, источник легенды
о том, как был открыт периодический закон, еще не
успел затеряться.
В архиве Музея истории Ленинградского государ
ственного университета хранится рукопись воспомина-
ний университетского товарища Менделеева, профес-
сора геологии и палеонтологии Александра Алек-
21
сандровича Иностранцева. В этой рукописи сказано:
«Как-то я зашел к Д. И. Менделееву по какому-то де-
лу и застал его в превосходном настроении духа; он да-
же шутил, что было крайней редкостью. Это было вскоре
после его знаменитого открытия периодичности элемен-
тов. Я, воспользовавшись этим благодушным на-
строением Д. И., обратился к нему с вопросом, что
натолкнуло его на знаменитое открытие. На это он
сообщил, что уже давно подозревал известную связь
элементов между собою и что много и долго думал
об этом. В течение последних месяцев Д. И. пере-
портил массу бумаги с целью отыскания в виде таблицы
этой законности, но ничего не удавалось. В последнее
время он снова усиленно занялся этим вопросом и, по
его рассказу, был даже близок к этому, но окончательно
все-таки ничего не выходило. Перед самым открытием
закона Д. И. провозился с искомою таблицею целую ночь
до утра, но все же ничего не вышло; он с досады
бросил работу и, томимый желанием выспаться, тут же,
в рабочем кабинете, не раздеваясь, повалился на диван
и крепко заснул. Во сне он увидел вполне ясно ту табли-
цу, которая позднее была напечатана. Даже во сне ра-
дость его была настолько сильна, что он сейчас же про-
снулся и быстро набросал эту таблицу на первом клочке
бумаги, валявшемся у него на конторке... Возможно, что
этот клочок бумаги сохранился и до настоящего време-
ни. Менделеев нередко пользовался для заметок не-
использованными полулистками почтовой бумаги от
полученных им записок».
Долгое время к рассказу об открытии периодиче-
ского закона во сне относились как к басне. Однако же
известно, как много может порою открыться исследова-
телю, решившему пуститься по следам преданий. Шли-
ману, поверившему в Гомера, удалось раскопать
легендарную Трою, Эвансу — лабиринт критского царя
Миноса. Академик Борис Александрович Рыбаков
извлек из русских сказок про чудо-юдо под калиновым
мостом конкретные технические подробности охоты на
мамонтов. Нашелся человек, взявшийся проверить
легенду про Менделеева,— академик Бонифатий Ми-
хайлович Кедров. Начал он с того, что решил разыскать
упомянутый в воспоминаниях Иностранцева «первый
клочок бумаги», на котором Менделеев будто бы
набросал привидевшуюся ему во сне таблицу,— тот
22
самый «полулисток бумаги от полученных им записок».
В 1924 году в Ленинграде случилось сильное на-
воднение, невские волны добрались до здания «Две
надцати коллегий», на первом этаже которого на-
ходится музей-квартира Менделеева. В спешке архив
ученого был сложен и увязан как попало, идеальный
порядок, в котором содержал его владелец, нарушился.
Наведение былого порядка началось только более чем
через два десятилетия, когда директором музея стала
младшая дочь Менделеева, Мария Дмитриевна. Разби-
рая одну из связок, сотрудницы музея обнаружили в ней
папку с документами, относящимися к открытию перио
дического закона. В папке лежал ранее неизвестный
русский оригинал менделеевской статьи «Периоди-
ческая законность», опубликованной на немецком языке
в «Анналах Либиха», и две таблицы элементов. Одна
таблица — черновик, со множеством исправлений и
пометок; другая — переписанная набело тою же, не-
сомненно менделеевской рукой. На беловой таблице
была проставлена дата:
18 уу 69
Узнав о находке, Кедров приехал в Ленинград,
осмотрел менделеевские автографы и понял, что найде-
ны важнейшие документы, проливающие свет на то, как
в действительности произошло открытие периодическо
го закона. Но ни одна из найденных таблиц не
была «набросана» ни на «клочке бумаги», ни на «полу
листке от полученных записок». Перед Кедровым ле-
жали обычные листы, исписанные с одной стороны.
Значит, либо среди таблиц не было той, о которой упо-
минал Иностранцев, либо в его воспоминания вкралась
какая-то ошибка. Тщательный сравнительный анализ
автографов позволил отвергнуть первое предположе
ние: переписанная набело таблица, по-видимому, и была
той самой, легендарной, увиденной во сне. Так значит,
верно второе предположение?
Казалось бы, иной альтернативы не найти. Но
геологи и палеонтологи всегда отличались особой
точностью описаний — таковы особенности этих наук.
И мог ли быть чистой выдумкой упомянутый Ино-
странцевым «полулисток»? Покидая музей, Кедров
попросил Марию Дмитриевну при дальнейшей разборке
архива обращать особое внимание на все бумаги,
23
помеченные той же датой, что значилась на таблице —
семнадцатым февраля тысяча восемьсот шестьдесят
девятого года.
И вот через некоторое время, перебирая бумаги
в папке, где были сложены документы, касающиеся
сельского хозяйства, сотрудницы музея увидели письмо,
а верней записку, датированную тем самым числом.
На полулистке почтовой бумаги было написано:
«Потрудитесь, многоуважаемый Дмитрий Иванович,
известить меня, нужно ли писать от В. Э. общества
ректору университета о вашем отпуске для осмотра
артельных сыроварен и на какой срок. Искренне
преданный и уважающий Вас
А. Ходнев
17 февраля 1869 г
Поверх ровных, чуть выцветших строк виднелся еще
более выцветший желтоватый круг диаметром семь-во-
семь сантиметров, словно огромный почтовый штем-
пель. А на обороте полулистка совсем другим почер-
ком — не ровной, спокойной гладью, а порывистой
менделеевской скорописью были набросаны химические
символы и цифры.
Записка Ходнева, а также другие документы, най-
денные в менделеевском архиве, позволили академику
Кедрову чуть ли не по часам прохронометрировать
день 17 февраля 1869 года, последовательность
событий, из которых сложилось великое открытие.
По-видимому, уже за завтраком (круглый след на
записке Ходнева — от кружки с чаем) Дмитрию Ива
новичу приходит неожиданная мысль: сопоставить
близкие атомные веса не родственных элементов, как
делали вслед за Дёберейнером и Одлинг и все другие
химики, а наоборот — элементов, полярных по своим
химическим свойствам. Так появились на обороте
записки Ходнева один под другим символы хлора и
калия.
Это было, действительно, нечто совершенно новое
Но сопоставлялись элементы, не просто противо-
положные по свойствам — тут привычно было бы на-
писать символы натрия и хлора, образующих поварен
ную соль. Менделеев нашел парадоксальное сочетание
24
противоположности и близости. Противоположность —
в химической индивидуальности элементов: клас-
сический металл и классический неметалл, клас-
сический носитель щелочных свойств и классический
носитель кислотных свойств. А близкими у них были
атомные веса: у хлора — 35,5, у калия — 39. Такое
парадоксальное сочетание свойств вряд ли могло
быть простой случайностью. И Менделеев тут же, на том
же клочке бумаги, стал набрасывать символы других
элементов, отыскивая среди них подобные же пара-
доксальные пары. Выписав все галогены и все щелочные
металлы, проставив их атомные веса, он убедился, что
калий и хлор не исключение, что и остальные элементы
этих семейств подчиняются только что обнаружившему-
ся парадоксальному правилу: полярные по свойствам
элементы оказываются ближайшими по атомному весу
Для каждого щелочного металла нашелся такой гало-
ген, у которого атомный вес был лишь чуть меньше.
Разница между атомными весами натрия и фтора
оказалась даже меньше, чем у хлора с калием,— всего
4, между рубидием и бромом — 5, между цезием
и иодом — снова 4.
Далее, по логике вещей, с галогенами надо было
сравнивать семейство элементов, атомные веса которых
чуть уступали бы атомным весам фтора, хлора,
брома, иода. Таким семейством было семейство кисло-
рода. Менделеев выписал символы и веса кислорода
и его химических аналогов и увидел, что неведомая
закономерность проявляется все более отчетливо и ши-
роко: разница между атомными весами фтора и кисло-
рода— 3, хлора и серы — 3, брома и селена 1 (!),
иода и теллура — 1 (!).
Далее, все по той же логике постепенного уменьше-
ния атомных весов, следовали группы азота и углерода
В первой все оказалось как нельзя лучше: разница в
атомных весах между кислородом и азотом — 2, между
серой и фосфором — 1, селеном и мышьяком — 5, тел-
луром и сурьмой — 6. С группой углерода тоже в прин-
ципе все было в порядке; правда, в ней не нашлось
элемента, который бы на несколько единиц отличался
от мышьяка, тут обнаружился непонятный пробел.
Такие же пробелы обнаруживались и в некоторых
других родственных группах элементов по мере того, как
Менделеев подстраивал новые шеренги к уже
25
выстроившимся. С одной стороны, в строю элементов
зияли пробелы; с другой стороны, для некоторых эле-
ментов в строю вовсе не находилось места, они оказы-
вались лишними.
Менделеев изготовил «химическую карточную ко-
лоду» и целый день, до позднего вечера, переставлял
«карты» с обозначенными на них символами элементов
и атомными весами на разные места, однако полного
порядка так и не смог добиться. Правда, ему удалось
одержать одну принципиальную победу: он отыскал
место для бериллия.
Трудность с бериллием возникла еще в самом начале
работы; у бериллия был тот же атомный вес, что и у
азота 14 и места для этого металла не нашлось.
В то же время в группе щелочноземельных металлов
как раз не хватало сочлена с атомным весом, средним
между литием и бором (9). И в конце концов Менде-
леев решился определить бериллий на это место, рос-
черком пера изменив приписываемый этому элементу
атомный вес с 14 на 9,4.
В первом выпуске «Основ химии» бериллий характе-
ризовался так: «Белый, легкий металл. Редкий, соеди-
ненный с кислородом, кремнеземом и глиноземом в ми-
нерале берилле». Похоже характеризовался алюми-
ний: «Белый, легкий металл... Входит в состав земной
коры в соединении с кислородом (глиноземом) в глине,
содержащей, кроме глинозема, кремнезем и воду».
Эти два металла почти всеми исследователями, начиная
с первооткрывателя бериллия Воклена, считались близ-
кими химическими родственниками. Из этого вытекало
непреложное следствие: бериллий, как и алюминий,
должен быть трехвалентным. Чтобы определить атом-
ный вес бериллия, его эквивалент (4,7) умножали
на три и получали примерно 14.
Правда, был человек, который не соглашался с этим
общепринятым взглядом на бериллий — горный инже-
нер Авдеев. Он несколько лет работал на Урале,
многократно исследовал изумруды и бериллы и на опыте
убедился в том, что в своих соединениях бериллий
проявляет иную валентность, чем алюминий: не 3, а 2.
Отсюда следовало, что атомный вес бериллия не 14, а 9.
Однако мнение Авдеева, противоречившее мнению
виднейших авторитетов Европы, в их числе и самого
Берцелиуса, не было принято в расчет.
26
Теперь появился человек, кровно заинтересованный
в истине. И поскольку мнение Авдеева, конкретные
экспериментальные результаты, полученные русским
горным инженером на далеком Урале, подтверждались
только что открытым парадоксальным правилом, Мен-
делеев приписал бериллию новый атомный вес.
В тот момент, когда бериллий занял в строю элемен-
тов принадлежавшее ему место, совершилось событие
величайшего значения и смысла: игра ума обернулась
законом природы. Предчувствие обернулось предви-
дением. Вера превратилась в знание. Человечество
обогатилось новым могущественным инструментом
научного познания.
Конечно, 17 февраля 1869 года об этом знал еще
только сам Менделеев. Окончательно исправленный им
атомный вес бериллия был признан только через десять
лет, когда два соотечественника Берцелиуса, Нильсон
и Петерсон, в прямом эксперименте, измерив плотность
паров хлорида бериллия, определили атомный вес эле-
мента, и он оказался в точности таким, каким принял
его на основе своих теоретических представлений Мен-
делеев.
Итак, место для бериллия было найдено. Однако
«лишних» элементов оставалось еще немало, например
эрбий, которому в то время приписывали такой же атом-
ный вес, как у железа; индий — с атомным весом, как у
мышьяка; торий — с атомным весом, как у олова.
Ни в одно из обнаруженных пустых мест поставить
эти «лишние» элементы не удавалось — они не подходи-
ли не только по приписанным им атомным весам, но
и по своим химическим свойствам.
Утомленный многочасовым напряженным трудом,
Менделеев отошел от конторки, за которой работал,
прилег на диван, стоявший тут же в кабинете,
и заснул. Такое, по свидетельству очевидцев, бывало
с ним и раньше. Он иногда, увлеченный работой, не
спал по нескольку ночей подряд, а потом засыпал у себя
в кабинете, даже не раздевшись.
На этот раз, по-видимому, сон был недолгим, и во
время сна мозг ученого продолжал работать. Про-
снувшись, Менделеев набросал на листе бумаги табли-
цу элементов, которая привиделась ему во сне. Ту самую
беловую таблицу, которую разыскали в конце концов в
музее. Она была построена более логично, чем предыду-
27
щая: элементы располагались в ней по мере увеличения
атомного веса, а не по мере уменьшения.
Теперь, когда строй элементов предстал перед ним
в еще более естественном порядке, Менделеев преодолел
пропасть, перед которой остановился Ньюлендс: при-
нялся заполнять пустые места в своей таблице. Уверен-
ный в том, что найдено не просто удобное, логичное
правило расстановки элементов, а закон природы,
Менделеев в соответствии с этим законом определил
существование в природе нескольких еще не открытых
элементов с присущим именно этим элементам атомным
весом. Рассчитывая эти атомные веса, он руководство-
вался не только законом триад. Триады Дёберейнера,
как и тетрады и пентады других исследователей,
классифицировавших элементы по семействам, ока-
зались лишь частным случаем общей закономерности,
объединяющей и родственные и неродственные элемен-
ты в единую систему И эта общая закономерность
позволяла находить атомный вес любого элемента,
исходя из атомных весов его соседей не только в
«семейной шеренге», но и по вертикальному ряду
Атомный вес элемента, который должен был бы
заполнить пустое место между кальцием (40) и титаном
(50), Менделеев определил как среднее арифметическое
этих чисел (45) Сейчас на этом месте находится
открытый в 1879 году скандий, атомный вес которого
44,955918.
Между цинком (65) и мышьяком (75) недоставало
двух элементов — одного родственника бора и одного
родственника кремния. Атомный вес первого получился
равным 68, второго — 70. Сейчас на этих местах
располагаются галлий (69,72) и германий (72,59).
Кроме того, Менделеев вычислил атомный вес тяжелого
аналога циркония — 180 (когда его открыли, он был
назван гафнием, атомный вес этого элемента 178,49)
На следующий день «Опыт системы элементов,
основанной на их атомном весе и химическом сходстве»
был отвезен в типографию, отпечатан на отдельном
листке и вскоре стал известен как в России, так и за
границей.
В законченной через пять дней после создания
первого варианта периодической системы статье «Со-
отношение свойств с атомным весом элементов» Мен-
делеев писал: «...Элементы, расположенные по величине
28
Е83А1 В'ХШЕ 8У5ТЕМЕ БЕЗ Й1^МЕ№Г8
ВЛРКЕ5 ЬЕТОЗР0Ю8 АТ0МК}ЦЕ5 ЕТРО КСТИЖ5 СШтфДО
раг Р. Меп<1е1ееСГ
рго!е5$. <1е Шп1уег5. а 8-Рё*ег$Ъоигд
Н-1
Ве- 9.
В—11
С-12
N-14
0-16
Г-19
Ы-7Ка-23
18^69
Т1-50 2г- 90 ?-180.
У-51 N5- 94 Те- 182.
Сг-52 Мо- 96 \^-186.
Мп-55 КН* 104л Рт-197.
Ре-56 Ки= 104,4 1г-198
№-Со«59 Р1=106,в 05-199
Си-63,4 Ав-108 Не =200
<Мв-24 2п-05.* Са—112
А1-27,4 ?«68 Г1г-11в Аи-1977
51-28 ?-70 $п = 118
Р-31 Аз~75 8Ь-122 В1-210?
8-32 Зе~79,4 Те-128?
С1-35.зВг«80 1-127
К-39 НЬ-85,4 Сз = 133 Т1-204
Са-40 5г«87,в Ва-137 РЬ-207
?«45 Се = 92
?Ег = 56 Ьа = 94
?У1 = вО 01 = 95
?1п*75.вТЬ-П8?
«Опыт системы элементов, основанной на их атомном весе и хими»
ческом сходстве». Первый вариант Периодической системы элемен-
тов Д. И. Менделеева, в которой уже предусмотрены места для
четырех в то время еще неоткрытых элементов — скандия, галлия,
германия и гафния.
их атомного веса, представляют явственную периодич-
ность свойств. Сходственные по химическим отправ-
лениям элементы представляют или близкие атомные
веса (подобно платине, иридию, осмию), или последо-
вательно и однообразно увеличивающиеся (подобно
29
калию, рубидию, цезию).. Должно ожидать открытия
еще многих неизвестных простых тел, например, сход-
ных с алюминием и кремнием элементов с паем 65—
75». Паем называли тогда атомный вес.
Вскоре Менделеев развернул это свое предсказание
в обширную статью, которая называлась: «Естествен
ная система элементов в применении к указанию свойств
неоткрытых элементов» Основной ее тезис заключался
в следующем. Каждый элемент получал в системе
элементов однозначно определенное место, так что
свойства элемента предопределялись положением, ко-
торое он занимал. Отсюда вытекало важнейшее след-
ствие: зная место элемента в системе, можно без всяких
лабораторных исследований определить все его
свойства. И следствие из следствия: зная место, за
нимаемое элементом, можно определить его свойства
еще до того, как он будет фактически обнаружен.
«Я желаю высказать,— писал Менделеев, — неко-
торые заключения относительно свойств, как хими-
ческих, так и физических, тех элементов..., которые еще
не открыты... Мы не имели до сих пор никакой
возможности предвидеть отсутствие тех или других
элементов... и тем боле не имели поводов предсказы-
вать свойства таких элементов..-
С указанием периодической зависимости между ве-
сом атома и свойствами всех элементов открывается
возможность не только указать на отсутствие некоторых
из них, но даже определить... свойства этих, еще ныне
неизвестных элементов; можно указать их атомный вес,
плотность в свободном состоянии или в форме окисла,
кислотность или основность степеней окисления, спо-
собность к раскислению и образованию двойных солей,
означить при этом свойства металлоорганических и хло-
ристых соединений данного элемента, даже есть воз-
можность описать и свойства некоторых соединений
этих неизвестных элементов с гораздо большими ечще
подробностями».
Наиболее подробные предсказания Менделеев еде
лал для трех неоткрытых элементов, которые по своим
свойствам должны были являться химическими анало-
гами бора, алюминия и кремния. Первый из них
он назвал экабором, второй — экаалюминием, третий —
экасилицием. На древнеиндийском языке, санскрите,
«эка» — это числительное «один».
30
«В ряду наиболее обыкновенных элементов яснее
всего поражает недостаток большого числа аналогов
бора и алюминия, т. е. элементов, относящихся к
III группе, а именно, несомненно, что недостает элемента
из этой группы, следующего тотчас за алюминием
и долженствующего находиться в четном, а именно,
во 2-м ряду вслед за калием и кальцием. Так как
атомный вес этих последних близок к 40, и так как
затем в этом ряду следует элемент из IV группы,
Т1 = 50, то атомный ве<\ этого недостающего элемента
должен быть близок к 44... Экабор в отдельности
должен представлять металл, имеющий объем атома
около 15, потому что в ряду элементов 2-го ряда, как
и во всех четных рядах, объем атома быстро уменьшает-
ся при переходе от первых групп к следующим... Этот
металл будет не летуч, потому что и все металлы в чет-
ных рядах во всех группах (кроме I) не летучи;
следовательно, он едва ли может быть открыт обычным
путем спектрального анализа».
Периодический закон позволял судить не только о
свойствах еще не открытых элементов, но, что особен-
но важно, и о способах, с помощью которых эти
элементы могут быть открыты.
В полной мере это проявилось при составлении
«досье» на экаалюминий — элемент из той же группы,
что и экабор, но средний по своим свойствам, с одной
стороны, между алюминием и индием, а с другой сторо-
ны,— между цинком и другим незнакомцем, экасили-
цием, родственником кремния. С точки зрения химиче-
ской криминалистики у экаалюминия было перед экабо-
ром капитальное преимущество: он обязан был отли-
чаться большей летучестью, и потому можно было на-
деяться обнаружить его следы с помощью спектроскопа.
Местонахождение экаалюминия Менделеев не
указал, хотя такую возможность его система давала.
Экаалюминий был аналогом не только алюминия, но и
индия; поэтому можно было предположить, что эка-
алюминий может быть обнаружен в том же минерале,
что и индий, тем более, что этим минералом была
цинковая обманка, природный сульфид цинка, а цинк —
непосредственный сосед экаалюминия.
Что такое открытие? Казалось бы, задавать такой
вопрос — ломиться в открытую дверь. Однако же, если
31
бы все было так просто, не было бы и приоритетных
споров.
Зависимость химических свойств элементов от их
физических свойств, в том числе от атомного веса,
отмечали и до Менделеева. Однако никто, кроме
него, не усмотрел в этом общей закономерности и не
решился вывести из нее какие-либо теоретические
или практические следствия, чтобы попытаться исполь-
зовать их как новое научное оружие.
По мере углубления работы Менделеева над перио-
дической системой число и положение неоткрытых эле-
ментов в его таблице увеличивалось и уточнялось.
В 1871 году он предсказал возможность существова-
ния 37 неоткрытых элементов, в том числе одиннадцати
трансурановых.
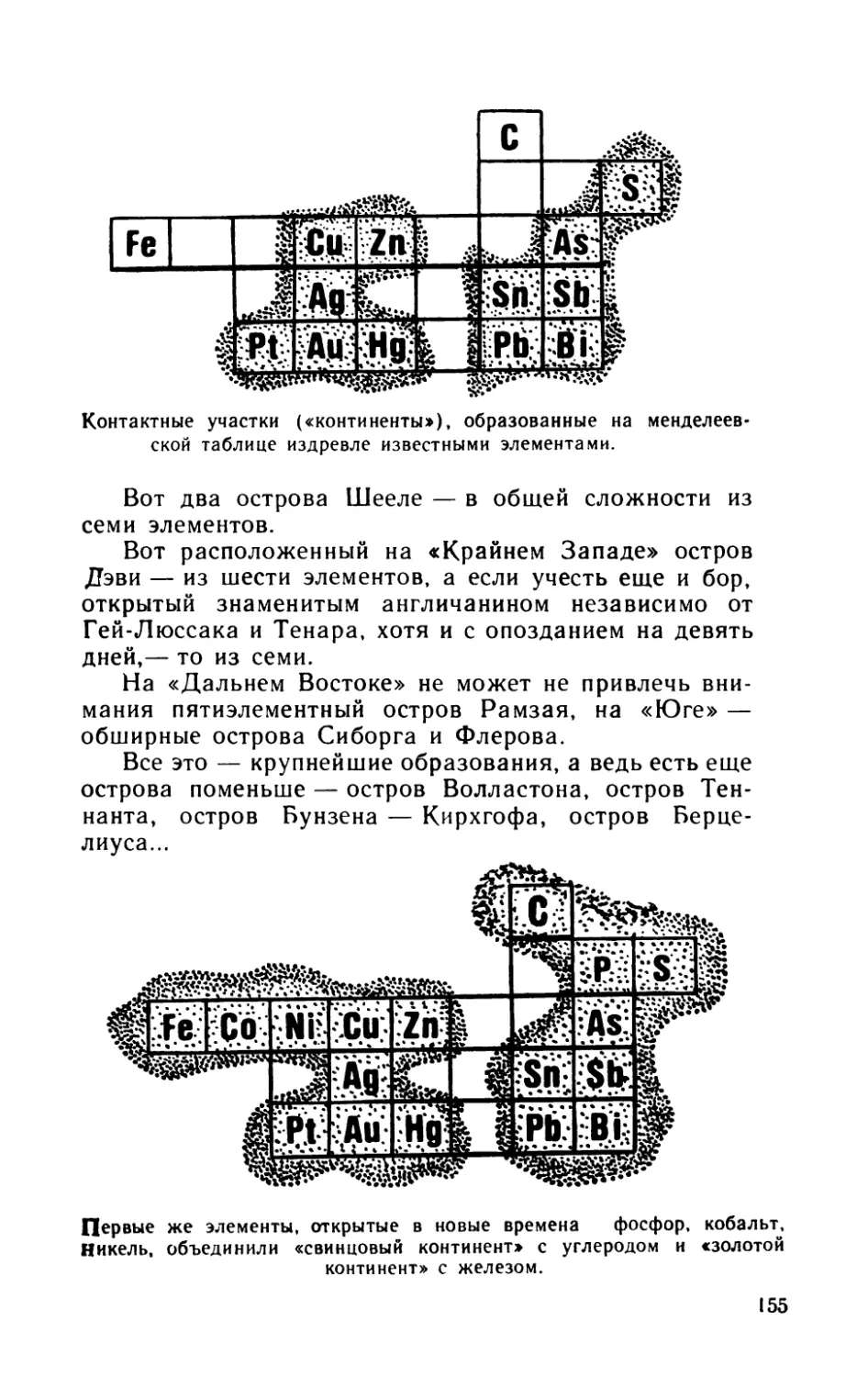
| Ре | Со
н
|Яи|НИ
р!Т1
»о«К
~й]
Рй|
Р|]
ЭрфйИЗтЕибйГПОуНоГдТтУЫи
:|ть[Ди
Химические элементы, найденные в природе после
открытия периодического закона
32
ЭКААЛЮМИНИЙ ПРЕВРАЩАЕТСЯ
В ГАЛЛИЙ
Работа Менделеева «Естественная система элемен-
тов и применение ее к указанию свойств неоткрытых
еще элементов» вышла в свет в 1871 году. А уже в 1875
году французский химик Поль Эмиль Лекок де Буабо-
дран обнаружил описанный в этой статье экаалюминий.
Обнаружил в цинковой обманке — в том самом минера-
ле, в котором был ранее найден индий.
Приступая к поискам нового элемента, Буабодран
ничего не знал о периодическом законе и о пред-
сказаниях, сделанных Менделеевым. Не потому, что
замечательное открытие русского химика прошло в
Западной Европе незамеченным — просто в то время
подавляющее большинство химиков не проявляло осо-
бого интереса к теоретическим работам и скептически
относилось к каким бы то ни было предсказаниям,
особенно чужим. Положение радикально изменилось
только после триумфальных открытий, послуживших
убедительным подтверждением периодического закона.
Однако общая ситуация в химии во второй половине
XIX столетия, пусть пока не очень заметно, все же
отличалась от той, что существовала в его первой
половине. В двери науки стучался атом. Был уже
изобретен прибор, способный распознать его в лицо,
анализируя фотоны, испускаемые или поглощаемые
электронными оболочками атомов. Именно поэтому
Буабодран вел свой поиск не просто на авось — он знал,
чего ищет.
Буабодран родился в старинной протестантской
семье винокуров в городке Коньяк, давшем имя извест-
ному напитку. Окончив Политехническую школу в Па-
риже, он вернулся домой, устроил себе неплохую ла-
бораторию, в которой и проводил все свое время.
Больше всего его интересовали спектроскопические
исследования. Впрочем, не сами по себе: как и Менде-
леев, Буабодран с первых шагов в науке искал связь
между массой элемента и прочими его свойствами,
прежде всего спектром.
«Когда Бунзен и Кирхгоф опубликовали свои иссле-
дования о цезии и рубидии,— сообщал Буабодран в
ш
2 Зак. 527
33
письме, отправленном в 1865 году в Парижскую акаде-
мию наук,— меня глубоко поразил рисунок, на котором
были представлены спектры щелочных металлов...».
Рисунок, поразивший двадцатичетырехлетнего натура-
листа, был помещен в статье знаменитых немецких
исследователей, опубликованной во Франции в 1862
году. Из этой публикации ему удалось извлечь
действительно поразительную информацию: характер-
ные линии, по которым в свое время был обнаружен
цезий, он разглядел и в спектре рубидия, и в спектре
калия, и в спектрах натрия и лития — всех остальных
щелочных металлов.
Заметить сходство спектральных линий было совсем
непросто. «Более двух лет я размышлял о соотношениях,
связывающих свойства тел с их атомными весами,—
писал Буабодран в академию.— Рассмотрение этого
рисунка привело к новому замечательному соотноше-
нию: спектральные линии щелочных металлов, разбитые
на классы в соответствии с их преломляемостью, распо-
лагаются, как и химические свойства, в определенном
порядке, отвечающем изменению атомных весов эле-
ментов. Так, спектр рубидия аналогичен спектру калия,
но только сдвинут в красную область. Чтобы получать
сопоставимые результаты, надо строить спектры,
оставляя между линиями промежутки, пропорциональ-
ные длинам волн. Тогда получается рациональный
спектр, который можно будет использовать для на-
хождения очень интересных численных отношений».
Письмо начинающего провинциального исследовате-
ля в Париж никаких последствий не имело; только
через полвека соединенными усилиями многих блестя-
щих физиков удалось установить, что спектр — это
визитная карточка электронной оболочки атома. Тогда
же... Молодой человек пишет, что длина волны от
элемента к элементу увеличивается? И пусть себе
увеличивается. Как использовать это наблюдение, никто
не знал. Первым об этом догадался сам Буабодран,
написав в одной из своих статей: «Этот закономерный
ход спектральных линий будет полезен для установле-
ния с помощью простого спектрального анализа не
только существования новых тел, но и их свойств».
Отсутствие поощрительных откликов из столицы его
не смутило; он проявил фанатичное упорство и не сошел
с открывшегося ему пути, хотя целых десять лет этот
34
путь не приводил его ни к каким ощутимым результа-
там. Упорство было вознаграждено.
Однажды Буабодран измерял сдвиги в спектрах эле-
ментов, родственных алюминию, и сравнивал получен-
ные числа с величиною сдвигов в семействе щелочных
металлов. Он заметил странную вещь: сдвиг между
сходными линиями в спектрах алюминия и индия ока-
зался вдвое больше, чем полагалось бы. Это привело
исследователя к мысли о том, что между алюминием
и индием должен находиться еще не открытый элемент
с промежуточными свойствами.
Так получилось, что экаалюминий оказался пред-
сказанным дважды, и притом разными способами.
Буабодран был настолько убежден в своей правоте,
что выписал с пиренейского рудника Пьерфитт не-
сколько фунтов минерала, в котором, по его соображе-
ниям, мог скрываться новый элемент. Соображения
были такие: незнакомец должен находиться либо там,
где есть алюминий, либо там, где есть индий. Но
алюминий — один из распространеннейших элементов,
и пытаться искать неизвестный элемент в боксите
или квасцах — все равно, что иголку в стоге сена. Индий
же — элемент редчайший, и в минерале, в котором
его нашли, есть шансы разглядеть и скрывающегося
родственника. Индий был найден Райхом и Рихтером
в цинковой обманке. Этот минерал и был заказан
Буабодраном.
Посылку из Пьерфитта он получил осенью 1868 года
и тут же приступил к анализу присланных образцов.
Но сходу обнаружить в них что-либо неизвестное ему не
удалось. Он нисколько не сомневался в правильности
избранного пути, однако от дальнейших поисков его
отвлекли более общие научные вопросы. В конце 60-х
годов в печати появились еще три работы, посвященные
той же закономерности в сдвигах спектральных линий,
которую первым обнаружил Буабодран. В одной работе
анализировались сдвиги сходных линий бора, углерода,
кремния, титана и циркония, в другой сравнивались
спектры серы, селена н теллура. Третья работа про-
извела на Буабодрана особенно сильное впечатление;
она принадлежала видному французскому химику
Дюма, который отмечал перспективность выявления
связи между атомным весом элементов и их спектрами
для создания научной классификации элементов.
2*
35
Буабодран и сам так считал, но одно дело, когда
необычная мысль возникла лишь у тебя одного, и сов-
сем другое, когда так же думают и другие, а тем более
авторитетные в науке люди. И Буабодран, прервав
поиски нового элемента, решил подвести итоги всем
своим наблюдениям над спектрами.
Итоговая работа—она была опубликована в 1871
году — не прошла мимо Менделеева. Буабодран до-
казывал, что в пределах одного семейства родственных
химических элементов средняя длина волны сходной
группы спектральных линий есть функция атомного
веса. Конечно, это было лишь небольшой частью
общего правила, гласящего, что физические и хими-
ческие свойства элементов суть периодическая функция
их атомных, весов. Но и такое частичное подтвержде-
ние новым экспериментальным материалом, притом
точным, подчиняющимся математике, было ценной
подмогой, ценным подтверждением периодической си-
стемы.
Прерванные поиски неизвестного сородича алюми-
ния и индия Буабодран возобновил в феврале 1874
года, когда получил новую партию цинковой обманки.
Он растворил ее в царской водке и принялся последо-
вательно, одну за другой, вытеснять из раствора метал-
лическим цинком различные примеси — медь, кадмий,
мышьяк, ртуть, селен, серебро, олово, таллий, индий.
После каждой очередной фильтрации он вносил каплю
оставшегося раствора в спектроскоп.
27 августа 1875 года, через девятнадцать месяцев
после начала работы с новой партией цинковой об
манки, Буабодран заметил в спектре очередной капли
хлорида цинка две ранее не наблюдавшиеся фиолетовые
полоски. Одна была поуже, но зато яркая, другая —
пошире, едва заметная. Он несколько раз повторил
опыт, убедился, что полоски не исчезают, и, взяв бутыль
с раствором, поспешил в Париж. Там, в лаборатории
профессора Шарля Вюрца, в присутствии многочислен-
ных коллег, еще раз проделал все то, что делал дома
И все увидели на экране спектроскопа «дактилоскопи-
ческие отпечатки» нового химического элемента. Буа-
бодран назвал его галлием — в честь своей родины.
20 сентября, на двадцать третий день после первого
явления галлия человеку, статья о замечательном
36
открытии уже появилась в «Отчетах Парижской акаде-
мии наук». Такой оперативности можно позавидовать и
сегодня.
Химических подробностей о новом элементе в первой
публикации было немного. «Исключительно малое
количество вещества, которым я располагал,— сообщал
автор открытия,— не позволило мне отделить новое тело
от избытка цинка, который является его спутником».
И тем более удивительной для парижских академи-
ков оказалась быстрота, с какой появился первый от-
клик на эту публикацию. Он пришел уже в ноябре из да-
лекого Петербурга. Русский профессор Менделеев
так подробно перечислял свойства новооткрытого
элемента и многих его соединений, их поведение в ре-
акциях с другими веществами, как будто сам был
первооткрывателем галлия.
Между тем настоящий первооткрыватель еще почти
ничего о своем элементе сказать не мог — как раз в это
время он исследовал первые полученные им милли-
граммы нового металла, его окислов и солей. Статью
об этих исследованиях он закончил в начале декабря.
Почти все, что говорилось в письме из Петербурга
про экаалюминий, один к одному относилось к галлию.
Менделеев: «При соприкосновении с воздухом он не
будет окисляться».
Буабодран: «Галлий заметно не окисляется при
сушке на свободном воздухе».
Менделеев: «Он дает квасцы».
Буабодран: «Я получил соль, которая, как я думаю,
есть аммиачные квасцы галлия».
Менделеев: «Его окись ЭагОз».
Буабодран: «Окись галлия...»
И так далее.
Только одно несоответствие обнаружил французский
исследователь между своим галлием и менделеевским
экаалюминием* у них оказалась разная плотность:
у гипотетического металла плотность должна была
быть 5,9, а натуральный имел всего 4,7.
Узнав об этом расхождении, Менделеев ни на минуту
не усомнился в своей цифре. Металлический галлий
был получен Буабодраном с помощью натрия, нат-
рий — один из легчайших металлов, его примесь вполне
37
могла повлиять на результат измерения плотности гал-
лия. Он рекомендовал Буабодрану тщательней очистить
металл и снова измерить его плотность.
Осенью 1876 года Буабодран сумел приготовить
полграмма галлия и многократно измерил его плот-
ность. У предельно чистого образца она "оказалась
равной 5,956. Сообщив об этом в статье «О физических
свойствах галлия», французский химик счел не-
обходимым заметить: «Я думаю, что нет нужды на-
стаивать на исключительной важности подтверждения
теоретических взглядов г. Менделеева относительно
плотности нового элемента».
Итак, все предсказания Менделеева для экаалюми-
ния полностью подтвердились. Сейчас для нас в этом
нет ничего удивительного. А как же иначе? Закон есть
закон.
Однако в те времена, когда все это происходило,
совпадение свойств открытого Буабодраном галлия с
вычисленными Менделеевым свойствами экаалюминия
произвело впечатление факела, внесенного в темную
пещеру. Открытие галлия — экаалюминия экспери-
ментально подтвердило в глазах мирового научного
сообщества открытый Менделеевым периодический
закон — главный закон мира веществ.
Что же касается Лекока де Буабодрана, то он не
только стал решительным сторонником периодической
системы, но и сам впоследствии воспользовался
периодическим законом, чтобы предсказать наличие в
природе новых элементов, относительно которых в ра-
ботах Менделеева никаких предсказаний не имелось.
Но об этом будет рассказано в своем месте — в гла-
ве «По образцу учителя нашего...»
ЭКАБОР ПРЕВРАЩАЕТСЯ
В СКАНДИЙ
В высшей степени интересно, что первым элементом,
обнаруженным после открытия Менделеевым периоди-
ческого закона, был один из тех трех элементов, относи-
тельно которых он сделал свои первые и наиболее
подробные предсказания.
В
38
Однако одна ласточка еще не делает весны. И по-
тому еще более интересно, что вторым обнаруженным
элементом был второй, а третьим — третий из пред-
сказанной Менделеевым тройки элементов (если не
принимать в расчет обнаружение редкоземельных
металлов, строение атома, свойства и история открытия
которых, как и их положение в естественной системе
элементов, представляет собой некоторое исключение).
Можно ли считать случайностью такое точное сов-
падение очередности открытий с очередностью пред-
сказаний? Вряд ли. Скорее можно предположить, что
это и другие совпадения свидетельствуют о неслучайном
характере процесса открытий. Мы обсудим этот вопрос
после того, как познакомимся с фактической стороной
дела,— в последних главах книги.
Последующие за 1875 годом несколько лет ознаме-
новались тем, что многие химики сосредоточили свое
внимание на редкоземельных элементах, не на-
ходивших себе места в периодической таблице Менде-
леева,— на церии, эрбии и тербии.
А не нашлось им места по нескольким причинам.
Как стало понятно впоследствии, главная причина
заключалась в том, что из-за особенностей строения
электронных оболочек атомы лантана и 14 его редко-
земельных родственников химически похожи друг на
друга даже не как просто родные братья, а как
близнецы, хоть и достаточно сильно различаются по
атомному весу. И в таблице Менделеева все они должны
занимать одну-единственную клетку. Случай исклю-
чительный, и додуматься до такого решения было
непросто.
Гораздо проще было предположить, что у эрбия,
тербия, церия атомные массы определены неверно.
Из-за редкостного химического сходства редкоземель-
ных элементов долго не удавалось получить чистых
солей и оксидов каждого из этих элементов, не гово-
ря уже о выделении простого вещества в свободном
виде. То, что считалось оксидом одного простого
вещества, на самом деле было смесью очень сходных
по химическому поведению оксидов нескольких веществ.
В известной степени тут повторялась история с эле-
ментами платинового семейства, только сходство между
элементами семейства лантана оказалось гораздо более
39
близким, чем между платиноидами. И поэтому раз-
делить их было еще труднее, тем более, что по своей
химической активности редкоземельные металлы зна-
чительно превосходят элементы платинового семейства,
которые относятся к числу наиболее стойких к различ-
ным воздействиям благородных металлов.
Предыдущий этап истории открытия редкозе-
мельных элементов закончился тем, что окись церия
оказалась смесью окиси церия и окиси лантана, а окись
иттрия — смесью окиси иттрия, окиси эрбия и окиси
тербия.
В 1878 году женевский профессор химии и минера-
логии Жан Шарль Галиссар Мариньяк попытался раз-
ложить нитрат эрбия, выделенный из гадолинита. Он
раскалял его длительное время, а потом промывал спек
шуюся массу водой, и получил два раствора разного
цвета. Из одного он выделил красный оксид, который
назвал оксидом эрбия, из другого — бесцветный оксид,
его он назвал оксидом иттербия.
Оба названия образованы от имени все того же
шведского городка Иттербю, где когда-то был найден
первый образец нового минерала иттербита, в котором
была найдена окись иттрия, а в ней — окись эрбия.
На следующий год другой исследователь — Ларе
Фредерик Нильсон, профессор аналитической химии
университета в Упсале, древней столице Швеции
выделил из окиси иттербия еще одну ранее неизвестную
окись. По своим свойствам она походила на окись
иттербия, но некоторые соли нового элемента отлича
лись от соответствующих солей иттербия достаточно
сильно, и это позволило их разделить.
Тщательное изучение новых веществ показало, что
содержащийся в них ранее неизвестный элемент (Ниль-
сон назвал его скандием, в честь Скандинавии) как
две капли воды похож на предсказанный Дмитрием
Ивановичем Менделеевым экабор:
Экабор Скандий
Атомная масса .... 44 45,1
Оксид экабора .... ЕЬ203 5с203
Плотность оксида . . . 3,5 3,884
Гидроксид нераство- нерастворим в щелочах
рим в ще-
лочах
Сульфат трудно- труднорастворим
растворим
40
Экабор
Скандий
Двойная сернокислая Двойная сернокислая
соль калия и экабора не соль калия и скандия
будет изоморфна с окта- кристаллизуется в виде
эдрами квасцов призм
Изумленный Нильсон писал: «Не остается никакого
сомнения, что в скандии открыт экабор... Так под-
тверждаются нагляднейшим образом соображения рус-
ского химика, которые не только дали возможность
предсказать существование... скандия и галлия, но и
предвидеть заранее их важнейшие свойства».
Материализация экабора в виде скандия произвела
в скептических умах химиков семидесятых годов прош-
лого века еще большие изменения, чем материализа-
ция экаалюминия в виде открытого Буабодраном гал-
лия. Одно совпадение — это еще может быть случай-
ностью. Два совпадения — это уже похоже на закон.
Еще одно совпадение — и периодический закон станет
безусловным для всей мировой науки. Но прежде, чем
это произошло, охотники за редкоземельными элемен-
тами сделали еще несколько открытий, не предсказан-
ных, во всяком случае сколько-нибудь подробно
творцом периодической системы.
РАЗДВОЕНИЕ ДИДИМА
(ГОЛЬМИЙ, ТУЛИИ, ГАДОЛИНИЙ,
ПРОМЕТИЙ, НЕОДИМ)
Но Ти|5т Си Рг №
Коллега Нильсона по Упсальскому университету,
профессор химии Пер Теодор Клеве (в его честь впо-
следствии был назван минерал клевеит, в котором был
найден гелий) попросил у Нильсона эрбиевую «землю»,
т. е. оксид эрбия, из которого были удалены оксиды
иттербия и скандия. Клеве хотел установить точную
атомную массу эрбия, которая ранее не могла быть
правильно определена.
Но и у Клеве долго дело не ладилось — важнейшая
характеристика элемента не желала быть постоянной,
41
получалась то одна величина, то другая. Видимо,
очищенный от скандия и иттербия препарат все еще не
был оксидом одного только эрбия.
Тогда Клеве обратился к еще одному своему коллеге
по Упсальскому университету — физику Талену с
просьбой провести спектроскопический анализ полу-
ченной от Нильсона «земли». (Спектральный анализ
к тому времени уже стал непременным оружием при
поисках новых элементов.)
Профессор Тален исполнил просьбу Клеве и со-
общил коллеге, что его предположения совершенно
справедливы. В спектре исследованного вещества кроме
линий эрбия явственно видны линии еще двух элемен-
тов, причем ранее такие линии никем из спектроскопис-
тов зафиксированы не были.
Клеве пришлось, что называется, засучить рукава,
и взяться за переработку десятков килограммов гадо-
линита — исходного редкоземельного минерала.
Когда знаешь, что искать и где искать, поиски не
могут не привести к успеху. И успех пришел к профес-
сору Клеве довольно быстро. Сначала ему удалось
выделить из «окиси эрбия» немного оранжевой соли
нового редкоземельного элемента, который он пред-
ложил назвать гольмием в честь своего родного города
Стокгольма (его латинское название — Голмия). А за-
тем, переработав еще 11 килограммов гадолинита,
Клеве сумел получить оксид второго нового редко-
земельного элемента и его бледно-зеленые соли. Этот
элемент он назвал тулием (Туле — древнее название
Скандинавии). Так что Скандинавия в названиях хи-
мических элементов была увековечена дважды. Она это
право заслужила — ее сыны открыли в общей сложности
24 химических элемента, и среди них кобальт, никель,
кислород и азот, хлор и фтор, марганец, молибден
и вольфрам, кремний и цирконий. Решающий вклад
внесли скандинавы в открытие лантаноидов.
Сам лантан был открыт одним из ближайших
друзей и помощников Берцелиуса Карлом Густавом
Мосандером, он же открыл эрбий и тербий, он же открыл
дидим, оказавшийся впоследствии смесью неодима и
празеодима. Подобно эрбиевой «земле», дидимовая
«земля», т. е. вещество, которое считалось окисью
дидима, тоже отличалась непостоянством атомного ве
са, И уже в 1853 году Мариньяк заподозрил в нем
42
сложное вещество. Однако разделить этот дидим долго
не удавалось.
Первоначально дидим был найден в цериевой земле.
Однако наибольшее его количество оказалось не в мине-
рале дерите, а в другом минерале, впервые найденном
тоже в Швеции, а затем в России и получившем
название самарскит — в честь русского горного инже-
нера Василия Евграфовича Самарского, предоставив-
шего образцы этого минерала для исследований.
Самарскит содержит уран, тантал, вольфрам и ред-
коземельные металлы. После того, как его, помимо
Швеции и России, обнаружили также в Северной
Америке, его состав стали изучать во многих лабора-
ториях и скоро обнаружили в нем «окись дидима».
А подвергнув это вещество спектральному анализу
нашли в спектре две новые голубые линии. Ранее
в спектрах образцов дидима таких линий не наблю-
дали.
Первым об этих новых линиях сообщил ученик Ма-
риньяка, швейцарский химик Марк Делафонтен.
В 1879 году дидимом занялся Лекок де Буабодран.
Пытаясь разложить полученный из самарскита
«оксид дидима», он растворил его в кислоте, а затем
стал небольшими порциями добавлять в раствор
гидроксид аммония и осадок, выпадавший после каж-
дой новой порции, рассматривал в спектроскоп. В одной
из первых же фракций осадка Буабодран нашел две
новые голубые линии — но вовсе не те, что описал
Делафонтен, а другие!
Элемент, который давал эти линии, Лекок де Буа-
бодран предложил назвать самарием — по названию
минерала, так же, как, например, иттрий был назван
по минералу иттербиту, молибден — по молибдениту,
вольфрам — по вольфрамиту.
Так второй — после рутения — химический элемент
оказался связан своим названием с нашей страной
А как же с элементом, который давал две голубые
линии, замеченные Делафонтеном? Его нашли в
следующем, 1880 году сразу двое охотников за элемен-
тами. Одним из них, естественно, был учитель Делафон-
тена Мариньяк, а другим — тоже естественно,— Лекок
де Буабодран. По предложению Буабодрана, с которым
согласился и Мариньяк, новый элемент был назван
гадолинием. Это был первый — ив течение долгого
43
времени единственный — элемент, названный в честь
ученого. Так было закреплено навечно в науке имя
Юхана Гадолина, открывшего первый редкоземельный
оксид и вместе с тем целое новое семейство элементов,
похожих один на другой*
Однако и на этом дело с дидимом не закончилось.
Напомним: то, что Мосандер назвал дидимом, уже было
разделено на три фракции — дидимовую, самариевую
и гадолиниевую. Те, кто продолжал работать с диди-
мовой фракцией, чувствовали, что это еще не индиви-
дуальное вещество. Но в течение почти двух лет раз-
делить ее не мог никто.
Первого успеха добился в 1882 году один из лучших
исследователей редкоземельных элементов, друг Менде-
леева чешский химик Богуслав Браунер, работавший
в Пражском университете. Он изучал с помощью
спектрального анализа «дидимовую фракцию дидимо-
вой земли», т. е вещество оставшееся после извлече-
ния оксидов самария и гадолиния из «окиси дидима»,
и заметил, что в спектре его проглядывают одновремен-
но два элемента. Для одного наиболее характерна
группа голубых а для другого — группа желтых полос.
Первым выделить эти два новых элемента сумел
соотечественник Браунера венский химик Ауэр фон
Вельсбах, всю жизнь занимавшийся редкоземельными
металлами и придумавший некогда знаменитые «ауэ-
ровские колпачки». Так назывались металлические
сетки с покрытием из смеси оксидов редкоземельных
металлов. Эти сетки надевались на газовые горелки
и, будучи накалены, давали яркий белый свет. Газо-
калильными лампами долгое время освещались улицы
Москвы и Вены, Лондона и Парижа, всех больших
городов, пока их окончательно не вытеснило электри-
ческое освещение
Первый патент на газокалильное освещение Ауэр
фон Вельсбах получил в сентябре 1885 года. А тремя
месяцами ранее он доложил Венской академии наук
об открытии двух новых элементов.
Вельсбах взял цитрат дидима и, растворив его,
принялся фракционно осаждать растворенное вещество
гидроксидом аммония. Ему удалось получить два раз-
ных оксида. Один — бледно-зеленый, другой — серо-го-
лубой Бледно-зеленый давал зеленые соли, серо-голу-
бой — розовые, красные, фиолетовые.
44
Вельсбах назвал их празеодим и неодим, т. е. зе-
леный дидим (празеос, по-гречески,— зеленый, как
лук) и новый дидим.
Из дидимовой земли было выжато все. Но неутоми-
мые исследователи редкоземельных элементов про-
должали свои поиски. И в следующем, 1886 году все
тот же Лекок де Буабодран заметил нечто новое
в спектре вещества, считавшегося окисью гольмия.
Тонким фракционным осаждением кислого раствора
этого вещества сначала гидроксидом аммония, а затем,
повторно, сульфатом калия, Буабодран сумел выделить
новую окись.
Новый элемент был назван диспрозием — «трудно-
доступным».
После этого волна открытий редкоземельных элемен-
тов спала. Продолжение «редкоземельной эпопеи» со-
стоялось уже в новом, XX веке. А следующим ново-
открытым элементом оказался предсказанный Менделе-
евым экасилиций.
ЭКАСИЛИЦИЙ ПРЕВРАЩАЕТСЯ
В ГЕРМАНИЙ
Уже в самом первом варианте периодической табли-
цы элементов, составленном Дмитрием Ивановичем
Менделеевым 17 февраля 1869 года, между кремнием
и оловом было оставлено место для еще неоткрытого
элемента с атомным весом 70.
Еще несколькими годами ранее отсутствие элемен-
та с атомным весом, промежуточным между атомными
весами этих элементов, было отмечено Ньюлендсом и
Одлингом. Однако далее прочерка в таблицах ни тот
ни другой не пошли.
Менделеев же предсказал наличие в природе не-
открытого элемента. В статье «Естественная система
элементов и применение ее к указанию свойств не-
открытых элементов», опубликованной в 1871 году в
«Журнале русского физико-химического общества», он
писал:
«Наиболее интересным из несомненно недостающих
металлов будет тот, который принадлежит к IV группе
45
аналогов углерода, именно в третьем ряду. Это будет
металл, следующий тотчас за кремнием, и потому назо-
вем его экасилицием. Экасилиций должен обладать
атомным весом около Ев = 72, потому что за ним сле-
дует в этом ряду мышьяк. По свойствам своим экаси-
лиций должен обладать качествами, средними между
кремнием и оловом... Экасилиций (довольно легко вос-
станавливаемый из Ез02 и КгЕзРв) должен иметь
объем около 13, потому что объем кремния—11, а
объем олова — 16. Того же самого результата дости-
гаем, если пойдем в ряду третьем и перейдем от цинка,
объем которого равен 9, к экаалюминию, экакремнию
и мышьяку, объем которого =14, а потом перейдем
к 5е=18 и Вг = 27 В этом, как и в следующих нечет-
ных рядах, объем последовательно увеличивается,
начиная с меди до брома, следовательно свободный эка-
силиций должен иметь удельный вес около 5,5. Осталь-
ные его свойства будут настолько напоминать свойства
кремния и мышьяка, насколько свойства самого мышья-
ка напоминают свойства фосфора и селена, т. е. это бу--
дет во всяком случае плавкий металл, способный в силь-
ном жару улетучиваться и окисляться, с трудом разлага-
ющий водяные пары, не действующий почти на кисло-
ты, т. е. не выделяющий из них водорода и образующий
очень мало постоянные соли. Щелочи, конечно, будут
оказывать на него действие, подобное тому, которое
оказывают они на цинк и мышьяк...»
Далее в статье описывались свойства оксида эка-
силиция.
В истории науки бессмертным подвигом называют
сделанное французским астрономом Леверье пред-
сказание о существовании неизвестной планеты, позд-
нее названной Нептуном. Леверье указал только мес-
то этой планеты в небесной сфере. Менделеев же,
кроме места в системе, сумел «на кончике пера» найти
все основные характеристики неизвестного дотоле
объекта природы — как будто держал его в руках
В отличие от прочих предсказанных элементов -
того же экабора или экаалюминия — Менделеев в дан-
ном случае не ограничился одним лишь расчетом
свойств гипотетического экакремния, а предпринял и не-
которые шаги к его обнаружению. Сохранилось письмо
Дмитрия Ивановича к немецкому химику Эрленмейеру
(октябрь 1871 года), в котором Менделеев писал:
46
«Потом обращусь к Т\, 2г, Ыв и Та, поштудирую их,
и когда буду господином этих химических редкостей —
постараюсь, изучая подходящие случаи, поискать
между ними один из предсказанных мной экаметал-
лов».
Из других документов явствует, что речь в этом
письме шла именно об экасилиции. Менделеев считал,
что этот элемент, вероятнее всего, будет обнаружен
в минералах элементов, стоящих в таблице поблизости
от экасилиция, т. е. в минералах титана и циркония
или близких к цирконию ниобия и тантала.
Однако эти предположения.не оправдались. Кстати,
в теоретических предсказаниях суждения Менделеева
были гораздо более реальными. Он не выводил каких-
либо свойств экасилиция, пользуясь аналогиями с ти-
таном и цирконием или ниобием и танталом,
а руководствовался в основном свойствами кремния
и мышьяка.
Не может не поражать убежденность Дмитрия Ива-
новича в том, что экасилиции будет «наиболее инте-
ресным» из трех недостающих элементов. Действи-
тельно, ни скандий, ни даже галлий ничем выдающим-
ся до сей поры себя не проявили, между тем как
менделеевский экасилиции «сделал карьеру»: именно
ему в наибольшей степени мы обязаны электроникой.
Открытие экасилиция развивалось по одной из
традиционных в истории открытия элементов схем,
а именно по схеме изучения вновь открываемых минера-
лов.
В данном случае речь шла о минерале весьма ред-
ком. Его открыл на руднике Гиммельсфорст близ Фрей-
берга — во вдоль и поперек изрытой горняками Сак-
сонии — профессор минералогии Фрейбергской горной
академии Альбин Вейсбах. Минерал содержал главным
образом серебро, и потому Вейсбах назвал его арги-
родитом. Для подробного исследования он передал
новый минерал лучшему аналитику академии, профес-
сору технической химии Клеменсу Александеру Вин-
клеру.
Винклер быстро убедился в том, что аргиродит
недаром получил свое имя — благородного металла
оказалось в нем 74,72 процента. В аргиродите оказа-
лось также довольно много серы — 17,13 процента.
Винклер нашел в минерале немного железа, кислорода,
47
ртути, цинка. Но все это, вместе взятое, не добирало до
94 процентов первоначальной массы образца. Куда-то
пропало почти семь процентов массы!
Винклер предположил, что он упустил какой-то
новый элемент, и обратился к помощи спектроскопа,
но никаких незнакомых линий не обнаружил. Впослед-
ствии было установлено, что характерные линии
экасилиция заметить не так просто: они лежат в ультра-
фиолетовой, недоступной для глаза части спектра этого
элемента.
Тогда исследователь продолжил анализ минерала
традиционными средствами аналитической химии.
И ему удалось поймать недостающие проценты ве-
щества — им оказалась двуокись нового металла, ко-
торую удалось легко восстановить в токе водорода
при сравнительно небольшом нагреве — до 600 —
700 градусов.
В феврале 1886 года Клеменс Винклер сделал со-
общение о новом химическом элементе в Немецком
химическом обществе и обратился к Менделееву со
следующим письмом:
«Милостивый государь!
Разрешите мне при сем передать Вам оттиск со-
общения, из которого следует, что мной обнаружен но-
вый элемент «германий». Сначала я был того мнения,
что этот элемент заполняет пробел между сурьмой и
висмутом в Вашей, замечательно проникновенно по-
строенной периодической системе и что этот элемент
совпадает с Вашей экасурьмой, но все указывает на то,
что здесь мы имеем дело с экасилицием.
Я надеюсь вскоре сообщить Вам более подробно об
этом интересном веществе; сегодня я ограничиваюсь
лишь тем, что уведомляю Вас о весьма вероятном
новом триумфе Вашего гениального исследования
и свидетельствую Вам свое почтение и глубокое уваже-
ние.
Преданный Клеменс Винклер.
Фрейберг, Саксония,
26 февраля 1886 года»
Подробные исследования германия и в самом деле
стали новым триумфом периодического закона.
48
Экасилиций
Германий
72
5,5
Ез02
4,7
ЕзС14
жидкость
около 90 °С
72,60
5,469
Се02
4,703
ОеС14
жидкость
83,0 °С
Атомная масса .
Плотность . .
Высший оксид ,
Плотность оксида
Хлориды , • .
Агрегатное состояние
Температура кипения
И так далее, и так далее — с такою же удивитель-
нейшей точностью. Винклер даже подумывал о том, что-
бы дать новому элементу название нептуний — в знак
того, что он, подобно планете Нептун, сперва был
открыт теоретически, а уж потом в натуре. Однако
это название считалось в то время скомпрометирован-
ным: нептунием был назван в 1850 году элемент, вы-
деленный из одного американского минерала и на по-
верку оказавшийся ниобием. Не стоило искушать
судьбу. В общем, в конце концов от своего перво-
начального намерения Винклер отказался и — вслед
за Буабодраном — увековечил в имени нового металла
название родной страны. Подобным же образом посту-
пят впоследствии и некоторые другие первооткрыватели.
Так или иначе, открытие экасилиция в природе
подвело, казалось, под периодический закон незыбле-
мый экспериментальный фундамент. Однако новые
факты нередко ставят под сомнение самые, казалось
бы, адекватные природе законы и правила, найденные
в процессе ее познания.
Так получилось, в частности, после открытия сле-
дующего по хронологическому порядку химического
элемента.
ПО ОБРАЗЦУ УЧИТЕЛЯ
НАШЕГО (АРГОН, ГЕЛИЙ)
Аг Не
Если не считать германий, который был открыт без
применения спектрального анализа, вернее, с приме-
нением, но бесплодным, то все химические элементы
после 1859 года, года создания Кирхгофом и Бунзеном
спектрального анализа, были обнаружены с помощью
спектроскопа.
49
Иногда новый спектр был первой вестью о наличии
в веществе нового элемента. Иногда спектроскопом
пользовались для распознавания фракций, содержащих
новое вещество. Но так или иначе, а без спектро-
скопа ни один серьезный аналитик уже не мыслил
себе поисков новых элементов.
Не подлежит сомнению, что первый из обнаружен-
ных на нашей планете инертных газов был бы открыт
не в 1894 году, а столетием раньше — будь тогда
спектроскоп в руках первооткрывателей азота и кисло-
рода. Во всяком случае, в 1785 году Генри Кавендиш,
удалив из сосуда с воздухом весь азот и весь кисло-
род, не смог химически связать оставшийся в сосуде
газ — приблизительно '/120 часть первоначального
объема — никаким реагентом, настолько инертным
оказался этот остаток. Он никому не сообщил об этом.
Только через сто лет после смерти Кавендиша была
обнаружена в его лабораторном журнале запись, ко-
торая удостоверяла, что как минимум один из первых
исследователей состава воздуха «напал на след» инерт-
ных газов. Можно предположить, что и другие иссле-
дователи — в первую очередь Шееле и Пристли, пер-
вооткрыватели кислорода, и Дэниэл Резерфорд, счи-
тающийся первооткрывателем азота, тоже лицом к
лицу, и не раз, встречались с ними. Но, по всей вероят-
ности, отличить их от самой большой и весьма не-
деятельной части воздуха, азота, не могли. Не могли
сделать этого и химики, работающие в первой половине
прошлого столетия, поскольку еще не существовало
методов, позволявших уверенно установить наличие
инертных газов в природе.
Однако и с изобретением спектроскопа шансов стало
не слишком много. Ведь инертные газы присутствуют
в воздухе в столь малом количестве, что без огромной
предварительной работы, так сказать «без упаривания»
воздуха, заметить сверхслабые их линии в спектре
воздуха невозможно. А «упаривать» воздух можно ста-
ло только после того, как научились его ожижать,
превращать в жидкое тело.
Впервые жидкий воздух был получен в 1877 году, но
только в девяностые годы трудами нескольких ученых
и изобретателей ожижение воздуха стало достаточно
простым делом и жидкий воздух стали получать в ко-
личествах, достаточных для лабораторных и даже
50
промышленных целей. Казалось бы, теперь существова-
ли все необходимые условия для того, чтобы обнару-
жить новую группу элементов.
И действительно, как только появились условия,
эти элементы сразу же и были обнаружены.
Новая встреча — через 110 лет после Кавендиша —
началась драматически. Дело было так. Директор Ка-
вендишской лаборатории в Кембридже известный фи-
зик Джон Уильям Стратт (лордРэлей) занимался опре-
делением плотности газов, составляющих атмосферный
воздух. Он начал с кислорода. Плотность его оказалась
равной не х/\ъ плотности водорода, как считалось
прежде, а 15,882. Рэлей измерял плотность не только
кислорода воздуха, но также и кислорода, получен-
ного из многих химических соединений. И во всех
случаях цифра оказывалась той же самой.
После кислорода Рэлей, естественно, занялся азо-
том. И тоже стал измерять плотность образцов, по-
лученных разными способами. Казалось бы, на примере
кислорода он уже убедился, что плотность элементного
газа не зависит от метода его получения. Но подобное
отсутствие логики многократно приносило в науке не-
ожиданные результаты. Именно так получилось и на
этот раз.
Азот из гидроксида аммония оказался легче азота,
полученного из воздуха. Правда, не намного — всего
на пять тысячных. Но и пяти тысячных не должно
было быть, как, впрочем, и одной тысячной или одной
миллионной. Рэлей решил исключить все возможные
ошибки эксперимента.
Прежде всего, конечно, разница могла возникнуть
оттого, что он пользовался недостаточно чистыми
веществами, измерял плотность не чистого азота, а
азота с примесью кислорода. Однако это объяс-
нение пришлось сразу же отвергнуть. Разница между
плотностями азота и кислорода ничтожна, и загрязне-
ние должно было быть несуразно большим, чтобы раз-
ница в плотностях образцов азота составила пять
тысячных. Такую примесь нельзя было не обнаружить.
Но причины могли быть и более тонкие. А что если
в атмосферном воздухе существуют не только двух-
атомные молекулы азота, но и трехатомные — напо-
добие озона, трехатомных молекул кислорода?
51
Чтобы проверить это свое предположение, Рэлей
решил пропустить через азот электрические разряды,
это должно было бы увеличить число гипотети-
ческих трехатомных молекул (озон в атмосфере образу-
ется при грозе), соответственно увеличилась бы и плот-
ность газа. Но ожидаемого эффекта не наблюдалось.
Не в силах справиться с веществом, явно нарушав-
шим закон постоянства состава, Рэлей обратился к чи-
тателям журнала «1Ча(иге» («Природа») — авторитет-
ного английского естественнонаучного журнала —
с просьбой предложить свои объяснения. «Я очень удив-
лен,— писал Рэлей,— недавними определениями плот-
ности азота и буду признателен, если кто-либо из чита-
телей сможет указать причину. В зависимости от двух
разных способов приготовления я получаю разные
величины. Относительная разница около 1/юоо, незна-
чительна, но она лежит за пределами ошибок опыта
и может быть приписана только разнице в характере
азота».
Письмом директора Кавендишской лаборатории за-
интересовался лондонский профессор химии Уильям
Рамзай — между прочим, ученик Роберта Бунзена. Рам-
зай подробно изучил результаты экспериментов Рэлея
и высказал естественное предположение: в атмосферном
азоте содержится какая-то более плотная примесь.
И оба исследователя взялись за выделение из атмо-
сферного воздуха этой примеси. Естественно, что физик
Рэлей использовал физический метод — тот самый, ко-
торый применял еще Кавендиш. Он стал пропускать
электрические разряды через смесь атмосферного воз-
духа с кислородом, поглощая образовывавшиеся
окислы азота щелочью. Химик Рамзай действовал, как
положено действовать химику: он сначала связал
кислород воздуха раскаленной медью, а затем при-
нялся связывать оставшийся в сосуде азот раскаленным
магнием и кальцием. Все меры предосторожности про-
тив попадания в сосуд водяного пара, пыли и диоксида
углерода были, конечно, приняты. И все же, когда из
первоначального объема азота осталось всего 40 ку-
бических сантиметров и он измерил плотность остав-
шегося газа, оказалось, что она на 1/[4 превышает
плотность исходного азота.
Рамзай продолжал пропускать.находившийся в со-
суде газ над раскаленным докрасна порошком маг-
52
ния до тех пор, пока у него не осталась Уво перво-
начального объема. Измерения показали плотность
этого газа по отношению к водороду была не 14, как
у азота, а 19,086.
Рэлей тоже получил немного газа такой же примерно
плотности.
И Рэлей, и вслед за ним Рамзай приняли этот газ
за «азотный озон», т. е. за вещество, состоящее из
трехатомных молекул азота. Почему же они сразу
не поняли, что перед ними новый элемент^
По той простой причине, что верили в правильность
периодического закона. Единственным же наглядным
воплощением этого закона была периодическая таблица
Менделеева. А в периодической таблице уже был эле-
ментарный газ с такой же примерно плотностью по
отношению к водороду, или, что то же самое, с такой
же атомной массой,— фтор. Правда, атомная масса
фтора была чуть меньше, но это было еще хуже1 По
лучалось, что обнаруженное в воздухе инертное ве
щество должно располагаться, будь оно новым элемен-
том, между фтором и натрием. Но места для подобного
элемента в таблице Менделеева не было, ибо не су-
ществовало ни одного известного элемента, который
находился бы между галогенами и щелочными метал-
лами.
Положение было воистину драматическим. Но не
трагическим, не безысходным ведь уже существовал
спектроскоп! Гипотеза о «трехатомном азоте» могла
быть легко проверена.
И как только Рамзай направил щель спектроскопа
на светящуюся трубочку с «азотным озоном», он тут
же заметил наряду с линиями азота серии зеленых
и красных линий, которые ранее ни у какого газо
образного вещества не наблюдались А Уильям Крукс,
который по просьбе Рамзая провел тщательное спектро
скопическое исследование этого газа, обнаружил в его
спектре около двухсот новых линий!
Итак, в воздухе обнаружен не просто новый газ, а
новый элемент. И этот элемент не желал вписываться
в таблицу Менделеева, правильность которой так бли
стательно была подтверждена открытиями галлия,
скандия, германия.
Пока суд да дело, Рамзай занимался изучением
странного нового газа. Уже из самого способа его по-
53
лучения явствовало, что по своей инертности он пре-
восходит азот. Последующие опыты показали, что в
этом отношении он вообще не имеет себе равных:
он отказывался взаимодействовать с каким бы то ни
было веществом при любых достижимых температурах
и давлениях.
Более того, атомы этого газа отказывались вступать
в связь даже друг с другом — они не образовывали,
наподобие азота и кислорода, двухатомных молекул,
а существовали в атомарном состоянии. Так что атом-
ный вес этого газа был равен не 19, а удвоенному значе-
нию. Значит, он должен был находиться в таблице эле-
ментов не между фтором и натрием, а между хлором
и калием. Однако ничуть легче от этого не было —
ни там, ни там в таблице Менделеева свободного
места не предусматривалось.
И несмотря на спектроскопические доказательства
индивидуальности нового газа, Менделеев продолжал
считать его аллотропической разновидностью азота —
как первоначально считали Рамзай и Рэлей.
В августе 1884 года Рамзай и Рэлей доложили
об открытии в атмосферном воздухе нового инертного
газообразного элемента на съезде Британской ассоциа-
ции естествоиспытателей в Оксфорде. Председатель-
ствовавший на съезде доктор X. Г. Медан предложил
назвать новый газ аргоном — по-гречески это означа-
ет «ленивый», «бездеятельный».
А уже в марте следующего, 1895 года в издаваемом
Круксом журнале «Кемикл ньюс» появилась статья
Лекока де Буабодрана «Заметки об атомных весах»,
в которой предсказывалось наличие в природе целого
нового семейства инертных газов с атомными весами
20,09; 36,40; 84,01; 132,71. Буабодран также утвер-
ждал — в соответствии с буквой и духом периодиче-
ской системы — что первые два представителя се-
мейства значительно более распространены, чем
остальные.
Все это Буабодран написал совершенно правиль-
но — разве что атомные массы впоследствии были
несколько уточнены. Однако следующим в семействе
инертных газов был открыт элемент, Буабодраном не
предсказанный, хотя и обнаруженный уже довольно
давно — только не на Земле, а на Солнце.
54
У этого элемента было уже даже имя, но что это
инертный газ, по своим свойствам родственный аргону,
никто еще не знал. И вообще, кроме названия, у него
еще не было ничего — только название и спектр.
Спектральный анализ, созданный физиком Кирх-
гофом и химиком Бунзеном, сразу же взяли на вооруже-
ние не только химики, увидевшие в нем еще один, и
притом несравненно более тонкий, чем прежние, метод
исследования веществ в лаборатории. Не меньшее, а,
может быть, даже большее значение он имел для астро-
номов — ведь это был первый метод, который давал
им возможность изучать вещественный состав далеких
небесных тел. Первый — и вплоть до появления косми-
ческих аппаратов — единственный. Ранее в распоряже-
нии ученых было только то небесное вещество, кото-
рое попадало на Землю в виде метеоритов.
С великой тщательностью сопоставляли астрономы
спектры известных на Земле химических веществ со
спектрами небесных тел.
Исключительную возможность для спектроскопи-
стов, изучающих наше светило, представляют солнеч-
ные затмения: при этом можно исследовать состав
невидимой в обычных условиях солнечной атмосферы,
солнечной короны, огненных выбросов — протуберан-
цев. Первое после изобретения спектроскопа полное сол-
адчное затмение наблюдалось в некоторых районах
Земли 19 августа 1868 года. Это был первый серьезный
фане открыть на Солнце неизвестный элемент. И шанс
этот был использован даже не на сто, а на все двести
процентов.
Французский астроном Жюль Жансен, направив
щель спектроскопа на сияющую вокруг черного лунного
диска солнечную корону, обнаружил в тщательно
изученном еще Фрауенгофером солнечном спектре
новую яркую желтую линию, очень похожую по цвету
на двойную линию натрия, с которой и начался
спектральный анализ, но чуть сдвинутую вправо, в сто-
рону более коротких волн.
Жансен попытался получить такую линию в лабора-
тории, но ему это не удалось. Не удалось ему отыскать
ее и в опубликованных спектрах различных веществ.
Только тогда он решился направить в Парижскую
академию наук письмо, в котором, сообщая о своем
открытии, высказывал предположение о наличии в
55
атмосфере Солнца какого-то химического элемента,
отсутствующего на Земле.
В тот же самый день Парижская академия наук
получила письмо от английского астронома Нормана
Локьера, который извещал французских коллег о том,
что он открыл в спектре протуберанца желтую линию
нового элемента Поскольку желтые линии были у мно
гих элементов (в том числе и у натрия), Локьер предло-
жил нарушить традицию, начавшуюся с цезия («небес
но-голубой»), и назвать гипотетический элемент не по
цвету характерных спектральных линий, а по месту
обнаружения. Так появилось название гелий, в честь Ге-
лиоса — Солнца.
Прошло немало времени, прежде чем гелий был
открыт и на Земле И это вполне естественно: на
Земле гелия очень мало — в килограмме земного
вещества всего три тысячные доли миллиграмма
(В космосе он второй по распространенности элемент
после водорода: на его долю приходится более 20 %
массы всей Вселенной.)
В пробах газов, отобранных в кратере Везувия,
гелий обнаружил итальянский химик Пальмиери. Это
произошло в 1881 году. Однако на сообщение
малоизвестного итальянского исследователя никто не
обратил внимания. А каких-либо весомых — в прямом
смысле этого слова — доказательств Пальмиери не
представил
Вторым человеком, которому земной гелий попался
на глаза был Уильям Френсис Гиллебранд — амери
канский химик, тот самый, который получил чистый
церий. Еще первые химики, работавшие с минералами
урана, заметили, что при растворении в крепкой
серной кислоте этих минералов появляются пузырьки
какого-то газа. В 1889 году Гиллебранд собрал этот
газ и принялся его исследовать. Газ оказался на ред
кость инертным, и Гиллебранд решил уже было, что
нашел новый газообразный химический элемент. Но
потом у него возникло сомнение в полученных результа-
тах, и в отчете об этом исследовании он назвал вы-
деленный из урановой смолки газ азотом.
Не следует судить Гиллебранда слишком строго —
ведь и такие авторитеты, как Рэлей, Рамзай и Мен-
делеев, сочли сначала новооткрытый аргон модифика-
цией азота.
56
В 1895 году Гиллебранд, будучи в Англии, рас-
сказал об «азоте» из урановой смолки Уильяму Рам-
заю, который только что открыл первый инертный газ.
И Рамзай подумал: а не аргон ли был в руках
у Гиллебранда? И решил проверить его сообщение.
Не найдя урановой смолки, Рамзай взял другой
урановый минерал, клевеит, и вместе со своим ас-
систентом Морисом Траверсом действительно выделил
из него газ. И газ действительно оказался в хими-
ческом отношении совершенно инертным, как аргон.
Но это был не аргон. В его спектре ярко светилась
желтая полоска — почти в том же месте, где в спектре
соли была двойная линия натрия.
Неужели еще один новый элемент?
По всей вероятности — так! Рамзай решил дать ему
имя криптон — от греческого слова криптос, скрытный:
уран был известен уже почти сто лет, и все это
время в нем скрывался никому не известный газ!
За подтверждением своего открытия Рамзай обра-
тился к двум лучшим спектроскопистам Англии — Нор.
ману Локьеру и Уильяму Круксу. Он послал тому
и другому запаянные трубочки с новым газом.
Первым откликнулся Крукс. Его телеграмма гласи-
ла: «Криптон есть гелий тчк приезжайте посмот-
реть тчк».
Так из гипотезы гелий стал реальностью. А название
криптон, как мы увидим дальше, тоже не пропало.
Теперь, когда в семействе инертных газов оказалось уже
два элемента — гелий с атомным весом 4 (между водо-
родом и литием) и аргон с атомным весом 38 (между
хлором и калием),— стало очевидным, что предсказан
ное Буабодраном семейство инертных газов действи-
тельно существует.
Осенью 1897 года, выступая в Канаде с докладом об
аргоне и гелии, Рамзай не только объявил о существо
вании целой группы инертных газов, но и «по образцу
учителя нашего Менделеева» предсказал свойства еще
не открытых элементов этого семейства. Произнося эти
слова, английский химик имел в виду менделеевские
предсказания в отношении экабора, экаалюминия, эка-
силиция. Между тем — этого Рамзай не знал — у Мен-
делеева одно время были если не в полной мере пред-
сказания, то, во всяком случае, догадки, прямо от-
носящиеся к предмету доклада Рамзая. Сам Дмитрий
57
Иванович никогда об этом не упоминал. Впервые об-
наружил относящийся к этому делу документ наш
современник, известный исследователь истории перио-
дического закона академик Бонифатий Михайлович
Кедров.
«Вскоре после открытия периодического закона,—
пишет Кедров,— при его первичной обработке для пуб-
ликации Менделеев случайно обнаружил возможность
сгруппировать элементы совсем особым образом —
в два столбца, через один элемент. В одном столбце
собрались все нечетноатомные элементы, в другом все
четноатомные...». То есть в левом столбце оказались
элементы, которые впоследствии получили нечетные
порядковые номера, а в правом — элементы, получив-
шие четные порядковые номера.
«Разность в «ходе» атомных весов,— пишет далее
Кедров — в обоих столбцах получалась примерно оди-
наковой, равной 4. Но при этом обнаружились три
пропуска во втором столбце: во-первых, перед Ве,
во-вторых, между О и Мо, в-третьих, между 5 и Са.
Менделеев поставил возле этих пропусков знак вопроса,
так как разность атомных весов оказалась в первом слу-
чае равной бив двух остальных 8, т. е. удвоен-
ной по сравнению с той, какая была повсюду
Менделеев предположил, что между двумя нечетно-
атомными элементами — галогеном и щелочным метал-
лом ■-*- должны стоять какие-то неизвестные четно-
атомные элементы х: между 0=16 и Мо = 24 (иначе
говоря, между Р = 19 и Ыа = 23) «недостает дс = 20>,
а между 5=32 и Са = 40 (т. е. между С1 = 35,5 и
К = 39) «недостает х = 38». Это будущие Ые и Аг.
Между Н=1 и 1л = 7 (перед Ве = 9,4) Менделеев
поставил условно молекулярный водород Нг, предвидя,
что здесь должен стать какой-то неоткрытый еще
элемент, по свойствам близкий к Нг. Это бу-
дущий гелий. Более того, отнеся эти неизвестные
элементы к числу четноатомных, Менделеев сделал по-
пытку определить их атомность (т. е. валентность —
В* Р), из его записей следует, что нужно было бы
принять ее равной нулю Но, очевидно, такой вывод
должен был показаться ему столь одиозным и сомни-
тельным, что он не стал продолжать эти выкладки».
И — прибавим мы — не стал даже нигде и никогда
упоминать о них. А жаль!
58
СКРЫТНЫЙ, НОВЫЙ, СТРАННЫЙ
(КРИПТОН, НЕОН, КСЕНОН)
Аргон, которого в земной коре 0,04 г на тонну,
был открыт первым из инертных газов, в 1884 году.
Гелий, которого на нашей планете в 24 раза меньше,
чем аргона, был открыт вторым, в 1895 году. Следую-
щие два года прошли в бесплодных попытках отыскать
другие инертные газы методом, подобным тому, каким
был открыт гелий.
Рамзай с Траверсом и некоторые другие исследо-
ватели раскаляли самые разные редкие минералы и вы-
делившиеся из них газы исследовали при помощи
спектроскопа. Но никаких неизвестных линий спектро-
скоп не выдавал.
Тогда Рамзай решил пойти другим путем — по-
пытаться разделить аргон на фракции разной плотности,
чтобы выделить небольшие примеси других инертных га-
зов, если таковые в аргоне имеются. Удобней всего было
бы поступить таким образом: превратить газ в жид-
кость, а затем делить ее на фракции по летучести.
Охладить аргон до превращения его из газа в жид-
кость можно с помощью жидкого воздуха, но в те годы
он был еще большой редкостью — криогенная техника
делала первые шаги. И когда в самом начале 1898
года физик Уильям Гемпсон подарил Рамзаю литр
жидкого воздуха, они с Траверсом не рискнули сразу же
заняться экспериментами с драгоценными пятью-
десятью литрами газообразного аргона, накопленного
ими с немалым трудом. Было решено сперва «набить
руку» в манипуляциях с жидким воздухом и заодно
поглядеть, не отыщется ли в самом воздухе новый
инертный газ, кипящий при более высокой температуре,
чем аргон.
Так они и сделали. Им удалось сохранить немного
жидкого воздуха. Разумеется, он состоял главным
образом из азота и кислорода, и сначала Рамзай и
Траверс связали эти газы с помощью раскаленной меди
и раскаленного магния. У них осталось 25 кубических
сантиметров какого-то газа; они считали, что это аргон.
Однако все же следовало проверить, аргон ли это.
На следующее утро, как повествуют историки науки,
Рамзай сказал:
Кг Не Хе
59
Может быть, у нас здесь уже есть новый газ,
Траверс?
На что Траверс ответил:
— Конечно'
Они исследовали этот газ химическими методами,
убедились в его полнейшей инертности, затем поместили
его в газоразрядную трубку, стали пропускать через
трубку электрический ток и рассматривать спектр.
В спектре было несколько отчетливых новых линий!
Особенно порадовала исследователей очень яркая зе-
леная линия, несомненно отличная от зеленых линий
аргона, гелия, ртути и других элементов.
Это произошло 31 мая 1898 года.
Вот тут и пригодилось название, первоначально при
думанное Рамзаем для скрытного гелия.
Назвав новый газ криптоном, Рамзай с Траверсом
принялись определять его атомную массу, и к один-
надцати часам вечера выяснили, что она равна 84
И что, следовательно, криптон должен занимать в
периодической таблице место между бромом и руби-
дием, а не между фтором и натрием, как они пред-
полагали. Иными словами, они нашли не тот более
высококипящий инертный газ, который собирались
обнаружить, а более низкокипящий.
Дальнейший ход исследований был для них ясен.
Надо было заморозить имеющийся у них запас аргона
и выделить, поймать наиболее летучую фракцию. Так
они и поступили.
Превратив весь свой аргон в жидкость, Рамзай
и Траверс принялись осторожно испарять ожиженный
газ и, собрав первую, самую летучую часть, помести-
ли ее в газоразрядную трубку. Яркий красный свет ее
сразу показал, что они нашли новый газ. Атомная
масса его оказалась около 20. Самыми характерными
в спектре были красные линии.
Новый газ без долгих раздумий так и назвали:
«новый» — по-гречески неон.
Это произошло в июне того же 1898 года.
Когда знаешь, что ищешь, и метод отлажен, дело
двигается быстро.
В июле, приготовив с помощью нового криогенного
аппарата довольно большое количество жидкого крип-
тона, Рамзай и Траверс выделили из него самую
низкокипящую фракцию, небольшой остаток, сохра-
60
нившиися в дьюаре после того, как улетучилось почти
все его содержание. Остаток этот, как они и предпола-
гали, оказался последним из предсказанных Буабодра-
ном элементов нового семейства. Первооткрыватели
назвали этот газ ксеноном — от греческого слова
ксенос — странный, чужой (поскольку он был чуже-
родной примесью к криптону).
Наполненная ксеноном газоразрядная трубка свети-
лась ярко-голубым светом.
Три новых элемента в течение одного года! Подобное
в истории открытия элементов было только однажды,
когда Гемфри Деви с помощью вольтова столба от
крыл щелочные и щелочноземельные металлы Он
тоже знал, что ищет — наличие в оксидах этих метал-
лов новых элементарных тел было предугадано Лаву-
азье. Он тоже владел новым методом — вольтов столб
был только что изобретен. Крупные успехи редко
объясняются одной лишь удачей. Как говорил Напо-
леон Бонапарт, победа обычно бывает на стороне
больших батальонов.
Неон, криптон и ксенон были открыты не случайно
Периодический закон указывал Рамзаю и Траверсу
прямую дорогу к новым элементам. И хотя природа
приготовила для охотников за элементами еще немало
сюрпризов, имея в руках эту Ариаднину нить, можно
было выбраться из любого лабиринта
А следующим сюрпризом оказалась радиоактив-
ность.
ЛУЧЕИСПУСКАТЕЛИ
(ПОЛОНИЙ)
Слово радиоактивность появилось несколькими го-
дами позже, чем было обнаружено само явление-
способность некоторых элементов самопроизвольно
испускать невидимые лучи (радиус — по-гречески луч,
впрочем, это известно из геометрии)
Первый химический элемент, у которого была обна-
ружена радиоактивность, уран, в течение столетия
скрывал свое важнейшее свойство. Этому не. следует
удивляться. Исследователи долго не принимали в
61
расчет, что в мире существуют невидимые излучения,
хотя, конечно, способность нагретых тел излучать тепло
была известна с незапамятных времен.
Первым человеком, обнаружившим еще одни неви-
димые лучи, был, по-видимому, английский химик
Уильям Волластон, первооткрыватель двух родствен-
ников платины — родия и палладия, один из круп
нейших ученых Европы в начале XIX века. Он вообще
отличался исключительной наблюдательностью: на-
пример, заметил в солнечном спектре темные линии,
получившие затем название фрауенгоферовых — по
имени исследователя, который провел их детальное
изучение.
Наблюдая солнечный спектр, Волластон отметил
и такую его особенность: некоторые химические вещест-
ва, например галогениды серебра, восстанавливались
до металла не только на свету, но и в тех случаях,
когда соль помещали за пределами того места, на ко-
торые падали фиолетовые лучи. Опыты Волластона —
и он понял это — свидетельствовали о том, что Солнце
испускает невидимые ультрафиолетовые лучи.
В 1878 году другой английский химик— Уильям
Крукс, первооткрыватель таллия, обнаружил еще один
тип невидимых лучей. Эти лучи испускал катод газо-
разрядной трубки, их так и назвали катодными.
Впоследствии было доказано, что катодные лучи пред
ставляют собой не что иное, как поток быстролетящих
электронов, частиц материи, в тысячи раз меньших,
чем самый легкий атом. Доказал это преемник Рэлея
на посту директора Кавендишской лаборатории Джо-
зеф Джон Томсон.
Катодные лучи изучали во многих лабораториях
мира, но целых семнадцать лет никто не замечал, что
в том месте «круксовой трубки», в которое ударяются
катодные лучи, помимо зеленоватого свечения (фос-
форесценция) возникает еще один вид невидимого излу-
чения. По имени исследователя, который их обнаружил,
эти лучи получили название рентгеновских.
Профессор физики Вюрцбургского университета
Вильгельм Конрад Рентген, сделав в конце 1895 года
свое замечательное открытие, немедленно известил об
этом ученый мир.
Зачитав письмо Рентгена своим коллегам, француз-
ским академикам, президент академии знаменитый ма-
62
тематик Анри Пуанкаре высказал вполне естественное
предположение. Раз фосфоресцирующее пятно круксо-
вой трубки излучает еще и невидимые рентгеновские
лучи, не исключено, что такие же лучи испускают и дру-
гие фосфоресцирующие объекты.
Минералов и получаемых в лабораториях веществ,
которые обладали свойством светиться после того, как
их освещали солнечным светом, подогревали или
помещали в газоразрядную трубку, было известно не-
мало. И все они, оказывается, могли скрывать еще
одно замечательное свойство — способность испускать
невидимые лучи.
Проверить догадку Пуанкаре взялся крупнейший
знаток фосфоресценции Анри Беккерель. Фосфорес-
ценция была фамильным делом Беккерелей — ею за-
нимался отец Анри Беккереля Эдмон и даже дед Антуан
Сезар Беккерель.
Метод проверки, выбранный Анри Беккерелем, был
достаточно прост. Он брал одно за другим вещества,
известные своей способностью фосфоресцировать,
выставлял их на подоконник открытого окна на яркий
солнечный свет, а затем, несколько часов спустя, поме-
щал облученные солнечным светом крупицы на фото-
графическую пластинку, завернутую в черную бумагу.
Было уже хорошо известно, что черная бумага, за-
держивая обыкновенный свет, не служила препятствием
для рентгеновских лучей.
По чистой случайности одним из первых Беккерель
подверг испытанию кусочек минерала, именуемого
урановой смолкой, и — поразительное дело! — опыт
подтвердил догадку Пуанкаре. Во всяком случае,
Беккерель был совершенно в этом убежден, ибо на бли-
жайшем же заседании Парижской академии наук вы-
ступил со следующим сообщением:
«Если взять фотографическую пластинку, обернуть
ее двумя листками очень плотной черной бумаги, а свер-
ху положить какое-нибудь фосфоресцирующее вещество
(бисульфат урана и калия), выставить все это на
солнце на несколько часов, а затем пластинку проявить,
то на ней появится силуэт фосфоресцирующего веще-
ства».
Но как ни велико было почтение Анри Беккереля к
авторитету Анри Пуанкаре, все же речь шла о научном
эксперименте, и Беккерель прекрасно понимал: чтобы
63
эксперимент, о котором он доложил коллегам, мог
считаться безупречным, однозначным, нужен еще
контрольный эксперимент.
Погода благоприятствовала Беккерелю. Вся сле-
дующая неделя была пасмурной — возможности осве-
щать образцы ярким солнечным светом не было. И Бек-
керель положил на фотопластинку кусочек урановой
смолки, не облученный предварительно солнцем. Когда
он эту пластинку проявил, на ней было светлое
пятно, размером и очертаниями точно отвечающее
образцу минерала.
Фосфоресценция оказалась ни при чем. Ему по-
везло — он обнаружил что-то новое — рентгеновские
лучи без рентгеновской трубки!
Что делать дальше, было совершенно ясно. Дальше
он должен выяснить — испускают или не испускают
такие же невидимые, проникающие сквозь черную бу-
магу лучи, и другие минералы? Беккерель работал
в Музее естественной истории, и вся богатейшая кол-
лекция минералов музея была в его распоряжении.
Прошло немного времени, и Беккерель убедился в
двух вещах: во-первых, в том, что такие лучи испус-
кают все без исключения минералы, содержащие
элемент уран, и, во-вторых, в том, что соответствие
между количеством урана в минерале и интенсивностью
излучения наблюдается далеко не во всех случаях. В не-
которых образцах урановой смолки из Иоахимсталя
урана было гораздо меньше, чем в чистом химическом
препарате двойной ураново-калиевой соли. Однако
излучали они в несколько раз интенсивней!
И подобно тому, как Рэлей, не сумев самостоятельно
решить загадку аномально плотного азота, обратился
за помощью к читателям журнала «Ыа1иге», Анри
Беккерель, не сумев самостоятельно решить загадку
аномально излучающей смолки, обратился за по-
мощью к своим друзьям. Этими друзьями были Пьер
и Мария Кюри. Они пришли к тому же примерно
мнению, какое по поводу сверхплотного азота высказал
Рамзай. Они заподозрили, что в более интенсивно
излучающей смолке содержится неизвестный, более
сильно, чем уран, излучающий элемент.
И супруги Кюри энергично взялись за работу.
«Метод, примененный нами,— писала впоследствии
Мария Кюри,— это новый метод химического анализа,
64
основанный на радиоактивности. Он заключается в раз-
делении обычными средствами химического анализа и
в измерении... радиоактивности всех выделенных про-
дуктов. Таким образом можно составить себе представ-
ление о химических свойствах искомого радиоактив-
ного элемента; последний концентрируется в тех фрак-
циях, радиоактивность которых становится все больше
и больше по мере продолжающегося разделения».
Исследуя этим методом урановую смолку, супруги
Кюри обнаружили, что интенсивность излучения мине-
рала повышает не один новый элемент, а по меньшей
мере два: после выделения урана радиоактивность кон-
центрировалась в двух разных фракциях, одна содер-
жала в основном соли висмута, другая — соли бария.
Сначала супруги Кюри принялись за висмутовую
фракцию. Они руководствовались периодической табли-
цей Менделеева: рядом с висмутом должен был на-
ходиться еще не открытый элемент, аналог теллура,
в то время как для аналога бария свободное место име-
лось лишь под клеткой бария. Еще Менделеев в самой
первой своей работе о периодической системе элемен-
тов заметил, что наиболее распространены в природе
элементы верхней части таблицы и, наоборот, чем ниже
расположен элемент, тем реже он встречается. Можно
было ожидать, что элемент, находящийся на один ряд
ниже, содержится в минерале в гораздо меньшем
количестве, чем аналог теллура.
Из висмутовой фракции удалось выделить препарат,
который по своей активности в 400 раз превосходил
уран. Содержащийся в этом продукте новый элемент
был наз-ван полонием — в честь родины Марии Скло-
довской-Кюри Польши (по латыни — Полония).
После рутения, галлия, скандия, туллия, германия
это шестой элемент, своим названием прославивший
родину первооткрывателя.
Символ Ро появился в лабораторном журнале
супругов Кюри 13 июля 1898 года. В том же месяце
появилось и первое официальное сообщение об
открытии полония.
Через четыре года после того, как полоний нашли
в урановой смолке, он был выделен в чистом виде.
Берлинский химик Вилли Марквальд разделил на
разные фракции две тонны урановой смолки. И, опустив
в раствор висмутовой фракции пластинку металли-
3 Зак. 527
65
ческого висмута, осадил новый металл. Его атомный
вес (212) и плотность (9,3) были примерно такими,
как предсказанные Менделеевым для экателлура. По
химическим свойствам новый металл тоже походил на
теллур. А еще он был очень радиоактивен — в миллион
раз активнее урана. По всем этим причинам Марк-
вальд назвал его радиотеллуром. Немного погодя стало
ясно, что Марквальд получил уже открытый супругами
Кюри полоний.
Интересно, что предположение о большей распро-
страненности этого элемента, чем того, который скры-
вался в бариевой фракции, оказалось неверным. Поло-
ния на Земле гораздо меньше, чем радия.
ГРАММ — ДОБЫЧА, ГОД — ТРУДЫ
(РАДИЙ)
Через полгода после открытия полония, в декабре
того же 1898 года, супруги Кюри объявили об открытии
в урановой смолке второго радиоактивного элемента —
радия. Он был обнаружен ими в бариевой фракции.
Причем не только обнаружен, но и, в отличие от
полония, выделен в свободном виде, вернее, в виде
соли.
Разумеется, они могли бы выделить и полоний,
но, как писала Мария Кюри, «результаты, полученные
после года работы, ясно показали, что радий легче
выделить, чем полоний; поэтому усилия были скон-
центрированы на радии».
Легче не означает — легко. Супругам Кюри при-
шлось переработать около тонны отходов уранового про-
изводства, полученных из Иоахимсталя. На это ушло не-
сколько лет. Работа Марии и Пьера Кюри по выделению
радия стала символом беззаветного труда. В 1902 году в
руках у них оказались, наконец, ощутимые количества
радиевой соли — десятая часть грамма. Теперь можно
было подвергнуть новый элемент тщательному исследо-
ванию, определить его атомную массу. Она оказалась
равна 226.
Новый элемент, как и ожидали, оказался тяжелым
аналогом бария, экабарием, по терминологии Менделе-
Ш
66
ева, последним природным элементом семейства ще-
лочноземельных металлов. Название «радий» было да-
но ему в соответствии с его наиболее характерным
свойством — радиоактивностью, способностью испус-
кать невидимые лучи.
В течение полувека — пока физики не научились
получать искусственные радиоактивные вещества — ра-
дий был основным радиоактивным веществом, приме-
нявшимся для медицинских и исследовательских целей.
Хотя в земной коре радия очень мало, почти в 20 мил-
лиардов раз меньше, чем урана, по сравнению с поло-
нием он не так уж и редок — того еще в 5 тысяч
раз меньше. Это вполне естественно: радий образуется
при ядерном распаде урана, а полоний — при ядерном
распаде радия.
В 1910 году, когда Пьера Кюри уже не было в
живых, Мария Кюри и ее помощник Анри Дебьерн
электролизом водного раствора хлорида радия получи-
ли на ртутном катоде амальгаму радия; а затем,
нагрев амальгаму в струе водорода, им удалось
приготовить чистый радий — не очень тяжелый (плот-
ность 6) серебристо-белый металл, самый активный из
щелочноземельных: он бурно разлагает воду.
Симптоматично, что в чистом виде радий был выде-
лен тем же в принципе способом, каким Гемфри Дэви
выделил родственные ему элементы II группы периоди-
ческой таблицы — кальций, магний, стронций, барий.
Но метод поисков радиоактивных элементов был раз-
работан впервые именно супругами Кюри. Без этого
метода не удалось бы открыть и опознать все остальные
радиоактивные элементы.
ЧЕТВЕРТЫЙ ИЗ СМОЛКИ
(АКТИНИЙ)
Порядок открытия радиоактивных элементов в об-
щем-то соответствовал порядку их распространенности
в природе. Очередность выделения радия и полония
соответствует очередности их положения в периодиче-
ской таблице. Этой очередности соответствует и
открытие следующего нового элемента.
з*
67
В 1899 году единственный человек, помогавший
(причем добровольно и безвозмездно) супругам Кюри в
их тяжелом труде по выделению радия, двадцати-
пятилетний химик Анри Дебьерн, исследуя отходы
урановой смолки, из которой ранее были извлечены
уран, радий и полоний, заметил, что эти отходы
все еще обладают радиоактивностью.
Это означало, по мнению Дебьерна — а его мне-
ние поддерживали супруги Кюри,— что смолка содер-
жит еще один радиоактивный элемент, четвертый. По-
скольку он во всех химических процедурах, которым
подвергался исходный материал, следовал за редко-
земельными элементами, резонно было предположить,
что новый элемент является тоже одним из химических
аналогов лантана. А для тяжелого аналога лантана —
экалантана, по терминологии Менделеева, как раз оста-
валось в периодической таблице незаполненное место —
рядом с радием.
На это место и был определен обнаруженный
Дебьерном новый радиоактивный элемент. Его назвали
актинием, от греческого «актис» — «излучающий».
Впоследствии выяснилось, что Дебьерн обнаружил
излучение не самого актиния (оно слишком слабое,
и существовавшими тогда методами обнаружить его
было невозможно), а продукта радиоактивного рас-
пада актиния — одного из изотопов тория.
Если бы не периодическая таблица Менделеева, то
открытие актиния задержалось бы на два года, потому
что эксперементальные основания для признания
открытия Дебьерна были очень невелики.
В 1902 году редкоземельной фракцией отходов ура-
нового производства занялся немецкий химик Фридрих
Гизель. Ему удалось выделить вместе с лантаном и це-
рием очень небольшое количество солей актиния. Выде-
ляя его, он руководствовался радиоактивностью —
так же, как и Дебьерн, принимая излучение дочерне-
го продукта, изотопа тория, за излучение самого акти-
ния.
Крайне ничтожное содержание актиния в минералах
и вообще в природе (кларк у него такой же, как у
полония) долго препятствовало получению этого эле-
мента в свободном виде. Через 10 лет после открытия
актиния известный физик Фредерик Содди подвел итог:
«Атомный вес — неизвестен; средняя продолжитель-
68
ность жизни — неизвестна; материнское вещество —
неизвестно; исходным веществом, вероятно, является
уран; продукт распада — радиоактиний (изотоп то-
рия.— В. Р.)».
Чистый актиний был получен только в двадцатые
годы — как один из продуктов распада радия. Он
оказался серебристо-белым, тяжелым (плотность
более 10), химически активным металлом. В воздухе
актиний превращается в оксид. Плавится примерно
при 1000 °С.
Получили металлический актиний старыми верными
способами: восстанавливая хлорид раскаленными па-
рами калия и трифторид — раскаленными парами
лития.
ПОСЛЕДНИЙ ГАЗ
(РАДОН)
Следующим новым элементом, тоже радиоактивным,
был последний из элементов, находящихся в обычных
земных условиях в виде газа. Среди газов — самый
редкий. В этом смысле открытие его в самую
последнюю очередь было вполне закономерно. Столь
же закономерно, что этот радиоактивный газ был
открыт после радия, полония, актиния — ведь газы, как
правило, вообще открывали позже, чем твердые тела:
кислород после серы, азот после фосфора.
Впервые радиоактивный газ был обнаружен в конце
1899 — начале 1900 года выдающимся английским фи-
зиком Эрнстом Резерфордом, работавшим тогда в
одном из канадских университетов, в Монреале,
и другим профессором того же университета Р. Оуэнсом.
Они исследовали торий — давно открытый хими-
ческий элемент, который, подобно урану, долгое время
скрывал свое важнейшее свойство — радиоактивность.
И сразу же обнаружили некоторые странности.
«Оказалось,— писал впоследствии Резерфорд,— что
радиоактивное воздействие окиси тория может прохо-
дить сквозь дюжину листков бумаги, положенных
поверх этой окиси, но задерживается тончайшей
пластинкой слюды, как будто излучается что-то,
69
способное диффундировать сквозь поры бумаги. Тот
факт что прибор был очень чувствителен к движению
воздуха, поддерживал эту диффузионную гипотезу.
Затем мы провели эксперименты, в которых воздух
проходил над окисью тория, а затем попадал в иони-
зационную камеру Эти опыты показали, что активность
может переноситься воздухом... Я назвал это газо-
образное вещество, которое может диффундировать
через бумагу, переноситься воздухом и в течение не-
которого времени сохранять свою активность... эма-
нацией тория... В те времена многие получали не-
повторяющиеся результаты, помещая предметы вбли-
зи радиоактивных веществ; по-видимому, все это
могло объясняться наличием таких же эманации,
как обнаруженная нами у тория. Прежде чем считать
такое объяснение правильным, необходимо было вы-
яснить истинную природу эманации . Это было очень
трудно, так как доступное количество ее было всегда
очень мало. С самого начала Содди и я предположи-
ли, что это, должно быть, инертный газ, так как нам
не удавалось заставить его соединиться с каким-либо
химическим веществом-..,»
И Резерфорд, и Содди прекрасно знали, что пустая
клетка для такого инертного газа в таблице Менделе-
ева имеется.
Резерфорд был прав, предполагая наличие таких же
«эманации» других радиоактивных элементов. Новые
изотопы того же радиоактивного газа вскоре обнару-
жил Анри Дебьерн среди продуктов распада актиния,
а Дорн, Рамзай и Содди — среди продуктов распада
радия.
Каждый исследователь придумал свое название
Резерфорд, как уже известно читателю, назвал откры-
тый им газ «эманацией тория»; Дебьерн — актиноном,
от актиния; Дорн — радоном, от радия; Рамзай и Сод
ди —-^Итоном, от латинского слова «нитенс» (блестя-
щий),
В распоряжении первооткрывателей нового элемен-
тарного газа находились ничтожные его количества —
сотые части кубического миллиметра. Тем не менее
Рамзаю удалось доказать, что радон (в конце концов
возобладало это название) действительно представ-
ляет собой инертный газ с атомной массой около
220. При температуре минус 65 °С и нормальном
70
атмосферном давлении радон превращается в жидкость,
флуоресцирующую ярким голубым или фиолетовым
светом — именно за эту особенность нового элемента
Содди с Резерфордом и хотели назвать его нитоном.
При дальнейшем понижении температуры до минус
71 °С радон становится твердым непрозрачным телом.
Если учесть, что в Антарктиде температура воз-
духа снижается иногда до минус 80 °С, то следует
признать, что термин «газ» может быть применен к ра-
дону с определенной оговоркой. (Впрочем, и ртуть
далеко не везде на нашей планете — жидкость; в Яку-
тии зимой, например, она нередко бывает твердым ме-
таллом.
САМЫЙ ЛЕГКИЙ ЛАНТАНОИД
(ЛЮТЕЦИЙ)
В то время как многие талантливые молодые
исследователи устремились на поиски 'новых радио-
активных элементов, принялись изучать законы радио-
активного распада, действующие в только что открытом
мире ядерных превращений, большинство химиков про-
должали вести те исследования, которыми они зани-
мались раньше. Были среди них и такие, кто продол-
жал распутывать хитросплетения редкоземельных эле-
ментов.
Если при поисках новых радиоактивных элемен-
тов главным орудием исследователей был разра-
ботанный Марией и Пьером Кюри метод, сочетавший
обычный химический анализ с анализом излучений,
то при поисках новых редкоземельных элементов
главным орудием продолжало оставаться сочетание
традиционного химического анализа со спектральным
анализом.
Впрочем, было бы неправильным утверждать, что
те, кто занимались радиоактивностью, вовсе не прибе-
гали к помощи спектроскопа. Когда супруги Кюри,
например, обнаружили резкое увеличение радиоактив-
ности в бариевой фракции урановой смолки, Пьер Кюри
взял образец продукта и направился на Бульвар Бертье,
в одну из лучших парижских лабораторий — к Эжену
71
Анатолю Демарсе. И Демарсе нашел в спектре прине-
сенного вещества линии до того неизвестного химиче-
ского элемента. Так что можно было бы сказать, что
первым человеком, для которого существование радия
стало очевидным, был именно Демарсе. Между прочим,
когда спектроскоп был еще новинкой, человек, пер-
вым увидевший новые спектральные линии, причислял-
ся к первооткрывателям, даже в том случае, когда
препарат предоставлялся ему другим исследователем.
Так было, например, с Теодором Рихтером, которому
препарат, содержавший новый элемент, предоставил
для спектроскопического исследования Фердинанд
Райх, страдавший дальтонизмом. Рихтер действительно
увидел новые линии и в истории науки значится одним
из первооткрывателей индия.
Однако сам Демарсе считал свою роль в открытии
радия вполне заурядной. Он вошел в историю
науки как первооткрыватель нового редкоземельного
элемента, который сумел найти в веществе, считавшем-
ся оксидом самария.
Собственно, первое сообщение об этом элементе по-
ступило еще в 1886 году от Крукса: исследуя спектр
фосфоресценции самарскита, он заметил полоску,
отсутствующую в спектрах известных элементов. Ту
же линию нашел он и в спектре смеси оксидов
самария и иттербия.
Не одну, а несколько новых спектральных линий
обнаружил затем в том, что считалось оксидом са-
мария, и его первооткрыватель Лекок де Буабодран.
Крукс и Буабодран по праву считались опытнейшими
спектроскопистами, и немудрено, что другие исследова-
тели не смогли увидеть этих новых линий. Они не рас-
полагали ни достаточно чистыми препаратами, ни
достаточно совершенными приборами.
Однако недаром Пьер Кюри направился со своим ба-
риевым препаратом именно к Демарсе. Дело в том, что
тот усовершенствовал спектроскопическую аппаратуру
настолько, что 1 получаемых им спектрах отсутство-
вали какие-либо побочные линии, кроме линий чистой
платины, из которой был сделан нагревательный эле-
мент установки.
Эта установка помогла Демарсе разобраться в пу-
таной картине, которую представляли собой спектры
редкоземельных металлов.
72
В течение нескольких лет он упорно занимался
фракционным разделением двойного соединения са-
мария и магния, тщательно изучая спектр каждой
фракции и подбирая такие условия разделения, при
которых новые спектральные линии, обнаруженные
впервые Круксом и Буабодраном, выступали все более
и более явственно. В конце концов в 1896 году ему уда-
лось выделить небольшую толику оксида нового редко-
земельного элемента — по некоторым свойствам он,
несомненно, отличался от оксида самария.
В 1901 году Демарсе окончательно установил, что
в этом оксиде содержится новый элемент. Демарсе
назвал его европием. В свободном виде европий удалось
получить только в 1937 году. Это самый легкий из
лантаноидов — его плотность 5,245 г/см3.
САМЫЙ ТЯЖЕЛЫЙ ЛАНТАНОИД
(ЕВРОПИЙ)
Самый тяжелый лантаноид — лютеций, плотность
его 9,7 — был открыт в 1907 году другим французским
химиком, Жоржем Урбеном. Европий был открыт
в соединениях предшествующего ему в периодической
таблице самария, лютеций — в соединениях предше-
ствующего ему в периодической таблице иттербия.
В этом смысле история повторилась.
Жорж Урбен, профессор Парижского университета,
друг Пьера Кюри, был человеком весьма разнообраз-
ных научных и не только научных интересов — физик,
химик, музыкант, живописец, скульптор. Между про-
чим, он был единственным западным ученым, приняв-
шим участие в подготовке первого советского издания
главного труда Дмитрия Ивановича Менделеева «Ос-
новы химии». Многие годы отдал Урбен исследованию
редкоземельных элементов, в том числе попыткам даль-
нейшего разложения открытого Мариньяком иттербия.
В 1907 году это удалось ему сделать. И почти одно-
временно это сделал еще один исследователь, перво-
открыватель неодима и празеодима Ауэр фон Вельсбах.
И тот и другой занимались многократной фракцион-
ной перекристаллизацией нитрата иттербия с помощью
73
разбавленной азотной кислоты. И оба получили в конце
концов оксиды двух разных, хотя и очень сходных по
своим химическим свойствам элементов.
Вельсбах назвал эти элементы звездными име-
нами — альдебаранием и кассиопием, Урбен — зем-
ными: неоиттербием и лютецием. Название неоиттербий
было филологическим аналогом названия неодим. Лю-
теция же — латинское имя Парижа, родного города
Урбена. Так что лютеций — филологический аналог
гольмия.
Более привычные названия, предложенные Урбеном,
стали общепринятыми, только у неоиттербия была
отброшена приставка. И это тоже было сделано вполне
логично — ведь самарий не стал неосамарием после
того, как в нем был обнаружен европий.
После лютеция в периодической системе элементов
неоткрытым остался только один лантаноид. Но в те
годы знать о том, что он должен существовать, еще
никто не мог. Абсолютно точные предсказания возмож-
ности существования того или иного химического эле-
мента могли быть сделаны только через шесть лет
после открытия лютеция — тогда, когда вместо атом-
ного веса фактором, определяющим конструкцию
периодической системы, стал порядковый номер хими-
ческого элемента, численно равный заряду ядра. Пока
этого не произошло, периодическая таблица не препят-
ствовала многочисленным попыткам открыть несуще-
ствующие элементы. Одну такую ошибку совершил
и Жорж Урбен. В 1911 году он объявил, что им открыт
новый элемент, которому он дал название «кельтий».
Наряду с правильными предсказаниями периодиче-
ская таблица элементов — в том виде, в каком она
существовала до 1913 года, особенно в периферийных
своих частях — не исключала возможности и непра-
вильных предсказаний. И это несмотря на значитель-
ные успехи в понимании местоположения инертных
газов и редкоземельных металлов.
Инертные газы в виде нулевой группы первым поме-
стил в периодическую таблицу бельгийский химик
Эррера. Еще более трудную задачу размещения в таб-
лице редкоземельных элементов сумел решить Брау-
нер — он определил их в одну клетку. Правда, сначала
не в ту, в которой они должны находиться, не вместе
74
с лантаном, а в следующую после него, между лантаном
и танталом. Эта ошибка вполне объяснима —у Брау-
нера не было никаких данных о том, где проходит
граница лантаноидного царства.
Надо сказать, что великолепная догадка Браунера
о том, что редкоземельные элементы занимают в есте-
ственной системе элементов одно место, завоевала
общее признание далеко не сразу. В восьмом издании
«Основ химии», изданном в 1906 году, на том месте,
куда Браунер поместил все редкоземельные, кроме
лантана, у Менделеева стоит один церий.
И вообще, как уже было отмечено, до 1913 года еще
нельзя было иметь строго однозначного суждения
о естественной системе элементов, особенно в перифе-
рийных ее частях. Так, в таблице, помещенной в вось-
мом издании «Основ химии», между водородом и ура-
ном было обозначено 33 места для неоткрытых элемен-
тов. Вместе с 71 открытым это составляло 104 элемента.
А на самом деле в таблице по уран включительно могло
разместиться лишь 92 химических элемента.
Открытая Менделеевым периодическая зависимость
химических свойств элементов от их массы (атомного
веса) позволяла представить себе естественную систему
химических элементов далеко еще не во всех деталях.
Как стало ясно впоследствии, химическая индивидуаль-
ность элемента в конечном счете определяется конструк-
цией электронной оболочки атома — числом электро-
нов и порядком их расположения. Число же электронов
в нейтральном атоме определяется лишь зарядом атом-
ного ядра. А этот заряд, в свою очередь, определяется
лишь числом протонов, ядер водорода, в ядре атома
того или иного элемента. В этом смысле догадка Уилья-
ма Праута была совершенно верна: можно сказать, что
все химические элементы построены из водорода.
Однако атомная масса, как мы теперь знаем, пред-
ставляет собой сумму масс не только электронов и про-
тонов атома, но еще и нейтронов, которые входят
в состав атомных ядер, и притом в количествах, отнюдь
не всегда пропорциональных числу протонов. Нейтроны,
масса которых в ядрах наиболее распространенных
изотопов весьма значительно и, как правило, превы-
шает массу протонов, вносят некоторую дезорганиза-
цию в характер зависимости химических свойств эле-
ментов от их массы.
75
Именно потому и вынужден был Менделеев поста-
вить теллур и кобальт не на те места в периодической
таблице, которые им полагались по их ахетной массе;
затем такую же перестановку пришлось сделать с арго-
ном, атомная масса которого оказалась не меньше,
а немного больше, чем у калия. Если бы поступить
с ними, как со всеми остальными элементами, то кобальт
поменялся бы местом с никелем, теллур с иодом, аргон
с калием. Первая рокировка еще не вызвала бы краха
всей периодической системы — кобальт и никель во
многом похожи друг на друга. Но определение теллура
в родственники к брому, а иода — к селену и такая же
операция с инертными газами и щелочными металлами,
напрочь исказили бы всю систему.
То, что Менделеев пошел на нарушение им самим
сформулированного закона и расставил эти элементы
не по их атомным массам, а по совокупности их
свойств — одно из самых впечатляющих достижений
его творческой мысли.
СИСТЕМА ОБЗАВОДИТСЯ
ФУНДАМЕНТОМ
Строгую теоретическую базу под Менделеевскую
систему удалось подвести только после того, как были
установлены основные детали конструкции атома.
В штурме этой твердыни природы приняли участие
многие выдающиеся умы.
Перечислим только самые важные достижения
и назовем только самых главных первооткрывателей.
В 1897 году Джозеф Джон Томсон — преемник Рэлея
по Кавендишской лаборатории — открыл электрон.
В 1900 году берлинский профессор Макс Планк обна-
ружил, что энергия, подобно веществу, прерывна, она
делится на порции — кванты. В 1911 году Эрнст Резер-
форд, к тому времени перебравшийся из Канады в Анг-
лию, открыл атомное ядро. В 1913 году двадцатисеми-
летний датчанин Нильс Бор, приехавший к Резерфорду
на стажировку, создал теоретическую модель атома
водорода — это была первая научная модель строения
атома.
76
В том же 1913 году было, наконец, установлено,
какая именно характеристика атома определяет место
химического элемента в естественной системе элемен-
тов и, следовательно, в периодической таблице. Уста-
новлению того факта, что этой характеристикой яв-
ляется положительный заряд ядра, численно равный
порядковому номеру элемента в периодической таблице,
наука обязана главным образом двум ученым — гол-
ландцу Антониусу Ван-ден-Бруку и англичанину Генри
Гвину Мозли.
Ван-ден-Брук выдвинул и теоретически обосновал
идею о порядковом номере, численно равном заряду
ядра. Мозли перевел эту идею из разряда гипотез
в разряд экспериментально подтвержденных теорий.
Надо сказать, что научная судьба обоих исследова-
телей сложилась далеко не ординарно.
Антониус Ван-ден-Брук по образованию и основ-
ному роду занятий был юристом; периодическим зако-
ном, периодической таблицей элементов он занимался
как любитель. Но занимался так серьезно, что дилетан-
том его назвать никак нельзя. Он внимательнейшим
образом следил за всеми событиями в физике и в числе
первых пытался сообразовать периодическую систему
с новыми фактами. Это позволило ему вскоре после
публикации фундаментальной работы Резерфорда
«Рассеяние альфа и бета-частиц веществом и строение
атома», в которой было указано, что «атом содержит
центральный заряд, распределенный в очень малом
объеме» (термин «ядро» возник несколько позже),
сделать следующее заключение: «количество возмож-
ных элементов равно количеству возможных постоян-
ных зарядов каждого знака в атоме». Статья Резерфор-
да появилась в печати в мае, а статья Ван-ден-Брука
уже в июле 1911 года.
Первого января 1913 года в одном и том же номере
английского журнала «РЫ1о5оргнса1 Ма^ахте» была
напечатана статья Нильса Бора с теоретическим расче-
том числа электронов в атомах и статья Ван-ден-Брука,
в которой утверждалось: «каждому элементу должен
соответствовать внутренний заряд, соответствующий
этому порядковому номеру, т. е. я-му элементу должно
соответствовать п внутренних зарядов каждого знака,
ибо заряды известны нам только как целые единицы,
а не как части такой единицы».
77
Почти сто лет прошло с тех пор, как Уильям Праут
высказал гениальную догадку о том, что все элементы
состоят из водорода. Интуитивно большинство физиков
и химиков ощущало, что так оно и есть. Однако един-
ственной количественной характеристики атомов, изве-
стной науке XIX столетия,— атомной массы — было
недостаточно для того, чтобы превратить предположе-
ние Праута в точную теорию. Точнейшие измерения,
проведенные десятками исследователей, свидетельство-
вали о том, что масса атома не есть целое число. Атом-
ная масса хлора, например, во всех измерениях рав-
нялось примерно 35,5, меди — 63,5, цинка — 65,4 и так
далее.
Но вот у атома было обнаружено ядро, обладающее
зарядом; атом получил еще одну точную количествен-
ную характеристику. И тотчас нашелся человек, кото-
рый понял, что в силу своей целочисленности (заряд
не может быть дробным) эта новая характеристика
и есть естественное основание системы элементов. В од-
ной из последующих статей Ван-ден-Брук писал: «Каж-
дый возможный внутриатомный заряд соответствует
возможному элементу».
Если бы идея, провозглашенная голландским теоре-
тиком, была подтверждена точным и непоколебимым
экспериментом, под гипотезу Праута и под периодиче-
ский закон Менделеева была бы, наконец, подведена
фундаментальная база.
Этим и занялся молодой сотрудник Резерфорда, анг-
личанин Мозли.
Его жизнь в науке продолжалась немногим более
трех лет. В 1910 году он окончил Оксфордский универ-
ситет и поступил на работу в Кавендишскую лабора-
торию. А летом 1914 года началась первая мировая
война, и Мозли ушел на фронт, где вскоре погиб от
турецкой пули...
Но в разные эпохи год году не равноценен. Как раз
в те три года, которые были отпущены молодому англи-
чанину на научное творчество, лавина открытий, начав-
шаяся с катодных лучей Крукса, икс-лучей Рентгена,
засвеченной ураном фотопластинки Беккереля, привела
к величайшим открытиям XX века — открытию атом-
ного ядра и электронной оболочки атома.
Мозли повезло не только в том, что эти три года
были исключительными сами по себе. Ему повезло еще
78
и в том, что он находился в эпицентре событий —
там, где совершались величайшие открытия: он узнавал
о них из первых рук. Его руководителем был Резерфорд,
его товарищем — Бор.
Однако одним везением дело, конечно, не ограничи-
валось. Мозли отличала высокая культура научного
труда. Как и Беккерель, он был сыном и внуком
профессора, как и Кавендиш, был фанатически предан
науке. Все три года он почти невылазно провел в лабо-
ратории.
С первого же дня работы в Кавендишской лабора-
тории Генри Мозли занялся невидимыми лучами —
к тому времени их было известно уже немало. Он хотел
подобрать такие излучения, длина волны которых была
бы сопоставима с размерами атомов. Такие — и только
такие — лучи могли бы дать существенную информа-
цию о строении атома.
Мозли начал с изучения бета-лучей и гамма-лучей,
испускаемых радиоактивными элементами. Но кроме
соответствующей длины волны нужные лучи должны
были обладать еще одним важным свойством —
их интенсивность должна была поддаваться регули-
ровке. И Мозли перешел к лучам Рентгена.
Несколькими годами ранее было обнаружено любо-
пытное явление: если подводить к рентгеновской трубке
все более высокое напряжение, то длина волны рентге-
новых лучей будет уменьшаться только до определен-
ного предела. Свыше этого предела ни при каком
напряжении она не уменьшалась. И что самое заме-
чательное — если анод был сделан из меди, то эта
минимальная длина волны была одной, а если из ста-
ли — то другой.
Длины волн этого предельного, постоянного излу-
чения зависели только от материала, из которого
сделан анод трубки. Это означало, что характеристичен
ское рентгеновское излучение (так его назвали) имеет
самое непосредственное отношение к элементному со-
ставу анода, к атомам, из которых он состоит.
Когда характеристическое излучение пропускали
через спектроскоп, полученные спектры отличались
замечательной особенностью. В отличие от обычных,
спектров с множеством линий в них были видны лишь
единичные серии из нескольких полосок: у лития —
одна, у калия — две, начиная с рубидия, появлялась
79
третья. Сравнивать между собой такие простые спектры
было довольно легко.
Этим и решил воспользоваться Мозли для экспери-
ментального доказательства догадки Ван-ден-Брука.
И то, что в течение нескольких десятилетий хотел, но
так и не смог сделать Лекок де Буабодран,— а именно
найти математический закон изменения спектров при
переходе от одного химического элемента к другому —
Мозли сделал за считанные месяцы.
Он поступил следующим образом: напылил на анод
рентгеновской трубки разные металлы и сфотографиро-
вал их спектры; затем он расположил снимки в той по-
следовательности, в какой эти металлы шли в Менде-
леевской таблице. И он увидел, что от снимка к снимку
одинаковые серии линий смещались в сторону все
более коротких волн. Частота излучения явно зависела
от порядкового номера элемента.
Мозли провел тщательные измерения и убедился
в том, что от элемента к элементу серии смещались
пропорционально порядковым номерам и величине
заряда ядер.
Когда Мозли выстроил элементы в соответствии с
выведенным им математическим законом изменения
характеристических спектров, то кобальт с никелем,
теллур с иодом и калий с аргоном попали каждый на
свое место — туда, где они стояли в Менделеевской
таблице. По очередности атомных масс так не получа-
лось, а по очередности зарядов получилось.
Теперь, когда Мозли экспериментально подтвердил
догадку Ван-ден-Брука, что природная система элемен-
тов — это непрерывный ряд постоянно возрастающих
ядерных зарядов, что каждый следующий по порядко-
вому номеру элемент имеет ровно на один заряд больше,
чем предыдущий — теперь можно было со всей опреде-
ленностью выявить все еще не занятые места в таблице
элементов. На всем ее пространстве — от водорода до
урана — наступила полная ясность. Если, например,
у водорода один заряд, а у гелия — два, значит ника-
кого промежуточного элемента в природе нет и быть не
может. А если молибден отличается от рутения на два
заряда, значит между ними имеется место для еще
одного неоткрытого элемента.
Мозли в двух своих статьях, опубликованных в
1913 и в 1914 году, поместил сведения о незаполненных
80
местах между алюминием и золотом — таковы были
пределы его экспериментов. Таких мест выявилось
три — для неоткрытых элементов с порядковыми но-
мерами 43, 61 и 75.
Элемент № 72 Мозли считал открытым — Жорж
Урбен объявил о его обнаружении и назвал кельтием.
Две маленькие статьи Генри Мозли были опублико-
ваны всего за несколько месяцев до его отправки на
фронт, и все же он успел дожить до экспериментального
подтверждения абсолютной надежности своего откры-
тия. Ему помог Жорж Урбен. Он прислал Мозли смесь
соединений редкоземельных элементов, над точной
идентификацией которых трудился не один десяток
лет. Мозли за несколько дней получил рентгеновские
спектры с характеристическими линиями эрбия, тулия,
иттербия и лютеция и послал их Урбену. Затем они
вместе провели рентгеновскую спектроскопию соедине-
ния, в котором, по мнению Урбена, присутствовал
открытый им кельтий. Но ничего кроме линий, принад-
лежащих иттербию и лютецию, в спектрах не оказалось
Точный список неоткрытых элементов пополнился
четвертым химическим индивидуумом — с порядковым
номером 72.
Вскоре в этот список вошли неоткрытые элементы,
место которых в таблице было после золота: 85, 87 и 91
АКТИНИЙ ОБРЕТАЕТ РОДИТЕЛЯ
(ПРОТАКТИНИЙ)
Первым был обнаружен элемент, замыкавший спи-
сок; его соседями в периодической таблице были —
слева торий, а справа уран. В таблицах начала XX века
сверху с ним соседствовал тантал. Менделеев пред-
сказал его наличие еще в 1871 году, назвал экатанта-
лом и указал, что его атомная масса должна быть
около 235, а формула оксида ЕЬОб.
Впервые экатантал был обнаружен среди продуктов
распада урана в 1913 году. Профессор физики Мюнхен-
ского университета поляк Казимир Фаянс и химик из
Карлсруэ О. Г. Геринг, обнаружившие экатантал по
радиоактивности, выделить его не смогли, однако
Ш
81
название все же дали — бревий, от латинского слова
«бревис» — «короткий»: радиоактивность наполовину
затухала уже через минуту с небольшим.
В то время у тория и урана было найдено столько
всяких продуктов распада, среди которых было такое
множество изотопов разных химических элементов,
что точно определить, какая вновь замеченная актив-
ность принадлежит новому изотопу уже открытого эле-
мента, а какая — еще неизвестного, не было воз-
можности.
Кроме того, Фаянсу и Герингу «не повезло» — они
нашли самый короткоживущий из природных изото-
пов элемента № 91 и к тому же самый редкий: в при-
роде его в миллионы раз меньше, чем наиболее распро-
страненного изотопа. Бревий Фаянса и Геринга пред-
ставлял собой продукт распада урана-238, а наиболее
распространенный изотоп элемента № 91 — это про-
дукт распада урана-235.
Общепризнанным существование элемента № 91
стало лишь после того, как новый элемент был иден-
тифицирован по своим химическим свойствам, а не
только по радиоактивным. Две группы исследователей,
независимо одна от другой открывшие долгоживущий
изотоп элемента № 91 и представившие убедительные
доказательства того, что это именно новый элемент,—
Отто Ган и Лизе Мейтнер в Германии, а Фредерик
Содди и Джон Кренстон в Англии — действовали по
заранее намеченному плану.
Руководствовались и те и другие двумя законами
природы: периодическим законом Менделеева и зако-
ном смещения, открытым Содди и Фаянсом в 1913 году
(этот год вообще был феноменально богат открытиями).
Закон смещения гласит: если распадающийся элемент
испускает альфа-частицы, то продукт распада пред-
ставляет собой элемент с порядковым номером на две
единицы меньше, чем у распавшегося, а если испу-
скается бета-частица, то продукт распада — элемент
с порядковым номером на единицу больше, чем у рас-
павшегося. Объясняется все это тем, что альфа-частица
(ядро гелия), покидая атомное ядро, уносит с собой
два положительных заряда, а бета-частица (электрон)
уносит с собой один отрицательный заряд.
Отто Ган в начале своей химической карьеры был
сотрудником Уильяма Рамзая, затем стал директором
82
крупнейшего в Берлине химического института Обще-
ства кайзера Вильгельма (это общество в кайзеровской
Германии выполняло функции академии наук), в кото-
ром работала и австрийский химик Лизе Мейтнер.
Содди, долгое время сотрудничавший с Резерфордом,
был затем профессором физики в Глазго, там же рабо-
тал и Джон Кренстон.
В соответствии с законом смещения, открытый
Дебьерном в 1889 году актиний, элемент № 89, никак
не мог получиться непосредственно из урана, элемента
№ 92. Родителем актиния должен был быть испустив-
ший альфа-частицу элемент с зарядом ядра 91. Суще-
ствование актиния однозначно свидетельствовало
в пользу наличия на Земле такого элемента.
Периодический закон указывал химический путь
обнаружения этого элемента среди продуктов распада;
экатантал следовало выделять теми же методами, что
и тантал.
Но ведь в продуктах распада радиоактивных эле-
ментов никакого тантала нет? Как же быть?
Пришлось прибегнуть к методу, сходному с тем,
каким пользуются голубятники, когда хотят сманить
к себе чужого голубя. Они выпускают стаю своих
голубей, и чужак прибивается к ней. В химии подоб-
ный метод называют методом носителей.
Обе группы — и немецкая и английская — посту-
пили следующим образом. Остатки урановой смоляной
руды смешивали с танталовой кислотой, а затем разде-
ляли. Получившаяся танталовая фракция оказалась
радиоактивной — испускала альфа-частицы. А среди
продуктов ее распада удалось заметить короткоживу-
щие продукты распада актиния. Все это могло значить
только одно: присутствие в пятиокиси тантала примеси
пятиокиси экатантала. Менделеев предсказал формулу
высшего оксида экатантала совершенно правильно.
Так как элемент № 91 был родителем актиния, его
назвали протактинием — «протос» по-гречески озна-
чает первый, исходный, начальный. От того же слова
образовано название внутриядерной частицы, несущей
один положительный заряд,— «протон».
Общепризнанное открытие протактиния в Берлине
и Глазго состоялось в 1917—1918 годах.
А в виде свободного продукта он был выделен еще
через десять лет, в 1927 году, американским химиком
83
Аристидом Гроссе. Гроссе переработал около тонны
иоахимстальских радиевых остатков и выделил два
миллиграмма оксида протактиния — белого порошка,
который не растворялся ни в азотной, ни в хлороводо-
родной (соляной) кислоте.
Еще через семь лет, в 1934 году Гроссе и другой
американец М. Аргусе, наработав 100 миллиграммов
оксида протактиния, сумели восстановить его до эле-
мента. Для этого им пришлось сначала превратить
оксид в галогенид (иодид и бромид), а затем разложить
его в вакууме.
Протактиний оказался светло-серым металлом
с атомной массой 231. На воздухе он, подобно алюми-
нию, сразу же покрывался пленкой окисла и далее не
окислялся.
В истории открытия протактиния есть одна особен-
ность, которую внимательный читатель, вероятно, уже
заметил.
Дело в том, что в современной периодической таб-
лице, как и в Менделеевской, протактиний расположен
между торием и ураном. Но вместе с ними он составляет
теперь особую группу элементов, приуроченную к тому
же месту, на котором стоит актиний, и входит в III груп-
пу элементов. Но тантал находится в V группе, и поэто-
му по своему расположению в современной таблице
протактиний не может быть назван экатанталом. Эка-
танталом сейчас можно считать элемент № 105.
Но если на самом деле протактиний не экатантал,
то как же его извлекли из смеси с другими элементами
с помощью танталовой кислоты? Случайно?
Нет, не случайно.
Для химических свойств элемента важное значение
имеет не только заряд ядра, но и тонкое строение его
электронных оболочек. Именно поэтому пришлось не-
которые семейства химически родственных элементов
располагать не классическим способом, как, например,
щелочные металлы, а иначе. Это относится и к железу
с кобальтом и никелем, и к платиновому семейству,
в еще большей степени — к редкоземельным элементам
и к актинию, протактинию, урану, торию и некоторым
трансуранам — об этом семействе будет подробнее рас-
сказано позже. Но вот что надо сказать сейчас. Далеко
не все особенности поведения химических элементов
могут быть отражены в таблице. Все же таблица — это
84
схема, и как всякая схема она менее богата содержа-
нием, чем объект, который она моделирует.
По своим химическим свойствам протактиний дей-
ствительно ближе к танталу и ниобию, чем к актинию.
Таковы особенности строения его электронных оболо-
чек, обусловливающих его поведение как химического
индивидуума.
Но как это мог предугадать Менделеев в то время,
когда электрон еще не был открыт? Как удалось ему
правильно определить химические свойства экатантала,
руководствуясь «неправильным» положением этого эле-
мента в периодической системе? По-видимому, иногда
интуиция может помочь и там, где схема — логическая
модель — отказывает...
ВООРУЖЕННЫЕ ТЕОРИЕЙ БОРА
(ГАФНИЙ)
Единственный среди еще не найденных элемент
с четным порядковым номером 72, как и прочие хими-
ческие индивидуумы с четными номерами, встречается
в природе не так уж редко. Во всяком случае, в земной
коре его в два раза больше, чем брома, в десятки раз
больше, чем иода, висмута, сурьмы, в сотни и тысячи
раз больше, чем серебра и золота, в миллионы раз
больше, чем открытого перед ним протактиния. Так что
гораздо более позднее открытие элемента № 72 по
сравнению с другими столь же распространенными
химическими элементами есть своего рода консенс.
Этот элемент настолько похож по своим химиче-
ским свойствам на цирконий, что во всех химических
реакциях копирует его превращения. Поэтому в метал-
лическом цирконии всегда есть примесь элемента № 72.
Достаточно эффективный метод разделения этих метал-
лов был разработан только в 1949 году — через
двадцать шесть лет после открытия элемента № 72.
И все же дело не только в химическом поведении
этого элемента. В конце концов столь же хитро маски-
ровавшиеся редкоземельные металлы удалось обнару-
жить раньше. Долгое время элемент № 72 искали не
там, где его надо было искать.
Ш
85
Если сравнить две периодические таблицы — совре-
менную и 1906 года, из последнего прижизненного
издания «Основ химии» Д. И. Менделеева, то можно
увидеть, что в таблице 1906 года место семьдесят
второго элемента отдано церию. В других таблицах
того же и несколько более позднего времени вместе
с церием на месте, законно принадлежащем элементу
№ 72, располагались по предложению Браунера
и остальные известные к тому времени редкоземельные
металлы.
Много лет никто не знал, на каком именно порядко-
вом номере заканчивается семейство редкоземельных
металлов. Теперь мы знаем, что последний лантаноид —
это лютеций, элемент № 71. Но пока Нильс Бор не
создал теорию строения электронных оболочек, никто
не мог этого сказать. И элемент № 72 искали в редко-
земельных минералах, где его и быть не могло. А к сооб-
щениям об открытии новых элементов в циркониевых
минералах относились с недоверием — в таблице Мен-
делеева для таких элементов свободных мест не было.
Между тем, подобных сообщений было немало. Еще
в 1825 году Брейтхаупт объявил, что нашел в минерале
остраните элемент остраний, в 1845 году Сванберг
сообщил об открытии в минерале цирконе элемента
нория, в 1869 году Сорби — джаргония, а Черч —
нигрия, в 1901 году Гофман и Прандтль известили
коллег, что ими найден новый элемент эвксений.
Во всех этих случаях эксперименты первооткрыва-
телей не выдерживали повторных проверок. Неужели
все эти исследователи действительно заблуждались?
Скорее всего невоспроизводимость их опытов зависела
от крайнего сходства химических свойств всех этих
нориев и эвксениев со свойствами циркония, в десятки
раз превосходящего элемент № 72 по своему содер-
жанию в исследованных минералах. И еще — не исклю-
чено — от недостаточной убежденности исследователей
в возможности существования в природе неоткрытого
родственника циркония.
Это последнее обстоятельство подтверждается тем,
что исследователи, убежденные в том, что элемент
№ 72 — родственник лантана, объявляли о его откры-
тии среди редких земель. Наиболее яростно отстаивал
свою позицию Жорж Урбен. В 1911 году он сообщил
об открытии среди редкоземельных металлов своего
86
кельтия, о котором читатель уже знает, и настаивал
на том, что открыл пятнадцатый по счету порядковых
номеров лантаноид, элемент № 72.
Первая модель атома, как уже говорилось, была
создана Нильсом Бором в 1913 году. Это была модель
простейшего атома — водородного. К началу 20-х годов
Бор сумел рассчитать модели других, гораздо более
сложно устроенных атомов. Из расчетов следовало,
что элементов, подобных лантану, может быть лишь 14,
а элемент № 72 по строению своих электронных обо-
лочек аналогичен не лантану, а цирконию и, значит, по
своим свойствам должен быть его аналогом.
Такой интересный теоретический прогноз, конечно
же, было очень заманчиво проверить. Особых трудно-
стей это не представляло: циркониевых минералов
достаточно много.
Взялись за проверку два молодых сотрудника
Нильса Бора — венгр Дьердь Хевеши и голландец Дик
Костер. После выщелачивания кипящими кислотами
норвежских и гренландских цирконов они получили
характеристические рентгеновские спектры оставшихся
продуктов и нашли в этих спектрах линии, вычисленные
по формуле Мозли для элемента № 72.
В 1923 году Хевеши и Костер объявили о своем
открытии и предложили назвать новый элемент в честь
города, в котором оно было сделано и в котором жил
и работал их учитель Нильс Бор, один из величайших
физиков нашего столетия. Предложенное ими название
«гафний» (Гафнией в древности называли Копенгаген)
стало общепринятым; только соотечественники Урбена
еще четверть века продолжали называть этот элемент
кельтием.
Вещества, которые раньше считались чистыми пре-
паратами циркония, на поверку оказались смешанными
препаратами циркония и гафния. Первый очищенный
от гафния цирконий в том же 1923 году получили
Хевеши и Костер. А чуть позже Хевеши получил и обра-
зец металлического гафния 99 %-ной чистоты. Ему
пришлось многократно перекристаллизовывать комп-
лексные фториды калия, циркония и гафния, а затем
он восстанавливал гексафторид гафния металлическим
магнием; по существу, Хевеши использовал метод,
которым Берцелиус столетием раньше впервые выделил
цирконий.
87
ПОИМКА ДВИМАРГАНЦА
(РЕНИЙ)
Причина, по которой от внимания исследователей
столь долго ускользал элемент, занимающий ныне семь-
десят пятую клетку Менделеевской таблицы, сродни той,
по которой почти столь же долго не могли открыть
гафний* элемент № 75 тоже искали не там. Только
поиски осложнялись еще тем, что как и все тяжелые
элементы с нечетным числом протонов в ядре, этот
элемент гораздо более редок, чем гафний,— его в зем-
ной коре в тысячу раз меньше.
Правда, по сравнению с гафнием у элемента № 75
было и преимущество — он находится достаточно
далеко от лантаноидов, поэтому составить прогноз
о его свойствах можно обычным химическим способом,
не прибегая к теоретическим представлениям о строении
электронных оболочек. Однако тут стоит повторить то
же самое, что было однажды сказано в связи с откры-
тием протактиния, считавшегося поначалу экатанталом:
таблица — это модель естественной системы элементов,
и что-то она, как и всякая модель, упрощает. И еще
одно обстоятельство — элемент № 75 занимал «невы-
годное» положение в периодической таблице: сверху
и снизу у него не было соседей, с которыми его можно
сравнить, а соседом справа был не слишком надежный
осмий, сам во многом, как и остальные платиноиды,
представлявший в таблице некоторую аномалию.
Первое предсказание об элементе № 75 сделал в
1871 году Дмитрий Иванович Менделеев. Он заметил,
что в группе марганца непременно должны существо-
вать еще два неоткрытых элемента — экамарганец,
расположенный по порядку атомных весов между мо-
либденом и рутением, и двимарганец — между вольф-
рамом и осмием.
Сколько-нибудь подробно о свойствах экамарганца
и двимарганца Менделеев не высказывался. Его осто-
рожность понятна: поскольку марганец был единствен-
ным известным представителем группы, предсказать
свойства его тяжелых аналогов методом интерполяции
в группе было невозможно, триады в наличии не име-
лось, а экстраполяция была бы слишком рискован-
ной.
И
88
Интуиция и на этот раз не подвела Менделеева.
Однако многие другие химики, исходя из явной
близости свойств элементов по группам у ванадия —
ниобия — тантала и хрома — молибдена — вольфрама,
считали очевидным, что экамарганец и двимарганец
должны быть химическими аналогами марганца и что
искать их следует в марганцевых минералах — напри-
мер, в пиролюзите.
Долголетние неудачи этих поисков привлекли в
1921 году внимание двух молодых немецких химиков —
Вальтера Ноддака и Иды Такке (впоследствии жены
Вальтера). Они начали с того, что составили тщатель-
ные прогнозы важнейших свойств экамарганца и дви-
марганца, а главное — аналитических свойств их сое-
динений, с тем, чтобы разработать наиболее реальный
план открытия этих элементов.
«Для этой цели,— писала позже Ида Ноддак-Так-
ке,— было недостаточно сведений... в известных тогда
учебниках по неорганической химии. Оказалось необ-
ходимым познакомиться с рефератами и оригинальными
статьями почти за сто лет, просмотрев в библиотеках
столько литературы, сколько было возможно за пол-
ный рабочий день на протяжении 11 —12 месяцев... Мы
собирали все указания о свойствах и о химическом
поведении тяжелых металлов, окружающих экамар-
ганцы в периодической системе. При этом мы твердо
установили, что в вертикальных группах системы наблю-
дается не только постоянное изменение свойств элемен-
тов, но и скачкообразное. Подобных скачкообразных
изменений в свойствах по аналогии следовало ожидать
между марганцем и расположенными ниже экамарган-
цами... Мы составляли таблицы и строили кривые, дела-
ли расчеты... наконец, составили подробный прогноз
ожидаемых свойств обоих элементов, искать которые
намеревались. Пользуясь этим прогнозом, мы разрабо-
тали для минералов различных типов точный метод
их химического обогащения. Нам ведь было заранее
известно, что экамарганцы исключительно редки... и
встречаются только в очень низких концентрациях в
минералах, образованных другими элементами (отнюдь
не преимущественно в минералах, содержащих мар-
ганец)... Мы применили наши методы обогащения глав-
ным образом в отношении минералов, содержащих
одновременно возможно большее число тяжелых ме-
89
таллов, прежде всего ближайших соседей экамарган-
цев: молибден, вольфрам, рутений и осмий».
Поскольку рутений и осмий содержатся в сырой
платине, с нее Ноддак и Такке и начали. И уже в 1922 го-
ду выделили из образца уральской платины летучий
белый оксид, весьма похожий на предполагаемый выс-
ший оксид элемента № 75 (вспомним — его сосед осмий
даже название свое получил из-за исключительной
летучести).
Однако незначительное количество этого продукта,
имевшееся у них в руках, было потеряно во время
анализов, а платины они достать больше не смогли.
(Не исключено, между прочим, что первым исследова-
телем, обнаружившим элемент № 75, был русский хи-
мик С. Керн, сообщивший в 1877 году об открытии
им в образце сырой платины с острова Борнео нового
элемента, который он назвал дэвием...)
Итак, платины больше не было, а наиболее доступ-
ными минералами, всегда содержащими примеси мно-
гих тяжелых металлов, были колумбит и танталит.
За их переработку супруги Ноддак и взялись.
Помните — «в грамм добыча, в год труды»? Эту
строку Маяковского можно отнести не только к добыче
радия. Три года потратили Ноддаки на многократное
растворение, выпаривание, выщелачивание, перекрис-
таллизацию более полутора тысяч образцов минера-
лов — и это при наличии заранее разработанных схем!
Правда, в финансовом отношении Ноддаки забот не
знали — всю работу финансировал электротехнический
концерн «Симменс». Руководители концерна надея-
лись, что экамарганцы по своим свойствам подойдут
для изготовления нитей для ламп еще больше, чем
вольфрам. Они тоже неплохо разбирались в таблице
Менделеева.
Разумеется, все получаемые в результате многочис-
ленных операций конечные продукты Ноддаки прове-
ряли на рентгеновском спектроскопе. И наконец в одном
из полученных препаратов обнаружили пять новых
линий — как раз таких, какие были вычислены для эле-
мента № 75 по формуле Мозли. Это произошло в сере-
дине 1925 года.
В том же году об открытии тех же линий в разных
минералах сообщили еще две группы — чешская (Ян
90
Гейровский и В. Долейжак, Прага) и английская
(Ф. Лоринг и И. Друце, Лондон).
Интересное совпадение, неправда ли? То никто, то
сразу три группы исследователей... В процессе откры-
тия химических элементов тоже наблюдаются какие-то
кванты.
5 сентября того же года супруги Ноддак офи-
циально объявили об открытии элемента № 75, назван-
ного ими рением — в честь Рейнской области, родины
Иды Ноддак-Такке.
В следующем, 1926 году они же получили из норвеж-
ского молибденита первые два миллиграмма рения,
а в 1928 году, переработав более полутонны мине-
рала,— первый грамм простого вещества — серебри-
стого, жаропрочного (более жаропрочного, чем вольф-
рам), пластичного металла, стойкого (почти как пла-
тина) к воздействию хлороводородной, серной и фторо-
водородной кислот.
Свойства рения и его соединений с большой точ-
ностью совпали с прогнозными — составленными пер-
вооткрывателями в период составления программы
поиска.
Прогноз Эксперимент
Атомная масса 188 186,31
Плотность 21 20,9
Температура плавления 3300°С 3170°С
Высший оксид ЕМ2°° Ке207
Рений был последним стабильным химическим эле-
ментом, открытым в природе. Все элементы, открытые
после него, не имеют ни одного стабильного изотопа.
Даже те, что расположены гораздо ближе к началу
таблицы.
По отношению к элементам № 85 и № 87 такое
ожидалось: ведь в периодической системе последними
стабильными элементами были элементы № 82
и № 83 — свинец и висмут. После висмута все элементы
были радиоактивными, распадающимися: полоний, ра-
дон, радий, актиний, торий, протактиний, уран.
Но два все еще пустующих места располагались
в таблице не после свинца с висмутом, конечных про-
дуктов распада радиоактивных элементов с неустой-
чивыми тяжелыми ядрами, а до них, и намного до
них. Один — на двадцать с лишним порядковых номе-
ров, а другой' — на сорок!
91
Этого, конечно, предполагать никто не мог. Отсут-
ствие среди открытых элементов экамарганца с поряд-
ковым номером 43 и редкоземельного элемента с поряд-
ковым номером 61 казалось совершенно непонятным.
(Н)
и
N8
К
Си
ВЬ
Ад
Сз
~Д|Г
Ег
Ве
Мд
Са
2п
5г
Сй\
~Ва1
Нд
На
Гв~
Га1
5с
Са
V
1п
Га
Т1
С
81
Л
Се
2г
$п
НГ
РЬ
,11
[■*""
V
А$
№
$0
Та
В!
0
$
Сг
$е
МО
Те
Ж
Ро
Н
Е
С1
Мп
вГ
И
1
Ве
Не]
Ч
Аг
\**\
[КгП
Ни!
хё]
0$
дг ГТ1
Ки 1105 1 106 107 108
Со
№
ВЬ
Рй|
1г
Р!
Се Рг МБЕЗ$П1 Ей СЛ ТЬ Оу Но Ег Тт УЬ М1
ЩШШНр Ри Ат|Ст Вк С1!Е5|Рт Мй||02-1оз
Искусственные химические элементы.
ПЕРВЫЙ ИСКУССТВЕННЫЙ
(ТЕХНЕЦИЙ)
Протактиний, гафний и рений были открыты с раз-
рывом всего в несколько лет — если не считать годы
мировой войны. Следующая пустующая клетка обрела
своего жильца лишь через 12 лет.
92
Аналогично шестнадцатилетнему перерыву в сере-
дине XIX века — между открытием рутения и открытием
цезия — двенадцатилетний перерыв в XX веке был
обусловлен тем, что имевшиеся методы обнаружения
еще не известных элементов исчерпали свои возмож-
ности. А новый поток открытий (начиная с 1937 года)
означал, опять-таки аналогично предыдущему потоку
открытий, появление нового метода, позволившего,
наконец, добраться до неуловимых элементов № 43,
№ 61, № 85, № 87.
То, что все эти элементы были нечетные, само по
себе уже означало их относительную редкость в при-
роде, во всяком случае — тех из них, у которых был
достаточно большой порядковый номер. Но истинные
трудности, связанные с их обнаружением, стали прояс-
няться лишь тогда, когда наука сделала значительный
шаг вперед в изучении изотопного состава каждого
элемента. В 1934 году австрийский физик Иозеф Мат-
таух сформулировал в виде правила, которое так и
называется правилом Маттауха, удивительное явление,
которое впервые еще в 1923 году заметил советский
химик Сергей Александрович Щукарев. Наблюдения
показали, что среди равных по массе изотопов разных
элементов не могут существовать стабильные элементы
соседних порядковых номеров, т. е. если изотоп цирко-
ния с такой-то массой стабилен, то изотоп ниобия с той
же атомной массой будет непременно радиоактивным,
а изотоп молибдена опять может быть стабильным.
Маттаух не нашел в замеченном Щукаревым явлении
ни одного исключения, так вели себя все известные изо-
топы. Следовательно, это был закон, общий для всех
элементов.
Когда «правило Маттауха» применили к четырем
еще не открытым элементам (а сделать это не состав-
ляло труда, ведь каждый из них был окружен изучен-
ными изотопами соседних элементов), то оказалось,
что у них не может быть ни одного стабильного изотопа.
Особенно трудно было представить себе, почему не
может быть стабильно такое сравнительно негромозд-
кое сооружение, как ядро атома элемента № 43. Да
и по отношению к элементу № 61 это казалось совер-
шенно непонятным.
В общем, скрывающиеся элементы были не только
редкими, но и короткоживущими. Это, конечно резко
93
увеличивало трудность их обнаружения. Что касается
малой распространенности, то она была очевидной хотя
бы их простого взгляда на таблицу Менделеева: экаце-
зий должен встречаться настолько реже радия, на-
сколько цезий реже бария; экаиод настолько реже
радона, насколько талий реже свинца; редчайшим
среди редкоземельных мог быть элемент № 61. Пожа-
луй, больше всего шансов оказаться замеченным имел
элемент № 43, экамарганец, которого должно было бы
образовываться никак не меньше, чем рения, но лишь
на короткое время. Впрочем, на какое именно — никто
сказать не мог. И главное — где и как можно было
надеяться найти пусть радиоактивные, распадающиеся,
но все же, хотелось думать, имеющиеся в природе
ядра.
В те годы знали только такие виды радиоактив-
ного распада, при которых от ядра отщеплялась либо
альфа-частица (ядро гелия), либо бета-частица (тогда
было известно, что (3-лучи представляют собой поток
электронов, и только; позже было установлено, что они
имеют более сложный состав). И так как элемент
№ 43 расположен очень далеко от радиоактивных
элементов (все они тяжелее свинца и висмута), то
нельзя было ожидать появления элемента № 43 среди
продуктов распада урана и тория.
Дело могло бы показаться безнадежным, но начи-
ная с 1932 года «охотники за элементами» получили
принципиально новую, хотя вначале только еще теоре-
тическую возможность достигнуть успеха. От поисков
новых элементов, созданных силами природы, они могли
перейти к самостоятельному, искусственному созданию
этих еще неизвестных элементов.
В 1932 году сотрудник Резерфорда Джеймс Чедвик
открыл нейтрон (подробнее об открытии нейтрона будет
рассказано дальше). Вскоре после того стало известно,
что ядро любого атома состоит из протонов и нейтро-
нов (нейтронов нет только в ядре самого легкого изо-
топа водорода) Стало известно, что число протонов
определяет значение положительного заряда ядра,
а общее число протонов и нейтронов — массу ядра
(массовое число). Следовательно, чтобы создать искус-
ственно тот или иной изотоп того или иного элемента,
надо «соорудить конструкцию» из заранее известного
числа протонов и нейтронов.
94
Это можно сделать, в принципе, двумя путями,
подойти к делу с двух сторон. Можно идти со стороны
более массивных ядер, отбирая у них часть протонов
и нейтронов. Можно идти со стороны менее массивных
ядер, дополнительно вводя недостающие протоны
и нейтроны. Например, экамарганец, элемент № 43,
можно было попытаться создать искусственно из
элемента № 44, рутения, либо из элемента № 42, мо-
либдена. Элемент № 87 можно было попытаться по-
лучить подобными же способами: из последующего за
ним радия или из предшествующего ему радона. И так
далее.
Но принципиальная возможность — это еще не все,
нужны технические средства. А какие средства имелись
тогда в распоряжении ядерной физики? Только суще-
ствующие в природе радиоактивные изотопы.
При бета-распаде, когда из ядра вылетал электрон,
заряд ядра становился на единицу больше — один из
его нейтронов превращался в протон, и получался сле-
дующий по порядковому номеру элемент. При альфа-
распаде ядро теряло два положительных заряда и ста-
новилось ядром химического элемента на два порядко-
вых номера меньше. Так, при бета-распаде радона
должен был бы получиться элемент № 87. И он же
должен был бы получиться при альфа-распаде актиния.
Существовала и еще одна заманчивая возможность.
Можно было попытаться бомбардировать вылетаю-
щими из радиоактивных ядер альфа-частицами ядра
других элементов — при этом, не исключено, некоторые
альфа-частицы слились бы с некоторыми ядрами и обра-
зовали элементы на два порядковых номера больше.
Правда, тут была одна капитальная трудность.
Альфа-частица имеет заряд +2 и все прочие ядра
заряжены положительно, причем чем больше их поряд-
ковый номер, тем соответственно больше и заряд. Но
одноименные заряды отталкиваются.
Вот если бы можно было разогнать посильнее альфа-
частицу или, еще лучше, частицу, имеющую не два
заряда, а всего один, тогда слить какие-нибудь ядра
с такими частицами удалось бы со значительно большей
долей вероятности.
В том, что такой «разгон» осуществить можно, сом-
нений не было. Любая заряженная частица взаимодей-
ствует с электромагнитным полем, а значит, может
95
быть разогнана с помощью электрического тока (как
например, разгоняются электроны в рентгеновской
трубке).
Но для того, чтобы разогнать не электрон, а напри-
мер, частицу с зарядом + 1, ядро водорода, в 2000 раз
более массивное, чем электрон, надо было и ускоритель
создать гораздо более мощный, чем рентгеновская труб-
ка. А для разгона ядер гелия (альфа-частиц) — еще
более мощный. Кстати, ядро обычного водорода не
всегда подходит в качестве кирпичика в ядерном строи-
тельстве. Во многих случаях надстраивать ядра одними
протонами нельзя, требуются еще и нейтроны. Поэтому
«снаряд» должен содержать не один протон, а как
минимум один протон и один нейтрон; такая частица
существует: это дейтрон, ядро атома тяжелого водо-
рода, дейтерия. Дейтрон разогнать легче, чем альфа-
частицу.
В общем, на повестке дня стоял один вопрос: созда-
ние ускорителя.
Как обычно, человеческая мысль вначале движется
по традиционным путям. И сначала физики стали
строить ускорительные трубки — наподобие рентгенов-
ских, только огромные. Но и эти гиганты не могли
разгонять дейтроны и альфа-частицы до нужных ско-
ростей.
Нужно были отойти от традиционных представлений.
Американский физик Эрнест Орландо Лоуренс, рабо-
тавший в городе Беркли, в Калифорнийском универ-
ситете, изобрел циклотрон. Циклотрон раскручивал
заряженную частицу, как праща раскручивает камень,
и затем направлял ее в мишень. Физики в Беркли
метали дейтроны и ядра гелия в тончайшие метал-
лические листочки.
Надо сказать, что американцы вовсе не задавались
при этом целью создать новые ядра, это их в то время не
интересовало. Просто они хотели посмотреть, что прои-
зойдет при столкновении ядер, при разрушении одним
ядром другого ядра.
Это было прямым продолжением классических опы-
тов Резерфорда и других европейских физиков, получив-
ших множество замечательных результатов, например,
открывших нейтрон при бомбардировке бериллиевых
листочков альфа-частицами, вылетавшими из радиоак-
тивных препаратов.
96
На циклотроне Лоуренса в Беркли и был синтези-
рован первый искусственный элемент. Однако сама по
себе возможность такого синтеза была еще столь гипо-
тетична в глазах большинства исследователей, что ни
сам Лоуренс, ни работавшие на его циклотроне другие
физики и радиохимики происшедшего эпохального
события даже не заметили.
О нем догадался работавший в Риме молодой
итальянский физик Эмилио Сегре.
Разумеется, циклотрон ускорял не одну частицу,
а целый поток частиц. Для того чтобы частицы отбрасы-
вались в нужную сторону — в сторону мишени, Лоуренс
поставил у них на пути металлический зуб. А чтобы
бешено мчащиеся частицы не смогли расплавить его,
1оуренс сделал зуб из тугоплавкого молибдена.
Это было известно десяткам, а может быть, даже
сотням физиков. Но только один из них, а именно
Эмилио Сегре, догадался, что из всего этого с неизбеж-
ностью должно было проистекать.
Часть раскрученных в циклотроне дейтронов, ядер
тяжелого водорода, ударившись о молибденовый зуб,
должна была поглотиться им, слиться с ядрами молиб-
дена. А это означало, что часть атомов молибдена пре-
вращалась в атомы следующего по порядковому номеру
элемента. И поскольку порядковый номер молиб-
дена 42, то некоторые его атомы неминуемо должны
были превратиться в загадочный и неуловимый элемент
№ 43 — менделеевский экамарганец.
Именно об этом превращении и догадался Сегре.
Он раздобыл кусок облученного молибденового зуба
и проверил, не излучает ли он. Ведь у элемента № 43
все изотопы должны быть радиоактивными — по пра-
вилу Маттауха. Оказалось, что излучает бета-частицы.
Впрочем, из этого еще не следовало, что в нем
непременно присутствует именно элемент № 43. За три
года до того, как Сегре начал работу с облученным
в циклотроне молибденом, дочь и зять Марии Кюри —
Ирен Кюри и Фредерик Жолио-Кюри обнаружили, что
стабильные атомы, будучи облучены, могут превра-
щаться в радиоактивные изотопы других элементов.
Они открыли искусственную радиоактивность, искус-
ственное превращение элементов, ядерную алхимию.
В опытах Сегре излучение могло быть вызвано не
элементом № 43, а другими искусственными радио-
4 Зак. 527
97
активными изотопами, которые могли образоваться
как из самого молибдена, так и из примесей.
30 января 1937 года Сегре и помогавший ему химик
Карло Перье растворили 200 миллиграммов облучен-
ного молибдена в царской водке. Затем из раствора
стали последовательно удалять «близлежащие» к
искомому экамарганцу металлы — сам молибден, дви-
марганец — рений, марганец, ниобий, рутений, цирко-
ний. Однако и после этого излучение не исчезло.
Теперь излучателем мог быть только элемент № 43.
В июне опыты были закончены, и Сегре объявил
об открытии первого искусственного нового элемента.
Первооткрыватели так и назвали его технеций — по-
гречески «искусственный».
А еще через два года, когда была обнаружена
способность ядер урана-235 делиться, раскалываясь
пополам, среди продуктов деления химических элемен-
тов средней части периодической таблицы были найдены
и ядра технеция. Таким образом, элемент «искусствен-
ный» образуется в природе и естественным путем,
хотя в земных условиях — в крайне незначительном
количестве.
Любопытно, что технеций обнаружен в спектре
одной из звезд созвездия Андромеды, причем, судя
по интенсивности его спектральных линий, он встреча-
ется на этой звезде не реже, чем цирконий, молибден,
ниобий и рутений.
В ядерных реакторах технеций накапливается в
довольно больших количествах: 10 г на 1 кг осколков,
т.е. один процент. Это главным образом изотоп Те "
с периодом полураспада более 200 000 лет, вполне
достаточным для того, чтобы можно было его исполь-
зовать как обычный металл.
Металлический технеций больше похож на рений,
чем на марганец. Он тоже тяжелый, тугоплавкий —
точка плавления 2140 °С — и химически стойкий.
ПОИМКА ЭКАЦЕЗИЯ
(ФРАНЦИЙ)
Из-за несомненной принадлежности экацезия к ще-
лочным металлам долгое время пытались его искать
в лепидолите и поллуците, в самарските, в соленой воде,
например, Мертвого моря, в золе различных трав и гри-
бов, даже в пепле сигар. И не раз появлялись сооб-
щения о том что эти поиски привели к успеху. В хими-
ческой литературе ненадолго возникали обретенные эка-
цезием имена «алкалиний», «виргиний», «Молдавии».
Последнее название предложено румынским химиком
Г. Хулубеем в 1937 году, когда уже было более или
менее ясно, что экацезий должен быть нестабильным
и по всей вероятности быстро распадающимся эле-
ментом
Первым о существовании элемента № 87 в качестве
одного из продуктов распада актиния сообщил Джон
Кренстон, первооткрыватель протактиния. Еще в
1913 году он заметил слабое альфа-излучение у изо-
топа актиния. Актиний, элемент №89, теряя альфа-
частицу, два положительных заряда, превращался
в элемент № 87. Кренстон заметил излучение у изотопа
актиния с массовым числом 228. Значит, атомы этого
изотопа превращались в изотоп акацезия с массовым
числом 224.
Впоследствии этот факт подтвердился Но в 1913 го-
ду на сообщение Кренстона внимания не обратили.
Год спустя три австрийских физика — Мейер, Гесс
и Панет обнаружили подобное же альфа-излучение
у другого изотопа актиния — с массовым числом 227.
Значит, небольшая часть атомов и этого изотопа тоже
превращалась в ядра элемента № 87 с массовым
числом 223.
И к этому сообщению химики отнеслись без боль-
шого доверия.
Недоверие и невнимание объяснялись тем, что в те
годы исследователи радиоактивных веществ нередко
работали с недостаточно чистыми материалами и поэто-
му допускали немало ошибок.
Но вот прошло еще 12 лет, радиохимики накопили
значительный опыт. И тогда нашелся исследователь,
который взялся за планомерный поиск элемента № 87.
4*
99
Это была ученица Марии Кюри — Маргарита Пере.
В 1938 году она повторила эксперименты трех
австрийцев и убедилась, что их наблюдения были совер-
шенно правильными: актиний-227, несомненно, испу-
скал альфа-частицы.
Теперь надо было доказать, что это излучение дей-
ствительно принадлежит актинию, а не протактинию,
элементу № 91. Иначе в результате наблюдаемой
ядерной реакции получался бы не экацезий, а все тот
же актиний. И Маргарита Пере принялась за очистку
излучающего раствора от нещелочных элементов.
Сначала с помощью гидроксида церия она удалила
радиоактиний, изотоп тория, из которого получается
протактиний, затем, с помощью карбоната бария,—
радий, дочерний продукт распада актиния, и затем,
с помощью гидроксида лантана,— актиний.
Оставшийся раствор мог содержать только щелоч-
ные и аммонийные соли. Маргарита Пере выпарила
раствор и проверила радиоактивность полученного
осадка; он излучал бета-частицы, причем его актив-
ность довольно быстро падала — период полураспада
неизвестного радиоактивного изотопа равнялся 22 ми-
нутам.
То, что этот изотоп имел щелочные свойства,
подтверждало предположение: да, актиний превра-
щался в экацезий. Теперь надо было найти подходящий
носитель. Естественно, наиболее подходящим для эка-
цезия носителем должен был быть сам цезий.
Снова растворив осадок, Пере добавила к раствору
перхлорат цезия и затем осадила его. Кристаллы
перхлората цезия стали радиоактивными, и активность
их убывала с все тем же периодом полураспада —
22 минуты. Будь жив Митчерлих, открывший закон
изоморфизма, он бы порадовался.
Итак, теперь сомнений быть не могло: менделеев-
ский экацезий, последний щелочной металл, тяжелый
радиоактивный аналог цезия, наконец пойман. 9 сентяб-
ря 1939 года Маргарита Пере официально объявила
о своем открытии. Семью годами позже она предло-
жила для элемента № 87 название франций — в честь
своей родины. В 1949 году это название было официаль-
но утверждено.
Маргарита Пере разработала методы извлечения
франция, но достаточные для взвешивания количества
100
его никогда получены не были. Только 1,2 % атомов
актиния-227 распадаются с образованием франция.
Подсчитано, что во всей земной коре содержится
немногим более полукилограмма атомов элемента № 87.
Франций был последним элементом, впервые обна-
руженным в природном продукте.
В принципе он мог быть открыт гораздо раньше:
первые наблюдения, позволявшие сделать вывод о его
наличии, были, как уже говорилось, сделаны еще
в 1913 году. И если он был открыт лишь через 22 года
после протактиния, который тоже нашли в природных
продуктах, и примерно теми же методами, то потому
лишь, что франция в земной коре в 100 000 000 раз
меньше, чем протактиния.
ВТОРОЙ ИСКУССТВЕННЫЙ
(АСТАТ)
Та же самая закономерность — более позднее откры-
тие менее распространенного элемента — очень хорошо
проявилась в истории открытия следующего элемента,
для которого в периодической таблице отводилась
пустующая клетка № 85.
В земной коре его в десятки раз меньше, чем фран-
ция. По современным подсчетам, общее его количество
в каждый данный момент не превышает 30 граммов.
Но природный экаиод был обнаружен уже после того,
как он был получен искусственным путем. Как это сде-
лать, после синтеза технеция было совершенно оче-
видно.
Технеций, элемент № 43, образовался в циклотроне
при бомбардировке молибдена, элемента № 42, дейтро-
нами, ядрами тяжелого водорода. К 42 протонам
добавили еще один, получилось 43 — именно столько,
сколько нужно для ядра атома технеция. В то время
с помощью циклотрона или естественных излучателей,
например радия, можно было прибавлять к ядрам
других элементов либо один протон — тогда получался
элемент со следующим порядковым номером (как
в случае с технецием), либо два протона (альфа-
частицу) — тогда номер элемента увеличивался на два.
В
101
Этими способами нельзя было получить франций, ибо
не было подходящей мишени: радон —-газ, а экаиод
еще не был получен. И франций пришлось открывать
в природном веществе.
Иное дело элемент № 85. Чтобы его получить, доста-
точно было взять ядро висмута и вбить в него альфа-
частицу. Принципиальная возможность такой операции
после получения технеция сомнений не вызывала.
Нужен был лишь достаточно мощный циклотрон, кото-
рый мог бы придать альфа-частицам достаточно энер-
гии, чтобы они были в состоянии преодолеть отталки-
вающую силу положительно заряженного ядра атома
висмута. В конце 30-х годов такой ускоритель был
построен, все в том же Беркли.
Синтезом элемента № 85 занялся в 1940 году эмиг-
рировавший в США из фашистской Италии первооткры-
ватель технеция Эмилио Сегре вместе с двумя амери-
канцами — Д. Корсоном и К. Мак-Кензи. В том же году
им удалось зарегистрировать образование ядер изотопа
элемента № 85 с периодом полураспада 7,5 часа. До-
казательством образования именно этого элемента
служили ядерные превращения при дальнейшем его
распаде.
В 1943 году австрийские химики Б. Карлик и Т.Бар-
нет доказали, что элемент № 85 непременно должен
существовать в природе, потому что его атомы должны
образовываться при распаде полония-218. Затем было
доказано, что разные изотопы элемента № 85 обра-
зуются при распаде урана и тория.
Химическим путем природный экаиод удалось
выделить американцам Э. Хайду и А. Гиорсо из продук
тов распада франция-223.
В 1947 году по предложению первооткрывателей
новый элемент получил название «астатин», а еще
немного позднее это название изменили на «астат».
Оба названия образованы от греческого слова «аста-
тос» — «неустойчивый». Действительно, в то время
неустойчивость, нестабильность, атомов экаиода каза*
лась поразительной. Самый долгоживущий его изотоп
имеет период полураспада 8,3 часа.
Существование экаиода в естественной системе
элементов было предсказано еще Менделеевым. На
основании периодического закона Менделеев опреде-
лил некоторые его свойства, в частности атомную массу,
102
которая, согласно предсказанию, должна была превос-
ходить атомную массу водорода примерно в 215 раз.
Предсказания эти оправдались полностью. Атомная
масса астата оказалась равной 214,998!
По своим химическим свойствам астат, с одной
стороны, сходен с иодом, а с другой — близок к тяже-
лым металлам, например к полонию.
Обращает на себя внимание тот факт, что экаиод
и экацезий — последний щелочной металл и последний
галоген — были открыты почти одновременно. Истори-
ческая судьба элементов этих групп — наиболее резко
выраженных металлов и наиболее резко выраженных
неметаллов — вообще близка. И началось знакомство
человека с этими элементами одновременно, а с их
наиболее распространенным соединением, поваренной
солью,— с глубокой древности. И периодический закон
был «подсказан» сопоставлением щелочных металлов
с галогенами.
Из всех химических элементов (по уран включи-
тельно) астат — самый редкий. И если бы результатив-
ность поисков новых элементов зависела только от их
распространенности, то астат должен был бы скры-
ваться от исследователей дольше всех своих собратьев.
Однако на самом деле астат был обнаружен не послед-
ним из всех элементов до урана, а предпоследним.
Последним же был найден элемент № 61, которого
в природе, а точнее, в земной коре примерно втрое
больше, чем астата. Впрочем, тут нет ничего удиви-
тельного: элемент № 61 по своему положению в таблице
относится к лантаноидам, которые никогда не были
легким объектом для исследователей.
Но прежде чем это случилось, прежде чем уда-
лось открыть последний лантаноид, в истории открытия
элементов произошли события, по своим последствиям
несопоставимые со всеми предыдущими: вооружен-
ные циклотроном исследователи изготовили элемен-
ты с порядковым номером большим, чем у урана.
РАЗДВИГАЯ ГРАНИЦЫ
(НЕПТУНИЙ)
Первая попытка раздвинуть границы периодической
системы, искусственно получить заурановые элементы,
была предпринята выдающимся итальянским физиком
Энрико Ферми в 1934 году с помощью метода, для
объяснения которого следует вернуться еще на два
года назад, к тому времени, когда Джеймс Чедвик
открыл нейтрон.
Впрочем, если начинать с самого начала, то надо
отступить еще почти на двадцать лет. Незадолго до
первой мировой войны Эрнст Резерфорд поручил своему
ассистенту Эрнсту Марсдену провести эксперименты
по обстрелу альфа-частицами, вылетавшими из радия,
различных веществ. И в этих экспериментах Марсден
обнаружил неизвестно откуда берущиеся потоки ядер
водорода. Марсден предположил, что их источник
тот же, что и у альфа-частиц — радиевая соль. И что,
следовательно, радий, помимо уже известных альфа-
частиц, бета-частиц и гамма-лучей (высокоэнергичных
квантов электромагнитного излучения), испускает еще
и водородные ядра.
Затем началась война, Марсдена забрали в армию,
и опыты прекратились.
Возобновил их Резерфорд уже с другим помощни-
ком — Джеймсом Чедвиком. Они установили, что ядра
водорода действительно вылетают, только не из радия,
а из атомов азота. Это означало, что ядра атомов
водорода входят в состав атомов других обычных
элементов. Разумеется, Резерфорд вспомнил Праута.
Он назвал эти водородные ядра, входящие в состав
других ядер, протонами (как уже говорилось, от гре-
ческого слова «протос» — первый, исходный, на-
чальный).
Но на этом Резерфорд не остановился. Он заду-
мался над тем, как может быть устроено ядро более
массивное, чем ядро атома водорода, например, как
устроено ядро следующего за водородом элемента,
гелия.
У ядра гелия два положительных заряда; следова-
тельно, в нем имеются два протона. Но масса гелия не
вдвое, а вчетверо превышает массу ядра водорода;
104
значит, рассуждал Резерфорд, там имеются не два,
а четыре протона, только два заряда из четырех нейтра-
лизуются отрицательными зарядами двух электронов,
которые, следовательно, тоже имеются в ядре гелия.
В том, что электроны могут находиться в ядрах элемен-
тов, у Резерфорда не было никаких сомнений. Ведь
существование бета-лучей было надежно установлен-
ным фактом.
Но, размышлял далее Резерфорд, если ядро гелия
состоит из четырех протонов и двух электронов, то,
значит, одного электрона хватает для того, чтобы
прочно связать два протона. Следовательно, еще
более прочной, чем ядро гелия, могла бы быть система,
в которой один электрон приходится не на два протона,
а на один протон. И вроде бы нет никаких причин, отчего
бы такой конструкции не существовать на самом деле.
Почему же она до сих пор не обнаружена? Потому,
вероятно, что не так-то легко обнаружить нейтральную
частицу: ведь частица, состоящая из одного протона
и одного электрона, не должна иметь электрического
заряда. Следовательно, это объект, у которого заряд
ядра нулевой и электронной оболочки нет вообще Он
не будет взаимодействовать ни с химическими веще-
ствами, ни с магнитным полем.
Такой гипотетический, в принципе не исключенный
законами природы, но никем и никогда не наблюдав-
шийся объект Резерфорд назвал нейтроном.
В течение полутора десятков лет придуманный Ре-
зерфордом нейтрон никому ни для чего не пригодился.
В полном забвении он находился до 1932 года, когда
понадобился самым срочным образом, потому что
в ядерной физике возникла новая ситуация.
Еще в 1930 году два немецких физика наблюдали
совершенно необъяснимое явление. Они обстреливали
альфа-частицами из ампулки с солью полония разные
металлические листочки. И все шло обычным образом,
пока они не сделали мишень из тончайшего листочка
бериллия. Вот тут появился странный эффект — все
выглядело так, как будто бы за пластинкой возникал
мощный поток лучей. Но на магнитное поле этот поток
никак не реагировал. Вальтер Боте и Ганс Беккер, так
звали исследователей, известили коллег о странных
«бериллиевых лучах», однако понять, с чем они имеют
дело, не смогли.
105
Тотчас же после того, как появились первые сообще-
ния Боте и Беккера, их опыты повторили супруги Жо-
лио-Кюри. Все было верно: из облученной полонием
бериллиевой пластинки шел мощный поток странной
радиации. Что это была за радиация? Почему не реаги-
ровала на магнит? И, главное, откуда бралась? Ведь
«доподлинно» было известно, что ничего, кроме прото-
нов и электронов, в ядрах атомов нет, а в оболочках
нет ничего, кроме электронов!
Супруги Жолио-Кюри тоже не нашли объяснения
странному эффекту.
Узнал о «бериллиевых лучах» и Джеймс Чедвик —
тот самый Джеймс Чедвик, который вместе с Резерфор-
дом экспериментально установил наличие в ядрах эле-
ментов протонов и вместе с Резерфордом мечтал о нейт-
роне — идеальном, неотталкиваемом снаряде для
обстрела атомных ядер. Чедвик провел подробные
исследования, в ходе которых установил, что «берил-
лиевые лучи» состоят из нейтральных частиц с массой,
близкой по величине к массе протона. Получалось, что
придуманные Резерфордом диковинные нейтральные
объекты существуют на самом деле, а именно в ядрах
атомов бериллия, и вряд ли одного лишь бериллия.
27 февраля 1932 года Чедвик объявил об открытии
еще одной внутриядерной частицы — предсказанного
Резерфордом нейтрона. И прежняя модель ядра (из
протонов и электронов) должна была уступить место
новой модели — из протонов и нейтронов (нуклонов).
Первыми ее постулировали советский физик Дмитрий
Дмитриевич Иваненко и итальянец Этторе Майорана.
Такая модель могла, наконец, объяснить, что же такое
в самом деле изотопы, почему они, будучи химически
подобными, различаются своей массой. Теперь это стало
понятным: на одно и то же число протонов в их ядрах
приходится разное число нейтронов.
Как и предполагал Резерфорд, нейтроны оказались
идеальными снарядами для обстрела атомных ядер:
масса, как у протона, и полная индифферентность по
отношению к кулоновским силам ядер. Физики, зани-
мавшиеся изучением ядра, сразу же оценили новое
научное оружие. Опытами по обстрелу ядер нейтронами,
т. е. излучением, возникавшим за бериллиевой пластин-
кой, подвергавшейся в свою очередь обстрелу альфа-
лучами, занялись сразу несколько групп физиков
106
и химиков. Новый метод, как это бывало и прежде,
сулил новые результаты.
Конечно, никто не предполагал тогда, что весьма
скромные опыты закончатся результатами, которые до
основания потрясут весь мир, дадут человечеству неви-
данной мощи орудия войны, невиданного размера
источники энергии.
Наиболее упорно и последовательно работали две
группы исследователей — одна в Риме, под руковод-
ством двадцатипятилетнего Энрике Ферми, другая
в Берлине под руководством Отто Гана. И те и другие
рассчитывали получить элементы с порядковым номе-
ром более 92, рассуждая так: поглотив один или не-
сколько нейтронов, атомы урана испустят бета-лучи,
и таким образом возникнут элементы, чье место в перио-
дической таблице на одну или даже несколько клеток
дальше.
Согласно общепринятым тогда взглядам на перио-
дическую систему, элемент № 93 должен представлять
собой аналог рения. И действительно, среди продуктов,
полученных при воздействии нейтронов на уран, Ферми
заметил такие, которые были по свойствам подобны
рению. Но еще больше продуктов оказались похожими
на редкоземельные металлы, а также на... бром, на...
рубидий, на... стронций. Этому не находилось никаких
объяснений.
Такими же непонятными были результаты, получен-
ные немецкими исследователями.
Некоторое время физики топтались на месте. Но
в 1939 году Ган и его сотрудник Штрассман совер-
шенно точно установили, что при бомбардировке альфа-
частицами урана у них получался барий: поглотив один
или несколько нейтронов, ядро с 92 протонами превра-
щалось в ядро с 56 протонами. Это могло означать
только одно: ядерное взаимодействие протекало совер-
шенно иначе, чем предполагали ранее. Вместо посте-
пенного наращивания ядра происходило его разруше-
ние. Нейтрон разваливал ядро урана.
Догадались об этом не Ган со Штрассманом, а уз-
навшая об их экспериментах Лизе Мейтнер, эмигриро-
вавшая к тому времени из гитлеровской Германии,
и ее племянник Отто Фриш.
Так было установлено, что при попадании нейтрона
в ядро урана оно делится примерно пополам, образуя
107
два ядра элементов средней части периодической таб-
лицы. При этом могут возникать и ядра технеция.
Именно технеций, вероятно, и ввел в заблуждение
Энрико Ферми, считавшего одно время, что он синте-
зировал экарений, элемент № 93.
Однако совсем не эти соображения обратили на
работу Гана и Штрассмана внимание всех самых круп-
ных физиков мира. Исходя из существовавших пред-
ставлений об энергиях связи между нуклонами в ядрах
с разными массовыми числами, можно было предпо-
ложить, что при делении атома урана на две части
должно непременно высвобождаться гигантское коли-
чество энергии.
После многочисленных сложных экспериментов по
определению числа новых нейтронов, образующихся
при делении ядра урана-235, возникла надежда, а затем
и уверенность в том, что удастся осуществить цепную
ядерную реакцию.
Так поиски новых элементов привели к открытию
способа производства (чаще говорят — высвобожде-
ния) огромных количеств ядерной энергии. Это один
из самых убедительных примеров исключительного
значения фундаментальных научных исследований для
практики, для всей человеческой цивилизации.
12 декабря 1942 года эмигрировавший из фашист-
ской Италии в США Энрико Ферми пустил первый
атомный котел — ядерный реактор. Работа по со-
зданию атомного оружия, а затем и ядерной энерге-
тики была несопоставима по масштабам с исследова-
ниями, направленными на поиск и синтез новых хими-
ческих элементов. Но в качестве ее ответвления эти
исследования также приняли более широкий и целе-
направленный характер. Дело в том, что в распоряже-
нии ученых-атомняков было не так уж много ядер-
ного горючего.Способным к делению тепловыми нейтро-
нами оказался сравнительно мало распространенный
в природе изотоп урана с массовым числом 235.
А от заурановых элементов можно было ожидать такой
же способности, как у этого изотопа. Заурановые эле-
менты могли оказаться новым ядерным горючим.
Впрочем, первый трансуран был открыт раньше,
чем эти соображения стали волновать физиков, и не
только физиков.
События развивались так.
108
В том же 1939 году, когда выяснилось, что нейтроны
способны делить ядро урана примерно пополам, физик
Эдвин Макмиллан из Калифорнийского университета
занялся изучением этих осколков. Его интересовало,
какое расстояние они могут преодолеть.
Макмиллан поставил такой эксперимент. Разогнан-
ные в циклотроне дейтроны, ядра тяжелого водорода,
с огромной силой ударяли в бериллиевую пластинку,
выбивая из нее поток нейтронов, который, в свою оче-
редь, ударял в слой оксида урана, нанесенный на первый
листок гармошки, изготовленной из папиросной бумаги.
Осколки от деления урановых ядер должны были
застревать в других листках бумажной гармошки, где
их можно было обнаруживать по излучению.
Все получилось так, как ожидал Макмиллан,—
в соответствии со своей массой и энергией осколки ока-
зывались в местах, менее или более удаленных от
первого листка с оксидом урана.
Но кроме этого ожидаемого результата эксперимент
подарил Макмиллану два неожиданных: в листке со
слоем оксида урана появились два новых излучателя —
один с периодом полураспада 23 минуты, другой
2,3 суток. По данным Отто Гана и Лизе Мейтнер,
с периодом в 23 минуты распадался тяжелый изотоп
урана с массой ядра 239. Значит, этот изотоп образо-
вывался в установке Макмиллана из обычного ура-
на-238, который захватывал нейтрон. Естественно, что
такое тяжелое ядро не могло покинуть листка с оксидом
урана под ударом нейтрона.
Но в таком случае и другой новый излучатель,
раз он находился тут же, должен был быть достаточно
массивным. Если он был продуктом бета-распада ура-
на-239, то его порядковый номер обязан был быть 93.
Трансуран!
Прежде всего следовало доказать, что неизвестный
новый излучатель не имеет отношения к осколкам от
деления урана. Макмиллан знал, как это сделать.
Было известно, что ядра урана-235 делятся не всякими
нейтронами, а только тепловыми — медленными, обла-
дающими сравнительно небольшой энергией. Вместе
с тем было известно, что именно такие малоэнергичные
нейтроны хорошо поглощаются кадмием.
Макмиллан покрыл листок с оксидом урана кадмие-
вой фольгой, запустил свою установку и убедился,
109
что кадмий нисколько не уменьшил количества обра-
зующихся излучателей с периодом полураспада 23 ми-
нуты и 2,3 суток. Это подтвердило, что новые излуча-
тели не осколки, а какие-то элементы с массивным
ядром.
Можно было приступать к химическому опозна-
нию — химической идентификации неизвестного излу-
чателя с периодом полураспада 2,3 суток.
С помощью своего друга химика Филиппа Эйбел-
сона Макмиллан принялся изучать химические свойства
этого излучателя. Они убедились, что он не походит
на рений, но очень походит на уран. И то и другое они
определили методом изотопных носителей, которым
пользовался Сегре при открытии технеция. Для того
чтобы определить, не аналог ли рения новый излуча-
тель, к раствору добавляли рений, а затем его осажда-
ли: экарений должен был бы уйти в осадок вместе с ре-
нием. Этого не произошло. Новый излучатель остался в
растворе.
Чтобы получить точный ответ на вопрос о химиче-
ской индивидуальности нового радиоактивного изотопа,
следовало попытаться исследовать его обычными мето-
дами химического анализа. Для этой цели искусней-
шими стеклодувами была изготовлена сверхминиатюр-
ная химическая посуда — пробирки и мензурки
объемом в стотысячную долю миллилитра, соответ-
ствующие микропипетки, микроцентрифуги и другой
инструментарий. Всю аппаратуру установили на пред-
метном столике микроскопа.
Излучатель с периодом полураспада 2,3 суток уда-
лось осадить вместе с избытком редкоземельных метал-
лов. Весь осадок растворили в серной кислоте, доба-
вили фтористоводородную кислоту, осадили редкозе-
мельные металлы. Затем в виде гидроксида осадили
новый изотоп и прокалили его.
Так бь|ли получены первые микрограммы нового эле-
мента — первого трансурана. По имени первой транс-
урановой планеты Нептун элемент № 93 назван был
нептунием.
В 1942 году в ядерном реакторе был обнаружен
гораздо более долгоживущий изотоп нептуния с перио-
дом полураспада свыше двух миллионов лет.
Впоследствии оказалось, что под воздействием
космических лучей и нейтронов, испускаемых ураном
110
при спонтанном* делении, нептуний (правда, в ничтож-
ном количестве) образуется и в природных условиях.
Долгоживущий нептуний-237, распадаясь, образует
в конечном счете один из изотопов висмута.
НОВОЕ ЯДЕРНОЕ ГОРЮЧЕЕ
(ПЛУТОНИЙ)
В декабре 1940 года, через несколько месяцев после
выделения Макмилланом и Эйбелсоном нептуния, тот
же Макмиллан вместе с радиохимиками Сиборгом,
Уолом и Кеннеди, облучая уран ускоренными в циклот-
роне ядрами дейтерия, превратили некоторые ядра
урана в короткоживущий изотоп нептуний-238. А этот
изотоп, излучая бета-частицу, превратился в изотоп
следующего трансуранового элемента — № 94 с перио-
дом полураспада около 80 лет.
Новый элемент назвали плутонием, по имени сле-
дующей за Нептуном планеты Плутон, открытой
в 1930 году. Любопытное совпадение: химический эле-
мент уран был открыт Клапротом тоже через десять
лет после открытия планеты Уран.
А в 1941 году Сиборг, Кеннеди, Уол и Сегре, изу-
чая продукты распада нептуния-239, обнаружили еще
один изотоп элемента № 94 — с массовым числом 239.
Этот изотоп оказался столь же необычным, как и
уран-235: медленные нейтроны делили его пополам,
и при этом испускалось несколько новых нейтронов.
Новое ядерное горючее!
При ядерном распаде одного ядра плутония-239
выделяется в 50 миллионов раз больше энергии, чем
при сгорании одного атома углерода; это примерно
столько же, сколько дает распад ядра урана-235. ^Уо
при этом у плутония есть то колоссальное преимуще-
ство, что в него можно превратить весь уран-238.
* Спонтанное, самопроизвольное, деление некоторой части ато-
мов урана было обнаружено в 1939 году молодыми советскими
физиками Георгием Николаевичем Флеровым и Константином Анто-
новичем Петржаком, работавшими под руководством Игоря Василье-
вича Курчатова.
9
111
Плутоний-239 образуется в ядерных реакторах. Туда
загружают природный уран, т. е. природную смесь
урановых изотопов, и под воздействием нейтронов,
главным образом тех, что испускаются ураном-235,
ядра урана-238 превращаются в ядра плутония-239.
Поскольку урана-238 — сырья для производства
плутония — в природном уране содержится в сто с лиш-
ним раз больше, чем делящегося медленными нейтро-
нами урана-235, плутоний оказался не просто еще
одним ядерным горючим, а главным ядерным горючим.
И, судя по всему, до решения проблемы управляемого
термоядерного синтеза таковым и останется.
Пожалуй, после получения железа и открытия урана
не было в истории ознакомления человечества с хими-
ческими элементами события, которое по своей важно-
сти можно было бы сопоставить с синтезом плутония.
В принципе так же, как и в урановом реакторе,
плутоний образуется в природе, только в миллиард
миллиардов раз медленнее. Плутония на земле в 400 000
раз меньше, чем радия.
Химические свойства плутония удивили исследова-
телей не меньше, чем свойства нептуния. Как нептуний
оказался вовсе не похожим на рений, так плутоний
оказался вовсе не похожим на осмий, хотя в соответ-
ствии с периодическими таблицами тех лет ему полага-
лось быть именно экаосмием. Больше всего плутоний,
как и нептуний, походил на уран, и еще почему-то —
на редкоземельные элементы, особенно на самарий. Это
очень затрудняло его выделение.
Химически чистый плутоний — серебристый, очень
тяжелый металл плотностью почти 20 г/см3— получили,
восстановив его тетрафторид парами бария при темпе-
ратуре 1200 °С — т. е. тем же классическим способом,
каким Берцелиус получил торий. Плавится плутоний
довольно легко — уже при 640 °С.
В общем, второй трансурановый задал немало
загадок и теоретикам, и практикам. И прежде чем
двигаться дальше, в глубь страны Трансурании, было
бы хорошо главные из этих загадок разгадать.
СЕМЕЙСТВО
АКТИНОИДОВ
В начале 40-х годов казалось очевидным, что теми
же в принципе способами, какими из урана были
получены нептуний и плутоний, можно из плутония
получить следующие трансураны. И еще одно было
вроде бы очевидно: раз нептуний и плутоний по своим
химическим свойствам похожи на уран, то и следую-
щий за плутонием элемент № 95 тоже будет похож на
уран.
Однако проводившиеся в обстановке строгой сек-
ретности в США работы по синтезу нового трансурана
далеко не сразу привели к желанному успеху. Секрет-
ность вызывалась реальной — после синтеза плуто-
ния — возможностью получения новых видов ядерного
горючего, а отсутствие успеха — главным образом
теоретической неразработанностью методов выделения
и химической идентификации трансурановых элементов.
Итак, некоторое время все попытки выделить нового
родственника урана из продуктов нейтронной бомбар-
дировки плутония оставались безуспешными.
Когда на поставленный природе вопрос эксперимент
дает отрицательный ответ там, где теория предска-
зывает положительный ответ, приходится пересматри-
вать теорию, иногда придумывая что-то новое, иногда —
возвращаясь к забытому. Дело сдвинулось с мертвой
точки только после того, как Гленн Сиборг, один из
первооткрывателей плутония, вспомнил предсказание,
сделанное еще в 1923 году Нильсом Бором.
Нильс Бор задался тогда таким на первый взгляд
преждевременным вопросом: какими должны быть
электронные оболочки элементов с порядковым номе-
ром больше, чем у урана, если такие элементы могут
существовать на самом деле? Напомним: способов полу-
чения трансуранов еще не было, до открытия нейтрона
оставалось еще десять лет. И тем не менее Бор пришел
к выводу, что, начиная с элемента № 95, электронные
оболочки будут больше всего походить на электронные
оболочки лантаноидов.
Накопленные с того времени факты, касающиеся
химического поведения элементов конца периодической
таблицы, были таковы. Вплоть до актиния эти эле-
113
менты по своим химическим свойствам были аналогами
более легких элементов своих групп, как это следо-
вало еще из первых периодических таблиц, составлен-
ных самим Менделеевым. Полоний был экателлуром,
астат — экаиодом, радон — экаксеноном, франций —
экацезием, радий — экабарием, актиний — экалан-
таном.
А вот дальше все пошло не так гладко. Торий,
протактиний, уран, будучи отчасти похожими на цир-
коний, ниобий, вольфрам, во многом походили на ред-
коземельные металлы. Это следовало уже из их геохи-
мической судьбы: ведь они встречались в тех же мине-
ралах, что и редкоземельные металлы, например
в монаците.
Что же касается нептуния и плутония, то они более
всего по своим химическим свойствам походили на
уран, однако для того чтобы отделить плутоний от
урана, можно было в качестве носителя использовать
лантан.
Проанализировав все эти факты, Гленн Сиборг
выдвинул следующее предположение. Предсказанное
некогда Нильсом Бором экалантаноидное семейство
действительно существует. Только начинается оно не
с элемента № 95, как считал в 1923 году Бор, а с эле-
мента № 89 — актиния, экалантана. Это было бы впол-
не логично даже из самых общих соображений: ведь
и семейство лантаноидов началось с открытия именно
более легкого химического аналога актиния. Такая
аналогия напрашивалась сама собой при рассмотре-
нии периодической таблицы.
Что же касается тория, протактиния и урана, а так-
же нептуния и плутония — трансактиниевых элементов,
не проявлявших, однако, явных актиноидных свойств
(например, валентность урана, нептуния и плутония
в различных химических соединениях чаще всего была,
как у вольфрама, а не как у актиния и лантаноидов),—
то Сиборг дал этому довольно логичное объяснение.
Лантаноиды столь близки друг к другу химически
потому, что у них одинаковые внешние электронные
оболочки; отличаются же они числом электронов на
подоболочках. То же относится и к актиноидам. Однако
пока на подоболочке находятся два, три, четыре элект-
рона, она еще не влияет существенно на химические
свойства элемента. Лишь по мере приближения к поло-
114
винному заполнению ее влияние становится преобла-
дающим. Всего на подоболочке могут существовать —
по аналогии с лантаноидами — 14 электронов. Оче-
видно, наиболее выраженные свойства «актиноидно-
сти» будут у элемента № 96 с семью электронами. Но
уже и элемент № 95 тоже должен быть очень похож на
актиний.
КОНИ И ВСАДНИКИ
(КЮРИЙ, АМЕРИЦИЙ)
Исходя из актиноидной гипотезы Гленна Сиборга,
элементы № 95 и № 96, если только они могли образо-
ваться при нейтронной бомбардировке плутония, следо-
вало попытаться извлечь из плутониевого раствора
с помощью редкоземельных аналогов. Редкоземельные
элементы-носители должны были сыграть тут роль
коней, а трансурановые элементы — роль всадников,
которых эти кони выносят из боя.
И вот тут-то как раз эксперименты оказались вна-
чале обескураживающими. Множество попыток полу-
чить из плутония элемент № 95 прямым путем, т. е.
обстреливая ядра плутония дейтронами, прибавляя
к 94 протонам плутония девяносто пятый протон, окон-
чились ничем. Никаких новых излучателей зафиксиро-
вано не было.
Очевидно, элемент № 95 (нечетный, как и его редко-
земельный аналог европий) был во всех отношениях
крайне неустойчивым, и это делало его синтез и обнару-
жение особенно трудным. Поэтому Сиборг и его коллеги
из Металлургической лаборатории Мичиганского
университета (впоследствии переименованной в Аргон-
нскую национальную лабораторию) решили изменить
условия эксперимента — перешагнуть через ближай-
ший нечетный трансуран и получить сразу ближайший
четный, обещавший быть более устойчивым,— эле-
мент № 96, аналог гадолиния. Ведь и гадолиний был
открыт раньше, чем европий.
Для того чтобы получить ядра элемента № 96,
проще всего было взять мишень из плутония-239
и обстрелять ее ускоренными на циклотроне ядрами
Ст|Ат|
115
гелия. Так и сделали. При этом некоторые ядра плуто-
ния поглощали ядра гелия, т. е. два протона и четыре
нейтрона, и тут же излучали один нейтрон. В резуль-
тате получалось ядро с 96 протонами и массовым
числом 242.
Первый полученный изотоп девяносто шестого эле-
мента периодической системы оказался альфа-излучате-
лем с периодом полураспада 162 дня. Как и предпо-
лагал Сиборг, после того, как он сформулировал свою
актиноидную гипотезу, новый элемент удалось отделить
от плутония с помощью редкоземельных носителей.
Актиноидный аналог гадолиния, получившего свое
имя в честь первооткрывателя редкоземельных элемен-
тов, тоже решили назвать в честь ученого. И он полу-
чил название «кюрий».
Открытый в 1944 году кюрий-242 — не самый инте-
ресный изотоп этого элемента. Более интересными свой-
ствами обладают два других изотопа кюрия — с мас-
совыми числами 245 и 247.
Кюрий-245 с периодом полураспада 3320 лет спосо-
бен, подобно урану-235 и плутонию-239, делиться под
действием медленных нейтронов, но в три с лишним
раза быстрее, чем уран и плутоний. Для того чтобы
возникла цепная реакция, кюрия-245 требуется во много
раз меньше, так что кюриевые реакторы могут быть
значительно меньше урановых и плутониевых. Это осо-
бенно перспективно для разных транспортных средств—
морских судов, космических кораблей. Но получать
в больших количествах этот изотоп пока еще не
научились.
Кюрий-247 отличается своим долголетием — его
период полураспада 14—16 миллионов лет. Он может,
очевидно, в некотором количестве накапливаться
в естественных условиях.
Через несколько месяцев после получения кюрия та
же группа исследователей из Мичиганского универ-
ситета решила тем же способом, каким она получила
из плутония кюрий, получить из урана-238 плуто-
ний-241. Обстреляв уран-238 ядрами гелия, они действи-
тельно получили плутоний-241 и заметили, что этот
изотоп — бета-излучатель. А это означало, что неко-
торые атомы плутония-241 приобретают еще один поло-
жительный заряд и превращаются в атомы элемента со
116
следующим порядковым номером. То, чего не удалось
сделать прямым путем, было достигнуто в результате
обходного маневра.
И действительно, элемент № 95 был тут же заре-
гистрирован по специфическому альфа-излучению. А
затем с помощью редкоземельных носителей его удалось
отделить от плутония.
Назвали элемент № 95, аналог редкоземельного эле-
мента европия, аналогичным именем — «америций».
А вскоре было обнаружено, что и кюрий, и амери-
ций вовсе не такая уж редкость. В довольно больших
количествах они синтезируются в ядерных реакторах.
Плутоний-239 захватывает один нейтрон и становится
плутонием-240, который тоже захватывает один нейт-
рон, сразу же испускает бета-частицу и превра-
щается в америций-241. Период полураспада этого
изотопа около 500 лет. За это время немалая часть его
ядер может, поймав по нейтрону и испустив по элект-
рону, превратиться в ядра кюрия-242.
Отделить атомы кюрия от атомов америция не
менее трудно, чем атомы европия от атомов гадолиния.
ДЕВЯТЬ МИЛЛИАРДНЫХ
(ПРОМЕТИЙ)
К 1944 году граница менделеевской таблицы была
отодвинута за уран уже на четыре клетки. Это было
великим достижением экспериментаторов и теоретиков.
Синтез кюрия и америция подтвердил правильность
актиноидной гипотезы Сиборга, и гипотеза преврати-
лась в признанную большинством химиков теорию.
Торий и уран покинули свои насиженные места в
периодической таблице, на которых они находились
в течение почти семидесяти лет. А в самой нижней
части таблицы, под четырнадцатиместной шеренгой
лантаноидов, начала выстраиваться точно такая же
шеренга актиноидов — правда, заполненная пока лишь
наполовину. Однако ни у кого почти не вызывало
сомнений, что со временем она заполнится целиком.
Впрочем, прежде чем двигаться дальше, хорошо
было бы заполнить зияющую брешь в шеренге ланта-
117
ноидов — в том месте, где должен был бы находиться
редкоземельный аналог нептуния — элемент №61.
Начиная с 1902 года, когда существование элемента
№ 61 было предсказано Болеславом Браунером на
основании разницы атомных весов неодима и самария,
и особенно после 1913 года, когда Генри Мозли со
всей достоверностью установил, что в периодической
системе есть место для ядер с 61 положительным заря-
дом, было потрачено немало усилий для розысков
этого химического индивидуума.
В 20-е годы о своем успехе объявили две группы
исследователей. Одна — американская, из Иллиной-
ского университета, назвала будто бы открытый ею
спектроскопическим методом элемент № 61 иллинием.
Другая группа, итальянская, из Флорентийского уни-
верситета, тоже будто бы открывшая недостающий
лантаноид, предложила свое название — «Флоренции».
Восемь лет изучали пятнадцать препаратов, в кото-
рых предполагалось наличие иллиния — Флоренция,
Ида и Вальтер Ноддаки. С присущей им тщательностью
и последовательностью они переработали центнер ред-
коземельных минералов и доказали, что если в них
и существует элемент № 61, то в количествах менее
одной десятимиллионной доли неодима или самария
в этих минералах.
Вывод Иды Ноддак, сделанный в итоге этой про-
верки в 1932 году, был таков: «Мы стоим перед зага-
дочным явлением: не хватает элемента среди трехва-
лентных земель, распространение которых в общем за-
кономерно и электронное строение хорошо изучено».
Но раз загвоздка не могла заключаться в строении
электронной оболочки, можно предположить, что она
заключалась в особенностях строения ядра. Сама Ида
Ноддак так и считала: по-видимому, элемент № 61
был полностью представлен короткоживущими радио-
активными изотопами, которые давно распались и ныне
в земной коре не существуют.
Это мнение было косвенно подтверждено в 1932 —
1934 годах открытием радиоактивных свойств, хотя
и слабых, у соседей элемента № 61 — неодима и сама-
рия: самарий, оказалось, испускает альфа-частицы,
неодим — электроны. Но, испуская электрон, неодим,
элемент № 60, должен был бы превращаться как раз
в элемент № 61. Почему же его не находят? Потому
118
что получающиеся из ядер неодима изотопы тут же
и распадаются?
Окончательно предположение Иды Ноддак подтвер-
дил первооткрыватель «Флоренция» Луиджи Ролла.
В 1933 году он изучил изотопы неодима и самария
и доказал, что, в соответствии с правилом Маттауха,
все места для стабильных изотопов, которые мог бы
занять элемент № 61, уже заняты. Следовательно, все
его изотопы безусловно нестабильны, радиоактивны.
Первую атаку на непокорный лантаноид с помощью
циклотрона предприняли в 1938 году американские
физики М. Пул и Л. Квилл из университета штата
Огайо. На циклотроне Мичиганского университета
в Чикаго они бомбардировали неодимовую мишень уско-
ренными ядрами дейтерия и обнаружили радиоактив-
ный продукт с периодом полураспада 12,5 часа, кото-
рый сочли изотопом элемента № 61 и назвали цикло-
нием — от слова «циклотрон».
Вскоре такую же работу провели Эмилио Сегре
и Ву Цзиньсян: они тоже наблюдали короткоживущий
излучатель, который сочли изотопом недостающего
лантаноида.
Однако доказать химическими методами, что уда-
лось получить именно элемент № 61, ни та ни другая
группа не смогла.
На этот раз атака с помощью циклотрона, заме-
чательного аппарата, позволившего открыть четыре
первых трансурана, а впоследствии и еще несколько
трансурановых элементов, не удалась.
Прошло несколько лет, и наступила новая эпоха
в синтезе радиоактивных изотопов — эпоха ядерных
реакторов. Эти реакторы производят не только огром-
ное количество энергии, но и огромное — несравнимое
по своим масштабам с циклотронным «производ-
ством» — количество радиоактивных изотопов, продук-
тов деления урана-235 и плутония-239, и среди них
великое множество изотопов редкоземельных металлов.
Именно здесь, конечно же, следовало поискать до того
времени ускользавший от исследователей элемент № 61.
В 1947 году такой поиск начала группа американ-
ских радиохимиков — Дж. Маринский, Л. Гленденин,
Ч. Кориэлл. Обычными методами химического анализа
они выделили из продуктов распада урана ланта-
ноиды, смесь полусотни радиоактивных изотопов.
119
Читатель помнит, надо полагать, об исключительных
трудностях, с которыми столкнулись в свое время Ма-
риньяк, Мосандер и другие химики при разделении
лантаноидов. Многие годы, десятки лет были потрачены
на сотни и тысячи перекристаллизации. Ни такого
времени (распадающиеся продукты!), ни такого коли-
чества исходных материалов не было у Марийского
и его коллег. Следовало придумать что-то более быст-
рое, более избирательное. То, что было придумано,
получило наименование ионообменной хроматографии.
Суть нового метода заключалась в следующем.
Первый этап — подготовительный. Брали стеклян-
ную трубку и заполняли ее крупицами полимерного
вещества, способного извлекать из раствора ланта-
ноиды и удерживать их с тем большей силой, чем
меньше масса атома. Затем заливали в эту трубку
раствор лантаноидных солей, которые вытягивались
из него крупинками полимерного вещества. Затем брали
раствор, который был способен отобрать захваченные
полимером лантаноиды, например раствор хлороводо-
родной кислоты, и понемногу промывали им трубку.
С первыми каплями из трубки выходил наиболее тяже-
лый изотоп, т. е. изотоп с наибольшим порядковым
номером и наибольшим числом нейтронов, за ним —
более легкий, за ним соответственно все более легкие,
со все меньшими порядковыми номерами и все меньшим
числом нейтронов.
Этим методом, отличавшимся совершенно исклю-
чительной избирательностью, удалось отделить один от
другого все изотопы до единого.
Успех оказался полным. Среди пятидесяти выделен-
ных изотопов два были изотопами нового химического
элемента, рентгеновский спектр которого соответство-
вал рентгеновскому спектру элемента № 61, рассчитан-
ному по формуле Мозли. И что очень важно, этих
изотопов оказалось много: в общей массе лантанои-
дов — почти 4 %.
К тому же один из изотопов — с массовым числом
147 — оказался довольно живучим, его период полу-
распада составляет более двух с половиной лет. Это
позволило получить химически чистые его препа-
раты — розовый хлорид и желтый нитрат. Оба соеди-
нения были продемонстрированы первооткрывателями
на симпозиуме Американского химического общества
120
28 июня 1948 года. И хотя каждой соли было получено
всего по три миллиграмма, открытие самого скрытного
лантаноида стало очевидным фактом.
Таким же необычным, как история открытия эле-
мента № 61, стало и его имя. В нем было увекове-
чено не какое-либо свойство элемента, как это было
с рубидием или с актинием, не название страны либо
города, не имя знаменитого ученого. Его назвали проме-
тием. Почему?
«Это название не только символизирует драматиче-
ский путь получения нового элемента в заметных коли-
чествах в результате овладения людьми энергией ядер-
ного деления, но и предостерегает человечество от
грозящей опасности — стервятников войны»,— так от-
ветили на вопрос об имени сами первооткрыватели.
Название «прометий» предложила для нового элемента
жена Кориэлла. В нем трудно не услышать отзвуки
трагедии Хиросимы и Нагасаки...
В ядерном реакторе прометий получился в резуль-
тате деления ядер урана-235 медленными нейтронами.
Но ведь в природе постоянно происходит спонтанное
деление этого изотопа, а значит, пусть в самом ничтож-
ном числе, но должны образовываться и ядра проме-
тия.
Все же интересно, сколько прометия в земной коре?
Подсчеты показали — считанные граммы.
И тем не менее в 1964 году финский химик Эря-
мятся, переработав на фабрике удобрений 6000 тонн
апатитового концентрата, получил 20 тонн лантаноид-
ных соединений, а из них выделил 0,000000009 грамма
прометия.
СКРОМНЫЙ ТРИУМФ
(БЕРКЛИЙ)
В самом начале истории открытия химических
элементов место элемента в «очереди открытий» нимало
не соответствовало его порядковому номеру. Правда,
у самого первого элемента, с которым познакомились
люди, углерода, порядковый номер был невелик: раз-
ница между его местами в «очереди открытий» и в
121
«очереди зарядов» составляла всего 5 единиц. Но зато
у других издревле известных металлов эта разница
была огромной: у меди — 25, золота — 76, у сереб-
ра — 42, железа — 27, свинца — 75, у олова — 44.
Впоследствии разница эта, как правило, уменьша-
лась. Процесс поиска новых элементов стал более осо-
знанным; из наиболее распространенных неоткрытых
элементов исследователям в первую очередь попада-
лись элементы с относительно меньшим порядковым
номером. У водорода «разница мест» — 15, у азота —
12, кислорода — 12, фтора — 14, хлора — 5, кобаль-
та— 10, никеля—10, натрия — 7, марганца — 4,
у хрома — 5.
Естественно, что еще большее совпадение последо-
вательности открытий с порядковыми номерами наблю-
дается в конце XIX — начале XX века, когда неоткры-
тыми остались лишь наиболее редкие элементы, имею-
щие большие порядковые номера (исключение состав-
ляют лишь инертные газы в силу своей уникальной
инертности). У полония «разница мест» 4, у радия
и актиния — 7, радона — 3, протактиния — 5, аста-
та — 6, у франция — 3.
Открытие законов строения атомов и превращения
ядер позволило свести эту разницу к минимуму: у непту-
ния — 1, у плутония — 1, америция — 0, кюрия — 1.
С открытием прометия — последнего необнаруженного
доуранового элемента — разница очередностей могла
быть окончательно сведена к нулю.
Разумеется, в дальнейшем могли возникнуть
(и действительно возникли!) какие-то новые трудности:
дорога открытий тем менее бывает гладкой, чем ориги-
нальнее открытие. И все же можно считать скромным
триумфом науки то, что девяносто седьмым открытым
элементом стал элемент, занимающий девяносто седь-
мое место в периодической системе, естественной
системе элементов.
Путь к его синтезу был ясен. Надо было накопить
столько америция, элемента с 95 протонами в ядре,
чтобы из него можно было сделать мишень. Поста-
вить эту мишень в мощный циклотрон. Обстрелять ее
потоком ускоренных альфа-частиц, двухпротонных ядер
гелия: 95 + 2 = 97. Что и требовалось доказать.
Главной трудностью было накопление достаточно-
го количества материала для мишени. На это ушло
пять лет.
122
В 1949 году Гленн Сиборг и его коллеги Стенли
Томпсон, Альберт Гиорсо установили мишень из амери-
ция-241 в циклотрон Радиационной лаборатории
Калифорнийского университета в Беркли и подвергли
ее бомбардировке ускоренными альфа-частицами.
И, как и ожидалось, получили изотоп нового, 97-го эле-
мента. Сначала его обнаружили по специфическому
излучению, а затем выделили методом ионообменной
хроматографии, доказавшим свою исключительную
избирательность и вместе с тем простоту при выделении
прометия.
Для работы с актиноидами этот метод был еще
несколько усовершенствован. Предварительно через
хроматографическую колонку пропустили лантаноиды,
заметили время выхода каждого редкоземельного эле-
мента и составили таблицу, с помощью которой можно
было определять момент, когда из колонки будет выхо-
дить и актиноидный аналог того или иного лантаноида.
Элемент № 97, аналог элемента № 65 — тербия,
вышел из колонки точно тогда же, когда в предва-
рительном эксперименте с лантаноидами выходил
тербий.
Затем в ядерных реакторах при облучении мощными
потоками нейтронов урана, плутония, америция и кюрия
были получены весовые количества элемента № 97 —
его изотопа с массовым числом 249 и периодом полурас-
пада 314 дней, почти год. Применительно к элементу
№ 97 весовые количества означали сначала 0,02 микро-
грамма диоксида, а затем 5 микрограммов чистого
металла. Получили его, восстановив литием фторид,—
испытанным методом Берцелиуса.
Назвали элемент № 97 берклием — по имени го-
рода, в котором он явился на свет Напомним, что его
лантаноидный аналог тербий получил свое имя в честь
города Иттербю.
УРОЖЕНЕЦ СВЕРХНОВОЙ
(КАЛИФОРНИЙ)
После того как элемент № 92, уран, обнаружил
способность делиться и освобождать при этом гигант-
ское количество энергии, синтезировать трансурановые
элементы стали отнюдь не только из чистой любозна-
тельности — более существенным стимулом была
надежда на новые виды ядерного горючего.
И действительно, плутоний, элемент № 94, оправдал
эти надежды: он сильно, в добрую сотню раз расши-
рил сырьевую базу производства ядерной энергии
для самых разнообразных целей.
Можно было рассчитывать на то, что последующие
четные трансураны — элементы № 96 и № 98 — будут
делиться быстрее, чем уран и плутоний, будут при
каждом акте деления испускать больше новых нейтро-
нов и, следовательно, цепная реакция начнется при
меньшей массе ядерного горючего. В таком случае
размеры атомных двигателей можно было бы умень-
шить во много раз.
Один из изотопов элемента № 96, кюрий-245, эти
расчеты оправдал, но только отчасти; будучи втрое
более склонным, к делению, чем уран-235 и плуто-
ний-239, кюрий-245 отличается одним «неудобным»
свойством: образовавшись в реакторе, его ядра тут же
под действием новых порций нейтронов распадались.
В результате выход именно этого, самого нужного
изотопа оказывался ничтожным.
После синтеза берклия надежды на новое высо-
коэффективное ядерное горючее стали связывать со
следующим по порядку номеров четным элементом —
элементом № 98.
Первые несколько тысяч атомов этого элемента
были синтезированы в 1950 году Гленном Сиборгом,
Альбертом Гиорсо, Стенли Томпсоном и Генри Стритом.
Они продолжали пользоваться тем же методом, кото-
рый привел к синтезу предыдущих трансуранов: нако-
пив достаточно кюрия, поместили его в циклотрон
и обстреляли потоком быстрых альфа-частиц. Некото-
рые ядра элемента № 96 присоединили альфа-частицу
с ее двумя протонами, и образовались ядра элемен-
та № 98.
124
Для того чтобы выделить эти ядра из смеси осколков
деления и самого кюрия, и новообразованного элемента,
кюриевую мишень растворили и раствор ввели в хрома-
тографическую колонку, через которую атомы разных
элементов проходили с разной скоростью. Исследова-
тели рассчитывали, что атомам элемента № 98 понадо-
бится на прохождение через колонку точно такое же
время, как и его лантаноидному аналогу — диспрозию.
Они не ошиблись, и это было еще одним подтвержде-
нием правильности актиноидной теории. Точно в назна-
ченный срок капли раствора вынесли на платиновую
пластинку первые атомы элемента № 98.
Его назвали калифорнием. «Известно,— писали
первооткрыватели нового элемента,— что название
«диспрозий» происходит от греческого слова «трудно-
доступный». Назвав открытый элемент калифорнием,
мы хотели отметить, что первооткрывателям элемента
пришлось столь же трудно, как век назад пионерам
Америки трудно было достигнуть Калифорнии».
Справедливости ради стоит заметить, что многие
другие элементы были открыты с еще большим тру-
дом,— не только америций, но, скажем, франций или
рений. Всего вернее было бы считать, что в названии
нового элемента Сиборг и его коллеги хотели уве-
ковечить свой университет и штат, в котором он на-
ходится.
Что же касается ожидаемых ядерных свойств кали-
форния, то его изотопы действительно оказались мощ-
ным ядерным горючим. Однако применять калифорний
в реакторах невыгодно: чтобы получить один грамм
калифорния, надо затратить центнер плутония.
Мощный поток нейтронов, испускаемый калифор-
нием, можно использовать не только для осуществления
цепной реакции. В медицине, геологии, химии, физике
нужны достаточно сильные и вместе с тем компактные
источники нейтронов. Ведь до сих пор мощный поток
нейтронов можно было получить лишь в ускорителях,
бомбардируя ускоренными нейтронами бериллиевую
пластинку, и в ядерном реакторе при делении урана
или плутония. Все это огромные, громоздкие сооруже-
ния. А теперь можно воспользоваться крупицей кали-
форния: один микрограмм калифорния-252 испускает
в секунду миллион нейтронов. Время жизни этого изо-
топа, который, кстати, образуется в ядерных реакторах
125
в наибольшем количестве, достаточно велико: более
двух лет.
Калифорний удалось обнаружить и в природе. Прав-
да, не на нашей планете, а в спектре сверхновой звезды.
В ТЕРМОЯДЕРНОЙ КОЛЫБЕЛИ
(ЭЙНШТЕЙНИЙ, ФЕРМИЙ)
Для того чтобы получить следующий трансурановый
элемент с 99 протонами в ядре, нужно было бомбар-
дировать альфа-частицами мишень из берклия или дей-
тронами — мишень из калифорния. Но для изготов-
ления мишеней следовало сначала накопить сравни-
тельно большое количество элементов с 97 и 98 про-
тонами в ядре.
Можно было попытаться отыскать элемент № 98
и в ядерном реакторе. Под воздействием мощного
потока нейтронов отдельные ядра урана превращаются
в нептуний, отдельные ядра нептуния - в плутоний,
плутония — в америций, америция — в кюрий, кю-
рия — в калифорний, калифорния — в элемент № 99.
Но чтобы в реакторе образовалось заметное количество
этого элемента, требуются годы.
Наконец, существовала еще одна теоретическая
возможность: взять обыкновенный уран, сделать из
него мишень, мишень установить в ускорителе и бом-
бардировать ее не альфа-частицами, а ускоренными
ионами азота. В уране 92 протона, в азоте — 7. 92 + 7=99.
Очень простая арифметика. Правда, для того чтобы
решить этот нехитрый школьный пример на ядерном
уровне, надо было сначала построить такие ускорители,
которые могли бы разгонять до нужных скоростей (фи-
зики говорят: сообщать нужную энергию) не дейтроны
и альфа-частицы, а гораздо более тяжелые ядерные
снаряды.
В конце концов элемент № 99 был синтезирован
всеми тремя способами, но уже после того, как его полу-
чили совсем иным способом, которого раньше просто
не существовало.
I ноября 1952 года американцы провели первое
испытание своего нового ядерного оружия, взорвали
Е$Рш
126
на коралловом островке Элугелаб в Тихом океане тер-
моядерное устройство.
Как известно, мощность взрыва водородных бомб
во много раз больше, чем «обычных» урановых или плу-
тониевых. Потоки нейтронов при термоядерном взрыве
так велики, что трансураны, в том числе и более мас-
сивные, чем калифорний, синтезируются в них в миллио-
ны раз быстрее, чем в ядерном реакторе.
Американские физики и радиохимики решили поис-
кать их в радиоактивных осадках, выпавших на близ-
лежащих к эпицентру взрыва островках. (Что касается
самого Элугелаба, то на его месте в морском дне обра-
зовался кратер пятидесятиметровой глубины и полу-
торакилометрового диаметра.)
Поиски начались вскоре после того, как в пробах
грунта с этих островков были найдены ранее неизвест-
ные массивные изотопы плутония — плутоний-244 и
плутоний-246. Это означало, что некоторые ядра ура-
на-238, находившиеся в запальном устройстве термо-
ядерного заряда, захватили по шесть и по восемь
нейтронов. В некоторых случаях тот же уран мог за-
хватить, скажем, 15 нейтронов и после нескольких
бета-распадов превратиться в элемент № 99.
Сиборг, Гиорсо, Томпсон и еще один исследователь,
Хиггинс, переработав центнеры грунта с продуктами
термоядерного взрыва, выделили актиноидную фрак-
цию и пропустили ее через хроматографическую ионо-
обменную колонку, уже зная из опыта, когда следует
ожидать появления капель с первым, самым тяжелым
трансураном — калифорнием.
Но еще до капель с калифорнием появились капли,
испускавшие неизвестное ранее альфа-излучение с энер-
гией 6,6 мегаэлектрон-вольт. Оно принадлежало эле-
менту, еще более тяжелому, чем калифорний. Поскольку
капли с новым излучателем по времени своего появле-
ния соответствовали каплям с гольмием, новый элемент
обязан был оказаться его актиноидным аналогом, т. е.
именно элементом № 99.
В этом эксперименте были зарегистрированы лишь
сотни атомов нового элемента. О химическом исследова-
нии стало возможным говорить только после получе-
ния его микрограммовых количеств, а точнее, десятых
долей микрограмма (разумеется, в циклотронах и реак-
торах.)
127
Накопить его весовые количества очень трудно.
Новое по сравнению с предшествующими трансуранами
препятствие — его крайне короткий век: долгожитель
с массовым числом 254 распадается наполовину уже
через 250 дней. Поэтому до сей поры в мире не существо-
вало одновременно одного миллиграмма элемента № 99.
Все же удалось установить, что это типичный акти-
ноид, а из лантаноидных сородичей он больше всего
походит на гольмий. Менделеевская таблица продол-
жала служить открывателям новых элементов верой
и правдой.
Через несколько месяцев после открытия элемен-
та № 99, 16 января 1953 года, в капле раствора вытекав-
шего из ионообменной колонки с актиноидной фрак-
цией, выделенной из продуктов термоядерного взрыва,
та же группа исследователей обнаружила первые двести
ядер тяжелого аналога эрбия — элемента № 100.
Входящий в «запал» термоядерного устройства
уран-238, захватив во время взрыва семнадцать нейтро-
нов, превратился в уран-255, который испустил восемь
бета-частиц. Таким образом образовался сотый элемент
периодической системы с массовым числом 255.
Через два года сотый элемент был синтезирован
в специально построенном для получения трансуранов
мощном ядерном реакторе в американском штате Ай-
дахо. А вскоре после того, в том же 1955 году, с исследо-
ваний по элементам № в9 и № 100 был снят гриф «се-
кретно», появились сообщения об их открытии и состоя-
лось их крещение.
Сотый элемент назвали в честь Энрико Ферми,
а девяносто девятый — в честь Эйнштейна. Так по-
явились в менделеевской таблице эйнштейний и фермий.
Однако вернемся в 1953 год.
Естественно, что Сиборг и его группа не собирались
свертывать свои исследования после того, как обнару-
жили элемент № 100. Однако их попытки найти в про-
дуктах термоядерного взрыва еще более массивные
ядра, а вернее, ядра с большим числом протонов,
потерпели неудачу. Столь же неудачными оказались
попытки отыскать их в ядерных реакторах.
Очевидно, это не было случайностью. Что-то мешало
образованию ядер с большим порядковым числом, чем
у фермия, путем накапливания нейтронов и последую-
щего бета-распада. Но что именно?
128
Это удалось выяснить уже после того, как ядра не-
скольких последующих элементов были синтезированы
другим способом.
В июле 1969 года на подземном полигоне штата
Невада был произведен очередной термоядерный взрыв.
Из десяти килограммов породы, взятой на месте взрыва,
сотрудники Радиационной лаборатории в Беркли выде-
лили пять миллиардов атомов самого тяжелого извест-
ного в^то время изотопа фермия — фермия-257. Это со-
ставляло всего навсего две миллиардные доли грамма.
Все это количество фермия поместили на бериллие-
вую фольгу в циклотрон и обстреляли дейтронами. Как и
положено, из бериллия вырвался поток нейтронов.
Эти нейтроны поглощались ядрами фермия-257, кото-
рый превращался в еще более массивный изотоп фер-
мий-258 и... уже за 380 миллионных долей секунды
половина всех ядер нового изотопа подвергалась спон-
танному делению.
Так что при термоядерном взрыве после захвата
ядрами урана нейтронов цепочка бета-распадов обры-
валась на фермии-258, который вместо превращения
в сто первый элемент распадался на осколки.
Однако, как уже было сказано, специалисты по син-
тезу трансуранов, не дожидаясь объяснения факта
отсутствия более тяжелых, чем фермий, элементов
в продуктах ядерного синтеза и ядерного деления, вос-
пользовались другим хорошо известным методом син-
теза — с помощью альфа-частиц.
РАСЧЕТАМ ВОПРЕКИ
(МЕНДЕЛЕВИЙ)
Весь накопленный к середине 50-х годов опыт сви-
детельствовал о том, что по мере увеличения порядково-
го номера трансуранов срок их жизни уменьшается.
Правда, для четных элементов это уменьшение шло
с меньшей скоростью, чем для нечетных.
Если самый долгоживущий изотоп нептуния рас-
падался наполовину через 225 000 лет, а плутония —
через 75 000 000, то период полураспада америция —
795 лет, кюрия — 14 000 000, берклия — 700, кали-
'4 5 Зак. 527 129
В
форния — 660; далее счет шел уже на дни ^период
полураспада эйнштейния — 250 дней, фермия —
4,5.
Зная это, нужно было, приступая к синтезу сле-
дующего, сто первого элемента, приготовиться к тому,
что полученные ядра будут существовать считанные
часы, а еще более вероятно — считанные минуты. И что-
бы за столь короткое время обнаружить их и доказать,
что они есть не что иное, как именно ядра сто первого
элемента, надо было придумать какой-то очень быстрый
способ их обнаружения.
В чем было главное неудобство способов, приме-
нявшихся до тех пор для химического выделения полу-
ченных в циклотронах трансуранов? Прежде всего
в том, что исследование начинали с растворения под-
вергшейся ядерной бомбардировке мишени. А там были
самые разные актиноиды, отделить которые друг от
друга, а главное, от самого материала мишени — урана,
плутония, кюрия,— было очень хлопотным и долгим
делом.
И вот что придумали исследователи, решившие
синтезировать элемент № 101,— уже знакомые чита-
телю Сиборг, Гиорсо, Томпсон и еще не знакомые Бер-
нард Гарвей и Грегори Чоппин. Они взяли два тончай-
ших золотых листка. На один листок, на его заднюю
сторону, напылили весь имевшийся тогда в США запас
эйнштейния — несколько миллиардов атомов. А на рас-
стоянии 5,5 миллиметра за ним расположили другой
золотой листок — чистый. 'Расчет был такой: когда
циклотрон разгонит альфа-частицы до нужной скорости
и направит их в первый листок, то альфа-частицы про-
нижут насквозь тоненький слой золота и врежутся в ядра
напыленных на задней стороне этого листка атомов
эйнштейния. При этом энергия альфа-частиц будет
еще такой большой, что они не только смогут преодолеть
силу отталкивания ядер эйнштейния и слиться с ними,
образовав ядра сто первого элемента, но и сорвут ново-
образованные ядра с золотой подложки и понесут к сле-
дующему золотому листку, в котором они и застрянут.
И поскольку актиноидных атомов среди атомов золота
окажется сравнительно немного, их будет гораздо
легче разделить.
Такой способ позволял убить двух зайцев сразу:
провести быстрое опознание нового элемента и сохра-
130
нить мишень — напыленные на первом листке сверх-
драгоценные частицы эйнштейния.
Сказано — сделано. Как только бомбардировка
мишени ядрами гелия была прекращена, Гарвей пинце-
тами снял второй золотой листок, вложил в пробирку
и бросился бежать в лабораторию, которая находи-
лась в том же помещении, что и циклотрон. Там он
передал пробирку Чоппину, который растворил листок
в нагретой царской водке. В это время Гиорсо уже
ждал в машине возле здания циклотрона, и как только
Гарвей и Чоппин вскочили в автомобиль, на полной ско-
рости помчался в радиационную лабораторию, которая
располагалась в миле от циклотрона,— к Томпсону, ожи-
давшему их у аппаратуры, предназначенной для выде-
ления гипотетического сто первого элемента.
Первым делом раствор пропустили через ионообмен-
ную колонку, в которой задерживалось золото, затем —
через колонку, предназначенную для разделения акти-
ноидов; каждая капля, капавшая из этой колонки, при-
нималась на отдельную платиновую пластинку, которую
затем подставляли под нагревательную лампу, чтобы
подсушить. Затем эти пластинки устанавливали в спе-
циальные счетчики радиоактивного распада, соединен-
ные с записывающим устройством. По характеру записи
можно было судить о характере распада. И так как
характер распада ядер был известен, то появление
неизвестного распада свидетельствовало бы о появле-
нии (точнее, о гибели) неизвестного ядра.
Первый сигнал о таком неизвестном распаде по-
явился примерно через час после начала эксперимента.
А всего в первых опытах удалось зарегистрировать
17 ядер нового изотопа. Период полураспада у него
оказался равен примерно получасу.
Время появления капель с синтезированными ато-
мами соответствовало времени появления капель с ту-
лием. Значит, новый актиноид был его аналогом, т. е.
элементом № 101. Периодический закон продолжал
оставаться верным и незаменимым маяком. В честь его
творца Дмитрия Ивановича Менделеева и назвали
новый элемент его первооткрыватели. «Для нового эле-
мента было предложено наименование «менделевий»,—
писали они в книге «Трансурановые элементы»,— в знак
признания заслуг великого русского химика Д. И. Мен-
делеева, который первый использовал для предсказания
5*
13!
химических свойств неоткрытых элементов периодиче-
скую систему элементов, принципы которой явились
ключом для открытия большинства трансурановых
элементов».
Не меньшей сенсацией, чем само открытие менде-
левия, явилось получение его дол го живущего изотопа,
совершенно неожиданное для теоретиков. В начале
периодической системы наиболее стабильны те изотопы,
у которых в ядре содержится протонов и нейтронов
примерно поровну. Чем ближе к концу таблицы, тем
больше становится необходимый избыток нейтронов.
У тяжелых элементов шестого периода оптимальное
соотношение нейтронов и протонов — 3:2. Поэтому
ожидалось, что самыми долгоживущими изотопами
менделевия будут изотопы со 151 или 152 нейтронами,
т. е. менделевий-252 или менделевий-253.
Первым, в начале 1955 года, был получен изотоп
менделевий-255 с периодом полураспада около 30 минут.
Затем удалось синтезировать менделевий-256. Период
полураспада оказался у него втрое больше — полтора
часа. Но подлинную сенсацию вызвал полученный в кон-
це 1967 года менделевий-258: период полураспада ока-
зался у него равен уже не часам, и даже не дням,
а двум месяцам.
Так выяснилось, что теоретики сильно недооценили
«клеящую способность» избыточных нейтронов в яд-
рах более далеких трансурановых элементов.
А само по себе обнаружение у сто первого (нечет-
ного!) элемента изотопа, который живет в десять с лиш-
ним раз дольше, чем самый долгоживущий изотоп пре-
дыдущего, сотого элемента (четного!), возбудило
надежды на успешный синтез еще гораздо более тяжелых
ядер, на обнаружение новых закономерностей в пове-
дении далеких трансуранов.
СНАРЯДЫ СТАНОВЯТСЯ ТЯЖЕЛЫМИ
(ЭЛЕМЕНТ № 102)
Менделевий был последним элементом, который уда-
лось получить, используя легкие снаряды, ибо эйн-
штейний был последним элементом, который можно
было использовать в качестве мишени для синтеза но-
вых элементов. Получать значительные количества
фермия из продуктов подземного термоядерного взрыва
невозможно по многим причинам. А в циклотронах и
реакторах фермия получается чрезвычайно мало. Еще
меньше получается менделевия, из которого в прин-
ципе можно было бы получить следующие трансураны
с помощью дейтронов.
Оставался теперь единственный путь — утяжелить
снаряды, увеличить второе слагаемое, вместо ядер водо-
рода и гелия использовать для бомбардировки мишеней
ионы неона, углерода, азота, кислорода и других эле-
ментов. А мишени в этом случае можно было бы делать
из относительно доступных материалов — кюрия, аме-
риция, плутония и даже урана.
Для более тяжелых снарядов и орудие требуется
более мощное. И американцы приступили к его построй-
ке. Однако тут их опередили советские ученые.
То, что первые трансураны были синтезированы и
идентифицированы в США, неудивительно. В то время
Европа была полем боя, американцы же могли без
помех заниматься ядерной физикой и радиохимией.
Более того, война способствовала проведению в США
этих исследований: во-первых, за океан эмигрировали
десятки самых лучших ученых Западной Европы —
достаточно назвать бежавших от фашистской чумы
Альберта Эйнштейна, Нильса Бора, Энрико Ферми;
во-вторых, американское правительство ассигновало
на работы по овладению атомной энергией колоссаль-
ные суммы денег. Все это позволило американцам выр-
ваться вперед в ядерных исследованиях, первыми соз-
дать атомную промышленность.
К сожалению, достижениями науки в первую оче-
редь воспользовались империалистические силы в США
для организации ядерного шантажа, направленного
против нашей страны. И поэтому в первые послевоен-
ные годы советским физикам-атомникам пришлось все
в
133
свои силы направить на ликвидацию американской
атомной монополии, на создание советской атомной
промышленности.
«Ядерной проблемой № 1,— рассказывал впослед-
ствии один из первооткрывателей спонтанного деления
урана, создатель и руководитель Лаборатории ядерных
реакций Объединенного института ядерных исследова-
ний в Дубне академик Георгий Николаевич Флеров,—
было осуществление цепной ядерной реакции, ее различ-
ных практических приложений. Решение этой задачи
потребовало десятка лет чрезвычайно напряженной ра-
боты. В начале пятидесятых годов наступил переломный
момент: ядерная проблема была практически решена.
Пришла пора выбора нового направления исследова-
ний. После долгих дискуссий, детальных обсуждений
с Игорем Васильевичем Курчатовым выбор пал на проб-
лему синтеза далеких трансурановых элементов. Для
этого было несколько причин. К 1954 году было полу-
чено девять трансурановых элементов. Один из них —
плутоний — оказался практически очень важным. Ис-
следования других трансуранов значительно обога-
тили наши знания о природе вещества, причем не только
ядерного.
Было ясно, что на пути синтеза трансурановых эле-
ментов придется решать очень сложные задачи: раз-
рабатывать новые методы ускорения заряженных ча-
стиц, детектирования продуктов ядерных реакций, соз-
давать уникальные исследовательские установки. Все
это должно было обеспечивать развитие ядерной фи-
зики, а на каком-то этапе и техники, в Советском Союзе
и странах социалистического содружества.
Учитывалось и то обстоятельство, что в Советском
Союзе был накоплен немалый опыт исследования спон-
танного деления. С этим явлением советские физики
были близко знакомы, а именно спонтанное деление
определяет главное свойство — время жизни атомных
ядер элементов с порядковым номером больше ста.
Когда направление исследований было определено,
возникли новые вопросы. И первый из них — выбор
наиболее эффективного метода синтеза новых элемен-
тов.
Ученые США, открывшие первые девять трансура-
новых элементов, разумеется, не стояли на месте. Они
также искали оптимальные пути синтеза и изучения
134
новых атомных ядер. В те годы в США много писали
о подземных ядерных взрывах — этот способ реклами-
ровался как наиболее перспективный, единственный,
который ведет к цели кратчайшим путем. Эти заявления
могли играть роль «фигового листка», прикрывавшего
стремление провести подземные испытания ядерного
оружия. И все же какое-то время разговоры о «термо-
ядерном» методе синтеза новых элементов отвлекали
внимание, мешали сосредоточиться на главном направ-
лении.
Как известно, в импульсном нейтронном потоке тер-
моядерного взрыва ядра тяжелой мишени, например
урана, примерно за миллионную долю секунды зах
ватывают до 17 нейтронов. Образовавшиеся насыщен-
ные нейтронами изотопы урана с массовым числом
около 250 превращаются после последовательной цепи
бета-распадов в высшие элементы. Однако получение
изотопов с атомными номерами больше 100 в импульс-
ных нейтронных потоках термоядерного взрыва нам —
продолжает Г. Н. Флеров — представлялось неперспек-
тивным.
Дело не только в том, что эти атомы очень неста-
бильны и их весьма сложно извлечь из зоны термо-
ядерного взрыва за время, сравнимое с их временем
жизни, но еще и в том, что для синтеза элементов вто-
рой сотни необходимы сверхмощные нейтронные потоки,
недостижимые в земных условиях сегодня и в обозри-
мом будущем. Это объясняется значительным уменьше-
нием массового числа ядер, скажем, урана, захватив-
ших более двадцати нейтронов, из-за испускания ядра-
ми так называемых запаздывающих нейтронов. Откры-
тый в Лаборатории ядерных реакций новый вид радио-
активного распада — запаздывающее деление атомных
ядер также уменьшает шансы на успех.
В США усиленно развивались и работы по созданию
специальных линейных ускорителей, предназначенных
для ускорения тяжелых ионов. Интенсивные пучки
тяжелых ионов с энергиями, превосходящими кулонов-
ский барьер доступных для эксперимента тяжелых ми-
шеней,— прекрасное средство синтеза и изучения транс-
урановых элементов. Именно метод тяжелых ионов
в 1955 году представлялся нам наиболее перспективным.
Возникла альтернатива: либо строить линейный ускори-
тель тяжелых ионов, т. е. идти по пути американских
135
ученых, который считался тогда наиболее обещающим,
либо создавать нечто иное.
У американских физиков уже был накоплен теоре-
тический и экспериментальный задел по созданию ли-
нейных ускоряющих систем. Поэтому решено было идти
своим путем, конструировать циклотрон для ускорения
тяжелых ионов с параметрами лучшими, чем у линейных
ускорителей.
При выборе научных направлений различают два
вида смелости — смелость от знания и смелость от нез-
нания. Наша смелость иногда нам самим кажется при-
надлежащей к последнему роду. Но, вероятно, это толь-
ко так кажется. На деле интуиция, выработанная за
годы трудных и емких исследований, подсказывала:
догоняя, не обгонишь, а именно в положении догоняю-
щих мы бы оказались, если бы пошли по «линейному»
пути.
Строительство циклотрона тяжелых ионов в Дубне
началось в 1957 году. В результате уже в 1960 году
в Объединенном институте ядерных исследований на
полную мощность работал классический циклотрон,
дававший пучки тяжелых ионов с интенсивностью при-
мерно в 20 раз большей, чем лучшие ускорители США
и других стран.
Неудивительно, что ученые социалистических стран
ушли вперед. Были впервые изучены многие изотопы
элементов от 102 до 107-го...»
В тот самый год, когда в Дубне началось строитель-
ство циклотрона для тяжелых ионов, шведские физики,
работавшие совместно с англичанами и американцами
в Стокгольме, в Нобелевском институте физики, объяви-
ли об успешном синтезе их группой одного из изотопов
элемента № 102. Они даже предложили для него наз-
вание — «нобелий» (в честь Альфреда Нобеля, основав-
шего фонд, из которого присуждаются знаменитые
нобелевские премии за выдающиеся научные дости-
жения.
Однако стокгольмская группа ошиблась. Исследо-
вателей ввели в заблуждение многочисленные продукты
ядерных реакций, образовавшиеся вследствие того, что
использованная ими кюриевая мишень состояла из
трех разных изотопов, а снарядами служили два изото-
па углерода.
Тогда же были предприняты аналогичные попытки
еще двумя группами физиков — в Институте атомной
136
энергии в Москве и вРадиационной лаборатории Кали-
форнийского института в Беркли. Советские исследова-
тели бомбардировали плутоний ионами кислорода,
американские — кюрий ионами углерода. И те и другие
предполагали, что в их экспериментах были получены
изотопы сто второго элемента.
Однако характеристики полученных изотопов —
периоды полураспада и энергия альфа-излучения,
определенные в то время в Москве и в Беркли, впослед-
ствии не подтвердились. Следовательно, и сам факт
синтеза не подтвердился тоже.
Первые атомы элемента № 102 удалось получить
только в 1963 году группе ученых социалистических
стран, работавшей под руководством Георгия Николае-
вича Флерова в Лаборатории ядерных реакций Объеди-
ненного института ядерных исследований в Дубне. Они
бомбардировали мишень из урана-238 ионами неона-22,
и слившиеся ядра этих элементов образовали элемент
№ 102 с массовым числом 256. Период полураспада
этого изотопа оказался равен 4 секундам. Обнаружили
его тремя независимыми методами: по характеристике
испускаемых им альфа-частиц, по характеристике спон-
танного деления его ядер и по продукту распада —
фермию-252.
В последующие годы в Дубне и в Беркли были син-
тезированы еще восемь изотопов сто второго элемента.
Самым долгоживущим, как и следовало ожидать, ока-
зался наиболее богатый нейтронами изотоп с массовым
числом 259—на 102 протона у него приходится 157
нейтронов. Период полураспада этого изотопа исчис-
ляется не секундами, а часами; точнее, он равен полу-
тора часам (правда, эта величина была определена
с точностью ±0,5 часа).
По тем немногочисленным химическим свойствам,
которые удалось определить различными косвенными
путями, сто второй элемент относится к числу актинои-
дов, он — аналог иттербия.
6 Зак 527
ГРАНИЦА АКТИНОИДНОГО ЦАРСТВ,
(КУРЧАТОВИЙ, ЭЛЕМЕНТ № 103)
Вообще говоря, ничто не мешало сразу же после
сто второго элемента приступить к синтезу и идентифи-
кации сто третьего. Но эта работа была значительно
менее привлекательной, чем попытка синтеза сто чет-
вертого элемента.
Взгляните — который уже раз! — на периодическую
таблицу. Сто третий элемент, согласно актиноидной
теории Сиборга, должен был представлять собой акти-
ноидный аналог последнего лантаноида, лютеция. И это
делало работу по синтезу сто третьего элемента, во-
первых, рутинной, а во-вторых, малообещающей.
Рассчитывать на успех его химического исследова-
ния особенно не приходилось: уже сто второй элемент
напрямую химически опознать не удалось. А если бы
даже и удалось установить принадлежность сто третье-
го элемента к актиноидам, это еще не доказывало бы,
что дальняя граница, предсказанная Сиборгом для
актиноидов, действительно проходит сразу же за сто
третьим элементом. Нет, воистину, особого соблазна
возиться со сто третьим не было...
Иное дело— сто четвертый! Согласно теории Си-
борга он должен быть трансурановым аналогом
гафния, «нормальным» элементом и занимать поло-
женную ему клетку таблицы Менделеева, а не делить
ее с почти полутора десятком других элементов. Тут
сразу решалось, правильны или неправильны представ-
ления современной науки о строении электронных обо-
лочек атомов химических элементов седьмого периода
периодической системы.
Да и шансы на убедительную химическую иденти-
фикацию сто четвертого элемента были солидные: отде-
лить элементы IV группы от элементов III группы пред-
ставлялось вполне осуществимым делом.
Что же касается исходного материала для синтеза,
то им мог быть плутоний, который следовало «обстре-
лять» ионами неона — тоже дело вполне освоенное.
В 1964 году дубненская группа исследователей под
руководством Флерова приступила к получению сто чет-
вертого элемента. И в том же 1964 году дубненские
физики научились объединять ядра плутония и неона
138
в ядро со ста четырьмя протонами, регистрируя такие
ядра по их спонтанному делению. В одном из экспе-
риментов^ проведенном летом того года, в течение
1000 часов удалось зарегистрировать почти полторы
сотни ядер нового элемента.
Теперь можно было переходить к самому интерес-
ному — к определению химической индивидуальности
сто четвертого.
Подготовку к химической идентификации сто четвер-
того элемента Флеров начал еще до открытия сто вто-
рого элемента — в 1960 году. Он поручил своим сотруд-
никам разработать метод химического отделения ато-
мов сто четвертого элемента от атомов актиноидов.
Прежде всего надо было найти надежный способ
отделять элементы IV группы периодической таблицы
от элементов III группы. Остановились на реакции
хлорирования при температуре около 250 °С. В этих
условиях хлориды гафния и его аналогов переходят
в газообразное состояние, а хлориды элементов III груп-
пы, следовательно, и лантаноидов, остаются твердыми.
Аналогичной разницы можно было ожидать от сто чет-
вертого и актиноидов.
Проверку избранного способа провели в той же
аппаратуре, которая предназначалась для сто четвер-
того. Прежде чем начать химическую идентификацию
сто четвертого элемента, возможности реакции хлори
рования при температуре около 250 °С проверили на
гафнии. В циклотрон поместили мишень из самария:
ведь самарий — лантаноидный аналог плутония, при
бомбардировке ионами неона он обязан был превра-
титься в аналог сто четвертого, гафний.
Разогнанные ионы неона ударяли в тончайшую!
пленку самария. Часть ядер самария превращалась
в ядра гафния, часть — в ядра лютеция, иттербия и дру-
гих лантаноидов. Все эти новые ядра отрывались от
мишени и подхватывались током горячего хлорида
циркония, который превращал их в соответствующие
хлориды.
Твердые хлориды лантаноидов оседали затем
на стенках газопроводной трубки и в специальной ло-
вушке, а газообразный хлорид гафния благополучно'
добирался до индикатора.
Так исследователи убедились, что избранный метод
должен привести к успеху.
6*
(39
Когда все было готово к замене в циклотроне сама-
риевой мишени на плутониевую, начались многочасовые
эксперименты, в ходе которых до индикатора добрались
двенадцать ядер трансуранового аналога гафния —
изотопа со 104 протонами и 156 нейтронами, с периодом
полураспада в десятую долю секунды. Победа!
В 1969 году удалось обнаружить в пятьдесят раз
более долговечный изотоп сто четвертого элемента —
со 155 нейтронами.
Флеров и его коллеги дали вновь открытому эле-
менту название «курчатовий» — в честь Игоря Василье-
вича Курчатова, возглавлявшего важнейшие работы по
ядерной физике в нашей стране.
Открытие курчатовия стало новым триумфом теоре-
тиков, оно подтвердило правильность понимания того,
как устроены электронные оболочки трансурановых
элементов.
Открытие курчатовия стало новым триумфом экс-
периментаторов: был разработан очень тонкий и точ-
ный метод отделения от актиноидов последующих транс-
урановых элементов.
Вскоре после курчатовия был получен и сто третий
элемент.
В принципе, его можно было синтезировать из амери-
ция и кислорода, из калифорния и бора, из калифорния
и азота, из кюрия и азота, из берклия и кислорода.
Впервые его получили первым способом в 1965 году
в Дубне под руководством Г. Н. Флерова.
Дубненские исследователи синтезировали легкий
изотоп сто третьего элемента со 153 нейтронами. Период
полураспада у него всего 35 секунд. А самый тяжелый
изотоп — со 157 нейтронами с периодом полураспада
не менее трех минут — был получен в Беркли в 1971 го-
ду. Хитроумнейшими опытами с единичными атомами
дубненским химикам удалось подтвердить, что сто
третий элемент, как и сто второй,— актиноид.
Общепринятого названия у него еще нет. Первоот-
крыватели предлагают назвать его резерфордием —
в честь Эрнста Резерфорда, открывшего атомное ядро.
СИНТЕЗ ЭКАТАНТАЛА
(ЭЛЕМЕНТ № 105)
После того как были изучены основные характери-
стики изотопов сто четвертого и сто третьего элементов
и отработаны методы химической идентификации с по-
мощью нагретых хлоридов, можно было смело браться
за следующий неоткрытый элемент — сто пятый, аналог
ниобия и тантала.
Первые опыты по его синтезу группа Флерова нача-
ла в 1967 году. Мишень из америция-243 бомбарди-
ровали в циклотроне ионами неона-22, к началу 1968 го-
да обнаружили около десятка новых ядер, которые
с определенной долей уверенности можно было считать
ядрами сто пятого элемента. С определенной, но далеко
не полной. Ничтожные примеси свинца, которые могли
быть в мишени, способны были превратиться в радиоак-
тивные изотопы со сходными характеристиками.
Исследователи решили устанавливать присутствие
атомов сто пятого элемента по их спонтанному делению,
которое для некоторых изотопов сто пятого элемента
непременно должно быть основным видом распада.
И действительно, в первом же эксперименте с приме-'
нением новой аппаратуры, предназначенной для реги-
страции спонтанного деления — эксперименте, длив
шемся почти неделю,— были зарегистрированы 58 сле-
дов спонтанного деления ранее неизвестных ядер с пе-
риодом полураспада около двух секунд.
Только после десятка контрольных опытов, в ходе
которых было зарегистрировано более 400 ядер нового
элемента, Флеров и его коллеги опубликовали сообще-
ние об открытии сто пятого элемента. Это было 18 фев-
раля 1970 года. А 28 апреля появилось сообщение об
аналогичном успехе американских исследователей из
Беркли.
Советские ученые предложили назвать этот элемент
в честь Нильса Бора, американские — в честь Отто Гана.
Официального имени элемент еще не получил.
Химические свойства сто пятого сочлена периоди-
ческой системы элементов исследовали в Дубне, усовер-
шенствовав для этой цели метод, которым был опознан
курчатовий. Усовершенствовать его пришлось по той
причине, что отделить летучие хлориды сто пятого эле-
т
141
мента следовало не только от нелетучих хлоридов акти-
ноидов, но и от других летучих хлоридов, например того
же курчатовия.
Продукты, образовавшиеся при бомбардировке
ионами неона америциевой мишени, подхватывались
потоком горячего азота, который уносил их в длинную
стеклянную трубку; температура в трубке постепенно
понижалась, а в самое начало подавались для хлори-
рования парообразные тетрахлорид титана и хлорид
тионила.
В начале этой «термохроматографической колонки»
выпадали наименее летучие хлориды, затем все более
летучие. Жидкостной хроматографией заранее опреде-
ляли время выхода капель тех или иных актиноидов
на основании предварительных опытов с лантаноидами.
Точно так же и при термохроматографическом опре-
делении заранее отмечали участки стеклянной трубки,
где выпадали хлориды лантаноидов, ниобия, тантала,
гафния.
А чтобы установить, где выпадут атомы нового
элемента, вдоль всей трубки расположили детекторы
спонтанного деления.
* Если при бомбардировке ионами неона мишени из
америция действительно образовывался элемент № 105,
то максимальное число спонтанных делений должно
было приходиться на участок трубки, в котором в преж-
них опытах выпадали ниобий и тантал; точнее, на уча-
сток, несколько более близкий к началу трубки, потому
что по расчетам хлорид экатантала должен был быть
несколько менее летучим, чем хлориды ниобия и тан-
тала.
Эксперименты полностью подтвердили это предска-
зание.
Открытие сто пятого элемента, таким образом, было
подтверждено не только физическими, но и химическими
свойствами полученных атомов.
МАГИЧЕСКАЯ МИШЕНЬ
(ЭЛЕМЕНТ № 106)
Пословица «чем дальше в лес, тем больше дров»
применима далеко не ко всяким поискам — во всяком
случае, к поискам трансуранов она неприменима совсем.
Тут, «чем дальше в лес», тем больше не дров, а, скорее,
щепок. С увеличением порядкового номера трансурано-
вых элементов все меньшее число атомов удается син-
тезировать за то же самое время, все большая часть
бомбардируемых ядер делится на осколки, все меньше
период полураспада новых ядер.
В общем и целом все это так. И потому следующий
элемент, сто шестой, получение которого по реакции
калифорний плюс неон было теоретически очевидным,
оказался достаточно крепким орешком. Атаки на эту
очередную ядерную крепость, начавшиеся в 1970 году,
сразу же после получения сто пятого элемента, завер-
шились успехом лишь в 1974 году. Но главным резуль-
татом этих атак оказались, пожалуй, не сами несколько
новых ядер, а новый метод, которым их получили в
Дубне.
После того как на менделевии были исчерпаны воз-
можности создания мишеней из все более тяжелых
трансуранов, единственным путем дальнейших синтезов
стало создание все более тяжелых снарядов. Чтобы
получить разные изотопы сто второго, сто третьего, сто
четвертого и сто пятого элементов, пришлось делать
мишени из все тех же урана, плутония, кюрия, амери-
ция, калифорния, но обстреливать их ионами бора,
углерода, кислорода и даже неона. При этом полностью
подтвердились предсказания теоретиков о том, что с ро-
стом числа зарядов снаряда получение новых элемен-
тов станет все более и более трудным. И что главных
препятствий будет два.
Первое препятствие — кулоновский барьер, т. е.
сила взаимного отталкивания двух положительно заря-
женных объектов бомбардирующего ядра и ядра —
мишени. Согласно закону Кулона эта сила прямо про-
порциональна произведению взаимодействующих заря-
дов. И потому с увеличением заряда снарядов кулонов-
ский барьер растет с колоссальной быстротой. Напри-
мер, заряд у ядра углерода всего на единицу больше,
В
143
чем у ядра бора. Но если вместо ионов бора обстре-
ливать мишень из урана ионами углерода, то кулонов-
ский барьер возрастет в 92 раза! И чтобы теперь ион
слился с ядром мишени, преодолел столь возросшую
силу отталкивания, этому иону надо придать гораздо
большую скорость.
К сожалению, затруднение не только в том, что
построить более мощные ускорители — дело непростое
и весьма дорогое. Основная сложность заключается в
другом: высокоэнергичные, разогнанные до еще боль-
ших скоростей ионы вместо того, чтобы образовывать
с ядрами мишени новые, более крупные ядерные агре-
гаты, чаще всего разбивают эти ядра на осколки. Если
же прибегнуть к более точной терминологии, то огромная
энергия, привносимая ионом в объединенную ядерную
каплю, как правило, не успевает испариться в окру-
жающее пространство, и это новообразование почти
мгновенно разрывается на части. По этой причине с уве-
личением энергии ионов (необходимого из-за увеличе-
ния кулоновского барьера) образование новых элемен-
тов происходит все реже и реже и в конце концов дол-
жно прекратиться совсем.
Таково было второе препятствие, впрочем зави-
сящее от первого.
Была ли принципиальная возможность преодолеть
эти препятствия? На первый взгляд такой возможности
не было. Закон Кулона есть закон Кулона. И увеличе-
ние энергии ионов абсолютно неизбежно, если мы хотим,
чтобы они достигли ядер мишени. Вот если бы чем-
нибудь укрепить эти ядра, чтоб они не раскалывались
от избытка энергии, привносимого ионами, тогда вы-
сокоэнергичные ионы были бы не так опасны...
Такая мысль вроде бы совершенно еретична, с точки
зрения любого человека, знающего, что деление ядра
потому и называется спонтанным, что оно самопроиз-
вольно и повлиять на него ничем нельзя. Но недаром
говорится: «Умный в гору не пойдет, умный гору обой-
дет»!
Удалось придумать, как «обойти гору», как сделать,
чтобы составные ядра были более прочными. Надо
делать мишень не из обыкновенных ядер, а из «маги-
ческих».
В самом начале 20-х годов нашего века Нильс Бор
понял, почему инертные газы отличаются такой исклю-
144
чительной невосприимчивостью к химическим воздейст-
виям. Необычайная химическая инертность гелия,
неона, аргона, криптона, ксенона и радона объясняется
тем, что их электронные оболочки до отказа заполнены
электронами. Они — как рыцари, чьи доспехи не имеют
ни малейшего изъяна.
К 60-м годам идеи Бора относительно электронных
оболочек атомов были с большим успехом применены
американкой Марией Гипперт-Мейер и западногерман-
ским физиком Иенсеном для объяснения особой проч-
ности некоторых ядер. Они выдвинули предположение,
согласно которому протоны и нейтроны расположены
в ядрах не как попало, а тоже образуют оболочки —
протонные и нейтронные. И в этих оболочках тоже
может находиться не произвольное, а строго определен-
ное максимальное число частиц: 2, 8, 20, 50, 82, 114, 126,
184.
Эти числа получили название магических, а ядра
с магическим числом частиц — магических ядер. Они
отличаются такой же прочностью по отношению к чу-
жим протонам и нейтронами, как «магические» атомы
инертных газов — к чужим электронам.
Поэтому и было решено изготовлять мишени не из
трансуранов, и даже не из урана, а из свинца — эле-
мента № 82, обладающего, следовательно, магическим
по числу протонов ядром. А один из его изотопов, сви-
нец-208, обладает к тому же и.магическим числом ней-
тронов— 126, т. е. ядро у него дважды магическое.
Были весьма серьезные основания рассчитывать, что эти
сверхпрочные ядра смогут выдержать удар сверхэнер-
гичных ядер хрома и образовать с ними достаточно
прочное (физики говорят — холодное) ядерное объеди-
нение— элемент № 106.
Это была действительно оригинальная мысль. До тех
пор исследователи стремились сделать мишень из ядер
с максимально возможным порядковым числом, продви-
нуться в очереди порядковых чисел подальше. И вдруг
предлагается, наоборот, отступить даже от плутония.
Даже от урана. Отступать, отступать и отступать, пока
в распоряжении не окажется подходящая крепость.
К этому времени в Дубне уже работало циклотрон-
ное устройство, позволявшее создавать мощные потоки
высокоэнергичных ионов вплоть до ионов ксенона —
с 54 протонами. Так что снаряды из хрома — с 24 про-
145
тонами — никого не смущали. Смущало другое —
результат столкновения ядра хрома с ядром свинца.
Чтобы подстраховаться, Флеров предпринял синтез
106-го элемента и с помощью уже проверенных сна-
рядов — ионов неона, которыми в этом случае надо
было бомбардировать мишень из кюрия. Но «магичес-
кое» направление стало главным: ведь в случае успеха
оно открывало дорогу и к более далеким трансуранам.
Прежде чем приступить к попыткам синтеза нового
элемента, решили синтезировать на основе свинцовой
мишени уже известный изотоп, который можно было
бы легко обнаружить по присущему его ядру периоду
полураспада. Остановились на изотопе фермий-244
с периодом полураспада по спонтанному делению 3,3
миллисекунды. Свинцовую мишень облучили восем-
надцатипротонными ионами аргона и действительно
получили спонтанно делящиеся ядра с периодом полу-
распада 3,3 миллисекунды.
Затем решили проверить метод на еще более много-
зарядных ионах — элемента № 22, титана. И облучив
ими свинец, получили два дотоле неизвестных изотопа
курчатовия.
Осенью 1973 года Флеров, наконец, счел предвари-
тельную работу законченной, и начались эксперименты
уже с ионами хрома, которые должны были привести
к синтезу сто шестого элемента.
Десять месяцев продолжались эти эксперименты.
Результаты каждого из них тщательно проверялись
и перепроверялись. В июле 1974 года появилось первое
официальное сообщение: при ядерной реакции между
ядрами свинца-207 и ионами хрома-54 получено более
50 ядер сто шестого элемента с массовым числом 259,
подверженного альфа-излучению и спонтанному делению.
Ядра были зарегистрированы по характеристикам
спонтанного деления — с периодом полураспада около
семи миллисекунд.
Два месяца спустя радиофизики из Беркли опубли-
ковали сообщение о том, что им удалось в результате
бомбардировки калифорния ионами кислорода полу-
чить другой изотоп сто шестого элемента с массовым
числом 263 и периодом полураспада около 0,9 секунды.
146
СИНТЕЗ ТРИМАРГАНЦА
(ЭЛЕМЕНТ № 107)
Через два года после того как была заполнена
106-я клетка Менделеевской таблицы, пришла очередь
следующей клетки. Группе Флерова удалось синтези-
ровать и надежно опознать элемент № 107.
Если элемент № 106 можно считать экавольфрамом,
то элемент № 107 можно считать экарением, или, если
угодно, тримарганцем. Первое научное сообщение о его
открытии было опубликовано в январе 1976 года. Он
явился в мир в виде изотопа с массовым числом 261:
на 107 протонов у него приходится 154 нейтрона. Роди-
тели его — висмут-209 (почти «магический» — со 125
нейтронами) и хром-54. Отпрыск недолговечен: пример-
но 20 % атомов подвержено спонтанному делению
с периодом полураспада около двух миллисекунд.
Остальные атомы тотчас после рождения испускают
по альфа-частице и превращаются в атомы экатантала,
элемента № 105.
Осенью 1984 года почти одновременно в печати
появились сообщения из Дубны и Дюссельдорфа о
синтезе и идентификации первых ядер элемента № 108.
Физики надеются, что более насыщенные нейтро-
нами изотопы тримарганца, когда их удастся получить,
будут жить несколько дольше. Но отнюдь не это вдох-
новляет на новые многотрудные поиски Георгия Нико-
лаевича Флерова, его дубненских коллег, большие груп-
пы исследователей в Америке и Западной Европе. Их
влечет «область стабильности».
ОБЛАСТЬ
СТАБИЛЬНОСТИ
Вообще говоря, чем больше заряд ядра, тем менее
оно устойчиво. Недаром у химических элементов, у кото-
рых в ядре более 83 протонов, нет уже ни одного ста-
бильного изотопа. Недаром у химических элементов,
у которых в ядре более 100 протонов, определяющим
становится не альфа-распад, а спонтанное деление —
В
147
когда ядро уже теряет не мелкие обломки, а сразу раз-
валивается на две крупные части. Недаром самый устой-
чивый изотоп фермия живет в миллиард раз меньше,
чем самый устойчивый изотоп плутония.
Все так — в общем и целом с увеличением заряда
ядра его устойчивость действительно уменьшается.
Но если бы это правило было абсолютным, действовало
не в общем и целом, а во всех случаях без исключения,
то, может быть, и не стоило бы тратить столько сил
на получение все новых и новых трансурановых эле-
ментов. Ядра, однако, ведут себя не так однозначно.
Согласно оболочечной теории строения атомных ядер,
о которой рассказывалось в главе «Магическая ми-
шень», те ядра, у которых протонные и нейтронные
оболочки заполнены до конца, обладают особой проч-
ностью. Вспомним, что по этой теории на оболочках
может быть не более 2, 8, 20, 50, 82, 114, 126 и 184 ча-
стиц.
Нет пока оснований предполагать, что эта законо-
мерность подведет, когда дело коснется никем еще не
виданных атомов со 114, 126 и 184 протонами, или с та-
ким же числом нейтронов, или, тем более, протонов и
нейтронов одновременно. Это подтвердили и расчеты,
проведенные теоретиками, в том числе в Дубне. Бо-
лее того, по расчетам получается, что будут особо проч-
ными ядра не только с точно магическими числами про-
тонов и нейтронов, но и с близкими к ним, что может
•существовать целое семейство трансуранов-долгожи-
телей, целая область стабильности в далеких заура-
новых просторах. Вполне возможно, например, что
вдвойне магический экасвинец—элемент № 114 со
114 протонами и 184 нейтронами — окажется столь
прочным, что время жизни некоторых его ядер будет
исчисляться не миллисекундами, а миллионами лет.
Такая игра стоит свеч! Но в чем именно она должна
заключаться? Какие пути могут привести к обнаруже-
нию жителей области стабильности? На сегодня можно
представить себе по крайней мере три направления
поисков.
Первое направление основано на предположении,
что трансураны-долгожители имелись в составе перво-
начального материала, из которого создавалась Сол-
нечная система, в том числе и наша планета. В таком
случае их стоило бы поискать на Земле. Вторая воз-
ив
можность . основана на предположении, что синтез
подобных ядер где-то во Вселенной продолжается и в
наши дни. Следовательно, их можно поискать в косми-
ческих лучах. Наконец, третий путь — это обстрел тяже-
лых ядерных мишеней «сверхтяжелыми» ядерными сна-
рядами. Например, чтобы получить дважды магическое
ядро со 126 протонами и 184 нейтронами, нужно было
бы мишень из плутония-242 обстрелять ионами герма-
ния-72 или мишень из тория-232 облучить пучком ионов
криптона-82. Все это выглядит на бумаге довольно про-
сто, но, кроме всего прочего, легче получить ядро с нуж-
ным числом протонов, чем с достаточным числом ней-
тронов: ведь чем больше заряд, тем больший избыток
нейтронов в ядре нужен для сохранения его устойчи-
вости. А где эти избыточные нейтроны взять? Вот если
бы можно было вдобавок к сверхтяжелым ионам одно-
временно обстреливать ядра мишени еще и нейтронами!..
В общем, ни один из этих путей не обещает быть
легким. Но одну из трудностей, которая непременно
встретится на всех трех путях, удалось уже если не
преодолеть, то во всяком случае подробно обсудить.
Речь идет о трудности узнавания.
До сих пор надежным компасом для исследователей
трансурановых элементов служила Менделеевская таб-
лица, седьмой период которой был построен в соответ-
ствии с актиноидной теорией Гленна Сиборга. Но каки-
ми будут элементы восьмого и девятого периодов —
те самые, которые вроде бы должны отличаться пара-
доксальной продолжительностью существования? На
какие из предшествующих элементов будут они похожи?
Какие нужны носители, чтобы можно было выделить
их из мешанины уже известных ядер?
На что, например, будет похож магический элемент
№ 126? Если восьмой период Менделеевской таблицы
в принципе аналогичен седьмому и в его составе имеется
семейство из 14 экаактиноидов, то элемент № 126 ока-
жется химическим аналогом плутония. А значит, наибо-
лее химически стоек он окажется в соединениях, где его
валентность будет более трех. Соответственно следует
тогда подбирать и носитель.
Однако согласно расчетам, сделанным еще в 1968 го-
ду советским ученым Виталием Иосифовичем Гольдан-
ским, восьмой период не будет аналогичным седьмому.
В восьмом периоде должно появиться еще одно допол-
149
нительное семейство из восемнадцати элементов, и как
раз в это семейство попадет и сам элемент № 126, и
ближайшие к нему элементы, от которых тоже можно
ожидать долголетия. И все они будут аналогами акти-
ноидов. Так что химически наиболее стойкими будут
именно трехвалентные соединения элемента № 126.
И носитель для него надо подбирать с учетом этого
обстоятельства, иначе с ним получится так же, как с не-
которыми трансуранами до появления актиноидной тео-
рии: даже если он будет синтезирован, заметить его
все равно не удастся.
ПОСЛЕДНИЕ
НАБЛЮДЕНИЯ
В предыдущей главе речь шла о трех возможных
направлениях поисков трансуранов- долгожителей.
Во всех этих направлениях сейчас идет работа.
Продолжаются поиски «ядерных динозавров» — сох-
ранившихся на нашей планете «сверхъядер», элементов
из области стабильности. Если они действительно сох-
ранились, то скорее всего в наиболее древнем веществе
нашего земного шара — в ядре, в мантии. Конечно,
непосредственно до ядра и даже до мантии пока еще
добраться невозможно — самые глубокие пробуренные
скважины едва преодолели первый десяток километров
земной коры. Однако геологи считают, что вещество
мантии, растворенное подземными водами, кое-где вы-
носится на поверхность Земли. Например, оно может
находиться в некоторых соленых источниках Туркмении
и Узбекистана. В этих водах обнаружено немало тя-
желых элементов. Почему .бы не попытаться обнару-
жить там и далекие трансураны?
Сотрудники Г. Н. Флерова направились в пустыню,
на полуостров Челекен, захватив с собой тонну ионо-
обменной смолы, и пропустили через заполненные ею
колонки тысячи кубометров соленой воды одного из
источников. Осажденное в колонке вещество затем
помещали в специальные счетчики, с большой точ-
ностью регистрирующие ядерный распад. При этом
иногда удавалось наблюдать импульсы, похожие на те,
150
что должны были бы появляться в случае спонтанного
деления ядер некоторых еще не известных трансурано-
вых элементов. Однако достаточно четких и надежных
результатов, позволявших говорить о поимке нового
трансурана, а тем более трансурана из области ста-
бильности, пока еще получить не удалось.
Интенсивно ведутся поиски трансуранов-долго-
жителей «современного», космического происхождения.
Американские физики включили такие поиски в про-
грамму работы космической станции «Скайлэб».
Сверхъядра пытались выловить сетью из полимерной
пленки, заброшенной в космическое пространство на
220 суток. В этом эксперименте были зарегистрированы
23 ядра тяжелых элементов — от радона до фермия.
Но ни одно ядро с зарядом более 100 не оставило на
пленке своего следа.
Исследователи из Дубны решили использовать бо-
лее эффективные детекторы небесных трансуранов —
метеориты. Эти космические тела — ровесники нашей
планеты, т. е. облучаются в космосе уже миллиарды
лет. Примерно через каждые 200 миллионов лет они
разрушаются, и у них образуются чистые поверхности,
на которых космические частицы могут оставлять такие
следы, которые до падения метеорита на нашу планету
еще не будут стерты последующими ударами косми-
ческих частиц. Эти естественные детекторы работают
в космосе в сотни миллионов раз дольше, чем забрасы-
ваемые в космос на спутниках. Так что и шансов обна-
ружить нужные следы тут в сотни миллионов раз
больше.
В 1980 году сотрудники Флерова В. П. Перелыгин
и С. Г. Стеценко обнаружили в кристаллах оливина;
вкрапленных в метеорит Марьялахти, несколько сотен
треков ядер тяжелых элементов. Почти все треки ока-
зались следами ядер тория, урана, известных транс-
уранов. Но четыре трека разительно отличались от
остальных: они были почти вдвое длиннее, чем треки
ядер тория и урана.
Чтобы создать эталонные треки, с которыми можно
было бы сравнить треки, обнаруженные в метеорите,
исследователи подвергли кристаллы оливина обстрелу
ускоренными тяжелыми ионами. Сравнение показало,
что четыре сверхдлинных трека оставлены ядрами,
заряд которых, по всей вероятности, не меньше 110.
151
Полным ходом идет работа и по синтезу и иссле-
дованию ядер, следующих за элементом № 108, в том
числе и трансуранов, относящихся к области стабиль-
ности. В Дубне пущен новый циклотрон, который может
создавать значительно более интенсивные потоки тя-
желых ионов, чем прежде. Результаты, надо полагать,
не заставят себя ждать слишком долго.
ТАИНСТВЕННЫЕ
ОСТРОВА
Лет сто назад ученый мир был до такой степени
потрясен удивительным совпадением удельных весов,
температур плавления и прочих свойств новооткрытых
элементов — галлия, скандия и германия со свойствами
экаалюминия, экабора и экасилиция, предсказанными
Дмитрием Ивановичем Менделеевым на основе перио-
дического закона, что еще одно удивительное совпаде-
ние прошло незамеченным. Никто не обратил внимания
на то, что первыми после появления периодического
закона были открыты именно предсказанные на его
основе элементы.
Буабодран, Нильсон и Винклер словно специально
пошли по указанному Менделеевым следу, как если бы
в природе не было еще двух десятков неоткрытых эле-
ментов.
Вообще история открытия химических элементов на
редкость богата удивительными совпадениями.
Если взять менделеевскую таблицу и закрасить
на ней клетки элементов, знакомых человеку еще до
открытия фосфора — первого открытия такого рода,
автор которого доподлинно известен,— то сразу же
обнаружится странная вещь. Цветные пятна не распо-
ложатся по площади таблицы равномерно, а образуют
на карте элементов два больших скопления — как бы
континента: в одном — платина, золото, ртуть, серебро,
медь и цинк, в другом — олово, свинец, висмут, сурьма,
мышьяк и сера. И только два издревле известных че-
ловеку простых вещества разместятся хоть и непода-
леку, но отдельно — углерод и железо.
152
весые^ аосиэо
Г'«.
00
3 I
а) га
о. о.
й> т
с
оэ
1НЭНИ11ЮН
и1яао1лнияэ
'■И.1МЦ.. *.-
•СО
СО
СП
1о
со
00
<—8-
X
ш О
О Н
к- ^
1-0 с;
Э1/ЭЭП1
ЯОС11ЭО
••'О'
.со
СП
и,
—н
со
СО
Ю
СО
и
О V
ГО о
ЭЙ
БХНВННЭ^
вОСкЭО
•о о
о. о.
СО
Флер
остров
•
•
;
1
,
\
103
СЧ1
о 1
К]
!*
со
ш
и
т
Е
и
)Е
2
ч«..»>
ы
го
Б о.
X °
2
° V
х та
8в
X Я
5 О.
С О
ё
э* со
§. §х
& "*
О о-
$ га
т и.
<-> са
15 §
О со
а о.
н -
■=; ^
Ш О)
са н
н со
о т
!§
и
со и
со х
су
Ч -
« ^
■2 =
Х 2
ефоУхс!и>^
•внэенХд воскэо
БэЛии-эТкЗэд
ЯОскэо
Что помешало равномерному, «гомогенному» рас-
пределению древнейших открытий по всей таблице?
Какая сила стянула элементы в свинцовый и золотой
континенты? Словно сама природа как бы показывала
людям элементы не поодиночке, а группами.
Выдвинем гипотезу: если даже непреднамеренные
открытия делались закономерно, если и в самом деле
существует некая причина, заставляющая острова
вновь открываемых элементов соединяться в континен-
ты, то в последующем вновь открываемые элементы
должны располагаться в таблице в виде перешейков,
соединяющих отдельные части древнего архипелага.
В 1669 году гамбургский алхимик Генниг Бранд
открыл фосфор. С точки зрения самого Бранда, а также
с точки зрения всех ученых людей того времени, это
открытие было совершенно случайным. Бранд, разорив-
шийся купец, искал философский камень, чтобы с его
помощью изготовить золото и тем поправить пошатнув-
шиеся дела Но вместо философского камня он нашел
фосфор.
Ну, а если посмотреть на это открытие с точки зре-
ния нашей гипотезы? С этой точки зрения открытие
Бранда было вполне закономерным. Ведь фосфор обра-
зовал на карте химических элементов как раз один
из ожидаемых перешейков между древним свин-
цовым континентом и древним же углеродным островом.
Следующий новый элемент, кобальт, был открыт
в 1735 году шведским химиком Георгом Брандтом.
И тут загадочная сила проявила себя вполне однознач-
но: открытый Брандтом элемент примкнул к другому
древнему острову — железу, причем на карте химиче-
ских элементов он почему-то расположился как раз
в направлении древнего золотого континента. А завер-
шило строительство второго перешейка открытие оче-
редного элемента — никеля, сделанное в 1751 году
Акселем Фредериком Кронштедтом.
В дальнейшем история открытия химических элемен-
тов продолжала развиваться все тем же путем. Стара-
ниями выдающихся охотников за элементами в XVIII,
XIX и нынешнем XX веке йа карте открытий появилось
немало компактных образований, подчас не уступавших
по величине континентам древности.
Поглядите на эту карту.
154
Ре
I
.-лиг
**
*$
ш
аШй
: -фрл
А*
%^^^%^
«4.
ш
т
ш
ж
А^Ш
5л
т
ы$
5Ь
В1
«
И
У^л^ЩР
Контактные участки («континенты»), образованные на менделеев-
ской таблице издревле известными элементами.
Вот два острова Шееле — в общей сложности из
семи элементов.
Вот расположенный на «Крайнем Западе» остров
Дэви — из шести элементов, а если учесть еще и бор,
открытый знаменитым англичанином независимо от
Гей-Люссака и Тенара, хотя и с опозданием на девять
дней,— то из семи.
На «Дальнем Востоке» не может не привлечь вни-
мания пятиэлементный остров Рамзая, на «Юге» —
обширные острова Сиборга и Флерова.
Все это — крупнейшие образования, а ведь есть еще
острова поменьше — остров Волластона, остров Тен-
нанта, остров Бунзена — Кирхгофа, остров Берце-
лиуса...
Ш
Первые же элементы, открытые в новые времена фосфор, кобальт.
Никель, объединили «свинцовый континент» с углеродом и «золотой
континент» с железом.
155
Прежде чем вернуться к тому, с чего мы начали,—
к открытию предсказанных Менделеевым экаэлементов,
упомянем еще одну группу удивительных совпадений.
Впрочем, об одном таком совпадении мы уже только
что упомянули: бор был открыт независимо и почти
одновременно в Англии и во Франции. Точно так же
независимо и почти одновременно были открыты:
азот (первооткрыватели Шееле, Кавендиш, Дэниел
Резерфорд);
кислород (Шееле, Пристли);
марганец (Кайм, Шееле);
теллур (Мюллер, Китайбель);
титан (Грегор, Клапрот);
хром (Воклен, Клапрот, Ловиц);
церий (Берцелиус, Клапрот);
стронций (Клапрот, Ловиц);
кадмий (Штромейер, Герман и Ролов, Мейснер);
алюминий (Эрстед, Вёлер);
бром (Лёвиг, Балар);
ванадий (дель Рио, Вёлер, Сефстрём);
таллий (Крукс, Лами);
гелий (на Солнце — Жансен, Люмьер; на Земле —
Пальмиери, Гиллебранд, Рамзай);
гадолиний (Мариньяк, Буабодран);
полоний (супруги Кюри, Марквальд);
актиний (Дебьерн, Гизель);
радон (Эрнест Резерфорд и Оуэне, Дебьерн, Рамзай
и Содди, Дорн);
европий (Крукс, Буабодран, Демарсе);
лютеций (Урбен, Вельсбах);
протактиний (Фаянс и Геринг, Ган и Мейтнер, Содди
и Кренстон);
рений (супруги Ноддак, Друце и Лоринг, Гейров-
ский и Долейжек)
Список стал бы еще больше, если бы к естественным,
существующим в природе элементам мы решили доба-
вить искусственные, полученные в циклотронах. Но и
без того он слишком велик, чтобы подобные совпадения
можно было считать случайными. Опять-таки некая не-
ведомая причина направляла действия исследователей
к одной и той же цели. Не та ли самая, что заставила
Буабодрана, Нильсона и Винклера открывать менде-
леевские экаэлементы? А безвестных металлургов древ-
ности — выплавлять металлы золотого и свинцового
156
континентов? А Бранда, Брандта и Кронштедта — со-
единять эти континенты перешейками?
В истории открытия брома была одна любопытная
деталь: первым новый элемент попался на глаза не
препаратору Балару, опубликовавшему о нем первое
сообщение, и не абитуриенту Лёвигу, упомянутому
в перечне первооткрывателей, а Юстусу Либиху, ко-
торый в отличие от никому не известных Балара и Лё-
вига был уже университетским профессором. Однако
профессор не увидел в бурой жидкости ничего приме-
чательного и впоследствии был так раздосадован, что
в истории науки навсегда осталось его ядовитое заме-
чание : «Не Балар открыл бром, а бром открыл Балара»
Но в сердитой реплике Либиха есть и гораздо более
глубокий смысл. Стоит лишь задаться вопросом: какая
из двух возможностей была более вероятной — та,
что именно Балар будет первооткрывателем брома,
или та, что бром так или иначе будет открыт примерно
тогда, когда его действительно открыли?
По-иному можно повернуть и историю с открытием
экаэлементов, если задаться вопросом не о том, почему
были открыты именно они, а почему Менделеев уверенно
предсказал наличие в природе и подробно описал
свойства именно экаалюминия, экабора, экакремния,
а не каких-либо иных из неоткрытых к тому времени
элементов.
Вот как ответил на этот вопрос сам Менделеев:
«Судить об элементах, стоящих внутри системы в тех
пределах, для которых известны уже многие элементы,
мы имеем полное право; но нельзя того же сказать об
элементах, долженствующих помещаться в крайних
частях системы».
Иными словами, делая свои теоретические пред-
сказания, Менделеев опирался на хорошо изученные
элементы, окружавшие клетки еще не открытых
элементов.
Но ведь и практически открывать новые элементы
можно было прежде всего те, для выделения которых
имелись уже в наличии необходимые методы. А такие
методы были разработаны для уже известных веществ.
Так что и предсказания и экспериментальные откры-
тия основывались, в сущности, на одном и том же —
на имевшихся в то время знаниях и технических сред-
ствах.
Накапливаются определенные знания, определен-
ные навыки — и возникают золотой и свинцовый кон-
тиненты; и фосфорный и кобальтово-никелевый пере-
шейки связывают их с углеродом и железом; и бром
открывает Балара; и Менделеев открывает периоди-
ческий закон и предсказывает свойства еще не открытых
элементов, а Буабодран, Нильсон и Винклер находят
их в природе. Всему свой час!
Посмотрите на рисунок, помещенный на 3 стр.
обложки, там представлена зависимость темпов открытия
химических элементов от важнейших достижений науки
и техники, вооружавших исследователей новыми мето-
дами обнаружения и выделения элементов. Эта зави-
симость имеет циклический характер; особенно четко
выглядят последние два цикла. Полное отсутствие от-
крытий в шестом десятилетии XIX века объясняется
полным исчерпанием возможностей имевшихся тогда
методов — с их помощью обнаружить скрывавшиеся
редкие и рассеянные элементы было невозможно.
Из тупика вывело изобретение в 1859 году спектроскопа.
С открытием периодического закона и радиоактивности
темпы открытий стали еще выше. Однако к началу
XX века почти все существующие на нашей планете
в заметных количествах элементы были уже открыты,
и начался очередной спад. Он сменился новым подъе-
мом лишь тогда, когда удалось найти способы синтеза
искусственных ядер.
ПРИГЛАШЕНИЕ К АНАЛИЗУ:
ПРАВИЛА ОТКРЫТИЙ
Могла ли история открытия химических элементов
быть иной? В силу каких причин один элемент был
открыт раньше, а другой позже?
Готовых ответов на эти вопросы не существует.
Попробуем поискать их сами. Но прежде чем приступать
к поискам объективных факторов, от которых зависит
очередность открытия элементов, необходимо зафикси-
ровать более или менее точно момент каждого открытия.
А сделать это далеко не во всех случаях легко и просто.
158
Например, первый минерал фтора, плавиковый
шпат, был обнаружен еще в средние века. Первое
искусственное соединение фтора, плавиковая кислота,
получено в 1670 году Шванхардом. В 1780 году Шееле
догадался, что в плавиковой кислоте содержится но-
вый элемент. В 1798 году Лавуазье поместил его («ра-
дикал плавиковой кислоты») в таблицу простых тел.
А в свободном виде фтор был выделен только в 1886 году
Муассаном. Что же принимать за момент открытия
этого элемента? Обычно считают, что фтор был открыт
в 1886 году.
Теперь вспомним историю другого элемента —
диспрозия. Его первое соединение, триоксид, было обна-
ружено Буабодраном в том же 1886 году, когда Муассан
выделил фтор. А в свободном виде диспрозий был полу-
чен в 1905 году Урбеном. Казалось бы, по аналогии
с фтором годом открытия этого элемента должен был
считаться 1905 год. Однако в общепринятой метрике
диспрозия значится 1886 год.
Такой же беспорядок царит в хронологии открытия
многих других элементов. Одни, как кобальт, хлор, ка-
лий, считаются открытыми тогда, когда их выделили
в свободном виде. Другие — как стронций, уран, ли-
тий,— когда было выделено их специфическое соеди-
нение. Третьи — как цезий, астат, трансураны,— когда
их присутствие было обнаружено каким-либо физичес-
ким или химическим методом. Поэтому, чтобы иметь
возможность говорить об очередности открытий, надо
сначала установить какой-то единый объективный кри-
терий, более или менее пригодный для всех случаев.
В первом приближении таким критерием для про-
стых веществ, известных в древности, могло бы служить
их первое археологически или литературно зафикси-
рованное использование, а для всех прочих элемен-
тов — первое обнаружение любым способом в любом
виде (свободном или связанном). Тогда датой открытия
фтора следовало бы считать 1780 год, а диспрозия —
1886.
Правда при таком подходе придется отказаться
от некоторых привычных представлений. Водород, на-
пример, окажется открытым не Кавендишом в 1766
году, а на сотню лет раньше — Бойлем, которому пер-
вому удалось собрать в сосуд «летучую серу Марса».
И все же, только руководствуясь одним критерием,
159
можно составить себе объективное представление о
последовательности открытий.
Теперь можно начинать поиск факторов, от которых
могла бы зависеть очередность открытий. Простейшее
предположение, вероятно, такое: установленный нами
порядок открытий должен зависеть от распространен-
ности элементов на нашей планете — от так называе-
мых кларков (содержание в земной коре — литосфере,
в % по массе).
Попробуем сопоставить последовательность откры-
тий с последовательностью кларков, а для инертных
газов — с последовательностью их содержания в воз-
духе, тоже в % по массе (в табл. римские цифры).
Само по себе прямое сопоставление этих двух рядов
чисел как будто ничего не дает. В самом деле, наиболее
распространенные на Земле элементы — кислород и
кремний. Но в очереди открытий кислород занял лишь
двадцать шестое место, а кремний — двадцатое.
Попробуем зайти с другого конца — посмотрим,
какова распространенность какого-либо из давно из-
вестных элементов, например ртути. Оказывается, что
в очереди кларков ртуть занимает шестьдесят девятое
место — вслед за индием, открытым в XIX веке.
Опять не получается.
И все же простая житейская логика заставляет нас
снова и снова возвращаться к мысли, что невозможно
же, чтобы распространенность того или иного элемента
никак не влияла на вовлечение его в сферу материаль-
ных интересов разумных обитателей планеты, значит,
в конце концов, и на очередность открытия.
А что если сопоставить, скажем, первые пятнадцать
элементов? Оказывается, четыре совпадения есть: четы-
ре элемента наличествуют в первых полутора десятках
обоих перечней, хотя и занимают там разные места.
Вот эти элементы: углерод, железо, сера, фосфор.
Прибавим еще пятнадцать элементов и посмотрим,
сколько одних и тех же окажется теперь в обоих переч-
нях. Углерод, железо, сера, фосфор, медь, олово, цинк,
водород, калий, натрий, кальций, кремний, кобальт,
никель, алюминий, магн**й, азот, кислород, марганец,
хлор, барий. Из тридцати элементов, открытых первыми,
двадцать один попадает в первую тридцатку по распро-
страненности! Может ли быть случайным такое совпа-
дение? Вряд ли.
160
Последователь-
ность
кларков
откры-
тий
Элементы
Последователь-
ность
кларков
откры-
тии
Элементы
Последователь-
ность
кларков
откры-
тий
Элементы
Последователь-
ность
Элементы
кларков
откры-
тий
"^ Г"4 ОЪ О ОЪ СЛ I""»
00 > Ю СО Г^ ч*« Г*-
СМ СО ^ Ю СО N 00 О) О — СМ СО -^ Ю СО ^ 00 0> О — СМ ^ СО Ю СО N
ОООООООООООООООООО)С7)0)0>0)О)0)О)0)ОООООООО |
55 '5 *Е « сч со т»« ю со г^
х й=хоооооо
_х 8Ж_ * »х «»я х я ш _ ^ _ ^ — ^
«ж »х в н я »* ж х х х .ж СХ'Х си
5 а со 2 сх ^ 5 * Р- С а; Ч 2 5 О- & я « а» и
оо см оо г- со о оо т»< оо ^ ю СN ю оо —■ см г>- — см г>- а> „ > •—1 ^ см о
СО СМ "* Ю Г>- т*< — Ю СО ЕП СО Ю -ч*« Ю СО -* СО ч*| СО ^ СО « ■— ^ 00 00
ЮЮМЮФО- МСО.^ЮСОМЙФО- СМСОт^ЮСО^ОООО —
Ю Ю Ю Ю Ю СО СО СО СО СО СО СО СО СО СО Г^ Г^-Ь* Г^ Ь-Г^ Г^ 1^ N. 1^. 00 00
»х 5 »х
»х _ я я х »я „
« »Х * X 'Я »Х * X с* _ 2 X Я *
эх: *, 'Хх ^'К- 'ХО^Х == я О 25 О X О х5
о я а. и >>*> >>я = 3ян*3>.«1я а. а> х %• а- а. и о о я
СО — 1Л СО <Л Ь- СМ О СО ОЭ — —< О "^ СО Ю СТ> — СО О 00 Ю СО СО СМ со СО
— Ю — т»< — — Г>-Ю Ю СМ СО СМ ■*« СО Ю СМ N Ь- Ь- (^. СО СМ СО СО Ю СО
00 О О — СМ СО т*> Ю СО 1^- 00 О О — СМ СО "* Ю СО Ь- 00 О О —< СМ СО ч*
СМ СЧ СО СО СО СО СО СО СО СО СО СО ч* т* т^ т*< т* ч* -ч*< т»< т*« ч* Ю Ю Ю 10 Ю
2* « я ж х 5
*0 ,Я -0- =»; -сОя чкя*я»Х*5. »ХЯ= Я
о,= хла.§^ х я * о. 8 яо ?. я ч я я § *< 2 В * 2 Ь
ч5вЗнн5оа1;зРй&8ЙМ§уао5я5^1Я
-«ю^^^о^слоосо^ср^соо^союм^юсооо^-м
— см с*-со со со —■ со см ч*« сою ь- — — см см см —
— СМ СО ч* Ю СО Г*- 00 0> О — СМ СО т»< Ю СО N 00 О О — СМ СО ^ Ю СО N
'X д-
О О 0° Я" Мн1й§ ЭХХХ2Л=« О. =
о 2хо^сио « л ?>,52 а.'Х к ах ^ ^ 5 з о00
ч^ч^55ОСх!^х^а.оС0огзчьча>\о*2^оо^.
5 « о « »• ш Ч си и 3 3>.з^Оояяяйо5^пН
161
Все особенности поведения химических элементов
шределяются в конечном счете периодическим законом.
Не проявится ли в периодической таблице с большей
ясностью, чем при простом сличении двух рядов цифр,
зависимость между очередностью открытия элементов
и их распространенностью в земной коре?
Начнем с самого начала таблицы, с группы 1А.
Среди щелочных металлов первыми практически одно-
временно были открыты натрий и калий, третьим —
литий, четвертым — цезий, пятым — рубидий, ше-
стым — франций. А вот последовательность кларков:
натрий, калий, рубидий, литий, цезий, франций. Так что
единственный нарушитель точного соответствия очеред-
ностей в этой группе — рубидий. Не очень серьезный,
поскольку, пропустив без очереди два элемента, он все
же попал в вилку между наиболее и наименее распро-
страненными щелочными металлами.
Проверим группу НА. Очередь открытий: кальций,
магний, барий, стронций, бериллий, радий. Последова-
тельность кларков: кальций, магний, барий, стронций,
бериллий, барий. Совпадение полное.
Группа ША. Та же картина, что и со щелочными
металлами: есть один мелкий нарушитель — галлий.
А вот с группы 1УА начинается беспорядок: все
элементы, обнаруженные в древности,— углерод, олово,
свинец — проникли в таблицу без очереди.
И в группе УА очередь нарушили известные со сред-
них веков мышьяк, сурьма, висмут.
Любопытная картина сложилась в группе У1А. Един-
ственный древний элемент — сера — конечно же, еле
дуя непонятной традиции, нарушил строй, заняв при-
читающееся кислороду первое место. А селен стал нару-
шителем «второго сорта», вроде рубидия и галлия.
В группе УНА судьбу мелких нарушителей разделил
бром.
В группе У1ПА относительный порядок. Первым
был открыт гелий, которого, правда, в земной атмос-
фере меньше, чем аргона и неона, но зато на Солнце,
где он был впервые обнаружен, гелия гораздо больше
по сравнению с другими инертными газами. Несколько
нарушает очередность неон — примерно так же, как
рубидий и подобные ему второстепенные нарушители
в других группах.
Перейдем от главных групп к побочным.
162
В группе 1Б, полностью представленной «древними»
элементами, как и следовало ожидать, полный хаос.
В группе 11Б последовательности кларков не подчи-
няется древняя ртуть. Зато все остальные побочные
группы ведут себя вполне пристойно, в них только два
нарушителя — хром и платина. Разумеется, если не го-
ворить о лантаноидах и актиноидах, занимающих в пе-
риодической системе особые места. Впрочем, ланта-
ноиды в целом тоже склонны к порядку; первым
был открыт наиболее распространенный церий, послед-
ним — вообще отсутствующий в земной коре прометий.
Да и актиноиды тоже — сначала были открыты наи-
более распространенные уран с торием, затем редчай-
шие актиний с протактинием, а уж потом искусственные
трансураны.
Подытожив наш маленький анализ, можно сказать,
что в первом приближении очередность открытий в груп-
пах периодической таблицы соответствует распростра-
ненности элементов. Чем более распространен элемент
данной группы, тем раньше его открывают. Этой за-
кономерности — так сказать, правилу больших клар-
ков — более или менее подчиняются 94 из ныне извест-
ных 107 элементов. Только 13 элементов составляют
безусловное исключение.
Прежде чем рассматривать эти исключения, обра-
тимся к мелким нарушителям.
Вот элементы, которые, в общем подчиняясь правилу
больших кларков, все же проявили некоторую недис-
циплинированность: рубидий, галлии, селен, бром, неон,
торий, тулий, самарий, гадолиний, диспрозий. Все они
«опоздали на работу»: были открыты несколько позже,
чем полагалось бы, судя по их кларкам. Рубидий
должен был открыться исследователям до лития и
цезия, галлий — до таллия и индия, селен — до теллура,
бром — до иода, неон — до криптона, торий — до урана
и так далее.
Поищем причину задержки. Вспомним, напри-
мер, историю открытия рубидия. В минеральных
водах немецких курортов рубидия было гораздо больше,
чем цезия. Но Бунзен и Кирхгоф сперва обнаружили
цезий, а рубидию еще целый год удавалось прятаться
в калиевой фракции. Он опоздал потому, что слишком
сильно похож на гораздо более распространенный и
давно известный калий.
163
Та же самая причина вызвала и остальные мелкие
нарушения. Рубидий в своей группе следует сразу же
за гораздо более распространенным калием, галлий —
за алюминием, селен — за серой и так далее.
Все мелкие нарушители прятались за широкими
спинами своих видных родственников—широко рас-
пространенных и очень близких по свойствам химичес
ких элементов.
Теперь можно вернуться к настоящим исключениям
Уже одно то, что из тринадцати элементов, решитель-
но отказавшихся подчиняться правилу больших клар-
ков, двенадцать были открыты в древности и в средние
века, свидетельствует о неслучайном характере этих
исключений. И поскольку тут дал осечку чисто количе-
ственный подход, можно предположить, что в историю
открытий вмешался некий качественный фактор.
Самая общая качественная характеристика любого
химического элемента — это, пожалуй, его химическая
активность. Правда, химическая активность— понятие
несколько расплывчатое, поскольку по отношению к
разным веществам химическая активность данного
простого вещества может быть различной. И все же
интуитивное представление о том, что одни элементы
более активны, а другие менее активны, в общем-то
правильно: ведь есть инертные газы и благородные
металлы, а есть всеядный фтор.
В 1865 году русский химик Николай Николаевич
Бекетов опубликовал знаменитое «Исследование над
явлениями вытеснения одних элементов другими», в ко-
тором впервые появился известный в наше время каж-
дому старшекласснику ряд напряжений — перечень ме-
таллов, построенный в зависимости от их химической
активности в растворах. По степени возрастания ак-
тивности металлов начало ряда напряжений выглядит
так: золото, платина, серебро, ртуть, медь, свинец,
олово...
Вот они и попались— «древние нарушители»!
Значит, первыми были открыты металлы, обладаю-
щие самой малой химической активностью. Оно и по-
нятно—чем активнее металл, тем крепче связывается
он с другими веществами, тем труднее разрушить эту
связь и выделить металл в чистом виде Относительно
большинства металлов эта задача в древности и в сред-
164
ние века была вообще неразрешима, не было еще тогда
нужных технических средств.
В общем и целом очередность открытия того или
иного химического элемента зависела от сочетания
его распространенности и химической активности. При-
чем значение этих двух факторов по мере развития
техники не оставалось неизменным: на ранних ступенях
цивилизации перевешивала активность, на более позд-
них — распространенность. Сначала были открыты
наименее активные неметаллы и металлы. Затем —
уже в научный период — очередность открытия элемен-
тов в общем соответствовала их распространенности.
В пределах каждой группы периодической системы эта
закономерность соблюдалась более или менее точно:
только элемент, расположенный сразу после наиболее
распространенного, в группах А обычно уступает свою
очередь одному или даже двум элементам, расположен-
ным после него.
Конечно, в истории открытия элементов не удается
обнаружить столь же строгих закономерностей, как
те, что обусловливают, например, превращения элемен-
тов и их соединений. Найденные закономерности ско-
рее походят на правила грамматики — ив тех и в дру-
гих немало исключений. Но для каждого исключения
есть объяснение.
История открытия химических элементов, по-види-
мому, подходит к концу. Во всяком случае, все хими-
ческие элементы, которые в заметном количестве имеют-
ся на нашей планете, в Солнечной системе, в нашей
Галактике и обозримой части внегалактического про-
странства, уже открыты и познаны. Познаны не только
все элементы по отдельности, строение электронных
оболочек атомов всех видов, но и эволюция их в ядер-
ных реакциях и, главное, их естественная система.
Сегодня внимание фундаментальных наук переклю-
чено в основном на открытие и познание структур и
систем, образующих живую материю, а также «нижние
этажи» природы: мельчайшие материальные структуры,
из которых в конечном счете образуются атомы. Сле-
дующий важнейший научный фронт сегодня — химия
и физика космоса.
Но чем бы ни занимались сегодня химики, физики,
биологи, вдохновляющим примером для них служит
великая победа человеческого разума, сумевшего поз-
нать мир химических элементов. Самое главное — эта
победа доказала, что природа познаваема. Вместе с тем
в процессе открытия химических элементов наука обо-
гатилась огромным исследовательским опытом, который
помогает двигаться вперед во всех главных научных
направлениях.
Вряд ли можно сомневаться в том, что ближайшие
десятилетия будут ознаменованы новыми триумфаль-
ными открытиями. И в учебниках наряду с Периоди-
ческой системой химических элементов появятся естест-
венные системы элементарных частиц, небесных тел,
а когда-нибудь (мечтать, так мечтать!) живых и даже
разумных существ.
РЕКОМЕНДУЕМАЯ
ЛИТЕРАТУРА
Менделеев Д. И. Периодический закон. М., Изд-во АН СССР,
1958.
Кедров Б. М. Прогнозы Д. И. Менделеева в атомистике. Неизвест-
ные элементы М., Атомиздат, 1977.
Всеобщая история химии. Становление химии как науки. М., Наука,
1983.
Популярная библиотека химических элементов. М., Наука, 1983.
Энгельс 3., Н о в а к А. По следам элементов. М., Металлургия,
1983.
Р и ч В. Охота за элементами. М., Химия, 1982.
Кнорре Е. Путешествие в мир трансуранов. М., Атомиздат, 1971
Валентин Рич
В ПОИСКАХ ЭЛЕМЕНТОВ
Редактор
Г, Н. ГОСТЕЕВА
Художник
Ю. П. ТРАПАКОВ
Художественный редактор
Н. В. НОСОВ
Технический редактор
Н. Ю. ЕФИМОВА
Корректор
М. В. ЧЕРНИХОВСКАЯ
ИБ № 1590
Сдано на фотонабор 04.03.85. Подп в печ
18.06.85. Т-13841 Формат бумаги 84Х 108'/з2
Бумага тип. № 2. Гарнитура литературная
Печать высокая. Усл. печ. л 8,82- Уел
кр.-отт 9,03. Уч -изд. л. 8,75. Тираж 50 000 экз
Заказ № 527 Цена 30 к Изд. № 2768.
Ордена «Знак Почета» издательство «Химия».
107076, Москва, ул. Стромынка, 21, корп 2
Ленинградская типография № 2 головное
предприятие ордена Трудового Красного
Знамени Ленинградского объединения «Тех-
ническая книга» им. Евгении Соколовой
Союзполиграфпрома при Государственном
комитете СССР по делам издательств, поли-
графии и книжной торговли. 198052, г Ленин-
град, Л-52, Измайловский проспект, 29.
30 к.