Author: Веснин А. Г. Семенов И.И.
Tags: семиология симптоматология признаки и симптомы заболеваний исследование диагностика пропедевтика опухоли новообразования бластомы хористомы гамартомы онкология медицинская радиология и рентгенология медицина
ISBN: 5-7940-0110-0
Year: 2002
А. Г. Веснин, И. И. Семенов
Портал бесплатной медицинской литературы
MedWedi.ru
Уважаемый читатель!
Если вы скопируете данный файл. Вы должны незамедлительно удалить его сразу после ознакомления с содержанием.
Копируя и сохраняя его Вы принимаете на себя всю ответственность, согласно действующему международному законодательству.
Все авторские права на данный файл сохраняются за правообладателем. Любое коммерческое и иное использование кроме предварительного ознакомления запрещено.
Публикация данного документа не преследует никакой коммерческой выгоды.
Но такие документы способствуют быстрейшему профессиональному и духовному росту читателей и являются рекламой бумажных изданий таких документов.
Все авторские права сохраняются за правообладателем. Если Вы являетесь автором данного документа и хотите дополнить его или изменить, уточнить реквизиты автора или опубликовать другие документы, пожалуйста свяжитесь с нами - мы будем рады услышать ваши пожелания.
Данный файл скачан с портала MedWedi (http://medwedi.ru) **★ Заходите - будем рады :-)
А. Г. Веснин, И. И. Семенов
АТЛАС
ЛУЧЕВОЙ ДИАГНОСТИКИ ОПУХОЛЕЙ
ОПОРНО-ДВИГАТЕЛЬНОГО АППАРАТА
Часть первая
Опухоли скелета
%BINOM
^PUBLISHERS
Москва
Санкт-Петербург
2002
УДК 616-073.75:616-006
ББК 53.6:55.6
В38
А. Г. Веснин, И. И. Семенов
В38 Атлас лучевой диагностики опухолей опорно-двигательного аппарата:
Часть 1: Опухоли скелета. — СПб.: “Невский Диалект”, 2002. — 182 с., ил.
О?тся первым отечественным изданием, в котором представлены изображения наиболее чающихся злокачественных опухолей опорно-двигательного аппарата, полученные лу-одами, и возможности их дифференциальной диагностики с доброкачественными ново-чми и неопухолевыми заболеваниями. Приведены классификации основных патологических процессов, клинико-анамнестические данные, помогающие в постановке диагноза, а также кратко изложены лечебная тактика и прогноз.
В первой части описаны костные поражения различного характера и генеза. Вторая часть посвящена почти не отраженной в литературе рентгено-эхографической диагностике новообразований и неопухолевых заболеваний мягких тканей.
Книга предназначена для специалистов по лучевой диагностике, онкологов, врачей других специальностей, студентов медицинских учебных заведений.
Все права защищены. Никакая часть этой книги не может быть воспроизведена в любой форме или любыми средствами, электронными или механическими, включая фотографирование, магнитную запись или иные средства копирования или сохранения информации, без письменного разрешения издательства.
ISBN 5-7940-0110-0
© “Невский Диалект”, 2002
ОГЛАВЛЕНИЕ
Предисловие.....................................................4
Введение........................................................6
Классификация и клинико-рентгенологическая характеристика опухолей скелета..............................................7
Костеобразующие опухоли.......................................11
Вторичные саркомы.......................................-.....30
Хрящеобразующие опухоли.......................................34
Соединительнотканные опухоли..................................61
Гигантоклеточная опухоль (ГКО)................................66
Сосудистые опухоли............................................73
Костномозговые поражения......................................80
Редкие злокачественные опухоли...............................124
Метастазы....................................................129
Неопухолевые процессы........................................140
Список литературы............................................169
Перечень рисунков........................................... 171
ПРЕДИСЛОВИЕ
В связи с успехами современной комплексной терапии раннее выявление злокачественных новообразований позволяет существенно улучшить прогноз заболевания, однако большинство больных саркомами поступает в специализированное отделение уже в запущенной стадии. В то же время пациенты с доброкачественными изменениями костей зачастую подвергаются неоправданным, порой калечащим, оперативным вмешательствам. Как показывает практика, лучевую семиотику новообразований и опухолеподобных заболеваний скелета до настоящего времени специалисты знают гораздо хуже, чем симптомы другой патологии. Во многом это объясняется тем, что уже на протяжении нескольких десятилетий в России по этой проблеме не издавались руководства, подробно иллюстрированные на хорошем современном уровне. По сути же дела, рентгенологическая, эхографическая и другая диагностика базируется в большей степени на анализе изображений тела, полученных разными способами, а не на их словесном “портрете”.
Опухоли костей, описанию которых посвящена первая часть атласа, как никакие другие обладают зачастую настолько специфичной рентгенологической картиной, что ее грамотная интерпретация в сочетании с анализом клинико-анамнестических данных позволяет сразу же направить лечение больного по верному пути. К сожалению, во множестве ситуаций этого пока не происходит, в основном из-за недостаточного знакомства врачей с рентгеносемиотикой заболеваний костно-суставной системы. В медицинских учебных заведениях на изучение скелета отводится мало учебного времени, специальная литература на русском языке фрагментарна и во многом устарела, особенно в отношении классификации опухолей и качества иллюстраций. Собственный же опыт практикующих рентгенологов обычно невелик, так как данные новообразования относительно редки.
В книге главное внимание уделено анализу рутинных рентгенограмм, которые обычно достаточно полно регистрируют основные, в том числе и ранние, изменения. Известно, что саркомы, достигшие значительных размеров, как правило, не вызывают диагностических сомнений, поэтому в атласе демонстрируются патологические очаги, обнаруженные в большинстве своем уже при первом обращении пациента. Наряду с типичными локализациями опухолей даны наблюдения редкого развития заболевания в различных отделах скелета. При интерпретации снимков анализируются не только костные структуры, но и смежные участки мягких тканей, нередко выпадающие из поля зрения рентгенолога.
Лучевая диагностика новообразований мягких тканей чрезвычайно скудно освещена в специальной литературе, ее почти не преподают на курсах специализации, исключительно редко подвергают больных рентгено- и эхографии, вследствие чего диагностические и лечебные ошибки бывают достаточно частыми и грубыми. Во второй части книги сделан акцент на способы распознавания патологических процессов в мягких тканях уже при первом обследовании больного с использованием оборудования, имеющегося практически в любой поликлинике.
Приступая к составлению атласа, авторы ставили своей главной целью восполнить существующий пробел в изучении новообразований опорно-двигательного аппарата.
Работу с атласом облегчает перечень рисунков, являющийся своеобразным предметным указателем,— он приведен в самом конце книги. Надеемся, что атлас станет настольной книгой для специалистов по лучевой диагностике, которые первыми исследуют больного и от которых во многом зависит своевременность и адекватность лечения, а в конечном итоге — прогноз заболевания.
Заместитель директора по науке Центрального рентгено-радиологического института М3 РФ, руководитель отдела лучевой диагностики, доктор медицинских наук, профессор Л. А. Тютин
ВВЕДЕНИЕ
Злокачественные опухоли скелета встречаются редко, характеризуются тяжелым течением, быстрым прогрессированием и в подавляющем числе случаев вызывают гибель больных. Однако современные методы неоадъювантной и адъювантной терапии, выполнение органосохраняющих операций заметно улучшают прогноз и качество жизни. Проведение активных лечебных мероприятий актуально еще и потому, что большинство сарком возникает у детей и лиц молодого возраста.
Своевременное распознавание патологического процесса — основной залог успешной терапии. Между тем сегодня, как и десятилетия назад, диагностические ошибки при первичном обращении пациента достигают 60-90 %. Результатом этого является неоправданно длительное наблюдение, неадекватное лечение, а в ’/(случаев — назначение абсолютно противопоказанной физиотерапии, провоцирующей резкую активизацию заболевания. С другой стороны, при доброкачественных процессах (хондромы, ювенильные кисты, неоссифицирующие фибромы и пр.) порой выполняются ненужные и нередко калечащие хирургические вмешательства.
Ведущую роль в распознавании опухолей скелета по-прежнему сохраняет обычная рентгенография. Вопреки ожиданиям, внедрение новых технологий с высокой разрешающей способностью (КТ, МРТ и пр.), позволивших существенно усовершенствовать визуализацию истинного распространения опухолевого процесса, не повлекло за собой значительного улучшения первичной диагностики. Сплошь и рядом вместо диагноза “опухоль кости” (как в нашей стране, так и за рубежом) делается весьма неопределенное заключение о некоем “объемном образовании”.
Недостаточная специфичность клинико-рентгенологических проявлений затрудняет не только уточнение природы и характера опухоли, но и решение вопроса об опухолевом или ином генезе процесса. По этой причине наиболее перспективным представляется комплексный подход к проблеме посредством совместной работы клинициста, лучевого диагноста и цитоморфолога.
Литература на русском языке поданной проблеме скудна, имеющиеся монографии во многом устарели, особенно если учесть, что в последних классификациях некоторые вилы опухолей заняли иное место, открыты новые нозологические формы.
В этой связи, несомненно, полезным и актуальным следует назвать руководство, составленное с использованием обширного верифицированного материала НИИ онкологии им. проф. 11. И. Петрова М3 РФ.
Авторы выражают сердечную признательность всем сотрудникам отделения лучевой диагностики НИИ онкологии им. Н. Н. Петрова М3 РФ и, в первую очередь — Дануте Антоновне Голубевой, за неоценимую помощь в подборе обширного материала.
КЛАССИФИКАЦИЯ
И КЛИНИКО-РЕНТГЕНОЛОГИЧЕСКАЯ ХАРАКТЕРИСТИКА ОПУХОЛЕЙ СКЕЛЕТА
Скелет представляет собой сложную структуру, содержащую большинство тканей организма (костную, хрящевую, фиброзную, сосудистую, жировую и пр.), каждая из которых может дать начало соответствующей опухоли.
В основу всех классификаций новообразований костей положено их гистологическое строение. Известно около пятидесяти нозологических форм, объединенных в восемь-десять гистогенетических групп с доброкачественными и злокачественными аналогами. Ниже приведена упрощенная рентгено-морфологическая классификация наиболее часто встречающихся новообразований скелета и патологических процессов, которые необходимо дифференцировать с опухолями.
Костеобразующие
Доброкачественные: остеома, остеоид-остеома, остеобластома.
Злокачественные: остеосаркома, злокачественная остеобластома, юкстакортикальная остеосаркома.
Хрящеобразующие
Доброкачественные: остеохондрома (остеохондроматоз), хондрома (хондроматоз), хондробластома, хондромиксоидная фиброма.
Злокачественные: хондросаркома.
Соединительнотканные
Доброкачественные: неоссифицирующая фиброма (фиброзный кортикальный дефект), ксантофиброма (доброкачественная фиброзная гистиоцитома).
Злокачественные: злокачественная фиброзная гистиоцитома, фибросаркома.
Г/1гантоклеточная опухоль (ГКО) (остеокластома)
Сосудистые
Доброкачественные: гемангиома (ангиоматоз), гломусная опухоль.
Злокачественные: злокачественная гемангиоэндотелиома, злокачественная гемангиоперицитома.
Костномозговые
Опухолеподобное заболевание — гистиоцитоз из клеток Лангерганса.
Злокачественные: миелома, первичная злокачественная лимфома кости, саркома Юинга.
Другие злокачественные опухоли
Хордома, адамантинома.
Саркомы, развивающиеся на фоне предсуществующих процессов
Болезнь Педжета, доброкачественные опухоли, фиброзная дисплазия, после облучения.
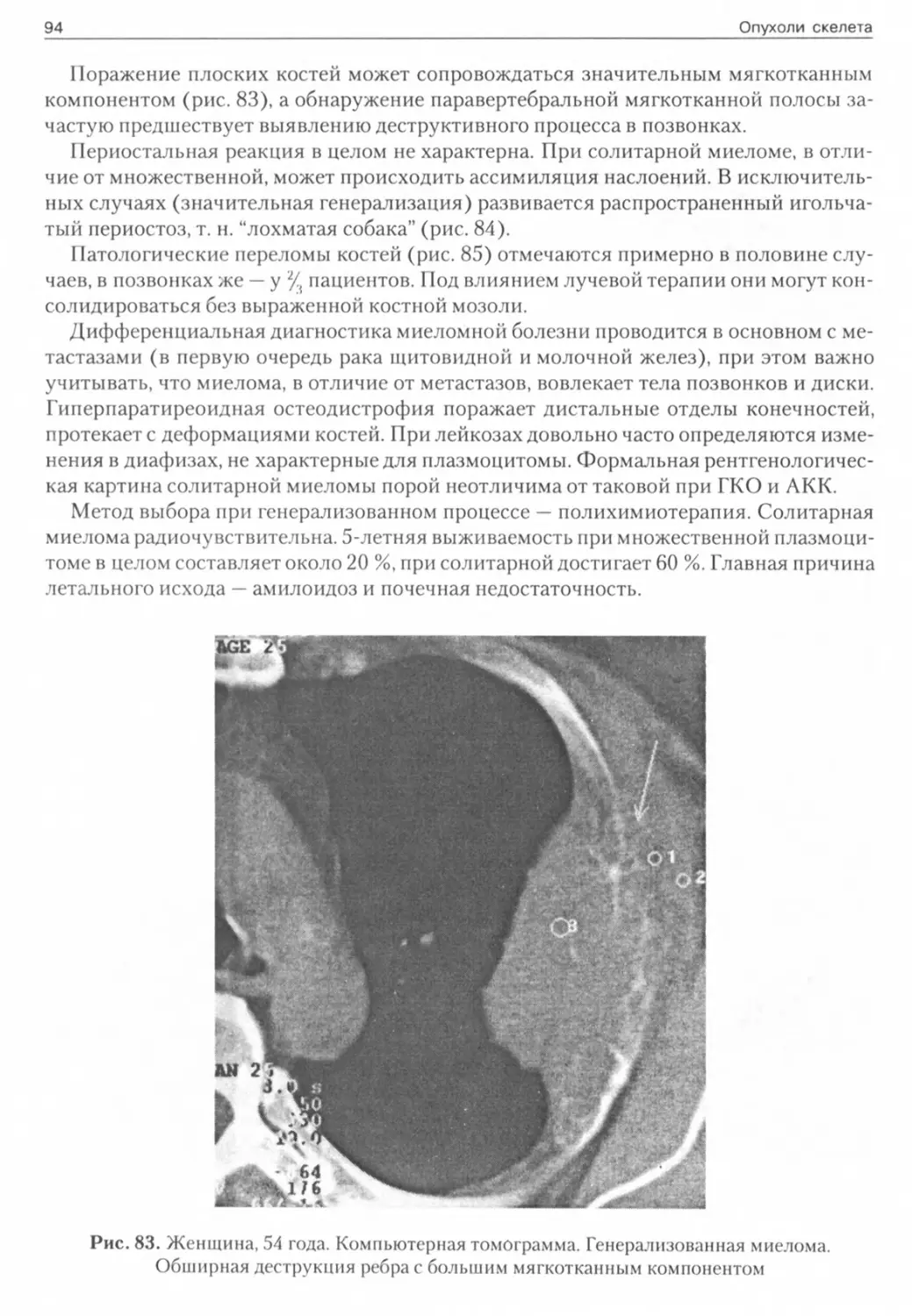
Метастазы
Неопухолевые процессы
Фиброзная дисплазия, юношеская ювенильная киста, аневризмальная костная киста (АКК), оссифицирующий миозит.
Многолетний опыт НИИ онкологии показывает, что в дифференциальной диагностике опухолей скелета приходится достаточно часто дополнительно принимать во внимание ряд патологических процессов-, т. н. первично-хронический остеомиелит, стрессовый перелом, остеоартропатию, обызвествленный инфаркт костного мозга и др.
В диагностике опухолей следует учитывать общую частоту того или иного процесса, возраст больного, локализацию очага в скелете, клиническую картину, анамнестические данные, рентгенологические проявления, находки при биопсии.
Частота. В целом к наиболее частым злокачественным новообразованиям относятся миелома, остео- и хондросаркомы, костномозговые, гигантоклеточные опухоли, фибросаркома, злокачественная фиброгистиоцитома, а также метастазы; к чрезвычайно редким — злокачественные сосудистые новообразования, ангиобластома, хордома и пр., а также саркомы, развивающиеся на фоне предсуществующих доброкачественных опухолей, фиброзной дисплазии, болезни Педжета, после облучения.
Наиболее распространенные доброкачественные опухоли — хрящевые (хондромы и остеохондромы), неоссифицирующие фибромы, остеоид-остеомы, остеомы, гемангиомы и пр. Гораздо реже наблюдаются хондробластомы, хондромиксоидные фибромы, остеобластомы и пр.
Возраст. Более половины первичных опухолей обнаруживается у детей и молодых людей. Чаще всего у них встречаются костномозговые опухоли и остеосаркомы, а среди метастазов — нейробластомы и опухоли Вильмса. В этих возрастных группах практически не наблюдается хондросарком, фибросарком, миеломы, ГКО (появляется лишь после 12 лет). Среди доброкачественных опухолей преобладают энхондромы, остеохондромы, неоссифицирующие фибромы, остеоид-остеомы, эозинофильные гранулемы, среди неопухолевых изменений — ювенильная киста, АКК, остеомиелит, стрессовый перелом.
У пациентов старше 20 лет нарастает частота развития ГКО, фибросарком, хондросарком, юкстакортикальных остеосарком и др., включая ангиобластому, хордому, а также обнаруживаются доброкачественные хондробластомы, остеобластомы, хондромы, гемангиомы и пр.
У людей старше 50 лет в любой деструкции кости следует в первую очередь подозревать метастаз или миелому, а также хондросаркому.
Локализация. Большое разнообразие костных новообразований связано со сложными процессами роста и обновления скелета. Вид опухоли зависит от преобладающего процесса перестройки, протекающего на ее месте в условиях нормального остеогенеза, а начало клинических симптомов обычно соответствует наивысшей активности исходной клетки. Это, в частности, объясняет частоту встречаемости первичных новообразований в местах наиболее интенсивного роста кости, в метафизах. Поскольку возникновение опухоли во многом связано с функцией местных популяций клеток, можно предполагать ту или иную нозологическую форму по ее локализации в кости. Так, хондробластомы “привязаны” к ростковой зоне, хондросаркомы располагаются в эпиметафизе и распространяются на метадиафиз, остеосаркомы — в метадиафизе, месте наибольшей активности остеобластов, ГКО — в эпифизе (зоне остеокластов), костномозговые — в метафизах и диафизах с быстрым распространением подлиннику кости, фибросаркомы образуются из соединительной ткани костного мозга длинных костей и т. п.
Типичные места развития злокачественных новообразований — длинные кости, в первую очередь нижних конечностей (и прежде всего области коленного сустава).
Некоторые опухоли “предпочитают” определенные кости: ангиобластома — большеберцовую, хордома — чаще всего крестец, хондробластома — плечевую, остеомы — череп и придаточные пазухи. Метастазы наиболее часто поражают позвоночник, плоские кости, богатые костным мозгом. Можно отметить также относительную редкость возникновения первичных и вторичных злокачественных новообразований в дистальных отделах конечностей.
Клинические проявления. Доброкачественные внутрикостные опухоли обнаруживаются в основном при патологическом переломе или рентгенографии по иному поводу. Экзофитные (остеохондромы) прощупываются в виде твердых несмещаемых образований, покрытых неизмененной кожей.
Боли, особенно постоянные и ночные, можно считать довольно характерной чертой злокачественных опухолей, поэтому наличие их должно служить обязательным показанием к рентгенографии. Однако не всякая саркома сперва манифестирует болями, а ряд неопухолевых процессов с самого начала сопровождается выраженным болевым синдромом (АКК, остеомиелит и пр.).
Припухлость, изменения кожи, нарушение функции сустава, как правило, представляют собой поздние проявления злокачественного процесса.
В целом ранние клинические симптомы злокачественных опухолей скелета мало специфичны.
При анализе анамнестических данных следует обращать внимание на предшествующее заболевание (травма, инфекция и пр.), первые симптомы (боль), скорость роста опухоли, температурную реакцию и пр.
Рентгенологическое исследование. Хотя данные рутинной рентгенографии зачастую отстают от клинических проявлений (болей), именно ей принадлежит привилегия первой визуализации патологического очага в скелете. При этом необходимы технически безупречные снимки и их квалифицированная интерпретация.
При рентгенографии очень важны выполнение адекватных укладок (нередко дополнительных, нестандартных), выбор правильных значений напряжения и экспозиции (для хорошей проработки структуры кости), а также полноценное проявление (в машине или вручную, но “по времени”). Желательно получить изображение всей пораженной кости.
Кроме снимков на “костных” режимах для установления диагноза весьма полезно сделать рентгенограммы параоссальных тканей, в частности мягкотканного компонента опухоли. Нужна оптимальная укладка объекта с выведением пальпируемого образования в краеобразующее положение, чтобы смежные структуры не перекрывали изображение нужного участка. Для исследования частей тела с небольшим объемом и подкожной клетчатки используется съемка без усиливающих экранов в специальных картонных кассетах или двух слоях черной бумаги (35-50 Кв, 70-150 мАс, фокусное расстояние около 60 см, тщательное диафрагмирование).
При анализе рентгенограмм следует учитывать количество патологических очагов, развитие их в той или иной кости (трубчатой, короткой, плоской), локализацию в ее конкретном отделе (эпифиз, метафиз, диафиз, тело, отросток, дуга, крыло и пр.), центрально или эксцентрично, в кортикальном слое, субпериостально, параоссально и пр.
После оценки этих данных изучают непосредственно рентгенологические симптомы: размеры и ориентацию патологического очага (распространение преимущественно подлиннику или поперек кости), характер контуров (четкие, нечеткие), структуры (однородная, неоднородная — трабекулярная, ячеистая и пр.), обызвествления (пато
логическое костеобразование, аморфные, ангиолиты, “хрящевого” вида, по типу губчатой кости и пр.), изменений на границе здоровой кости (замыкающая пластинка, склеротический ободок, массивное склерозирование, остеопороз), состояние кортикального слоя (истончение, разрушение — изнутри или снаружи, утолщение), наличие секвестров в кости или мягких тканях, тип периостальной реакции (свежая — линейная, однослойная, многослойная, спикуловидная, периостальный “козырек", бахромчатая и пр., ассимилированная, гиперостоз и пр.), характер мягкотканного компонента (размеры по сравнению с очагом в кости, особенности структуры — ячеистость, обызвествления), отграничение от мягких тканей (периостальная “скорлупа”, четкость контуров, инфильтрация смежных тканей).
Типичная картина злокачественной опухоли — наличие нечетко очерченного быстро увеличивающегося литического или склеротического очага с той или иной структурой, развивающегося центрально или эксцентрично, с разрушением кортикального слоя и выходом в мягкие ткани, образованием периостального “козырька” и/или мягкотканного компонента. В целом злокачественные опухоли к моменту обращения пациента достигают значительной величины.
Доброкачественные новообразования, как правило, растут годами, имеют меньшие размеры, центральные, эксцентричные или экзофитные, четко очерчены замыкающей пластинкой, не сопровождаются реакцией периоста (кроме случаев патологического перелома).
Группе неопухолевых процессов присущи разнообразные рентгенологические проявления, напоминающие как доброкачественные, так и злокачественные неоплазмы. Дифференциальная диагностика осуществима в комплексе с клиническими и цито-морфологическими данными.
КОСТЕОБРАЗУЮЩИЕ ОПУХОЛИ
Доброкачественные новообразования включают остеомы, остеоид-остеому и остеобластому.
Остеомы представляют собой самые зрелые и дифференцированные опухоли скелета, построенные из компактной или губчатой костной ткани. Обычно они одиночные, а множественные (остеоматоз черепа) наблюдаются лишь при синдроме Гарднера (в сочетании с полипозом кишечника и мягкотканными узлами).
Типичная локализация — кости, преформируюшиеся через соединительную ткань, например кости черепа (придаточные пазухи, нижняя челюсть, свод); развитие в дру
гих отделах скелета отмечается исключительно редко.
Экзофитно растущие опухоли прощупываются как твердые несмещаемые образования небольших размеров, покрытые неизмененной кожей; эндокраниальные обнаруживаются, как правило, только на рентгенограммах.
Компактные остеомы рентгенологически выглядят интенсивными однородными, четко очерченными образованиями на широком основании или, реже, на ножке (рис. 1), губчатые имеют структуру спонгиозы, покрытой тонкой пластинкой кортикального слоя (рис. 2).
Дифференциальная диагностика обычно не нужна.
Лечение - при косметических неудобствах - оперативное. Озлокачествления не бы-
вает.
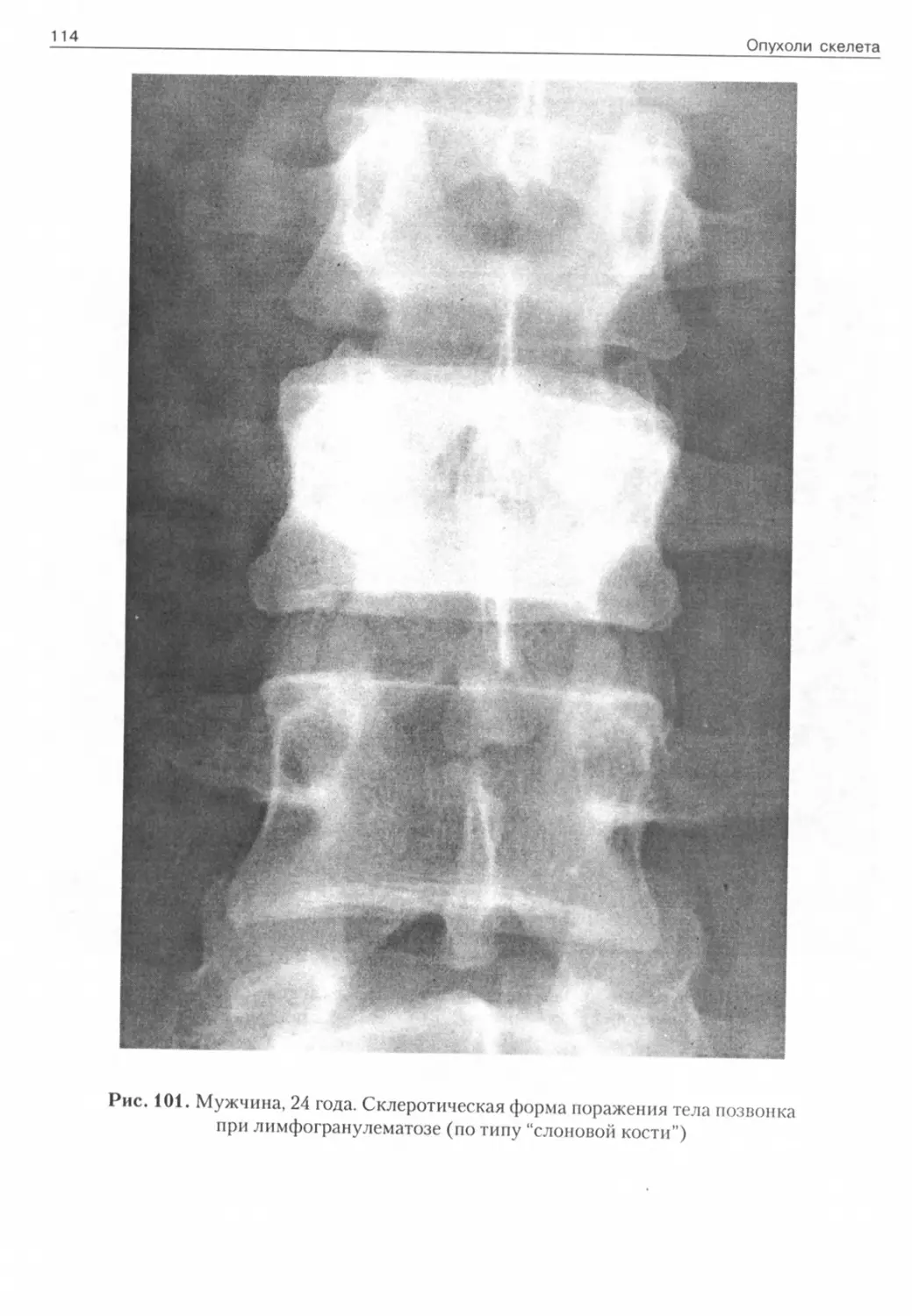
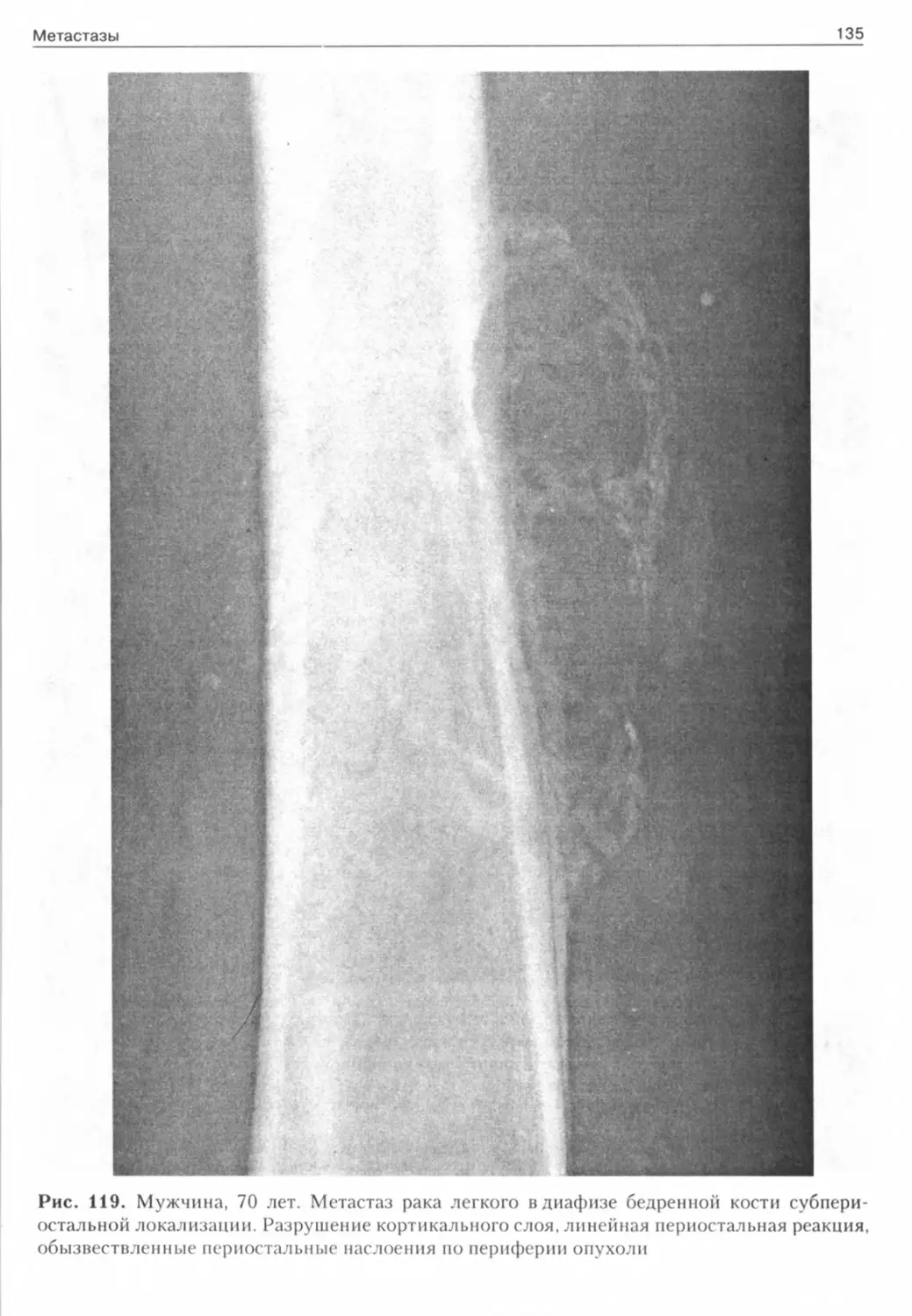
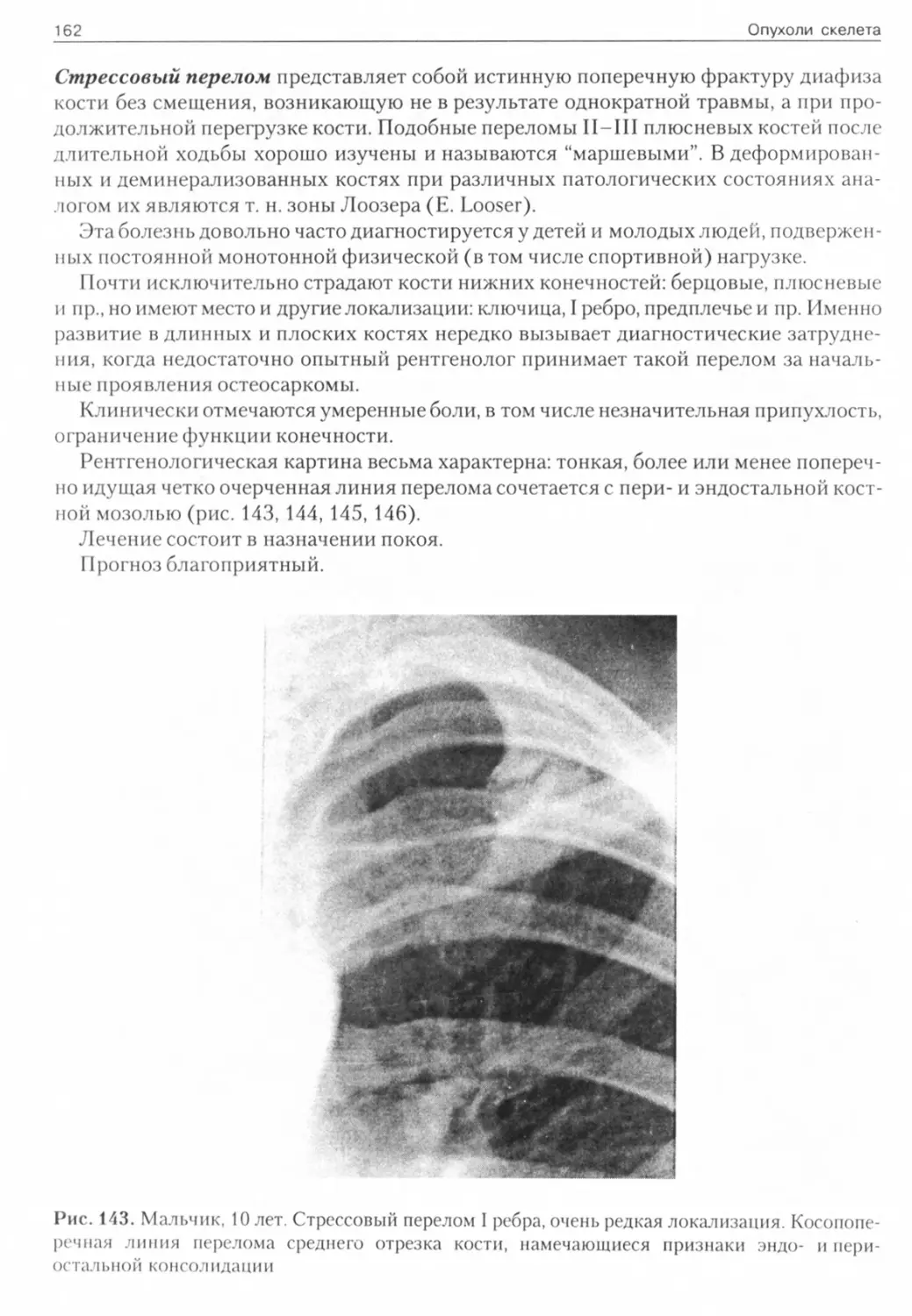
Рис. 1. Мужчина, 40 лет. Компактная остеома Рис. 2. Мужчина, 57 лет. Губчатая остеома височной кости скуловой кости
Остеоид-остеому считают истинной доброкачественной остеобластической опухолью с тех пор, как в 1935 г. Джеффи (Jaffe) выделил ее из группы остеомиелитов. Бактерий в патологическом очаге обнаружить не удается.
Данные о частоте заболевания варьируются в пределах от 3 до 10 % доброкачественных новообразований скелета.
Болезнь встречается преимущественно у детей и молодых людей (80 % случаев в возрасте до 25 лет). После 40 лет остеоид-остеома практически не наблюдается.
Наиболее частая локализация — диафизы трубчатых костей (около половины случаев — большеберцовая кость). Описаны наблюдения двух-трех очагов в различных костях. Остеоид-остеома не отмечена в черепе, грудине, ключице, телах позвонков, фалангах пальцев.
Основная клиническая черта — нарастающие интенсивные боли, включая ночные, купирующиеся принятием аспирина. При поражении ребер болевой синдром может стать причиной сколиоза.
Рентгенологическая картина (рис. 3-6) практически патогномонична: на фоне диффузно асимметрично утолщенного кортикального слоя выявляется т. н. “нидус” —
Рис. 3. Мужчина, 30 лет. Остеоид-остеома типичной локализации в бедренной кости. Кортикальный слой утолщен на протяжении 10 см, содержит “нидус” 1 см в диаметре
Рис. 4. Женщина, 23 года. Остеоид-остеома II пястной кости. На фоне гиперостоза — “нидус” с плотным ядром в центре
Рис. 5. Мальчик, 12 лет. Остеоид-остеома в заднем отрезке VII ребра. Умеренный гиперостоз, “индус” до 1,5 см в диаметре с плотным ядром в центре
полость до 1 см в диаметре с плотным ядром внутри. В губчатых костях склерозирование менее выражено.
В дифференциальной диагностике может рассматриваться лишь кортикальный остеомиелит.
Лечение оперативное — краевая резекция кости или кюретаж. После нерадикального иссечения нидуса возможны рецидивы. Озлокачествления не бывает.
Доброкачественная остеобластома гистологически весьма сходна с остеоид-осте-омой (по Далину [ Dahlin] — это “гигантская остеоид-остеома”), однако отличается от нее размерами, клинико-рентгенологическими чертами и встречается в несколько раз реже (около 1 % доброкачественных новообразований костей).
Возрастные различия пациентов в обеих нозологических формах несущественны.
Наиболее типичная локализация — позвонки, включая тела. Трубчатые кости (бедренная, большеберцовая, плечевая) — второе по частоте место развития. Мультицент-ричные остеобластомы наблюдаются исключительно редко.
Рентгенологически склерозирование кости выражено умеренно, “нидус” — около 2 см в диаметре, может иметь место небольшое вздутие (рис. 7). Размеры всего патологического участка порой достигают 10 см по протяженности.
В дифференциальной диагностике рассматривается лишь остеоид-остеома. Лечение — краевая резекция пораженного участка.
Рис. 7. Женщина, 34 года. Остеобластома в дистальной трети диафиза бедренной кости. Умеренный локальный гиперостоз, легкое вздутие. В центре склерозированного участка — “нидус” более 2 см с неоднородным ядром
Злокачественные аналоги — остеосаркома, злокачественная остеобластома и юк-стакортикальная остеосаркома.
Остеосаркома — истинная высокозлокачественная, рано метастазирующая опухоль, клетки которой продуцируют опухолевый остеоид, костную, фиброзную и хрящевую ткань.
По-видимому, это вторая по частоте (после плазмоцитомы) саркома — на нее приходится около 20 % злокачественных новообразований скелета. Существуют первичные и вторичные разновидности.
Большинство первичных остеосарком встречаются во втором-третьем десятилетиях жизни.
Они могут развиваться в любом месте скелета, однако самая типичная локализация — метафизы длинных костей, составляющих коленный сустав. Диафизарное расположение — не редкость. У молодых пациентов преимущественно поражаются трубчатые, у взрослых — одинаково часто трубчатые и плоские, у лиц старше 50 лет — в основном плоские кости.
Клинически остеосаркомы характеризуются коротким анамнезом (месяцы и неде ли), нарастающими болями, усиливающимися по ночам, увеличивающейся припухлостью, местной гипертермией, ограничением функции ближайшего сустава. К сожалению, в начале заболевания врачи поликлиники зачастую (до 30 % наблюдений) ошибочно прописывают абсолютно противопоказанную физиотерапию, не назначая рентгенографию.
Рентгенологически условно различают: 1) остеобластическую, 2) остеолитическую и 3) смешанную разновидности остеосаркомы.
В первом типе (рис. 8, 9) превалирует склерозирование патологического очага, не распространяющееся через ростковую зону. Наблюдается раннее разрушение кортикального слоя, образование периостального “козырька”, спикул, мягкотканного компонента, в структуре которого обнаруживаются участки патологического костеобразования. Примерно в каждом четвертом случае возникают т. н. “прыгающие” метастазы — очаги остеобластического роста в других отделах той же кости.
Остеолитические формы (рис. 10, И) отличаются преобладанием деструкции без склеротической реакции. На ранних этапах единственным проявлением саркомы может служить нежная периостальная реакция с подлежащим участком разрежения костной структуры. Деструктивный очаг (центральный или эксцентричный) быстро распространяется вдоль и поперек кости в виде сливающихся мелких очагов (“изъеден-ность молью”), разрушается кортикальный слой. Наряду с многослойной линейной реакцией, периостальным “козырьком” можно наблюдать спикулы различной длины и толщины, исходящие как бы из одного центра (в отличие от костномозговых сарком). Примерно в 20 % случаев, в основном у детей, наблюдается патологический пе; релом.
В смешанных разновидностях (рис. 12) остеолиз и остеосклероз сосуществуют в той или иной пропорции.
Опухоли диафизарной локализации могут быть любого из трех указанных типов. Особенность их изображения — выраженность периостальной реакции, в частности значительная длина спикул, что обусловлено развитием в зоне активной надкостницы. В отличие от костномозговых, остеосаркомы растут преимущественно не вдоль, а из кости (рис. 13).
Рис. 8. Девочка, 10 лет. Остеобластическая остеосаркома проксимального метадиафиза большеберцовой кости. Интенсивное однородное склерозирование медиальной половины поперечника кости, не переходящее через ростковую зону. Нежная периостальная реакция линейного типа со стороны диафиза. Небольшой мягкотканный компонент
Рис. 9. Мальчик, 9 лет. Остеобластическая остеосаркома дистального метадиафиза бедренной кости. Разрушение кортикального слоя и мягкотканный компонент ио медиальной поверхности с патологическим костеобразованием в структуре. Периостальный “козырек”, мелкие "прыгающие” остеобластические метастазы в костномозговом канале. Ростковая зона не разрушена
Рис. 10. Мужчина, 19 лет. Остеолитическая остеосаркома в латеральной части метадиафиза бедренной кости. Очаг деструкции спонгиозы с разрушением кортикального слоя и мягкотканным компонентом. Нежный периостальный “козырек" со стороны диафиза
Рис. 11. Женщина, 28 лет. Остеолитическая остеосаркома медиальной части крыла подвздошной кости, распространяющаяся на боковую массу крестца с выходом опухоли в мягкие ткани. Очагов патологического костеобразования в структуре не определяется
Рис. 12. Девочка, 14 лет. Остеосаркома смешанного типа в дистальном метадиафизе бедренной кости. Мелкоочаговая деструкция и зона склероза. Д инейная периостальная реакция по передней, спикулы и мягкотканный компонент — по задней поверхности диафиза. Ростковая зона интактна
Рис. 13. Девочка, 10 лет. Диафизарная остеосаркома плечевой кости. Мелкоочаговая деструкция, спикулы различной длины и толщины, очаги патологического костеобразования в мягкотканной “муфте”. Периостальный “козырек” у обоих полюсов опухоли
11аряду с центральными и эксцентричными опухолями встречаются остеосаркомы преимущественно субпериостальной локализации, у которых мягкотканный компонент существенно доминирует над размерами костной деструкции (рис. 14, 15).
Мультицентричные остеосаркомы синхронно поражают две кости или более при отсутствии легочных метастазов, могут быть одного и разных рентгенологических типов. У детей и подростков порой наблюдаются симметричные остеобластические очаги в метафизах парных костей.
Метахронные остеолитические очаги различной величины обнаруживаются у подростков и взрослых в разных костях, причем дифференцировать множественные первичные новообразования от метастазов довольно трудно.
К редкой разновидности остеолитической саркомы относится телеангиэктатичес-кая, отличающаяся богатством сосудов, наличием обширных аневризматических полостей и очагов некроза в структуре. Данная опухоль характеризуется весьма быстрым ростом, коротким анамнезом, выраженными клиническими симптомами, крайне неблагоприятным прогнозом.
В рентгенологической картине преобладают очень большие размеры деструкции, вздутие кости, истончение и разрушение кортикального слоя, отсутствие патологического костеобразования. На ангиограммах имеются выраженные морфологические и функциональные признаки злокачественности (рис. 16).
Рис. 14. Девушка, 15 лет. Остеосаркома субпериостальной локализации в дистальном метадиафизе малоберцовой кости. В мягкотканной части опухоли визуализируются очаги патологического костеобразован ия
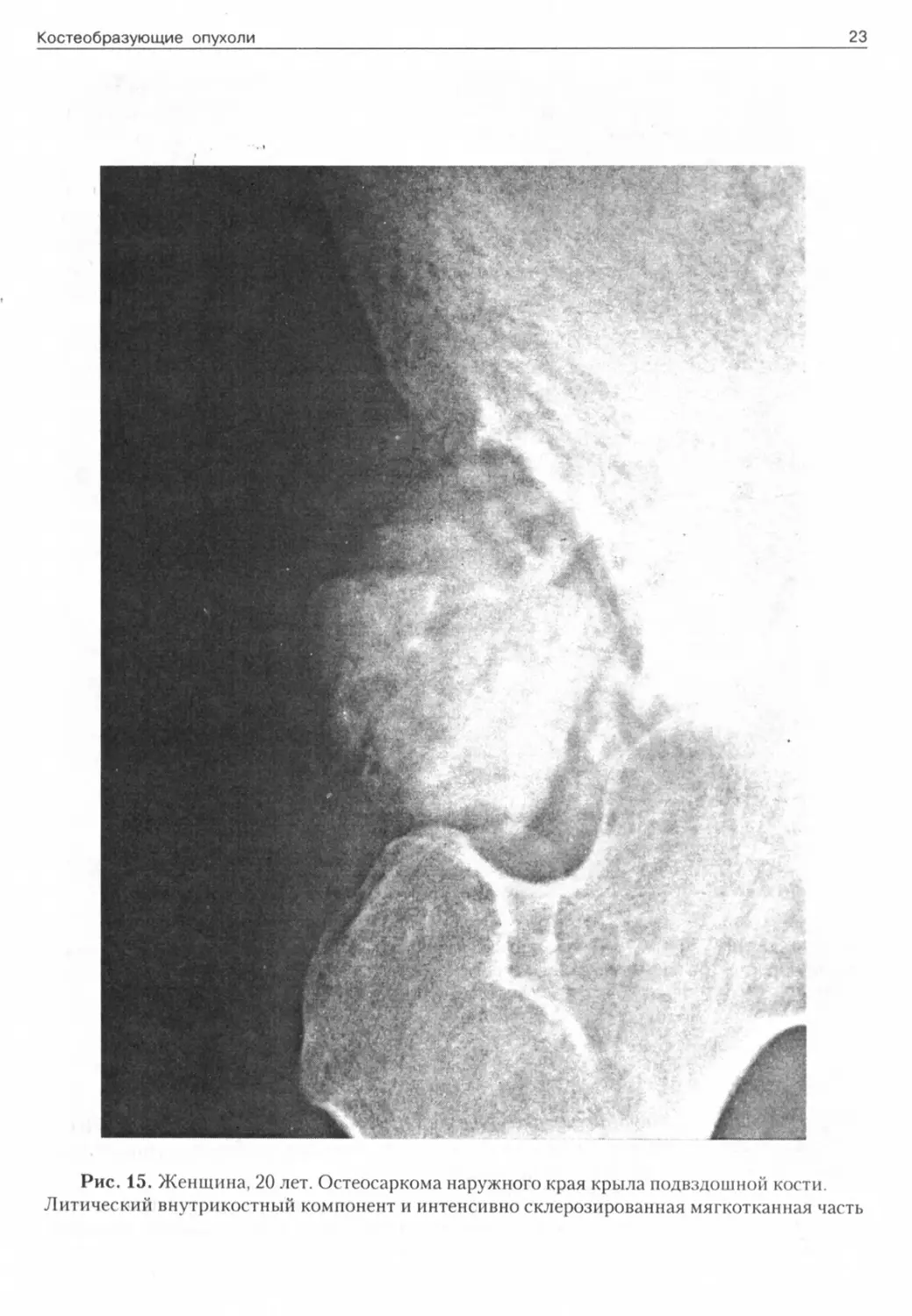
Рис. 15. Женщина, 20 лет. Остеосаркома наружного края крыла подвздошной кости. Литический внутрикостный компонент и интенсивно склерозированная мягкотканная часть
Рис. 16. Мужчина, 26 лет. Телеангиэктатическая остеосаркома дистального эпиметадиафиза бедренной кости. Ангиограмма, ранняя венозная фаза. Высоковаскуляризированная опухоль больших размеров, разрушающая и вздувающая кость
Злокачественная остеобластома — редкая и весьма необычная опухоль. Возраст больных и локализация опухоли не отличаются от таковых для общей группы остеосарком; клиническая картина не отчетливая.
Рентгенологически в костномозговом канале определяется очаг деструкции овоид-ной формы, в центральных отделах которого постепенно нарастает склерозирование, а по периферии сохраняется литический ободок. Периостальная реакция слабая (рис. 17).
Рис. 17. Мальчик, 10 лет. Злокачественная остеобластома дистальной трети диафиза большеберцовой кости. В костномозговом канале — нечетко очерченный участок деструкции овоид-ной формы с неоднородно склерозированным центром. Истончение и разрушение кортикального слоя, легкое вздутие по передненаружной поверхности, линейная периостальная реакция
Юкстакортикальная (параоссальная) остеосаркома — разновидность остеосаркомы, которая развивается в пери- и параоссальных тканях, характеризуется низкой степенью злокачественности, редким и поздним метастазированием, рецидивированием после неадекватных резекций. Врастание в кортикальный слой вначале отсутствует.
Данные опухоли встречаются редко — они составляют около 1 % злокачественных новообразований скелета.
Типичная локализация (более половины наблюдений) — задняя поверхность дистального метадиафиза бедренной кости {planum popliteum). Другие длинные кости поражаются редко (проксимальные концы большеберцовой и плечевой костей и др.).
Возрастной показатель пациентов, страдающих юкстакортикальной остеосаркомой, выше, чем в общей группе остеосарком: третье-четвертое десятилетия жизни; женщины заболевают чаще.
Анамнез заболевания продолжительный, многолетний. Боли выражены незначительно, прощупывается медленно увеличивающаяся несмещаемая твердая припухлость, покрытая обычной кожей.
Рентгенологическая картина (рис. 18-20) порой более информативна, чем данные биопсии. Параоссально выявляется конгломерат интенсивно обызвествленных узлов с бугристой поверхностью, как правило, отделяющийся от кортикального слоя тонкой пограничной полоской.
Лечение — адекватная резекция.
Рис. 18. Женщина, 23 года. Небольшая юкстакортикальная остеосаркома типичной локализации в подколенной ямке. Томограмма. Интенсивно обызвествленная опухоль неправильно уплощенной формы без четких контуров, отделяющаяся от кости узкой мягкотканной полоской
Прогноз гораздо лучше, чем при других остеосаркомах: отдаленные метастазы наблюдаются примерно в 15 % случаев, при этом легочные очаги, подобно первичной опухоли, рентгенологически очень плотные, склерозированные.
Исключительно редко встречаются экстраоссальные остеогенные саркомы, отличающиеся от других злокачественных опухолей мягких тканей содержанием очагов патологического костеобразования.
Рис. 19. Женщина, .35 лет. Юкстакортикальная остеосаркома. Томограмма. В структуре опухоли — сливающиеся аморфно обызвествленные узлы
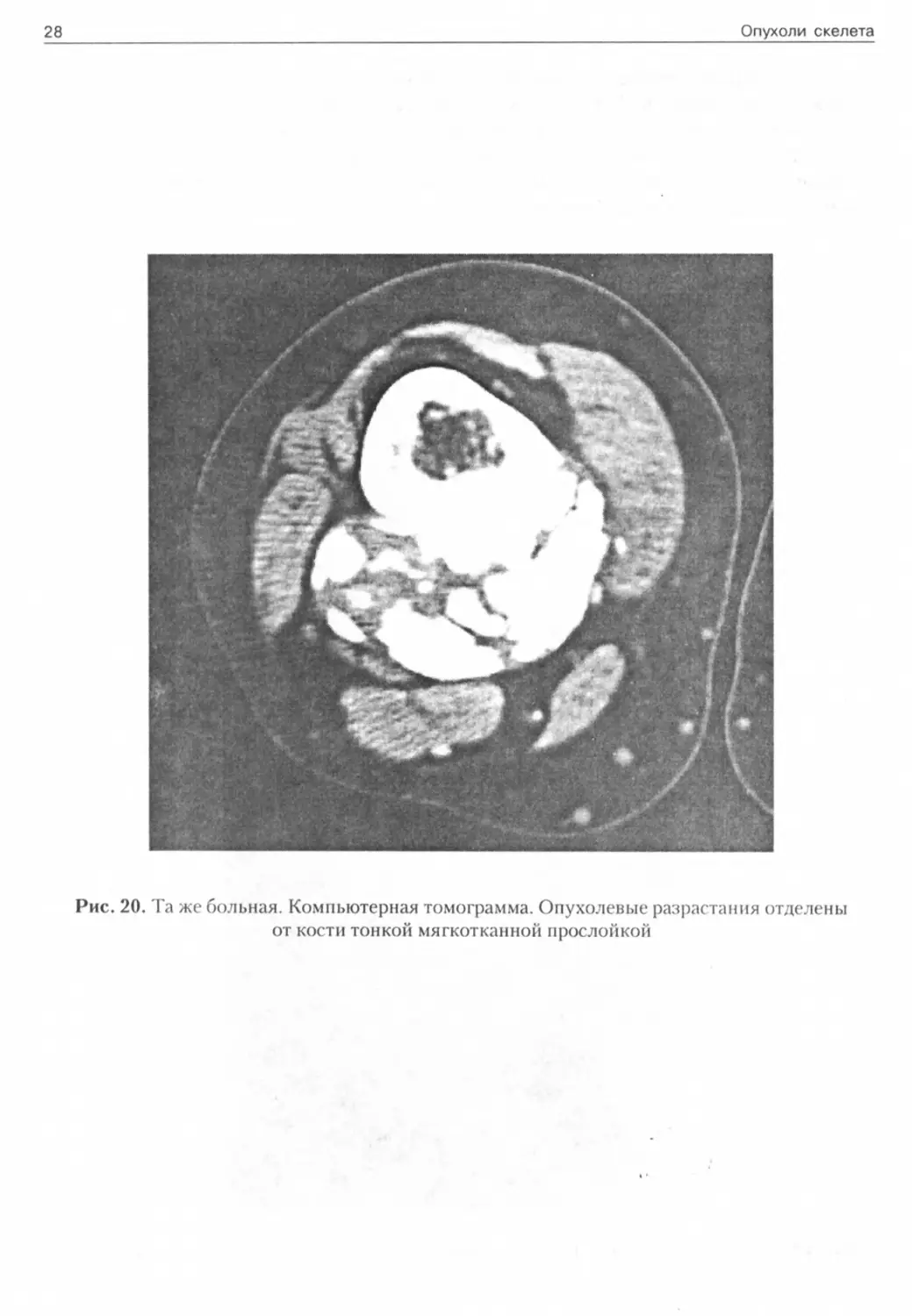
Рис. 20. Та же больная. Компьютерная томограмма. Опухолевые разрастания отделены от кости тонкой мягкотканной прослойкой
Рецидивы после неадекватных резекций и ампутаций имеют вид узлов в мягких тканях, обычно также с выраженным склерозированием структуры (рис. 21).
Рис. 21. Юноша, 15 лет. Рецидив остеосаркомы в мягких тканях после нерадикальной резекции малоберцовой кости. Нечетко очерченный узел с патологическим костеобразованием в структуре
ВТОРИЧНЫЕ САРКОМЫ
Вторичные остеосаркомы — это результат малигнизации предсуществовавших доброкачественных изменений: при болезни Педжета, фиброзной дисплазии, а также после облучения дозой свыше 30 Гр (через 4 года и позднее). Кроме остеосарком могут развиваться фибро- (30 %) и хондросаркомы (10 %).
В целом вторичные опухоли встречаются очень редко (менее 1 % злокачественных новообразований).
Клинически в любом случае на фоне многолетнего бессимптомного периода возникают нарастающие боли и увеличивающаяся припухлость.
Рентгенологически определяется развитие деструктивного очага и мягкотканного компонента с патологическим костеобразованием в структуре или картина остеобла-стической саркомы (рис. 22, 23, 24).
Прогноз при вторичных саркомах — неблагоприятный.
Рис. 22. Мужчина, 58 лет. Остеосаркома проксимального эпиметадиафиза плечевой кости, развившаяся через 7 лет после лучевой терапии саркомы мягких тканей дозой 60 Гр. Распространенная центральная деструкция, зона склероза в головке, спикуловидная реакция по наружной, линейная — по внутренней поверхности,патологический перелом
Рис. 23. Мужчина, 56 лет. Вторичная остеосаркома, развившаяся на фоне болезни Педжета. В структуре проксимальной трети диафиза большеберцовой кости — сливающиеся деструктивные зоны, по наружной поверхности — спикуловидная периостальная реакция, очаги патологического костеобразования, зона Лоозера
Рис. 24. Женщина, 25 лет. Вторичная остеосаркома в одном из очагов полиоссальной фиброзной дисплазии. По задней поверхности диафиза локтевой кости — деструкция кортикального слоя и мягкотканный компонент опухоли
В дифференциальной диагностике остеосарком в целом лишь ранние рентгенологические проявления остеолитических разновидностей могут представлять определенные трудности, напоминая очаги остеомиелита. На этом этапе необходимы онкологическая настороженность и скорейшая морфологическая верификация процесса. Низкодифференцированные саркомы изредка выглядят как “типичный” воспалительный процесс (рис. 25). Телеангиэктатические опухоли неотличимы рентгенологически от злокачественных гигантоклеточных и т. н. “гигантских4 аневризмальных кист.
Рис. 25. Мужчина, 20 лет. Атипичная картина низкодифференцированной остеосаркомы, напоминающая остеомиелит. Центральная деструкция с секвестром в полости, периостальная реакция бахромчатого типа, отек мягких тканей. Неинтенсивные параоссальные очаги патологического костеобразования в мягких тканях являются единственным патогномоничным признаком остеосаркомы
ХРЯЩЕОБРАЗУЮЩИЕ ОПУХОЛИ
Хрящеобразующие опухоли — это, по-видимому, наиболее распространенные новообразования скелета. Группа доброкачественных включает остеохондромы, энхонд-ромы, хондробластому, хондромиксоидную фиброму.
Остеохондромы представляют собой костную опухоль с шапочкой из гиалинового хряща. Они бывают одиночными и множественными (костнохрящевые экзостозы, остеохондроматоз, экзостозная болезнь — семейное заболевание).
Это наиболее часто встречающиеся доброкачественные новообразования скелета (40-50 %), подавляющее число которых выявляется во втором-трстьем десятилетиях жизни.
Типичная локализация — метадиафизы длинных костей, но поражению подвержена любая кость, преформирующаяся через хрящ.
Клинически бессимптомные остеохондромы медленно увеличиваются (рост может прекратиться с остановкой развития скелета), проявляются деформациями. Боли сопровождают подногтевые опухоли или свидетельствуют о малигнизации, наблюдающейся в 1 % одиночных и 20 % множественных остеохондром. Наиболее склонны к озлокачествлению опухоли дистального конца бедренной кости, а среди множественных малигнизироваться может любая, обычно одна.
Рис. 2G. Мальчик, 14 лет. Остеохондрома на широком основании по латеральной поверхности дистальной трети большеберцовой кости, атрофия от давления на прилежащем участке малоберцовой
Рентгенологически — это грибовидные образования различной величины на ножке или широком основании (рис. 26, 27). Хрящевая шапочка на снимках не видна, если не содержит обызвествлений. Экзостозы на длинных костях отклоняются в сторону диафиза. Подногтевые образования, считающиеся скорее реактивным процессом (травма, инфекция), достигают 1 см в диаметре, локализуются обычно на большом пальце.
Лечение — широкая резекция опухоли с ее основанием. Неадекватные вмешательства приводят к рецидивам. При отсутствии косметических и функциональных неудобств показано наблюдение.
Прогноз в целом благоприятный, необходимо лишь вовремя регистрировать возможную малигнизацию.
Рис. 27. Мужчина, 22 года. Остеохондрома на ножке (костнохрящевой экзостоз) с обызвествленной хрящевой шапочкой проксимального метадиафиза большеберцовой кости
Энхондромы — это внутрикостные опухоли, построенные из зрелого гиалинового хряща. Множественные очаги могут сосуществовать с остеохондромами. Вторая по частоте встречаемости (около 20 %) доброкачественная нозологическая форма в скелете.
Период наиболее раннего выявления — второе-четвертое десятилетия жизни.
Локализация энхондромы в 50 % случаев — короткие кости, в частности кисть. Множественные могут отмечаться в одном пальце, чаще кисти, на одной или разных конечностях, с одной или с обеих сторон. Выделение одностороннего хондроматоза (Олье) в настоящее время считается малооправданным.
Бессимптомные клинически, эти опухоли выявляются после патологического перелома или как случайная находка при рентгенографии.
Рентгенологически (рис. 28,29) определяются очаги деструкции различных размеров — центральные, эксцентричные или субпериостальные, ограниченные замыкающей пластинкой, вызывающие истончение кортикального слоя, вздутие и деформации кости. В структуре зачастую содержатся мелкие четко очерченные обызвествления. Внутрикостные обызвествленные (оссифицирующие) энхондромы, локализующиеся в костномозговом канале метадиафизов, выглядят как неправильной вытянутой формы зоны обызвествления мелкоочаговой структуры (рис. 30). В отличие от инфарктов костного мозга при опухолях происходит истончение кортикального слоя изнутри за счет атрофии от давления. При озлокачествлении вокруг зоны обызвествления развивается деструктивный процесс.
Опухоли мелких костей малигнизируются редко — в 1 % случаев, тогда как в других отделах скелета перерождение хондром, особенно крупных, более 8 см в диаметре, возможно в 50 % случаев. При этом теряется четкость контуров, размеры очага увеличиваются за счет мягкотканного компонента.
Дифференциальная диагностика — главным образом с центральными хондросаркомами.
Рис. 28. Женщина, 58 лет. Энхондро.ма проксимальной части основной фаланги П пальца кисти. Четко очерченный очаг деструкции с точечными обызвествлениями в структуре. Истончение кортикального слоя, легкое вздутие кости. Периостальная реакция отсутствует
Рис. 29. Мужчина, 50 лет. Множественные энхондро-мы кисти. Состояние после экзартикуляции IV пальца по поводу малигнизации одной из опухолей
Рис. 30. Женщина, 51 год. Оссифицируюшая энхондрома проксимального метадиафиза плечевой кости. В костномозговом канале — опухоль из множественных обызвествленных узлов, истончающая кортикальный слой, слегка вздувающая кость, без реакции периоста
В подавляющем большинстве случаев энхондромы не требуют хирургического вмешательства и могут наблюдаться многие годы. Лишь признаки малигнизации служат показанием для выполнения радикальной операции.
Редкие внутрисуставные доброкачественные опухоли бывают одиночными или множественными (хондроматоз, остеохондроматоз). Первые клинические признаки ограничение функции, блокада сустава. Рентгенологическая картина типична и не нуждается в дифференциальной диагностике (рис. 31).
Рис. 31А. Женщина, 60 лет. А. Внутрисуставная хондрома в ромбовидном пространстве коленного сустава
Рис. 31 Б. Та же больная через 7 лет. Рост опухоли при сохранении четкости контуров. Множественные точечные обызвествления в структуре, атрофия от давления на прилежащих участках надколенника, эпифиза большеберцовой кости и нижнего полюса хондромы
Параоссальные хондромы мягких тканей бессимптомны, твердой консистенции, на снимках выглядят небольшими овоидными опухолями из интенсивно обызвествленного хряща (рис. 32).
Рис. 32. Мужчина, 55 лет. Внекостная хондрома с характерной “хрящевой” структурой в мягких тканях тыльной поверхности дистальной трети лучевой кости
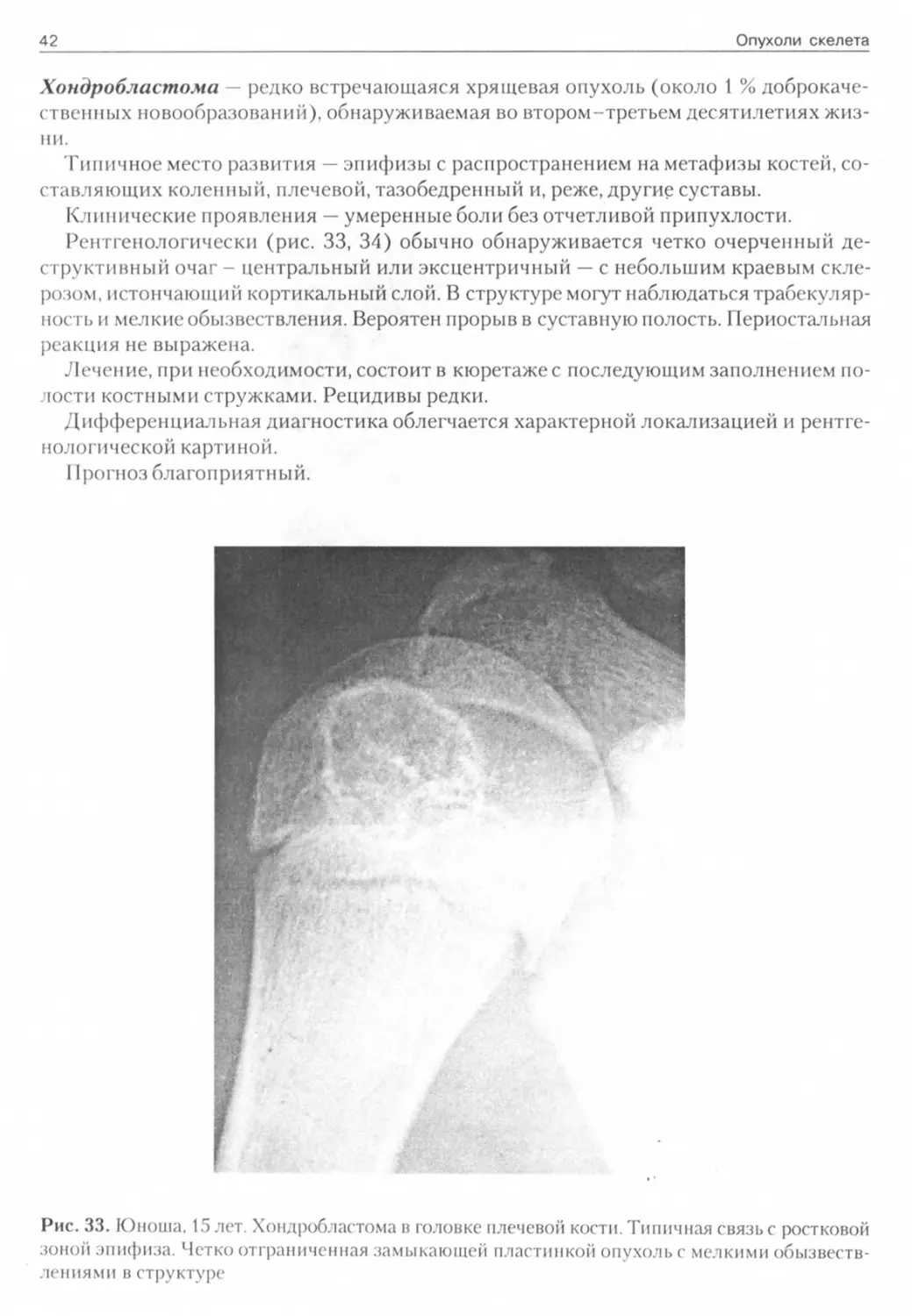
Хондробластома — редко встречающаяся хрящевая опухоль (около 1 % доброкачественных новообразований), обнаруживаемая во втором-третьем десятилетиях жизни.
Типичное место развития — эпифизы с распространением на метафизы костей, составляющих коленный, плечевой, тазобедренный и, реже, другие суставы.
Клинические проявления — умеренные боли без отчетливой припухлости.
Рентгенологически (рис. 33, 34) обычно обнаруживается четко очерченный деструктивный очаг - центральный или эксцентричный — с небольшим краевым склерозом, истончающий кортикальный слой. В структуре могут наблюдаться трабекуляр-ность и мелкие обызвествления. Вероятен прорыв в суставную полость. Периостальная реакция не выражена.
Лечение, при необходимости, состоит в кюретаже с последующим заполнением полости костными стружками. Рецидивы редки.
Дифференциальная диагностика облегчается характерной локализацией и рентгенологической картиной.
Прогноз бл а го п р ия т н ы й.
Рис. 33. Юноша. 15 лет. Хондробластома в головке плечевой кости. Типичная связь с ростковой зоной эпифиза. Четко отграниченная замыкающей пластинкой опухоль с мелкими обызвествлениями в структуре
Рис. 34. Мальчик, 13 лет. Хондробластома аналогичной локализации. Нечетко очерченный деструктивный очаг с единичными мелкими обызвествлениями в структуре. Многослойная линейная реакция периоста на патологический перелом основания большого бугра (снимок выполнен по поводу травмы)
Хондромиксоидная фиброма — редко (0,5 %) встречающаяся доброкачественная опухоль, сформированная из хондроидной и миксоидной ткани.
Диагностируется преимущественно у пациентов второго-третьего десятилетия
жизни.
Локализация — метадиафизы длинных костей, главным образом большеберцовой. Клинические проявления ограничиваются умеренными болями и припухлостью. Рентгенологическая картина (рис. 35) достаточно характерна: четко очерченный неправильной овоидной формы эксцентричный деструктивный очаге фестончатыми контурами, ячеистой структурой.
Кортикальный слой постепенно истончается, периостальная реакция не свойственна.
Дифференциальная диагностика в типичных случаях не нужна. При выраженных клинических проявлениях следует исключить хондросаркому.
Широкое иссечение обеспечивает безрецидивное излечение.
Прогноз благоприятный.
Рис. 35. Девочка, 10 лет. Хон-дромиксоидная фиброма в проксимальной части диафиза большеберцовой кости. Четко очерченная деструкция из сливающихся узлов с фестончатыми контурами. Истончение кортикального слоя по медиальной поверхности, легкое вздутие, ассимилированная периостальная реакция у нижнего полюса опухоли, патологический перелом. Атрофия от давления на прилежащем участке малоберцовой кости
Хондросаркомы занимают 2-3-е место среди злокачественных опухолей скелета. Различают первичные хондросаркомы, возникающие de novo, и вторичные, развивающиеся из предсуществующих доброкачественных хрящевых новообразований, дисплазий и пр.
Хондросаркомы наблюдаются в любом возрасте, однако в большинстве случаев — у больных старше 40 лет; у детей встречаются исключительно редко.
Данные опухоли в % случаев поражают плоские кости, туловище и проксимальные метадиафизы конечностей. Различают центральные и периферические, а также внутрисуставные, экстра- и параоссальные новообразования.
Клиническая картина в определенной мере коррелирует со степенью анаплазии опухолевых клеток. В целом она отличается относительно медленным развитием (средняя продолжительность анамнеза — около полутора лет), болевой синдром выражен умеренно. При периферических вариантах раньше начинает прощупываться плотное несмещаемое образование.
Рентгенологически обнаруживаются опухоли обычно значительных размеров (в среднем около 9-10 см в диаметре) с неоднородной структурой и разнообразными центральными обызвествлениями “хрящевого” типа (хлопьевидные, точечные, глыб-чатые и пр.).
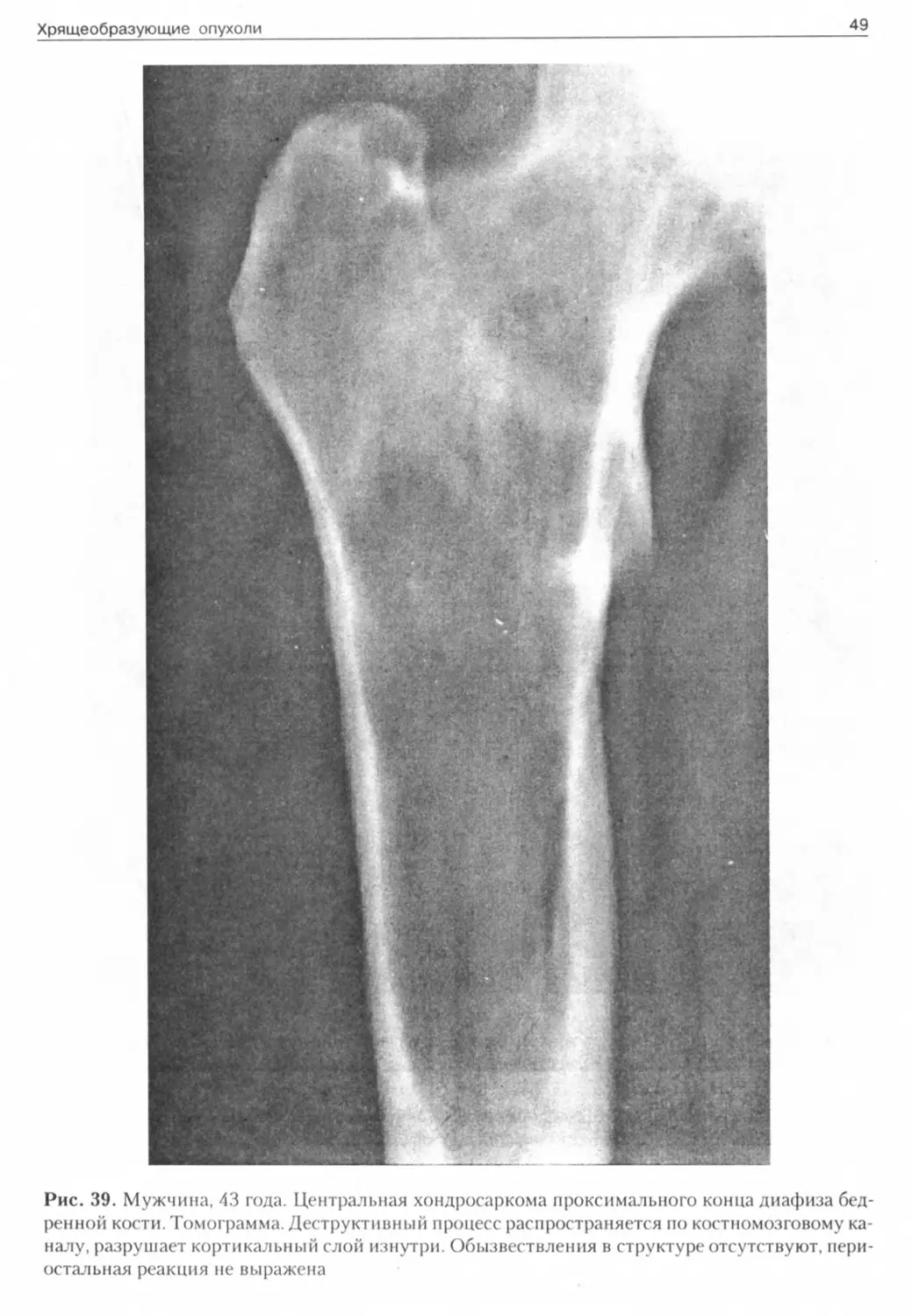
В центральных саркомах (рис. 36-39) деструктивный очаг развивается изнутри, истончает и разрушает кортикальный слой, который на отдельных участках может быть и утолщен, нередко имеется умеренное вздутие кости (отражение медленного роста). После прорыва кортикального слоя образуется периостальный “козырек”, мягкотканная часть.
В периферических саркомах (рис. 40) с самого начала превалирует экзофитный компонент. Кортикальный слой кости разрушается снаружи.
Внутрисуставные хондросаркомы клинически проявляются нарастающим увеличением объема сустава (обычно коленного) и прогрессирующим болевым синдромом. На рентгенограммах пространства сустава выполнены опухолевыми массами с множественными мелкими обызвествлениями без отчетливой костной деструкции (рис. 41).
Экстраоссальные новообразования (рис. 42) отличаются от других сарком мягких тканей повышенной плотностью тени, четкими контурами, а главное — "хрящевыми” обызвествлениями в структуре.
На основании клинико-рентгенологических данных не удается дифференцировать отдельные гистотипы хондросарком (высоко-, низко- или дедифференцированные, светлоклеточные и пр.). Исключение — мезенхимальные хондросаркомы, которые встречаются у лиц более молодого возраста, имеют выраженную клиническую картину, а рентгенологически характеризуются деструкцией без четкого отграничения. Около //данных сарком развиваются в мягких тканях. В очаге деструкции и параоссаль-ных узлах довольно постоянно выявляются обызвествления по типу губчатой кости, нс наблюдающиеся в других опухолях (рис. 43).
Рецидивы хондросарком манифестируют краевой деструкцией в области резекции кости и/или мягкотканным узлом. В большинстве случаев в опухоли имеются характерные обызвествления, облегчающие их распознавание на обычных снимках (рис. 44, 45).
Рис. 36. Мужчина, ЗОлет. Центральная хондросаркома в шейке бедренной кости, первоначально принятая за воспалительный процесс. Небольшой деструктивный очаг без четких контуров. В структуре мелкие обызвествления. Выход опухоли в полость сустава по верхнему краю шейки
Рис. 37. Женщина, 62 года. Центральная хондросаркома дистального эпиметадиафиза бедренной кости. Сливающиеся деструктивные очаги и массивное склерозирование внутрикостной опухоли и умеренной мягкотканной части. Периостальная реакция не выражена. Основной признак в дифференциальной диагностике с остеобластической остеосаркомой — пожилой возраст больной
Рис.38. Мужчина,61 год. Центральная хондросаркома стернального отдела III ребра. Компьютерная томограмма. Больших размеров узел, разрушающий и вздувающий кость, с обызвествлениями в центре и по периферии. Опухоль распространяется преимущественно внутрь за счет отрицательного давления в плевральной полости
Рис. 39. Мужчина, 43 года. Центральная хондросаркома проксимального конца диафиза бедренной кости. Томограмма. Деструктивный процесс распространяется по костномозговому каналу, разрушает кортикальный слой изнутри. Обызвествления в структуре отсутствуют, периостальная реакция не выражена
Рис. 40. Мужчина, 38 лет. Хондросаркома периферического типа на гребне крыла подвздошной кости. Большая интенсивно обызвествленная опухоль с неровными бугристыми контурами
Рис. 41А. Женщина, 36 лет. Внутрисуставная хондросаркома. Опухолевые массы, содержащие множественные мелкие обызвествления, видны во всех отделах коленного сустава
Рис. 41 Б. Та же больная через 4 месяца. Выраженное прогрессирование опухолевого процесса
Рис. 42. Мужчина, 49 лет. Параоссальная хондросаркома. В подколенной ямке — крупный ово-идный узел с мышечной плотностью тени. В структуре — множественные, преимущественно центральные, четко очерченные обызвествления различной формы (“хрящевого” типа). Атрофия от давления на кортикальном слое бедренной кости
Рис. 43. Женщина, 34 года. Мезенхимальная хондросаркома в мышечном слое голени. Нечетко очерченный узел, имеющий одинаковую с мышцами плотность тени. В структуре — центральные обызвествления, напоминающие губчатую кость
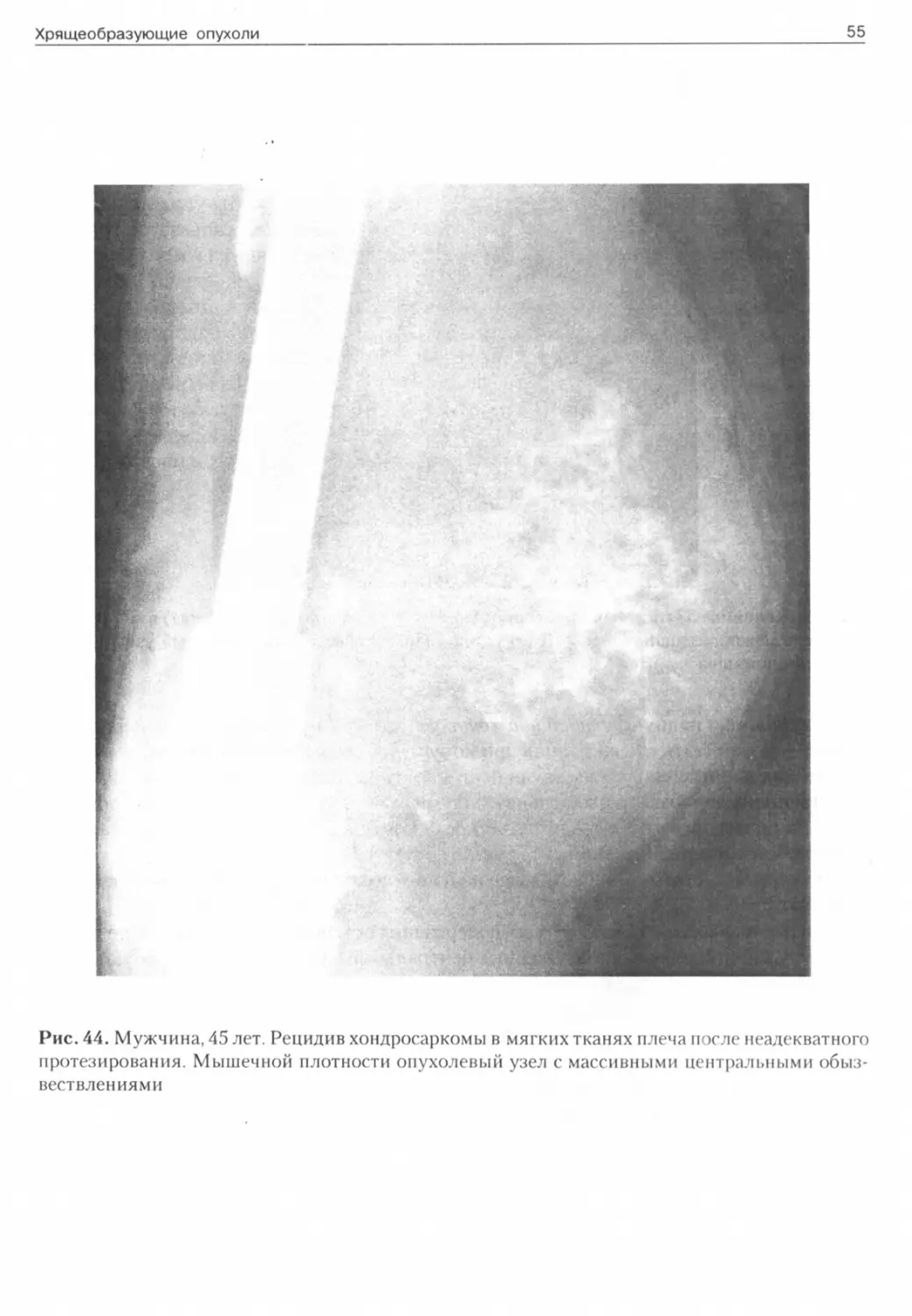
Рис. 44. Мужчина, 45 лет. Рецидив хондросаркомы в мягких тканях плеча после неадекватного протезирования. Мышечной плотности опухолевый узел с массивными центральными обызвествлениями
Рис. 45. Женщина, 53 года. Рецидив хондросаркомы ("транспортный” метастаз) в мягких тканях после межподвздошно-брюшной ампутации. Интенсивно обызвествленный узел области операционного шва
Заключение о наличии вторичной хондросаркомы — центральной или периферической — может быть сделано лишь при получении несомненных клинико-рентгено-логических данных, свидетельствующих о малигнизации предсушествующей доброкачественной хондромы (параллельное болями и увеличением пальпируемой припухлости на рентгенограммах теряется четкость контуров, появляются периостальная реакция, мягкотканный компонент [рис. 46-48]).
Легочные метастазы отличаются высокой плотностью тени и также зачастую обызвествляются.
Если распознавание хондросарком, содержащих обызвествления, обычно не вызывает затруднений, то необызвествленные центральные опухоли нередко требуют дифференциальной диагностики, главным образом с солитарным остеолитическим метастазом и миеломой. И поскольку локализация деструкции и возраст пациентов в обоих случаях примерно одинаковы, то необходимо учитывать весь комплекс клинико-рентгенологических данных.
Так, солитарные метастатические очаги нередко развиваются бессимптомно и обнаруживаются лишь при патологическом переломе, локализуются в любом отделе кости, включая диафиз, где хондросаркомы практически не встречаются. Периостальная реакция, мягкотканный компонент при метастазах не характерны. Следует, однако, исключить вероятность наличия первичной опухоли (легкое, почка, щитовидная железа и пр.).
При солитарной миеломе часто наблюдаются изменения крови (анемия, высокая СОЭ и пр.), а рентгенологически — диффузный остеопороз, деструктивные очаги в дру
гих отделах скелета (ребра, позвонки и пр.). В сложных случаях не обойтись без адекватной биопсии, костномозговой пункции.
Периферические хондросаркомы, не сопровождающиеся выраженной клинической картиной, приходится дифференцировать с остеохондромами аналогичных размеров. Соответствующие клинические данные, признаки деструкции, мягкотканный компонент должны служить ранними свидетельствами злокачественности.
Внутрисуставные хондросаркомы рентгенологически могут напоминать кавернозные гемангиомы синовиальной оболочки, которые содержат типичные множественные мелкие флеболиты — обызвествленные тромбы в венах. В отличие от сарком гемангиомы практически бессимптомны и обнаруживаются уже в детском возрасте.
Лечение хондросарком — возможно более ранняя и широкая хирургическая операция. К сожалению, ввиду обычно запоздалой диагностики вмешательство редко заканчивается простой ампутацией или резекцией, тогда как экзартикуляции и более обширные пособия являются скорее правилом.
Прогноз в целом благоприятнее, чем при других саркомах. Метастазирование в легкие (примерно в 15-20 %) происходит относительно поздно.
Рис. 46. Мужчина, 49 лет. Вторичная центральная хондросаркома, развившаяся из энхондро-мы основной фаланги I пальца стопы. Нечетко очерченный деструктивный очаг в диафизе, разрушение кортикального слоя по медиальной поверхности, обызвествления в мягкотканной части опухоли
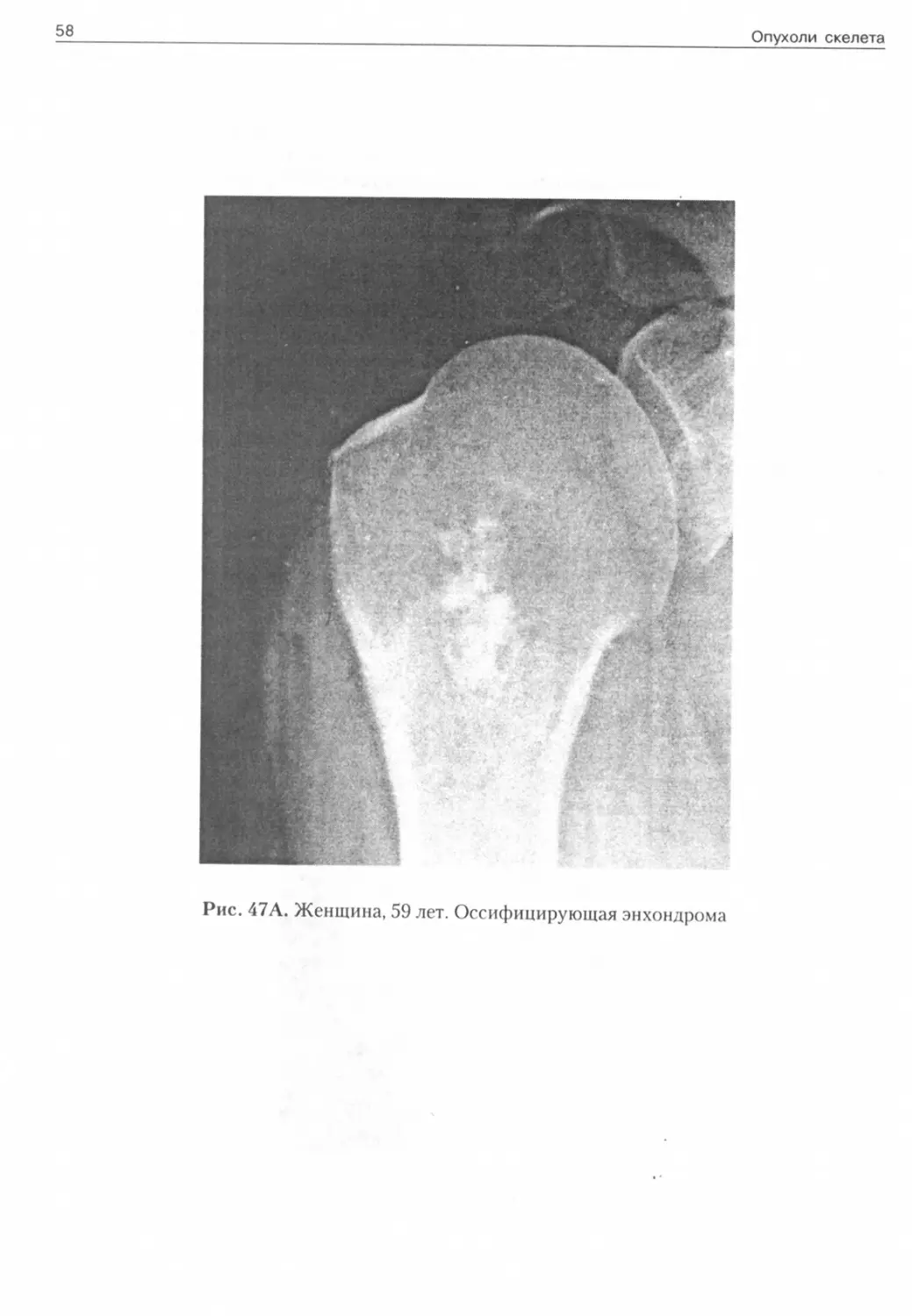
Рис. 47Л. Женщина, 59 лет. Оссифицирующая энхондрома
Рис. 47Б. Та же больная через 5 месяцев. Болевой синдром, незначительная травма. Распространенная деструкция эпиметадиафиза, нарастание центральных обызвествлений, патологический перелом, выход опухоли в мягкие ткани. Вторичная центральная хондросаркома
Рис. 48. Мужчина, 48 лет. Вторичная хондросаркома периферического типа по задней поверхности дистальной трети диафиза бедренной кости. Ножка остеохондромы разрушена, в области хрящевой шапочки — мышечной плотности опухолевый узел без обызвествлений в структуре
СОЕДИНИТЕЛЬНОТКАННЫЕ ОПУХОЛИ
Среди доброкачественных новообразований соединительнотканной природы наиболее часто встречается неоссифицирующая фиброма, или фиброзный кортикальный дефект. Другие нозологические формы, в частности ксантофиброма (доброкачественная фиброзная гистиоцитома), наблюдаются чрезвычайно редко.
Существует мнение, что неоссифицирующая фиброма — это не истинная опухоль, а отшнуровавшийся участок ростковой зоны.
Большинство неоссифицирующих фибром распознается до 20 лет — случайно, например при патологическом переломе.
Данные образования локализуются в кортикальном слое метафизов длинных костей, главным образом нижней конечности. По мере роста кости они постепенно смещаются в сторону диафиза.
Клинически бессимптомные, фибромы выявляются лишь рентгенологически в виде небольшого краевого дефекта кости с фестончатыми контурами, ограниченного замыкающей пластинкой. Изредка опухоли достигают 5-7 см по длиннику роста, имеют дольчатое строение (рис. 49, 50).
Дифференциальной диагностики обычно не требуется.
11еоссифицирующие фибромы исчезают без лечения, параллельное закрытием ростковых зон, изредка со склерозированием структуры.
Рис. 49. Мальчик. 9 лет. Неоссифицирующая фиброма (фиброзный кортикальный дефект) в заднелатеральном крае дистальной трети диафиза большеберцовой кости. Овоидной формы дефект кости с фестончатыми контурами, окруженный замыкающей пластинкой. Легкое истончение кортикального слоя. Смещение к середине диафиза на 2 см. Наиболее типичная картина
Рис. 50. Женщина, 20 лет. Неоссифицирую-щая фиброма (фиброзный кортикальный дефект) в заднем крае дистальной трети бедренной кости, на 6 см сместившаяся к середине диафиза. Ячеистая структура с тонкими перегородками
Ксантофиброма — исключительно редко встречающаяся доброкачественная опухоль, наблюдающаяся у лиц любого возраста.
Локализация — метадиафизы длинных костей.
Клинические симптомы выражены слабо.
Рентгенологически определяется центральная мелкоочаговая деструкция в сочетании с циркулярным утолщением кортикального слоя, без свежей периостальной реакции (рис. 51).
Злокачественная фиброзная гистиоцитома — нозологическая форма, лишь недавно выделенная из группы фибро- и остеосарком, так что данные о ее истинной частоте пока отсутствуют. Известны наблюдения возникновения гистиоцитом на месте длительно существующих инфарктов костного мозга.
“Излюбленная” локализация, подобно таковой у многих сарком,— область коленного сустава. Поражаются и другие отделы скелета.
Преобладающий возраст больных — около 40 лет.
Клиническая картина соответствует таковой при медленно прогрессирующей злокачественной опухоли, анамнез заболевания может достигать трех лет. Нередки патологические переломы.
Рентгенологически выявляется многоочаговая центральная деструкция без четкого отграничения и выраженной периостальной реакции, развивающаяся в метафизе с переходом на эпифиз и диафиз. Обызвествления в структуре отсутствуют (рис. 52).
Рис. 51. Женщина, 48 лет. Ксантофиброма (доброкачественная фиброзная гистиоцитома) диафиза большеберцовой кости. Циркулярное утолщение кортикального слоя, сужение и крупнопетлистая структура костномозгового канала
Фибросаркома — это редко встречающаяся опухоль кости, которая наблюдается у лиц любого возраста, но несколько чаще — во втором-четвертом десятилетиях жизни.
Локализация фибросарком совпадает с таковой при остеосаркомах.
Клиническая картина характеризуется умеренными болями и медленно увеличивающейся припухлостью.
Рентгенологически определяется нечетко очерченный очаг деструкции в костномозговом канале метаэпифиза, без периостальной реакции, с умеренным мягкотканным компонентом (рис. 53).
Лечение фиброзных гистиоцитом и фибросарком — исключительно хирургическое (ампутации различного уровня).
Подобно всем злокачественным опухолям костей соединительнотканные саркомы активно метастазируют в легкие.
Рис. 52. Мужчина, 21 год. Злокачественная фиброзная гистиоцитома проксимальной трети диафиза плечевой кости. Мелкие сливающиеся очаги деструкции, разрушение кортикального слоя, периостальная реакция незначительная, мягкотканный компонент по наружной поверхности без обызвествлений в структуре
Рис. 53. Женщина, 20 лет. Фибросаркома медиальной полуокружности метадиафиза большеберцовой кости. Неоднородная нечетко очерченная деструкция кости, разрушение кортикального слоя. Периостальная реакция, мягкотканная часть выражены незначительно
ГИГАНТОКЛЕТОЧНАЯ ОПУХОЛЬ (ГКО)
Гигантоклеточные опухоли, развивающиеся из мезенхимальных зачатков соединительной ткани, представляют собой новообразования с невыясненной до конца природой и непрогнозируемым клиническим течением. В целом это прогрессирующий, изначально или потенциально злокачественный процесс, способный к рецидивированию и метастазированию. Условно выделяют доброкачественные (15 %), первично злокачественные (30 %) и малигнизирующиеся формы, обладающие выраженной тенденцией к озлокачествлению, в частности после лучевой терапии. Среди различных названий сейчас наиболее приняты аббревиатура ГКО и термин “остеокластома”. Термин “остеобластокластома”, широко распространенный в отечественной литературе, менее обоснован.
ГКО наблюдается достаточно часто (от 5 до 11 % всех опухолей скелета).
Возрастной показатель большинства пациентов — второе-четвертое десятилетия жизни, с преобладанием женщин среди более молодых больных. По общепринятому в настоящее время мнению, ГКО не встречается до 12 лет. Отмечено, что лица с доброкачественными вариантами моложе больных злокачественными ГКО.
“Излюбленные” локализации — места скопления остеокластов; эпифизы трубчатых костей, плоские кости, причем половина случаев ГКО приходится на коленный сустав. Вторая по частоте поражения — лучевая кость. В коротких костях кисти и стопы, в нижней челюсти развиваются, по-видимому, не истинные ГКО, ат. н. гигантоклеточная реакция на травму и пр.
Рис. 54. Женщина, 54 лет. Гигантоклеточная опухоль (ГКО) в заднемедиальной части дистального эпифиза большеберцовой кости. 11амечающаяся ячеистая структура, вздутие, тонкая периостальная “скорлупа”. Периостальная реакция не выражена. Диффузный регионарный остеопороз
Ведущие клинические симптомы — постоянные боли и увеличивающаяся опухоль. Близость процесса к суставу обусловливает раннее нарушение его функции. Характерно местное повышение температуры, истончение кожи.
На рентгенограммах (рис. 54-57) вначале выявляется эксцентричный нечетко очерченный деструктивный очаг в эпифизе (эпиметафизе), постепенно распространяющийся на метадиафиз. Опухоль истончает и разрушает кортикальный слой, вздувает кость, проникает в мягкие ткани. Периостальная реакция не выражена. Особенность ГКО состоит в способности распространения на соседнюю кость через суставные структуры. В 15 % случаев возникают патологические переломы. Условно выделяют остеолитическую, ячеисто-трабекулярную и смешанную формы, которые могут трансформироваться одна в другую. Ячеистость, однако, можно обнаружить в периферических зонах любой остеолитической ГКО. В процессе лучевой терапии ГКО проходит т. н. "парадоксальную" фазу (увеличение размеров и потеря структуры очага), после чего нарастает ячеистость, предшествующая репарации (рис. 58). Малигнизированные или первично-злокачественные ГКО выглядят как типичные остеолитические саркомы (рис. 59).
Рис. 55. Женщина, 42 года. ГКО в эпифизе лучевой кости. Нечетко очерченная деструкция, незначительное вздутие, неотчетливая ячеистая структура, отсутствие периостальной реакции
Рис. 56. Мужчина, 40 лет. ГКО (гигантоклеточная реакция?) основной фаланги II пальца кисти. Мелкоячеистая деструкция проксимальной части фаланги, небольшое вздутие основания кости, истончение и разрушение кортикального слоя; периостальная реакция не выражена
Рис. 57. Женщина, 42 года. ГКО крыла подвздошной кости. Обширный участок деструкции в области гребня без четкого отграничения от'здоровой костной ткани. Значительный мягкотканный компонент. В структуре опухоли — множественные ячейки с тонкими стенками
Рис. 58А. Мужчина, 21 год. ГКО проксимального эпиметадиафиза большеберцовой кости. Характерные рентгенологические проявления
Рис. 58Б. Тот же больной в процессе лучевой терапии: т. н. парадоксальная фаза — увеличение размеров деструктивного очага, разрежение структуры, патологический перелом
Рис. 58В. Тот же больной через год после окончания лучевой терапии. Выраженное склерозирование опухоли, консолидация перелома
Рис. 59. Мужчина, 29 лет. Злокачественная ГКО эпиметадиафиза малоберцовой кости. Полная деструкция кости, намечающаяся ячеистая структура, вздутие, разрушение кортикального слоя и выход в мягкие ткани. Периостальная реакция отсутствует
Дифференциальная диагностика во многом зависит от степени злокачественности и локализации ГКО в скелете.
Так, злокачественная ГКО может напоминать клинико-рентгенологическими признаками телеангиэктатическую остеосаркому.
Практически всегда ГКО нужно дифференцировать с аневризмальной костной кистой (АКК). В трубчатых костях АКК встречается у более молодых людей, болевой синдром менее выражен, она не переходит на эпифиз, отграничена от мягких тканей тонкой периостальной “скорлупой”. При локализации опухоли в плоских костях следует помнить, наряду с АКК, об атипично развивающейся остеолитической саркоме. ГКО крестца могут напоминать хордому. В позвоночнике АКК обнаруживается во много раз чаще, чем ГКО.
Лечение ГКО — полноценная резекция пораженного участка. Экскохлеация очага, как правило, ведет к рецидиву. При невыполнимости оперативного вмешательства методом выбора служит лучевая терапия, способствующая уменьшению размеров и склерозированию очага. Однако почти в 60 % случаев наступают рецидивы и появляются очаги малигнизации в виде деструктивных зон на склерозированном фоне.
СОСУДИСТЫЕ ОПУХОЛИ
Доброкачественные сосудистые новообразования (гем[лимф]ангиомы) дизонтогене-тического происхождения составляют около 1 % опухолей скелета. Встречаются у лиц любого возраста, нередко после 40 лет.
11аблюдаются солитарные и множественные поражения, ограниченные пределами кости или сосуществующие с изменениями в мягких тканях, локализованные или распространяющиеся на анатомическую область (ангиоматоз). 60 % гемангиом развиваются в позвонках, до 20 % — в костях свода черепа, остальные — в любой кости.
В большинстве случаев клинически бессимптомные, гемангиомы являются случайной находкой на рентгенограмме, в частности при патологическом переломе. Могут отмечаться умеренные боли, припухлость, легкое повышение местной температуры кожи. Ангиоматозы манифестируют увеличением объема пораженного отдела конечности.
Рентгенологическая картина костных гемангиом достаточно характерна. В телах позвонков (рис. 60) определяется типичная картина грубых вертикальных трабекул, в корнях дуги может быть видна ячеистость, тело позвонка иногда приобретает бочкообразную форму. В костях свода черепа (рис. 61) обнаруживается четко очерченный овоидный участок с радиарной трабекулярной исчерченностью. В других костях наблюдается вздутие в сочетании с ячеисто-трабекулярной структурой, без периостальной реакции (рис. 62, 63,).
При ангиоматозах изменяется кровоснабжение соответствующего отдела. Увеличенный приток крови к костям приводит к их удлинению, возникновению участков гиперостоза. В то же время наличие сосудистых клубочков в параоссальных тканях вызывает появление участков атрофии от давления на кортикальном слое. При этом нарушается и структура мягких тканей: в подкожной клетчатке обнаруживаются сосудистые уплотнения различной формы и величины, в мышечном слое — участки атрофии, жирового перерождения с пониженной плотностью тени, флеболиты (рис. 64).
Рис. 60. Женщина, 47 лет. Гемангиомы V и VII грудных позвонков. Боковая томограмма. Характерная вертикальная трабекулярность структуры при нормальной высоте тел
Рис. 61. Женщина, 42 года. Гемангиома теменной кости. Округлый четко очерченный очаг с раднарной структурой
Рис. 62. Женщина, 20 лет. Гемангиома заднего отрезка VII ребра. Вздутие, радиарно-трабекулярная перестройка структуры кости без периостальной реакции
Рис. 63. Женщина, 42 года. Гемангиома проксимального эпиметадиафиза плечевой кости. Вздутие, радиарно-трабекулярная перестройка структуры кости, контуры четкие, периостальная реакция отсутствует
Рис. 64. Женщина, 62 года. Ангиоматоз голени. Малоберцовая кость в проксимальной половине вздута, структура ее — ячеисто-трабекулярная, кортикальный слой неравномерно истончен, контуры кости четкие. Вместо нормального перистого рисунка мышц выявляются разнообразные уплотнения (сосудистые клубочки), разделенные “прозрачными” участками жировой ткани. Множественные флеболиты (обызвествленные тромбы в венозных сосудах). Большеберцовая кость — без отчетливых изменений
11е часто наблюдающаяся гломусная опухоль обычно локализуется в ногтевых фалангах и клинически проявляется резкой болезненностью и гиперестезией, а рентгенологически — наличием очага остеолиза в ногтевой фаланге (рис. 65).
Костные лимфангиомы, встречающиеся чрезвычайно редко, бессимптомны; на рентгенограммах определяются зоны остеолиза без реакции окружающих тканей.
Описаны немногочисленные наблюдения ангиосарком — злокачественных сосудистых опухолей (ангиоэндотелиома, гемангиоперицитома, лимфангиосаркома). Клиническая картина аналогична таковой при быстро растущих саркомах с выраженной симптоматикой. В рентгенологической картине доминируют обширные разрушения кости, значительная мягкотканная часть, в структуре которой могут присутствовать различные обызвествления (ангиолиты и пр.) (рис. 66).
Рис. 65. Мальчик, 10 лет. Гло.мус-ангиома ногтевой фаланги III пальца кисти. Полная деструкция кости до ростковой зоны. Однородная тень мягкотканной опухоли, замещающей фалангу
Рис. 66. Женщина, 46 лет. Компьютерная томограмма. Гемангиоперицитома тела и крыла левой подвздошной кости. Огромных размеров бугристая опухоль из множественных узлов, разрушающая кость. В структуре — множественные разнообразные обызвествления, пониженной плотности участки некрозов и ослизнения
КОСТНОМОЗГОВЫЕ ПОРАЖЕНИЯ
Гистиоцитоз из клеток Лангерганса — опухолеподобное заболевание костного мозга, известное ранее как гистиоцитоз X, характеризуется локализованной или диссеминированной пролиферацией дендритных клеток с фенотипом клеток Лангерганса. Этиология его остается не ясной. Согласно наиболее распространенным представлениям это заболевание является аномальным иммунным ответом на неизвестный патогенный фактор либо клональным неопластическим процессом.
Гистиоцитоз из клеток Лангерганса — редкое (0,2-1,0 : 100 000) заболевание детского возраста, но может наблюдаться и у взрослых.
Наиболее остро протекающая форма — болезнь Леттерера-Сиве — развивается у младенцев, болезнь Хенда-Шюллера-Крисчена — в 3-5 лет, эозинофильные гранулемы (самые часто встречающиеся) — в старшем детском и юношеском возрасте.
Гранулемы могут локализоваться в любой одной или нескольких костях солитарными или множественными очагами. В первую очередь страдают плоские кости: свод черепа, челюсти, ребра, таз, затем позвоночник, длинные трубчатые кости (метафизы и диафизы, реже эпифизы).
Продолжительность анамнеза — от месяца до года. Клиническая картина весьма вариабельна — от спонтанно регрессирующего бессимптомного солитарного очага (эозинофильная гранулема) до хронически протекающего (болезнь Хенда-Шюллера-Крисчена) или стремительно развивающегося диссеминированного процесса (болезнь Леттерера-Сиве) с поражением скелета, внутренних органов, лимфатических узлов, кожи.
Для генерализованной формы характерно наличие тетрады признаков: несахарное мочеизнурение, пучеглазие, гепато- и спленомегалия, отит. Возможны умеренный лейкоцитоз, СОЭ до 20-40 мм/ч и преходящая эозинофилия (8-20 %).
I Сражение костей (в основном трубчатых) проявляется умеренными непродолжительными болями, мягкоэластической (при разрушении коркового слоя) или плотной (при вздутии кости) припухлостью. Нарушения двигательной функции отмечаются редко, как и наличие неврологической симптоматики. Учитывая вероятность бессимптомного течения гранулем, при подозрении на гистиоцитоз необходимо делать снимки наиболее часто поражаемых костей и грудной клетки.
Рентгенологическая картина большинства поражений скелета представлена четко очерченными центральными очагами деструкции неправильной формы с более или менее выраженным ободком склероза по периферии. Очертания крупных очагов — фестончатые.
Эозинофильные гранулемы в своде черепа выглядят “штампованными” очагами (рис. 67), при генерализованных формах определяются ландкартообразные дефекты в диплоэ (рис. 68), захватывающие обе пластинки, с более или менее склерозированными контурами без периостальной реакции. Наружная пластинка обычно разрушена сильнее, в результате чего деструктивный очаг имеет характерный двойной контур. Изредка наблюдаются секвестры в виде “пуговицы” сохранившейся кости в центре литической зоны (рис. 69).
Вовлечение альвеолярных отростков челюстей проявляется достаточно типичной, но не вполне патогномоничной для гистиоцитоза картиной “плавающих” зубов (рис. 70).
Рис. 67. Мальчик, 8 лет. Эозинофильная гранулема чешуи лобной кости
А
Рис. 68. Мальчик, 3 года. Болезнь Хенда-Шюллера-Крисчена. А. Множественные ландкартообразные дефекты в костях свода черепа. Б. Через 5 лет после лечения. Полное восстановление костной структуры
Б
Рис. 69. Женщина, 35 лет. Эозинофильная гранулема. Очаг деструкции в правой теменной кости с фестончатыми контурами и “пуговичным” секвестром в центре
Рис. 70. Девочка, 11 лет. Поражение нижней челюсти при гистиоцитозе. 11антомограмма. Деструкция парадонта, симптом “плавающих” зубов
Деструкция плоских костей может сопровождаться вздутием с сетчатой, ячеистой структурой (рис. 71).
При обширном поражении трубчатых костей наблюдаются разрушение кортикального слоя, наличие мягкотканного компонента, многослойная линейная периостальная реакция, иногда ассимилированная (рис. 72, 73, 74).
Патологические переломы тел позвонков настолько типичны, что обнаружение компрессии одного или нескольких позвонков у ребенка в возрасте до 15 лет позволяет сразу заподозрить эозинофильную гранулему. Характерно равномерное снижение высоты тела {vertebra plana) вплоть до его полного коллапса (рис. 75). Переломы других костей случаются редко.
Дифференциальная диагностика генерализованных форм гистиоцитоза проводится в первую очередь с лейкозами, а солитарных эозинофильных гранулем — с остеомиелитом, метастазами, миеломой, лимфомами.
Лечение (в зависимости от формы заболевания) — от кюретажа, местных инъекций стероидов или применения малых доз лучевой терапии при поражении одной системы до различных схем химиотерапии при диссеминированных формах. Современная полихимиотерапия обеспечивает стойкую ремиссию (до 5 лет) даже при агрессивных формах. Прогноз эозинофильной гранулемы благоприятный, хотя могут развиваться рецидивы. В редких случаях происходит спонтанное излечение.
Рис. 71. Мальчик, 5 лет. Эозинофильная гранулема. Деструктивный очаг с ячеистой структурой в лопатке
Рис. 72. Девочка, 5 лет. Эозинофильная гранулема малоберцовой кости. Центральная деструкция с циркулярными линейными периостальными наслоениями
Рис. 73. Девочка, 6 лет. Эозинофильная гранулема бедренной кости. Центральный очаг деструкции с ассимилированными периостальными наслоениями
Рис. 74. Девочка, 11 лет. Эозинофильная гранулема лобной кости с выраженным мягкотканным компонентом и периостальной реакцией
Рис. 75. Мальчик, 14 лет. Эозинофильная гранулема с компрессионным переломом III поясничного позвонка
Злокачественные заболевания включают миелому, лимфомы и саркому Юинга.
Миелома (плазмоцитома) рассматривается в настоящее время как опухолевое заболевание кроветворных органов, характеризующееся разрастанием атипичных плазматических клеток. Различают генерализованную (множественную) и, более редкую, солитарную формы. Плазмоцитома считается самой часто встречающейся первичной злокачественной опухолью скелета (30-40 % всех сарком). Возрастной показатель около :,/4 больных, страдающих миеломой,— пятое-седьмое десятилетия жизни; до 40 лет болезнь наблюдается редко. Соотношение заболеваемости у мужчин и женщин — 2:1.
Множественная миелома локализуется главным образом в аксиальном скелете (позвонки, ребра, череп, а также плечевой и тазовый пояс), солитарная нередко развивается в метафизах длинных костей, особенно бедренных. Вовлечение диафизов, дистальных отделов конечностей происходит в основном при генерализации процесса.
Солитарная миелома проявляется лишь болями, плотной опухолью, при генерализованной форме клиническая картина более вариабельна. Наряду с болями в костях уже в начальной стадии возникают симптомы интоксикации: отсутствие аппетита, потеря массы тела, субфебрилитет, в крови — снижение содержания гемоглобина, повышение СОЭ до 70-90 мм/ч, наличие патологических плазматических клеток. Весьма важным признаком служит обнаружение в сыворотке патологического белка — миеломного парапротеина. У 60 % пациентов диагностируется Бенс-Джонс-протеинурия, являющаяся порой единственным симптомом в течение многих лет. При компрессионных переломах позвонков больные предъявляют неврологические жалобы. В терминальной стадии наблюдается миеломная нефропатия.
Рентгенологически выделяют следующие основные разновидности: многоочаговую (до % всех случаев), диффузную литическую и, редкие (1-2 %), остеопоротическую и остеосклеротическую.
Солитарная миелома обычно имеет вид обширного, довольно четко отграниченного либо поликистозного (по типу “мыльных пузырей”) (рис. 76) участка деструкции. При этом возможно разрушение коркового слоя, вздутие, особенно в ребрах, грудине и ключице (рис. 77). Обычно через 2-3 года наступает диссеминация, хотя есть наблюдения длительного, до 20 лет и более, локализованного процесса.
Классическая картина генерализованной миеломы — наличие множественных четко очерченных “штампованных” очагов деструкции различной величины в своде черепа (рис. 78), ключицах, ребрах, костях таза и пр. Достаточно часто наблюдается ячеистая или сетчатая структуры — от “пчелиных сот” до “мыльных пузырей” (рис. 79,80). В костях таза и метафизах трубчатых костей встречаются и чисто деструктивные изменения, распространяющиеся на кортикальный слой.
Генерализованный диффузный остеопороз, обусловленный повышенной остеокла-стической активностью, нередко обнаруживается у молодых мужчин, обычно в позвонках, сперва поясничных (тела, дуги, отростки).
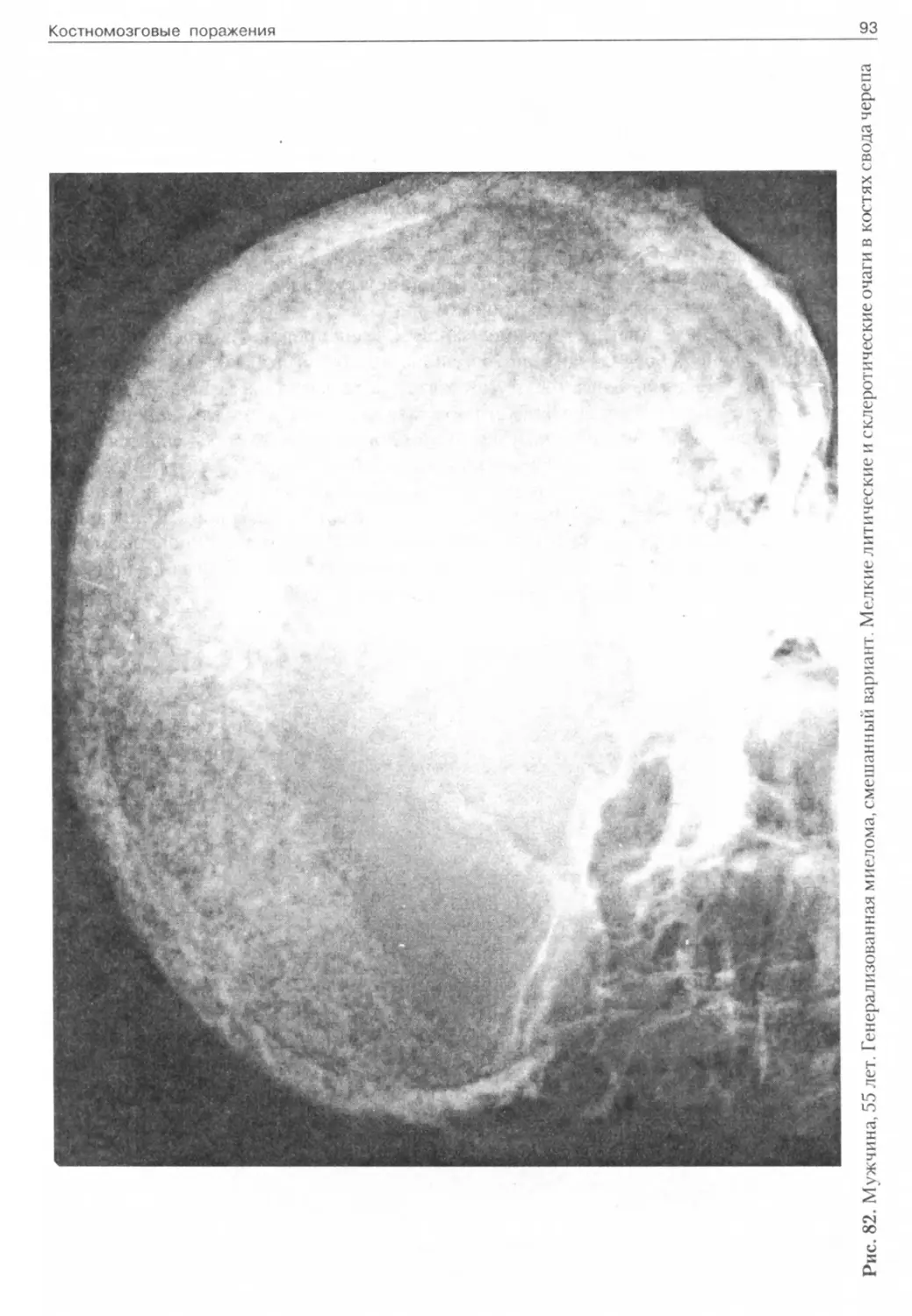
Остеобластический вариант (по типу склеротических метастазов или диффузный) наблюдается в основном в ребрах, позвонках, грудине и костях таза (рис. 81). Смешанные (остеолитические и остеобластические) изменения (рис. 82) регистрируются редко, как правило, у нелеченных больных, но могут являться и свидетельством положительного ответа на проводимое лечение.
Рис. 76. Мужчина, 66 лет. Солитарная миелома. Поликистозная деструкция по типу "мыльных пузырей” со вздутием и деформацией ключицы
Рис. 77. Мужчина, 32 года. Солитарная миелома ребра. Четко отграниченный участок деструкции со вздутием
Рис. 78. Мужчина, 50 лет. Генерализованная миелома. Множественные четко очерченные (“штампованные”) очаги деструкции в костях свода черепа
Рис. 79. Мужчина, 68 лет. Генерализованная миелома. Деструкция в крыле подвздошной кости мелко- (по типу “пчелиных сот”) и крупноячеистой структуры. Патологический перелом
Рис. 80. Мужчина, 55 лет. Генерализованная миелома. Крупноячеистая деструкция метадиафиза плечевой кости с распространением на диафиз. Выраженный остеопороз. Участок мелкоочаговой деструкции в теле лопатки
Рис. 81. Мужчина, 52 года. Генерализованная миелома, остеобластический вариант. Диффузный неравномерный склероз костей таза и поясничных позвонков
Опухоли скелета
Рис. 82. Мужчина, 55 лет. Генерализованная миелома, смешанный вариант. Мелкие литические и склеротические очаги в костях свода черепа
Костномозговые поражения
«3 со
Поражение плоских костей может сопровождаться значительным мягкотканным компонентом (рис. 83), а обнаружение паравертебральной мягкотканной полосы зачастую предшествует выявлению деструктивного процесса в позвонках.
Периостальная реакция в целом не характерна. При солитарной миеломе, в отличие от множественной, может происходить ассимиляция наслоений. В исключительных случаях (значительная генерализация) развивается распространенный игольчатый периостоз, т. н. “лохматая собака” (рис. 84).
Патологические переломы костей (рис. 85) отмечаются примерно в половине случаев, в позвонках же — у % пациентов. Под влиянием лучевой терапии они могут консолидироваться без выраженной костной мозоли.
Дифференциальная диагностика миеломной болезни проводится в основном с метастазами (в первую очередь рака щитовидной и молочной желез), при этом важно учитывать, что миелома, в отличие от метастазов, вовлекает тела позвонков и диски. Гиперпаратиреоидная остеодистрофия поражает дистальные отделы конечностей, протекает с деформациями костей. При лейкозах довольно часто определяются изменения в диафизах, не характерные для плазмоцитомы. Формальная рентгенологическая картина солитарной миеломы порой неотличима от таковой при ГКО и АКК.
Метод выбора при генерализованном процессе — полихимиотерапия. Солитарная миелома радиочувствительна. 5-летняя выживаемость при множественной плазмоцитоме в целом составляет около 20 %, при солитарной достигает 60 %. Главная причина летального исхода — амилоидоз и почечная недостаточность.
Рис. 83. Женщина, 54 года. Компьютерная томограмма. Генерализованная миелома. Обширная деструкция ребра с большим мягкотканным компонентом
Рис. 84. Мужчина, 51 год. Генерализованная миелома. Поражение бедренной кости с игольчатой и ассимилированной периостальной реакцией
Рис. 85. Женщина, 64 лет. Генерализованная миелома. Диффузный остеопороз позвоночника. Компрессионные переломы тел VI. VIII, IX и XII грудных позвонков
Злокачественные лимфомы — новообразования лимфоидной ткани, отличающиеся универсальным распространением на любые органы и системы организма. Изменения в скелете бывают двух видов: первичное поражение с возможными метастазами в регионарных лимфатических узлах и вторичное вовлечение костей при генерализации процесса.
Первичную злокачественную лимфому кости долгое время называли ретикулосар-комой, пока в 1963 г. Ивине (Ivins) и Далин (Dahlin) не отнесли ее к группе неходж-кинских лимфом. Сюда же включают крайне редко встречающееся первичное солитарное поражение костей при лимфогранулематозе.
Данный процесс составляет около 5-6 % всех злокачественных новообразований скелета и выявляется в любом возрасте, наиболее часто в третьем-четвертом десятилетиях жизни, редко у детей в возрасте до 10 лет. Соотношение заболеваемости у мужчин и женщин — 2,5 : 1.
I [сражаются любые кости, обычно метадиафизы длинных трубчатых (бедро, плечо, голень), особенно область коленного сустава; вовлечение плоских и мелких костей не столь типично, а в черепе эта опухоль не наблюдалась.
Известны три варианта клинического течения: непрерывно прогрессирующее, волнообразное и бессимптомное. Боли возникают при инфильтрации кортикального слоя, усиливаются по ночам, могут существовать до двух лет. Затем появляются плотноэластическая несмещаемая припухлость, изменения кожи, нарушения функции сустава. В то же время распространенные разрушения кости порой протекают без выраженной симптоматики.
В рентгенологической картине преобладает мелкоочаговая, “ползучая” деструкция по типу “изъеденности молыо”(рис. 86, 87) — литическая форма (до 70 % случаев). Смешанная (до 25-28 %) характеризуется чередованием литических и склеротических участков (рис. 88), что объясняется способностью опухолевых клеток в определенной степени стимулировать остеопоэз. Остеобластический тип обнаруживается весьма редко.
Инфильтрация кортикального слоя приводит к его расслоению, нарушению кровоснабжения, что иногда сопровождается образованием секвестров (рис. 89). При относительно медленном прогрессировании иногда имеет место умеренный гиперостоз. Контуры деструкции нечеткие, оценить ее протяженность на снимке затруднительно, и при морфологическом исследовании размеры опухоли значительно превышают те, что установлены рентгенологически. Не исключается распространение через межпозвонковые и крестцово-подвздошные сочленения.
В диафизах трубчатых костей мелкие деструктивные очаги вытянуты вдоль кости, распространяются на кортикальный слой, контуры его становятся неровными и нечеткими (рис. 90), затем образуется мягкотканная часть. Метафизарный процесс может быть эксцентричным, переходить на сустав с появлением выпота.
Ангиографическая картина типична для злокачественной опухоли (рис. 91).
Поражение плоских костей отличается большими размерами, ландкартообразными контурами, реактивным костеобразованием (рис. 92).
Линейная одно- или многослойная периостальная реакция (в трубчатых костях) выражена слабо (рис. 93). Периостальный “козырек”, однородная мягкотканная часть наблюдаются у ’/-’/2 части пациентов.
Рис. 86. Мужчина, 51 год. Первичная злокачественная лимфома большеберцовой кости. Мелкоочаговая “ползучая” центральная деструкция с распространением на кортикальный слой и выходом в мягкие ткани
Рис. 87. Мужчина, 20 лет. Первичная злокачественная лимфома III плюсневой кости. Редкая локализация процесса
Рис. 88. Мужчина, 18 лет. Первичная злокачественная лимфома бедренной кости. Смешанная форма
Рис. 89. Мужчина, 21 год. Первичная злокачественная лимфома плечевой кости. Мелкоочаговая деструкция, разрушение кортикального слоя, игольчатый секвестр, периостальная реакция
Рис. 90. Девушка. 16 лет. Первичная злокачественная лимфома большеберцовой кости с большим распространением, литическая форма, “ползучая” деструкция кости
Рис. 91. Мужчина, 36 лет. Первичная злокачественная лимфома бедренной кости с большой мягкотканной частью. Ангиографическая картина злокачественной опухоли
Рис. 92. Юноша, 17 лет. Первичная злокачественная лимфома подвздошной кости. Литическая форма, местами склеротический ободок, склероз у нижнего контура
Рис. 93. Девушка, 17 лет. Первичная злокачественная лимфома плечевой кости. Типичная линейная многослойная периостальная реакция
Патологические переломы (15-20 % случаев) развиваются в трубчатых костях, ребрах (рис. 94), позвонках. Характерна полная компрессия тел позвонков без изменений дисков.
Более точную информацию о распространенности поражения в скелете дает МРТ (низкая интенсивность сигнала от костного мозга на Т-1 и высокая — на Т-2), позволяющая заподозрить лимфому даже при отрицательных данных рентгенографии.
Картина первичной и вторичной лимфомы может быть идентичной, поэтому необходимо иметь данные рентгенографии грудной клетки, УЗИ и/или КТ брюшной
полости, сцинтиграфии скелета. У детей этот процесс следует дифференцировать с саркомой Юинга, метастазами нейробластомы, гистиоцитозом, лейкемией, у подростков — с литической остеосаркомой, у взрослых — с миеломой и метастазами, в группе пациентов с неопухолевыми заболеваниями — с остеомиелитом, главным образом диафизарной локализации.
Рис. 94. Мужчина, 47 лет. Первичная злокачественная лимфома ребра. Большой мягкотканный компонент. Патологический перелом
11срвичная лимфома хорошо поддается лучевой и полихимиотерапии, в особенности после хирургического удаления очага. 5-летняя выживаемость достигает 50 %. 11ериостальная реакция, наличие мягкотканного компонента и переломов считаются неблагоприятными факторами. В половине всех случаев наступает генерализация заболевания.
Вторичные лимфомы кости. Вторичное вовлечение скелета происходит посредством лимфогематогенной диссеминации или распространения процесса с пораженных лимфатических узлов и других органов. При лимфогранулематозе костные поражения регистрируются в 10-30 % случаев через два-четыре года от начала заболевания, при неходжкинских лимфомах — в 5-15 % случаев уже на первом-втором году заболевания.
Поражаются органы, богатые костным мозгом (позвонки, таз, ребра, грудина, эпиметадиафизы). Изменения в дистальных отделах конечностей не типичны. В половине случаев процесс полиоссальный. Суставной хрящ и межпозвонковые диски остаются интактными.
Самый частый симптом — боли различного характера. Припухлость может определяться в доступных для пальпации местах. Кожа обычно не изменена. Ограничение функции и неврологические нарушения наблюдаются при околосуставной локализации и поражении позвонков. Клинические проявления нередко опережают рентгенологические на много месяцев и лет. Наиболее важный лабораторный тест — определение активности щелочной фосфатазы в крови.
Рентгенологически при контактном распространении (позвоночник, ребра, крестцово-подвздошные сочленения) обнаруживается краевая узурация без выраженной периостальной реакции. В позвонках отмечается нечеткость переднебоковых контуров тел с дальнейшим развитием глубоких узур и “козырьков" по краям (остатки костной структуры) (рис. 95). Прослеживается паравертебральная тень увеличенных лимфатических узлов. Краевая склеротическая реакция особенно характерна для крестцово-подвздошных сочленений (рис. 96).
Костные изменения при лимфогематогенном распространении подразделяют на литические (рис. 97, 98), склеротические (рис. 99) и смешанные (рис. 100). Литический (до % всех случаев) и смешанный типы ничем не отличаются от соответствующей картины первичных лимфом. Остеобластическая форма встречается в основном в позвонках в виде выраженного диффузного склерозирования тел (по типу “слоновой кости”) (рис. 101).
Периостальная реакция не типична, проявляется минимальными бахромчатыми или линейными наслоениями в диафизах и метадиафизах (рис. 102).
Примерно в '/:i случаев наблюдается мягкотканный компонент, порой значительных размеров (см. рис. 102). На уровне пораженных позвонков прослеживается паравертебральная мягкотканная тень.
При литической и смешанной формах часто имеют место патологические переломы ребер, компрессия позвонков (рис. 103).
Дифференциальная диагностика обычно не требуется, поскольку основной диагноз бывает уже известен.
Лечение проводится по общепринятым схемам с добавлением лучевой терапии на очаг. Клиническое улучшение предшествует репаративным процессам в кости. Наличие костных изменений не влияет на прогноз, а при лимфогранулематозе может свидетельствовать и о более благоприятном течении заболевания.
Рис. 95. Мужчина, 24 лет. Краевая узура и склерозирование тела II поясничного позвонка — переход процесса с пораженных парааортальных лимфатических узлов при злокачественной лимфоме
Рис. 96. Женщина, 32 лет. Лимфогранулематоз. Томограмма. Поражение боковой массы крестца и подвздошной кости — переход процесса с пораженных подвздошных лимфатических узлов
Рис. 97. Женщина, 52 года. Поражение бедренной кости при неходжкинской лимфоме, IV стадия
Рис. 98. Девушка, 16 лет. Поражение переднего отрезка ребра при лимфогранулематозе, IV стадия. Литическая форма, сопровождающаяся вздутием кости
Рис. 99. Мужчина. 26 лет. Склеротическая форма поражения плечевой кости при лимфогранулематозе, IV стадия
Рис. 100. Женщина, 59 лет. Смешанная форма поражения костей черепа при неходжкинской лимфоме, IV стадия
Рис. 101. Мужчина, 24 года. Склеротическая форма поражения тела позвонка при лимфогранулематозе (по типу “слоновой кости")
Рис. 102. Женщина, 21 год. Поражение плечевой кости при лимфогранулематозе, IV стадия. Нерезко выраженная периостальная реакция, большая мягкотканная часть. Патологический перелом
Рис. 103. Мужчина, 2.3 года. Поражение позвонка при неходжкинской лимфоме, IV стадия. Литическая форма, компрессионный перелом
Саркома Юинга. Впервые эту опухоль описал Юинг (Ewing) в 1921 г. Позднее (1968) Фридман (Friedman) и Голд (Gold) установили, что саркома Юинга возникает из незрелых ретикулярных клеток или примитивной мезенхимы костного мозга и напоминает гистологически первичную лимфому кости. Однако различия в клиническом течении и терапевтических подходах позволяют считать ее самостоятельной нозологической единицей, составляющей 5-7 % всех злокачественных опухолей скелета.
Саркома Юинга встречается чаще в детском и юношеском возрасте (первое-второе десятилетия жизни) и крайне редко после 40 лет. Соотношение заболеваемости у мужчин и женщин — 2:1.
Местом развития данной саркомы может служить практически любая кость. В возрасте до 20 лет чаще поражаются длинные (бедренная, берцовые, плечевая), после 20 лет — плоские (подвздошная, ребра, лопатка), причем 2/{опухолей локализуются на нижних конечностях и в тазовом поясе. Локализация в позвоночнике, мелких костях кисти и стопы не типична.
Клинически отмечаются нарастающие в течение месяцев болевой синдром и припухлость с возможными светлыми промежутками. В дальнейшем страдает функция близлежащего сустава, появляются покраснение и повышение температуры кожи над опухолью, симптомы интоксикации (гипертермия, лейкоцитоз, повышение СОЭ).
Рентгенологическая картина деструктивно-склеротического процесса в кости обладает большим сходством с таковой при первичной лимфоме. Поскольку в патологической области сохраняется определенная часть костных пластинок, степень распространенности поражения, устанавливаемая по снимкам, обычно занижается, и правомерно считать, что ко времени обнаружения опухоль фактически занимает весь костномозговой канал.
В плоских костях превалирует мелко- или крупноочаговая сливного характера деструкция с чередованием участков остеосклероза и остеолиза (рис. 104). Иногда деструктивный очаг, сопровождающийся медленной периостальной аппозицией, вздувает кость, симулируя картину аневризмальной кисты (рис. 105). Чисто склеротический тип опухоли встречается редко — в плоских костях, ребрах, метафизах.
Распространение процесса на кортикальный слой вызывает его разволокнение, неровность и нечеткость контуров. Отдельные фрагменты лишаются питания и превращаются в секвестры. Нередко истончение корковых отделов сосуществует с умеренным гиперостозом (рис. 106).
Периостальная реакция, обычно пластинчатого и игольчатого типа, имеет место в половине наблюдений. Как правило, спикулы примерно одинаковы подлине и толщине, ориентированы перпендикулярно длиннику кости и равномерно распределены вдоль диафиза (рис. 107) в отличие от остеосарком, где грубые неравномерные спикулы расходятся как бы из одного центра. Периостальный “козырек” служит свидетельством быстрого роста (рис. 108).
Характерно наличие значительной, однородной, без обызвествлений, мягкотканной части опухоли, по размерам нередко превосходящей видимую на снимках костную деструкцию (рис. 109).
Патологические переломы (2-5 % случаев) происходят обычно в метафизах, могут протекать безболезненно и выявляться лишь на снимках.
I Io рентгенологической картине саркому Юинга следует дифференцировать с первичной лимфомой и миеломой, а также с остео- и хондросаркомой, эозинофильной гранулемой. Из группы неопухолевых процессов наиболее важна дифференциальная диагностика с остеомиелитом; наряду с рентгенологическими данными в таких случаях целесообразно использовать эхографию, при которой мягкотканный компонент опухоли имеет вид гипоэхогенной муфты с широким основанием на кости, тогда как затеки гноя в мягких тканях выглядят анэхогенными скоплениями жидкости.
Саркома Юинга весьма радиочувствительна. В настоящее время разработаны эффективные схемы лучевой и полихимиотерапии, тем не менее прогноз остается неблагоприятным. 5-летняя выживаемость не превышает 50 %. Метастазирование гематогенное — в легкие и литического типа — в кости.
Рис. 104. Женщина, 20 лет. Саркома Юинга лопатки. Очаговая, местами сливного характера, деструкция
Рис. 105. Мужчина, 19 лет. Саркома Юинга ключицы. Литического характера деструкция со вздутием кости
А о о
о 2 о ш
о 09 £ ф
<о
Рис. 106. Мальчик, 6 лет. Саркома Юинга большеберцовой кости. Мелкоочаговая, местами сливного характера, деструкция с участками остеосклероза без отграничения от здоровой кости. Линейная периостальная реакция
Рис. 107. Юноша, 16 лет. Саркома Юинга костей таза. Превалирование склеротических изменений. Характерный игольчатый периостоз
Рис. 108. Девочка, 3 года. Саркома Юинга бедренной кости. Мелкоочаговая деструкция, периостальный “козырек”
Рис. 109. Мальчик, 9 лет. Саркома Юинга лопатки. Мелкоочаговая деструкция с разрушением кортикального слоя и большим мягкотканным компонентом
РЕДКИЕ ЗЛОКАЧЕСТВЕННЫЕ ОПУХОЛИ
Адамантинома (ангиобластома) — своеобразная редко встречающаяся злокачественная опухоль неизвестного генеза, гистологически сходная с адамантиномой челюсти. Диагностируется преимущественно у лиц молодого и среднего возраста.
Локализация — почти исключительно большеберцовая кость, однако описано поражение бедренной, плечевой, локтевой и лучевой костей.
Клинически выявляется медленно увеличивающаяся припухлость с умеренной болезненностью. Нередко сочетается с очагами фиброзной дисплазии.
Рентгенологически обнаруживается эксцентричный очаг (очаги) деструкции в диафизе со склеротичеким отграничением, зачастую в кортикальном слое. Периостальные изменения малохарактерны, мягкотканный компонент выражен слабо (рис. 110, 111).
При типичной локализации дифференциальной диагностики практически не требуется.
Лечение — хирургическое, как правило, ампутация. После краевой резекции неизбежны рецидивы.
Прогноз при своевременной операции благоприятный. Частота метастазирования достигает 20 %.
Хордома происходит из зачатков нотохорды и не является истинной костной опухолью, однако топографически связана со скелетом и потому внесена в классификацию новообразований костей.
Данное новообразование встречается редко (не более 1 % злокачественных неоплазм скелета), наблюдаются обычно после 30 лет, преимущественно у мужчин.
Наиболее частые места развития — крестцовая и шейно-затылочная области, тогда как в грудном и поясничном отделах позвоночника известны лишь спорадические наблюдения.
Клиническая картина не специфична, вначале нарастает болевой синдром, в дальнейшем возникают неврологические нарушения.
Рентгенологически (рис. 112, ИЗ) определяется центральная деструкция стенок спинномозгового канала с постепенным распространением на смежные ткани (боковые массы крестца, затылочную кость и пр.). В структуре нечетко очерченного очага могут присутствовать пятнистые обызвествления. Мягкотканный компонент выходит основной массой в полость малого таза.
Лечение хордом представляет серьезную проблему. Хирургическое вмешательство осуществимо далеко не всегда, сопровождается рецидивами, которые какое-то время удается контролировать облучением.
Прогноз зависит от локализации опухоли. В частности, хордомы затылочной области довольно рано приводят к летальному исходу. Метастазы регистрируются в 10 % случаев.
Дифференциальная диагностика необызвествленных хордом должна проводиться с ГКО и вызывает значительные трудности. При наличии обызвествлений следует исключить хондросаркому, что также не просто.
Выполнение биопсии необходимо практически всегда.
Рис. 110. Девочка, 13 лет. Ангиобластома проксимального метадиафиза большеберцовой кости. Эксцентричная нечетко очерченная деструкция и вздутие латеральной полуокружности кости. Кортикальный слой трабекулярно разво-локнен, периостальная реакция отсутствует
Рис. 111. Мужчина, 24 года. Ангиобластома дистальной трети диафиза большеберцовой кости. Эксцентричная нечетко очерченная зона деструкции передней полуокружности кости, исходящая из кортикального слоя. Вздутие, отсутствие периостальной реакции. Ниже но задней поверхности — второй аналогичный очаг небольших размеров в кортикальном слое
Рис. 112. Мужчина, 37 лет. Хордома. Фронтальная томограмма. Центральная нечетко очерченная деструкция крестца на уровне S1-S2, распространяющаяся на L1
Рис. 113. Мужчина, 43 года. Хордома. Центральная деструкция практически всего крестца без четких контуров, распространяющаяся на крыло левой подвздошной кости. Выход опухоли в полость малого таза
МЕТАСТАЗЫ
Любая злокачественная эпителиальная или мезенхимальная опухоль способна метастазировать в скелет. Большинство метастазов попадают в кость гематогенно, через питающие артерии, или лимфогенно. В пределах одной кости может происходить ин-траканаликулярный переброс опухолевых клеток. Существует также вертебральный путь метастазирования — ретроградное поступление клеток по превертебральным (пре-сакральным) венозным сплетениям, лишенным клапанов. Изменения в легких при этом порой отсутствуют.
Метастазы встречаются гораздо чаще первичных злокачественных новообразований скелета.
В большинстве случаев они выявляются у взрослых, так что деструкция кости у лиц старше 50 лет скорее всего метастатического происхождения. У детей вторичное поражение скелета наблюдается обычно при нейробластомах, опухоли Вильмса, остеосаркомах, рабдомиосаркомах и пр.
Комплексы опухолевых клеток оседают преимущественно в костях, богатых костным мозгом: осевом скелете (позвоночник — до 60 % случаев, таз), а также грудине, черепе, ребрах, бедренных костях и пр. Редкие локализации — ключица, коленная чашечка, конечности дистальнее локтевого и коленного суставов. Около 50 % метастазов в кисти и стопе приходятся на долю рака легкого.
Ведущий клинический симптом — нарастающие боли, особенно ночные, к которым затем присоединяются функциональные нарушения. Однако не редки наблюдения клинически “немых” очагов, распознаваемых только при патологическом переломе.
Высокочувствительным методом обнаружения метастазов является радиоизотопная сцинтиграфия, хотя она дает существенный процент гипердиагностики. Известно, что при рутинной рентгенографии определяются лишь те деструктивные зоны, где деминерализация костной структуры превышает 30 %. Они составляют не более половины всех депозитарных изменений скелета. Так, в теле позвонка не всегда видны очаги до 15 мм в диаметре. При характерной множественности метастазы в 10-25 % случаев бывают и солитарными (рак легкого, почки, слюнной железы и пр.).
Рентгенологически выделяют остеолитические (50 %), остеобластические (40 %) и смешанные (10%) формы. Остеолитические встречаются при любых опухолях и присущи всем неэпителиальным новообразованиям, остеобластические наблюдаются в основном при раке предстательной железы, семиномах и пр.
В картине первой группы преобладает центральный деструктивный очаг (очаги) однородной или ячеистой структуры со вздутием кости или без такового (рис. 114, 115,116,117). Периостальная реакция не считается редкостью, варьируется от линейной до спикуловидной — при опухолях желудочно-кишечного тракта, мочевого пузыря, нейробластоме и пр. (рис. 118, 119). Для поражения позвонков типично разрушение корней дужек при интактности диска (рис. 120). Мягкотканный компонент, как правило, незначительный, кроме отдельных локализаций опухоли (ребра, череп, таз. дистальные отделы конечностей и пр.) (рис. 121, 122). Относительно ранним проявлением метастазов в позвоночнике служит полоса уплотнения паравертебральных тканей. Обызвествления в депозитарных очагах отмечаются редко, главным образом это специфическое склерозирование при остео- и хондросаркомах. Патологические переломы сопровождают развитие большинства метастазов, причем признаки возможной консолидации не исключают истинного характера процесса. Остеобластические очаги на снимках визуализируются отчетливее, чем литические (рис. 123).
При верифицированной первичной опухоли множественные деструктивные очаги в скелете дифференциальной диагностики не требуют. Если источник не найден, целесообразно в первую очередь заподозрить миеломную болезнь.
Одиночный очаг в зависимости от его локализации может напоминать различные процессы: первичную костную опухоль (чаще всего хондросаркому), ГКО, аневриз-мальную костную кисту, солитарную миелому.
Солитарные метастазы отдельных локализаций удаляют посредством резекции кости, при множественных современная химиотерапия позволяет определенный период времени контролировать процесс.
Прогноз всегда неблагоприятный.
Рис. 114. Мужчина. 44 года. Метастаз меланобластомы в шейке бедренной кости. Округлый дефект с однородной структурой
Рис. 115. Женщина, 55 лет. Метастаз рака прямой кишки. Зона деструкции без четких контуров в отростках седалищной и лонной костей
Рис. 116. Мужчина, 46 лет. Метастаз гипернефромы в диафизе плечевой кости. Нечетко очерченный литический очаг с ячеистой структурой и небольшим вздутием кости. Патологический перелом
Рис. 117. Женщина, 62 года. Множественные метастазы рака молочной железы. Остеолитические очаги в ключице, деструкция и вздутие переднего конца IV ребра
Рис. 118. Мальчик, 7 лет. Метастаз нейробластомы в теменной кости. Разволокнение и деструкция обеих пластинок и диплоэ, тонкие спикулы
Рис. 119. Мужчина, 70 лет. Метастаз рака легкого в диафизе бедренной кости субпериостальной локализации. Разрушение кортикального слоя, линейная периостальная реакция, обызвествленные периостальные наслоения по периферии опухоли
Рис. 120. Женщина, 60 лет. Метастазы рака молочной железы в поясничном отделе позвоночника. Разрушение корней дуг и поперечных отростков позвонков в сочетании с умеренным склерозированием тел без выраженной компрессии
Рис. 121. Мужчина, 60 лет. Метастаз рака легкого в диафизе большеберцовой кости. Деструкция почти всего поперечника кости, бугристый мягкотканный компонент с мелкими костными фрагментами, периостальной реакцией на сохранившейся части кортикального слоя
Рис. 122. Мужчина. 55 лет. Метастаз гипернефромы в чешуе лобной кости. Обширная деструкция кости и большой мягкотканный компонент
Рис. 123. Мужчина. 62 года. Метастазы рака предстательной железы а поясничных позвонках и костях таза. Множественные сливающиеся остеобластаческие очаги
НЕОПУХОЛЕВЫЕ ПРОЦЕССЫ
Фиброзная дисплазия — порок развития костеобразующей мезенхимы, замещение костного мозга фиброзным — довольно широко распространенное заболевание скелета.
Обычно диагностируется в детском и молодом возрасте, отличается медленным развитием, прекращающимся после окончания роста скелета.
Считается, что фиброзная дисплазия — наиболее часто встречающийся патологический процесс в ребрах; кроме того, он локализуется в черепе, челюстях, проксимальных концах длинных костей. При полиоссальном поражении может сосуществовать множество очагов.
Клинически заболевание протекает бессимптомно, за исключением случаев деформации костей, и нередко распознается лишь после патологического перелома.
В рентгенологической картине (рис. 124, 125) преобладают гиперостоз, деформации, перестройка структуры ячеистого характера, умеренное вздутие, истончение кортикального слоя изнутри. Периостальная реакция отсутствует. По мере роста кости очаг из метафиза смещается к середине диафиза.
При дифференциальной диагностике следует помнить об основном отличии фиброзной дисплазии — “спокойной” клинико-рентгенологической картине.
Лечения в большинстве случаев не требуется, за исключением коррекции деформаций.
Озлокачествление происходит чрезвычайно редко.
Юношеская (ювенильная) киста — это однокамерная киста с соединительнотканной стенкой, заполненная серозной жидкостью. Этиология ее до сих пор не известна.
Данное заболевание не относится к редко встречающимся, к тому же определенная часть кист, возможно, не регистрируется.
Ювенильная киста диагностируется исключительно в детском и юношеском возрасте, как правило, при патологическом переломе.
Классическая локализация — проксимальные метадиафизы бедренной и плечевой костей.
Клинические симптомы до перелома отсутствуют.
На рентгенограммах выявляется центральная киста, умеренно вздувающая кость, истончающая кортикальный слой; в структуре имеются тонкие перегородки, контуры очага четкие (рис. 126).
Дифференциальной диагностики в типичных случаях не требуется.
Поскольку кисты подвергаются обратному развитию, хирургического вмешательства следует избегать.
Малигнизации не бывает.
Рис. 124. Девочка, 11 лет. Фиброзная дисплазия лобной кости. Гиперостоз надглазничного края
Рис. 125. Мужчина, 33 года. Фиброзная дисплазия VIII ребра. Вздутие, гиперостоз и перестройка структуры кости
Рис. 126. Девочка, 6 лет. Ювенильная киста в проксимальном метадиафизе плечевой кости. Четко очерченный литический процесс с перегородками в структуре, легким вздутием, отделяющийся от ростковой зоны
Аневризмальная костная киста (АКК) — доброкачественный неопухолевый остеолитический процесс с опухолеподобным деструктивным ростом, в основе которого лежит локальное нарушение кровообращения в кости, сопровождающееся местным повышением давления. АКК обычно представлена интра- и экстраоссальными компонентами, построенными из множественных сливающихся полостей с жидкой кровью и сгустками, без эндотелиальной выстилки.
В отличие от опухолей в этиологии АКК определенную роль играет травма кости.
АКК существует как самостоятельная нозологическая форма либо развивается в структуре некоторых опухолей (телеангиэктатическая остеосаркома, ГКО, хондробластома и пр.)
АКК не принадлежит к редким заболеваниям, встречается преимущественно в детском, юношеском и молодом возрасте, локализуется в любой кости, но чаще в длинных костях и позвоночнике.
По наличию выраженного болевого синдрома и увеличивающейся припухлости напоминает развитие злокачественной опухоли. При локализации в позвоночнике возникают неврологические расстройства, вплоть до парезов.
По рентгенологической картине АКК подразделяются на центральные, эксцентричные и субпериостальные.
В типичных случаях виден нечетко очерченный литический очаг, в структуре которого прослеживаются ячеистость и трабекулярность, более отчетливо — в периферических участках. Кортикальный слой истончается и разрушается изнутри, происходит значительное вздутие кости, появляется периостальная линейная реакция. Мягкотканный компонент нередко гораздо больше интраоссального, в нем прослеживаются тонкие ячейки, а по наружной поверхности — тонкая обызвествленная периостальная “скорлупка” (рис. 127,128, 129,130,131). Процесс не распространяется через ростковую зону.
В дифференциальной диагностике формально следует учитывать все заболевания, сопровождающиеся вздутием кости (ГКО, миелома, метастаз, остеосаркома и пр.). Тщательный анализ клинико-анамнестических и рентгенологических данных в сопоставлении с результатами пункционной биопсии обычно позволяет разрешить диагностические затруднения.
Адекватная резекция пораженного участка кости обеспечивает выздоровление, однако оперативное вмешательство не всегда осуществимо. Экскохлеация очага, как правило, не гарантирует полного удаления патологического участка. Метод выбора — облучение дозой до 30 Гр, приводящее к склерозированию кисты (рис. 132). В отличие от ГКО парадоксальная фаза при этом выражена слабо. Не исключены маргинальные рецидивы.
АКК не озлокачествляются.
Рис. 127. Девушка, 18 лет. Аневризмальная костная киста (АКК) дистального метадиафиза локтевой кости. Центральная деструкция с намечающейся трабекулярностью структуры, истончение кортикального слоя, вздутие
Рис. 128. Девочка. 8 лет. ЛКК пяточной кости. Четко очерченный центральный очаг деструкции с ячеистой структурой, легкое вздутие кости по подошвенной поверхности
Рис. 129. Девочка, 14 лет. ЛКК дистального метадиафиза бедренной кости. Эксцентричный участок деструкции передней полуокружности кости без четких контуров, довольно однородной структуры. Истончение и разрушение кортикального слоя, мягкотканный компонент с тонкостенными ячейками и нежной периостальной “скорлупкой”
Рис. 130. Девушка, 16 лет. АКК L3. Задняя томограмма. Эксцентричная зона деструкции % тела и корня дуги позвонка. Большая мягкотканная часть
Рис. 131. Женщина, 30 лет. ЛКК субпериостального типа в диафизе малоберцовой кости. Ячеистая структура и периостальная “скорлупа”. Краевая узура кортикального слоя
Рис. 132Л. Юноша, 15 лет. АКК проксимального отдела большеберцовой кости. Обширная деструкция медиальной полуокружности диафиза без четких контуров. Значительный мягкотканный компонент с тонкостенными ячейками и периостальной "скорлупой”. Линейная периостальная реакция по латеральной поверхности кости
Рис. 132Б. Тот же больной через 2 года после лучевой терапии. Выраженное склерозирование деструктивного очага и мягкотканного компонента, ассимиляция периоста
Определенные разновидности остеомиелита можно по праву отнести к группе опухолеподобных процессов. Главным образом это относится к гематогенному, т. н. первично-хроническому заболеванию, которое протекает медленно, без выраженных симптомов воспаления.
Судя по солидному числу больных остеомиелитом, направляемых к онкологу, подобные формы наблюдаются достаточно часто. Превалируют пациенты детского и молодого возраста.
Очаги остеомиелита развиваются в любых местах скелета и различных отделах кости: метафизах, диафизах и даже эпифизах, костномозговом канале и кортикальном слое и т. д.
Клинические признаки недостаточно специфичны: ноющие боли, в том числе ночные, субфебрилитет, реже — припухлость. В анамнезе зачастую содержится указание на недавно перенесенные ангину или грипп, ОРЗ и пр.
Как правило, только рентгенологическое исследование позволяет поставить диагноз.
Известно, что в первые недели заболевания изменения в кости на рентгенограммах не визуализируются. В таких случаях целесообразно выполнение безэкранных рентгенограмм мягких тканей пораженного участка, на которых достаточно рано обнаруживается местный воспалительный отек в подкожной клетчатке.
Развитый воспалительный процесс характеризуется богатым спектром рентгенологических симптомов в том или ином сочетании: деструктивный очаг (очаги) разнообразной величины и формы, склеротическая реакция окружающей кости, каналы -выпускники гноя, открывающиеся в мягкие ткани, секвестры в очаге и/или каналах, периостальная реакция (линейная, бахромчатая, без спикул и периостального “козырька”), гиперостоз различной степени выраженности, сужение костномозгового канала, отек мягких тканей при отсутствии мягкотканного компонента.
Можно выделить ряд основных клинико-рентгенологических типов т. н. опухолевидного остеомиелита.
Наибольшее практическое значение имеет правильная оценка воспалительного процесса, проявляющегося одиночным (рис. 133, 134) или множественными (рис. 135, 136) деструктивными очагами в костномозговом канале, поскольку их приходится постоянно дифференцировать с саркомами, в частности костномозговыми, которые тоже порой сопровождаются образованием секвестров и неоднородным склерозированием при сходстве многослойной периостальной реакции. В определенной степени помогает обнаружение внутрикостных каналов, сужения костномозгового пространства, отсутствие мягкотканного компонента или наличие натечника (рис. 137) при воспалительном процессе.
Плазмоцитарный остеомиелит протекает без образования гноя и без высеваемой бактериальной флоры. Рентгенологически в костномозговом пространстве выявляются литические сливающиеся зоны, иногда в виде “языков” с легким склеротическим обрамлением, открываются в мягкие ткани без секвестров и периостальной реакции (рис. 138). При этом даже макро- и микроскопически патологическую ткань удается обнаружить далеко не всегда.
Кортикальный остеомиелит (рис. 139) протекаете выраженным утолщением коркового слоя, напоминающим остеоид-остеому, но без “нидуса”. На склеротическом фоне могут определяться секвестры в гнойном канале, ведущем в мягкие ткани, бахромчатый периостит (рис. 140).
Редкое заболевание, напоминающее кортикальный остеомиелит (т. н. конденсирующий остеит), поражает почти исключительно ключицу, а также I-II ребра у детей в возрасте 7-15 лет, значительно реже — у взрослых.
Процесс развивается исподволь, сопровождается умеренными болями, утолщением ключицы, легким ограничением функции; температурная реакция не специфична. Посевы материала биопсий остаются стерильными.
11а рентгенограммах (рис. 141) обнаруживается выраженный гиперостоз почти всей ключицы, утолщение ее в 1,5-2 раза; на фоне склероза намечаются участки, напоминающие полости и секвестры, однако истинных секвестров не отмечается; линейная одно- или многослойная реакция выражена умеренно или ассимилирована.
Заболевание протекает годами, без выраженной динамики, без определенной реакции на антибактериальную терапию.
Рис. 133. Юноша, 15 лет. Остеомиелит медиальной части метафиза бедренной кости. Солитарный нечетко очерченный очаг вблизи ростковой зоны без выраженной склеротической и периостальной реакции. В структуре — нежные секвестры. Мягкотканный компонент отсутствует (сравн. с рис. 10.)
Рис. 134. Мальчик, 11 лет. Остеомиелит пяточной кости. Солитарный деструктивный очаг без четких контуров вблизи ростковой зоны. Слабо выраженное склерозирование смежных участков кости. Отек мягких тканей места прикрепления ахиллова сухожилия
Рис. 135. Мальчик, 2 года. Остеомиелит проксимального отдела плечевой кости. Сливающиеся зоны деструкции в костномозговом пространстве и кортикальном слое метадиафиза, распространяющиеся через ростковую зону на эпифиз. Множественные мелкие секвестры. Склеротическая реакция не выражена. Ассимилированный периостит у дистального края очага
Рис. 136. Девочка, 5 лет. Остеомиелит диафиза бедренной кости. Мелкоочаговая деструкция в слегка суженном костномозговом пространстве. Намечается внутрикостный канал у ее нижнего края. Многослойный линейный периостит
Рис. 137. Девочка, 1 год 2 мес. Остеомиелит дистальной трети диафиза бедренной кости. Мелкие очаги с тонкой склеротической каймой у латерального края кости, канал в мягкие ткани и субфасциальный натечник, точечные обызвествления в гное
Рис. 138. Мальчик, 12 лет. Плазмоцитарный остеомиелит дистального метадиафиза большеберцовой кости. Сливающиеся литические зоны в костномозговом пространстве и кортикальном слое с легким склеротическим обрамлением. Канал в мягкие ткани по медиальной поверхности. Периостальная реакция отсутствует
Рис. 139. Юноша, 15 лет. Кортикальный остеомиелит средней трети диафиза бедренной кости. Типичная картина. Томограмма. Резкое утолщение кортикального слоя без “нидуса”
Рис. 140. Девочка. 14 лет. Кортикальный остеомиелит дистального отдела бедренной кости. В резко утолщенном кортикальном слое — деструктивный очаг со склеротической реакцией вокруг. Широкий выход в отечные мягкие ткани. Многослойный линейный и бахромчатый периостит
Рис. 141. Мальчик, 11 лет. Конденсирующий остеит ключицы. Томограмма. Гиперостоз и неоднородное склерозирование структуры кости. Многослойная линейная отслоенная и ассимилированная периостальная реакция
Оссифицирующий миозит — это как правило, посттравматический процесс, манифестирующий развитием оссификации в мышечном слое, пери- и экстраоссальных тканях.
Большинство пациентов — молодые люди, получившие травму за многие месяцы до обнаружения припухлости.
Процесс обычно локализуется на нижних конечностях, в частности на бедре.
При пальпации выявляется безболезненное твердое несмещаемое образование в мягких тканях, слегка ограничивающее двигательную функцию.
Рентгенологически (рис. 142) параоссально определяется интенсивно обызвествленная зона, имеющая неправильную овоидную вытянутую форму и различную структуру — от однородной до повторяющей строение поперечно-полосатой мышцы.
При необходимости проводится оперативное лечение.
Рис. 142. Мужчина, 30 лет. Бедро. Оссифицирующий миозит. Массивное четко очерченное параоссальное обызвествление с лентовидными участками в структуре
Стрессовый перелом представляет собой истинную поперечную фрактуру диафиза кости без смещения, возникающую не в результате однократной травмы, а при продолжительной перегрузке кости. Подобные переломы плюсневых костей после длительной ходьбы хорошо изучены и называются “маршевыми”. В деформированных и деминерализованных костях при различных патологических состояниях аналогом их являются т. н. зоны Лоозера (Е. Looser).
Эта болезнь довольно часто диагностируется у детей и молодых людей, подверженных постоянной монотонной физической (в том числе спортивной) нагрузке.
Почти исключительно страдают кости нижних конечностей: берцовые, плюсневые и пр., но имеют место и другие локализации: ключица, I ребро, предплечье и пр. Именно развитие в длинных и плоских костях нередко вызывает диагностические затруднения, когда недостаточно опытный рентгенолог принимает такой перелом за начальные проявления остеосаркомы.
Клинически отмечаются умеренные боли, в том числе незначительная припухлость, ограничение функции конечности.
Рентгенологическая картина весьма характерна: тонкая, более или менее поперечно идущая четко очерченная линия перелома сочетается с пери- и эндостальной костной мозолью (рис. 143, 144, 145, 146).
Лечение состоит в назначении покоя.
Прогноз благоприятный.
Рис. 143. Мальчик, 10 лет. Стрессовый перелом I ребра, очень редкая локализация. Косопоперечная линия перелома среднего отрезка кости, намечающиеся признаки эндо- и периостальной консолидации
Рис. 144. Мальчик, 11 лет. Стрессовый перелом проксимальной части диафиза большеберцовой кости. Неотчетливая тонкая линия перелома с эндостальной и периостальной мозолью. Типичная локализация
Рис. 145. Мужчина, 19 лет. Стрессовый перелом дистальной части диафиза большеберцовой кости, редкая локализация. Тонкая четко очерченная линия перелома, незначительное смешение по ширине. Выраженная пери- и эндостальная костная мозоль
Рис. 146. Мальчик, 12 лет. Стрессовый перелом дистальной части диафиза малоберцовой кости, редкая локализация. Неотчетливая линия перелома. Циркулярные многослойные периостальные наслоения на значительном протяжении без заметной эндостальной реакции
Остеоартропатия — это нейродистрофический процесс, сопровождающий ряд заболеваний (сирингомиелия, сухотка спинного мозга и пр.). В основе поражения опорно-двигательного аппарата лежат атрофические и гипертрофические изменения костных и суставных структур (дегенерация суставного хряща, атрофия суставной головки, гипертрофия суставной впадины, расширение суставной щели, выпот, мягкотканные разрастания, костные секвестры внутри сустава и пр.).
Заболеванию преимущественно подвержены молодые мужчины. При сирингомиелии страдают главным образом суставы нижних конечностей. Встречается моно- и по-л иоссальное, в том числе симметричное, поражение. Чаще других вовлекаются локтевой, плечевой и лучезапястный суставы, а также дистальные отделы кисти.
Клинически достаточно характерны разболтанность пораженного сустава той или иной степени в сочетании с нарушением температурной чувствительности кожи. В целом бросается в глаза несоответствие благополучного состояния больного и выраженности рентгенологических изменений.
В картине последних обращает на себя внимание противоречивое сочетание атрофических и гипертрофических изменений: суставная головка, как правило, сглажена и атрофирована; суставная впадина интенсивно склерозирована и резко расширена; высота суставной щели заметно увеличена, капсула сустава растянута; выявляются окостеневшие суставные элементы — секвестры, “скобы” и пр., а также мягкотканные образования различных размеров (рис. 147).
Остеоартропатию порой принимают за злокачественную опухоль сустава с большим мягкотканным компонентом.
Местное лечебное воздействие при наличии косметических и функциональных неудобств, обусловленных развитием мягкотканных образований, состоит в иссечении последних.
Рис. 147. Женщина, 63 гола. Остеоартропатия плечевого сустава при сирингомиелии. Характерная деформация головки плечевой кости в виде ее уплощения, суставная впадина лопатки резко увеличена, склерозирована, щель сустава значительно расширена. Известковые параар-тикулярные “скобы”. Большое мягкотканное образование над ключично-акромиальным сочленением
Обызвествленный (анемический) инфаркт костного мозга может развиваться у лиц любого возраста при нарушении кровоснабжения кости в результате эмболии, артериосклероза, кессонной болезни и пр. В большинстве случаев этиология заболевания остается неизвестной.
Процесс локализуется, как правило, на концах длинных костей (бедренная, большеберцовая, плечевая и др.).
На рентгенограммах свежий инфаркт не виден. По мере нарастания обызвествлений центрально в костномозговом канале формируется неправильной формы зона неоднородного склерозирования с ландкартообразными контурами (рис. 148). В отличие от энхондром аналогичной локализации внутренние контуры кортикального слоя остаются ровными.
Рис. 148. Мужчина, 40 лет. Обызвествленный инфаркт костного мозга в проксимальной части диафиза плечевой кости, случайная находка. Участок неоднородного обызвествления в костномозговом канале без изменений внутреннего контура кортикального слоя (сравн. с рис. 30)
СПИСОК ЛИТЕРАТУРЫ
1. Ахмедов Б. П. Метастатические опухоли.— М.: Медицина, 1984.— 186 с.
2. Виноградова Т. П. Опухоли костей,— М.: Медицина, 1973.— 336 с.
3. Волков М. В. Болезни костей у детей.— М.: Медицина, 1974.— 560 с.
4. Клиническая рентгенология. Т. 3. Рентгенодиагностика повреждений и заболеваний костей и суставов/ Под ред. Г. А. Зедгенидзе.— М.: Медицина, 1984.
5. Лагунова И. Г. Опухоли скелета,— М.: Здоровье, 1962.— 320 с.
6. Опухоли костей (клиника, диагностика, лечение)/ Под ред. Ю. В. Л ацмана,— Томск, 1990.— 316с.
7. Рейнберг С. А. Рентгенодиагностика заболеваний костей и суставов. Т. 2,— М.: Медицина, 1964.
8. Рубашева А. Е. Частная рентгенодиагностика заболеваний костей и суставов — Киев, 1967,— 534 с.
9. Руцкий А. В., Михайлов А. Н. Рентгенодиагностический атлас. Т. I. Болезни опорно-двигательного аппарата.— Минск: Высшая школа, 1979.
10. Трапезников И. Н„ Еремина Л. А., Амирасланов А. Т., Синюков П. А. Опухоли костей,— М.: Медицина, 1986.— 304 с.
11. Хмелев О. Н., Петровичев П. Н., Аннамухаммедов А. Злокачественная фиброзная гистиоцитома кости (к вопросу о рентгенодиагностике)//Вестник рентгенологии и радиологии,— 1985,-№6,- С. 21-28.
12. Чаклин В. Л. Опухоли костей и суставов,— М.: Медицина, 1974,— 286 с.
13. Adler С.-Р. Knochenkrankheiten.— Stuttgart; New York, 1983,— 386 S.
14. Bone Tumors/Ed. by Ranniger К./Diseases of the skeletal system (roentgen diagnosis). Part 6.-Berlin; Heidelberg; New York, 1977,— 825 p.
15. Brower A. C., Sweet D. E„ Keats T. E. Condensing osteitis of the clavicle: a new entity//Amer. J. Roentgenol.—1974.—Vol. 121—№1,— P. 17-25.
16. FechnerK. E„ Mills S. E. Atlas of tumor pathology/Tumors of the bones and joints. Third Series.— V. 8,— Washington, 1993.— 300 p.
17. Dahlin D. C. Bone tumors. 3rd ed.— Thomas; Springfield; Illinois, 1978,— 365 p.
18. Dominok G. U7., Knoch H.-G. Knochengeschwiilste und geschwulstahnliche Knochener-krankungen.—Jena, 1971,—366 S.
19. Ecleiken-Monroe B., Edeiken J., Rim E. E. Radiologic concepts of lymphoma of bone//RadioI. Clin. North Am.- 1990,- V. 28 - P. 841-864.
20. EwingJ. A review of the classification of bone tumors//Surg. Gynaecol. Obstet.— 1939,— V. 68.— P. 971-976.
21. Frommhold IV., Gerhardt P. Knochentumoren/Klinisch-radiologishes Seminar.— B. 10,— Stuttgart: New York, 1980,— 174 S.
22. Greenspan A., Remagen W. Differential diagnosis of tumors and tumor-like lesions of bones and joints.— Philadelphia, 1997,— 445 p.
23. Huvos A. G., Woodard II. Q., Cahan U7 G. et al. Postradiation osteogenic sarcoma of bone and soft tissues//Cancer.— 1985,— V. 55.— № 6,— P. 1244-1255.
24. Jaffe II. L. Tumors and tumorous conditions of the bones and joints. —Philadelphia, 1958.— 450 p.
25. LlaugerJ., Palmer J., AmoresS. et al. Primary tumors of the sacrum: diagnostic imaging//Amer. J. Roentgenol.- 2000,- V. 174,- № 2,- P. 417-424.
26. Malligan M. E., McRae G. A., Murphey M. D. Imaging features of primary lymphoma of bone// Amer. J. Roentgenol.- 1999,- V.173.- N 6,- P. 1691-1697.
27. Murphey M. D., Nomikos G. C„ Flemming D.J. et al. Imaging of giant cell tumor and giant cell reparative granuloma of bone: radiologic-pathologic correlations// Radiographics.— 2001. — Vol. 21,- P. 1283-1309.
28. Parker F,Jackson H. Primary reticulum cell sarcoma of bone//Surg. Gynaecol. Obstet.— 1939. -V. 68,-№1,- P. 45-53.
29. Schajovicz F. Tumors and tumorlike lesions of bone and joints.— New York; Heidelberg; Berlin: Springer-Verlag, 1981.
30. Singer C. R. ABC of clinical haematology: Multiple myeloma and related conditions//British Med. J.- 1997 - V. 314,- P. 960-975.
31. Sundaram M., Totty W. G., Kyriakos M. et al. Imaging Findings in Pseudocystic Osteosarcoma// Amer. J. Roentgenol.- 2001,- V. 176,- P. 783-788.
32. White L. M., Schweitzer M. E„ Khalili K. et al. MR imaging of primary lymphoma of bone: variability of Т-2-weighted signal intensity//Amer. J. Roentgenol.— 1998,— V. 170,— P. 1243-1247.
ПЕРЕЧЕНЬ РИСУНКОВ
Рис. 1. Компактная остеома височной кости, с. 11
Рис. 8. Остеобластическая остеосаркома большеберцовой кости, с. 16
Рис. 2. Губчатая остеома скуловой кости, с. 11
Рис. 9. Остеобластическая остеосаркома бедренной кости, с. 17
f I
Рис. 3. Остеоид-остеома
бедренной кости, с. 12
II
Рис. 10. Остеолитическая остеосаркома в латеральной части метадиафиза бедренной кости, с. 18
Рис. 4. Остеоид-остеома II
пястной кости, с. 12
Рис. И. Остеолитическая остеосаркома крыла подвздошной кости, с. 19
Рис. 5. Остеоид-остеома в заднем отрезке VII ребра, с. 13
Рис. 12. Остеосаркома смешанного тина бедренной кости, с. 20
Рис. 6. Остеоид-остеома
пяточной кости, с. 13
Рис. 13. Диафизарная остеосаркома плечевой кости, с. 21
Рис. 7. Остеобластома бедренной кости, с. 14
Рис. 14. Остеосаркома малоберцовой кости субпериостальной локализации, с. 22
Рис. 15. Остеосаркома крыла подвздошной кости, с. 23
Рис. 22. Остеосаркома плечевой кости после лучевой терапии, с. 30
Рис. 16. Телсангиэктати-ческая остеосаркома бедренной кости, с. 24
Рис. 23. Вторичная остеосаркома большеберцовой кости на фоне болезни Педжета, с. 31
Рис. 17. Злокачественная остеобластома большеберцовой кости, с. 25
Рис. 24. Вторичная остеосаркома локтевой кости при фиброзной дисплазии, с. 32
Рис. 18. Небольшая юкстакортикальная остеосаркома бедра, с. 26
Рис. 25. Атипичная картина низкодифференцированной остеосаркомы бедренной кости, напоминающая остеомиелит, с. 33
Рис. 19. Юкстакортикальная остеосаркома бедра, с. 27
Рис. 26. Остеохондрома по медиальной поверхности большеберцовой кости, с. 34
Рис. 20. Юкстакортикальная остеосаркома бедра. Та же больная. Компьютерная томограмма, с. 28
Рис. 27. Остеохондрома большеберцовой кости на ножке (костнохряще-вой экзостоз), с. 35
Рис. 21. Рецидив остеосаркомы в мягких тканях голени, с. 29
Рис. 28. Энхондрома основной фаланги II пальца кисти, с. 36
Рис. 29. Множественные энхондромы кисти, с. 37
Рис.36. Центральная хондросаркома в шейке бедренной кости, с. 46
Рис. 30. Оссифицируюшая энхондрома плечевой кости, с. 38
Рис. 37. Центральная хондросаркома бедренной кости, с. 47
И
Рис. 31А. Внутрисуставная хондрома в ромбовидном пространстве коленного сустава. Б. Через 7лет. Рсхт опухоли, с. 39-40
А Б
Рис. 38. Центральная хондросаркома III ребра, с. 48
Рис. 32. Внскостная хондрома предплечья, с. 41
I
Рис. 39. Центральная хондросаркома бедренной кости, с. 49
Рис. 33. Хондробластома в головке плечевой кости, с. 42
Рис. 40. Хондросаркома периферического типа крыла подвздошной кости, с. 50
Рис. 34. Хондробластома в головке плечевой кости, с. 43
Рис. 41А. Внутрисуставная хондросаркома коленного сустава. Б. Через 4 месяца. Выраженное прогрессирование, с. 51 -52
А Б
Рис. 35. Хондромиксоидная фиброма большеберцовой кости, с. 44
Рис. 42. Параоссальная хондросаркома в подколенной ямке, с. 53
Рис. 43. Мезенхимальная хондросаркома в мышечном слое голени, с. 54
Рис. 50. Неоссифицирую-шая фиброма (фиброзный кортикальный дефект) бедренной кости, с. 62
Рис. 44. Рецидив хондросаркомы в мягких тканях плеча, с. 55
Рис. 51. Ксантофиброма (доброкачественная фиброзная гистиоцитома) диафиза большеберцовой кости, с. 63
Рис. 45. Рецидив хондросаркомы (“транспортный” метастаз) в мягких тканях, с. 56
Рис. 52. Злокачественная фиброзная гистиоцитома плечевой кости, с. 64
Рис. 46. Вторичная центральная хондросаркома, развившаяся из энхондромы основной фаланги I пальца стопы, с. 57
Рис. 53. Фибросаркома большеберцовой кости, с. 65
Рис. 47. Вторичная центральная хондросаркома плечевой кости. А. Оссифици-руюшая энхондрома. Б. Через 5 месяцев, с. 58-59
Рис. 54. Гигантоклеточная опухоль (ГКО) эпифиза большеберцовой кости, с. 66
Рис. 48. Вторичная хондросаркома бедренной кости периферического типа, с. 60
1
$
Рис. 55. ГКО в эпифизе лучевой кости, с. 67
Рис. 49. Неоссифициру-юшая фиброма (фиброзный кортикальный дефект) большеберцовой кости, с. 61
Рис. 56. ГКО (гигантоклеточная реакция?) фаланги II пальца кисти, с. 68
Рис. 57. ГКО крыла подвздошной кости, с. 68
Рис. 63. Гемангиома плечевой кости, с. 77
Рис. 58. А. ГКО большеберцовой кости. Б. В процессе лучевой терапии. В. Через год после окончания лучевой терапии, с. 69-71
Рис. 64. Ангиоматоз
голени, с. 78
Рис. 65. Гломус-ангиома ногтевой фаланги III пальца кисти, с. 79
Рис. 61. Гемангиома теменной кости, с. 75
Рис. 59. Злокачественная ГКО эпиметадиафиза малоберцовой кости, с. 72
Рис. 60. Гемангиомы грудных позвонков, с. 74
Рис. 68. Болезнь Хенда-Шюллера- Крисчена.
А. Множественные ландкартообразные дефекты в костях свода черепа. Б. Через 5 лет после лечения. Полное восстановление костной структуры, с. 82
Рис. 62. Г емангиома ребра, с. 76
Рис. 66. Гемангиоперицитома подвздошной кости, с. 79
Рис. 67. Эозинофильная гранулема чешуи лобной кости, с. 81
Рис. 72. Эозинофильная гранулема малоберцовой кости., с. 85
Рис. 73. Эозинофильная гранулема бедренной кости, с. 85
Рис. 74. Эозинофильная гранулема лобной кости, с. 85
Рис. 69. Эозинофильная гранулема в теменной кости, с. 83
Рис. 70. Эозинофильная гранулема нижней челюсти, с. 83
Рис. 77. Солитарная миелома ребра, с. 89
Рис. 76. Солитарная миелома ключицы, с. 88
Рис. 71. Эозинофильная гранулема в лопатке, с. 84
Рис. 78. Генерализованная миелома, с. 89
Рис. 79. Генерализованная
миелома, с. 90
Рис. 80. Генерализованная миелома, с. 91
1
Рис. 75. Эозинофильная гранулема III поясничного позвонка, с. 86
Рис. 81. Генерализованная миелома, с. 92
Рис. 82. Генерализованная миелома, с. 93
Рис.83. Генерализованная миелома. Компьютерная томограмма, с. 94
Рис. 90. Первичная злокачественная лимфома большеберцовой кости, с. 102
Рис. 84. Генерализованная миелома, с. 95
Рис. 91. Первичная злокачественная лимфома бедренной кости, с. 103
Рис. 85. Генерализованная
миелома, с. 96
Рис. 86. Первичная злокачественная лимфома большеберцовой кости, с. 98
Рис. 87. Первичная злокачественная лимфома III плюсневой кости, с. 99
Рис. 92. Первичная злокачественная лимфома подвздошной кости, с. 104
Рис. 93. Первичная злокачественная лимфома плечевой кости, с. 105
Рис. 94. Первичная злокачественная лимфома ребра, с. 106
и
Рис. 88. Первичная злокачественная лимфома бедренной кости, с. 100
Рис. 95. Краевая узура и склерозирование тела поясничного позвонка. Злокачественная лимфома, с. 108
Рис. 89. Первичная злокачественная лимфома плечевой кости, с. 101
Рис. 96. Лимфогранулематоз. Поражение боковой массы крестца и подвздошной кости, с. 106
Рис. 97. Неходжкинская лимфома. Поражение бедренной кости, с. 110
Рис. 104. Саркома Юинга лопатки, с. 118
Рис. 98. Лимфогранулематоз. Поражение ребра, с. 111
Рис. 105. Саркома Юинга ключицы, с. 119
Рис. 99. Лимфогранулематоз. Поражение плечевой кости, с. 112
Рис. 106. Саркома Юинга большеберцовой кости, с. 120
Рис. 100. Неходжкинская лимфома. Поражение костей черепа, с. 113
Рис. 107. Саркома Юинга костей таза, с. 121
Рис. 101. Лимфогранулематоз. Поражение тела позвонка, с. 114
Рис. 108. Саркома Юинга бедренной кости, с. 122
Рис. 102. Лимфогранулематоз. Поражение плечевой кости, с. 115
Рис. 109. Саркома Юинга лопатки, с. 123
Рис. 103. Неходжкинская лимфома. Поражение позвонка, с. 116
Рис. 110. Ангиобластома большеберцовой кости, с. 125
Рис. 111. Ангиобластома большеберцовой кости, с. 126
Рис. 118. Метастаз нейробластомы в теменной кости, с. 134
Рис. 112. Хордома крестца, с. 127
Рис. 119. Метастаз рака легкого в бедренной кости, с. 135
Рис. ИЗ. Хордома крестца, с. 128
Рис. 120. Метастазы рака молочной железы в поясничном отделе позвоночника, с. 136
Рис. 114. Метастаз мела-нобластомы в шейке бедренной кости, с. 130
Рис. 121. Метастаз рака легкого в большеберцовой кости, с. 137
Рис. 115. Метастаз рака прямой кишки в отростках седалищной и лонной костей, с. 131
Рис. 122. Метастаз гипернефромы в лобной кости, с. 138
Рис. 116. Метастаз гипернефромы в плечевой кости, с. 132
Рис. 123. Метастазы рака предстательной железы в поясничных позвонках и костях таза, с. 139
Рис. 117. Множественные метастазы рака молочной железы, с. 133
Рис. 124. Фиброзная дисплазия лобной кости, с. 141
Рис. 125. Фиброзная дисплазия ребра, с. 142
Рис. 132Л. АКК большеберцовой кости. Б. Через 2 года после лучевой терапии, с. 150-151
Рис. 126. Ювенильная киста плечевой кости, с. 143
Б
Рис. 127. Аневризмальная костная киста (АКК) локтевой кости, с. 145
Рис. 133. Остеомиелит бедренной кости, с. 153
Рис. 128. АКК пяточной кости, с. 146
Рис. 129. АКК бедренной кости, с. 147
Рис. 134. Остеомиелит пяточной кости, с. 154
Рис. 135. Остеомиелит плечевой кости, с. 154
Рис. 130. АКК позвонка, с. 148
d
Рис. 131. АКК малоберцовой кости, с. 149
Рис. 136. Остеомиелит диафиза бедренной кости, с. 155
Рис. 137. Остеомиелит бедренной кости, с. 156
Рис. 138. Плазмоцитарный остеомиелит большеберцовой кости, с. 157
II
Рис. 144. Стрессовый перелом проксимальной части диафиза большеберцовой кости, с. 163
Рис. 139. Кортикальный остеомиелит бедренной кости, с. 158
II
Рис. 145. Стрессовый перелом дистальной части диафиза большеберцовой кости, с. 164
Рис. 140. Кортикальный остеомиелит бедренной кости, с. 159
п
Рис. 146. Стрессовый перелом дистальной части диафиза малоберцовой кости, с. 165
Рис. 141. Конденсирующий остеит ключицы, с. 160
Рис. 147. Остеоартропатия плечевого сустава при сирингомиелии, с. 167
Рис. 142. Оссифициру-юший миозит в мышцах бедра, с. 161
Рис. 148. Обызвествленный инфаркт костного мозга в плечевой кости, с. 168
Рис. 143. Стрессовый перелом 1 ребра, с. 162
Учебное издание
А. Г. Веснин, И. И. Семенов
АТЛАС лучевой диагностики опухолей опорно-двигательного аппарата
Часть I
ОПУХОЛИ СКЕЛЕТА
Главный редактор Н. Ю. Фролова
“Издательство БИНОМ” 103473, Москва, Краснопролетарская ул., 16 Лицензия на издательскую деятельность №065249 от 26.06.1997 г.
Издательство “Невский Диалект” Санкт-Петербург, Политехническая ул., 16 Лицензия на издательскую деятельность серия ЛР, № 065012 от 18.02.1997 г.
Подписано в печать 03.08.2002 г. Формат 70 х 100/6 Бумага офсетная. Печать офсетная Гарнитура PeterburgC.
Усл. печ. л. 15,6. Тираж 2000. Заказ № 370
Отпечатано с готовых диапозитивов в Академической типографии “Наука” РАН 199034, Санкт-Петербург, 9-я линия, 12
"СПб Дом Книги" А-382
P1IIIIIIIIII —8 00 2 “OOOOl 1 049997"
Веснин А.Г. и др. Атлас лучевой диагностики опухолей опорно-/)
I v /У 11 11 I н? 14 V 1 1 v.l •’ 47 IV I 11 171 X Ч V пип
диагностики 11ИИонкологии им. 11.1I.11етрова М3 РФ. врач с 40-летним стажем, доктор медицинских наук, профессор, автор более 250 научных трудов, включая 4 монографии.
СЕМЕ! ЮВ Игорь 11ванович — ведущий научный сотрудник отделения лучевой диагностики НИИ онкологии им. И И. Петрова М3 РФ. врач с 35-лепhim стажем, докн>р медш цпгских 11аук. iцэофессор, автор более 150 научных трудов.
А тлас является результа том изучения патологических изменений скелета более чем у 50 000 пациентов, обследованных или консультированных в НИИ онкологии им. И. И. Петрова М3 РФ.
издательство ДИАЛЕ^
www.nd.spb.ru
профессиональная компьютерная и медицинская литература