Author: Туфанов Д.Г.
Tags: типы домохозяйств металлургия химический состав металлов
ISBN: 5-229-00531-9
Year: 1990
Text
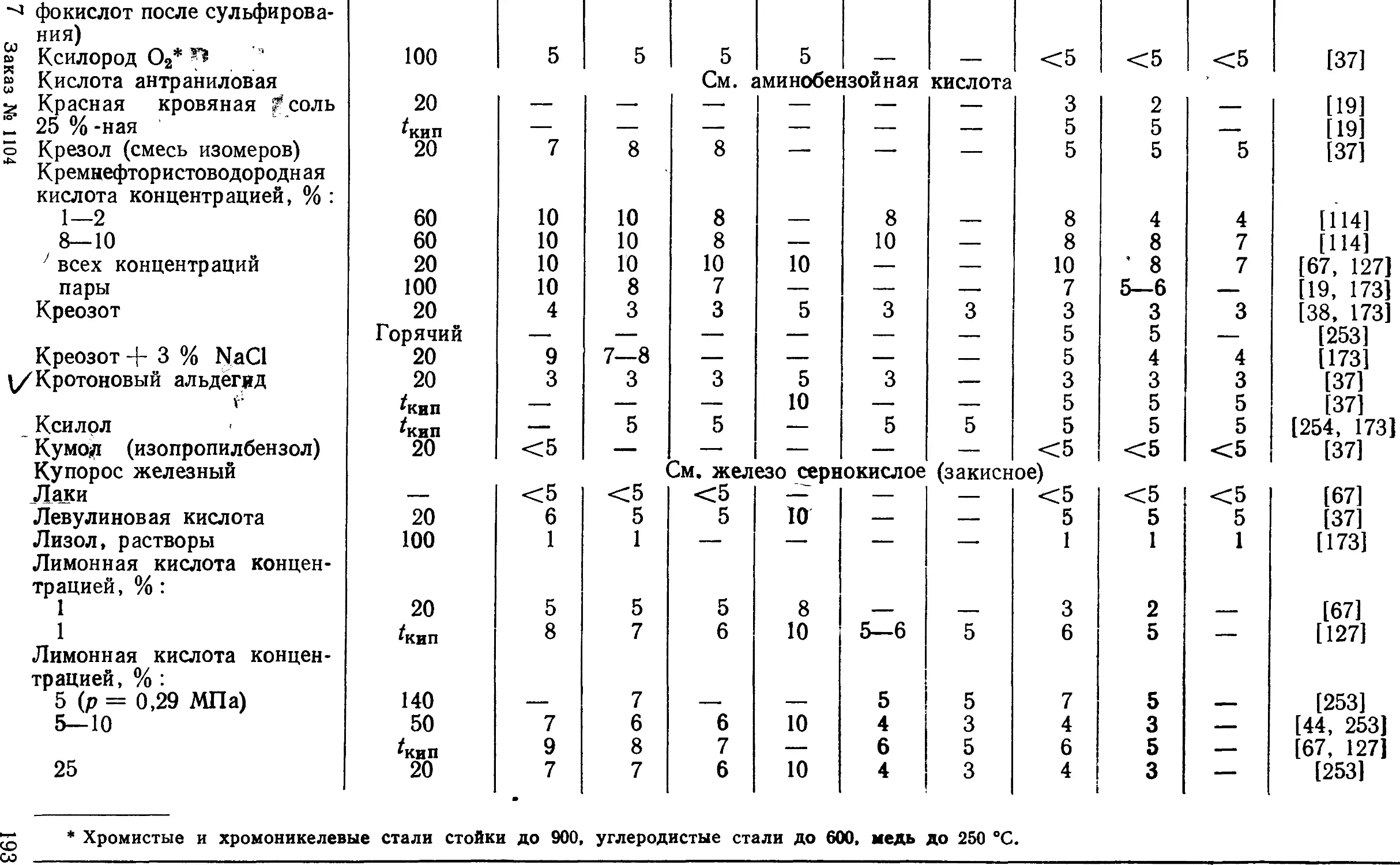
7
УДК 640.191@8)
Рецензент докт. техн. наук Т. В. Свистунова
УДК 640.191@8)
Туфанов Д. Г. Коррозионная стойкость нержавеющих сталей, сплавов и
чистых металлов. Справочник, 5-е изд. перераб. и доп.— М.: Металлургия. 1990.
320 с.
В пятом издании (четвертое — в 1982 г.) приведены показатели
коррозионной стойкости нержавеющих сталей, сплавов и чистых металлов. Дан
химический состав сталей и сплавов, их свойства и технологические данные,
а также ГОСТы и ТУ на поставку металла.
Помимо нержавеющих сталей и сплавов для сравнительной оценки,
параллельно с ними, даны показатели коррозионной стойкости углеродистых
и низколегированных сталей. В справочнике представлены коррозионные
характеристики нержавеющих низкоуглеродистых, литейных и двухслойных
сталей, а также прецизионных сплавов.
Справочник рассчитан на широкий круг инженерно-технических
работников проектно-конструкторских организаций, исследовательских институтов и
предприятий металлургии и машиностроения* Ил. 17. Табл. 20. Библиогр.
список: 354 назв. ~—->- • ,,'%.*ї Ї
і Ті. , " ' .
СПРАВОЧНИК
Дмитрий Григорьевич ТУФАНОВ
КОРРОЗИОННАЯ СТОЙКОСТЬ НЕРЖАВЕЮЩИХ СТАЛЕЙ,
СПЛАВОВ И ЧИСТЫХ МЕТАЛЛОВ
Редактор издательства В. Б. Левин
Художественный редактор А. А. Якубенко
Технический редактор О. Б. Ковалёва
Корректор Ю. И. Королева
И Б № 3964
Сдано в набор 31.03.89. Подписано в печать 19.01.90. Т-02221. Формат бумаги 60Х901/,,
Бумага книжно-журнальная Гарнитура литературная. Печать высокая. Усл. печ. л. 20,0
Усл. кр.-отт. 20,0. Уч.-изл л 26,55 Тираж 7800 экз. Заказ № 1104. Цена 1 р. 70 к
Изд. № 2204.
Ордена Трудового Красного Знамени издательство «Металлургия»
119857, ГСП, Москва, Г-34. 2-й Обыденский пер., д. 14
Ленинградская типография № 1 ордена Трудового Красного Знамени Ленинградского
об7:>единення «Техническая книга44 им. Евгении Соколовой Государственного комитсі;
СССР по печати 191126, Ленинград. Социалистическая ул., 11
26Q8QQQ00Q—066
Т " 040@1)—00 " 70~90
ISBN 5—229—00531—9 (С) Д. Г. Туфапов, издательство «Металлургия», 199Г
СОДЕРЖАНИЕ
Предисловие 4
Введение 8
Коррозионная характеристика чистых металлов 10
Металлы группы I 15
Металлы группы П 17
Металлы группы III 20
Металлы группы IV 22
Металлы группы V 26
Металлы группы VI 27
Металлы группы VII 30
Металлы группы VIII 31
Травление чистых металлов 34
Коррозионная стойкость чистых металлов 35
Коррозионностойкие (нержавеющие) стали и сплавы 95
Методы удаления окалины с поверхности металла 100
Влияние некоторых видов холодной обработки и новых методов выплавки
на коррозионную стойкоегь сталей и сплавов 110
Условия повышения коррозионной стойкости, виды коррозии и области
применения сталей и сплавов П4
Условия хранения сгалей и сплавов 142
Сплавы, стойкие в травильных растворах 143
Низкоуглеродистые коррозионностойкие стали . . 144
Литейные коррозионностойкие стали 147
Двухслойные коррозионносюйкие стали и сплавы 153
Прецизионные сплавы 155
Никельмолибденовые и никсльхромомолибденовые сплавы 276
Приложения. Некоторые справочные материалы 293
Библиографический список 309
= ПРЕДИСЛОВИЕ
Анализ развития промышленности, капитального строительства
и транспорта показывает, что и в далеком будущем металлы
останутся основным конструкционным материалом.
В мире накоплено огромное количество металла. Этот фонд
всегда будет увеличиваться. Вместе с тем возросла задача
сохранения этого фонда от преждевременного разрушения, т. е.
от коррозии. Учение о коррозии и защите металлов по
сравнению с многими другими науками сформировалось сравнительно
недавно. Эта область науки является, по определению Г. В.
Акимова, пограничной между металловедением и электрохимией
в том смысле, что для ее возникновения и развития
понадобилось взаимодействие этих двух наук.
Потери от коррозии велики. Поэтому борьба с коррозией
металлов ведется во многих странах мира и особенно большая
работа в этом направлении проводится в Советском Союзе.
В настоящее время имеется значительный практический
материал по борьбе с коррозией металлов, полученный в научно-
исследовательских институтах, учебных заведениях и в
эксплуатационных условиях на предприятиях во многих отраслях
промышленности. Однако этот материал, опубликованный в
различных журналах и сборниках, иногда недоступен или
неизвестен широкому кругу специалистов. Поэтому потребовалось
обобщение показателей по коррозионной стойкости металлов.
Систематизированные данные по этому вопросу являются
ценным справочным материалом при выборе, усовершенствовании
и разработке новых нержавеющих (коррозионностойких)
сталей и сплавов.
Техническое перевооружение производства, создание
принципиально новой техники и прогрессивной технологии находятся
в прямой зависимости от правильного, эффективного,
экономически выгодного применения металлов и их сплавов
повышенной коррозионной стойкости.
Большую роль в этом случае играют нержавеющие стали и
химически стойкие сплавы. В настоящее время почти
невозможно назвать область современной техники, где бы не
применяли эти стали и сплавы.
Одна из особенностей нержавеющих сталей и сплавов
состоит в их высокой коррозионной стойкости во многих
агрессивных средах, что позволяет применять эти стали и сплавы
без дополнительных защитных покрытий. В справочник
включены сведения о наиболее распространенных нержавеющих
сталях и сплавах, выпускаемых металлургической
промышленностью в большом объеме и широком ассортименте.
В последние годы широко применяют чистые металлы.
Интерес к их коррозионным свойствам, особенно к свойствам ту-
гоплавких металлов, все более возрастает. Кроме того,
сведения о коррозионных характеристиках чистых металлов как
легирующих элементов полезны для правильной оценки
стойкости нержавеющих сталей и сплавов. Поэтому в справочнике
отдельно дана коррозионная характеристика чистых металлов.
При отборе данных по скорости коррозии предпочтение во
всех случаях отдавали результатам достаточно длительных
испытаний: при лабораторных исследованиях, например, > 100 ч.
Однако в работах [19, 20, 40, 125, 127, 130, 253, 254, 288]
продолжительность испытаний составляет 3—5 циклов по 100 ч
каждый цикл. Результаты этих испытаний получены в
Центральном научно-исследовательском институте черной
металлургии им. И. П. Бардина на образцах опытных и
промышленных марок нержавеющих сталей и сплавов; в производственных
условиях испытания проводили в течение 500—1000 ч и более;
на коррозионных станциях 1, 2 года, 5 и 10 лет.
Испытания осуществляли на образцах металла в состоянии
поставки, т. е. после оптимальной термической обработки (см.
табл. 4).
При оценке скорости коррозии часто пользуются
показателем г/(м2«ч), т. е. определяют потерю массы образца металла
за соответствующий промежуток времени и относят к единице
площади.
Однако такую величину по весовым потерям применять для
сравнительной оценки разнородных металлов нельзя, так как
при одних и тех же весовых потерях проникновение коррозии
в глубину металла, точнее уменьшение толщины образца,
пластины или толщины стенки какого-либо изделия, окажется
весьма различной для металлов и их сплавов с неодинаковой
плотностью. Так, например, если скорость коррозии у
алюминия и железа будет одинаковой — по 0,1 г/(м2-ч), то
проникновение в глубину в мм/год у алюминия будет в три раза больше,
чем у железа. Поэтому, чтобы не было путаницы, в
справочнике в качестве основной и единой величины скорости
коррозии — проникновения коррозии в глубину металла — приняты
миллиметры в год.
Таким образом, проектировщики, конструкторы, технологи
и другие специалисты, работающие в различных областях
техники, при выборе металлов для деталей, аппаратов или
агрегатов, предназначенных для эксплуатации в агрессивных средах,
должны брать в качестве расчетной величины скорость
коррозии, выраженную в мм/год.
В качестве основной характеристики коррозионной
стойкости принята скорость коррозии, выраженная в линейных
размерах— миллиметры в год. Однако при определении общей
коррозии часто пользуются другим показателем: определяют
потерю массы образца металла за определенный промежуток
времени, отнесенный к единице площади, г/м2.
5
Проникновение коррозии Я, мм/год, рассчитывают по
формуле
п = — ю-3,
о
где k — потеря массы, г/(м2*год); o — плотность металла, г/см3.
Оценку коррозионной стойкости металлов и сплавов при
условии их равномерной коррозии осуществили согласно ГОСТ
13819—68 в баллах по десятибалльной шкале (см. ниже).
ДЕСЯТИБАЛЛЬНАЯ ШКАЛА КОРРОЗИОННОЙ СТОЙКОСТИ
Группа стойкости
Совершенно стойкие
Весьма стойкие
Стойкие
Понижен ностойкие
Малостойкие
Нестойкие
Скорость коррозии металла, мм/год
<0,001
>0,001 до 0,005
>0,005 » 0,01
>0,01 » 0,05
>0,05 » 0,1
>0,1 » 0,5
>0,5 » 1,0
>1,0 » 5,0
>5,0 » 10,0
>10,0
Балл
1
2
3
4
5
6
7
8
9
10
Принятая шкала обеспечивает одинаковый подход к оценке
коррозионной стойкости металлов и их сплавов.
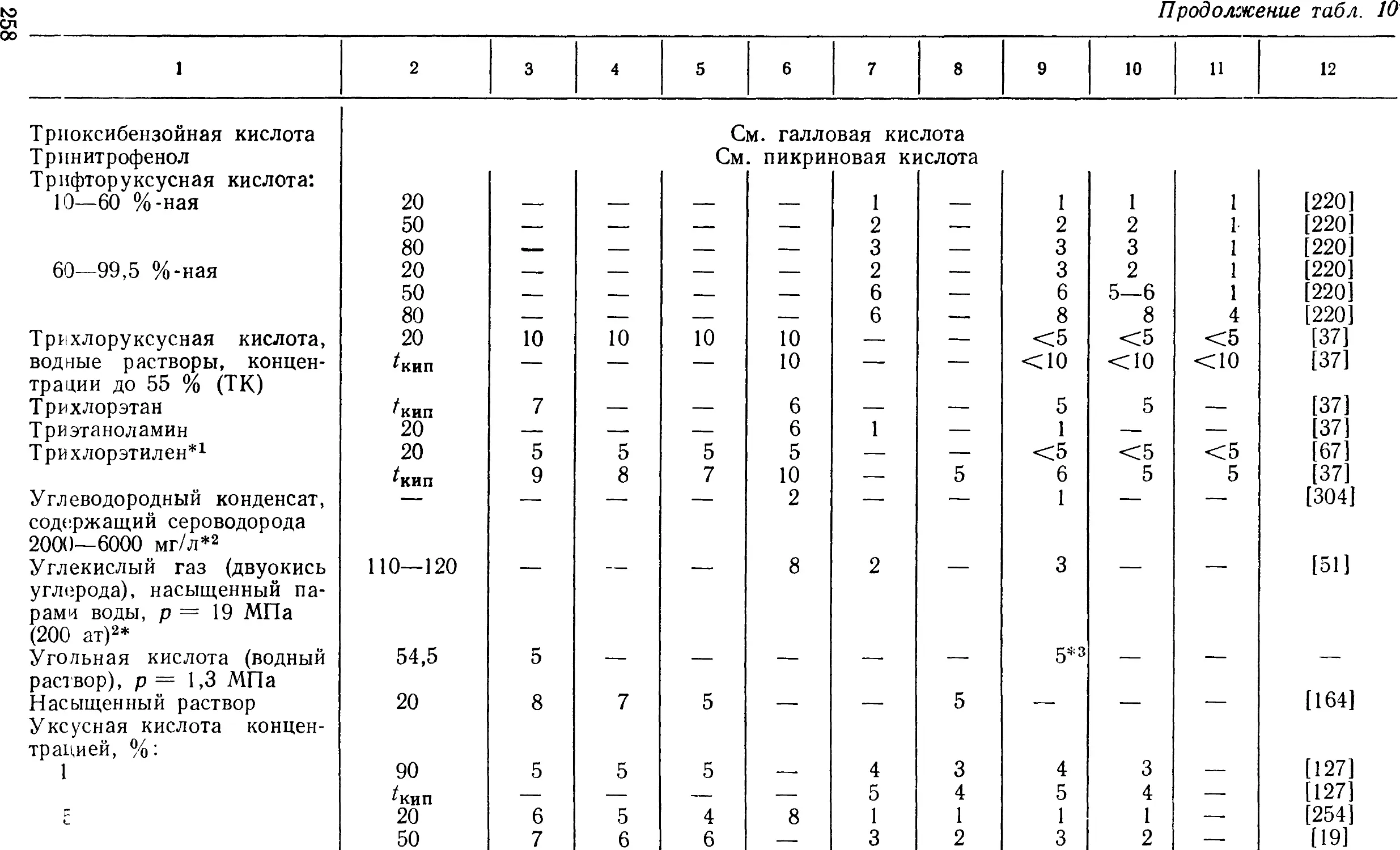
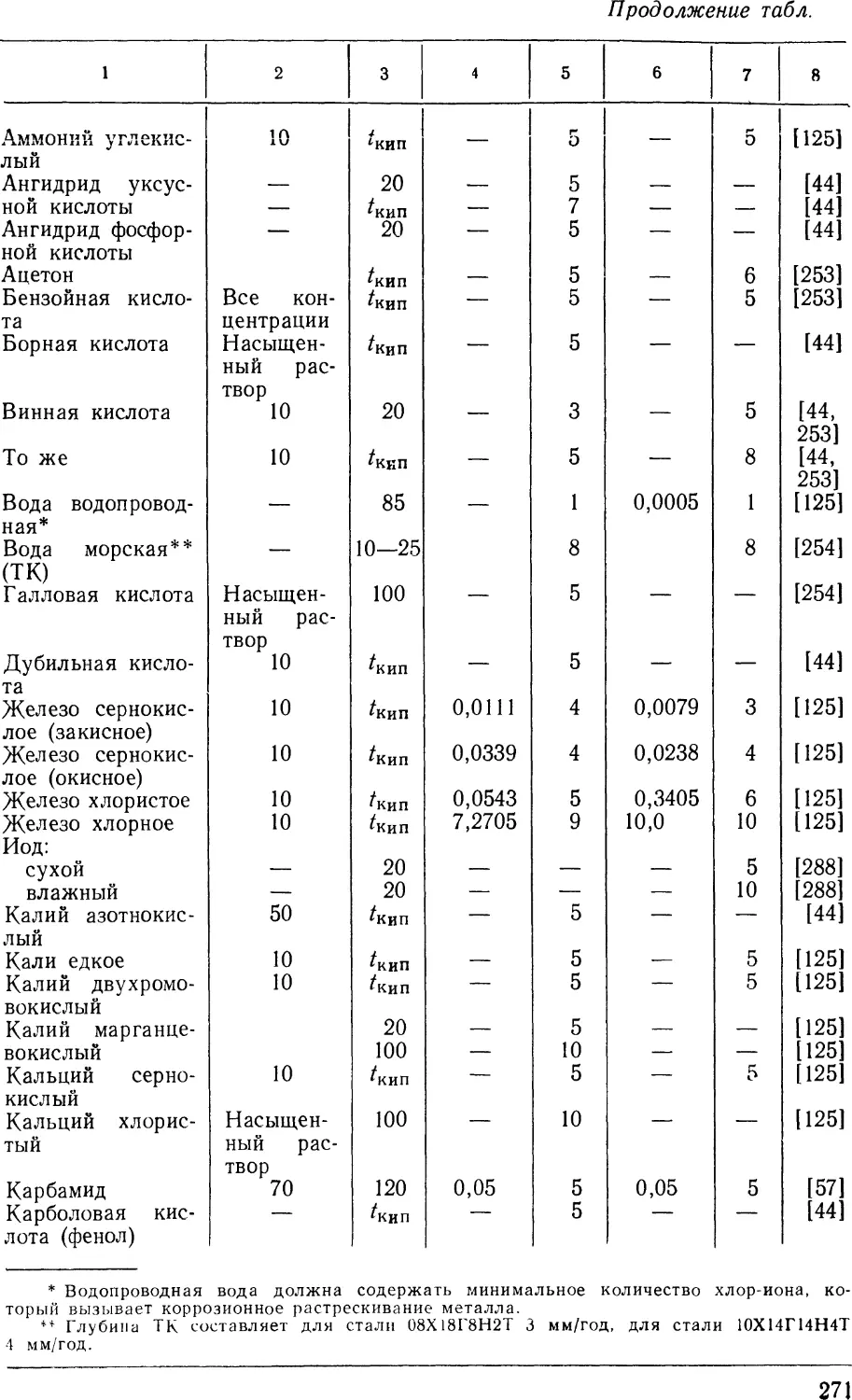
Показатели коррозионной стойкости металлических
материалов приведены в табл. 1, 10, 11 и 12. Наряду с показателями
стойкости (в баллах) в таблицах указаны коррозионные среды,
их концентрации и температуры (коррозионные среды
расположены в алфавитном порядке); в табл. 10 пищевые продукты и
получение различных химических веществ, например
производство адипиновой кислоты, получение глинозема, кожевенное,
коксохимическое, текстильное производство и т. д., выделены
в отдельную графу и следуют по алфавиту после пиридина;
табл. 1 относится к чистым металлам; табл. 10 является
основным материалом справочника; в ней приведены показатели
коррозионной стойкости хромистых, хромоникелевых
нержавеющих сталей и высоколегированных сплавов; здесь же для
сравнительной оценки даны показатели стойкости углеродистых и
низколегированных сталей.
В табл. 11 приведены показатели коррозионной стойкости
нержавеющих хромомарганцовоникелевых сталей; в табл. 12
дана коррозионная стойкость хромоникельмолибденовых и ни-
кельмолибденовых сплавов, предназначенных для работы
в особо агрессивных средах, для которых нержавеющие стали
и сплавы непригодны.
6
Для некоторых нержавеющих сталей, не приведенных
в справочнике, но близких по химическому составу,
сравнительная оценка их коррозионной стойкости в аналогичных условиях
может быть установлена согласно табл. 10 или 11. Технология
и технологические особенности изготовления нержавеющих
сталей и сплавов описаны в работах [8, 20, 45, 46, 61, 67, 142,
320, 326].
Нержавеющие стали и кислотостойкие сплавы в некоторых
средах, помимо общей коррозии, могут быть подвержены
точечной, контактной, межкристаллитной коррозии, коррозии под
напряжением и др. В справочнике все указанные виды
коррозии подробно описаны. Среды, например, вызывающие
точечную коррозию, в таблицах указаны сокращенно (ТК). При
этом стойкость приведена в соответствии с глубиной точечного
разрушения, хотя общая коррозия в данном случае может быть
незначительной.
В справочнике отдельно описаны коррозионные свойства
низкоуглеродистых, литейных нержавеющих сталей,
двухслойных нержавеющих сталей и сплавов, а также прецизионных
сплавов.
Основой для составления данного справочника послужили
работы, проводимые в течение многих лет автором главным
образом в Центральном научно-исследовательском институте
черной металлургии им. И. П. Бардина. Наряду с этим автор
широко использовал материалы, опубликованные как в
отечественной, так и зарубежной литературе.
ВВЕДЕНИЕ
Коррозией 1 металлов называют разрушение металлической
поверхности под влиянием химического или электрохимического
воздействия окружающей среды.
Коррозионные процессы проходят на границе раздела
металл— среда, т. е. реакций, происходящих на границе раздела
двух фаз. Подобного рода реакции развиваются во всей массе
вступающих во взаимодействие реагентов. Результатом любого
коррозионного процесса является переход атомов металла
металлической решетки в ионное состояние, т. е. образование
растворимых соединений типа окиси, гидроокиси или более
сложных комплексных соединений металла.
К химической коррозии следует отнести процессы
непосредственного химического взаимодействия между атомами
металла и газовыми средами.
Для химической коррозии характерны реакции,
возникающие не только при контакте с сухими газами, но и с жидкими
неэлектропроводимыми средами (неэлектролитами).
Практически наиболее распространенным видом химической
коррозии является газовая коррозия, т. е. процесс окисления
металла, взаимодействие с кислородом или химическое
взаимодействие металлов с активными газовыми средами (сернистый
газ, сероводород, галоиды, водяные пары, двуокись углерода
и т. д.) при высоких температурах. Однако понятие «высокая
температура» чисто условное и зависит от металла и среды.
Так, например, газовая коррозия железа в воздухе
начинается примерно при 400 °С. При этом следует заметить, что
химическая (газовая) коррозия железа в перегретом паре с
понижением температуры переходит в электрохимическую.
От газовой коррозии сильно разрушаются многие
ответственные изделия, узлы и детали (лопатки газовых турбин, сопла
реактивных двигателей, элементы электродвигателей,
колосники, арматура печей и т. д.). Много металла теряется от
газовой коррозии (угар, образование окалины) при горячей
прокатке, ковке и термической обработке.
Электрохимическая коррозия — наиболее распространенный
вид коррозии. Металлы и их сплавы в большинстве активных
химических среды, а также в природных условиях — в морской
воде, воздушной атмосфере, грунтовых водах — корродируют
по электрохимическому механизму. При этом виде
коррозии в результате микронеоднородности, несовершенства
кристаллической решетки металла и других факторов на
поверхности изделия в контакте со средой в общем процессе образуются
два самостоятельных, но сопряженных анодных и катодных
1 Коррозия — от латинского слова «corrodere» — разъедать, разрушать.
8
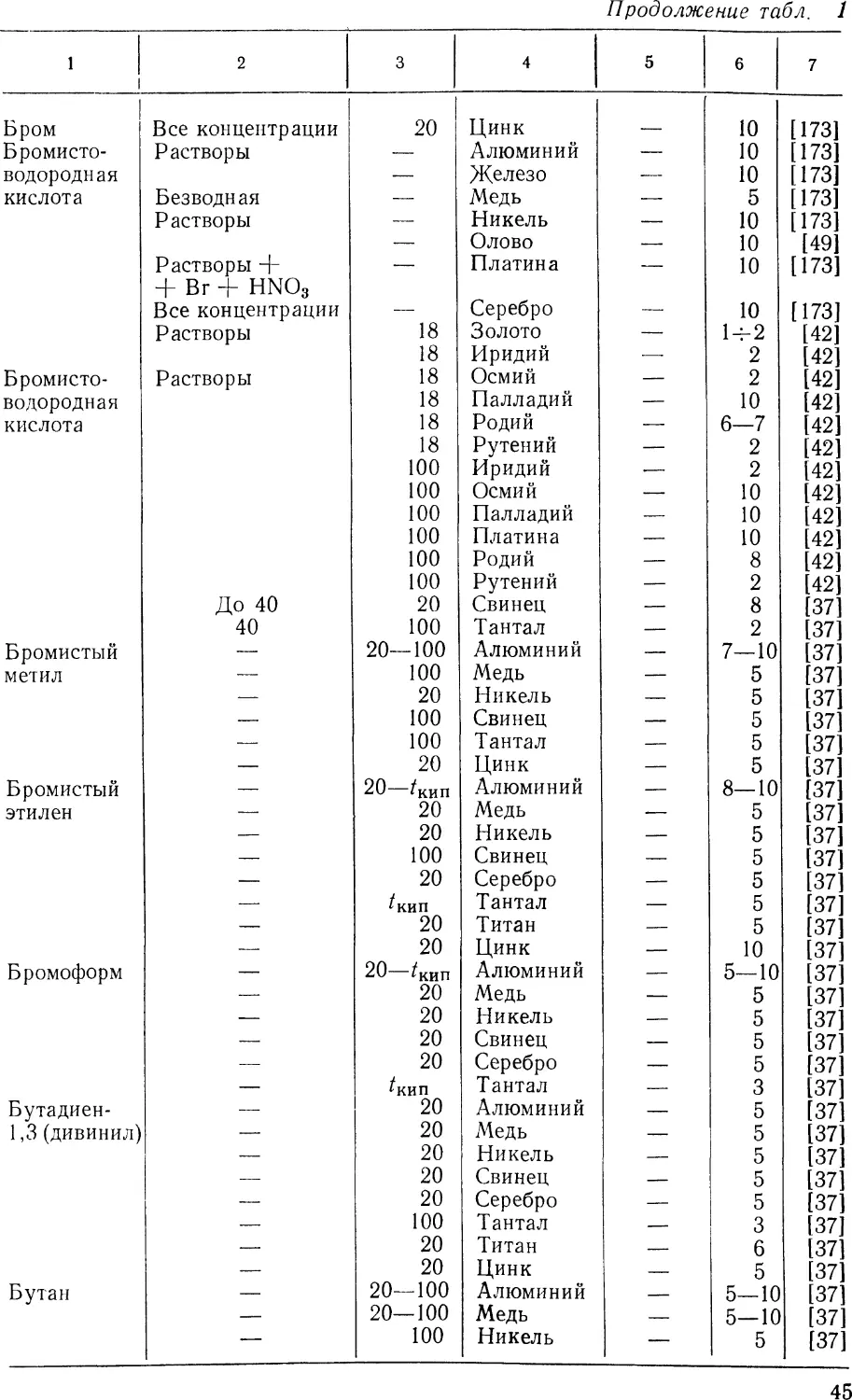
участка, между которыми возникает ток (рис. 1). На анодных
участках атомы металла переходят в раствор.
При этом важно отметить, что во всех этих случаях
валентные электроны атома металла непосредственно не участвуют
в анодном процессе.
Рис. 1. Схема коррозионного процесса:
а — металл; б — электролит; А — анод; К — катод
На других же сопряженных катодных участках происходит
ассимиляция остающихся в металле избыточных электронов
какими-либо деполяризаторами (D), т. е. атомами, молекулами
или ионами раствора, которые в результате этого будут
восстанавливаться. В большинстве химических сред при
определенных природных условиях коррозия металлов, в том числе
нержавеющих сталей и кислотостойких сплавов, протекает по
электрохимическому механизму. При этом следует указать, что на
основании теоретического рассмотрения [121] и
экспериментальных исследований [284] в особых случаях нельзя исключать
возможность протекания коррозии по химическому механизму
параллельно с электрохимическим.
В литературе часто применяют термин
«высокотемпературная коррозия». До настоящего времени под
высокотемпературной коррозией понимали газовую коррозию, т. е. коррозию
в газах при повышенных температурах.
Теперь в это понятие, кроме газовой коррозии, входит
коррозия в расплавленных металлах, в расплавах солей, а также
в водных электролитах при температурах, превышающих
температуру кипения данного раствора, т. е. в условиях повышенных
давлений.
КОРРОЗИОННАЯ ХАРАКТЕРИСТИКА
ЧИСТЫХ МЕТАЛЛОВ
Коррозионные свойства сплавов зависят от коррозионных
свойств чистых металлов. Поэтому, прежде чем перейти к
рассмотрению коррозии нержавеющих сталей, приведем краткую
коррозионную характеристику чистых металлов.
Анализ научных исследований позволил сделать вывод, что
коррозионная устойчивость чистых металлов определяется
одной из следующих причин: металл коррозионно устойчив
вследствие своей термодинамической стабильности. Степень
термодинамической стабильности металлов и коррозионных средах
может быть приблизительно установлена по величине их
стандартных электродных потенциалов.
К металлам с низкой термодинамической устойчивостью
принадлежат: литий, бериллий, магний, цинк, алюминий, титан,
цирконий, ванадий, ниобий, хром, марганец, железо и др.,
имеющие стандартный потенциал отрицательнее —0,414 В.
Указанные металлы корродируют в нейтральных водных средах, даже
не содержащих кислорода.
К металлам с недостаточной термодинамической
устойчивостью принадлежат: кадмий, таллий, олово, свинец, молибден,
кобальт и никель, имеющие стандартный потенциал —0,414—
0,0 В. Эти металлы корродируют в нейтральных средах только
при наличии кислорода. В кислых средах коррозию
наблюдают при отсутствии кислорода или окислителей.
К металлам с повышенной термодинамической
стабильностью относятся: медь, серебро, ртуть, сурьма и висмут,
стандартный потенциал которых колеблется от 0,0 до +0,815 В.
Эти металлы корродируют в кислых и нейтральных средах
только при наличии кислорода.
К металлам с высокой термодинамической стабильностью
принадлежат: золото, иридий, палладий, платина, имеющие
стандартный потенциал положительнее +0,815 В. Указанные
металлы могут корродировать только в кислых средах при
наличии кислорода или окислителей.
Металл устойчив в результате пассивного состояния.
Многие металлы в аэрируемых растворах, в азотной кислоте и
других окислителях находятся в пассивном состоянии. Однако
наиболее сильно эта способность выражена у хрома, титана,
алюминия, тантала, ниобия, никеля, магния и железа.
В результате пассивации на поверхности металла
образуются защитные пленки, по толщине соответствующие одному
или нескольким слоям кислорода. Такая тонкая поверхностная
пленка с хорошей электронной, но с очень плохой ионной
проводимостью будет избирательно тормозить процесс анодного
растворения металла.
10
Пассивное состояние металлов может нарушаться при
наличии активных ионов (Cl~, Br~, F~) или в восстановительных
средах. При этом вытесняется кислород с образованием
растворимого соединения, например Ме + 2С1~->МеС12 + 2е.
Металл устойчив в результате возникновения
малорастворимого и достаточно плотного слоя из продуктов коррозии. В
качестве примера можно указать на сравнительно высокую
коррозионную стойкость в восстановительных средах железа в
растворе фосфорной кислоты или молибдена в соляной кислоте.
Образование кроющих защитных пленок при этом происходит
вследствие взаимодействия анодно-растворяющих ионов
металла с анионами раствора, например Ме2+ + 2ОН~-^Ме(ОНJ,
2 S2MSO
Образующиеся продукты реакции могут выделяться на
поверхности металла в виде достаточно толстых и часто видимых
слоев.
Металл устойчив вследствие отсутствия в нем примесей,
образующих эффективные катоды. Примером может служить
относительно высокая устойчивость чистого железа в растворе
H2SO4 по сравнению с чугуном. Скорость коррозии чистых
металлов в указанных условиях сильно возрастает при
загрязнении их примесями других металлов с более низким
перенапряжением водорода. Такой же эффект увеличения скорости
коррозии наблюдают при введении в корродирующий раствор
ионов более благородного металла.
Приближенная характеристика коррозионной стойкости
некоторых металлов в разных средах и при комнатной
температуре в зависимости от их положения в периодической системе
Д. И. Менделеева рассмотрена Г. В. Акимовым [7, 8] и
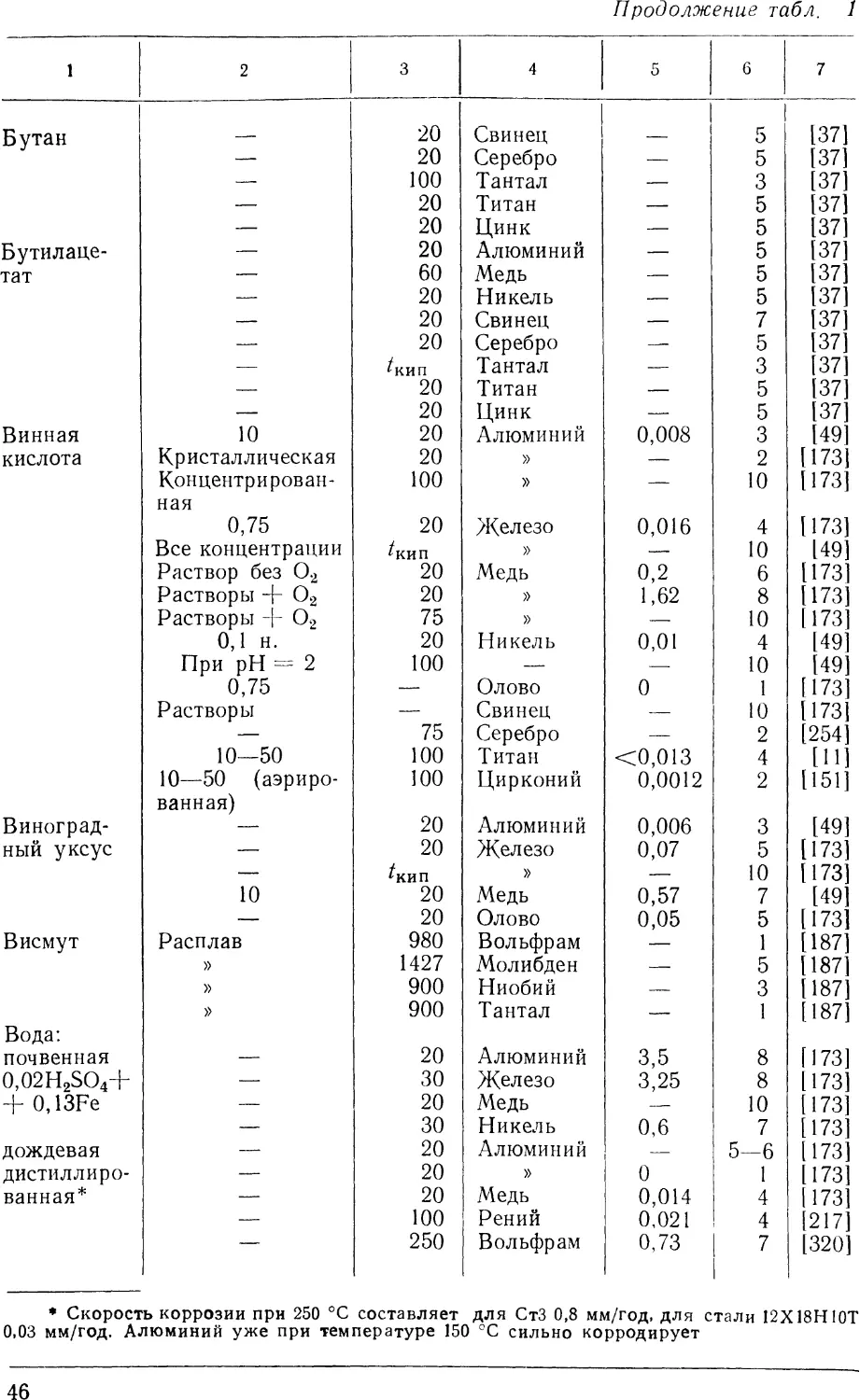
дополнена Н. Д. Томашовым [121] см. рис. 2.
В дальнейшем аналогичная работа была выполнена
Д. Г. Туфановым с той лишь разницей, что испытания
проводились в более жестких условиях, т. е. в кипящих кислотах
(HNO3, H2SO4, HC1, Н3РО4), и в интервале всех концентраций.
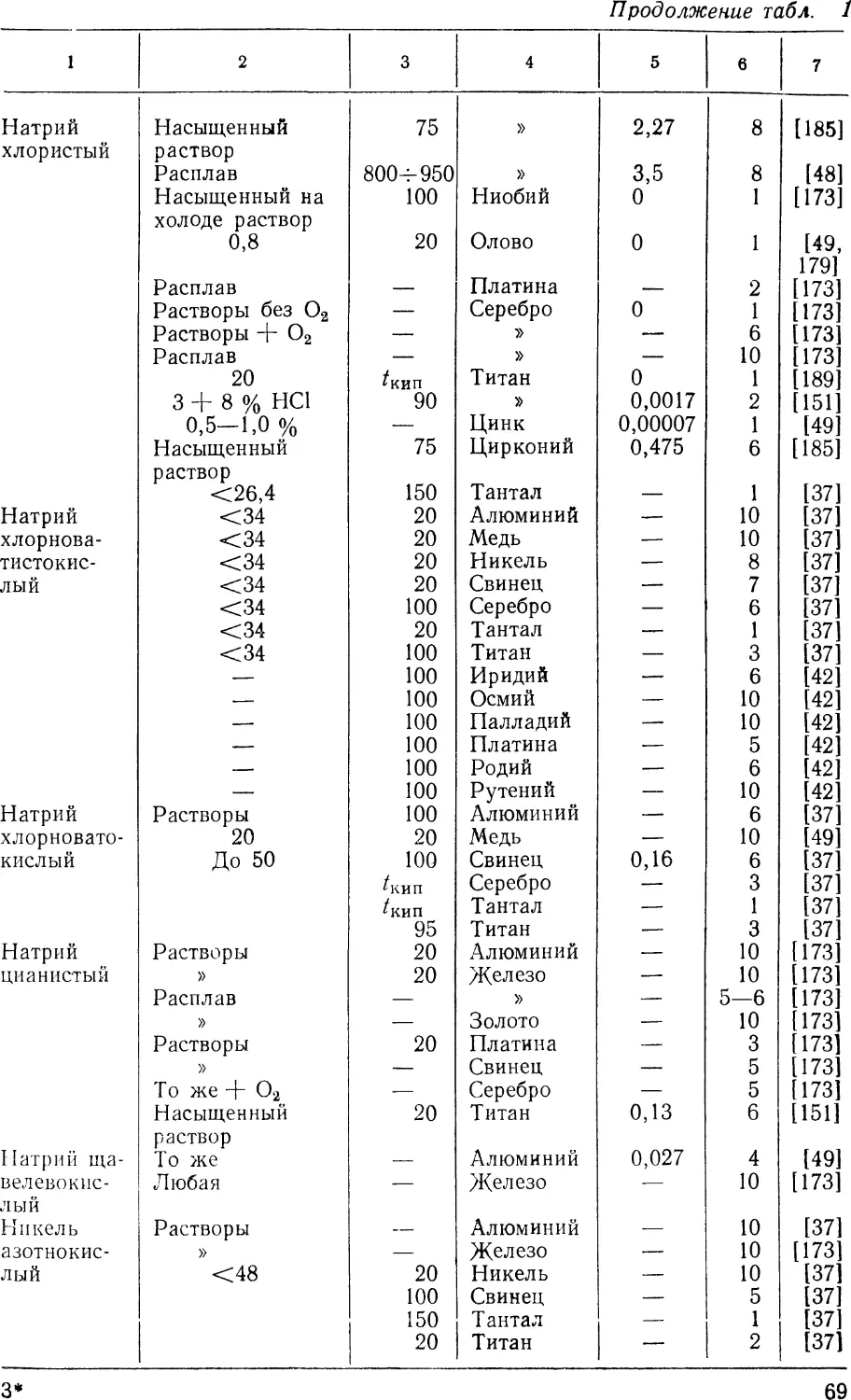
Результаты данных исследований представлены на рис. 3. При
этом к коррозионностойким отнесены металлы, имеющие
скорость коррозии <0,1 мм/год, и к нестойким металлам
>0,1 мм/год.
Из рис. 3 следует, что скорость коррозии металлов зависит
от температуры нагрева кислот. Так, например, бериллий,
алюминий, железо, осмий, кобальт, никель в азотной кислоте при
комнатной температуре устойчивы, а в кипящих растворах
сильно корродируют.
Аналогичным образом ведут себя в серной кислоте медь,
индий, германий, цирконий, олово, свинец, ниобий, молибден,
вольфрам, железо и никель, т. е. указанные металлы в
растворах серной кислоты при комнатной температуре устойчивы,
а в кипящих растворах наблюдают их сильную коррозию.
11
Серебро, олово, ниобий, сурьма и осмий в соляной кислоте
при комнатной температуре устойчивы, в кипящих растворах
сильно растворяются.
ЛЕМЕНТОВ
Рис. 2. Приближенная характеристика коррозионной стойкости некоторых чистых
металлов [7, 8, 121]. Приведенные данные относятся к испытаниям при комнатной
температуре и средним или повышенным концентрациям кислот или щелочей.
Условные обозначения характеризуют устойчивость в различных средах:
/ — благородные металлы; 2 — легкопассивирующиеся; 3 — очень неустойчивые; 4—9 —
устойчивые в ІШОз D), H2SO4 E), НС1 F), органических кислотах G), щелочах
(<§), аэрированном растворе NaCl (9)
ІІЕРИС
1
2
3
4
5
6
7
РЯДЫ
І
II
III
IV
V
VI
VII
VIII
їх
X
1
н
Li 3
Na11
к І9
R:O
29 Си
OADO
Rb37
47 Ag
OAD I
Cs 55
79 Au
• ABI
Fr 87
II
RO
Be 4
О ДР
Mg12
одра
Ca2"
30 Zn
о дпа
Sr 38
4* Cd
од p а
Ba56
80 Hg
ОД
Ra""
Г P
III
R:O,
5 в
од
13 AI
одра
Sc21
одра
31 Ga
• P
Y 39
одра
49 In
ОДР
La57
58-71
81 >-p ¦
ОДВ
Ac89
90-103
У II II
IV
RH4 RO2
6 С
14 Si
Ті 22
• ADO
32 Ge
OAB
Zr40
• ABG
50 Sn
О AD 0
Hf 72
82 Pb
OAD 0
Ы
RH
V
о
о
э
V
7 N
15 р
23
ADO
33 As
В
Nb41
• ADO
О
Та
О
51 Sb
D
73
ABI
83 Ві
0
Л Е
VI
RH2
8
16
M
RO3
О
s
Cr 24
• ADO
34
Se
Mo42
OAB«
52
Те
w 74
• ABI
84
Po
?
RH
H 1
VII
RjO-
(H)
' F
17 Cl
Mn25
OAD
Tc
35 Br
43
53 J
Re75
OAB
85 At
В
г о в
—
Fe26
OAD
Ru44
Os76
OAD
•o.
a
a
VIII
Co27
OAD
Rh45
Ir 77
• AB
a
і
і
AA6 ВС
RO,
Ni28
OAD
Pd46
OAB
Pt 78
• AB
в Юг
a
і
і
Рис. З. Приближенная характеристика коррозионной стойкости некоторых чистых металлов (темные значки — стойкие металлы, светлые -
нестойкие). Приведенные данные относятся к испытаниям в кипящих кислотах:
a—HNO3; б — H2SO4; в — НС1; г - Н3РО4
При разработке новых сплавов или применении в чистом
виде большой практический интерес как наиболее коррозионно-
стойкие материалы представляют тугоплавкие металлы.
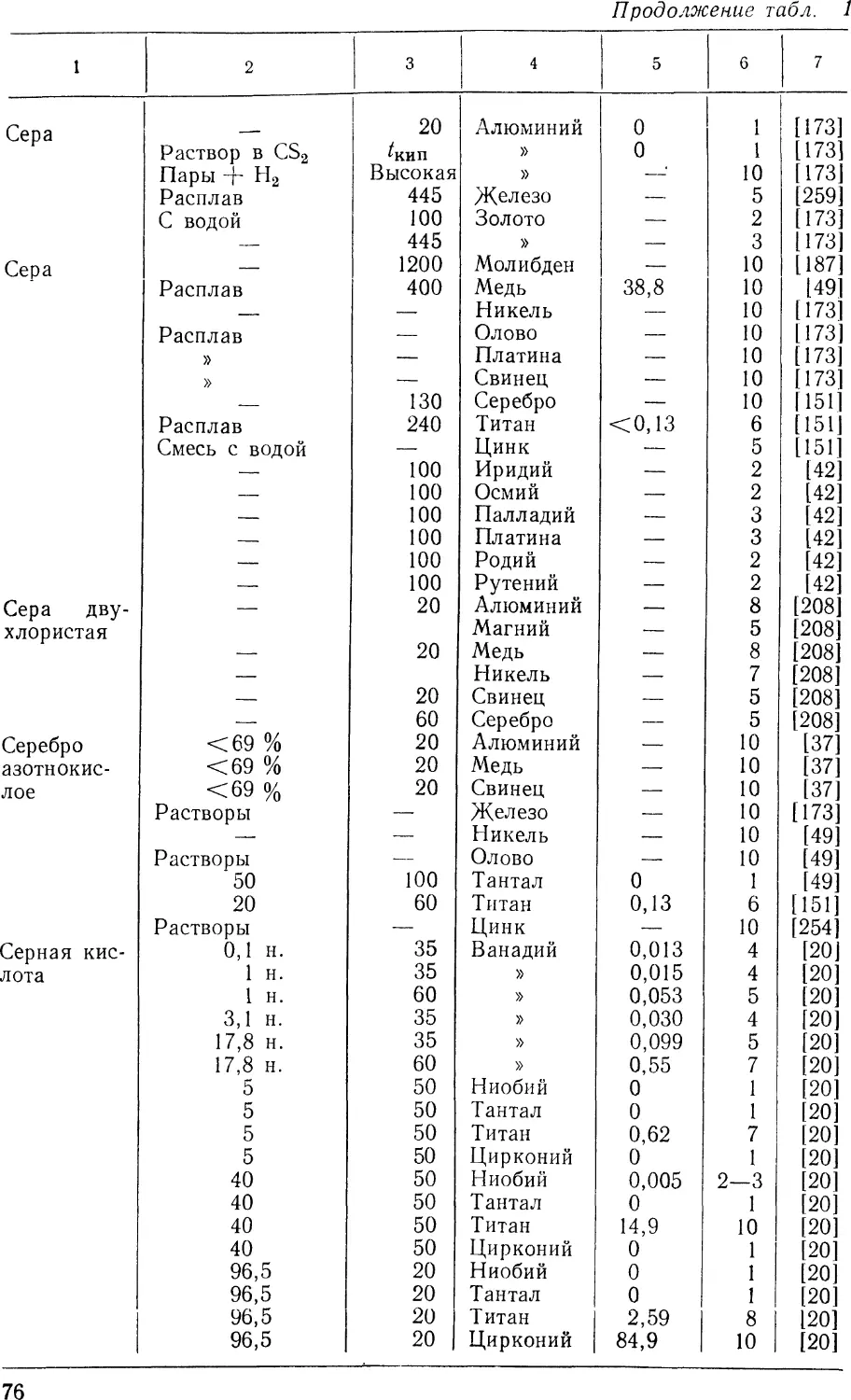
На рис. 4, а—г показана кинетика скорости коррозии
тугоплавких металлов в зависимости от концентрации и
температуры.
В азотной кислоте (рис. 4, а) тантал, ниобий, цирконий,
титан и вольфрам при кипении и концентрации до 70 % 5івляются
стойкими. Однако с увеличением температуры нагрева кислоты
скорость коррозии этих металлов, за исключением титана,
остается низкой. Титан при нагреве кислоты до 190 °С при
концентрации 25—55% корродирует со скоростью >2,0 мм/год.
та
/
Та
§ О 10 20 JO W 50 60 70 О
I HNOj,%
20 40 60 80 100
д}0
ь°
I **
%0,50
ІТІ
та
Zr
ІГ \ ND
\)
е
10 20 J0
НС1,%
20 bO 60 80 fOO
Рис. 4. Зависимость скорости коррозии некоторых тугоплавких металлов от
концентрации кислоты и температуры ее нагрева:
а — в HNCV, б —в H2SO4; в — в HC1; г —в Н3РО4; ( при кипении; zli^j^ при
температуре 190 °С; г — при температуре 250 °С)
Тантал, ниобий и цирконий в азотной кислоте даже при
температуре 250 °С являются стойкими. Молибден и ванадий
в азотной кислоте и других окислительных средах —
совершенно нестойкие материалы.
14
В серной кислоте (рис. 4, б) тантал при кипении и в
интервале почти всех концентраций обладает высокой стойкостью.
Другие тугоплавкие металлы, например молибден и цирконий,
стойки в серной кислоте при концентрации до 60%, а
вольфрам— 40%. Ванадий и титан в кипящей серной кислоте —
нестойкие материалы.
В соляной кислоте (рис. 4, в) тантал, вольфрам, молибден
и цирконий при кипении в интервале всех концентраций
являются стойкими металлами. При нагреве кислоты до 190 °С
тантал, вольфрам и молибден также стойкие. Указанные металлы
при этом корродируют со скоростью примерно 0,25—0,5 мм/год.
В кипящей фосфорной кислоте (рис. 4, г) тантал, вольфрам
и молибден являются стойкими металлами. Цирконий стоек при
концентрации до 40%, титан и ванадий в кипящей Н3РО4
нестойкие, молибден, вольфрам и особенно тантал при 190 °С
относительно стойкие. Скорость коррозии при этом составляет
0,25—0,5 мм/год.
Ниобий и тантал в восстановительных средах (НС1, H2SO4
и Н3рО4) становятся хрупкими вследствие значительного
поглощения водорода. В связи с этим при применении ниобия и
тантала в случае протекания коррозионного процесса с
выделением водорода следует избегать контактов с другими
металлами, в паре с которыми ниобий и тантал будут катодами.
Металлы группы I
Литий. Входит в группу наиболее химически активных
металлов, известных под названием щелочных. При сгорании в
кислороде литий дает окись ЫгО и перекись U2O2. На воздухе
литий быстро тускнеет, а при >200 °С загорается. Литий
энергично разлагает воду, а в хлоре и парах брома и иода
воспламеняется. С азотом литий соединяется при комнатной
температуре. Литий легко соединяется с водородом и кислородом и
серой.
Медь. Нормальный электродный потенциал меди для
процесса Cu^Cu+ равен +0,52 В, а для процесса Cu^=>Cu2+
составляет + 0,35 В. Следовательно, с точки зрения термодинамики
более легким процессом является образование не
одновалентных, а двухвалентных ионов меди. Стационарный потенциал
меди в 3%-ном растворе NaCl равен +0,05 В, а в 1 н.
растворе НС1 составляет +0,15 В.
В щавелевой кислоте медь корродирует сильно. При
комнатной температуре сухие хлор, фтор, бром и иод не вызывают
заметной коррозии меди, а влажные они становятся
агрессивными. Сера и сернистые соединения, а также аммиак и
аммиачные соединения сильно разрушают медь. На воздухе, в воде,
нейтральных сульфатных и слабещелочных (без доступа
кислорода) растворах медь устойчива. В растворах КМпО4 и К2СГ2О7
происходит пассивирование меди. Медь устойчива против
15
коррозии в пресной, горячей и холодной воде. Особенно она
пригодна для транспортировки мягких вод с высоким
содержанием растворенного кислорода и с небольшим содержанием
углекислоты и солей марганца. Медь стойка также в
деаэрированных горячих и холодных разбавленных растворах серной,
фосфорной и уксусной кислот. Медь не устойчива в
окислительных кислотах, например в НЫОз, в горячей концентрированной
H2SO4 и в аэрированных неокислительных кислотах (включая
углекислоту), в NH4OH, содержащем О2, в аминах.
Рубидий. Энергично, подобно калию, взаимодействует
с воздухом и водой. Он образует четыре оксида: желтый оксид
Rb2O, темно-коричневый двуоксид или перекись Rb2O2, черный
трехоксид Rb2O3, темно-оранжевый четырехоксид Rb2O4. На
воздухе он быстро покрывается серо-голубой пленкой смеси
оксидов Rb2O2 и Rb2O4. Рубидий самовоспламеняется на
воздухе, не менее энергично, чем с кислородом, взаимодействует
он с хлором и бромом.
Серебро. Имеет равновесный электродный потенциал,
равный +0,799 В, т. е. немного отрицательнее равновесного
потенциала кислородного электрода. Таким образом, серебро
способно окисляться кислородом воздуха при обычных
температурах. Поэтому серебро — коррозионностойкий металл в
неокислительных средах и во многих неаэрированных разбавленных
кислотах при нагреве. Стационарный потенциал серебра
в 3 %-ном растворе NaCl равен +0,12 В.
Серебро, стойкое в холодных растворах органических
кислот, не загрязняет и не изменяет окраски фенола, фруктовых
соков, эфирных масел, вина и многих фармацевтических
препаратов. Оно коррозионностойко в щелочах и мочевине. Серебро
в виде ионов (так называемая серебряная вода) имеет весьма
сильное бактерицидное действие. Сернистые соединения, окись
углерода, водород, фтор, азот, сухой аммиак вызывают
коррозию серебра. Сухой сероводород, однако, при обычных
температурах не оказывает заметного действия. Галогены, влажный
аммиак разъедают серебро. Потускнение и потеря
отражательной способности серебра на воздухе связаны с присутствием
сернистых соединений (наряду с влагой и кислородом) и
образованием пленки Ag2S. Введением цинка, олова, сурьмы и
особенно кадмия увеличивают стойкость серебра против
потускнения. Однако в атмосферных условиях эти добавки (обычно
составляющие <1—1,5%) не исключают потемнения. При
добавке 0,5—1,5% Be значительно повышается стойкость его
против потускнения. Серебро, содержащее 40 % Pd и более, не
тускнеет. Надежную защиту от потемнения в обычных условиях
(например, при хранении серебряных изделий) дают пары
1 %-ного раствора морфолина (О : [CH3CH2]NH).
Золото. Электроположительный металл, его равновесный
потенциал для процесса Ag->Ag3++3e равен +1,5 В. Высокая
16
коррозионная стойкость золота зависит не от образования
пассивной пленки, а от малой химической активности его. Золото
разрушается в сильных окислителях, содержащих свободные
галогены, например в азотной и соляной кислотах, в серной
кислоте и гипохлорате, в соляной кислоте и марганцевокислом
калии и др. Однако в смеси азотной и плавиковой кислот
золото устойчиво. Чистая соляная кислота не воздействует на
золото, но в присутствии кислорода и при нагреве наблюдают
сильную коррозию. Золото устойчиво в муравьиной и
плавиковой кислотах. Оно растворяется в царской водке и растворе
цианистого калия или натрия, быстро разрушается в горячих
смесях серной и азотной кислот и серной кислоты с окислами
тяжелых металлов. Золото частично растворяется при
кипячении в азотной и серной кислотах в присутствии кислорода при
>250 °С. Чистое золото стойко в кислороде, сере, сернистом
ангидриде и селене.
Золото обладает низким сопротивлением против истирания
и является достаточно мягким. По данным работы [183], оно
является одним из лучших смазочных материалов, применяемых
в космической технике. Золото превосходит по свойствам
многие обычные материалы, которые в космических условиях
быстро испаряются или разрушаются под действием радиации.
Важнейшая особенность золота заключается в его высокой
отражательной способности (>90 % в инфракрасной части
спектра). В космической технике его применяют для покрытий.
Металлы группы II
Бериллий. По своим свойствам сходен с магнием и
алюминием. Равновесный потенциал его равен —1,7 В. Стационарный
электродный потенциал бериллия в растворе 0,5 н. NaCl равен
—0,76 В. Бериллий имеет большое сродство к кислороду, но
вследствие образования защитных пленок он довольно ycToft4HBv
на воздухе. Окисление идет очень медленно и ускоряется по
мере увеличения температуры нагрева, при 1200 °С он сгорает.
Холодная и горячая вода не влияют на бериллий. Пар при
высокой температуре, вызывает коррозию металла. Бериллий не
стоек в плавиковой кислоте. Уксусная, лимонная и винная
кислоты реагируют довольно энергично, и через некоторое время
реакция растворения прекращается. Фтор реагирует с
бериллием при комнатной температуре, а хлор, бром, иод, NO2, H2S
действуют при повышенной температуре. Водород не вступает
в реакцию с бериллием. Водные растворы щелочей медленно
растворяют бериллий. В виде порошка он реагирует с
расплавленными щелочами. Эта реакция сопровождается взрывом.
Бериллий и его соединения очень токсичны [157].
Бериллий легко взаимодействует с серной и соляной
кислотами. Разбавленная HNO3 слабо растворяет бериллий, тогда
как концентрированная HNO3 почти на него не действует. Рас-
17
творы щелочей реагируют с бериллием с выделением водорода.
При обычных температурах бериллий очень устойчив против
окисления на воздухе. Тщательно отполированные поверхности
чистого металла сохраняют свой блеск в течение нескольких
лет. При 700 °С окисление бериллия становится заметным,
а при 1000 °С протекает с очень большой скоростью. При
температурах выше 900 °С бериллий взаимодействует с азотом,
образуя нитрид бериллия Be3N2. Карбид бериллия Ве2С
образуется при взаимодействии бериллия с углеродом при
температурах выше температуры плавления металла.
Магний. Коррозионностойкий металл; равновесный
потенциал его равен —2,37 В. Стационарный потенциал магния
в 0,5 н. растворе NaCl составляет —1,45 В. Однако, несмотря
на наличие отрицательных электрохимических потенциалов,
магний имеет сравнительно высокую коррозионную стойкость,
что определяется его способностью к пассивированию. Магний
устойчив в хромовой и фтористоводородной кислотах, в
щелочах, в атмосфере и дистиллированной воде, но при наличии
напряжений растрескивается. Магний не стоек в морской воде,
в бензинах, содержащих соединения свинца, во фреоне с водой.
Цинк. Равновесный потенциал равен —0,76 В,
стационарный потенциал его в 0,5 н. растворе NaCl составляет около
—0,83 В. Цинк заметно пассивируется в растворах хроматов.
В нейтральных растворах цинк корродирует, в щелочах и
органических кислотах он не стоек. В воде цинк устойчив до 50 °С.
В чистой и морской воде цинк — коррозионностойкий металл.
Загрязнения атмосферы SO2, SO3, HC1 вызывают сильную
коррозию цинка.
Применение цинка и его сплавов основывается на их
способности образовывать защитные пленки.
Цинк не пригоден для химического аппаратостроения, но
его широко используют в качестве защитного покрытия
деталей, работающих в атмосферных условиях и в водопроводной
воде.
С помощью цинковых покрытий [124, 256] в течение
длительного времени можно эффективно защищать от атмосферной
коррозии многие строительные изделия, а также хозяйственный
инвентарь. Их можно использовать как грунтовку,
предохраняющую от коррозии железо перед окраской. Кроме того,
применение цинка в качестве грунта устраняет необходимость в
дорогостоящих работах по снятию ржавчины при последующей
окраске.
Однако следует отметить, что цинковые покрытия повышают
стоимость изделия на 10—30 %, но и срок эксплуатации
металлической конструкции, например автомобильного кузова при
применении оцинкованной стали, увеличивается в 3—5 раз.
Кадмий. По электрохимическим свойствам близок к
железу. Раьниьесный потенциал кадмия равен —0.40 В. а стацио-
18
нарный потенциал в 0,5 н. растворе NaCl —0,52 В. Кадмий
в отличие от цинка не растворяется в щелочах, однако
растворяется в растворе нитрата аммония, образуя комплексное
соединение кадмия и аммония.
Барий. По химической активности превосходит кальций и
стронций. Барий — металл белого цвета; при хранении
приобретает желтую окраску, покрываясь слоем окиси и нитрида. По
отношению к сложным газам (углекислоте, окиси углерода,
сернистому газу и парам воды) барий ведет себя аналогично
кальцию и стронцию. Металлический барий легко реагирует не
только с водой, но и со многими кислотами. При нагревании
бария в водороде до 200 °С происходит бурная реакция
образования гидрида бария. Это — твердое соединение серого цвета,
легко растворяющееся в воде и в кислотах. Нитрид бария при
нагревании разлагается со взрывом. С углеродом и азотом
барий взаимодействует, образуя термически устойчивые
соединения.
Ртуть — единственный металл, находящийся при
комнатной температуре в жидком состоянии. Ртуть обладает
способностью растворять в себе многие металлы, образуя жидкие и
твердые сплавы— амальгамы.
Особенно легко образуется амальгама золота, вследствие
чего золотые изделия не должны соприкасаться с ртутью.
Железо не образует амальгамы, поэтому ртуть можно перевозить
в стальных сосудах. Ртуть не взаимодействует с азотом, бором,
кремнием, углеродом и с молекулярным водородом.
Соляная и разбавленная серная кислота, а также щелочи ке
действуют на ртуть. Легко растворяется ртуть в азотной
кислоте. Концентрированная серная кислота растворяет ртуть при
нагревании.
На воздухе ртуть при комнатной температуре не окисляется.
При продолжительном нагревании до температуры, близкой
к температуре кипения, ртуть соединяется с кислородом
воздуха, образуя оксид ртути HgO. Пары ртути очень ядовиты и
могут вызвать тяжелое отравление.
Для этого достаточно ничтожного количества паров,
которые образуются при комнатной температуре. Не следует
держать открытыми сосуды с ртутью. Работы производить на
эмалированных или железных подносах.
Очень опасна ртуть, пролитая на пол. При попадании на
пол она разбивается на множество мелких капель, которые
попадают в щели и могут в течение длительного времени
отравлять атмосферу. Поэтому, если ртуть пролилась на пол,
необходимо немедленно и тщательно собрать ее с помощью
пылесоса или пипетки с грушей.
Удалять ртуть можно реактивами, например 10%-ным
водным раствором перманганата калия, подкисленным соляной
кислотой.
19
Металлы группы III
Бор. При обыкновенной температуре—инертный металл; не
реагирует с водой, не окисляется на воздухе и не соединяется
с другими элементами; легко соединяется со фтором, хлором,
бромом и иодом. Чистый бор не взаимодействует с хлором при
температурах ниже 500 °С, но быстро соединяется с ним при
550 °С, образуя трихлорид бора. В соляной и плавиковой
кислотах бор не растворяется даже при кипении. Бор окисляется
в горячей азотной кислоте, однако горячая концентрированная
серная кислота и горячий раствор хромовой кислоты в серной
кислоте на бор почти не действуют. Бор растворяется в смеси
азотной, соляной и серной кислот.
Концентрированная перекись водорода медленно окисляет
порошкообразный бор, а горячий раствор персульфата аммония
оказывает на него лишь слабое действие. Кипящий
концентрированный водный раствор едкого натра не взаимодействует
с бором. Расплавленная перекись натрия и расплавленная
смесь соды и нитрата калия энергично реагируют с бором.
При нагревании спрессованного бора на воздухе заметного
окисления не происходит примерно до 750 °С, но при 800 °С на
поверхности появляется блестящая черная пленка, которая,
очевидно, полностью предохраняет его от дальнейшего
окисления вплоть до 1000 °С. В чистом кислороде при 1000 °С
окисление протекает очень быстро. В концентрированных щелочах
бор растворяется с выделением водорода. При нагревании
химическая активность бора возрастает, в этих условиях он легко
соединяется с галогенами и углеродом. При 1200 °С бор
разлагает углекислоту и окись углерода; обладает способностью
соединяться со многими металлами, образуя бориды, которые
более химически устойчивы.
Легирование хромоникелевых нержавеющих сталей
небольшими количествами бора приводит к получению металла с
мелкозернистой структурой и более высокими механическими и
коррозионными свойствами.
В практике применяется также поверхностное насыщение
стальных изделий бором — борирование, что повышает
твердость и коррозионную стойкость металла. По данным [353] обе
модификации бора — кристаллическая и аморфная — инертны
по отношению к водороду.
Алюминий. Металл, имеющий нормальный, равновесный
потенциал —1,67 В. Однако в результате склонности к
пассивации он устойчив в воде, в нейтральных и слабокислых
растворах, а также в атмосферных условиях. Загрязнения хлором,
фтором, бромом и щелочами снижают стойкость алюминия.
Стационарный потенциал алюминия в 0,5 н. растворе NaCl
равен —0,63 В. Поверхность алюминия в пассивном состоянии
покрыта пленкой из Аі2й3 или Ai2O3*H2u. Защитная пленка на
20
алюминии легко растворяется в сильных кислотах (неокисляю-
щих) и в щелочах. Алюминий стоек к газовой коррозии вплоть
до температуры плавления. Алюминий не стоек в хлористом или
бромистом метиле, в НС1, НСЮ4, Н3РО4, трихлоруксусной
кислоте, в щелочах, извести и свежем бетоне, в хлорированных
растворителях, а также в безводных этиловом, пропиловом и
бутиловом спиртах при повышенных температурах. Следы НгО
действуют как ингибитор.
Анодированный алюминий и его сплавы с глубокой
химической окраской в черный цвет должны быть широко
использованы в строительстве наземных солнечных электростанций.
Указанный металл обеспечит легкость конструкций и,
по-видимому, может служить экономичным концентратором солнечной
энергии.
Анодированный алюминий и его сплавы с химической
окраской в различные цвета широко применяются в строительстве
и для изделий широкого потребления.
Скандий. Металл с металлическим блеском со слегка
желтоватым оттенком, появляющимся при хранении на воздухе.
Это мягкий металл, который легко обрабатывается в чистом
виде. Он легко реагирует с кислотами, но длительное время не
теряет блеска на воздухе и не подвергается действию воды.
При высоких температурах E00—800 °С) скандий окисляется
на воздухе. Он не реагирует со смесью A:1)
концентрированной азотной и 48%-ной плавиковой кислот.
Галлий. Редкий металл, легко окисляется на воздухе.
Окислы галлия белого цвета и хорошо предохраняют металл
от коррозии. Галлий не разлагает воду и остается светлым при
кипячении в ней. Он корродирует в щелочных и аммиачных
растворах с выделением водорода. С галогенами галлий
соединяется на холоду, образуя соли.
Хлористые соединения галлия летучи. При 100 °С он не
разлагает воду, однако медленно растворяется в минеральных
кислотах; горячая азотная кислота окисляет металл и растворяет
окись. Царская водка также растворяет галлий. В растворах
едкого натра и едкого кали галлий растворяется с выделением
водорода. Фторид галлия может быть приготовлен
растворением металла в концентрированной плавиковой кислоте.
Галлий токсичен.
Иттрий. Имеет небольшую плотность D,472 г/см3) и
относительно высокую температуру плавления A510 °С).
Полиморфные превращения в иттрии отсутствуют почти до
температуры плавления. Иттрий устойчив в растворах
фтористоводородной кислоты и в смесях ее с другими кислотами,
в разбавленных растворах хромовой, фосфорной и щавелевой
кислот. Иттрий нестоек в 98 %-ной H2SO4 B5 °С), в 37%-ной
НС1, в 70 %-ной НІМОч и НСЮи Иттрий в атмосфере устойчив,
он лишь слегка тускнеет, но никогда не теряет металлического
21
блеска. Иттрий окисляется при более высокой температуре.
С иттриевыми стружками следует обращаться осторожно, так
как при нагревании они энергично сгорают. В атмосфере
водяного пара при 750 °С иттрий покрывается плотной окисной
пленкой, предохраняющей металл от дальнейшего окисления.
И н д и й. Гсакционную способность индия можно оценить
по его положению в ряду напряжений. Нормальный потенциал
реакции Ino->In3+ + 3e приблизительно равен —0,34 В. Таким
образом, индий является несколько более благородным
металлом, чем кадмий. Тонко измельченный индий (губка или
порошок) реагирует с водой, образуя гидроокись. Индий легко
растворяется в щелочах; не стоек в органических кислотах; при
нагревании сохраняет светлый оттенок вплоть до температуры
плавления; с галогенами соединяется непосредственно, образуя
треххлористый, бромистый и йодистый литий. Пары серы и
сероводорода в атмосфере не влияют на индий.
Лантан. По свойствам аналогичен щелочноземельным
металлам. Легко окисляется кислородом, разлагает воду с
выделением водорода, поглощает при нагревании водород и
соединяется с азотом. Даже в атмосфере сухого воздуха лантан
быстро тускнеет.
Таллий. Металл белого цвета с голубовато-серым
оттенком. На воздухе темнеет и становится похожим на свинец.
С серой, фосфором и галогенами соединяется непосредственно.
В сухом воздухе, кислороде и азоте таллий не окисляется,
а лишь тускнеет. При 100 °С окисление таллия идет быстро,
а в расплавленном состоянии таллий в кислороде сгорает; в
воздухе расплавленный таллий дает темные пары. В присутствии
влаги таллий окисляется воздухом, поэтому его сохраняют под
глицерином или вазелиновым маслом. Таллий при 20 °С
медленно окисляется на воздухе; с повышением температуры
окисление протекает гораздо быстрее. При обычной температуре на
воздухе таллий за несколько недель покрывается толстым
слоем окиси. Легко растворяется в азотной кислоте; в
разбавленной серной кислоте растворение происходит очень медленно,
в концентрированной — гораздо быстрее. В соляной кислоте
растворение таллия протекает чрезвычайно медленно.
Металлы группы IV
Углерод. Как и кремний, является важным легирующим
компонентом большинства железных сплавов. Стационарный
потенциал его в 3 %-ном растворе NaCl составляет 0,34 В.
Углерод при обыкновенной температуре — химически устойчивый
элемент, подвергается действию только очень энергичных
окислителей. Нагрев до высоких температур резко увеличивает
активность углерода, который легко соединяется при этом с
кислородом, а при очень высоких температурах — с водородом,
серой, кремнием и многими металлами.
22
Кремний. Электродный потенциал этого элемента в 3%-
ном растворе NaCl составляет —0,435 В. Кремний не устойчив
в щелочах, способен разлагать воду в присутствии следов
щелочи, образуя кремнезем и водород. Кремний легко реагирует
с газообразной и жидкой плавиковой кислотой, но трудно
поддается действию соляной, бромистоводородной и йодисто-
водородной кислот даже при температуре красного
каления.
Кремний легко соединяется со всеми галогенами; с трудом
горит на воздухе, не реагирует с кислородом при температуре
красного каления, с серой при 600 °С и азотом при 1000 °С.
При нагревании в электрической печи кремний соединяется
с бором, углеродом, титаном и цирконией. Легко растворяется
в расплавленном магнии, меди, железе и никеле с
образованием силицидов; растворяется также в алюминии и серебре,
выпадая при охлаждении в виде кристаллов, в смесях азотной и
плавиковой кислот. Кремний при высокой температуре
медленно реагирует с водяным паром с выделением водорода;
кроме того, реагирует с расплавленным едким натром, содой,
бихроматом и нитратом калия.
Нержавеющие стали и высоколегированные сплавы,
содержащие 5,5—6,5 % кремния, являются коррозионностойкими
металлами в азотной кислоте и других окислительных средах. По
данным [8] высокая коррозионная стойкость нержавеющих
сталей и высоколегированных сплавов, содержащих кремний,
объясняется тем, что при действии кислот на поверхности металла
возникает прочная оксидная пленка SiCb.
Титан. Имеет равновесный электрохимический потенциал
(по отношению к 1 н. водородному электроду) —1,63 В.
Однако стационарный потенциал вследствие большой склонности
к образованию защитных пассивных пленок сдвигается в
положительную сторону, например в морской воде при 25 °С
составляет + 0,09 В. Титан стоек в гипохлоритах, не стоек в
дымящейся 98%-ной азотной кислоте и соляной, исключая
разбавленные кислоты, или при средних концентрациях при ингибити-
ровании, например К2СГ2О7, NaNCb или при легировании Ft
или Pd.
Титан не стоек в кипящих растворах >55 % СаСІ, в
концентрированных горячих щелочах, в расплавленных солях,
например NaCl, LCI и фторидах. Титан также не стоек на
воздухе, в азоте и водороде при высоких температурах.
Окисление на воздухе происходит при 450 °С с образованием окислов
и нитридов титана. Гидрид титана быстро образуется при
температурах выше 250 °С. Адсорбция О2, N2 и Н2 при
повышенных температурах ведет к хрупкости титана.
В титане, по данным [331], при температуре 400 °С и
давлении по сравнению с многими другими металлами наблюдается
наибольшая растворимость водорода.
23
Растворимость водорода в металлах связана с его
способностью диффундировать через металлы. Кроме того, водород
является самым легким газом: он в 14,5 раза легче воздуха,
водород обладает наибольшей скоростью диффузии: его
молекулы быстрее молекул всех других газов распространяются
в среде другого вещества. Особенно велика способность
водорода к диффузии при повышенном давлении и высоких
температурах.
Германий. Металл, который по своим химическим
свойствам напоминает во многом углерод и кремний. В
соединениях может быть двух- и четырехвалентным, соединения
четырехвалентного германия более устойчивы. Германий при 25 °С
вполне устойчив на воздухе, в водопроводной и
дистиллированной воде и кислороде. При 600—700 °С он быстро окисляется
на воздухе и в кислороде, образуя два оксида: GeO и Ge2O.
При нагревании свыше 200 °С с галогенами германий легко
образует соответствующие тетрагалогениды. Наиболее энергично
взаимодействует с хлором, затем с бромом и иодом. Соляная
и серная кислоты при комнатной температуре взаимодействуют
с германием слабо, при 100 °С серная кислота медленно
растворяет германий. Азотная кислота и царская водка при их
нагреве сильно действуют на германий. Водные растворы едкого
натра и едкого кали реагируют с германием очень слабо, тогда
как в присутствии Н2О2 расплавленные щелочи быстро его
растворяют.
Цирконий. Стационарный потенциал циркония в 3%-ном
растворе NaCl и в первую минуту измерения имеет
отрицательное значение (—0,1 В). В дальнейшем, например через сутки,
потенциал его сдвигается в положительную сторону и
составляет примерно +0,2 В.
Цирконий обладает в ряде агрессивных сред высокой
коррозионной стойкостью, что зависит от наличия на поверхности
металла невидимой окисной пленки, состоящей из двуокиси
циркония ZrO2, устойчив в азотной кислоте при нагреве ее до
250 °С, а также в разбавленной кипящей серной кислоте (до
60%). С увеличением концентрации серной кислоты и
повышением температуры ее нагрева скорость коррозии циркония
резко возрастает. Металл становится нестойким.
Цирконий при обычной температуре абсорбирует водород,
но к кислороду устойчив. В галогенах заметную коррозию
циркония наблюдают при 200 °С с образованием летучих
соединений.
Цирконий стоек в щелочах, включая расплавленную щелочь,
и соляной кислоте при всех концентрациях и температурах
вплоть до температуры кипения. Выше температуры кипения
под давлением металл становится хрупким; скорость его
коррозии в кипящей фосфорной кислоте при концентрации <55 % и
в кипящей молочной кислоте увеличивается.
24
Цирконий нестоек в СиСЬ, в НС1, H2SiF6, во влажном хлоре,
в кислороде, азоте, водороде при повышенных температурах
и в царской водке.
Олово. Имеет нормальный равновесный потенциал,
равный —0,136 В, стационарный потенциал в 0,5 н. растворе NaCl
равен —0,25 В. Олово слабо пассивируется; неустойчиво в
щелочах, а также в уксусной и щавелевой кислотах. Стеариновая
и олеиновая кислоты при высоких температурах быстро
разрушают олово. В хлоре, броме и иоде оно корродирует даже при
низких температурах. Фтор реагирует с оловом при 100 °С и
выше. В винах олово нестойко. В кипящих соках (лимонном,
томатном, виноградном и яблочном) наблюдается его
значительная коррозия. Водопроводная и дистиллированная вода,
молоко слабо действуют на олово даже при обильном доступе
кислорода. Олово практически не корродирует в нефтяных
продуктах— бензине, керосине, смазочных маслах. В сильно
разбавленных растворах хлорида натрия и хромата натрия
образуются эффективные защитные пленки. Нагретое на воздухе до
210 °С олово полностью пассивируется.
Гафний. По химическим свойствам близок к цирконию,
но значительно уступает ему в активности. Все реакции,
характерные для циркония, свойственны гафнию. На воздухе при
комнатной температуре поверхность гафния покрывается
защитной оксидной пленкой. При нагревании в кислороде при
высоких температурах горит. При нагревании в атмосфере
водорода гафний поглощает его, а с галогенами и азотом дает
в тех же условиях соединения.
Азотная, серная, соляная, бромистоводородная, иодистово-
дородная, хлорная, фосфатная, уксусная, хлоруксусная, дихлор-
уксусная, трихлоруксусная, трифторуксусная, муравьиная и
щавелевая кислоты не растворяют гафний. Он устойчив также по
отношению к щелочам.
Свинец. Имеет нормальный равновесный потенциал
—0,126 В, стационарный потенциал в 0,5 н. растворе NaCl для
свинца равен —0,26 В. Он не пассивируется в окислительных
средах; устойчив в средах, где образуются нерастворимые
продукты коррозии. Неустойчив в плавиковой, уксусной и
муравьиной кислотах, а также в щелочах. В горячей серной кислоте
(до 50%) свинец стоек, при более высоких концентрациях он
корродирует. В присутствии кислорода свинец корродирует
в мягких водах, в дистиллированной и дождевой, в подземных
водах, содержащих органические кислоты. Свинец стоек в
атмосфере, загрязненной сернистыми соединениями, нестоек
в концентрированной H2SO4 (>96%) при комнатной
температуре и во многих аэрированных органических кислотах.
Значительное число свинцовых солей обладает небольшой
растворимостью, что приводит к образованию защитных пленок
в соответствующих пягтяппах кислот или солей,
25
В растворах сульфата и фторида натрия, как и в слабой
серной кислоте, образуются эффективные защитные пленки.
Металлы группы V
Ванадий. На воздухе не окисляется, но при нагреве в
кислороде переходит (не полностью) в V2O5. Нагретый в хлоре
ванадий соединяется с ним, а при 1000 °С вступает в реакцию
с азотом. Ванадий неустойчив в соляной, серной, плавиковой и
азотной кислотах, а также в царской водке. При действии
расплавленных щелочей образуются соответствующие ванадаты.
Мышьяк. Металлический мышьяк обладает невысокой
химической активностью. В воде он нерастворим; при комнатной
температуре очень медленно окисляется на воздухе.
Электродный потенциал в 3%-ном растворе NaCl составляет —0,09 В.
В измельченном виде или в смеси с окислителями мышьяк
быстро окисляется, образуя AS2O3, а при нагревании на воздухе
компактный мышьяк легко окисляется до триоксида.
Азотная кислота и царская водка окисляют мышьяк с
образованием мышьяковистой кислоты, а соляная кислота действует
на мышьяк очень медленно и только в присутствии воздуха.
При обычной температуре мышьяк непосредственно
соединяется с галогенами; при нагревании с серой водные растворы
щелочей не действуют на него, но с расплавленными щелочами
он реагирует, образуя соли мышьяковистой и мышьяковой
кислот.
Ниобий. При обычных температурах обладает высокой
коррозионной стойкостью, при повышенных температурах легко
соединяется с водородом, азотом, кислородом и углеродом.
В отличие от молибдена окислы ниобия (Nb2O5), образующиеся
на его поверхности при нагреве, нелетучие, и поэтому они
обладают надежными защитными свойствами. Однако кислород,
входящий в состав пленки, при >500 °С растворяется в
металле, и ниобий становится хрупким. Ниобий устойчив в
атмосферных условиях. При >700 °С он окисляется кислородом
воздуха и парами воды. Ниобий энергично вступает в реакцию
с фтором при 20 °С, а с хлором при 200 °С.
Сурьма. В металлическом состоянии при обычной
температуре на воздухе не окисляется, а при нагреве горит, образуя
Sb2O3. С галогенами сурьма соединяется непосредственно
с большим тепловым эффектом. Вода и разбавленные кислоты
на сурьму не действуют. Она легко растворяется в царской
водке. Растворение сурьмы происходит с выделением водорода.
При температуре красного каления сурьма разлагает пары
воды.
Тантал. Высокая коррозионная стойкость тантала во
многих агрессивных средах объясняется наличием на поверхности
металла окисной пленки сине-серого цвета (ТаО5).
26
Тантал устойчив в кипящих уксусной, муравьиной и
щавелевой кислотах различных концентраций: устройств в Н3РО4 и
НЫОз нагретых до 190 °С, различных концентраций; в кипящей
серной кислоте до 80%-ной концентрации. При 80—100%-ной
концентрации коррозионная стойкость тантала резко падает.
Устойчив в кипящей соляной кислоте всех концентраций. При
нагреве соляной кислоты до 190 °С тантал устойчив до 30 %-ной
концентрации. Тантал стоек в горячей и холодной хромовой
кислоте. Для 85 %-ной Н3РО4 при 225 °С скорость коррозии
составляет 0,089 мм/год. Коррозия происходит при более низких
температурах, если кислота загрязнена (HF>4 мг/л); в
газообразных галоидах во влажном или сухом С12 до 150 °С и Вг2
до 175 °С; в окислительных горячих растворах хлоридов
металлов.
Тантал нестоек в HF и щелочах, а также в газообразном
фторе и броме при повышенных температурах. Он сильно
поглощает водород, в результате чего становится очень хрупким;
не стоек в дымящейся H2SO4; в кислороде, азоте, водороде при
повышенных температурах. Скорость окисления на воздухе
становится заметной при температуре 250 °С. В щелочах
возникает хрупкость при 100 °С.
Висмут. При обыкновенной температуре в сухом и
влажном воздухе и кислороде устойчив, но при нагреве на воздухе
покрывается тонкой окисной пленкой. Электродный потенциал
в 3 %-ном растворе NaCl составляет —0,18 В. Висмут
корродирует во фторе и вступает в реакцию с хлором и парами брома
и иода. Разбавленная НС1 не действует на него. Окислители
ускоряют растворимость висмута в кислотах.
Металлы группы VI
Хром. Легко пассивируется; это свойство хром придает
нержавеющим сталям и другим сплавам, в которые он входит
в качестве легирующего элемента. В активном состоянии хром
переходит в раствор в виде двухвалентных ионов. Пассивность
хрома объясняется присутствием на его поверхности защитного
окисла — трехвалентного хрома. Восстановление этого окисла
до двухвалентного приводит к катодной активности хрома,
а окисление до шестивалентного — к анодной активации его.
Равновесный нормальный потенциал хрома —0,74 В,
электродный потенциал его в 3 %-ном растворе NaCl в результате
пассивации сдвигается в положительную сторону и равен +0,23 В.
Хром устойчив в хромовой кислоте, имеет большое сродство
к кислороду, азоту и углероду; устойчив на воздухе даже в
присутствии примесей H2S, SO2 и СО2. Хром неустойчив в
восстановительных средах и средах, содержащих хлор-ион. При
нагреве до 1800 °С в атмосфере кислорода хром сгорает, образуя
триоксид Сг2О3. При этой же температуре он способен
соединяться с галогенами, азотом, углеродом, кремнием, бором
27
Хром реагирует с безводными галогенами, хлористым и
фтористым водородом. Водные растворы плавиковой и соляной
кислот, бромистого и йодистого водорода растворяют хром, так
же как и разбавленная серная кислота. При растворении хрома
в разбавленной серной кислоте выделяется водород, а при
растворении в кипящей концентрированной серной кислоте
выделяется диоксид серы. При комнатной температуре на хром не
действуют дымящая азотная кислота и царская водка.
Некоторые кислоты, например концентрированная азотная,
фосфорная, хлорноватая, хлорная, образуют на хроме окисную
пленку, что приводит к его пассивации. В этом состоянии хром
обладает исключительно высоким сопротивлением коррозии и
на него не действуют разбавленные минеральные кислоты.
Растворенный кислород отличается достаточной окислительной
способностью, чтобы поддерживать пассивность в
нейтральных растворах, но в растворах с низкой величиной pH для
сохранения пассивности должны присутствовать более сильные
окислители (а галоидные кислоты должны отсутствовать).
Обычно стойкость хрома против коррозии сходна со стойкостью
наиболее высоколегированных нержавеющих сталей. Как
правило, хром незапассивированный является
электроотрицательным по отношению к обычным металлам и сплавам, а если он
образует с ними гальваническую пару, то сам будет сильно
корродировать.
При повышенных температурах ( — 600—700 °С) на хром
действуют едкие щелочи, но на него не влияют расплавленные
карбонаты щелочных металлов. Когда хром реагирует с парами
серы или сероводорода при 600—700 °С, образуются сульфиды.
В этом температурном интервале он также реагирует с
диоксидом серы. В окиси углерода при —1000 °С происходит
окисление металла, при —800 °С на него действует фосфор. Аммиак
взаимодействует с хромом при 850 °С с образованием нитрида,
а горячая окись азота образует с хромом как нитрид, так и
оксид. Пары кальция оказывают небольшое влияние на
раскаленный докрасна металл.
Помимо высокой коррозионной стойкости в ряде химических
сред, хром обладает повышенной твердостью, стойкостью
против износа, небольшим коэффициентом трения. Поэтому на
практике во многих отраслях машиностроения значительное
распространение получило электролитическое покрытие
хромом [289].
Селен. Соляная кислота не действует на элементарный
селен. Разбавленная азотная кислота слабо растворяет
загрязненный селен и почти не йСёйствует на селен высокой степени
чистоты. Концентрированная азотная кислота на холоде
быстро растворяет загрязненный селен, тогда как селен
высокой степени чистоты (99,99%) растворяется в ней очень
медленно,
Горячая концентрированная азотная кислота бурно
реагирует с загрязненным селеном, но реакция с селеном высокой
чистоты протекает чрезвычайно медленно.
Слабая серная кислота (до 6 н.) —холодная и горячая — на
селен почти не действует. Более концентрированная C6 н.)
горячая серная кислота энергично растворяет селен. Он
растворим в водных растворах щелочей.
Селен — типичный полупроводник. Применяется в
производстве полупроводниковой техники для изготовления
выпрямителей и фотоэлементов.
Металлургия выпускает нержавеющую сталь 12Х18Н10Е
(ЭП 47), содержащую селена 0,18—0,35 %.
Сталь 12Х18Н10Е по коррозионной стойкости та же, что и
и сталь марки 12Х18Н9, но обладает лучшей
обрабатываемостью на станках.
Селен и все его соли [325, 332] ядовиты. Поэтому
нержавеющую сталь с селеном, работающую в контакте с пищевыми,
биохимическими, лекарственными и другими продуктами, при
изготовлении соответствующей аппаратуры применять не
следует.
Молибден. Имеет равновесный потенциал —0,20 В.
Стационарный потенциал молибдена значительно положительнее и
зависит от окислительных условий среды. Для спокойного
аэрированного 0,5 н. раствора NaCl он равен +0,1 В. В щелочи
@,1 н. раствор), где окисная пленка на молибдене
неустойчива, потенциал оказывается отрицательным, порядка —0,23 В.
На молибдене могут образовываться защитные пленки не
только оксидного характера, но также и хлорокислого состава
(МоОСЬ). Поэтому молибден сохраняет устойчивое пассивное
состояние в средах, содержащих большое количество хлор-иона.
В восстановительных средах (водород, пары спирта, соляная
кислота и др.) молибден устойчив.
Молибден устойчив также в расплавах металлов натрия,
калия, лития, галлия, свинца, висмута, ртути и меди. Кроме
того, молибден быстро разрушается в расплавленном олове,
цинке, алюминии и железе. Он не стоек в расплавах щелочей
и окисляющих солей, например в NaNO3.
При повышенных температурах молибден окисляется
парами воды, двуоксидом серы, закисью и оксидом азота и дву-
оксидом углерода. В атмосфере водорода молибден инертен при
всех температурах, а в атмосфере азота относительно инертен
приблизительно до 1093 °С. Молибден не реагирует с
фосфором. При высоких температурах он реагирует с углеродом и
углеводородами, образуя карбиды, и с кремнием, образуя
силициды. Молибден реагирует с хлором и бромом при
температуре >250°С, а со фтором при комнатной температуре.
Теллур. Напоминает серу и селен, но менее активен и
имеет более ре^к^ льтпажрнные металлические свойства, чем
29
селен. При обычной температуре теллур устойчив на воздухе,
а при сильном нагревании загорается и переходит в ТеО2. При
повышенных температурах теллур непосредственно соединяется
с галогенами и некоторыми металлами, образуя с ними
соединения, известные под названием теллуридов. Теллур
растворяется в щелочах и поддается действию HNO3 и
концентрированной H2SO4.
Вольфрам. Равновесный потенциал для процесса W +
+ 2H2O->WO2 + 4H++4e равен —0,05 В. Стационарный
потенциал в 1 н. растворе НС1 равен +0,256 В и в 1 н. растворе
NaOH —0,315 В. Вольфрам в присутствии кислорода или
хлор-иона склонен к пассивации. Он устойчив в интервале всех
концентраций в НС1, HNO3 и Н3РО4, нагретых до 190 °С.
Вольфрам устойчив в холодных и горячих растворах
плавиковой кислоты, а также в разбавленной до 40 % серной
кислоте. В кипящей H2SO4 (>40%), т. е. в более
концентрированной кислоте, вольфрам не стоек. Он не корродирует в
холодной и горячей воде. В отсутствие кислорода водные щелочные
и аммиачные растворы не действуют на него. В присутствии
кислорода и других окислителей в расплавленных щелочах и
в расплавах азотистых солей вольфрам сильно корродирует.
Сера, бор, углерод и кремний при повышенных
температурах образуют соединения с вольфрамом. Вольфрам образует
с углеродом два карбида: W2C и WC.
Металлы группы VII
Марганец. Равновесный потенциал марганца равен —1,05В.
На воздухе марганец окисляется, образуя окислы фиолетового
цвета (МпО, МпО2, МпО3, Мп2О7). Самое устойчивое
кислородное соединение этого элемента — двуоксид МпО2. Как и железо,
марганец горит на воздухе или в кислороде при нагревании. Он
медленно разлагает воду на холоде и быстро при нагреве,
образуя гидрат закиси марганца Мп(ОНJ с выделением
водорода. Марганец легко растворяется в разбавленных
минеральных кислотах, при этом также выделяется водород и
образуются соответствующие соли двухвалентного марганца.
При нагреве фтор, хлор и бром реагируют с марганцем,
а с азотом или аммиаком Мп образует различные нитриды.
Марганец взаимодействует с серой с образованием сульфидов.
Он не стоек в окислительных в восстановительных средах,
растворяется в разбавленной азотной и соляной кислотах.
Расплавленный марганец, подобно железу, растворяет
углерод, образуя при этом карбиды. При температурах >330 °С
марганец реагирует с СО и СО2; взаимодействие начинается
при более высоких температурах. Существование гидридов
марганца не установлено, но твердый и жидкий марганец
растворяет заметные количества водорода, электролитический
марганец обычно содержит 0,015% Н. Освобожденный от водорода,
30
обработанный в печи металл является промышленным
продуктом, так как содержащие азот марганцевые сплавы
используют для введения марганца и азота в специальные коррозион-
ностойкие сплавы и стали. Кипящие концентрированные
растворы едкого кали и едкого натра почти не действуют на
марганец.
Рений. На воздухе начинает окисляться только при
1000 °С. Он практически нерастворим в НС1 и HF, но легко
растворяется в HNO3.
Галогены, за исключением иода, реагируют с рением очень
активно. Азот не реагирует с металлическим рением даже при
повышенных температурах.
Металлы группы VIII
Железо. Входит в группу VIII периодической системы
элементов Д. И. Менделеева, образуя в ней вместе с кобальтом и
никелем подгруппу железа. Нормальный равновесный
потенциал железа для процесса Fe-HFe2+ равен —0,44 В,
равновесный потенциал образования трехвалентных ионов железа Fe~>-
->Fe3+ составляет —0,0366 В.
На воздухе железо пассивируется и потенциал при этом
может составить +1,0 В. Однако железо, находящееся в
водных растворах, содержащих хлор-ион, быстро разблагоражн-
вается, что связано с нарушением пассивной пленки. В чисто
кислородной атмосфере железо находится в пассивном
состоянии, не корродирует. В большинстве слабокислых,
нейтральных и слабощелочных растворов при растворении железа
образуются нерастворимые продукты коррозии.
В кипящих (фтористоводородной, уксусной, муравьиной,
щавелевой и лимонной) кислотах железо сильно корродирует.
В кипящих растворах щелочей и особенно в расплавах оно
также неустойчиво. В аммиаке железо устойчиво, за
исключением горячих концентрированных растворов, в которых оно
растворяется, а также устойчиво в четыреххлористом углероде
до кипения. Однако в присутствии влаги наблюдается коррозия.
Кобальт. Равновесный потенциал равен —0,277 В, т. е.
немного отрицательнее равновесного потенциала никеля
В 3%-ном растворе NaCl электродный потенциал составляет
—0,45 В. Кобальт легко пассивируется, поэтому он коррозион-
ностоек по отношению к воде, влажному воздуху, щелочам и
органическим кислотам. Из металлов подгруппы железа
кобальт менее всех способен растворить водород. При нагреве
выше 300 °С на воздухе или в кислороде кобальт начинает
окисляться, при 900 °С окисление происходит довольно быстро.
Кобальт реагирует с галогенами, образуя соответствующие
галогениды и легко растворяется в НС1, H2SO4 и HNO3;
медленно разъедается едким натром и водным раствором аммиака.
31
Никель. Равновесный потенциал его для процесса
Ni^Ni2++2e равен — 0,25 В, стационарный потенциал в 0,5 н.
растворе NaCl составляет —0,02 В. Никель, так же как и
кобальт, пассивируется. Это и определяет в какой-то мере его
коррозионную характеристику. В атмосферных условиях никель
устойчив, немного тускнеет; в присутствии SO2 корродирует;
растворяется в аэрированных аммиачных растворах. Коррозия
никеля заметно повышается при увеличении концентрации
окислителей (FeCl3, CuCl2, AgNO3, Н2О2, Н2Сг04 и др.). Он не стоек
в HNO3 в гипохлоритах щелочных металлов и в
восстановительных средах, содержащих серу при температурах >315 °С,
но стоек в NH4OH горячем или холодном, в хладагентах
(фреоне).
Никель нетоксичен, не разрушает витамины, поэтому его
применяют в больших количествах в пищевой промышленности.
По данным работы [244], никель после литья наряду с
прочими примесями содержит водород и кислород. Если не
применять раскисления, металл получается пузырчатым.
Причиной образований пузырей в слитках является водяной
пар, образующийся по реакции NiO + Ni[H]^Ni + H2O, где
Ni[H] — количество водорода, растворенного в никеле.
Рутений. Вместе с другими элементами этой группы
(родием, палладием, осмием, иридием и платиной) образует
платиновую подгруппу. Рутений устойчив в кипящей уксусной,
бромистоводородной, иодистоводородной кислотах и в горячей
A00 °С) царской водке. Сильная коррозия наблюдается в
растворах HgCb и NaCIO не только при 100 °С, но и при
комнатной температуре. В хлоре, броме и иоде при комнатной
температуре рутений устойчив, он сильно окисляется при сплавлении
со щелочами.
Родий. Устойчив в кипящей уксусной и иодистоводородной
кислотах, в кипящей царской водке. В растворах HgCb, CuSO4,
A12(SO4K, FeCl3 при 100 °С родий не корродирует. Хлор, бром,
сероводород (сухие и влажные) при комнатной температуре,
кроме влажного иода, не действуют на родий. В
концентрированной H2SO4 и NaCIO при 100 °С родий корродирует со
скоростью 0,03 г/(м2-ч). В дымящей бромистоводородной кислоте
при 100 °С сильно корродирует.
При сплавлении со щелочами родий окисляется. Родиевая
чернь, получаемая при восстановлении родиевых солей смесью
алкоголя и едкого кали или смесью аммиака, муравьиной и
уксусной кислот, легко растворяется в присутствии воздуха
в концентрированных серной и соляной кислотах и царской
водке. Родий в виде черни является катализатором ряда
химических реакций: разлагает муравьиную кислоту на углекислоту
и водород при комнатной температуре, превращает
виннокислый калий в уксуснокислый и др. В присутствии родия
коричная кислота превращается в гидрокоричную, малеиновая в ян-
32
тарную, бензонитрил в бедензиламин, ацетон в изопропиловый
спирт, бензол в циклогексан, азобензол в циклогексан и
аммиак. Родий адсорбирует водород только в виде черни, При
нагреве до 400—450 °С адсорбция водорода резко уменьшается,
и чернь превращается в губку. После пребывания в атмосфере
кислорода родиевая чернь становится химически активной.
Сплавлением родия, цинка и кадмия с последующей
обработкой сплава соляной кислотой получают взрывчатый родий. При
нагреве до 100—200 °С в течение нескольких суток способность
родия к взрыву теряется. При получении родия указанным
выше способом, но без доступа кислорода нерастворимый
в кислоте остаток теряет способность взрываться.
Палладий. Стационарный потенциал для процесса
PcU=>=Pd2+ + 2e равен +0,987 В. Палладий не тускнеет и не
окисляется на воздухе. В промышленной атмосфере реагирует сЭОг-
Палладий стоек в горячей НС1, но в присутствии кислорода
значительно растворяется. Палладий растворяется при
комнатной температуре в царской водке. В кислотах (хлорной,
соляной, бромистоводородной при 100 °С), а также в растворах
FeCb, CuCb, NaCIO палладий неустойчив. Хлор, сухой и
влажный бром при комнатной температуре растворяют палладий.
В уксусной кислоте (ледяной), в растворах HgCb, CUSO4,
A1(SO4K при 100 °С палладий устойчив. В сероводороде
(влажном), иоде (сухом) при комнатной температуре
палладий также устойчив.
Платина. Является химически стойким металлом; ее
стандартный электродный потенциал при 25 °С для реакции Pt^
+±:Pt2+ + 2? равен +1,2 В. Стационарный потенциал платины
в 3%-ном растворе NaCl равен +0,4 В. Платина не
окисляется на воздухе и в кислороде до температуры плавления,
однако подвергается разрушению в атмосфере, содержащей СО.
Платина устойчива при 100 °С в хлорной и плавиковой
кислотах, а также в растворах HgCl2, СиСЬ и CuSO4. Платина слабо
корродирует при 100 °С в бромистоводородной кислоте.
Влажный хлор, бром и иод при комнатной температуре слабо
действуют на платину. В кипящей царской водке, а также в
бромистоводородной и иодистоводородной кислотах платина
неустойчива. При нагреве платины в аммиаке она чернеет
вследствие отложения на поверхности платиновой черни. Платина
в компактном виде (проволока, листы, лента), в виде черни и
в коллоидном состоянии представляет собой весьма активный
катализатор ряда химических реакций. Содержание в платине
никеля не снижает ее каталитического действия, алюминий,
кобальт и висмут значительно уменьшают, а медь, цинк, серебро,
олово и железо полностью нейтрализуют это действие.
Осмий. В кипящих растворах NaCIO, FeCl3,
бромистоводородной и иодистоводородной кислотах неустойчив, t, а также
при комнатной температуре в царской водке; во влажном броме
2 Заказ N9 1104 33
и иоде он устойчив. Порошкообразный осмии легко вступает
в реакцию с кислородом, легко поглощает водород. Такое
соединение может воспламеняться при комнатной температуре.
Иридий. Стандартный электродный потенциал для
реакции 1г=ё*1г3+ + 3е при 25 °С равен +1,0 В. Иридий устойчив
в кипящих бромистоводородной и уксусной кислотах, в
растворах HgCl2, CuSO4, A12(SO4K, а также в кипящей царской
водке; не растворяется в расплаве свинца.
ТРАВЛЕНИЕ ЧИСТЫХ МЕТАЛЛОВ
Для получения рельефных изображений на поверхности
деталей и выполнения сквозных отверстий применяют
электролитическое или химическое травление.
Железо травят на аноде в растворе следующего состава:
75 г/л FeCb, 50 г/л NaCl, анодная плотность тока 10—15 А/дм2;
температура раствора 18—25 °С.
Алюминий травят на аноде в одном из трех растворов:
1. 500 г/л Н3РО4 (плотность 1,54), 80—100 г/л NaCl. Анодная
плотность тока 40—60 А/дм2, температура раствора 18—25 °С.
2. 15—20%-ный раствор НС1. Анодная плотность тока 40—
60 А/дм2, температура раствора 18—25 °С. 3. 200 г/л СаС12,
200 г/л NH4C1, анодная плотность тока 30—60 А/дм2,
температура раствора 20—40 °С. Для химического травления
алюминия применяют кислотные и щелочные растворы. Для
кислотного травления используют раствор, содержащий 150 г/л
CuSO4-5H2O и 150 г/л НС1 (плотность 1,8), температура
раствора 20—40 °С. Для щелочного травления применяют раствор,
содержащий 650 г/л едкого натра, температура раствора 70—
80 °С.
Олово удаляют травлением на аноде в 10%-ном растворе
едкого натра. Анодная плотность тока 2—4 А/дм2, температура
раствора 70—80 °С. Катодами служат железные пластины.
Цинк травят в 5—10%-ном растворе серной или соляной
кислот, температура раствора 18—25 °С.
Кадмий травят в 10—15%-ном растворе азотнокислого
аммония при 18—25 °С.
Хром растворяют химически в 15—20 %-ном растворе
соляной кислоты при 18—25 °С. Такой раствор применяют для
удаления хрома с поверхности стальных, медных, латунных и
никелевых деталей. Его удаляют также травлением на аноде
в 10—15%-ном растворе едкого натра при анодной плотности
тока 10—20 А/дм2 и температуре раствора 18—25 °С. Такой
способ применяют для удаления хрома с поверхности стальных
деталей. Катодами служат стальные пластины.
Хром и никель удаляют растворением на аноде в 80 %-ном
растворе серной кислоты; анодная плотность тока 5—10 А/дм2,
температура раствора 18—25 °С. Катодами служат свинцовые
пластины
34
Никель травят химически в растворе: 40 % H2SO4, 20 %
HNO3, остальн9е вода, температура раствора 80—90 °С.
Медь травят в растворе 15—20%-ной H2SO4, температура
раствора 40—70 °С.
Свинец травят электролитически в 10—15%-ном растворе
едкого натра при анодной плотности тока 3—5 А/дм2,
температура раствора 60—70 °С. Катоды изготовляют из листовой
стали.
Молибден травят в смеси 50 % (объемн.) НС1, 5 % (объемн.)
HNO3, 55—45% Н2О, температура раствора 18—50 °С.
Ниобий и рений травят в смеси 35—50 % (объемн.) Н3РО4,
35—50 % (объемн.) НЫОз, остальное вода, температура
раствора 18—20 °С.
Золото травят в смеси, состоящей из 1 ч. (по объему)
концентрированной азотной кислоты и 3 ч. (по объему)
концентрированной соляной кислоты.
КОРРОЗИОННАЯ СТОЙКОСТЬ ЧИСТЫХ МЕТАЛЛОВ
Коррозионная стойкость чистых металлов приведена в табл. 1.
ТАБЛИЦА 1.
Коррозионная среда
1
Адипиновая
кислота
Азота окис-
пы (оксиды)
коррозионная стойкость
ЧИСТЫХ МЕТАЛЛОВ
(ПО ДЕСЯТИБАЛЛЬНОЙ ШКАЛЕ)
Состояние:
концентрация, %
(по массе)
2
—
—
Безводные
Влажные
Безводные
Влажные
Любой
концентрации
То же
N0
N20
Сухой газ
—
Температура, °С
3
90
90
90
60
20
20
20
20
20
200
20
20
500
150
20
Металл
4
Алюминий
Медь
Железо
Свинец
Алюминий
»
Железо
»
Медь
Никель
Серебро
»
Тантал
Никель
Свинец
Скорость
коррозии
мм/год
5
0,25
0,5
—
—
—
—
—
—
—
—
—
—
—
балл
6
7
6
5
5
1
10
5
10
10
10
1
10
10
5
5
сх >}«
S«^
к « ^
g Я к
7
[49]
[49
[49
[254
[173
[173
[173
[173
[173
[173]
[173]
[173]
[173]
[37]
[37]
2*
35
Продолжение табл. 1
1
Азота
окислы (оксиды)
Азот
Азотная
кислота
Азотная
кислота
2
—
___
0,1 н.
0,1 н.
0,1 н.
0,1 н.
0,1 н.
0,1 н.
0,5 н.
0,5 н.
1 н.
1 н.
1 н.
1 н.
1 н.
1 н.
2 н.
2 н.
2 н.
2 н.
2 н.
2 н.
2 н.
2 н.
2 н.
—
3—5
3—10
10
65
65
65
65
70
70
70
70
70
70
70
70
70
Дымящаяся
»
»
»
»
»
3
100
20
<2300
>300
18
18
18
18
18
18
35
60
18
18
18
18
18
18
35
60
18
18
18
18
18
18
18
—
100
20
100
20
20
20
20
100
100
100
100
100
100
100
100
100
18
18
18
18
18
18
4
Свинец
Цинк
Вольфрам
Ниобий*
Золото
Иридий
Палладий
Родий
Рутений
Серебро
Ванадий
»
Золото
Иридий
Палладий
Родий
Рутений
Серебро
Ванадий
»
Золото
Иридий
Осмий
Палладий
Родий
Рутений
Серебро
Медь
Молибден
Никель
»
Ниобий
Тантал
Титан
Цирконий
Серебро
Золото
Иридий
Осмий
Палладий
Платина
Родий
Рутений
Серебро
Золото
Иридий
Осмий
Палладий
Платина
Родий
5
—
___
___
—
—
—
—
—
—
0,025
0,Ю
—
—
—
—
—
—
0,069
88
—
—
—
—
—
—
—
—
—
3,0
10,0
0
0
0
0
—
—
—
—
—
—
—
—
—
—
—
6
10
10
<5
3
1
5
1—2
1—2
4
4
6
3
1
6—7
1—2
1—2
5
5
10
4
1—2
6—7
8
2
2
9
10
10
8
10
1
1
1
1
10
5
3
10
10
4
3
3
10
6
5
10
10
4
5
7
[37]
[37]
[49]
[49]
[42]
[42]
[42]
[42]
[42]
[42]
[20]
[20
[42
[42
[42:
[42
[42
[42
[20
20]
42
42
42
[42
.42]
42]
[42]
[49]
[2541
[1731
[1731
[20і
W
[20!
[20
42]
42
42
42
42
[42]
[42
[42
[42:
[42
[42
[42
[42
[421
42]
* Образуются нитриды ниобия.
Продолжение табл. 1
1
Азотная
кислота
Азотная
кислота
(красная)
Акрилонит-
рил
Алюминий
Алюминий
азотнокислый
Алюминий
азотнокислый
Алюминий
сернокислый
Алюминий
хлористый
2
Дымящаяся
»
16— 20NO2
16— 20NO2
6,5NO2
6,5NO2
16— 20NO2
—
—
—
—
—
Расплав
»
»
»
Водные растворы
до 43
Безводный и
влажный
Растворы
—
10
10
Насыщенный
Водные растворы
до 26
Растворы
»
Безводный
Растворы
3
18
18
20
20
20
20
150
20
20
20
20
^кип
20
20
750
750
750
—
—
20
100
20
20
20
20
20
20
20
20
—
20
100
100
100
100
100
20
^кип
20
100
100
100
100
100
Любая
»
20
20
4
Рутений
Серебро
Алюминий
Железо
Золото
Олово
Тантал
Алюминий
Никель
Свинец
Серебро
Тантал
Титан
Цинк
Железо
Ниобий
Никель
Платина*
Тантал
Алюминий
»
Медь
Никель
Свинец
Серебро
Титан
Цинк
Алюминий
Железо
Медь
Никель
»
»
Медь
Никель
Свинец
Серебро
»
Титан
Иридий
Палладий
Платина
Родий
Рутений
Свинец
Тантал
Алюминий
»
5
—
0,11
0,26
0,18
0,005
0
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
<0,1
<1,0
<0,1
—
—
—
—
—
—
—
—
—
0
0
—
6
5
5
6
6
6
3
1
<5
<5
<5
<5
<5
<5
<5
10
10
10
—
10
7
10
10
<5
<5
<5
<5
10
10
10
1
5
7
5
6
7
<5
<3
<5
<5
1
1
1
3
1
<5
1
1
10
7
[42]
[42
[173
173
173
173
173
[37
37
37
37]
37
37
37
173
187
173
173
187
37
37
37
37
37
[37
[37
[37
[173,
[1,73
[49
[49
[173
[173
[37
[37
[37
[254
[254
[37
[42
42
42
42
49
49
[49
[173
[173
* При высоких температурах образуется сплав, ухудшающий свойства платины.
Продолжение табл. 1
1
Алюминий
хлористый
Амилацетат
Аминобен-
зойная
кислота (смесь
изомеров)
Аммиак
2
Безводный
Растворы
»
»
»
Любой
концентрации
5—25
10
20
30
40
5-25
Безводный и
с 50 % Н2О
Безводный и
с 50, 80 и 90 %
бензина
Любой
концентрации
0,5—21,8
Газообразный
Концентрирован-
ЦТ TTI
МЫ ?\
Газообразный
Все концентрации
Растворы без О2
Газообразный
Растворы
Газообразный
Растворы
Все концентрации
То же
13-25
Растворы
Растворы без
кислорода
3
20
20
—
—
100
150
150
150
122
100
20
20
Любая
^кип
20—ТОО
20
20
20
20
20
20
20
20
20
20
20
зон
O\J\j
20
750
20
20
Высокая
20
20
20
20
20
100
20
20
4
Железо
Медь
Олово
Свинец
Серебро
Тантал
Титан
»
»
»
»
Цирконий
Алюминий
»
Магний
Алюминий
Медь
Никель
Свинец
Серебро
Тантал
Цинк
Алюминий
Никель
Свинец
Серебро
Тантал
Титан
Алюминий
»
>>
Вольфрам
Железо
Золото
»
Кадмий
»
Кобальт
Медь
Никель
Ниобий
Олово
Платина
і
5
0
—
—
—
0
0,006
<0,13
>* 1,3
>1,3
>1,27
0,0061
0
0
—
—
—
—
—
—
—
—
—
—
—
15,7
0,1
0,07
0
0
0
6
1
10
10
10
10
<5
1
3
6
8
8
8
3
1
1
10
<5
<5
5—10
<5
<5
<5
<5
<5
<5
<5
<5
<5
<5
10
5
7
5
1
1
1
Растрескивание
—
0
—
¦—
0
0
0
10
1
10
10
10
3
10
1
1
1
7
[173]
[173]
[49]
[173]
[49]
[173]
[151]
[И]
[151]
[151]
[151]
[И]
[151]
[173;
[173]
[173]
[37]
37
37
37:
[37]
[37
[37
[237
[237
[237
[237
[237
[237
[173
[173
[173
[173]
[173]
[173
[173
[173
[173
[173
[173
[2541
[254'
[173
[173
[49:
1173
[173]
38
Продолжение табл. 1
1
Аммиак
Аммоний
азотнокислый
Аммоний
бромистый
Аммоний
молибдено-
вокислый
Аммоний
сернистый
Аммоний
сернокислый
2
Газообразный
35
Щелочной раствор
Газообразный
Растворы без О2
Все
концентрации + О2
10
28
100
Водный раствор
10
Насыщенный
Растворенный
в H2SO4
Расплав
Растворы
10
10
70
Растворы
»
Пары
Насыщенный
раствор
Растворы
»
»
10
10
10
Насыщенный
раствор
Насыщенный
раствор + 2 % H2SO4
10
10
Насыщенный
—
Растворы
»
Нейтральные и
кислые растворы
Концентрированный раствор
То же
3
Высокая
20
20
300
20
20
^кип
100
40
18
18
18
18
18
20
20
^кип
60
120
—
20
100
70
^кип
—
100
100
—
20
20
20
20
20
180
20
100
—
—
—
Высокая
20
50
ПО
4
»
Свинец
»
»
Серебро
»
»
Тантал
Титан
»
Иридий
Осмий
Палладий
Родий
Рутений
Алюминий
»
»
»
»
»
Медь
Никель
»
Титан
Алюминий
Железо
Платина
Титан
Алюминий
Магний
Платина
Алюминий
Железо
Медь
»
»
Никель
»
Тантал
Титан
Цинк
Олово
Платина
Свинец
Свинец
»
5
Растрескивание
0,4
—
0
0
—
—
0
0,1
—
—
—
—
-—
—
0,003
—
—
—
—
—
—
1
<з,о
—
—
—
—
—
0
0
—
0,0096
—
0,20
—
16,0
<0,1
<1,0
—
—
0,21
—
—
0
0,07
0,9
6
4
10
1
1
10
10
1
5
3
2
2
2
2
2
2
2
5
8
10
5
10
3
8
2
7
10
2
4
1
1
6
3
10
6
8
10
5
7
4^-6
5
6
10
1
1
5
7
7
[173]
[173]
173]
173]
173]
173]
173]
[173]
[49]
[И]
[42]
[42]
[42]
[42
[42
173
[173
[173
173
173
173
173
173
173
[173
[173
[173
[173
[И
[173]
[173
[173
[49;
[254
[49
[49
[173
[173
[173
173
151
173
173
[173
[173
[173]
[173
Продолжение табл. 1
1
Аммоний
сернокислый
Аммоний
углекислый
Аммоний
фосфорнокислый
Аммоний
фтористый
Аммоний
хлористый
Аммоний
хлористый
Ангидрид
уксусной
кислоты
Ангидрид
фосфорной
кислоты
Анилин
Анилин
солянокислый
2
Растворы
Насыщенный
»
»
»
»
100
—
3
3
10
10
Все концентрации
Кислые растворы
—
—
—
10
5
Насыщенный
раствор
Все растворы
»
33
10-50
10—50
35+ 0,5NH3
Пары и растворы
10
Все растворы
»
99
Безводный
Влажный
—
Безводный
.
—
—
98 + 2А1С13
—
—
—
—
—
—
5-20
3
20
20
20
20
20
—
—
20
60
20
60
20
20
^кип
20
—
20
20
20
85
^кип
20
—
20
^кип
^кип
100
100
^кип
20
20
500
60
20
180
20
20
316
20
20
20-гКЙП
20
20
100
20
100
4
Серебро
Железо
Медь
Никель
»
Серебро
Тантал
Цинк
Алюминий
»
»
»
Железо
Хром
Цинк
Железо
Магний
Медь
Алюминий
Железо
Железо
»
Медь
Молибден
Никель
»
Платина
Свинец
Титан
Цирконий
Титан
Алюминий
»
Тантал
Титан
Алюминий
Медь
Свинец
Тантал
Титан
Алюминий
Медь
Никель
Свинец
Серебро
Титан
Цинк
Цирконий
5
—
—
—
—
—
0
—
0,027
0,7
0,23
25,5
—
—
—
—
—
—
0,03
0,17
8,0
—
—
0
—
—
0,1
—
0
<0,13
0,0048
—
—
—
—
<1,3
—
.
0
>1,3
—
—
—
—
—
—
—
0
6
2
5
10
2
9
9
1
4
4
7
6
10
10
8
10
10
5
10
4
6
9
10
10
1
8
10
5
10
1
6
2
3
5
10
10
8
3
10
10
2
1
8
3
10
8—10
7
5
3
10
1
7
[173]
[254]
[254
[254
[254
[254]
[173]
[173]
[173]
[173]
[173]
[173]
[254]
[254]
[173;
173
173]
173]
173]
173]
[173]
[254]
[254
[49
[49
[49
[49
[173]
[173]
[И]
[111
[И]
[173]
[49;
173]
151
173
173
173
173
173]
[И]
[173]
[173]
[37]
[37
[37
[37
[37
[151
Продолжение табл. 1
Анилин
хлористый
Ацетальде-
гид
Ацетанилид
Ацетил -
ацетон
Ацетилен
Ацетил
хлористый
Ацетилцел-
люлоза
5—20
Чистый
Безводный
Влажный
Безводный
Технический
Чистый
Чистый
безводный
23 %-ная,
растворенная в смеси
85 % ацетона и
15 % этилового
спирта
100
15
ип
20
п
20
20
10
20
20
20
п
20
20
20
20
20
20
20
20
Высокая
480
20
>200
>200
20
Титан
Алюминий
»
Медь
Никель
Свинец
Серебро
Тантал
Титан
Цинк
Алюминий
Никель
Свинец
Серебро
Тантал
Титан
Цинк
Алюминий
Никель
Свинец
Тантал
Титан
Алюминий
Железо
0,13
0,006
0,02
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
0
0
3
4
5—6
5
5
5
1
1
10
5
3
5
3
1
3
5
5
1
3
1
1
1
5—6
1
10
Золото вступает в соедине-
нение с ацетиленом
Медь с ацетиленом
образует ацетиленовую медь,
взрывающуюся при
нагреве и ударе
и
5-6
5
10
3
5
3
10
Никель
»
»*
Олово
Платина**
Свинец
Серебро
Тантал
Цинк
Цирконий
Железо
Титан
<0,1
0,1
—
<0,1
—
<0,1
<0,1
<0,1
—
0
* Охрупчивается.
¦¦ При красном калении охрупчивается.
Продолжение табл. 1
1
Ацетон
Барий
хлористый*
Бензальде-
гид
Бензилаце-
тат
Бензидин
Бензин
2
Технический
»
—
—
—
—
10
Растворы
»
Все концентрации
5—20
5—20
Водные
растворы, концентрация
до 20
»
»
»
50 %-ный раствор
в толуоле
Раствор в эфире
Раствор в воде
Растворы
»
»
—
—
—
—
—.
—
—
—
—
—
—
—
—
—
—
—
—
—
—
Бензин +
+ спирт +
+ сера
Бензин +
+ спирт
3
20
—
—
20
20
—
20
150
—
20
100
100
20
100
100
100
100
20
>100
179
—
—
—
—
20-/кип
20-/кип
^кип
20
20
20
180
20
20
—
—
/кип
/кип
^кип
20-/кип
20 /кип
20
20-/кип
20
20
4
Алюминий
Железо
Медь
Никель
Серебро
Тантал
Цинк
Алюминий
Железо
Магний
Серебро
Титан
Цирконий
Медь
»
Никель
Свинец
Тантал
Цинк
Алюминий
»
»
Кобальт
Медь
Никель
Свинец
Серебро
Тантал
Алюминий
Медь
Никель
Свинец
Серебро
Тантал
Алюминий
Железо
Алюминий
Медь
Никель
Свинец
Серебро
Тантал
Титан
Цинк
Олово
Цинк
5
0,0007
—
—
0
—
0
—
0,006
-0,1
—
—
<0,13
0,0018
—
—
—
—
—
—
0
0
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
6
1
5—6
3
1
3
1
5
3
5
10
3
6
2
3
6
2
3
2
10
2
1
10
10
10
10
5—10
5—10
2
<5
<5
<5
<5
<5
<5
10
10
5
5
5
5—10
5-8
3
3
5—10
3
1
7
[49]
[173
[173
[173
[173
[173
[173
[173
[49:
[49:
[173
[1511
49]
37]
37
37:
37
37:
37
[173)
[173]
[173]
[173]
[173]
[173]
[37!
[37
[37:
[37;
[37
[37
[37
[37;
[37
[173
[17з;
37]
37
37
37]
37]
37]
37]
[37]
[173]
[173]
• Скорость коррозии в разбавленных растворах по сравнению с концентрированными
больше.
Продолжение табл. 1
1
Бензин
Бензоил
хлористый
Бензоин
Бензол
Бензол
Бензойная
кислота
Бензосуль-
фоновая кис
лота
Бензотри-
хлорид
2
Моторный бензол
Коричневый
угольный
бензин + 1,13 %S
Безводный
»
50
Молярный
раствор в пиридине
Чистый
Бензол + 20 %
л Y~r ТУ f*\ T* О
спирта
Бензол + 1 %
н2о
Чистый
»
»
»
Чистый + сера
Чистый + спирт
Чистый
»
»
Чистый + спирт
Твердая
Все концентрации
»
Раствор в
пиридине
Пары
Все концентрации
Пары
Растворы
»
Насыщенный
раствор
Все концентрации
То же
»
»
»
»
»
—
—
—
3
20
20
20
200
20
30
20
20
20
20
—
20
20
—
—
^кип
20
—
—
При
сублимации
20
^кип
20
250
^кип
250
—
/кип
50
20 4- 60
100
20ч-/кип
20
20
20
100
20ч-/Кип
204-/кип
100
20
4
Цинк
»
Алюминий
»
»
Медь
Алюминий
»
Алюминий
Железо
Магний
Медь
Никель
Олово
Свинец
Серебро
Титан
Цинк
»
Алюминий
Железо
»
Медь
»
Никель
»
Свинец
Серебро
Титан
Алюминий
Медь
Никель
Свинец
Серебро
Тантал
Титан
Алюминий
Медь
Свинец
Серебро
5
—
0
—
—
2,49
—
0
—
0,0023
0
—
—
—
<0,13
0
—
0
—
—
—
—
—
0
—
—
0,13
—
—
—
—
—
—
0,4
—
—
—
6
9—10
9—10
1
10
10
8
3
1
3
5—6
2
1
1
5
5
1
6
1
5
3
8
10
10
5—6
2
1
10
2
6
6
5
5—8
6
5
3
7
5-Ю
5—10
5
5
7
[173]
[173]
173]
173]
173]
173]
[49]
[173]
[173]
[173,
49]
[173,
49]
[173,
/im
4У]
173]
173
173
173
151
173]
151]
173]
[173]
[173]
[173]
[173]
[173]
[173]
[173]
[173]
[151]
[37]
[37]
[37]
137]
[37]
[37
[37
[37
[37
[37
[37
Продолжение табл. 1
Борная
кислота
Бор
хлористый
Бром
Бертолетова соль, см. калий
До 4,8
» 4,8
» 4,8
» 4,8
» 4,8
5
5
Насыщенный
раствор
То же
Растворы
—
—
Влажный
Безводный
Влажный
Безводный
Влажный
Безводный
»
Влажный
Безводный
Влажный
Безводный
Влажный
Безводный
Влажный
Безводный
Влажный
Безводный
При красном
калении вольфрама
Безводный
Влажный
Безводный
Растворы
»
Все концентрации
»
Насыщенный
раствор
Все концентрации
Безводный и
растворы
Сухой
Влажный
—
Насыщенный
раствор
Влажный и
газообразный
60
100
100
^кип
20
20
100
20
'кип
20
20
20
20
20
20
20
20
150
150
18
18
18
18
18
18
18
18
18
18
20
—
20
20
20
20
20
20
—
100
20
20
20
20
^кип
60
30
Алюминий
»
Медь
Тантал
Цинк
Железо
»
Никель
Свинец
Серебро
Алюминий
Тантал
Алюминий
»
Медь
»
Тантал
»
Иридий
»
Осмий
»
Палладий
»
Родий
»
Рутений
»
Вольфрам
Железо
Золото
»
Кобальт
Медь
Никель
Ниобий
Олово
Платина
Свинец
»
Серебро
Титан
»
хлорноватистый
—
—
—
—
—
>Ю,0
<0,1
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
<0,1
0
—
—
—
—
<0,13
>1,3
6
10
5
3
10
5—6
10
3
5
3
2
10
1—2
10
3
10
7
1—2
1—2
2
2
10
2—8
10
10
2
2
2
2
2
10
3
10
5
10
10
10
5
1
10
5-г-б
5-г-б
10
10
6
8
37
37
37
37
37
[173
[173
[173
[173]
[173]
[173
37
37
37
37
37
37:
37
37
42
42]
|42]
42]
42]
421
[42]
[42]
[42
[42:
[173
[49
173]
173]
173]
173
173
173:
173
173
[173]
[173]
173]
173]
173]
151]
[И]
Продолжение табл.
1
Бром
Бромисто-
водородная
кислота
Бромисто-
водородная
кислота
Бромистый
метил
Бромистый
этилен
Бромоформ
Бутадиен-
1,3 (дивинил)
Бутан
2
Все концентрации
Растворы
Безводная
Растворы
Растворы +
+ Вг + HNO3
Все концентрации
Растворы
Растворы
До 40
40
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
3
20
—
—
—
—
—
—
—
18
18
18
18
18
18
100
100
100
100
100
100
20
100
20—100
100
20
100
100
20
20-/кип
20
20
100
20
^кип
20
20
20-/кип
20
20
20
20
^кип
20
20
20
20
20
100
20
20
20—100
20—100
100
4
Цинк
Алюминий
Железо
Медь
Никель
Олово
Платина
Серебро
Золото
Иридий
Осмий
Палладий
Родий
Рутений
Иридий
Осмий
Палладий
Платина
Родий
Рутений
Свинец
Тантал
Алюминий
Медь
Никель
Свинец
Тантал
Цинк
Алюминий
Медь
Никель
Свинец
Серебро
Тантал
Титан
Цинк
Алюминий
Медь
Никель
Свинец
Серебро
Тантал
Алюминий
Медь
Никель
Свинец
Серебро
Тантал
Титан
Цинк
Алюминий
Медь
Никель
5
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
6
10
10
10
5
10
10
10
10
ІЧ-2
2
2
10
6—7
2
2
10
10
10
8
2
8
2
7—10
5
5
5
5
5
8—10
5
5
5
5
5
5
10
5—10
5
5
5
5
3
5
5
5
5
5
3
6
5
5—10
5-Ю
5
7
[173
[173
[173
[173
[173
[49
[173
[1731
42]
42
42
42]
421
[42]
42]
42]
42]
42]
421
[42]
[37]
[37]
[37]
[37
[37
[37
[37
[37
[37
[37
[371
37]
37]
37]
37]
[371
[37]
[37]
[37]
[37]
[37]
[37]
[371
37]
37]
37
37
37
371
[37]
[37
[37
[37
1
Бутан
Бутилацетат
Винная
кислота
Виноградный уксус
Висмут
Вода:
почвенная
0,02H2SO4+
+ 0,13Fe
дождевая
дистиллированная*
2
—
—
—
—
—
—
—
—
—
—
—
—
10
Кристаллическая
Концентрированная
0,75
Все концентрации
Раствор без О2
Растворы + О2
Растворы + О2
0,1 н.
При pH = 2
0,75
Растворы
—
10—50
10—50
(аэрированная)
—
—
10
—
Расплав
»
»
»
—
—
—
—
—
—
—
—
—
3
20
20
100
20
20
20
60
20
20
20
^кип
20
20
20
20
100
20
^кип
20
20
75
20
100
—
—
75
100
100
20
20
'кип
20
20
980
1427
900
900
20
30
20
30
20
20
20
100
250
4
Свинец
Серебро
Тантал
Титан
Цинк
Алюминий
Медь
Никель
Свинец
Серебро
Тантал
Титан
Цинк
Алюминий
»
»
Железо
»
Медь
»
»
Никель
—
Олово
Свинец
Серебро
Титан
Цирконий
Алюминий
Железо
»
Медь
Олово
Вольфрам
Молибден
Ниобий
Тантал
Алюминий
Железо
Медь
Никель
Алюминий
»
Медь
Рений
Вольфрам
Продолжение табл
5
—
—
—
—
—
—
—
—
—
—
0,008
—
—
0,016
0,2
1,62
—
0,01
—
0
—
—
<0,013
0,0012
0,006
0,07
—
0,57
0,05
—
—
3,5
3,25
—
0,6
—
0
0,014
0,021
0,73
6
5
5
3
5
5
5
5
5
7
5
3
5
5
3
2
10
4
10
6
8
10
4
10
1
10
2
4
2
3
5
10
7
5
1
5
3
1
8
8
10
7
5-6
1
4
4
7
1
7
[37]
37]
37]
37]
37]
37]
37]
[37]
[37]
[37]
[37]
[37]
[37]
[49]
[173]
[173]
[173]
[49]
[173]
[173]
[173]
[49]
[49]
[173]
[173]
[254]
[11]
[151]
[49]
[173]
[173]
[49]
[173]
[187]
[187]
[187]
[187]
[173]
[173]
[173]
[173]
[173]
[173]
[173]
[217]
[320]
• Скорость коррозии при 250 °С составляет для СтЗ 0,8 мм/год, для стали 12Х18Н10Т
0,03 мм/год. Алюминий уже при температуре 150 °С сильно корродирует
46
Продолжение табл.
1
Вода:
дождевая
дистиллированная
дистиллированная
+ со2
водопроводная
эечная,
содержащая
хлориды
морская
минеральная с СО2
Воздух
Газы
2
—
—
—
—
—
—
—
—
—
Влажный + НС1
Влажный +
щелочные
загрязнения
Влажный + НС1
Влажный +
щелочные
загрязнения
Влажный + НС1
Влажный +
щелочные
загрязнения
Влажный + НС1
То же
Дымовые без
конденсата
Дымовые +
конденсат
Топочные без
влаги
3
250
250
250
250
250
250
250
250
250
20
150
20
20
20
12
95
20
20
20
20
20
20
20
—
—
—
—
—
20
20
20
20
20
20
20
20
—
—
—
4
Кадмий
Медь
Молибден
Никель
Ниобий
Платина
Титан
Хром
Цирконий
Никель
Олово
Цинк
Алюминий
Железо
Цинк
Титан
Алюминий
Железо
Медь
Никель
Олово
Свинец
Титан
Цинк
Цирконий
Алюминий
Медь
Олово
Свинец
Цинк
Железо
»
Медь
»
Никель
—
Титан
Цирконий
Алюминий
»
Медь
5
0,02
0,40
0,57
0,05
0,00
0,00
0,02
0,33
0,11
—
0
0,16
0,21
0,035
0,75
1,0
0,02
0,1
—
0,0127
0
0,022
0,0001
—
—
—
—
—
1,45
0,075
0,52
0,022
0,12
0
0
0,1
0
—
—
6
4
6
7
5
1
1
4
6
5—6
5
1
6
5-6
6
4
7
10
8
4
5
5
4
1
4
1
5
10
5
10
10
8
5
7
4
6
1
1
5
1
10
5-6
7
[320]
[320]
[320]
[320
320
320
320
320
320
173
173
173
173
[173
[173
[49
[254]
[254]
[49]
[173]
254]
254]
185]
151]
151]
173
254
254
254
[254
[185
[185]
[185]
[185]
[185]
[185]
[185]
[185]
[173]
[173]
[173]
Продолжение табл. 1
1
Галлий
Галловая
кислота
Гарпиус
Гексамети-
лентетрамин
Гексахлорбензол
Гексахлор-
циклогексан
Гидразин
Гидрат
окиси бария
Гидроксид
кальция
(гашеная
известь)
Гидроксила-
мин
сернокислый
Гликолевая
кислота
Глицерин
Глюкоза
Гудрон
Гуминовые
кислоты
2
Расплав
»
Расплав
»
»
»
1—50
—
С водой
20
20
32 %-ный раствор
в метаноле
Безводный
Концентрированный раствор
Все концентрации
То же
Расплав
Концентрированный раствор
Разбавленный
пягтипп
С бисульфитом
В процессе
гидролиза
Нейтральный
ПЯРТКЛП
w Civ* I DULJ
Водный раствор
—
—
—
—
—
—
—
—
—
—
—
—
—
3
800
300
450
450
400
450
100
—
—
—
66
20
20
20
20
^кип
100
—
20
20
20
20
20
80
70
40
^кип
—
100
100
100
100
^кип
100
20—tKun
20
20
—
100
100
20
20
4
Вольфрам
Молибден
Ниобий
Тантал
Титан
»
Алюминий
5
—
0,022
См. канифоль
Железо
Алюминий
Свинец
Титан
Алюминий
Цинк
Алюминий
Никель
Платина
»
Тантал
Цинк
Ниобий
Тантал
Титан
Цирконий
Свинец
»
»
Титан
Алюминий
Магний
Медь
Никель
Свинец
Серебро
Тантал
Титан
Цинк
Алюминий
Медь
Алюминий
Алюминий
Медь
Никель
Свинец
—
—
0,19
—
0,03
0
0
0
—
0,09
0,28
0
0
0,01
1,02
0,38
<0,13
0
—
—
—
0
—
—
—
—
6
1
5
5
1
5
10
4
5—6
10
5—6
6
5
5
4
1
1
10
1
10
5
8
1
1
4
8
6
2
1
10
7
5
10
7
5
3
5—10
5
5
1
5
5
5
10
7
187
187
187
187
[И
[И
[173
[173]
[173]
[173]
[151]
[173]
[173]
[173]
173
173
173
173
[173]
[20]
[20
[20
[Ю
[173
[173
[173]
[49]
[173]
[173
37
37
37
37
37
37
37]
37
37
49
37
371
37]
[37]
48
Продолжение табл. 1
1
Гуминовые
кислоты
d-винная
кислота
2
_
—
—
—
До 58
3
100
100
100
20ч- /кип
204-100
204-75
20—100
20
20
100
75
4
Серебро
Тантал
Титан
Цинк
Алюминий
Медь
Никель
Свинец
Тантал
Титан
Серебро
5
_
—
—
—
—
6
5
3
5
6—10
5—10
8—10
8—10
10
1
3
5
7
[37]
[37]
[37]
[37]
37]
37
37
37
37
37
37
Двуокись
хлора
Дибутил-
фталат
Дибутил-
фталат
Диоксан
Дихлорбен-
зол
Дихлор-
метан
Дихлорук-
сусная
кислота
Дихлорэтан
Декстроза. См.
Водные растворы
То же
»
»
»
15
15
—
—
—
—
—
—
—
—
—
—
—
—
—
—
5 %-ная НС1
5 %-ная НС1
—
—
—
—
—
—
глюкоза (виноградный
20
20
204-/кип
20
20
45
45
100
100
20
100
100
100
100
100
20—/кип
100
20
100
100
100
100
20
355
355
20—/кип
20—/кип
20—/кип
20—/кип
100
100
^кип
^кип
20
Алюминий
Медь
Свинец
Серебро
Тантал
Титан
Цирконий
Алюминий
Медь
Никель
Свинец
Серебро
Тантал
Титан
Цинк
Алюминий
Медь
Никель
Свинец
Серебро
Тантал
Титан
Цинк
Титан
Цирконий
Алюминий
Медь
Никель
Свинец
Серебро
Тантал
Титан
Цинк
Титан
Цирконий
Алюминий
Медь
Никель
сахар)
—
—
—
—
0
0,0007
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
0,1
0,025
—
—
—
—
—
0,13
0,21
—
—
5
10
5—8
10
1
1
1
5
5
5
5
5
3
5
5
5—10
5
5
5
5
5
5
5
5
4
5—10
5—10
5
5—10
5
5
5
5-Ю
6
6
5
6
2
[37
[37
[37
[37
[37
[185]
[185]
[37]
37]
37
37
37
37]
37]
37]
37]
37]
37]
[37]
[37]
[37:
[37
[37
[185
[185
37
37
37
37
37
37
37
[37]
[151
[151
[37]
[37]
[37]
Продолжение табл. 1
1
Дихлорэтан
Дихлор-
этилен
Едкое кали
Едкий натр
(гидрооксид
натрия)
2
—
—
—
—
—
—
—
—
—
6
33
Растворы
50
Растворы
Расплав
13КОН + 13КС1
10—50
10—50
Растворы
10
Разбавленные
растворы
10
Растворы
10
Расплав
13 КОН + 13 КС1
Растворы
13 КОН + 13 КС1
Разбавленные
растворы без О2
Концентрированные растворы
33
20
Расплав + О2
Растворы
Разбавленные и
концентрированные растворы
50
20
Разбавленные
растворы
Концентрированные растворы
0,8
20
20
Концентрированные растворы
3
^кип
20
^кип
20-/кип
^кип
^кип
^кип
^кип
^кип
^кип
*кип
20
20
—
35
>100
500
30
20
100
—
25
20
100
—
100
360
30
—
30
100
100
20
400
—
—
100
35
20
100
100
20
20
40
100
4
Свинец
Серебро
Титан
Цинк
Алюминий
Медь
Никель
Свинец
Серебро
Тантал
Титан
Титан
Железо
Кобальт
Медь
Никель
»
»
Ниобий
»
Олово
Рений
Свинец
»
Серебро
Тантал
Титан
»
Цинк
Цирконий
Вольфрам
»
Железо
»
Золото
Кобальт
Молибден
Медь
Никель
Ниобий
»
Олово
Свинец
Свинец
»
5
—
—
—
—
—
—
—
—
—
—
—
—
0
0,012
0
0,1
0,210
0,001
0,210
—
0,0062
—
—
0
—
—
—
—
0,0022
0
0
0
10,0
—
0
0
0
0,1
0,45
—
0,22
1,9
2,0
—
6
5
5
5
5
1
5
5
5
5
5
5
10
5
1
4
1
5
1
2
6
10
3
5
10
1
2
5
3
10
2
1
5—6
1
10
3
1
1
1
5
6
8—9
6
8
8
10
7
[37]
[37
[37]
37]
37
37
37
37]
37]
37
37
[173]
[185
[173]
[173
[173
[173
[173
[49
[49:
[173
[217
[173;
[173]
[173
[151
[151
[173
[173
[185
[187]
[187]
[49]
[143]
[173]
[173]
[187]
[49]
[49]
[187]
[187]
[173]
[173
[173
[173
Продолжение табл. 1
1
Едкий натр
(гидроксид
натрия)
Желатина
Железо
азотнокислое
Железо
сернокислое
закисное
2
10 + окислитель
Расплав +
окислитель
Разбавленные и
концентрированные растворы
Расплав
10
10
10
10
40
40
40
40
40
Расплав
»
»
»
»
»
»
»
»
Растворы
»
»
»
»
»
Растворы
1
1
10
10
Концентрированная
То же
Растворы
»
Расплав
Растворы
10
20FeSO4 +
+ ютю2 +
+ 19,5H2SO4
Растворы
»
»
1
3
20
550
100
—
20
20
20
*кип
20
20
20
20
80
500
500
500
500
500
500
500
500
500
80
—
80
20
—
—
^кип
20
100
20
100
20
100
^кип
^кип
20
94
70
—
^кип
До 100
4
Серебро
»
Тантал
»
Ниобий
Тантал
Титан
Ниобий
Тантал
Титан
Цирконий
»
Золото
Иридий
Никель
Осмий
Палладий
Платина
Родий
Рутений
Серебро
Алюминий
Железо
Медь
Никель
Олово
Серебро
Медь
Алюминий
»
»
»
»
»
Железо
Золото
»
Медь
»
Никель
Олово
Свинец
Серебро
Цинк
5
0,002
—
—
—
0,018
0,01
0,015
0,02
0,018
0,01
0,015
0
0,13
—
—
0,11
—
0,06
—
—
—
—
—
0,007
—
—
0,025
0,65
0,27
9,05
0,28
38,9
—
0
—
0,5
—
—
6
2
3
2
10
4
3
4
4
4
3
4
1
6
2
6
5—6
8
6
5
6
8
5
5-6
10
5-6
3
3
3
10
4
7
6
9
6
10
10
1
10
5
6
10
10
10
10
10
7
[173]
[173]
[187]
[173]
[20
[20
[20
[151
[20
[20
[20
[20
[151]
[60]
[42]
[60]
[42]
[42]
[60
[42
[42
[42
[173
[173]
[173]
[173
[173
[173
[193
173]
173]
173]
[173]
[173]
[173]
[173]
[49]
[186]
[186]
[186]
[186]
[173
[186
[173
[173
Продолжение табл. 1\
1
Железо
сернокислое
окисное
Железо
хлористое
Железо
хлорное
Изоприл
азотнокислый
Йод
2
Водные
растворы,
концентрация до 81
Растворы
Все концентрации
То же
»
Водные растворы,
концентрации до
38
20
Растворы
»
»
50
5
Растворы
»
1 — 15
1—15
Растворы
10
Растворы
—
Безводный
Пары
Раствор в спирте
1,5 %-ный
водный раствор
При красном
калении
Безводный
Водные растворы
3
20
100
^кип
100
20
20
45
*кип
Любая
20
20
20
100
20
100
20
100
20
100
100
100
^кип
20
*кип
^кип
—
20
—
20
20
20
100
^кип
^кип
^кип
100
100
100
100
100
20
20
20
20
20
—
20
20
4
Алюминий
Никель
Свинец
Тантал
Титан
Цинк
Железо
Золото
Медь
Серебро
Алюминий
Медь
»
Никель
»
Свинец
»
Серебро
»
Тантал
Титан
»
Цинк
Алюминий
Железо
Золото
Медь
Молибден
Никель
Олово
Тантал
Титан
»
Цинк
Цирконий
Иридий
Осмий
Палладий
Родий
Рутений
Титан
Алюминий
»
»
»
Вольфрам
Железо
»
5
—
—
—
>10,0
—
—
—
—
—
—
—
—
—
—
—
—
—
—
8,7
—
—
10,0
0
0,01
—
1,3
—
—
—
0,13
0
—
—
1,62
—
6
10
10
10
1
5
10
10
3
10
9
10
5
10
6
10
7
10
2
5
1
5
6
10
9
10
10
10
8
10
10
1
4
10
10
8
3
10
10
3
3
2
1
5—6
10
8
8
1
10
7
[37]
[37]
[37]
[37]
[37]
[37:
[173
[186
[186
[254
[37
[37
[37
[37
[37
[37]
[37]
[37]
[37]
[37]
[37]
[37]
[37]
49
[173]
[49]
[49]
[49]
[49
[173
[173
[173
[И
[173
[1511
42]
42
42
42
421
[151]
[173]
[49]
[173]
[173]
[187]
[173]
[173]
Продолжение табл. 1
1
Йод
Йод*
Йод
Йодистый
водород
Иодистово-
дородная
кислота
2
Сухой
Растворы в
этиловом эфире
Раствор в спирте
Водные растворы
»
»
»
Раствор в спирте
То же
»
»
»
Водные растворы
Сухой
Пары сухие
Пары влажные
Безводный
Влажный
Жидкий
0,5 о/ Н2О
Газ
Растворы
Раствор +
окислители
Растворы
Разбавленные
растворы
То же
»
»
»
»
»
»
»
»
»
»
»
»
»
»
3
20
20
18
18
20
20
20
20
18
18
18
18
18
20
20
600
20
20
170
170
170
170
300
20
20
20
^кип
20
20
20
100
20
20
100
100
100
^кип
100
100
100
100
100
100
100
4
Золото
»
»
Иридий
Медь
Никель
Олово
Платина
Палладий
Платина
Родий
Рутений
Серебро
»
Тантал
»
Цинк
»
Молибден
Ниобий
Тантал
Молибден
Ниобий
Тантал
Золото
Медь
Никель
Олово
Платина
Платина
Серебро
Алюминий
Медь
»
Никель
Свинец
»
Серебро
Тантал
Титан
Золото
Иридий
Осмий
Палладий
Платина
Родий
Рутений
5
—
—
—
—
—
—
—
—
—
—
0
0
—
—
0,009
0,010
0,005
0,009
0,010
0,005
—
0
0
—
—
—
—
—
—
—
—
—
—
—
—
6
2
о
о
10
8
2
10
10
10
10
6
1
6
6
6
10
1
1
0
10
3
4
3
3
4
3
10
10
1
10
1
10
10
7
5
10
3
5
10
6
2
3
3
2
8
9—10
9—10
3
3
7
[173]
[173]
[173]
[42]
[42;
[173
[173
[173
[173
42]
42
42
42
42
[173]
[173]
[173]
[173]
[173]
[41]
[41
[41
[41
[41
[41
[173
[254
[254
[173
[173
[173]
[173]
[37]
[37]
37]
37
37
37
37
[371
37]
42
42
42
42
І42]
[42]
[42]
Коррозионностойкие стали, Н70МФ и никель — нестойкие металлы в этих уело-
Продолжение табл.
1
Йодоформ
Калий
Калий азо-
тистокис-
лый
Калий
азотнокислый
Калий
бромистый
Калий
двухромо-
вокислый
Калий же-
лезосинеро-
дистый
(красная)
кровяная
соль)
2
Растворы
—
Расплав
»
»
Растворы
»
Раствор 10 %
Расплав
»
»
10
Растворы
10
Расплав
5
5
Растворы
»
»
»
Расплав
10
Растворы
5+5 %-ная
H2SO4
15
Разбавленные
растворы
Насыщенный
раствор
Водные растворы,
концентрация
до 10,7
Нейтральный
раствор
Щелочной
раствор
Растворы
»
»
Водные растворы,
концентрация
до 45
3
100
20
100
100
100
100
900
600
800
20
20
98
550
550
350
100
20
8
550
20
20
20
—
—
20
—
20
—
38
20
—
20
100
20
60
100
100
20
100
100
100
—
—
—
100
100
100
4
Алюминий
Медь
Никель
Свинец
Серебро
Тантал
Титан
Молибден
Титан
»
Алюминий
Магний
Алюминий
Железо
Золото
Молибден
Никель
Олово
Свинец
Серебро
Цинк
Алюминий
Железо
Никель
Свинец
Серебро
»
Алюминий
Магний
Медь
Свинец
Серебро
Титан
Медь
Никель
Свинец
Тантал
Титан
Цинк
»
Алюминий
»
Золото
Свинец
Серебро
Медь
Никель
Тантал
5
0
—
—
—
—
—
0
—
0,47
0
—
108
0,1
—
0,08
—
0,0005
0,004
—
—
—
—
0,0001
0
24,26
0,01
0
0,13
0
—
—
—
—
—
—
—
6
1
5
3
5
3
2
4
5
5
8
1
10
6
1
2
10
5
5
5
10
1
2
10
5
5
5
10
1
1
10
4
1
6
5
2
5
1
5
7
10
1
10
10
4
10
5
3
1
7
[173]
37]
37]
37]
37]
37
37
[187]
[И
[И
[173
[173]
[208]
[173]
[173]
[208]
[173]
[173]
[173]
[173]
[173]
[49]
[173
[173
[173;
—
[173]
[173]
[173]
[173]
[173]
[173]
[151]
[37]
[37]
[37]
[37]
[37]
[37]
[37]
[173]
[173]
[173]
[173]
[173]
[371
[37]
[37]
54
1
Калий же-
лезистоси-
неродистый
[желтая
кровяная
соль)
Калий
йодистый
Калий иод-
новатокис-
лый
Калий иод-
новатокис-
лый
Калий
кислый
щавелевокислый
Калий
ганцевокислий
Калий над-
сернокис-
лый
2
10
Насыщенный
раствор
Растворы
—
Водные растворы
до 59
Растворы
Расплав
Водные растворы
»
ДО 7
5
Водные растворы,
концентрация
ДО 6,0
Водные растворы,
концентрация
до 5,0
3
20
20
100
—
20
20
100
20
20
100
20
100
100
—
800
850
800
850
900
800
850
900
20
'кип
20
^кил
20
100
20
100
20
^кип
20
100
100
20
100
20
20
60
20
20
20
20
20
20
100
100
20
4
Алюминий
Золото
Никель
Свинец
Серебро
Алюминий
»
Никель
Свинец
»
Серебро
Тантал
Титан
Железо
»
»
Медь
Медь
Медь
Никель
»
»
Алюминий
»
Свинец
»
Тантал
»
Титан
»
Алюминий
Алюминий
Медь
»
Никель
Свинец
Тантал
Серебро
Алюминий
»
Железо
Медь
Никель
Свинец
Серебро
Тантал
»
Титан
Цинк
Продолжение табл
5
0,0161
0,1
—
—
—
—
—
—
—
—
—
8,25
13,2
13,8
16,8
30,1
1,2
4,0
10,0
—
—
—
—
—
—
0,06
<0,1
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
6
4
10
5
5
10
5
10
5
2
10
6
1
5
5
9
10
10
10
10
8
8
10
5
7
2
6
1
2
3
5
5
5
3
7
5
10
3
10
5
10
10
10
10
10
10
1
3
8
10
1
7
[173]
[173]
[173]
[173]
[173]
[37]
37]
37
37:
37
37
37]
[37]
[173]
[48]
[48]
[173]
[173]
[173]
48]
48]
48]
37]
37]
37]
37]
37]
37]
[37]
[37]
[173]
[37,
173]
37]
37]
37]
37]
371
[173]
[37]
[37
[173
[37
[37
[173
[37]
37
37
[37]
[254]
Продолжение табл. 1
1
Калий
роданистый
Калий
сернистый
Калий
сернокислый
Калий
углекислый
Калий
суснокислый
Калий
хлорнова-
тистокис-
лый
2
Водные растворы
до 68
Растворы
»
»
Растворы
»
Расплав
Растворы
Расплав
Растворы
Расплав
Концентрированный раствор +
+ 10 % NaCl
5
5
Кислые растворы
Расплав
»
»
Насыщенный
t\ орфвлп
pdLlbUp
Влажный
Насыщенный
раствор
Расплав
10 %-ный
Растворы
Растворы
Расплав
50
Водные растворы,
до 72
Водные растворы,
все концентрации
3
20
20
20
100
—
20
20
—
—
20
—
20
—
20
^кип
^кип
60
—
—
—
60
20
120
—
98
—
Любая
—
—
20
100
^кип
20
100
100
100
20
20
20
20
100
100
120
4
Никель
Серебро
Цинк
Алюминий
Железо
Платина
Железо
Золото
»
Платина
»
Серебро
»
Алюминий
Железо
Никель
Олово
Платина
Свинец
Серебро
Титан
Алюминий
Железо
Золото
Ниобий
Олово
Платина
»
Цинк
Алюминий
»
Медь
Никель
Серебро
Тантал
Титан
Алюминий
Медь
Никель
Свинец
Серебро
Тантал*
Титан
5
—
—
0
—
—
од
—
—
—
—
—
—
—
—
—
—
—
—
—
<0,13
0,08
—
1,63
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
6
5
3
10
1
10
5—6
5
2
10
3
10
8
10
5—6
10
5
10
10
5-6
10
6
3
5
3
8
10
1
5-6
10
5
10
5
5
5
1
5
3
4
5
5
5
10
2
7
[37]
[37:
[254
173
173
173
173
173
173
173
[173
[173
[173
[173]
254]
173
173
173
173
173
[151]
[151]
[151]
[173]
[181]
[173]
[173
[173
[173
[37;
[37
[37
[37
[37?
[37
[37
[37
[37
[37
[37
[37
[37
[37
* В щелочных растворах не стоек, в нейтральных и кислых растворах не
корродирует.
56
Продолжение табл.
1
Калий
хлорновато-
кислый
(бертолетова соль)
Калий
хлористый
Калий
хромовокислый
Калий
цианистый
2
5
5
5
5
Растворы
Расплав
12
12 + следы НС1
Водные растворы,
концентрация
до 6,8
Растворы
50
Растворы +
+ NaNO3
Расплав 20 без
воздуха
20 + воздух
Расплав
Насыщенный
раствор
Расплав
КС1 + KNO3
Растворы
Расплав
Насыщенный
раствор
35
Расплав
5—50
Растворы
Разбавленные
растворы
Растворы
»
Разбавленные
растворы
Концентрированные растворы
Разбавленные
растворы
Концентрированные растворы
Растворы
Расплав
Растворы
—
3
20
20
20
100
До *кип
370
^кип
^кип
^кип
100
20
20
20
—
860
80
80
800—900
100
860
>100
—
—
100
по
600
20
100
—
20
20
20
20
20
20
20
20
635
60
КИ18
100
4
Алюминий
Железо
Никель
»
Платина
»
Свинец
»
Серебро
Тантал
Титан
Цинк
Алюминий
Железо
»
Медь
»
»
Никель
»
Платина
Серебро
»
Тантал
Титан
»
Цинк
Алюминий
Железо
Магний
Цинк
Алюминий
»
Железо
Золото
Медь
Платина
Серебро
Никель
Палладий
5
0,006
—
0,1
1,0
0
—
0,64
3,4
—
—
—
—
—
—
—
5,2
0,2
3,7
6,5
0,1
2,1
—
—
0
0,13
—
0,004
0
0
0
—
—
—
—
—
—
—
—
—
—
6
3
10
5
8
1
10
7
8
3
1
2
6
10
10
5-6
9
6
8
9
5
8
10
1
10
1
6
7
2
1
1
1
5
5—6
10
5-6
10
9—10
9—10
9—10
8—9
5
6—7
8
10
7
[49]
[173
173
173
173
173
173
[173
[37
[37
[37
[254
173
173
173
[48]
[49]
[49]
—
[173]
[48]
[173
[173
[173
[173
[151]
[49]
149]
[173]
[173]
[173]
[173]
[173]
[173]
[173]
[173]
173]
173]
173
173
37
37
42
42
Продолжение табл.
Калий
цианистый
Калий
велевокислый
Кальций
азотисто-
кислый
Кальций
азотнокислый
Кальций
сернокислый
Кальций
хлористый
Кальций
хлорновати-
стокислый
Кальций
хлорновато-
кислый
2
_
—
—
—
5
Растворы
»
10
Растворы
Водные растворы,
концентрация
до 56
Водные растворы,
концентрация
до 0,2
Насыщенный
раствор
Растворы
25
0,15
0,18
10
62
1,5
Растворы
10
62
62
1,5
62
(аэрированный)
Водные растворы,
все концентрации
18—20
2—6
18—20
Водные растворы,
до 66
3
100
20
100
20
—
—
20
100
100
20
100
20
100
100
100
*кип
100
100
100
60
Любая
20
18
200
20
310
20
—
20
154
310
20
175
20
100
100
20
100
100
20
30
100
30
^кип
100
100
20
4
Платина
Свинец
Тантал
Титан
Алюминий
Алюминий
Магний
Алюминий
Железо
Алюминий
Медь
»
Никель
»
Серебро
Титан
Алюминий
Медь
Никель
Свинец
Тантал
Титан
Цинк
Алюминий
Железо
»
Медь
Никель
Олово
Свинец
Серебро
Тантал
Титан
Цинк
Цирконий
Алюминий
Медь
Никель
Свинец
Серебро
Тантал
Цинк
Титан
»
Цирконий
Алюминий
Медь
Никель
Свинец
5
0,057
0
0,0001
—
—
—
—
—
1,02
—
—
<0,13
—
0,006
0,54
0,01
0,4
0,09
—
0
1,0
1,71
_
—
—
—
0
0,13
0,025
—
6
8
10
1
10
5
1
10
1
10
5
5
10
5
10
5
5
8
5
5
1
1
6
10
3
7
4
1
6
5
10
5
1
8
10
8
10
8
10
8
5
1
10
1
6
4
5
8
7
7
7
421
37]
37]
371
[173]
[173]
[173]
[49]
[173
37]
37
37
37
37
37
37]
37]
37
37
37
371
[151
[173]
[173
[49
[173
[173
[185
[185
[49
[254
[185
[151
[185
[151
[37
137
[37
[37
[37
254]
254
151
151
1511
[37
[37
137
[37
Продолжение табл. 1
Кальций
хлорновато-
кислый
Камфора
Канифоль
Каприловая
и
каприновая кислоты
Карболовая
кислота
Каустический поташ
Каустическая сода
Квасцы
алюминиевые
Квасцы алю-
моаммиач-
ные
Квасцы алю-
миниево-
калиевые
Квасцы
калий
хромовые
Керосин
2
—
—
—
Расплав
—
—
5
10
10
Кислые растворы
45
45
45
45
45
45
Водные растворы,:
концентрация
до 10
1
10
Растворы
Насыщенный
раствор
То же
—
—
3
100
100
100
—
—
20
160
180
100
20—/кип
20—/кип
100
100
100
20
20
20
100
—
20
'кип
20
/кип
20
/кип
20
20
100
20
100
20
100
20
100
20
20
20
20
20
100
20
20
150
4
Свинец
Серебро
Титан
Алюминий
Железо
Никель
Алюминий
Медь
Алюминий
Медь
Никель
Свинец
Серебро
Тантал
Титан
Цинк
См. фенол
5
—
0,637
0,089
—
—
—
—
См. едкое кали
См. едкий натр
Алюминий
Никель
»
Олово
Цинк
Алюминий
»
Свинец
»
Медь
»
Алюминий
Медь
»
Никель
»
Свинец
»
Серебро
»
Цинк
Алюминий
»
Железо
Никель
»
Никель
Свинец
Титан
0,0512
0,1
1,0
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
1,0
3,0
—
—
0,004
6
10
5
5
4
5
5
7
5
4
6—10
5-8
10
5
1
1
10
5
5
7
10
](Л
1U
10
8
4
3
4
6
5
6
7
5
8
6
7
6
7
10
5—6
8—10
10
6
8
6
5
2
7
[37
[37
[37
[173
[173
[173
[15
15
37
37
37
37
37
37
37
[37]
[49
[173
[173
[173
[173
201
201
201
201]
201]
[201
[37
[37
[37
[37
[37
37
37
37
37
37
[173
[173
[173
[173]
[173]
[37
[37
[37]
Продолжение табл. 1
1
Крезол
Кремнефто-
ристоводо-
родная
кислота
Кремнефто-
ристоводо-
родная
кислота
Кротоновый
альдегид
Кумол (изо-
пропилбен-
зол)
Левулино-
вая кислота
2
Безводный, сырой
Растворы в спирте
—
—
—
—
—
—
—
Концентрация
до 35
10
10
10
10
10
10
10
10
10
—
—
—
—
—
—
—
—
—
—
—
—
—
—
z
—
—
—
—
—
—
3
140
60
20—100
^кип
20
100
100
100
20
20
20
100
20
100
20
60
20
60
20
20
60
20
70
70
70
70
70
70
70
70
70
20—100
100
20
20
100
100
100
100
100
60
100
100
100
100
20
20—100
20—100
20—100
50
100
100
50
20
4
Алюминий
»
Медь
Никель
Свинец
Серебро
Тантал
Титан
Цинк
Алюминий
Медь
»
Никель
»
Свинец
»
Серебро
»
Тантал
Титан
»
Цинк
Ванадий
Вольфрам
Медь
Молибден
Никель
Ниобий
Олово
Свинец
Хром
Алюминий
Медь
Никель
Свинец
Серебро
Тантал
Титан
Алюминий
Медь
Никель
Свинец
Серебро
Тантал
Титан
Цинк
Алюминий
Медь
Никель
Свинец
Серебро
Тантал
Титан
Цинк
5
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
13,5
0,07
2,8
0,17
2,2
4,5
3,7
3,0
0,03
—
—
—
0,0087
—
0
—
6
10
5—6
7—8
5
7
5
5
5
7
10
7
10
5
10
5
8
3
5
10
8
10
10
10
5
8
6
8
8
8
8
4
7
5
5
10
5
1
2
5
5
5
5
5
5
5
5
7-Ю
5—8
5—8
3
5
5
1
10
7
[173]
[173]
[37]
[37]
[37]
[37]
[37]
[37]
[254]
[37]
[37]
[254]
[37]
[37]
[37
[37
[37
[37
[37
[254
[371
254]
279]
279
279
279
279
2791
[279
[279
[279
[37
[37
[37
[371
37
37
37
37
37;
37:
37
37
[37]
[37]
[254]
[37]
[37]
[37]
[37]
[37]
[37]
[37]
[254]
60
Продолжение табл. 1
1
Лимонная
кислота
Литий
Литий
хлористый
Лития
гидрат
Магний
Магний
сернокислый
2
1 — 10,72
5
5
10
50+ Н2
50+ Н2
Насыщенный
раствор
5
50
10
0,2
0,75
Растворы
10—50
10—50
50, аэрированная
50, неаэрирован-
ная
Растворы
10—50,
аэрированная
Расплав
»
»
Водные растворы,
до 45
Расплав
»
»
»
Расплав
»
»
»
10
10
Растворы
»
Насыщенный
раствор
То же
3
20
70
20
20
20
20
20
20
20
*кип
20
20
—
^кип
20
100
^кип
Любая
100
900
1000
1000
20
100
20
100
^кип
20
60
20
100
100
20
850
850
850
20
100
20
600
610
1150
1150
20
^кип
100
Любая
60
2U
4
Алюминий
»
Железо
»
Медь
»
»
Никель
»
Ниобий
Олово
»
Свинец
Серебро
Тантал
Титан
—
Цинк
Цирконий
Молибден
Ниобий
Тантал
Алюминий
» t v:f
Медь 7
»
Никель
Свинец
»
Серебро
Тантал
Титан
Цинк
Железо
Медь
Никель
Титан
Алюминий
Никель
Серебро
Вольфрам
Молибден
Ниобий
Тантал
Алюминий
»
Никель
Свинец
Титан
Цинк
5
0,01
0,01
0,18
—
0,1
0,57
0,01
0,1
—
0,018
0,1
0,0025
—
—
0
<0,13
<1,3
—
0,0057
—
—
—
—
—
—
—
—
—
—
17,0
26,4
13,2
10
—
—
—
—
—
0,0006
1,6
—
—
0,13
—
6
3
4
6
10
5
7
4
5
8
4
5
2
10
1
1
6
8
10
3
5
5
5
8
10
5
10
7
2
6
5
5
5
10
10
10
10
10
10
8
5
5
5
5
5
1
8
5
1
6
5
7
[173]
[173
[173
[173
[173
[173
[173
[173]
[173]
[20
[173
173
173
173
151
151
151]
[173]
[151]
[187]
[187]
[187
[37;
[37
[37
[37
[37
[37
[37:
[37
[37
[37
[254
[151
[151
[151
37
37
37
37
[187
[187
[187
[187
[49
[173
173
173
151
[49]
Продолжение табл. 1
1
Магний
хлористый
Малеиновая
кислота
Марганец
сернокислый
Марганец
хлористый
Масляная
кислота
2
0,9
Щелок
0,1
0,1
5
0,6
0,9
Без
Растворы
42
1,2
42
<41
<41
<41
<41
<41
<41
<41
<41
<39
<39
<39
<39
<39
<39
<39
<39
—
—
—
—
—
—
—
5—20
20
1—50
1
Концентрированные растворы
То же
Растворы
1
1
—
0,5
1
—
3
20
20
*кип
15
200
183
20
20
100
100
Любая
132
20
^кип
20—100
20—/кип
20
20
100
100
20
20
60
100
100
20
20
100
20
20
100
20
60
100
20
20
100
100
100
20
60
20
60
—
20
60
20
60
20
4
Алюминий
тк
То же
»
Железо
»
Медь
Никель
Олово
Платина
»
Серебро
Титан
Цинк
Цирконий
Алюминий
Медь
Никель
Олово
Свинец
Серебро
Тантал
Цинк
Алюминий
»
»
Медь
Свинец
Серебро
Тантал
Титан
Медь
»
Никель
»
»
Свинец
Серебро
Тантал
Титан
Цирконий
Алюминий
»
»
»
Железо
Медь
»
»
Никель
Олово
Серебро
5
0,31
0,04
5,86
0,22
0,18
0,15
0,12
0
—
0
0,01
0
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
<0,13
0,0023
0,1
1,0
0,075
0,2
—
0,07
0,44
—
<0,1
0,02
—
6
6
4
9
6
6
10
6
6
1
10
5
1
4
1
5—10
5—10
5
10
6
5
1
10
5
7
8
5
5
5
5
5
5
8
5
6
8
10
5
2
6
2
5
7
5
6
10
5
6
8
5
4
2
7
[173]
[173]
[173
[173
[173
[173
[173
[173
[173
[173
[173
[151
[173]
[151]
[37]
[37
[37
[173
[37
[37
[37;
[37
[37
[37
[37
[37
[37
[37;
[37
[37
[37
[37
[ЗГ
[37:
[37;
[371
137]
[37]
[151
[151
[173
[173
[173
[173
[173
[173
[173
[173
[173
[173
[173
62
Продолжение табл. 1
1
Масляная
кислота
Медь
азотнокислая
Медь
сернокислая
Медь
уксуснокислая
Медь
хлористая
Медь
хлорная
Маркаптаны
2
Все концентрации
То же
»
Растворы
»
»
<17
<17
<17
<17
<17
—
—
—
—
—
Все концентрации
6,7
6,7
6,7
6,7
6,7
6,7
Растворы
»
»
»
»
40
Расплав
Растворы
—
—
—
—
—
—
—
—
Любая
»
»
Растворы
Любая
40
5
10
—
—
—
—
3
100
20
20
Любая
»
»
20
100
100
100
20
100
100
100
100
100
Любая
20
100
20
20
100
20
Любая
»
»
»
»
^кип
450
Любая
20
100
20
100
100
100
100
100
100
Любая
»
»
»
»
Гкип
100
35
100
20—100
20—100
20^КЙ~
20—100
4
Тантал
Титан
Цинк
Алюминий
Железо
Медь
Никель
»
Свинец
Серебро
Цинк
Иридий
Палладий
Платина
Родий
Рутений
Тантал
Алюминий
Медь
Никель
Свинец
Тантал
Цинк
Алюминий
Железо
Золото
Никель
Серебро
Титан
»
Цинк
Медь
»
Свинец
»
Тантал
Иридий
Палладий
Платина
Родий
Рутений
Железо
Золото
Медь
Никель
Серебро
Титан
Цирконий
»
Алюминий
Медь
Никель
Свинец
Серебро
5
—
—
—
—
—
—
—
—
—
—
0
>10
—
—
—
—
—
—
—
—
—
—
—
<1,3
—
—
—
—
—
—
—
—
—
—
—
0
0,0005
0,488
—
—
—
—
6
5
5
10
10
10
10
6
10
1
3
10
2
3
4
2
2
1
10
5
5
10
5
10
10
10
10
10
10
5
8
10
5
10
7
10
1
2
6
2
2
2
10
10
10
10
10
1
1
6
5
7—10
5—10
5—8
7—10
7
[37]
[37;
[254
[173
[173
[173]
37]
37
37
371
[254]
[42]
[42]
[42
[42
[42
[49
[37
[37
[37
[37
[37
[254:
[173
[173
[173
[173
[173
[173
[151
[173
37
37]
37
37
37
42
42:
42
[42]'
[42
[254
[173
[173
[173
[173
[151
[151
[151
[37
[37
137
[37
[37
Продолжение табл. 1
1
Маркаптаны
Метанол
Метилэтил-
кетон
Молочная
кислота
Монохлор-
уксусная
кислота
Мочевина
Муравьиная
кислота
2
См.
80
10,
концентрированная
1,0
1,0
80
0,5
10
10
10
10
10
85
1,0
Растворы
10,
концентрированная
То же
85
10—100
Любая
—
—
—
Растворы
В процессе
производства
Расплав
Расплав + CS2
40
Концентрированная
Газ
Растворы без О2
Газ '
3
100
100
20—100
4
Тантал
Титан
Цинк
5
_
—
—
спирт метиловый (древесный)
20
^кип
^кип
^кип
*кип
20
20
20
20
65
20
20
100
^кип
*кип
*кип
^кип
^кип
20
—
20
^кип
20
*кип
Любая
^кип
100
100
20
—
150
150
150
190-4-200
1904-240
100
^кип
100
100
zO— Гкип
20
20
650
20
100
Алюминий
Медь
Свинец
Серебро
Тантал
Титан
Цинк
Алюминий
Железо
Медь
»
»
Никель
»
Ниобий
Тантал
Титан
Цирконий
Ниобий
Олово
Свинец
Серебро
»
Тантал
Титан
Алюминий
Железо
Медь
Никель
Свинец
Алюминий
Железо
Никель
Свинец
Титан
»
Алюминий
Медь
Серебро
Тантал
Цинк
Алюминий
»
Вольфрам
Золото
»
—
—
—
—
—
—
—
0,018
—
0,06
0,3
—
<0,1
<1,0
0,01
0,0
0,0
0,0
0,025
0,09
—
—
—
0
0,13
—
7,4
6,8
0,6
—
—
—
0,8
7,7
0,017
0
—
—
—
—
—
0,04—
0,14
0,02—
0,10
0
0
—
6
1
5
5—10
7
[37]
[37]
[254]
5
5
5
5
1
5
5
4
10
5
6
8
5
7
3—4
1
1
1
4
5
10
2
8
1
6
10
9
9
7
10
10
10
7
9
4
1
10
10
3
1
5—10
4—6
4—6
1
1
10
[37
[37
[37
[37
[37
[37]
[254]
[173]
[254]
[49]
[173
[173
[173
[173
[20
[20
[20
[20
[20
[173
[173
[173
[173]
L173]
151]
173]
L173
[173]
[173
[173
[173
[173
[173
[173
[151
[151
[173
[37
[37
[37
[254
[173]
[173]
[173]
[173]
[173]
64
Продолжение табл. 1
Муравьиная
кислота
Мыло
Мышьи ко* :
вистый
ангидрид
Мышьяко- !
вая кислота
Натрий
Натриево-
калиевый
сплав
Натрий азо-
тистокис-
лый
Натрий
азотнокислый
2
Растворы без О2
Растворы + О2
—
10
20
20
10—25
Растворы без
Газ
Растворы
Растворы без О2
Разбавленные
растворы
10,
концентрированная
10—90
Все концентрации
Жидкое
В процессе
производства
Растворы
—
Жидкое
13—25
До 2
» 2
» 2
Расплав
Все концентрации
То же
»
»
»
»
»
»
Расплав
»
»
»
»
»
До 46
Все концентрации
Расплав
Раствор + иод
Расплав
3
20
20
—
20
20
100
100
100
100
20
20
—
100
*кип
^кип
20
—
—
—
—
20
—
100
20
20
20
—
20
20
100
20
20
100
100
20
900
1500
900
900
1000
1000
20
20
20
100
20
—
4
Медь
»
Молибден
Никель
»
»
Ниобий
Платина
»
Свинец
Серебро
»
Тантал
Титан
Цирконий
Алюминий
Железо
Золото
Медь
Никель
Свинец
Серебро
Цинк
Ниобий
Алюминий
Никель
Свинец
Тантал
Алюминий
Медь
»
Никель*
Свинец*
Серебро
Тантал
Цинк
Вольфрам
Молибден
Вольфрам
Молибден
Ниобий
Тантал
Алюминий
Медь
Никель
Алюминий
»
»
Железо
5
<0,29
<1,Ю
—
<0,1
<1,0
<3,0
0
0
—
—
0
—
0
1,3
0,005
0,26
—
0
—
—
—
—
—
0
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
0
0
—
—
6
6
8
10
5
7
8
1
1
10
10
1
10
1
8
3
6
5—6
1
10
1
10
2
5-6
1
7
5
5
10
10
5
10
10
10
5
1
10
5
5
5
5
3
2
5
7
7
1
1
10
10
7
[173]
[173
[190
[173
[173]
[173
[173
173
173
173
173
173
[173]
[151]
[151]
[173]
[254]
[173]
[173]
[173]
[173]
[173]
[173]
[232
[37
[37
[37
[37
[37
[37
[37
[37]
[37;
[37
[37
[254
[186
186
186
186
186]
[186]
[37]
137]
[37]
[173]
[173]
[173]
[173]
* В присутствии азотной кислоты и других окислителей.
3 Закяя ЛГо 1104
Натрий
азотнокислый
Натрий
борнокислый
Натрий
двууглекислый,
кислый
Натрий
кислый сернис-
токислый
Натрий
кислый
сернокислый
Натрий
кремнекислый
Натрий
кремнефто-
ристоводо-
родный
2
Расплав
»
»
»
»
»
»
»
»
»
»
»
»
До 20
До 20
До 20
До 20
До 20
10
Расплав
Все концентрации
То же
»
»
»
»
»
»
До 22
До 22
До 22
До 22
До 22
Расплав
Нейтральный
раствор
Щелочной рас-
твор
Растворы
До 37
» 37
» 37
» 37
0,75
Расплав +
воздух
Расплав + N2
или СО2
Расплав + Н2
3
_
—
310
—
—
—
—
—
—
—
20
20
20
20
20
^кип
*кип
20
—
100
20
100
20
^кип
100
100
100
20
100
20
100
100
^кип
100
20
20
60
20
100
20
20
50
—
—
—
4
Золото
Медь
Никель
Серебро
Тантал
Золото
Иридий
Осмий
Палладий
Платина
Родий
Рутений
Серебро
Алюминий
Медь
Никель
Свинец
Серебро
Та нтал
Титан
Алюминий
Серебро
Алюминий
Железо
Медь
Никель
Свинец
Серебро
Тантал
Титан
Алюминий
Медь
Никель
Свинец
Серебро
»
Тантал
Титан
Алюминий
»
Титан
Медь
Никель
Свинец
Серебро
Алюминий
Железо
Железо
Продолжение табу
5
—
<0,1
—
0
—
—
—
—
—
—
—
—
—
0,0003
—
—
6,4
—
—
—
—
—
—
—
—
—
—
0
—
<0,13
—
—
—
—
—
—
6
3
5-6
5
10
1
3
2
10
6
1
6
6
3
1
3
2
6
9
1
1
1
10
10
9
7
6
5
5
1
4
6
7
5
5
5
10
1
8
1
10
8
5
5
6
5
10
10
10
і. 1
7
173]
173
173
173
173
[42]
[42;
[42;
[42;
[42;
[42;
[42]
[42]
37
37
37
37
37
37
37
[49,"
173]
[173
[37;
[254;
37]
37
37
37
37
[37]
[37
[37
[37
[37
[37
[37
[37
[37
[151]
[173]
[151]
[37]
[37]
[37]
[37]
[173]
[173]
[173]
і
10 [173]
66
Продолжение табл. 1
•
Натрий
кремнефто-
ристоводо-
родный
Натрий
салициловый
Натрий сер-
нистокислый
Натрий
сернистый
Натрий
сернокислый
Натрий
углекислый
2
Расплав
15 %-ные
растворы
Растворы
10
Растворы
Любая
2,5
20
Все концентрации
Растворы
Расплав
Растворы
»
9 %-ный
Растворы
»
»
»
10
Насыщенный
раствор
48—57 %
48—57 %
48-57 %
65—70 %
10
10
14,2
Насыщенный
раствор
Расплав
Растворы
»
Расплав
»
Насыщенный
18
Насыщенный
Расплав
»
»
»
»
0,5
2,5—40
Расплав + воздух
Расплав -j- N2
Расплав + N2
Насыщенный
раствор
Расплав
1—20
3
—
70
—
20
20
20
75
20
20
20
—
20
20
98
20
20
20
20
^кип
20
172
190
20
20
85
^кип
—
—
20
—
—
*кип
100
60
—
—
—
—
—
20
20
850
850
850
104
-
100
4
Золото
Титан
Железо
Алюминий
Железо
Медь
Титан
Алюминий
Железо
Золото
»
Медь
Никель
Ниобий
Олово
Платина
Свинец
Тантал
Титан
»
Железо
Хром
Цинк
Хром
Алюминий
Железо
»
»
Золото
Медь
Никель
Платина
Серебро
»
Титан
»
Иридий
Осмий
Палладий
Родий
Рутений
Алюминий
»
Железо
»
»
Железо
Золото
Никель
5
—
—
—
0,0061
—
—
—
—
—
—
—
—
1,0
0,091
—
—
—
0
0,025
0,13
—
0,003
0,96
0,009
0,011
<0,010
0,П
—
—
—
—
—
—
—
—
0,13
—
—
—
—
5,7
10,0
115,0
10,0
0,056
—
б
10
9—10
10
3
10
5
5
10
5
10
10
10
7
5
10
10
10
1
4
6
10
2
8
3
4
4
6
10
5
3
3
10
10
10
5
6
2
6
8
8
6
9
10
10
10
9
5
10
8
7
[173]
[151]
[173]
[173]
[254
[173
[151
[49
173]
173]
1731
[173]
[173]
[181]
[173]
[173]
[173]
[173]
[189]
[151]
[237]
[237]
[237]
[237
[49
[173
[254
[254]
[173]
[173]
[173]
[254]
[173]
[254]
[151
[151
42]
42
42
42
42
173
173
173
173
1731
[173]
[173]
[173]
Продолжение табл. 1
1
Натрий
углекислый
Натрий
суснокислый
Натрий
форнокислый
Натрий
форнокислый двухза-
мещенный
Натрий
фтористый
Натрий
хлористый
2
Расплав
0,5
Расплав
Растворы
»
Расплав
20
1 н. раствор
Растворы
<32
<32
<32
<32
<32
<32
1 — 10
—
8
Растворы
Расплав
Насыщенный
раствор
10
Растворы
Расплав
Растворы
10
Разбавленные
растворы
Насыщенный
раствор
Расплав
Растворы
Расплав
»
До 4
Концентрированный раствор
Концентрированный раствор +
+ Н2О2
25
Насыщенный
»
Расплав
Раствор -|-
+ NaNO2 +
+ квасцы
Расплав
5
10
3
—
20
100
—
^кип
20
20
60
*кип
^кип
100
100
100
98
100
100
98
—
—
20
98
^кип
—
—
85
850
—
950
850—900
20
20
20
98
20
70
8004-950
—
880
20
20
4
Ниобий
Олово
Платина
Свинец
Тантал
»
Титан
Алюминий
Железо
Медь
»
Свинец
Серебро
Тантал
Титан
Алюминий
Медь
Никель
Ниобий
Серебро
—
Титан
Алюминий
Никель
Серебро
Цинк
Алюминий
Железо
»
»
Магний
Медь
Никель
Тантал
Алюминий
тк
Алюминий
тк
То же
Железо
»
»
Золото
Медь
»
Никель
5
_
—
—
—
0
—
0,13
0,007
—
—
—
—
—
—
—
—
—
—
1,34
—
—
<0,13
0,04—
0,054
0,005
—
—
0,019
—
2,16
>10,0
0
10,0
<5,0
—
—
—
30,1
0,075
0,52
5,5
—
10,0
0,021
0.1
6
10
10
10
5
1
10
6
3
10
5
8
10
5
2
5
12
7
5
3
3
10
6
5
3
10
10
4
6
8
10
1
10
8
10
5—6
10
10
5
7
9
10
10
4
5
7
173]
173]
173]
173]
173]
173]
151]
173]
[173]
[37;
[37;
[37
[37
[37
[37
[173
[37;
[49
[181
[49
[49]
[151]
[173]
[254]
[254]
[254]
[49]
[173]
[173]
[48
[173
[48
[48
[37
[173
[173]
[173]
[185]
[49]
[48]
[173]
[48]
[49]
[49.
173]
68
Продолжение табл. 1
1
Натрий
хлористый
Натрий
хлорнова-
тистокис-
лый
Натрий
хлорновато-
кислый
Натрий
цианистый
Натрий
велевокислый
Никель
азотнокислый
2
Насыщенный
раствор
Расплав
Насыщенный на
холоде раствор
0,8
Расплав
Растворы без О2
Растворы + О2
Расплав
20
3 + 8 % НС1
0,5—1,0 %
Насыщенный
раствор
<26,4
<34
<34
<34
<34
<34
<34
<34
—
—
—
—
—
—
Растворы
20
До 50
Растворы
»
Расплав
»
Растворы
»
То же + О2
Насыщенный
pdLTBUp
То же
Любая
Растворы
»
<48
3
75
8004-950
100
20
—
—
—
—
^кип
90
—
75
150
20
20
20
20
100
20
100
100
100
100
100
100
100
100
20
100
^кип
^кип
95
20
20
—
—
20
—
—
20
—
—
—
20
100
150
20
4
»
»
Ниобий
Олово
Платина
Серебро
»
»
Титан
»
Цинк
Цирконий
Тантал
Алюминий
Медь
Никель
Свинец
Серебро
Тантал
Титан
Иридий
Осмий
Палладий
Платина
Родий
Рутений
Алюминий
Медь
Свинец
Серебро
Тантал
Титан
Алюминий
Железо
»
Золото
Платина
Свинец
Серебро
Титан
Алюминий
Железо
Алюминий
Железо
Никель
Свинец
Тантал
Титан
5
2,27
3,5
0
0
0
—
—
0
0,0017
0,00007
0,475
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
0,16
—
—
—
—
—
—
—
—
—
—
0,13
0,027
—
—
—
—
—
—
—
в
8
8
1
1
2
1
6
10
1
2
1
6
1
10
10
8
7
6
1
3
6
10
10
5
6
10
6
10
6
3
1
3
10
10
5—6
10
3
5
5
6
4
10
10
10
10
5
\
2
7
[185]
[48]
[173]
[49,
179]
[173]
[173]
173]
173]
189]
151]
[49]
[185]
37]
37
37
37
37:
37:
37
37
[42
[42
[42
[42
[42
[42
[37
[49
[37
[37]
[37]
[37]
[173]
[173]
173]
173]
173]
173]
173]
[151]
[49]
[173]
[37]
[173]
[37]
[37]
[37]
[37]
Продолжение табл. 1
1
Никель
сернокислый
Никель
хлористый
Никель
хлористый
Нитробензол
Нитроглицерин
Нитрофенол
Нитробензол,
каталитическое
восстановление
Нитрозил
хлористый
Оксид
свинца
Оксид
углерода
2
<28
<28
<28
<28
<28
<37,5
<37,5
<37,5
<37,5
<37,5
<37,5
5—20
5—20
Нитробензол +
+ HNO3
То же
—
—
—
При изготовлении
То же
—
—
—
—
—
—
—
—
—
—
Твердая
»
»
—
—
—
—
—
—
—
3
20
20
100
100
100
20
100
100
20
^кип
150
100
100
—
—
—
—
—
—
140
100
200
200
—
—
20
100
20
100
—
—
20
100
700—800
Высокая
450
20
550
500—700
—
Красное
каление
300
4
Алюминий
Медь
Никель
Свинец
Тантал
Алюминий
Медь
Никель
Свинец
Серебро
Тантал
Титан
Цирконий
Железо
Никель
Алюминий
Железо
Магний
Свинец
Железо
Медь
Никель
Титан
Алюминий
Железо
Золото
»
Олово
Платина
»
Серебро
Цинк
Алюминий
Тантал
Железо
Серебро
Цинк
Алюминий
»
Железо*
Кобальт*
Медь
Молибден
Никель**
Платина
Серебро
5
>10
—
—
—
—
—
—
—
—
—
—
<0,13
0,0003
17,0
—
—
—
—
—
—
0,18
—
—
—
—
0
0
—
—
—
—
—
—
0
—
—
—
—
—
6
10
10
7
3
1
10
10
10
10
5
1
6
1
10
10
3
5
10
5
5
6
9
9
10
10
1
3
10
1
2
3
10
10
1
10
10
10
1
5
—
—
10
10
10
10
7
[37]
37]
37]
37]
37]
37]
37]
37
37
37
37
[151
[151
[173;
[173]
173]
173]
173]
173
173
[173
[202
[202
[173]
[173]
[173]
[173
[173
173
173
173
173
[37
[37
[173
[173]
[173]
[173
[173
[173
[173
[173]
[173]
[173]
[173]
[173]
* Разлагают окись углерода до углерода.
** Катализатор разложения окиси углерода.
70
Продолжение табл. 1
1
Оксид
углерода
Олеиновая
кислота
Олово дву-
хлористое
Олово
хлористое
Олово
хлорное
Пальмитиновая
кислота
Парафин
Перекись
(пероксид)
бария
Перекись
(пероксид)
водорода
2
Сухая + О2
—
—
—
—
—
—
Водные растворы
То же
»
Растворы
—
Насыщенный
раствор
5—10
5—24
ДоЗ
—
—
—
—
—
—
—
—
—
Растворы
Расплав
»
Растворы
6
<50
Техническая
»
Растворы
»
В процессе
производства
3—30
3
350
20
130
130
130
130
300
100
20
20
20
20
100
—
20
20
100
150
20
20
20
20
20
150
150
^кип
100
100
100
100
100
100
100
20
—
20
20
—
20
20
20
20
100
20
4
Тантал
Цинк
Алюминий
Железо
Медь
Никель
Серебро
Цинк
Алюминий
Медь
Никель
Свинец
Титан
Алюминий
Никель
Тантал
Титан
Цирконий
Алюминий
Медь
Никель
Свинец
Серебро
Тантал
Титан
Алюминий
Алюминий
Железо
Медь
Никель
Свинец
Серебро
Титан
Цинк
Железо
Золото
Платина
Серебро
Алюминий
Алюминий*1
Железо*2
Марганец*3
Медь
Никель
Тантал
Титан
5
_
0
0,005
0,051
1,166
0,31
' —
—
—
—
—
—
—
—
—
0
0,13
0,0033
—
—
—
—
—
—
0
0
—
—
—
—
—
—
—
—
—
—
—
0,0002
—
—
—
—
—
0
<0,13
6
1
1
3
5
8
6
3
10
10
8
8
10
6
10
10
1
6
2
10
10
10
10
10
1
2
1
1
3
2
1
2
2
1
3
5
10
10
3
1
—
—
—
10
5
1
6
7
A73]
[173
[186
[186
[186
[186
[254
[254
37
37
37
37
[151
[173
[173
[173
[151]
[151
[37
[37;
[37
[37
[37
[37
[37
[37,
173]
[173]
[173
37
37
37
37
37
254
173
173
173
173
[49
173
173
173
173
173
173;
[151]
•' Пригоден для перевозки воды.
*2 Неприменимо, так как происходит каталитическое разложение H2Oj.
*а Неприменим в чистом виде и в сталях, так как происходит сильное
каталитическое разложение Н2О2.
Продолжение табл. 1
1
Перекись
(пероксид)
натрия*1
Перхлор-
этилен
Пиво
Пикриновая
кислота
Пиридин
Пирогаллол
Производство поливи-
нилацеталей
(в водных
растворах
смесей)
Масляный
альдегид*2
Соляная
кислота
Циклогекса-
нон +
соляная кислота
2
Расплав
»
»
Расплав
»
»
»
»
Растворы
»
»
—
—
—
—
В процессе
производства
Насыщенный
раствор
Расплав
—
Расплав
—
—
—
—
100
—
6
4
10
1,5
3
—
—
—
20
100
100
100
250
250
250
25
25
25
25
25
—
20
125
20
125
—
125
20
20
^кип
60
^кип
100
—
20
50
35
4
Золото
Иридий
Осмий
Палладий
Платина
Родий
Рутений
Серебро
Железо
»
Серебро
Тантал
Железо
Титан
Цирконий
Алюминий
Медь
Никель
Олово
Цинк
Алюминий
Железо
Медь
Никель
Олово
Свинец
Цинк
Алюминий
Медь
Свинец
Титан
Цинк
Алюминий
Железо
Титан
»
»
5
_
—
—
—
—
—
—
—
—
—
—
0,675
3,25
1,0
—
—
—
—
—
—
10,0
—
—
0
—
—
—
—
—
0,13
—
0
—
0,0023
1,77
0,06
6
10
8
8
10
10
6
8
2
5
10
10
10
7
8
7
8-10
5
3
3
10
10
10
10
10
1
10
10
10
7
7
6
7
1
10
2
8
5
7
42]
42]
42]
42]
42]
42
42
42
[173
[173
[173
[173
185
185
[185
254
173]
173]
173]
[173]
[49,
173]
[49]
[173]
[49]
[173]
[173]
[173]
[37]
[37]
[37]
[151]
[254]
[173]
[173]
[291]
[291]
[291]
*' Перекись (пероксид) натрия — очень сильный окислитель. Многие органические
вещества при соприкосновении с ним воспламеняются.
*2 Коррозионностойкая сталь 12Х18Н10Т при 20 °С корродирует со скоростью
0,48 мм/год, а при 50 °С 5,25 мм/год.
72
Продолжение табл.1
I
Формальдегид +
соляная
кислота + этил-
целлозольв
Производство
поливинил ацетал ей
Формальдегид*1 +
соляная
кислота + этил-
целлозольв
Формальдегид +
соляная
кислого #2
та
То же
Формальдегид +
соляная
кислота + аце-
тальдегид
Формальдегид +
соляная
кислота +
ацетал ьдегид*3
То же
Производство
ирисового эфир-
Т Т ґ~\ Т^ґ\ \(л л Tf л
ного масла
Гидродистилляция
ириса*4
Производство карбами-
ноилхлори-
да*5
2
3
3
45
1
1
45
3
10
10
3
3
6
1
3
3
Паровая и жидкая
фазы
3
90
90
60
90
70
20
70
95—100
350-400
4
Титан
»
»
»
»
Титан
»
Алюминий
Железо
Титан
Цинк
Вольфрам
Молибден
Никель
Ниобий
Тантал
Титан
5
1,15
0,05
3,1
12,3
1,45
0,004
0,38
—
—
—
—
0,04
0,02
1988
506
2,48
142
6
8
5
8
10
8
2
6
10
10
1
10
4
4
10
10
8
10
7
[291]
[291]
[291]
[291]
[291]
[291]
[291]
[128]
[128]
[128]
[128
[64
[64
[64
[64
[64]
[64]
корродирует со скоростью
при 20 СС корродирует
5 мм/год,
со скоростью
*' Коррозионностонкая сталь 12Х18Н10Т
*2 Коррозионностойкая сталь Х18Н10Т
0,33 мм/год, а при 70 °С 7,80 мм/год.
*3 Коррозионностойкая сталь Х18Н10Т при 20 °С корродирует со скоростью 0,33,
а при 70 °С 7,80 мм/год. „ „
*4 Дегустация образцов ириса, находящихся в контакте с коррозионностоикои
сталью Х18Н10Т, показала, что масло темнеет и приобретает резкий неприятный запах.
*5 Коррозионностойкие стали, сплавы ХН65МВ и Н70МФ являются нестойкими
мс і амілами.
Продолжение табл. 1
1
Производство сульфи-
доаммония*
Восстановление до
сульфида
Пропионо-
вая кислота
Расплав
Ртуть**
Ртуть
Ртуть
хлорная (сулема)
Ртуть
хлористая
(каломель)
2
(NH4),S
400 г/л
(в реакторе
сероводород и
аммиачная вода)
Расплав
80
Безводная
1 н. раствор
1 н. раствор
Пары
2А1С13+ INaCl
Влажная
Безводная
—
—
—
—
—
—
<6,6
<6,6
<6,6
<6,6
<6,6
<6,6
Растворы
»
»
»
»
—
1 н. насыщенный
раствор
3
55—60
1000
250
20
250
20
190
200
20
20
600
Любая
500
400
600
—
Любая
»
20
20
100
20
20
100
20
20
20
100
20
—
100
4
Алюминий
Титан
Золото
Медь
Платина
Цирконий
Алюминий
»
Железо
Магний
Никель
Свинец
Титан
Алюминий
Молибден
Никель
Свинец
Титан
Алюминий
»
Вольфрам
Золото
Молибден
Никель
Ниобий
Олово
Платина
Серебро
Тантал
Алюминий
Медь
Никель
Свинец
Серебро
Титан
Алюминий
Железо
Никель
»
Золото
Серебро
Титан
5
—
—
—
—
—
3,58
—
—
0,075
—
0,99
<1,3
4,87
0,51
4,92
7,84
12,4
—
—
0,1
—
—
—
—
—
—
<1,0
—
0,005
—
—
<0,1
<1,0
—
<0,13
6
4—5
3—4
5
8
5
5
8
9
10
5
8
7
8
8
7
8
9
10
10
5
3
10
5
5
2
10
2
10
1
10
10
7
10
10
3
10
10
5
7
5
10
6
7
[210]
[210]
266]
266]
266]
266]
173]
173]
[173]
49]
49]
49
49
80
80
80
80
80
[173
173
187
173]
173]
[173]
[185]
[173
[173
[137
[185
[37
[37]
[37]
[37]
[37]
[37
[173
[254
[173
[173
[173
[173
[173,
151]
* В этих условиях будут стойкими алюминиевые сплавы типа АМц и АМг-3.
** Коррозионностойкая сталь 12Х18Н10Т в этих условиях корродирует со скоростью
13,0 мчи/год.
74
Продолжение табл. 1
1
Салициловая кислота
Сахар
Свинец
Свинец
азотнокислый
Свинец
суснокислый
Свинцово-
висмутовый
сплав
Свинцово-
оловянный
сплав
Селен
Селеновая
кислота
Селеновая
кислота
2
Насыщенный
раствор
Растворы
»
В процессе
производства
Жидкий сок
Густой »
Сырой »
» »
Сироп слабый и
концентрирован-
ныи
То же
—
Расплав
»
»
»
»
»
»
Растворы
<34
<34
<34
<34
<34
<сЗО,5
<30,5
<10
<сЗО,5
^:30,5
<30,5
Расплав
10
—
Растворы
Растворы + НС1
Раствор
3
80
—
20
—
—
—
—
—
—
20
20
350
600
1100
—
1100
—
1000
100
20
20
20
20
20
100
20
100
20
20
29
800
600
Высокая
»
»
»
20
20
100
100
20
20
100
4
Алюминий
Железо
Никель
Олово
Алюминий
»
»
Железо
Золото
Медь
Никель
Олово
Алюминий
Железо
Молибден
Никель
Ниобий
Платина
Тантал
Алюминий
Никель
Свинец
Серебро
Тантал
Цинк
Алюминий
Медь
Никель
Свинец
Серебро
Цинк
Молибден
Молибден
Алюминий
Золото
Платина
Тантал
Алюминий
Железо
Золото
Платина
»
Свинец
Палладий
5
0,17
—
<0,1
—
8,1
0,17
0
2
—
0,008
0,1
0
0
0
—
—
—
—
—
—
0,08
—
0,1
—
—
6
6
10
5
3
9
6
1
8
1
3
5
1
1
1
5
10
2
10
1
10
5
5
5
1
10
5
1
5
10
3
10
5
5
10
2
10
10
10
10
2
1
10
10
10
7
[173]
[254]
[173]
[173]
173]
173'
173:
254і
173:
173]
173
173
173
254
254
186
187
173
187
[173
[37
[37
[37
[37
[254
[49
[37
[173
[37
[37
[254
[187
[187]
[173]
[і7з;
[173
[173
[173
[173
[421
[42
[173
[173
[42]
Продолжение табл. 1
1
Сера
Сера
Сера дву-
хлористая
Серебро
азотнокислое
Серная
кислота
2
Раствор в CS2
Пары + Н2
Расплав
С водой
Расплав
Расплав
»
»
Расплав
Смесь с водой
<69 %
<69 %
<69 %
Растворы
Растворы
50
20
Растворы
0,1 н.
1 н.
1 н.
3,1 н.
17,8 н.
17,8 н.
5
5
5
5
40
40
40
40
96,5
96,5
96,5
96,5
3
20
*кип
Высокая
445
100
445
1200
400
—
130
240
—
100
100
100
100
100
100
20
20
20
60
20
20
20
—
—
—
100
60
—
35
35
60
35
35
60
50
50
50
50
50
50
50
50
20
20
20
20
4
Алюминий
»
»
Железо
Золото
»
Молибден
Медь
Никель
Олово
Платина
Свинец
Серебро
Титан
Цинк
Иридий
Осмий
Палладий
Платина
Родий
Рутений
Алюминий
Магний
Медь
Никель
Свинец
Серебро
Алюминий
Медь
Свинец
Железо
Никель
Олово
Тантал
Титан
Цинк
Ванадий
»
»
»
»
»
Ниобий
Тантал
Титан
Цирконий
Ниобий
Тантал
Титан
Цирконий
Ниобий
Тантал
Титан
Цирконий
5
0
0
—¦
—
—
—
—
38,8
—
—
—
—
<0,13
—
—
—
—
—
—
—
—
—
—
—
—
—
—
-_
0
0,13
—
0,013
0,015
0,053
0,030
0,099
0,55
0
0
0,62
0
0,005
0
14,9
0
0
0
2,59
84,9
6
1
1
10
5
2
3
10
10
10
10
10
10
10
6
5
2
2
3
3
2
2
8
5
8
7
5
5
10
10
10
10
10
10
1
6
10
4
4
5
4
5
7
1
1
7
1
2—3
1
10
1
1
1
8
10
7
[173]
[173]
[173
[259
[173
[173
[187]
[49]
[173]
[173]
[173]
[173]
[151]
[151]
[151]
[42]
[42]
[42]
[42]
[42
[42
[208
[208
[208
[208]
[208]
[208]
[37]
[37]
[37]
[173]
[49]
[49]
[49]
[151]
[254]
[20]
[20
[20
[20
[20
[20]
[20]
[20]
[20]
[20]
[20]
[20]
[20]
[20]
[20]
[20]
[20]
[20]
76
Продолжение табл. 1
1
Серная
кислота
Сернистая
кислота
Сернистый
ангидрид
2
Концентрированная
То же
»
»
>>
»
»
»
»
»
»
»
»
»
0,2—3,0
5—10
0,3—0,4
0,3—0,4
4,5
Концентрированная
Растворы
5
5
Растворы
6
< 8,6
< 8,6
< 8,6
Сухой
Сжиженный
Влажный
Сухой
Влажный
Сухой
»
Сухой
Сухой
»
Сухой и влажный
_
Влажный
3
100
100
100
100
100
100
100
100
250
250
250
250
250
250
250
250
20
20
40
75
130
18
100
—
20
100
—
20
20
20
20
20
20
20
400
20
20
500
700
> 100
20
700
20
1200
20
> 100
20
4
Золото
Иридий
Осмий
Палладий
Платина
Родий
Рутений
Серебро
Золото
Иридий
Осмий
Палладий
Платина
Родий
Рутений
Серебро
Алюминий
»
»
»
»
Железо
Золото
Магний
Медь
»
Свинец
Титан
Никель
Тантал
Цинк
Алюминий
»
»
»
Железо
»
»
»
Золото
»
Кобальт
Медь
Никель
Олово
Платина
Свинец
Серебро
Титан
5
—
—
—
—
—
—
—
—
—
—
—
0,11
0,14
0,13
1,7
1,95
3,25
—
—
—
—
0,13
—
—
—
0,0014
0
—
0
0
2,1
7,5
> 10,0
0
0
—
0
0
0
0
6
2—3
1—2
1-2
6
2
2
2
10
5
3
6
8
4
4
3
10
6
6
6
8
8
8
1
10
5
10
5
6
10
1
10
2
1
3
1
1
8
9
10
1
10
10
1
10
1
1
1
10
1
7
[42]
[42]
[42]
[42]
[42;
[42;
142
[42
[42;
[42
[42]
[42]
[42]
[42]
[42]
[42]
[173]
[173]
[173]
[173]
[173]
[254]
[173]
[173]
[173]
[173]
[173]
[151]
[37]
[37]
254]
173]
173]
173]
[173]
[173
[173
[173
254]
173
173
173
173
173]
173]
173]
[173]
[173]
[173]
Продолжение табл.
Сернистый
ангидрид
Сернистый
натрий
Сероводород
Сероуглерод
Скипидар
Смесь
кислот:
адипино-
вая + глу-
таровая
адипиновая
+уксусная
адипиновая +
азотная
2
Насыщенный
водой
Воздух + SO2
65,5
Газ влажный
Газ влажный +
+ н2
То же
Газ влажный +
i~ U2
Газ сухой +
-і- о
і vJ2
То же
Газ влажный
—
Раствор + О2
Газ + О2
Газ
—
—
Насыщенный
раствор
Газ сухой + О2
Газ влажный
»
»
»
»
—
—
—
—
—
—
—
—
Безводный
»
Пары
Безводный
25+ 20
25 + 65
17+ 38
3
20
20
160
—
400
600
20
20
—
1200
20
100
100
—
20
70
20
18
18
18
18
18
^кип
20
850
—
—
20
20
100
—
35
35
> 100
35
'кип
195
122
90
4
—
Цинк
Марганец
Никель
Хром
Цинк
Алюминий
Железо
»
Золото
Кобальт
Медь
»
Молибден
Никель
Олово
Платина
Родий
Свинец
Титан
Цинк
Иридий
Осмий
Палладий
Рутений
Серебро
Алюминий
Железо
»
Медь
Серебро
Титан
Никель
Алюминий
Железо
Медь
Никель
Свинец
Серебро
Титан
Титан
»
5
0,13
—
—
0,58
0,0024
6—8
0
6
10,0
—
0
1,0
0
0,13
—
—
—
—
—
—
0
> 10,0
0
0
0,13
0
—
0
—
0,01
0,13
0,13
0,13
6
6
10
10
7
2
9
1
9
10
1
1
1
6
10
7
3
2
1
5
6
5
1
1
2
1
3
5
1
10
, 1
1
6
7
1
5
4
3
1
2
2
6
6
6
7
[151]
[173
[312
312
312
312
173
173
[173]
[173]
[173]
173
173
187
173
173
[173
[173
[173
[151
[173]
42]
42]
42]
42]
42
[173
[254
[254
[173
[173
[151
[37
[173
[173
[254
[254]
[173]
[254]
[37]
[254]
[254]
[254]
78
Продолжение табл. 1
1
Серная +
+ азотная
кислоты
Серная +
+ азотная
кислоты
Соляная
кислота +
+ железо
хлорное
Смесь пен-
тахлоридов
ниобия и
тантала*
Сок
ананасный
Сок
апельсиновый
Сок
виноградный
Сок
лимонный
Сок
томатный
Соляная
кислота
2
25+ 75
25+ 75
25+ 75
75+ 25
75+ 25
75+ 25
10+ 1
10+ 1
10+ 1
10+ 1
C0—40) +
+ F0—70)
Аэрированный
Неаэрированныи
—
Аэрированный
»
»
1,0 н.
1,0 н.
2,0 н.
6,1 н.
6,1 н.
9,8 н.
11,7 н.
1
1
1
1
10
10
10
10
20
20
20
20
36
3
50
50
50
50
50
50
^кип
^кип
^кип
^кип
^кип
^кип
^кип
^кип
^кип
^кип
^кип
20
20
80
^кип
(вакуум)
20
20
70
35
60
35
35
60
60
35
*кип
'кип
^кип
^кип
^кип
^кип
^кип
^кип
^кип
^кип
^кип
*кип
18
4
Медь
Никель
Серебро
Медь
Никель
Серебро
Ниобий
Тантал
Титан
Цирконий
Вольфрам
Золото
Молибден
Никель
Платина
Рений
Серебро
Никель
»
»
»
»
»
»
Ванадий
»
»
»
»
»
»
Ниобий
Тантал
Титан
Цирконий
Ниобий
Тантал
Титан
Цирконий
Ниобий
Тантал
Титан
Цирконий
Золото
5
—
—
0,004
0
3,5
0,03
0,0317
0,0000
0,3005
6,2900
0,0035
0,0079
1,5430
0,46
0,10
0,25
0,02
0,63
0,51
1,12
0,015
0,028
0,028
0,131
0,90
3,33
0,76
0
0
3,84
0
0,005
0
16,5
0,008
0,208
0
375,0 *
0,025
—
6
10
10
10
10
10
10
5
1
8
4
4
1
6
9
2
3
8
6
5
6
4
7
7
8
4
4
4
6
7
8
7
1
1
8
1
2
1
10
3
6
1
10
3
2
7
—
—
[20]
[20]
[20
[20
281
281
281
281
281
281
[281
[188
[188]
[188]
[188]
[188]
[188]
[188]
[20]
[20
[20
[20
[20
[20
20
20
20
20]
20
20
[20:
[20
20
20
20
20
20
[42]
* Коррозионностойкие хромистые и хромоникелевые стали в этих условиях
нестойкие.
Продолжение табл.
1
Соляная
кислота
Спирт
амиловый
Спирт
бензил овый
Спирт
бутиловый
Спирт
метиловый
(древесный)
Спирт
этиловый
2
36
36
36
36
36
36
36
.36
36
36
36
36
36
36
36
—
—
—
—
—
—
—
—
—
Чистый
безводный
То же
»
»
»
»
»
—
—
—
—
—
—
—
—
—
—
—
—
—
3
18
18
18
18
18
18
18
100
100
100
100
100
100
100
100
^кип
»кип
20
20
20
20
20
20
20
100
20
20
20
20
20
100
—
100
60
20
ч*ип
20
^кип
^кип
20-""„п
^КИП
^кип
35
^кип
^кип
^кип
20
20
20
4
Иридий
Осмий
Палладий
Платина
Родий
Рутений
Серебро
Золото
Иридий
Осмий
Палладий
Платина
Родий
Рутений
Серебро
Алюминий
Медь
Никель
Свинец
Серебро
Тантал
Титан
Цинк
Алюминий
»
Медь
Никель
Свинец
Серебро
Тантал
Алюминий
Медь
Железо
Никель
Свинец
Серебро
Тантал
Цинк
Алюминий
Магний
Медь
Никель
Свинец
Серебро
Тантал
Титан
Цинк
Алюминий
Медь
Никель
Свинец
Серебро
5
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
6
7
2
3
2
2
*2
7
5
10
8
5
3
3
3
10
5
5
5
5
5
1
5
5
5
10
5
5
5
5
1
10
5
6
5
5
5
5
5
2
10
5
5
5—10
5
1
7
10
3
5
2
5
5
7
[42
[42
[42
[42
[42
[42
42
42
42
42]
42]
42]
42]
421
42]
37
37
37
37
[37
[37
[37
[37
[37
[173
[37
[37
37
37]
371
[173]
[37]
[173]
37]
37
37
37
37
[37]
[173
[37]
[37]
[37]
[37]
[37]
[37
[173
[37
37
37
37
37
80
Продолжение табл. 1
Спирт
этиловый
Стеариновая кислота
Стирол
Сурьма
Сурьма
треххлори-
стая
Сурьма
треххлори-
стая
Сурьма
хлористая
Танин
Тетрахлор-
этан
<90
<90
<90
<90
<90
<90
<90
<90
<90
—--' оп
Безводная
Влажная
»
10
5
5
10
Растворы
15
Толуол
Трифтор-
хлорэтилен
Чистая
Безводная
100
Расплав
20
^кип
киізо
^кип
киізо
130
100
180
20
20
100
20
20
20
100
100
20
100
20
150
20
20
20
20
20
20
Высокая
20
20
100
20
20
100
20
^кип
. 20
20
20
20
20—^
кип
100
20
20
20
Тантал
Титан
Цинк
Алюминий
»
»
Медь
Никель
Серебро
Титан
Алюминий
Медь
Никель
Цинк
Алюминий
Железо
Платина
Алюминий
Медь
»
Никель
Свинец
Серебро
Тантал
Титан
Цинк
Железо
»
Кобальт
Свинец
Алюминий
Железо
»
Никель
Свинец
Тантал
Титан
Алюминий
Медь
Никель
Свинец
Титан
Алюминий
Медь
Никель
Свинец
Алюминий
Медь
Никель
Свинец
Серебро
0,13
—
0,03
0
0,29
0,0045
—
0
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
0,009
—
<0,1
—
0
<0,13
>ю,о
—
—
—
—
—
—
—
—
1
6
5
4
1
10
б
2
2
1
5
10
5
5
10
10
10
10
6
7
6
5
Q
О
5
1
10
5
10
10
10
5
3
5
10
5
10
1
6
10
5
5
5
5
5
5
5
5
5—10
5
5
5
5
1
Трихлорук-
сусная
кислота
Трихлор-
этан
Трихлор-
этилен
Триэтанол-
амин
Углерод
Углерода
оксид
Углерода
оксид
Углерода
двуоксид*3
Углерода
двуоксид*4
2
<55
<55
<55
<55
<55
<55
100 (аэрированная)
—
—
—
—
—
—
—
—
—
—
—
Сухой + графит+
+ электролит
—
Чистый
—
—
—
—
—
—
Сухая + О«
—
Сухой газ
»
Сухой газ
»
»
»
»
»
»
3
20
'кип
100
*кип
100
20
*кип
^кип
20
^кип
20
*кип
20
^кип
^кип
^кип
•кип
50
20
20
650
20
Высокая
1200
Высокая
20
550
500—700
—
—
Красное
каление
300
350
20
100
100
20
600
20
600
150
100
20
4
Алюминий
Медь
Свинец
Серебро
Тантал
Цинк
Цирконий
Алюминий
Медь
Никель
Свинец
Титан
Цинк
Алюминий
Медь
Никель
Титан
Алюминий
Медь
Тантал
Алюминий
» !
Железо
Никель
Платина
Тантал
Алюминий
»
Железо*1
Кобальт*1
Медь
Молибден
Никель*2
Платина
Серебро
Тантал
Цинк
Алюминий
Медь
Никель
»
Свинец
Серебро
Тантал
Титан
Цинк
Продолжение табл
5
—
—
—
—
—
11,375
—
—
—
0,23
0,13
—
—
—
—
—
—
—
—
—
—
6
10
10
10
5
1
*5
10
5
1
4
6
6
10
5
5
4
2
1
10
5
5
10
Науглероживается
—
0
—
—
—
—
—
—
—
—
0
—
—
—
—
—
—
10
5
10
1
5
—
—
10
10
—
10
10
2
1
1
5
1
10
5
5
5
10
7
1. 1
7
37]
37]
37]
37]
37]
37]
[151]
37]
37]
37]
37]
37
[254]
[37
[37
[37
[37]
37]
37
[37]
[173]
[173]
[173]
173]
173
173
173
173
173
173
173
173
173
173
[173]
[173]
[173]
37]
37
37
37
37]
37]
37]
37]
[254]
*' Разлагает окись углерода до углерода^'
*2 Катализатор разложения окиси, углерода.
*3 В сухом газе скорость коррозии всех металлов значительно меньше.
*4 В сухом газе скорость коррозии всех металлов значительно меньше.
82
Продолжение табл. 1
1
Углерод че-
гыреххло-
Э ИСТЫЙ
Уксусная
кислота
-
Уксусно-
амиловый
эфир
Уксусный
ангидрид
2
Сухой
Влажный
»
Сухой
»
Влажный
Чистый + 0,6 г/л
Сухой
Влажный
Сухой
Влажный
»
Сухой
Влажный
Сухой
Влажный
»
Любая
Чистый + 1 %
Все концентрации
33
33
1—5
100
50
Растворы
Все концентрации
То же
60
98
98
Любая
10+ 1
10+ 1
5—99,5
Ледяная
5—75
Чистый
»
Пары
Пары+ 10%-
ный СНзСООН
3
20
20
67
20
67
^кип
20
. 67
78
20
67
20
20
/кип
77
20
67
—
20
^кип
Любая
^кип
20
^кип
20
/кип
20
/кип
20
—
20
^кип
20
20
^кип
100
/кип
^кип
^кип
240
100
4
Алюминий
»
Железо
»
»
»
Медь
»
»
Никель
»
»
Олово
Олово
Свинец
»
»
Серебро
Тантал
Титан
Алюминий
»
Железо
»
Медь
Никель
Молибден
Олово
»
Свинец
»
»
Серебро
Ниобий
Тантал
Титан
»
Цирконий
См. амилацетат
25
60
500
—
Алюминий
»
»
5
0
А. ЯЧ
*г,ОО
0,102
4.1
0
—
—
0,05
1,4
0,006
0,003
0,07
0
0,0001
0,503
6
1
о
6
8
1
3
5
5
8
3
2
5
1
1
6
Образуется
белая корка
0,0035
0,027
0
0,0004
0,05
0
0
0
>1,15
>10,2
1,34
3,08
0,09
7,1
—
0,025
0,5
4,18
0,72
2,13
6,0
—
0
0
<0,13
2,52
0,0007
0,005
0,12
—
—
2
4
1
1
5
1
1
1
8
10
8
8
5
9
8
4
7
8
7
8
9
5
1
1
6
8 -
1
3
6
5—6
10
7
[173]
[173]
[188]
188
254
254
254
254
254
254
[254
[254:
[49
[49
[49
[49:
[49]
49
49
49
49
49
49
[151
[49]
[173]
[173]
[173
[49:
[49
{254
[190
[49
[173
[173
[173]
[173
[49
[20
[20
[151
[151
[151
173]
173
[173
[173
Продолжение табл. 1
Уксусный
ангидрид
Уротропин
Фенол
Формалин
(формальдегид)
Формамид
Чистый
»
В процессе
получения 20 + 80 %
ледяной уксусной
кислоты
То же
99,5 (пссізриро-
ізашіля)
50 -:- 75
Раствор в спирте
Безводный
Влажный
Чистый
Концентрированный
Концентрированный +
формальдегид
Чистый
Влажный +
воздух + фенол
Чистый
Насыщенный
раствор
Воздух + фенол
20
20
Водный раствор
15 + 2 %
муравьиной кислоты
10
15 + 2%
муравьиной кислоты
Без НСООН
С НСООН
40
40
40
40
25
75
25
ч<ип
130
Медь
»
Олово
Серебро
Титан
Цирконий
0,06
1,16
1,59
7,6
0,01
0,0007
20 Ниобий
См. гексаметилентетрамин
70 ¦ '
20
^КИП
20
104
20
100
20
20
'кип
20
20
20
20
70
20
135
104
135
20
20
'кип
ЧІИП
100
20-/кип
100
100
100
^кип
100
20-/кип
9
1
4
1
10
Алюминий
Алюминий
»
Железо
Медь
Никель
»
Олово
Свинец
Серебро
Тантал
Титан
Цинк
Алюминий
»
Железо
»
Медь
Никель
Никель
Олово
»
Свинец
Серебро
Тантал
Титан
Цинк
Алюминий
Медь
Никель
Свинец
Серебро
Тантал
Цинк
0,013
0
0,16
0,45
<0,1
—
0
4,66
0
<0,13
0,11
0,12
4,56
. 0,038
—
0,023
0,28
0
—
—
—
—
—
—
—
4
1
10
6
6
<5
5
1
8
5
1
6
6
6
8
4
8
5
4
6
1
10
10
5
1
5
7—10
5
5
3
5
5
2
5—10
84
1
Фосфор
треххлори-
стый
Фосфор пя-
тихлорис-
тый
Фосфорная
кислота
Фреон
Фталевая
кислота
Фтор
2
—
—
—
—^
—
Пар
»
»
»
»
»
—
—
—
—
—
—
—
70**
70
—
—
—
—
—
Газообразный
»
—
Безводный
»
»
»
»
—
—
Безводный
»
»
»
»
3
20
20
100
20
20
76
300
167
250
250
200
250
250
100
100
100
100
100
100
100
200
200
150
180
150
^кип
20
80
220—228
20
450
600
20
200
250
300
400
500
20
300
—
400
. 400
500
600
700
20
4
Алюминий
Медь
1 1И КОЛІ)
Гитан
»
»
Алюминий
Золото
Иридий
Медь
Платина
Титан
Золото
Иридий
Осмий
Палладий
Платима
Родий
Рутений
Медь
Тантал
Алюминий
Медь
Свинец
Серебро
Цинк
Алюминий
Никель***
Свинец
Алюминий
»
Вольфрам
Железо
»
»
»
»
Золото
»
Кобальт
Медь
Никель
»
»
»
Ниобий****
5
0,136
—
...
0,024
0
0,005
0,00A*
>Ю,0
>5,0
>5,0
>Ю,0
>5,0
>Ю,0
0,15
0
16,5
0
0,61
<3,0
7,31
>10,0
—
0,21
1,56
8,8
10,4
—
6
6
10
3
4
1
2
3
К)
9
9
10
9
10
3
2
10
4
2
2
2
10
3
5
5
6
5
5
6
8
6
1
10
10
1
7
8
9
10
1
10
10
10
6
8
9
10
10
7
[117]
[37
[371
117
117
[117
[117
187
187
[87]
{87
187:
[87
142
J421
42]
42:
42:
42:
421
[254
9Я41
L
[37
37
37
371
[254
[37:
[37
[37]
[190
•
190
187
194
194
194
194
[194
[173
[173
[173
[1Q0
190
190]
190]
190]
187]
*» В этих условиях коррозионностоикие хромистые и хромоникелевые стали явля
ются нестойкими металлами.
*2 Сплав Н70МФ и сталь 10Х17Н13М2Т — нестойкие.
*3 Данные для паров фталевой кислоты.
*4 Быстро вступает в реакцию с фтором.
Продолжение табл. 1
1
Фтор
Фтористый
водород
Фтористоводородная
кислота
2
да
—
—
—
—
Газ
»
Сухой газ
»
»
»
»
»
»
Растворы
»
»
Жидкая и
паровая фазы
100
6
6
20
40
60
Жидкая фаза
Паровая фаза
Все концентрации
HF + HNO3
6
6
6
20
20
20
40*
3
400
20
20
—
—
100
100
20—60
200
20-100
20—100
500
500
60-100
500
500
20—100
20
20
20
—
100
—
90
100
20
50
80
20
50
80
20
50
80
20
50
80
90
90
100
20
20
50
80
20
50
80
20
4
Олово
Платина
Свинец
Серебро
Тантал
Цинк
Золото
Платина
Медь
Никель
Титан
Алюминий
Железо
Магний
Медь
»
Никель
Свинец
Серебро
Титан
Цинк
Алюминий
Вольфрам
Железо
Магний
»
Медь
»
»
»
»
»
»
Медь
»
»
»
»
Молибден
»
Никель
»
»
»
»
»
»
5
—
—
—
—
—
—
—
—
—
10,0
12,8
0,44
1,52
0,91
—
—
>1,3
—
—
—
—
0
0,1 — 1,0
0,2
0,45
0,69
0,26
0,62
0,95
0,43
0,87
1,37
0,19
0,37
0,85
—
—
—
0,25
0,49
0,69
0,18
0,7
1,82
0,35
6
10
10
5
5
, 10
10
5
6
5
5
5—10
6
10
10
6
8
7
10
2
8
10
10
5
10
1
8
6
6
7
6
7
7
6
7
8
6
6
7
8
9
5
10
6
6
7
6
7
8
6
7
[173
173
173
173
173
173
[42]
42]
37]
37]
37]
37]
[254]
[194]
[37]
[194]
[194
[37
[37
[151
[254
[173]
[187]
[173]
[106]
232]
276]
276]
276
276
276
[276
276
276
276
276
276
276
106
106
[49,
1 *7ОІ
173]
[187
276
276
276
276
[276
[276
[276]
¦ Наиболее стойким в данных условиях является сплав НМЖМу 28-2,5-1,5.
86
Продолжение табл. 1
Фтористоводородная
кислота
Фурфурол
Хлорангид-
рид
бензойной кислоты
Хлор
2
40*
40*
60
60
60
Паровая и
жидкая фазы
5сТ
10
30
Все концентрации
Жидкая и паро-
т"» л *т /ТЛО от і
вая фазы
Разбавленная
без О2 + HNO8
60 + СгОз
18
Разбавленная без
Все концентрации
1
Паровая и
жидкая фазы
—
—
—
—
—
—
Безводный
»
Водный
Безводный
—
Безводный
»
»
»
Влажный
3
50
80
20
50
80
90
100
20
20
20—100
90
40
80
—
20-100
20
90
—
18
18
18
18
18
18
18
18
100
100
100
4
»
»
»
Ниобий
»
Ниобий
Палладий
Платина
Свинец
Серебро
Тантал
Титан
Хром
Гафний
Цирконий
Золото
Иридий
Осмий
Палладий
Платина
Родий
Рутений
Серебро
Алюминий
Медь
Никель
Свинец
Серебро
Тантал
5
1,38
4,47
0,5
0,7
1,79
—
Пассивируется
0,34
0,62
—
0
—
2,91
1,3
—
—
—
—
—
—
—
—
—
0,19
0,29
—
—
—
См. бензоил хлористый
20
250
20
20
250
50
150
20
90
20
Алюминий
»
»
Ванадий
Вольфрам
Гафний
»
Железо
»
»
—
—
—
>ю,о
>ю,о
0,40
8,43
—
—
6
8
8
6
7
8
9
4
6
7
10
1
1
3
8
5
10
8
10
10
10
3
2
2
4
3
2
2
7—8
6
6
5
3
2
1
1
10
10
10
10
6
9
3
10
10
7
[276]
[276
[276
[276
[276
[106
[173]
[173]
[173]
[187]
[106]
[173]
173
173
173
187
151
106
[ЮЗ]
[103
[42
[42
[42:
42
42
42
42
42
37
37
37
37
37
37
[173]
[173]
[173]
[87]
[173]
[87]
[87]
[173]
[173]
[173]
* Наиболее стойким в данных условиях является сплав НМЖМу 28-2,5-1,5,
Продолжение табл. 1
1
Хлор
2
•
Безводный газ
—
—
Безводный
Влажный
—
—
Газообразный
(сухой)
То же
Сжиженный +
|- следы Н2О
Хлорная вода
Безводный
»
»
»
»
Влажный
Безводный
Газообразный
(сухой)
Сжиженный
(сухой)
Сжиженный + Н2О
Хлорная вода
Газообразный
(сухой)
100 (сухой +
+ 0,005 % Н2О)
Хлорная вода
Газообразный
(сухой)
То же (влажный)
То же (сухой)
То же (влажный)
Сухой
Влажный
Сухой
Влажный
Сухой
Влажный
Сухой
Влажный
3
20
150
—
—
200
93
20
20
—
100
100
20
100
150
200
20
500
20
20
20
20
80
20
60
30
75
20
20
60
76
18
18
18
18
18
18
18
18
4
Ниобий*
Золото
Кобальт
Магний
Молибден
Молибден
Никель
Олово
Платина
»
»
»
Рений
»
»
Родий
»
»
Ртуть
Свинец
Серебро
»
»
Титан
Титан поро
5
_
—
—
—
>10,0
0,60
—
—
Хлорир
0
—
0,2
0,80
>10,0
<0,001
>Ю,0
0,001
>10,0
0
—
0,001
—
6
10
8
10
10
10
* 7
3
10
5
уется
1
1
6
7
10
2
10
2
10
1
1
10
2
10
шкообразный,
вспыхивает и горит
Титан
Цинк
»
Цирконий
»
Золото
»
Иридий
»
Осмий
»
Палладий
»
* Ниобий энергично вступает в реакцию с хлором.
0,13
0
—
2,25
—
—
—
—
—
—
—
6
1
10
10
8
7
10
1
5
1
-8
8
10
7
[187]
[173]
[173]
[173]
[87]
[87]
173]
173]
173]
[173]
[173]
[173]
87]
87]
87]
87,
173]
[87,
1 7Q1
1 1 О\
[87,
1 ТІЛ
1 /о]
[87]
[173]
[173]
[173]
[49,
173]
[185]
[189]
[49,
1 ЯО1
loyj
[173]
[173
[185
[185
[42
42
42
42
[42
[42]
[42[
[42]
Продолжение табл. 1
1
Хлор
Хлористый
ацетил
Хлорбензол
Хлористый
бензил
Хлористый
бензоил
Хлористый
водород
Хлористый
метил
Хлористый
сульфурил
Хлористый
этил
2
Сухой
Влажный
Сухой
Влажный
Сухой
Влажный
— *
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
Газообразный
(сухой)
То же (влажный)
То же (сухой)
»
»
—
—
—
—
—
—
Чистый
—
—
—
Чистый
—
—
3
18
18
18
18
18
18
20
20
20
20
20
20
20
100
100
100
20
100
130
20
100
20-Аип
20
20
20
200
20
20
20
20
—
150
20
70
60
100
100
100
100
20
*кип
>150
>150
300
300
20
70
60
4
Платина
»
Роди й
»
Рутений
»
Алюминий
Медь
Никель
Свинец
Серебро
Тантал
Цинк
Алюминий
Медь
Никель
Свинец
Серебро
Титан
Алюминий
Медь
Никель
Свинец
Серебро
Тантал
Цинк
Алюминий
Медь
Никель
Алюминий
»
Медь
Олово
Серебро
Алюминий
Медь
Никель
Свинец
Серебро
Тантал
Титан
Цинк
Алюминий
Железо
Золото
Платина
Свинец
Серебро
Цинк
Алюминий
Медь
Никель
5
_
—
—
_
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
0
0
—
—
6
6
7
1
5
1
5
8
7
5
7
3
1
10
5
5
5
5
3
5
8
8
5
5
3
1
10
10
5
7
1
10
10
10
10
2
4
5
5
5
2
2
10
5
10
10
10
5
1
1
2
4
5
7
[42
[42
[42
[42
[42
42
37
37
37
37]
37]
37]
[254
[37
37
37
37
37
37
37
37
37
37
37
137
[254
[37
[37.
[37:
[173]
[173]
[.173
[173
[173
[37
37
37
37
37
37
[37
254
173
173
173
173
254
254
173
[37;
[37;
[37]
1
Хлористый
этил
Хлорная
известь
Хлорноватая кислота
Хлорноватистая
кислота
Хлорная
кислота
Хлороформ
Хлорсила-
ны
Хлорсила-
ны
Хлоруксус-
ная кислота
Хлорсуль-
фоновая
кислота
2
_
—
—
—
—
1
5
70
Растворы
—
Все концентрации
То же
»
»
»
»
Все концентрации
17
—
—
—
—
—
—
—
—
—
—
—
—
—
—
Все концентрации
То же
—
—
—
—
—
50
100
100 (неаэрирован-
ная)
Безводная
Влажная
3
100
100
100
100
20
20
—
100
100
—
—
20
20
20
20
20
20
20
20
38
100
^кип
20—/кип
^кип
^кип
^кип
*кип
*кип
20-гК1Ш
ч<ип
20
100
100
100
20
20-/кйп
100
20
*кип
100
20
20
^кип
'кип
—
20
4
Свинец
Серебро
Тантал
Титан
Цинк
Алюминий
Медь
Никель
Ниобий
Олово
Свинец
Алюминий
Медь
Никель
Свинец
Серебро
Тантал
Цинк
Алюминий
Цирконий
Платина
Алюминий
Медь
Никель
Свинец
Серебро
Тантал
Титан
Цинк
Медь
Никель
Свинец
Серебро
Тантал
Алюминий
Медь
Никель
Свинец
Серебро
Тантал
Цинк
Железо
Титан
Цирконий
Железо
»
Титан
Продолжение табл
5
_
—
—
—
0,32
—
<0,1
0
—
6
5
3
2
10
6
5
5
1
10
Применим для
хлорных
—
—
—
—
—
—
—
—
0,049
—
—
—
—
—
—
—
—
—
—
—
—
—
—
„ —
—
—
—
—
—
—
0,13
0
—
1,3
камер
10
10
10
10
10
3
10
6
4
2
5
4—6
3
5
5
3
1
5—10
5
3
5
5
3
10
5—10
7
10
5
3
10
10
6
1
3
10
8
1
7
[37]
[37]
[37]
[37]
[254]
[49,
173]
[49]
173]
[173]
[173]
[173]
[37]
[37]
[37]
[37]
[37]
[37
[254
[37
[151
[42]
37]
37
37
37
37
37
37
[254
[37]
37]
37
37
37]
37]
[37]
37
37
37
37
[37]
[254]
[151]
[151]
[173]
[173]
[151]
Продолжение табл. 1
1
Хромовая
кислота
Хромовая
кислота
Царская
водка
Цемент(при
схватывании)
Циклогексан
2
10
Концентрированная
То же
Растворы
Разбавленные
растворы + •
+ H2SO4
Растворы
»
Концентрированная
Растворы
10
50
—
Концентрированная
10
10
Концентрированная
—
—
—
—
—
—
—
—
—
—
—
—
Портланд-цемент
Глиноцемент
Шлакоцемент
Гольдцемент
—
—
Цемент + песок
—
—
—
—
—
—
—
3
70
20
70
—
—
—
^кип
—
'кип
^кип
20
20
20
20
100
20
20
100
18
'кип
18
'кип
18
^кип
18
^кип
18
^кип
18
^кип
18
^кип
—
—
—
^кип
^кип
^кип
^кип
*кип
*кип
20
4
Алюминий
»
»
Медь
Никель
Олово
Платина
Свинец
Серебро
Титан
»
Железо
Золото
»
Молибден
Ниобий
»
Платина
»
Тантал
Иридий
»
Осмий
»
Палладий
»
Платина
»
Родий
»
Рутений
»
Серебро
»
Алюминий
»
Железо
»
Медь
Свинец
Цинк
Алюминий
Медь
Свинец
Серебро
Тантал
Титан
Цинк
5
0,63
0,94
3,69
—
—
0
—
—
0
0,13
—
—
0,14
—
0
0,02
0,008
0,16
0
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
6
7
7
8
10
5-6
10
1
2
2
1
6
10
10
6
10
1
4
3
6
1
1
3
10
10
10
10
10
10
3
5-6
1
5—6
7
10
10
5—6
5—6
5—6
10
10
5
5
5
5
5
3
3
5
7
[173]
[173]
[173]
[49]
[173]
[173]
[173]
[173]
173]
189
151
254
173
[173
[187
[49
[49
[173
[173
[173]
42
42
42
42
42
42
42
42
42
42
42]
42
42:
42
[173
[173
[173
[173
[173
[173
[173
37
37
37
37
37
37
[254
Продолжение табл.
1
Щиклогекса-
нон
Цинк
Цинк
сернокислый
Цинк
хлористый
Цирконий
хлористый
Щавелевая
кислота
2
•
—
—
—
Расплав
>
»
»
2
10
10
<35
<35
<35
<35
<35
<35
10
94 + 18FeCl3
94 + 18FeCl3
70 + 18FeCl3
78 + 18FeCl3
78 + 18FeCl3
78 + 18FeCl3
10
10
1
1
40
10
80
Растворы
75—90
—
10
10
6,3
13,4
Насыщенный
раствор
To же
Растворы
»
0,75 без Оа
Растворы
Насыщенный
раствор
То же
3
100
20—/кип
100
100
100
100
20
500
500
500
500
500
500
—
20
200
20
100
20—100
100
100
100
20
20
'кип
^кип
20
20
/кип
20
100
—
—
*кип
200
—
200
930
20
80
20
20
100
20
100
20
—
20
90
4
Алюминий
Медь
Свинец
Серебро
Тантал
Титан
Цинк
Алюминий
Железо
Золото
Никель
Ниобий
Титан
Алюминий
Никель
Алюминий
Медь
Никель
Свинец
Тантал
Титан
Алюминий
Железо
»
Медь
»
Никель
»
Олово
»
Тантал
Титан
»
Цинк
Цирконий
»
Алюминий
»
Железо
Молибден
Никель
»
Ниобий
»
Олово
Свинец
Тантал
*
5
—
—
—
—
—
—
>10,0
—
0,0041
<С0,1
<ci,o
—
—
—
—
0,013
0,44
108,8
8,14
1,5
0,11
0,15
0,1
1,0
—
—
0
0
> 1,3
—
>1,3
>6,0
0,112
1,49
0,41
0,051
0,1
<С 1,0
0І0001
0,011
0,001
—
0
—
6
5
5-8
5
5
• 3
3
5
10
6—7
10
10
3
10
2
5
7
4
6
5—7
7
1
5
4
6
10
9
8
6
6
5
8
10
10
1
1
8
10
8
9
6
8
6
5
5
7
1
4
2
10
1
3
7
37]
37
37
37
37
[37
[254:
173
173
173
173
[49:
151
173
173
173
[37
/37'
37
37
37
37:
49;
49
49
49
49
49
[49
[173
[173
[173
[173
[20
151
151
173
151
185
[173]
[173]
[190]
[190]
[190]
[49]
[173]
[173]
[173]
[173]
[173]
Продолжение табл. 1
1
Щавелевая
кислота
Этан
Этаналь
Этан четы-
реххлорис-
тый
Этан пяти-
хлористый
Этиленбен-
зол
Этилен
Этиленгли-
коль
Этилен
хлористый
2
10 (аэрированная)
10 (неаэрирован-
ная)
0,1
25 (аэрированная)
25 (аэрированная)
— ^
—
3
35
60
20
60
100
20
1050
100
/кип
^кип
КИ20
20
См. ацетальдеги;]
Сухой
Влажный
Сухой
Влажный
Сухой
Влажный
Влажный
—
—
—
—
—
—
Безводный
Пары
Безводный
—
100
—
>100
>100
20
100
20
20
^кип
20
100
20—100
20
20
20
20
20
20
20
20
20
20
20
20
100
20—/кип
100
'кип
100
100
100
20
20
^кип
^кип
4
Титан
Цинк
Цирконии
»
Алюминий
Железо
Медь
Никель
Свинец
Тантал
Титан
Цинк
5
<0,13
>1,3
0,1002
0,3120
—
6
6
8
10
5 -6
6
5
Образуется
кокс
—
—
—
—
—
{ (уксусный альдегид)
Алюминий
Железо
»
Медь
»
Олово
Свинец
»
Алюминий
Железо
Медь
Никель
Алюминий
Медь
Никель
Свинец
Серебро
Тантал
Титан
Цинк
Алюминий
Медь
Никель
Свинец
Серебро
Тантал
Титан
Алюминий
Медь
Никель
Свинец
Серебро
Тантал
Титан
Цинк
Алюминий
»
Свинец
—
—
—
—
—
—
0
—
—
—
—
1,0
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
0
0
—
4
5
5
3
5
7
7
[151]
[151]
[151
[151
[151
[37
[37]
[37]
[37]
37
37
37
5
5
5
5
10
10
1
10
10
5
5
8
5
5
5—10
5
3
1
3
5
5
5
5
5
5
5
5
5
5—8
5
8
5
1
3
5
1
1
5
[173]
[173
[173
[173
173]
173
173
173
173
173
173
173
37:
37]
37]
37]
37
37
[37]
[254
[37
[37]
[37]
[37:
[37;
[37
[37]
[37]
37]
37]
37;
37;
[37
[37;
[37;
[173
[173
[173
Продолжение табл. 1
1
Этилен дву-
хлористый
Этилен
треххлорис-
тый
Этилен
хлоргидрин
Эфир уксус-
ноэтиловый
Эфир уксус-
ноэтиловый
Эфир
этиловый
Яблочная
кислота
Янтарная
кислота
2
•
—
—
—
95
Жидкий и пары
Чистый
3»
»
Влажный
—
Чистый
—
—
—
—
—
—
—
—
—
10
Концентрирован-
ныи
10
Концентрирован-
ныи
—
—
—
—
—
—
—
—
—
—
Растворы
Концентрированная
0,67
0,75
<6,9
3
^кип
—
'кип
^кип
'кип
'кип
20
20
^кип
^кип
20
^кип
^кип
20
100
20
20
20
20
100
20
20
'кип
'кип
—
—
'кип
*кип
*кип
*кип
20
20
20
20
20-гКИп
20
^кип
100
20
20
20
20
90
20
4
Алюминий
Железо
Медь
Никель
Свинец
Титан
Алюминий
Железо
Медь
Никель
»
Олово
Свинец
Титан
Цинк
Алюминий
Медь
Никель
Свинец
Серебро
Тантал
Титан
Алюминий
»
Алюминий
»
Железо
Никель
Серебро
Алюминий
Медь
Никель
Свинец
Серебро
Тантал
Титан
Цинк
Алюминий
Железо
Медь
Никель
Олово
Свинец
Серебро
Тантал
Титан
Цинк
5
0
—
0
<0,1
0
<0,13
0
0,04
0,008
0,03
0,027
—
0,02
<0,13
—
—
-
—
—
—
0,46
0,04
70,3
0,68
—
—
—
—
—
—
—
—
—
—
0,17
0,004
—
0,195
6
1
1
1
. 5
1
6
1
4
3
4
4
10
4
6
10
4
8
4
4
1
1
3
6
4
10
7
5
5
5
6
5
5
5
3
2
6
5
3—6
10
10
6
2
5
3
2
6
8
7
173]
173
173
173
173
151
173
[173
[173
[173
[173
[173
[173
[151
[151
37
37
37
37
37
37
[37
[173
[173
[173]
[173]
[173]
[173
[173
[37
[37]
[37]
[37
[37
[37
[37
[37
[37
[173
[254
[173]
[173
[37
37
37
37
[254
94
КОРРОЗИОННОСТОЙКИЕ (НЕРЖАВЕЮЩИЕ)
СТАЛИ И СПЛАВЫ
Коррозионностойкими сталями обычно называют сплавы на
основе железа и хрома, содержащие углерод, а в некоторых
случаях и другие легирующие элементы: никель, молибден,
марганец, медь, титан и т. д.
Обычно коррозионностойкие стали содержат (главным
образом в твердом растворе с железом) не менее 12—13% хрома.
Важнейшими структурными составляющими коррозионно-
стойких сталей являются: твердые растворы, содержащие
железо, хром, углерод и другие элементы и обладающие
пространственной решеткой сс-железа (феррит); твердые растворы,
содержащие железо, хром, углерод и другие элементы,
имеющие пространственную решетку у-железа (аустенит); продукты
частичного или полного распада твердых растворов, сложные
хромсодержащие карбиды, неметаллические включения и др.
К элементам, способствующим образованию с железом
твердого раствора феррита (сс-раствора), помимо хрома, относятся
молибден, титан, ниобий, кремний, алюминий и др.
К элементам, добавляемым к железу для увеличения
области твердого раствора аустенита (v-раствор), относятся никель,
марганец, кобальт, которые образуют с железом ряд
непрерывных твердых растворов. Углерод, азот, медь также являются
аустенитообразующими элементами, однако они ограничивают
область твердого у-раствора вследствие выделения избыточной
фазы.
Свойства элементов расширять ^-область или сужать ее
используются в практике для получения сплавов с
определенными свойствами. Добавляя к сплаву железо — углерод аусте-
нитообразующие элементы, можно расширить ^-область и
сохранить ее при комнатной температуре. Ценные свойства
аустенита заключаются в высокой пластичности и хорошей
свариваемости. Кроме того, аустенит немагнитен.
Добавляя к сплаву железо — углерод ферритообразующие
элементы, которые замыкают у-область, можно в зависимости
от количества этих элементов получить промежуточные
структуры — начиная от мартенсита и кончая ферритом. Таким
образом, коррозионностойкие стали, применяемые в технике,
обладают сложной структурой. Важнейшими их структурными
составляющими, определяющими их коррозионную стойкость,
являются твердые растворы, содержащие значительное
количество хрома. Чем ближе структура к однородному твердому
раствору, тем выше ее коррозионная стойкость. Нарушение
однородности структуры ведет к снижению коррозионной
стойкости нержавеющих сталей.
Примечание, Химические элементы в сталях обозначены
следующими буквами: А — азот; Б — ниобий; В — вольфрам;
95
Г — марганец; Д — медь; Е — селен; М — молибден; Н —
никель; Р —бор; С — кремний; Т — титан; Ю — алюминий; К —
кобальт; X —хром; Ц — цирконий.
Наименование марої? сталей состоит из обозначения эле-
ментон и следующих за ними цифр. Цифры, стоящие после букв,
указывают среднее содержание легирующего элемента в целых
единицах (кроме элементов, присутствующих в стали в малых
количествах). Цифры перед буквенным обозначением
указывают среднее или максимальное (при отсутствии нижнего
предела) содержание углерода в стали в сотых долях процента.
Букву А (азот) ставить в конце обозначения марки не
допускается.
Наимсмюпание марок сплавов состоит только из буквенных
обозначений элементов, за исключением никеля, после
которого указываются цифры, обозначающие его среднее
содержание в процентах.
Ниже перечислены коррозионностойкие (нержавеющие)
стали и сплавы, которые указаны в данном справочнике.
Причем, все стали и сплавы, согласно ГОСТ 5632—72, обозначены
по-новому. В скобках приведено прежнее обозначение: 08X13
@X13, ЭИ496); 12X13 AX13); 12X17 (Х17); 08Х17Т @Х17Т,
ЭИ645); 14Х17Н2 AХ17Н2, ЭИ268); 12Х21Н5Т AХ21Н5Т,
ЭИ811); 08Х22Н6Т @Х22Н5Т, ЭП53); 08Х21Н6М2Т
@Х21Н6М2Т, ЭП54); 12Х18Н10Т (Х18Н10Т); 08Х18Н10Т
@Х18Н10Т, ЭИ914); 15Х25Т (Х25Т, ЭИ439); 15X28 (Х28,
ЭИ349); 10Х17Н13М2Т (Х17Н13М2Т, ЭИ448); 10Х17Н13МЗТ
(Х17Н13МЗТ, ЭИ432); 10Х14Г14Н4Т 1ХШЧ4НЗТ, ЭИ711);
08Х18Г8Н2Т @Х18Г8Н2Т, КО-3); 08Х17Н15МЗТ @Х17Н16МЗТ;
ЭИ580); 03Х21Н21М4ГБ @00Х20Н20М4Б, ЭИ35); 06Х28МДТ
@Х23Н28МЗДЗТ, ЭИ943); 03Х28МДТ @00Х23Н28МЗДЗТ,
ЭП516).
Химический состав нержавеющих сталей, ГОСТы и
технические условия на поставку металла приведены в табл. 2 и 3.
Для повышения коррозионной стойкости деталей из
нержавеющих сталей и сплавов в процессе изготовления их
подвергают соответствующей термической обработке.
В табл. 4 приведены режимы термической обработки и
получаемые при этом механические свойства нержавеющих
сталей и сплавов.
ТАБЛИЦА 2
w
03
X
w
Z. Марки стали и сплавов
о
08X13
12X13
12X17
08X17Т
14Х17Н2
15Х25Т
10Х14П4Н4Т
08Х18Г8Н2Т
15X28
12Х21Н5Т
08Х22Н6Т -/
08Х21Н6М2Т
12Х18Н10Т .
08Х18Н10Т
10Х17Н13М2Т
10Х17Н13МЗТ
06ХН28МДТ __
03ХН28МДТ
СО
ХИМИЧЕСКИЙ
СОСТАВ (%) НЕКОТОРЫХ КОРРОЗИОННОСТОЙКИХ
(НЕРЖАВЕЮЩИХ) СТАЛЕЙ И (
С
Н€
0,08
0,09—0,15
0,12
0,08
0,11—0,17
0,15
0,10
* 0,08
0,15
0,09—0,14
0,08
0,08
0,12
0,08
0,10
0,10
0,06
\
0,03
/
Si
более
0,80
0,80
0,80
0,80
0,80
1,0
0,80
0,8
1,0
0,80
0,80
0,80
0,80
0,80
0,80
0,80
0,80
0,80
Мп
0,80
0,80
0,80
0,80
0,80
0,80
13—15
7,0—9,0
0,80
0,80
0,80
0,80
2,0
2,0
2,0
2,0
0,80
. 0,80
Сг
12—14
12—14
16—18
16—18
16—18
24—27
13—15
17—19
27—30
20—22
21—23
20—22
17—19
17—19
16—18
16—18
22—25
22—25
ЗПЛАВОВ ПО ГОСТ 5632-^72
Ni
Ост. до 0,6
Ост. до 0,6
0,6
0,6
1,5—2,5
Ост. до 0,6
2,8—4,5
1,8—2,8
—
4,8—5,8
5^6,0
5^-6,5
9—11
9,0—11,0
12—14
12—14
26—29
26—29
S
не (
0,025
0,025
0,025
0,025
0,025
0,025
0,020
0,020
0,025
0,025
0,025
0,025
0,020
0,020
0,020
0,020
0,020
0,020
р
5олее
0,030
0,030
0,035
0,035
0,030
0,035
0,035
0,035
0,035
0,035
0,035
0,035
0,035
0,035
0,035
0,035
0,035
0,035
Ті
¦ н. б. — 0,2
н. б.,0,2
—
5С—0,8
—
5С—0,9
5 (С—0,02)—0,6
0,20—0,5
н. б. 0,2
0,25—0,5
5С—0,65
0,20—0,40
5С—0,8
5С—0,70
5С—0,7
5С—0,7
0.5—0,9
0,5—0,9
Другие элементы
<0,30Си
<0,30Си
<0,30Си
<0,30Си
<0,30Си
<0,30Си
<0,30Си
<0,30Счі
<0,30Си
<0,08Си
<0,30Си
1,8—2,5Мо
<0,30Си
<0,30Си
2,0—3,0Мо
3,00—4,00Мо
2,5—З.ОМо
2,5—3,5Си
2,5—3,0Мо
2,5—3,5Си
$
ТАБЛИЦА 3
Марка
08X13 (ЭИ496)
12X13
12X17
08Х17Т(ЭИ645)
14Х17Н2(ЭИ268)
15X28 (ЭИ349)
15Х25Т (ЭИ439)
10Х14Г14Н4Т(ЭИ711)
08Х18Г8Н2Т(КО-3)
12Х21Н5Т(ЭИ811)
08Х22Н6Т (ЭП53)
08Х21Н6М2Т (ЭП54)
12Х18Н10Т(ЭЯ1Т)
08Х18Н10Т(ЭИ914)
1017Н13М2Т (ЭИ448)
10Х17Н13МЗТ(ЭИ432)
06ХН28МДТ (ЭИ943)
03ХН28МДТ (ЭП516)
ГОСТЫ И ТУ НА
Ленга
14-1-3250—81**
14-1-3249—81**
4986—79*
14-1-367—72**
14-1-2929—80**
—
—
14-1-2289—77**
14-1-2275—77**
—
—
—
—
—
4986—79*
4986—79*
4986—79*
4986—79*
4986—79*
—
ПОСТАВКУ МЕТАЛЛА (ПО ВИДАМ ПРОДУКЦИИ)
Тонкий лист
5582—75*
5582—75*
—
5582—75*
5582—75*
5582—75*
5582—75*
5582—75*
14-132-89—74**
5582—75*
5582—75*
5582—75*
5582—75*
5582—75*
5582—75*
5582—75*
5582—75*
• 5582—75*
Толстый
лист
7350—77*
7350—77*
7350—77*
7350—77*
7350—77*
—
7350—77*
7350—77*
7350—77*
7350—77*
7350—77*
7350—77*
7350—77*
7350—77*
7350—77*
7350—77*
7350—77*
7350—77*
Сорт
5949—75*
19442—74*
5949—75*
5949—75*
5949—75*
5949—75*
18907—73*
5949—75*
18907—73*
5949—75*
5949—75*
5949—75*
5949—75*
5949—75*
5949—75*
5949—75*
5949—75*
5949—75*
5949—75*
5949—75*
Трубы
9940—81*
9941—81*
9940—81*
9941—81*
9940—81*
9941—81*
9940—81*
9941—81*
—
9940—81*
9940—81*
9941—81*
9940—81*
—
11068—81*
9940—81*
9941—81*
9940—81*
9941—81*
9940—81*
19277—73*
9941—81*
19277—73*
9940—81*
9941—81
—
—
—
Проволока
18143—72*
14-1-1625—75**
14-1-1639—75**
—
14-1-981—74**
—
18143—72*
18143—72*
18143—72*
—
* ГОСТы. ** ТУ.
ТАБЛИЦА 4
РЕЖИМЫ ТЕРМИЧЕСКОЙ ОБРАБОТКИ И МЕХАНИЧЕСКИЕ СВОЙСТВА
Марка сталей
и сплавов
Режим термической обработки
Н/мм*
НЕКОТОРЫХ НЕРЖАВЕЮЩИХ СТАЛЕЙ И
Н/мм2
а, %
*ф, %
ап, кДж/м2
СПЛАВОВ
НВ
12X13
14Х17Н2
08X13
08Х17Т
І5Х25Т
15X28
12Х21Н5Т
08Х22Н6Т
08Х21Н6М2Т
08Х18Г8Н2Т
10Х14П4Н4Т
12Х18Н10Т
08Х18Н10Т
10Х17Н13М2Т
10Х17Н13МЗТ
06ХН28МДТ
03ХН28МДТ
Стали ферритно-мартенситного класса
Отжиг при 780 °С (печь); закалка
с 1000—950° С, масло;
отпуск при 700 °С, воздух
600
400
Стали аустенитно-мартенситного класса
Закалка с 975—1025 °С, масло;
отпуск при 275—350 °С, воздух 1000 700
Стали ферритного класса
Закалка с 1000 °С, масло;
отжиг при 700—780 °С, воздух
Отжиг при 780 °С, воздух
Отжиг при 730—770 °С, воздух
Отжиг при 680—720 °С, воздух
Стали аустенитно-ферритного класса
Закалка с 950—1000 °С, воздух
Закалка с 1050 °С, воздух
Закалка с 950—1050 °С, воздух
Закалка с 980—1020 °С, вода
Стали и сплавы аустенитного класса
Закалка с 1050 °С, вода
Закалка с 1080 °С, вода
Закалка с 1080 °С, вода
Закалка с 1080 °С, вода
Закалка с 1080 °С, вода
Закалка с 1080—1100 °С, вода
Закалка с 1080—1100 °С, вода
20
10
60
30
600
400
450
450
400
200
300
300
20
20
20
20
60
50
45
45
600
550
650
650
350
350
350
350
18
25
20
25
40
40
40
—
650
550
500
550
500
550
500
250
220
220
220
200
200
200
35
40
40
40
35
35
35
50
55—60
55
50
45
40
40
900 (9)
500 E)
1000A0)
2000 B0)
600 F)
3200 C2)
2600 B6)
1400 A4)
1400A4)
1000A0)
1000A0)
121—187
260
120—180
255-
170
130—190
250—380
200—275
140—170
140
140
140
180
160
МЕТОДЫ УДАЛЕНИЯ ОКАЛИНЫ
С ПОВЕРХНОСТИ МЕТАЛЛА
Неудаленная окалина, всякого рода загрязнения, плохая
отделка поверхности деталей резко снижают коррозионную
стойкость металла. Поэтому с поверхности деталей следует
полностью удалять даже следы окалины, а также мельчайшие
частички железа.
В практике применяют химические, электрохимические и
механические способы удаления окалины.
К химическим и электрохимическим способам относятся
травление, пассивирование и электролитическое полирование,
а к механическим — галтовка, крацевание, шлифование и
полирование.
Коррозионная стойкость полированной поверхности
значительно выше, чем шлифованной или травленой (непассивиро-
ванной). Поэтому в процессе отделки деталей из нержавеющих
сталей следует добиваться высокой чистоты поверхности и
полного сглаживания мельчайших неровностей.
Аустенитные хромоникелевые стали хуже шлифуются и
полируются, чем хромистые стали. Многие детали, применяемые
в машиностроении, подлежат отделке. Поэтому с двухфазных
сталей типа 08Х22Н6Т окалину целесообразно удалять
механическими способами, так как при химических в результате
вытравливания ферритной фазы поверхность металла становится
шероховатой и ее дополнительно требуется шлифовать и
полировать.
Травление и пассивирование. Процесс травления
состоит из следующих операций: обработки в щелочном
расплаве, промывки в холодной проточной воде, травления в
растворе кислоты, промывки, пассивирования, промывки, протирки
и сушки.
При обработке в щелочном расплаве окись хрома
взаимодействует со щелочью:
Сг2О3 + 2NaOH -> 2NaCrO2 + Н2О.
Хромит натрия при окислении селитрой переходит в легко
растворимый в воде хромат натрия:
2NaCrO2 + 3NaNO3 + 2NaOH -> 2Na2Cr04 + 3NaNO3 + H2O.
Входящие в состав окалины окислы железа и хромит железа
окисляются селитрой:
2FeO + NaNOg -> Fe2O3 + NaNO3;
2Fe3O4 + NaNO3 -> 3Fe2O3 + NaNO2;
2FeO. Cr2O3 + NaNO3 -> Fe2O3 + 2Cr2O3 + NaNO3.
Эти химические реакции вызывают изменение структуры
окалины, в результате чего она легко разрушается.
100
Щелочной расплав состоит из 60—70% едкого натра, 25—
35 % натриевой селитры и 5 % поваренной соли. Металл
выдерживают в расплаве 5—25 мин при 450—500 DC.
Детали перед загрузкой в расплав тщательно просушивают.
В процессе обработки металла в расплаве окалины частично
отслаивается и оседает в виде шлама на дно ванны.
Оставшуюся окалину после промывки удаляют травлением в
растворе, содержащем 10—18% серной кислоты (плотность 1,84)
с добавкой 3—8 % ^поваренной соли, или в растворе,
содержащем 20% серной кислоты, 1,5% азотнокислого натрия и 2,5%
поваренной соли. Продолжительность травления 3—5 мин,
температура раствора 70—80 °С. При травлении хромистых
нержавеющих сталей типа 1X13, Х17, Х25 и Х27 температура
раствора должна быть 50—60 °С.
По данным работы [277], при травлении нержавеющих сталей
в указанном растворе можно применять ингибитор катапин.
Травильный раствор корректируют, добавляя серную
кислоту при уменьшении ее концентрации <11 %. Кислоту вводят
в таком количестве, чтобы после тщательного перемешивания
ее содержание в растворе составляло 18—22 %. Хлористый
натрий и селитру добавляют в тех случаях, когда поверхность
протравленного металла приобретает серый цвет.
Двухфазные стали типа ЭИ811 рекомендуют травить в 15—
18%-ном растворе соляной кислоты при 60—70 °С в течение
3—10 мин.
В случае появления рыхлой отслаивающейся пленки на
поверхности металла двухфазных сталей (ЭП53, ЭП54) после
травления в соляной кислоте в травильный раствор
рекомендуют вводить 0,9 % ингибитора ПБ-8/2. Двухфазные стали
можно также травить в сернокислотном растворе следующего
состава: 18 %-ная H2SO4 + 3 % NaCl + 0,015% 4M (травильная
присадка) при температуре раствора 80 °С в течение 5—
10 мин.
После травления стали подвергают пассивированию в 3—
5 %-ном растворе азотной кислоты при 40—50 °С в течение 3—
5 мин. Для пассивирования хромистых сталей применяют тот
же раствор, но рекомендуют вводить в него дополнительно
1—2 % бихромата натрия. После пассивирования поверхность
полуфабрикатов и деталей становится серебристо-матовой,
чистой, в результате значительно повышается коррозионная
стойкость металла.
Во избежание в процессе пассивирования почернения
поверхности металла следует составлять пассивирующий раствор на
чистой воде, не содержащей хлоридов. Кроме того, для
получения самой пассивной пленки с более высокими коррозионными
свойствами промывные воды и щелочные растворы, применяемые
при этом процессе, должны содержать минимальное количество
хлоридов, а еще лучше не содержать их.
101
На машиностроительных заводах часто отсутствуют
установки с щелочными расплавами. В таких случаях для
облегчения кислотного травления перед термической обработкой детали
следует погружать в йасыщенный раствор поваренной соли.
Во время термической обработки NaCl вступает во
взаимодействие с окислами металла и окалина, остывая, при
малейшем постукивании легко осыпается.
Окалина может удаляться с поверхности стали *и без
предварительного разрыхления в щелочном расплаве. Для этого
применяют растворы следующего состава: 200—250 г/л
азотной кислоты, 15—25 г/л фтористого натрия и 15—25 г/л
хлористого натрия. Температура раствора комнатная,
продолжительность травления 15—90 мин.
Можно применять раствор с меньшей концентрацией
компонентов: 100 г/л азотной кислоты и 4 г/л фтористого натрия при
температуре раствора 50—60 °С.
Для предварительного разрыхления толстой окалины можно
использовать раствор (частей по объему):
Серная кислота (плотность 1,84) . . 6—8
Соляная кислота (плотность 1,19) . . 2—4
Вода 100
Для получения блестящей, глянцевой поверхности металла
применяют травильную смесь кислот, % (объемн.):
Соляная кислота 20 Фосфорная кислота . . 5
Азотная кислота 5 Вода 70
Гидриднонатриевый метод травления применяют для
удаления окалины с поверхности деталей из нержавеющих сталей
различных марок, сплавов на основе титана, никеля и других
металлов, не растворяющихся в щелочах.
Детали обрабатывают в расплавленной щелочи с добавкой
2% гидрида натрия (NaH), который образуется в травильной
ванне при взаимодействии металлического натрия с водородом.
Окислы железа полностью восстанавливаются по реакции
4NaH + Fe3O4 = 3Fe + 4NaOH.
Окислы хрома восстанавливаются частично:
NaH + Cr2Q3 - 2CrO + NaOH.
Металл, загруженный в расплав, должен быть совершенно
сухим, поэтому детали предварительно прогревают в печах при
300 °С. Продолжительность выдержки в расплаве (в
зависимости от состояния окалины) составляет 5—20 мин,
температура расплава 350—380 °С.
Восстановленная акалина, имеющая вид рыхлой губчатой
массы, остается на поверхности деталей; ее удаляют с их
поверхности струйной промывкой холодной водой.
102
Для получения блестящей поверхности стальные детали
после гидриднонатриевой обработки дополнительно травят
2—5 мин в 5—10% -ном растворе серной кислоты; детали из
нержавеющей стали после травления дополнительно
пассивируют в течение 1 мин в 5—10%-ном растворе азотной кислоты
при 60—70 °С; детали из сплавов титана подвергают
травлению -в смеси азотной и плавиковой кислот; детали из сплава
типа нимоник травят в смеси азотной кислоты и хлорного
железа.
В лабораторных условиях без предварительного
разрыхления окалины для травления образцов из нержавеющей стали
можно применять растворы следующего состава: 5 мл азотной
кислоты (плотность 1,4), 45 мл соляной кислоты (плотность
1,19) и 50 мл воды. Температура раствора 60—70 °С,
продолжительность травления 5—10 мин. В процессе удаления
окалины образцы металла несколько раз вынимают из травильного
раствора, промывают водой и зачищают металлическими
щетками (сделанными из нержавеющей проволоки).
Удалять окалину с поверхности нержавеющих сталей можно
так называемым щелочным раствором пермлнганата [229].
В качестве раствора используют 50—100 гД^едкого натра,
50—100 г/л перманганата калия. Температура раствора 80—
100 °С. Продолжительность 1—30 мин в зависимости от
толщины окалины. При составлении раствора сначала растворяют
в воде щелочь, затем вводят необходимое количество
перманганата. После обработки металла в указанном растворе
следует промывка в воде и дополнительное травление в кислотных
растворах. Считают более эффективной такую
последовательность операции: травление в кислотах, обработка в щелочном
растворе перманганата калия и повторное травление в
кислотах.
Удаление окалины с металла объясняется объемными
изменениями, происходящими при переходе низших окислов
металла в высшие. Так, например, на нержавеющих хромистых
сталях окалина состоит из окислов трехвалентного хрома,
которые под действием перманганата окисляются до
шестивалентного. Окисел шестивалентного хрома легко растворяется в
щелочном растворе.
Поскольку перманганат калия является дорогим
химикатом, процесс удаления окалины в этом растворе в
производственных условиях будет также неэкономичным.
Его можно применять для удаления окалины в
лабораторной практике.
Электролитическое травление нержавеющих сталей можно
также проводить в 5—10%-ном растворе азотной кислоты при
комнатной'температуре, продолжительность 10 мин. Катодная
плотность тока 3—4 А/дм2. В качестве анодов применяют
кремнистый чугун, катодами служит нержавеющая сталь.
103
Детали с резьбой, а также детали, которые «после
термической обработки нельзя механически зачищать и шлифовать,
травят на аноде в растворе следующего состава: 100 мл серной
кислоты (плотность 1Д4), 800 мл фосфорной кислоты
(плотность 1,54), 100 г хромового ангидрида, 100 мл воды.
Температура раствора 70—75 °С, плотность тока на аноде 70—75 А/дм2,
продолжительность травления 5—10 мин (катодами служат
свинцовые пластины).
Окислы, образующиеся на поверхности стали в* процессе
сварки, и травильный шлам можно удалять в 15—20%-ном
растворе перекиси водорода. Продолжительность процесса
5—10 мин, температура раствора комнатная. Помимо
травильных качеств, раствор перекиси водорода обладает хорошими
пассивирующими свойствами. Перекись водорода при
взаимодействии с окислами металлов быстро разлагается, в связи
с чем значительно повышается ее расход, и травление в
указанном растворе требует больших затрат.
Для удаления ржавых пятен, образующихся на изделиях
в процессе хранения, можно применять 10%-ный раствор
лимоннокислого натрия.
Осветление стали Х18Н10Т [246] с целью очистки
поверхности от цветов побежалости, окислов и неудаленного
травильного шлама можно осуществлять в 30%-ной перекиси водорода
при температуре 55—65 °С или в смеси, состоящей из 25 мл/л
30%-ной перекиси водорода и 75 мл/л азотной кислоты
(плотность 1,32) при температуре 20—60 °С. Скорость удаления
травильного шлама резко возрастает при повышении температуры
растворов.
Осветление стали 10Х17Н13М2Т [299] с целью удаления
окислов после сварки металла 1 рекомендуют выполнять пастой
следующего состава: 200 г/л H2SO4, 20 % NaCl и 400 г/л
асбеста, а пассивацию сплава 06ХН28МДТ [171] после шлифования
металла — в 19%-ной серной кислоте, содержащей 0,1 %
перекиси водорода.
Анодное травление мелких деталей и образцов из аустенит-
ных сталей типа Х18Н10Т проводят в хромовом электролите,
содержащем 200—250 г/л хромового ангидрида и 2—2,5 г/л
серной кислоты, при температуре 50—55 °С и анодной
плотности тока 540—50 А/дм2. Продолжительность травления 3—
10 мин. Катодами при этом служат свинцовые пластины. После
травления следует промывка в воде. При наличии на
поверхности нержавеющей стали травильного шлама применяют
декапировку в 5—15%-ном растворе соляной кислоты с
последующей промывкой, нейтрализацией остатков кислоты и
сушкой.
1 Окислы, оставшиеся на металле, вызывают окрашивание растворов
роданистого натрия, что недопустимо, например, в производстве волокна
нитрон.
104
Анодное травление можно также осуществлять в 10%-ном
водном растворе серной кислоты при плотности тока 10—
20 А/дм2 в течение 2—10 мин. Температура комнатная. В
качестве катодов применяют свинцовые пластины или пластины из
нержавеющей стали.
Химическое травление. Удалять окалину после
термической обработки с нержавеющих хромоникелевых сталей
можно химическим травлением в водном растворе 4%-ной
азотной кислоты (плотность 1,35), 36%-ной соляной кислоты
(плотность 1,19). Температура раствора 35—50 °С,
продолжительность травления 3—6 мин.
Травление пастами. Данный вид очистки применяют
для листового проката из двухслойной стали, например
нержавеющей стали Х18Н10Т и СтЗ.
Травильную пасту приготовляют из 200—250 г/л H2SO4,
150—175 г/л NaCl и 15—20 г/л NaNO3. В раствор вводят
измельченную огнеупорную глину до получения сметанообразной
консистенции.
Пасту наносят кистью на поверхность коррозионностойких
листов, затем их укладывают горизонтально и выдерживают
в течение суток. После чего пасту смывают водой и биметалл
травят по режиму для углеродистой стали в течение 10—15 мин,
промывают, пассивируют и сушат.
Для слабого травления (удаления оксидов) рекомендуют
насыщенные водные растворы сульфата меди, сильно
подкисленные соляной кислотой. Для травления применяют также
царскую водку (смесь концентрированных кислот): 3 ч. НС1 +
1 ч. HNO3.
Одновременное травление и окрашивание в темный цвет
поверхности нержавеющих сталей достигается в растворе,
содержащем 250 см3 концентрированной НС1 и 750 мл воды, в
который добавляют 50 г нитрата висмута и 50 г теллуристой
кислоты. Для этих же целей (травление и окраска) можно
использовать смесь, состоящую из концентрированного раствоіра
800 мл FeCl3 и концентрированной НС1 B0 мл).
Химическое клеймение деталей из стали типа Х18Н10Т
проводят в растворе следующего состава:
Азотная кислота (плотность 1,4), мл 40
Соляная кислота (плотность 1,19), мл .... 40
Селен (металлический), г 4
Оксид меди, г 4
Вода, мл 100
Клеймо наносят резиновым штампом, смачивая его о
подушечку из листового асбеста или пористой резины. Раствор
следует хранить, в стеклянной банке с притертой пробкой.
Электролитическое полирование. Сущность
этого способа заключается в анодной обработке поверхности
металла в специальных электролитах. Поверхность металла
105
сглаживается в результате растворения выступающих участков.
При электролитическом полировании удаляются лишь мелкие
шероховатости (второго порядка). Поэтому изделия после
грубой обработки резцом »ли изделия, имеющие глубокие впадины
на поверхности (шероховатости первого порядка), перед
электрополированием должны предварительно подвергаться
механической обработке и иметь поверхность, соответствующую
7—8-му классу чистоты обработки.
Электролитическое полирование может быть осуществлено
в растворе, содержащем 45 % фосфорной кислоты, 40 % серной
кислоты, 5% хромового ангидрида и 10% воды. Температура
раствора 50—70 °С, плотность тока 30—60 А/дм2,
продолжительность полирования 10—15 мин. В качестве катодного
материала применяют свинец, а также в растворе: 20 % серной
кислоты, 55 % лимонной кислоты, 25 % воды, температура
раствора 80—85 °С, плотность тока 10—25 А/дм2,
продолжительность полирования 5—10 мин (катодом служат медные
пластинки).
Химическое полирование. Для химического
полирования аустенитных сталей может быть применен раствор
следующего состава: 4 объема соляной кислоты, 1 объем азотной
кислоты, 0,5 объема серной кислоты, 5 г/л уксусной кислоты,
температура раствора 80—150 °С.
Для химического полирования хромистых и хромоникеле-
вых нержавеющих сталей, а также углеродистых сталей
готовят раствор фосфорной кислоты, который медленно нагревают
до 250 °С, при этом фосфорная кислота частично переходит
в пирофосфорную. Реакция продолжается 1,5 ч (ее окончание
определяют по прекращению выделения газа). Затем кислоту
быстро охлаждают и добавляют около 10% серной кислоты.
Чем больше содержание углерода в стали, тем меньше
добавляют кислоты. Полирование проводят при 200 °С в течение
1 —10 мин. После пассивирования, электролитического или
химического полирования необходима нейтрализация остатков
кислоты на деталях, которую осуществляют в 1—3%-ном
растворе кальцинированной соды с последующей промывкой и
сушкой.
Дли химического полирования пружин из стали 12Х18Н10Т
рекомендуют раствор следующего состава:
Азотная кислота (плотность 1,4), мл 40
Соляная » ( » 1,19), мл .... 70
Серная » ( » 1*84), мл .... 230
Клей столярный, г/л 10
Хлористый натрий, г/л 5—6
Краситель кислотный черный, г/л 5—6
Температура раствора 65—70 °С, выдержка 5—30 мин.
После электролитического (или химического) полирования
получают поверхность с вышкой отражательной способностью,
106
которая не загрязняется остатками полировальных веществ.
Такому полированию подвергают, предварительно хорошо
отшлифованную поверхность. Вместе с тем электролитическое
(и химическое) полирование имеет существенный недостаток:
детали, подвергнутые сильной деформации, приобретают
шероховатую поверхность, а сварные швы, невидимые при
механическом полировании, резко выявляются.
Крацеванис. Крацсвание применяют для удаления
разрыхленного слоя окалины и шлама с поверхности изделий
сложной конфигурации.
Операцию крацевания выполняют на крацевальных станках
круглыми щетками из тонкой упругой нержавеющей стальной
проволоки диаметром 0,1—0,4 мм. Частота вращения щеток
750—1000 мин-1.
Поверхность изделий во время крацевания смачивают 3—
5%-ным раствором кальцинированной соды или полировочной
известью.
Галтовка. Эту операцию осуществляют перед
шлифованием для удаления с поверхности металла различных
загрязнений, травильного шлама, грубых неровностей и заусенцев.
Детали обкатываются совместно с абразивными
полирующими материалами во вращающихся барабанах или колоколах
с частотой вращения 30—60 мин-1.
Различают галтовку мокрую и сухую. В первом случае
детали обрабатывают с абразивными материалами, к которым
добавляют 2—3%-ный раствор соды, во втором —с сухими
абразивными материалами.
Не допускается обработка деталей, выполненных из кор-
розионностойких сталей, шариками из обычной стали.
Гидроочистка. К гидроочистке относятся
гидрошлифование и гидрополирование.
На большинстве установок гидроочистки все операций, за
исключением загрузки и выгрузки деталей, механизированы.
Детали шлифуются и полируются в перфорированных
барабанах, при этом устраняется ручная отделка на войлочных
кругах. Чистота поверхности повышается до 8—9-го класса.
Жидкостному шлифованию и полированию подвергают
мелкие детали (массой до 500 г) после штамповки, литья,
механической обработки с чистотой поверхности не ниже 4—6-го
классов.
Сущность процесса гидроочистки заключается в обработке
деталей вместе со шлифующими материалами, помещенными
в шестигранный барабан. Последний погружают в ванну с
рабочей жидкостью, где он вращается со скоростью 25—ЗО об/міин.
При отделке хромистых сталей частота вращения барабана
может быть увеличена до 50 мин-1.
При вращении барабана детали и шлифующий материал
перемешиваются и взаимно притираются. Барабан с отвер-
107
стиями диаметром 3—5 мм выполнен из виницласта, ванна из
стали СтЗ внутри облицована винипластом.
Все металлические детали крепления, привод форсунки,
баки, мешалки, змеевики и сопла (при струйной подаче
жидкости) должны быть выполнены из коррозионностойкой стали,
пластмассы или стекла.
Установка должна быть предназначена специально для
отделки коррозионностойких сталей. Не допускается
одновременная загрузка деталей из обычных сталей.
В качестве рабочей жидкости применяют кипяченую воду,
добавляя 0,1-7-0,2 % нейтрального мыла и 0,1—0,2 %
кальцинированной соды. Температура раствора 25—45 °С.
При шлифовании в качестве абразивного материала
используют бой электрокорундовых кругов зернистостью 150—180.
Барабан загружают из расчета 2 ч. (по массе) абразивного
материала и 1 ч. (по массе) деталей.
При полировании применяют фарфоровый бой, иногда
добавляют шарики из коррозионностойкой стали (Х17Н2 или
Х18). Соотношение полирующих материалов и деталей в
барабане примерно то же, что и при шлифовании.
В процессе жидкостного шлифования и полирования не
допускается загрязнение раствора металлической пылью,
ржавчиной, а также применение в качестве абразивного материала
наждака и других веществ, содержащих окислы железа.
Данный процесс обработки широко применяют на
машиностроительных заводах легкой и пищевой промышленности при
обработке точеных, литых и штампованных деталей различной
конфигурации, изготовленных не только из коррозионностойких,
но и из углеродистых сталей, а также меди^ титана и их
сплавов.
Шлифование и полирование. Шлифование
осуществляют для предварительной подготовки поверхности металла
перед полированием.
При шлифовании острорежущие грани зерен абразива
сглаживают крупные неровности на поверхности деталей, однако
при этом остаются риски. Шлифование выполняют на станках
с вращающимися кругами (главным образом фетровыми), на
поверхность которых наклеивают абразивный материал.
Детали из коррозионностойких сталей перед шлифованием
и механическим полированием следует декапировать в 5—
8%-ном растворе азотной кислоты для удаления всех следов,
оставленных инструментом.
При шлифовании и полировании необходимо учитывать
состав стали, ее структуру и физико-химические свойства.
Аустенитные стали следует шлифовать с давлением образца
на круг 3,0—7,5 МН/м2 C0—75 кгс/см2), дальнейшее
увеличение давления уменьшает чистоту поверхности металла. При
шлифовании хромистых (мартенситных) сталей давление об-
108
разца на круг не сказывается на чистоте поверхности и
практически может повышаться до 25 МН/м2 B50 кгс/см2).
Шлифование коррозионностойких сталей следует вести кругами с
абразивным порошком, предварительно просаленным жировыми
веществами.
Из абразивных материалов при шлифовании и полировании
коррозионностойких сталей наиболее широко используют
корунд, содержащий 99 % А12О3. Для получения поверхности
высокого качества шлифование и полирование следует вести
с большим числом переходов и последовательным применением
абразивов соответствующих номеров.
Горячекатаный металл шлифуют кругами с тремя
переходами абразива № 60—80, 100—120, 150—200. Полируя
холоднокатаный лист, обработку ведут с двумя переходами (№ 250
и 300).
При шлифовании камнями нужно чаще править круги (так
как они быстро засаливаются) и применять интенсивное
охлаждение. При чистовом полировании коррозионностойких
сталей для получения зеркальной поверхности применяют
войлочные круги, а также круги, сшитые из дисков эластичной кожи
и ткани.
Полирование устраняет неровности, которые остаются после
шлифования, и поверхность металла приобретает зеркальный
блеск.
Его осуществляют на том же оборудовании, что и
шлифование. Для полирования архитектурных украшений из
коррозионностойких сталей, вмонтированных в конструкцию, можно
использовать электрополировальную машину ЗИЛ и
полировальную машину НИАТ.
При полировании коррозионностойких сталей применяют
известковые, алюминиевые и хромовые пасты. Наилучшими из
хромовых паст являются пасты, состоящие из окиси хрома, так
называемые пасты ГОИ (различают грубые, средние и тонкие).
При шлифовании и полировании коррозионностойких сталей
такие материалы, как наждак, содержащий до 35 % окиси
железа, карборунд с небольшим количеством графита, крокус и
железный сурик, применять нельзя. Окислы железа в пастах
вызывают появление ржавчины, а графит науглероживает
поверхность деталей, что может сделать металл склонным к меж-
кристаллитной коррозии. По этим же причинам не следует
применять наждачную и особенно крокусную пасту.
Пассивность, а следовательно, и коррозионная стойкость
коррозионностойких сталей связаны не только с состоянием
поверхности металла, но и со структурой. Поэтому для снятия наклепа
и напряжений металл следует подвергать закалке. Режимы этого
вида термической обработки для отдельных коррозионностойких
сталей приведены в табл. 4. После термической обработки
окалина должна быть полностью удалена. Однако в процессе
109
межоперационного хранения на поверхности коррозионностои-
ких сталей иногда образуются ржавые участки, которые
необходимо удалить промывкой в 10%-ном растворе лимоннокислого
натрия. Для очистки не отедует применять металлические щетки
из обычной углеродистой проволоки. Необходимо помнить, что
любые частицы железа, остатки окалины, окислы после сварки
могут вызвать образование ржавчины.
Обезжиривание и пассивирование. Поале
окончательной механической обработки с целью повышения
коррозионной стойкости деталей следует производить обезжиривание
и пассивирование их с тщательной промывкой в горячей воде.
Обезжиривание (удаление жировых загрязнений)
осуществляют в одном из следующих растворов, г/л:
1. NaaCO3 или КаСО3 .... 30—50
NaOH или КОН 10—20
Жидкое стекло или мыло . 2—3
2. КаСО3 или Na2CO3 .... 15—25
Na3PO4 15—25
NaOH 5—10
Жидкое стекло или мыло . 2—3
Температура растворов 80—90 °С и выше.
Пассивирование — создание тонкой пленки окислов на
поверхности металла — происходит в результате его обработки
в 5 %-ной азотной кислоте при температуре раствора 50—60 °С
в течение 3—5 мин.
Покрытия. На детали из нержавеющих сталей типа
Х18Н10Т можно наносить металлические покрытия.
Омеднение выполняют в электролите следующего состава,
г/л: 200 сернокислой меди; 50 серной кислоты; 5—7 фтористого
натрия; плотность тока при этом составляет 3—5 А/дм2.
Никелирование осуществляют в обычных электролитах.
Однако перед нанесением никеля требуется предварительная
электрохимическая обработка поверхности нержавеющей стали
в растворе хлористого никеля 250 г/л и соляной кислоты 8 %
(объемн.), температура раствора 18—23 °С, плотность тока
3,2 А/дм2, аноды представляют никелевые пластины.
ВЛИЯНИЕ НЕКОТОРЫХ ВИДОВ
ХОЛОДНОЙ ОБРАБОТКИ И НОВЫХ
МЕТОДОВ ВЫПЛАВКИ НА КОРРОЗИОННУЮ
СТОЙКОСТЬ СТАЛЕЙ И СПЛАВОВ
Ферритные коррозионностойкие стали, а также ферритно-аусте-
нитные стали обрабатываются сравнительно легко, аустенит-
ные стали и сплавы — значительно труднее. Объясняется это
склонностью таких сталей к наклепу; незначительная
деформация приводит к сильному упрочнению металла. В процессе лю-
110
бой операции холодной обработки это в свою очередь может
привести к поломке инструмента и повреждениям поверхности
металла в виде задиров, царапин, ссадин и забоин.
Шероховатая поверхность с различными дефектами благоприятна для
развития коррозии. Так, например, при фрезеровании могут быть
дефекты в виде вырывания металла. При разметке не
рекомендуется вычерчивать вспомогательные линии и осуществлять
кернение, так как поврежденные участки будут очагами
коррозии. Поэтому вычерчивание и кернение допускаются только
по кромкам элементов разверток, т. е. по линиям обрезов.
Маркировку и обозначения наносят краской. В результате
проведенных исследований М. М. Абелевым [248] установлены
оптимальные режимы, дающие качественную обработку при
точении и сверлении сплава 06ХН28МДТ. Так, например, точение
сплава 06ХН28МДТ можно выполнять инструментом,
применяемым для обработки стали Х18Н10Т.
Поправочный коэффициент на скорость резания должен
составлять 0,6—0,7.
Стойкость инструмента при точении сварного соединения
принимают близкой к стойкости его при обработке основного
металла; коэффициент ухудшения обрабатываемости
составляет 0,92—0,95.
Сверление деталей из сплава 06ХН28МДТ можно
осуществлять сверлами из быстрорежущей стали Р18 следующей
геометрии: а = —15°; 2ф=150°. Режимы сверления: подача 0,15—
0,43 мм/об при скорости резания u=ll—20 м/мин.
Важным условием для достижения высокой стойкости
является работа сверлами с короткой рабочей частью. Вибрации
таких сверл при оптимальной геометрии малы, что способствует
нормальной работе сверла и увеличению его стойкости.
На стойкость сверла в большой степени оказывают
влияние скорость резания и подача. С увеличением подачи от 5 =
= 0,15 до 0,43 мм/об стойкость сверла уменьшается в 7—8 раз.
Сверление сплава 06ХН28МДТ нужно проводить в
соответствии с режимами резания, указанными в табл. 5.
Для улучшения обрабатываемости иногда в аустенитные
стали вводят серу и селен. Однако это улучшение
обрабатываемости достигается, к сожалению, в результате уменьшения
коррозионной стойкости.
Обрабатываемость стали Х18Н10Т можно улучшить,
подвергнув ее отжигу при 700—750 °С. Это вызывает выделение
карбидов, вследствие чего стружка становится более хрупкой,
легче удаляется и уменьшается износ инструмента. Однако
такие детали после механической обработки склонны к межкри-
сталлитной коррозии и повышению общей коррозии. Чтобы
обеспечить * такому металлу максимальную коррозионную
стойкость, следует его вновь подвергнуть закалке при 1050—1080 °С
и охлаждению в воде.
111
ТАБЛИЦА 5
Диаметр
сверла,
мм
6
10
15
20
25
Подача
мм/об
0,Ю
0,15
0,15
0,20
0,15
0,20
0,15
0,20
0,25
0,15
0,20
0,25
РЕЖИМЫ РЕЗАНИЯ
Скорость
різання,
м/мин
11,4
9,5
12,1
10,7
13,6
11,9
15,4
13,5
12,2
16,8
14,7
13,3
СПЛАВА
Частота
вращения,
МИН
600
560
386
342
240
254
226
198
180
191
188
170
[248]
Осевое
усилие,
1 120
1 440
2 660
3 150
4 320
5 150
5 450
7 160
8 200
7 700
9 100
10 400
Крутящий
момент,
Н.см
92
* 116
204
237
314
344
465
500
570
547
643
720
При резке листового проката ножницами следует принимать
меры, предупреждающие образование на лицевой стороне
металла ссадин и забоин, главным образом во время укладки его
на стол ножниц и передвижения вдоль ножей в процессе резки.
Это рекомендуют осуществлять при помощи шаровых оіпор. Во
время резки на поверхности среза возможно налипание металла
инструмента, что вызвает появление ржавчины, но это не
отражается на коррозионной стойкости нержавеющей стали.
При гибке, например, труб, на поверхности металла
возникают растягивающие напряжения. Под их действием в
некоторых средах наблюдают коррозионное растрескивание.
Опасность коррозионного разрушения заключается в том, что при
отсутствии заметных видимых изменений в процессе
эксплуатации металл может внезапно разрушаться за очень короткое
время.
Штамповка. Аустенитные стали в закаленном состоянии,
имеющие максимальную вязкость, хорошо штампуются и в то
же время подвергаются наклепу.
При штамповке следует избегать применения свинцовых
штаміпов. Во время термической обработки или работы
деталей при высоких температурах, если свинец и другие
легкоплавкие металлы не удалены, коррозионностойкая сталь будет
подвержена межкристаллитной коррозии.
В. А. Масловым [84] установлено, что после штамповки
сталь 12Х18Н10Т корродирует немного больше, чем в
состоянии поставки. Так, например, в кипящей 40%-ной HNO3 в
состояния поставки скорость коррозии равна 0,0604 г/(м2-ч),
после первой штамповки 0,0654 и после второй 0,0688 г/(м2-ч).
Эта же сталь в 98 %-ной'кипящей HNO3 в состоянии поставки
корродирует со скоростью, равной 5,820 г/(м2-ч), после первой
112
штамповки 5,980 и после второй 6,260 г/(м2-ч). Аналогичная
закономерность установлена для стали 10Х17Н13М2Т в
уксусной кислоте, причем скорость коррозии в этом случае
значительно меньше 0,1 г/(м2-ч).
Влияние деформации на коррозионную стойкость стали
12Х18Н10Т изучали в работе [305]. Авторы показали, что
увеличение скорости коррозии деформиронанной стали в кипящей
ВЛИЯНИЕ РАЗЛИЧНЫХ МЕТОДОВ ВЫПЛАВКИ
НА КОРРОЗИОННУЮ СТОЙКОСТЬ СПЛАВА 36НХТЮ
TeMneDaTVDa
°С
20
50
80
20
50
80
20
50
80
20
50
80
20
50
80
20
50
80
20
50
80
Скорость коррозии. г/(м3-ч),
ои
0,0134
0,08670
14,0935
2,5400
8,0184
43,6210
2,9600
6,2170
41,3212
6,2170
35,4155
ви
57 %-ная
0,0066
0,0699
5,7926
60 %-ная
1,3450
5,5543
29,3394
5 %-ная НС1
2,5805
3,9716
19,2584
20 %-ная НС1
2,5805
3,9716
при методе
ои+эшп
0,0042
0,0487
4,6721
1,2030
14,2240
1,2000
2,2519
25,1919
0,8818
33,1679
Образцы растворились
:
0,0111
0,0600
2,1558
0,2300
1,2302
5,6883
0,0000
* 0,0012
0,0032
15 %-ная Н3РО4
0,0050
0,0560
1,5105
0,0045
1,7300
60 %-ная НСООН
0,0532
0,2460
4,8304
8 %-ная NaOH
0,0000
0,0007
0,0016
0,0475
3,4850
0,0000
0,0000
0,0030
выплавки
ОИ+ВДП
0,0039
0,0519
2,3000
1,5610
6,4638
29,9730
3,9300
21,6620
0,6840
42,8830
0,0079
0,0335
1,4700
0,0500
0,2037
3,7440
0,0000
0,0000
0,0009
серной кислоте объясняется образованием ос-фазы, обладающей
пониженной коррозионной стойкостью и увеличивающей
гетерогенность системы. При этом облегчается анодный процесс
ионизации металла в результате повышения энергии решетки
и катодного процесса водородной деполяризации из-за
уменьшения работы выхода электрона.
В этой же работе [305] отмечено, что деформация
обжатием перед отпуском повышает устойчивость стали Х18Н10Т
к межкристаллитной коррозии.
Выплавка. Нержавеющие стали и сплавы, выплавленные
новыми способами, корродируют с различной скоростью. Так,
например, в работе [252] исследован пружинный оплав 36НХТЮ
(С<0,05%, Si 0,3—0,7%, Мп 0,8—1,2%, № 35—37%, Ті 2,6—
3,2%, AI 0,9—1,2%, Cr 11—13%), выплавленный в открытой
индукционной печи (ОИ), в вакуумной индукционной (ВИ),
в открытой индукционной с последующим электрошлаковым
переплавом (ОИ + ЭШП) и в открытой индукционной с
последующим вакуумно-дуговым переплавом (ОИ + ВДП).
Листовые образцы сплава 36НХТЮ, выплавленного
различными способами, были испытаны в ряде кислот и щелочей при
температурах 20, 50 и 80 °С. Результаты испытаний (табл. 6)
показали, что в 57%-ной HNO3, при комнатной температуре,
независимо от способа выплавки, металл будет коррозионно-
стойким. При 50 °С металл ОИ становится нестойким (скорость
коррозии 0,8670 г/(м2-ч), а металл, выплавленный другими
способами, остается коррозионностойжим.
Повышение температуры испытания увеличивает скорость
коррозии. Как следует из табл. 6, сплав в 57%-ной HNO3 при
80 °С, независимо от способа выплавки, становится нестойким.
Однако максимальную скорость коррозии обнаруживают у
металла, выплавленного в ОИ. Аналогичную закономерность
наблюдают в других кислотах. Высокая коррозионная стойкость
в едком натре обусловлена большим содержанием в сплаве
никеля металла, стойкого в щелочных средах. Таким образом,
выплавка новыми способами сплава 36НХТЮ повышает его
коррозионную стойкость по сравнению с выплавкой в ОИ.
УСЛОВИЯ ПОВЫШЕНИЯ
КОРРОЗИОННОЙ СТОЙКОСТИ, ВИДЫ
КОРРОЗИИ И ОБЛАСТИ ПРИМЕНЕНИЯ СТАЛЕЙ
И СПЛАВОВ
Высокая коррозионная стойкость сталей и сплавов основана на
явлении пассивности [7, .8, 9, 123, 335], открытом еще в 1738 г.
нашим знаменитым соотечественником Михаилом
Васильевичем Ломоносовым [35].
114
Большой вклад в изучение явления пассивности внесли наши
ученые Н. А. Изгарышев, В. А. Кистяковский, Г. В. Акимов,
Н. Д. Томашов и др.
Пассивность металлов до настоящего времени широко и
всесторонне исследуется.
Пассивность — состояние высокой коррозионной стойкости
металла или сплава (в условиях, когда с термодинамической
точки зрения они являются »полис рслкцношіоспособішми),
вызванное избирательным торможением анодного процесса
[121].
Коррозионностойкие стали хорошо пассивируются не только
в азотной ^кислоте, но и в других реагентах, представляющих
сильные окислители.
Пассивирующим агентом является также кислород воздуха.
Пассивность коррозионностойких сталей зависит от
содержания хрома как основного легирующего элемента. Наименьшее
содержание хрома, обеспечивающее сталям пассивное
состояние, составляет 12 %.
С увеличением содержания хрома коррозионная стойкость
сталей в окислительных средах резко возрастает.
Явление пассивности металлов обычно объясняют
воздействием окислительной среды, однако известно, что некоторые
металлы очень энергично пассивируются и в неокислительных
средах, например молибден в НС1. Поэтому не случайно, что
в средах, содержащих хлор-ион, для уменьшения точечной
коррозии и повышения общей стойкости следует применять
коррозионностойкие стали, в состав которых входит молибден.
В морской воде и в восстановительных средах (сернистая,
фтористоводородная, муравьиная, щавелевая кислоты)
применяют стали 08Х21Н6М2Т, 10Х17Н13М2Т, 10Х17НЗМЗТ и др.,
коррозионная стойкость которых значительно выше, чем ста.лей
аналогичного состава, не содержащих молибдена..
Для придания высо/кой коррозионной стойкости в ряде
случаев стали легируют не только хромом, никелем и
молибденом, но также медью, ниобием и другими элементами.
На рис. 5 показано влияние легирующих элементов на
коррозионную стойкость сталей в серной кислоте. Сталь Х18Н10
в серной кислоте при комнатной температуре в интервале почти
всех концентраций является нестойкой. В стали 20Х23Н18
(рис. 5,6), где содержание хрома и никеля больше, чем в стали
Х18Н10, диапазон стойкости значительно больше. Никель, хотя
и в значительно меньшей степени, чем хром, повышает пассиви-
руемость стали вследствие торможения анодного процесса
растворения и практически не оказывает влияния на катодную
реакцию водородной деполяризации. На рис. 5, в и г показано, что
и другие легирующие элементы, например медь и молибден,
также способствуют еще большему повышению коррозионной
стойкости стали. Примером такой стали, содержащей медь и мо-
115
либден, служит сталь 06ХН28МДТ (см. рис. 5, г)«,
предназначенная для работы в условиях производства серной кислоты и
других сернокислотных сред.
-
••'•Л
•¦ ;•.'.*
\ і
a
е
.і •'.*•'. і ¦'. * '•*.
20 40 60 60 fOO О 20 I/O 60 60 ЮО
Рис. 5. Влияние легирующих элементов в коррозионностойких сталях на коррозионную
стойкость в серной кислоте:
а-для 12Х18Н10Т; б — для 10Х23Н18; в — для 06ХН28МТ @Х23Н28М2Т); г - для
06ХН28МДТ @3ХН28МДТ) (область устойчивого, короззионностойкого состояния
заштрихована)
Механизм защитного действия меди и молибдена в сплаве
06ХН28МДТ сводится к следующему: медь уменьшает площадь
анодных участков в результате накопления ее в поверхностном
слое. Это происходит в области анодного растворения, где в
результате электрохимической реакции обмена медь переходит из
раствора, осаждаясь на поверхность стали и создавая таким
образом защитный экранирующий слой.
Молибден, по-видимому, также накапливается в
поверхностном слое стали, так как скорость коррозии его при потенциалах,
характерных для активного состояния стали, очень мала и
обусловлена высокой химической стойкостью поверхностной пленки,
которая не восстанавливается на катоде.
Для исследования механизма пассивности и кинетики
процессов, протекающих при пассивации, используют потенциоста-
тический метод.
Сущность метода заключается в определении скорости
коррозии растворения металла при заданном, поддерживаемом
постоянным значении потенциала и установлении зависимости
скорости растворения металла от потенциала в широкой
области его значений.
116
На рис. 6 показана схематическая -є \
кривая для коррозионностойкой стали,
полученная потенциостатическим
методом.
Кривая начинается участком
активного растворения металла (EUEU). В
точке Еп (потенциал імесішации)
наступает торможение анодной реакции.
На участке ЕиЕт металл находится в
пассивном состоянии,
характеризующемся низкими скоростями растворения,
При потенциале Ет наступает процесс
перепассивации, сопровождающийся
значительным возрастанием скорости
растворения с ростом потенциала.
Из рис. 6 следует, что в активной
области и области перепассивации
скорость коррозии коррозионностойких
сталей возрастает со смещением
потенциала в соответствии с законом
электрохимической кинетики. В
активно-пассивной области, наоборот, скорость
коррозии сталей уменьшается с увеличением
потенциала, что связано с постепенной
пассивацией поверхности металла.
При полной пассивации скорость
коррозии практически не зависит от
потенциала. КоррОЗИОННаЯ СТОЙКОСТЬ СТалей
Определяется ВелИЧИНОЙ СТаЦИОНарнОГО ласть перепассивации
потенциала или потенциалом коррозии. Его значение зависит от
кинетики катодного и анодного процессов и определяется
точкой пересечения катодной кривой с анодной.
На основании анализа потенциостатических кривых скорость
коррозии — потенциал можно сделать общий вывод, что при
разработке нового конструкционного материала необходимо,
чтобы потенциал его в условиях эксплуатации находился в
области пассивного состояния, которое возникает при
определенном значении потенциала пассивации (?п) и плотности
анодного тока пассивации (/п). Для самопассивации сталей и
других металлов необходимо, чтобы
окислительно-восстановительный потенциал среды, а следовательно, потенциал катодной
реакции имел более положительное значение, чем потенциал
полной пассивации металла (?п. п), и чтобы катодный ток
(скорость катодного процесса) превышал значение плотности
анодного тока пассивации (/п). При отсутствии этих условий металл
находится в, активном состоянии и интенсивно растворяется.
Общая коррозия. Коррозионную стойкость сталей
в различных агрессивных средах определяют по потере массы
117
Рис. 6. Схематическая по-
тсициостатичсская анодная
кривая коррозионностойкой
сіяли:
?° — равновесный
(стационарный) потенциал; ?п-
потенциал пассивации; ?пл—
потенциал полной
пассивации (фладепотенциал); ?т —
потенциал перепассивации;
состояния; / — область
активного состояния; // — ак-
металла па единицу поверхности за
единицу времени и выражают в
баллах. Такая оценка возможна в случае,
,если коррозионное воздействие среды
равномерно по всей поверхности ме-
талла, однако наряду с равномерной
коррозией всегда при выборе корро-
зионностойкой стали следует4 учиты-
вать Другие виды коррозии, связан-
ные с разрушением локальных (от-
»A К "*^\vl *¦*,' : дельных) участков металла.
'Г очечная коррозия. При то-
Piic. 7. точочіми корроши iT.uiii чечной коррозии (рис. 7) металл раз-
12X1 j и морском иоде рушается в отдельных местах
(точках). Особенности точечной коррозии
заключаются в быстром ее развитии и поражении металла на
большую глубину, что снижает механическую прочность.
Причина, вызывающая точечную коррозию в коррозионно-
стойких сталях, связана с местным нарушением пассивности
металла, которое возникает в средах, содержащих в основном
хлор-ион. Развитию точечной коррозии способствуют дефекты
стали (плены, раковины, трещины, неметаллические включения
и т. п.), а также наличие на поверхности металла остатков
неудаленной о<калины или ржавчины.
Этот вид коррозии наблюдают также на стали Х18Н10Т
в минеральных водах. В источнике № 6 Тбилисского
месторождения она равна 0,06 г/(м2-ч), а глубина местного поражения
за 6 мес составляет 0,16 мм.
Хромистая коррозионностоикая сталь Х13 в этих же
условиях корродирует со скоростью 0,031 г/(м2-ч), а глубина
местного поражения за тот же период испытания достигает 0,24 мм.
В процессе получения метакриловои кислоты [91] коррозион-
ностойкие стали и сплавы подвергаются точечной коррозии.
Причем скорость коррозии в углублениях в пересчете на год
работы аппарата составляет для стали 12Х18Н10Т 0,32—2,16,
08Х22Н5Т 0,54—2,34 и 10Х17Н13М2Т 2,4 мм/год. Сплав
06ХН28МДТ в этих условиях корродирует равномерно и
незначительно @,0005 мм/год).
В тех случаях, когда металл не подвержен точечной
коррозии и аппаратура предназначена для получения технических
продуктов, т. е. не требующих химической чистоты, можно
применять стали с баллом 6 по коррозионной стойкости.
Контактная коррозия. Опасность разрушения под
влиянием контактной коррозии очень велика. Разрушения этого
вида возникают в случае, когда два металла с различными
электродными потенциалами находятся в контакте в
коррозионной среде. При этом металл с более низким потенциалом
становится анодом и вследствие этого под влиянием другого ме-
118
талла (катода) подвергается
сильному разрушению. На рис. 8
показаны образцы стали
Х18Н10Т и магния, испытанные
во влажной атмосфере.
Поскольку магний по сравнению с кор-
розионностойкой сталью имеет
более отрицательный потенциал, г
он корродирует сильнее. /
В работе [221] показано, что * * х *
скорость коррозии в морской
воде достигает 3 мм/год для
СТаЛЬНЫХ КОНСТРУКЦИЙ В КОНТаК- Рис- 8- Контактная коррозия:
ТЄ СО СТаЛЬЮ 12Х18Н10Т И 5- ' -<™ь 12Х18Н10Т; 2- магний
7 мм/год для алюминиевых конструкций также в контакте
с коррозионностоикои сталью.
В практике нередко наблюдается контактная коррозия
металлов с неметаллами. Так, например, сталь 12X181 НОТ в
контакте с текстолитом в крепкой азотной кислоте подвержена
усиленной коррозии. Аналогичный вид разрушения наблюдается на
стали 12X13. находящейся в контакте с хлорвиниловой
прокладкой в морской воде.
В приложении VI приведены электродные потенциалы (по
водородной шкале) некоторых металлов и сплавов в морской
и шахтной воде.
По данным работы [106], стационарный потенциал для стали
Х18Н10Т в окислительной среде A0 н. HNO3) с повышением
температуры раствора сдвигается в положительную сторону.
Облагораживание электродного потенциала металла при этом
связано с уменьшением катодной поляризации. Обратное
явление наблюдается в восстановительной среде; так, например,
в 0,1 н. НС1 повышение температуры раствора приводит к
некоторому сдвигу электродного потенциала стали Х18Н10Т
в отрицательную сторону. Это следует объяснить тем, что
повышение температуры значительнее ускоряет анодную реакцию
ионизации металла, чем реакцию разряда ионов водорода.
Нужно отметить тот факт, что контакт разных металлов в
условиях химической среды приводит к более сильной коррозии
металла с отрицательным потенциалом. Скорость коррозии
будет тем выше, чем больше разность потенциалов между двумя
металлами, находящимися в контакте и соприкасающимися с
химической средой. Поэтому при выборе конструкционных
материалов нельзя допускать, чтобы в контакте работали стали
с большой разностью электродных потенциалов.
Все виды соединений низколегированных сталей можно
применять, не опасаясь появления усиленной контактной
коррозии, т. е. места контактов будут разрушаться с одинаковой
скоростью, как и основная поверхность металла.
119
Низколегированные и углеродистые стали могут работать
в контакте с хромистыми и хромомарганцовистыми сталями.
Однако непосредственный контакт коррозионностойких хромо-
никелевых стелой и сплавов с хромистыми и
хромомарганцовистыми и тем более с низколегированными сталями
недопустим. В таких случаях необходима замена одного из металлов
или применение прокладок из изоляционных материалов. В
целях предотвращения контактной коррозии также широко
применяют металлические, лакокрасочные и другие покрытия.
Углеродистые низколегированные стали в контакте с медью
или ее сплавами в слабоагрессниных средах остаются почти без
изменения. Один ко енелогичный контакт, например в морской
воде, ирпиодит к интенсивному растворению стали.
Коитактпея коррозии может возникнуть не только в том
случае, когда конструкция выполнена из разнородных металлов,
но и при изготовлении ее ил одного металла с применением
сварки, пайки, заклепочных и болтовых соединений.
Сварной шов, как правило, отличается по
электрохимическому потенциалу от основного металла.
Нагартовка отдельных частей конструкций и механические
напряжения также приводят к возникновению контактных пар.
Большое значение имеет соотношение площадей контактируе-
мых металлов, так как сочетание большой поверхности катода
с небольшой поверхностью анода будет вызывать, несмотря на
небольшую разность потенциалов, значительное растворение
металла. Следовательно, разность потенциалов сама по себе
еще не может однозначно характеризовать коррозионное
поведение анода, находящегося в контакте с катодом. Не меньшее
влияние оказывает поляризация, т. е. изменение начальных
потенциалов под действием тока, текущего в системе, и
омического падения потенциала в растворе.
Обширные исследовательские работы по контактной
коррозии систематизированы в работе [290].
Коррозия под напряжением (коррозионное
растрескивание). В химических аппаратах, выполненных из
нержавеющего металла и находящихся под постоянным повышенным
давлением, при совместном действии коррозионной среды и
статических растягивающих напряжений наблюдают коррозионное
растрескивание.
При наличии в металле напряжений сжатия коррозионного
растрескивания не происходит.
Общая коррозионная стойкость металла, как правило, не
является показательной для определения склонности его к
коррозии под напряжением. Однако следует считать
установленным, что этот вид разрушения, происходящий при
одновременном действии коррозионной среды и напряжений, вызванных
внешней нагрузкой, также зависит и от растягивающих
остаточных напряжений в поверхностном слое металла.
120
Опасность коррозионного растрескивания увеличивается от
того, что при отсутствии видимых изменений может произойти
внезапное разрушение металла за очень небольшое время.
Следует отметить, что коррозионное растрескивание
происходит в очень немногих химических средах и зависит от
давления и температуры. Известно, например, что закаленная сталь
Х18Н10Т, испытанная под напряжением в кипящем 20 %-ном
растворе поваренной соли, разрушается через 20 ч.
На рис. 9 показаны образцы стали X181 ПОТ после
испытания под напряжением в кипящем 42 % ном хлористом магнии.
Разрыв металла происходит не по границам зерен, как при
межкристалл итной
коррозии, а транскристал-
литно, т. е. по зернам.
Коррозионному
растрескиванию
подвержены не только хромонике-
левыс, но и другие кор-
розпонностойкие стали.
Установлено, что
с увеличением
содержания никеля в коррозион-
ностойкой стали с 18 % С
и 0,05 % С время до
растрескивания возрастает
(рис. 10). Известно
также, что растворы
поваренной соли, хлористых
Рис. 9. Коррозионное растрескивание. Сталь
12ХіЗН10Т после испытания под напряжением
0,75 от предела текучести в 42 %-ном
хлористом магнии при 153 °СХ300:
а — нетравленый шлиф; б — травленый
fO 15 20
Содержание Ni,%
Рис. 10. Зависимость
коррозионного растрескивания от
содержания никеля в стали,
содержащей 18 % Сг и 0,05 % С
121
металлов (MgCl, ZnCl2, LiCl), сернистого водорода* (H2S) и
морская вода являются наиболее характерными средами, в
которых происходит ускоренное растрескивание коррозионностой-
ких сталей, находящихса под постоянно действующей
нагрузкой.
В работе [129] исследована склонность к коррозионному
растрескиванию 23 опытных плавок коррозионностойкой стали
аустенитного класса, отличающихся содержанием николя и
добавками легирующих элементов (фосфора, меди, азота,
молибдена, никеля, вольфрама и бора). Испытания проводили в
кипящем 42 %-ном растворе хлористого магния (при 153°С) и при
напряжении, составляющем 75 % предела текучести.
Химический состав сталей и результаты испытаний
представлены и табл. 7, из которой следует, что в сталях на основе
Х18Н12 фосфор @,044%), азот @,3—0,35%), а также медь
@,68%), молибден @,61%), вольфрам B,7%) и ниобий
@,62—1,6%), введенные раздельно, снижают стойкость
металла к коррозионному растрескиванию.
Содержание 0,061 % азота, 0,005 % бора и 0,81 % кремйия
не оказывает существенного влияния на стойкость против
данного вида разрушения; 0,095 % бора существенно увеличивают
стойкость против коррозионного растрескивания.
При испытании установлено, что повышение содержания
углерода от 0,04 до 0,20 %, а также дополнительный отпуск при
600 °С в течение 1500 ч не оказывают существенного влияния
на коррозионное растрескивание стали Х16Н15М2Б.
В этой же работе автор показал, что введение 0,3 % азота
или 0,044 % фосфора резко снижают время до коррозионного
растрескивания в растворе MgCl2 образцов стали 0Х18Н12Б
при напряжении 0,75 ао,2-
Таким образом, может быть сделан важный для практики
вывод: азот и фосфор снижают стойкость стали 0Х18Н12Б
к коррозионному растрескиванию, поэтому содержание
указанных элементов в аустенитных хромоникелевых сталях,
по-видимому, необходимо строго лимитировать.
Дальнейшие исследования [98, 161] подтвердили возможность
существенного снижения содержания никеля в аустенитных
коррозионностойких сталях и сплавах при сохранении их
высокой стойкости против коррозионного растрескивания
вследствие уменьшения в них азота и фосфора. Следовательно, азот
и фосфор оказывают отрицательное влияние на долговечность
аустенитных коррозионностойких сталей при коррозии под
напряжением.
Защитное действие ингибиторов и смазок против
коррозионного растрескивания приведено в работе [27]. Так, например, при
испытании стали типа Х18Н10 под напряжением в кипящем
42%-ном хлористом магнии с ингибитором ПБ-5 @,1%)
образцы не растрескивались в течение 730 ч. В то же время ана-
122
ТАБЛИЦА 7
КОРРОЗИОННОЕ РАСТРЕСКИВАНИЕ КОРРОЗИОННОСТОЙКИХ АУСТЕНИТНЫХ СТАЛЕЙ [129]
Номер
плавки
Марка стали
Содержание,
Си
Мо
W
другие
элементы
Н/мм2
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
22
23
Х18Н10Т
Х18Н12
Х18Н12П
Х18Н12Д
Х18Н12А
Х18Н12Р
Х18Н12Р .
Х18Н12М
Х18Н12С
Х18Н12Б
Х18Н12Б
Х18Н12Б1
Х18Н12Б2
Х18Н12БЗ
Х18Н12ВЗБ
Х18Н12АБ
Х18Н12АБ1
Х18Н12АМ2
Х18Н15Б
Х18Н15М2
Х18Н15М2Б
Х18Н18
Х16Н23Б
0,06
0,05
0,05
0,05
0,05
0,05
0,05
0,05
0,05
0,05
0,05
0,05
0,05
0,05
0,05
0,05
0,05
0,05
0,04
0,05
0,04
0,05
0,05
0,9
0,8
0,79
0,85
0,87
0,87
0,86
0,84
0,95
0,89
0,93
0,84
0,85
0,94
0,85
0,87
0,83
0,86
0,83
0,86
0,82
0,83
0,80
0,29
0,24
0,29
0,22
0,14
0,22
0,38
0,28
0,81
0,22
0,19
0,35
0,39
0,33
0,35
0,16
0,47
0,42
0,38
0,51
0,34
0,25
0,43
18,69
18,40
18,30
18,59
18,40
18,59
18,68
18,47
18,88
18,30
17,66
17,94
18,00
18,10
18,17
18,78
22,10
21,60
14,60
16,26
16,36
17,47
16,50
10,36
12,32
12,18
12,18
12,18
12,18
12,25
11,76
12,04
12,18
12,17
12,10
12,00
12,32
12,24
12,18
13,43
12,39
16,50
15,24
15,18
17,64
23,50
—
—
—
—
—
—
—
0,61
—
—
—
—
—
—
—
2,71
2,50
3,00
—
—
• —
—
—
—
—
—
—
0,62
0,72
1,30
1,60
—
0,60
0,63
1,28
—
1,03
—
0,78
—
1,14
0,32Ti
0,044Р
0,68Си
0,06N
0.05В
0,095В
—
—
—
—
—
2J0W
2.85W
0,056Х
0,30Х
0.35Х
—
—
—
248
218
243
246
223
212
226
207
246
265
229
208
228
265
248
257
494
509
210
257
247
210
231
* Во всех остальных плавках содержится 0,020 с
** Образцы не разрушились, сняты с испытания.
S и 0,025 % Р. Исходное состояние — закалка до 1050 °С, охлаждение в воде.
логичные образцы без ингибитора в этих условиях
растрескиваются в течение 5—7 ч. В этой же работе показано, что смазки
ЦИТМ-19 и ЦИТМ-51 существенно замедляют скорость
коррозионного растрескивания *латуней в 25%-ном растворе
аммиака по сравнению с опытами в отсутствие смазок и при
нанесении на поверхность образцов чистой пушемазки.
В работе [77] приведены сравнительные испытания в
паровоздушной среде напряженных образцов стали 0Х18Ш0Т,
покрытых методом распыления нихромом, никелем и
алюминием.
Наиболее высокую стойкость против коррозионного
растрескивания показали образцы с алюминиевым покрытием. В
данном случае высокая электрохимическая защита связана с тем,
что покрытие получается состоящим не из чистого алюминия,
а из его оксида (А12О3).
Щелевая коррозия обычно развивается в узком
пространстве между двумя стенками близко расположенных однородных
или разнородных материалов. Щелевая коррозия возникает
также в тех случаях, когда в металле имеются трещины,
идущие от поверхности в глубь металла, или когда в местах
крепления деталей из нержавеющей стали с прокладками
образуются неплотные соединения. Вследствие застоя в этих участках
агрессивного раствора (даже при его смене) и отсутствия
свободного доступа кислорода, необходимого для удержания
пассивного состояния металла, создаются условия для развития
коррозионных процессов. Этому также способствует
накопление продуктов коррозии на поверхности металла.
Щелевая коррозия при достаточно близком контакте
металла с другими материалами нередко проявляется на
металлической поверхности в виде язв или точечных поражений,
возникающих часто даже тогда, когда общая сопротивляемость
стали коррозионному разрушению достаточно высока.
В том случае, когда основная часть поверхности металла
может сохранять пассивное состояние, в щелях и зазорах
вследствие затруднения диффузии окислителя и анодного
замедлителя возникает активное состояние. Установлено, что
уменьшение концентрации пассивирующих агентов в щели приводит
к постепенной потере металлом пассивного состояния и к
сильному разблагораживанию потенциала. Это явление может
быть также объяснено с помощью дифференциальных анодных
и катодных кривых. Скорость коррозии в щелях усиливается
под влиянием локального тока, возникающего между
пассивными и активными участками изделия, т. е. за счет разности
стационарных потенциалов (Ei—Е2). В зависимости от общего
потенциала, достигаемого в процессе поляризации, в
высокоэлектропроводных средах.на отдельных участках поверхности
узла или аппарата будут различные плотности анодного
тока.
І 24
При сравнительно низких окислительно-восстановительных
потенциалах и концентрации окислителя возникает щелевая
коррозия. В условиях более высоких
окислительно-восстановительных потенциала и концентрации окислителя все участки
узла или аппарата находятся в пассивном состоянии.
Для предотвращения щелевой коррозии необходимо при
изготовлении аппаратов или отдельных узлов избегать
образования зазоров, щелей и карманов, а к качеству поверхности
металла предъявлять высокие требования, не допуская
применения коррозионностойких сталей, имеющих разные дефекты.
Пассивность и коррозионная стойкость полуфабрикатов и
изделий из коррозионностойких сталей тесно связаны с
микрогеометрией поверхности металла, которая еще в большей
степени влияет на стойкость против точечной коррозии, чем на
стойкость против общей коррозии.
Совершенной пассивности поверхности достигают с помощью
полирования. Однако поверхность, подвергнутая пескоструйной
обработке, обладает пониженной стойкостью.
Эрозионно-коррозионное разрушение
Фильтрующие сита центрифуг при обезвоживании продуктов
обогащения угля подвержены эрозионно-коррозионному
разрушению. Трение угольных частиц в центрифугах вызывает
сильную эрозию металла. Влага, содержание которой в продуктах
после обогащения доходит до 25 %, и остатки кислот вызывают
коррозию металла; pH водной среды колеблется от 4 до 9, в
отдельных случаях достигает 2. Сита, изготовленные из
углеродистой стали, в таких условиях практически являются
непригодными. Раньше на обогатительных фабриках сита центрифуг
изготовляли из листовой коррозионностойкой стали типа
Х18Н10Т. Толщина их составляла 4—6 мм, срок службы не
превышал 2—2,5 мес при работе на концентрате и 1 мес при
работе на промпродукте. Экспериментальные и производственные
испытания подтвердили [133], что при применении для
изготовления сит из стали 12Х18Н10Т в состоянии поставки и после
нагартовки при 30%-ном обжатии они подвергаются сильному
износу (рис. 11). При этом эрозионный износ превалирует над
коррозионным разрушением.
Испытания и проверка в заводских условиях подтвердили,
что хромистые стали 20X13 BX13) и 30X13 CX13) являются
значительно более стойкими против эрозионно-коррозионного
разрушения, чем стали типа Х18Н10Т. При этом следует
отметить, что указанные хромистые коррозионностойкие стали по
сравнению со сталью Х18Н10Т имеют высокие прочностные
свойства. Это позволяет изготовлять сита для центрифуг,
применяемых для фильтрации мелкого угля и продуктов
обогащения, из 3-мм листовой стали марок 20X13 или 30X13.
125
Рис. 11. Эрозиоппо корро шонный mime сита, изготовленного из стали 12Х18Н10Т
Подводные крылья [221] изготовляют из сталей Х18Н10Т и
0Х17Н7Ю. Однако, например, для стали 12Х18Н10Т
характерен значительный коррозионный износ, особенно в морской воде.
В этом случае целесообразно применять нержавеющую сталь
08Х21Н6М2Т, которая по сравнению со сталью 12Х18Н10Т
имеет более высокие прочностные и коррозионные свойства.
Межкристаллитная коррозия
Хромоникелевые, хромоникелевомарганцовистые, хромистые
коррозионностойкие стали и высоколегированные сплавы при
нарушении их структуры в ряде химических сред склонны
к межкристаллитной коррозии (МКК).
Согласно современным теориям [7, 20, 31, 122, 152, 267],
МКК трактуют как электрохимический процесс. В результате
выделения второй фазы, более богатой хромом (карбиды хрома,
а-фаза, а-фаза), на границах зерен создается зона, обедненная
хромом и склонная к коррозии (анод), а само зерно остается
пассивным (катод).
Таким образом, при данном виде коррозии ослабевают
связи между зернами, возникают трещины, приводящие к
разрушению металла.
Межкристаллитная коррозия возникает в результате
нарушения химического состава, термической обработки и при
всевозможных отклонениях от технологии (сварки, гибки и т. д.),
которые влияют на структуру металла и при эксплуатации
могут привести к МКК, а следовательно, и выходу из строя
оборудования.
Например, при воздействии азотной кислоты или морской
воды образцы металла внешне не изменяются, однако при их
изгибе появляются трещины (рис. 12).
126
Рис. 12. Макроструктура стали 12Х18Н10Т @,09 % С) после закалки и
провоцирующего отпуска при 650 °С в течение 2 ч:
а — стабилизированная титаном @,4% Ті, не подвержена межкристаллитной коррозии);
б — недостаточно стабилизированная @,22 % Ті), подверженная межкристаллитной
коррозии - *t"*^*5ki
Практически если межкристаллитная коррозия возникает по
всей толщине листа, то металл становится настолько хрупким,
что его можно растереть руками в порошок.
Появление межкристаллитной коррозии в хромоникелевых,
хромомарганцовистых аустспитных коррозионностойких сталях
объясняется тем, что при нагревании от 450 до 750 °С
происходит распад однородного твердого раствора аустенита, и в зернах
металла образуются карбиды, богатые хромом. В результате
этого границы зерен, обедненные хромом, в соответствующих
химических реагентах не пассивируются и становятся
нестойкими против коррозии.
На рис. 13 показана микроструктура стали Х18Н10Т,
склонной к межкристаллитной коррозии. Границы зерен сильно
растравлены, что является особенностью данного вида разрушения.
При правильной термической обработке хромоникелевых
сталей (нагрев до 1050—1080 °С) весь углерод переходит в твердый
раствор (аустенит), а при охлаждении в воде достигается
однородность твердого раствора. Такой
металл не подвержен
межкристаллитной коррозии.
Однако нагревом > 1080 °С и
увеличением времени выдержки
увлекаться не следует, так как в ау-
стенитных сталях,
стабилизированных титаном, с повышением
температуры закалки возрастает
растворимость карбида титана. При
повторном нагреве до температуры
500—700 °С, поскольку титан
израсходован, будут образовываться
карбиды хрома, которые приводят
к обеднению границ зерен
металла.
Рис. 13. Микроструктура
стали 12Х18Н10Т, склонной к
межкристаллитной коррозии.
Х300
127
Коррозионностойкис высокохромистые стали ' также могут
подвергаться межкристаллитной коррозии, но только не в
интервале температур 450—750 °С, как аустенитные хромоникеле-
вые стали, а в результате быстрого охлаждения от температур
>900 °С. Механизм межкристаллитной коррозии
высокохромистых сталей тот же, что и хромоникелевых, т. е. при быстром
охлаждении сталей с повышенным содержанием хрома,
нагретых до высоких температур, карбиды хрома не могут
удержаться в твердом растворе феррита и выделяются, обедняя
границы зерен.
Двухфазные! аустенитно-ферритные стали марок 12X21Н5Т,
08Х22Н6Т, 08Х21Н6М2Т, 08Х18Г8Н2Т и др.) с нарушенной
структурой склонны к МКК.
Основной причиной возникновения склонности к МКК
двухфазных хромоникелевых сталей, как и аустенитных
хромоникелевых сталей, является, по-видимому, также обеднение границ
зерен хромом вследствие связывания его в карбиды. Углерод и
хром, необходимые для роста карбидов, переносятся путем
диффузии из объема зерна к его границе.
Поскольку скорость диффузии углерода выше, чем хрома, то
на образование карбидов расходуется почти весь углерод
твердого раствора, в то время как в реакцию карбидообразования
вступает хром, находящийся около границ. В результате этого
в приграничных объемах образуются участки с содержанием
хрома <12 %, что приводит к снижению их коррозионной
стойкости и, следовательно, к появлению МКК.
При рассмотрении возникновения МКК двухфазных сталей
следует учитывать различную растворимость элементов в
феррите и аустените.
Так, например, в состоянии поставки, т. е. после закалки, по
данным работы [225], в стали 08Х22Н6Т б-феррит содержит
25 % Сг и 4,0 % Ni, а аустенит 20 % Сг и 6,5 % Ni. По данным
работы [61], в стали 08Х18Г8Н2Т б-феррит содержит 22% Сг
и 2,0 % Ni, а аустенит 21 % Сг и 2,8 % Ni.
Ферритно-аустенитные коррозионностойкие стали в
зависимости от количества образующейся при .нагреве ферритной
фазы могут вести себя по-разному. Чем выше температура
нагрева, тем больше образуется ферритной фазы в стали и тем
относительно большая вероятность появления у стали склонности
к МКК в результате быстрого последующего охлаждения, как
это наблюдается у ферритных сталей.
Наиболее высокую склонность к МКК обнаруживают в том
случае, когда сталь имеет структуру феррита. При обработке
ферритно-аустенитной стали, у которой соотношение феррита и
аустенита изменяется с температурой, большое влияние на
развитие склонности ее к МКК может оказывать также скорость
охлаждения от высокой температуры до температуры, при
которой уже не изменяется соотношение фаз а и у.
128
При прокатке двухфазных сталей зерна феррита и аустенита
вытягиваются вдоль направления деформации, создавая
слоистую структуру, которая сохраняется и после нагрева сталей иод
закалку.
Слоистое расположение зерен аустенита и феррита тормозит
развитие МКК в глубь металла. В этом, по-видимому,
заключается основная причина повышенной стойкости к МКК
двухфазных сталей по сравнению с однофазными.
Все коррозионностоикие стали перед поставкой подвергают
термической обработке. Аустенитные стали поступают в
передел после закалки с 1050—1080°С (охлаждение в воде),
высокохромистые— после отжига при ~700 °С, двухфазные (фер-
рито-аустенитные)—после закалки с 950—1000 °С (охлаждение
на воздухе), сталь 08Х18Г8Н2Т —после закалки с 980—1020°С
(охлаждение в воде), см. табл. 4. После такой термической
обработки металл не подвержен МКК.
В сталях с очень низким содержанием углерода в условиях
эксплуатации при нагреве свыше 600 °С наблюдается
образование карбидов и возможно выделение также сг-фазы. Это
приводит к МКК.
У никельмолибденовых и хромоникельмолибденовых
сплавов склонность к МКК развивается в результате выделения
сг-фазы иного состава, чем у коррозионностойких сталей, и
обеднения границ зерен не только хромом, но и молибденом.
Разновидностью межкристаллитной коррозии является так
называемая ножевая коррозия, возникающая в сварных
соединениях и очень узкой зоне: обычно от нескольких сотых до
нескольких десятых долей на границе сварной шов — основной
металл. Этот тип коррозии может возникать при сварке даже
коррозионностойких сталей, стабилизированных титаном или
ниобием. Объясняется это следующим образом: в узкой около-
шовной зоне металла, перегретого до температуры — 1300 °С и
выше, происходит растворение карбидов титана или хрома. При
последующем быстром охлаждении этой зоны карбиды титана
или ниобия не успевают вновь выделиться, и углерод остается
в твердом растворе. Например, этот вид коррозии был
обнаружен при кипячении стали 12Х18Н10Т в HNO3.
Для предотвращения ножевой коррозии в стали 12Х18Н10Т
рекомендуют применять низкоуглеродистые коррозионностоикие
стали аналогичного состава или подвергать сварные соединения
закалке при температуре 1080°С с охлаждением в воде (см.
табл. 4).
Однако появление склонности к МКК у сталей и сплавов
зависит не только от состояния металла, но также от свойств
коррозионных сред, воздействию которых они подвергаются.
В серной, азотной, фосфорной, соляной, уксусной, муравьиной
кислотах, их смесях, в морской воде, в паре высокого давления
и многих других средах наблюдают появление МКК.
5 Заказ № 1104 129
В условиях эксплуатации коррозионностоикая'сталь
подвергается МКК в зависимости от среды по-разному и иногда
длительное время. Натурные испытания в таких случаях
неприемлемы. •
Па практике требуется быстрая оценка качества отдельных
партий металла, а также различных полуфабрикатов. Поэтому
необходимо применять ускоренные методы.
Таким образом, при выборе металла необходимо знать,
вызывает ли данная среда межкристаллитное разрушение. В тех
химических средах, где имеется вероятность появления этого
вида разрушения, образцы подвергают контрольному
испытанию (ГОСТ 6032—84) на склонность металла к МКК. Наиболее
распространенным методом испытания коррозионностойких
сталей является химический метод AM: кипячение образцов в
сернокислотном растворе, содержащем 160 г CuSO4 + 5 г НгО +
100 мл H2SO4 (плотность 1,835)+ 1 л дистиллированной воды +
медная стружка. Испытания проводят в стеклянных колбах
с обратным холодильником. На дно колбы насыпают
стеклянные бусы, слой медной стружки, поверх которой загружают
образцы одной марки стали. Потом в колбу заливают раствор
на 20 мм выше верхнего края образцов. Кипячение проводят
непрерывно. В случае вынужденного перерыва образцы
извлекают из колбы, промывают и просушивают. Повторную загрузку
образцов осуществляют в том же порядке. Медную стружку
после испытания можно использовать для последующих
испытаний. При потемнении медной стружки ее травят в течение
2—5 с в 5—10 %-ном растворе азотной кислоты, затем
тщательно промывают в воде и высушивают.
Продолжительность испытания образцов на МКК в
зависимости от группы сталей составляет 15—24 ч. По окончании
испытания образцы извлекают из колбы, промывают,
просушивают и сгибают на 90°. При изгибе образцов в тисках или на
гибочном приборе радиус закругления губок или оправки
должен быть не менее трехкратной толщины образца, но не более
10 мм. Допускается изгиб образцов под прессом. Образцы
изготовляют из листового материала, сорта и труб размером
80X20 мм. Из проволоки нарезают куски длиной 80 мм.
Поверхность металла перед испытанием должна быть отшлифована до
высокой степени чистоты. Нержавеющие стали испытывают в
состоянии поставки после закалки или дополнительного
кратковременного (провоцирующего) нагрева. Необходимость
провоцирующего нагрева оговорена в ТУ на сталь. Оценку качества
поверхности образца, изогнутого на 90°, осуществляют с
помощью лупы при увеличении 8—12 раз.
В тех случаях, когда невозможен изгиб образцов,
необходимо осуществлять металлографические исследования, которые
проводят на травленых шлифах. Просмотр и фотографирование
шлифа осуществляют при увеличении в 300—400 раз. Призна-
130
ком брака является разрушение границ зерен металла на
глубину >30 мкм в случе повышенной травимости границ зерен по
всей поверхности шлифа и на глубину >50 мкм в случае
повышенной травимости границ единичных зерен.
В ГОСТ 6032—84, помимо метода AM, приведены еще два
примерных метода АМУ и В.
По, методу АМУ раствор содержит 50 г CuSO4-5H2O +
+ 250 мл H2SO4+IOOO мл дистиллированной воды + медная
стружка; продолжительность кипячения 8 ч. Метод АМУ
отличается от метода AM содержанием серной кислоты и медного
купороса в растворе. Оба метода (AM и АМУ) рекомендуют для
всех наиболее распространенных хромоникелевых коррозионно-
стойких сталей.
В третьем сернокислотном методе (В) раствор содержит
ПО г CuSO4 + 55 мл H2SO4+1000 мл дистиллированной водыН-
+ 5 г цинковой пыли (раствор без медной стружки);
продолжительность кипячения 144 ч.
Метод В предназначен для контроля образцов сплавов
06ХН28МДТ, 03ХН28МДТ и 03Х21Н21М4ГБ на склонность
к МКК.
Авторы работы [139] считают, что кипящий раствор В
непригоден для определения склонности к МКК стали типа
Х21Н21М4ГБ с низким содержанием углерода @,005%).
Взамен рекомендуют метод испытания в 10 %-ной НЇ\ІОз + 3 %-ной
HF при температуре 80°С или метод потенциостатического
травления в том же растворе (в течение 5—10 мин,
предпочтительно в интервале потенциалов 0,25—0,5 В).
В работе [132] изучено влияние
окислительно-восстановительного потенциала на МКК в стандартном растворе серной
кислоты и медного купороса (без цинковой пыли и медной
стружки), а также в растворах В и AM для сплава типа
Х23Н28МЗДТ @,2 % С и 0,02 % С) после закалки и закалки
с отпуском.
Результаты испытаний показали, что
окислительно-восстановительный потенциал стандартного и В растворов в процессе
испытаний колеблется от 0,35 до 0,8 В.
Окислительно-восстановительный потенциал методов AM и АМУ зависит от реакции
СиМет + Си++^Си+, т. е. от наличия металлической меди в
растворе, и на протяжении всего периода испытаний составляет
0,35—0,4 В. Следовательно, медная стружка способствует
поддержанию потенциала постоянно на низком уровне. Этим
отчасти объясняется высокая агрессивность растворов,
применяемых при использовании методов AM и АМУ.
В ГОСТ 6032—84 приведен метод ДУ, основанный на оценке
потерь массы после испытания в кипящей 65 %-ной (р. 1,391)
азотной кислоте. Метод предназначается для контроля
низкоуглеродистых хромоникелевых коррозионностойких сталей марок
03Х16Н15МЗ, 03Х17Н14МЗ, 03Х18Н11 и 03Х18Н12,
5* 131
Этот метод широко распространен в США и других странах.
Исследование этим методом заманчиво, но требует
осторожности. Ясно, например, что потери массы совершенно различны
для обралцои с крупно- и мелкозернистой структурой, даже
если их склонность к МКК почти одинакова. Кроме того, этим
способом трудно выявить слабо выраженную склонность к
данному виду коррозии, так как за это время испытаний
выкрашивания зерен не происходит. Во всех случаях кипячение в 65 %-
ной азотной кислоте сопровождается значительными общими
коррозионными потерями, величина которых должна быть
предварительно определена на образцах сталей, не склонных к МКК.
Дополнительные осложнения вносит влияние продуктов
растворения металла на скорость коррозии. Применение метода
кипячения і) 65%-ной азотной кислоте, по-видимому, будет
оправдано в том случае, если сталь предназначают для
изготовления деталей, работающих исключительно в контакте с сильно
окислительными средами. Однако при этом следует учесть, что
метод кипячения в 65%-ной азотной кислоте не всегда
отражает условия эксплуатации.
Так, например, при испытании в кипящей 65%-ной азотной
кислоте окислительно-восстановительный потенциал раствора
(рис. 14) составляет не более 1,3 В, а в рабочих условиях при
контакте металла с 98%-ной азотной кислотой окислительно-
восстановительный потенциал среды будет равен 1,75 В. Как
известно [83], при таком потенциале A,75 В) наблюдают
перепассивацию. Коррозионностойкая сталь из пассивного
состояния переходит в активное, т. е. металл значительно
растворяется. При этом, когда наблюдают общую коррозию, уже не
представляется возможным
проследить за МКК. Кроме
15 того, нельзя не отметить,
с^ что метод кипячения
^N в 65%-ной азотной кислоте
V \ является очень длительным
^ E циклов по 48 ч).
?/| В ГОСТ 6032—84
приведен еще один химический
метод ВУ для определения
°>9 склонности к МКК сплавов
06ХН28МДТ, 03ХН28МДТ
и 03Х21Н21И4ГБ. Этот ме-
«тод заключается в кипяче-
60 f00
HN03,%
Рис. 14. Некоторые свойства растворов азот- НИИ В ТЄЧЄНИЄ 48 Ч образ-
цов в 50%-нои серной
кислоте + 40 г сернокислого
окисного железа и 1000 мл
серной кислоты указанной
выше концентрации.
ной кислоты:
/ — степень диссоциации (а); 2 — содержание
ионов водорода (Cj-[+); 3 — концентрация не-
диссоциированных молекул азотной кислоты
(CNChOH); 4 —
окислительно-восстановительные потенциалы, измеренные на платине при
20 °С; 5 — при 60 °С; 6 — при температуре
кипения
132
На практике, помимо химических, применяют ускоренные и
электрохимические методы. Так, например, анодное травление
полуфабрикатов из коррозионностойкой стали — в 60 %-ной
серной кислоте при плотности тока 0,65 А/см2 и температуре 20 +
10 °С. Продолжительность травления 5—10 мин.
В настоящее время предложены новые методы потенциоста-
тического травления для определения склонности коррозионно-
стойких сталей и сплавов к МКК.
В работе [238] показано, что снятие анодных потенциокине-
тических кривых обратного хода может быть использовано
в качестве ускоренного метода определения склонности аусте-
нитных сталей и сплавов к МКК.
Испытания проводили в 20 %-ной H2SO4 при комнатной
температуре в течение 3—8 мин на образцах стали 12Х18Н10Т и
сплава 06ХН28МДТ. Для снятия потенциостатических кривых
с целью выявления склонности коррозионностойкой стали
к МКК предложен [199] другой новый эффективный электролит
A н. НСЮ4 + 0,1 н. NaCl), обладающий высоким
избирательным действием на пограничные зоны, обедненные хромом, и
позволяющий при комнатной температуре и постоянном
потенциале @,3 В) четко дифференцировать анодное поведение
коррозионностойкой стали с различной степенью склонности к МКК.
Реакторы и другие материалы, применяемые
при испытании коррозионностойких сталей и сплавов
на межкристаллитную коррозию (МКК)
1. Медь сернокислая (CuSO4-5H2O) по ГОСТ 4165—78 или
медный купорос по ГОСТ 2142—67.
2. Серная кислота, р. 1,84, ч. д. а., ГОСТ 4204—77.
3. Соляная кислота, р. 1,19, ч. д. а., ГОСТ 3118—77.
4. Азотная кислота, р. 1,4, ч. д. а., ГОСТ 4461—77 B0—
30 %-ные растворы). "
5. Азотная кислота ГОСТ 11125—78, 65±0,2 %-ный раствор,
р. 1,391.
6. Вода дистиллированная, ГОСТ 6709—72.
7. Медь в виде стружки, ГОСТ 858—78.
8. Порошок цинковый, ГОСТ 12601—76, класс А.
9. Железо сернокислое Fe(SO4K-9H2O, ГОСТ 9485—74.
10. Уротропин (или другой ингибитор для серной кислоты),
0,5 %-ный раствор (C6H12N4), ГОСТ 1381—73.
11. Спирт этиловый, ГОСТ 17299—78.
Области применения
Хромистые коррозионностойкие стали типа Х13 могут служить
материалом для изделий, эксплуатируемых в слабоагрессивных
средах (пищевая, мясо-молочная, спирто-водочная отрасли
промышленности, шахтное оборудование, медицинские приборы
и предметы домашнего обихода), а также в азотной и
уксусной кислотах при комнатной температуре.
133
Свариваемость этих сталей удовлетворительная. В качестве
присадочного материала может быть применена проволока той
же стали с обмазкой ЭНТУЗ, при этом свойства сварного
шва близки к основному металлу. Для сварки необходимо
предварительно подогревать кромки до 200—300°С. Для повышения
коррозионной стойкости и пластических характеристик
сварного соединения рекомендуют подвергать изделия термической
обработке по режиму: нагрев до 950°С, охлаждение на воздухе
и последующий отпуск при 700 °С. В тех случаях, когда
термическую обработку изделий осуществить невозможно, следует
подвергать местному кратковременному отпуску при
указанной выше температуре только снариое соединение. Любые
окислы, полученные и процессе сварки или термической
обработки па палях указанного типа и на любых коррозионностой-
ких ел ал их, должны быть полностью удалены.
Стали типа Х17 применяют в качестве материала для
оборудования, используемого при производстве азотной кислоты
средней концентрации, азотных удобрений, для оборудования
пищевой и мясомолочной промышленности, торгового
оборудования. Сталь Х17Н2 применяют для изготовления деталей,
эксплуатируемых под большим напряжением при производстве
молока, дрожжей, крахмала, бумаги, в насосах, клапанах.
Свариваемость сталей 12X17, 08Х17Т, 14Х17Н2
удовлетворительная. В качестве присадочного материала используют
электроды из стали Х18Н10Б с обмазкой ЦЛ11. Для стали 12X17
необходим предварительный подогрев кромок до 200—300 °С.
Сварные соединения сталей 12X17 и 14Х17Н2 в зоне
термического влияния обладают пониженной стойкостью к
межкристаллитной и общей коррозии. Для повышения коррозионной
стойкости сварного соединения этих сталей необходим общий или
местный нагрев до 720 °С с охлаждением на воздухе. Сварные
соединения стали 08Х17Т обладают удовлетворительной
стойкостью к межкристаллитной и общей коррозии и не отличаются
по этим характеристикам от основного металла.
Стали 15Х25Т, 15X28 и другие высокохромистые коррозион-
ностойкие рекомендуют как жаропрочные материалы для
изготовления аппаратов, работающих в газовых средах и в
некоторых агрессивных средах. Так, например, стали 15Х25Т и
15X28 в виде двухслойного металла и монометалла применяют
для изготовления оборудования, эксплуатируемого в крепких
щелочах и расплавах сернистого натрия.
Учитывая относительно низкую прочность высокохромистых
сталей при высоких температурах, применять их для изделий
при переменных или постоянных нагрузках нельзя.
Свариваемость этих сталей удовлетворительная. Наиболее
высоким запасом пластичности и коррозионной стойкости
обладают сварные соединения, выполненные с применением
электродов из сталей аустенитно-ферритного класса.
134
Двухфазные аустенитно-ферритные стали 12X21Н5Т,
08Х22Н6Т и 08Х21Н6М2Т могут • быть использованы взамен
дорогих и дефицитных хромоникелевых сталей 12X181 ПОТ,
10Х18Н12М2Т и др. Так, например, сталь 12Х21Н5Т можно
применять в качестве материала для оборудования пищевой,
мясо-молочной, химической, электротехнической
промышленности, торгового оборудования, железнодорожного транспорта.
Свариваемость сталей удовлетворительная. В клчестне
присадочного материала применяют проволоку из той же стали.
Сталь 08Х22Н6Т рекомендуют в качестве мліеріила для
оборудования при производстве: азотной кислоты
концентрацией до 55% и при температуре до 55°С (рис. 15), лимонной
кислоты концентрацией до 15% и при температуре до 60 °С,
мочевины концентрацией до 55—65 % и при температуре до
ПО °С, адипиновой кислоты D5%-ная азотная кислота при
температуре до 95°С), серной кислоты концентрацией до 98% и
при температуре до 50 °С, органических красителей.
Сталь ЭП54 рекомендуют в качестве материала для
оборудования: при производстве искусственного волокна, хлористого
аммония методом выпаривания, при промывке целлюлозы, для
фильтрующей аппаратуры в условиях производства сульфатной
и сульфитной целлюлозы, при производстве термической
фосфорной кислоты концентрацией до 77 %, чистой кипящей
уксусной кислоты концентрацией до 70 %, для хранения морской
воды.
Все двухфазные стали в условиях эксплуатации при
высокой температуре охрупчиваются, поэтому их рекомендуют
применять при нагреве <300°С.
Коррозионные испытания [111] показали, что сталь 08Х22Н6Т
можно применять взамен стали 08Х18Н10Т для изготовления
Рис. 15. Сепаратор для 50 %-ной азотной кислоты, выполненный из стали 08Х22Н6Т
@Х22Н5Т, ЭП53)
135
выпарных аппаратов, работающих в мелассно-спиртовом
Производстве. Стали аустснитно-ферритного класса A2Х21Н5Т,
08Х22Н6Т, 08Х21Н6М2Т и 08Х18Г8Н2Т) в результате
относительно длительных выдержек при температурах 350—650 °С
проявляют склонность к охрупчиванию. Поэтому температура
эксплуатации их в условиях агрессивных сред не должна быть
< 300 °С.
Сталь 10Х14Г14Н4Т аустенитного класса обладает высокими
пластическими свойствами, ее рекомендуют применять в
слабоагрессивных средах, например для стиральных машин, в
кондитерском производстве для шоколадных форм. Следует учесть,
что марганец не повышает коррозионную стойкость сплава. Он
не повышает сопротивлении стали окалинообразованию, более
того, марганец окисляется легче, чем железо. Хромомарганцо-
вистые стали и марганец обладают каталитическим свойством,
разлагая, например, перекись водорода. Свариваемость стали
удовлетворительная, присадочный материал — сталь 08Х18Н10Т.
Коррозионная стойкость стали 10Х14Г14Н4Т определяется
в основном содержанием хрома. Поэтому она по своей
коррозионной стойкости близка к сталям типа Х13. Другие хромо-
марганцовистые стали, например 08Х18Г8Н2Т, по
коррозионной стойкости могут быть приравнены к сталям типа XI7.
В ряде случаев для повышения прочностных свойств в хромо-
марганцовистые коррозионностойкие стали вводится азот, при
этом маргенец способствует растворению азота в металле.
Примером такой стали является 12Х17Г9АН4.
Введение марганца в сталь в основном преследует цель
частичной замены никеля и образования аустенитной
(немагнитной) структуры. Однако следует отметить, что скорость
коррозии не связана со структурой, а зависит только от
химического состава металла, Так, например, стали 10Х14Г14Н4Т и
12Х18Н10Т, имеющие одинаковую аустенитную структуру,
корродируют во многих средах по-разному: первая очень сильно,
а вторая фактически является коррозионностойким металлом
(см. табл. 11).
Однако сталь 10Х14Г14Н4Т обладает /высокой
коррозионной стойкостью в ряде агрессивных сред. Так, например, по
данным работы [195], сталь 10Х14Г14Н4Т применяют взамен
стали 12Х18Н10Т при изготовлении оборудования для
производства фенола.
Сталь 10Х14Г14Н4Т (ЭИ 711) в виде ленты, нагартованной
(обжатие 20—40 %) и тщательно отполированной, может найти
применение в кондитерской промышленности для изготовления
шоколадных форм.
Коррозионностойкая сталь 10Х14Г14Н4Т широко
применяется в криогенной технике. Однако сталь 10Х14Г14Н4Т и
другие хромомарганцовисїьіе стали являются нестойкими в хлор-
содержащих средах, например в морской воде. Кроме того,
136
практика показала, что всякое дополнительное легирование кор-
розионностойких аустенитных хромоникелевых сталей
марганцем снижает их стойкость против коррозионного
растрескивания, что установлено при испытании их в растворе.
Стали 12Х18Н10Т, 08Х18Н10Т и др. близкого или
аналогичного состава (см. ГОСТ 5632—72) отличаются в основном со-
держганием углерода, поэтому их свойства достаточно близки.
Однако надо отметить, что во всех хромоникелспых сталях
с уменьшением содержания углерода коррозионная стойкость
повышается. Наиболее высокой коррозионной стойкостью
обладают также стали после термической обработки, состоящей из
закалки в воде или на воздухе с 1050—1080°С. Закалка может
быть заменена стабилизующим отжигом при 825—875 °С. В
случае переработки сталей у потребителя важно учитывать, что
необходима повторная термическая обработка. Все
перечисленные стали обладают хорошей свариваемостью всеми видами
сварки. В качестве присадочного материала применяют
электроды марок ЭА1, ЭА1ФС, ЭА1БС, ЭАМФ. Типы покрытий
ЭНТУЗ, Л40М, А38М, ЦЛ11.
Стали типа Х18Н10Т находят самое широкое
распространение. Их рекомендуют в качестве материала для оборудования;
при производстве азотной кислоты; азотнокислых солей;
термической фосфорной кислоты; большинства органических
продуктов; в пищевой промышленности; в химико-фармацевтической
(получение фталазола, пирамидона и других медикаментов);
при производстве медицинского инструмента.
К сталям 10Х17Н13М2Т, 10Х17Н13МЗТ следует отнести
близкие по составу 09Х16Н15МЗБ и 08Х17Н15МЗТ. Все они
отличаются от сталей типа Х18Н10Т наличием молибдена и более
повышенным содержанием никеля. Молибден увеличивает
устойчивость пассивного состояния и обеспечивает более высокую
стойкость этих сталей в восстановительных средах и средах,
содержащих хлор-ион.
Для повышения пластических свойств и улучшения
коррозионной стойкости коррозионностоикие стали, как и все аустенит-
ные, следует применять в термически обработанном состоянии
после закалки с 1050—1080 °С в воде или на воздухе. Стали
указанных марок обладают хорошей свариваемостью.
В качестве присадочного материала применяют электроды
тех же марок сталей, а также электроды НЖ13 и ЭА400/18
(сварочная проволока Х18Н11М) или электроды КБЗ-М
(сварочная проволока Х25Н13; при этом молибден вводят через
обмазку).
Стали типа 10Х17Н13М2Т и 10Х17Н13МЗТ рекомендуют
в качестве ^материала для оборудования, применяемого в
судостроении (морская вода); рыбоперерабатывающей и
целлюлозной промышленности; при производстве муравьиной, молочной,
уксусной, сернистой кислот и других химикалий.
137
Сплав 06ХН28МДТ рекомендуют для изготовления
оборудования, устойчивого в серной кислоте различных концентраций
до температуры 80°С. Так, например, из сплава 06ХН28МДТ
изготовляют зкегаустербі для двойного суперфосфата, фильтры
для производства жести, литые горизонтальные центробежные
насосы для коксохимических цехов металлургических заводов,
насосы марок ХП и ХПС второй промывной башни при
производстве серной кислоты.
Сплав 06ХН28МДТ применяют в производстве двуокиси
титана [166], из ,сплава изготовляют вакуум-фильтры с
барабанами (скорость коррозии металла фильтра составляет 0,003
мм/год). Сплав рекомендуют в качестве конструкционного
материала [171] для реактора синтеза гидроксиламинсульфата.
Его можно сваривать электродуговым методом в атмосфере
аргона. В качестве присадочного материала используют
проволоку из сплава 03ХН28МДТ. Однако сплав 06ХН28МДТ в
соляной и серной кислотах, в растворах хлористых солей, во
влажном хлоре, фторе, броме и других агрессивных средах
сильно корродирует. Молибденовые сплавы обладают высокой
коррозионной стойкостью, их применяют в ряде агрессивных
сред.
Сплавы Н70МФ (ЭП814А) и Н70МФ (ЭП496),
отличающиеся один от другого только содержанием углерода,
применяют при изготовлении оборудования для производства
пропилена, полифосфорных кислот, каталитического крекинга,
пиролиза, органического синтеза, радиохимических процессов,
гербицида, дифениламина, хлорктанов из этилена и соляной
кислоты и т. д.
Из сплава ХН65МВ (ЭП567)* изготовляют оборудование,
предназначенное для эксплуатации в уксусной кислоте, в
окислительных средах, содержащих хлор-ионы, и т. д.; для
изготовления ректификационных колонн, работающих в наиболее
агрессивных условиях при получении уксусной кислоты методом
окисления ацетальдегидов (см. табл. 12).
Углеродистые и низколегированные стали являются
стойкими в карболовой кислоте и аммиаке всех концентраций и
температур, а при температуре до 20 °С также в олеиновой
кислоте, двууглекислом и углекислом аммонии, этиловом спирте
и смазочных маслах; в 50—70 %-ном едком натре до 90 °С;
в смесях азотной и серной кислот до 20 °С; в смеси серной
кислоты + 5 % двухромовокислого калия при 35°С. Однако в
большинстве других сред углеродистые и низколегированные стали
корродируют сильно и почти с одинаковой скоростью (см.
табл. 10).
* Для изготовления толстолистового проката (>10 мм) взамен сплава
ХН65МВ применяют сплав Х65М16В (ЭГТ760). Новый сплав содержит
^0,1 %Si и ^05, %Fe, остальные элементы, как и в сплаве ХН65МВ,
Новый сплав менее чувствителен к МКК-
138
t,vc
7U0
120
700
$?
60
40
20
0
-
-
-\
1 1
2 1
^^
J 4 6
і і і
О 70 20 JO ЬО JO 60
О 20 40 60 вО ЮО
Рис. 16. Коррозионная стойкость
сталей и сплавов в HNO3,
H2SO4, HC1 и Н3РО4:
/ —08Х2Н6Т; 2 — 08Х21Н6М2Т;
3 - 12Х18Н10Т; 4 - 10Х17Н13М-
2Т; 5 — 06Х28МДТ; 6 — ХН65МВ;
7 — Н70МФ
На рис. 16 в обобщенном виде изображено изменение
коррозионной стойкости некоторых высоколегированных сталей и
сплавов в зависимости от концентрации и температуры кислоты
(каждая кривая соответствует определенной марке стали или
сплава). Область, расположенная выше кривой, соответствует
скорости коррозии >0,1 мм/год. Область высокой
коррозионной стойкости металла (скорость коррозии <0,1 мм/год)
располагается ниже кривой.
Как следует из рис. 16, а, в азотной кислоте стали
08Х22Н5Т, 08Х21Н6М2Т и 08Х18Н10Т обладают наибольшей
коррозионной стойкостью, которая в основном зависит от
содержания в них хрома. Известно, что хром легко
пассивируется в окислительных средах; это свойство хром переносит и
на коррозионростойкие стали, в которые он входит в качестве
легирующего элемента. Однако хром не оказывает
существенного влияния на скорость анодного процесса стали, но
значительно облегчает пассивируемость металла.
139
Сплав 06ХН28МДТ и сталь 10Х17Н13М2Т устойчивы в
кипящей азотной кислоте до 35 %-ной концентрации. С
увеличением концентрации скорость коррозии возрастает. Однако
в 60 %-ной HNO3 эти .металлы можно применять до
температуры 83—85 °С.
Сплав ХН65МВ устойчив в разбавленной (до 3 %)
кипящей азотной кислоте. С увеличением концентрации кислоты
коррозионная стойкость уменьшается и в 60 %-ной HNQq сплав
устойчив только при температурах ^38°С.
Сплав Н70МФ не стоек даже в сильно разбавленной
азотной кислоте, так как основной легирующий элемент сплава —
молибден — в этих условиях легко растворяется. В серной
кислоте (рис. 16, б) наибольшей стойкостью обладает сплав
Н70МФ, который можно применять в кипящей кислоте <40 %-
ной концентрации.
Сплавы ХН65МВ, 0Х40МДТЮ и 06ХН28МДТ по своей
коррозионной стойкости в H2SO4 почти одинаковы.
При комнатной температуре сталь 08Х21Н6М2Т устойчива
в серной кислоте до 18 %-ной концентрации, а сталь 08Х18Н10Т
только до 5 %-ной. Стали 08Х22Н6Т и 10Х17Н13М2Т по своей
коррозионной стойкости занимают промежуточное положение.
При высоких концентрациях серной кислоты (более 80 %) и
комнатной температуре стали 08Х21Н6М2Т, 08Х22Н6Т,
10Х17Н13М2Т и 08Х18Н10Т становятся коррозионностой-
кими.
В соляной кислоте (рис. 16, в) наибольшей стойкостью
обладают сплавы типа Н70МФ, содержащие значительное
количество молибдена, образующего в НС1 не только окисные, но
и хлорокисные защитные пленки. С увеличением концентрации
соляной кислоты сплавы заметно корродируют, и в 37 %-ной
соляной кислоте их можно применять только при температуре
^70 °С.
Сплав ХН65МВ менее стоек, чем сплавы типа Н70МФ. Все
коррозионностойкие стали совершенно нестойки в НС1.
В фосфорной кислоте (рис. 16, г) наибольшей стойкостью
обладают сплав ХН65МВ и сталь 03Х21Н21М4ГБ, которые
можно применять в кипящей фосфорной кислоте до
концентрации 60 7о, а при температуре 115 °С — в кислоте любой
концентрации. Наименьшей стойкостью обладает коррозионностойкая
сталь 08Х18Н10Т. Однако и она имеет удовлетворительную
стойкость и ее можно использовать при температуре кипения
до концентрации 35 %.
Стали 08Х21Н6М2Т, 08Х22Н6Т и 08Х17Н13М2Т более
стойкие в Н3РО4, чем сталь 08Х18Н10Т.
На рис. 17 изображены данные по коррозионной стойкости
некоторых нержавеющих сталей в трех органических кислотах
(уксусной, муравьиной, молочной).
140
100
60
20
0 fa,, ^
\ f 4 J 2 / /
Y /-'
\ I I I L/
/ tHUff
\ 6 4 г r j^J A
\ і і і і /7
0 20 40 60 dO WO 0 20 40 00 60 /00
20 40 60 вО fOO
Рис. 17. Коррозионная стойкость
сталей и сплавов в СН3СООН,
НСО2Н и CjH6O3:
/ —08Х22Н6Т; 2 — 08X21Н6М2Т; 3 —
12Х18Н10Т; 4— 10Х17Н13М2Т; 5 —
08Х17Т; 6 — 08Х17Н15МЗТ
На рис. 17, а видно, что в кипящей уксусной кислоте всех
концентраций стойкими являются стали 08Х17Н15МЗТ,
08Х17Н13М2Т и 08Х21Н6М2Т.
Сталь 08Х22Н5Т можно применять в данных условиях до
температуры ^90°С, а сталь типа Х18Н10Т — до ^75°С.
Хромистая коррозионностойкая сталь 08Х17Т в СНСООН
всех концентраций малоустойчива и с повышением температуры
стойкость ее снижается.
Из рис. 17, б видно, что в кипящей муравьиной кислоте
наибольшей стойкостью обладают стали 10Х17Н13М2Т,
08Х17Н15МЗТ и 08Х21Н6М2Т. Сталь 08Х18Н10Т и особенно
хромистая 08Х17Т являются нестойкими металлами.
На рис. 17, в показана коррозионная стойкость сталей в
молочной кислоте. Наибольшей стойкостью, как и в
других.органических кислотах, обладают стали 08Х17Н15МЗТ и
10Х17Н13М2Т, наименьшей —сталь 08Х18Н10Т. Стали
08Х21Н6М2Т и 08Х22Н5Т более стойкие, чем 08Х18Н10Т.
Опыт эксплуатации в органических кислотах показал, что
все хромоникелевые стали, легированные молибденом, имеют
более повышенную стойкость, чем стали без молибдена.
Известно, что диметилформамил (ДМФА) широко
используется в производстве волокон; в частности поливинилхлоридных
(ПВХ) в качестве растворителя полимеров.
В работе [348] представлены данные по коррозионной
стойкости сталей на наиболее уязвимых участках производства
ПВХ волокна в обычных условиях и после проведения
мероприятий по изменению технологических сред:
Из таблицы видно, что, не нарушая хода технологического
процесса, путем уменьшения содержания кислот и хлоридов
в технологических средах можно существенно снизить
коррозию сталей на ответственных участках данного производства.
141
Среда •
Парогазовая смесь
испарителя ректификационной
колонны
Парожидкостная смесь на нижней
тарелке ректификационной колонны
Горячий прядильный р.'їстіюр
A05° С)
Охлажденный прядильный раствор
E0—60° С)
Марка стали
08Х18Н10Т
10Х17Н13М2Т
08Х18Н10Т
10Х17Н13М2Т
08Х21Н6М2Т
08Х18Н10Т
10Х17Н13М2Т
08Х18Н10Т
Скорость коррозии,
мм/год
в обычных
условиях
9,3—11
3,1—6,6
0,76
0,46-0,57
0,54—0,78
1,4
0,56
после
проведения
мероприятий
1 1,0—2,4
1,5—1,6
0,0008
0,00036
0,0003
0,58
0,011
0,04
В итоге это очень эффективное и экономически выгодное новое
направление по борьбе с коррозией металлов.
По данным [330], коррозионностойкие хромоникелевые, хро-
момарганцевоникелевые стали и коррозионностойкие сплавы
находят широкое применение в криогенной технике.
УСЛОВИЯ ХРАНЕНИЯ СТАЛЕЙ И СПЛАВОВ
Полуфабрикаты и детали из коррозионностойких сталей и
сплавов лучше хранить в закрытых помещениях на деревянных
стеллажах из досок или бревен. Если применяют невысушенное
дерево, влажное, содержащее смолы и органические кислоты
(муравьиную и уксусную), то это приводит к коррозии
металла.
Для хранения проката и деталей из коррозионностойких
сталей рекомендуют отводить особый участок, изолированный
от места хранения углеродистых сталей. Наличие мельчайших
дефектов на поверхности (в виде углублений, царапин и
трещин) способствует задержке и скоплению влаги и загрязнений.
Все это ускоряет образование ржавчины, а следовательно,
снижает стойкость металла против общей, точечной и щелевой
коррозии. Таким образом, в целях повышения коррозионной
стойкости металла следует добиваться высокой чистоты
поверхности и полного сглаживания мельчайших неровностей.
На практике чистоту поверхности получают путем
холодной прокатки, шлифования и полирования. Листовая сталь
в состоянии поставки (после травления) по сравнению с
полированной имеет относительно более низкую коррозионную
стойкость.
142
В процессе хранения и при эксплуатации в атмосферных
условиях поверхность сталей тускнеет и приобретает серый
оттенок. При этом коррозионная стойкость металла не снижается,
а следовательно, изменение внешнего вида поверхности не
является браковочным признаком.
Рекомендуют периодически на складах осматривать и
очищать металл для удаления пыли и других загрязнений.
Во избежание потовых загрязнений работу следует
осуществлять в хлопчатобумажных сухих рукавицах. Установлено
[278], что коррозиднностойкими против потопых загрязнений
являются сталь 40X13 DX13), алюминий и его сплавы, а также
хромовые покрытия. Под влиянием потовых загрязнений сильно
корродируют углеродистая сталь, серебро, сплавы на основе
меди, особенно бронза БрБ2 и никелевые покрытия.
Для защиты от действия избыточной влажности следует
применять обезвоживающее средство — силикагель (SiC^).
При упаковке ответственных металлических полуфабрикатов
и изделий силикагель помещают в пыленепроницаемые
мешочки, которые кладут внутрь упаковочной тары вместе с
металлом. Поглощая влагу, силикагель поддерживает
относительную влажность воздуха до 30 %.
СПЛАВЫ, СТОЙКИЕ
В ТРАВИЛЬНЫХ РАСТВОРАХ
Травильные растворы, применяемые для удаления окалины
с углеродистых и коррозионностойких сталей, обладают
высокой агрессивностью. В серной и соляной кислотах, а также
в ряде других сред при повышенных температурах коррозион-
ностойкие хромистые, хромоникелевые и хромомарганцевони-
келевые стали являются совершенно нестойкими
материалами.
В работах [107, 108, 109, 234] на основании
экспериментальных данных и проверки в производственных условиях
установлено, что детали и узлы травильных агрегатов при
эксплуатации в определенных средах могут быть изготовлены:
1. В сернокислых растворах, содержащих 10—20 % серной
кислоты и 7—22% сернокислого железа при температуре 95 °С
из сплавов 06ХН28МДТ @Х23Н28МЗДЗТ, ЭИ943) и
03ХН28МДТ @00Х23Н28МЗД9Т, ЭП516).
2. В сернокислых растворах с добавками HNO3, NaNO3,
NaCl, HC1 при температурах 80—90°С, из сплавов ХН65М16В
(ЭП760), ХН60МБ (ЭП758) и ХН65МВ @Х15Н65М16В,
ЭП567).
3. В солянокислых растворах 14—16% HCl-flO—12%
FeCl2 при 80°С и 1—4% НС1+18—27% FeCl2 при 75°С из
титана,
ИЗ
4. В растворах 15—25%-ной соляной кислоты с
содержанием железа до 4 % при температуре 50—60 °С из сплава
Н70МФ (Н70М27Ф, ЭП814А).
5. В растворах 16—18% HNO3 + 4 % HF при 50—60°С из
сплава ХН58В (ЭП795).
НИЗКОУГЛЕРОДИСТЫЕ
КОРРОЗИОННОСТОЙКИЕ СТАЛИ
Металлургической промышленностью освоены и выпускаются
в широком ассортименте низкоуглеродистыс коррозионностой-
кис стали. Все стали с низким содержанием углерода (~0,03 %)
изготовляют без добавок титана.
Эти стали по сравнению с обычными коррозионностойкими
сталями, т. е. стабилизированные Ті и Nb, обладают почти
одинаковой стойкостью к МКК, однако, например, сталь 03Х18Н10
в азотной кислоте имеет более высокую стойкость против.
ножевой коррозии, чем стали 12Х18Н10Т.
Следует также отметить, что в низкоуглеродистых сталях
(при эксплуатации и нагреве свыше 600°С) развивается кар-
бидообразование.
В ряде химических сред сталь 03Х23Н6 можно использовать
вместо 03Х18Н11 или 12Х18Н10Т, а сталь 03Х22Н6М2 взамен
03Х17Н13М2 или 10Х17Н13М2Т.
В работе [36] представлены сравнительные данные по
коррозионной стойкости некоторых сталей с различным
содержанием углерода, испытанных в средах абсорбционно-сушильного
цикла при производстве контактной серной кислоты. Так,
например, в абсорбере моногидрата (98,4%-ная H2SO4 при 60 °С)
скорость коррозии стали 03Х23Н6 составляет 0,0694, а стали
08Х22Н6Т 0,0836 мм/год. В этих же условиях сталь
03Х22Н6М2 корродирует со скоростью 0,073, а сталь
08Х21Н6М2Т 0,0872 мм/год. Таким образом, коррозионная
стойкость низкоуглеродистых сталей почти одинакова в отличие от
сталей аналогичного состава, легированных титаном и
содержащих больше углерода.
Поэтому сравнительная оценка стойкости всех
низкоуглеродистых сталей может быть осуществлена по табл. 10.
Сталь 03Х18Н11. Химический состав определен в ГОСТ
5632—72. Механические свойства пос.ле закалки с 1050—1080°С,
охлаждение в воде: ав^500 Н/мм2; ао,2^2ОО Н/мм2; 6^40 %.
Сталь — аустенитного класса. Хорошо поддается обработке
в холодном состоянии. Температурный интервал горячей
деформации составляет 1100—900 °С. Ручную электродуговую
сварку осуществляют с помощью электродов АНВ-13 и ОЗЛ-22,
используя сварочную проволоку из сплава 02Х19Н9. Автомати-
144
ческую сварку выполняют под флюсом или в защитных газах;
сварочную проволоку применяют из стали марки 04Х18Н10,
флюс марки АН-18.
Сталь поставляют в виде сорта по ТУ 14-1-1160—74; тонкого
листа по ТУ 14-1-1180—74 и ГОСТ 5582—75; толстого листа по
ТУ14-1-30—80; трубы по ТУ14-3-697—78 и ТУ14-3-681—78.
Сталь 03Х18Н11 применяют, как и сталь 12Х18Н10Т, в самых
различных отраслях промышленности. Высокой стойкостью эта
сталь обладает в азотной и адипиновой кислотах, в аммиачной
селитре и других средах.
Сталь 03Х17Н14МЗ. Химический состав по ГОСТ
5632—72. Механические свойства после закалки с 1050—1080°С,
охлаждение в воде: ав^500 Н/мм2; ао,2^2ОО Н/мм2; 6 = 40%.
Сталь — аустенитного класса. Хорошо обрабатывается в
холодном состоянии. Температурный интервал горячей деформации
равен 1150—900 °С. Сталь 03Х17Н14МЗ сваривают
электродуговым ручным и автоматическим методами. Используют
электроды ОЗЛ-20, сварную проволоку из стали марки 03Х17Н14,
флюс АН-26.
Сталь поставляется в виде сорта ТУ14-1-3303—82; лист
холоднокатаный по ТУ 14-1-792—73; лист горячекатаный до 50 мм
по ТУ 14-1-2144—77; трубы до 159 мм по ТУ 14-3-396—75 и до
269 мм по ТУ 14-3-697—78. Ее рекомендуют для изготовления
сварных конструкций, работающих в условиях производства
карбамида, капролактама, а также в кипящей фосфорной и
10 %-ной уксусной кислотах.
Сталь 03Х23Н6. Химический состав по ТУ 14-1-1541—75.
Механические свойства после закалки с 1000—1050 °С,
охлаждение в воде: (Тв>520—550 Н/мм2; (То,2>ЗОО Н/мм2; б>
^25%. Сталь ферритно-аустенитного класса с соотношением
фаз приблизительно 1 : 1. При холодной пластической
деформации ее структура стабильна. Температурный интервал горячей
деформации составляет 1150—850 °С. Сталь сваривают ручным
электродуговым способом. Применяют электроды марки
ОЗЛ-22. Сталь поставляется в виде сорта по ТУ 14-1-1554—75;
тонкий лист по ТУ 14-1-1905—76; толстый лист по ТУ 14-1-
2864—80. Сталь может применяться в производстве азотной
кислоты, аммиачной селитры и т. д.
Сталь 03Х22Н6М2. Химический состав по ТУ14-1-1541—
75. Механические свойства при 20 °С (термическая обработка;
закалка с 1050°С, охлаждение в воде): ав^520—550 Н/мм2;
(То,2>300 Н/мм2; б>25 %. Сталь ферритно-аустенитной
структуры с соотношением фаз 1 : 1. Температурный интервал
горячей деформации 1150—850 °С. Сталь сваривают
электродуговым ручным способом. Применяют электроды ОЗЛ-20.
Сталь поставляется в виде сорта по ТУ 14-1-1584—75; тонкий
лист по ТУ 14-1-2864—76; толстый лист по ТУ 14-1-2864, трубы
по ТУ 14-3-1298—84.
145
Низкоуглеродистыс стали 03Х22Н6М2 и 03Х23Н6,
легированные небольшим количеством никеля, по сравнению со
стабилизированными сталями являются более стойкими к ножевой
коррозии п ряде химических сред. Сталь 03Х22Н6М2
применяют п производстве серной кислоты, при органическом синтезе,
а также в целлюлозно-бумажной промышленности. Сталь
пригодна для изготовления изделий, работающих в контакте с
морской водой.
Сталь 04Х25Н5М2. Химический состав, %: <0,04 С;
^0,4 Si; ^0,025 S; <g0,035 P; 1,0—2,0 Мп; 24,5—26,5 Сг;
5—6 Ni; 2,3—2,8 Mo.
Механические свойства (закалка 1000—1050 °С, охлаждение
в воде); (Тп^670 Н/мм2; аОB^53О Н/мм2; 6 = 25%.
Сталь ферритно-аустснитной структуры. Температурный
интервал горячей деформации равен 1180—900 °С. Сталь
поставляют в виде поковок по ТУ14-1-1847—76. Она обладает
высокой коррозионной стойкостью в средах, содержащих хлор-ион.
Сталь можно широко применять в химической,
микробиологической, целлюлозно-бумажной промышленности, судостроении
и других отраслях. Сталь 04Х25Н5М2 обладает высокими
прочностными и пластическими свойствами, в 1,5—2 раза более
высоким пределом текучести по сравнению с аустенитными
сталями.
Сталь 03Х21Н21М4ГБ. Химический состав по ГОСТ
5632—72. Механические свойства (после закалки с 1080—
ИЗО °С в воде): ав>500 Н/мм2; аОJ>220 Н/мм2; 6>30—40 %.
Структура стали после закалки аустенитная, возможны
выделения а-фазы. Температурный интервал горячей деформации
1200—850 °С. Сталь хорошо поддается деформации в холодном
состоянии и удовлетворительной обработке резанием.
Сваривают ее ручным электродуговым и аргонодуговым методами.
Используют электроды марки ОЗЛ-17У и сварочную проволоку
из сплава 01Х23Н28МЗДЗТ (ЭП516).
Сортамент и условия поставки
Сталь 03Х21Н21М4ГБ поставляют в закаленном состоянии и
в виде тонкого листа по ГОСТ 5582—75; толстого листа по
ГОСТ 7250—77; сорта согласно ТУ 14-1-1190—75.
Эту сталь применяют в производстве экстракционной
фосфорной кислоты, содержащей фтористые соединения [18]. Она
отличается от сплава 06ХН28МДТ отсутствием меди и
вследствие низкого содержания углерода и стабилизирующей
добавки ниобия обладает лучшей сопротивляемостью к ножевой
и МКК в сварных соединениях. Так, например, в среде,
содержащей 32 % Р2О3; 2 %F; 1,6 % SO3 и фосфогипс, при
температуре 68—72 °С сварные соединения из этой стали корродируют
со скоростью от 0,011—0,010 до 0,033—0,038 г/(м2-ч).
146
В работе [167] описана коррозионная стойкость сталей
03Х21Н21М4ГБ, 08Х21Н6М2Т, 08Х22Н6Т и сплава 06Х28МДТ
в производственных условиях в растворе 41,4 %-ной Н3РО4
с различным количеством добавок H2SO4 A и 5 %), а также
HF @,5 и 1,5 %) при 70 °С.
В производственных условиях в растворе 41,4 %-ной Н3РО4
без добавок все стали и сплав обладают иысокой коррозионной
стойкостью. В растворе 41,4 %-ной H3I O4 с добавкой 0,5 %HF
сталь 03Х21Н21М4ГБ корродирует со скоростью 7,5—
11,4 г/(м2-ч).
Стали 08Х21Н6М2Т и 08Х22Н6Т в этих условиях также
сильно корродируют, а сплав 06Х28МДТ устойчив. Скорость
коррозии составляет 0,077 г/(м2-ч). В растворе 41,4 %-ной
Н3РО4 с добавками H2SO4 и HF эти стали и сплав являются
коррозионно-нестойкими металлами.
Ниже показано, что сталь 03Х21Н21М4ГБ (ЭИ-35) должна
найти широкое применение в химической промышленности.
Гидроксиламин сульфат (ГАС) является одним из основных
компонентов производства капролактама, ряда медицинских и
других продуктов. По данным [350], в средах получения (ГАС)
рекомендуют применять сталь 03Х21Н21М4ГБ взамен сплава
03ХН28МДТ (ЭП516). Сталь и сплав в указанных условиях
являются коррозионностойкими металлами и корродируют почти
с одинаковой скоростью. Однако наличие в сплаве меди
затрудняет проведение технологического процесса, что не позволяет
рекомендовать сплав 03ХН28МДТ для изготовления
реакторов.
ЛИТЕЙНЫЕ КОРРОЗИОННОСТОЙКИЕ СТАЛИ
Литейные стали наряду с деформируемыми
коррозионностойкими сталями и сплавами находят широкое применение в
энергетике, судостроении, химической, нефтехимической, целлюлоз-
нобумажной и других отраслях промышленности.
Коррозионная стойкость литых деталей в соответствующих
агрессивных средах, как правило, мало отличается от
коррозионной стойкости деформированных хромоникелевых коррозион-
ностойких сталей.
Химический состав некоторых литейных (коррозионностой-
ких) сталей и механические свойства согласно ГОСТ 2176—77
приведены в табл. 8 и 9.
Повышенной коррозионной стойкости указанных сталей
достигают надлежащей термической обработкой отливок и
полировкой их поверхности.
Областил применения отливок из коррозионностойких
сталей разнообразны и с развитием новой техники
расширяются.
147
•Г ТАБЛИЦА 8
ХИМИЧЕСКИЙ СОСТАВ ЛИТЕЙНЫХ КОРРОЗИОННОСТОЙКИХ СТАЛЕЙ (ГОСТ 2176-77)
Марка стали
20Х13Л
10Х14НДЛ
09Х16Н4БЛ
09Х17НЗСЛ
10Х12НДЛ
15Х13Л
15Х25ТЛ
08Х14Н7МЛ
35Х23Н7СЛ
16Х18Н12С4ТЮЛ
07X18Н9Л
12Х18Н9ТЛ
10Х18Н11БЛ
12Х18Н12МЗТЛ
18Х25Н19СЛ
45Х17Г13НЗЮЛ
12Х18Н12БЛ
С
0,16—0,25
0,10
0,05—0,13
0,05—0,12
0,10
0,15
0,10—0,20
0,08
0,35
0,13—0,19
0,07
0,12
0,10
0,12
0,18
0,40—0,50
0,12
Si
0,20—0,80
0,20—0,40
0,20—0,60
0,80—1,50
0,17—0,40
0,20—0,80
0,50—1,20
0,20—0,75
0,50—1,20
3,80—4,50
0,20—1,00
0,20—1,00
0,20—1,00
0,20—1,00
0,80—2,00
0,80—1,50
0,55
Содержание, %
Мп
0,30—0,80
0,30—0,60
0,30—0,60
0,30—0,80
0,20—0,60
0,30—0,80
0,50—0,80
0,30—0,90
0,50—0,85
0,50—1,00
1,00—2,00
1,00—2,00
1,00—2,00
1,00—2,00
0,70—1,50
12,0—15,0
0,50—1,00
Сг
12,0—14,0
13,5—15,0
15,0—17,0
15,0—18,0
11,5—13,0
12,0—14,0
23,0—27,0
12,0—15,0
21,0—25,0
17,0—19,0
17,0—20,0
17,0—20,0
17,0—20,0
16,0—19,0
22,0—26,0
16,0—18,0
17,0—19,0
Ni
0,50
1,20—1,60
3,5—4,5
2,80—3,80
1,00—1,50
0,50
0,50
6,0—8,50
0,00—8,00
11,00—13,00
8,00—11,00
8,00—11,00
8,00—12,0
11,0—13,0
17,0—21,0
2,50—3,50
11,0—13,0
Си
0,30
1,20—1.60
0,30
0,30
0,80—1,10
0,30
0,30
0,30
0,30
0,30
0,30
0,30
0,30
0,30
0,30
0,30
0,30
не
0,025
0,030
0,025
0,030
0,025
0,025
0,030
0,030
0,035
0,030
0,030
0,030
0.030
0,030
0,030
0,030
0,025
р
более
0,030
0,030
0,030
0,035
0,025
0,030
0;035
0,030
0,035
0,030
0,035
0,035
0,035
0,035
0,035
0,035
0,020*
Другие элементы
—
Nb 0,05—0,20
—
Ті 0,40—0,80
Mo 0,5—1,00
—
Ті 0,40—0,70
AI 0,13—0,35
—
Ті 5ХС—0,80
Nb 0,45—0,90
Ті 5ХС—0.80
Mo 3,00—4,00
Ті 0,20
Mo 0,20
AI 0,60— 1,00l
Nb 0,7—1,10
Сера + фосфор <-0,040 %.
ТАБЛИЦА 9
МЕХАНИЧЕСКИЕ СВОЙСТВА ЛИТЕЙНЫХ КОРРОЗИОННОСТОЙКИХ СТАЛЕЙ
Марка стали
20Х13Л
10Х14НДЛ
09Х16Н4БЛ
09Х17НЗСЛ
10Х12НДЛ
15Х13Л
15Х25ТЛ
08Х14Н7МЛ
35Х23Н7СЛ
16Х18Н12С4ТЮЛ
07X18Н9Л
12Х18Н9ТЛ
10Х18НПБЛ
12Х18Н12МЗТЛ
18Х25Н19СЛ
45Х17Г13НЗЮЛ
12Х18Н12БЛ
теку-
т'
Пред
ЧЄСТЇ
450
450
800
750
450
400
280
700
250
250
180
200
200
220
250
200
ное
звле-
Us І
600
600
950
1000
650
550
450
1000
550
600
450
450
450
450
500
500
400
тель-
шне-
S g^
О § я
16
15
10
8
14
16
10
12
15
25
25
25
25
25
10
13
• а>
л я
Ч X
(U (U
s rj,
Я лі °*
о §¦?
40
40
15
зо
45
25
—
ЗО
35
32
35
ЗО
28
18
18
в
а
к л
Зо? R
400
600
400
200
300
500
300
280
1000
600
600
600
1000
200
Сталь 20Х13Л менее коррозионностойкая, чем сталь 12X13.
Известно, что при постоянном содержании хрома увеличение
углерода приводит к падению потенциала металла, т. е.
переходу его в активное состояние. Наибольшей коррозионной стой-
кости сталь 20Х13Л и другие литейные стали достигают с
помощью термической обработки и тщательной полировки. Сталь
20Х13Л применяют для изготовления деталей, подвергающихся
ударным нагрузкам (турбинные лопатки, клапаны
гидравлических прессов, арматура крекинг-установок, формы для стекла,
предметы домашнего обихода и т. д.). Сталь 20X13 в хлоридах
и морской воде подвержена усиленной точечной коррозии.
Сталь 10Х14НДЛ коррозионностойкая в морской воде и
атмосфере. Из этой стали, например, изготовляют гребные винты
и другие детали для машиностроения.
Сталь 09Х16Н4БЛ коррозионностойкая и высокопрочная при
нормальной температуре. Она устойчива против окисления в
атмосферных условиях при температуре до 500 °С. Применяют ее
в авиационной, химической и других отраслях промышленности.
Для литейных коррозионностойких сталей применяются
следующие режимы термической обработки:
20Х13Л — отжиг при 950 °С, закалка с 1050 °С, охлаждение
в масле или на воздухе, отпуск при 750 °С,
охлаждение на воздухе
149
10Х14НДЛ — закалка с 1100 С, охлаждение на воздухе,
отпуск при 660—670 °С, охлаждение на воздухе
09Х16Н14БЛ — нормализация при 1050 °С, охлаждение на
воздухе, отпуск при 600 °С, охлаждение на
воздухе, закалка с 950—1050 °С, охлаждение
в масле или на воздухе, отпуск при 600 +
20 °С, охлаждение на воздухе.
09Х17НЗСЛ —отжиг при 660—670 °С, закалка с* 1040—
1060 °С, охлаждение в масле, отпуск при
, 300—350 °С, охлаждение на воздухе.
Закалка с 1040—1060 °С, охлаждение
в масле, отпуск при 670—690 °С, охлаждение
на воздухе, отпуск при 670—690 °С,
охлаждение на воздухе.
10Х12НДЛ — нормализация при 940—960 °С, охлаждение на
воздухе или закалка с 950—1050 °С,
охлаждение со скоростью 30 °С/ч, отпуск при 650—
680 °С, охлаждение на воздухе.
15Х13Л — отжиг при 950 °С, закалка с 1050 °С, охлаждение
в воде, масле или на воздухе, отпуск при 750 °С,
охлаждение на воздухе.
15Х25ТЛ — без термической обработки.
08Х14Н7МЛ — закалка с 1090—1110 °С, нагрев в защитной
среде, охлаждение на воздухе, обработка
холодом при —50—70 °С, отпуск при 250—
350 °С, охлаждение на воздухе.
35Х23Н7СЛ — без термической обработки.
16Х18Н12С4ТЮЛ —закалка с 1150—1200 °С, охлаждение
в воде.
07Х18Н9Л —закалка с 1050—1100 °С, охлаждение в воде,
масле или на воздухе.
12Х18Н9ТЛ —закалка с 1050—1100 °С, охлаждение в воде,
масле или на воздухе, отпуск при 860—880 °С.
10Х18Н11БЛ — закалка с 1100—1150 °С, охлаждение в воде.
12Х18Н12МЗТЛ —закалка с 1100—1150 °С, охлаждение
в воде.
18Х25Н19СЛ — закалка с 1100 °С, охлаждение 6 воде, масле
или на воздухе.
45Х17Г13НЗЮЛ — без термической обработки.
12Х18Н12БЛ — закалка с 1180 °С, охлаждение на воздухе,
двойное старение, 7800 °С, 10 ч или 750 °С,
16 ч.
Сталь 09Х17НЗСЛ коррозионностойкая и высокопрочная при
нормальной температуре. Устойчива в растворах азотной
кислоты, азотнокислых солей и некоторых органических
растворителей. Сталь по коррозионной стойкости равноценна сталям
типа Х17.
150
Сталь 10Х12НДЛ коррозионностойкая, кавитационностойкая
в условиях проточной речной воды. Применяют ее для
изготовления деталей гидротурбин. Эта сталь нестойкая в морской
воде.
Сталь 15Х13Л коррозионностойкая в атмосферных условиях,
в речной и водопроводной воде. Наибольшей коррозионной
стойкости- достигают ее термической обработкой и полировкой.
Сталь предназначена для изготовления турбинных лопаток. По
коррозионным свойствам она близка к деформируемым
хромистым сталям типа Х13.
Сталь 15Х25ТЛ коррозионностойкая и жаростойкая при
температуре <1100 °С. Она предназначена для деталей, не
подвергающихся действию постоянных и переменных нагрузок. Эту
сталь применяют в производстве азотной кислоты и других
окислительных сред. Из стали изготовляют печную арматуру,
различные плиты и др.
Сталь 08Х14Н7МЛ коррозионностойкая. Пригодна для
изделий, работающих при комнатной и низких (<: —196 °С)
температурах.
Сталь 35Х23Н7СЛ коррозионностойкая в сернистых средах.
Предназначена для изготовления деталей трубчатых печей
нефтезаводов, работающих при температуре <1000 °С.
Сталь 16Х18Н12С4ТЮЛ коррозионностойкая. Из этой стали
изготовляют сварные изделия, работающие в азотной кислоте
и других окислительных средах.
Сталь 07Х18Н9Л коррозионностойкая и жаростойкая до
750 °С. Применяют для изготовления коллекторов выхлопных
систем и деталей печной арматуры.
Сталь 12Х18Н9ТЛ коррозионностойкая и жаростойкая при
температуре 750 °С и жаропрочная при <600 °С. Ее можно
применять для сварной аппаратуры, как и деформируемую сталь
12Х18Н10Т.
Сталь 10Х18Н11БЛ коррозионностойкая и жаропрочная при
температуре до 800 °С. Из стали 10Х18Н11БЛ изготовляют
детали газовых турбин, трубокомпрессоров, работающих при
малых нагрузках. Сталь применяют для деталей аппаратов
целлюлозно-бумажной, азотной, пищевой и мыловаренной
промышленности.
Сталь 12Х18Н12МЗТЛ используют для изготовления
деталей, устойчивых при воздействии кипящих сернистой,
фосфорной, муравьиной, уксусной и других кислот, а также деталей,
длительное время работающих под нагрузкой при температуре
до 800 °С.
Сталь 12Х15Н12МЗТЛ является менее коррозионностойкой,
чем сталь 12Х18Н9ТЛ в кипящих растворах азотной кислоты и
других сильных окислителях.
Сталь 12Х15Н12МЗТЛ практически является непригодной
для применения в указанных выше средах. Причиной понижен-
151
ной коррозионной стойкости стали 12Х15Н12МЗТЛ является
наличие в ней молибдена. При выборе стали следует учесть, что
молибден — металл дефицитный и дорогой.
Сталь 18Х25Н19СЛ коррозионностойкая и жаростойкая. Она
предназначена для изготовления деталей паровых и газовых
турбин, котельных установок, лопаток и венцов компрессоров.
Сталь 45Х17Г13НЗЮЛ легирована небольшим количеством
никеля. Применяют взамен стали 40Х24Н12СЛ. Сталь
устойчива в сернистых средах, жаростойкая при температуре
<900 °С. Из стали 45Х17Г13НЗЮЛ изготовляют детали
отпускных, закалочных и цементационных печей, подовые плиты,
короба, тигли и другие детали, работающие при высоких
температурах.
Сталь 12Х18ІІ12БЛ применяют для литых деталей
энергоустановок с длительным сроком работы при 600—650 °С и
ограниченным при 700 °С.
Сталь 20Х5ТЛ жаростойкая при температуре <450 °С,
а сталь 20Х5МЛ при <600 °С. Применяют ее для изготовления
деталей, работающих под давлением в горячих нефтяных
средах, содержащих сернистые соединения.
В работе [112] изучена возможность применения литейной
коррозионцостойкой двухфазной стали Х21Н6М2ТЛ и хромо-
марганцевоникелевых сталей Х17Н5Г9АБЛ и Х14Г14НЗТЛ.
Отливки из указанных сталей следует подвергать термической
обработке по следующим режимам: для стали Х21Н6М2ТЛ
закалка с 1050 °С, охлаждение в воде и старение при 550 °С; для
сталей Х17Н5Г9АБЛ и Х14Г14НЗТЛ закалка с 1050 °С,
охлаждение в воде. Указанные стали в термически обработанном
состоянии не склонны к МКК.
Литейные двухфазные стали 10Х21Н6М2ТЛ и 10Х22Н6ТЛ
широко применяются в гидролизной промышленности на
участках переработки сернокислых гидролизаторов, в качестве
запорной и регулирующей аппаратуры.
Сплавы железа с кремнием, содержащие 14—18 % Si,
находят применение в промышленности ввиду их высокой
коррозионной стойкости во многих агрессивных средах, за
исключением плавиковой кислоты и концентрированных щелочей.
Повышенная коррозионная стойкость сплавов с высоким
содержанием кремния, по-видимому, обусловлена образованием на их
поверхности пассивной пленки S1O2, в то время как на сплавах
с меньшим содержанием кремния пленка состоит в основном из
оксидов железа.
Кремнистые сплавы широко применяют при изготовлении
вентилей центробежных насосов для перекачивания
агрессивных жидкостей.
152
ДВУХСЛОЙНЫЕ
КОРРОЗИОННОСТОЙКИЕ СТАЛИ И СПЛАВЫ
Двуслойные листы с основным слоем из углеродистой или
низколегированной стали и плакирующим слоем из коррозионно-
стойкой стали или сплана, никеля и монель-металла широко
применяют в химическом машиностроении, судостроении, в
производстве торгового оборудования, пищевой промышленности и
во многих других отраслях народного хозяйства для защиты от
коррозии поверхности взамен монолитных сталей и сплавов
[249, 293, 294, 295, 319]. Преимущество двухслойной коррозион-
ностойкой стали или сплава состоит в экономичности и
возможности получения новых эксплуатационных свойств.
Слой биметалла по своей коррозионной стойкости одинаков
с монолитной коррозионностойкой сталью или сплавом [209].
Изготовление упарочных котлов, применяемых при
производстве сернистого натрия из биметалла 12Х25Т + ВСтЗсп,
значительно повышает их коррозионную стойкость, что в свою
очередь обеспечивает длительную и бесперебойную работу
указанной аппаратуры.
Применение двухслойных металлов с плакирующим слоем из
коррозионностойких сталей или сплавов позволяет экономить
высоколегированные стали, сплавы и цветные металлы. При
этом стоимость двухслойных листов, плакированных
коррозионностойкой сталью или высоколегированным сплавом, будет
значительно ниже, чем цельнометаллических.
Двухслойные коррозионностойкие стали и сплавы
поставляют по ГОСТ 10885—85. Двухслойные листы изготовляют из
следующих материалов: основной слой из ВСтЗсп, 10, 20 к,
09Г2, 16ГС, 09Г2С, 10ХСНД, 10ХГСН1Д, 12МХ, 12ХМ, 10Х2М1;
коррозионностойкий слой из 08X13, 08Х17Т, 15Х25Т, 08X1OH10T,
12Х18Н10Т, 10Х17Н13М2Т, 10Х17Н13МЗТ, 08Х17Н16МЗТ,
08Х22Н6Т, 06ХН28МДТ, ХН65МВ, ХН65МВУ, Н70МФ-ВИ,
ХН78Т, монеля НМЖМц 28-2,5-1,5 и никеля НП-2.
Двухслойные листы поставляют в термически обработанном
состоянии. Вид и режим термообработки устанавливают на
предприятии-изготовителе. Разрешается поставка листов без
термической обработки при условии обеспечения заданных
свойств.
Поверхность коррозионностойкого слоя в двухслойных
листах не должна иметь окалины, раскатанных пузырей,
прокатанных плен, трещин (раскатанных и шлифовочных). Дефекты
должны быть удалены пологой зачисткой, глубина которой не
должна выводить толщину коррозионностойкого слоя за его
минимальную* величину.
Допускаются без зачистки отдельные отпечатки, царапины,
риски, рябизна, не выводящие толщину листов и коррозионно-
153
стойкого слоя за минусовые предельные отклонения, а также
следы разделительного слоя при пакетном способе производства
двухслойных листов.
По согласованию изготовителя с потребителем допускается
зачистка на большую глубину или вырубка дефектных участков
коррозионностойкого слоя с последующей их заваркой. При
этом общая площадь исправленных участков не должна
превышать 5 % площади обрезного листа.
При изготовлении листов с травленой поверхностью следы
перетравы не допускаются.
Склонность коррозионностойкой стали к межкристаллитной
коррозии контролируется на одном листе от каждой плавки.
Изготовление образцов, подготовка их к испытаниям,
проведение испытаний и оценка склонности к межкристаллитной
коррозии плакирующего слоя из стали всех марок и сплава марки
06ХН28МДТ проводится по ГОСТ 6032—84, а из сплавов марок
ХН65МВ, ХН65МВУ, Н70МФВ-Ви по ГОСТ 24982—81.
Маркировка упаковки, транспортирование и хранение листов — по
ГОСТ 7566—81 со следующими дополнениями: со стороны
основного слоя наносят марки обоих слоев (или условное их
обозначение): номер плавки основного слоя и номер листа.
Листы транспортируют в открытых вагонах или
полувагонах.
Поверхность основного слоя в двухслойном листе должна
соответствовать требованиям ГОСТ 14637—69. Отслои
коррозионностойкого слоя не допускается. Маркировка и упаковка листов
должны соответствовать требованиям ГОСТ 7566—69 и ГОСТ
10885—75.
При изготовлении химической аппаратуры из двухслойных
сталей основным и наиболее сложным процессом является
сварка, поскольку слои свариваются электродами различного
состава. При сварке двухслойных сталей необходимо учитывать
как химический состав, так и основные структурные
особенности сталей, их физические свойства. В связи с тем, что коррози-
онностойкая сталь в биметалле имеет сравнительно тонкий слой,
при сварке важно соблюдать особую осторожность, чтобы не
нарушить слой коррозионностойкой стали. Поэтому следует
обращать особое внимание на форму подготовки кромок под
сварку, состав применяемых электродов (ручная сварка),
сварочную проволоку и флюс при автоматической сварке и ряд
других условий. Технология ручной сварки двухслойных сталей
разработана в НИИхиммаше и Гипронефтемаше, а
автоматической сварки — в Институте электросварки им. Е. О. Патона и
ВНИИПТхимнефтеаппаратуры (г. Волгоград). Большой опыт
по сварке биметаллов накоплен на заводах Минхимнефтемаша
(Уралхиммаше и др.).
154
ПРЕЦИЗИОННЫЕ СПЛАВЫ
В приборостроении широко применяют различные сплавы с
самыми разнообразными физическими и физико-механическими
свойствами. По физическим свойствам и областям применения
сплавы делят на группы: магнитно-мягкие, магнитно-твердые,
омического сопротивления, с заданным коэффициентом
теплового расширения, с высокими упругими свойствами,
сверхпроводящие термобиметаллы и аморфные сплавы. Эти снлавы
называют прецизионными. Состав таких сплавов должен быть
точным; колебания содержания легирующих элементов должны
быть небольшими, в результате чего обеспечивается получение
оптимальных свойств. С этой же целью в ряде случаев
применяют специальные виды термической обработки.
Прецизионные сплавы в технической литературе описаны как
большие группы сплавов, различно легированные, в отдельных
случаях вместо сплавов применяют чистые металлы.
В работах [НО, 324] приведены химический состав,
физические, физико-механические, технологические и другие свойства
прецизионных сплавов, а также ГОСТы и ТУ на их поставку.
Прецизионные сплавы изготовляют главным образом в виде
тонкой ленты, полос, листов, проволоки, прутков и поковок.
Специальные физические и физико-механические свойства
прецизионных сплавов исследованы детально. Однако
коррозионные характеристики изучены недостаточно. Условия
эксплуатации подтверждают, что коррозия не только влияет на
изменение свойств металла, но подчас преждевременно выводит из
строя отдельные узлы, приборы и целые конструкции.
Прецизионные сплавы, помимо общей коррозии, могут быть
подвержены контактной, точечной, щелевой, коррозии под
напряжением, межкристаллитной коррозии и другим видам
разрушения. Эти виды коррозии детально рассмотрены выше.
Прецизионные сплавы изготовляют в основном на железной,
никелевой и кобальтовой основах. Легирование железа, никеля
и кобальта отдельно или небольшими добавками хрома,
молибдена, вольфрама, ванадия, меди, алюминия и других металлов
осуществляют для получения определенных физических и
физико-механических свойств прецизионных сплавов. В то же
время нельзя не отметить, что дополнительное легирование
различно будет влиять на их коррозионную стойкость.
Известно, что никель и кобальт в водных растворах в
атмосферных условиях по коррозионным характеристикам
отличаются от железа. Подтверждением этого является также то,
что стандартный потенциал никеля и кобальта выше, чем
железа.
Применение прецизионных сплавов системы железо —
никель обусловлено их особыми физическими свойствами. При
легирования железа никелем коррозионная стойкость возрастает
155
с увеличением содержания в них никеля. Сплавы Fe—Ni будут
более устойчивы, чем обычные углеродистые стали, в
атмосферных условиях, в морской воде, а также в слабых растворах
солей, кислот и щелочей. В« то же время нельзя не отметить, что
в этих сплавах наличие железа >20 % способствует появлению
на поверхности металла точечной коррозии, например в
растворах, содержащих ионы С1~~, Вг~, 1~ и CIO4-. Аналогичные
сплавы подвержены коррозионному растрескиванию в
»растворах NaOH и КОН, особенно в присутствии хлористых солей.
Легирование железа, например хромом, заметно повышает
коррозионную стойкость сплава вследствие перевода его в
пассивное состояние. Гсзкос повышение коррозионной стойкости
наблюдают при содержании в сплавах 12—13 % Сг. Такое
количество хрома является минимальным для сплавов,
которые будут корро:шонностойкими в окислительных средах и в
атмосферных условиях. Увеличение содержания хрома > 13 %
приводит к дальнейшему повышению коррозионной стойкости
сплава.
Коррозионная стойкость прецизионных сплавов на железной
основе повышается с увеличением в них содержания как хрома,
так и никеля.
Сплавы на основе Ni менее чувствительны к структурной
коррозии, чем коррозионностойкие стали, что, по-видимому,
связано с повышенной коррозионной стойкостью Ni в активном
состоянии в неокислительных средах по сравнению с железом и
хромом.
Никелевые сплавы в некоторых условиях могут проявлять
склонность к межкристаллитной коррозии и коррозии под
напряжением. Так, например, сплавы системы Ni—Си могут
подвергаться коррозионному растрескиванию при воздействии
ртути и ртутных соединений и растворов кремнефтористоводо-
родной кислоты. Концентрированные растворы NaOH при
высокой температуре вызывают коррозионное растрескивание этих
сплавов.
Общеизвестно, что никель с медью дает непрерывный ряд
твердых растворов. Сплавы никеля, содержащие <50 % Ni, по
коррозионной стойкости обычно близки к чистому никелю.
И наоборот, сплавы никеля, в которых >50 % Ni, утрачивают
пассивность, характерную для никеля, и ведут себя аналогично
меди, сохраняя при этом высокую стойкость против ударной
коррозии.
При выборе материалов необходимо учитывать, что никель
и медь являются дефицитными металлами, поэтому сплавы Ni—
Си следует применять в исключительных случаях.
Сплавы никеля с хромом называют нихромами. Эти сплавы
обладают высокой коррозионной стойкостью в атмосферных
условиях и во многих агрессивных средах.
Сплавы никеля, легированные молибденом, устойчивы в не-
156
окислительных средах. Эффективное снижение скорости
коррозии никеля наблюдают при введении в сплав 27—28 % Мо.
Сплавы никеля с молибденом и чистый молибден имеют
высокую коррозионную стойкость в соляной кислоте и низкую в
растворах азотной кислоты.
При легировании никеля одновременно молибденом и
хромом сплав получается стойким в окислительных средах и не
подвержен точечной коррозии в морской воде.
Поскольку кобальт и никель имеют одинаковые
коррозионные характеристики, кобальтовые сплавы по своей
коррозионной стойкости близки к сплавам на никелевой
основе.
Кобальт обеспечивает высокую прочность и твердость
сплава. Однако дефицит кобальта крайне ограничивает
применение этих сплавов, тем более что высокие магнитные свойства
получают в сплавах железо — никель — алюминий.
Прецизионные сплавы на никелевой и железной основах
применяют в качестве элементов, обладающих высоким
электросопротивлением. Эти сплавы работают при высоких температурах
и подвержены газовой коррозии.
Поведение сплавов при высоких температурах на практике
оценивают с помощью двух важнейших характеристик —
жаростойкости и жаропрочности.
Жаростойкостью (окалиностойкостью) называют
способность металла сопротивляться коррозионному воздействию
газов при высоких температурах, а жаропрочностью —
способность металла сохранять при высоких температурах достаточно
высокие механические свойства: длительную прочность и
сопротивление ползучести.
Прецизионные сплавы, работающие при высоких
температурах, должны обладать хорошей жаростойкостью (окалинострй-
костью) и высокой жаропрочностью. Жаростойкость зависит от
химического состава сплава, температуры нагрева и состава
газовой среды.
На примере некоторых чистых металлов видно, что в
отдельных газовых средах, таких как СЬ, НгО и СО2 и SCb при
температуре 700 °С, коррозия будет неодинакова.
Железо сильно корродирует во всех средах. Никель и
кобальт относительно устойчивы в среде U2, Н2О и CU2, но очень
сильно корродирует в SO2. Кобальт в отличие от никеля имеет
высокую стойкость в сероводороде. Хром устойчив во всех
четырех средах. Медь совершенно устойчива в SO2 и относительно
незначительно корродирует в Ог, Н2О и СО2.
Скорость коррозии металлов в указанных средах с
увеличением температуры нагрев возрастает. Железо и обычные
углеродистые стаЛи при высокой температуре в чистом воздухе по
сравнению с воздухом, содержащим SO2 и пары воды,
корродируют значительно меньше.
157
Необходимо отметить, что нагревательные элементы,
изготовленные из прецизионных сплавов, многое оборудование,
аппараты, промышленные печи и приборы бытовой техники
работают с частыми остановками, поэтому они не должны быть
чувствительными к теплосменам.
Колебания температуры (попеременный нагрев и
охлаждение) увеличивают скорость окисления, например, железа и
стали. При этом в окалине вследствие возникновения
»температурных напряжений образуются трещины и она отслаивается от
металла.
Кроме того, если при высокой температуре металл
подвергается газовой коррозии, то при остывании его в зависимости от
окружающей среды можно наблюдать также и
электрохимическую коррозию.
Помимо химического состава сплава, термической обработки
его и ряда других факторов, на электрохимическую и газовую
коррозию влияет также состояние поверхности металла.
Общеизвестно, чем тщательнее обработана поверхность изделия, тем
выше коррозионная стойкость металла.
Поэтому все элементы, изготовленные из прецизионных
сплавов, следует полировать. Кроме того, следует обращать
внимание на места соединений, которые должны быть чистыми, без
оксидов и других продуктов коррозии.
Наилучшими соединениями будут цельнометаллические,
спаянные или сваренные. В тех случаях, когда соединения сделаны
из коррозионностойких или разнородных металлов, необходима
дополнительная защита. Наличие зазоров не только, например,
между металлическими пластинами, но даже между металлом и
фарфором или около полихлорвиниловых прокладок приводит
к интенсивной щелевой коррозии. Указанный вид коррозии
наблюдают в резьбовых и винтовых соединениях.
Следовательно, уже при конструировании нужно избегать
неплотных контактов, зазоров, углублений, шероховатостей
поверхности, т. е. мест, где может конденсироваться и собираться
влага. При наличии указанных дефектов, например в морских
условиях, может возникнуть щелевая коррозия даже на таком
стойком в коррозионном отношении металле, как сталь
Х18Н10Т. Если при конструировании этого достигнуть не
удается, то при монтаже надо тщательно защищать щели и зазоры
путем нанесения герметиков, грунтов, красок и других
покрытий. Окислы, образовавшиеся при сварке, и флюсы, оставшиеся
при пайке, должны быть удалены. При монтаже также следует
не допускать механических повреждений, так как известны
случаи, например, когда сильный натяг приводит к
растрескиванию металла. Для всех изделий из прецизионных сплавов важно
обеспечить соответствующую антикоррозионную защиту при
изготовлении, транспортировке и хранении.
158
Ниже приведены краткие коррозионные характеристики
некоторых прецизионных сплавов по .группам К
Магнитно-мягкие сплавы
Магнитно-мягкие сплавы обладают высокой магнитной
проницаемостью и малой коэрцитивной силой2 в слабых полях. Такие
сплавы подвергают попеременному намагничиванию.
В этой группе представлено более C0 марок. Так, например,
сплавы 27КХ, 36КНМ, 49КФ, 50КФ, 65К, 92К, никель НП-2Т,
никоей, 05НС, ЗОНГ, 31НХГ, 32НХ, 32Н6ХЮ, ЗЗНХ, ЗЗНЮ,
ЗЗНКМС, 34НКМП, 35НКХСП, 37НКДП, 38ЫС, 38НХ,
40НКМПЛ, 45Н, 47НК, 47НКХ, 47НД, 47Н5К, 50Н, 50НУ,
50НП, 50НПУ, 50НХС, 52Н, 64Н, 65НГ, 68НМ, 69НМП,
72НМДХ, 76НХД, 77НМД, 78Н, 79НМ, 79НМУ, 79НЗМ, 80НМ,
80НЮ, 80Н2М, 80НХС, 81НМА, 83НФ, 10СЮ, ТКМ, Фехко, 16Х,
8Ю, 12Ю, 12ЮК, 14Ю, 16ЮХ, 16ЮИХ.
В первую очередь следует выделить два сплава: 16Хи Фехко,
обладающих высокой коррозионной стойкостью в
окислительных средах. Их можно применять без защитных покрытий.
Сплав 16Х, содержащий 15,5—16,5 % Сг и остальное Fe, по
стойкости аналогичен коррозионностойкими сталям типа Х17.
Сплав Фехко, содержащий 24 % Сг, 2 % Со, остальные Fe, по
стойкости равноценен сталям типа Х25. Таким образом,
сравнительная оценка коррозионной стойкости сплавов 16Х и Фехко
во многих химических средах может быть установлена по
данным табл. 10.
Сплав никоей, содержащий 3,5—4,5 % Со; 1,3—2,0 % Si и
остальное Ni, по стойкости может быть приравнен к чистому
никелю. Коррозионная стойкость чистого никеля (НП-2Т) дана
в табл. 1.
В сплавах 76НХД, 77НХД, 72НМДХ медь, как и молибден,
повышает коррозионную стойкость металла в пресной и
морской воде и других средах. Однако медь снижает стойкость
сплава в аммиачных растворах и в ряде органических и
неорганических кислот. Особенно чувствителен в этих условиях
сплав 72НМДХ, содержащий 13,8—14,2 % Си. Сплавы 12Ю,
12ЮК, 16ЮХ, 14Ю, 8Ю на железной основе, легированные
алюминием, являются жаростойкими металлами. Применять такие
сплавы в щелочных, аммиачных и других средах не
рекомендуется.
1 При рассмотрении коррозионных свойств взяты сокращенные
буквенно-цифровые обозначения сплавов с указанием содержания основных
элементов. Полный химический состав смотрите в справочнике
«Прецизионные сплавы» [МО].
2 Интенсивностью намагничивания называют магнитную проницаемость;
коэрцитивной силой — напряженность поля, которая должна быть прщіїш
жена к образцу для того, чтобы его размагнитить. . A*
159
Сплав 36КНМ, содержащий 22 % Ni, 36 % Co, 3 % Mo и
остальное Fe, применяют в основном для изготовления деталей,
работающих в морской воде. Морская вода — слабый
окислитель, так как в ней содержится растворенный кислород. Кроме
того, в морской воде содержится значительное количество хлор-
иона, вследствие чего она является агрессивной средой.
При рассмотрении сплава 36КНМ надо отметить, что
коррозионная стойкость его, помимо кобальта и никеля, зависит от
легирования молибдена, который пассивируется в хлорсодержа-
щих средах, в том числе и в морской воде. Высокой
коррозионной стойкостью в морской воде обладают нержавеющие хромо-
никелевые стали, легированные Мо, а именно 10Х17Н13М2Т,
10Х17Н13МЗТ, 03Х17И13М2, 08Х21Н6М2Т, 03Х22Н6М2 и др.
Коррозионностойкими металлами в морской воде будут также
высокохромистыс коррозионностойкие стали, содержащие
небольшое количество Мо.
Сплав 05НС представляет слаболегированное
малоуглеродистое железо. Его предназначают для экранирования кабеля
связи на линиях железных дорог, где используют однофазный
переменный ток.
Остальные сплавы этой группы по стойкости превосходят
обычные низколегированные стали. Повышенная стойкость
объясняется высоким содержанием в сплавах Ni или Со. Однако
большинство магнитно-мягких сплавов на железной основе
являются коррозионнонестойкими и применять их следует в
герметических емкостях или с защитными покрытиями. Покрытие
должно удовлетворять основному требованию — отсутствию
химического взаимодействия или взаимной диффузии компонентов
металла и покрытия.
Согласно ТУ некоторые магнитно-мягкие сплавы, например
45Н, 50Н, 78Н, 79Н и др., не подвержены коррозии при
температуре 25±10 °С и относительной влажности <40 %. Однако
это по существу идеальные условия хранения для складских
помещений, которые желательно соблюдать при транспортировке
металла и при монтажных работах. С изменением температуры
и с увеличением влажности >40 % указанные сплавы будут
корродировать.
Магнитно-мягкие сплавы используют в качестве
сердечников магнитопроводов и магнитных экранов аппаратуры
радиосвязи, радиолокации, автоматики, управления по радио, счетно-
решающих машин и др.
Магнитно-твердые сплавы
Магнитно-твердые сплавы предназначают для постоянных
магнитов. От этих сплавов требуются высокие коэрцитивная сила
и остаточная индукция, а также их постоянство во времени.
Остальные магнитные характеристики для этих сплавов
практического значения не имеют.
160
Наибольшее распространение получили следующие сплавы
этой группы: 12ГН, 12КВ, 16КВМ, 12КМ, 24КН, 25КФН,
25КХФ, ЗОКХ, 35КХ, 35КХФ, 35КФН, 52КФ, 12НГ, 20НЮ,
22НЮ, 25НЮ, 5ХВ, 5ХМВ, ЕВ6, ЕХЗ, ЕХ5К5, ЕХ9К15М2, Ку-
нико I, II, ПлК-78, а также сплавы систем Fe—AI—С; Fe—
Cr—Ni; Mn—AI и др.
Многие сплавы этой группы на железной основе, как,
например, ЕХЗ, содержащий 2,8—3,8 % Сг, остальное Fe; EX5K5
содержащий 5,5—6,5 % Сг, 5,5—6,5 % Со, остальное Fe; EB6,
содержащий 5,2—6,2 % В, остальное Fe, и другие по своей
коррозионной стойкости близки к обычным низколегированным
сталям. Поэтому они являются коррозионнонестойкими и их
следует применять в закрытых объемах или с защитными
покрытиями.
Сплав 12ГН A1,5—12,5% Мп; 3—4% Ni; 2,5—3% Mo;
1,2—1,7 % V; остальное Fe) следует отнести так же, как и
другие сплавы на железной основе, к коррозионнонестойким
металлам. Пониженную стойкость наблюдают особенно в хлорсо-
держащих средах, например в морской воде. В 10 %-ной
серной кислоте при комнатной температуре скорость коррозии
сплава 12ГН составляет 6 мм/год.
Этот сплав применяют для стрелок компасов, фиксирующих
магнитов и отклоняющих систем электроннолучевых трубок и
цветных телевизоров. Однако ряд сплавов этой группы имеет
сравнительно высокую коррозионную стойкость.
Это относится в первую очередь к сплавам на основе
драгоценных металлов, а также к сплавам системы Си—Ni—Со.
Кобальтплатиновые сплавы
Оба сплава D8—49 % Pt и 51—52 % Со и 48—45 % Pt, 50 %
Со и 2—5 % Pd) являются коррозионностойкими
металлическими материалами и обладают свойствами чистой платины
(коррозионную стойкость чистой платины см. в табл. I).
Механизм защитного действия указанных сплавов, содержащих
значительное количество платины D5—49%), заключается в том,
что на поверхности металла образуется сплошной слой,
состоящий из атомов благородного компонента. Однако такие сплавы
являются очень дорогими и применяют их в случае особой
необходимости.
Сплав Кунико-1 E0 % Си. 21 % Ni и 29 % Со)
Этот сплав в разбавленных щелочных растворах, в
водопроводной и морской воде, в воздушной атмосфере имеет относительно
высокую коррозионную стойкость. Во влажной атмосфере
сернистого ангидрида, сероводорода, хлора и брома при
повышенной температуре наблюдают значительную коррозию. Сплав
Кунико-1 неустойчив в аммиачных растворах, в азотной и
соляной кислотах.
6 Заказ № 1104 161
Сплавы 30КХ15, 35КХ12, 35КХ15 на основе Ре, содержащие
30—35 % Со и 12—15 % Сг, устойчивы в атмосферных
условиях и окислительных средах, а также являются жаростойкими
материалами. По стойкости их можно сравнить с коррозионно-
стойкими хромоникелевыми сталями аналогичного состава.
Магнитно-твердые сплавы используют как элементы
памяти— носители сигналов и постоянные магниты в
радиоаппаратуре автоматических систем, работающих по заданной
программе, в накопителях информации счетно-решающих машин
и др.
Сплавы омического сопротивления
Общеизвестно, что легирование, например меди, алюминия,
железа и других металлов, приводит к повышению их
электросопротивления. Поэтому для элементов омического
сопротивления применяют не чистые металлы, а сплавы. В качестве таких
материалов применяют сплавы на железной и никелевой
основе, которые идут для изготовления электронагревателей,
резисторов (реостатов), тензорезисторов и термосопротивлений.
Сплавы для электронагревателей, помимо общих
требований, должны обладать дополнительно еще высокой
жаростойкостью (окалиностойкостью). Такое свойство сплавов
омического сопротивления в первую очередь зависит от содержания
в них хрома, препятствующего их окислению (хром обладает
высокой стойкостью к газовой коррозии). Чем выше
температура, при которой работает элемент, тем больше хрома
должно быть в сплаве. Легирование сплава никелем в количестве
<10 % не повышает заметно стойкости металла против
окисления. При 20 % Ni и выше повышается окалиностойкость
в атмосфере, не содержащей серы и сернистых соединений.
При этом следует отметить, что жаростойкость сплавов
системы Ni—Cr выше, чем чистого хрома.
Алюминий, кремний сильно повышают окалиностойкость
сплавов. Сера, фосфор и марганец не влияют на окисление
железа. Ванадий, бор и молибден действуют отрицательно, т. е.
они сильно снижают жаростойкость сплава. Так, например,
W, V и Мо могут ускорить окисление металла при высоких
температурах, что связано с легкоплавкостью и летучестью
образовавшихся окислов или их эвтектик.
Окислы МоОз плавятся при 795 °С. Окислы Nb2Os и Та2О5
устойчивы до 1370 °С. Небольшое содержание в нихромах
титана и ниобия положительно сказывается на жаростойкости
сплавов.
Для электронагревателей применяют следующие сплавы:
Х13Ю4(900); 0Х23Ю5A150); 0Х23Ю5АA175); Х27Ю5АA250);
Х15Н60(950); Х15Н60-НA050); Х20Н80A050) и Х20Н80-Н
A150). Сплавы с индексами А и Н — наиболее .высокого ка-
162
чества, которое обеспечивается прецизионной технологией их
изготовления (в скобках указана оптимальная рабочая
температура, °С). Сплавы 023Ю5А и 0Х27Ю5А устойчивы в
окислительной атмосфере, а также углеродсодержащих средах
(СО—СО2—СН4—О2—Н2О—N2), генераторном газе (СО—Н2—
N2) и в атмосфере SO2 и H2S. Сплавы Х20Н80, Х20Н80-Н и
0Х27Ю5А можно применять в восстановительной атмосфере
(Н2, пары спирта и др.).
В атмосфере азота более устойчивы сплавы Х20Н80 и
Х20Н80-Н. Указанные два сплава пригодны также для работы
в аммиачной атмосфере. Применять железные сплавы с
высоким содержанием AI и Сг в атмосфере азота нельзя.
Сплав Х20Н80-Н устойчив в водяном паре при рабочей
температуре <1150 °С и в атмосфере хлора и брома при <300 °С.
Сплавы Х15Н60-Н и 0Х23Ю5А применяют для работы в
вакууме (Ю-1—10~4 мм рт. ст.). При давлении 10~4 мм рт. ст. и
температуре 1100 °С испаряются компоненты, обладающие
более высокой упругостью пара. У железохромалюминиевых
сплавов такими компонентами являются алюминий и хром,
а у нихромов хром и кремний. Поэтому при конструировании
вакуумных печей следует предусмотреть защиту, например,
экранами.
Защитные экраны можно изотовлять из тугоплавких
металлов или их сплавов. Известно, что вольфрам, тантал,
молибден и др. не испаряются в вакууме даже при очень высоких
температурах.
При применении сплавов следует учитывать, что упругость
паров какого-либо компонента в сплаве отличается от значений
этой характеристики для чистого металла. Кадмий, цинк и
неметаллы являются непригодными материалами для глубокого
вакуума. Газовые примеси в сплавах легко испаряются, что
отрицательно сказывается на свойствах металла.
Технологические особенности
применения электронагревателей
Сплавы Fe—Сг—AI склонны к химическому взаимодействию,
с окислами металлов. Для них в отличие от нихромов
непригодна любая керамика, выпускаемая промышленностью для
высокотемпературных печей. Для температур 1100—1400 °С
огнеупорная масса должна содержать >75 % А12Оз и
минимальное количество окислов железа (<1 %). Для температур
400—1100 °С пригодна огнеупорная масса, содержащая >60 %
А12О3 и <1 % оксидов железа. Этим требованиям отвечает
шамот класса А.
На практике хорошо зарекомендовал себя способ
обмазывания керамики в местах контакта с нагревательными
элементами высокоглиноземистой массой (смесь 30 % корунда
крупной фракции (-25 мкм), 45% корунда мелкой фрайщк
6* 163
(~5 мкм), 25 % каолина и воды). Разрушающее действие на
окалину Fe—Сг—AI сплавов оказывают пары и брызги
некоторых металлов — меди, цинка, алюминия и свинца. Недопустим
контакт поверхности нагревателя с кремнеземом, поваренной
солью, шлаками, эмалями и железной окалиной. Недопустимо
также изготовление нагревателей из поржавевшей проволоки
и ленты. Нихромы проявляют значительно меньшую склонность
к взаимодействию с керамикой. Однако на них разрушающе
действует контакт с асбестом при температуре 400 °С и с
кизельгуром 1 (инфузорная земля, диатомит, горная мука).
При высокой температуре недопустим также контакт
шлаков, эмалей, стекла со сплавами, содержащими много железа
или марганца. Прокатная железная окалина разрушает все
сплавы, применяемые для электронагревателей.
При изготовлении нагревателей рекомендуют аргоно-дуго-
вую сварку, при которой состав свариваемых сплавов в месте
шва практически не меняется.
Сплавы для резисторов и тензорезисторов
В этой подгруппе применяют сплавы: Н80ХЮД (—70) —
( + 480); Х20Н75Ю (—70) —( + 480); Н63ГХ (—60)—( + 300);
ХГ45Ф (—60) —( + 250); НМ23ХЮ (—196) —( + 500);
0Х21Ю5ФМ (—196) —( + 800); 0Х21Ю9 (—196) —( + 800);
манганин ( + 15) — ( + 35) и константан (—60) — ( + 350) (в скобках
указан оптимальный рабочий интервал температур в °С).
Из этого ряда сплавы НМ23ХЮ, 0Х21Ю5ФМ и 0Х21Ю9
применяют для работы при низких температурах в интервале
+ 20—196 °С.
Для тензорезисторов, проволока или лента которых может
нагреваться до 800 °С, используют жаростойкие сплавы
0X21Ю9, 0Х21Ю5ФМ и НМ23ХЮ. Сплавы 0X21Ю9 и
0Х21Ю5ФМ — стойкие в окислительной атмосфере. Сплав
НМ23ХЮ устойчив в восстановительной среде (Н2), но
совершенно нестоек в азотной кислоте и других окислительных
средах.
Для сплавов, предназначенных для резисторов (реостатов)
и работающих максимально до 500 °С, жаростойкость не имеет
существенного значения. Поэтому сплав следует выбирать
с учетом среды, колебаний температуры и влажности, в
которых скорость коррозии будет различной.
Сплавы Х20Н75Ю и Н80ХЮД устойчивы в различных
атмосферных условиях, за исключением серы и сернистых
соединений. Сплав Х20Н75Ю более устойчив, чем сплав Н80ХЮД,
в аммиачной среде. Сплав НГ45Ф неустойчив во влажной
атмосфере и совершенно непригоден для работы без защиты
в морских условиях.
1 Кизельгур в своей массе содержит большое количество серы,
164
Ниже рассмотрены медные сплавы: манганин (84 % Си,
4 % Ni, 12 % Мп) и константан. E9 % Си, 40 % Ni, 1 % Мп).
Оба сплава не являются жаростойкими, однако их применяют
при повышенных температурах. Поэтому следует учесть, что
при легировании чистой меди алюминием A0 %) или
кремнием повышается стойкость ее к газовой коррозии. Добавки
к меди марганца, железа, никеля и титана практически не
влияют на жаростойкость ее, а хром оказывает даже
отрицательное действие.
Манганин стоек в закрытых помещениях, где нет высокой
влажности и значительного изменения ее. Он неустойчив во
влажной атмосфере, содержащей хлористые соединения,
а также пары щелочей и аммиака.
Константан устойчив в атмосфере водяного пара при
высоких температурах, но в отсутствие углекислого газа. Он также
устойчив в других атмосферах, за исключением промышленной,
содержащей серу и сернистые соединения. Константан
устойчив при 20 °С в разбавленных растворах серной и плавиковых
кислот, в уксусной и других органических кислотах, в морской
воде, в разбавленных растворах щелочей. Он нестоек в
аммиаке (всех концентраций), в соляной кислоте, в хлористом
аммонии, в растворах хлористого железа, в азотной кислоте
(в концентрированных растворах) обнаруживает сильную
коррозию, нестоек также в атмосфере сероводорода.
Сплавы для термосопротивлений
Для термосопротивлений наибольшее распространение получил
сплав Н50КЮ E0—52 % Ni; 10—11 % Со, остальное Fe).
Предельная рабочая температура составляет 500 °С. Сплав
Н30Х18 дешевле, чем Н50КЮ, так как легирован меньшим
количеством никеля и не содержит других дефицитных
металлов. Однако сплав Н30Х18 находится еще в стадии
лабораторных исследований.
Сплавы омического сопротивления обладают высоким
удельным электрическим сопротивлением, жаростойкостью. Их
применяют в качестве тарированных сопротивлений в
радиоэлектронике, термо- и тензодатчиков для аппаратуры,
регистрирующей и управляющей тепловыми и механическими нагрузками
нагревательных элементов в промышленных печах, в приборах
бытовой техники.
Сплавы с заданным коэффициентом теплового расширения
Прецизионные сплавы с заданными температурными
коэффициентами линейного расширения (ТКЛР) по комплексу свойств
и в зависимости от условий применения подразделяют на
сплавы с минимальными ТКЛР, на ферромагнитные сплавы
с низкими и средними ТКЛР и немагнитные сплавы с
заданными ТКЛР.
165
^Сплавы с минимальными ТКЛР предназначают для
деталей приборов, применяемых в метрологии, геодезии, криогенной
технике и других отраслях промышленности.
Наибольшее распространение получили железоникелевые
(инвары), железоникелькобальтовые и железокобальтовые
Ї ""е' 36НВИ' X6H" МНКД 32НКВИ
35НКЇ; 30КПд
Хром, медь и другие элементы, за исключением кобальта и
палладия (до определенных концентраций), обычно вводят
в инварные сплавы с целью повышения ТКЛР.
В то же время дополнительное легирование небольшими
добавками хрома, меди, палладии и других металлов, как и ва-
куумно-индукционная выплавка и тщательная полировка,
повышает коррозионную стойкость этих сплавов.
Однако все железоникелевые сплавы во влажной атмосфере
являются некоррозиоиностойкими материалами, поэтому их
следует применять с дополнительной защитой.
Из серии сплавов с минимальным ТКЛР, имеющих
повышенную стойкость, следует отметить сплавы 54К9Х и ЗОНПд
Сплав 54К9Х E4 % Со; 8,85—9,1 % Сг, остальное Fe)
устойчив в окислительных средах. Сплав ЗОНПд C0 % Ni; 6,0—
10,0 % Pd, остальное Fe) легирован палладием. Стойкость этого
сплава возрастает в результате смещения потенциала в
положительную сторону, в область пассивных значений. Палладий
.является эффективной катодной добавкой, аналогичной
платине, которая повышает коррозионную стойкость сплава.
Ферромагнитные сплавы с низким и средним ТКЛР
По химическому составу сплавы этой подгруппы
подразделяют на Fe—Ni сплавы, легированные Си и Cr D7HX 48НХ
47НЗХ, 47НД, 49НД, 46НХ, 42Н, 52Н, 52Н-ВИ, 46Н, 43н'
58Н); Fe—Ni—Со сплавы B9НК, ЗОНКД, 38НКД, ЗЗНК,
38НК, 34НК) и железохромистый сплав 18ХТФ.
Применяют их в многочисленных электровакуумных
приборах (приемо-усилительные лампы, телевизионные трубки,
герметические вводы и корпуса полупроводниковых приборов
и др.).
Сплавы Fe—Ni используют также в точном
приборостроении и станкостроении для изготовления элементов приборов.
Сплавы Fe—Ni—Co в промышленности применяют для
спаев с термостойкими стеклами и некоторыми керамиками.
Для спаев со стеклом применяют также сплав 18ХТФ.
Высокое содержание в сплаве хрома способствует образованию
плотной окисной пленки и прочного спая.
1
Сплав 36Н-ВИ (эакуумно-индукционной выплавки) отличается от
сплава 3№ меньшим содержанием углерода И газов, Он меньше загрязнен
неметаллическими рклїочєниядои " - ' '•
168 ¦
Сплавы для спаев выбирают не только с учетом свойств
металла, но и характеристик теплового расширения
неорганических диэлектриков и других материалов.
Все перечисленные сплавы систем Fe—Ni и Fe—Ni—Со
с небольшими добавками Си и Сг во влажной атмосфере
обладают пониженной коррозионной стойкостью. Они также не
стойки при температуре 20—25 °С в п:штиой кислоте (всех
концентраций), в соляной и сернистой кислотах. В 2—5 %-ном
растворе серной кис'лоты металлы корродируют со скоростью
0,15 мм/год, но с* увеличением концентрации и температуры
скорость коррозии возрастает. В 65 %-ном растворе
азотнокислого аммония скорость коррозии составляет <0,8 мм/год.
По данным [213], прецизионный сплав 29НК в
расплавленной сере, нагретой до температуры 150 °С, при 6-ч выдержке не
корродирует. Однако при дальнейшем повышении температуры
нагрева расплава, скорость коррозии возрастает, что показано
ниже:
Температура, °С
150 175 200 250 300 350 400
Скорость коррозии, мм/год
0,00 0,42 0,736 1,156 3,26 7,99 41,51
Таким образом, сплав 29НК следует применять в контакте
с расплавом серы при температуре не выше 150 °С.
Сплавы 38НКД, 47НД, 49НД, содержащие в своем составе
5—7 % меди, непригодны для эксплуатации в аммиачных
средах.
Сплав 18ХТФ A7,0—19,0% Сг; 0,25—0,45% W; 0,4—0,8%
Ті) обладает высокой коррозионной стойкостью в атмосферных
условиях, в растворах азотной кислоты и других
окислительных средах. По стойкости сплав 18ХТФ может быть приравнен
к сталям типа Х17.
Немагнитные сплавы с заданными и высокими ТКЛР
К таким сплавам относятся: сплав с низким ТКЛР на основе
циркония, легированного титаном (93ЦТ); сплавы со средним
ТКЛР на никелевой основе и легированные вольфрамом,
молибденом, хромом, а также медью G5НМ, 80НМВ, 70НВД,
80НМВХЗ, 76НХВГ). Эти сплавы являются жаростойкими.
К немагнитным относятся также сплавы с высоким ТКЛР
систем Мп—Сг—Ni и Mn—Pd E6ДГНХ и 73ГНПд).
Сплав 93ЦТ обладает высокой коррозионной стойкостью
во многих агрессивных средах. Он стоек в соляной и азотной
Продукты коррозии растрескиваются, отслаиваются от металла.
167
кислотах. Щелочные расплавы не оказывают на него никакого
действия. Окисные пленки на сплаве менее проницаемы, чем
на чистом цирконии.
Сплав стоек в атмосферных условиях, в морской воде, но
сильно корродирует в плавиковой и хлорноватистой кислотах.
В большинстве сред он по стойкости приближается к чистому
цирконию.
Сплав 75НМ B4,5—26,0 % Мо, остальное Ni) на* основе
никеля содержит высокий процент молибдена, который
обеспечивает стойкость металла в неокислительных средах. Сплав
стоек в НС1 всех1 концентраций до температуры 70—75 °С.
Легирование никельвольфрамового сплава 76НХВГ A3,6—
14,6 % Ni, 4,0—5,0 % Сг, остальное W) хромом значительно
повышает его коррозионную стойкость в окислительных средах,
например в HNO3, но одновременно снижает его стойкость
в НС1. Аналогичное действие оказывает хром на сплавы
систем Ni—W—Mo и Ni—Mo.
Сплав 75НМ по коррозионной стойкости можно сравнить
с кислостойким сплавом Н70МФ (ЭП814), а сплав
76НХВГ —со сплавом ХН65МВ (ЭП567).
Сплавы 75НМ, 80НМВ, 70НВД, 56ДГНХ и 93ЦТ испытаны
циклическим погружением в 3 %-ном растворе NaCl, в
результате чего показали относительно высокую стойкость. Так,
например, скорость коррозии сплава 93ЦТ при этом испытании
составляла 0,0002 г/(м2-ч).
Сплав 73ГНПд опробован в качестве активной
составляющей термобиметаллов. Он содержит много марганца, элемента
нестойкого как в окислительных, так и в восстановительных
средах. Этот сплав нестоек во влажной атмосфере. Поэтому
его следует применять с надежной защитой.
Сплавы с заданным и высоким коэффициентом теплового
расширения используют для спаев с различными стеклами,
керамикой, слюдой и другими диэлектриками в радиолампах и
электронно-лучевых приборах, для деталей измерительных
приборов с постоянными размерами, для согласованных
соединений с легкими металлами.
Сплавы с высокой упругостью
В ряде случаев требуется металл с не изменяющимися с
температурой модулями упругости, применяемый для пружин
различных приборов и других деталей. Такие сплавы часто
называют пружинными.
По способу упрочнения и физико-механическим свойствам
пружинные сплавы в свою очередь можно разделить на три
основные подгруппы:
Аустенитные дисперсионно твердеющие сплавы основаны
на системах Fe—Ni—Cr, Ni—Cr, Cr—Ni, Co—Ni и Nb—Ті,
168
а именно: 36НХТЮ, 36НХТЮМ5, 36НХТЮМ8, 75НХТЮБ,
70НХБМЮ, 40ХНЮ, 47XHM, 67КН5Б и 55БТЮ.
Сплав 36НХТЮ C5—37% Ni; 11,5—13,0% Cr; 2,7-3,2%
Ті; 0,9—1,2 % AI, остальное Fe) обладает высокой
коррозионной стойкостью в атмосферных условиях, в окислительных и
других средах. На примере сплава 36НХТЮ (см. табл. 6)
показано, ^что вакуумно-индукционная и другие новые методы
выплавки по сравнению с выплавкой в открытых
индукционных печах повышают коррозионную стойкость металла.
Сплавы 36НХТЮМ5 и 36НХТЮМ8 отличаются от сплава
36НХТЮ тем, что они дополнительно легированы
соответственно 5 и 8 % молибдена. Эти сплавы более устойчивы в
морской воде, чем сплавы без молибдена.
Все перечисленные сплавы при содержании хрома 12—14 %
обладают высокой коррозионной стойкостью в окислительных
средах. Однако значительное увеличение хрома в сплаве
приводит к резкому уменьшению растворения металла. Например,
сплав 47ХНМ в кипящей 65 %-ной HNO3 корродирует со
скоростью 0,1 мм/год.
Следует отметить, что все сплавы системы Fe—Ni—Cr
наибольшей коррозионной стойкостью обладают в закаленном
состояний. При старении в интервале температур 350—750 °С
скорость коррозии возрастает и металл в некоторых средах
становится склонным к межкристаллитной коррозии.
Сплавы 75НХТЮБ и 70НХБМЮ обладают высокой
коррозионной стойкостью в окислительных средах. Сплав 70НХБМЮ,
содержащий молибден, более пригоден для работы с морской
водой.
Сплав 67КН5Б B7—29 % Ni; 4,8—5,2 % Nb, остальное Со)
в одинаковых условиях по своей коррозионной стойкости
близок к чистому кобальту. Сплав хорошо смачивается ртутью.
Его применяют для токоведущих упругих элементов,
контактных пружин, в частности для электромагнитных и ртутных
реле.
Сплав 55БТЮ E3—56 % Nb, 37—40 % Ті и 5—6 % AI)
предназначен для пружин ответственного назначения. Она
обладает высокой коррозионной стойкостью в ряде агрессивных
сред. Этот сплав по стойкости можно сравнить со сплавом
65БТ, коррозионная характеристика которого дана в группе
сверхпроводящих материалов.
Аустенитные деформационно твердеющие немагнитные
сплавы основаны на системах Со—Сг—Ni и Со—Ni—Or,
а именно: 40КХНМ, 40KXHMH(R), 40KXHMB, 45КХВН,
40КНХМВТЮ, 40КНХМ10ВТЮ и 40КНХМВТЮФ. Все сплавы,
за исключением 45КХВН, содержат примерно одинаковое
количество кобальта C9—41 %), никель колеблется от 15 до
20 %, хрома в них от 12 до 21 %, кроме того, все сплавы
дополнительно легированы малыми добавками МО, W, Ті и AI.
169
Сплав 45КХВН содержит 44—46% Со, 9—11-% Ni, 19—
21 % Сг и 16—18 % W. Сплавы этой подгруппы обладают
высокими коррозионными свойствами, но поскольку они содержат
в своем составе большое количество очень дефицитных
металлов— кобальта, никеля, вольфрама и молибдена, применять
их следует в особых случаях.
Сплавы с низким и постоянным модулем упругости (элинвары).
Сплавы 36НХ11 и ЭП297 относятся к деформациоцно-твер-
деющим металлам, имеющим в своем составе, помимо железа
и никеля, хром A0—12 %), что обеспечивает сплавам высокую
коррозионную стойкость в атмосферных условиях и в ряде
окислительных сред.
Остальные сплавы этой подгруппы, а именно: 42НХТЮ,
42НХТЮА, 44МХТЮ, 43НКТЮ и 43НХВТ, относятся к диспер-
сионно-твердеющим элинварам.
Эти сплавы — на железной основе и, кроме никеля,—
легированы отдельно или в комплексе небольшими добавками Сг,
Ті, AI, Со и W. По своей коррозионной стойкости все
перечисленные сплавы значительно уступают сплавам 36НХ1Г и
ЭП297, поэтому применять их следует в герметичных
емкостях.
Сплавы с высокими упругими свойствами применяют в
качестве пружин и пружинных элементов, упругочувствительных
элементов измерительных приборов, мембран расходомеров,
резонаторов фильтров для выбора генерирования и настройки
на заданную частоту.
Сверхпроводящие материалы
Это новый особый тип проводниковых сплавов, отличающихся
нулевым значением сопротивления в определенном диапазоне
температур, магнитных полей и плотностей тока.
В ЦНИИЧМ разработаны и производят следующие
сверхпроводящие сплавы: ЗОБТц, ЗОБТЮ, 35БТ, 50БТ, 65БТЮ, 70Б,
70БЮ, 60ТБ, 70ТМ, БТц и др. Сплавы изготовляют на основе
систем Nb—Ті и Ті—Mo.
Некоторые сплавы этой группы находят широкое
применение в медицинской технике [324].
Сплав 36НКТЮ используют для инъекционных игл.
Сплав 40КХНМ применяют для скобок сшивки
кровеносных сосудов, протезирования культи глазного яблока, для
костных хирургических операций в ортопедии — «гвозди» для
скрепления костей, протезы суставов, для „витых пружин,
применяемых при сращивании костей под давлением, для
кратковременной стимуляции сердца и др.
Сплав 40К27ХНМ с Та применяется для электродов при
длительной и постоянной стимуляции тканей и органов человека
(сердца, головного мозга, мочевого пузыря,
желудочно-кишечного тракта и др.).
170
Высокая коррозионная стойкость сплава 40К27ХНСМСТа
в организме человека по сравнению со сплавом 40КХНМ
обусловлена наличием тантала. Этот металл в чистом виде, а также
в сплавах должен найти широкое распространение в
медицинской технике.
Сплав 40ХНМЮ-ВИ применяется для общехирургических
скальпелей. Этот сплав обладает высокой износостойкостью и
повышенными коррозионными характеристиками. В статье
[252] приведены данные о влиянии новых методов выплавки на
качество металла и* показано, что металл вакуумно-индукцион-
ной выплавки (ВИ) по сравнению с открытой индукционной
(ОИ) обладает более высокой коррозионной стойкостью.
Коррозионная стойкость тугоплавких металлов подробно
описана в данной работе. Стойкость тугоплавких металлов
в азотной, серной, соляной и фосфорной кислотах (см. рис. 4)
зависит от концентрации и температуры.
По данным о стойкости чистых металлов можно дать
ориентировочную оценку коррозионной устойчивости сплава. Так,
например, в 10 %-ной кремнефтористоводородной кислоте при
температуре 70°С тугоплавкие металлы (V, Mo, Nb, Та, Ті), за
исключением W, являются нестойкими. Таким образом, все
сплавы на основе Nb—Ті и Ті—Mo в данной среде будут сильно
корродировать.
Ниобий, титан и молибден неустойчивы в галогенах.
Причем с хлором и фтором ниобий энергично вступает в реакцию,
а титан взаимодействует со взрывом.
Сплавы 65БТЮ и 50БТ устойчивы в азотной кислоте в
интервале всех концентраций A—65%) и при температуре до
190°С, в хлористом натрии (насыщенный раствор) при
температуре до 100 °С и в техническом иоде (твердая фаза) при
.температуре 115 °С металлы корродируют со скоростью
0,05 мм/год.
В слабых растворах соляной кислоты (концентрация
^5%) указанные сплавы также стойкие, однако с
увеличением концентрации и температуры скорость коррозии
возрастает.
Сплав 70ТМ имеет высокую коррозионную стойкость в
серной, фосфорной и соляной кислотах, а также в кипящих
растворах FeCb, но неустойчив в окислительных средах.
Сплав 35БТ устойчив в кипящей азотной кислоте и нестоек
в горячей соляной кислоте и других восстановительных
средах.
Сверхпроводящие сплавы могут быть использованы для
изготовления очень мощных малогабаритных магнитов и находят
применение в физике высоких энергий, в области криогенных
температур, в энергетике и других областях техники.
:* 17!
Термобиметаллы
Материал, состоящий из двух и более слоев металлов или
сплавов с различными коэффициентами теплового расширения,
сваренных между собой и по всей поверхности соприкосновения,
называют термобиметаллом.
Составляющую термобиметалла с большим температурным
коэффициентом линейного расширения (ТКЛР) принято
называть активным слоем, с минимальным ТКЛР — пассивным
слоем. Иногда между активным и пассивным слоями
располагается промежуточный слой с высокой
электропроводностью.
Для активной составляющей термобиметаллов применяют
сплавы 75ГНД, 20НГ, 19НХ, 24НХ, 27НМ, 28НХТЮ, Л62, Л90
и чистый никель марки НП-3.
Сплав 75ГНД A4—16% Ni; 9,5—11,0% Си; остальное Мп)
неустойчив во влажной атмосфере, морских условиях, в
окислительно-восстановительных и аммиачных средах.
Скорость коррозии сплавов 20НГ, 27НМ и 24НХ при
применении в аналогичных условиях меньше скорости коррозии
обычных низколегированных сталей, однако и для этих сплавов
необходима дополнительная защита.
Сплавы 19НХ A8—20% Ni; 10—12% Сг; остальное Fe) и
28НХТЮ B8—30 % Ni; 8—9 % Сг; остальное Fe) содержат
'много хрома. Поэтому они по сравнению со сплавами Fe—Ni
без хрома обладают повышенной стойкостью в атмосферных
условиях и окислительных средах. Латуни Л90 и Л62
относительно стойкие в щелочах, за исключением аммиачных
растворов. Латуни устойчивы в атмосферных условиях, в перегретом
до 300 °С паре, не корродируют в азоте, фтор для них слабо
агрессивен, хлориды действуют сильнее, бром и иод вызывают
сильную коррозию. В H2SO4 слабых концентраций при
температуре 20 °С латуни устойчивы, но с повышением
концентрации и температуры скорость коррозии увеличивается. В
азотной и соляной кислотах они корродируют сильно. Латунь Л90
устойчива в морских условиях. Латунь Л62 по сравнению
с Л90 более устойчива в сероводороде.
Для пассивной составляющей термобиметаллов применяют
в основном такие сплавы, как 36Н, 42Н, 46Н, 50Н и др. Все
перечисленные сплавы в обычной влажной атмосфере, в
морских условиях и других средах являются нестойкими, поэтому
применять их следует с защитой.
Сплав 45НХ, помимо железа и никеля, содержит 5,0—6,5 %
хрома. Сплавы 45НТЮ и 52НТЮ дополнительно легированы
2,2—2,6 % титана и 0,4—0,8 % алюминия.
Сплавы 45НХ, 45НТЮ и 52НТЮ устойчивы в атмосферных
условиях, в нейтральных слабощелочных и других средах.
Самыми уязвимыми местами всех термобиметаллов, изготов-
172
ленных из полос или ленты, являются ребра, и особенно сильно
будут корродировать те составляющие, которые имеют разные
основы. В таких случаях нужна надежная защита.
В термобиметаллах возможно возникновение коррозионного
разрушения от циклических нагрузок. Поскольку готовый
термобиметаллический элемент при измерении температуры
вследствие разности ТКЛР составляющих изгибается, то при этом
возникают внутренние напряжения. При охлаждении полосы
платина изгибается в противоположную сторону. Таким
образом, при наличии растягивающих усилий повторно-переменных
нагрузок, а также коррозионной среды на поверхности металла
возможно образование трещин. Этот вид коррозии наблюдают
на нагартованной латуни Л62 в аммиачной среде, а на сплавах
системы Fe—Сг—Ni — в хлоридах. Для защиты от коррозии
готового термобиметаллического элемента в зависимости от
условий работы применяют различные металлические и
лакокрасочные покрытия, а также покрытия эмалями и смазками.
Для защиты изделий, работающих в различных атмосферах
до температуры 90 °С, широкое распространение нашли
разнообразные лакокрасочные покрытия.
Для обычной влажной атмосферы применяют покрытия
цинком, а для работы в морской воде — покрытия кадмием.
Изделия, работающие при температуре >90°С, покрывают
кремнеорганическими эмалями, никелем, хромом, а также
применяют многослойные покрытия Ni + Cr или Cu + Ni + Cr.
В отдельных случаях для термобиметаллических элементов
можно применять металлизацию тугоплавкими металлами.
Термобиметаллы применяют в качестве чувствительных
элементов для измерения температуры окружающей среды, а
также определения изменения состояния процесса и параметров,
связанных с колебаниями температуры. Применяют их также
в качестве защитных элементов в предохранителях, тепловых и
защитных реле.
Термобиметаллы нашли широкое применение в
промышленных и бытовых приборах.
Аморфные сплавы
Аморфные сплавы — новый особый класс прецизионных
сплавов, отличающихся от кристаллических сплавов структурой и
способом изготовления. Структура аморфных сплавов подобна
замороженной жидкости. Аморфные сплавы иногда называют
металлическими стеклами.
Аморфизация идет при больших скоростях охлаждения.
Данные по коррозионной стойкости аморфных сплавов в
литературе отсутствуют.
173
Требуется накопление результатов испытаний, близких к
условиям эксплуатации. Причем испытания для накопления
сравнительных данных следует проводить параллельно на
аморфных и кристаллических образцах металла. При этом должно
быть учтено состояние подготовки поверхности и влияние
различных физико-механических факторов. Повышенная
гомогенность и отсутствие дефектов на поверхности пассивной* пленки
аморфного сплава способствуют повышению коррозионной
стойкости металла. Однако следует отметить, что коррозионная
стойкость аморфных, как и кристаллических, сплавов в
основном будет зависеть от химического состава. Поэтому
имеющиеся в литературе представления о влиянии легирующих
элементов на коррозионные свойства сплавов в кристаллическом
состоянии, по-видимому, могут быть распространены и на
аморфные сплавы.
Специфичность технологии позволяет изготовить аморфные
сплавы в виде лент толщиной менее 100 мкм и микропровода
с диаметром металлической жилы от 5 до нескольких десятков
микрометра.
Аморфные сплавы находятся в термодинамически
неравновесном состоянии и при нагреве приобретают кристаллическую
структуру. Поэтому для стабильной работы деталей и изделий
йеобходимо, чтобы их температура не превышала указанной
для каждого сплава максимальной- рабочей температуры.
По своим физическим свойствам и областям применения
аморфные сплавы могут быть разделены на те же группы, что
и кристаллические.
По данным справочника [324], наибольшее развитие
получили магнитно-мягкие аморфные сплавы. В этой же книге
приведены механические, физические и другие свойства аморфных
сплавов.
1. Магнитно-мягкие аморфные сплавы
В ЦНИИЧМ разработаны и изготовляются следующие
магнитно-мягкие аморфные сплавы: 45НПР-А, 44НМР-А, 85КСР-А
и 94ЖСР в виде ленты толщиной 20—40 мкм и шириной 1—
30 мм.
Сплав 94ЖСР-А. Аморфный сплав на основе железа может
быть рекомендован для применения в трансформаторах
мощности и генераторах.
2. Аморфные сплавы инварного класса
В этой группе представлены аморфные сплавы на основе
железа, такие как железо — бор, железо — фосфор — бор,
а именно: 86ЖХР-А, 93ЖХР-А, 96ЖР-А и др.
3. Резистивные аморфные,сплавы
В этой группе разработан аморфный сплав НМЮХС на
основе никеля.
174
ТАБЛИЦА 10
КОРРОЗИОННАЯ СТОЙКОСТЬ СТАЛЕЙ И СПЛАВОВ В РАЗЛИЧНЫХ
СРЕДАХ (ПО ДЕСЯТИБАЛЛЬНОЙ ШКАЛЕ)
Коррозионная среда
1
Адипиновая кислота:
20 %-тя
всех концентраций
Адский камень
Азотистая кислота:
5 %-ная
концентрированная
Азотная кислота
концентрацией, %:
1
1
5
5
5
5
10
10
10
10
10
10
Температура,
°С
2
100
180—190
20
20
20
80
20
60
85
^кип
20
40
50
75
85
чсип
Коррозионная стойкость сталей и сплавов, баллы
, 12X13
со
X
§
3
—
10
8
—
3
6 '
4
<6
<7
8
<5
5-6
5
6
7
8
, 08Х17Т,
Н2
XX
4
—
—
0
—
<3
<5
<з
5
<5
7
4
4
4
5
5
7
Т, 15X28
8
X
ю
5
5
—
09Г2С,
НД, 16Г2АФ
¦coU
и«
6 • щ
—
10
У
ю to
ЕЕ
XX
<М 00
«о
7
5
7
Н6М2Т
X
00
о
8
6
8
См. серебро азотнокислое
4
—
<2
5
<3
5
<5
5
<4
4
4
5
5
6
9
10
10
10
—
—
—
10
—
—
—
—
—
<з
3
<2
3
4
—
2
—
<4
<4
<4
<5
—
—
3
4
3
3
4
—
3
—
<4
<5
5
5
®2
*Ж
<5
5
<з
3
3
3
3
<з
<4
—
3
<4
<4
<5
5
5
т
со со
ЕЕ
5х
ОО
<5
5
<з
3
<з
3
3
<3
<4
—
3
4
5
5
5
ад
ЕЕ
XX
<О СО
ос?
5
>5
<3
3
—
—
—
—
5
Литературный
источник
12
[253]
[254]
[20]
[19]
[19, 30]
[254]
[19]
[19]
[30]
[19]
[30, 67]
152]
253
253
253
130
Продолжение табл. 10
1
Азотная кислота
концентрацией, %:
20
20
20
25
25
25
ЗО
ЗО"
ЗО
зо
ЗО, при р = 0,54 МПа
E,5 ат)
ЗО, при р= 1,27 МПа
37
37
40
40
40
40
50
Азотная кислота
концентрацией, %:
60
60 при р = 0,54 МПа
60
65
2
20
50
*кип
20
9CL
'кил
20
60
85
^кип
80
140
20
'кип
20
60
90
* ^КИП
20
50
80
чсип
60
50
85
*кип
20
3
5
5
9
5
8
9
5
8
9
—
10
6
9
6
7
8
9
6
7
8
9*
7
8
9
6
4
5
4
8*
5
7
8
4
5
7
8
—
5
8
5
6
7
8
6
6
7
8
7
7
8
• 5
5
4
4
7
4
6
7
4
5
6
7
—
5
7
5
5
6
7
5
5
6
7
5
6
7
5
6
10
—
—
10
10
10
10
10
—
10
7
<5
3
4—5
<5
4
5
Ґ
7—8
—
<5
*
<5
5
—
—
4
5
<5
<5
6
—
8
—
5—6
3
<5
5
—
5
—
8
-*-
5—6
—
<5
5
—
—
4
5
<5
7
—
9
3
4
5
3
<5
5
4
<5
5
5
7
5
3
4
<5
5
3
4
4—5
5
<5
<5
5
6
4
10
3
5
3
<5
5
<5
5
—
8
5—6
—
4
<5
5
3
4
4
5
<5
7
4
11
—
5
5
—
5
—
5
—
—
5
—
—
—
5—6
<5
—
9**
—
12
[ЗО, 67]
[ЗО, 67]
[ЗО, 49]
[253]
[253]
[130, 254]
[19, ЗО]
[19, ЗО]
119, ЗО)
[130]
[51]
[253]
[44]
Н27, 253]
[19]
[19]
[ЗО]
[127]
[ЗО, 67]
[ЗО, 67]
[254] .
[130]
[253]
[51]
[ЗО]
[19, 254]
[44, 67]
при
70 и окислы азота
р = 0,54 МПа
80
80 -
80
85
90
90
90
98, при р = 0,54 МПа
E,5 ат)
99
99
концентрированная,
плотность 1,52, дымящаяся
1—15 под давлением
20—70 под давлением
6,5 красная
16—20
6,5
16—20
Акролеин
Акриловая к:ислота:
водные растворы
всех концентраций
Акрилонитрил
Альдегид бензойный
Альдегид муравьиной
кислоты
50
60
85
^кип
20
30
65
^кип
85
20
80
'кил
0—40
20
190 (
190
20
20
120—150
120—150
20
160
20
7
9
10
_
8
10
10
8
10
10
8
10
10
5
5
10
10
—
<5
8
7
7
8
9
_
7
9
9
7
9
10
7
9
9
5
5
<ю
10
—
—
6
6
7
8
—
6
8
8
6
8
10
—
7
9
9
5
5
9
9
—
—
„
—
_
—
—
—
8
10
10
—
6
—
5
5
7
5
5
8
Ф
5
_
8
8
8—9
<10
5
5
—
4
<5
5
5
7
—
_
5
8
8—9
5
8
—
9
9
10
10
5
5
—
—
5
5
5
7
5
4
5
8
8
5
7—8
10
5
6—7
9
9
8—9
10
5
5
10
9
4
1
<5
<5
5
5
5
7
—
4
5
8
8—9
5
10
—
6-7
9—10
9
10
10
5
5
10
9
3
<5
<5
5
—
7—8
—
—
—
—
—
—
10
10
5
5
10
9
3
__
<5
<5
* Наблюдают коррозионное растрескивание.
** Сплав после отпуска при 650 °С, выдержка
См. бензальдегид
См. Формалин
2 ч, подвержен межкристаллитной коррозии.
Продолжение табл. 10
1
Альдегид уксусной кислоты
Алкилдиамин, жидкость,
пары
Ал кил пиридин (в процессе
производства), пары
Алкилсульфат (дистилляция
ал кил сульфатов) жидкость
Алкилсульфат (дистилляция
алкилсульфатов), пары
Алкилсульфат (кислото-
сульфатная реакция):
жидкость
пары
Алкилфенол (производство
алкилфенолов), пары
Алюминий расплавленный
Алюминий азотнокислый:
всех концентраций:
10 % -ный и 75 % -ный
насыщенный раствор
Алюминий сернокислый:
2 %-ный и 10 %-ный
насыщенный раствор
Алюминий солянокислый
50 %-ный
2
ПО
100
140
150
190
195
200
50
60
70
50
70
90
90
30—200
* 700
20
90
^кип
20
'кип
20
»кип
20
3
—
—
—
—
—
—
—
—
—
—
—
10
1
4
6
8
10
4
10
4
—
—
—
—
—
—
—
—
—
—
—
—
—
10
1
3
5
7
<9
—
10
„
5
—
—
—
—
—
—
—
—
—
—
10
1
3
5
6
—
—
—
6
7
8
См. ацетальдегид
- —
—
—
—
—
—
1—2
—
—
—
—
—
10
8
10
10
10
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
10
1
2
4
4
5
5
—
10
—
—
—
—
—
—
—
—
—
—
10
1
3
4
3
4
5
—
10
9
1
5
8
8
8
3
6
2
—
1
6
1
6
7
1
10
1
3
4
3
8
5
8—9
10
10
—
—
—
—
—
—
—
—
—
—
—
—
10
1
3
4
3
4
5
8
И
—
—
—
—
—
—
—
—
—
—
—
—
9
1
3
4
—
—
—
5
8
12
[49]
[49]
•
49J
49
49
49
49
49
49
49
49]
[49]
[49]
[49]
[49]
[127, 254]
[67, 127]
[19, 254].
[67, 254]
[253]
[253]
[253]
[67, 253]
[130]
Алюминий уксуснокислый
Алюминий фтористый (ТК)*
Алюминий хлористый (ТК),
50 % -ный
Алюмоаммиачные квасцы,
45 %-ный раствор
Амилацетат
Амил хлористый (ТК) (амил-
хлорид)
Аминобензойная кислота
(смесь изомеров)
Аммиак, водный раствор,
всех концентраций
Аммиак 25 %-ный
насыщенный ^—
Аммоний азотнокислый
10 %-ный и 75 %-ный
горяченасыщенный
раствор
расплавленный
Аммоний бромистый (ТК)
1—5 %-ный
До 43 %
Аммоний кислый
углекислый (двууглекислый)
Аммоний кремнефтористый
Аммоний надсернокислый
Аммоний нахлорнокислый
10 %-ный
Горяченасыщенный раствор
Аммоний роданистый, 200 г/л
Аммоний сернокислый,
насыщенный раствор
20
'кип
20
50
21
21
20
20
100
100
90
165
50
100
20
^кип
20
20
'кип
20
'кип
'кип
'кип
*кип
3
5
—
10
5
5
5
3
5
<7
3
6
_
10
_
4
10
—
7
10
10
2
5
3
5
9
10
4
—
2
5
<6
3
5—6
6
10
3
8—9
3
8-9
7
10
10
—
5
3
5
9
10
5
_
4
—
2
5
—
3
5—6
5
10.
3
—
3
—
—
—
—
5
10
—
5
—
—
_
—
7
9
10
_
—
9
10
—
—
—
8
10
5
6
—
_
—
4
3
5
<5
—
3
5
5
_
3
3
—
2
4
5
5
—
_
—
—
2
5
<5
—
3
5
5
2
3
3
2
5
9
8
4
3
3
4
3
5
<5
2
3
8
5
9
3
5
5
3
5
5
8
10
4
4
2
5
8
6
—
3
3
3
2
5
<5
2
3
5
6
8
2
5
4—5
3
4
5—8
8
4
3
2
4
-г
—
2
2
3
3
5
-2
3
—
8
3
5
5—7
4
* ТК — здесь и далее означает точечную коррозию.
Продолжение табл. 10
1
Аммоний сернистый всех
концентраций
Аммоний сернокислый всех
концентраций
Аммоний углекислый
(карбонат)
Аммоний фосфорнокислый
Аммоний фтористый (ТК)*
Аммоний хлористый
Аммоний хлорнокислый
Аммоний щавелевокислый
Ангидрид мышьяковистой
кислоты (водные растворы,
концентрация до 2 %)
Ангидрид уксусной кислоты
Ангидрид фосфорной
кислоты, сухой или влажный
Английская соль
Анилин (аминобензол) 3 %-
ный и насыщенный раствор
Анилин солянокислый (ТК)
Антихлор
Атмосфера:
промышленная (ТК)**
морская (ТК)
в сельской местности
тропиках
Ацетальдегид
2
20
20
*кип
20
^КИП
20
^кип
100
*кип
20
20
20
*кип
20
20
21
20
20
20
60
20
3
5
6
10
<4
6
7
10
10
—
5
9—10
—
7—8
9
<5
—
10
Civ
8
6
4
—
8
4
5
10
<4
5
7
9
10
—
4
8—9
—
5
8
<5
См.
и
10
5
5
8
<3
5
6
9
10
См
—
3
—
—
—
—
<5
магний
5
10
6
10
7—8
10
<6
8
—
—
10
7
—
—
—
5
—
—
8
—
6
—
—
4
—
—
. хлористый аммоний
—
—
—
—
—
—
<5
6
3
—
—
—
—
—
5
2
—
—
—
—
—
9
5
5
7—8
<4
5
5
8—9
6
3
5
<5
2
6—7
—
сернокислый (сульфат магния)
—
—
—
—
—
—
5
9
:. натрий серноватистокислый (гипосульфит нат
6
5
3
_1
<5
3
4
2
—
<5
—
—
—
—
2
2
— -
1
<5
1
1
—
1
—
2
2
1
2
<5
10
5
- 5
6
<з
5
4
8—7
5
5
2
—
<5
3
5—6
—
5
8
рия)
1
1
1
1
<5
11
—
—
—
—
—
—
5
—
—
—
<5
2
5
—
—
8
1
1
¦ 1
1
<5
12
[37]
[127]
[67, 253]
[19]
[127]
[254]
[164]
[37]
•
[254]
[254]
[173]
[37]
[29]
[29]
[44]
[164]
[159]
[25]
[67]
[25]
[254]
[37]
Ацетанилид
Ацетил ацетон
Ацетат алюминия
Ацетил целлюлозы, 20 %-
ный раствор в ацетоне
Ацетилен
концентрированный про^мышленно чистый
Ацетил хлористый (ТК)
Ацетон ****
Барий азотнокислый (нитрат
бария)
Барий сернистый
(насыщенный)
Барий сернокислый (сульфат
бария)
Барий углекислый (карбонат
бария
Барий хлористый (хлорид
бария) насыщенный (ТК)
Белильная известь
Бензальдегид
Бензил ацетат
Бензин
Бензойная кислота всех
концентраций
'кип
20
20
20
20
20
*кип
20
20
20
20
21
20
20
'кип
20
<5
—
<5
<5
<5
<5
—
—
5
<5
—
—
—
<5
<5
5
<5
<5
<5
<5
—
7
9
6
8
—
5
5
7—8
5
6
8
5
7
—
5
5
5—6
См. а.
—
5
—
5
5
5—6
ЛЮМИНИР
10
—
8
10
5
—
—
10
: уксусн
5
—
4—6
7
3
5
—
—
—
5—6
ОКИСЛЫ?
5
—
4—5
6
3
5
—
—
—
5
5
3
6
8
3
5
6
5
<5
<5
5—6
5
—
5
6
3
5
5
—
<5
<5
5
5***
5
6
3
5
5
—
—
—
5
См. известь хлорная
<5
5
3
5
3
5
<5
—
3
5
2
4
<5
3
5
1
3
7
—
10
10
—
—
1
5
2
—
—
2
<5
<5
3
5
1
2
<5
<5
3
5
1
2
<5
<5
3
5
* С течением времени горячие растворы приобретают кислую реакцию, при которой стали становятся коррозионно-нестойкими
металлами.
** Хромистые коррозионностойкие стали подвержены ТК, глубина поражения на стали 12X13 составляет 1—1,5, а на стали 08Х17Т
0,12—0,15 мм/год.
*** Стали с медью применять нельзя, так как мЪдь вступает в соединение с ацетиленом, образуется ацетиленовая медь, взрывающаяся
,_. при нагреве и ударе.
оо **** При высоких температурах не применяется.
Продолжение табл. 10
^Бензол
Бензосульфоновая кислота
всех концентраций
Бензотрихлорид
Бертолетова соль
Бикарбонат аммония или
калия
Бикарбонат натрия
Биоксалат калия
Бифторид аммония
концентрацией, %:
50 (в растворе)
50 (в паре)
80 (в растворе)
80 (в паре)
насыщенный на холоду
Бифторид калия
концентрацией, %:
50 (в растворе)
50 в (паре)
50 (в растворе)
50 (в паре)
90 (в растворе)
90 (в паре)
Бифторид калия* (расплав)
Бисульфат натрия или
калия
Борная кислота
разбавленная и концентрированная
Бор хлористый безводный
Бром (сухой)
20
*кип
50
80
20
50
50
90
90
20
50
*50
100
100
115
115
300
20
*кип
20
20
3
5—6
1
5—4
10
3
5
5
10
3
10
7
6
7
8
5
См. натрий или калий сернистокислый
См. калий хлорноватокислый
См. аммоний или калий углекислый
См. натрий кислый углекислый (питьевая сода)
См. калий кислый щавелевокислый
10
2
2
2
5
2
5
9
<5
8
10
10
<5
7
10
<4
5
10
8
10
10
—
—
5
—
—
<5
—
—
2
<5
5—6
10
2
<5
5
8
—
' 8
Бром в присутствии водяных
паров (ТК)
Бромистый метил
Бромистый этилен
Бромная вода: '
0,3 %-ная
1,0 %-ная
Бура 5 %-ная и
насыщенный раствор
Бутадиен-1,3 (дивинил)
Бутан
Бутилацетат
Бутил хлористый
Винил хлористый
Винная кислота
концентрацией, %:
1
5
10
15
20
25
40
50
20
20
100
20
'
20
20
кип
60
100
20
21
20
40
*кип
20
^кип
20
85
^кип
50
75
100
20
'кип
20
20
'кип
10
5
8
5
5
1
5
8
—
6
7
7
9
7
8
9
8
9
10
8
10
8
8
10
10
_
—
—
_
5
1
—
5
—
4
5
6
8
6
7
8
7
8
8
6
8
7
7
8
—
10
_
—
—
_
—
5
—
5
—
3
4
6
7
6
7
.8
—
6
7
6
7
6
6
7
—
10
_
10
—
_
—
10
—
7
7
7
8
—
—
—
—
—
—
—
—
—
10
_
—
—
_
—
<5
—
—
2
3
5
2
5
3
4
5
—
—
2
5
—
3
5
—
10
—
_
<4
_
—
5
—
2
3
4
2
5
2
3
5
3
4
5
2
5
2
2
5
—
10
5
8
5
7
10
5
1
5
5
5
5
2
3
5
2
5
3
4
5
—
—
3
5
3
3
5
10
10
5
Q
о
5
7
8
<5
1
»5
5
5
5
2
3
4
2
5
2
3
5
3
4
5
2
5
2
2
5
7
10
5
* 5
5—6
7
<5
1
5
5
—
—
—
2
3
5
—
—
—
2
5
* Высокой стойкостью в этих условиях обладает молибден, который корродирует со скоростью 0,01 мм/год. Никельмолибденовые
сплавы имеют удовлетворительную стойкость. Так, например, скорость коррозии сплава Н70МФ (ЭП496) составляет 0,51 мм/год. Никель
корродирует со скоростью 3,15 мм/год.
Продолжение табл. 10
1
Винная кислота,
насыщенный раствор
Виннокаменная кислота
Винный камень
Винный спирт
Витерит
Вода минеральная
проточная (ТК)
Вода морская (ТК)
Вода сточная, pH = 3, 4-5-4:
1900 мг/л (окисляемость),
1380 г/л неопределенных
углеводородов, 44 мг/л
летучих фенолов, 2962 мг/л
летучих кислот (в
пересчете на уксусную кисло-
Вода сточная: *\»
~~химического производства,
содержащая амины,
повышенное количество ионов
хлора, сульфата, сульфита
и других органических и
неорганических продуктов
(место сброса — прудона-
ко питель)
Вода шахтная (кислая, pH =
= 0,5)
Водород**
Газолин
2
'кип
48
20
80
40—50
15—30
20
60
100
20
3
10
4
4
8
—
10
5
8
5
5
4
10
—
4
7
—
10
5
7
5
4
5
9
6
_
7
8
См. винная кислота
9
8
См. калий кислый виннокислый
См. спирт этиловый
См. барий углекислый
—
2
—
—
10
5
—
—
4
8
8
9
10
' ""Ч
9^
10
10
—
—
—
—
—
—
—
—
5—6
г
—
—
—
3
—
7
. —
5
—
—
3
3*
6*
1
8
4
5—6
5
3
10
7
1
2
3
—
9
3
5
—
3
1
6
1
1
1
—
5
¦»
2
3
—
2
12
[127]
[118]
[23, 24]
—
•
[268]
[292]
*
[22]
[254]
[37]
[164]
Газы нитрозные с парами
воды и кислородом при р =
= 1,27 МПа
Галловая кислота:
5 % -ная
насыщенный раствор
Гарпиус
Гидроперекись ]
Гипосульфит
Гипохлорит натрия или
кальция
Гипс, насыщенный раствор
Глауберова соль
Гликоль
Глицерин
Горькая соль
Гуминовые кислоты
d-винная кислота:
водные растворы
концентрация до 58 %
Двуокись углерода
Двуокись хлора (водные
растворы)
Двухлористая ртуть
Дибутилфталат
Диметилкетон
Динитрохлорбензол
Диоксан
Дифтордихлорметан
Дихлорметан
140
70
100
20
20
20
100
20
20
100
20
'кип
20
21
20
20
9
4
5
4
5
4
5
\
8
4
5
7
3
5
8
4
5
6
3
5
3
[253]
См. канифоль
См. перекись (переоксид) водорода
См. натрий серноватистокислый
См. хлорноватистокислыи натрий или кальций
5
8
3
5
5
7
3
4
5
—
<5
<5
<5
См. натрий сернокислый водный
5
2
4
—
5
10
4
—
—
3
—
4
1
4
<5
3
1
3
<5
2
1
3
См. магний сернокислый
5
5
10
—
5
—
10
—
5
10
—
_
—
—
<5
5
5
—
_
—
4
<5
5
3
<5
5
3
<5
5
—
См. углекислый газ
10
—
1 <5
5
1
10
—
—
—.
—
—
—
См. ртуть хлорная (сулема)
—
—
<5
- і -
См. ацетон
10
—
См. фреон
—
—
—
—
—
—
6
10
<5
5
5
1
5
6
10
<5
5
5
1
5
5
8
<5 |
5
1
5
[254]
[37]
[37]
[37]
[37]
[37]
[37]
[37]
[29]
[37]
[37]
[37]
* После отпуска склонна к МКК и в напряженном состоянии подвержена растрескиванию.
** При температуре 500 °С металл становится хрупким.
Продолжение табл. 10
Дихлорметан при очистке
дизельных топлив
Дихлорэтан
Дихлорэтилен
Древесный спирт
Дубильная кислота
концентрацией, % :
1—10
10
10
50
насыщенный раствор
Дымящая серная кислота
Дубитель железный
(коагулянт железный)
Едкое кали концентрацией,
%:
25
50
50
68
расплав
Едкий натр концентрацией,
%:
10
20
20
20
20** при р = 29,4 МПа
30
40
20—40
100—120
20
80
'кип
20
кип
20
ї*КИП
120
300
90
50
90
'кип
400
10
5
9—10
10
См. спирт метиловый
См. олеум
См. железо сернокислое (окисное)
10
5
8
8
8
6
8
5
5
6
7
5
7
5
5
5
6
5
6
—
—
—
—
—
—
—
—
5
5
5
5
—
5
5
5
5
5
5
5
5
5
6
5
5
5
5
5
5
5
5
5
5
5
5
кип
90
4
2
7
7
10
5
4
6
8
—
6
4
2
7
7
10
5
4
5
5
—
—
6
4
2
6
6
10
—
—
—
—
—
6
—
—
8
10
—
—
—
9
—
—
3
2
5
5
10
5
4
5
5
6
—
3
2
5
5
10
4
3
4
5
5
—
4
2
7
5
10
5
4
5
5
8
6
5
3
2
6
5
10
4
3
4
5
8
5
5
3
2
5
5
10
5
—
50
50
60
70 -
78
90
расплав
Жавельная вода
Желатина
Железо азотнокислое всех
концентраций
Железо сернокислое (закис-
ное):
10 %-ное
насыщенный раствор
Железо сернокислое (окис-
ное):
10 %-ное
насыщенный раствор
Железо хлористое (ТК),
10 %-ное
Железо хлорное (ТК):
1 % -ное
5—75 % -ное
100
90
100
120
90
120
160
90
1201
300
318
20
20
20
'кип
'кип
20
70
20
20
60
8
8
8
8
9
10
2
6
8
7
—
9
10
2
6
—
—
7
—
—
9
10
2
—
8
—
—
—
—
—
10
6
5
6
5
9
5
5
—
9
5
5
5
—
—
5
—
8
5
—
5
—
9
7
5
6
6
8
5
6
9
5
9
7
8
10
5
5
5
5
8
5
8
5
—
5
8
fo
—
:—
—
—
7
10
См. калий хлорноватистокислый
<5
3
5
3
8
7
8
9
10
_
10
<5
2
5
3
6
7
5
6
9
10
6
10
<5
2
5
3
6
7
5
5
8
10
6
9
—
10
—
10
10
10
10
7
10
10
10
10
10
10
<5
2
5
3
6
7
5
5
8
10
6
10
10
—
з
5
3
5
5
5
5
8
9
_
8
10
—
2
5
3
5
5
5
5
6
8
9
* В паровой фазе на поверхности стали наблюдается точечная коррозия.
** Стали склонны к растрескиванию.
Продолжение табл. 10
Желтая кровяная соль (же-
лезистосинеродистый)
Известь хлорная:
15 % -ная
сухая
влажная
насыщенный раствор
Известь хлорная —
активный хлор, г/л:
2,5
4—8
10
50—200
Иод (ТК):
влажный
сухой
газообразный*
Йодоформ (ТК):
кр иста л л ически й
пар
Кадмий, расплав
Калий азотнокислый:
всех концентраций
расплав
Калий бромистый
(ТК), 1-Ю %-ный
Калий двухромовокислый
(бихромат калия):
20 % -ный
25 % -ный
Калий двууглекислый:
20
20
40
20
20
40
20
кип
35
20
20
200
21
50
,400
кип
550
15
50
90
10
10
5
4
8
10
<3
5
6
9
10
ПО
5
<3
5
10
10
5
10
10
<б
<5
<3
5
5
6
5
6
8
<8
<5
6
4
5
8
4
5
3
5
ю
<3
5
5
6
5
б
7
5
5
5
5
<6
<5
6
4
5
7
4
5
3
5
15 % -ный
Калий железистосинероди-
стый
Калий железосинеродистыи
Калий йодистый, водный
раствор
Калий кислый виннокислый
(насыщенный раствор при
100 °С)
Калийдсислый сернокислый,
2—15 % -ный^
Калий кислый
щавелевокислый
Калий кремнекислый
Калий марганцевокислый
всех концентраций
Калий надсернокислый
Калий роданистый
Водные растворы до 68 %
Калий сернистый (растворы)
Калий серноватокислый
концентрированный
Калий сернокислый всех
концентраций
Калий углекислый (ТК):
50 % -ный
расплав
Калий углекислый, 40%-
ный раствор, насыщенный
СО2
Калий углекислый, 40%-
ный раствор, насыщенный
97%
60
20
'кип
20
90
20
^кип
20П
105
20
20
*кип
кип
900
109
109
5 | - | 5 | 5 I 5 I
См. желтая кровяная соль
[127]
8
10
10
8
10
5
10
5
4
8
7
9
10
7
10
3
5
—
4
7
См. і
6
8
10
7
?
3
—
—
3
6
красная
—
10
—
—
—
—
8
5
8
кровяная соль
—
—
—
—
—
—
—
—
5
2
4
—
4
5
—
—
—
-
5
3
5
7—8
6
9
3
5
5
3
5
2
5
7—8
5
8
3
5
6
2
5
3
.
7—8
7
5
2
5
См. персульфат калия
10
10
—
<8
7
10
10
9
10
9
—
<7
5
10
—
—
—
8
—
—
5
10
—
—
10
10
—
—
—
—
—
—
5
—
—
10
—
—
—
4
—
—
10
—
—
10
5
7
<5
4
10
6
5
6
4
—
<5
3
8
—
—
7
3
—
<5
3
—
—
*— * В этих условиях тантал, ниобий, молибден — стойкие; цинк, медь, свинец — нестойкие.
Продолжение табл. 10
1
Калий уксуснокислый рас-
ллавленный
Калий хлористый (ТК):
насыщенный раствор
расплав
Калий цианистый, водные
растворы, концентрация до
49 %
^? /0
Калий щавелевокислый:
1 %-ный
концентрированный
раствор
Кальций азотнокислый:
насыщенный
расплав
Кальций кислый сернисто-
кислый (бисульфит кальция):
водный раствор при р =
= 1,96 МПа
Кальций кислый
сернокислый (бисульфат) 5 % -ный
То же, при р = 1,96 МПа
Кальций сернокислый
Кальций хлористый (ТК):
5 % -ный
10—20 % -ный
сухой кристаллический
влажный кристаллический
насыщенный раствор
2
292
20
*кип
860
20
^кип
20
20
?кип
100
148
^КиП
, 200
^кип
200
20
. 20—50
20
20
20
^кип
3
7
10
—
4
7
3
5
10
—
—
5
10
6
7
5
8
7
• 9
4
5
8
—
3
2
2
4
9
5
—
1
5
9
5
6
5
7
6
8
5
—
—
—
3
2
2
—
—
5
—
—
5
—
5
6
—
—
—
—
6
10
10
—
5
10
5
—
10
—
—
См
—
—
—
—
10
7
—
—
—
—
—
4
5
гипс
—
5
—
—
—
8
5
—
—
—
—
1
1
3
5
—
5
—
—
5
6
9
5
5
6—7
8
3
7
2
3
5
4
—
2
3—5
4
8
4
5
5
7
5
7
10
5
" 5
6
—
3
7
2
3
5
4
5
1
1
3
5
4
5 "
5
6—7
5
6
п
5
—
—
8
3
5
2
—
—
3
5
1
—
—
—
—,
—
—
—
—
5
12
[19]
[127]
[127]
[48]
[37]
[37]
[127]
[173]
[173]
[127]
[19]
[19, 127]
[44, 127]
[253]
[253]
[127]
[127]
[67]
[67]
[127]
[67, 253]
Кальций хлорноватистокис-
лый, % :
<2
>2
18—20
2—6
Каломель
Камфора
Канифоль расплав
Канифоль *:
в ампулах
в колбах
Каприловая кислота**:
100 % -ная
100 %-ная под давлением
Каприновая кислота:
100 % -ная
100 % -ная под давлением
Капроновая кислота:
100 % -ная
100 % -ная под давлением
Карбамид
Карболовая кислота (до
100 %)
20
20
30
100
20
180
200
200
160
220
260
100
160
220
260
100
160
220
20
5
10
—
3
—
—
10
6
—
—
6
10
—
—
6
8
—
4
6
5
10
—
2
5
—
—
—
—
6
10
_
—
—
7
8
3
5
—
—
—
—'
См. ртут
2
—
—
—
—
—
10
_
—
—
—
—
3
—
—
10
8
—
—
—
—
—
9
—
10
—
—
ь хлорш
2
5
—
—
6
8
—
5
7
8
5
7
8
См. мочевина
3
5
—
—
:тая
1
—
—
4
5
5
—
5
5
7
4
5
6
5
10
—
2
5
5
5
4
5
6
7
5
8
5
7
8
5
5
7
3
5
6
1
5
-*
4
5
5
4
5
5
5
4
5
6
2
5
А
4
5
—
_
5
5
4
5
5
5
5
5
2
5
* Алюминий корродирует в ампулах со скоростью 1,07, в колбах 0,01 мм/год. Разницу в скоростях коррозии в закрытой системе
(ампула) и открытой (колба), по-видимому, можно объяснить тем, что процесс декарбоксилирования канифоли, снижающий ее
кислотность, более интенсивно проходит в колбах, чем в ампулах.
** При наличии в кислотах хлоридов коррозия металла возрастает. Молибден в сталях повышает их коррозионную стойкость.
Продолжение табл. 10
Карналлит (ТК)
насыщенный
Каустическая сода
Каустический поташ
Квасцы алюминиевокалие-
вые концентрацией, % :
2,5
5,5
10
насыщенный раствор
Квасцы аммиачные (горяче-
насыщенный раствор)
Квасцы хромовые, 6 % :
17 % -ный раствор,
насыщенный при 20 °С
40 % -ный горяченасыщен-
ный раствор
Керосин
Керосинбензол (отгонка
бензола)
Керосинбензол и олеум
(реакция сульфированная
олеумом)
Керосинбензол
(сульфирование смесью)
Керосинбензол и
сульфокислота (выделение чистых суль-
90
К2И0
90
^кип
20
20
20
кип
20
20
'*¦
См. едкий натр
См. едкое кали
Ю
7
9
6
7
10
6
10
10
4
7
8
6
9
<5
—
•—
7
8
6
7
8
6
10
10
3
б
7
6
8
<5
—
—
б
7
6
6
7
6
10
10
2
6
6
5
7
<5
—
—
10
—
—
—
—
8
—
—
—
—
4
5
3
4
5
—
—
—
5
3
—
—
—
—
—
3
5
2
3
5
—
—
—
2
4
5
4
—
—
—
—
—
5
6
3
5
6
3
8
9
2
5
5
3
7
<5
5
6
5
8
3
5
2
3
5
3
—
8
—
3
5
4
8
<5
5
—
5
8
6
—
5
6
—
—
—
5
<5
—
—
—
—
фо кислот после
сульфирования)
Ксилород О2*^
Кислота антраниловая
Красная кровяная ^соль
25 %-ная
Крезол (смесь изомеров)
Кремнефтористоводородн ая
кислота концентрацией, % :
1—2
8—10
1 всех концентраций
пары
Креозот
Креозот + 3 %
^/Кротоновый альдегид
Ксилол
КумоіЛ (изопропилбензол)
Купорос железный
Лаки
Левулиновая кислота
Лизол, растворы
Лимонная кислота
концентрацией, % :
1
Лимонная кислота
концентрацией, % :
5 (р = 0,29 МПа)
5—10
25
100
20
60
60
20
100
20
Горячий
20
20
20
100
20
140
50
5 — —
См. аминобензойная кислота
<5
<5
См. железо сернокислое (закисное)
<5
—
—
7
10
10
10
10
4
9
3
<5
—
8
10
10
10
8
3
7—8
3
5
—
—
8
8
8
10
7
3
3
5
—
—
—
—
10
—
5
5
10
—
—
—
8
10
—
3
3
5
—
—
—
3
5
—
3
5
5
8
8
10
7
3
5
5
3
5
5
<5
2
5
5
4
8
* 8
5—6
3
5
4
3
5
5
<5
5
4
7
7
3
4
3
5
5
<5
<5
6
1
5
8
7
9
7
<5
5
1
5
7
7
6
8
7
<5
5
5
6
6
7
6
10
8
10
10
10
—
5^6
5
4
6
4
—
5
5
3
5
3
<5
5
1
3
6
7
4
6
4
<5
5
1
2
5
5
3
5
3
<5
5
1
—
—
* Хромистые и хромоникелевые стали стойки до 900, углеродистые стали до 600, медь до 250 °С.
Продолжение табл. 10
1
Лимонная кислота
концентрацией, %:
:і 25
50
насыщенная, при 100 °С
6? % -ная
Литий хлористый (ТК)
10 %-ный
Литий хлористый*
(процесе сушки)
Ляпис
Магний сернокислый:
10 %-ный
насыщенный
Магний углекислый
(влажная масса)
Магний хлористый влажный
кристаллический (ТК):
2,5 %-ный
10 % -ный
Магний хлористый]
влажный кристаллический (ТК):
30 % -ный
42 %-ный.
2
50
85
'кип
20
50
^кип
21
tKnn
150—200
20
tKnn
20
20
20
t
20
tKnn
135
153
3
8
9
10
8
9
10
10
10
—
8
7
9
5
•
5
7
9
7
9
¦
4
8
9
10
7
8
10
10
8
—
7
5
7
5
4
6
8
5
7
5
7
8
9
5
8
10
—
8
—
6
і
5
—
5
3
5
7
—
—
6
—
—
—
—
—
—
8
10
—
7
5
6
8
3
5
5
—
—
—
5
8
4
5
7
2
4
5
—
—
—
5
9
5
6
8
3
5
8
10
3
5
6
Zu. серебро азотнокислое
—
—
10
—
10
—
—
—
3
—
—
3
4
5
—
—
3
—
3
5
—
—
3
5
5
3
4
5
5
5
5—6
2—5**
10
4
. 5
7
2
4
5
6
2
5
6
3
5
5
2
3
5
*
4
5
7—
17**
11
—
2
—
5
2
5
2
—
—
—
100**
12
253]
253
253
253
253
253
253
[159]
[130]
[205]
[127]
[19]
[19]
[19]
[127] .
[67]
[67]
[67]
[152]
[96, 129]
' Малеиновая кислота:
1 %-ная
50 %-ная
Марганец сернокислый всех
концентраций
Масло льняное (горячее)
Марганец хлористый (ТК):
10 %-ный
50 % -ный
Масляная кислота всех
концентраций
Медь азотнокислая всех
концентраций
Медь мышьяковистая всех
концентраций
Медь сернокислая всех
концентраций
Насыщенный раствор при
100 °С
Медь углекислая
Медь уксуснокислая,
насыщенный раствор
Медь хлорная:
1 (ТК
1
1
5
8
(ТК
(ТК
(ТК)
(ТК)
20
100
20
20
'Ж
'"Я"
'К2И0
*кип
20
20
20
20
20
60
75
20
20
5
10 v
3
1
7
10
8
10
3
7
3
5
5
3
5
7
3
3
5
—
4
3
—
3
5
10
7
10
2
б
3
5
5
3
5
6
3
2
4
_
—
4
—
3
—
—
5
—
2
6
3
5
5
2
4
5
2
1
3
—
10
10
—
—
8
8
10
10
10
—
10
—
5
10
_
10
10
3
—
5
3
5
—
5
б
5
—
3
3
2
—
3
8
9
4
5
—
5
3
5
—
5
5
—
5
—
2
2—3
2
—
—
2
8
8
3
4
U
3
5
3
2
5
3
5
2
7
2
5
5
1
3
3
2
1
3
3
8
9
4
5
3
5 V
3
5
3 —
2
5
1
2
2-3
2
1
3
2
8
8
3
4
* Все коррозионностойкие стали и сплавы подвержены точечной коррозии, глубина поражений на хромистых сталях составляет 0,2,
на хромоникелевьк 0,1 мм/год. У всех аустенитных сталей и сплавов после испытания в местах клеймения и вокруг отверстий
поверхность покрыта чёткой трещин. У сталей феррихного и аустенитно-ферритного классов коррозионного растрескивания не наблюдали.
Высокой коррозионной стойкостью в процессе сушки хлористого лития обладают сплав ХН65МВ @Х15Н65М16В, ЭП567) и титан
^ ВТ1, скорость коррозии которых составляет 0,001 мм/год.
со ** Время до полного растрескивания сплава в часах.
Продолжение табл. 10
1
всех концентраций
Медь цианистая,
насыщенный раствор
Me л амин:
40 г/л, pH = 10—12
1,5—2,0 г/л
Метакриловая кислота,
98 %-ная
Метилбензол
Метамин 40 %-ный
Метанол
Метилфенол
Мети лэтил кетон
Минеральное масло
Молочная кислота
концентрацией, %:
1
1
1
5
5
5
5
5
10
10
Ю
10
10
10
25
25
2
'кип
20
^кип
90—95
20—30
30
160,5
95
*кип
50
20
50
*кип
20
50
80
90
*кип
20
50
75
90
100
чкип
20
50
3
10
5
—
—
—
5
8
—
5
5
6
7
7
8
9
10
10
10
8
9
ю'
10
10
10
9
4
10
4
5
—
—,
4
8
—
—
5
6
7
7
7
8
10
10
10
7
8
9
9
10
10
8
9
5
10
4
5
—
—
—
—
—"
См.
—
5
5
5
—
6
8
10
10
10
6
7
8
9
10
10
7
8
6
10
—
—
—
—
7
10
См.
—
7
10
—
—
3
3
—
—
8
—
—
3
3
—
—
толуол
5
—
9
8
3
5
—
2
5
—
спирт метиловый древесный
См. крезол
—
—
8
—
—
—
—
—
—
—
9
—
—
—
—
—
—
—
—
3
—
—
—
4
—
5
3
—
5
—
6
—
4
—
—
2
3
4
—
3
4
5
2
—
4
4
5
6
—
3
5
<5
о
4
6
з
4
5
6
7
3
4
5
6
7
7—8
3
5
ю
8
2
4
—
—
! 4
-
5
<5
2
3
4
2
3
4
4
5
2
3
4
4
5
5—6
2
3
и
_
3
—
—
—
2
-
5
<5
2
3
4
—
—,
—
4
2
3
4
• —
5
—
3
12
[253]
[67]
[19]
[49, 73]
[49]
[56]
[56]
J253]
[37]
[67]
[254]
[44]
[254]
[19]
[254]
[19]
[254]
[67, 254]
[67, 127].
[19]
[254]
[254]
[254]
[127]
[19]
[254]
25
40
50 4
50
50
50
50
50
75 *
75
75
75
концентрированная
I
Мочевина концентрацией,
/о •
55—65
60 и 92
Монохлоруксусная кислота
Муравьиная кислота
концентрацией, %:
0,5
1
1
1
1
2
2
2
2
5
5
5
90
90
20
50
80
90
100
f
20
50
75
100
20
80
100
кип
20
ПО
20
70
20
40
60
f й
20
40
60
100
20
40
60
10
10
9
10
10
10
10
10
—
z
9
9
10
10
10
1
io
7
8
9
10
8
9
9
10
9
9
-9
9
10
8
9
10
10
10
10
—
—
8
9
9
10
10
1
10
_
6
7
8
10
7
8
8
9
8
8
8
а
9
7
8
10
10
10
10
—
—
7
8
8
9
9—10
1
10
6
6
8
9
6
7
8
9
7
8
8
10
10
10
—¦
—
—
—
—
—
—
1
10
10
10
10
10
—
10
10
10
7
3
4
7
—
3
—
3
—
5
2
3
4
5
2
3
4
4
3
—
5
2
3
4
5
6
—
z
2
:
—
2
4
2
2
3
4
2
3
3
4
2
3
4
8
8
3
5
6
7
7
8
3
5
z
3
7
8
9
10
1
10
2
3
5
6
2
3
4
5
3
—
4
5
2
3
4
5
2
4
0
Л
2
6
7
8
1
10
4
2
2
3
4
2
3
4
5
2
4
5
4
2
. 3
3
_
—
2
3
3
4
5
1
—
2
3
3
—
Продолжение табл. 10
1
Муравьиная кислота
концентрацией, %:
5
5
5
10
10
10
10
10
20 *
25
25
25
30
40
50
50
50
50
50 (под давлением)
60
80
80
80 (под давлением)
90
90
90
"ТОО—
100
100
2
80
100
/кип
20
40
60
100
'кип
'кип
90
'кип
'кип
20
50
80
/кип
140
/кип
20
'кип
140
) 20
40
60
80
20
60
'кип
3
10
10
10
8
9
10
10
10
10
8
10
10
—
10
9
9
10
10
—
—
8
10
6
8
9
10
8
9
Ю
4
9
9
10
7
8
9
9
10
10
8
9
10
10
9
9
9
10
—
—
7
10
5
6
9
10
6
7
10
5
9
9
6
8
8
9
9
9
10
9
8
9
9
10
—
6
10
5
6
9
6
6
8
6
-
—
—
—
—
—
- —
—
10
—
—
—
—
—
—
—
—
7
5
3
4
5
6
8
8
3
8
9
9
3
9
10
8
2
9
10
3
5
8
8
4
_^_
5
2
3
3
4
5
6
2
5
6
8
8
2
8
8
8
2
8
8
2
3
—
2
4
6
9
6
7
5
6
8
8
9
10
3
6
9
10
10
3
6
8
8
10
10
5
8
10
5
6
8
~~~ —
3
5
8
10
5
-
2
3
3
4
5
5
1
4
5
8
8
2
5
6
7
8
8
2
7
8
3
4
5
6 s-
2
4"
6"
11
.
.
2
5
5
2
2
6
6
6
7
6
6
7
2
5
2
5
12
[254]
[17, 127]
[127, 253]
[19, 127]
144]]
[19]
[17, 130]
[130]
[130, 127]
[lfr, 127]
[44, 254]
[127]
[127, 130]
[127, 130]
[67, 127]
[19]
[44]
[127, 130]
ИЗО]
[130]
[44, 130]
[19]
[130] •
[127, 67]
[19]
[19]
[253]
[253]
[253]
[44, 254]
Мыло
Мышьяковая кислота
(водный раствор)
Натрий азотнокислый всех
концентраций
расплав
Натрий азотнокислый
горя ченасыщённый, раствор
Натрий ^борнокислый
Натрий бромистый (ТК):
10 %-ный
^20 %-ный
Натря,й двууглекислый
Натрий кислый сернистокис-
лый 5—40 %-ный
Натрий кислый сернокислый
концентрацией, %:
2
5
5
10
10
10
15
Натрий кремнекислый
насыщенный
Натрий лимоннокислый
3,5 %-ный
Натрий силициловокислый
насыщенный
Натрий сернокислый:
25 %-ный
5—50 %-ный
Натрий серноватистокислый,
25 %-ный водный раствор
Натрий сернокислый вод-
2 ный всех концентраций
20
65
360
*кип
20
20
80
60
20
85
20
85
20
50
^кип
85
20
20
20
Асип
20
5
—
1
1
—
1
5
—
7
7
8
8
9
10
10
3
5
5
5
5
5
8
7
5
1
1
1
1
1
_
—
5
—
7
6
8
7
8
10
10
2
5
4
4
5
5
2
6
5
1
1
1
1
1
_
—
5
—
—
—
2
5
3
3
4
5
2
5
10
—
5
5
—
10
—
10
—
—
—
—
—
—
10
—
8
8
10
10
4
1
1
1
1
__
—
5
5
—
—
5
—
2
6
—
—
—
5
3
1
1
1
1
_
—
5
5
5
4
5
4
—
6
6
2
—
—
—
—
5
4
1
1
1
1
1
3
5
5
6
6
—
7
6
7
8
8
2
5
3
3
5
5
2
5
3
1
—
1
1
1
2
5
6
5
—
5
4
—
6
6
2
5
3
3
5
5
2
5
5
1
—
—
2
4
—
—
3
—
—
—
Продолжение табл. 10
1
Натрий углекислый:
растворы
расплав
Натрий уксуснокислый на-
РМТТТ РН МЫ Й
ідо ідея лізі и
Натрий фосфорнокислый
всех концентраций
Натрий фтористый:
5 %-ный (ТК)
расплав
Натрий хлористый (ТК):
3 %-ный
20 %-ный
20 %-ный
насыщенный
»
Натрий хлор но кислый
10 %-ный
Нафтеновые кислоты *
Нашатырь
Нефтяной эфир
Никель азотнокислый 5—
10 %-ный
Никель сернокислый
насыщенный
Никель хлористый (ТК),
водный раствор
Нитрат железа
Нитробензол
2
*кип
900
*кип
*кип
20
800
20
20
^КиП
20
^кип
*кип
130—150
180—200
250—280
330—350
20
20
*кип
20
21
3
5
10
5
5
8
—
7
8
8
10
7
7
10
10
5
5
—
—
4
5
10
4
5
7
—
6
7
8
7
8
—
5
5
6
—
5
5
10
4
5
7
—
5
6
7
—
—
5
5
5
—
6
9
10
10
10
9
10
10
10
—
—
7
10
4
—
5
5
—
3
9
5
10 Ю
3 j 5
5
5
— :, —
—
4
—
—
4
—
—
9
5
5
5
6
7
5
2
2
6
10
См. аммоний хлористый
9
10
10
( 7
—
—
5
5
5
5
10
5
10
3
5
7
—
4
5
5
6
6
4
2
2
4
8
5
5
5
4
См. железо азотнокислое
—
Г з
і / з ;
її
—
—
—
5
6
—
—
—
— ,
5
5
4
—
—
—
—
5
5
4
3
—
12
[127]
[127, 253]
[19, 254]
[67, 254]
[127]
[254]
[254]
[19]
[127]
#[67]
[19, 67]
[19, 254]
[10]
[101
НО]
НО]
[67]
[191 .
[19]
[19, 37]
| [37, 159]
Нитробензол [ каталитичес-
ское восстановление нитро-
хлорбензола в хлорамин при
давлении водорода 1,96 МПа
и содержании в зоне катали
затора ионов хлора 3 %
(мол.)]
Озон (при получении)
Оксипропионовая кислота
О
Олеиновая кислота
Олифа
Олово аммонийнохлористое,
насыщенный раствор
Олово металлическое,
расплав
Олово хлористое (ТК):
5 %-ное
насыщенный раствор
100
150
200
300
20
20
60
300
400
500
600
20
20
Олово хлорное (ТК):
5_24 %-ное
24 %-ное
Оксид бария, насыщенный
раствор
Оксид углерода
газообразный
Осветительный газ
180
20
760
870
20
5
5
9
5
См. молочная кислота
8**
8
6
5
8
9
10
<5
9
10
8—10
—
—
—
10
10
10
10
5
5
—
5
5
7
10
9
<5
8
10
—
—
—
—
10
10
10
10
5
5
5
5
5
6
9
8
<5
—
—
—
—
10
10
5
5
5
5
8
—
—
10
10
—
—
—
10
—
—
10
10
—
—
—
5
5
5
—
—
10
—
—
—
5
5
5
—
—
10
_
—
—
—
5
5
6
7
<5
3
10
5
7—8
9—6
10
6
7
10
7—8
10
5
5
5
5
5
5
5
6
<5
2
10
5
7—8
9
10
6
6—7
10
7—8
10
5
5
5
5
5
5
6
2
10
—
—
5
—
* Скорость коррозии металлов в жидкой и паровой фазах почти одинакова. Титан в этих условиях устойчив. Скорость коррозии при
330—340 °С составляет 0,03 мм/год.
** Межкристаллитная коррозия (мкк).
1
Пальмитиновая кислота
Пар водяной насыщенный с
10—12% СО и 5—6 % H2S
при р = 2,47 МПа
Парафин
Пары воды
Пары H2SO4
Пары H2SO4, HNO3
Пары SO2, NH3 (влажный)
Пары SO2 (влажный)
Пары H2SO4, SO2
Пары H2SO4, SO2, NH3
Пары кремнефтористого во-
ттл г\ґ\ Тї СІ
Пары фтористого водорода
(пары плавиковой кислоты)
Пары хлористогр водорода
Перекись бария A0 %-ный
раствор)
Перекись водорода 20 % -ная*
Перекись натрия 10 % -ная**
Перманганат калия
Персульфат аммония
Перхлорат аммония
Персульфат калия 5 % -ный
Перфторалкан жидкий
Перхлорат натрия
Пикриновая кислота 10 %-
ная
2
185
150
100
300
55
55
55
55
55
55
100
100
20
100
500
95
20
Q0
100
40
0
20
^кип
3
5
5
7
6
4
4
6
6
4
—
—
—
—
9
3
1П
7
—
__
5
10
4
10
5
5
6
6
4
4
6
5
4
—
—
z
—
—
3
8
1 6
—
—
5
10
5
__
—
5
5
6
4
4
6
5
4
—
—
—
—
—
3
й
о
5
См
См
См.
—
—
См
5
—
6
—
—
—
8
6
6
8
7
5
—
—
—
5
10
1П
і и
10
7
~5
—
5
3
3
4
4
3
—
—
5
5
5
8
5
5
—
—
4
3
2
3
4
2
—
—
—
—
—
2
5
9
8
5
5
5
4
3
3
4
4
2
6
7
6
7
9
5
3
7
5
. калий марганцевокислый
аммоний надсернокислый
аммоний надхлорнокислый
—
—
5
—
5
—
—
—
натрий надхлорнокислый
10
10
—
—
—
—
5
5
Продолжение табл
10
5
5
5
—
2
2
2
3
3
2
—
—
z
—
5
3
7
5
И
—
5
5
—
—
—
—
—
—
—
—
—
—
5
3
. W
12
[253]
[253]
[67]
[67]
300]
300
300
300
300
300
W4]
[44]
[49
44]
44]
44]
1071
[127]
[1971
L u/ j
[253] .
—
4
—
—
[127]
[49]
5
5
5
5
[67]
[67]
Пирогалловая кислота:
10 %-ная
всех концентраций
Пиридин
Поташ
Виноделие
Виноградное сусло, pH =
= 2,4 + 3,5
Сусло бродящее
Виноградные вина, pH =
= 2,8 + 3,8:
херес
десертное
портвейн
рислинг
кагор
красное полусухое
цинандали, pH = 3,1 +
+ 3,4
Виноградный сок (вакуум)
Виноградный уксус
Водка особая
Водка 40 %^ная
20
^КИЕ
21
25
25
25
25
25
2S
25
25
25
14
^кип
20
20
20
2
5
—
2
5
—
2
5
—
7
7
—
—
1
5
5
1
5
5
1
5
—
См. калий углекислый
Пищевые вещества
—
—
—
—
9
—
—
1
1
1
1
1
1
1
1
1
2
2
8
1
1
—
—
—
—
—
—
—
6
6
3
7
7
8
—
6
9
—
6
6
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
1
1
1
1
1
1
1
3
2
5
1
1
—
—
—
—
—
—
—
—
2
5
1
1
—
—
—
—
—
—
—
—
—
—
—
—
—
* Углеродистые, низколегированные стали и сплавы и следы ржавчины на металле вызывают каталитическое разложение
перекиси водорода.
** Многие органические вещества при соприкосновении с перекисью (пероксидом) натрия воспламеняются.
Продолжение табл. 10
3
1
1
4
1—2
1
5
1
1
6
—
7
1
1
8
—
9
1
—
10
1
- —
11
1
1
Виио крепленое» имеющее
кондиции:
спирт 18,7 %, сахар 4,5 %
75 г/л, кислотность 5 г/л
Коньячный спирт крепостью
62%
Питательная жидкость,
поступающая в дрожжерасти-
льный аппарат, pH = 4
Жидкость из дрожжера-
стильного аппарата
Меласса, pH = 7-^7,5
Карамельный сироп по
нормальной рецептуре на
патоке, pH = 6,22
Карамельный сироп по
нормальной рецептуре на ин-
верте, pH = 6,14
Тоже, подкисленный, pH =
= 2,12
Сахарный сироп с
добавлением 1 % молочной и 1 %
лимонной кислот, pH =
= 2,87
18—20
18—20
20—32
20—32
20
120
120
120
120
—
—
Производство
3
2
3
—
—
дрожжей
—
—
—
—
—
—
1
1
1
—
—
—
—
Производство кондитерских изделий
—
—
—
1
1
1
4
—
—
—
—
—
—
8
—
—
—
—
—
—
—
4
3
4
4
—
—
—
—
—
—
—
Карамельный сироп по
нормальной рецептуре на патоке
с добавлением 1 %
лимонной и 1 % молочной кислот,
pH = 2,81, влажность 16 %
Варочный бак для роспуска
и уваривания карамельной
крошки*
Варочный бак для
карамельного сиропа
Карамельная масса с
добавлением 1 % лимонной
кислоты
Начинка для карамели: 1 ч.
яблочного пюре +1 ч.
сахара
Подварка яблочная (из
дички)
Пюре без кислоты
Пюре + 1 % молочной
кислоты
Пюре + 2 % триоксиглута-
ровой кислоты
Подварка абрикосовая
Пюре без кислоты
Пюре + 1 % молочной
кислоты
Пюре + 2 % триоксиглута-
ровой кислоты
Подварка алычовая
Пюре без кислоты
120
105
105—110
145
95
120
120
120
120
120
120
120
—
—
—
—
—
—
—
—
і
і
і
і
і
5
5
6
1
6
6
1
—
—
—
—
—
—
—
—
—
—
—
—
—
—
і
і
і
і
і
і
6
і
і
6
і
I
Примечание. В крепленом вине с увелинением продолжительности испытанна скорость коррозии сталей уменьшается,
по-видимому, за счет образования пассивной пленки; коррозионностойкие хромомаргандовнстые стали 10Х14П4Н4Т н 08Х18Г8Н2Т
соответственно корродируют со скоростью 0,00157 мм/год и 0,00077 мм/год.
Продолжение табл. 10
3
4
5
6
7
8
9
10
12
Пюре + 1 % молочной
кислоты
Пюре + 2 % триоксиглута-
ровой кислоты
Подварки, содержащие 60 %
сахара
Начиночный
вакуум-аппарат (для карамели)
Конденсатор мокровоздуш-
ного насоса начиночного
вакуум-аппарата
Сборник для пюре @,3—
0,12 % SO2)
Яблочное пюре с
различными консервантами в
количестве 0,1 %:
бензокислый натрий
сорбиновая кислота
сернистая кислота*
Яблочное пюре сульфитиро-
ванное, содержащее 0,12 %
сернистой кислоты; общая
кислотность 0,62 %
Фруктово-ягодная смесь,
%:
абрикосовое пюре,
яблочное пюре, клубничная под-
варка 58,6, сахар 40,
лимонная кислота 0,3, лак-
тат натрия 1,1, общая ки-
120
120
85—90
95
95
90
90—100
Производство кондитерских
—
—
1
—
—
—
4
1
1
6
1
1
8
6
5
5
6
4
1
—
—
1
—
—
—
5
1
—
—
—
8
—
8
—
6
—
изделии
—
—
—
—
—
—
1
1
—
—
—
—
—
—
—
1
1
—
1
4
1
3
5
5
1
1
—
—
—
—
—
—
1
—
—
—
—
—
—
—
—
слота 0,8—1 % (по
лимонной кислоте)
Смесь, %**:
сахар 6, яблочная
кислота 1,5, молочная кислота
0,05, лимонная кислота
0,0002, кислотность 0,97—
среды по яблочной
кислоте, pH = 2,4
Индиго (синий)
концентрацией , %:
1
10
40—45
10
Амарант (кислотный
красный С) концентрацией, %:
10
45
10
Нафтоловый желтый:
1 %-ный
10 %-ный
10 %-ный
70
25
25
25
90
9^
20
25
90
25
25
90
Яблочное пюре (ТК)>
содержащее 0,12 % SO2
25
2
2
2
—
2
—
2
1
—
Пищевые красители
—
—
—
2
1
1
2
1
1
2
—
—
і їм
2
—
—
5
2
—
—
—
2
—
—
—
1
1
1
2
1
1
—
—
—
—
—
—
Производство мармелада
6—6
* В этом случай лучше применять стали с- молибденом, например 08Х21Н6М2Т с 10Х17Н13М2Т.
** Состав смеси соответствует составу наиболее агрессивных фруктово-ягодных продуктов.
Продолжение табл. 10
1
Смесь двух сортов яблочного
ТТІППР "
хнирс.
купаж (без сахара), 0,18—*
0,12 % SO2
с сахаром, 0,015 % SO2
То же
Мармелад (готовый) 0,015 %
Патока (крахмальная)
влажность 20—22 %, 78 %
сухих веществ
Вытяжка из свекловичного
жома
2
25
25
80
80
80
40
80
3
—
—
—
—
—
—
4
4
1
5
1
1
4
8
5
—
—
—
—
6
—
3
1
—
7
—
—
—
—
8
—
—
—
—
9
4
1
4
1
1
2
9
10
—
—
—
8
и
—
—
—
—
12
[5]
[5]
[5]
[5]
П1
[1]
Производство пива
Пивное сусло
Пиво
СпИрТОВЫЙ ПОГОН ТрОСТНИКО-
ВЬІИІ
газообразная фаза
жидкая фаза
Бражка тростниковая:
газообразная фаза
жидкая фаза
Барда ацетонобутиловая:
газообразная фаза
жидкая фаза
Упаренный фильтрат ацето-
нобутиловой барды:
5-100
5—100
80—100
80—100
80—100
80—100
80—100
80—100
—
—
2
2
—
—
5
5
—
—
—
—
1
1
—
—
Производство спиртов
4
1
2
2
2
3
2
2
2
2
—
—
6
7
8
7
8
6
—
—
—
—
1
2
2
2
__
—
—
—
—
газообразная фаза
жидкая фаза
Спирт-сырец этиловый:
газообразная фаза
жидкая фаза
Спирт-ректификат этиловый:
газообразная фаза
жидкая фаза
Бражка зерновая:
газообразная фаза
жидкая фаза
Бражка паточная:
газообразная фаза
жидкая фаза
Эфиро-альдегидная фракция:
газообразная фаза
жидкая фаза
Фракция из зоны сивушного
масла:
газообразная фаза
жидкая фаза
Лютерная вода:
газообразная фаза
жидкая фаза
Фруктовые соки:
абрикосовый
алычевый
облепихи
80—100
80—100
80—100
80—100
80—100
80—100
80—100
80—100
80—100
80—100
80—100
80—100
80—100
80—100
80—100
80—100
20
20
20
1
1
1
1
1
2
2
2
2
2
2
1
2
5
4
2
—
—
—
—
1
1
1
2
1
1
2
5
1
1
1
4
2
1
1
1
1
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
8
6
6
4
—
—
8
7
6
8
4
5
6
7
5
10
7
8
7
Производство сахара
Диффузионный сок следую*
щего состава:
17,85 % сухих веществ,
сахаристость 15,53 %,
87 %-ная
доброкачественность, pH = бЗн-65
65
1
1
1
1
1
2
1
2
1
1
1
4
2
2
1
1
1
—
—
—
—
—
—;
_
—
—
— і
— ' —
—
—
—
1
1
1
—
—
3
2
2
7
4
1
[271]
Продолжение табл. 10
3
4
5
6
7
8
9
10
11
Мучной кислый пшеничный
затор, pH = 3,5
Закваска для ржаного хлеба
из отбойной муки,
кислотность 12° по Нейману
Горчица
Льняное масло
То же +3 % H2SO4
Кофе, водный раствор*1
Кровь (мясные соки)
Лярд
Молоко
Молоко кислое
Овощи
Патока
Пищевое топленое масло
Сахарин
Сыры
Уксус столовый
Эссенция
Пищевые эссенции*2
(клубничная, грушевая,
ванильная, пищевая, кизиловая,
вишневая, апельсинная)
20
20
200
200
'К20
20
20
К20
/кип
§0
^кип
100
20
20
К20
киї
54
22
Хлебопекарное производство
—
—
1
1
—
—
7
6
—
—
—
—
1
1
—
1
—
—
Прочие пищевые
7
3
5
3
5
5
—
9
10
—
—
1
-i_
10
7
10
6
3
5
2
4
<5
5
—
8
8
4
1
5
1
6
8
6
9
5
2
4
2
3
<5
5
—
7
7
4
1
1
6
8
6
8
веществ;
—
8
8
8
10
—
—
—
—
10
—
І
3
—
2
2
3
3
—
4
5
8
3
—
5
2
2
2
2
—
—
3
3
5
—
3
1
3
5
2
2
3
3
3
5
6
1
1
4
1
5
8
5
8
3
1
2
5
2
2
2
2
2
4
5
1
1
3
1
3
5
3
5
3
1
,
—
4
5
1
—
1
• —
—
2
Производство антибиотиков
Пенициллин
Стрептомицин
Биомицин
Раствор, пенициллина,
подкисленный H2SO4 до pH =
= 1,5, и бутилацетат
Раствор стрептомицина,
подкисленный щавелевой
кислотой до pH = 3,3
Элюат стрептомицина в
присутствии сульфат-ионов,
pH = 4,4
Концентрат стрептомицина
перед угольной очисткой и
поступлением на сушку
Метанол ьно-х лор кальциевый
экстракт биомицина
Производство тиамина
(витамин Вх)
Смесь: ацетонитрил,
этанол, дихлорэтан, хлористый
водород, водород B0 %)
Производство борной
кислоты
Реактор:
пульпа G4—75 % серной
кислоты, боратовая мука,
промывные воды)
28
28
28
25
25
25
80
20
35
95
—
—
—
—
—
мм
—
—
—
—
—
—
—
—
—
6
6
6
10
—
—
—
—
2*з
2*з
2*з
6
2
2
2
3*4
2
—
—
2*з
2*з
2*з
5
2
2
3
3
2
5
8
2*з
2*з
2*з
7
2
2
2
4*4
2
5
—
_
*
—
—
—
8
[282]
[282]
[282]
[282]
[282]
[282]
[282]
[282]
[282]
[280]
[280]
*1 В кипящем кофе коррозионностойкими являются серебро и никель.
*2 Во всех эссенциях потерь металла нет. В-клубничной при 20 °С скорость коррозии стали Х17Т составляет 0,0020 г/(м2-ч).
*3 Скорость коррозии составляет 0,001—0,003 мм/год.
*4 Скорость коррозии сталей 0,010 мм/год. Однако в антибиотиках недопустимо наличие посторонних примесей, в том числе и железа.
Продолжение табл. 10
3
—
_
—
—
—
—
—
—
4
—
—
—
—
—
—
—
5
—
_
—
—
—
—
—
—
6
—
_
—
—
—
—
10
—
7
6
2
2
2
2
2
—
6
10
6
2
2
5—6
11
—
—
—
4
12
Производство
водорастворимой П-третично-бутилфенол-
салицид-формальдегидной
смолы (ВБФС-4*1)
Параметричный бутилфенол,
салициловая кислота,
формальдегид (pH = 1)
Производство гидрата оксида
бария
Реактор C0—60 г/л
гидрата окиси натрия)
Производство адипиновой
кислоты
Дистилляционный куб F0 %
азотной кислоты, 2—3 %
щавелевой кислоты)
Отдувочная колонна G %
двуоксида азота и воздух)
Ректификационная колонна
F0 % азотной кислоты,
2—3 % щавелевой кислоты)
Производство алкилсульфо-
натов
Сульфомасса A3,3 % алкил-
сульфокислоты, 29,6 %
углеводородов, 3,7 % серной
кислоты, 2,1 % сернистого
ангидрида, 51,3 % воды)
Жидкая фаза*2
Производство аминоэпсило-
новой кислоты 1 %
соляной кислоты, присутствие
96
80
100
100
100
100
30
103
[280]
{280]
[280]
«
[280]
[280]
[280]
[269]
[280]
минеральных солей и
упаренный раствор аминоэпси-
лоновой кислоты
Производство аминных от-
вердителей:
Высокотемпературные
электрофильтры,
работающие в среде сернистого
газа5—12 % (по объему),
сернистого ангидрида
0,2 % и воды 5,8 %
Гидролизное производство
Емкость гидролизата:
гидролизат после
гидролизного аппарата, pH =
= 1.5-Г-2
Нейтрализатор:
нейтрализат после
нейтрализации, pH = 4,2-^-4,5
Производство гидроксила-
миносульфата
Гидролизер:
120 г/л гидроксиламино-
сульфата и 85—100 %
серной кислоты
450
95—100
90
105
1 1 1 1
1 1 1 1
—
10
2
7
4
8
3
6
4
8
2
—
—
[323]
[280]
[280]
[280]
•* При производстве алкидной полиэфирной (ПЭ-220), эпоксидной (Э-40). формальдегидной лаковой смолы (ВМЛ-3) и других веществ
стали 08Х22Н6Т, 08Х21Н6М2Т, 08Х18Н10Т и 10Х17Н13М2Т являются стойкими материалами. Максимальная скорость коррозии при этом
составляет 0,01 мм/год.
*2 Скорость коррозии в газовой фазе значительно меньше, чем в жидкой; свинец в этих условиях нестоек.
Продолжение табл. 10
10 11
12
10
10
10
10
[280]
[274]
[154]
[306]
[306]
Колонна дисоли:
аммоний сернокислый
кислый, аммоний
азотнокислый, ангидрид серный,
дисульфат, гидроксила-
мин
Производство глинозема
щелочным гидрохимическим
способом
Щелочная среда:
500 г/л
Процессы
гидрометаллургии цветных металлов:
выпарка растворов
медного сульфата
то же, сульфата цинка
Производство диметилтере-
фталата
Емкость оксидата:
ПТ-кислота,
моноэтиловый эфир терефталевой
кислоты, ПТ-эфир,
уксусная и муравьиная
кислоты и П-ксилол. Кислотное
число 250—280
Отстойник реакционных
кислых вод:
реакционная вода,
содержащая муравьиную и
уксусную кислоты и следы
органических веществ
Емкость фильтрата:
105
290
105
105
180—190
20—40
ДМТ сырой, ПТ-эфир и
ПТ-кислота
бен^ола^ДНХБ), жидкая
"TfJablF ~™~
Нитратор B1,5 %
хлорбензола; 0,15—39 % ДНХБ;
62—83 % H2SO ; 33—5 %
HNO3; 4,7-18 % Н2О;
0,3—0,5,% примесей)
Донитратор @,9—0,0 % хлор
бензола; 39 % ДНХБ; 81;
5—83 % H2SO4; 6,0—1,5 %
HNO3; 18 % Н2О; 0,5 %
примесей)
Сепаратор разделения
отработанной кислоты и
ДНХБ:
отработанная кислота
@,5 % ДНХБ; 81,5—83%
H2SO4; 0,4 % HNO3; 18%
воды; 0,2 % примесей)
ДНХБ (95,4 % ДНХБ;
65 % H2SO4; 15 % Н2О;
следы HNO3)
Промывной аппарат D %
ДНХБ; 2 % H2SO4; 97 %
Н2О, следы HNO3, 0,5 %
примесей)
Производство 2,4-динитро-
хлорбензола
Сепаратор B % HNO3, 74—
75 % H2SO4, динитрохлор-
бензол)
160
55—60
90—100 — — — —
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
2
4
6
4
4
3
2
2
—
—
—
—
—
2
—
4
6
4
4
2
2
—
4
6
4
4
4
3
—
—
—
—
—
—
—
[306]
[228]
[228]
90—100 — — — —
90—100
65—70
50
[228]
[228]
[228]
[280]
*о * Хромистые стали подвержены коррозионному растрескиванию. На СтЗ наблюдают язвенную коррозию,
ел
Продолжение табл. Ю
3
—
—
—
—
—
4
—
—
—
—
—
5
—
—
—
—
—
6
—
5
—
—
—
—
7
3
—
—
—
8
4
—
—
—
6
9
4
__
—
4
8
10
3
—
—
4
5
11
—
4
4
4
6
—
12
Промежуточный сборник
(динитрохлорбензол, 2,5 %
H2SO4; 2,3 % HNO3)
Производство
дихлорангидрида изофталевой
кислоты*1
100 % хлористого тионила
90 % хлористого тионила,
0—10 % изофталевой
кислоты, 0—10 %
дихлорангидрида изофталевой
кислоты*2
99 % хлористого тионила,
следы хлористого водорода,
остальное примеси
90 % дихлорангидрида
изофталевой кислоты, 1,0 % мо-
нохлорангидрида
изофталевой кислоты, остальное
примеси*3
50 % дихлорангидрида
изофталевой кислоты, 50 %
петролейного эфира
Производство изофталевой
кислоты*4
70—75 % уксусной
кислоты, 21,5 % метаксилола,
0,31 % ацетата кобальта,
0,31 % бромида кобальта,
1 % метатолуиловой
кислоты, 0,7 % изофталевой
кислоты, 5 % воды
90
45
80
80
140
70
100
[280]
[145]
[145]
[145]
[145]
[145]
[307]
90—95 % уксусной кислоты,
0—5 % метаксилола, 0—5 %
воды
86 % бензола, 8,8 % воды,
5,2 % уксусной кислоты
62 % хлорбензола, 28 %
воды, 10 % уксусной
кислоты
91 % уксусной кислоты,
0,2 % бензола; 0,5—1,5 %
воды; 5 % метатолуиловой
кислоты; 0,8 % изофталевой
кислоты; 0,1 % бромида
кобальта
35 % бензола, 30 % воды,
30 % уксусной кислоты,
2,5 % метатолуиловой
кислоты, 0,05 % ацетата
кобальта, 0,05 % бромида
кобальта
85 % изофталевой кислоты,
8 % воды, 7 % уксусной
кислоты, следы ацетата и
бромида кобальта
45 % уксусной кислоты,
50 % воды, 2,5 %
метатолуиловой кислоты, 0,4 %
изофталевой кислоты, 0,05 %
ацетата кобальта, 0,05 %
бромида кобальта
125
70
90
120
70—80
100
100
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
5
—
—
6
—
—
7
3
2
8
2
3
3
4
2
3
4
2
—
5
—
—
—
—
—
—
[307]
[307]
[307]
[307]
[307]
[307]
[307]
*> Скорость коррозии металлических материалов в жидкой и газовой фазах почти одинаковая.
*2 В этих условиях алюминий нестоек, никель и сплав Н70ФМ стойкие.
*3 В этих условиях сплав Н70МФ корродирует со скоростью 0,13 мм/год, а титан совершенно нестоек.
*4 Титан ВТ-1 и сплав ХН65МФ являются стойкими материалами в этих условиях.
Продолжение табл. 10
3
4
5
6
7
8
9
10
11
12
Кожевенная промышленность
Дубитель № 2:
сульфированная фенол-
формальдегидная смола
с возможным
содержанием разбавленных серной
и уксусной кислот,
свободного фенола и сульфо-
кислоты, 150 г/л дубящих
средств
Дубитель № 12:
продукт формальсульфи-
рования фенолов
резорциновой группы. Может
содержать разбавленную
серную кислоту,
свободные гомологи резорцина,
сульфокислоты резорцина,
150 г/л дубящих средств
Дубитель СПС-
продукт диспергирования
лигнофенольных смол в
лигносульфоновых
кислотах. Может содержать
свободную лигносульфо-
новую кислоту, фенолы
резорциновой группы,
150 г/л дубящих средств
Дубитель БНС:
продукт конденсации 2-
нафтолсульфокислоты с
80
80
80
80
4
—
4
4
4
4
6
—
—
—
—
—
—
3
—
4
3
4
4
5
2
—
3
4
4
4
5
5
4
3
4
[321]
[321]
[321]
[321]
ди оксидифенил сул ьфоном;
может содержать 2-нафтол-
сульфокислоту, диокси-
дифенилсульфон,
разбавленную серную кислоту,
150 г/л дубящих средств
Дубовый экстракт:
водная вытяжка из
древесины дуба; содержит тани-
ды, слабые органические
кислоты типа уксусной и
молочной и их соли, 150 г/л
танидов
Хромовый экстракт:
основная сернокислая
соль хрома, содержащая
свободную серную
кислоту. Основность 38,7 %,
концентрация хрома в
пересчете на 150 г/л Сг2О3
Хромовый экстракт:
основная соль хрома,
содержащая свободную
серную кислоту. Основность
19,5 %, содержание хрома
в пересчете на 150 г/л
Сг2О3
Пикельный раствор:
водный раствор
поваренной соли (80 г/л) и серной
кислоты A0 г/л)
80
80
80
80
4
7
9
10
4
4
4
10
—
—
—
—
—
—
—
—
4
4
5
7
4
4
5
9
4
5
5
7
4
4
5
7
4
4
4
6
[321]
[321]
[321]
[321]
Продолжение табл. 10
3
9
7
4
9
7
5
—
6
—
7
9
7
8
8
6
9
7
6
10
6
8
и
6
3
12
Пикельный раствор с гольем:
водный раствор
поваренной соли и серной кислоты,
в которой одновременно с
образцами помещали
кусочки шкуры, обезволо-
шенной и предварительно
обработанной в растворе
извести и сернистого
натрия, 80 г/л NaCl, 10 г/л
H2SO4 (начальная), для
голья pH = 13
Смесь 10 г/л Na2Cr204 и 4 г/л
H2SO4
30
[321]
30
[321]
5—12 % серной кислоты,
через которую барботирует
коксохимический газ состава:
60 % водорода, 10 г/м8
аммиака, 20 г/м3
сероводорода, 35 г/м3
углеводорода и примеси циана,
фенола и сернистого газа
Сбросные воды:
роданистый натрий,
гипосульфит натрия,
сернокислый натрий и примеси
сероводорода, фенола всего
250—300 г/л (в вакууме)
Маточный раствор:
—
—
<;оксохш
—
—
ническое
—
—
произв
—
—
эдство
—
—
—
—
—
2
—
2
1
60-70
97—100 — — —
[151]
[151]
20 % H2SO4, 7,5 % N2
(в пересчете на сульфат
аммония 35,4 %), 13,9 %
г/л пиридиновых
оснований (кислотность 4—5 %)
Пиролиз отходов
Конденсат парогазовой
смеси
0,4 °о соляной кислоты и
0,25 °о муравьиной
кислоты*
Производство красителей
паранитроанилина
Анилин и муравьиная
кислота
Крашение:
тканей C0 г/л H2SO4)
шерсти D—6 %-ная
уксусная или серная кислота)
Производство кислотного
темно-голубого красителя
Амины, сульфомасса
нафталина (среда от
слабокислой до нейтральной)
Получение крезолов
Расплавленная 100 %-ная
м-толуиловая кислота**
20
80
100
102—145 —
70
95
155
160
200
250
6
00 00 00
—
—
—
—
8
—
—
—
—
—
8
—
—
—
6
8
8
8
—
—
—
10
1—2
3—4
4—5
—
8
4
2
—
1—2
2—1
2
—
6
4
2
—
1
1—2
2
2
8
—
2
2
8
9
1
2
2
6
—
2
3
4
6
—
5
—
—
—
[302]
[352]
[352]
[352]
[151]
[280]
[280]
[280]
[263]
[263]
[263]
* В условиях пиролиза отходов коррозионностойкая сталь 08Х18Г8Н27 корродирует при 20 °С со скоростью 0,01 мм/год и при
80 °С 0,1 мм/год. При этом авторы работы с целью уменьшения скорости коррозии металла рекомендуют периодически проверять pH
и производить нейтрализацию сред при рН = 1.
** Высокой стойкостью при 250 °С обладает титан.
Продолжение табл. 10
1
Производство лимонной
кислоты
Варочный котел
(разбавленная мелассасдобавкой H2SO4
до pH = 7—6; 18 см3 желтой
кровяной соли 10 %-ного
раствора на 1 л мелассы)
Выдерживатель
(стерильный раствор мелассы,
который выдерживают при р =
¦= 0,245 МПа)
Ферментатор (лимонная
кислота до 7 %-ной
концентрации)
Запарник G %-ная
лимонная кислота)
Емкость для хранения
сброженных растворов G—15 %-
ная лимонная кислота с
примесью щавелевой, гликоно-
вой и других кислот)
Нейтрализатор @,1 %-ная
остаточная кислотность)
Емкость после первой
упарки G0 % -ная лимонная
кислота)
Кристаллизатор (98 %-ная
лимонная кислота)
Сборник для маточных
растворов (после
кристаллизации содержит примеси
органических кислот, комплекс -
2
80—100
ПО
60
80—90
30—40
100
25—30
20—30
20—30
3
_
—
—
—
—
—
—
—
4
4
4
—
2
5
6
2
1
5
2
2
3
—
2
4
4
2
1
6
—
—
—
—
—
—
—
—
7
2
3
4
4
1
3
6
2
—
8
2
3
3
4
1
2
3
—
—
9
2
4
4
4
1
4
5
2
1
10
—
—
—
—
—
—
—
—
—
U
—
—
—
—
—
—
—
12
[62]
г col
[Ь2\
г col
162]
[62]
FCQl
[62]
[62]
Г СО 1
[62]
162]
[62]
ные соединения лимонной
кислоты с кальцием, калием
и другими металлами.
Содержание загрязнений в
растворе 8—12 %)
Кюветы A4 %-ная
лимонная кислота)
Производство малеинового
ангидрида
Дегидратор (малеиновая
кислота, малеиновый
ангидрид)
Колонна дегидратора (пары
воды, малеиновый ангидрид)
Дефлегматор (флегма —
малеиновый ангидрид и
малеиновая кислота)
Отстойник A2—20 %-ная
малеиновая кислота)
Получение 2-меркаптобенз-
тиазола
Реактор синтеза
(сероводород в присутствии влаги под
давлением 6—7 МПа)
Паровая фаза
Производство по обработке
меха
2—2,5 % серной кислоты,
40—60 г/л хлористого
натрия, 1,5—4 г/л оксида
хрома, pH = 1,0
20—30
50—175
60—160
60—160
20
270
46
[62]
[280]
\280]
[280]
[2801
[340]
[340]
1280]
Продолжение табл. 10
3456789 10 11
12
Производство муравьинокис-
лого амидопирина
Раствор натриевой соли
сульфоаминоантипирина,содержащий 150 г/л
муравьиной кислоты и 50 г/л
формалина
Производство нафтеновых
кислот керосиновых
фракций
Дистилляция нафтеновых
кислот
Производство особо чистого
йодистого натрия и едкого
натра*1
Стадия упарки йодистого
натрия и нейтрализации
йодистого водорода:
едкий натр C0 %) +
йодистый натрий G0 %)
Условия хранения и
транспортировки:
едкий натр Юн.
(плотность 1,83)
Производство паранитро-
ацетанилида
Процесс ацетилирования
(80 %-ная уксусная
кислота)
Производство паранитроани-
лина
105
10
330
[2701
50
50
140
[313]
[3131
[280]
95 %-ная муравьиная
кислота
Производство пикриновой
кислоты
Декантер C0 % H2SO4, 1 %
HNO3 и пикриновая кислота)
Производство полиэтилена
низкого давления
Буферная емкость
(суспензия полиэтилена в бензине,
катализаторный комплекс,
15 % (объемн). изопропило-
вого спирта)
Промывная емкость — раз-
лагатель (суспензия
полиэтилена в бензине, изопро-
пиловый спирт, продукты
разложения катализатор-
ного комплекса, в том числе
алкоголяты алюминия и
титана, 0,1 %-ная соляная
кислота, pH -=- 2-f-5)
Нейтрализатор (смесь
бензина и изопропилового
спирта, продукты разложения
катализаторного комплекса,
в том числе алкоголяты
алюминия и титана, соляная
кислота, 20 %-ный раствор
NaOH, гидрооксиды,
хлориды)
140
20—80
50
50
20
5
5
5
—
8
5
4
4
6
4
7
4
8
5
4*2
7*2
4
6
4
1 I I I 1
[280]
[280J
[200]
[200]
[200]
*1 Загрязнение продукта железом не должно превышать регламентированную величину A0~*%). Содержание примеси железа, %
в пересчете на «стандартный» аппарат, при упарке и транспортировке соответственно составляет: 3,06 • 10~5 и 0,000 для стали 12Х18Н10Т;
1,77 • 1(Г5 и 0,000 для стали 10Х17Н13М2Т; 0,89 -10~5 и 0,000 для сплава 06ХН28МДТ7.
*2 Незначительная точечная коррозия.
*3 Сильная точечная коррозия. В промывной емкости-разлагателе весьма стоек титан.
Продолжение табл. 10
Сборник лоидепелта (водный
конденсат после второй
промывки суспензии
полиэтилена, pH - 5—6, хлориды)
Производство сеоаци новой
кислоты
Дистилляция касторового
масла едким натром B4—
75 %)
Производство сульфогидра-
та натрия
Сульфогидратная башня:
90 % сероводорода, 24 %
гидроокепда натрия, до
22 % счльфогидрата
натрия
Производство сажи
(оборудование, работающее на
жидком сырье). Холодильник-
испаритель, сажегазовая
смесь D—6 % СО2; 17—
19 % СО; 8—12 % Н2;0,5—
1,5 % СН4; 63-66 % N„
1 % S)
Газоход от холодильника-
испарителя до
электрофильтра (сажегазовая смесь
состава, указанного выше)
Электрофильтр, среда D—
6 %СО2;7-20 % СО; 0,3—
0,6 % О2; 0,5—1,5 % СН4;
63—60 % No)
20
180—265
1380—300 —
190—270 —
270—190
3
__
—
6
—
—
7
4
—
—
4
8
2
7
5
—
__
4
8
—
—
6
—
—
9
9
8
6
7
—
7
2
5
1
1
8
1
—
2
—
__
1
9
1
8
4
6
2
1
10
[200]
[286]
[71!
[71]
°° Циклоны, состав среды тот
же, что и электрофильтра
Газопенный охладитель,
среда C,51 % СО,; 18,65 %
СО; 3,5 % Оо; 10—24 % Н2;
0,4 % СН4; 63,49 % N2;
1 % S, осветленная вода,
пульпа)
Градирня (состав среды —
осветленная вода)
Циркуляционная вода
Обработка сажи
Производство ламповой и
форсуночной сажи
Холодильник-испаритель
(верхняя часть) (ТК)
Газоход (ТК)
Бункер-электрофильтр (ТК)
Производство сернокислого
алюминия
Кристаллизатор.
Расплавленная масса (гидрат
оксида алюминия с серной
кислотой, pH -= 2)
Реактор. Среда, см.
Кристаллизатор
Производство сернокислого
глинозема
Кристаллизатор, 13,5—
14,06 % AUV, 1,0 %
нерастворимого в воде осадка;
0,7 % Fe.2O3
Производство сернистого
натрия
Преду марочный котел, 32—
45 %-ный Na.,S
200—250
До 60
25—30
20—30
20
250—300
280—230
150—180
От ПО
120—130
105
108—120
10
10
10
4
6
7
1
1
4
4
3
10
—
10
6
—
6
1
1
1
4
4
2
8
10
10
6
—
—
—
—
—
6
9
6
—
[71]
[71]
[71]
[71]
[71]
[247]
[247]
[247]
[285]
[285]
[275]
[312]
Продолжение табл. 10
1
Упарочный котел, 54—
69 %-ный Na2S
Камера гашения, 16—40%-
ныи 1\а2о
Сборник пульпы, 25—32 %-
ный Na2S
Репульпатор № 1, 19—
20 %-ный Na2S
Производство сернистого
НЯТП И ЇТ
Котлы первого упарочного
каскада*1, 48—57 %-ный
Na2S
Котлы пятого упарочного
каскада*2, 65—70 %-ный
Na2S
Производство серы
Автоклавная выплавка
серы при переработке
сульфидов цветных металлов (pH =
¦=9-7-11; 1 г/л
Фазовый обмен в среде
расплавленного серного
концентрата и высококипящего
хлористого кальция.
Наличие паров воды,
сероводорода и сернистого газа
Производство
суспензионного полистирола*4
Аппарат предварительного
смешения [11 ч. (по массе)
2
130—180
100—120
95—120
88—102
162—172
180—190
130—140
130
20—25
3
—
—
—
10
10
5
O
4
8
—
7
4
8
10
—
8
2
5
6
—
4
4
4
6
5
8
1
6
8
—
8
7
10
10
9
—
8—10
7
7
4
2
4
6
8
5
—
1
8
7
4
4
4
7
8
—
—
—
9
8
5
4
3
9
10
5
6*з
1
10
8
7
6
2
10
10
5
—
—
U
—
—
—
6
8
5
6
—
12
[312]
[312]
[312]
[3121
[237]
[237]
[146]
[146]
[203]
стирола, 1 ч. перекиси бен-
зоила]
Полимеризатор [маточный
раствор: 2200 ч. (по массе)
маточника, 27 ч. латекса, 8 ч
поливинилового спирта,
до 1 % перекиси бензоила]
Сборник суспензии [1 ч.
(по массе) полистирола и 2 ч.
воды]
Серуулавливающие
установки
Крышка скруббера, газоход
очищенного газа, выхлопная
труба (относительная
влажность 100 %; 0,01— 0,06 %
SO2; 0,007—0,04 мг/л С1,
0,0002—0,0007 мг/л F, 0,2
г/м3 пыли)
Трубопровод
поглотительной суспензии B0—30 г/л
MgSO3, 100—120 r^MgSO4,
pH = 6,0-7-6,2)
Циркуляционный сборник
<30 г/л MgSO3, 130 г/л
MgSO4)
Вакуум-камера ленточного
вакуум-фильтра, вакуум-
сборник фильтрата A30 г/л
MgSO4, 30 г/л MgSO3, 5 г/л
Mg (HSO3J, pH = 5,6ч-5,8)
25
30—35
45
50
45
40
2
1
—
—
—
2
1
7
7
7
7
2
1
—
—
—
8—10
8—10
8
8
8
8
1
1
—
—
—
—
—
—
—
—
—
1
1
7
7
7
7
—
—
5
5
5
5
—
—
—
4
—
3
[203]
[203]
[309]
[309]
[309]
[309]
*х Высокой стойкостью в этих условиях обладает хромистый чугун Х25СНЗД.
*2 Хромомарганцовистая сталь 08Х25Г15С корродирует со скоростью 0,005—0,008 мм/год.
*3 Сталь подвержена коррозионному растрескиванию. Сплав Н70МФ корродирует в этих условиях со скоростью 0 01 мм/год
*4 СтЗ и другие углеродистые и низколегированные стали непригодны, так как они не обеспечивают получения выс
лимера Все коррозионностойкие стали в т исл 10Х14Г14Н4Т б й й
олучения высокой чистоты
З друи улерде и орованые стали непригодны, так как они не обеспечивают получения высокой чистоты
полимера. Все коррозионностойкие стали, в том числе и 10Х14Г14Н4Т, обладают высокой стойкостью и корродируют со скоростью 0,002—
р
to
О
Продолжение табл. 10
3
—
—
—
—
4
—
—
—
—
5
—
—
—
—
6
—
—
—
—
7
—
—
—
—
8
6
1
2
7
9
6
6
6
6
10
5
1
3
6
И
—
—
—
—
12
Синтез ароматических диа-
мидов
Нитрование дифеиилсуль-
фона:
98 %-ная серная кислота,
азотная кислота (плотность
1,5), дифенилсульфон,
3,3-динитродифенилсуль-
фон при перемешивании
Высаждение динитропродук-
та:
40—50 %-ная серная
кислота, следы азотной кис- |
лоты, 3,3-динитродифенил-
сульфон
Сочетание п-нитрохлорбен-
зола с сульфидом натрия:
п-нитрохлорбензол, ди-
метилформалин, 13—14 %-
ный раствор сульфида
натрия, 4,4-дннитродифенил-
сульфид (вода при
перемешивании жидкой фазы*)
Окисление 4,4-динитроди-
фен ил сульфида:
4,4-динитродифенилсуль-
фид, хромовый ангидрид
(плотность 1,16), уксусная
кислота (ледяная) при
перемешивании жидкой
фазы*
90—110 —
[316]
50—60
105—110 —
[316]
[316]
105—110
[316]
Текстильное производство
Производство вискозного
волокна
Осадительная ванна C0—
150 г/л серной кислоты, 15—
340 г/л "сульфата натрия, б—
ПО г/л сульфата цинка, до
1,5 г/л гексаметилентетра-
мина)
Отбельная ванна [гипохло-
рит натрия (содержание
активного хлора 0,8—1 г/л),
pH = 8,5—9] I
Производство полиакрило-
нитрильного волокна
(нитрона)
Мономеры (~1 % акрилни-
трила и метил акр ил ата,
^0,06 % роданистого
натрия, остальное вода)
51,5 %-ный раствор
роданистого натрия
Прядильная ванна (8—11 %
роданистого натрия)
Ванна предварительного
нагревания D %-ный
раствор роданистого натрия)
Ванна для промывки жгута
@,5—0,8 %-ный раствор
роданистого натрия)
50—56 — — —
30
10
9—11
50
50
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
10
8
—
—
—
—
—
—
—
—
—
—
—
—
—
—
2
2**
—
—
—
8
1
2
2**
—
—
—
7
3
2
2**
3
3
3
6
2
—
—
—
—
[318]
[318]
[298]
[298]
[299]
[299]
[299]
* Скорость коррозии сталей в газовой фазе меньше, чем в жидкой.
** Цвет раствора меняется до темно-бурого, что недопустимо в производстве волокна нитрон. Окалина, образующаяся при сварке.
Продолжение табл. 10
9 ю и
12
Отбеливающие растворы:
1) 23 г/л едкого натра,
2,52 г/л гипохлорида
натрия в пересчете на
активный хлор; 2) 8—9 г/л
едкого натра, 5,5 г/л
перекиси водорода
Камера термозольного
крашения
Пароводяная среда в
присутствии 40 г/л поваренной
соли и кальцинированной
соды*1
Производство
триацетатного (тац) волокна
19—21 % тац в смеси
СН2С1 + С2Н5ОН
Производство титановых
белил
Вакуум-выпарная
установка B10 г/л Ті, 420 г/л H2SO4,
170— 180 г/л FeSO4, 55- 85 г/л
Al2 (SO4)S, 3—4 г/л Ті)
Вакуум-кристаллизационная установка A20—130 г/л
ТіО2, 220—240 г/л H2SO4,
260—300 г/л FeSO4, 20—
50 г/л Al2 (SO4K, 2—3 г/л
ТО
Производство углекислого
натрия (соды)
70—80
—
—
—
—
—
—
—
—
—
—
—
—
10
8*2
—
—
—
2
—
—
—
2
__
2
8
2
—
—
6
2
9
8
—
—
—
7
6
[151]
105—107 — — —
28
70
55
[254]
[262]
[50]
[50]
65 % аммиака + 12 % дву-
оксида углерода
Производство уксуснокис-
лотное *3
Обесспиртовывающий
аппарат непрерывного действия
(ретортная жижка,
кислотность 7—9 % , растворенных
смол 7—9 %, спиртовых
продуктов 3—4 %,
остальное вода)
Эфирокислотный аппарат
(ректификационная
колонна), кислотность 3,5—4,0 %
Эфирокислотный аппарат
(верхняя часть каландрии)
кислотность 60 %
Чернокислотный аппарат
непрерывного действия
(верхняя часть каландрии),
среда: остатки черной
кислоты, содержащие 15—20 %
уксусной кислоты и ее
гомологов и 80 % смолы
Этерификатор G2 %-ная
уксусная кислота, 2—3 %-
ная серная кислота, до 10 %
этилового спирта и 5—7 %
эфира)
Производство фенола
Выпарной аппарат G5—
80 % гидрата окиси натрия)
67
90—95
58—60
114—116
160
100
220
—
—
—
—
—
—
1
—
—
—
—
2
4
5
5
8
—
—
—
—
—
—
—
6
—
—
5
8
—
8
—
—
5
7
8
6
1
—
5
8
—
—
—
—
—
—
8
—
—
,
—
—
—
—
1280]
[138]
[138]
[138]
[138]
[138]
[280]
*' Коррозионностойкие стали подвержены коррозионному растрескиванию.
*2 Углеродистые спали изменяют окраску и сильно загрязняют метиленхлоридные растворы продуктами коррозии.
*3 Скорость коррозии в жидкой и парогазообразной фазах одинаковая.
Продолжение табл. 10
3
6
5
6
__
—
—
—
—
__
4
5
6
5
_
—
—
—
—
—
5
—
—
—
—
—
6
6
5
5
__
5—6
7
—
—
—
10
8
7
—
—
—
—
5
—
8
—
_
—
—
—
—
—
9
5
5
6
8
6
6
6
10
6
5
—
10
5
4
5
7
6
6
10
6
—
—
11
—
8
5
5
6
10
5
—
8
12
Производство фреонов
Смесь фтористого водорода
и хлористого водорода
Реактор синтеза фреона-12:
жидкая фаза
газовая фаза
Сборник чистого фреона-11
Реактор синтеза фреона-
114В2
Сборник продуктов броми-
рования E—10 %
кальцинированной соды; 0,1 %
брома и тетрафторэтилена)
Куб ректификационный
колонны фреона-114В2 (бром
фреон-114В2, тетрафторзти-
лен)
Электротермический способ
производства фосфора
Извлечение фосфора из
шлама*, pH = 4-і-5, при
давлении р = 0,78 МПа (8 ат),
паровая и жидкая фазы
Производство фтористого
водорода
Газоход и аппарат очистки
газа: 81 % HF; 8,7 %
HoSO4; 3,5 % Н2О; 3,6 %
SiF; 0,9 % SO, (газовая
фаза);
40
100
250
60—80
60—80
15—40
60—100
20—25
48—75
160
150—170 — —
[ЮЗ]
[103]
[ЮЗ]
[ЮЗ]
[ЮЗ]
[103]
[ЮЗ]
[76]
[ЮЗ]
8—16 % HF; 64—80 %
H2SO4 (жидкая фаза)
Бромсодержащие
хлорированные и подкисленные
серной кислотой рассолы A9,5 %
NaCl; 11,4 % КС1; 0,7 г/л,
плотность 1,23 г/см3)
Бромовоздушная смесь
A,4 г/м3 Вг2, 0,08 г/м3 С12)
Сборная вода после
извлечения брома (90 мг/л
свободного брома и 27 мг/л хлора)
Бромистое железо D26,4 г/л
FeBry, 3,77 г/л FeBr3; 4,92 г/л
FeCl3)
Упарка бромистого железа
B85—370 г/л FeBr2; 130—
212 г/л FeBr3; 25 г/л FeCl3)
Иодовоздушная смесь (80—
90 г/л H2SO4); жидкая (85—
90 г/л HI)
Иод технический
Насыщенные пары над иодом
техническим
Производство солей фтора
Водные растворы фторидов:
86 % NH4F
80 % NH4F
Расплав H4F + H4HF2
80—100
20
40
20
18
20—132
45
50
200
80*1
115*2
115*3
190—200
—
—
10
10
6
10
10
8
8
—
—
10
10
10
6
10
—
10
9
—
—
10
10
8
6
10
9
10
8
—
6
10
10
9
8
10
10
10
9
8
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
8
10
7
5—6
10
10
10
6
6
4
—
7
_
4
3
10
8
10
6
4
5
5
—
—
—
—
8
10
5
5
4
7
[ЮЗ]
[ЮЗ]
[103
[103
[103
[ЮЗ]
*' Титан BT-I при 27 °С совершенно стойкий материал. Кремний значительно
основе.
*2 В жидкой фазе.
*3 В газовой фазе.
уменьшает скорость коррозии сплавов на железной
Продолжение табл. 10
3
—
—
—
—
—
4
—
—
—
—
—
—
5
—
—
—
—
—
—
6
—
—
—
9
9
coco
—
7
7
7
6
—
—
—
8
2
4
—
—
—
—
9
—
—
6
8
3
6
10
10
—
—
—
00 00
—
—
11
—
—
—
7
8
—
10
12
Производство хлористого
аммония методом упаривания
25,93 % хлористого
аммония, 15,8 % хлористого
натрия, 10,0 % сернокислого
натрия
25,93 % хлористого
аммония, 18,8 % хлористого
натрия, 10,0 % сернокислого
натрия, 0,4 г/л серноватисто-
кислого натрия
50 % азотной кислоты +
хлористый аммоний +
соляная кислота
Производство безводного
фтористого водорода
Аппарат предварительной
очистки реакционного газа
(80 % HF; 5—10 % H2SO4;
примеси сернистого газа, че-
тырехфтористого кремния,
кислорода и азота):
в жидкой фазе
в газовой фазе
Производство и очистка
хлоридов ванадия
Хлорокись ванадия*
Тетрахлорид ванадия*
Производство хлористого
цинка**
40 % хлористого цинка +
до 3 % соляной кислоты в
114
114
60
[280]
[280]
[280]
80
120—150
170—230 — —
[206]
[206]
[177]
[177]
[254]
присутствии перекиси
водорода, аэрация воздухом
Производство целлюлозы
по сульфатному способу
Черный щелок
Хлоратор (известковое
молоко)
Выпарной аппарат (черный
крепкий щелок, плотность
1,18—1,2; р = 0,12 МПа
0,3 ат)
Мерник (раствор кальция ги-
похлорита + 25—35 г/л
активного хлора)
Производство целлюлозы по
сульфитному способу
Коллектор газа (газовая
среда + 8—10 % двуокиси
серы)
Холодильник I ступени
(газовая среда + 10—11 %
двуокиси серы)
Холодильник II ступени
(газовая среда + 10—11 %
двуокиси серы)
Селеновая камера (газовая
среда + 15—16 %
двуокиси серы). Напряжение на
электродах 26—27 тыс. В
Сборник сульфитного
щелока (сульфитный щелок +
+ 0,1 % двуокиси серы +
+ 0,4—0,5 % органических
кислот, pH = 2,5-^2,7)
160—180
30—50
100—130 —
25—45
120
100
60—70
35—40
85—90
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
4
5
6
6
5
10
6
10
1
4
6
4
7
—
—
—
—
—.
4
5
4
5
5
—
6
—
1
5
6
3
6
4
8
6
7
1
—
—
—
—
—
—
—
—
[280]
[280]
[280]
[280]
[280]
[280]
[180]
[280]
[280]
* Высокой стойкостью обладает никель НП-2, скорость коррозии соответственно составляет 0,016 и 0,095 мм/год.
** Сталь 08Х18Г8Н2Т, сплавы Н70МФ и ХН65МВ являются нестойкими металлами.
Продолжение табл. 10
1
Производство эбонитовых
изделий
Вулканизационные котлы*1:
паровоздушная среда
(сернистый газ, сероводород,
углекислый газ и следы
меркаптанов)
острый пар под давлением
р — 0,39 МПа D ат)
Производство этанолами-
нов*8
Производство эфирного
ирисового масла*4
Гидродистилляция ириса в
жидкой фазе
Производство эфирного
розового масла
Пропиленгликоль
Пропилен двухлористый
Пропионовая кислота*7:
40 %-ная
60 %-ная
98,8 %-ная
Пятиокись ванадия
(расплав)*8
Роданистый аммоний, 20 %-
ный
Ртуть азотнокислая,
насыщенный раствор
Ртуть металлическая
Ртуть хлористая:
0,1 %-ная
2
145—155
140—165
170—190
ПО
30
20
20
'кип
^кип
^кин
800
75
^кип
20
^кип
20—50
20
3
8
—
—
8
з*5
3
4
—
—
—
—
4
4
3
5
5
8
4
6
—
—
—
—
2
3
2
4
—
—
—
—
3
5
5
7
5
3
—
—
—
—
—
—
2
4
—
8
—
—
3
5
5
7
6
—
8
8
—
5*6
—
—
10
10
10
—
7
8
8
10
—
—
7
4*2
8
8
6
—
—
—
2
2
8
—
4
4
3
5
5
—
8
—
8
8
6
1
—
—
—
—
—
—
—
—
3
5
' 5
—
9
4*а
8
8
6
1
1
1
2
6
—
10
4
4
3
5
5
6
10
—
8
7
5
1
—
—
2
2
—
—
1
4
3
5
5
5
И
—
.—
—
4
—
—
—
2
2
3
—
3
5
3
5
5
5
12
[211]
[227]
[227]
[128]
[317]
[173]
[173]
[10]
[10]
НО]
[303]
[296]
[296]
[67, 254]
[254, 67]
[67, 254]
[67, 127]
0,7 %-ная
Ртуть хлорная (ТК):
0,1 °/о-ная
0,7 %-ная
5 %-ная
Ртурь цианистая 5 %-ная
Салициловая кислота:
0,5 %-ная
10 %-ная
Свинец азотнокислый, 50 %-
ный
Свинец, расплав
Свинец уксуснокислый,
концентрацией, %:
20
25
кип
20
^кип
20
^кип
20
^кип
'кип
20
20—85
20
400
600
900
20
90
^кип
90
10
9
10
7
10
8
10
10
3
3
5
—
10
—
3
5
б
5
б
10
8
10
6
9
7
10
10
3
3
4
5
9
—
3
4
5
4
5
10
7
10
6
8
7
10
10
3
3
5
8
9
—
3
4
5
4
5
—
—
—
10
—
10
10
10
—
10
—
10
—
.—
—
—
—
__
—
—
—
5
—
5
6—3
—
3
—
—
5
—
—
—
—
—
—
8
5
—
—
5
—
3
—
—
5
7—8
7
10
6
8
7
4
9
5
2
2
3
5
7
8
9
2
3
5
3
5
б
7
10
5
6
—
8
9
5
2
2
3
5
5
6
8
2
3
5
3
5
5
—
—
5
5
—
4
5
2
2
—
5
—
—
—
—
4
*' В этих условиях может применяться хромомарганцевоникелевая сталь 08Х18Г8Н2Т (КО-3), которая корродирует равномерно со
скоростью 0,0362 г/(м2-ч).
*2 ТК.
*3 Реакционная смесь содержит 0,3—0,4 % двуокиси углерода.
*4 Дегустация образцов ириса, находящихся в контакте с коррозионностойкими сталями типа Х18Г14Н4Т, показала, что масло
темнеет и имеет неприятный запах.
*5 Хромистые коррозионностойкие стали в контакте с розовым маслом ухудшают его запах и цвет.
*6 Углеродистые стали и чистое железо в контакте с розовым маслом изменяют его цвет до темно-коричневого.
*7 В указанных условиях титан — стойкий, медь — нестойкая. Сталь СтЗ при комнатной температуре корродирует со скоростью 0,916 мм/год.
Коррозионностойкие стали окрашивают пропионовую кислоту, поэтому оборудование для последних стадий получения товарного продукта
следует изготовлять из титана ВТ-1, который не влияет на цвет и качество пропионовой кислоты.
*8 Высокой стойкостью обладают никель и его сплавы.
Продолжение табл. 10
3
4
5
6
—
—
4
4
5
5
7
10
5
3
4
5
7
10
6
5
—
—
—
7
—
—
—
8
—
—
—
9
3
4
5
—
—
10
3
4
5
—
—
11
2
3
4
7
10
Свинец уксуснокислый,
концентрацией, %:
75
насыщенный раствор
То же
Селен:
простая или
окислительная переплавка и его
дистилляция
сжигание селена в токе
кислорода
Селитра аммиачная
Селитра калиевая или
калийная (нитрат калия)
Сера:
расплав
»
кипящая
Серебро азотнокислое:
5 %-ное
10 %-ное
расплав
Серебро бромистое (ТК)
Серебро хлористое (ТК)
Серная кислота*
концентрацией, %:
0,15
0,5
0,5
0,5
(под давлением)
20
90
230—210
550—600
114
130
445
20
^кип
250
50
20
50
100
195
См. аммоний азотнокислый
См. калий азотнокислый
5
6
10
<5
10
—
9
8
8
10
—
4
5
10
<5
9
9
5
8
7
8
10
—
3
4
8
<5
8
5
7
6
10
10
8
9
—
10
10
10
10
—
10
—
—
<5
5
5
5
—
4
3
4
7
—
—
—
<5
5
6
5
—
3,
• 2
3
6
—
5
6
8
<5
5
6
8
5
6
4
6
8
—
5
6
—
<5
5
6
5-6
5
4
3
5
7
7
—
—
<5
—
—
—
2,
1
2
5
6
2,0
2,5
З
10
20
50
85
20
70
20
50
80
100
- 20
50
75
85
*кип
20
50
75
t
8
10
10
9
10
9
10
10
10
10
10
10
10
10
10
10
10
10
10
10
10
10
10
10
10
10
9
10
10
8
10
10
7
10
10
8
10
8
10
10
10
8
10
10
10
10
10
10
10
10
10
10
10
10
10
10
10
10
8
10
10
7
9
10
6
10
—
10
7
10
10
10
7
10
10
10
10
10
10
10
10
10
10
10
10
10
10
10
10
8
10
10
6
8
10
10
10
—
10
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
5
—
10
—
—
3
4
6
3
6
3
4
6
8
3
4
8
9
10
5
6
7
10
7
8
9
10
7
7—8
8
10
4
10
10
4
9
—
2
3
6
3
5
3
4
5
7
3
4
7
8
9
4
5 -
6
10
6
7
8
10
6
6—7
7
10
4
9
10
4
8
4
6
S
4
7
4
6
7
9
3
6
8
9
10
5
6
7
10
7
8
9
10
7
7—8
8
10
4
10
10
5
9
10
3
5
7
3
6
3
5
6
8
2
5
7
8
9
4
5
7
10
7
8
9
10
6
6—7
7
10
3—4
9
10
5
8
10
1
2
—
1
3
2
3
3
4
Г
3
4
4
5
3
3
4
5
2—3
3—4
5
6
3
3
4
7
1
6
8
1
1
<j
/
8
кип
20 20
60
75
100
25 20
40 20
50
100
60 20
70
100
80 20
60
80
ПО
* Присутствие малых количеств азотной и мышьяковистой кислот, меди, оксидов железа и некоторых органических веществ оказывает
защитное действие. Аэрированные растворы серной кислоты менее агрессивны, чем растворы, не содержащие воздуха. В данной таб-
лице приведена коррозионная стойкость при отсутствии воздуха, т. е. для более жестких условий.
1
Серная кислота концентра-
ттыртт 0Z •
ULHtrJH, /0 .
85
85
93
94
98
100
То же, с 5 % SO3
» » 10 % SO3
» » 60 % SOg
» » 60 % SO3.
Тоже, 1—2 %, под
давлением
Всех концентраций под
давлением
Сернистая кислота*
концентрацией, %:
2
20
насыщенная
То же
2
20
60
80
120
20
80
ПО
70
80
20
100
150
20
70
150
65
100
20
65
190
190
250
20
50
20
20
100
3
8
9
10
5
—
6
8
10
5
—
10
.—
—
9
9—10
10
4
7
8
10
5
6
8
10
4
—
10
—
—
—
7
8
9
8—9
10
5
6
8
10
5
—
6
7
10
4
—
10
—
—
—
7
8
8
8
10
6
10
—
—
—
—
—
6
—
—
—
—.
—
—
8
—
—
—
7
—
—
4
10
10
9
9
4
10
10
4
—
5
5
—
10
10
—
—
—
5
—
8
3
8
8
3
9
10
8
8
3
9
10
3
7
10
—
5
5
—
10
10
—
—
—
5
—
9
4
8
8
10
4
10
10
10
10
4
10
10
5
9
10
8
5
5
—
10
10
—
—
5
5
8—7
Продолжение і
10
4
- 8
8
9
3
9
10
8
8
3
9
10
3
8
Ю
—
5
5
—
10
10
—
5
5
5
11
2
4—5
5
6
1
5
8
1
1
1
5
10
1
5
8
—
—
10
10
10
—
—
—
—
4
naoj
г. 10
12
254]
254]
254]
254]
254
254
254
[254]
[254
[254
[19, 30]
[254]
. [254]
[254]
[30]
[154]
254]
254]
254]
[254]
[254]
[19]
[254]
[19]
[253]
[67]
Сернистый газ:
насыщенный водный
раствор
насыщенный водный
раствор при р, МПа:
0,39
0,58
0,78
0,98
1,76
Сероводород:
влажный
сухой
влажный
сухой
Сероводород
Сероводород и водяной пар
20
135
140—150
160
180
200
20
20
100
200
200
170
200
310
360
420
550
650
170
9ПП
310
360
420
500
550
650
10
10
—
4
5
—
10
5
—
—
—
9
9
—
8
5
—
10
5
—
—
—
9
—
5
—
10
5
.
—
—
—
10
—
—
10
—
—
—
7
7
8
9
10
10
10
10
8
8
8
9
10
10
10
—
—
—
—
—
—
—
4
—
—
2
—
—
—
—
—
—
5
—
—
—
—
4
—
2
.
—
—
—
5—6
7
7
о
о
8
9
'з
5
10
5
1
1
6
7
8
10
10
10
5
6
6
8
10
10
5
5
5
с
О
7
8
3
5
—
—
—
—
—
4
2
—
2
4
—
—
—
* Контакт свинца и сталей с молибденом в сернистой кислоте опасен.
1
Сероводород, разбавленный
азотом*
1
j
Серосинеродистый каліїй
Сероуглерод
Сильвинит
Силикат калия
Синь-кали желтое
Синь-кали красное
Скипидар
В смеси кислот**,
содержащих 600 мг/л ионов С1:
HNO3@,l %) +
+ H2SO4@,5 %)
HNO3@,5 %) +
+ H2SO4@,l %)
HNO3@,5 %) +
+ H2SO4 @,5 %)
HNO3(l,0 %) +
+H2SO4(l,0 %)
Смесь кислот, %:
азотная + серная
0,5 70
1,0 50
2
170
200
310
360
420
500
550
650
^кип
35
160
160
160
160
70
50
3
—
—
—
—
—
4
—
—
—
—
—
5
—
—
—
—
—
—
6
6
7
8
8
8
10
10
—
См. калик
5
5
5
-—
7
—
—
—
—
—
—
8
—
—
—
—
—
роданистый
5
5
См. калий хлористый
См. калий
См. желтая кровяная соль
См. красная кровяная соль
5
—
—
—
—
—
—
5
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
10
10
кремнекислый
9
—
5
7
7
—
6
6
5
'железистосинеродистый
(железосинеродистый
—
9
6
8
8
—
4
—
8
4
4
5
—
4
1
9
7
8
8
6
5
Продолжение
10
—
—
—
—
5
калий)
калий)
1
8
4
5
6
5
4
11
—,
—
—
—
—
5
—
6
4
4
4
3
4
табл
і Ю
12
[155
[155
[155
[155
[155
155]
155]
155]
[29, 254]
[67]
[102]
[102]
[102]
[102]
[253]
[253
]
1,9
3
3
3
3
3
3,3
5
5
5
5
5
5
5
8
10
10
10
10
10
10
10
ЗО
10
10
13
15
15
15
15
20
20
20
82
ЗО
ЗО
60
60
69
52,5
15
ЗО
ЗО
50
55
65
65
40
10
25
50
60
60
60
70
5
70
70
38
20
60
80
80
70
80
80
60
50
^кип
ПО
^кип
60
85
^кип
95
К5И0П
85
70
100
80
65
85
85
60
ПО
160
160
50
95
168
85
50
60
20
60
60
20
60
—
—
—
—
—
—
—
—
—
—
:
—
—
—
—
10
—
—
7
5
7
—
5
6
—
10
—
—
—
—
—
—
—
—
—
—
—
—
5
—
10
4
6
—
4
¦ —
10
—
—
—
—
—
—
—
—
—
—
—
—
5
10
—
—
—
4
6
—
4
—
10
—
—
—
10
10
—
10
—
10
10
10
—
10
10
10
—
10
—
—
10
10
—
10
10
10
10
—
4
8
—
5
5
5
—
5
5
7
9
5
5
5
—
—
5
—
5 .
4
5
4
—
4
7
—
5
7—8
5
5
—
5
5
5
9
6
6
5
—
—
5
—
5
4
—
5
4
—
5
7
6
8
5
5—6
5
5
8
5
5
8
10
6
5
6
6
5
7
10
5
7
10
7
5
5
6
5
5
6
5
6
—
5
5
5
5
—
5
5
7
9
6
6
5
—
5
7
10
6
5
4
—
5
4
—
4
—
5
5
5
5
—
5
5
—
5
.
5
—
—
5
—
—
5
—
5
—
5
3
і
и
[
12
[
[2
- [2
[:
[2
Г С
с
с
с
і
[
[.
[.
[2
[
[.
[
[2
[
[2
[2
* В этих условиях высокой стойкостью обладают алюминиевые сплавы, а также чистый алюминий, но совершенно нестойка медь.
** В этих условиях коррозионностойкие стали и сплавы, помимо общей коррозии, подвержены МКК и ТК. Для их уменьшения сле-
to дует применять воду с минимальным содержанием ионов С1.
4*
Продолжение табл. 10
1
Смесь кислот, %
25 25
25 25
25 70
25 70
25 70
25 75
25 75
25 75
30 10
30 25
36 5
38 60
40 10
40 20
40 25
40 60
40 60
40 60
50 10
50 50
50 50
50 50
52 45
55 5
88 %-ная азотная + 12 %-
ная серная, остальное вода
Азотная + уксусная
20 20
40 20
Азотная E0 %-ная) -f
щавелевая C50 г/л)
2
80
40
20
60
100
60
95
157
85
85
85
50
85
85
85
20
60
100
85
Щ
95
^кип
40
85
10—27
120—150
20
20
70
3
—
5
5
6
9
8
—
10
—
—
—
—
—
—
5
8
9
—
7
*>
—
5
—
3
5
—
—
—
4
—
5
5
6
8
7
—
10
—
—
—
—
—
—
—
5
7
8
—
7
—
—
5
—
—
—
—
—
—
5
—
5
5
5
7
5
—
10
—
—
—
—
—
—
—-
5
7
8
—
6
—
—
5
—
—
—
—
—
—
6
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—.
—
—
—
10
10
—
—
—
10
—
—
—
10
7
—
4
4
—
—
5
—
—
5
5
—
5
5
—
5
—
—
5
—
—
—
5
—
—
—
3
—
8
—
4
5
—
—
5
—
—
—
—
—
—
—
5
—
5
—
—
5
—
—
—
—
—
—
—
3
—
9
7
5
5
5
7
5
7
9
5
6
5
5
5
5
8
5
7
6
6
5
7
10
5
5
4
8
3
3
5
10
—
4
4
5
—
5
—
—
—
5
5
—
5
—
5
6
6
—
5
6
10
5
—.
—
—
3
—
4
11
—
4
4
5
—
—
—
— ¦
—
—
—
—
—
—-
—
—
—
—
—
—
—
—
—
—
3
—
4
12
[253]
[253]
[253]
[19]
[253]
[253]
[19]
[19]
[19]
[253]
[253]
[19]
[253
[253
[253
[253
[253
[19]
[19]
[253]
[19]
[19]
[19]
[253]
[30]
[30]
253]
253]
253]
Серная
2
2
5
Серная
10
уксусная
О", 55
25
90
• уксусная
90
Смесь кислот, ,„.
серная + уксусная +
уксусный ангидрид
5 47,5 47,5
5 47,5
5 47.5
Смесь кислот,
47,5
47,5
серная + фосфорная
1 30
2 40
2 40
H2SO4 (плотность 1,83), 12 %
(объемн.) + Н8РО4
(плотность 1,579), 75 %
(объемн.) + глицерин, 13 %
(объемн.)
H2SO4 (илотность 1,83),
33 % (объемн.) + вода, 34%
(объемн.) + глицерин, 33 %
(объемн.)
H2SO4 (плотность 1,83),
40 % (объемн.) + Н3РО4
(плотность 1,579), 40 %
(объемн.) + хромовый ангидрид,
3 % (объемн.) + вода, 17 %
(объемн.)
Серная A %), фосфорная
E5 %) и кремнефтористово-
дородная A %) кислоты (ТК)
ип
80
20
20
20
40
80
20
80
^кип
90
60
90
90
70
10
10
—
10
9
10
—
—
—
10
10
—
10
10
10
8
10
—
—
—
10
10
—
8
7
10
—
—
—
—
—
—
10
10
—
—
—
—
5
3
5
8
10
—
—
—
—
4
2
4
5
7
10
8
10
5
5
8
5
5
3
5
7
8
9
10
10
5
—
8
7
4
4
2
4
5
7
—
—
9
8
4
—
2
4
5
5
5
5
—
1
Уксусная F3 %) и
муравьиная C,3 %) кислоты при
давлении р = 0,78 МПа
Уксусная (80 %) и
муравьиная @,1 %) кислоты
Уксусная (96 %) и
муравьиная @,35 %) кислоты
Уксусная (98—99 %) и
муравьиная @,3 %) кислоты
Смесь продуктов окисления
н-бутана F4 % уксусной
кислоты, 3 % муравьиной
кислоты, 8 % этилметилке-
тона, 3 % ацетона, 4 %
бутилового спирта, 1 % бутил-
ацетата, остальное вода)
Смесь кислот Сі—С4 B5 %
уксусной кислоты, 46 %
муравьиной, 95 % пропионо-
вой, 9,5 % масляной
кислоты, 10 % воды)
Смесь кислот, %:
уксусная + муравьиная
60 2
60 5
60 10
96 2
93 5
88 10
60 10
с доступом воздуха в
открытых сосудах:
2
145
103
70
113
50
118
140
160
20
60
*кип
/кип
?кип
'кип
/кип
'КИП
*кип
60
3
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
4
—
—
—
—
—
—
—
4
5
8
8
—
5
—
—
—
—
—
—
—
—
—
—
—
—
6
—
—
—
—
—
—
—
—
—
—
—
—
—
—
7
6
7
4
8
2
8
8
8
4
5
8
7
8
8
6
7
—
5
8
5
3
1
3
2
5
6
6
4
5
7
5
6
6
5
5
6
4
9
6
3
3
5*
3
5*
8
8
4
5
8
8
8
8
6
7
—
5
Продолжение і
10
5
2
1
3
2
4*
6
6
4
5
7
6
6
6
5
5
6
4
И
—
—
— •
—
—
—
—
—
—
—
—
—
—
—
—
—
2
-абл. 10
12
[17, 254]
[17, 254]
[17]
[254]
[17]
[254]
[38]
[38]
[38]
[38]
[38]
38]
38
38
38
38
38
38]
90 10
90 2
Уксусная кислота
техническая
Уксусная кислота 90 %-ная
Уксусная кислота 90 %-
ная + муравьиная 2 %-ная
Уксусная кислота 90 %-
ная + муравьиная 5 %-ная
Уксусная кислота 90 %-
ная
Уксусная кислота 90 %-
ная + муравьиная 20 %-
ная
Уксусная кислота 90 %-
ная + муравьиная 5 %-ная
Смесь кислот:
50 % уксусной + 4 %
муравьиной при
давлении, МПа:
0,02
0,19
0,29
0,02
0,39
0,78
Смесь жирных кислот:
С5-С9
60
95
95
В токе
воздуха
V= 250
см3/мин
95
В токе
азота
V= 250
см8/мин
150
150
150
165
165
165
225
265
280
300
z
—
_
—
—
—
—
—
5
—
—
—
—
1 1 1 1 1 1
—
—
—
—
—
6
4
4
6
4
—
—
—
—
—
—
—
5
5
6
4
5
5
6
7
7
—
6
8
8
9
4
5
4
4
4
4
6
5
6
6
4
4
8
5
5
5
7
5
5
6
4
5
6
6
7
7
7—8
7—9
5—8
8
8
5
6
7
7
8
4
5
4
3
4
4
4
4
6
8
4
4
8
7
4
5
5
5
7
3
4
—
—
—
—
—
—
тк.
Продолжение табл. 10
1
'Смесь жирных кислот:
Сів—Сів
С17—C2i
Фосфорная кислота (80 %-
ная) и 1 %
фтористоводородной (ТК)
Фосфорная кислота 75 %-
ная + 2 % H2SO4
То же + 2 % H2SO4 +
+ 0,6 % F'
То же + 2 % H2SO4 +
+ 120 мг/л С1
То же + 2 % H2SO4 +
+ 0,8 F' + 120 мг/л С1
Сернистая кислота +
кислый сернистокислыи
кальций; H2SO3 + Са (HSO3J
Водный раствор с 6 % SO2
Смесь кислот и солей
Азотная кислота F0 %) +
+ насыщенный
азотнокислый натрий
Серная кислота A5 %) +
+ азотнокислый натрий
E %) + соляная кислота
C %)
2
225
265
280
300
225
265
280
300
120
30
30
30
30
140
70
80
3
—
—
—
—
—
—
—
—
10
—
—
—
—
—
—
—
4
—
—
—
—
—
—
—
—
10
—
—
—
—
—
—
—
5
—
.—
—
—
—
—
—
—
10
—
—
—
—
—
—
—
6
—
—
—
.
—
—
—
—
10
—
—
—
—
10
—
—
7
6
8
8
9
6
8
8
9
9
—
—
—
—
—
5
—
8
5
5
5
7
5
5
5
7
8
—
—
—
—
5
5
—
9
6
7
7
8*
6
7
7
8
10
3
8
5
9
8
5
—
10
5
5
5
7
5
5
5
7
7
2
5
4
7
5
5
—
11
—
—
—
—
—
—
—
6
—
—
—
—
—
—
10**
12
[38]
[38]
[38]
[38]
[38]
[38]
[38]
[38]
[2531
[233]
[233]
[233]
[2-33]
[254]
[253]
[254]
дву-
%
5
2,5
5
5
Серная кислота, % +
сернокислый аммоний, %
1 38
2 40
2,5 55
Молочная кислота B%) +
+ двухромовокислый калий
B,5 %)
Серная кислота,
хромовокислый калий,
1
1,5
5
10
Серная кислота, % -\-
сернокислый аммоний, %
1 35
2 40
2,5 55
10 Насыщенный
(NH4JSO4 G5 %-ный
раствор) + до 20 г/л
свободной H2SO4 (р = 0,098 МПа
A ат)
Серная + сернокислое
кисло- железо (закис-
та, % ное), %
8 20
10 2
кип
90
100
35
^кип
35
35
Ип
90
100
100
80—90
10
10
3
4
4
10
5
8
10
10
—
2
—
3
3
10
—
5
8
—
2
—
3
3
5
7
—
10
10
10
8
5
—
5
5
—
—
5
—
4
7
5
5
—
4
7
8
5
8
5
2
5
3
—
8
5
8
9
5
4
8
5
2
5
3
3
4
9
8
2
5
3
3
* тк.
** Сплавы, в том числе ХН40МДТЮ, подвержены МКК.
Продолжение табл. 10
1
Серная + сернокислая
кисло- окись железа, %
та, %
2 10
8 1
8 2
10 2
Серная + сернокислая
кисло- медь, %
та, %
5 1
4 5
5 Насыщенная
8 0,05
8 1
8 5
10 10
Серная кислота E %) и
сернокислый натрий A5 %)
Азот-+ азот- + азотно-
ная кис- нокис- кислый
лота, % лый ка- алюми-
лий, % ний, %
15 13 30
65 11 20
Серная + сернокислый
кислота, никель
500 г/л 400 г/л
Серная + сернокислый
кислота, % цинк, %
0,5 30
2 30
2
100
20
20
^кип
20
20
20
80
20
20
^кип
95
90
60
ПО
^кип
80
3
—
4
2
5
10
5
5
10
10
7
8
10
—
10
—
10
4
—
3
2
5
9
5
5
10
8
7
7
9
—
10
—
10
5
—
3
2
4
8
5
5
10
8
6
—
—
—
10
—
—
6
—
—
.
—
10
.
8
—
—
—
10
—
—
7
4
3
3
9
5
5
5
9
5
5
5
—
—
10
—
—
8
4
3
3
8
4
4
4
9
5
4
5
5
—
10
5
8
9
5
4
3
9
5
5
5
9
5
5
5
9
5—6
5—6
10
—
9
10
4
3
3
8
4
4
4
8
5
4
5
9
5—6
5—6
9
8
—
11
3
3
3
—
3
3
3
—
—
6
—
—
12
[253]
[253
[253
[253
253]
253
253
253
253
253
253
253
[19]
П9]
[254]
[253]
[
253]
2 45
Серная кислота и
сернокислый кальций (водный
раствор с 6 % SO2)
Серная кислота C %) и
суперфосфат
Уксусная + хлористый
кислота, % натрий, %
7 5
10 5
Уксусная кислота +
уксусный цинк + хлористый
ангидрид
33,3 + 33,3 + 33,3
33,3 + 33,3 + 33,3
Фосфорная кислота A0 %)и
азотнокислый аммоний
C0 %)
Фосфорная кислота (до
15 %), серная кислота (до
20 %) и сернокислый
аммоний (до 30 %)
Фосфорная кислота D %),
серная кислота B %) и
сернокислый кальций E0 %)
Смесь солей: 300 г/л
HNO3+ 120 г/л Р2О5 и
растворов аммиачной
селитры (под налив)
Двухромовокислый калий
2,5 % + аммоний
уксуснокислый 3 %
Железо натрий хлори-
хлорное стый
5 10 (ТК)
5 10
80
140
20
70
20
40
80
100
50
!0—90
25
70
10
—
—
—
—
—
—
—
—
10
—.
—
5
9
—
—
—
—
—
¦
—
—
5
9
—
—
—
—
—
—
10
—
—
—
—
—
10
—
—
—
3
5
—
—
5
—
10
8
—
5
5
3
5
5
—
5
—
5
5
10
9
7
5
6
6—7
5
8
5
8
5
5
5
10
6
5
5
5—6
3
5
5
—
5
—
5
5
10
—
—
—
—
5
—
—
10
[253]
[19]
[19]
[253]
[253]
[253]
[253]
[253]
[254]
[19]
[51]
[254]
[19]
[254]
Продолжение табл. IQ
—
—
—
—
—
10
9
5
5
4
—
—
—
—
—
10
10
—
5
5
—
—
—
—
—
—
—
—
5
6
10
—
—
—
—
—
—
—
8
7
—
—
—
9
10
9
10
9
—
—
—
—
8
5
—
—
8
10
9
10
9
—
5
—
—
9
5
5
8
6
9
10
9
10
9
10
—
6
5
5
10
5
5
—
8
9
8
10
8
10
5
—
5
И
—
5
—
7
9
7
10
7
—
—
—
—
Смесь иода 2 % + йодистый
калий 1 %-ный водный
раствор (ТК)
Натрий хлорноватистокис-
лый> % + натрий
хлористый, %
30 5
35 + насыщенный раствор
NaCl
70 + насыщенный раствор
NaCl
Хлорная + натрий хлори-
медь, % стый, %
2 5
5 10
10 10
Смесь щелочи и солей, г/л:
едкий натр 65 % +
натрий сернистый 10 %
едкий натр E0 %) +
натрий фосфорнокислый
(Ю %)
едкий натр G %) +
хлористый натрий @,4 %)
едкий натр B,5 %) +
сернистый натрий A %)
Газо-жидкая смесь
(газожидкий поток, содержащий
углекислоты 10 % и
сероводорода 5 % и водяной пар при
20
120
120
70
К7И0П
'КИП
70
165
80
кип
кип
150
[254]
[19]
[19]
[19]
[130]
[130]
[130]
[130]
[130]
[254]
[254]
[49]
[19]
[254]
давлении р = 29,4 МПа
Смесь хлористого метила с
водой
[хлористый метил,
насыщенный водой (жидкая фаза)]
Вода, насыщенная
стым метилом
хлори-
Вода — жидкий хлористый
метил (граница раадела фаз)
Вода — газообразный
хлористый метил (граница
раздела фаз)
Смола (паровая фаза)*
Смола очищенная
Смола, содержащая 15 %
кислот (паровая фаза)*
Смола, содержащая 12 %
кислот (паровая фаза)
Сода
Соляная кислота (ТК)
концентрацией, %:
0,2
0,5
15
40
50
60
76
40
50
60
70
76
15
80
60
70
220
^кип
'кип
170
20
50
20
50
—
_
1
—
—
1
1
4
7
—
—
—
1
1
—
—
1
3
3
6
6
9
9
9
10
5
6
8
10
—
—
—
—
—
—
—
1
1
2
6
—
—
—
—
—
—
—
—
1
1
5
6
1
1
1
1
2
1
1
5
6
6
2
5
2
6
1
1
4
7
—
—
—
—
—
1
—
—
—
—
—
—
—
—
—
См. натрий углекислый
кип
20
50
8
8
8
8
10
9
9
6
7
6
7
10
9
9
6
7
6
7
10
8
9
9
10
10
—
5
6
10
6
9
4
5
5
6
9
5
8
4
5
5
6
9
5
9
4
5
4
5
8
5
8
4
5
4
5
8
4
6
В жидкой фазе металлы корродируют меньше. Алюминий в этих условиях нестоек.
Продолжение табл. 10
1
Соляная кислота (ТК)
концентрацией, %:
2
3
5
10
20
30
37
Спирт амиловый
Спирт бензиловый
То же
Спирт бутиловый
Спирт метиловый а/
То же
Спирт этиловый
То же
Спирт этиловый + 1 %
H2SO4
Спирт метиловый с
примесями НС1 @,07—0,082 %)
Стеариновая кислота
2
20
60
20
20
60
20
60
20
60
20
60
20
60
100
100
20
*кип
20
20 «*-
*кип
20
*кип
40
18—25
20
80
100
130
3
9
10
9
9
10
10
10
10
10
10
10
10
10
10
5
3
3
ЗГ-*
2
4
—
3
5
6
—
4
8
9
9
8
10
10
10
10
10
10
10
10
10
10
—
2
2 .
3
2
3
—
2
2
3
5
—
5
8
9
8
8
10
10
10
10
10
10
10
10
10
10
—
—
2
1
2
1
2
—
5
2
3
4
—-
6
—
10
—
—
—
—
—
10
—
6
6
6
5
8
6
9
5
—
—
7
6
9
6
7
10
7
10
9
10
9
10
10
10
10
—
—
' Г
2
2
—
—
—
—
8
5
8
5
6
9
6
9
8
8
8
9
10
10
10
—
—
—
—
—
—
—
—
—
—
—
—
9
5
9
5
6
9
6
9
8
8
8
9
9
10
10
3
1
4
1
1
3
1
2
6
5*
2
3
4
5
10
5
8
5
5
8
6
9
7
8
7
8
9
10
10
2
1
3
1
1
1
1
2
4
5*
1
2
3
3
И
і
5
8
5
5
7
6
8
6
8
6
7
7
10
10
1
1
—
1
1
1
1
2
—
—
л 1
—
2
—
12
[19]
[254]
[19]
[254]
[19]
[30]
[19]
[254]
[19]
19
19
49
19
[49]
37]
37
37
37
37
371
37]
37]
[173]
[297]
[127]
[19]
[37, 127]
[19
]
Стирол
Сулема
Сульфат цинка A4 %),
насыщенный раствор
Сульфид натрия
Сульфитовый газ,
содержащий отходящие газы при р =
= 0,58 МПа
Сульфитовый щелок, свежий
варочный или отработанный
Скипидарное масло
Скипидар
Син-кал и желтое
Сурьма расплавленная
Сурьма хлористая
Танин:
10 %-ный
50 %-ный
Тетрахлорид циркония в
потоке паров
Тионилхлорид:
чистый
сырец
_ Толуол
Треххлористая сурьма всех
концентраций
300
20
ии
20
^кип
150
20
80
1 4П
і tu
20
35
КИП
650
20
^кип
20
^кип
350
450
830
45
45
201
8
2
5
8
7
См.
4
7
6
—
ртуть хлорная
3
—
—
- —
1
—
—
6
1
5
(двухлористая ртуть)
1
2
2
3
2
3
5
—
4
—
1
2
—
10
10
См. натрий сернистый
10
10
3
3
—
10
10
3
3
4
—
10
2
2
4
10
10
—
—
—
—
—
—
—
4
5
—
—
—
—
1
8
3
6
8
1
2
4
5
2
4
5
1
2
—
—
—
—
—
1
—
См
10
желтая кровяная соль
| 10 | 10 | 10
10
10
10 ! [49, 1271
3
6
4
9
—
5
4
5 „-
10
2
5
2
6
—
• 5
5 _
10
См. і
2
5
2
6
—
5
10
греххлор
—
—
6
8
истая с
—
—
—
—
—
—
7
10
урьма
—
—
—
—
8
1
4
2
5
6
7
10
4
4
5 *
10
1
4
2
5
—
—
—
5 '
8
1
—
—
—
—
—
—
5 і
7
¦Максимальную скорость коррозии сталей 12Х18Н10Т и 10Х17Н13М2Т наблюдают при температуре 38—50 °С. Она составляет 1,0—
1,2 мм/год. При температуре от > 50 °С до *кип скорость коррозии уменьшается.
Продолжение табл. Ю
1
Триоксибензойная кислота
Тринитрофенол
Трифторуксусная кислота:
Ю—60 %-ная
60—99,5 %-ная
Трихлоруксусная кислота,
водные растворы,
концентрации до 55 % (ТК)
Трихлорэтан
Триэтаноламин
Трихлорэтилен*1
Углеводородный конденсат,
содержащий сероводорода
2000—6000 мг/л*2
Углекислый газ (двуокись
углерода), насыщенный
парами воды, р = 19 МПа
B00 атJ*
Угольная кислота (водный
раствор), р= 1,3 МПа
Насыщенный раствор
Уксусная кислота
концентрацией, %:
1
«_
2
20
50
80
20
50
80
20
'кип
^кип
20
20
^кип
110—120
54,5
20
90
^кип
20
50
3
—
10
—
7
—
5
9
—
—
5
8
5
—
6
7
4
—
—
10
—
—
—
5
8
—
—
—
7
5
—
5
6
5
6
7
8
См. галловая кислота
См. пикриновая кислота
—
10
—
—
—
5
7
—
—
—
5
5
4
6
—
10
10
6
6
5
10
2
8
—
—
—
—
8
—
1
2
3
2
6
6
—
—
—
1
—
—
—
2
—
—
4
5
1
3
—
—
—
—
—
—
—
5
—
—
—
5
3
4
1
2
9
1
2
3
3
6
8
<5
<10
5
1
<5
6
1
3
5*з
—
4
5
1
3
10
П
12
1
2
3
2
5—6
8
<5
<10
5
—
<5
5
—
—
—
—
3
4
1
2
1
1
1
1
1
4
<5
<10
—
—
<5
5
—
—
—
—
—
—
—
—
220]
220]
220]
220
220
220
[37]
[37]
37]
37
67
37
[304]
[51]
—
[164]
[127]
[127]
[254]
[19]
10
Уксусная кислота, %:
15
15
15
15
20
20
25
25
25
25
33
33
33
33
50
50
50
50
50
50
50
50 (пар)
75
90
^кип
20
75
90
20
40
80
20П
^кип
50
75
90
2К0П
40
80
20П
50
60
75
90
100
''кип
'кип
8
9
10
7
8
9
10
7
8
9
10
7
10
8
9
9
10
8
8
10
10
7
8
—
8
9
10
10
6
7
8
6
7
8
9
6
7
8
9
6
9
7
8
8
10
7
8
9
10
7
7
—
7
8
9
10
10
6
6
7
6
6
7
7
6
7
7
8
6
8
7
7
7
9
6
7
8
9
6
7
7
7
8
10
10
10
—
—
10
10
10
4
6
2
3
5
6
1
2
4
2
6
2
3
1
3
4
—
1
3
4
9
3
3
4
5
1
2
4
5
1
2
3
5
1
5
3
4
4
5
1
2
3
5
1
2
3
4
5
5
7
3
4
6
6
2
3
5
8
1
4
5
8
2
8
3
5
7
8
1
3
5—6
8
3
3
4
5
6
8
9
10
3
4
5
1
2
3
5
1
2
3
5
1
4
2
3
4
5
1
2
3
1
2
3
4
5
5
5
—
—
—
—
—
1
—
—
—
—
—
—
—
—
—
—
—
—
—
*' В присутствии влаги скорость коррозии металла возрастает.
*2 Высокой стойкостью обладают алюминий и его сплавы.
*3 В присутствии H2S наблюдают коррозионное растрескивание.
Продолжение табл. 10
1
Уксусная кислота, %:
60
60
60
70
70
70
80
80
80
80
концентрированная
»
»
»
»
»
98
98
100
100
100
100
100
і 00
Уксусноамиловый эфир
Уксуснобутиловый эфир
Уксусный ангидрид
То же
2
20
40
20
40
'кип
20
40
80
'к
20
75
80
90
100
'кип
165
200
'кип*
20
75
80
90
100
'кип
20
80
'кип
3
7
8
10
7
8
10
6
8
9
10
5
6
7
8
9
10
—
—
6
7
8
9
10
10
5—6
8
10
4
6
7
—
5
7
8
9
3
5
—
—
8
9
—
5
5
8
10
5
5
9
5
6
7
—
5
6
—
8
3
4
—
—
8
8
—
5
5
8
6
10
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
7
3
5
6
3
4
7
1
3
—
8
3
3
—
5
—
—
9
—
6
—
6
8
3
5
5
2
3
6
1
2
4
6
2
3
3
5
6
6
7
—
5
4
—
5
5
6
7
См. амилацетат
См. бутилацетат
7
—
10
—
—
8
2
—
7
9
3
5
7
3
4
8
2
5
5
8
3
3
4
5
—
8
8
10
7
5
6
7
6
8
3
5
8
10
2
3
5
2
3
5
2
4
5
6
2
—
3
5
—
6
7
8
5
4
5
5
6
2
4
5
11
—
—
6
—
—
—
—
—
6
6
—
—
—
—
—
12
[19]
[254]
[17]
[19
[19]
[254
[254
[254
[19]
[130]
[254]
[67]
[19]
[19]
[254]
[44]
[130]
[44]
[38]
[253]
[253]
[253]
[253]
[253]
[253]
—
[67]
[44]
Фенил амин
Фенилкарбоновая или орто-
ксибензойная кислота
Фенол
Фенол и вода A0 %)
Фиксаж кислый: 40 %
Na,S2O8-5H2O+ 4,7 %
Na.>SO8-7H2O + 0,5 %
H2SO4
Флюорид натрия
Формальдегид, 40 %-ный
раствор
Формалин:
9,2 %-ный
40 %-ный
Формамид
»
Фосген жидкий, безводный
Фосфат натрия
Фосфиты 24,1 % Р2О5,
3,4 % SO3, 0,94 % F.
Фосфорная кислота**
концентрацией, %:
1
I
5
5
5
5
*кип
20
20
*кип
90
20
'кип
20
^кип
20
76
20
^кип
20
50
85
*кип
См. анилин
См. салициловая кислота
См. карболовая кислота
5 1 - I - I -
См. натрий фтористый
5
10
10
10
5
10
1
См. натрий фосфорнокислый
Ч 2
4
2
5
4
8
4
5
5
3
7
3
4
4
7
2
7
2
3
3
10
—
—
—
—
1
3
1
2
3
4
1
3
1
2
2
4
4
1
3
1
2
2
4
1
3
1
2
2
2
—
2
—
—
149]
253
[253
253
253
253
127
¦Коррозионностойкие стали корродируют сильнее в неаэрированных растворах уксусной кислоты, чем в аэрировавных. В
концентрированной уксусной кислоте сплав ХН65МВ @Х15Н65М16В) устойчив до 200 °С. С повышением температуры скорость коррозии сплава
возрастает. При 250 °С скорость коррозии составляет 1,0 мм/год (в жидкой фазе). Сталь 10Х17Н13МЗТ устойчива до температуры 150 °С.
•* Следы плавиковой и серной кислот, содержащихся в фосфорной кислоте, ускоряют коррозию. В таких случаях рекомендуется
применять хромоникелевые стали с молибденом.
Продолжение табл. Ю
1
Фосфорная кислота*1
концентрацией, %:
10
10
10
10
20
25
25
25
25
30
40
45
50
65
80
85
2
20
50
85
^кип
^кип
20
50
85
^кип
20
100
50
100
^кип
20
^кип
20
50
85
^кип
20
80
ПО
60
100
ПО
20
50
3
8
—
—
9
9*2
8
9
9
10
8
10
9
10
10
9
10
8
—
—
10
10
10
10
10
10
10
4
5
4
8
—
—
8
—
7
8
8
—
7
9
8
9
10
7
10
7
7
8
9
8
8
9
9
9
10
4
5
5
6
—
—
—
—
6
7
7
—
6
8
6
8
8
5
9
5
5
6
8
5
6
9
—
9
10
3
5
6
10
—
—
—
—
—
—
—
10
—
—
—
—
10
—
—
—
—
—
—
—
—
—
—
—
—
7
1
3
3
4
—
1
—
3
4
—
4
3
—
—
—
—
2
4
5
—
2
4
7
.—
—
—
4
—
8
1
2
3
4
—
1
3
5
—
4
3
5
—
—
—
2
3
4
2
2
4
6
—
—
—
3
—
9
1
3
3
4
4
1
2
3
5
2
5
3
6
—
—
6—7
3
4
5
—
3
5
8
5
8
9
4
5
10
1
3
3
4
—
1
2
3
4
2
5
3
5
5
—
3
3
4
5
3
5
6
5
7
7
3
4
11
—:
—
3
—
—
—
4
—
—
—
—
—
—
—
2
—
—
—
—
—
—
12
[30, 127]
[44]
[254]
[67, 127]
[152]
[127]
[19]
[254]
[127]
[19]
[254]
[253]
[253]
[19]
[44]
[44]
[67, 127]
[253]
[253]
[130]
[253]
[253]
[254]
[19]
[67]
[44]
[127]
[253]
90
Фосфорная кислота:
концентрированная
10—50 %-ная под
давлением
105 %-ная
Фосфор
Фосфор треххлористый
Фосфора хлорокись
Фотопроявительные ванны
(ТК)
Фреон
Фреон-11*3
Фталиевая кислота
Фталеводибутиловый эфир
Фтор (ТК), сухой газ
85
'кип
20
80
100
180
120
150
200
95
20
76
300
20
104,5
300
20
150
250
20
220
20
200
9
10
5
—
10
10
—
—
—
5
—
—
—
—
—
—
8
2
10
—
8
10
5
—
10
10
—
—
—
5
—
—
—
—
—
—
6
2
4
7
—
8
10
5
—
10
10
—
6
—
—
5
—
—
1
—
1—2
1
5
2
—
—
—
—
—
—
—
—
3
3
6
6
8
5—6
—
5
7
10
—
7
5
5
—
_
10
—
—
1*4
—
—
1
1
4
—
1
—
6
5
4
—
10
10
5
7
10
—
—
1
—
6
8
4
7
10
10
10
5—7
9
10
5
2
2
6
8
3
5
2
4
5
8
5
7
4
6
10
10
10
6
6
10
5
1
1
2
3
4
1
5
5
6
10
1
6
1
8
1
См. дибутилфталат
—
10
—
—
1
1
1
1
*' Следы плавиковой и серной кислот, содержащихся в фосфорной кислоте, ускоряют коррозию. В гаких случаях рекомендуется
применять хромоникелевые стали с молибденом.
*2 Коррозионное растрескивание.
*3 Хромоникелевые стали под напряжением склонны к коррозии. Интенсивно взаимодействуют с фреоном-11 титановые, алюминиевые
и медные сплавы. Медь, сурьма, цирконий, гафний, ниобий сильно изменяют состав газообразной фазы и при избытке фреона могут
полностью превращаться в галогениды.
*4 тк
Продолжение табл. 10
3
10
10
10
10
4
5
8
10
—
—
_
4
10
10
10
5
5
8
10
—
—
5
—
10
10
4
—
—
—
—
—
6
—
10
10
6
8
10
10
—
—
7
—
10
10
10
1
5
—
—
—
—
8
—
10
—
—
8
7
—
—
5
і
—
—
—
—
9
10
10
10
7
8
10
8
1
2
1
3
5
5
10
—
—
__
8
7
8
8
10
10
10
—
7
7
7
8
7
1
2
2
3
5
5
10
5
5
7
8
—
_
7
8
8
10
Фтор (ТК), сухой газ
Фтористоводородная
кислота (ТК)*:
5 %-ная
10 %-ная
40 %-ная
сухой газ
90 %-ная в растворе
80 %-ная в парах
Ф урфурол
(концентрированный раствор)
Хинин сернокислый
(сульфат хинина) всех
концентраций
Хлор (сухой газ):
влажный газ (ТК)
водный раствор; 0,1 г/л
С1 (ТК)
то же
водный раствор 1,3 г/л
С1 (ТК)
то же
водный раствор,
насыщенный (ТК)
Хлор (ТК)
250
300
20
20
100
20
100
115
115
*кип
Пары
20
20
20
20
50
20
50
20
280
315
343
400
455
6
1
1—2
5
5
[30]
[30]
[130]
[263]
[19]
[254]
[30]
ИЗ]
[13]
[19, 37]
[19]
[67]
[254]
[130]
[254]
[254]
[254]
[254]
[30]
[30]
[30]
[30]
[30]
Хлораль (примеси: хлор,
вода, этиловый эфир)
Хлорамин
Хлорбензол
Хлористый аммоний (ТК)
концентрацией, %:
1
5
5
10
10
10
10
25 %-ный, насыщенный
при 20 °С
30 %-ный, насыщенный
при 50 °С
40 %-ный насыщенный
50 %-ный насыщенный
Хлористый аммоний (пары)**
Хлористый ацетил
Хлористый бензин
Хлористый бензоил
Хлористый бензол
Хлористый водород
(газообразный) сухой
Хлористый метил
Хлористая сера
'кип
'кип
^кип
20
90
'кип
20
50
90
^кип
90
^кип
50
'кип
400n
\JKJ\J
^кип
20
1 ии
20
20
20
100
^КИП
20
8
—
<4
8
9
6
8
10
9
10
10
10
8
10
10
10
5
8
10
8
5
—
<з
7
8
5
7
8
8
9
_
10
10
10
10
5
8
10
8
—
<з
6
7
5
6
7
—
9
7
10
—
—
10
—
10
10
—
10
—
10
—
—
—
—
<5
5
—
5
5
—
8
5
9
—
—
<5
5
—
5
—
<4
4
.
4
5
5
5—6
5
8
—
—
—
<5
5
6
7—8
5
<з
<5
5
4
<5
5
8
8
8
5
9
9
9
10
6
5
5
5
7—8
10
10
5
<5
5
—
5
5
<3
<4
5
3
—
4
5—6
5
6—7
5
8
8
5—6
5
5
5
5—6
10
10
5
<5
5
—
5
5
—
.
5—6
—
5—6
6
5
5
5
—
—
—
* Наиболее инертным металлом является сплав 06ХН28МДТ.
** Сплавы с более высоким содержанием никеля корродируют в этих условиях меньше, чем стали типа Х18Н10. Так, например,
для сплава ХН38ВТ скорость коррозии составляет при 400 °С 0,38 мм/год и при 600 °С 0,90 мм/год.
Хлор-силаны
Хлористый фосфор
Хлористый цинк (ТК)
Насыщенный
Хлористый этил (хлорэтан)
сухой
Хлористый этилен
Хлорная кислота (ТК)
Хлорноватая кислота (ТК)
Хлорносерная кислота
/тт/\.
UK).
0,5 %-ная
10 %-ная
концентр ированная
Хлорноватистокислый
кальций (гипохлорит кальция),
разбавленный раствор:
с 0,3 % С1
>3 % С1
более концентрированные
растворы
Хлороформ
Хлорсульфоновая кислота
10 %-ная
Хлоруксусная кислота (ТК):
10 %-ная
50 %-ная
концентрированная
Хромовая кислота
концентрацией, %:
10
2
20
20
20
^кип
20
^кип
20
20
20
20
20
20
20
20
20
70
20
^кип
20
20
20
20
40
3
10
8
10
<4
5—6
—
8
10
10
10
10
8
9
10
10
4
7—8
10
10
10
10
5
4
10
7
10
<з
5—6
—
8
10
9
—
7
8
9
10
3
6
10
10
10
10
5
5
—
6
9
<3
—
—
7
10
9
—
—
—
—
3
5
10
10
10
10
5
6
—
—
10
5
10
—
—
—
10
10
10
—
—
—
—
—
10
—
—
10
10
7
—
—
—
—
—
—
—
—
5
—
5
—
—
—
—
—
4
—
ь
10
10
8
—
—
6
<з
5
4
—
—
5
7
5
—
—
—
—
—
3
—
—
9
9
—
9
5
8
6
9
<4
5
5
7
9
5
8
5
6
7
8
10
2
—
10
5
10
10
5
Продолжение табл.
10
5
7
5
8
<з
5
4
—
8
5
7
5
6
7
8
10
1
3
9
5
9
9
5
И
5
—
—
—
<з
—
3
—
8
—
—
5
5
—
—
1
3
9
5
9
—
5
10
12
[37]
[67, 127]
[67, 127
[44, 280
[67, 254
[67, 254
[254]
[19]
[19]
[254]
[19]
[254]
[67]
[130]
[67]
[67]
[19, 37]
[173, 254]
[173, 254]
[37]
[19]
[130]
[19]
10
20
40
50
50
62 ?о*ная насыщенная
Хромпик калиевый
Бихромат калия
Царская водка (смесь
концентрированных кислот соляной
и азотной 3:1)
Целлюлоза (при варке)
Целлюлоза триацетат
Цианистая кислота,
насыщенный раствор
Циановая кислота
Циклогексан
Циклогексанон
Цинк металлический
(расплав)
'кип
50
50
20
^кип
20
40
'кип
20
—
20
—
*кИп
20
500
8
—
8
7
10
7
8
10
10
8
10
10
5
5
10
7
5
8
7
10
—
—
—
10
6
8
9
—
—
10
7
5
7
—
—
—
—
—
—
—
—
—
—
—
—
—
—
5
—
—
—
—
—
10
—
—
5
—
—
8
—
—
7
—
7
5
8
7
8
10
См. калий двухромовокислый
См. калий кислый хромовокислый
10
—
—
—
—
—
—
—
10
1
См. ацетил целлюлоза
7
8
—
—
10
—
—
—
—
10
—
—
5
—
10
—
—
—
—
10
5
5
5
5
10
7
5
8
8
8
9
10
10
1
5
5
5
5
10
—
—
—
—
—
—
—
—
—
—
—
5
5
[127]
[253]
[253]
[127]
[127]
[253]
[19]
[253]
[127]
[49]
[67]
[173]
[37]
[37]
[127]
Продолжение табл. №
I
Цинк сернокислый
Цинк цианистый, водный
раствор
Цирконий хлористый
Чернила
Четыреххлористый титан
Четыреххлористый углерод:
сухой
1—50 %-ный
Щавелевая кислота
концентрации, %:
2,5
5
10
25
30
2
20
40—930
20
20
20
^кип
''кип
^кип
20
85
20
50
75
^кип
85
^кип
75
3
8
—
8
10
3
5
8
10
8
8
8
8
8
10
9
10
10
4
8
—
7
10
3
5
8
10
7
7
7
8
8
10
9
10
10
5
(
6
5
—
3
5
—
10
6
7
6
7
8
10
8
10
10
6
7
8
1м. сульфат цинка
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
5
—
8
9
—
—
6
—
—
—
—
—
—
—
6
5
5
—
7
7
9
—
9
5
—
5
8
3
5
8
10
5
7
5
6
7
10
9
10
9
10
5
7
5
7
3
5
7
8
4
5
5
5
6
9
8
9
—
11
—
—
—
—
—
—
7
5
—
—
—
—
—
6
—
—
—
12
[67]
[49]
[67]
[67, 127]
[67]
[67]
[19]
[254]
[19]
[19]
[17, 127]
[19]
[19]
[17, 130]
[19]
[44]
[19]
50
80
Щавелевокислый натрий
или калий всех
концентраций
Этан
Этилбензол
Этилен
Этиленгликоль
Этиленхлоргидрин
То же
Этилен двухлористыи
Этилен треххлористый
чистый
Этилен хлористый чистый,
безводный
То же,с небольшим
содержанием пара
Эфир
Эфир азотистоэтиловый
Эфир уксусноэтиловый
Эфир этиловый
Яблочная кислота:
1 %-ная
5—50 %-ная
Янтарная кислота всех
концентраций
70
20
20
20
20
20
150
20
100
^кип
^кип
ПО
20
20
^кип
20
100
^кип
10
—
5
7
5
5
5
2
5
5
10
5
8
—
—
5
5
—
5
5
10
10
10
—
3
5
—
—
—
—
—
—
4
7
—
—
5
5
—
5
4
—
8
10
—
3
—
—
—
—
—
—
—
3
—
—
—
5
5
—
5
3
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
8
—
10
10
—
—
—
—
5
5
—
—
—
5
—
4
—
—
—
—
—
5
3
5
5
7
—
—
—
—
—
—
—
—
3
—
—
9
—
—
5
2
4
4
5
10
10
3
5
5
5
5
2
5
5
8
4
4
1
10
5
5
5
5
3
5
5
5
10
8
3
5
5
5
5
2
—
4
7
3
3
—
8
5
5
—
5
2
4
4
5
6
—
—
5
5
5
2
—
5
2
2
—
7
_
—
—
5
—
—
ТАБЛИЦА 11
КОРРОЗИОННАЯ СТОЙКОСТЬ ХРОМОМАРГАНЦЕВОНИКЕЛЕВЫХ СТАЛЕЙ
(по десятибалльной шкале)
Коррозионная среда
1
Азотистая кислота
Азотная кислота
Азотнокислый
аммоний
Азотнокислый
аммоний + H2SO4
Аммоний
сернокислый
Аммоний
хлористый
Алюминий
сернокислый
Концентрация, %
2
5
5
5
7
7
10
10
20
20
20
30
37
40
40
50
58
65
66
Концентрированная
дымящая,
плотность
1,52
Насыщенный
раствор
Насыщенный рас-
ТИПИ
і вир
10
ее
о,
fr
03
8
к
3
20
80
^кип
20
^кИп
80
^кип
20
80
^кип
^кип
^кип
80
^кип
^кип
20
80
^кип
20
80
^кип
20
^кип
20
^кип
^кип
60
120
20
100
85
^кип
^кип
Скорость.коррозии стали
08ХІ8Г8Н2Т
мм/год
4
0,0020
0,0780
—
—
0,0020
0,1485
—
0,13
0,2016
0,4786—
0,528
4,495
0,125
0,4220—
0,67
2,17
—
0,154
2,88
—
0,210
—
—
—
—
—
—
—
—
—
—
—
—
—
балл
5
2
5
2
5
2
6
3
6
6
6
6
6
7
8
5
6
8
5
6
8
4
8
5
9
5
5
10
5
10
5—6
9—10
5
10ХІ4П4Н4Т
мм/год
6
0,0127
0,2535
—
—
0,0291
0,2742
—
—
0,3196—
0,42
0,7787—
0,92
—
0,154
0,9978—
1,03
2,5227
—
0,165
3,1921
0,319
—
—
—
—
—
—
—
—
—
—
—
—
—
балл
7
9
4
6
4
6
4
6
5
6
6
7
8
6
8
8
5
6
8
5
6
8
—
—
—
—
6
—
—
—
—
—
5
Pi
та о
|lg
^ XX
8
[288]
[125]
[125]
[44,
253]
[44,
ОЕОІ
125]
125]
125]
125]
125]
125]
[44,
253]
[125]
[125]
[30]
[125
125
125
125
125]
125]
[44
[44
[44
[44;
[44,
254]
[125]
[125]
[125]
[125]
[125]
[125]
[125]
270
Продолжение табл.
2
10
—
Все
концентрации
Насыщенный
раствор
10
10
—
—
Насыщенный
раствор
10
10
10
10
10
50
10
10
10
Насыщенный
раствор
70
3
'кип
20
К2И0П
/кип
20
'кЕп
85
10—25
100
'кип
'кип
'кип
'кип
20
20
'кип
20
100
'кип
100
120
4
—
—
Ill I
—
—
0,0111
0,0339
0,0543
7,2705
—
—
—
0,05
5
5
5
7
5
5
5
5
3
5
1
8
5
5
4
4
5
9
5
СЛ СЛ
СЛО СП
10
5
5
6
—
—
Ill I
—
0,0005
0,0079
0,0238
0,3405
10,0
—
—
Z
0,05
7
5
—
6
5
5
8
1
8
3
4
6
10
5
10
LO LO
5
5
Аммоний
углекислый
Ангидрид
уксусной кислоты
Ангидрид
фосфорной кислоты
Ацетон
Бензойная
кислота
Борная кислота
Винная кислота
То же
Вода
водопроводная*
Вода морская**
(ТК)
Галловая кислота
Дубильная
кислота
Железо
сернокислое (закисное)
Железо
сернокислое (окисное)
Железо хлористое
Железо хлорное
Иод:
сухой
влажный
Калий
азотнокислый
Кали едкое
Калий двухромо-
вокислый
Калий марганце-
вокислый
Кальций
сернокислый
Кальций
хлористый
Карбамид
Карболовая
кислота (фенол)
* Водопроводная вода должна содержать минимальное количество хлор-иона,
который вызывает коррозионное растрескивание металла.
** Глубина ТК составляет для стали 08Х18Г8Н2Т 3 мм/год, для стали 10Х14Г14Н4Т
4 мм/год.
Продолжение табл. 11
1
Квасцы калиево-
алюминиевые
Кремнефтористо-
водородная
кислота
Лимонная кислота
Льняное масло
Малеиновая
кислота
Медный купорос
Молочная кислота
Молоко
Муравьиная
кислота
Натрий азотнокис-
JTMW
Натр едкий
Натрий
сернокислый
Натрий сернисто-
І/-ГІГ» ТТт-ттт
ivilV-vlDlil
Натрий
серноватисто кислый
Натрий сернистый
Натрий
углекислый
2
10
10
Пары
10
10
—
—
10
Насыщенный рас-
ттюп
1 DUp
1,5
1,5
5
10
10
Свежее
10
10
10
20
30
40
50
50
70
80
10
Расплав
10
10—25
25
50
29
27,5
48—55
10
Насыщенный
3
3
20
/кип
100
20
/Кип
100
/к п
20
80
20
кип
К20
80
(КиП
/кип
кип
20
/кип
/кип
/кип
3<>0
'кип
'кип
'кип
/кип
70
88—96
160
/кип
/к
ип
85
4
—
—
—
—
—
0,0036
—
—
—
—
—
—
—
—
10,0
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
5
5
8
10
3
8
—
5
2
4
3
5
6
3
7
—
3
4
10
10
10
10
3
10
10
10
5
10
6
7
5
5
—
—
5
5
—
6
_
—
—
—
—
—
0,0115
—
—
—
—
—
—
—
—
10,0
—
—
—
—
—
—
—
—
—
—
—
0,0045
0,0102
2,89
—
—
0,0004
7
—
—
5
—
5
—
4
5
—
10
—
—
5
8—9
5
10
10
10
10
8-9
10
10
10
5
7
8
5
5
2
4
8
—
5
1
8
[44]
[44]
[125]
[44,
253]
[44]
[288]
[125]
[125]
[44,
253]
[44]
[44
[253
[44;
[44
[288]
[44,
253]
[125]
[125
[125
[125
[125
[44,
125]
[44,
1 0^1
1Z0J
[125]
[125]
[125]
[125]
[125]
[125]
[44]
[44,
312]
[312]
[312]
[312]
[44,
253]
[44,
253]
1125]
272
Продолжение табл. 11
Натрий
фосфорнокислый
Натрий хлористый
(ТК)
Натрий
хлорновато кислый
Никель
сернокислый
Никель
углекислый
Олеиновая
кислота техническая
при р = 1,47 МПа
Перекись
водорода*
Перекись натрия
Пирогалловая кис
лота
Сера
Серная кислота
Сернистая кислота
Сероводород
Смесь кислот:
HNO3 + H2SO4
HNO3 + H2SO4
HNO3 + H2SO4
HNO3 + H2SO4
Смесь кислот и
солей:
HNO3 (плотность
l,52)+Ala(NO8)a
HNO3 (плотност:
1,52)+ KNO«
5
20
10
10
Все
концентрации
20
20
10
Все
концентрации
Расплавленная
3
5
10
20
40
60
80
98
Насыщенный
раствор
15+ 80
20+ 80
50+ 50
25+ 75
10
10
'кип
85
'кип
К20
'кип
/кип
80
100
150
180
20
90
'кип
'кип
125
425
20
20
20
20
20
20
20
20
20
100
200
20
60
60
60
'кип
'кип
—
0,017
0,028
10
—
—
—
—
—
—
—
—
—
3,44
24,70
71,22
78,55
46,4
—
—
—
—
—
—
—
—
5
4
4
—
5
5
5
5
6
—
10
5
5
10
8
10
10
10
10
6
5
5
10
5
8
6
7
8
9
—
0,025—
0,04
—
0,065
—
—
—
—
—
—
10
—
—
—
—
—
—
—
—
—
—
—
—
4
—
5
—
6
5
2
5
—
5
10
—
—
7
10
10
10
10
10
7
6
—
—
5
9
8
8
—
* Все хромомарганцовистые стали вызывают каталитическое разложение перекиси
водорода.
Продолжение табл. 11
1
Смесь кислот и
солей:
H2SO4+CuSO4X
X 5Н2О
H2SO4+FeSO4X
Х7Н2О
H2SO4+FeSO4X
Х7Н2О
H2SO4+FeSO4X
X 7Н2О + медь
металлическая
Соляная кислота
Соляная кислота
Стиральные
порошки «Астра» и
«Лотос»
Углерод четырех-
хлор истый
Двуокись
углерода
Уксусная кислота
Уксусный
ангидрид
Уксуснокислый
свинец
Формальдегид
Фосфорная
кислота
2
10+ 10
10+2
20+ 10
10+ 16
0,5
0,5
3,6
5
10
20
3
Сухой
Влажная
10
10
20
30
50
80
—
25
40
10
10
10
20
20
40
3
/кип
'кип
'кип
^кип
20
'кип
20
20
20
20
85
/Кип
100
80
^кип
80
/Кип
80
'кип
80
'кип
80
/Кип
20
^кип
'кип
^кип
20
80
^кип
80
'кип
80
4
—
—
Сильное
растворение
0,1000
—
—
42,10
65,5
90,24
—
—
—
—
0,0160
—
0,052
—
0,024
0,022
—
0,041
0,22
—
—
—
—
—
—
0,085
—
0,075
—
5
6
7
10
5
9
10
10
10
10
10
—
5
7
2
4
3
5
3
4
2
6
4
6
—
—
5
5
2
4
5
4
5
4
6
—
—
Сильное
растворение
0,2911
—
—
_
0,0002—
0,0005
—
—
—
0,7501
—
0,826
—
0,86
—
2,85
1,76
—
—
—
—
—
0,3
—
0,12
—
7
—
—
10
6
9
10
10
10
10
10
1
—
—
5
7
5
7
5
7
4
8
5
8
5
7'
8
5
3
5
7
5
6
5
8
[44]
[44]
[125]
[125]
[44,
253]
[44,
253]
[44,
ПГО1
ZOO]
253]
125]
125]
125]
[125]
[125]
[125]
[44,
275]
[125]
[125]
[125]
[125]
[125]
[44,
1251
125]
125
288
288]
[44,
253]
[125]
[44
[125
[125
[125
[125
125]
Продолжение табл. 11
1
Фосфорная
кислота
Фтористоводородная кислота
Хлорное железо
Хинин кислый
сернокислый
Хинин
сернокислый
Хлор
Хлорная известь
Хлористый марга-
ГТ ЛІТ
п. с д
Хлористое олово
Хлористая ртуть
Хлористый цинк
X лоросульфоно-
вая кислота
Хромовая кислота
Цинк
металлический
Царская водка
Щавелевая
кислота*
2
40
45
45
60
80
80
80
10
40
Пар
30
—
Влажный
—
50
Насыщенный рас-
твор
0,1
—
10
10
50
Расплав
—
10
20
3
20
'кип
80
20
80
/кип
20
20
100
'кип
20
20
20
20
100
'кип
20
20
'кип
20
'кип
'кип
500
20
20
80
'кип
80
'кип
4
0,84
1,1
—
—
—
—
11,0
—
11,0
11,0
—
—
—
—
—
—
—
—
—
—
—
—
—
0,0254
0,9
0,0240
1,22
5
7
7
9
8
6
8
10
—
10
10
10
9
6
10
10
9
10
6
6
8
5
7—8
10
—
—
5
4
7
4
8
6
—
—
—
—
—
—
_
—
—
—
—
—
—
—
—
—
—
0,4226
—
7
8
8
10
—
10
10
10
10
10
—
_
—
8
10
10
10
8
5
6
5
9
8
[125,
288]
[30,
44]
[30,
44]
[125]
[30,
АЛЛ
44]
[125,
288]
[44]
[288]
[30,
288]
[30,
288]
[44,
253]
[125]
L I**«-» J
[125]
[125]
[125]
[125]
[125]
[125]
[44,
zooj
[44,
253]
[125]
[125]
[125]
[44]
[44]
[125
[125
[44
275]
[125]
[125]
* Сталь 10Х14Т14Н4Т в кипящей щавелевой кислоте в первые часы испытаний
сильно растворяется, в дальнейшем образуется плотная прочная желтая пленка,
защищающая металл, и коррозия почти прекращается.
Продолжение табл. 11
1
Щавелевая
кислота*
Яблочная кислота
2
30
50
5
3
80
^кип
80
^кип
80
4
0,32
—
0,41
—
—
5
6
9
6
10
5
6
—
—
—
—
7
5
10
8
10
8
8
[125]
11251
11251
[125]
[253]
* Сталь 10Х14Т14Н4Т в кипящей щавелевой кислоте в первые часы испытаний сильно
растворяется, в дальнейшем образуется плотная прочная желтая пленка, защищающая
металл, и коррозия почти прекращается.
Сплав 45НПР-А. Аморфный сплав на основе железа и
никеля. Рекомендуется для изготовления магнитных экранов и
оболочек для кабелей, а также сердечников трансформаторов.
Сплав 85КСР-А. Аморфный сплав на основе кобальта.
Может быть рекомендован для применения в сердечниках
магнитных усилителей и миниатюрных трансформаторах и ячейках
памяти.
НИКЕЛЬМОЛИБДЕНОВЫЕ
И НИКЕЛЬХРОМОМОЛИБДЕНОВЫЕ
СПЛАВЫ
В химической и во многих других отраслях промышленности
для аппаратуры, работающей, например, в соляной, серной,
фосфорной кислотах и их смесях при повышенных
температурах, коррозионностойкие стали являются непригодными
металлами. Сравнительная оценка коррозионной стойкости сталей и
сплавов приведена на рис. 16.
Высокой коррозионной стойкостью в указанных выше
кислотах обладают тугоплавкие металлы: молибден, ниобий,
тантал, вольфрам и др. (рис. 4).
В средах восстановительного характера применяют сплавы
на основании системы Ni—Mo, а в средах
окислительно-восстановительного характера — сплавы системы Ni—Сг—Мо [46,
396].
Кроме высокой коррозионной стойкости, сплавы Ni—Mo и
Ni—Cr—Mo обладают высокими механическими свойствами при
высокой прочности, что делает их ценным конструкционным
металлом. Эти сплавы имеют минимальное содержание углерода,
что позволяет быть металлу более стойким к межкристаллит-
ной коррозии.
276
Сплав Н65М-Ви (ЭП982-Ви)
Сплав является самым усовершенствованным сплавом по
сравнению с другими примерного состава:
1. Химический состав, %: С^0,02; Si^0,l; Mn^0,5; Si^0,015;
Р^0,015; Cr^0,3; Mo 30—32; Fe 2—3; Ті<0,Ю; А1<0,3;
Се 0,005 (расч.); Ni-+- основа.
2. Структура. Сплав после термической обработки (закалка
с 1060—1070 °С, охлаждение в воде) имеет структуру а-твер-
дого раствора с выделением первичных карбидов типа Ме^С.
3. Механические свойства горячекатаного листового проката
в состоянии поставки (закалка с 1060 °С в воде)
Толщина листа, мм
6
10
22
ТУ 14.1-2878—80
gbgo,2« н/мм2
970 490
930 470
940 515
>800 >400
6, %
55
55
50
>40
кси,
Дж/см2
140—240
200—240
НВ
217
217
207
<с220
4. Коррозионная стойкость. По ТУ 14.1-2878—80, ТУ 14-1.2879—
80 лист из сплава Н65М-Ви стоек к межкристаллитной
коррозии после провоцирующего нагрева при 800 °С в течение 30 мин,
испытание проводится в 21 %-ном растворе НС1
продолжительностью 200 ч.
Сплав в кипящей 20—40 %-ной серной кислоте корродирует
со скоростью 0,047 мм/год, а в 50 %-ной серной кислоте
скорость коррозии составит 0,074 мм/год.
В кипящей 15—20 %-ной соляной кислоте скорость
коррозии будет 0,1—0,2 мм/год.
Сплав устойчив в галогенах (фтор, бром, иод), во влажном
хлористом водороде, в уксусной кислоте (в присутствии
бромистых катализаторов *, в хлоридах (А1С13, MgCb, ZnCl2,
SbCla).
5. Технологические параметры. Термическая обработка сплава,
обеспечивающая оптимальные сочетания коррозионной
стойкости и других свойств, состоит в закалке с 1070±20°С
(продолжительность нагрева 5 мин/мм толщины) с охлаждением
в воде. Аналогичная обработка рекомендуется для снятия на-
* Практика показывает, что некоторые катализаторы резко увеличивают
скорость металла, по сравнению с данными без катализатора.
277
клепа после горячей и холодной деформации. Температурный
интервал горячей деформации (слитков) 1220—950 °С. Горячую
штамповку следует производить в интервале 1200—1000 °С.
Сварка сплава разработана НИИхиммашем [336] и
Московским опытно-сварочным заводом. Сварка производится аргонно-
дуговым методом по технологии приведенной в ОСТ 26-01-858—
80. Рекомендуется применять проволоку 2—3 мм из сплава
Н65М-Ви.
Для придания сплавам формы может быть использовано
большинство известных методов. Так, в горячем состоянии
применяют ковку, прокатку, штамповку, прессование и т. д., в
холодном— прокатку, штамповку, волочение. Детали, требующие
значительной степени деформации металла, штампуют в
горячем состоянии.
Сплавы Ni—Mo, подобно всем сплавам на никелевой основе,
нагартовываются в значительно большей степени, чем аустенит-
ные нержавеющие стали. Поэтому требуется большое
количество промежуточных стадий нагрева при штамповке или
холодной деформации. После окончательной деформации необходима
термическая обработка.
Механическая обработка сплавов Ni—Mo
Сплавы Ni—Mo обрабатывают резанием (точением, сверлением,
фрезерованием), однако они поддаются этим операциям
значительно хуже, чем стали типа Х18Н10Т. При точении резцы
должны быть оснащены пластинами твердосплавных сплавов ВК8,
ВК8М, ВК6М и др. Для сверления применяют монолитные
твердосплавные сплавы марок ВКЮ, ВКЮМ, ВК15 и ВК15М
или спиральные сверла из быстрорежущей стали марок Р9К,
Р9КЮ, Р18 и др.
При этом обработку ведут с пониженными скоростями
резания [336].
6. Сортамент сплава Н65М-Ви
№
пп.
1
2
3
4
Сортамент
Сорт, 20—100 мм
Горячекатаный лист,
O = 4—20 мм
Холоднокатаный
лист, б = 1,5—3,9 мм
Холоднокатаная
проволока 2—3 мм
Состояние
поставки
Без
термообработки
Термообработка
То же
Технические условия
ТУ 14-1-26-74—79
ТУ 14-1-2878—80
ТУ 14-1-2879—80
ТУ14-1-3281—84
3 авод—поставщи к
Завод
«Электросталь»
Ашинский
металлургический завод
То же
Завод
«Электросталь»
278
7. Назначение. Сплав имеет исключительно высокую
коррозионную стойкость в широкой гамме высокоагрессивных сред
восстановительного характера [254]. Сплав рекомендуется к
применению в химическом машиностроении для изготовления
сварного химического емкостного, теплообменного оборудования,
работающего при повышенных температурах в солянокислых,
сернокислых средах, а также в их смесях и других средах.
Сплав Н70МФВ-Ви (ЭП814А-Ви)
1. Химический состав, %: С^0,02; Si^0,l; Mn^0,5; Mo 25—
27; W 1,00—0,45; V 1,4—4,7; Fe^0,8; Cr<0,3; Р<0,025;
S<0,012.
2. Сплав Н70МФВ на никелевой основе имеет в закаленном
состоянии структуру 7'твеРДОго раствора с выделениями
первичных карбидов типа МебС.
3. Механические свойства: после закалки от 1050—1100 °С
в воде: (Тв^ЭОО Н/мм2; аОJ^4ОО Н/мм2; 6^30%; ап^
^3700 кДж/м2; НВ 210-^220.
4. Коррозионная стойкость. Сплав Н70МФВ-Ви отличается,
например, от сплава Н70МФ (ЭП496) меньшим содержанием
углерода и железа. Поэтому сплав Н70МФ (ЭП814А) будет более
стойким к межкристаллитной коррозии при испытании в
кипящей 21 %-ной соляной кислоте, чем сплав ЭП496.
Сплав стоек против коррозионного растрескивания под
напряжением в среде хлоридов.
Наряду с высокой коррозионной стойкостью в агрессивных
средах восстановительного характера сплав обладает рядом
других особенностей. Так, сплаву свойственны значения
прочностных свойств, твердости и электропроводности в 1,5—2 раза
выше, чем у стали 12Х18Н10Т, а значения теплопроводности и
коэффициента линейного расширения в 1,5—2 раза ниже, чем
у сплавов на основе железа. Сплав немагнитен.
5. Технологические параметры. Температурный интервал
горячей деформации 1220—950 °С. Сплав удовлетворительно
обрабатывается в холодном состоянии при режимах, как и все
другие сплавы Ni—Mo.
Сплав сваривается аргоно-дуговым методом. В качестве
присадочного материала используют проволоку из сплава
Н70М27. Ручную электродуговую сварку осуществляют с
помощью электродов ОЗЛ-23.
6. Сортамент. Сплав Н70МФВ (Эп814А-Ви) поставляется
в виде сорта до 10 мм (ТУ 14-1-2260—77), листа горячекатаного
(ТУ 14-1 -2262—77), ленты холоднокатаной ТУ 14-1 -2230—77,
труб (электросварных) ТУ14-3-740—78.
7. Назначение. Сплав применяют в химическом
машиностроении для изготовления сварных емкостей и трубопроводов,
работающих в производстве ионнообменных смол, галлоидово-
279
дородных кислот, полипропилена, в процессах органического
синтеза, окиси углерода, в химико-фармацевтических
препаратах и др.
Ni—Сг—Мо сплавы
1. Сплав ХН65МВ (ЭП567) на никелевой основе имеет в
закаленном состоянии структуру у-твердого раствора с
выделениями первичных карбидов типа Ме6С.
2. Химический состав, %: 0=^0,03; Si^0,15; Мп<1,0;
Сг 15; Мо 16; W^3,5; Fe 1; остальное никель.
3. Механические свойства. После закалки с 1050 °С, в воде:
ав = 900-М000 Н/мм2; aO2 = 45O-f-6OO Н/мм2; 6 = 404-50%; ап =
= 1800-^2000 кДж/м2; НВ 200-^230.
4. Технологические параметры. Наилучшим сочетанием
высокой коррозионной стойкости и сопротивляемости к
межкристаллитной коррозии с высокими значениями прочности и
пластичности, сплав обладает после закалки в воде с 1070 °С с
выдержкой при данной температуре 5 мин на 1 мм толщины.
Температурный интервал горячей пластической деформации
для сплава составляет 1200—950 °С. Сплав удовлетворительно
деформируется в холодном состоянии, обрабатывается резанием
и сваривается аргоно-дуговым методом.
В качестве присадочного материала используют проволоку
из сплава ХН65МВ (ЭП567). Ручную электродуговую сварку
производят с помощью электродов ОЗЛ-21 (ТУ-ОСЗ).
5. Сортамент и условия поставки. Сплав поставляется в виде
сорта (ТУ 14-1-2138—77), листа горячекатаного 3,9—10 мм
(ТУ 14-1-2475—78); листа холоднокатаного 1,5—4,0 мм (ТУ 14-
1485—75); электросварных труб (ТУ 14-152—73); проволоки и
ленты.
6. Назначение. Сплав ХН65МВ (ЭП567) может быть
использован для изготовления сварочных конструкций, работающих
при высоких температурах в сернокислых, солянокислых и
других средах, обладающих окислительно-восстановительными
свойствами.
Сплав ХН65МВУ (ЭП760)
Металлургическая промышленность освоила этот новый сплав,
который применяется в ряде случаев взамен сплава ХН65МВ
(ЭП567). Новый сплав содержит ^0,1 % Si и ^0,5% Fe.
Остальное— как и в сплаве ЭП567.
Новый сплав менее чувствителен к межкристаллитной
коррозии. Сварные соединения сплавов ЭП760 и ЭП567 не
подвержены межкристаллитной коррозии в кипящем растворе 30 %
H2SO4-H0 г/л Fe2(SO4K. Сплавы ЭП760 и ЭП5С7 в отличие от
сплава Х15Н55М16В (ЭП375) не требуют термической
обработки после сварки. Коррозионная стойкость сплавов
представлена по десятибалльной шкале в табл. 12,
280
ТАБЛИЦА 12
КОРРОЗИОННАЯ СТОЙКОСТЬ СПЛАВОВ Н65М-Ви (ЭП982-Ви),
Н70МФВ (ЭП814А), ХН65МВ (ЭП567) и ХН65МВУ (ЭП760)
Коррозионная
среда
1
Азотная кислота
Под давлением
Алюминий
солянокислый
Алюминий
хлористый
Амид
Бензосульфокис-
лота
Бромистоводород-
ная кислота:
пары
жидкая фаза
паровая фаза
Бромистоводород-
ная кислота, р =
Q Q ЛДПо
= у,о Ml la
Бром влажный
Бромная вода
Дихлорбензол +
+ 4,0—5,0 % НС1
Железо
азотнокислое
Железо
сернокислое (закисное)
Железо
сернокислое (окисное)
Железо хлористое
Железо хлорное
Иод
Иод технический
(кристаллический)
Кетокарбоновая
кислота
X
1
а>
I e
2
10—70
10—40
50—70
10—40
50—70
1—15
20—70
5
25
10—80
—
—
6
40
40
46
—
0,3
1,0
—
10
10
5—75
5—75
10
10
5—75
5—75
100
—
98
а
ера
с
«и
3
20
70
70
І кип
/кип
190
190
20
20
/кип
130
100
120—450
/кип
'кип
105
20
20
20
355
^кип
20
70
20
60
20
70
20
60
100
300
50
Скорость
Н65М-Ви
Н70МФВ-Ви
мм/год
4
—
—
—
—
—
—
—
—
—
о,и
од
0,16
0,3
—
од
—
—
0,01
—
—
—
—
—
—
—
—
—
—
—
балл
5
—
—
10
10
10
10
5
3
5
5
4
5
6
6
6—7
5
—
—
3
9—10
—
—
—
—
—
9—10
—
5
7
5
коррозии
ХН65МВ
ХН65МВУ
мм/год
6
—
—
—
—
—
—
—
—
0,006
—
—
—
—
0,002—
0,13
—
—
0,02
—
—
—
—
—
—
—
—
—
—
—
—
балл
7
6
8
8—9
8—10
10
10
10
5
5
—
5
3
—
—
—
—
2—6
5
5
4
—
3
5
3
5
3
5
3
5
—
—
5
)НЫ{
>>*:
«> 5
9-ї
Лите
ИСТО1
8
[49]
[49
[49]
170
170
170
170
130
[130
[254
[40
[311
[47]
[47]
[47]
[40]
[173]
[130]
[130]
[185]
[130]
[40
[40
[40
[40
130
130
130
130
[40
[40
[40]
Продолжение табл. 1
2
3
4
5
6
7
Смесь кислот
Кетокарбоновая
кислота
Соляная кислота
Муравьиная
кислота
Кетокарбоновая
кислота
Соляная кислота
Муравьиная
кислота (остальное
вода, под
давлением)
Кетокарбоновая
кислота
Соляная и
муравьиная кислоты
(остальное вода,
под давлением)
Кремнефтористо-
водородная
кислота
Медь хлорная
Метахлорнитро-
бензол + хлорное
железо
Метиловый эфир
метакриловой
кислоты
Метанольные
маточники
гексахлорана
Муравьиная
кислота:
93—96
1
4,8
5—7
56
4—6
60—70
2
1 — 15
20
10
10—20
8
трированная
3
20—30
—
10—60
10—20
30—40
50
60
89
50
80
95
—
—
30—40
90—100
25—170
40—50
40—50
70
80
20
*кип
20
80
95—120
50
65
*кип
*кип
^кип
*кип
*кип
140
140
70
50
250
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
5
6
6
—
—
10
—
—
7
5
6
6
5
5
5
5
5
5
5
—
5
—
—
—
—
1,7
—
—
—
—
—
—
—
—
—
—
—
—
—
0,3
—
0,0012
5
—
6
5
6
8
8
5
10
5
5
—
5
4
5—6
7
7
7
5
5
5
6
5
2
под давлением
с аэрацией
Олово хлористое
Перхлорэтилен +
* Титан и цирконий в этих условиях мало устойчивы.
282
Продолжение табл. 12
Производство
вискозного волокна
Пластификацион-"
ная ванна:
30—150 г/л
серной кислоты,
15—340 г/л суль
фата натрия,
6—120 г/л
сульфата цинка,
до 1,5 г/л гекса-
метилентетра-
мина
Производство
дифениламина
Соляная
кислота — хлористый
аммоний — анилин
Производство ди-
фенилпропана:
73 %-ная серная
кислота +
фенол + ацетон +
+ толуол + тио-
гликолевая
кислота
Производство
кремнийорганиче-
ской жидкости
в соляной кислоте:
жидкая фаза
газообразная
фаза
Производство
кремнефтористово-
дородной кислоты
Производство
ионообменных смол*
Производство
метилового эфира
метакриловой
кислоты**
Амидатор:
амид
метакриловой кислоты
амид а-оксиизо-
масляной
кислоты
95—98
1,02
0,12
[318]
300
40
0,1
0,018
[259]
[228]
20
20
20%
10%
70%
27—30 %
3%
100
100
80
0,5
1,0
3,0
0,17
0,05
4,921
[40]
[40]
[259]
[224]
ПО
0,03
0,06
[257]
* Чистый титан и титан, легированный танталом или палладием, в этих условиях
совершенно нестойкие.
** Коррозионностойкие стали типа Х18Н10, высоколегированный сплав 06ХН28МДТ
и титан сильно корродируют.
283
Продолжение табл. 12
1
Амидатор:
кислый
сернокислый эфир
а-оксиизобутил-
амида
серная кислота
вода
Эфиризатор:
амид метакри-
ловой кислоты,
метакриловая
кислота, серная
кислота,
бисульфат
аммония, эфир ме-
тилметакрило-
вой кислоты,
вода
Второй отгонный
куб:
эфир метилмета-
криловой
кислоты
метакриловая
кислота
серная кислоїа
бисульфат
аммония
вода
Третий отгонный
куб:
эфир метилмета-
криловой
кислоты
метакриловая
кислота
серная кислота
бисульфат
аммония
вода
Производство
монохлор уксусной
кислоты
Состав продуктов
хлорирования, %*
монохлоруксус-
ная кислота
дихлоруксусная
кислота
2
3 %
64 %
3—5 %
—
20—15
1,5—3
35—30
38—40
5,5—12
5
3—5
35—40
40—45
17—15
88,6
6,4
3
—
—
—
90
120
—
—
—
120
—
—
—
—
100
—
—
4
—
—
—
0,06
0,034
—
—
—
—
0,042
—
—
—
—
0,08
—
—
5
—
—
—
5
4
—
—
—
—
4
—
—
—
—
5
—
—
6
—
—
—
0,089
0,23
—
—
—
—
—
—
—
—
0,124
—
—
7
—
—
—
5
6
—
—
—
—
—
—
—
—
6
—
—
8
—
—
—
[257]
[257]
—
—
—
—
[257]
—
[241]
—
—
* В этих условиях чистые металлы корродируют со скоростью, мм/год: серебро
0,07, медь 0,72, свинец 1,5 и титан 21,6. В газовой фазе указанные металлы и сплавы
корродируют с меньшей скоростью.
284
Продолжение табл. 12
3 4
Состав продуктов
хлорирования, %*:¦
уксусная
кислота
уксусный
ангидрид
ацетилхлорид
(жидкая фаза)
Производство
органических
полупродуктов
2%-ная H2SO4
с добавлением
фталевого
ангидрида, метакри-
ловой Щ кислоты,
толуола, триэти-
ленгликоля
Производство по-
лиэтиленполиами-
нов
25 %-ный раствор
аммиака; 1,5—
1.7 %-ная
соляная кислота;
дихлорэтан;
хлористый аммоний (на
1 т годного
продукта 1,3 т
хлористого аммония
и полиэтиленпо-
лиамины);
давление до 1,76 МПа
Производство
трихлоруксуснои
кислоты:
жидкая фаза
паровая фаза
Производство
уксусной кислоты
методом
окисления ацетальде-
гида
Производство
первичных хлорал-
канов из этилена
и соляной
кислоты под давлением
9.8 МПа
0,3
2,0
2,71
20
До 150
80
80
100
0,005
0,1
0,3
0,05
10
0,055
0,0873
0,01
[259]
Г314]
[259]
[259]
[259]
[259]
* В этих условиях чистые металлы корродируют со скоростью, мм/год: серебро 0,07,
медь 0,72, свинец 1,5 и титан 21,6. В газовой фазе указанные металлы и сплавы
корродируют с меньшей скоростью.
285
Продолжение табл. 12
1
Производство
хлоргидрата мо-
ноэтаноламина и
и пиперазина
Производство
экстракционной
фосфорной кислоты
Производство
эфира метакриловой
кислоты*1
Среда содержит
от 40 до 70 %
H2SO4
Ртуть хлорная
Сероводород
(влажный)
Серная кислота
кислота
Серная кислота
под давлением
Синтез йодистого
водорода
Газовая смесь
(Н2+12+Н1)*2
Смесь кислот*3
2
—
—
5
1—3
10
20
20—50
55
55
60
60
60
75
75
75
80
80
85
85
93
1—2
5
5
—
3
80
130
20
100—300
400
^кип
^кип
^кип
^кип
95
120
20
70
^кип
20
70
^кип
70
^кип
70
^кип
^кип
190
190
250
230
400
90
4
3,0
До
0,026
—
—
—
0,08
—
—
0,07—
0,08
0,10—
0,11
—
—
—
—
—
—
—
—
0,033
0,034
0,0012
5
5
8
4
—
3—5
6
3
5
5
5
5
5—6
4
5
7
4
5
9
5
10
5
10
8
7
10
10
4
4
2
6
—
0,05
0,035
0,109
—
—
—
—
0,85
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
0,00
7
—
5
4—6
5
—
—
6
7
8
8—9
—
—
5
8
10
5
7
10
5—6
10
5—6
10
8
8
10
10
—
—
1
8
[259]
[259]
[40]
[130,
253]
[40]
[40]
[130]
[130]
[130]
[130]
[283]
[283]
130]
130
130
130
130
130
130]
130]
[130
[130
[130
[170
[170
[170
[41]
[41]
[254]
** Сплав 06ХН28МДТ и коррозионностойкие стали в этих условиях — нестойкие
металлы.
*2 Коррозионностойкие стали являются нестойкими металлами. Тантал и ниобий при
температуре 370—400 °С охрупчиваются и полностью разрушаются. Молибден и платина
в этих условиях обладают высокой стойкостью. Молибден оксидируется в синий цвет.
*3 Хромоникелевые стали в этих условиях являются совершенно нестойкими
материалами. Скорость коррозии сплава 06ХН28МДТ составляет в растворе I 0,6197 мм/год,
в растворе II 0,219 мм/год.
286
Продолжение табл. 12
1
Раствор I. 40 %
(объемн.) серной
кислоты
(плотность 1,83) +40%
(объемн.)
фосфорной кислоты
(плотность 1,579)+
+ 20 % (объемн.)
воды
Раствор П. 20 %
(объемн.) серной
кислоты
(плотность 1,83) + 80 %
(объемн.)
фосфорной кислоты
(плотность 1,579)
Синтез полиэфир-
акрилатов:
фталевый
ангидрид
триэтиленгли-
коль
метакриловая
кислота
серная кислота
толуол
Смесь кислот,
солей и других
химических веществ
Азотная кислота
Серная кислота
Вода
Азотная кислота
Серная кислота
Соляная кислота
Железо хлорное +
натрий хлористый
Медь сернокислая
Натрий хлористый
Серная кислота
Медь хлорная +
натрий |хлористый
Натрий'
азотнокислый
Серная кислота
Соляная кислота*
Муравьиная
кислота + толуол
Олеум + HF:
жидкая фаза
газообразная
фаза
2
—
12
26
16
2
44
10
30
60
3—5
15—20
1,5—2,0
5
10
1,0—2,0
0,5—1,1
10—25
5
10
5
10—18
3
80
20
Насыщенный
раствор
' 3
90
112—120
—
—
—
—
80
60
70
^кип
70
—
70
^кип
85
—
100
108
108
4
0,072
—
—
—
—
—
>10
—
—
—
—
—
—
10
—
—
—
—
5
5
5
—
—
—
—
—
10
10
10
—
—
10
10
10
—
5
8
5
6
0,0027
—
—
—
—
—
0,43
0,02
—
—
0,2
—
—
—
0,07
—
—
—-
—
7
2
5
—
—
—
—
6
4
2
5
6
—
5
5
5
—
5
—
—
8
[254]
[253]
—
—
—
—
[283]
[40]
[130]
ИЗО]
[40]
—
[130]
[130]
[40]
—
—
[40]
[40]
[40]
* В этом растворе сплав 06ХН28МДТ склонен к межкристаллитной коррозии.
287
Продолжение табл. 12
1
Сера + хлористый
алюминий @,5 %
от массы серы)
Серная кислота +
+ железо
сернокислое (закисное)
Серная кислота +
+ железо
сернокислое (закисное)
Серная кислота +
+ железо
сернокислое
(закисное) + железо
сернокислое (окис-
ное)
Серная кислота +
+ железо
сернокислое (окисное)
Серная кислота +
+ железо
сернокислое
(закисное) + окись
титана +
сернокислые соли AI, Cr и
Мп
80 %-ная серная
кислота +
метиловые эфиры
жирных кислот
Серная кислота +
+ натрий хлорис-
тыи
Серная кислота +
+ натрий
хлористый-)- натрий
азотнокислый
(травильный
раствор)
Серная кислота +
+ натрий
хлористый + двух- и
трехвалентные
соли железа
Серная кислота +
+ никель
сернокислый
Серная кислота +
+ хромпик
калиевый или
натриевый + глюкоза
Серная кислота +
+ соляная
кислота + вода
остальное
2
20
20
30
20
30
1
30
4
50
5
4
—
10
5
20
2
2
10
10
—
28
40
20
25
10
9
10
81
3
Расплав
^КИП
—
—
^кип
—
^кип
—
125
—
—
120
80
^кип
80
—
'кип
60—80
—
—
ПО
—
107
—
—
^кип
—
4
__
0,15—
0,25
1,8—
1,4
—
1,0
—
—
—
—
—
—
—
—
—
0,2
—
—
—
—
—
—
—
—
—
0,12
—
5
6
6
8
—
8
—
—
—
—
8
—
—
6
5
6
—
—
6
—
—
5
8
—
—
6
—
6
0,12—
0,22
0,8—0,9
0,45
—
—
2,31
2,31
—
—
—
0,06
0,08—
0,036
—
0,5—
0,66
—
—
—
—
—
—
7
6—7
6
7
6
—
8
8
—
4
5
5
—
7
3
—
—
5
—
6
—
—
—
—
8
[40]
[40]
[40]
[40]
[283]
[40]
[40]
[253]
[40]
[40]
[40]
[40]
—
—
[40]
[253]
—
[253]
—
288
Продолжение табл. 12
Соляная
кислота + алюминий
хлористый
Соляная
кислота + анилин +
+ хлористый
алюминий, давление
0,98МПаA0ат)
Соляная
кислота + железо
хлористое
Соляная
кислота + железо
хлористое
Соляная
кислота + железо
хлористое
Соляная
кислота + марганец
хлористый
Сплав свинца -Ь--
+ (натрий) 10 %)
Спиртовой раствор
с 25—30 %-ной
соляной
кислотой*
Уксусная
кислота + уксусный
ангидрид +
перекиси
Фенол + ацетон +
+ толуол + тио-
гликолевая
кислота
Фосфорный
ангидрид + кремнефто-
ристоводородная
кислота + соляная
кислота + серная
кислота
Фтор истоводород-
ная кислота +
+ кремнефтористо-
водородная
кислота
HF H3PO4 H2SO4
Следы 30 50
3 45 5
1 25 2
Соляная кислота
1
0,8
18
20
18
22
20
40
32
1
2
2
22,5
35
1—2
0,14—
0,15
300
80
80
80
75
300
40
100
60—80
90
43,5
140
50
80
20
5—6
1,96
1,95
0,058
4—5
0,15
0,20
10
5
8—9
2
[253]
[То]
[40]
[40]
[40]
[40]
[40]
[301]
[40]
[40]
[253]
[215]
[40]
[40
[40
[130
* Коррозионностойкие стали нестойкие, сплав 06ХН28МДТ корродирует со
скоростью 2,193 мм/год.
Ю Заказ № 1104
289
Продолжение табл. 12
1
Соляная кислота
Соляная кислота
под давлением
Сульфоугольная
кислота
Сурьма хлористая
Трихлоруксусная
кислота
Углерод двухло-
ристый
Уксусная кислота
Фосфорная
кислота
Под давлением
Производство
фосфорной кислоты
в электропечах
Фтористоводородная кислота
2
1—2
1—2
5
5
5
10
20
21
25
37
1—2
3—5
5—20
20—37
—
Все
концентра-
ттии
дли
То же
65
50
80
98
трированная
50—60
60—70
70—80
85
10—50
85
5
10
10
25
30
30
45
3
70
^кип
20
70
^кип
20
70
^кип
20
70
*кип
^кип
20
70
^кип
20
70
190
190
190
190
60—80
20
20
120
^кип
^кип
165
^кип
^кип
*кип
чсип
190
^кип
20
70
96
20
70
95
20
4
_
—
—
—
—
—
—
—
—
—
—
0,51
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
0,067
—
—
—
—
—
5
3
6
3
5
6
3
5
6
4
5
7
7
3
5
7
4
7
8
7
7
9
10
6
5
—
—
3
4
5
5
5—6
6
6
7
7
5
4
6
7
6
7
8
5
6
_
—
—
—
—
—
—
—
—
—
—
—
—
—
—
26,62
79,52
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
12,25
—
—
—
—
—
7
5
8
3
6
8
5
7
9
5
8
10
—
5
8
—
5
10
10
10
10
10
10
—
—
5
5
3
4
5
5
5—6
6
6
8
9
10
5
7
8
6
7
7
6
8
[130]
ИЗО]
[130]
[130]
[130]
130]
130
130
130
130
130
254
130
130
[49]
[130
[49
[49]
[170
[170
[170
[170
ко:
[130]
[130]
[253]
130]
130]
130
130
130
130
130
130
130
215]
130
130
130
130
130
130
130
290
Продолжение табл. 12
1
Фтористоводородная кислота
Хлор влажный
С содержанием
воды
Хлор безводный
Хлора диоксид
Хлорирование
нитробензола
Хлорирование
паронитробензола
до 3,4 дихлорбен-
зола
Хлористый
аммоний
Хлористый барий
Хлористый метил
Хлористый
метилен
Хлористый цинк
Хлорноватисто-
кислый кальций
(раствор с 3 %
хлора)
Хлоруксусная
кислота
Хлорная кислота
2
45
Сухой
газ
—
0,4
4,0
15,0
22,0
—
—
—
—
—
25
Насыщенный
Все
центрации
25
—
70
40
68
—
—
10—50
трированная
1—2
5
10
15
20
25
3
100
100
20
100
100
100
100
300
400
500
45
80
80
^кип
^кип
140—144
100
80
60
^кип
^кип
20
70
20
20
^кип
20
70
'кип
20
70
*кип
20
^кип
20
70
^кип
20
70
/кип
20
70
4
_
—
—
—
—
—
—
0,19
3,68
5,46
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
5
—
2
3
4
7
8
6
8
9
—
6
7
—
—
5
—
6
5
—
5
—
—
5
6
10
2
3
6
2
6
7
2
7
3
6
7
3
7
8
4
7
6
_
—
—
—
—
—
—
1,19
—
5,32
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
7
10
3
3
4
5
3
9
6
—
9
6
7
8
3
5
—
5
—
5
6
5
4
8
5
5
10
3
5
8
3
6
8
3
8
4
7
10
5
8
10
5
8
8
[130]
[130]
[130]
[40
[40
[40
[40
[87
[87
[87
[130
[40
[40]
[130]
[130]
[49]
253]
130
253
253
130
130
130
[130]
[130]
130]
130
130
130
130
130
[130]
[130]
ИЗО]
[130]
[130]
[130
[130
[130
[130
[130
10*
Продолжение табл. 12
1
Хлорная кислота
Хлорноватая
кислота
Хлорноватая
кислота
Щавелевая
кислота
Этилен хлористый,
содержащий
небольшое
количество пара
Этилмеркурхло-
рид
2
37
1—2
5
10
15
20
25
10—50
—
—
3
20
70
20
70
/кип
20
70
/кип
20
70
/кип
20
70
/кип
20
70
/кип
20
70
20
/кип
ПО
85
4
_
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
5
4
7
CNJ
6
7
3
6
7
4
6
7
4
6
7
4
6
7
5
7
3
5
—
—
6
_
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
7
5
3
6
8
4
7
9
5
7
9
5
8
10
5
7
10
5
8
3
5
5
5
8
[130]
[130]
[253]
[253]
[258]
253]
253]
253]
253
253
253
253
253
253
253
253
[253
[253
[253
[130]
[130]
[130]
[40]
ПРИЛОЖЕНИЯ
ПРИЛОЖЕНИЕ 1.
ПЕРЕЧЕНЬ КОРРОЗИОННЫХ СРЕД
Наименование среды
1
Адипиновая кислота
Азота окислы
Азотистая кислота
Азотная кислота
Азотная кислота (красная)
Акриловая кислота
Акрилонитрил
Акролеин
Алкилдиамин
Алкилсульфат
Алкилфенол
Алюминий
Алюминий азотнокислый
Алюминий сернокислый (сульфат алюминия)
Алюминий солянокислый
Алюминий уксуснокислый (ацетат алюминия)
Алюминий фтористый
Алюминий хлористый (хлорид алюминия)
Амид
Амилацетат (уксусноамиловый эфир)
Амил хлористый (амилхлорид, хлорамил,
хлорноватистоамиловый эфир)
Аминобензойная кислота (кислота антрани-
ловая)
Аммиак
Аммоний азотнокислый (селитра аммиачная,
нитрат аммония)
Аммоний бромистый (бромид аммония)
Аммоний двууглекислый (аммоний кислый,
углекислый, бикарбонат аммония)
Аммоний кремнефтористый
Аммоний молибденовокислый
Аммоний надсернокислый (персульфат
аммония)
Аммоний надхлорнокислый (перхлорат
аммония)
Аммоний сернистокислый (сульфит)
Аммоний сернистый
Аммоний сернокислый (сульфат)
Аммоний углекислый (карбонат аммония)
Аммоний фосфорнокислый (фосфат аммония)
Аммоний фтористый
Аммоний хлористый (см. хлористый
аммоний)
Аммоний хлорнокислый
Аммоний щавелевокислый (оксалат аммония)
Ангидрид муравьиной кислоты
Химическая формула
2
(СН2СН2ССШаJ
NO, N02, N2O3, N2O5, N20
HNO2
HNOg
HNO3 + N02 + NO
CH2=CHCO2H
CH2=CHCN
CH2 :CHCHO
C2H4(NHJ
C2H5SO4
C2H5C6H5OH
Al
A1(NO3K
A1(SO4K
AlCls
A1(C2H3O2K
A1F3
AICI3
NH
СН3СО2С5НП
C5H4C1
NH2C6H4CO2H
NH3
NH4NO3
NH4Br
NH4HCO3
(NH4JSiF6
(NH4JMoO4
(NH4JS2O8
(NH4)C1O4
(NH4JSO3
(NH4JS
(NH4JSO4
(MH4JCO3
(NH4KPO4
NH4F
NH4CI .0:
(NH4)C1O4
(NH4JC2O4
CHaOHCOH
4
Продолжение прил. 1
1
Ангидрид уксусной кислоты
Ангидрид фосфорной кислоты
Английская соль (магний сернокислый)
Анилин (аминобензол, фениламин)
Анилин солянокислый (хлористоводородный,
анилиновая соль)
Анилин хлористый
Аспирин (ацетилсалициловая кислота)
Ацетальдегид
Ацетанилид (анилид уксусной кислоты, анти-
фсирин^
Ацетилацетон
Ацетил хлористый
Ацетилен
Ацетилцеллюлоза (целлюлозы триацетат)
Ацетон (диметилкетон)
Барий азотнокислый (нитрат бария,
баритовая селитра)
Бария окись
Бария перекись
Барий сернистый (сульфид бария,
сернокислый барит)
Барий сернокислый (сульфат бария)
Барий углекислый (карбонат бария)
Барий хлористый (хлорид бария)
Белильная известь (хлорная известь)
Бензальдегид (бензойный альдегид)
Бензилацетат
Бензидин (диаминобифенил, диаминодифе-
нил)
Бензол хлористый (бензол хлорид, хлоран-
гидрид бензойной кислоты)
Бензойная кислота
Бензол
Бензолсульфоновая кислота
Бензотрихлорид
Бифторид аммония
Бифторид калия
Борная кислота
Бор хлористый
Бром
Бромистоводородная кислота
Бромистый метил
Бромистый этилен
Бромоформ
Бура борнонатриевая (пироборный натрий)
Бутадиен 1, 3 (дивинил)
Бутан
Бутилацетат (бутиловый эфир уксусной
кислоты, уксуснобутиловый эфир)
Бутил хлористый
Винил хлористый
Винная кислота (кислота виннокаменная)
2
с4н6о3
р2о5
MgSO4-7H2O
C6H5NH2
C6H5NH2C1
C6H5NHC1
с9н8о4
СН3СНО
C6H5NHCOCH3
СН3СОСН2СОСН3
CHgCOCl
с2н2
[C12H17O7(ONO2K]4
CH3COCH3
Ba(NO3J
BaO
BaO2
BaS
BaSO4
BaCO3
BaCl2
Ca(C10J
C6H5CHO
CH3COOCH2C6H5
NH2C6H4C6H4NH2
C7H5OC1
C6H5COOH
сбн6
C6H5SO3H
C6H5CC13
NH4HF
K-HF
HBO3
BC13
Rr
LJL
HBr
CH3Br
BrCH2CH2Br
CHBr2
Na2B4O7-10H2O
CH2=CH-CH=CH2
CH3CH2CH2CH3
CH3CO2C4H3
C4H3C1
CH2 : CHC1
C2H2(OHJ(COOHJ
294
Продолжение прил. 1
1
Винный камень (калий кислый виннокислый)
Вода
Газ углекислый (насыщенный парами воды)
Галловая кислота (или триоксибензойная)
Гашеная известь (гидрат окиси кальция,
известковое молоко)
Гексаметилентетрамин (уротропин)
Гексахлорбензол
Гидрид лития
Гидразин
Гидроокись бария
Гипс (водный сернокислый кальций)
Глауберова соль (водный сернокислый
натрий, водный сульфат натрия)
Гликоль (этиленгликоль)
Гликолевая кислота
Глицерин
Глутаровая кислота
Глюкоза (виноградный сахар, декстроза,
крахмальный сахар, картофельный сахар)
d-винная кисюта (кислота виннокаменная)
Двуокись углерода (углекислый газ,
угольный ангидрид, углекислота)
Двуокись хлора
Дибутилфталат
Динитрохлорбензол
Диоксан
Дихлорбензол
Дихлорметан
Дихлоруксусная кислота
Дихлорэтилен
Дубильная кислота (дигалловая)
Едкое кали (гидрат окиси калия,
каустический поташ)
Едкий натр (гидрат окиси натрия,
каустическая сода)
Железо азотнокислое (нитрат железа)
Железо сернокислое (закисное)
Железо хлористое
Железо хлорное
Желтая кровяная соль (железистосинеродис-
тый калий, боруссикум)
Жидкое стекло
Известь хлорная (белильная известь)
Иод
Иодистоводородная кислота
Йодистый водород (безводный)
Йодоформ
Кадмий
Калий азотнокислый (нитрат калия)
Калий бромистый (бромид калия)
Калий двухромовокислый (калиевый
хромпик)
2
кс4н5об
Н9О
CO2 + Н2О
СбН2(ОНJСООН
Са(ОНJ
(CH2NN4
С6С16
LiH
CH3CONHNHC6H5
Ва(ОНJ-8Н2О
CaSO4-2H2O
NaSO4- ЮН2О
СН2ОН-СН2ОН
НОСН2СО2Н
СНОН(СН2ОНJ
СО2Н(СНK-СО2Н
СН2ОН(СНОНLСНО
СООН(СНОНJСООН
со2
СЮ3
С6Н4(СО2С4Н9J
C6H3(NO2JC1
ОСН2-ОСН2СН2-СН2
СбН4С12
СН2С12
С2Н2С12О2
СНС1-СНС1
С14Н10Ое
кон
NaOH
Fe(NO3K-9H2O
FeSO4-7H2O
FeCl2-4H2O
FeCl3-6H2O
K4Fe(CNN-3H2O
K2O-nSiO2 или Na2OttSi02
Ca(OClJ
^2
HI
HI
CHI3
Cd
KNO3
KBr
K2Cr207
295
Продолжение прил. I
1
Калий двууглекислый (бикарбонат калия)
Калий йодистый
Калий иодноватокислый
Калий кислый виннокислый (винный камень)
Калий кислый сернистокислый (биосульфит
калия)
Калий кислый сернокислый (бисульфат
калия)
Калий кислый щавелевокислый (двущавеле-
вокислый калий, биоксалат калия)
Калий кремнекислый (силикат калия,
калиевый вассергласс)
Калий марганцевокислый (перманганат
калия)
Калий надсернокислый (персульфат калия)
Калий роданистый (серосинеродистый калий,
роданид, сульфоцианид калия)
Калий сернистый (сульфид калия)
Калий серноватистокислый (метабисульфат)
Калий сернокислый (сульфат калия)
Калий углекислый (поташ, карбонат калия)
Калий уксуснокислый (ацетат калия)
Калий хлористый (хлорид калия, хлоркали)
Калий хлорноватокислый (бертолетова соль,
хлорат калия)
Калий хлорноватистокислый
Калий цианистый
Калий щавелевокислый (оксалат калия)
Кальций азотнокислый (норвежская селитра,
иПТПОТ I/O ТТТ-ТТТ,Т«тЛ
rirllUal КаЛЬЦИЯ)
Кальций кислый сернистокислый (двусернис-
тый кальций, бисульфит кальция)
Кальций хлористый (хлорид кальция)
Кальций хлорноватистокислый (гипохлорит
кальция)
Кальций хлорноватокислый
Камфора
Каприловая кислота
Каприновая кислота
Капроновая кислота
Карбамид (мочевина)
Карналлит
Карболовая кислота (фенол)
Квасцы алюминиевокалиевые
Квасцы аммиачные
Квасцы хромовые (калийхромовые квасцы)
Кислород
Красная кровяная соль (калий железосине-
Крезол (метилфенол)
Кремнефтористоводородная кислота
Кремний четыреххлористый
Кротоновый альдегид
2
КНСОз
КІ
кю3
кнс4н4о6
KHSO3
KHSO4
кнс2о4
K2Si03
КМоО4
K2S2O8
KNCS
K2S
K2S2O3
K2SO4
к2со3
КС2Нз02
КС1
KC1O3
ксю
KCN
K2C2O4
Ca(NO3J
CaHSO3
CaCl3
Ca(OClJ-4H2O
Ca(OClK-2H2O
cjHuCH(NHa)COOH
CH3(CH2)8-COOH
CH3(CH2L-COOH
NH2COONO4
MgCl2 + KC1
C?H5OH
KA1(SO4J-24H2O
(NH4)A1(SO4J- 12H2O
KCr(SO4J-12H2O
o2
K3Fe(CNN
CH3C6H4OH
H2SiF6
SiCl4
CH3CH=CHCHO
296
Продолжение прил. 1
Ксилол
Кумол (изо-пропиленбензол)
Купоросное масло
Левулиновая кислота
Ледяная уксусная кислота
Лимонная кислота
Литий хлористый
Магний сернокислый (английская соль,
горькая соль, сульфат магния)
Магний углекислый (карбонат магния)
Магний хлористый (хлорид магния, хлормаг-
ний)
Магний хлористый, гидрат 42 %-ный
Малеиновая кислота
Марганец сернокислый (сернокислая закись
марганца, марганцевый купорос, сульфат
марганца)
Марганец хлористый (хлорид марганца)
Масляная кислота
Медь азотнокислая
Медь мышьяковистая
Медь сернокислая (медный купорос)
Медь уксуснокислая
Медь хлористая (однохлористая)
Медь хлорная (двухлористая)
Медь цианистая
Меламин
Меланж кислотный
Меркаптаны
Метабисульфит
Метакриловая кислота
Метиламин
Мети лэтил кетон
Молочная кислота (оксипропионовая
кислота)
Монохлоруксусная кислота (хлоруксусная
кислота)
Муравьиная кислота
Мышьяковистый ангидрид
Мышьяковая кислота
Мышьяк хлористый
Миристиновая кислота
Натрий азотистокислый (нитрит натрия)
Натрий азотнокислый (нитрат натрия)
Натрий бромистый (бромид натрия)
Натрий двууглекислый (натрий кислый
углекислый, бикарбонат натрия, двууглекислая
сода)
Натрий борнокислый
Натрий кислый сернокислый (бисульфат
натрия)
СвН5С3Н7
H2SO4 (90,5—92,5 %-ная)
СН3СОСН2СН2СО2Н
100 %-ная уксусная кислота
(твердая)
С6Н8О7-Н2О
LiCl
MgSO4
MgCO3
MgCl2
MgCl2-6H2O
C2H2(COOHJ
MnSO4
MnCl2
C3H7COOH
Cu(NO3J
Cu3As2
CuSO4-5H2O
CuOH(C2H3O2V6H2O
Cu2Cl2
CuCl2
Cu(CNJ
C3N3(NH2K
HNO3 + H2SO4 (87—89
HNO3)
RSH
K2S2O3 или Na2S2O3
CH2=C(CH3)COOC4H9
CH3NH2
C2H5COCH3
CH3CHOHCOOH
-ная
CH2C1COOH
HCOOH
As2O3
H3AsO4-0,5H2O
AsCl3
CH8(CH2I2COaH
NaNO2
NaNO3
NaBr
NaHCO3
NaB4O7
NaHSO4
297
Продолжение прил.
1
Натрий кислый сернистокислый (бисульфит
LT -1 "Г ї~і Т а ?Т ¦
rtdlpHHj
Натрии кремнекислый (силикат натрия,
жидкое стекло)
Натрий кремнефтористый
Натрий лимоннокислый (цитрат натрия)
Натрий надхлорнокислый (перхлорат
натрия)
Натрий салициловокислый (салицилат
натрия)
Натрий сернистый (сульфид натрия)
Натрий сернистокислый (сульфит натрия)
Натрий серноватистокислый (гипосульфит
натрия, тиосульфат, антихлор)
Натрий сернокислый (сульфат натрия,
глауберова соль)
Натрий углекислый (стиральная, бельевая,
кальцинированная сода, карбонат натрия)
Натрий углекислый кислый (питьевая
очищенная сода)
Натрий уксуснокислый (ацетат натрия, ук-
суснонатриевая соль)
Натрий фосфорнокислый (фосфат натрия)
Натрий фтористый (флюорид натрия)
Натрий хлористый (поваренная соль)
Натрий хлорноватистокислый (гипохлорит)
Натрий хлорноватокислый (хлорат натрия)
Натрий хлорнокислый (перхлорат натрия)
Натрий цианистый (цианид натрия)
Натрий щавелевокислый (оксалат натрия)
Нашатырный спирт
Нашатырь
Никель азотнокислый
Никель сернокислый (сульфат никеля, нике-
7Т U ТЭТ_ТТЛ \Т \ ГТТ /"ЧЇЛ Ґ\Ґ* ¦
лсьыи купоросу
Никель хлористый (хлорид никеля)
Нитробензол (мирбановое масло, мирбановая
эссенция)
Нитроглицерин (нитрат глицерина,
азотнокислый глицерин)
Нитрозил хлористый
Нитрофенол
Нитрозил хлористый (нитрохлорбензол)
Озон
Окись бария
Окись свинца
Окись углерода
Олеиновая кислота
Олеум (дымящая серная кислота)
Олово
Олово аммонийнохлористое
Олово хлористое (олово двухлористое)
Олово хлорное (олово четыреххлористое)
2
NaHSO3
Na2Si03
Na2SiF6
Na2C6H5O7-2H2O
NaC104
C6H4(OH)CO2Na
Na2S-9H2O
Na2SO3-7H2O
Na2S2O3-5H2O
Na2SO4- 10H2O
NaCO3- 10H2O
NaHCO3
CHgCOONa
Na3PO4-12H2O
NaF
NaCl
NaCIO
NaC103
NaC104-H20
NaCN
Na2C2O4
NH4OH B4 % NH3)
NH4C1
Ni(NO3J
NiSO4-7H2O
NiCl2-6H2O
C6H5NO2
C3H6(OHO2K
NOC1
NO2C6H4OH
C1C6H4NO3
o3
BaO
PbO
СО
C17N33COOH
H2SO4+ AiSO3 A8,5—60 % SO3)
Sn
(NH4JSnCle
SnCl2
SnCl4
298
Продолжение прил. 1
1
Пальмитиновая кислота
Пары кремнефтористого водорода
Пары фтористого водорода
Пары хлористого водорода
Пенициллин
Пергидроль
Перекись бария
Перекись водорода
Перекись калия
Перекись натргия
Персульфат калия
Перхлорэтилен
Пикриновая кислота (тринитрофенол)
Пирогалловая кислота (пирогаллол)
Пиридин
Пропиленгликоль
Пропилен двухлористый
Пропионовая кислота
Ртуть азотнокислая (нитрат ртути)
Ртуть металлическая
Ртуть хлористая (каломель)
Ртуть хлорная (сулема, двухлористая ртуть)
Ртуть цианистая
Салициловая кислота (ортооксибензойная)
Сахарин
Свинец азотнокислый (нитрат свинца)
Свинец металлический
Свинец уксуснокислый (ацетат свинца,
свинцовый сахар, сахар-сатурн)
Селен
Селеновая кислота
Сера
Сера двухлористая
Сера хлористая
Серебро азотнокислое (ляпис, нитрат
серебра, адский камень)
Серебро бромистое
Серебро хлористое (хлорид серебра)
Серная кислота
Сернистая кислота
Сернистый ангидрид (сернистый газ,
двуокись серы, ангидрид сернистой кислоты)
Сероводородная кислота (сероводород)
Сероуглерод (сернистый углерод)
Соляная кислота (хлористоводородная)
Спирт амиловый
Спирт бензиловый (фенилкарбинол)
Спирт бутиловый (бутанол)
Спирт древесный (метиловый, метанол,
карбинол)
Спирт винный (этиловый, этанол, метилкар-
бинол, обыкновенный спирт)
2
СН3(СН2I4-СО2Н
H2SiF6
HF
неї
C9HnO4N2SR
H2O2, 27—31 %-ный водный
раствор
ВаО2
Н2О2
К2О4
Na2O2
K2S2O8
СС12—СС12
(NO2KC6H2OH(NO2K
С6Н3(ОН)з
C3H6NOH
СН2СНОН-СН2ОН
СН2СН : СС12
С2НбСО2Н
Hg(NO3J
Hg
Hg2Cl2
HgCl2
Hg(CNJ
HO(C6H4CO2H)
CeH4SO2NHCO
Pb(NO3J
Pb
(CH3COOJ
Se
H2Se04
s
SC12
S2C12
AgNO3
AgBr
AgCl
H2SO4
H2SO3
so2
H2S
cs2
неї
CH3(CH2KCHOOH
C6H6CH2OH -
CH3(CH2JCH2OH
CH3OH
C2H5OH
299
Продолжение прил. 1
Стеариновая кислота
Стирол
Стрептомицин
Сульфоугольная кислота
Сурьма
Сурьма треххлористая (хлористая,
сурьмяное масло)
Сульфат цинка (цинк сернокислый, цинковый
купорос, белый купорос)
Сурьма хлористая, см. треххлористая сурьма
Танин
Тетрахлорэтан
Тиогликолевая кислота
Толуол (метилбензол)
Треххлористая сурьма
Трихлорэтан
Трихлорэтилен
Трихлоруксусная кислота
Трифторхлорэтилен
Триэтаноламин
Углерод четыреххлористый (тетрахлорметан)
Угольная кислота
Уксусная кислота
Уксусная медь
Уксусный ангидрид (ангидрид уксусной
кислоты)
Формамид
Формалин (формальдегид, метиловый
альдегид, муравьиный ангидрид)
Фосген жидкий (хлорокись углерода)
Фосфорная кислота (ортофосфорная)
Фосфор
Фосфор треххлористый
Фосфора хлорокись
Фреон
Фталиевая кислота
Фтор
Фтористоводородная кислота (плавиковая
кислота)
Фтористый натрий
Фурфурол (фурол, фуранальдегид)
Хинин сернокислый (сульфат хинина)
Хлор
Хлорамил
Хлорбензол (хлористый бензол)
Хлористый аммоний (нашатырь)
Хлористый ацетил
Хлористый бензил
Хлористый бензоил
Хлористый метил (хлорметил)
Хлористая сера
Хлористый фосфор
і72б2Н
C2iH3oO12N7
CH3CO2HCO3
Sb
SbCl3
ZnSO4
SbCl3
СібН52О46
CHC12-CHC12
HS-CH2-CO2H
C6H5CH3
SbCl
CH2C1CHC12
C2HC13
CC13COOH
CC1F=CF2
N(CH2=CH2OHJ
CC14
H3CO3
CH3COOH
Cu(C2H3O2J
(CH3COJO
HCONH2
CH2O
COC12
H3PO4
p
РСІЗ
POC13
CFC12-CFC12
CeH4(CO2HJ
F
HF
NaF
C5H4O2
C20H24O2N2-H2SO4
C5H„C1
C6H5C1
NH4C!
CH3COCI
C6H5CH2C1
C6H5COC1
CH3C1
SC14
PC15
300
Продолжение прил. 1
Хлористый цинк
Хлористый этил
Хлористый этилен
Хлорная известь (белильная известь)
Хлорная кислота
Хлорноватая кислота
Хлорноватистая кислота
Хлорноватистокислый кальций (гипохлорит
кальция)
Хлороформ
Хлорсерная кислота
Хлорсиланы
Хлорсульфоновая кислота
Хлоруксусная кислота
Хромпик калиевый
Хромовая кислота
Царская водка
Цезий хлористый
Цианистая кислота
Циановая кислота
Циклогексан
Циклогексанол
Цинк металлический
Цинк сернокислый
Цинк цианистый
Цирконий хлористый
Четыреххлористый титан
Четыреххлористый углерод (тетрахлорметан)
Щавелевая кислота
Щавелевокислый натрий (оксалат натрия)
Этан
Этаноламин
Этан пятихлористый
Этан четыреххлористый
Этиленбензол
Этилен
Этилен двухлористый (дихлорэтан)
Этиленгликоль
Этиленхлоргидрин
Этилен хлористый
Этилмеркурхлорид
Этиловый эфир
Эфир уксусно-этиловый (этилацетат)
Эфир этиловый
Яблочная кислота
Янтарная кислота (этилендикарбоновая)
ZnCl2
С2Н5С1
С1СН2-СН2С1
Са(ОС1J
НСЮ4
НСЮ3
нею
Са(С1ОJ-4Н2О
CHClg
HOCISOa
(CH2ClLSi
HC1SO3
CH3COOC1
K2Cr04
H2Cr04
Смесь
азотной
CsCl
HCN
HCNO
концентрированных
и соляной кислот 1 : З
I
C6H12O
Zn
ZnSO4
Zn(CNJ
ZrCl4
TiCl4
CC14
H2C2O4
Na2C2O4
CH3CH3
H2NCH2CH2OH
CHC15
(CHC12J
C?H5CH2CH3
CH2 : CH2
CH2C1-CH2C1
CH2OH-CH2OH
HOC12CH2C1
C2H5C1
CH3HgCl
(C2H5JO
C4H8O2
(C2H5JO
C4H6O5
C2H4(COOHJ
301
ПРИЛОЖЕНИЕ II.
ФИЗИЧЕСКИЕ СВОЙСТВА НЕРЖАВЕЮЩИХ СТАЛЕЙ И СПЛАВОВ
Марка стали
и сплавов
1
08X13
12X13
12X17
08X111
14Х17Н2
15Х25Т
15X28
12Х21Н5Т
08Х22Н6Т
08Х21Н6М2Т
10Х14Г14Н4Т
08Х18Г8Н2Т
12Х18Н10Т
08Х18Н10Т
10Х17Н13М2Т
10Х17Н13МЗТ
06Х28МДТ
Н70МФ
ХН65МВ
03Х18Н11
03Х17Н14МЗ
03Х23Н6
03Н22Н6М2
04Х25Н5М2
03Х21Н2ІМ4ГБ
03Х28МДТ
Н65М-ВИ
ЭП 982-ВИ
І
Пло
г/см
2
7,77
7,75
7,7
7,7
7,67
7,6
7,6
7,8
7,8
7,7
7,8
7,7
7,8
7,8
7,9
7,9
7,96
9,2
9,2
7,85
7,75
7,6
7,7
7,8
7,99
7,96
9,308
g
1*0
Ока.
косі
3
750
750
850
850
950
1100
1100
1000
1000
950
700
900
875
875
850
850
950
—
—
—
—
900
—
—
Коэффициент линейного расширения 10~°
20-100
4
10,5
10,5
10,0
10,0
10,0
10,1
10,0
11,0
10,0
12,0
16,0
12,3
16,8
16,0
16,5
16,5
10,9
6,7
8,0
—
—
9,5
—
13,7
—
—
в интервале температур, С
20—200
5
11,0
11,0
10,5
10,0
10,5
10,7
10,5
14,0
13,0
12,5
16,7
13,2
17,1
17,0
17,5
17,5
12,9
8,5
9,5
—
13,8
13,8
13,8
—
15,3
12,85
—
2Q 300
6
11,5
11,5
10,5
10,5
11,0
11,0
10,5
16,8
16,0
12,7
17,5
14,4
17,5
17,0
18,0
18,5
13,6
9,5
9,5
—
14,4
16,0
16,0
—
16,75
13,60
—
20—400
7
12,0
12,0
10,5
10,5
11,0
11,2
11,0
16,8
16,0
13,0
20,0
14,8
17,9
18,0
18,5
18,5
14,4
10,0
10,0
—
—
—
17,4
—
—
20 500
8
12,0
12,0
11,0
11,0
11,0
11,3
11,0
17,4
16,4
13,5
20,0
15,4
18,3
18,0
19,0
18,5
14,8
10,2
10,4
17,0
ПРИЛОЖЕНИЕ III.
НЕКОТОРЫЕ СВОЙСТВА ЧИСТЫХ МЕТАЛЛОВ
Металл
1
Алюминий
Барий
Бериллий
Бор
Ванадий
Атомный
номер
2
13
56
4
5
23
Радиус
атома, нм
3
0,141
0,221
0,113
0,091
0.134
Плотность
при 20 °С,
г/см3
4
2,7
3,76
1,85
2,34
5.96
Температура, °С
плавления
5
660
710
1285
2070
1900
кипения
6
2500
1640
2970
3700
3000
Коэффициент
линейного
расширения
(при 20 °С)
7
23,1
12,2
8.3
сть
о
5
hl
8
20
140
260
302
Продолжение прил. Ill
1
Висмут
Вольфрам
Галлий
Гафний
Германий
Железо*
Золото
Индий
Иттрий
Иридий
Кадмий
Калий
Кобальт
Лантан
Литий
Магний
Марганец*
Медь
Молибден
Мышьяк
Натрий
Никель
Ниобий
Олово*
Осмий
Палладий
Платина
Рений
Родий
Ртуть
Рубидий
Рутений
Свинец
Селен
Серебро
Скандий
Стронций
Сурьма
Таллий*
Тантал
Теллур
Титан
Хром
Цезий
Церий
Цинк
Цирконий
2
83
74
31
72
32
26
79
49
39
77
48
19
27
57
3
12
25
29
42
33
11
28
41
50
75
46
78
75
45
80
37
44
82
34
47
21
38
51
81
73
52
22
24
55
58
30
40
3
0,182
0,140
0,139
0,159
0,139
0,126
0,144
0,166
0,181
0,135
0,156
0,236
0,125
0,187
0,155
0,160
0,130
0,128
0,139
0,148
0,189
0,124
0,145
0,158
0,135
0,137
0,138
0,137
0,134
0,160
0,248
0,134
0,175
0,117
0,144
0,164
0,160
0,161
0,171
0,146
0,137
0,146
0,127
0,268
—
0,139
0,160
4
9,80
19,3
5,90
13,3
5,32
7,87
19,3
7,31
4,48
22,6
8,65
0,86
8,89
6,16
0,53
1,74
7,44
8,96
10,2
5,72
0,97
8,91
8,57
7,29
22,5
12,2
21,6
21,0
12,4
13,5
1,53
12,4
11,34
10,5
3,02
1,74
6,68
11,85
16,6
6,25
4,500
7,19
1,90
6,8
7,13
6,45
5
271,3
3410
29,0
1975
236
1539
1063
156,4
1528
2450
321,0
63,55
1492
920
179
651
1245
1083
2625
817
97,8
1495
2500
231,9
3050
1551
1790
3190
1960
—38,9
38,8
2250
327,4
217
960
1539
151
630,5
304
3000
449,81
1665
1890
28,5
630
419,5
1855
6
1550
5500
2205
—
2850
2870
2600
2000
3300
4400
367
776
3100
3450
1350
1107
2150
2300
4800
630
883
3080
3700
2430
5000
2940
3800
—
3700
356,7
705ч
4200
1750
685
2167
2850
1107
1634
1475
990
3260
2470
690
—
306
3580
7
4,3
—
—
11,5
9,7
—
—
—
12,5
25,7
22,1
16,5
4,9
—
13,5
7,2
46,6
—
—
—
—
—
—
—
—
28,1
14,2
—
—
—
7,14
6,2
—
32,5
6,23
8
300
70
19
18
150
20
50
30
200
35
150
—
60
80
5
350
30
30
50
—
200
4
25
—
30
3
—
80
100
—
35
100
ліеіалльї су ш,есі ьу tu і ч
ских модификациях.
ПРИЛОЖЕНИЕ IV.
ПЛОТНОСТЬ ОКСИДОВ НЕКОТОРЫХ МЕТАЛЛОВ
Формула
Л!аОа
А12О
CdO
CoO
Со3О4
Со2О3
Сг2О3
СгО3
Си2О
CuO
FeO
Fe3O4
Fe2O3
NiO
Ni2O3
Плотность,
г/см8
3,9
4,0
8,15
6,47
6,07
5,18
5,21
2,70
6,0
6,4
5,7
5,2
5,24
6,8
4,83
Формула
MnO
Mn3O4
Mn2O3
MnO2
Mo2O7
MoO2
MoO
Nb
NbO
Nb2O5
Pb2O
PbO
PbO2
Pb3O4
SnO
SnO2
Плотность,
г/см3
5,45
4,86
4,50
5,03
2,4
4,52
4,5
8,4
6,27
4,6
8,34
9,4
9,38
9,1
6,45
7,0
Формула
MgO
Ta2O2
Ta2O5
Ti2O3
ТіО
ТіО2
V2O3
v2o4
v2o5
wo2
WO3
ZnO
ZrO2
Плотность,
г/см3
3,65
7,35.
8,74
4,6
4,93
3,84
4,87
4,34
3,36
12,11
7,16
5,47
5,49
ПРИЛОЖЕНИЕ V.
РАСТВОРЫ ДЛЯ УДАЛЕНИЯ ПРОДУКТОВ КОРРОЗИИ
Металл
1
Коррозионностойкие
стали
Состав раствора
2
1. 600 г едкого натра +
+ 400 г углекислого
натрия
2. 10—15 %-ный раствор
едкого натра
3. 10—15 %-ный раствор
лимонной + 5 % серной
кислоты + 0,1 %
ингибитора
Обработка, режим
3
Механическая зачистка
чернильной резинкой
Электрохимическая, / =
= 400° С, ?>к = 15 А/дм2.
Образец подключают к
катоду, анодом служит кор-
розионностойкая сталь,
площадь анода в 5 раз
больше площади образца
Электрохимическая, t =
= 40 -т- 50 °С, DK =
= 10 А/дм2
Химическая, / = 60° С
304
Продолжение прил. V
1
Коррозионностойкие
стали
Стальные детали с
жесткими допусками
Конструкционные,
углеродистые и
низколегированные стали
Никель и никелевые
сплавы
Ниобий
Титан и его сплавы
Молибден
Медь и медные сплавы
2
4. 40—60 мл/л HF D0 %-
ный) + 80—100 мл/л
H2SO4 (плотность 1,83)+
'+ Ш—\Ъ0мл/л HNOj'
(плотность 1,41)
200 г/л хромового
ангидрида + 50 г/л фосфорной
кислоты
1. 10—15 %-ный раствор
едкого натра
2. 10 %-ный раствор
лимоннокислого аммония
3. То же
4. 10 %-ный раствор
персульфата аммония
5. 1000 мл соляной
кислоты (плотность 1,19) +
+ 20 г трехокиси
сурьмы + 50 г хлористого
олова
6. 20 %-ная соляная
кислота 4- 0,5 %
уротропина
10—18 %-ный раствор
серной кислоты
250 мл/л соляной
кислоты (плотность 1,19) +
+ 125 мл/л серной
кислоты (плотность 1,83) +
+ 125 мл/л азотной
кислоты (плотность 1,41)
600 мл/л азотной
кислоты (плотность 1,41) +
+ 200 мл/л плавиковой
кислоты
Расплав едкого натра
1. 18 %-ная H2SO4
2. 100 г/л раствора
бисульфата натрия
3. 50 мл H2SO4
(плотность 1,83) 4 950 мл
воды
3
/= 15 -f- 25 °С
Химическая, t = 80 -г-
-f- 90 °С
Электрохимическая, / =
= 25° С, выдержка 15—
25 мин, DK = 1,5 ч-
+ 2,5 А/дм2
Электрохимическая,
D = 1,1 А/дм2
Химическая, до 70 °С
То же
То же, при 15—25 °С
То же
Химическая, t = 15 -f-
~ 25 °С, выдержка 2—
3 мин, очистка под водой
щетками
Химическая, t = 20 -*¦
-5- 25 °С, выдержка 10—
30 мин
Химическая
Химическая, t = 318 -г-
-?- 320 °С, выдержка 2—
5 мин, после выдержки
образцы тщательно
промывают в воде,
высушивают
Химическая, t = 20 ч-
-г- 25 °С, выдержка 2—
3 мин, очистка под водой
щетками
То же, при 20—40 °С
То же
305
Продолжение прил. V
1
Медь и медные, сплавы
Олово и оловянные
сплавы
Свинец и свинцовые
сплавы
Цинк и цинковые сплавы
Магний и его сплавы
Кадмий
Алюминий и его сплавы
2
4. —
1. 15 %-ный кипящий
раствор трифосфата
натрия
2. 5 %-ный раствор
соляной кислоты + 0,2 %
ингибитора
3. 100 мл соляной
кислоты (плотность 1,19) +
+ 900 мл воды
1. Насыщенный раствор
уксуснокислого аммония
2. 3—5 %-ный раствор
уксусной кислоты
1. 10 %-ный раствор
хлористого аммония
2. 5 %-ный кипящий
раствор хромового
ангидрида + 1 %
азотнокислого серебра
3. 50 мл ледяной
уксусной кислоты + 950 мл
воды
4. Насыщенный раствор
уксуснокислого аммония
20 %-ный кипящий
раствор хромового
ангидрида + 1 %
азотнокислого серебра
5 %-ный раствор
цианистого натрия
1. 35 мл 85 %-ной
фосфорной кислоты + 20 г
хромового ангидрида +
+ 945 мл воды
2. 5 %-ная азотная
кислота
3. 20 % фосфорной
кислоты + 8 % хромового
ангидрида
4. 45 мл/л фосфорной
кислоты, 20 г/л
хромового ангидрида
5. 50 г/л водного
раствора едкого натра
3
Механическая зачистка
чернильной резинкой
Химическая,
выдержка 10 мин, очистка
щетками
Химическая, t = 20 °С
То же, при 20—40 °С
Химическая, / = 20 -f-
-ь 40° С
То же
Химическая, t = 70 °С,
выдержка ^ 2 мин
Химическая, выдержка
20—25 мин.
Азотнокислое серебро
предварительно растворяют и
добавляют в кипящий раствор
Химическая, / = 20 -f-
- 40 °С
Химическая, t = 20 °С
Химическая, выдержка
1 мин, /кип
Химическая, t = 20 °С
Химическая, t = 98 -5-
-т- 100° С
То же, /= 10 + 15 °С
То же, t = 20 °С,
выдержка 15—30 мин
То же, / = 90 ч- 95 °С,
выдержка 10—20 мин
То же, / =• 60 °С,
выдержка до 2 мин
306
ПРИЛОЖЕНИЕ VI.
ЭЛЕКТРОДНЫЕ ПОТЕНЦИАЛЫ МЕТАЛЛОВ, СТАЛЕЙ И СПЛАВОВ,
ИЗМЕРЕННЫЕ В СИНТЕТИЧЕСКОЙ МОРСКОЙ И ШАХТНОЙ ВОДАХ
Металл
Потенциал, В
ачал
ерез
Металл
Потенциал, В
'S К
я s
В синтетической морской воде
СтЗ
Стб
Сталь 10
Сталь 20
Сталь 30
НЛ2
15ХНДЮ
15ХНДТ
38ХА
13Н5А
15Х2НД
12ХЗНД
10X3
12X4
Х17Н2М
Х17Н2М2
Х17Н2 с бором
Х17Н2Ю
10Х4ГЗ
10Х4Г2Ю
15Х4ГЗБ
Х13Н4Г9
12Х18Г8
08Х18Н9
10Х18Н10Т
10Х17Н13М2Т
10Х17Н13МЗТ
08Х22Н5Т
ЗОХГСА
Баббит 83
БрА10-2
Латунь C0 %)
Бронза E—10 %)
Магниевый сплав
F % AI, 3 %Zn,
0,5 % Mn)
—0,28
—0,26
—0,24
—0,24
—0,26
—0,19
—0,18
—0,15
—0,25
—0,15
—0,22
—0,08
—0,18
—0,14
—0,049
—0,044
—0,044
—0,054
—0,17
—0,20
—0,13
—0,04
—0,13
+0,00
+0,015
+0,07
+0,08
—0,01
—0,22
—0,166
+ 0,07
—
—
і
—0,45
—0,45
—0,45
—0,43
—0,44
—0,43
—0,42
—0,43
—0,43
—0,37
—0,42
—0,38
—0,41
—0,36
—0,074
—0,119
—0,164
—0,119
—0,37
—0,40
—0,34
+0,02
—0,07
+0,19
+0,18
+0,25
+0,30
+0,27
—0,45
—0,182
+0,059
—0,08
—0,10
— 1,20
10X5
12ХЗЮ
10Х4Ю
10Х5Ю
СХЛФ
15ГСД
12Х8Д
12X13
20X13
20X1ЗМ
20X1ЗМ2
20X1ЗД
20X13 с бором
Х17Н2
Купроникель
C0 %)
Инконель
A1—14% Сг,
1 % Мп, 1 % Fe)
Сплав
ХН65МВ
08Х21Н6М2Т
БрАЖМ
БрАН
Алюминиевый
сплав
A0% М^)
То же
A0% Zn)
Томпак E—10 %
Zn)
Дюралюминий
Монель-металл
Сплав Н70МФ
—0,13
—0,14
—0,14
—0,11
—0,20
—0,20
—0,12
—0,14
—0,144
—0,039
—0,099
—0,004
—0,114
—0,029
—
—0,098
+ 0,12
+0,010
+ 0,015
—
—
—
—
—0,158
—0,37
-0,36
—0,38
—0,36
—0,43
—0,44
—0,33
—0,26
—0,234
—0,204
—0,199
—0,134
—0,254
—0,164
—0,02
+0,08
+0,130
+ 0,34
+0,020
+0,040
—0,74
—0,70
—0,08
—0,50
+0,17
—0,158
Продолжение прил. VI
В шахтной воде
Металл
Железо
СтЗ
НЛ2
15ХНДЮ
15ХНДТ
13Н5А
12ХЗЮ
10Х4ГЗ
15ХДП
15ХЗДП
12X6
12ХЗД
12X13
08Х18Н10Т
Потенциал, В
начальный |
1
(pH
—0,314
—0,316
—0,304
—0,360
—0,322
—0,249
-0,384
—0,396
—0,316
—0,374
—0,316
—0,314
—0,294
+0,061
конечный
=1.9)
—0,449
—0,344
—0,345
—0,469
—0,354
—0,464
—0,424
—0,476
—0,374
—0,462
—0,424
—0,409
—0,339
+0,265
начальный
(pH
—0,345
—0,364
—0,357
-0,356
—0,354
-0,334
—0,352
-0,354
—0,349
—0,336
—0,339
—0,344
—0,284
+0,515
конечный
=2,5)
—0,494
—0,390
—0,390
—0,393
—0,392
—0,484
—0,404
—0,39
—0,402
—0,376
—0,379
—0,459
+0,585
+ 0,641
ПРИЛОЖЕНИЕ VII.
СТОИМОСТЬ МЕТАЛЛОВ [45]
Металл
Железо
Свинец
Цинк
Алюминий
Сурьма
Медь
Магний
Марганец
Никель
Олово
Относительная
стоимость
1
2,5
3
6
6,5
7,5
8
10
17
22
Металл
Хром
Кобальт
Висмут
Ртуть
Титан
Вольфрам
Молибден
Серебро
Ванадий
Ниобий
Относительная
стоимость
25
35
50
65
90
120
170
500
750
800
Металл
Тантал
Рубидий
Палладий
Золото
Рений
Иридий
Осмий
Платина
Родий
Относительная
стоимость
1 500
2 200
5 000
11 000
12 000
25 000
25 000
27 000
45 000
Примечание: Стоимость металла — фактор возможности и экономической
целесообразности его применения. В приложении показана отнссительная стоимость
разных металлов (за единицу принята стоимость железа, точнее простой углеродистой
стали). Стоимость 1 кг проката простой углеродистой стали примерно равна 20 коп.
308
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Авдеева А. В. Коррозия металлов в пищевых производствах и способы
защиты. М.: Пищевая промышленность, 1972. 276 с. с ил.
2. Авдеева А. В., Соколовский А. Л., Цыганова П. А. — Хлебопекарная
и кондитерская промышленность, 1957, № 4, с. 12—14.
3. Авдеева А. В., Соколовский А. Л., Цыганова П. А., Бегунова Т. Н,—
Хлебопекарная и кондитерская промышленность, 1958, Ш 2, с. 14—15.
4. Авдеева А. В., Соколовский А. Л., Цыганова П. Л.— Хлебопекарная
и кондитерская промышленность, 1958, № 7, с. 14—16.
5. Авдеева А. В., Сосновский Л. Б., Цыганова П. А.— Хлебопекарная и
кондитерская промышленность, 1959, № 7, с. 7—8.
6. Авдеева А. В., Цыганова П. А., Сосновский Л. Б.— Хлебопекарная и
кондитерская промышленность, 1957, № 5, с. 12.
7. Акимов Г. В. Теория и методы исследования коррозии металлов. М.—
Л.: Изд-во АН СССР, 1945. 414 с. с ил.
8. Акимов Г. В. Основы учения о коррозии и защите металлов. М.: Метал-
лургиздат, 1946. 463 с. с ил.
9. Акимов Г. В.— В кн.: Исследования по нержавеющим сталям. М.—Л.:
Изд-во АН СССР, 1956, с. 11—21.
10. Аллахвердиев Г. А., Муталлимов М. Д., Байрамов Б. Г.—
Азербайджанское нефтяное хозяйство, 1970, № 2, с. 34—36
11. Андреева В. В., Казарин В. И. Новые конструкционные химически
стойкие металлические материалы. М.: Госхимиздат, 1961, вып. 17. 190 с.
с ил.
12. Антоновская Э. И., Вилък Ю. Н.—Химическая промышленность, 1960.
№ 5, с. 77.
13. Антоновская Э. И., Тахтарова Л. В.— Журнал Всесоюзного химического
общества им. Д. И. Менделеева, 1961, т. VI, № 4, с. 477—478.
14. Анучин П. //., Тимин Н. В.— Гидролизная и лесохимическая
промышленность, 1971, № 3, с. 16—17.
15. Анучин П. И., Фирсов А. Я.— Гидролизная и лесохимическая
промышленность, 1967, № 5, с. 23—24.
16. Бабаков А. А., Туфанов Д. Г.—Специальные стали и сплавы: Науч. тр./
ЦНИИЧМ. М.: Металлургиздат, 1960, № 17, с. 184—203.
17. Бабаков А. А. Новые материалы и сплавы для машиностроительной
промышленности: ВИНИТИ. Передовой научно-технический
производственный опыт, 1961, вып. 7. 24 с. с ил.
18. Бабаков А. А., Посысаева Л\ И., Петровская В. А., Сидоркина Ю. С.—
Защита металлов, 1971, т. VII, № 2, с 99—103.
19. Бабаков А. А. Нержавеющие стали, свойства и химическая стойкость
в различных агрессивных средах. М.: Госхимиздат, 1956. 130 с. с ил.
20. Бабаков А. А., Приданцев М. В. Коррозионностойкие стали и сплавы.
М.: Металлургия, 1971. 320 с. с ил.
21. Бабаков А. А.} Гуляев А. П., Жадан Т. А., Туфанов Д. Г.— Специаль-
ны-е стали и сплавы. М.: Металлургия, 1965 (ЦНИИЧМ, сб. № 39),
с. 73—80.
22 Бабаков А. А. Туфанов Д. Г.— Специальные стали и сплавы: Науч.
тр./ЦНИИЧМ. М.: Металлургиздат, 1960, № 17, с. 311—321.
23. Бабаков А. А., Улановский А. Б., Туфанов Д. Г., Коровин Ю М.—
Исследования по коррозии металлов: Науч. тр./ИФХАН. М.: Изд-во АН
СССР, 1960, № 8, с. 345—353.
24. Бабаков А. А., Туфанов Д. Г. Труды Всесоюзного совещания по борьбе
с морской коррозией металлов. Баку: Азербайджаниздат, 1958, с. 148—
173.
25. Бабаков А. А., Туфанов Д. Г.— ЖПХ, 1960, т. XXXIII, вып. 6,
с. 1334—1340.
26. Бабаков А. А., Гуляев А. П., Жадан Т. А., Туфанов Д. Г.—Специальные
стали и сплавы: Науч. тр./ЦНИИЧМ. М.: Металлургиздат, 1963, № 35,
с. 63—66.
309
27. Балезин С. А., Романов В. В., Подобаев К. Я.—ДАН СССР, 1958 т 123,
№ 5, с. 902—905.
28. Баканов С. И., Генель С. В. Коррозионная стойкость металлов и
металлических покрытий в кондитерских средах. М.: ЦИНТИпищепром, 1962.
32 с. с ил.
29. Баранник В. П. Краткий справочник по коррозии: Химическая стойкость
материалов. М.— Л.: Госхимиздат, 1953. 456 с.
30. Батраков В. П. Коррозия конструкционных материалов в агрессивных
средах: Справочник. М.: Оборонгиз, І952. 452 с. с ил.
31. Батраков В. П.— В кн.: Коррозия и защита металлов. М.: Оборонгиз,
1962, с. 5—81.
32. Бозин Н. А., Миролюбов Е. Н., Куртепов М. М.— Коррозия металлов и
сплавов: Науч. тр./ИФХ АН СССР. М.: Металлургия, 1965, № 2,
с. 117—135.
33. Борисова Л. Г.— Химическое и нефтяное машиностроение, 1969, № 9,
с. 17.
34. Бабаков А. А., Туфанов Д. Г., Сабинин А. А.— Специальные стали и
сплавы: Науч. тр./ЦНИИЧМ. М.: Металлургиздат, 1960, с. 228—246.
35. Ломоносов М. В. Полное собрание сочинений, т. I. Изд-во АН СССР,
1950.
36. Бозин Н. А., Широкова Н. В., Сазонова В. Н.— Химическая
промышленность, 1976, № 3, с. 52.
37. Воробьева Г. Я. Коррозионная стойкость материалов в агрессивных
средах химических производств. М.: Химия, 1975. 816 с.
38. Воробьева М. А., Клипов И. Я — Коррозия химической аппаратуры:
Науч. тр./МИХМ. М.: Машиностроение, 1964, с 55—69.
39. Герасимов В. В., Герасимова В. В. Коррозионное растрескивание аусте-
нитных нержавеющих сталей. М.: Металлургия, 1976. 175 с.
40. Свисту нова Т. В., Туфанов Д. Г.— МиТОМ, 1971, № 9, с. 39—42.
41. Гинзбург В. И., Кабакова О. Я.—Защита металлов, 1969, № 6, с. 627—
632.
42. Головин В. Л., Ульянова Э. X.— Свойства благородных металлов и
сплавов: Справочник. М.: Металлургия, 1964. 188 с.
43. Голованенко С. А.— Специальные стали и сплавы: Науч. тр./ЦНИИЧМ.
М.: Металлургия, 1974, № 3, с. 5—14.
44. Гудремон Э. Специальные стали: Пер. с нем. М.: Металлургия, 1966,
т. I, с. 639—651.
45. Гуляев А. П. Металловедение. М.: Металлургия, 1985. 542 с. с ил.
46. Свистунова Т. В., Доронин В. М.— В кн.: Коррозионностойкие
металлические конструкционные материалы и их применение. М.: Знание, 1974,
с. 13—21.
47. Долинкин В. U., Шварц Г. Л., Кудрявцева Е. Ф. и др.— Химическое и
нефтяное машиностроение, 1971, № 10, с. 17.
48. Гурович Е. Я.—ЖПХ, 1960, т. XXXIII, вып. 9, с. 2096—2101.
49. Дятлова В. Н. Коррозионная стойкость металлов и сплавов: Справочник.
М.: Машиностроение, 1964. 352 с.
50. Дятлова В. //., Фроликова Е. М.— Химическое машиностроение, 1963,
№ 2, с. 32—33.
51. Егоров В. П., Круглое Б. И., Брусенцова В. М. и др.—Химическая
промышленность, 1964, № 7, с. 61—66.
52. Жетвин Н. П., Раховская Ф. С, Ушаков В. И. Удаление окалины с
поверхности металла. М.: Металлургия, 1964. 195 с. с ил.
53. Жадан Т. Л.—МиТОМ, 1976, № 5, с. 30—32.
54. Жук Н. П. Курс теории коррозии и защиты металлов. М.: Металлургия,
1976. 472 с. с ил.
55 Кильчевская Т. Е., Анохина Т. А.— Химическое и нефтяное
машиностроение, 1979, № 11, с. 24—26.
56. Захарочкин Л. Д., Мратова Г. Л.— Защита от коррозии оборудования
для переработки нефти: Науч. тр./Гипронефтемаш. М.: Недра, 1964, № 2,
с. 12—16.
310
57. Зедгинидзе Л. И., Двали Т. М., Бахтадзе Э. Я.— Защита металлов,
1974, т. X, № 5, с. 555—557.
58. Осадчук Г. И., Кузьмич Л. Д., Голованенко С. Л.— Железнодорожный
транспорт, 1976, № 3, с. 61—64.
59. Исследования материалов для новой техшки/Аллахвердиев Г. А.,
Манджагаладзе С. Н., Муталлимов М. Д., Эфенди-Заде С. М., Агала-
рова А. Ф. Тбилиси: Мецниереба, 1971, с. 267—273.
60. ГамйЗиь Б. П., Товмаш п. Ф., Гамизиии Л. Б.— Исследования в обласіи
электрохимии и коррозии металлов: Науч. тр./Днепропетровский
государственный университет. Днепропетровск, 1968, с. 126—131.
61. Гуляев А. П., Жадан Т. А. Новые низколегированные нержавеющие
стали. М.: Машиностроение. 1972. 104 с. с ил.
62. Истрина 3. Ф., Воликова И. Г., Крутиков А. #., Фроликова Е. М.—
Химическое и нефтяное машиностроение, 1964, № 2, с. 36—37.
63. Захарочкин Л. Д.} Борисова Л. Г.— Защита от коррозии оборудования
для переработки нефти: Науч. тр./Гипронефтемаш. М.: Недра, 1964,
№ 2, с. 17—20.
64/ Абабков В. Т., Гинзбург В. И., Волков Ю. К.— Специальные стали и
сплавы: Науч. тр./ЦНИИЧМ. М.: Металлургия, 1970, № 77, с. 72—76.
65. Левин Я. А., Кильчевская Т. Е.— Защита от коррозии оборудования
для переработки нефти: Науч. тр./Гипронефтемаш. М.: Недра, 1964,
№ 2, с. 41—44.
66. Инструкция по санитарно-химическому исследованию новых видов
пищевой посуды, тары и других изделий, изготовленных с применением
синтетических лаков, эмалей, клея, резины, шпаклевки и пластмассы.
М.: Медицина, 1964. 98 с.
67. Коломбье Л., Гохман Н. Нержавеющие и жаропрочные стали: Пер.
с франц. М.: Металлургиздат, 1958. 179 с. с ил.
68. Колотыркин Я. М.— Журнал Всесоюзного химического общества им.
Д. И. Менделеева, 1975, т. XX, № 1, с. 59—70.
69. Колотыркин Я. М.— Защита металлов, 1975, т. XI, № 6, с. 675—685.
70. Колотыркин Я. М., Княжева В. М.— Химическая промышленность, 1963,
№ 2, с. 1—7.
71. Колмогоров Я. В., Ершова Н. Я.—Химическое и нефтяное
машиностроение, 1966, № 10, с. 24.
72. Крутиков А. Н., Акшенцева А. П., Воликова И. Г.— Химическое
машиностроение, 1961, № 6, с. 33—38.
73. Крутиков А. Н., Истрина 3. Ф., Арест Т. В. и Фроликова Е. М.—
Химическое и нефтяное машиностроение, 1965, № 1, с. 30—34.
74. Колотыркин Я. М., Каспарова О. В.— В кн.: Коррозия и защита от
коррозии. М.: ВИНИТИ, 1978, т. 6, с. 180—217.
75. Кучина Ф. М., Полохов Н. Л.—Сталь, 1958, № 5, с. 465.
76. Колесников В. А., Мирошников Н. Л., Приходько В. Г.— Нефтяное и
химическое машиностроение, 1971, № 12, с. 24—25.
77. Герасимов В. В., Павлова Ф. С., Кузнецова В. Н., Братчиков В. П.
Защита металлов, 1970, т. VI, № 4, с. 420—424.
78. Лабутин А. Л., Мальшина Л. Г.— Химическое машиностроение, 1963,
№ 4, с. 28—29.
79. Лабутин Л. Л.} Рожков Ю. Я.— Химическое машиностроение, 1963, № 6,
с. 26.
80. Четвериков Л. В., Жигайло А. Я., Корчинская С. Л.— Защита
металлов, 1971, т. VII, № 5, с. 604—606.
81. Лепинь Л. К. Известия Академии наук Латвийской ССР, Серия
химическая, 1981, № 1, с. 12—25.
82. Лукин В. Г., Куртепов М. М., Казарин В. Я.—Защита металлов, 1979,
т. XV, № 4, с. 445—446.
83. Конструкционные материалы: Справочник/Под ред. Туманова А. Т.,
т. II, М.: Советская энциклопедия, 1964. 408 с. с ил.
84 Маслов В. А.. Тернюк М. И.. Герман В Т.— Химическое
машиностроение, 1964, № 1, с. 28—30.
311
85. Голованенко С. А.— МиТОМ, 1969, № 2, с. 35—42.
86. Натрадзе А. Г., Лозовик Г. Я-, Розанова Ю. М. Защита от коррозии
в химико-фармацевтической промышленности. М.: Медицина, 1974. 304 с.
с ил.
87. Мигай Л. Л., Тарицына Т. А. Коррозионная стойкость материалов
в хлоре и его соединениях: Справочник. М.: Металлургия, 1976. 119 с.
с ил.
&8. Устименко В. А.} Карбонов П. Л.—Специальные стали и сплавы: Науч.
тр/ЦНИИЧМ. М.: Металлургия, 1974, № 3, с. 109—115.
89. Поверенный В. В.} Пригожин Б. Ю., Мещерякова И. Д., Кащеева Т. П.—
Химическая промышленность, 1976, № 6, с. 25—26.
90. Коррозия и защита от нее металлоконструкций гидротехнических
сооружений. Науч. тр./НИИ гидротехнических сооружений им. Б. Е. Веде-
нева. Л.: Энергия, 1973, № 79. 108 с.
91. Пономарева О. В., Шварц Г. Л., Сычева В. Я.—Химическая
промышленность, 1972, № 9, с. 28—29.
92. Исаев Н. И., Васильев В. Ю., Серебряков Л. В. и др.— Защита
металлов, 1980, т. XVI, № 1, с. 9—13.
93. Приданцев М. В.} Бабаков А. Л.—Сталь, 1962, № 11, с. 1035—1039.
94. Электроды для дуговой сварки и наплавки: Марочник. М.: ВНИИСТ,
1977, 181 с.
95. Романов В. В. Методы исследования коррозии металлов. М.:
Металлургия, 1965. 280 с. с ил.
96. Романов В. В. Коррозионное растрескивание. М.: Машгиз, 1960. 179 с.
с ил.
97. Рябченков А. В.} Герасимов В. И.} Сидоров В. П.— Защита металлов
1966, т. 2, № 3, с. 257—278.
98. Рябченков А. В., Герасимов В. И., Сидоров В. П.—В кн.: Коррозия и
защита от коррозии. М.: ВИНИТИ, 1976, т. 5, с. 48—106.
99. Рябченков А. В., Никифорова В. М.— В кн.: Межкристаллитная
коррозия и коррозия металлов в напряженном состоянии. М.: Машгиз, 1960,
с. 178—197.
100. Савицкий Е. М., Бурханов Г. С. Металловедение сплавов тугоплавких и
редких металлов. М.: Наука, 1971. 354 с. с ил.
101. Герасимов В. В. Коррозия сталей в нейтральных водных средах. М.:
Металлургия, 1981. 192 с.
102. Клипов И. А., Воробьева М. А.— Коррозия химической аппаратуры:
Науч. тр./МИХМ. М.: Химиздат, 1975, вып. 67, с. 41—47.
103. Коррозия и защита химической аппаратуры: Справочное руководство/
Под ред. Сухотина А. М. Л.: Химия, 1969, т. 1. 556 с.
104. Коррозия и защита химической аппаратуры: Справочное руководство/
Под ред. Сухотина А. М. Л.: Химия, 1971, т. 5. 365 с.
105. Коррозия и защита химической аппаратуры: Справочное руководство/
Под ред. Сухотина А. М., Лабутина А. Л. Л.: Химия, 1972, т. 6. 373 с.
106. Бардиж Н. П., Миролюбов Е. П., Куртепов М. М.— В кн.: Коррозия
металлов и сплавов. М.: Металлургиздат, 1963, с. 368—379.
107. Свисту нова Т. В., Туфанов Д. Г., Телегин В. Г.—Сталь, 1974, № 10,
с. 930—941.
108. Свистунова Т. В., Туфанов Д. Г., Черменская И. Ф.— Сталь, 1975, № 3,
с. 265—267.
109. Свистунова Т. В., Рунова 3. К., Киреева Т. С. и др.—Сталь, 1976, № 9,
с. 851—853.
НО. Прецизионные сплавы: Справочник/Под ред. Молотилова Б. В. М.:
Металлургия, 1974. 447 с.
111. Гаевская Л. В., Скирстымонский А. И., Мамуня А. У., Бутник-Сивер-
ский А. Б.— Ферментная и спиртовая промышленность, 1979, № 8,
с. 10—12.
112. Фролов Н. А., Фроликова Е. М., Юкалов И. Н. и др.—Металлы и
сплаяьт r химическом машиностроении- Няуц тп /НИИхиммяттт М • Мя-
ШИНОСТроение, 1973, № 57, с. 54—64.
312
113. Скорчеллетти В. В. Теоретические основы коррозии металлов. 71.: Химия
1973, 264 с. с ил.
114. Уваров Е. В., Копылов В. Л.—Химическая промышленность, 1968, № 1,
с. 44—45.
115. Стали с пониженным содержанием никеля: Справочник/Под ред. При-
данцева М. В. и Лившица Г. Л. М.: Металлургиздат, 1961. 200 с.
116. Стрижак Н. С, Больщенко 3. М. Основные правила безопасной работы
лаборашрии. М.: Госхимиздат, 1961. 41 с.
117. Уткина Н. А., Ларин В. В.— Защита металлов, 1968, т. IV, № 5,
с. 576—578.
118. Тавадзе Ф. Н., Манджагаладзе С. Н. Коррозия и защита металлов
в минеральных водах Грузии. Ч. I. Тбилиси: Изд-во АН ГССР, 1956.
199 с.
119. Титов В. А. Коррозия и защита металлов в спиртовой промышленности.
М.: ГОСИНТИ, 1959. 32 с.
120. Титов В. В., Бабкин Ю А., Баландин Н. М.— ЖПХ, 1959, т. 32, № 5,
с. 1167—1169.
121. Томашов Н. Д. Теория коррозии и защита металлов. М.: Изд-во АН
СССР, 1960, 591 с. с ил.
122. Томашов Н. Д.г Чернова Г. П. Коррозия и коррозионностойкие сплавы.
М.: Металлургия, 1973. 232 с. с ил.
123. Томашов Н. Д., Чернова Г. П. Пассивность и защита металлов от
коррозии. М.: Наука, 1965. 208 с. с ил.
124. Туфанов Д. Г.— Строительная промышленность, 1948, № 2, с. 16—18.
125. Туфанов Д. Г.— МиТОМ, 1970, № 3, с. 39—41.
126. Туфанов Д. Г. Новые прогрессивные мероприятия по борьбе с
коррозией: Передовой научно-технический и производственный опыт. М.:
ЦИТЭИН, 1961, вып. 16. 11 с.
127. Туфанов Д. Г.—МиТОМ, 1963, № 7, с. 33—40.
128. Туфанов Д. Г., Белик М. А., Чипига А. П., Крючек В. Т.—
Масложировая промышленность, 1971, № 12, с. 34—35.
129. Туфанов Д. Г.—МиТОМ, 1964, № 4, с. 15—21.
130. Туфанов Д. Г.—МиТОМ, 1964, № 11, с. 42—48.
131. Туфанов Д. Г.— Травление металлов и их сплавов: Передовой научно-
технический и производственный опыт. М.: ВИНИТИ, 1958. 16 с. с ил.
132. Туфанов Д. Г., Бабаков А. А. Влияние окислительно-восстановительного
потенциала на межкристаллитную коррозию высоколегированных
сталей: Передовой научно-технический и производственный опыт. М.:
ЦИТЭИН, 1960, № 30. 12 с.
133. Туфанов Д. Г., Бабаков А. Л.—Специальные стали и сплавы: Науч. тр./
ЦНИИЧМ. М.: Металлургия, 1966, № 46, с. 93—98.
134. Туфанов Д. Г., Тюрин С. Т., Черванева В. В.— Виноделие и
виноградарство СССР, 1966, № 3, с. 52—55.
135. Тюрин С. Т., Базанова А. И., Ильиченко Б. Н. Защитные покрытия
резервуаров в виноделии. Симферополь: Крым, 1965. 104 с. с ил.
136. Тюрин С. Т., Базанова А. И., Брейтман И. Г. Герметические резервуары
и защитные покрытия в виноделии. М.: Пищевая промышленность, 1974.
160 с. с ил.
137. Ульянин Е. А., Туфанов Д. Г.— Специальные стали и сплавы: Науч. тр./
ЦНИИЧМ. М.: Металлургия, 1972, № 1, с. 97—106.
138. Федоров Е. А., Воликова И. Г., Жданова А. В. — Гидролизная и
лесохимическая промышленность, 1960, № 4, с. 16—19.
139. Фокин М. Н., Петровская В. А., Николаева Г. Н.— Защита металлов,
1977, т. XIII, № 1, с. 71—75.
140. Фрианович Г. М., Колотыркин Я. М.— ДАН СССР, 1963, т. 151, № 1,
с> 144—147.
141. Химушин Ф. Ф. Пути экономии нержавеющих сталей: Материалы
семинара. М.: МДНТП им. Ф. Э. Дзержинского, 1960. 21 с. с ил.
142. Химушин Ф. Ф. Нержавеющие стали. М.: Металлургия, 1967. 798 с. с ил.
143. Цейтлин X. JL, Курченинова И. Д., ЬаЬицкая С". М., ьабаков А. А.—
313
Химическая промышленность, 1954, № 7, с. 54—56.
144. Цирельников В. И., Комиссарова Л. Н., Спицын В. И.— Атомная
энергия, 1962, вып. 1, т. 13, с. 51—53.
145. Перин Ю. И., Валиева Р. А., Бурмистрова Л. К-, Евстигнеева В. П.—
Химическое и нефтяное машиностроение, 1971, № 1, с. 30—31.
146. Зубакин А. А., Салей С. М.— Защита металлов,' 1976, т. XII, № 3,
с. 305.
147. Шанина Т. М., Бабаков А. А., Негреев В. А., Туфанов Д. Г.—
Коррозия металлоконструкций в море: Науч. тр./Гипроморнефть. Баку: Азнеф-
теиздат, 1954, № 1, с. 13—56.
148. Тюрин С. Т., Налимова А. А., Черванева В. В., Максименко В. М.
Садоводство, виноградарство и виноделие Молдавии, 1981, № 4, с. 44—46.
149. Шварц Г. Л.—Кокс и химия, 1957, № 6, с. 51—55.
150. Шварц Г. Л., Воликова И. Г., Кузнецова Ю. С.— Металлы стойкие
к коррозии под напряжением в растворах едкого натра: Науч. тр./
НИИхиммаш. М.: НИИхиммаш, 1958, вып. 25, с. 87—101.
151. Шварц Г. Л., Макарова Л. С, Акшенцева А. П. Таблицы коррозионной
стойкости титана и его сплавов. М.: НИИхиммаш, 1961. 137 с.
152. Шварц Г. Л., Кристаль М. М.— Защита металлов, 1965, т. 1, № 2,
с. 137—149.
153. Шварц Г. Л., Кристаль М. М. Коррозия химической аппаратуры. М.:
Машгиз, 1958. 204 с. с ил.
154. Шварц Г. Л., Сидоркина Ю. С.— Коррозия и износ металлов: Науч.
тр./НИИхиммаш, М.: НИИхиммаш, 1959, N° 27, с. 62—74.
155. Цейтлин X. Л., Мерзлоухова Л. В., Стрункин Н. Л.— ЖПХ, 1957,
т. XXX, № 10, с. 1553—1557.
156. Эванс Ю. Р. Коррозия и окисление металлов: Пер. с англ. М.: Машгиз,
1962, 856 с. с ил.
157. Юхим И. #.— МиТОМ, 1964, № И, с. 39—41.
158. Батраков В. В., Батйлева С. К., Богданов Н. В. Кожевенно-обувная
промышленность, 1980, № 12, с. 29—31.
159. Morgan М. Я.—Chem. Eng. 1950, № 8, p. 197—200.
160. Нannum R. E.~ Corrosion, 1961, V. 17, № 5, p. 79—80.
161. Герасимов В. И., Рябченков А. В., Аксенова Л. И., Буткевич В. Г.—
Защита металлов, 1977, т. XIII, № 2, с. 148—153.
162. Томашов Н. Д., Голованенко С. А., Ульянин Е. А. и др.— Защита
металлов, 1980, т. XVI, № 2, с. 105—112.
163. Rowlands /. С—Corrosion Technology, 1959, v. 6, № 12, p. 359—363.
164. United States Steel Corp. Stainless and Heat Resisting Steels, Pittsburgh,
1957.
165. Ульянин E. А. Коррозионностойкие стали и сплавы: Справочник. М.:
Металлургия, 1980. 208 с. с ил.
166. Кочанов В. А., Сидоркина Ю. С, Никитин Д. Г. и др.— Химическое и
нефтяное машиностроение, 1978, № 6, с. 29—30.
167. Киселев В. Д., Добролюбов В. В. — Химическая промышленность, 1979,
№ 3, с. 32—33.
168. Lingnau Е.— Werkstoffe u. Korrosion. 1957, Н. 4, S. 216—233.
169. Macleary D.— Corrosion, 1962, v. 18, № 2, p. 67—69.
170. Bishop С. R.— Korrosion, 1963, v. 19, p. 308t—314t.
171. Беляков Б. П., Цыпин Л. //., Шипельская Л. И. и др.— Химическая
промышленность, 1978, № 9, с. 44—45.
172. Kohl Я.—Werkstoffe u. korrosion, 1963, Н. 10, S. 831—837.
173. Ritter F.— Korrosionstabellen metallischer Werkstoffe, Springer-Verlag,
Wein, 1958, 290S.
174. Ried G.— Werkstoffe u. Korrosion, 1964, H. 6, S. 468—483.
175. Солнцев С. С, Туманов А. Т. Защитные покрытия металлов при
нагреве: Справочное пособие. М.: Машиностроение, 1976. 240 с. с ил.
176. Morgan A. R.— Corrosion, 1959, v. 15, № 7, р. 351t.
177. Третьякова К. В., Тимофеева С. И., Райков Ю. А., Абрамов Л. А.—
Защита металлов, 1978, т. XIV, № 4, с. 492—493.
314
178. Пименова С. И., Цровянников Н. П.— Эксплуатация, модернизация и
ремонт оборудования в нефтеперерабатывающей и нефтехимической
промышленности, 1979, № 3, с 7—9.
179. Bien D., Field /.— Corrosion, 1961, v. 17, № 7, p. 89—91.
180. Oppenheim R.— Werkstoffe u. Korrosion, H. 1, S. 1 — 11.
181. Tinglev J. /., Rogers R. /?.—Corrosion, 1965, v. 21, № 4, p. 132—136,
182. Чигал В., Рябченков А. В., Поборжил Ф., Герасимов В. И.— Защита
металлов, 1976, т. XII, № 5, с. 499—512.
183. Missel Leo-Electroplat and Metal Finish, 1973, № 5, p. 17—21. (Экспресс-
информация: Коррозия и защита металлов, 1973, № 44, с. 27—28).
184. Даниельян Л. В., Папоян А. Г. — Промышленность Армении, 1977, № 11,
с. 27—28.
185. Gerner P. ]., Wilson W. L. The corrosion resistance of Titanium and
Zirconium in chemical plant exposutes Filteenth annual conference 1959,
Preprint paper № 49.
186. Rabald E., Bretschneider H., Dehema-Werkstofftabellen, Dritte
Bearbeitung. Lieferung 7, Frankfurt a. M., 1957.
187. Hampel С. Д.—Corrosion, 1958, v. 14, Nb 12, p. 29—32.
188. Mason J. F.—Chemical Eng., 1948, v. 55, Nb 12, p. 232.
189. Hutchinson G. E., Permar P. H. Corrosion, 1949, v. 5, № 10, p. 319—325.
190. Wetternik L— Werkstoffe u. korrosion, 1956, H. 11, S. 628—633.
191. Влияние технологических факторов при производстве хромоникелевых
сталей на их коррозионную стойкость: Обзорная информация. Серия:
Антикоррозионная защита в химической промышленности. М.:
НИИТЭхим. ВНИИК, 1975, 35 с.
192. Коррозия сталей и сплавов в неводных средах: Обзорная информация.
Серия: Акрилаты и поливинилхлорид. М.: 1976, НИИТЭхим, 81 с.
193. Heitz Е., Meysentug С—Werkstoffe u. Korrosion, 1965, Н. 7, S. 578.
194. Mayers W., Belong W— Chemical Eng. Progress, 1948, v. 44, № 5,
p. 359—362.
195. Кондратюк В. И., Курова К. П., Николаев А. И.— Эксплуатация,
модернизация и ремонт оборудования в нефтеперерабатывающей и
нефтехимической промышленности, 1979, № 7, с. 7—10.
196. Alon A., Schor М., Vromen Л.—Corrosion, 1966, v. 22, № 1, p. 1—6.
197. Hopkins ?.—Werkstoffe u. Korrosion, 1965, H. 12, S. 1025—1033.
198. Ульянин Е. А., Тараканов Л. А., Горонкова Л. Д. и др.— Качественные
стали и сплавы: Науч. тр./ЦНИИЧМ. М.: Металлургия, 1979, № 4,
с. 80—88.
199. Медведева Л. А., Княжева В. М., Колотыркин Я. М., Бабич С.
Г.—Защита металлов, 1975, т. XI, № 6, с. 699—705.
200. Флерова Tf^r., Веричова Л. А., Жильцов Н. П.— Химическое и
нефтяное машиностроение, 1975, № 12, с. 19—20.
201. Абалян Н. П., Кропивницкая Р. А.— Химическое и нефтяное
машиностроение, 1966, № 5, с. 17.
202. Антоновская Э. И., Позднеева А. А.— Химическая промышленность,
1966, № 4, с. 64—65.
203. Абалян Н. П., Овчиян В. Н., Мирзоян М. А.— Химическое и нефтяное
мащиностроение, 1969, № 7, с. 23—24.
204. Изгарышев Н. А., Горбачев С. В. Курс теоретической электрохимии.
М.: Госхимиздат, 1951. 503 с. с ил.
205 Токарева Т. Б., Смолин В. В.— Химическое и нефтяное
машиностроение, 1974, № 2, с. 23.
206. Зотиков В. С, Бахмутов Г. Б., Бочарова Н. А.— Химическое и
нефтяное машиностроение, 1973, № 5, с. 21—23.
207. Инжечик В. Г., Януш А. В. — Химическая промышленность, 1955,
№ 1, с. 39—42.
208. Сухотин А. М., Зотиков В. С.— Химическое сопротивление материалов:
Справочник. Л.: Химия, 1975. 408 с.
209. Кристаль М. М., Хализова В. Н., Адугина Н. А.— Химическое и
нефтяное машиностроение, 1966, № 4, с. 36—39.
315
210. Полубоярова Л. А., Сидельникова Э. Л.—Кокс и химия, 1973, № 4
с. 49—50.
211. Воробьева Г. Я-, Апраксина Л. М.— Химическое и нефтяное
машиностроение, 1972, № 9, с. 22—23.
212. Розенфельд И. Л. Атмосферная коррозия металлов, М.: Академиздат,
I960. 352 с. с ил.
213. Фокин М. Н., Жигалова К. А. Методы коррозионных испытаний
металлов.— М.: Металлургия, 1986. 79 с. с ил.
214. Гуляев А. П., Зотова Е. В., Устименко М. Ю., Посысаева Л.
Я.—Известия АН СССР. Металлы, 1966, № 5, с. 102—106.
215. Тодт Ф. Коррозия и защита от коррозии: Пер. с нем. М.— Л.: Химия,
1966. 847 с. с ил.
216. Томашов Н. Д., Жук Н. П., Титов В. А., Веденева М. А. Лабораторные
работы по коррозии и защите металлов. М : Металлургиздат, 1961.
239 с. с ил.
217. Сачков С. И., Грибоедова В. Г., Осипова А. Д. и др Защита металлов,
1980, т. XVI, № 4, с. 478—486.
218. Фельдгандлер Э. Г., Карева Е. Н., Брусснцова В. М.— Химическая
промышленность, 1966, № 2, с. 151.
219. Коррозия и заіДита химической аппаратуры: Справочное руководство.
Т. 7/Под ред. Сухотина А. М. и Лабутина А. Л. Л.: Химия, 1972. 439 с.
220. Ганкин Е. А., Бахмутова Г. В., Семенова Н. Л. и др.— Защита
металлов, 1974, т. X, № 4, с. 417—418.
221. Климова В. Л.—Судостроение, 1974, № 7, с. 45—49.
222. Справочник по пайке/Под ред. Лоцманова С. Н., Петрунина И. Е.,
Фролова В. П. М.: Машиностроение, 1975. 407 с.
223. Калмыкова Н. #., Якубенко А. Р.—Судостроение, 1966, № 12, с. 43—45.
224. Назаров В. Н., Бойков А. 3., Демьяненко Н. С. и др.— Химическая
промышленность, 1975, № 8, с. 33—34.
225. Савкина Л. Я, Фельдгандлер Э. Г. Специальные стали и сплавы: Науч.
тр./ЦНИИЧМ. М.: Металлургия, 1970, № 77, с. 92—95.
226. Хвостов В. П., Анощенко И. Я.—Защита металлов, 1980, т. XVI, № 3,
с. 310—312.
227. Корягина Л. Н.— Химическая промышленность, 1967, № 3, с. 233.
228. Лельчук С. Л., Шварц Г. Л., Гусакова Д. Я. и др.— Химическое и
нефтяное машиностроение, 1972, № 11, с. 19.
229. Possei Н. S., Anderson F. f., Shrode L. D. Plating, v. 55, № 8, p. 833—
838.
230. Poboril F., Cihal V., Zezulova M.— Hutnicke Listy, 1966, № 7, S. 484—
492.
231. Edstrom /., Lofblad В.— Werkstoffe u. Korrosion, 1967, H. 9, S. 769—777.
232. Srefen Mladenov C— Zastita Mater, 1967, № 11—12, S. 496-507; 1968,
№ 1—2, S. 6—16.
233. Steensland O., and Pulkkinen R.— Brit. Chem. Engin., 1969, v. 14, № 4,
p. 516—519.
234. Киреева Т. С, Свистунова Т. В. и Рунова 3. К.— Сталь, 1979, № 2,
с. 141 — 143.
235 Огнева В. К., Воликова И. Г.—Защита металлов, 1977, т. XIII, № 6,
с. 675—679.
236. Бялобежский Л. В., Цирин М. С, Красилов Б. И. Высокотемпературная
коррозия и защита сверхтугоплавких металлов. М.: Атомиздат, 1977.
224 с.
237. Полубоярова Л. А., Рейфер А. А., Осинцев В. Д. и др.—Химическая
промышленность, 1977, № 1, с. 38—39.
238. Томашов Н. Д., Доронин В. М., Маркова О. Н. и др.— Защита
металлов, 1975, т. XI, № 3, с. 290—295.
239. Гру Б. А., Соколов В. К., Цинман А. И.— Химическое и нефтяное
машиностроение, 1975, № 11, с. 22—23.
240. Лисов В. Н., Ляпин А. П., Харчишин А. Д., Серкова Л. П.— Украинский
химический журнал, 1974, № 12, с. 1264—1268.
316
241. Туманова Т. А., Мартынов Ю. М., Сергеев Е. В., Алеева С. Д.—
Химическая промышленность, 1975, № 4, с. 271—273.
242. Зезянов С. П., Калугина А. В.— Защита металлов, 1975, т. XI № 1
С. 53—54.
243. Левицкий Н. И., Мельников В. П., Соколова И. М.— Защита
металлов, 1975, т. XI, № 2, с. 227—228.
244. Гнездилов Н. А., Милиции К. Я.—Цветные металлы, 1967, № 2,
~ ОО О7
245. Коррозионная и химическая стойкость материалов: Справочник/Под ред.
Доллежаля Н. А. М.: Машгиз, 1954. 570 с.
246. Павлова Ф. С, Кузнецова В. #., Герасимов В. В.— Защита металлов
1969, т. V, № 4, с. 451—453.
247. Кузюков А. #., Харлампиев И. Г.— Химическое и нефтяное
машиностроение, 1968, № 6, с. 27.
248. Абелев М. М.— Химическое и нефтяное машиностроение, 1968, № 6,
с. 26—28.
249. Меандров Л. В., Чуб В. М., Коляда А. А., Зубченко А. С—Химическое
и нефтяное машиностроение, 1968, № 5, с. 21—22.
250. Ващенко К. И. Химически стойкие отливки из высоколегированных
железоуглеродистых сплавов. М.: Машгиз, 1946. 131 с. с ил.
251. Томашов Н. Д.—Защита металлов, 1967, т. III, № 1, с. 3—19.
252. Белов Б. Г., Ту фанов Д. Г.— МиТОМ, 1968, № 10, с. 60—61.
253. Туфанов Д. Г.— В кн.: Новые коррозионностойкие стали и сплавы, М.:
Черметинформация, 1966, с. 100—123.
254. Туфанов Д. Г. Коррозионная стойкость нержавеющих сталей, сплавов
и чистых металлов: Справочник. М.: Металлургия, 1982, 354 с.
255. Туфанов Д. Г.— Защита металлов, 1969, т. 5, № 5, с. 532—535.
256. Туфанов Д. Г.— Городское хозяйство Москвы, 1948, № 3, с. 34—37.
257. Климова Г. В., Кристаль М. М.} Шетулов Д. И.— Химическое и
нефтяное машиностроение, 1972, № 9, с. 20—21.
258. Улиг Г. Коррозия металлов: Пер. с англ. М.: Металлургия, 1968. 306 с.
с ил.
259. Шварц Г. Л., Макарова Л. С, Герасименко Г. И.— Химическое и
нефтяное машиностроение, 1969, № 5, с. 20—22.
260. Михалюк Г. Ф., Анучин П. И.— Гидролизная и лесохимическая
промышленность, 1968, № 2, с. 19—20.
261. Воробьева Г. Я., Апраксина Л. М.— Химическое и нефтяное
машиностроение, 1972, № 9, с. 22—23.
262. Сретенская Г. В., Талаева Г. В.— Химические волокна, 1970, № 3,
с. 55—58.
263. И супова И. Д., Усанова М. С.— Кислородосодержащие соединения из
нефтяного сырья: Науч. тр./НИИнефтехим. М.: Химия, 1970, № 2,
с. 54—57.
264. Анучин Г. Я.—Гидролизная и лесохимическая промышленность, 1971,
№ 7, с. 10—12.
265. Сошникова Л. А., Пайкин В. А.— Цветные металлы, 1969, № 2, с. 75.
266. Некрич М. И., Беляев А. К., Алексеев В. И.— Вестник Харьковского
политехнического института, 1968, № 32, с. 101 —104.
267. Чигал В. Межкристаллитная коррозия нержавеющих сталей: Пер.
с чешек. Л.: Химия, 1969. 232 с. с ил.
268. Федоров Е. А.— Гидролизная и лесохимическая промышленность, 1970,
№ 2, с. 28—29.
269. Рискин И. В., Фролова Ф. А., Балакирев Е. С— Химическая
промышленность, 1972, № 10, с. 28—29.
270. Негреев В. Ф., Касумзаде Н. Г.— Азербайджанский химический
журнал, 1966, № 6 D8), с. 101—103.
271. Супрунчук В. К, Щеголев В. Н., Вдовенко И. Д., Грацианский Н. Н.
— Сахарная промышленность, 1968, № 2, с. 9—13.
272. Клячко Ю. А., Дехтяренко Н. Г.— Ферментная и спиртовая
промышленность, 1969, № 7, с. 18—20.
317
273. Ту фанов Д. Г.—Вестник инженеров и техников, 1946, № 8, с. 268—270.
274. Спивак Ю. М., Нил П., Пономарев В. Д., Сивков Ю. Е.— Физико-химия
и технология соединений алюминия и титана: Науч. тр./Институт
металлургии и обогащения АН КазССР. Алма-Ата: Наука, 1969, № 28,
с 71—73.
275. Шарнин А. А., Баландина Л. И., Якименко Т. Р.—Защита металлов,
1966, № 1, с. 108—110.
276. Зотиков В. С, Бахмутова Г. Б., Бачарова Н А и др.— Химическая
промышленность, 1975, № 10, с. 53—54.
277. Чанкова Е. Н., Тыр С. Г., Мурашкин А. А. и др.— Защита металлов,
1973, т. IX, № 4, с. 496—497.
278. Третьякова Г. А., Баранник В. П.— Защита металлов, 1973, т. IX, № 6,
с. 715—717.
279. Бозин Н. А., Успенская М. М., Максудов Г. Л.— Защита металлов. 1969.
т. V, № 6, с. 668—771.
280. Таблицы коррозионной стойкости сталей с пониженным содержанием
никеля марок 0Х22Н5Т (ЭП53) и 0Х21Н6М2Т (ЭП54)/Под ред. Шипи-
лова В. Д. М.: НИИхиммаш, 1969. 100 с.
281. Микляев А. Д., Пустильник А. И., Нисельсон Л. А.— Защита металлов,
1969, т. V, № 6, с. 698—701.
282. Сойфер Р. Д., Бойко И. Д., Бринберг С. Л. и др.— Медицинская
промышленность СССР, 1963, № 2, с. 25—30.
283. Анучин П. И., Чащин А. М. Коррозия и способы защиты оборудования
лесохимических производств: Справочник. М.: Лесная промышленность,
1970. 392 с.
284. Колотыркин Я. М.—Защита металлов, 1967, № 2, с. 133—134.
285. Крыщенко К. И., Кристаль М. М., Сидоркина Ю. С. и др.— Химическая
промышленность, 1969, № 4, с. 73.
286. Кузюков А. Н., Харлампиев И. Г.— Химическое и нефтяное
машиностроение, 1968, № 1, с. 27.
287. Приданцев М. В., Талое Н. П., Левин Ф. Л. Высокопрочные аустенит-
ные стали. М.: Металлургия, 1969. 247 с. с ил.
288. Материалы в машиностроении. Справочник, Т. З/Специальные стали и
сплавы. Под ред. Химушина Ф. Ф. М.: Машиностроение, 1968. 446 с.
с ил.
289. Туфанов Д. Г.—Станки и инструмент, 1956, № 5, с. 34—36.
290. Розенфельд И. Л. Коррозия и защита металлов. М.: Металлургия, 1970.
448 с. с ил.
291. Филиппенко Н. М., Болотников Ф. С— ЖПХ, 1969, № 9, с. 2138—2142.
292. Цейтлин X. Л., Сорокин Ю. И., Глейзер М. М. и др.— Химическая
промышленность, 1973, № 1, с. 44—46.
293. Голованенко С. А., Меандров Л. В. Производство биметаллов. М.:
Металлургия, 1966. 304 с. с ил.
294. Меандров Л. В. Двухслойные коррозионностойкие стали. М.:
Металлургия, 1970. 228 с.
295. Гладыревская С. А., Меандров Л. В., Голованенко С. А., Быков А. А.
Двухслойные стали в химическом машиностроении. М.: Машиностроение,
1965. 127 с.
296. Громов Е. И., Карюкин А. В., Петухова Л. Д., Меликенцов Б. И.— Кокс
и химия, 1969, № 7, с. 51—54.
297. Шарин А. А., Солункина Г. П., Абалян Н. А.— Промышленность
Армении, 1969, № 5, с. 24—26.
298. Верещагин К. И., Колмогоров И. В.— Химическое и нефтяное
машиностроение, 1965, № 11, с. 34.
299. Фроликова Е. М., Прокопьева Т. К.— Химические волокна, 1969, № 5,
с. 60—62.
300. Кузюков А. И., Зайцева Л. В.— Химическое и нефтяное
машиностроение, 1970, № 3, с 20—21.
301. Усачева Р. И., Рутковский М. Л.—Защита металлов, 1967, т. VI, № 2,
с. 222.
318
302. Клочков А. И., Емельянова В. П., Коваль А. Б. и др.— Кокс и химия,
1968, № 6, с. 51—54.
303. Цейтлин X. Л., Зальцман Т. Л.— Теплоэнергетика, 1968, № 1, с. 57—59,
304. Шукуров Б. Р., Завьялова Э. П., Иоаннидис О. К-— Узбекский
химический журнал, 1968, № 5, с. 59—61.
305. Мигай Л. Л., Веденева М. А., Жук, Н. П.— Химическое и нефтяное
машиностроение, 1971, № 2, с. 22—24.
306. Лиференко И. Г., Истрина 3. Ф., Фроликова Е. М.— Химическое и
нефтяное машиностроение, 1964, № 5, с. 29—31.
307. Перин Ю. И., Валиева Р. А., Бурмистрова Л. К-— Химическое и
нефтяное машиностроение, 1970, № 7, с. 20—21.
308. Голубева Л. С, Туфанов Д. Г., Щеголева Р. П., Ручьева Н.
Л.—Порошковая металлургия: Науч. тр./ЦНИИЧМ. М.: Металлургия, 1970,
№ 72, с. 128—135.
309. Воликова И. Г., Новикова Т. Б.— Химическое и нефтяное
машиностроение, 1970, № 7, с. 18—19.
310. Долинкин В. Н., Хаскина Д. Б., Максимова В. И.— Химическая
промышленность, 1970, № 7, с. 22—23.
311. Бульдукян А. М., Овчиян В. Н.— Промышленность Армении, 1970, № 12,
с. 56-57.
312. Полубоярцева Л. А., Рейфер А. А., Манторова Т. М. и др.— Химическая
промышленность, 1966, № 3, с. 70—73.
313. Гинзбург В. //., Кабакова О. Я.—Защита металлов, 1971, т. VII, № 3,
с. 298—301.
314. Кузнецова Л. И., Калашников Н. А.— Химическое и нефтяное
машиностроение, 1970, № 8, с. 20.
315. Коваленко В. С. Металлографические реактивы: Справочник. М.:
Металлургия, 1973. 110 с. с ил.
316. Перин Ю. И., Валиева Р. А., Шелыгова М. С.— Химическое и нефтяное
машиностроение, 1970, № 9, с. 22—23.
317. Белик М. А., Туфанов Д. Г., Захаров Ю. В.— Масло-жировая
промышленность, 1971, № 2, с. 41—42.
318. Защита оборудования и строительных конструкций заводов химических
волокон от коррозии/Барочина Б. Я., Телаева Г. В., Зак С. Л., Ха-
рит Д. М. М.: Химия, 1970. 215 с. с ил.
319. Кардонов Б. А., Правдин А. В., Белинский А. Л., Герасименко Г. И.
Химическое и нефтяное машиностроение, 1971, № 3, с. 22—23.
320. Ульянин Е. А. Коррозионностойкие стали и сплавы. Справочник. М.:
Металлургия, 1980. 208 с.
321. Туфанов Д. Г., Левашова Е. П., Захаров Ю. В. и др.— Кожевенно-
обувная промышленность, 1971, № 5, с. 20—23.
322. Нисельсон Л. А., Третьякова В. В., Мельников Л. В. и др.— Цветные
металлы, 1982, № 7, с. 54—57.
323. Еремина Л. В., Меликсетян С. Л., Сотниченко Н. Л., Михайлова Е. А.
Цветная металлургия, 1982, № 21, с. 33—34.
324. Прецизионные сплавы: Справочник, изд. 2-е, под ред. Молотилова Б. В.
М.: Металлургия, 1983. 438 с.
325. Глинка И. Л. Общая химия. Л.: Химия, 1985. 702 с.
326. Ульянин Е. А., Свистунова Т. В., Левин Ф. Л. Коррозионностойкие
сплавы на основе железа и никеля. М.: Металлургия, 1986. 263 с. с ил.
327. Томашов Н. Д., Чернова Г. Г. Теория коррозии и коррозионностойкие
конструкционные сплавы. М.: Металлургия, 1986. 359 с. с ил.
328. Васнев А. И., Решетников Ю. П., Филиппова Т. В., Щербакова Т. Г.,
Пархаев Э. М. Тр. ВНИИ химических реактивов и особо чистых веществ.
М., 1983, вып. 45, с. 123—126.
329. Каламбет Г. А. Химическая промышленность, 1985, № 5, с. 283—284.
330. Ульянин Е. А., Сорокина Н. А. Стали и сплавы для криогенной техники:
Справочник. М.: Металлургия, 1984. 205 с. с ил.
331. Галактионова Н. А. Водород в металлах, изд. 2-е. М.: Металлургия,
1967. 303 с.
319
332. Бондарев Л. Г. Ландшафты, металлы и человек. М.: Мысль, 1976. 72 с.
333. Сабитов В. X. Медицинские инструменты. М.: Медицина, 1985. 174 с.
с ил.
334. Потемкин А. Я-, Шейдеман Ю. И., Фролов Ю. П., Бенедиктова Г. П.
и др. Материалы для авиационного приборостроения и конструкций.
Под ред. академика А. Ф. Белова. М.: Металлургия, 1982. 400 с. с ил.
335. Кемхадзе В. С. Коррозия и защита металлов во влажных субтропиках.
М.: Наука, 1983. 103 с.
336. А.белев М. М. Технология химического и нефтяного машиностроения и
новые материалы. Сплавы на никелевой основе и их применение в
химическом машиностроении. М.: ЦИНТИ Химнефтемаш, 1973, сер. ХМ-9.
46 с.
337. Соломатина К. 3., Тюрин С. Т. Общесоюзный перечень материалов и
веществ, разрешенных Минздравом СССР к применению в
винодельческой промышленности № РМ-3-1980.—Ялта: Таврида, 1980, 44 с.
338. Сб. Коррозионная стойкость и опыт применения экономно-легированных
никелей и безникелевых сталей в технологических средах химических
производств. М.: НИИТЭХИМ, 1984. 148 с.
339. Манохин А. И., Митин Б. С, Васильев В. А., Ревякин А. В. Аморфные
сплавы. М.:.Металлургия, 1984. 160 с. с ил.
340. Шлыкова Г. А., Коваленко И. П., Комаров Р. А., Курочкина Л. Г.
Химическая промышленность, 1985, № 9, с. 574.
341. Каспарова Э. В., Колотыркин Я. М.— Защита металлов, т. XXI, 1985,
№ 6, с. 854—860.
342. Антропов Л. И. Теоретическая электрохимия. М.: Высшая школа, 1984.
519 с. с ил.
343. Кеше Г. Коррозия металлов: пер. с нем., под ред. академика Я. М. Ко-
лотыркина и докт. хим. наук В. В. Лосева. М.: Металлургия, 1984.
400 с. с ил.
344. Коломыцев П. Т. Газовая коррозия и прочность никелевых сплавов. М.:
Металлургия, 1984. 215 с. с ил.
345. Ранее X., Стефанова С. Справочник по коррозии: Пер. с болг., под ред.
докт. хим. наук проф. Н. И. Исаева. М.: Мир, 1982. 520 с. с ил.
346. Зрунек. Противокоррозионная защита металлических конструкций:
Пер. с чешек., под ред. А. А. Герасименко. М.: Машиностроение, 1984.
132 с. с ил.
347. Р. Юхневич, В. Богданович, Е. Валашковский, А. Видуховский. Техника
борьбы с коррозией: Пер. с польск., под ред. А. М. Сухотина, Л.: Химия,
1980. 224 с. с ил.
348. Сб. Атмосферная коррозия в промышленном и гражданском
строительстве. Ред. Д. Гримме, К. А. ван Этерен, М. Пёчке, В. Швейк, пер. с нем.,
под ред. М. Н. Фокина. М.: Металлургия, 1981. 192 с.
349. Голубев В. Г., Рюмина Т. П., Васильева 3. К-—Химические волокна,
1986, № 4, с. 47—49.
350. Сидоркина Ю. С.г Бекоева Г. П., Маневич Т. В. и др.— Химическое и
нефтяное машиностроение, 1986, № 1, с. 31—33.
351. Сазонов Р. Я.— Теплоэнергетика, 1983, № 1, с. 40—43.
352. Горчаков Л. В., Макеева К. В., Тимофеев Г. Л.—Жилищное и
коммунальное хозяйство, 1986, № 6, с. 15—16.
353. Антонова М. М., Браханова И. Т., Борисова А. Л. и др. Свойства
элементов, т. II. М.: Металлургия, 1978. 384 с.
354. Андреев Ю. Я. Коррозия металлов и сплавов. М.: МИСиС, 1983. 100 с.
Д. Г. Туфанов
КОРРОЗИОННАЯ СТОЙКОСТЬ
НЕРЖАВЕЮЩИХ СТАЛЕЙ,
СПЛАВОВ И ЧИСТЫХ
МЕТАЛЛОВ
Издание пятое, дополненное и переработанное
МОСКВА «МЕТАЛЛУРГИЯ» 1990