Author: Филов В.А. Курляндский Б.А.
Tags: философия психология фармакология фармация токсикология медицина охрана труда
ISBN: 5-225-04609-6
Year: 2002
Text
ОБЩАЯ
ТОКСИКОЛОГИЯ
Под редакцией
профессора Б.А.Курляндского,
профессора В.А.Филова
МОСКВА
“МЕДИЦИНА”
2002
УДК615.9(035.3)
ББК 52.84
028
028 Общая токсикология/Под ред. Б.А.Курляндского, В.А.Фи-
лова. — М.: Медицина, 2002. — 608 с.: ил.
ISBN 5-225-04609-6
В книге с современных позиций рассмотрены и проанализированы
основные механизм!! действия химических веществ различных классов
на организм человека, патогенез и симптоматика интоксикаций в зави-
симости от количества вещества, путей поступления и времени контакта.
Специальные разделы посвящены канцерогенному, генотоксическому,
эмбриотропному, иммунотоксическому и другим видам специфического
действия. Описаны подходы к диагностике и лечению интоксикаций,
оказанию первой помощи при отравлениях. Изложены научные и мето-
дические основы клинической, профилактической, экологической ток-
сикологии, современные подходы к оценке риска.
Для врачей широкого профиля, специалистов-токсикологов, врачей-
гигиенистов, экологов, специалистов по охране труда и технике безопас-
ности.
ББК 52.84
General Toxicology, Ed. by B.A. Kurlyandsky, V.A. Filov. —
Moscow: Meditsina Publishers, 2002. ISBN 5-225-04609-6
Basic mechanisms of the effects of chemicals of different classes on human
body, pathogenesis and symptoms of intoxication depending on the substance
dose, routes of entry into the body, and duration of exposure are discussed
and analyzed in this book from a modem viewpoint. Special sections deal with
carcinogenic, genotoxic, embryotropic, immunotoxic, and other specific ef-
fects. Approaches to the diagnosis and treatment of intoxication, first aid in
poisoning are described. Scientific and methodological basis of clinical, pre-
ventive, and ecological toxicology and modem approaches to evaluation of risk
are presented.
Addressed to physicians of general profile, toxicologists, hygienists, ecolo-
gists, and specialists in labor protection and safety engineering.
ISBN 5-225-04609-6
© Коллектив авторов, 2002
Все права авторов защищены. Ни одна часть этого издания не может
быть занесена в память компьютера либо воспроизведена любым спосо-
бом без предварительного письменного разрешения издателя.
Коллектив авторов
Курляндский Борис Аронович, д-р мед. наук, проф., директор Российского регистра
потенциально опасных химических и биологических веществ Минздрава России (Мос-
ква)
Филов Владимир Александрович, д-р биол. наук, проф., акад. РАЕН, науч, руководи-
тель Института ксенобиотиков РАЕН, руководитель лаборатории НИИ онкологии им. проф.
Н.Н.Петрова Минздрава России (Санкт-Петербург)
Безель Виктор Сергеевич, д-р биол. наук, проф., зав. лабораторией Института эколо-
гии растений и животных Уральского отделения РАН (Екатеринбург)
Василенко Наталья Мироновна, д-р мед. наук, проф., руководитель лаборатории Ин-
ститута медицины труда (Харьков)
Дарьина Людмила Викторовна, канд. биол. наук, ст. науч. сотр. Военного университета
радиационной, химической и биологической защиты МО РФ (Москва)
Жминько Петр Григорьевич, канд. биол. наук, руководитель лаборатории общей ток-
сикологии Института экогигиены и токсикологии им. Л.И.Медведя (Киев)
Жолдакова Зоя Ильинична, д-р мед. наук, проф., зав. лабораторией НИИ экологии
человека и гигиены окружающей среды им. А.Н.Сысина РАМН (Москва)
Забродский Павел Францевич, д-р мед. наук, проф., зав. лабораторией Саратовского
медицинского университета (Саратов)
Иванов Николай Георгиевич, д-р мед. наук, проф., зав. лабораторией Российского
государственного медицинского университета (Москва)
Каган Юрий Соломонович, д-р мед. наук, проф., чл.-кор. АМН и НАН Украины, руково-
дитель отдела Института экогигиены и токсикологии им. Л.И.Медведя (Киев)
Кацнельсон Борис Александрович, д-р мед. наук, проф., руководитель отдела Екате-
ринбургского медицинского научного центра профилактики и охраны здоровья рабочих
промышленных предприятий (Екатеринбург)
Кокшарева Наталия Владимировна, д-р биол. наук, руководитель лаборатории Инсти-
тута экогигиены и токсикологии им. Л.И.Медведя (Киев)
Кузьмин Сергей Владимирович, д-р мед. наук, директор Медицинского научного цент-
ра профилактики и охраны здоровья рабочих предприятий Минздрава России
Лошадкин Николай Андреевич, д-р мед. наук, проф., старший науч. сотр. Военного уни-
верситета радиационной, химической и биологической защиты МО РФ (Москва)
Лужников Евгений Алексеевич, д-р мед. наук, проф., чл.-кор. РАМН, руководитель
науч. отделения лечения острых отравлений НИИ скорой помощи им. Н.В.Склифосов-
ского (Москва)
3
Привалова Лариса Ивановна, д-р мед. наук, зам. дир. по науч, работе Уральского
регионального центра “Экологическая эпидемиология" Уральского филиала Центра про-
филактики и охраны здоровья рабочих промышленных предприятий (Екатеринбург)
Ревазова Юлия Анатольевна, д-р мед. наук, проф., ведущий науч. сотр. НИИ экологии
человека и гигиены окружающей среды им. А.Н.Сысина РАМН (Москва)
Ротенберг Юрий Семенович, д-р мед. наук, руководитель лаборатории НИИ по биоло-
гическим испытаниям химических соединений (Москва)
Сивочалова Ольга Витальевна, д-р мед. наук, зав. лабораторией НИИ медицины
труда РАМН (Москва)
Софронов Александр Генрихович, д-р мед. наук, проф. Военно-медицинской акаде-
мии (Санкт-Петербург)
Софронов Генрих Александрович, д-р мед. наук, проф., акад. РАМН, зав. лаборато-
рией Военно-медицинской академии (Санкт-Петербург)
Томилина Людмила Алексеевна, канд. мед. наук, ведущий науч. сотр. Российского
регистра потенциально опасных химических и биологических веществ Минздрава Рос-
сии (Москва)
Трахтенберг Исаак Михайлович, д-р мед. наук, проф., акад. АМН и чл.-кор. НАН
Украины, руководитель лаборатории НИИ медицины труда АМН Украины (Киев)
Фесенко Марина Александровна, д-р. мед. наук, старший науч. сотр. НИИ медицины
труда РАМН (Москва)
Харчевникова Инна Вениаминовна, канд. мед. наук, старший науч. сотр. НИИ экологии
человека и гигиены окружающей среды им. А.Н.Сысина РАМН (Москва)
Худолей Вениамин Викторович, д-р мед. наук, акад. РАЕН, руководитель отдела НИИ
онкологии им. проф. Н.Н.Петрова Минздрава России (Санкт-Петербург)
Шафран Леонид Моисеевич, д-р мед. наук, проф., зав. отделом Украинского НИИ
медицины транспорта (Одесса)
Оглавление
Предисловие............................................................ |и
Глава 1. Введение в токсикологию. — Г.А.Софронов....................... 12
1.1. Определение и основные понятия. Предмет, задачи и методы токсиколо-
гии............................................................... 12
1.2. История становления токсикологии.................................. 17
Глава 2. Взаимодействие организма н ксенобиотика; хемобнокинетика. — В.А.Фи-
лов.................................................................... 32
2.1. Общие представления............................................... 32
2.2. Механизмы метаболизма ксенобиотиков............................... 34
2.3. Биохимические механизмы токсического действия..................... 39
2.4. Хемобиокинетика................................................... 42
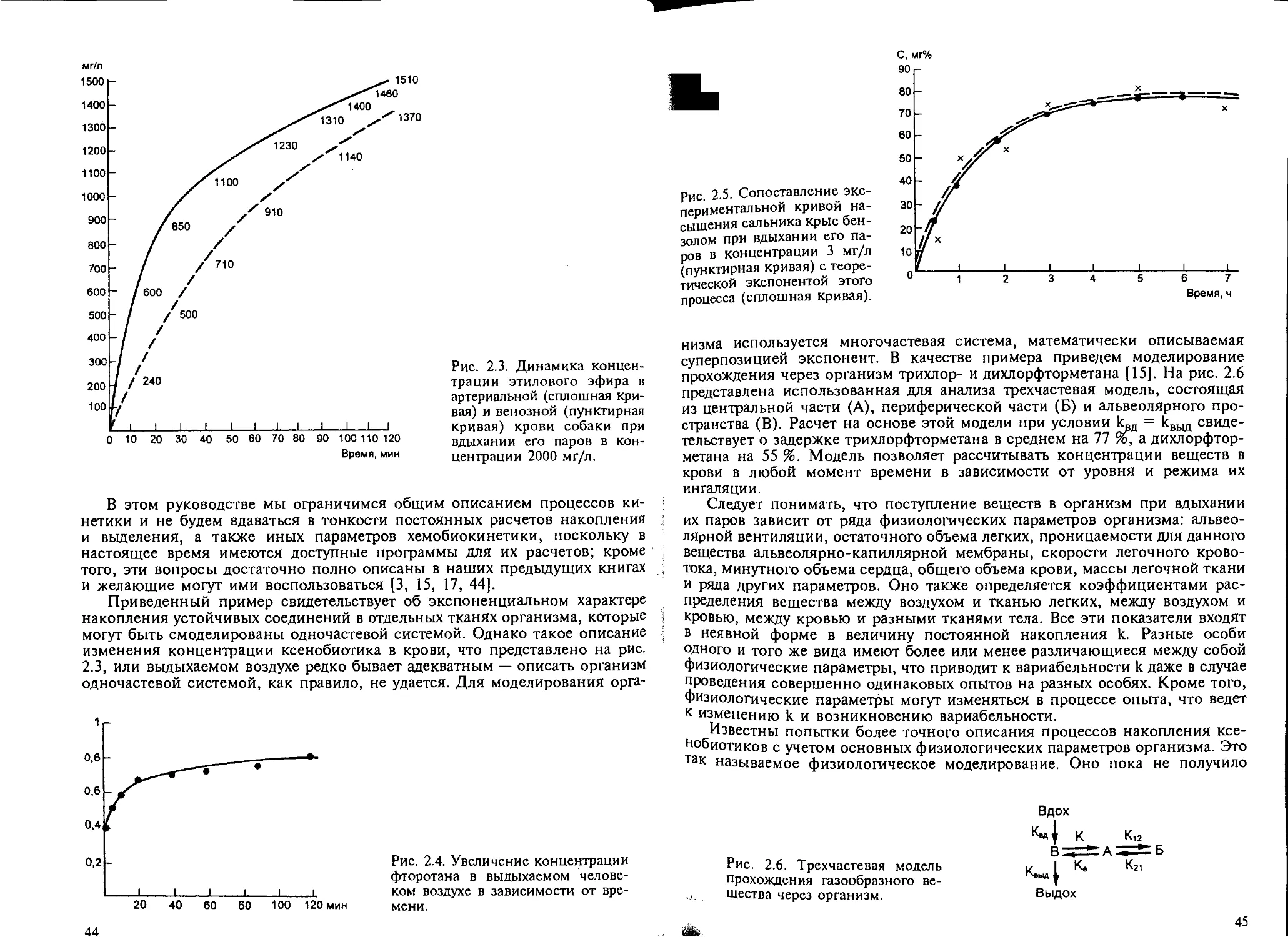
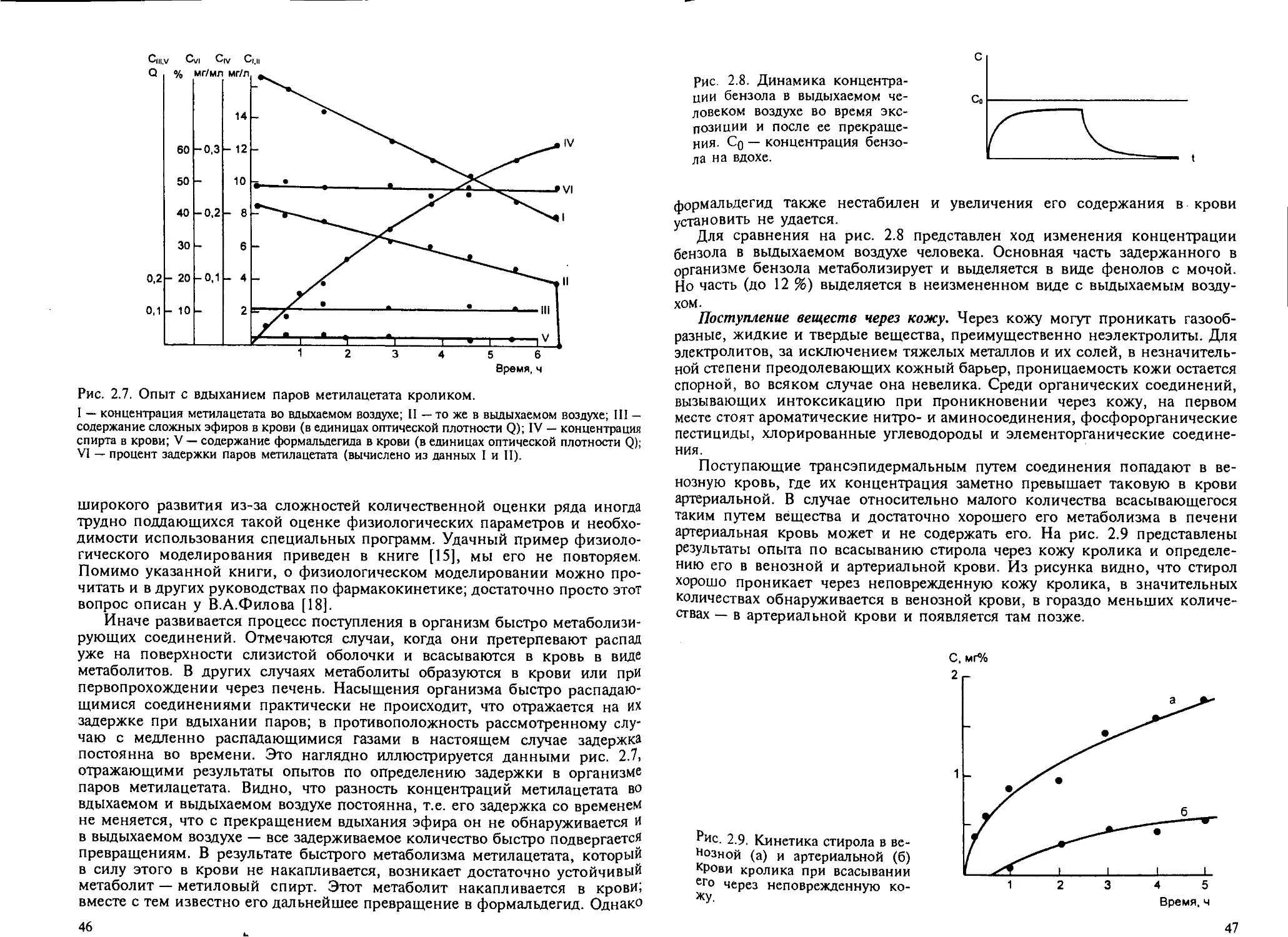
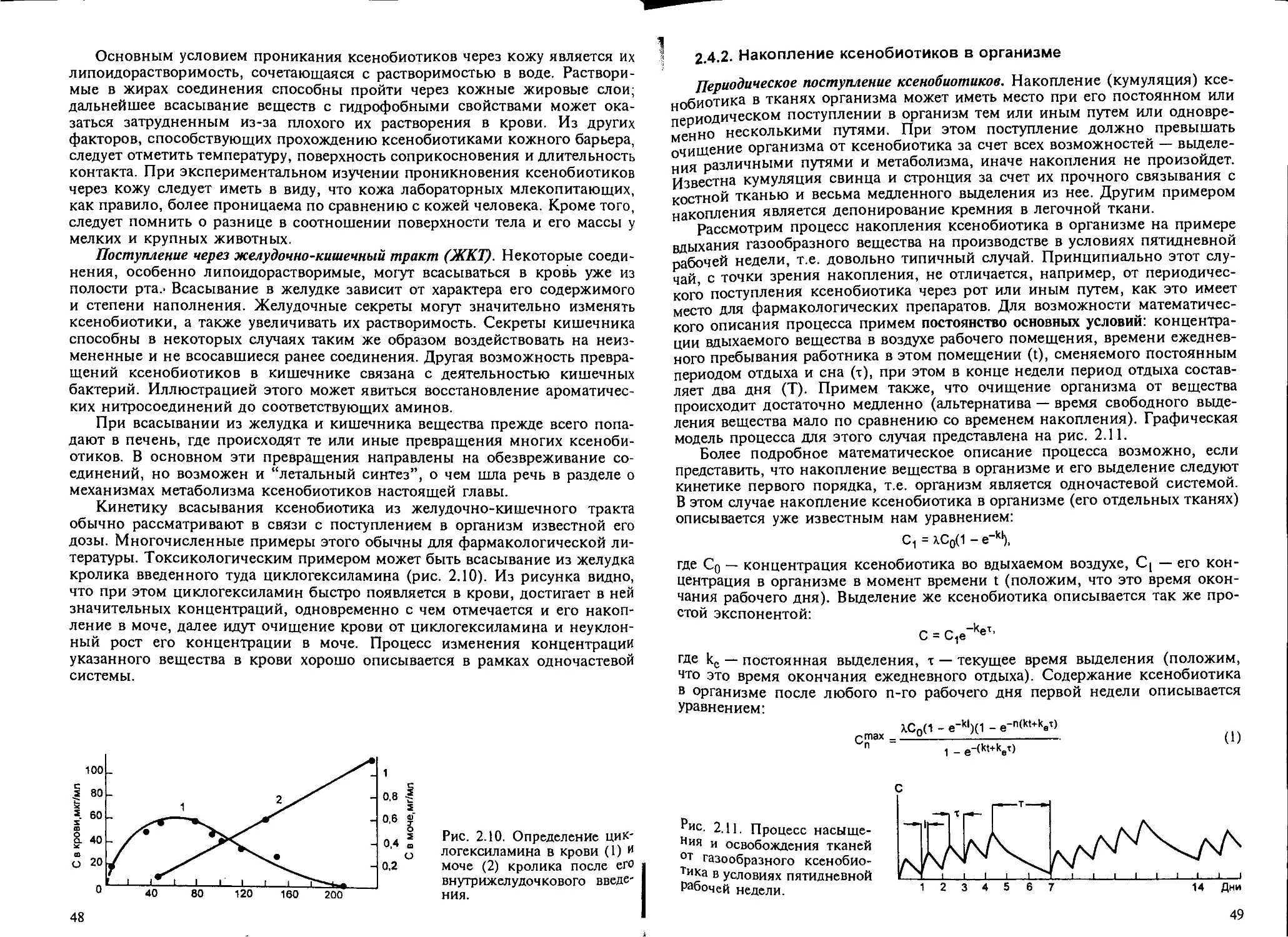
2.4.1. Поступление ксенобиотиков в организм....................... 43
2.4.2. Накопление ксенобиотиков в организме....................... 49
2.4.3. Выделение ксенобиотиков из организма....................... 52
2.4.4. Хемобиокинетика системы: материнский организм — плод...... 54
2.4.5. О нелинейных эффектах в хемобиокинетике.................... 55
2.4.6. Факторы, модифицирующие хемобиокинетику.................... 59
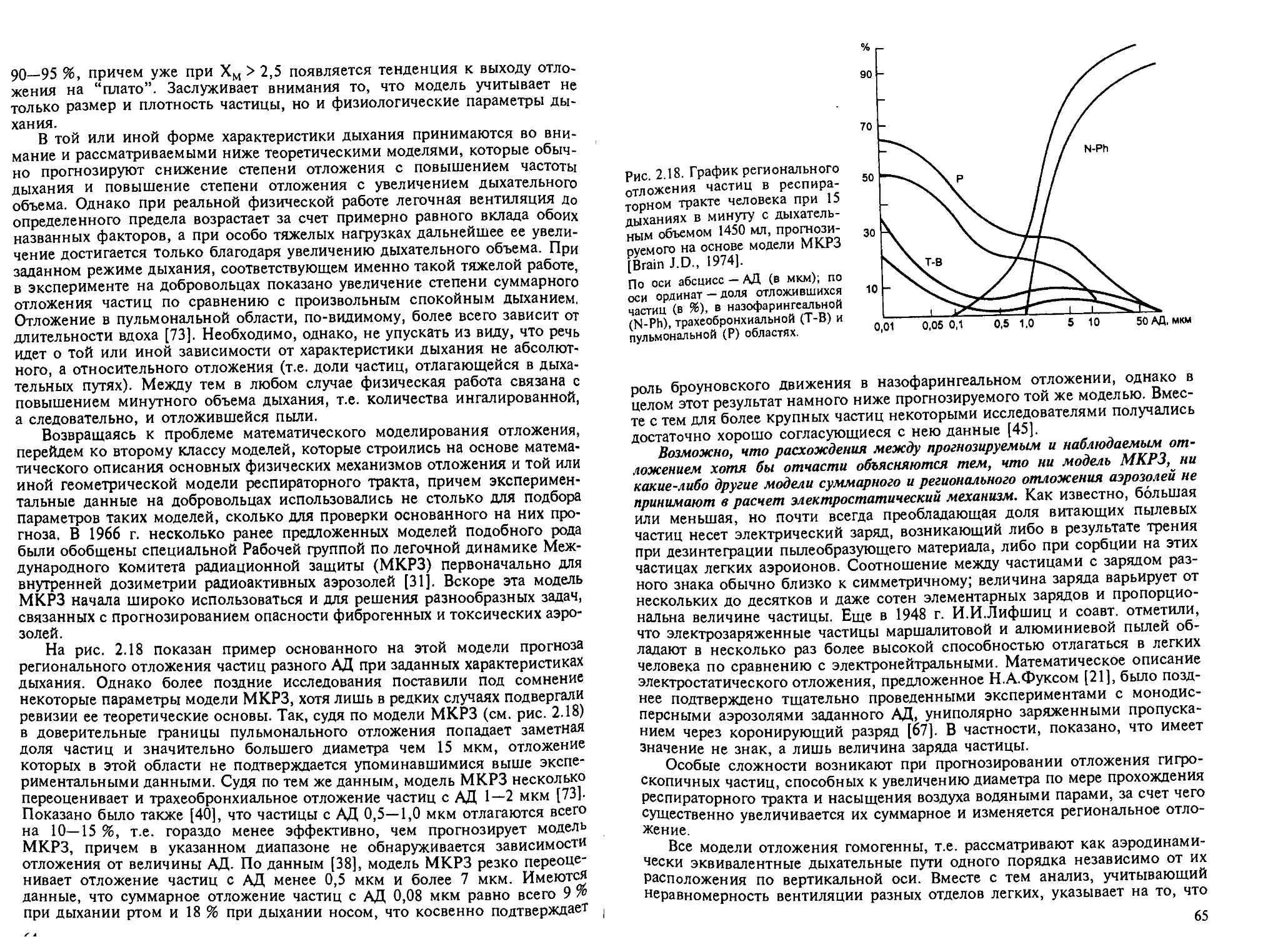
2.4.7. Особенности хемобиокинетики аэрозолей. — Б.А.Кацнельсон... 60
2.5. Количественная зависимость между структурой и активностью ксенобио-
тиков при их биотрансформации. — З.И.Жолдакова, И.В.Харчевникова 76
Глава 3. Влияние ксенобиотиков на биоэнергетические процессы. — Б.А.Курлян-
дский, Ю. С. Ротенберг, Л.А. Томилина.................................. 89
3.1. Действие ксенобиотиков на тканевое дыхание........................ 89
3.2. Нарушения энергетического обмена под влиянием ксенобиотиков...... 99
Глава 4. Тиоловые яды. — И.М.Трахтенберг, Л.М.Шафран.................. 111
4.1. Патогенез и механизмы токсического действия тиоловых ядов........ 111
4.1.1. Общие положения........................................... 111
4.1.2. Физико-химические основы токсичности тяжелых металлов как
тиоловых ядов.................................................... 114
4.1.3. Тиоловые группы белков, их роль в клеточном метаболизме и
патогенезе отравлений тяжелыми металлами.................. 116
4.2. Физиологический синергизм и антагонизм в механизме действия тяже-
лых металлов.......................................................... 131
4.3. Токсикокинетика и токсикодинамика тиоловых ядов.................. 133
4.4. Острые отравления................................................ 138
4-5. Хронические отравления........................................... 142
4.5.1. Нейротоксичность в патогенезе отравлений тяжелыми металлами 143
4.5.2. Кардиотоксичность тиоловых ядов........................... 154
4.5.3. Нефротоксичность тиоловых ядов............................ 160
4.5.4. Гепатотоксичность тиоловых ядов........................... 165
4.6. Общие принципы лечения отравлений тиоловыми ядами... 166
5
Глава 5. Блокаторы холинэстеразы. — Ю.С.Каган, Н.В.Кокшарева, П.Г.Жминько 176
5.1. Механизм передачи нервного импульса и роль в нем холинэстеразы.. 176
5.2. Обшие свойства холинэстераз, механизм их взаимодействия с ацетилхо-
лином ............................................................... 1^9
5.3. Классификация антихолинэстеразных веществ....................... 181
5.4. Фосфорорганические соединения................................... 182
5.4.1. Краткая история, строение и физико-химические свойства ФОС 182
5.4.2. Взаимодействие ФОС с холинэстеразой и холинорецепторами 185
5.4.3. Антихолинэстеразная активность ФОС in vitro.............. 187
5.4.4. Антихолинэстеразные свойства ФОС при остром и хроническом
воздействии в зависимости от пути поступления в организм......... 189
5.4.5. Зависимость токсичности и антихолинэстеразной активности
ФОС от их химической структуры.............................. 194
5.5. Токсикокинетика ФОС............................................. 200
5.6. Метаболизм ФОС.................................................. 202
5.7. Избирательное действие ФОС ..................................... 205
5.8. Патогенез отравлений ФОС........................................ 212
5.8.1. Влияние ФОС на центральную нервную систему и нервно-мы-
шечные синапсы................................................... 212
5.8.2. Нейротоксическое действие ФОС замедленного типа.......... 217
5.8.3. Влияние ФОС на дыхание и сердечно-сосудистую систему..... 220
5.8.4. Влияние ФОС на гладкомышечные и внешнесекреторные органы... 222
5.8.5. Влияние ФОС на кровь, печень, почки и другие системы..... 223
5.9. Производные карбаминовой кислоты................................ 225
5.9.1. Строение и взаимодействие с холинэстеразой............... 225
5.9.2. Токсичность, кинетика, метаболизм........................ 227
Глава 6. Токсикология алкилирующих соединений. — Н.А.Лошадкин, Б.А.Кур-
ляндский, Л.В.Дарьина................................................ 236
6.1. Типы алкилирующих соединений. Механизмы реакций с нуклеофильны-
ми реагентами....................................................... 236
6.1.1. Алкилирование. Типы алкилирующих соединений............ 236
6.1.2. Механизмы взаимодействия алкилирующих соединений с нуклео-
фильными реагентами.............................................. 238
6.2. Биохимические мишени алкилирующих соединений. Общая токсиколо-
гическая характеристика.............................................. 239
6.2.1. Биохимические мишени алкилирующих соединений............. 239
6.2.2. Общая токсикологическая характеристика алкилирующих соеди-
нений. Концентрационные эффекты.................................. 240
6.3. Токсикология ипритов............................................ 242
6.3.1. Общая характеристика и токсичность....................... 242
6.3.2. Механизм токсического действия........................... 242
6.3.3. Симптомы поражения....................................... 243
6.3.4. Токсикологические характеристики рецептур иприта (НТ, HQ,
HL), вязкие рецептуры............................................ 245
6.3.5. Противоопухолевые лекарственные средства. Производные бис-
(2-хлорэтил)амина................................................ 249
6.4. Токсикология алкилирующих соединений, используемых в народном хо-
зяйстве ............................................................. 250
6.4.1. Токсикология галоидных алкилов........................... 250
6.4.2. Метиловые эфиры минеральных кислот....................... 253
6.4.3. Биологически активные природные алкилирующие соединения.. 253
6.5. Принципы оказания первой медицинской помощи при поражениях ал-
килирующими соединениями............................................. 255
6
Глава 7. Действие ксенобиотиков на систему крови. — Н.М.Василенко....... 258
7 1 Токсические поражения пигмента крови.............................. 258
7.1.1. Карбоксигемоглобинемия.................................... 260
7.1.2. Метгемоглобинемия......................................... 266
7.1.3. Метгемоглобинобразователи неорганической природы.......... 276
7.1.4. Поражение крови при первичном гемолизе.................... 277
7 2 Угнетение ксенобиотиками системы кроветворения.................... 281
7.2.1. Поражение крови по типу бензольной гемопатии.............. 281
7.2.2. Клиника острого и хронического отравления бензолом........ 285
7.2.3. Вещества с бензолоподобным действием на кровь............. 288
7.2.4. Первичное токсическое угнетение синтеза гемоглобина....... 289
Глава 8. Вещества наркотического действия. — А.Г.Софронов, Г.А.Софронов. 300
8.1. Общие представления о наркотических веществах.................... 300
8.2. Общие проявления клинического течения токсикоманических интокси-
каций................................................................. 303
8.3. Биологические механизмы (патогенез) химической зависимости......... 305
8.4. Частные формы токсикоманий....................................... 307
8.5. Лечение токсикоманий............................................. 319
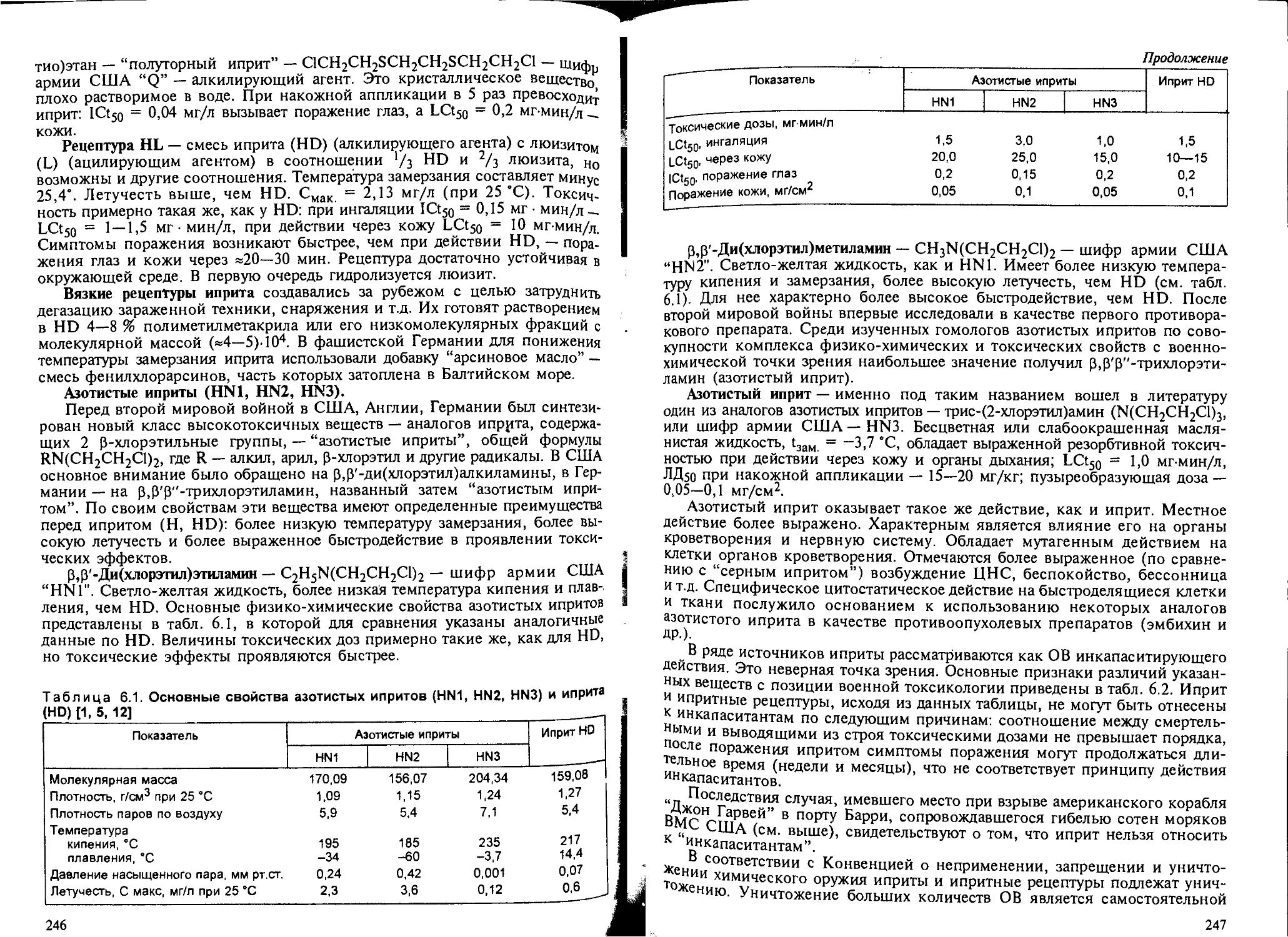
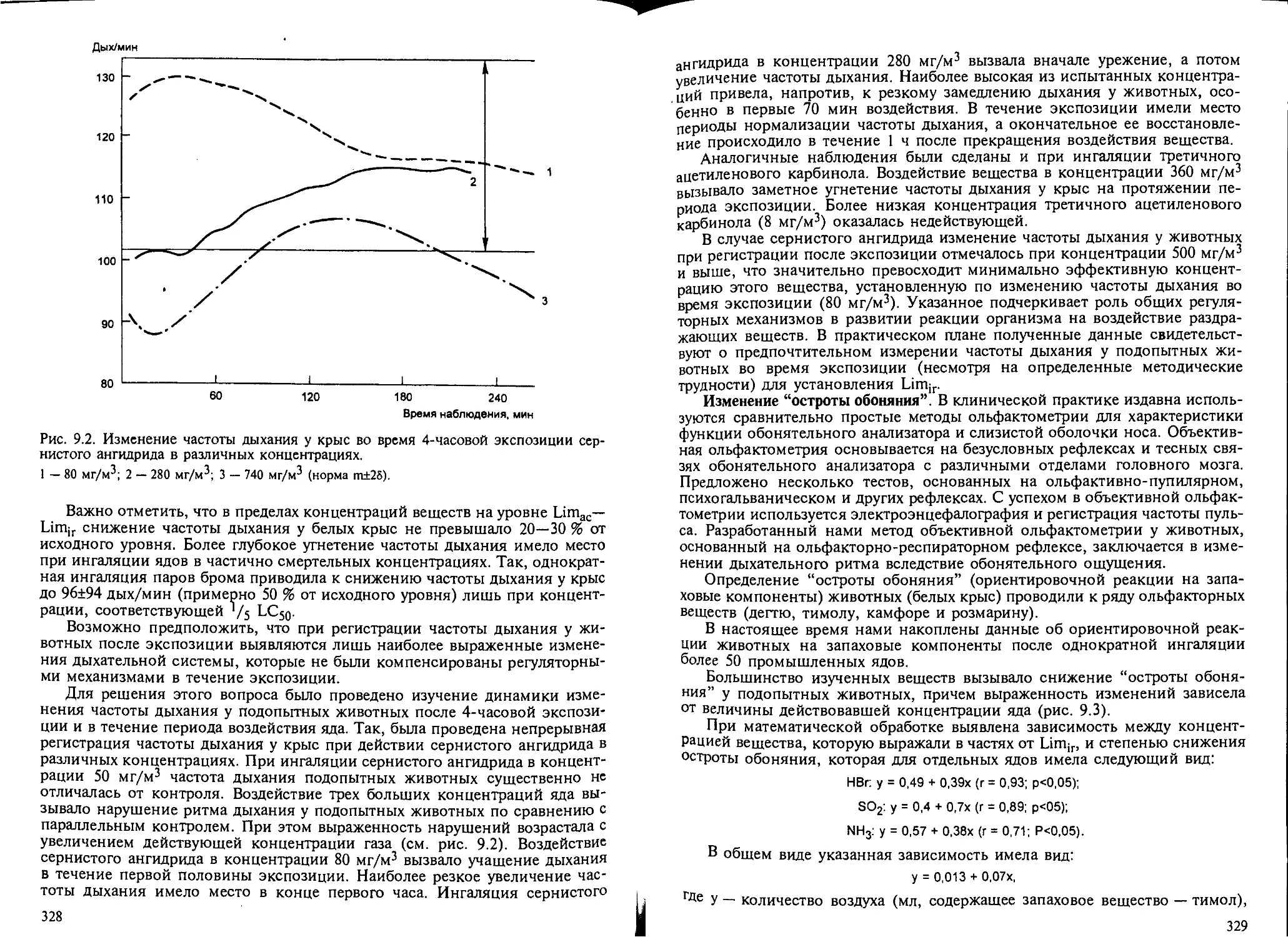
Глава 9. Вещества раздражающего действия. — Н.Г.Иванов................ 325
9.1. Общие положения.................................................. 325
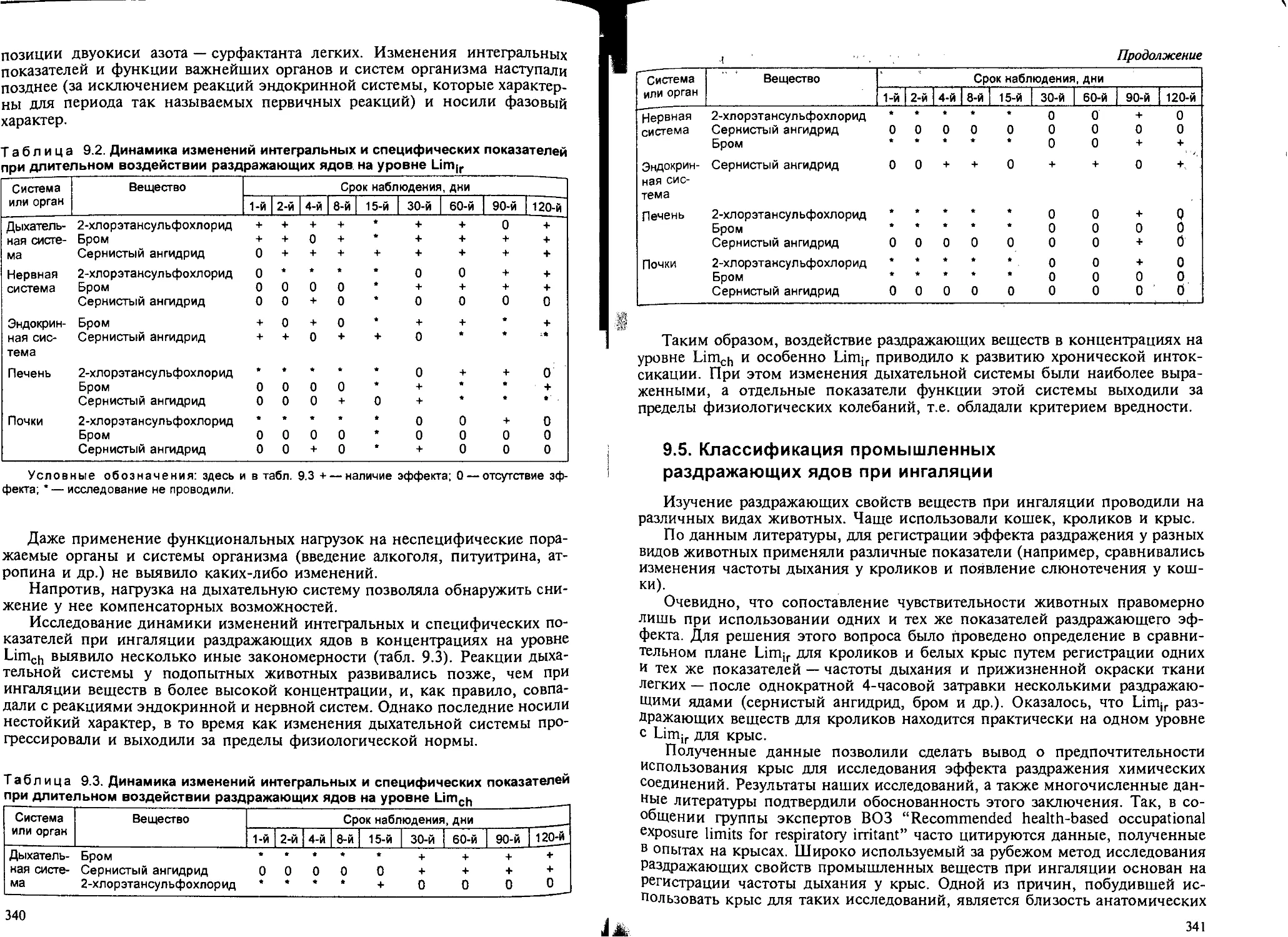
9.2. Биомаркеры раздражающего действия веществ на дыхательную систему... 326
9.3. Характерные изменения дыхательной системы при кратковременном воз-
действии раздражающих ядов............................................ 337
9.4. Особенности развития хронической интоксикации при ингаляции раз-
дражающих ядов в различных концентрациях.............................. 339
9.5. Классификация промышленных раздражающих ядов при ингаляции......... 341
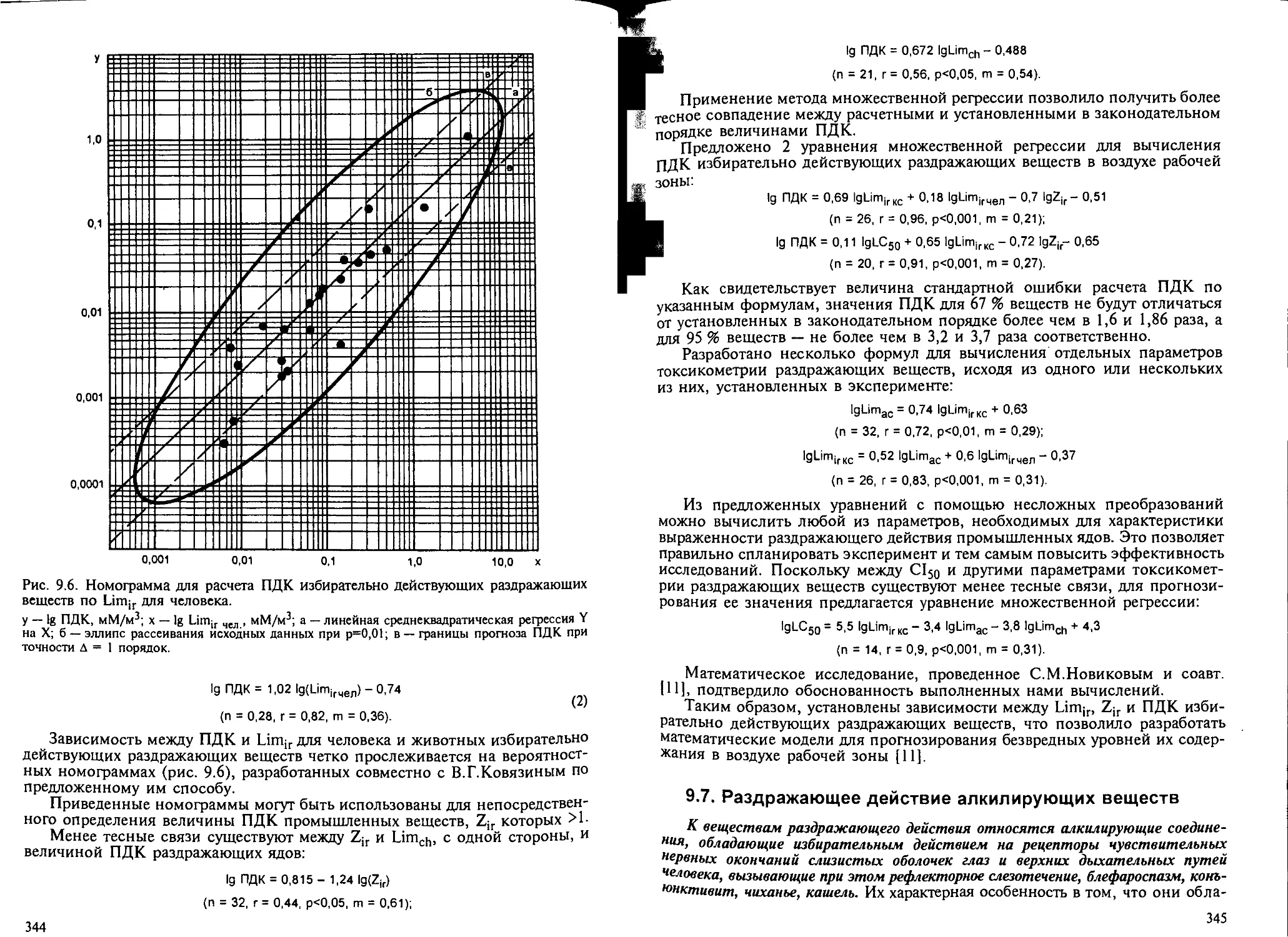
9.6. Анализ параметров токсикометрии раздражающих веществ............. 343
9.7. Раздражающее действие алкилирующих веществ. — Н.А.Лошадкин,
Л. В.Дарьина.......................................................... 345
Глава 10. Влияние ксенобиотиков на иммунный гомеостаз. — П.Ф.Забродский... 352
10.1. Общая часть..................................................... 352
10.2. Изменения неспецифической реактивности организма................ 355
10.3. Действие токсикантов на гуморальный клеточный иммунитет..... 363
10.4. Влияние атмосферных загрязнений на иммунологическую резистент-
ность организма и возникновение заболеваний........................... 382
Глава 11. Генотоксическое действие ксенобиотиков. — Ю.А.Ревазова...... 385
11.1. Общая часть..................................................... 385
11.2. Генетические эффекты в соматических и зародышевых клетках человека 386
11.3. Оценка потенциальной генотоксичности ксенобиотиков.............. 390
11.4. Оценка суммарной генотоксичности и модификация мутагенных эффек-
тов при комбинированных воздействиях.................................. 396
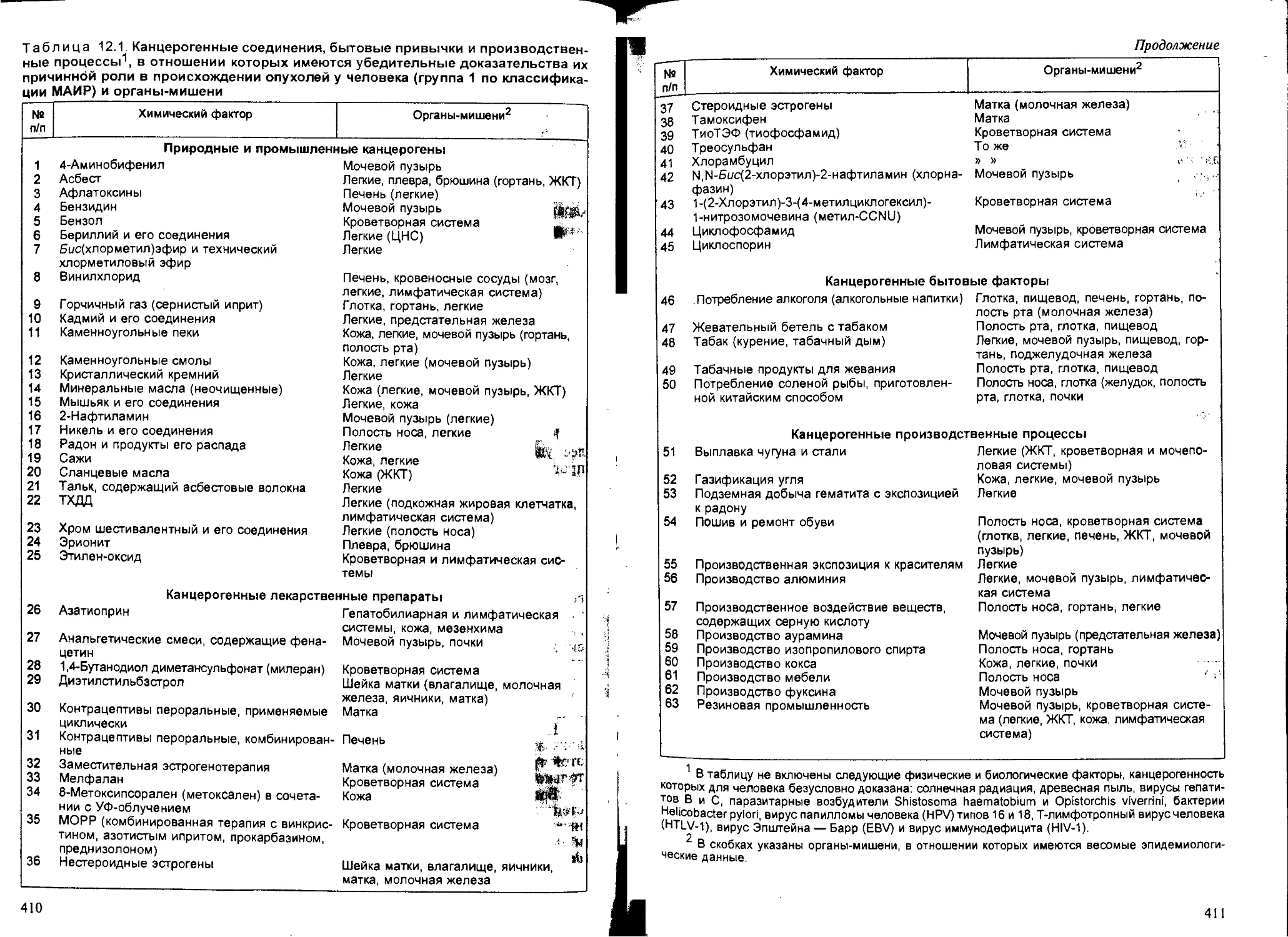
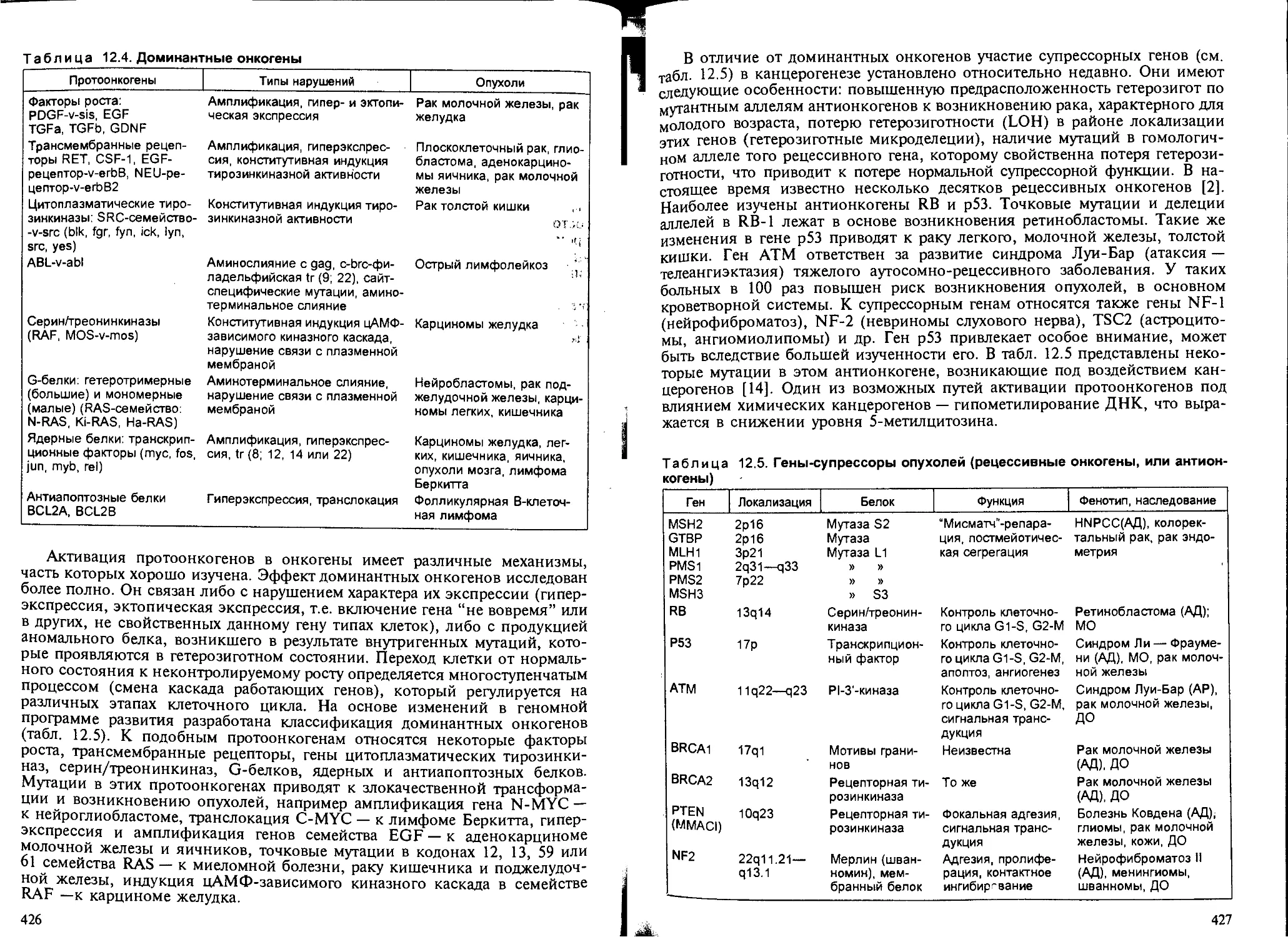
Глава 12. Химический канцерогенез, — В.В.Худолей...................... 407
12.1. Общие понятия и определения..................................... 407
12.2. Классификация канцерогенов...................................... 408
2.3. Закономерности канцерогенеза и механизмы действия химических кан-
церогенов........................................................ 418
7
1
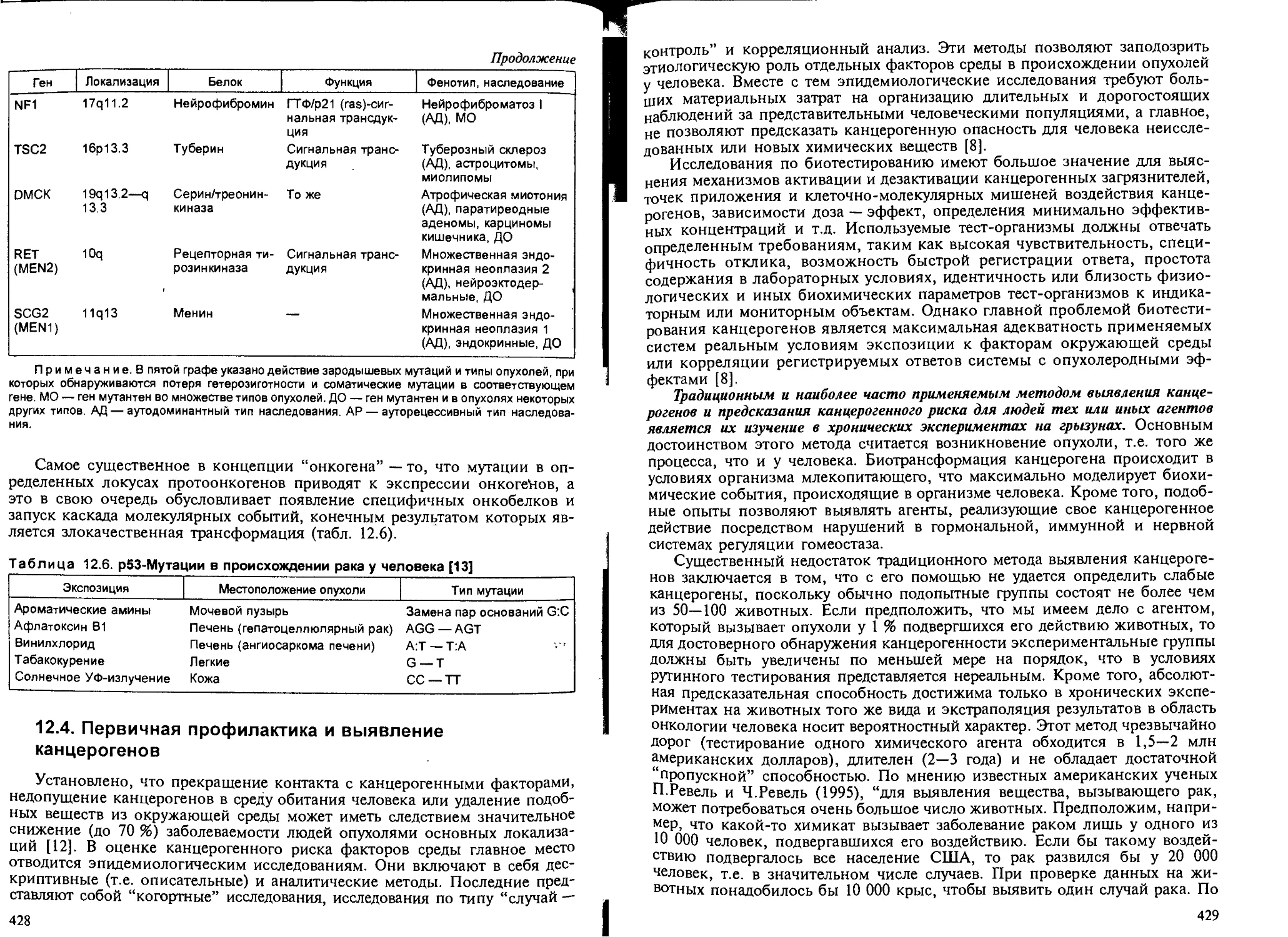
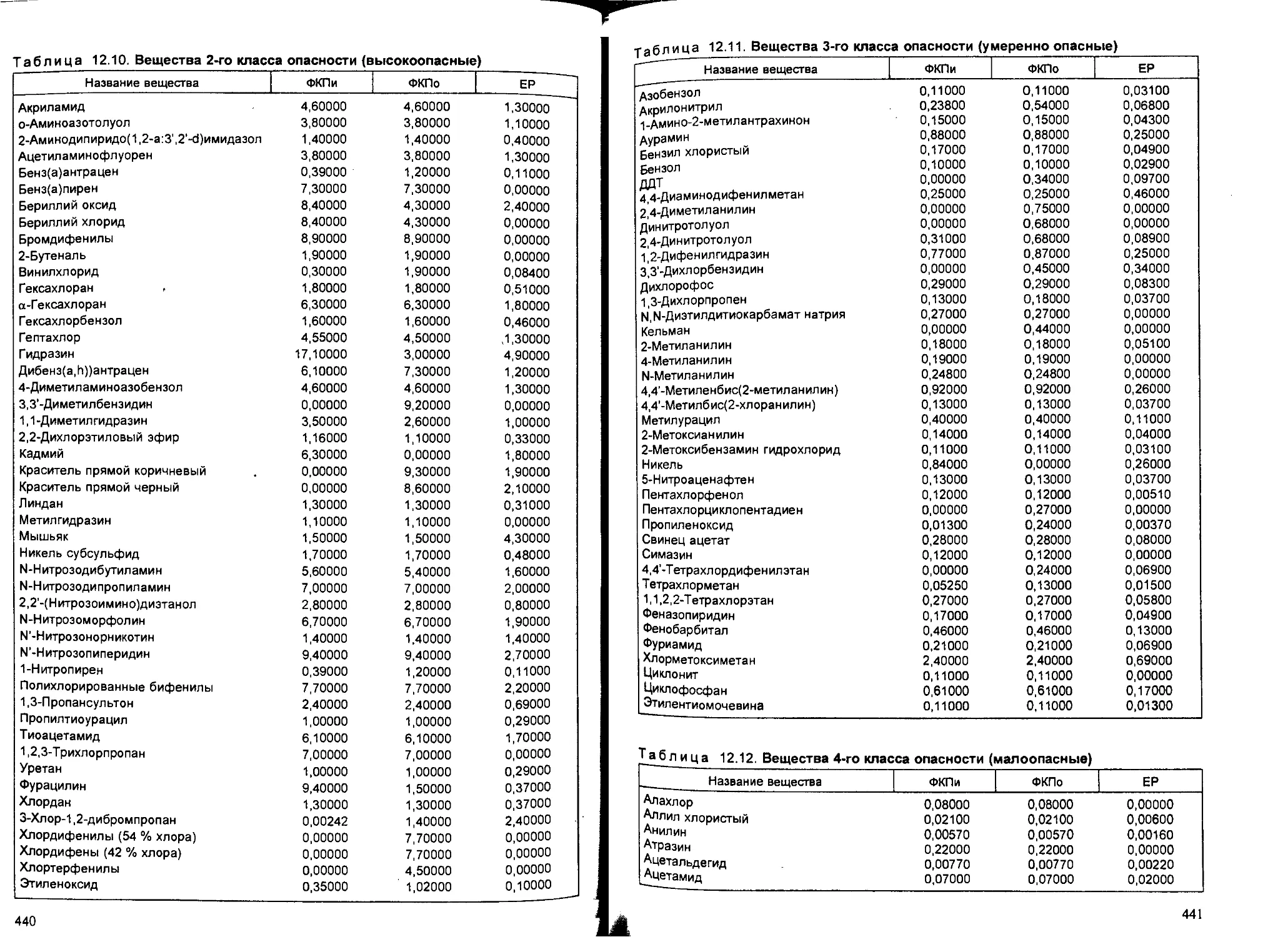
12.4. Первичная профилактика и выявление канцерогенов................. 428
12.5. Регламентирование химических канцерогенов и количественная оценка
канцерогенной опасности. — Б.А.Курляндский................... 432
Глава 13. Действие ксенобиотиков на процессы репродукции. — О.В.Сивочало-
ва, М.А.Фесенко....................................................... 445
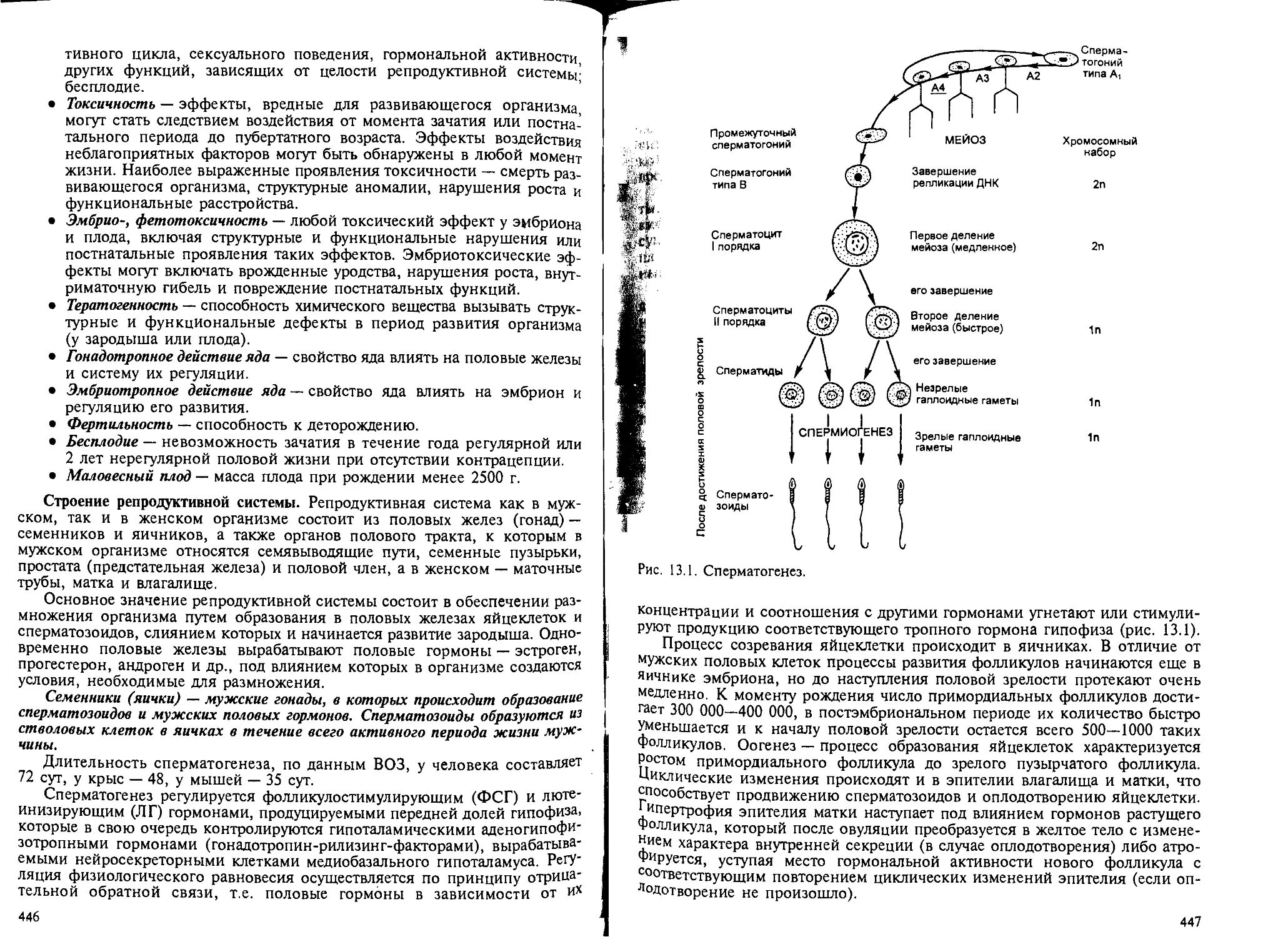
13.1. Общая часть............................ ........................ 445
13.2. Методы изучения влияния ксенобиотиков на репродуктивную функцию 449
13.2.1. Исследование гонадотропного действия химических веществ.. 451
13.3. Патогенетические аспекты и клинические проявления нарушений репро-
дуктивной функции..................................................... 455
13.4. Классификация ксенобиотиков, действующих на репродуктивную систему... 464
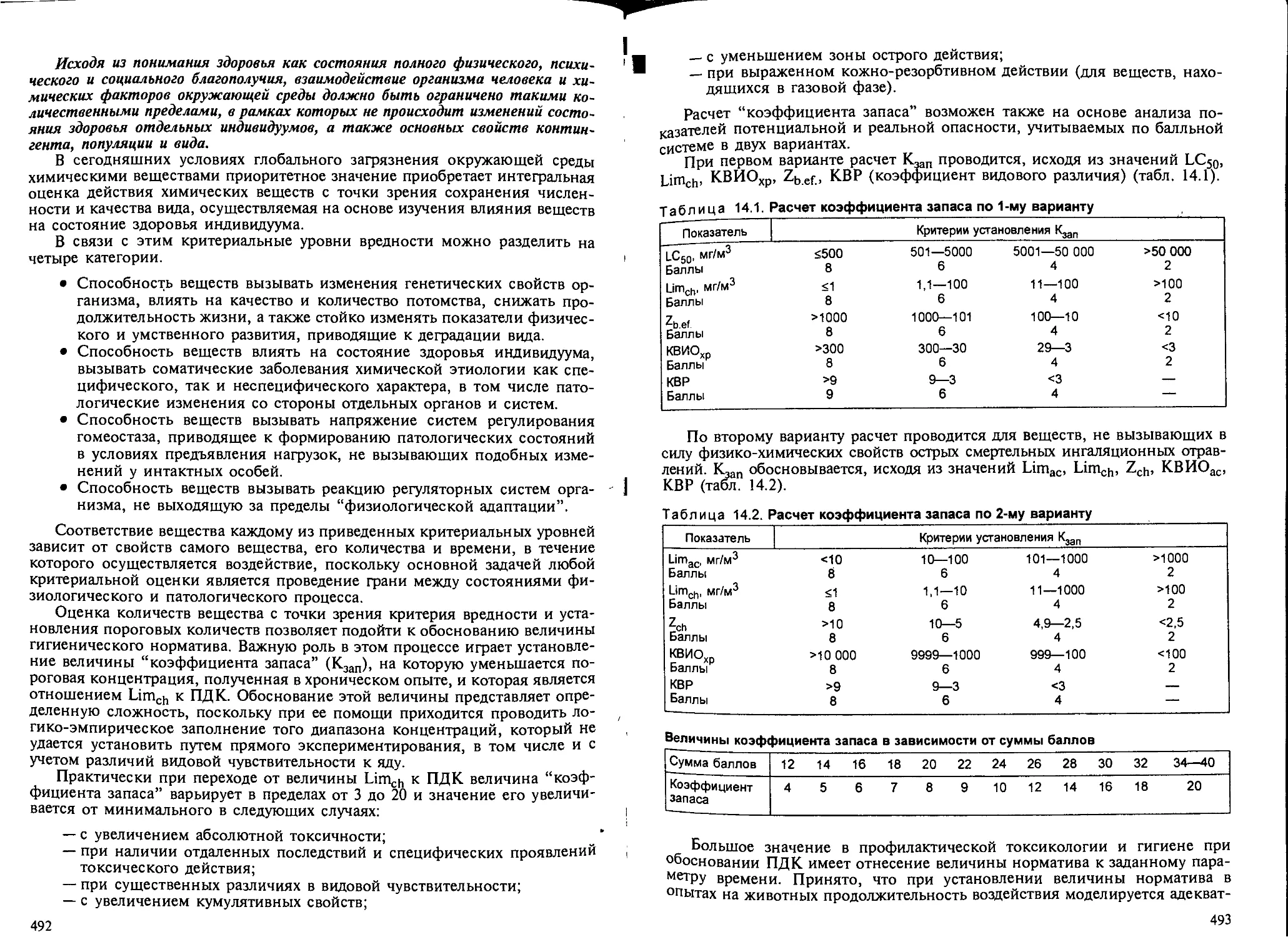
Глава 14. Основы профилактической токсикологии. — Б.А.Курляндский..... 474
14.1. Задачи и принципы............................................... 474
14.2. Информация об основных свойствах вещества и условиях его воздейст-
вия на организм....................................................... 475
14.3. Создание экспериментальных моделей, адекватных условиям воздейст-
вия вещества на организм человека..................................... 477
14.4. Установление основных параметров токсичности (токсикометрия).... 479
14.5. Изучение патогенетической значимости изменений в организме и их
оценка с позиций критерия вредности................................... 482
14.6. Экстраполяция экспериментальных данных с животных на человека... 487
14.7. Гигиеническое регламентирование химических веществ.............. 488
14.8. Комбинированное действие химических веществ. — Б.А.Кацнельсон... 497
14.8.1. Многофакторный характер токсической экспозиции........... 497
14.8.2. Различные дефиниции типов комбинированного действия...... 500
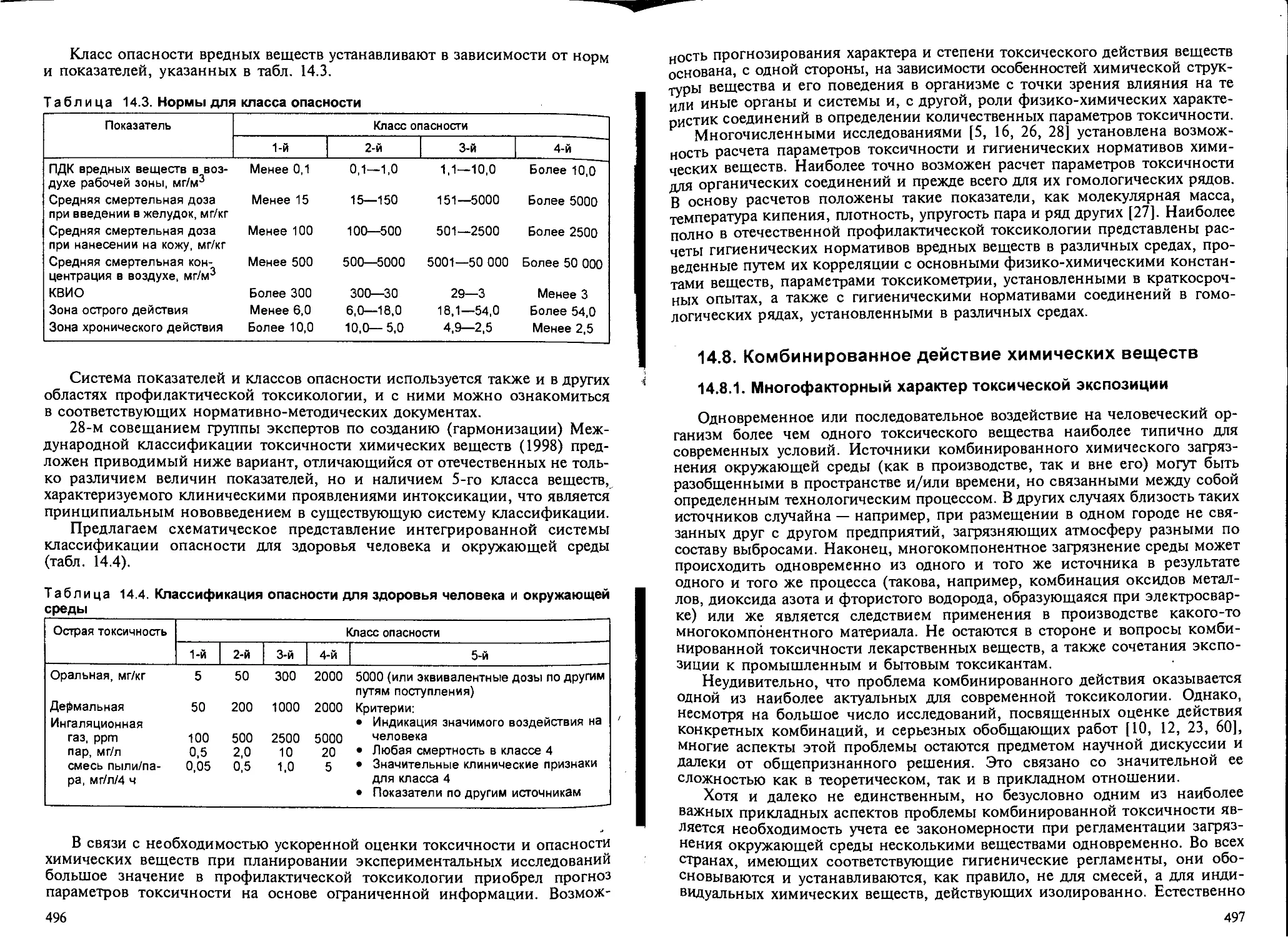
14.8.3. Токсикологический антагонизм............................. 503
14.8.4. Неоднозначность комбинированного действия................ 505
14.8.5. Механизмы комбинированного токсического действия......... 507
14.8.6. Сочетанное действие...................................... 512
14.8.7. Комплексное действие химических веществ.................. 516
Глава 15. Методология оценки риска и некоторые проблемы ее применения в
условиях России. — Б.А.Кацнельсон, Л.И.Привалова, С.В.Кузьмин......... 521
15.1. Характеристика проблемы и основные понятия...................... 521
15.2. Общее описание методологии оценки риска......................... 523
15.2.1. Идентификация вредного фактора (факторов)............... 524
15.2.2. Оценка экспозиций....................................... 526
15.2.3. Оценка зависимости доза — ответ......................... 529
15.2.4. Характеристика риска (“risk characterization”).......... 538
15.2.5. Связь между оценкой риска и управлением им.............. 540
Глава 16. Основы экологической токсикологии. — В.С.Безель............. 545
16.1. Предмет, цель, задачи........................................... 545
16.2. Надорганизменный характер зависимости доза —эффект.............. 547
16.2.1. Содержание токсичных веществ в компонентах биоты — важней-
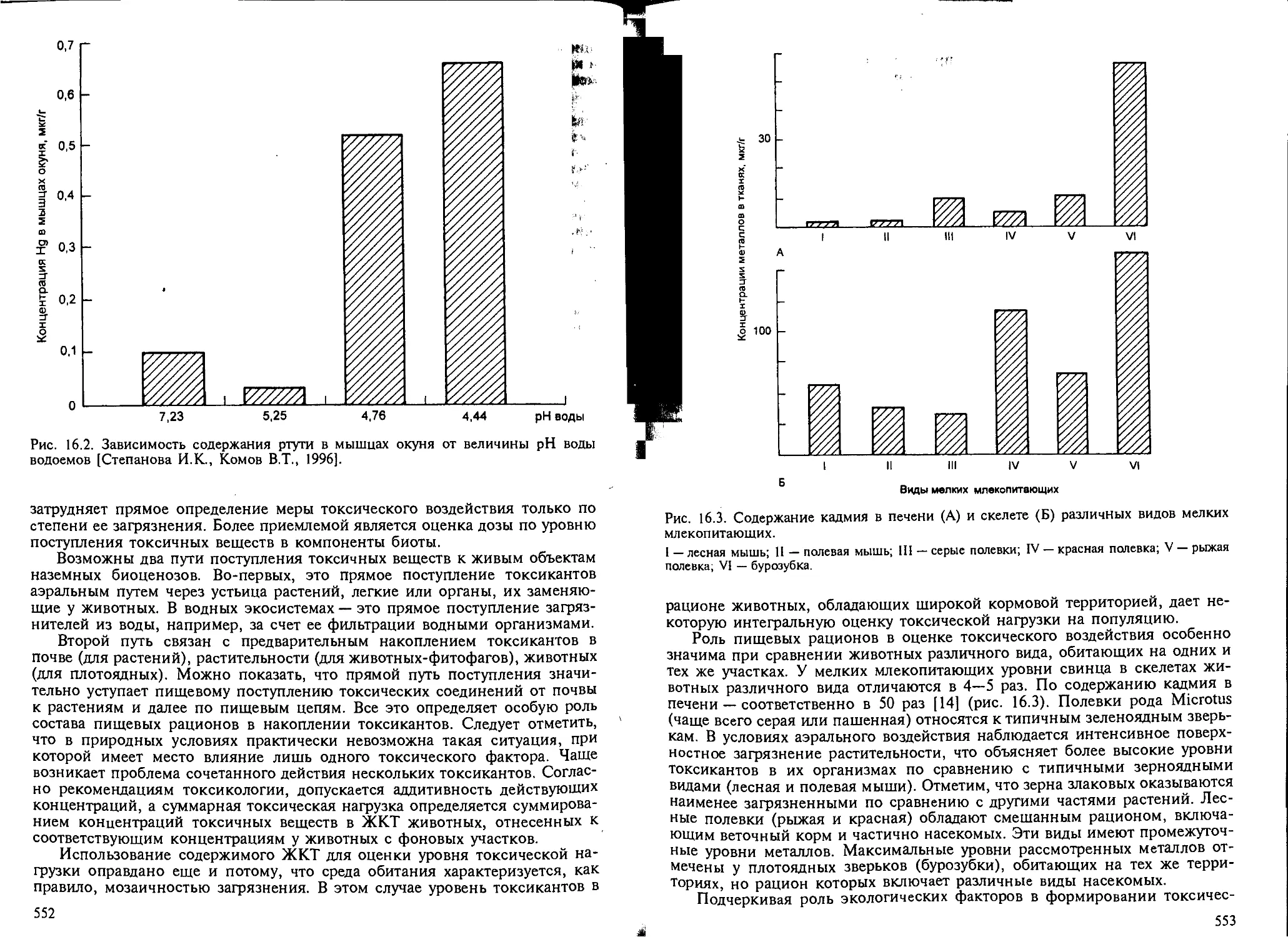
ший экотоксикологический показатель меры токсической нагрузки 550
16.2.2. Реакция экологических систем на загрязнение среды обитания
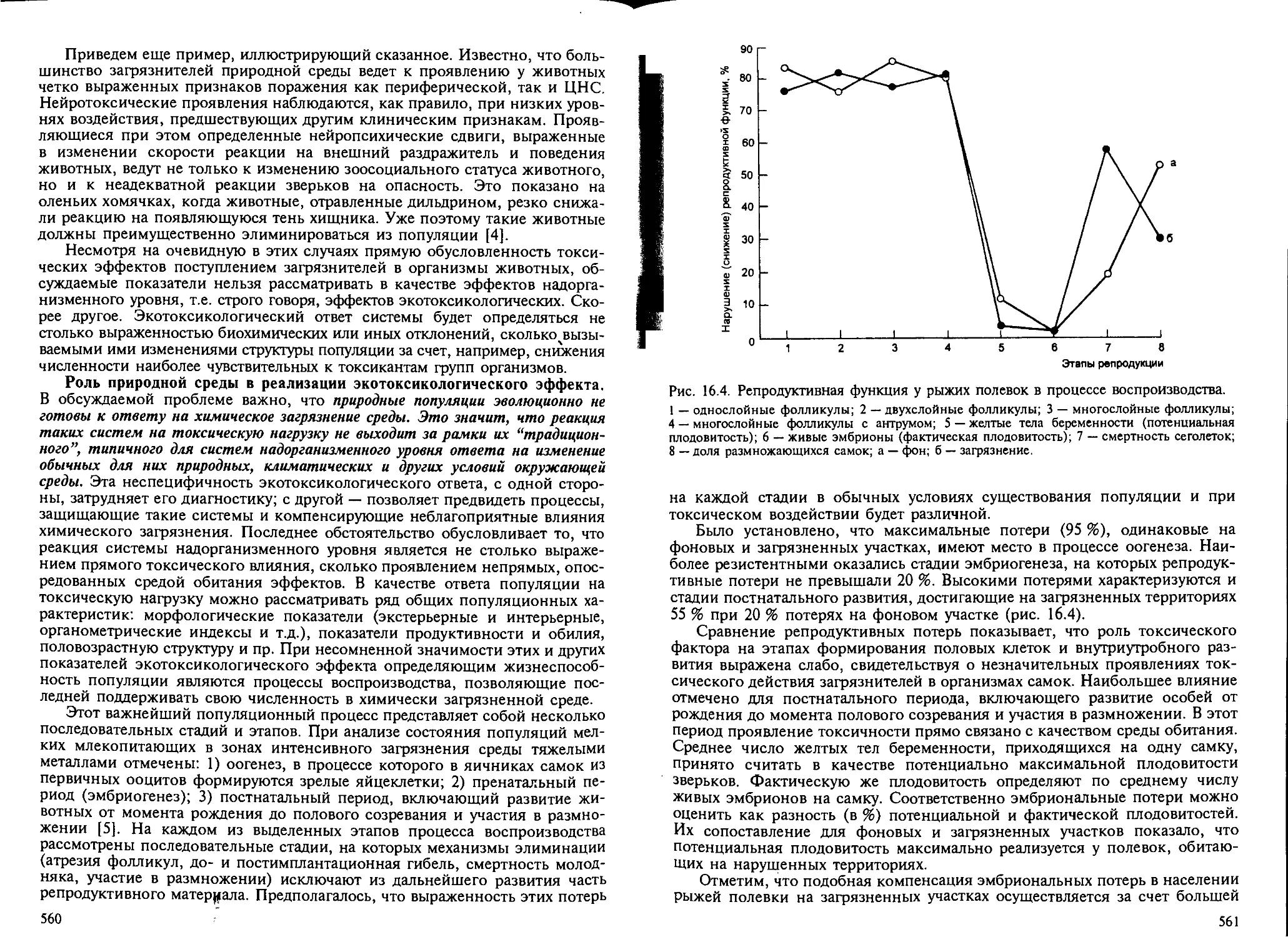
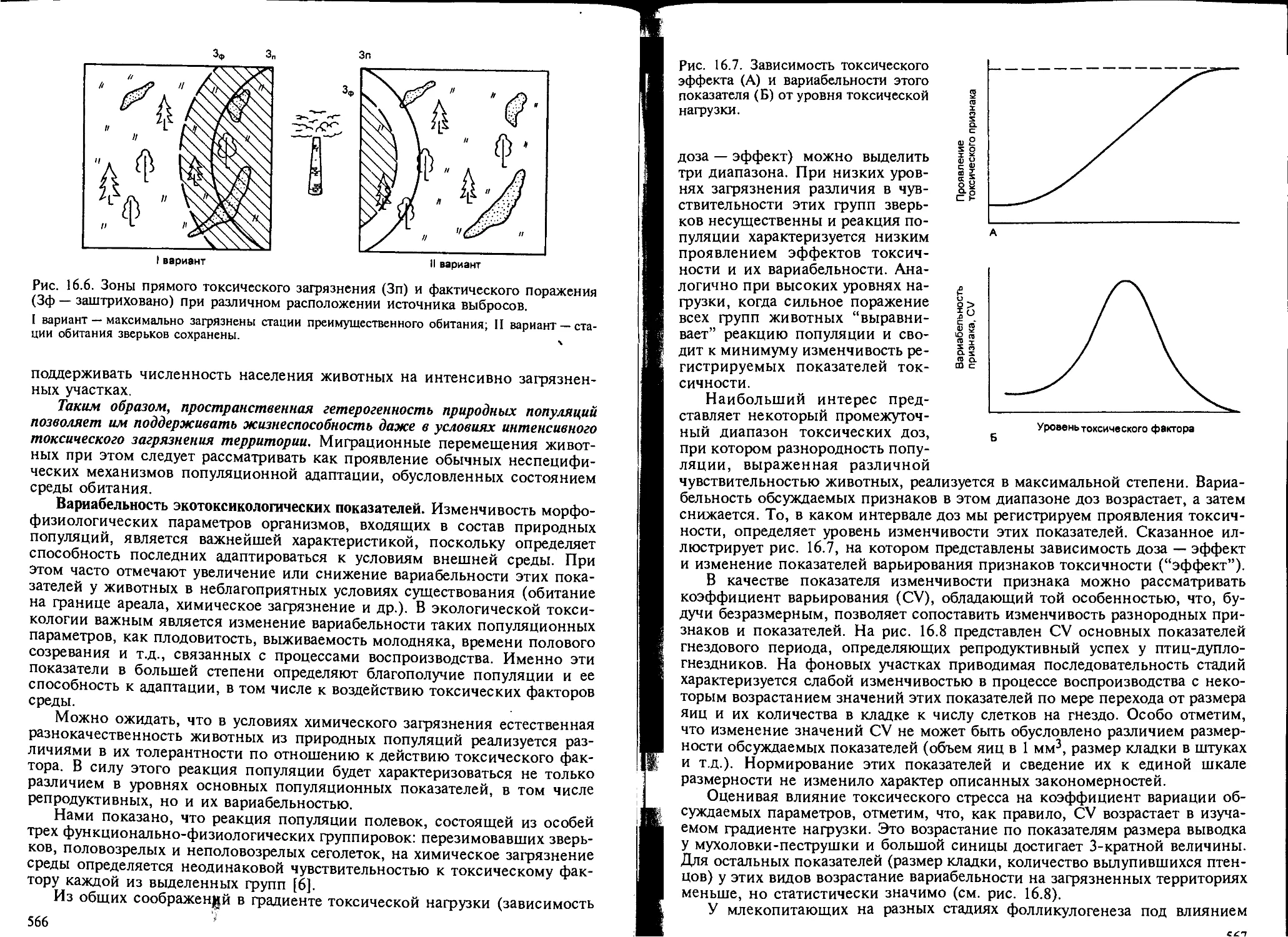
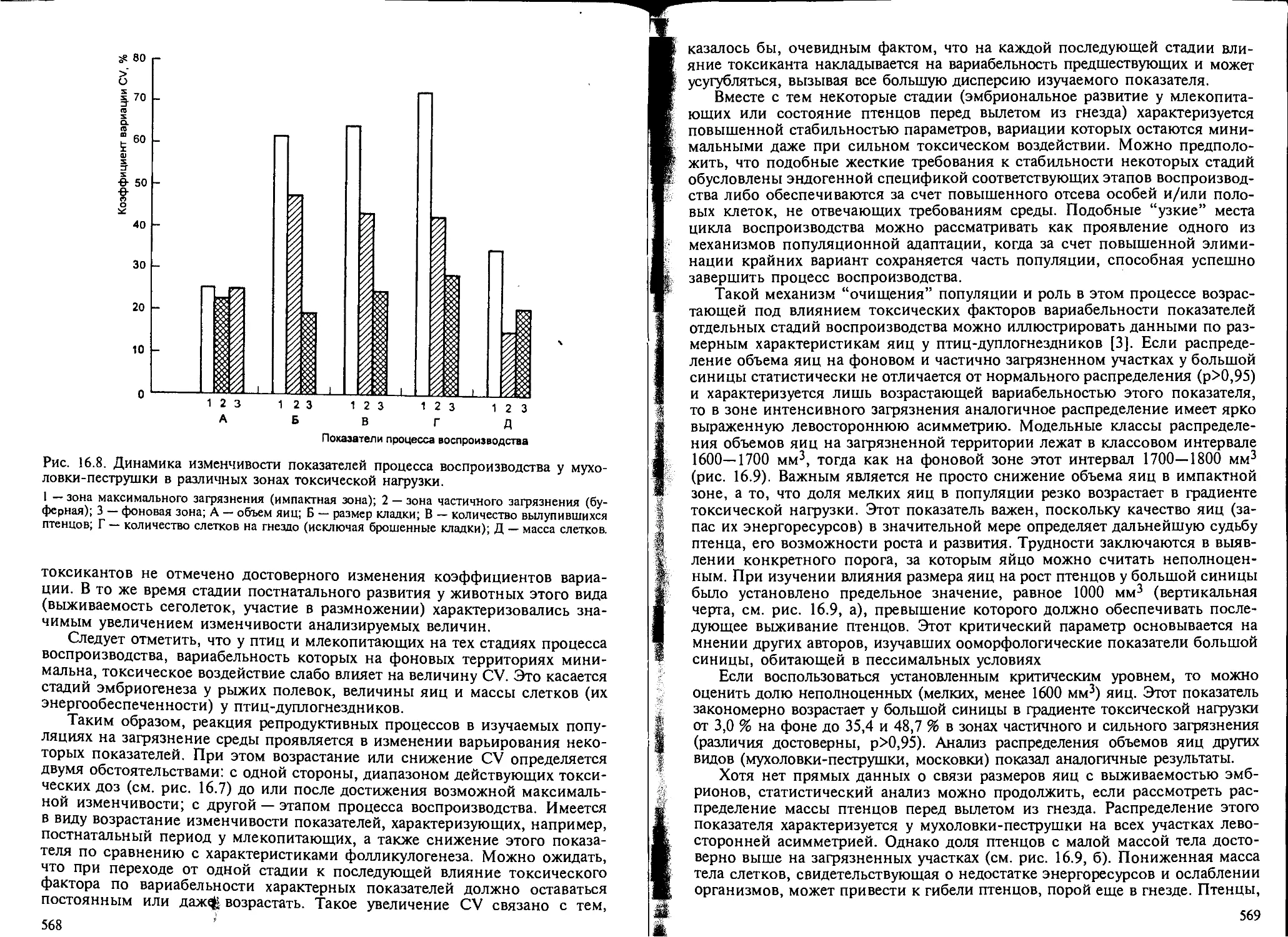
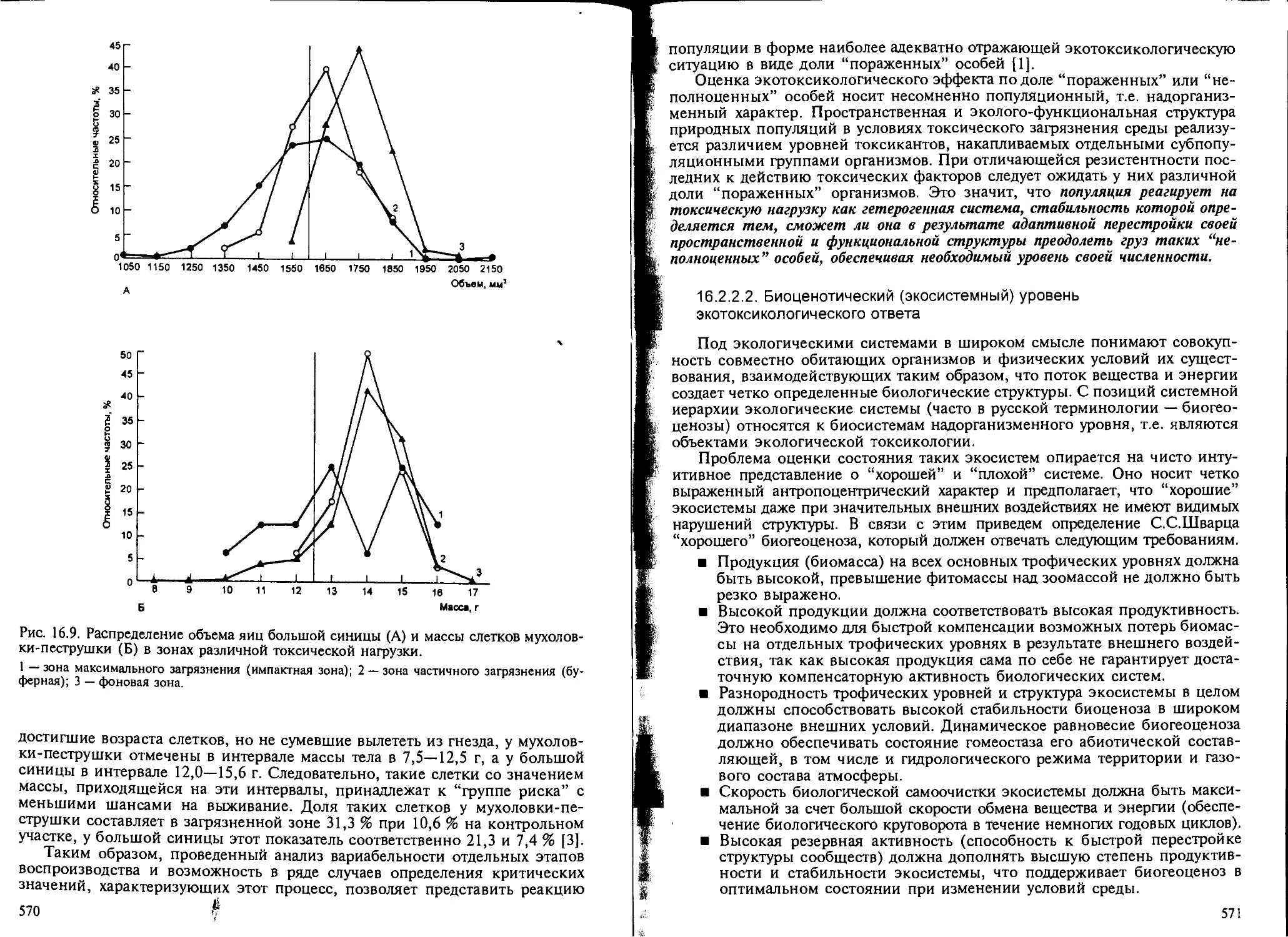
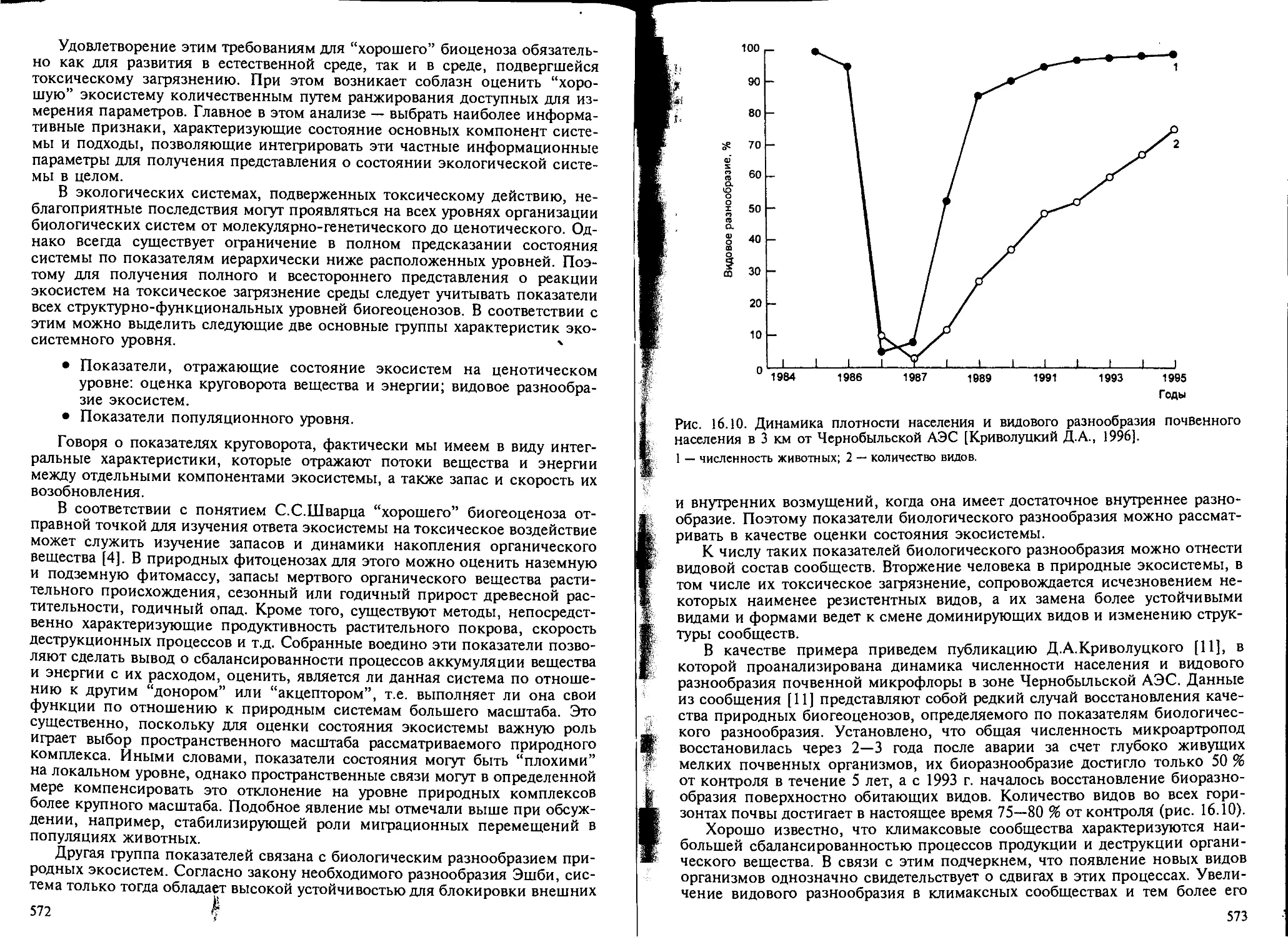
как показатель экотоксикологического эффекта..................... 558
16.3. Проблема адаптации в экологической токсикологии................. 576
16.4. Проблемы экологического нормирования............................ 579
8
Глава 17. Общие принципы диагностики и лечения острых отравлений. —
Е.А.Лужников......................................................... 587
17.1. Распространенность острых отравлений и их причины............. 587
17 2. Клиническая картина и диагностика острых отравлений............ 588
173. Лечение острых отравлений....................................... 589
173.1. Стимуляция естественной детоксикации..................... 590
173.2. Методы искусственной детоксикации........................ 592
17.3.3. Специфическая (антидотная) фармакотерапия............... 593
17.3.4. Симптоматическая фармакотерапия......................... 594
17.4. Основные виды острых отравлений................................ 596
17.4.1. Лекарственные отравления................................ 596
17.4.2. Отравления алкоголем и его суррогатами.................. 598
17.4.3. Отравления прижигающими жидкостями...................... 599
17.4.4. Отравления фосфорорганическими инсектицидами............ 600
17.4.5. Отравления угарным газом................................ 601
Предметный указатель................................................. 602
Предисловие
Проблема химической безопасности приобрела сегодня всемирное зна-
чение для судеб человечества, опередив в этом отношении такой, безусловно
приоритетный фактор, как радиационный. Многообразие химических ве-
ществ, обращающихся в среде обитания, различие их химической структуры
и физико-химических свойств, трудности управления риском химических
воздействий превратили химические соединения в реальную угрозу выжи-
вания человека и живой природы. Сегодня глобальная проблема химической
опасности изложена в таких авторитетных документах, как “Программа
действий, Повестка дня на XXI в.” (Рио-де-Жанейро, 1992 г.) и решение
“3-го Всемирного межправительственного форума по химической безопас-
ности” (Сальвадор да Байя, 2000 г.), определившими основную тенденцию
конца ЮС — начала XXI вв. как интеграцию международных усилий в со-
здании единой системы химической безопасности. В этих же документах
обращено внимание на важнейшее значение токсикологического изучения
химических веществ, особенностей их действия, а также профилактики и
лечения отравлений.
Химическим веществам с их структурным разнообразием присущи пре-
дельно разнообразные формы воздействия на живые организмы: от возник-
новения тяжелых соматических заболеваний и неспецифических изменений
реактивности до влияния на наследственные свойства и систему воспроиз-
водства. Присутствие химических веществ практически во всей среде оби-
тания и в самых различных количествах неизбежно ставит во главу угла
изучение общих закономерностей взаимодействия организма человека и
токсического фактора.
Сегодня в мировой литературе опубликовано много материалов по во-
просу действия химических веществ на живые организмы. Выпущены фун-
даментальные издания, посвященные как общим, так и частным вопросам
токсикологии.
В нашей стране в силу ряда объективных причин и научных традиций,
токсикологические исследования, а соответственно и научные издания до
сих пор были только по отдельным разделам токсикологической науки и
практики.
До настоящего времени в стране отсутствовало фундаментальное токси-
кологическое руководство, обобщающее все основные разделы токсиколо-
гии, объединенные на основе обобщающего анализа токсических свойств
веществ, механизмов их токсического действия, отдаленных последствий
интоксикации, а также клиники и лечения отравлений. Поэтому авторы
настоящего руководства исходили из необходимости представления мате-
риала на основе анализа действия вещества в организме, исходя из свойств,
присущих ему как структурной единице, а также в зависимости от его
количества и путей поступления в организм.
Такое построение монографии позволило подробно рассмотреть влияние
основных групп веществ, сходных и различных по механизму токсического
действия, на всех количественных и временных уровнях: от острых инток-
сикаций до изменений реактивности организма, связанных с длительным
воздействием малых количеств токсикантов. В книге подробно представлено
10
действие веществ в организме, их токсикокинетика, описаны токсические
эффекты и механизмы их возникновения, а также особенности воздействия
на отдельные органы и системы. Рассмотрены современные воззрения на
проблемы химического мутагенеза, канцеро- и тератогенеза, влияние на
иммунную систему, систему крови и т.д.
Учитывая важность профилактики химических воздействий, в книге
изложены основные понятия и принципы экологической и профилактичес-
кой токсикологии, методика оценки риска. Определены основные принци-
пы клинической токсикологии. Широко представлена литература по всем
основным разделам токсикологии.
Редакторы и авторский коллектив (а это ведущие специалисты России
и Украины в области токсикологии) надеются, что предлагаемое “Руковод-
ство по общей токсикологии” представит интерес и принесет большую
пользу широкому кругу специалистов, работающих как в области токсико-
логии, так и в области других смежных дисциплин, связанных с проблемами
химической безопасности.
Б. А. Курляндский, В. А. Филов
Глава 1
ВВЕДЕНИЕ В ТОКСИКОЛОГИЮ
1.1. Определение и основные понятия.
Предмет, задачи и методы токсикологии
Токсикологию (от греч. слов toxikon — яд, в который погружают нако-
нечники стрел, toxikos — лук и logos — слово, понятие, учение) обычно
определяют как науку о законах (закономерностях) взаимодействия токсичных
химических веществ (ядов) и живых организмов.
Будучи достаточно общим, это определение не отражает в должной мере
предмет токсикологии, совокупность ее современных направлений и задач,
пространство исследований и практического использования полученных
результатов, границы и соотношения с другими науками, а следовательно,
нуждается в уточнении и обсуждении. Свидетельством справедливости ска-
занного может, в частности, служить тот факт, что фармакологи традици-
онно считают фармакологию наукой “о взаимодействии химических соеди-
нений с живыми организмами” [30]. Шмидеберг в конце прошлого столетия
определял фармакологию как учение об изменениях в живом организме под
влиянием химически действующих веществ. Н.П.Кравков называл фарма-
кологию учением “о действии на организм вообще всех веществ, способных
в той или другой степени растворяться в нем и всасываться” [11].
Столь близкие, если не идентичные, толкования предмета токсикологии
и фармакологии проистекают оттого, что существуют серьезные трудности
в строго научном определении понятия яд (токсичное химическое вещест-
во). Прежде всего потому, что яд — категория количественная.
Крупнейший ученый эпохи Ренессанса Парацельс (1493—1541), впервые
поставивший на научную основу проблему “доза — эффект” и определив-
ший химическую природу ядов, так сформулировал свое третье правило:
“Что является и что не является ядом? Все вещества являются ядами и не
бывает веществ без ядовитости. Только доза определяет ядовитость” [32].
Действительно, для огромного числа веществ типично токсическое действие
в высоких дозах, но они относительно безвредны в низких. Например,
винилхлорид обладает сильной гепатотоксичностью в больших дозах, явля-
ется канцерогеном и ангиотоксикантом при длительном воздействии в
малых [12]. Хрестоматийны примеры с кислородом и некоторыми металла-
ми. Без кислорода, как известно, невозможна жизнь. Тем не менее при
высоком парциальном давлении во вдыхаемом воздухе кислород обладает
мощным пульмонотоксическим действием. Микроэлементы — железо, медь,
магний, марганец, кобальт, кадмий и др. — являются жизненно необходи-
мыми. При недостаточном поступлении с пищей развивается их дефицит в
организме, что отражается, в частности, на активности целого ряда фермен-
тов. В больших дозах металлы проявляют сильное токсическое действие:
кадмий, например, избирательно повреждает гонады.
Эффекты большинства лекарственных средств, несмотря на достаточную
терапевтическую широту, также обнаруживают отмеченную тенденцию. Ат-
ропин в количестве 1—2 мг на прием широко употребляется как лекарст-
12
венный препарат. Начиная с 5 мг pro dosi, у человека выявляются заметные
побочные эффекты. После приема 15—20 мг и более доминируют грубые
расстройства психической сферы. В дозе 100—200 мг атропин вызывает
коматозное состояние. При увеличении дозы до 0,5 г препарат становится
опасным для жизни.
Следовательно, химические вещества при воздействии на организм в
определенных дозах проявляют токсичность — внутренне присущую химичес-
кому веществу способность оказывать вредное действие, которое проявляется
только при взаимодействии вещества с живыми организмами. Токсичность —
понятие количественное, при этом измерению подлежат биологический
эффект, формирующийся в результате химической агрессии, и доза (кон-
центрация), в которой тот или иной химический агент вызывает различной
выраженности повреждения. Наиболее объективна оценка токсичности по
смертельному эффекту [23].
Оценка токсичности химических веществ — очень непростая задача.
Токсичность зависит от пути проникновения ядов в организм, возраста,
пола, состояния организма, условий его обитания и большого числа других
факторов. Она может быть острой и хронической. Разработка принципов и
адекватных методов измерения токсичности входит в задачи целого раздела
токсикологии — токсикометрии. Токсикометрия представляет собой совокуп-
ность, систему принципов, методов и приемов оценки токсичности и опаснос-
ти химических веществ [10]. При этом под опасностью понимают вероят-
ность проявления химическим веществом своих токсических свойств в оп-
ределенных условиях.
Наконец, понятие яда имеет и качественный аспект, так как одно и то
же химическое вещество может быть очень токсичным для одних видов и
нетоксичным для других. Например, четыреххлористый углерод обладает
сильнейшим гепатотоксическим действием для многих видов животных, но
к нему относительно малочувствительны куры и почти невосприимчивы
некоторые линии кроликов [33]. Еще более впечатляют различия в чувст-
вительности некоторых видов животных к 2,3,7,8-тетрахлордибензо-р-диок-
сину (ТХДД, диоксин). По тесту инволюции тимуса токсичность диоксина
для морских свинок составляет 0,04 мкг/кг, а для хомяков — 500 мкг/кг.
Заметим, что избирательность токсического действия химических аген-
тов лежит в основе изыскания пестицидов, инсектицидов, противоопухоле-
вых, противопаразитарных и других средств [2].
В современном понимании яд — это химическое вещество, которое в
соприкосновении с живыми организмами в определенных условиях среды обита-
ния и в определенном количестве способно оказывать повреждающее влияние
на живые организмы, вплоть до гибели.
В современной научной литературе в качестве синонима слова яд часто
употребляется слово ксенобиотик (от греч. xenos — чужой и bios — жизнь,
т-е. чуждый организму).
В соответствии с этим предметом исследования в токсикологии являются
яды (токсичные химические вещества), механизмы их токсического дейст-
вия на биологические системы различных уровней их организации (от
молекулярного до надорганизменного, популяционного) и те патологичес-
кие состояния, которые формируются в живых организмах в результате
взаимодействия с токсичными химическими веществами.
Задачи токсикологии как науки проистекают из опасности химических
веществ. В конечном счете они сводятся к накоплению знаний и понима-
нию закономерностей, которые определяют токсичность и опасность хими-
13
ческих веществ для индивидуумов и их сообществ с тем, чтобы оценивать
(прогнозировать) опасность и управлять ею. Прогнозирование и понимание
сущности химической опасности обеспечивает создание научных основ раз-
работки способов и средств профилактики токсических воздействий, мето-
дов диагностики и лечения заболеваний, обусловленных токсичными хими-
ческими веществами.
Область исследований в токсикологии обширна. В сфере ее интересов
находятся животные и растения различных видов, человек. Этим объясня-
ется, что токсикология — одновременно и биологическая, и медицинская
наука. В ней выделяют ряд хорошо очерченных, но тесно связанных между
собою направлений.
Прежде всего это теоретическая, фундаментальная токсикология. Главные
ее задачи — выяснение механизмов биологической активности токсичных
химических веществ; установление связи между токсичностью, опасностью
и химическим строением, физико-химическими свойствами ядов; познание
закономерностей взаимодействия токсичных химических веществ и живых
организмов, т.е. хемобиокинетики (токсикокинетики) и токсикодинамики
ядов. Хемобиокинетика — раздел токсикологии о путях поступления, механиз-
мах всасывания, распределения, биотрансформации в организме и выведения
токсичных химических веществ. Основное содержание токсикодинамики со-
ставляют биологические реакции организма в ответ на воздействие яда.
В теоретической токсикологии разрабатывают экспериментальные моде-
ли патологических состояний и процессов, развивающихся в результате
воздействия ядов; обосновываются методы экстраполяции эксперименталь-
ных данных на человека. При этом решающее значение приобретает изуче-
ние механизмов видовой чувствительности животных к ядам.
Методы, которые применяются в экспериментальной токсикологии, раз-
нообразны и определяются объектом изучения и задачами эксперимента.
Так, при исследовании механизмов действия ядов широко используются
биохимические методы (биохимическая токсикология). Они охватывают мо-
лекулярный уровень, взаимодействие ядов с рецепторами, ферментами, в
том числе с ферментами биотрансформации химических веществ, с другими
макромолекулами. Клеточный уровень требует привлечения широкого
спектра морфологических методик. В тех случаях, когда объектом изучения
является нервная система, возникает необходимость в нейрофизиологичес-
ких и нейрохимических методах. Исследование физиологических реакций
или патологических процессов на органном или организменном уровнях
осуществляется с помощью физиологических методов. Среди них особая
роль принадлежит поведенческим тестам (поведенческая токсикология). С
их помощью оценивается влияние токсикантов на поведение животных и
человека. Поведение, как известно, является интегральным показателем
состояния периферической и центральной нервной системы, а также орга-
низма в целом. Изменение различных форм поведения дает ценную инфор-
мацию о тропности химического воздействия, о возможных нарушениях
высших регуляторных функций. Методы поведенческой токсикологии ши-
роко используются в хроническом эксперименте при оценке эффектов ток-
сикантов в малых дозах, а также при изучении отдаленных последствий
перенесенной интоксикации.
В экспериментальной токсикологии существуют и собственные, токси-
кологические методы и приемы. Они незаменимы при создании моделей
патологических состояний, вызванных химическими токсикантами, и осо-
бенно в токсикометрии. Параметры токсикометрии служат количественны-
14
ми рамками патогенеза отравления (интоксикации). В любом токсикологи-
ческом эксперименте объектом исследования служит то или иное патоло-
гическое состояние, созданное целенаправленно путем строго количествен-
ного воздействия. Экспериментальная модель будет тем ближе к замыслу
исследования, чем строже и полнее соблюдается “токсикологическое обрам-
ление” эксперимента: адекватны доза, путь (накожный, ингаляционный,
пероральный и др.) введения, скорость поступления яда и т.д.
Не будет преувеличением утверждение, что токсикометрия имеет клю-
чевое значение для всей токсикологии, для всех ее направлений и разделов.
Количественные критерии токсичности будут предметом анализа в одной
из последующих глав, поэтому здесь уместно лишь упоминание основных
методов и приемов, отличающих токсикометрию. Среди них химико-анали-
тические методы, предназначенные для идентификации и определения ток-
сичных химических веществ в окружающей среде (например, контроль кон-
центраций ядов в камерах для ингаляционных затравок) и в биологическом
материале. Следует также отметить многообразный арсенал токсикологичес-
ких тестов — от исследования острой и хронической токсичности на живот-
ных до оценки генотоксичности с использованием технологии клеточных
культур (так называемые альтернативные методы в токсикологии). Все воз-
растающее значение придается методам изучения патогенеза интоксикации
на субклеточном, клеточном, тканевом и органном уровнях. Наконец, ме-
тоды биометрии и статистики. С их помощью осуществляется анализ полу-
ченной информации, дается количественная характеристика опасности хи-
мических веществ, разрабатываются математические прогностические мо-
дели.
Как уже отмечалось, токсикометрия составляет методологический фун-
дамент всей токсикологии, но особый смысл и значение она приобретает в
профилактической токсикологии. Профилактическая (гигиеническая) токсико-
логия изучает токсичные химические факторы окружающей среды, обосновы-
вает размеры допустимой “химической нагрузки” на человека, разрабатывает
способы медицинской профилактики токсических воздействий в реальных ус-
ловиях жизнедеятельности людей. Присутствие токсичных химических ве-
ществ в той или иной среде обитания человека (жилище, производственная
сфера, пищевые продукты, лекарства и т.д.) позволяет подразделить профи-
лактическую токсикологию на коммунальную, промышленную, сельскохо-
зяйственную, корабельную, пищевую, лекарственную и т.д.
При прогнозе и оценке опасности химических соединений используются
те же методические приемы, которые уже обсуждались при характеристике
теоретической токсикологии и токсикометрии. Для прогнозирования воз-
можности развития отдаленных эффектов хронического действия токсичных
химических веществ в малых дозах применяются иммунологические тесты,
а также методы оценки мута-, канцеро- и тератогенеза, и эмбриотоксичнос-
ти. Заметим, что изучение репродуктивной функции — высокоэффективный
способ выявления “химического неблагополучия” в окружающей человека
сРеде. На субпопуляционном уровне большую пользу приносят эпидемио-
логические исследования заболеваний, имеющих химическую этиологию.
В качестве следующего направления назовем клиническую токсикологию.
Клиническая токсикология изучает острые и хронические заболевания, вызван-
ные токсичными химическими веществами, с целью научного обоснования
методов диагностики, профилактики и терапии отравлений. В связи с этим
задачи в клинической токсикологии подразделяют на диагностические, ле-
чебные и профилактические [18]. Их решение достигается посредством
15
клинических, инструментальных и лабораторных методов обследования
больных. Широко используются методы аналитической химии (методы га-
зовой, жидкостной хроматографии, хромато-, масс-спектрометрии и др.) для
идентификации химических веществ в биосредах (в крови, моче, лимфе и
т.д.).
В последние два десятилетия стремительно формируется новое направ-
ление в токсикологии — экологическая токсикология. Это научное направле-
ние на стыке экологии и токсикологии изучает токсические эффекты хими-
ческих веществ на живые организмы, преимущественно на популяции организ-
мов и биоценозы, входящие в состав экосистем. Экологическая токсикология
изучает источник поступления вредных веществ в окружающую среду, их
распространение в окружающей среде, действие на живые организмы. Человек,
несомненно, является наивысшей ступенью в ряду биологических мишеней [3].
Предметом экологической токсикологии являются надорганизменные
системы в условиях химической нагрузки антропогенного происхождения.
Экологическая токсикология оценивает потенциальную опасность контакта
популяций живых организмов с вредными химическими веществами, чуже-
родными для организма (ксенобиотики) или жизненно необходимыми для
него (эндогенные), но поступающими в избыточном количестве, и обосно-
вывает меры профилактики губительных последствий такого контакта для
животных, растений и человека. Существенно, что экологическая токсико-
логия рассматривает первичные токсические эффекты ксенобиотиков на
молекулярно-генетическом, клеточном, органном уровнях в качестве пуско-
вых механизмов нарушений биологических систем на популяционном уров-
не. Это не только сближает концептуально классическую профилактическую
(гигиеническую) токсикологию с экологической токсикологией, но и дает
последней основание для использования ее методологических принципов и
приемов гигиенического нормирования химической опасности. Вместе с тем
специфика предмета экологической токсикологии предопределяет своеобра-
зие ее методических подходов, позволяющих в конечном счете давать ко-
личественную оценку наносимого экосистемам ущерба в результате хими-
ческой агрессии. Более подробно проблемы токсикологии изложены в
главе 16.
Завершая рассмотрение современных направлений токсикологии, нужно
отметить также некоторые достаточно обособленные ее разделы, такие,
например, как токсикология военная, судебная и ветеринарная. Будучи ее
прикладными разделами, они различаются спецификой предмета и своими
задачами. Так, военная токсикология изучает токсичные химические веще-
ства, характерные для военного труда мирного и военного времени, меха-
низмы их токсического действия на организм человека и формирующиеся
патологические состояния с целью изыскания наиболее эффективных спо-
собов и средств профилактики и терапии отравлений. Она широко исполь-
зует методы и достижения экспериментальной, профилактической и клини-
ческой токсикологии.
Судебная токсикология является неотъемлемой частью судебной меди-
цины, и ее главная задача состоит в экспертизе отравлений. Для этого
применяются методы судебной химии, клинической токсикологии и пато-
логической анатомии.
Ветеринарная токсикология, помимо прикладного значения, имеет и
теоретический аспект, поскольку различные виды сельскохозяйственных
животных используются для моделирования отравлений и последующей
экстраполяции полученных данных на человека. Другое важное обстоятель-
16
ство заключается в том, что с помощью знаний ветеринарной токсикологии
можно получить дополнительную информацию о перемещении химических
токсикантов по пищевым цепям в организм человека.
Говоря о соотношении токсикологии с другими науками, следует указать
на первостепенное значение для нее химии, биохимии, физиологии, фар-
макологии, общей патологии, иммунологии, эпидемиологии, гигиены и
экологии. В свою очередь токсикология концептуально и методически су-
щественно обогащает гигиену, фармакологию, клиническую и судебную
медицину. Без нее немыслимы современное здравоохранение, общая пато-
логия и генетика. Фундаментальная токсикология привносит новые идеи в
экологию и перспективы в природоохранную деятельность человечества.
Рассмотрение теоретических и методологических основ современной
токсикологии свидетельствует об их единстве для всех ее направлений.
Краткий анализ предмета, задач, методов токсикологии дает возмож-
ность определить ее как науку о токсичных химических факторах среды
обитания живых организмов, о законах взаимодействия токсичных химических
веществ и живых организмов, определяющих потенциальную опасность хими-
ческих веществ для индивидуумов и их популяций, а также способы и средства
минимизации химической опасности, профилактики, диагностики и терапии
отравлений.
1.2 История становления токсикологии
Токсикология родилась, по-видимому, одновременно с медициной, по-
скольку человека всегда окружали ядовитые животные и растения. Древние
яды представляли собой вытяжки из растений, яды животных и некоторые
минералы. Они были окружены тайной, использовались для охоты, войн,
судебных наказаний и ритуальных обрядов. История ядов — это одна из
огромных глав человеческой истории, в которой удивительным образом
переплетены человеческие любознательность и гений (не всегда добрый),
научные открытия, многовековой опыт медицины и других естественных
наук и одновременно интриги, преступления, политика, личные трагедии
великих людей и простых смертных, войны, природные катастрофы и чу-
довищные химические аварии современности. Об этом, в частности, гово-
рится в увлекательной книге И.Д.Гадаскиной и Н.А.Толоконцева (1988).
Наиболее ранним документом, свидетельствующим о знаниях древних о
ядах, считают Эберский папирус, написанный примерно за 1500 лет до н.э.
[35]. Сегодня его рассматривают как самую раннюю фармакопею, дошедшую
из древности до наших дней. Она содержит сведения о некоторых ядах —
опии, мышьяке, аконите, циансодержащих гликозидах и др. Упоминается
также яд, получаемый из калабарских бобов (Physostigmine venenesa) и
используемый в то время для судебных наказаний (пыток). Поразительно,
что этот препарат — физостигмин (эзерин) входит и во все современные
фармакопеи в качестве лекарственного средства из класса обратимых инги-
биторов холинэстеразы, производных карбаминовой кислоты. Одновремен-
но он широко известен и как достаточно сильное ядовитое химическое
соединение.
Точно так же из далекой древности пришел к нам строфантин. Имеются
сведения, что доисторические охотники масаи, населявшие Кению несколь-
ко тысяч лет назад, использовали экстракт растения вида Strophantus для
смазывания дротиков и стрел, которыми они убивали животных на охоте и
своих врагов в различных столкновениях. Сведения о ядах содержатся во
17
1
многих древних книгах: в древнеиндийских текстах — Ведах (XII и IX сто-
летия до н.э.), в “Одиссее” Гомера (около 850 г. до н.э.), в сочинениях
Аристотеля (384—322 гг. до н.э.), Овидия (43 г. до н.э. — 18 г. н.э.) и др.
В древнекитайской медицине ядам придавалось огромное значение. Легенды
говорят о том, что император Шен-Нунгу прожил 140 лет и знал не менее
70 ядов и противоядий. Утверждают, что китайские императоры умирали,
выпив настойку из волшебных снадобьев, которые даровали им якобы вечную
жизнь.
Расцвет наук в Древней Греции в VII и VI вв. до н.э. коснулся и
медицины. Наиболее известна Косская школа, основателем которой был
Гиппократ (около 460—370 гг. до н.э.). Гиппократ отвергал яды как орудия
убийства. В творениях Гиппократа нет ни слова о ядах, их действиях, и это
потому, что отец медицины дал клятву не говорить о них, и это запретил
своим ученикам, что соблюдено Плинием и Галеном, которые говорят
только о противоядиях [6]. Клятва Гиппократа жива и сегодня. В части ядов
она звучит так: “Я не дам никому просимого у меня смертельного средства
и не покажу пути для подобных замыслов”.
Ученые древности знали немало о ядах. Знания они получали из наблю-
дений за случайными отравлениями, а также при преднамеренном воздей-
ствии ядами. В отличие от стран Востока в Древнем Риме и Древней Греции
яды часто использовались как орудия убийства осужденных. Так, древнегре-
ческий поэт и врач Никандр в поэме “Териака” описывает клиническую
картину отравлений различными ядами животного происхождения. В другом
своем поэтическом труде “Алексифармика” Никандр дает характеристику
растительным ядам, а также излагает способы терапии отравлений. В част-
ности, он рекомендовал вызывание рвоты, как весьма эффективный способ
оказания помощи при отравлениях. Рвоту он советовал вызывать питьем
подогретого льняного масла, раздражением глотки и пищевода с помощью
простых приспособлений, изготовленных из бумаги или перьев птиц. Мно-
гое из того, о чем сообщал Никандр, основано на его собственных экспе-
риментах на осужденных преступниках.
Значительно раньше Платон описал смерть своего учителя Сократа,
которую тот принял, выпив по решению Афинского суда (399 г. до н.э.)
жидкость, содержащую яд, по-видимому, цикуту. Цикуту получали из рас-
тений Conium maculatum, которое содержит алкалоид кониин — блокатор
передачи нервно-мышечного проведения.
В трактате “Материя медика” Диоскорид (40—80 гг. н.э.) — врач
Нерона — представил классификацию ядов (растительные, животные, ми-
нералы), которая имела практическое хождение среди врачей более 15 веков.
В трактате впервые излагались способы идентификации некоторых ядов.
Среди ядов-минералов в античных трактатах упоминаются ртуть, мы-
шьяк, свинец и др. Никандру, по-видимому, принадлежит заслуга первого
описания отравления свинцом. Как известно, в Древнем Риме свинец получил
широкое распространение в быту: из него изготовлялись водопроводные трубы,
сосуды для вина, посуда и т.д. Для улучшения качества в уже готовое вино
добавляли свинцовые пластинки. Свинец в то время был очень дорог и
доступен только богатым. Неудивительно, что хронические свинцовые отрав-
ления стали бичом древнеримской аристократии. Некоторые историки пола-
гают, что одной из причин падения Древнего Рима были массовые хрони-
ческие отравления свинцом. Древние римляне и греки хорошо знали об
опасности ртути. Именно поэтому, как сообщал Диоскорид, рудокопы
надевали маски, чтобы предохранить себя в шахтах от “ртутных паров” [6].
18
В Древнем Риме получило широкое распространение использование ядов
с криминальной целью. Римский диктатор Сулла в 81 г. до н.э. был вынуж-
ден издать специальный закон, предусматривавший наказание, вплоть до
смертной казни, виновных в преступном использовании ядов.
Широкую известность как отравители получили древнеримский импера-
тор Калигула, большой знаток ядов, экспериментировавший на рабах, и не
раз решавший политические разногласия со своими противниками посред-
ством ядов, и Локуста, использовавшая мышьяк для убийства императора
Клавдия по заказу его жены Агриппины, замыслившей привести к власти
своего сына Нерона, пасынка Клавдия. Позднее, теперь уже по заказу
Нерона, Локустой был убит Британник — родной сын Клавдия и, следова-
тельно, прямой наследник престола. Так, в неполные 17 лет Нерон стал
императором, а Локуста получила от него вознаграждение и право иметь
учеников. Императорский титул не принес, как известно, счастья Нерону.
В последующем он добровольно принял смерть от своего слуги, страшась
предстать перед римским сенатом, вынесшим ему смертный приговор.
Для истории токсикологии как медицинской науки важны не отравители
и содеянные преступления, а вызванная ими “эпидемия отравлений” и
необходимость изыскания противоядий. В то время родилась идея о неком
универсальном антидоте, способном защитить от большинства, если не от
всех, ядов.
До наших дней дошли многочисленные свидетельства фанатичного по-
иска такого средства. Приведем лишь некоторые из них. Весьма поучительна
история царя Митридата VI Понтийского. Панически опасаясь отравлений,
Митридат серьезно занимался токсикологией: изучал эффекты различных
ядов на людях, осужденных преступниках и невольниках, конструировал
противоядия и опять-таки испытывал их действие на обреченных. В итоге
он создал препарат, состоящий из более чем 36 компонентов и названный
в Римской фармакопее “митридатикум”. Препарат имел репутацию лучшего
в те годы антидота, способного предупредить действие таких ядов, как
аконитин, токсины змей, скорпионов, пауков и т.д. [35]. Митридат прини-
мал свой препарат каждый день и, по-видимому, приобрел со временем
весьма значимую толерантность к ядам. Такая устойчивость организма Мит-
ридата к отравлениям сыграла с ним злую шутку. В старости Митридат
пытался покончить жизнь самоубийством, приняв большую дозу яда, но
остался жив. Тогда он приказал солдату убить его мечом, что и было
исполнено. История Митридата, его экспериментов и противоядий была
описана Галеном в 3 книгах: “Антидоты I”, “Антидоты П”, “Териаки от-
равлений”. Заметим, кстати, что древние греки использовали термин “те-
риака” для обозначения вначале ядов животных, а затем — антидотов ядов
животного происхождения. “Алексифармикой” они долгие годы называли
способ терапии отравлений вызыванием рвоты. Гален сообщал и о других
териаках. Например, териак Андромаха, врача Нерона, содержал уже 73
ингредиента. Вследствие этого спектр его защитной активности был значи-
тельно шире, нежели у антидота Митридата. В опытах на животных Гален
получил объективные доказательства эффективности териака Андромаха.
В средние века и в период Ренессанса рецептура териака Андромаха была
Дополнена новыми компонентами, их число превысило 100. Поиск териаков
и их применение с целью профилактики и лечения отравлений использова-
лись в Европе до начала XVIII столетия, а в Турции — даже до начала XX в.
Более поздние, нежели у Галена, сведения о териаках и о различных методах
лечения отравлений были представлены в книге еврейского врача и фило-
19
1
софа Мозеса Моймонида (1135—1204). Его трактат о ядах и противоядиях
вышел на арабском языке в Кордове в 1198 г. и составил заметную веху в
истории токсикологии [5]. В нем изложен тысячелетний опыт лечения
отравлений, а также дано описание клинической картины интоксикации ранее
неизвестными ядами. В первой части трактата Моймонид приводит описание
отравлений ядами животного происхождения (укусы взбесившихся собак, ос,
змей, пауков, скорпионов и других животных). В клинической картине он
впервые различает нейро- и гематотоксические проявления интоксикации. Во
второй части трактата речь идет о минеральных и растительных ядах. Харак-
теризуя, например, отравление белладонной, Моймонид отмечает покрасне-
ние кожных покровов и своеобразное “возбуждение” больных. Среди лечебных
мероприятий автор особо выделял опорожнение желудка посредством рвоты,
вызываемой теплым молоком, растительным маслом и пр. Первостепенное
значение он придавал назначению териаков и митридатиков в качестве
средств неотложной помощи и в процессе последующего лечения [34].
Из античности в средние века и даже в более позднюю эпоху пришел
не только опыт успешного использования различных способов терапии
отравлений, но и опыт отравителей. Папа римский Александр VI и его
потомки, известное семейство Борджиа, печально прославились многочис-
ленными убийствами с использованием ядов. Александр VI был наказан
судьбой, выпив по ошибке отравленное вино, предназначавшееся для оче-
редной жертвы. Французская королева Екатерина Медичи (1519—1589) во-
шла в историю как королева-отравительница. Она освоила итальянскую
технику приготовления ядов и исследовала их действие на больных, нищих
и осужденных.
В конце XVII — начале XVIII вв. в Италии отравительница Тоффана,
проживавшая в Неаполе, отравила более 600 человек, главным образом с
помощью триоксида мышьяка. Тоффана в конце концов была осуждена и
казнена.
В царствование короля Франции Людовика XIV было несколько громких
дел отравительниц — маркизы де Бренвилье, мадам Ла Вуазен и др. В част-
ности, услугами Ла Вуазен пользовалась ближайшая фаворитка Людовика
XIV маркиза де Монтеспан. Деятельность отравительниц достигла такого
масштаба, что Людовик XIV издал специальный закон. В этом законе,
изданном в июле 1682 г., в частности, дается такое определение яда: “Все,
что может причинить скорую смерть или медленно разрушить здоровье
человека, если оно простое или сложное вещество, должно быть почитаемо
действительным ядом” [29]. Чтобы завершить историю о французских от-
равительницах, укажем, что маркиза де Бренвилье, мадам Ла Вуазен и их
сподвижницы были казнены, а маркиза де Монтеспан, мать восьми вне-
брачных детей Людовика XIV, отправлена в ссылку в Нидерланды.
Несмотря на большой объем сведений, ранняя токсикология была чисто
описательным, эмпирическим разделом медицины. Ее предпосылки как
науки были заложены Парацельсом (1493—1541). Уже упоминалось, что он
четко определил яды как химические вещества, а их эффекты как произ-
водное от использованной дозы. Парацельсу принадлежит честь установле-
ния связи заболеваний рудокопов, литейщиков с их профессиональной
деятельностью.
Современник Парацельса Агрикола (1494—1555) был одновременно и
врачом, и металлургом. В своем труде “О металлургии” он представил не
только детальную характеристику горного дела тех времен, но и уделил
немало внимания вопросам безопасности труда горняков.
20
Особое место в истории токсикологии принадлежит Рамаццини (1633—
1714). Его по праву считают основоположником профессиональной патоло-
гии. Всю свою жизнь он посвятил изучению условий труда ремесленников
самых различных специальностей. В 1700 г. он выпустил книгу “О болезни
ремесленников. Рассуждения”, в которой дал описание труда и болезней
работников почти 70 профессий.
В начале XIX в. наиболее крупной фигурой в токсикологии был М.П.Ор-
фила (1787—1853) — французский врач родом из Испании. Он был первым,
кто выделил токсикологию из фармакологии, клинической и судебной ме-
дицины, придав ей статус самостоятельной науки. В 27 лет М.П.Орфила
написал книгу “Трактат об отравлениях” (1814), которая выдержала пять
изданий. В 1824 г. в русском переводе вышла другая его работа “Средства
для спасения отравленных и мнимоумерших, с прибавлением приличных
способов узнавать яды, подделанные вина и различать истинную смерть от
кажущейся”. В своих трудах М.П.Орфила дал классификацию всех извест-
ных ядовитых веществ, представил описание клинической картины отрав-
лений выделенными им классами ядов, а также рекомендовал химические
методы идентификации ядов в биологическом материале. М.П.Орфила был
самым известным в Европе судебно-медицинским экспертом-токсикологом
и судебным химиком. После его трудов стало обязательным проведение
судебно-химического анализа для юридического подтверждения факта от-
равления. В современной литературе до сих пор приводится, как наиболее
удачное, данное М.П.Орфилой определение понятия яд: “Яд —такое веще-
ство, которое в малом количестве, будучи приведено в соприкосновение с
живым организмом, разрушает здоровье и уничтожает жизнь”.
Середину XIX в. можно определить как время начала формирования
современной токсикологии. Решающее влияние при этом принадлежало
успехам аналитической химии (аналитической токсикологии) и все больше
укреплявшемуся в теоретической медицине экспериментальному методу.
Именно в те годы появились фундаментальные исследования французских
ученых Франсуа Мажанди (1783—1855) и его ученика Клода Бернара (1783—
1878) по механизму действия стрихнина, цианидов, кураре, угарного газа и
других ядов. Ряд методов оценки некоторых физиологических функций, в
частности внешнего дыхания, нервно-мышечного проведения, предложен-
ных Клодом Бернаром, сохранялись в экспериментальной практике более
100 лет. Ему же принадлежит блестящая мысль о том, что токсичные
вещества могут служить прекрасным инструментом в физиологических ис-
следованиях. “Эти вещества можно рассматривать как истинные реактивы
на жизнь, которые разносятся потоком кровообращения во все точки орга-
низма, действуют на некоторые ткани, изолируют их и ведут к смерти,
причем механизм гибели указывает на физиологическую роль той ткани, на
которую они действуют... Это изучение представляет большой интерес с
точки зрения общей физиологии” [4]. В своих опытах с кураре К.Бернар
показал, что яд парализует произвольные мышцы, не влияя на проводимость
импульсов по двигательным нервам и не нарушая сократимость мышц. Тем
самым была выявлена особая чувствительность зоны мионеврального соеди-
нения к яду кураре. Эти наблюдения позднее послужили серьезным аргу-
ментом при становлении теории нейрохимической передачи возбуждения в
нервной системе.
Примерно в эти же годы происходило становление токсикологии и в
России. Принято считать, что преподавание токсикологии, как самостоя-
тельной научной дисциплины, начато Г.И.Блосфельдом (1798—1884) в Ка-
21
занском университете (с 1842 г.). Справедливости ради заметим, что в курсе
судебной медицины токсикологию к тому времени уже давно преподавали
в Военно-медицинской академии и на медицинском факультете Московско-
го университета.
Наиболее интенсивно отечественная токсикология развивалась в XIX в.
в Медико-хирургической (Военно-медицинской) академии (Санкт-Петер-
бург). Как и во всем мире, формирование токсикологии в России происхо-
дило в рамках судебной медицины. Так, например, в отечественном “На-
ставлении врачам при судебном осмотре и вскрытии мертвых тел” (1829)
содержались главы “Об исследовании отравлений” и “О противодействую-
щих средствах, употребляемых для открытия ядов”. Они были основаны на
работе профессора Военно-медицинской академии А.П.Нелюбина “Правила
для руководства судебного врача при исследовании отравлений с присово-
куплением судебно-медицинских таблиц о ядах”.
В первом отечественном руководстве по судебной медицине “Краткое
изложение судебной медицины для академического и практического упот-
ребления” (1832) проф. С.А.Громова (возглавлял кафедру судебной медици-
ны академии с 1806 по 1837 г.) вопросам токсикологии отведено значитель-
ное место. В руководстве дается классификация ядов, излагаются основные
проявления интоксикации мышьяком, опием, синильной кислотой, медным
и свинцовым составами и пр.; описываются способы обнаружения ядов.
Начало экспериментальной токсикологии в России связывают с именем
проф. Е.В.Пеликана, руководившего кафедрой судебной медицины в период
1852—1857 гг. Одним из первых он стал активно использовать эксперименты
на животных для изучения механизма действия ядов, в частности кураре и
стрихнина. В 1854 г. Е.В.Пеликан опубликовал работу “Опыт применения
современных физико-химических исследований к учению о ядах”, в которой
он дал определение понятию яд, представил классификацию ядов, охарак-
теризовал пути поступления ядов в организм, механизмы их действия, в том
числе механизмы “метаморфоз” ядов в организме человека. Широкую из-
вестность получили работы Е.В.Пеликана по токсикологии цианидов (1855),
нитроглицерина, кураре и др. В предисловии к “Руководству по токсиколо-
гии” Рабюто (изданного в переводе с французского в Санкт-Петербурге в
1878 г.) он писал: “У нас в России до начала 50-х годов строго научного
направления в токсикологии не существовало. Скромно зачавшись только
с этого времени при кафедре судебной медицины Медико-хирургической
академии, оно вскоре после того получило быстрое распространение и
развитие благодаря современному физиологическому принципу и методу,
которые были внесены в академию свежими силами в лице проф. И.М.Се-
ченова и С.П.Боткина. Под влиянием этой школы, кроме трудов чисто
физиологического и патологического значения, вышло всего более научно-
токсикологических самостоятельных исследований, приобретших извест-
ность во всем ученом мире. С того же времени у нас при всех университетах
возникли лаборатории или кабинеты, в которых под руководством профес-
соров производятся с успехом подобные исследования, внесшие уже также
свою долю научного материала в европейскую науку”. В приложении к
“Руководству...” Рабюто Е.В.Пеликан сделал краткий анализ наиболее зна-
чительных работ отечественных авторов по токсикологии. Е.В.Пеликан в
своей стране и за границей был признан лучшим токсикологом России
своего времени и вошел в историю науки как родоначальник отечественной
токсикологии.
Дальнейшее развитие токсикологического направления научных иссле-
22
лований связано с именем профессора И.М.Сорокина, возглавлявшего ка-
федру в период 1871 — 1891 гг. И.М.Сорокин имел в академии хорошо
оборудованную лабораторию, где проводил токсикологические исследова-
ния Исследования И.М.Сорокина выходили за рамки прикладных судебно-
медицинских интересов. Он изучал действие на организм животных соля-
нокислого морфия, стрихнина, цианистых соединений, фосфора и других
веществ. Ученики И.М.Сорокина исследовали механизм действия сулемы,
мышьяковистой кислоты, стрихнина и его производных, аконитина, кокаи-
на, хинина, бензина, колхицина и др.
’ Судебно-медицинская токсикология составляла главное направление на-
учных исследований и в период руководства кафедрой проф. Д.П.Косоро-
това (1898—1911). Д.П.Косоротовым был написан “Краткий учебник токси-
кологии”, который вобрал в себя достижения науки того времени и был
издан впервые в 1902 г., а повторно в 1911 г. Характеризуя токсикологию
как науку, Д.П.Косоротов писал: “Токсикология по буквальному смыслу
есть учение о ядах; по отношению же к медицинской практике это не вполне
верно. Если представить себе даже такое сочинение по токсикологии, ко-
торое рассматривало бы яды со всей полнотой и всесторонностью, то тогда
главнейшую и наиболее обширную часть составило бы рассмотрение не
самого яда, а тех расстройств в животном организме, функциональных и
анатомических, которые обусловливаются введением в него ядов”. И далее,
“... Токсикология не есть фармакология. Это ясно уже из исторического
развития этих наук. Наконец, одни и те же вещества рассматриваются с
совершенно различных точек зрения: в токсикологии с точки зрения вреда
для организма, а в фармакологии — пользы при болезнях”.
В конце XIX — начале XX вв. проблемы токсикологии были в сфере
внимания и специалистов других профилей. Профессора Н.П.Кравков,
И.С.Тарханов (автор монографии “О ядах в организме животных и человека
и о борьбе с ними”), ААЯрошевский внесли существенный вклад в ее
развитие.
В переиздававшемся 14 раз руководстве “Основы фармакологии”
Н.П.Кравков рассматривает токсикологические проблемы с позиций фар-
макологии: общие вопросы “поведения” ядов в организме (поступление,
фазы действия в организме; их превращение, выведение). Из частных во-
просов специально фиксируется внимание на характеристике ядовитых ци-
анистых соединений, парасимпатических и ганглионарных ядах, местно-
анестезирующих ядах. Н.П.Кравков внес огромный вклад в такие фунда-
ментальные проблемы, как связь между структурой, пространственной кон-
фигурацией химических веществ и их физиологической активностью, зави-
симость физиологических реакций от дозы (концентрации) вещества, ком-
бинированное действие химических соединений. Он занимался изучением
токсического действия кавказских бензинов.
В Москве на медицинском факультете университета во второй половине
XVII] в. большим успехом у преподавателей и студентов пользовался учеб-
ник французского профессора фармакологии и токсикологии С.П.Гальтье
(1858). В этом обстоятельном руководстве даются определения токсикологии
как науки и яда (“...это всякое тело, которое вследствие своего физико-ди-
намического местного действия и особливо всасывания может произвести
сложные или смертельные расстройства в органах и отправлениях”); при-
водятся сведения из истории токсикологии, классификация ядов, характе-
ристика отравлений различными классами химических веществ, способы
лечения, “предсказания” и “распознавания” отравлений; излагаются “судеб-
23
но-химические” и “судебно-медицинские, вопросы”; даются рекомендации
по составлению “токсикологических отношений и рапортов”, а также “ток-
сикологических заключений”.
Еще раньше — в 1815 г. — в Москве вышло руководство по токсикологии
Иосифа Франка, “главного врача при общественной больнице в Вене” [29].
Книга была издана по “определению Московского отделения Император-
ской медико-хирургической академии”. На родине автора, в Вене, книга
вышла еще в 1803 г. Для своего времени она отличалась высоким научным
уровнем. Как Франк, например, определяет яд? “Дать яду положительное
определение очень трудно... Яд есть такое тело, которое, действуя на чело-
века в малейшем количестве, подвергает его жизнь величайшей опасности;
хотя ядовитое вещество организмом не распространяется, ниже им усили-
вается”. Характеризуя отравления свинцом, отмечает, что его действию
“наиболее подвержены художники и мастеровые из-за употребления свин-
цовых составов”. “В металлическом состоянии свинец не оказывает особен-
ных действий, но в виде окислов, солей — ядовит.” “Легче предупредить
отравление свинцом, нежели его лечить”. В руководстве можно прочесть:
“Атмосфера служит растворяющим средством для многих веществ... В руд-
никах, после землетрясений и изрыгания огнедышащих гор, в рабочих
комнатах некоторых мастеровых и т.д. подымаются часто частицы разных
металлов, например мышьяка, свинца, ртути и т.п.; смешиваются с атмо-
сферой и делаются источником многоразличных ужасных болезней, непо-
средственным следствием коих может быть смерть”. А вот как И.Франк
излагал проблему “видовой чувствительности”. “Многие для человека ядо-
витые растения бывают жилищем и пищей насекомых; ни мышьяк, ни
сулема не удерживают различных жуков от наших съестных припасов и
собраний растений. В Понтийской области пчелы едят ядовитые растения
Azalea и приготовляют из нее мед, которым, как повествует Ксенофонт,
отравилась однажды целая греческая армия... Рыбы и пресмыкающиеся едят
многие растения, которые суть яд для человека. Так, например, некоторые
птицы любят семя омела и употребляют его без всякого вреда... Свиней
можно кормить ягодами красавки, лошади едят сухую траву волчьего корня
(aconitum)... Напротив, многие вещества, которые человеку ни мало не
вредны, или по крайней мере не действуют на него смертельно, суть яды
для прочих животных. Ртуть есть яд всех круглых глистов и вшей..., камфара
для всех малых насекомых; обыкновенная соль для водной ящерицы, бу-
зинные ягоды для цыплят, горький миндаль для большей части птиц, а
также для некоторых четвероногих...”
До середины XIX столетия токсикология была наукой описательной, но
“старые” авторы умели, согласитесь, преподносить свой предмет блестяще.
В начале XX в. на развитие токсикологии сильное влияние оказал рост
химической промышленности. Особенно интенсивно химическое производ-
ство развивалось в Германии. Так, стоимость произведенной в 1913 г.
химической продукции в Германии превышала таковую Франции, Англии
и Италии, вместе взятых. Немецкие химики были монополистами целых
химических отраслей, например производства красителей. Крупнейший
концерн “И.Г.Фарбен” одним из первых стал финансировать не только
прикладные, но и теоретические исследования в области химии. В лабора-
ториях концерна под руководством Ф.Габера был разработан способ связы-
вания атмосферного азота для получения аммиака и нитратов, используемых
в производстве красителей, взрывчатых веществ и других продуктов химии.
Ф.Габер был удостоен в 1918 г. Нобелевской премии. В истории наук
24
ф Габер известен и по другой причине: его называют “отцом” химического
оружия. Перед первой мировой войной он возглавил в концерне “И.Г.Фар-
бен” военно-химические исследования. Именно по предложению Ф.Габера
и при его непосредственном техническом руководстве состоялась первая
химическая атака немцев против англо-французских войск 22 апреля 1915 г.
около местечка Ипр в Бельгии. В последующем, союзники — Франция,
Англия, США и Россия — также стали использовать химические вещества
с военной целью. За 4 года войны — с 1915 по 1918 г. — в армиях воюющих
государств от химического оружия пострадало около 1,3 млн человек, из
которых более 100 тыс. погибло.
Для истории науки существенно, что военная токсикология, параллельно
военной химии, стремительно прогрессировала со времен первой мировой
войны в течение более 70 лет и немало способствовала развитию всех
направлений классической токсикологии: теоретической (фундаменталь-
ной), профилактической и клинической.
Реакция отечественных токсикологов на применение немцами “удушли-
вых газов” была вынужденной и быстрой. В Петрограде создается Военно-
химический комитет, в состав которого входил газовый отдел, предназна-
ченный для координации научных исследований по разработке средств
противохимической защиты. Руководителем отдела был профессор Военно-
медицинской академии Г.В.Хлопин. В Москве аналогичные задачи решала
Физико-химическая лаборатория земского и городского союзов. К работе
были привлечены крупнейшие специалисты. Интересно, что в Петрограде
закладывались тогда все основные направления современной военной ток-
сикологии. Вопросы санитарно-химической защиты, содержание которых
по преимуществу было профилактическим, решались под руководством
Г.В.Хлопина, заведовавшего кафедрой гигиены Военно-медицинской акаде-
мии. Механизм действия отравляющих веществ (хлора, фосгена, иприта и
др.) и патогенез интоксикации изучались на кафедрах фармакологии Воен-
но-медицинской академии и Женского медицинского (1-го медицинского)
института. Кафедры возглавлялись соответственно Н.П.Кравковым и
А.А.Лихачевым, к тому времени уже известными в России фармакологами:
Н.П.Кравков руководил кафедрой с 1899 г., а А.А.Лихачев — с 1900 г.
Клиника, лечение поражений боевыми отравляющими веществами стали
уделом клиницистов, в основном терапевтов. Наиболее яркой фигурой здесь
был В.И.Глинчиков — профессор Военно-медицинской академии.
Благодаря столь представительному научно-методическому руководству
научные исследования были изначально организованы в соответствии с
лучшими традициями отечественной экспериментальной и клинической ме-
дицины. В результате в Петрограде (Ленинграде) сложилась наиболее авто-
ритетная отечественная научная школа в области военной токсикологии.
В разные годы проблемами военной токсикологии занимались такие видные
Ученые, как С.В.Аничков, В.М.Карасик, Н.Н.Савицкий, Н.В.Лазарев,
М.Я.Михельсон, С.Н.Голиков, Л.А.Тиунов, Н.В.Саватеев, С.Д.Заугольни-
ков, И.И.Барышников1.
В России (позднее в СССР) сформировались еще две крупные научные
школы военных токсикологов: в Москве и Киеве. К московской школе
относятся Н.А.Сошественский, А.Н.Гинзбург, С.М.Марков, Ю.В.Другов,
1 А.Патрушев, В.А.Яковлев, А.А.Покровский, Г.А.Степанский, Н.А.Лошад-
1 Активно занимается автор данной главы. — Примеч. ред.
25
л
кин, В.Б.Имашев. Киевская школа представлена А.И.Черкесом, Б.С.Бравер-
Чернобульской, Ф.П.Тринусом.
Оценивая в самом общем виде роль военной токсикологии в развитии
токсикологии как науки, нужно отметить прежде всего вклад в становление
и формирование таких ее разделов или направлений, как токсикометрия
чрезвычайно токсичных химических веществ, молекулярная (биохимичес-
кая) токсикология, сравнительная и клиническая токсикология. Опыт воен-
ных токсикологов широко использовался при решении теоретических и
практических токсикологических проблем, крупномасштабных химических
аварий и катастроф нового времени.
Появление химического оружия среди прочего имело следствием осо-
знание человечеством глобальных масштабов опасности, которую таят в себе
токсичные химические вещества.
Техническая революция и особенно развитие химической промышлен-
ности привели к массовым профессиональным заболеваниям. Как уже упо-
миналось, отравления химическими веществами на производстве были из-
вестны давно, однако на рубеже XIX—XX вв. они достигли размеров, по-
требовавших законодательных решений. Так, уже в 1863 г. в Великобрита-
нии был принят закон о так называемых щелочных производствах. Закон
регулировал выбросы химических веществ в атмосферный воздух и призна-
вал заболевания персонала, связанные с производством, профессионально
обусловленными [19]. Тем не менее лишь в 20-х годах XX в. началось
планомерное развитие промышленной токсикологии, ставшей предтечей
современной профилактической токсикологии. Главной ее задачей стало
формирование теоретических предпосылок и экспериментальных подходов
к регламентированию вредного (опасного) действия химических веществ.
За рубежом наиболее крупным промышленным токсикологом в начале
века был К.Леман (Германия). Им заложены начала промышленной коли-
чественной токсикологии. В период становления отечественной промыш-
ленной токсикологии заметную роль сыграли работы Гендерсона и Хаггарда
(США) и Ф.Флюри и Ф.Церник (Германия).
Развертывание работ в области промышленной токсикологии в нашей
стране также приходится на 20-е годы. В 1923 г. в Москве создается науч-
но-исследовательский институт гигиены труда и профессиональных заболе-
ваний. В следующем году подобные институты были открыты в Ленинграде
и Харькове. Стратегическим направлением исследований в новых научных
учреждениях стало создание теоретических основ гигиенической регламен-
тации вредных веществ в воздушной среде производственных помещений.
Благодаря широкому размаху проводившихся работ в СССР впервые были
сформулированы основные принципы гигиенической регламентации про-
мышленных ядов. Основоположниками отечественной промышленной ток-
сикологии стали Н.В.Лазарев (1895—1974) и Н.С.Правдин (1882—1954).
В работе “Общие основы промышленной токсикологии” (1938) Н.В.Ла-
зарев теоретически и экспериментально обосновал систему принципов и
методических приемов регламентирования вредного действия токсичных
химических веществ на производстве. Он внес огромный вклад в общую
токсикологию, создав теорию неэлектролитного действия химических ве-
ществ и “биолого-физико-химическую” классификацию органических со-
единений. Классификация основана на анализе зависимости характера био-
логического действия химических веществ от их физических свойств. Клю-
чевым критерием классификации был определен коэффициент распреде-
ления оливковое масло/вода. Проведя огромную аналитическую работу,
26
Н В Лазарев разделил все органические соединения на 9 групп в соответст-
вии с возрастанием коэффициента распределения масло/вода. В результате
возникла систематизация химических веществ, обладающая предсказательной
возможностью в отношении прогноза их возможного биологического действия.
В практическом плане благодаря этой работе стали возможными ориентиро-
вочные расчеты различных параметров токсичности химических веществ [27].
Н.В.Лазареву принадлежит фундаментальный справочник “Вредные вещества в
промышленности”, переиздававшийся с дополнениями семь раз. Энциклопе-
дичность творчества, способность к глубоким теоретическим обобщениям,
огромное научное наследие делают Н.В.Лазарева наиболее крупной фигурой в
современной токсикологии. Диапазон его научных интересов охватывает вы-
явление молекулярных механизмов биологического действия химических
веществ и глобальные экологические аспекты химических загрязнений (мо-
нография “Введение в геогигиену”). Н.В.Лазарева по праву называют выда-
ющимся химиобиологом современности [27].
Н.С.Правдину принадлежит приоритет в обосновании ряда ключевых
понятий общей и промышленной токсикологии, в частности порога вред-
ного действия, предельно допустимой концентрации (совместно с Н.В.Ла-
заревым), токсикометрии (токсометрии по Н.С.Правдину) химических воз-
действий малой интенсивности, зоны токсического действия и др.
Н.С.Правдину принадлежит первое отечественное руководство по промыш-
ленной токсикологии (1934), в котором он сформулировал основные задачи
промышленной токсикологии. В течение многих лет настольной книгой
токсикологов была другая работа Н.С.Правдина — “Методика малой токси-
кологии промышленных ядов” (1947). В монографии изложены принципы
и методы токсикологической оценки новых химических веществ, впервые
внедряемых в производство.
Наряду с методологическими аспектами активно изучались механизмы
токсичности ядовитых веществ. В исследованиях начала века трудно было
провести грань между фармакологией, физиологией и токсикологией. В част-
ности, это касается становления теории рецепторов биологической актив-
ности химических веществ. Дж.Н.Ленгли был первым, кто эксперименталь-
но доказал, что такие яды, как никотин, кураре и адреналин, действуют на
“рецептивные субстанции” клетки. В своей Круниановской лекции в мае
1906 г. он предельно четко сформулировал эту концепцию. В сборнике работ
“Теория химической передачи нервного импульса”, составленном проф.
М.Я.Михельсоном, содержится полный перевод работы Дж.Н.Ленгли. Даль-
нейшее развитие рецепторная токсофорная теория действия химических
веществ получила в исследованиях П.Эрлиха (ему же принадлежит термин —
рецептор”), позднее А.Кларка, В.Пейтона. Сущность концепции заключа-
лась в представлении, что специфичность физиологического действия хи-
мических веществ определяется их сродством к определенным субстанциям
(рецепторам, биологическим мишеням). Такими рецепторами могут быть
некоторые структуры мембран клеток, активные центры ферментов, нукле-
иновые кислоты, пуриновые и пиримидиновые нуклеотиды и т.д. Особен-
ности структурной организации рецепторов у различных видов животных
лежат, как оказалось, в основе избирательного действия многих токсичных
химических веществ.
Рецепторная теория сыграла конструктивную роль в понимании природы
токсических эффектов цианидов, фосфорорганических соединений, алкили-
РУющих агентов, многих металлов, токсинов природного происхождения и т.д.
месте с тем в 20—30-х годах накапливалось все большее число экспери-
27
ментальных данных о том, что многие вещества действуют на клетку не
строго избирательно, а неспецифически, вызывая токсический эффект “сво-
им присутствием”. Такое действие типично для веществ с самой различной
химической структурой. Для определения такого типа биологических эф-
фектов Н.В.Лазарев, как уже отмечалось, предложил термин “неэлектролит-
ное действие”. Неэлектролитное действие характерно для многих промыш-
ленных ядов — углеводородов, спиртов, простых эфиров и т.д.
После второй мировой войны в 40—50-х годах и особенно в 60-е годы
быстро накапливались новые экспериментальные материалы. Бурно разви-
валась химическая промышленность, и все большее число химикатов втор-
галось в быт человека. В частности, резко возросло количество новых
лекарственных средств — они стали исчисляться тысячами. Новые приметы
времени нашли отражение и в развитии токсикологии.
К концу 60-х годов окончательно сложилась теория гигиенического
регламентирования вредных химических производств (работы И.В.Саноцко-
го, Г.Н.Красовского, Б.А.Курляндского, Н.П.Улановой, С.Д.Заугольникова,
Л.А.Тиунова, Е.И.Люблиной, И.М.Трахтенберга, В.А.Филова, Б.А.Кацнель-
сона, Б.М.Штабского и др.). В 1962 г. в Москве по инициативе А.В.Цессар-
ского и Б.А.Курляндского была создана первая в СССР токсикологическая
лаборатория в системе санитарно-эпидемиологической службы, положив-
шая начало созданию аналогичных лабораторий во всех регионах страны. В
своей деятельности они сочетали решение научных задач в аспекте хими-
ческой безопасности с выполнением некоторых надзорных функций за
объектами химической и нефтехимической промышленности.
Этапными работами, в которых подведены итоги развития токсикологи-
ческих исследований тех лет и намечены пути их дальнейшего развития,
стали монографии под ред. И.В.Саноцкого (1970), Н.АТолоконцева и В.А.Фи-
лова (1976), а также монография А.А.Голубева, Е.И.Люблиной, Н.А.Толо-
концева, В.А.Филова (1973р.
Принципиально новым явлением стало быстрое развитие клинической
и лекарственной токсикологии. Первые токсикологические стационары воз-
никли в Европе — в Копенгагене и Будапеште — в самом конце 40-х годов.
В 1949 г. в Нидерландах стал функционировать первый токсикологический
информационный центр. В США в 1958 г. была создана Американская
ассоциация контрольных центров отравлений, а в 1968 г. — Американская
академия клинической токсикологии. В том же году академия организовала
выпуск журнала “Клиническая токсикология” [35].
В СССР специализированный центр по лечению острых отравлений был
открыт при НИИ скорой помощи им. Н.В.Склифосовского в Москве в
1963 г. Ведущая роль в становлении центра принадлежит проф. Е.А.Лужникову.
Примерно в то же время в Ленинграде создается аналогичный центр в
Военно-медицинской академии на базе клиники военно-полевой терапии
(руководитель — проф. Е.Б.Закржевский) и в городской больнице скорой
помощи.
Е.АЛужникову и его сотрудникам принадлежит приоритет в разработке
большинства методологических вопросов отечественной клинической ток-
сикологии. Наиболее полно они отражены в подготовленных им руковод-
1 В настоящее время авторы подготавливают многотомное издание “Вредные
химические вещества”, включающее сведения и о промышленно значимых вещест-
вах. Из печати вышли 7 томов этого издания — см. список литературы. Для завер-
шения издания намечены еще 5 томов. — Примеч. ред.
28
ствах (1982, 1989, 2001). В 1992 г. в России по инициативе Б.А.Курляндского
и под его редакцией начал издаваться специализированный научный и
практический журнал “Токсикологический вестник”.
Р Быстрый прогресс лекарственной токсикологии был обусловлен необхо-
димостью разработки системы прогноза безопасности для человека все воз-
растающего числа новых лекарственных средств. Две трагедии показали
несовершенство существовавших критериев безопасности. Первая относится
к 1937 г. и связана с жидкой лекарственной формой сульфаниламидного
препарата, предназначенного для детей. В качестве растворителя в этом
“эликсире” использовали 72 % диэтиленгликоль. Было произведено и реа-
лизовано 1100 л микстуры. В результате ее применения в сентябре и октябре
1937 г. умерли 107 человек, преимущественно дети.
Вторая трагедия связана с употреблением седативного препарата тали-
домид. Этот препарат назначали беременным женщинам в Европе, Австра-
лии и Канаде, что привело в 5000 случаев к появлению у плодов различных
аномалий развития.
Потребовалось проведение большого объема экспериментальных иссле-
дований для создания многоэтапной и жесткой системы предклинических
и клинических испытаний новых лекарственных средств с целью исключе-
ния опасности их использования человеком.
Новейший этап в истории токсикологии характеризуется рядом крупных
теоретических обобщений. К их числу следует отнести концепцию общих
механизмов токсического действия химических веществ [8], базирующуюся
на общебиологических представлениях об универсальности реакций орга-
низма на воздействие токсикантов.
Другим важным достижением теоретической токсикологии следует счи-
тать учение об естественной детоксикации, сформировавшееся в рамках
биохимической токсикологии, как основе формирования механизмов адап-
тации и компенсации нарушенных функций при действии химических ве-
ществ [1, 25, 31]. Наконец, нужно отметить становление нового направле-
ния — токсикологии пестицидов.
Общепризнано, что среда обитания современного человека отличается
ростом химической нагрузки, достигающей подчас предельных значений.
Вполне адекватным выглядит быстрое развитие уже обсуждавшегося нового
направления в токсикологии — экологической токсикологии. В качестве
Другой отличительной особенности современности (применительно к про-
блемам токсикологии) следует назвать возрастание опасности крупномас-
штабных химических катастроф.
Нельзя сказать, что это абсолютно новая проблема. Так, еще в 79 г. н.э.
во время извержения Везувия в Помпее от ядовитых выбросов погибло более
2000 человек. Применение химического оружия в первой мировой войне
также привело к массовой гибели пораженных и формированию у выжив-
ших отдаленных последствий перенесенной интоксикации. Тем не менее
статистика химических аварий свидетельствует о значительном росте их
частоты и разрушительной силы. Только на долю техногенных аварий 80-х
г°дов приходится 47 % погибших и 2Д пораженных от общего числа всех
пострадавших в промышленных авариях XX в. Такую ситуацию специалисты
объясняют чрезмерной концентрацией химического производства и его ги-
гантскими объемами.
Приведем лишь два наиболее типичных примера химических катастроф.
Одна из них случилась в 1976 г. в Севезо (вблизи Милана, Италия).
в Результате до конца не выясненных причин на химическом заводе ком-
29
пании “Хоффман ля Рош”, производившем 2,4,5-трихлорфенол, произошел
взрыв реактора и в окружающую среду было выброшено около 1,7 кг
2,3,7,8-тетрахлордибензо-р-диоксина (ТХПЛ). Как известно, диоксин относит-
ся 'к числу наиболее опасных экотоксикантов. Общая площадь загрязнения
диоксином составила более 20 км2 с населением около 38 тыс. человек. Работа
по очистке территории продолжалась в течение нескольких лет, а медицинское
наблюдение за состоянием здоровья пострадавших продолжается до насто-
ящего времени. Как свидетельствуют материалы многолетних наблюдений,
у экспонированной группы населения не выявлено каких-либо отдаленных
последствий интоксикации. Тем не менее нельзя исключить, что последст-
вия воздействия диоксина на людей проявятся в более отдаленные сроки.
Другая авария произошла в 1984 г. в Бхопал (Индия) на заводе корпо-
рации “Юнион Карбайд Индия Лимитед”, который специализировался на
производстве инсектицида севина (1-нафтил-метилкарбамат). Аварийная си-
туация возникла на участке хранения метилизоцианата — промежуточного
продукта для синтеза севина. В результате произошла утечка изоцианата в
количестве около 30 т. Облако метилизоцианата распространилось на пло-
щади более 65 км2, охватив 3 жилых района города с населением 200 тыс.
человек, и удерживалось почти 8 ч. Последствия были ужасающими: погибло
более 2,5 тыс. человек, еще у 11,5 тыс. пострадавших была диагностирована
тяжелая форма отравления метилизоцианатом. Всего же в медицинской
помощи нуждались 170 тыс. человек.
Богатая история токсикологии показывает, что, несмотря на тяжелые, а
порой трагические события, сопутствовавшие развитию химической про-
мышленности, внушительные успехи токсикологической науки и практики
вселяют глубокую уверенность в том, что Человечество может успешно
противодействовать химической опасности во всех формах ее проявления.
ЛИТЕРАТУРА
1. Арчаков А.И. Микросомальное окисление. — М., 1975. — 327 с.
2. Альберт А. Избирательная токсичность/Под ред. В.А.Филова. — М.: Медицина,
1989.-Т. 1.-400 с.; Т. 2.-430 с. j
3. Безель В.С., Большаков В.Н. Экологическая токсикология: проблемы, задачи,
подходы//Токсикол. вестник. — 1995. — № 1. — С. 2—7. j
4. Бернар К. Физиологический анализ свойств мышечной и нервной систем с |
помощью кураре. — В кн.: Теория химической передачи нервного импульса j
(этапы развития): Сборник/Составитель М.Я.Михельсон. — Л., 1981. — С. 2—7.
5. Гадаскина И.Д., Толоконцев НА. Яды — вчера и сегодня. — Л., 1988. — 202 с.
6. Галыпье С.П. Начертание общей токсикологии или науки о ядах и отравлениях
вообще. - М., 1858. - С. VII.
7. Гендерсон, Хаггард. Вредные газы в промышленности. — М.—Л., 1930. — 207 с.
8. Голиков С.Н., Саноцкий И.В., Тиунов Л.А. Общие механизмы токсического дей-
ствия. — М., 1986. - 277 с.
9. Голубев А.А., Люблина Е.И., Толоконцев Н.А., Филов В.А. Количественная токси-
кология. — Л., 1973. — 287 с.
10. Каспаров А.А., Саноцкий И В. (ред.). Токсикометрия химических веществ, загряз-
няющих окружающую среду. — М., 1986. — С. 10.
11. Кравков Н.П. Основы фармакологии. Ч. 1, изд. 13-е. — М.—Л., 1930. — С. 23.
30 g
12 Курляндский Б.А. Регламентирование содержания химических бластомогенных
агентов в окружающей человека среде. Итоги науки и техники//Токсикология. —
1978. - Т. 9. - С. 67.
13 Курляндский Б.А. К вопросу об организации и работе токсикологической лабо-
ратории при СЭС г. Москвы//Гиг. и сан. — 1965. — № 6. — С. 12.
14. Лазарев Н.В. Общие основы промышленной токсикологии. — М,—Л., 1938. — 388 с.
15. Лазарев Н.В. Введение в геогигиену. — М.—Л., 1966. — 323 с.
16. Ленгли Дж.Н. О нервных окончаниях и о специальной возбудимой субстанции
в клетках (Круниановская лекция). — В кн.: Теория химической передачи нерв-
ного импульса (этапы развития): Сборник/Составитель М.Я.Михельсон. — Л.,
1981.-С. 23-32.
17. Лужников Е.А. Клиническая токсикология. — М., 2000. — 368 с.
18. Лужников Е.А., Костомарова Л.Г. Острые отравления. — М., 1989. — С. 11.
19. Маршал В. Основные опасности химических производств. — М., 1989. — 671 с.
20. Орфила М.П. Средства для спасения отравленных и мнимоумерших, с прибав-
лением приличных способов узнавать яды, подделанные вина и различать ис-
тинную смерть от кажущейся. — М., 1824. — 186 с.
21. Правдин Н.С. Руководство по промышленной токсикологии. — М.—Л., 1934.
22. Правдин Н.С. Методика малой токсикологии промышленных ядов. — М., 1947. —
217 с.
23. Саноцкий И.В. Методы определения токсичности и опасности химических ве-
ществ. — М., 1970. — 343 с.
24. Саноцкий Н.В. Основные понятия токсикологии. — В кн.: Методы определения
токсичности и опасности химических веществ. — М., 1970. — С. 14.
25. Тиунов ЛА Биохимические механизмы адаптации и компенсации нарушенных
функций при действии на организм химических веществ. — В кн.: Структурные
основы адаптации и компенсации нарушенных функций. — М., 1987. — С. 366—380.
26. Толоконцев НА, Филов В.А. Основы промышленной токсикологии (руководст-
во). - Л., 1976. - 303 с.
27. Филов ВА, Курляндский Б.А. Н.В.Лазарев — выдающийся ученый-химиобио-
лог//Токсикол. вестник. —1995. — № 5. — С. 2—6.
28, Флюри Ф., Церник Ф. Вредные газы. — М., 1938.
29. Франк И. Руководство к токсикологии, или наука о ядах и средствах против
оных. — М., 1815.—402 с.
20, Харкевич ДА Фармакология, 4-е изд. — М., 1993. — С. 4.
21- Bruin de A. Biochemical toxicology of environmental agents//Elsevier Worth, Holland. —
Biomedical PGS. — 1976. — 1544 p.
22. Gallo M.A., Doull J. History and Scope of Toxicology. — In: M.O.Amdur, J.Doull,
C.E.Klassen (eds). Casarett and Doulls Toxicology: The Basic science of poisons/4th
ed. - New York: 1991. - P. 3-11.
23. Hodgson E. Introduction to Toxicology. — In: A Textbook of modem Toxicology/
E.Hodgson, P.E.Levi (eds). — New York, Amsterdam, London. — 1987. — P. 2.
? Moses Maimonides treatise of poisons//JAMA. — 1968. — 205. — P. 98—
25- Wax P.M. Historical principles and perspectives. — In: Goldfrank’s Toxicological
Emergencies, 5th ed. — Norwalk. — Connecticut. — 1994. — P. 1.
31
Глава 2
ВЗАИМОДЕЙСТВИЕ ОРГАНИЗМА И КСЕНОБИОТИКА;
ХЕМОБИОКИНЕТИКА
Рис. 2.1. Транспорт ксенобиотиков веществ (В) и их метаболитов (М) через организм.
2.1. Общие представления
Биологический, а также токсический эффект поступившего в организм
ксенобиотика возникает только тогда, когда он достигнет точки своего
приложения. Обычно говорят, что вещество взаимодействует с рецептором.
При этом разные вещества взаимодействуют с различными рецепторами, а
для некоторых веществ рецепторов может быть несколько. Под “рецепто-
ром” понимается биологическая структура, обычно биомолекула (ее белок-
содержащая, ДНК-содержащая или иная часть), упорядоченный конгломе-
рат молекул, результатом взаимодействия с которыми и является тот или
иной эффект. Рецепторами могут быть, например, ферменты, действие
которых обратимо или необратимо блокируется ксенобиотиком; структуры,
ответственные за проведение нервных импульсов; участки мембран клеток
или их органелл, которые оккупируются ксенобиотиком с последующим
нарушением мембранной проницаемости и др. Если у ксенобиотика не-
сколько точек приложения (он взаимодействует с несколькими рецептора-
ми), то и эффектов может быть несколько, например основной и побочный.
Зачастую взаимодействие с несколькими рецепторами приводит к симпто-
мокомплексу, в котором весьма сложно выделить составляющие эффекты.
Подробнее о рецепторах можно узнать из монографий [13, 14].
Токсическое действие на организм проявится только при условии доста-
точного для этого количества ксенобиотика. Если это количество незначи-
тельно для развития токсического эффекта, то его не будет либо фактически,
либо в силу его практической незаметности.
Разовьется или нет отравление вслед за поступлением ксенобиотика в
организм, какова будет степень его проявления, сколь долго оно будет
продолжаться, зависит от вида ксенобиотика и его рецептора (рецепторов).
Однако в значительной мере это зависит от того, что и с какой скоростью
будет происходить с веществом в организме. С момента поступления и до
взаимодействия с рецептором ксенобиотик подвергается воздействию раз-
нообразных биологических факторов: попав в кровоток, он разносится по
всему организму, на том или ином этапе проходя через печень; через
эпителий капилляров проникает в ткани и органы, иногда задерживаясь и
даже откладываясь в некоторых из них; в той или иной степени подвергается \
превращениям и, наконец, выделяется из организма в неизмененном виде я
или в виде метаболитов. Превращения некоторых ксенобиотиков могут 1
происходить уже в месте соприкосновения с тканями. В крови чужеродные 1
вещества в той или иной мере вступают в связь с плазменными белками, 1
преимущественно с альбуминами. Обычно такая связь снижает возможность
взаимодействия с рецепторами и/или затягивает этот процесс. Указанные
динамические процессы, которым ксенобиотик подвергается в организме,
время и сила его связывания с рецепторами, интенсивность метаболизма в
значительной степени обусловливают не только силу, но и сам характер его
токсического действия. Все эти процессы протекают во времени. Изучением
временных зависимостей их течения в организме занимается кинетика.
Применительно к организму говорят о токсико- и фармакокинетике, что
по существу одно и то же. Различие здесь только прикладное — фармако-
кинетика обычно рассматривает кинетику лекарственных веществ, токсико-
кинетика — токсических. Отсюда могут происходить различия в акцентах:
первая, имея дело чаще всего с парентеральным или пероральным введением
веществ, в значительной степени сосредоточена на кинетике поступления
этими путями; токсикология часто имеет дело с ингаляционным поступле-
нием ксенобиотиков, при этом растянутым во времени, а сами вещества
могут находиться не только в газообразной форме, но и в виде аэрозолей;
хотя возможны и другие пути проникновения через кожу и др. Соответст-
венно токсикокинетика более сосредоточена на этих путях поступления.
Однако в любом случае методы исследования, способы обработки и описа-
ния данных, их конечный результат остаются одними и теми же. Термины —
фармако- и токсикокинетика сложились исторически. Более верным термином
является хемобиокинетика, поскольку он отражает суть процесса (кинетика
химического вещества в биологическом объекте) и объединяет оба названия.
В дальнейшем мы пользуемся только этим термином.
Хемобиокинетика — это область изучения кинетики прохождения ксеноби-
отиков через организм, включая процессы их поступления, распределения, ме-
таболизма и выделения. Само же прохождение ксенобиотиков через организм
хорошо иллюстрирует рис. 2.1.
В заключении краткого введения сопоставим хемобиокинетику с токси-
кодинамикой (можно было бы сказать хемобиодинамикой, но это опреде-
ление не обладало бы всеми достоинствами первого). Обе они — составные
части токсикологии и имеют общий объект исследования — систему яд —
организм. При этом токсикодинамика сосредоточена на тех эффектах, ко-
торые возникают в организме под влиянием воздействия ксенобиотиков.
взаимодействие
Ксенобиотик — - ... Организм
Рис. 2.2. Взаимосвязь между хемобиокинетикой и токсикодинамикой.
32
2 — 7107
33
Однако суть заключается в том, что не бывает однонаправленного действия;
организм в свою очередь воздействует на ксенобиотик (метаболизм, распре-
деление, элиминация) и поэтому еледует говорить об их взаимодействии.
Хемобиокинетика сосредоточена на поведении ксенобиотиков под влиянием
организма. На рис. 2.2 представлены взаимоотношения между хемобиоки-
нетикой и токсикодинамикой.
В настоящей главе остановимся, по необходимости кратко, на вопросах
метаболизма ксенобиотиков, биохимических механизмах их токсического
действия, хемобиокинетики и подробнее на описании хемобиокинетики
аэрозолей. Последнее оправдано практическим отсутствием книг по хемо-
биокинетике аэрозолей. Вместе с тем литература, посвященная метаболизму,
механизмам и кинетике, представлена весьма широко. Вот лишь некоторые,
рекомендуемые нами монографии по этим вопросам [15, 16, 44].
2.2. Механизмы метаболизма ксенобиотиков
Биохимические механизмы биотрансформации чужеродных веществ
принадлежат к наиболее древним механизмам. Возникновение жизни на
Земле требовало защиты первых примитивных организмов от агрессивной
окружающей среды, составным элементом которой были разнообразные
ксенобиотики. Эволюционное развитие такой защиты шло разными путями,
в частности развивался и в процессе совершенствования жизни постепенно
усложнялся биохимический путь детоксикации ксенобиотиков, Их метабо-
лизм, направленный на такое преобразование, которое способствовало бы-
стрейшему их выведению из организма или полному разрушению до неток-
сичных продуктов.
Молекулярные механизмы метаболизма ксенобиотиков в организме ус-
ловно можно разделить на два типа. Первый из них связан с функциони-
рованием монооксигеназных систем гладкого эндоплазматического ретику-
лума и сопряженных с ними реакциями конъюгации. Заметим, что для
монооксигеназных систем существует несколько равноиспользуемых сино-
нимов: оксидазы со смешанными функциями, система цитохрома Р-450,
цитохром Р-450-содержащая монооксигеназная система и др. Этот тип ме-
таболизма функционирует главным образом при действии на организм жи-
рорастворимых соединений. Второй тип метаболизма ксенобиотиков объ-
единяет молекулярные механизмы, локализованные в цитозоле, митохонд-
риях, лизосомах и пероксисомах. Этот тип функционирует преимущест-
венно при действии на организм водорастворимых ксенобиотиков.
Для экспериментальных и иных целей ферменты монооксигеназных
систем гладкого эндоплазматического ретикулума выделяют путем диффе-
ренциального центрифугирования в виде фракции микросом. В этой фрак-
ции много разных ферментов, но из их числа в механизмах метаболизма
ксенобиотиков преимущественно участвуют оксидазы со смешанными
функциями и ферменты, обеспечивающие процессы конъюгации. Оксидазы
катализируют реакции С-гидроксилирования ксенобиотиков в алифатичес-
кой цепи, в ароматическом и алициклических кольцах и в алкильных боко-
вых цепях, N-гидроксилирования, О-, S- и N-дезалкилирования, окисли-
тельного дезамидирования и дезаминирования, десульфирования и эпокси-
дирования. Эти же ферменты катализируют реакции восстановления нитро-
и азотосоединений; реакции восстановительного дегалогенирования. В ре-
зультате указанных реакций ксенобиотики приобретают реактивные группы
ОН, NH2, СООН, SH, которые обеспечивают вступление в реакции конъ-
34 ।
аиии с образованием малотоксичных соединений, легко выводящихся из
ЮГ анизма с мочой, желчью и калом. Таков самый общий путь метаболизма
°₽енобиотиков. На самом же деле все происходит существенно сложнее и
KCnDouecce многоступенчатого метаболизма зачастую образуются весьма
токсичные соединения, но об этом — в конце раздела.
Оксидазы со смешанными функциями представляют собой полифер-
ментный комплекс. Одним из составляющих этого комплекса является
гемсодержащий белок — цитохром Р-450 (название от полосы поглощения
восстановленного при взаимодействии с оксидом углерода цитохрома при
450 нм). Цитохрому Р-450 присущи многообразие форм (известно несколько
десятков изоферментов этого цитохрома) и широта субстратной специфич-
ности. Этот белок является важнейшим компонентом микросомной моно-
оксигеназной системы, ответственным за активацию молекулярного кисло-
рода и связывание субстрата. Помимо цитохрома Р-450, в состав моноок-
сигеназной системы входят НАДФН-цитохром Р-450-редуктаза, цитохром
Ь5 и НАДН-цитохром Ь5-редуктаза. Входят в систему и иные ферменты,
менее значимые. Все они связаны с мембранными белками эндоплазмати-
ческого ретикулума. Ведущую роль в метаболизме ксенобиотиков играют
НАДФН -зависимые реакции; НАДН-зависимые реакции составляют при-
мерно лишь 10—30 % от общей активности монооксигеназных систем. Весь
этот комплекс, а здесь о нем сказано весьма схематично, обеспечивает очень
слаженную работу по метаболизму ксенобиотиков. И происходит это при-
мерно так. Липофильный ксенобиотик на I стадии взаимодействует с окис-
ленной формой цитохрома Р-450 с образованием фермент-субстратного
комплекса. На II стадии фермент-субстратный комплекс восстанавливается
электроном, поступающим из НАДФН-зависимой цепи переноса от
НАДФ Н с помощью ряда ферментов. Следующая III стадия — это взаимо-
действие восстановленного фермент-субстратного комплекса с кислородом.
На IV стадии тройной комплекс фермент — субстрат — кислород восстанав-
ливается вторым электроном. V стадия — это внутримолекулярные пере-
стройки восстановленного тройного комплекса и его распад с освобожде-
нием воды и гидроксилированного субстрата (ксенобиотика). При этом
цитохром Р-450 переходит в исходную форму, готовую к взаимодействию
со следующей молекулой ксенобиотика. Из этой схемы, описанной лишь в
самых общих чертах, следует, что при метаболизме ксенобиотиков один атом
кислорода используется для его окисления, а второй восстанавливается до
воды. Именно это послужило основанием для наименования ферментных
систем, обеспечивающих указанный процесс, оксидазами со смешанными
Функциями. А использование для окисления субстрата лишь одного атома
кислорода оксидазами со смешанными функциями явилось основанием для
отнесения их к монооксигеназным системам. Более подробно об указанной
здесь роли цитохрома Р-450 в процессах окисления ксенобиотиков можно
видеть в монографии [28].
Самым крупным органом, принимающим участие в метаболизме ксено-
и?1^Ков> является печень. Она составляет 2 % от массы тела человека
и 4 % от массы тела животных. В печени метаболизируют примерно 2/з от
оощего количества ксенобиотиков, попадающих в организм. Серные, глута-
ноновые и глюкуронидные конъюгаты ксенобиотиков из печени могут
Оделяться с желчью в кишечник, подвергаться там дальнейшей биотранс-
формации, реабсорбироваться в кровь и вновь поступать в печень. Далее
и с°единения выделяются с мочой или повторно поступают с желчью в
Шечник и выделяются с калом. В такой процесс внутрипеченочной цир-
35
г-
куляции вовлекаются ксенобиотики с определенной молекулярной массой —
для белых крыс, кроликов и человека она составляет соответственно 325
400 и 500.
Помимо печени, микросомные монооксигеназы обнаружены в коже,
легких, тонкой кишке, почках, головном мозге, надпочечниках, гонадах и
плаценте. Именно в этих органах и тканях претерпевает метаболизм остав-
шаяся '/з попавших в организм извне ксенобиотиков. При этом кожа,
легкие и кишечник играют особую роль, поскольку служат первыми барье-
рами для токсических соединений, проникающих в организм кожным, ин-
галяционным и пероральным путями.
Реакции конъюгации составляют вторую фазу метаболизма жирораство-
римых ксенобиотиков, которые в первой фазе гидроксилировались или
получили иные нуклеофильные группы при помощи микросомных моноок-
сигеназ. Химические же соединения, которые уже имеют в своем составе
реакционноспособные группы (ОН, СООН, NH2, SH), сразу вступают в
реакции конъюгации без предварительных превращений с участием оксидаз
со смешанными функциями. У млекопитающих наиболее распространены
следующие реакции конъюгации: глюкуронидная, сульфатная, с глутатио-
ном, с глутамином, с аминокислотами, метилирование, ацетилирование,
гликозилирование. При этом чаще всего и не только у млекопитающих
встречается конъюгация с глюкуроновой кислотой.
Реакции конъюгации — это реакции биосинтеза, которые протекают с
потреблением энергии. Вторым важным обстоятельством этих реакций яв-
ляется особенность их внутриклеточной локализации. Значительная часть
реакций конъюгации протекает на мембранах эндоплазматической сети кле-
ток, непосредственно в месте образования под влиянием оксидаз со сме-
шанными функциями высокореактивных метаболитов. Это позволяет свести
до минимума токсическое действие промежуточных продуктов метаболизма
ксенобиотиков. Надо отметить, что реакции конъюгации протекают и на
других внутриклеточных структурах, а также в цитозоле, что дает возмож-
ность связывать токсические продукты, появляющиеся в клетке вне эндо-
плазматической сети. Много интересного и детального материала о роли
конъюгации в процессах метаболизма ксенобиотиков и их токсичности
содержится в сборнике [39].
Не входя в рассмотрение механизмов различных видов конъюгации,
отметим лишь, каким типам ксенобиотиков свойственны те или иные ее
виды. При этом не будем забывать, что в результате конъюгации из липо-
фильного ксенобиотика образуется менее токсичное или нетоксичное со-
единение, водорастворимое и поэтому сравнительно легко выделяющееся из
организма. Однако этому процессу может препятствовать процесс деконъю-
гации. Кроме того, конъюгация — процесс дозозависимый; в зависимости
от дозы ее вид может меняться. В наиболее распространенную конъюгацию
с глюкуроновой кислотой в основном способны вступать четыре группы
химических соединений. Первую из них составляют вещества, образующие
с глюкуроновой кислотой О-глюкурониды (фенолы, первичные, вторичные
и третичные спирты, ароматические и алифатические карбоновые кислоты,
кетоны, гидроксиламины). Вторую группу составляют соединения, образую-
щие N-глюкурониды (карбаматы, ариламины, сульфонамиды). Третья груп-
па включает соединения, образующие с глюкуроновой кислотой S-глюкуро-
ниды: арилмеркаптаны, дитиокарбоновые кислоты. Четвертую группу со-
ставляют вещества, образующие С-глюкурониды: ксенобиотики, содержа-
щие пиразолидиновую группировку и еще некоторые другие, например
фенилбутазон.
36
В сульфатную конъюгацию вступают фенолы, алкоголи, ароматические
I Гидроксиламины, ариламины, некоторые стероиды. Эволюционно
аМ1ьсЬатная конъюгация является наиболее древним видом конъюгации и
СУиболее примитивным. Об ее несовершенстве говорят некоторые факты,
на образующиеся продукты токсичны. В реакции конъюгации с глутати-
К°ом вступает большое число самых разнообразных соединений. Их объ-
оНИНЯет наличие электрофильного центра, способного реагировать с SH-
гоуппой глутатиона. Это эпоксиды, ареноксиды, альдегиды, нитрилы, про-
тые и сложные ароматические соединения, нитрофураны, триазоны и мно-
с другие — всего более сорока типов соединений. Конъюгация с амино-
кислотами является биохимическим механизмом детоксикации ароматичес-
ких соединений, содержащих карбоксильные группы, в частности это аро-
матические карбоновые кислоты, их производные, акриловые кислоты и их
производные, производные уксусной кислоты, гетероциклические и поли-
циклические карбоновые кислоты. С какой именно аминокислотой про-
изойдет конъюгация, зависит от химической структуры ксенобиотика. Ме-
тилированию подвергаются ксенобиотики или их метаболиты, содержащие
гидроксильные, сульфгидрильные и аминогруппы. К их числу относятся, в
частности, алкилфенолы, метоксифенолы, галогенфенолы, тиолы, первич-
ные и вторичные амины. Следует заметить, что в результате метилирования
не всегда изменяется растворимость и токсичность образующегося соедине-
ния. Ацетилированию подвергаются ксенобиотики, содержащие амино-,
гидрокси- и сульфгидрильные группы (ароматические и алифатические ами-
ны, гидразины, гидразиды, сульфаниламиды).
Активность микросомных монооксигеназ, катализирующих биотранс-
формацию ксенобиотиков в первой фазе детоксикации, а также активность
ферментов, принимающих участие в реакциях конъюгации, составляющих
вторую фазу детоксикации, зависит от многих факторов. Например, от
функционального состояния организма, от возраста и пола, от режима
питания, имеют место сезонные и суточные колебания активности и др.
Однако наиболее выраженное действие на функционирование биохимичес-
ких систем, ответственных за процессы детоксикации, оказывают химичес-
кие вещества, относящиеся к индукторам и ингибиторам микросомных
монооксигеназ. Комбинированное действие ксенобиотиков зачастую опре-
деляется именно индукторными или ингибиторными свойствами участвую-
щих в комбинациях соединений. Индукторы или ингибиторы микросомного
окисления могут служить основой для средств профилактики и лечения
интоксикаций.
В настоящее время известно около 300 химических соединений, вызы-
вающих увеличение активности микросомных ферментов, т.е. индукторов.
Это, например, барбитураты, бифенилы, спирты и кетоны, полицикличес-
кие и галогенуглеводороды, некоторые стероиды и многие другие. Они
относятся к разнообразным классам химических соединений, но имеют
некоторые общие черты. Так, все индукторы являются липоидорастворимы-
ми веществами и характеризуются тропизмом по отношению к мембранам
эндоплазматического ретикулума. Индукторы являются субстратами микро-
сомных ферментов. Имеется прямая корреляция между мощностью индук-
торов и периодом их полусуществования в организме. Индукторы также
могут обладать определенной специфичностью по отношению к чужерод-
ным веществам или иметь широкий спектр действия. Более подробно обо
нссм этом и многом ином можно прочитать в следующих книгах и моно-
Пэафиях [16, 78, 80].
37
Многое из сказанного выше относится и к ингибиторам микросомных
монооксигеназ, точно так же, как и ссылки на главу Л.А.Тиунова И др.
К числу ингибиторов относятся вещества из самых разных классов хими-
ческих соединений. С одной стороны, это могут быть весьма сложные
органические соединения, а с другой — простые неорганические соединения
типа ионов тяжелых металлов. Нами, в частности, описан и применен на
практике с целью увеличения противоопухолевой активности известных
противоопухолевых препаратов ингибитор метаболизма ксенобиотиков гид-
разин сернокислый [20]. Перспективным считается применение ингибито-
ров для увеличения активности пестицидов. В том и другом случаях моди-
фицирующее действие ингибиторов основано на задержке или предотвра-
щении метаболизма исходных соединений, что при подборе соответствую-
щей дозы и схемы применения ингибиторов дает возможность изменять
силу и качество эффекта.
По механизму действия ингибиторы метаболизма подразделяются на 4
группы. К первой из них относят обратимые ингибиторы прямого действия: |
это эфиры, спирты, лактоны, фенолы, антиоксиданты и др. Вторую группу 3
составляют обратимые ингибиторы непрямого действия, оказывающие влия- I
ние на микросомные ферменты через промежуточные продукты своего мета- I
болизма путем образования комплексов с цитохромом Р-450. В этой группе |
производные бензола, алкиламины, ароматические амины, гидразины и др. 1
Третья группа включает необратимые ингибиторы, разрушающие цитохром 1
Р-450 — это полигалогенированные алканы, производные олефинов, производ- |
ные ацетилена, серосодержащие соединения и др. Наконец, к четвертой группе I
относятся ингибиторы, тормозящие синтез и/или ускоряющие распад цитох- 1
рома Р-450. Типичными представителями группы являются ионы металлов, •
ингибиторы синтеза белка и вещества, влияющие на синтез гема.
До сих пор речь шла только о микросомных механизмах метаболизма
ксенобиотиков. Однако' имеются и другие, внемикросомные механизмы. Это
второй тип метаболических превращений, он включает реакции немикро-
сомного окисления спиртов, альдегидов, карбоновых кислот, алкиламинов,
неорганических сульфатов, 1,4-нафтохинонов, сульфоксидов, органических
дисульфидов, некоторых эфиров; с его помощью происходит гидролиз эфир-
ной и амидной связей, а также гидролитическое дегалогенирование. Ниже
перечислены некоторые из ферментов, участвующих во внемикросомном
метаболизме ксенобиотиков: моноаминоксидаза, диаминоксидаза, алкоголь- j
дегидрогеназа, альдегиддегидрогеназа, альдегидоксидаза, ксантиноксидаза, |
эстеразы, амидазы, пероксидазы, каталаза и др. Таким путем метаболизиру- |
ют преимущественно водорастворимые ксенобиотики. Ниже приведены не- I
которые примеры. |
Алифатические спирты и альдегиды метаболизируют преимущественно I
в печени млекопитающих, Так, 90—98 % этанола, поступившего в организм, I
метаболизирует в клетках печени и лишь 2—10 % в почках и легких. При j,
этом часть этанола вступает в реакции глюкуронидной конъюгации и вы- |
водится из организма; другая часть подвергается окислительным превраще- ;
ниям. Соотношение этих процессов зависит от вида животных, от химичес- |
кого строения спирта и от его концентрации. При действии низких кон-
центраций алифатических спиртов главным путем их биотрансформации в
организме является окислительный путь с помощью алкогольдегидрогеназы.
В основном внемикросомный механизм метаболизма используется для де-
токсикации цианидов. При этом главной реакцией является вытеснение
цианогруппой сульфитной группы из молекулы тиосульфата. Образующийся
тиоцианат практически нетоксичен.
38
<
Деление механизмов детоксикации на микросомные и внемикросомные
несколько условно. Метаболизм ряда групп химических соединений может
носить смешанный характер, как это следует из примера со спиртами.
Как уже кратко описано выше, монооксигеназная система, содержащая
цитохром Р-450 в виде его различных изоформ, защищает внутреннюю среду
организма от накопления в ней токсических соединений. Принимая участие
в первой фазе метаболизма ксенобиотиков — превращая низкомолекуляр-
ные ксенобиотики с низкой растворимостью в воде в более растворимые
соединения — она облегчает их выведение из организма. Однако эта их
функция может представлять и серьезную опасность для организма, что
встречается не так уже и редко. Дело в том, что механизм реакций окисления
предусматривает образование в организме промежуточных реакционноспо-
собных метаболитов, относящихся к двум типам. Прежде всего это продукты
частичного восстановления кислорода: перекись водорода и супероксидные
радикалы, которые являются источниками наиболее реакционноспособных
гидрофильных радикалов. Последние способны окислять самые различные
молекулы в клетке. Другой тип — это реакционноспособные метаболиты
окисляемых веществ. Уже в незначительных количествах эти метаболиты
могут оказывать те или иные побочные эффекты: канцерогенные, мутаген-
ные, аллергенные и иные, в основе которых лежит их способность кова-
лентно связываться с биологическими макромолекулами — белками, нукле-
иновыми кислотами, липидами биомембран [1]. Внимание на указанные
здесь обстоятельства обратили не так уж давно и в основном вследствие
развития представлений о молекулярных механизмах процессов детоксика-
ции. Но именно эти представления позволили объяснить многие, казавшие-
ся ранее непонятными факты высокой токсичности некоторых соединений
в определенных условиях.
На 16-м Европейском рабочем совещании по метаболизму ксенобиоти-
ков (июнь 1998 г.) были представлены многочисленные примеры модифи-
кации токсичности ксенобиотиков. В частности, 2,6-дихлорметилсульфо-
нилбензол (2,6-ДХБ) образует в обонятельной системе мышей токсические
метаболиты, а 2,5-ДХБ не образует. Метаболизм бензола в печени одних
линий мышей приводит к образованию токсических метаболитов, других —
нет, причем зависит это от активности цитохрома Р-450. Метаболическая
активация противоопухолевых соединений у разных видов различна; разли-
чие может относиться и к разным особям. Изозимы цитохрома Р-450 опре-
деляют различие в кинетике метаболизма ксенобиотиков. На основе разви-
тых представлений предложена тест-система in vitro для определения мета-
болизма и токсичности ксенобиотиков по отношению к печени, легким,
кишечнику и почкам разных индивидуумов человека. Указано на обязатель-
ное проведение терапевтического мониторинга при лечении алкоголизма
дисульфирамом: необходимо назначать лечебную дозу препарата в зависи-
мости от особенностей его метаболизма у разных особей, а не в зависимости
от массы тела пациента, как это принято. Примеры можно видеть и в
трехтомной Encyclopedia of Toxicol [43].
2.3. Биохимические механизмы токсического действия
Токсическое действие ксенобиотиков на живые системы определяется их
способностью вмешиваться в течение фундаментальных биохимических про-
цессов и нарушать их. К таким фундаментальным биохимическим процессам,
составляющим основу жизнедеятельности, относятся синтез белка, дыхание,
39
энергетический обмен, метаболизм, в том числе и ксенобиотиков. Эти
фундаментальные процессы связаны с определенными внутриклеточными
структурами. Применительно к токсическому действию ксенобиотиков
Л.А.Тиунов [16] выделяет четыре основных структурно-метаболических ком-
плекса:
а эндоплазматический ретикулум, связанный с метаболизмом ксено-
биотиков;
а комплекс, связанный с процессами биосинтеза белка;
а митохондриальный, связанный с процессами биоэнергетики;
а лизосомный, связанный с процессами катаболизма.
Как всякая классификация, эта тоже условна, поскольку многие ксено-
биотики оказывают повреждающее действие на разные структурно-метабо-
лические комплексы. Примером могут явиться мембранотропные яды, ко-
торые повреждают любые биологические мембраны, составляющие основу
внутриклеточных структур и основу согласованно протекающих на них
биохимических реакций.
Рассмотрим кратко механизмы токсического действия применительно к
указанным выше структурно-метаболическим комплексам. Прежде всего
расскажем о механизмах, связанных с нарушением процессов метаболизма
ксенобиотиков. Многое о них было сказано в предыдущем разделе, но
дальше будут приведены новые примеры; одновременно остановимся и на
других механизмах. Самый благоприятный случай реализуется при согласо-
ванном действии оксидаз со смешанными функциями с ферментами конъ-
югации, а также антирадикальными и антиперекисными защитными меха-
низмами: интоксикация при попадании в организм липофильных ксенобио-
тиков, если их количество не слишком велико, не развивается. Однако в
случае превышения определенных уровней или сроков воздействия ксено-
биотиков возникает выраженное ингибирование или активирование оксидаз
со смешанными функциями; в этом случае система детоксикации оказыва-
ется не в состоянии обеспечить поддержку гомеостаза и развивается инток-
сикация. В частности, попадание в организм достаточного количества ин-
гибиторов микросомных монооксигеназ с последующим подавлением их
активности приводит к резкому возрастанию токсичности тех ксенобиоти-
ков, продукты микросомного превращения которых менее токсичны по
сравнению с исходными веществами. Так, введение белым крысам 1,1-ди-
хлорэтилена на фоне действия ингибиторов оксидаз со смешанными функ-
циями приводит к резкому возрастанию смертности животных. Уже упомя-
нутый нами ингибитор гидразин сернокислый приводит к частичной или
полной гибели белых мышей, которым введена далеко не смертельная доза
этанола, и эта гибель пропорциональна дозе гидразина и обратно пропор-
циональна времени его введения перед введением этанола. Усиление ток-
сических эффектов некоторых ксенобиотиков регистрируется не только при
подавлении активности микросомных монооксигеназ, но и других звеньев
системы детоксикации. Так, например, блокада печеночного глутатиона
диизопропиленацетоном вызывает значительное повышение частоты хрома-
тидных нарушений под влиянием бензпирена.
Активаторы и индукторы микросомных ферментов усиливают токсичес-
кое действие тех ксенобиотиков, токсичность которых ниже сравнительно
с токсичностью продуктов их метаболизма. Как и в случае ингибиторов
монооксигеназ, действие активаторов и индукторов зависит от их дозы и
времени воздействия.
Изменение устойчивости к действию ксенобиотиков является лишь
40
одной из форм проявления токсического действия, связанного с нарушени-
ем процессов их метаболизма. Другим видом патологии в результате воздей-
ствия ингибиторов или индукторов оксидаз со смешанными функциями
могут явиться эндокринные расстройства. Помимо ксенобиотиков, микро-
сомные ферменты обеспечивают катаболизм многих эндогенных соедине-
ний и в первую очередь стероидных гормонов. Нормальное функциониро-
вание микросомных ферментов поддерживает на необходимом уровне со-
держание стероидов в организме. Повышение активности этих ферментов
или их подавление приводит соответственно к снижению или чрезмерному
накоплению содержания стероидных гормонов в организме. Например, мно-
гие серосодержащие пестициды угнетают гидроксилирование тестостерона,
прогестерона, эстрадиола. Напротив, хлоруглеводороды повышают актив-
ность оксидаз со смешанными функциями и как следствие приводят к
уменьшению уровня подобных гормонов в организме. И в том, и в другом
случаях возникают гормональные нарушения.
Имеют место также токсические эффекты, связанные с непосредствен-
ным действием ксенобиотиков на микросомные монооксигеназы. Типич-
ным здесь является механизм токсического действия четыреххлористого
углерода, который растворяется во всех мембранных элементах клеток пе-
чени с преимущественным накоплением в микросомной фракции. Здесь он
связывается с цитохромом Р-450, и быстро протекающая реакция восста-
новления приводит к образованию радикала CCI3, который и является
пусковым звеном в механизме повреждающего действия этого ксенобиотика.
Радикал резко стимулирует перекисное окисление липидов, вызывая по-
вреждение биомембран, и приводит к деструкции цитохрома Р-450. В итоге
эти механизмы, вкупе с другими, менее существенными, вызывают гибель
клеток. Для описанного здесь вкратце механизма токсичности А.И.Арчаков
ввел термин “летальный распад”.
При взаимодействии ксенобиотиков с микросомными монооксигеназа-
ми могут образовываться не радикалы, а стабильные высокотоксичные про-
дукты, приводящие к интоксикации. Этот вариант токсического действия
называется “летальным синтезом”. Например, образование токсичной фтор-
лимонной кислоты из фторацетата, накопление формальдегида и муравьи-
ной кислоты при окислительном превращении метанола и др.
Все химические вещества, повреждающие синтез белка, можно подраз-
делить на 2 группы. Первая из них включает ксенобиотики, оказывающие
опосредованное влияние на синтез белка через изменение процессов био-
энергетики, гормонального статуса, проницаемости биомембран и т.д. На-
рушение синтеза белка в механизме их токсического действия является
вторичным явлением, осложняющим, но не определяющим развитие инток-
сикации. Примером могут быть хлоруглеводороды. Так, тетрахлоралканы
тормозят включение метионина и лизина в сывороточные белки и белки
печени. Имеет место и иной механизм: в процессе метаболизма ксенобио-
тиков образуются активные радикалы и перекиси, воздействующие на фос-
фолипиды мембран эндоплазматического ретикулума и повреждающие их,
что и способствует нарушению синтеза белка. В частности, ингаляция дихлор-
этана ведет к торможению включения лейцина в белки печени мышей и
обусловливает повреждение полирибосомных структур гепатоцитов. При си-
ликозе в легких тормозится синтез макрофагального белка; при хроническом
ериллиозе нарушаются процессы включения аминокислот в белки легких,
од воздействием свинца угнетается использование метионина для синтеза
елка; подавляется этот процесс и ртутьорганическими соединениями.
41
1
Вторая группа ксенобиотиков включает соединения, непосредственно
ингибирующие белковый синтез либо вмешиваясь в процессы транскрип-
ции, либо в процессы трансляции. Значительная часть ксенобиотиков на-
рушает процессы транскрипции, повреждая матрицу, т.е. ДНК. Под их
влиянием нарушаются ковалентные связи между нуклеотидами и модифи-
цируются их функциональные группы за счет образования комплексов,
выпадения или разрушения участков цепи ДНК. Именно так действуют
алкилирующие соединения. Блокирует ДНК большая группа антибиотиков.
Матричные свойства ДНК повреждает большой класс ксенобиотиков акри-
динового ряда, интеркалируя между основаниями нуклеиновых кислот.
В результате снижается синтез мРНК (матричная рибонуклеиновая кислота)
и угнетается биосинтез белка. Аманитины, продукты ядовитых грибов рода
Amanita, нарушают транскрипцию путем угнетения активности РНК-поли-
меразы, что также приводит к подавлению синтеза белка.
Ксенобиотики, нарушающие трансляцию, могут быть подразделены на
группы в зависимости от стадии трансляции, на которую они действуют.
Так, например, на стадии инициации процесса трансляции действует дигид-
роксимасляный альдегид и метилглиоксаль, синтетические анионы — поли-
винилсульфат, полидекстрансульфат и др., трихотеценовые токсины грибов.
При этом механизм их действия может быть различным: алифатические
альдегиды блокируют прикрепление мРНК к рибосомам; поливинилсульфат
связывается с рибосомами в участке, где прикрепляется мРНК; другие
полианионы блокируют взаимодействие рибосомных субъединиц. Ксено-
биотики, нарушающие трансляцию на стадии элонгации, также могут иметь
разный механизм действия. Например, образование пептидной связи на
стадии элонгации блокируется эритромицином и олеандомицином. Дифте-
рийный токсин нарушает транслокацию. Несколько иным способом нару-
шают транслокацию циклогексимид и его производные. На стадии терми-
нации процесса трансляции действует тенуазоновая кислота, подавляющая
отделение новообразованных белков от рибосом.
В заключении рассмотрения нарушения синтеза белка ксенобиотиками
укажем на возможность подавления процессов активирования аминокислот
и угнетения активности аминоацил-тРНК-синтетаз. К веществам, действу-
ющим именно таким образом, в первую очередь относятся синтетические
аналоги природных аминокислот, например 5-метилтриптофан, 2-метилгис-
тидин, метилгомоцистеин, цисфторпролин, фторфенилаланин, этионин, ка-
наванин и др. Эти ксенобиотики тормозят включение в белки природных
аминокислот за счет конкурентного ингибирования соответствующих ами-
ноацилсинтетаз.
Общебиологическим механизмом реализации токсических эффектов яв-
ляется также нарушение биоэнергетических процессов, обычно связанное с
митохондриальным структурно-метаболическим комплексом.
2.4. Хемобиокинетика
Термин хемобиокинетика встречается не столь уж часто, обычно говорят
о фармакокинетике и реже — о токсикокинетике. Однако именно этот тер-
мин отражает суть предмета, в котором идет речь о прохождении химичес-
кого вещества через биологическую систему — организм, рассматриваемое ,
во времени. С точки же зрения использования терминологии это синонимы 1
[19], о чем уже говорилось в начале этой главы и что полезно подчеркнуть
еще раз. |
47 а»
На рис. 2.1, представленном выше, приведены пути проникания ксено-
биотиков в организм, основные направления их возможного перемещения
в нем, равно как и их метаболитов, и пути выделения тех и других из
организма. Очевидно, что в случае каждого конкретного соединения его
поступление, равно как и дальнейшие перемещения, метаболизм и выделе-
ние из организма достаточно индивидуальны, в том числе и в отношении
скорости этих процессов. Иначе говоря, судьба веществ в организме и их
кинетика характерны для каждого ксенобиотика. Однако в поведении ксе-
нобиотиков существуют общие закономерности, которые могут быть опи-
саны простыми математическими выражениями, иначе — математическими
моделями. И только некоторые параметры таких моделей оказываются ха-
рактерными для конкретных веществ. Нашей задачей является ознакомле-
ние с общими закономерностями кинетики и параметрами математических
моделей; более же полное ознакомление с хемобиокинетикой можно полу-
чить из цитированных в начале главы книги большого количества нецити-
рованных, но изданных и обычно имеющих в заголовке слово фармакоки-
нетика.
2.4J. Поступление ксенобиотиков в организм
В реальных условиях через легкие в организм поступают газообразные
(парообразные) ксенобиотики. Если вдыхаемое вещество достаточно устойчи-
во в организме, т.е. не подвергается или почти не подвергается биотранс-
формации, происходит его накопление. Последнее является результатом
динамического распределительного процесса, в котором кровь играет роль
промежуточной фазы: получая вещество из вдыхаемого воздуха, кровь отдает
его тканям, различающимся кровоснабжением и “емкостью” для данного
вещества. В результате отмечается характерная картина накопления доста-
точно устойчивых ксенобиотиков в крови, когда рост их концентрации в
артериях на первых порах заметно обгоняет рост концентрации в венах.
Однако с течением времени, по мере насыщения тканей, различие между
содержанием вещества в артериальной и венозной крови постепенно умень-
шается (рис. 2.3). Непосредственным отражением этого процесса является
постепенное увеличение концентрации ксенобиотика в выдыхаемом воздухе.
В итоге концентрация в выдыхаемом воздухе стремится к концентрации во
вдыхаемом, что соответствует наступлению насыщения. Практический при-
мер указанной зависимости представлен на рис. 2.4: измерялась концентра-
ция фторотана в выдыхаемом человеком воздухе (Св) при ее постоянной
концентрации во вдыхаемом (Со) и результат выражался в виде отношения
Св/С0. Это отношение может меняться от 0 до 1; последняя величина
достигается при полном насыщении организма.
Накопление устойчивых соединений в крови и в тканях может быть
описано экспоненциальной зависимостью, что наглядно представлено на
Рис. 2.5, где даны экспериментальная и теоретическая кривые насыщения
сальника крыс бензолом при вдыхании его паров. Математическое описание
этого процесса, т.е. его математическая модель такова:
С = хсо(1 - е-м),
— постоянная концентрация вещества в окружающей среде; А.—
оэффициент распределения ксенобиотика между сальником крыс и окру-
_ющей средой; к — постоянная величина накопления вещества в сальнике;
текущее время.
Время, мин
Рис. 2.3. Динамика концен-
трации этилового эфира в
артериальной (сплошная кри-
вая) и венозной (пунктирная
кривая) крови собаки при
вдыхании его паров в кон-
центрации 2000 мг/л.
В этом руководстве мы ограничимся общим описанием процессов ки-
нетики и не будем вдаваться в тонкости постоянных расчетов накопления
и выделения, а также иных параметров хемобиокинетики, поскольку в
настоящее время имеются доступные программы для их расчетов; кроме
того, эти вопросы достаточно полно описаны в наших предыдущих книгах
и желающие могут ими воспользоваться [3, 15, 17, 44].
Приведенный пример свидетельствует об экспоненциальном характере
накопления устойчивых соединений в отдельных тканях организма, которые
могут быть смоделированы одночастевой системой. Однако такое описание
изменения концентрации ксенобиотика в крови, что представлено на рис.
2.3, или выдыхаемом воздухе редко бывает адекватным — описать организм
одночастевой системой, как правило, не удается. Для моделирования орга-
Рис. 2.4. Увеличение концентрации
фторотана в выдыхаемом челове-
ком воздухе в зависимости от вре-
мени.
Рис. 2.5. Сопоставление экс-
периментальной кривой на-
сыщения сальника крыс бен-
золом при вдыхании его па-
ров в концентрации 3 мг/л
(пунктирная кривая) с теоре-
тической экспонентой этого
процесса (сплошная кривая).
низма используется многочастевая система, математически описываемая
суперпозицией экспонент. В качестве примера приведем моделирование
прохождения через организм трихлор- и дихлорфторметана [15]. На рис. 2.6
представлена использованная для анализа трехчастевая модель, состоящая
из центральной части (А), периферической части (Б) и альвеолярного про-
странства (В). Расчет на основе этой модели при условии крД = квыд свиде-
тельствует о задержке трихлорфторметана в среднем на 77 %, а дихлорфтор-
метана на 55 %. Модель позволяет рассчитывать концентрации веществ в
крови в любой момент времени в зависимости от уровня и режима их
ингаляции.
Следует понимать, что поступление веществ в организм при вдыхании
’ их паров зависит от ряда физиологических параметров организма: альвео-
лярной вентиляции, остаточного объема легких, проницаемости для данного
вещества альвеолярно-капиллярной мембраны, скорости легочного крово-
тока, минутного объема сердца, общего объема крови, массы легочной ткани
и ряда других параметров. Оно также определяется коэффициентами рас-
пределения вещества между воздухом и тканью легких, между воздухом и
j кровью, между кровью и разными тканями тела. Все эти показатели входят
в неявной форме в величину постоянной накопления к. Разные особи
одного и того же вида имеют более или менее различающиеся между собой
физиологические параметры, что приводит к вариабельности к даже в случае
проведения совершенно одинаковых опытов на разных особях. Кроме того,
физиологические параметры могут изменяться в процессе опыта, что ведет
к изменению к и возникновению вариабельности.
Известны попытки более точного описания процессов накопления ксе-
нобиотиков с учетом основных физиологических параметров организма. Это
так называемое физиологическое моделирование. Оно пока не получило
Рис. 2.6. Трехчастевая модель
прохождения газообразного ве-
щества через организм.
Вдох
к«д| к К,2
В~^~^А^±ХБ
К I Ке Кг1
г'выд I
Выдох
45
44
Рис. 2.7. Опыт с вдыханием паров метилацетата кроликом.
I — концентрация метилацетата во вдыхаемом воздухе; II — то же в выдыхаемом воздухе; III —
содержание сложных эфиров в крови (в единицах оптической плотности Q); IV — концентрация
спирта в крови; V — содержание формальдегида в крови (в единицах оптической плотности Q);
VI — процент задержки паров метилацетата (вычислено из данных I и II).
широкого развития из-за сложностей количественной оценки ряда иногда
трудно поддающихся такой оценке физиологических параметров и необхо-
димости использования специальных программ. Удачный пример физиоло-
гического моделирования приведен в книге [15], мы его не повторяем.
Помимо указанной книги, о физиологическом моделировании можно про-
читать и в других руководствах по фармакокинетике; достаточно просто этот
вопрос описан у В.А.Филова [18].
Иначе развивается процесс поступления в организм быстро метаболизи-
рующих соединений. Отмечаются случаи, когда они претерпевают распад
уже на поверхности слизистой оболочки и всасываются в кровь в виде
метаболитов. В других случаях метаболиты образуются в крови или при
первопрохождении через печень. Насыщения организма быстро распадаю-
щимися соединениями практически не происходит, что отражается на их
задержке при вдыхании паров; в противоположность рассмотренному слу-
чаю с медленно распадающимися газами в настоящем случае задержка
постоянна во времени. Это наглядно иллюстрируется данными рис. 2.7,
отражающими результаты опытов по определению задержки в организме
паров метилацетата. Видно, что разность концентраций метилацетата во
вдыхаемом и выдыхаемом воздухе постоянна, т.е. его задержка со временем
не меняется, что с прекращением вдыхания эфира он не обнаруживается и
в выдыхаемом воздухе — все задерживаемое количество быстро подвергается
превращениям. В результате быстрого метаболизма метилацетата, который
в силу этого в крови не накапливается, возникает достаточно устойчивый
метаболит — метиловый спирт. Этот метаболит накапливается в крови;
вместе с тем известно его дальнейшее превращение в формальдегид. Однако
рис. 2.8. Динамика концентра-
ции бензола в выдыхаемом че-
ловеком воздухе во время экс-
позиции и после ее прекраще-
ния. Со — концентрация бензо-
ла на вдохе.
формальдегид также нестабилен и увеличения его содержания в крови
установить не удается.
Для сравнения на рис. 2.8 представлен ход изменения концентрации
бензола в выдыхаемом воздухе человека. Основная часть задержанного в
организме бензола метаболизирует и выделяется в виде фенолов с мочой.
Но часть (до 12 %) выделяется в неизмененном виде с выдыхаемым возду-
хом.
Поступление веществ через кожу. Через кожу могут проникать газооб-
разные, жидкие и твердые вещества, преимущественно неэлектролиты. Для
электролитов, за исключением тяжелых металлов и их солей, в незначитель-
ной степени преодолевающих кожный барьер, проницаемость кожи остается
спорной, во всяком случае она невелика. Среди органических соединений,
вызывающих интоксикацию при проникновении через кожу, на первом
месте стоят ароматические нитро- и аминосоединения, фосфорорганические
пестициды, хлорированные углеводороды и элементорганические соедине-
ния.
Поступающие трансэпидермальным путем соединения попадают в ве-
нозную кровь, где их концентрация заметно превышает таковую в крови
артериальной. В случае относительно малого количества всасывающегося
таким путем вещества и достаточно хорошего его метаболизма в печени
артериальная кровь может и не содержать его. На рис. 2.9 представлены
результаты опыта по всасыванию стирола через кожу кролика и определе-
нию его в венозной и артериальной крови. Из рисунка видно, что стирол
хорошо проникает через неповрежденную кожу кролика, в значительных
количествах обнаруживается в венозной крови, в гораздо меньших количе-
ствах — в артериальной крови и появляется там позже.
Рис. 2.9. Кинетика стирола в ве-
нозной (а) и артериальной (б)
кРови кролика при всасывании
его через неповрежденную ко-
c. мг%
46
47
Основным условием проникания ксенобиотиков через кожу является их
липоидорастворимость, сочетающаяся с растворимостью в воде. Раствори-
мые в жирах соединения способны пройти через кожные жировые слои;
дальнейшее всасывание веществ с гидрофобными свойствами может ока-
заться затрудненным из-за плохого их растворения в крови. Из других
факторов, способствующих прохождению ксенобиотиками кожного барьера,
следует отметить температуру, поверхность соприкосновения и длительность
контакта. При экспериментальном изучении проникновения ксенобиотиков
через кожу следует иметь в виду, что кожа лабораторных млекопитающих,
как правило, более проницаема по сравнению с кожей человека. Кроме того,
следует помнить о разнице в соотношении поверхности тела и его массы у
мелких и крупных животных.
Поступление через желудочно-кишечный тракт (ЖКТ). Некоторые соеди-
нения, особенно липоидорастворимые, могут всасываться в кровь уже из
полости рта.* Всасывание в желудке зависит от характера его содержимого
и степени наполнения. Желудочные секреты могут значительно изменять
ксенобиотики, а также увеличивать их растворимость. Секреты кишечника
способны в некоторых случаях таким же образом воздействовать на неиз-
мененные и не всосавшиеся ранее соединения. Другая возможность превра-
щений ксенобиотиков в кишечнике связана с деятельностью кишечных
бактерий. Иллюстрацией этого может явиться восстановление ароматичес-
ких нитросоединений до соответствующих аминов.
При всасывании из желудка и кишечника вещества прежде всего попа-
дают в печень, где происходят те или иные превращения многих ксеноби-
отиков. В основном эти превращения направлены на обезвреживание со-
единений, но возможен и “летальный синтез”, о чем шла речь в разделе о
механизмах метаболизма ксенобиотиков настоящей главы.
Кинетику всасывания ксенобиотика из желудочно-кишечного тракта
обычно рассматривают в связи с поступлением в организм известной его
дозы. Многочисленные примеры этого обычны для фармакологической ли-
тературы. Токсикологическим примером может быть всасывание из желудка
кролика введенного туда циклогексиламина (рис. 2.10). Из рисунка видно,
что при этом циклогексиламин быстро появляется в крови, достигает в ней
значительных концентраций, одновременно с чем отмечается и его накоп-
ление в моче, далее идут очищение крови от циклогексиламина и неуклон-
ный рост его концентрации в моче. Процесс изменения концентраций
указанного вещества в крови хорошо описывается в рамках одночастевой
системы.
Рис. 2.10. Определение цик-
логексиламина в крови (1) и
моче (2) кролика после его
внутрижелудочкового введе-
ния.
48
2.4.2. Накопление ксенобиотиков в организме
Периодическое поступление ксенобиотиков. Накопление (кумуляция) ксе-
нобиотика в тканях организма может иметь место при его постоянном или
периодическом поступлении в организм тем или иным путем или одновре-
менно несколькими путями. При этом поступление должно превышать
очищение организма от ксенобиотика за счет всех возможностей — выделе-
ния различными путями и метаболизма, иначе накопления не произойдет.
Известна кумуляция свинца и стронция за счет их прочного связывания с
костной тканью и весьма медленного выделения из нее. Другим примером
накопления является депонирование кремния в легочной ткани.
Рассмотрим процесс накопления ксенобиотика в организме на примере
вдыхания газообразного вещества на производстве в условиях пятидневной
рабочей недели, т.е. довольно типичный случай. Принципиально этот слу-
чай, с точки зрения накопления, не отличается, например, от периодичес-
кого поступления ксенобиотика через рот или иным путем, как это имеет
место для фармакологических препаратов. Для возможности математичес-
кого описания процесса примем постоянство основных условий: концентра-
ции вдыхаемого вещества в воздухе рабочего помещения, времени ежеднев-
ного пребывания работника в этом помещении (t), сменяемого постоянным
периодом отдыха и сна (т), при этом в конце недели период отдыха состав-
ляет два дня (Т). Примем также, что очищение организма от вещества
происходит достаточно медленно (альтернатива — время свободного выде-
ления вещества мало по сравнению со временем накопления). Графическая
модель процесса для этого случая представлена на рис. 2.11.
Более подробное математическое описание процесса возможно, если
представить, что накопление вещества в организме и его выделение следуют
кинетике первого порядка, т.е. организм является одночастевой системой.
В этом случае накопление ксенобиотика в организме (его отдельных тканях)
описывается уже известным нам уравнением:
Cl = xC0(1-e-kl),
где Со — концентрация ксенобиотика во вдыхаемом воздухе, С[ — его кон-
центрация в организме в момент времени t (положим, что это время окон-
чания рабочего дня). Выделение же ксенобиотика описывается так же про-
стой экспонентой:
С = с1е"кет'
где ке — постоянная выделения, т — текущее время выделения (положим,
что это время окончания ежедневного отдыха). Содержание ксенобиотика
в организме после любого n-го рабочего дня первой недели описывается
Уравнением:
ХС0(1 - e’k,)(1 - e-n<k,+ke’)
ис- 2.11. Процесс насыще-
ния и освобождения тканей
°т газообразного ксенобио-
ика в условиях пятидневной
Рабочей недели.
1 2 3 4 5 6 7 14 Дни
49
К началу следующего рабочего дня первой недели содержание ксенобио-
тика составит:
г min _r max Л-к_т
ип - сп е 6
(2)
Теперь рассмотрим вариант с рабочей неделей, состоящей из а рабочих
дней, включающих период работы t и период отдыха т, а также период
длительного отдыха Т (выходные дни), как это представлено на рис. 2.11.
Тогда содержание вещества в организме в конце любого рабочего дня р,
принадлежащего (т+1) неделе, можно найти из уравнения:
KCn(1 - e"k,)(1 - e-P<kt+ke’)
ртах _ 04________2______________
ат+р 1 _ e-(kt+k т)
+ C™ne’pkt e-<P-1)ke’.
(3)
причем 0 < р < а. Вывод этих уравнений можно найти в книге [15], там же
содержатся. некоторые подробные численные примеры, иллюстрирующие
использование уравнений. Даем эти примеры в сокращенном виде. Рассмот-
рим малорастворимый в воде хлороформ и смешивающийся с водой этило-
вый спирт. Достаточно реальной является ситуация, когда время работы
t = 8,4 ч, время ежедневного отдыха т = 15,6 ч, рабочих дней в неделе п = 5.
Постоянные для хлороформа: X. = 10,3; к ® ке « 0,08 мин'-1. Подставив
эти цифры в уравнение (1) и произведя расчет накопления хлороформа в
организме к концу рабочей недели, получим:
Сидень * Ю,ЗС0.
В конце любого другого рабочего дня также получим 10,ЗСд. А это
значит, что в результате работы в условиях вдыхания хлороформа в кон-
центрации Со каждый день достигается равновесное насыщение организма
хлороформом. Рассчитав выделение хлороформа по формуле (2), для конца
ежедневного отдыха получим 0, что свидетельствует об отсутствии накопле-
ния хлороформа в организме. Каждый день происходит насыщение орга-
низма парами хлороформа и затем полное его выделение, что находится в
соответствии и с экспериментальными данными.
Постоянные для спирта: А. = 2000, к » ке » 0,0007 мин-1. С§]^день = 94ОСо.
Воспользовавшись уравнением (3), найдем, что содержание спирта в орга-
низме в конце второй недели составит 942Cq, в конце третьей — 944Со и
т.д., т.е. будет происходить постепенное, хотя и очень медленное, нарастание
спирта в организме. При этом полного выделения его из организма не будет
даже в результате двух выходных дней: Cmin = ЗОСд. Это также соответствует
опытным данным.
Накопление ксенобиотиков, претерпевающих биотрансформацию. В этом
случае картина накопления ксенобиотика усложняется по сравнению с
накоплением вещества инертного, не подверженного метаболизму. Рассмот- ;
рим ее. Модель процесса такова: среда содержит ксенобиотик в постоянной j
концентрации Сд; биологическая система, в которую он проникает в coot- j
ветствии с кинетикой первого порядка, может быть интерпретирована одно- s
частевой моделью; метаболизм ксенобиотика в биологической системе, за- j
висящий от особенностей биологической системы и природы ксенобиотика, ,
также соответствует кинетике первого порядка. Математическая модель, j
вывод которой дан в указанной выше монографии, выглядит так: 1
c = ^£o-(1_e-(k + km)t)i
k + km
50
Рис. 2.12. Графическое изображение
процессов накопления в биологичес-
кой системе неметаболизирующих (1)
и метаболизирующих (2) (k = кт) ксе-
нобиотиков при одном и том же Сд.
с
где х _ коэффициент распределения ксенобиотика между средой и биоло-
гической системой, к — постоянная накопления вещества, km — постоянная
его метаболизма, С — концентрация ксенобиотика в биологической системе
в момент времени t.
Рассмотрим три частных случая: первый — накопление происходит зна-
чительно быстрее метаболизма, т.е. k > кт. Тогда кт можно пренебречь по
сравнению с к и уравнение примет вид:
С = ХС0(1 - e-kt).
Это уже известное нам уравнение накопления неметаболизирующих со-
единений.
Второй случай — скорости накопления и метаболизма равны, т.е. k = кт.
В этом случае С = 0,5XCg(l — e-2kt).
Устремив t к оо, получим предел, к которому стремится концентрация
вещества: С -> 0,5ХСд. Предел в этом случае в 2 раза меньше, чем в случае
нереагирующего вещества (при тех же X и Сд), достигается же он в 2 раза
быстрее, что иллюстрирует рис. 2.12. Третий случай — скорость метаболизма
значительно превышает скорость накопления, т.е. k < кт. Тогда
кХСп , . к
С = (1 - e’W)- При t -> оо, С ХС0.
Кт Кт
Следовательно, накопление ксенобиотика в биологической системе и в
этом случае имеется, но оно мало, тем меньше, чем меньше к по сравнению
с ^т- С увеличением разницы между постоянными накопления и метабо-
лизма предел накопления ксенобиотика стремится к 0. Логически это вполне
понятно —очевидно, что для процесса метаболизма вещества необходимо
его предварительное накопление хотя бы в незначительном количестве. При
этом скорость метаболизма вещества, измеряемая количеством метаболизи-
рующих в единицу времени его молекул, будет тем больше, чем больше
общее содержание вещества. При некоторой концентрации скорость мета-
болизма уравновешивается со скоростью поступления, что и определяет
насыщение биологической системы. Практически мы наблюдали этот слу-
чаи при изучении накопления сложных эфиров винилового спирта и жир-
ных кислот, а также некоторых других в организме животных. Благодаря
наличию в крови и тканях организма весьма активных эстераз сложные
фирм, попадая в организм, практически сразу же распадаются и при
Дыхании их паров в крови не обнаруживаются. Однако в случае вдыхания
сложных эфиров в массивных концентрациях имеют место их накопление
51
и возможность определения в крови. Понятно, что сразу после прекращения
вдыхания сложных эфиров они быстро, практически мгновенно, метаболи-
зируют и в организме уже не обнаруживаются.
Примеры практического использования приведенной формулы можно
видеть в книге [15].
2.4.3. Выделение ксенобиотиков из организма
Освобождение организма от ксенобиотиков и их метаболитов происхо-
дит разными путями, главные из которых — почки и кишечник. Элимина-
ция летучих соединений, нередко присутствующих в производственной сре-
де, в атмосферном воздухе или в жилых помещениях, в значительной сте-
пени осуществляется с выдыхаемым воздухом. Как правило, с выдыхаемым
воздухом выделяются неизмененные вещества сами по себе или вместе со
своими ближайшими летучими метаболитами. Лишь весьма редко в процес-
се метаболизма из нелетучих соединений образуются летучие. В этих случаях
они могут выделяться через легкие.
Растворимые в воде соединения выделяются главным образом через
почки. Уже указывалось, что в процессе метаболизма происходит преиму-
щественное увеличение полярности, а следовательно, и водоростворимости
метаболитов по сравнению с исходными соединениями. Это повышает воз-
можности их выделения с мочой. Меньшую роль играет выделение через
желудочно-кишечный тракт; большое практическое значение этот путь вы-
деления имеет для солей тяжелых металлов. Некоторое количество отдель-
ных ксенобиотиков может выделяться с потом, слюной и молоком.
Достаточно часто токсические вещества и их метаболиты выделяются
сразу несколькими путями, причем преимущественное значение имеет ка-
кой-либо один из них. Примером может быть этиловый спирт. Большая
часть спирта подвергается в организме превращениям. Остальная часть,
примерно 10 % от общего количества, выделяется в неизмененном виде
главным образом с выдыхаемым воздухом, затем — с мочой, и в небольшом
количестве с калом, потом, слюной и молоком.
Если биологический объект, из которого выделяется ксенобиотик, мож-
но моделировать одночастевой системой, то процесс выделения описывается
простой экспонентой. Экспонента в полулогарифмических координатах пре-
образуется в прямую линию. На рис. 2.13 в полулогарифмических коорди-
натах показан процесс освобождения эпидидимального жира крыс от бен-
зола. Здесь же показан способ графического нахождения периода полувы-
деления вещества (рассмотрено 2 случая снижения концентрации бензола
наполовину). Это типичный случай выделения вещества в соответствии с
кинетикой первого порядка. Здесь вполне пригодна одночастевая система,
поскольку рассматривается обособленная ткань. В отдельных случаях кине-
тика выделения ксенобиотика из организма в целом или снижение его
концентрации в крови также может быть представлена простой экспоне-
нтой. Однако при более детальном анализе во всех этих случаях можно
установить, что выделение следует более сложному закону. Описание кине-
тики выделения веществ с помощью экспоненты является просто первым
приближением, иногда достаточным, а иногда и нет. Но и в случае отдель-
ных тканей такое моделирование не всегда оправдано. Например, снижение
концентрации сероуглерода в подкожном жире крыс описывается биэкспо-
ненциальной зависимостью (рис. 2.14). Математическое выражение этой
двойной экспоненты имеет вид:
52
Рис. 2.14. Графическое изображение вы-
деления сероуглерода из подкожной жи-
ровой клетчатки крыс.
Рис. 2.13. Графическое изображение сни-
жения концентрации бензола в эпидиди-
мальном жире крыс.
С = 8,66e-0'46t+ 0,052e-O'°35t.
При детальном изучении очищения крови собак от дихлортетрафторэта-
на была установлена трехэкспоненциальная зависимость:
С = 1250e-o,375t+ 75e-0'06t+ 42e-0016t.
Хемобиокинетика дихлортетрафторэтана у собак может быть интерпре-
тирована, таким образом, трехчастевой моделью (она включает одну цент-
ральную часть и две периферических, тканевых, части). Выделение свинца
из крови экспериментальных животных в полулогарифмических координа-
тах соответствует четырехэкспоненциальному процессу, конкретное описа-
ние которого в математических терминах таково:
С = I8e-O’8t+ 4e~°'04t+ 1,1e-0'007t+ O,16e~°'ooo6t.
Приведенные уравнения свидетельствуют о многофазности объекта, из
которого имеет место элиминация изучаемого ксенобиотика. При этом
многофазность следует понимать не только буквально, в виде, например,
разных, резко различающихся между собой по физико-химическим свойст-
вам тканей, но и в виде различной связанности ксенобиотика с тканевыми
структурами одной ткани. Примером последнего является рассмотренное
нами выше двухэкспоненциальное выделение сероуглерода из подкожного
Жира крысы.
В монографии [44] и ее предшественнице [3] рассмотрен математический
аппарат кинетики выделения ксенобиотиков двумя и более независимыми
путями, выделения метаболита или параллельно образующихся нескольких
метаболитов, выделения метаболитов и исходного соединения и др.
53
2.4.4. Хемобиокинетика системы: материнский организм — плод
Известно, что многие ксенобиотики проникают через плаценту и попа-
дают в плод. Считается, что основным механизмом прохождения ксенобио-
тиками плаценты является диффузия. Хемобиокинетика этого процесса в
математических терминах может быть представлена достаточно просто при
некоторых допущениях. Первое из них — моделирование материнского ор-
ганизма и плода одночастевыми системами с хорошим перемешиванием;
далее — ксенобиотик достаточно стабилен, т.е. метаболизирует не слишком
быстро. При этих условиях уравнение для расчета концентрации ксенобио-
тика в плоде (Сп) имеет вид:
Сок
Сл = ГТ(е м е >
к - км
где Со — начальная концентрация введенного в материнский организм ксе-
нобиотика, к — постоянная перехода вещества через плаценту, км — посто-
янная уменьшения концентрации вещества в материнском организме.
Эта зависимость концентрации ксенобиотика в плоде от времени имеет
максимум в момент времени tmax:
lnkM - Ink
‘max= kM-k
Следовательно, при сделанных допущениях концентрация в плоде вве-
денного в материнский организм вещества изменяется от нуля в начальный
момент до максимальной величины в момент tmax и далее снова падает до
нуля t -» оо.
Все эти теоретические представления были подтверждены на примере
9,Ю-диметил-1,2-бенз-(а)-антрацена и 3,4-бенз-(а)-пирена, вводимых внут-
ривенно беременным мышам и крысам. Действительно, концентрация ука-
занных веществ в печени матери уменьшалась экспоненциально у мышей с
периодом полувыведения 40 мин, у крыс — 160 мин. На рис. 2.15 представ-
лены графики зависимости концентрации этих углеводородов от времени в
эмбрионах крыс. Графики соответствуют вышеприведенному уравнению.
Существенно, что снижение концентрации 9,10-диметил-1,2-бенз-(а)-антра-
цена и бенз-(а)-пирена в тканях эмбрионов происходит значительно мед-
леннее, чем в тканях матерей. Например, период полувыведения бенз-(а)-
пирена из эмбрионов мышей составляет примерно 180 мин (для матерей —
40 мин). В то время как в материнском организме вещества практически
уже отсутствуют, в тканях эмбрионов они продолжают определяться в за-
метных количествах. Это же было показано и для ртути при введении
беременным мышам метилртути [65]. Интересно, что с увеличением срока
Рис. 2.15. Динамика концентра-
ции ДМБА (1) и БП (2) в эм-
бриональных тканях крыс в за-
висимости от времени после
введения беременным живот-
ным.
54
беременности, при которой вводили это вещество, содержание ртути в
плодах возрастало, что можно трактовать как увеличение проницаемости
плаценты по мере приближения момента родов.
2.4.5. О нелинейных эффектах в хемобиокинетике
Обсуждая хемобиокинетические зависимости, до сих пор мы основыва-
лись на закономерностях кинетики первого порядка, т.е. на экспоненциаль-
ных зависимостях. При этом имеет место пропорциональность между ско-
ростью протекания процесса переноса и/или метаболизма вещества и раз-
ностью концентраций вещества в частях, между которыми этот перенос
осуществляется. В этом случае все кинетические постоянные, т.е. посто-
янные переноса и периоды полусуществования, являются действительно
постоянными, которые не изменяются со временем и при изменении
условий протекания процесса, например при изменении количества или
концентрации ксенобиотика. Вместе с тем каждый, кто имел дело с хемо-
биокинетическим экспериментом, знает, что на практике дело обстоит
далеко не всегда так. Постоянство кинетических параметров сохраняется
далеко не во всех случаях. Иногда их изменениями можно пренебречь,
особенно при формальном рассмотрении процессов, как это мы и делали
в предыдущем изложении материала. На практике же так бывает далеко
не всегда.
Графически нелинейные эффекты выражаются в том, что график про-
цесса в полулогарифмических координатах не линеен, в противоположность
представленному выше (см. рис. 2.13 и 2.14).
Причины нелинейности разнообразны и коренятся прежде всего в самом
объекте — живом организме с его многообразием приспособительных реак-
ций и богатыми возможностями изменчивости функционирования органов
и систем, а говоря языком кинетики — нестабильности частей. С другой
стороны, нелинейность может быть связана с особенностями поведения
ксенобиотиков. Например, нелинейные эффекты при рассмотрении абсорб-
ции веществ могут быть вызваны плохой их растворимостью и связанной с
этим низкой скоростью растворения и соответственно всасывания. Среди
основных причин отклонений от линейности находится насыщаемость ак-
тивных процессов всасывания при высоких дозах ксенобиотиков; изменение
гемодинамических показателей в области всасывания ксенобиотиков; вариа-
ции pH в желудочно-кишечном тракте, влияющие на судьбу ионизирован-
ных соединений; более или менее прочное связывание части вещества со
слизистой кишечника, с тканями, с белками крови и др.
Рассмотрим возможность количественного выражения нелинейных эф-
фектов в хемобиокинетике. Примером является кинетика ферментативных
процессов при достаточно высоких концентрациях метаболизирущегося ве-
щества. Причина нелинейности в этом случае связана с ограниченностью
ресурсов фермента. Имеет место его блокирование веществом по мере
увеличения концентрации последнего. На рис. 2.16 показано влияние кон-
центрации метаболизируемого вещества (С) на скорость его ферментатив-
ного превращения dC/dt. При низкой концентрации вещества скорость его
превращения возрастает пропорционально его концентрации. Иначе говоря —
это область кинетики первого порядка, при которой сохраняются все опи-
санные выше закономерности. Коэффициент пропорциональности в данном
^лучае является постоянной метаболизма вещества и в зависимости от своей
личины определяет наклон прямолинейной зависимости dC/dt = kC. На
dC
Рис. 2.17. График линейной и нелинейной
хемобиокинетики. Прямая линия 1 соответ-
ствует к=2,2; передняя 2 — к=0,55; линия 3
имеет параметры Vmax = 0,22 и Км = 0,1.
Рис. 2.16. Зависимость между кон-
центрацией вещества и скоростью его
ферментативного превращения.
I — зона реакции первого порядка; II —
зона смешанной реакции; 111 — зона реа-
кции нулевого порядка.
рис. 2.17 прямые 1 и 2 соответствуют значениям величин постоянной
метаболизма 2,2 и 0,55.
Однако фактически же, по мере возрастания концентрации вещества, в
связи с постепенным насыщением ферментативной системы, уже не успе-
вающей перерабатывать его в метаболит, рост скорости метаболизма веще-
ства замедляется (см. рис. 2.16). В зоне II концентрация кинетика первого
порядка сменяется смешанной кинетикой. При дальнейшем увеличении
концентрации вещества скорость метаболизма становится практически по-
стоянной, не зависящей от концентрации, максимально возможной. Обычно
эту скорость обозначают индексом Vmax dC/dt Vmax при С -» оо. По ее
достижении реакция превращения вещества в метаболит приобретает нуле-
вой порядок, при котором в единицу времени превращается определенное
количество вещества независимо от его концентрации. На основе рассмот-
ренных здесь в общей форме закономерностей создана количественная
теория ферментативных реакций, основное уравнение которой называется
уравнением Михаэлиса — Ментен по имени авторов теории:
dC _ Углах С
dt ” Км+С ’
где Vmax и Км — параметры уравнения. Это уравнение описывает кривую,
представленную ранее (см. рис. 2.16).
Понятно, что уравнение Михаэлиса — Ментен может быть приложено к
ферментативным процессам превращения любых ксенобиотиков, играющих
роль промышленных, бытовых, сельскохозяйственных и прочих ядов. Оно
будет справедливо также в случае неферментативных процессов насыщен-
ного характера. Примером может служить насыщение канальцевой секреции
вещества в почках при его большой концентрации в крови. Этим же урав-
нением описывается очищение крови от этилового спирта при его больших
концентрациях ранее. На рис. 2.17 приведено сравнение линейной и нели-
нейной кинетики. Кривая 3 на этом рисунке получена из уравнения Миха-
элиса — Ментен при условии, что Vmax = 0,22 и Км = 0,1. В этом случае
S6
У = 2,2 и прямая 1 — касательная к кривой 3; константа к — 2,2
линейного процесса — максимальная величина, если процесс нелинеен.
Не все причины нелинейных эффектов допускают использование урав-
нения Михаэлиса — Ментен. Например, резкое изменение гемодинамичес-
ких показателей или прочное связывание части вещества с биосубстратом
ведут к модификациям хемобиокинетики, не поддающимся столь простому
описанию.
Гигиеническая (профилактическая) токсикология чаще всего имеет дело с
небольшим количеством ксенобиотиков, проникающих в организм. При этом
часто соблюдаются законы кинетики первого порядка. Нелинейные эффекты
начинают проявляться в области относительно больших концентраций ксено-
биотиков. Другие причины нелинейности обычно встречаются незакономер-
но и ведут к отклонениям от линейности, воспринимаемым как случайные
явления. Именно это обстоятельство привело к тому, что хемобиокинетика
долгое время развивалась на основе линейных зависимостей. При этом у
многих исследователей вызывал неудовлетворенность факт зависимости ос-
новных параметров хемобиокинетики — постоянных переноса и периодов
полузавершения процесса — от дозы или концентрации. На основе рассмот-
ренных в настоящем разделе представлений этот факт, не поддающийся
описанию в рамках классической линейной хемобиокинетики, получил не-
сложное количественное описание, что позволило предположить широкое
использование в будущем параметров Vmax и Км вместо ныне применяемых
постоянных переноса и ti^.
Рассмотрим случай элиминации ксенобиотика из биологической систе-
мы за счет двух параллельных процессов — выведения неизмененного со-
единения и его метаболизма, т.е. весьма типичный случай. Первый из этих
процессов подчиняется кинетике первого порядка, а второй совершается в
соответствии с уравнением Михаэлиса — Ментен. Пока концентрация ксе-
нобиотика невелика, процессы соответствуют кинетике первого порядка,
поскольку метаболизм происходит в зоне I (см. рис. 2.16). В этом случае
постоянная элиминации равна сумме постоянных выделения неизмененного
вещества и постоянной метаболизма: к + Км. При достаточно высокой
концентрации отношение скоростей процессов элиминации окажется непо-
стоянным и зависимым от концентрации. Для математического описания
этого утверждения рассмотрим схему, где процесс В линеен, а процесс С —
нелинеен:
А.
Система уравнений, описывающая скорости элиминации ксенобиотика
по двум путям (VB и Vc), такова: VB = kA
,, VmaxA
с= км+а'
Отношение скоростей элиминации
\7~ = у (Км+А)
*С vmax
зависит от концентрации ксенобиотика (А).
57
Если в организм введена определенная доза вещества (D), то количества,
элиминированные за счет линейного процесса выведения неизмененного
ксенобиотика и нелинейного процесса его метаболизма, могут быть найдены
путем интегрирования уравнений вышеприведенной системы VB и Ус. Не
входя в детали интегрирования, приводим результат:
BT = D+^T£(1-e-k,)-VmaXT-
cT = vmaxT.
Разделив B-j- на Су, получим: тш
ВТ _ Vmax 1 - e~kt
СТ k %ахТ‘-
Последнее уравнение свидетельствует, что соотношение путей элимина-
ции зависит от дозы. При прочих равных условиях выделение неизменен-
ного вещества увеличивается с увеличением дозы.
Практических примеров увеличения выведения вещества в неизменен-
ной форме с увеличением дозы можно привести много. В частности, в моче
кроликов при дозе анилина 0,1 — 1 мг/кг в неизмененной форме его выде-
ляется менее 1 %, а при дозе 20—150 мг/кг — от 1 до 5,9 %. При дозе
циклогексана 0,3 мг/кг в выдыхаемом воздухе кролика он практически не
выделяется, а при дозе 360—390 мг/кг выделяется в неизмененной форме
25—38 %. При дозе сероуглерода 4 мг/кг в выдыхаемом воздухе крысы
выделяется 68 % сероуглерода, а при дозе 80 мг/кг — почти 100 %. При дозе
фторбензола 0,5 мг/кг крыса выдыхает 42 % неизмененного вещества, а при
дозе 1 мг/кг — 65 %.
Может быть случай, когда попавшее в организм вещество элиминируется
за счет метаболизма двумя независимыми путями. Классическим является
пример связывания бензойной кислоты или ее производных с глюкуроновой
кислотой и параллельно — с глицином. При этом реакция с глицином
нелинейна и в случае достаточно больших количеств бензойной кислоты ее
скорость ограничивается запасом свободного глицина. Образование же глю-
куронида обычно следует кинетике первого порядка. Очевидно, что приве-
денное выше рассмотрение полностью подходит и для этого случая.
Обратимся вкратце к нелинейным эффектам накопления ксенобиотиков
в биологической системе. Линейное накопление пропорционально дозе или
концентрации. Оно предусматривает сколь угодно высокое накопление ве-
щества в организме при увеличении его дозы. Понятно, что такой случай
нереален. Ввиду ограниченности объема организма и любой его ткани в них
может накопиться только ограниченное количество вещества. Для каждой
ткани существует свой предел насыщения веществом. Для разных веществ
этот предел различен, но он ограничивает возможность дальнейшего по-
ступления вещества в ткань, что проявляется возникновением нелинейнос-
ти. Уравнения таких процессов сложны и для работы с ними необходимо
обращаться к компьютерам с соответствующими программами. По существу
все простые уравнения мы представили в настоящей главе.
Следует подчеркнуть, что в большинстве практических случаев нелиней-
ные эффекты не имеют значения и могут не приниматься во внимание.
Особенно это относится к области гигиенической токсикологии, где посту-
пающие в организм количества ксенобиотиков, как правило, невелики. В этих
случаях кинетические процессы протекают в зоне линейных участков и
отклонения либо отсутствуют вовсе, либо малы. Нелинейность обычно
58
проявляется зависимостью кинетических параметров от дозы или концент-
рации вещества, а также их изменением во времени. С теоретической точки
зрения правомочно предложение И.В.Саноцкого [12] использовать переход
к нелинейным эффектам в качестве одной из характеристик вредного дей-
ствия ксенобиотиков. Подробнее этот вопрос рассмотрен в [15]. К сожале-
нию, практически этот переход трудно определяем, да и причины возник-
новения нелинейности различны.
2.4.6. Факторы, модифицирующие хемобиокинетику
Кинетические закономерности прохождения ксенобиотиков через организм
могут изменяться, как правило, количественно, в зависимости от многих условий.
Последний из известных нам обзоров о модификации хемобиокинетики был
опубликован в 1984 г. [19]. С тех пор появилось множество исследований,
авторы которых на конкретных примерах изучали действие тех или иных
факторов на кинетику веществ в организме или его отдельных частях. Мы
попытались классифицировать эти факторы и представить их в виде таблицы
(табл. 2.1). При этом в таблице нет указаний на направленность и интенсив-
ность модификаций; нам представляется, что этого сделать просто нельзя.
Таблица 2.1. Классификация факторов, модифицирующих хемобиокинетику
Название группы факторов Факторы, входящие в группу
Факторы, связанные с биологичес- ким объектом Индивидуальные особенности (генотип, фенотип) Время Возраст Пол ‘ Масса тела Видовые особенности Этнический фактор . ,.
Физиологические факторы Пища Физическая нагрузка Сон и положение тела Стресс Гемодинамические факторы Беременность и роды • Лактация. Яйценоскость кур и др. Циркадные ритмы ю
Патологические состояния Патология — печени — почек * — сердечно-сосудистая ’ Инфекция, воспаление, лихорадка 1 Заболевания эндокринной системы Метаболические нарушения Кистозный фиброз Онкологические заболевания Ожог
Факторы, связанные с окружающей средой Алкоголизм, наркомания Сезон года Температура
Факторы, связанные с формой по- ступления ксенобиотиков в орга- низм Давление кислорода г, Величина дозы, концентрация Режим поступления веществ в организм Путь поступления Форма поступления (лекарственная форма)
59
Продолжение
Название группы факторов Факторы, входящие в группу
Взаимодействие ксенобиотиков в Комплексоны
организме Курение Алкоголь
Различные загрязнители Лекарства и др.
Структура веществ и их физико-хи- Г омологи
мические свойства Изомеры Энантиомеры
,Г\ . ' Vil. Радикалы и др. ,,
Понятно, что эта таблица может быть дополнена. Однако она позволяет
в достаточной степени ориентироваться в возможных влияниях на течение
кинетических процессов с ксенобиотиками в организме. В случае действия
нескольких факторов одновременно картина их влияния может быть весьма
сложной.
2.4.7. Особенности хемобиокинетики аэрозолей
Аэрозоли составляют значительную часть токсичных загрязнителей ат-
мосферы и воздуха производственных помещений, а для таких классов веществ,
как металлы, их оксиды, соли и др., загрязнение воздушной среды встречается
почти исключительно в аэрозольной форме. Многие из этих веществ характе-
ризуются низкой растворимостью и даже практически нерастворимы, одна-
ко хроническая аэрозольная экспозиция приводит к развитию не только
местных патологических изменений респираторного тракта (хронические
бронхиты, силикоз и другие пневмокониозы), лишь условно, хотя и тради-
ционно выведенных за пределы интересов собственно токсикологии, но и
типичных интоксикаций (например, свинцовой). Ключом к пониманию
этих процессов и обязательным условием как грамотной оценки токсико-
аэрозольной экспозиции человека, так и ее адекватного моделирования в
эксперименте на животных является анализ токсикокинетики аэрозолей,
которая на первых и важнейших своих стадиях принципиально отличается
от токсикокинетики газов.
Анатомо-функциональные особенности респираторного тракта, вырабо-
танные эволюцией в направлении оптимизации условий газообмена — меж-
ду воздухом и кровью, а также строгого “кондиционирования” физических
характеристик воздуха, достигающего глубоких дыхательных путей, одновре-
менно делают органы дыхания почти идеальным “пылезадерживающим уст-
ройством”. В результате масса пыли, которая за относительно короткий срок
откладывается в них при дыхании даже обычным атмосферным воздухом,
могла бы оказаться несовместимой с жизнью, если бы та же эволюция не
обеспечила развитие физиологических механизмов самоочищения дыхатель-
ных путей от пылевых частиц, оседающих на их поверхности.
Действительно, два основных звена процесса самоочищения: фагоцитоз
частиц на свободной поверхности органов дыхания и мукоцилиарный транс-
порт, обнаруживаются уже в легких земноводных, т.е. на той эволюционной
ступени, на которой респираторный тракт как таковой еще только начинает
формироваться. Понятно, что иначе переход позвоночных к дыханию воз-
духом был бы невозможен. Хотя механизмы самоочищения функционируют
60
непрерывно, однако практически непрерывен (варьируя лишь по интенсив-
ности) и процесс отложения частиц из вдыхаемого воздуха. В силу того что
рассматриваемая ниже регуляция указанных механизмов адаптирует их к
уровню и характеру аэрозольной нагрузки с неизбежным запаздыванием,
динамическое равновесие между отложением и элиминацией не достигает
полной “чистоты” легких, в которых всегда оказывается задержанной та или
иная масса ингалированных частиц. Токсикокинетическое значение этой
массы двояко: с одной стороны, она определяет интенсивность местного
патологического процесса, вызываемого в легочной ткани накапливающим-
ся в них пульмонотоксичным и/или фиброгенным материалом, а с другой —
служит тем “депо”, из которого токсическое вещество может тем или иным
путем оказать действие на другие органы и ткани.
Поэтому для токсиколога необходимо прежде всего достаточно глубокое
знакомство с основными закономерностями отложения, элиминации и за-
держки ингалируемых частиц. Недоучет этих закономерностей или даже
принципиально неверные представления о них нередко служат основой
экспериментальных артефактов и необоснованных выводов. Иногда возни-
кают недоразумения и в связи с терминологическими неточностями; по-
этому имеет смысл дать краткое определение терминам, которые уже упо-
минались нами: “отложение”, “элиминация” и “задержка” частиц.
Под “отложением” подразумевается сепарация частиц из ингалирован-
ного воздуха за время полного дыхательного цикла, обусловленная различ-
ными причинами контакта этих частиц с поверхностью дыхательных путей
на любом уровне последних. Мерой отложения является разность между
концентрациями частиц в выдыхаемом и вдыхаемом воздухе. При его тео-
ретическом описании и моделировании респираторный тракт обычно делит-
ся по глубине на три области: назофарингеальную, трахеобронхиальную и
пульмональную (нередко называемую также альвеолярной, хотя в нее вклю-
чаются не только альвеолы, но и в целом глубокие дыхательные пути ниже
верхней трети терминальной бронхиолы). Соответственно рассматривается
суммарное или же региональное отложение частиц.
Понятие “элиминация частиц” употребляется наряду с понятиями “ле-
гочное самоочищение”, или “клиренс”. Различают назофарингеальный, тра-
хеобронхиальный и альвеолярный клиренс, кинетика и механизмы которых
различны. Однако в целом под клиренсом понимается освобождение дыха-
тельных путей от частиц, отложившихся в них при ингаляции, независимо
от путей, механизмов и скорости этого процесса.
Термин “задержка” обозначает относительно стойкое накопление в лег-
ких и в региональных лимфатических узлах тех частиц, которые не были
элиминированы. Однако элиминация не ограничена во времени, с чем
связана недостаточно четкая количественная определенность понятия “за-
держка” и ее оценок. Как будет ясно из дальнейшего, при хронически
постоянной пылевой экспозиции со временем может установиться более или
Менее стойкое равновесие между отложением и элиминацией частиц, т.е.
задержанная их масса более не нарастает. Однако чаще всего идет речь не
° такой равновесной задержке, а о массе вещества в легких через то или
иное время после кратковременной ингаляционной экспозиции.
Отложение частиц при дыхании. Не всегда учитывается, что концентра-
ция частиц в окружающем воздухе, даже измеренная непосредственно возле
головы, не эквивалентна концентрации в воздухе, входящем в верхние
Дыхательные пути, т.е. в ингалированном. Завышенная оценка последней
может обусловить завышенную же оценку степени отложения частиц в
61
дыхательных путях и в целом — токсической аэрозольной экспозиции. Это
связано с тем, что аэродинамические характеристики воздушного потока,
втягиваемого в ноздри, обусловливают определенную сепарацию витающих
в нем частиц по размерам, форме и плотности или, в общем выражении,
по аэродинамическим диаметрам (АД). Это обусловливает неодинаковую
“ингалябильность” частиц разного АД, которая зависит также от объема
дыхания и подвижности окружающего воздуха. Так, ингалируемая фракция
аэрозоля при объеме дыхания, соответствующем умеренной физической
нагрузке, и ветре не более 8 м/с равна приблизительно 100 % для мельчай-
ших частиц, но снижается до 50—55 % для частиц с АД 20—30 мкм, более
не изменяясь с увеличением АД до 100 мкм [81].
Следовательно, те относительно крупные частицы, которых в наиболее
распространенных полидисперсных аэрозолях дезинтеграции обычно не-
много по числу, но на которые приходится значительная или преобладаю-
щая часть суммарной массы витающей пыли, могут наполовину вообще не
попасть в дыхательные пути. Между тем пока практически не решена
важнейшая задача создания таких пробоотборников, которые адекватно
моделировали бы ингаляцию аэрозолей человеком, т.е. позволяли бы изме-
рять не суммарную концентрацию пыли, а именно “ингалябильную” ее
фракцию. Этот термин не следует путать с понятием “респирабельная”
фракция, о котором речь пойдет ниже. Не разработан теоретически и вопрос
о вероятных межвидовых различиях “ингалябильности”, т.е. нет пока уве-
ренности в том, что ингалябильная фракция суммарной концентрации аэро-
золя для человека и лабораторных животных совпадает.
Дальнейшая судьба ингалированных частиц, т.е. вероятность их отложе-
ния, определяется в основном тремя физическими механизмами: седимен-
тацией, импакцией и диффузией. Седиментация (осаждение), т.е. равномер-
ное прямолинейное движение частиц книзу при уравновешивании силы
тяжести силой сопротивления вязкой среды описывается известным физи-
ческим законом Стокса. Скорость такого движения пропорциональна вто-
рой степени диаметра сферической частицы и лишь первой степени ее
плотности. Импакция, или инерционное отделение аэрозольной частицы,
происходит при резком изменении направления воздушного потока, когда
частица продолжает движение в прежнем направлении и ударяется о по-
верхность слизистой оболочки дыхательных путей. Диффузионный меха-
низм связан с хаотическим (броуновским) движением мельчайших частиц,
размеры которых соизмеримы с длиной свободного пробега газовых молекул
и которые поэтому оказываются под неуравновешенными ударами послед-
них. Чем интенсивнее такое хаотическое движение частицы и чем ближе ее
среднее положение к поверхности слизистой оболочки, тем выше вероят-
ность ее соударения с этой поверхностью и отложения на ней. Наряду с
перечисленными основными механизмами более или менее важная роль
принадлежит электростатическому отложению тех частиц, которые несут
электрический заряд.
Вклад всех этих механизмов в отложение частиц разного диаметра и на
разных уровнях респираторного тракта существенно неодинаков, что и оп-
ределяет основные закономерности как суммарного, так и регионального
отложения аэрозолей при дыхании. Так, вероятность седиментационного
отложения возрастает с увеличением АД, т.е. с повышением скорости седи-
ментации и уменьшением среднего расстояния от взвешенной в воздухе
частицы до подлежащей поверхности слизистой (т.е. с уменьшением диа-
метра дыхательной трубки) и со снижением скорости воздушного потока,
62
“сносящего” эту частицу в направлении своего движения и тем препятст-
вующего ее оседанию (эта скорость тем ниже, чем глубже дыхательные
пути). Поэтому если суммарное отложение нарастает с увеличением АД, то
иля отложения регионального зависимость от размера частицы более слож-
на Относительно крупные частицы, отлагаясь в вышележащей области
респираторного тракта, тем самым не могут проникнуть или только частич-
но проникают в нижележащую, что снижает вероятность их отложения в
последней. Например, исследователи [73] нашли, что альвеолярное отложе-
ние нарастает с увеличением АД только до приблизительно 4 мкм, а при
дальнейшем увеличении АД оно снижается. При этом в альвеолярную (пуль-
мональную) область вообще не проникают частицы с АД 15 мкм, в то время
как частицы до 2—2,5 мкм только здесь и отлагаются, поскольку они
практически не успевают осесть в вышележащих областях.
Инерционный механизм отложения действителен только для частиц с
достаточно большой массой и при этом требует достаточно высокой ско-
рости воздушного потока перед изменением его направления. Поэтому вклад
этого механизма в трахеобронхиальное отложение невелик, а в пульмональ-
ное — ничтожен, но он существен для назофарингеальной области, где бла-
годаря импакции отлагаются наиболее крупные пылевые частицы. Вместе с
тем в этой области существенную роль играет и диффузионный механизм
отложения мельчайших частиц, по-видимому, в связи с тем, что турбулент-
ность потока воздуха в носовых ходах, глотке и гортани повышает вероят-
ность приближения пылевых частиц к слизистой оболочке на такое рассто-
яние, которое делает возможным их удар о слизистую оболочку в результате
броуновского движения. Обычно принимается, что ниже верхней части
трахеи воздушный поток ламинарен, однако в пульмональной области рас-
стояние даже от оси потока до поверхности слизистой оболочки настолько
мало, что вероятность диффузионного отложения вновь возрастает. Естест-
венно, что как в назофарингеальной, так и в пульмональной области этот
механизм обусловливает отложение только тех мельчайших частиц, которые
способны к броуновскому движению. Большинством исследователей при-
нимается, что как общее, так и альвеолярное отложение, достигнув мини-
мума при АД приблизительно 0,2—0,4 мкм (в силу закономерностей седи-
ментации), с дальнейшим уменьшением диаметра частиц резко возрастает
за счет диффузионного механизма. Этот теоретический прогноз закладыва-
ется во все математические модели отложения аэрозолей, однако он недо-
статочно подтвержден экспериментальными данными.
Математические модели отложения аэрозолей при дыхании предлагались
многими авторами, однако до сих пор задача не решена. Некоторые модели
строятся эмпирически, т.е. представляют собой математическую функцию,
аппроксимирующую набор конкретных экспериментальных данных, полу-
ченных в опытах на добровольцах. Примером подобной модели может
служить уравнение для расчета так называемого фактора отложения (Хм):
xM = pg£--1.43Ylg
I ио I
-B/A-V (_1?[24/Q/Qq
Po^oJ ('о]
A d -—.диаметр частицы (от 0,5 до 8 мкм), р — ее плотность (от 0,91 до
’ г'см )< Q — средняя объемная скорость дыхания, t — длительность ды-
ельного полуцикла (при Qo = 1 мл/с, р0 = 1 г/см\ d0 =1 мкм, t0 = 1 с).
5—1о^ значении Хм от -1,0 до 0 суммарное отложение составляет всего
~~ 7о, но с увеличением Хм от 0 до приблизительно 3,0 нарастает до
63
90—95 %, причем уже при Хм > 2,5 появляется тенденция к выходу отло-
жения на “плато”. Заслуживает внимания то, что модель учитывает не
только размер и плотность частицы, но и физиологические параметры ды-
хания.
В той или иной форме характеристики дыхания принимаются во вни-
мание и рассматриваемыми ниже теоретическими моделями, которые обыч-
но прогнозируют снижение степени отложения с повышением частоты
дыхания и повышение степени отложения с увеличением дыхательного
объема. Однако при реальной физической работе легочная вентиляция до
определенного предела возрастает за счет примерно равного вклада обоих
названных факторов, а при особо тяжелых нагрузках дальнейшее ее увели-
чение достигается только благодаря увеличению дыхательного объема. При
заданном режиме дыхания, соответствующем именно такой тяжелой работе,
в эксперименте на добровольцах показано увеличение степени суммарного
отложения частиц по сравнению с произвольным спокойным дыханием.
Отложение в пульмональной области, по-видимому, более всего зависит от
длительности вдоха [73]. Необходимо, однако, не упускать из виду, что речь
идет о той или иной зависимости от характеристики дыхания не абсолют-
ного, а относительного отложения (т.е. доли частиц, отлагающейся в дыха-
тельных путях). Между тем в любом случае физическая работа связана с
повышением минутного объема дыхания, т.е. количества ингалированной,
а следовательно, и отложившейся пыли.
Возвращаясь к проблеме математического моделирования отложения,
перейдем ко второму классу моделей, которые строились на основе матема-
тического описания основных физических механизмов отложения и той или
иной геометрической модели респираторного тракта, причем эксперимен-
тальные данные на добровольцах использовались не столько для подбора
параметров таких моделей, сколько для проверки основанного на них про-
гноза. В 1966 г. несколько ранее предложенных моделей подобного рода
были обобщены специальной Рабочей группой по легочной динамике Меж-
дународного комитета радиационной защиты (МКРЗ) первоначально для
внутренней дозиметрии радиоактивных аэрозолей [31]. Вскоре эта модель
МКРЗ начала широко использоваться и для решения разнообразных задач,
связанных с прогнозированием опасности фиброгенных и токсических аэро-
золей.
На рис. 2.18 показан пример основанного на этой модели прогноза
регионального отложения частиц разного АД при заданных характеристиках
дыхания. Однако более поздние исследования поставили под сомнение
некоторые параметры модели МКРЗ, хотя лишь в редких случаях подвергали
ревизии ее теоретические основы. Так, судя по модели МКРЗ (см. рис. 2.18)
в доверительные границы пульмонального отложения попадает заметная
доля частиц и значительно большего диаметра чем 15 мкм, отложение
которых в этой области не подтверждается упоминавшимися выше экспе-
риментальными данными. Судя по тем же данным, модель МКРЗ несколько
переоценивает и трахеобронхиальное отложение частиц с АД 1—2 мкм [73].
Показано было также [40], что частицы с АД 0,5—1,0 мкм отлагаются всего
на 10—15 %, т.е. гораздо менее эффективно, чем прогнозирует модель
МКРЗ, причем в указанном диапазоне не обнаруживается зависимости
отложения от величины АД. По данным [38], модель МКРЗ резко переоце-
нивает отложение частиц с АД менее 0,5 мкм и более 7 мкм. Имеются
данные, что суммарное отложение частиц с АД 0,08 мкм равно всего 9 %
при дыхании ртом и 18 % при дыхании носом, что косвенно подтверждает
Рис. 2.18. График регионального
отложения частиц в респира-
торном тракте человека при 15
дыханиях в минуту с дыхатель-
ным объемом 1450 мл, прогнози-
руемого на основе модели МКРЗ
[Brain J.D., 1974].
По оси абсцисс — АД (в мкм); по
оси ординат — доля отложившихся
частиц (в %), в назофарингеальной
(N-Ph), трахеобронхиальной (Т-В) и
пульмональной (Р) областях.
роль броуновского движения в назофарингеальном отложении, однако в
целом этот результат намного ниже прогнозируемого той же моделью. Вмес-
те с тем для более крупных частиц некоторыми исследователями получались
достаточно хорошо согласующиеся с нею данные [45].
Возможно, что расхождения между прогнозируемым и наблюдаемым от-
ложением хотя бы отчасти объясняются тем, что ни модель МКРЗ, ни
какие-либо другие модели суммарного и регионального отложения аэрозолей не
принимают в расчет электростатический механизм. Как известно, большая
или меньшая, но почти всегда преобладающая доля витающих пылевых
частиц несет электрический заряд, возникающий либо в результате трения
при дезинтеграции пылеобразующего материала, либо при сорбции на этих
частицах легких аэроионов. Соотношение между частицами с зарядом раз-
ного знака обычно близко к симметричному; величина заряда варьирует от
нескольких до десятков и даже сотен элементарных зарядов и пропорцио-
нальна величине частицы. Еще в 1948 г. И.И.Лифшиц и соавт. отметили,
что электрозаряженные частицы маршалитовой и алюминиевой пылей об-
ладают в несколько раз более высокой способностью отлагаться в легких
человека по сравнению с электронейтральными. Математическое описание
электростатического отложения, предложенное Н.А.Фуксом [21], было позд-
нее подтверждено тщательно проведенными экспериментами с монодис-
персными аэрозолями заданного АД, униполярно заряженными пропуска-
нием через коронирующий разряд [67]. В частности, показано, что имеет
значение не знак, а лишь величина заряда частицы.
Особые сложности возникают при прогнозировании отложения гигро-
скопичных частиц, способных к увеличению диаметра по мере прохождения
респираторного тракта и насыщения воздуха водяными парами, за счет чего
существенно увеличивается их суммарное и изменяется региональное отло-
жение.
Все модели отложения гомогенны, т.е. рассматривают как аэродинами-
чески эквивалентные дыхательные пути одного порядка независимо от их
расположения по вертикальной оси. Вместе с тем анализ, учитывающий
неравномерность вентиляции разных отделов легких, указывает на то, что
65
наибольшая часть отложения ингалируемых частиц приходится на базаль-
ные, наименьшая — на апикальные отделы легких, причем эта неравномер-
ность уменьшается с увеличением дыхательного объема [70].
Как бы ни уточнялись математические модели отложения частиц в
легких, они в состоянии дать лишь усредненную его оценку и сами по себе
недостаточны для индивидуального прогнозирования опасности аэрозоль-
ной экспозиции, поскольку существует широкая межиндивидуальная вари-
абельность отложения. Укажем лишь на два подобных исследования. G.Tar-
roni и соавт. [76] показали, что суммарное отложение негигроскопичных
сферических частиц плотностью 1 г/см' и диаметром 0,3 мкм варьирует у
разных здоровых испытуемых от 8,7 до 21,4 %; у них же широка межинди-
видуальная вариабельность отложения частиц диаметром 0,6 мкм, причем
для этих частиц найдена корреляция отложения с резервным объемом вы-
доха. По данным [72], для разных аэрозолей и разных режимов дыхания
степень межиндивидуальной вариабельности отложения различна, но всегда
достаточно велика; коэффициент вариации от 14,3 до 60 % для альвеоляр-
ного отложения и примерно в тех же пределах для трахеобронхиального и
назофарингеального. Возможно, что эта вариабельность связана с индиви-
дуальными особенностями геометрии дыхательных путей.
Наряду с этим показано, что суммарное отложение в легких частиц
диаметром 1,0 мкм усиливается с нарастанием патологии обструктивного
типа и даже у бессимптомных курильщиков выше, чем у некурящих здоро-
вых испытуемых [57]. Это объясняется повышением эффективности седи-
ментационного отложения в связи с уменьшением диаметра мелких и мель-
чайших бронхов и замедлением тока воздуха. Наконец, важно отметить, что
при математическом моделировании отложения тонкодисперсных аэрозолей
с учетом возрастных морфометрических и функциональных особенностей
респираторного тракта прогнозируется более высокая степень отложения у
детей, особенно при расчете дозы отложившихся частиц на единицу поверх-
ности дыхательных путей, причем во всех областях (за исключением альве-
олярного отложения у новорожденных) [83].
При экстраполяции на человека данных экспериментального моделиро-
вания аэрозольных интоксикаций у животных (в том числе при использо-
вании этих данных для гигиенической регламентации) редко уделяется
должное внимание вопросу о межвидовых различиях отложения ингалиру-
емых частиц. Между тем если межвидовые различия “ингалябильности”, как
было отмечено выше, практически не изучены, то межвидовые различия
отложения несомненны. Согласно теоретическим соображениям и согласу-
ющимися с ними экспериментальными данными, полученными на мышах,
крысах, хомячках, кроликах и собаках, оно в целом пропорционально ве-
личине легочной вентиляции в расчете на единицу массы тела [64]. Экстра-
полируя эту зависимость, можно заключить, что у человека отложение
частиц относительно ниже, чем у мелких лабораторных животных. Иными
словами, при равных концентрациях частиц в ингалированном воздухе до-
зовая нагрузка на легкие подопытной крысы заведомо выше, чем на легкие
человека. Однако задача экстраполяции, как будет показано далее, значи-
тельно усложняется тем, что у этих видов существенно различны также
кинетические параметры элиминации, а следовательно, и задержки частиИ
в легких, которые у мелких животных (особенно у крыс) самоочищаются
значительно быстрее.
Задержка отложившихся частиц. Частицы хорошо растворимых веществ
либо превращаются в капельки соответствующих растворов еще в насыщен*
66
водяными парами воздухе дыхательных путей, либо растворяются вско-
НО,после отложения в них. Для таких частиц резорбция в кровь и отчасти
Ре фу является основным механизмом элиминации из респираторных
В ганов но одновременно и механизмом пульмонотоксического, а также
°бШетоксического действия. Однако, как уже подчеркивалось выше, для
большого класса аэрозолей весьма существенное значение имеет длительная
япержка пыли в легочной ткани частиц, характеризующихся крайне низкой
астворимостью, основные механизмы элиминации которых подчиняются
не физическим, а физиологическим закономерностям, хотя и для таких
частиц вклад растворения в кинетику легочного клиренса не всегда может
быть сброшен со счетов.
Даже для практически нерастворимой минеральной пыли сопоставление
той ее массы, которая обнаруживается посмертно в легких человека после
многолетней профессиональной экспозиции, с расчетным отложением за
тот же период, свидетельствует о том, что 98—99 % отложившейся пыли по
массе были элиминированы [49]. Это хорошо согласуется с прогнозом,
основанным на математических моделях отложения и клиренса, согласно
которому к концу 25-летнего периода работы в пыльной атмосфере в легких
должно остаться лишь 1,5 % всей той массы пыли, которая вошла в них за
весь этот период [45]. Все подобные оценки свидетельствуют о высокой
эффективности физиологических механизмов клиренса. Наряду с этим про-
водились и эксперименты на добровольцах, ингалировавших меченые мо-
нодисперсные тест-аэрозол и, с последующей регистрацией внешнего гамма-
излучения грудной клетки, которые дают непосредственную оценку инди-
видуальной эффективности легочного клиренса за то или иное (обычно не
превышающее несколько дней) время после разовой экспозиции. По дан-
ным этих экспериментов, задержка частиц к концу фиксированного отрезка
времени является весьма стабильной характеристикой каждого испытуемого,
но у разных лиц различается до 2—5 раз [26].
Эксперименты на добровольцах и животных свидетельствуют о том, что
раньше и полнее всего выводятся более крупные частицы. Наиболее просто
это объясняется тем, что чем больше АД частицы, тем на более высоком
уровне дыхательных путей находится максимум ее отложения, а следова-
тельно, тем короче путь ее транспорта из респираторного тракта в глотку.
Не следует забывать, однако, что при последующем прохождении через ЖКТ
частицы могут оказаться более растворимыми в кислом или щелочном
содержимом, и таким образом, не столько накопление подобного материала
в легочной ткани, сколько процесс ее самоочищения оказывается основным
токсикокинетическим механизмом, обусловливающим резорбцию и разви-
тие хронической интоксикации. К тому же на эту фракцию аэрозоля при-
ходится основная часть его массы.
О существенных межвидовых различиях свидетельствуют многие данные:
апример, в одном эксперименте период полувыведения частиц 5^Fe из
альвеолярной области был найден равным 16 дням у кошки, 28 дням у
^Рысы, 280 дням у обезьяны и 300 дням у человека [62]. По данным [75],
амоочищение легких от ингалированных частиц дизельного выхлопа у крыс
нЛЧительно эффективнее, чем у морских свинок, причем только у послед-
заметно снижение накопленной массы этих частиц за время длительного
^экспозиционного периода.
Отличительной особенностью кинетики самоочищения легких, реги-
е Рируемой в вышеописанных экспериментах на людях и животных, явля-
я то, что ее не удается описать одной экспоненциальной функцией, но
67
кривая элиминации частиц обычно легко разлагается как минимум на две
такие функции вида
у = х0 e"w,
где х0 — количество вещества, первично отложившегося при разовой инга-
ляционной экспозиции, a t — прошедшее после нее время.
Значения константы скорости элиминации к для каждой функции су-
щественно различны, и поэтому в течение какого-то времени кинетика
самоочищения практически определяется тем процессом, который характе-
ризуется наибольшим значением к, а потом резко замедляется. Первая, так
называемая быстрая фаза клиренса связывается преимущественно с элими-
нацией частиц, первично отложившихся в трахеобронхиальной области,
“медленная фаза” — с элиминацией частиц из пульмональной области. Пе-
риод полувыведения Ti^ зависит от величины и других особенностей частиц,
но если для первой фазы он может измеряться часами, то для второй —
днями и неделями. Вместе с тем при более длительных постэкспозиционных
наблюдениях обнаруживается и третья, еще более медленная фаза, для
которой Ti^ измеряется многими месяцами, а то и годами. Если кинетика
второй фазы определяется элиминацией частиц преимущественно со сво-
бодной поверхности легочного ацинуса (морфологической единицы, при-
мерно соответствующей понятию “пульмональная область”), то третью, еще
более замедленную фазу связывают с выведением из легких тех частиц,
которые проникли в интерстициальную ткань или иным образом оказались
“фиксированными” в легких [35].
Необходимо подчеркнуть, что самоочищение всех областей респираторного
тракта начинается одновременно и протекает параллельно. Тем не менее за
первой фазой утвердилось условное наименование “трахеобронхиальный”,
а за второй — “пульмональный”, или “альвеолярный”, клиренс.
Трахеобронхиальный клиренс. Клиренс частиц, первично отложившихся в
трахеобронхиальной области либо попавших в нее в результате перемещения
из пульмональной, осуществляется вместе с транспортом слизи, побуждае-
мым мерцательной активностью клеток реснитчатого эпителия. Таков же
основной механизм самоочищения назофарингеальной области. Нередко
поэтому говорят о “мукоцилиарном клиренсе” или “мукоцилиарном эска-
латоре”. Слизь движется дискретными порциями в виде капелек диаметром
0,5—10 мкм или более крупных “бляшек”, образовавшихся в результате их
слияния. Участки однонаправленного и одновременного биения ресничек
охватывают от нескольких до нескольких сотен рядом расположенных кле-
ток. Между отдельными такими участками нет ни синхронизации, ни даже
строгой однонаправленности биения, но тем не менее ими обеспечивается
общее краниальное направление мерцательной активности в бронхах, трахее
и гортани и общее каудальное направление — в носовых ходах. Скорость
перемещения слизи постепенно нарастает и, по некоторым оценкам, в
трахее она в 20—40 раз выше, чем в терминальных бронхиолах. Надежные
результаты непосредственного измерения этой скорости имеются только ДЛЯ
трахеи. Например, у крыс она равна 7,4±2,6 мм/мин, у собак — от 4,1 Д°
15,6 мм/мин, у некурящих испытуемых — 18,5±6,0 мм/мин [71]. Учитывая
значительно более существенные различия линейных размеров респиратор-
ного тракта, легко увидеть, что, несмотря на меньшую скорость мукоцили-
арного транспорта у мелких животных по сравнению с человеком, он обес-
печивает более быстрое самоочищение трахеобронхиальной области.
При неадекватности мукоцилиарного транспорта величине пылевой на-
грузки на назофарингеальную и трахеобронхиальную области дополнитель-
68
удаление слизи и отложившихся на ней частиц обеспечивается соответ-
ноеенНо чиханьем и кашлем (или сморканием и отхаркиванием мокроты).
п Внако количественный вклад этих рефлекторных и поведенческих реакций
освобождение органов дыхания от пыли пока не оценен.
В Пульмональный клиренс. С позиций количественного прогнозирования
зможности образования того токсикокинетического “депо”, каким явля-
ся масса малорастворимых аэрозольных частиц, накопившихся в легких,
механизмы самоочищения так называемой пульмональной области пред-
ставляют наибольший интерес, поскольку именно в ней происходит наибо-
лее длительная задержка неэлиминированных частиц. Кроме того, именно
эта масса обусловливает интенсивность развития наиболее характерных
местных патологических реакций хронического типа.
Хотя эти механизмы выяснены далеко не полностью, что объясняется
практической невозможностью непосредственного наблюдения за процес-
сом однако ряд взаимно согласующихся косвенных аргументов позволяет
составить о нем достаточно обоснованное представление. Несомненно, что
частицы, отложившиеся на свободной поверхности легочного ацинуса, в
норме довольно быстро начинают переноситься в зону действия мукоцили-
арного эскалатора, начинающуюся выше границы между средней и верхней
третями терминальной бронхиолы, причем попадают сюда как свободно
лежащие пылинки, так и содержащие их фагоциты. Именно причины этого
переноса остаются предметом догадок и косвенных умозаключений. Так,
предполагается, что дыхательные экскурсии альвеол обусловливают своего
рода “прибойное движение” жидкой выстилки, содержащей особый поверх-
ностно-активный фосфолипид (легочный сурфактант), который выносит
частицы и клетки к устью ацинуса подобно тому, как морской прибой
выносит на берег плавающий в воде мусор. По мнению ряда авторов, играет
роль также присасывание этой жидкости на границе со слизью благодаря
продвижению последней под действием дистальных реснитчатых клеток.
Частицы, не выведенные из альвеолярной области по ее свободной
поверхности с помощью рассмотренных или иных физических механизмов,
оказываются в состоянии проникнуть (пенетрировать) через альвеолярную
стенку в тканевую жидкость подлежащей интерстициальной ткани, т.е. в
зону лимфатического дренажа легких. По-видимому, короткие лимфатичес-
кие пути, открывающиеся устьями в бронхиолах, либо особые так называе-
мые жидкостные вены в альвеолярной стенке приводят значительную часть
этой пенетрировавшей пыли опять-таки в зону действия мукоцилиарного
транспорта, по мнению одних авторов, преимущественно в свободном, по
мнению других, также в фагоцитированном состоянии. Надо сказать, что
ни силы, заставляющие частицу пенетрировать, ни пути, по которым эта
пенетрация происходит, не выяснены. Неясно, является она результатом
эндоцитоза частиц клетками альвеолярного эпителия либо связана с их
проникновением в межклеточные поры Кона.
Какая-то часть пенетрировавших частиц неизбежно остается в ткани
межальвеолярных перегородок или переносится по длинным лимфатичес-
им путям в периваскулярную и перибронхиальную ткань, под плевру, во
Угрилегочные лимфоидные образования, во внелегочные (региональные
отдаленные) лимфатические узлы, а с дальнейшим лимфотоком — и в
Ровь, причем на всех этапах движения частицы накапливаются в том или
ом количестве и могут быть фагоцитированы. Поэтому именно пенетра-
оог частиц создает основную предпосылку к длительной задержке их в
Р анизме, прежде всего в легких и лимфатических узлах. Способны ли к
69
этой пенетрации и дальнейшей транслокации только свободные (т.е. не
успевшие фагоцитироваться либо вновь освободившиеся после распада ко-
ниофага) пылевые частицы? Мнения исследователей по этому поводу до сих
пор противоречивы, однако косвенные аргументы в совокупности указыва-
ют на преимущественную роль свободных частиц. Хорошо известно, напри-
мер, что чем цитотоксичнее пыль, т.е. чем интенсивнее вызываемый ее
частицами распад макрофага, тем больше ее обнаруживается в региональных
лимфатических узлах, а это накопление, как ясно из сказанного выше,
служит своего рода маркером пенетрации частиц в альвеолах. Напротив',
защита макрофага от цитотоксического повреждения пылью, например по-
ливинилпиридин-М-оксидом или глутаминатом натрия, приводит к сниже-
нию задержки цитотоксичной кварцевой пыли в лимфатических узлах всегда
в еще большей степени, чем снижает задержку ее в легких.
С этих позиций роль фагоцитоза частиц на свободной поверхности
ацинуса в пульмональном клиренсе пыли легче всего может быть объяснена
именно тем, что для поглощенных частиц исчезает или во всяком случае
сводится к минимуму возможность пенетрации, а следовательно — стойкой
задержки, и тем самым повышается вероятность пассивного перемещения
их в как бы “упакованном” клеткой состоянии по свободной поверхности
в сторону трахеобронхиальной области легких. Следует учесть, что при очень
большом выходе фагоцитов создается опасность задержки этого перемеще-
ния в устье ацинуса, которое имеет значительно меньшую площадь, чем вся
дренируемая им поверхность. Таким образом, избыточная мобилизация фа-
гоцитирующих клеток может из механизма клиренса пыли превратиться в
дополнительный механизм ее задержки. Риск подобного неблагоприятного
варианта особенно велик при воздействии высокоцитотоксичных пылей,
которые в силу причин, рассматриваемых далее, вызывают особо активную
мобилизацию кониофагов.
Вместе с тем о важном значении фагоцитоза в самоочищении свидетель-
ствуют данные о снижении задержки пыли в легких при повышении резис-
тентности альвеолярных макрофагов к повреждению и распаду. Однако в
подобных случаях организм обеспечивает эффективное самоочищение легких
не только без увеличения, но даже при снижении числа участвующих в нем
клеток. Это важное обстоятельство является одним из фактов, свидетельству-
ющих о наличии регуляторного процесса, связывающего мобилизацию фа-
гоцитирующих пыль клеток с интенсивностью их повреждения этой пылью.
Реакция альвеолярного фагоцитоза. Поглощение пылевых частиц, отло-
жившихся из воздуха на поверхности альвеол, выстланной жидкостью и
легочным сурфактантом, осуществляется лежащими в этой выстилке много-
численными свободными фагоцитоспособными клетками. При дыхании
фильтрованным воздухом у животных эта клеточная популяция на 98—99 %
состоит из макрофагов с небольшой примесью лимфоцитов и полиморфно-
ядерных лейкоцитов. В обычных условиях содержания и особенно при
наличии обычных для лабораторных крыс воспалительных явлений в легких
доля полинуклеаров — особенно за счет нейтрофильных лейкоцитов (НЛ)
заметно возрастает; присутствуют они в составе популяции свободных аль-
веолярных клеток и у людей, особенно у курильщиков. Так называемые
альвеолярные макрофаги (AM) относятся, подобно макрофагам других ор-
ганов и моноцитам крови, к системе фагоцитирующих мононуклеаров
(СФМ) и подобно всем клеткам СФМ имеют костномозговое происхожде-
ние. Однако наряду с транспортом этих клеток из костного мозга с кровью
(в форме моноцита) в некоторых органах существует местный самоподдер"
70
аюшийся пул макрофагов-резидентов, который позволяет организму наи-
Ж*18 е оперативно и без лишней системной реакции кроветворения воспол-
бО\ местный расход макрофагов и отвечать на умеренные локальные по-
НЯТбности в повышении их числа. В частности, экспериментами D.H.Bow-
Г34] убедительно показано, что подобным источником AM служит пул
нтерстициальных легочных макрофагов (нередко обозначаемых как гисти-
Нциты)- Вместе с тем наряду с таким местным источником мобилизации
макрофагов на свободную поверхность альвеолярной области популяция
свободных AM может пополняться также за счет прямой мобилизации
моноцитов из крови, а отчасти и благодаря сохранившейся способности AM
к делению [35].
Поскольку макрофаги интерстициального легочного пула безусловно
фагоцитируют часть пылинок, пенетрировавших в интерстициум в свобод-
ном состоянии, они так же, как и AM, могут подвергаться более или менее
выраженному повреждающему действию поглощенных частиц вплоть до
потери жизнеспособности и разрушения. Однако те интерстициальные мак-
рофаги, которые при некоторой пылевой нагрузке все еще сохранили ак-
тивную подвижность, могут вынести эту пыль из интерстициума на свобод-
ную поверхность пульмональной области при их мобилизации в качестве
AM. Этот механизм является наиболее вероятной причиной того, что после
прекращения пылевых экспозиций в легких у животных сравнительно бы-
стро снижается задержанная масса пыли, а на фоне продолжающихся экс-
позиций — причиной упоминавшегося выше постепенного достижения
“плато” задержки [53].
Основным методом количественного изучения свободной клеточной по-
пуляции респираторного тракта являются подсчет и цитологическая харак-
теристика клеток в осадке промывной жидкости — так называемого брон-
хоальвеолярного лаважа (БАЛ). Отмечаемая при этом усиленная мобилиза-
ция клеток в ответ на отложение аэрозольных частиц часто именуется
“реакцией альвеолярного фагоцитоза” (РАФ). Резкое увеличение числа AM
в БАЛ после пылевого воздействия с последующим постепенным возвраще-
нием к исходному уровню, происходящим параллельно пульмональному
клиренсу, отмечено уже давно, что послужило важным аргументом в пользу
гипотезы о ключевой роли РАФ в качестве механизма этого клиренса.
Увеличение числа AM в БАЛ зависит не столько от массы, сколько от числа
введенных пылевых частиц, и при равной дозе по массе тем выше, чем
меньше диаметр частиц [34, 36]. Если учесть, что вероятность встречи AM
с отложившейся в альвеолярной области частицей не зависит от массы
последней, то такое приспособление реакции именно к числу частиц био-
логически целесообразно. Следует отметить лишь, что на число AM влияют
Два противонаправленных процесса: не только мобилизация новых клеток,
но и разрушение части AM. В зависимости от дозы пыли, интенсивности
ее повреждающего действия и времени, прошедшего после отложения час-
тиц, соотношение между этими влияниями может быть различным. Поэто-
му, хотя безусловно доказано, что чем цитотоксичнее пыль и чем выше ее
Доза, тем больше мобилизуется AM, однако при определенных дозах высо-
оцитотоксичных пылей нередко улавливается начальная фаза снижения
числа AM в БАЛ.
Вместе с тем при любом пылевом воздействии всегда еще более резко
выщается число НЛ в БАЛ, причем возрастает численное соотношение
меЖДУ НЛ и AM [51, 55]. Такая усиленная мобилизация НЛ тем более
РДЖена, чем цитотоксичнее пыль. Она зависит и от дозы пыли, нарастая
71
с ее увеличением не ступенчато, как мобилизация AM, а непрерывно, что,
по-видимому, соответствует единственному источнику мобилизации НЛ в
легкие (из циркулирующих НЛ крови). При одном и том же пылевом
воздействии мобилизация НЛ тем менее выражена, чем выше групповая или
индивидуальная резистентность AM к цитотоксическому действию.
Связь между количеством и соотношением клеток БАЛ, с одной сторо-
ны, и интенсивностью повреждения макрофагов — с другой, навела на
мысль, что продукты разрушения макрофага (ПРМ) могут играть роль
естественного регулятора РАФ, которая и адаптируется к указанному по-
вреждению в соответствии с количеством образующихся ПРМ. Эта гипотеза
придает особую роль компенсаторного механизма именно мобилизации НЛ,
которая таким образом рассматривается как важный вспомогательный ме-
ханизм альвеолярного клиренса. И, действительно, несмотря на то, что
единичный НЛ поглощает в среднем значительно меньше пылевых частиц,
чем может поглотить единичный AM, за счет резко возросшего числа НЛ
суммарное число фагоцитированных пылинок в обоих клеточных пулах
может оказаться вполне соизмеримым. Это в особенности справедливо для
высокоцитотоксичных пылевых частиц, которые не могут оказаться в боль-
шом числе и внутри единичного AM, поскольку верхний предел этого числа
ограничивается повреждением и гибелью клетки. Ограниченная же фагоци-
тарная активность единичного НЛ как бы предохраняет его от цитотокси-
ческого повреждения. Перенос части пылевой нагрузки на пул НЛ (наряду
с увеличением числа AM) снижает вероятность “перегрузки” единичного
AM и тем самым — вероятность его гибели, т.е. в конечном счете способ-
ствует повышению эффективности клиренса.
Очевидно, ограничению той “жадности”, с которой AM фагоцитируют
высокоцитотоксичные частицы, в определенной мере способствует и то, что
резкое возрастание общего числа AM при отложении в легких таких частиц
происходит не только благодаря миграции зрелых клеток из легочного
интерстициального пула макрофагов, но и за счет тех клеток, которые еще
не полностью адаптировались к условиям функционирования на свободной
поверхности альвеол, а также за счет моноцитов крови. Эффективный
клиренс, с одной стороны, требует такого ограничения (во всяком случае,
когда речь идет о цитотоксичной пыли), а с другой — невозможен без
фагоцитирования частиц, переводящего их из свободного, т.е. создающего
условия для пенетрации, во внутриклеточное положение. Поддержание
близкого к оптимуму соотношения между этими противонаправленными
запросами выступает в качестве одной из задач адаптации фагоцитарного
механизма клиренса к степени цитотоксичности пыли.
Роль ПРМ в адаптации РАФ к количеству и степени агрессивности
отложившихся пылевых частиц, а также соотношение такой ауторегуляции
клеточных механизмов пульмонального клиренса с нейрогуморальной регу-
ляцией детально рассмотрены Б.А.Кацнельсоном и соавт. [8].
Математическое моделирование процессов клиренса и задержки. Модель
кинетики аэрозолей в респираторном тракте, предложенная Рабочей груп-
пой МКРЗ наряду с уже рассматривавшимся нами математическим прогно^
зом отложения частиц в разных областях, дает также прогноз их дальнейшей
судьбы, т.е. элиминации и задержки. Было принято, что из всех трех облас-
тей (т.е. назофарингеальной, трахеобронхиальной и пульмональной) воз-
можны как всасывание растворяющегося вещества в кровь, так и трансло-
кация в ЖКТ, а из пульмональной области также в лимфатическую систему
(откуда они тоже могут попасть в кровь или же резорбироваться в результате
72
тепенного растворения). Для этой же области в отличие от двух других
пОС описывает два потока частиц в ЖКТ: относительно быстрый и
М°Досительно медленный. Все эти потоки характеризуются, во-первых, оп-
°еНеленным значением периода полувыведения (Т1Л), а во-вторых, — фик-
сированной оценкой той доли отложившегося вещества, которая выводится
менно данным потоком. При этом, учитывая в основном растворимость
Иецхества, все возможные аэрозоли были разделены на классы D (от days —
в и) W (ot weeks — недели) и Y (от years — годы), характеризующиеся
Разными скоростями клиренса, а также разными величинами задержки.
Например, для класса Y параметры модели таковы. Назофарингеальный
клиренс таких аэрозолей характеризуется величиной Ti^ = 4 мин, причем
поток в ЖКТ составляет 99 %, а в кровь — 1 %. Для трахеобронхиального
клиренса Ти = Ю мин ПРИ том же соотношении между потоками. Быстрый
поток в ЖкТ из пульмональной области составляет 40 % клиренса и осу-
ществляется с Т.л = 24 ч; остальные потоки из нее имеют Т\а = 360 дней,
причем на медленный поток в ЖКТ приходится также 40 %, на поток в
кровь — 5 % и в лимфу — 15 %.
Не следует, однако, упускать из виду не только крайне ориентировочный
характер этих оценок, но и то, что базировались они скорее на отсутствии
конкретных экспериментальных данных, чем на их обобщении. Весьма
сомнительны и теоретические основания, например, для допущения одной
и той же скорости для резорбции вещества в кровь, контролируемой его
растворимостью, для пенетрации в лимфоток, зависящей прежде всего от
цитотоксичности частиц, и для транспорта в ЖКТ, осуществляемого рядом
сопряженных физиологических механизмов. Нет оснований и для предпо-
ложения о постоянстве соотношения между потоками. Наоборот, как уже
упоминалось, сегодня совершенно несомненно, что поток в лимфатическую
систему может быть больше или меньше в зависимости от цитотоксичности
частиц; что аэрозоли аморфного диоксида кремния, хотя и относятся к тому
же классу, что и кварцевая пыль, задерживаются в пульмональной области
меньше в силу того, что их растворимость (а следовательно, способность
всасываться в кровь) хотя и очень мала в обоих случаях, но все же сущест-
венно различна. Отметим также, что принятая моделью неизокинетичность
вещества, отложившегося в любой описываемой ею области респираторного
тракта, и доступность определенного элиминационного потока из этой об-
ласти только для строго фиксированной части этого вещества означают, что
с позиций частевого моделирования хемобиокинетических процессов каж-
дая область должна была бы быть описана как система, состоящая более
чем из одной части. В частности, наиболее интересующая нас кинетика
задержки пыли в пульмональной области требовала бы для своего описания
ч-частевой модели, если согласиться с четырьмя элиминационными пото-
ками из нее, принятыми авторами модели МКРЗ. Однако в этой модели
связи между такими частями отсутствуют и ее прямой перевод на язык
частевого моделирования неосуществим. Не описывая внутренних связей
процесса, она не дает возможности моделировать основные физиологичес-
Ие закономерности его и тем самым прогнозировать кинетические эффекты
Факторов, которые влияют на различные его механизмы и звенья и могут
УЩественно изменить его эффективность.
<-ама по себе неизокинетичность частиц, выводимых из пульмональной
ласти, соответствует и теоретическим предпосылкам, и эксперименталь-
1м данным. Наиболее явна неодинаковая скорость выведения в сторону
УКоцилиарного эскалатора, т.е. в конечном счете в ЖКТ тех частиц,
73
Рис. 2.19. Схема 7-частевой модели кинетики задержки практически нерастворимых
частиц в легких и региональных лимфатических узлах [Katsnelson В.А., 1992; 1994].
которые с помощью тех или иных механизмов переносятся в этом направ-
лении со свободной поверхности альвеол, и тех, которые уже успели фик-
сироваться в интерстициальной легочной ткани. Так, в экспериментах на
людях M.R.Bailey и соавт. [30] отметили, что кинетика самоочищения пуль-
мональной области от нерастворимых частиц с АД 1 мкм описывается
двухэкспоненциальной функцией с Т1Л порядка десятков дней для “быстро-
го” и порядка сотен дней для “медленного” компонента. J.D.Brain [35]
полагает, что “как только частицы покидают поверхность альвеолы и пе-
нетрируют под эпителиальный барьер, их удаление замедляется” и дает для
человека следующие оценки Ti^ самоочищения пульмональной области: от
дней до месяцев для непенетрировавших и до тысячи дней — для пенетри-
ровавших частиц (см. рис. 2.18).
T.J.Smith [71] предложил многочастевую модель пульмонального клирен-
са и задержки, в которой как свободная поверхность альвеол, так и интер-
стициальная ткань описываются несколькими частями (например, “свобод-
ные частицы”, “частицы в макрофагах” двух гипотетических классов, “вре-
менные” и “инкапсулированные” частицы интерстициальной ткани). К со-
жалению, многие допущения этой модели являются чисто умозрительными
и не учитывают реальных путей и механизмов пульмонального клиренса и
задержки (в том числе роли НЛ), а некоторые основанные на ней прогнозы
не соответствуют имеющимся эпидемиологическим данным. Нами была
предложена семичастевая модель, основанная на развитых в этой главе
представлениях (рис. 2.19).
Xi обозначает количество частиц в каждой части, Kij — константу ско-
рости переноса частиц из части j в часть i (kyoo — в ЖК.Т), w — постоянную
отложения частиц в пульмональной области из воздуха. Модель позволила
имитировать сдвиги, происходящие в результате “поломки” макрофагально-
74
механизма и нейтрофильной компенсации, а также различия кинетики
Г° пи связанные с зашитой макрофагов от повреждения действием глута-
пь1ната натрия [53]. С помощью этой же модели, вводя в ее константы
М*пько те изменения, которые соответствуют различиям пылей по степени
Т°тотоксичности, удалось хорошо имитировать экспериментальные данные
ЦИ кинетике накопления в легких и лимфатических узлах не только той
Пвапцитной пыли, для которой эти константы были первоначально найдены,
но и значительно менее склонной к такому накоплению малоцитотоксичной
пыли диоксида титана, а также значительно более к нему склонного высо-
коцитотоксичного кварца DQ12 [9, 54]. Тем самым находят подтверждение
те основные теоретические положения, на которые эта модель опирается:
способность только свободных частиц к пенетрации в интерстициум и к
переносу в лимфатические узлы, вспомогательная роль нейтрофильного
фагоцитоза, наличие обратного потока пыли макрофагами, мобилизуемыми
на свободную поверхность пульмональной области.
Позднее была предложена в принципе сходная модель, развитая шот-
ландскими исследователями с учетом наших теоретических положений [79].
Из иных представлений исходят W.Stober и соавт. [74], в многочастевой
модели которых описывается предполагаемый перенос пыли с макрофагами
не из интерстициума, а в него. Эта модель, хотя и дает хорошую аппрокси-
мацию экспериментальных данных по задержке многих пылей, оказывается
не в состоянии имитировать даже тенденцию к выходу на “плато”. Кроме
того, в ней нет связей, которые позволили бы прогнозировать кинетические
эффекты различной цитотоксичности частиц или действия цитопротекто-
ров, как это легко удается с помощью нашей модели.
Однако для многих практических целей та же пульмональная задержка
может быть достаточно адекватно описана одночастевой моделью, на что
указывает возможность аппроксимации ее кинетики одноэкспоненциальной
функцией, рассмотренной ранее. Экспериментальные и секционные данные
о накоплении в легких пыли при хронической экспозиции, полученные в
разные сроки длительного ингаляционного периода, фактически оценивают
содержание пыли суммарно в частях Х4 и Xg нашей модели, поскольку чем
дольше длилась экспозиция, тем меньше относительный вклад тех частиц,
которые содержатся в остальных, быстро очищающихся частях. Этот вклад
не выходит за пределы ошибки определения суммарной массы пыли в легких
(отдельно можно в этих случаях рассматривать лишь часть Х5 — пыль в
лимфатических узлах). Развертывание такой одночастевой модели в более
сложные, дающие системное описание процесса, имеет смысл лишь для
теоретических прогнозов и только тогда, когда имеются хотя бы косвенные
данные для идентификации такой многочастевой модели, т.е. для придания
определенных численных значений ее константам, что случается достаточно
редко. Вместе с тем в некоторых особых случаях оправдано некоторое
Усложнение одночастевой модели длительной пульмональной задержки, даю-
щей простое математическое описание опытных данных. Например, для
писания хронической задержки асбестовой пыли в эксперименте R.E.Bol-
°п и соавт. [33] была предложена модель с “перегрузкой” (т.е. с изменением
эффициента скорости элиминации после достижения некоторого уровня
адержки), а позднее [82] — модель с секвестрацией. В последнем случае в
Ульмональной области выделяется часть-"ловушка", неспособная к самоочи-
цы”ИЮ' В сУмме с лимфатическими узлами часть “инкапсулированные части-
является такой же ловушкой и в системной многочастевой модели [71].
Дело в том, что секционные и эпидемиологические данные некоторых
75
авторов согласуются с допущением, по которому после прекращения много-
летней пылевой экспозиции элиминация частиц, задержавшихся в легких
человека, пренебрежимо мала, так что моделью этой задержки вполне может
служить подобная часть-ловушка. Однако с лабораторными грызунами дело
обстоит совершенно иначе: за 8 нед после 40-недельной экспозиции масса
кварцевой пыли в легких заметно уменьшилась [66], так что безэлиминаци-
онная модель была бы совершенно неприемлемой (хотя для хуже элимини-
руемой асбестовой пыли модель с ловушкой и может оказаться адекватной).
При этом речь идет не о каких-либо принципиальных межвидовых разли-
чиях кинетики пыли, а лишь об упоминавшейся значительно меньшей
скорости ее элиминации у человека, что позволяет пренебречь самоочище-
нием легких за тот период жизни, который остается ему после многолетнего
“пылевого” стажа.
2.5. Количественная зависимость между структурой
и активностью ксенобиотиков при их биотрансформации
Исследование количественных зависимостей структура — биотрансформа-
ция — активность подразумевает построение математических моделей, по-
зволяющих количественно оценить сравнительную вероятность возникновения
токсического или иного биологического эффекта в ряду химических соединений.
Для получения таких зависимостей используются различные физико-хими-
ческие параметры, зависящие от структуры соединений. Для построения
наиболее обоснованных и надежных моделей связи структура — активность
необходимо понимание механизма интоксикации, которая, как показано в
предыдущей главе, непосредственно связана с биотрансформацией.
Биотрансформация — это биохимический процесс, в ходе которого вещест-
ва трансформируются под действием ферментных систем организма. Это
явление называют также метаболизмом или детоксикацией. Вместе с тем
определение “метаболизм” подразумевает усвоение организмом вещества в
качестве продукта питания, источника энергии. Очевидно, что далеко не все
чужеродные химические вещества могут играть эту роль, хотя их биотранс-
формация осуществляется в результате тех же химических реакций и с
участием тех же ферментных систем, что и биотрансформация продуктов
питания и эндогенных веществ.
В течение многих лет процесс превращения веществ в организме рас-
сматривался только как позитивное явление, направленное на уменьшение
токсичности, а случаи увеличения токсичности считались исключением и
получили название “летальный синтез”, поэтому термин “детоксикация”
был вполне оправдан. Однако, как будет показано ниже, с течением времени
накопилась информация о том, что повышение токсичности в результате
биохимических превращений веществ — скорее правило, чем исключение.
Поэтому термин “биотрансформация” более универсален и точен, чем ме-
таболизм или детоксикация.
Биотрансформация является важнейшей составляющей механизма хемо-
токсикокинетики и представляет собой сложный многостадийный процесс.
В ходе биотрансформации может образовываться ряд продуктов, часть из них
представляет собой соединения, менее опасные, чем исходные вещества, однако
другие могут быть более реакционноспособными, чем исходные, и вследствие
этого обладать более высокой биологической активностью. В предыдущей
главе подробно описаны биохимические механизмы метаболизма и токси-
ческого действия, а также обсуждены понятия “летальный распад” и “ле-
ьный синтез”. Процесс биотрансформации, в ходе которого образуются
Т сокоактивные продукты или промежуточные соединения, называется так-
ВЫ биоактивацией. Высокая химическая активность этих соединений опре-
же ет их способность легко связываться с биомолекулами. Взаимодействие
Омических веществ или продуктов их трансформации с биомолекулами
Хоедставляет собой ключевую реакцию механизма токсического действия.
Ключевая реакция запускает целый ряд биохимических и феноменологичес-
ких изменений' которые приводят к наблюдаемому токсическому эффекту.
Определение того, какой именно продукт трансформации (или исходное
вещество) участвует в этой ключевой реакции, позволяет теоретически обо-
сновать механизм токсического действия и выявить наиболее биологически
активное вещество.
В последние годы появились многочисленные экспериментальные и
теоретические исследования процессов биотрансформации, результаты ко-
торых приведены, например, в монографии [41]. Такие исследования вклю-
чают биологические эксперименты in vitro и in vivo, в ходе которых с
помощью методов современной аналитической химии (газожидкостная хро-
матография, масс-спектрометрия и др.) идентифицируются продукты био-
химических превращений, а также их аддукты с биомолекулами. Оценива-
ется также сравнительная токсичность исходных веществ и продуктов био-
трансформации.
Поскольку хемобиокинетика представляет собой сложный многостадий-
ный процесс взаимодействия вещества с организмом, нет и не может быть
универсального параметра или модели, с помощью которых можно было бы
описать все случаи интоксикации. Так, на первой стадии происходит аб-
сорбция вещества и транспорт его через липидные биомембраны и гидро-
фильные фрагменты клеток к активному центру, на котором происходит
биотрансформация вещества или его взаимодействие с рецептором. На этом
этапе важны такие показатели, как гидрофобность, растворимость, объем,
площадь поверхности молекулы. Эти параметры используются для построения
зависимостей структура — токсичность, описывающих неспецифическое дей-
ствие веществ, так называемые базовые модели. Базовая токсичность, опреде-
ляемая по этим моделям, соответствует случаю, когда эффект зависит в ос-
новном от дозы вещества, дошедшей до активного центра, а не от различий
в природе и скорости химического взаимодействия на этом центре.
Вторая стадия механизма токсического действия представляет собой
процесс биотрансформации с участием ферментов. На третьей стадии про-
исходит взаимодействие образовавшихся в ходе биотрансформации веществ
или интермедиатов с биомолекулами. На этой же стадии происходит взаи-
модействие стабильных веществ, не подвергающихся биотрансформации, с
биомолекулами-рецепторами, определяющее токсическое действие.
Вторая и третья стадии механизма взаимодействия представляют собой
химические реакции с участием ферментов, белков, ДНК. Если токсический
эффект определяется таким химическим взаимодействием, для описания
токсичности важны параметры, характеризующие реакционную способ-
ность. Физико-химические показатели, характеризующие каждую стадию
заимодействия в терминах патогенетической модели интоксикации, изло-
жены в работе [5].
Параметры реакционной способности веществ, в частности энергетичес-
е параметры, характеризующие вероятность (скорость, легкость) прохож-
нойИЯ химических реакций, могут быть рассчитаны методами вычислитель-
й, в частности квантовой, химии. Однако каждая стадия механизма вза-
77
имодействия вещества с организмом очень сложна для моделирования в
силу сложности структуры биомолекул, расчет электронных параметров для
которых на современном этапе практически невозможен. Поэтому при по-
строении соотношений структура — активность приходится использовать
параметры, характеризующие упрощенные модельные химические реакции
для описания более сложных биохимических взаимодействий. Так, в оксе-
ноидной модели действия монооксигеназ для построения соотношений
структура — активность рассчитывают параметры модельной реакции хими-
ческих веществ с атомарным кислородом [10].
Выбор параметров должен определяться тем, какая стадия взаимодейст-
вия является определяющей для веществ данного структурного ряда, т.е.
такой, на которой небольшие изменения химической структуры веществ
приводят к большой разнице в их токсичности.
В случае, когда определяющей стадией является взаимодействие веще-
ства с рецептором, необходимо рассчитывать параметры, характеризующие
электронное строение и реакционную способность самого вещества (энер-
гии высшей заполненной и нижней свободной молекулярных орбиталей,
заряды на атомах и т.д.). Если в результате экспериментальных исследований
установлено, что токсичность вещества определяется биоактивацией с об-
разованием высокореакционноспособных короткоживущих интермедиатов,
целесообразно рассчитывать параметры реакции, моделирующей реакцию
их образования [энергии образования интермедиатов A(AHf)], разности
энергий граничных орбиталей веществ (AEq,). Когда в результате биоакти-
вации образуются устойчивые высокотоксичные метаболиты, используются
параметры, характеризующие электронное строение и реакционную способ-
ность этих метаболитов (табл. 2.2).
Таблица 2.2. Выбор электронных параметров для построения количественных
соотношений структура — активность
Ключевая стадия взаимодействия веще- ства с организмом Параметры Примеры
Взамодействие ве- Характеристики исходных ве- Полихлорированные дибензо-р- щества с рецептором ществ: заряды на атомах, энер- диоксины, полихлорированные гии граничных молекулярных ор- бифенилы, взаимодействие с биталей Аь-рецептором Биоактивация с обра- Характеристики модельной реак- 1. Общая токсичность замещен- зованием короткожи- ции биоактивации: энергия акти- ных бензолов вущих интермедиа- вации, разность полных энергий 2. Общая токсичность аромати- тов или теплот образования интер- ческих аминов медиата и исходного вещества 3. Мутагенность и метгемогло- бинобразующая активность аро- матических аминов 4. Общая токсичность алифати- ческих нитрилов 5. Канцерогенность и мутаген- ность ПАУ Биоактивация с обра- Характеристики метаболитов: Мутагенность алифатических га- зованием устойчивых энергии граничных молекуляр- логенсодержащих соединений с метаболитов, более ных орбиталей, заряды на ато- короткой цепью токсичных, чем ис- мах, электронные плотности на ходные вещества атомах на граничных орбиталях молекул метаболитов
Примечание. ПАУ — полициклические ароматические углеводороды.
78
J
Интенсивное развитие в последние годы экспериментальных исследова-
й механизма взаимодействия на молекулярном уровне с изучением хемо-
!?Иокинетики и идентификацией образовавшихся метаболитов позволяет
елать обоснованные предположения о том, какая стадия является опреде-
СдЮщей. Пример результатов такого исследования — схема метаболизма
хлор- и бромзамещенных алифатических соединений — пропанов, пропенов
пропанолов описан в монографии [60, 61]. В ходе исследования были
определены пути биотрансформации, промежуточные соединения и ста-
бильные высокотоксичные метаболиты — галогензамещенные ненасыщен-
ные альдегиды и кетоны, взаимодействием которых с биомолекулами и
определяет в основном токсическое действие этих веществ на млекопитаю-
щих. Различия в токсичности веществ этого ряда могут быть описаны с
использованием параметров, характеризующих реакционную способность
метаболитов.
Для исследования зависимостей структура — биотрансформация — ак-
тивность необходимо подобрать ряд структурно родственных соединений.
Этот этап может быть выполнен с использованием компьютерных инфор-
мационно-поисковых систем, например RTECS (register of toxicologicol ef-
fects of chemicals), системы по токсичности и опасности веществ в воде [6]
или IRIS (integrated risk information system). Далее проводится поиск и анализ
литературы по биохимическим механизмам действия веществ этого ряда на
организм, процессам биотрансформации, данных о предполагаемых метабо-
литах и экспериментальных оценках их активности. Такие сведения не обяза-
тельно необходимы для всех членов ряда, а хотя бы для нескольких типичных
соединений. На основании собранных данных выбираются электронные пара-
метры, которые должны быть рассчитаны методами вычислительной химии и
использованы для построения соотношений структура — активность.
Изложенный подход, основанный на учете биотрансформации и приме-
нении методов вычислительной химии, был применен для получения соот-
ношений структура — активность в различных структурных рядах [7, 23—25].
Обзор зарубежных работ дан в монографии [4] и в [63, 68]. Этот подход был
применен при описании зависимостей смертельных и пороговых эффектов,
мутагенного и канцерогенного эффектов, метгемоглобинобразующей актив-
ности, нейротоксичности и других видов биологической активности от
структуры. В табл. 2.3 приведены данные таких зависимостей, в основном
из работ З.И.Жолдаковой и соавт.
Таблица 2.3. Установление зависимости структура — токсичность с использова-
нием электронных параметров
Структурный ряд Эффект Регрессионное уравнение
Замещенные бензо- лы Ароматические амины Общая токсичность Мутагенная активность в тесте Эймса Метгемоглобинобразующая ак- тивность на млекопитающих Токсичность для млекопитаю- щих lgLD5n= 1,64 + 1,23 AEmin г= 0,78 п = 25 р < 0,001 IgLCgn (мг/м3) = 4,55 + 0,93 ДЕт|П г = 0,93 л = 23 р < 0,001 1дМНД = -2,76 + 1,95 4Emin г = 0,91 п= 13 р< 0,001 1д(1/С) =-1,65 - 0.15 A(AHf) г - 0,82 п = 10 р < 0,01 ур %MtHb = 66,9 + 5,03 Д(ДН|) «I г = 0,91 п = 10 р < 0,001 lgl_D50 = -33,17 - 4,05 Д(ДН,) г = 0,82 п = 22 р < 0,01
79
Продолжение
Структурный ряд Эффект Регрессионное уравнение
Галогензамещен- Некроз почек IgC = -16,69 + 1,71 ДЕГ ные пропаны г = 0,99 п = 6 р < 0,001 Генотоксичность in vivo IgC = -18,07 + 1,73 ДЕГ г = 0,99 п = 6 р < 0,001 Галогензамещен- Мутагенная активность на бак- ^0™^ = -17,62 + 1,55ДЕГ- 0,79lgp ные углеводороды териях (вариант без активации) г = 0,76 п = 25 р < 0,001 и спирты с корот- Мутагенная активность на бак- lgDm„t = -26,24 + 2,54ДЕГ моль кой цепью териях (вариант с активацией) г = 0,76 п = 21 р < 0,001 IgD ш=-2,69-5,74|1дС| г = 0,76 п = 21 р < 0,001
Примечание. D — доза, С — концентрация, MtHb — метгемоглобин, Dmut — доза мутаген-
ности, МИД — минимальная действующая доза, IgP — коэффициент распределения октанол/вода.
Здесь и далее по всей книге летальная доза и летальная концентрация
обозначены в русском или латинском написании соответственно как ЛД50
или LD50 и ЛК50 или LC50.
Одним из примеров являются регрессионные уравнения зависимости
структура — острая и хроническая токсичность в ряду замещенных бензолов
[7, 10]. Токсичность бензола определяется его биоактивацией в процессе
гидроксилирования и эпоксидирования. Согласно оксеноидной модели и
результатам теоретического изучения методами квантовой химии [59], клю-
чевой реакцией, запускающей процесс биоактивации ароматических ве-
ществ, является присоединение кислорода к одному из атомов углерода
бензольного кольца с образованием “тетраэдрического” интермедиата:
Гипотеза состояла в том, что токсичность замещенных бензолов может
быть описана с использованием энергетического параметра (Emjn) — разнос-
ти полных энергий промежуточного ареноксидного интермедиата и исход-
ной молекулы замещенного бензола. В результате исследований получена
достоверная зависимость токсичности от этого параметра и показано, что
чем он меньше, т.е. чем устойчивее интермедиат и, следовательно, чем легче
он образуется, тем токсичнее соединение. Модель на основе этого параметра
применена также для соединений со сложными заместителями: бифенила,
хлорированных бифенилов, бифениловых эфиров, соединений типа дифе-
нилметана [7].
В проявлении канцерогенной и мутагенной активности ПАУ, например
80
нз(а)пирена и их производных (алкил-, галогено-, нитро-, аминозамещен-
&е ПДУ), определяющую роль играет биотрансформация. Наиболее зна-
НиЬмой характеристикой канцерогенной активности ПАУ является стабиль-
ость триолкарбониевых ионов [52]. Эти ионы являются интермедиатами
оеакции замещения S^l, в которую вступают метаболиты ПАУ — диолэпок-
сиды при взаимодействии с нуклеофильными центрами ДНК. Роль био-
тпансформации в канцерогенной активности ПАУ подтверждается соотно-
шениями структура — активность для последовательных метаболитов ПАУ —
эпоксидов и диолэпоксидов.
Канцерогенная и мутагенная активность нитрозамещенных алифатичес-
ких и ароматических углеводородов связана с биоактивацией через восста-
новление нитрогруппы под действием нитроредуктаз. Достоверные зависи-
мости мутагенной активности этих веществ для бактерий, полученные с
использованием в качестве параметров разности теплот образования про-
межуточных соединений реакции восстановления — анион-радикалов и ис-
ходных соединений, или энергии нижней свободной молекулярной орбита-
ли исходных соединений [42] подтверждают это положение.
Токсическое действие ароматических аминов определяется биоактива-
цией, на первой стадии которой происходит N-окисление аминогруппы.
При N-окислении ариламинов образуются N-фенилгидроксиламины, кото-
рые в кислой среде могут подвергаться перегруппировке Бамбергера до
аминофенолов. Было показано [47], что ферменты печени крыс могут ката-
лизировать такую перегруппировку. Первой стадией перегруппировки Бам-
бергера является образование нитрениевых ионов [27]. Нитрениевые ионы
могут образовываться также при неферментативном гетеролизе эфиров N-
фенилгидроксиламинов. Клеточные нуклеофилы, такие как глутатион и
нуклеофильные группы белков и ДНК, связываются с резонансно-стабили-
зированным ионом арилнитрения.
Кроме того, N-фенилгидроксиламины окисляются в эритроцитах окси-
гемоглобином до арилнитрозосоединений с одновременным образованием
перекиси водорода и метгемоглобина. Этим определяется метгемоглобиноб-
разующая активность многих ариламинов [2, 69].
Биотрансформация ариламинов может быть представлена ниже.
NO
81
На основании этой схемы была выдвинута гипотеза, что зависимости !
структура — мутагенная активность и структура — метгемоглобинобразую-
щая активность ароматических аминов могут быть описаны с использова-
нием одного энергетического параметра, характеризующего относительную
устойчивость двух последовательных метаболитов соединений на пути био-
активации через N-окисление: фенилгидроксиламинов и нитрениевых ио-
нов A(AHf) [24]. Вид полученных уравнений (см. табл. 2.3) свидетельствует,
что как мутагенная, так и метгемоглобинобразующая активность зависят от
этого параметра, и эти зависимости разнонаправлены. Чем устойчивее нит-
рениевый ион относительно фенилгидроксиламина, тем больше способность
ариламина вызывать мутагенный эффект и тем менее сильным метгемогло-
бинобразователем он является.
Количественные зависимости структура — острая и хроническая токсич-
ность ароматических аминов [25] являются еще одним подтверждением
возможности использования оксеноидной модели действия монооксигеназ.
Реакция N-окисления ароматических аминов может проходить через обра-
зование N-оксидного интермедиата ArNHO. Поэтому должен быть исполь-
зован параметр, характеризующий легкость реакции образования этого ин-
термедиата — разности теплот образования интермедиата и исходной моле-
кулы A(AHf)jnt. Достоверная зависимость острой токсичности для млекопи-
тающих при внутрижелудочном поступлении от параметра A(AHf)jnt показы-
вает, что чем устойчивее интермедиат относительно исходного соединения,
тем больше токсичность. По значению этого параметра вещества раздели-
лись на кластеры, показатели хронической токсичности в которых различа-
лись не более чем на порядок.
Зависимости структура — общая токсичность и структура — мутагенная
активность галогензамещенных углеводородов и спиртов с короткой цепью,
в частности галогензамещенных пропанов [22] построены с использованием
результатов экспериментальных исследований [60, 61]. Схема метаболизма
приведена выше на рис. 2.1. Для описания мутагенной активности для
бактерий наилучшим параметром является разность энергий граничных
молекулярных орбиталей ДЕгр. Этот параметр представляет собой характе-
ристику реакционной способности соединений в реакциях определенного
типа. Чем меньше ДЕгр, тем более реакционноспособно соединение. В данном
случае предполагалось, что этот параметр характеризует реакционную спо-
собность соединения в реакции замещения 5^2, при которой под дейст-
вием глутатион-5-трансферазы образуются короткоживущие эписульфоние-
вые ионы. Полученные уравнения свидетельствуют, что чем больше реак-
ционная способность соединения, тем выше его мутагенная активность. Для
соединений этого ряда возможен также метаболизм под действием моноок-
сигеназной системы цитохрома Р-450, присутствующей в клетках печени
млекопитающих, но отсутствующей у бактерий. В результате могут образо-
вываться стабильные высокотоксичные метаболиты — ненасыщенные гало-
гензамещенные альдегиды. Предположение состояло в том, что мутагенная
активность для млекопитающих может быть описана с использованием
электронных параметров стабильных метаболитов веществ этого ряда (раз'
ности энергий граничных орбиталей ДЕгр и максимального коэффициент^
при некарбонильном атоме С на нижней свободной молекулярной орбитали)-
Последний параметр характеризует способность метаболитов образовывать
циклические аддукты с ДНК. С применением этих параметров построены
соотношений структура — мутагенная активность в тесте для бактерий в
82
утствии микросомальной фракции клеток печени, содержащей моно-
ПРгигеназную ферментную систему (см. табл. 2.3).
оКСЕще одним примером зависимостей структура — биотрансформация —
ивность является полученное в работе [48] достоверное регрессионное
а1<авнение для прогноза острой токсичности алифатических нитрилов для
Ур при внутрижелудочном введении. Токсичность алифатических нитри-
лов определяется биотрансформацией, протекающей по схеме:
он
[О] |
R1 _ сн — CH -» R1 — с- — CN +он- -» R-1 — С — CN
L R2 R2 R2
Р I !.”
r1 _ С = O+ HCN
R2
Ключевой реакцией является образование радикалов, что подтверждает-
ся полученным регрессионным уравнением, в котором использован один
параметр — разность теплот образования радикала и исходного соединения.
Токсичность полихлорированных дибензо-р-диоксинов, полихлориро-
ванных дибензофуранов и полихлорированных бифенилов определяется их
взаимодействием с цитозольным Аь-рецептором. Способность полихлори-
рованных дибензо-р-диоксинов вызывать индукцию монооксигеназ корре-
лирует с величиной энергии высшей заполненной молекулярной орбитали
соединений [4], канцерогенность коррелируете поляризуемостью, т.е. опас-
ность определяется характеристиками исходных соединений. Подробно ме-
ханизм биологической активности и опасности этого класса соединений
изложен в обзоре [63].
При построении моделей структура — активность могут быть определены
граничные значения энергетических электронных параметров, за пределами
которых эффект не выявляется, что дает возможность отделить активные
соединения от неактивных. Так, в работе [32] с применением метода линей-
ного дискриминантного анализа показано, что по значению одного пара-
метра — энергии высшей заполненной молекулярной орбитали ароматичес-
кие амины могут быть разделены на обладающих мутагенной активностью
в тесте на бактериях и неактивных. Соединения, для которых значение этого
параметра выше определенной величины, обладают активностью, остальные
неактивны. Полученные результаты могут быть использованы для опреде-
ления минимальных энергетических требований для того, чтобы соединение
подвергалось биоактивации через N-окисление, поскольку энергия высшей
молекулярной орбитали характеризует способность соединений к окисле-
нию. Энергия высшей заполненной молекулярной орбитали метаболитов
ароматических аминов, N-фенилгидроксиламинов позволяет отделить со-
единения, обладающие метгемоглобинобразующей активностью, от неактив-
bix. Этот параметр связан с энергетическими требованиями процесса окис-
ения N-фенилгидроксиламинов в нитрозосоединения, в ходе которого об-
разуется метгемоглобин [23].
( Биотрансформация наблюдается как в организме, так и в биосистемах
те_ОЛогических системах) в окружающей среде и поэтому представляет ин-
Жаю ПрИ Оценке не только влияния на организм, но и поведения в окру-
ЦиЮц*ей среде. Оценки способности различных веществ к биотрансформа-
и в окружающей среде под действием различных биосистем (например,
83
специальных штаммов бактерий) может быть дана с использованием элек-
тронных параметров, характеризующих легкость реакций биотрансформа-
ции. Так, особенности биодеградации (скорость и путь трансформации) ди-
и трихлорзамещенных бифенилов под действием бактерий объяснены в
работе [56] с использованием того же параметра, который был использован
для характеристики легкости биотрансформации и токсичности замещенных
бензолов для млекопитающих.
Теоретически и экспериментально обоснованные количественные соот-
ношения структура — биотрансформация — активность позволяют подтвер-
дить наличие определенного механизма токсического действия и выделить
вещества, для которых данный механизм нехарактерен, дать количественную
оценку выраженности эффекта, отделить активные соединения от неактив-
ных, прогнозировать механизм и количественные характеристики биологи-
ческой активности неизученных веществ.
ЛИТЕРАТУРА
1. Арчаков А.И., Карузина И.И. Цитохром Р-450: окисление чужеродных соедине-
ний и проблемы экотоксикологии. — В кн.: 1-й съезд токсикологов России.
Тезисы докладов. — М., 1998. — С. 4.
2. Вредные химические вещества. Азотсодержащие органические соединения:
Справочник/Под ред. Б.А.Курляндского. — Л.: Химия, 1992.
3. Голубев А.А., Люблина Е.И., Толоконцев Н.А., Филов В.А. Количественная токси-
кология. — Л.: Медицина, 1973. — 288 с.
4. Дьячков П.Н. Квантовохимические расчеты в изучении механизма действия и
токсичности чужеродных веществ. — В кн.: Итоги науки и техники ВИНИТИ.
Сер. Токсикология. — 1990. — Т. 16. — 280 с.
5. Жолдакова З.И. Прогноз токсичности веществ в воде на основании зависимостей
структура — акгивность//Гиг. и сан. — 1987. — № 7. —С. 9—13.
6. Жолдакова З.И., Журков В.С., Харчевникова Н.В. и др. Методические основы
развития банка данных по эколого-гигиеническим свойствам веществ, загряз-
няющих окружающую среду//Гиг. и сан. — 1995. — № 2. — С. 27—30.
7. Жолдакова З.И., Харчевникова Н.В., Кустова Е.В., Синицына О.О. Прогноз ток-
сичности и опасности в проблеме единого эколого-гигиенического нормирова-
ния веществ в окружающей среде//Экология человека. — 1996. — № 3. — С. 16—21.
8. Кацнельсон Б.А., Алексеева Л.К., Привалова Л.И., Ползик Е.В. Пневмокониозы:
патогенез и биологическая профилактика. — Екатеринбург: УрО РАН, 1995. —
326 с.
9. Кацнельсон Б.А., Конышева Л.К, Привалова Л.И., Шарапова Н.Е. Математическое
моделирование кинетики задержки в легких и в легочно-ассоциированных лим-
фоузлах пылей разной степени цитотоксичности//Вопр. гиг. труда, проф. пато-
логии и пром, токсикологии. — Екатеринбург: Мед. научный центр, 1996.—
С. 59-66.
10. Кузнецов А.В., Дьячков П.Н. К оксеноидной модели механизма активации моле-
кулярного кислорода цитохромом Р-450: роль структуры субстрата//Молекуляр-
ная биология. — 1990. — Т.24. — Вып. 5. — С. 1373—1380.
11. Новиков С.М., Поройков В.В., Тертичников С.Н. Анализ тенденций в развитии
информационных технологий и обоснование концепции разработки банка ток-
сикологических данных SARETbase//THr. и сан. — 1995. — № 1. — С. 29—33.
12. Саноцкий И.В. Использование уравнений кинетики выведения ядов и их мета*
84
болитов из организма для установления порогов вредного действия. — В кн.:
Применение математических методов для оценки и прогнозирования реальной
опасности накопления пестицидов во внешней среде и организме. — Киев,
1976. — С. 48—50.
Сергеев П.В, Шимановский Н.Л. Рецепторы физиологически активных веществ. —
М.: Медицина, 1987. — 400 с.
14 Сергеев П.В., Галенко-Ярошевский П.В., Шимановский Н.Л. Очерки биохимичес-
кой фармакологии. — М.: РЦ “Фармединфо”, 1996. — 384 с.
15 Соловьев В.Н., Фирсов А.А., Филов В.А. Фармакокинетика. — М.: Медицина,
1980. — 424 с.
16 Тиунов Л.А. Биохимические механизмы токсичности. — В кн.: Общие механиз-
мы токсического действия. С.Н.Голиков, И.В.Саноцкий, Л.А.Тиунов. — Л.: Ме-
дицина, 1986. — С. 114—204.
17. Толоконцев Н.А., Филов В.А. Основы промышленной токсикологии. — Л.: Меди-
цина, 1976. — 304 с.
18. Филов В.А. Вопросы кинетики поступления, распределения, метаболизма и вы-
деления вводимых в организм извне химических агентов. — В кн.: Итоги науки.
Фармакология. Токсикология (проблемы токсикологии). 1965. — М.: ВИНИТИ,
1967. - С. 45-92.
19. Филов В.А. Модификация фармакокинетики и токсикокинетики. — В кн.: Итоги
науки и техники. Серия Фармакология. Химиотерапевтические средства. Т. 14.
Проблемы фармакокинетики. — М.: ВИНИТИ, 1984. — С. 3—113.
20. Филов В.А. Сегидрин — противоопухолевый препарат нового типа//Вопр. онкол. —
1994. - Т. 40, № 1-3. - С. 3-14.
21. Фукс Н.С. Механика аэрозолей. — М.: АН СССР, 1955.
22. Харчевникова Н.В., Жолдакова З.И., Журдов В.С. Теоретическое обоснование
связи структура — генотоксичность для млекопитающих и бактерий в ряду га-
логензамещенных алифатических соединений с короткой цепью//Вест. РАМН. —
1997. - С. 8-13.
23. Харчевникова Н.В., Жолдакова З.И. Соотношения “структура — метгемоглобин-
образующая активность” в ряду ароматических аминов//Гиг. и сан. — 1997. —
№ 3. — С. 41-44.
24. Харчевникова Н.В., Жолдакова З.И., Журков В.С. Теоретические подходы к про-
гнозу метаболизма и токсичности ароматических аминов//Гиг. и сан. — 1998. —
№ 4. - С. 62-65.
25. Харчевникова Н.В., Жолдакова З.И. Прогноз опасности веществ в рамках зави-
симостей структура — активность с учетом биотрансформации//Гиг. и сан.—
2000. — № 1.
26. Albert R., Lippmann М., Peterson N.T. et al. Bronchial deposition and clearance of
aerosols//Arch. Intern. Med. - 1973.-Vol. 131.-P. 115-127.
22. Anders M. W. (ed.). The bioactivation of foreign compounds. — New York: Academic
Press Inc. - 1985.
28. Archakov A.I., Bachmanova G.I. Cytochrome P-450 and active oxygen. London etc.:
laylor and Francis. — 1990. — 339 p.
Bolley M.R., Fry F.A., James A.C. Long-term retention of particles in the human
respiratory tract//J. Aerosol Sci. - 1985. - Vol. 16. - P. 295-305.
Bailey M.R., Hodgson A., Smith H. Respiratory tract retention of relatively insoluble
Particles in rodents//J. Aerosol Sci. — 1985. — Vol. 16. — P. 279—293.
85
31. Bates D.V., Fish D.R., Hatch T.F. et al. Deposition and retention models for internal 1
dosimetry of the human respiratory tract//Health Phys. — 1966. — Vol. 12. — P. 173— '
201.
32. Benign! R., Andreoli C. QSAR models for both mutagenic potency and activity;
applicayion to nitroarenes and aromatic amines//Environ. and Mol. Mutagen. — 1994 —
Vol. 24. - P. 208-219.
33. Bolton R.E., Vincent J.M., Jones A.D. et al. Ait overload hypothesis for pulmonary
clearance of UICC amosite fibers inhaled by rats//Brit. J. Industr. Med. — 1983. —
Vol. 40. - P. 264-272.
34 Bowden D.H. The alveolar macrophage//Environm. Health Perspect. — 1984. —
Vol. 55. - P. 327-342.
35. Brain J.D. Macrophages in the respiratory tract//Handbook of Physiology. Section:
Respiratory System. — Vol. II. Bethesda: Amer. Physiol. Soc. — 1985. — P. 447—471.
36. Brain J.D., Godleski J.J., Sorokin S.P. Quantification, origin and fate of pulmonary
macrophages//Respiratory Defence Mechanisms. — N.Y.: Marcel Dekker. — 1977. —
P. 849-892.
37. Brain J.D., Valberg P.A. Models of lung retention based on the ICRP task group
report//Arch. Environm. Health. — 1974. — Vol. 28. — P. 1 — 11.
38. Chan T.L., Lippman M. Experimental measurements and empirical modeling of the
regional deposition of inhaled particles in humans//Amer. Industr. Hyg. Assoc. J. —
1980. - Vol. 41. - P. 3399-3409.
39. Conjugation-Deconjugation Reactions in Drug Metabolism and Toxicity. Berlin etc.:
Springer. — 1994. — 530 p.
40. Davies C.N. Deposition of inhaled particles in man//Chemistry and Industry.—
1974. _ Vol. 11. - P. 441-444.
41. De Matteis F., Lock E.A. (Eds.) Selectivity and molecular mechanisms of toxicity. —
New York: McMillan. — 1987.
42. Debnath A.K., Debnath G., Shusterman A.J., Hansen C.A. QSAR investigation of the
role of hydrophobicity in regulating mutagenicity in the Ames test: 1. Mutagenicity of
nitroaromatic amines in Salmonella typhimurium TA98 and TA100//Environmental
and Molecular Mutagenesis. — 1992. —Vol. 19. — P. 37—52.
43. Encyclopedia of Toxicology. — London: Academic Press. — 1998. — Vol. 3. — 1500 p.
44. Filov V.A., Golubev A.A., Liublina E.L, Tolokontsev N.A. Quantitative Toxicology. N.Y.:
John Wiley. — 1979. — 462 p.
45. Gerrity T.R., Garrard S.C., Yeates D.B. A mathematical model of particles retention
in the air-spaces of human lungs//Brit. J. Industr. Med. — 1983. — Vol. 40. — P. 121—
130.
46. Goldblum A., Loew G.H. Theoretical study of cyrtochrome P450 mediated amine
oxidation//!. Amer. Chem. Soc. — 1985. — Vol. 107. — P. 4265—4272.
47. Gorrod J. W., Manson D. The metabolism of aromatic amines//Xenobiotica. —1986. —
Vol. 16, N 10. - P. 933-955.
48. Grogan J., De Vito S.C., Korzekwa K.R. et al. Modeling cyanide release from nitriles-
prediction of cytochrome P450 mediated acute nitrile toxicity//Chem. Res. Toxicol.
1992. - Vol. 5. - P. 548-552.
49. Gross P. The processes involved in the biological aspects of pulmonary deposition,
clearance and retention of insoluble aerosols//Health Phys. —1964.—Vol. 10."
P. 995-1002.
50. Hahn H., Eder E., Deininger C. Genotoxicity of l,3-dichloro-2-propanol in the 80S
86 J
rhromotest and in the Ames test. Elucidation of the genotoxic mechanism//Chem.
Biol. Interact. - 1991. - Vol. 80. - P. 73-88.
. Hemenway D.R., Absher M., Landesman M. et al. Differential lung response following
5 silicon dioxide polymarphs aerosol exposure. — In: Silica, silicosis and cancer. — N.Y.:
Praeger. - 1986. - P. 105-116.
52 Jerina D.M., Sayer J.M. et al. Carcinogenicity of polycyclic aromatic hydrocarbons:
the bay-region theory. — In: Carcinogenesis: fundamental mechanisms and environ-
mental effects/Ed. Pullman B., 1980. — P. 1 — 12.
53 Katsnelson B.A., Konysheva L.K., Privalova L.L, Morosova K.V. Development of a
multicompartmental model of the kinetics of quartz dust in the pulmonary region of
the lung during chronic inhalation exposure of rats//Brit. J. Industr. Med. — 1992. —
Vol. 49. - P. 172-181.
54. Katsnelson B.A., Konysheva L.K., Sharapova N.Ye., Privalova L.I. Prediction of the
comparative intensity of pneumoconiotic changes caused by chronic inhalation expo-
sure to dusts of different cytotoxicity by means of a mathematical model//Occup. and
Environm. Med. - 1994. - Vol. 51. - P. 173-180.
55. Katsnelson B.A., Privalova L.I. Recruitment of phagocytizing cells into the respiratory
tract as a response to the cytotoxic action of deposited particles//Environm. Health
Perspect. - 1984. - Vol. 55. - P. 3133-3325.
56. Kharchevnikova N.V., Zholdakova Z.I., D’yachkov P.N., Krasovsky G.N. Theoretical
study of the biodegradation of polychlorinated biphenyls//Fresenius Envir. Bull. —
1994. - Vol. 3. - P. 422-427.
57. Kim C.S, Lewars G.L., Sackner N.M. Measurements of total lunge aerosoldeposition
as index of lung abnormality//! Appl. Physiol. — 1988. — Vol. 64. — P. 1527—1536.
58. King C.M. (ed.) Carcinogenic and mutagenic responses to aromatic amines and
nitroarenes. — New York: Elsevier, 1988.
59. Korsekwa K., Loew G. et al. Cytochrome P-450 mediated aromatic oxidation: a
theoretical study//J. Am. Chem. Soc. — 1985. — Vol. 107. — P. 4273—4279.
60. Lag M., Omichinski J.G., Dybing E. et al. Mutagenic activity of halogenated propanes
and propenes: effect of bromine and chlorine positioning//Chem. — Biol. Interact. —
1994. - Vol. 93. - P. 73-84.
61.
62.
63.
64.
65.
66.
67.
Lag M.t Soderlung E.J., Omichinski J.G., Brunborg G. et al. Effect of bromine and
chlorine positioning in the inducrion of renal and testicular toxicity by halogenated
propanes//Chem. Res. Toxicol. - 1991. - Vol. 4. - P. 528-534.
Le Bouffant L., Henin J.-P., Martin C., Daniel H. Etude experimentale de 1’epiration
pulmonaire//Lille Medic. - 1972. - Vol. 17. - P. 1091-1101.
McKinney J. D. Reactivity parameters in structure-activity relationship-based risk assessment
of chemicals//Environmental Health Persp. — 1996. — Vol. 104. — P. 810—816.
McMahon T.A., Brain J.D., Lenott S. Species differences in aerosol deposition//lnhaled
Particles IV. N.Y.: Oxford: Pergamon Press. - 1977. -P. 23-333.
Olson F.C., Massaro E.J. Pharmacodynamics of methyl mercury in the murine mater-
nal/embrio: fetal unit//Toxicol. and Appl. Pharmacol. - 1977. - Vol. 39, N 2. -
P. 263-273.
Privalova L.L, Katsnelson B.A., Yelnichnykh L.N. Some peculiarities of the pulmonary
Phagocytotic response: dust kinetics and siilicosis development during long-term expo-
sure of rats to high quartz dust levels//Brit. J. Industr. Med. - 1987. - Vol. 44. -
p 228-235.
Prodi И, Mularoni A. Electrostatic lung deposition: experiments with humans and
animale//Ann. Occup. Hyg. - 1985. - Vol. 29. - P. 229-240.
87
68. Richards A.M. Role of computational chemistry in support of hazard identification:
mechanism-based SARs//Toxicology letters. — 1995. — Vol. 79. — P. 115—122.
69. Sabbioni G. Hemoglobin binding of monocyclic aromatic amines: molecular dosimetry
and quantitative structure activity relationships for the N-oxidation//Chem. Biol.
Interactions. — 1992. — Vol. 81. — P. 91 — 117.
70 Scott Ж R., Taulbee D.W. Aerosol deposition along the vertical axis of the lung//j
Aerosol Sci. - 1985. - Vol. 16. - P. 323-3333.
71. Smith T.J. Development and application of a model for estimating alveolar and
interstitial dust levels//Ann. Occup. Hyg. — 1985. — Vol. 29. — P. 495—516.
72. Stahlhofen W., Gebhart J., Heyder J. Biological variability of regional deposition of
aerosol particles in the respiratory tract//Amer. Industr. Hyg. Assoc. J. — 1981. — Vol
42. - P. 348-352.
73. Stahlhofen W., Gebhart J., Heyder J., Scheuch G. New regional deposition date of the
human respiratory tract//J. Aerosol. Sci. — 1983. — Vol. 14. —P. 181 — 188.
74. Stober W., McClellan R.O., Morrow P.E. Approaches to modeling disposition of inhaled
particles and fibers in the lung//Toxicology of the Lung. — N.Y.: Raven press.—
1993. - P. 527-601.
75. Strom K.A., Johnson J.T., D'Aroy J.B. Pulmonary retention in rats and guinea pigs
chronically exposed to low concentrations of diesel exhaust//Toxicologist. — 1986. —
P.170.
76. Tarroni G., Melandry C„ Prodi V. et al. An indication on the biological variability of
aerosol total deposition in humans//Amer. Industr. Hyg. Assoc. J. — 1980. — Vol. 41. —
P. 826-831.
77. Toomes H., Vogt-Moykopf J., Heller W.D., Osterrat H. Measurement of mucociliary
clearance in smokers and nonsmakers using a bronchoscopic video-technical me-
thod//Lung. - 1981. - Vol. 159. - P. 27-34.
78. Toxicology of Industrial Compounds/Ed. H.Thomas, R.Hess and F.Waechter. — Lon-
don: Taylor and Francis. — 1995. — 381 p.
79. Tran C.L., Jones A.D., Donaldson K. Mathematical model of phagocytosis and inflam-
mation after the inhalation of quartz at different concentrations// Scand. J. Work.
Environm. and Health. — 1995. — Vol. 21., Suppl. 2. —P. 50—54.
80. Tumbrell J.A. Principles of Biochemical Toxicology. — London: Taylor and Francis. —
1991.-415 p.
81. Vincent J. H, Armbruster L. On the quantitative definition of the inhalability of airborne
dust//Ann. Occupat. Hyg. — 1981. — Vol. 24. — P. 245—246.
82. Vincent J.H., Johnson A.M., Jones A.D. et al. Kinetics of deposition and clearance of
mineral dusts during chronic exposure//Brit. J. Industr. Med. — 1985. — Vol. 42. —
P. 707-715.
83. Yu C.P., Xu C.B. Predicted depositions of diesel particles in young humans//!. Aerosol.
Sci. - 1987. - Vol. 18. - P. 419-429.
Глава 3
ВЛИЯНИЕ КСЕНОБИОТИКОВ
НА БИОЭНЕРГЕТИЧЕСКИЕ ПРОЦЕССЫ
3.1. Действие ксенобиотиков на тканевое дыхание
Одним из наиболее распространенных видов биологического действия
химических веществ является их способность влиять на процессы тканевого
дыхания и энергетического метаболизма в клетке. Поэтому важным дости-
жением токсикологии явилось установление закономерностей влияния раз-
личных по своей структуре химических веществ на процессы окислитель-
ного и энергетического обмена, осуществляющиеся на субклеточном и мо-
лекулярном уровнях. Энергозависимость всех протекающих в клетке про-
цессов, обеспечивающих в конечном итоге жизнедеятельность целостного ор-
ганизма, позволяет использовать биоэнергетические показатели для определе-
ния влияния химических веществ на процессы биоэнергетики, установления
величин пороговых концентраций (или доз) токсичных веществ, прогнозирова-
ния их степени опасности и гигиенических регламентов.
Углубленное исследование роли нарушений биоэнергетики клетки, про-
исходящих при воздействии на организм токсичных веществ, базировалось
на тесной связи процессов, обеспечивающих клетку энергией с процессами
окислительного метаболизма, интегрируемыми на уровне целостного орга-
низма функцией потребления кислорода, изучение которой по показателям
легочного газообмена было начато в области токсикологии еще Н.П.Крав-
ковым. Удалось показать, что различные токсичные вещества способны в
той или иной степени влиять на газообмен. Эти данные были подтверждены
исследованиями других авторов, получив свое развитие в работах
Н.С.Правдина и его школы. В результате было сформулировано положе-
ние о том, что показатели газообмена, изменяющиеся при воздействии на
организм токсических агентов, обладают высокой чувствительностью и ин-
тегративностью реакций на различные химические раздражители. На осно-
вании этих исследований была показана высокая информативность и
гигиеническая значимость изменений окислительного метаболизма, при-
сущая химическим веществам, обладающим специфическим действием на
процессы тканевого дыхания, интегрируемым сдвигом показателей внеш-
него дыхания.
Последующие исследования динамики кислорода непосредственно в
тканях организма, вначале — по показателю напряжения кислорода (рС>2)
18, 20], а в последнее время — по изменению процессов дыхания и
°пряженных с ними механизмов окислительного фосфорилирования непо-
Редственно в митохондриях, значительно расширили представления о хи-
ических веществах, обладающих способностью оказывать влияние на про-
цессы тканевого дыхания [11, 14, 15, 25, 30].
Изучение напряжения кислорода (pOj) в тканях в условиях воздействия
л ЗЛичных химических веществ показало, что, например, цианид калия в
°зах 0,1—0,05 LD50 повышает уровень рОг в мозге животных и уменьшает
89
скорость его утилизации. Цианид натрия в дозах, превышающих летальные
в 1,5—2 раза, вызывает быстрое падение рО2 в коре головного мозга.
Установлено, что указанный механизм действия солей синильной кислоты
выявляется в опытах in vitro и сохраняется в условиях целостного организма
[18]. Свое влияние на скорость утилизации кислорода мышечной тканью
оказывает в опытах на мышах классический разобщитель тканевого дыхания
и окислительного фосфорилирования — 2,4-динитрофенол (2,4-ДНФ), ак-
тивирующий тканевое дыхание. Эту способность 2,4-ДНФ.проявляет и в
целостном организме [18].
Изменения pOj в тканях мозга и подкорковых образованиях, носящие
фазовый характер, получены при действии ингаляционного наркотика —
эфира. Группа других представителей этого вида наркотиков — фторолефи-
нов — снижала рО2 в тканях мозга без начального повышения этого пока-
зателя [6, 18].
Интересен факт понижения pOj в различных тканях организма (мозге,
языке) у животных, подвергавшихся воздействию нитрита натрия и нитро-
глицерина — соединений, улучшающих оксигенацию тканей путем расши-
рения сосудов мозга и других тканей. В связи с этим снижение рО2 не может
быть объяснено гемодинамическими причинами, а вызывается, видимо,
усилением утилизации кислорода. Аналогичные результаты получены при
введении животным адреналина и норадреналина [18].
Факты изменения потребления кислорода различными тканями организ-
ма установлены в условиях острых и хронических опытов при воздействии
пропионовой кислоты и ряда ее производных. При этом изменения пока-
зателя были различными по направленности при воздействии разных соеди-
нений этого ряда. Так, в острых опытах на уровне сравнительно низких доз
(0,1 LD50) сама пропионовая кислота активировала потребление кислорода
различными тканями. Наоборот, монохлорпропионовая кислота активно
угнетала этот процесс. В хронических опытах при действии низких концент-
раций монохлорпропионовой кислоты данный показатель оказался наиболее
чувствительным и его изменения четко зависели от концентрации и времени
действия вещества [18].
Проведенное в последние три десятилетия фундаментальное изучение
углубленных механизмов окислительного метаболизма по показателям про-
цессов тканевого дыхания и сопряженных с ними механизмов окислитель-
ного фосфорилирования показало, что специфичность действия химических
факторов окружающей среды на процессы биологического окисления и синтеза
макроэргических соединений проявляется на субклеточном и молекулярном
уровнях и определяется характером взаимодействия того или иного вещества
(или группы веществ) с соответствующим компонентом клетки. Происходя-
щие вследствие этого взаимодействия нарушения окислительного и/или
энергетического обмена, в основе которых лежат конкретные молекулярные
механизмы ингибирования, интегрируются нарушением тканевого дыхания
и энергетическим голодом клетки. Дня сотен химических веществ выявлены
характер и локализация их действия на молекулярные мишени митохондрий,
что является одним из важнейших путей реализации их токсического дей-
ствия на целостный организм [3, 11, 22, 26, 29].
Вызываемые химическими веществами нарушения процессов окисления
и фосфорилирования, происходящие на клеточном и субклеточном уровнях,
приводят к дефициту энергии. Указанные процессы имеют интегральный
характер в силу принципиального сходства изменений метаболических со-
стояний изолированных митохондрий и клеток целостного организма, при-
90
водЯших к общему конечному результату — подавлению потребления кис-
лороДринципиальная качественная общность вовлечения основных энерго-
образующих звеньев как изолированных митохондрий, так и тканей целост-
ого организма в осуществление перестроек их биологической активности,
НЫзываемых воздействием химического вещества, является основой для
переноса данных, получаемых на изолированных митохондриях, на целост-
нЬ1Й организм. Правомочность этого положения подтверждена количествен-
ным соответствием и жесткой корреляционной зависимостью между кон-
центрациями химических веществ, вызывающими подавление тканевого ды-
хания изолированных митохондрий на 50 % (Ci50), с величинами статис-
тически определяемых основных параметров токсикометрии этих же инги-
биторов тканевого дыхания " 1 ! " nmzx
следующими уравнениями:
(LDsq, LC50, Limac, ПДК), что выражается
lg 1/LD50 = 1,30 + 0,55 lg1/Ci50 r=0,981 (1)
lg VLC50 = 3,05 + °'60 |91/Ci50 r=0,936 (2)
lg 1/Limac = 4,15 + 0,605 Igl/CigQ r=0,868 (3)
lg 1/ПДК р.з. = 5,20 + 0,95 lg1/Ci50 r=0,920 (4)
lg 1/ПДК а.в. = 7,70 + 0,95 lg1/Ci50 r=0,902 (5)
Установлено, что наиболее жесткая корреляционная зависимость суще-
ствует между Ciso и LD50 (уравнение 1). Этой зависимости подчиняется
действие самых разнообразных по химической природе неорганических и
органических соединений, в том числе и неявляющихся специфическими
ингибиторами тканевого дыхания, что может свидетельствовать о том, что
нарушение процессов дыхания и энергопродукции клетки является обязатель-
ным компонентом действия химических факторов на организм как в случае
специфического, так и неспецифического характера ингибирования ими биоэнер-
гетики клетки.
Влияние токсических агентов на биоэнергетику реализуется в митохонд-
риях, на долю которых приходится большая часть всей вырабатываемой
клеткой энергии (около 90 %). Причем если в цитозоле клетки энергия
вырабатывается за счет гликолитического фосфорилирования, то в мито-
хондриях энергообразование происходит в процессе окислительного фосфо-
рилирования. Повреждение структурной основы митохондрий токсическим
агентом приводит к нарушению их энергообразующей функции.
Размещение митохондрий в клетке не является строго определенным и
зависит от органной специфичности ткани и ее функционального состоя-
ния. Как правило, митохондрии тяготеют к тем участкам клетки, где в
Данный конкретный момент наблюдается наибольшая потребность в энер-
гии. От цитозоля клетки митохондрии отделены двумя мембранами — внеш-
ней и внутренней. Во внешней мембране локализованы ферменты, не при-
имающие непосредственного участия в процессах окислительного фосфо-
рилирования. Во внутренней мембране находятся основные ферментные
мплексы, осуществляющие окисление субстратов, перенос электронов по
1Хательной цепи и сопряженный с ними механизм синтеза и накопления
Р™». В состав дыхательной цепи входит ферментный комплекс — уби-
м °н> ЦИТОХРОМЫ Ь, с, С], а и а3. Помимо этого комплекса, во внутренней
ген °Ране локализованы аденозинтрифосфатаза (АТФаза), сукцинатдегидро-
каг>а3а (СДГ), дегидрогеназы а-кетокислот, p-Оксибутиратдегидрогеназа и
Ртининацилтрансфераза. На поверхности крист (перегородок внутренней
91
мембраны митохондрий) находится так называемый фактор F1 — один из
важнейших компонентов АТФазы митохондрий. Между кристами в матрик-
се локализованы ферменты цикла трикарбоновых кислот, а также глутамат-
дегидрогеназа и ферменты, катализирующие окисление жирных кислот.
Очень важной особенностью внутренней мембраны митохондрий является
ее способность к сопряженному с дыханием синтезу макроэргического со-
единения — аденозинтрифосфата (АТФ), являющегося универсальным ис-
точником большинства эндергических функций клетки. Необходимая для
синтеза АТФ-энергия выделяется при окислении интермедиаторов в цикле
трикарбоновых кислот вдыхательной цепи [12, 13, 18, 27].
Функции митохондрий осуществляются представленными структурами.
Так, процессы дыхания сводятся к многоступенчатому окислению сложных
органических веществ, обладающих высокомолекулярным энергетическим
и восстановительным потенциалом. Этот процесс связан с окислением кар-
боновых кислот и осуществляется в цикле трикарбоновых кислот и в со-
пряженной с ним дыхательной цепи. Освобождаемая в процессе окисления
энергия выделяется в дыхательной цепи последовательно и утилизируется
клеткой. При этом основная часть энергии, заключенной в исходных био-
полимерах, выделяется на участке между циклом трикарбоновых кислот и
молекулярным кислородом. По сравнению с участком субстрат — цикл три-
карбоновых кислот ее количество больше в 13 раз.
Общую схему дыхательной цепи митохондрии и сопряженных с ней
участков окислительного фосфорилирования аденозиндифосфата (АДФ) в
АТФ можно для наглядности представить в следующем виде (рис. 3.1) [9].
Каждая из таких дыхательных цепочек, состоящая из белков ферментов,
участвующих в функционировании системы переноса электронов и окисли-
тельного фосфорилирования, и локализованная во внутренней мембране
митохондрий, многократно в ней повторяется. Это находится в прямой
зависимости от функциональной активности клетки и ткани, в состав ко-
торой она входит, и определяемой интенсивностью дыхания. В тканях,
характеризующихся высокой активностью и связанной с ней высокой ин-
тенсивностью дыхания (например, сердце и почки), поверхность внутренних
мембран митохондрий и соответственно содержащихся в них дыхательных
цепочек намного больше, чем, например, в печени, состоящей из клеток с
низкой интенсивностью дыхания.
Изучение влияния химических веществ на биоэнергетические процессы,
осуществляющиеся митохондриями, проводят, как правило, в двух вариан-
тах их воздействия на данные органеллы клетки. В одном из них в герме-
тически закрытую ячейку, содержащую помещенные в ту или иную среду
инкубации (сукцинат, НАД-зависимые субстраты окисления) митохондрии
различных модельных систем: суспензий изолированных митохондрий, вы-
деленных из различных органов; гомогенатов и кусочков тканей, их срезов,
в ходе эксперимента последовательно вводятся активаторы дыхания — сна-
чала АДФ, затем 2,4-ДНФ, и после каждого из них исследуемый токсичес-
кий агент в нарастающих концентрациях до получения выраженного эф-
фекта ингибирования дыхания, носящего градуальный характер (рис. 3.2/
[12, 23].
Другой вариант предусматривает воздействие химического фактора
различных дозах и/или концентрациях (при разной длительности воздейст-
вия — от однократного до хронического) на целостный организм и после-
дующее выделение из него указанных выше модельных систем, на мито-
хондриях которых, как и в первом варианте, в условиях in vitro проводите
92
Комплекс II
Сукцинат
Малонат
FAD
FeS
Карбоксин
TTFA
Место сопряжения 1 Место сопряжения 2
Место сопряжения 3
Рис. 3.1. Схема дыхательной цепи митохондрией и сопряженных с ней участков
описательного фосфорилирования аденозинфосфата в АТФ. Указаны предполагае-
мые участки ингибирования дыхательной цепи специфическими лекарственными
веществами, химическими реагентами и антибиотиками; а также участки, где пред-
положительно происходит сопряжение с фосфорилированием.
BAL — димеркапрол; TTFA — теноилтрифторацетон; FeS — железосерный белок (негемовое
железо); FAD — флавопротеин (флавинмононуклеотид); FMN — рибофлавинфосфат (флавин-
адениндинуклеотид): комплекс 1 — NADH: убихинон-оксиредуктаза; комплекс II — сукцинат:
убихинон-оксиредуктаза; комплекс 111 — убихинон: ферроцитохром с-оксиредуктаза; комплекс
IV — ферроцитохром с: кислород-оксиредуктаза; АДР — аденозиндифосфат; АТР — аденозин-
трифосфат; Pi — неорганический фосфат; Q — убихинон; NADH — никотинамидадениндинук-
леотид, восстановленная форма.
изучение процессов биологического окисления. Оно оценивается по убыли
кислорода в герметически закрытой ячейке, характеризующей скорость ды-
хания митохондрий. Последняя регистрируется полярографическим мето-
дом. Методические рекомендации “Экспрессное определение параметров
Рис. 3.2. Оригинальная поляро-
грамма регистрации дыхания
изолированных митохондрий.
SA — янтарная кислота: a-KG — a-
кетоглутаровая кислота; МН — ми-
тохондрии; DNP — динитрофенол;
ADP — аденозиндифосфат.
93
токсикометрии новых химических агентов на изолированных митохондриях
печени” определяют порядок выделения митохондрий и работы с ними
установления концентраций токсичных веществ, ингибирующих дыхание
митохондрий, расчета концентрации химического агента, ингибирующего
дыхание на 50 % (С150) [23].
Установление параметров токсикометрии (LD50, LC50, ПДК) изучаемого
соединения проводят либо расчетным путем по приведенным выше форму-
лам (при проведении исследований по первому варианту), либо указанные
параметры определяются в эксперименте при помощи любого из использу-
емых в профилактической токсикологии традиционных методов затравки по
показателям интенсивности процессов дыхания и окислительного фосфори-
лирования (при проведении исследований по второму варианту) [18, 21].
Оценку дыхания митохондрий проводят, изучая состояние различных *
участков дыхательной цепи. Исследование НАД-Н-дегидрогеназного участка
ведется с использованием субстратов, окисляющихся с участием НАД-а-ке-
тоглутаровой кислоты, либо смеси яблочной и глутаминовой кислот. При
использовании в качестве субстрата окисления сукцината может происхо-
дить накопление щавелевоуксусной кислоты (ЩУК), являющейся специфи- 1
ческим ингибитором СДГ. Этот эффект, называемый ЩУКовым торможе-
нием, является важным показателем при изучении механизмов влияния
токсичных веществ на дыхание митохондрий.
Эффективность работы механизмов фосфорилирования устанавливается
обычно путем добавления к дышащим митохондриям АДФ и последующего
учета, скорости дыхания в состоянии 3 (см. рис. 3.2), скорости фосфорили-
рования и величины отношения АДФ/О. Состояние энергетической регу-
ляции оценивается по величинам дыхательного контроля и стимуляции
дыхания. При двукратной добавке АДФ появляется возможность более пол-
ного выявления функциональной возможности энергосинтезирующей сис-
темы митохондрий и энергетической регуляции дыхания.
Регистрация дыхания и окислительного фосфорилирования митохонд-
рий описывается типичной полярографической кривой, по показателям
которой производится расчет скоростей дыхания [18, 24]. Она имеет сле-
дующий вид (см. рис. 3.2) [18].
На этой кривой выделяют несколько метаболических состояний: Vo (или
метаболическое состояние 2), при котором скорость дыхания митохондрий
лимитируется отсутствием акцептора неорганического фосфата-АДФ; V3
(или состояние активности) — дыхание митохондрий резко увеличивается
после добавки в ячейку определенного количества АДФ-акцептора неорга-
нического фосфата. Именно в этом состоянии скорость дыхания лимити-
руется работой механизмов фосфорилирования и скоростью переноса АДФ
и фосфата через мембрану митохондрий. После исчерпания всей добавлен-
ной АДФ (перехода ее в АТФ) дыхание вновь резко замедляется — проис-
ходит переход в метаболическое состояние 4 (или отдыха). Это явление
называется дыхательным контролем. Последующая добавка 2,4-динитрофе-
нола (ДНФ), разобщающего процессы дыхания и фосфорилирования, вы-
зывает резкую и необратимую активацию дыхания, которая длится до пол-
ного исчерпания кислорода в ячейке.
Наибольший интерес в прикладных биоэнергетических исследованиях,
в том числе токсикологических, имеют два основных метаболических со-
стояния — 3 и 4. Именно они характеризуют важнейшие аспекты функци-
ональной активности митохондрий — синтез АТФ и дыхательный контролы
Специфические для клетки повреждения связаны с воздействием токси- ।
94
1
ских вешеств на процессы, обеспечивающие ее энергией, необходимой
че поддержания структуры и функции клетки, и происходящие в основном
^митохондриях. Для сотен химических веществ установлен механизм их
В йствия на внутриклеточную биоэнергетику, связанный с повреждением
Донкретного звена в сложной многоступенчатой цепи окислительных и
неогетических процессов. Это дало возможность классифицировать токси-
еские агенты в зависимости от точки их приложения в общей цепи меха-
низмов выработки энергии, локализующихся в митохондриальных структу-
рах клетки.
Классификация ксенобиотиков по характеру и локализации их действия
на молекулярные мишени митохондрий проведена путем сопоставления
указанных показателей с химическим строением вещества [17].
У Установлено, что разные этапы сложного и многоступенчатого процесса
окислительного фосфорилирования, начиная от отщепления протона и элек-
трона от субстрата окисления и заканчивая включением неорганического
фосфата в молекулу АДФ, далеко в неравной степени чувствительны к дей-
ствию токсичных веществ. Наиболее частые причины нарушения этого
процесса — ингибирование НАД-Н-дегидрогеназы, а также протоноформное
разобщение дыхания и фосфорилирования. Именно в этих точках локали-
зуется действие основной массы токсических агентов.
Ингибиторами НАД-Н-дегидрогеназного участка переноса электронов в
дыхательной цепи являются насыщенные алифатические и циклические
углеводороды, спирты, альдегиды (кроме формальдегида), ароматические
соединения (в том числе ПАУ), дифенилы, циклодиеновые углеводороды,
галоидпроизводные углеводородов, ароматические кислоты, дитиокарбама-
ты, пиридины и другие гетероциклы, стероиды, жирорастворимые витами-
ны, фосфороорганические соединения, свинец и др.
Наиболее высокоспецифичными токсическими агентами среди перечис-
ленной группы химических веществ являются ротенон, пиридин.
Высокоспецифичными химическими веществами, разобщающими в ды-
хательной цепи митохондрий процессы дыхания и фосфорилирования, яв-
ляются 2,4-динитрофенол и тетрахлортрифторметилбензимидазол. Вместе с
тем эффект “разобщения” свойствен достаточно большой группе главным
образом органических соединений, благодаря чему этот механизм воздейст-
вия токсических агентов на окислительные внутриклеточные процессы за-
нимает второе по частоте место. Способность разобщать дыхание и фосфо-
рилирование установлена для представителей таких классов химических
соединений, как галоген производные алифатических углеводородов, фено-
лы, дифенолы; ароматические кислоты; нитро- и аминосоединения; бензо-
тиазолы; дитиокарбаматы; гетероциклы и др. Часто “разобщающее” дейст-
вие токсических соединений сочетается с их способностью оказывать вли-
яние на другие звенья процессов дыхания, протекающих в дыхательной цепи
митохондрий.
Механизмы, благодаря которым осуществляется “разобщающее” дейст-
ото токсического агента, могут быть разными. Показано, например, что при
цииаВЛе*кИИ динитР°Фенолом происходит выраженное снижение концентра-
щей СВО°ОДНЬ1Х радикалов. 2,4-Динитрофенол в концентрации, разобщаю-
Дика°КИСЛИТеЛЬН°е ФосФ°РилиР°вание, снижает содержание свободных ра-
нол) °В В МИТОХОНДРИЯХ печени. Диносеб (2,4-динитро-6-фтор-бутилфе-
РадикТакже обладающий “разобщающим” эффектом, угнетает свободно-
nopTa^hHh16 пРоцессы в митохондриях, и это связано с нарушением транс-
электронов в энергетической цепи. Эксперименты показали, что при
95
острых отравлениях алкилпроизводными 2,4-динитрофенола происходят
значительные изменения электронно-транспортных цепей в клетках печени
с угнетением энергетической и детоксицирующей систем. Механизм всего
процесса заключается в том, что эти ксенобиотики резко снижают эффек-
тивность функционирования железосодержащих белков печени, что влечет
за собой нарушение окислительного фосфорилирования. В результате про-
изошедшего разобщения биологического окисления может уменьшиться со-
держание флавинов и кофермента Q, являющихся источниками свободных
радикалов [18].
Ингибирование переноса электронов по другим участкам дыхательной
цепи встречается гораздо реже. Так, ингибирующим действием на уровне
СДГ обладают малоновая и щавелевоуксусная кислоты, фенолы с pH < 7,5;
батофенантролин; теноилтрифторацетон; норбормид. Среди этих соедине-
ний высокоспецифичными агентами являются малоновая и щавелевоуксус-
ная кислоты.
Ингибирующим действием переноса электронов по цитохромному участ-
ку дыхательной цепи до цитохромоксидазы обладают гладиоловая кислота,
1Ч-М-ди(хлорэтил)парааминофенилуксусная кислота, батофенантролин,
свинец, цинк, антимицины. Выявлена способность витамина D ингибиро-
вать ферменты цитохромной системы. Наиболее высокоспецифичные среди
них — цинк и антимицин А.
На уровне цитохромоксидазы перенос электронов блокируют окись уг-
лерода, сульфиты, сульфиды, азиды, цианиды, фосфин, формиаты, арома-
тические и алифатические нитрилы (кроме непредельных). Наиболее выра-
женным специфическим действием на цитохромоксидазу обладают цианиды
и азиды.
Определены вещества, обладающие ингибирующими свойствами в отно-
шении АТФазы: алкилирующие соединения (азотистые иприты), дицикло-
гексилкарбодиимид, триэтилолово, дибутилоловосульфид, бнс(трибутилоло-
во)оксид, формальдегид. 5,«с(трибутилолово)оксид, а также олигомицин об-
ладают наибольшими специфическими свойствами ингибирования АТФазы.
Ряд других химических соединений объединен по их способности инги-
бировать трансмембранный перенос:
• неорганического фосфата (тиоловые яды — кадмий, ртуть и их неор-
ганические и органические соединения, малеимиды, азотистые ипри-
ты и др.). Наибольшим специфическим действием обладают ртутьор-
ганические соединения;
• адениннуклеотидов (опиаты, бонгрековая и агаровая кислоты);
• катионов (алкиляторы, местные анестетики, формальдегид, комп-
лексные соединения кобальта и лантана). Наиболее высокоспецифич-
ный агент — гексаминкобальтхлорид;
• субстратов (фторцитрат, фусцин, триалкильные соединения олова)-
Наибольшим специфическим действием обладают аналоги субстратов
(например, бутилмалонат).
Как видно из приведенной классификации, количество химических ве-
ществ, обладающих высокой специфичностью ингибирования конкретно
структурно-функциональной единицы митохондрий, незначительно. Специ-
фичность действия основной массы токсичных веществ на конкретны^
участок дыхательной цепи митохондрий является по сути дела относитель-
ной, так как ингибирование этого участка достигается при более низко
действующей концентрации химического вещества или меньшем времен
96 j
”.
воздействия, а при их увеличении может подавляться активность и
еГ° звена дыхательной цепи митохондрий [18].
дРу-ра1<1 например, в модельных опытах на кусочках тканей печени и почек
при воздействии на них 0,1 эффективной дозы (ЕД™) трихлорэтилена
ГГХЭ) в двух вариантах — непосредственное внесение ТлЭ в среду инкуба-
ми или 30-минутная инкубация тканевого препарата с этим токсическим
агентом — было показано, что независимо от времени воздействия ТХЭ на
поепараты изменения тканевого дыхания в них происходят прежде всего за
счет протоноформного разобщения дыхания и фосфорилирования, а также
в результате изменения дыхания НАДН-зависимых субстратов. Однако вы-
пфкенность изучавшегося процесса была большей за счет разобщающего
действия ТХЭ, что особенно наглядно проявилось при увеличении времени
контакта тканевых препаратов с этим химическим веществом [26, 30].
Интоксикация фтором приводит к дефициту субстратов окисления, ин-
гибированию гликолиза и цикла Кребса, в результате чего уменьшается
количество НАД-Н. Реокисление НАД-Н в дыхательной цепи затрудняется
торможением активности НАД Н-дегидрогеназы, СДГ и цитохромоксидазы,
что сопровождается снижением утилизации кислорода тканями и повыше-
нием его содержания в венозной крови. Развитие в результате нарушений
окислительного и энергетического метаболизма гипоксии гистотоксического
типа обусловливает в свою очередь клиническую и патофизиологическую
картину, характерную для воздействия фтора.
В силу указанных причин названные выше химические вещества или им
подобные соединения (или их классы) могут одновременно размещаться
среди разных групп веществ, ингибирующих различные участки дыхательной
цепи (например, свинец, ароматические кислоты, алкилирующие соедине-
ния, галоидпроизводные углеводородов и др.).
В описываемой классификации обращает на себя внимание тот факт, что
НАДН-дегидрогеназный участок дыхательной цепи ингибируется практически
всеми классами органических соединений, а также некоторыми неорганичес-
кими веществами, в то время как терминальный участок дыхательной цепи
высокоустойчив к действию токсических веществ. Он ингибируется узким
кругом относительно простых неорганических соединений [17, 18].
Эффекты ингибирующего действия ксенобиотиков, локализующиеся на
различных участках ферментной системы митохондрий, осуществляющей
процессы дыхания и окислительного фосфорилирования, не являются не-
обратимыми. Однако воздействие высокоспецифичных по отношению к
биологической мишени отдельных веществ (или их классов) в летальных
Дозах/концентрациях может привести к гибели организма. Речь прежде всего
идет о химических веществах, относящихся к области военной токсиколо-
ии. На примере их действия становится понятным, как первичные, высо-
оспецифичные эффекты этих веществ в отношении той или иной биоло-
ческой мишени, входящей, в частности, в систему обеспечения работаю-
еи клетки энергией, интегрируются в общепатологические процессы, при-
Дящие организм к гибели. Одним из таких процессов является развитие
дан°Т°КСИЧеСК°й гипоксии вследствие ингибирования определенного для
мако°Г° ксен°биотика звена в системе биологического окисления и синтеза
кис °ЭРГИЧеСКИХ соеДинений в митохондриях, приводящего к нарушениям
телк|?ТНО'Щелочного гомеостаза за счет метаболического ацидоза и дыха-
°го алкалоза и развитию вторичной гипоксии [18].
ствия°гласно классификации токсичных веществ высокоактивного типа дей-
юТся ’ вещества ~ ингибиторы тканевого дыхания в клетках — подразделя-
4-7127
97
• ингибиторы ферментов тканевого дыхания на стадиях, предшествую,
щих циклу Кребса. Они вызывают угнетение гексокиназы, пируват,
оксидазы и других ферментов. К таким веществам относятся иприты
люизиты и другие физиологически активные вещества;
• ингибиторы ферментов цикла Кребса. Этим эффектом обладают фтор,
карбоновые кислоты, а также их соли и эфиры;
• ингибиторы дыхательной цепи в митохондриях. Классическими пред. |
ставителями этой группы веществ являются цианиды и другие токси- |
ческие вещества — доноры CN-rpynn [7].
Известна большая группа токсичных веществ, действие которых на струк-
турно-функциональный биоэнергетический комплекс митохондрий осущест-
вляется опосредованно. Это прежде всего яды, обладающие активностью в
отношении биологических мембран клетки и митохондрий. Для ряда из них,
например фосфорорганических соединений (ФОС) и в особенности фос-
форорганических инсектицидов (ФОИ), установлен механизм мембрано-
тропности, связанный с их высокой липофильностью, активным окислени-
ем, образованием вследствие этого свободных радикалов и в результате
резким нарастанием перекисного окисления липидов. Все это приводит к
увеличению проницаемости мембран и изменению их физического состоя-
ния [1, 2, 16]. Если для клетки этот процесс сопровождается массивным
вхождением ионов кальция, что может явиться причиной ее гибели, то
активация окисления липидов митохондрий может привести к нарушению
их энергетической функции с последующим развитием тканевой гипоксии
[5]. Последствия сорбции высоколипофильных ФОИ на мембранах и рас-
творения их в липидной фазе столь значимы для функционального состоя-
ния клеток и субклеточных структур и, в частности, для энергообразующей
деятельности митохондрий, что действие таких веществ в отношении мем-
бран характеризуется как мембранотоксическое. В результате этого проис-
ходят не только специфические для ФОС холинергические эффекты, свя-
занные с большим сродством этих соединений к холинэстеразе (ХЭ), но и
взаимодействие ФОС с рядом других ферментов, в том числе непосредст-
венно участвующих в процессах тканевого дыхания и окислительного фос-
форилирования митохондрий (СДГ, АТФаза, цитохромоксидаза) [16]. Наи-
более чувствительным звеном воздействия фосфорорганических ингибито-
ров является окисление НАД-зависимых субстратов в метаболическом
состоянии 3, т.е. при высокой окисленности компонентов дыхательной
цепи. Этот механизм ингибирующей активности установлен для различных
по токсичности (высоко-, умеренно- и низкотоксичных) и химической
структуре ФОС (фосфакола, армина, хлорофоса, дибутил монотио- и дибу-
тилдитиофосфатов калия, роннела и его аналогов, хлорфенвинфоса, пара;
тиона, малатиона и др.), что позволяет говорить о ингибировании ФОС
тканевого дыхания как об общей закономерности [18]. Грубое нарушение
энергетики головного мозга при острых отравлениях ФОИ является следст-
вием развития метаболических нарушений, связанных с описанными выШе
механизмами, и может привести к гибели больных в результате паралича
дыхательного центра, нарушений процессов тканевого дыхания и окисли-
тельного фосфорилирования, развития тканевой гипоксии и несовместим '
го с жизнью ацидоза. Цитотоксический эффект ФОС приводит к гибел
нейронов, гепато- и кардиомиоцитов. я
Между ингибиторной активностью ФОС на процессы тканевого дыхани
и их острой токсичностью существует выраженная зависимость. Она выл
лена для столь различных по своей структуре и биологической активное
98 j
единений, как, например, армии и дибутилмонотиофосфат калия, отли-
с°ющихся по диапазону активности более чем на три порядка.
Характер и степень выраженности изменений процессов энергообразования
митохондриях являются одной из фундаментальных основ индивидуальной
их/вствительности организма к действию токсического агента. Это выража-
ется например, в разной тяжести интоксикации при отравлении животных
одной и той же дозой химического вещества. Так, введение хлорофоса
гоуппе подопытных животных в дозе LD50 вызывает развитие двух степеней
отравлений — средней тяжести и тяжелой. При этом в митохондриях печени
при отравлении средней тяжести происходит увеличение скорости окисле-
ния субстратов, повышение величины дыхательного контроля. Усиление
дыхания митохондрий развивается в условиях прочного сопряжения
окисления и фосфорилирования, о чем свидетельствует повышение показа-
теля Уд„ф/Уо> где Уднф ~ это скорость дыхания при добавлении динитрофе-
нола, Уд—• исходная скорость.
При развитии тяжелой степени отравления хлорофосом в митохондриях
печени отмечается резкое увеличение скорости дыхания в исходном состо-
янии, отсутствует ответ на добавку АДФ, снижаются величины дыхательных
контролей и коэффициент Уднф/У0.
Изучение влияния ксенобиотиков на интенсивность энергетического
обмена различных тканей позволяет установить молекулярные механизмы
индивидуальной чувствительности организма к действующему токсическому
агенту, обусловливающей развитие отравлений различной степени выражен-
ности при действии одной и той же дозы/концентрации химического веще-
ства. Так, например, при внутрижелудочном введении крысам хлорофоса в
дозе, соответствующей LD50, у животных развиваются острые отравления
средней и тяжелой степени. При этом первые сопровождаются увеличением
скорости окисления субстратов, повышением величины дыхательных кон-
тролей. Усиление интенсивности дыхания происходит при условиях проч-
ного сопряжения окисления и фосфорилирования, о чем свидетельствует
повышение Уднф/У0.
При острых отравлениях хлорофосом тяжелой степени в митохондриях
печени отмечается резкое увеличение скорости их дыхания в исходном
состоянии, отсутствие реакции на добавку АДФ, снижение величины дыха-
тельных контролей.
Таким образом, активация процессов энергообразования при острых
отравлениях хлорофосом средней степени тяжести связана с действием
зкстраклеточных регулирующих систем и отражает компенсаторные возмож-
ности организма. При тяжелых отравлениях хлорофосом в митохондриях
печени снижается энергообразующая функция, что выражается в разобще-
нии окисления и фосфорилирования, митохондрии работают только на
поддержание собственного метаболизма, выключаясь из общей цепи мета-
олических процессов всего организма.
3.2. Нарушения энергетического обмена
под влиянием ксенобиотиков
Ни^аРУшения процессов тканевого дыхания и окислительного фосфорилирова-
чес’коЫЗА1л^еЛ1Ь1е химическими веществами, приводят к развитию энергети-
BblD/0 <’е<Рии'ита тканей. Поэтому, обусловленная его глубиной и степенью
нос₽т?енности’ клиническая картина интоксикации связана с избиратель-
но поражения той или иной физиологической системы организма, в
4*
99
основе деятельности которой лежит ее особая чувствительность к дефициту
энергии. На первом месте в этом ряду находится ЦНС, отличающаяся
высокой интенсивностью проходящих в ней окислительных процессов. При
их угнетении на 65 % возникает реальная угроза летального исхода’ отрав-
ления. Клиническим проявлением интоксикации никотином, введенным в
дозе 40 мкг/кг, является токсический отек мозга, связанный с резким
снижением уровня АТФ и возрастанием количества АМФ при неизменном
содержании АДФ. Уменьшение одновременно с этим суммарного количе-
ства макроэргов и энергетического заряда характеризует глубокое нарушение
биоэнергетики мозговой ткани, выражающееся энергетическим дефицитом.
На фоне формирования токсического отека мозга развивается недостаток
нуклеотидного фонда, что связано с нарушением ресинтеза макроэргов, о
чем свидетельствует угнетение главных энергообеспечивающих процессов —
гликолиза и окислительного фосфорилирования, а также уменьшение ак-
тивности Na+-, К+-АТФазы, осуществляющих гидролиз АТФ [4].
Торможение, вплоть до блокады, аэробного пути окисления является
причиной доминирования клинических проявлений со стороны ЦНС при
отравлениях цианидами, а также рядом органических соединений (напри-
мер, нитрилами), образующими в процессе метаболизма свободные циан-
ионы (CN-). Присущее мозгу интенсивное кровообращение способствует
поступлению в ткани токсического агента, в данном случае — CN-ионов,
которые, вступая в высокоспецифическое для них взаимодействие с гемом
аз цитохромоксидазы — терминального участка дыхательной цепи мито-
хондрий, ингибируют активность этого фермента, блокируют тканевое ды-
хание и вызывают энергетический дефицит в мозговых тканях. Токсический
эффект зависит от интенсивности подавления активности цитохромоксида-
зы. Так, введение пропионитрила вызывает угнетение активности цитохром-
оксидазы головного мозга на 60 %, приводящее к летальному исходу. То же
происходит и при введении животным эквитоксической дозы цианида
калия.
Вследствие резкого угнетения цианидами тканевого дыхания, ингибиро-
вания окислительного фосфорилирования и энергетических процессов в
нервных клетках острое отравление сопровождается клиническими симпто-
мами, связанными с поражением ЦНС. Отмечаются нарушения координа-
ции движений, выраженные клонико-тонические судороги, нарастающее
расстройство дыхания, одышка, паралич дыхательного центра и смерть от
остановки дыхания.
Клиническая симптоматика подострых и хронических интоксикаций хи-
мическими соединениями — донорами свободных CN-ионов — определяет-
ся степенью совместимости с жизнью блокирования цитохромоксидазы
терминального участка митохондриальной дыхательной цепи и возмож-
ностью участия дополнительных механизмов обеспечения клеток и тканей
энергией, играющих в обычных физиологических условиях незначитель-
ную роль в общей схеме снабжения организма необходимой для его
жизнедеятельности энергией [10]. Например, при хроническом ингаляци-
онном воздействии 3-диметиламинопропанонитрила нарушения энергети-
ческого дыхания и связанных с ним окислительно-восстановительных про-
цессов обусловлены ингибированием отщепляющейся в процессе метабо-
лизма соединения CN-группой конечного акцептора протонов дыхательной
цепи митохондрий — цитохромоксидазы на 27 % (при концентрации соеди-
нения 290 мг/м3).
В процессе хронического взаимодействия CN-иона с гемом аз цитохром-
100
идазы повышается значение гема а, обеспечивающего так называемое
оКСноезистентное дыхание и поддерживающего этим совместимый с жиз-
циа уровень тканевого дыхания и окислительного фосфорилирования. Дру-
НЬ“° составляющей этого процесса являются гликолитические механизмы
гоИепирования энергии, которые при острых отравлениях не успевают ак-
ГбНизироваться, а при хронических могут получить необходимое развитие и
беспечить, даже при незначительных запасах гликогена в мозговой ткани,
°есцнтез макроэргических фосфорных соединений в условиях кислородного
голодания, вызванного частичной и медленно развивающейся блокадой
аэробного пути окисления.
НСпецифическое (цианидное) действие в отношении цитохромоксидазы
присуще не всем нитрилам [25]. Так, при 3-дневном введении диметилами-
нопропионитрила (ДМПН) в дозе, близкой к среднесмертельной, ее актив-
ность составляла 73 % от контроля, что приводило к развитию признаков
интоксикации, характерных для действия свободных CN-ионов (судорож-
ные явления, покраснение кожных покровов и видимых слизистых) с по-
следующей гибелью животных в относительно ранние сроки. В то же время
эти симптомы не отмечаются при острых интоксикациях, вызываемых двумя
другими нитрилами, — диметилцианэтилпропандиамином (ДМЦПД) и
N-P-цианэтилдиэтилентриамином (N-P-ЦЭДТА) — при введении их в изо-
эффективных дозах. Клиническая картина отравлений этими соединениями
развивается вяло, гибель животных происходит в более поздние сроки (на
2—з-и сутки). Активность цитохромоксидазы составляет 119% от уровня
контроля, т.е. отсутствует специфическое для цианидов угнетение фермента
[25].
Показано, что отличия в действии нитрилов — производных алифатичес-
ких соединений — на цитохромоксидазу обусловлены особенностью их ме-
таболизма. При остром воздействии на уровне смертельных доз скорость
отщепления CN-группы от молекулы нитрила тем выше, чем меньше его
молекулярная масса и лучше растворимость вещества в воде. Острая ток-
сичность нитрилов с высокой скоростью метаболизма обусловлена комби-
нированным действием целой молекулы вещества и его метаболита — CN-
иона. Нитрилы с низкой скоростью превращения действуют в основном
Целой молекулой. Это прослежено по кинетическим константам накопления
метаболитов (роданидов) в моче животных при внутрижелудочном одно-
кратном введении им ДМПН и N-p-ЦЭДТА в динамике нарастающих доз
(0,025; 0,03; 0,05; 0,1; 0,3). При введении ДМПА в сравнении с другим
нитрилом ускорение процесса образования роданидов в 3 раза выше при
меньшей дозе вещества, при которой скорость накопления роданидов равна
'2 максимальной скорости их накопления, что свидетельствует о высокой
скорости отщепления CN-группы ДМПН и эффективности механизма де-
оксикации цианида в широком диапазоне вводимых доз нитрила. Однако,
н чиная с определенных доз каждого вводимого нитрила, происходит паде-
ctv СКОР°СТИ накопления роданидов. Торможение этого процесса при по-
ингбеНИИ ДМПН в дозах свыше 0,1 LD5Q обусловливается прежде всего
и ибированием свободными CN-ионами, которые не успевают связываться
Тат 1ВодиТься парными соединениями энергетического дыхания. В резуль-
снижРаЗВИВаЮЩег0СЯ снижения активности цитохромоксидазы происходит
Рези бНИе содеРжания гликогена в гепатоцитах, падение активности циан-
Ма pC-Vso1 ”25° микРосомального окисления, снижение содержания цитохро-
Ингибирование образования роданидов при введении N-p-ЦЭДТА на-
101
чинается при относительно небольшой дозе (в 1,3 раза меньшей, чем прц
введении ДМПН) и низкой скорости их накопления (0,18 мкг/мл/ч), т.е. в
условиях, когда возможности организма по связыванию CN-иона еще дале-
ко не исчерпаны. Предполагают, что, так же как при метаболизме пропио-
нитрила и изовалеронитрила, лимитирующим звеном отщепления цианида
является предшествующий метаболизм молекулы N-p-ЦЭДТА по какой-
либо другой связи, который быстро начинает тормозиться избытком суб-
страта — целой молекулой нитрила, в результате чего падает скорость по-
следующей реакции отщепления CN-иона. Именно с этим связано отсутст-
вие признаков специфического (цианидного) угнетения цитохромоксидазц
при действии данного нитрила.
Отсутствие специфического цианидного действия ДМПН и N-p-ЦЭДТД
обнаруживается при хроническом ингаляционном воздействии этих нитри-
лов на уровне пороговых (25 и 2,8 мг/м3 соответственно) и выраженных
токсических (290 и 9 мг/м3 соответственно) концентраций. Важно отметить,
что вещество с более высокой скоростью метаболизма (ДМПН), в процессе
которого освобождаются CN-ионы, оказывается в условиях хронического
воздействия менее опасным, чем N-p-ЦЭДТА, метаболизм которого проис-
ходит с гораздо меньшей скоростью. Это указывает на ведущую роль целой
молекулы вещества в процессе хронической интоксикации, тогда как обра-
зование свободных CN-ионов не оказывает существенного влияния на раз-
витие хронического отравления [25].
Приоритетная роль нарушений энергетического обмена в развитии кли-
нической картины отравлений окисью углерода (СО) наряду с образованием
карбоксигемоглобина установлена только с развитием учения о биоэнерге-
тике клетки и методических приемов ее изучения. Имеющиеся данные
указывают на несоответствие степени тяжести отравлений СО и количества
содержащегося при этом в крови карбоксигемоглобина. Так, наблюдение за
194 больными с острыми отравлениями окисью углерода выявило лишь у
пяти из них содержание карбоксигемоглобина на уровне 60 %. У всех ос-
тальных больных, несмотря на крайне тяжелую форму интоксикации, со-
держание карбоксигемоглобина не превышало 20—30 %. Учитывая, что ве-
дущую роль в развитии клинической картины интоксикации СО играют
резкие нарушения структуры и функции ЦНС, глубина поражения послед-
ней не может быть связана только с последствиями гипоксемии вследствие
образования карбоксигемоглобина. Еще предыдущими исследованиями по-
казано резкое угнетение окисью углерода дыхания тканей мозга, особенно
его подкорковых узлов. В настоящее время установлено, что влияние СО
на энергетический обмен осуществляется через терминальное звено дыха-
тельной цепи митохондрий — цитохромоксидазу, что приводит к гистоток-
сической форме гипоксии [28]. Последствиями ее являются глубокие нарУ'
шения окислительных процессов, ограничивающие образование макроэрги-
ческих фосфорных соединений, несущих необходимую для жизнедеятель-
ности организма энергию. Уменьшением запасов энергетических ресурс06
не ограничиваются нарушения в энергетическом обмене при интоксикации
СО. Они распространяются также на процесс использования аккумулир0'
ванной в макроэргических соединениях энергии тканями организма. Поми-
мо этого, СО подавляет активность АТФазы, что сказывается на процесс
освобождения накопленной энергии.
Поражение токсичными веществами определенного звена митохонДРи
альной дыхательной цепи может иметь неравнозначные последствия ДО
различных тканей организма. Установлено, например, что при отравления
102
оторыми органическими соединениями, вызывающими энергетический
нежИцИт путем ингибирования АТФазы или разобщения процессов дыхания
Д окислительного фосфорилирования, характерным симптомом является
И пажение органа зрения. Так, при повторных поступлениях в организм
ких разобщителей, как 4-нитро-2,6-дихлоранилин и 2,4-динитрофенол,
^мечаются поражения конъюнктивы, роговицы, при которых возможно
быстрое развитие катаракты со вторичной глаукомой. Однако наиболее
тяжелые изменения вызывает интоксикация метиловым спиртом, при кото-
й поражения глаз возможны при всех путях поступления яда в организм.
Они возникают в результате воздействия этого токсического агента на
митохондрии сетчатки и зрительного нерва, в которых тормозится актив-
ность одного из ферментов дыхательной цепи — АТФазы. Помимо этого,
высокотоксичный продукт метаболизма метанола — формальдегид — обла-
дает способностью разобщать процессы дыхания и окислительного фосфо-
рилирования в митохондриях, что в совокупности приводит к дефициту
макроэргов. Углублению этого дефицита способствует торможение формаль-
дегидом анаэробного гликолиза в тканях глаза, в результате чего недостаток
АТФ нарастает. Даже временное нарушение синтеза АТФ в клетках сетчатки
может привести к потере зрения.
Качественные различия реакции энергообразующих процессов мито-
хондрий на действие одного и того же химического фактора одинаковой
интенсивности обусловливают различные механизмы реализации его токси-
ческого эффекта на организменном уровне. Наблюдаемая клиническая кар-
тина отравления средней степени тяжести связана с активизацией процессов
энергообразования под влиянием экстраклеточных регулирующих систем,
что отражает компенсаторные возможности организма. Другой, более тяже-
лый тип реакции на то же токсическое воздействие, выражающийся сниже-
нием энергообразующей функции митохондрий и приводящий к разобще-
нию окисления и фосфорилирования, означает выключение метаболических
возможностей митохондрий из общей цепи приспособительных метаболи-
ческих реакций целостного организма. Связь изменений функции ЦНС,
выражающаяся в ее угнетении, с изменениями внутриклеточных окисли-
тельных процессов установлена при действии низкомолекулярных хлорор-
ганических алифатических соединений, применяющихся для ингаляционно-
го наркоза и местной анестезии. Существенное уменьшение потребления
кислорода, установленное при воздействии таких веществ на уровне целост-
ного организма, сочетается с торможением дыхания изолированных мито-
хондрий. Так, добавление в среду инкубации 1,1,1-трихлорэтана в концент-
рациях до 2 мкммоль/мг митохондриального белка сильно подавляет дыха-
ние изолированных митохондрий в состоянии 3 при окислении НАД-зави-
симых субстратов. В состоянии 4 низкие концентрации (до 0,8 мкммоль/мг
Митохондриального белка) 1,1,1-трихлорэтана стимулируют дыхание, а при
Увеличении концентраций происходит его угнетение. Это соединение вызы-
ет также угнетение дыхания, стимулированного 2,4-динитрофенолом.
I присутствии олигомицина (высокоспецифичного ингибитора АТФазы)
р’ ’ ^ТРихлорэтан не влияет на скорость дыхания изолированных митохонд-
ног ^0НцентРации токсического агента ниже 2 мкмоль/мг митохондриаль-
I о белка не вызывают изменений коэффициента АДФ/О. Концентрация
н’ ’ 'тРихлорэтана, вызывающая 50 % ингибирование дыхания изолирован-
митохондрий в состоянии 3, составляет 0,65 мкмоль/мг митохондри-
ьного белка [18].
ызываемому 1,1,1-трихлорэтаном торможению дыхания в состоянии 3
103
не способствует ни кофактор, ни субстрат, что подтверждается результатами
экспериментов на изолированных митохондриях, подвергнутых циклу ох-
лаждение — нагревание в присутствии НАД+ и цитохрома с.
Активными ингибиторами митохондриальных метаболических процессов
являются оловоорганические соединения, обладающие выраженной нейро-
и гепатотоксичностью [18, 22]. Действие этих химических соединений на
биоэнергетику клетки характеризуется достаточно широким диапазоном эф-
фектов и уровней активности, Ci50 которых может отличаться для крайних
представителей ряда этих соединений в тысячи раз. Так, Ci50 трибутилоло-
вометакрилата составляет 2,1-10-3 М, а быс(трибутилолово)оксида — 110~6 М.
Высокая липофильность оловоорганических соединений обусловливает не-
сколько большую эффективность ингибирования ими НАД-зависимого пути
окисления. Действие трибутилоловохлорида, трибутилоловометакрилата, ди-
бутилоловосульфида и диэтилдикаприлатолова локализуется в области фер-
ментных систем, расположенных по субстратную сторону от убихинона,
тогда как точка приложения дибутилдиизооктилтиогликолятолова находится
в терминальном участке дыхательной цепи митохондрий между убихиноном
и цитохромом Ь.
Указанные механизмы действия оловоорганических соединений на пере-
нос электронов по дыхательной цепи осуществляются на полностью разо-
бщенных митохондриях. На фосфорилирующих митохондриях некоторые
оловоорганические агенты, например дибутилоловосульфид и быс(трибути-
лолово)оксид, проявляют высокое сродство к окислению, сопряженному с
синтезом АТФ. Они тормозят АДФ — активированное дыхание митохонд-
рий в концентрациях, в десятки и тысячи раз более низких, чем дыхание в
присутствии разобщителя — 2,4-д и нитрофено л а [22].
С влиянием оловоорганических соединений на энергетический метабо-
лизм митохондрий тесно связаны их значительная общая токсичность и
избирательность токсического действия. Сопоставление параметров острой
токсичности соединений с их ингибирующей активностью показывает прак-
тически полное совпадение расчетных (по Ciso) и экспериментально най-
денных величин. Единичные исключения могут быть связаны, например, с
образованием более токсичного метаболита, что выявлено для тетраэтило-
лова, у которого расчетные и экспериментальные величины основных пара-
метров острой токсичности различаются в 5,4 раза [18, 22].
Характерное для оловоорганических соединений выраженное нейро- и
кардиотоксическое действие связано с тем, что эти ткани характеризуются
высоким уровнем энергетического метаболизма и, следовательно, высоко-
чувствительны к его ингибированию.
Многие химические вещества обладают опосредованным влиянием на био-
энергетику клетки, что связано прежде всего с механизмами их мембраноток-
сического действия [7, 10]. Так, липофильные соединения, вступая во взаи-
модействие с эндогенными липидами биологических мембран, запускают
реакции перекисного окисления, в результате которых целостность биомем-
бран нарушается, и токсический агент, проникая, в частности, внутрь ми-
тохондрий, оказывает воздействие на их энергетику. Этот процесс может
быть связан не только с действием целой молекулы химического вещества,
но и с продуктами его метаболизма.
Одним из характерных примеров подобного механизма влияния токсич-
ного вещества на протекание процессов дыхания в митохондриях является
четыреххлористый углерод (ССЦ). Установлено, что центральное место в его
метаболизме занимает радикал CCI3, образующийся на первой стадии транс-
104
жопмаиии примерно из 20 % адсорбированной дозы ССЦ в системе цито-
пома Р-450 [2]. ССЦ взаимодействует с липидами биомембран клетки и
убклеточных структур, инициируя реакции перекисного окисления липи-
нов продукты которых ингибируют процессы тканевого дыхания митохонд-
рий Однако образование хлорметильного радикала происходит в основном
Р печени и не происходит в головном мозге, в связи с чем влияние CCI4 на
энергетические процессы в тканях этих органов различно [6, 18].
При однократном сублетальном отравлении животных СС14 первые, наи-
более ранние изменения энергетических процессов происходят именно в
клетках печени [18]. Уже через 15 мин отмечается их активация, выражаю-
щаяся повышением скорости дыхания в активном состоянии 3 после первой
добавки АДФ, а также увеличением коэффициента АДФ/О, свидетельству-
ющим о повышении эффективности сопряжения при окислении митохонд-
риями янтарной и глутаминовой кислот. После повторной добавки АДФ
появляются признаки умеренного низкоэнергетического сдвига (снижение
скорости дыхания в активном состоянии 3 и величины дыхательного конт-
роля при окислении сукцината), сопровождающиеся характерным для ЩУК
торможением активности СДГ.
Описанная реакция активации дыхания митохондрий печени не наблю-
дается при окислении НАД-зависимых субстратов, обеспечивающих реак-
ции второй ветви энергетического обмена. Реакции аналогичных показате-
лей в митохондриях мозга в этот же период времени характеризовались лишь
незначительным повышением интенсивности дыхания, стимулированного
АДФ при окислении сукцината, и не изменяются в присутствии глутами-
новой кислоты.
Если спустя 1 ч после отравления животных сублетальной дозой ССЦ в
их печени отмечается углубление патологического процесса, о чем свиде-
тельствует смена явлений стимуляции энергетического обмена митохондрий
на явления угнетения процессов дыхания и окислительного фосфорилиро-
вания (снижение скоростей дыхания в состоянии 3 после двух добавок АДФ,
скорости фосфорилирования и средней величины дыхательного контроля
при окислении сукцината), то в тканях мозга изменения со стороны их
биоэнергетических систем отсутствуют вовсе. Они начинают появляться
лишь через 1 сут после отравления ССЦ, но существенно отличаются по
степени выраженности от аналогичных изменений в печени. Так, если в
последней в среде инкубации с сукцинатом и глутаматом снижение скорости
Дыхания митохондрий в активном состоянии 3 составляет 34 %,
хондриях мозга — 13 %; снижение скорости фосфорилирования ______ .._г
вой и второй добавок АДФ митохондриями печени составляло 29 и 45 %
^ответственно, митохондриями мозга — 18 и 17 %.
В ткани мозга в последующие сроки наблюдения какие-либо изменения
процессов дыхания и окислительного фосфорилирования отсутствуют, в то
Ремя как в митохондриях печени на 7-й день после отравления ССЦ
оявляются признаки нормализации их биоэнергетики по изучавшимся
казателям, завершившиеся еще через неделю их полной нормализацией.
н Дзличия в реакциях биоэнергетических систем печени и мозга сохра-
1-йпТС)Я[б П18^ ДРУ™Х интенсивностях воздействия на организм ССЦ (Limac,
Ношения биоэнергетики при различных интоксикациях происходят не
д Ко в °Рганах> определяющих ведущие симптомы отравлений, но и в ряде
Физ*1Х’ изменения деятельности которых создают в совокупности полимор-
м клинической картины интоксикации. Одним из ярких примеров этого
то в мито-
после пер-
105
являются клинические проявления токсического действия сероуглерода, ко-
торый при хроническом воздействии приводит к поражениям центральной,
вегетативной, периферической нервной системы, эндокринных и внутрен-
них органов, системы крови, ряда других систем. В клинической картине
интоксикации присутствуют проявления заболеваний ЖКТ и, в частности,
желудка [10]. Изучение причин его поражения сточки зрения биоэнергетики
выявило изменения в протекании в его тканях процессов тканевого дыхания
и окислительного фосфорилирования. На гомогенатах из тканей желудка
животных, полученных после ингаляционной затравки сероуглеродом в те-
чение 3 и 6 мес в разных концентрациях (соответственно 265 и 12 мг/м3),
с использованием в качестве субстратов окисления глюкозы и гликогена,
показано, что интоксикация, развивающаяся от воздействия большей кон-
центрации токсического агента, приводит к значительному снижению тка-
невого дыхания и окислительного фосфорилирования в ткани желудка,
причем нарушения последнего более выражены. Параллельное уменьшение
показателя фосфорилирования (P/О), т.е. отношения использованного фос-
фора к поглощенному кислороду, свидетельствует о разобщении процессов
окисления и фосфорилирования и нарушении синтеза макроэргических
субстратов. Изменение активности ряда ферментов различных участков ды-
хательной цепи не носит определенного и выраженного характера. Напри-
мер, активность СДГ, обеспечивающей введение электронов в систему тер-
минального окисления, либо не изменяется, либо умеренно ингибируется.
Активность АТФазы, напротив, несколько увеличивается.
Таким образом, высокие концентрации сероуглерода угнетают в тканях
желудка аэробные пути генерации энергии, что сопровождается активацией
гликолиза без существенного изменения гликогенолиза.
Низкая концентрация сероуглерода не вызывала изменений дыхательной
и фосфорилирующей активности митохондриального аппарата желудка, а
также активности АТФазы. В то же время активировались обе ветви мета-
болизма углеводов — гликолиз и гликогенолиз, что свидетельствует о том,
что течение реакций, обеспечивающих энергией жизнедеятельность клеток
желудка, сдвигается в сторону анаэробных процессов прежде, чем происхо-
дят нарушения функциональных возможностей системы аэробной генера-
ции энергии.
Изменения процессов обеспечения энергией тканей одного и того же
органа имеют качественные и количественные отличия в зависимости от
дозы/концентрации действующего токсического агента. Основное из них
заключается в том, что высокие концентрации сероуглерода и возникающие
в процессе его метаболизма продукты, повреждая систему митохондриаль-
ного окисления, вызывают прежде всего угнетение аэробных путей генера-
ции энергии с параллельным увеличением скорости гликолиза, что осущест-
вляется ингибицией переноса электронов на уровне СДГ и разобщением
окисления и фосфорилирования в митохондриях. Последнее является одним
из основных молекулярных механизмов токсического действия сероугле-
рода.
В то же время при действии малых доз/концентраций токсического
агента феномена разобщения не отмечается, а основные изменения продук-
ции энергии связаны с увеличением скорости гликолиза и гликогенеза.
Таким образом, токсическое действие сероуглерода в разных концентра-
циях связано с нарушением координации двух основных механизмов синтеза
макроэргических соединений со сдвигом в сторону менее эффективных и
выгодных для организма анаэробных путей энергообеспечения. В таких
106
овиях создается возможность для снижения запасов макроэргических
УсЛлИнений, т.е. формируется энергетический дефицит. Последний оказы-
т отрицательное влияние на структурно-функциональное состояние же-
^ка снижая интенсивность пластических процессов в его тканях, что
Л иво'дит к его структурным повреждениям с последующим формированием
иронического гастрита, являющегося одним из клинических проявлений
хронической интоксикации сероуглеродом [10].
И При интоксикациях изменения процессов тканевого дыхания и окисли-
тельного фосфорилирования в различных органах происходят неравномер-
но Они развиваются чаще в тех органах, которые характеризуются высоким
окислительным метаболизмом. Помимо ЦНС, такой уровень указанного
процесса характерен для почечной ткани. В сравнительных экспериментах
in vitro на кусочках тканей печени и почек при воздействии на них равных
концентраций ТХЭ более выраженные изменения тканевого дыхания, в виде
угнетения на 42 % сукцинатного дыхания, на 47 % — НАД Н-зависимого
дыхания на фоне разобщающего эффекта, были выявлены в почечной ткани
(в печеночной ткани эти показатели составляли примерно 2—3 и 12 %
соответственно), что свидетельствует о большей уязвимости почечной ткани
к повреждающему действию ТХЭ [26].
У некоторых близких по строению химических веществ, часто обладаю-
щих при этом существенными различиями в токсичности, одновременно
выявляются выраженные различия в механизме их влияния на дыхание
митохондрий. Так, классические тиоловые яды (арсениты) подавляют окис-
ление пировиноградной и а-кетоглутаровой кислот за счет связывания SH-
групп дигидролипоилдегидрогеназы, а также нарушают транспорт неоргани-
ческого фосфата через мембрану митохондрий. Совсем иной механизм дей-
ствия у арсенатов. Они активируют дыхание митохондрий в состоянии 4,
снижают отношение P/О, активируют латентную АТФазу. Считают, что
анион мышьяковой кислоты может подменять собой неорганический фос-
фат и, формируя макроэргическую связь с АДФ, образует аденозиндифос-
фатмоноарсенат. Последний легко гидролизуется на АДФ и анион арсената.
В результате создается постоянный высокий уровень нефосфорилированной
АДФ, что приводит к необратимой активации дыхания [18].
Высокоспецифичными неорганическими веществами, обладающими ин-
гибиторным действием на различные участки дыхательной цепи митохонд-
рий, являются цинк, цианиды и азиды. Действие цинка локализуется в
одной точке дыхательной цепи, расположенной между цитохромами в ИС|,
в которой и происходит ингибирование переноса электронов, в то время
как на участки, расположенные по обе стороны от специфически ингиби-
руемого, заметного влияния цинка не выявлено. С высокой специфичнос-
к> и чувствительностью дыхательной цепи митохондрий к цинку связыва-
ло регулирующее влияние на интенсивность ее работы [17, 18].
т ингибирующим влиянием на следующее звено дыхательной цепи ми-
НД°ИДРНЙ ~ цитохромоксидазу — связано высокоспецифическое действие
сое Нерго°бразующие митохондриальные процессы двух классов химических
реагИНений ~ цианидов и азидов. Ионы этих соединений — CN- и N3-,
дыха^^ При весьма низких концентрациях с этим ферментом, подавляют
ИонпНИе митохондРий- Ингибиторная активность других неорганических
(SO 2-\В отношении цитохромоксидазы намного ниже. Так, сульфит-ион
пОр3 ' П0Давляет активность цитохромок- чдазы в концентрациях на 3—4
адка ниже, чем высокоспецифичные цианиды и азиды.
Дь>хание
107
Установлено ингибирующее действие ряда неорганических соединений
на трансмембранный перенос неорганического фосфата. Такие тиоловые
яды, как кадмий, ртуть и их неорганические соединения, подавляют транс-
порт неорганического фосфата, нарушают окислительное фосфорилирова-
ние, почти до нуля снижая величину P/О. Хроническое воздействие ацетата
свинца также снижает эффективность сопряжения (по величине P/О), ЧТо
приводит к значительному подавлению окислительных процессов в мито-
хондриях печени, причем изменения P/О и дыхания митохондрий происхо-
дят раньше, чем характерный для свинца клинический признак интоксика-
ции — появление в крови базофильно-зернистых эритроцитов. В митохонд-
риях не только печени, но и почек свинец вступает в конкурентные взаимо-
отношения с неорганическим фосфатом. При его отсутствии свинец пол-
ностью ингибирует дыхание в концентрации 0,2 ммоль, а 25 ммоль фосфата
полностью снимают этот эффект [18].
Помимо ингибирующего эффекта в отношении трансмембранного пере-
носа неорганического фосфата, кадмий и ртуть увеличивают активность
латентной АТФазы и транспорт калия, усиливают выброс протона из мито-
хондрий. Им присущи не только ингибиторная активность, но и разобща-
ющие свойства, однако последние проявляются в очень узком концентра-
ционном диапазоне. Так, CdCl2 в концентрации 1,610“6 М полностью
разобщает окислительное фосфорилирование (субстрат окисления — сукци-
нат), а при концентрации 3,3-10“6 М (при окислении янтарной кислоты)
окислительное фосфорилирование ингибируется уже на 30 % [18].
Аналогичный механизм действия на дыхание митохондрий установлен и
для органических соединений ртути и кадмия [18].
Нарушения энергообразующей функции митохондрий, связанные с ин-
гибиторным действием на трансмембранный перенос неорганического фос-
фата, установлены для малеимидов. Они являются эффективными ингиби-
торами окислительного фосфорилирования, причем дыхание, связанное с
фосфорилированием АДФ, угнетается более низкими концентрациями от-
дельных веществ, входящих в этот класс химических соединений, чем ды-
хание в разобщенном состоянии, когда скорость переноса электронов по
дыхательной цепи не лимитируется работой механизмов, обеспечивающих
фосфорилирование АДФ [19].
ЛИТЕРАТУРА
1. Владимиров Ю.А., Азизова О.А., Деев А.И. и др. Свободные радикалы в живых
системах. — В кн.: Итоги науки и техники. Серия Биофизика. — М.: ВИНИТИ,
1991. -Т. 29. - С. 250.
2. Голиков С.Н., Саноцкий И.В., Тиунов Л.А. Общие механизмы токсического дей-
ствия. — Л.: Медицина, 1986. — С. 280.
3. Ершов Ю.А., Плетнева Т.В. Механизмы токсического действия неорганических
соединений. — М.: Медицина, 1989. — С. 272.
4. Жаров А.Н., Новиков В.Е. Состояние окислительного фосфорилирования в ми-
тохондриях головного мозга при его токсическом и травматическом отеке-на-
бухании//Вопр. мед. химии. — 1992. — Т. 38. — Вып. 5. — С. 24—25.
5. Коржеев А.А., Комиссарова И.А. О механизме повреждающего действия гипоксии
на дыхательную цепь и способы ее фармакологической коррекции//Экспер-
клин, фармакол. — 1994. — Т. 57. — № 1. — С. 45—47.
108
Курляндский Б.А. О некоторых закономерностях развития хронических интокси-
каний промышленными органическими веществами (к проблеме токсических
воздействий малой интенсивности): Дис. ... д-ра мед. наук. — М., 1970.
7 Курочкин В.К., Лошадкин Н.А., Попов А.Г. и др. Классификация информации по
химическим веществам и военной токсикологии в контексте проблем химичес-
кого разоружения//Токсикол. вестн. — 1994. — № 3. — С. 19—23.
g Лошадкин Н.А., Абнизов С. С. Классификация токсичных веществ, вызывающих
оазличные типы гипоксий на начальных стадиях интоксикации//Токсикол.
вестн. - 1995. - № 3. - С. 25-27.
о Марри Р., Греннер Д., Мейс П.. Родуэлл В. Биохимия человека: Пер.с англ. —
1993. — М.: Мир. — Т. 1.
10 Метаболические аспекты действия на организм индустриальных химических
соединений. — В кн.: Сб. научн. трудов Красноярского мед. ин-та. — Красно-
ярск, 1988.-С. 14-89, 86-91.
ц. Милаева Е.Р., Тюрин В.Ю., Харитонашвили Е.В. и др. Молекулярные механизмы
действия ртутьорганических соединений на электрон-транспортную цепь мито-
хондрий. — В кн.: Материалы XVI Менделеевского съезда по общей и приклад-
ной химии. - СПб. - 1998. - Т. 4. - С. 102.
12. Митохондрии. Аккумуляция энергии и регуляция ферментативных процессов. —
М.: Наука, 1977.
13 Митохондрии. Структура и функции в норме и при патологии. — М.: Наука,
1971. - 195 с.
14. Митрохин Н.М., Жигачева И.В., Чаморовская Л.Т. и др. Влияние комбинирован-
ного действия солей металлов и фенола на энергетику изолированных мито-
хондрий печени крыс//Бюл. экспер. биол. и мед. — 1992. — № 1. — С. 47—50.
15. Осипова В.П., Пименов Ю.Т., Берберова Н.Т. и др. Ингибирующее действие
ртутьорганических соединений на процессы клеточного и митохондриального
дыхания//Токсикол. вестн. — 1999. — № 1. — С. 21—26.
16. Прозоровский В.Б., Ливанов ГА. Некоторые теоретические и клинические про-
блемы токсикологии фосфорорганических инсектицидов//Токсикол. вестн. —
1997. — № 3. - С. 2-10.
17. Ротенберг Ю.С. Проблема влияния промышленных токсических веществ на
биоэнергетические процессы организма в гигиене и токсикологии: Дис. ... д-ра
мед. наук. — М., 1980.
18. Ротенберг Ю.С. Классификация ксенобиотиков по локализации их действия на
ферментные системы митохондрий//Бюл. экспер. биол. и мед. — 1982. — № 9. —
С. 42-45.
*9. Ротенберг Ю.С., Кельман Г.Я. Ингибирование процессов дыхания и фосфори-
лирования производными малеимида//Биохимия. — 1975. — Т. 40. — Вып. 3. —
С. 489-496.
20- Ротенберг Ю.С., Курляндский Б.А. О влиянии длительного действия токсических
веществ на напряжение кислорода в тканях центральной нервной системы//Акт.
вопр. гигиенич. токсикол. — М. — 1972. — С. 76—77.
21- Ротенберг Ю.С., Курляндский Б.А. О возможности расчета токсических и мини-
мально действующих концентраций промышленных ядов в тканях по их инги-
биторной активности//Гиг. труда и проф. заб. — 1978. — № 5. — С. 38—41.
Ротенберг Ю.С., Мазаев В.Т., Шлепнина Т.Г. Особенности действия оловоалки-
лов на дыхание и окислительное фосфорилирование митохондрий печени
*рыс//Укр. биохим. журнал. — 1978. — Т. 50, № 6. — С. 695—700.
109
23. Ротенберг Ю.С., Сербиновская Н.А. Экспрессное определение параметров токси-
кометрии новых химических агентов на изолированных митохондриях печени-
Методические рекомендации. — М., 1977. — 37 с.
24. Руководство по изучению биологического окисления полярографическим мето-
дом. — М.: Наука, 1973. — 221 с.
25. Сидорин Г.И., Дьякова Л.И., Луковникова Л.В. и др. Нитрилы: токсикокинетика
токсичность и опасность//Токсикол. вестн. — 1996. — № 1. — С. 19—22.
26. Сидорин Г.И., Суворов И.М., Луковникова Л.В. и др. О патогенезе трихлорэтиле-
новой интоксикации//Гиг. труда и проф. заб. — 1992. — № 2. — С. 32—35.
27. Скулачев В.П. Трансформация энергии в биомембранах. — М.: Наука, 1972.
28. Толкачев Д.А. Влияние хронического воздействия оксида углерода в минимально
эффективных концентрациях на организм экспериментальных животных//Ток-
сикол. вестн. — 1994. — № 4. — С. 31—33.
29. Фролова АД. Гигиеническое регламентирование металлов на основе механизма
повреждающего действия: Автореф. дис. ... д-ра мед. наук. — Л., 1990. —41 с.
30. Фролова А.Д., Луковникова Л.В. Изучение процессов биологического окисления
in vitro для ускоренного прогнозирования метаболической активности промыш-
ленных ядов//Токсикол. вестн. — 1994. — № 4. — С. 20—24.
н V.r- .
«ЯМВЖЖЧ» ..... 3 ..
кдфЛ. н?1 > m-й. : г •
4.1-' ч. .. .- . .
•“-J? «И’-- / - • .
s ,
.«!• . tislyp- ' .-"'I'.:
— .1 ItWh*-- - . У 4 ; :
.< г ... о - -
XStiiV- г. ‘ . ... .г ’ Is. .V-
...........р:’
Л ' " '-У' ‘
Г лава 4
ТИОЛОВЫЕ ЯДЫ
4.1. Патогенез и механизмы токсического действия
тиоловых ядов
4.1.1. Общие положения
Токсикология тиоловых ядов и в первую очередь металлов рассматрива-
ется как один из ведущих разделов промышленной токсикологии прежде
всего в связи с преимущественно профессионально обусловленным контак-
том с этими элементами в чистом виде, а также в сплавах, огромном
количестве неорганических и органических соединений, используемых
практически во всех сферах хозяйственной деятельности человека. Широкое
распространение указанных элементов и их соединений в природе, посто-
янно возрастающее антропогенное загрязнение ими окружающей среды,
которое приняло глобальный характер, явились основой интенсивного изу-
чения металлов в экологической токсикологии. Как в первом, так и во
втором направлениях среди необозримого количества научных работ и пуб-
ликаций преобладают исследования, посвященные тяжелым металлам, или
тиоловым ядам.
К тиоловым ядам относятся химические вещества, способные блокировать
сульфгидрильные (SH-) группы белков и тем самым нарушать обменные про-
цессы в организме.
Хотя в группу ферментных ядов [75] входят многие элементы и соеди-
нения неорганической и органической природы, с понятием “тиоловые
яды” прежде всего ассоциируются мышьяк и тяжелые металлы (кадмий,
ртуть, свинец), а также медь, железо, кобальт, цинк, марганец, молибден,
хром, ванадий, никель. Поэтому в данном разделе будут рассмотрены имен-
но представители названного класса ядовитых веществ общетоксического
Действия. Правильнее было бы назвать эти химические агенты блокаторами
Функционально активных групп белков, так как они связывают также амин-
ные, карбоксильные и другие группы, хотя и в существенно больших дозах.
Но сульфгидрильные группы, как правило, блокируются при более низ-
ких концентрациях соединений трехвалентного мышьяка, тяжелых металлов
и Других тиоловых реагентов, что, вероятно, и послужило основанием для
такого группового названия этих ядов. Важно подчеркнуть, что предпочти-
тельными лигандами1 для тяжелых металлов являются пептиды и аминокис-
отные остатки белков, тогда как взаимодействие с низкомолекулярными
росодержащими лигандами у них не столь однозначно по своим вероят-
ым биологическим эффектам. Поэтому рассмотрение природы тяжелых
зыв' Вигандами называют вещества, связывающие металлы. Если металл при свя-
хедаНИИ с лигандом заключен между двумя элементами (N, О, S), образуется
TenJH°e“кольцо- таком соединении металл более прочно связан с лигандом.
Ин ‘хелат” происходит от греческого слова khele — клешня краба.
111
металлов, их физико-химических свойств, предпочтительных органов-мц-
шеней, объектов взаимодействия в организме — важная задача в раскру.
тии патогенетических механизмов вероятных отравлений и заболеваний
химической этиологии, связанных с токсическим воздействием тиоловых
ядов.
Вопросы клиники, лечения и профилактики острых и хронических от-
равлений тяжелыми металлами изучены достаточно хорошо, тогда как па-
тогенетические механизмы токсического действия описаны лишь фрагмен-
тарно и требуют дальнейшего изучения. Такое положение вполне естествен-
но отражает непреходящий процесс познания новых элементов бесконечной
гаммы, сложной мозаики физиологических реакций, структурных преобра-
зований и обменных нарушений, в совокупности формирующих данный вид
патологии (болезнь), описываемый типичной клиникой конкретного забо-
левания. Интегрируя в себе специфику экзогенного “причинного” фактора
с характерными видовыми и индивидуальными особенностями экспониро-
ванного организма, патогенез остается прерогативой, “свойством реагирую-
щего субстрата” по И.В.Давыдовскому [18]. Поскольку число переменных в
рассматриваемых системах огромно, а их результирующие носят стохасти-
ческий характер, изучение патогенетических механизмов представляется
сложной и трудно выполнимой задачей. Прежде всего это касается биохи-
мических механизмов на молекулярном и клеточном уровнях. Как неодно-
кратно подчеркивали А.А.Покровский [43] и Л.А.Тиунов [57], яды не только
раскрывают клеточные и субклеточные субстраты токсического воздействия,
но и позволяют “препарировать” метаболические пути и комплексы, изби-
рательно изменять скорость и направление биохимических процессов в
живом организме и тем самым познавать их физиологическое значение,
целенаправленно строить системы фармакологической коррекции и профи-
лактики. Таким образом, изучение механизмов действия тяжелых металлов
имеет также общебиологическое значение.
В патогенезе отравлений и функциональных нарушений организма, экспо-
нированного тяжелыми металлами, тесно сочетаются специфические элемен-
ты (избирательная токсичность) и реакция стрессорного, неспецифического
характера.
Это определяется особенностями рассматриваемой группы ядов, с одной
стороны, и различиями в реагировании организмов на их поступление,
обусловленными фило- и онтогенетическими отличиями, — с другой. В пер-
вом случае важно учитывать физико-химические свойства металла в элемен-
тарной, ионизированной (соли) и соединенной с органическим лигандом
формах. А.Альберт [1] указывает на четыре основные группы факторов,
определяющих избирательную токсичность ядов в этом плане: ионизация,
редокс-потенциал, стерические особенности ковалентной связи и раствори-
мость. Однако перечисленные свойства отнюдь не относятся к категории
независимых и конвергируют в широких пределах. Так, стерические факто-
ры влияют на ковалентную гидратацию. Например, метильная группа по-
вышает липофильность соединения, препятствуя присоединению молекулы
к соседней двойной связи. Электронодонорная метильная группа при нали-
чии ее связи с атомом углерода понижает кислотность и ведет к росту
основности соединения с существенным изменением его биологическом
активности. Значение указанных закономерностей наиболее четко просле-
живается при рассмотрении мышьяк-, олово-, свинец- и ртутьорганически
соединений, биологические эффекты которых обусловлены свойствами ме-
талла, органического лиганда и молекулы в целом.
Что касается объекта воздействия, то, во-первых, большая часть метал
112
в относится к категории биоактивных и необходимых для нормальной
Жизнедеятельности организма. Это вызывает негативные реакции, измене-
ние физиологических функций и метаболизма не только при избытке, но и
пои недостатке микроэлементов в организме. Р.Мартин [35] распределяет
химические вещества, в том числе и ионы металлов, в зависимости от их
поведения в живых системах на необходимые, инертные и токсичные. При
этом он сразу же оговаривает условность такого подразделения, так как в
зависимости от концентрации и времени контакта металл может действовать
По каждому из названных типов.
Слабость такой классификации объясняется также тем неоспоримым
фактом, что само понятие “необходимость” постоянно уточняется. При
этом главное внимание справедливо уделяется взаимосвязи между химией
ионов металлов и их жизненно важной ролью, хотя в решении этой про-
блемы, по справедливому мнению Х.Зигеля [20], мы находимся в самом
начале пути.
Именно приложение координационной химии металлов к биологичес-
ким проблемам привело к развитию нового перспективного направления в
биохимии, получившего наименование “неорганическая биохимия” [81].
Во-первых, раскрытие закономерностей образования комплексов металлов
с олигомерами, пептидами, белками и небелковыми макромолекулами мо-
жет иметь большое значение для познания, в частности, механизмов ток-
сического действия ионов металлов, в том числе переходных и тяжелых.
Во-вторых, имеет место функциональное взаимодействие эссенциальных,
бионеобходимых микроэлементов в организме, вне деформации которого
рассмотрение механизмов токсического действия тяжелых металлов не мо-
жет быть признано удовлетворительным. Наконец, в-третьих, в известных
пределах существует обратная функциональная взаимосвязь между величи-
ной действующей или суммарной дозы тяжелого металла и выраженностью
его избирательной токсичности (полнотой проявления специфических био-
логических свойств, особенно на клеточном и молекулярном уровнях). В то
же время воздействие в очень низких дозах, если исключить парадоксальные
эффекты [7, 45], представляет наибольшие трудности в интерпретации на-
блюдаемых изменений, так как в сложных и многоэтапных процессах био-
трансформации вводимого вещества, сочетания повреждающих и компен-
саторных реакций вычленить и охарактеризовать токсическое действие
крайне затруднительно, а сделанные обобщения могут носить лишь спеку-
лятивный характер.
Отличительной особенностью рассматриваемой группы токсикантов яв-
ляется их выраженная способность к материальной кумуляции в биообъектах
признаками токсического действия после более или менее про-
латентного периода (хронотропность данной группы ядов).
Безусловно, существуют определенные особенности клинических прояв-
лений отравлений тяжелыми металлами при разных путях их поступления
организм, зависящие от соотношения местного и общего (общетоксичес-
кого) компонентов повреждения и реагирования, распределения ядов в
канях ^скорости достижения критической концентрации металла в органе,
’ ' такой (по определению ВОЗ, [86]) концентрации, когда в любой из его
*ТОк возникают обратимые или необратимые неблагоприятные функцио-
роМЬНЫе изменения. При этом за критический орган принят такой, в кото-
ппи ВпеРВЬ1е или раньше достигается критическая концентрация металла
определенных условиях для данной популяции данного биологического
<• возможными
должительного
113
вида. При этом для данной группы ядов биохимические изменения в орга-
низме человека и животных являются наиболее показательными.
Ведущим механизмом токсического действия тяжелых металлов призна-
ется угнетение ими многих ферментных систем в результате блокирования
сульфгидрильных и других функциональных групп в активных центрах и иных
биологически важных участках белковых молекул [15, 60].
Традиционно объектами наиболее пристального внимания являются
ферментные системы энергетического обмена. Например, ведущим процес-
сом в механизме токсического действия мышьяка и арсенитов, кадмия
свинца, ртути и других металлов, принадлежащих к числу меркаптидообра-
зующих тиоловых ядов, является блокирование SH-групп пируватоксиля?.
ной системы, которая содержит ковалентно-связанный дитиоловый кофак-
тор — липоевую кислоту. На ее примере был прослежен один из ставших
классическим в токсикологии биохимических механизмов токсичности, дав-
ший начало систематическому изучению тиоловых ядов, позволивший кар-
динально решить проблему их антидотной терапии, а также положивший
начало широкому использованию химических соединений с известным
механизмом действия и природных ядов в препаративной биохимии,
молекулярной биологии, фармакологии и экспериментальной терапии [48'
56, 71].
4.1.2. Физико-химические основы токсичности
тяжелых металлов как тиоловых ядов
Как известно, к тяжелым металлам относятся элементы, обладающие
металлическими свойствами и имеющие высокую плотность. Е.А.Лужников,
Л.Г.Костомарова [17] относят к этой группе более 40 элементов с плотнос-
тью выше 6 г/см3, тогда как А.Т.Пилипенко и соавт. [52] — такие элементы,
плотность которых превышает 5 г/см3. И.М.Трахтенберг и соавт. [61] вклю-
чают в эту группу 43 из 84 металлов, входящих в Периодическую систему
элементов Д.И.Менделеева. Среди них 10 обладают наряду с металлически-
ми свойствами признаками неметаллов и имеют плотность 7,14—21,4 г/см3.
Так, в V группе металлические свойства (например, электропроводность)
отмечают уже у мышьяка, который рассматривают также в группе тяжелых
металлов. Наличие металлических свойств предполагает меньшую электро-
отрицательность рассматриваемого атома по отношению к окружающим его
лигандам и особенно непосредственно присоединенным к металлу донор-
ным атомам. Общее количество последних называется координационным
числом. Легкие переходные металлы имеют более высокие, а тяжелые —
более низкие координационные числа. У многих металлов ионная модель в
силу эффектов кристаллического поля не имеет сферической формы, что
приводит к переходу от ионной к ковалентной связи. Для этих комплексов
важно оценить такие показатели, как нейтрализация зарядов и кислотность
по Льюису. Здесь понятие “кислота” относится к иону металла в состоянии
окисления, а “основание” — к донорным атомам лиганда [6]. Среди биоло-
гически активных типов донорных атомов в лигандах кислород и алифати-
ческий азот относят к жестким (с ними преимущественно взаимодействуют
“жесткие” ионы металлов, например А13+, Ве2+, Сг3+), ароматический азот —
к промежуточным, а серу — к мягким (с ней соединяются преимущественно
мягкие ионы металлов — Cd2+, CH3Hg+, Hg2+, Т1+ и промежуточный РЬ >
но не другие промежуточные ионы металлов). Вообще, РЬ2+ — единствен-
ный металл, проявляющий практически в равной мере признаки всех трех
114
сов соединений, образуя также аномально сильные гидрокомплексы в
^“тоальных и щелочных растворах. В то же время мягкий Cd2+ в отличие
НбИ оугих металлов данного класса не реагирует с эфирной серой (в метио-
°ине) тогда как жесткий Со3+ и промежуточный Си2+ взаимодействуют
с ней.
Наличие в биологических системах отклонении от существующей клас-
Аикации еще раз подтверждает сложность биохимических механизмов
С ксического действия ионов металлов, сохраняющихся в них многочислен-
ных неопределенностей и компромиссов [35].
" При оценке токсичности иона металла не менее важен показатель ус-
тойчивости его связи с лигандом. Он оценивается по константам устойчи-
вости с бидентатными лигандами, ряд которых от магния до двухвалентной
птути характеризуется различиями по стандартным лигандам: глицину — 108
и 1,2-этилендиамину — 1014 раз [2]. Инкремент между ионами металлов
увеличивается в ряду донорных атомов 0<N<S. При этом соединение с
серой для Cd2+ и РЬ2+ имеет более высокий ранг, чем в стандартных сериях.
По величине устойчивости связи с серосодержащим лигандом (сульфгид-
рильные группы как высокомолекулярных, так и низкомолекулярных соеди-
нений) получен такой ряд: Cd2+<Pb2+<CH3Hg+<Hg2+. Следует подчеркнуть,
что такой же характер устойчивости комплексов по Ирвингу — Уильямсу
сохраняется для них с монодентатным (ОН-) и тридентатным (гистидин)
лигандами.
Г.К.Фримэн [69], характеризуя металлы, предпочитающие серосодержа-
щие доноры (по сравнению с кислород- и азотсодержащими), подчеркивает
их способность образовывать не только сильные 0-связи с легко поляризу-
емыми лигандами, но также и тг-связи посредством обратного переноса
электронов с бтг-орбиталей металла на dx- и ртс-орбитали лиганда в связи с
тремя особенностями серосодержащих лигандов:
• в связи с низкой электроотрицательностью серы и высокой поляри-
зуемостью в поле маленького иона металла с высокой плотностью
заряда, даже если ион металла имеет конфигурацию d ,
• расчеты показали, что для ионов с конфигурацией d 0 ни поляризу-
емость, ни теплота образования простой ковалентной связи не могут
объяснить даже порядков устойчивости сравниваемых связей металл-0
и металл-S, что привело к заключению о существовании бл—dn-связи
металл — лиганд;
• серосодержащие лиганды занимают различные положения в спектро-
химической серии (от низких до высоких), что в случае связей с
низкоспиновыми ионами с конфигурацией d8 дает дополнительную
стабилизацию за счет увеличения энергии стабилизации кристалли-
ческим полем (ЭСКП).
ны Доказательства предпочтительного связывания серы с металлом получе-
вид сРаанением ИК-спектров твердых образцов со спектрами в УФ- и
среИМ0/* властях. Большинство этих элементов находятся в природных
с ЧГ 'атмосФеРе и гидросфере) в концентрациях менее 1 ммоль/м3, в связи
Уровн “ИХ часто называют следовыми металлами. Локальное повышение
добы еИ эт*1х элементов в атмосфере и гидросфере связано с развитием
сельсВаЮЩей и пеРеРабатывающей промышленности, а также интенсивных
Хозяйственных технологий и транспорта. Предел, до которого атмо-
115
сфера привносит металл (М) на поверхность земли либо океана сверх
природного циклического уровня, Г.Спозито [51] выражает с помощью
фактора обогащения EFA:
где Jj4 — средний поток (осадки) на землю либо поверхность океана; JIM _
средний поток (осадки) индексного металла (IM).
Обычно в качестве IM выбирают А1. Низкие значения EF* для Атлан-
тического океана и Северного моря, приведенные автором (0,02 для Cd, 0,03
для Hg и только для РЬ этот показатель составлял 4,1—5,9), указывают на
относительно низкие уровни антропогенного загрязнения океана, тогда как
этот же показатель (EFA) для земной поверхности составил для Cd 5917, а
для Hg — 1972. Антропогенный вклад для системы земля — воздух наиболее
существен для Мп, Си, Zn, Cd, РЬ. Они наряду с Ag, Sb, Sn, Hg представляют
наибольшую потенциальную опасность. Автор приходит к справедливому
заключению, что значительное обогащение окружающей среды этими ме-
таллами из антропогенных источников наряду с низким природным уровнем
в биосфере и высокой мягкостью в водных средах требует постоянного
изучения и контроля влияния на состояние здоровья населения.
4.1.3. Тиоловые группы белков, их роль в клеточном
метаболизме и патогенезе отравлений тяжелыми
металлами
Практически любая биологическая система реагирует на следовые коли-
чества катионов тяжелых металлов, поступающих из внешней в ее внутрен-
нюю среду. В качестве лигандов в организме млекопитающих могут высту-
пать аминокислоты, пептиды, нуклеотиды, порфирины, гормоны и белки.
Однако в тканях и биологических жидкостях организма металлы прежде
всего связываются с пептидами и аминокислотными остатками белков. Для
выяснения механизмов связывания металлов с пептидами используют пеп-
тидоподобный комплекс — биурет (Biu). Он ведет себя как монодентатный
лиганд в комплексах с Со, Си, Hg, образуя по одной связи металл —
амидный кислород. Атомы металла, например Cd, при этом соединены в
бесконечные цепи металл-С^-металл мостиками из двух атомов хлора, ко-
торые дополняют октаэдрическую координацию Cd^iuHjhClj- Другим при-
мером может быть образование формамидного комплекса, который имеет
такую же конфигурацию — Cd(HCONH2)2Ch [69].
Характеристика основных групп атомов в аминокислотах и пептидах,
потенциально способных к связыванию металла, оказывает существенную
помощь в изучении взаимосвязи металлов с белками. Однако последняя
может существенно отличаться за счет ограничений, накладываемых третич-
ной структурой белка, где активность функциональных групп подчиняется
геометрическим требованиям, налагаемым цепью белка и контактом с ДРУ'
гими группами, координированными с тем же атомом металла. Белок как
полифункциональный лиганд действует полидентатно, он замещает ряд мо-
лекул воды или другого монодентатного лиганда из окружения иона металл ,
придавая образующемуся хелатному комплексу дополнительную термодин
мическую устойчивость. Кроме того, активные центры ферментов, в то
числе и металлоферментов, находятся в полостях белковой структуры, к
116
nbie выстланы главным образом неполярными боковыми цепями амино-
кислот и моделируют неводные растворы. Следовательно, связывание ме-
Калла таким активным центром или вблизи него осуществляется в неводных
тасТворах, где физико-химические закономерности существенно отличаются
Р таковых в водных растворах электролитов, в которых обычно изучается
°3аимодействие металлов с пептидами. Тем не менее Г.К.Фримэн считает
эти опасения преувеличенными и модельные исследования in vitro весьма,
информативными.
Среди функциональных групп белковых молекул высокой реакционной
способностью и разнообразием химических реакций выделяются серосодер-
жащие, особенно сульфгидрильные группы, необходимые для проявления
биологической активности и поддержания макромолекулярной структуры
многих белков [58].
SH-группы не образуют в белках каких-либо внутримолекулярных кова-
лентных связей, помимо дисульфидных и связей, опосредованных через ион
металла. Нарушение комплекса в результате модификации SH-группы (вы-
теснения из связи с ионом металла) может приводить к изменению струк-
туры белка, а также оказывать непосредственное деформирующее влияние
присоединившейся молекулы ингибитора (ее гидрофильного либо гидро-
фобного радикала или заряженной группы) на соседние участки белковой
глобулы и ее влияние на взаимодействие между субъединицами. Меркури-
нитрофенолы и р-меркурибензоат вызывают диссоциацию гемоглобина на
а- и p-цепи. Хлорная ртуть не только не вызывает, но и обращает диссо-
циацию.
Активность большинства ферментов подавляется множеством соедине-
ний. Процесс часто отличается высокой специфичностью. В этом случае
структура ингибитора позволяет изучать строение активных центров и ком-
плементарность биомолекул. Ингибирование ферментов лежит в основе
действия большинства токсикантов и лекарственных средств, в том числе и
тиоловых ядов. Они могут выступать как конкурентные ингибиторы, струк-
турно аналогичные субстрату, при этом обратимо связываются с субстрат-
связывающим центром. В ряде случаев может иметь место неконкурентное
ингибирование — ингибитор связывается не только со свободным фермен-
том, но и ферментсубстратным комплексом. Ингибитор соединяется одно-
временно с субстратом, отличается от него по своей структуре и связывается
с аллостерическим центром.
Подавление активности фермента может быть связано с искажением его
трехмерной структуры (конформации). При действии тиоловых ядов это
может быть обусловлено как нарушением трехмерной структуры молекулы
оелка, так и происходить вследствие нарушений внутримолекулярных связей
либо из-за деформирующего влияния ингибитора на молекулу белка.
Связанный ингибитор может также экранировать активный центр. Бло-
кирование SH-групп затрудняет возвращение белка в исходную, более энер-
тически выгодную и более стабильную конформационную форму.
Иногда связывание с аллостерическим центром ведет к активации фер-
КфТ-? (например, активация кадмием уреазы). Уреаза (ключевой фермент —
ак $ 1-5) катализирует гидролитическое расщепление мочевины на амми-
никелГЛеКИСЛЬ1й Газ ^8]- Каждая молекула уреазы связана с двумя атомами
Мат^РИ недостатке в пищевом рационе никеля у цыплят развиваются дер-
нУ1ЛТь1, в клетках происходит набухание митохондрий, расширение пери-
клеарного пространства, нарушение функции мембран.
117
Токсичность никеля относительно низкая, а его содержание в тканях
составляет 1—5 мкг/л. В сыворотке никель связан в низкомолекулярные
комплексы с альбумином. Есть и специфический никельсодержащий
белок — никелоплазмин. Не исключено, что никель в уреазе играет ту же
роль, что и цинк в карбоксипептидазе. Тогда при интоксикации кадмием
имеет место его синергизм с никелем. Не исключено, что последний обра- i
зует координационное соединение с аммиаком, тогда ионы никеля и других
переходных металлов могут участвовать и в работе других ферментов, ката-
лизирующих гидролиз глутамина с образованием аммиака, а последний, как
известно, может играть существенную роль в инициации их нейротоксичес-
кого действия.
Для понимания механизмов действия тиоловых ядов необходимо вначале
рассмотреть химические свойства сульфгидрильной (-SH) группы цистеина,
дисульфидной (-S-S-) группы цистина и тиоэфирной (-S-CH3) группы ме-
тионина, а также данные о роли серосодержащих групп в ферментах и других
биологически активных белках.
Участие этих групп в ферментативном катализе и связывании субстратов
и кофакторов (ионов металлов и коферментов) нередко определяет спектр
изменений в организме при поступлении тиоловых реагентов, в том числе
арсенита и тяжелых металлов.
При реакции SH-групп с ионами металлов образуются меркаптиды (Me):
R-SH + Ме+ -» R-SMe + Н+ (2)
В отличие от реакций алкилирования реакции меркаптидирования носят
обратимый характер, но равновесие смещено в сторону образования слабо-
диссоциирующих меркаптидов. Ионы металлов легко реагируют как с RS-
ионами, так и с недиссоциированными SH-группами. Одновалентные ка-
тионы серебра, меди, золота и двухвалентные катионы ртути, свинца, кад-
мия и цинка, а также соединения трехвалентного мышьяка и сурьмы обла-
дают особенно высоким сродством к SH-группам. Старое название тиолов
“меркаптаны” происходит от латинского “mercurio aptum” — соединенный
с ртутью. Сродство ионов двухвалентных металлов к SH-группам уменьша-
ется в такой последовательности: Hg2+>Pb2+>Cd2+>Zn2+ [35]. Однако если
ионы ртути блокируют сульфгидрильные группы белков, цистеина, унитио-
ла, гемоглобина и небелковых гемолизатов эритроцитов, то не отмечалось,
например, блокирования тиоловых групп унитиола ионами кадмия, олова и
свинца. В то же время ионы кадмия и свинца блокировали SH-группы
цистеина на 27 и 50 % соответственно.
Существенные различия выявлены в степени связывания ионов тяжелых
металлов с SH-группами гемоглобина. Подобные результаты получены так-
же на гемолизатах эритроцитов [17]. Так, ионы ртути блокировали их на
100 %, ионы свинца — на 18 %, ионы кадмия — на 11 %, а ионы олова
вообще не вступали в реакцию с сульфгидрильными группами данного
белка. В связи с тем что SH-группы в белках обязаны своему наличию
остаткам цистеина, это обстоятельство служит подтверждением того факта,
что реакционная способность SH-групп во многом зависит от структуры
соединения, в которое они входят, о чем свидетельствуют многочисленные
экспериментальные исследования. Так, на основании сравнения данных
амперометрического титрования и реакции с нитратом серебра было пока-
зано, что между серебром и кадмием в организме существуют конкурентные
взаимоотношения, что связано с различной прочностью соединений типа
118
л _ сера при взаимодействии тяжелых металлов с тиоловыми соеди-
МеТиями. С аминотиолами и дитиолами ионы этих металлов образуют также
!JeHee прочные комплексы, чем с монотиолами. Логарифмы констант ста-
бильности комплексов Zni+ с тиолами и ЭДТА составляют для меркапто-
анола 5,9, меркаптоэтиламина и цистеина — 9,9, дитиотреитола — 10,3,
Эимеркаптопропанола — 13,5, для ЭДТА — 16,4. Данный показатель учиты-
д т при разработке системы лечебно-профилактических мероприятий, в
в числе реагентов, прочно соединяющихся с тяжелыми металлами.
Уже в 1953 г. Е.С.Баррон упоминает 17 реагентов на SH-группы и 42
тиоловых фермента. Представители всех классов ферментов, почти все из-
вестные дегидрогеназы, ферменты обмена аминокислот, углеводов и жиров,
биосинтеза белков ингибируются реагентами на SH-группы. Показана роль
этих групп в мышечном сокращении, окислительном фосфорилировании,
нервной деятельности, делении клеток, действии отравляющих веществ и
радиации.
Влияние тиоловых реагентов на упомянутые физиологические функции обу-
словлено блокированием SH-групп ферментов и других белков, а также низко-
молекулярных, функционально важных тиолов, выполняющих роль кофакторов
или простатических групп в различных ферментных системах.
В ферментативных реакциях участвуют и другие функциональные груп-
пы белков: имидазольная группа гистидина, гидроксильная — серина, е-ами-
ногруппы лизина, со-карбоксильные группы аспарагиновой и глутаминовой
кислот, фенольная группа тирозина и др. Однако SH-группы отличаются
исключительно высокой реакционной способностью и многообразием хи-
мических реакций. Они вступают в реакции алкилирования, ацилирования,
окисления, тиолдисульфидного обмена, реакции с сульфенилгалоидами, об-
разования меркаптидов, полумеркапталий, меркаптолов, комплексов с пере-
носом заряда и др. Большинство реагентов на различные функциональные
группы белка наиболее быстро реагируют со свободными SH-группами. Во
многих из этих реакций SH-группы принимают участие в форме меркап-
тидного иона. Он реагирует с а- и p-ненасыщенными соединениями (на-
пример, акрилонитрилом) в 280 раз быстрее, чем непротонированная ами-
ногруппа. Скорость реакции с 2,4-динитрофторбензолом у SH-группы цис-
теина в 90 раз выше, чем у фенольного гидроксила; в 160 раз выше, чем у
аминогрупп, и в 1600 раз выше, чем у имидазола. Меркаптидные группы,
таким образом, — более сильные нуклеофилы, чем другие группы белка.
Сильная нуклеофильность меркаптидных ионов обусловлена главным обра-
зом высокой поляризуемостью относительно большого атома серы. Атом
серы метионина образует координационную связь с ионом ртути. Тиоэфир-
ная группа метионина алкилируется бромбензилом в 50 раз быстрее, чем
деионизированная SH-группа, и в 33 раза быстрее, чем нейтральная
мидазольная группа гистидина или индольное кольцо триптофана. Лишь
н®Ркап™дный ион превосходит ее по нуклеофильной реакционноспособ-
Реа иоэФиРные и Дисульфидные группы вступают не в столь разнообразные
зНаКЦИИ’ как $Н-группа. Устойчивость -S-S-связей при физиологических
бцпЧениях pH хорошо соответствует их основной функции — участию ста-
акп?3аЦИИ макР°молекУляРной структуры белков. Дисульфидные группы в
врацВНЬ1Х центРах окислительных ферментов подвергаются обратимому пре-
кято ению в SH-группы при взаимодействии с субстратами и участвуют в
Фактической реакции.
119
Не менее важным элементом токсического действия тиоловых ядов явля
ется нарушение ими проницаемости клеточных мембран.
Это, в частности, отчетливо показано на примере мембраны эритроцитов
[111]. После преинкубации эритроцитов кролика в течение часа с ионами
тяжелых металлов оказалось, что действие ионов Hg, Pb, Cd в концентрации
1-Ю-3 М вызывает изменение хода кривой осмотической резистентности
эритроцитов в соотношении Hg2+>Pb2+>Cd2+, тогда как олово из опытов
было исключено ввиду снижения под его влиянием pH вследствие частич-
ного гидролиза соли SnC12. При этом ионы ртути вызывали полный гемолиз
а остальные — частичный. Это объясняется наличием тесной взаимосвязи
между структурной детерминированностью эритроцитов, с одной стороны
и их SH-группами — с другой. Последнее подтверждается признаками де-
стабилизации липопротеиновых комплексов, происходящей за счет конфор.
мационной перестройки апопротеиновой части комплексов из-за блокиро-
вания SH-rpynn.
Скрытые повреждения мембраны эритроцитов при действии тяжелых
металлов, помимо снижения осмотической резистентности эритроцитов,
проявляются в изменении кислотной, щелочной и сапониновой резистент-
ности эритроцитов, определяемой методом эритрограмм. Ионы ртути, свин-
ца и кадмия изменяют ход кривой осмотической резистентности эритроци-
тов уже в концентрациях 1 10“3 М. Наиболее интенсивным гемолитическим
действием обладают ионы ртути, а наиболее слабым — ионы кадмия. Инте-
ресно отметить существование коррелятивной связи между степенью вызы-
ваемого разными тяжелыми металлами разрушения липопротеидных ком-
плексов в экстрактах печени и стабильностью мембраны эритроцитов в
условиях проникновения в них ионов ртути, свинца, кадмия и олова. Осо-
бенно четко прослеживалась связь между щелочной резистентностью эрит-
роцита и модификацией белков мембраны ионами металла.
Монотиолы реагируют с соединениями трехвалентного мышьяка, обра-
зуя гидролизующиеся моно- и дитиоарсениты. Дитиолы реагируют с арсе-
ноксидами или арсенитом с образованием циклических дитиоарсенитов,
которые значительно стабильнее, чем моно- и дитиоарсениты, возникающие
при реакции с монотиолами. Особенно стабильны пятичленные кольца,
возникающие при взаимодействии соединений мышьяка с 1,2-дитиолами
(смежными дитиолами).
Именно с учетом сказанного показателен механизм токсического дейст-
вия мышьяка в организме [38]. Арсенат AsO4 подобен фосфату по таким
химическим свойствам, как размер молекулы, структура и способность всту-
пать в биохимические реакции. Но эфиры мышьяковой кислоты обладают
гораздо меньшей устойчивостью; если они образуются на поверхности фер-
мента, то легко гидролизуются при отщеплении от фермента. Этим объяс-
няется высокая токсичность соединений мышьяковой кислоты. Арсенат
может замещать фосфат во всех фосфоролитических реакциях, например в
реакциях расщепления гликогена, катализируемой гликогенфосфорилазоИ-
Появляется промежуточный продукт глюкозо-1-арсенат, который быстро
гидролизуется с образованием глюкозы (арсенолиз). Это же замещение
происходит и при окислении глицеральдегид-3-фосфата. Вместо фосфата
используется арсенат; возникающий ациларсенат гидролизуется с появлени-
ем 1-арсено-З-фосфоглицерата, который дает 3-фосфоглицерат, т.е. процесс
не прекращается, но не образуется АТФ (арсенат разобщает процессы окис~
ления и фосфорилирования). Он же частично замещает фосфор в стимула
ции дыхания митохондрий с разобщением окислительного фосфорилиров
120
Идет медленная реакция превращения соответствующего нефосфори-
пированного субстрата.
л eqt описанного патогенетического механизма существенно отличается
всяческое действие арсенита. Он способен энергично реагировать с тио-
т°„ь1Ми группами, особенно дитиолами, например липоевой кислотой. Бло-
л° я окислительные ферменты, зависящие от липоевой кислоты, арсенит
Кпособствует накоплению пирувата и других а-кетокислот в тканях. Через
5 и 150 мин после внутривенного введения арсенита натрия новозеландским
кроликам в дозе 7 мг/кг (LD10) активность пируватдегидрогеназного ком-
плекса (ПВДГ) возрастала с 0,088 до 0,288 и 0,33 ммоль/л соответственно
Ц11]. В то же время, по мнению авторов, величина активности комплекса
пируватдегидрогеназы не может использоваться при мониторинге отравле-
ний мышьяком, так как повышение ее активности может носить однотип-
ный характер при голодании животных или других стрессовых воздействиях,
а не только при интоксикации арсенитом.
Отмечены различия в действии двух типов соединений трехвалентного
мышьяка: монозамещенного (R—As=O) и дизамещенного (R-AsCl-R'). Пер-
вые эффективно блокируют SH-группы, а вторые — нет. Торможение неко-
торых ферментов (сукцинатдегидрогеназы, альдегиддегидрогеназы, глута-
минсинтетазы, тиолтрансацетилазы, люциферазы, ацетил-КоА-карбоксила-
зы) арсенитом резко усиливается в присутствии моно- и дитиолов. Вероятно,
роль тиола состоит в восстановлении дисульфидной группы белка в сбли-
женных SH-группах, реагирующих с арсенитом. Однако этот механизм не
может быть признан единственным. Например, пируватоксидаза эффективно
ингибируется без дитиолов (на 50 % при концентрации арсенита 1,710“5 М),
причем торможение не снимается цистеином.
Применение арсенита и арсеноксидов способствовало выявлению дити-
оловых группировок (пространственно сближенных пар SH-групп, принад-
лежащих остаткам цистеина) в активных центрах дигидролипоатдегидроге-
назы и некоторых альдегиддегидрогеназ. Это действие было впервые обна-
ружено на пируватоксидазной системе, которая содержит ковалентно-свя-
занный дитиоловый кофактор — липоевую кислоту. Признаком наличия
дитиоловой группировки является высокая чувствительность фермента к
торможению низкими концентрациями арсенита или арсеноксидов (порядка
Ю —10~4). Ферменты, ингибированные препаратами мышьяка, полностью
реактивируются при добавлении избытка 2,3-димеркаптопропанола. При
этом монотиолы малоэффективны.
SH-группы, входящие в состав активных центров ферментов, при взаи-
модействии с субстратами подвергаются обратимому превращению в S-S-
группы. Однако последние существуют в белках самостоятельно и играют
определенную роль в их структуре и функционировании. Связь между двумя
Двухвалентными атомами серы прочнее, чем связь между двумя атомами
ислорода; энергия разрыва связи составляет 70 и 39 ккал/моль соответст-
гилН°' ДисУльФйДНые группы образуются также в процессе окисления (де-
идРнрования) SH-групп низкомолекулярных тиолов и белков в “мягких”
рат°Виях' Скорость и характер окисления SH-групп зависят от pH, темпе-
Уры, пространственного расположения сульфгидрильной группы в белке
и Других условий.
Рова нактивация альдолазы мышц (КФ 4.1.2.13), наступающая при ацили-
«ии ^Н-групп р-меркурибензоатом, является следствием обратимых
ВаниНеНИй В стРУктУРе фермента. Инактивация не наступала при блокиро-
и наиболее реакционно-способных SH-групп, а только возникала при
121
наличии вяло реагирующих SH-групп. Потеря активности становится ре,
зультатом конформационных изменений, наступающих после блокирования
SH-групп. Действие р-меркурибензоата, метилмеркуринитрата и иодацета-
мида вызывает не только подавление активности фермента, но и его распад
на 4 субъединицы. Скорость инактивации сопоставима с образованием
меркаптидных связей. Так же ведет себя при действии тиоловых реагентов
и глутаматдегидрогеназа (ГДГ), гексокиназа, 3-фосфоглицеринальдегидде-
гидрогеназа (3-ФГАДГ, КФ 1.2.1.12), синтетаза жирных кислот и пируват-
карбоксилаза печени, многие другие ферменты.
Изменения в структуре ферментов (трансконформация) под влиянием
меркаптидобразующих агентов могут приводить и к росту активности фер-
ментов. Небольшое количество р-меркурибензоата в присутствии ионов
Са2+ вызывает увеличение аденозинтрифосфатазной активности миозина в
3—4 раза. Однако повышение концентрации агента приводит к ингибиро-
ванию и полному подавлению активности: малатдегидрогеназы (МДГ, КФ
1.1.1.37) — под действием ртути, глутаматдегидрогеназы (ГДГ, КФ 1.4.1.2) —
под действием органортутных соединений.
Одной из причин изменений в макромолекулярной структуре белков при
блокировании SH-групп может быть разрыв внутримолекулярных связей, в
образовании которых принимают участие SH-группы (их возможная роль в
гидрофобных взаимодействиях), нарушается упаковка неполярных боковых
цепей, аминокислотных остатков внутри молекулы белка.
Ионы серебра и ртути ускоряют гидролитическое расщепление S-S-свя-
зей в щелочной среде. Начальная скорость реакции гидролиза пропорцио-
нальна концентрации ионов серебра, т.е. роль ионов металла не сводится
лишь к сдвигу равновесия в гидролитическом расщеплении связи, а ион
металла присоединяется к связи с образованием комплекса, который затем
гидролизуется под влиянием нуклеофильной атаки гидроксильных ионов.
Конечными продуктами реакции является меркаптид и сульфоновая кислота
в соотношении 1 моль дисульфида — 1,5 моля меркаптида. Дисульфидные
группы стабилизируют макромолекулярную структуру белков. S-S-связи
в нативных белках не реагируют с тяжелыми металлами при комнатной
температуре и pH 4,0—8,0. Дисульфидные группы восстанавливаются ти-
олами. В организме действует тиолдисульфидный обмен, например с глу-
татионом.
Глутатион представляет собой трипептид у-глутамилцистеинилглицин,
который существует в восстановленной (Г-SH) и окисленной (rS-ST) фор-
мах. Его функции в клетках весьма разнообразны. Внутриклеточная кон-
центрация 0,4—12 ммоль. Все функции глутатиона выполняются при учас-
тии SH-группы. Он осуществляет перенос аминокислот через клеточные
мембраны. В тканях есть глутамильный цикл, ответственный за синтез
глутатиона:
АТФ + глицин + цистеин + глутамат + оксипролин -> глутатион (Г-SH) (3)
Ключевым ферментом, ответственным за синтез Г-SH в печени, является
у-глутамилцистеинсинтетаза (КФ 6.3.2.3), а за его распад — у-глутамилтранс-
фераза (КФ 2.3.2.1). Если активность первой не изменяется с возрастом, то
второй — увеличивается, что может быть одним из механизмов повышени
чувствительности к тиоловым ядам у лиц пожилого возраста.
Глутатион защищает SH-группы внутриклеточных ферментов от окисле-
ния, блокирования тяжелыми металлами и другими ядами; участвует
защите тканей от радиационных поражений, в устранении свободных раДи'
122
лов и перекисей. В частности, восстановление Н2О2 (в меньшей степени)
перекисей липидов (в основном) катализируется селенсодержащей глута-
И онпероксидазой. Биологическая значимость селена в реализации катали-
тической функции ГП подтверждается, например, тем фактом, что эбселен
другие его соединения обладают ГП-активностью [29]. Авторы показали,
14 о а-фенилселенилацетофенон увеличивал скорость реакции Г-SH с Н2О2
□ет-бутилгидропероксидом, куменгидропероксидом, с гидроперекисями
линолевой кислоты и дилинолеиллецитина в 7,0; 25,1; 34,1; 19,1 и 8,4 раза
соответственно. Скорость реакции между Г-SH и Н2О2 в присутствии эбсе-
лена (50 мкмоль) возрастала в 5—6 раз. Каталитический эффект указанных
соединений обусловлен окислением и образованием селеноксида, с которым
взаимодействует Г-SH, образуя дисульфид. Окисленный глутатион восста-
навливается под действием глутатионредуктазы в результате окисления
NADPH в NADP+, восстановление которого происходит за счет глюкозо-6-
фосфатдегидрогеназы (Г-6-ФДГ, КФ 1.1.1.49) и 6-фосфоглюконатдегидро-
геназы (КФ 1.1.1.43) в реакциях пентозофосфатного цикла.
Обсуждается роль GSH в механизмах защиты нервных клеток, гепато-
цитов, эритроцитов от реактивных интермедиатов кислорода (О^-; НО-;
Н2О2; гидроперекисей), что традиционно связывают с формированием глу-
татионовой антиоксидантной системы (ГАОС), в которую входят глутати-
онпероксидаза, ГР и Г6ФДГ [9, 22]. ГАОС отличается высокой мобильнос-
тью и участвует в защитных реакциях, прежде всего в тканях головного
мозга, при различных метаболических, в том числе токсических нарушениях
гомеостаза.
При длительных воздействиях развивается функциональная недостаточ-
ность защитной системы, в тканях мозга накапливаются продукты, которые
окисляют поверхностно расположенные и структурно замаскированные белко-
вые SH-группы, что лежит в основе структурно-функциональных нарушений,
прежде всего в тканях мозга.
Введение белым мышам подкожно диэтилмалеата (0,43—1,29 г/кг) вы-
зывают быстрое истощение уровня Г-SH в печени и мозге [136]. Уровень
ингибиторного действия зависит от дозы и времени после введения пре-
парата. В печени уровень Г-SH восстанавливается до контрольных значений
через 6 ч после инъекции, а в мозге остается значительно сниженным и
через 12 ч после нее. При инъекции диметилмалеата истощение Г-SH
наблюдается только в мозге, но не в печени. Введение ингибитора синтеза
Г-SH бутионинсульфоксимина (1 ммоль/кг) значительно снижает уровень
Г-SH в различных отделах мозга. Его содержание остается пониженным в
течение 24 ч после введения, затем постепенно возрастает и через 60 ч
достигает контрольных значений. Чувствительность различных отделов моз-
га к истощению Г-SH в этих условиях снижается в ряду: ствол мозга >
мозжечок > стриатум > кора > гиппокамп. Предварительное снижение в
мозге уровня Г-SH под влиянием обоих препаратов значительно усиливает
нейротоксичность акриламида.
Необходимо подчеркнуть, что функциональная активность Г-SH прояв-
яется как самостоятельно, так и в сочетании с белковыми системами. При
том наряду с ГАОС фигурируют такие защитные формирования, как глу-
тион-З-трииефсриэы, металлотионеины и др., хотя их влияния могут реа-
отп°ВЫВаТЬСЯ И независимо- Например, при остром экспериментальном
§_Равлении ацетатом свинца (100 мг/кг) снижалась активность глутатион-
Че ансФеРазы вслеД за уменьшением содержания Г-SH с задержкой более
м на 1 день [115]. Кроме того, предварительное введение L-метионина
123
(250 мг/кг) не препятствовало снижению содержания Г-SH, вызванного Рь
В противоположность метионину диметилмалеат — агент, вызывающий
истощение Г-SH, приводит к увеличению активности глутатион-8-транс-
феразы.
Таким образом, введение РЬ снижает интенсивность второй фазы мета-
болизма ксенобиотиков, хотя истощение Г-SH не является обязательным
фактором, участвующим в изменении функциональной активности глутати-
oH-S-трансферазы per se. Дисульфид глутатиона участвует в регуляции бел-
кового синтеза, а также в окислительном фосфорилировании. Превращения
глутатиона тесно связаны с метаболизмом СоА. Имеются данные об участии
Г-SH и глутатион-8-трансферазы в синтезе простагландинов и лейкотрие-
на С4.
Важная физиологическая функция глутатиона состоит в обезвреживании
чужеродных органических соединений, что имеет прямое отношение к био-
трансформации металлорганических соединений, т.е. и тиоловых ядов.
Глутатион вступает в реакции сочетания с теми соединениями, которые
содержат электрофильные атомы, способные реагировать с SH-группой. Эти
реакции катализируются глутатион-8-трансферазами, представляют началь-
ный этап образования меркаптуровых кислот. Образование конъюгатов с
Г-SH является в то же время одним из путей активации ксенобиотиков,
возникновения цитотоксичных, генотоксичных или мутагенных соединений
[82]. Образование конъюгатов с Г-SH — преобладающий путь биотрансфор-
мации галогенированных алкенов и активации других токсикантов, что
рассматривается как типичный альтернативный путь функционирования
Г-SH. В результате метаболизма глутатионовых конъюгатов ксенобиотиков
образуются реактивные интермедиаты, способные ковалентно связываться
с клеточными макромолекулами и, таким образом, оказывать цитотоксичес-
кое действие. Это наиболее четко прослежено в экспериментальных иссле-
дованиях. Так, при инкубации со срезами легочной ткани хомяков СоС12
(1 ммоль) отмечены резкое окисление внутриклеточного Г-SH , увеличение
уровня rS-ST и последующее развитие дисфункции клеток [107]. Одновре-
менное действие СоС12 и Н2О2 (250 мкмоль) или СоС12 и ингибитора
глутатионредуктазы (1,3-^мс-[2-хлорэтил]-1-нитрозомочевины) усиливало
окислительные эффекты СоС12 и снижало соотношение уровней Г-SH/TS-
SE Однако значительного усиления клеточной дисфункции, стимулируемой
СоС12, в этих условиях не наблюдалось. При инкубации срезов с трет-бу-
тилгидроперекисью (100 мкмоль) увеличение внутриклеточного уровня TS-
ST достигало таких же значений, как при действии СоС12 и Н2О2, но без
значительного ослабления клеточной функции.
Сочетанное действие СоС12 и Н2О2, а также других использованных
маркерных соединений не оказывало существенного влияния на уровни
белковых SH-rpynn.
Полученные данные показали, что токсический эффект СоС12 на клетки
легочной ткани не связан с изменениями тиодисульфидного статуса клетки.
Он может быть опосредован, в частности, интенсивным синтезом металло-
тионеина. Последнее подтверждено, например, в опытах с введением голо-
давшим крысам внутрижелудочно CdCl2 в дозе 75 мг/кг [135]. Содержание
металлотионеина в печени у голодавших и неголодавших крыс через 24 ч
после введения CdCl2 составило 360 и 280 мкг/г печени соответственно.
Голодание не влияло на активность ГП и ГР. Морфологические изменения
в печени были более выражены у голодавших крыс. Сделан вывод, чТ°
печеночный Г-SH играет важную роль в защите от токсического действия,
124
синтезе металлотионеина, высокий уровень которого может усиливать
Е^сические эффекты CdCl2.
10 реакционноспособность SH-групп даже в нативных белках варьирует в
ооких пределах (легко реагирующие, вяло реагирующие и замаскирован-
Ш р или скрытые). Неодинаково реагируют на связывание SH-групп и
Головые ферменты. Сукцинатдегидрогеназа (СДГ, КФ 1.3.99.1) и 3-ФГАДГ
омозятся уже при связывании легко реагирующих SH-групп, уреаза, аль-
Т°лаза МДГ — после блокирования медленно реагирующих и замаскиро-
ванных групп. Резких граней между различными типами SH-групп не су-
ществует. В белках реакционная способность SH-групп ниже, чем в простых
тиолах, и возрастает при денатурации. Но из этого правила есть исключения.
Так папаин (КФ 3.4.4.10) и фицин (КФ 3.4.4.12) реагируют с хлорацетами-
дом в 15—20 раз, а с 2-бромацетамид-4-нитрофенолом — в 3000 раз актив-
нее чем цистеин; 3-ФГАДГ, алкогольдегидрогеназа (АДГ, КФ 1.1.1.1), фос-
форилаза мышц —в 9, фосфофруктокиназа (КФ 2.7.1.11) —в 10—13 раз
выше, хотя в последних SH-группы не в каталитическом центре.
SH-группы, расположенные в активных центрах ферментов, активированы
в результате образования водородных связей с соседними функциональными
группами, например имидазолом или карбоксилом. Участие протона SH-группы
в образовании водородной связи приводит к увеличению электронной плотности
у атома серы и, следовательно, к возрастанию его нуклеофильных свойств.
Поэтому, например, скорость алкилирования SH-групп в активных цент-
рах АДГ и АТФ-креатинфосфотрансферазы не меняется в широком интер-
вале pH (4,0-10,0).
Маскирование SH-групп происходит в результате замедления или отсут-
ствия их реакции со специфическими тиоловыми реагентами. Встречается
чаще, чем активация.
Есть две гипотезы по поводу его механизма:
• стерическая недоступность за счет пространственного экранирования
аминокислотными остатками;
• образование SH-группами внутримолекулярных химических связей
(химическая маскировка).
Гемоглобин лошади, например, содержит две пары SH-групп, из которых
только одна легко реагирует с тиоловыми реагентами. Вторая находится
внутри глобулы (замаскирована). Это приводит к затруднениям при реаги-
ровании, вызванным размерами молекулы реагента. В некоторых случаях
молекула ингибитора, присоединившегося к SH-группе, может создавать
стерическое препятствие для доступа субстрата к активному центру и тем
самым тормозить активность. Ртутьорганические соединения при росте раз-
меров молекулы (этилмеркурихлорид < фенилмеркурихлорид < п-ацетами-
^Феннлмеркуриацетат) ингибируют активность АТФ-фосфотрансферазы
пг>Ф 2-7.1.38) на 25; 55 и 75 % соответственно [62]. Влияние размера и заряда
рисоединившегося реагента прослежено и на примере изоцитратдегидро-
п »азы (ИЦДГ, КФ 1.1.1.41). Показана почти полная инактивация фермента
еркурибензоатом и 5,5'-дитиобис(2-нитробензоатом), тогда как замена
тротиобензоата на цианид-ион снижает степень ингибирования на 50 %.
2 ^°4ные РезУльтаты получены для аспартатаминотрансферазы (ACT, КФ
Дост Мышиь1 сердца свиньи. Но между размерами молекул реагента и
фак/ПН°СТЬЮ ^Н-групп нет прямой связи. Вероятно, есть дополнительные
Кото°РЫ’ влияюЩие на этот процесс: в частности, влияние соседних групп,
рые могут способствовать или препятствовать приближению реагентов
125
к SH-группам, изменять степень ионизации SH-групп, участвовать в стабц.
лизации переходного состояния, образовывать внутримолекулярные связи с
ними.
Из различных типов взаимосвязей в белках, в которые могут быть во-
влечены SH-группы, наиболее вероятны гидрофобные. Доказано наличие
внутримолекулярных ковалентных связей (кроме дисульфидных), опосредо-
ванных через ион металла, т.е. меркаптидных связей, участвующих в обра-
зовании клешневидных комплексов. У ряда металлоферментов — это один
из вариантов маскирования SH-rpynn.
Функция SH-группы заключается в образовании тиоэфирной связи с
ацильной группой молекулы субстрата. Две SH-группы, сближенные в тре-
тичной структуре белка, образуют активный центр, доказательством чему
являются инактивация фермента низкими концентрациями арсенита, кото-
рый обладает высоким сродством к дитиолам, а также конкурентные отно-
шения между субстратами и арсенитом. Дитиолы легко реактивируют фер-
мент. SH-группы белка могут играть роль реакционноспособного акцептора
при реакциях ферментативного переноса ацильных, амидных, фосфатных и
других остатков.
SH-группы окислительных ферментов могут играть роль промежуточных
переносчиков электронов от субстратов к акцепторам, например к НАД+,
Примером может служить липоатдегидрогеназа (НАДНлипоамидоксидоре-
дуктаза, КФ 1.6.4.3). Этот фермент (ЛипДГ) входит в состав а-кетоглутарат-
и пируватдегидрогеназных комплексов и катализирует реакцию:
Лип (SH)2 + НАД* -> Лип (S-S) + НАДН + Н+ (4)
ЛипДГ является флавопротеидом и не содержит связанной с белком
липоевой кислоты. Но после предынкубации фермента с НАДН его актив-
ность резко тормозится арсенитом. Обработка фермента НАДН приводит к
образованию двух SH-групп на молекулу ФАД. Дисульфидная группа белка
является первичным акцептором электронов и протонов от дигидролипоата;
при этом дисульфидная группа восстанавливается в дитиоловую [30]. Она
отдает один протон и электрон молекуле ФАД, которая переходит в семи-
хинонную форму. Потом к одной из SH-групп дитиола присоединяется
молекула НАД+, восстанавливающаяся в НАДН с регенерацией исходной
формы фермента. Реакционноспособная -S-S-группа, участвующая в пере-
носе электронов, обнаружена также в активных центрах глутатионредуктазы
(ГР, КФ 1.6.4.2) и тиоредоксинредуктазы (КФ 1.6.4.5). Они также содержат
две молекулы ФАД на одну молекулу белка и катализируют восстановление
-S-S-связи в субстратах при помощи НАДФН.
Титрование ГР глутатионом или НАДФН в анаэробных условиях при-
водит к росту числа титруемых SH-групп в ферменте. Механизм действия
аналогичен таковому у ЛипДГ.
Помимо прямого участия в каталитическом акте SH-группы, входящие
в состав активных центров ферментов, могут также играть роль в Ус^а~
новлении связей между апоферментом и молекулами субстрата или кофер"
мента.
В этом случае они входят в состав контактного участка активного ненТР
(binding site). Доказательством служит тот факт, что сукцинат, фумарат
малонат защищают SH-группы СДГ от действия не только окислителей^^
и алкилирующих агентов, соединений трехвалентного мышьяка, ионов ртУ^
и n-меркурибензоата. Теперь это установлено для сукцинат-, малат-, ла
тат-, изоцитрат-, 3-фосфоглицерат-, 3-фосфоглицеральдегид-, р-оксибути
126
глутамат-, гомосерин-, альдегид-, алкогольдегидрогеназ, цитохромре-
Руктазы, альдолазы, глутаминсинтетазы и многих других ферментов и по-
пужило толчком к развитию целого направления в использовании карбо-
совых кислот, в частности сукцината, для профилактики и коррекции на-
ущений энергетического обмена, происходящих под действием ксенобио-
Субстраты и коферменты могут уменьшить инактивацию фермента под
влиянием тиолового яда путем стабилизации структуры (конформации) бел-
ковой молекулы фермента, а также в результате изменения белковой моле-
кулы. Например, НАД+ и этанол не только защищают АДГ от инактивации
этилмеркурхлоридом и р-меркурбензоатом, но и уменьшают количество
титруемых SH-групп. Избирательное карбоксиметилирование метилртутью
одной из 14 SH-групп АДГ печени приводит к инактивации фермента: НАД+
и НАДН защищают фермент от инактивации, а SH-группу — от алкилиро-
вания. Позднее оказалось, что SH-группы не принимают участия ни в
связывании кофермента, ни в катализе, но 6 из 14 SH-групп принимают
участие в связывании ионов цинка.
В присутствии Мп2+ фенилмеркурацетат почти не влияет на активность
пролидазы (КФ 3.4.3.7) — фермента, гидролизующего пептидную связь, об-
разованную иминогруппой пролина или оксипролина. Фермент почти пол-
ностью теряет активность в отсутствие ионов марганца. SH-группа является
одним из лигандов, связывающих ион Са2+ в активных центрах амилазы,
цитохромоксидазы, ионов цинка в аспартаттранскарбомилазе, ионов железа
в негемовых белках — переносчиках электронов: ферредоксинах и рубредок-
сине. SH-группы металлопротеидов принимают участие в связывании иона
металла: АДГ-цинк, металлотионеин — кадмий, цинк, цитохром оксидаза —
медь, лейцинаминопептидаза — марганец. Таким образом, ион металла, со-
единенный меркаптидной связью с атомом серы, обладает способностью
образовывать дополнительные координационные связи с различными функ-
циональными группами белка (азотистыми, карбоксильными и др.). В ре-
зультате возникают хелатные (клешневидные) комплексы, которые могут
выполнять непосредственно каталитическую функцию и участвовать в уста-
новлении связей между различными участками белковой молекулы или
отдельными субъединицами, обеспечивая поддержание уникальной трехмер-
ной конформации ферментов.
В свете современного понимания многообразия биологических функций
сульфгидрильных групп белков в известной мере может быть понята реакция
различных функциональных систем организма на действие тиоловых ядов.
Для неорганического свинца характерно влияние на ключевые стадии син-
теза гемов, которые используются не только для построения молекул гемог-
лобина и миоглобина, но и в системе окислительного обмена клетки (ци-
тохром-с-оксидаза, цитохром Р-450, цитохромы b и с, каталаза и перокси-
даза). В частности, РЬ ингибирует не только аланиндегидратазу, феррохе-
латазу, копропорфириногеноксидазу, т.е. ферменты порфиринового обмена,
но и трансаминазы (АЛТ, КФ 2.6.1.2 и ACT, КФ 2.6.1.1), ЛДГ (КФ 1.1.1.17)
И ДмГИе ФеРменты [Ю2].
Механизм действия этого типичного представителя тиоловых ядов за-
дается в угнетении активности ферментных систем в результате блоки-
II вания карбоксильных, аминных и особенно SH-групп белковых молекул.
в^ДО°Нь1е изменения ферментативной активности установлены также при
ртутСНИИ экспеРИментальным животным (крысы, мыши, кролики, собаки)
Ути, меди, вольфрама, молибдена, марганца и цинка. Молибден в кон-
127
центрациях 3,0—19,5 мг/м3 при хронической ингаляции приводит к сниже-
нию активности каталазы, кислой и щелочной фосфатаз, АЛТ и ACT
цитохромоксидазы и повышению активности ацетил- и бутирилхолинэсте-
раз. Cd снижает активность пищеварительных ферментов — трипсина и в
меньшей мере пепсина, активирует уреазу, аргиназу. Под действием С<1
изменяется каталазная активность крови и тканей печени, причем малые
дозы активируют ее, а большие угнетают. Установлена возможность вклю-
чения Cd в комплекс с ферментами: Cd — щелочная фосфатаза, Cd — кар-
боксипептидаза, Cd — цитохромоксидаза [86].
Однако было бы неправомерным относить все проявления токсического
действия тиоловых ядов лишь за счет специфических особенностей поражае-
мых ими белковых систем. Не менее важную роль играют и особенности
химического строения, вероятные биологические функции и количественные
параметры содержания в организме конкретных металлов.
Например, кадмий влияет не только на активность ферментов и белко-
вый обмен, но и на углеводный обмен, вызывая гипергликемию. Он угнетает
синтез гликогена в печени, нарушает фосфорно-кальциевый обмен, вмеши-
вается в метаболизм ряда микроэлементов, таких как Zn, Си, Fe, Мп, Se.
На токсичность Cd влияет содержание в пищевом рационе белка, витаминов
С и D, а также Са, Zn, Си, Fe, Se.
Как известно [142], ионы металлов относятся к ингибиторам микросо-
мальных монооксигеназ 4-го типа, которые тормозят синтез и ускоряют
распад цитохрома Р-450. Их действие направлено преимущественно на ге-
мовую часть цитохрома, как это четко показано для неорганических соеди-
нений свинца [102], а активация либо ингибирование ПОЛ может носить
вторичный дозозависимый характер.
С пероксидацией липидов в органах-мишенях связывают острую токсич-
ность Ni2+ [103, 140]. И хотя этот механизм представляется в известной мере
гипотетическим, процесс может развиваться по следующим четырем основ-
ным направлениям:
• замещение никелем железа и меди в интрацеллюлярных структурах;
• ингибирование никелем клеточных систем антиоксидантной защиты,
прежде всего каталазы, супероксиддисмутазы, глутатионпероксидазы,
альдегиддегидрогеназы и других ферментов, которые защищают клет-
ку от свободнорадикального окисления или которые метаболизируют
продукты ПОЛ; 2+ 3+
• генерирование кислородных свободных радикалов в цепях’Ni2 /Nk J
Ni2+ + Нз = Ni3+ + OH + OH+ (реакция Фентона); Ni3+ + O ~
= Ni2+ + O2; H2O2 + О 2 = OH + OH+ + O2 (реакция Габера -
Вайса);
• никель может усиливать деградацию липопероксидов из липидно-
кислородных радикалов за счет усиления аутокаталитического пере-
окисления полиеновых жирных кислот.
Необходимо подчеркнуть, что эти механизмы не взаимоисключают ДрУ1"
друга и могут проявляться одновременно. Имеются экспериментальные под-
тверждения гидропероксидной гипотезы механизма действия двухвалентного
иона никеля в реализации его острой токсичности и канцерогенности [H'J-
Тем не менее рассматриваемый механизм не может быть распространен на
все тяжелые металлы. В частности, в опытах на затравленных Cd перорально
в дозах 0,05 LDso крыс на первых этапах преобладала реакция снижения
содержания ДК и МДА в тканях мозга, печени и почек [76]. Нарушение
128
стоальных направлений обеспечения энергией клеточных систем в дан-
Ма“И(Ьазе токсического воздействия практически не приводит в действие
Н°Ибоднорадикальные процессы, а в связи с угнетением микросомальных
СВСнооксигеназ имеет место даже существенное снижение уровней ДК и
Ш1А в тканях, в первую очередь головного мозга и почек, где, вероятно,
гцность этих систем ниже, чем в тканях печени. Кроме того, играет
Мпоеделенную роль и нарушение нейрорегуляторных механизмов. Преиму-
щественной для затравленных Cd крыс была реакция снижения содержания
иеновых конъюгатов (ДК): в тканях головного мозга и почек — на 60 %, в
печени — на 44 %. Уровень малонового диальдегида (МДА) в печени, мозге
и почках по отношению к контролю составил 61; 92 и 70 % соответственно.
При этом активность ферментов глутатионовой антиоксидантной системы,
особенно глутатион редуктазы, существенно возрастала.
Сочетание токсического воздействия с невротизацией давало более слож-
ный эффект. На первом этапе опыта уровень ДК и МДА наиболее сущест-
венно возрастал в тканях мозга (на 53 и 72 % соответственно) с последую-
щим падением ниже контрольных величин. В почках их содержание про-
грессивно снижалось (до 42 и 56 % по отношению к исходному уровню
соответственно), а в печени изменения были несущественны. В дальнейшем
картина значительно изменялась: отмечался достоверный рост ДК, особенно
МДА, уровень которого в мозговой ткани составлял 211 % по отношению
к исходному уровню, тогда как в печени и почках его уровень повышался
не более чем на 25—30 %.
Подобные же результаты были получены в опытах на крысах-самцах
Лонг-Эванс, которым вводили раствор CdClj в дозе 25 мкг Cd на 1 кг массы
тела внутрибрюшинно [113]. Через 24 ч содержание веществ, реагирующих
с тиобарбитуровой кислотой (МДА) в легких и мозге, возрастало до 140 и
170 % по сравнению с контролем. В семенниках и сердце содержание МДА
снижалось до 50 и 75 % соответственно, а в печени и почках не изменялось.
При повышении дозы Cd2+ до 500 мг/кг содержание МДА в легких, семен-
никах, печени и почках возрастало до 200, 140, 130 и 120 % соответственно,
а в сердце оставалось неизменным. Введение Cd2+ (в дозе 1250 мг/кг)
приводило к снижению содержания МДА в печени на 50 % и к его увели-
чению в легких до 200 % при отсутствии изменений в остальных исследо-
ванных тканях.
Авторами сделан вывод о различиях в чувствительности тканей крысы к
стимулирующему ПОЛ действию Cd2+. Однако описанный эксперимент
свидетельствует также о дозозависимых различиях в динамике исследуемых
показателей.
Нарушение магистральных направлений обеспечения энергией клеточных
систем малыми дозами тяжелых металлов практически не приводит в дей-
ствие свободнорадикальные процессы, а в связи с угнетением микросомальных
в онооксигеназ имеет место даже существенное снижение уровней ДК и МДА
тканях, в первую очередь головного мозга и почек, где, вероятно, мощность
систем ниже, чем в тканях печени.
Меха °Ме того’ опРеДеленную роль играет и нарушение нейрорегуляторных
кот Низмов- Эти данные хорошо согласуются с материалами А.Д.Фроловой,
УровРаЯ1/П°КазаЛа [70]’ что ПрИ де^ствии солей Со, Cd, РЬ, Мп даже на
ченоНе 5 LD50 после однократного внутрибрюшинного введения не отме-
нил floCTOBePHoro увеличения уровня промежуточных продуктов превраще-
ненасыщенных жирных кислот (ДК) и конечного метаболита (МДА),
5-71
129
что послужило основанием для отказа от дальнейших исследований в этом
направлении. Однако если речь идет, например, о трансформации металл-
органических соединений в организме, столь категоричные суждения пред,
ставляются неправомерными.
При ингаляции 10-хлорфеноксарсина (1,6 мг/м3) в хроническом экспе-
рименте у крыс отмечен рост уровня МДА в тканях печени на 47 %, мозга —
на 62 %, почек — на 78 % при угнетении ферментов ГАОС (ГП — в 1 з
ГР — в 2,2, Г-6-ФДГ — в 2,6 раза по отношению к контролю) [47]. При
исследовании токсичности бис(три-п-бутилолово)оксида (ТБТО) в дозах 0 3'
3,0 и 30 мг/кг в тканях мозга крыс отмечены резкое усиление процессов
ПОЛ при максимальной нагрузке (рост ДК в 1,8 и МДА—в 2,3 раза) и
фазовые изменения (краткосрочное повышение с последующим снижением
ниже контрольных значений) при низких дозах [13]. Для других металлов
эти соотношения могут также существенно изменяться. Например, Ю.С.Ка-
ган и соавт. [126] при изучении токсического действия хлорокиси меди
обнаружили существенный рост хемолюминесценции в крови крыс через
24 ч после перорального введения животным препарата на уровне 0,5 LD50
(65 импульсов за 6 мин х 103 при 40 в контроле). Вероятно, эти механизмы
нуждаются в дальнейшем детальном изучении.
Более четко определены молекулярные механизмы действия ионов ме-
таллов, связанные с биотрансформацией их как водорастворимых соедине-
ний. Они локализованы преимущественно в митохондриях, цитозоле и ли-
зосомах клеток. В основе повреждающего действия металлов через АТР-за-
висимый ионный транспорт лежит предпосылка о Физико-химической ус-
тойчивости комплекса катионов с фосфатными группами АТР [17]. Прак-
тически все металлы могут конкурировать за места связывания в фосфатных
группах с катионами жесткого класса А, к которому относятся такие био-
логически значимые ионы, как Са и Mg. В связи с тем что Со, Cd, РЬ, Мп
обладают большим сродством к фосфатному лиганду АТР, чем Mg, они
вызывают диссоциацию комплекса Mg-ATP и образуют такого же типа
хелатный комплекс Ме-АТР, который, однако, не может обеспечить эффек-
тивную работу ионных насосов. Статистически значимое ингибирование
ионного транспорта проявляли не только РЬ и Со в дозах */5 и '/щ соот-
ветственно, но и металлорганические соединения ртути, мышьяка и олова
[13, 31, 62].
Имеются и другие попытки объяснения преимущественно митохондри-
альных эффектов тяжелых металлов с позиций ионного взаимодействия. В
частности, обсуждается возможная роль Са2* в цитотоксичности тяжелых
металлов [146]. На основе анализа обширных данных литературы авторы
показали, что метаболизм ксенобиотиков, в частности тяжелых металлов,
вызывающих окислительный стресс, сопровождается нарушениями GSH-за-
висимого баланса тиолы/дисульфиды и усилением ПОЛ мембранных липидов.
Это ведет к нарушению гомеостаза Са2+ за счет локализованного в клеточных
мембранах пула этого иона. Инактивация Са, Mg-АТРазы, обусловленная
окислением SH-групп, также вызывает повышение уровня Са2+ в цитозоле.
Ионы таких металлов, как Hg2+, Cu2+, Cd2+, Pb2+, Zn2+, обладающие высоки
сродством к SH-группам и способные действовать на функции SH-содержаШ^
белков, в случаях окислительного стресса могут стимулировать выход Са
через вольтозависимые каналы в различных биосистемах, дезорганизуют е
гомеостаз и через этот механизм ингибируют Са, Mg-АТРазу, нарушая те
самым митохондриальные функции клеток различных организмов.
130
Познание закономерностей взаимодействия токсичных металлов с кальци-
1 дтгими эссенциальными микроэлементами биосистем по конкурентному
Uomv механизму существенно расширяет наши представления о патогенезе
Правлений, возможностях их профилактики и лечения.
4 2. физиологический синергизм и антагонизм
в механизме действия тяжелых металлов
Сложная проблема взаимодействия между микроэлементами в организме
азоаботана крайне недостаточно. В клетках содержится большое количест-
во ионов металлов. Хотя твердый остаток при сжигании составляет всего
3—5 %, в организме человека массой 70 кг содержится 1050 г Са, 245 г К,
105 г Na, 35 г Mg, 3 г Fe, 2,3 г Zn, 1,2 г Rb [38]. Важную биологическую
роль играют не менее 7 элементов, которых содержится менее 1 г: Си —
100 мг, Мп — 20 мг, Со — 5 мг, Mo, Cr, Sn, V — менее 6 мг. Эритроцит
объемом 80 мк3 содержит 3,108 молекул белка, преимущественно гемогло-
бина, 7,105 атомов меди и 1,105 атомов олова. В нем имеется 2,104 атомов
серебра’(концентрация его более 1,10"7 М); присутствуют бор и алюминий —
3,105 атомов, мышьяк — 7,105 атомов, свинец — 7,104 и никель — 2,104 ато-
мов. При этом Rb, Sr, Ni считаются малотоксичными, a Sb, As, Ba, Be, Са,
Pb, Hh, Ag, Tl, Th — высокотоксичными.
Внутриклеточные системы имеют собственные механизмы концентриро-
вания ионов. Митохондрии могут концентрировать ионы К, Са2+, Мп2* и
других двухвалентных металлов за счет обменной диффузии, т.е. путем
вторичного активного транспорта. Дифференцированный характер накопле-
ния тяжелых металлов в компартментах клетки имеет биофизическую при-
роду. Цитоплазма клеток напоминает ионообменные смолы, несущие фик-
сированные заряды. Смолы, содержащие остатки сульфокислот, связывают
калий, а содержащие остаток фосфорной кислоты, — натрий. Включение
тиоловых ядов в этот процесс определяет в известной мере их влияние на
ионный обмен в клетках. Так, при введении Cd в организм нарушается
обмен кальция, фосфора, железа и меди [119]. Особенно четко это просле-
живается по отношению к Са. Содержание последнего в крови и моче у
хронически экспонированных малыми концентрациями сульфата кадмия
крыс (ингаляция по 4 ч ежедневно в течение 4 мес в дозе 0,3 мг/м3)
снижалось на 24,3 и 21,2 % соответственно. На фоне малобелковой диеты
уменьшается содержание кальция и цинка в костях. Кадмий угнетает про-
цесс образования активной формы витамина D в почках (1,25-дигидрокси-
олекальциферол), что замедляет абсорбцию Са в кишечнике [86]. У бере-
жных крыс отмечены гипокальциемия и выраженный остеопороз, а у
отомства — искривление передних конечностей.
и о^Ка3аН аддитивный эффект соединений ртути с кадмием. Кадмий, как
метя Ь> связывается в организме со специфичным транспортным белком
Пос) Л°ТИОНеином ^0]- Если связывание производить вне организма, то
Вове*еСС последУюШего связывания в крови и печени снижается. В проти-
ЛругихСИНеРГИЗМУ кадмия и ртути отмечен выраженный антагонизм этих и
выми ТЯЖелых металлов с цинком и селеном. Вероятно, угнетение тиоло-
т°ЛькоЯбаМИ ахтивности металлоферментов может быть обусловлено не
иновых°Л°КаДОЙ сУльФгидрильных групп, но и нарушением металлопроте-
евойств КЯМПЛексов с утратой либо ослаблением последними каталитических
интокс 1°Ложительный эффект селена особенно четко прослеживался при
и«ациях кадмием, ртутью и никелем людей, а также в эксперимен-
5*
131
тальных исследованиях. Эти наблюдения послужили основанием для
пользования селена при комплексном лечении широкого круга заболеваний
в том числе и химической этиологии [112, 127, 128]. и>
Как справедливо указывают М.Г.Коломийцева и Р.Д.Габович [28], лежа
щие в основе физиологического взаимодействия микроэлементов в организ
ме человека и животных влияния на ферментативные процессы, функций
желез внутренней секреции, синтез гормонов и витаминов, энергетику клет
ки могут носить как содружественный, так и антагонистический характер
Важно учитывать их соотношение между собой [4], а также условия прояв-
ления этого взаимодействия, которое определяется многочисленными эндо-
и экзогенными факторами. Так, при изучении токсичности и характера
совместного действия кобальта, вольфрама и титана установлено, что био-
логически малоактивный титан усиливает токсичность кобальта и вольфра-
ма [23]. Если для чистого кобальта смертельная доза для крыс при интра-
трахеальном введении составляла 10 мг, то в смеси с титаном она снижалась
до 4 мг. Совместное действие кобальта и окиси углерода также приводит к
усилению токсичности каждого компонента смеси.
При внутримышечном введении крысам 200 мкг хлорида кадмия выве-
дение с калом алюминия возрастало в 9,3, молибдена — в 6,4 и серебра —
в 2 раза [10]. Предварительное воздействие малых нетоксичных доз Cd
повышало устойчивость к некрозу яичек при последующем введении боль-
ших доз (за счет индукции синтеза металлотионеина), что свидетельствовало
об адаптивном характере защитного действия данного белка.
Металлотионеин имеется во всех животных тканях, связывает большие
количества ионов многих металлов, особенно цинка. Он содержит 33 %
цистеина и связывает 6 ионов металла на молекулу белка; может быть
окислительно-восстановительным буфером, подобно глутатиону и способ-
ствует удалению экзогенных тяжелых металлов из организма. С металлотио-
неином соединено до 20 % адсорбируемого из ЖКТ и соединенного с
низкомолекулярными белками Cd (сначала он соединяется с альбумином,
а затем с металлотионеном). Этот белок выносит Cd в почечные канальцы
и далее в мочу. В предотвращении токсичности Cd ведущая роль также
принадлежит металлотионеину. Последний одновременно регулирует вынос
из клеток Zn и Си, образующих с Cd в организме динамические биоактив-
ные пары. Угнетение кадмием оксидаз со смешанной функцией также
снимается металлотионеином, чем объясняется обратимый характер подав-
ления им процессов микросомального окисления.
В комплексах с металлотионеином и в металлоферментах ионы цинка
могут быть заменены марганцем и кобальтом, а также другими ионами без
существенного снижения каталитической активности. С цинком в этом
плане конкурируют также медь и кадмий.
В экспериментальных исследованиях на крысах при совместном введе-
нии с цинком выявлено усиление действия свинца на порфириновый обмен
(рост выведения с мочой в 4,5 раза). При затравке крыс и кроликов пылью
хромоцинкового катализатора (37 мг/м3) отмечено отставание в прирост
массы подопытных животных по отношению к контролю на 42 %. В то ж
время имеются данные [59, 60] о выраженном антагонизме никеля и хрома,
никеля и марганца, никеля и кобальта в острых опытах при явления
аддитивности (для никеля и кобальта) в хроническом эксперименте.
Связывание, распределение и выведение ксенобиотиков-металлов в ор
ганизме зависит прежде всего от обеспеченности его эссенциальными ми
роэлементами и состоянием их обмена. Например, накопление цинка
132
и3ме экспериментальных животных приводит к снижению содержания
°РгаНСи тогда как добавление в корм Fe предотвращало потерю меди в
Fe * Отмечен определенный синергизм при действии на половую сферу
пе4еотных марганца и цинка. При изучении кроветворения показано взаи-
жиВействие не менее 6 микроэлементов (кобальта, железа, меди, цинка,
м0Дганца, никеля). Эти ионы оказывали также положительное воздействие
ма16Иологическую сопротивляемость организма к заболеваемости. Имеется
на исследований об антагонизме меди и цинка, меди и молибдена, меди и
Р5111 ганца в организме. Но данные по этим позициям достаточно противо-
Мечивы На модели Oncorhynchus mykiss после 10-дневного воздействия *на
Рих медью в концентрациях 0,1; 0,2 и 0,3 мг/л, составляющих 0,15; 0,31 и
0 46 от 96-часовой LD50, исследовали поведенческие реакции при форми-
ровании социальной иерархии в группе [123]. Концентрации 0,2 и 0,3 мг/л
вызывали достоверные изменения в поведении популяции: уменьшалось
число атак, увеличивалось число угроз, удлинялось время формирования
иерархии. При действии смеси тяжелых металлов (Си, Zn, Ni, Cr, Fe)
изменения были более выраженными и касались не только изменения
индивидуального и группового поведения, но также респираторных и дви-
гательных реакций (0,0015—0,0059 % от LD50), давали эффект порога и
достигали LDso- При этом летальную токсичность связывают преимущест-
венно с присутствием в смеси меди [124]. Последнее чрезвычайно важно с
точки зрения видовых отличий в чувствительности к разным компонентам
смеси, а также в вопросе о доминирующем компоненте смеси тяжелых
металлов во внешней среде, что подлежит дальнейшему специальному изу-
чению.
Недостаточность меди в организме нередко носит вторичный характер
вследствие того, что цинк препятствует ее поглощению у животных либо
она связывается молибдатом в инертный комплекс. При этом возникают
нарушения в костной ткани (остеопороз), обесцвечиваются волосы, теряется
эластичность артерий, нарушается синтез гемоглобина [38].
Нарушение баланса названных выше элементов при взаимодействии с
ионами тяжелых металлов является одним из важных аспектов биологичес-
кой активности последних, а изучение поражений разными химическими
формами тяжелых металлов на малых уровнях воздействия, их связывание,
биотрансформация, транспорт у человека и животных (в том числе и транс-
плацентарный транспорт), нейроповеденческие, иммунологические (вклю-
чая гиперчувствительность) эффекты у экспонированных в разных условиях
контингентов населения признаются приоритетными направлениями даль-
нейших исследований в ряде монографий ВОЗ из серии “Гигиенические
Критерии состояния окружающей среды” (см. список литературы к настоя-
щей главе). Именно эти аспекты проблемы в наибольшей мере определяют
патогенетические механизмы отравлений рассматриваемой группой хими-
ческих веществ в их современном понимании и должны учитываться при
комплексном лечении и профилактике отравлений.
4-3. Токсикокинетика и токсикодинамика
тиоловых ядов
ным еДИНеНИЯ тяжель1Х металлов могут поступать в организм ингаляцион-
бом ’ (^е*экУтанным> пероральным путями, а также парентеральным спосо-
прав иднако если поступление ядов в дыхательные пути и на кожу, как
ило, носит профессионально обусловленный характер, в плане развития
133
бытовых отравлений среди населения наибольшее значение имеет перорад
ный путь их попадания в организм. Поступившие в организм тиоловые яд*'
распределяются в органах и тканях крайне неравномерно, что затрудн^ц’1
сопоставление, особенно в ряду металлов. т
До 50 % введенного ингаляционным путем Cd содержится в легких. Пои
поступлении в ЖК.Т в организме задерживается от 1 до 8 % введенной дозы
Имеются большие индивидуальные колебания этого показателя. Наиболь-
шая зарегистрированная абсорбция не превышает 20 %. Созданная в 70-х
годах одночастная модель токсикокинетики Cd в организме все время раз-
вивается и стала многочастной, учитывающей распределение в почках, пе-
чени и крови, а также такие показатели, как суточное поступление, масса
органа и др. Кадмий проникает в головной мозг и в небольших количествах
(до 2,5 %) сохраняется там в течение всего периода наблюдения.
Пары ртути при ингаляции почти на 100 % абсорбируются в альвеолах
легких, переходя в Hg2+ в эритроцитах и тканях организма. В ЖКТ погло-
щается не более 10 % введенной Hg, но этот показатель существенно воз-
растает у детей, причем 75—90 % введенной дозы выводится через кишеч-
ник. В почки попадает 50—90 % Hg от общего содержания в организме.
Относительно высокие уровни отмечены в гонадах и железах внутренней
секреции. У детей и подростков, молодых животных в эксперименте пока-
затель накопления в почках ниже, а в тканях печени и мозга — относительно
выше, чем у взрослых особей. В тканях плода крыс содержание Hg в 40 раз
превосходило средний уровень в теле взрослых животных. Общее распреде-
ление можно представить таким образом: 50 % — в почках, 20 % — в печени,
25 % — в желчи и до 5 % — в мозге. В выведении Hg из организма отмечают
две фазы: первая — с Т50 продолжительностью 2—5 дней, когда выводится
до 90 % накопленного количества, и вторая — с Т50 — до 30—40 дней.
Однократное введение неорганической ртути в организм приводит к
накоплению ее преимущественно в цитоплазматической (54 %) и ядерной
(30 %) фракциях клеток почек. По мере удлинения срока поступления
(хроническое в течение 6 мес подкожное введение хлорида ртути) наблюда-
ется возрастание ее содержания в ядерной, лизосомальной и митохондри-
альной фракциях клеток без увеличения концентрации в цитозоле. В более
поздние сроки Hg продолжает накапливаться только в лизосомах. Характер
распределения Hg в субклеточных компартментах других органов (печень,
головной мозг) аналогичен; он также существенно не отличается от распре-
деления в клетке органических соединений. В нейронах Hg связывается с
мембранами митохондрий, эндоплазматической сети, комплекса Гольджи,
ядер и лизосом.
Таким образом, проникая через клеточные и субклеточные мембраны,
Hg задерживается на них, распределяясь по всем субклеточным фракциям.
Различия в содержании Hg в разных фракциях клетки можно объяснить,
вероятно, неодинаковым сродством к ней функциональных групп биомоле-
кул субклеточных частиц. Влияние Hg на уровень и скорость синтеза ДНК
и РНК в клетках культуры и тканях живого организма является, по-види^
мому, следствием избирательной локализации этих соединений в ядерной
фракции клетки. С обнаруженными особенностями ее внутриклеточного
распределения можно связать развитие патологических изменений физио-
логических и биохимических процессов в организме, в частности ее гона-
дотоксическое, эмбриотоксическое и мутагенное действие. ,
Отличное от ртути и свинца распределение в клетке свойственно О •
Значительная его часть накапливается в надосадочной части гомогенат
134
что объясняется способностью Cd вызывать индукцию и связывать-
пеЧеНбелком тионеином, содержащимся в этой фракции печени. Такое же
сЯ Спеделение установлено в клетках монослойной культуры гепатоцитов.
Рас" 2 ч после воздействия во фракциях цитозоля, ядер, митохондрий,
ЧероОСОМ обнаруживали соответственно 56, 23, 14 и 7 % добавленного
М ичества металла. При увеличении времени культивирования до 20 ч
к°лИчество Cd в цитозоле возрастало, а в остальных субклеточных фракциях
pH иж ал ось.
Накопление Cd в клетках культуры почек происходило параллельно
вышению степени его цитотоксичности. Установлена линейная зависи-
ость между увеличением содержания и временем действия в первые 6 ч, а
после 18 ч инкубации наблюдали плато. Вместе с тем характер распределе-
ния Cd в клетке не зависел от выраженности цитотоксического действия:
более 90 % его связано с цитозолем, остальная часть — с микросомной,
митохондриальной, ядерной фракциями и клеточными фрагментами. В ин-
тактных лимфоцитох селезенки мышей общее потребление CdClj109 зависе-
ло от дозы и составляло 0,1 — 10 мкмоль. Распределение в ядрах, цитозоле
и фракциях органелл составило 60, 34 и 6 % соответственно независимо от
концентрации Cd и времени его воздействия. Накапливаясь на внутренних
мембранах митохондрий и гепатоцитов, Cd уменьшает энергоснабжение и
стимулирует ПОЛ в концентрациях 10—100 мкмоль. В случае более низкого
содержания кадмия (1 мкмоль) отмечалось нарушение целостности мембран
митохондрий без стимуляции процессов ПОЛ.
Изучение субклеточного распределения Cd в печени позволило расшиф-
ровать механизм возникновения толерантности к данному токсиканту при
его предварительном введении. Установлено, что снижение чувствительнос-
ти к Cd обусловлено изменением его распределения не в тканях, а в
цитозольной субклеточной фракции печени, где происходит связывание его
с металлотионеином.
На монослойной культуре клеток СР4С показано, что проникновение
Cd в клетку происходит через потенциалзависимые кальциевые канальцы.
Cd вызывает ультраструктурные изменения клеточных мембран, митохонд-
рий, цистерн аппарата Гольджи, сети трубочек, хроматина, ядрышка, мик-
рофиламентов и рибосом. Поражение клеточной оболочки являлось наибо-
лее ранним признаком действия Cd, особенно при длительном поступлении
в клетки.
Неорганические соединения свинца задерживаются в легких на 35—50 %.
При поступлении в ЖКТ этот показатель составляет 15—50 %, что связано
с режимом питания, диетой, возрастными особенностями и другими фак-
торами. Концентрация в крови (РЬВ) достаточно четко коррелирует с вве-
денной дозой свинца. Распределение в мягких тканях и их Т50 существенно
тличаются от таковых для костной ткани. Если в крови и мягких тканях
онцентрация РЬ снижается вдвое примерно за 35—40 дней, то в костях этот
ч?оКа3аТеЛЬ составляет примерно 27 лет. При этом необходимо подчеркнуть,
ван В зависимости от возраста в костях депонируется 75—94 % абсорбиро-
голо°Г° РЬ’ Мобилизация его в различных стрессовых ситуациях (болезнь,
лениДаНИе’ отРавление Другими ядами) может давать патологические прояв-
При б У Ранее практически здоровых людей. Особенно важен этот момент
матеп еРеменности, когда мобилизация РЬ может стать угрозой здоровью
До 90 V* плода’ тем более что в пупочной вене концентрация РЬ составляет
Иму1ц °Т таков°й в крови матери. Из организма свинец выводится пре-
ственно почками, что существенно отличает его соединения от со-
135
единений ванадия, которые только на 30 % выводятся с мочой, а на 70 %
с фекалиями (по ванадату натрия), и от солей хрома Cr (III), которьГ
практически полностью экскретируются через кишечник. Если наивысщае
концентрация ванадия в легких в 20 раз выше, чем в других органах, хрома Л
в селезенке и почках, то кадмий и ртуть аккумулируются в основном "в
почках. Примерно такие соотношения получены для соединений трех- и
пятивалентного мышьяка; неорганические и метилированные его соедине-
ния выводятся из организма через почки за несколько дней на 46 % и более
от полученной дозы. Прием неорганических соединений As приводит к
образованию в организме диметиларсиновой и (в существенно меньшей
степени) монометиларсиновой кислот. При этом As (V) предварительно
восстанавливается в As (III).
Никель распределяется достаточно равномерно в легких, печени, почках
селезенке, гонадах, а его содержание в щитовидной железе и надпочечниках
примерно в 10 раз выше. Через кожу человека всасывается до 88 % нано-
симого препарата. 90 % никеля выводится через кишечник, а 10 % — через
почки. Вводимый в организм кобальт обнаруживается в крови (при интра-
трахеальном поступлении) уже через 5 мин. В отличие от свинца Со отли-
чается более высоким содержанием в плазме, чем в эритроцитах (в 2 раза).-
Адсорбция Со в крови характеризуется экспоненциальной зависимостью и
двумя периодами полувыведения, которое осуществляется в основном по-
чками и заканчивается в течение недели после введения.
Приведенные данные позволяют получить общую картину и основные
особенности поступления, распределения и выведения из организма веду-
щих представителей рассматриваемого класса токсикантов. Этот перечень
информации можно было бы продолжить с учетом физико-химических
особенностей, путей поступления яда в организм и характеристики поража-
емого объекта. Формализация этих данных, как и сопоставление, представ-
ляет большие трудности. Тем не менее только на этом пути можно построить
удовлетворительную модель, отражающую не только качественные, но и
количественные закономерности токсикокинетики тиоловых ядов.
К числу первых в этом направлении следует отнести модели для ртути
и свинца, разработанные Е.Пиотровски, которыми широко пользуются в
расчетах по настоящее время. Их детальное рассмотрение, как и моделей
других авторов, может быть предметом самостоятельного исследования [93,
118]. Применительно к целям данной работы следует обратить внимание не
на уравнения регрессии, обобщающие результаты моделирования, а на те
ограничения, которые связаны с величиной действующей дозы (концентра-
ции), трансформацией вводимого вещества в организме, ролью легочных
макрофагов в солюбилизации исходного продукта, депонирование и моби-
лизации яда и др.
Применительно к ртути, например, хорошо известно, что практически
вся поступившая в организм ртуть достаточно быстро ионизируется, а все
органические соединения переходят в метилртуть. Однако получены много-
численные подтверждения того, что обратимость указанных процессов ле-
жит в основе одномоментного определения различных форм этого металл
в ионизированной, нейтральной и органической формах. -г КТО
Еще большее многообразие характерно для органометаллов. Так, ТЫ
подвергается дебутилизации с образованием дибутильных и монобутильных
производных, небольшие количества которых становятся объектами микр°
сомальных монооксигеназ (большие дозы подавляют активность последних^
Органические соединения ртути более длительно, чем неорганические, н
136
сЯ в организме в неизменном виде. Это определяется липофильностью
хоДЯлпроизводных Hg, которые вследствие выраженной липофильности ку-
MovK)T в богатых липидами тканях, в частности в нервной системе: они
МуЛ обны проникать через гематоэнцефалический барьер [62]. Финилртут-
сП0Ссоединения, напротив, довольно быстро распадаются с освобождением
НЬ'е ганической Hg. При ингаляционном отравлении именно легочные мак-
НС(Ьаги ответственны за солюбилизацию малорастворимых соединений тя-
Р°лых металлов (например, окись ртути, каломель), что приводит к усиле-
нию токсичности вводимого вещества.
" Практически весь поступающий в кровь свинец абсорбируется эритро-
итами а затем откладывается в костях (для сравнения укажем, что Hg в
крови приблизительно одинаково распределяется между эритроцитами и
плазмой крови, но органические соединения превалируют в эритроцитах).
Оба эти обстоятельства оказывают существенное влияние на кинетику вы-
ведения РЬ из организма. Кинетика процесса хорошо прослеживается при
введении в организм меченых изотопов и удовлетворительно описывается
ди- и даже триэкспоненциальной моделью, отражающей первично проте-
кающий процесс миграции обменного иона в крови и печени, выведение
его почками, а затем и включение мобилизационных эффектов с участием
костных депо. Вероятно, эти данные отражают общебиологическую законо-
мерность биокинетики низкомолекулярных химических веществ в организ-
ме и относятся не только к ксенобиотикам, но и эссенциальным ионам.
Так, обмен калия мышц на калий среды (42К) совершается вначале быстро,
а потом замедляется [66]. Кривая замещения включает три экспоненциаль-
ные компоненты и может быть удовлетворительно описана уравнением:
[K]m = Ae-at + Be-bt + Се"01, (5)
где [K]m — незамещенный калий мышц за время t; А, В, С — начальные
концентрации трех фракций мышечного калия; а, Ь, с — постоянные вели-
чины уравнения, характеризующие данный ион.
Количественные данные эксперимента показывают, что фракция А со-
средоточена в межклеточных пространствах и является наиболее быстро
обмениваемой, фракция В — цитоплазматическая, а фракция С (более 50 %
по балансу) принадлежит структурам мышечных волокон. Именно такого
рода кинетические модели рассматриваются В.А.Филовым и Е.Пиотровски
Для свинца и ртути, а предложенные системы дифференциальных уравнений
Позволяют количественно описать и оценить их токсикокинетику, что под-
тверждено многочисленными экспериментальными данными.
На эти процессы влияет достаточно много экзо- и эндогенных факторов,
звестно [72], что желудочно-кишечная абсорбция РЬ зависит от состава
Диеты, энергетического баланса, а его аккумуляция снижается в присут-
вии кальция, железа, фосфата, витаминов D и Е. При молочной диете
ленЧИТеЛЬН° повышается аккумуляция Cd в организме, тогда как полива-
спо™к е катионы Са и Zn подавляют его адсорбцию путем изменения его
Шен°бН°СТИ ирикрепляться к мембране кишечника [66]. Такие соотно-
Металло*4 осо^енности токсикокинетики установлены и для других тяжелых
РУетаСЫваНие' РаспРе^еление и выведение тиоловых ядов из организма регули-
тран в пеРвУю очередь на клеточном уровне за счет механизмов мембранного
чему ПоРта от простой диффузии до активного транспорта через мембраны,
А1^тал Значителън°й мере способствует относительная легкость связывания
°в в катионной форме с мембранными и клеточными белками.
137
Не случайно, например, молярная концентрация катионов в эритроцИтя
человека на 17 % не компенсирована соответствующими анионами [бб?
Если растворимость является фактором, ограничивающим поступление ток
сикантов в клетку, то адсорбционное и химическое связывание действуе"
в обратном направлении. Это действие проявляется тем сильнее, цем
ниже концентрация поглощаемых клетками химических соединений. Об-
ратимая денатурация клеточных белков при связывании с тиоловыми ядами
является важным регулирующим фактором поступления ионов металлов в
клетку.
Токсичность металлов обусловлена разными механизмами, кинетика ак-
кумуляции и выведения из организма характеризуется нелинейными соот-
ношениями с вводимой дозой, а их токсикодинамика (и в первую очередь
металлорганических соединений) может быть описана достаточно сложными
моделями с учетом вклада каждой составляющей в этот процесс. Такого
рода исследования весьма перспективны и представляют не только приклад-
ной, но и большой научно-теоретический интерес.
4.4. Острые отравления
Острые отравления тяжелыми металлами профессионального характера
благодаря комплексу эффективных превентивных мер чрезвычайно редки.
Они могут возникать при аварийных ситуациях, при несчастных случаях на
производстве и в быту (случайные отравления), носить суицидный (попытка
к самоубийству) либо криминальный (с целью убийства) характер.
Статистика ВОЗ и национальных органов здравоохранения разных стран
свидетельствует о наличии острых отравлений ядами рассматриваемой груп-
пы, в том числе и со смертельным исходом, которые при интоксикациях
рассматриваемыми токсикантами могут достигать 20—25 %.
Применительно к данному виду ядов, как и представителям всех осталь-
ных групп, диагноз “отравление неизвестным ядом” действительно не имеет
практической ценности [34], а предполагает выявление специфических при-
знаков, характеризующих групповую и(или) индивидуальную избирательную
токсичность предполагаемого яда. В то же время на пути даже очень активно
и скрупулезно проводимого скрининга симптоматики острого отравления
врача-токсиколога ждет разочарование, так как среди многообразных кли-
нических проявлений такого рода патологии химического генеза избиратель-
ное (специфическое) токсическое действие занимает достаточно скромное
место, существенно уступая обилию неспецифических симптомов. При мол-
ниеносных формах отравления и первые, и вторые иногда просто не успе-
вают развиться.
Интригующее же название известной и чрезвычайно полезной книги
А.Альберта “Избирательная токсичность” [1], во-первых, характеризует ле-
карственные средства; во-вторых (и вследствие этого), такая токсичность
более присуща небольшим дозам вводимых в организм ксенобиотиков при
их повторном поступлении, т.е. чаще прослеживается при хроническо
отравлении. Тем не менее знание клинической картины, подкрепление
данными анамнеза и лабораторного исследования, позволяет удовлетвор
тельно осуществлять диагностику острых отравлений, в том числе и тиоло
выми ядами. х
С учетом перечисленных видов отравлений, а также физико-химическ
свойств широко применяемых на производстве и в быту конкретных вешес
и соединений наиболее частым путем поступления данного вида ядов |
138 J
м следует считать пероральный, что определяет в значительной мере
оРга« симптоматику поражений, этапность развития клинических прояв-
и другие диагностически важные особенности отравления.
ЛеНКак указывают Е.А.Лужников и Л.Г.Костомарова [34], у 97,3 % больных,
ступающих в клинику с острыми отравлениями, наблюдаются ЖКТ-по-
П°жения, обусловленные главным образом прижигающим действием иони-
Ра ованных форм токсикантов. Местнораздражающее действие на слизис-
ЗИге оболочки присуще подавляющему большинству неорганических и орга-
Тических представителей данного класса, в первую очередь в достаточной
н е растворимых, хотя воспалительные эффекты в местах поступления в
Мпганизм аэрозольных частиц тяжелых металлов (дыхательные пути, желу-
дочно-кишечный тракт) также достаточно выражены. Именно с этими па-
тогенетическими механизмами связаны такие общие симптомы, как боль
при глотании, тошнота, рвота, металлический вкус во рту, боль по ходу
пищевода, в животе (преимущественно в эпигастральной области либо раз-
литые). В тяжелых случаях отмечается повторный жидкий стул, у 22 %
пострадавших уже в первые часы возникают пищеводно-желудочные и ки-
шечные кровотечения.
При обследовании больных отмечаются гиперемия зева и задней стенки
глотки, боль при пальпации шейного отдела пищевода, эпигастральной
области, по ходу кишечника, чаще в нисходящем отделе толстого кишечника
либо разлитая болезненность при пальпации живота. Такая боль наиболее
патогномонична для отравлений свинцом, когда она может носить характер
кишечной колики.
Выделительный стоматит и колит обусловлены выделением тяжелых
металлов слизистыми оболочками полости рта и толстого кишечника, при-
чем стоматит наиболее характерен для отравлений соединениями ртути и
свинца. Он проявляется темной сульфидной каймой на деснах, болями в
полости рта, в горле при глотании, гиперемией, набуханием, кровоточивос-
тью, изъязвлением десен, расшатыванием зубов, слюнотечением, увеличе-
нием и болезненностью при пальпации подчелюстных лимфатических узлов.
Выделительный колит варьирует от катарального до некротически-язвенно-
го, иногда сопровождаемого повторными кишечными кровотечениями. Для
соединений мышьяка более характерен острый холероподобный гастроэн-
терит, который появляется вследствие местного (энтерального) токсического
Действия, приводящего к парезу капилляров стенок кишечника, повышению
проницаемости сосудов и транссудации большого количества жидкости в
просвет кишечника (гастроинтестинальная форма отравлений).
Тошнота и рвота, ожог слизистых оболочек ЖК.Т — наиболее частые
признаки острых отравлений соединениями ртути, мышьяка и меди. При
отравлении мышьяком рвотные массы имеют зеленый, а меди — голубой и
голубовато-зеленый цвет.
Обширный ожог пищеварительного тракта приводит в 25,7 % случаев к
Р звитию экзотоксического шока, который чаще отмечается при отравлени-
гаеСОеДр нениями мышьяка, меди и хрома. Экзотоксическим шоком В.Н.Да-
На в и Е.А.Лужников [33] предлагают обозначать особую реакцию организма
ДейЧРеЗВЫча^Ное по своей силе Длительности острое химическое воз-
НИяСтвие с пРизнаками шока. Он развивается в первые часы после отравле-
боде*1 °бУсловливает 60—70 % летальности. Шок при острой химической
Жит НИ ~ Разно«идность гиповолемического шока, в основе которого ле-
Разл1?еЗКаЯ плазмопотеРя как результат расстройств сосудистой регуляции
чного генеза. В данном случае она связана с повреждением слизистой
139
оболочки желудочно-кишечного тракта, является причиной уменьшени
венозного возврата к сердцу, снижения ударного объема сердца и артери1
ального кровяного давления. Именно последнее служит стимулом симпато'
адреналовой системы с выбросом в кровь катехоламинов. Это в свою очередь
приводит к распространенной вазоконстрикции (кроме сосудов сердца
мозга) как проявлению мобилизации адаптивных резервов, что известно в
литературе как централизация кровообращения.
На время компенсируются явления шока, сохраняются на удовлетвори-
тельном уровне минутный объем сердца и артериальный тонус. Но умень-
шение кровоснабжения органов и тканей приводит к их ишемии, развива-
ется клеточная гипоксия за счет нарушения аэробного метаболизма, сопро-
вождающаяся накоплением недоокисленных продуктов обмена и развитием
ацидоза.
Преимущественно кардиогенный шок развивается не только при отрав-
лении тяжелыми металлами, но и при остром отравлении ФОС, дихлорэта-
ном, снотворными препаратами, раздражающими ядами (аммиак, хлор), т.е.
практически не зависит от вида химического агента. Но развитие гипо-
волемии определяется при разных видах интоксикаций неодинаковыми
механизмами, что необходимо учитывать при назначении терапевтических
средств.
При ингаляционных отравлениях, вызванных вдыханием паров и пыли
оксида Cd в концентрации более 1 мг/м3 в течение 8 ч рабочей смены или
более высоких концентраций за меньшее время, развивается токсическая
пневмония, а затем отек легких. Симптомы появляются через 1—8 ч скры-
того периода (при более низких концентрациях явления интоксикации на-
блюдаются спустя 10—36 ч). Первый признак отравления — раздражение
гортани. Затем появляются сильный кашель, тяжелая одышка, повышение
температуры, боль в грудной клетке, тошнота, рвота, цианоз, отек легких.
В этот период наблюдаются раздражение слизистых оболочек верхних и
глубоких дыхательных путей, сладкий вкус во рту, боль в области лба,
головокружение, слабость, тошнота, боль в подложечной области. Возника-
ют трахеит, бронхит, бронхиолит с приступами судорожного кашля с мок-
ротой, сильной одышкой и синюхой, часто развиваются пневмонии, отек
легких, возникает боль за грудиной, в суставах, застойные явления (расши-
рение сердца, увеличение печени). При тяжелых ингаляционных отравле-
ниях возможна смерть на 3—5-е сутки от отека легких или бронхопневмонии
(до 15 % пострадавших с тяжелыми формами отравления). Подобная карти-
на характерна также для соединений ртути. Ингаляция паров соединений
меди и цинка приводит к резкому подъему температуры (до 39—40 °C) и
развитию признаков литейной лихорадки: головная боль, общая слабость,
одышка, сухой кашель.
Для большинства ядов данной группы, особенно меди, мышьяка, свинца,
характерно развитие гемолитической и гипохромной анемии.
При отравлении кадмием в крови повышается число лейкоцитов, ней-
трофилов и эритроцитов. Лейкоцитоз исчезает через 2 дня, но сохраняется
увеличенное число эритроцитов. При отравлениях сулемой в крови вначале
увеличивается содержание гемоглобина и эритроцитов, затем развивается
анемия. Резистентность эритроцитов понижена, выявляются нейтрофиль-
ный лейкоцитоз, ускоренная СОЭ. Наступают также существенные измене-
ния в периферической крови при остром отравлении свинцом (нейтрофилез,
лимфопения, эозинофилия, ускорение СОЭ, умеренная гипохромная ане-
мия).
140
ксИческая нефропатия наблюдается у 67,6 % пострадавших. При этом
исимости от степени тяжести отравления появляются белок в моче,
в 3аВеоативные и воспалительные изменения, в начальной стадии интокси-
Деге» усиливается мочеотделение, которое на последних этапах отравления
каПИ щается и даже полностью прекращается. Для “сулемовых” некронеф-
умень /»сулемовой почки”) характерны отсутствие отеков, повышение об-
Ро3° содержания белка в крови, некрозы эпителия извитых канальцев с
Ше палом и слущиванием, к которым часто присоединяется обызвествление
мертвых элементов.
С нефропатией, как правило, сочетается поражение печени (жировая
„фильтрация и дегенерация клеток, застойные явления, увеличение пече-
ни болезненность при пальпации).
Токсическое действие тяжелых металлов и мышьяка, в особенности их
органических соединений, проявляется в широкой гамме психоневрологических
симптомов вплоть до токсической энцефалопатии.
При отравлении кадмием характерны повышенная возбудимость, раздра-
жительность либо угнетение, бессонница, головная боль и головокружение;
при действии сулемы и нитрата ртути — атаксия, общая возбудимость, в ряде
случаев тремор, парезы, иногда судороги; при отравлении свинцом — изме-
нения вегетативной нервной системы (астения, потливость, яркий разлитой
дермографизм).
Эти признаки поражения ЦНС хорошо моделируются в опытах на жи-
вотных. У белых мышей, крыс и кроликов при однократном воздействии
соединений РЬ в дозах, вызывающих токсический эффект со смертельным
исходом, развивается интоксикация, протекающая в три стадии. Первая
стадия проявляется кратковременным возбуждением, повышенной двига-
тельной активностью, вторая — состоянием угнетения, адинамией, третья —
судорогами, парезами, параличами, расстройством дыхания. Во второй ста-
дии на фоне адинамии отмечаются нарушения координации движений,
расстройства ритма дыхания, фибриллярные подергивания отдельных групп
мышц.
При острых отравлениях соединениями РЬ у человека отмечаются метал-
лический вкус во рту, головная боль, тошнота, слюнотечение, рвота, потеря
сознания, нередко боль в животе, понос со слизью, часто с кровью, сильная
жажда, чувство жжения во рту, набухание и кровоточивость десен. В даль-
нейшем появляются неустойчивость походки, тремор, параличи конечностей,
снижение остроты зрения и слуха, слепота, боль в суставах, затрудненное
глотание, непроизвольные мочеиспускание и дефекация — типичная картина
токсической энцефалопатии.
Наиболее показательны острые отравления тетраэтилсвинцом (ТЭС),
оторый представляет сильный нервный яд, способный кумулировать в
организме. Скрытый период действия составляет от нескольких часов до
ескольких суток. Токсичность связана с образованием в организме три-
н0“Лсаинца — активного ингибитора метаболических процессов. В началь-
тед1 Фазе отРавления выявляется расстройство условнорефлекторной дея-
симНОСТИ’ затем развиваются расстройства функции симпатической и пара-
6ысПатическ°й нервных систем. Отмечаются головная боль, слабость,
деч Р?я Утомляемость, потеря аппетита, расстройства сна, замедление сер-
тела°И деятельнос™> понижение кровяного давления, падение температуры
пило СЛЮнотечение> потливость, стойкий белый дермографизм, длительный
Ний ( ОТО₽НЬ1Й РеФлекс- Характерно нарастание психопатологических явле-
' аллюцинации, психомоторное возбуждение, расстройство сознания).
141
л
Возможны парез лицевого нерва, нарушение конвергенции, птоз, атакси
торможение рефлексов или их усиление, обильный пот. ПатоморфологичеЯ’
кие изменения в ЦНС более резко выражены в таламо-гипоталамическо“
области, мозжечке, фронтальной части коры и гиппокампе. При остры11
отравлениях появляются как нервно-сосудистые изменения, так и дегенепаХ
тивные процессы в ганглиозных клетках. При отравлении мышьяком воз-
можна “молниеносная”, или нервно-паралитическая, форма отравления
Таким образом, даже краткая характеристика клинической картины ост-
рых отравлений тимоловыми ядами дает представление о сложном взаимо-
отношении общих неспецифических и присущих сугубо данной группе
токсикантов специфических признаков поражения, степень и широта про-
явления которых носит дозозависимый характер. Однако при однократном
поступлении яда в организм не могут проявиться его кумулятивные свой-
ства, которые чрезвычайно важны именно для токсичности тяжелых метал-
лов. Они проявляются в полной мере в картине хронического отравления
Для более детального изучения патогенеза отравлений и лежащих в его
основе механизмов следует попытаться вычленить наиболее типичные син-
дромы и рассмотреть во взаимосвязи протекающие в системном плане
патологические процессы под действием тиоловых ядов при длительном
повторном поступлении в организм. Таких синдромов может быть не менее
четырех: нейро-, кардио-, гепато- и нефротоксичность, хотя не меньший
интерес представляют гонадотоксичность, влияние ядов на организм бере-
менных женщин и систему мать — плод, а также комплекс отдаленных
последствий, характеризующих профессиональный и экологически обуслов-
ленный контакт с тиоловыми ядами.
4.5. Хронические отравления
Хронические отравления тиоловыми ядами в последние десятилетия
превалируют в клинике профессиональных заболеваний наряду с мало- и
бессимптомными формами патологии (микромеркуриализм, микросатур-
низм, отдельные виды “носительства”), а также влиянием длительного кон-
такта с тяжелыми металлами на течение общих, этиологически не связанных
с трудовой деятельностью болезней, вызывая их обострения, осложнения и
рецидивы [46]. Эта же тенденция прослеживается среди населения в связи
с экологическими проблемами, обусловленными интенсивным антропоген-
ным загрязнением окружающей среды.
Типичные формы как острых, так и хронических интоксикаций, харак-
терные для воздействия высоких концентраций тиоловых ядов, практически
не встречаются. Это касается тяжелых форм интоксикации ртутью (ртутные
энцефалопатии, сулемовая почка), свинцом (свинцовая колика, свинцовые
параличи), марганцовокислым калием (марганцевый паркинсонизм) и ДРУ;
гими токсикантами. Клинические проявления хронических интоксикации
тяжелыми металлами имеют много общего, поскольку они обладают вира*
женным нейротоксическим действием. Их относят к категории нейротроп-
ных токсичных веществ. Кроме того, они существенно влияют на эндокрин'
ную систему, сердце, сосуды, печень, почки, а также процессы обмена, в
частности белкового, воздействуют на функциональное состояние половой
сферы мужского и женского организма, его репродуктивые функции.
Преобладание среди указанных этиологических факторов вредносте^
малой интенсивности, их сочетание с высоким нервно-эмоциональным на
142
ением требуют более углубленного изучения патогенеза и механизмов
пря*тия функциональных нарушений в организме, а также соответствую-
РЭЗВ им клинических проявлений и симптомов заболеваний. Этому может
шиХйствовать посиндромный подход к изучению данной сложной и много-
аспектной проблемы.
4 5 1. Нейротоксичность в патогенезе отравлений
тяжелыми металлами
В литературе накоплены обширные данные о воздействии тяжелых ме-
аллов на центральную, периферическую и вегетативную нервную системы
V экспонированных рабочих, различных контингентов населения, беремен-
ных женщин и детей, а также у животных разных видов в эксперименталь-
ных токсикологических исследованиях.
При этом учитывают и проявления избирательного действия ядов на
нервную систему, и преобладающие психоневрологические симптомы при
общетоксическом действии химических веществ на организм [40]. Соедине-
ния ртути, свинца (в первую очередь органические), марганца, мышьяка
относятся к типичным представителям ядов нейротропного действия, хотя
классическое понятие “нейротоксикоз” обязано своему появлению клини-
ческому синдрому неврологических нарушений, развивающихся под дейст-
вием высоких доз и концентраций этих веществ.
Нейротоксичность тяжелых металлов и мышьяка связана прежде всего с
их способностью преодолевать гематоэнцефалический барьер и накапливаться
в различных отделах нервной системы, прежде всего богатых липидами тканях
мозга.
При повторном воздействии малых концентраций Hg происходят значи-
тельный выброс гормонов надпочечников и активирование их синтеза. От-
мечены фазовые изменения в содержании катехоламинов в надпочечниках,
возрастание моноаминоксидазной активности митохондриальной фракции
печени.
Биохимические сдвиги заключаются в нарушении окислительного фос-
форилирования в митохондриях глиальных клеток, что приводит к развитию
тканевой гипоксии, к которой особенно чувствительна ЦНС. Происходящее
одновременно в печени нарушение равновесия между активностью катали-
заторов ресинтеза и распада гликогена сказывается на обеспечении мозга
глюкозой — основным энергетическим субстратом нервной ткани. Поэтому
при проявлении парами Hg нейротоксичности, особенно страдают высшие
отделы нервной системы.
При хронических интоксикациях парами ртути в концентрациях 0,085—
Л мг/м3 у крыс происходит угасание сформировавшихся условных рефлек-
сов, торможение безусловных пищевого и ориентировочного рефлексов. Их
ыраженность коррелирует с типом ВНД обследованных животных, степе-
Рроникновения исследованных соединений через гематоэнцефаличес-
барьер. Показан обратимый характер нарушений, развивающихся под
иянием малых концентраций Hg.
28 Нал,И11ие в воздухе даже минимальных концентраций ртути (2,7; 14 и
Ротгп/я М ' В мозге КРЫС вызывает рассогласование в констелляциях мик-
в мо °ЧеК За счет взаимодействия ртути с тубулином. Концентрации ртути
ИнтеГе ВозРастали в 11—47 раз, а содержание ГТФ снижалось на 41—74 %.
обнаРеСН°’ ЧТО под°бНЬ1е изменения в структурах и метаболизме мозга
РУжены при болезни Альцгеймера у людей. В связи с тем что полиме-
143
ризация тубулина зависит от ГТФ, именно этот механизм может лежать
основе хронических поражений мозга малыми концентрациями ртути [90]В
Микротрубочки строятся из полимеризованного тубулина и образую?
скелет ЦНС, нейрональной мембраны и ответственны за аксональный
транспорт, обеспечивая выживание нейронов. Метилртуть взаимодействует
с тубулином, приводя к распаду ассоциаций микротрубочек и другим мор-
фофункциональным изменениям, подобным таковым при болезни Альцгей-
мера [91, 122].
Исследовано влияние свинца на нейрональные и глиальные компоненты
первичной мезэнцефальной культуры клеток [138]. Пролиферирующие гли-
альные клетки могут модулировать нейротоксичность свинца. При этом
токсичность свинца может быть обусловлена как субститутом Са в регуля-
торных процессах [95], так и его взаимодействием с тиоловыми, карбок-
сильными и имидазольными группами, присутствующими в L-цистеине
глутатионе и протеинах [144]. Кинетика транспорта РЬ в клетку недостаточ-
но изучена, но ионизированный, коллоидный и протеинсвязанный свинец
в равной мере могут проникать в клетку. В частности, показано, что L-цис-
теин образует со свинцом тиоловый комплекс, который захватывается гли-
альными клетками и нейронами. Свинец вызывает некроз до 13 % клеток в
культуре в концентрациях 6—12 мкммоль. Эффект обусловлен поражением
глиальных клеток, главным образом астроцитов. Добавление в среду инку-
бации сыворотки крови защищает культуру от действия РЬ [131].
В крови 60 % свинца быстро соединяется с L-цистеином, а остальной —
с альбумином и неорганическими ионами, которые осуществляют транс-
портную функцию и способствуют накоплению РЬ в нервной ткани. Дли-
тельное воздействие РЬ изменяет синаптическую передачу за счет нарушения
(дерегуляции) Са гомеостаза путем Pb-Са-взаимодействий, приводящему к
ухудшению диффузии Са и росту содержания свинца в клетках. Последний
заменяет Са в карбоксильных соединениях с протеинами, такими как каль-
модулин, тропонин С, парвальбумин. Свинец-кальциевые взаимодействия
приводят к снижению уровня нейротрансмиттеров — дофамина и серотони-
на. Наконец, свинец, как уже отмечалось выше, с большой аффинностью
соединяется с тиоловыми группами аминокислот и протеинов в цитозоле и
внутриклеточных компартментах нейронов и глиальных клеток.
Свинец также может оказывать нейротоксическое действие за счет вы-
теснения цинка из богатых тиоловыми группами соединений. В концентра-
циях 10—100 мкмоль он не вызывает некроза клеток, но ведет к их гибели
за счет снижения концентрации К+ с 25 до 5 тМо и полностью блокирует
постсинаптические глутаматные рецепторы. Изучение рецепторов, ответст-
венных за поступление Са, с помощью актиномицина D и циклогексимида,
указало на роль этого механизма в токсичности свинца. Возрастающая
токсичность свинца может быть обусловлена снижением трофической функ-
ции высоких концентраций К+. Этот ион обеспечивает межклеточный го-
меостаз, снабжая нейроны глутамином, глутатионом, в известной мере от
ветственных за детоксикацию и выведение тяжелых металлов.
Астроциты, как известно, поддерживают внутриклеточный ионный г0~
меостаз, снабжают нейроны глутамином и глутатионом, стимулируют ме
таллотионен I/II, 2п2+-связывающие протеины, ответственны за гомеост
Zn2+, выведение тяжелых металлов и свободных радикалов. Присутстви
цинка блокирует Са-зависимые эндонуклеазы и предотвращает апоптиче
кую гибель клеток [85].
144
Отравление тяжелыми металлами, нагрузка ионами металлов организма
вставляют собой стресс, который сопровождается активацией процессов
П^боднорадикального окисления в тканях, интенсификации ПОЛ в биомембра-
св^х и включением систем антиоксидантной защиты, в том числе глутатио-
И°в<Б Ф.Керимов и С.А.Алиев [25] показали, что процессы глутатионовой
шиты нервных клеток при стрессе взаимосвязаны с изменением содержа-
ли поверхностно расположенных и структурно замаскированных белковых
сн-групп- Свободные радикалы окисляют сульфгидрильные группы, спо-
собствуя тем самым структурно-функциональным изменениям в нервных
клетках. Это приводит к активации ГП в гипоталамусе, сенсомоторной,
лимбической и орбитальной коре (в 1,5—2 раза выше, чем в продолговатом и
среднем мозге), что носит, вероятно, адаптационный характер. При хроничес-
ком стрессе происходит тотальное угнетение активности данного фермента.
Это связывают, в частности, с истощением запасов восстановленного глута-
тиона, с одной стороны, и уменьшением клеточной концентрации мета-
болически активной формы селена — с другой. Последнее представляет
большой интерес в плане возможных конкурентных взаимоотношений с
тяжелыми металлами, которые, однако, до сего времени практически не
изучены.
Активность ГР, поддерживающей стационарный редокс-потенциал кле-
ток, изменяется незначительно при достаточных адаптационных резервах и
снижается при выраженных формах дизадаптации. Как известно, данный
фермент через цепь биохимических изменений вместе с сопряженной с ним
Г-6-ФДГ восстанавливает окисленный глутатион, являющийся потенциаль-
но сильным нейротоксином, ингибирующим активность ряда ферментов
энергетического обмена (гексокиназы, аденилатциклазы, креатин кин азы)
мозга, а также биосинтеза белка. Именно благодаря этому механизму в
тканях мозга соотношение F-SH/r-S-S-Г поддерживается на очень высоком
уровне — 100/3, обеспечивая защиту нервной системы от свободнорадикаль-
ного окисления, в том числе и при действии тяжелых металлов.
Если для соединений ртути, свинца, мышьяка, марганца нейротоксич-
ность является общепризнанным ведущим механизмом, активно изучаемым
в клинических и экспериментальных исследованиях, то вопросы нейроток-
сичности кадмия остаются недостаточно экспериментально обоснованными.
Поэтому полученная в последние годы информация нуждается в специаль-
ном рассмотрении, тем более что за последние 25 лет значительно возрос
интерес к кадмию как к одному из продуктов радиоактивного распада,
накапливающемуся в организме человека и животных, токсичному элементу
и анти метаболиту ряда химических элементов. Среди кадмиозов человека
четко выделены кадмиевый ринит, кадмиевая нефропатия с типичной про-
теинурией, кадмиевая остеомаляция (болезнь итаи-итаи). Кроме поражения
зрительного аппарата, почек, печени, костной системы, при интоксикации
а развивается также нейротоксический синдром [39]. Хотя в механизме
©логического действия Cd основное внимание уделяется его нефроток-
ичности, в литературе имеются указания о его влиянии на ЦНС [94] и
в°веденческие реакции у человека и животных [98]. Все эти виды патологии
патогенетическом плане взаимосвязаны с особенностями токсигенной
ивности Cd в организме, среди которых выделяют следующие:
отсутствие эффективного механизма гомеостатического контроля;
материальная кумуляция в организме с необычно долгим периодом
Полувыведения, составляющим у человека в среднем 25 лет;
145
• преимущественное накопление в печени и почках, где создаются
депо токсиканта; интенсивное взаимодействие с другими двухва-
лентными металлами как в процессе всасывания, так и на тканевом
уровне.
В соответствии с накопленными в литературе данными о действии Cd
на клеточном и биохимическом уровнях установлено:
• стимулирующее действие этого микроэлемента на синтез цАМФ, ак-
тивность анаболических ферментов in vivo и обратный эффект в
опытах in vitro;
• разобщение окислительного фосфорилирования и тканевого дыхания'
• ингибирующее действие на активность каталазы и карбоангидразы и
в меньшей степени щелочной и кислой фосфатаз;
• снижение активности пищеварительных ферментов — трипсина и в
меньшей степени пепсина;
• уменьшение в малых дозах активности 1,25-дигидрохолекальциферола
(витамина D3), угнетение секреции инсулина;
• стимуляция активности алкоголь- и глутаматдегидрогеназы, глутати-
онредуктазы, аденилаткиназы, альдолазы, пируваткарбоксилазы;
• основной, а возможно и единственный путь поступления Cd в клет-
ки — через потенциалзависимые Са-каналы, причем органические
антагонисты Са -каналов (нимодипин) защищают клетки от цито-
токсического действия Cd [99];
• Cd блокирует Са -каналы с IC50 = 4 мкмоль [101, 141];
• ионы Cd способны связываться с Са-активируемыми К-каналами и
открывать их [120];
• Cd блокирует тетродотоксинустойчивые Na-каналы (в концентрации
3 ммоль на 64,6 %) [100];
• ионы Cd вызывают конформационные изменения кальмодулина и
активируют фосфодиэстеразу [41].
Однако нейротоксическое действие Cd в эксперименте изучено недоста-
точно, что и явилось предпосылкой проведения дополнительных исследо-
ваний в данном направлении. В первой серии опытов изучали токсичность
хлорида кадмия в дозе 0,1 LD50 (10 мг/кг), вводимого 5 раз в неделю в
течение 4 нед самостоятельно либо на фоне сформировавшегося невроза.
Контролем служили интактные животные, а также невротизированные без
токсического воздействия.
Исследования показали, что естественный процесс нарастания массы
тела у интактных животных при невротизации имел тенденцию к замедле-
нию; более четко это прослеживалось у животных, получавших внутриже-
лудочно CdClj. У затравленных на фоне невротизации животных масса тела
снижалась по отношению к исходному уровню. На 3—4-й неделе опыта в
двух последних группах отмечался падеж животных. При морфологическом
исследовании отмечены полнокровие сосудов внутренних органов, дистро-
фические изменения в печени, почках, точечные некрозы слизистой обо-
лочки желудка и кишечника. В органах и тканях выявлено накопление
кадмия (табл. 4.1). Как следует из данных табл. 4.1, за время подострой
затравки отмечено существенное накопление Cd в тканях эксперименталь-
ных животных.
146
блица 4.1. Содержание кадмия в тканях внутренних органов белых крыс при
п^ллстром введении хлорида кадмия в дозе 0,1 LDS0__________________
Группа животных Исследуемые органы, содержание Cd, мкг/г сырой ткани (М±т)
мозг печень ПОЧКИ кишечник
Интактные 0,11 ±0,02 0,78±0,03 1,93±0,07 0,43±0,03
Интоксикация Cd 0,46+0,04 5,36±0,12 13,6±0,35 2,64±0,11
Интоксикация + невротизация 0,59+0,08 8,26±0,25 10,7±0,34 1,58+0,14
Наиболее интенсивно возрастало содержание кадмия в почках, печени
и кишечнике, тогда как в тканях мозга оно было на порядок ниже. На фоне
предварительной невротизации уровень накопления Cd в тканях почек и
кишечнике существенно снижался (на 21,3 и 40,2 % соответственно), тогда
как в печени он возрастал на 54,1, а в головном мозге — на 28,3 %.
Поведенческие реакции у лабораторных животных при моделировании
невротических состояний и интоксикации Cd существенно изменялись. Так,
изучение двигательной активности у невротизированных крыс в процессе
выработки условного рефлекса одностороннего избегания показало, что уже
при первом обследовании уровень локомоций у них снижался по отноше-
нию к исходному на 60 %, вертикальный компонент реакции — на 20 %,
грумминг возрастал в 2,6 раза. При этом норковый рефлекс снижался на
67 %. На последующих этапах опыта оба показателя моторной активности
продолжали снижаться, составляя к концу эксперимента 28 и 31 % от
исходного соответственно. Количество болюсов соответствовало исходным
величинам, однако при проведении опыта появились такие эмоциональные
реакции, как повышенная возбудимость и повышение ориентировочной
реакции. При этом норковый рефлекс существенно повышался.
Невротизация вызвала нарушение соотношения горизонтального и вер-
тикального компонентов моторной реактивности животных: если до прове-
дения исследований оно составляло 5,2:1, то в конце опыта — 3,5:1. Затравка
Cd также приводила к изменениям поведенческих реакций у подопытных
животных. Горизонтальный компонент локомоций снижался при первом
обследовании на 36 %, вертикальный — на 26 %, а к концу эксперимента —
на 79 и 76 % соответственно. Число болюсов уменьшалось в 3,5 раза,
понижались также показатели норкового рефлекса.
Особенно активными оказались поведенческие реакции у крыс, затрав-
ленных Cd на фоне развившегося невроза. Горизонтальный компонент
реакции вырос при первом обследовании в 1,8 раза, вертикальный — в 2,6
раза, эмоциональная активность повысилась на 68 %, количество болюсов
Увеличилось в 3 раза, а норковый рефлекс — в 2,4 раза. При дальнейшем
родолжении опыта моторный компонент реакции резко угнетался, тогда
H£K эмоциональный и грумминг — оставались на достаточно высоком уров-
е. И только к концу эксперимента поведенческие реакции животных имели
енденцию к нормализации.
же при первом обследовании затравленных Cd животных экскреция
(таб° М?ч°й существенно возрастала, тогда как выведение ДОФА снижалось
бь л‘ 4-2). В последующие сроки исследования выведение НА, ДА и ДОФА
° относительно высоким, тогда как экскреция А падала.
147
Таблица 4.2. Показатели экскреции КА с мочой и содержания их в надпочечниках
у экспериментальных животных при введении Cd и невротизации
Группа животных Экспозиция, нед Содержание исследуемых КА в суточной моче, нг/л
А НА ДА ДОФА
Интактные До опыта 622,5124,4 465,6118,7 1967+125 15,4+?28~ 4 585,4131,5 399,1122,3 17481109 12,310^54 Невротизированные До опыта 546,45133,1 402,7+20,8 17941136 14,3±0 44 1 533,5122,4 17721125 14 71036 2 694,5126,5 426,9124,6 17321118 1.3,91037 3 766,8125,2 396,4121,8 17181126 13,11024 4 805,6131,5 379,9126,5 17051125 12 71031 712,5124,2 Интоксикация Cd До опыта 592,3143,4 428,8124,1 17891132 14,610,25 , 1 832,4138,1 573,2128,3 22311156 6,71014 " 2 686,5139,2 612,3138,5 23801146 10,41018 3 606,4129,5 698,5135,4 22651136 15,410,22 4 517,5124,7 711,3138,4 22941142 17,710,25 Cd + невротизвция До опыта 601,5136,2 417,4131,2 18051135 15,110,28 1 715,8129,4 556,3128,5 18421124 15,510^36 2 808,5127,4 594,6132,2 19751125 16,310,28 “ 876,4132,5 644,3135,9 21281132 14,210,34 4 761,0129,2 917,9154,2 15821144 12,610,18 Содержание КА в тканях надпочечников, мкг/г Интактные 524,2131,6 475,3+22,7 28641136 31,612,4 Невротизироввнные Cd 734,5138,2 428,3127,1 32161164 26,212,7 566,4141,8 872,5138,6 41631227 21,512,8 CD + невротизация 476,9138,4 992,5153,8 50281345 19,712,5 Данные литературы 407—865 232—575 2357—4800 15—73 (норма)
В группе животных, подвергшихся сочетанному действию химического
фактора на фоне невроза, снижение экскреции А было менее выраженным,
уровень НА и ДА в первый период возрастал при снижении экскреции
ДОФА. К концу эксперимента выведение ДОФА с мочой было на 19%,
А — на 30 % выше, чем в контроле, НА повышалось в 2,3 раза, тогда как
выведение ДА снижалось.
По окончании эксперимента определяли также содержание КА в тканях
надпочечников. Как видно из представленных в табл. 4.2 данных, у невро-
тизированных животных содержание А в тканях повышалось, а под влия-
нием Cd как на фоне невротизации, так и самостоятельно отмечено по-
вышение уровня НА по отношению к интактным животным и в сравнении
с данными литературы [63]. Таким образом, симпатоадреналовая система
чутко реагировала на невротизирующее и нейротоксическое воздействие в
модельных опытах на лабораторных животных, о чем свидетельствовало
изменение не только экскреции КА и их предшественников с мочой, но и
признаков гормонально-медиаторной диссоциации, относительной недоста-
точности резервов, а также их биосинтеза в надпочечных железах. Все это
свидетельствует о глубине происходящих сдвигов и биологической значи-
мости рассматриваемого механизма для данного вида патологии.
В современной токсикологии при оценке действия на нервную ткань
148
личных химических веществ все большее внимание уделяется состоянию
РайооМедиаторных систем и протеканию синаптических процессов как ран-
Н м чувствительным и информативным критериям повреждающего дейст-
НИЯ токсикантов [24]. Особенно информативным может стать изучение
Вейпотоксичности химических веществ при их действии на параметры функ-
ционально-противоположных нейромедиаторных систем, таких как ГА.МК-
огическая и система возбуждающих аминокислот [14].
еР Главная физиологическая функция возбуждающих аминокислот глута-
ята и аспартата состоит в передаче быстрого возбуждающего сигнала от
одного нейрона к другому [44]. Избыточный же выброс глутамата или
аспартата ведет к усиленному притоку Са в нервные клетки, что является
одним из универсальных механизмов повреждения нервной ткани при ин-
токсикациях и других неблагоприятных воздействиях [27].
Наоборот, ГАМКергическая система — это основная тормозная система
мозга. Она играет ведущую роль в ограничении повреждающего действия
процесса перевозбуждения при неблагоприятных воздействиях [36, 129].
ГАМК (гамма-аминомасляная кислота) выполняет две основные функции
в нервной системе: с одной стороны, она является основным медиатором
торможения, с другой — одним из промежуточных субстратов ГАМК-шунта,
участвующим в компенсации метаболических расстройств в головном мозге.
В ткани мозга ее концентрация довольно высока (2—10 мкмоль/г), причем
60—80 % ГАМК локализовано в цитозоле клеток, а остальная находится в
связанном состоянии в синаптосомах [54]. Кроме того, сами ГАМКергичес-
кие клетки мозга обладают высокой электрической активностью и поэтому
легко повреждаются [26]. Процесс поглощения (14-С)-ГАМК срезами коры
головного мозга крыс при различных экспериментальных условиях был
изучен нами ранее [13]. В развитие этого вопроса в данном разделе иссле-
дования было изучено на переживающих срезах коры головного мозга крыс
в различных экспериментальных условиях поглощения (14-С)-аспартата и
произведено сравнение влияния Cd на системы активного поглощения
(14-С)-ГАМК и (14-С)-аспартата в экспериментах in vitro и in vivo.
Исследования выполнены на белых крысах-самцах линии Вистар массой
120—170 г. Всего использовано 60 животных. В первой серии опытов иссле-
довали зависимость интенсивности поглощения (Й-С)-аспартата от времени
инкубации. Поглощение нарастало на 2—3-й и 8—10-й минутах. На 4—5-й
и 13—15-й минутах отмечалось снижение поглощения, а затем вновь про-
исходит его возрастание к 20-й минуте. Можно предположить, что процесс
поглощения сопровождается метаболизацией аспартата и периодическим
выходом меченых продуктов из клетки. Известно [71], что одной из важных
характеристик синаптического оборота нейромедиаторов является их погло-
щение (обратный захват) пресинаптической терминалью и околосинапти-
ческой глией. В ходе этого процесса выделившийся передатчик удаляется
из синаптической щели.
Во второй серии опытов исследовали зависимость интенсивности погло-
NgNM5Lаспартата от температуры инкубационного раствора и наличия ионов
Поглощение плавно возрастает от 0 до 25 °C, затем выходит на плато
4(р^ке немного снижается при 40 °C. Вероятно, при температурах порядка
Ри система находится в наиболее стабильном состоянии. В этих экспе-
ста1еНТах ВЬ1Явлен Ка+-независимый компонент поглощения, который со-
пл примерно половину от Na+-3aBHCHMoro.
ГАМкПее были проведены опыты по изучению влияния Cd на поглощение
К- Они свидетельствуют о том, что хлорид кадмия усиливает поглоще-
149
ние ГАМК в двух диапазонах концентраций. В области сверхнизких кон-
центраций наблюдалось два пика стимуляции поглощения кадмия — Пр'
10“13 и Ю-10 М. При концентрациях от 10~9 до 10~5 М изменений погло-
щения не наблюдалось. В области высоких концентраций также обнаружено
два пика стимуляции поглощения ГАМК при концентрациях кадмия Ю~3
и Ю-1 М. Кроме этого, при концентрациях 10-11 и 10~4 М отмечена
тенденция к снижению поглощения, однако эти данные статистически
недостоверны.
Хлорид кадмия, как и в случае с ГАМК, также существенно влиял на
поглощение (14-С)-аспартата. В диапазоне сверхнизких концентраций эф-
фект Cd наблюдался при 10-15, 10-14, 10-11, 10~9 М. В диапазоне концент-
раций 10-8—10~4 достоверного влияния не обнаружено. В области высоких
концентраций стимуляция отмечена при 10-2 М.
При подострой затравке белых крыс Cd поглощение (14-С)-ГАМК и
(14-С)-аспартата существенно изменялось. После затравки крыс внутриже-
лудочно водным раствором CdCl2 в дозе ’/20 от LD50 (16,45 мг/кг) снижалось
поглощение ГАМК (на 24 %) и более значительно увеличивалось поглоще-
ние аспартата (на 76 %).
Проведенные эксперименты показали, что поглощение (14-С)-аспартата,
как и ранее изученное поглощение (14-С)-ГАМК, является активным, энер-
го-, температуре- и Na-зависимым процессом. В обоих случаях соотношение
ткань/среда составляло 4,3—4,6, что указывает на хорошую жизнеспособ-
ность срезов. Однако зависимость поглощения аспартата от времени не
подчиняется экспоненциальной зависимости в отличие от поглощения
ГАМК. Вероятно, это свидетельствует о более раннем и активном метабо-
лизме (14-С)-аспартата в срезах. Cd в этих условиях преимущественно
стимулирует поглощение этих нейромедиаторных аминокислот. В обоих
случаях зависимость концентрация — эффект носит нелинейный характер.
Транспорт ГАМК достоверно стимулируется при четырех концентрациях —
при 10~11, 10“9, 10~6, 10~2 М. Транспорт аспартата стимулируется также при
четырех концентрациях — при 10-13, IO-10, 10~5, 10-2 М (при 10-4 М от-
личия от контроля недостоверны).
Интересно отметить, что при концентрации кадмия 10~2 М синхронно
активируются транспортные системы обоих нейромедиаторных аминокис-
лот. Это свидетельствует, вероятно, о едином механизме влияния Cd при
указанной концентрации. Как показывают опубликованные данные, Cd в
миллимолярной концентрации уменьшает проводимость Na-каналов и вы-
зывает открывание Са-зависимых К-каналов за счет их прямой активации
и увеличения сродства к Са [13]. Эти эффекты ионов Cd должны приводить
к нарушению деполяризации нервных клеток, поддержанию их мембранного
потенциала, а следовательно, и Na-градиента, что создает улучшенные по
сравнению с нормальными условия для работы переносчика.
Что касается остальных пиков активации транспорта при нано-, пико-
и фемтомолярных концентрациях, то здесь отмечалась следующая законо-
мерность: транспортная система аспартата реагировала на Cd при концент-
рациях, на 1—2 порядка более низких, чем транспортная система ГАМК-
Кроме этого, в большинстве случаев поглощение аспартата стимулировалось
в 2—3 раза сильнее, чем поглощение ГАМК. Следовательно, в условиях 1П
vitro транспорт аспартата проявил себя процессом, более чувствительным к
Cd, чем транспорт ГАМК.
В отличие от опытов in vitro, где Cd вызывал однонаправленные изме-
нения транспорта обеих нейромедиаторных аминокислот, в условиях поД'
тпого эксперимента in vivo поглощение ГАМК снижалось, а поглощение
°сТР„тата стимулировалось. Такой результат представляется вполне законо-
аСонь1М- В экспериментах in vitro Cd подводили непосредственно к нервным
М еткам, выделенным из организма. При этом эффект токсиканта опреде-
лялся действием на молекулу переносчика либо на клеточные системы,
Лсуществляющие ее метаболический контроль. В этой ситуации однонаправ-
°енность эффекта, вероятнее всего, объясняется сходством молекулярной
структуры и метаболического контроля систем транспорта ГАМК и аспар-
тата [26]. .
В экспериментах in vivo действие Cd на системы транспорта опосредо-
вано реакцией целого организма, и разнонаправленность этого действия
объясняется, вероятно, различной физиологической функцией ГАМК и
аспартата как нейромедиаторов. В связи с тем что гиперфункция системы
возбуждающих аминокислот является одним из универсальных механизмов
повреждения нервной ткани при неблагоприятных воздействиях [129], уси-
ление обратного захвата аспартата можно рассматривать как стремление
защитных систем мозга уменьшить его синаптическую концентрацию и
ограничить повреждающее действие. Наоборот, торможение обратного за-
хвата ГАМК, вероятно, направлено на повышение ее внеклеточной кон-
центрации для усиления эффекта торможения, а значит — и защиты мозга
от повреждения.
Проведенные исследования позволяют прийти к заключению, что по-
глощение (14-С)-аспартата срезами коры головного мозга крыс является
активным энергозависимым процессом. Ионы Cd в условиях in vitro пре-
имущественно стимулируют транспорт как (14-С)-ГАМК, так и (14-С)-ас-
партата. Стимуляция транспорта нейромедиаторных аминокислот проявля-
ется при целом ряде концентраций Cd, включающем фемтомолярные. Сис-
тема поглощения аспартата более чувствительна к действию Cd, чем система
поглощения ГАМК.
In vivo в условиях подострой затравки Cd оказывает разнонаправленное
действие на изученные транспортные системы. Он стимулирует поглощение
(14-С)-аспартата и ингибирует поглощение (14-С)-ГАМК.
В целом приведенные в настоящем разделе результаты эксперименталь-
ных исследований убедительно показывают, что Cd в дозах, равных 0,1 и
0,05 LD50, обладает выраженными нейротоксическими свойствами, что яв-
ляется новым элементом в исследовании механизмов токсического действия
этого важного с экологических позиций ксенобиотика. Данные об участии
симпатоадреналовых механизмов в реализации его нейротоксичности, так
же как и действие на нейромедиаторные аминокислоты, открывает новую
главу в нейрохимии и токсикологии тяжелых металлов и имеет общетеоре-
тическое значение.
В порядке продолжения работ в указанном направлении определенный
интерес представляют также результаты, полученные при исследовании ней-
ротоксичности 5«с(три-н-бутилолово)оксида (ТБТО), которое широко по-
льзуется в промышленности, а также является ведущим биоцидом при-
®няеМых в мировой практике судовых необрастающих красок [133]. Не-
НЯ°?РЯ на имеющуюся информацию о нейротоксичности ТБТО, его влияние
Функциональное состояние ГАМКергической системы мозга, специфич-
°^Ть обнаруживаемых нейротоксических эффектов до сего времени не
Учены. Между тем положительное решение этого принципиального во-
роса позволит по-новому представить патогенез интоксикаций не только
гИиНЫм’ Но и Другими нейротоксикантами со сходным механизмом биоло-
еского действия на ЦНС человека и животных.
151
В процессе проведения исследований было обращено внимание на оп
ределен ное несоответствие между параметрами общей токсичности ТБТО
с одной стороны, и его биологическими эффектами в опытах in vitro в
сверхнизких (пико- и наномолярных) концентрациях — с другой. Известно
[1], что такого рода эффекты нередко отражают наличие у исследуемых
веществ избирательной токсичности, причем реакции наиболее поражаемой
функциональной системы, органов-мишеней либо показателей метаболизма
проявляются часто при действующих дозах и концентрациях, которые на
2—3 порядка ниже необходимых для проявления других признаков инток-
сикации. Именно это обстоятельство позволяет постулировать наличие у
ТБТО избирательной нейротоксичности. Такое положение априорно бази-
руется на известных данных литературы о более выраженном по сравнению
с неорганическими представителями центральном нейротоксическом дейст-
вии у металлорганических соединений. Так, открытие нейротоксичности у
метилртути и ее детальное изучение в связи с массовым поражением насе-
ления (болезнь минамату) содействовали выделению нейротоксикологии в
самостоятельную и интенсивно развивающуюся научную дисциплину [62
125]. Это же можно подтвердить данными о нейротоксичности метил- и
этилпроизводных свинца [137], органических соединений марганца [104] и
ряда оловоорганических соединений [3].
Проведенные исследования позволили выявить в опытах in vivo истоще-
ние синаптического пула ГАМК, усиление ее выброса и нарушение погло-
щения, изменение активности ферментов ее метаболизма — глутаматдекар-
боксилазы (ГДК, КФ 4.1.1.15) и ГАМК-трансаминазы (ГАМК-Т). Повыше-
ние уровня суммарного глутамата и ГАМК в гомогенате мозга при острой
интоксикации ТБТО (доза 3 мг/кг), вероятно, связано с ограничениями,
накладываемыми на процессы их метаболизма угнетением трикарбонового
цикла, одного из типичных для специфического действия ТБТО проявлений
нарушения энергетического обмена в клетке. В то же время наблюдается
дозозависимое истощение синаптического пула глутамата и ГАМК с макси-
мумом эффекта через 4—24 ч после воздействия токсикантом. Активация
ГР и Г-6-ФДГ при слабовыраженной активации ПОЛ может быть связана
с накоплением и усилением метаболизма в тканях восстановленных НАДН*
и НАДФН+, ибо для тяжелых металлов характерно повышение соотношений
НАДН/НАД и НАДФН/НАДФ.
Более четко зависимости типа концентрация — эффект прослежены в
опытах in vitro, в которых однотипные эффекты отмечаются при дозах и
концентрациях на 3—4 порядка ниже, чем в опытах in vivo [97]. Из пред-
ставленных в табл. 4.3 данных видно, что в поглощении (14-С)-ГАМК
определяется два максимума при концентрациях ТБТО 10—° и 10-4 М,
которые, вероятно, осуществляются по разным механизмам. Если при низ-
ких концентрациях ответ обусловлен изменением гидрофобной молекулой
ТБТО состояния клеточной мембраны и нарушением работы переносчика,
то при высоких концентрациях происходят преимущественно угнетение
энергопродукции за счет специфического блокирования тиоловых групп
ферментов энергетического обмена и снижение пула макроэргов. Стимуляция
высвобождения ГАМК наблюдается уже при концентрациях ТБТО Ю-1 М,
что свидетельствует о высокоспецифичном взаимодействии токсиканта с
системами, ответственными за К+-стимулируемое высвобождение ГАМК-
Включаясь в работу ГАМК шунта, ТБТО ингибирует максимальную и по-
вышает эндогенную активность ГДК с одновременной активацией ГАМК->
в концентрации 10-12 М.
152
Таблица 4.3. Влияние ТБТО на показатели ГАМКергической системы мозга крыс vitro
^Исследуемые пока- затвли Концентрации ТБТО (М±т)
конт- роль кг14 КГ12 ю-10 10*8 кг6 КГ4
"р^лощенив ГАМК, рмоль/ (мг мин) 17,8+ 16,4± 16,4± 11,4± 12,2± 17,7± 7,9±
±1,13 ±0,92 ±1,35 ±0,87* ±0,64* ±1,26 ±0,43*
Высвобождение 4,10± 5,00± 8,20± 4,90± 5,7± 4,00± 4,2±
ГАМК при К-стиму- лировании, % Высвобождение ±0,29 ±0,25 ±0,38* ±0,24 ±0,27* ±0,22 ±0,29
1,90± 2,30± 2,10± 1,66± 2,60± 2,70± 4,50+
ГАМК спонтанное, ±0,094 ±0,19 ±0,15 ±0,11 ±0,17 ±0,18 ±0,26
% Избирательное 269± 265± 232± 182± 271± 173± 180±
связывание, ±14,5 ±11,7 ±9,83 ±7,65* ±12,6 ±9,41* ±7,82*
нмоль/мг белка ГДК-эндогенный, 0,079± 0,082± 0,147± 0,072± 0,151± 0,088± 0,119±
мкмоль/(гмин) ±0,0041 ±0,0058 ±0,0083 ±0,0029 ±0,0084* ±0,0037 ±0,0085*
ГДКтах, мкмоль/ 0,57± 0,49± 0,51± 0,47± 0,39± 0,46± 0,41±
(г-мин) ±0,019 ±0,022 ±0,028 ±0,023* ±0,031* ±0,025* ±0,017*
ГАМК-Т, мкмоль/ 0,168± 0,217± 0,245± 0,164 ± 0,230± 0,173± 0,219±
(гмин) ±0,011 ±0,017 ±0,015* ±0,012 ±0,014* ±0,018 ±0,015*
ДК ВЖК, нмоль/г 21,3± 22,5± 24,7± 22,4± 23,6± 21,6± 21,3±
ткани ±1,26 ±1,39 ±1,05* ±1,44 ±1,08* ±1,42 ±1,69
МДА, нмоль/r тка- 250± 228± 246± 223± 245± 246± 248±
ИИ ±13,8 ±12,6 ±15,2 ±10,9* ±9,85 ±13,9 ±15,6
ГП, мкмоль/(г мин) 17,9± 16,4± 18,2± 16,9± 17,0± 17,9± 24,6±
±1,24 ±2,06 ±1,32 ±1,84 ±1,38 ±1,22 ±1,07*
р < 0,05.
Активация процессов ПОЛ в тканях мозга рассматривается нами как
неспецифический вторичный процесс, развитие которого может быть инду-
цировано переходом на резервный, недостаточно эффективный в условиях
кислородоемкого метаболизма тканей мозга путь микросомального окисле-
ния, связанный с гипоксией и накоплением жирных кислот вследствие
активации процессов липолиза. Как уже указывалось выше, подавление
активности цитохрома Р-450, дыхания и фосфорилирования в тканях мозга
не создает условий для нерегулируемых реакций свободнорадикального
окисления, а окисление свободных жирных кислот идет на уровне первой
фазы (образования диеновых конъюгатов). Поэтому, вероятно, процесс об-
разования конечного продукта МДА, как и активность ферментов антиок-
сидантной защиты, не приобрело генерализованных форм.
° целом проведенные исследования позволили систематизировать совре-
ниННЫе пРедставления о нейротоксических эффектах кадмия и оловоорга-
ческих соединений, дополнив представления о патогенезе нейротоксич-
кий™ тяжелых металлов такими важными механизмами, как адренергичес-
Ва при интоксикации кадмием и ГАМКергический при действии ТБТО.
ДоздНЬ!М аспектом проблемы является активность соединений в сверхмалых
ромХ’ Помня ° таком типичном для тяжелых металлов явлении, как мик-
еРКуриализм, микросатурнизм и др. Большинство соединений, активных
153
в. сверхмалых дозах, являются эндогенными регуляторами — гормонами и
регуляторными пептидами.
Полученные данные о функциональных изменениях в тканях мозга при
действии сверхнизких концентраций кадмия и ТБТО свидетельствуют об ис-
ключительно высокой чувствительности метаболических систем мозга к дей-
ствию этого класса токсикантов.
Клиническая значимость полученных данных определяется взаимосвя-
зью степени истощения синаптического пула глутамата и ГАМК, с одной
стороны, и развития кататонического синдрома — с другой. Острая инток-
сикация ТБТО сопровождается вестибулярными нарушениями, двигатель-
ными расстройствами, иногда судорогами [145]. В нашей лаборатории впе-
рвые выявлен кататонический синдром при экспериментальной интоксика-
ции ТБТО [130]. В нейрофизиологическом эксперименте установлены
поведенческие проявления кататонии, обнаружена гиперреактивность хвос-
татого ядра, сочетающаяся с развитием судорожных потенциалов в коре
мозга. Однако нарушение ГАМКергических механизмов мозга может и не
быть первичным в нейротоксических эффектах ТБТО, поскольку проявле-
ния кататонии могут быть связаны также с гиперактивностью адренергичес-
ких структур, что также имеет место при отравлении тяжелыми металлами.
Вероятно, следует постулировать наличие дисбаланса в функции различных
нейромедиаторных систем. Множественный характер механизмов нейроток-
сического действия ТБТО обусловлен мембранотропными эффектами всей
молекулы токсиканта, а также влиянием иона олова после его деалкилиро-
вания [105]. Эти аспекты биоактивности и, в частности, токсичности ТБТО
признаются Международным сообществом (ВОЗ, [145]) приоритетами в
перспективных научных исследованиях на ближайшее десятилетие. Они
представляют интерес применительно ко всем видам металлорганических
соединений, ибо патогенетические механизмы при долгосрочном контакте
человека и животных с этими ядами, особенно в сверхмалых концентрациях
(порядка нанограммов в 1 л), остаются дискутабельными.
4.5.2. Кардиотоксичность тиоловых ядов
Проблема кардиотоксичности тяжелых металлов сложна и недостаточно
разработана, хотя в литературе имеется большое число указаний на наличие
изменений сердечно-сосудистой системы (ССС) у лиц, экспонированных
тяжелыми металлами. Для ее успешного решения необходимо сочетание
эпидемиологических, клинико-физиологических и экспериментальных ис-
следований [59]. Детальный анализ данных литературы и материалов собст-
венных исследований позволил прийти к заключению о наибольшей изу-
ченности токсического воздействия на ССС именно тяжелых металлов, что
подтверждается глубиной рассмотрения сложных патогенетических механиз-
мов кардиотоксикозов, данных клинических наблюдений и их эксперимен-
тального подтверждения, что существенно облегчает изложение материалов
данного раздела.
Поражения химической этиологии сердца и сосудов возникают не изолиро-
ванно, а во взаимосвязи с другими функциональными нарушениями в организме,
что вызывает большие трудности в их диагностике и нозологической диффе'
ренциации.
В реализации кардиотоксических эффектов различают непосредственное
воздействие химических веществ на сердце и сосуды, а также опосредован-
ное (экстракардиальное). Е.А.Лужников [32] относит большинство наблю-
154
1
х при действии разнообразных химических веществ к категории вто-
даемых Так, при действии марганца, неорганической ртути, свинца возни-
РИЧт преимущественно гипертензивные, а этилмеркурхлорида и тетраэтил-
ка!?нца — гипотензивные реакции как проявления вегетососудистой дисто-
СВ и и дистрофии миокарда, развивающихся на фоне нейротоксических
Н<Ъ(Ьектов и нарушений клеточного метаболизма с превалированием призна-
ки тканевой гипоксии. Марганец и сурьма, например, влияют на баланс
К?ектролитов в миокарде, что может играть важную роль в нарушении
ократительной функции миокарда [65]. В зависимости от повреждающего
действия на миокард исследованные металлы расположились в следующем
порядке: кобальт > кадмий > свинец > никель > медь, тогда как по способ-
ности снижать содержание сульфгидрильных групп в миокарде — медь >
> свинец > никель > кадмий > кобальт.
В этом обобщающем исследовании авторы также попытались интеграль-
но оценить экстракардиальные пути реализации вредного воздействия хи-
мических веществ. Они рассматривают в качестве основных путей ЦНС —
при воздействии токсических веществ на поясную извилину, миндалевид-
ный комплекс; гиппокамп — основные нейрональные структуры лимбичес-
кой системы; гипоталамическую область — как высший центр регуляции
висцеральных функций, а также гипоталамо-гипофизарно-адренокортикаль-
ную систему, реализующую ответные реакции организма на действие стрес-
соров.
Свинецсодержащие соединения характеризуются выраженным вазокон-
стрикторным действием, преимущественно проявляющимся в мелких сосу-
дах и капиллярах.
При содержании в питьевой воде 50 мкг/л РЬ в хроническом экспери-
менте у крыс отмечено существенное увеличение АД, особенно скорость
возрастания артериального давления (dP/dtmax).
Одним из наиболее информативных показателей признано исследование
системного АД, т.е. его динамики при нагрузочных пробах с введением
животным вазопрессина на фоне проводимой хронической интоксикации
исследуемым веществом [64]. Данный нагрузочный тест оказался предпо-
чтительным перед пробой с введением питуитрина как более физиологич-
ный, учитывая роль вазопрессина в физиологической регуляции сосудистого
тонуса.
Под действием ацетата свинца в дозах 0,1 LD50 уже на 15-й секунде
опыта системное АД возрастало на 19,7 мм рт.ст. и не возвращалось к
исходному уровню через 3 мин, как это наблюдалось в контроле.
При морфологическом исследовании тканей миокарда отмечены гипер-
трофия левого желудочка как следствие повышенной гемодинамической
нагрузки, утолщение сосудов мышечно-эластичного типа преимущественно
за счет средней оболочки, достоверное повышение уровня холестерина в
рови, а у кроликов — атерогенные изменения в аорте и миокарде.
Сравнение результатов хронических и подострых опытов, выполненных
ЛоЦелью изучения кардиотоксического действия свинца, не только послужи-
основанием для вывода о достаточной информативности этих резуль-
НИ°В И возможности их использования для гигиенического нормирова-
занийН?бИ спосо^ствовало разработке соответствующих методических ука-
П *
с РЯДе исследований М.П.Чекунова и соавт. [73, 74] изучили кардиоток-
То Ские эффекты кадмия, кобальта, меди, никеля, свинца и сурьмы. Ав-
Установили, что в основе наблюдаемых функциональных нарушений
155
лежат биохимические сдвиги, в частности снижение уровня гликогена, уси
ление процессов гликолиза, рост концентрации пировиноградной кислоте
в миокарде, снижение активности ЛДГ, рост активности лизосомальных
гидролаз, фосфорилазы, кислой фосфатазы, нарушение обмена норадрена-
лина (НА) и адреналина (А) уже при однократном воздействии. В подострых
и хронических опытах у подопытных животных отмечено существенное
увеличение активности моноамин оксидазы (МАО), кислой рибонуклеазы и
фосфатазы, фосфорилазы и катепсинов.
Под действием сульфата кобальта (ингаляция 0,005 мг/м3) отмечены рост
ЧСС в спокойном состоянии и замедление его восстановления после дозиро-
ванной физической нагрузки, изменение зубцов Р и Т на ЭКГ. При хрони-
ческой интоксикации сурьмой выявлены изменение желудочкового комплекса
ЭКГ, рост вольтажа зубцов Р и Т, смещение интервала ST вверх от изолинии
обеднение миокарда НА и обогащение А. Авторы подразделяют исследованные
металлы по механизму патогенетического действия на миокард:
• не обладающие избирательной кардиотоксичностью и характеризую-
щиеся преимущественно тиоловым механизмом действия (свинец и
медь);
• отличающиеся выраженным кардиотоксическим действием по кате-
холаминовому механизму (кадмий и кобальт).
Подчеркивая компенсаторно-приспособительную основу наблюдаемых
сдвигов, М.П.Чекунова обращает внимание на их фазовый характер (1 —
развитие повреждения и формирований компенсаторно-приспособительных
реакций; 2 — снижение интенсивности проявляющихся морфофункцио-
нально-метаболических сдвигов; 3 — выраженные нарушения структуры и
функции сердца, обусловленные истощением адаптационных резервов).
Именно на последней стадии развиваются необратимые изменения в мио-
карде, которые лежат в основе сердечной недостаточности при хроническом
кардиотоксическом действии металлов.
Подобные результаты получены в экспериментальных исследованиях с
введением животным ртути, ее неорганических и органических соединений:
изменение ЧСС и АД, нарушение предсердно-желудочковой проводимости,
сердечного ритма, экстрасистолия, характерные изменения ЭКГ, биохими-
ческие и морфофункциональные сдвиги [8, 143].
С результатами эксперимента согласуются материалы некоторых клини-
ческих наблюдений. Так, показано достоверное повышение систолического
АД у контактирующих с кадмием рабочих по отношению к обследованным
контрольной группы [87]. Отмечена корреляция между уровнем загрязнения
окружающей среды кадмием в ряде префектур Японии, с одной стороны, и
заболеваниями гипертонией среди населения [134], содержанием кадмия в
воздухе городов США и обусловленной гипертонией и сердечными заболе-
ваниями, смертностью населения [106]. Установлена взаимосвязь между
высоким уровнем никеля в крови и инфарктами миокарда и ИБС у рабочих,
выплавлявших никель. Эти нарушения развивались на фоне коронарной
вазоконстрикции, хотя другие сердечно-сосудистые заболевания и смерт-
ность от них не отличались от таковых у других контингентов населения в
данном районе [47]. Характерным синдромом при интоксикациях кобальтом
является “кобальтовая миокардиопатия”, протекающая с развитием миокар-
диодистрофии вследствие метаболических и ишемических изменении,
также выраженной гипотонии [78]. Именно артериальная гипотония, бРа'
дикардия, нарушение внутрижелудочковой проводимости и миокардиодис~
трофия являются наиболее типичными сердечно-сосудистыми нарушения
156
егистрируемыми у лиц контактной группы при действии органических
*оединений ртути, что совпадает с результатами экспериментальных иссле-
дований [62].
Д Анализ данных, касающихся кардиотоксичности тяжелых металлов, по-
оляет на основе современных представлений о патофизиологических и
3 етаболических изменениях в функционировании сердечно-сосудистой сис-
темы и ее регуляции построить общую схему включения основных патоге-
нетических механизмов в этот процесс.
Первичная рецепция тяжелого металла в дыхательных путях при инга-
ляции либо в желудочно-кишечном тракте реализуется как адаптивная ре-
акция на стрессорное воздействие, которая является по своему характеру
адренергической [45]. Это предполагает коронароспазм, прогрессирующее
развитие гипоксии и ишемии миокарда как обязательные атрибуты нейро-
гуморальных и метаболических сдвигов, лежащих в основе структурно-
функциональных нарушений сердечной мышцы и системы кровообращения
в целом. Не случайно уже на первых этапах интоксикации организма кад-
мием, свинцом, органическими соединениями олова и мышьяка возрастают
концентрация катехоламинов (КА) в крови и уровень их биосинтеза в
надпочечниках [76, 77, 79]. КА способствуют включению двух взаимосвя-
занных между собой механизмов [37]. Первый проявляется ускоренным
вхождением в кардиомиоцит через медленный канал сарколеммы Са2+.
Транспорт Са2+ в клетку регулируется аденилатциклазой, активность кото-
рой при стрессе возрастает. Повышаются уровень цАМФ и содержание
активного кальмодулина (его комплекса с Са2+) — главного активатора фи-
зиологических функций и процессов энергообразования. Действие кальмо-
дулина через ферменты фосфорилирования (протеинкиназы) приводит к
мобилизации гликолиза, ингибированию синтеза гликогена, активации про-
цессов окислительного фосфорилирования за счет повышенного потребле-
ния О2 и расхода АТФ [5].
Второй механизм реализуется на уровне адренергических рецепторов
миокарда и кровеносных сосудов. Установлено [19], что КА в сердце ока-
зывают влияние на проницаемость клеточных мембран, находящихся в
напряжении под влиянием потенциала действия. В частности, под действи-
ем А и НА повышается мембранный потенциал и понижается частота
потенциала действия. Оба эти явления должны уменьшить выход К+, тогда
как ингибиторное действие КА приводит к его росту. Этот эффект опосре-
дован а-адренорецепторами, тогда как Р-рецепторы активируют аденилат-
циклазный механизм. Последний включается также рядом трансмиттеров, в
том числе дофамином. Можно полагать, что дофаминовые рецепторы также
участвуют в активации цАМФ, ибо вызываемое p-рецепторами повышение
ее внутриклеточного уровня невелико. В результате цАМФ активирует про-
теинкиназу, которая в свою очередь катализирует фосфорилирование мем-
ранного белка, регулирующего прохождение ионов через мембрану. Не
меньшее значение имеет при этом и изменение концентрации Са2+ у внут-
ренней поверхности клеточной мембраны. Таким образом, как можно легко
тметить при прослеживании путей клеточной и системной регуляции, оба
еханизма достаточно тесно связаны между собой.
^люстрацией к рассмотренным механизмам кардиотоксичности тяже-
дел Металлов в известной мере могут быть данные, характеризующие опре-
хикЯеМЫе У контак™рующих с Cd рабочих артериальную гипертензию, та-
Од^РДИю и изменения показателей ЭКГ (у 45 % обследованных) [11, 143].
ко в экспериментальных исследованиях таких изменений прослежено
157
% к контролю
аб аб аб аб аб аб аб аб аб аб аб а
12341 2341 234
% к контролю
cd N Cd+N Недели
Рис. 4.1. Динамика показателей ЭКГ при воздействии кадмия, невротизации и
сочетанного действия этих факторов в течение 4 нед.
Cd — кадмий; N — невротизация; Cd+N — сочетанное действие; а — зубец Т; б — расстояние
между зубцами Р н Т на ЭКГ; в — частота сердечных сокращений; г—расстояние меЖДУ
зубцами Р и Q на ЭКГ; д — расстояние между зубцами Q и Т на ЭКГ; е — зубец R на ЭКГ.
158
было. Именно этот аспект требовал проверки в наших эксперименталь-
“С исследованиях.
Н При введении хлорида кадмия белым крысам в течение 4 нед в дозе 0,05
п снижались вольтаж зубцов R и Т, рост отношения Р/Т на ЭКГ,
линение интервалов PQ и QT, тенденция к снижению ЧСС (на 28 %),
toiee четко прослеживаемая к концу опыта (рис. 4.1). Невротизация сопро-
ь ждалась четкими полярными (по отношению к животным, затравленным
Cd) сдвигами примерно той же степени выраженности. В частности, обра-
щали на себя внимание рост вольтажа зубца А на 50 % в первые недели
опыта, укорочение интервалов PQ и QT, повышение ЧСС, стабильное в
течение всего опыта на уровне 140—160 % по отношению к контролю.
Весьма сложная картина наблюдалась при сочетанном воздействии кад-
мия и невротизации: для нее было характерно в общем плане преобладание
показателей, идентичных по направленности с невротизированными живот-
ными, на первых двух неделях опыта. Это особенно четко прослеживалось,
например, при анализе значения ЧСС, вольтажа зубца R, интервала QT.
Введение Cd на фоне невротизации после краткого периода активации
симпатического звена вызывало существенное угнетение всех учитываемых
показателей при выраженном преобладании парасимпатических влияний
над симпатическими (резкий рост Р/Т). Это хорошо согласовывалось и с
данными оценки поведенческих реакций, и с характером динамики выве-
дения КА с мочой у подопытных животных, которые были проанализиро-
ваны при характеристике нейротоксических эффектов кадмия в предыдущем
разделе.
В обычных условиях для компенсирования вышеназванного комплекса
метаболических сдвигов должен срабатывать регуляторный механизм удале-
ния Са2+ из клетки, ингибирования аденилатциклазы и активации фосфо-
диэстераз, приводящих к инактивации цАМФ. Этого не происходит в усло-
виях продолжающегося процесса интоксикации (за счет кумуляции и по-
вторного поступления ионов металл ов-стрессоров), что ведет к дальнейшим
нарушениям ионного баланса (накопление в клетке Са2+ и Na+ при сни-
жении концентрации К+), окислительного фосфорилирования в митохонд-
риях кардиомиоцитов и функционального состояния биомембран. Послед-
нему способствуют липотропные эффекты КА (активация активности липаз,
фосфолипаз и процессов ПОЛ, рост уровня и проявлений детергентного
действия на липиды мембран лизофосфатидов и жирных кислот), а также
гипоксический по своей природе и направленности характер изменений
основных звеньев энергетического обмена (активация анаэробного глико-
лиза, снижение активности ферментов трикарбонового цикла и дыхательной
Цепи, переключение на использование липидов в качестве субстратов энер-
гообмена с активацией процессов свободнорадикального окисления в мио-
Такого рода неспецифические изменения безусловно доминируют в па-
нгенезе кардиотоксического действия тяжелых металлов. Тем не менее
льзя исключать участия в этих процессах и специфических механизмов,
без)еДеЛЯЮЩиХ их токсическое действие как тиоловых ядов. Среди них
Условно ведущими являются такие, как снижение активности ферментов
блокГетИческого обмена (ПВДГ, Г-6-ФДГ, а-КДГ, ИЦДГ, СДГ) вследствие
Ния ^Н-групп, нарушение активного транспорта ионов за счет сниже-
МеталНеРГеТИЧеск°г° потенНиала клетки и конкуренции ионов токсичных
бран Лов с эссенциальными (прежде всего Са2+), возможное прямое мем-
отоксическое действие на кардиомиоциты.
159
Сопоставление механизмов стрессорного (неспецифического) и избира-
тельного (специфического) действия тиоловых ядов на миокард показывает
что они в большинстве своем носят однонаправленный характер и могут
усиливать-взаимные эффекты. Это, например, может быть прослежено на
примере кардиотоксического действия кобальта [53]. Так, из 413 обследо-
ванных рабочих кобальтовых цехов в возрасте до 40 лет у 19 был установлен
диагноз кобальтовой миокардиопатии: тахикардия, снижение ударного ц
минутного объема крови, повышение удельного периферического сопротив-
ления и среднего гемодинамического давления при нормальном систоли-
ческом и диастолическом давлении. На ЭКГ отмечены депрессия сегмента
S—T, сглаженный, двухфазный и отрицательный зубец Т, коронароподоб-
ные изменения зубца 5, признаки гипертрофии левого желудочка. На поли-
кардиограмме — изменения в фазовой структуре сердечного цикла, сниже-
ние сократительной функции миокарда.
Механизм кардиотоксического действия кобальта связывают с наруше-
нием обмена биогенных аминов, метаболизма миокарда вследствие блоки-
рования SH-групп в системе пируватдегидрогеназы. В то же время отмечены
угнетение активности ЛДГ, СДГ, каталазы и цитохромоксидазы, нарушение
фосфорно-кальциевого обмена [23]. Все это позволяет констатировать, что
кардиотоксический синдром может быть одним из ведущих в клинической
картине отравления тяжелыми металлами.
Компенсаторно-приспособительный характер наблюдаемых изменений
проявляется в согласованной в плане общей концепции адаптационного
процесса взаимосвязанной смене преимущественно катаболической и ана-
болической фаз динамики клеточного метаболизма и его нейрогуморальной
регуляции [49].
Вопросы этиопатогенеза артериальной гипертензии у рабочих, контак-
тирующих со свинцом, а также значимости данного фактора в развитии
сердечно-сосудистой патологии у населения до сего времени остаются в
центре внимания исследователей. Это связано прежде всего с наличием
разноплановой статистики, нашедшей отражение в работах Selevan [132],
Cooper [88], Fanning [92], Neri и др. [116], Moller и Kristensen [114] и других
авторов, которая не позволила подтвердить наличие причинно-следственной
связи между этими показателями. Тем не менее доказанность кардиоток-
сичности тяжелых металлов в токсикологическом эксперименте, сложность
вычленения сопутствующих, зачастую разнонаправленно действующих фак-
торов в клинико-эпидемиологических исследованиях, высокая вариабель-
ность показателей индивидуальной чувствительности к тиоловым ядам тре-
буют продолжения исследований в указанном направлении, которое оста-
ется одним из актуальных в профилактической и клинической токсико-
логии.
4.5.3. Нефротоксичность тиоловых ядов
В симптоматике острых поражений ртутью, свинцом и особенно кадми-
ем важное место занимают поражения почек и мочевыводящих путей.
Н.И.Шиманко [80] считает, что с различными по выраженности и функци-
ональной значимости поражениями почек протекают до 70 % острых экзо-
генных отравлений. Среди 400 наблюдавшихся указанным автором больны_
у 50 человек выявлена острая почечная недостаточность, связанная с воз-
действием соединений ртути, у 5 — мышьяка, у 7 — других тяжелых метал
лов.
1КП
Лица с острой почечной недостаточностью токсической этиологии со-
вляют до 20 % среди больных, находящихся на лечении в почечных
СТа тоах. Из 11 000 больных, лечившихся в Центре по лечению отравлений
стцтута скорой помощи им. Н.В.Склифосовского, за 10 лет нефропатия
зличной степени тяжести была обнаружена у 67,9 %, тогда как острая
Р чечная недостаточность — у 8,5 % пострадавших. В то же время среди
П пиентов с отравлениями соединениями мышьяка и тяжелых металлов
ПеФР°патиЯ выявлена у 55 % и острая почечная недостаточность — у 32,4 %
больных. Эти данные позволяют сделать важный вывод о том, что токси-
ческие нефропатии при рассматриваемом виде отравлений встречаются не
пеже чем при других видах патологии химической этиологии. Кроме того,
они в 3,8 раза чаще осложняются острой почечной недостаточностью.
Острые отравления чаще всего приводят к развитию острой почечной
недостаточности или острой токсической нефропатии (ОТН), под которой
понимают возникновение внезапных нарушений функции почек по обеспечению
водно-электролитного баланса, кислотно-основного состояния, нормотонии,
эритропоэза и выведения продуктов азотистого обмена. Наряду с комплексом
функциональных нарушений имеет место развитие морфологических изменений
в паренхиме почек, чаще всего типа некронефроза.
Тяжелое клиническое течение и высокая летальность при такого рода
осложениях острых отравлений связаны с рядом причин: сочетанным нару-
шением функций почек и печени, сопутствующим поражением ССС,
гемо- и лимфодинамики в паренхиматозных органах, одновременным
вовлечением в процесс других органов и систем, прежде всего ЦНС и
системы крови. Это положение еще раз подчеркивает условность выделе-
ния органных и системных синдромов в патогенезе отравлений тиоловы-
ми ядами, которое несет также специальную нагрузку, позволяя выделять
особенности в действии конкретных ядов в пределах одной группы токсич-
ных веществ.
Для 20 металлов и их солей (барий, бериллий, бор, висмут, вольфрам,
железо, золото, йод, кадмий, молибден, мышьяк, медь, ртуть, свинец, се-
ребро, сурьма, таллий, уран, хром) доказано наличие нефротоксических
эффектов. Их список можно было бы продолжить. При этом в ряде случаев
имеет место специфическое избирательное воздействие (ртуть, мышьяк,
кадмий). Эти вещества оказывают влияние непосредственно на почечную
ткань, что, с одной стороны, объясняется повышенной осмолярностью
почечной ткани и в связи с этим высокой концентрацией токсичного
вещества в почках. При отравлении сулемой, медным купоросом содержание
их в почках во много раз превосходит таковое в других органах. В течение
первых 48 ч после отравления с мочой экскретируется до 80—90 % ртутного
препарата. Именно прямым воздействием на эпителий почечных канальцев
° ъясняют некротическое действие выводимых почками тяжелых металлов.
Другой стороны, эти вещества воздействуют на метаболизм почечной
ни, вступая в соединение с тиоловыми группами ферментов. Этим
чтоСМ °НИ 8ызывают Деструкцию клеточных структур (митохондрий, ядер),
почк^еЖИТ В основе нарушения энергетического и других видов обмена в
ВиемДНаК° В клиническ°й практике ОТН нередко наблюдается под дейст-
случ Химических веществ, не обладающих такого рода тропизмом. В этих
Нал аях Развитие почечной недостаточности может быть связано с прере-
ными поражениями (шок, резкое снижение кровяного давления, умень-
161
шение объема циркулирующей крови, гемолиз и миолиз), а также аллерген
ними механизмами.
Для отравлений большими дозами тяжелых металлов и мышьяка харак
терно развитие токсического либо (менее вероятно) болевого шока. Имени"
этот синдром лежит в основе нарушений почечного кровообращения и
гемодинамики, которые вначале протекают с явлениями относительной (де.
локирование крови), а потом и абсолютной (нарушение проницаемости
сосудов) гиповолемии, что вместе с истощением нервной регуляции приво-
дит к падению артериального давления, кровотока в почках и нарушению
периферической циркуляции крови. Если общий объем циркулирующей
крови уменьшается в 2 раза, то его протекание через почки уменьшается в
30 раз. Это вызывает резкое снижение клубочковой фильтрации и раз-
витие канальцевой анурической нефропатии. Помимо гемодинамических
расстройств, при образовании шоковой почки важную роль играет повыше-
ние внутрипочечного давления в связи с замедлением и стазом крови, а
также повышением проницаемости сосудов медуллярной и юкстамедулляр-
ной зон. Гипоксия почек возникает не только как результат гипотензии
свойственной торпидной фазе шока, но и вследствие рефлекторного спазма
почечных сосудов, ведущего к дистрофическим и некробиотическим изме-
нениям в почечных канальцах.
Е.М.Тареев [55], указывая на резкое снижение почечной микроциркуля-
ции в результате длительного спазма преартериол и артериовенозного шун-
тирования при затяжном шоке (шоковый статус), считал, что “организм
приносит при этом в жертву в первую очередь почки для сохранения
центральной церебрально-коронарной гемодинамики”. Наличие определен-
ного “ранжирования” при критическом состоянии физиологических функ-
ций неоднократно рассматривалось позже и другими авторами. Об этом
свидетельствует и наличие рефлекторного спазма артерий коры почек, рас-
крытие артериовенозных анастомозов, позволяющее осуществлять сброс ос-
новной массы крови по юкстамедуллярному пути (шунт Труэта). Механи-
ческая блокада канальцев сочетается с их закупоркой слущивающимся эпи-
телием и пигментными цилиндрами вследствие отека интерстиция в усло-
виях ацидоза, гиповолемии, дегидратации и гипоксии.
Таким образом, в патогенезе ОТН преобладают полиэтиологические
механизмы, включающие локальные почечные и системные элементы. В со-
вокупности они формируют и клиническую картину, и синдромы острых
интоксикаций тиоловыми ядами, в том числе и токсической нефропатии.
Острая почечная недостаточность как тяжелая степень нефропатии всег-
да развивается на фоне уже выраженной клинической картины отравления.
Независимо от этиологического фактора в ее клинической картине разли-
чают четыре стадии:
I — начальная шоковая, или фаза агрессии, с преобладанием нервно-
рефлекторных явлений;
II — олигоанурическая стадия;
III — стадия полиурии или восстановления диуреза;
IV — выздоровление.
Шоковая стадия проявляется остро ознобом, гиперемией лица, сменяю-
щейся цианозом, повышением температуры тела, болью в пояснице, за
грудиной, кашлем, поверхностным дыханием, тошнотой, рвотой и С°ПР°"
вождается вазоконстрикцией с блокадой почечного кровообращения. Хар
ктерным симптомом являются снижение диуреза, протеинурия, гематури
(лейкоциты и эритроциты в моче). Состояние больного зависит не о
162
ени уремической интоксикации, а от вида токсиканта, дозы, степени
поражения других органов.
П° Стадия II развивается чаще через 1—2 сут после отравления и характе-
ся резким падением функциональной активности почек. Суточное
Р ичество мочи снижается до 50—100 мл. Это постоянный и доминирую-
щий признак острой почечной недостаточности. Стадия может длиться от
Ш скольких часов до нескольких недель. Нарушение азотистого, водно-
неектролитного обмена, кислотно-основного баланса сочетается с синдро-
Эами поражения ЦНС, сердечно-сосудистой и дыхательной систем, гемо-
поэза Классическое течение уремии в настоящее время при активной те-
рапии наблюдается исключительно редко.
р Первичные признаки поражения ЦНС сводятся к астении, головной
боли, редко судорогам и сухожильным подергиваниям. Больные сонливы,
заторможены, при гипогидратации возможны беспокойство, нарушения
психики.
Сердечно-сосудистые осложнения наблюдались у 49 % больных [80].
Возрастание минутного объема сердца, венозная гипертония могут расце-
ниваться как признаки правожелудочковой недостаточности. Но наиболее
опасен синдром по типу легочного сердца, сходный также с эмболией
легочной артерии в олигоанурической фазе ОТН, возникшей в результате
отравления.
Особую опасность в этом периоде острой почечной недостаточности
представляют инфекционные осложнения, причем пневмонии и трахео-
бронхиты дают до 40 % летальных исходов. Они осложняются развитием
отека легких, который может возникать самостоятельно уже в первые дни
после отравления. Бедность клинических признаков может компенсировать-
ся рентгенологической картиной. В основе такого контраста лежит быстрое
изменение осмотического градиента в тех отделах легких, которые обеспе-
чивают выделительную функцию слизисто-белковых желез бронхиального
дерева. Выпота в альвеолы не происходит, что не создает предпосылок для
возникновения хрипов.
Период олигурии при ОТН сопровождается гипохромной анемией, ко-
торая обусловливается не только внутрисосудистым гемолизом, но и сис-
темными нарушениями гемопоэза в результате специфического поражения
костного мозга, а также действия продуктов азотистого обмена. Развитию
геморрагий способствуют токсический гепатит и уремический гастроэнте-
рит.
Накопление продуктов метаболизма, в частности белкового катаболизма,
лежит в основе гипертермии. Рост содержания мочевины в среднем на
> ~0,7 г/л в сутки при этом чрезвычайно показателен и информативен,
ем не менее при поражении печени степень накопления мочевины может
Ыть и небольшой.
ее б^адерЖка ВОДЫ в организме обусловлена блокадой почечной функции, а
гид ЭЛанс опРеДеляется соотношением дегидратации (рвота, понос) и гипер-
"Дратации (задержка натрия, клеточный и тканевый катаболизм, введение
идкостей с терапевтической целью).
и КалСЛИ Почки единодушно признаются критическим органом при ртутных
ленн МИеВЫХ отРавлениях, то большая часть также преимущественно накоп-
зован Г° В почках неорганического свинца находится в пузырьковых обра-
Функп ЯХ’ КОТоРые выполняют по отношению к этому токсиканту защитную
Чию. Острое ртутное отравление характеризуется триадой симптомов:
«•
163
олигурия, тубулярный некроз, острая сердечная недостаточность. Проявл
ния нефропатии при продолжающемся воздействии малых доз перевод6'
патологию в вяло текущий интерстициальный нефрит с прогрессивно на
растающим фиброзом и гломерулярным склерозом. Протеинурия (низкомо-
лекулярные белки в моче) служит интегральным проявлением вяло текущего
патологического процесса, который при ртутной интоксикации связан с
явлениями нефроза, а при кадмиевой — нефрита. Из других признаков этого
плана следует указать на глюкозурию, аминоацидурию и гиперкальцийурию
Последнее особенно характерно также для свинцовых отравлений в связи с
мобилизацией Са2+ из тканевых депо.
Материалы клинических наблюдений согласуются с данными экспери-
ментальных исследований. Во-первых, в цитированной литературе имеется
множество указаний на преимущественное накопление Hg2+ в тканях почек
(для органических соединений статистика несколько отлична). Так, при
введении крысам повторно CdCl2 в дозах 2,7 и 200 мг/кг показано, что
кумуляция Cd в печени и почках зависит от времени воздействия [121].
Особенно существенное повышение концентраций иона Cd наблюдалось в
корковом слое почек (по сравнению с мозговым и почечной лоханкой)
независимо от вводимой дозы. Морфологические изменения отмечены так-
же в проксимальных и дистальных мочевых канальцах. Имеются веские
доказательства, что кадмий-металлотионеиновый комплекс в почечной тка-
ни обладает повреждающим действием [86, 121]. Дистрофические явления
в почечной ткани обусловлены в том числе и окислительным стрессом. Уста-
новлено образование Н2О2 инкубированными in vitro митохондриями коры
почек крыс в присутствии HgCl2 (12 нмоль/мг белка) до 0,34 нмоль/(мин-мг)
[ПО]. В присутствии 15 нмоль/мг HgCl2 образование МДА росло при ис-
пользовании в качестве субстрата смеси малата и глутамата (с 7 до 22 нмоль
за 30 мин на 1 мг белка). Полученные данные указывают на важную роль
накопления Н2О2 и стимуляции ПОЛ в нефротоксическом действии Hg2+.
Хроническое воздействие закиси кобальта на крыс (20 мг/кг) вызывало
некроз эпителия извитых канальцев, дегенеративные изменения эпителия
прямых канальцев и его жировую дистрофию [23].
Приведенные в настоящем разделе данные показывают, что нефротичес-
кий синдром занимает важное место в патогенезе острых и хронических
отравлений тяжелыми металлами. Это определяется преимущественной ма-
териальной кумуляцией указанных токсикантов в эпителиальных клетках
мочевыделительной системы, наличием вторичных эффектов со стороны
почек типа мочекаменной болезни в связи с нарушением электролитного
баланса в организме, ухудшением условий для реабсорбции белка в парен-
химе почек и почечных канальцах, где отмечаются дистрофические морфо-
функциональные сдвиги, а также сопутствующие изменения в печени.
Активный клинико-лабораторный скрининг почек и всей мочевыделительнои
системы при подозрении на отравление тяжелыми металлами является обя-
зательным.
Как правило, его симптоматика и клиническое течение взаимосвязаны
и во многом определяются функциональным состоянием и степенью нарУ'
шений, происходящих в сердечно-сосудистой, дыхательной системах, желУ
дочно-кишечном тракте и особенно в печени, что необходимо учитывать
при определении стратегии и тактики в осуществлении комплекса лечебны
мероприятий.
164
4 5 4. Гепатотоксичность тиоловых ядов
Нарушение морфофункциональной целости гепатобилиарно-панкреати-
ого комплекса является одним из интегральных патогенетических ме-
чеСцЗМов в токсическом действии тиоловых ядов. Это определяется их
хаНсобностью связывать сульфгидрильные группы белков, замещать Са+2 и
£,+2 в беЛКах, липидах и других биологически активных соединениях. Не
^Пучайно в большинстве руководств по клинической токсикологии не толь-
СЛ подчеркиваются пестрота синдромов и полиорганный характер пораже-
К°йй тяжелыми металлами и мышьяком, но и отводится должное место
печеночной недостаточности как постоянному симптомокомплексу уже в
ранний период развития интоксикаций [12, 32, 108, 109]. Иногда при остром
отравлении соединениями мышьяка и солями тяжелых металлов клиничес-
кая картина характеризуется преимущественно признаками поражения пе-
чени с типичными проявлениями токсического гепатита. Болезненность в
правом подреберье, набухание печени сочетаются с положительной прямой
реакцией на билирубин и появлением желчных пигментов в моче. В рвотных
массах наблюдаются примеси крови и желчи. При пероральном отравлении
препаратами ртути преобладают атрофические изменения паренхимы пече-
ни, а солями железа (например, сульфат двухвалентного железа) — некроз
печени и печеночная кома. Повышение общего азота и азота мочевины
манифестирует нарушение процессов синтеза белка в печени и нарушение
углеводного обмена: рост сахара, пирувата и лактата в крови. Происходит сдвиг
кислотно-основного состояния (метаболический ацидоз) и развивается водно-
электролитный дисбаланс. Нарушаются также дезинтоксикационная и экскре-
торная функции печени. Особенно тяжело, с крайне неблагоприятным ис-
ходом протекает сочетанная почечно-печеночная недостаточность.
Ионы тяжелых металлов проникают в гепатоциты путем эндоцитоза-эк-
зоцитоза и в меньшей степени в результате диффузии. Будучи преимущест-
венно связанными в кровяном циркуляторном русле с низкомолекулярными
транспортными белками (металлотионеины, трансферрин, ферритин, церу-
лоплазмин), тиоловые яды подвергаются одному из трех видов эндоцитоза:
пиноцитозу, адсорбции либо связыванию рецепторами. Затем эндоцитозные
пузырьки передают свое содержимое лизосомам и аппарату Гольджи, где
они метаболизируются и выделяются в желчь [16].
Углубленные исследования механизмов транспорта тяжелых металлов
через плазматическую мембрану гепатоцитов стали возможны на моделях с
изолированными клетками печени [139]. Стационарная концентрация ксе-
нобиотика в клетке печени определяется соотношением скорости протека-
ния таких процессов, как транспорт ксенобиотика через плазматическую
Мембрану из внеклеточной среды в клетку; метаболические превращения
вещества в клетке; его связывание с мембранными и внутриклеточными
компонентами; экскреция вещества из клетки. Такое многообразие породи-
° определенные трудности в экспериментальных исследованиях. И только
Рименение изолированных гепатоцитов позволило, в частности, обнару-
жь несколько систем переноса тяжелых металлов. Одна из них ингибиру-
теоЯ азидом’ Цианидом и олигомицином, зависит от температуры и харак-
сиРнИЗУеТСЯ насыШением. Другая специализированная система стимулируется
Этическими аналогами стероидных гормонов (дексаметазон), которые в
кагоЧИе °Т коРтизона и гидрокортизона в присутствии инсулина или глю-
от сНа осУЩествляют трансмембранный перенос цинка. Кадмий независимо
тов ОСТояния окислительного фосфорилирования в митохондриях гепатоци-
поглощается двухфазно: вначале (10—15 мин) идет быстрое, а потом
165
медленное поглощение. Именно во второй фазе происходит внутриклеточ
ное связывание кадмия металлотионеинами (предварительная индукци'
этих белков введением животным хлорида цинка приводила к усилению
аккумуляции кадмия в клетках печени), тогда как первая фаза определяется
диффузионными процессами [139].
Картина поражения печени конкретными металлами характеризуется
рядом особенностей. Так, при отравлении людей цинком и его соединения-
ми увеличивается печень, появляются сахар и уробилин в моче, развиваются
гипогликемия, гиперхолестеринемия, нарушаются практически все функции
печени и поджелудочной железы [28].
Кадмий вызывает угнетение ряда ферментных систем печени, нарушение
метаболизма эссенциальных микроэлементов. Для него характерны жировая
инфильтрация гепатоцитов, увеличение, жировая дегенерация печени и под-
желудочной железы. Независимо от формы введения, доз и сроков экспозиции
накопление Cd2+ в почках превосходит его содержание в печени, а проявления
нефротоксичности более значительные, чем гепатотоксичности [10].
Неорганические соединения ртути при острых интоксикациях преиму-
щественно вызывают атрофические изменения печени, тогда как для хро-
нических отравлений характерны дистрофия и очаги некроза в печени,
нарушение всех ее метаболических и антитоксической функций [60]. Орга-
нические соединения вызывают дегенеративные изменения в печени [62].
Поражения печени при свинцовых отравлениях протекают с нарушением
пигментной, углеводной, антитоксической, белковообразовательной и жи-
ровой функций. Отмечаются активности аспартат- и аланинаминотрансфе-
раз. Гипербилирубинемия при действии свинца имеет в своей основе нару-
шение активности трансаминаз микросом гепатоцитов, их дистрофические
изменения [102].
Марганец поражает гепатобилиарную систему, вызывает нарушения об-
мена Са, диспротеинемию, вакуольное перерождение гепатоцитов, наруше-
ния витаминного обмена (в первую очередь В]), нарушение практически
всех функций печени [35].
Указанные особенности в патогенезе отравлений различными тиоловыми
ядами следует учитывать при диагностике и лечении отравлений.
4.6. Общие принципы лечения отравлений
тиоловыми ядами
Клинические формы отравления, интеркуррентные заболевания у людей,
контактирующих на производстве и в быту с тяжелыми металлами, конта-
минация одежды, кожных покровов, рабочих мест и других элементов среды
обитания человека, установление факта носительства по результатам прове-
денных по любому поводу исследований — все это должно служить основа-
нием для экстренной врачебной консультации, клинико-лабораторного об-
следования и проведения курса детоксикации организма.
Под детоксикацией обычно понимают прекращение воздействия токси-
ческих веществ и их удаление из организма [12, 32, 34]. Большинство
методов искусственной детоксикации организма включает разведение, Диа;
лиз и сорбцию, которые наряду с антидотной терапией и мобилизацией
защитных систем организма охватывают практически все пути и способы
борьбы с тиоловыми ядами, вызываемыми ими нарушениями в организме,
а также с осложнениями и последствиями контакта с ядом и его пребыва-
нием в организме.
166
1
Исходя из этиопатогенетических особенностей тиоловых ядов, наличия
ительно доказанной избирательной токсичности, сочетающейся с об-
убеД ддЯ окислительного стресса, гипоксии механизмами повреждающего
Ш1“Мтвия, нет необходимости приводить имеющиеся в учебно-методической
^правочной литературе материалы по конкретным, частным лечебно-про-
1 Фактическим мероприятиям, а следует лишь указать на принципиальные
зииии в комплексной терапии отравлений, вытекающие из обобщенной
п тогеНетической концепции лечения отравлений мышьяком и тяжелыми
П таллами. Они могут быть приняты за основу таких мероприятий не только
выраженных клинических проявлениях острых и хронических отравле-
ний но и при установлении отдельных симптомов и симптомокомплексов
V лиц, имеющих производственный, бытовой или случайный контакт с
такого' рода ядами, а также зафиксированных лабораторно случаях носи-
тельства и его микропризнаках.
Ведущим элементом детоксикации организма служит антидотная тера-
пия, поэтому положительное применение унитиола оказывает лечебный
эффект и одновременно подтверждает клинический диагноз.
Перитонеальный диализ, гемодиализ, ультра- и гемофильтрация, гемо-
и энтеросорбция наиболее активны для удаления из организма низкомоле-
кулярных веществ, в том числе и тяжелых металлов. Они хорошо сочетаются
со способами разведения, снижения концентрации яда в биологических
жидкостях организма за счет использования инфузионных средств, плазмо-
замещающих препаратов и переливания крови.
Усиление естественных процессов очищения организма включает про-
мывание желудка, применение рвотных и слабительных средств, электро-
стимуляции кишечника вместе с водно-электролитной нагрузкой, осмоти-
ческим и салуретическим диурезом.
Применение препаратов, подавляющих нерегулируемые очаги возбужде-
ния в коре головного мозга и преобладающие симпатические либо парасим-
патические влияния; регулирующих ферментативные процессы; стимулиру-
ющих защитные метаболические системы, включая применение микроэле-
ментов-антагонистов, витаминов является обязательной составной частью
комплексной терапии отравлений.
Представленная схема добавляется и изменяется симптоматическими
средствами, соответствующими виду и степени изменения различных функ-
ций, выраженности проявлений конкретных симптомов, общему функцио-
нальному состоянию больного.
ЛИТЕРАТУРА
1- Альберт А. Избирательная токсичность. Физико-химические основы терапии:
Чер. с англ. В 2 томах. — М.: Медицина, 1989. — Т.1. — С. 56—69.
2
Ангеличи Р.Дж. Устойчивость координационных соединений. — В кн.: Неорга-
ническая биохимия. - М.: Мир, 1978. -Т. 1. — С. 89-132.
Архангельский В.И. Вопросы гигиены труда в промышленной токсикологии
роизводства и применения оловоорганических соединений: Автореф. канд.
Дне. - м„ 1976. - 19 с.
5абе«к0 Г.А. О взаимодействии микроэлементов в обмене веществ. — В кн.:
икроэлементы в медицине: Материалы 1-й Всесоюзн. научн. конф. — Ивано-
5 фРанковск, 1969.-С. 185-187.
Бужурина И.М., Панов М.А. Механизмы формирования клеточного ответа на
167
внешние воздействия. — В кн.: Общие проблемы физико-химической биолог,
(Итоги науки и техники. ВИНИТИ АН СССР). — М., 1986. — Вып. 3. — 258
6. Букингем Д.А. Структура и стереохимия координационных соединений. — В кн •
Неорганическая биохимия. — М.: Мир, 1978.—Т. 1. —С. 17—88.
7. Бурлакова Е.Б., Конрадов А.А., Худяков И.В. Воздействие химических агентов в
сверхмалых дозах на биологические объекты//Известия АН СССР. Серия био-
логическая. — 1990. — № 2. — С. 184—193.
8. Верин Г.С. Про кардютоксичну д!ю тюлових отрут//Ф1зюл. ж. АН УРСР _
1971. — № 1.- С. 107-109.
9. Владимиров Ю.А., Арчаков А.И. Перекисное окисление липидов в биологических
мембранах. — М.: Наука, 1972. — 252 с.
10. Воробьева Р.С. Кадмий. — М.: МРПТХВ, 1985. — Вып. 69. — 58 с.
11. Воробьева Р.С., Еремеева Е.П. Состояние сердечно-сосудистой системы у рабо-
чих, контактирующих с кадмием//Гиг. и сан. — 1980. — № 10. — С. 22—25.
12. Ганжара П.С., Новиков А.А. Учебное пособие по клинической токсикологии. —
М.: Медицина, 1979. — 336 с.
13. Герасимяк Г.Р. Изучение нейротоксичности б«с(три-п-бутилолово)оксида как
основа его гигиенической регламентации: Автореф. канд. дис. — Одесса, 1993 —
17 с.
14. Герасимяк Г.Р., Розанов В.А., Шафран Л.М. Изучение влияния б«с(п-трибутило-
лова)-оксида на ГАМК-ергическую систему мозга in vitroZ/Укр. биохим. журн. —
Киев, 1994. - Т. 66. - № 2. - С. 71-79.
15. Гольдштейн Б.И. Тиоловые группы тканевых белков. Их химические свойства и
биологическое значение. — В кн.: Тиоловые соединения в медицине. Труды
научн. конф. —Киев, 16—19 декабря 1957 г. — Киев: Госмедизд. УССР, 1959. —
С. 49-52.
16. Гулак П.В., Дудченко А.М., Зайцев В.В. и др. Гепатоцит: функционально-метабо-
лические свойства. — М.: Наука, 1985. — 272 с.
17. Давлетов Э.Г О механизме гемолитического действия тяжелых металлов//Ци-
тология. — 1974. — Т. 16, № 5. — С. 648—651.
18. Давыдовский И.В. Общая патология человека. Патогенез. — М.: Медицина,
1969. - С. 30-37.
19. Дженкинсон Д.Х., Хейлетт Д. Дж., Коллер К. Влияние катехоламинов на ионную
проницаемость клеточных мембран. — В кн.: Рецепторы клеточных мембран для
лекарств и гормонов: междисциплинарный подход/Под ред. Р.У. Штрауба,
Л.Болис. — М.: Медицина, 1983. — 368 с.
20. Зигель X. Некоторые вопросы токсичности ионов металлов. Предисловие: Пер.
с англ./Под ред. Х.Зигеля, А.Зигель. — М.: Мир, 1993. — С. 7—9.
21. Ицкова А.И. Никель и его соединения. — М.: МРПТХВ, 1984. — 40 с.
22. Каган В.Е. Механизмы структурно-функциональной модификации биомембран
при перекисном окислении липидов: Автореф. докт. дис. — М.: 1981. — 48 с.
23. Каган В.Ю., Петухова Е.В. Кобальт. — М.: МРПТХВ, 1986. — Вып. 100. — 51 с'
24. Квитницкий-Рыжов Ю Н. Современные представления о нейротоксичности//
Фармакол. и токсикол. — 1990. — Т. 53, № 4. — С. 77—82.
25. Керимов Б.Ф., Алиев С.А. Глутатионовая защитная система в различных сТРУ^’
турах головного мозга при голодании//Укр. биохим. журн. — 1991. — Т. б-’’
№ 5. - С. 62-67.
168
26.
27.
28.
КрптисД-Р- Аминокислотные нейромедиаторы//Фармакол. и токсикол. — 1989. —
-р 52, № 6. — С. 4—18.
Козловский В.М. Эндогенные факторы нейродеструкции. Фармакологические
асПекты//Фармакол. и токсикол. — 1990. — Т. 53, № 5. — С. 7—13.
Коломийцева М.Г., Габович Р.Д. Микроэлементы в медицине. — М.: Медицина,
1970. — 288 с.
Кундиев Ю.И. Предисловие. — В кн.: Химические факторы производственной
™ среды и сердечно-сосудистая система/Под ред. И.М.Трахтенберга, Э.А.Бабаяна. —
Ереван: Айастан, 1992. — С. 3—6.
30 Ленинджер А. Основы биохимии. — М.: Мир, 1985. — Т. 2. — С. 498—500.
31 Добуренко А.П. Обоснование гигиенических регламентов, обеспечивающих без-
опасность применения судовых мышьяксодержащих необрастающих красок:
Автореф. дис. ... канд. мед. наук. — Киев, 1990. — 23 с.
32. Лужников Е.А. Клиническая токсикология. — М.: Медицина, 1999. — 368 с.
33. Лужников Е.А., Дагаев В.Н. Особенности лечения терминальных состояний при
острых отравлениях. — В кн.: Основы реаниматологии/Под ред. В.А.Неговско-
го. — М.: Медицина, 1966. — С. 329—349.
34. Лужников Е.А., Костомарова Л.Г. Острые отравления: Руководство для врачей. —
М.: Медицина, 2000. — 432 с.
35. Мартин Р. Бионеорганическая химия токсичных ионов металлов. — В кн.: Не-
которые вопросы токсичности ионов металлов: Пер. с англ./Под ред. Х.Зигеля,
А.Зигель. — М.: Мир, 1993. — С. 25—61.
36. Меерсон Ф.З. Адаптация, стресс и профилактика. — М.: Наука, 1981. — 278 с.
37. Меерсон Ф.З. Патогенез и предупреждение стрессорных и ишемических повреж-
дений сердца. — М.: Медицина, 1984. — 272 с.
38. Мецлер Д. Биохимия. — М.: Мир, 1980. — Т. 1—2. — 582 с.
39. Микроэлементозы человека: этиология, классификация, органопатология/
А.П.Авцын, А.А.Жаворонков, М.А.Риш, Л.С.Строчкова; АМН СССР. — М.: Ме-
дицина, 1991. - С. 361-385.
40. Милков Л.Е., Думкин В.Н. Профессиональные заболевания с преимущественным
поражением нервной системы: Руководство по профессиональным заболевани-
ям/Под ред. Н.Ф.Измерова. — М.: Медицина, 1983.— Т. 1. — С. 151—213.
41. Орлов С.Н. Кальмодулин. — В кн.: Итоги науки и техники. Серия: Общие
проблемы физико-химической биологии. — М., 1987. — Т. 8. — 78 с.
42. Пиотровски Е. Использование кинетики метаболизма и выведения токсичес-
ких веществ в решении проблем промышленной токсикологии. — М., 1976. —
43.
44.
45.
46.
Q0l^0e^u“ Мембранотоксины//Вестн. АМН СССР. — 1976. — № 9. —
Прихожан А. В. Нейроанатомия и нейрохимия возбуждающей аминокислотной
передачи. — В кн.: Итоги науки и техники. Серия: Физиология человека и
животных. - М., 1989. - Т. 36. - С. 6-24.
Розанов В.А., Шафран Л.М. Основные проявления и механизмы нейротоксич-
с°<=™ оловоорганических соединений//Нейрохимия. — 1991. — Т. 10, № 1—2. —
руководство по профессиональным заболеваниям/Под ред. Н.Ф.Измерова. —
Медицина, 1983. - Т. 1.- 320 с.
169
47. Сенкевич Н.А., Рашевская А.М. Профессиональные заболевания, обусловлены
воздействием некоторых металлов и их соединений: Руководство по профеСсЫе
ональным заболеваниям. — М.: Медицина, 1983. — Т. 1. — С. 296—310. и"
48. Сергеев П.В., Шимановский Н.Л. Рецепторы физиологически активных вешестп
М.: Медицина, 1987. — 400 с. '"
49. Соколов Е.И., Белова Е.В. Эмоции и патология сердца. — М.: Наука 19Яя
С. 98-100. ’
50. Соловьев В.Н. Кинетические процессы в биологической системе. — В кн.: Соло
вьев В.Н., Фирсов А.Л., Филов В.А Фармакокинетика. — М.: Медицина 19R0
С. 8-86.
51. Спозито Г. Распределение потенциально опасных следов металлов. — В кн
Некоторые вопросы токсичности ионов металлов: Пер. с англ./Под ред. Х.Зи-
геля, А.Зигель. — М.: Мир, 1993. — С. 9—24.
52. Справочник по элементарной химии/А.Т.Пилипенко, В.Я.Починок, И.ПСеоепа
и др. - Киев, 1977. - С. 27. ’ Р
53. Суворов КМ. Кобальтовые миокардиопатии в клинике профессиональных забо-
леваний//Клин. мед. — 1978. — № 10. — С. 58—63.
54. Сытинский И.А. Гамма-аминомасляная кислота — медиатор торможения. — Л.:
Наука, 1977. — 139 с.
55. Тареев Е.М. Острая почечная недостаточность//Сов. мед. — 1973. — № Ю —
С. 39-46.
56. Ташмухамедов Б.А., Усманов П.Б. Нейротоксины в исследовании биологических
мембран. — М.: Высшая школа, 1991. — 112 с.
57. Тиунов Л.А. Биохимические механизмы токсичности. — В кн.: Голиков С.Н.,
Саноцкий И.В., Тиунов Л.А. Общие механизмы токсического действия/АМН
СССР. — Л.: Медицина, 1986. — С. 114—204.
58. Торчинский Ю.М. Сера в белках. — М.: Наука, 1977. — 303 с.
59. Трахтенберг И.М. Проблема сердечно-сосудистой патологии химического ге-
неза. — В кн.: Профилактическая токсикология. — М.: ЦМП, ГКНТ, 1984.—
С. 233-244.
60. Трахтенберг И.М. Хроническое воздействие ртути на организм. — Киев: Здоро-
в’я, 1969. - 392 с.
61. Трахтенберг И.М., Колесников В. С., Луковенко В.П. Тяжелые металлы во внеш-
ней среде: Современные гигиенические и токсикологические аспекты.—
Минск: Навука i тэхн1ка, 1994. — 285 с.
62. Трахтенберг И.М., Коршун М.Н. Органические соединения ртути. — М-
МРПТХВ, 1989. - Вып. 117. - 69 с.
63. Трахтенберг И.М., Сова Р.Е., Шефтель В. О. и др. Проблема нормы в токсико-
логии (современные представления и методические подходы, основные пара-
метры и константы). — М.: Медицина, 1991. — 208 с.
64. Трахтенберг И.М., Тычинин В.А., Верич Т.Е. Принципы и методы эксперимен-
тальной оценки влияния промышленных ядов на ССС//Гиг. труда. — Киев.
Здоровье, 1978. — Вып. 14. — С. 74—90.
65. Трахтенберг И.М., Тычинин В.А., Верич Т.Е. и др. Экспериментальные данные
о кардиовазотоксическом действии вредных химических веществ. — В 1<н”
Химические факторы производственной среды и сердечно-сосудистая систе-
ма/Под ред. И.М.Трахтенберга, Э.А.Бабаяна. — Ереван: Айастан, 1992. — С. 38"
170
66.
67.
68.
69.
Трошин А.С. Распределение веществ между клеткой и средой. — Л.: Наука, 1985. —
192 с.
Ускоренная оценка действия химических веществ на сердечно-сосудистую сис-
tpmv в эксперименте с целью гигиенического нормирования: Методические
указания. - № 4546-87. - М, 1988. - 16 с.
филов В.А. Токсикокинетика. — В кн.: Соловьев В.Н., Фирсов А.А., Филов В.А.
фармакокинетика. — М.: Медицина, 1980. — С. 315—396.
феимэн Г.К. Комплексы металлов с аминокислотами и пептидами. Неоргани-
ческая биохимия. — М.: Мир, 1978. — Т. 1. — С. 151—204.
70 Фролова А.Д. Гигиеническое регламентирование металлов на основе механизмов
их повреждающего действия (к проблеме ускоренного и группового регламен-
тирования): Автореф. докт. дис. — Л., 1990. — 42 с.
71 Хухо Ф. Нейрохимия: Основы и принципы. — М.: Мир, 1990. — 384 с.
72 Хэммонд П.Б., Фолкс Э.К. Токсичность иона металла в организме человека и
животных. — В кн.: Некоторые вопросы токсичности ионов металлов: Пер. с
англ./Под ред. Х.Зигеля, А.Зигель. — М.: Мир, 1993. — С. 131 — 165.
73. Чекунова М.П., Минкина Н.А., Суворов И.М., Чекоданова Н.В. Действие тяжелых
металлов на сердечную мышцу//Гиг. труда и профзабол. — 1983. — № 5. —
С. 22-25.
74. Чекунова М.П., Фролова А.Д., Минкина Н.А. О прогнозировании кардиотокси-
ческого действия металлов//Гиг. и сан. — 1986. — № 7. — С. 29—30.
75. Черкес А.И. Тиоловые соединения в антидотной терапии интоксикаций. — В кн.:
Тиоловые соединения в медицине: Труды научн. конф. Киев, 16—19 декабря
1957 г. - Киев: Госмедизд. УССР, 1959. - С. 101-110.
76. Шафран Л.М., Бормусова Э.А., Шафран К.Л. Экогигиена и токсикология кадмия
в урбанизированном комплексе. — В кн.: Экология городов и рекреационных
зон: Материалы международной научно-практической конференции. 25—26
июня 1998 г. Одесса. — Одесса: Агропринт, 1998. — С. 180—184.
77. Шафран Л.М., Нейжмакова Н.А., Розанов В.А. и др. Нормирование олово- и
медьсодержащих биоцидов необрастающих красок для воздуха рабочей зоны. —
В кн.: Актуальные проблемы медицины транспорта: Тез. докладов Украинской
межведомственной научн.-практ. конф. 22—24 сентября 1993 г., Одесса. — Одес-
са, 1993.-Т. II.-С. 405.
78. Шафран Л.М., Чумаченко Р.М., Юшина Е.Ф., Любимов Ю.Г. Исследование неко-
торых механизмов биологического действия мышьякорганических компонентов
синтетических необрастающих красок. — В кн.: Актуальные вопросы санитар-
ной химии и токсикологии синтетических материалов судостроительного назна-
чения. - Л.: ЦНИИ “Румб”, 1982. - С. 96-97.
79. Шафран Л.М., Шафран К.Л., Потапов Е.А. и др. Свинец в проблеме питьевой
воды и охраны здоровья населения. — В кн.: Вода и здоровье — 98: Материалы
Международной научн.-практ. конф. 15—18 сентября 1998 г., Одесса. — Одесса,
*998. - С. 56-60.
Щиманко ИИ. Поражение почек при острых экзогенных отравлениях. — М.:
Медицина, 1977. - 208 с.
82 Эйхгорн Г. Неорганическая биохимия. — М.: Мир, 1978. — Т. 1. — С. 7—11.
Biochemical and physiological disposition of glutathione conjugates//Drug.
Metab. Rev. - 1990. - Vol. 22, N 6-7. - P. 637-647.
N- Mechanisms of metal transport acres liver cell plasma membranes//Drug.
Metabol. Rev., 1992. - Vol. 23, N 1-2. - P. s3-132.
171
84. Biological monitoring of metals/C.-G. Elinder, L.Friberg, T.Kjellstrom et al.//WHO
Geneva: IPCS, 1994. — 78 p.
85. Burger J., Gochfeld M. Lead and Neurobehavioral Development in Gulls: a Model fo
Understanding Effects in the Laboratory and the Field//Neurotoxicology. — 1907 J
Vol. 18, N 2. - P. 495-506.
86. Cadmium. Environmental Health Criteria 134//WHO. — Geneva. — 1992. — 280 p
87. Carroll R.E. The relationship of cadmium in the air to cardiovasculare disease death
rates/J. Amer. Med. Assoc. — 1966. — Vol. 198, N 3. — P. 267—269.
88. Cooper W.C. Deaths from chronic renal disease in US battery and lead production
workers//Environ. Health Perspect. — 1988. — Vol. 78. — P. 61—63.
89. Cotgreave Lan A., Moldeus P.M., Braffsand R. et al. a-(Phenylseleneny)acetophenone
derivatives with glutathione peroxidase-like activity. A comparison with ebselen//Bio-
chem. Pharmacol. — 1992. — Vol. 43, N 4. — P. 793—802.
90. Duhr E.F., Pendergrass C, Kasarskis E., Slevin J., Haley B. Hg2+ induces GTP-tubulin
interactions in rat brain similar to those obsreved in Alzheimer’s disease//FASEB J —
1991.-N 5. - P. 456.
91. Falconer M.M., Valliant A., Reuhl K.R., Laferriere N. The molecular basis of micro-
tubule stability in neurons//Neurotoxicology. — 1994. — Vol. 74, N 1. — P. 109—122.
92. Fanning D. A mortality study of lead workers, 1926— 1985//Arch. Environ. Heath. —
1988. - Vol. 43. - P. 247-251.
93. Friberg L., Vahter M. Assesment of exposure to lead and cadmium through biological
monitoring: results of a UNEP/WHO global study//Environ. Res., 1983. — Vol. 30. —
P. 95-128.
94. Gabbiani G., Bale D., Delziel C. Toxicity of cadmium for the central nervous sys-
tem/Exp. Neurol. — 1967. — Vol. 18. — P. 154—160.
95. Goering P.L. Lead-protein interactions as basis for lead toxicity//Neurotoxicol. —
1993. - Vol. 14, N 1. - P. 45-60.
96. Green E„ Juns R.H., Bright J.E. Pyruvate measurement in rabbit tissues as a measure
of arsenic intoxication//Hum. and Exp. Toxicol. — 1991. — Vol. 10, N 1. — P. 81.
97. Harvey A.L. Possible developments in neurotoxicity testing in vitro//Xenobiotica. —
1988. - Vol. 18, N 6. - P. 625-632.
98. Heinz G.H., Haseltine S.D., Sileo L. Altered avoidance bihavior of black ducks fed
cadmium//Environ. Toxicol. Chem. — 1983. — N 2. — P. 419—421.
99. Hinkle H.M., Kinsella P.A., Osterhaudt KS. Cadmium uptake and toxicity via voltage-
sensitive calcium channels//!. Biol Chem. — 1987. — Vol. 252, N 34. — P. 1633—
1637.
100. Ikeda S.R., Schofield G.G. Tetrodotoxin-resistant sodium current of rat nodose neu-
rones: monovalent cation selectivity and divalent cation block//J. Physiol. — 1987. —
Vol. 389. - P. 255-270.
101. Imari K. Camaux. calciques des cellules musculaires lisses//J. Physiol. — 1986. — Vfl-
81, N 3. - P. 168-176.
102. Inorganic Lead. Environmental Health Criteria. — WHO. — Geneva. — 1995. — Vol-
165. — 300 p.
103. Inoue S., & Kawanishi S. ESR evidence for superoxide, hydroxyl radicals and singly
oxygen produced from hydrogen peroxide and nickel (II) complex of glycylglycyl'
histidine//Biochem. Biophys. Res. Communal. — 1989. — Vol. 159, N 2. — P- 443"
451.
177
„ „„ C L Lonnerdal В., Hurley L.S. Manganese//Biochem. Essent. Ultratrace. Elem. —
104- Jew York, London, 1984. - P. 89-132.
Klein S., Waggon H. Zinn und Organozinnver bindungen — unter besonderer Beruck-
105- von Biotransformations reactionen//Gesamt. Hyg. — 1983. — B. 29. — N 5. —
S. 246-249.
Leach C.A., Linden J.V., Hopfer S.M. et al. Nickel concentrations in serum of patients
1°°' with acute 'myocardial infarction or unstable angina pectoris//Clin. Chem.. — 1985. —
Vol. 31, N 4. - P. 556-560.
107 Lewis C.P.L., Demedts M., Nemery B. The role of thiol oxidation in cobalt (II) —
induced toxicity in hamster lung//Biochem. Pharmacol. — 1992. — Vol. 43, N 3. —
P. 519—525.
108 Locket S. Clinical Toxicology. The Clinical Diagnosis and Treatment of Poisoning. —
' London: Henry Kimpton. — 1957. — 772 p.
109 Ludewig R., Lohs K.H. Acute Fergiftungen. Ratgeber fur toxicologische Notfalle/Fur
die medicinische Praxis. — Jena, VEB Gustv Fischer. — Verlag, 1966. — 456 s.
110 Lund B.-O., Miller D.M., Woods J.S. Mercury-induced HjOj production and lipid
peroxidation in vitro in rat kidney mitochondria//Biochem. Pharmac. — 1991. — Vol. 42,
Suppl. - P. 181-187.
Ill, Magnani M., Stocchi V., Ninfali P. et al. Action of oxidized and reduced glutathione
on rabbit red blood cell hexokinase//Biochim. Et biophys. Acta. — 1980. — Vol. 615,
N 1. - P. 113-120.
112. Magos L., Berg G.G. Selenium/Clarkson T. W. et al. Biological monitoring of toxic
metals. — New York — London: Plenum Press, 1988. — P. 383—406.
113. Manca D., Ricard A.C., Trottier B., Chevalier G. In vitro and in vivo responses of rat
tissues to cadmium-induced lipid peroxidation//Bul. Environ. Contain, and Toxicol. —
1991. - Vol. 46, N 6. - P. 929-936.
114. Moller L., Kristensen T.S. Blood lead as a cardiovascular risk factor//Amer. J. Epi-
demiol. - 1992. - Vol. 136. - P. 1091-1100.
115. Nakagawa K. Decreased glutathione-S-transferase activity in mice livers by acute
treatment with lead, independent of alteration in glutathione content//Toxicol. Lett. —
1991. - Vol. 56, N 1-2. - P. 13-17.
H6. Neri L.C., Hevitt D., Orser B. Blood lead and bloode pressure analysis of cross-sectional
and longitudinal data from Canada//Environ. Health Persp. — 1988. — Vol. 78. —
P. 123-126.
117 383^' Environmental Health Criteria//WHO. - Geneva. - 1991. - Vol. 108,-
118. Nomiyama K. The chronic toxicity of cadmium: influence of environmental and other
variables. — Handbook of experimental pharmacology. — Berlin — Heidelberg — Sprin-
ger - Verlag. - 1986. - Vol. 80. - P. 101-133.
119. Nordberg G., Nordberg M. Biological monitoring of cadmium/Clarkson T.W. ed. — In.:
moiogicai monitoring of toxic metals. — New York — London: Plenum Press. —
1988.-p. 151-168.
120. Oberhauser A., Alvarez O., Lattore R. Activation by divalent cations of a Ca-acti-
pat67 K"channel muscle membrane//J. Gen. Physiol. — 1988. — Vol. 92, N 1.—
21
• &cu&a A., Hanafusa M., Imada M. et al. Accumulation of cadmium and morphological
anges of kidney observed by scanning electron microscope: [Pap.] Int. Congr. Anal.
Chiba, 25-31 Fug, 1991//Anal. Sci. - 1991. - Vol. 7, N 1. - P. 815-816.
173
122. Pendergrass J. C., Haley B.E., Vimy M.J. et al. Mercury Vapor Inhalation Inhib'
Binding of GTP to Tubulin in Rat Brain: Similarity to Molecular Lesion in Alzhein?tS
Diseased Brain//Neurotoxicol. — 1997. — Vol. 18, N 2. — P. 315—324. er
123. Petrauskiene L. Changes of agonistic beheviour in rainbow trout Oncorhynchus mvK
exposed to copper//Ekologija. — Vilnius. — 1995. — N 4. — P. 3—7. y ss
124. Petrauskiene L., Daniulyte G. Lethal and sublethal effects of haevy metals mixture n
rainbow trout//Ekologija. — Vilnius. — 1996. — N 1. — P. 7—12. n
125. Principles and methods of neurotoxicity associated with exposure to chemicals —
Environmental Health Criteria. — WHO. — Geneva. — 1986. — Vol. 60. — 180 p
126. Prognosis of pesticide combined action/Kagan Y.S., Leonenko O.B., Zminko Pg et
al.//ACES. - 1996. - Vol. 8, N 3-4. - P. 57-66. ’ '
127. Prohaska J.R., Ganther H.E. Selenium and glutathione peroxidase in developpine rat
brain//Neurochem. - 1976. - Vol. 27, N 16. - P. 1379-1387.
128. Rana S. KS.; Boora P.R. Antiperoxidative mechanisms offered by selenium against liver
injury caused by cadmium and mercury in rat//Bull. Environ. Contain. Toxicol —
1992. - Vol. 48, N 1. - P. 120-124.
129. Roberts E. 3-Aminobutyric acid (GABA): a major inhibitory transmitter in the verte-
brate nervous system//Sci. Essays. Biochem. Biol, and Chem. — Tokyo. — 1981 —
P. 227-233.
130. Rosanov V.A., Gerasimyak G.R., Lobasuk B.A. GABA-ergic mechanisma of bis(tri-n-
butyltin)-oxide (TBTO) neurotoxicity//Toxicol. Lett. — 1992. — Suppl. — P. 189.
131. Scortegagna M. and Hanbauer I. The Effect of Lead Exposure and Serum Deprivation
on Mesencephalic Primary Cultures//Neurotoxicol. — 1997. — Vol. 18, N 2. — P. 331—
340.
132. Selevan S.G., Landrigan P.J., Stem F.B., Jones J.H. Brief report: lead and hypertansion
in mortality study of lead smelter workers//Environ. Health Perspect. — 1988. —
Vol. 78. - P. 65-66.
133. Shafran L.M. Neurotoxicity problems in Marine Medicine. — In.: 2-nd International
Symposium on Maritime Health. June 2—6, 1993. — Antwerpen: Belgium. — Antwer-
pen. — 1993. — P. 12—18.
134. Shigematsu I., Minov/a M., Nagai M. et al. A retrospective mortality study on cad-
mium-exposea populations in Japan (supplement): mortalitiesby level of pollution in
Toyama Perfecture. — In.: Tne influence of nutritional factors on cadmium adminis-
tered to monkeys. — Tokyo: Japan Environment. Agency. — 1983. — P. 158—174.
135. Shimizu M., Morita S. Effects fasting on cadmium toxicity, glytathione metabolism,
and metallothionein synthesis in rats//Toxicol. and Appl. Pharmacol. — 1990. — Vol.
103, N 1. - P. 28-39.
136. Shivakumar B.R., Ravindranath V. Selective modulation of glutathione in mouse brain
regions and its effect on acrylamide-induced neurotoxicity//Biochem. Pharmacol. —
1992. - Vol. 43, N 2. - P. 263-269.
137. Siedman B.C., Olsen R.W., Verity M.A. Triethyllead inhibits 3-aminobutyric acid
binding to uptake sytes in synaptosimal membranes//J. Neurochem. — 1987. — Vol. 49,
N 2. - P. 415-420.
138. Simons T.J.B. Lead-calcium interactions in cellular lead toxicity//Neurotoxicology-"
1993. - Vol. 14, N 1. - P. 77-85.
139. Stacey N.H., Klaasen C.D. Cadmium uptake by isolated rat hepatocytes//Toxicol. And
Appl. Pharmacol. — 1980. — Vol. 55, N 4. — P. 448—455.
174
>4 0. Sunderman F. W.Jr. Lipid peroxidation as a mechanism of acute nickel toxicitv//Toxi-
col. Environ. Chem. — 1987. — N 15. — P. 59—69.
|4 1. Taylor W.R. Permeation of barium and cadmium through-slowly inactivating calcium
channels in cat sensory neurones//! Physiol. — 1988. — Vol. 407, N 2. — P. 433—452.
142. Testal B., Jenner P. Inhibitors of cytochrome P-450 and their mechanisms of ac-
tion//Drug Metabol. Rev. — 1981. — Vol. 12, N 1. — P. 1 — 117.
143. Thun M.J., Osorio A.M., Schober S. et al. Nephropathy in cadmium workers —
assesment of risk from airborne occupational cadmium exposure//Brit J Industr
Med. - 1989. - Vol. 46, N 6. - P. 689—697.
144. Tiffani-Castiglioni E, Sieira E.M., Wu J.-N., Rowles T.K. Lead toxicity in neuronal
and glial cells//Neurotoxicity. — 1993. — Vol. 14. — P. 513—536.
145. Tributyltin Compounds. Environmental Health Criteria. — WHO — Geneva — 1990 —
Vol. 116. - 273 p.
146. Viarengo A., Nicotera P. Possible role of Ca2+ in heavy metal cytotoxicity//Comnar
Btochem. and Physiol. — 1991. — Vol. 100, N 1—2. — P. 81—84,
Глава 5
БЛОКАТОРЫ ХОЛИНЭСТЕРАЗЫ
5.1. Механизм передачи нервного импульса
и роль в нем холинэстеразы
Вопросы, связанные с изучением холинэстеразы (ХЭ) и антихолинэсте-
разных веществ, в течение многих лет находятся в центре внимания специ-
алистов различного профиля (энзимологов, нейрохимиков, физиологов
фармакологов и токсикологов). Это обусловлено в первую очередь тем, что
ХЭ относится к числу ферментов, играющих центральную роль в обеспече-
нии специфической функциональной активности нервной системы, в част-
ности синаптической передачи.
Известно огромное количество химических соединений, способных по-
давлять активность ХЭ. Среди них оказались вещества самого различного
химического строения с весьма разнообразными фармакологическими свой-
ствами. Большую часть антихолинэстеразных веществ (в зависимости от той
функциональной химической группы, которая определяет их антихолинэс-
теразные свойства) можно разделить на 4 основные группы:
• четвертичные аммониевые соединения;
• сложные эфиры карбаминовой кислоты (уретан и карбаматы);
• фосфорорганические соединения (ФОС);
• прочие.
Вместе с тем достаточно отчетливым антихолинэстеразным действием
могут обладать и другие вещества, например наркотики, стрихнин, вещества
курареподобного и местно-раздражающего действия, азотистые иприты и
др. Однако это действие они проявляют только в сравнительно высоких
концентрациях, в связи с чем способность подавлять активность ХЭ не
играет определяющей роли в механизме их биологического действия. К анти-
холинэстеразным препаратам следует относить все холинопотенцирующие
вещества, способные ингибировать ХЭ не выше 110~6 М.
Большинство антихолинэстеразных соединений обладает выраженной
физиологической активностью, в связи с чем многие из них (эзерин, про-
зерин, фосфакол, армии, пиридостигмин и др.) нашли применение в тера-
певтической, хирургической, невропатологической, офтальмологической и
акушерской практике, в промышленности, а также в качестве высокоток-
сичных отравляющих нейропаралитических веществ (табун, зарин, зоман,
V-газы). В настоящее время фосфорорганические пестициды (ФОП) и про-
изводные карбаминовой кислоты составляют значительную часть ассорти-
мента препаратов, широко используемых в сельском и лесном хозяйстве,
животноводстве, в качестве активных инсектицидов и акарицидов.
Вопросы токсикологии и механизма действия антихолинэстеразных со
единений различных классов широко и всесторонне обобщены в ряде °
стоятельных монографий [7, 9, 13, 27, 31, 32, 62, 63, 70, 75, 80, 83]. Можн*
считать общепризнанным, что ведущим звеном в механизме действия эти
веществ на организм человека и теплокровных животных является наруш
176
каталитической функции фермента ХЭ во всех органах и структурах,
нИеюШИх холинергическую иннервацию, и прежде всего в нервной системе.
рМсвязи с этим ФОС и карбаматы справедливо относят к нервным или
синаптическим ядам.
Систематическое описание этого механизма в связи с изложенным выше
зможно только после рассмотрения основных положений теории хими-
В°ской медиации нервных импульсов и достижений в области строения
челинэстераз и холинорецепторов, имеющих важнейшее значение в меха-
низме токсического действия этих веществ.
" Открытие роли ацетилхолина (АХ) как медиатора нервных импульсов
принадлежит О .Леви (1921). В дальнейшем благодаря исследованиям отече-
ственных физиологов и фармакологов А.Ф.Самойлова (1925), А.В.Кибякова
(1964), А-Г.Гинецинского (1970) [2, 71 и др.], а также зарубежных авторов
[39 77, 85, 88 и др.] была доказана химическая природа передачи нервного
импульса в различных звеньях центральной и вегетативной нервной систе-
мы, а также с двигательных нервов на мышцы.
В настоящее время известно несколько веществ, которые могут рассмат-
риваться как медиаторы нервных импульсов: АХ, норадреналин, серотонин,
у-аминомасляная кислота, субстанция Р.
АХ является медиатором в ЦНС, при передаче импульсов с двигательных
нервов на мышцы, во всех ганглиях (как парасимпатических, так и симпа-
тических), при переходе возбуждения с постганглионарных симпатических
волокон, иннервирующих потовые железы.
Биохимические системы, воспринимающие эффекты, разделяют на ад-
рено- и холинореактивные. Белки, непосредственно воспринимающие эф-
фекты медиаторов, называют также холино- и адренорецепторами. Холино-
реактивные системы ганглиев и эффекторных клеток не являются идентич-
ными. Их разделяют на никотиночувствительные (Н-холинореактивные) и
мускариночувствительные (М-холинореактивные). Экспериментальными
исследованиями установлено, что Н-холинореактивные системы находятся
в ганглиях симпатической и парасимпатической нервной системы, мозговом
слое надпочечников, каротидных клубочках и поперечнополосатой муску-
латуре. М-холинореактивные системы расположены в гладкомышечных и
секреторных органах, а также в сердце.
Медиатор нервного возбуждения АХ синтезируется в нервных клетках
из холина и уксусной кислоты при участии фермента ХЭ и ацетилкоэнзи-
ма А. По последним данным, фермент в нервных клетках содержится не в
клеточных органеллах (митохондриях), а локализуется в цитоплазме преиму-
щественно в растворенном виде. ХЭ обладает высоким сродством к мем-
бранам, которое может играть важную роль в синтезе АХ. Медиатор накап-
ливается в окончаниях нервных волокон, где располагается в синаптических
пузырьках — везикулах. Каждый пузырек содержит около 10 000 молекул
передатчика.
С помощью электронной микроскопии удалось изучить основные струк-
туры синаптических образований в ЦНС и нервно-мышечных синапсах,
становлено, что нервное окончание отделено от синаптической щели пре-
инаптической мембраной. Ширина синаптической щели — 20—50 нм. За
ею расположена постсинаптическая мембрана. В синаптических образова-
ИЯу™стохимически обнаружены ферменты ХЭ, гидролизующей АХ.
си Может быть расположена как на пресинаптической, так и на пост-
иаптической мембране. Это внеклеточная ХЭ, играющая основную функ-
°нальную роль. В естественных условиях биологические мембраны поля-
177
ризованы. Величина мембранного потенциала — 50—90 мВ. Когда нервный
импульс, распространяясь вдоль аксона, достигает синаптического оконча-
ния и деполяризует его, в синапсе происходит быстрое и обратимое увели-
чение концентрации ионов кальция. Это приводит к перемещению и сли-
янию части пузырьков с пресинаптической мембраной и в конечном итоге
к процессу экзоцитоза — выбросу медиатора в синаптическую щель. На один
нервный импульс в нервном окончании из пузырьков через синаптическую
мембрану высвобождается синхронно примерно 150 квантов АХ. Молекулы
медиатора быстро достигают постсинаптической мембраны и взаимодейст-
вуют с холинорецептором (ХР), представляющим собой мембранный ком-
плекс белковой природы, прочно встроенный в липопротеидную структуру
мембраны.
В состав активного центра ХР входит отрицательно заряженный анион-
ный центр, который реагирует с катионной “головкой” АХ. Второй участок
активного центра — эстерофильный — взаимодействует с карбонильной
группой и кислородом эфирной связи молекулы АХ. Конформационные
изменения в специфических белках, возникающие под воздействием ни-
чтожных количеств медиатора, могут приводить к “открытию” или “закры-
тию” каналов к определенным ионам (натрия, калия, кальция, хлора), в
результате чего возникает деполяризация этой мембраны, которая регистри-
руется как потенциал концевой пластинки (ПКП). Все эти процессы осу-
ществляются в очень короткое время. Для изменения конформации ХР
требуются доли миллисекунды, а для транспорта ионов через мембрану —
нескольких миллисекунд. Столь быстрое прекращение этих процессов свя-
зано со скоростью ферментативного гидролиза АХ. Возможно, что в пре-
кращении действия АХ некоторая роль принадлежит его диффузии из си-
наптической щели и процессам десенситизации — снижению чувствитель-
ности рецептора к субстрату [60]. Возникшее в результате нервного импульса
изменение проницаемости мембраны и перераспределение ионов восстанав-
ливается с помощью натрий-калиевого насоса, суть которого состоит в
активном транспорте ионов против их электрохимических градиентов,
что возможно благодаря использованию энергии макроэргических соеди-
нений.
Кванты АХ из отдельных пузырьков могут выделяться спонтанно, без
нервного импульса. В ответ на действие одного кванта медиатора появляется
слабая (0,2—2 мВ), кратковременная (3—4 мс) деполяризация в виде мини-
атюрного потенциала концевой пластинки (МПКП). Частота МПКП регу-
лируется пресинаптически и составляет один потенциал в секунду [100].
При действии антихолинэстеразных веществ может нарушаться каждое
из перечисленных выше звеньев цепи синаптической передачи возбуждения.
Так, частота выделения квантов существенно возрастает при деполяризации
нервных окончаний, что приводит к учащению МПКП. Амплитуда МПКП
увеличивается под влиянием антихолинэстеразных веществ, задерживающих
разрушение АХ вследствие торможения синаптической ХЭ. Использование
микроэлектродной техники позволяет регистрировать увеличение амплиту-
ды и длительности МПКП, а также ПКП при воздействии токсических Д°3
ряда ФОП (ДДВФ, афуган, хостаквик) и некоторых карбаматов — карбофУ'
ран, пиримор, диоксикарб (рис. 5.1) [40, 42, 47].
Установление роли АХ в процессах передачи нервного возбуждени
привлекло внимание исследователей к изучению строения и функции ФеР
ментов, названных холинэстеразами, обеспечивающих быстрый гидроли
АХ.
178
5 1. Потенциалы концевой плас-
тинки сегментарной латеральной мыш-
1Ы хвоста крысы при раздражении вен-
тпального нерва подпороговыми сти-
мулами (А) и спонтанные миниатюр-
uuie потенциалы той же мышцы до (А)
и после (Б) введения ДДВФ (40 мг/кг).
. ПКП до введения ДДВФ, потенциал
покоя мышечного волокна (ПП) — 72 мВ;
2 — ПКП через 20 мин после введения хос-
таквика в ответ на четыре одиночные сти-
мула ПП - 67 мВ; 3 - ПКП и ПД через
30 мин после введения ДДВФ, ПП — 65 мВ;
4 5- спонтанные миниатюрные потенциа-
лы сегментарной латеральной мышцы хвос-
та крысы до введения ДДВД (40 мг/кг),
соответственно и после него.
1
2
3
20мВ|___
10МС
0.5 мВ
10 МС
Б
А
5.2. Общие свойства холинэстераз, механизм
их взаимодействия с ацетилхолином
В соответствии с классификацией и номенклатурой ферментов, приня-
той Международным биохимическим союзом, различают три типа ХЭ: аце-
тилхолинэстеразу (АХЭ), или ацетилхолингидролазу (шифр 3.1.1.7), бути-
рилхолинэстеразу (БуХЭ), или ацилгидролазу ацилхолинов (3.1.1.8), и бен-
зоилхолинэстеразу (БеХЭ), или бензоилхолингидролазу (3.1.1.9). Эти
ферменты отличаются друг от друга субстратной специфичностью, различ-
ным отношением к концентрации субстратов, оптимумом pH и различным
отношением к ингибиторам. Ведущая роль в гидролизе АХ принадлежит
АХЭ. Наличие АХЭ в синаптических образованиях подтверждено гистохи-
мическими и электронно-микроскопическими исследованиями. АХЭ легко
расщепляет АХ и ацетил- в метилхолин и практически не гидролизует
бутирилхолин и бензоилхолин. АХЭ отличается от БуХЭ также по локали-
зации. Она содержится в сером веществе мозговой ткани, симпатических
ганглиях, мотонейронах спинного мозга, аксоновой терминали, двигатель-
ных концевых пластинках, мембране ядра, эритроцитах, эндоплазматичес-
ком ретикулуме, мышцах. БуХЭ локализуется в плазме крови, оболочке
кишечника, печени и поджелудочной железе. Вместе с тем в большинстве
тканей можно обнаружить оба фермента, однако в одних более активна
АХЭ, в других — БуХЭ.
В последнее время к одним из наиболее распространенных методов
определения активности ХЭ в токсикологической практике можно отнести
методы Hestrin (1949) и Ellman (1961). Активность ХЭ в различных биосуб-
тратах людей и теплокровных животных представлена в табл. 5.1.
К- настоящему времени получено много данных о строении и функции
п ИВ^Ь1Х Центров ХЭ, ХР и их взаимодействии с АХ. Все эти вопросы
“одробно изложены в ряде монографий [7, 13, 27, 62, 72, 74].
чес)<° современным представлениям, ХЭ осуществляют мощный каталити-
ани ИИ эФФект благодаря наличию в их молекуле двух активных центров:
Вет °ННого (соответствующего катионной головке АХ) и эстеразного (соот-
твующего сложноэфирной его группировке), обладающих высокой ре-
179
Таблица 5.1. Активность ХЭ в различных биосубстратах людей и теплокровны*
животных [Каган Ю.С., Кокшарева Н.В., 1984] *
( Биосубстраты Активность ХЭ ~~
по методу Hestrin по методу Ellman
Люди, ммоль/(ч л) Цельная кровь 300±12,3 (п = 12) 277±9,2 (п = 25)
Крысы, ммоль/(ч л) 115±9,5 (п = 12) 105,3±4,5 (п = 25)
Кролики, ммоль/1 мг белка в час Кошки, мкг/(млмин) Люди, ммоль/(ч л) 0,44±0,07 (п = 10) 96,2±1,8 (п = 10) Плазма 84,7+2,6 (п = 25)
Крысы, ммоль/(ч л) 30,0±3,7 (п = 8) 33,8±3,4 (п = 8)
Люди, ммоль/(ч л) Эритроциты 198,5±9,9 (п = 25)
Крысы, ммоль/(ч л) 34,5±2,6 (п = 8) 71,5±5,0 (п = 8)
акционной способностью к АХ (один активный центр ХЭ в минуту гидро-
лизует около миллиона молекул АХ). Анионный центр свойствен только ХЭ
и играет ориентировочную роль (притягивает к себе катионную часть моле-
кулы АХ). Эстеразный центр, расположенный на расстоянии 4—5 А от
анионного, выполняет гидролизующую функцию. Он имеет реакционноспо-
собную нуклеофильную группу, могущую взаимодействовать с имеющим
некоторый недостаток электронов (электрофильным) атомом карбонильной
группы субстрата. Важная роль в реакции гидролиза АХ холинэстеразой
отводится гидроксиду серина и азоту имидазольного кольца гистидина.
Установлено, что вокруг анионного и эстеразного центров ХЭ имеются
гидрофобные участки, играющие важную роль в реакциях, протекающих на
поверхности фермента.
В общем виде реакцию АХ под действием АХЭ можно представить в
виде последовательного процесса: активный фермент обратимо реагирует с
АХ, в результате чего образует комплекс субстрат — фермент. В этом ком-
плексе связь между ферментом и субстратом осуществляется не только за
счет взаимодействия эстеразного центра с углеродом карбамильной группы
АХ, но также за счет притяжения катионной головки АХ к анионному
центру и взаимодействия неполярных групп субстрата с гидрофобными
участками активного центра. Распад комплекса фермент — субстрат с обра-
зованием продуктов реакции происходит в два этапа. На первом этапе
ацетильный остаток субстрата присоединяется к ферменту, замещая содер-
жащийся в нем протон, а остаток холина отщепляется в виде свободного
холина. Далее следует деацетилирование эстеразного участка фермента с
восстановлением его первоначальной структуры и образованием уксусной
кислоты. Схематически это выглядит следующим образом:
О О
НЕ + RO — С — СН3 — Е — С — СН3 + ROH
Фермент АХ Ацетилированный Холин
фермент
180
Высокая вероятность взаимодействия между ХЭ и АХ достигается бла-
я конформационным изменениям молекул субстрата и фермента в
Г°Дмент реакции. В результате этого создается высокая каталитическая эф-
фективность реакции ХЭ с АХ и синапс готов к приему новых импульсов,
Фе и является условием нормального функционирования нервной системы.
ЧТ°АХ может реагировать в организме не только с ХЭ, но и с ХР.
I 5 3. Классификация антихолинэстеразных веществ
1
Антихолинэстеразные вещества на основе особенностей их взаимодей-
ствия с ХЭ классифицируются на обратимые и необратимые ингибиторы.
Под этим подразумевается, что одни ингибиторы подавляют активность ХЭ
обратимо, а другие — необратимо. К обратимым относятся четвертичные
аммониевые соединения и эфиры карбаминовой кислоты, к необрати-
мым —ФОС. Вместе с тем значительное количество антихолинэстеразных
веществ, в частности карбаматы, хотя и вызывают временное, обратимое
торможение ХЭ, но являются необратимыми реагентами. Они разрушаются
на поверхности фермента. В.И.Розенгарт (1965) предложил именовать ин-
гибиторы, меняющиеся в процессе реакции, ингибиторами, вступающими
с ХЭ в ковалентную связь (ФОС, карбаматы), и противопоставлять их
ингибиторам, не вступающим в ковалентную связь (четвертичные аммоние-
вые соединения). Ингибиторы, не устанавливающие ковалентной связи,
вступают с ХЭ в слабое электростатическое взаимодействие. Образующийся
при этом комплекс непрочен, а потому вещества такого типа являются
обратимыми ингибиторами. Характерной особенностью веществ этой груп-
пы является большая скорость установления равновесия:
Е + I = EI,
где Е — фермент; I — ингибитор; EI — неактивный комплекс фермент —
ингибитор. Особенностью реакций ингибиторов, образующих ковалентную
связь (ФОС, карбаматы) с ХЭ, является наличие двух стадий реакции [5,
76]. В первую стадию реакция осуществляется по типу обратимой конку-
рентной, а во вторую, в результате установления ковалентной связи инги-
битора с серином ХЭ в эстератическом центре, становится необратимой:
Е + I = El + R = E + I + R.
От ингибитора отщепляется радикал R, в результате чего ингибитор,
входящий в комплекс с ферментом, отличается от своей первоначальной
формы. Если в результате последующего гидролиза ингибитор высвобожда-
ется из комплекса, то его первоначальная структура не восстанавливается.
От типа соединения во многом зависит прочность образования связи. Наи-
г’лее легко гидролизуется карбомилированный фермент, наиболее трудно —
Фосфорилированный, поскольку прочность связи возрастает в следующем
C-o<S-O<P — О.
Внутри каждой группы прочность связи зависит от радикалов при ак-
вном атоме. Некоторые вещества обладают способностью утрачивать часть
ЗДикалов уже после того, как они вступили в реакцию. Скорость восста-
СоВЛения исходной активности ХЭ, ингибированной ФОС, определяется
паяТВетственно скоростью гидролиза фосфорилированного фермента, кото-
зависит от строения ФОС. В результате деалкилирования прочность
181
связи с ХЭ резко возрастает, т.е. происходит старение комплекса инги
битор — фермент. Комплекс АХЭ с метилфторфосфорилгомохолином ста'
реет практически мгновенно. Комплекс с зоманом (pH 7,0, и 30) стареет
наполовину за 30 с, с зарином (pH 8,37) — за 3,9 ч [60].
Изложенное выше позволяет относить (согласно принятой классифика-
ции) ФОС к необратимым, а четвертичные соединения и карбаматы — %
обратимым ингибиторам [8].
5.4. Фосфорорганические соединения
5.4.1. Краткая история, строение и физико-химические
свойства ФОС
Впервые синтез ФОС был осуществлен при помощи реакции этерифи-
кации спиртов фосфорными кислотами в 1820 г. [63]. Уже в 1847 г. фран-
цузским ученым Тенардом были синтезированы многие фосфины [86]. Од-
нако интенсивному развитию исследований по химии ФОС послужили
работы Михаэлиса и А.Е.Арбузова.
В 1903 и 1915 гг. Михаэлис опубликовал фундаментальные работы по
синтезу амидированных производных фосфорной, фосфиновой и тиофос-
форной кислот. Открытая реакция Михаэлиса — Беккера дала возможность
получать эфиры алкилфосфоновых кислот из галоидалкилов и диалкилфос-
фитов.
А.Е.Арбузов открыл новый путь получения соединений пятивалентного
фосфора из эфиров кислот трехвалентного фосфора, который получил на-
звание “перегруппировки Арбузова”. Способ синтеза эфиров фосфорной
кислоты был опубликован А.Е.Арбузовым в 1906 г. Это легло в основу химии
органических соединений и послужило широкому синтезу многих высоко-
активных ингибиторов ХЭ, которые нашли широкое применение в качестве
пластификаторов для пластмасс и резины, экстрагирующих веществ, анти-
оксидантов для смазочных масел, флотоагентов в горнорудной промышлен-
ности, лекарственных средств. Наибольшее применение органические со-
единения фосфора различной структуры находят в сельском хозяйстве в
качестве инсектицидов, акарицидов, фунгицидов и регуляторов роста рас-
тений.
Развитие исследований токсических свойств и биологической активнос-
ти ФОС начато с 30-х годов XX столетия. В этом направлении исследований
большую роль сыграли работы немецких ученых В.Ланге и Г.Крюгера (1932),
которые синтезировали фторпроизводные фосфорной кислоты — диметил-
и диэтилфторфосфаты и установили их высокую физиологическую актив-
ность. В конце 30-х годов большое количество ФОС получил Г.Шрадер,
который обнаружил у некоторых из них инсектицидные свойства. В 1937 г.
он запатентовал общую формулу контактных инсектицидов, согласно кото-
рой были синтезированы многие вещества, нашедшие применение в сель-
ском хозяйстве в качестве инсектицидов (ТЭПФ, паратион, параоксон,
шрадан и др.), а также зарин, табун, зоман, которые были взяты на воорУ*
жение Германией в качестве боевых отравляющих веществ.
Открытие Г.Шрадером и его сотрудниками амидоэфира цианзамешен-
ной фосфорной кислоты под названием “табун”, а также других высокоток-
сичных ядов (ДФФ), способных необратимо ингибировать ХЭ, послужил
причиной интенсификации исследований механизма антихолинэстеразного
действия ФОС [30, 71].
182
Изучение механизма действия ФОС начато в Германии с 1938 г. Парал-
ельно аналогичные исследования проводились в Англии Эдрианом, Фельд-
fieoroM, Килби и др., в Советском Союзе — А.Г.Генецинским [71, 86].
° Поскольку первые созданные ФОС оказались чрезвычайно токсичными
опасными для теплокровных животных и человека, это побудило к изыс-
канию новых соединений с избирательной токсичностью и исследованию
их механизма токсического и селективного действия, метаболизма, изыска-
нию средств антидотной терапии.
Из многих тысяч синтезированных в последнее время ФОС большая
часть синтезирована в Советском Союзе в лабораториях А.Е.Арбузова и
Б.В.Арбузова (октаметил, дитио, хлорофос и др.), М.И.Кабачника (М-74,
М-81, Р-2 и др.), Н.Н.Мельникова (меркаптофос, метилмеркаптофос, тио-
фос, метафос, карбофос, фосфамид и др.). Существенный вклад в изучение
механизма биологической активности ФОС, закономерностей антихолинэс-
теразной активности внесен М.И.Кабачником и его сотрудниками. Систе-
матическое и плодотворное изучение вопросов токсикологии и механизма
токсического действия ФОС проводится в лабораториях М.Я.Михельсона,
К.С.Шадурского, С.Н.Голикова, В.И.Розенгарта, Ю.С.Кагана, Ю.И.Кундие-
ва и др.
Полученные в последние годы основные закономерности биологическо-
го действия ФОС в зависимости от их структуры будут рассмотрены ниже.
Химическая структура и номенклатура ФОС подробно освещены О’Брай-
ном [63], для ФОП — в Материалах ВОЗ [81].
Химическое строение большинства ФОС может быть выражено общей
схематической формулой:
R1
P(S)
,Р
R2 ^Х,
где R1 и R2- одинаковые или различные алкильные, алкоксильные, алкил-
аминные, арильные или арилокси группы.
Группы R1 и R2 могут быть непосредственно присоединены к фосфору
(в фосфинатах) или связаны через кислород или серу (в фосфатах). В фос-
фонатах R1 может иметь непосредственную связь с фосфором, a R2 связан
с фосфором через кислород или серу. В фосфороамидатах углеродный атом
группы R соединен с фосфором через NH-группу. В качестве группы X
может быть остаток неорганической или органической кислоты, соединен-
ных непосредственно с фосфором, либо различные замещенные и развет-
вленные алифатические, ароматические или гетероциклические группы, со-
единенные с фосфором обычно через кислород или серу. Группа X рассмат-
ривается как отходящая или отщепляемая группа, так как при взаимодейст-
j и с ХЭ она отщепляется, а остаток соединяется с молекулой фермента,
Фосфорилируя его. Атомом с двойной связью может быть кислород или
Ра’ и соответствующие соединения именуются фосфатами или фосфор-
°атами (названия “тиофосфаты” или “тионофосфаты” в настоящее
Р мя используются реже).
ные а ™ческ™У строению ФОП можно разделить на 5 групп: производ-
или (₽осФорной, тиофосфорной, дитиофосфорной, пирофосфорной и фос-
* НОВЫХ кислот.
зависимости от различия в фосфорной группе ФОП выделяют 3
183
i
основные группы соединений: фосфаты (без атома серы), фосфоротиоаты
(с одним атомом серы) и фосфородитиоаты (с двумя атомами серы).
Форма Р=О сложного эфира тиоата может рассматриваться как оксон и
часто включается в тривиальное наименование. Например, паратион явля-
ется исходящим P=S соединением параоксона. ФОС формы P=S обладают
большей внутренней стабильностью, чем Р=О, поэтому многие пестициды
производятся в форме P=S, которая в тканях организма превращается в
биологически активный оксон. Механизм этого превращения обсуждается
ниже.
В настоящее время известны десятки тысяч отдельных ФОС, их число
возрастает с каждым днем и дать их полный перечень не представляется
возможным. Химическое строение, физико-химические и токсические свой-
ства многих ФОС отражены в работах [30, 31, 67, 68, 86 и др.]. Подробную
информацию и легальный файл для большинства ФОС можно получить в
Международном регистре потенциально токсичных химических веществ.
ФОС могут находиться в различном агрегатном состоянии. Большинство
из них представляют собой маслянистую жидкость либо кристаллический
порошок, нерастворимы либо плохо растворимы в воде, хорошо растворимы
в органических растворителях. Многие из них имеют неприятный специфи-
ческий запах. Плотность ФОС находится в пределах 1,1—1,7.
Среди ФОС имеются вещества с различной степенью летучести. К ве-
ществам, обладающим очень высокой летучестью (насыщающая концентра-
ция больше 10 мг/м3), относятся димефокс, ДДВФ, фосдрин, тионовый
изомер метилмеркаптофоса, тимет, зарин, ронелл и др. Летучесть в данном
ряду ФОС составляет 925; 145; 27; 23,3; 12,4; 12; 11 мг/м3 соответственно.
К веществам с относительно высокой летучестью (1—10 мг/м3) относятся
зоман, октаметил, табун, тиоловый изомер меркаптофоса, препарат М-81,
меркаптофос, ТЭПФ, карбофос, диазинон и др. Летучесть их составляет 10;
9,5; 6; 4,5; 4; 3,67; 2,5; 2,26; 1,39 мг/м3 соответственно. ФОС со средней
летучестью (0,1—1 мг/м3) являются метилнитрофос, байтекс, параоксон,
фосфамидон, метафос, хлорофос, фосфамид и др., их летучесть составляет
0,82; 0,46; 0,41; 0,18; 0,14; 0,11; 0,11 мг/м3 соответственно. Низкой степенью
летучести (менее 0,1 мг/м3) обладают паратион, хлортион, дикаптон, три-
тион, гузатион, фенкаптон и др., их летучесть — 0,09; 0,07; 0,05; 0,0057;
0,0042; 0,00085 мг/м3 соответственно. Следует отметить, что с возрастанием
температуры летучесть ФОС значительно увеличивается.
ФОС достаточно стабильны при нейтральной pH, легко гидролизуются
в щелочных растворах (pH 8,0 и выше), в меньшей степени в кислых
растворах (при pH 2,0 и ниже). Фосфороамидаты гидролизуются в ходе
катализируемой кислотой реакции даже при pH 4,0—5,0 и после образования
кислоты разложение ускоряется из-за автокатализа. На скорость гидролиза
оказывают влияние такие факторы, как характер заместителей в молекуле
ФОС, катализаторы (азотсодержащие соединения, гидроксамовые кислоты,
хлор, медь и др.), растворители, изменение температуры и pH. Механизм и
скорость гидролиза ФОС описаны у О’Брайна [63].
При хранении, нагревании и перегонке некоторые ФОС способны к
изомеризации. Наиболее обычной является изомеризация фосфоротиоатов
(тионфосфатов) типа (RO)2P(S)OX, где R — алкильная группа, X — может
иметь различное строение. В результате изомеризации образуются продукты
типа (RO)(RX)P(O)OX или (RO)2P(O)SX, которые более токсичны, чем
исходное вещество.
В лабораторных условиях процесс изомеризации катализируется диме-
184
формамидом [97]. Для обеспечения полной изомеризации необходимо
™p2gBaHHe до 160 °C в течение нескольких часов.
н Г1ри хранении алкилфосфоротиоатов в теплых и влажных климатических
ловиях также наблюдается изомеризация, но протекает этот процесс мед-
УСцНей. Изомеризация ФОС ускоряется под влиянием тепла и света, а также
под воздействием растворителей.
Процесс, типы изомеризации и другие неферментативные превращения
фОС описаны О’Брайном, У .Дотерманом, Фукуто и др. [18, 63, 99].
Одним из первых препаратов, для которого показано в условиях in vitro
повышение антихолинэстеразного действия под влиянием ультрафиолетово-
го излучения (УФИ) и солнечного света, был паратион. Наряду с неизвест-
ными продуктами превращения паратиона идентифицированы параоксон,
S-этиловый и S-фениловый изомеры паратиона [18].
Под воздействием УФИ окисление EPN приводило к образованию его
кислородного аналога и р-нитрофенола, что свидетельствует о разрыве связи
р=О-арил. При изучении фората, дисульфотона и тиометона в качестве
продуктов воздействия УФИ обнаружены соответствующие сульфоксиды и
сульфоны. Влияние УФИ или солнечного света на хлорпирифос приводит
к гидролизу с выделением 3,5,6-трихлор-2-пиридинола, который затем под-
вергается полному фотодехлорированию с образованием диолов, триолов и
тетраолов.
Гидролиз и окисление некоторых ФОП в объектах окружающей среды
под влиянием физических и химических факторов подробно освещены
Н.Н.Мельниковым и соавт. [60].
5.4.2. Взаимодействие ФОС с холинэстеразой
и холинорецепторами
Механизм взаимодействия антихолинэстеразных соединений детально
изучен. Подробное описание этого механизма можно найти в монографиях
[7, 13, 27, 62].
ФОС проявляют свое токсическое действие в результате того, что имеют
определенное сходство в строении с естественным субстратом ХЭ — АХ (как
стериохимически, так и по реакционной способности). При достижении ак-
тивного участка ХЭ их взаимодействие с ферментом сводится к фосфори-
лированию (или карбамилированию) гидроксила серина.
Различие во взаимодействии ХЭ с АХ и ФОС заключается в том, что в
первом случае образуется ацетилированный фермент — весьма непрочное
соединение, быстро подвергающееся гидролизу, в результате чего активные
Фпг?Ь1 ХЭ освобождаются для новых реакций с АХ. При взаимодействии
фОС с ХЭ эстеразный центр прочно связывается с остатком фосфорной
кислоты, что приводит к образованию чрезвычайно устойчивого к гидролизу
фосфорилированного фермента, неспособного реагировать с молекулами АХ
потому утратившему свою основную каталитическую функцию. Блокиро-
ание ХЭ ФОС осуществляется в две фазы. В первой фазе подавление
фермента обратимо. И только через определенный промежуток времени
б стУпает вторая фаза. Первая фаза начинается сразу после контакта инги-
ПпТ0Ра С ФеРментом. Переход от обратимого ингибирования к необратимому
ИнгибитДИТ постепенно и зависит от температуры, строения и концентрации
св 5>0^Ф°Рилирующая способность ФОС зависит от прочности эфирной
и фосфора с кислотным остатком и от дефицита электронов вокруг
185
атома фосфора. Важное значение имеют стерические факторы и гидрофо^_
ные взаимодействия. Гидролиз фосфорилированной ХЭ происходит очень
медленно. При этом устойчивость фосфорилированной ХЭ к гидролизу
зависит от характера алкоксигрупп, связанных с фосфором. Легче всего
происходит гидролиз в случае угнетения ХЭ диметиловыми эфирами кислот
фосфора, значительно труднее — после воздействия диэтиловых, которые
практически необратимо угнетают ХЭ диизопропиловые эфиры.
В связи с тем что ХЭ и ХР имеют в своем строении много общего в
механизме действия антихолинэстеразных соединений определенное значе-
ние может иметь их взаимодействие не только с ферментом, но и с ХР. При
этом некоторые ФОС (фосфакол, ДФФ, паратион, армии и др.) могут
проявлять как возбуждающее, так и блокирующее действие на ХР [3 Ц 16
66]. ’ ’ ’
Для взаимодействия ФОС с ХР необязательно наличие в них катионной
группы, определяющей возможность реакции с анионным пунктом рецеп-
тора. Блокирующее действие на ХР таких веществ, как диизопропилфтор-
фосфат, армии, фосфакол, связано, по-видимому, с их взаимодействием с
эстерофильным участком ХР [73]. Влияние на Н-холинореактивные систе-
мы проявляется главным образом в случае введения больших доз этих пре-
паратов.
Армин в концентрации 2-10"4 М нарушает проведение высокочастотных
импульсов с двигательного нерва на изолированную портняжную мышцу
лягушки. В то же время на одиночные раздражения мышца отвечает сокра-
щением. Это характерно для антихолинэстеразного действия ФОС. При
более высоких концентрациях армина (510~4 М) уменьшаются, а затем
исчезают ответы не только на высокочастотные, но и на одиночные им-
пульсы, но сохраняется ответ на прямое раздражение мышцы электрическим
током. Этот эффект свидетельствует уже о прямом блокирующем действии
ФОС на ХР.
При введении крысам ФОП ДДВФ в низких концентрациях наблюдалось
блокирование высокочастотных импульсов (100—30 Гц). В токсических до-
зах (40 мг/кг) возникает блок проведения одиночных импульсов при сохра-
нении прямого ответа скелетной мышцы на раздражение [41]. Этот опыт
подтверждает возможность прямого взаимодействия фосфорорганических
инсектицидов с ХР. Поскольку ДДВФ не имеет в своей структуре групп,
позволяющих допустить возможность его взаимодействия с анионным пунк-
том ХР, по-видимому, речь идет о взаимодействии с его эстерофильным
участком. Более подробно вопрос о влиянии химической структуры ФОС
на их взаимодействие с ХР рассмотрен М.И.Кабачником и соавт. (1965).
Одним из аргументов в пользу прямого блокирующего действия ФОС на
нервно-мышечное соединение в опытах на целом животном является также
восстановление функции органа при наличии глубокой ингибиции фермента.
Вместе с тем практически у всех антихолинэстеразных средств антихо-
линэстеразное действие сопровождается другими вариантами фармакологи-
ческих реакций [73].
Данные, полученные при отведении процессов непосредственно от кон-
цевой пластинки, позволили установить, что под влиянием токсических Д°3
ФОИ и карбаматов происходит облегчение спонтанного выброса квантов
АХ нервным окончанием [41, 45].
Представления о сенсибилизирующем, облегчающем, мимитическом И
литическом действии ингибиторов ХЭ обобщены в монографии [66].
186
5 4.3. Антихолинэстеразная активность ФОС in vitro
Взаимодействие ФОС с ХЭ представляет собой реакцию фосфорилиро-
вания которую можно изобразить схематически:
ЕН + (RO)2P(O)X = (RO)2P(O)E + хн,
где ЕН — активная холинэстераза (механизм взаимодействия ХЭ и ФОС
описан выше).
В.Н.Олдридж показал, что процесс взаимодействия ФОС с ХЭ подчиня-
ется кинетическим уравнениям простой бимолекулярной реакции, когда
один из компонентов (ингибитор) находится в избытке, и может быть
описан кинетическим уравнением первого порядка. Скорость реакции пря-
мо пропорциональна концентрации ингибитора [89]. Реакция протекает во
времени, чем дольше ингибитор контактирует с ХЭ, тем больше торможение
активности фермента. Степень ингибирования ХЭ определяется по моляр-
ной концентрации ингибитора, вызывающей торможение фермента на 50 %
(150), а величина plso является отрицательным десятичным логарифмом I50.
Оба параметра изменяются во времени. Поэтому они могут быть определены
только при условии, если продолжительность инкубации известна. Более
достоверным параметром для определения “силы” ингибитора (т.е. сродства
с активным центром ХЭ) является бимолекулярная константа скорости К.2
при определенных температуре и pH.
Уравнение первого порядка справедливо, когда отношение ингибитора
к ферменту не меньше чем 25:1. Если это условие не соблюдается, то для
описания зависимости степени торможения от времени и концентрации
используют кинетическое уравнение второго порядка [63]. Взаимодействие
ФОС и ХЭ является химической реакцией, поэтому скорость этого процесса
повышается с возрастанием температуры.
Описан целый ряд примеров, когда реакция ФОС и ХЭ не подчиняется
кинетическим уравнениям первого порядка. Это может быть связано с тем,
что исследуемое соединение имеет примеси, обладающие антихолинэстераз-
ным действием; источник ХЭ недостаточно чист и содержит реакционно-
способные ферменты или вещества, которые в реакции с ФОС конкурируют
с активным центром ХЭ; молярная концентрация сильного ингибитора
незначительно превышает концентрацию активных центров ХЭ либо иссле-
дуемое соединение является слабым ингибитором ХЭ; фосфорилированная
ХЭ может восстанавливать свою активность благодаря спонтанной реакти-
вации; ингибитор может быть неустойчивым в воде или гидролизоваться
ферментами, содержащимися в препарате [63].
Установлено, что в условиях in vitro с увеличением времени инкубации
ингибиторов с ХЭ степень угнетения активности ХЭ нарастает. Значитель-
ное угнетение активности фермента отмечается в первые 15 мин инкубации,
при более длительном контакте ФОС с ХЭ нарастание степени угнетения
фермента выражено менее резко. Оптимальное время инкубации для дости-
ения выраженности угнетения ХЭ составляет 30—60 мин.
Антихолинэстеразная активность ФОС представлена в табл. 5.2 и 5.3,
заимствованных из работ D.Grob и Ю.С.Кагана [30, 72].
вещ 3 та^л- 5.2 видно, что наиболее токсичный в рассматриваемой группе
ДффТВ зарин значительно превосходит по антихолинэстеразной активности
акти ’ Та(зУн и паратион. При действии зарина и табуна ингибирование
степВН°СТИ ХЭ в различных биосубстратах выражено примерно в равной
Сте ени- ТЕПФ, Дфф и паратион угнетают активность ХЭ в большей
ени в плазме, чем в эритроцитах, мозге и мышцах.
187
Таблица 5.2. Чувствительность ХЭ плазмы, эритроцитов, коры мозга и мыши человека к антихолинэстеразным веществам в опытах in vitro, по данным D.Groti
Веществе ХЭ
плазмы I эритроцитов | мозга I мышц
Зарин 4.2-10-9 3-Ю-9 3,3-1 о-9 3,6-10"9
Табун 1.3-1О-8 1.5-10-8 1,5-10“8 2-10~8
ТЕПФ 5-Ю-9 3,5-10~8 3.2-10-8 3,5 10~8
ДФФ 9,5 10-9 4-10-7 3-10-7 2,5-10~7
Паратион 1-Ю-6 1,2 10-5 1,3-Ю'5 1.5 10~5
* Приведены молярные концентрации ингибиторов, вызывающих угнетение ХЭ на 50 %.
Указанные соединения обладают выраженным антихолинэстеразным дей-
ствием и в условиях in vivo. При поступлении в кровь даже малых количеств
ФОС происходит угнетение активности ХЭ эритроцитов и плазмы. Одно-
кратное воздействие зарина в дозе 0,02 мг/кг вызывает у человека выражен-
ное снижение активности ХЭ плазмы и эритроцитов, при этом отмечаются
симптомы острой интоксикации.
Таблица 5.3. Антихолинэстеразная активность и токсичность некоторых ФОИ, по
данным Ю.С.Кагана*
Препараты IgQ, МОЛЬ LD50
псевдохолин- эстераза лошадиной сыворотки холинэстера- за мозга крыс в мг/кг в моль/кг
Тиоловый изомер меркаптофоса 5,8-Ю-7 3,1-Ю-7 6,6 2,17-Ю-6
Тионовый изомер меркаптофоса 2.910-6 6,1-Ю-6 12,5 48.5-10-6
М-74 1.5-10"4 — 4,6 16,8-Ю-6
М-81 1,4 10-4 1,3-1 о-4 36 14610-6
Л-11-6 2.010-5 6,0 ю-5 1,7 6,5-Ю-6
Л-метильный 2,85 Ю-5 — 7,6 32,8-10-6 .
Тиофос (технический) 5,5-Ю-6 — 14,5 50 10-6
Метафос (технический) 4,0-Ю-5 — 33,4 127-10-6
Октаметил (технический) 1,2-Ю-3 — 13,5 47-10-6
* I5Q определено путем интерполирования данных, полученных в опытах in vitro, LD50 —в
опытах на мышах методом пробит-анализа.
Из табл. 5.3 следует, что между антихолинэстеразным действием ФОС и
их токсичностью не всегда наблюдается паралеллизм. Так, препарат М-74
по токсичности примерно равен тиоловому изомеру меркаптофоса, а его
антихолинэстеразная активность по отношению к ХЭ лошадиной сыворотки
слабее в 258 раз. Препарат Л-11-6 имеет наибольшую токсичность из всех
изученных веществ, а по антихолинэстеразной активности уступает тиоло-
вому изомеру меркаптофоса — по отношению к ХЭ лошадиной сыворотк
в 35 раз, ХЭ мозга крыс — в 194 раза. Октаметил менее токсичен, чем
тиоловый изомер меркаптофоса, всего в 2,4 раза, а обладает более слабым
действием на ХЭ лошадиной сыворотки в 3200 раз. Тиоловый изомер мер-
каптофоса, препараты М-74, М-82, Л-метиловый, тиофос, метафос имею
188
абую антихолинэстеразную активность in vitro, однако обладают высокой
сЛксичностыо. Этот факт можно объяснить тем, что в организме теплокров-
ных животных они метаболизируются в более сильные антихолинэстеразные
пешее тв а.
Сопоставление данных об антихолинэстеразной активности ФОС in vitro
их токсичностью и антихолинэстеразными свойствами in vivo показывает,
что между этими свойствами не всегда имеется прямая зависимость. Это
касается в первую очередь тиофосфатов (фосфоротиоатов). Например, такие
тиофосфаты, как тиофос, карбофос, ЭПН, не вызывают угнетение холинэс-
теразы in vitro, однако эти соединения отличаются выраженными антихо-
линэстеразными свойствами in vivo и высокой токсичностью.
a
5.4.4. Антихолинэстеразные свойства ФОС при остром
и хроническом воздействии в зависимости от пути
поступления в организм
Внутривенный путь поступления является наиболее адекватным для изу-
чения антихолинэстеразных свойств, токсикодинамики и токсикокинетики
ФОС, поскольку исключает влияние на токсикодинамические и токсикоки-
нетические параметры такого важного фактора, как всасывание из ЖКТ
через кожу или дыхательные пути.
D.F.Heath проанализировал большое число данных литературы, касаю-
щихся токсичности и антихолинэстеразной активности многих ФОС при
внутривенном поступлении в организм, и установил четкую корреляцию
между токсичностью и угнетением активности ацетилхолинэстеразы [102].
При внутривенном введении ФОС быстро достигают мишени, и анти-
холинэстеразное действие проявляется сразу после введения вещества. Осо-
бенность антихолинэстеразного действия некоторых ФОП достаточно хоро-
шо демонстрируют опыты, представленные в монографии Ю.С.Кагана [30].
При однократном внутривенном введении кролику тиолового изомера мер-
каптофоса в дозе 1 мг/кг уже через 1 ч развилась интоксикация, и животное
вскоре погибло. Тионовый изомер меркаптофоса даже в дозе 5 мг/кг не
вызывал видимых признаков интоксикации, хотя степень ингибирования
активности АХЭ и ХЭ крови была около 90 %. Максимальное ингибирова-
ние активности АХЭ и ХЭ крови наблюдалось в первый день опыта как при
воздействии тиолового, так и тионового изомера меркаптофоса.
Выявлено значительное расхождение между дозой вещества, степенью
ингибирования активности фермента и клиническими признаками инток-
сикации. Выраженность антихолинэстеразного эффекта в зависимости от
введенной дозы была больше при воздействии тиолового, чем тионового,
изомера меркаптофоса.
При воздействии тиолового изомера в дозе 0,1 мг/кг и тионового — 1 мг/кг
восстановление активности фермента происходило уже на 2-й день. С уве-
чивадИеМ Д03ы веществ время восстановления активности фермента увели-
Аналогичные данные были получены и при исследовании других ФОС:
м'74, М-81, Л-11-6, Л-метильного.
25оАнтихолинэстеРазная активность исследованных веществ in vitro в 20—
О ОоГ меньше> чем У тиолового изомера меркаптофоса, и составляет от
Ноет Д° 0’05 ед’ его активности. Относительная антихолинэстеразная актив-
0 4] Ь Этих пРепаРатов в опытах in vivo повышается и составляет от 0,07 до
активности тиолового изомера меркаптофоса.
189
Относительная токсичность всех исследуемых препаратов была выще
чем следовало бы предположить на основании данных об антихолинэсте-
разной активности in vitro и in vivo. Отсутствие строгой зависимости между
антихолинэстеразным действием in vitro и токсичностью свидетельствует о
том, что в организме они превращаются в более активные антихолинэсте-
разные вещества.
При пероральном однократном воздействии на организм крыс ряда
фосфорорганических инсектоакарицидов (табл. 5.4) в дозах, соответствую-
щих */2 LD50, была выявлена такая же закономерность изменений антихо-
линэстеразной активности, как и в опыте с внутривенным введением ФОП
(см. выше).
Таблица 5.4. Ингибирование активности ХЭ эритроцитов крыс при однократном
пероральном воздействии некоторых ФОП в дозе, соответствующей 1/2 LD50 (по
данным П.Г.Жминько, 1997)
Наименование вещества LDso. мг/кг Сроки и степень ингибирования ХЭ, %
Зч 1 сут 3 сут 7 сут 15 сут
Гетерофос 33 86,1 81 56,9 16,7 3,7
Этафос 375 95,1 91 61,9 67 22,8
ЕШ-7 95 100 70 39,1 22,7 6,9
Тиоловый изомер цик- лофоса 240 91,8 83 58,8 11,9 3,1
Как видно из табл. 5.4, наиболее выраженное угнетение АЗЭ эритроци-
тов крыс отмечается через 3 ч после введения препаратов. В этот период
наблюдалась наибольшая выраженность холинергических симптомов инток-
сикации. Через сутки после введения гетерофоса, этафоса, ЕШ-7 и тиоло-
вого изомера циклофоса произошло восстановление активности АХЭ эрит-
роцитов на 6; 4,3; 30 и 9,6 % соответственно. Через 3 сут клинических
симптомов интоксикации не отмечалось, восстановление активности фер-
мента составляло 38—61 % и на 15-е сутки исследований активность ХЭ не
отличалась от контрольных животных, за исключением этафоса. В условиях
in vitro изученные ФОС являются умеренными ингибиторами холинэстера-
зы, in vivo они оказывают выраженный антихолинэстеразный эффект.
Показано, что антихолинэстеразное действие изученных ФОП значи-
тельно повышается при индукции монооксигеназной системы, что свиде-
тельствует о превращении их в организме в вещества с более выраженными
антихолинэстеразными свойствами. Различия в выраженности и стойкости
антихолинэстеразного эффекта данных веществ зависят от состояния мета-
болизирующей системы, скорости и направленности их метаболизма и дрУ*
гих процессов химического гомеостаза [20, 34].
При дермальном пути поступления ФОС, как и при пероральном, мак-
симальное снижение активности ХЭ проявляется в первые сутки. Однако
угнетение фермента нарастает медленнее, а активность энзима начинает
восстанавливаться и достигает нормы несколько позже, чем при перораль-
ном поступлении. Наблюдаемое более продолжительное изменение актив-
ности ХЭ при дермальном пути поступления связано с депонированием
вещества в липоидах кожи и постепенным высвобождением из “депо’ •
Однако для некоторых соединений, например дифоса (абат), токсическое
действие препарата больше выражено при дермальном пути поступления,
чем пероральном. Это связано с тем, что дифос легко всасывается через
190
оврежденную кожу. Эта закономерность характерна и при субхроничес-
S воздействии дифоса [15]
К Для некоторых соединении, например фталофоса и трихлорметафоса-3
(ТХМФ'3)> антихолинэстеразное действие не зависит от пути поступления
в организм.
По данным Л.П.Даниленко (1969), фталофос при однократном перораль-
ном поступлении в организм крыс в токсических дозах (100 и 125 мг/кг), при
поступлении через кожу крыс и кроликов в дозах 1060, 1200 и 1325 мг/кг.
ингаляционном воздействии (крысы, кошки) в концентрациях 31—65 мг/м3
угнетал активность ХЭ крови и внутренних органов на 45—98 %. Снижение
активности ХЭ отмечалось уже через 1—3 ч и достигало максимума через
94 ч Восстановление фермента до исходного уровня наблюдалось в течение
12 дней.
ТХМФ-3 в токсичных дозах при однократном пероральном и дермаль-
ном воздействии на организм крыс в дозах соответственно 63 и 100 мг/кг,
а также при ингаляционном влиянии на организм кошек (0,017—0,022 мг/м3,
экспозиция 4 ч) вызывал ингибирование активности ХЭ крови и внутренних
органов на 48—98 %. Максимальная степень угнетения ХЭ отмечалась через
24 ч после воздействия. При пероральном и дермальном пути поступления
в организм крыс максимальное снижение активности ХЭ отмечалось в
сердце и печени (89—98 %), минимальное — в больших полушариях голов-
ного мозга (48,1—57,1 %). Активность ХЭ сыворотки крови, цельной крови,
селезенки, почек, продолговатого мозга и мозжечка по степени угнетения
занимала промежуточное место (63,2—81 %).
В большинстве случаев токсичность при ингаляционном поступлении
ФОП в организм выше, чем при введении этой же дозы перорально.
Несмотря на количественные различия эффектов ингаляционного и пер-
орального действия, часто наблюдается их качественная однонаправлен-
ность, выражающаяся в сходстве изменений органов и биохимических по-
казателей подопытных животных.
На высоких уровнях воздействия любая зависимость доза — эффект мо-
жет быть представлена экспоненциальной кривой. В динамике эффективных
Доз более низкого уровня наблюдаются различные вариации, которые, од-
нако, всегда сводятся к S-образным либо экспоненциальным кривым.
При пероральном поступлении ФОС более обоснованной является S-об-
Разная зависимость доза — эффект, так как форма этой кривой отражает
эффективную детоксикацию яда в печени при воздействии малых доз. При
ингаляционном пути поступления более оправданной будет экспоненциаль-
ная зависимость, так как препарат попадает непосредственно в кровь, по-
этому даже малые дозы вызывают заметное угнетение ХЭ и АХЭ [8].
При однократном воздействии независимо от пути поступления в орга-
низм существует зависимость доза — эффект. Чем выше доза антихолинэс-
^Разного вещества, тем больше степень ингибирования АХЭ нервной ткани
®ыРаженности интоксикации. Ингибирование АХЭ эритроцитов при воз-
Ин CrBИИ °ДН0Й и той же дозы вещества может существенно изменяться от
о гибирования АХЭ нервной ткани. Влияние на ХЭ плазмы и внутренних
ОднН°В (печень> почки, селезенка, сердце, мышцы) также зависит от дозы.
Личи ° междУ степенью ингибирования активности холинэстеразы в раз-
Чи ЫХ биосубстратах существует диспропорция, в некоторых случаях зна-
био ЛьНая’ Для отдельных веществ ХЭ плазмы более чувствительна к инги-
висимаНИЮ’ ЧеМ АХЭ эритроцитов, однако чаще наблюдается обратная за-
191
Степень ингибирования активности ХЭ плазмы не всегда соотносится с
тяжестью интоксикации. Типичная холинергическая интоксикация отмеча-
ется только при значительном ингибировании АХЭ нервной ткани.
Некоторые фосфорорганические инсектициды оказывают ингибирующее
действие на карбоксилэстеразы тканей (например, малатион) в дозах, кото-
рые ниже уровней, влияющих на АХЭ и ХЭ. В связи с этим первичное
ингибирование карбоксиэстераз может потенцировать токсичность веществ
для теплокровных животных, детоксикация которых обычно осуществляется
эстеразами тканей.
Признаки интоксикации ФОС могут развиваться сразу или спустя несколь-
ко часов после воздействия. Для более липофильных соединений, которые тре-
буют метаболической активации, симптомы интоксикации развиваются мед-
ленно и могут сохраняться несколько суток. Клиника острой интоксикации
ФОС включает мускариноподобные и никотиноподобные нарушения, изменения
со стороны центральной нервной системы и дыхания.
В зависимости от структуры вещества, скорости и направленности ме-
таболизма может изменяться выраженность тех либо других нарушений
центральной нервной системы.
Первые признаки холинергических симптомов в большинстве случаев
появляются тогда, когда активность АХЭ в крови снижается до 50 %. Об-
щепризнано, что ингибирование активности АХЭ и ХЭ крови для человека
на 75 % является индикатором опасности и требует принятия срочных мер
по устранению воздействия вещества. Ингибирование активности АХЭ на
25—30 % является пороговым эффектом, при котором отсутствуют какие-
либо вредные последствия для здоровья. Активность ХЭ крови восстанав-
ливается медленно и зависит от величины дозы и пути поступления. Однако
такая зависимость между степенью ингибирования АХЭ и клиническими
симптомами интоксикации наблюдается не всегда.
При отравлении человека ДФФ в дозе 3 мг/кг первые симптомы
интоксикации появляются после угнетения ХЭ эритроцитов на 30 %,
падение активности ниже 40 % уже сопровождается тяжелыми симптома-
ми [63].
Общим в действии многих ФОС как в остром, так и хроническом опытах
является зависимость доза — эффект.
С увеличением дозы вводимого вещества усиливается эффект независи-
мо от пути поступления в организм. С нарастанием эффекта в антихолин-
эстеразные механизмы вовлекается все большее количество физиологичес-
ких систем. Степень выраженности ингибирования при введении одних и
тех же доз зависит от видовой чувствительности животных. Вещества с
большим антихолинэстеразным эффектом in vitro проявляют токсическое
действие в первые часы после введения вещества. Для веществ с менее
выраженными антихолинэстеразными свойствами in vitro, а также ве-
ществ, требующих предварительной активации (тионофосфаты), токсичес-
кое действие и антихолинэстеразный эффект проявляются в более поздние
сроки. -
При субхроническом и хроническом действии ФОС зависимость меясоу
степенью ингибирования активности ХЭ крови и тяжестью интоксикаир
может не сохраняться. „а
В некоторых случаях при повторном воздействии ФОС активность Ал
эритроцитов угнетена почти на 100 % без появления признаков интоксик
ции или без какой-либо связи с имеющимися симптомами, возникшим
после получения первой дозы вещества. Одной из причин такой реакии
192 *
ХЭ эритроцитов на повторное воздействие ингибитора ХЭ является чрез-
^чайно низкая скорость восстановления ее активности [30].
ВЫ При хроническом воздействии многих ФОС не отмечается корреляции
У уровнем ХЭ крови и тканей. В различных тканях может наблюдаться
ме,н0направленный эффект (снижение или повышение активности ХЭ). В
Рекоторых случаях наблюдаются фазовые изменения активности ХЭ крови
Н тканей. В восстановительном периоде иногда активность ХЭ в исследуе-
мых биосубстратах подопытных животных выше, чем в контроле.
Выявленные особенности антихолинэстеразного действия при субхрони-
ческом и хроническом влиянии ФОС можно продемонстрировать данными
многих экспериментальных исследований.
Хроническое пероральное воздействие офунака вызывает выраженное
угнетение активности ХЭ эритроцитов, плазмы и печени крыс. Значительно
меньший антихолинэстеразный эффект проявлялся в сером и белом веще-
стве головного мозга, а также в спинном мозге, наименьший — в мозжечке.
Угнетение активности ХЭ в различных биосубстратах зависело от воздейст-
вующей дозы вещества [52].
фозолон при многократном воздействии на организм крыс и кошек в
низких дозе и концентрации (1,04 мг/кг — крысы, 0,27 мг/л — кошки) не
оказывал антихолинэстеразного и токсического действия на организм. В
дозе и концентрации в 2 раза выше вызывал фазовые изменения активности
ХЭ крови и внутренних органов. Степень ингибирования колебалась от 29
до 67,6 %.
С увеличением дозы и концентрации (5,2 мг/кг и 2 мг/л соответственно)
возрастал антихолинэстеразный эффект и поражалось все больше органов
и систем. Такая же зависимость сохранялась и при дермальном воздействии.
Фозолон оказывал более выраженное токсическое действие на организм
кошек, чем крыс.
При хроническом ингаляционном воздействии афоса на организм крыс
и морских свинок в концентрации 4 мг/м3 не выявлено различий в угнете-
нии активности ХЭ в сыворотке, эритроцитах, печени, мозге. Наибольший
антихолинэстеразный эффект отмечался через 2 нед опыта. Снижение ак-
тивности ХЭ в хвостатом ядре полосатого тела и нервно-мышечных синап-
сах выявлено только у морских свинок.
Амидофос и ТХМФ-3 при хроническом воздействии на организм кро-
ликов в дозах, соответствующих 0,02, 0,01 и 0,002 LD50, в первые 2 мес
затравки ингибировали активность ХЭ крови только на 30—40 %. На этом
Уровне активность фермента сохранялась в течение 3—5 мес исследований.
Через 6 мес активность фермента восстанавливалась до уровня контроля.
Амидофос оказывал большее ингибирующее влияние на АХЭ, ТХМФ-3 —
На БуХЭ. При воздействии амидофоса и ТХМФ-3 не выявлено корреляции
между уровнем ХЭ крови и тканей. Через 2 мес пероральной ежедневной
затравки кроликов в дозах, соответствующих 0,02 LDjq, оба вещества вызы-
вали повышение активности фермента в миокарде. Активность ХЭ в мы-
ечной ткани повышалась только при воздействии ТХМФ-3. В печени и
очках не наблюдалось изменений активности ХЭ. Через 6 мес отмечалось
в ачительное повышение ХЭ в почках и мышцах при действии обоих
Ви^ес^в’ В печени активность ХЭ незначительно снижалась под воздейст-
д.?1 ТХМф-3 и повышалась под влиянием амидофоса. Разнонаправленный
быт ТХМФ-3 14 амВД°Ф°са на активность ХЭ органов и тканей может
ь обусловлен различиями в химическом строении пестицидов (связь Р=О
193
7-7127
в амидофосе и связь P=S в ТХМФ-3) и характером метаболических реакций
в этих органах и тканях.
При хроническом ингаляционном воздействии ТХМФ-3 в течение 4 ме
в концентрации 0,0006 мг/л (жидкий аэрозоль) видимые признаки инток-
сикации отсутствовали. Угнетение активности ХЭ в цельной крови состав-
ляло 54,6 %, в легких — 26,8 %, в сердце — 10,3 %, в продолговатом
мозге —19,8 %. В остальных органах и сыворотке крови изменений не
выявлено.
Для некоторых ФОС, особенно тиоэфиров (тиофос, метафос, малатион
и др.), уровень токсичности не соответствовал степени угнетения ХЭ. При
воздействии на организм животных, помимо их антихолинэстеразного дей-
ствия, в патологический процесс вовлекаются ряд важнейших физиологи-
ческих систем, что и определяет их токсикодинамику.
В условиях применения ФОС в сельском хозяйстве характерен преры-
вистый режим воздействия их на организм рабочих. Выяснение особеннос-
тей антихолинэстеразного действия ряда ФОС (афоса, циклофоса, рицида-П
гетерофоса и др.) при монотонном и прерывистом режимах воздействия
показало, что при прерывистом влиянии независимо от пути поступления
в организм исследованные препараты оказывают менее выраженный анти-
холинэстеразный эффект, чем при монотонном. Гистоморфологические и
патобиохимические изменения во внутренних органах и головном мозге
были выражены в меньшей степени, а восстановление активности холинэс-
теразы и нарушенных физиологических функций организма происходило
быстрее при прерывистом воздействии, чем при монотонном [23, 69].
5.4.5. Зависимость токсичности и антихолинэстеразной
активности ФОС от их химической структуры
Успехи в области изучения механизма действия ФОС послужили основ-
ной предпосылкой для более глубокого понимания проблемы связи их
эффектов со строением. Вначале была установлена роль отдельных хими-
ческих группировок в молекуле соединений типа (RO)2(S)X, где К=СНз,
С2Н5, 1С3Н7; X — кислотный остаток. Было показано [30], что наибольшей
токсичностью обладают соединения, в которых фосфор связан с двумя
этоксильными группами. Метоксильные аналоги оказались менее токсич-
ными, чем этоксильные, в 4—12 раз. Токсичность веществ, в которых
фосфор связан с двумя пропилокси- и изопропилоксигруппами, значительно
снижается по отношению к токсичности веществ, в структуре которых
имеются метокси- или этоксигруппы.
В условиях in vitro антихолинэстеразная активность диметиловых эфиров
находилась на уровне диэтиловых эфиров либо была несколько меньшей.
Замена этоксильных групп на изопропилоксильные либо не изменяла анти-
холинэстеразную активность вещества, либо повышала ее.
В организме животных антихолинэстеразная активность диэтиловых
эфиров значительно выше, чем метиловых. Различия в антихолинэстеразной
активности и токсичности диметиловых и диэтиловых эфиров кислот ф°с"
фора связаны с неодинаковой стойкостью их фосфорилированного энзима
в организме животных. Связь диэтилфосфорила с энзимом оказалась более
прочной, чем диметилфосфорила, что и обусловило большую антихолинэс-
теразную активность и токсичность этиловых эфиров, чем метиловых.
Таким образом, следует полагать, что скорость гидролиза диалкилфос'
форилированной ХЭ в организме является одним из ведущих факторов,
194
ловливающих большую токсичность для теплокровных животных ди-
обуС вых эфиров кислот фосфора по сравнению с диметиловыми.
этил табл. 5.5 представлены данные о влиянии на токсичность белых мышей
ы алкоксильного радикала алкильным и диалкиламидо группой. Замена
заМокСильной группы на алкильную, т.е. превращение эфиров фосфорной
аЛКлоты в эфиры фосфиновой кислоты, приводит к значительному увели-
КИнию токсичности. Антихолинэстеразная активность in vitro при этом сни-
мется незначительно. Замена алкоксильной группы на диалкиламидную,
Моборот, приводит к снижению токсичности и сильному понижению анти-
холинэстёразной активности.
Замена этилоксигруппы на изопропилоксигруппу в молекуле тиофторфос-
Лонатов вызывает небольшое понижение токсичности, а замена на фенилок-
сигруппу снижает токсичность в несколько раз. Введение фенилоксигруппы в
молекулу тиофторфосфонатов вместо парахлорфенильной группы приводит к
резкому снижению токсичности.
у Так, величина токсичности LD50 препарата К4, имеющего в своей струк-
туре этилоксигруппу, составляет 6,4 мг/кг, препарата Kj (с изопропилокси-
группой) — 9,6 мг/кг, препарата Kjv(c фенилоксигруппой) — 44 мг/кг, пре-
парата К5 (с пара-хлорфенильной группой) — 2400 мг/кг. Изменение анти-
холинэстеразной активности у данных соединений in vitro происходило в
противоположном направлении. Антихолинэстеразная активность препарата
К5 была в 7,2 раза выше, чем у препаратов К4 и К2-
Таблица 5.5. Зависимость токсичности и антихолинэстеразной активности от
строения радикалов в некоторых алкилмеркаптоалкиловых эфирах тиофосфор-
ной и тиофосфиновой кислот [30]
i Формула Лаборатор- ный шифр LDcq, мг/кг Относи- тельная токсич- ность, % l50, моль Относи- тельная антихолин- эстераэ- ная актив- ность, %
С2Н5°\ М-74 4,6 100 1,5-Ю-4 ЮО С2Н5о// ^SCHjCHjSC^j Сн3 //$ ГД'15 1,7 270 2•10—4 75 С2Н5(/ ^sch2ch2sc2h5 C2hsQ zO Меркап- 5,6 100 5,8 • 10-7 Ю0 \ " тофос тиоловый С2Н5° SCH2CH2SC2H5 (C2H5)2N О Гд-54 9,8 57 3,3 Ю-5 0,57 \/ р \сн2СН2SC2H5
1 г 195
1
По данным Н.Н.Годовикова [9], ингибирующее действие О-этил-S-R
бутилметилтиофосфонатов типа СНз(КО)Р(О)5С4Н9 по отношению к бути2
рилхолинэстеразе значительно увеличивается (в 18 000 раз) при удлинений
О-алкильного радикала от метильного до гептильного.
Повышение значений константы скорости взаимодействия К2 происхо-
дило неравномерно. При взаимодействии с АХЭ удлинение О-алкильного
радикала данного типа соединений сопровождалось увеличением К2 лишь
при переходе от метильного к бутильному производному. При дальнейшем
увеличении R-антихолинэстеразная активность несколько уменьшалась и
колебалась в незначительных пределах. Поскольку электрофильная фосфо-
рилирующая активность (рКа) практически одинакова, полагают, что изме-
нения К2 связаны с изменением способности ФОС к образованию фермент-
субстратного комплекса. В связи с этим можно считать, что антихолинэс-
теразная способность ФОС связана с гидрофобной сорбцией и зависит от
длины О-алкильного радикала. Поскольку гидрофобная сорбция ФОС на
АХЭ менее выражена, чем на БуХЭ, то и ингибирующая способность в
отношении АХЭ наблюдается в меньшей степени.
Таким образом, способность ФОС ингибировать ХЭ зависит в значительной
степени от характера группировок, связанных с атомом фосфора, которые не
отщепляются в процессе фосфорилирования фермента. Величина и степень
разветвленности алкоксильных, алкильных, диалкиламидо- и других группировок
сильно влияют на способность к образованию ферментингибиторного комплек-
са и антихолинэстеразную активность ФОС.
Вторая группа закономерностей касается влияния на токсичность ФОС
в зависимости от строения групп Х-кислотного остатка и Y-(P=O(S)).
Интересные закономерности выявлены при изучении зависимости ток-
сичности алкилмеркаптоэтиловых эфиров тиофосфорных кислот — общей
формулы (RO)2PSSCH2CH2SRi от строения алкила (R0.
Показано, что с увеличением длины углеродной цепочки в составе ра-
дикала R[ токсичность веществ уменьшается. Наиболее токсичными оказа-
лись метилмеркаптоэтиловые соединения, менее токсичными — этилмер-
каптоэтиловые и наименее токсичными — пропилмеркаптоэтиловые и бу-
тилмеркаптоэтиловые.
На токсичность алкилмеркаптоалкиловых эфиров дитиофосфорной кис-
лоты существенное влияние оказывают также количество метиленовых
групп между двумя атомами серы и наличие в боковой цепи атомов серы-
С увеличением количества метиленовых групп между атомами серы от одной
до двух в алкилмеркаптоалкиловых эфирах токсичность соединений снижа-
ется в несколько раз.
Иная зависимость антихолинэстеразных свойств ФОС от строения ал-
кильного радикала получена Е.В.Розенгартом (1964) при изучении О-этил-
S-алкил-метилтиофосфинатов типа C2H5O(CH3)P(O)SR.
В ряду соединений с нормальным алкильным радикалом антихолинэс-
теразное действие по отношению к БуХЭ и АХЭ резко возрастало с удли-
нением цепи вплоть до гексильного производного (R^CgH^), а затем
практически не менялось. В ряду соединений, содержащих С(СНз)з*грУпГ1У
в тиоалкильном радикале ^=(СН2)пС(СНз)з], при постепенном отдалении
этой группы от атома фосфора антихолинэстеразная активность сначала сни-
жалась (минимум при п = 2), а затем возрастала вплоть до соединения ~
п = 4 и в дальнейшем оставалась неизменной. Наиболее сильным антихолиН"
эстеразным действием обладали вещества с п = 4, 5 и 6. По эффективност
они приближались к известному ингибитору холинэстеразы армину.
196
Как видно, различия в антихолинэстеразной активности исследованных
ств определяются пространственной конфигурацией их молекулы, ко-
веиХя в значительной степени зависит от характера и величины индукцион-
ного эффекта.
" В зависимости от характера индукционного влияния все заместители
0 разделить на 2 группы и расположить по силе их индукционного
эффекта следующим образом.
Заместители, оказывающие отрицательный индукционный эффект:
F > О > CI > Вг > ОСН3 > С6Н5.
Заместители, оказывающие положительный индукционный эффект:
СН3 < С2Н5 < СН(СН3)2 < С3н7 < С(СН3)3.
Индукционный эффект водорода равен 0.
Исследованиями, проведенными И.А.Франковым [82], показано, что
антихолинэстеразная активность некоторых ФОС, относящихся к амидам,
диалкилфосфорным кислотам, пирофосфатам и соединениям, построенных
по типу пирофосфатов, но содержащих в качестве связи между атомами
фосфора не кислород, а атом азота или более сложные группировки, повы-
шается при введении:
• в амидную группу заместителей, проявляющих отрицательный индук-
ционный эффект;
• в оксиалкильные радикалы заместителей, проявляющих положитель-
ный индукционный эффект.
Антихолинэстеразная активность ФОС снижается при замещении:
• любого водородного атома амидной группы заместителями, оказыва-
ющими положительный индукционный эффект;
• любого водородного атома оксиалкильных радикалов заместителями,
оказывающими отрицательный индукционный эффект.
Чем больше индукционное влияние вводимого заместителя, тем сильнее
проявляются антихолинэстеразные свойства веществ. Однако возможность
усиления антихолинэстеразных свойств ФОС путем повышения положи-
тельного индукционного влияния алкильных радикалов, идущего за счет
удлинения углеводородной цепи последних, ограничена, так как при этом
резко снижается растворимость исследуемых веществ.
Многочисленными работами Н.Н.Годовикова и соавт. показано, что
антихолинэстеразная активность эфиров монотиокислот фосфора в значи-
тельной степени зависит от положительного заряда на атоме сульфидиола
серы (в этилтиоалкильной группе), увеличения расстояния между атомами
и атомом сульфониевой серы (в метилсульфометилатах), изменений усло-
и сорбции ФОС на активной поверхности фермента, индукционного
ияния положительного заряда, изменяющего электрофильную фосфори-
РУЮщую способность, от длины и степени разветвленности алкильных,
коксильных и алкотиольных радикалов, от природы заместителя [7].
а у ФОС, построенных по типу эфиров и тиоэфиров, токсичность и
(bn |?{0линэстеразная активность существенно зависят от характера связей
v сфора с кислородом и серой.
Наибольшей токсичностью и антихолинэстеразной активностью облада-
197
ют соединения, где фосфор связан с атомом кислорода (Р=0), чем с атомом
серы (P—S). Более высокая токсичность веществ со связью Р=0 характери-
зуется не только меньшими величинами летальных доз, но и более быстрым
развитием их токсического действия.
Так, если после введения летальных доз ФОИ со связью Р=О (М-96
фосфакола) гибель белых мышей наблюдалась в первые 5—10 мин, то при
введении веществ со связью P=S (М-93, М-98) животные погибали в течение
2—3 сут. Это свидетельствует о том, что тиофосфаты и дитиофосфаты
постепенно превращаются в организме в анти холинэстеразные агенты.
Изложенные в данном разделе частные закономерности находят единое
объяснение благодаря раскрытию основных механизмов действия ФОС на
АХЭ, ХЭ и холинорецепторы.
В результате поляризации сложноэфирной группировки ФОС, а также
вследствие того, что р-электроны двойной связи оттянуты от фосфора в
сторону кислорода (в эфирах фосфорной кислоты), на фосфоре создается
дефицит электронов, что облегчает его взаимодействие с нуклеофильной
группой эстераз. Исходя из этого, легко объяснить, почему тионовые эфиры
в отличие от тиоловых являются слабыми ингибиторами ХЭ. Атом серы,
связанный двойной связью с фосфором, оттягивает электроны от фосфора
во много раз слабее, чем кислород, и тем самым уменьшает реакционную
способность молекулы ФОС и ее способность фосфорилировать фермент.
Введение электрофильных атомов в группу X благодаря индукционному
эффекту приводит к созданию на атоме фосфора электронного облака
меньшей плотности, что способствует взаимодействию группы X с гидрок-
силом серина активного центра ХЭ. Индукционный эффект электрофиль-
ных атомов вследствие перераспределения электронной плотности в моле-
куле способствует ее поляризации. Полярность молекулы обусловливает
характер ее распределения в различных растворителях, способность проник-
новения через биологические мембраны. Введение в молекулу электрофиль-
ных атомов отражается на степени ионизации молекулы, т.е. на величине
рКа. Эта величина показывает значение pH, при котором 50 % кислоты
ионизировано. Электрофильные атомы F, Cl, NO2, О понижают величину
рКа, т.е. увеличивают кислотные свойства молекулы.
На взаимодействие ФОС с ХЭ электронные факторы оказывают значи-
тельное влияние. Показана высокая взаимосвязь между степенью угнетения
ХЭ ФОС, имеющих в структуре ароматическое ядро, и характером замести-
теля в бензольном кольце. Мерой влияния заместителя в ароматическом
ядре на реакционную способность соединений является константа Гаммета
[28]. В алифатических соединениях такой мерой служит константа Тафта d
[83]. T.Fucuto и соавт. (1972) выявлена высокая корреляционная взаимосвязь
между константой Тафта различных радикалов в алкильных группах и их
токсичностью по отношению к комнатной мухе и способностью к гидролизу
для ФОС следующего строения:
С2Н5О о
Для этил-р-нитрофенилалкилфосфонатов C.Hansch и E.W.Deutsch усы-
новили высокую корреляционную взаимосвязь между константой Тафта Es,
198
Р° х факторов в антихолинэстеразном действии ФОС
л,еС торы определяют пространственное взаимоотношение
ФаКблегчают или, наоборот, затрудняют взаимодействие
ктеризующей стереоспецифичность заместителя, и константой ингиби-
хаРа„,ла АХЭ мозга комнатных мух ке, что доказывает важную роль стери-
[100]. Стерические
атомов в молекуле
одних молекул с
ДРУ Различают три вида стереоизомерии — оптическую, геометрическую и
„формационную [12]. Оптическая изомерия связана с наличием в моле-
ре асимметричного атома, соединенного с четырьмя различными замес-
ителями. В молекуле ФОС асимметричными могут быть атомы фосфора
и углерода. Оптическая изомерия за счет асимметричного атома фосфора
может проявляться у многих фосфонатов, у которых фосфор связан с
одним алкильным остатком через кислород, а другим непосредственно
(С-Р-связь).
Примером такого соединения служит хлорофос. За счет асимметрии при
углеродном атоме оптически активным может быть карбофос. Препарат под
шифром Ш-142 (синтезирован в лаборатории М.И.Кабачника) имеет два
асимметричных центра — на атоме фосфора и атоме углерода.
Оптически активные ФОС проявляют различную антихолинэстеразную
активность. В токсичности и антихолинэстеразной активности оптических
изомеров важную роль также имеют особенности строения активного центра
ХЭ.
В составе активного центра ХЭ имеются 1-аминокислоты, которые могут
определять неодинаковую реакционную способность при взаимодействии с
ними двух энантиомеров.
Геометрическая или цис-транс-изомерия свойственна соединениям,
имеющим двойную связь между атомами углерода или полиметиленовую
цепочку. Свободное вращение вокруг углеродных связей невозможно, поэ-
тому молекулы таких соединений обладают определенной степенью жест-
кости и различное расположение атомов в них приводит к образованию
геометрических изомеров. В цис-изомерах заместители расположены с од-
ной стороны от двойной связи, в транс-изомерах — с разных сторон.
Геометрические изомеры, так же как и оптические, проявляют разную
антихолинэстеразную активность. Так, цис-изомер мевинфоса имеет в 10
раз более высокую константу скорости угнетения АХЭ мозга мух, чем
транс-изомер. Высокая антихолинэстеразная активность и токсичность цис-
изомера мевинфоса может быть объяснена тем, что у него расстояние между
фосфором и карбэтоксильной группой приблизительно соответствует рас-
стоянию между анионным и эстеразным центрами АХЭ (0,475 нмоль).
у транс-изомера мевинфоса это расстояние равно 0,33 нмоль, что, вероятно,
затрудняет его взаимодействие с АХЭ. Однако Фукуто [83] полагает, что
олее высокая скорость угнетения АХЭ цис-изомером мевинфоса может
ыть объяснена более выгодным энергетическим переходным состоянием,
инетический анализ с определением констант сродства цис- и транс-изо-
еров мевинфоса к АХЭ и констант фосфорилирования показал, что их
Ручная антихолинэстеразная активность зависит в большей степени от
купонной способности, чем от стерических факторов.
^Наряду с оптической и геометрической изомерией в реакции ФОС с
разлМ0Жет иметь значение также конформационная изомерия. Среди
ствеИбНЫХ положений> которые молекулы могут принимать в простран-
Имек> ЛагодаРя способности вращения их атомов вокруг простых связей,
тся отдельные предпочтительные устойчивые конформации. Конфор-
199
мационные углы в молекулах ингибиторов и субстратов могут влиять на их
реакции с АХЭ.
В настоящее время можно считать доказанным, что реакционная спо-
собность ФОС определяется тремя типами факторов: электронными, стери-
ческими и гидрофобными. В данном разделе рассмотрены только некоторые
общие положения о связи действия ФОС с их химическим строением, в
отдельных случаях эта зависимость определяется рядом других факторов
которые играют важнейшую роль в токсичности ФОС. В частности, это
способность ФОС проникать через биологические мембраны и тканевые
барьеры и роль стереоспецифической регуляции биологических мембран в
проникновении молекул веществ внутрь клеток и организма. Частные и
общие положения теории зависимости биологического действия ФОС от их
структуры отражены в многочисленных работах и обзорах [7, 9, 24, 25 31
56, 72, 75, 82-84, 96, 98, 102, 103, 106]. ’ ’
5.5. Токсикокинетика ФОС
Большинство ФОС не ионизируются и обладают значительными липофиль-
ными свойствами. В связи с этим при поступлении в организм через желудок,
легкие, кожу они легко всасываются.
Всасывание через ЖКТ большинства ФОС протекает относительно бы-
стро и эффективно. Максимальная концентрация в крови для различных
ФОС наблюдается от нескольких часов до суток после введения яда и
зависит от особенностей строения ФОС, дозы, вида животного и других
факторов. Распределение ФОС между различными органами происходит
неравномерно. При пероральном введении радиоактивно меченных ФОС
вначале отмечается максимальный уровень в печени и легких, затем в крови
и несколько позже в других органах.
Всасывание ФОС через легкие происходит быстро и для многих веществ
может считаться полным. Рассчитаны коэффициенты поглощенной дозы
для некоторых ФОС в зависимости от воздействующей концентрации. По-
казано, что при воздействии бутифоса, метилмеркаптофоса, хлорофоса, фос-
фамида в концентрациях от 0,01 до 0,09 мг/м* наблюдается полное погло-
щение их паровой фазы в дыхательных путях животных. Коэффициент
поглощения (Kv) равен 1,0. При повышении концентраций от 0,1 до 0,69 мг/кг
поглощается не все количество вещества, содержащееся в воздухе. В этом
случае Kv для различных веществ составлял 0,53—0,83 [55].
При дермальном пути поступления степень поглощения вещества зави-
сит от дозы, концентрации, площади, целостности и состояния кожи, гид-
рофобности вещества, присутствия растворителей и эмульгаторов, которые
могут способствовать всасыванию. Концентрация вещества в крови нарас-
тает плавно, максимальный подъем определяется спустя несколько дней [30,
54, 81]. Для высоколипофильных веществ, не проходящих стадию первичных
метаболических превращений в печени (DEF, ЕРМ), всасывание через кожу
очень значительное, и их токсичность может быть такой же, как и при
пероральном поступлении.
Наиболее опасный путь поступления ФОС — внутривенный. При внут-
ривенном введении сразу создается высокая концентрация вводимого веще-
ства в крови, что приводит к выраженному токсическому эффекту. Однако
высокий уровень вещества сохраняется недолго. По данным J.E.Casida и ДР-’
дихлофос в дозе 1 мг/кг при внутривенном введении коровам снижал
200
ность холинэстераз на одну треть. Та же доза дихлофоса, введенная
акТИВожу или перорально, была неэффективной [92]. Показано, что при
п°д ^венном введении легкие являются своеобразным депо для ФОС,
внУФ сорбируюТся на поверхности легочных капилляров. При этом кон-
к0Т°Р ,,мЯ ФОС в легких в 20—30 раз превышает уровень равномерного
ЦеНТР4и^ния [4 5]
раСрР зависимости от введенной дозы, пути поступления, липофильности
ФОС изменяются их распределение и накопление в различных органах и
Фа„ях. При дробном введении некоторых веществ может проявляться боль-
ший токсический эффект, чем от той же дозы, введенной одномоментно.
Распределение ФОС в различных органах и тканях организма также
ависит от способности проникать через мембраны и гистогематические
барьеры и неспецифической сорбции на мембранах, с белками и липопро-
теидами. г-
Большие концентрации ФОС обнаруживаются в печени и легких как
первых органах на пути поступления веществ в организм и могут значитель-
но превышать их содержание в крови в ранние сроки после введения.
Высокие концентрации ФОС также отмечаются в почках. Более низкие
концентрации обнаруживаются в жировой клетчатке, коже, мышцах, сердце,
мозге, костях, в стенке желудка и составляют величины, в 2—3 раза мень-
шие, чем в крови.
Однако вещества с выраженными липофильными свойствами, содержа-
щие циклическую структуру (абат, корал, дурсбан, циклофос и др.), способ-
ны накапливаться в жировой ткани в неизменном виде и их содержание
может составлять до 43 % введенной дозы.
Независимо от способа введения концентрации многих ФОС в мозге зна-
чительно меньше, чем в других тканях. Это связано с тем, что гематоэнце-
фалический барьер наиболее трудно проницаем для ФОС.
Значительное влияние на проницаемость ФОС через гематоэнцефали-
ческий барьер оказывают липофильность молекулы ингибитора и наличие
в ней заряда. Чем выше липофильность вещества, тем больше оно проникает
в мозг. ФОС, имеющие положительный заряд, практически не способны
проникать в мозг. С увеличением дозы снижается роль гистогематических
барьеров в распределении ФОС в организме и их распределение между
органами приближается к равномерному [61].
Исследованиями на экспериментальных животных показано, что боль-
шая часть меченной радиоактивными изотопами дозы ФОС выводится с
мочой и меньшая с воздухом и экскрементами. Некоторые соединения
выделяются также с молоком.
Большинство ФОС быстро метаболизируются и выводятся из организма;
скорость выведения обычно достигает пика за 2 дня, затем быстро снижа-
ется, однако не достигает нуля из-за накопления в жировой ткани и связы-
вания с различными белковыми структурами.
С увеличением гидрофобности ФОС неспецифическая сорбция на мем-
Ранах эритроцитов, белках сыворотки крови (альбуминах), липопротеидах
озрастает и носит обратимый характер. Постепенное высвобождение ФОС из
к азанного состояния может поддерживать свободную концентрацию их в
Ровц, в связи с чем отмечается пролонгирование токсического эффекта.
ацтИсан слУчай отравления человека фенитротионом [95], когда после отмены
Hoirr^0™0^ теРапии (атропина и оксимного реактиватора) возобновлялись
(то^РИ06 ингибирование АХЭ и клинические симптомы интоксикации
Шнота, диарея), что связывают с периодами мобилизации жировой ткани.
201
5.6. Метаболизм ФОС
ФОС в организме теплокровных животных и человека могут подвергать
ся различным химическим превращениям. В результате метаболизма обпа'
зуются продукты распада, имеющие большую полярность и гидрофильность
по сравнению с исходным веществом, что обеспечивает их быстрое выве-
дение почками.
Метаболизм ФОС может протекать по двум направлениям: детоксикации
когда образуются метаболиты, менее токсичные, чем исходное соединение и
активации, когда в ходе метаболических превращений возникают высокоток-
сичные метаболиты. На самом деле метаболизм ФОС — это сложный биоло-
гический процесс, включающий многообразие путей превращения с участием
различных ферментных систем организма и направленный на поддержание
химического гомеостаза. Детально информация о биологическом превращении
ФОС изложена в работах разных авторов [18, 31, 61, 71, 96, 106].
Ниже представлены основные типы превращений ФОС в организме
животных и человека.
Гидролиз. Гидролитическое расщепление представляет собой наиболее
часто встречающийся путь ферментативного превращения ФОС и в боль-
шинстве случаев приводит к детоксикации.
Гидролиз ФОС осуществляется ферментами-гидролазами, широко пред-
ставленными в тканях млекопитающих (печень, плазма, кишечник и др.).
В зависимости от места гидролиза в молекуле ФОС выделяют фосфатазы —
ферменты, расщепляющие связи при атоме фосфора; карбоксилэстеразы,
действующие на сложноэфирные связи; карбоксиламидазы, осуществляю-
щие гидролиз карбоксиламидной связи.
В результате ферментативного гидролиза образуются ионизированные
продукты, обладающие большей гидрофильностью и лишенные антихолин-
эстеразных свойств. Более подробно изучен гидролиз ангидрид но-кислотной
эфирной связи триэфиров (рис. 5.2) и гидролиз эфирных связей карбоновых
кислот и карбоксиламидных связей ФОС (рис. 5.3).
Метаболизм ФОС, содержащих галоидангидридную связь (ДФФ, табун,
зарин, зоман и др.), осуществляется путем гидролиза ангидридной связи при
помощи ферментов, известных как А-эстеразы или фосфорилфосфатазы.
Образующиеся диалкилфосф(он)аты чаще всего не подвергаются дальней-
шим превращениям и выводятся в основном с мочой.
Гидролиз эфирных связей карбоновых кислот и карбоксиламидных свя-
зей в ФОС может катализироваться карбоксилэстеразами (В-эстеразами).
Наиболее изучен гидролиз подобным путем у малатиона. Важность этого
пути метаболизма подтверждается тем фактом, что при ингибировании
карбоксилэстераз тканей токсичность малатиона повышается в 100 раз.
Трансферазные реакции. Трансферазы локализованы в печени и некото-
рых других тканях, участвуют в отщеплении в молекуле ФОС алкильных и
арильных радикалов с последующей конъюгацией их с глутатионом или
серной кислотой. Реакции конъюгации способствуют выведению первичных
продуктов метаболизма, которые обычно не обладают антихолинэстеразной
активностью и менее токсичны. Однако при накоплении в организме они
могут вызывать различные токсические эффекты. Глутатионзависимое деал-
килирование характерно для ряда диметиловых эфиров фосфорной и тион-
фосфорной кислот (метафос, метилнитрофос, бромофос, базудин, сумитиоН,
фосдрин и др.). В результате трансферазных реакций образуются S-алкИЛ
или S-арилглутатион и О-деалкилпроизводное ФОС.
202
о
II
a. (i-C3H7O)2P —F
Диизопропилфторфосфат
C2HSO . О
б. Р—CN
(CH3)2N ч
Табун
Параоксон
СН3О О
\ //
Г. Р—ОСН=СС12
СН3О
Дихлорвос
Рис. 5.2. Гидролиз триэфиров [18].
---— (i - С3Н2О)2 Р ОН + F"
С2Н5О о
---•- Р ОН +CN”
(CH3)2N
о
II
---► (С2Н5О)2 РОН + NOj—О’
СН3О о
---•- Р^ОСН=СС12
ОН^
Деметилированный дихлорвос
Биологическое окисление. Большую роль в биологическом окислении
играют ферментные системы, локализованные в эндоплазматическом рети-
кулуме печени и других органов и имеющие общее название — оксидазы
смешанных функций. Реакции окисления чужеродных соединений протека-
ют с участием кофермента — восстановленного никотинадениндинуклеоти-
да (НАДФ Нт), иногда НАД-Нт, молекулярного кислорода, цитохромов Ь< и
Р-450.
1. Окислительная десульфурация — это реакция отщепления серы, свя-
занной с атомом фосфора, и замена ее кислородом. В результате окисли-
тельной десульфурации тио- и дитиофосфаты, не обладающие или имеющие
слабую антихолинэстеразную активность, превращаются в кислородные ана-
логи с выраженными антихолинэстеразными свойствами. Окислительная
десульфурация доказана для метафоса, карбофоса, фосфамида, метилнитро-
фоса, ЕГ-20 и др. Большая скорость этой реакции наблюдается у насекомых,
s о
II II
а. (СН3О)2 Р S СН СОС2Н5 Карбоксилзстераза
СН2СОС2Н5
Малатион
S О
б- (СН3О)2 S СН2 S NHCH, Амилаза
Диметоат
Ис- 5.3. Гидролиз функциональных групп [18].
(СН,О)2 Р S СН С ОН
I
СН2СОС2Н5
а-Монокислота
S О
II II
(СН3О)2 Р S сн2 с он
Кислый диметоат
203
с чем, вероятно, связана избирательность действия тиофосфатов по отНо
шению к насекомым [64].
2. Окислительное N-деалкилирование — отщепление алкильных радика-
лов, связанных с атомом азота. Окислительному N-деалкилированию под-
вергаются диалкиламидопроизводные кислот фосфора. Реакция протекает
поэтапно. Вначале гидроксилируется метильная или этильная группа по
а-углеродному атому. Затем следует отщепление алкоксильной группы в виде
альдегида. Окислительное N-деалкилирование характерно для дикротофоса
нувакрона, фосфамида, октаметила. ’
3. Окислительное О-деалкилирование — реакция отщепления алкила
связанного с фосфором через кислород. В результате О-деалкилирования
триэфиры преобразуются в диэфиры, обладающие меньшей антихолинэсте-
разной активностью и токсичностью. В связи с этим процесс превращения
ФОС рассматривают как детоксикацию. О-деалкилирование показано ддя
хлорфенвинфоса и гордоны.
4. О-деарилирование — тип окислительного превращения ФОС, пред-
ставляющий собой отщепление ароматического радикала, связанного с фос-
фором через кислород. В отличие от О-деалкилирования, которое характер-
но для фосфатов, эта реакция протекает только с фосфоротиоатами (тиона-
тами). О-деарилирование доказано для тиофоса и базудина. Обычно эта
реакция протекает одновременно с окислительной десульфурацией. В отли-
чие от последней в результате О-деарилирования образуются продукты,
лишенные антихолинэстеразных свойств и обладающие меньшей токсич-
ностью.
5. Окисление тиоэфиров. Для алкилмеркаптоалкильных производных
кислот фосфора (меркаптофоса, метилмеркаптофоса, тимета, байтекса, ди-
сульфотона и др.) важное значение в их метаболизме имеет окисление
сульфидного атома серы в фосфор-серо-углеродной части молекулы. В ре-
зультате окисления образуются сульфоксиды и сульфоны, являющиеся более
активными ингибиторами АХЭ, чем исходное соединение.
6. Окисление алкильных групп. Окисление алкильной группы впервые
было установлено для триортокрезилфосфата. Образование циклического
соединения идет через стадию гидроксилирования метильной группы с
последующей циклизацией. Циклический продукт обладает более выражен-
ной антихолинэстеразной активностью и токсичностью. Окисление замес-
тителей в алифатическом ядре характерно для диазинона, ТПЭФ, фенитро-
тиона, метилпаратиона. Этот процесс протекает ступенчато с окислением
простых алкильных групп до уровня гидрокси-, окси- или карбоксипрои-
зводных.
Другие виды ферментативных превращений ФОС. Определенную роль в
метаболизме ФОС играют также реакции восстановления и дегидрохлори-
рования.
Реакции восстановления протекают при участии редуктаз, в присутствии
кофермента НАДФ. Известны реакции восстановления нитрогруппы в амино-
группу и альдегидной группы в спиртовую. Примером реакции восстановления
является восстановление нитрофенольной группы тиофоса в аминофенольнуЮ-
Эту реакцию рассматривают как детоксикацию тиофоса, поскольку амино-
группа обладает электронодонорными свойствами и в силу индукционного
эффекта снижает величину положительного заряда на атоме фосфора, что
делает невозможным взаимодействие аминопроизводного тиофоса с эстераз"
ным центром фермента. Восстановление альдегидной группы антио приводи'
к образованию фосфамида (диметоата) — более токсичного, чем антио.
204
4
Реакции дегидрохлорирования могут протекать в живом организме. Од-
Г доказательств ферментативного характера этого процесса пока не име-
цако данным С.С.Михайлова и И.Г.Щербак [57], реакция дегидрохло-
еТСЯования в организме животных может осуществляться спонтанно. В ре-
РИР тате дегидрохлорирования хлорофоса образуется более токсичный
дДВФ (дихлофос).
5.7. Избирательное действие ФОС
Проблема избирательной токсичности является одной из наиболее важ-
ных и трудных теоретических проблем современной биологии и медицины.
По А Альберту [2], избирательность вещества — это его способность воздей-
ствовать на клетки только одного определенного типа и не влиять на другие,
даже находящиеся в контакте с первым. Известно большое количество
избирательных веществ. В медицине и ветеринарии они называются лекар-
ственными препаратами, тогда как средства для уничтожения сорняков,
насекомых и грибов — пестицидами.
Принципы, лежащие в основе избирательного действия всех этих соеди-
нений, одинаковы. Выделяют три основных фактора, определяющих воз-
можность проявления избирательной токсичности биологически активными
веществами.
Первый фактор, обусловливающий избирательность, — это способность
вещества накапливаться во вредных клетках, которая может быть вызвана
морфологическими особенностями; например, сильная опушенность сорня-
ков по сравнению с культурными злаками или относительно большая (в
расчете на единицу массы) уязвимая поверхность тела насекомых по срав-
нению с млекопитающими, что приводит к большей площади контакта
вещества с вредным видом. В большинстве случаев избирательное накопле-
ние осуществляется по более сложным механизмам и связано с различиями
во всасывании, распределении и выведении вещества. Важное значение в
процессах распределения и накопления имеет проницаемость природных
мембран.
Второй фактор, который обусловливает избирательность, связан с био-
химическими различиями. Несмотря на универсальность и фундаменталь-
ность биохимической основы организмов, известно множество различий в
биохимических процессах различных клеток и тканей (как у одного и того
же вида, так и разных видов), что позволяет с успехом использовать этот
фактор для поиска избирательно действующих веществ. Примером могут
служить особенности в строении ДНК и РНК, количественные и качест-
венные различия ферментов; отличия путей метаболизма как естественных
веществ, так и ксенобиотиков; наличие специфических гормонов и т.д.
1ретий фактор — это цитологические различия, которые весьма значи-
cofibf“bI У Растений, насекомых и животных. Кроме того, различаются между
ои и клетки разных тканей одного и того же организма.
Наиболее Фундаментальные исследования по вопросу избирательной
возмИЧНОС™ ФОС были проведены РД.О’Брайном [63]. Им рассмотрены
схе °Жные механизмы избирательной токсичности ФОС и предложена
ма различных видов избирательности (схема 5.1).
эКолазличают избирательность экологическую и физиологическую. Под
°бИТаГИческ°й избирательностью понимают особенности поведения и место
Мет НИя насекомых. Например, системные внутрирастительные ФОС —
лмеркаптофос, нитратион, фосфамид — вызывают гибель прежде всего
205
Схема 5.1. РАЗЛИЧНЫЕ ВИДЫ ИЗБИРАТЕЛЬНОСТИ ПО Р.Д.О’БРАЙНУ
тех насекомых, которые питаются соками растений, содержащих эти веще-
ства.
Физиологическая избирательность связана либо с различиями во всасы-
вании веществ, либо с разной судьбой его внутри организма различных
видов (внутренняя избирательность). Применительно к пестицидам харак-
терна чаще всего внутренняя избирательность, возникающая уже после
всасывания яда в организм, хотя для ионизированных соединений, а также
веществ, имеющих достаточно поляризованные молекулы, факторы, связан-
ные с проникновением веществ в кровоток (всасывание из ЖКТ, кожи,
слизистых оболочек), имеют немаловажное значение.
Все же в основе механизмов избирательной токсичности ФОС лежат
особенности их метаболизма в различных организмах и влияния на фермен-
ты и рецепторы, ответственные за развитие токсического процесса.
Избирательность, связанная с особенностями проникновения (всасыва-
ния) ФОС, определяется, во-первых, различиями анатомического строения
и химического состава между наружными покровами насекомых и млеко-
питающих; во-вторых, тем, что величина отношения поверхности тела к его
объему у насекомых значительно выше, чем у млекопитающих. Вероятно,
эти два обстоятельства и определяют тот факт, что у млекопитающих раз-
личия в токсичности при инъекции инсектицида и его местном нанесении
выражены гораздо больше, чем у насекомых. Так, LD50 малатиона при
инъекции и местном нанесении для американского таракана составляет 8,4
и 23,6 мкг/кг, для крыс — 50 и более 4000 мг/кг.
Кроме того, у насекомых проницаемость интегумента более высокая, чем
кожи у теплокровных. Скорость всасывания через наружные покровы зави-
сит от полярности молекулы ФОС, природы растворителя, места апплика-
ции, дозы вещества, наличия и степени активности детоксицирующих фер-
ментов и других факторов.
Как известно, точкой приложения действия всех контактных ФОС слу-
жит АХЭ центральной нервной цепочки насекомых. Обязательным условием
206
проявления специфического действия является проникновение инсек-
в эту область организма насекомого. Нервная система насекомых
„..а жесткой гомогенной оболочкой и надежно защищена от проник-
П°вения ионизированных соединений. Поскольку у насекомых нервно-мы-
Н<ечные синапсы носят не холинергический характер (нейромедиатором
Ш-х синапсов служит глутамат),что в отличие от млекопитающих при
э*йствии неионизированных ФОС гибель насекомых связана только с цент-
________14rxUUPUnnnQUULTP ГПР nUUAUUO UP ГТТГЧГТЧ^HRI ГТгЛГМЛЛIZ5TL
для
тццида
покрыта
щечные
этих <
Дальными эффектами. Ионизированные соединения не способны проникать
в нервную цепочку насекомых и, следовательно, лишены токсичности для
этого класса животных.
у млекопитающих соединения антихолинэстеразного действия, если они
и не проникают в центральную нервную систему, могут оказывать выражен-
ный периферический эффект, подавляя АХЭ нервно-мышечных синапсов
и нарушая тем самым нервно-мышечную передачу. Поскольку у млекопи-
тающих токсический эффект и смерть могут развиваться в результате как
центрального, так и периферического действия ФОС (остановка дыхания в
результате нервно-мышечного блока и паралича дыхательной мускулатуры,
наличия бронхоспазма и т.д.), ионизированные соединения для них столь
же опасны, как и неионизированные.
Выраженная непроницаемость барьеров ЦНС для ионов характерна не
для всех членистоногих. Некоторые червецы тли, насекомые из отряда
полужесткокрылых, а также клещи, подобно млекопитающим, весьма чув-
ствительны к ионизированным ФОС.
В связи с этим всех животных можно разделить на две группы. Одна из
них охватывает млекопитающих, клещей и тлей, другая — остальных живот-
ных. Первые могут быть убиты как ионизированным или способным к
ионизации соединением, так и неионизированным. Вторые чувствительны
только к неионизированным соединениям.
Различия в распределении и накоплении ФОС в определенных структу-
рах организма насекомых и млекопитающих также могут обусловливать
различия в их токсичности для этих классов животных.
Распределение ФОС в организме теплокровных животных рассмотрено
выше. У насекомых оно изучено весьма неполно, и исследования проведены
преимущественно на американском таракане. Выявлены следующие зако-
номерности: наибольшее накопление ФОС, таких как параоксон, ТЭПФ,
систокс, димефокс и др., наблюдается в передней кишке (орган выделения
ФОС). В нервной системе обнаруживается чрезвычайно низкая концентра-
ция веществ. Следовательно, эффективная концентрация ФОС в нервной
цепочке насекомых, так же как и в мозге млекопитающих, составляет
небольшую часть от общего содержания ФОС. В крови соединения нахо-
дятся в течение длительного времени. У некоторых видов насекомых местом
значительного депонирования могут быть наружные покровы.
Одним из факторов, влияющих на распределение, является гидрофоб-
ость ФОС. Можно предполагать, что отсутствие у насекомых анатомичес-
ких образований, аналогичных эндотелию капилляров млекопитающих, ис-
НьЮч^т возможность такого механизма снижения токсичности гидрофоб-
ROrrij как соРбЦИонные потери. На примере ряда ФОС строения
_ 3cH3)P(O)SC6H18 показана возможность получения ФОС избирательного
наяСТВИЯ Путем ирндииия соединениям необходимой гидрофобности. Начи-
к с пропильного производного, токсичность соединений данного ряда для
ТокС Существенно снижается, что хорошо коррелирует с гидрофобностью.
сичность для членистоногих изменялась мало, а в некоторых случаях
207
при повышении гидрофобности веществ повышалась. Например, при пере-
ходе от метильного к гексильному производному токсичность для тлей
возрастала почти в 10 раз, для крыс снижалась в 11 раз.
Поскольку основным в механизме токсического действия ФОС является
антихолинэстеразный эффект, то избирательность, связанная с природой
холинэстеразы, представляет определенный интерес. Известно, что АХэ
ЦНС по чувствительности к ФОС может различаться у разных видов жи-
вотных. АХЭ мозга морских свинок в-12 раз более чувствительна к зарину
чем АХЭ мозга мыши. Выявлены отчетливые видовые различия в чувстви-
тельности АХЭ мозга и эритроцитов разных видов животных к тиофосфо-
натам, в частности к препаратам ЛГ-56 и ЛГ-63. Для этих веществ различия
могут быть 15—30-кратными.
Примеры выраженных различий в чувствительности АХЭ разных насе-
комых приведены в работе И.Л.Брик и соавт. [91]. Показано, что чувстви-
тельность АХЭ разных насекомых может отличаться на несколько порядков.
В частности, чувствительность АХЭ тли и саранчи к веществу Гд-7 отлича-
ется почти на 3 порядка.
Избирательность основана на различиях в чувствительности АХЭ к ФОС
и показана для многих веществ: паратиона, его диизопропильного гомолога,
фоксима, фенитротиона, диметоксона, ДДВФ, Ш-140 и др. Так, при дейст-
вии паратиона ингибирование активности АХЭ мух было выражено в боль-
шей степени, чем пчел, и он оказался в 250 раз токсичнее для мух, чем для
пчел. Избирательность действия кислородного аналога фенитротиона, а
также некоторых близких по структуре фосфатов связана с более выражен-
ным действием на АХЭ мух, чем на АХЭ эритроцитов теплокровных жи-
вотных. Показано, что токсичность фенитротиона и некоторых эфиров
тиофосфорной кислоты при введении метильной группы в положение 3 фе-
нильного кольца резко снижает токсичность для млекопитающих. По срав-
нению с метилпаратионом токсичность фенитротиона для мышей снизилась
в 50 раз. Этот факт позволяет предположить, что алкильный радикал в
положении 3 повышает сродство ФОС к участку АХЭ мух, расположенному
в районе анионного центра, тогда как в АХЭ эритроцитов и, по-видимому,
вообще млекопитающих имеются стерические препятствия при сорбции
веществ, содержащих такой радикал [71].
Различия в скорости ингибирования ФОС АХЭ мозга насекомых и мозга
млекопитающих могут варьировать в широких пределах. Для ДДВФ кон-
станта скорости угнетения (Кц) АХЭ гомогената мозга мух составляет
1,4-106, АХЭ гомогената мозга крыс — 4,4-Ю3, для АХЭ тли — 5,4104, АХЭ
мозга быка — 1,1104/моль~'-мин-1. Константа скорости взаимодействия с
АХЭ клещей Tetranuchus urticae, чувствительных к диазоксону, составляет
3-106, а резистентных — 2-104/моль-1-мин-'. Для параоксона эти различия
были выражены в большей степени, что соответствовало более выраженной
устойчивости клещей к паратиону, чем к диазинону. Роль различий чувст-
вительности АХЭ к ФОИ в механизме резистентности показана и для дрУгИХ
членистоногих. На примере ФОС (ометоат, параоксон, малаоксон, тетра-
хлорвинфос и др.) было установлено, что бимолекулярные константы
скорости торможения АХЭ чувствительных к этим ФОС мух были в 4—^
раз выше, чем резистентных. Снижение активности ряда ФОС по отно-
шению к АХЭ резистентных мух зависит как от уменьшения суммарно
константы торможения (Кц), так и от уменьшения сродства ингибиторов
АХЭ (Kd). уэ
Как видно из представленных данных, различия в чувствительности АД
208
гут определять и межвидовую и внутривидовую (особенно чувствительных
М резистентных штаммов) избирательность.
Я РОднако необходимо учитывать особенности избирательного влияния
фОС на весь спектр эстераз теплокровных и насекомых, а также различную
функциональную роль этих ферментов в живых организмах. В механизме
ействия ФОС у насекомых существенную роль играют как АХЭ, так и
Алиэстераза и арилэстераза. Весь комплекс эстераз образует как бы ступен-
чатую защиту. Первой подвергается ингибирующему действию ФОС АХЭ,
расположенная в периферических областях нейропиля. Затем во взаимодей-
ствие с ними вступают функционально-резервные эстеразы — алиэстераза и
арилэстераза, локализующиеся в центральных структурах нейропиля гангли-
ев. Взаимодействие ФОС с эстеразами осуществляется в синаптических
соединениях, вначале в рецепторных и эффекторных терминалях перифе-
рической нервной системы, а затем и в ЦНС, что приводит к гибели
насекомых. Полагают [64, 65], что алиэстераза играет роль детоксицирую-
щего ФОС фермента и что участие арил- и алиэстераз является решающим
в механизме токсического действия ФОС на насекомых. В механизме дей-
ствия ФОС на теплокровных ингибирование холинэстераз играет более
важную роль по сравнению с другими эстеразами. Учитывая возможную
функциональную роль различных эстераз у насекомых, выраженное их
ингибирование ФОС может быть одной из причин избирательной токсич-
ности.
Среди факторов, от которых зависит избирательное действие ФОС, ме-
таболическим превращениям принадлежит главное место. ФОС относятся к
веществам с очень высокой реакционной способностью и легко вовлекаются в
обменные процессы.
Разнообразие их структуры предопределяет множественность и разно-
типность наблюдаемых метаболических превращений. Классификация ме-
таболических превращений ФОС и характеристика метаболических процес-
сов подробно освещены в литературе [31, 61, 63, 71, 106].
И.Г.Щербаком (1974) показано, что скорость ферментативного гидроли-
за 0-алкил-8-алкилметилтиофосфонатов не зависит от длины алкильного
радикала и резко возрастает при переходе от О-этильного к О-метильному
радикалу. В гомогенатах печени и крови ферменты детоксикации О-алкил-
S-алкилметилфосфонатов весьма не стабильны, а в гомогенатах мозга и
почек они сохраняют активность не менее 6 ч при 37 °C и pH 7,5. Уста-
новлено также, что ферментативная детоксикация дихлофоса достаточно
эффективна лишь в печени и почках и в меньшей степени в стенке кишки
и сыворотке крови. Эти процессы могут оказывать влияние на степень
ингибирования ХЭ — в тканях с низкой активностью ферментов детоксика-
ции создаются условия (в том числе и в нервной ткани) для более сильного
ее торможения.
Приведенные данные свидетельствуют не только о наличии значитель-
ых видовых различий в способности гидролизовать ФОС, но и о различном
PI Держании гидролизующих ферментов в тканях одного и того же вида.
-видимому, активность и распределение в соответствующих организмах
06vPMeHT0B’ гВДР°лизующих ФОС, является одним из ведущих факторов,
Условливающих их избирательную токсичность.
На Ма пРИмеРе Ряда карбоксиэфирных производных ФОС показано, что
токс^У С их ФеРментативным гидролизом для проявления избирательной
актиИЧН°С™ важное значение имеет соотношение процессов окислительной
вации и ферментативного гидролиза. Более эффективный гидролиз
209
отмечается у тех ФОС, которые в организме теплокровных медленнее под-
вергаются окислительной активации. Различная активность оксидаз сме-
шанной функции у чувствительных и резистентных к ФОС организмов
может играть основную роль в избирательной токсичности. Так, диизопро-
пиловый аналог тиофоса малотоксичен для медоносных пчел и высокоток-
сичен для комнатных мух. Оксидаза смешанной формы у мух сильнее
активирует это соединение, в результате чего у них происходило накопление
кислородного аналога, с которым связано возникновение токсического эф-
фекта.
Основным различием метаболизма паратиона у насекомых и млекопи-
тающих является наличие в организме последних ферментов, обеспечиваю-
щих его О-деалкилирование, что приводит к детоксикации. Таким образом
одним из направлений изыскания избирательных ФОС может быть исполь-
зование возможности их более быстрой окислительной активации в орга-
низме насекомых.
Существует еще несколько аспектов проявления избирательности ФОС.
К ним относятся особенности возрастной, половой и индивидуальной чув-
ствительности организма к токсичным веществам. Очевидно, как видовую,
так и возрастную, половую избирательность и индивидуальную чувствитель-
ность следует отнести к физиологической, поскольку они обусловлены фи-
зиологическими и биохимическими особенностями организма.
Как правило, новорожденные и молодые животные более чувствительны
к воздействию ФОС, чем половозрелые. Однодневные крысята оказались в
9 раз более чувствительны к малатиону, чем 17-дневные особи [109]. По
мере развития крыс с момента рождения токсичность метилпаратиона и
паратиона снижалась [90]. Понижение токсичности коррелировало с возрас-
тающей способностью животных метаболизировать аналоги как окислитель-
ным, так и гидролитическим путем.
Различия в возрастной чувствительности можно объяснить разной ак-
тивностью монооксигеназной и других ферментных систем, участвующих в
метаболизме ксенобиотиков, поскольку в неонатальном периоде детоксици-
рующая система менее совершенна, чем во взрослом организме. Отмечается
повышение чувствительности и у стареющих животных. В период старения
снижается активность монооксигеназной и иммунной систем, отмечается
перестройка гормональной активности, что ведет к повышению чувствитель-
ности к ксенобиотикам.
Из всех исследованных химических групп пестицидов (хлорорганичес-
кие, фосфорорганические, нитроаминосоединения и др.) только к фосфор-
органическим веществам выявлены половые различия [53]. Как правило,
более чувствительны самки, чем самцы. Выраженная чувствительность к
ФОС в зависимости от пола установлена, в частности, для паратиона. Его
токсичность для крыс самцов была в 6 раз ниже, чем для самок. Самки
крыс также более чувствительны к меркаптофосу, ЭПН, ТЭПФ, потазану,
ДФФ. Для самцов характерна повышенная чувствительность к октаметилу
и карбофосу. Кастрация изменяет чувствительность крыс к тиофосу и ок-
таметилу в сторону противоположного пола. Такого эффекта можно достичь
введением самцам эстрогена, а самкам тестостерона.
Выявленные особенности половой чувствительности можно объяснить
прежде всего различиями гормонального статуса животных и состоянием
монооксигеназной системы. У самцов активность ферментов монооксиге-
назной системы значительно выше, чем у самок, что обеспечивает более
быструю детоксикацию ксенобиотиков.
210
Индивидуальная чувствительность может зависеть от ряда факторов —
стояния здоровья, генетических особенностей, питания, пищевого рацио-
С и ДР- Острая токсичность диазинона в 2 раза выше для крыс, потребля-
Нмых корм с очень низким (4 %) и с очень высоким (81 %) содержанием
арпкя по сравнению с кормовым рационом, имеющим стандартное содер-
жание (29 %) [6].
Синтезирован ряд ФОС, обладающих выраженной избирательностью по
отношению к насекомым — абат, йодфенфос, бромофос, валексон, цианокс,
гардона, фосфамид и др. У всех этих веществ коэффициенты избиратель-
ности (отношение величины LD50 в мг/кг для теплокровных животных к
LD50 в мг/кг для насекомых) значительно выше 100, и хотя многие из них
получены эмпирическим путем, изучение особенностей их поведения и
метаболизма в соответствующих организмах — перспективный путь созда-
ния теоретических основ избирательной токсичности.
Ю.С.Каганом [31] сформулированы основные принципы, которые могут
быть использованы при изыскании новых ФОС, обладающих избирательной
токсичностью.
1. Использование более эффективной детоксикации ФОС у теплокров-
ных по сравнению с насекомыми. Наличие у теплокровных более активных
ферментов детоксикации — карбоксилэстераз, пептидаз, микросомальных
ОСФ — дает основание полагать, что введение в молекулу ФОС детоксици-
рующих групп — карбоксиэфирных, карбоксиамидных, создание препара-
тов, которые при участии микросомальных ферментов преимущественно
подвергаются детоксикации, должны привести к увеличению избиратель-
ности. Возможно введение в молекулу более чем одной детоксицирующей
группы.
2. Сочетание введения в молекулу детоксикационных групп с введением
групп, обеспечивающих постепенную окислительную активацию. Время,
необходимое для активации ФОС в организме теплокровных, эффективно
используется для еще более быстро протекающего процесса детоксикации.
Препараты, обладающие способностью к окислительной десульфурации (со-
держание P=S связь), будут более избирательными для насекомых, микро-
сомальные ферменты которых эффективно активируют их.
3. Устранение стерических препятствий к детоксикации обеспечивает
более быструю детоксикацию у теплокровных, так как у них более высокая
активность карбоксилэстераз и пептидаз.
4. Учет степени ионизации молекулы ФОС. Степень ионизации оказы-
вает существенное влияние на процессы всасывания, распределения, про-
никновения через клеточные мембраны, гематоэнцефалический барьер, ме-
таболизм и выделение.
5. Выбор препаратов с более выраженной избирательностью по отноше-
нию к эстеразам насекомых по сравнению с ацетилхолинэстеразами тепло-
кровных.
6. Использование синергистов, ускоряющих процессы биологической
ктивации ФОС у насекомых или замедляющих их детоксикацию в орга-
змах, подлежащих уничтожению и не мешающих детоксикации в орга-
низме теплокровных.
7. Предпочтение должно отдаваться тем ФОС, которые распадаются на
Тественные метаболиты. В этом случае меньше оснований ожидать небла-
приятных отдаленных последствий их действия.
211
л
5.8. Патогенез отравлений ФОС
Под патогенезом отравлений понимают механизм развития целого ком-
плекса патологических процессов, возникающих в организме после поступ-
ления яда, начиная от первичного взаимодействия токсичного агента с
молекулами рецептора, изменений в отдельных органах и системах и закан-
чивая реакцией всего организма.
Поскольку ФОС избирательно блокируют ХЭ во всех холинергических
структурах (М- и Н-холинорецептивные системы), в патологический про-
цесс могут вовлекаться практически все физиологические системы и органы.
При этом изменения деятельности центральной и периферической нервной
системы, а также как следствие нарушения дыхания и сердечной деятель-
ности оказывают решающее влияние на исход отравления. В связи с этим
для понимания патогенеза антихолинэстеразных веществ необходимо Кратко
рассмотреть их влияние на основные жизненно важные органы и системы
организма.
5.8.1. Влияние ФОС на центральную нервную систему
и нервно-мышечные синапсы
Определяющим в физиологическом механизме действия антихолинэстераз-
ных соединений является их вмешательство в процесс проведения нервных
импульсов, поэтому их справедливо относят к нервным или синаптическим
ядам.
В клинической картине отравления ФОС симптомы поражения ЦНС
(изменение психики, тремор, периодические клонико-тонические судороги
и др.) играют ведущую роль. Нарушения функционального состояния раз-
личных отделов ЦНС (головной и спинной мозг) под влиянием ФОС
связаны с угнетением активности ХЭ мозга и накоплением медиатора в
центральных синапсах. Поэтому для понимания центральных эффектов
ФОС представляется важным изучение их способности преодолевать гема-
тоэнцефалический барьер. Следует учитывать, что проницаемость гематоэн-
цефалического барьера в различных отделах ЦНС неодинакова, в связи с
чем одно и то же вещество в неодинаковой степени угнетает ХЭ в различных
структурах мозга. Наряду с фактором избирательной проницаемости различ-
ных участков гематоэнцефалического барьера и неодинаковым распределе-
нием ХЭ в мозге нельзя не учитывать и избирательность в действии самих
ФОС, которые могут проявлять большую активность по отношению к ка-
кой-то определенной структуре мозга.
Экспериментальным путем установлено, что различные по своему стро-
ению ФОС могут существенно отличаться друг от друга степенью проник-
новения из крови в мозг. Наиболее отчетливые различия были обнаружены
между третичными и четвертичными соединениями.
Такие яды, как ДФФ, зарин, зоман, которые хорошо растворяются в
липоидах и легко проникают в мозг, оказывают выраженное центральное
действие. Так, при внутривенном введении ДФФ в дозе 1 мг/кг АХЭ
ингибируется в различных отделах мозга неодинаково: в среднем мозге —
на 70 %, продолговатом — на 35 % и в коре — только на 21 %. Вместе с
тем октаметилпирофосфат, имеющий низкий коэффициент распределе-
ния в системе масло — вода, практически не проникает в ЦНС и не
угнетает ХЭ мозга. В клинической картине отравления этим ФОС преобла-
212
_ периферические мускарино- и никотиноподобные симптомы инток-
Su.™ |72].
В опытах на курах было показано, что фунгицид афос при введении в
токсических дозах ингибирует активность фермента преимущественно в
ильной крови и седалищном нерве к практически не вызывает угнетения
*ХЭ в различных отделах головного и спинного мозга [35].
На модели отравления крыс и кроликов ДДВФ, хостаквиком, этафосом
и карбофосом (в дозе LD50) показано, что ФОИ, не содержащие заряда,
хорошо проникают через гематоэнцефалический барьер и вызывают почти
полное (на 68—80 %) угнетение АХЭ в тех отделах головного мозга, где в
условиях нормы активность фермента особенно велика: продолговатый мозг,
верхние и нижние холмики крыши среднего мозга, морской конек, подбу-
горная область, хвостатое ядро [42].
Данные, полученные путем сочетания электронно-микроскопических и
гистохимических исследований, показали, что при остром отравлении
ДДВФ степень угнетения ХЭ в различных отделах мозга значительно варьи-
рует. Наиболее выраженное угнетение отмечено в ядрах моста мозга (варо-
лиева моста), наименьшее — в передних рогах спинного мозга. Существен-
ные изменения обнаруживаются в синаптических образованиях (число ве-
зикул уменьшается, затем возникают патологические изменения в мито-
хондриях аксональных окончаний и дендритов) [17].
Для изучения функционального состояния ЦНС в эксперименте широко
используются методы электроэнцефалографии (ЭЭГ), а также методы ис-
следования поведенческой деятельности животных.
В результате всестороннего изучения влияния различных антихолинэс-
теразных веществ (в том числе и ФОС) на электрическую активность мозга
различают три фазы изменений ЭЭГ: 1) предсудорожную фазу, которая на
ЭЭГ регистрируется как реакция активации; 2) фазу генерализованных су-
дорожных разрядов; 3) фазу затухания электрической активности мозга.
Практически все ФОС при введении в малых дозах вызывают изменения
биоэлектрической активности головного мозга по типу “реакции пробужде-
ния”, которая характеризуется низкоамплитудной быстрой активностью.
Применение препаратов в токсических дозах сопровождается более зна-
чительными и качественно иными изменениями. Так, при отравлении крыс
ДДВФ в дозе 40 мг/кг (LD50) на ЭЭГ регистрируются генерализованная
реакция десинхронизации, появление судорожных разрядов, а затем резкое
угнетение биопотенциалов, что подтверждает центральное действие пре-
парата [31, 58].
Подобные изменения биоэлектрической активности описаны при дей-
ствии карбофоса, хлорофоса, фозалона, фосфакола в токсических дозах [31,
а также при введении курам триортокрезилфосфата (ТОКФ) [22].
При хроническом отравлении меркаптофосом на ЭЭГ наблюдается по-
явление патологических (3-волн [79].
У кошек после внутримышечного введения тиофоса (50—100 мг/кг) в
отведениях от коры мозга появляются (3-волны, а также судорожная актив-
ность. Атропин препятствует развитию описанных изменений ЭЭГ только
^начальной стадии отравления. При нанесении тиофоса непосредственно
кору головного мозга кроликов возникает судорожный синдром.
дф«аиб°лее хаРактеРным Для таких высокотоксичных ФОС, как зарин,
R ’ паРатион, является возникновение судорожных разрядов [72].
н “ Н.Александровский [1] проанализировал изменения ЭЭГ у больных,
одившихся в коматозном состоянии в результате отравления ФОС. Он
213
отметил, что у этих больных ЭЭГ характеризуется высокочастотными рит-
мами (20—26 колебаний в секунду) нередко веретенообразной формы, низ-
кой амплитуды.
В опытах М.И.Никифорова (1971) фосфакол и армии в дозах от 5 д0
30 мкг при непосредственном нанесении на кору мозга или при субарахно-
идальном введении вызывали локальную активацию р- и g-ритмов, что
свидетельствует о прямом влиянии ФОС на кору больших полушарий. По
мере резорбции ядов развивалась генерализованная активация высокочас-
тотных ритмов с одновременным исчезновением p-активности и возникно-
вением стандартных g-ритмов.
Механизм действия ФОС на биоэлектрическую активность мозга изучен
недостаточно. Показано [5], что в первую очередь поражаются те отделы
мозга, в которых холинергическая передача имеет особое значение (ретику-
лярная формация среднего мозга).
Большие возможности в изучении действия ФОС на ЦНС открывает
использование методов условных и безусловных рефлексов. Поскольку ХЭ
мозга высокочувствительна к действию ФОС, изменения высшей нервной
деятельности могут быть одним из ранних признаков воздействия этих ядов
на организм (ВОЗ).
Как правило, ФОС обладают двухфазным действием на высшую нервную
деятельность в зависимости от дозы. В малых дозах (от 0,01 до 0,1 LD50)
они усиливают дифференцировочное и угасательное торможение, а в боль-
ших (от 0,3 LD50 и выше) угнетают условные рефлексы по типу наркоти-
ческой фазы [94].
Изменения условнорефлекторной деятельности кошек наблюдались при
введении тиофоса, карбофоса и метилмеркаптофоса в дозах, которые не
вызывали видимых признаков интоксикации и слабо (на 15—40 %) ингиби-
ровали активность ХЭ. При угнетении активности фермента на 45 % и более
наступали отчетливые изменения условных рефлексов (удлинение времени
латентного периода реакции на положительные условные сигналы) [31].
Хлортион в малых и средних дозах усиливает, а в больших, наоборот,
ослабляет процессы возбуждения в коре головного мозга крыс. При дли-
тельном введении малых доз яда имели место обратимые нарушения услов-
норефлекторной деятельности, что расценивается как развитие процесса
адаптации [37].
При введении кошкам меркаптофоса в пороговых дозах (0,25 мг/кг)
улучшались показатели выработки условных рефлексов. Увеличение дозы
препарата до 1 мг/кг приводило к постепенному снижению активности ХЭ
(до 20 %) в крови, что коррелировало с нарушением условнорефлекторнои
деятельности.
Нарушения условных рефлексов возникали при снижении ХЭ на 40—60 %
и были резко выражены при угнетении фермента на 80—90 % [30]. Однако
изменения условнорефлекторной деятельности не всегда коррелировали с
изменением активности ХЭ в крови. Так, если степень торможения актив-
ности фермента зависела только от величины вводимой дозы или концент-
рации ФОС, то изменение условных рефлексов у животных существенно
зависело от типа его высшей деятельности. В опытах на кошках с относи-
тельной слабостью тормозного процесса условнорефлекторная деятельность
нарушалась при небольшом снижении активности ХЭ. У кошек с сильным
тормозным процессом при снижении активности ХЭ эритроцитов на 90
условные реакции снижались только на свет и зуммер; реакции восстанав-
ливались на 3-й день опыта.
214
1м
d
При хроническом воздействии ФОС (меркаптофос, фосфамид, фозалон)
концентрациях, вызывающих прогрессирующее понижение активности
АХЭ эритроцитов и ХЭ сыворотки крови, сначала отмечалось нарушение
условных рефлексов по типу наркотической фазы, а затем в ходе экспери-
мента происходила их нормализация, несмотря на продолжавшееся воздей-
ствие ядов. По всей вероятности, наблюдаемый эффект объясняется при-
выканием нервных клеток к избыточному количеству АХ, так как актив-
ность ХЭ в крови оставалась на достаточно низком уровне.
Изменение условных рефлексов связано непосредственно с влиянием
фОС на головной мозг. Так, препараты, которые плохо проникают в ЦНС
(октаметил), способны изменять условные рефлексы только при введении
в токсических дозах незадолго до гибели животных [31].
Такие яды, как зарин, зоман, дихлорвос, паратион и др., при введении
даже в небольших дозах — от 0,1 до 0,3 LD5Q — оказывают влияние на регу-
лярность и воспроизводимость непроизвольных врожденных реакций (воспри-
ятие слуховых и зрительных стимулов, потребление воды и пищи) [94].
Клонико-тонический характер судорог при остром отравлении ФОС
(фосфакол, ДФФ, зарин, табун, паратион, ДДВФ, хостаквик и др.) свиде-
тельствует о вовлечении в патологический процесс спинного мозга.
Механизм действия ФОС на рефлексы спинного мозга связывают с их
влиянием на холинергический синапс, расположенный между коллатераль-
ным ответвлением двигательного аксона и тормозным вставочным нейроном
Реншоу, а также на ретикулярную формацию, которая регулирует функци-
ональный уровень спинномозговых рефлексов.
Показано, что АХ и антихолинэстеразные вещества вызывают возбужде-
ние в синапсе клеток Реншоу. Вместе с тем отсутствует прямая зависимость
между степенью угнетения ХЭ и выраженностью соответствующего эффекта.
Так, ДФФ в дозах, вызывающих угнетение ХЭ мозга на 90 %, не влияет на
рефлекторную деятельность спинного мозга, в то время как пирофос при
таком же уровне ингибирования фермента существенно нарушает рефлек-
торную деятельность спинного мозга, что свидетельствует о возможности
ФОС в больших дозах оказывать прямое влияние на спинной мозг [13].
Определенное представление о влиянии ФОС на нейроны спинного
мозга можно получить по изменениям в моносинаптической рефлекторной
Дуге. При введении токсических доз ДДВФ резко повышается возбудимость
мотонейронов поясничного отдела спинного мозга крыс, что, по всей веро-
ятности, обусловлено угнетением АХЭ в клетках Реншоу, от которых посту-
пают тормозные влияния на мотонейроны [42, 49]. Использование метода
электронной микроскопии обнаружило непосредственное влияние яда на
нервные волокна спинного мозга: дезорганизацию ультраструктур в нейро-
Цитах (деструкцию митохондрий, изменения эндоплазматического ретику-
лума, маргинальную конденсацию хроматина), а также патологические из-
енения в миелинизированных волокнах спинного мозга (“разрыхление”
миелиновых мембран, отсутствие миелина на отдельных участках, появление
редних вакуолей и др.). Аналогичные изменения ультраструктуры спинного
°згд наблюдаются также при введении крысам токсических доз хлорофоса.
Наряду с влиянием на ЦНС в патогенезе ФОС важную роль играет действие
веществ на нервно-мышечные синапсы. Блокирующее действие ФОС на
рвно-мышечные синапсы включает в себя три основных момента:
вы антихолинэстеразный механизм, нарушающий проведение в синапсе
ШаьоКОЧасТОТНЬ1Х ИМПУЛЬСОВ; 2) непосредственное воздействие на ХР, нару-
Ющее проведение одиночных импульсов (при сохранении ответов мышцы
215
1
2
Рис. 5.4. Потенциалы действия икроножной мышцы крысы при непрямом раздра-
жении после введения хостаквика (1) и хостаквика совместно с реактиватором ХЭ
диэтиксимом (2).
а — на одиночное и ритмическое (100 Гц) раздражение нерва до введения хостаквика (155 мг/кг);
б — через 10 мин после введения; в — на одиночное и ритмическое раздражение (20 Гц) через
20 мин после инъекции хостаквика; г — на одиночное раздражение через 40 мин после введе-
ния; д — через 60 мин на одиночное и ритмическое (100 Гц) раздражение после введения
хостаквика (155 мг/кг) и реактиватора ХЭ диэтиксима (20 мг/кг); е, ж — то же на ритмическое
раздражение нерва (70 и 30 Гц соответственно).
на прямое раздражение); 3) действие на сократительную способность самой
мышцы [16].
Наличие указанных трех механизмов развития нервно-мышечного блока
подтверждено в эксперименте при введении крысам ряда высокотоксичных
ФОС (ДДВФ, хостаквика, метафоса, афугана) [42, 46, 50]. Уже в первые
минуты после введения хостаквика в дозе 155 мг/кг (LD50) блокируется
проведение высокочастотных импульсов (100—50 Гц), при этом амплитуда
потенциала действия икроножной мышцы на одиночное раздражение резко
(на 64 %) уменьшается (см. рис. 5.5). Через 30 мин возникает полный блок
нервно-мышечной передачи. На прямое раздражение икроножная мышца
отвечает даже через 60 мин.
В связи с тем что в норме АХ разрушается в пределах нескольких
миллисекунд, нервно-мышечное соединение способно пропускать более 100
импульсов в секунду. При угнетении ХЭ требуется больше времени для
разрушения накопившегося медиатора, и функциональная способность мио-
неврального синапса понижается. Поэтому нарушение ответов мышцы на
высокочастотные раздражения обусловлено антихолинэстеразным действи-
ем и накоплением в синапсе АХ. Проведение одиночных импульсов при
этом еще возможно, так как АХ удаляется из синапса в промежутках между
раздражениями за счет диффузии. Блокада ХР (глубокая деполяризация
постсинаптической мембраны) исключает проведение даже одиночных им-
пульсов, но мышца еще не утрачивает способность к сокращению. Если
действие ФОС распространяется на все мышечное волокно, оно теряет
сократительную способность.
Влияние ФОС на Н-холинореактивные системы проявляется главным
образом в случае введения больших доз препаратов (LD50 и выше). При
введении ДДВФ или хостаквика в дозах, составляющих 0,1— 0,2 LD50, ПР0'
ведение импульсов при раздражении нерва частотой до 20 Гц сохраняется.
216
Рис. 5.5. Фрагменты осциллограмм частоты и амплитуды миниатюрных потенциалов
концевой пластинки скелетной мышцы.
А —до введения ДДВФ и метафоса; Б—В — через 30 мин после введения ДДВФ (40 мг/кг) и
метафоса (14 мг/кг) соответственно.
Наиболее важное патогенетическое значение при нарушении нервно-
мышечной передачи имеет антихолинэстеразный механизм. Реактиваторы
ХЭ обладают способностью устранять развитие нервно-мышечного блока.
Это показано при использовании дипироксима или диэтиксима (рис. 5.4).
Внутриклеточное отведение МПКП латеральной мышцы крыс позволило
выявить в первой стадии острого отравления ФОС резкое увеличение, а
затем уменьшение их амплитуды. Повышение амплитуды МПКП (на 50—
280 %) и их длительности (на 100—170 %) связано с антихолинэстеразным
действием ФОС и стабилизацией АХ в мионевральных синапсах, сниже-
ние—с их курареподобным действием. Учащение частоты МПКП (в 1,4—4,5
раза) свидетельствует об облегчении высвобождения квантов АХ нервным окон-
чанием под влиянием ФОС на пресинаптические образования (рис. 5.5).
Наряду с блокированием нервно-мышечной передачи ряд ФОС (ДЦВФ,
актеллик, метафос) в токсических дозах вызывает резкое (на 40—50 %)
снижение скорости распространения возбуждения по периферическому
нерву, что связано с нарушением мембранных процессов и дегенерацией
Двигательных аксонов [33, 41, 42].
5.8.2. Нейротоксическое действие ФОС замедленного типа
Ряд ФОС способны оказывать отдаленное нейротоксическое действие
(ОНД). Этот эффект проявляется постепенно после определенного латент-
ного периода (обычно через 14—21 день, а иногда 1—5 лет после перене-
сенного острого отравления) и характеризуется клинически — возникнове-
нием атаксии, мышечной слабости, парезов и параличей конечностей; мор-
фологически — демиелинизацией волокон проводящих путей спинного моз-
Га и периферических нервов. К настоящему времени описано 40 тыс. случаев
(Тгн/ КНОВения парезов и параличей у людей в результате воздействия ФОС
НОКф, мипафокс, хлорпирофос, хлорофос и др.) [59, 104, 107].
обладают лептофос, метамидофос, трихлоронат, дихлофос, мерфос,
Дфф, цианофенфос, сумитион и др. [48, 101, 107].
си э _ЭКспеРименте установлено, что фунгицид афос (0,0-дифенил-ацетоок-
'2,2,2-трихлорэтилфосфонат) проявляет выраженную нейропаралитичес-
217
кую активность в широком диапазоне доз (3000—25 мг/кг). Его воздействие
сопровождается снижением двигательной активности, возникновением па-
резов и параличей, функционально-морфологическими изменениями нерв-
ной и мышечной ткани животных. ОНД афоса более избирательно, чем у
классического нейропаралитического яда ТОКФ. Так, дозы ТОКФ, приво-
дящие к параличам у кур, составляют 1/з—*/4 LD50, в то время как у афоса
такими дозами являются 1/зо— Г/б0 LDso- При этом афос в указанных дозах
в отличие от ТОКФ не вызывает видимых признаков интоксикации. Гисто-
логические исследования (на модели введения афоса) выявили в седалищ-
ном нерве кур дегенерацию миелиновых волокон, очаговый зернистый рас-
пад миелина; в спинном мозге — ультраструктурные изменения нейроцитов
синапсов и нервных волокон (расслоение миелиновых пластин вплоть до
частичного оптического “лизиса”) [78, 112, ИЗ].
Механизм ОНД ФОС окончательно не выяснен. В эксперименте, а также
на клиническом материале не установлена прямая зависимость между их
антихолинэстеразным и нейропаралитическим действием. Показано, что
мощные ингибиторы АХЭ не вызывают демиелинизацию. Попытки объяс-
нить последнюю действием нейропаралитических препаратов (ТОКФ и др.)
на ложную ХЭ также не привели к успеху, так как оказалось, что другие
избирательные ингибиторы ложной ХЭ (например, октаметил) к демиели-
низации не приводят [13].
Важным патогенетическим звеном поражения считают фосфорилирова-
ние белка, относящегося к карбоксилэстеразам и названного нейротокси-
ческой (или нейропатической) эстеразой (НТЭ) [104, 106]. Отдаленные
нейропатии возникают только в случае воздействия таких ФОС, которые
являются ингибиторами НТЭ, причем развитие ОНД связано не только с
угнетением НТЭ, но и с последующим ее “старением” (фермент должен
быть заингибирован не менее чем на 70—80 %). “Старение” НТЭ, ингиби-
рованной ФОС (ТОКФ, лептофос, мипафокс, афос и др.), происходит
чрезвычайно быстро — уже через 1—24 ч после однократного воздействия
препаратов [35, 101].
Схожесть гистопатологических изменений, а также однотипное влияние
ФОС на НТЭ людей и кур позволяют использовать птиц для эксперимен-
тального моделирования нейропатий. Удобной моделью для воспроизведе-
ния нейропатий являются также кошки и морские свинки [26].
Вместе с тем ФОС, оказывающие избирательное нейротоксическое дей-
ствие (ТОКФ, афос, оксифосфонат, лептофос), сильно ингибируют НТЭ
мозга при введении не только наиболее чувствительному виду животных —
курам, но и морским свинкам и даже крысам. В то же время препараты, не
оказывающие ОНД (ортен, офунак, этафос и др.), ингибируют НТЭ этих
животных слабо (на 3—20 %). Важно, что нет существенных различий в
чувствительности НТЭ различных видов животных в опытах in vitro и in vivo
(табл. 5.6). Выявленный эффект позволяет рекомендовать использование
крыс и морских свинок для скрининга новых ФОС на ОНД [48].
Чувствительность экспериментальной модели может быть повышена пу-
тем использования промоторов ОНД [36].
Одними из ранних признаков нейропатий являются также резкое (на
35—40 %) замедление скорости распространения возбуждения по перифери-
ческим нервам кур и морских свинок и снижение амплитуды потенциала
действия нерва, которые отмечаются до развития других клинических изме-
нений — атаксии, парезов и параличей (рис. 5.6). Наблюдаемые изменения
указывают на потерю возбудимости в первую очередь толстыми быстропрО"
218
Рис. 5.6. Потенциал действия седалищного нерва курицы (А) до введения ТОКФ (к)
и на 7-й день после введения ФОС и изменение скорости распространения возбуж-
дения (Б) по периферическому нерву кур при введении ТОКФ в дозе 1 г/кг (1),
афоса 200 мг/кг (2) и лептофоса 600 мг/кг (3).
По оси абсцисс — время после введения препаратов (сут); по оси ординат — СРВ (в % по
отношению к контролю).
водящими нервными волокнами A-а. Процесс демиелинизации в перифе-
рических нервах и спинном мозге подтвержден морфологически [35, 113].
В патогенезе ОНД ФОС имеют место иммунопатологический компонент
(развитие аутоиммунного процесса) и усиление свободнорадикальных про-
цессов в нервной ткани.
Эффект ОНД обнаружен для ФОС различной структуры — фосфатов,
фосфонатов, амидофосфатов. Сопоставление структуры ФОС и торможения
НТЭ in vitro показало, что ФОС с гидрофильными и гетероциклическими
заместителями, а также карбаматы наименее опасны в плане развития ней-
ропатии [59].
Таблица 5.6. Изменение активности НТЭ в головном мозге животных через 24 ч
после воздействия ФОС в дозе LD5q (опыты in vivo) и головном мозге кур (опыты
in vitro, n = 8)
ФОС Ингибирование НТЭ, %
куры морские свинки крысы in vitro, 10~3 М
ТОКФ 90,0 87,0 84,5 88,0
Афос 89,0 89,0 89,0 70,0
Оксифосфонат 92,0 89,0 90,0 89,0
Лептофос 88,0 87,0 85,0 67,0
Ортен 6.0 5,0 5,0 4,8
Офунак 3,0 4,0 4,0 2,0
Этафос 4,0 8,0 6.0 14,0 ч''-
пео^ПИсаН слУчаев возникновения психических расстройств у лиц,
капН^СШИХ остРое отравление либо хроническую интоксикацию ФОС (мер-
Дали°Ф°С’ ХЛОР°ФОС> карбофос, тиофос и др.) [31]. У пострадавших наблю-
ИсПуСЬ РасстР°йства памяти, изменение речи, нарушение сна, беспокойство,
кий Г’ агРессивность или депрессия, шизофренический психоз, астеничес-
синдром и др. Е.А.Лужников [57] наблюдал гиперкинезы хореатического
219
типа после выхода из коматозного состояния и инсультоподобное течение
отравления.
Иногда нервно-психические расстройства возникали через длительное
время после контакта с ФОС или перенесенного острого отравления (3 мес
1—3 года). Полагают, что в основе изменения психики лежит торможение
ХЭ мозга.
Для профилактики и лечения психозов рекомендуют сочетание атропина
с центральными реактиваторами холинэстеразы (изонитрозин, диэтиксим)
и психотропными средствами.
5.8.3. Влияние ФОС на дыхание и сердечно-сосудистую систему
Расстройства дыхания играют ведущую роль в патогенезе отравлений
ФОС. Различают три основных механизма, лежащих в основе нарушений
дыхания при отравлении антихолинэстеразными веществами: прямое и реф-
лекторное влияние на дыхательный центр; бронхоспазм и усиление секре-
ции бронхиальных желез; паралич дыхательной мускулатуры.
Экспериментальные исследования свидетельствуют, что те ФОС, кото-
рые проникают в ЦНС, могут вызывать прямое угнетение дыхательного
центра. Так, при введении ТЭПФ непосредственно в субарахноидальное
пространство мозга наблюдалось локальное снижение активности ХЭ в
продолговатом мозге (до 8—10 % активности, установленной в контроле),
что приводило к остановке дыхания. Центральные холинолитики являются
антагонистами ФОС по действию на дыхательный центр.
Иногда угнетению дыхания предшествует фаза возбуждения. Ее наличие
может быть связано как с непосредственным действием ФОС на дыхатель-
ный центр, так и с возбуждением Н-холинореактивных систем каротидного
клубочка, что было подтверждено в опытах при пропускании тиофоса через
изолированный каротидный синус кошки [30].
Бронхоспазм приводит к нарушению легочной вентиляции, затрудняет
дыхание и играет важную патогенетическую роль в развитии интоксикации.
Расстройства дыхания усиливаются еще в большей степени оттого, что
бронхоспазм сочетается с усилением бронхиальной секреции. Накопление
секрета в дыхательных путях является механическим препятствием поступ-
лению воздуха. В эксперименте бронхоспазм воспроизведен у лабораторных
животных при введении им различных антихолинэстеразных веществ, в том
числе и ФОС (паратион, фосфакол, табун, зарин, пирофос и др.). Развитие
бронхоспазма является результатом антихолинэстеразного действия ФОС.
Паралич (парез) дыхательной мускулатуры возникает в связи с наруше-
нием нервно-мышечной проводимости и наблюдается в основном при воз-
действии больших доз ФОС. При этом наряду с антихолинэстеразным
механизмом возникновения блока существенное значение принадлежит пря-
мому влиянию препаратов на ХР, а также повышению чувствительности
поперечнополосатых мышц к АХ.
При введении кошкам ДДВФ в дозе 10 мг/кг (LD50) в первые минуты
наблюдалось угнетение функции дыхания, сопровождающееся резким (на
50 %) уменьшением амплитуды и частоты дыхания. Через 6—8 мин насту-
пала полная остановка дыхания (рис. 5.7). Учитывая, что ДДВФ хорошо
проникает в ЦНС и ингибирует активность АХЭ в продолговатом мрзг
почти полностью (на 70 %), наблюдаемый эффект может быть связан как
развитием паралича в дыхательной мускулатуре, так и с прямым действие
ФОС на дыхательный центр.
220
a
Рис. 5.7. Изменение частоты
дыхания кошки при введе-
нии ДДВФ (10 мг/кг).
а — до введения; б—г — через 3,
5 и 8 мин после введения.
10 сек
антагонистами ФОС по отношению к их
Реактиваторы ХЭ являются
эффекту на дыхательную мускулатуру.
Расстройство функции сердечно-сосудистой системы при острой инток-
сикации ФОС развивается параллельно с угнетением дыхания. При этом
артериальная гипотония, брадикардия, снижение силы сокращения миокар-
да, спазм коронарных сосудов сердца чрезвычайно неблагоприятно влияют
на течение отравления и в значительной мере утяжеляют картину дыхатель-
ной недостаточности. Эти эффекты обусловлены влиянием ФОС на цент-
ральные и ганглионарные синапсы, а также стабилизацией АХ в перифери-
ческих холинореактивных системах.
Изменения кровяного давления при воздействии ФОС (зарин, ДФФ,
табун, тиофос, октаметил, карбофос, меркаптофос, хлорофос, ДДВФ) суще-
ственно зависят от вводимой дозы. Большие (смертельные) дозы вызывают
стойкое падение кровяного давления, которому обычно предшествует крат-
ковременная гипертония; действие небольших доз, напротив, может сопро-
вождаться повышением кровяного давления [13, 31].
ФОС (тиофос, октаметил, меркаптофос) могут вызывать изменения сер-
дечной деятельности при введении кроликам в дозах, не вызывающих ви-
димых холинергических симптомов интоксикации. Эти изменения сводятся
к замедлению сердечной деятельности и увеличению зубца R, что говорит
о раннем повышении тонуса блуждающего нерва. При введении токсичных
и смертельных доз ФОС в ряде опытов имела место неполная атриовентри-
кулярная блокада. Изменение высоты зубцов Р и Т, а также смещение
сегмента выше изоэлектрической линии позволяют предположить наличие
в этих случаях нарушений коронарного кровообращения.
Экг И введении кроликам токсичных доз ДДВФ уже в первые минуты на
КГ отмечались изменение ритма по типу брадикардии (в среднем с 291 до
Ударов в 1 мин), желудочковая экстрасистолия, негативация зубца Т,
вменение положения сегмента S—T по отношению к изоэлектрической
нии. У некоторых животных наблюдалась фибрилляция желудочков серд-
ец последующей его остановкой [Кокшарева Н.В., 1975].
ни А С Савина и А.В.Захарова (1975) проанализировали данные о пораже-
ф0И-1С\?диа У '975 человек, отравившихся ФОС (тиофос, карбофос, хлоро-
д с' У большинства обследованных зарегистрирована синусовая брадикар-
Про ‘50 ударов в 1 мин). У 19 % больных были нарушены ритм и
р в°Димость по типу внутрижелудочковой блокады или политропных груп-
221
повых желудочковых экстрасистол с переходом в фибрилляцию желудочков
и остановку сердца. Эти изменения сопровождались нарушением электро-
литного баланса: гипокалиемией, гипонатриемией, увеличением содержания
калия и снижением натрия в эритроцитах. В 30 % случаев на ЭКГ отмечены
фазы реполяризации по типу гипоксии. В случае смерти выявлялись выражен-
ные диффузные некробиотические и некротические процессы, а также нару-
шение активности ферментов цикла Кребса в миокарде. Авторы считают, что
поражение сердца связано с антихолинэстеразным действием и прямым
блокирующим влиянием ФОС на клеточные окислительные процессы.
При остром отравлении хлорофосом средней степени отмечались учаще-
ние пульса и гипертензия. Брадикардия и гипотензия наблюдались в случае
тяжелых и очень тяжелых отравлений.
5.8.4. Влияние ФОС на гладкомышечные
и внешнесекреторные органы
В развитии отравления ФОС немаловажное значение имеют изменения,
связанные с их воздействием на М-холинореактивные системы.
ФОС вызывают сокращение круговой мышцы радужной оболочки глаза,
что приводит к сужению зрачка (миоз) и спазму аккомодации; спазмам
бронхиальной мускулатуры (бронхоспазм), мускулатуры ЖКТ, мочевого пу-
зыря, матки, а также усиливают секреторную функцию желудка и кишеч-
ника. Все эти эффекты обусловлены антихолинэстеразным действием ФОС
в области периферических М-холинореактивных систем, предупреждаются
и устраняются атропином и другими М-холинолитическими веществами.
ФОС с выраженным антихолинэстеразным действием (I50 ~ 14'10-7 —
14-10-9 М) — сильные миотики. Миоз может служить критерием тяжести
состояния больных. При тяжелых отравлениях точечные зрачки сохраняются
долго, реакция на свет отсутствует, отмечается вертикальный и горизонталь-
ный нистагм [58].
В низких концентрациях ФОС оказывают стимулирующее (возбуждаю-
щее) действие, что позволяет использовать эти вещества в клинической
практике для устранения послеоперационных парезов и параличей, атонии
кишечника, усиления родовой деятельности, при глаукоме.
В различных условиях опыта удалось установить количественную связь
между степенью угнетения ХЭ и повышением тонуса кишечника. Возбуж-
дающее действие ФОС (фосфакол, тиофос, меркаптофос, хлорофос, пиро-
фос) на моторику кишечника устраняется М-холинолитическими соедине-
ниями, реактиваторами ХЭ, ганглиоблокирующими веществами и ингиби-
торами синтеза АХ.
Реактиваторы ХЭ (диэтиксим и дипироксим) обладают способностью
блокировать М-ХР, что проявляется в уменьшении ацетилхолиновой кон-
трактуры (рис. 5.8) кишки крысы [Кокшарева Н.В., 1975].
В больших дозах антихолинэстеразные вещества могут приводить к па-
раличу кишечника. ФОС являются стимуляторами секреции пищеваритель-
ных желез, поджелудочной железы, усиливают секрецию потовых, слезных
и других желез. Усиление секреции слюнных желез — один из первых при-
знаков отравления ФОС. Дизурические явления обусловлены влияние*1
ФОС на мускулатуру мочевого пузыря, имеющего холинергическую иннер-
вацию.
Влияние ФОС на сократительную активность матки обусловлено в ос-
новном их антихолинэстеразным действием.
222
Рис 5.8. Устранение диэтиксимом (1) и дипироксимом (2) контрактуры двенадца-
типерстной кишки крысы, вызываемой ацетилхолином.
В эксперименте (опыты in vitro и in situ) установлено, что под влия-
нием различных концентраций ДДВФ и метилмеркаптофоса (с 1410-4 до
14.10"° М) усиливается двигательная спонтанная активность матки кроли-
ков что проявляется увеличением амплитуды сокращений, быстрой генера-
лизацией возбуждения, увеличением времени сокращения и уменьшением
времени между спонтанными сокращениями.
Армин в чрезвычайно низких концентрациях (141O-10—1410"1'), не
оказывающих влияния на ХЭ, стимулирует мышечные волокна матки. Этот
эффект связывают с холиносенсибилизирующим действием армина.
Беременная матка более чувствительна к ФОС по сравнению с небере-
менной.
5.8.5. Влияние ФОС на кровь, печень, почки и другие системы
К нехолинергическим механизмам действия ФОС относится их способ-
ность изменять картину периферической крови, воздействовать на печень,
почки, протеолитические ферменты и др.
У людей, отравившихся ФОС (хлорофос, карбофос, ДДВФ, меркапто-
фос, метилмеркаптофос), изменения крови находились в прямой зависимос-
ти от степени тяжести интоксикации и не коррелировали с угнетением
активности ХЭ. Изменение состава периферической крови является симп-
томом общетоксического действия ФОС и существенно зависит от хими-
ческого строения препаратов.
В.В.Таращук (1967) проанализировал изменения морфологического со-
става крови в 39 случаях отравления метилмеркаптофосом. Он считает
характерным развитие лейкоцитоза с нерезким нейтрофилезом (около 76 %),
сдвигом лейкоцитарной формулы влево, лимфопенией, эозинопенией и
Увеличением содержания гемоглобина. В эксперименте на белых крысах
автор наблюдал увеличение количества эритроцитов, гемоглобина и ретику-
лоцитов. Ретикулоцитоз является характерной реакцией кроветворных орга-
нов на воздействие ФОС.
Исследованиями установлено, что при введении таких ФОС, как актел-
наб’ ДДВФ’ карбофос, мирал, гетерофос в токсических дозах (0,5 LD50),
матЛ,°Дается ПОВЬ1Шение количества эритроцитов, уровня гемоглобина, ге-
лейкКРИТа’ РетикУл°Читов [87]. Реакция белой крови часто сопровождается
тель Оцитозом> нейтрофилезом, эозинопенией, лимфоцитопенией. При дли-
Указа°М мес) ввеДении этих ФОС в малых дозах (0,01—0,001 мг/кг)
нымиННЫе изменения носили фазовый характер и были менее выражен-
тУры^3УЧеНИе кР°ветв°Рения показало, что ФОС в зависимости от их струк-
по-разному влияют на систему крови. В токсических дозах и концент-
223
рациях эфиры тиофосфорной кислоты с триазольным (мирал) и одним
фенольным (гетерофос) радикалом вызывают стимуляцию эритропоэза
Ациклический дихлорвинилфосфат слабо угнетает эритро-, гранулоцито- и
тромбоцитопоэз. Производные фосфорной кислоты с гептадиеновой (хос-
таквик) и тиофосфорной кислоты с пиримидиновой (актеллик) группами
активизируют лимфоцитопоэз в селезенке. Смесь тиол- и тионного изоме-
ров диметиловых эфиров тиофосфорной кислоты с циклогексильным коль-
цом (циклофос) обладает существенным гемолизирующим эффектом, вслед-
ствие чего развивается неэффективный эритропоэз. Тиофосфонат с фтали-
мидной группой — плондрел — приводит к гипоплазии костного мозга; од-
новременно в селезенке развивается заместительное кроветворение. Пести-
циды, в состав которых входят циклические группы (циклофос, тиофос
пландрел, метафос, метилнитрофос), вызывают анемию. Анемизирующее
действие ФОС, по всей вероятности, связано с усилением разрушения
эритроцитов, о чем свидетельствуют ретикулоцитоз, полихроматофилия, си-
дероцитоз, увеличение количества гемосидерина в селезенке. При этом не
выявлено прямой зависимости изменений системы крови от антихолинэс-
теразной активности и степени токсичности ФОС.
Ингаляционное поступление ФОС в организм оказывает более значи-
тельное влияние на систему гемопоэза по сравнению с пероральным по-
ступлением в сопоставимых количествах.
Острая интоксикация лабораторных животных ФОС (октаметил, хлоро-
фос) сопровождается повышением содержания адреналина в крови, сниже-
нием его концентрации в надпочечниках. Одновременно возрастают содер-
жание норадреналина в надпочечниках и концентрация серотонина в крови
и тканях головного мозга.
Повышение уровня серотонина в крови и уменьшение его запасов в
энтерохромаффинных клетках наблюдаются как в острых, так и хронических
опытах при введении очень малых доз ФОС (октаметил, хлорофос, карбо-
фос, трихлорметафос-3), не вызывающих изменения активности ХЭ крови
и органов. Изменения эти неспецифичны, так как отмечаются и при воз-
действии других веществ. При действии низких доз хлорофоса и изофоса
нарушается фагоцитарная активность нейтрофилов, подавляются их фаго-
цитарные свойства, снижается фосфатазная активность лейкоцитов, что
свидетельствует об изменении иммунологической реактивности организма.
При тяжелых отравлениях ФОС (хлорофос, фосфамид, карбофос) харак-
терны такие изменения в печени, как нарушение выделительной функции,
свертывающей и антисвертывающей системы крови, расстройство регионар-
ной гемодинамики с последующим развитием явлений белковой дистрофии
и холестаза.
ФОС, в структуре которых имеются атомы хлора (ДДВФ, хлорофос),
обладают выраженным токсическим действием на печень, что имеет осо-
бенно важное патогенетическое значение при хронических интоксикациях
этими веществами. При длительном (в течение 6—9 мес) поступлении этих
ФОС в организм крыс в малых дозах (0,01 LD50) отмечалось нарушение
углеводной функции печени (уменьшение содержания гликогена, измененИ
характера гликемических кривых после нагрузки галактозой, повышени
гипер- и постгликемических коэффициентов). Угнетение антитоксическо^
функции печени выражалось в уменьшении синтеза гиппуровой кислота
увеличении продолжительности гексеналового сна. Замедление элиминани
из крови бромсульфалеина свидетельствовало о нарушении экскреторно
функции печени. Возрастала относительная масса печени. Снижались а
224
вНость аланинаминотрансферазы в сыворотке крови и печени, аспартата-
Т*инотрансферазы в сыворотке, уменьшалась активность щелочной фосфа-
^зы развивались дистрофические и пролиферативные процессы. Наруше-
та обезвреживающей, синтетической, углеводной и белковообразователь-
нИй функции печени обнаружены при введении животным различных доз
Ц?05—0,02 LD50) метафоса, бутифоса, фенкаптона, метилнитрофоса, ами-
по’фоса/метилмеркаптофоса.
Д В клинических работах с описанием острых и хронических отравлений,
а также в эксперименте на животных имеются указания на нарушение
деятельности почек при воздействии ФОС. У людей, работающих с ФОС
(метилацетофос), отмечались нарушение адаптационной функции (умерен-
ная олигурия, никтурия, изостенурия), снижение азотовыделительной функ-
ции, уменьшение клубочковой фильтрации. Наиболее чувствительным по-
казателем являлось уменьшение хлоридов в моче. При интоксикации мети-
лацетофосом собак нарушались почечная гемодинамика, протеинурия,
набухание эндотелия артериол клубочков, экссудат в капсулах Шумлянско-
го, мелкие кровоизлияния и др.
’ В случае острого и подострого отравления крыс ФОС обнаружены уве-
личение количества белка в моче и уменьшение диуреза при водной нагруз-
ке. У животных, получавших ежедневно фталофос или сайфос (0,1 LD50),
повышалось содержание остаточного азота в крови (до 62,5 мг%), изменя-
лась водовыделительная функция почек.
Установлено действие ФОС на активность протеолитических ферментов.
ДФФ, фосфакол, тиофос подавляют как эстеразное, так и протеолитическое
действие трипсина и химотрипсина. ДФФ тормозит свертывающее действие
тромбина и его эстеразную способность, а также блокирует некоторые
протеазы растительного происхождения.
Нехолинергические механизмы проявляются в основном при повторных
поступлениях в организм небольших доз препаратов, неспособных вызывать
выраженные холинергические реакции, и играют обычно большую роль в
действии менее токсичных ФОС, к которым относятся многие пестициды.
5.9. Производные карбаминовой кислоты
5.9.1. Строение и взаимодействие с холинэстеразой
После обнаружения антихолинэстеразных свойств эзерина было синте-
зировано и изучено большое число соединений с целью выяснить, какой
химической группировке обязан эзерин своей способностью угнетать ХЭ.
казалось, что определяющую роль играет карбаминовая группа, так как
соответствующие фенолы, получающиеся при гидролизе карбаминовых эфи-
инВ> 5ьи1и лишены антихолинэстеразных свойств. Наиболее выраженными
гибиторами являются карбаминовые эфиры со следующими заместителя-
ми при карбаматном азоте:
проилагодаря спосо^ности угнетать активность АХЭ в нервной системе
зводные карбаминовой кислоты являются высокоэффективными ин-
225
сектицидами. К ним относятся ариловые эфиры N-карбаминовой кислоты
Их общая формула:
СН3 —NH—С—OR,
где R — ароматическая или алифатическая группа.
Ариловые эфиры алкилкарбаминовых кислот образуются при взаимодей-
ствии алкилизоцианатов с фонолами и ароматическими спиртами.
Большинство из них — сложные эфиры N-метилкарбаминовой кислоты
(байгон, дикрезил, севин и др.) и N-диметилкарбаминовой кислоты (пиролан)
В течение многих лет считалось, что карбаматы вызывают обратимое
ингибирование ХЭ. В дальнейшем было показано, что вещества этого типа
реагируют с ХЭ подобно ФОС — в две стадии с установлением ковалентной
связи [13]. Следует учитывать, что реакции ацилирования белковых молекул
протекают по смешанному типу, когда инактивация рецепторов обусловлена
присутствием в них не целых молекул, а их осколков (частей). Поэтому
степень антихолинэстеразного действия в данном случае зависит от проч-
ности образовавшихся комплексов. Безусловно, фосфорилированная ХЭ
выходит из строя на более длительные сроки по сравнению с карбамилиро-
ванной. Однако в обоих случаях образуется промежуточный комплекс, а
затем ацилированный энзим с расщеплением ингибитора; с ферментом
связывается в первом случае фосфорильная, а во втором — карбамильная
группа. Скорость восстановления исходной активности фермента, ингиби-
рованного карбаматами, определяется соответственно скоростью гидролиза
карбамилированного фермента, которая зависит от строения ингибитора. Кар-
бамилированные эстеразы гидролизуются значительно быстрее, чем фосфори-
лированные. Однако в том и другом случае первоначальная молекула ингиби-
тора уже не восстанавливается, так что реакция является необратимой.
Как правило, метилкарбаматы угнетают активность ХЭ в 5—10 раз силь-
нее, чем диметилкарбаматы. Так, для всех производных диметилкарбамино-
вой кислоты активность ХЭ восстанавливается наполовину за 27—30 мин,
для производных метилкарбаминовой кислоты — за 45—50 мин. В то же
время для бисчетвертичных карбаматов это время достигает 1400—2300 мин,
что говорит о необратимости процесса.
Высокая антихолинэстеразная активность обнаружена у севина, дикре-
зила, байгона, тиофанокса, пропоксура и других карбаминовых пестицидов.
Установлено, что севин способен угнетать активность ХЭ в дозах и
концентрациях, которые не вызывают видимых признаков отравления. Мак-
симальное ингибирование фермента при однократном введении токсичных
доз этого карбамата происходит уже в первые 30—60 мин. При этом актив-
ность ХЭ в мозге, эритроцитах и плазме крови спустя 24 ч оставалась
сниженной на 27; 60 и 38 % соответственно. Восстановление активности
фермента наступает через 48—72 ч.
Дикрезил даже при кратковременном воздействии в концентрации Ю—
74 мг/м3 понижает активность ХЭ крови людей на 38—45 %. Введение
животным небольших доз тиофанокса (1 мг/кг) приводит к торможению Х^
плазмы на 58 %, эритроцитов — на 79 %, мозга — на 30 %. Восстановление
фермента происходит замедленно — спустя 30—36 ч [76]. -р,
Существенное угнетение активности ХЭ наблюдается уже в первые 3
мин после введения карбофурана, диоксикарба и пиримора (табл. 5./J-
Спонтанное восстановление активности фермента происходит замедленно "
спустя 28 ч.
226
ина 5 7 Изменение активности ХЭ в биосубстратах крыс при воздействии
^ар^миновых пестицидов [42, 47]______________________________________
каРу^Т--- LD50 (мг/кг) Снижение активности ХЭ по отношению к контролю, %
плазма эритроциты мозг
КарбофУРан (8) диоксикарб (55) Пиримор (155) 81 64 72 77 91 61 79 86 70
При введении диоксикарба (25 мг/кг) кроликам ингибирование АХЭ в
оазличных отделах головного мозга (продолговатый мозг, верхние и нижние
холмики, морской конек + подбугорная область, хвостатое ядро) соответст-
венно составило 70; 68; 69 и 80 %. Установлена прямая зависимость между
выраженностью холинергических симптомов интоксикации и степенью тор-
можения активности ХЭ мозга.
Перспективной группой карбаматов инсектицидного действия с резко
выраженными холинергическими свойствами являются метилкарбаматы
различных оксимов: алдикарб, метомил, карбарил, пиримикарб, бутикарб.
Эти препараты в токсичных дозах ингибируют активность фермента в раз-
личных тканях животных на 60—80 % уже в первые 10—15 мин после
введения. При этом аккумуляция АХ в нервно-мышечных синапсах опре-
деляет появление симптомов интоксикации со стороны нервной системы и
прямо пропорциональна их антихолинэстеразной активности.
5.9.2. Токсичность, кинетика, метаболизм
Острая токсичность различных карбаматов варьирует от высокотоксич-
ных до слаботоксичных и практически нетоксичных. Для крыс LD50 состав-
ляет от менее 1 до 100 и 1000 мг/кг массы тела [38]. Для некоторых
метилсодержащих карбаматов величина LD5q в 20 раз выше, чем эффектив-
ная доза. Это означает, что ранние симптомы отравления могут проявляться
до абсорбции летальной дозы.
Нафтиловые (севин и др.) и крезиловые (дикрезил и др.) эфиры метил-
карбаминовой кислоты менее токсичны для теплокровных животных, чем
производные метил- и диметилкарбаминовых кислот, в молекуле которых
содержатся гетероциклические радикалы (пиролан и др).
Острая, дермальная токсичность карбаматов характеризовалась в основ-
ном слабой и средней выраженностью. Исключение составил высокоопас-
ныи препарат алдикарб (табл. 5.8).
Карбаматы легко проникают через неповрежденную кожу, слизистые
б °Лочки> дыхательные пути и пищеварительный тракт. Как правило, мета-
нты менее токсичны по сравнению с исходным карбаматом.
ты __нсектициды — производные метил- и диметилкарбаминовой кисло-
ма в ПОдвеРгаются окислению либо гидролизуются и выводятся из организ-
этд виде парных соединений с серной и глюкуроновой кислотами. Первый
лоту мета^олизма карбаматов — гидролиз с переходом в карбаминовую кис-
амиУньГ°ТОРаЯ Распадается на двуокись углерода (СО2) и соответствующие
при^МеТИЛОВЬ1е каР^аматы проходят через изоционаты сразу, в то время как
и°ном Р°ЛИЗе ^-диметиловых соединений промежуточный продукт вместе с
гидроксила образует спирт и N-диметилзамещенную кислоту.
в* 227
Реакции окисления (при участии оксидаз смешанной функции) включа
ют гидроксилирование ароматического кольца, О-деалкилирование, N-ме"
тилгидроксилирование, N-диалкилирование, окисление алифатических
групп в цепи, сульфоксидацию в соответствующие сульфоны. Конъюгиро-
вание в организме млекопитающих приводит к образованию О- и N-глю-
куронидов, сульфатов и производных меркаптуровой кислоты.
Производные карбаминовой кислоты слабо аккумулируются в тканях
животных. Остатки карбаматов определяются в печени, почках, мозге, жи-
ровых и мышечных тканях. Период полураспада в организме крыс состав-
ляет 3—8 ч. Выделяются в основном с мочой и фекалиями.
Таблица 5.8. Острая токсичность ряда карбаминовых инсектицидов при перо,
ральном и накожном воздействии [38]
Препарат , Оральные воздействия Дермальные воздействия
LD5q( мг/кг вид животного массы тела LD50, мг/кг вид животного массы тела
Алдикарб 0,9 Мыши > 10 Кролики 0,93 Крысы Альдоксикарб 26,8 Мыши 700—1400 Кролики 29,0 Крысы Байгон 116 Крысы 1000 Крысы 82 Мыши Бендиокарб 40—150 Крысы 566—600 Кролики Бутокарбоксим 310 Крысы 337 Крысы 72 Мыши Дикрезил 430 Крысы 845 Крысы 270 Мыши Диоксикарб 55 Крысы 1990 Кролики . 72 Мыши ' Карбофуран 6,14 Кролики 3400 Кролики 8,0 Крысы Кронетон 63,250 Мыши 5000 Крысы 400,0 Крысы Пиримор 68 Мыши 900 Крысы 111—150 Крысы Промекарб 61 Крысы > 1000 Крысы Севин 275 Мыши 4000 Крысы 720 Крысы 153 Кошки
ЛИТЕРАТУРА
1. Александровский В.Н., Садовникова Е.Д., Цуников А.И. Изменения центральной
нервной системы в тяжелых случаях отравления фосфорорганическими инсек-
тицидами и дихлорэтаном. — В кн.: Особенности реанимации при острых от-
равлениях: Мат. Всероссийской научн.-практ. конф. — Иркутск: Изд-во рай-
центра по лечению острых отравлений М3 РСФСР, 1975. — Вып. 12. — С. 126—
130.
2. Альберт А. Избирательная токсичность. Физико-химические основы терапии-
В 2 томах. Т. 1: Пер. с англ. М.А.Думпис, М.Б.Ганиной/Под ред. проф. В.А-ФИ
лова. — М.: Медицина, 1989. — 399 с.
228
з.
4.
5.
6.
Аничков С.В. Избирательное действие медиаторных средств. — Л.: Медицина,
1974. — 295 с.
Балашова Е.К., Певзнер Д.Л., Розенгарт В.И., Шерстобитов О.Е. Гидрофобность
АпггЬооорганических ингибиторов холинэстеразы и некоторые особенности их
распределения в организме//Укр. 6ioxiM. журн. — 1974. — Т. 46, № 3. — С. 312—
317.
Балашова Е.К., Певзнер Д.Л., Розенгарт В.И., Шерстобитов О.Е. Исследование
особенностей распределения в тканях, заряженных фосфорорганических инги-
Китооов холинэстеразы и их незаряженных аналогов//Укр. 6ioxiM. журн. —
1975. _ Т. 47, № 6. - С. 734-738.
Бпйд Э М Пищевые белки и токсичность пестицидов для крысят и мышей//
Бюд. ВОЗ. - 1969. - Т. 40, № 5. - С. 813-817.
7 Бресткин А.П. О роли гидрофобного взаимодействия в ингибировании холинэс-
тераз. — В кн.: Химия и применение фосфорорганических соединений. — М.:
Наука, 1973. — С. 322—323.
8 Войтенко Г.А., Семчинская Е.И. Сравнительное изучение зависимости “доза —
эффект” при оральном и ингаляционном поступлении фосфорорганических
пестицидов//Гиг. и сан. — 1987. — № 8. — С. 71—72.
9. Годовиков Н.П. Антихолинэстеразные свойства некоторых фосфорорганических
соединений. — В кн.: Химия и применение фосфорорганических соединений. —
М.: Наука, 1972. - С. 423-431.
10. Голиков С.Н. Профилактика и терапия отравлений фосфорорганическими ин
сектицидами. — М.: Медицина, 1968. — 168 с.
11. Голиков С.Н., Кузнецов С.Г. Современные представления о природе холиноре-
цептора//Вестник АМН СССР. — 1970. — № 2. — С. 67—85.
12. Голиков С.Н., Кузнецов С.Г., Зацепин Э.П. Стереоспецифичность действия лекар-
ственных веществ. — Л.: Медицина, 1973. — 184 с.
13. Голиков С.Н., Розенгард В.И. Холинэстеразы и антихолинэстеразные вещества. —
Л.: Медицина, 1964. — С. 140.
14. Голиков СИ, Селиванова А.Т. Холинергические механизмы высшей нервной
деятельности. — В кн.: Достижения современной фармакологии/Под ред. Н.П.
Бехтерева, С.Н. Голикова. — Л.: Медицина, 1976. — С. 195—199.
15. Гончаренко Н.Г Токсикология нового инсектицида дифоса (абата) и профилак-
тика интоксикаций при работе с ним: Автореф. дис. ... канд. мед. наук. — Киев,
1977. - 22 с.
16. Данилов А.Ф., Рожкова Е.К О трех механизмах блокирующего действия фос-
форганических антихолинэстеразных веществ на нервно-мышечное проведение. —
В кн.: Гигиена и токсикология пестицидов и клиника отравлений. — Киев:
Здоров’я, 1965.— С. 284—291.
17. Дишовски X. Экспериментальные исследования механизма действия некоторых
Реактиваторов при отравлении ДДВФ: Автореф. дис. ... канд. мед. наук. — Киев,
971. — 24 с.
18. Доутерман У. Биологическое и небиологическое превращение фосфороргани-
ческих соединений//Бюл. ВОЗ. - 1972. - Т. 44, № 1. - С. 135-151.
19- Евдокимов С.М. Патоморфогенез отравления животных карбаматными пестици-
дами. — В кн.: Всесоюзная учредительная конференция по токсикологии. — М.,
2i~28 ноября, 1980. - С. 218.
Ершова Е.А., Жминько П.Г. Роль монооксигеназной гидроксилирующей системы
ечени в тион-тиольной изомеризации циклофоса. — В кн.: Химия физиологи-
229
чески активных соединений: Тезисы докладов. Всесоюзный семинар. 13—is
ноября 1989. — Черноголовка. — 1989. — С. 96.
21. Ершова Е.А., Жминько П.Г., Письменная М.В., Каменко Л.Б. Роль связывания с
сывороточными белками в токсичности и избирательности действия фосфорор-
ганических пестицидов. — В кн.: Гигиена применения, токсикология пестици-
дов и полимерных материалов. — Вып. 16. — Киев, 1986. — С. 71—74.
22. Ершова Л.К., Кокшарева Н.В. Реакция центральной нервной системы на диэтик-
сим и фенобарбитал после воздействия трйортокрезил-фосфата//Физиол жуп
нал. - 1985.-Т. 31, № 4. - С. 439-444. и
23. Жминько П.Г. Особенности токсического действия циклофоса в условиях моно-
тонного и интермиттирующего воздействия//Гиг. и сан. — 1986. — № 8 —
С. 42-44.
24. Заиконникова И.В., Студенцова И.А., Гараев Р.С. Химическая структура, токсич-
ность и антихолинэстеразная активность нитрофенольных эфиров диалкилфос-
финовых кислот и их циклических аналогов. — В кн.: Фармакология и токси-
кология ФОС и других биологически активных веществ: Материалы конферен-
ции, посвященной 100-летию кафедры фармакологии Казанского мед. инс-
титута. — Казань, 1969. — С. 47—49.
25. Зеймаль Э.В., Михельсон М.Я., Рыболовлев Р.С. Связь между химическим стро-
ением и фармакологическим действием некоторых холинолитических, холино-
миметических и антихолинэстеразных веществ. — В кн.: Физиологическая роль
ацетилхолина и изыскание новых лекарственных веществ. — Л., 1957. — С. 424—
441.
26. Зильбер Ю.Д. Влияние три крезил фосфата на миелиновые оболочки и его мем-
бранотоксическое действие (некоторые вопросы патогенеза отравлений): Авто-
реф. дис. ... д-ра мед. наук. — М., 1971. — 26 с.
27. Кабачник М.И. Влияние фосфорорганических веществ на передачу нервно-мы-
шечного возбуждения//Вестник АН СССР. — 1968. — № 5. — С. 86—94.
28. Кабачник М.И., Мастрюкова Т.А., Шостаковский М.Ф. Некоторые вопросы стро-
ения и реакционной способности фосфорорганических соединений. — В кн.:
Химия и применение фосфорорганических соединений. — М., 1962.— С. 24—
45.
29. Каган Ю.С. Общая токсикология пестицидов. — Киев: Здоров’я, 1981. — 176 с.
30. Каган Ю.С. Токсикология фосфорорганических инсектицидов и гигиена труда
при их применении. — М.: Государственное издательство медицинской литера-
туры, 1963. — 326 с.
31. Каган Ю.С. Токсикология фосфорорганических пестицидов. — М.: Медицина,
1977. - 293 с.
32. Каган Ю.С. Токсикология фосфорорганических пестицидов. — В кн.: Гигиена
применения пестицидов: сборник учебно-методических материалов/Под реД-
Ю.И.Кундиева. — М.: Центр международных проектов Госкомприроды СССР,
1991.-С. 153-167.
33. Каган Ю.С., Войтенко Г.А., Паньшина Т.Н. Комплексное токсиколого-гигиени-
ческое исследование фосфорорганического инсектицида актеллика//Гиг. и сан. —
1983. - № 6. - С. 32-36.
34. Каган Ю.С., Ершова Е.А., Леоненко О.Б., Жминько П.Г., Клисенко М.А., Зейналов?
Т. Роль монооксигеназной системы в метаболизме и механизме действия неко-
торых пестицидов//Вестник АМН СССР. — 1988. — № 1. — С. 70—76.
35. Каган Ю.С., Кокшарева Н.В., Ткаченко И.И. О ранних проявлениях и механизме
230
1
у ^токсического действия фосфорорганических пестицидов//Бюл. эксп. биол.
иемед-1986.-№9.-С. 310-312.
Л мед-
зб.
37.
38.
39.
40.
к ган Ю.С., Кокшарева Н.В., Ткаченко И.И. Прогнозирование отдаленного ней-
тлксического действия фосфорорганический соединений//Токсикол. вестник. —
1995 - № 2. - С. 21-24.
Калоянова Ф. Нейротоксичность пестицидов. — В кн.: Гигиена применения пес-
тицидов. Сборник учебно-методических материалов/Под ред. Ю.И.Кундиева. —
М ' Центр международных проектов Госкомприроды СССР, 1991. — С. 137—152.
Карбаматные пестициды: общее введение//Гигиенические критерии состояния
окружающей среды 64/Материалы ВОЗ. — Женева, 1991. — 127 с.
Катц Б. Нерв, мышца и синапс. — М.: Мир, 1968. — С. 220.
Кибяков А.В. Химическая передача нервного возбуждения. — М.—Л.: Наука,
1964. — 208 с.
41 Ковтун С.Д., Кокшарева Н.В. Электрофизиологический анализ действия ряда
антихолинэстеразных веществ на функцию периферического нерва и нервно-
мышечную передачу теплокровных животных//Физиолог. журнал. — 1980. —
Т. XXVI, № 4. - С. 541-545.
42. Кокшарева Н.В. Механизм нейротоксического действия фосфорорганических и
карбаматных пестицидов, обоснование основных принципов комплексной те-
рапии отравлений: Автореф. дис. ... д-ра биол. наук. — Киев, 1985. — 24 с.
43. Кокшарева Н.В. Оценка терапевтического действия хлоргидрата S-диэтил-ами-
ноэтилового эфира р-бромбензтиогидроксимовой кислоты при отравлении фос-
форорганическим инсектицидом ДДВФ//Фармакол. и токсикол. — Киев: Здо-
ров’я, 1975. — Вып. 10.-С. 129-131.
44. Кокшарева Н.В. Терапевтическая эффективность аллоксима при эксперимен-
тальной интоксикации карбаминовыми пестицидами//Экспериментальная и
клиническая фармакология. — 1992. — № 6. — С. 51—53.
45. Кокшарева Н.В. Терапевтическая эффективность диэтиксима при отравлении
карбаминовыми пестицидами антихолинэстеразного типа действия//Фармакол.
и токсикол. — 1982. — № 4. — С. 81—85.
46. Кокшарева Н.В. Электрофизиологический анализ действия реактиваторов холи-
нэстеразы на функцию периферического нерва и мионевральное соединение
при интоксикации диметилдихлорвинилфосфатом//фармакол. и токсикол. —
Киев: Здоров’я, 1978. - Вып. 13. - С. 86-91.
47. Кокшарева Н.В., Бадаева Л.Н. Структурно-функциональные изменения в цент-
ральной нервной системе при действии диоксикарба//Физиол. журнал. — 1988. —
Т. 34, № 3. — С. 27—32.
48. Кокшарева Н.В., Каган Ю.С., Ткаченко И.И. Проблема отдаленного нейротокси-
ческого действия фосфорорганических пестицидов (обзор)//Гиг. и сан. — 1990. —
№ 2. - С. 62—67.
49- Кокшарева Н.В., Ковтун С.Д., Каган Ю.С. Действие нового реактиватора холи-
нэстеразы диэтиксима на центральную нервную систему//Бюлл. экспер. биол.
50 и медицины. - 1977. - Т. LXXXIII, № 1. - С. 29-32.
Кокшарева Н.В., Ковтун С.Д. Влияние фенобарбитала на функциональное со-
стояние нервно-мышечного соединения и периферического нерва белых крыс
РИ действии ДДВФ и афугана. — В кн.: Доклады АН УССР, серия Б: “Геоло-
гические, химические и биологические науки”. — Киев, 1981. — № 2. — С. 78—
51, гг
кшарева Н.В., Ткаченко И.И., Каган Ю.С. Воздействие фосфорорганических
231
соединений, обладающих отдаленной нейротоксичностью//Гиг. и сан. — 1988
№ 10. - С. 83-84.
52. Котеленец А.И., Карасева А.Е. Активность ацетилхолинэстеразы различных от-
делов нервной системы при интоксикации офунаком. — В кн.: Фармакология и
токсикология природных и синтетических соединений: Тез. докл. V съезда
фармацевтов, фармакологов и токсикологов. — Минск, 1989. — С. 62—63.
53. Красовский Г.Н. Возрастная, половая и видовая чувствительность к химическим
веществам. — В кн.: Профилактическая токсикология: Сб. учебно-метод. мате
риалов. - М.: МРПТХВ, 1984. - Т. 1. - С. 268-281.
54. Кундиев Ю.И. Всасывание пестицидов через кожу и профилактика отравлений. —
Киев: Здоров’я, 1975. — 200 с.
55. Кунак Ю.А. Поглощение паровой фазы фосфорорганических пестицидов в ды-
хательных путях животных//Фармакол. и токсикол. — Киев. — 1972. — № 7 —
С. 140-142.
56. Лошадкин Н.А. Некоторые вопросы биохимического механизма и токсикологи-
ческого действия фосфорорганических ингибиторов холинэстераз. — В кн.:
Б.Сондерс. Химия и токсикология органических соединений фосфора и фтора. —
М.: Изд. иностр, лит., 1961. — С. 315—418.
57. Лужников Е.А. Клиническая токсикология. — М.: Медицина, 1982. — 368 с.
58. Лужников Е.А., Костомарова Л.Г. Острые отравления: Руководство для врачей. —
М.: Медицина, 1989. — 432 с.
59. Махаева Г.Ф., Малыгин В.В., Мартынов И.В. Отставленная нейротоксичность
при действии фосфорорганических пестицидов//Агрохимия. — 1987. — № 12. —
С. 103-124.
60. Мельников И.И., Волкова А.И., Короткова О.А. Пестициды и окружающая среда. —
М.: Химия, 1977.-С. 148-179.
61. Михайлов С.С., Щербак И.Г. Метаболизм фосфорорганических ядов. — М.: Ме-
дицина, 1983. — 112 с.
62. Михельсон М. Я., Зеймаль Э.В. Ацетилхолин. — Л.: Наука, 1970. — С. 28.
63. О’Брайн Р.Д. Токсичные эфиры кислот фосфора: Пер. с англ. проф. В.И.Розен-
гарта/Под ред. акад. И.Л.Кнунянца. — М.: Мир. — 1964. — 631 с.
64. Одинцов В.С. Биохимические основы применения фосфорорганических инсек-
тицидов. — Киев: Наукова думка. — 1972. — 175 с.
65. Оппенорт Ф. Резистентность насекомых: роль метаболизма и возможность ис-
пользования//Бюл. ВОЗ. — 1972. — Т. 44, № 1—3. — С. 197—206.
66. Прозоровский В.Б., Саватеев Н.В. Неантихолинэстеразные механизмы действия
антихолинэстеразных веществ. — М.: Медицина, 1976. — 160 с.
67. Промоненков В. К, Каспаров В.А., Варшавская И.С. Мировое производство и
применение фосфорорганических пестицидов/Итоги науки и техники. Серия
Органическая химия. Т. 8. Актуальные направления исследования и применения
химических средств защиты растений. Фосфорорганические соединения. — М-
ВИНИТИ, 1988. - 203 с.
68. Пурдела Д., Выльчану Р. Химия органических соединений фосфора. —
Химия, 1972.- 752 с.
69. Риза Л.В. Сравнительное изучение влияния на организм животных монотонно^
и интермиттирующего воздействия рицида-П//Гиг. и сан. — 1986. — №
С. 77-79.
232
70.
71-
72.
73.
енгард В.И. Холинэстеразы. Функциональная роль и клиническое значение. —
В кн ' Проблемы медицинской химии. — М.: Медицина, 1973. — С. 66—106.
р зенгарт В.И., Шерстобитов О.Е. Избирательная токсичность фосфороргани-
ских инсектоакарицидов (сравнительно-биохимические аспекты)/Под ред.
д П Бресткина. — Л. — Наука: Ленинградское отделение, 1978. — 176 с.
Руководство по токсикологии отравляющих веществ/Под ред. С.Н.Голикова. —
М.: Медицина, 1972. — 470 с.
Рыболовлев Р.С. Роль эстератических участков холинорецепторов в блокирую-
щем действии некоторых инсектицидов. — В кн.: Гигиена и токсикология пес-
тицидов и клиника отравлений. — Киев: Здоров’я, 1965. — С. 452—458.
74 Садыков А.С., Розенгард Е.В., Абдувахабов А.А. Холинэстеразы. Активный центр
и механизм действия. — Ташкент: ФАН, 1976. — С. 205.
75 Сондерс Б. Химия и токсикология органических соединений фосфора и фтора. —
М.: Изд-во иностр, лит., 1961. — 424 с.
76 Справочник по пестицидам (гигиена применения и токсикология)/Под ред.
А.В.Павлова. — Киев.: Урожай, 1986. — С. 125—130.
77 Тасаки И. Нервное возбуждение: макромолекулярный подход. — М.: Мир, 1971. —
222 с.
78 Ткаченко И.И., Каган Ю.С., Кокшарева Н.В., Бадаева #Я.//Фармакол. и токси-
кол. - 1980. - № 6. - С. 80-83.
79. Тремасов М.Я., Жуков Ю.А. Изменение биоэлектрической активности тканей и
гемодинамика мозга у кроликов при действии фосфакола. — В кн.: Разработка
эффективных методов профилактики и лечения животных при инфекционных
заболеваниях. — Казань, 1982. — С. 118—120.
80. Турпаев Т.М. Медиаторная функция ацетилхолина и природа холинэстеразы. —
М.: Изд-во АН СССР, 1962. - С. 140.
81. Фосфорорганические инсектициды: общее введение. Гигиенические критерии со-
стояния окружающей среды 63. ВОЗ. — Женева, 1990. — 168 с.
82. Франков И.А. Зависимость токсичности и антихолинэстеразных свойств от хи-
мического строения в ряду алкиламидов ди-диалкилфосфорных кислот. — В кн.:
Химия и применение фосфорорганических соединений. — М.: Изд. АН СССР,
1957. - С. 366-371.
83. Фукуто Т. Зависимость между строением фосфорильных соединений и их ин-
гибиторной активностью в отношении ацегилхолинэстераз//Бюл. ВОЗ. — 1972. —
Т. 44, № 1-3. - С. 33-43.
84. Хадсон Р. Структура и механизм реакций фосфоросоединений. — М.: Мир,
1967. — 360 с.
85- Ходжкин А. Нервный импульс. — М.: Мир, 1965.
86. Шрадер Г. Новые фосфорорганические инсектициды: Пер. с нем. А.Г.Зенькеви-
Ча, Я.А.Мандельбаума, К.Д.Швецовой-Шиловской/Под ред. проф. Н.Н.Мельни-
кова. - М.: Мир, 1965. - 488 с.
37
Шуляк В.Г. Влияние фосфорорганических пестицидов на гемопоэз: Автореф.
Дне. канд. биол. наук. — Киев, 1989. — 22 с.
88 з
’ кклс Дж. Синапс. Молекулы и клетки. — М.: Мир, 1966. — С. 167-185.
Aldridge W.N. Some properties of specific cholinesterase with particular reference to
e mechanism of inhibition of diethyl p-nitro-phenyl thiophosphate (E605) and
anal0gus//Biochem. J. - 1950. - Vol. 46. - P. 451-460.
233
90. Benke G.M., Murphy S.D. The influence of age on the toxicity and metabolism of
methyl parathion and parathion in male and female rats//Toxicol. appl. Pharmacol 1
1975. - Vol. 31. - P. 254-269.
91. Brick I.L., Brestkin A.P., Mandelshtam J.E., Sazonoya LN. Substrate and inhibitor
specificity of cholinesterases from certain insects//Environment quality and safetv
Suppl. VIII. - Stuttgart. - 1975. - P. 539-543. "
92. Casida J.E., Sanderson D.M. Reaction of certain phosphorothionate insecticidex with
alcohols and potentiation by breacdown products//), agric. food Chem. — 1963 — Vol
11.-P. 91-96.
93. Clinical and experimental toxicology of organophosphates and carbamates/Eds
B. Ballantyne and T.C.Marrs. — Oxford: Butterworth — Heinemann Ltd, 1992.
641 p.
94. D’Mello D.G. Neurobehavioural toxicology of anticholinesterases. — In: Clinical and
experimental toxicology of organophosphates and carbamates/Eds. B.Ballantyne and
T.C. Marrs. — Oxford: Butterworth — Heinemann Ltd, 1992. — P. 61—75.
95. Ecobichon D.J., Ozere R.L., Reid E., Crocker J.F.S. Acute fenitrothion poisoning//Can
Med. Assoc. J. - 1977. - Vol. 116. - P. 377-379.
96. Eto M. Organophosphorous Pesticides: Organic and Biological Chemistry. — Cleve-
land, Ohio: CRC Press, 1974.
97. Eto M. and Ohkawa H. Alkylation reaction of organophosphorus pesticides: its chemical
and biochemical significance. In: Biochemical toxicology of insecticides. New York,
London. — Academic Press. — 1970. — P. 93—104.
98. Fest C., Schmidt KJ. The chemistry of organophosphorus pesticides. Springer Verlag.
Berlin — Heidelberg — New York, 1973. — 539 p.
99. Fukuto T.R., Metcalf R.L.//S. Am. Chem. Soc. — 1954. — Vol. 76. — P. 103.
100. Hansch C., Deutsch E.W. Biochem. Biophys. Acta. — 1966. — Vol. 112. — P. 381.
101. Hayes WJ. Pesticides studied in man. — Baltimor; London: Williams and Wilkins,
1982. - 672 p.
102. Heath D.F. Organophosphorus Poisons. New York: Pergamon Press. — 1961.—
P. 150-202.
103. Jarv J. Stereochemical aspects of cholinesterase catalisis//J. Bioorgan. Chem. — 1984. —
Vol. 12. - P. 259-278.
104. Johnson M.K Improved assay of neurotoxic esterase for screening organophosphates
for delayed neurotoxicity potential//Arch. Toxicol. — 1977. — Vol. 37. — P. 113—115.
105. Kagan Yu.S. Principles of pesticide toxicology. Centre of international projects. GKNT —
Moskow, 1985. — 176 p.
106. Kagan Yu.S., Kokshareva N.V., Tkachenko 1.1. Selective delayed neurotoxic effects °f
certain organophosphorous pesticides. — In: The 6th Intern, congress of pesticides
chemistry IUPAC, Aug., 1986. — Ottawa, Canada. — P. 3-A—34.
107. Lotti M., Becker C.E., Aminoff M.Y. Organophpsphate polyneuropathy: pathogenesis
and prevention//Neurology. — 1984. — N 34. — P. 658.
108. Maxwell D.M., Lenz D.E. Structura-activity relationships and anticholinesterase activ
ity//Clinical and Experimental Toxicology of Organophosphates and Carbarn® j
Bryan Ballantyne, Timothy C.Marrs. Foreword by: W.N.Aldridge. — Butterworth
Heinemann. — 1992. — P. 47—58.
109. Mendoza C.E. Toxicity and effects of malathion on esterases of suckling albi*10
rats//Toxicol. appl. Pharmacol. — 1976. — Vol. 35. — P. 229—238.
234
Principles and methods for the assessment of neurotoxicity associated with exposure to
1Ю- hemicals: Environmental health criteria 60//Environ: health criteria. — 1986. — N 60. —
T80 p. *
Sharma RP-, Tomar R.S. Immunotoxicology of anticholinesterase agents. — In: Clini-
П * ° । ncj experimental toxicology of organophosphates and carbamates/Eds. B.Ballan-
tyne and T.C. Marrs. — Oxford: Butterworth — Heinemann Ltd, 1992. — P. 203—210.
и? Tkachenko 1.1., Kokshareva N. V., Kagan Yu.S. A study of the delayea neurotoxic effect
2 of a new organophosphorous fungicide 0,0-diphenyl-l-acetoxy-2,2,2-trichlorethylphos-
nhnnate (aphos). Communication 1. Clinical manifestations and neurotoxic esterase
h"hibition//Fresenius Env. Bui. - 1992. - N 1. - P. 571-576.
ПЗ Tkachenko 1.1., Kokshareva N.V., Kagan Yu.S. A study of the delayed neurotoxic effect
of a new organophosphorous fungicide 0,0-diphenyl-1 -acetoxy-2,2,2-trichlorethylphos-
nhonate (aphos). Communication 2. Electrophysiological and morphological investi-
gations//Fresenius Env. Bui. - 1993. - N 2. - P. 131-136.
Глава 6
ТОКСИКОЛОГИЯ АЛКИЛИРУЮЩИХ СОЕДИНЕНИЙ
6.1. Типы алкилирующих соединений.
Механизмы реакций с нуклеофильными реагентами
6.1.1. Алкилирование. Типы алкилирующих соединений
Алкилированием в органической химии называют реакции, сопровождающие-
ся введением алкильного радикала в структуру нуклеофильных реагентов. К
последним относят амины, меркаптаны, спирты, нуклеиновые основания и
другие соединения.
Типичными алкилирующими соединениями являются галоидные алкилы
(йодистый метил, бромистый метил и др.), реакцию которых с нуклеофиль-
ными реагентами, например с меркаптанами и аминами, описывают урав-
нениями 1 и 2:
RX + HSR6' -> RSR + XH. (1)
RX + H2NR' -> RNH-R + XH, (2)
где R означает СН3; С2Н5 или другие алкильные радикалы, X — галоид,
R' — алкильный радикал в молекуле субстрата, с которым реагирует алки-
лирующий агент. В данных реакциях продуктом алкилирования служат
тиоэфиры и алкилированные амины.
Такие же свойства имеют и другие соединения, представляющие собой
замещенные галоидные алкилы и их производные. К ним относятся иприты
(серный иприт и азотистые иприты) и их аналоги.
Алкилирующее действие оказывают алкиловые (метиловые и др.) эфиры
сульфокислот и кислот фосфора, а также других минеральных кислот:
CH3OSO2OCH3 + H2NR -> CH3NHR + HOSO2OCH3. (3)
Алкилирующими свойствами также обладают олефины и их производ-
ные, содержащие активированные кратные связи, раскрытие которых про-
исходит при реакциях с нуклеофильными реагентами. Реакционная способ-
ность олефинов зависит от электронного и пространственного влияния
заместителей у атомов углерода, находящихся в сопряжении с кратными
связями. Индукционные и мезомерные эффекты заместителей у атомов
углерода в олефинах влияют на степень поляризации кратных связей, что
определяет реакционную способность соединений и механизмы реакции.
Этим можно объяснить, почему “несимметричные” алкены, как правило,
более реакционноспособны, чем их симметричные аналоги. Например, изо-
бутилен более реакционноспособен по отношению к нуклеофильным Реа'
гентам, чем бутен-2 (симметричный изомер). Природа заместителей так*6
влияет на направление атаки нуклеофила и состав продуктов реакции. Так,
при реакции изобутилена с нуклеофильным реагентом, имеющим подви*'
ный атом водорода (H-Nu), нуклеофильная группа присоединяется к наи-
более гидрированному атому углерода (правило Марковникова):
236
(4)
xch3
CH2 = с + Н—Nu —» <ЗН2СН(СН3)2.
^СНз Nu
9то справедливо для незамещенных алкенов. При появлении рядом с
ной связью электроотрицательных заместителей изменяется направле-
Крнуклеофильной атаки. Так, при реакции нуклеофила (H-Nu) с акроле-
ние образуется алкилированная молекула акролеина, но присоединение
нуклеофильного реагента происходит иначе:
СН2=СН—С(О)Н + Н—Nu -> СНз—|СН—С(О)Н. (5)
Nu
Аналогично реакции с акролеином (уравнение 5) реакция нуклеофиль-
ного реагента с перфторизобутиленом (ПФИ) также проходит “против”
правила Марковникова:
х CF3
CF2=C + Н—Nu —> CF2H—C(CF3)2Nu. (6)
^CFg
Приведенные примеры свидетельствуют о значимости понимания меха-
низмов и скоростей реакций алкилирующих соединений с нуклеофильными
реагентами. В соответствии с этими представлениями становится понятным,
почему ПФИ обладает высокой реакционной способностью по отношению
к нуклеофильным группам биомишеней и высокой физиологической актив-
ностью при ингаляции (LCtso — 1,5 мг-мин/л).
К алкилирующим агентам относятся также соединения, содержащие ак-
тивированные кратные связи, в частности раздражающие вещества, такие
как акролеин, хлорацетофенон, вещества “CS”, “CR” и др.
В указанных выше реакциях в качестве нуклеофильных реагентов ис-
пользовались соединения, содержащие подвижный атом водорода. В таких
случаях реакции алкилирования формально можно рассматривать как реак-
ции замещения атома водорода в нуклеофильном реагенте на алкильный
радикал. Наряду с этим при реакциях алкилирующих соединений с нукле-
офильными реагентами без подвижного атома водорода имеет место алки-
лирование атома азота, содержащего свободную неподеленную пару элек-
тронов с образованием аммониевых солей. Реакция сопровождается изме-
нением степени гибридизации электронов атома азота (sp2 — sp3):
RX+NR'3 -> RN+R3 + X". (7)
Подобные реакции возможны при алкилировании нуклеиновых основа-
нии ипритами и другими алкилирующими агентами, что является причиной
мУтаций.
Аналогичным путем происходит алкилирование тиоэфиров с образова-
ием сульфониевых структур:
RX + R'SR" -> R'S+(R)R" + Х~. (8)
& Эт°й реакции изменяется степень гибридизации электронов атома серы
— sp2).
В оРганизме эти реакции, катализирующиеся ферментами из класса
веще ераз’ игРают важную роль при защите организма от чужеродных
щ ств в результате образования ониевых соединений, растворимых в воде.
237
6.1.2. Механизмы взаимодействия алкилирующих соединений
с нуклеофильными реагентами
Типичной реакцией алкилирующих соединений с нуклеофильными ре
агентами является гидролиз ипритов и их аналогов. Рассмотрим в качеств
примера механизм гидролиза аналога азотистого иприта — бис(2-хлог)э
тил)метиламина — “эмбихина”. р '
/СН2СН2С1 + Н2О /СН2СН2ОН + Н2О
CH3N. ---» CH3N ----»
CH2CH2CI -HCI XCH2CH2CI -HCI
_хСН2СН2ОН
CH3hk
СН2СН2ОН.
Реакция проходит в две стадии с образованием конечного продукта
бмс(2-оксиэтил)метиламина через промежуточное соединение.
Аналогичным образом гидролизуется иприт с образованием тиодигликоля:
/СН2СН2С1 + Н2О /СН2СН2ОН + Н2О
S. * ----*
XH2CH2CI -HCI ^CH2CH2CI -HCI
(10)
/CHjCHjOH
s\
СН2СН2ОН.
Эти реакции можно рассматривать как реакции нуклеофильного заме-
щения у атома углерода, находящегося в P-положении к атому азота (или
серы) по типу SN2-механизма. Скорость гидролиза растворенного иприта
при избытке воды высокая: среднее время гидролиза иприта при 25 °C —
8,5 мин в дистиллированной воде и 60 мин в морской. Высокая гидроли-
тическая устойчивость иприта связана не с низкой реакционной способнос-
тью растворенного иприта, а с его низкой растворимостью в воде (0,07 %).
Изучение механизмов реакции показало, что гидролиз аналога азотистого
иприта эмбихина проходит через образование промежуточных этйлениминовых
структур, которые взаимодействуют с водой при большой скорости [8]:
В данном случае отмечается SN]-механизм, при котором образование
ленаммониевых структур является* стадией, определяющей скорость ре-
ЭТИЛии Аналогичным образом установлена возможность образования эти-
а₽нсульфониевых структур и в случае серного иприта [8].
ЛС Образование подобных структур зависит от электронных и пространст-
ь1х эффектов других заместителей у атома азота (серы), что определяет
алкилирующие свойства подобных соединений.
371 Накопленные в середине 50-х годов данные о высокой реакционной
пособности структур, содержащих этилениминные группы, были исполь-
зованы при синтезе противоопухолевых препаратов.
Выше были рассмотрены основные типы алкилирующих соединений и
взаимодействие их с нуклеофильными реагентами. Скорость подобных ре-
акций различается на порядки в зависимости от строения алкилирующих
соединений, нуклеофильных реагентов и условий реакции (температура, pH,
природа растворителя и другие факторы). Исследованию этих процессов
посвящены многие работы в области химии и токсикологии алкилирующих
соединений [8, 12].
^СН2СН2С1
CH3N
^СН2СН2С1
^-СН2СН2ОН
CH3N «---- *
^СНгСНгС!
СЙ3 СН2СН2С1
+ Н2О
-HCI
СН2—СН2
N
^СН2СН2ОН
+Н2О
-HCI
/СН2СН2ОН
сн3ьг
\сн2сн2он
6.2. Биохимические мишени алкилирующих соединений.
Общая токсикологическая характеристика
6.2.1. Биохимические мишени алкилирующих соединений
Под биохимическими мишенями в токсикологии обычно понимают мо-
лекулярные структуры — ферменты, рецепторы, нуклеиновые кислоты, струк-
турные элементы биологических мембран и другие субклеточные структуры,
взаимодействие которых с физиологически активными и токсичными веще-
ствами является пусковым механизмом в развитии патологических процес-
сов на всех уровнях организации организма.
Основные биомишени алкилирующих соединений — аминокислоты, пепти-
ды, белки, нуклеиновые кислоты, липиды и другие биологически важные соеди-
нения. С функциональными группами этих соединений (амино-, сульфо-,
окси- и карбоксигруппы и др.) реагируют алкилирующие соединения, нарушая
структуру и функции активных центров ферментов, рецепторов и других
биологически важных макромолекул. Помимо взаимодействия с нуклео-
фильными группами активных центров, алкилирующие соединения реа-
гируют с
имеющие
структуры
реагирует
активного
При взаимодействии ипритов и других алкилирующих соединений с
нуклеиновыми кислотами возможно алкилирование нуклеиновых (как пра-
вило, пуриновых) оснований с образованием ониевых соединений. Молеку-
а гуанина алкилируется по атому азота в положении 7 с образованием
^твертичного заряженного соединения. В последующем имеет место разрыв
-гликозидной связи с депуринизацией нуклеотида.
ди В Этом состоит молекулярный механизм мутации при действии ипритов,
лек етилсУльФата и других алкилирующих соединений. “Выпавшее” из мо-
Щат ЛЫ в результате алкилирования пуриновое основание может заме-
реп Ься ДРУГИМ основанием (“точечная мутация”), что проявляется при
ликации и транскрипции НК. В клетках существуют системы фермен-
группами, не входящими в активные центры ферментов, но
важное значение в поддержании третичной и четвертичной
белков. Так, установлено, что с одной молекулой папаина
17 молекул иприта, из которых большинство реагируют вне
центра фермента.
238
239
он
ная связь I
Цепь ДНК
+ RX
-X
Разрыв рибоза
N-гликозидной I
связи Цепь ДНК
+ ОН
I
Дезокси-
рибоза
I
Цепь ДНК
без гуанина
тативных процессов (ДНК-полимеразы, лигазы и др.), направленные на
восстановление нативных молекул НК. В том случае, если одновременно
имеет место алкилирование двух нуклеиновых оснований, расположенных
рядом (либо одно над другим в одной цепи ДНК, либо в противоположных
цепях ДНК), то в результате их алкилирования и последующей депурини-
зации образуются более серьезные дефекты в двойной спирали ДНК, вос-
становление которых в ходе репарационных процессов затруднено. Вот
почему бмс-алкилирующие соединения (иприты и их аналоги, соединения
типа ТЭФ и др.) обладают более выраженными мутагенными свойствами.
Помимо взаимодействия с нуклеиновыми основаниями, важную роль
играют взаимодействия иприта с ферментами углеводного обмена, кофер-
ментами дегидрогеназ (НАД, НАДФ и др.), гексокиназой и другими фер-
ментами, что приводит к блокаде гликолиза [12, 13].
Биомишени, на которые направлено действие алкилирующих соедине-
ний, находятся в разных тканях, расположенных на различных стадиях
контакта с веществом и проникновения его в организм, что в совокупности
со свойствами веществ важно при формировании “биоответа” в виде функ-
циональных нарушений организма и симптомов интоксикации.
6.2.2. Общая токсикологическая характеристика
алкилирующих соединений. Концентрационные эффекты
Различают местное, рефлекторное и общерезорбтивное действие алкили-
рующих соединений. При количественной оценке местного и рефлекторного
действия обычно используют концентрационные характеристики токсичес-
кого действия. Общерезорбтивное действие оценивают, как правило, вели-
чинами токсических доз (при относительно коротких экспозициях — мину-
ты, десятки минут) [1,4, 10, 12].
Местное действие алкилирующих соединений проявляется в развитии па-
тологических процессов в местах их нанесения (аппликация). При этом
типичны поражения ипритом кожи, слизистых оболочек глаз и верхних
дыхательных путей. Рассмотрим механизмы развития поражения кожи и
общие закономерности зависимости степени поражения от количества (д°"
зы) и концентрации алкилирующих соединений.
Эпидермис кожи человека — сложная биомембрана гетерогенного стро-
ения. Гидратированные волокна а-спиралей белка кератина чередуются с
липидным матриксом эпидермиса. Вещества, хорошо растворяющиеся 0
липидах (иприты и др.), быстро (минуты) поступают в верхние слои эпи-
дермиса и сальные железы. Накопление вещества в базальных клетках пр°"
ходит медленнее. В соответствии с законом Фика скорость поступления
них зависит от концентрации вещества в эпидермисе и степени сродст0
240
j
lecTBa к структурным элементам рогового слоя эпидермиса человека, что
ве бШеМ ВИде пропорционально коэффициенту распределения вещества в
В °геме липид — вода (1g Р по подходам Ганга). В этом отношении наиболь-
си опасность представляют случаи, когда липидофильные алкилирующие
Единения попадают на значительную площадь кожи и в большом количестве.
С°еПо мере поступления вещества в базальные клетки эпидермиса проис-
пит их поражение. Иприты и их аналоги ингибируют ферменты углевод-
Хого обмена (гексокиназу, НАД и др.), блокируя гликолиз и процессы
Нканевого дыхания в клетках, вызывают мутации хромосом ядер базальных
клеток, нарушая их митозы. Клетки базального слоя эпидермиса кожи
гибнут' Гибнут также клетки эндотелия кровеносных капилляров эпидерми-
са под базальной мембраной. Жидкая часть крови (плазма) поступает в
пространство между базальным и роговым слоем, на коже образуются “пу-
зыри”, характерные для действия ипритов и других алкилирующих соеди-
нений на кожу человека.
Общерезорбтивное действие алкилирующих соединений. Иприты и другие
алкилирующие соединения поступают в ткани внутренних органов с кровью
через органы дыхания, кожу, слизистые оболочки глаз, верхних дыхательных
путей и ЖКТ. Наибольшую опасность представляет поступление ОВ через
органы дыхания ингаляционным путем.
При поступлении паров и мелкодисперсного аэрозоля (частицы разме-
ром 5—10 мкм и менее) в органы дыхания алкилирующие соединения
проникают через стенки альвеол на большой поверхности («70—100 м2) и
быстро поступают в кровь через легочные капилляры. С артериальной кровью
вещество в доли секунд поступает в сердце, а затем в ткани внутренних органов.
При проникновении в клетки тканей внутренних органов иприты и
другие алкилирующие соединения нарушают процессы тканевого дыхания
(ингибируя гексокиназу и другие ферменты углеводного обмена) и вызывают
нарушение генетического аппарата клеток.
Клетки, подвергшиеся воздействию ипритов и других алкилирующих
соединений, оказывающих мутагенное действие, имеют системы защиты
генетического аппарата на молекулярном уровне в виде так называемых
репарационных процессов. В ходе этих процессов, направленных на восста-
новление первичного генетического материала, “специфические” ферменты
(они разные в клетках различных организмов) вырезают “поврежденные”
фрагменты и восстанавливают структуру ДНК и РНК. Это требует опреде-
ленного времени. Если скорость репарационных процессов оказывается
меньше скорости деления клеток, то возникшие мутации приводят к тяже-
лым последствиям. Клетка с поврежденным генетическим аппаратом не
может делиться либо дочерние клетки становятся нежизнеспособными. Вот
почему при общерезорбтивном действии ипритов и других алкилирующих
соединений в первую очередь страдают клетки тех тканей и органов, кото-
рые обладают высокой митотической активностью (клетки кроветворных
органов, слизистых оболочек, половых желез и др.), т.е. тканей, наиболее
ЛВствительнь1Х к действию проникающей радиации (радиомиметический
Ффект алкилирующих соединений).
сОР°Месте„с тем способность аналогов ипритов и других алкилирующих
Динений вызывать хромосомные мутации и гибель быстроделящихся
препар используют химики и фармакологи при создании противоопухолевых
ляютаИб°Лее типичными представителями алкилирующих соединений яв-
ся иприты, применяемые в качестве боевых отравляющих веществ.
241
6.3. Токсикология ипритов 1
Иприт — наиболее эффективное ОВ, известное со времен первой миро-
вой войны (“желтый крест”, “Lost”, “горчичный газ”).
С военными целями это вещество впервые было использовано Герма-
нией с 12 на 13 июля 1917 г. при обстреле химическими снарядами англо-
французских войск в долине р. Ипр (Бельгия), откуда и пошло его название
Несмотря на то что иприт был применен на фронтах первой мировой войны
позже других ОВ, потери от него были такими же, как от всех других ОВ
вместе взятых [10, 12]. Это можно объяснить тем, что иприт вызывает
поражения при различных видах аппликации. По опыту первой мировой
войны наиболее характерными были “местные” поражения кожи, глаз и
органов дыхания, приводящие к потере боеспособности. На этом основании
в некоторых монографиях иприт относят к “несмертельным агентам”, но
это неверно.
6.3.1. Общая характеристика и токсичность
Иприт — |3,Р'-дихлордиэтилсульфид — S(CH2CH2C1)2 — отравляющее ве-
щество (шифр армии США — “Н”, “HD”).
Иприт представляет собой бесцветную или слабо окрашенную маслянис-
тую жидкость. Технический иприт — бурая маслянистая жидкость с запахом
чеснока или горчицы (откуда и название в литературе “горчичный газ”),
= 14 °C, но может быть и ниже в зависимости от примёсей, tKHn = 217 "С.
Пары иприта в 5,5 раза тяжелее воздуха, Смакс 20 ’С = 0,6 мг/л. Несмотря на
малую упругость пара, концентрации иприта, создающиеся в воздухе, могут
вызывать поражения глаз, органов дыхания и кожи различной степени тяжести.
Иприт плохо растворим в воде (0,07 %), чем объясняется его высокая
гидролитическая устойчивость. Растворенный иприт гидролизуется с отно-
сительно высокой скоростью с образованием нетоксичного тиодигликоля и
НС1. Время гидролиза наполовину растворенного в дистиллированной воде
иприта при 5 °C составляет 3 ч, при 10 “С — 51 мин, при 20 °C — 10 мин, а
при 37 °C — 3 мин. В морской воде гидролиз проходит с более низкой
скоростью. Сравнительно малая летучесть и высокая гидролитическая ус-
тойчивость благодаря плохой растворимости в воде обеспечивают стойкость
иприта на поверхности техники и местности: летом — в течение многих
недель, зимой — месяцев. Иприт хорошо растворим в органических раство-
рителях, а также в резине, масляной краске и лаках, куда быстро проникает. *
Все это характеризует иприт как устойчивое, труднодегазируемое вещество.
Основная форма применения — аэрозоль. Пороговая токсическая доза —
0,05 мг мин/л; LCt50 = 0,15—0,2 мг мин/л; LCt50 = 1,0—1,5 мг-мин/л. Иприт
оказывает кумулятивное действие. При действии через кожные покровы |
LD50 = 50—70 мг/кг. Дозы, вызывающие поражения кожи, 0,05—0,1 мг/см
[6, 7]. ПДКрабз - 2-10-4 мг/мз. пДКатм в - 2-10-6 мг/м3 [8]; ПДКводы '
2-10 4 мг/л.
6.3.2. Механизм токсического действия
Иприты обладают уникальными механизмами токсического действия: вы-
зывают нарушения структуры и функции генетического аппарата клет<>к’
необратимо угнетают ферменты тканевого дыхания и другие ферменты,
поражая тем самым ключевые звенья метаболических процессов клетки.
242
Иприт является сильным клеточным ядом, что обусловлено его способ-
стьк? взаимодействовать с нуклеофильными группами белков и нуклеи-
н°вых кислот. Это приводит к образованию связей (С—N и др.), характе-
Низующихся высокой энергией (приблизительно 500 кДж), которые не могут
быть реактивированы с помощью нуклеофильных реагентов. Это одна из
основных причин отсутствия до сих пор специфических антидотов от ип-
рита. , _
Иприт угнетает ферменты углеводного обмена, в частности гексокиназу,
катализирующую фосфорилирование глюкозы на I стадии ее окисления.
Механизм ингибирования обусловлен алкилированием ипритом нуклео-
фильных групп в активном центре гексокиназы:
^CH2CH2CI h2n—Ё
''""CH2CH2CI HS—|
-2HCI
н
.СН2СН2 —N —|
S I \
^сн2сн2 —s —
где Е — фермент (энзим) — гексокиназа.
Торможение гексокиназы в клетках базального слоя эпидермиса кожи
наиболее выражено спустя 2—4 ч после нанесения иприта на кожу (т.е. к
концу “скрытого” периода), что способствует нарушению углеводного об-
мена в клетках эпидермиса и их гибели [3, 4].
Нарушение тканевого дыхания обусловлено также взаимодействием ип-
рита с пуриновыми основаниями НАД и НАДФ — коферментов дегидроге-
наз, участвующих в окислительно-восстановительных процессах в клетках,
что приводит к нарушению гликолиза, синтеза АТФ и гибели клеток.
Помимо взаимодействия с гексокиназой, и НАД и НАДФ, иприт, как
отмечалось выше, реагирует с нуклеиновыми кислотами, алкилируя пури-
новые основания (в основном остатки гуанина), которые выпадают из
полимерных цепей ДНК и РНК. Нарушение строения ДНК и РНК является
основной причиной мутагенного действия иприта, что приводит к наруше-
нию деления клеток (митозов) и синтеза белков.
6.3.3. Симптомы поражения
Иприт обладает выраженным местным и резорбтивным свойством. Для
него характерны следующие особенности:
• отсутствие раздражающего действия в момент контакта;
• привыкание к его запаху, когда человек перестает ощущать запах
горчицы (чеснока) через несколько минут;
• наличие скрытого периода;
• воспалительно-некротические процессы в тканях, в которые иприт
проникает;
• медленное течение процессов восстановления и часто присоединяю-
щиеся вторичные инфекции;
• повышенная чувствительность к повторным воздействиям иприта.
При попадании на кожу капельно-жидкого иприта он быстро растворя-
Ся в липВДной смазке кожи. Если дегазация не произведена в течение 5 мин,
СтвИПРит пРоникает в глубокие слои эпидермиса, накапливаясь преимуще-
енно в сальных железах и волосяных фолликулах кожи. На участках с
243
более тонкой и нежной кожей и большим количеством сальных и потовых
желез (кожа шеи, груди, подмышечных впадин и др.) поражения более
выражены. Доза 0,05 мг/см2 при действии в течение 5 мин вызывает эри-
тему, доза 0,1—0,25 мг/см2 при этих же условиях — образование пузырей
[12].
Скрытый период — 2—6 ч. Затем появляются признаки поражения кожи
(покраснение, зуд, отечность). Вначале возникают мелкие пузыри, напол-
ненные прозрачной жидкостью. Увеличиваясь в объеме, пузыри сливаются
образуя более крупные. Максимальное развитие пузырей — в конце 1—2-х
суток (в зависимости от дозы иприта). Затем оболочка пузырей прорывается
и возникают язвы, которые часто инфицируются и медленно заживают
(недели, месяцы). На месте язв, как правило, образуются рубцы, которые в
области суставов могут ограничивать подвижность и нарушать их функцию.
Пары иприта при токсических дозах 0,1—0,3 мг-мин/л вызывают эрите-
му; 0,2—1,0 мг-мин/л — пузыри и 0,75—1,5 мл-мин/л — серьезные пораже-
ния кожи с образованием множественных пузырей [12]. Симптомы пораже-
ния развиваются, как правило, спустя несколько часов. Сначала возникают
покраснения с последующей пигментацией, напоминающей солнечный за-
гар; затем — пузыри, на месте которых через 2—3 сут образуются язвы. При
действии паров и аэрозолей иприта возможны поражения на большой пло-
щади, что обычно сопровождается выраженным резорбтивным действием.
Глаза наиболее чувствительны к действию иприта. Токсические дозы
иприта, равные ® 0,07 мг-мин/л, вызывают поражение глаз легкой степени
(конъюнктивиты); 0,1 мг-мин/л — поражение глаз с нарушением зрения и
0,2 мг-мин/л — серьезные нарушения зрения с потерей трудоспособности
[10, 12]. Симптомы поражения развиваются через 1— 2 ч. Вначале возникает
неприятное ощущение наличия постороннего предмета в глазах (“ощущение
попадания в глаза песка”), затем слезотечение, светобоязнь, покраснение и
отек век, которые обычно склеены обильными гнойными выделениями. Как
правило, зрение ухудшается. При поражениях средней и тяжелой степени
имеет место воспаление роговицы (кератит) с возможным болевым эффек-
том и последующим помутнением и даже некрозом роговицы. В тяжелых
случаях может быть воспаление всего глазного яблока. Наивысшего развития
процесс достигает на 2—5-е сутки. Выздоровление затягивается на недели
и месяцы.
При ингаляции паров и аэрозолей иприта обычно ощущается характер-
ный чесночный запах (или запах горчицы) при концентрации ® 0,0015 мг/л,
однако восприятие запаха быстро притупляется. Это характерная особен-
ность действия иприта: постепенно человек перестает ощущать запах паров
иприта, а при концентрации порядка 1-10-3 мг/л, которые на 2 порядка
ниже Стах, возникают серьезные поражения. Симптомы поражения, как
правило, отмечают через 2—6 ч. Появляются чувство “саднения” в носо-
глотке, кашель и насморк. Кашель усиливается. Голос делается хриплым, а
иногда совсем пропадает — развивается афония из-за поражения голосовых
связок. Нарушение голоса может сохраняться длительное время (иногда
годы).
При воздействии более высоких концентраций иприта поражаются более
глубокие отделы органов дыхания. При кашле выделяется обильная гнойная
мокрота. Температура повышается до 38 °C и выше. Развивается одышка.
Чаще всего смертельные исходы бывают на 2—4-й и 7—9-й день после
поражения. При благоприятном течении болезни выздоровление начинается
через 2—3 нед. Наиболее частые осложнения — бронхиты (хронические).
244
i?
бронхоэктатическая болезнь, пневмосклероз, которые трудно поддаются ле-
чеНрЮорганы пищеварения иприт попадает с зараженной водой и пищей.
Скоытый период — 1—3 ч в зависимости от дозы. Затем появляются боли в
С пложечной области, тошнота, рвота, понос (часто с кровью). В тяжелых
Плучаях возможно прободение стенок желудка и кишечника с последующим
развитием перитонита.
и Как правило, при поражении ипритом имеет место резорбтивное деист-
ие Изменения со стороны ЦНС проявляются в общей вялости, угнетении
и сонливости. Отмечают снижение кровяного давления и нарушение сер-
дечной деятельности, обмена веществ (снижение массы тела — кахексия).
Изменяется состав крови: в первые дни отмечается лейкоцитоз, в последую-
ще _ лейкопения (лейкоцитов до 2—3 тыс. в 1 мм3).
В 1943 г. в итальянском порту Бари произошел взрыв американского
корабля “Джон Харвей”, на борту которого имелись химические снаряды с
ипритом. Моряки были вынуждены спасаться вплавь в воде, зараженной
ипритом. У многих наряду с поражением кожных покровов было сильно
выражено резорбтивное действие иприта. Спасенные моряки погибли в
первые трое суток при явлениях тяжелой общей депрессии и острой гипо-
тонии, по типу шокового состояния. Второй пик смертности наблюдали на
8—9-й день, когда у пораженных развивалась сильная лейкопения. Это была
основная причина гибели — “вторичные” инфекции и лейкопения. Как
правило, практически все ветераны первой мировой войны, пораженные
ипритом, погибли в последующие десятилетия с диагнозами “хронические
бронхопневмонии”, “пневмосклероз” и “опухоли легких” [6, 12]. При по-
ражении ипритами наиболее частыми отдаленными последствиями являют-
ся снижение или потеря массы тела, рубцы на коже, которые могут огра-
ничивать функции конечностей, пневмосклероз, бронхоэктатическая бо-
лезнь, лейкопения, снижение иммунитета, повышенная чувствительность к
простудным и инфекционным заболеваниям, онкологические заболевания.
6.3.4. Токсикологические характеристики рецептур
иприта (НТ, HQ, HL, вязкие рецептуры)
Перед второй мировой войной и во время нее за рубежом проводили
исследования по получению тактических рецептур иприта, особенно с целью
получения: а) низкозамерзающих, б) более токсичных (прежде всего по
параметрам быстроты действия) и в) способных заражать технику, снаряже-
ние и местность на более длительное время. Первые две задачи были решены
получением за рубежом тактических рецептур “НТ”, “HQ” и “HL”; послед-
няя — вязких рецептур агентов “Н” и “HD”.
_ Рецептура НТ — низкозамерзающая, содержащая 60 % HD и 40 %
РР-опс(2-хлорэтилтио)диэтилового эфира — CKCHjHjSCHjCHjCOj, который
имеет тривиальное название “кислородный иприт”, в фашистской Германии
имел шифр “O-Lost”. Кислородный иприт — алкилирующий агент, пред-
авляет собой маслянистую жидкость, практически нерастворимую в воде.
дп7ВОрим в °Рганических растворителях (бензоле, толуоле, ацетоне и
имеет низкую летучесть, Смак = 2,4-10-3 мг/л. Превосходит HD по
0 ксИчности в 3—3 5 раза ПрИ действии на кожу и ингаляции (ICt50 =
н’а мг мин/л). В целом рецептура НТ более токсичная и более устойчивая
местности, имеет более низкую температуру замерзания, чем HD.
ецептура HQ содержит в качестве добавки к иприту 1,2-<?пс(р-хлорэтил-
245
тио)этан — “полуторный иприт” — C1CH2CH2SCH2CH2SCH2CH2C1 — шифр
армии США “Q” — алкилирующий агент. Это кристаллическое вещество
плохо растворимое в воде. При накожной аппликации в 5 раз превосходив
иприт: ICt5o = 0,04 мг/л вызывает поражение глаз, a LCt50 = 0,2 мг-мин/л
кожи.
Рецептура HL — смесь иприта (HD) (алкилирующего агента) с люизитом
(L) (ацилирующим агентом) в соотношении '/3 HD и 2/з люизита, но
возможны и другие соотношения. Температура замерзания составляет минус
25,4°. Летучесть выше, чем HD. Смак = 2,13 мг/л (при 25 °C). Токсич-
ность примерно такая же, как у HD: при ингаляции ICt50 = 0,15 мг • мин/л —
LCt5o = 1—1,5 мг • мин/л, при действии через кожу LCt50 = 10 мг-мин/л.
Симптомы поражения возникают быстрее, чем при действии HD, — пора-
жения глаз и кожи через ®20—30 мин. Рецептура достаточно устойчивая в
окружающей среде. В первую очередь гидролизуется люизит.
Вязкие рецептуры иприта создавались за рубежом с целью затруднить
дегазацию зараженной техники, снаряжения и т.д. Их готовят растворением
в HD 4—8 % полиметилметакрила или его низкомолекулярных фракций с
молекулярной массой («4—5)-104. В фашистской Германии для понижения
температуры замерзания иприта использовали добавку “арсиновое масло” —
смесь фенилхлорарсинов, часть которых затоплена в Балтийском море.
Азотистые иприты (HN1, HN2, HN3).
Перед второй мировой войной в США, Англии, Германии был синтези-
рован новый класс высокотоксичных веществ — аналогов иприта, содержа-
щих 2 p-хлорэтильные группы, — “азотистые иприты”, общей формулы
RN(CH2CH2C1)2, где R — алкил, арил, p-хлорэтил и другие радикалы. В США
основное внимание было обращено на р,Р'-ди(хлорэтил)алкиламины, в Гер-
мании — на р,Р'р"-трихлорэтиламин, названный затем “азотистым ипри-
том”. По своим свойствам эти вещества имеют определенные преимущества
перед ипритом (Н, HD): более низкую температуру замерзания, более вы-
сокую летучесть и более выраженное быстродействие в проявлении токси-
ческих эффектов.
Р,Р'-Ди(хлорэтил)этиламин — C2H5N(CH2CH2C1)2 — шифр армии США
“HN1". Светло-желтая жидкость, более низкай температура кипения и плав-
ления, чем HD. Основные физико-химические свойства азотистых ипритов
представлены в табл. 6.1, в которой для сравнения указаны аналогичные
данные по HD. Величины токсических доз примерно такие же, как для HD,
но токсические эффекты проявляются быстрее.
Таблица 6.1. Основные свойства азотистых ипритов (HN1, HN2, HN3) и иприта
(HD) [1, 5, 12] __
Показатель Азотистые иприты Иприт HD
HN1 HN2 HN3
Молекулярная масса 170,09 156,07 204,34 159,08
Плотность, r/см3 при 25 °C 1,09 1,15 1,24 1,27
Плотность паров по воздуху 5,9 5,4 7,1 5,4
Температура
кипения, °C 195 185 235 217
плавления, °C -34 -60 -3,7 14,4
Давление насыщенного пара, мм рт.ст. 0,24 0,42 0,001 0,07
Летучесть, С макс, мг/л при 25 °C 2,3 3,6 0,12 0,6 J
246
Продолжение
Показатель Азотистые иприты Иприт HD
HN1 HN2 HN3
Токсические дозы, мг-мин/л LCtsn ингаляция 1,5 3,0 1,0 1,5 LCUni через кожу 20,0 25,0 15,0 10-15 iCtcQ, поражение глаз 0,2 0,15 0,2 0,2 Поражение кожи, мг/см2 0,05 0,1 0,05 0,1
р,Р'-Ди(хлорэтил)метиламин — CH3N(CH2CH2C1)2 — шифр армии США
“HN2". Светло-желтая жидкость, как и HN1. Имеет более низкую темпера-
туру кипения и замерзания, более высокую летучесть, чем HD (см. табл.
6.1). Для нее характерно более высокое быстродействие, чем HD. После
второй мировой войны впервые исследовали в качестве первого противора-
кового препарата. Среди изученных гомологов азотистых ипритов по сово-
купности комплекса физико-химических и токсических свойств с военно-
химической точки зрения наибольшее значение получил р,р'Р"-трихлорэти-
ламин (азотистый иприт).
Азотистый иприт — именно под таким названием вошел в литературу
один из аналогов азотистых ипритов — трис-(2-хлорэтил)амин (N(CH2CH2Cl)3,
или шифр армии США—HN3. Бесцветная или слабоокрашенная масля-
нистая жидкость, t3aM = —3,7 °C, обладает выраженной резорбтивной токсич-
ностью при действии через кожу и органы дыхания; LCt50 = 1,0 мг-мин/л,
ЛД50 при накожной аппликации — 15—20 мг/кг; пузыреобразующая доза —
0,05—0,1 мг/см2.
Азотистый иприт оказывает такое же действие, как и иприт. Местное
действие более выражено. Характерным является влияние его на органы
кроветворения и нервную систему. Обладает мутагенным действием на
клетки органов кроветворения. Отмечаются более выраженное (по сравне-
нию с “серным ипритом”) возбуждение ЦНС, беспокойство, бессонница
ит.д. Специфическое цитостатическое действие на быстроделящиеся клетки
и ткани послужило основанием к использованию некоторых аналогов
азотистого иприта в качестве противоопухолевых препаратов (эмбихин и
др.).
В ряде источников иприты рассматриваются как ОВ инкапаситирующего
Действия. Это неверная точка зрения. Основные признаки различий указан-
ных веществ с позиции военной токсикологии приведены в табл. 6.2. Иприт
и ипритные рецептуры, исходя из данных таблицы, не могут быть отнесены
к инкапаситантам по следующим причинам: соотношение между смертель-
ный и выводящими из строя токсическими дозами не превышает порядка,
после поражения ипритом симптомы поражения могут продолжаться дли-
тельное время (недели и месяцы), что не соответствует принципу действия
ннкапаситантов.
“Л Последствия случая, имевшего место при взрыве американского корабля
в ПОРТУ Барри, сопровождавшегося гибелью сотен моряков
v и США (см. выше), свидетельствуют о том, что иприт нельзя относить
к инкапаситантам”.
Же “ соответствии с Конвенцией о неприменении, запрещении и уничто-
“и химического оружия иприты и ипритные рецептуры подлежат унич-
ению. Уничтожение больших количеств ОВ является самостоятельной
247
Таблица 6.2. Некоторые свойства, характеризующие типы веществ в соответст-
вии с тактической классификацией ОВ и токсинов [7]
Свойства вещества Тип вещества - . —
летальные агенты инкапаситанты ирританты
Характер действия на организм Вероятность смер- тельных исходов* Величины смертель- ных токсических доз Отношения токсичес- ких доз LCt5Q Нарушения жизненно важных функций, приводящие к гибели организма Высокая (р£ 0,95) Низкие < 10 Нарушения функций, приводящие к сниже- нию работо- и бое- способности без смер- тельных исходов Низкая (р < 0,05) Высокие 102—103 Раздражающее действ вие на слизистые обо- лочки глаз и верхних дыхательных путей. Рефлекторное дейст- вие Низкая (р < 0,01) Высокие >103
ICt5o (ECt 5qj Длительность дейст- вия Медицинская по- мощь по жизненным показаниям Часы, сутки, недели Требуется Часы, сутки Не требуется Минуты, часы Не требуется
* При концентрациях в полевых условиях.
большой и сложной проблемой. В США иприт уничтожают путем сжигания
в специальных установках на о. Джонсон в Тихом океане. В нашей стране
разработана двухстадийная технология. На первой стадии иприт путем хи-
мической деградации превращается в нетоксичный продукт, который на
второй стадии подвергается дальнейшей обработке. Рассматривается во-
прос о возможности использования конечного продукта в народном хо-
зяйстве.
Определенную опасность для соблюдения Конвенции могут представлять
некоторые токсичные алкилирующие соединения, в частности азотистые
иприты, так как полупродукты их синтеза в промышленных масштабах могут
накапливаться в мирное время в химической и фармацевтической промыш-
ленности как полупродукты синтеза лекарственных противоопухолевых пре-
паратов — аналогов азотистого иприта. В качестве примера можно отметить,
что противоопухолевый препарат эмбихин имеет такое же строение, как
химический агент “HN2”, обладающий более низкой температурой замерза-
ния и большей летучестью, чем иприт (см. табл. 6.1).
Специфическое цитотоксическое действие ипритов на быстроделяшиеся
клетки, подобное действию проникающей радиации, послужило основанием
для применения этих соединений и их аналогов в качестве противоопухо-
левых препаратов. В основе радиомиметического действия производных
азотистых ипритов и других соединений, содержащих этилениминовые груп-
пировки, лежит способность этих соединений нарушать структуру и функ-
цию ДНК путем алкилирования в основном пуриновых оснований, а также
взаимодействие с ферментами обмена нуклеиновых кислот.
248
6 3.5. Противоопухолевые лекарственные средства.
Производные бис(2-хлорэтил)амина
Одной из основных целей работы химиков, токсикологов и фармаколо-
ов в течение длительного времени являлось получение соединений, харак-
теризующихся высокой противоопухолевой активностью и малой токсич-
ностью с учетом побочного действия на организм. Токсичность азотистых
ипритов и их производных для животных и человека достаточно высокая.
Трис(2-хлорэтил)амин (CICHjCHj^N — азотистый иприт. Обладает вы-
сокой токсичностью. В опытах на крысах при подкожном введении ЛД5о =
48 мг/кг гибель в течение первых 2—3 сут. При регистрации гибели живот-
ных в более отдаленные сроки (7—10 дней) ЛД50 понижается почти на
полпорядка. Со временем (после 3 сут) развивается лейкопения. Действие
на нервную систему более выражено, чем для иприта. Проявляются беспо-
койство, возбуждение ЦНС.
Для человека смертельной является концентрация 1,6 мг/л. Лейкоцитоз
в первые 2—3 сут сменяется лейкопенией, в первую очередь за счет лимфо-
пении. Наблюдаются поражение печени и ЦНС, тахикардия. При местном
действии на кожу в дозе 0,01 мг/см2 — эритема, при дозе 0,05—0,1 мг/см2
образуются пузыри.
Отдаленные последствия — поражение органов кроветворения, сниже-
ние иммунитета. Повышение частоты новообразований.
М-метил-#ис(2-хлорэтил)амин (CICHjCHj^NC^ — эмбихин. Первый
противоопухолевый препарат, прошедший широкие испытания среди ана-
логов азотистых ипритов. Имеют место поражения нервной системы —
возбуждение, мышечная слабость, тахикардия, лейкопения, падение артери-
ального давления.
Применяется при лимфогранулематозе, миелозе, раке легких и других
новообразованиях. Вводится по 0,1 мг/кг в течение нескольких дней или по
0,4 мг/кг при однократном введении внутривенно. Лечение проводится под
врачебным контролем. Особое внимание обращают на возможные побочные
явления со стороны органов кроветворения и печени. При снижении коли-
чества лейкоцитов до 2500—3000 в 1 мкл крови лечение прекращают. В ка-
честве побочного действия могут также наблюдаться местные поражения в
области введения препарата.
2-Хлорэтилдиэтиламин C1CH2CH2N(C2H5)2- Обладает достаточно вы-
сокой токсичностью. В опытах на крысах при внутримышечном введении
ЛД50 = 17 мг/кг. Возникают беспокойство, нарушения деятельности высших
отделов нервной системы, затруднение дыхания, раздражение слизистых
оболочек глаз и верхних дыхательных путей; при действии на кожу —
гиперемия и образование пузырей.
... После открытия эмбихина и внедрения его в клиническую практику
(40—60-е годы) было испытано большое количество производных бмс(2-хло-
Рзтил)амина: новэмбихина, сарколизина, допана, лофенала, 4-хлорбутина,
афенцина, циклофосфана и других препаратов, которые применялись при
различных формах злокачественных новообразований. В свое время была
формулирована концепция о том, что в молекулу аналогов азотистого
Рита целесообразно вводить группировки, выполняющие “рецептофиль-
а 1е (транспортные) функции, в частности в виде остатков гидрофобных
татИНо£исл°Т- пеРвых этапах не были получены положительные резуль-
ничен^ДНаК° шиР°кое их применение в клинической медицине было огра-
Алкилирующие противоопухолевые препараты, содержащие группы этилен-
, 249
имина, алкилируют нуклеиновые основания ДНК, нарушая их структуру и
функции. Подобно ипритам, бисалкилирующие соединения обладают радиоми-
метическим действием и выраженной токсичностью для млекопитающих.
В качестве примера приведены данные по трис(этиленимино)фосфату и его
тиоаналогу.
7дис(этиленимино)фосфиноксид, ТЭФ. Действие на организм подобно
действию ипритов. В опытах на овцах при пероральном введении в дозе
50 мг/кг — гибель в первые сутки. Доза 5 мг/кг при повторных введениях
вызывает гибель через 7—9 введений. Отмечается снижение количества
лейкоцитов, в первую очередь лимфоцитов. При вскрытии наблюдаются
дистрофические изменения в лимфатических узлах и костном мозге. С лечеб-
ными целями применяется под врачебным контролем.
Тиофосфамид-три(этиленимино), тиофосфамид, ТиоТЭФ.
Подобно другим бисалкилирующим соединениям взаимодействует с
ДНК и нарушает митозы в быстро делящихся, в том числе опухолевых,
тканях. Более эффективен в лечебных целях, чем ТЭФ. Применяется при
раке яичников, молочной железы и других опухолях. Вводят по 15 мг/кг (в
виде раствора внутримышечно или внутривенно) обычно через день. Курс
лечения 150—200 мг. В ходе лечения проводится контроль за состоянием
крови. Лечение прекращают при снижении количества лейкоцитов до 3000
и тромбоцитов до 100 000 в 1 мкл крови. *"
Помимо тиофосфамида, исследовались и другие соединения, содержа-
щие этилениминовые группы: бензо, фторбензотэф, дийодбензотэф, дипин
и другие препараты, которые нашли применение при различных злокачест-
венных опухолях (молочная железа, гортань и др.), и метастазах опухолей.
6.4. Токсикология алкилирующих соединений,
используемых в народном хозяйстве
В химической промышленности разных стран используются различные
алкилирующие соединения, обладающие выраженной физиологической ак-
тивностью. Наиболее типичные их представители — галоидные алкилы, га-
лоидсодержащие кетоны, алкиловые эфиры минеральных кислот, соедине-
ния, содержащие активированные кратные связи и другие соединения. Ниже
приводится краткая токсикологическая характеристика отдельных предста-
вителей указанных классов соединений.
6.4.1. Токсикология галоидных алкилов
Галоидные алкилы обладают в основном резорбтивным действием и
некоторые из них — местным и рефлекторным действием. Физиологическая
активность обусловлена не только действием этих соединений на органы
кроветворения, печень и др. как алкилирующих агентов, но и проявлением
наркотического действия, а также действия на периферическую нервную
систему. С увеличением количества атомов галоида в молекуле галоидного
алкила наркотический эффект, как правило, усиливается. Примером тому
является трихлорметан (хлороформ), использовавшийся в свое время как
наркотическое средство в хирургической практике. Непредельные углеводо-
роды, содержащие атом галоида (хлористый аллил), обладают местным и
раздражающим действием, характерным для алкилирующих соединений. Но
в целом галоидпроизводные углеводороды алифатического ряда обладают
аженным резорбтивным действием с проявлением эффектов нейротроп-
Ва?о и гепатотропного действия.
Н° ХлоРпРоизводные ЖИРНОГО Ряда и непредельных углеводородов. Большин-
подобных соединений, за исключением хлористого метила, хлористого
СТВда и хлористого винила, — жидкости. Растворимость в воде очень мала,
Эястворимы в спирте, эфире и других органических растворителях. Реакци-
раная способность — характерная для галоидных алкилов. Алкилирующие
свойства зависят от строения вещества.
По характеру токсического действия — это наркотики, обладающие од-
новременно гепатотропным и кардиотропным действием. Влияние на пе-
чень особенно выражено у четыреххлористого углерода, дихлорэтана и дру-
гих липиофильных соединений. При действии на кожу вызывают дерма-
титы.
Хлористый метил СН3С1 применяется в химической промышленности в
качестве метилирующего агента, как хладагент (холодильные установки), как
растворитель фунгицидов. Температура кипения — 24 °C, при температуре
20—30 °C — это газ.
Раздражающее действие слабо выражено; сильно угнетает нервную сис-
тему. Вызывает острые и хронические отравления [3].
Концентрация 2 мг/л при экспозиции 4 ч вызывает гибель белых мышей
(LCtюо — 480 мг-мин/л). В опытах на крысах смертельная доза 750—800
мг-мин/л. В опытах на собаках показано, что повторное вдыхание СН3С1 6
мг/л по 6 ч в день в течение 6 дней приводит к гибели через 5—6 дней.
При интоксикации людей (аварии на холодильных установках и др.)
наблюдаются поражения нервной системы: расстройства речи, зрения. 2 %
концентрация при 2-часовом воздействии вызывает смерть. При хроничес-
ком воздействии концентрации 3—5 мг/л в течение 3—4 нед и более гибель
животных (белых мышей, крыс, кроликов, кошек, собак и обезьян) насту-
пала через несколько недель.
Отдаленные последствия: нарушение (угнетение) высшей нервной дея-
тельности, функции печени и других внутренних органов. ПДК — 0,21 мг/л
(США).
Хлористый метилен CH2CI2 — жидкость, применяется в химической про-
мышленности как растворитель целлюлозы, смол, каучука, в производстве
пластмасс. Летучая жидкость, tKHn = 42 °C. При действии открытого пламе-
ни образуются токсичные продукты (фосген, НС1 и др.). Наркотик — при
2-часовой экспозиции в опытах на мышах, концентрация 30 мг/л вызывает
боковое положение, 35 мг/л — наркотический эффект и 50 мг/л — гибель.
Человек ощущает запах, характерный для хлороформа, при концентра-
ции 1 мг/л. Концентрация 4 мг/л переносится в течение 30 мин без замет-
ного эффекта, при более высоких концентрациях через 5—10 мин наблю-
даются парестезии конечностей, раздражение слизистых оболочек глаз. Глу-
окий наркоз наступает при концентрации 70 мг/л после экспозиции 30 мин.
ри хронических воздействиях на человека концентраций порядка десятых
леи миллиграмма на литр наблюдаются головная боль, сонливость, симп-
мы угнетения нервной системы. ПДК — 0,05 мг/л.
сое ЙК летУчая жидкость, в которой хорошо растворяются органические
ПенДИ|?ения> хлористый метилен используется для получения растворов (сус-
Вьезии) Различных органических соединений. Так, во время войны во
По ™аме гористый метилен применялся американскими войсками для
ген» ения Раст8оР°в вещества “CS”, а те в свою очередь — в носимых
«ераторах аэрозолей “Майти-Майти”.
251
Хлористый аллил СН2=СНСН2С1 — высококипящая жидкость. Применя-
ется при синтезе различных хлорсодержащих соединений. Обладает выра- =1
женным раздражающим действием. Наркотическое действие менее выра-
жено. Поражает почки. В опытах на белых мышах при 10 мг/л через
несколько минут наблюдается раздражение глаз. Через 2—3 ч — гибель жи- *
вотных (LCt = 120—180 мг-мин/л). В опытах на белых крысах при 20 мг/л
имеют место раздражение глаз и наркотический эффект, гибель наступает
через 2 ч (LCt = 240 мг мин/л). Высокие концентрации вызывают отек
легких. ПДК — 0,003 мг/л.
Бромпроизводные углеводородов жирного ряда — наркотики, оказываю-
щие значительно более выраженное токсическое действие на организм по
сравнению с хлорпроизводными. Поражают нервную систему, почки, печень
и другие внутренние органы. С увеличением количества атомов брома об-
щетоксическое действие, как правило, увеличивается.
Бромистый метид СН3ВГ — газ, растворяющийся в спирте. Метилирую-
щий агент применяется в химической промышленности, хладагент — в ог-
нетушителях. У белых мышей острое отравление возникает при концентра-
ции 6 мг/л и экспозиции 30 мин (LCtso = 180 мг-мин/л; для сравнения LCt50 ’
хлористого метила = 480 мг-мин/л). Вдыхание 5,2 мг/л в течение 45 мин
вызывает гибель через 10 ч (LCt50 = 230 мг-мин/л). На белых крысах при
экспозиции 2 ч и LC50 - 2,25 мг/л LCt50 = 270 мг-мин/л (для сравнения
LCt5o хлористого метила = 750—800 мг-мин/л).
Характерно медленное развитие симптомов интоксикации и гибели. Да-
же при тяжелых отравлениях людей симптомы интоксикации возникают
после скрытого периода. Так, после взрыва цилиндра с бромистым метилом
симптомы интоксикации возникли у пострадавших через 6—8 ч, а у неко-
торых — через 2—3 сут. Считается, что концентрации, вызывающие смер-
тельные поражения людей при острых интоксикациях, равны » 30—35 мг/л.
Местное действие паров бромистого метила вызывает поражения кожи,
гиперемию, ожоги с образованием пузырей (по типу ипритных поражений).
При воздействии относительно низких концентраций наблюдаются дерма-
титы с образованием мелких пузырей, которые проходят через несколько
дней; отмечаются раздражение слизистых оболочек глаз и ВДП. ПДК —
0,001 мг/л.
Йодпроизводные углеводородов жирного ряда. Токсические свойства в
общем подобны свойствам аналогичных бромпроизводных. Наркотическое
действие менее выражено, более выражено общерезорбтивное токсическое
действие на печень, почки и нервную систему. Особенно опасен йодистым
метил.
Йодистый метил СН31 — высоколетучая жидкость. Применяется в про-
мышленности как метилирующий агент. Белые мыши погибают при экспо-
зиции 1 ч и концентрации 5 мг/л (LCtjo = 300 мг-мин/л). При концентрации
25 мг/л и экспозиции 10 мин наблюдается раздражение слизистых оболочек,
гибель наступает в течение первых суток. При попадании на кожу отмеча-
ются поражения, подобные при действии иприта.
Из рассмотренного материала следует, что для галоидных алкилов ха-
рактерно общерезорбтивное действие с поражением нервной системы (нар*
котическое действие), печени, почек и других внутренних органов. Некото-
рые галоидные алкилы (хлористый метил, хлористый аллил, бромисты
метил) обладают выраженным местным действием, по типу действия ипрМ" ।
тов. jj
252 1
6 4.2. Метиловые эфиры минеральных кислот
Помимо галоидных алкилов, выраженными алкилирующими свойствами
бладак>т некоторые метиловые эфиры кислот серы, фосфора и других
°ислот, которые активно используются в качестве алкилирующих агентов.
Типичным в этом отношении является диметиловый эфир серной кислоты —
пиметилсульфат. Это маслянистая жидкость, tKMn = 188 ’С, Смак = 3,8 мг/л,
плохо растворяется в воде, хорошо — в спирте, эфире, бензоле. Применяется
в химической промышленности в качестве алкилирующего агента.
Пары ди метил сульфата обладают раздражающим и прижигающим дей-
ствием на слизистые оболочки глаз и дыхательных путей. При действии на
кожу жидкого диметилсульфата наблюдаются гиперемия, пузыри, некроти-
ческие изменения, которые заживают очень медленно (подобно иприту).
При резорбтивном действии наблюдаются явления отека легких. В опытах
на кошках при 10-минутной экспозиции концентрации 0,7—0,9 мг/л вызы-
вают смерть через несколько дней. В опытах на обезьянах концентрация
0 066 мг/л при действии в течение 20 мин вызывала тяжелые интоксикации. При
концентрации, равной 0,132 мг/л, и экспозиции 40 мин (LCt — 5,3 мг мин/л)
гибель обезьян наступила через 3 сут.
Описаны случаи интоксикации людей. При поражениях легкой степени
скрытый период длится до 15 ч, средней степени — до 5 ч, тяжелых пора-
жениях — до 2—3 ч. Основные симптомы: раздражение слизистых оболочек
глаз и дыхательных путей. При тяжелых поражениях —отек легких. Таким
образом, диметилсульфат является высокотоксичным веществом алкилиру-
ющего действия с проявлением эффектов местного, рефлекторного и обще-
резорбтивного действия. ПДК — 5 мг/м3 (США) и 1 мг/м3 (РФ).
Рассмотренные выше свойства галоидных алкилов и диметилсульфата
являются иллюстрацией токсических свойств алкилирующих соединений,
используемых в промышленности и народном хозяйстве.
6.4.3. Биологически активные природные алкилирующие
соединения
В научном плане интересна химическая защита некоторых растений от
микроорганизмов и других организмов, включая млекопитающих. С этой
Целью в растениях осуществляется синтез и выделение специальных ве-
ществ -- фитонцидов, обладающих бактериостатическим и бактерицидным
действием. Так, летом 1 га лиственного леса выделяет до 2 кг летучих
веществ в сутки, благодаря чему лесной воздух содержит в 200—250 раз
меньше микроорганизмов, чем городской воздух.
Фитонциды — это сложный комплекс органических соединений различ-
ного строения, включающий в себя фурановые, пирановые, азотсодержащие
Другие гетероциклические фрагменты, в сочетании с системами сопряжен-
1Х активированных связей. Можно полагать, что эти соединения обладают
оГЦИальнЬ1МИ алкилирующими свойствами при взаимодействии с нукле-
мов ЬНЬ1МИ П’Уппами биомишеней клеток бактерий и других микроорганиз-
’ Х0ТЯ количественные данные о свойствах фитонцидов как алкилирую-
щ х агентов мало исследованы.
ствуюК0Т0РЬ1е Растения выделяют сильные раздражающие вещества, воздей-
тельнь1*116 на„чУвствительные рецепторы слизистых оболочек глаз и дыха-
пИк. *х (капсаицин-раздражающее соединение красного перца, лак-
анный фактор лука и др.) [9].
253
Биологически активные вещества, синтезируемые микроорганизмами, pac„
тениями и животными, в качестве химической защиты являются химичес-
кими соединениями уникальных структур. Многие природные яды (такие как
батрахотоксин, голотурин, тетродотоксин, сакситоксин, палитоксин и другие
соединения), характеризующиеся высокой токсичностью для млекопитающих
содержат, как правило, системы сопряженных активированных кратных свя-
зей, эфирные, тиоэфирные и другие гетероциклические структуры, а также
подвижные метильные радикалы и другие группировки, которые могут способ-
ствовать проявлению потенциальной реакционной способности природных ядов
как алкилирующих соединений с образованием более прочных комплексов с
биомишенями клеток-“хозяев”. Это утверждение с химических позиций тре-
бует дополнительных исследований.
Антибиотики, обладающие свойствами алкилирующих соединений. В борьбе
за существование грибы выработали защиту от своих врагов по эволюцион-
ной лестнице — бактерий и других микроорганизмов — в виде биологически
активных соединений — антибиотиков. Механизм действия антибиотиков
обусловлен их способностью нарушать строение и функции НК, ферментов
метаболизма НК, структурных элементов биомембран и ферментов их ме-
таболизма и других биологически важных компонентов клеток. Образование
прочных комплексов антибиотиков с биомишенями обусловлено гидрофоб-
ными, кулоновскими и диполь-дипольными взаимодействиями, водородны-
ми связями и способностью образовывать более прочные связи за счет
алкилирования и ацилирования. Так, хорошо известный антибиотик — пе-
нициллин — содержит в своей молекуле (3-лактам-тиазолиновую бицикли-
ческую систему пенама, обладающую высокой алкилирующей способностью
по отношению к нуклеофильным реагентам.
В последующем были выделены другие антибиотики: стрептомицин,
цифалоспорины, цефаломицины, клавулановая и оливановая кислоты, тие-
номицин и другие антибиотики. Характерной чертой в строении этих анти-
биотиков является наличие в их молекулах активированных кратных связей,
которые могут участвовать в образовании прочных комплексов с молекулами
биомишеней, в том числе за счет алкилирования нуклеофильных групп
ферментов и нуклеиновых кислот.
Достаточно хорошо изученными в этом отношении являются митоми-
цины, порфиромицин, блео- и флеомицины и др.
Митомицины А, В, С и порфиромицин представляют собой комплекс
антибиотиков, продуцируемых грибами Streptomyces, действующих на ДНК
бактерий. Впервые описаны японскими исследователями в начале 50-х
годов, позже их строение установлено рентгеноструктурным и химическим
анализом в 60-е годы. Ниже приведено строение антибиотиков (митомици-
нов и др.), обладающих алкилирующими свойствами.
Наиболее характерной чертой строения митомицинов является редко
встречающееся в природных соединениях наличие в их молекулах азириди-
нового цикла, обусловливающего алкилирующие свойства.
254
Митомицины — быстродействующие бактерицидные и цитостатические
параты. Они вызывают нарушения строения ДНК путем алкилирования
пРиновых оснований (одно основание на 200—300 пар оснований) и обра-
ПУванием “сшивок” двух цепей ДНК при алкилировании пуриновых осно-
ваний в противоположных цепях ДНК (одна “сшивка” на 2000—5000 пар
оснований).
Помимо митомицинов, многие другие антибиотики, обладающие цито-
токсической активностью в основном за счет действия на нуклеиновые
кислоты, ферменты их метаболизма и компоненты биомембран, содержат
фрагменты молекул с алкилирующими свойствами, что определяет их спо-
собность образовывать прочные комплексы с биомишенями.
6.5. Принципы оказания первой медицинской помощи
при поражениях алкилирующими соединениями
С целью предотвращения поражения токсичными веществами и оказа-
ния медицинской помощи пораженным основными принципами защиты и
лечения являются:
• профилактика поражений и защита от токсичных веществ;
• оказание первой медицинской помощи;
• лечение пораженных и оказание им квалифицированной специали-
зированной медицинской помощи. Необходимо отметить, что анти-
доты специфического действия при поражении алкилирующими со-
единениями отсутствуют. Это объясняется особенностями механизма
их токсического действия на организм млекопитающих. Как уже
отмечалось ранее, при взаимодействии алкилирующих соединений с
нуклеофильными группами биомишеней (аминогруппами, меркаптогруп-
пами и др.) образуются прочные ковалентные связи (C-N.C-S), реак-
тивация которых с помощью антидотов практически невозможна.
I Кроме того, подобных связей в клетках организма огромное количе-
ство (в молекулах белков, нуклеиновых кислот и других биосубстра-
тах). Поэтому получить антидот, который бы избирательно реактиви-
ровал функциональные группы, алкилированные ипритом и другими
I алкилирующими соединениями, без воздействия на аналогичные свя-
зи в белках и нуклеиновых кислотах, практически невозможно. Вот
почему, несмотря на то что иприт известен более 85 лет, до сих пор
нет специфических антидотов для лечения пораженных им [11].
Медицинская помощь при интоксикации ипритами. Несмотря на замедлен-
ое проявление клиники, первую медицинскую помощь необходимо оказы-
вать немедленно после поражения. Она предусматривает следующие меро-
• частичную санитарную обработку открытых участков кожи (в том
числе лица) содержимым индивидуального противохимического па-
кета (ИПП) и обильное промывание глаз водой (в течение первых
5 мин);
• надевание противогаза;
• в случае ранения — кожу в окружности раны обработать ИПП, на
рану наложить стерильную салфетку и марлевую повязку;
в случае попадания ОВ в желудок с пищей и водой рекомендуется
обильное промывание его.
255
Необходимо эвакуировать людей из очага поражения и быстро сменить
одежду-
Доврачебная помощь — лечение в зависимости от симптомов поражения-
промывание глаз 2 % раствором гидрокарбоната натрия, промывание желуд-
ка, прием внутрь таблеток от кашля, при тяжелых поражениях — подкожное
введение кордиамина (сульфокамфокаина), при пероральных поражениях
промывание желудка и пероральный прием активированного угля.
Первая врачебная помощь оказывается после санитарной обработки. При
поражении глаз и наличии боли в них применяют 1 % раствор дикаина, за
веки закладывают глазную мазь с антибиотиками, Пораженному необходимо
затемнить глаза.
При ингаляционных поражениях — промывание носоглотки раствором
гидрокарбоната натрия и прием внутрь таблетки от кашля. По показаниям
вводят кордиамин, сульфокамфокаин, антибиотики. В тяжедых случаях при
симптомах развития отека легких применяют кислород, коргликон.
При поражениях кожи в стадии эритемы рекомендуется обработка поражен-
ных участков этиловым спиртом. При наличии зуда кожу обрабатывают рас-
твором димедрола. В стадии пузырей накладывают марлевую повязку с 1 %
раствором хлорамина (дегазация и антисептическая обработка). Пузыри лучше
не вскрывать, а их содержимое извлекать с помощью шприца. При наличии
эрозий и язв произвести их обработку с последующим наложением марлевой
повязки с антибиотиками. Не рекомендуются повязки по типу компрессов.
Пероральные поражения после обильного промывания желудка и после-
дующего введения 10—15 г активированного угля лечат при наличии соот-
ветствующих признаков. Для снижения резорбтивных поражений внутри-
венно вводят 10—15 мл 30 % раствора тиосульфата натрия, подкожно —
витамины С и группы В, внутривенно — раствор глюкозы. При поражении
смесью иприта с люизитом (рецептура HL) на протяжении всего лечения
применяют антидот от люизита — унитиол.
Квалифицированная медицинская помощь включает в себя мероприятия,
описанные выше в более полном объеме.
В случае тяжелых поражений уделяют внимание поддержанию дыхатель-
ной и сердечной деятельности, предупреждению отеков легких, возникно-
вению абсцессов и гангрены. При резорбтивном действии ОВ необходимо:
• внутривенное введение 30 % раствора тиосульфата натрия по 10—20 мл;
• применение витаминов С, Bi, Вг, Вб, В12, метгелурацила по 1 г 3 раза
в день, нуклеата натрия — по 0,1—0,2 г 3 раза в день, анаболических
препаратов типа неробола — по 0,005 г 3 раза в день;
• показано переливание крови по 200 мл через 5—6 дней;
• при угнетенном состоянии — нейростимуляторы (кофеин, коразол,
сиднокарб по 0,005 г 1—2 раза в день).
Поражения кожи лечат как гнойно-трофические плохо заживающие язвы
или раны. Так, пока язва или рана не очистилась от гнойно-некротического
отделяемого, рекомендуются повязки с гипертоническим раствором хлорида
натрия и с фурацилиновым раствором. Для очищения применимы, протео-
литические ферменты (2 % раствор хемотрипсина, стрептокиназы). После
очищения язвы используют ускоряющие эпителизацию и заживление сред-
ства (мазь Вишневского, мерациловая мазь и мазь с антибиотиками). Рек°'
мендованы термопарафиновые аппликации (до 50—60 °C) в течение Ю""1
дней, гелиотерапия, ультрафиолетовое облучение в субэритемных дозах. ПР
наличии болей применимы болеутоляющие медикаменты. Л.
Медицинская помощь при интоксикациях диметилсульфатом (СНзО)^—"
(ДМС). При поражении ДМС лечение во многом аналогично лечению
256
f
поражений серной кислотой и другими алкилирующими соединениями При
раздражении слизистой оболочки дыхательных путей необходимы вентиля-
ция легких, ингаляция раствора бикарбоната натрия, вдыхание паров эти-
лового спирта, эфира, хлороформа, 10 % ментола в хлороформе.
При попадании на кожу или слизистые оболочки необходимо обильное
промывание водой. При наличии ожогов кожи применяют повязки с 2—3 %
раствором соды. При инфицировании пораженных участков или для пред-
упреждения инфицирования накладывают влажные повязки с риванолом
(1:1000) или фурацилином (1:5000). Рекомендуются коагулирующие методы
лечения, например 1—2 % спиртовые растворы генцианового фиолетового
или метиленового синего. При ожогах II—III степени применяются стреп-
тоцидовая, синтомициновая эмульсии, затем мазевые повязки (мази пени-
циллиновые, Вишневского и др.). Наряду с этим ведется борьба с болевым
шоком. В последующем рекомендованы согревающие укутывания, обильное
питье, введение глюкозы с аскорбиновой кислотой.
При попадании в глаза после обильного промывания водой рекомендуется
закапывание в глаза 2 % раствора новокаина или 0,5 % раствора дикаина с
адреналином (1:1000) с последующим введением в конъюнктивальный ме-
шок стерильного вазелинового или персикового масла.
Лечение. В последующем реабилитация больных с использованием ме-
тодов симптоматического лечения и предупреждения отдаленных последствий
(рубцов кожи, слизистых оболочек глаз, пневмосклероза и других синдромов).
ЛИТЕРАТУРА
1 Александров В.Н., Емельянов В.И. Отравляющие вещества. — М.: Воениздат,
1990. - С. 123-124.
2. Вредные вещества в промышленности/Под ред. Н.ВЛазарева, И.Д.Гадаски-
ной. — М.: Химия, 1977. — С. 72—73.
3. Вьетнам — химическая война. — Ханой: Изд. литературы на иностр, языках,
1972. - С. 135-143.
4. Каракчиев А.Н. Токсикология ОВ и зашита от ядерного и химического оружия. —
4-е изд. — Ташкент: Медицина, 1988. — С. 113—116.
5. Лошадкин Н.А., Кнунянц И.Л. Военная токсикология. — М.: Воентехниздат,
1991. - С. 92-99.
6. Лужников Е.А. Клиническая токсикология. — М.: Медицина, 1982. — 85 с.
7. Овчинников Ю.А. Биоорганическая химия. — М.: Просвещение, 1982. — С. 538.
8- Росс У. Биологические алкилирующие вещества. — М.: Медицина, 1969. — С. 43—
46, 100.
9- Руководство по токсикологии отравляющих веществ/Под ред. С.Н.Голикова. —
М.; Медицина, 1972. — С. 229—253.
10- Сошественский Н.А. Токсикология боевых отравляющих веществ. — М.: Сельхо-
зиздат, 1933. - С. 140—147.
Ч- Отройков Ю.Н. Клиника, диагностика и лечение поражений отравляющими
веществами. — М.: Медицина, 1978. — С. 83—97.
warfare agents. Toxicology and treatment/Ed. T.C.Marrs, R.L.Maynard,
KR.Shell et al. - 1996. — P. 143-154.
4. Dixon M. Biochim. Soc. — Suppl. — 1948. — P. 38.
9-7127
257
Глава 7
ДЕЙСТВИЕ КСЕНОБИОТИКОВ НА СИСТЕМУ КРОВИ
Среди специфических проявлений повреждающего действия химических ве-
ществ на организм значительное место принадлежит поражениям системы
крови. Возникшее в связи с этим понятие “яды крови” в известной мере условно
учитывая, что последние нередко обладают и другими специфическими видами
биологической активности. Вместе с тем механизмы биологического пораже-
ния крови имеют отличительные особенности, во многом обусловленные
природой действующих агентов.
Исходя из современного уровня знаний, правомерно выделить следую-
щие вещества, вызывающие 3 разновидности токсического поражения
крови, отличающиеся причинными особенностями пускового механизма
действия, в частности:
• вещества, вызывающие заболевания, связанные с изменением пиг-
мента крови (оксид углерода, нитро-, аминопроизводные бензола,
нитраты и нитриты и др.);
• вещества, вызывающие первичный гемолиз (мышьяковистый водо-
род, фенилгидразин и др.);
• вещества, вызывающие первичное угнетение гемопоэза (бензол и его
производные, свинец).
7.1. Токсические поражения пигмента крови
Проявления гемотоксического действия химических веществ за счет
первичного воздействия на пигмент крови разнятся по характеру в зависи-
мости от генеза нарушений. Однако во всех случаях речь идет о вмешатель-
стве в обмен порфиринов за счет инактивации гемоглобина, в результате
которой последний лишается возможности обратимо присоединять кисло-
род и транспортировать его тканям.
Для того чтобы была понятна роль порфиринового обмена применитель-
но к дыхательной функции крови, уместно привести сведения о химической
структуре гемоглобина, его синтезе и превращении в организме.
Как видно на рис. 7.1, гемоглобин — это сложный белок, состоящий из
собственно белка-глобина и простетической группы — гема. Последний
представляет собой комплекс закисного (двухвалентного) железа с прото-
порфирином, т.е. железопорфирин. Примечательно, что железо в составе
порфирина приобретает новые свойства. Оно в 1000 раз активнее железа
неорганических соединений. За счет этого железо становится катализатором
окислительных процессов. Однако способность лабильно связывать кисло-
род железопорфин приобретает только при соединении с белком, т.е. в
составе гемоглобина [45]. При синтезе гема сукцинил-КоА взаимодействует
с глицином с образованием дельта-аминолевулиновой кислоты, процесс
образования которой катализируется ферментом синтетазой дельта-амино-
левулиновой кислоты. В результате конденсации двух молекул дельта-ами-
нолевулиновой кислоты при участии фермента дегидратазы этой кислоть
258
Рис. 7.1. Структурная формула молекулы гемоглобина.
[41] образуется порфобилиноген — непосредственный предшественник про-
топорфирина. Для образования одной молекулы протопорфирина необхо-
димо 4 молекулы порфобилиногена. Именно в протопорфирин при участии
фермента гемсинтетазы происходит включение атома железа, источником
которого является белок ферритин (трансферрин), транспортирующий же-
лезо. На этом этапе образуется протогем, который, в свою очередь соеди-
няясь со специфическим белком, превращается в гемоглобин. Схематично
этот процесс может быть представлен следующим образом:
сукцинил КоА + глицин -> дельта-аминолевулиновая кислота (конден-
сация 2 молекул) -> порфобилиноген (конденсация 4 молекул) -> прото-
порфирин + Fe (из ферритина) -> протогем + глобин -> гемоглобин.
Как известно, гемоглобин находится в эритроцитах и синтезируется в
физиологических условиях там же, где происходит образование эритроци-
тов, т.е. в костном мозге [32]. Дальнейшая судьба гемоглобина тесно связана
с распадом эритроцитов, который осуществляется в клетках ретикулоэндо-
лиальной системы (РЭС). В процессе распада эритроцитов гемоглобин
н исляется с образованием вердоглобина (зеленый пигмент холеглобин), в
м гем еще соединен с глобином. Порфириновое кольцо при этом не
веп^ШеН°’ желез° находится в центре данного кольца. Следующим после
зеле°ГЛ°бина продуктом распада гемоглобина является желчный пигмент
стан °ГО цвета — биливердин с разрушением порфиринового кольца. Вос-
НогоОВЛеНИе Последнего приводит к образованию красновато-желтого желч-
частиПИГМеНТа билирубина. Поступая с желчью в кишечник, билирубин
пает вНо всасывается в кровь и через систему воротной вены вновь посту-
ПРЯмойПеКЧеНЬ- этом Различают свободный или непрямой билирубин и
билирубин. Первый мало растворим и токсичен. В печени путем
259
соединения с глюкуроновой кислотой и образования растворимого диглю-
куронида он обезвреживается, превращаясь в прямой билирубин. В кишеч-
нике билирубин восстанавливается в пигменты кала (стеркобилиноген) й
мочи (уробилиноген), которые на воздухе окисляются в стерко- и уробилин
Чтобы перейти непосредственно к описанию поражений крови химичес-
кой этиологии, связанных с воздействием на пигмент крови, в частности
железопорфирин как составляющую часть гемоглобина, уместйо остано-
виться на физиологической роли гемоглобина в организме. Роль его опре-
деляется непосредственным участием в транспорте кислорода от капилляров
легочных альвеол к капиллярам всех органов и тканей. Механизм переноса
кислорода гемоглобином, содержащимся в эритроцитах, заключается в его
способности обратимо присоединять кислород. Под обратимым присоеди-
нением кислорода понимают способность гемоглобина образовывать с кис-
лородом лабильное соединение (оксигемоглобин) согласно реакции:
НЬ + О2 > НЬО2.
7.1.1. Карбоксигемоглобинемия
Классическим примером повреждающего действия на кровь с наруше-
нием ее дыхательной функции, обусловленным инактивацией кровяного
пигмента — гемоглобина, служит образование карбоксигемоглобина (НЬСО)
под влиянием оксида углерода. Превращение гемоглобина в НЬСО приводит
к изменению спектральных характеристик крови, что легло в основу коли-
чественного определения его в крови. НЬСО образуется в результате взаи-
модействия оксида углерода (СО) с железом гемоглобина, что лишает его
способности к оксигенации, приводит к нарушению транспортной функции
и как результат вызывает развитие гемической гипоксии. Появление НЬСО
служит следствием поступления СО в легкие с вдыхаемым воздухом. Обра-
зование НЬСО начинается с периферии эритроцитов уже в легочных капил-
лярах. В дальнейшем с увеличением содержания СО во вдыхаемом воздухе
НЬСО образуется не только в периферических отделах эритроцита, но и в
центральных его отделах. Причем скорость образования НЬСО прямо про-
порциональна величине концентрации СО во вдыхаемом воздухе, а макси-
мум его в крови определяется временем контакта. Способность гемоглобина
связывать О2 и СО одинакова при условии, что 1 г гемоглобина может
связывать 1,33—1,34 мл О2.
Эта зависимость носит название константы Хюфнера. Вместе с тем
сродство гемоглобина к СО в 250—300 раз больше, чем к О2. Примечательно,
что оболочка эритроцитов служит своего рода защитным барьером при
образовании НЬСО, так как во взвеси эритроцитов этого деривата гемогло-
бина образуется на 20 % меньше, чем в растворе гемоглобина. Валентность
железа в НЬСО остается неизмененной, происходит лишь перестройка свя-
зей Fe2+. Все непарные электроны участвуют в образовании НЬСО. Парал-
лельно с образованием связей между СО и Fe2+ изменяется характер связи
железа с глобином и порфирином. Она теряет свой ионный характер и
превращается в ковалентную. Взаимодействие СО с НЬО2 выражается вза-
имно сопряженными реакциями.
НЬО2 + СО -> НЬСО + 02
НЬСО + о2 -> ньо2 + со
Скорость этих реакций и образование НЬСО определяются парциальным
давлением СО и О2 в воздухе. При этом количество образовавшегося НЬС
260
мо пропорционально давлению СО в окружающей среде и обратно
пропорционально давлению О2. Несмотря на высокое, как указывалось
проп дство со к гемоглобину, ассоциация его с гемоглобином проис-
ВЬ11ит'в Ю раз медленнее, чем таковая с О2. Однако при этом диссоциация
гГьСО протекает в 3600 раз медленнее, чем диссоциация НЬО2 [74]. По этой
ичине НЬСО очень быстро накапливается в крови даже при сравнительно
большом содержании СО во вдыхаемом воздухе. Таким образом, помимо
не1КЛЮчения части гемоглобина из транспорта кислорода, еще одним пато-
Венетически важным звеном в нарушении дыхательной функции крови на
Лоне карбоксигемоглобинемии служит замедление диссоциации оксигемо-
глобина под влиянием НЬСО, что известно под названием эффекта Холдена.
Так в физиологических условиях повышение концентрации СО2 в крови
способствует ускоренному отщеплению О2 от НЬО2, при наличии НЬСО
ЭТот сбалансированный процесс нарушается. Принято считать, что суть
эффекта Холдена заключается в том, что при взаимодействии СО с гемо-
глобином поступивший в кровь СО соединяется только с 3 из 4 атомов
железа в молекуле гемоглобина, тогда как с 4-м атомом железа соединяется
О2, сродство которого к этому атому железа резко возрастает, что, естест-
венно, затрудняет диссоциацию оксигемоглобина. Еще одним причинным
фактором угнетения диссоциации НЬО2 под влиянием СО служит снижение
уровня промежуточного метаболита 2,3-дифосфоглицерата, который обра-
зуется в процессе реакции гликолиза. 2,3-Дифосфоглицерат обладает спо-
собностью усиливать процесс диссоциации НЬСО за счет вызываемых им
конформационных изменений гемоглобина, поэтому естественно, что дефи-
цит этого метаболита косвенно тормозит высвобождение О2 из НЬО2 [65].
Итак, основным пусковым механизмом развития специфической геми-
ческой гипоксии при отравлении СО является образование НЬСО, который
утрачивает способность переносить кислород в сочетании с угнетающим
влиянием на процесс диссоциации НЬО2. Неопровержимое доказательство
того, что первопричиной развития СО-интоксикации является карбоксиге-
моглобинемия, — прямая зависимость между уровнем НЬСО в крови и тя-
жестью интоксикации. Так, по данным V.E.Henderson [87], при содержании
НЬСО в крови, равном 10 %, отмечена лишь одышка при физическом
напряжении, при 40—50 % НЬСО появляются явные признаки интоксика-
ции: головная боль, помрачение сознания вплоть до его потери, концент-
рация НЬСО в крови свыше 60 % ведет к летальному исходу. Во всяком
случае у людей, впадающих в коматозное состояние или погибающих от
острого отравления СО, содержание НЬСО, как правило, не менее 50 % [44].
Однако не всегда прослеживается прямая связь между содержанием в крови
НЬСО и тяжестью отравления. Известны случаи, когда тяжелая форма
отравления развивалась уже при 20 % НЬСО и, наоборот, при 60 % НЬСО
встречаются легкие формы отравления [7]. Во многом это объясняется
Достаточно большой индивидуальной чувствительностью к СО, которую
вязывают с генетическим фактором.
Мо бальным подтверждением кислородного голодания за счет карбоксиге-
СопГЛОбинемии при тяжелой острой интоксикации СО является снижение
недержания кислорода в артериальной крови до 13,4—12,4 об.% сравнитель-
на с *°—20 об.% в норме. Одновременно падает артериально-венозная
КисдИЦа В содеРжании О2 с 6—7 об.% до 3,0—2,2 об.%, снижается утилизация
Умен°Р°Да тканями> исходя из величины соответствующего коэффициента,
45 обЬ7Э[еТСЯ содеРжание СО2 в крови до 35 об.% в сравнении с нормой
261
Образование НЬСО под влиянием СО не является единственным нару-
шением порфиринового обмена. Так, при остром СО-отравлении при вды-
хании СО в концентрациях 40—600 мг/м3 растет содержание прото- й
уропорфирина в эритроцитах, а также развивается копро- и уропорфирин-
урия. Причем рост копропорфиринов в моче обусловлен образованием про-
дуктов синтеза СО с железопорфиринами тканей, которые, поступая в
кровь, выделяются затем с мочой. В особо тяжелых случаях прослежено
увеличение содержания порфобилиногена [61]. Возможно возрастание уров-
ня метгемоглобина и появление сульфгемоглобина в крови [65]. И наконец
под влиянием СО возрастает содержание ключевого продукта синтеза ге-
моглобина дельтааминолевулиновой кислоты в плазме и эритроцитах, что
по-видимому, свидетельствует об угнетении синтеза гемоглобина под влия-
нием СО.
Долгое время считали, что механизм токсического действия СО опреде-
ляется исключительно нарушением дыхательной функции крови за счет
образования НЬСО. Однако со временем эта концепция была пересмотрена.
Убедительно доказано, что СО действует на многие биологически активные
системы организма, содержащие железо, а именно: миоглобин, цитохромсодер-
жащие дыхательные ферменты, такие как цитохром Р-450, цитохромокси-
даза (цитохром aj), цитохром с, пероксидаза, каталаза [65].
При взаимодействии СО с миоглобином образуется карбоксимиоглобин,
хотя сродство СО к миоглобину меньше, чем к гемоглобину. В то же время
сродство миоглобина к СО, по разным данным, в 25—50 раз больше, чем к
кислороду [44].
Таким образом, при отравлении СО наряду с образованием НЬСО про-
исходит также образование карбоксимиоглобина. При этом его нарастание
в мышцах протекает параллельно росту этого деривата гемоглобина в крови.
Не исключено, что появление карбоксимиоглобина в мышцах играет опре-
деленную роль в патогенезе СО-интоксикации, во всяком случае поражение
мышц при этом однозначно связывают с воздействием на миоглобин. Есть
данные, что соотношение карбоксимиоглобина и НЬСО независимо от
уровня воздействия СО составляет 0,52. При тяжелых отравлениях более
25 % миоглобина может быть связано с СО.
Результаты многочисленных исследований свидетельствуют в пользу то-
го, что в патогенезе СО-интоксикации далеко не последнюю роль играет
взаимодействие СО с системой цитохромов — железосодержащих дыхатель-
ных ферментов, что приводит к угнетению тканевого дыхания. Как выяс-
нилось, тяжесть нарушений в организме именно за счет этого механизма
существенно превосходит таковые, вызванные банальной кислородной не-
достаточностью, связанной с дефицитом О2 во вдыхаемом воздухе.
Основное внимание при оценке токсического воздействия СО на орга-
низм до определенного времени уделялось острым отравлениям, возникаю-
щим под влиянием этого газа. Несмотря на то что пусковым механизмом
развития острой интоксикации СО служит его взаимодействие с гемоглоби-
ном и другими железосодержащими биохимическими структурами, в кли-
нической картине интоксикации преобладают прежде всего симптомы рас"
стройств со стороны ЦНС, выраженность которых, как правило, зависит от
содержания НЬСО в крови.
Учитывая, что патогенез острого отравления СО изначально определя-
ется повреждающим действием на кровь, уместно охарактеризовать, как при
этом изменяется морфологический и биохимический состав крови. На вы-
соте интоксикации увеличивается количество эритроцитов до 5,5—
262
^1012/л, что обусловлено, с одной стороны, сокращением селезенки за
6Л рефлексов с каротидных синусов и поступлением в кровь депониро-
СЧ6ных эритроцитов, а с другой стороны, причиной эритроцитоза может
?аН, непосредственная стимуляция СО образования эритропоэтина. И на-
°ЫТец нельзя исключить гипоксию как еще один причинный фактор воз-
К°стания числа эритроцитов. Эритроцитоз — чаще всего явление временное,
Ранако иногда развивается истинная полицитемия либо сразу вслед за ост-
интоксикацией, либо как последействие спустя месяцы и даже годы.
Пои повторных отравлениях СО на фоне лимфоцитоза в крови появляются
нопмобласты при повышенном содержании ретикулоцитов. Примечательно,
что изменения содержания гемоглобина при СО-интоксикации мало харак-
терны- „
В ряде случаев исходом поражения красной крови при отравлении СО
является развитие анемии типа Бирмера в сочетании с нейтропенией [65].
По мнению А.М.Рашевской и Л.А.Зориной [48], изменения со стороны
белой крови встречаются чаще, чем таковые со стороны красной. Это
проявляется нейтрофильным лейкоцитозом иногда до 20—25-109/л со сдви-
гом влево на фоне лимфо- и эозинопении при снижении фагоцитарной
активности. Считается, что механизм лейкоцитоза связан со стрессом, а
угнетение фагоцитоза — с угнетением активности цитохромоксидазы в ней-
трофилах. У людей при отравлении СО зафиксировано повышение актив-
ности щелочной фосфатазы нейтрофилов.
Что касается костного мозга, то клетки его претерпевают дегенеративные
изменения при явлениях раздражения, о чем свидетельствует увеличение
ядросодержащих элементов со сдвигом формулы влево с вершиной в области
миелоцитов и метамиелоцитов.
Существенно важными при интоксикации СО представляются некото-
рые сдвиги биохимического характера: увеличение негемоглобинового же-
леза крови (может достигать 50 %), что имеет непосредственное отношение
к состоянию красной крови. При повторных острых отравлениях параллель-
но происходит падение содержания железа в тканях за счет соединения с
СО, что расценивается как механизм детоксикации. Достаточно хорошо
изучены и некоторые другие биохимические сдвиги в периферической крови
при остром отравлении СО. Так, со стороны углеводного обмена выявлены
нарушения в виде гипергликемии и глюкозурии. По мнению одних авторов,
эти сдвиги могут быть следствием изменений центральных механизмов
регуляции углеводного обмена, по мнению других, причина — в усиленном
распаде гликогена печени за счет интенсивного выделения адреналина.
Достаточно закономерным при этом считают увеличение содержания мо-
лочной кислоты в крови при повышении уровня НЬСО до 30 %. Нарушения
отистого обмена при острой интоксикации СО сводится в основном к
^ленномУ накоплению азотистых шлаков в крови, а именно мочевины,
обусловлено нарушениями антитоксической функции печени. Со сто-
жиг>Ы ЛИпидного обмена прослежены стимуляция окисления свободных
мен ЫХ кислот и снижение продукции триглицеридов. Электролитный об-
и ocofS^*16715161051 дис®алансом содержания в крови и тканях кальция, магния
сепп» ННо калия и натрия. Последнее приводит к нарушению деятельности
рдечнои мышцы.
подвер1ТеЛЬН°е вРемя возможность развития хронического отравления СО
Патолог-аЛаСЬ сомнению- В настоящее время общепризнано, что такая форма
РенциоИИ сУществУет- Однако ввиду того, что при этом сложно диффе-
Ровать истинное хроническое воздействие СО от повторных острых
263
отравлений, вопрос был однозначно решен на основании данных эксперт
мента.
По аналогии с приведенными выше данными об остром отравлении Со
повторные многократные воздействия последнего на животных разных ви-
дов в концентрациях 200—1000 мг/м3 приводят к увеличению уровня HbCO
в крови до 20—30 %. Естественно, что это влечет за собой развитие кисло-
родной недостаточности и компенсаторное стимулирование эритропоэза с
увеличением числа ретикулоцитов и гемоглобина. При снижении действую-
щей концентрации СО до 50—100 мг/м3 содержание НЬСО не превышает
10 % при условии, что небольшое количество СО находится в плазме, будучи
связаннным с негемоглобиновым железом.
По аналогии с острым отравлением в эксперименте на животных при
воздействии концентраций СО в пределах 100—80—40—30 мг/м3 наблюда-
ются нарушения порфиринового обмена и обмена железа. При этом уровень
общего железа и негемоглобинового железа сыворотки возрастает [22].
С течением врёмени по мере развития интоксикации содержание железа в
крови уменьшается, что соответствует первоначальному повышению коли-
чества эритроцитов крови с последующим их падением. С этим согласуются
данные об увеличении уровня гемоглобина и значения гематокрита при
30-суточном воздействии СО в концентрации 120 мг/м3 при ежедневной
8-часовой экспозиции. По результатам исследований В.А.Тетерина и
А.И.Эйтингона [62], наиболее закономерными сдвигами в условиях хрони-
ческого воздействия СО в концентрации 22 мг/м3 у крыс было увеличение
в плазме уровня негемоглобинового железа, дельтааминолевулиновой кис-
лоты и содержания копропорфирина на фоне усиленного потребления кис-
лорода. В моче при этом повышается содержание дельтааминолевулиновой
кислоты, копро- и уропорфирина. Это подтверждает закономерность нару-
шений порфиринового обмена при любых режимах воздействия СО на
организм.
Хроническое отравление СО у людей может возникнуть при длительном
вдыхании воздуха с содержанием СО в концентрации порядка 10—50 мг/м3.
Обычно при этом в крови обнаруживается 3—13 % НЬСО, в то время как в
крови у некурящих людей содержание НЬСО составляет 1,5—2 %. Со сто-
роны красной крови в условиях хронического отравления СО прослежены
увеличение содержания гемоглобина и эритроцитов иногда на фоне рети-
кулоцитоза, сдвиг лейкоцитарной формулы влево, более редко наблюдается
тромбоцитоз. При этом содержание эритроцитов может достигать значений
61012/л и выше. Однако в поздних стадиях интоксикации, а иногда уже на
начальных ее этапах, возможно развитие анемии. Описаны даже единичные
случаи пернициозной и гиперхромной анемии с перерождением в парами-
елобластлейкемию, что обычно заканчивалось летальным исходом. Приме-
чательно, что в условиях хронического воздействия СО на людей при со-
держании НЬСО в крови в среднем 4 % в эритроцитах возрастало содержа-
ние дельтааминолевулиновой кислоты до 2,7—6,9 мкг/мл в сравнении с
исходным (0,7—2,5 мкг/мл). В последующем это сопровождалось наруше-
нием синтеза порфиринов и гема. В целом нельзя исключить и прямое
воздействие СО на биосинтез гема в клетке. В известной мере по содержа-
нию дельтааминолевулиновой кислоты в эритроцитах можно судить о чув-
ствительности организма к СО [33]. Изменения со стороны белой кровй
характеризуются разнонаправленностью, в частности может иметь место ка^
лейкоцитоз, так и лейкопения на фоне эозинопении, лимфоцитоза, мон°'
цитоза. Описана также токсическая зернистость нейтрофилов [65]. ПР
ническом воздействии СО в нейтрофилах обнаружено увеличение
п^нК и снижение РНК при условии падения в них активности перокси-
( при изучении воздействия СО на человека в концентрациях порядка
ff-20 мг/м3 в условиях термокамеры на протяжении 1—3 мес обнаружены
едуюшие закономерные изменения: сдвиг кислотно-щелочного равнове-
/ля в сторону ацидоза, появление в крови НЬСО в пределах 10,5—14 %, рост
Сегемоглобинового железа сыворотки до 149 мкг% при 127 мкг% в исходном
НоСТоянии (в случае концентрации СО порядка 20 мг/м3) и снижение ин-
екса каталазы [23]. Как уже указывалось выше, между содержанием НЬСО
в крови и выраженностью клинических симптомов не всегда прослеживается
прямая зависимость. Однако особенно часто этот феномен имеет место при
анализе случаев хронического отравления. Это значительно затрудняет его
диагностику. Объяснение таким фактам, когда при прогрессирующем сни-
жении уровня НЬСО в крови вплоть до нормальных величин симптомы
отравления сохраняются, заключается в том, что поступивший в организм
СО фиксируется гемоглобином в виде НЬСО и выводится из организма
после его разрушения. Исследованиями ряда авторов доказано, что СО
способен фиксироваться в клетках ряда органов, в частности печени, селе-
зенки, мышц, головного мозга. Это сочетается с возрастанием при хрони-
ческом отравлении СО содержания негемоглобинового железа плазмы [56],
в результате чего СО длительное время находится вне связи с гемоглобином.
Ростом негемоглобиного железа сыворотки можно объяснить и увеличение
содержания р-глобулиновой фракции белков сыворотки, которая содержит
в своем составе транспортную форму железа — трансферрин. Такое предпо-
ложение прямо подтверждается серией соответствующих работ, в которых
показано, что при хронической интоксикации СО рост содержания железа
в сыворотке и протопорфиринурия сочетаются с нарастанием р-глобулино-
вой фракции белков сыворотки [65].
Хорошо известно, что клиника как острых, так и хронических отравле-
ний СО изобилует симптомами поражения в первую очередь ЦНС, а также
других органов и систем, что объясняется в первую очередь результатом
развивающейся гемической гипоксемии и гипоксии, а также в известной
мере блокадой ферментных систем, содержащих железопорфириновые
структуры. Для хронического воздействия характерны расстройства ЦНС:
астенический синдром, вегетативная дистония и ангиодистонический син-
дром с наклонностью к ангиоспазмам [46, 48], а также изменения психи-
ческой сферы [65]. Доказано, что хроническая интоксикация СО сопровож-
дается^ нарушением функции сердечно-сосудистой системы при условии
разной степени поражения сердечной мышцы за счет гипоксии. Возможны
изменения артериального давления как в сторону гипо-, так и особенно
пертонии. Несколько менее закономерно, но тем не менее возможно
зникновение отклонений со стороны эндокринной системы, в том числе
половой сфере, а также показателей функций щитовидной железы и
надпочечников.
Яни^’ нак°нец, существуют данные о нарушениях органов чувств под вли-
HoftCM хроническ°й СО-интоксикации. Это касается органа слуха (кохлеар-
наИ вестибУляРн°й части внутреннего уха), а также органа зрения с
НИяУШениями конвергенции, аккомодации, цветоощущения, остроты зре-
Со ’ сУЖением полей зрения и, наконец, изменениями глазного дна в виде
УДистой патологии сетчатки различной интенсивности.
265
7.1.2. Метгемоглобинемия
К поражениям крови за счет инактивации дыхательного пигмента крови
помимо карбоксигемоглобинемии, относятся патологические состояния, ко-
торые сопровождаются развитием метгемоглобинемии и сульфгемоглобине-
мии. Метгемоглобин — патологический дериват гемоглобина, в котором же-
лезо из двухвалентного переходит в окисленную трехвалентную форму, утра-
чивая при этом способность присоединять кислород и транспортировать его
к органам и тканям. Иными словами, в случае метгемоглобинемии по
аналогии с карбоксигемоглобинемией нарушается дыхательная функция
крови. Отличительная особенность метгемоглобинемии заключается в том
что она способствует повышению сродства кислорода к оксигемоглобину в
силу чего затруднена диссоциация последнего и дыхательная функция крови
страдает примерно вдвое больше, чем при простом падении уровня функ-
ционально активного кислорода. Замедленная реакция трансгемирования в
условиях метгемоглобинемии тоже служит косвенным подтверждением по-
вышенного сродства гемоглобина к кислороду [8]. Среди соединений, ко-
торые обладают способностью к мет- и сульфгемоглобинобразованию, наи-
более известны амино- и нитропроизводные бензола, нитриты и нитраты,
красная кровяная соль, бертолетова соль и некоторые другие вещества.
Поскольку ключевым механизмом поражения крови под влиянием ве-
ществ-метгемоглобинобразователей служит процесс метгемоглобинобразо-
вания, целесообразно осветить механизм этого процесса, который в насто-
ящее время достаточно подробно изучен [11]. В основе данного процесса
лежит окисление гемоглобина различными окислителями, в результате чего
железо гемоглобина из двухвалентного состояния (Fe2+) переходит в трех-
валентное (Fe3+), т.е. образуется метгемоглобин.
В физиологических условиях в организме человека и животных посто-
янно происходит образование и восстановление метгемоглобина, общее
количество которого в крови колеблется в пределах 0,1—2,5 %. Если бы не
происходил процесс постоянного его восстановления, то в сравнительно
короткое время (через 4—7 дней) весь гемоглобин окислился бы в метге-
моглобин.
Метгемоглобинемия в указанных пределах носит защитный характер,
обезвреживая цианиды, сероводород, фенол, янтарную, масляную и мышья-
ковую кислоты, роданиды и другие вещества путем связывания их в ком-
плексные сравнительно безвредные соединения. Полезная роль метгемогло-
бина в физиологических условиях заключается в том, что он способствует
также каталитическому распаду перекиси водорода, являющейся обязатель-
ным компонентом в реакциях окислительной деградации гемоглобина и
образования вердоглобинов. В этом случае метгемоглобин проявляет свой-
ства пероксидазы.
Процесс восстановления метгемоглобина до гемоглобина в организме
осуществляется двумя ферментными системами: НАД-Н-зависимой и
НАДФ-Н-зависимой метгемоглобинредуктазами. При этом основную роль
играет редуктаза, зависящая от НАД Н, активность которой в 10—20 раз
выше, чем активность НАДФ-Н-зависимой метгемоглобинредуктазы как У
человека, так и у животных. Активность метгемоглобинредуктазных систем
у разных видов животных выражена по-разному. Например, у кроликов она
настолько велика, что практически предотвращает развитие метгемоглоби"
немии даже при воздействии сильных метгемоглобинобразователей [64J-
Аналогичная способность в виде высокой редуцирующей способности по
отношению к метгемоглобину свойственна мышам [96].
266
Образование метгемоглобина может происходить за счет прямого окисле-
гемоглобина в метгемоглобин под влиянием упоминавшихся ранее веществ,
НиЯ nevio очередь анилина, нитробензола и их многочисленных производных, а
в Пкже за счет усиления эндогенного образования метгемоглобина. Последнее
^блюдается в случае возрастания в эритроцитах уровня эндогенной пере-
иа „ водорода. Обычно это случается при подавлении активности таких
Леоментов, как каталаза, глютатионредуктаза, глютатионпероксидаза, что в
тоге влечёт за собой образование эндогенного метгемоглобина. Примеча-
тельно, что в процессе интоксикации метгемоглобинобразователями зачас-
тую активность каталазы повышается, что следует расценивать как защит-
ную адаптивную реакцию.
По мнению Л.А.Тиунова [64], большинство метгемоглобинобразователей
обладают смешанным типом действия, вызывая как прямое окисление ге-
моглобина в метгемоглобин, так и косвенное за счет усиления эндогенного
метгемоглобинобразования, связанного с подавлением активности метге-
моглобинредуктазных систем. Поскольку подавляющее большинство метге-
моглобинобразователей принадлежат к амино- и нитропроизводным бензо-
ла, уместно остановиться на особенностях механизма образования метге-
моглобина именно под влиянием представителей веществ этого класса.
Многочисленные данные литературы свидетельствуют о том, что анилин,
нитробензол и другие дериваты сами по себе метгемоглобинобразующей
способностью не обладают [10]. Существуют убедительные доказательства
того, что ответственными за образование метгемоглобина при воздействии
на организм ароматических аминов и нитросоединений являются их про-
межуточные метаболиты фенилгидроксиламин (ФГА) и нитрозобензол
(НЗБ), способные обратимо превращаться друг в друга. При этом сущность
метгемоглобинобразования под влиянием системы ФГА — НЗБ заключается
в круговом ферментативном окислительно-восстановительном процессе,
первым этапом которого является реакция сопряженного окисления ФГА в
НЗБ и гемоглобина в метгемоглобин [37]. При этом НЗБ значительно
уступает ФГА в метгемоглобинобразующей активности. При внутривенном
введении изомолярных доз ФГА и НЗБ образуется соответственно 57,8 и
36,6 % метгемоглобина [93]. Вторая фаза кругового процесса образования
метгемоглобина заключается в восстановлении НЗБ вновь в ФГА с помощью
НАД Н и НАДФ Н -зависимых редуцирующих систем, после чего весь ход
реакции воспроизводится заново. Как подчеркивает М.С.Кушаковский [36,
3'], круговой окислительно-восстановительный процесс ФГА — НЗБ — ФГА
обладает высокой метгемоглобинобразующей потенцией и способен длиться
ч с момента добавления к крови ФГА, судя по результатам соответ-
ствующего эксперимента. Однако интенсивность этого процесса определя-
тся главным образом редукцией НЗБ в ФГА (т.е. второй фазой), так как
ервая фаза сопряженного окисления ФГА в НЗБ и гемоглобина в метге-
оглобин протекает чрезвычайно быстро. ФГА в зависимости от дозы обес-
^чивает образование от 60 до 700 эквивалентов метгемоглобина, в связи с
20 аЬэплИН *П v*vo (т е’ после превращения в ФГА) способен окислять от
ного° эквивалентов гемоглобина. Не исключено, что потенция указан-
ся н пР°цесса усиливается еще и за счет способности НЗБ восстанавливать-
Это только в ФГА, но и в исходное соединение, в частности анилин, хотя
роисходит значительно медленнее, чем редукция НЗБ в ФГА.
пРевпя<ИМ °бРазом, ароматические амины и нитросоединения, способные
Потещ111371,051 в М-гидроксидамино- и N-нитрозопроизводные, являются
ЧИальными метгемоглобинобразовате^шми [10]. Как свидетельствуют
267
многочисленные данные литературы, N-гидроксиламино- и особенно
нитрозобензолдериваты выделены как промежуточные продукты биотранс-
формации анилина, N-алкиланилинов, р-фенетидина, р-хлоранидина
р-нитрохлорбензола, 2-аминофлюорена, р-аминопропиофенона, что под-
ностью согласуется с хорошо известной метгемоглобинобразующей актив-
ностью перечисленных соединений.
Установлено, что некоторые ароматические амины, такие как р-хлор-
анилин и р-аминопропиофенон, легче подвергаются N-гидроксилированию
чем гидроксилированию в ядро. Этим и объясняется чрезвычайно высокая
метгемоглобинобразующая активность как р-хлоранилина, намного превос-
ходящего по этому признаку анилин [11], так и р-аминопропиофенона —
одного из наиболее сильных метгемоглобинобразователей среди ароматичес-
ких аминов.
Вместе с тем, кроме промежуточных продуктов метаболизма аромати-
ческих аминов и нитросоединений, метгемоглобинобразующей активностью
обладают и их конечные метаболиты — аминофенолы, хотя они значительно
уступают по этому признаку промежуточным метаболитам. Механизм мет-
гемоглобинобразования под влиянием аминофенолов имеет принципиаль-
ные отличия, будучи процессом неферментативным, протекающим в сте-
хиометрических отношениях, когда 1 моль аминофенола дает 1 эквивалент
метгемоглобина. При этом аминофенолы самоокисляются, превращаясь в
хиноидные структуры, окисляющие гемоглобин в метгемоглобин, при усло-
вии, что окислителем аминофенолов служит сам гемоглобин.
При воздействии на организм веществ-метгемоглобинобразователей, поми-
мо метгемоглобина, путем окисления метиновой группы порфиринового кольца
гема, как правило, образуется еще один патологический дериват — сульфгемо-
глобин. Химическая структура сульфгемоглобина до настоящего времени не
идентифицирована. И хотя железо в сульфгемоглобине остается в двухва-
лентном состоянии, он лишен способности обратимо присоединять кисло-
род. Способ связи гема с глобином у сульфгемоглобина изменен за счет
включения атома серы в кольца пиррола. Это отличает сульфгемоглобин от
естественных промежуточных продуктов превращения гемоглобина — зеле-
ных пигментов (вердоглобинов).
Сульфгемоглобин никогда не встречается в нормальной крови, в отличие
от метгемоглобина — это необратимый дериват гемоглобина и остается в
эритроците вплоть до полного его разрушения. Поэтому срок сохранения
сульфгемоглобина в крови равняется в среднем минимальному сроку жизни
эритроцитов. Последнее предложено использовать для определения срока
сохранности эритроцитов в сосудистом русле [88].
Прямым следствием инактивации кровяного пигмента крови с возник-
новением метгемоглобинемии служит появление в эритроцитах своеобраз-
ных включений, так называемых телец Гейнца. По своей природе тельца
Гейнца представляют денатурированный и осажденный внутриклеточно в
виде преципитата кровяной пигмент, что установлено в результате много-
летней дискуссии. Необратимая денатурация гемоглобина наступает лишь в
том случае, если происходит окисление тиоловых групп глобина. Причем
этот процесс может предшествовать образованию метгемоглобина или про-
текать параллельно с ним. Ослабление связи гема с глобином, как считает
А.Э.Горн [19], служит одним из пусковых механизмов формирования телеи
Гейнца. Заслуживает внимания вопрос о причинной связи образования
телец Гейнца с метгемоглобинобразованием. Если на примере соединении
из класса аминов и нитросоединений бензола эта взаимосвязь четко дока-
268
[ill то при нитратной или врожденной метгемоглобинемии образова-
заНтелец Гейнца не происходит в силу того, что в этих случаях редуктазные
НИЯ емы достаточно быстро и на новом уровне обеспечивают восстановле-
ниеТнарушенного равновесия [36].
" В итоге в основе образования телец Гейнца лежит окисление или блокада
х реактивных тиоловых групп глобина при условии, что превращение фер-
гема в ферригем (т.е. переход гемоглобина в метгемоглобин) значительно
^повышает вероятность окисления тиоловых групп глобина, а следовательно, и
денатурированного пигмента.
Окисление, равно как и восстановление уже окисленных тиоловых групп
глобина, во многом зависит от восстановленного глютатиона (Г-SH). Пос-
ледний/помимо защиты тиоловых групп глобина, препятствует инактивации
тиоловых ферментов и сульфгидрильных групп мембраны эритроцитов. Не-
даром Г-SH получил название “тиоловый щит эритроцитов”, который под-
держивает красящее вещество крови в деятельном состоянии. Как правило,
под влиянием веществ-метгемоглобинобразователей запасы Г-SH истоща-
ются, хотя не исключено и увеличение уровня Г-SH, что может рассматри-
ваться как компенсаторная реакция, связанная с усиленной потребностью
в нем при восстановлении метгемоглобина. Важную роль в денатурации
кровяного пигмента играют также SH-группы мембраны эритроцитов, по-
скольку они являются первичным диффузным барьером по предотвращению
проникновения веществ-окислителей внутрь клеток.
По данным D.Allen [79], наряду с инактивацией SH-групп мембраны
эритроцитов происходит окисление сначала двух реактивных тиоловых
групп глобина, а затем и остальных 4 SH-групп, что приводит к денатурации
молекулы гемоглобина. Денатурированный гемоглобин связывает молекулы
Г-SH, полимеризуется через водородные связи и выпадает в виде телец
Гейнца. Размеры последних прямо пропорциональны времени денатурации
гемоглобина и количеству молекул Г-SH.
Схематично процесс образования телец Гейнца может быть представлен
следующим образом [11]:
1. Окисление гемоглобина в метгемоглобин до равновесного состояния
гемоглобин — метгемоглобин.
2. Окисление двух реактивных SH-групп глобина.
3. Окисление оставшихся SH-групп глобина.
4. Денатурация и осаждение пигмента в виде телец Гейнца.
Как правило, эритроциты, содержащие тельца Гейнца, под их влиянием
разрушаются, что в итоге приводит к гемолизу с укорочением срока жизни
эритроцитов. Однако в данном случае существенную роль играют размеры
телец Гейнца. Известно, что при незначительной степени воздействия тех
же нитро- и аминосоединений ряда бензола тельца Гейнца остаются мел-
^ими, иногда имея пылевидную форму [10], сохраняются в эритроците до
3 нед без нарушения их целостности. Однако чаще всего, а при выра-
1_^НЬ1Х Формах отравления всегда, тельца Гейнца достигают размеров до
раз й И б°лее в диаметре, выделяясь из эритроцита уже на 3—4-й день и
сел^ШаЯ его’ Н° вместе с тем следует отметить удивительную способность
Есте3еНки Удалять тельца Гейнца из эритроцитов, не разрушая последние,
же S?BeHHo> что в первую очередь это касается мелких включений. Конечно
геле гЛ^е Универсальная реакция — разрушение эритроцитов по выходе
с пал еЙНца из внутри- во внеклеточное пространство. В результате наряду
чеГо ением Уровня гемоглобина падает и число эритроцитов, следствием
является развитие гемолитической анемии с образованием продуктов
269
распада метгемоглобина, при котором не происходит разрыва порфйрино
вого кольца.
Особенность гемолиза под влиянием метгемоглобинобразователей за-
ключается в том, что он является вторичным. Как следствие острого гемо-
лиза развивается гиперхромная гемолитическая анемия регенераторного
типа. Об омоложении красной крови свидетельствуют ретикулоциты, появ-
ление нормобластов, телец Жолли, повышение кислотоустойчивое™ эрит-
роцитов, судя по уплощению кислотных эритрограмм или сдвигу вправо.
Гемолитическая анемия неизбежно приводит к развитию аноксемии и
аноксии гемического типа. Как результат этого возможно токсическое вли-
яние на эритропоэз, о чем свидетельствуют такие изменения клеток красной
крови, как мегалобластоидия, кариорексис, атипизм митозов нормобластов
анизо- и пойкилоцитоз [3].
Учитывая разную степень проявления мет- и сульфгемоглобинобразую-
щей активности, а также анемизирующего действия амино- и нитропроиз-
водных бензола предложена классификация соединений, принадлежащих к
этому классу по степени гемотоксического действия [10]. Она включает
5 градаций с учетом таких критериев, как пиковые значения сульф- и
метгемоглобинемии, число телец Гейнца и падение уровня общего гемогло-
бина и оксигемоглобина. На примере более чем 40 веществ доказано, что
более половины из них обладают гемотоксическими свойствами в чрезвы-
чайно сильной или сильной степени по одному или нескольким признакам,
хотя встречаются и такие, которые имеют их в слабой степени или даже
отмечается полное их отсутствие.
В результате изучения сравнительной гемотоксической активности в
стандартных условиях эксперимента убедительно доказано, что выраженной
способностью избирательно поражать красную кровь по типу веществ-мет-
гемоглобинобразователей, помимо анилина и нитробензола, обладают
алкил- и алкоксипроизводные анилина (все изомеры толуидина, анизидины,
р-фенетидин, цианпроизводные этиланилина), хлоранилины, нитрохлор-
бензолы, динитро- и тринитротолуол, р-нитрофенетол, т- и р-нитро-о-ами-
ноанизол [9, 10, 26].
Показатели гемотоксического действия при остром отравлении метгемогло-
бинобразователями. Острое токсическое действие на кровь метгемоглобиноб-
разователей из класса аминов и нитросоединений известно давно в связи с
описанием еще в довоенные годы острых профессиональных отравлений
анилином, нитробензолом, изомерными нитрохлорбензолами, р-нитроани-
лином, р-фенетидином. Позже перечень этот пополнился динитробензолом,
р-хлоранилином, р-толуидином.
При этом наиболее характерным видимым симптомом острой интокси-
кации является цианоз, выраженность которого, как правило, пропорцио-
нальна тяжести отравления. Цианоз, проявляясь особенно на деснах, губах,
ушах, кончике носа, в основном обусловлен усиленным образованием в
крови метгемоглобина и находится в прямой зависимости от его уровня.
Наличие в крови 1,4—2 г% метгемоглобина свидетельствует о развитии
острого отравления. В случаях тяжелого острого отравления содержание
метгемоглобина превышает 50 %, достигая иногда 60—80 %, находится на
уровне не более 30—50 % в случаях отравления средней тяжести и 10—12 % "
при отравлениях легкой степени [102]. При метгемоглобинемии порядка
20—30 % она подвергается обратному развитию в течение 1—3 дней без
лечебного вмешательства, а при наличии в крови свыше 40 % метгемогло-
бина необходимы активные лечебные меры для его ликвидации, так ка
270
„моглобинемия такой степени может привести к летальному исходу,
невидимому, способность организма противостоять высокому уровню мет-
^°'оглобина резко варьирует в зависимости от индивидуальных особеннос-
Ге- Так, известны случаи благополучного исхода (острая интоксикация
те^лоранилином) при 70 % метгемоглобина [82], тогда как есть мнение [42],
Р" этот уровень не совместим с жизнью.
что Примечательно, что цианоз обусловлен не только метгемоглобинемией,
в еше большей мере появлением в крови сульфгемоглобина, который,
Нбоазно выражаясь, в 3 раза “темнее” метгемоглобина, так как цианоз
°динаковой интенсивности (при уровне восстановленного гемоглобина 5 г%)
взвивается при наличии 1,52 и 0,5 г% мет- и сульфгемоглобина соответст-
венно. Как упоминалось выше, существенным различием между острой мет-
и сульфгемоглобинемией служит сравнительно быстрое исчезновение из
крови метгемоглобина и сохранение в ней сульфгемоглобина вплоть до
разрушения эритроцита.
Среди симптомов острого отравления метгемоглобинобразователями
обязательно присутствуют все признаки анемии (падение гемоглобина, чис-
ла эритроцитов) в сочетании с падением осмотической резистентности эрит-
роцитов. Следствием гемолиза является повышение содержания непрямого
билирубина до 20—100 % вплоть до гемолитической желтухи [28]. Билиру-
бинемия при этом сопровождается уробилинурией. Иногда наблюдается и
копропорфиринурия, что может быть сопряжено с образованием продуктов
распада метгемоглобина, при котором не происходит разрыва порфирино-
вого кольца.
Специфическим симптомом острого гемолитического состояния при от-
равлении метгемоглобинобразователями служит появление телец Гейнца.
Между степенью анемии и интенсивностью их образования существует па-
раллелизм, поскольку именно они приводят к разрушению эритроцитов. Осо-
бенностью анемии под влиянием метгемоглобинобразователей служит де-
фицит кислородной емкости крови. В частности, имеются наблюдения, что
насыщение кислородом падает в 3—4 раза при острых профессиональных
отравлениях анилином, нитробензолом и нитрохлорбензолом на фоне воз-
растания уровня метгемоглобина до 45 % и падения гемоглобина до 39 %.
Аналогичные результаты получены в эксперименте при моделировании ост-
рой интоксикации у собак. Вполне естественно, что в таких условиях раз-
вивается кислородная недостаточность по типу гемической гипоксии. О реге-
неоаторном характере развивающейся анемии при остром отравлении ани-
лином, нитробензолом и их производными свидетельствуют ретикулоцитоз,
появление нормобластов, телец Жолли, увеличение диаметра эритроцитов,
анизоцитоз, а также повышение кислотоустойчивости красных кровяных
клеток, судя по сдвигу кислотных эритрограмм вправо [10]. Причиной
стимуляции эритропоэза служат продукты гемолиза и гипоксемия как спе-
цифические раздражители этого процесса. На фоне острого гемолитического
состояния под влиянием метгемоглобинобразователей (например, фенаце-
ина) возможна метгемоглобинурия [85].
Имеющиеся экспериментальные данные [10] позволяют оценить дина-
гематологических изменений при остром отравлении метгемоглоби-
п Раз°вателями на примере анилина, нитробензола и их многочисленных
роизводных. Первой во времени развивается метгемоглобинемия с макси-
соде°М ее СПустя 1,5—2 ч. При этом примерно в половине случаев падает
в кпРЖаНИе оксигемогл°бина и появляется в крови сульфгемоглобин. Позже
рови появляются тельца Гейнца и падает общий гемоглобин.
271
Примечательно, что снижение уровня оксигемоглобина во времени зна
чительно опережает снижение общего гемоглобина, в силу чего содержани"
последнего не может в должной мере характеризовать дыхательную фунц6
цию крови в первые часы интоксикации, когда происходит образование
большого количества неактивных пигментов (мет- и сульфгемоглобина)
которые определяются в составе общего гемоглобина. Спустя 6—7 сут под-
вергаются обратному развитию мет- и сульфгемоглобинемия. Казалось бы
это противоречит распространенному мнению [88, 92] о медленном исчез-
новении из крови сульфгемоглобина. Объяснение этому кроется в достаточ-
но быстром разрушении эритроцитов при большом количестве телец Гейн-
ца, что имеет место при выраженном остром отравлении. Полное исчезно-
вение телец Гейнца обычно сопровождается во времени нормализацией
уровня гемоглобина (как общего, так и окисленного) или даже предваряет
ее. К особенностям динамики острой метгемоглобинемии как таковой от-
носится ее волнообразное течение, особенно ступенчатый спад, что четко
прослеживается на примере анилина. Первоначальный быстро нарастающий
пик метгемоглобинемии обязан стремительно развивающемуся круговому
ферментативному процессу взаимного превращения промежуточных мета-
болитов ФГА -> НЗБ -> ФГА. После каждого пика, длящегося не многим
более 12 ч, что соответствует примерной длительности сочетанного окисле-
ния гемоглобина в метгемоглобин и ФГА в НЗБ, уровень метгемоглобина
резко падает. Спад метгемоглобинемии уже в первые сутки можно объяснить
прежде всего быстрым выведением соединения-метгемоглобинобразователя
(в частности, анилина) из организма. Дальнейшее, хотя и менее выраженное
повышение содержания метгемоглобина в известной мере возможно обу-
словлено частичным восстановлением НЗБ не только в ФГА, но и в анилин
[86]. Но скорее всего пролонгирование метгемоглобинемии на невысоком
уровне после первоначального пика обусловлено образованием метгемогло-
бина по “хиноидному” типу под влиянием конечных метаболитов амино- и
нитропроизводных бензола — аминофенолов, о чем упоминалось выше.
Кривая падения метгемоглобина на конечном отрезке имеет пологий вид,
поскольку метгемоглобинобразование под влиянием аминофенолов (конеч-
ных метаболитов) протекает как неферментативная реакция в стехиометри-
ческих пропорциях, подчиняясь законам обычных химических реакций.
Появление при острых отравлениях телец Гейнца вслед за пиком метге-
моглобинемии согласуется с точкой зрения о том, что они являются про-
дуктами деструкции гемоглобина [19] после предварительного окисления его
в метгемоглобин [91]. Эритроциты, содержащие тельца Гейнца, обречены
на быстрое разрушение, являя собой пример ускоренного старения [95].
Следствием этого процесса и является развитие острой гемолитической
гиперхромной анемии, как итог первичной инактивации кровяного пигмента.
Наряду с избирательным поражением красной крови для аминов ряда
бензола при остром отравлении характерны расстройства функции ЦНС по
типу синдрома гипотонического возбуждения, характерного для веществ —
доноров водорода [38].
Показатели гемотоксического действия при хроническом отравлении метге-
моглобинобразователями. Вопрос о развитии хронических отравлений под
влиянием метгемоглобинобразователей из класса аминов и нитросоедине-
ний бензола долгое время оставался дискуссионным. На определенном этапе
возможность развития хронического отравления, в частности анилином,
вообще исключалась. По-видимому, такое ошибочное представление сло-
жилось в связи с не изученными к тому времени и общеизвестными сейчас
272
аМИ привыкания к анилину, которое приводит к нормализации пока-
^едей крови даже в условиях продолжающегося воздействия яда, но спра-
за1дИво оценивается как фаза хронической интоксикации. Поэтому в на-
тояшее время возможность возникновения хронических отравлений амино-
С нитропроизводными бензола признана вполне реальной. В частности,
Писаны хронические профессиональные отравления анилином, р-нитро-
° илином, тринитротолуолом, р-нитрохлорбензолом с синдромом анемии
и 01 Есть данные о развитии анемии в результате длительного употребления
фенацетина как лекарственного препарата [94].
Отличительная особенность анемии при хроническом отравлении арома-
тическими аминами и нитросоединениями — ее гипохромный характер срав-
нительно с гиперхромной анемией при остром отравлении. В остальном спе-
цифические изменения красной крови в целом аналогичны таковым, опи-
санным выше применительно к острому отравлению, включая мет- и сульф-
гемоглобинемию, а также тельца Гейнца. Вместе с тем клиника поражения
крови во многом зависит от фазы интоксикации. Например, хроническое
отравление ароматическими аминами на ранних стадиях характеризуется
возрастанием гемоглобина и числа эритроцитов [51], а затем уже развива-
ются явные признаки анемии с падением гемоглобина и эритроцитов.
Прослежены особенности течения хронических анемий в зависимости
от того, какие конкретно соединения ее вызвали. Так, своеобразие анемии
при хроническом воздействии нитрохлорбензола заключается в замедленном
на начальном этапе, а затем бурном ее течении.
Грозным осложнением анемии при хронической интоксикации тринит-
ротолуолом (ТНТ) может быть развитие в отдельных случаях апластических
состояний, что совершенно нехарактерно для действия других веществ этого
класса.
Помимо специфических изменений морфологического состава перифе-
рической крови в условиях хронического воздействия ароматических амино-
и нитросоединений, известны и изменения ее биохимического состава.
В частности, описаны разнонаправленные изменения в содержании неге-
моглобинового железа сыворотки как в сторону падения, так и в сторону
повышения [15] при хронической интоксикации ТНТ, что, по-видимому,
обусловлено фазовостью ее течения. В эксперименте на животных просле-
жено увеличение содержания связанного трансферрина (сидерофидина),
отождествляемого с транспортной формой железа, т.е. негемоглобиновым
железом сыворотки, в условиях повторного воздействия анилина, нитробен-
зола, р-нитроанилина и дихлорпаранитроанилина. Такой сдвиг — вторичное
проявление регенераторной анемии, которая неизбежно сопровождается
усиленным транспортом железа из депо в костный мозг. Примечательно,
что сдвиг в сторону гиперферримии на примере р-нитроанилина сочетался
с повышением уровня железа в печени и особенно в селезенке (более чем
в 4 раза по сравнению с контрольными цифрами). Подобные изменения
можно объяснить тем, что резко выраженная гемолитическая анемия под
влиянием р-нитроанилина приводит к избыточному депонированию железа
виде ферритина и гемосидерина не только в селезенке, но и в печени,
рямым следствием поражения красной крови при хронической интокси-
ВДи метгемоглобинобразователями становится вовлечение в патологичес-
ки процесс ретикулоэндотелиальной системы (РЭС), в результате чего
с Вивается сплено- и гепатомегалия [31]. По данным Н.М.Василенко [10],
4g ди испытанных в эксперименте на предмет поражения красной крови
веществ-метгемоглобинобразователей в 24 случаях имело место увеличе-
273
ние относительной массы селезенки, что сочеталось иногда с дефицитом
витамина С в этом органе. Увеличение массы селезенки объясняется гемоли-
тической природой анемии, когда продукты гемолиза утилизируются селе-
зенкой, а в особо тяжелых случаях и купферовскими клетками печени со
скоплением в этих органах гемосидерина и гематоидина, содержащих железо
Особое место при оценке длительного (подострого и хронического)
воздействия аминов и нитросоединений ряда бензола следует отвести нару.
тениям обмена серосодержащих соединений, как правило, имеющих пря-
мое отношение к механизму их токсического влияния.
Об активном вмешательстве метгемоглобинобразователей в обмен серо-
содержащих соединений, судя по данным обширных экспериментальных
исследований, свидетельствует снижение уровня свободных SH-групп крови
под влиянием большинства (в 34 случаях из 43) производных анилина и
нитробензола. При этом особо характерен такой сдвиг при воздействии
веществ с выраженными гемотоксическими свойствами, что подтверждает
его специфичность. Еще одним доводом в пользу этого является избира-
тельность блокады SH-групп именно цельной крови, т.е. эритроцитов, при
сохранности их в сыворотке. Механизм подавления тиоловых структур в
эритроцитах может быть различным [67], а именно за счет инактивации
SH-групп глобина, цитоплазмы эритроцитов и, наконец, их мембраны.
Однако в любом случае такой сдвиг свидетельствует о нарушении стабиль-
ности эритроцитарных структур.
В ряде случаев блокаду SH-групп крови можно расценить как предуп-
реждение об угрозе окисления гемоглобина в метгемоглобин, хотя угроза
эта не всегда реализуется, как это прослежено на примере производных
нитроанилина. Следовательно, тиоловые системы эритроцитов способны
неопределенно долго ограждать гемоглобин от действия окислителей. Со-
держание восстановленного глютатиона (Г-SH) в условиях повторного воз-
действия метгемоглобинобразователей в эксперименте в большинстве слу-
чаев возрастает в 1,5—2 раза сравнительно с контролем. Это весьма суще-
ственно, если учесть, что именно Г-SH в наибольшей мере обеспечивает
защиту эритроцитов от гемолизирующих и окисляющих агентов [30], а также
активизирует фермент гемсинтетазу [27]. Скорее всего в случае воздействия
нитро-аминосоединений механизм повышения уровня Г-SH может быть
связан с ростом активности фермента глюкозо-6-фосфатдегидрогеназы
(Г-6ФДГ), который характерен для регенераторной анемии любого проис-
хождения.
Как известно, рост активности Г-6ФДГ сопровождается усиленным пре-
вращением глюкозо-6-фосфата в фосфоглюконовую кислоту, в процессе
которого генерируется избыток НАДФ Н. Водород последнего расходуется
в первую очередь на восстановление окисленной формы глютатиона (Г-Sj
S-Г) в Г-SH. Это полностью согласуется с данными о более интенсивном
продукции глютатиона молодыми формами эритроцитов по сравнению со
зрелыми [55]. Еще одним механизмом образования избытка Г-SH может
служить угнетение фермента глютатионпероксидазы, катализирующей со-
пряженный процесс окисления Г-SH и восстановление эндогенной переки-
си водорода в эритроцитах. Косвенным подтверждением этому является,
во-первых, сульфгемоглобинемия, источником которой, по утверждению
G.R.Frendo (1970) и Fh.Tursz (1974) [83, 100], служит Г-SH при условии
угнетения глютатионпероксидазы, а во-вторых, тельца Гейнца, образующие-
ся в результате преципитации Г-SH. Угнетение глютатионпероксидазы на
фоне метгемоглобинемии представляется вполне реальным, если учесть при*
274
ю метгемоглобину пероксидазную активность и возможное ингибиро-
С ие в таком случае глютатионпероксидазы по закону конкурентных вза-
Ва*оотношений. И наконец, прирост Г-SH в присутствии метгемоглобина
иМ быть обусловлен высвобождением его из формы, связанной с гемо-
м° бином (всего такая форма составляет '/s-% от общего содержания Г-SH
ГЛэоИтроцитах) по аналогии с разрывом такой связи в случае НЬСО [36].
В Наряду с описанными выше патогномоничными для хронической ин-
токсикации метгемоглобинобразователями из класса аминов и нитросоеди-
нений ряда бензола изменениями красной крови при их профессиональном
воздействии, а также изменениями биохимического состава крови, доста-
точно четко прослеживаются и неспецифические изменения со стороны
белой крови в виде нейтрофильного лейкоцитоза со сдвигом влево, а также
ускорения СОЭ [58].
В то же время, по данным Н.М.Василенко [10], полученным на крысах,
из 43 веществ, изученных по этому признаку, только в половине случаев
отмечен лейкоцитоз. Не исключено, что такая неоднозначность результатов
объясняется лимфоидным типом кроветворения у крыс, неадекватным та-
ковому у человека.
Возможны изменения иммунологической реактивности, в основном по
типу ее угнетения, в виде падения фагоцитарной способности нейтрофилов,
что прослежено на примере моно- и динитротолуолов, но особенно четко
при воздействии нитроанилинов. Наблюдаются также разнонаправленные
изменения таких показателей, как фагоцитарное число и фагоцитарный
индекс при длительном воздействии метгемоглобинобразователей, что со-
гласуется с фазовостью проявления симптомов интоксикации. Известны
результаты специальных исследований по оценке влияния ароматических
нитро- и аминосоединений (испытано 42 вещества) на процесс гемокоагу-
ляции. Они свидетельствуют о высокой чувствительности такого интеграль-
ного показателя гемокоагуляции, как время свертывания. Выявлено доста-
точно закономерное укорочение времени свертывания крови и гораздо реже
удлинение его (ди- и тринитротолуол). Укорочение времени свертывания
крови скорее всего служит неспецифическим сдвигом, поскольку он может
быть обусловлен, с одной стороны, изменением константных условий, ко-
торые требуются для любых ферментативных реакций, в том числе и такого
сложного ферментативного процесса, как гемокоагуляция, за счет присут-
ствия в крови чужеродных соединений (как исходных веществ, так и их
метаболитов). С другой стороны, причину ускорения времени свертывания
крови можно усматривать в усилении синтеза ферментных белков (к кото-
рым относятся и факторы гемокоагуляции) печенью, по механизму индук-
ции этого процесса химическими веществами. Если речь идет об удлинении
времени свертывания под влиянием ди- и тринитротолуола, то его можно
объяснить их общеизвестными гепатотоксическими свойствами с угнетени-
ем ферментобразовательной функции печени.
Несмотря на несомненную специфичность повреждающего действия на
кровь ароматических аминов и нитросоединений, им присущи и другие
специфические виды биологической активности, особенности которых за-
исят от химической структуры конкретных веществ. Так, к веществам, для
с°т°Рых симптомы поражения печени являются ведущими, но в сочетании
выраженными специфическими изменениями крови, относятся ди- и
Ринитротолуол, изомерные нитрохлорбензолы, в известной мере р-толуи-
«’ а также практически не влияющие на кровь о-нитроанилин, р-ацета-
инофенол (парацетамол), мононитротолуолы.
275
Для отдельных соединений из класса аминов и нитросоединений весьма
характерным является повреждающее действие на почки. В первую очередь
это касается ацетпроизводного р-фенетидина (фенацетина), а также самого
р-фенетидина. Широко известны факты развития интерстициального фена-
цетинового нефрита [80, 99] с исходом в сморщенную почку [89]. Достаточ-
но выраженными нефротоксическими свойствами обладают толуидины и
метоксидпроизводные анилина (анизидины) и нитробензола (нитроанизо-
лы), а также моно-, ди- и тринитротолуолы и р-ацетаминофенол.
О-толуидин известен как бластомоген [35], вызывающий опухоли моче-
вого пузыря, в том числе и злокачественные [14]. Среди ароматических
аминов 2-нафтиламин известен как вещество с доказанной канцерогенной
активностью для человека — группа 1 [35]. К канцерогенам принадлежит
также фенацетин (N-ацетилпарафенетидин) (группа 2Б согласно классифи-
кации МАИР).
Одним из проявлений политропности тринитротолуола служит его спо-
собность вызывать катаракту.
Динитроанилин и хлординитроанилин являются разобщителями окисли-
тельного фосфорилирования и ингибиторами переноса электронов по ды-
хательной цепи на участке цитохромоксидазы [9].
И наконец, 2,4-динитрохлорбензол и р-фенилендиамин широко извест-
ны как классические аллергены. Таким образом, можно заключить, что
причисление нитро- и аминосоединений ряда бензола строго к ядам, изби-
рательно поражающим кровь, является в известной мере условным, во
всяком случае для некоторых из них.
7.1.3. Метгемоглобинобразователи неорганической природы
Помимо метгемоглобинобразователей из класса ароматических нитро- и
аминосоединений, специального внимания заслуживают метгемоглобиноб-
разователи, являющиеся солями азотистой и азотной кислоты, т.е. нитриты
и нитраты [76, 77]. Чаще всего это соли натрия. При этом истинными
метгемоглобинобразователями являются нитриты, а нитраты принадлежат к
ним постольку, поскольку они, попадая в организм, восстанавливаются в
нитриты за счет микрофлоры кишечника, обладающей редуцирующими
свойствами. Отсюда термин “нитратно-нитритная” метгемоглобинемия.
Особенностью образования метгемоглобина под влиянием нитритов служит
то, что реакция окисления гемоглобина в метгемоглобин протекает в сте-
хиометрических отношениях, не будучи ферментативной и не обладая вы-
сокой потенцией, которая свойственна ферментативной реакции по типу
“анилиновой” метгемоглобинемии. Поэтому продолжительность ее в первом
случае значительно короче. К метгемоглобинобразователям принадлежит
также окись азота (единственная среди окислов азота, обладающая этим
свойством) за счет превращения ее в организме в нитриты [78]. В связи с
нитритной метгемоглобинемией возникло такое понятие как “бессимптом-
ная” метгемоглобинемия, когда уровень метгемоглобина в крови может
достигать 15 %, при отсутствии видимых признаков интоксикации (цианоз
и др.). Между тем, как выяснилось, “бессимптомность” в данном случае
только кажущаяся, поскольку на ее фоне прослеживаются сдвиги функци-
онального состояния ЦНС, в том числе ЭЭГ, сердечно-сосудистой системы
с изменениями ЭКГ, что сопровождается падением кислородной емкости
крови. Примечательно, что именно на примере нитратно-нитритной метге-
моглобинемии убедительно доказана гораздо более высокая чувствитель-
276
молодых организмов к метгемоглобинобразователям по сравнению со
Н°СТслыми. Это особенно актуально в связи с наличием достаточно боль-
ВЗР° количества нитратов в питьевой воде некоторых регионов, которую
ШОГ°ебляют люди всех возрастных категорий, включая грудных детей. Пос-
ПО1ние при прочих равных условиях гораздо более чувствительны к дейст-
Лю метгемоглобинобразователей. Так, у детей раннего грудного возраста в
ВИ их случаях развивается интенсивно синяя окраска (“голубые” дети по
терминологии американских авторов) с нарушениями функций сердечно-
осудистой системы и дыхания, в то время как у детей дошкольного и
Школьного возраста, а тем более у взрослых эти симптомы отсутствуют, хотя
крови повышен уровень метгемоглобина [60]. Столь высокая чувствитель-
ность к нитратам и нитритам у грудных детей обусловлена наличием у них
легко окисляющегося фетального гемоглобина и недоразвитием метгемо-
глобинредуктазных ферментных систем.
К метгемоглобинобразователям принадлежит также хлорат калия (бер-
толетова соль), вызывающий метгемоглобинемию с цианозом, гемолиз и в
тяжелых случаях закупорку почечных капилляров за счет метгемоглобину-
рии, что в итоге приводит к олигурии, анурии и почечной недостаточности,
возможна гемолитическая желтуха.
7.1.4. Поражение крови при первичном гемолизе
В отличие от гемолитических состояний, развивающихся как вторичные
явления (после предварительной деструкции гемоглобина метгемоглобинобра-
зователями), существует так называемый первичный или внутрисосудистый
гемолиз, характерный для воздействия ряда соединений. К ним относятся
мышьяковистый водород, нафталины, фенилгидразин, гидроперекись изо-
пропилбензола и некоторые другие соединения, в частности уксусная эс-
сенция.
Механизм первичного гемолиза под влиянием ядов крови бывает двоя-
ким: гемолиз может быть вызван либо повреждающим действием яда на
оболочку эритроцитов, либо за счет вмешательства в течение ферментатив-
ных процессов, обеспечивающих целостность эритроцитов [67]. Поврежда-
ющим действием непосредственно на оболочку эритроцитов обладают мы-
шьяковистый водород, нафталины и некоторые другие соединения. Кон-
кретный механизм их действия заключается в первичной блокаде сульфгид-
рильных групп белков в мембранах эритроцитов. В результате происходят
конформационные изменения белковых структур мембраны, нарушаются их
связи с липидами, вплоть до разрыва. В итоге повреждается оболочка
эритроцитов. Как правило, наряду с блокадой SH-групп мембраны блоки-
руются SH-группы молекулы гемоглобина и снижается уровень восстанов-
ленного глютатиона, который играет важную роль в поддержании стабиль-
но состояния структуры мембраны эритроцитов. Это обусловлено тем, что
§истема восстановленный глютатион — окисленный глютатион (Г-SH-F-S-
Со ~ своего рода буферная защита эритроцитов от действия окислителей.
держание Г-SH может снижаться за счет окисления его гемолитиком,
систТеНИЯ ег° синтеза> увеличения распада или дисбаланса ферментных
па-, ем’ РегУлирующих его уровень в клетке. Во всех этих случаях возможно
Развитие гемолиза [67].
мичеТ°Р°й ваРиант механизма гемолиза заключается в ингибировании хи-
ВеШесКИМИ веществами Ряда ферментных систем эритроцитов. К таким
твам относятся прежде всего фенилгидратан и его производные. Под
277
их влиянием угнетается Г-6-ФДГ как первичное звено патологическог
процесса, что приводит к снижению уровня Г-SH. Конкретный механизм
такого явления заключается в том, что гемолитик, угнетая активность Г-6
ФДГ, тем самым угнетает образование НАДФ Н, который в качестве кофак"
тора необходим для восстановления окисленной формы глютатиона (Г-S-S-
Н) в восстановленную Г-SH. Иными словами, гемолитик подавляет актив-
ность глютатионредуктазы, за счет чего падает содержание Г-SH.
Глубинный механизм гемолиза в случае блокады фермента Г-6-фДГ и
как следствие падение уровня Г-SH заключается в следующем. Помимо того
что Г-SH поддерживает стабильность сульфгидрильных структур гемоглоби-
на и белков оболочки эритроцитов, он еще обеспечивает нормальное про-
текание реакции гликолиза, поскольку многие ферменты гликолиза содер-
жат сульфгидрильные группы и поэтому нуждаются в Г-SH. Падение уровня
Г-SH в эритроците может привести к торможению в нем гликолиза, к
падению содержания АТФ, что в свою очередь нарушает функционирование
“натриевого насоса”. Последнее приводит к потере внутриклеточного калия
и проникновению в эритроцит натрия и воды. Такой сдвиг ионного равно-
весия вызывает набухание эритроцита, его разрушение и в конечном итоге
гемолиз.
Нельзя упускать из вида еще один возможный механизм действия гемо-
литиков. Речь идет об образовании избыточного количества эндогенной
перекиси водорода за счет угнетения активности таких ферментных систем,
как глютатионпероксидаза и каталаза. Так, действие ряда гемолитиков обу-
словлено накоплением эндогенной перекиси водорода, а также экзогенного
ее поступления, что сопряжено с угнетением активности ферментов системы
глютатиона, а также каталазы. Это влечет за собой снижение гемолитичес-
кой стойкости эритроцитов и как следствие гемолиз. Именно так действуют
органические перекиси, в частности гидроперекись изопропилбензола (ги-
периз).
Расшифровка механизма развития гемолиза позволяет объяснить факт
существования достаточно выраженной индивидуальной чувствительности
к веществам-гемолитикам. Впервые это было обнаружено на примере неко-
торых лекарственных препаратов с антималярийной активностью, в первую
очередь примахина. Как оказалось, он вызывает гемолиз у лиц с выраженной
недостаточностью фермента Г-6-ФДГ и нестабильностью в связи с этим
Г-SH.
Именно этот феномен служит причиной развития гемолиза при таких
уровнях воздействия гемолитиков, которые являются недействующими в
обычных условиях.
Поскольку мышьяковистый водород является классическим гемолити-
ком, вызывающим первичный внутрисосудистый гемолиз за счет блокады
SH-групп мембраны эритроцитов, целесообразно списать на его модели
клинику интоксикации гемолитиками с таким типом действия.
Выраженность клинических симптомов интоксикации мышьяковистым
водородом зависит от тяжести интоксикации. При легких формах острой
интоксикации симптоматика в основном не отличается специфичностью-
Она характеризуется общей слабостью, головной болью, тошнотой, незна-
чительным ознобом. Специфическим признаком служит иктеричность склер
[59]. При выраженных формах отравления, как правило, имеет место про-
дромальный период, длящийся от 2 до 8 ч, несмотря на процесс гемолиз ,
который начинается непосредственно после поступления яда в организм-
Это состояние сменяется периодом бурно прогрессирующего гемолиза, ко
278
й сопровождается цианозом, усилением иктеричности склер, появле-
ТОРЬм иктеричности кожи, болями в эпигастрии, правом подреберье и пояс-
ние на фоне нарастающей слабости, головной боли, тошноты, рвоты тем-
НИ оливковыми массами из-за примеси желчи (в особо тяжелых случаях с
Н°явлением крови), подъема температуры. Одновременно моча приобретает
П°мно-красный цвет за счет гемоглобинурии. Иногда гемоглобинурия фик-
^пуется как первый признак интоксикации. Кровь приобретает темно-крас-
w окраску, а плазма становится розовой. Стул при этом жидкий, кровя-
истый. В ряде случаев гемолиз развивается настолько бурно, что количе-
ство эритроцитов падает до 1 млн/мм3 и даже ниже; также падает уровень
гемоглобина, иногда до 5 г% [48]. Продукты гемолиза стимулируют эритро-
поэз что приводит к ретикулоцитозу до 200—500%о. При этом появляются
эритроциты с базофильной пунктацией, наблюдается нейтрофильный лей-
коцитоз до 15—25 тыс/мм3 со сдвигом влево, иногда лимфо- и эозинопения.
Возможно появление миелоцитов, СОЭ ускорена (22—50 мм/ч), уровень
SH-групп в крови падает [21].
Бурный распад эритроцитов приводит не только к гемоглобинурии, но и к
протеинурии с развитием олигурии, анурии, азотемии и других признаков по-
чечной недостаточности, что обусловлено закупоркой почечных канальцев про-
дуктами деструкции эритроцитов. Недаром А.М.Рашевская и Л.А.Зорина
[48] специально выделяют почечный синдром при интоксикации мышьяко-
вистым водородом.
В связи с гемолизом также грубо нарушается пигментный обмен с
развитием билирубинемии первоначально за счет непрямой фракции, а в
последствии при нарушении пигментной функции печени и за счет прямой
фракции. Гипербилирубинемия приводит к появлению желтухи, которой
предшествует желтовато-бронзовая окраска кожи на фоне повышения тем-
пературы тела до 38—39 °C. Вовлечение в патологический процесс печени,
что обычно происходит на 3—5-е сутки, приводит к увеличению ее размеров,
болезненности и появлению явных симптомов нарушения функции.
Летальный исход при острой интоксикации мышьяковистым водородом
может наступить в ранние сроки от кислородного голодания, вызванного
стремительным гемолизом (“аноксемическая смерть”). В более поздние сро-
ки смерть наступает вследствие почечной недостаточности при явлениях
олигурии и даже анурии (“смерть в подостром периоде”). Морфологически
выявляется разной степени отек слизистых оболочек полости рта, дыхатель-
ных путей, легких, мозга. В почках — скопление распавшихся эритроцитов,
в тяжелых случаях — явления некроза почек и гломерулонефрита в печени —
скопление гемосидерина в клетках РЭС, в селезенке — атрофия фолликулов,
нервные клетки в состоянии отека при наличии дистрофических изменений,
а также мелких кровоизлияний и нейронофагии.
В эксперименте на животных при однократном и повторном поступле-
нии мышьяковистого водорода проявления интоксикации аналогичны та-
овым у человека и также сопровождаются развитием гемолитического
стояния со всеми вытекающими из него последствиями.
коь Р°НИчеСкие отравления мышьяковистым водородом в эксперименте на
0₽ icax при круглосуточном ингаляционном воздействии в концентрации
’ Мг/м В течение 3 мес характеризовались метгемоглобинемией, падением
селеНЯ гемогл°бина и SH-групп крови, реактивными изменениями РЭС
Ностой*?! И печени> что> безусловно, сопряжено с гемолитической актив-
дорОпЮ У человека при хроническом отравлении мышьяковистым во-
Дом наряду с симптомами анемии развиваются симптомы, свидетельст-
279
вующие о желудочно-кишечных расстройствах, а также признаки нарушения
функционального состояния нервной системы в виде головокружений, бо-
лей в конечностях, шее, груди, животе, спине, онемения пальцев рук и’ног
Возможны изменения ЭКГ. Описанные явления протекают на фоне сдвигов
общего характера в виде повышенной утомляемости, исхудания.
Механизм гемолитического действия нафталина близок к таковому
свойственному мышьяковистому водороду {64]. Поражение крови по типу
гемолиза под влиянием нафталина характерно только при хроническом
отравлении [70]. При этом, помимо признаков гемолиза, появляются тельца
Гейнца, развивается лейкоцитоз.
При подостром воздействии нафталина на крыс в дозах 0,2—0,004 LD50
снижалось число эритроцитов, появлялся ретикулоцитоз, наблюдалась поли-
хромазия. По другим данным [49], даже при массивных повторных воздей-
ствиях картина крови существенно не менялась. В отличие от этого в
условиях хронической ингаляции насыщенными парами нафталина в тече-
ние 2—5 мес круглосуточно у кроликов имело место сначала повышение, а
затем снижение числа эритроцитов (при неизмененном содержании гемо-
глобина), что характерно для внутрисосудистого гемолиза. Одновременно с
этим наблюдались пойкило- и анизоцитоз, полихромазия и базофильная
зернистость, а также лейкоцитоз. У работающих в контакте с нафталином
изменения со стороны крови носили аналогичный характер с тем различием,
что содержание гемоглобина снижалось, появлялась тромбоцитопения, а
лейкоцитоз сопровождался лимфоцитозом. Примечательно, что при хрони-
ческой интоксикации нафталином развивались не только признаки гемоли-
за, но и достаточно характерным было помутнение хрусталика с появлением
катаракты.
К. гемолитикам-ингибиторам фермента Г-6-ФДГ относятся прежде всего
фенилгидразин и его производные.
Клиника как острого, так и хронического отравления фенилгидразином
в эксперименте на животных и согласно наблюдениям на людях представ-
ляет собой картину классического гемолитического состояния. Так, при
воздействии на кроликов и крыс снижается в первую очередь число эрит-
роцитов, значительно (в 4 раза) увеличивается количество ретикулоцитов,
падает уровень гемоглобина, в 3—4 раза возрастает содержание метгемогло-
бина. В условиях хронического эксперимента на крысах сначала возрастает,
а затем падает активность фермента Г-6-ФДГ, аналогична динамика изме-
нения содержания SH-групп крови [69].
У людей острое отравление фенилгидразином характеризуется с самого
начала анемией с высоким ретикулоцитозом и билирубинемией за счет
непрямой фракции, т.е. типичными признаками гемолиза. При этом появ-
ляются желтушность кожных покровов, цианоз губ, моча приобретает цвет
пива, печень и особенно селезенка увеличиваются в размерах, в области
правого подреберья — болезненность. Все это протекает на фоне общих
неспецифических симптомов интоксикации — слабости, головной боли, го-
ловокружения, тошноты.
Хроническое отравление фенилгидразином у людей протекает со сниже-
нием числа эритроцитов и уровня гемоглобина, ретикуло- и пойкилоцито-
зом, появлением телец Гейнца, спленомегалией [54].
Среди ядов-гемолитиков высокой гемолитической активности, котор
сочетается с метгемоглобинобразованием, обладает гидроперекись изопро^
пилбензола (гипериз). Механизм гемолиза под влиянием гипериза обуслов
лен угнетением ферментов, содержащих SH-группы, включая снижен
280
вности ряда дегидрогеназ. Гипериз обладает также свойствами окисли-
аКТИ вызывая образование метгемоглобина, при условии замедленного его
Постановления [65].
ви У ЖИВотных (мышеи) резкий гемолиз вплоть до полного исчезновения
тооиитов и вызванная этим почечная недостаточность возникали при
^едении гидроперекиси изопропилбензола в брюшную полость.
ВВ При действии гипериза на работающих в контакте с ним отмечено
нижение содержания гемоглобина, числа эритроцитов, лейкоцитов, а также
уровня SH-групп крови [40].
7.2. Угнетение ксенобиотиками системы кроветворения
К этой категории относятся 2 разновидности повреждающего влияния
на систему крови, которые отличаются патогенетическими особенностями
угнетения гемопоэза.
Одна из разновидностей поражения гемопоэза заключается в подавлении
гемопоэтической активности всех ростков кроветворной ткани с развитием
в конечном итоге гипо- и апластических состояний. Моделью такого пора-
жения крови служит интоксикация бензолом. Сходные, но менее выражен-
ные гематологические изменения вызывают хлорбензол, гексаметилендиа-
мин, гексаметиленимин, гексахлорциклогексан, сульфаниламидные и пира-
золоновые лекарственные препараты. Вторая разновидность угнетающего
влияния на гемопоэз характеризуется расстройством порфиринового обмена
и как следствие этого нарушением синтеза гема на стадии включения железа
в порфириновое кольцо. Таков механизм гемотоксического действия
свинца.
7.2.1. Поражение крови по типу бензольной гемопатии
Повреждающее действие на кровь по типу бензольной гемопатии сопровож-
дается снижением продукции клеточных элементов органами кроветворения и
уменьшением количества клеток в периферической крови, что определяется
термином “депрессия кроветворения” [59]. Конкретные механизмы развития
этого процесса с учетом интенсивности, длительности воздействия соответст-
вующих гематотропных веществ уместно оценить на примере бензола.
Согласно классической формуле, повреждающее действие бензола на
кровь при достаточных по интенсивности и времени уровнях воздействия в
конечном итоге определяется тремя последовательно развивающимися син-
дромами: лейко-, тромбоците- и эритроцитопенией.
Однако окончательное представление о патогенезе поражения крове-
творной системы под влиянием бензола с учетом всего многообразия гема-
тологических изменений, интимных механизмов развития каждого из трех
Упомянутых выше взаимосвязанных и взаимообусловленных процессов, ха-
P ктеризующих бензольную гемопатию, сложилось лишь последние два де-
ятилетия. Это стало возможным благодаря накоплению и теоретическому
данЬ1СЛеНИЮ большого числа как клинических, так и экспериментальных
полНЫХ П° пР°блеме “бензол и система крови”. Изменения в системе крови
Неппвли?нием бензола есть результат специфического (гематотропного),
Те ециФического, в том числе компенсаторного, а также антигенного (гап-
ного) или аутоиммунного его влияния [72].
в угнУЩН°СТЬ спепиФическ°го гематотропного влияния бензола заключается
стен и и кроветворения, которое касается всех его ростков. Одним из
281
основополагающих моментов депрессивного воздействия бензола на систему
крови служит уменьшение количества полипотентных стволовых клеток
(предшественников всех видов клеточных элементов крови в органах кро-
ветворения). Видимый признак такого явления — уменьшение клеточности
в органах кроветворения в костном мозге и селезенке [24]. Снижение
количества клеток-родоначальников может быть обусловлено прямым ци-
тотоксическим действием на них бензола, с одной стороны, и угнетающим
влиянием микроокружения стволовых клеток — с другой.
Есть прямые доказательства того, что основной причиной уменьшения
количества стволовых клеток является изменение гемопоэзининдуцирующе-
го микроокружения, которое представлено стромальными, в частности ре-
тикулярными клетками кроветворных органов, а также неклеточными эле-
ментами, т.е. средой для роста и развития стволовых клеток. Столь значи-
тельное угнетающее значение микроокружения на стволовые клетки объяс-
няется в первую очередь низкой пролиферативной активностью ретикуляр-
ных клеток стромы, которая за счет специфической способности накапли-
вать значительные суммарные дозы бензола еще больше угнетается. Подоб-
ного рода изменения гемопоэзининдуцирующего микроокружения стволо-
вых клеток приводят к уменьшению колоний кроветворных клеток, в ос-
новном гранулоцитарных и мегакариоцитарных и в меньшей мере эритро-
идных, что свидетельствует о нарушении соотношения дифференциации
ростков кроветворения. В итоге происходит сужение плацдарма продукции
стволовых клеток, особенно за счет гранулоцитопоэза при большей устой-
чивости эритропоэза [16].
Отмечено, что повреждающему действию бензола на кроветворную ткань
по типу гипоплазии всегда сопутствуют неспецифические реакции, во многом
носящие компенсаторный характер. В первую очередь это касается пула
стволовых и ретикулярных клеток. Так, на ранних стадиях, особенно при
малых интенсивностях воздействия, он усиливается, судя по количеству
стволовых клеток, находящихся в состоянии синтеза ДНК. В результате
увеличивается доля полипотентных клеток, вступающих в митотический
цикл. С одной стороны, при этом усиливается пул дифференцированных
кроветворных клеток, а с другой — истощается пул стволовых клеток. К ком-
пенсаторным реакциям костного мозга относится также усиленный переход
клеток предшественников из дремлющего в активное состояние: миелоблас-
та в миелоцит, проэритробласта в полихроматофильный эритробласт. За счет
усиления пролиферативного пула в целом на некоторый период увеличива-
ется плацдарм кроветворения, в результате чего вытесняется жировой кост-
ный мозг за счет “гиперплазии” красного костного мозга. Это является
одним из механизмов временной компенсации бензольной гемопатии, хотя
по сути имеет место скрытая патология, которая легко проявляется на фоне
нагрузочных проб.
В периферической крови неспецифические изменения проявляются ней-
трофильным лейкоцитозом на фоне лимфо- и эозинопении, ретикулоцитоза
с качественными изменениями форменных элементов крови. Последние
выражаются макроцитозом эритроцитов, повышением процентного содер-
жания дегенеративно измененных лейкоцитов, их цитохимическими изме-
нениями. Как правило, наиболее характерны неспецифические отклонения
на ранних стадиях воздействия бензола. Одним из признаков начальной
неспецифической реакции крови на действие бензола служит вариабель-
ность гематологических показателей (размах колебаний), которая предШе'
ствует последующему снижению их средних значений и является следствием
282
ущения регуляторных механизмов. Теоретическая трактовка явления ва-
на?бельности гемограммы заключается в том, что в начальный период
Ри еТения пролиферативных процессов в системе кроветворения регулятор-
Угн механизмы работают в режиме “рыскания” как бы в поисках нового
НЬяционарного состояния. Когда оно, наконец, достигается, наступает сни-
е гематологических показателей. Таким образом, временные, хотя
*огда и достаточно продолжительные превышения средних показателей
” , это не результат стимуляции, а проявления фазности процесса.
Н Неспецифические реакции крови в условиях воздействия бензола нераз-
оызно связаны с компенсаторными изменениями. Дополнительно к опи-
санным выше проявлениям компенсации со стороны кроветворных органов
существуют мощные гомеостатические механизмы, направленные на пред-
отвращение гематоцитопении в периферической крови. Среди конкретных
механизмов, противодействующих снижению числа клеток в кровяном рус-
ле помимо упоминавшегося выше возрастания пула кроветворных клеток,
отмечается ускоренный выход дозревающих клеток из кровяных депо. Далее
происходит перераспределение нейтрофилов и лимфоцитов между присте-
ночным и циркулирующим пулами в пользу последнего.
К числу компенсаторных относятся реакции, препятствующие снижению
суммарной функциональной активности клеток периферической крови и спо-
собствующие повышению доли активированных (более активно синтезирующих
ДНК) лимфоцитов, изменение цитохимических показателей нейтрофилов в
сторону повышения в них уровня гликогена, липидов, щелочной фосфатазы.
Сюда же относится макропланоцитоз эритроцитов, что обеспечивает при
сниженном их содержании увеличение количества транспортируемого кис-
лорода за счет активации субклеточных структур и изменений в мембранах.
И еще одним механизмом компенсации служит выработка биохимичес-
ких активных веществ: гемопоэтинов и лимфотоксина. Роль лймфотоксинов
заключается в элиминации “запрещенных” (генетически дефектных) кле-
точных клонов.
Если оценивать динамику гематологических изменений при бензольной
интоксикации с учетом приоритетности поражения ростков кроветворения,
то наибольшей чувствительностью отличается лимфоидная ткань, вследст-
вие чего угнетение лимфопоэза и гибель лимфоцитов наблюдаются как
самые ранние признаки гематотропности, когда другие кроветворные клетки
либо совсем не реагируют, либо дают лишь неспецифические реакции.
Примечательно, что различные субпопуляции лимфоидной ткани, отличаю-
щиеся гетерогенностью, неодинаково чувствительны к бензолу.
Причины столь высокой чувствительности лимфоидной ткани к бензолу
кроются в слишком большой длительности клеточного цикла, аэробном
Иде обмена и высокой скорости окислительного фосфорилирования лим-
фоидной ткани. Среди лимфоидных органов наибольшей чувствительностью
инт НЗ°ЛУ °^ладает тимус. При этом гомогенат тимуса мышей с бензольной
его °КСИКаЦИеЙ В отличие от ожидаемой стимуляции лимфопоэза вызывал
угнетеннс. Доказано, что клеточность тимуса снижается уже тогда, когда
зенк°ЧН°СТЬ лимФатических узлов и селезенки еще не изменяется. В селе-
соотн клеточность уменьшается за счет малых лимфоцитов при снижении
Нпг„ °Шения В/Т лимфоцитов, в лимфатических узлах — за счет равномер-
У снижения Т- и В-лимфоцитов.
и распЛеННЫЙ Распад лимФоидных клеток как в органах лимфопоэза, так
^здейс^ ЛИМФОЦИТОВ периферической крови на самых ранних стадиях
твия и при малой интенсивности последнего определяет иммуноде-
283
прессивное действие бензола. Первой страдает Т-система иммунитета, од-
нако при выраженных формах интоксикации угнетается и В-система имму-
нитета. При этом нарушается баланс как среди лимфоцитов различной
природы, так и между иммунокомпетентными и кроветворными клетками
В результате это приводит к нарушению как иммуногенеза (угнетение анти-
телогенеза), так и миелопоээа. Однако иммунодепрессивный эффект опере-
жает угнетение гемопоэза, проявляясь уже после однократного воздействия
тогда как снижение числа стволовых клеток наступает только в результате
повторного воздействия.
Поражение лимфоидной ткани под влиянием бензола имеет прямое
отношение и к его аутоиммунному эффекту. Об аутоиммунном механизме
действия бензола свидетельствует появление аутоантител: лейкоагглютини-
нов, а также антиэритроцитарных и антитромбоцитарных антител еще до
появления лейкопении, анемии и тромбоцитопении. Это правомерно рас-
ценить как аутоагрессию в противоположность защитной функции антител.
Дисбаланс клеточных коопераций лимфоидной системы ослабляет им-
мунологический контроль за антигенраспознающими свойствами лимфоци-
тов, что ведет к появлению “запрещенных клонов” и как следствие усиле-
нию аутоиммунных процессов. Собственно нарушение вышеупомянутой
“цензорной” функции лимфоцитов происходит потому, что наряду с угне-
тением лимфоидной ткани, приводящей к иммунодепрессии, происходит
активация некоторых субпопуляций лимфоидных клеток, относящихся к
“запрещенным” клонам. Кроме этого, такая активация может быть обуслов-
лена антигенным (гаптенным) действием бензола [2, 47].
Антигенное (гаптенное) действие бензола является одним из трех ком-
понентов его повреждающего влияния на систему крови и проявляется
прежде всего как раздражение лимфоидной ткани. Антигенное раздражение
активирует гемопоэз в условиях, когда активированные ростки гемопоэза
приобретают повышенную чувствительность к бензолу, что усиливает его
специфический гематотропный эффект. Эти изменения развиваются в силу
как бы “самосенсибилизирующего” действия бензола, при этом может раз-
виваться сенсибилизация и к другим вредным факторам. Конкретные при-
знаки цитотоксичности вследствие антигенного действия бензола: плазма-
тизация кроветворной ткани, возрастание гетерогенности лимфоцитов за
счет увеличения доли лимфоцитов с активированным синтезом РНК и
изменения ферментативной активности цитоплазмы лимфоцитов.
Примечательно, что иммунодепрессивный эффект бензола первичен не
только по времени, но и по механизму. Доказано, что именно лимфоидная
ткань обеспечивает нормальное течение клеточных дифференцировок в про-
цессе гемопоэза. Нарушение взаимодействия между клетками лимфоидного
ряда и другими видами кроветворных клеток является ключевым и служит
пусковым механизмом гематотропного действия бензола. Так, тимоциты
регулируют дифференцировку стволовых клеток в направлении эритропоэза.
Определенные фракции Т-лимфоцитов обеспечивают гранулоцитарную
дифференцировку. Не исключено, что регулирующее влияние лимфоцитов
опосредовано через макрофаги. В частности, лимфоидная дифференцировка
полипотентной стволовой клетки зависит от макрофагов, регулируюши
образование Т- и В-лимфоцитов путем выделения как стимуляторов, так и
ингибиторов этого процесса.
Механизмы нарушения взаимодействия иммунокомпетентных и
творных клеток, которые приводят к гипоплазии кроветворной ткани, могут
быть различными и заключаться в следующем.
284
• Прямое цитотоксическое действие Т-лимфоцитов на клетки-предше-
ственники костного мозга.
• Выработка антител против стволовых клеток с угнетением роста эрит-
роидных и лимфоидных коммитированных стволовых клеток.
• Выработка антител против гуморальных стимуляторов гемопоэза, на-
пример эритропоэтина.
Изменения лимфоидной ткани, в первую очередь с нарушениями имму-
ногенеза, являются не только самыми ранними, но и самыми стабильными
в отличие от воздействия на пролиферацию стволовых клеток и других
кооветворных клеток на всех уровнях созревания. Длительные иммунные
сдвиги способствуют “запуску” устойчивых изменений гемопоэза.
Таким образом, в лимфоидной ткани сфокусированы все 3 эффекта
поражения крови: специфический, неспецифический (с элементами ком-
пенсации) и антигенный, свидетельствующие о ее ключевой роли в развитии
бензольной гемопатии.
Бензольная гемопатия может иметь в качестве исхода злокачественное
поражение крови в виде лейкоза. Согласно МАИР [IARC, 1987] и ГН
1.1.029-95, бензол считается канцерогеном. Существует точка зрения, что
хроническая бензольная интоксикация с гипоплазией органов кроветворе-
ния чаще имеет исход в лейкоз, чем в аплазию. Однако единой точки зрения
о такой взаимосвязи нет. Наряду с мнением о бензольном лейкозе как
исходе гипоплазии существует точка зрения о самостоятельном развитии
бензольного лейкоза в разных его проявлениях без предшествующих гема-
тологических изменений. При этом лейкозы и лейкемоидные состояния у
людей могут быть острыми, подострыми и хроническими по течению. Чаще
всего наблюдаются миелоидные лейкемии, реже лимфолейкозы, эритролей-
кемический лейкоз, лейкемический и алейкемический миелоз, эритроблас-
тоз [5]. Экспериментальные данные по вопросу о канцерогенезе бензола
свидетельствуют о возможности воспроизведения лейкоза, ангиосаркомы,
гепатомы и рака цимбаловых и молочных желез у крыс и мышей чувстви-
тельных линий [24]. Доказана коканцерогенность бензола в эксперименте
на крысах [34].
Кроме этого, косвенным признаком бластомогенности бензола служат
данные о его мутагенности по критерию учета хромосомных аббераций,
результатам теста Эймса и микроядерного теста. Оба эффекта, мутагенный
и канцерогенный, обусловлены воздействием на генетический аппарат за
счет ковалентного связывания бензола с ДНК, в первую очередь в клетках
костного мозга, что инициирует канцерогенез. Кроме этого, канцерогенная
активность может быть следствием иммунодепрессивного действия бензола,
особенно подавлением Т-клеточной системы иммунитета и тимуса. Именно
эти системы обеспечивают отторжение чужеродных опухолевых клеток, что
согласуется с тем, что иммунодепрессия является важным компонентом
Реализации процесса онкогенеза.
7.2.2. Клиника острого и хронического отравления бензолом
хапа^ЗМеНения гематологических показателей при остром отравлении менее
ной КтеРНЬ1> чем ПРИ повторном и хроническом воздействии. При достаточ-
содеИНТеНСИВНОСТИ в°ЗДействия (75 мг/м3 в течение 2 ч) у людей падало
ядепнЖаНИе ЛИМФОЦИТОВ на фоне нейтрофильного лейкоцитоза с палочко-
Р ым сдвигом и нормализацией гематологических показателей спустя
сУт. У животных в условиях острого отравления имели место преходя-
285
щие изменения в гемограмме, как правило, в виде лимфопении, тромбоци-
тоза на фоне лейкоцитоза [5].
Однако для клиники острого отравления бензолом гораздо более характерны
расстройства со стороны ЦНС, свойственные всем веществам, обладающим
наркотическим действием, к которым принадлежит и бензол. Это может
выражаться в зависимости от степени воздействия различными состояния-
ми — от быстрой потери сознания и даже гибели до разнообразных измене-
ний неврологического статуса на фоне неспецифических симптомов — пло-
хого самочувствия в виде общего недомогания, головной боли, тошноты.
При легкой степени интоксикации все болезненные явления исчезают в
течение нескольких часов без последствий. При интоксикации средней
тяжести возможны стойкие функциональные нарушения в виде астеновеге-
тативного синдрома [4].
При хроническом отравлении бензолом в первую очередь поражается сис-
тема крови, главным образом кроветворные органы. Принято хронические
формы интоксикации бензолом делить на несколько стадий.
Первая, наиболее легкая стадия характеризуется умеренной лейко-, нейт-
ро- и эозинопенией и относительным лимфоцитозом, иногда нерезко вы-
раженной тромбоцитопенией, а также незначительной анемией. В крови
могут определяться антилейкоцитарные антитела, имеет место снижение
фагоцитарной активности нейтрофилов. Результатом тромбоцитопении мо-
жет быть кровоточивость десен.
Во второй стадии имеет место выраженное угнетение лейкопоэза с
лейкопенией до 2,5-109/л, тромбоцитопения до 150Ю9/л, эритропения с
увеличением СОЭ до 30—45 мм/ч.
В третьей стадии эритробластическая функция костного мозга настолько
поражается, что развивается анемия гиперхромного типа, реже гиперизо-
хромная. Анемия сопровождается гипоплазией или даже аплазией костного
мозга с резким падением уровня гемоглобина и снижением числа эритро-
цитов до 1 • 1012/л. Лейкопения достигает 1 109—0,8- 109/л, а тромбоцитопения
характеризуется содержанием тромбоцитов 10109/л. Изменения гемограммы
сочетаются с выраженными признаками геморрагического синдрома с
многочисленными кровоизлияниями в коже, сетчатке, упорными носовыми
кровотечениями. При этом геморрагические проявления могут иметь место
и при нормальном количестве тромбоцитов, что обусловлено нарушением
их склеивающей адгезивной и агрегационной активности со снижением и
даже полным отсутствием ретракции кровяного сгустка.
Четвертая и пятая стадии бензольной интоксикации характеризуются
прогрессирующим поражением органов кроветворения с язвенно-некроти-
ческими процессами на слизистой оболочке полости рта, ЖК.Т, распростра-
ненными явлениями геморрагического диатеза. Возможны массивные про-
фузные кровотечения. Иногда появляются незаживающие язвы в местах
наибольших кровоизлияний. Все это сопровождается высокой СОЭ и тяже-
лой анемией.
Наряду с классической динамикой гематологических изменений: лейко-
пения — тромбоцитопения — эритропения, достаточно часто встречаются
случаи с преимущественным сильно выраженным поражением эритропоэза,
когда гипопластическая анемия протекает без тромбоцитопении. Иногда в
начальном периоде тромбоцитопения сочетается с выраженным нейтро-
фильным лейкоцитозом, который постепенно подвергается обратному Раз'
витию, и через 1—2 года наступает лейкопения. В начальных стадиях ин-
токсикации в качестве компенсаторной реакции возможно усиление лейко-
286
тпопоэза в основном за счет гиперпродукции дозревающих клеток с
и Ценным поступлением в кровяное русло нормо- и мегалобластов и других
Спелых форм.
НС Очень тяжелая степень бензольной интоксикации с истощением крове-
ения и развитием апластической анемии обычно обусловлена индиви-
ТВ°льной чувствительностью. Весьма характерны изменения морфологичес-
Д го состава пунктатов костного мозга при гипопластических анемиях. Они
К°лажаются увеличением содержания молодых форм гранулоцитов и сни-
Вением числа сегментоядерных нейтрофилов. Именно за счет последних
*поисходит общее снижение содержания элементов миелоидного ряда. Од-
новременно наблюдается увеличение количества эритронормобластов на
<Ьоне ретикулоцитоза. Далее, в пунктате костного мозга может оказаться
сниженным число миелокариоцитов при увеличении числа ретикулярных
клеток и гемоцитобластов. Часто имеет место повышение клеточности кост-
ного мозга за счет ретикулярных, плазматических клеток и гемоцитобластов.
Бензольная интоксикация может сопровождаться гиперпластическими
процессами в костном мозге в виде лейкозов и лейкемоидных реакций.
Течение лейкозов может быть острым, подострым и хроническим. При этом
чаще всего развиваются миелоидные лейкемии, реже лимфолейкозы, эрит-
ролейкемические лейкозы, лейкемический миелоз, эритробластоз. Таким
образом, гематотоксичность бензола отличается значительным полиморфиз-
мом.
К наиболее тяжелым видам бензольной гемопатии, которые могут при-
вести к летальному исходу, относятся апластическая анемия, панцитопения,
тромбоцитопеническая пурпура, острая миелобластическая анемия, эритро-
лейкемия [84].
Морфологические изменения при вскрытии характеризуются в первую
очередь множественными кровоизлияниями во внутренних органах, струк-
турах мозга, на слизистых и серозных оболочках, а также в коже. Костный
мозг трубчатых костей, грудины и ребер в зависимости от стадий желтова-
то-красный или темно-красный. Кроветворная ткань находится в состоянии
различной степени гипоплазии вплоть до аплазии по типу панмиелофтиза.
Могут быть поражены все ростки костного мозга. Бензольная гипоплазия
кроветворения такого типа приводит к повышению титра антител к эрит-
роцитам, гранулоцитам, лимфоцитам костного мозга, что свидетельствует
об иммунной перестройке. При этом часто появляются противопеченочные
и противопочечные антитела, а также антитела в ткани мозга.
Реже встречается гиперплазия костного мозга в сочетании с очагами
экстрамедуллярного кроветворения в печени, селезенке, лимфатических уз-
лах. Это сопровождается избытком гемосидерина в органах, придающего им
ржавый оттенок. Паренхиматозные органы отличаются дистрофическими
зменениями, а также “плазматизацией” тканей.
Биохимические изменения в клетках крови касаются изменения актив-
ости ряда~ ферментов. Наиболее закономерен рост активности р-глюкуро-
оа*аЗЬ1 нейтР°Фил°в независимо от степени воздействия бензола. Для вы-
рокеННЬ1Х Ф°РМ отравления характерно уменьшение активности миелопе-
адапИДазЬ1 и Увеличение содержания липидов в нейтрофилах. В качестве
Тив тационных реакций со стороны нейтрофилов прослеживается рост ак-
В Ли°^™ лизосомальных ферментов: кислой фосфатазы и р-глюкуронидазы.
Ности пЦИТаХ на®людаются биохимические сдвиги аналогичной направлен-
измен Римечательно> что Для яиц молодого возраста наиболее характерны
ения клеточного состава костного мозга (в основном ядросодержащих
287
I
элементов), тогда как у лиц старшего возраста гораздо более выражень
изменения в периферической крови. 1
Наряду с поражением кроветворения для хронической бензольной ин-
токсикации характерны закономерные нарушения со стороны нервной сис-
темы в виде астеновегетативного и астеноневротического синдрома, а также
токсической энцефалопатии различной степени.
Существует мнение [29], что нарушение белкового обмена (положитель-
ная тимоловая проба, диспротеинемия), липидного и ферментного обменов
могут предшествовать ранним гематологическим изменениям, что объясня-
ется воздействием бензола на печень.
Нормализация патологических сдвигов, развивающихся в процессе хро-
нической интоксикации бензолом, может затягиваться до 10 лет и более.
Данные эксперимента в целом подтверждают и дополняют особенности
клиники бензольной интоксикации у людей. Наиболее чувствительными
животными для моделирования бензольной гемопатии являются кролики.
Состояние периферической крови характеризуется при этом снижением
уровня гемоглобина, изменением цветового показателя, гематокрита, появ-
лением ядросодержащих эритроцитов, анизо- и пойкилоцитозом, лейкопе-
нией, базофильной зернистостью и вакуолизацией протоплазмы нейтрофи-
лов, изменением числа и свойств тромбоцитов [5]. У кроликов при введении
им бензола в дозе 0,1 мг/кг подкожно через день в течение 13 мес отмечались
существенные изменения костномозгового кроветворения, в первую очередь
нейтрофилопоэза и эритропоэза при наличии лейкопении.
В условиях хронического воздействия малых доз бензола (0,1—0,4 мг/кг)
у кроликов и мышей развивались изменения клеточного иммунитета, пред-
шествующие появлению специфических гематологических сдвигов [66].
В эксперименте на кроликах при длительном ингаляционном и подкож-
ном поступлении бензола в организм доказана его тропность к гипоталамо-
гипофизарно-надпочечниковой системе. Установлено также гонадотокси-
ческое действие бензола на крысах (как самцах, так и самках), что вызывало
негативные последствия по отношению к потомству.
И наконец, есть множество экспериментальных данных о наличии у
бензола тератогенных, мутагенных свойств с соответствующими хромосом-
ными нарушениями, влиянием на синтез РНК и ДНК, а также канцероген-
ного эффекта по отношению к костномозговым гемопоэтическим клеткам
[81, 101]. Имеются доказательства гепатотоксичности бензола и его канце-
рогенности в опытах на крысах [97].
7.2.3. Вещества с бензолоподобным действием на кровь
Хлорбензол оказывает токсическое влияние на кровь, аналогичное бен-
золу. Однако степень гемотоксического эффекта при этом существенно
уступает бензольной гемопатии. Изменения в крови у людей при хроничес-
кой интоксикации хлорбензолом выражаются лейкопенией, относительным
лимфоцитозом, умеренной тромбоцитопенией при наличии кровоточивости
десен и слизистой оболочки носа. Возможно развитие нормохромной ане-
мии с тенденцией к макроцитозу в сочетании с лейкоцитозом за счет
лимфоцитоза и эозинопении. При этом изменения белой крови могут раз*
виваться без нарушений со стороны показателей красной крови [12].
В эксперименте на кроликах при введении им под кожу 0,9 мг/кг
хлорбензола после 20 инъекций в периферической крови возрастало про*
центное содержание палочкоядерных нейтрофилов и псевдоэозинофил0
288 j
отсутствии изменений в костном мозге. Введение хлорбензола в дозе
ПРИ /кг в желудок кроликам в течение 9 мес приводит к угнетению
О’ тоопоэза с падением в крови уровня гемоглобина и числа эритроцитов,
ЭР о- и пойкилоцитозом, ростом числа ретикулоцитов и тромбоцитов и
аиИйВлением митотической активности клеток костного мозга. При этом
П°меняется ряд параметров эритроцитов, характеризующих их функциональ-
нее состояние, а именно: объем, толщина, размеры, индекс сферичности,
н°лержание фосфолипидов и сульфгидрильных групп, активность дыхатель-
ных и гликолитических ферментов [12].
Н Гексаметиленамин обладает специфическим гематотропным действием
в эксперименте на животных (крысах) при повторном воздействии в дозе
2 мг/л в желудок. При этом происходит обеднение костного мозга клеточ-
ными элементами с уменьшением и дегенерацией мегакариоцитов. В пери-
ферической крови лейкопения за счет лимфопении [17].
Ф Гексаметилендиамин относится к веществам, действующим на кровь
сходно с бензолом. У животных (крысы) при подостром воздействии в крови
снижалось содержание эритроцитов и гемоглобина на фоне возрастания
числа лейкоцитов и ретикулоцитов и падения уровня SH-групп крови.
У кроликов в условиях хронической ингаляционной затравки в концентра-
ции 10 мг/м3 в течение 6 мес падало содержание гемоглобина, повышалось
число эритроцитов и лейкоцитов (за счет лимфоцитов и сегментоядерных
нейтрофилов). При введении в желудок кроликам гексаметилендиамина в
дозе 0,05 мг/кг на протяжении 6 мес наступало снижение содержания
лейкоцитов [75].
Гексахлорциклогексан будучи ядом политропного действия вызывает сре-
ди прочих нарушений поражение системы кроветворения. Так даже в ре-
зультате острого отравления у мышей и кроликов наступает анемия со
снижением насыщенности крови кислородом на фоне выраженного лейко-
цитоза. По данным наблюдения на людях известны аналогичные случаи,
клиника острого отравления которых характеризуется кровотечениями из
носа. Как следствие острого отравления могут развиться агранулоцитоз,
лейкемические состояния, анемия.
Наиболее четко угнетающее влияние гексахлорциклогексана на гемопоэз
проявляется в условиях хронического отравления. При этом происходит
тотальная гипо- и даже аплазия костного мозга с развитием панмиелофтиза.
Это сопровождается анемией, агранулоцитозом, тромбоцитопенией и может
заканчиваться летальным исходом. В качестве причин гемодепрессии в
данном случае рассматриваются прямое цитотоксическое действие, сенси-
билизация (очевидно, за счет аутоиммунных процессов по аналогии с бен-
золом), а также ферментативные нарушения в виде недостатка Г-6-ФДГ
эритроцитов [39].
7.2.4. Первичное токсическое угнетение синтеза гемоглобина
зы П°Ражение крови, обусловленное первичным нарушением синтеза гема, вы-
свинеи> и его соединения. Механизм токсического действия свинца на
НОсвЬ хаРактеризуется вмешательством его в порфириновый обмен, в част-
™ в пРои,есс синтеза гема, представляющего собой железопорфирин. Био-
костн3 ГеМЭ осУШествляется в основном в митохондриях эритробластов
тативн°Г0 мозга и представляет собой сложный многоступенчатый фермен-
гема ЫИ процесс (сХема 7.1). Как известно, исходным продуктом синтеза
является глицин вместе с сукцинил КоА. Последний образуется из
289
10'7127
Схема 7.1. БИОСИНТЕЗ ГЕМА
янтарной кислоты и коэнзима А. При взаимодействии глицина с сукцинил
КоА вначале образуется а-амино-р-кетоадипиновая кислота. Фактически
первый этап синтеза гема — это синтез дельтааминолевулиновой кислоты
(АЛК) в янтарно-глициновом цикле при участии фермента синтетазы АЛК
при условии, что коферментом этой реакции служит производное вита-
мина В6-пиридоксальфосфат. Следующая ступень синтеза — превращение
АЛК в порфобилиноген под влиянием дегидратазы АЛК. Далее через про-
межуточные продукты синтеза уро- и копропорфирин, после воздействия
на последний фермента декарбоксилазы (копрогеназы) образуется непосред-
ственный предшественник гема протопорфирин. Превращение протопорфи-
рина в гем осуществляется благодаря включению в его молекулу двухвалент-
ного железа, причем катализатором этого процесса является фермент гемо-
синтетаза.
Угнетающее действие свинца на биосинтез гема обусловлено его инги-
бирующим влиянием на ферменты, катализирующие синтез гема. Сущность
такого ингибирующего влияния заключается в том, что свинец блокирует
функционально активные центры ферментов: сульфгидрильные (SH), кар*
боксильные и аминные группы. Особенно характерной является блокада
SH-групп ферментов, участвующих в синтезе гема, что, впрочем, свойствен-
но всем “тиоловым” ядам, к которым принадлежит и свинец.
В результате падения активности фермента дегидратазы АЛК образуется
290
ток АЛК, которая в повышенных количествах выделяется с мочой.
И3 переменно’ с тормозящим действием свинца на дегидратазу АЛК анало-
®дННое воздействие оказывается и на ферменты декарбоксилазу и гемсин-
гиЧ Вследствие этого в эритроцитах накапливается избыток уро- и про-
теТОпфирина [71]. Причем по мере усугубления свинцовой интоксикации
Т°отношение между количеством избыточного количества копро- и прото-
С°гиЬирина смещается в сторону последнего [6]. Такое изменение первона-
Пальной пропорции между копро- и протопорфирином, по-видимому, обу-
Чловлено двояким влиянием свинца на порфириногенез. С одной стороны,
vooBeHb протопорфирина возрастает за счет стимулирования на первом
этапе декарбоксилирования копропорфирина (фермент копрогеназа) с пре-
вращением его в протопорфирин, а с другой стороны, уровень последнего
возрастает благодаря торможению процесса включения железа в протопор-
фириновое кольцо. По мере развития интоксикации стимулирующее влия-
ние на декарбоксилирование копропорфирина снижается, однако дисбаланс
в содержании копро- и протопорфирина в крови с преобладанием послед-
него сохраняется. Это объясняется усиленным выведением копропорфири-
нов с мочой, тогда как для протопорфирина почечный барьер непреодолим.
Следовательно, в целом сдвиг соотношения копропорфирин/протопорфи-
рин объясняется опять-таки двумя механизмами: гиперпродукцией прото-
порфирина с нарушением его утилизации, а также усиленным выведением
копропорфирина с мочой. Помимо традиционного пути образования про-
топорфирина из копропорфирина (см. схему 7.1), возможно его образование
непосредственно из АЛК.
Особенности вмешательства свинца в обмен порфиринов определяет
появление ранних признаков его воздействия на организм. Так, самыми
ранними диагностическими показателями влияния свинца на систему крови
служит появление в моче дельтааминолевулиновой кислоты в сочетании с
копропорфиринурией, а также протопорфиринемия. Угнетение биосинтеза
гема как такового приводит к дефициту гемоглобина. Поскольку при этом
нарушается включение железа в молекулу протопорфирина, в эритробластах
и эритроцитах появляется избыток неутилизированного железа (в виде гранул),
вследствие чего они превращаются в сидеробласты и сидероциты.
Нарушение синтеза гемоглобина приводит к стимуляции красного ростка
костного мозга, что сопровождается ретикулоцитозом и появлением базо-
фильно-зернистых эритроцитов, что свидетельствует об омоложении крас-
ной крови. При этом ретикулоцитоз и базофильная пунктация эритроцитов
обычно^ регистрируются параллельно. Существует точка зрения, согласно
которой базофильная зернистость имеет протоплазматическую природу и
появление ее обусловлено усилением регенераторной активности в сфере
^Ритропоэза. По мнению И.А.Кассирского (1970), базофильная зернистость
эритробластах и эритроцитах является следствием дезинтеграции кислого
ллоида, т.е. рибонуклеиновой кислоты, содержащейся в ретикулуме, что
пу*Ит «дверным доказательством ее костномозгового происхождения,
не мечательно> что увеличение числа базофильно-зернистых эритроцитов
оба Сегда сопровождается анемией так же, как и ретикулоцитоз. Поэтому
систе™ СИмптома являются наиболее ранними признаками изменений в
с”* Красной КРОВИ- При этом базофильная зернистость не является
влияниСПеЦИфичной для т°ксического воздействия свинца, появляясь и под
Рода аеМ ДРУГИХ ядов КР°ВИ (бензол, мышьяковистый водород, оксид угле-
углепо Ни£ин)> а также ряда нейротоксических веществ (сероводород, серо-
р д’ оензин и т.д.), однако наиболее закономерно ее появление при
h- 291
поступлении в организм свинца. Все же чрезвычайная лабильность этого
признака — быстрое появление и столь же быстрое исчезновение базофиль-
но-зернистых эритроцитов даже при непрерывном контакте со свинцом'
отсутствие корреляции с признаками анемии снижает диагностическую цен-
ность базофильной зернистости, если она регистрируется изолированно в
отсутствие других показателей свинцовой интоксикации [48].
Уже на ранних этапах свинцовой интоксикации развиваются грубые
отклонения в обмене железа прежде всего за счет торможения его утилиза-
ции в процессе биосинтеза гема, а следовательно, гемоглобина. Причем
именно подавление утилизации железа при образовании гема из протопор-
фирина является строго специфичным, так как образование других железо-
содержащих порфиринов при этом не страдает. Одним из наиболее значи-
мых изменений в обмене железа является накопление его избыточного
содержания в плазме в силу того, что угнетается процесс его включения в
протопорфирин. Однако имеют место и другие нарушения в обмене железа.
Как известно, до момента включения железа в ядро протопорфирина оно
выделяется из сидерофидина (трансферрина) плазмы, внедряется в строму
эритроцитов и соединяется с белком. Далее происходит освобождение же-
леза из стромы и поступление его в цитоплазму, и только потом осущест-
вляется включение железа в протопорфирин. Имеются доказательства того,
что свинец способствует задержке железа в строме эритроцитов, следствием
чего служит появление в ней при сатурнизме гранул железа. В результате в
костном мозге появляется большое количество сидеробластов, а в крови —
сидероцитов. Однако поскольку возможен усиленный синтез протопорфи-
рина непосредственно из АЛК, то протопорфиринемия не всегда сопровож-
дается гиперсидеремией.
Важным моментом в патогенезе свинцовой гемопатии служит нарушение
синтеза не только гема, но и глобина, который, как известно, относится к
важнейшим регуляторам нормального биосинтеза гема.
При достаточной интенсивности воздействия как конечный результат
токсического влияния свинца на красную кровь развивается гипохромная
гиперсидеремическая сидеробластная анемия.
Одной из особенностей свинцовой анемии служит появление в крови
гемоглобина фетального типа, что является следствием напряженного эри-
тропоэза [57]. По данным наблюдений на людях, в фазе свинцовой инток-
сикации, предшествующей анемии, прослежено появление фетального ге-
моглобина порядка 4,5 % (при норме 1,7 %) параллельно с падением коли-
чества SH-групп крови. Кроме этого, отмечено нарастание уровня “малых”
фракций гемоглобина А (основного типа гемоглобина у взрослых), а именно:
гемоглобина и А4 в количествах, вдвое превышающих таковые в нормальной
крови. Такие сдвиги свидетельствуют об извращении синтеза не только гема,
но и глобина, поскольку перечисленные гемоглобины отличаются от гемогло-
бина А различной структурой глобина и повышенным сродством к кислороду-
В результате появляются внутриэритроцитарные антитела.
Нарушение порфиринового обмена — не единственный механизм по-
вреждающего действия свинца на красную кровь. Об этом свидетельствует
способность свинца вызывать гемолиз эритроцитов, который обусловлен
ингибированием защитных систем, предохраняющих мембраны эритроцитов
от перекисного окисления [50]. Это доказано в опытах in vitro и свидетель-
ствует об окислительном характере гемолиза. Имеются и другие объяснения
происхождения гемолиза при свинцовой интоксикации. По одним данным,
свинец поражает эритроциты, циркулирующие в крови, приводя к потере
292
эластичности, вследствие чего они становятся более хрупкими, менее
ИХ ойчивыми, в связи с чем продолжительность их жизни сокращается. Есть
^спериментальные данные, свидетельствующие о том, что повышение про-
эКцаемости мембран эритроцитов под влиянием свинца сопровождается
утерей калия. Существует точка зрения, также основанная на результатах
П сперимента, согласно которой свинец в организме взаимодействует с неор-
ганическим фосфатом в клетках, вызывая образование нерастворимого неак-
ивного тиофосфата с одновременным освобождением свободной кислоты,
вызывающей повреждение мембран эритроцитов [48]. И наконец, господству-
ющее мнение о природе гемолиза при воздействии свинца заключается в том,
что свинец первично поражает клетки эритроидного ряда в костном мозге,
вызывая продукцию изначально неполноценных эритроцитов, которые
легко подвергаются гемолизу. Свинец поражает эритробласты, находящиеся
в стадии митотического деления, в результате чего усиленно продуцируются
элементы эритробластического ростка с образованием малостойких базо-
фильно-зернистых эритроцитов с последующим вторичным гемолизом.
Одним из проявлений токсического действия свинца на красную кровь
служит снижение эритропоэтической активности плазмы, в результате чего
тормозится процесс созревания клеток красной крови [20].
Токсическое влияние свинца на клетки красной крови непосредственно
связано с воздействием на морфофункциональное состояние эритробластов
и эритроцитов с нарушением происходящих в них биохимических процес-
сов. Высокой чувствительностью к свинцу обладают мембраны эритроблас-
тов и эритроцитов. Это обусловлено агрегацией низкомолекулярных белков
с образованием крупных фрагментов высокомолекулярных белков за счет
увеличения активности протеолитических ферментов [68]. Наиболее выра-
жено повреждающее действие свинца на мембраны в виде разбухания де-
маркационных мембран у мегакариоцитов [20]. Судя по данным экспери-
ментов на крысах, происходят глубокое втягивание мембраны цитоплазмы
и ядер эритробластов, частичная дезагрегация ядер, накопление рибосом,
уменьшение доли полирибосом, увеличение количества крист в митохонд-
риях, повышение электронной плотности эндоплазматического ретикулума.
Среди органелл клеток костного мозга наиболее чувствительны к свинцу
митохондрии и полирибосомы. При этом в клетках костного мозга накап-
ливаются гранулы, состоящие из железа и фосфора, что является причиной
повышения электронной плотности клеточного состава костного мозга.
Свойственное свинцу угнетающее действие на биосинтез гема во многом
обусловлено нарушением нормального течения биохимических процессов.
В опытах in vitro на эритроцитах показано, что свинец инактивирует многие
Ферменты, а именно, каталазу, Г-6-ФДГ, глютатионпероксидазу, глютати-
онредуктазу на фоне снижения уровня глютатиона. Кроме этого, свинец
Угнетает монооксигеназную активность микросомальной фракции печени,
г/?/4*1 ингибитором IV группы, согласно соответствующей классификации
14] способствует снижению уровня цитохрома Р-450, что прослежено при
ВеДении в организм свинца в дозе 10—100 мкмоль/кг.
Влияние свинца на клеточном уровне во многом определяется его срод-
л °м >< кальмодулину, низкомолекулярному Са-связывающему белку. Пос-
™ Регулирует функционирование многих ферментных систем (фосфо-
азЩСТераЗЬ1’ киназы> фосфорилазы, фосфолипаза, кальций-зависимая АТФ-
. а также многих клеточных процессов, в частности клеточную проли-
фосфорилирование мембран, высвобождение нейромедиаторов,
олимеризацию микротрубочек, многие постсинаптические и ядерные
293
процессы. Взаимодействие свинца с кальмодулином приводит к вытеснению
из последнего кальция и накоплению его избытка в клетке. Поэтому накоц.
ление кальция в клетке — высокочувствительный тест на цитотоксичность'
поскольку появление избыточного количества кальция предшествует моп^
фофункциональным изменениям клетки. Ингибирующее влияние свинца на
кальмодулин объясняется тем, что кальмодулин способен связывать не толь-
ко кальций, но и ионы тяжелых металлов, к которым относится свинец
Причем сродство кальмодулина к свинцу даже выше, чем к кальцию. Соб-
ственно в силу этого свинец вытесняет кальций из кальмодулина. Это
подтверждено in vitro на модели эритроцитов человека. Можно считать
доказанным, что кальмодулин является мишенью для свинца, как, впрочем
и для других тяжелых металлов [68].
При свинцовой интоксикации в результате многолетнего контакта со
свинцом развиваются изменения белой крови в виде абсолютного снижения
палочкоядерных нейтрофилов со сдвигом вправо и увеличения числа деге-
неративных форм нейтрофилов. При этом, судя по данным производствен-
ных наблюдений, уменьшается содержание ДНК и увеличивается содержа-
ние РНК в нейтрофилах [20]. Как правило, нарушения обмена нуклеиновых
кислот имеют место при наличии явных признаков анемии.
Обладая специфическим токсическим влиянием на кровь, свинец вместе
с тем относится к ядам с политропным характером действия, поражая,
помимо системы крови, нервную и периферическую нервную систему, со-
суды, печень, вмешиваясь в обменные процессы, в частности синтез белка,
вызывая гонадо- и эмбриотоксическое действие [52, 59].
ЛИТЕРАТУРА
1. Авилова Г.А., Карпухина Е.А. Бензол. — В кн.: Научный обзор советской литера-
туры по токсичности и опасности химических веществ/Под ред. Н.Ф.Изме-
рова. — М.: Центр международных проектов ГКНТ, 1985. — 43 с.
2. Алиева З.А. — В кн.: III съезд гигиенистов и санитарных врачей Азербайджана
(Тез. докл.) — Баку, 1975. — С. 203.
3. Артамонова В.А., Кашубин В.Г. и др. Вопросы ранней диагностики и терапии
интоксикаций метгемоглобинобразователями. — В кн.: Актуальные проблемы
ранней диагностики и профилактики профессиональных заболеваний химичес-
кой этиологии. — Л., 1973. — С. 53—57.
4. Артамонова В.Г., Шаталов Н.Н. Профессиональные болезни. — М.: Медицина,
1988. - 415 с.
5. Бандман А.Л. Ароматические углеводороды — производные бензола. — В кн.:
Вредные химические вещества. Углеводороды. Галогенпроизводные углеводоро-
дов: Справочник/Под ред. В.А.Филова. — Л.: Химия, 1990. — С. 111 — 140.
6. Барам М.Г. О нарушениях порфиринового обмена при сатурнизме. — В кн-:
Материалы I республ. науч. конф, профпатологов Таджикистана. — Душанбе,
1968.-С. 114-117.
7. Белявская Л. И. и др. О восстановлении транспортной функции гемоглобина в
случаях острых отравлений окисью углерода. — В кн.: Морфофункциональные
особенности адаптации организма. —Л.: Медицина, 1988. — С. 17—18.
8. Блюменфельд Л.А. Гемоглобин и обратимое присоединение кислорода. —
Советская наука, 1957. — 139 с.
9. Василенко Н.М. Ароматические амины. — В кн.: Вредные химические вещества-
294
10.
11.
лчлтсодержашие органические соединения: Справочник/Под ред. Б.А.Курлянд-
ского и В.А.Филова. - СПб.: Химия, 1992. - С. 88-242.
Василенко Н.М. Токсикология ароматических аминов и нитросоединений бен-
„„пьного ряда — продуктов анилинокрасочной промышленности: Дис. ... д-ра
мед. наук. — Харьков, 1979. — 488 с.
Василенко Н.М., Звездой В.И. Патологические превращения гемоглобина в усло-
виях острого и подострого отравления ароматическими нитро- и аминосоеди-
нениями. — В кн/. Материалы Республ. совещ. промышленных сан. врачей и
научн. сессии Харьк. НИИ ГТиПЗ: Сб. статей. — Киев: Здоров’я, 1968. —
С. 30—31.
17 Василенко Н.М., Семилеткина Н.Н. Хлорпроизводные бензола. — В кн.: Научные
обзоры советской литературы по токсичности и опасности химических веществ.
Программа ООН по окружающей среде МРПТХВ/Под ред Н.Ф.Измерова. — М.:
Центр международных проектов ГКНТ, 1988. — 32 с.
13 Василенко Н.М., Сонкин КС и др. К вопросу о бластомогенной опасности
толуидинов и ее профилактика. — В кн.: Профессиональный рак; Сб. научн.
тр. — Вып. 2. — М., МНИ И гигиены им. Эрисмана, Комитет по канцерогенным
веществам, 1981. — С. 85—88.
14. Василенко Н.М., Сонкин КС. и др. Клинико-гигиенические параллели в совре-
менном производстве толуидинов//Врач. дело. — 1979. — № 4. — С. 110—113.
15. Велдине Е.И., Пискунова В.В. Обмен железа при токсических анемиях. — В кн.:
Материалы по вопросам гигиены труда в клинике профзаболеваний. Вып. 7. —
Горький, 1957. — С. 8—12.
16. Гаврилов О.К, Файнштейн Ф.Э., Турбина А.С. Депрессия кроветворения. — М.:
Медицина, 1987. — 256 с.
17. Гадаскина И.Д. Нитро- и аминосоединения жирного и полиметиленового ряда. —
В кн.: Вредные вещества в промышленности. II. Органические вещества: Спра-
вочник для химиков, инженеров и врачей/Под ред. Н.В.Лазарева и Э.Н.Леви-
ной. - Л.: Химия, 1976. - С. 210-245.
18. Гаркави Л.Х., Квакина Е.Ю., Уколова М.А. Адаптационные системы организма. —
Ростов-на-Дону, 1977. — 120 с.
19. Горн А.Э. Цитохимическое исследование свойств и кинетика образования мет-
гемоглобина в отдельных эритроцитах: Автореф. дис. д-ра биол. наук. — Л.: Ин-т
Цитологии АН СССР, 1968. - 30 с.
20. Гродецкая Н.С. Свинец. — В кн.: Научные обзоры советской литературы по
токсичности и опасности химических веществ/Под ред. Н.Ф.Измерова. — М.:
Центр международных проектов ГКНТ, 1983. — 43 с.
21. Давыдова В.И. Мышьяк и его соединения. — В кн.: Вредные химические веще-
ства. Неорганические соединения элементов V—VIII групп: Справочник/Под
Ред. В.А.Филова. - Л.: Химия, 1989. - С. 82-102.
22. Даценко И И. Некоторые биохимические сдвиги в организме при хронической
интоксикации окисью углерода. — В кн.: Гигиена населенных мест: Республ.
межведомств, сборник. — Киев: Здоров’я, 1973. - Вып. 12. — С. 49—53.
Журавлев В.В., Карелина Э.М., Никитина Е.М. Реакция системы крови при
роническом воздействии малых доз окиси углерода в условиях замкнутого
°°ъема//Косм. биол. - 1980. - Т. 14, № 1. - С. 31-35.
nan d^°e Н'1 Караулов А.В. и др. Изменение системы крови при воздействии
радиации и бензола. — Новосибирск: Наука, 1990. — 239 с.
25 о
~*арова А. И., Манойлова И.К. О клинике хронического отравления тринитро-
толУолом//Гиг. труда. - 1971. - № 12. - С. 28-32.
295
26. Звездой В.И. Экспериментальное обоснование рациональных методов ранней
диагностики хронических отравлений ароматическими нитро-, аминосоедине
ниями и их использование при гигиеническом нормировании: Автореф. канл'
мед. наук. — Харьков, 1968. — 17 с. Д’
27. Идельсон Л.И. Нарушения порфиринового обмена в клинике. — Л.: Медицина
1968. - 183 с. на’
28. Идельсон Л.И., Дидковская Н.А., Ермильченко Г.В. Гемолитические анемии ~ м
Медицина, 1976. - 287 с.
29. Кармазь И.Ф. Вопросы теоретической и практической медицины. — М., 1979
С. 72-75.
30. Клиорин А.И., Тиунов Л.А. Функциональная неравнозначность эритроцитов. —
Л.: Наука, 1974. — 145 с.
31. Сердечно-сосудистая система при действии проф. факторов/Под ред. Н.М.Кон-
чаловской. — М.: Медицина, 1976. — 256 с.
32. Коржуев П.А. Гемоглобин. — М.: Наука, 1964. — 420 с.
33. Кротова Е.И., Кротова Е.И., Музыка В.И. Содержание дельта-аминолевулиновой
кислоты в эритроцитах, имеющих контакт с окисью углерода//Гиг. труда —
1974. - № 6. - С. 43-44.
34. Курляндский Б.А., Медведевский А.Г. О канцерогенном действии токсических
факторов малой интенсивности//Гиг. и сан. — 1972. — № 10. — С. 83—85.
35. Вредные химические вещества. Азотсодержащие органические соединения:
Справочник/Под ред. Б.А.Курляндского, В.А.Филова. — СПб.: Химия, 1992. —
431 с.
36. Кушаковский М.С. Методы качественного и количественного спектрофотомет-
рического анализа гемоглобина и его дериватов в эритроцитах и в плазме
крови. — Л.: Медицина, 1968. — 365 с.
37. Кушаковский М.С. Современные представления о процессах образования и вос-
становления метгемоглобина. — В кн.: Метгемоглобинемия различных этиоло-
гий и меры ее профилактики: Тезисы первой научн. конф, по метгемоглобине-
мии. - Л., 1971. - С. 31-33.
38. Лабори А. Регуляция обменных процессов. Теоретические экспериментальные,
фармакологические и терапевтические аспекты/Пер. с франц. — М.: Медицина,
1970. - 384 с.
39. Левина Э.Н. Органические окиси и перекиси. — В кн.: Вредные вещества в
промышленности. Органические вещества: Справочник/Под ред. Н.В.Лазарева,
Э.Н.Левиной. — Л.: Химия, 1976. — Т. 1. — С. 474—503.
40. Левина Э.Н. Хлорпроизводные циклопарафинов. — В кн.: Вредные вещества в
промышленности. Органические вещества: Справочник для химиков, инжене-
ров и врачей/Под ред. Н.В.Лазарева, Э.Н.Левиной. — Л.: Химия, 1976.—
С. 249-258.
41. Ленинджер А. Биохимия. Молекулярные основы и функции клетки/Под РеА
А.А.Баева, Я.М.Варшавского. — М.: Мир, 1974. — 975 с.
42. Лужников Е.А., Шиманко И. И. Острые отравления метгемоглобинобразуюшими
ядами. — В кн.: Вопросы травматологии, токсикологии, скоропостижной смерти
и деонтологии в экспертной практике: Сб. трудов. — М.: Медицина, 1966."
№ 3. - С. 104-107.
43. Маторова Н.И. и др. Эмбриотоксическое и тератогенное действия нафталина и
хлорнафталина. — В кн.: Проблемы гигиены труда и профпатологии и охран
внешней среды: Сб. научн. тр. Вып. XII. — М., 1981. — С. 62—64.
296
44.
45.
46.
47.
48.
Минкина Н.А. Оксиды углерода. — В кн.: Вредные химические вещества. Неор-
ганические соединения элементов I—IV групп: Справочник/Под ред. В.А.Фи-
дова. - Л.: Химия, 1988. - С. 303—331.
Михлин ДМ. Биохимия клеточного дыхания. — М.: АН СССР, 1960. — 320 с.
Монаенкова А.М. Актуальные вопросы современной клиники хронических про-
фессиональных интоксикаций. — В кн.: Профилактическая токсикология: Сб.
Хебно-метод. материалов/Под ред. Н.Ф.Измерова. — Центр международных
проектов. - Т. II, часть II. - М., 1984. - С. 222-233.
Ооуджов Р.А. — В кн.: III съезд гигиенистов и санитарных врачей Азербайджана
(Тез. докл.). — Баку, 1975. — С. 248—249.
Рашевская А.М., Зорина Л.А. Профессиональные заболевания системы крови
химической этиологии. — М.: Медицина, 1968. — 360 с.
49 Решетюк А.Л. и др. К токсикологии нафталинов. — В кн.: Вопросы гигиены
труда и профессиональной патологии в химической и машиностроительной
промышленности (Тез. докл.). — Харьков, 1966. — С. 45—46.
50. Рибаров С. и др. Гемолитическое действие свинца в опытах in УПго//Фармакол.
и токсикол. — 1980. — Т. 43. — № Б. — С. 20—22.
51. Румянцева Е.П. Материалы к изучению изменений крови при воздействии
экстралина на организм: Автореф. канд. мед. наук. — М., 1964. — 11 с.
52. Русин В.Я. Свинец и его соединения. — В кн.: Вредные химические вещества.
Неорганические соединения элементов I—IV групп: Справочник/Под ред.
В.А.Филова. — Л.: Химия, 1988. — С. 415—436.
53. Русин В.Я. Хлор и его соединения. — В кн.: Вредные химические вещества.
Неорганические соединения элементов V—VIII групп: Справочник/Под ред.
В.А.Филова. — Л.: Химия, 1989.— С. 369—386.
54. Русин В.Я., Филов В.А. Производные гидразина. — В кн.: Вредные вещества в
промышленности. Азотсодержащие органические соединения: Справочник/Под
ред. Б.А.Курляндского, В.А.Филова. — СПб.: Химия, 1992. — С. 247—249.
55. Рябов СИ., Шостка Г.Д. Молекулярно-генетические аспекты эритропоэза. — Л.:
Медицина, 1973. — 280 с.
56. Савина В.П., Соколов Н.П., Никитин Е.И. Зависимость содержания карбоксиге-
моглобина в крови и окиси углерода в выдыхаемом воздухе испытателей от
концентрации окиси углерода в воздухе гермокамеры//Косм. биол. — 1976. —
№ 6. - С. 62-65.
57. Семенчева Э.М. Усиленный синтез гемоглобина Аг и фетального у рабочих,
находящихся в длительном контакте со свинцом//Врач. дело. — 1971. — № 1. —
С. 130-132.
58- Соколов В. В., Грибова И.А. Адаптационные и компенсаторные реакции системы
крови при действии токсических факторов. — В кн.: Проблемы токсикологии.
Итоги науки и техники. — М., 1973. - Т. 5. - С. 103—110.
59. Соркина НС, Евлашко Ю.П. Профессиональные заболевания химической этио-
логии с преимущественным поражением системы крови. — В кн.: Профессио-
нальные заболевания: Руководство для врачей/Под ред. Н.Ф.Измерова. — М.:
Медицина, 1986. — Т. 1. — С. 94—136.
Метгемоглобинемия различных этиологий и меры ее профилактики. — В кн.:
nf/riCbI доклаД°в первой научн. конф, по метгемоглобинемии 21—22 сентяб-
ря/нод ред ф.н.Субботина. - Л.: М3 РСФСР, ЛСТМН, 1971. - 47 с.
^.Терин ЯЛ- вопросу о соотношении порфиринов, дериватов гемоглобина,
емоглобинового железа и пигментов плазмы при воздействии окиси углерода
к.
297
в остром эксперименте. — В кн.: Научн. труды Кубанского мед. ин-та. — Крас,
нодар, 1975. — Вып. 46. — С. 79—81.
62. Тетерин В.А., Эйтигон А.И. Влияние окиси углерода на порфириновый обмен при
остром и хроническом воздействии//Гиг. труда. — 1977. — № 12. — С. 33—36.
63. Тиунов Л.А. Биохимические механизмы токсичности (общие механизмы токси-
ческого действия). — М.: Медицина, 1986. — С. 114—205.
64. Тиунов Л.А. Механизмы гемолиза. — В кн.: Основы общей промышленной ток-
сикологии: Руководство/Под ред. Н.А.Толоконцева, В.А.Филова. — Л.: Медици-
на, 1976. - С. 192-195.
65. Тиунов Л.А., Кустов В.В. Токсикология окиси углерода. — Л.: Медицина, 1980.
66. Тихачек Е.С. и др. Механизмы повреждения и адаптации функциональных
систем организма. — Свердловск, 1978. — С. 25—30.
67. Толоконцев Н.А., Филов В.А. Основы общей промышленной токсикологии: Ру.
ководство. — М: Медицина, 1976. — 303 с.
68. Трахтенберг И.М., Колесников В. С., Луковенко В.П. Тяжелые металлы во внешней
среде. — Минск: Наука i тэхшка, 1994. — 288 с.
69. Фам-Куанг-Чи. О токсичности фенилгидразина при ингаляционном воздейст-
вии//Гиг. труда, 1979. — № 3. — С. 45—47.
70. Филов В.А., Левина Э.Н., Дикун П.П. Ароматические углеводороды с конденси-
рованными кольцами. — В кн.: Вредные химические вещества. Галогенопрои-
зводные углеводороды: Справочник/Под ред В.А.Филова. — Л.: Химия, 1990. —
С. 219.
71. Фомина Л.И., Алданазаров А.Т. Изменения уровня предшественников порфири-
нов при хронической свинцовой интоксикации//Вопр. гиг. труда и проф. забол. —
Алма-Ата. — 1972. — С. 30—32.
72. Фраш В.Н. Механизмы действия бензола на систему крови (экспер. исслед.):
Автореф. д-ра мед. наук. — М., 1980. — 43 с.
73. Фраш В.Н., Караулов А.В. О лимфопоэзе и гетерогенности популяции лимфоци-
тов при бензольной интоксикации//Гиг. труда. — 1976. — № 9. — С. 30—33.
74. Чарный А.М. Патофизиология аноксических состояний. — М.: Наука, 1961.—
270 с.
75. Шафиров Ю.Б. Алифатические ди- и полиамины. — В кн.: Вредные химические
вещества. Азотсодержащие соединения: Справочник/Под ред. Б.А.Курляндского
и В.А.Филова. — СПб.: Химия, 1992. — С. 56—58.
76. Эйтингон А. И. Нитраты//Программа ООН по окружающей среде. Научные
обзоры советской литературы по токсичности и опасности химических ве-
ществ/Под ред. Н.Ф.Измерова. — М.: Центр международных проектов ГКНТ,
1983. -47 с.
77. Эйтингон А.И. Нитриты//Программа ООН по окружающей среде. Научные
обзоры советской литературы по токсичности и опасности химических ве-
ществ/Под ред. Н.Ф.Измерова. — М.: Центр международных проектов ГКНТ-
1983. - 35 с.
78. Эйтингон А.И. Окислы азота//Программа ООН по окружающей среде. Научные
обзоры советской литературы по токсичности и опасности химических ве-
ществ/Под ред. Н.Ф.Измерова. — М.: Центр международных проектов ГК.НТ,
1989. - 79 с.
79. Allen D.W., Jandl Н. Oxidative hemolysis and precipiation of hemoglobin. И Role of
thiols oxidant drug action//! Clin. Invest. — 1961. — Vol. 40, N 3. — P. 454—475.
298
пппк K.D et al Cronlsche interstitialle nephritis bei langjahrigen Gebrauch phenacetihal-
8°- tjgef Asth-napulvers//Dtsch. med. Wehr. - 1973. - Vol. 98, N 47. - P. 2234-2238.
81 Dean E.G. Mutation Res. — 1985. — Vol. 154, N 3. — P. 16—25.
Fnivre M. et al. Methemoglobine toxique pour des derives de 1’aniline; paraphloroanil-
8 jne et paratoluidine (Deux cas)//Arch. Mai. Prof. — 1971. — Vol. 32, N 9. — P.
575-577.
од Frendo G R. Sulfeemoglobinemia//Folia medica oracoviesia. — 1972. — Vol. 14, N 1. —
P. 58-95.
84 Goldstein B.D. Benzene Toxiolty. F. Criterial Evaluation N.Y.eto., 1977. — P. 69—105.
85 Graisely B., Debray J. et al. Aneinie haemolytique’aique aveo methemoglobinemic due
a la phenaoetine. A propos d’une nouvel le observation//Sem. pep. Paris. — 1973. —
Vol. 49, N 24. - P. 758-1853.
86 Haan G et al. Reduction von nitrosobensol zu anilin in roten Blutzellen//Arch. exp.
' Path. Pharmak. - 1959. - Vol. 253, N 4. - P. 365-371.
87. Henderson V.E., Haggard A. H. Вредные газы в промышленности. Русский перевод
Гендерсон и Хагтард. — М,—Л/. Гострудиздат, 1930. — 52 с.
88. dope Е.М. The disappiarence of sulfhaemoglobin from the blood of TNT workers in
relation to the dyhantios of red oell destruction//Brit. J. Industr. Med. — 1964. —
N 3. - P. 136-142.
89 Nordenfelt O. Deaths from renal failure in abuses of phenacetincontain ing//Acta med.
soad. - 1972. - Vol. 191, N 1-2. - P. 11-16.
90. Pacseri J., Magos L. Detenriination of the measure of exposure nitro and amino
compounds//!. Hyg. Epid., Praha. — 1958. — Vol. 2, N 1. — P. 92—110.
91. Paiek J. Methemoglobinemic, hemolyza a tvorba heinzovych telisok v oervenych
cirvinkach//Lek. Ved. Zahn. — 1964. — N 1. — P. 1 — 10.
92. Paoholuk B. Toksyhologicza ooena niektoryoh oddzialow Z.P.B. “Boruta” w oparciu
о wybrane badania labolatoryjne//Bromatol. i Chem. Toxyhol. — 1972. — Vol. 5,
N 4. - P. 449-455.
93. Pfordte K. Uber die akute Toxisitat und hamiglobinbilden Eigenschaften einiger Indus-
trienoxen: Nitrobenzol und seine Reduktionsprodukte//Z. gesainte Hyg. — 1973. — Bd
19. - N l.-S. 35-39.
94. Popovic K. et al. Sideroblastio anemia in choronio misuse//Clin. Toxicol. — 1973. —
Vol. 6, N 4. - P. 585-598.
95. Prins H.K. et al. Congenital nonspherooytic hemolytio anemia, associated with glu-
tathione deficiency of the erythrocytes//Blood. — 1966. — Vol. 27. — P. 145—166.
96. Smith R.p. Chemically induced methaemoglobinemias in the mouse-63//Biochem
Pharmacol. - 1967. - Vol. 16. - P. 317-328.
97- Snyder G.A. et al. Airier//!. !nd. Med. - 1984. - Vol. 5, N 6. - P. 429-434.
98- Sonnenfeld Y„ Hudgens R. 1И//Cancer Res. - 1983. - Vol. 43, N 10. - P. 4720-4722.
^9. Suteanu St. et al. Asupra nefritei interstitiale toxice prin oonsum de fenacetina//Med.
interna. - 1973. - Vol. 25. - P. 1411-1434.
| Qq t-»
arsz Fh. et al. Sulfhemog-lobine et deficit in glutathion peroxydase//Nouv. Pres,
medic. - 1974. - Vol. 5, N 23. - P. 1487-1490.
102 ]V°lman SR Benzene Toxioity//A Critical Evaluation. N.Y., 1977. - P. 63-68.
et Chemical oyanosis anemia rvndrome//Aroh. Environ. Health. —
‘964. - Vol. 9, N 4. - P. 478-491.
299
Глава 8
ВЕЩЕСТВА НАРКОТИЧЕСКОГО ДЕЙСТВИЯ
8.1. Общие представления о наркотических веществах
Комплекс медицинских проблем, связанных с употреблением человеком
наркотических веществ, имеет отчетливый междисциплинарный характер и
вследствие этого не стал пока традиционным предметом токсикологических
исследований. Это обстоятельство обусловливает необходимость рассмотре-
ния некоторых ключевых терминов наркологии — “отрасли медицинской
науки, изучающей клинические проявления, этиологию и патогенез алко-
голизма, наркомании и токсикомании, а также медицинские, психологичес-
кие, социальные и правовые аспекты этих проблем и разрабатывающей
методы их предупреждения и лечения” [2].
Веществами наркотического действия (наркотические вещества, наркоти-
ческие средства) называют обширную группу веществ различной химической
структуры, удовлетворяющих следующим медицинским, социальным и юриди-
ческим критериям:
• вещество или лекарственное средство должно оказывать специфичес-
кое (стимулирующее, седативное, галлюциногенное и др.) действие
на ЦНС, что служит причиной его немедицинского потребления;
• потребление вещества имеет большие масштабы, вследствие чего при-
обретает большую социальную значимость;
• вещество в установленном законом порядке признано наркотическим
и включено в список наркотических веществ.
Способность вещества вызывать синдром зависимости называют нарко-
генным (токсикологическим, аддитивным) потенциалом. Наркогенный по-
тенциал — это качественная и количественная характеристика наркотичес-
кого вещества и, с точки зрения фармакологии, является нежелательным
свойством.
В последние годы в литературе, посвященной различным аспектам зло-
употребления наркотическими веществами, все чаще встречается термин
"психоактивное вещество" [4].
Психоактивное вещество (ПАВ) — химическое вещество, способное вызы-
вать при однократном приеме эйфорию либо другие желательные с точки
зрения потребителя психотропные эффекты, а при систематическом прие-
ме — психическую и физическую зависимость. Введение определенных средств
в организм приводит к появлению в ограниченном временном интервале
эйфории, стимуляции восприятия, идеаторного и моторного возбуждения,
седации, сна, галлюцинаций. ПАВ вызывают у индивидуума эмоционально-
позитивное состояние и нейтрализуют эмоционально-негативное. Этот тер-
мин был предложен относительно недавно в связи с тем, что после Кон-
венции о психотропных средствах (1971) существующий ранее термин “пси-
хотропные средства” приобрел тройной смысл: традиционный клиническии,
фармакологический (лекарственные средства, специфически действуют11
на ЦНС) и социально-юридический (в список психотропных веществ, с0'
ио Конвенции, включаются только те вещества, которые за счет специ-
ГЛа<еского действия на ЦНС вызывают патологическое привыкание и пред-
ФиЧляЮт опасность для здоровья человека и социальную проблему). Следует
став и то обстоятельство, что большая группа веществ, обнаруживающих
УЧе<хоактивные свойства, не входит в соответствующие списки Конвенции,
ПС акже в аналогичные международные и национальные документы. Отече-
3 Тенная классификация ПАВ учитывает эти обстоятельства и разделяет их
^находящиеся или не находящиеся под международным контролем [2, 3].
К первой группе относят наркотические и психотропные вещества, ко
торой — вещества, не отнесенные к наркотическим и психотропным. В обеих
группах выделяют лекарственные средства и вещества, не отнесенные к ним.
В первую группу также входят вещества, запрещенные для применения на
человеке.
Отличительным свойством ПАВ является их способность вызывать ток-
сикомании — группу заболеваний, характеризующихся стойким влечением к
регулярному употреблению ПАВ с целью получить удовольствие или под-
держать состояние психологического или физического комфорта. Общность
всех токсикоманий определяется наличием в их клинической картине трех
“больших наркоманических синдромов”: психической и физической зави-
симости и измененной реактивности организма к употребляемому веществу.
Наркоманиями традиционно называют токсикомании к веществам, отне-
сенным к списку наркотических. Разграничение этих понятий сугубо услов-
ное и определено правовым регулированием производства, хранения, рас-
пространения и употребления наркотиков и соответственно административ-
ной или уголовной ответственностью индивидуума за нарушение регламен-
тированных законом требований. Сохраняют свое значение и наименования
частных форм токсикомании (алкоголизм, никотинизм, гашишизм, кокаи-
низм и др.). В зарубежной литературе для описания патологических сдвигов
при контакте индивидуума с ПАВ наибольшее распространение получил
термин “лекарственная зависимость” (Drug abuse). Следует учесть, что в
английском языке слово “Drug” семантически трактуется шире чем “лекар-
ство”, поэтому сегодня широкое распространение получает термин “хими-
ческая зависимость”.
Токсикоманическая (наркотическая, наркоманическая) интоксикация (ток-
сикоманический эксцесс, опьянение) — состояние, развившееся после упот-
ребления ПАВ, имевшего своей целью удовольствие или поддержание со-
стояния психофизического комфорта. Термин предложен для разграничения
данного состояния с острой интоксикацией, под которой традиционно под-
разумевают отравление с острыми проявлениями, повлекшими за собой
более или менее продолжительное расстройство здоровья или смерть. Ток-
сикоманическая интоксикация в частных случаях может протекать незамет-
но для окружающих и стабилизировать или улучшать состояние индивидуу-
ма- Очевидно, что токсикоманическая интоксикация генетически связана с
острым отравлением. Во-первых, эффекты многих ПАВ проявляются ост-
рым нарушением сознания с оглушением, галлюцинозом или неадекватным
сведением, а также реакциями со стороны сердечно-сосудистой и дыха-
ПацН0^ систем- Во-вторых, сознательное или случайное увеличение дозы
С1/° вызывает передозировку, которая имеет все признаки острой инток-
нкации данным веществом.
ч Регулярное (систематическое) употребление ПАВ часто называют хрони-
ской интоксикацией или наркотизацией (при употреблении алкоголя —
°голизацией). Иногда в данном контексте используют и термин “зло-
301
употребление”. Однако в настоящее время под злоупотреблением понимают
и регулярное употребление ПАВ индивидуумом без очевидных признаков
зависимости. Так, в Международной классификации болезней (DSM-IV)
диагностические критерии зависимости и злоупотребления рассматривают
отдельно. Для последнего характерны следующие признаки: продолжаю-
щийся прием, несмотря на понимание того, что употребление ведет к
социальным, деловым, психологическим или соматическим проблемам; по-
вторяющийся прием в ситуациях, когда употребление веществ связано с
непосредственной опасностью (например, вождение автомобиля в состоя-
нии опьянения). Злоупотребление определяют следующие два критерия:
некоторые проявления сохраняются не менее одного месяца либо отмеча-
ются повторно в течение более длительного периода времени; никогда не
диагностировалась зависимость от ПАВ. В отечественной литературе этот
феномен также обозначают как наркотизм, привычный наркотизм, привы-
чная наркотизация (привычная алкоголизация, бытовое пьянство).
Психическая зависимость — состояние психического комфорта в токси-
команической (наркотической) интоксикации и болезненное влечение к упот-
реблению ПАВ с целью вновь ощутить желаемый гедонический эффект или
подавить состояние психического дискомфорта. Влечение может осозно-
ваться или не осозноваться, иметь обсессивный или компульсивный ха-
рактер, сопровождаться или не сопровождаться борьбой мотивов, а также
проявляться не менее остро и интенсивно, чем жажда или голод.
Физическая зависимость — состояние физического комфорта в токсико-
манической интоксикации и явления абстиненции (абстинентный синдром,
синдром отмены) при внезапном прекращении употребления вещества. Регу-
лярное употребление ПАВ приводит к перестройке регуляторных систем
организма, реализованной на всех биологических уровнях, а само вещество
включается в естественные метаболические циклы. В результате формиру-
ется новый гомеостаз, в котором психоактивному веществу отведена роль
регулятора. Внезапное прекращение употребления данного вещества сопро-
вождается гомеостатическим сдвигом, который и определяет патогенетичес-
кую сущность абстиненции как системной реакции организма. Абстинент-
ный синдром — комплекс психопатологических, вегетативных, неврологи-
ческих и соматических расстройств, возникающих вслед за прекращением
регулярного употребления ПАВ, причем постоянными симптомами являют-
ся психический и физический дискомфорт, а также выраженное влечение
к принимаемому веществу.
Синдром измененной реактивности организма заключается в модификации
центральных эффектов ПАВ и развитии к нему толерантности. Модифика-
ция проявляется изменением действия ПАВ на психику индивидуума ти-
пичного течения токсикоманической интоксикации. Например, при сфор*
мированной зависимости барбитураты обнаруживают активизирующие эф-
фекты вместо седации. Толерантность — способность переносить возрастаю-
щие дозы употребляемого вещества и одновременно потребность в посте-
пенном увеличении дозы для достижения желаемого эффекта. Толерант-
ность проявляется исчезновением защитных реакций организма, например
рвоты при интоксикации алкоголем или опиатами.
Общепринятой классификации ПАВ не существует. Обычно ориентиру*
ются на клинические классификации токсикоманий. Так, согласно МежДУ;
народной классификации болезней (1994) [5], частные формы токсикомании
подразделяют в зависимости от вида ПАВ (наркотического).
302
4
Fl 0 Психические и поведенческие расстройства в результате употреб-
ления алкоголя
F11 Психические и поведенческие расстройства в результате употреб-
ления опиоидов
F12 Психические и поведенческие расстройства в результате употреб-
ления каннабиноидов
F13 Психические и поведенческие расстройства в результате употреб-
ления седативных или снотворных веществ
F14 Психические и поведенческие расстройства в результате употреб-
ления кокаина
F15 Психические и поведенческие расстройства в результате употреб-
ления других стимуляторов, включая кофеин
F16 Психические и поведенческие расстройства в результате употреб-
ления галлюциногенов
F17 Психические и поведенческие расстройства в результате употреб-
ления табака
F18 Психические и поведенческие расстройства в результате употреб-
ления летучих растворителей
F19 Психические и поведенческие расстройства в результате употреб-
ления наркотиков и использования других психоактивных веществ
8.2. Общие проявления клинического течения
токсикоманических интоксикаций
“Большие наркоманические синдромы” ни в биологическом, ни в кли-
ническом отношении нельзя признать автономными. Так, наибольшая ин-
тенсивность влечения к ПАВ определяется на “пике” абстиненции; моди-
фикация действия вещества во многом обусловливает психический и физи-
ческий комфорт в токсикоманической интоксикации; влечение к веществу
может не исчезать при токсикоманической интоксикации и на фоне высо-
кой толерантности проявляться потерей количественного контроля за дозой;
компульсивное влечение может возникать в состоянии психофизического
комфорта спустя длительное время после прекращения наркотизации и т.д.
Все токсикомании являются прогредиентными заболеваниями с исходом
в наркоманический дефект. Хроническая интоксикация ПАВ вне зависи-
мости от их фармакологических свойств сопровождается постепенным раз-
витием психоорганического синдрома со стойкими астеническими, аффек-
тивными, интеллектуальными, мнестическими и другими нарушениями.
В свою очередь ПАВ определяют темп прогредиентности, наличие и выражен-
ность различных симптомов. Индивидуальные особенности потребителя ока-
зывают значительное влияние на прогредиентность. Токсикомании у лиц с
психическими расстройствами, в том числе резидуальными, легко форми-
руются, приводят к быстрому нарастанию тяжести симптомов дефицитар-
°го (негативного) круга, а также вызывают патоморфоз имеющейся пато-
°гии. Аналогичные закономерности прослеживаются и при клинической
Ценке токсикоманической интоксикации, проявлений психической и физи-
бь?К0Й зависимости- Например, при злоупотреблении алкоголем опьянение
вает типичным и атипичным (осложненным); психическая и физическая
исимость формируется в период от 1 года до 10 лет и более или не
Мирмируется вообще; абстиненция протекает с дисфорическими, депрессивны-
> тРевожно-фобическими или острыми психотическими расстройствами.
I 303
Абстинентный синдром при различных формах токсикомании имеет как
общие неспецифические, так и специфические проявления. К неспецифц.
ческим можно отнести резкое усиление тяги к употребляемому веществу
быстро нарастающую астенизацию, тревогу, депрессивный аффект, вегета-
тивные нарушения (потливость, тахикардия, тошнота, гиперсаливация, тре-
мор и др.). Характер специфических расстройств определяется фармаколо-
гическими особенностями употребляемого вещества. Так, при опиатной
абстиненции отмечают костно-мышечные боли, акатизию, диарею; при бар-
битуровой абстиненции — эпилептиформные припадки и т.д.
Регулярное употребление ПАВ может маскировать резидуальную психи-
ческую и соматическую патологию и даже повышать адаптационные спо-
собности индивида. Однако на фоне внезапной отмены употребляемого
вещества сопутствующие токсикомании заболевания претерпевают бурную
декомпенсацию. Поэтому клиника абстиненции определяется не только
типичными (облигатными) симптомами, но и симптомами сопутствующих
заболеваний, которые могут иметь различный генез, но их появление на-
прямую связано с отменой ПАВ. В структуре синдрома они играют факуль-
тативную роль, так как встречаются только у отдельных больных. Сомати-
ческие нарушения инфекционного или токсического генеза, суммируясь с
абстинентными явлениями, способствуют ухудшению общего состояния
больных. В тяжелых случаях (сепсис, обширные флегмоны, пневмония,
кровотечения, токсические реакции, сердечно-сосудистая недостаточность
и др.) абстинентный синдром протекает атипично, с затяжными сопороз-
ными и коматозными состояниями, нарушениями гемодинамики и дыхания,
нефро-, гепато- и коагулопатиями. Клинические проявления абстиненции
зависят также от суточной дозы ПАВ и периода непрерывной наркотизации
(алкоголизации).
Внезапная отмена ПАВ сопровождается декомпенсацией, обнажением
или манифестированием психических нарушений различных регистров. Эти
расстройства начинают доминировать в клинической картине постабсти-
нентного периода, структура которого включает энцефалопатические, асте-
нические, психопатоподобные и депрессивные проявления различной сте-
пени выраженности. У больных с неотягощенным преморбидом токсикома-
нии постабстинентные расстройства в большинстве случаев имеют трак-
зиторный характер и редуцируются одновременно с остаточными проявле-
ниями абстиненции. Психические нарушения, связанные с сопутствующей
психической патологией или последствием длительной наркотизации (алко-
голизации), не исчезают одновременно с редукцией остаточных проявлений
абстинентного синдрома, а приобретают динамику, соответствующую част-
ной нозологической принадлежности.
Таким образом, в частных случаях клиническая картина токсикомании
может быть представлена широкой палитрой психических и соматических
расстройств.
Ремиссия при токсикомании представляется как результат взаимодейст-
вия различных факторов. Факторами-предикторами являются биологичес-
кие механизмы, обеспечивающие адаптационные резервы организма при
отмене наркотика; факторами-индукторами — механизмы психологической
защиты от возврата к наркотизации (алкоголизации). Факторы-предикторы
формируют биологическую почву для реализации целей пациента, лежащих
вне плоскости токсикомании, которые не могут быть реализованы при
условии регулярного злоупотребления. В свою очередь установка на реали'
зацию целевой программы может быть пусковым фактором формирования
304
пемиссии. Факторы-индукторы вызывают деструкцию аддитивного поведе-
ния и способствуют формированию нового поведения, направленного на
достижение поставленных целей. В частных случаях наркомании представ-
денность и взаимодействие этих факторов имеют индивидуальные различия,
но длительная и качественная ремиссия всегда была результатом их опти-
мального сочетания.
В отечественной наркологии динамика токсикомании представляется
как трехстадийный процесс. Выделение стадий в какой-то мере искусствен-
но и условно, не лишено противоречий, но удобно для практики. Стадии
токсикомании отражают не только динамику больших наркоманических
синдромов, но и выраженность психических нарушений, связанных с упот-
реблением ПАВ.
I стадия характеризуется развитием психической зависимости и нарас-
танием толерантности при минимальной выраженности физической зави-
симости. Психическая зависимость проявляется обсессивным влечением к
употребляемому веществу. Формируется ритм наркотизации (алкоголиза-
ции). В клинической картине преобладают астенические расстройства с
заострением личностных черт, эмоциональной лабильностью, раздражитель-
ностью, нарушениями сна, повышенной отвлекаемостью, рассеянностью и
плохим запоминанием. Эти явления купируются повторным употреблением
ПАВ. Другими словами, у больного наряду с гедоническими эффектами
появляется психофизический комфорт в токсикоманической интоксикации.
При II стадии “большие наркоманические синдромы” достигают в своем
развитии максимальной выраженности. Влечение к употребляемому веще-
ству компульсивное. Абстинентный синдром тяжелый. Толерантность вы-
сокая. Ритм употребления ПАВ окончательно сформирован, токсикомани-
ческие эксцессы учащаются. Меняется форма токсикоманической интокси-
кации: эйфория и другие эффекты, связанные с переживанием удовольст-
вия, существенно ослабевают. Достижение психофизического комфорта ста-
новится самоцелью наркотизации (алкоголизации). Астения прогрессирует.
Появляются выраженные аффективные расстройства и отчетливые личност-
ные изменения. Манифестирует соматическая патология, обусловленная
злоупотреблением ПАВ.
III стадия характеризуется ослаблением толерантности, глубокими необ-
ратимыми психическими и соматическими расстройствами. Интеллектуаль-
ные и мнестические расстройства четко выражены. Больные резко астени-
зированы и эмоционально лабильны вплоть до недержания аффекта. Упот-
ребление ПАВ не обеспечивает психофизического комфорта.
8.3. Биологические механизмы (патогенез)
химической зависимости
Согласно теории функциональных систем П.К.Анохина (1975), инициа-
ция и закрепление новых форм поведения, равно как и деструкция поведе-
ния, потерявшего адаптационную ценность, реализуются через механизм
подкрепления. Подкрепляющие агенты, выступая в качестве генераторов
эмоционального состояния положительной модальности, закрепляют ту или
иную поведенческую реакцию, которая с высокой вероятностью будет иметь
место при повторном предъявлении стимула.
Механизмы подкрепления служат физиологической основой формиро-
вания зависимости. Для макроорганизма ПАВ — это один из бесконечного
множества стимулов окружающей среды. Контакт с веществом вызывает
305
эмоционально положительные реакции, а при повторном введении — био-
логически обусловленную сенситизацию к данному веществу. Сенситизация
при повторном введении ПАВ проявляется не только специфическим отве-
том, но и не связанным с введением вещества повышением активности
животного в обстановке, где проводился эксперимент, что говорит о почти
одномоментном включении новых мотивационных компонентов в поведе-
ние, которые в конечном счете формируют аддитивное поведение, т.е.
направленный поиск и самовведение ПАВ. Последнее постепенно стано-
вится “суррогатом” естественного подкрепления. Хроническое введение
ПАВ приводит к развитию толерантности, выражающейся в ослаблении
специфических центральных эффектов. Формируется “вторичный дефицит”
подкрепления, который преодолевается увеличением дозы и усиливает мо-
тивацию. Одновременно формируется синдром отмены — основное прояв-
ление “физической зависимости”. Синдром отмены заключает в себе авер-
сивные черты, которые также стимулируют самовведение наркотика и ад-
диктивное поведение. Физическая зависимость — это новый гомеостаз орга-
низма, сформировавшийся на фоне хронического введения ПАВ.
Длительные и сложные нейробиологические исследования показали, что
основным нейроанатомическим субстратом механизма подкрепления служит
вентро-тегментальная область (Ventro-tegmentic area — VTA) и n.accumbens
(NAc). В современных исследованиях убедительно доказано, что система
VTA/NAc и проводящие пути между мезолимбическими и переднемозговы-
ми областями опосредуют мотивационные компоненты поведения, участву-
ют в формировании ответа организма на стресс и обеспечивают реализацию
эффектов не только опиатов, кокаина и амфетамина, но и других ПАВ, в
частности этанола, никотина и каннабинолов.
Однократное введение ПАВ вызывает увеличение, а хроническое —
уменьшение внеклеточного дофамина. Возможно, что этот эффект является
рефлекторным адаптивным ответом на длительное стимулирующее воздей-
ствие на высвобождение дофамина. После отмены опиатов, кокаина и
алкоголя отмечается сначала увеличение, а затем падение содержания до-
фамина, что свидетельствует о наличии общих механизмов в формировании
зависимости от ПАВ. Эти данные подтверждают, что длительное угнетение
дофаминергических процессов в мезолимбической области может играть
роль в мотивационных механизмах самовведения ПАВ, с помощью которых
достигается увеличение внеклеточного дофамина.
Психотропные эффекты ПАВ реализуются в результате влияния на до-
фаминергическую систему и участия других медиаторных систем. Известно,
что гомеостаз обеспечивается механизмами межмедиаторных взаимодейст-
вий. В норме изменение параметров функционирования одной системы
сопровождается немедленным компенсаторным ответом со стороны других
систем. Этот механизм позволяет организму не только оптимально реагиро-
вать на раздражитель, но и возвращаться к исходному уровню функциони-
рования. Межмедиаторные взаимоотношения, как известно, осуществляют-
ся через ионные каналы, вторичные мессенджеры, G-протеины (АТФ/ГДФ-
связующие белки), а также с помощью других участников нейромедиации.
При этом серотонинергическая и ГАМКергическая системы наделены спе-
циализированными функциями регуляции межмедиаторного баланса. Во-
влечение межмедиаторных взаимоотношений в патогенез зависимости под-
тверждается и тем обстоятельством, что ПАВ, будучи лигандами различных
медиаторных систем, вызывают сходные нейрофизиологические феномены.
Толерантность является результатом вмешательства ПАВ непосредствен-
306
но в механизмы передачи сигнала, а не только десенситизации тех или иных
ецепторов. Речь идет об обратном влиянии изменений в системе цАМФ
jia активацию G-протеинов и проницаемость ионных каналов, а также об
изменении активности протеинкиназ. При этом происходит изменение чув-
ствительности всех рецепторов, сопряженных с G-протеином. Феномен
тоЛерантности опосредован и изменениями в системе кальция, что под-
тверждается данными о повышении аналитических эффектов морфина и
снижении толерантности на фоне введения зависимым животным антаго-
нистов кальция. Интересно, что агонисты серотонина обнаруживают такие
хе свойства. Хроническое введение ПАВ приводит к опосредованному сис-
темой цАМФ нарушению механизмов транскрипции и трансдукции генов,
ответственных за синтез медиаторов и прежде всего катехоламинов. О важ-
ной роли генетических факторов в формировании зависимости свидетель-
ствуют данные о существовании различной чувствительности к морфину у
искусственно выведенных мышей.
В основе абстинентного синдрома лежат межмедиаторные нарушения.
Целостная клиническая картина абстиненции при различных формах зави-
симости существенно отличается по тяжести, продолжительности и частным
проявлениям, но для всех случаев характерна своеобразная “мозаичность”
последних, свидетельствующая об одновременном возбуждении или, точнее,
о нарушении баланса медиаторных систем. Популярностью пользовалась
гипотеза, объясняющая развитие абстиненции избыточным выделением аце-
тилхолина в синапсах мозга в результате инверсии физиологического кон-
троля катехоламинов над холинергической системой и ослаблением тормоз-
ного влияния ГАМК. На фоне синдрома отмены наблюдался также прирост
серотонина мозга. При этом современные исследователи говорят о специ-
фическом вовлечении системы серотонина в патогенез абстиненции, считая,
что она опосредует ряд психических и соматических симптомов. Активация
серотонинергических рецепторов вызывает усиление болевой перцепции,
тошноту, рвоту, тревогу и психотические нарушения, которые в качестве
автономных симптомов входят в структуру синдрома отмены и имеют авер-
сивные свойства. Отмена ПАВ у зависимых животных вызывает в средне-
мозговых структурах сначала прирост, а затем падение дофамина. Значи-
тельная роль отводится и усилению транспорта кальция через ионные ка-
налы при абстиненции. Вместе с тем нейроанатомические исследования
показали относительность этих данных. В опытах по локальному измерению
нейромедиаторов в структурах мозга и повреждению проводящих путей было
установлено, что, во-первых, содержание тех или иных медиаторов в раз-
личных областях мозга существенно различается и, во-вторых, зависит от
нейрональной деятельности других областей. Недавние исследования под-
твердили, что при абстинентном синдроме отмечались нейробиологически
обусловленная диссоциация между соматическими и психическими наруше-
ниями, а также то, что ряд симптомов абстиненции, в частности интести-
нальные, имеют не центральную природу, а периферическую.
8.4. Частные формы токсикоманий
Алкоголизм. Типичное или простое алкогольное опьянение имеет фазы
возбуждения и торможения. Продолжительность и выраженность каждой
Фазы зависит от дозы алкоголя, крепости напитка, количества и характера
закуски, времени суток, психического и физического состояния и других
факторов. Выделяют три степени тяжести опьянения (легкая, средняя и
307
тяжелая). Тяжелое опьянение (острое отравление) наступает при содержании
алкоголя в крови свыше 350 мг%. Развивается сопор или кома. При затяж-
ном сопоре могут появиться патологические рефлексы и эпилептиформные
припадки. Кожные покровы багровые или бледно-цианотичные, влажные.
Сердечная деятельность ослаблена, постепенно нарастает артериальная
гипотензия. Дыхание урежается или становится периодическим. Характерны
рвота, непроизвольные дефекация и мочеиспускание.
Атипичное или осложненное алкогольное опьянение возможно на фоне
переутомления, острых психогенных реакций, при сопутствующей психи-
ческой, неврологической и соматической патологии и при злоупотреблении
суррогатами алкоголя. Выделяют маниакальноподобный, психопатоподоб-
ный, эпилептиформный, дисфорический и истерический варианты. Для
осложненных вариантов опьянения характерна перфорационная амнезия.
В судебной психиатрии для оценки вменяемости при совершении социально
опасных деяний используют диагноз “патологическое опьянение”. Состоя-
ния, объединенные понятием “патологическое опьянение”, можно отнести
к атипичным формам алкогольной интоксикации, однако клинические про-
явления этих состояний весьма специфичны. Выделяют эпилептоидную и
параноидную формы патологического опьянения, но возможны и другие
психотические варианты. Эти состояния генетически близки к сумеречным
расстройствам. Начало патологического опьянения проявляется остро воз-
никшей тревогой, страхом, растерянностью, отчуждением от окружающей
среды. Внешняя обстановка воспринимается как угрожающая. Могут раз-
виться зрительный, вербальный или сценоподобный галлюцинозы. Больные
совершают сложные действия с нормальной координацией, но бедной ре-
чевой продукцией. Реакция на внешние раздражители отсутствует или резко
ослаблена. Гораздо реже встречается эксплозивный тип реагирования на
раздражители.
Действия индивидуума, как правило, направлены на защиту от мнимой
угрозы для жизни. Соответственно поведение становится агрессивным, сте-
ничным, противоправным и непредсказуемым. Совершаемые субъектами
преступления против личности отличаются жестокостью и отсутствием мо-
тивировки. Для индивида при патологическом опьянении не характерны
кражи, хулиганство и изнасилования. Патологическое опьянение продолжа-
ется короткое время (от минут до нескольких часов), развивается в ответ на
различные дозы алкоголя и заканчивается внезапно наступающим сном.
После пробуждения отмечается полная или резко выраженная перфораци-
онная амнезия на имевшие место события. В генезе патологического опья-
нения участвуют многочисленные факторы, но у абсолютного большинства
больных удается выявить признаки органического поражения головного
мозга или другой психической патологии.
При алкоголизме употребление алкоголя наряду с регулярным может
быть и периодическим в форме запоев. Различают истинные запои и псев-
дозапои. Истинные запои перемежаются полной или почти полной трезвос-
тью, на фоне которой влечение к алкоголю существенно редуцировано или
вообще отсутствует. Предвестниками истинного запоя могут быть обостре-
ние тяги к алкоголю, снижение настроения, нарастание тревоги, дисфори-
ческие явления, бессонница и другие психические нарушения. Эти явления
наблюдаются и непосредственно в период запоя. Истинные запои часто
сочетаются с тяжелыми дисфориями или депрессиями и имеют характер
правильной периодичности, что дало основание некоторым авторам рас-
сматривать их как варианты эпилепсии и маниакально-депрессивного пси-
308
хоза. Такая форма употребления алкоголя получила название “дипсомания”
и длительное время претендовала на нозологическую самостоятельность.
В настоящее время перемежающееся пьянство рассматривают в рамках
алкоголизма, а алкоголизация при иных психических заболеваниях считает-
ся симптоматической. В первом случае появление истинных запоев — этап
в динамике алкоголизма, во втором — симптомы основного психического
заболевания, а алкоголизация совпадает с дисфорией или депрессией. В кон-
це истинного запоя толерантность к алкоголю падает.
Псевдозапои ситуационно обусловлены, т.е. периодичность их зависит
оТ внешних причин (праздники, выходные дни, дни зарплаты и т.д.). Обыч-
но они появляются на фоне систематического пьянства. Псевдозапои не
сопровождаются глубоким снижением настроения, но могут проявляться
атипичным опьянением, особенно в случаях, когда запой спровоцирован
психогенными факторами.
В большинстве случаев стадии алкоголизма хорошо очерчены. Следует
подчеркнуть, что во многих руководствах первую стадию описывают как
состояние, при котором не определяются симптомы физической зависимос-
ти [4, 6]. Вместе с тем диагноз “алкоголизм”, равно как и диагноз других
форм токсикоманий, может быть установлен только при наличии в клини-
ческой картине признаков всех “больших наркоманических синдромов”.
Поэтому правильнее говорить о минимальных или стертых проявлениях
абстиненции при первой стадии алкоголизма.
Для первой стадии алкоголизма характерен абстинентный синдром с
преобладанием астенических и вегетативных нарушений (общая слабость,
сухость во рту, повышенная потливость, тремор, тахикардия, головная боль
и т.д.). Состояние продолжается не более суток и может развиваться после
однократного (однодневного) алкогольного эксцесса. Желание опохмелить-
ся появляется во второй половине дня и в связи с обстоятельствами соци-
ального или этического характера может легко подавляться. В первой стадии
алкоголизма пьянство постепенно теряет культуральные мотивы. Алкоголь
все чаще рассматривается индивидуумом как атарактическое средство и
употребляется с целью “снять напряжение, расслабиться”. Больные указы-
вают также и на отчетливый стимулирующий эффект алкоголя. Мнестичес-
кие нарушения в опьянении не характерны.
Алкоголизация становится регулярной, появляются псевдозапои, растет
толерантность. В редких случаях алкоголизм изначально протекает с истин-
ными запоями. Социальная адаптация, как правило, не страдает. Психичес-
кие нарушения у большинства больных исчерпываются незначительной
астенизацией и обсессивным влечением к алкоголю.
Вторая стадия, как отмечалось выше, характеризуется максимальной
выраженностью “больших наркоманических синдромов”. Патологическое
влечение к алкоголю приобретает неудержимый, компульсивный характер.
В опьянении полностью теряется контроль над количеством выпиваемого
алкоголя, а во многих случаях — и ситуации. Появляются истинные запои.
Личностные особенности заостряются, поведение приобретает психопато-
подобную окраску. Абстинентный синдром проявляется не только вегета-
тивными, но и выраженными психическими расстройствами. Желание опох-
мелиться возникает с утра и сохраняется днем. Абстиненция возникает
после каждого алкогольного эксцесса. При этом типично резко сниженное
настроение с тревогой, чувством внутреннего напряжения, непоседливос-
тью, опасениями за свое здоровье, идеями самоуничижения. У личностей
возбудимого круга в состоянии абстиненции развивается тяжелая дисфория.
309
Очень характерны преследующие алкоголиков суицидальные мысли, бессон-
ница. Процесс засыпания больные описывают как “проваливание”, “забы-
тье” на фоне усиливающейся к ночи тревоги. Расстройства сна сопровож-
даются кошмарными сновидениями и частыми пробуждениями. Вегетатив-
ные нарушения проявляются сильным потоотделением, стойкой тахикар-
дией, подъемом артериального давления, размашистым тремором конечнос-
тей, языка, а иногда и генерализованным тремором. В первые дни абсти-
ненции могут развиться развернутые или абортивные судорожные припадки.
Аффективные и вегетативные нарушения без лечения постепенно убывают
к 5—6-м суткам и сменяются выраженной астенией. При этом суточные
колебания настроения, бессонница, быстрая утомляемость с вегетативными
компонентами могут сохраняться до 6 мес и более. Во второй стадии
манифестируют соматические заболевания, связанные с алкоголизацией.
Наиболее характерны жировая дистрофия печени с повышением актив-
ности трансаминаз, панкреатит и миокардиодистрофия. Социальный рост
прекращается и постепенно становится очевидным снижение способнос-
ти индивидуума адаптироваться к меняющимся условиям социальной
среды.
В третьей стадии алкоголизма происходит падение толерантности к
алкоголю, дальнейшее утяжеление абстинентного синдрома и быстрое на-
растание интеллектуально-мнестического дефекта вплоть до слабоумия (ал-
когольная деградация личности, корсаковский синдром и др.). Психические
компоненты абстиненции приобретают параноидные черты. Характерны
элементарные нарушения восприятия, немотивированный страх, сверхцен-
ные идеи отношения, преследования, виновности и другие включения суб-
психотического и психотического регистров. Симптомы абстиненции дости-
гают такой степени выраженности, что иногда бывают опасны для жизни
больного. В частных случаях на первый план могут выходить обратимые
психоорганические расстройства: оглушение, головокружение, атаксия, ге-
нерализованный тремор, судорожные припадки, дизартрия, анизорефлек-
сия, нистагм и пирамидные знаки. Соматические расстройства хронизиру-
ются. Больные выглядят существенно старше своих лет. Отмечается соци-
альная деградация. Для второй и третьей стадий алкоголизма характерны
алкогольные психозы.
Алкогольные психозы развиваются в состоянии абстиненции. Они, как
правило, манифестируют в вечернее и ночное время, наиболее часто воз-
никают после тяжелых и длительных запоев, при употреблении суррогатов
алкоголя, на фоне декомпенсированной соматической патологии и у лич-
ностей с признаками органического поражения головного мозга. Существует
различная систематизация алкогольных психозов. С практической точки
зрения необходимо выделять острые, затяжные и хронические психозы, а
также ведущие в клинической картине психопатологические синдромы: де-
лириозный, галлюцинаторный, параноидный, бредовый и др. Особенность
острых алкогольных психозов — своеобразный полиморфизм клинических
проявлений, не характерный для других экзогенно и эндогенно обусловлен-
ных состояний. Так, алкогольный делирий в частных случаях сопровожда-
ется транзиторным онейроидом, психическими автоматизмами, вербальным
псевдогаллюцинозом и т.д. При острых психозах важно учитывать и тяжесть
состояния, так как делирий или другой психоз может протекать на фоне
прогрессирующей энцефалопатии с отеком головного мозга и нарушением
функций жизненно важных органов и систем. В свою очередь алкогольные
энцефалопатии могут быть острыми и хроническими.
310
В связи с этим можно выделить следующие алкогольные (металкоголь-
нь1е) психозы:
• алкогольные делирии (абортивный, типичный, мусситирующий, ати-
пичный: систематизированный, с вербальным псевдогаллюцинозом,
с транзиторным онейроидом, психическими автоматизмами; острое
| течение);
| • алкогольные галлюцинозы (вербальный, с чувственным бредом, с
* психическими автоматизмами; острый, затяжной и хронический типы
течения);
• алкогольные бредовые психозы (алкогольный параноид, алкогольный
бред ревности; острый, затяжной и хронический типы течения);
алкогольные энцефалопатии (острая и хроническая энцефалопатия,
энцефалопатия Гайе-Вернике, алкогольный псевдопаралич).
На фоне современной терапии алкогольный делирий продолжается не
более 10 сут. Возможна последующая трансформация делирия в галлюциноз
или параноид. Другие алкогольные психозы считаются острыми, если реду-
цируются в течение месяца; затяжные психозы продолжаются до 6, а хро-
нические — свыше 6 мес.
Алкогольный делирий манифестирует с выраженной тревогой и стойкой
бессонницей, на фоне которых появляются парейдолические иллюзии. Ил-
люзорное восприятие окружающей обстановки быстро сменяется зритель-
ными и вербальными галлюцинациями. Сознание в этот период оценивают
как ундулирующее: при активации больного галлюциноз на короткое время
может претерпеть существенную редукцию вплоть до полного исчезновения.
Характерны кратковременные транзиторные состояния помрачения созна-
ния с нарушением ориентировки, которые больные описывают как “прова-
лы”, “забытье”, “кошмары” (абортивный делирий). Симптоматика сохраня-
ется мерцающей от нескольких часов до 1 сут, после чего галлюциноз
приобретает форму статичного состояния. Галлюцинации угрожающего ха-
рактера. Галлюциноз постепенно усложняется, становится сценоподобным.
Одновременно нарастает оглушение. Теряется ориентировка в месте и вре-
мени, но сохраняется в собственной личности (типичный делирий). Харак-
терны переживания бытового и профессионального плана. Нарастание при-
знаков помрачения сознания сопровождается уменьшением двигательной и
речевой продукции. Активность больного ограничена постелью. Он безучас-
тен к окружающей обстановке, перебирает пальцами одеяло, что-то нераз-
борчиво бормочет, не узнает близких (мусситирующий делирий). Повыша-
ется температура тела, резко снижается диурез, падает артериальное давле-
ние. Без лечения это состояние неблагоприятно для жизни. Алкогольный
делирий может состоять из симптомокомплексов других психопатологичес-
ких регистров (атипичный делирий).
Алкогольный галлюциноз — психоз с преобладанием слуховых, вербальных
галлюцинаций, бреда и аффективных тревожных расстройств. Острые тяжелые
алкогольные галлюцинозы по клинике близки к делирию. Так, на высоте
психоза может развиться галлюцинаторная спутанность, подобная клиничес-
ким проявлениям онейроидного помрачения сознания. Однако абсолютное
большинство алкогольных галлюцинозов протекает при ясном сознании.
Острые алкогольные психозы манифестируют на фоне бессонницы и
сопровождаются тревогой, двигательным беспокойством, аффектом недо-
умения. Эти явления могут исчезнуть после глубокого сна. Одновременно
ослабевают и аффективные расстройства. При дальнейшем развитии психоза
311
появляются множественные вербальные галлюцинации с бредом отноше-
ния, воздействия, обвинения, преследования или физического уничтожения.
Характерны приступы страха и паники.
Затяжные (протрагированные) и хронические алкогольные психозы харак-
теризуются стойким вербальным псевдо- или истинным галлюцинозом с
присоединением выраженных депрессивных и бредовых расстройств.
Алкогольный параноид проявляется чувственным бредом, тревожно-деп-
рессивным аффектом и сенсорными расстройствами. Для острого алкоголь-
ного параноида наряду с бредовой трактовкой окружающего характерно
иллюзорное восприятие. Больные в разговорах слышат в свой адрес угрозу,
издевательства, видят в бытовых предметах орудия убийства и т.д. Преоб-
ладает аффект страха. В отношении мнимых преследователей могут совер-
шаться агрессивные поступки. При затяжном параноиде исчезает иллюзор-
ный компонент бреда, наблюдается его некоторая систематизация. Поведе-
ние становится болёе упорядоченным, но больные остаются замкнутыми,
подозрительными. Настроение сохраняется тревожным, угрюмо-злобным.
Постепенно интенсивность переживаний ослабевает. Относительно длитель-
ное время сохраняется резидуальный бред.
Алкогольный бред ревности (алкогольная паранойя) — это психоз, преиму-
щественно с затяжным и хроническим типом течения, с преобладанием пер-
вичного систематизированного бреда. Встречается, как правило, у мужчин с
психопатическими паранойяльными чертами характера. Бред монотематичес-
кий, развивается постепенно, его формированию часто предшествуют реальные
негативные изменения в семейных отношениях, связанные с характерологи-
ческими особенностями и алкоголизацией супруга. Напряженные семейные
отношения становятся фабулой сверхценных переживаний. Сначала бредовые
высказывания появляются только в состоянии опьянения или похмелья. Со-
держание бреда нередко сохраняет правдоподобные черты. Однако со временем
круг событий, получающих бредовую трактовку, расширяется, а поведение
приобретает специфические бредовые черты. Возможны агрессивные и ауто-
агрессивные действия. Бред ревности может диссимулироваться. На фоне
лечения паранойяльный бред сменяется стойким резидуальным бредом.
Острые энцефалопатии наблюдают при массированной алкоголизации в
Ш стадии алкоголизма или при интоксикации суррогатами алкоголя и техни-
ческими жидкостями (метиловый спирт, этиленгликоль, дихлорэтан и др.). Для
этих состояний характерны помрачение сознания вплоть до аменции, делирий
и массированные неврологические нарушения. Проявления острой энцефало-
патии отчасти обратимы. Энцефалопатия Гайе-Вернике — это геморрагическая
энцефалопатия или верхний полиэнцефалит с подострым течением. Продром
продолжается 4—5 мес, проявляется выраженной астенизацией и нарастанием
дистрофических расстройств. На этом фоне остро развивается мусситирующий
делирий. Состояние быстро ухудшается, повышается температура тела, появ-
ляются кататонические явления, аментивная спутанность. Прогноз для жизни
неблагоприятный. Хроническая энцефалопатия по сути является исходом ал-
коголизма. В клинической картине наряду с деменцией могут наблюдаться
полиневриты, поражения мозжечка и мозолистого тела, корсаковский синдром
(фиксационная, ретро-, антероградная амнезия, конфабуляции, эйфория) и
другие расстройства. Алкогольный псевдопаралич — вариант хронической эн-
цефалопатии, проявляющийся интеллектуально-мнестическим снижением с
беспечностью, эйфорией, идеями величия.
Опиаты и опиоиды (алкалоиды опия и синтетические аналоги морфина:
морфин, кодеин, героин, промедол, омнопон, метадон, фентанил и др)-
312
Наибольшее распространение получили высокотоксичные препараты кус-
тарного изготовления, содержащие опий-сырец (маковая соломка, ханка) и
героин (ангидрированный опий). Применяют внутривенно, ингаляционно
(курение) и внутрь. Субъективное воздействие препаратов типа опия неоди-
наково для различных лиц и для одного и того же лица в разное время. Это
воздействие зависит от дозы, способа употребления, физических и психи-
ческих особенностей потребителя, а также от ожидаемого им результата.
Обычно прием препаратов типа опия создает ощущение “невесомости”,
“легкости”, “истомы”, которые сменяются эйфорией, благодушием, иллю-
зией отсутствия каких-либо проблем. При приеме больших доз наркотика
развивается сомноленция.
Острые отравления при злоупотреблении опиатами происходят вследст-
вие передозировки или попадания в раствор наркотика веществ общетокси-
ческого действия при нарушении технологии его изготовления. Передози-
ровку опиатами в основном фиксируют у лиц, не имеющих длительного
опыта наркотизации, после перенесенного абстинентного синдрома и при
комбинации наркотика с алкоголем или другими ПАВ. Для этого отравления
характерны глубокий сопор или кома, резкое угнетение дыхания, миоз,
брадикардия, артериальная гипотония. В крайне тяжелых случаях на фоне
брадикардии и гипотонии может быть мидриаз (табл. 8.1).
Таблица 8.1. Дифференциальный диагноз между отравлениями опиатами и дру-
гими средствами
Показатель Опиаты Барбитураты Бензодиазепины Атропиноподоб- ные
АД Резка или умеренна снижено Умеренно сни- жено В норме или умеренно сниже- но В норме или умеренно по- вышено
ЧСС Брадикардия, с уве- личением экспози- ции — тахикардия Умеренная тахи- кардия Умеренная тахи- кардия Выраженная та- хикардия
ЭКГ Синусовая брадикар- Синусовая тахикардия дия, при тахикардии высокий зубец Т Различные варианты нарушения проводимости Синусовая или пароксизмаль- ная тахикардия
Зрачок Миоз В норме или редко миоз В норме или ми- дриаз Мидриаз
Тонус ске- летных мышц Повышен, тризм же- вательных мышц, редко судороги Редко тризм же- вательных мышц и судороги Релаксация Релаксация
Тонус моче- выводящих путей Спазм В норме, редко спазм В норме Спазм ,
Реакция на налоксон Пробуждающий эф- фект, стабилизация гемодинамики и ды- хания Отсутствует или слабая Отсутствует Отсутствует
Реакция на аминостиг- Мин Не вводили Отсутствует Слабая Пробуждающий эффект, стаби- лизация гемоди- намики
Выход из комы Гипоксическая энце- фалопатия Выраженная астения, редко энце- фалопатия Делирий, асте- ния
313
В случаях средней тяжести и тяжелых течение отравления волнообраз-
ное. Передозировка опиатами сопровождается формированием энцефалопа-
тии различной степени тяжести. Структуру энцефалопатии составляют ас-
тенические, мнестические, аффективные и психотические нарушения. Ди-
намика энцефалопатии имеет 3 фазы: фазу оглушения со спутанностью,
нарушением ориентировки в месте и времени, ундулирующим сознанием;
фазу пробуждения с атаксией, дизартрией, мнестическими расстройствами
и аффективными нарушениями; фазу редукции с преобладанием расст-
ройств астенического круга. Тяжесть энцефалопатии напрямую зависит от
продолжительности бессознательного состояния. Среди лиц, злоупотребля-
ющих опиатами, часто встречаются случаи отравления снотворно-седатив-
ными и другими средствами, которые используют при самолечении абсти-
ненции.
Отравление веществами общетоксического действия отличается значи-
тельным полиморфизмом клинических проявлений. При этом далеко не
всегда удается установить этиологический фактор. Наименее дифференци-
рованные клинические проявления интоксикаций описывают как токсико-
аллергические реакции. Токсико-аллергическую реакцию дифференцируют
сепсисом, вирусным гепатитом, геморрагическим синдромом, гемолитичес-
кой реакцией и сифилисом (внутривенный путь заражения). Гемолитичес-
кую реакцию наблюдают редко, но ее можно считать специфичной для
героиновой и эфедроновой наркомании, так как в технологии изготовления
этих средств используют уксусную кислоту или уксусный ангидрид. Легкие
случаи гемолитической реакции по клинической картине близки к токси-
ко-аллергической реакции, гепатиту. Более сложны в диагностическом от-
ношении состояния, вызванные острым отравлением бензолом и хлористым
метиленом. Эти отравления связаны с использованием в изготовлении нар-
котика растворителей на основе бензола и хлорированных углеводородов.
При отравлении бензолом тяжесть состояния обусловлена глубокими пато-
логическими сдвигами в системе крови (нормохромная анемия III степени,
панцитопения). Тромбоцитопения служит основной причиной кровотече-
ний. Отравление хлористым метиленом, как и при интоксикации бензолом,
имеет подострый характер. Для этого отравления характерны эрозивный
гастрит, гепато- и спленомегалия, геморрагический синдром с анемией,
тромбоцитопенией, сдвигом лейкоцитарной формулы влево вплоть до мие-
лоцитов. Непосредственной причиной летальных исходов у данной группы
больных бывает вторичная инфекция, проявляющаяся в основном пневмо-
нией или сепсисом.
Хроническая интоксикация приводит к заострению неустойчивых черт
характера, волевым и эмоциональным нарушениям. Наркоманы становятся
все более грубыми, эгоистичными и лживыми. Без введения наркотиков
больные угнетены и раздражительны. Сразу же после инъекции они преоб-
ражаются, становятся веселыми, общительными, исчезают вялость, апатия,
упадок сил. В поздней стадии заболевания формируется глубокий астени-
ческий синдром. Характерны мнестические расстройства.
Толерантность к опиатам высокая. Психическая и физическая зависи-
мость выражены сильно. Зависимость формируется быстро и может быть
вызвана дозами, не превышающими терапевтические. У многих наркоманов
сразу после первых инъекций наркотика появляется непреодолимое желание
продолжить его прием и достать его любым способом.
Абстинентный синдром начинается через 8—16 ч после приема послед-
ней дозы, достигает максимальной интенсивности через 2—3 сут, а затем
314
постепенно убывает. Наиболее тяжелые симптомы обычно исчезают в тече-
ние 10 дней, но остаточные явления продолжаются долго. В синдром абс-
тиненции входят следующие симптомы (приблизительно в порядке разви-
тия): беспокойство, раздражительность, боли во всем теле, бессонница,
насморк, обильное потоотделение, приливы крови к лицу, тошнота, рвота,
понос, акатизия, повышение температуры, спазм гладкой мускулатуры ки-
шечника, обезвоживание организма. Внезапное прекращение наркотизации
для лиц с выраженной соматической патологией представляет опасность для
жизни.
Производные эфедрина. Наибольшее распространение получили препара-
ты нелегального изготовления — эфедрон и первитин, отличающиеся высо-
кой токсичностью. Применяются внутривенно. Наркоманическая интокси-
кация сопровождается ярко выраженной эйфорией, возбуждением, речевой,
двигательной и сексуальной расторможенностью. Некоторые наркоманы
склонны вводить эфедрон с интервалом 2—3 ч в течение нескольких суток.
При прекращении наркотизации нередко развивается психоз по типу дели-
рия или острого параноида.
Острые отравления вследствие передозировки проявляются психомотор-
ным возбуждением, психотическими явлениями, артериальной гипертен-
зией, пароксизмальной тахикардией. На фоне нарастающей сердечно-сосу-
дистой недостаточности развивается кома. Смерть может наступить от ин-
фаркта миокарда или кровоизлияния в мозг. При злоупотреблении препа-
ратами этой группы возможны гемолитические реакции, так как в техноло-
гии их изготовления используется уксусная кислота. Хроническая интокси-
кация приводит к формированию стойкого астенического синдрома с ши-
зоформными расстройствами мышления и интеллектуальным снижением.
Толерантность высокая. Психическая зависимость сильная. Физическая за-
висимость слабовыраженная. При внезапном прекращении наркотизации
появляются депрессивные с дисфорической окраской состояния и вегета-
тивные нарушения. Следует помнить о возможности развития психоза.
Производные каннабиса (гашиш, анаша, марихуана, план, чарс и др.).
Препараты каннабиса изготавливаются кустарно из дикорастущей конопли.
Психоактивные свойства обеспечиваются наличием в растении /пранс-тет-
рагидроканнабинола и других каннабиноидов.
Наркоманическая интоксикация проявляется морией или эйфорией, ис-
кажением восприятия пространства и времени, потерей ощущения подлин-
ности собственного “я” и чувства реальности происходящего, иногда зри-
тельными и слуховыми галлюцинациями.
Острое отравление вследствие передозировки вызывает сопор или кому
с последующим развитием энцефалопатии и полиневропатии (спутанность
сознания, галлюциноз, нарушение схемы тела, дизартрия, астазия-абазия,
апраксия, анестезии, парезы и др.). При хронической интоксикации наибо-
лее часто развивается “амотивационный синдром”, характеризующийся апа-
тией, аутизацией, пассивностью, вялостью, ослаблением памяти и интел-
лекта. Возможны деперсонализационные и дереализационные явления, ощу-
щения чуждости тела, нереальности и измененности всего окружающего.
В Других случаях клиническая картина проявляется грубым психоорганичес-
ким синдромом или шизофреноформными психозами. Считается, что кан-
набиноиды обладают свойством актуализовывать латентную психическую
патологию.
Толерантность невысокая, зависит от индивидуальных особенностей по-
требителя. Психическая зависимость умеренная или сильная. Абстинентный
315
синдром проявляется нестойкими нарушениями сна, повышенной возбуди-
мостью, тахикардией, неприятными ощущениями в области сердца, отсут-
ствием аппетита, потливостью и т.д.
Токсикомании к транквилизаторам и антидепрессантам (лекомании) полу-
чили преимущественное распространение среди лиц, принимавших их в
течение длительного времени. В отличие от большинства токсикоманий при
лекомании нет потребности в постоянном повышении доз. Привыкание к
этим препаратам сопровождается психической зависимостью. Физическая
зависимость слабо выражена. Явления абстиненции нестойкие и не выходят
за рамки вегетативных расстройств. Однако у некоторых больных непосред-
ственно после прекращения длительного приема транквилизаторов появля-
ются резкая раздражительность, тревога, сопровождающаяся двигательным
беспокойством, бессонницей, судорогами в конечностях и жалобами на
ломоту в суставах. Острые отравления бензодиазепинами протекают с нару-
шением сознания в форме сопора или комы, с относительно стабильными
показателями гемодинамики и мышечной релаксацией. После тяжелых от-
равлений может развиться энцефалопатия со стойким, до нескольких не-
дель, астеническим синдромом.
Средства с антихолинергическим действием (циклодол, димедрол, астматол,
белладонна и др.). Механизм токсического действия этих препаратов опре-
деляется способностью блокировать холинореактивные системы мозга. При
легких интоксикациях отмечаются нарушение запоминания, снижение ак-
тивного внимания, затрудняется осмысление происходящих событий. С
увеличением дозы возникает состояние тревоги, страха, наблюдается пси-
хомоторное возбуждение, нарушается ауто- и аллопсихическая ориентиров-
ка. Для отравлений средней тяжести характерны делириозные состояния.
Иллюзии и галлюцинации носят неприятный, устрашающий характер. Речь
больных становится бессвязной, контакт с ними невозможен. В тяжелых
случаях развиваются сопор или кома с нарушениями в деятельности сердеч-
но-сосудистой системы. В дальнейшем отмечаются грубые амнестические
расстройства, в течение длительного времени сохраняются астенические
нарушения. Соматовегетативные нарушения при отравлениях антихолинер-
гическими средствами проявляются расширением зрачков, сухостью слизис-
тых оболочек и кожных покровов, тахикардией, повышением температуры
тела. Зависимость к антихолинергическим средствам развивается крайне
редко. Злоупотребление ими распространено среди подростков и имеет
характер токсикоманических эксцессов.
Кокаин. Препарат применяется внутривенно или интраназально. Психо-
тропное действие кокаина сочетает мощный эйфоризирующий и психости-
мулирующий эффекты. На высоте интоксикации развивается психотическое
состояние с параноидными реакциями, психомоторным возбуждением и
нередко агрессивным поведением. Клиника острого отравления такая же,
как и у амфетаминов.
Хроническая интоксикация относительно быстро формирует психоорга-
нический синдром. Толерантность высокая. Психическая зависимость силь-
ная. Абстинентный синдром проявляется астеническими, депрессивными и
вегетативными расстройствами.
Барбитураты (барбамил, фенобарбитал, этаминал-натрий и др.). Принима-
ются внутрь, реже внутривенно. Наркоманическая интоксикация барбиту-
ратами напоминает алкогольное опьянение. Непродолжительная стадия эй-
фории и возбуждения сменяется оглушенностью, спутанностью сознания,
речевыми и двигательными нарушениями, с последующими глубоким сном
316
или сопором. Возможно появление колебаний аффекта, а также агрессивное
поведение. При хронической интоксикации развиваются нарушения по пси-
хоорганическому типу, атаксия, дизартрия, заторможенность, рассеянность
внимания, снижение интеллекта и памяти, эмоциональная неустойчивость,
у острых отравлений барбитуратами и опиатами имеются общие черты (см.
табл. 8.1).
Толерантность относительно невысокая. Употребляемая доза может пре-
вышать первоначальную в 5—10 раз. Опасная для жизни барбитуромана
доза — 2,5 г чистого вещества. При прекращении наркотизации толерант-
ность к барбитуратам быстро исчезает и больные могут стать даже более
чувствительными к наркотику, что нередко приводит к тяжелым отравлени-
ям. Психическая и физическая зависимость сильная. При внезапном пре-
кращении наркотизации развивается синдром абстиненции. Он начинает
проявляться в течение первых суток после прекращения приема наркотиков,
достигает максимальной интенсивности через 2—3 дня, а затем медленно
исчезает. В синдром абстиненции входят следующие симптомы (в порядке
их появления): беспокойство, дрожание рук и пальцев, прогрессирующая
слабость, головокружение, искажение зрительного восприятия, тошнота,
рвота, бессонница, резкое падение артериального давления, конвульсии
эпилептического типа, психические расстройства — реакции пароноидного
типа с бредом и галлюцинациями, состояния оцепенения и панического
страха. Для лиц с выраженной зависимостью от барбитуратов внезапное
прекращение наркотизации представляет опасность для жизни.
Амфетамины (фенамин, сиднокарб и др.). Наибольшее распространение
получил фенамин кустарного изготовления. Принимается внутрь и внутри-
венно. Случайное или нерегулярное употребление относительно малых доз
этих наркотиков создает ощущение уменьшения усталости, повышенной
ясности сознания и бодрости. Употребление больших доз (особенно путем
внутривенного введения) вызывает эйфорию, психомоторное возбуждение,
обусловливает стимуляцию и искажение восприятия.
Передозировка амфетаминами напоминает острое отравление производ-
ными эфедрина, протекает с острым параноидом. Хроническая интоксика-
ция приводит к значительным психическим нарушениям, нередко психоти-
ческого характера. Характерны затяжные шизоформные психозы. Быстро
формируется стойкий астенический синдром с депрессивными и апатоабу-
лическими включениями.
Толерантность высокая. Употребляемая доза может превышать первона-
чальную в сотни раз. Психическая зависимость сильная, физическая —
незначительная. С прекращением наркотизации наступает депрессия, кото-
рая резко усиливает стремление возобновить прием препарата. При внезап-
ном лишении наркотика у больных развиваются вялость, адинамия, общая
слабость, сонливость. В дальнейшем на первый план выступают симптомы
вегетативной группы.
Психотомиметики. Психотомиметики (галлюциногены, психодизлептики,
делиранты) — психоактивные вещества, вызывающие обратимые психоти-
ческие нарушения без выраженных соматических расстройств. В настоящее
время преимущественное распространение получили диэтиламид лизерги-
новой кислоты (ДЛК, ЛСД), псилоцибин (в России получает распростране-
ние злоупотребление псилоцибинсодержащими грибами, произрастающими
в средней полосе), фенциклидин и его производные (РСР, “экстази” и др.).
Препараты применяются внутрь и внутривенно. Имеются сведения о транс-
кутальном введении препаратов типа “экстази”.
317
В патогенезе психоза, вызываемого ДЛК и другими психотомиметиками,
>сновное значение придается влиянию этого вещества на серотонинерги-
1еские и дофаминергические системы мозга.
Классическим представителем группы психотомиметиков является ДЛК.
Эн относится к числу наиболее токсичных препаратов и вызывает у человека
>стрый психоз в дозе 0,0005—0,001 мг/кг. Психические расстройства разви-
>аются через 10—30 мин после попадания препарата в организм и сохраня-
ется в течение 5—10 ч.
Начальные симптомы отравления: общая слабость, головокружение,
-ошнота, ощущение жара или холода. Отмечаются мидриаз, потливость,
:люнотечение, рвота, тахикардия. В дальнейшем развиваются разнообразные
чсихотические расстройства. На высоте интоксикации с постоянством от-
лечаются различные обманы восприятия (гиперестезии, иллюзии, зритель-
лые и слуховые галлюцинации). Галлюцинаторные образы отличаются яр-
сой окрашенностью, калейдоскопически сменяют друг друга. Настроение
вольных, как правило, приподнятое, однако в ряде случаев возможно появ-
1ение подавленности, тревоги, страха, враждебности к окружающим. При
гяжелых отравлениях наблюдаются явления дереализации и деперсонализа-
тии, характерны расстройства восприятия времени. Нарушения мышления
зыражаются в его замедлении, невозможности сосредоточиться, возникно-
зении отрывочных бредовых идей. При этом в большинстве случаев больные
остаются доступными контакту. Только при очень тяжелых отравлениях
зарастает бессвязность мышления, нарушается ориентировка в окружаю-
щем, отмечаются грубые расстройства памяти. Двигательные нарушения
зроявляются как в виде речедвигательного возбуждения, так и развитием
заторможенности, иногда с явлениями восковой гибкости (каталепсии).
После редукции психотических нарушений сохраняются астенические рас-
стройства, выраженность которых зависит от тяжести интоксикации. В ряде
случаев возможно повторное развитие кратковременных психотических со-
стояний, появляющихся в отдаленные сроки после интоксикации ДЛК.
Психозы, вызываемые другими психотомиметиками, имеют общие черты
с проявлениями острой интоксикации ДЛК.
Хроническая интоксикация психотомиметиками сопровождается форми-
рованием астенических, апатоабулических и вялотекущих шизоформных
расстройств.
Психическая и физическая зависимость слабовыражены. Толерантность
низкая.
Эфирные растворители (ацетон, бензин, бензол, диэтилэфир, хлороформ,
голуол, четыреххлористый углерод и др.). Последнее время с токсикомани-
ческой целью преимущественно используется ацетон и толуол (составные
части многих промышленных продуктов, в том числе растворителей и не-
которых типов клея), а также бензин. Применяются ингаляционно, реже в
виде аппликации на волосистую часть головы.
Острая интоксикация сопровождается эйфорией со спутанностью созна-
ния и нарушениями ориентировки. Некоторые вещества, в том числе бензин
и толуол, вызывают иллюзию беспредельности собственных возможностей,
галлюцинации, значительную потерю самоконтроля, нередко с агрессивным
поведением. С увеличением дозы могут наступить судороги, кома и смерть.
Смерть возможна и от удушья, если ингаляция проводилась из пластикового
мешка и сопровождалась потерей сознания.
Хроническая интоксикация (бензином, бензолом и четыреххлористым
углеродом) приводит к патологическим изменениям в легких, печени, по-
318
1 чках и в составе крови. Развиваются глубокие психические нарушения по
1 психоорганическому типу. Толерантность незначительная, за исключением
• толуола. Психическая зависимость слабее по сравнению с другими типами
токсикоманий, а физическая — незначительна. Внезапное прекращение нар-
котизации приводит к появлению заторможенности, сонливости, раздражи-
тельности. Крайне редко развивается психоз, напоминающий алкогольный
делирий.
К* 8.5. Лечение токсикоманий
I С точки зрения практики, целесообразно разделить потоки больных по
1 виду оказываемой помощи. Можно выделить ургентную помощь (острые
интоксикации, абстинентный синдром, опасные для жизни соматические
j заболевания, обусловленные хронической интоксикацией наркотиком); ле-
i чение психических и соматических нарушений в постабстинентный период;
противорецидивную терапию. В одних случаях при поступлении больных в
плановом порядке эти виды помощи составляют этапы лечения, в других —
1 больным оказывается только один вид помощи (например, лечение острых
интоксикаций на догоспитальном этапе). Очевидно, что содержание отдель-
ных видов помощи требует участия в лечении различных специалистов,
компетентность которых выходит за рамки специальностей психиатр-нар-
колог или токсиколог. Современные подходы рассматривают каждый этап
лечения как необходимый и достаточный. Подход распространяется на
больных, поступающих как в неотложном, так и в плановом порядке. После
завершения первого этапа лечения (купирование абстинентного синдрома
или острой интоксикации в условиях стационара или амбулаторно) больным
в добровольном порядке предлагается перейти ко второму и третьему этапу
(соответственно коррекция постабстинентных психических расстройств и
; противорецидивная терапия).
I Лечение психических и соматических расстройств постабстинентного
11 периода проводится преимущественно в стационаре, однако при слабо вы-
раженной симптоматике допускается перевод больного на амбулаторный
режим помощи. Продолжительность второго этапа в частных случаях бывает
от 7 дней до месяца и более.
Третий этап помощи осуществляется амбулаторно. Продолжительность
противорецидивной терапии во времени не ограничивается. Лечение вклю-
чает комплекс фармакологических и психотерапевтических тактик, направ-
ленных на профилактику рецидива. При этом решающую роль будет играть
социальная реадаптация больного.
Если пациент в силу субъективных причин отказывается принимать
участие во всей терапевтической программе, то ему предлагается самостоя-
, тельно определить потребность в том или ином виде медицинской помощи.
Лечение острых отравлений ПАВ. Несмотря на значительную полиморф-
Ность острых отравлений, практически всем больным назначается трансфу-
зионная дезинтоксикационная терапия, направленная на максимально бы-
строе выведение токсиканта из организма, профилактику гиповолемических
и метаболических нарушений, коррекцию кислотно-основного и электро-
литного баланса. При продолжительной экспозиции токсиканта с целью
I влияния на осмотический градиент массопереноса в состав назначений
вводятся осмотически активные соединения — маннитол и гипертонический
раствор глюкозы. При длительной детоксикации в состав интенсивной те-
рапии включаются средства для парентерального питания. Форсированный
319
диурез проводится по общепринятым методикам в объеме до 6 л в сутки с
введением хлорида калия до 3 г в сутки и лазикса до 200 мг в сутки.
Кислотно-щелочной баланс регулируется введением закисляющего (аскор-
биновая кислота 10—15 мг/кг) и ощелачивающего (натрия гидрокарбонат)
препаратов. Для коррекции нарушений гемодинамики и дыхания применя-
ются аналептики — этимизол, сульфокамфокаин, дофамин. При выражен-
ной дыхательной недостаточности применяется искусственная вентиляция
легких. С целью профилактики гипоксической энцефалопатии при отравле-
ниях назначаются внутривенно пирацетам и рибоксин до 3 г в сутки.
При передозировке опиатами в качестве антидота используется налок-
сон. Инфузия препарата продолжается до развития абстиненции.
При отравлении веществами с антихолинергическим действием, ДЛК и
псилоцибином антидотами служат обратимые ингибиторы холинэстеразы —
галантамин и аминостигмин.
При отравлении метиловым спиртом и этиленгликолем антидотом явля-
ется этиловый спирт (30 % раствор на глюкозе, инфузия до состояния
опьянения).
При поступлении токсиканта в организм через ЖКТ необходимо сделать
зондовое промывание желудка, дать внутрь активированный уголь или дру-
гие сорбенты и слабительные средства.
Лечение абстинентного синдрома при опиатной наркомании. Лечение опи-
атного абстинентного синдрома представлено двумя подходами.
Первый подход является логическим продолжением методики “дробной
деморфинизации”, применявшейся с конца XIX в. Методика предусматри-
вала постепенное лишение наркотика в период от 2 до 6 нед. В настоящее
время за рубежом с данной целью назначают опиатные агонисты с пролон-
гированным действием (метадон и левоальфа-ацетилметадол) или селектив-
ные агонисты-антагонисты (бупренорфин). В России метадон пока не раз-
решен к применению.
Второй подход предусматривает одномоментное (абортивное) лишение
наркотиков и лечение абстинентного синдрома средствами, подавляющими
возбуждение в различных медиаторных системах.
Очевидно, что существование двух подходов обусловлено наличием у них
положительных и отрицательных сторон.
Лечение абстинентного синдрома метадоном является чрезвычайно эф-
фективным. Препарат позволяет купировать синдром за 6—8 дней. Более
того, у ослабленных больных или беременных женщин детоксикация мета-
доном является методикой выбора. Основным недостатком этого метода
является риск формирования новой зависимости, потому что метадон об-
ладает наркогенным потенциалом. Вместе с тем многие зарубежные специ-
алисты этот факт опускают, так как метадон используется для последующей
поддерживающей, а точнее заместительной терапии.
В отношении бупренорфина существуют аналогичные подходы. Изна-
чально на бупренорфин возлагались большие надежды, так как считалось,
что он лишен главного недостатка метадона — способности вызывать зави-
симость. Оптимальный срок детоксикации бупренорфином с постепенным
уменьшением дозы — 36 дней. В длительных циклах детоксикации метадон
и бупренорфин сопоставимы по эффективности. Существует методика де-
токсикации, предусматривающая сочетанное назначение бупренорфина и
опиатного антагониста — налтрексона. Препарат оказался эффективным
при лечении кокаинового абстинентного синдрома, острого отравления ко-
каином, случаев сочетанного злоупотребления героином и кокаином и слу*
320
чаев злоупотребления синтетическими психостимуляторами. Однако посте-
пеНно накопились данные, поставившие под сомнение его достоинства.
Было показано, что отмена бупренорфина сопровождается появлением
опиатоподобных абстинентных расстройств. Имеется и риск формирования
вторичной зависимости.
Среди методик абортивного лишения наркотиков с конца семидесятых
годов наибольшей популярностью за рубежом пользуется метод, основанный
на применении клонидина. Клонидин (клофелин) — агонист аг-адреноре-
цепторов, специфически подавляет адренергическое возбуждение, с кото-
рым связываются многие симптомы абстиненции. Клонидин позволяет ку-
пировать абстинентный синдром в течение 12—14 дней, однако препарат
неодинаково эффективен в отношении отдельных симптомов и малоэффек-
тивен в отношении тяжелых случаев. Клонидин слабо влияет на психические
нарушения при абстиненции и полностью лишен снотворного действия,
вызывает нежелательные гемодинамические сдвиги. Попытки купировать
синдром назначением повышенных доз оборачиваются гипотоническими
коллапсами, нарушением сердечного ритма, а в некоторых случаях и сину-
совой остановкой сердца. Препарат не рекомендуется при коронарной не-
достаточности, поражении сосудов мозга, почечной недостаточности и дру-
гой патологии, распространенной у наркоманов. Задача удержаться в рамках
терапевтических доз клонидина (0,6—0,8 мг в сутки) решается путем созда-
ния комбинаций препаратов из различных групп. В частности, удачной
оказалась комбинация клонидина и опиатного антагониста налорфина. Как
эффективные описываются комбинации клонидина с налоксоном или нал-
трексоном. В отечественной практике для купирования абстиненции из
препаратов с адренолитическим действием получили также распространение
пироксан, анаприлин (бета-адреноблокаторы).
Другим направлением в лечении абстиненции является применение ан-
тихолинергических средств. Выбор этих препаратов, по-видимому, основан
на представлении о холинергической природе симптомов абстиненции. Абс-
тиненция купируется атропином, комбинацией атропина с трициклически-
ми антидепрессантами, которые также обладают холинолитическими свой-
ствами. Как в первом, так и во втором случае течение абстиненции ослож-
нялось делирием, который купируется аминостигмином или галантамином.
Абстинентный синдром купируется в течение 3—6 сут кетамином. При
абстиненции также применяются барбитураты, нейролептики и транквили-
заторы, ноотропы с ГАМКергическими свойствами (баклофен, пирацетам).
Имеются сведения о попытках купировать абстинентный синдром с помо-
щью адренокортикотропного гормона, преднизолона, пептида дельта-сна,
микроволнового облучения, транскраниальной электроаналгезии, электро-
сна, иглорефлексотерапии, гемосорбции и плазмафереза. Внедрение экстра-
корпоральных методов детоксикации в практику лечения абстинентного
синдрома осуществили преимущественно отечественные клиницисты. Од-
нако в отношении частных методик нет единого подхода, а оценка реальной
эффективности экстракорпоральной детоксикации затруднена из-за того,
что она применяется в комплексе с другими средствами.
В собственных исследованиях нами установлена антиабстинентная ак-
тивность у верапамила (финоптин, изоптин) и у антидепрессантов с четы-
Рехциклической структурой: мапротилина (людиомил), миансерина (миан-
сан, леривон) и инказана (метралиндол).
Введение в схему анальгетиков — опиоидов (промедол, бупренорфин,
трамал и др.) мы считаем оправданным, так как в терапевтических дозах на
11 -7127
321
высоте абстиненции они потенцируют действие неопиатных антиабстинент-
ных средств. Трамал не обладает наркогенным потенциалом и не относится
к списку наркотических препаратов, поэтому может более широко исполь-
зоваться, чем другие опиоиды.
Согласно нашему опыту, оптимальной тактикой в фармакотерапии абс-
тинентного синдрома можно считать назначение комбинации лекарствен-
ных средств, которая будет построена на нескольких принципах:
• Выбор препаратов должен осуществляться с учетом их антиабстинент-
ного селективного действия.
• Дозировка и распределение назначений антиабстинентных средств
должны учитывать динамику облигатных и факультативных симпто-
мов и общую токсическую нагрузку на организм.
• При комбинировании лекарственных средств необходимо исключить
одновременное назначение препаратов, взаимно усиливающих отри-
цательное влияние на факультативные симптомы.
• Проявление побочных эффектов лекарственных средств может быть
ослаблено введением в схему лечения препаратов — функциональных
антагонистов, которые оказывают и положительное влияние на об-
лигатные симптомы абстиненции.
• При лечении абстинентного синдрома необходимо учитывать исход-
ное соматическое и психическое состояние больного.
В качестве примера удачной комбинации можно привести следующую
схему лечения.
На фоне начальных проявлений абстиненции больному назначается в
суточных дозах внутрь людиомил — 150 мг или миансан (леривон) в соот-
ветствующих дозировках; верапамил — 320 мг; амитриптилин — 75 мг; на-
трия оксибутират — 8—12 г; феназепам — 10 мг внутрь. Совокупность этих
назначений в первые сутки лечения обеспечивает сомнолентное состояние,
отсутствие психотических нарушений, стабильные показатели гемодина-
мики.
На 2-е сутки лечения в утренние часы отменяются или резко ограничи-
ваются все назначения, но в схему вводится трамал — 300—600 мг в сутки
подкожно или внутрь. Назначения от первых суток в разовых дозах повто-
ряются на ночь, что обеспечивает нормальный ночной сон.
На 3-и сутки трамал с утра дают только по показаниям (алгические
явления). В схему вводится пирацетам до 3 г в сутки. На ночь — трамал
200 мг и снотворные средства (натрий оксибутират, феназепам). На четвер-
тые сутки и далее — назначения аналогичные. Суточные дозы пирацетама и
трамала сокращаются.
Начиная с 6—7-х суток явления абстиненции полностью купируются.
В клинической картине на первый план выступают астенические, аффек-
тивные расстройства, стойкая бессонница и другие нарушения, являющиеся
задачей следующего этапа лечения.
Лечение абстинентного синдрома при других формах токсикоманий. В ле-
чении абстинентного синдрома при других формах токсикоманий соблюда-
ются изложенные выше принципы. Назначаются комбинации из адренобло-
кирующих средств (анаприлин, пироксан), антагонистов кальция (верапа-
мил, нифедипин), бензодиазепинов (феназепам, диазепам), натрия окси-
бутирата, антидепрессантов (амитриптилин, мапротилин, миансерин) и ней-
ролептиков (дроперидол, клозепин). Барбитураты и бензодиазепины отме-
няются только дробно с введением в схему противосудорожных средств
322
(финлепсин, бензонал). Наибольшую избирательную активность по отноше-
нию к дисфорическим состояниям при злоупотреблении психостимулятора-
ми обнаруживает клозапин (азалептин, лепонекс). Психомоторное возбуж-
дение лучше купировать дроперидолом.
Лечение абстинентного синдрома при алкоголизме. Особенностью алко-
гольной абстиненции является ее частое сочетание с явлениями интоксика-
ции подострого характера. Поэтому в случаях массированного алкогольного
эксцесса или запоя целесообразно провести форсированный диурез. Для
ускорения метаболизма ацетальдегида (метаболит этанола, сильный прото-
плазматический яд) в схему лечения вводятся аскорбиновая кислота, вита-
мины группы В, никотиновая кислота, рибоксин. Высокой детоксикацион-
ной и антиабстинентной активностью обладают метадоксил (Италия) и
пикамилон (Россия). Следует учесть, что алкогольная абстиненция часто
сопровождается артериальной гипертензией, пароксизмальной тахикардией,
острым панкреатитом и другой соматической патологией, требующей неот-
ложного вмешательства и набора средств симптоматической и патогенети-
ческой терапии. Комбинируя психотропные средства, следует сделать выбор
в пользу натрия оксибутирата и бензодиазепинов. Аминазин и амитрипти-
лин противопоказаны из-за их способности провоцировать психозы в ост-
ром периоде абстиненции. Психомоторное возбуждение купируется дропе-
ридолом.
Лечение алкогольного делирия и других острых алкогольных психозов.
Современная тактика лечения острых алкогольных психозов предусматри-
вает проведение форсированного диуреза с введением в схему больших доз
аскорбиновой кислоты, витаминов Bl (до 1 г в сутки) и Bg, АТФ и других
мероприятий для профилактики отеков, гипоксии головного мозга. Следует
учесть, что современные психотропные средства не обнаруживают достовер-
ной антипсихотической активности при острых экзогенных психозах. По-
казаниями для их применения являются тревога, бессонница и психомотор-
ное возбуждение. Препаратами выбора являются натрий оксибутират, бар-
битураты и бензодиазепины с противотревожным действием (феназепам,
диазепам). В случаях мусситирующего делирия и острых энцефалопатий
введение психотропных средств противопоказано.
Лечение затяжных и хронических алкогольных психозов. В лечении затяж-
ных и хронических алкогольных психозов следует придерживаться синдро-
мального подхода. Препаратами выбора являются нейролептики. При за-
тяжных и хронических галлюцинозах и параноиде назначается галоперидол
или другие нейролептики — бутирофеноны. Алкогольный бред ревности ле-
чится трифтазином.
Лечение психических нарушений постабстинентного периода. Вне зависи-
мости от формы токсикоманий в постабстинентном периоде наиболее ха-
рактерны аффективные, психопатоподобные и астенические расстройства.
При ведущих аффективных расстройствах выбор делается между амитрип-
тилином, мелипрамином, людиомилом и леривоном. Неулептил и азалептин
обнаруживают избирательную активность по отношению к психопатоподоб-
ным состояниям. При ведущих астенических явлениях эффективный резуль-
тат может быть достигнут неспиртовыми формами адаптагенов (экстракт
Родиолы розовой сухой, препараты женьшеня и др.).
Противорецидивная терапия. Противорецидивная терапия также предус-
матривает коррекцию психических нарушений, но на первый план высту-
пают психотерапия и социальная реабилитация. Целью психотерапии явля-
ется формирование стойкой установки на прекращение наркотизации (ал-
323
коголизации). В отдельных случаях эффективными оказываются эмоцио-
нально-стрессовые суггестивные процедуры.
При алкоголизме сохраняют свою актуальность методики, основанные
на назначении или имплантации препаратов дисульфирама (эспераль). Ди-
сульфирам при наличии в организме алкоголя блокирует распад ацетальде-
гида, вызывая тем самым токсико-аллергическую реакцию. Назначению
дисульфирама должна предшествовать аверсивная психотерапия. Суть ее
методов заключается во введении в организм одновременно с алкоголем
средств, вызывающих бурную вегетативную реакцию (например, рвоту).
С этой целью используется апоморфин (0,2—0,5 мл 1 % раствора). Антидо-
тами при тяжелой реакции служат нейролептики — фенотиазины (аминазин,
этаперазин). Менее выраженную реакцию вызывают магния сульфат и ни-
котиновая кислота. В последние годы с аналогичными целями стали ис-
пользоваться средства для наркоза короткого действия типа кетамина (ка-
липсол) и даже миорелаксанты типа дитилина. Процедуры с использованием
этих препаратов Должны выполняться анестезиологом в отделении интен-
сивной терапии.
При опиатной наркомании для противорецидивной терапии применяют
селективный опиатный /ш-антагонист налтрексон (трексан). Налтрексон
блокирует центральные эффекты опиатов, тем самым предупреждает слу-
чайный срыв. Более слабый антагонистический эффект с опиатами был
зарегистрирован у нифедипина (коринфар). Вместе с тем эти методы вне
комплексной психотерапии неэффективны. В отношении других токсико-
маний методы фармакологической антидотной терапии остаются неразра-
ботанными.
Большую роль в предотвращении рецидива играют мероприятия по нор-
мализации семейных отношений и социальной реадаптации.
ЛИТЕРАТУРА
1. Анохин П.К. Очерки по физиологии функциональных систем. — М.: Медицина,
1975.-447 с.
2. Бабаян Э.А., Ганопольский М.Х. Наркология. — М.: Медицина, 1990. —336 с.
3. Вальдман А. В., Бабаян Э.А., Звартау Э.Э. Психофармакологические и медико-
правовые аспекты токсикоманий. — М: Медицина, 1998. — 285 с.
4. Гельдер М., Гэт Д., Мейо Р. Оксфордское руководство по психиатрии/ Пер. с
англ. — Киев: Сфера, 1997. — Т. 2. — 435 с.
5. Международная классификация болезней (10-й пересмотр). Классификация пси-
хических и поведенческих расстройств/Пер. с англ. — СПб.: Алис, 1994. — 302
с.
6. Пятницкая П.Н. Наркомании. Руководство для врачей. — М.: Медицина, 1994. —
541 с.
Глава 9
ВЕЩЕСТВА РАЗДРАЖАЮЩЕГО ДЕЙСТВИЯ
9.1. Общие положения
Многие химические соединения обладают способностью оказывать раздра-
жающее действие — вызывать развитие воспалительного процесса в тканях
при контакте с ними. При этом первичный характер изменений зависит от
химических свойств вещества, а последующее воспаление не связано с природой
первичного поражения.
При острых ингаляционных отравлениях раздражающими ядами у по-
страдавших возможно развитие (в зависимости от концентрации и продол-
жительности экспозиции, реактивности организма и особенностей действия
вещества) от острого токсического ларингофарингита и/или бронхита до
токсической пневмонии и отека легких. Значительное место в течение
острой интоксикации принадлежит рефлекторным реакциям, которые обу-
словлены сильным раздражением интерорецепторов бронхиального дерева
и могут сопровождаться выраженными расстройствами моторики.
Длительное профессиональное ингаляционное воздействие раздражаю-
щих ядов в низких концентрациях (превышающих ПДК в воздухе рабочей
зоны в 3 раза и более) приводит к хроническим поражениям органов
дыхания работающих, которые могут иметь различную распространенность
и выраженность. В некоторых случаях процесс ограничивается нарушения-
ми в верхних дыхательных путях (катаральные, атрофические, реже — гипер-
трофические изменения слизистой оболочки), в других, наиболее часто
встречающихся случаях имеет место поражение более глубоких отделов
дыхательного тракта с развитием хронического токсического бронхита и
пневмосклероза.
При попадании на кожу раздражающие яды способны вызывать различ-
ные ее нарушения — от легкой формы контактного дерматита до тяжелых
некротических изменений с образованием труднозаживающих кровоточа-
щих язв.
В последние годы активно изучается роль раздражающих ядов в развитии
аллергических нарушений дыхательной системы у населения. Предполага-
ется, что определенную роль в патогенезе указанных заболеваний играет
стимуляция раздражающими веществами (такими как сернистый ангидрид
и двуокись азота) образования медиаторов воспаления — противовоспали-
тельных цитокинов (в том числе — a-фактора некроза опухолей и интерлей-
кина-1), хемокинов (интерлейкина-8), окиси азота и др. [17, 18, 20, 22, 23].
В силу особенностей вредного действия на организм — способности вы-
зывать у работающих неприятные субъективные ощущения и легко обнару-
живаемые поражения кожи, слизистых оболочек глаз и дыхательной систе-
мы — вещества с раздражающими свойствами издавна находятся в поле
зрения гигиенистов и токсикологов. Так, среди первых веществ, для которых
в нашей стране установлены в 1922 г. ПДК в воздухе рабочей зоны, были
сернистый ангидрид, окислы азота и хлористый водород.
Еще Г.Гендерсен и Х.Хаггард не только выделяли группу раздражающих
325
ядов, но и разделяли ее на две подгруппы. К первой — “первично раздра-
жающие вещества” относятся соединения, обладающие в основном раздра-
жающим действием. Ко второй — “вторичным раздражающим” относятся
химические соединения, действие которых суммируется за счет общего
токсического и раздражающего.
В настоящей главе описаны некоторые закономерности действия на
организм веществ первой группы, обладающих избирательным раздражаю-
щим эффектом. Критерием включения вещества в эту группу является
величина зоны специфического раздражающего действия (Zir = Limac/Limir).
Если раздражающее действие вещества проявляется в концентрации ниже,
чем общетоксический эффект (Zjr > 1), то оно относится к избирательно
действующим раздражающим ядам [6].
Избирательно действующие раздражающие яды (кислоты, щелочи, ве-
щества с кислотными и основными свойствами, амины, альдегиды и их
галоидопроизводные, некоторые иминосоединения и многие другие) часто
используются в промышленности. В списке “ПДК вредных веществ в воз-
духе рабочей зоны” (ГН 2.2.5.686-98), по нашим подсчетам, 8,7 % составля-
ют избирательно раздражающие яды. Среди химических загрязнителей ок-
ружающей среды также немало подобных веществ. В последние годы уста-
новлены гигиенические нормативы содержания в воздухе рабочей зоны и
атмосфере населенных мест для многих новых химических загрязнителей
окружающей среды с раздражающими свойствами (четырехфтористая сера,
хлорангидрид кротоновой кислоты и др.).
В настоящей главе приведены данные о биомаркерах раздражающего
действия на дыхательную систему, закономерностях развития хронической
интоксикации и видовой чувствительности к раздражающим ядам, а также
о зависимости между параметрами токсикометрии веществ этой группы. На
основе указанных данных разработана система оценки и гигиенического
нормирования раздражающих химических соединений в воздухе рабочей
зоны.
Данные экспериментальных исследований, приведенные в этой главе,
получены автором совместно с А.А.Германовой, В.С.Поздняковым, А.А.Ас-
мангуляном, Л.П.Коротич, А.М.Бегишевым, А.М.Клячкиной и Р.П.Родио-
новой, сотрудниками Отдела токсикологии НИИ медицины труда и про-
мышленной экологии РАМН.
9.2. Биомаркеры раздражающего действия веществ
на дыхательную систему
Измерение частоты дыхания. В механизме рефлекторного влияния раз-
дражающих ядов на дыхание основная роль принадлежит тройничному
нерву, что подтверждено в многочисленных экспериментах, включавших его
прямую стимуляцию или перерезку. При раздражении чувствительных во-
локон тройничного нерва в слизистой оболочке носа возникают афферент-
ные импульсы, которые вызывают снижение частоты дыхания. При инга-
ляции раздражающих веществ также происходит стимуляция окончаний
гройничного нерва, что и приводит к зависимому от концентрации сниже-
нию частоты дыхания.
Определение частоты дыхания у подопытных животных является наибо-
лее распространенным и доступным тестом при исследовании раздражаю-
щих ядов.
В диапазоне концентраций Limac — Limch ингаляция раздражающих ве-
326
Рис. 9.1. Изменение частоты дыхания у крыс при однократном воздействии раздра-
жающих веществ.
1 — хлорацетопропилацетат; 2 — этиловый эфир 6-кето-8-хлороктановой кислоты; 3 — аммиак;
4 — бромистый водород; 5 — сернистый ангидрид; 6 — бромацетопропилацетат; 7 — бром; 8 —
гидроперекись третичного бутила; 9 — морфолин; 10 — йод; 11 — средняя.
ществ, как правило, приводила к изменению частоты дыхания. Развитие
изменений указанного показателя было связано с увеличением концентра-
ции вещества в воздухе, что позволяет устанавливать минимально эффек-
тивные и недействующие уровни для раздражающих ядов. Подавляющее
большинство веществ вызывало угнетение частоты дыхания у подопытных
животных (при измерении непосредственно после окончания 4-часовой
экспозиции), что согласуется с представлениями о влиянии возбуждения
рецепторного поля тройничного нерва верхних дыхательных путей на час-
тоту дыхания и служит подтверждением именно раздражающего эффекта
изученных ядов [15].
Степень снижения частоты дыхания у подопытных животных зависит от
величины концентрации действующего химического агента (рис. 9.1).
Если выразить концентрации раздражающих веществ в частях от 1лт,г,
то для каждого из них возможно получить уравнение степени изменения
частоты дыхания от уровня воздействия. Например,
SO2: у = 178,6 - 54,5 • х (г = 0,96; р<0,05);
Вг2: у = 143,7 - 1,1 х (г = 0,65; р<0,05).
В целом указанная зависимость выражается уравнением:
у= 147-9 х (г =0,54; р<0,05),
где у — частота дыхания белых крыс (дыханий/минуту), х — концентрация
вещества в частях от Limir.
На рис. 9.2 демонстрируются изменения частоты дыхания у крыс при
ингаляции некоторых раздражающих веществ в различных концентрациях.
327
Рис. 9.2. Изменение частоты дыхания у крыс во время 4-часовой экспозиции сер-
нистого ангидрида в различных концентрациях.
1 — 80 мг/м3; 2 — 280 мг/м3; 3 — 740 мг/м3 (норма т±28).
Важно отметить, что в пределах концентраций веществ на уровне Limac—
Limjr снижение частоты дыхания у белых крыс не превышало 20—30 % от
исходного уровня. Более глубокое угнетение частоты дыхания имело место
при ингаляции ядов в частично смертельных концентрациях. Так, однократ-
ная ингаляция паров брома приводила к снижению частоты дыхания у крыс
до 96±94 дых/мин (примерно 50 % от исходного уровня) лишь при концент-
рации, соответствующей */5 ЬС50.
Возможно предположить, что при регистрации частоты дыхания у жи-
вотных после экспозиции выявляются лишь наиболее выраженные измене-
ния дыхательной системы, которые не были компенсированы регуляторны-
ми механизмами в течение экспозиции.
Для решения этого вопроса было проведено изучение динамики изме-
нения частоты дыхания у подопытных животных после 4-часовой экспози-
ции и в течение периода воздействия яда. Так, была проведена непрерывная
регистрация частоты дыхания у крыс при действии сернистого ангидрида в
различных концентрациях. При ингаляции сернистого ангидрида в концент-
рации 50 мг/м3 частота дыхания подопытных животных существенно не
отличалась от контроля. Воздействие трех больших концентраций яда вы-
зывало нарушение ритма дыхания у подопытных животных по сравнению с
параллельным контролем. При этом выраженность нарушений возрастала с
увеличением действующей концентрации газа (см. рис. 9.2). Воздействие
сернистого ангидрида в концентрации 80 мг/м3 вызвало учащение дыхания
в течение первой половины экспозиции. Наиболее резкое увеличение час-
тоты дыхания имело место в конце первого часа. Ингаляция сернистого
328
ангидрида в концентрации 280 мг/м3 вызвала вначале урежение, а потом
увеличение частоты дыхания. Наиболее высокая из испытанных концентра-
ций привела, напротив, к резкому замедлению дыхания у животных, осо-
бенно в первые 70 мин воздействия. В течение экспозиции имели место
периоды нормализации частоты дыхания, а окончательное ее восстановле-
ние происходило в течение 1 ч после прекращения воздействия вещества.
Аналогичные наблюдения были сделаны и при ингаляции третичного
ацетиленового карбинола. Воздействие вещества в концентрации 360 мг/м3
вызывало заметное угнетение частоты дыхания у крыс на протяжении пе-
риода экспозиции. Более низкая концентрация третичного ацетиленового
карбинола (8 мг/м3) оказалась недействующей.
В случае сернистого ангидрида изменение частоты дыхания у животных
при регистрации после экспозиции отмечалось при концентрации 500 мг/м3
и выше, что значительно превосходит минимально эффективную концент-
рацию этого вещества, установленную по изменению частоты дыхания во
время экспозиции (80 мг/м3). Указанное подчеркивает роль общих регуля-
торных механизмов в развитии реакции организма на воздействие раздра-
жающих веществ. В практическом плане полученные данные свидетельст-
вуют о предпочтительном измерении частоты дыхания у подопытных жи-
вотных во время экспозиции (несмотря на определенные методические
трудности) для установления Limjr.
Изменение “остроты обоняния”. В клинической практике издавна исполь-
зуются сравнительно простые методы ольфактометрии для характеристики
функции обонятельного анализатора и слизистой оболочки носа. Объектив-
ная ольфактометрия основывается на безусловных рефлексах и тесных свя-
зях обонятельного анализатора с различными отделами головного мозга.
Предложено несколько тестов, основанных на ольфактивно-пупилярном,
психогальваническом и других рефлексах. С успехом в объективной ольфак-
тометрии используется электроэнцефалография и регистрация частоты пуль-
са. Разработанный нами метод объективной ольфактометрии у животных,
основанный на ольфакторно-респираторном рефлексе, заключается в изме-
нении дыхательного ритма вследствие обонятельного ощущения.
Определение “остроты обоняния” (ориентировочной реакции на запа-
ховые компоненты) животных (белых крыс) проводили к ряду ольфакторных
веществ (дегтю, тимолу, камфоре и розмарину).
В настоящее время нами накоплены данные об ориентировочной реак-
ции животных на запаховые компоненты после однократной ингаляции
более 50 промышленных ядов.
Большинство изученных веществ вызывало снижение “остроты обоня-
ния” у подопытных животных, причем выраженность изменений зависела
от величины действовавшей концентрации яда (рис. 9.3).
При математической обработке выявлена зависимость между концент-
рацией вещества, которую выражали в частях от Limjr, и степенью снижения
остроты обоняния, которая для отдельных ядов имела следующий вид:
НВг: у = 0,49 + 0,39х (г = 0,93; р<0,05);
SO2: у = 0,4 + 0,7х (г = 0,89; р<05);
NH3: у = 0,57 + 0,38х (г = 0,71; Р<0,05).
В общем виде указанная зависимость имела вид:
у = 0,013 + 0,07х,
где у _ количество воздуха (мл, содержащее запаховое вещество — тимол),
329
Рис. 9.3. Зависимость изменения “остроты обоняния” крыс от концентрации раздра-
жающих веществ.
1 — этиловый эфир б-кето-8-хлороктановой кислоты; 2 — SO2; 3 — ГПТБ; 4 — СеСЦ; 5 — NH3;
6 — НВг; 7 — средняя.
которое изменяет частоту дыхания животного); х — концентрация раздража-
ющего вещества в частях от Limjr
После воздействия ядов отмечалось одновременное снижение остроты
обоняния животных ко всем 4 запаховым компонентам примерно в равной
степени, что позволяет сделать предположение о том, что ингаляция веществ
с раздражающими свойствами влияет не на ту или иную функцию обоня-
тельного анализатора, а поражает в целом слизистую оболочку верхних
дыхательных путей, в том числе обонятельный анализатор. При морфоло-
гическом исследовании слизистой оболочки носа после воздействия сернис-
того ангидрида, брома, бромистого водорода, йода, гидроперекиси третич-
ного бутила в концентрациях примерно на порядок выше минимально
эффективных по снижению остроты обоняния обнаружили изменения об-
щего характера — отек, небольшие кровоизлияния в области обонятельного
эпителия, деструктивные изменения клеток респираторной области.
При ингаляции более низких концентраций указанных веществ качест-
венных морфологических изменений не обнаружено.
От величины действовавшей концентрации вещества с раздражающими
свойствами зависит не только выраженность снижения остроты обоняния
непосредственно после ингаляции, но и скорость нормализации развившихся
изменений.
Так, в первые сутки после воздействия паров брома количество воздуха,
содержащего розмарин и вызвавшего изменения частоты дыхания у крыс,
330 i
возрастало в среднем до 5 мл. Нормализация данного показателя происхо-
дила на 3-и сутки. Аналогичное снижение чувствительности обоняния про-
исходило к тимолу, камфоре и дегтю. Ингаляция брома в концентрации на
порядок ниже также вызывала снижение чувствительности обоняния, одна-
ко через сутки каких-либо различий между подопытными и контрольными
животными не обнаружено. Ингаляция самой низкой из испытанных кон-
центраций паров Вг2 (0,75 мг/м3) не вызывала проявлений раздражающего
эффекта.
Клеточная реакция верхних дыхательных путей и легких. Важным показа-
телем функционального состояния слизистой оболочки верхних дыхатель-
ных путей является миграция на ее поверхность клеточных элементов. Еще
в 1931 г. М.А.Ясиновским было высказано предположение, что о выражен-
ности патологического процесса и степени поражения дыхательного тракта
можно судить по количеству свободных клеток, смываемых со слизистой
оболочки.
Увеличение миграции лейкоцитов на слизистую оболочку носа является
одним из ранних признаков поражения слизистой оболочки верхних дыха-
тельных путей у рабочих, подвергающихся хроническому влиянию низких
концентраций раздражающих веществ. Так, среднее количество клеточных
элементов на слизистой оболочке носа у рабочих, подвергающихся воздей-
ствию производственных вредностей, в том числе SO2, фтора и др., превы-
шало среднюю физиологическую норму в 3—12 раз.
Исследование качественного и количественного состава смывов с верх-
них дыхательных путей и легких крыс, подвергавшихся кратковременному
воздействию веществ, обладающих раздражающим действием, позволило
установить ряд закономерностей формирования клеточной реакции дыха-
тельной системы под влиянием химических агентов. Из 56 исследованных
ядов 48 вызывали изменения указанного показателя в концентрациях на
уровне Limac— Limir.
Так, было установлено, что ингаляция паров йода в концентрации
100 мг/м3 приводила к изменению клеточной реакции в обоих отделах
дыхательного тракта; воздействие яда в концентрации 30 мг/м3 вызывало
усиленный выход свободных клеточных элементов в легких, а пары йода в
концентрации 10 мг/м3 (Limjr) не влияли на количество свободных клеточ-
ных элементов в перфузате.
Воздействие монохлористой серы в концентрации 90 мг/м3 приводило к
увеличению количества свободных клеточных элементов и в верхних дыха-
тельных путях (опыт 354±48, контроль 155±21,4 кл/мм3, р<0,01), и в глубоких
отделах легких (опыт 164118,2, контроль 6415,3 кл/мм3; р<0,05), в то время
как ингаляция вещества на уровне 8—7 мг/м3 оказалась неэффективной.
Аналогичные результаты получены при воздействии бромистого водорода,
Четыреххлористого германия, йода, аммиака, третичного ацетиленового кар-
бинола, двуокиси азота, аэрозолей каустической соды и гидроперекиси
третичного бутила.
Значительная вариабельность содержания клеток в смывах с легких и
особенно верхних дыхательных путей (годовая физиологическая норма
ЗО7±268 кл/мм3) затруднила возможность установления зависимости коли-
чества клеток в перфузате от величины действующей концентрации. Но для
отдельных веществ указанная зависимость прослеживается. Так, при инга-
ляции аммиака в концентрации 463 мг/м3 количество клеток в перфузате
верхних дыхательных путей составило 734,4+58,9 кл/мм3, в то время как при
Ингаляции аммиака в концентрации 228 мг/м3 их количество равнялось
331
522,4±18,0 кл/мм3. Аналогичные результаты имели место в опытах с йодом,
монохлористой серой, гидроперекисью третичного бутила.
Проведение наряду с регистрацией общего количества клеток перфузата
детального цитологического его исследования позволило определить роль
отдельных клеточных элементов в формировании реакции на воздействие
раздражающих веществ. Важно было установить, какие именно клеточные
элементы принимают участие в этой реакции и зависит ли состав перфузата
от конкретного исследуемого соединения. При анализе клеточного состава
в перфузатах глубоких отделов дыхательного тракта обнаруживали альвео-
лярные макрофаги — крупные клетки с овальным или бобовидным ядром и
светлой “кружевной” протоплазмой; клетки бронхиального эпителия в виде
отдельных клеток или целых групп клеток, иногда с ресничками и ядрами,
расположенными линейно на некотором расстоянии от края клеток, а также
нейтрофилы и лимфоциты, имеющие те же отличительные особенности, что
и соответствующие элементы крови. В составе клеточных элементов перфу-
затов верхних дыхательных путей определялись нейтрофилы, лимфоциты,
клетки многослойного плоского эпителия, выстилающие преддверие носо-
вой полости и многоядерного плазматического мерцательного эпителия,
выстилающего дыхательную часть носовой полости, гортань и трахею. Два
последних вида клеток регистрировались нами как “эпителиальные клетки”.
Наряду с указанными клетками в составе перфузатов верхних дыхательных
путей были обнаружены клетки, напоминающие моноциты крови.
Показано, что от величины действующей концентрации яда зависело не
только общее количество клеточных элементов перфузата, но и его состав.
Так, при ингаляции четыреххлористого германия в концентрации 12,8 мг/м3
в составе перфузата легких преобладали макрофаги, а при воздействии
большей концентрации (18,8 мг/м3) к ним присоединяются нейтрофилы
(рис. 9.4). Однократное воздействие йода в концентрации 30 мг/м3 вызывало
в легких усиленный выход только макрофагов. Увеличение действующей
концентрации в 3 раза привело к тому, что в перфузате легких появились
нейтрофилы, эпителиальные клетки, лимфоциты, а в перфузате верхних
дыхательных путей — нейтрофилы. Подобная зависимость имела место и
при ингаляции бромистого водорода, аммиака, гидроперекиси третичного
бутила.
Состав перфузатов при действии различных соединений существенно не
различался между собой. В легких клеточная реакция на ингаляцию раздра-
жающих веществ определяется выходом в полость альвеол макрофагов. Чаще
всего к ним присоединялись нейтрофилы. Подобный характер изменений
имел место при воздействии четыреххлористого германия, монохлористой
серы, йода, гидроперекиси третичного бутила, двуокиси азота. Как известно,
миграция альвеолярных макрофагов может быть связана с непосредствен-
ным повреждающим действием изучаемых ядов на ткань легких, вследствие
чего усиливается имеющееся в физиологических условиях отторжение кле-
ток альвеолярной стенки. Одновременное присутствие в перфузате нейтро-
филов, свидетельствующее о повышении сосудистой проницаемости, позво-
ляет предположить, что часть макрофагов, входящих в состав перфузата
легких, мигрирует в альвеолы вместе с нейтрофилами из кровяного русла
или прилежащей соединительной ткани, имеет, таким образом, экстрапуль-
мональное происхождение.
Изменения в составе перфузатов верхних дыхательных путей после ин-
галяции раздражающих веществ большей частью определяли нейтрофилы-
Однако наряду с ними изменялось и содержание лимфоцитов и эпители-
332
Концентрация 12,8 мг/м3
Концентрация 9,0 мг/м3
Рис. 9.4. Изменение клеточного состава смывов с легких после однократного воз-
действия четыреххлористого германия в различных концентрациях.
I — макрофаги; 2 — нейтрофилы; 3 — лимфоциты; 4 — эпителиальные клетки; а — опыт; б —
контроль.
альных клеток (монохлористая сера), эпителия иммуноцитов (гидроперекись
третичного бутила) и лимфоцитов (третичный ацетиленовый карбинол).
Таким образом, состав перфузатов подтверждает воспалительный характер
изменений, возникающих в легких и верхних дыхательных путях после
действия раздражающими веществами, причем проявление воспаления не
зависело от химической структуры вызвавшего их соединения.
Ингаляция раздражающих веществ приводила не только к изменению
числа клеточных элементов, но и к изменению их функциональной актив-
ности. По данным Л.П.Коротич [8], ингаляция паров брома в концентрации
на уровне Limjr усиливало переваривающую способность альвеолярных мак-
рофагов, а после ингаляции вещества на уровне Limac имело место снижение
их фагоцитарной активности.
Большинство изученных веществ после ингаляции вызывало увеличение
333
количества свободных клеточных элементов перфузата. Подобная направ-
ленность реакции может быть объяснена именно воспалительным характе-
ром изменений, поскольку усиленная миграция клеточных элементов в очаг
воспаления является составным компонентом воспалительной реакции. Од-
нако ингаляция парами брома в концентрации в 5 раз выше Limjr приводила
к уменьшению клеточных элементов перфузатов легких. Причем более низ-
кая концентрация паров брома, напротив, стимулировала выход свободных
клеточных элементов в просвет альвеол. Принимая во внимание широко
известные данные о цитотоксическом действии некоторых химических со-
единений, можно предположить, что снижение свободных клеточных эле-
ментов связано с разрушающим действием на клетки испытанных веществ
в определенных концентрациях.
От величины действующей концентрации яда зависит и обширность
поражения дыхательного тракта.
В наших опытах одновременно с количественной оценкой реакции лег-
ких определялось содержание свободных клеточных элементов в просвете
верхних дыхательных путей экспериментальных животных. При этом пока-
зано, что после ингаляции испытанных веществ изменения клеточной ре-
акции возникали в различных отделах дыхательного тракта. Глубокие отделы
дыхательного тракта оказались более чувствительными к воздействию паров
брома, тетрахлорида германия, бромистого водорода, двуокиси азота, в то
время как аммиак, сернистый ангидрид, гидроперекись третичного бутила
вызывали преимущественное поражение верхних дыхательных путей.
Некоторые вещества (монохлористая сера, третичный ацетиленовый кар-
бинол) вызывали одновременное изменение и в глубоких, и в верхних
отделах дыхательного тракта. Учитывая некоторые физико-химические
свойства и, в частности, растворимость в воде, можно было предположить,
что преимущественное поражение того или иного отдела дыхательного трак-
та связано со способностью хорошо растворимых в воде веществ задержи-
ваться верхними отделами дыхательного тракта, а плохо растворимых —
проникать в глубокие отделы дыхательной системы [16].
Сернистый ангидрид и аммиак, хорошо растворимые в воде и практи-
чески полностью задерживающиеся слизистыми оболочками носоглотки,
вызывали прежде всего изменения качественного и количественного состава
перфузатов верхних дыхательных путей. Напротив, бром, растворимость
паров которого в воде в 2 раза ниже, чем SO2, проникал в глубокие отделы
дыхательной системы и вызывал их преимущественное поражение. Однако
эта зависимость прослеживается не для всех исследованных веществ. В част-
ности, такие хорошо растворимые вещества, как бромистый водород и
четыреххлористый германий, вызывали прежде всего изменения в глубоких
отделах дыхательного тракта. Более того, четыреххлористый германий —
соединение легко гидролизующееся — частично разлагался в верхних дыха-
тельных путях с образованием высокодисперсного аэрозоля НС1, проник-
новение которого в легкие затруднительно.
Отсюда следует, что связь преимущественного поражения того или иного
отдела дыхательного тракта с особенностями биологического действия изу-
чаемого соединения определяется не только растворимостью вещества в
воде. Вероятно, определенную роль в формировании клеточной реакции
играет и концентрация водородных ионов на поверхности слизистой обо-
лочки, которая может определять цитологическую картину экссудата при
воспалении [21].
Известно, что содержание свободных клеточных элементов в легких
334
изменяется при воздействии многих факторов внешней среды [26]. Выдви-
гались предположения использовать этот показатель для интегральной оцен-
ки качества атмосферного воздуха. Поэтому представляли интерес данные
об изменении количества клеток в дыхательной системе при однократной
ингаляции веществ, не обладающих раздражающим эффектом. Результаты
исследования гидрида германия (в концентрации в 2 раза выше Limac) и
диметилового эфира терефталевой кислоты, которые не являются раздража-
ющими ядами, показали отсутствие клеточной реакции легких и верхних
дыхательных путей при их кратковременной экспозиции. Указанные факты
позволяют сделать вывод о том, что выход клеточных элементов в просвет
дыхательного тракта после однократной ингаляции связан с наличием у
веществ раздражающих свойств.
Развитие паранекротических изменений в тканях легких. Как известно,
содержание основных гранулярных красителей в тканях позволяет судить о
функциональном состоянии клеток. При окраске нормальных клеток ядро
и цитоплазма остаются бесцветными, а краситель откладывается в прото-
плазме в виде гранул. При повреждении клетки наряду с подавлением
различных клеточных функций снижается ее способность откладывать кра-
ситель в гранулах. Одновременно ядра и цитоплазма приобретают способ-
ность окрашиваться диффузно. При возвращении клетки к исходному со-
стоянию восстанавливаются и нормальные отношения к красителю.
Показатели витального окрашивания весьма чувствительны к различным
воздействиям на организм.
В наших исследованиях изучали паранекротические изменения в ткани
легких с помощью регистрации прижизненной окраски по методу Я.И.Ажи-
па в модификации А.Л.Германовой.
Регистрацию накопления и выведение красителя нейтрального красного
в тканях легких проводили после ингаляции 47 химических соединений.
Подавляющее большинство веществ приводило к изменению накопления
и/или выведения красителя в ткани легких в зависимости от величины кон-
центрации. В этих случаях были установлены минимально эффективные и
недействующие по указанному показателю концентрации веществ в воздухе.
Следует отметить, что при действии ядов способность ткани легких
накапливать краситель изменялась по разному. Так, ингаляция 2-хлорэтан-
сульфохлорида в концентрации 12 мг/м3 вызывала увеличение накопления
красителя по сравнению с контролем (опыт — 0,68±0,022, контроль —
0,6±0,021 ед. экстинкции), а при концентрации 34 мг/м3 наблюдалось сни-
жение количества красителя в ткани легких (опыт — 0,62±0,02, контроль —
О,69±О,О21 ед. экстинкции). Аналогичные изменения наблюдались при воз-
действии хлорокиси фосфора. Концентрация яда 4 мг/м3 вызывала сниже-
ние, а концентрация 8 мг/м3 — повышение количества красителя в тканях
легких по сравнению с контролем.
В некоторых случаях отклонение показателя выведения отсутствовало,
тогда как при воздействии меньшей концентрации вещества изменения
имели место. При ингаляции большей концентрации яда отклонения от
контроля выявлялись вновь. Такие явления, которые могут быть связаны с
фазовыми колебаниями накопления и выведения красителя, отмечены при
воздействии бромацетопропилацетата. Указанное вещество в концентрации
4 мг/м3 вызывало только повышение скорости выведения красителя из
ткани легких; при воздействии концентрации 12 мг/м3 не наблюдалось
отличий от контроля ни накопления, ни выведения красителя, в то время
как при концентрации 19 мг/м3 оба приведенных показателя изменялись.
335
Рис. 9.5. Петля гистерезиса у здоровой крысы и у
крысы после однократного воздействия двуокиси
азота в концентрации на уровне Limjr.
1 — контроль; 2 — опыт.
Фазовые колебания накопления и выве-
дения красителя отмечали ряд авторов. Они
установили, что количество красителя в гра-
нулах в протоплазме зависит как от сродства
к красителю, так и от интенсивности про-
цесса гранулообразования. Поэтому сниже-
ние количества гранулярного красителя в
ткани может иметь место и при повышении
сорбционных свойств протоплазмы. При по-
вреждении протоплазмы некоторыми агента-
ми подавлению гранулообразования предше-
ствует стадия его усиления, что может сти-
мулировать увеличение сорбционной спо-
собности.
Активность сурфактанта легких. Сурфактант является основным компо-
нентом поверхностно-активной выстилки легких и играет главную роль в
установлении правильного дыхания после рождения, препятствуя спадению
раскрывшихся альвеол путем снижения их поверхностного натяжения. При
различных патологических процессах в легких сурфактант изменяет свои
поверхностно-активные свойства. Принято считать, что состояние поверх-
ностно-активных свойств сурфактанта в легких зависит от нормального
соотношения вентиляция — кровоток на уровне альвеол и адекватного тока
крови через альвеолярные капилляры.
При одних заболеваниях поверхностно-активные свойства сурфактанта
повышаются (эмфизема легких), при других — снижаются (ателектаз, отек
легких).
Известно, что раздражающие яды при кратковременных и длительных
экспозициях способны влиять на сурфактант легких. В наших исследованиях
установлено, что изменение поверхностно-активных свойств сурфактанта
зависит от физико-химических свойств ингалируемого раздражающего ве-
щества, в частности от растворимости в воде. Так, аммиак, подавляющая
часть которого при ингаляции абсорбируется слизистой оболочкой верхних
дыхательных путей, не проникает в глубокие отделы дыхательного тракта.
Воздействие этого вещества в концентрациях выше Limjr не приводило к
изменению сурфактанта легких.
В отличие от аммиака двуокись азота — плохо растворимый в воде газ —
проникает в легкие и вызывает угнетение поверхностно-активных свойств
сурфактанта и увеличение клеточной реакции легких. Вдыхание белыми
крысами двуокиси азота в концентрации 20,1±0,6 мгДР при 4-часовой
экспозиции вызывало угнетение поверхностно-активных свойств сурфак-
танта (контроль 0,91±0,022, опыт 0,7±0,02; р<0,01).
Как видно на рис. 9.5, у крыс, вдыхавших двуокись азота в указанной
концентрации, происходило значительное изменение петли гистерезиса.
Воздействие двуокиси азота в концентрациях 7,5±0,8 и 6,6+1,1 мг/м-* соот-
336
ветственно при 2- и 4-часовой экспозициях не вызывало изменений поверх-
ностно-активных свойств сурфактанта.
Изменение активности сурфактанта легких при ингаляции двуокиси
азота позволяет сделать предположение о нарушении микроциркуляции в
легких и изменении газообмена на уровне субклеточных мембран, которые
происходят уже после однократной ингаляции вещества в концентрации на
уровне Limir.
9.3. Характерные изменения дыхательной системы
при кратковременном воздействии раздражающих
ядов
Как следует из приведенных выше данных, для характеристики состоя-
ния дыхательной системы животных при кратковременном воздействии
раздражающих ядов используют ряд показателей, отражающих функцио-
нальное состояние различных ее функций. Проявления раздражающего дей-
ствия химических соединений на дыхательную систему зависят от величины
концентрации яда, что позволяет устанавливать Limir при ингаляции.
Сравнение величин эффективных концентраций ядов по отдельным по-
казателям позволяет выявить как наиболее ранние и характерные изменения
в дыхательной системе животных при однократном воздействии раздража-
ющих веществ, так и нарушения, которые возникают позже и характеризуют
далеко зашедший патологический процесс.
Так, у подопытных животных не удалось обнаружить сокращения глад-
кой мускулатуры трахеи и бронхов после однократного воздействия ряда
веществ с раздражающими свойствами с помощью методики, описанной
В.М.Бутом. Проба с флюоресцеином также оказалась недостаточно чувст-
вительным тестом.
Ингаляция раздражающих соединений прежде всего приводила к измене-
нию частоты дыхания, остроты обоняния, клеточной реакции верхних дыха-
тельных путей и легких, а также витальной окрашиваемости ткани легких.
В табл. 9.1 приведены изменения показателей дыхательной системы у
крыс при воздействии некоторых веществ в концентрации на уровне Limjr.
Таблица 9.1. Изменения показателей функции дыхательной системы при воз-
действии раздражающих веществ в концентрациях на уровне Limjr
№ п/п Вещество Частота дыхания Острота обоняния Клеточная реакция Прижиз- ненная окраска легких
вдп легкие
1 Аммиак — — + 0 + 2 Гидроперекись третичного бутила — — 0 0 0 , 3 Бром — — + 0 0 4 Йод 0 — 0 0 + 5 Монохлористая сера 0 — 0 0 — 6 Двуокись азота 0 0 0 + 0 ' 7 Сернистый ангидрид — — + 0 О' 8 Каустическая сода — — 0 0 0 9 2-Хлорэтансульфохлорид — * * * — Ю Бромистый водород — — 0 + *
337
Продолжение
№ п/п Вещество Частота дыхания Острота обоняния Клеточная реакция Прижиз- ненная окраска легких
вдп легкие
11 Бромацетопропилацетат 0 * * « —
12 Хлорацитопропилацетат 0 * * ♦ +
13 Третичный ацетиленовый карбинол — — + + 0
14 Этиловый эфир 6-кето-8-хлорок- тановой кислоты — 0 0 «
15 Хлорангидрид моноэтилового эфи ра адипиновой кислоты — + 0 *
16 Хлор 0 * — + •
17 Хлорангидрид монохлоруксусной кислоты * * * +
18 Этинилвиниловый эфир 0 * + 0 •
19 Четыреххлористый германий 0 0 0 + *
20 Ацетальдегид —. * * * 0
21 Хдорангидрид трихлоруксусной ки слоты 0 « * * +
22 Морфолин 0 • * +
23 Хлорокись фосфора — * * « 0
Условные обозначения: + — увеличение; — снижение; 0 — отсутствие изменений; вдп —
верхние дыхательные пути, * — исследование не проводили.
В целом для всей группы из 97 изученных раздражающих ядов частота
дыхания явилась лимитирующим показателем при определении Limir в 56 %
случаев, острота обоняния — в 84,5 % случаев, витальная окраска ткани
легких — в 52 % случаев, клеточная реакция верхних дыхательных путей —
в 46 % случаев и клеточная реакция легких — в 33 % случаев.
Таким образом, ни один из выбранных биомаркеров не изменялся при
ингаляции всех изученных ядов, что свидетельствует о разнонаправленном
действии веществ на дыхательную систему в минимально эффективных
концентрациях.
Для характеристики изменений дыхательной системы животных при
ингаляции веществ в концентрациях на уровне Limjr важное значение имеет
и сочетание изменений тех или иных ее функций. Оказалось, что наиболее
отчетливая и статистически значимая связь существует между снижением
частоты дыхания и остротой обоняния при воздействии раздражающих
веществ (р = 0,02). Одновременное снижение частоты дыхания и усиление
миграции клеточных элементов на поверхность слизистой оболочки верхних
дыхательных путей происходило после воздействия 60 % раздражающих ве-
ществ. Имеется связь между снижением остроты обоняния и увеличением
клеточной реакции верхних дыхательных путей.
Перечисленные показатели характеризуют в основном состояние верх-
них дыхательных путей, хотя и с различных сторон. Если изменение частоты
дыхания является следствием рефлекторной реакции, то снижение остроты
обоняния и особенно усиление миграции клеток на поверхность слизистой
оболочки свидетельствуют о непосредственном влиянии яда на слизистую
оболочку (и в том числе на обонятельный анализатор).
Как и следовало ожидать, зависимости между изменениями биомарке-
338
ров, характеризующими функциональное состояние различных отделов ды-
хательного тракта, менее существенны. Так, частота дыхания и витальная
окраска ткани легких одновременно изменялись лишь при ингаляции 26 %
изученных веществ, а снижение частоты дыхания у животных и увеличение
количества свободнолежащих клеток в легких имело место после воздейст-
вия 33 % исследованных соединений. Указанное, вероятно, связано с тем,
что только некоторые вещества (йод, монохлористая сера, 2-хлорэтансуль-
фохлорид, бромистый водород и др.) поражают дыхательный тракт на всем
его протяжении.
Реакции легких на воздействие раздражающих соединений весьма раз-
нообразны. Об этом свидетельствует тот факт, что одновременное изменение
витальной окраски легких и миграции клеточных элементов на поверхность
легких имело место после ингаляции лишь нескольких веществ.
Результаты проведенных исследований позволяют сделать важный в
практическом отношении вывод о том, что для установления Limjr промыш-
ленных ядов должен быть использован комплекс показателей, отражающих
функции различных отделов дыхательного тракта. Только многосторонняя
оценка позволяет достаточно точно определить минимально эффективные
концентрации промышленных веществ, оказывающих раздражающее дейст-
вие при ингаляции.
С точки зрения общих принципов гигиенического нормирования полу-
ченные результаты свидетельствуют о необходимости комплексной оценки
функционального состояния избирательно поражаемого органа или системы
при установлении порога острого специфического действия, на котором
основывается прогнозирование ПДК вредных веществ в воздухе рабочей
зоны и атмосфере населенных мест.
9.4. Особенности развития хронической интоксикации
при ингаляции раздражающих ядов в различных
концентрациях
Анализ собственных и литературных данных о токсикодинамике разви-
тия хронической интоксикации раздражающими ядами, в частности об
изменении биомаркеров функции различных органов и систем организма,
свидетельствует о ведущей роли величины действующей концентрации ве-
щества.
Для изучения закономерностей изменений биомаркеров функции дыха-
тельной системы (специфичных для раздражающих веществ) и отдельных
органов и систем организма были проведены исследования значительной
группы раздражающих ядов (сернистый ангидрид, двуокись азота, бром,
2-хлорэтансульфохлорид и др.) при длительном ингаляционном воздействии
в двух концентрациях — на уровне Limir и Limch.
Полученные данные свидетельствуют о различной динамике изменений
интегральных и специфических показателей интоксикации при ингаляции
Раздражающих веществ в концентрациях на указанных уровнях.
Как следует из приведенных в табл. 9.2 результатов исследования 3
типичных раздражающих ядов, изменения дыхательной системы у подопыт-
ных животных развивались с первого дня воздействия яда на уровне Limjr
и, как правило, сохранялись на протяжении всего периода наблюдений.
Имели место изменения остроты обоняния клеточной реакции легких и
верхних дыхательных путей, витальной окрашиваемости легких и при экс-
339
позиции двуокиси азота — сурфактанта легких. Изменения интегральных
показателей и функции важнейших органов и систем организма наступали
позднее (за исключением реакций эндокринной системы, которые характер-
ны для периода так называемых первичных реакций) и носили фазовый
характер.
Таблица 9.2. Динамика изменений интегральных и специфических показателей
при длительном воздействии раздражающих ядов на уровне Limir
Система или орган Вещество Срок наблюдения, дни
1-й 2-й 4-й 8-й | 15-й 30-й 60-й 90-й 120-й
Дыхатель- 2-хлорэтансульфохлорид + + + * + + 0 +
ная систе- Бром + + 0 + * + + + +
ма Сернистый ангидрид 0 + + + + + + + +
Нервная 2-хлорэтансульфохлорид 0 * * • « 0 0 + +
система Бром 0 0 0 0 * + + + +
Сернистый ангидрид 0 0 + 0 * 0 0 0 0
Эндокрин- Бром + 0 + 0 * + + « +
ная сис- Сернистый ангидрид + + 0 + + 0 * «
тема
Печень 2-хлорэтансульфохлорид * * * * * 0 + + 0
Бром 0 0 0 0 * + « « +
Сернистый ангидрид 0 0 0 + 0 + « « • '
Почки 2-хлорэтансульфохлорид • * « « * 0 0 + 0
Бром 0 0 0 0 • 0 0 0 0
Сернистый ангидрид 0 0 + 0 * + 0 0 0
Условные обозначения: здесь и в табл. 9.3 + — наличие эффекта; 0 — отсутствие эф-
фекта; ’ — исследование не проводили.
Даже применение функциональных нагрузок на неспецифические пора-
жаемые органы и системы организма (введение алкоголя, питуитрина, ат-
ропина и др.) не выявило каких-либо изменений.
Напротив, нагрузка на дыхательную систему позволяла обнаружить сни-
жение у нее компенсаторных возможностей.
Исследование динамики изменений интегральных и специфических по-
казателей при ингаляции раздражающих ядов в концентрациях на уровне
Limch выявило несколько иные закономерности (табл. 9.3). Реакции дыха-
тельной системы у подопытных животных развивались позже, чем при
ингаляции веществ в более высокой концентрации, и, как правило, совпа-
дали с реакциями эндокринной и нервной систем. Однако последние носили
нестойкий характер, в то время как изменения дыхательной системы про-
грессировали и выходили за пределы физиологической нормы.
Таблица 9.3. Динамика изменений интегральных и специфических показателей
при длительном воздействии раздражающих ядов на уровне Limch
Система или орган Вещество Срок наблюдения, дни
1-й | 2-й | 4-й | 8-й | 15-й | 30-й | 60-й | 90-й | 120-й
Дыхатель- Бром * * * * * + + + +
ная систе- Сернистый ангидрид 00000 + + + +
ма 2-хлорэтансульфохлорид • * * * + 0 0 0 0
340
Продолжение
г Система или орган Вещество Срок наблюдения, дни
1-й 2-й 4-й 8-й 15-й 30-й 60-й 90-й 120-й
Нервная 2-хлорэтансульфохлорид * * * * « 0 0 + 0
система Сернистый ангидрид 0 0 0 0 0 0 0 0 0
Бром « * * * * 0 0 + +
Эндокрин- ная сис- тема Сернистый ангидрид 0 0 + + 0 + + 0
Печень 2-хлорэтансульфохлорид * * * « « 0 0 + Q
Бром • « * * * 0 0 0 0
Сернистый ангидрид 0 0 0 0 0 0 0 + 0
Почки 2-хлорэтансульфохлорид « * * * * 0 0 + 0
Бром * * * * 0 0 0 0
Сернистый ангидрид 0 0 0 0 0 0 0 0 о
Таким образом, воздействие раздражающих веществ в концентрациях на
уровне Limch и особенно 1лггцг приводило к развитию хронической инток-
сикации. При этом изменения дыхательной системы были наиболее выра-
женными, а отдельные показатели функции этой системы выходили за
пределы физиологических колебаний, т.е. обладали критерием вредности.
9.5. Классификация промышленных
раздражающих ядов при ингаляции
Изучение раздражающих свойств веществ при ингаляции проводили на
различных видах животных. Чаще использовали кошек, кроликов и крыс.
По данным литературы, для регистрации эффекта раздражения у разных
видов животных применяли различные показатели (например, сравнивались
изменения частоты дыхания у кроликов и появление слюнотечения у кош-
ки).
Очевидно, что сопоставление чувствительности животных правомерно
лишь при использовании одних и тех же показателей раздражающего эф-
фекта. Для решения этого вопроса было проведено определение в сравни-
тельном плане Lirriir для кроликов и белых крыс путем регистрации одних
и тех же показателей — частоты дыхания и прижизненной окраски ткани
легких — после однократной 4-часовой затравки несколькими раздражаю-
щими ядами (сернистый ангидрид, бром и др.). Оказалось, что Limir раз-
дражающих веществ для кроликов находится практически на одном уровне
с Limir для крыс.
Полученные данные позволили сделать вывод о предпочтительности
использования крыс для исследования эффекта раздражения химических
соединений. Результаты наших исследований, а также многочисленные дан-
ные литературы подтвердили обоснованность этого заключения. Так, в со-
общении группы экспертов ВОЗ “Recommended health-based occupational
exposure limits for respiratory irritant” часто цитируются данные, полученные
в опытах на крысах. Широко используемый за рубежом метод исследования
Раздражающих свойств промышленных веществ при ингаляции основан на
регистрации частоты дыхания у крыс. Одной из причин, побудившей ис-
пользовать крыс для таких исследований, является близость анатомических
341
и физиологических характеристик их дыхательной системы к человеку.
Кроме того, поступление раздражающих веществ в дыхательную систему
человека и животных сопоставимо. Так, респираторная “доза” озона у
кроликов при экспозиции 100 мг/м3 составила примерно 80 % от получае-
мой человеком.
Представлялось важным сопоставить чувствительность к раздражающим
веществам человека и экспериментальных животных, но обязательно с уче-
том показателей, используемых для регистрации эффекта.
Для оценки эффекта раздражения у человека применяют различные
тесты — субъективные ощущения раздражения, частоту мигания, параметры
вентиляции легких, клиренс инертных частиц из дыхательного тракта и
некоторые другие.
Анализ многочисленных данных литературы не позволил нам отдать
предпочтение какому-либо из них. Это связано с тем, что при кратковре-
менном воздействии разных раздражающих веществ лимитирующими ока-
зывались различные показатели. В указанном плане особенно показательно
сравнение для таких наиболее изученных веществ, как сернистый ангидрид,
двуокись азота и озон. В целом можно сделать вывод о том, что Limir по
субъективным ощущениям для раздражающих веществ находится пример-
но на том же уровне, что и Lim;r по различным объективным тестам. Так,
Limir формальдегида по субъективным и объективным показателям состав-
ляет 1 мг/м3. Аммиак в концентрации 70 мг/м3 вызывал рефлекторную
задержку дыхания и раздражение тройничного нерва, а изменение электро-
кожного потенциала и учащение дыхания имели место при концентрации
20 мг/м3.
Снижение уровня подвижности ресничек слизистой оболочки носа и
легкий дискомфорт у испытуемых развивались после вдыхания в течение 5 ч
сернистого ангидрида в концентрации 2—6 мг/м3. При ингаляции формаль-
дегида в концентрации 2,45 мг/м3 отмечены субъективные явления раздра-
жения, но не найдены изменения вентиляции легких.
В опытах на животных также удалось отметить определенные параллели
между LinTjj. по субъективным и объективным тестам. Установлено, что
специально обученные животные “выключали” подачу в зону дыхания ам-
миака из-за ощущения раздражения при концентрации 231 мг/м3. Данная
концентрация совпадает с установленным нами Limjr этого вещества по
изменению клеточной реакции верхних дыхательных путей и витальной
окраски легких.
Поскольку субъективные ощущения раздражения являются достаточно
чувствительным показателем и который “увеличивается” с ростом концент-
рации" (Н.В.Лазарев), то они могут быть использованы для установления
Limir.
Анализ собственных и литературных данных позволил предложить клас-
сификацию раздражающих веществ по величине Limir для человека и раз-
личных видов лабораторных животных (табл. 9.4), которая основана на
принятой в РФ классификации токсичности и опасности химических ве-
ществ (ГОСТ 12.1.007—76). Как показано в следующем разделе (9.6), для
раздражающих веществ существует тесная зависимость между величиной
Liniir и ПДК в воздухе рабочей зоны. Поэтому при определении границ
классов выраженности раздражающих свойств веществ по величине Limir
при ингаляции (мг/м3) были использованы принятые в указанной класси-
фикации соответствующие значения ПДК (<0,1; 0,1 —1,0 мг/м3 и т.д.).
342
Таблица 9.4. Классификация промышленных веществ по степени выраженности
раздражающих свойств при ингаляции
Класс опас- ности Степень выраженности раздражающих свойств Limir для челове- ка по субъектив- ным ощущениям Limjr для кролика по частоте дыхания Limjr для крыс*
Концентрация веществ, мг/м3
1 Чрезвычайно раздражающие <0,5 <3 <1
2 Высокораздражающие 0,5—5 3—50 1—15
3 Умеренно раздражающие 5,1—5,0 51—600 15,1—200
4 Малораздражающие >5,0 >600 >200
* Оценивается по комплексу показателей, определяемых “Методическими указаниями к поста-
новке исследований по изучению раздражающих свойств и обоснованию ПДК избирательно дейст-
вующих раздражающих веществ в воздухе рабочей зоны".
9.6. Анализ параметров токсикометрии
раздражающих веществ
Материалы токсикологических исследований большой группы промыш-
ленных раздражающих ядов позволили провести математический анализ
существующих зависимостей между их параметрами токсикометрии.
В табл. 9.5 приведены коэффициенты корреляции между отдельными
параметрами токсикометрии изученной группы веществ. Обращает на себя
внимание сильная зависимость между ПДК и 1лггцг для человека и животных
(белых крыс).
Таблица 9.5. Коэффициент корреляции между параметрами токсикометрии изби-
рательно действующих раздражающих веществ и их ПДК в воздухе рабочей зоны
Параметры токси- кометрии С|50 'cum Limac Limir кс Limjr чел Limch ПДК
ЛЙ50 0,46 0,27 0,39 0,31 0,33 0,42 0,27
лк50 0,13 0,51 0,42 0,38 0,24 0,41
^cum 0,21 0,19 0,16 0,32 0,26
Limac 0,72 0,66 0,5 0,36
Limir КС 0,86 0,52 0,68
^'т1гчел 0,49 0,82
Limch 0,56
В то же время величина Limch, которой ряд авторов придают решающее
значение при обосновании гигиенического стандарта, в меньшей степени,
хотя и статистически значимо (р<0,05), коррелирует с ПДК. Остальные
параметры токсикометрии слабо связаны с ПДК (р>0,05) и их влияние на
ее величину менее выражено.
Помимо зависимости Limir чел — Limir кс, на которую уже обращалось
внимание в предыдущем разделе, статистически значима связь 1лпцг кс —
Llrnac кс и Limir чел - Limac.
Для вычисления ПДК, исходя из Limjr, разработаны два уравнения:
lg ПДК = 0,89 lg(LimirKC) - 1,034
(1)
(п = 33, г = 0,88, m = 0,32);
343
У
Рис. 9.6. Номограмма для расчета ПДК избирательно действующих раздражающих
веществ по Limjr для человека.
у — 1g ПДК, мМ/м3; х — 1g Limir чел , мМ/м3; а — линейная среднеквадратическая регрессия Y
на X; б —эллипс рассеивания исходных данных при р=0,01; в — границы прогноза ПДК при
точности Д = 1 порядок.
Ig ПДК = 1,02 lg(Limir4en) - 0,74
(п = 0,28, г = 0,82, m = 0,36).
Зависимость между ПДК и Limjr для человека и животных избирательно
действующих раздражающих веществ четко прослеживается на вероятност-
ных номограммах (рис. 9.6), разработанных совместно с В.Г.Ковязиным по
предложенному им способу.
Приведенные номограммы могут быть использованы для непосредствен-
ного определения величины ПДК промышленных веществ, Zir которых >1-
Менее тесные связи существуют между Zir и Limch, с одной стороны, и
величиной ПДК раздражающих ядов:
1g ПДК = 0,815 - 1,24 lg(Zir)
(п = 32, г = 0,44, р<0,05, m = 0,61);
344
Is Ig ПДК = 0,672 lgLimch - 0,488
(n = 21, r = 0,56, p<0,05, m = 0,54).
I Применение метода множественной регрессии позволило получить более
< тесное совпадение между расчетными и установленными в законодательном
~ порядке величинами ПДК.
Предложено 2 уравнения множественной регрессии для вычисления
ПДК избирательно действующих раздражающих веществ в воздухе рабочей
«в зоны:
к Ig ПДК = 0,69 lgLimjrKC + 0,18 lgLimjr4en - 0,7 lgZir- 0,51
(n = 26, г = 0,96, р<0,001, m = 0,21);
Ig ПДК = 0,11 lgLC50 + 0,65 lgLimirкс - 0,72 lgZir- 0,65
(n = 20, r = 0,91, р<0,001, m = 0,27).
Как свидетельствует величина стандартной ошибки расчета ПДК по
указанным формулам, значения ПДК для 67 % веществ не будут отличаться
от установленных в законодательном порядке более чем в 1,6 и 1,86 раза, а
для 95 % веществ — не более чем в 3,2 и 3,7 раза соответственно.
Разработано несколько формул для вычисления отдельных параметров
токсикометрии раздражающих веществ, исходя из одного или нескольких
из них, установленных в эксперименте:
lgLimac = 0,74 lgLimirKC + 0,63
(n = 32, г = 0,72, р<0,01, m = 0,29);
!gLimirKC = 0,52 lgl_imac + 0,6 lgLimir4en - 0,37
(n = 26, r = 0,83, p<0,001, m = 0,31).
Из предложенных уравнений с помощью несложных преобразований
можно вычислить любой из параметров, необходимых для характеристики
выраженности раздражающего действия промышленных ядов. Это позволяет
правильно спланировать эксперимент и тем самым повысить эффективность
исследований. Поскольку между CI50 и другими параметрами токсикомет-
рии раздражающих веществ существуют менее тесные связи, для прогнози-
рования ее значения предлагается уравнение множественной регрессии:
lgLC50 = 5,5 lgLimjr кс - 3,4 lgl_imac - 3,8 lgLimch + 4,3
(n = 14, г = 0,9, p<0,001, m = 0,31).
Математическое исследование, проведенное С.М.Новиковым и соавт.
(11], подтвердило обоснованность выполненных нами вычислений.
Таким образом, установлены зависимости между Linijr, Zjr и ПДК изби-
рательно действующих раздражающих веществ, что позволило разработать
математические модели для прогнозирования безвредных уровней их содер-
жания в воздухе рабочей зоны [ 11 ].
9.7. Раздражающее действие алкилирующих веществ
К веществам раздражающего действия относятся алкилирующие соедине-
ния, обладающие избирательным действием на рецепторы чувствительных
нервных окончаний слизистых оболочек глаз и верхних дыхательных путей
человека, вызывающие при этом рефлекторное слезотечение, блефароспазм, конъ-
юнктивит, чиханье, кашель. Их характерная особенность в том, что они обла-
345
дают раздражающим действием при низких концентрациях 10 3—10 4 мг/д
[1, 7, 9, 14, 19].
В зависимости от основных симптомов раздражающие вещества тради-
ционно делят на две группы: раздражающие преимущественно слизистые
оболочки глаз (лакриматоры); раздражающие преимущественно слизистые
оболочки верхних дыхательных путей (стерниты).
Однако эта классификация, принятая более полувека назад [14], во
многом в настоящее время условна, особенно после появления таких ве-
ществ, как CS, CR и СН, которые могут быть отнесены как к одной, так и
к другой группе. Кроме того, эти вещества вызывают раздражение кожных
покровов человека [19]. Поэтому в настоящее время за рубежом подобные
вещества обычно объединяют в одну группу веществ раздражающего дейст-
вия — ирританты.
В ряде стран ирританты CS и CR используются как “полицейские” газы.
Армия США широко применяла вещество CS во время войны во Вьетнаме
[4]. По тактической классификации ирританты относятся к веществам,
кратковременно выводящим человека из строя. Эти вещества не попадают
под действие Конвенции по запрещению ХО [10].
Механизмы токсического действия. Во время 1-й мировой войны иссле-
довалось и применялось большое количество (десятки) веществ раздражаю-
щего действия (“слезоточивые” и “чихательные” ОВ рефлекторного дейст-
вия). Исследователей в области химии и токсикологии физиологически
активных веществ интересовал вопрос, почему некоторые галоидные алкилы
обладают наркотическим действием без проявления эффектов раздражения
(хлороформ и др.), в то время как другие галоидные алкилы имеют выра-
женное раздражающее действие и не являются наркотиками (хлорпикрин,
хлорацетофенон и др.). В ходе этих исследований были выявлены опреде-
ленные закономерности по связи между строением, реакционной способ-
ностью, физико-химическими свойствами и физиологической активностью
различных типов соединений. В качестве примера в табл. 9.6 приведены
данные, иллюстрирующие основные закономерности по свойствам галоид-
ных алкилов, галоидацетонов, галоидацетофенонов и их производных. Для
сравнения в табл. 9.6 включено CS как алкилирующее соединение. Галоид-
ные алкилы, как правило, угнетают нервную систему. Раздражающее дей-
ствие выражено мало вследствие недостаточной подвижности галоида и
недостаточной реакционной способности по отношению к нуклеофильным
группам чувствительных рецепторов слизистых оболочек глаз и верхних
дыхательных путей. Введение в альфа-положение к атому углерода, кова-
лентно связанного с атомом галоида, электроотрицательных заместителей
приводит к повышению реакционной способности. Так, при замене атома
водорода в молекуле хлороформа (наркотическое вещество) на нитрогруппу
проявляются явные свойства раздражающего вещества (хлорпикрина). Введе-
ние электроотрицательной карбонильной группы рядом с метиленовой груп-
пой, содержащей атом галогена, приводит к возникновению раздражающих
свойств — переход от галоидных алкилов к галоидацетонам (см. табл. 9.6).
Важное значение имеет природа галогена. При переходе в ряду С1 ->
->Вг -> J физиологическая активность галоидацетонов повышается, что на-
ходится в соответствии с представлениями о более выраженных алкилиру-
ющих свойствах этих соединений. Замена метильной группы на фенильную
приводит к повышению подвижности атома галогена и увеличению физио-
логической активности. Примерами тому являются переходы от галогенаце-
тонов к галогенацетофенонам.
346
Таблица 9.6. Свойства галоидных алкилов, галоидацетофенонов и их производ-
ных [4, 14]
Вещество Формула Агрегатное состояние Характер действия на организм
-— Хлористый метил СН3С1 СНС13 Газ Угнетение ЦНС,
Хлороформ Жидкость наркотическое
Хлористый этил СН3СН2СН2С1 Газ действие
Хлористый пропил СН3СН2СН2С1 Жидкость
Бромистый пропил СН3СН2СН2Вг »
Хлорпикрин CCI3NO2 »
Хлорацетон СН3С(О)СН2С1 » Раздражение
Бромацетон СН3С(О)СН2Вг » слизистых обо-
Йодацетон CH3C(O)CH2J » лочек глаз (верх-
Хлорацетофенон С6Н5С(О)СН2С1 Т вердое них дыхатель-
Бромацетофенон С6Н5С(О)СН2Вг C6H5CHBrCN o-CIC6H4CH=C(CN)2 » ных путей), от-
Бромбензилцианид » сутствие нарко-
о-Хлорбензальмалонодинитрил » тического дейст- вия
I
Одновременно имеет место изменение целого ряда других свойств рас-
сматриваемых соединений. При переходе от галоидацетатов к галоидацето-
фенонам повышается липидофильность вещества. Так, коэффициенты рас-
пределения в системе оливковое масло — вода равны в случае хлорацетона —
1,0; хлорацетофенона — 99,0 и бромацетофенона 175,0. Благодаря выражен-
ной липидофильности лакриматоры-ирританты легко впитываются в по-
верхностный слой слизистых оболочек глаз и верхних дыхательных путей,
что способствует лучшему проникновению их к окончаниям чувствительных
волокон, в биомембраны слизистых оболочек глаз и быстрому взаимодей-
ствию с биомишенями. Все лакриматоры являются электрофильными реа-
гентами с достаточно выраженной реакционной способностью — они взаимо-
действуют с нуклеофильными (HS') группами рецепторов чувствительных
нервных волокон. Эти вещества обладают выраженным рефлекторным дей-
ствием. Напомним, что бромпроизводные не получили широкого примене-
ния в 1-ю мировую войну по “техническим причинам” — ввиду ограничения
исходного сырья в странах Европы (Франции и др.). С другой стороны,
важно отметить, что галоидацетофеноны являются твердыми веществами и
в этом случае имеет место действие на слизистые оболочки глаз и верхних
дыхательных путей частиц мелкодисперсного аэрозоля твердых веществ. По
мнению военных химиков и токсикологов, это является важным фактором
Для более эффективного проявления рефлекторного действия, чем действие
паров веществ. Так, хлорацетофенон обладает более выраженными раздра-
жающими свойствами, чем хлорпикрин. Именно так можно объяснить,
почему низкие концентрации паров иприта не приводят к выраженным
симптомам раздражения слизистых оболочек глаз, но вызывают их после-
дующие тяжелые поражения.
Введение электроотрицательных заместителей в фенильное кольцо при
наличии кратных связей в боковых заместителях, содержащих псевдогало-
идные группы, как правило, приводит к получению более активных соеди-
нений. Примером тому является о-хлорбензальмалонодинитрила (вещество
CS), обладающее выраженными свойствами раздражающего вещества.
347
В настоящее время наибольшее значение среди веществ раздражающего
действия имеют вещества CN, CS и CR (шифры армии США), токсиколо-
гическая характеристика которых приводится ниже.
Токсикология веществ раздражающего действия. Вещества CN, CS, CR
представляют собой твердые малолетучие вещества, плохо растворимые в
воде, лучше — в органических растворителях (ацетоне, хлористом метилене
и др.). Для дегазации могут быть использованы спиртовые растворы щело-
чей. Основная форма применения — аэрозоли (дымы) и как компоненты
пенных структур (CS и CR).
Хлорацетофенон (ХАФ) — шифр армии США CN. Во время мировых
войн предлагался к применению в качестве ОВ, однако это не было реали-
зовано. В Германии в конце второй мировой войны запасы ХАФ составляли
7,1 тыс. тонн, из которых часть была затоплена в Балтийском море. Во время
войны во Вьетнаме армией США он применялся в виде твердых аэрозолей.
ХАФ входит в .состав твердых и жидких рецептур в армиях многих стран
[4]. Разрешен к применению и в нашей стране.
Это твердое вещество, в очищенном виде бесцветное, технический про-
дукт — желто-серого цвета. Летучесть его составляет 0,11 мг/л. Хорошо
растворим в полярных растворителях. Устойчив на местности.
Вещество CN — типичный лакриматор. Слезотечение возникает при кон-
центрации 0,00005 мг/л, непереносимая концентрация — 0,002 мг/л. В воен-
ной токсикологии выводящей из строя токсодозой является 0,08 мг мин/л,
смертельная токсодоза LCt50 = 10—11 мг-мин/л. Симптомы поражения воз-
никают через несколько секунд после воздействия пороговых и неперено-
симых концентраций аэрозоля в воздухе.
Защита от ХАФ — противогаз. Первая медицинская помощь: использова-
ние противодымной смеси и фициллина, промывание глаз водой или рас-
твором бикарбоната натрия. Для дегазации применяются водно-спиртовые
растворы сернистого натрия.
Вещество CS — о-хлорбензальмолонодинитрил — твердое. При концент-
рации 2-Ю-5 мг/л наблюдается раздражение слизистых оболочек глаз. Непере-
носимая доза 0,001 мг-мин/л. Смертельная токсодоза (LCt50 = 61 мг-мин/л) в
тысячи раз выше выводящей из строя.
Вещество CR — соединение типа дибензоксиазепина твердое. Обладает
более сильным раздражающим действием на слизистые оболочки глаз и
верхних дыхательных путей, чем ХАФ и CS.
Вещество CH — 1-метил-1,3,5-циклогептатриен, жидкость. Обладает
сильным алгогенным действием. Вызывает сильные болевые эффекты в
местах контакта пара или аэрозоля с поверхностью тела человека. Смертель-
ная доза в два раза превышает смертельную дозу CS.
Хлорпикрин — трихлорнитрометан (C13CNO2) — жидкость бледно-желто-
го цвета с резким запахом. В воде растворяется плохо, а в органических
растворителях — хорошо. Непереносимая концентрация — 0,05 мг/л. В боль-
ших концентрациях обладает удушающим действием. Концентрации 0,5—
1 мг/л вызывают тяжелые поражения при 30-минутной экспозиции. Исполь-
зуется в работах для проверки средств защиты органов дыхания.
Структурные формулы перечисленных соединений приведены ниже.
Симптомы поражения лакриматорами. Сразу же после воздействия лакри-
маторов возникают симптомы раздражения слизистых оболочек глаз: жже-
ние, боль в глазах, слезотечение, блефароспазм и светобоязнь, которые
после выхода из зоны заражения начинают уменьшаться и через некоторое
348
о
II
[^CCH2CL
Хпорацетофенон
(вещество CN)
Вещество CR
CI
I
CI—с—no2
I
Cl
Вещество СН
Хлорпикрин
время (0,5—1 ч) постепенно проходят. При высоких концентрациях и дли-
тельных экспозициях возможны более выраженные симптомы — развивает-
ся резкий конъюнктивит, боль в области глаз, а также симптомы раздраже-
ния верхних дыхательных путей.
Первая помощь при действии лакриматоров', надеть противогаз. При по-
ражении ввести под шлем-маску противогаза ампулу с противодымной сме-
сью (состав смеси ПДС: хлороформ — 40 %, этиловый спирт — 40 %, серный
эфир — 19,7—19,5 % и 0,3—0,5 % нашатырный спирт). Помимо содержимо-
го ампулы ПДС, может быть использовано противораздражающее средство
фицилин. Через 5—10 мин можно повторно ввести ампулу. Промывание
глаз и носоглотки водой или 2 % раствором двууглекислой соды. Желательно
вытряхнуть одежду (обмундирование).
Природные алкилирующие соединения раздражающего действия. Среди
природных соединений, обладающих алкилирующими свойствами и раз-
дражающим действием, следует выделить капсаицин и его аналоги [1, 9].
Капсаицин — действующее начало красного перца, придающий ему жгу-
чий вкус.
° /-Ч°СНз
(CH3)2CHCH=CH(CH2)4CNCH2—/""V-он
н
Капсаицин — твердое вещество, нерастворимое в воде, хорошо раство-
римо в органических растворителях и растворах щелочей. Гидролитически
устойчиво. Его выделяют из перца или получают синтетическим путем из
ванилиламида и хлоргидрата 8-метилноненовой кислоты. Обладает выра-
женным раздражающим действием на слизистые оболочки глаз, верхних
Дыхательных путей и кожи. Непереносимая концентрация — 0,004 мг/л при
экспозиции 1—2 мин.
Синтетические аналоги капсаицина — ванилиламиды энантовой кислоты
также обладают раздражающим действием.
349
R — алкил или алкинил, содержащий 6—10 атомов углерода.
Под названием “перцовый газ” в США, Англии и других странах он
используется как компонент изделий для полицейских целей в виде гранат
и баллончиков. Данные о токсичности алкилирующих соединений, облада-
ющих раздражающим действием и представленных в этой главе, получены
в результате систематических работ по созданию высокоэффективных ир-
ритантов, в том числе в полицейских и военных целях.
ЛИТЕРАТУРА'
1. Александров В.Н., Емельянов В.И. Отравляющие вещества. — М.: Воениздат
1990. - С. 204-211.
2. Алпатов И.М. Экспериментальное обоснование аммиака в воздухе закрытых
кабин. Промышленная токсикология и клиника профессиональных заболеваний
химической этиологии. — М., 1982. — С. 200—202.
3. Вредные вещества в промышленности/Под ред. Н.В.Лазарева, И.Д.Гадаскиной. —
Л.: Химия, 1977.—С. 118.
4. Вьетнам — химическая война. — Ханой: Изд. литературы на иностр, языках,
1972. - С. 143.
5. Иванов Н.Г. Система обоснования гигиенических нормативов вредных веществ
на основе регистрации патогенетических изменений при краткосрочном воздей-
ствии//Токсикол. вестн. — 1997. — № 6. — С. 21—24.
6. Иванов Н.Г., Поздняков В.С., Шеина Н.И. и др. Биомаркеры патогенетических
изменений органов и систем организма при кратковременном воздействии вред-
ных веществ. — В кн.: Тез. докл. 1-го Съезда токсикологов России. — М., 1998. —
С. 283.
7. Каракчиев А.И. Токсикология ОВ и защита ядерного и химического оружия: 4-е
изд. — Ташкент: Медицина, 1988.—С. 146—150.
8. Коротич Л.П., Иванов Н.Г. Клеточная реакция легких и верхних дыхательных
путей как показатель раздражающего действия ядов//Токсикология новых про-
мышленных химических веществ. — М., 1975. — Вып. 14. — С. 73—81.
9. Лошадкин Н.А., Кнунянц И.Л. Военная токсикология. — М.: Воентехиздат, 1991. —
С. 118-122.
10. Материалы международной конференции по обсуждению Конвенции о запре-
щении разработки, производства, накопления и применения химического ору-
жия и его уничтожения. — Париж, 1993. — С. 25, 28.
11. Новиков С.М., Нургабылова А.Б., Филимонов Д.А. и др. Прогнозирование гигие-
нических регламентов промышленных веществ, обладающих раздражающим
действием//Гиг. и сан. — 1995. — № 12. — С. 16—20.
12. Руководство по токсикологии отравляющих веществ//Под ред. С.Н.Голикова. —
М.: Медицина, 1972. — С. 296.
13. Сгибнев А.К. Влияние малых концентраций паров формальдегида на организм
человека//Гиг. труда. — 1988. — № 7. — С. 20—25.
350
14. Сошественский Н.А. Токсикология боевых отравляющих веществ. — М.: Сель-
хозиздат, 1933. — С. 284—287.
15 Alarie Y. Sensory irritation of the upper airways by airborne chemicals//Toxicol. appl.
Pharmacol. - 1973. - Vol. 24, N 2. - P. 279-297.
16. Andersen J., Molhave L., Proctor D.F. Human response to controlled levels of combi-
nations of sulfur dioxide and inert dust//Scand. J. Work Environm. Health. — 1981. —
Vol. 7, N 1. - P. 1-7.
17 Barnes C., Lieuw F.Y. Nitric oxide and asthmatic inflammation//Immunol. Today,
1995.-Vol. 16. - P. 128-130.
18 Barnes P.J., Kharitonov S.A. Exhaled nitric oxide: a new lung function test//Thorax. —
1996.-Vol. 51.-P. 233-237.
19. Chemical warfare agents//Toxicology and treatment/Ed. T.C.Marrs, R.L.Maynard,
F.R.Shell, Jonh Willey and Sons. — 1996. — P. 223—225.
20 Frew A.J. The immunology of respiratory allergies//Toxicology Letters. — 1996. — Vol.
86. - P. 65-72.
21. Graham D.E., Koren H.S. Biomarkers of inflammation in ozone-exposed humans.
Comparison of the nasal and bronchoalveolar lavage//Am. Rev. resp. Dis. — 1990. —
Vol. 142. - P. 152-156.
22. Kimber I. Mechanisms of chemical respiratory allergy. In: J.G.Vos, M.Younes, E.Smith
(Eds.). Allergic Hypersensitivities Induced by Chemicals. Recommendation for Pre-
vention. — CRC Press, Boca Raton, FL, 1996. — P. 59—75.
23. Lovik M., Dybing E., Smith E. Environmental chemicals and respiratory hypersensiti-
sation: A synopsis//Toxicology Letters. — 1996. — Vol. 86. — P. 211—222.
24. Recommended health-based occupational exposure limits for respiratory irritants: Re-
ports of a WHO Study Group. — Geneva: WHO, 1984. — 154 p.
25. Schachter E.N., Witek T.J., Tosuk T. et al. A study of respiratory effects from exposure
to 2 ppm formaldehyde in healthy. Arch, environm. Hlth. — 1986. — Vol. 41, N 4. —
P. 229-239.
26. Steerenberg P.A., Fischer P.H., L. van Bree et al. Nasal lavage biomarkers in air pollution
epidemiology Proc. 1996 ELJROTOX Congress Meeting, Alicante, Spain, 22—25
September “Apllied Toxicology: Approaches Through Basic Science”//Arch, of Toxi-
cology. - 1996. - Suppl. 19. - P. 207-218.
27. Wood R. W. Determinants of irritant termination behavior//Toxicol. Appl. Pharmacol. —
1981.-Vol. 61, N 2.-P. 260-268.
Глава 10
ВЛИЯНИЕ КСЕНОБИОТИКОВ
НА ИММУННЫЙ ГОМЕОСТАЗ
10.1. Общая часть
За последние 20 лет сформировалось новое научное направление, зани-
мающееся изучением влияния ксенобиотиков на неспецифическую резис-
тентность организма и систему иммунитета, — иммунотоксикология. В рам-
ках этого перспективного направления выделяют такие разделы, как общая,
специальная и промышленная иммунотоксикология. В целом дифферен-
циация данного направления соответствует основным разделам токсико-
логии.
Предмет иммунотоксикологии — изучение влияния на иммунный гомеостаз
токсичных химических веществ (ТХВ), фармакологических средств и биологи-
ческих агентов [21]. При этом повреждение системы иммунитета может
быть результатом как прямого, так и непрямого действия ксенобиотиков
и(или) их метаболитов. Кроме того, на ксенобиотики (или их метаболиты)
может развиваться иммунная реакция с образованием антител. Следует
отметить и возможность модификации токсичных соединений, в результате
чего они приобретают свойства антигена. Возможно также образование
антител к комплексу токсикант — антиген [29].
Изучение влияния ксенобиотиков на иммунный гомеостаз — одна из
наиболее актуальных проблем токсикологии. Это обусловлено, во-первых,
нарастающим загрязнением окружающей среды различными соединениями,
извращающими иммунные реакции и вызывающими заболевания, связан-
ные с нарушением иммунного статуса, во-вторых, с необходимостью кор-
рекции нарушений иммунного гомеостаза как в случае хронических инток-
сикаций, так и при отравлениях, авариях на химических предприятиях,
несчастных случаях на производстве, в быту, при транспортировке, хране-
нии и уничтожении запасов отравляющих веществ.
Данные о влиянии ТХВ на систему иммунитета имеют как теоретическое
значение, раскрывая неизвестные механизмы регуляции иммуногенеза, так
и практическое, позволяя пересматривать предельно допустимые концент-
рации различных химических соединений, проводить научно обоснованные
профилактику и лечение возникающих при острых и хронических интокси-
кациях ТХВ многочисленных инфекционных, аллергических, аутоиммунных
и онкологических заболеваний в результате дисфункций системы иммуни-
тета [15, 27].
Возможности реализовать иммунотоксический (иммунотропный) эф-
фект ксенобиотиков весьма разнообразны. При рассмотрении влияния ТХВ
на неспецифическую резистентность организма (НРО) и иммунную систему
(ИС) на уровне организма необходимо отметить тесную связь действия
токсикантов на эти системы с функцией ЦНС и эндокринной систем (ЭС).
Таким образом, опосредованное влияние ТХВ через центральную нервную
и эндокринную системы сочетается с прямым действием ксенобиотиков на
352
Рис. 10.1. Взаимоотношения ЦНС, эн-
докринной системы (ЭС) с НРО и им-
мунной системой в реализации иммуно-
тропных эффектов токсичных химичес-
ких веществ.
Рис. 10.2. Способы реализации имму-
нотропных эффектов токсичных хими-
ческих веществ.
ЦНС — центральная нервная система; ЭС —
эндокринная система; П — печень; АГ —
антиген; Г — гаптен; ИКК — иммуноком-
петентная клетка.
показатели НРО, морфологические и функциональные элементы иммунной
системы. Взаимосвязь ЦНС, ЭС, НРО и ИС в реализации иммунотропных
эффектов представлена на рис. 10.1.
Токсичные вещества оказывают разнонаправленное воздействие неоди-
наковой интенсивности на различные звенья иммунной системы. В связи с
этим выделение группы токсикантов в зависимости от их преимуществен-
ного действия на Т-, В-систему иммунитета, различные субпопуляции им-
мунокомпетентных клеток (ИКК) и иммунные реакции весьма относитель-
но. Следует принимать во внимание и то обстоятельство, что данные ряда
авторов в отношении иммунотропных свойств ТХВ противоречивы. Тем не
менее для целенаправленного применения существующих иммуномодулято-
ров для коррекции нарушений иммунного гомеостаза при острых и хрони-
ческих интоксикациях выделение ТХВ по их избирательному действию на
различные звенья иммунитета, популяции иммунокомпетентных клеток
вполне оправдано. Наибольшего внимания заслуживает рассмотрение им-
мунотропных эффектов токсичных соединений, широко используемых в
промышленности, сельском хозяйстве и способных вызывать острые и хро-
нические отравления.
При действии ТХВ на ИКК возможны следующие варианты (рис. 10.2):
воздействие через ЦНС и ЭС, в частности вследствие реализации эффектов
различных медиаторов (ацетилхолин, катехоламины, нейропептиды и т.д.),
а также действия гормонов гипофиза, надпочечников, щитовидной железы
И других эндокринных органов:
• прямое воздействие токсиканта на иммунитет;
• действие метаболитов в результате биотрансформации ТХВ в печени
(легких, коже, лимфоцитах);
• иммунотропное действие ТХВ в качестве антигена;
• взаимодействие токсиканта, являющегося гаптеном, с белками с об-
разованием комплекса, который действует на ИКК как антиген;
• действие ТХВ в качестве толерогена (при этом токсикант отменяет
или снижает реализацию гуморальных или клеточных иммунных ре-
акций).
12-7127
353
Рис. 10.3. Механизмы взаимодействия ТХВ с клеточными структурами.
ПАУ — полициклические ароматические углеводороды; ПОЛ — перекисное окисление липи-
дов; Ah( 1) — белок цитозоля клетки, взаимодействующий с ПАУ; ЦНС — центральная нервная
система; ЭС — эндокринная система; 2 — рецепторы к гормонам и медиаторам; 3 — энзимы
цитозоля и органелл ИКК; 4 — структурные элементы мембраны клетки; 5 — геном ядра
клетки; 6 — липиды мембраны ИКК.
При рассмотрении действия ТХВ на ИКК на клеточном и субклеточном
уровнях (рис. 10.3) нарушение системы иммунитета может происходить в
результате: 1) инициации токсикантом перекисного окисления липидов
мембран клеток, в частности путем инактивации антиоксидантных фермен-
тов и витаминов (супероксиддисмутаза, каталаза, глутатионтрансфераза, глу-
татионпероксидаза, а-токоферол, p-каротин, витамины А, С); 2) действия
полиароматических хлорированных углеводородов (дибензпарадиоксины,
дибензфураны) на Ah-рецептор цитозоля мембраны ИКК с последующим
поступлением этого комплекса в ядро клетки и взаимодействием с ДНК;
3) влияния ТХВ на ЦНС и ЭС с последующей реализацией эффектов
медиаторов и гормонов, к большинству из которых на мембране ИКК
имеются соответствующие рецепторы; 4) инактивации ТХВ ферментов ци-
тозоля и мембраны ИКК (ацетилхолинэстераза, а-нафтил-AS-ацетатэстера-
за, а-нафтилбутират-эстераза, коферменты пируватоксидазной системы и
др.), а также энзимов системы тканевого дыхания в митохондриях иммуно-
цитов; 5) индукции или ингибирования синтеза Р-450-зависимых моноок-
сигеназ, локализованных преимущественно в естественных клетках-килле-
рах и Т-лимфоцитах; 6) действия ТХВ на мембрану ИКК, ее повреждение
с последующим образованием аутоантител, взаимодействующих с иммуно-
цитом [2, 7, 15]. В процессе иммуногенеза ТХВ могут воздействовать на
различные ИКК и их предшественники вплоть до полипотентной стволовой
кроветворной клетки (ПСКК) [2].
При взаимодействии макрофагов Т- и В-лимфоцитов, в результате чего
осуществляется Т-зависимое антителообразование (синтез иммуноглобули-
нов М, G, A, D, Е), ТХВ могут воздействовать как на клетки, участвующие
в данной кооперации, так и на продукцию ими лимфокинов, в частности
интерлейкинов (ИЛ-1, ИЛ-2 и т.д.) [7, 21].
Действие ТХВ на механизм реализации клеточного иммунитета, осу-
ществляемое цитотоксическими Т-лимфоцитами (Т-киллеры), многообраз-
но. Его нарушение может быть связано с действием ТХВ на процессинг
антигена макрофагами, представление его с молекулами главного комплекса
гистосовместимости (ГКГС) класса II Т-хелперам 1-го типа (Th]), продуЦИ"
рующими ИЛ-1 и у-интерферон, на предшественники Т-клеток-киллеров,
354
7-супрессоров, функцию Т-киллеров, осуществляющих цитотоксическую
реакцию. Как правило, ТХВ угнетают в той или иной степени НРО, гумо-
ральный иммунитет (ГИ) и клеточный иммунитет (КИ). Возможны такие
варианты, когда один из компонентов, обеспечивающих иммунный гомео-
стаз, повышается при супрессии других [7].
В 1983 г. G.Harris предположил, что причиной вторичных (в том числе
постинтоксикационных) иммунодефицитных состояний может быть по-
вреждение структуры ДНК лимфоцитов и(или) процессов репарации ДНК
под влиянием эндогенных метаболитов или лекарств, а нарушения функци-
онирования ИКК могут быть обусловлены неполноценностью процессов
реанжировки генов иммуноглобулинов, так как в этих процессах участвуют
те же ферменты, что и в репарации ДНК [11].
Таким образом, иммунотоксичность ТХВ может рассматриваться на раз-
личных уровнях интеграции организма: систем и органов, клеточном, суб-
клеточном и молекулярном. Кроме того, необходимо учитывать, что реали-
зация иммунотропных эффектов токсикантов происходит на различных
стадиях иммуногенеза, а также в процессе кооперации клеток при индуци-
ровании гуморального или клеточного иммунных ответов. В зависимости от
преимущественного изменения НРО, КИ, ГИ или особенностей их комби-
нированного поражения можно различать следующие типы нарушений им-
мунного гомеостаза.
10.2. Изменения неспецифической реактивности
организма
Накопленные за последние десятилетия данные о влиянии ТХВ на НРО
в целом определенно свидетельствуют о снижении неспецифических фак-
торов защиты организма под действием токсических агентов [7, 21, 27].
Механизмы сохранения иммунного гомеостаза включают неспецифичес-
кие и специфические (иммунологические) реакции. Иммунологическая ре-
зистентность организма тесно связана с НРО. Это обусловлено участием
моноцитарно-фагоцитарной системы (МФС), системы комплемента, лизо-
цима и других факторов в иммунном ответе. НРО зависит от нескольких
факторов защиты организма, к которым относятся бактерицидная актив-
ность сыворотки крови (БАСК), лизоцим, система комплемента, р-лизина,
пропердина, интерферонов, фагоцитоз (функция макрофагов и микрофа-
гов).
К факторам НРО относятся также биологические барьеры (кожные и
слизистые оболочки), бактерицидные субстанции тканей, гидролитические
ферменты, лактопероксидаза, лактоферрин. Важную роль в обеспечении
НРО играют ЦНС и ЭС, а также пассивные механизмы защиты, определяе-
мые генетическим контролем синтеза клеточных структур, развития ПСКК
БАСК является интегральным показателем естественной способности
крови к самоочищению от микроорганизмов. БАСК распространяется как
на грамположительные, так и на грамотрицательные бактерии и зависит от
многих неспецифических факторов защиты организма, являясь одним из
параметров, используемых для изучения влияния химических соединений
на организм. Данный показатель служит чувствительным тестом для выяв-
ления ранних изменений в организме под влиянием химических веществ,
в основе существующих методов определения БАСК лежат оценка индекса
ее бактерицидности, подсчет и изучение морфологии микробных клеток, а
355
12*
также изменение оптической плотности микробной взвеси до и после кон-
такта с сывороткой крови. Следует отметить, что в последние годы этот
метод оценки НРО при действии ТХВ используется крайне редко. Так, при
изучении хронического действия ФОС на БАСК не выявлено значимых
изменений данного показателя. Описано острое действие ФОС на БАСК,
приводящее к снижению данного показателя. При острой интоксикации
дихлорэтаном до 3 сут статистически значимо (р < 0,05) уменьшалась БАСК.
На 12-е сутки показатель БАСК практически не отличался от контрольного
значения [7]. В исследованиях, проведенных нами на неинбредных мышах
и крысах Wistar, отмечено, что через 2 сут после острой интоксикации
ацетонитрилом БАСК снижается. Редукция исследованного показателя была
прямо связана с дозой яда [6].
Установлено уменьшение БАСК при хроническом воздействии сернис-
того ангидрида, фенола, акролеина, окиси углерода, неорганических соеди-
нений фтора, стирола. Вполне закономерно снижение БАСК связывают с
повышением уровня заболеваемости различными инфекциями. Некоторые
ТХВ в малых дозах способны увеличивать БАСК. Так, доза гербицида
симазана, составляющая 0,001 LD50, через 1 мес повышала БАСК у крыс
Wistar [7].
Лизоцим (мурамидаза) — один из важных факторов неспецифической
защиты организма. Он был открыт в 1909 г. П.К.Лященко и изучен в 1922 г.
А.Флемингом. Это термостабильный кристаллический белок типа муколи-
тического энзима молекулярной массой от 10 000 до 25 000. Содержится во
многих секретах, жидкостях и тканях. Ферментативная специфичность ли-
зоцима заключается в разрушении связи между N-ацетилмураминовой кис-
лотой и N-ацетилглюкозамином в мукополисахариде, составляющем обо-
лочку многочисленных микроорганизмов, особенно грамположительных.
Образующиеся гликопептиды обладают адъювантной активностью, стиму-
лируют продукцию антител, повышают митотическую активность иммуно-
цитов, индуцируют гиперчувствительность замедленного типа. Источником
лизоцима являются нейтрофильные гранулоциты и моноциты. Некоторые
иммунологические реакции связаны с активностью лизоцима. Так, комплекс
IgA-антиген проявляет антибактериальную и нейтрализующую активность
после активации комплементом только в присутствии мурамидазы.
Использование показателя лизоцимной активности для оценки неблаго-
приятного действия химических факторов на организм позволяет характе-
ризовать данный тест как высокочувствительный. Метод определения лизо-
цима основан на его способности растворять индикаторный микрококк
(Micrococcus lysodeicticus). Как правило, химические соединения вызывают
снижение лизоцимной активности сыворотки крови. Однако свидетельством
отрицательного воздействия ксенобиотиков на организм может быть также
повышение содержания лизоцима в крови. Так, гербицид ликурон при
введении ежедневно перорально в течение 6 мес в дозе 10 МДУ повышал
уровень лизоцима в сыворотке крови крыс. Малая доза гербицида симазана
(0,001 LDso) у крыс Wistar через 1 мес также увеличивала сывороточную
активность лизоцима [7]. В результате хронической интоксикации бензолом
выявлены ферментные изменения в нейтрофилах и лимфоцитах, а также
сдвиги в содержании иммуноглобулинов A, D, G, М и лизоцима. Установ-
лено уменьшение лизоцимной активности при хроническом воздействии
сернистого ангидрида, ФОС, фенола, акролеина, окиси углерода, неоргани-
ческих соединений фтора, стирола [7, 17, 18].
Комплемент (в прошлом имел название а-лизин) представляет собой
356
сложную биологическую систему из 20 компонентов, активация которой
может иметь два основных последствия: необратимое повреждение мембран
чужеродных клеток и повышение специфических функций иммуноцитов.
Компоненты комплемента существуют в плазме в неактивной форме и
активируются в строгой последовательности (каскадный механизм). Извест-
ны два пути активации комплемента: классический, запускаемый реакцией
антиген — антитело, и альтернативный (неспецифический). Система ком-
племента играет важную роль в защите организма от инфекции, принимая
участие в обеспечении неспецифической и иммунологической резистент-
ности организма. Разносторонняя биологическая активность комплемента
способствует высвобождению гистамина и других вазоактивных аминов,
вызывает стимуляцию окислительного метаболизма, активацию внутрикле-
точных процессов, инициацию направленной миграции лейкоцитов, реали-
зацию антителозависимой клеточной цитотоксичности, потенцирование фа-
гоцитоза, модуляцию иммунных реакций, лизис бактерий и вирусов. Бак-
терии уничтожаются либо в результате прямого литического действия, либо
путем фиксации на их поверхности фрагментов комплемента, которые рас-
познаются рецепторами фагоцитов. Опухолевые клетки лизируются компле-
ментом при активации классического пути антителами, а в ряде случаев —
по альтернативному механизму.
Различные фрагменты 3-го компонента комплемента (СЗ) оказывают
селективное действие на разные субпопуляции лимфоцитов и могут моде-
лировать иммунный ответ на многих уровнях, включая рециркуляцию, пере-
работку антигена, пролиферацию и дифференцировку клеток. Токсичные
химические соединения, как правило, снижают активность комплемента.
Ряд компонентов комплемента, обладая эстеразной активностью, инги-
бируется ФОС. В системе эритроциты барана — антитела кролика — ком-
племент морской свинки в присутствии диизопропилфторфосфата пропор-
ционально концентрации данного ФОС ингибируется гемолиз эритроцитов.
Этот процесс связан со снижением активности основных компонентов ком-
племента. Комплекс антиген — антитело способен индуцировать образова-
ние фермента С1-эстеразы, под воздействием которого возникает энзима-
тически активный комплекс С2,4, обозначаемый как СЗ-конвертаза. Акти-
вация С1г и Cis компонентов С1 превращает их в эстеразу, в активном
центре которой находится остаток серина. Доказано, что этот фермент
ингибируется ФОС. Ингибирование С1 эфирами фосфорной кислоты при-
водит к снижению индуцируемого антигеном выделения гистамина из туч-
ных клеток легких морской свинки. Аналогичные результаты получены при
исследовании функции перитонеальных макрофагов. Изучено влияние ФОС
на функцию ряда компонентов комплемента (Cl, С2, СЗ, С4, С5) при
классическом пути его активации. Ингибирование выделения гистамина
фенил-, бензил-, 3-хлорпропил-, 5-хлорпентил- и 5-аминопентилфосфона-
тами на 50 % происходит при их концентрациях от 210~4 до 8-10~4 М.
Данная реакция зависит от количества атомов углерода в алкильном ради-
кале ФОС [7].
Существует различная видовая чувствительность С1 к различным ФОС.
!ак, у бензилфосфоната максимальная ингибирующая активность отмеча-
ется по отношению к С1 морской свинки, а у фенилфосфоната — к С1
кролика и крысы. ФОС ингибирует комплемент только в процессе его
активации комплексом антиген — антитело. Особенности структуры ФОС
влияют на ингибирование не только С1, но и на активность ацетилхолин-
эстеразы, трипсина и хемотрипсина. С ингибированием ФОС эстеразы
357
системы комплемента связано снижение хемотаксиса полиморфно-ядерных
лейкоцитов. Угнетение комплементарной активности сыворотки крови ФОС
установлено при их хроническом воздействии на животных. Острое действие
ФОС на комплементарную активность сыворотки крови, в частности на
основной компонент данной системы СЗ, приводит к существенному сни-
жению данных показателей. При введении гербицида ликурона в течение
6 мес ежедневно перорально в дозе 10 МДУ снижаются содержание ком-
племента и циркулирующих иммунных комплексов и количество катионных
белков лейкоцитов [7].
Тромбоцитарный катионный белок (р-лизин) — бактерицидное вещество
сыворотки крови (катионный белок), избирательно активное в отношении
грамположительных микроорганизмов и спорообразующих бактерий. От-
крыт в 1886 г. G.Nuttal и изучен в 1926 г. A.Pettersson, назван р-лизином в
отличие от а-лизина (комплемента). Бета-лизин обнаружен в сыворотке
крови, слюне, секрете слезных желез и других жидкостях организма. Источ-
ником р-лизина являются тромбоциты. Механизм его действия обусловлен
изменением проницаемости мембран микроорганизмов и блокадой их окис-
лительного метаболизма. Метод определения активности р-лизина основан
на избирательной чувствительности к его бактерицидному действию инди-
каторной культуры B.subtilis. Действие ТХВ на активность р-лизина прак-
тически не изучено. Как правило, отмечается угнетение активности данного
фактора НРО при острой и хронической интоксикации.
При острой интоксикации дихлорэтаном до 6 сут уменьшалось содержа-
ние лизоцима и р-лизина в сыворотке. На 12-е сутки значения неспецифи-
ческих факторов резистентности организма практически не отличались от
контрольных [7].
В результате исследований, проведенных нами на неинбредных мышах
и крысах Wistar, установлено, что через 2 сут после острой интоксикации
ацетонитрилом содержание р-лизина в сыворотке крови снижается. Умень-
шение исследованного показателя было прямо связано с дозой яда [6].
Фагоцитоз относится к клеточному фактору НРО. Процесс фагоцитоза
осуществляется микрофагами (гранулоциты) и макрофагами (моноциты
крови, клетки пульпы селезенки и эндотелия кровеносных сосудов, поли-
бласты, гистиоциты и др.). В настоящее время фагоцитоз рассматривается
как сложный многоступенчатый процесс, начинающийся с захвата фагоци-
том чужеродной субстанции и кончающийся ее перевариванием (хемотак-
сис, адгезия, пиноцитоз, формирование фагосомы, слияние фагосомы с
гранулами цитоплазмы, приводящее к активированию гидролаз, пироксидаз,
протеиназ, гибель и переваривание объекта фагоцитоза, выброс продуктов
деградации). Фагоцитоз подразделяется на неиммунный и иммунный (в
случае наличия информации — антител к антигенам клетки мишени). По-
мимо действия ферментов, уничтожение чужеродной клетки может осущест-
вляться путем “дыхательного” (кислородного) взрыва. Фагоцитоз может
быть завершенным и незавершенным. Функция макрофагов заключается не
только в фагоцитозе, но и в представлении переработанного (модифициро-
ванного) в лизосомах антигена Т-лимфоцитам. Взаимодействие макрофагов,
реэкспрессирующих в модифицированном виде антиген на клеточной мем-
бране, Т- и В-клеток, обеспечивает синтез антител на тимусзависимые
антигены. Макрофаги секретируют лизоцим, компоненты комплемента (С1,
С2, СЗ, С4, С5, Сб, фактор В), интерферон, эстеразы и пр. [14]. Действие
ТХВ на фагоцитоз достаточно изучено [21]. При этом, как правило, снижа-
ется функция макрофагов и нейтрофилов. Однако в ряде случаев отмечается
358
кратковременное повышение фагоцитарной активности. Кислородзависи-
мые антиинфекционные системы фагоцита оценивают чаще всего в НСТ-
тесте (тест восстановления нитросинего тетразолия), а кислороднезависи-
мые микробоцидные системы фагоцита — в лизосомально-катионном тесте.
Макрофаги, имеющие исключительно важное значение в многочислен-
ных иммунных реакциях, подвержены отрицательному действию большого
числа ТХВ. К ним относятся полигалогенизированные ароматические угле-
водороды, метилизоцианат, инсектицид токсафен, хлорофос, сероводород,
аммиак, инсектициды, анилин, гербицид 2,4-дихлорфеноксиуксусная кис-
лота (2,4-Д), карбофос, свинец, двуокись кремния, трихлорэтан, трихлор-
этилен, хлор, хлорфенол, оксид бутилолова, роданистый аммоний, тиомо-
чевина и др. Нарушение функции макрофагов легких вызывают оксиды
свинца, никеля, ванадия, диоксиды ртути, марганца, азота, хлориды кадмия
и никеля. Активность нейтрофилов при хронической интоксикации снижа-
ют многие пестициды, ароматические, хлорированные и фторсодержащие
углеводороды, бензин, свинец, ртуть, бериллий, сероуглерод, формальдегид.
Как правило, угнетение функции МФС сопровождается Т- и В-иммуноде-
фицитными состояниями. Нарушение фагоцитоза может происходить вслед-
ствие действия ТХВ на процессы хемотаксиса, адгезии, активации мембраны
фагоцита, образования фагосомы, слияния лизосомальных гранул с фагосо-
мой, уничтожения чужеродных клеток при помощи кислородзависимых или
кислороднезависимых механизмов.
Ряд химических соединений способен активировать фагоцитоз. Такими
свойствами обладают хлорид марганца, некоторые пестициды в начальном
периоде интоксикации, метилмеркаптан и нитроаминосоединения. В отно-
шении действия кадмия данные литературы противоречивы. Исследователи
описывают и стимуляцию фагоцитоза под влиянием этого металла, и его
супрессию. Дильдрин оказывает активирующее влияние на нейтрофилы
крыс, севин и метафос увеличивают миграционную активность макрофагов.
Установлено усиление фагоцитарной активности под влиянием ДДТ и се-
вина с последующим снижением данного показателя через 2—3 мес с мо-
мента начала хронической интоксикации. Активацию макрофагов вызывает
у мышей бенз(а)пирен в дозе 40 мг/кг. У крыс Wistar при дозе гербицида
симазана 0,001 LD50 через 1 мес увеличивались фагоцитарное число и
фагоцитарный индекс [2, 21, 29].
Бенз(а)антрацен, бенз(а)пирен и метилхолантрен подавляли фагоцитоз
бактерий и грибов макрофагами [12]. При хронической интоксикации фос-
форорганическими пестицидами снижается фагоцитарная активность ней-
трофилов. С уменьшением этого показателя под влиянием ФОС связывают
повышенную частоту заболеваний верхних дыхательных путей у лиц, кон-
тактирующих с фосфорорганическими инсектицидами. В начальный период
хронической интоксикации (2—3 мес) фагоцитарная активность нейтрофи-
лов повышается, а затем наступает ее существенное снижение. Острая
интоксикация карбофосом приводит к снижению функции лейкоцитов и
перитонеальных макрофагов. Хроническая интоксикация хлорофосом вы-
зывает супрессию фагоцитоза [7, 9, 10].
Диизопропилфторфосфат и другие ингибиторы холинэстеразы in vitro
нарушают процесс фагоцитоза вследствие взаимодействия с а-хлорацетат-
AS-эстеразой нейтрофилов, связанной с мембраной клетки, а также в ре-
зультате нарушения функции комплемента в ходе фагоцитарной реакции.
Угнетение фагоцитоза зависит от количества атомов углерода в алкильном
Радикале производных нитрофенилэтилфосфоната. Нарушение фагоцитар-
359
ной активности нейтрофилов отмечается при концентрации различных фос-
фонатов 3-10-4 — 1 -10—з М, меньшие дозы ФОС не влияют на фагоцитоз.
Рассматривая проникновение фагоцитов в патологический очаг (хемокинез)
как одну из фаз реакции фагоцитирующей клетки на раздражитель, следует
отметить ингибирование подвижности полиморфно-ядерных лейкоцитов под
влиянием диизопропилфторфосфата. При концентрациях 110~4 — 810~3 М
этого ФОС подвижность лейкоцитов уменьшалась в 3—4 раза. При возвра-
щении клеток в среду, не содержащую антихолинэстеразных соединений,
подвижность лейкоцитов не восстанавливалась. Вероятно, данный эффект
обусловлен ингибированием эстераз клеток, в частности а-хлорацетат-AS-
эстеразы [7].
Можно предполагать, что усиление фагоцитарной активности под вли-
янием острой интоксикации ФОС связано с действием ацетилхолина на
М-холинореактивные структуры макрофагов и нейтрофилов [4, 7].
Ацетат свинца снижает фагоцитарную активность перитонеальных мак-
рофагов (500 мг/кг, in vitro, 20 ч) мышей, что может являться одной из
причин уменьшения устойчивости крыс к инфекции (S.enteritidis). Дильдрин
снижал у мышей процессирование антигена, фагоцитарную активность мак-
рофагов, гуморальный иммунный ответ на ЭБ. В сублетальной дозе данный
препарат подавлял активность фагоцитоза, бактерицидные свойства макро-
фагов, их способность к переработке антигена, уменьшал внутриклеточную
резистентность к индуцированному вирусом цитолизу. В то же время дильд-
рин мало или вообще не влиял на жизнеспособность клеток, генерацию ими
супероксидного аниона и увеличение их количества в брюшной полости
после химической или иммунологической активации. В опытах in vitro на
лейкоцитах человека эндрин в концентрации 10 мкМ снижал хемотаксис на
23 %. Фагоцитарная активность перитонеальных макрофагов у мышей под
влиянием токсафена (10, 100, 200 ppm, внутрь, 8 нед) уменьшалась соответ-
ственно на 30, 80 и 66 %. При введении гербицида ликурона перорально в
дозе 10 МДУ ежедневно в течение 6 мес значительно угнетался фагоцитоз.
Некоторые ТХВ при остром воздействии способны активировать МФС. Так,
при малой дозе гербицида симазана у крыс через 1 мес увеличивались
фагоцитарное число и фагоцитарный индекс. В дозе % и V16 LD50 атразин
стимулировал фагоцитарную активность перитонеальных макрофагов. Нор-
мализация иммунологических показателей наступала через 14—40 сут после
введения исследованного гербицида [21, 26, 34].
Ванадий в концентрациях 5 и 10 мкг/мл in vitro при экспозиции 20 ч
снижает фагоцитарную активность макрофагов кроликов соответственно на
45 и 85 %. Аналогично реагируют гранулоциты при поступлении в организм
крыс метаванадата аммония в концентрации 0,15 мг/мл. При избытке железа
в организме снижается фагоцитарная активность макрофагов (в ряде слу-
чаев — других фагоцитов). Данные об иммунотоксичности соединений зо-
лота ограничены описанием ингибирующего действия хлорида золота на
хемотаксис полиморфно-ядерных лейкоцитов кроликов (0,23 мкмоль, in
vitro, 1 ч). Ацетат кадмия in vitro в концентрации 0,08—0,8 мкмоль в течение
30 мин снижал фагоцитоз перитонеальных и альвеолярных макрофагов, а
также их киллерную активность 25—75 %. В дозе 6 мг/кг (однократно) ацетат
кадмия уменьшал резистентность к бактериальной инфекции, вызванной
S.enteritidis и E.coli. При хроническом действии стирола на уровне, близком
к ПДК, отмечалось снижение бактерицидных свойств кожи и слизистой
оболочки ротовой полости, а также фагоцитарной активности нейтрофилов
360
Гр У крыс Wistar этанол (12 г/кг ежедневно перорально в течение 6 нед) на
4 30 % снижал функцию перитонеальных макрофагов. Аналогичные данные
получены при однократном внутрижелудочном введении крысам 0,5 мл
этилового спирта. Внутриклеточное переваривание полиморфно-ядерными
лейкоцитами E.coli у крыс снижалось при потреблении ими 20 % этанола в
течение 3 нед. In vitro этанол (64 мкг/мл, экспозиция 30 мин) на 80 %
уменьшал данный показатель при использовании S.aureus. При концентра-
ции этанола 0,8 и 1,6 мкг/мл in vitro (экспозиция 30 мин) хемотаксис
полиморфно-ядерных лейкоцитов человека возрастал на 10 %, при 3,2 и
6,4 мкг/мл не изменялся, а при 64 мкг/мл снижался на 99 %. Аналогичные
результаты получены при использовании этанола в концентрациях 8—20 мг/кг
(экспозиция 1 ч) [7, 23].
В результате исследований на мышах и крысах установлено, что через
2 сут после острой интоксикации ацетонитрилом снижается индекс актив-
ности нейтрофилов, оцениваемого в НСТ-тесте. Редукция этого показателя
была прямо связана с дозой яда [6].
Аналогичные результаты получены при изучении иммунотоксичности
дихлорэтана. В случаях хронического воздействия стирола на уровне, близ-
ком к ПДК, отмечалось снижение бактерицидных свойств кожи и слизистой
оболочки ротовой полости, а также фагоцитарной активности нейтрофи-
лов [7].
Почти через 100 лет после открытия И.И.Мечниковым фагоцитоза в
1882 г. в организме животных и человека были обнаружены цитотоксические
клетки нового типа. Это произошло в 1976 г. Такие клетки не имеют
антигенных маркеров, относящихся к Т- или В-лимфоцитам (так называе-
мые О-клетки). Предполагают, что естественные клетки-киллеры (ЕКК)
происходят из предшественников Т-лимфоцитов. На поверхности ЕКК
имеются антигены CD 16 и CD57 — маркеры этих клеток. При контакте с
клетками опухоли, клетками, пораженными вирусами или паразитами,
ксеногенными клетками, ЕКК уничтожают их. ЕКК не способны к фаго-
цитозу. Цитолиз клетки-мишени осуществляется при проникновении фер-
ментов из гранул ЕКК в цитоплазму клетки-мишени. Кроме того, ЕКК
обеспечивают уничтожение чужеродной клетки путем реализации “дыха-
тельного взрыва” (поражение активными радикалами кислорода, гидрок-
сильного радикала и т.д.). Активность ЕКК повышают интерфероны и
интерлейкины [14].
При обследовании групп населения хлопкосеющих районов Узбекистана
установлено, что интоксикация пестицидами сопровождается резким угне-
тением продукции Т-ростовых факторов (ИЛ-2), наиболее выраженным у
подростков. При этом отмечается преимущественное угнетение активности
ЕКК во всех возрастных группах. Супрессия активности ЕКК обусловлена
уменьшением как количества функционально зрелых клеток, так и абсолют-
ного числа их предшественников. Хлорсодержащие пестициды вызывают
угнетение ИЛ-2 у мышей. При этом супрессия выработки ИЛ-2 у мышей
^Проявляется независимо от Н-2 генотипа и носит транзиторный характер
Выявлено подавление активности естественных клеток-киллеров под
влиянием метилхолантрена и полихлорированных бифенилов. Отмечено
различное действие дитиокарбаматов на ряд иммунологических параметров
m vivo и на выживаемость in vitro лимфоцитов самок мышей B6C3Fp
Эффект зависел от дозы. Токсиканты по-разному воздействовали на массу
вилочковой железы и селезенки, киллерную активность клеток. Диэтилди-
361
тиокарбамат и этилен-бис-дитиокарбамат в отличие от метилдитиокарбамата
при введении в желудок в дозах 200, 225 и 300 мг/кг в сутки в течение 7
дней не влияли на киллерную активность клеток селезенки [11, 21].
Нетоксические концентрации цинка снижают активность ЕКК в 6—20
раз. Аналогичным свойством обладают хлорид никеля, растворитель пропи-
ленгликоль, оксид бутилола. В то же время некоторые химические вещества
усиливают активность ЕКК. Так, хлорид марганца при однократном введе-
нии в дозах 10—160 мг/кг повышает естественную цитотоксичность у мышей
вследствие возрастания уровня сывороточного интерферона [7].
При исследовании естественной цитотоксичности, отражающей функ-
цию ЕКК, установлено ее уменьшение, прямо связанное с дозой дихлорви-
нил-диметилфосфата (ДДВФ) [4].
В экспериментах на животных показано, что 2,4-Д уменьшает выражен-
ность реакции трансплантат против хозяина и функции естественных кил-
леров [3, 7].
Активность ЕКК и К-клеток, определяющих антителозависимую клеточ-
ную цитотоксичность, у человека снижается в прямой зависимости от кон-
центрации этанола (но не его метаболита уксусного альдегида), что не
связано с блокированием интерферона спиртом. Предполагается, что в
основе уменьшения резистентности у больных алкоголизмом к вирусам и
опухолям лежит прямое воздействие этанола на ЕКК. Этиловый спирт in
vitro снижал активность ЕКК мышей при концентрациях 0,5, 1 и 2 %
(экспозиция 4 ч) соответственно на 30, 60 и 90 % [23].
В проведенных нами исследованиях при острой интоксикации акрило-
нитрилом несущественно возрастала летальность мышей от эксперименталь-
ной инфекции, снижалась ЕД50 E.coli, значительно уменьшилось среднее
эффективное время (Etso), что может быть обусловлено выявленной редук-
цией функции ЕКК [7]. Установлено снижение антиинфекционной и про-
тивоопухолевой резистентности мышей различных линий при острой и
хронической интоксикации соединениями мышьяка [21].
Интерфероны (ИФ) занимают особое место среди гуморальных факторов
НРО. К первому типу ИФ относятся а-ИФ и (3-ИФ, индуцируемые виру-
сами, а также двухспиральной РНК. Эти ИФ оказывают противовирусное
(в отношении клеток, пораженных вирусами) действие. Альфа-ИФ проду-
цируется лейкоцитами, а (3-ИФ — фибробластами. ИФ подавляют размно-
жение вирусов в инфицированных ими клетках. Вторым типом ИФ является
у-ИФ (иммунный ИФ), который продуцируется Т-лимфоцитами и лимфо-
бластами. Стимулами к образованию у-ИФ служат антигены и митогены.
Гамма-ИФ обладает противовирусным и выраженным иммуномодулирую-
щим свойствами (подавляет пролиферацию клеток и рост опухолей, усили-
вает функцию макрофагов, ЕКК, способствует экспрессии на клетках анти-
генов главного комплекса гистосовместимости (ГКГС) и Fc-рецепторов,
влияет на образование антител и реализацию клеточного иммунного ответа.
Все соматические клетки имеют рецепторы для ИФ [14].
Диоксин тормозит антителопродукцию В-клетками in vitro, а человечес-
кий у-интерферон в дозе 0,5—500 ед/мл уменьшает этот эффект. Таким
образом, механизм снижения антителогенеза связан с у-интерфероном. Ин-
терферон тормозит также вызываемый диоксином процесс фосфорилирова-
ния. Редукцию экспрессии рецепторов к ИЛ-1, подавление продукции ин-
терферонов, ИЛ-2 и ИЛ-3, а также снижение антигенпрезентирующей спо-
собности макрофагов вызывает бенз(а)пирен [7, 32].
362
10.3. Действие токсикантов на гуморальный
клеточный иммунитет
Иммунный гомеостаз обеспечивается преимущественно системой имму-
нитета, более чувствительной к ТХВ, чем НРО. Иммунитет — способ защи-
ты организма от живых тел и веществ, имеющих признаки генетической
чужеродности. Иммунная система — это совокупность всех лимфоидных
органов и скоплений лимфоидных клеток тела. Лимфоидная система орга-
низма представляет собой морфологический синоним иммунной системы и
осуществляет иммунный ответ. В лимфоидной системе различают централь-
ные (вилочковая железа, костный мозг) и периферические (лимфатические
узлы, селезенка, кровь) органы. Клетки, осуществляющие иммунные реак-
ции, называют иммуноцитами, или ИКК [14].
В ответ на попадание чужеродных или собственных антигенов, микро-
организмов, злокачественно трансформированных клеток, появляющихся
при опухолях или внесенных при трансплантации чужеродных тканей, в
организме возникают гуморальные и клеточные иммунные реакции. Гумо-
ральные реакции требуют присутствия антител, комплемента, полиморфно-
ядерных лейкоцитов и макрофагов. Поскольку антитела вырабатываются
В-лимфоцитами (символы Т и В введены в иммунологическую литературу
И.Ройтом в 1969 г. и являются производными от определений на английском
языке “тимусзависимая” и “бурсозависимая” система), гуморальные иммун-
ные реакции расценивают как В-клеточный иммунитет (В-система иммуни-
тета). Синтез антител — белков, относящихся к тому или иному классу
иммуноглобулинов (М, G, А, Е, D), продукция которых стимулируется
после парентерального поступления антигена, отражает функцию В-системы
иммунитета. Гуморальный иммунный ответ на тимуснезависимые антигены
не требует участия вилочковой железы и возникает при действии их на
В-клетки. Определенную роль при этом играет ИЛ-1, продуцируемый мак-
рофагами. При тимусзависимой иммунной реакции необходимы переработ-
ка и представление антигена макрофагами В-лимфоцитам при участии Т-
клеток. Т-хелперы включают в антителогенез вместе с макрофагами В-лим-
фоциты, а Т-супрессоры тормозят этот процесс. При этом их миссия состоит
в блокировании аутоиммунных реакций и торможении гиперактивности
В-антителопродукции [14]. Рассматривая функцию Т-клеток при антитело-
образовании, оценивают Т-клеточный элемент (Т-клеточная версия) гумо-
рального иммунного ответа [19].
Различают Thj, участвующие в синтезе иммуноглобулинов М, G2 и
формировании ГЗТ, и Т-хелперы 2-го типа (Th2), способствующие синтезу
иммуноглобулинов Gi, А, Е [19].
Иммуногенез делится на три стадии. Первая стадия— дифференцировка
клеток лимфоидного и миелоидного ряда до попадания в вилочковую железу
ИЛИ костный мозг. На этой стадии количество митозов составляет примерно
°~7. Вторая стадия начинается после выхода ИКК из вилочковой железы
и костного мозга и их взаимодействия. Классический пример кооперации
иммуноцитов — взаимодействие Т-, В-клеток и макрофагов. На данном
этапе происходит 2—3 митоза клеток. Третья стадия — образование эффек-
торных клеток: памяти, киллеров, антителообразующих и др. При этом
отмечается такое же количество митозов, как и на первом этапе. В зависи-
мости от действия ТХВ на различные этапы иммуногенеза можно выделить
вещества, влияющие преимущественно на первую, вторую или на третью
стадию иммуногенеза [2]. При попадании антигена в организм различают
363
Рис. 10.4. Мишени действия ТХВ на иммуногенез.
I, II, III — стадии иммуногенеза; М — миелоидный ряд; Р — ретикулоцит; Мг — мегакариоцит;
П — промоноцит; Г — гранулоцит; пТ — протимоцит; Т — тимоцит; Тх/и — Т-хелпер/индуктор;
ЦТЛ — цитотоксический лимфоцит; Тс — Т-супрессор; НК — естественный киллер; пВ —пред-
шественник В-лимфоцита; В — В-лимфоцит; ВТз — В-Т-зависимый лимфоцит; ВТнз —В-Т-
независимый лимфоцит; ПК — плазматическая клетка; 1g — иммуноглобулины; двойная стрел-
ка — точка воздействия ТХВ на клетку.
следующие процессы: распознавание антигена, активацию клеток, пролифе-
рацию и дифференцировку лимфоцитов. Указанные процессы подвергаются
регуляции цитокинами, в частности интерлейкинами: активация — ИЛ-4,
пролиферация — ИЛ-5, дифференцировка — ИЛ-6. Следует отметить, что
это упрощенная трактовка довольно сложных механизмов. Данные о функ-
ции интерлейкинов уточняются, и процесс регуляции иммуногенеза далеко
не так прост и однозначен. В настоящее время исследовано 12 типов
интерлейкинов, выполняющих различные иммунорегуляторные функции.
Общее число известных интерлейкинов достигает 17 [2, 7, 19]. В процессе
иммуногенеза ТХВ могут воздействовать на различные ИКК и их предше-
ственники вплоть до полипотентной стволовой кроветворной клетки. Воз-
можные мишени для действия токсикантов отображены на рис. 10.4.
Причинами постинтоксикационной иммунодепрессии могут быть: 1) пере-
распределение колониеобразующих единиц (КОЕ) в кроветворной системе —
выброс их из костного мозга в кровоток; 2) уменьшение числа вспомога-
тельных клеток, необходимых для нормального колон необразован ия, при
неизменной численности КОЕ; 3) задержка пролиферации КОЕ на одной из
стадий клеточного цикла; 4) гибель КОЕ. ТХВ могут вызывать как усиление
продукции предшественников различных ростков кроветворения или миграции
из костного мозга, так и (обычно) угнетение этих процессов.
При введении мышам C57BL/J внутрибрюшинно бензола в дозе 600 мг/кг
2 раза в сутки в течение 2 дней в костном мозге на 3-и сутки снижается
число клеток, особенно лимфоцитарного и эритроцитарного ростков кро-
ветворения, а число предшественников и зрелых клеток гранулоцитарного
ряда возрастает. Это происходит вследствие неспособности стромальных
фибробластов синтезировать колониестимулирующий фактор, необходимый
для стволовых клеток и клеток-предшественников. Основную роль в этом
364
процессе играет метаболит бензола гидрохинон, ингибирующий преобразо-
вание преинтерлейкина-1а в цитокин. Рекомбинантный ИЛ-1а предотвра-
щает депрессию кроветворения в костном мозге. Снижение числа эритро-
идных колоний в костном мозге мышей под влиянием бензола отмечено у
спленэктомированных и ложнооперированных мышей. При этом влияние
удаления селезенки на супрессию эритропоэза было более выраженным. При
концентрации бензола 100, 300 и 900 мг/л (6 ч в сутки в течение 5 дней в
неделю) на протяжении 1 — 16 нед дозозависимо увеличивались количество
и размеры фибробластных КОЕ в костном мозге и снижалось содержание
гемопоэтических стволовых клеток. Кратковременное воздействие бензола
(10, 30, 100 ppm, 6 ч в сутки, 5 дней) обеспечивало преимущественный рост
гранулоцитарных клеток-предшественников по сравнению с эритроидными.
Хиноны в костном мозге образуются в результате действия пероксидазы в
гемопоэтических клетках-предшественниках, что имеет значение в патоге-
незе вызываемого бензолом лейкоза. При хроническом действии на мышей
паров стирола (330 ppm, 8 нед) отмечали увеличение вариабельности коли-
чества эритроидных колониеобразующих клеток (КОК) с тенденцией к
снижению их числа в селезенке. При этом число гранулоцитарных КОК не
изменялось. Считается маловероятной возможность лейкозогенного эффек-
та стирола. Метаболиты бензола (фенол, катехол, гидрохинон, парабензохи-
нон и транс-транс-муконовый альдегид) в концентрациях 4-10~8 — 4-10“3 М
вызывают дозозависимое снижение эритроидных (бурсо- и колониеобразу-
ющих) и гранулоцитарных (колониеобразующих) клеток-предшественников.
Фенол является наименее активным метаболитом. Комбинация его с кате-
холом и гидрохиноном оказывает аддитивное действие на рост исследован-
ных клеток [7].
Супрессия иммунологической резистентности организма при острой ин-
токсикации дихлорэтаном связана с супрессией одной из основных реакций
индуктивной фазы иммунного ответа — миграцией стволовых кроветворных
клеток из костного мозга в селезенку [7].
Исследования показали, что под влиянием ДДВФ в прямой зависимости
от дозы усиливается миграция ПСКК из костного мозга в селезенку. Ана-
логичное действие характерно и для ацетилхолина, а стрессорное воздейст-
вие и гидрокортизон дают обратный эффект. Полученные результаты сви-
детельствуют о том, что увеличение выхода ПСКК из костного мозга связано
с действием ацетилхолина, причем этот специфический эффект при необ-
ратимом ингибировании ацетилхолинэстеразы ДДВФ преобладает над тор-
можением миграции ПСКК, вызываемым повышением концентрации кор-
тикостерона в крови (неспецифический механизм) [4].
Установлено снижение функциональной активности лимфопоэтических
предшественников и числа клеток в костном мозге под влиянием хлорида
кадмия [21].
При действии ТХДД отмечалось значительное возрастание содержания
в периферической крови нейтрофилов в 2,4 раза (пре- и постнатальное
воздействие в дозах 4—5 мкг/кг перорально в течение 4 дней), а также
костномозговых клеток-предшественников гранулоцитарно-макрофагаль-
ных КОЕ [27].
В целом для всех ТХВ характерно действие в той или иной степени на
все стадии иммуногенеза. Однако для некоторых ядов, а также для имму-
нодепрессантов, применяющихся в клинической практике, точками прило-
жения токсического эффекта могут быть преимущественно афферентная,
Центральная или эфферентная фазы иммуногенеза [7, 21].
365
ТХВ
Рис. 10.5. Возможные мишени в процессе кооперации макрофагов, Т- и В-лимфо-
цитов.
М—макрофаг; АГ —антиген; Т-х — Т-лимфоцит-хелпер; Т-с — Т-лимфоцит-супрессор; В —
В-лимфоцит; ПК — плазматическая клетка; Ig — иммуноглобулины разных классов; двойная
стрелка — точка воздействия ТХВ на клетки и процессы иммуногенеза.
Наиболее обширна группа химических агентов, вызывающих супрессию
гуморального иммунного ответа, который зависит от процессов миграции,
активации, пролиферации и дифференцировки лимфоцитов, функции мак-
рофагов, Т-хелперов и В-клеток. Таким образом, ТХВ способны нарушать
антителообразование вследствие действия на различные иммуноциты и фазы
иммуногенеза. Избирательное действие на функцию В-клеток может быть
обусловлено нарушением процессов созревания В-лимфоцитов, клональной
экспансии, при которой зрелое потомство активированных антигеном В-
лимфоцитов образует многочисленную популяцию клеток, синтезирующих
иммуноглобулины. Супрессию синтеза антител к тимусзависимым антиге-
нам могут вызывать не только ТХВ, нарушающие функцию Т-хелперов, но
и токсиканты, блокирующие процессинг антигена в В-клетках и устраняю-
щие таким образом возможность распознавания Т-хелперами антигена, ас-
социированного с молекулами ГКГС II класса.
В процессе взаимодействия макрофагов Т- и В-лимфоцитов, в результате
чего осуществляется Т-зависимое антителообразование (синтез иммуногло-
булинов М, G, A, D, Е), ТХВ могут воздействовать как на клетки, участ-
вующие в данной кооперации, так и на продукцию ими интерлейкинов
(ИЛ-1, ИЛ-2 и т.д.). Следует отметить, что синтез иммуноглобулина М к
тимуснезависимым антигенам происходит без участия Т-хелперов. Возмож-
ные мишени для действия ТХВ в процессе кооперации макрофагов, Т- и
В-лимфоцитов показаны на рис. 10.5. Интимные механизмы нарушения
функции В-лимфоцитов для большинства ТХВ неясны. Исследование анти-
телопродукции под влиянием ТХВ является одним из основных тестов
оценки его иммунотоксичности.
К ксенобиотикам, подавляющим преимущественно В-систему иммуни-
тета, относятся хлорорганический инсектицид токсафен, трихлорэтан, сви-
нец, трихлорэтилен, монохлорамин, бромхлорметан, трибромметан, хлорид
бериллия при хронической интоксикации в течение 3 нед в дозе 0,1 LDso>
366
перхлорат натрия, диметилнитрозамин. Хроническое действие окислов азота
приводит к снижению концентрации иммуноглобулинов А и G, причем
супрессия их синтеза усиливается при возникновении хронических бронхи-
тов. Антителообразование угнетают также высокие дозы тиоционата и цио-
ната селена. Снижение синтеза иммуноглобулинов А отмечается у лиц,
контактирующих с роданистым аммонием и тиомочевиной [7, 18, 21].
Различные ПАУ действуют на гуморальный иммунный ответ неодно-
значно. Так, антрацен, бенз(а)пирен, перилен, хризен не оказывают на него
влияния, а бенз(а)антрацен и дибенз[а,Ь]антрацен снижают формирование
антителообразующих клеток в селезенке у мышей на 55—91 % [27].
В-иммунодефицит может наступить весьма нескоро даже при длитель-
ном действии яда. Например, среди работающих в контакте с парами ртути
снижение содержания иммуноглобулинов А и G отмечено только у лиц со
стажем работы более 20 лет. Супрессию антителообразования, а также умень-
шение фагоцитарной активности вызывают при хронической интоксикации
различные пестициды, хлорированные, ароматические, фторированные уг-
леводороды, ртуть, сернистый ангидрид, сероуглерод и другие соединения
[7, 17, 21, 33].
Дихлофос при хроническом воздействии в ежесуточной дозе 0,025; 0,05;
0,1 LD50 приводил к супрессии гуморальной иммунной реакции у кроликов
на брюшнотифозную вакцину. Аналогичное действие оказывал паратион,
который в дозе 2,2 мг/кг (0,1 LD50) при ежедневном пероральном поступ-
лении в течение 8 сут уменьшал содержание АОК в селезенке у мышей в
1,5 раза. Наблюдалось угнетение гуморального иммунитета при пятикратном
введении мышам карбофоса в дозах 0,05; 0,02; 0,01 LD50 [7, 9, 10].
Наряду с фактами, свидетельствующими о супрессии гуморальной им-
мунной реакции ФОС, установлено, что лептофос (фосфорорганический
пестицид) при концентрациях в пище от 10 до 500 ppm, вызывающих
снижение активности холинэстеразы сыворотки крови в 1,5—8,8 раза через
12 нед, не оказывал существенного влияния на количество АОК селезенки
при первичном и вторичном гуморальном иммунном ответе. Не обнаружены
сдвиги при исследовании содержания иммуноглобулинов у рабочих, обра-
батывающих теплицы ФОС. Хлорофос при хронической интоксикации в
течение 100 дней в ежедневной дозе 0,05 LD50 приводил даже к увеличению
титра антител к брюшнотифозному О- и Vi-антигену. Аналогичные сдвиги
под влиянием ФОС отмечены в отношении иммуноглобулинов М и G. При
этом в сыворотке крови уменьшалось только содержание иммуноглобули-
нов А [7].
Неоднозначность изменений гуморальной иммунной реакции под влия-
нием хронической интоксикации ФОС, вероятно, связана с использованием
различных доз антихолинэстеразных ядов и способов иммунизации.
В большей степени в литературе отражено влияние острого отравления
ФОС на гуморальный иммунный ответ в экспериментах на животных.
Паратион в дозе 22,3 мг/кг при интоксикации через 2 сут после имму-
низации ЭБ, т.е. в продуктивной фазе иммунного ответа, приводил к сни-
жению в 3,4 раза количества АОК в селезенке мышей. На индуктивную фазу
иммунного ответа при введении ФОС одновременно с иммунизацией пара-
тион существенного влияния не оказывал. Аналогичные результаты получе-
ны при острой интоксикации паратионом, малатионом, дихлофосом, мета-
мидофосом и другими фосфорорганическими пестицидами. Паратион в дозе
16 мг/кг, вызывающей выраженную холинергическую стимуляцию и гибель
*0 % мышей, на 65 % снижал количество клеток в селезенке, синтезирующих
367
IgM. При применении его через 2 сут после иммунизации (иммунный
ответ оценивали на 4-е сутки после иммунизации) в дозе 4 мг/кг, не
вызывающей симптомов интоксикации, паратион не подавлял иммунную
реакцию [20]. Показано значительное угнетение антителообразования фо-
залоном [7].
Супрессия гуморальной иммунной реакции под влиянием ФОС сопро-
вождалась снижением лимфоидных индексов вилочковой железы и селезен-
ки, уменьшением активности холинэстеразы в плазме крови и мозге, по-
вышением концентрации кортизола и глюкозы в крови, активности транс-
аминазы в печени. Отмечена обратная корреляция между активностью хо-
линэстеразы в плазме крови и мозге и угнетением антителообразования.
Восстановление содержания лимфоцитов в вилочковой железе и селезенке
при интоксикации диметоатом происходило через 72 ч. Атропин в дозе
75 мг/кг не оказывал защитного действия на синтез антител [20].
Снижение синтеза антител в описанных экспериментах наблюдалось не
только при дозах, вызывающих выраженную холинергическую стимуляцию,
но и при воздействии небольших доз ФОС (0,1 LD50). При дальнейшем
уменьшении дозы яда (действие метомидофоса 0,05 LD50) проявлялось сти-
мулирующее влияние ФОС на гуморальный иммунный ответ. Действие
ФОС на синтез IgM и IgG зависит от соотношения сроков интоксикации
и иммунизации. Как уже отмечалось, продукция IgM снижается при введе-
нии ФОС через 2 сут после антигенной стимуляции. При этом через 8 сут
обнаруживается тенденция к увеличению синтеза IgG. Однако если вызвать
интоксикацию через 6 сут после иммунизации, то количество клеток в
селезенке, синтезирующих антитела этого класса, снижается в 2 раза. Пред-
полагают, что супрессия иммунного ответа связана с увеличением содержа-
ния глюкокортикоидов в крови под влиянием ФОС, так как преднизолон в
дозе 100 мг/кг вызывает аналогичный эффект, а адреналэктомия устраняет
иммунотоксическое действие антихолинэстеразных ядов. Опыты in vitro
позволяют утверждать, что такой показатель функционального состояния
В-системы, как индуцированная антииммуноглобулинами подвижность
В-лимфоцитов, существенно подавляется под влиянием диизопропилфтор-
фосфата. Следовательно, нельзя признать основной роль глюкокортикоидов
в нарушении функции В-клеток под влиянием ФОС. В то же время в опытах
на крысах линии Wistar показано, что введение внутрь 0,01 LD50 (3,5 мг/кг)
форматиона в течение 2 мес вызывает повышение содержания кортикосте-
рона в крови, коррелирующее со снижением гуморального иммунитета [4,
7, 20].
По нашим данным, изменение иммунного статуса при действии ФОС
связано как с неспецифическим стрессорным влиянием кортикостероидов
на отдельные иммунные реакции, так и со специфическими механизмами,
к которым следует отнести ингибирование эстераз ИКК [16, 22] и действие
ацетилхолина. Значимость неспецифических и специфических эффектов в
формировании иммунодефицитного состояния после интоксикации ФОС
зависит от исследуемой иммунной реакции. Наличие ряда общих механиз-
мов возникновения иммуносупрессии при стрессе и интоксикации ФОС
позволяет предполагать возможность использования сходных способов фар-
макологической коррекции нарушений иммунного гомеостаза, вызываемых
этими факторами [4].
В условиях in vitro показано, что у-хлордан в дозе от 0,1 до 100 мкг/мл
резко подавляет гуморальный и клеточный иммунный ответ спленоцитов
мышей. Иммунодепрессивное действие носит дозозависимый характер и
368
наиболее выражено при изучении ответа в смешанной культуре. По срав-
нению с антителопродукцией клеточный ответ ослаблен в большей степени.
Добавление сыворотки крови человека к культуре клеток костного мозга
мышей предотвращает ингибирующее действие у-хлордана на включение
радиоактивной метки в эти клетки. Авторы делают вывод о неспособности
яда вызывать иммуносупрессию in vivo вследствие либо метаболизма его в
организме, либо связывания с белками крови [7, 9, 10].
Обширные исследования иммунотоксичности ДДТ показали, что данное
соединение способно снижать массы вилочковой железы и селезенки у кур
(100 ppm перорально в течение 40 дней) соответственно на 35 и 45 %. При
этом масса сумки Фабрициуса увеличивалась на 20 %. Антителообразование
под влиянием ДДТ (200 ppm внутрь в течение 35 дней), оцениваемое по
Т-зависимому антителообразованию к овоальбумину, снижалось на 30 %.
При использовании других антигенов, доз яда, видов животных либо не
отмечали эффекта, либо регистрировали эффект супрессии, либо констати-
ровали усиление гуморального иммунного ответа (крысам линии Wistar —
40 мг/кг внутрь ежедневно в течение 60 дней). Что касается клеточного
иммунитета, то отмечалось как повышение реакции гиперчувствительности
замедленного типа (ГЗТ) у крыс линии Wistar на бычий сывороточный
альбумин (40 мг/кг перорально ежедневно в течение 60 дней), так и сниже-
ние выраженности этой реакции на туберкулин у кроликов (150 ppm пер-
орально в течение 4 нед) на 60—75 %. Хемотаксис лейкоцитов у людей
(10 мкмоль in vitro) под влиянием ДДТ снижался на 23 %. Аналогичные
данные получены в отношении НРО, оцениваемой по течению эксперимен-
тальной инфекции у мышей. Описано усиление иммунотоксичности данно-
го пестицида, связанного с липопротеином, при переработке его макрофа-
гами по сравнению с использованием интактного ДДТ [21].
Линдан (у-гексахлор циклогексан) первоначально стимулировал иммуно-
реактивность, повышая синтез IgM (150 ppm перорально в течение месяца),
но затем вызывал иммунодепрессию. При этом бластогенез лимфоцитов
тормозился ингибитором кальциевых каналов верапамилом и ингибитором
кальмодулина трифторперазином. Дозозависимое изменение клеточного и
гуморального иммунитета, выражающееся в первоначальной стимуляции и
последующей его супрессии, сопровождалось отсутствием изменения функ-
циональной активности макрофагов. Линдан снижал Т-зависимый гумо-
ральный иммунный ответ (12 мг/кг ежедневно перорально 5 дней в неделю
в течение 5—6 нед) [7, 10, 33].
Мирекс в опытах на курах (100 ppm перорально в течение 40 дней)
существенно уменьшал массы вилочковой железы, селезенки и сумки Фаб-
рициуса, а при дозе 500 ppm в течение 5 нед вызывал супрессию Т-зависи-
мого гуморального иммунного ответа. Под влиянием токсафена у мышей
при пероральном и внутриматочном введении (100, 200 ppm в течение 8 нед)
снижалась выраженность Т-зависимого гуморального иммунного ответа на
бычий сывороточный альбумин [21].
При изучении иммунотропных свойств пиретроидных инсектицидов ус-
тановлено снижение под влиянием этих соединений гуморального и кле-
точного иммунитета. Так, аллетрин (10 мкмоль), циперметрин (50 мкмоль
2 дня), фенпропатрин (30 мкмоль) и перметрин (50 мкмоль) in vitro (экс-
позиция 2 сут) уменьшали пролиферацию В-лимфоцитов под влиянием
липополисахарида соответственно на 90, 100 и 100 %. Пиретроидный инсек-
тицид дельтиметрин при введении мышам внутрь в суточной дозе 6 мг/кг
в течение 84 дней либо 15 мг/кг в течение 14 дней вызывал супрессию
369
гуморального иммунного ответа на ЭБ, уменьшение числа Т-лимфоцитов в
селезенке и лимфатических узлах. Установлено также снижение гумораль-
ного Т-зависимого иммунного ответа при дозе циклогексидина 12,5; 25 и
50 мг/кг (ежедневно внутриперитонеально) соответственно на 30, 60 и 70 %,
который оценивали по числу антителообразующих клеток (АОК) в селезенке
мышей. Из фунгицидов выраженной иммунотоксичностью обладает каптан.
В опытах на крысах Wistar (1 г/кг внутрь ежедневно в течение 3 нед)
выявлено снижение массы вилочковой железы. Супрессия гуморального
Т-зависимого иммунного ответа, уменьшение пролиферации В-лимфоцитов,
индуцированной липополисахаридом, пролиферации Т-лимфоцитов под
влиянием фитогемагглютинина (ФГА) и конканавалина А (КонА) отмеча-
лись при использовании каптана в опытах на крысах различных линий и на
мышах BALB/c. Гексахлорбензол и пентахлорфенол в зависимости от доз и
вида животных вызывают как увеличение, так и уменьшение синтеза имму-
ноглобулинов различных классов, а также снижение или повышение анти-
инфекционной неспецифической резистентности организма к различным
микроорганизмам [21].
Под влиянием динокапа снижалась продукция IgM и IgG при иммуни-
зации мышей ЭБ, что было обусловлено замедлением достижения пика
продукции иммуноглобулинов. Наиболее распространенный в сельском хо-
зяйстве гербицид 2,4-Д у крыс линии Y59 угнетал ранний первичный гумо-
ральный ответ (на 15-й день) и вторичный иммунный ответ (на 21-й день).
Хлорид кадмия в дозе 7,5 мг/кг при введении мышам внутрь однократно
уменьшал Т-зависимое антителообразование на 25 %. Функция В-лимфоци-
тов, оцениваемая по розеткообразованию, при действии хлорида кадмия на
мышей в течение 10 нед в дозе 30 ppm снижалась на 30 %. При концент-
рации 10—100 мкмоль in vitro в течение 5 сут дихлорид кобальта снижал
Т-зависимое антителообразование к ЭБ у мышей на 35—49 %. Марганец при
концентрации 1 мкмоль и 0,1 ммоль (in vitro в течение 5 сут) снижал у
мышей Т-зависимый гуморальный иммунный ответ на ЭБ соответственно
на 53 и 84% [21].
В опытах на мышах установлено снижение Т-зависимого первичного и
вторичного иммунных ответов в 2—5 раз к ЭБ при хронической пероральной
интоксикации мышьяком (поступление мышьяковистого натрия в течение
3 нед в дозе от 0,5 до 10 ppm). Мышьяковистый галлий (2,5—200 мг/кг
однократно) уменьшает количество АОК к ЭБ в селезенке мышей, ослабляет
способность к презентации антигена премированными ЭБ макрофагами
популяции Т-клеток. При этом супрессия антителообразования не связана
с процессингом антигена макрофагами и продукцией ИЛ-1 этими клетками.
Снижение количества АОК к тимуснезависимому антигену динитрофе-
нилфиколу наблюдали при введении мышьяковистого галлия в дозе 100—
200 мг/кг. Максимальная доза приводила к снижению числа АОК в селе-
зенке на 54 %, а также числа Т-клеток, В-лимфоцитов и макрофагов. Суп-
рессия антителообразования была прямо связана с уменьшением количества
макрофагов в селезенке мышей [7, 21].
Хлорид никеля в однократной дозе 27,5 мг/кг снижает массу вилочковой
железы и селезенки, причем вилочковой железы при дозе 18,3 мг/кг. При
этом отмечается уменьшение Т-зависимого гуморального иммунного ответа
к ЭБ на 60—80 %. Аналогичные результаты получены и при меньших одно-
кратных дозах (8—12 мг/кг), которые вызывали супрессию иммунной реак-
ции на 15—20 %, а также при исследовании иммунотоксичности сульфата
никеля (мыши, 3—12 мг/кг однократно). Исследованные дозы не влияли на
370
Т-независимый гуморальный иммунный ответ и пролиферацию В-лимфо-
цитов. Соединения олова снижают Т-зависимый гуморальный иммунный
ответ у мышей при острой и хронической интоксикации, пролиферацию
Т-лимфоцитов крыс под влиянием митогенов, реакцию ГЗТ на туберкулин
и овоальбумин у крыс, уменьшают содержание лимфоцитов в крови, про-
лиферацию В-лимфоцитов крыс под влиянием липосахарида, содержание
IgG в сыворотке крови крыс, устойчивость животных к экспериментальной
инфекции. При остром действии на крыс диоктилдихлорида олова измене-
ния в селезенке и снижение синтеза IgM и IgG отмечались при дозе, более
высокой, чем доза, вызывающая атрофию вилочковой железы [21].
Хлорид ртути у мышей разных линий активирует предпочтительно Th[
(линия DBA/2) или Th2 (линия ASW). При этом Thj вызывают усиление
реакции гиперчувствительности IV типа (контактный дерматит), a Th2 ин-
дуцируют продукцию IgE и IgGj, опосредуемую ИЛ-4, и участвует в фор-
мировании гиперчувствительности I типа (анафилактические и аллергичес-
кие реакции). Иммунная система наиболее сильно подвержена влиянию
ртути у мышей C57BL/6, что проявляется увеличением числа ядросодержа-
щих клеток в селезенке, повышением в сыворотке крови IgE, образованием
антиядерных антител, двухфазной модуляцией гуморального иммунного от-
вета к ЭБ. Частично восприимчивость мышей к ртути связана с токсико-
кинетикой этого элемента. Так, у мышей C57BL/6 концентрация ртути в
крови, печени и почках была в 3 раза меньше, чем у мышей резистентной
линии DBA/2 [7].
Влияние ацетата свинца на гуморальный и клеточный иммунные ответы
выражается в снижении синтеза IgG (25—50 ppm, внутрь 10 нед в препост-
натальном периоде у крыс), Т-зависимого иммунного ответа к ЭБ у мышей
и крыс. При использовании клеточных клонов показано, что свинец уси-
ливает активацию клона Th2 и тормозит активацию клона Thp При этом
проявляется стимулирующее действие свинца на дифференцировку мыши-
ных В-клеток [7].
Под влиянием дихлорэтана (ДХЭ) происходило снижение гуморального
иммунного ответа к Т-зависимому и тимуснезависимому антигенам. Более
выраженная супрессия антителообразования отмечалась к тимусзависимому
антигену — ЭБ. Так, полученные результаты показывают, что к ЭБ антите-
лопродукция при действии ДХЭ снижена на 42 %, а к Vi-Ag — только на
23 %. Одним из основных механизмов угнетения тимусзависимого гумораль-
ного иммунного ответа под влиянием ДХЭ может являться ингибирование
ацетилхолинэстеразы и неспецифических эстераз, локализованных преиму-
щественно в Т-хелперах. О такой возможности свидетельствует установлен-
ное нами под влиянием ДХЭ выраженное уменьшение активности а-на-
фтил-А8-ацетатэстеразы спленоцитов [7].
Под влиянием острого отравления тетрахлорметаном (ТХМ) in vitro в
концентрации 3 ммоль происходит подавление гуморального иммунного
ответа на ЭБ, динитрофикол и липополисахарид. Снижаются активность
В-лимфоцитов и супрессорная функция Т-лимфоцитов. Под влиянием ТХМ
наблюдали угнетение функции В-клеток, особенно в ранние сроки после
поражения, вследствие чего уменьшается их способность к кооперации с
‘-клетками. Это приводит к снижению иммунного ответа на тимусзависи-
мый антиген ЭБ. При ингаляционном воздействии бензол при концентра-
циях 14 мг/м3 и 30 мг/м3 снижал число АОК в селезенке соответственно на
36 и 72 % через 7 сут. На 120-е сутки снижение количества АОК достигало
91—93 %. Бензол в концентрации 30 мг/л в течение 2 ч в сутки на протя-
371
жении 14 дней снижал гуморальный иммунный ответ. В более низких
концентрациях (4 и 10 мг/л) он такое действие не оказывал [7].
При иммунизации мышей ЭБ этанолом в однократной дозе 7 г/кг
ослаблялась продукция антител классов IgM и IgG^ но не изменялся синтез
антител IgG2 [7, 23].
По данным литературы, иммуносупрессирующее влияние полихлориро-
ванных бифенилов и тетрахлордибензофурана сопровождается снижением
уровня IgM, IgA и IgG. Полибромированные бифенилы, тетрахлордибензо-
фуран подавляют реакцию бласттрансформации лимфоцитов. Бенз(а)антра-
цен, бенз(а)пирен, метилхолентрен, ТХДД, полихлорированные бензфура-
ны, р-нафтофлавон снижают количество АОК в селезенке мышей после
иммунизации ЭБ [12].
ТХДД как при однократном (1,2—6 мкг/кг внутриперитонеально), так и
при многократном (0,008 мгк/кг перорально, 8 нед, морские свинки) вве-
дении снижал Т-зависимый и тимуснезависимый гуморальный иммунный
ответ. Морские свинки наиболее чувствительны к ТХДД. In vitro ТХДД при
концентрации 50 нг/мл на 70 % уменьшал пролиферацию В-лимфоцитов,
индуцированную липополисахаридом [12].
Действие ТХДД на В-клетки определяется супрессией Т-зависимого и
Т-независимого антителообразования, причем ТХДД влияет на дифферен-
цировку В-лимфоцитов, а не на их пролиферацию. В концентрации 30 и
60 ммоль ТХДД усиливает пролиферацию В-лимфоцитов через 72 и 92 ч in
vitro, а также синтез IgM этими клетками, выявляемый через 7 сут культи-
вирования. ТХДД нарушает способность Т-клеток активировать В-лимфо-
циты в процессе иммунного ответа [31, 32].
Результаты использования различных сочетаний в культуре макрофагов,
Т- и В-лимфоцитов от интактных и получавших ТХДД мышей показали,
что супрессия иммунного ответа (синтеза антител) связана с воздействием
ТХДД на В-лимфоциты. При этом подавляется синтез главным образом IgM.
Снижение способности к синтезу антител В-лимфоцитами не влияет на их
пролиферативную активность, индуцированную липополисахаридом in vitro
[7, 19].
Показана важная роль Т-лимфоцитов в реализации иммуносупрессивно-
го действия 1,2,3,4,6,7,8-гептахлордибензол-л-диоксина (основной иммуно-
токсический контаминант пентахлорфенола), так как подавление иммунно-
го ответа на Т-зависимый антиген носило более выраженный характер, чем
на Т-независимый [7].
У мышей и крыс под влиянием метилметакрилата и бутилакрилата в
зависимости от дозы яда снижается число АОК на ЭБ в селезенке и коли-
чество В-лимфоцитов в крови. Кроме того, в прямой зависимости от дозы
исследованных токсикантов возрастает мутагенный эффект в клетках кост-
ного мозга крыс [7].
Клеточный иммунитет проявляется в реакциях клеток иммунной систе-
мы на чужеродные для данного организма клеточные формы. Ютетками-ми-
шенями в этом случае могут быть клетки трансплантата, опухолевые клетки,
клетки, зараженные вирусом. Основными эффекторами в реакциях клеточ-
ного иммунитета являются Т-киллеры. Цитотоксическое разрушение кле-
ток-мишеней способны осуществлять и клетки других типов — естественные
киллеры, Т-клетки реакции гиперчувствительности замедленного типа (Thj),
макрофаги, полиморфно-ядерные лейкоциты. В реакции антителозависимой
клеточной цитотоксичности (АЗКЦ) эффекторные клетки разрушают клет-
ки-мишени в присутствии специфических антител, направленных против их
372
Рис. 10.6. Влияние ТХВ на первичное распознавание антигена Т-киллерами, Т-клет-
ками и Т-супрессорами.
ТХВ с отходящими стрелками — гипотетическое воздействие токсичных химических веществ
на распознавание, процессинг антигена и другие реакции, связанные с реализацией цито-
токсического эффекта Т-клеток; ГКГС-1 — главный комплекс гистосовместимости класса I;
ГКГС-П — главный комплекс гистосовместимости класса П; АГи — антиген интактный; АГп —
антиген процессированный (переработанный и представленный на поверхности клетки); Км —
клетка-мишень (опухолевая клетка, микроорганизм, клетка, пораженная вирусом); Тк — Т-кил-
лер (цитотоксический Т-лимфоцит, Т-эффектор); пТк — предшественник Т-киллера; ТЫ —
Т-лимфоцит-хелпер типа 1; М — макрофаг; Ти — Т-индуктор; Тс — Т-супрессор; пТс — пред-
шественник Т-супрессора; иТс — индуктор Т-супрессора; ИФу — у-интерферон; ИЛ-1 — интер-
лейкин 1; ИЛ-2 — интерлейкин 2; ЭФ — эффекторный фактор; ПГЕ — простагландин; ИФ —
индукторный фактор.
антигенных детерминант. Т-система (точнее Т-клеточные элементы гумо-
рального иммунного ответа) контролирует работу В-системы. Для изучения
влияния ксенобиотиков на Т-систему иммунитета исследуют содержание
различных субпопуляций Т-лимфоцитов в органах системы иммунитета и
крови, оценивают реакции бласттрансформации лимфоцитов, ГЗТ, оттор-
жения аллотрансплантата, торможения миграции лейкоцитов, продукцию
лимфокинов Т-клетками, естественную и антителозависимую клеточную
цитотоксичность и др. [14].
Формирование ГЗТ, широко используемое в иммунологических иссле-
дованиях, трактуется с двух позиций: во-первых, ее снижение является
одним из признаков супрессии Т-системы иммунитета, в частности Th!,
во-вторых, проявление реакций ГЗТ на химические аллергены в определен-
ных тестах свидетельствует о наличии у ТХВ свойств аллергена. При этом
реализация данной реакции гиперчувствительности осуществляется при
Участии ИЛ-2, у-интерферона, фактора некроза опухоли-р, ИЛ-3 и грану-
лоцитарно-макрофагального колониестимулирующего фактора [24].
Нарушение функции системы иммунитета, связанное с поражением
Т-клеток, возможно вследствие нарушения химическими соединениями
миграции лимфоцитов в вилочковую железу и последующей их дифферен-
цировки. Активацию Т-клеток ТХВ способны нарушать путем супрессии
синтеза ИЛ-2 антигенпрезентирующими клетками. Функция цитотоксичес-
ких Т-лимфоцитов может быть нарушена токсикантами в результате блоки-
рования синтеза рецепторов, распознающих антиген в комплексе с молеку-
373
лой главного комплекса гистосовместимости I класса. Действие ТХВ на
механизм реализации клеточного иммунитета, осуществляемое цитотокси-
ческими Т-лимфоцитами (Т-киллеры), многообразны. Они изучены крайне
недостаточно. На рис. 10.6 показано осуществление Т-клеточной иммунной
реакции — уничтожение клетки-мишени (опухолевая клетка), клетки, пора-
женной вирусом, ксеногенной клетки, в частности микроорганизма, клет-
кой-эффектором (цитотоксический Т-лимфоцит).
При хроническом воздействии фосфорорганических инсектицидов на
рабочих отмечалось ингибирование Т-клеточного эффекта на митогенную
стимуляцию ФГА и уменьшение содержания Е-РОК в крови. Под влиянием
хлорофоса существенно снижалась реакция трансплантат против хозяина. Дан-
ные экспериментальных исследований свидетельствуют, что угнетение клеточ-
ного иммунитета при интоксикации ФОС сопровождается изменением иммун-
ной структуры лимфатических фолликулов селезенки, в частности уменьше-
нием тимусзависимых зон в этом органе с атрофией коры тимуса [7, 9].
В опытах на мышах установлено, что малатион in vitro при концентра-
циях 75 мкг/мл и выше существенно снижает образование зрелых форм
цитотоксических Т-лимфоцитов под влиянием клеток аллогенной опухоли
Р815. Этилпаратион, метилпаратион, фенитротион и фентиол подавляют
генерацию цитотоксических Т-лимфоцитов в дозе 5—10 мкг/мл. Преинку-
бация ФОС с постмитохондриальным супернатантом печени крыс, приво-
дящая к их биотрансформации, значительно ослабляет этот эффект. Карбо-
фуран существенно не влияет на активность цитотоксических Т-клеток, а
карбанил подавляет ее в дозе 50—100 мкг/мл. Обработка карбаматов постми-
тохондриальным супернатантом не оказывала влияния на цитотоксичность.
Длительное введение малатиона (0,1 LD50) в течение 2 нед вызывало у
мышей уменьшение количества Т-клеток в вилочковой железе. Острая ин-
токсикация данным пестицидом (0,5 LD50) приводила к увеличению про-
лиферации Т-лимфоцитов при их стимуляции конканавалином А [7].
При изучении иммунотоксических свойств 5 пестицидов, в том числе
фосфорорганического инсектицида метилпаратиона, отмечалось существен-
ное уменьшение реакции ГЗТ на туберкулин у кроликов после получения
ими пестицидов в различных дозах в течение 10 и 24 сут. Супрессия реакции
ГЗТ прямо зависела от дозы и времени интоксикации. Так, метилпаратион
в дозе от 0,04 до 1,5 мг/кг, получаемой ежедневно, через 24 дня уменьшал
реакцию на повторные введения туберкулина в 1,2—2,8 раза. На 10-е сутки
после ежедневного получения пестицидов дозозависимый эффект метилпа-
ратиона и большинства исследованных пестицидов отсутствовал. Реакцию
ГЗТ в дозе 0,01 LD50 (13,5 мг/кг) при введении внутрь в течение 2 мес у
крыс Wistar снижал форматион, причем это было связано с увеличением
содержания кортикостерона в крови. ТХДД и полихлорированные бифени-
лы существенно снижали реакцию ГЗТ [7].
Хромосомные абберации в лимфоцитах крови рабочих, длительное время
подвергавшихся действию ФОС и других пестицидов, были в 2—3 раза
выше, чем у контрольных лиц.
С применением большого количества современных иммунологических
методов исследована способность макрофагов к представлению антигена
Т-клеткам и продукции ИЛ-1, проведено определение их 1а-позитивных
форм, изучены кооперативные взаимодействия между макрофагами, Т- и
В-клетками, бластогенный ответ спленоцитов на митогены, продукция ИЛ-2
под влиянием О,8,8-триметилтиофосфата. Считать установленные авторами
нарушения указанных иммунных реакций характерными для всех ФОС не
374
вполне оправдано, так как данное соединение, как уже указывалось, прак-
тически не оказывает антихолинэстеразное действие.
В механизме нарушений системы иммунитета при интоксикации ФОС
существенную роль играет глутатион. Так, в условиях in vitro исследовали
иммунотоксическое действие О,8,8-триметилтиофосфата и вовлеченность в
реализацию этого эффекта глутатиона. Преинкубация О,8,8-триметилтио-
фосфата с глутатионом усиливает иммунодепрессивные свойства O,S,S-Tpn-
метилтиофосфата в отношении гуморального иммунного ответа, цито-
токсической активности Т-лимфоцитов и макрофагов. Сделан вывод, что
О,5,8-триметилтиофосфат оказывает свое иммунотоксическое действие пря-
мым путем, без вовлечения в процесс клеток-супрессоров [7, 27].
У лиц, подвергшихся воздействию ФОС, значительно чаще встречаются
лимфопролиферативные заболевания. ФОС тормозят активность эстераз в
моноцитах, цитотоксических Т-лимфоцитах, интактных и активированных
лимфокинами естественных киллерах. Эти влияния ФОС ослабляют имму-
нологический контроль и эффекторные функции, опосредуемые данными
видами клеток. Развитие лимфомы часто связано с присутствием вируса
Эпштейна — Барр и человеческого герпесвируса-6, иммунитет к которым
опосредуется моноцитами, Т-лимфоцитами и естественными киллерами.
Выдвигается гипотеза, что торможение активности эстераз иммунокомпетент-
ных клеток, вызываемое ФОС, ослабляет процесс эстеразозависимой детокси-
кации, в результате чего способствует развитию процесса лимфомогенеза.
Кроме того, при снижении активности эстераз подавляется иммунитет к таким
патогенам, способствующим развитию лимфом, как герпесвирусы [28].
Впервые влияние ФОС на Т-клеточную цитотоксичность было описано
в 1972 г. [22]. В опытах в системе in vitro, где клетками-эффекторами
являлись спленоциты мышей, а клетками-мишенями — клетки опухоли,
установлено, что диизопропилфторфосфат и другие ФОС прямо пропорцио-
нально концентрации уменьшают активность Т-лимфоцитов-киллеров. Суп-
рессия цитотоксического эффекта обусловлена необратимым ингибирова-
нием так называемых активированных эстераз клеток. Данные эстеразы
приобретают активность под влиянием хемотаксического фактора или при
взаимодействии клетки-эффектора и клетки-мишени. Таким образом, убе-
дительно доказаны роль “активированных” эстераз, которые в настоящее
время идентифицированы как ацетилхолинэстераза, а-нафтил-А8-ацетатэс-
тераза и а-нафтилбутиратэстераза, в реализации Т-клеточной цитотоксич-
ности, и возможность существенного снижения выраженности данной им-
мунной реакции антихолинэстеразными ядами [16]. ФОС в зависимости от
структуры в диапазоне концентраций от 0,1 до 1,0 ммоль ингибировали
активность Т-киллеров на 5—100 %.
В реализации механизма, ингибирующего эффекты ФОС на цитотоксич-
ность Т-лимфоцитов, существенное значение имеет связанная с эстеразной
активностью проницаемость мембраны клетки-эффектора для ионов каль-
ция и магния. В свою очередь электролитный обмен этой клетки сопряжен
с внутриклеточным содержанием циклических нуклеотидов. Диизопропил-
фторфосфат уменьшает активацию Т-киллеров при концентрациях от 0,5 до
4 ммоль на 5-80 % [22].
Инсектицид бутоксид (10 мкммоль in vitro, экспозиция 3 сут) в опытах
на клетках человека на 25 % снижал пролиферацию Т-лимфоцитов, инду-
цированную ФГА, а также приводил к снижению хемотаксиса лейкоцитов
йа 42 %. Из регуляторов роста растений циклогексимид уменьшал у мышей
^miss массу вилочковой железы при дозах 25 мг/кг (внутриперитонеально
375
ежедневно 2 раза в неделю) и 50 мг/кг (условия применения те же) соот-
ветственно на 30 и 60 %. Введение фунгицида динокапа мышам в дозе
25 мк/кг в течение 12 сут вызывало уменьшение массы тела, содержания
клеток в тимусе и возрастание массы селезенки. Происходило торможение
бласттрансформации тимоцитов в ответ на КонА и ФГА, тогда как ответ
цитотоксических Т-лимфоцитов на клетки плазмоцитомы Р815 был усилен.
В условиях in vitro динокап (10 мкг/мл 72 ч) ослаблял пролиферативный
ответ мышиных тимоцитов на Т-митогены. При этом депрессивный эффект
выявлялся уже через 30 мин после контакта с ядом. Арсениты при концент-
рации 2—4 ммоль in vitro увеличивают пролиферацию Т-клеток теленка под
влиянием ФГА (инкубация 3 сут) и снижают данную реакцию при концент-
рациях 8 и 10 ммоль. Аналогичные данные получены и при исследовании
Т-лимфоцитов человека [21].
У животных с иммуносупрессией, обусловленной многократным поступ-
лением пиретроида, тималин оказывает нормализующее воздействие на по-
казатель гуморального и клеточного иммунитета. Это является косвенным
свидетельством преимущественного нарушения функции в основном Т-кле-
ток. Пиретроидный инсектицид фенвалерат in vitro в дозах 2—50 мкг/мл
вызывал появление фигур С-митоза (т.е. тормозил нормальный митоз). Это
торможение носило в целом дозозависимый характер, а также подтверждало
отсутствие фигур анафазы и телофазы.
Гербицид толуин в виде 2,5 % раствора в диметилсульфоксиде при под-
кожном введении в течение 5 дней морским свинкам в дозах 1,2 и 2,5 мг/кг
уменьшал относительное и абсолютное число Т-лимфоцитов соответственно
в 2 и 1,5 раза без существенного изменения В-лимфоцитов только при
максимальной дозе. При этом функция Т-лимфоцитов уменьшалась в 1,3
раза. Пероральное воздействие на организм крыс в течение длительного
времени гербицидов в малых дозах (диват, симазин, линуран) приводило к
существенному подавлению факторов неспецифической защиты (наряду со
стимуляцией некоторых из них), формированию Т-зависимого иммуноде-
фицита с проявлением аутосенсибилизации в сочетании с гиперчувствитель-
ностью немедленного и замедленного типов. При остром отравлении мор-
ских свинок децисом, фозалоном и изофеном отмечено относительное и
абсолютное снижение количества Т-розеткообразующих лимфоцитов и
бласттрансформации лимфоцитов. Показано, что введение в течение 2 и
4 мес морским свинкам ценеба (12,5 мг/кг), трибуфона (5 мг/кг) и севина
(1,5 или 15 мг/кг) способствовало удлинению скорости отторжения транс-
плантата и торможению анафилактической реакции. При 6-месячном вве-
дении эти показатели нормализовались [7, 9, 10, 21].
Потомство крыс с хроническим поражением печени трихлорметаном
характеризовалось депрессией клеточного иммунитета, проявлявшейся умень-
шением количества Т-клеток ГЗТ (Th2). Введение крысам ТХМ вызывало
снижение функциональной активности Т-лимфоцитов крови в реакции бласт-
трансформации в ответ на ФГА, особенно в ранние сроки. Позже экспери-
менты показали, что под влиянием ТХМ возрастает активность как Т-хел-
перов, так и Т-супрессоров, причем последних — более значительно. В экс-
периментах in vitro на клетках крови человека установлено, что бензол в
концентрациях 2,2 и 4,4 мг/мг в течение 3 сут не влияет на пролиферацию
Т-лимфоцитов, индуцированную ФГА и КонА. При этой же экспозиции
увеличение пролиферации Т-клеток на 3,3 %, вызванное ФГА, отмечалось
при концентрации 8,8 мг/мл. При ее повышении до 22 мг/мл изучаемый
эффект при использовании обоих митогенов угнетался на 99,1—99,6 %.
376
в концентрациях 10 и 30 мг/л бензол уменьшал количество Т-лимфоцитов
в периферической крови. При производственном действии бензола, толуола
и ксилола отмечали снижение количества Т-лимфоцитов без нарушения их
функции [7, 21].
Этанол in vitro (10—50 ммоль, инкубация 3 сут) уменьшал пролиферацию
Т-лимфоцитов человека, индуцированную ФГА и КонА на 25—85 %. Этанол
в концентрациях, сходных с таковыми в сыворотке крови людей, при уме-
ренном употреблении алкоголя подавляет пролиферацию Т-лимфоцитов,
индуцированную митогенами, форболмиристатацетатом и моноклональными
антителами к антигену CD3. Этанол не влиял на продукцию ИЛ-2 и экспрес-
сию рецепторов к ИЛ-2, но обладал способностью блокировать активность
экзогенного ИЛ-2. При введении крысам метоксиэтанола внутрибрюшинно
ежедневно на протяжении 10 сут в дозе 50—200 мг/кг наблюдалось снижение
массы вилочковой железы, подавление бласттрансформации Т-лимфоци-
тов (индуцированной ФГА и КонА) и продукции ИЛ-2 [7, 23].
Острое отравление ацетонитрилом приводит к снижению ГЗТ и АЗКЦ.
При этом нарушение клеточных иммунных реакций не связано со стресс-
реакцией (действием кортикостероидов) [6].
Известно, что вызываемое диоксином нарушение созревания тимоцитов
определяется через Ah-рецептор эпителиальных клеток тимуса мышей. У че-
ловека диоксин при прямом воздействии на Ah-рецептор эпителиальных
клеток вилочковой железы дает аналогичный эффект [11, 12].
К иммунотоксическому действию диоксина наиболее чувствительны де-
ти грудного возраста. У рабочих, контактирующих с ТХДД, нарушаются
клеточный иммунитет и функции периферической нервной системы. Атро-
фия вилочковой железы при воздействии диоксина связана с его влиянием
на претимоциты. Атрофия тимуса, индуцированная диоксином, обусловлена
активацией Са2-зависимой эндонуклеазы [7, 19, 31, 32]. По данным тестов,
использованных для оценки клеточного иммунного ответа под влиянием
ТХДД (ГЗТ, пролиферация Т-клеток, индуцированная ФГА, КонА или ми-
тогеном лаконоса), при острой и хронической интоксикации ТХДД, а также
в опытах in vitro (концентрация 50 мг/мл) у мышей и крыс различных линий,
морских свинок отмечалось более чем двукратное снижение исследованных
параметров [21].
In vitro показано действие меди на пролиферацию Т-клеток. При кон-
центрации сульфата меди 10-3 М происходит ее подавление, а снижение
содержания ионов данного металла до 10-5 М усиливает исследованную
реакцию. Выявлено снижение содержания Т-лимфоцитов в крови людей,
подвергшихся действию ароматических углеводородов и метилизоцианата.
Т-хелперы избирательно поражаются при остром отравлении полихлориро-
ванными дибензфуранами. Новый гербицид толуин при подостром действии
на морских свинок в 2 раза уменьшает число Т-лимфоцитов в крови и
снижает их функцию в 1,3 раза без существенного изменения содержания
и функции В-лимфоцитов. В опытах на мышах установлено, что соли
Никеля также поражают преимущественно Т-клеточно-опосредованные ре-
акции. Выраженное снижение Т-лимфоцитов в крови крыс линии Wistar
вызывает гербицид симазан. Гексахлорбензол у крыс поражает преимуще-
ственно зависимое от Т-клеток звено иммунной системы [7].
Подавление иммунных реакций организма может быть обусловлено ток-
сическим действием чужеродных соединений на популяцию Т-клеток суп-
рессоров, играющих важную роль в регуляции иммунного ответа. По дан-
ным экспериментов, повреждение Т-супрессорных клеток могут вызывать
377
свинец, дильдрин, гексахлорбензен, в результате чего усиливаются иммун-
ные реакции. Диоксин наряду с многочисленными иммунотоксическими
эффектами способен повышать супрессорную функцию Т-клеток, что ведет
к снижению генерации цитотоксических лимфоцитов. Введение мышам
карбофоса и 2,4-Д оказывает синергическое дозозависимое влияние на фор-
мирования антигенспецифических Т-супрессоров, определяемых в системе
сингенного адоптивного иммунитета. При этом иммуносупрессивный эф-
фект 2,4-Д выражен в большей степени, чем карбофоса [3].
К группе ТХВ, вызывающих комбинированные нарушения функции Т-
и В-систем иммунитета, относится большое число ксенобиотиков, наруша-
ющих как гуморальные, так и клеточные иммунные реакции: хлороргани-
ческие пестициды и карбаматы, ФОС, диоксид азота и озон, полигалогени-
зированные ароматические углеводороды, в частности диоксин, полихлори-
рованные дифенилы и др. По-видимому, нет ТХВ, способного поражать
только Т- или В-систему иммунитета вследствие тесной их взаимосвязи.
Механизмы ддновременного поражения этих систем иммунитета могут
быть объяснены в основном нарушением следующих процессов: дифференци-
ровкой полипотентных стволовых кроветворных клеток, созреванием клеток-
предшественников Т- и В-лимфоцитов, распознавания иммуноцитами антиге-
на, активации, пролиферации, дифференцировки и регуляции функции ИКК,
миграции лимфоцитов из костного мозга и перераспределения их между
органами иммунной системы, продукции лимфокинов Т-хелперами и другими
клетками, цитотоксической функции Т-клеток и синтеза антител плазматичес-
кими клетками. Реализация этих механизмов обеспечивается антимитоти-
ческим действием ТХВ, а также инициацией перекисного окисления липи-
дов мембран иммуноцитов, инактивацией энзимов, нарушением нейроэн-
докринной регуляции иммунологических процессов и другими эффектами.
В отношении большинства ТХВ механизм нарушения иммунологической
реактивности не исследован. В литературе описаны лишь некоторые про-
цессы, обусловливающие Т- и В-иммунодефицитные состояния. Нарушение
функции В-лимфоцитов под действием диоксина обусловлено преимущест-
венно изменением их дифференцировки. Снижение функции и содержания
Т- и В-лимфоцитов в крови, АОК в селезенке, атрофию вилочковой железы
вызывает бензол, причем для данного соединения характерны поражение
преимущественно Т-супрессоров и отсутствие выраженного влияния на
лимфоциты, содержащие эстеразу, к которым относятся Т-хелперы. Поли-
циклические ароматические углеводороды, обладающие канцерогенным эф-
фектом и присутствующие в атмосферном воздухе в результате сжигания
каменного угля, выделения выхлопных газов и других продуктов термичес-
кой деструкции снижают гуморальный и клеточный иммунный ответ вслед-
ствие действия их на нуклеиновый обмен, супрессии продукции макрофа-
гами ИЛ-1 и Т-хелперами ИЛ-2. Иммунотоксичность многих полицикли-
ческих ароматических углеводородов коррелирует с их способностью инду-
цировать синтез цитохром-Р-450-зависимых монооксигеназ в результате вза-
имодействия с Ah-рецепторами в цитозоле клеток. Интересно отметить, что
различные ПАУ могут оказывать отрицательное влияние либо одновременно
на Т- и В-системы иммунитета и НРО (3-метилхолантрен, 7,12-диметилбен-
зантрацен), либо только на гуморальные и клеточные иммунные реакции,
как, например, бенз(а)пирен [7, 19, 27, 34]. Нарушение функции Т- и
В-клеток, приводящее к снижению антителопродукции. вызывает хлорид
кадмия. Наряду с нарушением гуморального иммунитета и функции Т-кле-
ток диоксин, метилизоцианат, озон, полихлорированные дифенилы, хлорор-
378
ганические и другие пестициды вызывают в эксперименте супрессию фор-
мирования ГЗТ [7, 21, 27, 29].
Супрессия синтеза антител в ряде случаев при действии ТХВ может
сопровождаться избыточной активацией эффекторных механизмов клеточ-
ного и гуморального иммунитета. Стимуляция данных механизмов может
привести к формированию четырех из пяти основных типов реакций гипер-
чувствительности: анафилактических, гуморальных, цитотоксических реак-
ций, вследствие образования иммунных комплексов и возникновения пато-
логических иммунных реакций, опосредованных клетками [14]. К анафи-
лактическим иммунным реакциям, вызываемым токсикантами, относятся
реакции, обусловленные взаимодействием ТХВ (или его метаболитов), яв-
ляющихся антигенами, со специфическими IgE, связанными с соответству-
ющими Fc-рецепторами на поверхности тучных клеток. Гуморальные цито-
токсические иммунные реакции возникают при гибели клеток, с поверх-
ностными антигенами которых связаны аутоантитела, образующиеся на
модифицированные токсикантами белки или нуклеиновые кислоты. Гипер-
чувствительность этого типа может быть обусловлена образованием ТХВ,
являющихся гаптенами, антигенных комплексов на поверхности форменных
элементов крови и возникающей при этом продукцией соответствующих
цитотоксических антител, приводящей к гемолитической анемии, агрануло-
цитозу и тромбоцитопенической пурпуре.
При соединении токсиканта с сывороточными белками вполне вероятны
реакции гиперчувствительности, связанные с образованием иммунных ком-
плексов, сходные по механизму развития с астматическим бронхитом, раз-
вивающимся у сельскохозяйственных рабочих через 6—8 ч после контакта
с пылью от заплесневелого сена, а также вызываемым грибами, болезнями
голубеводов, сыроделов, меховиков, связанными с сенсибилизацией различ-
ными органическими частицами. Патологические иммунные реакции, опос-
редованные клетками ГЗТ, возникают при сенсибилизации химическими
соединениями (пикрилхлорид, формальдегид, оксиды азота, аммиак, диок-
сид серы, пестициды и др.) и протекают в виде контактного дерматита. При
этом ТХВ, соединяясь с поверхностными молекулами клеток Лангерганса
(КЛ), образуют новые антигены, которые и индуцируют ГЗТ [8, 25].
Аутоантитела к различным тканям организма (V тип реакции гиперчув-
ствительности) могут образовываться вследствие нарушения токсикантами
клональной делеции предшественников Т-лимфоцитов в вилочковой железе,
в результате чего цитотоксические Т-клетки не способны различать “свое”
и “чужое”, т.е. блокируется процесс формирования аутотолерантности. Эк-
зогенные раздражители могут стимулировать аутоиммунные реакции за счет
развития процессов денатурации, повреждения клеточных структур и некро-
за тканей.
В литературе описаны состояния, характеризующиеся стимуляцией ТХВ-
синтеза иммуноглобулинов. При этом, вероятно, наряду с выявляемым
увеличением содержания в крови IgM, IgG и IgA происходит и активация
синтеза IgE, который может способствовать развитию анафилактических
реакций. Установлено увеличение содержания IgG, IgA и IgM у работников
производства поливинилхлорида. Уровни иммуноглобулинов данных клас-
сов оказались повышенными у лиц, регулярно потребляющих с пищей
умеренные и высокие количества цианидов [7].
Некоторые металлы (хром, кобальт, никель, ванадий) увеличивают со-
держание IgE и IgG в крови лиц, контактирующих с ними, вызывая при
этом развитие бронхиальной астмы. В дозе 0,1 LD50 при ежедневном вве-
379
дении в течение 1 нед хлорид бериллия усиливает синтез IgM и IgG.
Действие диоксида азота в результате повреждения легочной ткани и изме-
нений в функциональных взаимоотношениях иммуноцитов усиливает им-
мунный ответ на антигены, попадающие в легкие из воздуха. Получены
данные, свидетельствующие об усилении антитело продукции в результате
действия кадмия на мышей в связи с ослаблением данным металлом суп-
рессорной активности лимфоцитов [7].
Формальдегид, являющийся основным. загрязнителем атмосферы прак-
тически всех крупных промышленных городов, вызывает при хроническом
действии антигенную стимуляцию иммунной системы, образование антител
к данному соединению (IgM, IgG, IgE), увеличение содержания Т-клеток
памяти [30]. Стимуляции ряда параметров гуморального иммунитета у людей
способствуют пары неорганической ртути при хроническом воздействии. На
мышах показано, что дифенилгуанидин, дебутилфталат, карбамат, неозон Д,
агидол-40 и агидол-2 (ингредиенты сырья латексных производств) обладают
иммуностимулирующими свойствами. Установлена опасность сенсибилизи-
рующего действия ПАУ, висмута, вольфрама и молибдена, никеля, оксида
этилена. При хронической интоксикации хлористой ртутью у крыс в сыво-
ротке крови увеличивается концентрация иммуноглобулинов всех классов,
особенно IgE, что связано с поликлональной активацией В-клеток, разви-
ваются аутоиммунные расстройства. Повышение синтеза IgE вызывают хлор
и ФОС при контакте с ними работающих более 1 года. Следует отметить,
что в экспериментах на мышах данные соединения обусловливают супрес-
сию синтеза IgE. Соединения кремния способны активировать Т-клеточные
иммунные реакции. Повышение содержания клеток с фенотипом Т8 и Т4
зарегистрировано у лиц, связанных с переработкой алюминия, причем ко-
личество клеток Т8 увеличивается в большей степени [7].
В последние годы установлено, что контактные аллергические (кожные)
и респираторные аллергические реакции реализуются вследствие включения
иммунологических механизмов. Контактные (кожные) и респираторные, в
том числе относящиеся к ТХВ, аллергены действуют соответственно на Thi и
Th2, которые способствуют продукции колониестимулирующего гранулоцитар-
но-макрофагального фактора и ИЛ-3. Однако дальнейшие события в результате
действия ИЛ-4, ИЛ-5, ИЛ-6, ИЛ-10, продуцируемых Th2, приводят к продук-
ции IgE, что обусловливает реализацию респираторных аллергических реак-
ций, а фактор некроза опухоли-0, ИЛ-2 и у-интерферон, секретируемые Thj,
ингибируют синтез IgE и участвуют в формировании ГЗТ [24].
Эпидермальные клетки Лангерганса играют важную роль в индукции
кожных аллергических реакций, в том числе вызванных химическими ал-
лергенами. Клетки Лангерганса с аллергеном доставляются к лимфатичес-
ким узлам в результате их миграции, которая регулируется фактором некроза
опухоли-а и ИЛ-10. Сенсибилизация кожных покровов приводит к выделе-
нию ИЛ-10 клеток Лангерганса, который действует на рецепторы ИЛ-lRI
клеток Лангерганса и кератиноцитов. Кератиноциты выделяют фактор не-
кроза опухоли-а, стимулирующий рецепторы клеток Лангерганса TNFRa к
этому фактору вместе с сигналом, получаемым клетками Лангерганса в
результате стимуляции ИЛ-lRI. Это приводит к миграции клеток Лангер-
ганса в лимфатические узлы с последующим формированием ГЗТ [25].
У 45,6 % рабочих вольфрамово-молибденового рудника выявлены изме-
нения иммунного статуса, а у 66 % — признаки сенсибилизации к металлам.
Соли меди проявляют себя как контактные аллергены [1]. В опытах на
морских свинках установлены выраженные свойства контактного аллергена
380
у сульфата никеля. У людей соли никеля вызывают аллергическую экзему,
сопровождающуюся изменением реакции торможения миграции лейкоцитов
и бронхиальной астмой. Интересно отметить, что увеличение количества
случаев контактной аллергии к никелю в последние десятилетия связано с
использованием женщинами серег из этого металла. Контакт кожи с детер-
гентами усиливает проникновение ионов [7]. Умеренная стимуляция В-сис-
темы происходит при действии малых доз свинца и коррелирует с форми-
рованием аллергических и аутоиммунных реакций [1]. Трихлорид хрома
вызывал выраженную аллергическую реакцию при подкожном введении
(0,1 %) морским свинкам. В опытах на этих животных установлено, что
сенсибилизация к хрому способствует увеличению продолжительности ост-
рого периода формирования язвы желудка, причем определенное значение
имеют цитотропные антитела [21]. Большинство металлов и их солей имеет
аутоиммунные и аллергические свойства [1]. ДДТ способен индуцировать
аллергический контактный дерматит у людей [21].
Состояние иммунной регуляции и клеточной кооперации у рабочих,
контактировавших в производственных условиях с продуктами синтеза хи-
мических волокон (акрилонитрил, метилакрилат, копролактам, сероугле-
род), значительно колебалось и зависело от степени аллергизации организ-
ма. Типы нарушений иммунного статуса коррелировали с наблюдаемыми у
рабочих определенными нозологическими формами (хроническая экзема,
бронхиальная астма, хронический гепатит, аллергический дерматит, крапив-
ница и др.) и характеризовались снижением содержания Т-лимфоцитов,
КонА-индуцированных супрессоров, В-лимфоцитов, IgM, IgG, IgA, а также
выраженности реакции бласттрансформации лимфоцитов с ФГА. Наиболее
часто нарушения иммунного статуса регистрировались в условиях производ-
ства, связанного с использованием акрилонитрила. У чувствительных линий
мышей и крыс ртуть вызывает аутоиммунные заболевания (гломерулонеф-
рит, системный васкулит, синдром Шегрена). Установлена роль генотипа в
развитии аутоиммунных эффектов у крыс. Хлорталонил, применяемый в
сельском хозяйстве, обладающий аллергизирующими свойствами, способен
вызывать кожные реакции гиперчувствительности, изменения в респиратор-
ной системе по типу феномена Артюса. Аллергическую реакцию можно
пассивно перенести сенсибилизированными лимфоцитами [7].
При разработке способов коррекции нарушений при иммунодефицитных
состояниях химической этиологии необходимо учитывать, что некоторые
ТХВ разнонаправленно изменяют функцию Т- и В-систем иммунитета. Так,
ФОС и карбаматы при хроническом воздействии на людей могут приводить
к уменьшению содержания Т-лимфоцитов и увеличению количества В-кле-
ток циркулирующей крови. Диметилнитрозамин подавляет функцию Т-лим-
фоцитов и усиливает бласттрансформацию В-клеток, активность ЕКК, ре-
акцию ГЗТ. Стимуляцию клеточного иммунного ответа и супрессию гумо-
ральной иммунной реакции вызывает хлорид марганца. Хлорид кадмия в
опытах на мышах тормозит генерацию аллореактивных Т-лимфоцитов путем
активации антигеннеспецифических супрессоров и стимулирует секрецию
В-клетками IgM и G. В целом аналогично влияет на иммунитет интокси-
кация хлористым свинцом. Углеводороды нефти у рабочих понижают функ-
циональную активность Т-клеток крови, уменьшают содержание в крови
Г-супрессоров и усиливают синтез IgG и М. В-лимфоциты по сравнению с
1-лимфоцитами и нулевыми клетками более чувствительны к действию
Формальдегида [7].
ТХВ по основным иммунотропным свойствам можно разделить на веще-
381
ства, снижающие НРО, подавляющие функцию МФС, снижающие активность
ЕКК, токсические агенты, поражающие преимущественно Т- или В-систему
иммунитета, вызывающие В- и Т-иммунодефицитное состояние, токсические
агенты, вызывающие реакции гиперчувствительности, токсиканты, разнонаправ-
ленно влияющие на Т- и В-звено иммунитета. Большинство ТХВ в той или иной
степени действуют как на Т- и(или) В-систему иммунитета, так и на МФС и
другие факторы, определяющие НРО. В зависимости от характера дисфункции
системы иммунитета при действии ТХВ для профилактики и лечения инфек-
ционных, онкологических и других связанных с иммунодефицитными со-
стояниями заболеваний можно использовать соответствующие средства им-
мунокоррекции и иммунореабилитации [15].
10.4. Влияние атмосферных загрязнений
на иммунологическую резистентность
организма и возникновение заболеваний
Значение “химического фактора” для формирования зон “экологичес-
кого неблагополучия” более чем очевидно. Размах антропогенного воздей-
ствия на окружающую среду достиг таких масштабов, что под угрозу по-
ставлена жизнь на планете. Особенно опасны антропогенные загрязнения
атмосферного воздуха и экологические последствия его для природных
экосистем [5].
В 90-х годах перед иммунологами открылась новая глобальная проблема,
связанная с поражающим действием на иммунную систему все большего
спектра загрязняющих веществ окружающей среды. С действием окружаю-
щих поллютантов связывают рост иммуноопосредованных заболеваний че-
ловека, в частности бронхиальной астмы, частота которой в последние годы
возросла на 58 %. Необходимо идентифицировать биохимические измене-
ния, что позволит изучать проблемы иммунной системы в связи с влиянием
ТХВ, а также поиск биологических маркеров в иммунотоксикологии. Воз-
действием поллютантов объясняют развитие артритов, сенной лихорадки,
психической депрессии и т.д. Возможно развитие специфических синдромов
типа “множественной химической чувствительности”. Многочисленные эпи-
демиологические исследования, проводимые в разных регионах страны,
однозначно свидетельствуют об ухудшении здоровья населения, одной из
основных причин которого является снижение резистентности организма к
вирусным и микробным инфекциям, возникновение аллергических, ауто-
иммунных и онкологических заболеваний вследствие поражения иммунной
системы химическими соединениями [13, 15].
Результатом взаимодействия химических веществ, загрязняющих атмо-
сферу, с иммунной системой может быть не только гипоактивность (суп-
рессия функций), но и гиперактивность, включающая такие иммунологи-
ческие феномены, как аллергия, аутоиммунные реакции, контактная гипер-
чувствительность, приводящие к бронхиальной астме, дерматитам, крапив-
нице, иммунной гемолитической анемии и другим аутоиммунным заболе-
ваниям. Снижение функций иммунной системы под влиянием токсичных
веществ вызывает вторичные (в отличие от первичных врожденных) имму-
нодефицитные состояния по Т- и В-типу (в зависимости от преимущест-
венного поражения клеточного или гуморального иммунитета) и смешан-
ного характера. Ряд иммунотоксикантов способен повышать или снижать
функцию только отдельных популяций (субпопуляций) иммуноцитов, эта-
382
пов иммуногенеза, оказывать разнонаправленное влияние на НРО, Т- и
В-звено иммунитета. Иммунотропность большинства химических соедине-
ний, которые в настоящее время производятся и используются (63 000 при
возрастании на 200—1000 наименований в год), не изучена. Иногда в ре-
зультате научных наблюдений появляются противоречивые сведения об им-
мунотоксичности (иммунотропности) химических веществ.
В регионах с загрязненной атмосферой иммунотоксиканты обусловли-
вают не только высокий уровень заболеваемости, но и снижение продол-
жительности жизни. Установлено, что смертность взрослого населения, про-
живающего на территории с развитой химической промышленностью, ха-
рактеризующейся высоким уровнем загрязнения атмосферы (превышение
ПДК в 2—19 раз) диоксидами серы и азота, хлористым водородом, аммиа-
ком, этилбензолом, бензолом и бенз(а)пиреном, в последние 20 лет возрос-
ла: от болезней органов дыхания — в 2,8 раза, от рака легкого — в 2,6 раза.
В Москве 20 % общего числа заболеваний жителей города связаны с загряз-
нением воздуха и речной воды [7].
Существуют различные способы профилактики нарушений иммунного
гомеостаза при действии токсичных химических веществ. Основные направ-
ления профилактических мероприятий рассматриваются в гигиеническом ас-
пекте и включают наряду с санитарным надзором повышение НРО путем
обеспечения полноценного питания, потребления необходимого количества ви-
таминов и т.д. Проблема профилактики и лечения иммунодефицитных состо-
яний химический этиологии применением иммуномодулирующих препаратов
в рамках экологической иммунотоксикологии практически не решена [15].
Данные, накопленные в области иммунофармакологии, позволяют оце-
нить влияние различных иммуностимулирующих препаратов на иммунный го-
меостаз. Зная наиболее поражаемые иммунотоксикантами звенья иммунитета
(популяции или субпопуляции лимфоцитов), можно использовать то или иное
фармакологическое средство для коррекции нарушений иммунного статуса.
При действии токсических агентов одновременно на НРО, гуморальный
и клеточный иммунитет назначение иммуностимуляторов должно носить ком-
бинированный характер. Необходимо проводить профилактику и лечение им-
мунодефицитных состояний препаратами широкого спектра действия.
ЛИТЕРАТУРА
1. Алексеева О.Г., Дуева Л.А. Аллергия к промышленным соединениям. — М.: Ме-
дицина, 1978. — 272 с.
2. Голиков С.Н., Саноцкий И.В., Тиунов Л.А. Общие механизмы токсического дей-
ствия. — Л.: Медицина, 1986. — 280 с.
Жамсаранова С.Д., Банаева С.А., Баглиев Т.Н.//Г'ЛГ. и сан. — 1990. — № 9. —
4. Забродский П.Ф.//Бк!Л. экспер. биол. и мед. — 1993. — № 8. — С. 181 — 183.
5. Забродский П.Ф., Кажекин А.А., Саватеев /7.2?.//Воен.-мед. журн. — 1994.—
№ 6. - С. 28-34.
6- ^54&СК55 КиРичук В.Ф.//Ьюл. экспер. биол. и мед. — 1998. — № 5. —
2- Забродский П.Ф. Иммунотропные свойства ядов и лекарственных средств. —
Саратов: Изд-во Сарат. мед. ун-та, 1998. — 214 с.
8. Кормейн Р.Х., Асгар С.С. Иммунология и болезни кожи. —М.: Медицина, 1983. —
256 с.
383
9. Криворучко В.И., Джабаров П.Д.//Гт. и сан. — 1989. — № 3. — С. 22—23.
10. Перелыгин В.И., Шмирт М.Б., Арипов О.А.//Гт. и сан. — 1971. — № 12. —
С. 29-33.
11. Москалева Е.Ю., Федоров Н.А., Кизенко О.А., Караулов Я.5.//Вестн. РАМН.—
1993. — № 4. — С. 12-17.
12. Саприн А.Н., Караулов А.В., Хроменков Ю.И., Пирузян Л.А. Докл. АН СССР. —
1982. - Т. 267, № 5. - С. 1276-1280..
13. Сидоренко Г.И., Федосеева В.Н., Шарецкий А.Н., Аристовская Л.В.//Тт. и сан. —
1989. — № 3.-С. 7-11.
14. Ройт А. Основы иммунологии. — М.: Мир, 1991. — 328 с.
15. Хаитов Р.М., Пинегин Б.В., Истамов Х.И. Экологическая иммунология. — М •
ВНИРО, 1995. - 211 с.
16. Хейхоу Ф.ГДж., Кваглино Д. Иммунологическая цитохимия. — М.: Медицина,
1983. - 319 с.
17. Штенберг А.И., Джунусова Р.М.//Ьк>л. экспер. биол. — 1968. — № 3. — С. 86—88.
18. Шубик В.М. Проблемы экологической иммунологии. — Л., 1976. — 216 с.
19. Annals of the New York Academy of Sciences: Immunomodulating drugs/Ed. V.S.Ge-
orgiev, H.Yamaguuchi. — 1993. — Vol. 685. — P. 816.
20. Calsale G.P., Cohen S.P., DiCapra R.A.//Toxicol. Appl. Pharmacol. — 1983. — Vol.
68, N 2. - P. 198-205.
21. Descotes J. Immunotoxicology of drugs and chemicals — Amsterdam — N.Y. — Ox-
ford: Else-Vier, 1986. — 400 p.
22. Fergula J., Asherson G.L., Becker EL.//Immunol. — 1972. — Vol. 23, N 4. — P. 577—
590.
23. Kaplan P.R.//Ct\\. Immunol. - 1986. - Vol. 102, N 1. - P. 1-9.
24. Kimber I. Langerhans cells and chemical allergx. Ed. R.J.Smidowicz, M.P.Holsapple. —
N.Y. — London — Tokyo, 1996. — P. 391—417.
25. Kimber I., Dearman R.J., Cumberbatch M., Huby R.J.D.//Cm. Open. Immunol. —
1998. - Vol. 10. - P. 614-619.
26. Lee T.P., Moscati R., Park B.H.//Chem. Pathol. Pharmacol. — 1979. — Vol. 23, N 3. —
P. 597-603.
27. Luster M.I., Blank J.A. Dean Rev. Pharmacol. Toxicol. —1987. — Vol. 27. —
P. 23-49.
28. Newcombe P.5.//Lancet. — 1991. — N 8792. — P. 539—541.
29. Sullivan J.B.//Clin. Toxicol. - Vol. 27, N 6. - P. 311-343.
30. Thrasner L.D., Broughton A., Micevich P.//Nmtt. J. Ind. Med. — 1988. — Vol. 14,
N 4. - P. 479-468.
31. Tucker A.N., Voze S.J., Luster M.J./fMxA. Pharmacol. — 1986. — Vol. 29, N 4. —
P. 272-377.
32. Vos J.G., Moore LA., Zinke Y.^.//Environ. Hlth Perspect. — 1973. —Vol. 5, N 5. —
P. 149-155.
33. Vos J.G., Kraing E.I., Beekhot P.K, Van Logten M. J.//Proc 5th Int. Congr. — Kyoto,
1982. - P. 497-504.
34. White K.L., Lysy //.Я.//Immunopharmacology. — 1985. — Vol. 9, N 3. — P. 155—
164.
384
Глава 11
ГЕНОТОКСИЧЕСКОЕ ДЕЙСТВИЕ КСЕНОБИОТИКОВ
11.1. Общая часть
Генетическая токсикология (токсикогенетика) — научное направление,
связанное с изучением действия факторов окружающей среды на генетичес-
кие структуры организма. Под генотоксичностью следует понимать свойство
химических, физических и биологических факторов оказывать повреждающее
действие на генетические структуры организма. Генотоксиканты включают
в себя мутагены — агенты различного происхождения, вызывающие насле-
дуемые изменения в геноме; митогены — факторы или вещества, влияющие
на процессы клеточного деления; анэугены, приводящие к увеличению или
уменьшению гаплоидного или диплоидного числа хромосом на одну или
более; кластогены, индуцирующие хромосомные разрывы и др. Ряд авторов
относят к генотоксикантам морфогены, вызывающие ненаследуемые гене-
тические изменения (морфозы) на уровне реализации признака в онтогене-
зе. В литературе термины “генотоксиканты” и “мутагены” часто использу-
ются как синонимы.
Генетическая токсикология родилась в недрах химического мутагенеза в
середине 70-х годов. Рождение химического мутагенеза датируется 1946 г.,
когда независимо друг от друга И.А.Рапопорт и Ш.Ауэрбах опубликовали
результаты исследований об открытии способности формальдегида и иприта
индуцировать частоту мутаций, сопоставимую по величине с действием
ионизирующей радиации. Однако первые работы в этой области относятся
к началу 30-х годов. В.В.Сахаров и М.Е.Лобашев на плодовой мушке дро-
зофиле показали слабую мутагенную активность йода и аммиака, первых
химических мутагенов. В 1934 г. A.Dustin открыл митогенные свойства
алкалоида колхицина. Настоящий бум выявления мутагенных свойств хи-
мических соединений начался уже в 50-х годах. Он был связан с резко
увеличившимся синтезом новых химических веществ, число которых к на-
стоящему времени достигло нескольких миллионов. Среди вновь синтези-
рованных химических соединений 5—10 % обладали различными полезными
видами биологической активности наряду с нежелательными свойствами —
токсичностью, мутагенностью, канцерогенностью, тератогенностью и др.,
что со временем привело к осознанию серьезной опасности их для челове-
чества.
В 1962 г. Н.В.Лазарев в статье “Очередные проблемы и трудности про-
мышленной токсикологии” писал: “В настоящее время жизнь поставила
перед специалистами в области промышленной токсикологии новые про-
блемы, в частности она требует изучения мутагенных свойств веществ” [8].
Всемирной организацией здравоохранения (ВОЗ) в 1965 г. всем нацио-
нальным службам здравоохранения была дана следующая рекомендация:
Развитие современной промышленности привело к появлению огромного
числа новых химических веществ, с которыми живые организмы никогда
раньше не сталкивались. Эти вещества синтезируются и применяются очень
разнообразно. Некоторые из них используются в качестве лекарственных
385
13-7197
средств, другие для защиты посевов, при изготовлении пищевых продуктов
или косметических средств. Новые вещества накапливаются в атмосфере и
других окружающих человека средах в виде отходов. Известно, что некото-
рые из таких веществ мутагенны, но большинство вообще не исследовано
в этом отношении. Наши знания о влиянии новых веществ на наследствен-
ность и здоровье человеческих популяций сводятся к нулю. Необходимо
безотлагательно развернуть исследования этих веществ на мутагенность ...
и принять надлежащие меры для борьбы с вредными веществами, прони-
кающими в окружающую человека среду” [3]. Профилактическая направлен-
ность этих исследований — основа генетической токсикологии, являющейся по
сути своей междисциплинарным научно-практическим направлением, интегри-
рующим некоторые разделы токсикологии, гигиены, фармакологии и других
медико-биологических дисциплин.
11.2. Генетические эффекты в соматических
и зародышевых клетках человека
Одна из самых сложных проблем генетической токсикологии связана с
возможностью увеличения частоты мутаций в соматических и половых клет-
ках человека в результате воздействия химических веществ — генотоксикан-
тов.
Соматические мутации, как генные, так и хромосомные, не передаются
потомству человека, подвергшегося воздействию, однако повышение частоты
этих мутаций может способствовать развитию приобретенных заболеваний,
в первую очередь рака.
Увеличение частоты мутаций в половых клетках, генных или хромосом-
ных, вносит вклад в частоту наследственных дефектов или заболеваний с -
выраженной генетической компонентой в потомстве экспонированных ин-
дивидов. Любая попытка определить, произошло ли в данной популяции
увеличение количества мутаций, встречается со значительными трудностя-
ми, среди которых одна из наибольших заключается в выявлении тех гене-
тических событий, анализ которых применим для данного исследования.
Мутации в половых клетках могут давать начало множеству фенотипов,
но лишь немногие могут быть использованы в эпидемиологии мутаций.
Аналогичная ситуация наблюдается и при определении мутаций в сомати-
ческих клетках, поскольку современными методами можно обнаружить
лишь часть мутаций.
Связь генетических событий в соматических клетках человека с наличи-
ем генотоксикантов в окружающей среде можно охарактеризовать путем
определения образовавшихся в результате метаболических превращений му-
тагенов аддуктов ДНК, разрывов нити ДНК, нарушения систем репарации
повреждений ДНК, а также изменений в последовательности оснований.
В настоящее время оценка образования аддуктов требует предварительного
знания их природы либо ограниченного размера популяции для идентифи-
кации всех определяемых аддуктов и, следовательно, еще не может быть
применена в качестве теста при мониторинге больших популяций.
Разрывы и репарация повреждений ДНК — обычно преходящий фено-
мен, возникающий в момент воздействия и обычно вскоре исчезающий, что
делает его условно пригодным для популяционного мониторинга мутаций,
но и полезным для оценки генетического статуса организма и его чувстви-
тельности к действию мутагенных факторов среды.
В последние годы для анализа изменений в последовательности основа-
386
ний ДНК применяется метод картирования с помощью рестриктаз. Этот
подход успешно используется с целью определения структуры генов, их
картирования и выявления полиморфизма, тогда как его применение для
скрининга мутационных событий затруднено малой доступностью соответ-
ствующих батарей проб ДНК (ДНК-маркеров).
Современная методическая база позволяет обнаруживать изменения
функции генов, определяющие приобретение устойчивости к действию от-
дельных факторов, а также в результате изменения или утраты составных
частей клетки, выявляемой многообещающими, но пока мало пригодными
для рутинного мониторинга иммунологическими методами. Чаще других
используются детально разработанные методы выявления Т-лимфоцитов
периферической крови человека, устойчивых к тиогуанину.
На хромосомном уровне генетические нарушения выражаются как из-
менения в числе или структуре хромосом. Хотя изменения в числе хромосом
обусловливают значительную долю наследственных заболеваний человека,
их последствия в соматических клетках выяснены в значительно меньшей
степени. Кроме того, изменения в числе хромосом в соматических клетках
могут быть следствием погрешностей в приготовлении препаратов для хро-
мосомного анализа. Изменения в структуре хромосом оценивают в сомати-
ческих клетках достаточно точно, и их можно наблюдать как хромосомные
аберрации или сестринские хроматидные обмены. В настоящее время эти
изменения наиболее доступны для анализа генетических событий, учет
которых широко используют при оценке соматических мутаций у человека
(цитогенетическая дозиметрия, цитогенетический мониторинг). По данным
Н.П.Бочкова, метод учета сестринских хроматидных обменов для монито-
ринга профессионально экспонированных групп применять нецелесообраз-
но из-за его высокой селективности по отношению к мутагенам [2].
Показана способность ряда генотоксикантов (тяжелые металлы, ингре-
диенты резиновых смесей, непредельные углеводороды, онкостатические
лекарственные препараты и др.) индуцировать хромосомные аберрации в
соматических клетках человека. Микроядра (результат структурных и чис-
ленных хромосомных аберраций) также могут быть использованы в эпиде-
миологических исследованиях в качестве индикатора этих нарушений.
Экстраполяция результатов исследований в соматических клетках чело-
века на частоту мутаций в половых клетках и на связанные с ними послед-
ствия для здоровья крайне затруднена. Такие попытки в свое время были
сделаны относительно ионизирующей радиации, что касается химических
загрязнений, то возможность использования этих подходов весьма пробле-
матична. Главной причиной является отсутствие точных доказательств вли-
яния химических веществ в условиях производства или в быту на зароды-
шевые клетки в популяциях людей, находящихся в контакте с генотокси-
кантами.
Мутации в зародышевых клетках охватывают широкий спектр как струк-
турных, так и количественных изменений. Изучение мутаций в половых
клетках предполагает количественное определение частоты именно насле-
дуемых генетических нарушений, поскольку воздействию генотоксикантов
подвергаются индивиды, а изучается частота событий у их потомства, что
важно учитывать при генетическом мониторинге. Считается, что значитель-
ная часть мутаций оказывает вредное действие на здоровье человека и
наследственность будущих поколений. Если ожидается увеличение частоты
мутаций в половых клетках, то главной задачей является оценка повышения
генетического риска и связанного с этим ухудшения состояния здоровья,
387
13*
обусловленного действием предполагаемого генотоксиканта или генотокси-
кантов.
Мутации в зародышевых клетках, как и в соматических, обычно делят на
две группы — хромосомные (численные и структурные) и генные. Мониторинг
этих мутаций может быть осуществлен путем хромосомного и биохимичес-
кого анализов и изучения индикаторных фенотипов. Понятно, что при
каждом из этих подходов используют анализ различных категорий генети-
ческих событий.
Хромосомные мутации в зародышевых клетках определяются примерно
в 5 % случаев диагностированной беременности, что делает их анализ вполне
приемлемым для изучения небольших популяций. Несбалансированный
хромосомный набор (избыток или нехватка хромосомного материала) почти
всегда сопровождается эффектами, снижающими жизнеспособность, что
приводит к внутриутробной гибели (спонтанный аборт), рождению живых
детей с аномалиями' и задержкой психического развития и(или) стерильнос-
тью. Сбалансированный хромосомный набор может содержать мутации без
фенотипического проявления, и, как правило, последствия мутации будут
сказываться преимущественно в следующем поколении потомков вследствие
образования несбалансированных хромосомных наборов.
К численным хромосомным аномалиям относятся трисомия, моносомия,
триплоидия и тетраплоидия. Такие аномалии почти всегда возникают у
потомства родителей, имеющих нормальные хромосомные наборы, и, сле-
довательно, такие аномалии могут быть результатом мутаций в половых
клетках.
Хотя еще не накоплено большого количества экспериментальных или
эпидемиологических доказательств связи численных хромосомных аномалий
с воздействием средовых факторов, увеличение частоты этих аномалий
должно рассматриваться как вероятное следствие воздействия возможных
мутагенов. Какая-то неизвестная часть случаев трисомии или моносомии
может стать результатом постзиготического нерасхождения, но трисомия
может быть унаследована от родителей (скрытых носителей) и, следователь-
но, может быть результатом мутаций в половых клетках в строгом смысле
слова. В зародышевых клетках в ооцитах в 1—2 % случаев наблюдается
аномальное число хромосом, 10 % имеют структурные перестройки, 13 % —
анеуплоидные клетки. В 50 % случаев причиной спонтанных абортов, осо-
бенно на ранних стадиях, являются хромосомные мутации, приводящие к
доминантной летальности, т.е. большая часть мутаций элиминируется гаме-
тическим и зиготическим отбором.
В 90 % случаев диагностированной беременности численные хромосом-
ные аномалии приводят к смерти плода, т.е. в любом исследовании, в
котором авторы ограничиваются изучением живорожденных, основная часть
численных хромосомных аномалий будет упущена из виду. До рождения
обычно доживают носители лишь немногих типов численных хромосомных
аномалий (синдром Дауна — трисомия по 21-й хромосоме с частотой 1 на
1000 новорожденных и выраженной связью с возрастом матери, трисомия
по 18-й и 13-й хромосомам, трисомия по Х-хромосоме — “сверхженщины”,
трисомия XXY — синдром Клайнфелтера и др.).
Значительная часть структурных нарушений хромосом в половых клет-
ках, как правило, наследуется, и поэтому нельзя сделать вывод относительно
их мутационного происхождения, пока не будет доказано, что оба родителя
не являются носителями обнаруженной у ребенка хромосомной аберрации-
В отношении чувствительности к средовым факторам структурные аберра-
388
ции в половых клетках более сходны с мутациями специфического локуса
в этих клетках, чем с численными аномалиями, так как оба типа аберраций
связаны с изменениями в структуре генетического материала.
Для изучения мутаций в половых клетках предложено много биохими-
ческих подходов, но в настоящее время большинство из них не может быть
использовано. Исследования, в которых проводилось генетическое типиро-
вание большого числа индивидов (с целью анализа популяционной струк-
туры или в ходе выполнения программ мониторинга частоты мутаций),
показали, что для широкомасштабного скрининга применим метод одно-
мерного электрофореза, а благодаря использованию высокоразрешающего
двумерного электрофореза количество белков, которые могут быть изучены
в одном образце, выросло до нескольких сотен. Изучение мутационных
событий, приводящих к потере функционального продукта гена, с приме-
нением количественных методов дополняет электрофоретические исследо-
вания. Как электрофорез, так и изучение ферментативной активности были
использованы для определения частоты индуцированных мутаций у мышей
и дрозофилы, что дает возможность получить данные о частоте мутаций в
популяциях человека, а также изучить некоторые проблемы, связанные с
экстраполяцией экспериментальных данных на человека.
Для выявления мутаций в популяциях человека возможно изучение
мутаций на уровне ДНК при помощи картирования с использованием
рестриктаз или любым другим способом, позволяющим непосредственно
обнаружить специфические изменения в структуре ДНК.
К индикаторным фенотипам, помимо хромосомных синдромов и внут-
риутробной гибели, относятся также “сторожевые” фенотипы, регистрируе-
мые различными медицинскими учреждениями, изучение которых очень
важно для здравоохранения. “Сторожевой” фенотип — это клиническое на-
рушение, которое возникает спорадически как следствие действия одного
высокопенетрантного мутантного гена, имеет доминантный или сцепленный
с Х-хромосомой характер наследования, наблюдается с заметной частотой
и связан с пониженной жизнеспособностью, имеет одинаковое и характер-
ное проявление и диагностируется с минимальными ошибками при родах
или сразу после них. Рождение таких индивидов имеет существенное зна-
чение для мониторинга мутаций в половых клетках, так как появление
ребенка с этими отклонениями у клинически здоровых родителей будет
означать мутацию, возникшую de novo. Реализация данного подхода может
быть сопряжена с трудностью точной нозологической диагностики вследст-
вие генетической гетерогенности этих фенотипов и отсутствием, как прави-
ло, хорошей клинической экспертизы. У человека существует около 2000
аутосомных доминантных признаков, но, по мнению ведущих специалистов
в области медицинской генетики, в качестве “сторожевых” можно рассмат-
ривать от 22 до 41 моногенного нарушения, в том числе ахондроплазию,
врожденную катаракту, синдром Марфана, полидактилию и др.
Таким образом, краткое описание типов генетических повреждений в
соматических и зародышевых клетках человека мутационного происхожде-
ния и вероятности их идентификации у людей свидетельствует об их доста-
точной разработанности и возможности применения для оценки неблаго-
приятного влияния факторов окружающей среды и величины мутационного
груза. Мутационным грузом называют частоту наследственно обусловленной
патологии, связанной с особенностями популяционной структуры населения и
с влиянием факторов среды. Предотвращение роста мутационного груза,
связанного с влиянием внешнесредовых факторов, вынуждает использовать
389
вероятностный подход при оценке генетической опасности контакта чело-
века с генотоксикантами в среде его обитания.
Решить эту задачу можно путем экспериментальных исследований по-
тенциальной генетической опасности факторов окружающей среды и в
первую очередь химических веществ антропогенного происхождения.
11.3. Оценка потенциальной генотоксичности
ксенобиотиков
Многие генетики на различных биологических объектах определили ге-
нетическую активность химических веществ разных классов и предназначе-
ния. В 60—70-х годах были разработаны и стандартизованы методы учета
мутаций в соматических и зародышевых клетках многих представителей
живого мира на Земле. Необходимость такой работы была связана с отсут-
ствием возможности выявить все типы генетических повреждений только
на одном объекте и одним методом, а правомочность экстраполяций на
человека справедливо аргументировалась общностью генетических мишеней
для всех биологических объектов. Понятно, что такого рода экстраполяции
носили вероятностный характер. Новый шаг в области химического мута-
генеза был сделан тогда, когда стало ясно, что технически невозможно
проверить на многих объектах и различными методами потенциальную
мутагенность всех важных в народном хозяйстве веществ. Возник вопрос об
этапности работ, конструировании тест-систем проверки мутагенности, чув-
ствительности и специфичности методов, создании набора методов, по-
зволяющих с высокой степенью вероятности выявлять мутагены, быть
при этом экономичными и воспроизводимыми. В тот период именно эти
работы соответствовали главному направлению исследований — обнаруже-
нию и оценке потенциальной генетической опасности факторов окружаю-
щей среды.
Наиболее полно общие подходы к выявлению мутагенов, оценке их
опасности для человека и принципам контроля за мутагенами в окружающей
среде были рассмотрены Международной комиссией по защите от мутаген-
ных и канцерогенных соединений. В докладах этой комиссии были опреде-
лены роль вновь возникших мутаций в заболеваемости населения и страте-
гия изучения мутагенной активности химических соединений, рассмотрены
подходы к контролю и ограничению контакта человека с мутагенами. Экс-
перты ВОЗ рекомендовали основы стратегии скрининга мутагенов среди
вновь синтезированных химических веществ, рассмотрели основные методы
и тест-системы оценки генотоксичности in vivo и in vitro, а также подходы
к интерпретации результатов тестирования (ВОЗ, 1985).
Разработки экспертов ВОЗ имеют рекомендательный характер, поэтому
системы оценки мутагенности в разных странах различаются, но в главном
имеют много общего. Прежде всего это наличие этапности исследований с
разными задачами каждого этапа и соответственно разным набором исполь-
зуемых методов, позволяющее оптимально решить главную задачу — быстро
и квалифицированно выявить мутагены и определить степень их опасности
для соматических и зародышевых клеток человека.
На первом этапе — этапе выявления мутагенов — используют внеэкспе-
риментальный прогноз, т.е. анализируют результаты предшествующих ис-
следований мутагенности, канцерогенности, тератогенности и других опас-
ных биологических характеристик веществ, близких изучаемому веществу
по химической структуре, физико-химическим параметрам и др. Это стало
390
возможным в результате накопления результатов большого количества экс-
периментов и организации банка данных токсических соединений, в том
числе мутагенов и канцерогенов, в разных странах и международных органи-
зациях (Международное агентство по изучению рака, подпрограмме UNEP —
по химическим веществам и др.)- Такого рода банки данных начали функци-
онировать в нашей стране, например при Российском регистре потенциаль-
но опасных химических и биологических веществ. Внеэкспериментальный
прогноз необходим для последующего конструирования оптимальной тест-
системы и определения очередности испытаний веществ, поскольку отсут-
ствует реальная возможность проверить на мутагенность все вновь вводимые
в среду обитания человека соединения. Для первоочередных исследований
выбирают не только предположительно опасные вещества, но и те, которые
широко распространены в народном хозяйстве, имеют значительную эко-
номическую или иную ценность и с которыми могут вступать в контакт
значительные контингенты населения в репродуктивном возрасте и пр.
С целью первичного просеивания (скрининга) возможных мутагенов в
экспериментах обычно используют краткосрочные тесты для учета генных
мутаций на микроорганизмах (тест Эймса салмонелла/микросомы, позво-
ляющий оценивать мутагенные эффекты химических веществ и их метабо-
литов в системе индукции обратных мутаций в гистидиновом локусе спе-
циально сконструированных штаммов Salmonella typhimurium по механиз-
мам замены оснований и сдвига считывания генетического кода), на плодо-
вой мушке дрозофиле (учет рецессивных, сцепленных с полом летальных
мутаций или соматического мозаицизма) или в культуре клеток млекопита-
ющих in vitro. В ряде случаев на первом этапе используют тест для учета
цитогенетических повреждений в соматических клетках млекопитающих in
vivo (индукция хромосомных аберраций или микроядерный тест).
В случае получения позитивных ответов на втором этапе вещество под-
вергается исследованию с использованием преимущественно методов учета
мутаций на соматических и зародышевых клетках млекопитающих и чело-
века с целью выявления зависимости доза — эффект для регламентирования
изучаемого генотоксиканта. К этим методам относятся учет хромосомных
аберраций в клетках костного мозга млекопитающих и клетках человека,
микроядерный тест, учет доминантных летальных мутаций в зародышевых
клетках мышей или крыс, транслокационный тест, учет индукции ДНК-по-
вреждений и систем их репарации в клетках человека или млекопитающих и
ряд других, подробно описанных в соответствующих руководствах [5, 20, 25].
При исследовании действия веществ, широко распространенных в среде оби-
тания человека и имеющих важное народно-хозяйственное значение, могут
быть использованы методы учета генных мутаций на млекопитающих (тест
специфического локуса) и ряд других, требующих больших временных и эко-
номических затрат и поэтому используемых крайне редко даже за рубежом.
На основе изучения сравнительной чувствительности и разрешающей
спосо.бности методов оценки мутагенности химических веществ с исполь-
зованием кластерного и факторного анализа, имитационного моделирова-
ния и т.д. определены взаимозаменяемые и взаимодополняемые методы,
наиболее предпочтительные для исследований с прикладной целью. В част-
ности, на первом экспериментальном этапе, как правило, достаточно ис-
пользовать два метода —тест Эймса для учета генных мутаций и микроя-
дерный тест или индукцию хромосомных аберраций на млекопитающих для
Учета хромосомных мутаций. Отрицательный ответ в обоих тестах является
основой вероятностного прогноза об отсутствии генетической опасности.
391
Программа испытаний должна быть увеличена, если изучаются широко
применяемый лекарственный препарат, пестицид, средство для очистки и
обеззараживания питьевой воды, пищевая добавка и т.д.
Практически во всех рекомендациях большая значимость придается по-
зитивным результатам, полученным в опытах на млекопитающих in vivo, с
целью использования их в прогнозе мутагенных эффектов для потомства и
прогноза канцерогенности (данные о мутагенных эффектах в соматических
клетках).
Заключительным этапом изучения генотоксичности веществ является их
регламентация, которая сводится к запрещению использования мутагена, ог-
раничению его применения (с учетом времени репродуктивного периода, по
жизненным показаниям для лекарственных препаратов, введение ограничений
по полу, численности контактирующих, временным параметрам и т.д.) или к
расчету допустимых уровней воздействия.
Существует общая точка зрения, что изучение генотоксичности — состав-
ная часть токсикологической оценки химических соединений, необходимой для
их регламентирования в окружающей человека среде.
В настоящее время единого подхода к регламентированию мутагенов нет.
Одни исследователи исходят из принципа пороговости, другие отрицают
правомочность этой концепции. Теоретически концепция беспороговости
действия мутагенов безупречна. Однако с прагматических позиций опреде-
ление так называемых безопасных уровней воздействия мутагенов может
иметь право на существование по той причине, что наличие систем репа-
рации генетических повреждений, эффективность их работы обусловливают
тот уровень, тот предел защиты генома от действия генотоксикантов, кото-
рый не позволяет значимо превышать спонтанный уровень мутаций и под-
держивает генетический гомеостаз.
В соответствии с одним из подходов к оценке опасности и регламенти-
рованию мутагенов, основанным на принципе пороговости, предложено
использовать традиционные схемы эксперимента с определением пороговой
дозы мутагена в острых и подострых опытах на млекопитающих. В зависи-
мости от соотношения между пороговой дозой по мутагенному эффекту и
пороговой дозой по общетоксическим показателям дается классификация
опасности веществ и рекомендуются коэффициенты запаса. И.В.Саноцкий
ввел в токсикологические исследования параметр “зона специфического
действия”, которая определяется как отношение порогов острого или хро-
нического действия по интегральным показателям к порогу по отдаленным
эффектам [17]. Величина показателя положена в основу классификации
промышленных ядов по отдаленным, в том числе мутагенным, эффектам:
1) чрезвычайно опасные с величиной зоны специфического действия более
100 и рекомендуемым коэффициентом запаса 100; 2) высокоопасные с зоной
специфического действия от 10 до 100 и таким же коэффициентом запаса;
3) умеренно опасные с зоной от 1 до 10 и коэффициентом запаса до 10;
4) малоопасные с зоной от 0,1 до 1. Мутагенность соединения учитывается
только в том случае, если порог по мутагенному эффекту был ниже порога
по общетоксическим интегральным показателям. От этого зависела тактика
изучения мутагенности: вещество испытывали в дозах на уровне порога, в
10 раз выше и в 10 и 100 раз ниже. Г.Н.Красовский и соавт. (1985) исполь-
зовали подобный подход при определении опасности и коэффициентов
запаса для регламентирования содержания химических веществ в воде во-
доемов. Однако коэффициенты запаса были более жесткими, поскольку
вода, загрязненная генотоксикантами, влияет на большие контингенты на-
392
селения. Недостаток этих подходов заключается в том, что авторы исходят
Из возможности определения истинной пороговой дозы в эксперименте. По-
скольку существующие методы определения мутагенности веществ в рамках
стандартизованных протоколов исследований позволяют выявлять не менее
чем двукратное достоверное превышение спонтанного уровня мутаций, считать
безопасными дозы ниже пороговой представляется неправомочным.
Другой подход в оценке опасности генотоксикантов был основан на
соотношении двух показателей — максимальной выраженности мутагенного
эффекта и минимальной эффективной дозе. Он нашел отражение в первых
отечественных методических рекомендациях по оценке мутагенности новых
лекарственных средств и пестицидов. Для лекарственных препаратов за
основу были взяты превышения темпа мутирования на разных объектах до
10, 25 и свыше 25 раз на уровнях доз, соответствующих 5-, 15- и выше
15-кратных по отношению к суточной терапевтической дозе, что позволяло
различать три уровня опасности изучаемых лекарств. Для пестицидов мак-
симальная выраженность эффектов сравнивалась с трех-, двукратным и
статистически достоверным превышением спонтанного уровня мутирова-
ния. По величине эффективной дозы пестициды были подразделены на пять
групп, что в дальнейшем позволяло делить их по степени мутагенной опас-
ности на четыре класса с целью уточнения гигиенических рекомендаций по
возможности и масштабам их применения.
Третий подход при оценке опасности и регламентировании генотокси-
кантов основан на расчете допустимой дозы мутагена, т.е. дозы, при которой
возможное повышение частоты мутаций не будет превышать допустимого
уровня. Следует подчеркнуть, что понятие “допустимый уровень” условно,
но для гигиенических законодательных актов необходимое. Сторонники
третьего подхода исходят из невозможности определения реального порога
в эксперименте и возможности расчета допустимого уровня мутагена по
позитивным данным эксперимента. К основным направлениям этого под-
хода относят сравнение уровня индуцированных мутаций со спонтанным
уровнем (оценка степени возрастания частоты мутаций), определение уд-
ваивающей дозы, расчет эквивалентной дозы ионизирующей радиации, учет
абсолютного числа мутантов.
Первое направление реализовано в работе В.С.Журкова (1985). Суть его
сводится к следующему. Допустимой дозой мутагена считается доза, повы-
шающая спонтанный уровень мутаций не более чем 1 % его величины в
экспериментах на млекопитающих. Изучение зависимости мутагенного эф-
фекта химических веществ в соматических и зародышевых клетках млеко-
питающих в острых и хронических экспериментах от дозы (доза — эффект)
дает возможность не только выявить активность, но и определить мини-
мально действующую дозу мутагена (МДД) в рамках стандартного протокола
испытаний, что в свою очередь позволяет экстраполировать эффекты в
области низких доз с помощью разработанных математических моделей [1].
В том случае, если зависимость доза — эффект не обнаружена, допустимую
Дозу мутагена вычисляют на основе линейной экстраполяции от ММД
мутагена по аналогии с рекомендациями по прогнозированию мутагенных
эффектов малых доз ионизирующей радиации.
Как правило, в экспериментах на генетических моделях in vitro и in vivo
общепринятые стандартные протоколы испытаний позволяют определить
тпТОТУ мутационных событий, превышающую спонтанный их уровень на
100—200 %. Отсюда допустимая доза (ДД) мутагена вычисляется по формуле:
ДДмут. =
ММДмут.
200
393
где МДДмут. — минимально действующая доза; 200 — коэффициент пе-ре-
хода, полученный на основе линейной зависимости доза — эффект в область
низких уровней эффектов. Гигиеническое нормирование мутагенов прово-
дят при сопоставлении ДДмут. с ПДК по другим лимитирующим показате-
лям вредности.
Расчет удваивающей дозы вещества близок к описанному направлению
и основан на определении дозы вещества, удваивающей спонтанный уровень
мутаций. Этим методом можно сравнивать вещества по степени их мутаген-
ности, но не удается получить дополнительную существенную информацию
для их регламентирования.
Рентген-эквивалент генотоксиканта определяют путем сравнения мута-
генного эффекта ионизирующих излучений и тестируемого соединения на
одном и том же тест-объекте при сходной схеме эксперимента. Рентген-эк-
вивалент мутагенности химического вещества считают дозой (концентра-
ция), индуцирующей такое же количество генетических повреждений, какое
вызывает облучение в дозе 0,01 Гр. Величина этого эквивалента зависит
также от спонтанного уровня мутаций у тест-объекта. Необходимо отметить,
что разные механизмы мутагенного действия химических веществ и радиа-
ции, различный спектр индуцируемых мутаций и неодинаковая чувствитель-
ность к действию этих мутагенов у разных видов животных и т.д. ограни-
чивают использование этого критерия в практике токсико-гигиенических
исследований.
Перспективной представляется разработка методов молекулярной дози-
метрии в организме с помощью количественной оценки реакций мутагенов
с клеточными макромолекулами (комплексы мутаген — ДНК, мутаген —
белок). В частности, возможна оценка генетического риска алкилирующих
соединений на основании расчета тканевой дозы вещества и степени алки-
лирования им ДНК. Прямые методы учета абсолютного числа мутаций в
первом поколении при действии мутагенов на млекопитающих базируются
на анализе частот доминантных мутаций скелета и доминантных мутаций
катаракты у мышей, но эти методы трудоемки и редко применяются при
регламентировании генотоксикантов среды.
Приведенные выше соображения стали основой для создания и утверж-
дения методических документов по оценке мутагенности лекарственных
препаратов, пестицидов, промышленных вредностей химических загрязне-
ний питьевой воды и атмосферного воздуха [4, 9].
Необходимо отметить, что последние варианты методических рекомен-
даций по изучению мутагенности пестицидов и лекарственных препаратов
основаны на новых современных подходах при оценке генетической опас-
ности генотоксикантов и адаптированы к зарубежным аналогам. Общие
принципы построения тест-систем сохранились, но стали менее жесткими:
батарея методов может включать любые стандартизованные методы, удов-
летворяющие требованиям выявления потенциальной способности веществ
индуцировать генные и хромосомные мутации и позволяющие оценивать
зависимость доза — эффект в диапазоне доз от субтоксических до недейст-
вующих при данном методе соответственно стандартным протоколам иссле-
дований.
Класс опасности устанавливают эксперты-специалисты, имеющие соот-
ветствующую квалификацию и опыт работы в этой области. Главную роль
играют достаточные доказательства мутагенности для человека в эпидемио-
логических исследованиях и наблюдениях, а также результаты эксперимен-
тов на млекопитающих. Например, для пестицидов установлено четыре
394
класса мутагенной опасности. К 1-му, наиболее опасному классу относят
вещества, для которых имеются достаточные доказательства мутагенности
для человека в эпидемиологических исследованиях (наличие мутагенности
в соматических и зародышевых клетках) или в порядке исключения огра-
ниченные доказательства мутагенности для человека (наличие мутаций в
соматических клетках) в сочетании с достаточными доказательствами мута-
генности для млекопитающих (дозозависимая мутагенность в рамках стан-
дартных протоколов исследований в соматических и зародышевых клетках
in vivo).
Второй класс составляют вещества, в отношении которых доказательства
мутагенности для человека по эпидемиологическим данным варьируют от
почти достаточных до полного отсутствия при наличии достаточных дока-
зательств мутагенности для млекопитающих, причем различают три под-
класса (2А, 2В и 2С).
Для подкласса А характерны единичные эпидемиологические наблюде-
ния мутагенного эффекта в соматических клетках человека при наличии
дозозависимой мутагенности в соматических и зародышевых клетках в опы-
тах in vivo, для подкласса В — отсутствие доказательств мутагенности для
человека и наличие дозозависимой мутагенности в соматических и зароды-
шевых клетках млекопитающих in vivo, для подкласса С — отсутствие дозо-
зависимой мутагенности в отношении млекопитающих, но наличие воспро-
изводимых позитивных результатов на млекопитающих в дозах ниже мак-
симально переносимых (МПД) в сочетании с достаточными доказательст-
вами мутагенности на стандартных лабораторных генетических объектах
(не млекопитающие, культуры клеток млекопитающих и человека in vitro
и пр.).
В 3-й класс (умеренно опасные вещества) входят препараты, для которых
имеются достаточные доказательства мутагенности, полученные на стан-
дартных лабораторных генетических объектах (не млекопитающие, культуры
клеток млекопитающих и человека in vitro) и/или воспроизводимые пози-
тивные результаты на млекопитающих в дозе, равной или выше МПД.
Наконец, отсутствие доказательств мутагенности на стандартных гене-
тических объектах в батарее тестов для учета генных и хромосомных мутаций
позволяет отнести изучаемое вещество к 4-му классу (генетически малоопас-
ные). Такая классификация вкупе с данными токсикологических характе-
ристик и результатами оценки других отдаленных эффектов (канцероген-
ность, тератогенность, аллергенность) позволяет определить условия их при-
менения в сельском хозяйстве.
Основным критерием применения лекарственных препаратов с мутаген-
ной активностью следует считать соотношение польза/риск, т.е. использо-
вание лекарств по жизненным показаниям возможно даже при наличии у
него генотоксических свойств, тогда как средства профилактики инфекци-
онных заболеваний или препараты для детей не должны иметь мутагенных
свойств, равно как и лекарства, назначаемые длительными курсами лицам,
не вышедшим из репродуктивного возраста.
Еще раз подчеркнем, что регламентация мутагенов в среде обитания
человека непременно нуждается в конкретной экспертной оценке. Правиль-
ность гигиенического регламентирования, его адекватность задачам оценки
Реального генетического риска может быть проверена только в эпидемио-
логических наблюдениях за людьми, контактирующими с реальным или
предполагаемым мутагеном или подвергающихся комплексным воздейст-
виям.
395
11.4. Оценка суммарной генотоксичности *г
и модификация мутагенных эффектов
при комбинированных воздействиях
Современная наука много знает о способности отдельных факторов
индуцировать мутации у разных биологических объектов. Гораздо меньше
известно о генетических эффектах комплексных воздействий. Именно по
этой причине, а также априорно (огромное число переменных, включая
различия в индивидуальной чувствительности биологических объектов к
мутагенным воздействиям) прогноз генетической опасности для человека в
условиях действия множества генотоксических факторов крайне затруднен.
Практически невозможно представить ситуацию, в которой человек ис-
пытывает на себе влияние только одного фактора окружающей среды. Даже
в том случае, когда мы принимаем лекарства, проводим монотерапию, в
организм попадает композиция химических веществ, одно из которых, на-
пример, дает лечебный эффект, а остальные, составляющие лекарственную
форму, обеспечивают наилучшую всасываемость или пролонгацию либо
снижают побочные эффекты самого действующего вещества, либо являются
просто растворителями.
С позиций возможных и реальных воздействий среда обитания человека
представляет собой очень сложный комплекс факторов, которые естество-
испытатели, в том числе генетики, для удобства разделили на физические
(ионизирующая радиация, температура, ультрафиолет, сверхвысокие часто-
ты и др.), химические (все классы органических и неорганических химичес-
ких соединений естественного и искусственного происхождения) и биоло-
гические (вирусы, бактерии, другие представители биоты, а также психоэ-
моциональные воздействия). Сложность оценки генотоксичности суммар-
ных загрязнений среды определяется, с одной стороны, недостаточностью
фундаментальных разработок, с другой — обилием отдельных работ, кото-
рым свойственны некоторая фрагментарность и различная методология ис-
следований. Сама проблема заслуживает создания специальных моногра-
фий, поэтому мы ограничимся изложением только некоторых ее аспектов.
Состав и уровень загрязнения генотоксикантами в отдельных компонен-
тах среды крайне разнообразен [19, 22]. Известно, что количество загрязни-
телей в окружающей среде столь велико, что с трудом поддается точному
учету. Например, в Великих озерах Северной Америки содержится более 450
соединений — контаминантов, а из питьевой воды некоторых городов вы-
делено около 300 веществ, часть из которых обладает мутагенной и канце-
рогенной активностью. В органических экстрактах пылевых загрязнений
атмосферного воздуха крупных городов может содержаться более 100 поли-
циклических ароматических углеводородов, а в состав большинства сложных
смесей, образующихся в процессе сгорания различного топлива, входят
сотни органических соединений, часто связанных с неорганическими ком-
понентами, вследствие чего полная химическая идентификация таких сме-
сей крайне затруднена. Почва может содержать все химические вещества,
радионуклиды и др., попадающие в нее из отходов промышленных пред-
приятий, в результате использования разнообразных пестицидов, биологи-
ческих средств защиты растений и др. По биологическим цепочкам эти
генотоксиканты могут попадать в водоисточники, растения, ткани сельско-
хозяйственных животных, затем и в пищевые продукты. Известно, что более
80 % загрязнителей среды, включая генотоксиканты, проникают в организм
человека с пищей, более 10 % — с питьевой водой, остальные — с воздухом,
396
через кожу (косметика, бытовые химикаты) и при приеме лекарственных
препаратов.
Основными источниками загрязнения атмосферного воздуха мутагенами
являются газовоздушные выбросы промышленных производств металлургичес-
ких, нефтеперерабатывающих, химических, теплоэлектроцентралей и др., вы-
бросы автомобильного транспорта, продукты сжигания твердого топлива
(дрова, уголь) и др. Наиболее опасными с точки зрения содержания мутагенов
и канцерогенов в воздухе рабочих помещений считают производство чугуна и
стали, резиновых изделий, электролитические производства свинца, алюминия,
медеплавильное производство, переработку асбеста, получение и переработку
бериллия, хрома, кадмия и многих других химических веществ, мутагенная и
канцерогенная активность которых с определенностью доказана. В воздухе
жилых помещений также содержится комплекс генотоксикантов, среди ко-
торых можно выделить радон, продукты сжигания бытового газа, табачный
дым, формальдегид и другие продукты, выделяющиеся из синтетических и
полимерных материалов, используемых для изготовления мебели, синтети-
ческих покрытий, лаков и др., а также токсиканты, применяемые в быту
для борьбы с насекомыми или в домашнем хозяйстве.
Как за рубежом, так и в нашей стране санитарным законодательством
жестко регламентируется содержание загрязнителей среды, в том числе
мутагенов, во всех компонентах окружающей среды. Существующие ГОСТы
на питьевую воду и медико-санитарные требования к качеству пищевых
продуктов и продовольственного сырья, ПДК содержания токсикантов в
воздухе рабочей зоны, атмосфере, почве и др. относятся, как правило, к
индивидуальным веществам или радиационным загрязнениям. Санитарно-
гигиенические нормативы для комплексных загрязнений пока крайне не-
многочисленны и при этом не следует забывать, что воздействие геноток-
сикантов химического происхождения может сочетаться и сочетается с вли-
янием физических и биологических факторов, что дополняет перечень гене-
тически опасных комплексных воздействий.
Попытаемся схематически представить себе возможные пути взаимодей-
ствия генетически активных факторов среды, которые приводят к модифи-
кации регистрируемых конечных мутагенных эффектов.
Взаимодействие генотоксикантов опосредовано компонентами внеш-
ней среды (воздух, вода, почва, пищевые продукты и пр.).
Взаимодействие генотоксикантов в организме человека происходит в
процессе нарушения барьерных функций тканей и клеток за счет
изменения токсикокинетики и токсикодинамики, конкуренции за суб-
страт (биохимический или генетический), влияния на системы репа-
рации генетических повреждений и т.д.
Модификация мутагенной активности химических веществ возможна
физическими факторами, представителями биоты в результате эпиде-
мий, при стрессовых нагрузках и т.д.
Взаимодействие генотоксикантов может происходить непосредственно в
процессе тестирования суммарной мутагенности в результате использования
различных сорбентов, растворителей, способов концентрирования и прове-
дения генетических экспериментов.
Многие исследования на разных объектах in vivo и in vitro показали, что
совместное действие генотоксикантов различного происхождения может
сопровождаться аддитивностью, синергидностью или антагонистическими
эффектами по аналогии с общетоксическим или с канцерогенным действи-
ем. Хотя синергическое действие встречается довольно редко, при наличии
397
огромного количества химических веществ в окружающей человека среде
все же внушает опасение потенциальная опасность подобных взаимодейст-
вий.
Самый известный пример трансформации химических веществ в окру-
жающей среде с образованием мутагенов — хлорирование воды. Различные
виды воды подвергаются загрязнениям органическими веществами, как ан-
тропогенными, так и природными, к которым относятся, в частности,
гуминовые кислоты. Многими авторами экспериментально доказано, что
добавление хлора как к пресным, так и к соленым (морским) водам с
высоким содержанием органических веществ приводит к образованию му-
тагенных соединений. В 1974 г. обнаружены тригалометаны, а к настоящему
времени выявлены основные мутагены, канцерогены и опухолевые промо-
торы, наиболее часто встречающиеся в питьевой воде. Мутагенные соеди-
нения подробно изучены в экстрактах воды плавательных бассейнов, сточ-
ных вод (промышленных и бытовых), в особенности после “суперхлориро-
вания”, в тканях рыб и других гидробионтов, населяющих загрязненные
водоемы. Доказано, что мутагенность хлорированных вод обусловлена ком-
плексом хлорорганических соединений, точная идентификация которых в
ряде случаев затруднена, но не хлороформом (нормируемое вещество), ко-
торый сам по себе не обладает мутагенной активностью, хотя и относится
к канцерогенам. При попадании хлорсодержащих соединений в морскую
воду возможно образование бромоформа, обладающего мутагенной актив-
ностью, а также других галометанов.
Образующиеся в водной среде мутагены могут поступать в организм
человека не только с питьевой водой, но и с пищевыми продуктами в
результате аккумуляции их гидробионтами и накапливания в пищевых це-
почках.
Тестирование пищевых продуктов на мутагенность позволило выявить
многие мутагены. Часть из них является природными ингредиентами (фла-
воноиды, фураны, гидразины), часть попадает из окружающей среды (пес-
тициды, микотоксины). Некоторые мутагенные соединения образуются в
процессе приготовления пищи. Отдельные компоненты сложных смесей,
таких как пищевые продукты, могут взаимодействовать с содержащимися в
них мутагенами, усиливая или снижая их мутагенную активность. Основ-
ными ингибиторами мутагенности считаются природные соединения съе-
добных растений (например, аскорбиновая кислота, хлорофилл, такие фер-
менты, как пероксидазы и др.), имеющие различную химическую структуру,
и их можно разделить на десмутагены и биоантимутагены. Биоантимутагены
работают на клеточном уровне путем взаимодействия с эндогенными про-
цессами, приводящими к мутационным событиям (например, эпигалло-ка-
техин-галлат, выделенный из японского зеленого чая, снижает мутационный
уровень путем изменения активности ДНК-полимеразы III). Десмутагены
инактивируют мутагены путем прямого взаимодействия. Например, пиро-
лизаты триптофана энзиматически инактивируются пероксидазами капусты
или могут быть адсорбированы высокомолекулярными субстанциями, таки-
ми как растительные волокна.
Исследования мутагенности, канцерогенности и метаболизма гетероцик-
лических аминов, образующихся при термической обработке мяса и рыбы,
показали, что в пиролизатах аминокислот и белков обнаружены производ-
ные пиридоимидазола, аминокарболина, имидазохинолина. Большинство
этих соединений являются промутагенами (косвенные мутагены). Они под-
вергаются N-гидроксилированию при участии цитохрома Р-448, продукты
398
метаболизма связываются с макромолекулами и вызывают мутагенные эф-
фекты. Во многих исследованиях обнаружено наличие мутагенных соедине-
ний в моче и фекалиях животных и человека, получавших жареные и(или)
копченые продукты. В процессе приготовления пищи мутагенные соедине-
ния образуются не только в обрабатываемом продукте, но и в окружающей
среде в виде летучих генотоксичных соединений. В связи с этим необходимо
заметить, что многие авторы признают существенную роль диеты в этиоло-
гии рака у человека.
Влияние температуры на выраженность мутагенных эффектов демон-
стрируют следующие наблюдения. Мутагенность конденсата сигаретного
дыма возрастает с повышением температуры, а генетическая активность
продуктов сгорания угольной золы исчезает при нагревании ее до 350 °C.
Кроме того, конденсат сигаретного дыма усиливает мутагенность полиаро-
матических аминов, таких как 2-аминофлуорен, 2-ацетиламинофлуорен,
4-ацетиламинофлуорен и 2-аминоантрацен.
Механизм синергидности сводится к включению продуктов конденсата
в пути метаболической активации флуорениламинов при превращении гид-
роксиламинов в высокореактивные соединения.
Приведем еще два примера, характеризующие сложность взаимоотноше-
ний химических веществ в окружающей среде. Известно, что гидробионты
являются кумуляторами загрязненной воды. Вместе с тем водные экстракты
из пресноводных растений содержат антимутагены к бенз(а)пирену. Из
атмосферного воздуха одного из японских городов выделены не только
мутагены, характерные для проб воздуха крупных городов, но и антимута-
гены (пальмитиновая, стеариновая и линолевая кислоты).
Описанные примеры свидетельствуют в первую очередь о неоднознач-
ности прогнозов относительно реальной мутагенной нагрузки на население
в тех случаях, когда определяют только наличие мутагенов в различных
компонентах окружающей среды. Прогноз становится еще более проблема-
тичным при оценке взаимодействий, которые могут происходить и проис-
ходят в организме млекопитающих и человека.
При сочетании генотоксикантов, если хотя бы один из них липофилен,
усиливается проникновение мутагенов не только из внешней среды, но и
внутрь организма через тканевые барьеры и клеточные мембраны. Различ-
ные токсико-кинетические и токсико-динамические характеристики мута-
генов могут быть причиной разных ответов клеток (генетические мишени)
на комбинированное воздействие. Наконец, если какой-то из компонентов
сложных смесей или иной фактор среды способен ингибировать или инду-
цировать системы репарации генетических повреждений, то регистрируемый
мутагенный эффект изменяется. Подробно эти аспекты проблемы изложены
в специальных обзорах и руководствах [15, 16].
Одной из причин отсутствия аддитивности в ответе организма на ком-
плексные воздействия считается конкуренция химических веществ, разли-
чающихся по структуре, физико-химическим параметрам и др., за тот био-
химический субстрат, который участвует в метаболизме ксенобиотиков-ге-
нотоксикантов.
В последние десятилетия наиболее широко развивающимся направлени-
ем химического мутагенеза было изучение метаболической активации мута-
генов, многие из которых находятся в окружающей среде в виде промута-
генов и для реализации их мутационного действия необходима метаболи-
ческая активация. Она представляет собой ферментативный процесс, сфор-
мировавшийся в процессе эволюции как универсальный механизм детокси-
399
кации любых ксенобиотиков, в том числе обладающих мутагенной актив-
ностью. В тех случаях, когда в организм поступает чрезмерно высокое
количество ксенобиотиков или активность монооксигеназ смешанных
функций изменяется, нарушается работа ферментов второго этапа детокси-
кации (этап конъюгации), высокореакционноспособные метаболиты (сво-
бодные радикалы, эпоксиды и др.) не успевают разрушиться и взаимодей-
ствуют с ДНК. Понятно, что мутагены прямого действия тоже являются
ксенобиотиками и, следовательно, могут подвергаться действию моноокси-
геназной системы, играющей в таких случаях не только детоксицирующую,
но и антимутагенную роль, снижая частоту мутационных событий. Эти
соображения следует иметь в виду при создании тест-систем учета мутаген-
ной активности прямых и косвенных мутагенов (тест Эймса, культуры
клеток млекопитающих и человека) и предполагают инкубацию культур с
добавленной микросомальной фракцией S-9 печени крыс.
Сложные смесц содержат, как правило, генотоксиканты разного меха-
низма действия, поэтому пути их метаболизма, скорости ферментативных
процессов могут быть у них различными, что в свою очередь затрудняет
прогноз уровня конечных мутагенных эффектов. Кроме того, принимая во
внимание существование генетического контроля за уровнем, скоростью и
направлением метаболических процессов, а также за работой ферментных
систем репарации генетических повреждений ДНК, приходится констати-
ровать важную роль индивидуальной чувствительности организма (завися-
щую в целом от свойств его гомеостаза) в становлении мутаций.
В генетике основополагающее биологическое понятие гомеостаза верифи-
цируется как приспособительное свойство организма динамически изменять
реакцию генотипа на повторные нарушения условий среды при том, что
функции организма существенно не меняются. Поскольку все жизнеобеспечи-
вающие системы организма (иммунная, гормональная, нервная и др.) взаимо-
связаны, нарушение гомеостатического равновесия, индуцированное факторами
окружающей среды, может быть причиной модификации мутагенных эф-
фектов, что более вероятно при комплексном воздействии генотоксикантов.
Например, в соответствии с теорией физиологического мутагенеза, разрабо-
танной М.Е.Лобашевым (1947), в экспериментах на млекопитающих была
однозначно доказана мутагенность психоэмоционального стресса. Прини-
мая во внимание колоссальные стрессорные нагрузки нашего времени,
крайне важно учитывать возможное модифицирующее влияние этого фак-
тора на другие мутационные воздействия. В серии исследований по изуче-
нию комбинированных воздействий эмоционального стресса и химических
факторов выявлен мутагенный эффект, отличный от аддитивного [7].
Четкие представления о механизме совместного действия ионизирующей
радиации и химических соединений отсутствуют, что не дает возможности
предсказывать результаты их комбинированного воздействия. Н.П.Бочков и
А.Н.Чеботарев [1] при анализе данных о цитогенетических эффектах ком-
бинированного действия химических веществ и облучения на организм
человека отметили увеличение общего количества хромосомных аберраций,
причем в основном за счет аберраций хромосомного типа. По-видимому, в
ближайшее время следует ожидать расширения работ по изучению совмест-
ного действия радиации (в первую очередь радионуклидов) и химических
загрязнителей среды, что связано с повышенным интересом к этой проблеме
после аварии на Чернобыльской АЭС и ряде других.
Из сказанного выше следует, что взаимодействие мутагенных факторов
окружающей среды отличается многоуровневыми (среда, организм, ткань,
400
.Я клетка) и разнонаправленными характеристиками. Поскольку эксперимен-
тальная проработка всех возможных вариантов оценки потенциальной му-
тагенности сложных смесей и комбинированных мутагенных воздействий
не представляется реальной, необходимо оценивать суммарную мутаген-
ность в среде обитания человека. В настоящее время прослеживаются два
подхода к решению комплексной проблемы организации и проведения
генетического мониторинга загрязнений окружающей среды и генетическо-
— го здоровья населения:
Л анализ суммарной мутагенности образцов различных компонентов
Нкк среды (атмосферного воздуха и воздуха рабочей зоны на предприятиях,
питьевой воды и воды водоисточников, почвы и пищевых продуктов,
лекарственных средств и пр.) на лабораторных тест-объектах в клас-
Н сических генетических экспериментах;
В эпидемиологический подход — проведение натурных исследований на
В растительных и животных объектах в условиях производства и в эко-
Впц логически опасных регионах, а также оценка генетических поврежде-
ВЬ ний у человека. Остановимся подробнее на основных задачах и слож-
ностях каждого из этих подходов. Отбор и подготовка проб для вве-
дения их в генетический эксперимент — один из наиболее важных
В вопросов при оценке суммарной мутагенности загрязнений различных
объектов окружающей среды.
® Как правило, в связи с низкими (для выявления мутагенов на генети-
ческих тест-объектах) концентрациями генотоксикантов прибегают к кон-
центрированию проб воздуха, воды и пр., осуществляемому с помощью
экстракции компонентов пробы органическими растворителями и(или) во-
дой. Изучены свойства многих растворителей, пригодных для этих целей,
но большинство исследователей пользуются ацетоном, бензолом, диметил-
сульфоксидом. При сравнении получаемых мутагенных эффектов проб воз-
духа, отобранных на специальные фильтры различных составов, значитель-
ных различий не выявлено. Неоднозначна проблема фракционирования
проб (суммарные экстракты). Так, разделение сложных смесей на фракции
не позволяет определить возможные антагонистические и синергидные про-
цессы, которые могут происходить в нативных смесях.
Например, в тесте Эймса был оценен эффект смешения некоторых
полициклических ароматических углеводородов и показано, что мутаген-
ность бенз(а)пирена возрастала при добавлении не мутагенного антрацена.
С другой стороны, антрацен снижал мутагенность 7,12-диметилбенз(а)ант-
рацена и бенз(а)антрацена. При фракционировании проб нельзя точно пред-
сказать суммарную мутагенность и требуется осторожно интерпретировать
такие данные. Интересны результаты международного межлабораторного
исследования [3] в зависимости от способов экстракции при изучении
мутагенности сложных смесей воздушных загрязнений (выбросы дизельного
топлива, угольного дегтя, бенз(а)пирена и 1-нитропирена). Авторы опреде-
ляли повторяемость (внутрилабораторная вариабельность) и воспроизводи-
мость (межлабораторная вариабельность) оценки мутагенности в тесте Эйм-
са. Оба показателя варьировали очень широко. По общему мнению, именно
межлабораторные различия в процедуре экстракции стали главной причиной
несовпадения результатов (57 % всей вариабельности). Разработка стандарт-
ного протокола экстракции проб воздушных загрязнений крайне необходи-
ма для получения сравнимых результатов.
Стандартизация протокола подготовки проб воды также необходима,
поскольку разные способы концентрирования образцов и экстракции гено-
401
токсикантов приводят к большим различиям в конечных результатах тести-
рования. Степень необходимой концентрации зависит от уровней загряз-
ненности тестируемого образца, а также предполагаемого набора химичес-
ких мутагенов в смеси. Наименее искажающим суммарные эффекты оказа-
лись вымораживание и вакуумное испарение. При изучении мутагенности
питьевой воды чаще других используются полимерные сорбенты. Стандарт-
ные протоколы подготовки проб воздуха и воды для последующей оценки
суммарной мутагенности описаны отечественными авторами [12].
Разработка подходов к количественной оценке мутагенности суммарных
загрязнений — главная и основная задача при попытках определения реаль-
ной мутагенной нагрузки на население. Одним из вариантов решения этой
задачи может стать токсико-гигиенический подход, основанный, с одной
стороны, на минимальных объемах тестируемых проб, давших позитивный
ответ, с другой — на реальных объемах потребляемой человеком воды, пищи
или вдыхаемого воздуха. При этом можно не учесть фактор неполной
экстракции генотоксикантов или их потерь в процессе подготовки проб и
фактор различий в видовой и индивидуальной чувствительности лаборатор-
ного тест-объекта и человека. Тем не менее такой подход перспективен в
качестве шага к оценке реальной мутагенной нагрузки на людей, поскольку
в таком варианте имеется возможность суммировать эффекты, определяе-
мые в различных компонентах среды.
Поиск главных “виновников” позитивных ответов тестирования слож-
ных смесей затруднен по описанным выше причинам, но необходим для
практических рекомендаций по улучшению качества окружающей среды с
позиций содержания в ней опасных сочетаний генотоксикантов и может
быть реализован проведением так называемых имитационных эксперимен-
тов на лабораторных тест-объектах с изучением различных комбинаций
генотоксикантов, обнаруженных в исследуемой пробе. Такого рода имита-
ционное моделирование ситуаций должно основываться на уже имеющихся
базах данных о механизмах мутагенного действия основных загрязнителей
среды и их метаболизме. Кроме того, используемые аналитические, статис-
тические и другие методы позволяют подтвердить предположение о потен-
циальных генотоксикантах в обследуемом регионе, сопоставить их концент-
рации с предельно-допустимыми, определить наиболее опасные сочетания
генотоксикантов и источники их появления в среде.
Параллельная оценка отягощенности наследственной патологией насе-
ления данного района (изучение частоты спонтанных абортов, врожденных
пороков развития, причин младенческой смертности, онкологических забо-
леваний, наследственных болезней, заболеваний с выраженной генетичес-
кой компонентой и др.), определение ретроспективной динамики и сравне-
ние ее с условно “контрольными” показателями, характерными для обсле-
дуемого региона, составляют суть второго подхода при генетическом мони-
торинге.
Следует еще раз упомянуть, что все используемые для тестирования
методы и объекты дают только вероятностный прогноз мутагенности. Более
того, многие мутагены видо- или тканеспецифичны и в 5—6 % вещества
дают ложноположительный или ложноотрицательный ответ при использо-
вании различных методов изучения разных биологических объектов. В на-
стоящее время можно определять исключительно относительную мутаген-
ность образцов в отношении друг друга либо в отношении стандартных
мутагенов или стандартизованных образцов. Одним из важных шагов на
этом пути стало создание стандартных образцов разных типов загрязнителей
402
среды (работа проводилась в рамках Международного сотрудничества по
унификации методов оценки суммарных загрязнений среды), таких как
обугленная пыль (SRM 1597), продукты сгорания дизельного топлива (SRM
1650), образец атмосферного воздуха современного города (SRM 1649) и др.
Последний образец получен в Вашингтоне в результате непрерывного 12-
месячного отбора проб.
Схема тестирования сложных смесей в целом аналогична оценке потен-
циальной генотоксичности индивидуальных веществ или факторов. Цель
первого этапа — получение альтернативного ответа относительно наличия
или отсутствия мутагенности в тесте Эймса и микроядерном тесте на мле-
копитающих (можно использовать метод учета хромосомных аберраций в
одной-двух дозах). Эксперименты следует предварять внеэксперименталь-
ным прогнозом наличия генотоксикантов в изучаемых образцах. Альтерна-
тивный ответ следует верифицировать без учета степени концентрирования
проб, масштабов производства и других данных, необходимых для второго
этапа, который может быть назван “полуколичественным” и проводится
только в случае выявления мутагенности на первом этапе.
Внеэкспериментальный раздел второго этапа включает анализ перечня
основных генотоксикантов, которые могут быть в образце, ориентировочное
определение количества людей, контактирующих с данной суммой загряз-
нителей, а также оценку масштаба производств, степень концентрирования
проб и соотнесение этой степени с реальным потреблением воды, пищевых
продуктов, объема вдыхаемого воздуха и др. Вся эта информация необхо-
дима для определения объема исследований, условий проведения экспери-
ментов и правильной трактовки результатов.
Изучение проб на втором этапе заключается только в экспериментах на
млекопитающих с использованием тест-систем для получения концентра-
ционных (дозовых) зависимостей (методы учета хромосомных аберраций,
внепланового синтеза ДНК и индукции систем репарации, изучение аддук-
тов ДНК и др.)
На третьем этапе проводят количественную оценку реальной мутагенной
опасности и расчеты экспонированной дозы на людях. Жестких регламентов
таких расчетов не существует, но можно использовать приемы, рекомендуе-
мые генетиками [21] и гигиенистами [13]. К внеэкспериментальной оценке
этого этапа может быть отнесен анализ заболеваемости изучаемого региона,
детерминируемый генетическими причинами. Экспериментальная часть
третьего этапа сводится к проведению эпидемиологических наблюдений за
людьми с целью изучения описанных в начале главы генетических наруше-
ний в соматических и зародышевых клетках человека.
Использование этапного подхода при оценке мутагенности суммарных
загрязнений среды необходимо в первую очередь для принятия главных
решений в соответствии с основной задачей работы — сохранением генети-
ческого здоровья населения и профилактикой неблагоприятных воздействий
генотоксикантов среды.
Пути снижения нежелательного действия мутагенов окружающей среды
на человека можно представить следующим образом:
снижение содержания или изъятие из окружающей среды генотокси-
кантов антропогенного происхождения путем технологических или
социально-экономических решений;
создание препятствий на пути поступления мутагенов в организм
человека средствами индивидуальной защиты (в первую очередь это
касается производственной среды и аварийных ситуаций);
403
технологические решения, направленные на изменение фазового со-
стояния мутагенов (в ряде случаев мутагенные эффекты могут быть
реализованы только при ингаляционном пути поступления, например
формальдегида и асбеста, или при парентеральном введении лекарств-
мутагенов, не проникающих через кожные покровы, и др.);
модификация этапов процесса становления мутационных событий в
организме с целью снижения их частоты, а также использование
антимутагенов.
Первые три пути сходны с токсико-гигиеническими и не требуют спе-
циальных пояснений. Относительно четвертого необходимо сказать следую-
щее. Известно, что индукция мутаций —сложный многоэтапный процесс,
составляющими которого являются поступление, распределение, биопревра-
щение и выведение генетически активного агента, его накопление в области
клетки или молекулы-мишени, взаимодействие с ДНК и влияние на систе-
мы репликации и репарации генетических повреждений. Воздействуя на
любой из перечисленных этапов становления мутаций, можно модифици-
ровать действие мутагена, в частности ослаблять регистрируемые мутаген-
ные эффекты.
Согласно одной из наиболее поздних классификаций, антимутагены
делятся на две большие группы — внеклеточные (ингибиторы образования
и поглощения мутагенов и ингибиторы превращения промутагенов в мута-
гены) и внутриклеточные (блокаторы поступления мутагенов в клетки, вза-
имодействующие с генетическими структурами за счет усиления активности
детоксицирующих ферментов или прямого взаимодействия с мутагеном,
антиоксиданты, т.е. ловушки свободных радикалов, и агенты, влияющие на
репарацию генетических повреждений). К неспецифическим антимутагенам
следует отнести адаптогены общего действия (витамины и микроэлементы),
прием которых работниками производств с высоким содержанием геноток-
сикантов в среде в ряде наблюдений дает хороший антимутагенный эффект,
снижая уровень цитогенетических повреждений.
Интерес к проблеме антимутагенеза очень велик. Активно идет поиск
антимутагенов среди природных веществ растительного и животного про-
исхождения и среди синтетических химических соединений не только за
рубежом, но и в нашей стране [8].
В заключение необходимо отметить, что генетическая токсикология пред-
ставляет собой молодое и активно развивающееся научно-практическое
направление с большим количеством нерешенных проблем, главная из ко-
торых а- организация и проведение генетического мониторинга. В класси-
ческом определении под генетическим мониторингом понимают слежение за
изменением генофонда флоры и фауны земли, в том числе генофонда человека.
В расширенное определение генетического мониторинга входит и слежение за
генетической активностью загрязнителей окружающей среды, а также за
генотоксикантами.
Только такое понимание генетического мониторинга, являющегося по
сути частью токсиколого-гигиенического мониторинга, позволяет выявить
связи между генотоксикантами среды и генетическими изменениями, кото-
рые могут возникать и возникают в геноме человека [24]. Комплексный
подход к решению таких вопросов, как подготовка и внедрение на терри-
тории России единых стандартных протоколов отбора и подготовки проб
для проведения генетических экспериментов, унификация самих генетичес-
ких исследований, создание новых методов оценки мутагенности проб ок-
404
ружающей среды и учета генетических повреждений у человека, разработка
и внедрение количественных методов оценки степени загрязнения среды
генотоксикантами и генетического риска для населения, позволит опреде-
лить пути сохранения генетического здоровья.
ЛИТЕРАТУРА
1. Бочков Н.П., Чеботарев А.Н. Наследственность человека и мутагены внешней
среды. — М: Медицина, 1989. — 270 с.
2. Бочков Н.П., Катосова Л.Д. Генетический мониторинг популяций человека при
реальных химических и радиационных нагрузках//Вест. РАМН. — 1992. - № 4. -
С. 10-14.
3. ВОЗ, серия технических докладов. Генетика человека и общественное здравоо-
хранение. Технический доклад № 289. — Женева, 1965.
4. Временные методические указания по обоснованию предельно-допустимых кон-
центраций загрязняющих веществ в атмосферном воздухе населенных мест.
Методика обоснования ПДК веществ, обладающих мутагенным действием (раз-
дел 4.3.4). - М.: М3 СССР, 1989.
5. Гигиенические критерии состояния окружающей среды 46: Руководство по изу-
чению генетических эффектов в популяциях человека. — Женева: ВОЗ, 1989.
6. Гигиенические проблемы канцерогенного и мутагенного действия факторов ок-
ружающей среды. — В кн.: Сборник научных трудов/Под ред. Г.И.Сидоренко. —
М., 1985. - 125 с.
7. Ингель Ф.И., Бодягин ДА., Геворкян Н.М. и др. Модификация психоэмоциональ-
ным стрессом мутагенных эффектов ксенобиотиков//Токсикол. вест. — 1995. —
№ 3. - С. 5-9.
8. Лазарев Н.В. Очередные проблемы и трудности промышленной токсикологии. —
В кн.: Промышленная токсикология и клиника профессиональных заболеваний
химической этиологии. — М.: Медгиз, 1962.
9. Методические рекомендации по оценке мутагенности новых лекарственных
средств. — М.: М3 РФ, 1994.
10. Методические указания по гигиенической оценке новых пестицидов. Изучение
мутагенных свойств пестицидов (раздел 3.2). — Киев: М3 СССР, 1988.
11. Методические указания по изучению мутагенной активности химических ве-
ществ при обосновании их ПДК в воде. —М.: М3 СССР, 1986.
12. Методические указания по экспериментальной оценке суммарной мутагенной
активности загрязнений воздуха и воды. — М.: М3 СССР, 1989.
13. Методы экспериментального исследования по установлению порогов действия
промышленных ядов на генеративную функцию с целью гигиенического нор-
мирования (методические рекомендации). — М.: М3 СССР, 1978.
14. Методы экспериментального исследования по установлению порогов действия
промышленных ядов на генеративную функцию с целью гигиенического нор-
мирования (Методические регламентации). — М.: М3 СССР, 1978.
15. Мутагены и канцерогены окружающей среды и наследственность человека.
Часть 1 и 2. — В кн.: Материалы Международного симпозиума. Москва, 18—21
октября 1994 г. — М., 1994. — 267 с.
16. Порошенко Г.Г, Абилев С.К. Антропогенные мутагены и природные антиму-
тагены. - М.: ВИНИТИ, 1988. - 206 с.
405
17. Саноцкий И.В., Фоменко В.Н. Отдаленные последствия влияния химических
соединений на организм. — М.: Медицина, 1979.
18. Середенин С.Б., Дурнев А.Д. Фармакологическая зашита генома. — М., 1992. —
160 с.
19- Худолей В.В. Химические факторы, вызывающие рак (справочник). — СПб.
1993.- 38 с.
20. DeSerres F.J., Hollaender A. (eds). Chemical mutagens: principles and methods for
their detection. — New York: Plenum Press, 1980. — Vol. 1—6.
21. Ehling U.H. Development of test systems and assessment of risk in genetic toxicology. —
В кн.: Материалы симпозиума по вопросам окружающей среды и здравоохра-
нения. Исследования и разработки в Европейских сообществах и в СССР. Аббеи
де Во-де-Сернэ (Франция), 11 — 14 марта 1990 г. — Т. 1. — С. 82—124.
22. Houk V.S. The genotoxity of industrial wastes and effluents. A review//Mutat. Res. —
1992. - Vol. 277, N 2.
23. Mutagenicity of complex mixture in Salmonella typhimurium. A report of the Interna-
tional Programme on chemical safety’s collaborative study on complex mixtures//
Mutat. Res. - 1992. - Vol. 276, N 1-2.
24. Revazova J., Ingel F., Lukmanova N. Genetic monitoring of the total environmental
factors. — In materials of the Second Symposium on environmental and health research
in countries of the European Community and of the USSR. Moscow, 14—17 October
1991, pp- 41/1-41/11.
25. Waters M.D., Sandhu S.S., Lewtas J. et al. (Eds). Short-term Bioassays in the analysis
of complex environmental mixtures 111 and IV. — New York: Plenum Press, 1983.
«•ft
ГЬС'..’N ’ t
FOpt X
&
Irn., ...V» ' . .... -.1
ЦцетМЬяС и : ' ”•
wk 6t »’ о. ,<• -D- .rj • ' *,
СВДЛл ’ft’ '.,‘1; «4. .>•-"! Y , '. - ' .
ЖЙ- . '<1 '
Глава 12
ХИМИЧЕСКИЙ КАНЦЕРОГЕНЕЗ
12.1. Общие понятия и определения
По данным ВОЗ, в 1998 г. в мире умерло от рака 8 млн человек и
диагностировано почти 20 млн новых случаев онкологических заболеваний.
В большинстве развитых стран они занимают второе место среди причин
смерти. В СССР число больных с впервые установленным диагнозом зло-
качественных новообразований в 1970 г. составило 430 тыс., в 1980 г. — 544
тыс., а в 1989 г. — уже 676,5 тыс. человек. В России, население которой на
1 января 1992 г. исчислялось в 148 704 800 человек, в 1991 г. зарегистриро-
вано 391 300, в 1993 г. - 409 312, в 1994 г. -411 848, а в 1995 г. -412 545
новых онкологических больных, а умер от злокачественных опухолей в этом
году 295 671 человек. Чем объясняется столь печальная статистика?
По мнению экспертов Международного агентства изучения рака
(МАИР), доминирующую роль (75—80 %) в происхождении этой болезни
играют факторы окружающей среды, главным образом химической природы
[1, 19].
Начиная с 1775 г., когда английский врач П.Потт установил, что рак
кожи у трубочистов вызывается действием сажи, накопилось огромное ко-
личество доказательств роли химических веществ и ряда других факторов в
происхождении рака у людей и животных. Часть из этих факторов, с кото-
рыми человек контактирует на производстве, в быту и повседневной жизни,
способны вызывать рак, т.е. имеют канцерогенные свойства.
Химические, биологические или физические агенты, вызывающие раз-
витие рака, принято называть канцерогенами (канцерогенными факторами).
Комитет экспертов ВОЗ дал следующее определение этому понятию: “Кан-
церогеном (физическим, химическим или вирусным) называют агент, способный
вызывать или ускорять развитие новообразования независимо от механизма
(или механизмов) его действия или от степени специфичности эффекта.
Канцероген — это агент, который в силу своих физических или химических
свойств может вызывать необратимое изменение или повреждение в тех
частях генетического аппарата, которые осуществляют гомеостатический
контроль над соматическими клетками” [3]. Современные представления о
процессах возникновения и развития опухолей, динамике и выраженности
Этих процессов позволили сформулировать более корректное научное опре-
деление этого понятия, согласно которому “канцерогеном называется фак-
тор, воздействие которого достоверно увеличивает частоту возникновения
опухолей, доброкачественных и(или) злокачественных, в популяциях чело-
века и(или) животных и(или) сокращает период развития этих опухолей”
[17]. Канцерогенез же можно определить как процесс возникновения зло-
качественных новообразований в результате действия канцерогенных фак-
торов или “процесс возникновения опухолей под влиянием канцерогенных
факторов (независимо от механизмов их действия), который выражается в
более частом и(или) более раннем появлении опухолей в популяциях чело-
века и(или) животных” [3].
407
Говоря о химическом канцерогенезе, следует указать на различие поня-
тий “канцерогенность вещества” и “канцерогенная опасность вещества”.
Канцерогенность отражает способность того или иного фактора вызывать
опухоли, но важно отметить, что эта способность “свидетельствует о
возможности развития злокачественных новообразований и позволяет прово-
дить сравнение веществ по этому признаку при непосредственном их воздей-
ствии на биологический объект”. Канцерогенная опасность (риск) — вероят-
ность значительного повышения частоты возникновения опухолей у людей,
подвергшихся или подвергающихся воздействию определенных канцерогенных
факторов в бы-my и(или) на производстве, коррелирующая с индивидуальными
особенностями образа жизни", эндогенными факторами (факторами организ-
ма), загрязнениями окружающей среды или профессиональными вредностями
[16]. Понятие “канцерогенная опасность” включает в себя и дополнитель-
ные условия, в частности распространенность вещества, возможности кон-
такта с ним, его* стабильность в окружающей среде или в местах потенци-
альных контактов с ним и др.
Сегодняшние показатели заболеваемости раком (с учетом латентного
периода развития опухолей) отражают то состояние (вернее, загрязнение
окружающей среды), которое было два-три десятилетия и более назад. При
сохранении предшествующих тенденций и неизменности влияющих факто-
ров к 2005 г. на территории бывшего СССР заболеет раком 988 тыс. человек.
Это огромная цифра (почти миллион случаев!), однако реально она будет
выше, если принять во внимание уже имеющуюся и все возрастающую
техногенную нагрузку на биосферу. Эксперты ВОЗ пришли к выводу, что
прекращение контакта с опухолеродными факторами, недопущение канце-
рогенов в сферу жизни человека или удаление подобных веществ из окру-
жающей среды могут привести к резкому (до 70 %) снижению заболевае-'
мости людей опухолями основных локализаций. В связи с этим важны и
актуальны знания о канцерогенах, их источниках и путях их образования,
распространении в окружающей среде — воде, воздухе, почве, продуктах
питания, лекарственных препаратах и т.д. Не менее важны сведения о судьбе
канцерогенов в организме, механизмах канцерогенеза, возможностях его
модификации.
12.2. Классификации канцерогенов
Химические канцерогены в зависимости от их происхождения могут быть
разделены на две группы: природные, т.е. не связанные с деятельностью
человека, и антропогенные, появление которых в окружающей среде обусловлено
деятельностью человека [16]. Однако подобная градация носит весьма ус-
ловный характер. Если канцерогенный минерал эрионит явно природного
происхождения, то другой канцероген — лекарственный препарат ТиоТЭФ
(кстати, широко применяемый в онкологии) синтезируется специально в
лабораторных условиях фармакологической индустрии. Полициклические
ароматические углеводороды (ПАУ) не только представляют собой продукты
вулканической или геохимической активности, но и генерируются в широ-
ких масштабах современной промышленностью. Ионизирующее излучение
возникает при распаде радона, образующегося из повсеместно распростра-
ненного в земной коре радия, а также в результате техногенных аварий и
катастроф атомных реакторов и т.д. Таким образом, практически все кан-
церогены “природного” происхождения могут поступать в окружающую
среду и извне в результате антропогенной или техногенной деятельности.
408
Принципиально различаются лишь источники поступления, но не само
действующее начало.
Столь же условно разделение канцерогенов на химические, физические
и биологические агенты. Что такое асбест или кремний: химические соеди-
нения или физические агенты? Афлатоксины — типичный биологический
фактор, действующий по всем правилам химического канцерогенеза. Коли-
чество подобных примеров можно увеличить. Такая классификация может
применяться лишь с известными оговорками и большого значения для
специалистов не представляет.
Существует классификация химических канцерогенов в зависимости от
характера их действия на организм:
вещества местного действия, вызывающие опухоли на месте апплика-
ции, например бенз(а)пирен;
агенты селективного действия, вызывающие опухоли определенных
локализаций (винилхлорид);
вещества множественного действия, индуцирующие опухоли различ-
к ной морфологической структуры в разных органах и тканях (2-ацети-
| ламинофлуорен). Подобное подразделение достаточно условно, так
| как в зависимости от метода введения в организм, экспозиции, объ-
I екта исследования, дозы введенного агента могут существенно менять-
ся локализация индуцированных опухолей и даже их морфологическая
структура, что обусловлено особенностями кинетики и трансформа-
ции канцерогенов в организме.
Наибольшим признанием пользуется классификация МАИР как наибо-
лее удобная в практическом плане. МАИР еще в 1969 г. разработаны
программа и критерии онкогенной опасности химических соединений. Кри-
тический анализ эпидемиологических, экспериментальных, а также вспомо-
гательных (или “поддерживающих”) данных позволил ранжировать 837 изу-
ченных факторов (большинство из них представляют собой химические
соединения) на четыре группы. В настоящее время эксперты МАИР [14,
16], проанализировав эти факторы, составили перечень канцерогенных аген-
тов. Кроме отдельных химических веществ и их смесей, применяющихся в
быту, на производстве, в медицине и сельском хозяйстве, в этот перечень
вошли вредные привычки (потребление алкогольных напитков, табакокуре-
ние и др.). Особо следует отметить, что в число опухолеродных факторов
включены и промышленные условия (газификация угля, производство фук-
сина, аурамина, изопропилового спирта). Это характеризует новый интег-
ральный подход к оценке степени канцерогенной опасности в тех случаях,
когда выделить конкретный причинный агент не представляется возмож-
ным, так как реальный риск обусловлен, очевидно, суммой или взаимоот-
ношением различных веществ и экспозицией к ним [7, 8].
К группе 1 отнесены вещества (факторы), которые имеют безусловные
доказательства опасности возникновения опухолей у человека. В перечне
этой группы 63 наименования, причем в это число включены факторы не
только химического, но и иного происхождения (табл. 12.1).
Более обширен список веществ (факторов) 2-й группы, которая по
степени доказательности на основе эпидемиологических, эксперименталь-
ных данных и результатов краткосрочных тестов разделена на подгруппы 2А
и 2Б. К группе 2А (59 факторов) отнесены агенты с весьма высокой степенью
доказательности, т.е. если они (вещества/факторы) имеют ограниченные для
человека и убедительные для животных свидетельства канцерогенности. В эту
группу включены также агенты, которые имеют ограниченные доказатель-
409
Таблица 12.1. Канцерогенные соединения, бытовые привычки и производствен-
ные процессы1, в отношении которых имеются убедительные доказательства их
причинной роли в происхождении опухолей у человека (группа 1 по классифика-
ции МАИР) и органы-мишени_________________________________________________
№ Химический фактор Органы-мишени2
п/п
Природные и промышленные канцерогены
1 4-Аминобифенил Мочевой пузырь
2 Асбест Легкие, плевра, брюшина (гортань, ЖКТ)
3 Афлатоксины Печень (легкие)
4 Бензидин Мочевой пузырь
5 Бензол Кроветворная система Легкие (ЦНС) *;
6 Бериллий и его соединения
7 Бис(хлорметил)эфир и технический хлорметиловый эфир Легкие
8 Винилхлорид Печень, кровеносные сосуды (мозг, легкие, лимфатическая система)
9 Горчичный газ (сернистый иприт) Глотка, гортань, легкие
10 Кадмий и его соединения Легкие, предстательная железа
11 Каменноугольные пеки Кожа, легкие, мочевой пузырь (гортань, полость рта)
12 Каменноугольные смолы Кожа, легкие (мочевой пузырь)
13 Кристаллический кремний Легкие
14 Минеральные масла (неочищенные) Кожа (легкие, мочевой пузырь, ЖКТ)
15 Мышьяк и его соединения Легкие, кожа
16 2-Нафтиламин Мочевой пузырь (легкие)
17 Никель и его соединения Полость носа, легкие
18 Радон и продукты его распада Легкие fe; Кожа, легкие , , ;п Кожа (ЖКТ) Д1'
19 Сажи
20 Сланцевые масла
21 Тальк, содержащий асбестовые волокна Легкие
22 ТХДД Легкие (подкожная жировая клетчатка, лимфатическая система)
23 Хром шестивалентный и его соединения Легкие (полость носа)
24 Эрионит Плевра, брюшина
25 Этилен-оксид Кроветворная и лимфатическая сис- темы
Канцерогенные лекарственные препараты г<
26 Азатиоприн Гепатобилиарная и лимфатическая . ' системы, кожа, мезенхима
27 Анальгетические смеси, содержащие фена- цетин Мочевой пузырь, почки ...}5
28 1,4-Бутанодиол диметансульфонат (милеран) Кроветворная система
29 Диэтилстильбзстрол Шейка матки (влагалище, молочная железа, яичники, матка)
30 Контрацептивы пероральные, применяемые Матка
циклически I
31 Контрацептивы пероральные, комбинирован Печень
32 ные Заместительная эстрогенотерапия Матка (молочная железа) L т Кроветворная система
33 Мелфалан
34 8-Метоксипсорален (метоксален) в сочета- Кожа Йф
нии с УФ-облучением
35 МОРР (комбинированная терапия с винкрис- тином, азотистым ипритом, прокарбазином, Кроветворная система "Ы
36 преднизолоном)
Нестероидные эстрогены Шейка матки, влагалище, яичники, матка, молочная железа
410
Продолжение
№ п/п Химический фактор Органы-мишени1 2
37 Стероидные эстрогены Матка (молочная железа) 38 Тамоксифен Матка 39 ТиоТЭФ (тиофосфамид) Кроветворная система 40 Треосульфан Тоже 41 Хлорамбуцил » » с- i-:.f 42 М,М-5ис(2-хлорэтил)-2-нафтиламин (хлорна- Мочевой пузырь . • , фазин) ' . , - 43 1-(2-Хлорэтил)-3-(4-метилциклогексил)- Кроветворная система 1-нитрозомочевина (метил-CCNU) 44 Циклофосфамид Мочевой пузырь, кроветворная система 45 Циклоспорин Лимфатическая система Канцерогенные бытовые факторы 46 .Потребление алкоголя (алкогольные напитки) Глотка, пищевод, печень, гортань, по- лость рта (молочная железа) 47 Жевательный бетель с табаком Полость рта, глотка, пищевод 48 Табак (курение, табачный дым) Легкие, мочевой пузырь, пищевод, гор- тань, поджелудочная железа 49 Табачные продукты для жевания Полость рта, глотка, пищевод 50 Потребление соленой рыбы, приготовлен- Полость носа, глотка (желудок, полость ной китайским способом рта, глотка, почки Канцерогенные производственные процессы 51 Выплавка чугуна и стали Легкие (ЖКТ, кроветворная и мочепо- ловая системы) 52 Газификация угля Кожа, легкие, мочевой пузырь 53 Подземная добыча гематита с экспозицией Легкие к радону 54 Пошив и ремонт обуви Полость носа, кроветворная система (глоткв, легкие, печень, ЖКТ, мочевой пузырь) 55 Производственная экспозиция к красителям Легкие 56 Производство алюминия Легкие, мочевой пузырь, лимфатичес- кая система 57 Производственное воздействие веществ, Полость носа, гортань, легкие содержащих серную кислоту 58 Производство аурамина Мочевой пузырь (предстательная железа) 59 Производство изопропилового спирта Полость носа, гортань 60 Производство кокса Кожа, легкие, почки 61 Производство мебели Полость носа 62 Производство фуксина Мочевой пузырь 63 Резиновая промышленность Мочевой пузырь, кроветворная систе- ма (легкие, ЖКТ, кожа, лимфатическая система)
1 В таблицу не включены следующие физические и биологические факторы, канцерогенность
которых для человека безусловно доказана: солнечная радиация, древесная пыль, вирусы гепати-
тов В и С, паразитарные возбудители Shistosoma haematobium и Opistorchis viverrini, бактерии
Helicobacter pylori, вирус папилломы человека (HPV) типов 16 и 18, Т-лимфотропный вирус человека
(HTLV-1), вирус Эпштейна — Барр (EBV) и вирус иммунодефицита (HIV-1).
z В скобках указаны органы-мишени, в отношении которых имеются весомые эпидемиологи-
ческие данные.
I
411
ства канцерогенного риска для человека или убедительные данные в отношении
животных, но при этом поддержаны положительными результатами крат-
косрочных тестов. В группе 2А находятся: бенз(а)пирен, диметилгидразин,
формальдегид и др. Группа 2Б (228 факторов) включает вещества, вероятно,
вызывающие рак у человека, т.е. имеющие либо ограниченные или неадекватные
доказательства канцерогенности для человека в отсутствие убедительных
свидетельств в опытах на животных. В некоторых случаях при неадекватных
данных (или в отсутствие результатов) обследования людей при ограничен-
ных доказательствах канцерогенности для животных и наличии достоверно
положительных сведений в краткосрочных пробах изучаемое соединение
причисляют к группе 2Б. К указанной категории отнесены акрилонитрил,
азотолуол, кобальт и некоторые другие.
К группе 3 (475 наименований) отнесены агенты (факторы), которые на
основании имеющихся в настоящее время сведений не могут быть классифи-
цированы в отношении их опухолеродной активности для человека (катехол,
хлордан, фуразолидон, клофибрат и др.).
Группу 4 составляют агенты, очевидно, не канцерогенные для человека
(из оцененных экспертами МАИР к таковым отнесен лишь капролактам).
Таблица 12.2. Ранжирование оцененных экспертами МАИР факторов по степени
доказательности канцерогенности для человека [13]
Номер группы Степень доказательности канцерогенности Количество факторов
1 Канцерогенные для человека 74
2А Вероятно, канцерогенные для человека 59
2В Возможно, канцерогенные для человека 228
3 Неклассифицируемые в отношении канцерогенности для человека 475
4 Вероятно, неканцерогенные для человека 1
Всего оценено 837
Настоящая классификация имеет важное практическое значение, по-
скольку дает возможность оценить реальную канцерогенность этих факторов
для человека и в случае обнаружения таковой на животных провести целе-
направленные углубленные эпидемиологические исследования [5]. Как по-
казывает опыт такой экспертной оценки, список включенных в эту класси-
фикацию агентов будет постоянно пополняться, причем часть из них будет
по мере накопления экспериментальных и эпидемиологических данных
переноситься в вышестоящие группы (например, ТХДД в 1977 г. был отне-
сен в группу 2Б, а в 1997 г. переведен в группу 1). С другой стороны,
последняя переоценка данных, предпринятая экспертами МАИР в 1999 г.,
позволила перевести акрилонитрил из группы 2А в группу 2Б, так как были
установлены некоторые погрешности эпидемиологических наблюдений, вы-
полненных ранее. Вместе с тем эта весьма объективная классификация,
будучи международной, не является классификацией опасности и носит
лишь информационный, рекомендательный характер, не являясь обязатель-
ной для законодательных мер, служб здравоохранения и охраны окружаю-
щей среды. В связи с этим и необходимостью конкретных мероприятий по
первичной профилактике в ряду развитых стран приняты национальные
перечни канцерогенных агентов. Подобный список действует и на террито-
рии России [5, 9]. Госсанэпиднадзор РФ в июне 1995 г. утвердил “Перечень
412
веществ, продуктов производственных процессов, бытовых и природных
факторов, канцерогенных для человека”, подготовленный членами Комис-
сии по канцерогенным веществам (см. ниже).
В национальный перечень химических канцерогенных факторов входят:
Д. Соединения и продукты, производимые и используемые промышленностью; при-
родные химические канцерогены
4-Аминобифенил
Асбесты
Афлатоксины Bl, В2, Gl, G2
Бензидин
Бензол
Бенз(а)пирен : ><
Бериллий и его соединения ;
Бисхлорметиловый и хлорметиловый эфиры ........ .
Винилхлорид
Возгоны каменноугольных смол и пеков
Иприт сернистый
Каменноугольная и нефтяная смолы
Каменноугольный и нефтяной пеки
Минеральные масла неочищенные и не полностью очищенные
Мышьяк и его неорганические соединения (триоксид, арсенат кальция, арсенит
натрия, пентоксид, сульфид)
1-Нафтиламин технический, содержащий более 0,1 % 2-нафтиламина
2-Нафтил амин
Никель и его соединения (никеля оксид, гидроксид, карбонил, хлорид, субсуль-
фид, карбонат, никелоцен, сульфид, хромфосфат)
Смеси соединений никеля (файнштейн, никелевый концентрат и агломерат,
оборотная пыль очистных устройств)
Сланцевые масла
Тальк, содержащий асбестовые волокна
О-толуидин
Хрома соединения шестивалентные (хроматы, бихроматы, оксиды, карбонил,
фосфат, хлорид, ацетат, сульфат)
Эрионит
Б. Производственные процессы, связанные с опасностью развития злокачественных
новообразований у рабочих
Деревообрабатывающее и мебельное производство (машинная обработка древе-
сины и мебельных заготовок в закрытых помещениях, фанерование)
Медеплавильное производство (плавильный передел, конверторный передел, ог-
невое рафинирование)
Производство 1-нафтиламина из нитронафталина, содержащего примесь 2-на-
фтиламина
Производство изопропилового спирта
Производство кокса, переработка каменноугольной, нефтяной и сланцевой смол,
газификация угля
Производство резиновых изделий
Производство технического углерода
Производство угольных и графитовых изделий, производство анодных и подовых
масс, а также предварительно обожженных анодов для электролизеров алюминия
Производство чугуна и стали (агломерационные фабрики, доменное и сталепла-
вильное производство, горячий прокат) и литья из них
Производственные процессы, связанные с экспозицией к аэрозолю сильных
неорганических кислот, содержащих серную кислоту
Электролитическое производство алюминия с использованием самоспекающихся
анодов, капитальный ремонт электролизеров
413
В. Лекарственные препараты и методы лечения
Азатиоприн
Анальгетические смеси, содержащие фенацетин
Каменноугольная смола терапевтическая (фармацевтическая)
Комбинированная химиотерапия с использованием азотистого иприта, винкрис-
тина, прокарбазина, преднизолона и других алкилирующих агентов
Мелфалан
Метоксал ен
Милеран
Раствор Фовлера (соли мышьяка)
Тиотепа
Треосульфан
Хлорамбуцил
Хлорнафазин
1-(2-Хлорэтил)-3-(4-метилциклогексил)-1 -нитрозомочевина
Циклоспорин
Циклофосфамид
Эстрогены стероидные (эстрадиол-17 и его эфиры, эстриол, эстрон, этинил-эст-
радиол, местранол, коньюгированные эстрогены)
Эстрогены нестероидные (диэтилстильбэстрол, диеноэстрол, гексэстрол)
Эстрогенсодержащие контрацептивы орального применения
Г. Бытовые и природные факторы
Алкоголь
Радон
Солнечная радиация
Табачный дым
Табачные продукты бездымные
В основу этого перечня положены материалы МАИР, но с некоторыми
отличиями, обусловленными адаптацией к требованиям отечественной
практики и большей конкретностью в отношении оценки канцерогенного
риска тех или иных соединений для человека. Так, в него вошли БП (группа
2А по МАИР), технический нафтиламин, содержащий более 0,1 % 2-нафтил-
амина, медеплавильная промышленность, производство технического угле-
рода, производство угольных и графитовых изделий и др. В нем также
учтены результаты исследований, проведенных отечественными авторами.
Все это направлено на дифференциацию информационно-правовых подхо-
дов для проведения профилактических мероприятий по снижению заболе-
ваемости злокачественными опухолями.
Наиболее часто химические канцерогенные факторы классифицируют
согласно их структуре и выделяют следующие группы: 1) полициклические
ароматические углеводороды и гетероциклические соединения; 2) аромати-
ческие азосоединения; 3) ароматические аминосоединения; 4) нитрозосое-
динения; 5) металлы и металлоиды; 6) алкилирующие канцерогенные аген-
ты. Эта классификация относительно удобна, но ее поверхностность оче-
видна, так как, с одной стороны, далеко не все представители указанных
групп канцерогенны, с другой — существуют агенты иной химической струк-
туры, которые также способны вызывать рак. Вместе с тем она дает воз-
можность ориентироваться в группах соединений, где с большей или мень-
шей вероятностью можно ожидать проявлений канцерогенного действия.
Именно поэтому следует несколько более подробно охарактеризовать эту
классификацию и агенты, входящие в нее.
Известно огромное количество ПАУ и гетероциклических соединений,
которые представляют собой химические вещества с тремя и более конден-
сированными бензольными кольцами (20-метилхолантрен) или имеют гете-
роциклические атомы азота (4-нитрохинолин-1Ч-оксид).
414
4-Нитрохинолин-М-оксид
Первые ПАУ, вызывающие рак, были выделены в начале 30-х годов XX в.
из каменноугольной смолы. Установлено, что эти вещества, как и гетеро-
циклические соединения, способствуют развитию опухолей на месте введе-
ния. Так, при накожной аппликации бенз(а)пирена мышам возникает рак
кожи, а при подкожном введении — саркомы подкожной жировой клетчат-
ки. Не все из сотен выделенных агентов этой группы канцерогенны, поэтому
было высказано предположение о роли электронной плотности в реализации
канцерогенного эффекта. Выраженная канцерогенность характерна для со-
единений, в которых сочетается “К-область” (т.е. с высокой электронной
плотностью) с неактивной “L-областью” (где активные атомы находятся в
мезоположениях). Это позволило предсказать канцерогенность ряда бенза-
кридинов. Однако указанное положение не является универсальной законо-
мерностью. Диоловые эпоксиды, образующиеся в области “bay-region”,
более канцерогенно активны, чем диолэпоксиды, в других положениях мо-
лекулы ПАУ.
Для ароматических азосоединений характерно присутствие двух или
более азогрупп.
п-Диметиламиноазобензол
СН, СН,
о-Аминоазотолуол
в 30-х годах XX в. японскими исследователями было показано, что
азокрасители о-аминоазотолуол и л-диметиламиноазобензол при скармли-
вании их крысам индуцируют у последних новообразования печени. По
более поздним данным, при подкожном введении и накожной аппликации
азосоединения способны вызывать опухоли в печени и мочевом пузыре,
причем канцерогенный эффект зависит от химической структуры.
415
К ароматическим аминосоединениям относят агенты, в состав которых
входят дифенил- или нафталиноподобные группировки (2-нафтиламин, бен-
зидин).
2-Нафтиламин
Бензидин
При изучении заболеваемости профессиональным раком мочевого пузы-
ря на анилиновых производствах в Германии впервые была установлена
канцерогенность ароматических аминов. В экспериментах было выявлено,
что у собак и реже у хомяков соединения этой группы индуцируют ново-
образования мочевого пузыря, а у крыс и мышей при различных способах
введения опухоли локализуются в других органах. Высказано предположе-
ние, что канцерогенность ароматических аминов обусловлена наличием
аминогрупп (вероятно, и нитрогрупп) в пара-положениях в ароматических
системах независимо от характера связи между бензольными кольцами.
Общей для нитрозосоединений является наличие группы N/NO. Один
из радикалов является алкильным или арильным, второй же может включать
различные ароматические, амидо- или другие группы.
СН3
O=N—NX
ЧСН3
СН3
O = N—
X C— NH2
N-Нитрозодиметиламин
О
N-Нитрозометилмочевина
Различают симметричные (N-нитрозодиметиламин), несимметричные
(N-нитрозометилэтиламин) и гетероциклические (N-нитрозопирролидин)
нитрозосоединения. Нитрозамиды содержат амидный или эфирный радикал
(N-нитрозометилмочевина). У нитраминов нитрозогруппа замещена элек-
тронно-активной нитрогруппой (NO). Установлена возможность эндогенно-
го синтеза нитрозосоединений из химических предшественников — вторич-
ных и третичных аминов, алкил- и ариламидов и нитрозирующих аген-
тов —нитратов, нитритов, окислов азота. Канцерогенность нитрозосоедине-
ний впервые была установлена Р.Magee и G.Barnes в 1956 г. Из 332 изучен-
ных соединений этой группы 87 % обладали способностью вызывать в
эксперименте опухоли у животных, причем чувствительными к их действию
оказались практически все исследованные биологические объекты (42 вида) —
от членистоногих и моллюсков до обезьян. Большинство нитрозосоедине-
ний оказывает селективное действие и способно индуцировать опухоли
различных локализаций и морфологии, причем их канцерогенность выра-
жение зависит от дозы и путей введения.
Как это показано в опытах на животных, канцерогенные свойства имеют
некоторые химические элементы — металлы и металлоиды. В эту группу
входят бериллий, кобальт, мышьяк, кадмий, свинец, никель, титан, железо,
цинк, хром. Большинство названных агентов способно вызывать опухоли
на месте введения, но в ряде случаев возможно индуцировать и новообра-
зования других локализаций.
416
в особую группу обычно выделяют разнообразной структуры алкилирую-
щие канцерогенные агенты: диазоалканы, лактоны, эпоксиды, альдегиды,
азиридины и др. Общее свойство этих агентов (как и нитрозосоединений) —
способность их алкильного радикала связываться с определенными участ-
ками макромолекул клетки (ДНК, РНК и белками). Весьма вероятно, что
именно от алкилирующей способности химических веществ этой группы
зависит многообразие их канцерогенных эффектов.
Н2С—С = О
Н2С—О
Р -Пропиолактон
(2-оксетанон)
н2сх
I /NH
Н2СГ
Азиридин
Свыше 30 химических соединений, являющихся продуктами жизнеде-
ятельности низших грибов, бактерий и растений, представляют собой
природные канцерогены. Подобное название, конечно, условно. Так,
бенз(а)пирен и асбест можно рассматривать и в этой группе химических
канцерогенов. Наиболее изучены микотоксины, прежде всего афлатоксины,
а также охратоксины, сафрол, этионин, гризеофульвин, циказин, стеригма-
тоцистин, фузариотоксин и некоторые другие. Они вызывают в основном
опухоли печени, однако механизмы действия этих веществ и выраженность
канцерогенных эффектов различны.
Афлатоксин В1
СН2— СН=СН2
Сафрол
В последние годы предложен другой подход к классификации канцеро-
генов, основанный на современных представлениях о механизмах их дейст-
вия. О самих механизмах будет сказано ниже. Здесь уместно лишь привести
указанную классификацию (табл. 12.3), согласно которой канцерогены могут
быть разделены на генотоксические, или ДНК-тропные, и негенотоксичес-
кие. Механизмы действия последних опосредованы иными, чем ДНК, струк-
турами, т.е. их эффект осуществляется на эпигенетическом уровне.
Таблица 12.3. Механизменная классификация химических канцерогенов
Тип Пример
ДНК-тропные канцерогены: прямые канцерогены проканцерогены неорганические Алкилирующие агенты ПАУ, нитрозоамины Соли ряда металлов'
417
14-7127
Продолжение
Тип Пример
Эпигенетические канцерогены: промоторы цитотоксические агенты: прямого действия непрямого действия гормональные агенты иммунодепрессанты индукторы пероксисом Неклассифицированные: смешанная группа неорганические Фенобарбитал, сахарин Ацетонитрил, d-лимонен Ь-Агонисты Эстрогены Циклоспорин Клофибрат Метаперилен, диоксан Соли ряда металлов1 НЧЕ. -м: Г '
В зависимости от типа металла их соли могут проявлять канцерогенные свойства либо по
генотоксическому механизму, либо эпигенетически (например, путем нарушения точности работы
ДНК-полимеразы).
12.3. Закономерности канцерогенеза и механизмы
действия химических канцерогенов
Между воздействием канцерогена и проявлением заболевания обычно
проходит довольно значительное время. Например, длительность латентного
периода в случае развития лимфом составляет 2—5 лет, рака мочевого
пузыря, вызванного контактом с ароматическими аминами, — 18 лет, а рак
легких и мезотелиомы плевры развиваются через 20—40 лет после вдыхания
асбестовой пыли, так же как и опухоли кожи после воздействия мышьяка.
Длительность латентного периода во многом определяется продолжительнос-
тью и интенсивностью экспозиции организма к канцерогенному фактору, а
также активностью агента. Последняя может широко варьировать в зави-
симости от видовых, половых и генетических особенностей организма, а
также от иммунного и гормонального статуса [11, 18, 20]. Принимая во
внимание, что последствия контакта с канцерогенами выявляются значи-
тельно позже контакта, необходимо определять возможную канцерогенность
тех веществ, которые поступают в окружающую среду и с которыми сопри-
касается человек.
Установлены прямые корреляции доза — эффект (больше доза — выра-
женнее действие), время — эффект (длительнее время экспозиции — выра-
женнее опухолеродная реакция). Однако корректнее говорить об определен-
ной закономерности доза — время — эффект. Это означает, что чем выше
доза, тем короче латентный период и тем с большей частотой возникают
опухоли (естественно, большое значение имеет и канцерогенная активность
агента). Указанная закономерность описывается предложенной формулой
J.Iball (отношение процента животных с опухолями к проценту животных,
доживших до момента обнаружения первой опухоли к среднему латентному
периоду), отражающей канцерогенную активность. Этот показатель исполь-
зуют при сравнении канцерогенности разных опухолеиндуцирующих аген-
тов при одинаковых стандартных условиях воздействия или при оценке
сравнительной чувствительности к канцерогенному действию различных
видов животных. При анализе динамики морфологических изменений, пред-
шествующих раку, установлена важная закономерность — стадийность. Эта
закономерность описана Л.М.Шабадом (1978) как последовательная смена
изменений в тканях органа-мишени от диффузной неравномерной гипер-
418
плазии, образования фокусов пролиферации до формирования доброкаче-
ственных и злокачественных опухолей. Важно отметить, что в ряде случаев
не удается проследить все стадии. Так, при воздействии на крыс 1,2-диме-
тилгидразином карциномы толстой кишки развивались, минуя стадию
доброкачественной опухоли. Подобная картина наблюдается и при индук-
ции ДМБА злокачественных новообразований в молочной железе.
Эффекты различной направленности и выраженности отмечены при
комбинированных воздействиях. При совместной аппликации двух канце-
рогенов, принадлежащих к одному химическому классу, может отмечаться
потенциирование эффекта — возрастание частоты индуцированных опухо-
лей (бензидин и 2-нафтиламин усиливали канцерогенез в кишечнике крыс).
Это явление получило название синканцерогенеза. Применение веществ с
различной канцерогенной активностью, но одинаковой органотропностью
может выражаться в торможении возникновения опухолей (например, опу-
холи кожи возникают значительно реже при совместном воздействии ди-
бенз(а)антрацена и бенз(а)антрацена, что можно объяснить конкуренцией
за внутриклеточные рецепторы). Антиканцерогенный эффект может наблю-
даться и при комбинации канцерогенов различных структурных классов.
Так, некоторые ПАУ, введенные в организм на фоне воздействия аромати-
ческих аминов или азосоединений, тормозят печеночный канцерогенез у
крыс. Этот эффект объясняется свойствами ПАУ индуцировать ферменты
микросомного окисления, которые дезактивируют амино- и азосоединения.
По многочисленным данным, риск развития злокачественных опухолей
увеличивается с возрастом. Возможно, по мере старения организма проис-
ходит накопление в органах-мишенях клеточных повреждений от спонтан-
ного воздействия средовых факторов или изменяется активность иммунной
и других защитных систем организма. Нельзя исключить, что именно это
лежит в основе изменения с возрастом чувствительности организма к дей-
ствию канцерогенных агентов (схема 12.1).
Одно из достижений последних двух десятилетий в экспериментальной
онкологии — признание того, что в большинстве случаев канцерогенез, индуци-
рованный химическими агентами, представляет собой многоступенчатый про-
цесс. Этот феномен показан на моделях развития в эксперименте опухолей
кожи, печени, мочевого пузыря, кишечника и подтвержден убедительными
данными при изучении эпидемиологии новообразований у людей.
Современные представления о механизмах развития опухолей позволяют
рассматривать многостадийный канцерогенез (схема 12.2) как процесс воз-
никновения и развития неопластических изменений, включающих последо-
вательно фазы инициации и промоции, и реализующийся только при опре-
деленном порядке аппликации сменяющих друг друга экзо- и(или) эндоген-
ных канцерогенных факторов, каждый из которых в отдельности не спо-
собен привести к индукции опухолей [4].
Первая стадия канцерогенеза — инициация — процесс возникновения
первичных мутационных изменений генотипа клеток-мишеней, выражаю-
щийся в необратимом переходе этих клеток в предрасполагающее к транс-
формации (инициированное) состояние. Основные характеристики инициа-
ции:
качественный и необратимый процесс, в основе которого лежит из-
менение генотипа;
изменение генотипа происходит вследствие мутаций, индуцированных
инициатором;
мутационные изменения могут быть вызваны только лишь реакцион-
419
14"
Схема 12.1. ИНДУКЦИЯ ЗЛОКАЧЕСТВЕННОГО РОСТА ГЕНОТОКСИЧЕСКИМИ
КАНЦЕРОГЕНАМИ [Катульский Ю.Н., 1983].
но-активной формой инициатора, взаимодействующей с макромоле-
кулами (главным образом с ДНК) клеток-мишеней;
действие инициирующего агента аддитивно, что обусловлено эффек-
том “памяти” к последующей аппликации инициатора.
Теоретически единичная аппликация инициатора в любой дозе является
достаточным условием для перехода нормальной клетки в инициированное (т.е.
предрасполагающее к трансформации) состояние.
В самой инициации следует различать фазы метаболической активации,
взаимодействия с ДНК и фиксации индуцированных изменений [4, 10]. Как
известно, большинство к8нцерогенов являются лишь проканцерогенами
(проканцероген, или непрямой канцероген, — химический канцероген, спе-
цифическая активность которого обусловлена образованием in vivo и(или)
in vitro реакционноспособных электрофильных метаболитов, реагирующих
с клеточными макромолекулами), т.е. приобретают инициирующую способ-
ность после метаболической активации — процесса биотрансформации про-
канцерогенов в их реактивные формы, протекающие in vivo и(или) in vitro
Схема 12.2. МНОГОСТАДИЙНЫЙ КАНЦЕРОГЕНЕЗ
[Инге-Вечтомов С.Г., Худолей В.В., 1998; Худолей В.В., 1993].
Инициация
ДНК-повреждения
Промоция
Г иперплазия
Генотоксические вещества,
радиация, ультрафиолет,
вирусы, ошибочный синтез ДНК
Факторы роста, гормоны,
негенотоксические
вещества
Прогрессия Метастазирование
Генетическая Инвазия
нестабильность
------------а» ------------------»-
Генная амплификация, потеря "нормаль-
ного" аллеля онкогена, потеря супрес-
сорного гена, дополнительные мутации
420
с участием различных энзиматических систем. Принято считать, что канце-
рогены различной химической структуры путем энзиматических превращений
или безферментного распада трансформируются в реакционноспособные мета-
болиты, наиболее общим свойством которых является электрофильность
(электрофилами называют соединения, содержащие в своей молекуле элек-
трон-дефицитные атомы). Образовавшиеся агенты высокореактивны и спо-
собны связываться с несущими атомы с повышенной электронной плотнос-
тью нуклеофильными центрами клеточных макромолекул (ДНК, РНК, бел-
ки). Это взаимодействие происходит по типу реакции SN1 и(или) SN2 и
приводит к повреждениям или модификациям ДНК. Метаболическая акти-
вация как фаза инициации не является необходимой для прямых химичес-
ких канцерогенов, активных per se. Для проявления его специфического
эффекта метаболическая активация необязательна.
Биотрансформацию ксенобиотиков, в том числе канцерогенов, в кото-
рой принимает участие большое количество энзиматических реакций, при-
нято рассматривать как этапный процесс, включающий в себя по крайней
мере две фазы [10]. Биохимические реакции, протекающие в I фазе, приво-
дят к образованию новых или модификации уже имеющихся функциональ-
ных группировок. Фаза II объединяет конъюгирующие реакции, обеспечи-
вающие транспорт и экскрецию метаболитов. Несмотря на то что в I и II
фазах реакции направлены в целом на обезвреживание ксенобиотиков, в
ряде случаев может наблюдаться активация последних. В биохимических
реакциях, катализирующих фазу I метаболических превращений в организ-
ме, основное место принадлежит системе микросомного окисления. Липи-
дорастворимые ксенобиотики превращаются микросомными монооксигена-
зами в более полярные гидроксилированные дериваты, способные к выве-
дению из организма. Круг реакций, катализируемых монооксигеназами,
включает в себя ароматическое или алифатическое гидроксилирование, фор-
мирование арен- и алкилоксидов, окислительное N-, О- и S-деалкилирова-
ние, сульфоокисление, окислительное деаминирование, десульфирование и
дегалогенирование. Цитохром Р-450, существующий в виде множественных
форм с различной субстратной специфичностью, связывает и метаболизи-
рует неполярные химические соединения. Маркерными энзимами моноок-
сигеназ являются арилгидрокарбонгидроксилаза (катализирует реакции гидро-
ксилирования в основном ПАУ) и N-деметилазы (осуществляют окислительное
деалкилирование нитрозосоединений и других субстратов). Меньшее значение
имеют и другие ферменты, способные осуществлять реакции в фазе I: флавоп-
ротеин-М-оксигеназа (катализ образования N-оксидов гидразинов), гидролазы
(эстеразы и амидазы, гидролизующие связи N—С и О—С в ароматических
аминах), эпоксидгидролаза (осуществляет гидролиз связи О—С в эпокси-
дах), азо- и нитроредуктазы (разрыв азо-, диазо- и нитросвязей).
Из немонооксигеназных ферментов, принимающих участие в метаболи-
ческой активации ксенобиотиков в реакционноспособные генотоксиканты,
следует выделить простагландинсинтетазы. Они участвуют в биосинтезе
широкого спектра простагландинов из полиненасыщенных жирных кислот
и обладают циклооксигеназной и пероксидазной активностью.
Наиболее важный процесс в фазе II метаболизма канцерогенов в орга-
низме большинства позвоночных животных — это конъюгация метаболитов
с глюкуроновой кислотой. Существенное значение в дезактивации и акти-
вации ксенобиотиков имеют также сульфотрансферазы, ацетилтрансферазы,
глутатионтрансферазы, которые осуществляют перенос активных групп к
различным акцепторам.
421
Второй фазой инициации является взаимодействие канцерогенных ме-
таболитов с ДНК, выражающееся в ее модификациях или повреждениях,
т.е. в генотоксическом эффекте (модификации генома половых или сома-
тических клеток, проявляющиеся качественными или количественными из-
менениями генной активности). Этот эффект может быть вызван как пря-
мым, так и непрямым действием инициатора. В первом случае взаимодей-
ствие инициатора происходит с покоящейся ДНК посредством алкилиро-
вания нуклеотидов, дезаминирования оснований, транслокации и делении
молекул ДНК путем инкорпорации аналогов оснований или интеркаляций
между нуклеотидами. Непрямой генотоксический эффект реализуется путем
индукции ошибок в ДНК-репарирующих или ДНК-реплицирующих фер-
ментах, различных нарушений рекомбинации или аномальной сегрегации
хромосом и главным образом взаимодействия реактанта с низкомолекуляр-
ными нуклеофилами, имеющими большое значение для синтеза пуриновых
оснований ДНК (гуанин, аденин, ГТФ, АТФ, АМФ, цАМФ, цГМФ). Наи-
более изучено метилирование гуанина, которое приводит к нарушению
комплементарности оснований, так как вместо обычного сочетания гуанин —
цитозин образуется пара метилгуанин — тимин. Поскольку в норме тимину
соответствует аденин, пара оснований гуанин — цитозин заменяется на аде-
нин — тимин, что и приводит к нарушению генетического кода. Вероятность
прямого генотоксического эффекта, очевидно, меньше, чем непрямого, так
как в ДНК концентрация нуклеофильных групп ниже по сравнению с
низкомолекулярными ее предшественниками и эти нуклеофильные сайты в
ДНК защищены от взаимодействия с реактивными метаболитами стеричес-
кими факторами. В обоих случаях принято говорить о мутациях, под кото-
рыми понимают изменение свойств, связанных с повреждением гена(ов) и
передаваемых потомству клеток. Более корректно следующее определение:
мутация — это возникновение наследственно закрепленных изменений (или
само изменение) в генетическом материале, выражающееся в приобретении
новых фенотипических признаков). Исходя из этого, мутагенный канцеро-
ген можно считать канцерогеном, воздействие которого обусловлено (или
коррелирует с) его способностью вызывать генотоксический эффект, про-
являющийся мутациями, повышающими гетерогенность популяции по не-
зависимым фенотипическим признакам.
Высокая положительная корреляция между мутагенезом и канцерогенезом
не исключает возможности взаимодействия метаболитов канцерогенов с ины-
ми, чем ДНК, макромолекулами клетки, которые содержат множественные
нуклеофильные участки, — РНК и белками. Ряд канцерогенов способен ал-
килировать транспортные РНК. Это в свою очередь ведет к нарушению
трансляции мРНК и синтеза белков. Значение таких биополимеров в кан-
церогенезе недостаточно ясно. Тем не менее поскольку генетическая ин-
формация связана с ДНК, именно модификации последней играют ключе-
вую роль в молекулярных событиях, конечным результатом которых явля-
ется инициация канцерогенеза [6].
Третья фаза инициации — фиксация индуцированных изменений. Ука-
занные выше повреждения ДНК должны проявиться в потомстве клеток-
мишеней, способных давать пролиферативный пул. Это могут быть стволо-
вые клетки, клетки-предшественники различных стадий зрелости, а также
дифференцированные клетки, обладающие пролиферативной активностью
в определенных условиях (гиперплазия, функциональная регенерация). Ес-
тественно, что повреждения ДНК могут быть “узнаны” контролирующими
и защитными системами организма, поддерживающими молекулярно-кле-
422
точный гомеостаз, а затем элиминированы путем включения систем репа-
рации.
Восстановление ДНК от повреждений осуществляется несколькими раз-
личными механизмами. В настоящее время насчитывается по крайней мере
шесть подобных типов репарации: эксцизионная, фотореактивация, постре-
пликативная, репликативная, SOS-репарация (аварийная) и рекомбинаци-
онная. Обычно репаративные системы разделяют на две основные группы:
дорепликативную репарацию, представляющую безошибочно протекающий
процесс, который объединяет первые два типа из приведенной выше клас-
сификации, и пострепликативную индуцибельную репарацию, протекаю-
щую с ошибками и включающую остальные четыре типа. Большое значение
в канцерогенезе имеет эксцизионная репарация, восстанавливающая исход-
ную структуру ДНК. В клетках, резистентных к действию канцерогенов,
скорость элиминации О6-метилгуанина значительно выше, чем других алки-
лированных аддуктов, т.е. для тканей-мишеней характерна задержка восста-
новления повреждений ДНК, что в свою очередь ведет к длительной персис-
тенции измененных оснований и искажению генетического кода. Ингибиро-
вание дорепликативной системы репарации имеет одно важное последствие:
помимо того, что часть повреждений остается нерепарированными, активиру-
ется пострепликативная репарация, но она происходит с ошибками. Обычно
же пострепликативное восстановление устраняет вторичные повреждения
(бреши), появляющиеся в геноме в местах, оппозитных повреждению.
Известно, что разнообразные типы репарации представляют собой мно-
гоэтапные процессы, осуществляемые при помощи ферментов и контроли-
руемые различными генами. Например, в эксцизионной репарации участ-
вуют эндонуклеазы и гликозидазы, экзонуклеазы и полимеразы, а также
полинуклеотидлигазы. Процесс пострепликативной репарации осуществля-
ется путем синтеза ДНК de novo с помощью экзонуклеаз, полимераз, лигаз.
Ферменты, участвующие в процессах репарации, и гены, контролирующие
эти процессы, охарактеризованы недостаточно полно. Нерепарируемые и
персистирующие в течение ряда репликаций повреждения ДНК ведут к
стабильному изменению генотипа, т.е. к мутациям. Понятно, что обратный
переход инициированной клетки в исходное состояние представляется не-
возможным или же такая возможность чрезвычайно низка (как вероятность
обратной мутации).
Не исключено, что ряд немутагенных химических соединений может
способствовать инициации канцерогенеза другими, опосредованными меха-
низмами без вовлечения в процесс ферментных систем и образования
электрофилов. К подобным агентам относят негенотоксические канцероге-
ны — индукторы гладкого эндоплазматического ретикулума (ДДТ, диэтил-
стильбэстрол), пролифераторы пероксисом (гиполипидемические средства),
митохондриальные пролифераторы (метапирилен-гидрохлорид, ди-2-этил-
гексилфталат) и вещества смешанного действия (асбест, никель, тиоацета-
мид). Известно, что пролифераторы пероксисом генерируют внутриклеточ-
ное образование Н2О2. Другие агенты инактивируют супероксид-дисмутазу.
В результате этих реакций происходит перекисное повреждение ДНК (раз-
рыв нитей). С другой стороны, увеличение активности под действием ука-
занных агентов в окислительной системе жирных кислот и образование
Радикалов кислорода приводят к окислению и переокислению липидов.
Продукты подобных реакций связывают тиосодержащие соединения, участ-
вующие в репарации. Признаками негенотоксических (“эпигенетических”)
канцерогенов [2, 20] являются:
423
1. Отсутствие генетических эффектов:
маловероятно превращение в электрофильную форму; ;
не обнаруживаются соответствующие аддукты в ДНК; &
тесты на генотоксичность отрицательные. ths--»
2. Наличие эпигенетических эффектов: ir.-
повреждение клеток в органе-мишени;
стимуляция пролиферации; ,тп
рост клонов предопухолевых клеток;
нарушение межклеточных контактов.
3. Дозовые и временные зависимости эффектов:
эффективны лишь высокие дозы при длительном применении;
эффект полностью обратим в ранних стадиях;
пороговость в проявлении эффектов;
зависимость доза — эффект как для эпигенетических проявлений, так
и для возникновения опухолей.
Вторая стадия канцерогенеза — промоция, под которой понимают про-
цесс возникновения вторичных эпигеномных изменений фенотипа иници-
ированных клеток, завершающийся переходом этих клеток в необратимое
трансформированное состояние. Основные характеристики промоции:
промоция — качественные и количественные изменения иницииро-
ванных клеток, в основе которых лежит перестройка клеточного фе-
нотипа;
перестройка фенотипа, происходящая вследствие эпигенетических из-
менений (т.е. генной экспрессии), индуцированных опухолевым про-
мотором;
опухолевые промоторы — тканеспецифические факторы;
промоторы неэффективны, если они применяются перед воздействием
инициатора, но дают промоцирующий эффект независимо от интер-
вала между первоначальной аппликацией инициатора и последующим
применением промотора;
для реализации программы канцерогенеза нужно интенсивное (т.е.
длительное и непрерывное) воздействие промотора.
Необходимым, но не достаточным условием промоции является проли-
ферация инициированных клеток.
Несмотря на интенсивные исследования опухолевых промоторов in vitro
и in vivo, все же механизмы их действия остаются во многом неясными.
Опухолевые промоторы вызывают разнообразные изменения в клетках. Наи-
более изучено их действие на клеточные мембраны, содержащие специфи-
ческие рецепторы к промоторам, ингибирующее влияние на внеклеточные
контакты, играющие основную роль в контроле клеточной пролиферации и
дифференцировки. Все перечисленные изменения носят эпигеномный ха-
рактер.
Предложенная нами [4] следующая гипотеза помогает объяснить меха-
низмы промоции изменениями в генной экспресии. При интенсивном дей-
ствии промотора инициированные клетки функционируют в предельном
или близком к нему режиме. В период, непосредственно предшествующий
митозу (О2-фаза клеточного цикла), синтезируется необходимое для нор-
мального течения митоза количество генных продуктов (например, хрома-
тиновых белков). Однако рано или поздно инициированные клетки стано-
вятся неспособными к работе в предельном режиме и при определенном
клеточном делении происходит их “срыв”, обусловленный дефицитом син-
424
теза необходимых для клетки генных продуктов (последних все же доста-
точно для завершения митоза). В результате “срыва” наблюдается переклю-
чение генов, т.е. изменение генной экспрессии, что дает возможность клетке
функционировать в условиях пониженного синтеза генных продуктов.
Описанные события являются первой, или ранней, стадией промоции,
заканчивающейся фенотипическими изменениями инициированных клеток.
В дальнейшем возможны два альтернативных пути: 1) если действие про-
мотора прерывается или прекращается (т.е. снимается воздействие проли-
феративного стимула), то клетка, синтезирующая меньшее количество ген-
ных продуктов, возвращается к первоначальному (т.е. инициированному)
состоянию; 2) если интенсивное воздействие промотора продолжается, то
происходит аккумуляция качественных изменений. Это значит, что посто-
янный дефицит генных продуктов обусловливает изменение генной экспрес-
сии и перестройку клеточного фенотипа.
Наконец, подобные клетки с фенотипическими изменениями достигают
определенного уровня синтеза генных продуктов, при котором реверсия
невозможна, даже при прекращении действия промотора. Такая клетка
становится трансформированной и отличается от нормальной как геноти-
пом, так и фенотипом. Достаточно только одного ее деления для перехода
на путь прогрессии. Таким образом, II (поздняя) фаза промоции представ-
ляет собой качественно-количественные изменения, охватывающие период
функционирования клетки в условиях переключения генной активности,
завершающийся образованием неопластически трансформированных клеток
(неопластическая трансформация — проявление признаков, характеризую-
щих возможность клеток к неограниченной пролиферации и дальнейшей
прогрессии, т.е. накоплению злокачественного потенциала).
Ряд авторов не ограничивают канцерогенез двумя рассмотренными ста-
диями (инициация и промоция), но включают в него также прогрессию и
метастазирование. Не вдаваясь в подробное описание этих процессов, заме-
тим лишь, что в основе прогрессии лежит генетическая нестабильность —
потеря “нормального” аллеля онкогена, генная амплификация, потеря суп-
рессорного гена, хромосомные перестройки, дополнительные мутации. По-
видимому, последние факторы также играют основную роль в метастазиро-
вании.
Последние достижения в области молекулярной биологии привлекли
внимание онкологов к концепции онкогена. Онкоген — ген, участвующий
в позитивном контроле клеточного размножения, активация которого при-
водит к трансформации. Более объемно определение онкогена как генети-
ческого элемента (структурно и функционально соответствующего понятию
гена, активация и экспрессия которого, вызываемые химическими, физи-
ческими, биологическими факторами или их сочетанием, индуцируют и
поддерживают нерегулируемый рост, трансформацию и развитие опухоли.
Общепринято рассматривать онкогены как факторы, в норме осуществляю-
щие контроль за клеточным ростом и дифференцировкой. Неизмененный
онкоген обычно называют протоонкогеном, а к собственно онкогенам от-
носят лишь мутированные аллели протоонкогенов, имеющие трансформи-
рующие свойства. Поскольку деление клетки контролируется системой по-
зитивных и негативных регуляторов, логично выделить доминантные и
рецессивные онкогены. Первые (табл. 12.4) представляют собой гены, ко-
дирующие белки, принимающие участие в стимуляции клеточной пролифе-
рации (позитивные регуляторы роста), вторые (их называют также супрес-
сорными генами, или антионкогенами) — кодируют белки, относящиеся к
негативным регуляторам роста.
425
Таблица 12.4. Доминантные онкогены
Протоонкогены
Факторы роста:
PDGF-v-sis, EGF
TGFa, TGFb, GDNF
Трансмембранные рецеп-
торы RET, CSF-1, EGF-
рецептор-v-erbB, NEU-pe-
цептор-У-егЬВ2
Цитоплазматические тиро-
зинкиназы: SRC-семейство-
-v-src (blk, fgr, fyn, ick, lyn,
src, yes)
ABL-v-abl
Типы нарушений
Амплификация, гипер- и эктопи-
ческая экспрессия
Амплификация, гиперэкспрес-
сия, конститутивная индукция
тирозинкиназной активности
Конститутивная индукция тиро-
зинкиназной активности
Серин/треонинкиназы
(RAF, MOS-v-mos)
G-белки: гетеротримерные
(большие)и мономерные
(малые) (RAS-семейство:
N-RAS, Ki-RAS, Ha-RAS)
Ядерные белки: транскрип-
ционные факторы (myc, fos,
jun, myb, rel)
Антиапоптозные белки
BCL2A, BCL2B
Аминослияние с gag, c-brc-фи-
ладельфийская tr (9; 22), сайт-
слецифические мутации, амино-
терминальное слияние
Конститутивная индукция цАМФ-
зависимого киназного каскада,
нарушение связи с плазменной
мембраной
Аминотерминальное слияние,
нарушение связи с плазменной
мембраной
Амплификация, гиперэкспрес-
сия, tr (8; 12, 14 или 22)
Гиперэкспрессия, транслокация
Опухоли
Рак молочной железы, рак
желудка
Плоскоклеточный рак, глио-
бластома, аденокарцино-
мы яичника, рак молочной
железы
Рак толстой кишки
О
-tj
Острый лимфолейкоз ‘'
Карциномы желудка
Нейробластомы, рак под-
желудочной железы, карци-
номы легких, кишечника
Карциномы желудка, лег-
ких, кишечника, яичника,
опухоли мозга, лимфома
Беркитта
Фолликулярная В-клеточ-
ная лимфома
Активация протоонкогенов в онкогены имеет различные механизмы,
часть которых хорошо изучена. Эффект доминантных онкогенов исследован
более полно. Он связан либо с нарушением характера их экспрессии (гипер-
экспрессия, эктопическая экспрессия, т.е. включение гена “не вовремя” или
в других, не свойственных данному гену типах клеток), либо с продукцией
аномального белка, возникшего в результате внутригенных мутаций, кото-
рые проявляются в гетерозиготном состоянии. Переход клетки от нормаль-
ного состояния к неконтролируемому росту определяется многоступенчатым
процессом (смена каскада работающих генов), который регулируется на
различных этапах клеточного цикла. На основе изменений в геномной
программе развития разработана классификация доминантных онкогенов
(табл. 12.5). К подобным протоонкогенам относятся некоторые факторы
роста, трансмембранные рецепторы, гены цитоплазматических тирозинки-
наз, серин/треонинкиназ, G-белков, ядерных и антиапоптозных белков.
Мутации в этих протоонкогенах приводят к злокачественной трансформа-
ции и возникновению опухолей, например амплификация гена N-MYC —
к нейроглиобластоме, транслокация C-MYC — к лимфоме Беркитта, гипер-
экспрессия и амплификация генов семейства EGF — к аденокарциноме
молочной железы и яичников, точковые мутации в кодонах 12, 13, 59 или
61 семейства RAS — к миеломной болезни, раку кишечника и поджелудоч-
ной железы, индукция цАМФ-зависимого киназного каскада в семействе
RAF —к карциноме желудка.
426
В отличие от доминантных онкогенов участие супрессорных генов (см.
табл. 12.5) в канцерогенезе установлено относительно недавно. Они имеют
следующие особенности: повышенную предрасположенность гетерозигот по
мутантным аллелям антионкогенов к возникновению рака, характерного для
молодого возраста, потерю гетерозиготности (LOH) в районе локализации
этих генов (гетерозиготные микроделеции), наличие мутаций в гомологич-
ном аллеле того рецессивного гена, которому свойственна потеря гетерози-
готности, что приводит к потере нормальной супрессорной функции. В на-
стоящее время известно несколько десятков рецессивных онкогенов [2].
Наиболее изучены антионкогены RB и р53. Точковые мутации и делеции
аллелей в RB-1 лежат в основе возникновения ретинобластомы. Такие же
изменения в гене р53 приводят к раку легкого, молочной железы, толстой
кишки. Ген ATM ответствен за развитие синдрома Луи-Бар (атаксия —
телеангиэктазия) тяжелого аутосомно-рецессивного заболевания. У таких
больных в 100 раз повышен риск возникновения опухолей, в основном
кроветворной системы. К супрессорным генам относятся также гены NF-1
(нейрофиброматоз), NF-2 (невриномы слухового нерва), TSC2 (астроцито-
мы, ангиомиолипомы) и др. Ген р53 привлекает особое внимание, может
быть вследствие большей изученности его. В табл. 12.5 представлены неко-
торые мутации в этом антионкогене, возникающие под воздействием кан-
церогенов [14]. Один из возможных путей активации протоонкогенов под
влиянием химических канцерогенов — гипометилирование ДНК, что выра-
жается в снижении уровня 5-метилцитозина.
Таблица 12.5. Гены-супрессоры опухолей (рецессивные онкогены, или антион-
когены)
Ген Локализация Белок Функция Фенотип, наследование
MSH2 2р16 Мутаза S2 “Мисматч’-репара- НЫРСС(АД), колорек- GT8P 2р1б Мутаза ция, постмейотичес- тальный рак, рак эндо- MLH1 Зр21 Мутаза L1 кая сегрегация метрия PMS1 2q3l—q33 » » PMS2 7р22 » » MSH3 » S3 RB 13q14 Серин/треонин- Контроль клеточно- Ретинобластома (АД); киназа го цикла G1-S, G2-M МО Р53 17р Транскрипцион- Контроль клеточно- Синдром Ли — Фрауме- ный фактор го цикла G1-S, G2-M, ни (АД), МО, рак молоч- апоптоз, ангиогенез ной железы ATM 11q22—q23 PI-З'-киназа Контроль клеточно- Синдром Луи-Бар (АР), го цикла G1-S, G2-M, рак молочной железы, сигнальная транс- ДО дукция BRCA1 17д1 Мотивы грани- Неизвестна Рак молочной железы нов (АД), ДО BRCA2 13q12 Рецепторная ти- Тоже Рак молочной железы розинкиназа (АД), ДО 10q23 Рецепторная ти- Фокальная адгезия, Болезнь Ковдена (АД); (MMACI) розинкиназа сигнальная транс- глиомы, рак молочной дукция железы, кожи, ДО NF2 22q1l.21— Мерлин (шван- Адгезия, про лифе- Нейрофиброматоз II q13.1 номин), мем- рация, контактное (АД), менингиомы, бранный белок ингибирование шванномы, ДО
427
Продолжение
Ген Локализация Белок Функция Фенотип, наследование
NF1 17q11.2 Нейрофибромин ГТФ/р21 (ras)-cnr- нальная трансдук- ция Нейрофиброматоз I (АД), МО
TSC2 16р13.3 Туберин Сигнальная транс- дукция Туберозный склероз (АД), астроцитомы, миолипомы
ОМСК 19ql3.2—q 13.3 Серин/треонин- киназа То же Атрофическая миотония (АД), паратиреодные аденомы, карциномы кишечника, ДО
RET (MEN2) 10q t Рецепторная ти- розинкиназа Сигнальная транс- дукция Множественная эндо- кринная неоплазия 2 (АД), нейроэктодер- мальные, ДО
SCG2 (MEN1) 11q13 Менин Множественная эндо- кринная неоплазия 1 (АД), эндокринные, ДО
Примечание. В пятой графе указано действие зародышевых мутаций и типы опухолей, при
которых обнаруживаются потеря гетерозиготности и соматические мутации в соответствующем
гене. МО — ген мутантен во множестве типов опухолей. ДО — ген мутантен и в опухолях некоторых
других типов. АД — аутодоминантный тип наследования. АР — ауторецессивный тип наследова-
ния.
Самое существенное в концепции “онкогена” — то, что мутации в оп-
ределенных локусах протоонкогенов приводят к экспрессии онкогенов, а
это в свою очередь обусловливает появление специфичных онкобелков и
запуск каскада молекулярных событий, конечным результатом которых яв-
ляется злокачественная трансформация (табл. 12.6).
Таблица 12.6. р53-Мутации в происхождении рака у человека [13]
Экспозиция Местоположение опухоли Тип мутации
Ароматические амины Мочевой пузырь Замена пар оснований G:C
Афлатоксин В1 Печень (гепатоцеллюлярный рак) AGG—AGT
Винилхлорид Печень (ангиосаркома печени) А:Т — Т:А
Табакокурение Легкие G —Т
Солнечное УФ-излучение Кожа СС —ТТ
12.4. Первичная профилактика и выявление
канцерогенов
Установлено, что прекращение контакта с канцерогенными факторами,
недопущение канцерогенов в среду обитания человека или удаление подоб-
ных веществ из окружающей среды может иметь следствием значительное
снижение (до 70 %) заболеваемости людей опухолями основных локализа-
ций [12]. В оценке канцерогенного риска факторов среды главное место
отводится эпидемиологическим исследованиям. Они включают в себя дес-
криптивные (т.е. описательные) и аналитические методы. Последние пред-
ставляют собой “когортные” исследования, исследования по типу “случай —
428
контроль” и корреляционный анализ. Эти методы позволяют заподозрить
этиологическую роль отдельных факторов среды в происхождении опухолей
у человека. Вместе с тем эпидемиологические исследования требуют боль-
ших материальных затрат на организацию длительных и дорогостоящих
наблюдений за представительными человеческими популяциями, а главное,
не позволяют предсказать канцерогенную опасность для человека неиссле-
дованных или новых химических веществ [8].
Исследования по биотестированию имеют большое значение для выяс-
нения механизмов активации и дезактивации канцерогенных загрязнителей,
точек приложения и клеточно-молекулярных мишеней воздействия канце-
рогенов, зависимости доза — эффект, определения минимально эффектив-
ных концентраций и т.д. Используемые тест-организмы должны отвечать
определенным требованиям, таким как высокая чувствительность, специ-
фичность отклика, возможность быстрой регистрации ответа, простота
содержания в лабораторных условиях, идентичность или близость физио-
логических и иных биохимических параметров тест-организмов к индика-
торным или мониторным объектам. Однако главной проблемой биотести-
рования канцерогенов является максимальная адекватность применяемых
систем реальным условиям экспозиции к факторам окружающей среды
или корреляции регистрируемых ответов системы с опухолеродными эф-
фектами [8].
Традиционным и наиболее часто применяемым методом выявления канце-
рогенов и предсказания канцерогенного риска для людей тех или иных агентов
является их изучение в хронических экспериментах на грызунах. Основным
достоинством этого метода считается возникновение опухоли, т.е. того же
процесса, что и у человека. Биотрансформация канцерогена происходит в
условиях организма млекопитающего, что максимально моделирует биохи-
мические события, происходящие в организме человека. Кроме того, подоб-
ные опыты позволяют выявлять агенты, реализующие свое канцерогенное
действие посредством нарушений в гормональной, иммунной и нервной
системах регуляции гомеостаза.
Существенный недостаток традиционного метода выявления канцероге-
нов заключается в том, что с его помощью не удается определить слабые
канцерогены, поскольку обычно подопытные группы состоят не более чем
из 50—100 животных. Если предположить, что мы имеем дело с агентом,
который вызывает опухоли у 1 % подвергшихся его действию животных, то
для достоверного обнаружения канцерогенности экспериментальные группы
должны быть увеличены по меньшей мере на порядок, что в условиях
рутинного тестирования представляется нереальным. Кроме того, абсолют-
ная предсказательная способность достижима только в хронических экспе-
риментах на животных того же вида и экстраполяция результатов в область
онкологии человека носит вероятностный характер. Этот метод чрезвычайно
дорог (тестирование одного химического агента обходится в 1,5—2 млн
американских долларов), длителен (2—3 года) и не обладает достаточной
пропускной” способностью. По мнению известных американских ученых
П.Ревель и Ч.Ревель (1995), “для выявления вещества, вызывающего рак,
может потребоваться очень большое число животных. Предположим, напри-
мер, что какой-то химикат вызывает заболевание раком лишь у одного из
10 000 человек, подвергавшихся его воздействию. Если бы такому воздей-
ствию подвергалось все население США, то рак развился бы у 20 000
человек, т.е. в значительном числе случаев. При проверке данных на жи-
вотных понадобилось бы 10 000 крыс, чтобы выявить один случай рака. По
429
меньшей мере 30 000 крыс необходимо, чтобы результаты считались статис-
тически достоверными”.
Более 6000 химических веществ были испытаны на канцерогенность в
хронических опытах на лабораторных животных [12]. Почти тысяча из них
оказались способными вызывать у этих животных злокачественные опухоли.
Более того, что дает сегодня обсуждаемый традиционный метод тестирова-
ния канцерогенности на грызунах, он дать не может. Вероятны два пути
развития исследований в данной области:
использование нетрадиционных животных объектов с чрезвычайно
высокой чувствительностью к канцерогенным воздействиям и доста-
точно коротким периодом развития опухолей;
применение для быстрого выявления канцерогенности так называе-
мых краткосрочных тестов (ускоренные методы, позволяющие с оп-
ределенной вероятностью предсказывать канцерогенную опасность тех
или иных факторов и основанные на оценке биологических эффектов,
коррелирующих или причинно-связанных с канцерогенезом).
Первый путь основан на той же логической посылке, что и традицион-
ный метод тестирования на грызунах, т.е. на регистрации опухолей. При-
мером могут служить некоторые виды аквариумных рыб, на которых испы-
тано большое количество известных химических канцерогенов для грызунов
и человека. Частота индуцированных опухолей у некоторых видов рыб
близка к таковой у млекопитающих, а латентный период развития опухолей
гораздо короче. Это делает указанный метод значительно более экономич-
ным. Вполне естественно, что данный способ также имеет свои преимуще-
ства, недостатки и ограничения. Методы выявления канцерогенов человека
на “рыбных” моделях широко апробированы и детально описаны. Как и
при других попытках подобного рода найти удобные и ускоренные тест-объ-
екты для оценки канцерогенности, при их использовании препятствием
служит косность традиционного мышления ряда онкологов-эксперимента-
торов, считающих основным условием для адекватности объекта его макси-
мальную приближенность к человеку по ряду физиологических параметров.
Но даже и преодолев эту косность, ждать ощутимых успехов в данном
направлении поиска удобных экспрессных тест-систем организменного
уровня не представляется реальным.
Гораздо более перспективен другой путь — использование краткосроч-
ных тестов (КСТ). Среди них наиболее распространены и теоретически
обоснованы пробы на мутагенность. Это связано с представлениями о том,
что в основе развития большинства опухолей, индуцированных канцероге-
нами (по крайней мере на стадии инициации), лежит генотоксический
эффект [6, 11].
При проведении тестов для определения мутагенов регистрируются глав-
ным образом генные, геномные и хромосомные мутации. Эти пробы харак-
теризуются простотой, краткосрочностью, высокой пропускной способнос-
тью и экономически выгодны. С помощью проб на мутагенность в различ-
ных лабораториях Западной Европы, США и Японии изучено около 20 000
химических веществ, в том числе практически все соединения, канцероген-
ность которых установлена для животных. Удалось предсказать канцеро-
геннную активность алкилнитрозомочевин, этиленоксида, фенацетина, пи-
щевого консерванта AF-2, синтезированных на основе ароматических ами-
нов красителей для волос, содержащихся в дизельных выхлопах нитропи-
ренов, некоторых белковых пиролизатов пищевых продуктов и ряда других
430
соединений. Вместе с тем отдельно взятые тесты дают важную, но ограни-
ченную информацию.
Информативность краткосрочного тестирования существенно повыша-
ется при создании батарей ускоренных методов. Это диктует необходимость
комплектования батарей из тестов, различающихся как по конечному эф-
фекту (ДНК-повреждения, точковые мутации, хромосомные аберрации, ми-
тотические рекомбинации, индукция микроядер, обмен сестринских хрома-
тид, анеуплоидия, доминантные летали, клеточная трансформация, ингиби-
рование межклеточных коммуникаций), так и по филогенетическому уров-
ню (прокариоты, низшие эукариоты, растения, насекомые, клеточные куль-
туры млекопитающих и человека, целостные организменные системы). Та-
кой подход позволяет выявлять агенты, различающиеся по механизмам
действия [20]. Перечень наиболее репрезентативных КСТ для скрининга
канцерогенов представлен в табл. 12.7.
Таблица 12.7. Перечень наиболее широко используемых КСТ для выявления
канцерогенов в окружающей среде
Объект Код1 Регистрируемые изменения
Бактерии Salmonella typhimurium SAF, SAO, SA2, SA9 Генные мутации
Escherichia coli ECK, ECW, ЕС2 » »
» » ЕСВ, ECD, ECL, ERD ДНК-повреждения
Bacillus subtilis BSD »
Дрожжи, грибы Saccharomyces cerevisiae SCF, SCR Генные мутации ’
Schizosaccharomyces pombe SZF, SZR » » .U
» » SZD ДНК-повреждения
Saccharomyces cerevisiae SZG, SCG Генная конверсия ц;7
Aspergillus nidulans ANN Анеуплоидия
Neurospora crassa NCN
Растения
Tradescantia sp. TSM Генные мутации
Hordeum sp. HSM » »
Vicia faba VFS Обмен сестринских хроматид
Tradescantia sp. TSI Микроядра
Vicia faba, Allium cera, Hordeum sp. VFC, ACC, HSC Хромосомные аберрации
Насекомые Drosophila melanogaster DMG Рекомбинации
» » DMM, DMX Генные мутации
» » DMC, DMH, DML Хромосомные аберрации
Drosophila melanogaster DMN Анеуплоидия
Клетки млекопитающих in vitro
Крысиные гепатоциты URP ДНК-повреждения
Клетки яичника хомяка GCO Генные мутации
Клетки легких хомяка G9H, G9O То же
Мышиная лимфома G5T » »
Культуры клеток грызунов (хомяки, крысы, мыши) SIC, SIM, SIR, SIS, SIT Обмен сестринских хроматид
MIA Микроядра
CIC, CIM, CIR, CIS, CIT Хромосомные аберрации
TBM,тем Клеточная трансформация
431
Продолжение
Объект Код1 Регистрируемые изменения
Клетки человека in vitro Фибробласты, лимфоциты, UHF, UHL, UHT ДНК-повреждения
трансформированные клетки SHF, SHL, SHT Обмен сестринских хроматид
CHF, CHL, СНТ Системы, опосредованные организмом Экскреты человека — бактерии BFH Хромосомные аберрации Генные мутации V-’ •>'
Организм животного — бактерии нмм
Организм животного Гепатоциты крысы UPR ДНК-повреждения
Мыши MST, SLP Генные мутации
Мыши, крысы, хомяки MVM, MVR, MVC Микроядра
Костный мозг грызунов СВА Хромосомные аберрации
Лейкоциты грызунов CLA » »
Мыши, крысы (доминантные летали) DLM, DLR » »
Организм человека Костный мозг in vivo UBH ДНК-повреждения
Лимфоциты in vivo СВН SLH Хромосомные аберрации Обмен сестринских хроматид
То же CLH Хромосомные аберрации
1 Расшифровка кодов КСТ дана [22] в IARC Monographs [22].
Перечисленные методы выявления канцерогенов в окружающей среде
реально связаны с первичной профилактикой рака. Комплекс указанных
методов позволяет ограничить или исключить канцерогены из сферы кон- _
такта с ними человека и тем самым снизить до минимального уровня частоту
рака. Расчеты специалистов показывают, что только в Европе, выявляя
средовые канцерогены и устраняя их из сферы обитания и контакта с ними
человека, можно было бы снизить заболеваемость (в перерасчете на 100 тыс.
населения в год) раком легких с 96,8 до 18,6, раком желудка — с 43,6 до 5,7,
раком молочной железы — с 85,6 до 16,2, раком мочевого пузыря — с 30,2
до 3,1, раком толстой кишки — с 32,3 до 5,2 [10, 17].
12.5. Регламентирование химических канцерогенов
и количественная оценка канцерогенной опасности
Канцерогенный эффект, формирующийся в результате воздействия хими-
ческого канцерогенного агента, представляет собой объективный показатель,
учитываемый в альтернативной форме. Статистическая оценка эффекта ос-
новывается на подсчете числа животных с опухолями. Вероятность возник-
новения опухоли (Р) определяется отношением числа случаев возникнове-
ния опухолей (/л) при воздействии дозы (d) к числу всех возможных случаев
(л), т.е.
P(d) = ^.
Указанный подход используется как при пожизненном наблюдении за
гибелью животных, так и при промежуточных расчетах для каждой забивае-
мой серии.
В ходе эксперимента, как правило, отмечается гибель животных от иных,
432
не связанных с канцерогенным эффектом причин, что иногда существенно
уменьшает число возможных случаев появления опухолей. Во избежание
занижения частоты опухолей в тех случаях, когда эксперимент анализиру-
ется в сроки дожития (посмертно), в качестве (л) принимается эффективное
число животных, т.е. количество животных, доживших до первой опухоли.
При расчете частоты опухолей для фиксированного срока забоя применяют
формулу
Pt = ~n~t'
где Pt — вероятность возникновения опухолей на срок забоя г; nt — число
забитых животных на срок I; mt — число животных с опухолью на срок t.
В тех случаях, когда у животных возникают не одна, а несколько опухолей,
используют коэффициент множественности R, представляющий собой сред-
нее число опухолей на одно животное.
о Kt
Kt = —,
f т(
где rt — общее количество опухолей у животных в исследуемой группе за
время наблюдения t; mt — количество животных с опухолями за это же
время.
Время появления опухолей обратно пропорционально разовой ежеднев-
ной дозе. Это соотношение описано в виде формулы
dtn = к,
где п>1; d— ежедневная доза; t— латентный период; к — постоянная вели-
чина; п — показатель степени.
Исходя из указанного соотношения, основными критериями канцеро-
генного воздействия принято считать дозу канцерогенного вещества и его
экспозицию. Вероятностный параметр оценки — эффективная бластомоген-
ная доза (БД50), представляющая собой суммарное количество вещества,
способное вызвать опухоль у 50 % подопытных животных в группе при
заданной экспозиции, за всю продолжительность жизни. Расчет БД50 и ее
доверительных границ может быть произведен известными методами мате-
матической статистики.
Время развития опухоли (латентный период) X представляет собой част-
ное от деления суммы всех латентных периодов (Dq) на общее число жи-
вотных с опухолями (л).
<1 +X2 + - + *n_E*i
п п
В тех случаях, когда распределение латентных периодов отличается от
нормального, используют среднюю геометрическую величину.
In Xi + In Х2 +... + in xn £ In Xg
I n Хд = —
9 n n
Эффективный латентный период (среднее время развития опухоли) L50
устанавливают либо путем расчета, либо путем экстраполяции бластомоген-
ной дозы (БД50) на зависимость доза — время [5].
Неизученность механизмов канцерогенеза и отсутствие единой гипотезы
возникновения рака не позволяют в настоящее время принять единую
систему регламентирования химических канцерогенов и оценки риска [3,
*0]. Основой регламентирования химических канцерогенов является постро-
433
Концентрация
1
ПДК-
Рн Рс
Эффект
Рис. 12.1. Установка ПДК
методом доверительных гра-
ниц.
1 — зависимость концентрация-
эффект; 2 — нижние доверитель-
ные границы; Рс — частота “спон-
танного” опухолеобразования;
Рн — частота, соответствующая
нижней доверительной границе
Рс.
ение зависимости доза — время — эффект, где под эффектом подразумева-
ется вероятность развития опухолей.
Основанием для регламентирования служит отнесение величины норма-
тива в область реальной недоказуемости (случайности), в том числе выне-
сение эффекта за пределы средней продолжительности жизни, либо обосно-
вание приемлемого риска. Мы не касаемся в данном случае проблемы
пороговости или беспороговости канцерогенного воздействия в связи с ее
дискуссионностью, тем более что эта дискуссия не оказывает реального
влияния на методику установления нормативов.
Наиболее часто используемый для регламентирования канцерогенов под-
ход, называемый методом “доверительных границ”, основан на выявлении
дозы (концентрации) вещества, дающей канцерогенный эффект, который
отличается от спонтанного и с определенным уровнем значимости может -
быть перенесенным на популяцию (рис. 12.1).
Метод, предложенный Б.А.Курляндским и Н.И.Невзоровой (1974), ос-
нован на логонормальной модели зависимости доза — эффект с использо-
ванием метода пробит-анализа и заключается в установлении величины
норматива на уровне, соответствующем точке пересечения верхней довери-
тельной границы линии доза — эффект с нижней доверительной границей
уровня спонтанного образования опухолей в контрольной группе. Довери-
тельные границы уровня контроля для графика доза — эффект определяются
по формуле:
М = Мер - mt,
где М — частота опухолей в контрольной группе (%); t— коэффициент Стью-
дента; т — ошибка средней.
Другой метод [Катульский Ю.Н., 1983] основан на использовании для
аппроксимации логистической модели:
1 +ас 0
где Р — частота опухолей; с — доза (концентрация) канцерогена; а и ₽ -
коэффициенты.
С помощью логарифмирования модель преобразуется в линейную функ-
цию, представляющую собой логит-преобразование для Р.
, р
Igy7^=a + blgc,
где а = Iga; b = р.
434
I Максимально недействующая концентрация (МНК)определяется авто-
рами как точка пересечения нижнего доверительного интервала с заранее
заданным уровнем значимости для обращенной регрессии х = + b{y и
нижним доверительным интервалом спонтанного уровня образования опу-
холей. Величину МНК рассчитывают из уравнения:
IgMHK = а-^ + Ь1 lg ₽0 - S*,
1 -Pq
где й] и Z>[ — параметры, рассчитываемые по формулам; Pq — значение ниж-
ней доверительной границы спонтанного выхода опухолей; 5* — величина
доверительного интервала для у, равного
, р°
lg-----
1 -Рб
т.е. логиту от Pq — значение нижней доверительной границы спонтанного
выхода опухолей; 5q определяют подстановкой в уравнение границы дове-
рительного интервала 5у вместо
Х= lg -—
1-рб
Особое место в химическом канцерогенезе занимает классифицирование
опасности химических канцерогенных веществ. До последнего времени его
основной задачей было доказательство связи химического соединения, про-
изводственного процесса, отрасли промышленности с возникновением рака
у человека. С этой целью была создана убедительная система доказательств,
позволяющая ответить на вопрос о причастности фактора к возникновению
рака: да, нет, возможно (см. предыдущий раздел). При классифицировании
способности вещества вызывать канцерогенный эффект ведущую роль иг-
рает экспертная (интеллектуальная) оценка. Принятая методология, как и
любая экспертная оценка, основанная на качественных критериях, не яв-
ляется исчерпывающей и допускает аргументацию предположения. Это осо-
бенно четко прослеживается при обосновании принятия решения об отне-
сении веществ к группам 2А, 2Б, где канцерогенность для человека эпиде-
миологически не подтверждена, но лишь предполагается, причем понятия
“вероятно” и “возможно” разделяет шаткая семантическая грань. Аналогич-
ные принципы положены в основу ряда других классификаций, отличаю-
щихся друг от друга лишь числом разрядов и некоторыми не столь прин-
ципиальными различиями в их аргументации, т.е. речь идет о качественном,
достаточно субъективном, классифицировании.
Исходя из изложенного выше, классификации подобного рода не следует
считать классификациями опасности, поскольку в группу веществ, канцеро-
генных для человека, входят такие различные по активности соединения,
как 2-нафтиламин и бензидин, винилхлорид и бензол, отличающиеся друг от
Друга по величине канцерогенного потенциала (соответственно 230:130:1,9:0,1).
в связи с этим в документах 5-го совещания группы консультантов OECD
по гармонизации классификаций, проходившего в Париже в сентябре 1997 г.,
записано, что указанная классификация МАИР не является классификацией
опасности, т.е. “не дает информацию об уровне риска для человека заболеть
Раком...”.
Этим обстоятельством в значительной мере объясняются неудачи клас-
сифицирования канцерогенной опасности на качественной основе, связан-
ные не только с существом вопроса, но и с известной терминологической
435
путаницей, возникающей при переводе с английского языка на русский
терминов hazard (of Chemicals) и risk. Наиболее заметно противоречия про-
явились в существующей классификации канцерогенной опасности пестици-
дов, основанной на уже описанном выше методологическом принципе. По-
пытка уменьшить неизбежные противоречия за счет увеличения числа классов
и подклассов опасности не привела к позитивному решению проблемы.
По нашему мнению, решение может быть найдено путем классифици-
рования веществ в двух направлениях:
создание классификации веществ по их способности вызывать рак у
человека;
создание классификации веществ по силе их действия, т.е. канцеро-
генной опасности.
Поскольку при классифицировании существенную роль должна играть
цель создания классификации, для прикладных задач, в том числе таких как
классификация пестицидов или промышленных веществ с профилактичес-
кими целями, градации должны быть более императивными, т.е. удельный
вес аргументов принятия положительных решений о канцерогенности ве-
щества может быть аггравирован, тем более что в большинстве случаев
решение принимается на основе результатов предварительных эксперимен-
тальных исследований.
Исходя из указанных предпосылок [6], предложили следующий вариант
классификации по способности химических веществ вызывать рак:
Класс 1. Вещества, канцерогенные для человека либо условно канце-
рогенные для человека.
Подкласс 1А. Вещества, канцерогенность которых установлена дока-
зательными эпидемиологическими наблюдениями за людьми.
Подкласс 1Б. Вещества, канцерогенность которых достоверно доказа- _
на в опытах на животных.
Класс 2. Вещества, подозреваемые как канцерогены для человека.
Класс 3. Вещества, не проявившие канцерогенной активности.
Если аргументация подкласса 1А очевидна и не требует дополнительных
доказательств, то подкласс 1Б аргументируется убедительной достовернос-
тью различий между опытом и контролем для не менее чем двух видов
животных, наличием в опыте опухолей, отсутствующих в контроле, общими
механизмами биотрансформации канцерогена у животных и человека, на-
личием мутагенной активности в опытах на теплокровных и др.
Класс 2 включает в себя вещества, которые в результате исследований
на людях и(или) на животных проявили определенную канцерогенную ак-
тивность, но такие доказательства не являются достаточно убедительными,
чтобы отнести эти вещества к классу 1.
В класс 3 входят вещества, не проявившие бластомогенной активности
в опытах на животных и при экспозиции на человеке.
Что касается классифицирования опасности химических канцерогенов,
то впервые попытка разделить канцерогенные вещества на четыре категории
по степени их опасности для человека была предпринята классиком отече-
ственной онкологии Л.М.Шабадом (1978). Согласно предлагаемой класси-
фикации, в первую категорию объединены вещества с доказанной канцеро-
генностью в опытах на животных и в эпидемиологических наблюдениях, во
вторую, несмотря на отсутствие данных о людях, — химические агенты с
“сильной” канцерогенностью, т.е. способные вызывать в высоком проценте
случаев опухоли у нескольких видов лабораторных животных и при разно-
образных способах введения, в третью — вещества, которые в эксперименте
436
вызывают опухоли лишь у 20—30 % животных при длительном латентном
периоде их развития, в четвертую — агенты с “сомнительной” активностью,
которые часто дают противоречивые результаты.
Поскольку известно, что обычно производители выдвигают требования
о предоставлении более полной информации с целью снижения, а не по-
вышения уровня озабоченности, необходимо четко обосновывать критерии,
которые следует обязательно учитывать при принятии решения, а также
дополнительные факторы, оценка которых может влиять на озабоченность.
В любом случае, в том числе при использовании существующих классифи-
каций, решение, принимаемое на основе экспертной оценки, и предлагае-
мое усиление ответственности оказывают положительное воздействие с точ-
ки зрения повышения надежности профилактических мероприятий.
Как следует из предшествующего анализа проблемы, классифицирование
химических канцерогенов на основе показателей опасности может быть
осуществлено по степени вероятности возникновения бластомогенного эф-
фекта, учитываемого на основе объективных количественных параметров
канцерогенеза. Таковыми могут быть эффективные бластомогенные дозы/
концентрации (БД50), средние латентные периоды (L50), количество первич-
но пораженных органов, количество наименований опухолей в опыте, не
встречающихся в контроле. Разработанная на этой основе классификация
приведена ниже [4].
Располагая вероятностными значениями эффективной бластомогенной
дозы (БД50) и среднего латентного периода, можно провести количествен-
ную оценку опасности вещества, обладающего бластомогенной активнос-
тью.
_______Г______100
L50 • ig бд50 • Т-| /v-t j
где С — показатель бластомогенной опасности; Т — число наименований
первично пораженных органов у животных подопытной группы; 7\ — число
наименований первично пораженных органов у животных контрольной
группы; Л50 — средний латентный период у животных подопытной группы;
БД50 — эффективная бластомогенная доза канцерогена в подопытной груп-
пе; п — число подопытных животных с опухолями; щ — число контрольных
животных с опухолями; N — число подопытных животных, доживших до
первой опухоли; Ny — число контрольных животных, доживших до первой
опухоли.
В табл. 12.8 представлено распределение классов опасности химических
канцерогенов по показателю С.
Таблица 12.8. Классы опасности химических канцерогенов
Канцерогены Класс опасности С
Чрезвычайно опасные 1 > 3
Высокоопасные 2 2,99—2
Умеренно опасные 3 1,99—1
Малоопасные ' 4 < 1
В последние годы в международной практике все большее место зани-
мает оценка канцерогенной опасности, проводимая на основе расчета ин-
дивидуальных и популяционных рисков, базирующаяся на использовании
437
тех же параметров оценки бластомогенной активности, что и ранее, т.е.
БД50, БД]о, БД5, БДо, tga и т.д.
Метод оценки риска основан на определении пределов его допустимости
с использованием логонормального распределения доз, вызывающих канце-
рогенный эффект в популяции, и описанием зависимости доза — эффект
кумулятивной функцией логонормального распределения [9], предлагает
допустимое количество канцерогена для населения в атмосферном воздухе,
соответствующее допустимому превышению возникновения опухолей за всю
продолжительность жизни, на 1Ю-4. Для производственных условий реко-
мендуется принять допустимое количество канцерогена с превышением
риска возникновения опухолей на 1-Ю-3.
В последние годы широкое распространение получила методика оценки
риска, рекомендованная Американским агентством по охране окружающей
среды (ЕРА 1992В).
В связи с необходимостью оценки показателей риска в приведенных
(стандартизованных) величинах предлагается использовать два количествен-
ных параметра — фактор канцерогенного потенциала (ФКП) и единичный
риск (ЕР). ФКП характеризуется функцией угла наклона в нижней (линей-
ной) части зависимости доза — ответ, ограниченной 95 % верхним дове-
рительным интервалом вероятности ответа на единицу дозы (концентра-
ции) потенциального канцерогена, экстраполируемой на определенный вре-
менной интервал, в данном случае на среднюю продолжительность жизни.
ФКП исчисляется величиной мг/(кгсут)-1 и может быть пересчитан в
зависимости от пути введения вещества. ЕР рассчитывают путем деления
ФКП на массу тела человека (70 кг) и умножения на объем суточной
легочной вентиляции (20 м3/сут) либо на объем суточного потребления воды
(2 л/сут).
Нами проведен анализ показателей ФКП при пероральном и ингаляци-
онном поступлении, а также ЕР, почерпнутых из зарубежных баз данных и
основанных на расчетах результатов экспериментов на животных, проведен-
ных по унифицированной методике. На основе анализа этих данных пред-
лагается классифицировать канцерогенную опасность веществ по величинам
ФКП и ЕР. Закономерность распределения значений ФКП при перораль-
ном (ФКПо) и ингаляционном (ФКПи) поступлении, а также ЕР анало-
гична и сохраняет степенную зависимость от слабых канцерогенов к
сильным [6].
На этом основании нами предложены числовые границы классов опас-
ности химических канцерогенных агентов в зависимости от ФКПо, посколь-
ку пероральный путь введения преобладает в экспериментах на животных.
1-й класс — чрезвычайно опасные, 10 и выше
2-й класс — высокоопасные, 1—9,999
3-й класс — умеренно опасные, 0,1—0,999
4-й класс — малоопасные, 0,01 и ниже.
Как видно из табл. 12.9—12.13, значения факторов потенциала, класси-
фицирование канцерогенной опасности на их основе практически полнос-
тью соответствуют сложившимся представлениям о реальной опасности
известных химических канцерогенов. Сочетанное использование обеих клас-
сификаций может служить основой для профилактических мероприятий при
производстве и применении веществ, а также их регламентирование в объ-
ектах окружающей среды.
438
Таблица 12.9. Вещества 1-го класса опасности (чрезвычайно опасные)
Название вещества ФКП и ФКПо ЕР
Азасерин 11,00000 11,00000 3,10000
Актиномицин D 8700,00000 8700,00000 2500,00000
Апдрин 17,10000 17,00000 4,90000
4-Аминодифенил 21,00000 21,00000 6,00000
Бензидин 230,00000 230,00000 67,00000
Бериллий сульфат (1:1) 3000,00000 3000,00000 860,00000
1,2,3,7,8,9-Г ексахлордибензо-р-диоксин 4600,00000 6200,00000 1300,00000
Дикарбазин 49,00000 49,00000 14,00000
7,12-Диметилбенз(а)антрацен 250,00000 250,00000 71,00000
Дибенз(а)пирен 39,00000 120,00000 11,00000
1,2-Диметилгидразин 37,00000 37,00000 11,00000
Диметилкарбамоилхлорид 13,00000 13,00000 3,70000
1,1-Дихлордиметиловый эфир 220,00000 220,00000 62,00000
Диэлдрин 16,00000 16,00000 4,60000
Диэтилстильбэстрол 0,00000 4700,00000 100,00000
Краситель основной красный 9 0,25000 240,00000 0,07100
Мелфалан 130,00000 130,00000 37,00000
З-Метилхол а нтрен 22,00000 22,00000 6,30000
Мирекс 18,00000 18,00000 5,10000
Митомицин С 8200,00000 8200,00000 2300,00000
Монокроталин 10,00000 10,00000 2,90000
2-Нафтиламин 1,80000 130,00000 0,00000
N-Нитрозодиметиламин 49,00000 51,00000 14,00000
N-Нитрозодиэтиламин 150,00000 150,00000 43,00000
Ы-Нитрозо-М-метил мочевина 120,00000 120,00000 34,00000
Ы-Нитрозо-М-метилуретан 110,00000 110,00000 31,00000
М-Нитрозо-Ы-этил мочевина 27,00000 140,00000 7,70000
N-Нитрозометиламин 22,00000 22,00000 6,30000
6-Нитрохризен 39,00000 120,00000 11,00000
Октахлордибензо-р-диоксин 0,00000 160,00000 0,00000
Прокарбазин 14,00000 14,00000 4,00000
Прокарбазин гидрохлорид 12,00000 12,00000 3,40000
Р-Пропиолактон 14,00000 14,00000 4,00000
Стрептозоцин 110,00000 110,00000 31,00000
2,3,7,8-Тетрахлордибензо-р-диоксин 150000,00000 150000,00000 38000,00000
2,3,7,8-Тетрахлордибензофуран 0,00000 60000,00000 0,00000
4,4'-Тиодианилин 15,00000 15,00000 4,30000
Трифосфамид 12,00000 12,00000 3,40000
Трифур 16,00000 16,00000 4,60000
Триптофан Р1 26,00000 26,00000 7,40000
Фенестерин 150,00000 150,00000 43,00000
Хлорозотоцин 240,00000 240,00000 69,00000
Хром 150,00000 510,00000 0,42000
Хром (VI) 510,00000 42,00000 150,00000
Эстрадиол 39,00000 39,00000 11,00000
Этиленимин . ... 65,00000 65,00000 19,00000
1
439
Таблица 12.10. Вещества 2-го класса опасности (высокоопасные)
Название вещества ФКПи ФКПо ЕР
Акриламид 4,60000 4,60000 1,30000
о-Аминоазотолуол 3,80000 3,80000 1,10000
2-Аминодипиридо(1,2-а:3',2'-б)имидазол 1,40000 1,40000 0,40000
Ацетиламинофлуорен 3,80000 3,80000 1,30000
Бенз(а)антрацен 0,39000 1,20000 0,11000
Бенз(а)пирен 7,30000 7,30000 0,00000
Бериллий оксид 8,40000 4,30000 2,40000
Бериллий хлорид 8,40000 4,30000 0,00000
Бромдифенилы 8,90000 8,90000 0,00000
2-Бутеналь 1,90000 1,90000 0,00000
Винилхлорид 0,30000 1,90000 0,08400
Гексахлоран . 1,80000 1,80000 0,51000
а-Гексахлоран 6,30000 6,30000 1,80000
Гексахлорбензол 1,60000 1,60000 0,46000
Гептахлор 4,55000 4,50000 ,1,30000
Г идразин 17,10000 3,00000 4,90000
Дибенз(а,Ь))антрацен 6,10000 7,30000 1,20000
4-Диметиламиноазобензол 4,60000 4,60000 1,30000
3,3’-Диметилбензидин 0,00000 9,20000 0,00000
1,1 -Диметил гидразин 3,50000 2,60000 1,00000
2,2-Дихлорэтиловый эфир 1,16000 1,10000 0,33000
Кадмий 6,30000 0,00000 1,80000
Краситель прямой коричневый 0,00000 9,30000 1,90000
Краситель прямой черный 0,00000 8,60000 2,10000
Линдан 1,30000 1,30000 0,31000
Метилгидразин 1,10000 1,10000 0,00000
Мышьяк 1,50000 1,50000 4,30000
Никель субсульфид 1,70000 1,70000 0,48000
N-Нитрозодибутиламин 5,60000 5,40000 1,60000
N-Нитрозодипропиламин 7,00000 7,00000 2,00000
2,2'-(Нитрозоимино)диэтанол 2,80000 2,80000 0,80000
N-Нитрозоморфолин 6,70000 6,70000 1,90000
N’-Нитрозонорникотин 1,40000 1,40000 1,40000
N’-Нитрозопиперидин 9,40000 9,40000 2,70000
1-Нитропирен 0,39000 1,20000 0,11000
Полихлорированные бифенилы 7,70000 7,70000 2,20000
1,3-Пропансультон 2,40000 2,40000 0,69000
Пропилтиоурацил 1,00000 1,00000 0,29000
Тиоацетамид 6,10000 6,10000 1,70000
1,2,3-Трихлорпропан 7,00000 7,00000 0,00000
Уретан 1,00000 1,00000 0,29000
Фурацилин 9,40000 1,50000 0,37000
Хлордан 1,30000 1,30000 0,37000
З-Хлор-1,2-дибромпропан 0,00242 1,40000 2,40000
Хлордифенилы (54 % хлора) 0,00000 7,70000 0,00000
Хлордифены (42 % хлора) 0,00000 7,70000 0,00000
Хлортерфенилы 0,00000 4,50000 0,00000
Этиленоксид 0,35000 1,02000 0,10000
440
таблица 12.11. Вещества 3-го класса опасности (умеренно опасные)
—
Название вещества ФКПи ФКПо ЕР
Азобензол 0,11000 0,11000 0,03100
Акрилонитрил 0,23800 0,54000 0,06800
1-Амино-2-метилантрахинон 0,15000 0,15000 0,04300
Аурами н 0,88000 0,88000 0,25000
Бензил хлористый 0,17000 0,17000 0,04900
Бензол 0,10000 0,10000 0,02900
ДДТ 0,00000 0,34000 0,09700
4 4-Диаминодифенилметан 0,25000 0,25000 0,46000
2,4-Диметиланилин 0,00000 0,75000 0,00000
Динитротолуол 0,00000 0,68000 0,00000
2,4-Динитротолуол 0,31000 0,68000 0,08900
1,2-Дифенилгидразин 0,77000 0,87000 0,25000
ЗЗ'-Дихлорбензидин 0,00000 0,45000 0,34000
Дихлорофос 0,29000 0,29000 0,08300
1,3-Дихлорпропен 0,13000 0,18000 0,03700
N.N-Диэтилдитиокарбамат натрия 0,27000 0,27000 0,00000
Кельман 0,00000 0,44000 0,00000
2-Метиланилин 0,18000 0,18000 0,05100
4-Метиланилин 0,19000 0,19000 0,00000
N-Метиланилин 0,24800 0,24800 0,00000
4,4’-Метиленбис(2-метиланилин) 0,92000 0,92000 0,26000
4,4’-Метилбис(2-хлоранилин) 0,13000 0,13000 0,03700
Метилурацил 0,40000 0,40000 0,11000
2-Метоксианилин 0,14000 0,14000 0,04000
2-Метоксибензамин гидрохлорид 0,11000 0,11000 0,03100
Никель 0,84000 0,00000 0,26000
5-Нитроаценафтен 0,13000 0,13000 0,03700
Пентахлорфенол 0,12000 0,12000 0,00510
Пентахлорциклопентадиен 0,00000 0,27000 0,00000
Пропиленоксид 0,01300 0,24000 0,00370
Свинец ацетат 0,28000 0,28000 0,08000
Симазин 0,12000 0,12000 0,00000
4,4'-Тетрахлордифенилэтан 0,00000 0,24000 0,06900
Тетрахлорметан 0,05250 0,13000 0,01500
1,1,2,2-Тетрахлорэтан 0,27000 0,27000 0,05800
Феназопиридин 0,17000 0,17000 0,04900
Фенобарбитал 0,46000 0,46000 0,13000
Фуриамид 0,21000 0,21000 0,06900
Хлорметоксиметан 2,40000 2,40000 0,69000
Циклонит 0,11000 0,11000 0,00000
Циклофосфан 0,61000 0,61000 0,17000
Этилентиомочевина 0,11000 0,11000 0,01300
Таблица 12.12. Вещества 4-го класса опасности (малоопасные)
Название вещества ФКПи ФКПо ЕР
Алахлор 0,08000 0,08000 0,00000
/лллил хлористый 0,02100 0,02100 0,00600
Анилин 0,00570 0,00570 0,00160
Атразин 0,22000 0,22000 0,00000
ацетальдегид 0,00770 0,00770 0,00220
Ацетамид 0,07000 0,07000 0,02000
441
Продолжение
Название вещества ФКПи ФКПо ЕР
Бензо[к]флуорантен 0,07300 0,07300 0,00000
Бромоформ 0,00390 0,00790 0,00110
Гексахлорбутадиен 0,07700 0,07800 0,00000
Гексахлорэтан 0,01400 0,01400 0,00400
2,4-Диаминоанизол 0,02300 0,02300 0,00660
2-Аминоантрахинон 0,03300 0,03300 0,00940
Дибромхлорметан 0,09400 0,09400 0,02700
3,3'-Диметоксибензидин 0,00000 0,01400 0,00000
1,4-Динитробензол 0,00000 0,02500 0,00000
1,4-Диоксан 0,00000 0,01100 0,00770
1,4-Дихлорбензол 0,00000 0,02400 0,01100
2,2’-Дихлоризопропиловый эфир 0,03500 0,07000 0,00000
Дихлорметан 0,00160 0,00750 0,00047
1,2-Дихлорпропан 0,00000 0,06800 ‘0,01800
1,1-Дихлорэтан 0,00570 0,00570 0,00160
1,2-Дихлорэтан 0,09100 0,09100 0,02600
1,1-Дихлорэтилен 0,18000 0,60000 0,05000
Ди(2-этилгекси л )фта лат 0,00000 0,01400 0,00240
Каптан 0,00000 0,00350 0,00066
Карбазол 0,00000 0,02000 0,00000
Краситель пигмент красный 0,00530 0,00530 0,00150
Краситель пищевой фиолетовый 2 0,02000 0,02000 0,00570
2-Метил-5-нитроанилин 0,00000 0,03300 0,00000
2-Метокси-5-нитроанилин 0,04600 0,04600 0,01400
2-Нитропропан 9,40000 0,00000 2,70000
Нитрофен 0,08200 0,08200 0,02300
м-Нитрохлорбензол 0,00000 0,01800 0,00000
о-Нитрохлорбензол 0,00000 0,02500 0,00000
N-Нитроэодифениламин 0,00900 0,00490 0,00260
р-Нитрохлорбензол 0,00000 0,01800 0,00000
Свинец ацетат основной 0,03800 0,03800 0,01100
1,4,5,8-Тетрааминоантрахинон 0,00000 0,00000 0,00000
4,4'-Тетраметилдиаминодифенилметан 0,04600 0,04600 0,01300
1,1,1,2-Т етрахл орэтан 0,02600 0,02600 0,07400
Тетрахлорэтилен 0,00203 0,05200 0,00052
Тиомочевина 0,07200 0,07200 0,02100
1,3-Толуилендиизоцианат 0,03900 0,03900 0,01100
Т риметилфосфат 0,03700 0,03700 0,00000
2,4,6-Трихлоранилин 0,03400 0,03400 0,00000
2,4,6-Трихлорфенол 0,01000 0,01100 0,00310
1,1,2-Трихлорэтан 0,05700 0,05700 0,01600
Трихлорэтилен 0,00600 0,01100 0,00200
Фенилен-1,2-диамин 0,00000 0,04700 0,00000
о-Фенилфенол 0,00190 0,00194 0,00000
Формальдегид 0,04550 0,00000 0,01300
Хлорметан 0,00630 0,01300 0,00180
Хлороталонил 0,00000 0,01100 0,00089
442
Продолжение
Название вещества ФКПи ФКПо ЕР
4-Хлор-о-фенилендиамин 0,01600 0,01600 0,00460
Хлороформ 0,08050 0,00610 0,02300 ' t
Хлорэндиковая кислота 0,091 0,091 0,026
Хризен 0,00610 0,00730 0,00000 ,
Эпихлоргидрин 0,00420 0,00990 0,00120 ’ ‘
Этилакрилат 0,04800 0,04800 0,00000
I Обязательным условием классифицирования является проведение экспери-
| ментальных исследований на животных в соответствии с существующими нор-
I мативно-методическими документами.
I Накопленный опыт нормирования химических канцерогенов позволил
разработать ориентировочные значения ПДК химических канцерогенов в
I различных средах в зависимости от классов опасности.
Таблица 12.13. Ориентировочные значения ПДК в зависимости от класса блас-
томогенной опасности
Класс опасности ПДКр.з., мг/м3 ПДКа.в., мг/100 м3 ПДК в.в., мг/л
Чрезвычайно опасные 0,0001 0,0001 0,000005 Высокоопасные 0,001 0,001 0,00005 Умеренно опасные 0,01 0,01 0,0005 С ’ Малоопасные 0,1 0,1 0,005
ЛИТЕРАТУРА
1. Двойрин В.В., Аксель Е.М., Трапезников Н.Н. Заболеваемость злокачественными
новообразованиями и смертность от них населения стран СНГ в 1995 г. — М.:
РАМН, Онкол. научн. Центр им. Н.Н.Блохина, 1996. — 286 с.
2. Катульский Ю.Н. О некоторых закономерностях зависимости эффекта от дозы
химических канцерогенов//Вопр. онкол. — 1983. — № 6. — С. 93— 99.
3. Кацнельсон Б.А. Еще несколько слов о “романтизме” и “необходимости” в сфере
санитарно-токсической регламентации//Токсикол. вестник. — 1997. — № 3. —
С. 29-31.
4. Курляндский Б.А., Медведовский А. Г. К методике количественной оценки опас-
ности канцерогенных воздействий. — В кн/. Канцерогенные углеводороды в
промышленности и окружающей человека среде. — Горький, 1976. — С. 18.
5- Курляндский Б.А., Невзорова Н.И. Регламентирование содержания химических
бластомогенных агентов в окружающей среде. — В кн/ Итоги науки и техни-
ки//Токсикология. - М/. ВИНИТИ, 1978. -Т. 9. - С. 88.
6- Курляндский Б.А., Новиков С.М. О классифицировании опасности химических
канцерогенов//Токсикол. вестник. —1998. — № 1. —С. 2.
1- Мутагены и канцерогены в окружающей среде. Новые подходы к оценке риска
Для здоровья/Под ред. С.Г.Инге-Вечтомов, В.В.Худолей. — СПб/ СПбНЦ РАН,
1998. - 172 с.
8- Общая онкология: Руководство для врачей/Под ред. Н.П.Напалкова. — Л.: Ме-
дицина, 1989. — 648 с.
443
9. Парфенов Ю.Д. Некоторые математические подходы к использованию экспери-
ментальных данных для санитарно-гигиенического нормирования канцероге-
нов. — В кн.: Санитарно-гигиенические аспекты радиационного и химического
канцерогенеза. — М., 1979. — С. 43—54.
10. Турусов В. С., Парфенов Ю.Д. Методы выявления и регламентирования химичес-
ких канцерогенов. — М.: Медицина, 1986. — С. 147.
11. Худолей В. В. Канцерогены: характеристики, закономерности, механизмы дейст-
вия. - СПб.: НИИХ СПбГУ, 1999. - 419 с.
12. Худолей В.В. Молекулярные механизмы инициации и промоции в многостадий-
ном химическом канцерогенезе//Вопр. онкол. — 1985. — 31. — № 12. — С. 94—
99.
13. Худолей В.В. Мутагенез и канцерогенез//Природа. — 1997. — № 2. — С. 15—19.
14. Худолей В.В. Химические вещества, которые вызывают рак; Справочник. — Спб.:
Блиц, 1993. — 84 с.
15. Худолей В.В., Мизгирев И.В. Экологически опасные факторы. — СПб.: Банк
Петровский, 1996. — 184 с.
16. Худолей В.В., Филов В.А. Химические канцерогены в окружающей среде и их
экологическое значение: 1. Принципы классификации//Экол. химия. — 1993. —
№ 2. - С. 145-149.
17. Шабад Л.М. Бластомогенная опасность среды обитания человека. — В кн.:
Итоги науки и техники. Токсикология. — М.: ВИНИТИ, 1978. — Т. 9. — С. 47.
18. Bartsch Н., Hietanen Е. The role of individual susceptibility in cancer burden related
to environmental exposure//Environm. Health Perspecti. — 1996. — Vol. 104, N 3. —
P. 569-577.
19. Cancer. Causes, Occurence and Control/Ed. in Chief. L.Tomatis//IARC Sci. Publ. N -
100. - Lyon: IARC, 1990. - 353 p.
20. Directories of Agents being Tested for Carcinogenicity/Ed by A.Meneghel, J.D.Wil-
boum. Sci publ. — N 17. — Lyon: LARC, 1996. — 360 p.
21. Green S. The search for molecular mechanisms of nongenotoxic carcinogens//Mutation
Research. - 1991. - Vol. 248, N 2. - P. 371-374.
22. IARC Monographs on the Evaluation of Carcinogenic Risks to Humans (Genetic and
Related Effects). Supplement 6. — Lyon: LARC, 1987.
23. IARC Monographs on the Evaluation of Carcinogenic Risks to Humans. Overall
Evaluations of Carcinogenicity: An Updating of LARC Monographs. — Vol. 1—42.
Suppl. 7. — Lyon: LARC, 1987. — 440 p.
24. Cancer Research for Cancer Control. — Lyon: LARC. — 1997. — 33 p.
25. Khudoley V. V, Schramm T, Pliss G.B. Chemical carcinogens and chemical carcino-
genesis: A Glossary. Archiv fur Geschwulstforschung. — 1984. — Bd 55. — N 4. —
P. 295-298.
26. Mechanisms of Carcinogenesis in Risk Identification/Ed. H.Vainio, P.Magee,
D.B.McGregor, A.J.McMichael. IARC Sci. Publ. N 116.— Lyon: IARC, 1992. —
615 p.
27. The World Health Report 1996. Fighting disease. Fostering development. — Geneva:
WHO, 1996. - 137 p.
28. Williams G.M., latropoulos M., Weisburgerv J. Chemical carcinogen mechanisms of
action and implications for testing methodology//Exp. Toxic. Pathology. — 1996. —
48. - P. 101-111.
444
Глава 13
ДЕЙСТВИЕ КСЕНОБИОТИКОВ
НА ПРОЦЕССЫ РЕПРОДУКЦИИ
Г
13.1. Общая часть
Первое широкое признание влияния химических веществ на репродук-
тивную систему получило в 60-е годы нашего столетия, когда применение
талидомида доказало общественности возможность развития врожденных
уродств, обусловленных химическим фактором. В начале 70-х годов у мо-
лодых женщин, матери которых принимали во время беременности диэтил-
стильбэстрол, обнаружены опухоли матки. Несколько позже было выявлено,
что у мужчин, профессионально подверженных воздействию дибромохлоро-
пропана, нарушалась функция яичек разной степени выраженности; потен-
циально это могло приводить к бесплодию. У женщин, чьи мужья на работе
контактировали с хлоропреном, увеличивалось число выкидышей. С тех пор,
особенно в последнее десятилетие, нарушения репродуктивного здоровья
женщины, здоровья плода и новорожденного под влиянием факторов окру-
жающей среды считаются важной проблемой общественного здоровья.
Реальную угрозу репродуктивной функции женщин и здоровью детей создает
широкое применение в промышленности и сельском хозяйстве различных хими-
ческих веществ. Женщины и дети как наиболее чувствительная часть насе-
ления раньше и острее реагируют на факторы внешней среды. Результаты
взаимодействия женщины с окружающей средой выражаются двумя катего-
риями: здоровьем самой женщины и здоровьем рожденного ею ребенка, опреде-
ляющими в будущем социально-трудовой потенциал населения [30].
Воздействие химических веществ на репродуктивную систему приводит
к возрастанию числа бесплодных браков, увеличению количества разнооб-
разной патологии беременности и родов, числа самопроизвольных выкиды-
шей, нарушений роста и развития детей, случаев злокачественных заболе-
ваний и преждевременному прекращению репродуктивной функции.
При рассмотрении вопросов воздействия химических веществ на про-
цессы репродукции необходимо остановиться на значении следующих тер-
минов.
• Репродуктивное здоровье — состояние полного физического, умствен-
ного и социального благополучия во всех вопросах, касающихся реп-
родуктивной системы, ее функций и процессов, включая воспроиз-
водство потомства и гармонию в психосексуальных отношениях в
семье (определение ООН).
• Репродуктивные токсиканты — химические, физические или биоло-
гические агенты, оказывающие вредное влияние на процессы репро-
дукции как в экспериментальном, так и в клиническом аспекте.
• Репродуктивная токсичность — вредное влияние на плодовитость, бе-
ременность или потомство, вызванное воздействием химического со-
единения на любого из родителей. Проявлениями токсичности могут
быть нарушения продукции и транспорта гамет, изменения репродук-
445
тивного цикла, сексуального поведения, гормональной активности
других функций, зависящих от целости репродуктивной системы’
бесплодие.
• Токсичность — эффекты, вредные для развивающегося организма
могут стать следствием воздействия от момента зачатия или постна-
тального периода до пубертатного возраста. Эффекты воздействия
неблагоприятных факторов могут быть обнаружены в любой момент
жизни. Наиболее выраженные проявления токсичности — смерть раз-
вивающегося организма, структурные аномалии, нарушения роста и
функциональные расстройства.
• Эмбрио-, фетотоксичность — любой токсический эффект у эмбриона
и плода, включая структурные и функциональные нарушения или
постнатальные проявления таких эффектов. Эмбриотоксические эф-
фекты могут включать врожденные уродства, нарушения роста, внут-
риматочную гибель и повреждение постнатальных функций.
• Тератогенность — способность химического вещества вызывать струк-
турные и функциональные дефекты в период развития организма
(у зародыша или плода).
• Гонадотропное действие яда — свойство яда влиять на половые железы
и систему их регуляции.
• Эмбриотропное действие яда — свойство яда влиять на эмбрион и
регуляцию его развития.
• Фертильность — способность к деторождению.
• Бесплодие — невозможность зачатия в течение года регулярной или
2 лет нерегулярной половой жизни при отсутствии контрацепции.
• Маловесный плод — масса плода при рождении менее 2500 г.
Строение репродуктивной системы. Репродуктивная система как в муж-
ском, так и в женском организме состоит из половых желез (гонад) —
семенников и яичников, а также органов полового тракта, к которым в
мужском организме относятся семявыводящие пути, семенные пузырьки,
простата (предстательная железа) и половой член, а в женском — маточные
трубы, матка и влагалище.
Основное значение репродуктивной системы состоит в обеспечении раз-
множения организма путем образования в половых железах яйцеклеток и
сперматозоидов, слиянием которых и начинается развитие зародыша. Одно-
временно половые железы вырабатывают половые гормоны — эстроген,
прогестерон, андроген и др., под влиянием которых в организме создаются
условия, необходимые для размножения.
Семенники (яички) — мужские гонады, в которых происходит образование
сперматозоидов и мужских половых гормонов. Сперматозоиды образуются из
стволовых клеток в яичках в течение всего активного периода жизни муж-
чины.
Длительность сперматогенеза, по данным ВОЗ, у человека составляет
72 сут, у крыс — 48, у мышей — 35 сут.
Сперматогенез регулируется фолликулостимулирующим (ФСГ) и люте-
инизирующим (Л Г) гормонами, продуцируемыми передней долей гипофиза,
которые в свою очередь контролируются гипоталамическими аденогипофи-
зотропными гормонами (гонадотропин-рилизинг-факторами), вырабатыва-
емыми нейросекреторными клетками медиобазального гипоталамуса. Регу-
ляция физиологического равновесия осуществляется по принципу отрица-
тельной обратной связи, т.е. половые гормоны в зависимости от их
446
Промежуточный
сперматогоний
Сперматогоний
типа В
Сперматоцит
I порядка
его завершение
Второе деление
мейоза (быстрое)
А2
Сперматиды
Сперматоциты
II порядка
его завершение
Незрелые
гаплоидные гаметы
СПЕРМИОГЕНЕЗ
Спермато-
зоиды
Зрелые гаплоидные
гаметы
Сперма-
тогоний
типа А,
Хромосомный
набор
2п
2п
1п
1п
1п
Рис. 13.1. Сперматогенез.
концентрации и соотношения с другими гормонами угнетают или стимули-
руют продукцию соответствующего тропного гормона гипофиза (рис. 13.1).
Процесс созревания яйцеклетки происходит в яичниках. В отличие от
мужских половых клеток процессы развития фолликулов начинаются еще в
яичнике эмбриона, но до наступления половой зрелости протекают очень
медленно. К моменту рождения число примордиальных фолликулов дости-
гает 300 000—400 000, в постэмбриональном периоде их количество быстро
Уменьшается и к началу половой зрелости остается всего 500—1000 таких
фолликулов. Оогенез — процесс образования яйцеклеток характеризуется
Ростом примордиального фолликула до зрелого пузырчатого фолликула.
Циклические изменения происходят и в эпителии влагалища и матки, что
способствует продвижению сперматозоидов и оплодотворению яйцеклетки.
* ипертрофия эпителия матки наступает под влиянием гормонов растущего
Фолликула, который после овуляции преобразуется в желтое тело с измене-
нием характера внутренней секреции (в случае оплодотворения) либо атро-
фируется, уступая место гормональной активности нового фолликула с
соответствующим повторением циклических изменений эпителия (если оп-
лодотворение не произошло).
447
ВОЗРАСТ
Зародышевый
период
Перед рождени-
ем или сразу
после него
После
рождения
ЭВОЛЮЦИЯ
ФОЛЛИКУЛОВ
Фолликулов нет @
Примордиальные
фолликулы
Ооцит I порядка
(мейоз)
МИТОЗЫ, ХРОМОСОМНЫЙ
МЕЙОЗ НАБОР
Оогонии (митоз)
После дости-
жения половой
зрелости
Первичные
фолликулы
Вторичные
фолликулы
Третичные
фолликулы
Ооцит I порядка
Остановка разви-
тия на стадии
первого деления
Ооцит I порядка
Завершение
первого и начало
второго деления
Овуляция
2п
2п
2п
2п
1п
Овулировав-
шее яйцо
Оплодотво-
ренное яйцо
Ооцит I порядка
Завершение
второго деления
мейоза
1п
1п +
сперматозоид
Рис. 13.2. Оогенез.
Совокупность этих процессов составляет овариально-менструальный цикл
у женщин, астральный цикл у млекопитающих. Их последовательность
регулируется гормонами: ФСГ вызывает рост фолликулов, ЛГ совместно с
ФСГ способствует созреванию фолликула, овуляции и образованию желтого
тела, ЛТГ (лютеотропный гормон) поддерживает желтое тело в активном
состоянии. По принципу обратной связи на гипофиз действуют гормоны
яичников: эстроген (синтезируется клетками растущих фолликулов) и про-
гестерон (вырабатывается клетками желтого тела). Секреция гипофизом
ФСГ и ЛГ регулируется активностью нервных клеток медиобазального ги-
поталамуса, которая зависит от концентрации в организме гормонов яич-
ника (рис. 13.2).
Оплодотворение — это взаимодействие сперматозоида с яйцеклеткой.
Важнейшие этапы этого процесса: проникновение сперматозоида в яйце-
клетку, активация в яйцеклетке разнообразных синтетических процессов,
слияние ядер клеток с восстановлением диплоидного набора хромосом (об-
разование зиготы). Начинается процесс дробления зиготы, который совер-
шается во время движения зародыша по маточной трубе к матке, где затем
происходит имплантация. Дальнейшее развитие включает образование заро-
дышевых листков (гаструляция), формирование органов и систем (органо^
генез). В условиях нормального развития преобразования отдельных частей
и организма в целом строго согласованы по срокам, месту и объему изме-
нений. Нарушения естественного хода эмбриогенеза приводят к формиро-
ванию уродств или пороков развития.
448
Пороки развития — это стойкие отклонения в строении органов, приводя-
щие к функциональным расстройствам.
Щ Врожденные пороки встречаются у животных разных видов и человека.
В процессе эмбриогенеза отмечаются наиболее чувствительные периоды,
когда воздействие различных факторов среды приводит к нарушению раз-
вития или гибели эмбриона. Это так называемые критические периоды,
которые в значительной степени определяют восприимчивость эмбриона к
вредному воздействию.
Связь плода с организмом матери осуществляется посредством плацен-
ты через которую происходит его снабжение питательными веществами и
кислородом. В норме кровь матери и плода не смешивается, между ними
существует плацентарный барьер, через который и осуществляется питание
плода. Некоторые химические вещества могут проникать через плацентар-
ный барьер, оказывая токсическое действие на плод.
Таким образом, в онтогенезе человека можно выделить несколько перио-
дов, наиболее важных для его развития и оценки возможных повреждений,
наносимых неблагоприятными факторами различного характера. К ним отно-
сятся развитие половых клеток — оогенез и сперматогенез, оплодотворение,
имплантация (7—8-е сутки эмбриогенеза), развитие осевых зачатков органов и
формирование плаценты (3—8-я неделя развития); стадия усиленного роста
головного мозга, формирование основных функциональных систем организма
и дифференцировка полового аппарата (15—24-я недели развития); рождение,
период новорожденное™ (до 1 года); половое созревание (11—16 лет).
Основные данные о структуре и функции репродуктивной системы,
приведенные выше, позволяют определить основные методы ее изучения,
используемые в токсикологических исследованиях.
13.2. Методы изучения влияния ксенобиотиков
на репродуктивную функцию
Для решения принципиальных вопросов охраны потомства необходим
комплексный методический подход, включающий социально-гигиеничес-
кие, клинико-статистические и экспериментальные исследования.
Цель гигиенических исследований — оценка факторов производственной
среды (вредные химические вещества, шум, вибрация, электромагнитное
излучение, неблагоприятный микроклимат и др.) и трудового процесса, про-
должительность воздействия, интенсивность и т.д. Параллельно изучают соци-
ально-бытовые факторы, оценивают группу обследуемых по возрасту, стажу,
проводят интервьюирование по специально разработанным анкетам и др.
При клинико-статистических исследованиях выявляют изменения реп-
родуктивной функции работающих при их осмотре, анализируют критери-
ально значимые показатели нарушений репродуктивного здоровья, которые
обычно подлежат статистическому учету:
• показатели материнской и детской смертности и самопроизвольные
выкидыши;
• показатели частоты рождения детей с врожденными пороками разви-
тия, связанные с воздействием вредных факторов окружающей среды,
в том числе производственной;
• показатели заболеваемости с временной нетрудоспособностью, свя-
занные с женскими болезнями и осложнениями беременности и
родов;
449
• показатели детской заболеваемости, особенно в период до 3 лет и в
период полового созревания;
• показатели заболеваемости репродуктивной системы мужчин.
Основная роль в профилактике патологии репродуктивной функции
отводится эксперименту, который дает основу как для прогнозирования
неблагоприятных эффектов до внедрения веществ в промышленность, так
и для дифференцирования этиологии повреждения репродуктивной функ-
ции, если вещество уже внедрено в производство. Задачи профилактической
токсикологии — определение порогов вредного действия ядов на функцию
и морфологию половых желез, развитие плода и потомства.
Меру избирательности (специфичности) действия предлагается определять
по зоне специфического действия (Zsp), т.е. по отношению порога интеграль-
ного действия (Limintegr) к порогу специфического действия (Ьцтц™.).
Если Zsp > 1, это свидетельствует об избирательном (специфическом)
действии химического агента на изучаемую функцию.
Влияние химических соединений на генеративную функцию оценивают
в модельных опытах на теплокровных животных разных видов. Для изучения
влияния химических веществ на репродуктивную функцию целесообразно
использовать прежде всего спонтанно-овулирующих животных — белых
крыс, мышей, а также, возможно, кошек и кроликов. Предпочтительны
гибридные линии и беспородные популяции. Для получения достоверных
данных важно соблюдение адекватных условий содержания лабораторных
животных и полноценного режима питания.
При изучении эмбриотропного действия химических веществ большое
значение имеют выбор экспериментальных животных, сроки беременности,
на которые приходится это действие, продолжительность и уровень воздей-
ствия, проницаемость вещества через плаценту.
Изучение эмбриотропного действия представлено на схеме 13.1.
В настоящее время нельзя указать универсальный вид животных, кото-
рый надежен для выявления тератогенного действия химических соедине-
ний. Одна из основных причин сложности интерпретации эксперименталь-
ных данных — недостаток информации о механизмах тератогенеза, об осо-
бенностях метаболизма ядов у человека и животных, о различиях во взаимо-
действиях матери и плода у человека и животных. Вопрос переноса данных
с животного на человека имеет определенные трудности, поскольку имеются
значительные различия в видовой и даже внутривидовой чувствительности
(например, классический тератоген для человека талидомид вызывает урод-
ства не у всех животных).
Вместе с тем на основании анализа многочисленных данных можно
предположить, что положительные результаты, выявленные в эксперименте,
свидетельствуют о высокой вероятности опасности химических соединений
для человека. Например, известные в настоящее время тератогены для
человека (стероидные гормоны, тиреостатики, антагонисты пурина или фо-
лиевой кислоты, метилртуть и др.) в эксперименте оказались тератогенами.
В связи с этим, по мнению группы экспертов ВОЗ (1968), при изучении
тератогенной активности химических продуктов необходимо проводить экс-
перимент на эмбрионах трех видов млекопитающих — крыс, мышей и кро-
ликов.
Исследование постнатального развития потомства в значительной сте-
пени позволяет избежать недооценки опасности воздействия химических
соединений на эмбриогенез, так как патология развития проявляется зачас-
450
Схема 13.1. ИЗУЧЕНИЕ ЭМБРИОТРОПНОГО ДЕЙСТВИЯ
V
Эмбриональный материал
Смертность Масса и размер плода. Состояние плаценты Морфология, биохимия
Потомство
Раннее постна- тальное развитие Неспеци- фические и специфи- ческие по- казатели Функцио- нальные нагрузки в соответ- ствии со специфи- кой дейст- вия яда
тую в более поздние периоды онтогенеза и на более низких уровнях воз-
действия.
Важно определение чувствительности эмбрионов при воздействии изу-
чаемых факторов: характер эффекта в значительной степени зависит от
стадии эмбриогенеза, на которую действует химическое вещество в течение
всей беременности.
Способ поступления яда в организм варьирует в зависимости от цели
эксперимента. Длительность эксперимента и экспозиции определяется ха-
рактером и целью исследования.
Количественная характеристика изменений при оценке опасности хими-
ческих соединений, установленная при применении комплекса показателей
(функциональных, морфологических и биохимических), может стать надеж-
ной основой для построения системы профилактических мероприятий.
13.2.1. Исследование гонадотропного действия
химических веществ
Методы оценки функционального состояния яичников у экспериментальных
животных. Исследование функционального состояния яичников при воздей-
ствии химических соединений проводят в эксперименте на самках белых
крыс массой 160—200 г с нормальным эстральным циклом. Применяются
следующие методы:
• исследование общей продолжительности эстрального цикла и отдель-
ных фаз, ритмичность их чередования;
• определение относительной массы и количественная оценка структу-
ры функциональных элементов яичников;
15*
451
• оценка активности гонадотропной функции гипофиза и других гор-
монов, определение фертильности:
, число оплодотворенных самок . пп
индекс фертильности:--------------—с----------------х 100;
число оставленных для оплодотворения
индекс гестации:
число родивших самок * ]qq%
число оплодотворенных
Заключение о полноценности потомства можно дать на базе комплекс-
ной оценки.
• Прирост массы тела — еженедельно; смертность до 5-го и 21-го дня.
На основании последних показателей вычисляют:
индекс выживаемости:
число живых новорожденных к 5-му дню
число родившихся
X 100%;
индекс лактации:
число живых новорожденных на 21-й день
число живых новорожденных на 5-й день
Функциональное и морфологическое состояние отдельных органов и
систем (периферическая кровь, печень, почки и др.). Особое внимание
должно быть уделено нейроповеденческим реакциям потомства.
• Половое созревание (состояние астрального цикла, сперматогенеза)
и фертильность I поколения.
• Выявление скрытых или мало выраженных изменений и полноцен-
ности потомства с помощью различных нагрузочных тестов.
Одним из перспективных методов, применяемых при оценке неблаго-
приятного действия химических факторов малой интенсивности на репро-
дуктивную систему, остаются морфологическое морфометрическое исследо-
вание матки, а также морфофункциональное изучение тканевых базофилов
с количественной оценкой этих нарушений в органах репродуктивной сис-
темы (рис. 13.3). В ряде работ было показано, что при действии веществ со
специфическими гонадотропными свойствами изменяются количество и
качественный состав тканевых базофилов, что позволяет считать их “био-
логическими маркерами” воздействия антропогенных факторов на репро-
дуктивную систему в клинике и эксперименте [59].
Изучение состояния сперматогенеза и функционального состояния сперма-
тозоидов. Эксперимент проводили на половозрелых животных-самцах в ус-
ловиях однократного (для установления Limac) и хронического (для уста-
новления Limch) воздействия исследуемых веществ.
Изучение гонадотропного действия химических веществ на мужскую
репродуктивную систему отражено на схеме 13.2.
Вследствие трудоемкости и продолжительности изучения состояния
мужской генеративной функции в условиях эксперимента в ряде случаев
исследования выполняют не в полном объеме, предусмотренном методичес-
кими рекомендациями. Ввиду дефицита времени заключение об отсутствии
избирательности (специфичности) химического агента часто основывается
на оценке 1—2—3 функциональных показателей. Результаты, полученные
при некорректно проведенных исследованиях, могут привести не только к
неправильно обоснованному конкретному гигиеническому стандарту, но и
иметь более неблагоприятные последствия, так как возможное групповое
нормирование или нормирование по аналогии будет базироваться на невер-
ной основе. Повышение информативности и надежности оцениваемых по-
452
Рис. 13.3. Увеличение общего числа тканевых базофилов и2-пиридин
ферм в мозговом слое яичника крысы при воздействии фФ
этилметакрилата. Окраска: основным коричневым по М Л . У° У
а — увеличение 63; б — увеличение 400.
453
Схема 13.2. ИЗУЧЕНИЕ ГОНАДОТРОПНОГО ДЕЙСТВИЯ ХИМИЧЕСКИХ
ВЕЩЕСТВ НА МУЖСКУЮ РЕПРОДУКТИВНУЮ СИСТЕМУ
Химическое вещество
Регуляторные системы
Семенники
Оценка функцио-
нального состоя-
ния сперматозо-
идов:
• характер и дли-
тельность дви-
жения;
• относительное
количество по-
движных спер-
матозоидов;
• относительное
количество де-
генеративных
форм;
• определение кон-
центрации спер-
матозоидов в
хвостовой части
придатка яичка;
• определение ки-
слотной и осмо-
тической резис-
тентности спер-
матозоидов;
• оплодотворяю-
щая способность;
• состояние потом-
ства F1
Макроскопи-
ческое иссле-
дование се-
менников
• весовые
коэффи-
циенты;
• размеры
(длина и
объем)
Микроскопичес-
кое исследова-
ние:
• индекс сперма-
тогенеза;
• количество ка-
нальцев со спу-
щенным спер-
матогенным
эпителием (в
100 канальцах);
• среднее коли-
чество нормаль-
ных спермато-
гоний (в 100 ка-
нальцах);
• относительное
число каналь-
цев с 12-й ста-
дией мейоза (в
100 канальцах)
Биохимичес-
кие и гормо-
нальные ис-
следования:
• содержание
половых
гормонов;
• содержание
гонадотроп-
ных гормо-
нов и др.
казателей с уменьшением времени их получения возможно при использо-
вании цитоморфологического метода оценки состояния мужской репродук-
тивной функции. Экспрессный цитоморфологический метод, разработан-
ный Ю.В.Ивановым (1988), позволяет подсчитать общую клеточность гомо-
гената ткани семенников, определить количество отдельных типов половых
клеток, опорно-трофических клеток Сертоли (сустентоциты) и инкреторных
клеток Лейдига (гландулоциты яичка) в окрашенном клеточном гомогенате
целого семенника, а также подсчитать число сперматозоидов в гомогенате
из эпидидимуса и определить целый ряд параметров состояния сперматоге-
454
не3а, характеризующих как интегральные его показатели, так и узловые
звенья процессов спермацито- и спермиогенеза. Проведенный сравнитель-
ной анализ результатов двух методических подходов показал их сопостави-
мость на изоэффективных уровнях.
При сопоставлении результатов экспериментальных исследований и кли-
нических наблюдений и оценке показателей сперматогенеза могут наблю-
даться различия: у человека возможны более выраженные нарушения, чем
у экспериментальных животных. Ряд авторов в своих работах сообщают об
отсутствии параллелизма между изменениями морфометрических и функ-
циональных показателей сперматогенеза у экспериментальных животных,
что, по их мнению, объясняется неадекватностью методов изучения функ-
ционального состояния сперматозоидов [12, 17, 54]. В эксперименте у крыс-
самцов была изучена взвесь сперматозоидов, полученных после разреза
эпидидимиса и помещенных в изотонический раствор натрия хлорида. Ес-
тественно, что этот материал не вполне идентичен сперме людей, а кроме
того, неизбежно привнесение субъективных факторов, зависящих от экспе-
риментатора (интенсивность вымывания сперматозоидов, величина разреза
придатка, качество изотонического раствора натрия хлорида и т.д.), поэтому
более достоверна информация, полученная при количественной морфомет-
рии ткани семенников экспериментальных животных.
13.3. Патогенетические аспекты и клинические
проявления нарушений репродуктивной функции
Анализ результатов современных исследований, касающихся влияния
неблагоприятных факторов на репродуктивную систему, показывает, что
ведущим среди этих факторов является химический. Вызываемые им изме-
нения в функциональных системах — следствие общего токсического дей-
ствия вещества на организм. Однако некоторые химические соединения, не
оказывая в определенных дозах влияния на общее состояние организма,
могут вызывать патологические нарушения в гонадах и процессе эмбриоге-
неза. В этом случае принято считать, что они обладают специфическим
действием на генеративную функцию, поэтому важно одновременное изу-
чение общих токсических свойств соединений и их специфических эффек-
тов [42].
Определив избирательное гонадотропное действие химического агента
на уровне порога острого действия, иногда трудно отдифференцировать
непосредственное поражение гонад от повреждения регулирующего их
Функцию нейро гуморально го аппарата. Практически единственным путем
решения вопроса специфичности действия химического агента на половые
железы при длительном его поступлении в организм в низких концентра-
циях (дозах) стало более углубленное изучение действия яда в эксперимен-
тальных исследованиях, в том числе при моделировании производственных
факторов и некоторых патологических состояний. Опыты на животных
позволяют выделить из комплекса неблагоприятных факторов ведущие, в
наибольшей степени влияющие на репродуктивную функцию, и определить
механизм действия яда.
Ядов^ обладающих специфическим действием на гонады (или непосред-
ственный аппарат регуляции их функций), относительно мало. К ним от-
носятся этиленимин, хлоропрен, марганец, винилхлорид, аллил-а-аллилок-
сикарбонилоксиакрилат, фосфат-поли-2-пиридилэтилметакрилат, третбу-
тилперацетат, фенол.
455
На основании клинико-экспериментальных данных и данных литературы
можно представить механизм развития нейроэндокринных изменений в репро-
дуктивной системе при воздействии химических веществ следующим образом.
Для действия химического фактора специфично развитие деструктивных
изменений как в центральных, так и в периферических отделах репродук-
тивной системы на фоне общетоксических перестроек. В отличие от физи-
ческих факторов химическое воздействие сопровождается менее отчетливой
фазной реакцией, выраженность которой во многом зависит от концентра-
ции используемого вещества.
Вдыхание химических веществ, воздействие повышенной температуры,
интенсивного освещения, адинамии и других факторов влечет за собой
изменение функционального состояния коры головного мозга, специфичес-
ких клеток гипоталамуса, координирующих эндокринные функции. При
длительном влиянии перечисленных факторов нарушается обмен веществ.
Ядра гипоталамуса, особенно чувствительные ко всем изменениям гомео-
стаза, реагируют повышенной секреторной активностью, что влечет за собой
возрастание содержания в крови гонадотропных и других гормонов, вызы-
вающих в свою очередь дискоординацию работы гипоталамо-гипофизарно-
гонадной системы. Через некоторое время это приводит к развитию морфо-
логических изменений в органах-мишенях (яичник, матка). Чем выше ин-
тенсивность воздействия, тем быстрее фаза возбуждения переходит в стадию
дистрофических изменений. Длительность периода временной компенсации
за счет перенапряжения адаптационных механизмов зависит от резистент-
ности организма и имеет индивидуальный характер.
Длительное возбуждение гипоталамо-гипофизарной системы способст-
вует усилению функции яичников, причем функциональное напряжение за-
кономерно сменяется пролиферацией гормональной ткани органа с вовлече-
нием не только фолликулов на разных стадиях развития, но и всей ткани
яичников. Повышенная гормональная активность закономерно вызывает
упорную пролиферацию эндометрия и патологические изменения в яичниках.
В экспериментальных исследованиях при изучении влияния химических
веществ на функцию яичников было выявлено характерное развитие обще-
токсических перестроек в организме, приводящих к изменениям нейроэн-
докринной регуляции полового цикла. При этом наблюдалось два типа
реакции нарушений эстрального цикла: эструсовый и диэструсовый. Для
эструсового типа свойственны повышение уровня эстрогенов и удлинение
фазы эструс в эстральном цикле. Например, значительное удлинение эструса
происходило у крыс в конце 4-месячного воздействия шестивалентного
хрома в концентрациях на уровне ПДК и на порядок выше.
Воздействие эфиров ортофталевой кислоты, креозола, гербицида 2,4-D,
бензина БР-1, хлорокиси фосфора на уровне пороговых концентраций об-
щетоксического и специфического действия в первые 2 нед вызывало удли-
нение активной фазы эстрального цикла, сохранявшейся в течение 2 мес
интоксикации, кроме того, усиливалось влияние эстрогенов в организме.
По мнению ряда авторов, возникновение гиперэстрогении обусловливает
развитие гиперпластических процессов в эпителии матки, что позволяет
считать реакцию репродуктивной системы по эструсовому типу прогности-
чески более неблагоприятной [41].
При диэструсовом типе снижается уровень эстрогенов в организме,
удлиняется фаза покоя эстрального цикла (диэструс), сохраняется ритмич-
ность чередования отдельных фаз циклов. Так, формальдегид (на уровне
ПДК) вызывает удлинение диэструса, увеличение коэффициентов массы
яичников, содержания лютеинизирующего гормона и прогестерона в крови.
456
Известно, что функция гонад по типу удлинения диэструса наиболее
аспространена при воздействии химических факторов. Активно переходя в
стадию покоя, организм выходит на более резистентный уровень жизнеде-
ятельности, позволяющий ему в определенных пределах переносить без
ущерба неблагоприятные воздействия.
У Удлинение диэструса необходимо отличать от диэструса — анэструса,
характерная особенность которого — отсутствие циклических изменений в
репродуктивных органах, развивающееся в результате патологических про-
цессов в них или при воздействии неблагоприятных факторов большей
интенсивности. Состояние анэструса сочетается с атрофическими измене-
ниями матки, особенно эндометрия.
При действии химических веществ наряду с нарушением нейроэндо-
кринного механизма регуляции процесса репродукции возможно и прямое
токсическое действие.
Непосредственное действие химических веществ заключается в их струк-
турном подобии эндогенным гормонам (эстрогены). Эти вещества связыва-
ют эстрогенные рецепторы и могут действовать как агонисты или антаго-
нисты эстрогенов, оказывая влияние на гонадотропин-регулируемый овари-
альный стероидогенез или фолликулярное созревание, могут пролонгировать
фолликулярную фазу эстрального или менструального цикла и вызывать
атрезию тех фолликулов, которые могли бы овулировать.
Например, хлордимеформ и амитраз могут задерживать или блокировать
овуляцию, прерывая выброс Л Г, или нарушать способность созревающих
фолликулов отвечать на гонадотропный сигнал.
Нестероидные соединения, относящиеся к производным трифенилэтана
(нафоксидин, кломифен, тамоксифен и др.), а также дифенилпроизводные
этана, производные нафталина и др., имея свободный или закрытый эфир-
ной связью гидроксил в бензольном кольце или не имея его вообще,
обладают сильной антиэстрогенной активностью, а также той или иной
степенью эстрогенной активности. Этот механизм действия токсичных ве-
ществ реализуется при поступлении стероидных гормонов, диэтилстильб-
эстрола, азатиоприна-6-меркаптопурина, галогенизированных полицикли-
ческих углеводородов. Увеличение степени эстрогенной активности, приво-
дящее к увеличению массы матки, наблюдалось при действии таких пести-
цидов, как метоксхлор, хлордекон, фитоэстрогены и др.
К химическим веществам, действующим путем метаболической актива-
ции и превращения в токсичные метаболиты, относятся ПАУ, циклофосфа-
мид, этанол. К ним же относятся и вещества, вызывающие индукцию или
ингибицию различных ферментов.
Нарушения функции яичников наблюдали при изменении активности мик-
росомальных монооксигеназ, эпоксидных гидраз и трансфераз, которые актив-
но участвуют в метаболизме некоторых химических веществ в яичниках.
Помимо этого, химические вещества оказывают влияние (стимулирую-
щее или угнетающее) на стероидную секрецию и изменение скорости гор-
монального синтеза. Изменение гормонального баланса наблюдалось у гры-
зунов при действии полициклических галогенизированных углеводородов,
включая полихлорированные и полибромированные бифенилы, трикрезол.
Высокая химическая реакционноспособность лежит в основе действия
тяжелых металлов свинца, кадмия, ртути, бора, вызывающих нарушение
Репродуктивной функции самок.
Гигиенически значимыми можно считать следующие морфологические
Изменения в яичниках:
457
• увеличение или уменьшение массы яичников, причинами которых
могут быть уменьшение числа ооцитов или фолликулов, замедление
формирования желтых тел, развитие кист, возрастные изменения
нарушения гипоталамо-гипофизарной функции;
• увеличение фолликулярной атрезии и атретических тел;
• уменьшение числа примордиальных фолликулов;
• уменьшение числа желтых тел;
• нарушение фолликулогенеза или лютеинизации — образование кис-
тозных фолликулов, лютеинизирующих фолликулов, отсутствие ову-
ляции.
Нарушение роста фолликула на различных стадиях его созревания у гры-
зунов вызывают свинец, ртуть, кадмий и полиароматические углеводороды.
Аммиак приводит к снижению числа примордиальных фолликулов. При дей-
ствии фосфат-поли-2-пиридилэтилметакрилата отмечаются увеличение числа
атретических тел и разрастание соединительной ткани в яичниках.
Схематически критерии нарушения репродуктивной функции крыс-самок
при оценке опасности новых промышленных веществ в зависимости от мор-
фофункционального состояния яичников и матки представлены ниже [20].
Критерии нарушения репродуктивной функции крыс-самок при оценке опасности
новых промышленных веществ
Показатель нару-
шений функции
Тип нарушений
репродуктивной
функции крыс-
самок при сохра-
ненной ритмич-
ности чередова-
ния фаз
Оценка атрезии
Оценка биологи-
ческой полноцен-
ности овоцитов
Критерии нарушения репродуктивной функции
Диэструсовый тип
Эстральный цикл — увеличение длительности ди-
эструса
Матка — уменьшение складчатости слизистой обо-
лочки и высоты покровного и железистого эпителия
Яичники — увеличение коэффициента массы и ко-,
личества атретических тел
Гормоны — уменьшение эстрогенных влияний
Эструсовый тип
Эстральный цикл — увеличение длительности эст-
руса
Матка — гиперемия и отечность, увеличение склад-
чатости слизистой оболочки и высоты покровного
и железистого эпителия, увеличение коэффициента
массы
Яичники — увеличение коэффициента массы, увели-
чение или уменьшение количества атретических тел
Гормоны — увеличение эстрогенных влияний
Качественная — физиологическая, дегенерационная
(компактные тела, кистозные фолликулы)
Количественная — количество атретических и жел-
тых тел
Способность к зачатию
Показатели эмбриональной смертности
458
i
Клинические проявления воздействия химических веществ на репродуктив-
ную функцию женщины. Отмечаются изменения менструального цикла, бес-
плодие, раннее наступление климакса, самопроизвольные аборты и выкидыши,
осложнения беременности и родов, рождение маловесных детей, врожденные
уродства и т.д. Ранее указанная патология наблюдалась при воздействии
таких хорошо изученных ядов, как свинец, ртуть, бензол. Эти исследования
находят подтверждение в последние годы, причем используются не только
данные клинических наблюдений, но и результаты специальных функцио-
нальных тестов.
Значительная распространенность менструальных нарушений у работниц
отмечена в производствах синтетических каучуков, капролактама, стироль-
ных и фенолформальдегидных пластических масс, химических волокон,
суперфосфатных удобрений, при контакте с пестицидами и др.
У работниц производства синтеза органических соединений (метионин,
резиновые ускорители — альтакс, каптакс, сероуглерод, диметиламин и др.)
наблюдалось увеличение частоты расстройств менструального цикла: гипер-
полименорея, гипоолигоменорея, альгодисменорея, частота развития кото-
рых нарастала с увеличением стажа работы [5].
Нарушения менструальной функции под влиянием промышленных ядов
проявлялись преимущественно в виде гиперменструального синдрома, ко-
торый в последующем иногда сменялся гипоменструальным синдромом.
Аменорея и ранний климакс наблюдались под влиянием свинца, ртути,
бензола, при контакте с сероуглеродом, фенолом и формальдегидом. При
этом часто концентрации вредных химических веществ в воздухе производ-
ственных помещений не выходили за пределы установленных ПДК. Такое
явление исследователи наблюдали в производствах, где работницы контак-
тировали со стиролом, фенолом, формальдегидом, сероуглеродом. Это дает
основание считать, что установленные ранее ПДК этих веществ небезраз-
личны для одной из важнейших функций организма [49].
Вредное воздействие химических веществ может проявиться и в возник-
новении бесплодия у женщин. Хотя причины бесплодия многообразны,
статистически достоверное учащение таких случаев у женщин, объединен-
ных общностью условий труда, по сравнению с адекватной контрольной
группой свидетельствует о производственной этиологии. Такие нарушения
наряду с ранее известными (для свинца, ртути, мышьяка) отмечены у
работниц, имеющих контакт с бензолом, ксилолом, толуолом, хлорирован-
ными углеводородами.
У женщин, имеющих контакт с комплексом промышленных химических
веществ — нитрилом акриловой кислоты, метилакрилатом, диметилформа-
мидом и радонистым натрием (на уровне ПДК), обнаружено появление
патологического климакса. Причиной климактерических кровотечений слу-
жило нарушение конъюгации эстрогенов с развитием относительной гипер-
эстрогении.
Профессиональный контакт с токсичными соединениями (органические
растворители, фтор и фторсодержащие соединения, лакокрасочные продук-
ты) вызывает патологическое течение беременности и родов, а также уве-
личение частоты врожденных пороков развития.
У работниц производства резины, искусственной кожи, синтетических
смол, коксохимических заводов при контакте с пестицидами, фенолом,
ацетоном, нитрилом акриловой кислоты, ртутью, свинцом и т.д. наиболее
часты такие осложнения беременности, как токсикозы, слабость родовой
Деятельности и угроза внутриутробной асфиксии плода.
459
У женщин, занятых в производстве по переработке сополимеров стирола
с метилметакрилатом, установлены токсикозы беременности, анемия, нару-
шение характера родовой деятельности, дородовое излитие околоплодных
вод, преждевременные роды. Выявлена зависимость частоты патологии от
стажа работающих [Соболев В.П., 1978]. В производстве оргстекла при
воздействии метилметакрилата на уровне ПДК отмечено выраженное эмб-
риотоксическое и тератогенное действие, зависящее от уровня воздействия.
Более интенсивное воздействие сопровождается повышенной частотой
спонтанных абортов, а низкое — увеличением случаев врожденных пороков
развития, мертворождений, асфиксии новорожденных [51].
Для работниц производства резиновых ускорителей характерны наруше-
ния состояния плацентарной системы и жизнедеятельности внутриутробно-
го плода. В крови матерей и в эмбриональной ткани обнаружен сероуглерод.
Значительный интерес представляют исследования, касающиеся воздей-
ствия химических веществ в малых концентрациях в производстве синтети-
ческого каучука на систему мать — плод — плацента. Количественное опре-
деление основных действующих соединений изучаемого производства (то-
луол, формальдегид) в биосредах позволило оценить проницаемость плацен-
тарного барьера и подтвердить повреждающее действие этих веществ на
плод.
В связи с тем что концентрации изучаемых веществ были больше в крови
матери по сравнению с их содержанием в крови плода и плаценты автор
предполагает, что плацента берет на себя защитную роль по отношению к
плоду. В условиях эксперимента установлена возможность прохождения
через плацентарный барьер формальдегида, диметилформамида, толуола, т.е.
основных компонентов производства синтетического каучука, и определе-
ния их в тканях плода и плаценты.
Воздействие диметилформамида (Limch < ПДК) на работающих женщин,
занятых в производстве искусственных волокон, как до, так и во время
беременности клинически проявлялось высоким уровнем гинекологической
заболеваемости, патологией периода гестации, осложненными родами, на-
рушениями в состоянии новорожденных, что позволило поставить вопрос
о возможных нарушениях в системе мать — плацента — плод на ранних
стадиях беременности. С целью определения барьерных функций плаценты
для химических веществ был вычислен индекс проницаемости плаценты, не
зависящий от срока беременности, позволяющий судить о барьерных функ-
циях плаценты, прогнозировать возможный отдаленный риск для здоровья
новорожденного, основанный на базе знаний специфического характера
воздействующего химического вещества [45, 46].
Химические вещества, поступая в организм, способны не только вызы-
вать изменения плаценты и нарушать развитие плода, но и менять микро-
элементный состав организма матери и плода. В плаценте женщин, работа-
ющих на разных участках производства фосфорных удобрений, содержание
фосфора было повышено в 2,8—6,7 раза.
Проницаемость плаценты зависит от многих факторов, в частности от
общего состояния материнского организма, срока беременности, строения
химических веществ и др.
Клинические данные, касающиеся проницаемости плаценты, немного-
численны. При морфологическом исследовании последов родильниц, рабо-
тавших в производствах по переработке пластмасс на основе стирола и
стеклопластиков, обнаружены признаки воспаления. В значительном числе
плацент выявлены гидропическое перерождение цитотрофобласта, повы-
460
щенное отложение фибриноида, отек, дистрофические и некротические
изменения, характеризующие признаки физиологического старения плацен-
ты ИЗ]-
у работниц производства синтетического каучука установлены измене-
на морфологических и морфометрических параметров плаценты, актива-
ция тучных клеток и термостабильной щелочной фосфатазы в крови, что
может быть связано с прямым повреждающим действием химических ве-
ществ на синцитиотрофобласт.
Известно более 600 химических веществ, способных проникать от матери
к плоду через плаценту и в той или иной степени отрицательно влиять на
еГо развитие [21].
Рассматривая основные механизмы воздействия вредных факторов на
состояние плода и новорожденного, можно выделить следующие клиничес-
кие проявления, обусловленные нарушениями структуры и функции пла-
центы [21]:
• высокая частота синдрома задержки развития плода (у 25 % беремен-
ных);
• функциональная незрелость плода и новорожденного (у 23 %);
• развитие конъюгационной желтухи II степени, требующей корриги-
рующей терапии;
• нарушение гормональной адаптации новорожденных;
• изменения иммунного статуса и биоценоза у новорожденных;
• изменение морфоструктуры форменных элементов крови.
Таким образом, влияние химических факторов на биологическую систе-
му мать — плацента — плод многообразно; важнейшими из этих факторов
являются:
неблагоприятное воздействие химических соединений на организм
матери и избирательная способность яда повреждать органы и системы
организма, обеспечивающие нормальное протекание беременности;
непосредственный контакт химического соединения или его метабо-
литов с эмбриональными клетками, избирательное накопление тканя-
ми плода в определенные периоды внутриутробного развития различ-
ных веществ;
поражение плаценты химическими веществами, вследствие чего может
меняться ее проницаемость;
свойство химических веществ вызывать генные и хромосомные мута-
ции в соматических и половых клетках.
Среди механизмов нарушения мужской репродуктивной функции при
Действии химических веществ следует отметить нарушение нейроэндокрин-
ной регуляции как одной из наиболее чувствительных функциональных
систем человеческого организма. Наиболее вероятным механизмом токси-
ческого влияния на нее следует считать, по-видимому, нарушение синтеза,
поступления в кровь, транспорта гипофизарных гонадотропинов и(или)
половых гормонов. Возможно непосредственное действие на ЦНС. Другой
Механизм нарушений — непосредственное действие яда на гонады, прояв-
ляющееся в расстройстве дифференцировки сперматогенного эпителия, уг-
нетении зрелых сперматозоидов или функции добавочных желез, нарушении
Функций гематотестикулярного барьера, клеток Сертоли и Лейдига и др.
Было показано, что для веществ, действующих на сперматогенез опос-
редованно (через механизм местной и центральной нейроэндокринной ре-
фляции — комплекс металлов, о-толуидин, пестицид ботрана), порог гона-
461
дотропного действия совпадает с общетоксическими эффектами на организм
или близок к ним.
У веществ, обладающих специфическими свойствами, таких как борная
кислота, кадмий, пестициды (кронетон и ромуцид), порог гонадотропного
действия совпадает с их цитотоксичностью относительно воздействия на
половые клетки и находится в тесной коррелятивной связи с их геноток-
сичностью и мутагенностью.
Нарушение репродуктивной функции при токсических воздействиях мо-
жет быть результатом изменения процесса сперматогенеза (при этом сни-
жается количество и качество эякулята и развивается бесплодие), а также
воздействия на зрелые сперматозоиды (путем изменения процесса нормаль-
ного оплодотворения).
Различные стадии созревания сперматозоидов обладают неодинаковой
чувствительностью к воздействующему агенту. Например, бисульфан и про-
карбазин влияют на сперматогоний, 2-метоксиэтанол — на сперматоциты,
метила хлорид — на сперматиды, 1,3-динитробензол и 2,5-гексанедион — на
клетки Сертоли; клетки Лейдига разрушаются при действии этана диметан-
сульфоната. Увеличение дозы приводит к поражению сперматозоидов на
всех стадиях созревания и нарушению регуляторных механизмов с развитием
бесплодия.
Снижение количества и качества эякулята обусловлено отсутствием или
недостаточным количеством жизнеспособных сперматозоидов, возникнове-
нием незрелых, аномальных сперматозоидов с нарушенной подвижностью
(табл. 13.1). Исключение таких сперматозоидов из функции репродукции
осуществляется при оплодотворении яйцеклетки в женском организме: на-
рушаются процессы проникновения сперматозоида, имплантации, нормаль-
ного течения эмбриогенеза. Накопление химических веществ в эпидидими-
се, семенных пузырьках, предстательной железе приводит к гибели сперма-
тозоидов.
Таблица 13.1. Характеристика действия некоторых химических веществ на реп-
родуктивную функцию мужчин
Вещество Снижение количества спермы Изменение формы спермато- зоидов Нарушение подвиж- ности спер- матозоидов Сексуаль- ные изме- нения
Свинец ч- ч- + ч-
Дибромхлорпропан + —- —-
Карбарил (севин) + + —
Толуендиамин + —.
Динитротолуол Этилена дибромид + + + * i
Стирол и ацетон + + ——
Этилена гликоль + ——
Моноэтиловый эфир Перхлорэтилен . +
Пары ртути +
Кепон -- + —
Сероуглерод +
2,4-Дихлорфеноксиуксусная кислота — + + ——
Пары брома + + + —•
» хлоропрена + —. + ——
Винилхлорид + + ——
Фтор + + ч- —
462
Нарушения репродуктивной функции могут быть связаны с поврежде-
ниями непосредственно на уровне семенников и зависеть от патологии
органов мочеполовой системы, участвующих в регуляции семяизвержения.
Например, нарушение эякуляции вплоть до полного ее отсутствия при
воздействии 3 % раствора гексахлорфена в эксперименте оказалось связан-
ным с фиброзом предстательной железы [67]. Нарушение функции эпиди-
димиса может наблюдаться при воздействии а-хлоридина, сульфасалазина.
Рассматривая регуляторные механизмы на тканевом, органном и орга-
низменном уровнях, обеспечивающие репродуктивную функцию, необходи-
мо особо выделить гематотестикулярный барьер, основной функцией кото-
рого является поддержание иммунологического гомеостаза, т.е. изоляция
сперматозоидов, обладающих аутоантигенной активностью, от иммунологи-
ческого аппарата организма.
По современным представлениям, барьерную функцию в семеннике
выполняют собственная оболочка семенных канальцев, цитоплазма клеток
Сертоли, стенка сосудов и белочная оболочка, однако существуют продукты,
способные разрушать барьер и проникать внутрь семенника и канальцев,
оказывая повреждающее действие на сперматогенез. Из химических ве-
ществ, оказывающих повреждающее действие на семенные канальцы, осо-
бенно детально был изучен хлорид кадмия. Профессиональный контакт с
соединениями шестивалентного хрома приводил к нарушениям сперматоге-
неза, но не оказывал вредного влияния на состояние копулятивного цикла.
Данные клинических наблюдений нашли подтверждение в проведенных
экспериментальных исследованиях. Как при однократном, так и при по-
вторном ингаляционном воздействии бихромата натрия не выявлено изме-
нений в содержании гипофизарных гормонов, тестостерона, 14-оксикорти-
костерона в сыворотке крови животных, а выявленные нарушения сперма-
тогенеза обусловлены непосредственным действием хрома, проникающего
через гематотестикулярный барьер, на генеративные структуры мужских
гонад [26].
Хлорид кадмия вызывает избирательное поражение сосудов семенника,
а также нарушение проницаемости других структур, осуществляющих функ-
цию тестикулярного барьера: клеток Сертоли и собственной оболочки се-
менных канальцев. Последнее обстоятельство определяет гибель клеток
сперматогенного эпителия либо в результате иммунных реакций, в частнос-
ти под влиянием цитотоксических антисеменниковых антител, содержащих-
ся в крови интактных животных, либо вследствие неспецифического изме-
нения среды, окружающей развивающиеся половые клетки.
Гематотестикулярный барьер выполняет также функцию генетической
защиты наиболее ранимых мейотически делящихся сперматоцитов и нахо-
дящихся в фазе конденсации хроматина сперматид. Показано, что стенка
семенных канальцев половозрелых млекопитающих непроницаема для про-
изводных акридина и некоторых других мутагенов, легко проникающих в
Ядро и способных стать причиной нежелательных мутаций.
Таким образом, гематотестикулярный барьер — один из важных меха-
низмов, контролирующих сперматогенез и плодовитость. Он изолирует ау-
тоантигенные половые клетки от иммунологического аппарата организма,
обеспечивает их генетическую защиту и участвует в гормональной регуляции
сперматогенеза [39].
Клиническими проявлениями нарушений репродуктивной функции мужчин
могут быть различные типы нарушений спермообразования: бесплодие, нару-
шения сексуального поведения.
463
Выраженную негативную роль при бесплодии играет интоксикация та-
кими химическими веществами, как свинец, мышьяк, сероуглерод, ртуть,
фосфор, этилированный бензин. Значительно чаще бесплодие встречается
у мужчин, занятых в производстве эфира, синтетических масел, анилиновых
красителей [23].
При обследовании рабочих, контактировавших с парами хлоропрена,
отмечено нарушение копулятивной функции мужчин со стажем работы
более 5 лет, выразившееся в ускорении семяизвержения. Сперматологичес-
кое исследование выявило изменения в эякуляте рабочих от функциональных
нарушений состояния сперматозоидов при стаже работы до 9 лет до морфо-
логических изменений в эякуляте рабочих со стажем работы более 10 лет [14].
У рабочих химического производства, контактирующих с винилхлоридом
в концентрациях, в основном не превышающих ПДК, при сексологическом
обследовании выявлены нарушения состояния копулятивного цикла в 59 %
случаев. Ухудшение состояния репродукции, проявившееся патологически-
ми изменениями эякулята, было обнаружено в основном после 10 лет
контакта с винилхлоридом [И].
У обследованных мужчин, страдающих фтористой интоксикацией, отме-
чено ослабление половой функции, выражавшееся в изолированном или
сочетанном нарушении либидо, эрекции и эякуляции. Картина сперматоге-
неза у обследованных мужчин характеризовалась уменьшением объема эя-
кулята, концентрации сперматозоидов в нем, а также увеличением непо-
движных и дегенеративных форм сперматозоидов. Частота этих нарушений
была в 3—4 раза выше, чем у лиц контрольной группы.
Таким образом, проведенные комплексные клинико-экспериментальные
исследования свидетельствуют о негативном влиянии химических соедине-
ний на процессы репродукции и воспроизводства здорового потомства.
13.4. Классификация ксенобиотиков, действующих
на репродуктивную систему
Единой классификации химических веществ, действующих на репро-
дуктивную систему, не существует. Вопрос о критериях оценки ядов,
обладающих действием на репродуктивную систему, требует дальнейшего
совершенствования. В промышленной токсикологии была создана класси-
фикация потенциальной опасности влияния промышленных веществ на
репродуктивную функцию в зависимости от величины зоны специфического
действия яда (Zsp). Чем выше зона специфического действия, тем опаснее
вещество. Рекомендуемый коэффициент запаса (Qs) при переходе от порога
хронического действия к ПДК также зависит от величины Zsp (табл. 13.2).
Таблица 13.2. Классификация потенциальной опасности влияния промышлен
ных веществ на репродуктивную функцию
Класс опасности ZSp Qs
I. Чрезвычайно опасные > 10 > 50
II. Высокоопасные 4—10 10—50
III. Умеренно опасные 1—3 До 10
IV. Малоопасные < 1 Обычный
464
При обосновании коэффициента запаса для веществ, действующих на
репродуктивную систему, представляется необходимым дополнительно учи-
тывать вариабельность видовой чувствительности по показателям токсич-
ности, поправочный коэффициент, отражающий характер выявляемых эф-
фектов, их обратимость и значимость.
Классификация веществ, применяемых в сельском хозяйстве (пестици-
ды), учитывает вредное воздействие на репродуктивную систему в зависи-
мости от степени выраженности этого эффекта как в эпидемиологических,
так и в экспериментальных исследованиях. Российская классификация пес-
тицидов предусматривает также 4 класса опасности веществ (чрезвычайно
опасные, опасные, умеренно опасные и малоопасные) и включает показа-
тели токсичности при пероральном, накожном, ингаляционном воздейст-
вии, критерии кумулятивного, аллергенного, тератогенного, эмбриотокси-
ческого, репродуктивного, мутагенного, канцерогенного действия и стой-
кости в почве (табл. 13.3).
Таблица 13.3. Критерии тератогенного, эмбриотоксического, репродуктивного
действия пестицидов в зависимости от класса веществ
Изучаемый показатель Класс
чрезвычайно опасный опасный умеренно опасный малоопас- ный
Тератоген- Доказана тератоген- Дозозависимый те- Наличие терато- Отсутствие
ность (при ность для человека в ратогенный эффект генного эффекта тератоген-
наличии эпидемиологических у потомства, вклю- у потомства при ного эффек-
множест- исследованиях или в чая дозы, нетоксич- воздействии доз, та в рамках
венных порядке исключения ные для материнско- токсичных для стандарт-
уродств и в единичных наблю- го организма, или материнского ор- ного прото-
редко встре- дениях на людях в значительное пре- ганизма. Отсутст- кола иссле-
чающихся аномалий вещество может быть перенесено в более вы- сокий класс опасности) сочетании с установ- ленной дозозависи- мой тератогеннос- тью для животных, включая дозы, неток- сичные для материн- ского организма вышение спонтанно- го уровня уродств у животных при воз- действии доз, ток- сичных для матерей вие дозовой зави- симости терато- генного эффекта дований
Эмбриото- Доказана эмбриоток- Дозозависимые про- Выявление эмб- Отсутствие
ксичность сичность для чело- века в эпидемиоло- явления эмбриоток- сичности на живот- риотоксического действия по от- эмбриоток- сического
гических исследова- ниях или в порядке исключения в еди- ничных наблюдени- ях на людях а соче- тании с установлен- ной дозозависимой эмбриотоксичностью в опытах на живот- ных, включая дозы, нетоксичные для ма- теринского организ- ма ных, включая дозы, нетоксичные для ма- теринского организ- ма, или значитель- ное превышение спонтанного уровня данного эффекта у животных при воз- действии доз, ток- сичных для матерей дельным показа- телям у потомст- ва при воздейст- вии доз, токсич- ных для материн- ского организма, при отсутствии дозовой зависи- мости проявле- ний данного эф- фекта эффекта в рамках стандарт- ного прото- кола иссле- дований
465
JI
Продолжение
Изучаемый показатель Класс
чрезвычайно опасный опасный умеренно опасный малоопас- ный
Репродук- Доказано влияние на Дозозависимые из- Влияние на от- Отсутствие тивная ток- репродуктивную менения комплекса дельные показа- репродук- сичность функцию человека показателей репро- тели репродук- тивной ток- в эпидемиологичес- дуктивной функции у тивной функции сичности ких исследованиях животных, включая у животных на в рамках fl или в порядке исклю- дозы, нетоксичные уровне доз, ток- стандарт- -£f s; чения в единичных для материнского и сичных для мате- нота прото- ; наблюдениях на лю- отцовского организ- ринского и отцоа- кола иссле- дях в сочетании с до- мов, или значитель- ского организмов, доааний зозависимой репро- ное превышение Отсутствие дозо- ' ' ' дуктивной токсич- спонтанного уровня вой зависимости ностью на животных, данного эффекта у проявлений дан- включая дозы, неток- животных при воз- него эффекта сичные для материн- действии доз, ток- ского и отцовского сичных для материн- f’; ’ организмов ского и отцоаского организмов
В странах Евросоюза, США, Канаде классификация химических веществ
основывается на наличии или отсутствии убедительных доказательств связи
химического соединения с возникновением нарушений процессов репро-
дукции как у человека, так и в экспериментальных исследованиях. Ведущую
роль при этом играет экспертная оценка, основанная на унифицированных
критериях.
Характеристика подходов к классификации химических веществ, дейст-
вующих на репродукцию в различных странах, представлена в табл. 13.4.
Как видно из табл. 13.4, в разных странах имеются определенные раз-
личия между предлагаемыми системами, например количество категорий
для каждого эффекта, учет специфических эффектов, используемые лими-
тирующие показатели. Кроме того, в странах Европейского Союза для
классификации и маркировки опасных свойств химических веществ (в том
числе действия на репродукцию) применяют R-фразы (фразы риска), кото-
рые используются для информирования людей, применяющих данное ве-
щество. Следующие фразы предлагаются для веществ, классифицируемых
как токсичные для репродукции:
• R60 — может влиять на фертильность;
• R61 — может вызвать вред для здоровья нерожденного ребенка;
• R62 — возможная опасность нарушения фертильности;
• R63 — возможная опасность нанесения вреда нерожденному ребенку;
• R64 — может причинять вред детям, вскармливаемым грудью.
В разных странах существуют списки химических веществ, действующих
на репродуктивную функцию и развитие. Эти списки содержат вещества как
“достаточно доказанные для человека”, так и с вероятным действием на
репродуктивную систему. Например, список веществ, классифицируемых
как токсичные для репродукции, в странах Европейского Союза насчитывает
33 вещества и включает такие химические вещества, как бенз(а)пирен,
сероуглерод, диметилформамид, 2-этоксиэтанол, соединения свинца, 2-ме-
466
467
токсиэтанол, никеля тетракарбонил и др. Имеются списки потенциальных
репродуктивных токсикантов во многих странах.
В нашей стране действуют СанПиН (Санитарные правила и нормы)
2.2.0555-96, содержащие перечень химических веществ (156 веществ), спо-
собных оказывать негативное действие на репродуктивную функцию. Вместе
с тем он нуждается в уточнении с учетом избирательности действия веществ
на репродуктивную систему, так как основным недостатком ранее проводи-
мых исследований было использование высоких доз веществ, которые вы-
зывали тяжелые токсические повреждения всех органов и систем, включая
и репродуктивную, а также установлении ПДК без учета специфического
действия.
В России разрабатывается единая классификация репротоксикантов, од-
нако существует настоятельная необходимость гармонизации имеющихся
классификаций для создания единой международной классификации ве-
ществ, действующих на репродукцию.
Таким образом, на современном этапе основными задачами токсиколо-
гии при изучении действия химических веществ на процессы репродукции
являются оценка действия новых химических соединений на репродукцию,
разработка методов прогнозирования развития гонадотропных и эмбрио-
тропных эффектов, унификация отечественных и зарубежных критериев
оценки опасности химических соединений на репродуктивное здоровье ра-
ботающих.
ЛИТЕРАТУРА
1. Абрамченко В. В. и др. Репродуктивная функция и особенности течения родов у
работниц полимерперерабатывающей промышленности. 3-я Всесоюзная конфе-
ренция “Эндокринная система организма и вредные факторы внешней среды”. —
Л., 1987. - С. 4.
2. Айламазян Э.К., Беляева Т.В., Виноградова Е.Г. Влияние экологической обстанов-
ки на репродуктивное здоровье женщины//Вестн. Рос. ассоциации акушеров-
гинекологов. — 1996. — № 2. — С. 13—19.
3. Алекперов И.И., Мир-Багирова Д.Д., Аливердиева Ш.С. Влияние производствен-
ных факторов на специфические функции, течение беременности и родов у
работниц производственного объединения “Оргсинтез”//Гиг. труда и профзабо-
леваний. — 1992. — № 2. — С. 9—11.
4. Англо-русский глоссарий избранных терминов по профилактической токсиколо-
гии. Промежуточный документ. Программа ООН по окружающей среде. — М.:
ГКНТ, 1982. - 68 с.
5. Андреева М.А. Влияние продуктов органического синтеза на клинику беремен-
ности, родов, состояние внутриутробного плода и новорожденного: Автореф-
дис. ... канд. мед. наук.— Л., 1980.
6. Баранов А.А. и др. Медицинские и экологические проблемы охраны материнства
и детства. — Н.Новгород: ГИПП “Нижполиграф”, 1993.
7. Баранов А.А., Волкова З.А., Сивочалова О.В., Кожин А.А. Медицинские и эколо-
гические проблемы охраны материнства и детства. — 1993. — 220 с.
8. Возовая М.А. Гинекологическая заболеваемость у работниц основных профессий
завода резинотехнических изделий. — В кн.: Гигиена труда и состояние специ-
фических функций у работниц нефтехимической и химической промышленнос-
ти: Сборник. — Свердловск, 1974. — С. 56—62.
9. Гайнуллина М.К., Каримова Л.К. Состояние здоровья женщин-работниц нефте-
468
перерабатывающих заводов//Медицина труда и промэкология. —1995. — № 12. —
С. 20-24.
Ю Гигиена труда женщин/Под ред. Н.Ф.Измерова, Х.Г.Хойблайна. — М.: Медици-
на, 1985. — 240 с.
11. Глущенко В.И. Натурные и экспериментальные исследования общего токсичес-
кого и специфического на сексуальную сферу действия винилхлорида и анти-
монита: Автореф. дис. ... канд. мед. наук. — М., 1980. — 27 с.
12. Глущенко В.И., Барабанов А.А. Состояние сексуальной сферы у рабочих, контак-
тирующих со свинцом. Современные проблемы гигиены труда и профпато-
логии. — В кн.: Сб. научн. трудов. — М., 1982. — № Д. — 4713 с.
13. Гончарук Е.И., Сидоренко Г.И, Голубчиков М.В., Прокопович С.А. Использование
системы мать — плод — новорожденный для изучения комбинированного дей-
ствия пестицидов и других химических веществ//Гигиена и санитария. —
1990. - № 6. - С. 4-7.
14. Давтян Р.М. Токсикологическая характеристика действия хлоропрена на репро-
дуктивную функцию: Автореф. дис. ... канд. мед. наук. — М., 1974. — 25 с.
15. Димитриев Д.А. Проблемы оценки влияния окружающей среды на репродуктив-
ное здоровье//Гиг. и сан. — 1997. — № 5. — С. 52—54.
16. Дыбан А.П., Баранов В.С., Акимова И.М. Основные методические подходы к
тестированию тератогенной активности химических веществ//Архив анат., гист.,
эмбр. — 1970. — № 10. — С. 89—99.
17. Иванов Ю.В. Ускоренные цитологические и цитофизиологические методы в
оценках гонадотоксического действия химических веществ. Ускоренные методы
санитарно-гигиенического нормирования вредных веществ в воздухе рабочей
зоны//Материалы Всесоюзной научной конференции. — Ереван, 1988 —С. 135—
137.
18. Изюмова А. С. Гинекологическая заболеваемость и менструальная функция ра-
ботниц производства полистирола: Автореф. дис. ... канд. мед. наук. — М., 1972.
19. Карш Ф., Линкольн Д.У., Линкольн Дж.А. и др. Гормональная регуляция размно-
жения у млекопитающих/Под ред. К.Остина и Р.Шорта. — М.: Мир, 1987. —
305 с.
20. Касаткин А.И. Экспериментальное исследование критериальной значимости
состояния репродуктивной системы женских особей для оценки опасности
новых промышленных веществ: Автореф. дис. ... канд. мед. наук. — Горький,
1989. - 24 с.
21. Кирющенков А.П. Влияние вредных факторов на плод. — М.: Медицина, 1978. —
С. 214.
22. Колесникова Т.Н. К вопросу о патогенезе вторичной аменореи у работниц произ-
водства фенолформальдегидных смол. — В кн.: Гигиена труда и состояние спе-
цифических функций у работниц нефтехимической промышленности. — Сверд-
ловск, 1974.-С. 129-135.
23. Коновалов О.Е. Социально-гигиенические аспекты распространенности абсо-
лютного и относительного бесплодия у мужчин//3дравоохранение РФ. — 1998. —
№ 1. - С. 36-37.
24. Коршунов С.Ф. Состояние эмбриона, плода и новорожденного в условиях дей-
ствия на организм матери фенолформальдегидных смол: Автореф. дис. ... канд.
мед. наук. — М., 1975.
25. Кулаков В.Н., Фролова О.Г. Медицинские и социальные аспекты охраны здоро-
вья работающих женщин//Вестн. РАМН. — 1997. — № 4. — С. 35—37.
469
26. Курмангалиев О.М. Общее токсическое и специфическое (гонадотропное) дей-
ствие шестивалентного хрома на мужской организм (Клинико-эксперименталь-
ное исследование): Автореф. дис. ... канд. мед. наук. — М., 1990. — 24 с.
27. Макаров И.А., Соловьева М.С., Гнелицкий Г.И. К вопросу о сексуальных наруше-
ниях у женщин, подвергавшихся хроническим воздействиям ММА и ВХ//Гиг.
труда и профзаболеваний. — 1984. — № 3. — С. 22—27.
28. Манджгаладзе Р.Н. Влияние соединений марганца на процессы репродукции:
Автореф. дис. ... д-ра мед. наук. — М., 1969.
29. Меерсон Е.А. Гигиена труда на этапах эксплуатации современных химических
производств и совершенствование медико-социального обеспечения работаю-
щих: Автореф. дис. ... д-ра мед. наук. — М., 1990.
30. Меерсон Е.А., Ермакова О.М. Интегративная экология и репродуктивное здоро-
вье женщин. — В кн.: Эколого-физиологические проблемы адаптации: материа-
лы VIII международного симпозиума, 27—30 янв. — М., 1998. — С. 254.
31. Методы экспериментального исследования по установлению порогов действия
промышленных ядов на генеративную функцию с целью гигиенического нор-
мирования: Методические рекомендации. — М., 1978. — 35 с.
32. Мотеюнене Н.П. Влияние малых концентраций паров ртути на заболеваемость
и материнскую функцию женщин: Автореф. дис. ... канд. мед. наук. — 1970. —
24 с.
33. Новиков С.М., Авалиани С.Л., Пономарева О. В. и др. Оценка риска воздействия
факторов окружающей среды на здоровье человека. Англо-русский глоссарий. —
М., 1998. - 146 с.
34. Оскерко Е.Ф. Общее токсическое и специфическое (гонадотропное и мутаген-
ное) действие, особенности нейроэндокринной регуляции репродуктивной
функции при воздействии аллил-аллилоксикарбонилоксиакрилата: Автореф.
дис. ... канд. мед. наук. — Горький, 1987. — 24 с.
35. Павленко Г.И., Силантьева И.В., Фоменко В.И Актуальные вопросы оценки
опасности влияния экзогенных веществ на репродуктивную функцию//Токси-
кол. вестн. — 1997. — № 6. — С. 12—17.
36. Пименова М.С., Янно Л.В., Бакина В.Н., Сушенок А.В. Оценка мутагенного
действия химического фактора на работающих//Медицина труда и промышлен-
ная экология. — 1997. — № 6. — С. 19—22.
37. Потапов А.И., Ракитский В.Н., Шицкова А.П. и др. Российская гигиеническая
классификация пестицидов//Гиг. и сан. — 1997. — № 6. — С. 21—24.
38. Принципы оценки риска для потомства в связи с воздействием химических
веществ в период беременности. — В кн.: Гигиенические критерии состояния
окружающей среды. — Вып. 30. — Женева, 1988.
39. Райцина С.С. Гематотестикулярный барьер. Современные проблемы спермато-
генеза/Под ред. Т.Д.Детлаф. — М.: Наука. — 1982. — С. 191—216.
40. Сальникова Л.С., Фоменко В.Н. Экспериментальное исследование влияния хло-
ропрена на эмбриогенез//Гиг. труда. — 1973. — № 8. — С. 23—26.
41. Савченко О.Н. Гормоны яичника и гонадотропные гормоны/Под ред. В.Г.Бара-
нова — Л.: Медицина. — 286 с.
42. Саноцкий И.В., Фоменко В.Н. Отдаленные последствия влияния химических
соединений на организм. — М.: Медицина, 1979. — 230 с.
43. Саноцкий И.В., Монаенкова А.М., Курляндский Б.А., Литвинов Н.Н. и др. CHJ&-
ленные эффекты действия химических соединений. — В кн.: Токсикометрия
470
химических веществ, загрязняющих окружающую среду. — М.: ЦМП ГКНТ,
1986. - С. 252-316.
44. Серов В.Н, Кожин А.А., Прилепская В.Н. Клинико-физиологические основы
гинекологической эндокринологии. — Ростов-на-Дону: Эверест, 1998. — 368 с.
45. Сивочалова О.В. Влияние растворителей на репродуктивную функцию работаю-
щих женщин (на примере диметилформамида). Современные проблемы диа-
гностики и лечения нарушений репродуктивного здоровья женщин. — В кн.:
Сборник научных трудов II съезда акушеров-гинекологов Северного Кавказа
9—11 сент., Ростов, 1998. — Ростов-на-Дону, 1998. — С. 414.
46. Сивочалова О.В., Денисов Э.И., Радионова ГК. От гигиены труда женщин к
охране репродуктивного здоровья работающих. Принципы и перспективы//Ме-
дицина труда и промышленная экология. — 1998. — № 7. — С. 19—22.
47. Силантьева И.В. Исследование эмбриотропного действия этиленимина. — В кн.:
Токсикология новых промышленных веществ. — Вып. 13. — М.: Медицина,
1972. - С. 70-76.
48. Соболев В.Б. Особенности течения беременности, родов и состояния здоровья
новорожденных у работниц производства полимеров на основе стирола. — В кн.:
Респ. сборник научных работ. Актуальные вопросы перинатологии. — М.,
1978.-Т. 1.-С. 145-150.
49. Соколова И.И., Савельева И.С., Малышева З.В., Тютюник И.Ф., Ерофеева Л.В.
Репродуктивное здоровье и экология. Проблемы и возможные пути решения.
Современные проблемы диагностики и лечения нарушений репродуктивного
здоровья женщин. — В кн.: Сборник научных трудов II съезда акушеров-гине-
кологов Северного Кавказа, 9—11 сент., Ростов, 1998 г. — Ростов-на-Дону,
1998 г. - С. 402.
50. Федорова Е.В. Влияние условий труда и быта женщин-маляров на состояние
здоровья их детей: Автореф. дис. ... канд. мед. наук. — М., 1992.
51. Федотова И.В. Профессиональный контакт женщин с метилметакрилатом и
негативные тенденции в процессе деторождения. — 1997. — № 4. — С. 19—21.
52. Фесенко М.А. Об избирательном действии противосиликотического препарата
пиракрила на репродуктивную систему//Гиг. труда и профзаболеваний. — 1987. —
№ 5. - С. 30-32.
53. Фокеева В. В. Роль химических антропогенов в экопатологии детского возраста. —
М„ 1995. - С. 60-66.
54. Фоменко В.Н. Использование ускоренных методов для выявления отдаленного
действия промышленных ядов на репродуктивную функцию. Ускоренные мето-
ды санитарно-гигиенического нормирования вредных веществ в воздухе рабочей
тоны. — В кн.: Материалы Всесоюзной научной конференции, Ереван, 1988. —
55. Хайруллина А.Ш. Состояние некоторых специфических функций женщин-работ-
ниц в производстве изделий из наиритовых латексов: Автореф. дис. ... канд. мед.
наук. — М., 1974.
56. Червякова А.П. Состояние репродуктивной функции подвергающихся комбини-
рованному воздействию химических соединений и пути профилактики ее нару-
шений: Автореф. дис. ... д-ра мед. наук. — Л., 1984.
57. Чиркова Е.М. Токсикологическая характеристика гонадотропного действия про-
фессиональных ядов: Автореф. дис. ... канд. мед. наук. — М., 1970. — 27 с.
58. Шашкина Л.Ф., Голубева М.И., Рожнов Г.И., Курляндский Б.А. и др. Сравнитель-
ная оценка опасности эстрогенных гормонов в условиях производства и окру-
жающей среды//Токсикол. вестн. — 1994. — № 6. — С. 25—29.
471
59. Яглов В.В., Шеина Н.И., Фесенко М.А. Тканевые базофилы — информативная
модель выявления вредных веществ в токсикологических исследованиях//Гиг.
труда и профзаболеваний. — 1991. — № 5. — С. 23—26.
60. Barlow S.M., Sullivan F.M. Reproductive Hazards of Industrial Chemicals: In Evalu-
ation of Animal and Human Data. — New York: Academic Press, 1982.
61. Berlin M., Lee I.P., Russel D. Effects of metals on male reproduction. Reprod, and
devel. Toxity metals. Proc. Joint. Meet. — Rochester, 24—27 May, 1982. — London
1983. - P. 28-40.
62. Bibbc M., Gill W.B., Azizi F. Follow study of mail and female off spring of DES exposed
mothers//Obstet. Gynecol. — 1977. — Vol. 49. — P. 1—8.
63. Bitman J., Cecil H.C. Estrogenic activity of DDT analogs and of polychlorinated
hydroxybiphenyls//J. Argic. Food Chem. — 1970. — Vol. 18. — P. 1108—1112.
64. Chapin R.E., Sloane R.A. Reproductive assessment by continuous breeding: evolving
study design and Summaries of ninety studies//Environ. Health Perspect. — 1997 —
Vol. 105, suppl. 1. - P. 199-395.
65. Detailed Review Document on Classification Systems for Reproductive Toxicity in
OECD Member Countries. — Paris: Publisher Organisation For Economic Co-Opera-
tion And Development, 1999, OECD Series On Testing And Assessment, Number 15.
66. Environmental Protection Agency. Proposed Amendedinents to the guidelines for the
Health Assesment of Suspect Developmental Toxins//Fed. Reg. 54. — 1989. —
P. 9386-9403.
67. Gellert Kio Wallace G., Wiesmeier E., Shuman R. Topical exposure of neonatales to
hexacnloropheme; long-standing effects on mating behavior and prostatic development
in rats//Toxicol. and Appl. Pharmacol. — 1978. — Vol. 43, N 2. — P. 339—342.
68. James W.H. Offspring sex ratio as an indicator of reproductive hazards associated with
pesticides [letter]//Occup. Environ. Med. — 1995. — Jun. — 52(6). — P. 429—430.
69. Kar A.B., Das R.P., Karkun J.N. Ovarian changes in prepubeital rats after treatment
wirh cadmium chloride//Acta. Bwl. Med. Germ. — 1959. — Vol. 3. — P. 272.
70. Korach K.S., Sarver P., Chae K., McLachlan J.A., McKinnev J.D. Estrogen receptor-
binding activity of polychlorinated hydroxybiphenyls: Conformationally restricted struc-
tural probes//Mol. Pharmacol. — 1988. — Vol. 33. — P. 120—126.
71. Коута L, Wada T., Nishisawa et al. Cyclophosphamide induced ovarian failure and
its therapeutic significance in patient with breast cancer//Cancer. — 1977. — Vol. 39. —
P. 1403-1409.
72. Latropoules M.J., Hobson W., Knauf V., Adams H.P. Morphological effects of hexaclor-
bensene toxicity in female rhesus monke//Toxicol. Appl. Pharmacol. 1976. — Vol. 37. —
P. 433-444.
73. Maronpot R.R. Ovarian toxicity and carcinogenicity in eight recent national toxicology
program studies//Environ. Health Perspect. — 1988. — Vol. 73. — P. 125—130.
74. Mattison D.R., Plowchalk D.R., Meadows M.J. et al. Reproductive toxicity: Male and
female reproductive systems as targets for chemical injury//Med. Clin. North. Am. —
1990. - Vol. 74. - P. 391-411.
75. Mattison D.R. The mechanisms of action of reproductive toxins//Am. J. Ind. Med. —
1983. - Vol. 4. - P. 65-79.
76. Mchachlan J.A., Newbold R.R. Estrogenic and Development Environ//Health Pers-
pect. - 1987. - Vol. 75. - P. 25-27.
77. Methods in Toxicology. Female Reproductive Toxicology/Ed. J.J.Heindel, R.E.Chapin.
Academic Press. — 1993. — Vol. 3. — Part B. — 404 p.
472
78. Methods in Toxicology. Male Reproductive toxicology/Ed. R.E.Chapin, J.J.Heindel.
Academic Press. — 1993. — Vol. 3. — Part A. — 389 p.
79 Rom W.N. Effects of lead on the female and reproduction: A review. Mt. Sinai//J.
Med. (NY). - 1976. - Vol. 43. - P. 542-550.
80 Scialli A.R., Zinaman M.J. Reproductive toxicology and infertility. — USA. — 1993. —
338 p.
81. Spielman H. Reproduction and Development//Environ. Health Perspect. — 1998,—
Vol. 106. Suppl 2. — P. 571—576.
82. U.S. EPA Guidelines for Reproductive Toxicity Risk Assessment, EPA/630/R-96/009. —
Washington: DC. — 1996 p.
83. Willis W.O., de Peyster A., Molgaard C.A., Walker C. et al. Pregnancy outcome among
women exposed to pesticides through work or residence in an agricultural area//J. Oc-
cup. Med. - 1993. - Sep. - 35 (9). - P. 943-949.
84. WHO Scientific Group: Principles of the testing of drugs for teratogenicity. WHO
Technical Report Series. — 1967. — 364. — P. 1 — 18.
Глава 14
ОСНОВЫ ПРОФИЛАКТИЧЕСКОЙ ТОКСИКОЛОГИИ
14.1. Задачи и принципы
Многообразие путей и форм воздействия вредных веществ на здоровье
человека, необходимость их изучения и предупреждения интоксикаций при-
вели к созданию одного из самых многогранных разделов химиобиологии —
профилактической токсикологии.
Зародившись в конце XIX — начале XX в. на стыке гигиены и клиники
профессиональных болезней химической этиологии первоначально как со-
путствующая дисциплина, как метод решения гигиенических проблем, это
направление обрело самостоятельное значение, став ведущим в понимании
природы интоксикаций, зависимости их возникновения и течения от
свойств вещества и условий воздействия. Благодаря основополагающим
работам отечественных токсикологов Н.П.Кравкова (1927) [15], Н.С.Прав-
дина (1934) [32], Н.В.Лазарева (1938) [24] профилактическая токсикология
превратилась в самостоятельную область знания, имеющую свой предмет,
свою методологию, свой понятийный аппарат. Происходившая в начале 70-х
годов [38] активная дискуссия о предмете, задачах и методах профилакти-
ческой (гигиенической) токсикологии, о том, что она является самостоя-
тельной наукой, а не методическим инструментом гигиены, в недрах кото-
рой она зародилась, закончилась аргументированным признанием профи-
лактической токсикологии в качестве самостоятельной дисциплины.
Приходится специально останавливаться на этом аспекте проблемы,
поскольку по сей день сохраняют свои названия традиционные разделы
профилактической токсикологии, обусловленные их первичной гигиеничес-
кой предназначенностью: промышленная токсикология, коммунальная ток-
сикология, пищевая токсикология и т.д. Следует также отметить, что, не-
смотря на определенные различия, связанные с условиями воздействия
веществ на организм, все перечисленные направления используют практи-
чески одни и те же методы изучения токсического действия, отличаясь лишь
деталями моделирования условий воздействия и интерпретацией результатов
исследований применительно к поставленным практическим задачам.
Изложенное выше, а также разработка в рамках профилактической ток-
сикологии таких фундаментальных проблем, как адаптация к химическим
воздействиям, патогенез интоксикации, влияние на иммунный гомеостаз,
отдаленные последствия и ряд других, дают полное основание считать про-
филактическую токсикологию самостоятельным направлением медицинской и
токсикологической науки, задачей которого является всестороннее изучение
взаимодействия организма человека и химических факторов среды, оценка
реальной опасности веществ, обоснование их минимально действующих и без-
опасных количеств, а также допустимых пределов риска с целью профилак-
тики неблагоприятного влияния на здоровье человека [34, 36, 47].
Задачи и методы профилактической токсикологии сегодня достаточно
четко определены, а ее преимущественно практическая направленность обу-
словливает соответствующие принципы, критерии, методические подходы.
474
Профилактической токсикологии, ее проблемам и методам посвящено, по-
жалуй, наибольшее количество токсикологических публикаций, в том числе
и обстоятельных монографий и руководств, что существенно облегчает
задачу автора этого раздела, позволяя адресовать читателя к соответствую-
щему литературному источнику, а также к предыдущим разделам книги.
Научная методология профилактической токсикологии базируется на ши-
роком круге медико-биологических дисциплин, позволяющих понимать
природу интоксикации, ее симптомы, выявлять преимущественно реагирую-
щие системы, оценивать влияние вещества на взаимодействие организма с
окружающей средой [19].
Другой важной особенностью методологии профилактической токсико-
логии наряду с изучением влияния свойств вещества на характер и степень
его воздействия на организм является необходимость учитывания условий,
в которых это воздействие совершается, т.е. путей поступления, количества
и качества вещества, экспозиции. Столь многостороннее изучение действия
вещества позволяет оценивать его с позиций критерия вредности, обосно-
вывать количественные параметры воздействия, устанавливать пределы,
обеспечивающие безопасные условия производства и применения [17].
Методология профилактической токсикологии базируется также на необ-
ходимости превентивной оценки действия вещества на организм с целью по-
лучения информации, достаточной для предупреждения вредного влияния и
последующего безопасного обращения.
Основным методическим приемом профилактической токсикологии явля-
ется проведение экспериментальных исследований на адекватных биологичес-
ких моделях, а также наблюдений влияния химических веществ на здоровье
человека [35].
Токсикологическое исследование вещества в профилактических целях
состоит из следующих основных этапов:
• сбор информации об основных свойствах вещества, возможных усло-
виях обращения в окружающей среде и его воздействий на организм;
• создание экспериментальных токсикологических моделей, адекватных
реальным условиям воздействия вещества на организм человека;
• изучение патогенетической значимости изменений, происходящих в
организме при воздействии вещества, и их оценка с позиций критерия
вредности;
• экстраполяция получаемых данных на человека, научное обоснование
степени опасности вещества и регламентирование условий его обра-
щения.
14.2. Информация об основных свойствах вещества
и условиях его воздействия на организм
Разнообразие возможных условий реального контакта человека с токсич-
ным веществом требует тщательного изучения как свойств этого вещества,
так и условий его воздействия. Получение информации необходимо для про-
гноза токсичности и опасности вещества, а также для обоснования програм-
мы экспериментальных исследований по его токсиколого-гигиеническому регла-
ментированию. Информация о веществе должна быть исчерпывающей и до-
стоверной. Единицы измерения, в которых представляется информация,
Должны соответствовать международным и российским стандартам. Следует
особенно обратить внимание на то, что профилактическая токсикология,
475
пожалуй, как ни одна другая область медицинской науки, требует исполь-
зования четких формализованных показателей, касающихся свойств веще-
ства и описания реакций организма на токсические воздействия.
Сведения о веществах, подлежащих токсикологическому исследованию
в профилактических целях, определены документом “Гигиенические крите-
рии для обоснования необходимости разработки ПДК и ОБУВ(ОДУ) вред-
ных веществ в воздухе рабочей зоны, атмосферном воздухе населенных мест,
в воде водных объектов (ГН 1.1.701-98). В зависимости от объема и характера
информации решается вопрос об уровне регламентирования и программе
экспериментальных исследований. Планирование эксперимента и интерпре-
тация получаемых данных также во многом зависят от имеющейся инфор-
мации о веществе.
Наряду с условиями производства и применения вещества, знание ко-
торых является обязательным, необходимы сведения о его строении, т.е.
эмпирическая и структурная формулы, а также известные синонимы и
торговые наименования.
Поскольку для проведения токсикологических исследований требуется
предварительный анализ информации о веществе, опубликованной в отече-
ственных и зарубежных источниках, первостепенное значение имеет иден-
тификация вещества в соответствии с международными требованиями. Та-
ковыми являются “Правила международного союза теоретической и при-
кладной химии” (International Union of Pure and Apleied Chemistry, IUPAC), a
также система идентификации CAS (Chemical Abstract Servise). Соблюдение
указанных условий позволяет быть уверенным в том, что речь идет именно
о том веществе, токсические свойства которого подлежат изучению. При-
мером может служить идентификация изомеров, имеющих общую эмпири-
ческую формулу.
Поведение вещества в организме и в окружающей среде зависит от его
физико-химических свойств. К числу основных показателей в связи с этим
относится молекулярная (атомная) масса вещества, существенно влияющая
на его свойства. Так, с повышением молекулярной массы возрастает тем-
пература кипения, снижается упругость пара, падает растворимость в воде,
повышается растворимость в жирах и органических растворителях. И на-
оборот, с уменьшением молекулярной массы физико-химические свойства
вещества изменяются в сторону повышения их опасности.
Точка (температура) кипения (t °C) представляет собой показатель, тесно
связанный с опасностью вещества, особенно при ингаляционном и кожном
поступлении в организм, поскольку от его величины зависят насыщающая
концентрация вещества, упругость пара, летучесть. Известны тесные корре-
ляции между температурой кипения вещества и его токсическими свойст-
вами.
Способность веществ растворятся в воде и жирах имеет важное значение
с точки зрения их поведения в организме. Так, вещества, хорошо раствори-
мые в воде, легко поступают в кровь при внутрижелудочном и ингаляцион-
ном введении. Они опасны с точки зрения возможности возникновения
острого отравления. Хорошо растворимые в воде газы и пары способны
поражать верхние дыхательные пути, конъюнктиву и слизистые оболочки
глаз. Вещества, малорастворимые в воде, не задерживаются в верхних ды-
хательных путях, достигают легких, вызывая их поражение. С гигиенической
точки зрения водорастворимые вещества опасны при поступлении в водо-
емы. С другой стороны, вещества, хорошо растворимые в жирах, способны
накапливаться в организме, подвергаться метаболическим превращениям,
476
оказывать кумулятивное действие. В качестве примера можно привести
ДДТ, полихлорированные бифенилы, ряд пестицидов. Жирорастворимые
соединения, как правило, хорошо проникают через кожу. Наиболее инфор-
мативным показателем в этом отношении является коэффициент распреде-
ления октанол/вода (log kow), по величине которого можно судить о харак-
тере распределения и накопления веществ в биосредах организма. В качестве
примера различия токсического действия в зависимости от растворимости
можно привести токсичность неорганических водорастворимых солей ме-
таллов и их жирорастворимых органических соединений [44].
С другой стороны, твердые, малорастворимые полиэлектролиты способ-
ны оказывать фиброгенное действие, определяемое поверхностными свой-
ствами частиц, а не их растворимостью. Что касается водородного показа-
теля (pH), то его значение свидетельствует о мере способности вещества
оказывать раздражающее действие на кожу и слизистые оболочки в равной
мере как для кислот, так и для щелочей. Примером может служить действие
гидроксидов щелочных металлов, а также различие в действии органических
и неорганических кислот.
О роли реакционной способности вещества можно подробно прочитать
в соответствующем разделе предлагаемой книги (хемобиокинетика). С этим
показателем более всего связана специфическая активность веществ, их
способность вступать во взаимодействие с активными структурами клетки,
подвергаться биотрансформации, образовывать активные метаболиты. Уста-
новлена связь реакционной способности веществ с их специфической ак-
тивностью, органотропностью, канцерогенной и мутагенной активностью
и т.д.
Большое значение в профилактической токсикологии придается такому
показателю, как стабильность вещества. Способность длительное время со-
храняться в окружающей среде, не подвергаясь существенным изменениям,
резко повышает опасность соединений, обладающих биологической актив-
ностью. Особенно это касается стойких органических соединений, способ-
ных включаться в пищевые и иные цепи, переноситься с водой и воздухом
на большие расстояния. К подобным веществам относятся ДДТ, полихло-
рированные бифенилы, диоксины и др.
Связь между структурой вещества, определяющей его основные свойства,
и активностью является фундаментальной характеристикой поведения хими-
ческих веществ в организме. Знание и понимание указанных закономернос-
тей позволяет строить математические модели поведения веществ в орга-
низме и прогнозировать параметры токсических эффектов [43].
14.3. Создание экспериментальных моделей, адекватных
условиям воздействия вещества на организм человека
Воспроизведение в эксперименте на животных процессов взаимодействия
химического вещества и организма составляет сегодня методическую основу
большинства токсикологических исследований [35]. Несмотря на то что эти-
ческие, материальные и другие актуальные проблемы обязывают настоятель-
но ставить вопрос об исключении теплокровных животных из токсикологи-
ческих экспериментов и замене их альтернативными моделями, опыты на
теплокровных являются сегодня преобладающими при оценке токсичности
и опасности веществ [5]. В качестве подопытных животных в токсикологи-
ческих исследованиях используются преимущественно грызуны: кролики,
Морские свинки, белые крысы, мыши. Значительно реже используются
477
собаки и кошки. Наиболее массово токсикологические эксперименты про-
водятся на беспородных животных, белых крысах и мышах. Они устойчивы
к интеркуррентным заболеваниям и равновесно стабильны с точки зрения
репрезентативности исследуемых функций и показателей. В тех случаях,
когда возникает необходимость изучения влияния химических веществ на
специфические функции, преимущественно свойственные отдельным видам
или породам животных, используют так называемых линейных животных,
получаемых в результате близкородственного разведения (инбридинга).
Такие животные могут быть низкораковыми или высокораковыми, низко-
лейкемическими или высоколейкемическими и т.д. Из линейных животных
для проведения массового токсикологического эксперимента наиболее при-
годна линия крыс “Вистар” аутбредного (стадного) разведения.
Что касается морских свинок, то они являются оптимальным объектом
для изучения аллергических реакций и накожных эффектов, в том числе и
резорбции ядов через кожу. Для аналогичных целей широко используются
кролики, особенно при изучении накожного и кожно-резорбтивного дейст-
вия, а также влияния веществ на слизистую оболочку глаз и роговицу.
Крольчихи являются хорошим объектом для изучения функции яичников.
Кролики представляют прекрасную модель для изучения безусловнорефлек-
торной деятельности. Собаки и кошки довольно редко используются в
токсикологии. Вместе с тем описано значительное число исследований на
собаках по изучению влияния химических веществ на пищеварение, цент-
ральную и вегетативную нервную систему, а также на кошках по изучению
биоэлектрической активности головного мозга.
Токсикологические исследования на биологических моделях в профи-
лактической токсикологии занимают ведущее место и проводятся в следу-
ющих целях:
• установление основных параметров токсичности веществ при остром,
подостром и хроническом воздействии (LD50, LC50, Kcum, Limac,
Limch и др.) при адекватных реальным условиям путях поступления
в организм (токсикометрия);
• выявление преимущественно поражаемых органов и систем при раз-
личных условиях, путях и времени воздействия, изучение патогенеза
интоксикации;
• изучение механизма действия вещества и его превращений в организ-
ме;
• изучение способности вещества вызывать отдаленные последствия
интоксикации и воздействовать на наследственные свойства;
• оценка полученных результатов исследований с позиций “критерия
вредности”, обоснование показателей опасности и допустимых коли-
честв вредных веществ, а также пределов риска;
• разработка методов специфической и неспецифической профилакти-
ки и терапии отравлений.
Предлагаемая система исследований является хотя и широко принятой,
но достаточно схематичной. Вместе с тем многообразие вопросов, возника-
ющих при изучении действия вещества на организм, предоставляет иссле-
дователю достаточную свободу выхода за ее пределы, более того, обязывает
помнить о том, что любая схема — одновременно постоянное напоминание
о необходимости творческого подхода, совершенствования и расширения
пределов знания.
478
14.4. Установление основных параметров
токсичности (токсикометрия)
Количественная характеристика токсических свойств веществ основыва-
ется на фундаментальном представлении о яде как о субстанции количест-
венной. Используя в качестве объективного свойства вещества его способ-
ность вызывать измеряемый эффект, исследователь получает возможность
не только количественной оценки данного эффекта, но и его сравнения
с аналогичными или иными эффектами в унифицированных единицах
измерения [46].
Базовым показателем среди количественных характеристик токсичности
рассматриваются смертельный эффект и его зависимость от дозы (концент-
рации). Числовым выражением этой зависимости служат средняя смертель-
ная (летальная) доза LD50 и средняя смертельная концентрация LCjq, имею-
щие вероятностное значение и стандартизованные параметры достовернос-
ти: среднюю ошибку m и среднее квадратическое отклонение S. Выбор
единиц измерения определяется агрегатным состоянием вещества и путями
поступления его в организм. Так, средняя смертельная доза выражается в
единицах массы вещества, отнесенных к единице массы тела подопытного
животного (г/кг). Как правило, при помощи средней смертельной дозы
(LD50) оценивают абсолютную ядовитость вещества при внутрижелудочном,
внутрибрюшинном, внутривенном, внутримышечном путях введения. В от-
дельных случаях среднесмертельные дозы (LD50) могут быть отнесены к
единице поверхности, например кожи (мг/см2).
Средняя смертельная концентрация (LC50) используется при оценке
ингаляционных отравлений, а также в тех случаях, когда необходимо оха-
рактеризовать ядовитость растворов вредных веществ. В качестве единиц
измерения концентрации используется отношение количества вещества к
единице объема (г/м3, мг/л и т.д.).
Если величины смертельных доз и концентраций рассматриваются как
показатели абсолютной токсичности яда, то в качестве показателя ядови-
тости (токсичности) используется величина, обратная LD50, LC50, т.е.
'/LD50, i/LC50, где чем выше значение дроби, тем более токсично вещество.
Выбор пути введения является достаточно сложным и требует серьезной
научной и практической аргументации. С одной стороны, обязательно изу-
чение действия вещества при пути поступления в организм, адекватном
таковому в реальных условиях среды. С другой стороны, следует учитывать
особенность прохождения вещества через тканевые барьеры, его метабо-
лизм, воздействие на клеточные рецепторы. Все это обязывает исследователя
Широко рассматривать проблему выбора пути введения, исходя из свойств
вещества и прогноза его реальной опасности.
Уже на начальных этапах исследования различие токсичности вещества
при различных путях введения позволяет предполагать особенности его
поведения в организме подопытных животных и человека. Наиболее реаль-
ным путем поступления вещества в организм является внутрижелудочный.
Использование его в эксперименте, за редким исключением, является универ-
сальным, так как этот путь введения позволяет проводить адекватную
сравнительную стандартизованную оценку токсичности веществ. Исключе-
ние представляют лишь те вещества, которые по своим физико-химическим
свойствам технически не могут быть введены per os. В этих случаях пара-
метры острой токсичности либо устанавливаются при иных способах и путях
479
введения, либо констатируется невозможность данного вещества вызывать
отравление при поступлении через ЖКТ.
Методика оценки острой ингаляционной токсичности описана достаточ-
но полно [31]. Обязательным условием проведения ингаляционного экспе-
римента является внесение определенного количества вещества в единицу
объема вдыхаемого воздуха. Условие это должно соблюдаться при любом
способе ингаляционной затравки как статической, так и динамической и
при условии объективного контроля за содержанием вещества. Создание
расчетных концентраций путем внесения заданных количеств вещества в
измеренный объем должно рассматриваться как исключение.
Важную информацию об ингаляционной опасности вещества для пла-
нирования ингаляционного эксперимента можно получить путем проведе-
ния предварительной статической затравки в условиях максимального на-
сыщения воздуха затравочной камеры парами вещества. Учет числа погиб-
ших животных и времени их гибели позволяет использовать насыщающую
концентрацию в качестве основы для расчета концентраций, подлежащих
испытанию в условиях острого ингаляционного эксперимента.
Изучение острой токсичности при других путях введения при различных
методических приемах основывается на тех же принципах, о которых можно
прочитать в большом числе методических указаний и руководств. Матема-
тическая обработка результатов исследования острой токсичности подробно
изложена [1].
Весьма часто исследователь встречается с ситуацией, когда максимально
достижимые при поступлении в организм количества вещества не вызывают
гибели животных. В этом случае целесообразно характеризовать указанные
количества вещества величиной LDjoCLCso), не имеющей вероятностных
характеристик и трактуемой как максимально переносимая.
Информативным показателем для оценки острого токсического действия
вещества является расчет среднего времени гибели животных LD50, позво-
ляющего прогнозировать время развития интоксикации и оптимальное вре-
мя оказания помощи при острых отравлениях.
Важное место в профилактической токсикологии занимает изучение ку-
мулятивных свойств веществ, характеризующих их способность вызывать
токсический эффект при последовательном, многократном поступлении в
организм [8]. Кумулятивное действие может проявляться накоплением ве-
щества в организме и образованием депо (материальная кумуляция) либо
накоплением (суммацией) эффекта (функциональная кумуляция).
Как правило, материальной кумуляции сопутствуют функциональные
изменения, связанные с токсическим действием накапливающегося в орга-
низме вещества, хотя может иметь место и бессимптомное носительство.
В обычных условиях эти изменения по своей интенсивности существенно
ниже, чем те, которые могли бы возникнуть при интенсивном выходе
вещества из депо, что наблюдается при чрезвычайных нагрузках, инфекци-
онных заболеваниях, охлаждении и т.д.
В профилактической токсикологии наиболее изученной и используемой
в качестве критериальной и патофизиологической основы оценки кумуля-
тивных свойств вещества является функциональная кумуляция, материаль-
ной основой которой служит постоянное поступление в организм токсичес-
кого агента или образование его активных метаболитов в количестве, доста-
точном для формирования патологических или предпатологических измене-
ний.
480
Отмечены четыре типа зависимости характера и степени кумуляции от
количества химического вещества [2, 8]:
• кумулятивное действие вещества уменьшается при снижении величины
ежедневно вводимой дозы. Подобные вещества, как правило, мало
опасны с точки зрения способности вызывать хронические отравле-
ния;
• кумулятивный эффект не зависит от величины ежедневной дозы.
Такие вещества более опасны, так как способны вызывать хроничес-
кие интоксикации;
• кумулятивный эффект возрастает при уменьшении дозы вводимого
вещества. Такого рода соединения наиболее опасны, поскольку спо-
собны вызывать хроническую интоксикацию в очень малых количе-
ствах;
• кумулятивный эффект претерпевает фазовые изменения. Он может
увеличиваться с уменьшением дозы, а затем снижаться. Может также
вновь усиливаться при продолжении введения вещества в начальных
дозах.
В отечественной профилактической токсикологии наибольшее распро-
странение получили два метода оценки функциональной кумуляции. Пер-
вый метод, предложенный Ю.С.Каганом и В.В.Станкевичем [9], основан на
ежедневном введении в организм подопытных животных равных доз веще-
ства, в долях от LD50.
Обычно затравки производятся ежедневно в дозах 0,1; 0,05; 0,02 LD5o,
хотя допустимы пределы от 0,2 до 0,01 LD5o- Для прогнозирования хрони-
ческого эффекта рекомендуется брать несколько (2—3) доз.
Второй метод [54] “Тест субхронической токсичности” основан на еже-
дневном введении животным вещества в нарастающих дозах через равные
промежутки времени, всего в течение 24±4 дня.
Первые 4 дня животные получают по 0,1 LD50, 5—8-й день —0,15,
9—12-й день — 0,22, 13—16-й день — 0,34, 17—20-й день — 0,5, 21—24-й
день — 0,75 LD50. Наивысшая доза, вводимая на 25—28-й день, — 1,12 LD5q.
По указанной схеме суммарная доза составляет 12,8 LD50 за 24 дня.
Расчет коэффициента кумуляции в первом и втором случаях проводится
по формуле:
LOSo '
где S • LD§0 — суммарная среднесмертельная доза вещества при многократ-
ном введении; LD5Q — смертельная доза вещества при однократном введе-
нии; Kcum — коэффициент кумуляции.
Как показывает опыт профилактической токсикологии, оба метода до-
статочно информативны. Преимущество первого заключается в возможнос-
ти получения количественной характеристики и оценки степени кумулятив-
ности вещества; достоинства второго — в меньшей длительности экспери-
мента и возможности оценки адаптации к яду. Количественную оценку
кумулятивности при использовании метода Lim можно проводить по сис-
теме, предложенной Л.И.Медведь и соавт. [30], для оценки кумулятивности,
Установленной по схеме [9]. При этом величина KcUm для метода Lim хотя
и будет несколько выше, чем при использовании метода Ю.С.Кагана и
В-В.Станкевича, однако это существенно не влияет на оценку степени
кумулятивности.
481
16-715
Исследование кумулятивных свойств вещества позволяет не только ус-
тановить количественные параметры кумуляции, но и составить представ-
ление о преимущественно поражаемых органах и системах, а также о глу-
бине этих поражений. Использование указанной информации необходимо,
поскольку в ней, в конечном итоге, заложена основа понимания патогенеза
интоксикации и определения методических подходов при планировании
хронического эксперимента и последующих исследований.
14.5. Изучение патогенетической значимости изменений
в организме и их оценка с позиций критерия вредности
При рассмотрении в динамике реакций организма на повторные воздей-
ствия обращает на себя внимание то, что она не является монотонной.
Будучи направленной на поддержание уровня гомеостаза, на сохранение посто-
янства внутренней среды организма и его способности адаптивно реагировать
на действие экзогенных факторов, реакция адаптивных систем характеризу-
ется закономерной сменой состояний, длительность и стабильность которых
зависит от свойств вещества, количества и продолжительности действия, а
также от исходного состояния организма [18].
Первоначальное поступление вещества в организм вызывает первичную
реакцию, являющуюся ответом реагирующих систем на информацию от ре-
цепторов о поступлении в организм токсичного агента. По своей природе эта
реакция имеет ориентировочный характер, она, как правило, кратковремен-
на и характеризуется повышением активности симпатического отдела ЦНС,
гипофизарно-адреналовой системы, активацией неспецифических моноок-
сигеназ, повышением скорости дыхания митохондрий печени. Длительность
этого периода, особенно при действии малых количеств вредных веществ,
может продолжаться от нескольких часов до 1—2 нед. При действии доз,
близких к летальным, первичная реакция практически не регистрируется,
так как быстро развиваются и доминируют выраженные проявления “хими-
ческого стресса”. Зависимость длительности, а также степени выраженности
первичной реакции от количества вещества продемонстрирована в опытах
на митохондриях печени при действии ряда веществ, различных по своим
свойствам [33]. Так, при введении доз, близких к летальным, наблюдалась
первоначальная активация дыхания и окислительного фосфорилирования,
сменяющаяся глубоким угнетением и гиперкомпенсацией. Однократное воз-
действие на уровне Limac сопровождалось более выраженной и растянутой
во времени реакцией активации, при которой фаза угнетения также была
выражена слабо, а гиперкомпенсация отсутствовала. Действия веществ на
уровне Limch вызывало лишь растянутую во времени (3—4 сут) фазу акти-
вации. Аналогичная реакция наблюдалась и со стороны функции регулятор-
ных систем, например подкорковых центров при действии паров бензола и
четыреххлористого углерода [34].
Следующий период, наступающий вслед за первичной реакцией, связан
с токсическим действием вещества и характеризуется снижением адаптаци-
онных свойств организма, преимущественно неспецифического характера
“Первичная декомпенсация” [34].
Наблюдаемая в эту фазу активация структур, ответственных за интегра-
цию парасимпатических влияний, сопровождается изменениями в централь-
ных регуляторных системах. Эти изменения проявляются снижением напря-
жения кислорода и повышением содержания нуклеиновых кислот в подкор-
ковых ядрах, усилением нейросекреторных реакций, повышением способ-
482
ности ткани мозга связывать гистамин. Для этой фазы характерно снижение
уровня гомеостаза, проявляющееся в снижении устойчивости к экстремаль-
ным нагрузкам: охлаждению, кровопотере, травме, интоксикации, физичес-
кой нагрузке и др. Длительность и степень выраженности этой стадии также
зависят от количества вещества и экспозиции. В случае прекращения воз-
действия наблюдавшиеся явления декомпенсации проходят и измененные
функции полностью нормализуются [18]. В тех случаях, когда при продол-
жении воздействия количество действующего вещества не достаточно вели-
ко для инициирования выраженных патологических изменений, формиру-
ется следующая фаза интоксикации, характеризующаяся “неспецифически
повышенной резистентностью”, сопровождающейся нормализацией функ-
ций организма либо повышением уровня гомеостаза. Определенные проти-
воречия, встречающиеся в названиях и интерпретации этой стадии, связаны
с тем, что сопоставляются и анализируются состояния организма, сформи-
ровавшиеся при действии различных веществ, в различных количествах, в
течение разного времени. И.В.Саноцкий [34] считает это состояние физио-
логической адаптацией и отмечает, что оно может быть кратковременным,
особенно при “относительно высоком уровне воздействия”.
Вместе с тем Н.В.Лазаревым и соавт. [25] показано, что при повторном
действии относительно высоких доз веществ симптомы интоксикации, вы-
явленные в начальном периоде, могут исчезать, уступая место состоянию
неспецифически повышенной сопротивляемости (СНПС). Это состояние
проявляется повышенной устойчивостью к дополнительным нагрузкам и
более быстрой нормализацией развивающихся патологических сдвигов.
Причем СНПС может проявляться на системном, органном, тканевом и
клеточном уровнях. Аналогичное состояние было выявлено при хрони-
ческом ингаляционном воздействии пороговых концентраций паров бен-
зола и четыреххлористого углерода. О выраженности и устойчивости по-
вышения адаптации, наступавшей на 2—3-м месяце воздействия, свидетель-
ствовала устойчивость к функциональным нагрузкам, нормализация
функции гипоталамо-гипофизарно-надпочечниковой системы, ЦНС. Инду-
цирование в этот период затравки подопытным животным 3,4-бенз(а)пи-
реном злокачественных новообразований сопровождалось увеличением
латентных периодов развития опухолей и снижением числа животных с
опухолями [18].
Показано также, что состояние повышенной резистентности формиру-
ется на фоне напряжения систем, в отношении которых исследуемое веще-
ство обладает специфической активностью. Так, при экстремальных нагруз-
ках, таких как кровопускание (1,5—2 % от массы тела), у животных, затрав-
ленных парами бензола, наблюдалось уменьшение красного ростка костного
мозга за счет гемоглобинсодержащих клеток и увеличение числа юных форм
нейтрофилов, миелоцитов и промиелоцитов с очень медленной нормализа-
цией. Аналогично были выявлены изменения в печени, характерные для
действия четыреххлористого углерода.
Своеобразной формой СНПС является “привыкание” организма к яду,
также проявляющееся повышением устойчивости к дополнительным нагруз-
кам “тренирующим веществом”. Вместе с тем “привыкание” может и не
сопровождаться СНПС, что свидетельствует о развитии состояния компен-
сированной патологии и возможности перехода к другому стабильному
состоянию, характеризующемуся декомпенсацией и устойчивым снижением
неспецифической сопротивляемости организма [29].
483
16-
Что касается механизмов повышения неспецифической сопротивляемос-
ти, то в ее основе лежит повышение уровня функционирования регулятор-
ных систем, в частности системы гипоталамус — гипофиз — кора надпочеч-
ника по типу “хронического стресса”. Показано также, что состояние по-
вышенной резистентности сопровождается усилением адренокортикотроп-
ной и нейросекреторной активности гипоталамических ядер, повышением
напряжения кислорода в мозговой ткани. Важным механизмом адаптации
является повышение устойчивости дегидрогеназ дыхательной цепи мито-
хондрий к ингибиторам [33], а также активация монооксигеназных систем,
обеспечивающих катаболизм стероидных гормонов [41]. Как отмечает
Л.А.Тиунов, химические вещества в зависимости от дозы и времени дейст-
вия способны усиливать или, наоборот, угнетать активность микросомаль-
ных монооксигеназ, резко меняя устойчивость организма к действию хими-
ческих веществ.
Последним периодом (фазой) интоксикации является стадия декомпен-
сации, сопровождающаяся стабильными патологическими изменениями, ха-
рактерными для действия вещества, а также снижением уровня гомеостаза.
Существенное значение имеет зависимость периодичности смены фаз
интоксикации от времени и количества действующего вещества. Установле-
но, что каждая последующая фаза интоксикации может наступить лишь в
том случае, если количество поступающего в организм вещества достаточно
для “накопления эффекта” и его динамического развития, поэтому по
динамике смены фаз возможно определение близости испытуемой концент-
рации (дозы) к пороговой [18].
Приведенные данные показывают, что, несмотря на многообразие и
сложность участия адаптационных систем в формировании реакции орга-
низма на химический раздражитель, последний определяется общебиологи-
ческими закономерностями, обусловливающими последовательность реак-
ции и формирование периодов (фаз) интоксикации. Понимание этих зако-
номерностей позволяет оценивать полученные изменения как с позиций
критерия вредности, так и прогнозировать развитие интоксикации в каждый
из ее периодов.
Практическая направленность, лежащая в основе токсикологических
исследований в профилактических целях, обусловила создание системы по-
казателей, позволяющих оценивать характер и степень действия химических
веществ на организм. Иначе говоря, концептуальной основой профилакти-
ческой токсикологии является возможность обоснования таких количеств
химических веществ, которые при данных конкретных условиях не оказы-
вают неблагоприятного действия на организм человека. Это может в равной
степени касаться как кратковременного пребывания людей в экстремальных
условиях, т.е. при действии высоких концентраций химических веществ, так
и длительного по времени контакта с малыми количествами химических
веществ в условиях производства в течение рабочего стажа, а также неогра-
ниченного по длительности контакта с химическим веществом в условиях
загрязнения атмосферного воздуха населенных мест, воды водоемов, про-
дуктов питания. Каждое из перечисленных условий требует различных под-
ходов для обоснования критериев вредности (безвредности). В одних случаях
таковым может быть компенсированный патологический процесс, в других —
состояние физиологической адаптации и, в-третьих, — отсутствие какого-
либо прямого или косвенного неблагоприятного действия на настоящие или
будущие поколения, не снижающего работоспособности человека, не ухуд-
шающего его самочувствия и санитарно-бытовых условий жизни.
484
Все перечисленное ставит одной из основных задач профилактической
токсикологии научное и практическое обоснование безвредных уровней
химических загрязнений, базирующееся на понятии пороговости как преде-
ле возможности нормального функционирования организма человека при
воздействии химического вещества.
В качестве порога вредного действия принято считать такое количество
вещества, при воздействии которого в организме (при конкретных условиях
поступления вещества) возникают изменения, выходящие за пределы фи-
зиологических приспособительных реакций, или скрытая (временно ком-
пенсированная) патология [34].
Будучи справедливым в отношении соматических эффектов при дейст-
вии химических веществ, приведенное определение достаточно дискуссион-
но, когда речь идет о генотоксических воздействиях, поражающих генети-
ческие структуры клетки. Принято считать, что в этих случаях имеют место
беспороговые эффекты, обусловленные случайным характером взаимодей-
ствия алкилирующего агента с ДНК [45].
Н.С.Правдин (1934) указывал, что порогов действия яда может быть
много — столько же, сколько систем организма реагирует на введение ве-
щества, поэтому при определении критерия вредности (безвредности) ре-
шающую роль играет выбор адекватности показателя, интегрируемой степе-
нью влияния вещества на уровень гомеостаза, на способность организма
адекватно реагировать на воздействие окружающей среды.
Установление пороговых величин независимо от того, в отношении
какого показателя это производится, основано на двух основных принципах:
степени отличия от нормального (исходного) уровня и повторяемости (вос-
производимости) этого различия. Методологической основой служит коли-
чественное сопоставление полученных изменений со спонтанным уровнем
течения аналогичных процессов в норме. Математически это может быть
выражено вычислением достоверности разности между средними значения-
ми показателей в опыте и контроле, а также путем вероятностного анализа
зависимости доза — эффект и ее экстраполяции на уровень спонтанных
эффектов либо на заданные уровни допустимых пределов риска.
Указанные подходы позволили сформулировать понятие “порог вредного
действия вещества” как минимального количества вещества (концентрация,
доза), вызывающего изменения в организме и имеющего следующие при-
знаки [35]:
— изменения достоверно отличаются от параллельного контроля и вы-
ходят за пределы физиологических колебаний для данного вида жи-
вотных в данное время года;
’ — наличие скрытых нарушений гомеостаза, выявляемых при помощи
различного рода нагрузок;
— изменения достоверно и устойчиво (более месяца) от параллельного
контроля, хотя и не выходят за пределы физиологической нормы.
В качестве критериев для установления порогов вредного действия может
быть использовано также проведение параллелей между результатами био-
химических, физиологических, морфологических и других исследований.
В тех случаях, если функциональные изменения выходят за пределы гоме-
остатических колебаний и сопровождаются изменениями структуры тканей
и органов, то найденные сдвиги следует рассматривать как патологические,
вредные для организма. Если обнаруженные функциональные изменения
прогрессируют во времени и, тем более, если они не исчезают в восстано-
485
вительном периоде, то их также следует рассматривать как вредные, пато-
логические.
В ряде случаев, когда при исследовании отсутствуют статистически зна-
чимые изменения по сравнению с параллельным контролем, возможны
скрытые нарушения равновесия с внешней средой (сужение адаптационных
возможностей), выявляемые с помощью функциональных нагрузок, адекват-
ных по силе и направленности действия. Наиболее рационально для этой
цели использовать пороговые нагрузки, позволяющие выявлять влияние
вещества на быстро реагирующие системы (центральная и вегетативная
нервная, сердечно-сосудистая, гипофиз-адреналовая и др.).
Возможно также применение экстремальных нагрузок: плавание, бег на
третбане, голод, кровопускание, облучение, гипер- и гипотерапия, гипоксия,
введение тифо-паратифозной вакцины, алкоголя и т.д. Рекомендовано также
введение сублетальных доз исследуемого вещества либо применение токси-
ческих нагрузок на системы, в отношении которых исследуемое соединение
проявляет специфическую активность.
Большое значение для экспериментального установления порогов дей-
ствия имеет выбор функции (органа, системы) исследуемого показателя,
адекватного характеру действия вещества. Наибольшее распространение в
профилактической токсикологии получили так называемые неспецифичес-
кие (интегральные) показатели, характеризующие системное организменное
реагирование на действие вещества. Это относится прежде всего к состоя-
нию центральной и вегетативной нервных систем, эндокринной системы,
системы крови, интенсивности обменных процессов, поведенческих реак-
ций. Интегральные показатели обязательно изучаются и при действии ве-
ществ, обладающих специфической активностью, так как сопоставление
специфических и неспецифических сдвигов позволяет оценивать степень
специфических изменений с точки зрения критерия вредности.
Специфические показатели характеризуют действие химических ве-
ществ, обладающих тропизмом в отношении отдельных органов и систем,
связанным с механизмом биологического действия вещества. Примером
ядов, оказывающих специфическое действие, могут служить тяжелые метал-
лы — блокаторы сульфгидрильных групп, фосфорорганические соединения —
блокаторы холинэстеразы, нитро- и аминосоединения — метгемоглобиноб-
разователи, а также ряд других веществ, в том числе и обладающих способ-
ностью специфически влиять на генетический аппарат, вызывая отдаленные
последствия интоксикации (канцерогенные, мутагенные, тератогенные
и т.д.).
Установление порогов действия ядов в профилактической токсикологии
производится в отношении количеств вещества, действующих в течение
заданных параметров времени. Наиболее информативными величинами яв-
ляются порог однократного (острого) действия Limac и порог хронического
действия Limch- Время экспозиции при установлении порогового показателя
определяется задачей эксперимента и его декретированной длительностью.
Устанавливаются также пороги действия по ряду специфических показате-
лей (Linisp), к каковым относятся пороги раздражающего, аллергенного,
гонадотропного, обонятельного действий и др.
Изложенное выше свидетельствует о том, что практически во всех слу-,
чаях речь идет об установлении “практического порога действия”, являю-
щегося договорной величиной, основанной на целом ряде допущений, но
вместе с тем достаточной для обоснования гигиенического норматива. Сте-
пень точности установленной пороговой величины обусловлена многими
486
факторами, в том числе точностью методов индикации, числом подопытных
животных, числом испытуемых доз (концентраций), диапазоном исследуе-
мых величин, возможностью поддержания стабильных уровней доз, выбран-
ным математическим методом и т.д. Технически наиболее сложно установ-
ление пороговых величин веществ, обладающих высокой токсичностью и
узкой зоной токсического действия.
14.6. Экстраполяция экспериментальных данных
с животных на человека
Перенос результатов экспериментальных исследований с животных на
человека представляет собой одну из наиболее сложных проблем профилак-
тической токсикологии. Различие видовых особенностей обмена веществ
человека и животных порой столь велико, что прямой перенос результатов
исследований может наряду с ложноположительными результатами привес-
ти к отрицательным эффектам, чреватым, порой, трагическими последст-
виями.
Наиболее драматическим примером может служить эксцесс с талидоми-
дом, более высокая чувствительность человека к которому (по сравнению с
мышью в 60 раз, крысой в 100 раз, собакой в 200 раз, золотистым хомячком
в 700 раз) привела к появлению тяжелых уродств новорожденных, несмотря
на отрицательные результаты лабораторных испытаний. И наоборот, более
близкой к человеку оказалась чувствительность некоторых реликтовых видов
животных. В литературе имеется большое количество данных о видовой
чувствительности человека и животных к тем или иным токсикантам, в
значительной мере направленных на поиск зависимости различий в видовой
чувствительности от тех или иных параметров развития, физиологических
или метаболических показателей.
Н.С.Правдин [31] высказал предположение, что в случае одинаковой
чувствительности к веществу разных видов животных, чувствительность к
ним человека не должна существенно отличаться. Г.Н.Красовским [16]
предложено использовать в экспериментах наиболее чувствительные виды
животных, исходя из наибольшей вероятности безопасного переноса полу-
ченных экспериментальных данных на человека. Фундаментальным пред-
ставляется подход, предложенный Л.А.Тиуновым [42], основанный на вы-
боре животных, течение метаболических процессов у которых наиболее
близко к человеку.
Всем предшествующим опытом профилактической токсикологии пока-
зано, что решение проблемы видовой чувствительности возможно только
при условии проведения экспериментальных исследований на нескольких
видах при достаточном числе животных. Соблюдение этих условий возмож-
но при работе с мелкими лабораторными животными-грызунами, как пра-
вило, мышами, крысами, кроликами, морскими свинками. Включение в
опыт более крупных животных — собак, малых свиней, кошек, осуществля-
ется по мере расширения задач исследования.
Выявление видовой чувствительности проводится на самых ранних ста-
диях эксперимента начиная с острого опыта. Наличие различий видовой
чувствительности требует при дальнейших исследованиях использовать до-
статочное число видов, но не менее двух.
И.В.Саноцкий, И.П.Уланова [37] предлагают в качестве критерия оценки
различий видовой чувствительности величину “коэффициента видовой чув-
487
ствительности” (К.ВЧ), являющегося отношением среднесмертельных доз
(концентраций) для исследуемых видов.
КВЧ Оценка различий видовой чувствительности
S3 Не выражена
3,1—9 Выражена
> 9 Резко выражена
Величина КВЧ учитывается при выборе коэффициента запаса с целью
обосновании ПДК, а также при планировании экспериментальных иссле-
дований с точки зрения оптимального выбора вида подопытных животных
и их количества.
14.7. Гигиеническое регламентирование химических
веществ
В соответствии с государственным законодательством Российской Феде-
рации все химические вещества, обращающиеся в народном хозяйстве, подле-
жат обязательной токсикологической оценке и гигиеническому регламентиро-
ванию. Под гигиеническим регламентированием понимается выполнение
стандартного набора обязательных требований с целью обеспечения без-
опасного для здоровья человека производства или применения товарной
продукции.
Применительно к токсиколого-гигиенической оценке химических ве-
ществ можно выделить следующие уровни регламентирования, предусмот-
ренные Федеральным законом России “О санитарно-эпидемиологическом
благополучии населения” (№ 52-ФЗ от 30 марта 1999 г.).
6.1. Санитарно-эпидемиологическое заключение — документ, удостове-
ряющий соответствие (не соответствие) санитарным правилам факторов
среды обитания, хозяйственной или иной деятельности, продукции, работ
и услуг, а также проектов нормативных актов, проектов строительства объ-
ектов, эксплуатационной документации (Гл.1, ст.1).
6.2. Государственные санитарно-эпидемиологические правила и норма-
тивы (далее санитарные правила) (Гл.1, ст.1).
6.3. Ведение государственных регистров потенциально опасных для че-
ловека химических, биологических веществ и отдельных видов продукции
(Гл.1, ст.5).
6.4. Государственная регистрация потенциально опасных химических и
биологических веществ (Гл.5, ст.43).
Каждый из перечисленных уровней регламентирования в зависимости
от свойств вещества и условий его обращения включает необходимый объем
токсиколого-гигиенической информации, предусмотренный соответствую^'
щими нормативно-техническими документами. Диапазон этих требований
достаточно широк, от первичной токсиколого-гигиенической оценки до
разработки санитарно-гигиенического норматива по полной программе экс-
периментально-токсикологических и эпидемиолого-гигиенических исследо-
ваний.
Объем токсикологической информации, необходимой для обеспечения
требуемого уровня регламентирования, зависит от целей, задач и масштабов
производства и применения веществ, физико-химических свойств вещества,
степени токсичности и опасности, числа контактирующих людей, актуаль-
ности (приоритетности) для экономики страны, распространенности в объ-
488
s
ектах окружающей среды, а также ряда других показателей, имеющих зна-
чение для оценки возможности влияния вещества на здоровье человека.
В обоснование выбора веществ применительно к уровню их регламен-
тирования положен поэтапный принцип, состоящий из 4 этапов.
Этап I. Осуществляются сбор и наработка информации, необходимой и
достаточной для решения вопроса о целесообразности проведения токсико-
логических исследований.
Этап II. На основании анализа имеющейся информации определяются
вещества, нуждающиеся и не нуждающиеся в разработке гигиенических нор-
мативов, определяется объем данных, достаточный для регламентирования.
Этап III. Определяются очередность и объем исследований, необходимых
для оценки опасности и ускоренного обоснования гигиенических нормати-
вов (ОБУВ, ОДУ, ПДК).
Этап IV. Принимается решение о разработке гигиенических нормативов
на основе проведения токсиколого-гигиенических исследований в соответ-
ствии с существующими методическими указаниями. В случае достаточнос-
ти информации, необходимой для регламентирования, токсикологические
исследования по числу этапов работ могут быть ограничены.
При наличии официальной зарубежной информации и опубликованных
фактических данных об опасных свойствах веществ и количественных пара-
метрах опасности, представленных показателями, соответствующими тако-
вым, предусмотренным отечественными нормативно-методическими доку-
ментами, утвержденными в установленном порядке, возможно использова-
ние этих сведений для принятия решения о необходимости и приоритет-
ности гигиенического нормирования.
Одной из основных задач профилактической токсикологии является
проведение экспериментальных исследований с целью обоснования гигие-
нических нормативов либо разработки иных показателей, необходимых для
санитарно-гигиенического регламентирования химических веществ в окру-
жающей среде. Наиболее полным в связи с этим является эксперименталь-
ное обоснование ПДК вредного вещества. Эксперименты по обоснованию
ПДК проводятся в соответствии с утвержденными методическими указания-
ми (МУ М3 СССР 04.04.1980, № 2163-80, ВМУ, М3 СССР 15.06.1988, М.,
1989, МУ 2.1.5.720-98).
В настоящем разделе мы касаемся преимущественно токсикологических
исследований, поскольку показатели влияния химических веществ на объ-
екты окружающей среды являются предметом специальных гигиенических
и эколого-гигиенических исследований и не входят в задачу настоящего
руководства.
Экспериментальное исследование токсических свойств веществ с целью
гигиенического регламентирования в различных средах состоит из следую-
щих основных этапов:
— изучение острой токсичности, индивидуальной и видовой чувстви-
тельности животных при путях введения вещества, адекватных усло-
виям воздействия. Установление основных параметров острой ток-
сичности (LD50, LC5o, LB50) и коэффициента видовой чувствитель-
ности (КВЧ). В тех случаях, когда вещество вызывает частичную
гибель или не вызывает гибели животных, целесообразно использо-
вать показатели LDmjn или LD0, равные максимально достижимой
дозе;
— изучение способности вещества оказывать воздействие на кожные
489
п окровы и слизистые оболочки глаз, а также способность проникать
через кожу;
— изучение субхронической токсичности в подостром опыте с опреде-
лением коэффициента кумуляции, а также выявлением наиболее
поражаемых органов и систем;
— установление пороговых концентраций по специфическим и неспе-
цифическим показателям при однократном воздействии вещества и
адекватных путях и времени поступления в организм;
— проведение хронического опыта при длительном многократном по-
ступлении вещества в организм с использованием путей поступления
адекватным таковым в реальных условиях среды. Оценка характера
и степени функциональных и морфологических изменений, наступа-
ющих в организме в результате хронического воздействия;
— изучение отдаленных последствий интоксикации (канцерогенного,
мутагенного, гонадо- и эмбриотоксического, аллергенного, атеро-
склеротического и др.);
— обоснование пороговых концентраций вещества при длительном воз-
действии с позиции критерия вредности и разработка гигиенического
норматива.
Все перечисленные исследования по установлению пороговых концент-
раций проводятся как минимум на двух видах животных. Каждый тест
испытывается не менее чем на 12 мелких или 6 крупных животных. Воз-
можны исследования нескольких показателей на одной и той же группе
животных в том случае, если определение одного показателя не влияет на
результаты другого. После применения экстремальных нагрузок животные
исключаются из эксперимента. Общее минимальное количество животных,
используемых в длительных экспериментах, должно быть не менее 36—48
особей. Исследования состояния здоровья животных проводятся в динами-
ке, в сроки, предусмотренные соответствующими методическими указания-
ми. По окончании эксперимента часть подопытных животных забивается
для гистологических исследований. На оставшихся животных прослежива-
ется восстановительный период длительностью в 1—2 мес. Аналогичные
требования распространяются на интактных животных параллельных кон-
трольных групп.
Проведение хронического экспериментального исследования с целью
обоснования гигиенического норматива имеет ряд особенностей, обуслов-
ленных техническими и экономическими причинами. Связано это прежде
всего с вынужденно малым числом испытуемых доз (концентраций), что
позволяет оценивать полученные результаты только путем прямого сравне-
ния средних величин показателей состояния подопытных животных с па-
раллельным контролем и практической невозможности построения зависи-
мости доза — эффект. Вторым ограничивающим обстоятельством является
то, что большинство используемых в токсикологическом эксперименте по-
казателей являются градированными и степень их отклонения от параллель-
ного контроля не отражает зависимости изменений показателя от величин
испытуемых количеств. В связи с этим при планировании хронического
эксперимента решающее значение приобретает оптимальный выбор испы-
туемых количеств вещества, их близость к прогнозируемой величине порога
хронического действия, а также выбор диапазона разрыва между ними.
Наиболее надежный способ выбора испытуемых количеств вещества для
хронического эксперимента основывается на анализе параметров острой
токсичности, порога однократного действия (Limac) и коэффициента куму-
490
ляции (Kcum)- Так, в ингаляционном эксперименте испытуемые концентра-
ции всегда не должны быть выше Limac и разрыв между ними, как правило,
не должен превышать десятикратного уменьшения каждой последующей
концентрации по отношению к предыдущей. Для веществ, обладающих
кумулятивными свойствами, рекомендуется проводить испытания не менее
чем 3 концентраций. В этом случае разрыв между испытуемыми концент-
рациями может быть уменьшен.
При внутрижелудочном введении вещества следует руководствоваться
теми же принципами при условии, что испытуемые дозы (концентрации)
вещества должны быть ниже максимально переносимых, т.е. максимальных
количеств вещества, не вызывающих гибели животных. Оптимальным ре-
зультатом хронического токсикологического опыта является установление
пороговой (Limch) и недействующей концентраций, что при малом числе
испытуемых доз (концентраций) не всегда удается. В этих случаях следует
основываться на сведениях о свойствах аналогов испытуемого вещества и
всей другой доступной информации, позволяющей логически обосновать
искомые величины.
Для оценки пороговости действия вещества И.В.Саноцким и И.П.Ула-
новой (1975) предложены следующие количественные параметры состояния
подопытных животных:
— изменения достоверно (р<0,05) отличаются от контроля и выходят за
пределы (>2о) физиологических колебаний показателя для данного
вида животных в данное время года;
— при отсутствии достоверных (р<0,05) отличий от контроля наблюда-
ются скрытые нарушения равновесия с внешней средой (сужение
возможности адаптации), выявляются, в частности, при помощи
функциональных и экстремальных нагрузок (реакции выходят за пре-
делы ±2ст соответствующей нормы);
— изменения достоверно (р<0,05) отличаются от контроля, хотя и на-
ходятся в статистических пределах физиологической нормы, однако
стойко сохраняются (в эксперименте на животных).
Помимо прямого сравнения средних величин показателей подопытных
и контрольной групп, анализ результатов хронического эксперимента можно
проводить путем перевода градированных показателей в альтернативные.
Достигается это построением зависимости доза — эффект на основе учета
числа особей, прореагировавших на воздействие вещества в каждой из
испытуемых доз (концентраций) [22]. Определение пороговых величин в
этом случае возможно либо путем экстраполяции полученной зависимости
на уровень аналогичных спонтанных эффектов в параллельном контроле,
либо путем установления заданных вероятностных пределов риска. Опреде-
ленный опыт в этом отношении накоплен при обосновании ПДК канцеро-
генных веществ [21].
Каковы бы ни были количественные критерии реакции организма на
действие токсиканта, решение вопроса о реальной опасности вещества не
может быть принято без проведения патогенетической оценки характера и
степени его токсического действия с позиций критерия вредности. Если при
Действии больших доз (концентраций) веществ токсический эффект прояв-
ляется гибелью животных или наличием выраженных морфологических
проявлений поражения, то при действий малых количеств токсиканта, осо-
бенно в течение длительного времени, оценка степени воздействия пред-
ставляет серьезную методическую проблему.
491
Исходя из понимания здоровья как состояния полного физического, психи-
ческого и социального благополучия, взаимодействие организма человека и хи-
мических факторов окружающей среды должно быть ограничено такими ко-
личественными пределами, в рамках которых не происходит изменений состо-
яния здоровья отдельных индивидуумов, а также основных свойств контин-
гента, популяции и вида.
В сегодняшних условиях глобального загрязнения окружающей среды
химическими веществами приоритетное значение приобретает интегральная
оценка действия химических веществ с точки зрения сохранения числен-
ности и качества вида, осуществляемая на основе изучения влияния веществ
на состояние здоровья индивидуума.
В связи с этим критериальные уровни вредности можно разделить на
четыре категории.
• Способность веществ вызывать изменения генетических свойств ор-
ганизма, влиять на качество и количество потомства, снижать про-
должительность жизни, а также стойко изменять показатели физичес-
кого и умственного развития, приводящие к деградации вида.
• Способность веществ влиять на состояние здоровья индивидуума,
вызывать соматические заболевания химической этиологии как спе-
цифического, так и неспецифического характера, в том числе пато-
логические изменения со стороны отдельных органов и систем.
• Способность веществ вызывать напряжение систем регулирования
гомеостаза, приводящее к формированию патологических состояний
в условиях предъявления нагрузок, не вызывающих подобных изме-
нений у интактных особей.
• Способность веществ вызывать реакцию регуляторных систем орга-
низма, не выходящую за пределы “физиологической адаптации”.
Соответствие вещества каждому из приведенных критериальных уровней
зависит от свойств самого вещества, его количества и времени, в течение
которого осуществляется воздействие, поскольку основной задачей любой
критериальной оценки является проведение грани между состояниями фи-
зиологического и патологического процесса.
Оценка количеств вещества с точки зрения критерия вредности и уста-
новления пороговых количеств позволяет подойти к обоснованию величины
гигиенического норматива. Важную роль в этом процессе играет установле-
ние величины “коэффициента запаса” (Кзап), на которую уменьшается по-
роговая концентрация, полученная в хроническом опыте, и которая является
отношением Limch к ПДК. Обоснование этой величины представляет опре-
деленную сложность, поскольку при ее помощи приходится проводить ло-
гико-эмпирическое заполнение того диапазона концентраций, который не
удается установить путем прямого экспериментирования, в том числе и с
учетом различий видовой чувствительности к яду.
Практически при переходе от величины Limch к ПДК величина “коэф-
фициента запаса” варьирует в пределах от 3 до 20 и значение его увеличи-
вается от минимального в следующих случаях:
— с увеличением абсолютной токсичности;
— при наличии отдаленных последствий и специфических проявлений
токсического действия;
— при существенных различиях в видовой чувствительности;
— с увеличением кумулятивных свойств;
492
— с уменьшением зоны острого действия;
— при выраженном кожно-резорбтивном действии (для веществ, нахо-
дящихся в газовой фазе).
Расчет “коэффициента запаса” возможен также на основе анализа по-
казателей потенциальной и реальной опасности, учитываемых по балльной
системе в двух вариантах.
При первом варианте расчет К.^ проводится, исходя из значений LC50,
Limch> КВИОхр, Zbef, КВР (коэффициент видового различия) (табл. 14.1).
Таблица 14.1. Расчет коэффициента запаса по 1-му варианту
Показатель Критерии установления Кзап
LC50, мг/м3 <;500 501—5000 5001—50 000 >50 000
Баллы 8 6 4 2
Limch, мг/м3 <1 1,1—100 11—100 >100
Баллы 8 6 4 2
^b.ef. Баллы >1000 1000—101 100—10 <10
8 6 4 2
КВИОХ„ >300 300—30 29—3 <3
Баллы 8 6 4 2
КВР >9 9—3 <3 —
Баллы 9 6 4 —-
По второму варианту расчет проводится для веществ, не вызывающих в
силу физико-химических свойств острых смертельных ингаляционных отрав-
лений. Кзап обосновывается, исходя из значений Limac, Limch, Zcb, КВИОас,
КВР (табл. 14.2).
Таблица 14.2. Расчет коэффициента запаса по 2-му варианту
Показатель Критерии установления Кзап
Limac, мг/м3 Баллы <10 10—100 101—1000 >1000
8 6 4 2
Limch, мг/м3 Баллы <1 1,1—10 11—1000 >100
8 6 4 2
>10 10—5 4,9—2,5 <2,5
Баллы 8 6 4 2
КВИОхо >10 000 9999—1000 999—100 <100
БаллыР 8 6 4 2
КВР >9 9—3 <3
Баллы 8 6 4 —
Величины коэффициента запаса в зависимости от суммы баллов
Сумма баллов 12 14 16 18 20 22 24 26 28 30 32 34—40
Коэффициент запаса *— 4 5 6 7 8 9 10 12 14 16 18 20
Большое значение в профилактической токсикологии и гигиене при
обосновании ПДК. имеет отнесение величины норматива к заданному пара-
метру времени. Принято, что при установлении величины норматива в
опытах на животных продолжительность воздействия моделируется адекват-
493
но реальному времени воздействия вещества на организм человека, с учетом
экстраполяции продолжительности жизни выбранного вида подопытных
животных.
Так, при разработке ПДК вредных веществ в воздухе рабочей зоны
опыты проводятся по 4 ч в день 5 раз в неделю на протяжении 4 мес. Для
атмосферного воздуха населенных мест ингаляционная затравка животных
осуществляется круглосуточно в течение до 4 мес. Для водоемов продолжи-
тельность эксперимента составляет от 3 до 6 мес и более в случае необхо-
димости внутрижелудочного введения вещества.
Все предельно допустимые концентрации по способу установления яв-
ляются средневзвешенными, так как их величина рассчитывается путем
деления суммы всех аналитических определений вещества в исследуемой
среде на число определений
где КсВ — средневзвешенная концентрация; SKn — сумма всех измеренных
концентраций; п — число измерений.
При непрерывном контроле средневзвешенная концентрация устанавли-
вается отношением измеренного количества вещества к исследованному
объему. Исключение составляют предельно допустимые максимально разо-
вые концентрации загрязняющих веществ в атмосферном воздухе населен-
ных мест, устанавливаемые при однократном воздействии по изменению
рефлекторных реакций. Среднесуточные ПДК вредных веществ в атмосфер-
ном воздухе населенных мест по способу установления и по системе кон-
троля идентичны.
Что касается ПДК вредных веществ в воздухе рабочей зоны, то способу
их установления, по существующей методике, соответствуют среднесменные
ПДК, разрабатываемые для высококумулятивных веществ и являющиеся в
соответствии с действующими методическими указаниями средними кон-
центрациями, полученными при непрерывном или прерывистом отборе
проб воздуха при суммарном времени не менее 75 % продолжительности
рабочей смены, или концентрациями средневзвешенными в течение дли-
тельности всей смены в зоне дыхания работающих на местах постоянного
или временного их пребывания. Аналогичный принцип положен сегодня в
основу обоснования максимально разовых ПДК в воздухе рабочих помеще-
ний, являющихся по способу установления для большинства веществ сре-
дневзвешенными (среднесменными). Поскольку максимально разовые ПДК
по форме контроля не должны в течение рабочей смены превышать 15 мин
для токсичных веществ и 30 мин для аэрозолей преимущественно фибро-
генного действия, повторяющихся не чаще 4 раз в смену, возникающее
противоречие при обосновании ПДК может быть устранено. Для этого/
при разработке максимально разовой ПДК ее величину целесообразно
устанавливать на уровне удвоенного среднеквадратического отклонения
от средневзвешенной концентрации, полученной в результате хроничес-
кого опыта.
Изложенное выше в известной мере объясняет различие в величинах
отечественных ПДК и TLV США. В тех случаях, когда речь идет о высоко-
кумулятивных веществах, эти различия невелики либо практически отсут-
ствуют, поскольку способ установления норматива и система критериев ДЛЯ
контроля практически одинаковы. И иная картина в тех случаях, когда ПДК
веществ, установленных как среднесменные, контролируются как макси-
мальные разовые, т.е. являются значительно заниженными.
494
ПДК вредных веществ в воде водоемов также устанавливается на основе
общих принципов токсикометрии при длительном внутрижелудочном поступ-
лении вещества в организм животных с водой и оценке по общетоксическому
(санитарно-токсикологическому) лимитирующему показателю вредности.
Практическая направленность профилактической токсикологии обусло-
вила необходимость экспериментального обоснования гигиенических пара-
метров и нормативов, положенных в основу создания системы показателей
опасности. Под опасностью вещества в профилактической токсикологии и
гигиене понимается вероятность возникновения вредных для здоровья эф-
фектов в реальных условиях производства или применения химических
веществ. Система показателей опасности наиболее обстоятельно разработана
в промышленной токсикологии (ГОСТ 12.1.1.007-76). Конкретно к показа-
телям опасности относятся:
1. ПДК вредного вещества в воздухе рабочей зоны (ПДКрабз) —кон-
центрация, которая при ежедневной (кроме выходных дней) работе в тече-
ние 8 ч и не более 40 ч в неделю в течение всего рабочего стажа не должна
вызывать заболеваний или отклонений в состоянии здоровья, обнаружива-
емых современными методами исследований в процессе работы или в от-
даленные сроки жизни настоящего и последующих поколений. В новом
издании ГН 2.2.5.686-98 указанная формулировка дополнена фразой: “Воз-
действие на уровне ПДК не исключает нарушение состояния здоровья лиц
с повышенной чувствительностью”.
2. Средняя смертельная доза при введении в желудок (LD50 в жел) — доза
вещества, вызывающая гибель 50 % животных при однократном введении в
желудок.
3. Средняя смертельная концентрация в воздухе (LC50) — концентрация
вещества, вызывающая гибель 50 % животных при двух-четырехчасовом
ингаляционном воздействии.
4. Средняя смертельная доза при нанесении на кожу (LDjqhk) — Доза
вещества, вызывающая гибель 50 % животных при однократном нанесении
на кожу.
5. Коэффициент возможности ингаляционного отравления (КВИО) —
отношение максимально достижимой концентрации вредного вещества в
воздухе при 20 °C к средней смертельной концентрации вещества для мы-
шей.
6. Зона острого действия (Zac) — отношение средней смертельной кон-
центрации вредного вещества к минимальной (пороговой) концентрации,
вызывающей при однократном ингаляционном воздействии изменение био-
логических показателей на уровне целостного организма, выходящих за
пределы приспособительных физиологических реакций.
7. Зона хронического действия (Zch) — отношение минимальной (поро-
говой) концентрации, вызывающей изменение биологических показателей
на уровне целостного организма, выходящих за пределы приспособительных
физиологических реакций к минимальной (пороговой) концентрации, вы-
зывающей вредное действие в хроническом эксперименте по 4 ч пять раз в
неделю на протяжении не менее 4 мес.
По степени воздействия на организм вредные вещества подразделяются
на четыре класса опасности:
• вещества чрезвычайно опасные;
• вещества высокоопасные;
• вещества умеренно опасные;
• вещества малоопасные.
495
Класс опасности вредных веществ устанавливают в зависимости от норм
и показателей, указанных в табл. 14.3.
Таблица 14.3. Нормы для класса опасности
Показатель Класс опасности
1-й 2-й 3-й 4-й
ПДК вредных веществ в воз- духе рабочей зоны, мг/м3 Менее 0,1 0,1—1,0 1,1—10,0 Более 10,0
Средняя смертельная доза при введении в желудок, мг/кг Менее 15 15—150 151—5000 Более 5000
Средняя смертельная доза при нанесении на кожу, мг/кг Менее 100 100—500 501—2500 Более 2500
Средняя смертельная кон- центрация в воздухе, мг/м3 Менее 500 500—5000 5001—50 000 Более 50 000
КВИО Более 300 300—30 29—3 Менее 3
Зона острого действия Менее 6,0 6,0—18,0 18,1—54,0 Более 54,0
Зона хронического действия Более 10,0 10,0—5,0 4,9—2,5 Менее 2,5
Система показателей и классов опасности используется также и в других
областях профилактической токсикологии, и с ними можно ознакомиться
в соответствующих нормативно-методических документах.
28-м совещанием группы экспертов по созданию (гармонизации) Меж-
дународной классификации токсичности химических веществ (1998) пред-
ложен приводимый ниже вариант, отличающийся от отечественных не толь-
ко различием величин показателей, но и наличием 5-го класса веществ,
характеризуемого клиническими проявлениями интоксикации, что является
принципиальным нововведением в существующую систему классификации.
Предлагаем схематическое представление интегрированной системы
классификации опасности для здоровья человека и окружающей среды
(табл. 14.4).
Таблица 14.4. Классификация опасности для здоровья человека и окружающей
среды
Острая токсичность Класс опасности
1-й 2-й 3-й 4-й 5-й
Оральная, мг/кг 5 50 300 2000 5000 (или эквивалентные дозы по другим путям поступления)
Дефмальная Ингаляционная 50 200 1000 2000 Критерии: • Индикация значимого воздействия на
газ, ppm 100 500 2500 5000 человека
пар, мг/л 0,5 2,0 10 20 • Любая смертность в классе 4
смесь пыли/па- ра, мг/л/4 ч 0,05 0,5 1,0 5 • Значительные клинические признаки для класса 4 • Показатели по другим источникам
В связи с необходимостью ускоренной оценки токсичности и опасности
химических веществ при планировании экспериментальных исследований
большое значение в профилактической токсикологии приобрел прогноз
параметров токсичности на основе ограниченной информации. Возмож-
496
ность прогнозирования характера и степени токсического действия веществ
основана, с одной стороны, на зависимости особенностей химической струк-
туры вещества и его поведения в организме с точки зрения влияния на те
или иные органы и системы и, с другой, роли физико-химических характе-
ристик соединений в определении количественных параметров токсичности.
Многочисленными исследованиями [5, 16, 26, 28] установлена возмож-
ность расчета параметров токсичности и гигиенических нормативов хими-
ческих веществ. Наиболее точно возможен расчет параметров токсичности
для органических соединений и прежде всего для их гомологических рядов.
В основу расчетов положены такие показатели, как молекулярная масса,
температура кипения, плотность, упругость пара и ряд других [27]. Наиболее
полно в отечественной профилактической токсикологии представлены рас-
четы гигиенических нормативов вредных веществ в различных средах, про-
веденные путем их корреляции с основными физико-химическими констан-
тами веществ, параметрами токсикометрии, установленными в краткосроч-
ных опытах, а также с гигиеническими нормативами соединений в гомо-
логических рядах, установленными в различных средах.
14.8. Комбинированное действие химических веществ
14.8.1. Многофакторный характер токсической экспозиции
Одновременное или последовательное воздействие на человеческий ор-
ганизм более чем одного токсического вещества наиболее типично для
современных условий. Источники комбинированного химического загряз-
нения окружающей среды (как в производстве, так и вне его) могут быть
разобщенными в пространстве и/или времени, но связанными между собой
определенным технологическим процессом. В других случаях близость таких
источников случайна — например, при размещении в одном городе не свя-
занных друг с другом предприятий, загрязняющих атмосферу разными по
составу выбросами. Наконец, многокомпонентное загрязнение среды может
происходить одновременно из одного и того же источника в результате
одного и того же процесса (такова, например, комбинация оксидов метал-
лов, диоксида азота и фтористого водорода, образующаяся при электросвар-
ке) или же является следствием применения в производстве какого-то
многокомпонентного материала. Не остаются в стороне и вопросы комби-
нированной токсичности лекарственных веществ, а также сочетания экспо-
зиции к промышленным и бытовым токсикантам.
Неудивительно, что проблема комбинированного действия оказывается
одной из наиболее актуальных для современной токсикологии. Однако,
несмотря на большое число исследований, посвященных оценке действия
конкретных комбинаций, и серьезных обобщающих работ [10, 12, 23, 60],
многие аспекты этой проблемы остаются предметом научной дискуссии и
далеки от общепризнанного решения. Это связано со значительной ее
сложностью как в теоретическом, так и в прикладном отношении.
Хотя и далеко не единственным, но безусловно одним из наиболее
важных прикладных аспектов проблемы комбинированной токсичности яв-
ляется необходимость учета ее закономерности при регламентации загряз-
нения окружающей среды несколькими веществами одновременно. Во всех
странах, имеющих соответствующие гигиенические регламенты, они обо-
сновываются и устанавливаются, как правило, не для смесей, а для инди-
видуальных химических веществ, действующих изолированно. Естественно
497
возникает вопрос о том, обеспечивают ли подобные нормативы безопас-
ность токсической экспозиции, если она оказывается многофакторной. На-
ряду с этим оправдано стремление гигиенической токсикологии регламен-
тировать в каких-то случаях и загрязнение среды многокомпонентной сме-
сью как таковой.
Начнем обсуждение проблемы не с теории, а с общих вопросов гигие-
нической регламентации при комбинированном токсическом воздействии,
поскольку именно здесь наиболее ясно проявляются некоторые сложности
и неопределенности проблемы в целом и в частности ее фундаментальных
понятий.
Рассмотрим этот вопрос на примере регламентации химического загряз-
нения воздуха рабочей зоны, для которого он имеет наиболее длительную
историю, но практически все возникающие здесь сложности достаточно
типичны и для подобной регламентации в других компонентах среды. Ин-
тересно сопоставить то, как эта задача решается в странах СНГ, с одной
стороны, и в США — с другой. Именно в бывшем СССР и в США решения
подобных задач наиболее разработаны и в целом однотипны, несмотря на
определенные различия тех нормативов, которые устанавливаются для изо-
лированного действия: ПДК в СНГ и “допустимого уровня экспозиции”
(permissible exposure leel — PEL) либо не имеющей обязательной силы “ве-
личины порогового предела” (threshold limit value — TLV) в США.
Действительно, регламентирующими документами обеих стран предла-
гаются два альтернативных решения, которые могут показаться простыми и
легко реализуемыми на практике. Для одних комбинаций контроль допус-
тимости многокомпонентного загрязнения воздуха предлагается осущест-
влять с учетом взаимодополняемости (аддитивности) действующих концент-
раций отдельных компонентов, т.е. требуется соблюдать условие, что сумма
отношений наблюдаемых концентраций каждого вещества к соответствую-
щей ПДК (PEL, TLV) не превышает 1,0:
С^/ПДК^ + С2/ПДК2 + ... + Ср/ПДКп s 1,0.
Для других комбинаций аддитивность не принимается во внимание (или
считается отсутствующей), т.е. требуется лишь, чтобы для каждого компо-
нента наблюдаемая концентрация не превышала установленной для него
ПДК (PEL, TLV). Таким образом, остается определить критерии выбора
одного из этих вариантов, что при ближайшем рассмотрении оказывается
далеко не простым.
В США первым из приведенных правил предлагается руководствоваться
тогда, когда в воздухе присутствуют два или более вредных веществ, которые
“действуют на одну и ту же систему органов”, а вторым —"когда есть
достаточно оснований полагать, что главные эффекты различных веществ
не аддитивны, а независимы". В отечественных регламентационных доку-
ментах говорится соответственно об “однонаправленном” и “разнонаправ-
ленном действии” одновременно присутствующих веществ, однако не уточ-
няется, к сожалению, идет ли речь о направленности эффектов этого дей-
ствия или (как в США) о совпадении точек его приложения. На практике
обычно принимается вторая трактовка. Она, вероятно, оправдана и потому,
что, как справедливо отмечают Ю.С.Каган и Б.М.Штабский [10], при оцен-
ке комбинированного эффекта по летальному исходу все токсичные веще-
ства выступают в качестве однонаправленных.
Надо признать, что термин “независимое” (“необщее”, “инонаправлен-
ное”) действие ядов не придуман авторами цитируемых формулировок, а
заимствован из классической системы понятий, развитой в 20—30-х годах
498
XX в. Леве и Н.В.Лазаревым. Сохраняется он и в современной научной
литературе.
Поскольку, однако, существует мало токсичных веществ, действующих
исключительно на какую-то одну систему органов, неизбежно возникает
вопрос, применимо ли уравнение суммации для двух или более политропных
ядов, если для них совпадает только часть таких органов-мишеней, или же
их действие следует считать разнонаправленным? В качестве примера можно
привести комбинацию диоксида азота и фтористого водорода: оба газа
действуют на легкие (пульмонотоксичны), но их резорбтивно-токсическое
действие имеет весьма существенные различия. К тому же ПДК могли быть
установлены как раз не по действию на “совпадающий орган” (как это и
имеет место в случае фтористого водорода).
Поэтому совсем не ясно, что считать независимым действием, по аме-
риканской формулировке, или разнонаправленным — по отечественной.
Правда, в американском определении уточняется независимое действие
следующим образом: “... как это имеет место, когда чисто локальные эф-
фекты на разные органы тела вызываются разными компонентами смеси”.
Однако даже если примеры строго местного действия и могут быть найдены,
едва ли есть основания утверждать, что поражения разных органов и систем
одного и того же организма действительно развиваются независимо одно от
другого. Это сомнительно не только с позиций понимания организма как
единого целого, но и в более узком, собственно токсикологическом смысле.
Например, даже избирательное поражение печени одним каким-то ядом
может ослабить детоксикацию другого и тем самым усилить его действие,
даже если оно избирательно влияет совсем на другой орган. Локальное
повреждение легких каким-либо пульмонотоксичным ядом может изменить
количественно судьбу отлагающихся в них аэрозольных частиц и тем по-
влиять на хемобиокинетику содержащегося в них, например, свинца или
другого яда, избирательно поражающего не легкие, а другие органы и
системы. Цитированное выше упоминание о “главных эффектах” лишь
добавляет еще один нерешенный вопрос: какими критериями определяется
отнесение эффекта к главным или к второстепенным?
Применение уравнения суммации формально не ограничено числом
веществ, входящих в комбинацию. Однако все те неопределенности, о
которых речь шла выше, резко возрастают с увеличением этого числа и для
действительно многокомпонентных комбинаций делают рассматриваемое
правило регламентации реально неосуществимым. К тому же, препятствием
к его применению может оказаться отсутствие установленной ПДК для
какого-либо вещества, входящего в комбинацию. Когда же таких компонен-
тов десятки или даже сотни, подобная ситуация неизбежна. Примером такой
смеси могут служить газоаэрозольные возгоны каменноугольных смол или
пеков, и именно этим случаем может быть проиллюстрирован простейший
выход из положения: как в США, так и в России допустимое содержание
этих возгонов регламентируется по всей общей массе компонентов, как для
единого вещества. В других случаях регламент может быть установлен по
одному какому-либо компоненту (преобладающему по содержанию либо ве-
дущему в картине отравления, либо наиболее легко и надежно определяемому
в воздухе). Как правило, и такая смесь при установлении для нее ПДК
исследуется как одно вещество, а характер комбинированного действия ее
компонентов, от которого зависит токсичность, выясняется лишь редко.
Однако снять подобными способами прикладное значение теории ком-
бинированной токсичности удается лишь тогда, когда смесь имеет постоян-
499
ный состав или когда соотношение между ее компонентами варьирует в
пределах, заметно не влияющих на ее суммарную токсичность, причем они
должны быть установлены специальным исследованием в каждом случае.
Такого, даже относительного постоянства может не наблюдаться не только
при разобщенности источников загрязнения среды, но и тогда, когда речь
идет об одном и том же источнике, функционирующем в меняющемся
режиме. Например, наблюдалось, что соотношение между концентрациями
марганца и хрома в воздухе на рабочем месте плавильщика в разные периоды
электроплавки одной и той же марки стали варьировало от 1:0,1 до 1:4 [11].
В подобных ситуациях не обойтись без информации о характере комби-
нированного действия, необходимой для обоснования того правила контроля
экспозиции, которое было бы применимым если не для всех мыслимых соот-
ношений между веществами, то хотя бы для определенного диапазона этих
соотношений. Если же в такой количественно изменчивой ситуации ком-
понентов слишком много, чтобы возможно было обеспечить надежность ука-
занной информации, то токсикологу приходится сосредоточить внимание на
закономерностях комбинированного действия лишь части этих компонентов,
выбрав те из них, которые преобладают по содержанию в комбинации и/или
по степени опасности. Опыт убеждает в том, что действительно выяснить
эти закономерности удается для комбинации не более 2—3 веществ.
14.8.2. Различные дефиниции типов комбинированного
действия
Следует отметить, что регламентирующие документы обеих стран не
только терминологически расплывчаты, но и оторваны от терминологии,
применяемой в научной токсикологии. Русский документ вообще не опре-
деляет терминов, характеризующих количественную сторону комбинирован-
ного действия и никак не соотносится с описывающими ее основными
понятиями теории комбинированной токсичности. Американский документ
лишь упоминает, не давая им строгого определения, понятия аддитивности
и синергического действия, или потенцирования. Действие менее аддитив-
ного и токсикологический антагонизм даже не упоминаются. Зато исполь-
зуется понятие “независимое” действие, вызывающее изложенные выше
сомнения и не имеющее ни качественной, ни количественной (токсикомет-
рической) определенности.
В какой-то степени это отражает и некоторую путаницу понятий в самой
токсикологической литературе. В 1981 г. этот вопрос рассмотрел специаль-
ный Комитет экспертов ВОЗ (WHO, 1981), который принял за основу опре-
деление аддитивного действия как такого типа комбинированного действия
химических веществ, при котором их совместный эффект равен сумме эф-
фектов веществ при изолированном действии каждого на организм. В случае,
если совместный эффект превышает эту сумму, комбинированное действие
обозначается как “более чем аддитивное” (потенцирование, синергизм). Если
же совместный эффект меньше суммы эффектов изолированного действия,
то речь идет о действии “менее чем аддитивном (антагонизме)”. Обосно-
ванность использования двух последних понятий (т.е. аддитивности и анта-
гонизма) как синонимов обсуждается нами ниже, а пока отметим главную
особенность тех определений, с которыми согласились эксперты ВОЗ. Она
состоит в том, что критерием типа и количественной выраженности ком-
бинированного токсического действия служит отношение наблюдаемого
суммарного эффекта комбинации к эффекту, ожидаемому при простом
500
арифметическом суммировании эффектов веществ, входящих в эту комби-
нацию. Если это отношение статистически и токсикологически значимо
больше или меньше чем 1,0, то говорят о потенцировании (синергизме) или
антагонизме соответственно; если отличие его от 1,0 несущественно, то
принимается гипотеза аддитивности.
Таким образом, понятие, принятое Комитетом экспертов ВОЗ за основу
классификации эффектов комбинированного действия, является понятием
аддитивности эффектов, иногда называемой также гетероаддитивностью.
Действительно, во многих экспериментальных работах по комбинированной
токсичности (особенно при проведении субхронических или хронических
экспериментов) в основу ее оценки явно или молчаливо вкладывается имен-
но это понятие. Вместе с тем, когда эта оценка используется для принятия
правила гигиенической регламентации, редко обращается внимание на то,
что оно связано с существенно иным понятием аддитивности доз (или
изоаддитивности). Оно также лежит в основе многих экспериментальных
исследований (в особенности при изучении острой токсичности) и принятых
способов математического анализа их результатов, требующих, чтобы было
количественно оценено действие достаточно широкого диапазона доз при
разных соотношениях между ними (что в хронических экспериментах прак-
тически неосуществимо). Не так уж редко один и тот же исследователь,
изучающий действие какой-либо конкретной комбинации веществ на раз-
ных уровнях и при разных длительностях экспозиции, меняет по ходу дела
основной понятийный критерий оценки. Как уже сказано, такая подмена
нередко неизбежна, но она должна совершаться осознанно, с тем чтобы
обеспечить необходимую осторожность заключений.
Что же такое аддитивность доз? В этом случае основной тип комбини-
рованной токсичности, т.е. аддитивное действие определяется как такое, при
котором отдельные компоненты комбинации являются полностью взаимо-
заменяемыми в пропорциональных долях их изоэффективных доз (напри-
мер, в долях от LD50, от ЭД50). Это определение может быть выражено
уравнением:
(C-j/M-t + С2/М2 + ... + Сп/Мп) К = 1,0,
где С], С2, ..., Сп — дозы или концентрации каждого компонента, Mj, М2,
..., Мп — их изоэффективные дозы (концентрации) по тому эффекту, кото-
рый исследуется, коэффициент (К) = 1,0. Другими словами, смесь некото-
рых долей от изоэффективных доз, равная в сумме единице, действует так
же, как действовал бы любой ее компонент в единичной изоэффективной
дозе (концентрации). Если смесь действует сильнее изоэффективных доз
компонентов, то для сохранения уравнения требуется величина коэффици-
ента К< 1,0, которая и служит количественной мерой потенцирования; если
требуется К>1,0, то речь идет о действии менее аддитивного (антагонизме).
Легко заметить сходство этого уравнения и приведенного выше регла-
ментационного правила аддитивности, если принять, что все ПДК (или все
TLV, PEL) эквивалентны (при любом эффекте, равном нулю). В действи-
тельности, однако, разрыв между ПДК и той концентрацией (дозой), кото-
рая вызывает некоторый эффект, для разных веществ заведомо различен и
Достаточно часто неизвестен. Поэтому истинно изоэффективными эти нор-
мативные величины не являются. Тем не менее несомненно, что именно
понятие аддитивности доз (а не аддитивности эффектов) является теорети-
ческой основой указанного правила.
Являются ли два типа аддитивности двумя различными явлениями или
всего лишь двумя разными способами оценки комбинированного действия?
501
По этому поводу в литературе нет полного единогласия, и оба понимания
проблемы можно иногда встретить в одной и той же статье [10]. Можно
думать, однако, что второй взгляд более оправдан, а если для каких-то
комбинаций выявляется только один тип аддитивности, то это может объ-
ясняться уровнем доз, при которых она исследовалась.
Действительно, оценка типа комбинированного действия на основе двух
рассмотренных определений аддитивности может совпасть только в том
диапазоне доз, в котором зависимость доза — эффект практически линейна.
Подобно тому как приращение на одну и ту же величину дозы какого-то
вещества дает в этом диапазоне одно и то же приращение эффекта, такое
же приращение последнего даст и добавление к этому веществу соответст-
вующей доли изоэффективной дозы другого (если их действие изоадцитив-
но). Но, как хорошо известно, в более широком диапазоне доз линейность
указанной зависимости, как правило, нарушается. Поэтому комбинация,
подчиняющаяся правилу аддитивности доз, в крайних частях такого диапа-
зона может дать эффект, существенно отличный от суммы эффектов изо-
лированных компонентов.
По мнению Ю.С.Кагана и Б.М.Штабского [10], доказанное отклонение
от изоадцитивности требует перехода к оценке комбинированного действия
по суммации эффектов. Однако многие исследования, рассматривающие
аддитивность эффектов, проводились с дозами, отношение которых к
каким-либо изоэффективным вообще не указано. Там же, где сопоставление
двух оценок комбинированного действия возможно, действительно нередко
оказывается, что они не совпадают.
“Отменить” одно из определений аддитивности и таким способом уст-
ранить все эти противоречия невозможно хотя бы потому, что на основе
каждого из них накоплен значительный экспериментальный материал. Од-
нако при сопоставлении выводов разных экспериментаторов необходимо
тщательно взвешивать этот материал, прежде всего с рассмотренных здесь
позиций, и с этих же позиций проявлять осторожность к обоснованию
регламентационных предложений.
В частности, до сих пор не найдено достаточных оснований к ужесто-
чению регламентации для каких-либо конкретных комбинаций веществ,
обладающих синергизмом, т.е. к тому, чтобы сумма отношений концентра-
ций этих веществ к их ПДК устанавливалась на уровне, не превышающем
какую-то величину < 1,0. Казалось бы, что в случае эффекта менее адди-
тивного или антагонизма жесткость регламентации может быть, наоборот,
снижена, например, установлением для каждого вещества в комбинации
более высоких ПДК по сравнению с теми, которые приняты для изолиро-
ванного действия. Другой подход, нередко осуществляемый на практике,
заключается в принятии именно для токсических веществ-антагонистов того
правила, которое в США относится к смеси веществ так называемого
независимого, а в России так называемого разнонаправленного действия.
Напомним, что это решение состоит в соблюдении для каждого вещества
его индивидуальной ПДК. В сущности оно равносильно тому, чтобы допус-
тить величину, значительно превышающую 1,0 (2,0, 3,0 и т.д. в зависимости
от числа веществ в комбинации) в качестве предельной для той же суммы
отношений. Значительно более осторожным и теоретически более оправ-
данным было бы установление такого регламентируемого предела на опре-
деленном уровне >1,0, но не столь высоком. Однако пока ни одного такого
регламентационного правила для конкретной комбинации не установлено.
В какой-то мере это может быть объяснено сохраняющимися неяснос-
тями в определении понятия и в оценке степени антагонизма.
502
14.8.3. Токсикологический антагонизм
Термины “действие, менее чем аддитивное” и “антагонизм” часто упот-
ребляются в качестве синонимов для обозначения одного и того же типа
комбинированной токсичности. Однако применительно к понятию “адди-
', тивность эффектов”, как должно быть ясно из изложенного выше, действие
& менее аддитивного может быть получено просто вследствие характера зави-
симости доза — эффект, что не имеет никакого отношения к обычному
пониманию термина “антагонизм” как “противодействие”, “противостоя-
ние”. В подобных случаях комбинация, дающая в некоторых дозах, испы-
танных экспериментатором, субаддитивное (по эффекту) действие, вполне
может проявить себя как аддитивная при менее высоких дозах.
Другое объяснение субаддитивного действия, в равной мере применимое
к обоим понятиям аддитивности, может быть связано с тем, что вещества,
входящие в комбинацию, конкурируют за общие рецепторы; или же какие-
то токсикодинамические особенности одного вещества тем или иным спо-
собом препятствуют развитию рассматриваемого токсического эффекта от
действия другого либо способствуют его детоксикации и/или элиминации
~ из организма и т.п. Далее будет показано, что подобные механизмы комби-
нированного действия могут иметь место. Во всех подобных случаях, когда
существует скрытый от глаз исследователя или выявленный механизм, пре-
пятствующий полному суммированию токсического действия компонентов
комбинации, феномен субаддитивности действительно должен трактоваться
как проявление токсикологического антагонизма. При его особой выражен-
ности эффект комбинации может оказаться ниже не только суммы эффектов
изолированного действия входящих в нее веществ, но и ниже эффекта
какого-то из них или даже (при бинарной комбинации) ниже эффекта
изолированного действия обоих. В этом случае иногда говорят о “явном
антагонизме”, однако следует иметь в виду, что причины такого “явного”
и “скрытого” (т.е. проявляющегося в форме субаддитивности) антагонизма
скорее всего носят один и тот же характер.
Вместе с тем к токсикологическому антагонизму относится и существен-
но иной феномен. Если два вещества вызывают в каком-то органе или
системе организма противонаправленные сдвиги одного и того же функци-
онального параметра, то именно суммация этих эффектов приводит к их
взаимному ослаблению. В этом случае комбинированное действие, которое
в полном формальном соответствии с понятием аддитивности эффектов
следовало бы назвать аддитивным, по существу своему и по токсикологи-
ческому проявлению является антагонистическим. В качестве примера та-
кого взаимоослабления противонаправленных эффектов на рис. 14.1 пока-
заны изменения числа эритроцитов (в % от параллельного контроля) в
периферической крови крыс при хроническом парентеральном воздействии
растворимых солей хрома, марганца и их комбинации. Начиная со 2-го
месяца затравки отчетливо видны стимулирующее эритропоэз действие мар-
ганца и ингибирующее его действие хрома, но и в этот срок, и позднее в
группе, подвергавшейся комбинированному воздействию, отличие от кон-
троля невелико, статистически незначимо, и если наблюдается, то только с
положительным знаком.
Таким образом, алгебраическое суммирование эффектов в подобных
случаях соответствует арифметическому вычитанию и действительно явному
токсикодинамическому антагонизму того типа, который В.В.Кустов и соавт.
[23] обозначали как физиологический антагонизм ядов. Тот тип антагониз-
ма, который проявляет себя как действие менее аддитивного, можно было
503
<Ц'-
ШУ’'
Рис. 14.1. Динамика изменений числа эритроцитов в крови к показателю параллель-
ного контроля у крыс, получавших внутрибрюшинно по 3 раза в неделю через день
бихромат калия при разовой дозировке 0,5 мг Сг/кг (верхняя кривая) либо хлорид
марганца при разовой дозировке 5,0 мг Мп/кг (нижняя кривая), либо комбинацию
этих веществ в тех же дозах (средняя кривая).
Звездочками (*) отмечены отклонения от контроля, статистически значимые при р<0,05. Ис-
пользованные дозы соответствуют 0,1 LD50 при однократном изолированном введении тех же
веществ.
бы назвать токсикометрическим. Однако многие токсические металлы про-
являют по тем или иным эффектам действия антагонизм и того, и другого
рода. Важно подчеркнуть, что они нередко хорошо известны и как собст-
венно физиологические антагонисты, выявленные по некоторым важным
эффектам их влияния на организм в качестве биомикроэлементов или по
кинетике этих микроэлементов; таковы, например, цинк и медь [49]. Между
тем в каком-то диапазоне относительно низких, но уже токсичных доз
подобного металла нередко еще сохраняются определенные эффекты той
физиологически благоприятной активности, которая свойственна ему в жиз-
ненно необходимых микродозировках. Когда этот благоприятный эффект
по своему характеру таков, что он может корректировать повреждение,
наносимое соответствующей функции другим токсическим веществом, то
при действии их комбинации может наблюдаться ослабление этого повреж-
дения. Именно это иллюстрируется приведенным на рис. 14.1 примером.
Отметим, что аналогичным образом марганец подавляет также индукцию
эритроцитоза, вызываемого у крыс никелем, при комбинированном дейст-
вии этих двух металлов [52].
Некоторые способы математического описания комбинированного ток-
сического действия формализуют идею аддитивности эффектов или доз и
понимание антагонизма только как действия менее аддитивного. В частнос-
ти, это относится к широко используемым полиномиальным уравнениям
регрессии, которые строятся на основе анализа результатов эксперимента,
построенного на основе ортогонального активного планирования. При обо-
значении доз двух входящих в комбинацию веществ как Xj и xq зависимость
от них эффекта комбинации (у) в общем случае выражается полиномом
следующего вида:
у = b0 + b1x1 + b^X^ + b2x2 + b22x22 + Ь12х-|Х2.
Обычно только в том случае, если коэффициент Ь12 оказывается значимо
504
отличным от нуля, т.е. имеет положительный или отрицательный знак,
комбинированное действие расценивается как отличное от аддитивного
(соответственно как потенцирование или как антагонизм). Однако если
эффекты противонаправлены, т.е. если коэффициенты при xj и при х2
имеют разные знаки, то даже при bj2 = 0 данное уравнение описывает
взаимоослабление эффектов, т.е. токсикологический антагонизм того рода,
который мы условно обозначаем как физиологический. В этом случае знак
последнего члена полинома не имеет решающего значения и может лишь
усилить или ослабить такую оценку комбинированного действия.
В конце предыдущего раздела этой главы уже говорилось о сложностях
принятия регламентационных решений по веществам, обладающим комби-
нированным действием менее аддитивного или “физиологическим” типом
антагонизма. Целесообразность осторожности в этих случаях связана, одна-
ко, не только с рассмотренными проблемами дефиниции и оценки антаго-
низма. Значительно важнее то, что обнаружение его для конкретной ком-
бинации при определенных дозах и соотношениях между ними и по каким-
то определенным эффектам не должно создавать уверенность в том, что в
других экспериментальных условиях та же комбинация не проявит себя как
аддитивная или даже синергическая.
14.8.4. Неоднозначность комбинированного действия
Наиболее часто отмечаемой является зависимость типа комбинирован-
ного действия от соотношения между компонентами смеси, в том числе при
выражении их доз в долях тех или иных изоэффективных, например, в долях
LD50 при анализе, основанном на понятии аддитивности доз. Наглядной
демонстрацией этой зависимости может служить изобола комбинированного
действия двух веществ по Леве. Эта изобола строится в прямоугольных
координатах, соответствующих дозам, выраженным указанным способом,
при комбинации которых имеется та же 50 % вероятность летального или
другого эффекта. Если точки на осях, соответствующие величинам ЭД50 или
LD50 этих веществ при изолированном воздействии, оказываются соединен-
ными прямой линией, то речь идет о полной аддитивности доз во всем их
диапазоне. Кривая, лежащая целиком выше этой прямой, представляет
собой изоболу субаддитивности (антагонизма), а кривая, лежащая целиком
ниже ее, — изоболой сверхаддитивности (синергизма), опять-таки во всем
диапазоне доз. Использование компьютера дает возможность решения по-
добных задач и для многокомпонентных комбинаций с построением не
линий, а поверхностей в р-мерном пространстве. Вместе с тем и для про-
стейших бинарных комбинаций подобные изоболы “полной” аддитивности
либо “полной” суб- или сверхаддитивности встречаются не слишком часто.
Напротив, показанная на рис. 14.2 изобола Леве для летального эффекта
комбинации фтора и марганца (эксперимент В.И.Давыдовой) вполне типич-
на. Такая двухфазная кривая демонстрирует, что в зависимости от преобла-
дания в смеси того или иного компонента их действие может оказаться как
аддитивным (по определению аддитивности доз), так и отличающимся от
аддитивного с одним или другим знаком. Напомним лишь, что, говоря о
преобладании, в этом случае имеют в виду соотношение доз не в массовом,
а в эффективном измерении. Анализ аддитивности доз, выраженных в
единицах массы, может оказаться полезным для прогнозирования комбини-
рованной токсичности конкретных смесей или в конкретных производст-
венных условиях.
505
Рис. 14.2. Изоболы комби-
нированного острого смер-
тельного действия фторида
натрия (ось абсцисс) и хло-
рида марганца (ось ординат)
для мышей (кривая I) и для
крыс (кривая II). Прямая
линия соответствует адди-
%. яд» тивности доз.
Тип комбинированной токсичности некоторых веществ может оказаться
также различным и зависит от уровня и продолжительности токсического
воздействия, а также от того, какой конкретно эффект оценивается. Напри-
мер, антагонизм при . хронической экспозиции типичен для большинства
эффектов резорбтивного токсического действия многих металлов, в част-
ности для комбинации хрома и никеля, хотя на уровне остро действующих
смертельных доз в определенных соотношениях те же авторы [3] обнаружили
при построении изоболы Леве и другие типы комбинированной токсичнос-
ти. Вместе с тем имеются данные о потенцировании хромом характерного
действия ингалируемых соединений никеля на клетки альвеолярного эпи-
телия типа II и накопление сурфактантного липида в легких [53]. Настора-
живают также данные о супераддитивности мутагенного действия тех же
двух металлов в тесте на трансформацию клеток млекопитающих [59], что
указывает на возможность особой онкологической опасности сочетания этих
двух металлов, безусловно канцерогенных для человека.
Ранее уже отмечен антагонизм хрома и марганца по действию на кровь.
Этот тип комбинированной токсичности преобладает и по другим эффектам
при хроническом действии, а также при однократном — не только по ле-
тальному эффекту, но и по цитотоксичности для легочных макрофагов как
in vitro, так и in vivo. Вместе с тем едва ли можно считать благоприятным
для организма усиление задержки хрома в печени при одновременном
воздействии марганца.
Не исключена вероятность изменения преобладающего комбинационно-
го эффекта также на разных фазах одного и того же хронического воздей-
ствия. Например, было обнаружено, что при чередующейся ежедневно экс-
позиции крыс к кварцевой пыли и к сернистому ангидриду развитие ком-
бинированного (токсико-пылевого) пневмосклероза в течение нескольких
месяцев отстает от чисто силикотического процесса, вызываемого ингаля-
цией только пыли, но позднее опережает его [13].
506
Между тем от токсиколога-эксперта справедливо ждут четкой и вполне
определенной рекомендации по поводу правила контроля безопасного со-
держания химических веществ в окружающей человека среде с учетом их
комбинированного действия. Поэтому для решения подобных вопросов
было предложено ввести вспомогательное понятие “основного”, или “опре-
деляющего”, типа комбинированного действия [14], принятое затем офици-
альным методическим документом (Минздрав СССР, 1987). При выборе
основного типа комбинированной токсичности следует принимать в расчет:
• преимущественное значение того типа комбинированного действия,
_ который обнаруживается для доз (концентраций), вызывающих хро-
В ническую интоксикацию, а при острой интоксикации — для доз,
I близких к пороговым;
В «в тех случаях, когда рассматриваемая комбинация в реальных усло-
В виях встречается главным образом в каком-то узком диапазоне соот-
В ношений между ее компонентами, преимущественное значение того
В типа комбинированного действия, который характерен для данного
В диапазона;
В «в тех случаях, когда известны органы и системы, реагирование кото-
fl рых наиболее вовлечено в токсикодинамику и хемобиокинетику ком-
fl бинированной интоксикации, преимущественное значение того типа
В комбинированного действия, который преобладает по сдвигам со
В стороны именно этих органов (систем);
В «в тех случаях, когда для веществ, входящих в комбинацию, или хотя
В бы для одного из них специфичны особо неблагоприятные эффекты
В на организменном или популяционном уровне (в особенности кан-
В церогенность, мутагенность, влияние на репродуктивную функцию)
В преимущественное значение того типа комбинированного действия,
которое обнаруживается по этим эффектам, в особенности если речь
идет о синергизме.
Однако необходимо подчеркнуть, что вне рамок задач гигиенической
регламентации не только основной тип, но и весь спектр возможных ком-
бинационных отношений представляет не только теоретический, но и прак-
тический интерес. Так, даже если в качестве основного типа комбиниро-
ванного действия, с учетом рассмотренных только что критериев, была
принята аддитивность, возможное ослабление каких-то проявлений инток-
сикации в результате свойственного им токсикологического антагонизма
может смазать ее клиническую картину, изменить отношение врача к диа-
гностической ценности соответствующих симптомов, а возможно, и лечеб-
ную тактику.
14.8.5. Механизмы комбинированного токсического действия
При обнаружении аддитивности эффектов или доз токсичных веществ
обычно не ставится вопрос о внутренних механизмах этого явления, которое
представляется тривиальным. Напротив, анализ механизмов потенцирова-
ния, как и механизмов антагонизма, привлекает к себе внимание многих
исследователей не только теоретическим интересом, но и вполне реальной
Практической значимостью. Во-первых, чем более понятны эти механизмы,
с тем большим доверием можно относиться к экспериментальным данным,
свидетельствующим о комбинированном действии, отличном от аддитивно-
го, и тем надежнее основываемые на этих данных практические рекомен-
507
дации. Во-вторых, только на базе понимания механизмов комбинированной
токсичности может быть получена возможность прогнозировать ее характер
для еще не исследованных комбинаций и, ориентируясь на такой прогноз,
отбирать для экспериментальной его проверки в первую очередь те из них,
которые представляются наиболее неблагоприятными. Все еще недостаточ-
ная разработанность общей теории комбинированного действия ядов делает
подобный отбор случайным, а огромное множество реальных комбинаций,
встречающихся в связи с многокомпонентным химическим загрязнением
среды, не позволяет рассчитывать на то, что все они могут быть исследованы
в эксперименте достаточно глубоко и надежно.
Не будем останавливаться подробно на возможной роли химического
или физико-химического взаимодействия вредных веществ в окружающей
среде, в результате которого может быть изменена их токсичность, однако
токсиколог должен помнить и о такой возможности. Наибольшее внимание
в этом отношении давно привлекает к себе сорбция раздражающих (пуль-
монотоксичных) газов на частицах аэрозолей, сочетающихся с ними, кото-
рая может сместить в более глубокие дыхательные пути основную точку
приложения раздражающего действия, пролонгировать его, а вместе с тем
усилить вредное действие самих частиц на легочную ткань. При одновре-
менном попадании разных химических загрязнителей в воду или в пищу
химическая реакция между ними может привести к образованию как более,
так и менее токсичных соединений. Одной из подобных ситуаций, приоб-
ретших особое значение в наше время, является образование высокотоксич-
ных и канцерогенных хлорпроизводных алканов (хлороформа, четыреххло-
ристого углерода и др.] в результате хлорирования воды, содержащей гуми-
новые и сульфокислоты. Физико-химическое взаимодействие между компо-
нентами может играть определенную роль и в хемобиокинетике некоторых
токсичных веществ, например, облегчая их резорбцию через кожу или из
ЖКТ. Так, органические растворители, входящие в состав препаративных
форм ряда ФОП и синтетических пиретроидов, ускоряют их всасывание из
ЖКТ и этим повышают пик концентрации в крови [10].
Однако наибольший интерес в свете проблемы комбинированного ток-
сического действия представляют механизмы взаимовлияния процессов ин-
токсикаций, развивающихся под влиянием разных ядов, действующих в
сочетании (одновременно или попеременно). Эти механизмы могут реали-
зовываться на всех уровнях от молекулярного, субклеточного и клеточного
до органосистемного и организменного, вовлекая к тому же большое число
прямых и обратных связей между различными звеньями токсикодинамики
и хемобиокинетики.
Выше уже упоминалась возможная роль конкуренции за рецепторы
Предполагается, например, что ослабляющее влияние марганца на токси-
ческие эффекты никеля связано именно с таким конкурентным механизмом
по отношению к каким-то местам биомакромолекул и мембран [52], в
пользу чего имеются и прямые экспериментальные данные [56]. В кинетике
металлов-биомикроэлементов (в первую очередь цинка и меди) и вместе с
тем в механизмах детоксикации более высоких доз этих же и многих других
токсичных металлов важную роль играют металлотионеины — специальные
белки с относительно низкой молекулярной массой, в составе которых 20
из 61 аминокислотных остатков представлены цистеином. По-видимому,
помимо связывания металлов, они могут также играть роль ловушки сво-
бодных радикалов [58]. Биосинтез металлотионеинов резко стимулируется
под влиянием многих металлов (в частности, цинка, меди, кадмия, серебра).
508
Тем самым на фоне действия одного металла-индуктора биосинтеза этих
белков может быть ослаблено токсическое действие другого. Таков, в част-
ности, один из вероятных механизмов токсикологического антагонизма,
цинка и кадмия [48] или цинка и меди [49]. Однако не следует упускать из
виду, что рассматриваемый молекулярный механизм реализуется на уровне
конкретных клеток как изменение их функционирования, могущее в свою
очередь сыграть важную роль в качестве токсикодинамического или токси-
кокинетического механизма подобного антагонизма. Так, например, медь и
цинк взаимно ингибируют всасывание этих металлов через клетки слизистой
оболочки кишечника [57].
Усиление биосинтеза металлотионеинов является одним из проявлений
влияния некоторых металлов на процессы генной экспрессии. Например,
показано, что двухвалентный марганец активирует PH К,-полимеразу [50].
Однако такое вмешательство в механизмы генной экспрессии не всегда
благоприятно для организма. В частности, усиленный биосинтез факторов
роста или активация экспрессии онкогенов, как предполагается, может
служить механизмами потенцирования каким-то, даже неканцерогенным
металлом канцерогенного действия другого металла соответственно на ста-
диях промоции или инициации [48]. Правда, в приведенной тем же автором
сводке экспериментальных результатов разных исследователей, изучавших
влияние некоторых металлов на канцерогенное действие никеля или кадмия,
оно либо не было обнаружено вовсе, либо было ослабляющим. Очевидно,
в данном случае уравновешивали или превалировали другие механизмы
комбинированного действия, например связанные с усиленным синтезом
тех же металлотионеинов. Вместе с тем напомним работу Stern [59], выявив-
шую супераддитивность мутагенного действия никеля и хрома, которая
может привести к тому, что и канцерогенное действие этих металлов в
комбинации окажется более чем аддитивным.
Молекулярным механизмом комбинированной токсичности сложных орга-
нических соединений может оказаться ингибирование или, наоборот, индуци-
рование активности тех ферментов, которые играют важную роль в био-
трансформации этих соединений, как детоксицирующей, так и приводящей к
образованию более токсичных продуктов. Например, потенцирование токсич-
ности в смеси хлорофоса с карбофосом объясняется тем, что первый подав-
ляет активность фермента, катализирующего процесс карбоксилэстеразного
гидролиза второго, т.е. его детоксикации [10]. Усиление биоактивации яда
может играть роль одного из механизмов потенцирования мутагенного и
канцерогенного действия органических канцерогенов в комбинации с ве-
ществами, не обладающими таким действием, но являющимися индуктора-
ми ферментов-биоактиваторов. С другой стороны, комбинированное токси-
ческое действие менее аддитивного может быть связано с усиленной деток-
сикацией компонентов комбинации через индукцию микросомальных моно-
оксигеназ (для липотропных веществ), а также через механизмы конъюгации
и антирадикальной защиты. Последняя может иметь существенное значение
и как причина токсикологического антагонизма металлов. Упомянутый вы-
ше механизм этой защиты в связи с усиленным биосинтезом металлотио-
неинов (“ловушек” для свободных радикалов) не является единственным.
Например, повышение активности селензависимой глютатионпероксидазы
может служить механизмом антагонистического действия селена по отно-
шению к тем токсичным веществам (в том числе таким металлам, как
кадмий, ртуть, серебро), в токсикодинамике которых заметную роль играет
усиление перекисного окисления липидов.
509
Таким образом, ферментозависимые механизмы комбинированной ток-
сичности могут быть связаны не только с кинетикой биотрансформации
ядов, но и с ролью тех или иных токсикодинамических процессов. Если же
последние связаны с ингибированием какой-либо ферментной системы под
действием “ферментного яда”, то действие другого вещества, в особенности
металла в качестве активатора другой ферментной системы, контролирую-
щей альтернативный путь метаболизма или поставляющей субстрат и/или
энергию для первой ферментной системы, может частично компенсировать
эффекты этого ингибирования. Подобный механизм предлагается, напри-
мер, в качестве еще одной причины антагонистического действия никеля и
марганца; если никель является ингибитором АТФазы, то марганец, акти-
вируя некоторые другие ферменты, играющие важную роль в энергетичес-
ком обмене, тем самым способствует окислительному фосфорилированию.
Роль взаимодействий на системном и организменном уровне изучается,
к сожалению, менее интенсивно, но их значение несомненно. Наиболее
очевидно оно в качестве механизма того, что было названо “физиологичес-
ким” антагонизмом токсичных веществ. В эксперименте с соединениями
хрома-VI и марганца-П показано, что выживаемость мышей при внутри-
брюшинном введении первого резко падает на фоне действия прозерина и
несколько повышается на фоне атропинизации, но не изменяется под вли-
янием эфедрина или резерпина, в то время как влияние этих фармакоди-
намических агентов на летальность мышей при остром отравлении марган-
цем было диаметрально противоположным [11]. Анализ изменений сердеч-
ного ритма у крыс при иммобилизационном стрессе показал, что на фоне
действия хрома резко возрастает процент животных, реагирующих по пара-
симпатическому типу, и снижается процент реагирующих по симпатическо-
му, но при комбинированной хром-марганцевой интоксикации этот эффект
хрома резко ослаблен. Противонаправленное влияние ядов на вегетативную
нервную систему — одна из вероятных причин их антагонизма, и рассмот-
ренный пример не является единственным.
Антагонистический характер комбинированного действия хрома и мар-
ганца, на которое авторы неоднократно ссылаются, является хорошим при-
мером и в том отношении, что оно проявляется на разных уровнях биоло-
гической организации и находит разные объяснения, не исключающие, а
взаимно дополняющие друг друга. Вместе с тем именно тот факт, что тип
комбинированной токсичности оказывается совпадающим на всех уровнях
и по самым разным показателям действия, указывает на вероятное сущест-
вование какой-то наиболее фундаментальной причины антагонизма этих
металлов, непосредственно или опосредованно лежащего в основе всех
остальных его механизмов. Выяснение этой причины — дело будущего.
Упомянутое нами ранее фазовое торможение вызываемого диоксидом
кремния пневмосклеротического процесса (силикоза) на фоне хронического
умеренного воздействия сернистого ангидрида — это один из примеров того
антагонизма, который трудно объяснить чисто локальными взаимодействия-
ми на органном уровне. Однако на организменном уровне он может быть
объяснен доказанным фактом развития при подобных экспозициях к раз-
дражающим газам (в частности, к сернистому) состояния неспецифически
повышенной сопротивляемости организма (СНПС) по Н.В.Лазареву. Непо-
средственным же механизмом торможения силикозогенеза служит одно из
проявлений этого состояния на клеточном уровне, а именно неспецифичес-
кое повышение резистентности легочных макрофагов к повреждающему
(цитотоксическому) действию самых различных агентов и в том числе к
510
достаточно специфическому по своим механизмам цитотоксическому дей-
ствию диоксида кремния, являющемуся ключевым звеном патогенеза сили-
коза [13].
Этот своеобразный механизм весьма важен для любых комбинаций, в
состав которых входит силикозогенная пыль, и мы еще коснемся его,
рассматривая данную проблему так называемого сочетанного действия фак-
торов. Однако для сочетания двух токсичных малорастворимых веществ,
воздействующих на организм в виде ингалируемых аэрозолей, сходный
феномен взаимного ослабления их цитотоксичности для макрофагов может
объясняться не развитием СНПС или других изменений общей реактивнос-
ти организма, а теми или иными конкурентными взаимодействиями на
субклеточно-клеточном уровне, типа рассмотренных выше. Так, при ком-
бинированном действии бихромата калия и диоксида марганца подобное
ослабление в уже упоминавшихся экспериментах С.Л.Балезина и Л.И.При-
валовой наблюдалось не только на целостном организме, но и на изолиро-
ванной культуре макрофагов.
Чем бы ни объяснялась защита альвеолярной субпопуляции легочных
макрофагов от повреждения поглощаемыми цитотоксичными частицами,
она должна (как видно из главы 3 — вопроса механизмов самоочищения
легких от отложившихся ингалируемых частиц) приводить к снижению
задержки этих частиц в легочной ткани и тем самым к существенному
изменению всей последующей хемобиокинетики. Например, у крыс, кото-
рые в течение 4 мес ингалировали аэрозоль дезинтеграции диоксида мар-
ганца при средней концентрации приблизительно 2,2 мг/м3 и аэрозоль
конденсации хромового ангидрида (0,05—0,06 мг/м3), содержание марганца
в легких равнялось 327±12 мкг на орган, а при такой же ингаляции только
диоксида марганца 90±28 мкг на орган. Естественно, что такое снижение
задержки металла в легких приводит не только к еще большему ослаблению
его местного действия (в том числе на легочные макрофаги), но и к сни-
жению токсических эффектов со стороны тех органов, куда он может
попасть через кровь.
Такая двусторонняя связь токсикодинамических и хемобиокинетических
механизмов комбинированного токсического действия не ограничивается
эффектами, связанными с влиянием на механизмы самоочищения легких.
Как уже упоминалось, эта связь может касаться также всасывания веществ
в ЖКТ (сравни приводившийся ранее пример комбинации меди и цинка),
их накопления не только в легких, но и в других органах-мишенях, их
биотрансформации и, наконец, элиминации, т.е. всех звеньев хемобиоки-
нетики. Приведем еще некоторые примеры.
Так, в том же хроническом ингаляционном эксперименте с хром-мар-
ганцевой экспозицией, а также при повторных внутрибрюшинных инъек-
циях радиоактивного хлорида марганца было найдено, что комбинация с
хромом резко усиливает элиминацию марганца через кишечник. Было по-
казано, что этот эффект зависит от двигательной активности кишечника, и
можно думать, что он в какой-то мере связан с уже известным нам холи-
номиметическим действием хрома, но вероятную роль играет также найден-
ное в этих экспериментах ослабляющее действие хрома на повреждение
марганцем гепатоцита, что способствует выделению желчи, а вместе с ней
и накапливающегося в печени марганца. С другой стороны, более гепато-
токсичный марганец, как было отмечено в тех же экспериментах, способ-
ствует накоплению хрома в печени и в связи с усиленным поступлением
его в орган в результате усиленного разрушения эритроцитов, и потому, что
511
снижается его элиминация с калом. Этот эффект явно неблагоприятен, но
поскольку ведущим фактором повреждения данного органа является не
хром, а марганец, то в комбинации превалирует ослабление гепатотоксич-
ности и общий антагонизм хрома и марганца сохраняется.
Однако чаще всего в тех случаях, когда при комбинированном действии
металлов наблюдаются хемобиокинетические сдвиги, они состоят не в по-
вышении, а в снижении задержки таких металлов в организме в целом и/или
в органах-мишенях. Например, Т.Н.Герасименко, продемонстрировавшая
преобладание антагонизма цинка и свинца как при острой, так и при
субхронической интоксикации, нашла, что элиминация свинца и через
почки, и через ЖКТ в комбинации с цинком усиливается при одновремен-
ном усилении депонирования его в скелете, но сниженном накоплении в
печени. В.И.Давыдова и соавт. [4], показавшие, что и для комбинации
свинца с медью антагонизм является основным типом комбинированного
действия, нашли, что содержание свинца в печени и в семенниках крыс
через 24 ч после внутрибрюшинного введения ацетата свинца и сульфата
меди существенно меньше, чем после введения одного ацетата свинца, в то
время как депонирование свинца в скелете и в этой комбинации повыси-
лось. Еще раньше R.C.Murthy и S.V.Chandra [55] обнаружили, что при
одновременном воздействии на свинок никеля и марганца снизилось на-
копление никеля в печени, почках, селезенке и семенниках.
Таким образом, различные механизмы, не обязательно, но очень часто
связанные с защитой от повреждения или со стимуляцией органов и про-
цессов, контролирующих хемобиокинетику, могут обусловить в целом бла-
гоприятные изменения ее при ряде комбинированных воздействий, что,
однако, не является общим правилом и, в частности, не может быть рас-
пространено на все случаи комбинированной токсичности сложных орга-
нических соединений. Уменьшение же токсической нагрузки органов-ми-
шеней (по компоненту комбинации, наиболее для них вредному) в свою
очередь ослабляет их повреждение. Между токсикодинамической и хемо-
биокинетической составляющими токсикологического антагонизма возни-
кает циклическая зависимость. Разумеется, особую важность имеют и те
случаи, в которых она носит противоположную направленность (“порочный
круг”), создавая предпосылки для усиления синергизма ядов. Например, те
же раздражающие газы, действуя в более высоких концентрациях или в
течение более длительного периода, нарушают механизмы трахеобронхиаль-
ного клиренса аэрозольных частиц (см. главу 3) и тем самым способствуют
задержке их в легких, в свою очередь усиливающих повреждение последних.
14.8.6. Сочетанное действие
Сочетанным действием многие отечественные авторы предпочитают на-
зывать совместное влияние на организм факторов разной природы (чаще всего
химических и физических), оставляя термин “комбинированное действие”
только для обозначения совместного влияния двух или более химических ве-
ществ. Это терминологическое различие не представляется ни необходи-
мым, ни удачным. Слово “комбинация” в переводе на русский как раз и
означает “сочетание”, так что указанная терминология затрудняет взаимр-
понимание российских и западных токсикологов. К тому же, до распростра-
нения термина “сочетанное действие” во многих отечественных публикаци-
ях по токсикологии, в том числе в монографии В.В.Кустова и соавт. [23],
озаглавленной “Комбинированное действие промышленных ядов”, под пос-
512
дедним подразумевались и описывались оба типа совместного влияния, что
еще более увеличивает нецелесообразность такой терминологической нова-
ции. Наконец, некоторые механизмы так называемого сочетанного действия
(особенно те, которые реализуются на организменном уровне) не имеют
принципиального отличия от уже рассмотренных механизмов комбиниро-
ванного действия химических веществ. В то же время не приходится отри-
цать своеобразие комбинационных эффектов химического и какого-либо
сопутствующего ему фактора, зависящее как от природы последнего и
особенностей реагирования организма на его воздействие, так и от специ-
фики токсического вещества.
При этом нередко выявляется не только та или иная количественная
модификация токсического действия, но и изменение тяжести, а иногда и
качественное своеобразие патологии, вызываемой сопутствующим факто-
ром. Так, например, для вибрационной болезни, развивающейся у горнора-
бочих в золотодобывающих шахтах с высоким содержанием мышьяка в
пыли, оказывается характерна особая выраженность сенсорного полиневри-
та [39]. Вместе с тем клинико-гигиенические и экспериментальные иссле-
дования этого автора и ее сотрудников свидетельствуют о потенцировании
токсического действия мышьяка, свинца и ртути под влиянием вибрацион-
ной экспозиции. Эта экспозиция изменяет также кинетику названных ток-
сических элементов, в частности неблагоприятно влияя на их накопление
в легких. Найдено, что под влиянием вибрации не повышается, как при
развитии СНПС, а снижается резистентность легочных макрофагов к цито-
токсическому действию малорастворимых частиц мышьяка, однако при од-
новременном снижении реакции мобилизации нейтрофильных лейкоцитов
в ответ на действие продуктов разрушения макрофага.
Давно известно, что высокая температура воздуха повышает чувствитель-
ность организма к острому действию многих токсичных веществ, в первую
очередь являющихся ядами дыхательных ферментов (СО, цианистый калий)
и в особенности разобщителями окислительного фосфорилирования (1,2,4-
динитрофенол, 4,6-динитро-о-крезол, динитро-фторбутилфенол и др.), для
отравления которыми характерно резкое перегревание тела. Отмечено также
усиление токсичности бензола, нитробензола, анилина и других веществ
сопутствующей высокой температурой [23]. Однако степень такого потен-
цирования зависит от соотношения меаду дозой яда и уровнем предвари-
тельной акклиматизации к действию высоких температур. Вместе с тем
следует избегать довольно распространенной ошибки экстраполяции на
человека результатов тех экспериментов, в которых наблюдалось усиленное
поступление токсичного вещества в легкие и затем в кровь животных в
результате резкого повышения объема дыхания под влиянием высокой ок-
ружающей температуры. У лабораторных грызунов такая гипервентиляция
является нормальным механизмом терморегуляции; у человека, обеспечен-
ного другим механизмом испарительного охлаждения (потоотделение), объ-
ем дыхания увеличивается лишь при выраженной гипертермии. Более не-
посредственное отношение к человеку имеют экспериментальные данные о
повышении токсичности многих ядов при охлаждении. Опять-таки это в
первую очередь наблюдается при действии ядов, нарушающих внешнее
дыхание, транспорт кислорода кровью и/или тканевое дыхание (например,
той же окиси углерода, окислов азота и др.) и тем самым препятствующих
повышению теплопродукции. Хотя у человека химическая терморегуляция
играет значительно меньшую роль, чем у животных, опасность охлаждения
тела при остром отравлении такими ядами хорошо известна.
513
Сложнее оценить токсикологическое значение длительной холодовой
акклиматизации организма. Несмотря на существенные различия как резе-
рвов, так и механизмов этого адаптационного процесса у человека и живот-
ных, общими являются два важнейших результата его. Во-первых, специ-
фический: повышается устойчивость терморегуляторных механизмов собст-
венно к действию низких температур и тем самым можно ожидать, что
потенцирование действия ядов, наблюдаемое при остром действии холода,
ослабевает. Во-вторых, именно акклиматизация к охлаждениям в отличие
от акклиматизации к высоким температурам является выраженным адапто-
геном (по терминологии Н.В.Лазарева), т.е. сопровождается неспецифичес-
ким повышением сопротивляемости по отношению к действию многих
потенциально вредных факторов — развитием СНПС.
К сожалению, прямых данных о том, как холодовая акклиматизация
влияет на чувствительность организма к действию различных токсичных
веществ, мы привести не можем. Известно лишь (из результатов собствен-
ных экспериментов), что при этом стойко и существенно повышается ре-
зистентность легочных макрофагов к цитотоксическому действию малорас-
творимых частиц, но резко усиливается мобилизация нейтрофильных лей-
коцитов в глубокие дыхательные пути в ответ на пылевую ингаляцию или
введение продуктов макрофагального разрушения и что такое усиление в
зависимости от его степени может как способствовать, так и препятствовать
самоочищению легких от этих частиц. Кроме того, СНПС и сама холодовая
акклиматизация вовлекают и другие механизмы, в том числе усиливающие
развитие иммунных (и иммунопатологических) и фибропластических реак-
ций. В целом развитие патологических изменений, вызываемых в легких
диоксидом кремния, при этом усиливается. Этот неоднократно воспроизво-
дившийся результат свидетельствует о том, что комбинированный эффект
хронического действия холода и токсических факторов неоднозначен и пока
трудно прогнозируем, требуя для своей оценки в каждом случае специаль-
ного исследования.
Однако для промышленной токсикологии не менее, если не более важ-
ным является часто встречающееся сочетание токсической экспозиции не с
физическими факторами, а с физиологической нагрузкой — мышечным тру-
дом большей или меньшей тяжести. Прежде всего отметим, что именно от
последней зависит объем легочной вентиляции (как у животных, так и у
человека) и, следовательно, поступление в организм яда из ингалируемого
воздуха. Это возрастание полученной дозы особенно важно для тех газов и
паров, которые не создают быстро достигаемого насыщения крови, а также
для любых аэрозолей, поскольку для последних дыхательные пути обеспе-
чивают более или менее длительную задержку, и в легких отлагается тем
больше аэрозольных частиц, чем больший объем загрязненного ими воздуха
был ингалирован за рабочую смену. К тому же наиболее высокие значения
минутного объема дыхания достигаются за счет преобладающего вклада
увеличенного дыхательного объема (“глубины” дыхания) по сравнению с
вкладом его учащения, а это повышает степень отложения частиц в легких
(см. главу 3). Для ядов гипоксического действия неблагоприятные эффек-
ты при тяжелой работе усиливаются также тем, что они (яды) препятст-
вуют реализации высокого кислородного запроса, связанного с такой
работой, а последняя усугубляет кислородное голодание тканей, вызывае-
мое ядом.
В.В.Кустов и соавт. [23] привели сводку данных литературы, свидетель-
ствующих о том, что в экспериментах на животных физическая нагрузка
514
действительно усиливала действие окиси углерода, четыреххлористого угле-
рода, аэрозоля серной кислоты, озона, аэрозолей и паров параоксона и
зарина, дихлордиэтилсульфида, крекинг-газа, содержащего сероводород и
пары углеводородов. Уже само разнообразие этих веществ, относящихся к
различным классам по направленности токсического действия, свидетель-
ствует о том, что неблагоприятный эффект данного сочетания является
скорее всего общим правилом. О возможности исключений из этого правила
свидетельствуют приводимые в том же обзоре данные о повышении LD50
хлорофоса при введении его мышам, утомляемым бегом на третбане, с
восстановлением исходной токсичности после отдыха. Объяснения этому
парадоксальному результату не дается.
Однако в производственных условиях сочетание токсической экспози-
ции с физической нагрузкой практически никогда не бывает однократным,
как в большинстве проводившихся по этому поводу экспериментов на
животных. Длительная же адаптация организма к мышечной работе суще-
ственно изменяет реактивность организма. Такая адаптация (тренировка),
как и холодовая акклиматизация, может иметь двоякое значение. С одной
стороны, для тренированного организма тяжелая работа как бы становится
более легкой за счет не только увеличения мышечной массы, но и повыше-
ния резервов кровообращения и дыхания и эффективности механизмов их
мобилизации. Следовательно, снижается возможность неблагоприятного
эффекта комбинированного воздействия разовой физической нагрузки и
яда. С другой стороны, и мышечная тренировка (в особенности специально
дозируемая в целях оздоровительной физической культуры) сопровождается
развитием СНПС. Наши эксперименты показали, что и в этом случае
повышение резистентности легочных макрофагов к цитотоксическому дей-
ствию частиц является следствием такого СНПС, но в целом развитие
силикоза в зависимости от тяжести нагрузок может быть при тренировке к
ним и ослаблено, и усилено. В этих экспериментах бег на третбане имел
место вне пылевой камеры либо после интратрахеального введения пыли и,
следовательно, не мог влиять на ее отложение в легких, т.е. изучалось лишь
влияние тренировок на развитие процесса через изменения реактивности
организма.
В целом же комбинированное действие хронических токсических экс-
позиций и повторяющихся мышечных нагрузок в условиях, моделирую-
щих либо физическую работу человека на производстве, либо физкуль-
турно-спортивные тренировки, до сих пор еще не изучается эксперимен-
таторами.
Некоторое внимание исследователей привлекало к себе комбинирован-
ное воздействие отдельных токсичных веществ и таких физических факто-
ров, как измененное (особенно пониженное) барометрическое давление,
ультразвук, ионизирующие и неионизирующие излучения. Результаты экс-
периментов, как правило, более неблагоприятны, чем при изолированном
воздействии тех же газов. Особо следует отметить важность проблемы мно-
гофакторного анализа риска при рассмотрении эпидемиологических дан-
ных, получаемых для оценки действия длительных радиоактивных загрязне-
ний среды обитания на здоровье населения там, где одновременно имеется
ее промышленное загрязнение токсичными веществами, действующими на
кровь, являющимися мутагенами/канцерогенами, вызывающими усиление
свободнорадикальных процессов, т.е. действующими синергично с ионизи-
рующей радиацией.
515
17*
14.8.7. “Комплексное” действие химических веществ
По прямому смыслу слова “комплексное” (сложное, состоящее из вза-
имосвязанных, но разнородных частей) можно было бы думать, что речь
идет о воздействии на организм более или менее сложного комплекса
потенциально вредных факторов. Именно в этом смысле В.В.Кустов и соавт.
[23] назвали одну из глав своей монографии “Комплексное воздействие на
организм токсических веществ, вибрации, шума и других производственных
факторов”. Однако позднее этот термин по неясной причине стал применять-
ся в гигиенической токсикологии для обозначения действия одного и того же
токсического вещества при поступлении его в организм одновременно или
попеременно разными путями.
Такая ситуация имеет немаловажное значение. Так, даже при загрязне-
нии окружающей среды только атмосферными выбросами промышленных
предприятий достаточно быстро тем или иным токсичным веществом ока-
зывается загрязнен не только воздух, но и почва, а через нее — водоемы с
водными биоценозами, а также продукты растениеводства и животноводст-
ва. Следовательно, токсическая экспозиция населения осуществляется с
вдыхаемым воздухом через легкие, с питьем и пищей — через ЖКТ; воз-
можно, также через кожу (через загрязненные почвой руки или при исполь-
зовании загрязненных водоемов для купания, стирки и т.п.). В производст-
венных условиях ингаляционное поступление токсических паров и/или
аэрозолей также может сочетаться с кожной резорбцией. Наряду с этим даже
изолированная ингаляционная аэрозольная экспозиция неизбежно приво-
дит к резорбции вещества не только в легких, но и по пути его элиминации
из легких в ЖКТ, т.е. также может рассматриваться как “комплексная”.
Поскольку речь идет об одном и том же веществе, рассмотренные
ситуации выходят за рамки проблемы комбинированной токсичности. По
сути дела в этом случае необходимо решить две взаимосвязанные задачи:
во-первых, определить суммарную дозу вещества, поступающего в организм
разными путями; во-вторых, выяснить, не могут ли иметь место достаточно
существенные различия хемобиокинетики (имея в виду не только кинетику
поступления, но и кинетику распределения яда в организме) в зависимости
от места резорбции яда в кровь. Например, достаточно существен вопрос о
том, эквивалентно ли по возможности накопления в том или ином органе-
мишени (прежде всего в печени) всасывание яда в кровь через легкие или
через ЖКТ, не говоря уже о возможности местного токсического действия
на орган, служащий входными воротами яда.
Для практических целей первый вопрос нередко решается с помощью
математических моделей; такова, например, “биокинетическая модель”, ис- '
пользуемая Агентством охраны окружающей среды США (US ЕРА) для
прогнозирования концентрации свинца в крови у детей с учетом различных
путей поступления. Однако все такие модели пока слишком приблизитель-
ны, и обоснованность принятых в них кинетических параметров явно не-
достаточна. Вопрос о возможных количественных и даже качественных
особенностях действия равных доз того или иного яда при разных путя^
поступления чаще всего не только не решается, но даже не ставится. Не
учитывается, что сравнительная оценка поступления в кровь через легкие
и через ЖКТ вещества, первично отлагающегося в виде ингалированных
аэрозольных частиц, существенно зависит от их распределения по разме-
516
рам (дисперсности) и особенно от растворимости; тем самым то, что от этих
характеристик аэрозоля может зависеть характер “комплексного” действия.
В целом, несмотря на всю практическую значимость этой проблемы, она
далека от теоретического и методического решения.
ЛИТЕРАТУРА
1 Беленький М.Л. Элементы количественной оценки фармакологического эффек-
та.-Л., 1962.-С. 152.
2. Голиков С.Н., Саноцкий И.В., Тиунов Л.А. Общие механизмы токсического дей-
ствия. — Л.: Медицина, 1986. — С. 95.
3. Давыдова В.И., Неизвестнова Е.М.. Блохин В.А. и др. Токсикологическая оценка
комбинированного действия марганца, хрома и никеля//Гиг. и сан. — 1981. —
№ 7. - С. 29-22.
4. Давыдова В.И., Рослый О.Ф., Герасименко Т.И. и др. Экспериментальная оценка
комбинированного действия соединений меди и свинца//Гиг. и сан. — 1988. —
№ 4. - С. 78-79.
5. Дядищев Н.Р., Рыбалкин СП., Марченко А.И. Биологические модели in vitro в
токсикологии. — В кн.: 1-й съезд токсикологов России (Тез. докл.) 17—20 но-
ября 1998 г. — М., 1998. — С. 276.
6. Заева ГН. Установление ПДК профессиональных ядов. — В кн.: Методы опре-
деления токсичности и опасности химических веществ. — М., 1970. — С. 37—46.
7. Заугольников С.Д., Лойт Л.О., Иваницкий А.М. К вопросу классификации ток-
сических веществ. — В кн.: Общие вопросы промышленной токсикологии. — М.,
1967. - С. 46-49.
8. Каган Ю.С. Общая токсикология пестицидов. — Киев: Здоров’я, 1981.
9. Каган Ю.С., Станкевич В.В. Коэффициент кумуляции как количественный
критерий для оценки кумулятивного действия яда. — В кн.: Актуальные вопросы
гигиены труда, промышленной токсикологии и профессиональной патологии в
нефтяной и нефтехимической промышленности. — Уфа, 1964. — С. 48.
10. Каган Ю.С., Штабский Б.М. Проблема изучения и оценки комбинированного
действия ксенобиотиков//Токсикол. вест. — 1996. — № 5. — С. 2—9.
11. Кацнельсон Б.А. Некоторые закономерности и методы экспериментальной оцен-
ки комбинированного действия аэрозолей металлов. — В кн.: Проф. болезни
пылевой этиологии. — М.: МНИИГ им. Ф.Ф.Эрисмана, 1990. — С. 29—43.
12. Кацнельсон Б.А. Проблема комбинированного действия токсических веществ при
их нормировании в воздухе рабочей зоны//Токсикол. вест. — 1993. — № 2. —
С. 15-20.
13. Кацнельсон Б.А. О некоторых механизмах комбинированного действия, играю-
щих роль в этиопатогенезе силикоза. — В кн.: Комбинированное действие хи-
мических и физических факторов производственной среды. — Свердловск: НИИ
гигиены труда и профзаболеваний, 1972. — С. 10—19.
14. Кацнельсон Б.А., Новиков М.М. Методические подходы к изучению комбиниро-
ванного действия промышленных вредных веществ//Гиг. и сан. — 1986. —
№ 8. - С. 59-63.
15. Кравков Н.В. Основы фармакологии. — М.: Гос. изд-во, 1927. — С. 380.
16. Красовский ГН. Токсикологические исследования при гигиеническом нормиро-
вании веществ в воде. — В кн.: Профилактическая токсикология, сборник учеб-
но-методических материалов. — М.: ЦМП, 1984. — Т. 2, ч. 2. — С. 16.
517
17. Курляндская Э.Б., Саноцкий И.В. О критерии вредности при нормировании
химических веществ в воздухе промышленных предприятий//Гиг. труда. —
1965. - № 3. - С. 3-9.
18. Курляндский Б.А. О гигиеническом значении фазовости адаптационных реак-
ций. — В кн.: II Всесоюзная конференция по промышленной токсикологии. —
М., 1970.
19. Курляндский Б.А. Токсикология на рубеже веков: состояние, проблемы, пер-
спективы. — В кн.: I съезд токсикологов России (Тез. докл.) 17—20 ноября
1998 г. - М., 1998. - С. 9.
20. Курляндский Б.А., Клочкова С.И., Эйзенгарт Р.С. Участие глубинных образований
мозга в формировании реакций на хроническую интоксикацию парами бензола. —
В кн.: Физиология и патология лимбико-ретикулярного комплекса. — М.: Наука,
1968. - С. 34.
21. Курляндский Б.А., Невзорова Н.И. Методические подходы к обоснованию ПДК
химических бластомогенов. — В кн.: Профессиональный рак. — М., 1981,—
Вып. 2. - С. 28.
22. Курляндский Б.А., Стовбур Н.Н., Духовная А.И. Вероятностная оценка сравни-
тельной чувствительности систем организма к отравлению винилхлорвдом//Гиг.
и сан. — 1978. — № 6. — С. 14.
23. Кустов В.В., Тиунов Л.А., Васильев Г.А. Комбинированное действие промышлен-
ных ядов. — М.: Медицина, 1975. — 256 с.
24. Лазарев Н.В. Общие основы промышленной токсикологии. — М,—Л., 1938.
25. Лазарев Н.В., Люблина Е.И., Розин М.А. Состояние неспецифически повышенной
сопротивляемости//Пат. физиол. — 1959. — № 4. — С. 16—21.
26. Лойт А.О. Предварительная токсиколого-гигиеническая оценка органических
соединений: Автореф. дис. ... д-ра мед. наук. — Л., 1974. — С. 38.
27. Люблина Е.И., Голубев А.А. Инструкция по установлению расчетным способом
ориентировочных предельно допустимых концентраций промышленных ядов в
воздухе рабочей зоны. — Л., 1967. — С. 11 — 12,
28. Люблина Е.И., Голубев А.А., Филов В.А. Определение расчетными методами ори-
ентировочных значений показателей токсичности химических агентов. — В кн.:
Фармакология, токсикология. Проблемы токсикологии. — М., 1967. — С. 11 —
14.
29. Люблина Е.И., Омонин И.В. Острые и хронические отравления, привыкание к
действию яда. — В кн.: Руководство по гигиене. — М., 1963. — Т. 2. — С. 147.
30. Медведь Л.И., Каган Ю.С., Спыну Е.И. Пестициды и проблемы здравоохране-
ния//Журн. всесоюзн. хим. общ-ва им. Д.И.Менделеева. — 1968. — № 3. —
С. 263-271.
31. Правдин Н.С. Методика малой токсикологии промышленных ядов. — М., 1947.
32. Правдин Н.С. Руководство по промышленной токсикологии. — М.: Биомедгиз,
1934. -Т. 1. - С. 259.
33. Ротенберг Ю.С. Классификация ксенобиотиков по локализации их действий на
ферментные системы митохондрий//Бюл. экспер. биол. — 1982. — № 9. —
С. 42-45.
34. Саноцкий И. В. (ред). Методы определения токсичности и опасности химических
веществ. — М.: Медицина, 1970. — С. 11—37.
35. Саноцкий И.В. Задачи и методы промышленной токсикологии. — В кн.: Профи-
лактическая токсикология. — М.: ЦМПГКНТ, 1984. — Т. 2, ч. 1. — С. 11.
518
76 Саноцкий И.В. Общие вопросы промышленной токсикологии. — М., 1967. —
С. 4—6.
37. Саноцкий И.В., Уланова И.П. Критерии вредности в гигиене и токсикологии при
оценке химических соединений. — М.: Медицина, 1975. — С. 5—18.
38. Степанский Г.А. Адаптация человека к современному химическому окружению. —
В кн.: Проблемы токсикологии. Адаптация и компенсация при химических
воздействиях. — М.: Итоги науки, 1973. — Т. 5. — С. 5—40.
39 Тартаковская Л.Я. Сочетанное действие вибрации и токсических веществ//Гиг.
труда. — 1983. — № 3. — С. II —14.
40 Тиунов Л.А. Общие механизмы токсического действия. — М.: Медицина, 1986. —
С. 181-186.
41. Тиунов Л.А. Основные механизмы метаболизма ксенобиотиков в организме
человека и животных. — В кн.: Токсикология. Итоги науки и техники. — М.,
1981. -Т. 12. - С. 5-64.
42. Тиунов Л.А. Подходы к определению видовой чувствительности эксперименталь-
ных животных для токсикологических исследований. — В кн.: Общие вопросы
промышленной токсикологии. — М., 1967. — С. 55—59.
43. Толоконцев Н.А., Филов В.А. (ред.) Основы промышленной токсикологии: Руко-
водство. — Л., 1976. — С. 12—34.
44. Трахтенберг И.М., Колесников В. С., Луковенко В.П. Тяжелые металлы во внешней
среде. — Минск: Навука и тэхника, 1994. — С. 61 — 108.
45. Турусов В.С., Ракитский В.Н., Ревазова Ю.А. Еще раз о проблеме порога в
химическом канцерогенезе//Вопр. онкол. — 1998. — Т. 44, № 4. — С. 468—472.
46. Филов В.А. Количественная токсикология. — Л.: Медицина, 1973. — С. 23.
47. Шандала М.Г. Профилактическая токсикология и профилактическая медици-
на. — В кн.: 1-й съезд токсикологов России (Тез. докл.) 17—20 ноября 1998 г. —
М„ 1998. - С. 22.
48. Beyersmann D. The significance of interactions in metal essentiality and toxicity. — In:
Metals and their compounds in the environment: occurence, analysis, and biological
relevance. — Weiheim, 1991. — P. 491—509.
49. Bremer J., Beattie J.H. Copper and zinc metabolism in health and disease: speciation
and interactions//Proc. Nutr. Soc. — 1995. — Vol. 54. — P. 489—499.
50. Eichhorn G.L., Clark P., Shin Y.A. et al. The influence of metalion — nucleic acid
interactions on genetic information transfer. — In: Frontiers in bioinorganic chemistry. —
Weinheim, 1986. - P. 80-83.
51. Harmonized Integrated Hazard Classification System for Human Health and Env:
ronmental Effects of Chemical Substances. As endorsed by the 28th Meeting of the
Chemicals Commitee and the Working Party on Chemicals in November 1998, OECD.
Par +2. - P. 1-15,
52. Hopftr S.M., Sunderman F. W., Jr. Manganese inhibition of nickel subsulfide induction
of erethrocytosis in rats//Res. Communic. Chem. Pathol. & Pharmacol. — 1978. —
Vol. 19. - P. 337-345.
53. Johansson A., Curstedt T, Robertson B. et al. Lung lesions after experimental combined
exposure to nickel and trivalmt chromium//Environm. Res. — 1989. — Vol. 50. —
P. 103-119.
54. Lim R.K., Riuk K.J., J lass H.J. et al. Method for evaluation of cumulation and tolerance
by the determination of acute and cubchronics median effective doses//Arch. int.
Pharmacodym. Therap. — 1961. — Vol. 130. — P. 665—672.
519
55. Murthy R.C., Chandra S. И Effect of interaction of manganese and nickel on their
content in various tissues of guinea pigs//Chemosphere. — 1979. — Vol. 8. — P. 35—
38.
56. Nandedkar A.K.N., Morse C.E., Friedberg F. Mn5++. Obinding by plasma proteins//Int.
J. Peptide & Protein Res. — 1973. — Vol. 5. — P. 279—281.
57. Oestreicher P., Cousins R.G. Copper and zinc absorption in the rat: mechanism of
mutual antagonism//.!. Nutr. — 1985. — Vol. 115. — P. 159—166.
58. Schaffer A., Kagi H.R. Metallotioneins. — In: Metals and their compounds in the
environment: occurence, analysis, and biological relevance. — Weiheim, 1991. —
P. 523-529.
59. Stem R.M. Nickel and chromium compounds and welling fumes in mammalian cell
transformation bioassay in vitro. — Copenhagen: The Danish Welding Institute,
1985. - N 85. - P. 37.
60. World Health Organization Technical Report Series 662. Health effects of combined
exposures in the work environment. — In: Report of a WHO Expert Committee. —
Geneva: WHO, 1981. - 76 p.
I
Глава 15
МЕТОДОЛОГИЯ ОЦЕНКИ РИСКА
И НЕКОТОРЫЕ ПРОБЛЕМЫ ЕЕ ПРИМЕНЕНИЯ
В УСЛОВИЯХ РОССИИ
15.1. Характеристика проблемы и основные понятия
Оценка риска в токсикологии и в целом в экологической медицине есть
многоступенчатый процесс, нацеленный на выявление или прогноз вероятности
неблагоприятного для здоровья результата воздействия на человека вредных
веществ, загрязняющих среду обитания или производственную среду. Она опи-
рается на разнообразную информацию об уровне этого загрязнения, токси-
ческих свойствах вещества, его миграции и превращениях в среде, путях
воздействия на человека, особенностях подвергающейся воздействию чело-
веческой популяции. В более узком (специальном) смысле имеется в виду
конкретная методология “оценки риска” (“risk assessment”), принятая пра-
вительственным Агентством США по охране окружающей среды (US ЕРА)
и рекомендуемая международными организациями (ВОЗ, UNEP). Постанов-
лением Главного государственного санитарного врача РФ и Главного госу-
дарственного инспектора РФ по охране природы от 10.11.97 было санкци-
онировано использование методологии оценки риска для управления каче-
ством окружающей среды и здоровья населения, но одновременно указано
на необходимость определенной адаптации ее к условиям России и наме-
чены основные направления такой адаптации.
В этой главе дается сжатая характеристика принципов и приемов оценки
риска в токсикологии на основе анализа обобщения материалов литературы,
относящихся именно к этой методологии [1 — 10, 13—28], а также ряда
методических документов. Наряду с этим мы опираемся и на собственный
опыт использования методологии оценки риска, накопленный при осущест-
влении некоторых проектов в сотрудничестве с американскими экспертами.
Основные понятия. Используемые в методологии оценки риска не явля-
ются принципиально новыми для читателя-токсиколога, однако некоторые
неточности перевода американских терминов на русский язык создают в
отечественной литературе нежелательную путаницу. Поэтому целесообразно
начать с формулировки этих понятий.
Риск — вероятность развития неблагоприятных для здоровья населения
последствий техногенного загрязнения окружающей среды либо наличия в
ней природных компонентов, обладающих вредным действием на организм.
Риск характеризуется либо величинами от нуля (выражающего уверен-
ность в том, что вред не будет нанесен никому) до единицы (выражающей
уверенность в том, что вред будет нанесен всем), либо как ожидаемая
частота неблагоприятных эффектов, возникающих в популяции от опреде-
ленного вредного воздействия. Первый способ выражения риска иногда
трактуется как индивидуальный, второй — как популяционный риск.
Источник опасности, или вредный фактор (в американских и международ-
ных документах — hazard), — химическое вещество, физический или биоло-
521
гический агент в окружающей среде, создающие потенциальную возмож-
ность риска для здоровья населения, которая реализуется лишь при опре-
деленных условиях экспозиции.
Экспозиция (exposure) — термин, обозначающий как простую констата-
цию воздействия вредного фактора, так и количественную меру этого воз-
действия на индивидуальный организм или на группу, популяцию с учетом
величины последней.
Доза — основная мера экспозиции, характеризующая то количество ве-
щества, которое воздействует на организм при ингаляции загрязненного им
воздуха, поглощении загрязненной им воды или пищи, контакте кожи с
ним. В американских документах этому соответствует термин potential dose
(потенциальная доза), в некоторых международных — intake, а применитель-
но к токсикологическим экспериментам на животных — administered dose
(назначенная, введенная доза).
Другие понятия дозы, принятые американской методологией: applied
dose (количества вещества на свободной границе анатомического барьера
между окружающей и внутренней средой организма), internal dose (внутрен-
няя доза — количество вещества, всосавшееся во внутреннюю среду) и bio-
logically effective dose (биологически эффективная доза — количество веще-
ства, поступающее в орган, с поражением которого связано развитие основ-
ных вредных эффектов экспозиции) представляют несомненный научный
интерес, но ввиду чрезмерной неопределенности их расчетов в реальных
работах по оценке риска используются достаточно редко.
Переносимая доза (в американских документах — reference dose (RfD), в
международных — tolerable intake — TI) — та доза, при действии которой на
человеческую популяцию, включая ее наиболее чувствительные подгруппы,
не ожидается риска развития каких бы то ни было уловимых вредных
эффектов на протяжении всего периода жизни.
При оценке риска, создаваемого только содержанием вредного вещества
в воздухе, доза обычно не рассчитывается и устанавливается допустимая
концентрация (reference concentration — RfC).
Коэффициент опасности (hazard quotient) — отношение действующей до-
зы (или концентрации) к допустимой.
Ответ (response) — доля человеческой популяции или популяции лабо-
раторных животных, проявляющая определенную неблагоприятную реак-
цию на определенную дозу вредного фактора.
Идентификация источника (источников) опасности (hazard identification) —
этап оценки риска, заключающийся в качественной характеристике возмож-
ных неблагоприятных эффектов воздействия на организм тех вредных фак-
торов, которые загрязняют окружающую среду в рассматриваемой зоне,
городе, регионе и могут служить потенциальным источником опасности для '
здоровья проживающего здесь населения или какой-то его части.
Оценка экспозиции — этап оценки риска, заключающийся в определении
того, какими путями, через какие компоненты окружающей среды, на каком
количественном уровне (выраженном как концентрация в этом компоненте
и/или как доза), в какое время, при какой периодичности и общей продол-
жительности имеет место реальное или ожидаемое воздействие конкретного
вредного фактора на человеческую популяцию или ее часть с учетом ее
численности.
Оценка зависимости “доза (концентрация) — ответ” — этап оценки риска,
заключающийся в установлении или прогнозировании связи между дозой
или концентрацией вредного фактора и относительным числом индивидуу-
522
I MOB с количественно определенной выраженностью качественно определен-
ного неблагоприятного эффекта.
Характеристика риска — завершающий этап оценки риска, на котором
синтезируются данные предыдущих трех этапов и связанных с ними неоп-
ределенностей для обоснования выводов в количественной, полуколичест-
венной или описательной форме, которые должны быть переданы лицу или
организации, принимающим решения в сфере экологической политики и
управления здоровьем населения, либо субъекту хозяйственной деятельнос-
ти, по заказу которого проводилась оценка риска.
Неопределенность — ориентировочная оценка пределов, в которых может
лежать предполагаемое истинное значение тех количественных параметров,
I которые используются на разных этапах оценки риска, а тем самым — и его
завершающая характеристика. Однако нередко указываются только причины
неопределенности и ожидаемый знак их влияния на итоговую оценку риска.
Управление риском (risk management) — система политических, техничес-
ких, законодательных и нормативных решений, направленных на ликвида-
цию или существенное уменьшение риска для здоровья населения, которая
принимается на базе результатов оценки риска с учетом ранжирования его
источников, сравнительной опасности (для индивидуума и для населения в
целом) возможных неблагоприятных эффектов, численности подвергаемых
риску популяций, а также всех тех факторов политики, экономики и обще-
ственного сознания, которые действуют на принятие решений в заданных
условиях места и времени. Разработка различных сценариев управления
риском предполагает выбор тех, которые обещают дать наибольший эффект
при наименьших затратах и/или наибольшей реализуемости.
Информация о риске (risk communication) лежит на ответственности экс-
перта или экспертного учреждения, проводящего оценку риска, передачу
развернутых результатов этой оценки лицам (органам), принимающим ре-
шение, взвешенное оповещение о них общественных природоохранных дви-
жений и организаций, а также населения (через СМИ), которым одновре-
менно предлагаются те или иные варианты управления риском.
15.2. Общее описание методологии оценки риска
В развернутом виде она осуществляется в 4 этапа:
• идентификация источника опасности (вредного фактора),
• оценка экспозиции,
• оценка зависимости доза — ответ,
• характеристика риска.
Связь между перечисленными этапами может быть как прямой, так и
обратной, хотя дальше каждый из них кратко описывается как определенная
последовательность действий, выполняемых по установленному алгоритму.
Следует вместе с тем подчеркнуть, что,
во-первых, исходная методология US ЕРА по сути своей является реко-
мендательной, а не строго обязательной как в целом, так и в отдельных
Деталях;
во-вторых, отличительной особенностью этой методологии является ее
гибкость, возможность адаптации к конкретным задачам, к вновь появля-
ющейся информации, возможность выбора между альтернативными подхо-
дами к оценке и т.п.;
в-третьих, даже руководящие материалы US ЕРА по оценке риска пери-
523
одически пересматриваются в связи с накопленным опытом и/или меняю-
щимися взглядами специалистов этого Агентства.
Важнейшей является задача овладения не только общей схемой оценки
риска, но и заложенными в этой методологии возможностями творческого
подхода.
15.2.1. Идентификация вредного фактора (факторов)
Как следует из приведенного выше определения, на этапе идентифика-
ции должна быть дана качественная оценка неблагоприятных для здоровья
эффектов какого-то фактора (или факторов) у людей или животных.
Например, если установлено, что соединения свинца могут вызывать
нарушения синтеза гемоглобина и поражение периферических нервов, ве-
гетативной и центральной нервной системы, вызывать задержку психичес-
кого развития у'детей, нарушать женскую репродуктивную функцию и т.д.,
то свинец идентифицирован как вредный для здоровья фактор. В этом при-
мере идентификация опирается не только на экспериментальную, но и на
обширную клиническую и эпидемиологическую базу. Однако нередко иден-
тификация вредного фактора основывается только на данных эксперимен-
тальной токсикологии. Если необходимой информации в доступных базах
данных или в известной литературе нет, то такая идентификация требует
проведения специальных токсикологических исследований. Как всякое
такое исследование, оно связано с предварительным изучением химичес-
ких и физических свойств вещества и, в частности, его реакционной
способности. Таким образом, этап идентификации опирается на теорети-
ческую, экспериментальную и клиническую базу токсикологической науки.
Важность этого этапа заключается в том, что только на его основе можно
определить те эффекты вредного воздействия на организм, в отношении
которых далее будет оцениваться зависимость доза — ответ и даваться за-
ключительная характеристика риска. Вместе с тем, как правило, ставится
задача выбрать из этих эффектов лимитирующие — тот или те, по которым
оценка риска наиболее актуальна, с учетом не только сравнительной тяжести
и/или индивидуальной и социальной значимости эффектов, но и того, какие
из них возможны при наиболее низких уровнях экспозиции. Другими сло-
вами, к решению этой важной задачи идентификации, требующей учета как
качественных, так и количественных характеристик токсичности, приходит-
ся возвращаться после анализа зависимостей доза — ответ. Например, для
того же свинца, исходя из этих критериев, критическим эффектом являются
снижение интеллектуального уровня и поведенческие отклонения от нормы
у детей младшего возраста [11], для кадмия — поражение почечных каналь-
цев [12] и т.п.
С другой стороны, лишь при совместном анализе токсикологической
характеристики веществ и оцененных (на следующем этапе работы) уровней
экспозиции может быть решена еще одна задача идентификации, а именно
выбор короткого списка тех загрязнителей окружающей среды из всех по-
падающих в нее на рассматриваемой территории, для которых вообще имеет
смысл переходить к этапу анализа зависимостей доза — ответ (самому слож-
ному и требующему наиболее высокой квалификации эксперта). Правда,
обычная практика американских экспертов состоит в том, чтобы проводить
полную оценку риска для всех зарегистрированных загрязнителей конкрет-
ной территории (или из конкретного источника), а затем ранжировать
оцененные риски. Однако нам эта практика не кажется подходящей для
524
условий России. Следует учитывать, что оценка риска необходима прежде
всего в высоко индустриализованных зонах, где выбросы, стоки и отходы
множества предприятий загрязняют окружающую среду десятками, а иногда
и сотнями различных вредных веществ. В России пока трудно обеспечить
адекватное качество оценки риска в столь широких масштабах. С другой
стороны, для большей части этих загрязнителей в России развита система
достаточно консервативных гигиенических стандартов загрязнения различ-
ных компонентов окружающей среды (ПДК, ОБУВ). Поэтому в конкретных
условиях те загрязнители, концентрации которых в значительной степени
ниже этих стандартов, могут быть без опасения исключены из дальнейшего
рассмотрения как явно не представляющие риска. В этих условиях целесо-
образно сконцентрировать внимание, имеющиеся знания и возможные за-
траты на тех загрязнителях окружающей среды, от которых есть основания
ожидать сколько-нибудь предсказуемых вредных эффектов для здоровья
населения, и именно для них давать оценку риска (с последующим сравне-
нием этих рисков).
Нами были предложены следующие критерии отбора приоритетных за-
грязнителей (“короткого списка”) на местном уровне, внедренные в прак-
тику планирования работы по оценке риска в промышленных городах Свер-
дловской области.
А. Превышение средними концентрациями вредного вещества соответ-
ствующей ПДК (а для веществ однонаправленного действия — сумма отно-
шений их концентраций к соответствующим ПДК, превышающая 1,0) хотя
бы в одном компоненте среды.
Б. Содержание вредного вещества на уровнях, соизмеримых с соответ-
ствующими ПДК в более чем одном компоненте окружающей среды при
особом внимании к загрязнению почвы, превышающему фоновое, и к
загрязнению продуктов питания местного производства. В качестве непре-
вышающих, но “соизмеримых с ПДК” условно принимаются те концент-
рации, которые укладываются в диапазон 0,1—1,0 ПДК.
В. Особо неблагоприятный характер предполагаемого вредного эффекта
вещества (канцерогенность, влияние на репродуктивную функцию и/или на
потомство, влияние на развитие нервной системы у детей).
В региональные приоритеты включаются те загрязнители окружающей
среды, которые присутствуют в “коротких списках” не менее чем двух
городов (территорий) региона. Внутри регионального “короткого списка”
загрязнители ранжируются в зависимости от общей численности населения
на этих территориях.
Представление о том, насколько ограничивается объем работы на основе
предлагаемого подхода, может дать пример города Верхняя Пышма (Свер-
дловская область), в котором окружающая среда загрязняется 29 учтенными
(и мониторируемыми) веществами. В качестве требующих оценки риска
нами были отобраны здесь только 9 из них: по критерию А — взвешенные
частицы, сернистый ангидрид, диоксид азота, аммиак; по критерию В —
бенз(а)пирен; по критериям А и Б — медь; по критериям А, Б и В — свинец,
мышьяк, кадмий.
В методологии, развитой в US ЕРА, до недавнего времени наиболее
Унифицированной и формализованной являлась идентификация канцеро-
генных веществ, которая требовала отнесения их к одной из 6 групп в
зависимости от характера и достаточности имеющихся эпидемиологических
и/или экспериментальных свидетельств в пользу или против признания
вещества канцерогенным для человека. В принципе эта группировка совпа-
525
дает с широко известной классификацией Международного агентства по
изучению рака (МАЙР).
При этом были даны четкие и в целом совпадающие с нынешними
критериями экспертов МАЙР дефиниции (отдельно для эпидемиологии и
эксперимента) тех 4 категорий, которыми оценивается качество имеющейся
суммы свидетельств как “достаточной”, “ограниченной”, “неадекватной”
или “отрицательной”.
Однако в 1996 г. US ЕРА выпустило проект нового руководства по
оценке риска канцерогенов (US ЕРА Proposed Guidelines for Carcinogen Risk
Assessment; Notice. Federal Register, April 23, 1996), которым предлагается, в
частности, отказаться от этой классификации, включающей 6 категорий, и
от их буквенного обозначения, заменив ее тремя “дескрипторами” (т.е.
описывающими категориями): “известный/вероятный” канцероген, “не мо-
жет быть определен” как канцероген, “вероятно не канцероген” (“known/
likely”, “cannot be determined”, “not likely”), в соответствии с которыми и
должна даваться описательная идентификация вещества в качестве канце-
рогена. При этом подчеркивается, что ее следует осуществлять экспертом с
учетом всего диапазона экспериментальной и эпидемиологической инфор-
мации, описываемой в каждом случае оценки риска и тщательно оценивае-
мой на этапе идентификации каждого вредного фактора.
Вместе с тем в названном выше проекте Руководства каждый из дес-
крипторов подразделяется на большое число субдескрипторов (в зависимос-
ти от характера и степени надежности указанной информации), так что в
итоге предлагается не 6, как прежде, а 13 вариантов идентификации. Этот
проект Руководства на конец 1998 г. еще не был утвержден, и, по имею-
щимся сведениям, прежние подходы к идентификации канцерогенов все
еще применяются даже американскими экспертами по оценке риска. Что
же касается России, то здесь “Перечень веществ, продуктов, производствен-
ных процессов, бытовых и природных факторов, канцерогенных для чело-
века”, утверждаемый Госсанэпиднадзором России, носит не рекомендатель-
ный (как соответствующие оценки US ЕРА и международные документы),
а обязательный характер. Следовательно, только факторы, включенные в
“Перечень...”, могут рассматриваться официально как создающие канцеро-
генный риск. Поэтому столь же официальный статус методологии оценки
риска для здоровья населения позволяет идентифицировать как канцероген-
ное только такое вещество, которое включено в указанный “Перечень...”, и
такая идентификация любого из перечисленных в ней веществ является
обязательной. Таким образом, в рамках действующего санитарного законо-
дательства, решение независимыми экспертами по оценке риска вопроса о
том, обоснована ли такая идентификация, исключается.
15.2.2. Оценка экспозиций
На этом этапе должна быть дана оценка того, какими путями и через
какие среды, на каком количественном уровне, в какое время и при какой
продолжительности имеет место реальное или ожидаемое вредное воздейст-
вие, а также оценка численности популяции, которая подвергается такому
воздействию или для которой оно представляется вероятным.
Когда по материалам мониторинга получены данные для оценки так
называемого многосредового риска, связанного с загрязнением разных ком-
понентов среды одним и тем же веществом и с разными путями экспозиции
(например, ингаляционным, пероральным, через кожу), то разумным под-
526
ходом к его оценке является определение суммарной дозы этого вещества,
получаемой всеми путями (или по меньшей мере теми, для которых имеется
достаточная информация). Для этогб необходим расчет дозы, поступившей
каждым путем в отдельности. Кроме того, в некоторых случаях различные
пути экспозиции ведут к поражению разных органов-мишеней, и получае-
мые таким образом дозы должны рассматриваться раздельно. Если же воз-
можна оценка риска от загрязнения только одного компонента среды (чаще
всего воздуха), то расчет дозы лишь вносит дополнительные неопределен-
ности в оценку уровня экспозиции, которая вполне может быть выражена
в единицах концентрации загрязнителя в этом компоненте.
На рассматриваемом этапе оценивается не только уровень экспозиции
(т.е. концентрации вещества в среде), но и фактор времени. Именно это
дает возможность косвенно судить о получаемой дозе, даже если она не
может быть определена непосредственно (например, с помощью химичес-
кого анализа крови или других биосред). Для оценки риска, не связанного
с профессией, доза обычно рассчитывается на период жизни продолжитель-
ностью 70 лет (или для конкретного отрезка времени, например, для периода
детства) как среднесуточная на 1 кг массы тела. Например, для среднесу-
точной дозы (ССД), получаемой ингаляционным или пероральным путем,
расчет осуществляется по формуле:
ССД = [Кср х ОП х ПЭ] : [МТ х ПУ],
где Кср — средняя (арифметическая) концентрация токсического вещества
в соответствующем компоненте среды, ОП — объем потребления этого ком-
понента (в тех же единицах объема или массы, к которым отнесена кон-
центрация), МТ — масса тела, ПЭ и ПУ — соответственно суммарный пе-
риод экспозиции и период усреднения (в днях).
Для расчета среднесуточной дозы за жизнь период усреднения равен
продолжительности жизни. Однако и для этого показателя, и для многих
других параметров экспозиции, учитываемых при расчете дозы (в частности,
для объема вдыхаемого воздуха, потребления воды, пищевых продуктов),
методология US ЕРА предусматривает определение двух оценочных вели-
чин, одна из которых именуется “центральная тенденция”, а другая —
“верхняя оценка”.
“Центральная тенденция” рассчитывается на основе средних или меди-
анных интенсивностей экспозиции и усредненных оценок ее частоты, про-
должительности, некоторых физиологических параметров (например, объ-
ема дыхания или потребления воды). “Верхняя оценка” (точнее “верхний
предел” — the upper bound) обычно соответствует верхней границе 95 %
доверительного интервала интенсивности экспозиции (например, концент-
рации токсичного вещества в воздухе), а для используемых физиологических
параметров и длительностей экспозиции — значениям 90-й или 95-й про-
центили. При наличии достаточной информации распределение экспозиции
может быть оценено и с помощью других математических моделей (напри-
мер, так называемой статистики Монте-Карло).
Экспозиция, соответствующая "центральной тенденции”, используется
Для оценки усредненного риска, которому подвергается население, “верхней
оценке”, рассматривается как основа реалистичного предсказания наиболь-
шего возможного риска для отдельных членов этой популяции. Вместе с
тем если имеются основания ожидать существенных различий и по “цент-
ральной тенденции” экспозиции между отдельными группами населения
(субпопуляциями), то она рассчитывается для таких групп раздельно. Наи-
более типичный пример этого — раздельная оценка экспозиции детей и
527
взрослых, для которых различия дозы могут быть связаны и с более высоким
потреблением воздуха, воды и пищи в расчете на единицу массы тела, и с
различиями рационов питания, и особенно с высоким значением для детей
дошкольного и младшего школьного возраста перорального пути экспози-
ции через руки, загрязненные почвой, содержащей осажденные из воздуха
токсичные вещества, либо в связи с извращенными пищевыми влечениями
(съедание почвы, снега, окрашенной штукатурки и т.п.).
Численность экспонированной популяции не входит в расчет дозы, но
является одним из важнейших факторов для решения вопроса о приоритет-
ности природоохранных мероприятий, возникающего при использовании
результатов оценки риска в целях “управления риском”. Важной и непро-
стой проблемой оказывается правомерность отнесения экспозиции (рассчи-
танной по данным мониторинга загрязнения, как правило, в ограниченном
числе точек) к более или менее широкой зоне, а тем самым — к определен-
ной популяции. 'Существенным фактором неопределенности может оказать-
ся и миграция населения (в частности, то, что значительная часть молодежи
покидает малые города), которая приводит к фактическому сокращению
длительности экспозиции.
В идеальном варианте оценка экспозиции действительно опирается на
фактические данные мониторинга загрязнения различных компонентов ок-
ружающей среды (атмосферный воздух, воздух внутри помещений, почва,
питьевая вода, продукты питания). Однако нередко этот подход неосущест-
вим в связи с большими расходами. Кроме того, он не позволяет оценить
связь загрязнения с конкретным его источником (что необходимо, если в
рассматриваемом городе один и тот же поллютант выбрасывается из разных
источников, а ставится вопрос об оценке риска, создаваемого одним из них)
и недостаточен для прогнозирования будущей экспозиции, когда данных
реального мониторинга еще не может быть. Поэтому во многих случаях
используются различные математические модели рассеивания атмосферных
выбросов, их оседания на почве, диффузии и разбавления загрязнителей в
грунтовых водах и/или открытых водоемах. Серьезной проблемой является
не только выбор наиболее адекватной модели, но и надежность инвентари-
зации промышленных выбросов в атмосферу и промышленных стоков,
являющейся исходной информацией для модельных расчетов концентраций
вредных веществ в воздухе и воде.
Существенно недостает моделей для расчета вредной экспозиции из
атмосферы через почву (прямо или через продукты растениеводства и жи-
вотноводства), как и вообще миграционных моделей, достаточно общих и
надежных для использования. Однако не только по данным моделирования
рассеивания, но и в реальных условиях недостатка надежных показателей /
мониторинга загрязнения всех существенных компонентов окружающей
среды, оценка экспозиции (и, следовательно, конечная характеристика
риска) редко может быть произведена как действительно “многосредовая”
и довольно часто ограничивается оценкой прямого воздействия атмосфер-
ного или водного загрязнения на людей. Вместе с тем даже такая неполная
оценка экспозиции (и тем самым риска) может оказаться полезной.
Иногда используют также биокинетические математические модели,
дающие оценку накопления токсичного вещества в организме человека
(например, концентрации свинца в крови детей разного возраста) с учетом
всех путей поступления.
528
15.2.3. Оценка зависимости доза — ответ
На этом этапе оценки риска осуществляется поиск количественных зако-
номерностей, связывающих получаемую дозу вещества с распространенностью
того или иного неблагоприятного (для здоровья) эффекта, т.е. с вероятностью
его развития. Глоссарий US ЕРА по оценке риска определяет термин зави-
симость доза — ответ как “связь между дозой и относительным количеством
(в процентах) индивидуумов с количественно определенной выраженностью
определенного эффекта в группе индивидуумов”. В тех случаях, когда про-
водится оценка риска, определяемого только загрязнением атмосферы, дан-
ный этап сводится к оценке зависимости концентрация — ответ. В принци-
пе тот же подход вполне применим и к оценке риска только загрязнения
питьевой воды, хотя в этом случае и принято переводить концентрацию
загрязнителя в его дозу (с учетом питьевого водопотребления).
Закономерности доза (концентрация) — ответ чаще всего (в особеннос-
ти, когда речь идет об относительно редких или новых загрязнителях)
выявляются в токсикологических экспериментах. Как известно, экстрапо-
ляция их с группы животных на человеческую популяцию связана с боль-
шим числом неопределенностей. Зависимости доза — ответ, обоснованные
эпидемиологическими данными, могут быть более надежны, но и они имеют
свои источники неопределенности. Например, при построении некоторой
эпидемиологической зависимости ответа от высоких уровней экспозиции (в
основном производственной) ее экстраполяция на диапазон менее высоких
уровней может оказаться ошибочной и зависит от произвольного выбора
математической модели. Располагаемые данные о вариабельности экспози-
ции внутри изученной популяции и/или о разнице экспозиций сравнивае-
мых популяций часто недостаточны. Иными словами, определенный ответ —
например, частота случаев рака, связываемый с усредненной оценкой экс-
позиции данной популяции, может быть обусловлен в основном той ее
частью, которая подвергалась существенно более высокой экспозиции, ос-
тавшейся неизвестной исследователю. Зависимость, найденная для одной
человеческой популяции, не обязательно справедлива для другой, имеющей
какие-то генетические или иные отличия, подвергающейся воздействию
другого комплекса факторов, сопутствующих изучаемой экспозиции, и т.ц.
Тем не менее эпидемиологическое обоснование зависимости доза —
ответ (в особенности использующее результаты метанализа нескольких эпи-
демиологических исследований) обоснованно признается более надежным,
чем экспериментальное. Кроме того, для системных токсикантов только оно
позволяет выражать “ответ” как явный вероятностный показатель риска для
человека.
Однако эпидемиологические исследования, позволяющие количественно
соотнести “ответ” с экспозицией, даже в последнее десятилетие, характери-
зующееся интенсивным развитием так называемой экологической эпидеми-
ологии (environmental epidemiology), проводятся не слишком часто в связи
с организационными и финансовыми трудностями. Кроме того, во многих
случаях такое исследование невозможно из-за недостаточно длительного
периода экспозиции, малой численности экспонированной популяции, на-
личия слишком большого числа мешающих эпидемиологическому анализу
сопутствующих факторов риска. Поэтому, как и в отечественной практике
установления ПДК, в большинстве случаев рассматриваемый этап оценки
риска базируется на экспериментальных данных.
Этап оценки зависимости доза — ответ в методологии US ЕРА различен
Для неканцерогенов и канцерогенов.
529
Для неканцерогенных токсичных веществ US ЕРА исходит из концепции
пороговости действия и признает возможным установить так называемую
референтную дозу (RfD) или референтную концентрацию (RfC), при дейст-
вии которых на человеческую популяцию, включая ее чувствительные под-
группы, не создается риска развития каких-либо уловимых вредных эффек-
тов в течение всего периода жизни.
Термин “reference dose” означает “доза для ссылки”, “справочная доза”
и т.п. и не отражает прямо идею безвредности этой дозы. В русском же
языке обычное употребление слова “референт” никак не соотносится с
термином “референтная доза” и делает его непонятным. Хотя “референтная
доза” уже успела войти в профессиональный жаргон узкого круга лиц,
занимающихся оценкой риска в России, и даже в некоторые документы,
целесообразно отказаться от этого термина. Не следует также употреблять
в этом контексте термины “допустимая доза или концентрация”, поскольку
в России они имеют вполне определенный юридический смысл. Наиболее
адекватен термин "tolerable intake” (“терпимая, переносимая доза”), исполь-
зуемый в документах ВОЗ, излагающих ту же методологию оценки риска.
RfD обычно выражается в мг/кг/день, RfC — в мг/м3.
Анализ имеющейся экспериментально-токсикологической информации
о зависимости ответа от дозы сводится к нахождению самого высокого
уровня дозы (экспозиции), при котором еще может быть достаточно убеди-
тельно, с точки зрения эксперта по оценке риска, показано отсутствие
статистически и биологически значимых вредных эффектов. Этот уровень
называется NOAEL (no observed adverse effect level — уровень, при котором
нет наблюдаемых неблагоприятных эффектов). В качестве критического (т.е.
лимитирующего) эффекта принимается тот, по которому найдено наимень-
шее значение NOAEL. При отсутствии надежных данных для оценки этой
величины в качестве ее суррогата может быть использован LOAEL (lowest
observed adverse effect level) — минимальный уровень экспериментальной
экспозиции, при которой еще наблюдался биологически и статистически
значимый неблагоприятный эффект. Отметим, что в некоторых случаях
LOAEL определяется на основе не экспериментальных, а “человеческих”
данных (чаще всего относящихся к профессиональным экспозициям).
Очевидно принципиальное сходство этих понятий с понятиями “недей-
ствующей” и “пороговой” дозы или концентрации, принятыми в россий-
ской системе установления ПДК. Общим для обеих методологий недостат-
ком является вероятностная неопределенность принимаемых величин. Стре-
мясь преодолеть этот недостаток, специалисты US ЕРА в последние годы
разрабатывают альтернативный подход: вероятностный анализ эксперимен-
тальных зависимостей доза — ответ с целью определения величин, которые
обозначаются как benchmark dose (BMD) при пероральной экспозиции
животных или benchmark concentration (ВМС) при ингаляционной экспози-
ции. (Benchmark — репер, отправная точка отсчета.) BMD/С определяется
как нижняя доверительная граница дозы (концентраций), вызывающей вы-
бранный уровень ответа. Например, BMD может представлять собой ниж-
нюю границу 95 % доверительного интервала дозы, соответствующей по-
вышению на 1 % частоты обнаружения определенного неблагоприятного
показателя по сравнению с контрольной группой. Линейная модель прини-
мается как основная для экстраполяции экспериментальных зависимостей
на низкие уровни, но возможен выбор и других моделей. Выбор же гранич-
ного уровня ответа (benchmark response level), например 1 %, достаточно
произволен, но рекомендуется устанавливать его таким, чтобы BMD оказа-
530
лась не намного ниже, чем LOAEL (иногда рекомендуется даже, чтобы она
находилась между LOAEL и NOAEL). В принципе этот подход близок к
тому, который используется иногда в российской практике установления
ПДК и обычно называется нахождением вероятностного порога.
Однако наиболее существенное различие между отечественной методо-
логией и практикой обоснования ПДК и наиболее часто встречающимися
случаями оценки риска неканцерогенных эффектов американскими экспер-
тами обнаруживается при ознакомлении с той фактической информацией,
которой располагает база данных US ЕРА для обоснования либо NOAEL,
либо BMD/С. Очень часто при этом не используются (или не принимаются
во внимание в качестве неблагоприятных) те тонкие функциональные и
биохимические сдвиги, на которых обычно основывается определение “по-
рогов” российскими токсикологами. Поэтому вполне реально, что доза,
установленная как NOAEL, рассматривалась бы для того же самого вещества
как действующая (надпороговая) или пороговая, с позиций отечественной
методологии обоснования ПДК.
При переходе от NOAEL (или BMD/С) к RfD или RfC вводится целый
ряд понижающих коэффициентов (по сути своей имеющих то же назначе-
ние, что и принятые в отечественной гигиенической токсикологии так
называемые коэффициенты запаса). Максимальные значения этих факторов
неопределенности равны:
10 — с учетом экстраполяции с животных на людей (для ингаляционной
RfC — 3, если учтены так называемые дозиметрические межвидовые разли-
чия, т.е. различия кинетики отложения и резорбции в респираторных орга-
нах);
10 — с учетом особо чувствительных людей;
10 или менее — при наличии только кратковременных экспериментов;
10 — при неполноте базы данных;
10 — если используется не NOAEL, a LOAEL.
При наличии токсикокинетической и/или токсикодинамической инфор-
мации, делающей экстраполяцию с животных на человека или учет межин-
дивидуальных различий более серьезно обоснованными, первые два фактора
снижаются. При этом рекомендуется исходить из того, что фактор неопре-
деленности межвидовых различий есть произведение фактора неопределен-
ности различий токсикокинетики, равного 4,0, и фактора неопределенности
различий токсикодинамики, равного 2,5; для различий межиндивидуальных
оба множителя фактора неопределенности принимаются равными 3,2. На-
пример, если установлено отсутствие существенных различий токсикодина-
мики рассматриваемого вещества у человека и у того вида лабораторных
животных, в эксперименте на котором установлена зависимость доза —
ответ, но не могут быть исключены межвидовые различия токсикокинетики,
то при переходе к RfD соответствующий фактор неопределенности прини-
мается равным не 10, а 2,5. Все эти допущения в высшей степени условны.
Если же эксперт усматривает в располагаемой информации какие-либо
дополнительные неопределенности, он может ввести еще так называемый
модифицирующий фактор, не превышающий 10. Если произведение всех
этих факторов превышает 10 000, то база данных признается слишком
слабой для использования. Нельзя, однако, не заметить, что и при величине
этого итогового делителя около 1000—10 000 теряет серьезное значение
оценка NOAEL или LOAEL с точностью, превышающей десятичные поряд-
ки величин. Всю эту процедуру установления пороговых (для животных), а
затем — переносимых (для человека) доз и концентраций, как и поиск
531
токсикологической информации, на которой она основывается, может осу-
ществлять самостоятельно каждый специалист по оценке риска, и именно
так работают наиболее квалифицированные специалисты по такой оценке
в США. Однако наряду с этим она часто основывается не только на
использовании созданной и периодически обновляемой в US ЕРА базе
данных IRIS (и ряда других баз данных), но для многих веществ и на
рекомендуемых этим Агентством (и приводимых в той же IRIS) величинах
NOAEL и RfD/C. Прямое использование “референтных” доз и концентра-
ций, применяемых в США, для решения задач оценки риска в России
возможно лишь как временная мера в связи с отмеченным выше несовпа-
дением принципов экспериментально-токсикологической оценки порого-
вых доз (концентраций) в этих странах. Следует также иметь в виду, что
полным такой список обоснованных переносимых доз никогда не окажется,
и всегда возможно появление загрязнителя окружающей среды, для которого
потребуется специальное обоснование переносимой дозы.
Зависимости доза — ответ, найденные на основе анализа, а иногда и
метанализа результатов эпидемиологических исследований, могут не огра-
ничиваться упомянутым выше нахождением LOAEL. В идеале они выража-
ются как уравнения регрессии, связывающие дозу (концентрацию) токсич-
ного вещества с ожидаемой частотой того или иного нарушения здоровья,
характерного для эффектов действия этого вещества, либо с частотой гос-
питализации по поводу определенного заболевания, либо со смертностью
и т.п. Подобного рода подход к этому этапу оценки риска хорошо разработан
для таких загрязнителей окружающей среды, как свинец, витающие в воз-
духе твердые частицы (particulate matters — РМ), сернистый ангидрид, но
вполне возможно и расширение его на другие факторы, если эксперт нахо-
дит в литературе соответствующие эпидемиологические материалы и пред-
лагает адекватный способ их использования.
Ряд исследований выявил неспецифическую связь между загрязнением
атмосферы и общей смертностью (от всех причин, не считая травм). По-
скольку чаще всего применяется линейная модель, обычным выражением
таких зависимостей служит коэффициент регрессии — прирост ответа на
определенный прирост дозы (концентрации). Например, имеются данные,
полученные в двух городах Польши, согласно которым каждый миллиграмм
на 1 м3 сернистого ангидрида в атмосфере дает избыточную общую смерт-
ность от 0,4 до 0,6 %, а по данным, полученным в одном из российских
городов, — от 1,5 до 2,8 %. Большое число работ посвящено зависимости
смертности (или иных ответов) от аэрозольного загрязнения атмосферы,
однако в них, как правило, используется показатель не суммарной, а фрак-
ционной концентрации пыли (чаще всего РМщ и PM2s), что делает широ-
кое использование этих зависимостей для оценки риска в условиях России
затруднительным. Ориентировочную оценку суммарной концентрации пыли
(total suspended particles — TSP) дает отношение, предложенное на основании
обобщения результатов мониторинга в разных городах: РМ10 = 0,55*TSP, от-
куда TSP = РМ10 ; 0,55.
Тем не менее обобщим некоторые результаты американских и канадских
эпидемиологов для того, чтобы дать представление о порядке величин риска,
связанных с действием частиц. Так, относительный риск общей “острой »
смертности” (т.е. регистрируемой в тот же день или через 1—2 дня после
пикового подъема концентрации) на каждые измеренные в течение 24 ч
50 мкг/м3 РМ10 варьировал по 13 разным городам 10 штатов от 0,98 (с
доверительным интервалом 0,90—1,05) до 1,08 (1,05—1,11), а при включении
532
в математическую модель и других загрязнителей (чаще всего SO2) до 1,19
(0,96—1,47). Относительный риск увеличения числа жителей старше 65 лет,
госпитализируемых по поводу респираторных заболеваний, с аналогичным
ростом PMio варьировал (в 4 городах разных штатов США и в Торонто) от
1,06 (1,00—1,13) до 1,23 (1,02—1,43), не изменяясь существенно при вклю-
чении других загрязнителей. Относительный риск заболевания пневмонией,
по разным данным, от 1,06 (0,98—1,13) до 1,09 (1,03—1,1,15) и также
определяется в основном концентрацией частиц. То же относится и к
полученным в Детройте данным по относительному риску ИБС: 1,02 (1,01—
1,03), независимо от того, учитывались или нет другие загрязнители.
По другим данным, каждые 25 мкг/м3 увеличения РМ2 5 (также при
24-часовом мониторинге) дают относительный риск острой смертности по
6 городам США от 1,020 (0,951-1,092) до 1,056 (1,038-1,071). Того же
порядка величины относительного риска госпитализации практически не
зависят от включения в модель также концентраций SO, О3 или Н+.
Значительно большая информативность показателей фракционной запы-
ленности атмосферы по сравнению с показателями содержания в ней раз-
дражающих газов видна и по тому, что результаты разных исследований,
ориентированных на РМП10 или РМ2 5, как можно было видеть, не разли-
чаются в столь большой степени, как приведенные выше результаты двух
исследований, ориентированных на сернистый ангидрид. К сожалению, как
уже было подчеркнуто, в литературе крайне мало количественных оценок
риска по показателю TSP.
По тем же 6 городам США, в которых TSP по среднегодовым концент-
рациям варьировала от 39 до 114 мкг/м3, связанный с этими различиями
показатель odds ratio для заболеваемости детей бронхитом найден был рав-
ным 2,80 (1,17—7,03). Показатель odds — “шансы” — означает в эпидемио-
логии отношение числа лиц, у которых имеется тот или иной неблагопри-
ятный эффект со стороны здоровья, к числу лиц, у которого этого эффекта
нет, a odds ratio — отношение этого показателя в популяции, на которую
действует изучаемый фактор риска, к такому же показателю в популяции,
в которой его нет или он менее выражен. Это несколько ниже, чем зави-
симость от PMi5/i0: 3,26 (1—1,13), но все же свидетельствует об информа-
тивности показателя TSP и о том, что проведение собственных эпидемио-
логических исследований в России для обоснования зависимостей “кон-
центрация — ответ” на основе этого показателя может быть более рацио-
нальной стратегией, чем ожидание того, пока вся система мониторинга
будет оснащена импакторами, специальными фильтрами и сверхточными
весами для фракционного мониторинга запыленности атмосферы.
Необходимо отметить существенную, на наш взгляд, неопределенность
оценки концентрация — ответ на основе результатов анализа временных
серий, относящихся к связи пиков смертности с пиками загрязнения. При
этом эксперты по оценки риска обычно допускают, что хронический эффект
является суммой острых эффектов, т.е. относят соответствующие коэффи-
циенты регрессии к усредненным за год концентрациям загрязнителей и к
фоновом числу смертей за год. Условность этого допущения очевидна,
поскольку эффекты продолжительного действия и пыли, и сернистого ан-
гидрида на респираторный тракт включают развитие таких заболеваний, как
хронический бронхит, пневмосклероз и эмфизема легких, и способствуют
развитию легочного туберкулеза и рака. Все эти болезни, помимо их небла-
гоприятного влияния на функцию дыхания, работоспособность и в целом
на качество жизни, существенно снижают вероятность дожития, что не
533
отражается простой суммой “острых смертей”. Таким образом, риск, оце- I
ненный на основе такого суммирования, вероятнее всего, является сущест- I
венно заниженным. Однако данных для вероятностной оценки зависимости
экспозиция — ответ по хроническим эффектам пыли и сернистого ангидри- I
да в известной нам литературе нет.
Для оценки риска, связанного со свинцовой экспозицией, US ЕРА
рекомендует ряд математических зависимостей, выражающих нелинейную
связь вероятности развития различных эффектов этой экспозиции с кон-
центрацией свинца в крови. К таким количественно определенным эффек-
там отнесены гипертония у мужчин, несмертельные инфаркты и инсульты,
а также рост общей смертности у взрослых обоего пола; неонатальная
смертность в связи с низким весом новорожденных; задержка психического
развития у детей (снижение IQ).
Например, зависимость увеличения вероятности гипертонии (AP(hyp)] у
взрослых мужчин, определяемой как наличие диастолического давления
>90 мм рт.ст., от концентрации свинца в крови (РЬВ мкг/дл) выражается
уравнением:
ДРфур) = 1;(1+е2,744-0,7931 пРЬВу
Следующим шагом обычно служит оценка риска избыточной смертности
на основе уравнения, связывающего ее с повышением диастолического
давления.
В свою очередь приняты определенные усредненные зависимости кон-
центрации свинца в крови от концентрации его в воздухе. Например, для
детей, проживающих в радиусе до 5 км от промышленного выброса свинца
в атмосферу, рекомендуется принимать прирост концентрации свинца в
крови 4,0 мкг/дл на каждый мкг/м3 воздуха (с учетом не только ингаляции, -
но и “непрямой” экспозиции через загрязняемую почву). Более точное
предсказание, основанное на данных о содержании свинца во всех компо-
нентах окружающей среды, дает токсикокинетическая модель US ЕРА Up-
take/biokinetic model for lead — Version 0,99d/. Таким образом, вся эта сис-
тема математических моделей, основанная на обобщении эпидемиологичес-
ких данных, позволяет установить зависимость экспозиция — ответ.
При оценке риска нефропатии, развивающейся в результате хронической
кадмиевой экспозиции населения (в основном с водой и пищей) авторы
совместно с K.Cunningham (эксперт-токсиколог консалтинговой фирмы Abt
Associates) проанализировали опубликованные результаты эпидемиологичес-
ких исследований, проводившихся в Японии. На основании полученных
данных мы смогли принять, что при допущении линейной зависимости
доза — ответ и при усреднении экспозиции за всю жизнь среднесуточная
доза, равная 0,1 мкг Cd/кг в день, вызывает поражение почечных канальцев ,
у 5,59 % экспонированных. (В качестве признака этого поражения, по дан-
ным литературы, было принята концентрация микроглобулина В2и в моче
свыше 300 мг/л.)
При оценке зависимости доза — ответ для канцерогенов US ЕРА чаше
всего (хотя и не всегда) рассматривает их действие как беспороговое. Такое
разграничение между канцерогенными и неканцерогенными токсикантами
не свойственно российской методологии обоснования ПДК, исходящей из ,
того, что неопровержимое доказательство концепции беспороговости (как
и концепции пороговое™) канцерогенного действия в принципе невозмож-
но. Можно обнаружить такой низкий уровень экспозиции, при котором
статистически значимое повышение частоты возникновения опухолей по
сравнению со спонтанным уровнем не удается установить ни эпидемиологу,
534 J
ни экспериментатору, хотя всегда остается какая-то гипотетическая вероят-
ность того, что на более многочисленных (и практически невозможных)
когортах людей или группах лабораторных животных такой ответ был бы
установлен и на этом низком уровне. Этот уровень полностью соответствует
американским определениям понятий NOAEL (для экспериментальных жи-
вотных) или RfD (для людей), которыми подчеркивается, что речь идет о
дозах, не вызывающих уловимого или статистически значимого эффекта. Таким
образом, препятствием к определению указанных параметров для канцеро-
генных веществ оказывается только чисто умозрительная приверженность
парадигме беспороговости их действия. Кроме того, в современной литера-
туре даже сторонниками этой парадигмы она принимается только для тех
веществ, канцерогенность которых является следствием их генотоксичности,
но не для достаточно большого числа негенотоксичных канцерогенов.
Именно поэтому упомянутый выше проект нового Руководства US ЕРА
по оценке риска канцерогенных веществ признает возможность пороговое™
для тех из них, канцерогенность которых не связана с мутагенностью (на-
пример, является вторичным следствием токсического действия, которое
само по себе имеет порог).
И в отношении рака наибольшим доверием, естественно, пользуются
зависимости доза — ответ, обоснованные эпидемиологическими данными,
однако число таких зависимостей, используемых при оценке риска, крайне
невелико. Наилучшим примером является мышьяк, для которого обоснова-
ны коэффициенты регрессии (факторы наклона) в (мг/кг/день)-1, разли-
чающиеся по отношению к раку разных локализаций: 1>0 — по раку печени,
2,5 — по раку легких и мочевого пузыря, 0,86 — по раку почек [11], 1,5 —
по раку кожи [11]. Трактовка фактора наклона дана ниже в связи с экспе-
риментально обоснованной версией его.
Задача оценки зависимости доза — ответ для канцерогенов при отсутст-
вии эпидемиологических материалов сводится к использованию экспери-
ментальных данных, которые рекомендуется получать на животных наиболее
чувствительных видов либо такого вида, о котором известно, что его реаги-
рование на данный канцероген наиболее сходно с человеческим. При этом
предпочтение отдается тем путям воздействия на животных, которые наи-
более соответствуют условиям человеческой экспозиции. Однако позитив-
ные результаты такого эксперимента на численно всегда ограниченных
группах лабораторных животных реально могут быть получены только при
действии относительно высоких доз, дающих высокую вероятность выхода
опухолей, а система оценки риска предполагает в качестве основы мер по
управлению риском определение тех доз, при действии которых эта вероят-
ность очень низка. Поэтому производится экстраполяция найденной зави-
симости доза — ответ на диапазон доз, которые существенно ниже реально
использованных в эксперименте. Для такой экстраполяции используются
различные математические модели (многоступенчатая, логистическая, про-
битная, модель одного удара, модель Вейбулла), дающие неодинаковую
оценку ответа в диапазоне низких доз. Каждая модель базируется на той
или иной общей теории канцерогенеза, а не на данных, полученных при
изучении действия конкретных химических веществ, и ни одна из них не
может быть ни строго доказана, ни убедительно опровергнута.
Ранее US ЕРА отдавало предпочтение так называемой линеаризованной
многоступенчатой модели (linearized multistage model) в качестве основы
унифицированного подхода к экстраполяции с высоких доз на низкие:
P(d) = l-expHq(O) + q(1)d + q(2)d**2 + ... + q(k)d**k]},
535
где P(d) есть вероятность развития рака от непрерывного уровня дозы d,
q(i) — константы, к — число групп, получавших разные дозы (d**) либо чис-
ло стадий, через которые предполагается проходящим процесс канцероге-
неза. (Модель исходит из гипотезы, согласно которой рак инициируется
клеточной мутацией через конечный ряд шагов.)
Основным параметром для расчета человеческого риска при этом явля-
ется так называемый фактор наклона (slope factor), в качестве которого
обычно используется верхний 95 % доверительный предел наклона линей-
ного участка кривой доза — ответ. Фактор наклона выражается как
(мг/кг/день)-1 и является мерой риска от единичной дозы канцерогена.
Например, если некто подвергается на протяжении всей жизни ежедневно
воздействию канцерогена в дозе 0,002 мг/кг, а фактор наклона найден
равным 0,02 (мг/кг/день)-1, то добавленный риск, получаемый умножением
дозы на фактор наклона, оценивается величиной 4-10"5. Иными словами,
признается вероятным развитие 4 дополнительных случаев рака на 100 000
человек, подвергающихся экспозиции такого уровня.
При этом принимаются следующие принципиальные допущения:
• процессы канцерогенеза у человека и лабораторных грызунов фунда-
ментально единообразны;
• вероятность развития рака под влиянием какого-то канцерогена, воз-
действующего на протяжении жизни животного, соответствует тако-
вой на протяжении человеческой жизни;
• возможные межвидовые различия токсикокинетики канцерогенных
веществ, обусловливающие неодинаковое содержание их в органах-
мишенях при эквивалентной дозировке, а также возможные межви-
довые различия токсикодинамики, а именно чувствительности этих
органов к действию одного и того же количества данного канцерогена
могут не приниматься во внимание, если только нет конкретной
токсикокинетической и токсикодинамической информации для ко-
личественного учета этих различий.
Однако остается сложная проблема эквивалентности дозировок, связан-
ная с необходимостью учесть существенные различия массы и поверхности
тела животных и человека. Рассмотрев теоретические и экспериментальные
предпосылки к различным способам пересчета доз, использованных в экс-
перименте, на дозы для расчета канцерогенного риска у человека, специ-
альная межведомственная группа американских специалистов остановилась
на единой рекомендации — считать эквивалентными дозы, отнесенные к
единице массы тела, возведенной в степень 3/4, т-е- выраженные как
мг/кг3/4/день. Той же группой были приняты перечисленные выше допуще-
ния 124].
Эти рекомендации в принципе сохранены и в уже упоминавшихся "Pro-
posed guidelines for carcinogen risk assessment” 1996 г., но ими подчеркивается,
что расчет, основанный на возведение массы тела в степень 3/4, применим
только для пероральной экспозиции, в то время как эквивалентность кон-
центраций ингалируемых газов или частиц должна учитывать межвидовые
различия их легочного поглощения или отложения [30]. Вместе с тем пред-»
ложенные в 1996 г. новые подходы к анализу зависимости доза — ответ
существенно отличаются от прежней методологии US ЕРА:
• В качестве исходной точки для экстраполяции на кривой, описываю-
щей экспериментальную зависимость доза — ответ, выбирается ниж-
536
няя 95 % доверительная граница дозы, соответствующей 10 % веро-
ятности развития рака — нижняя эффективная доза (НЭД), дающая
В 10 % ответ (НЭДю).
ы • При достаточных теоретических основаниях для допущения линейной
Ц зависимости в диапазоне малых доз (например, когда предполагается,
В что канцерогенность связана с действием данного вещества на ДНК)
В точка на кривой, соответствующая НЭДю, соединяется прямой с
В началом координат. Точка пересечения этой прямой линии с перпен-
В дикуляром, восстановленным из той точки на оси абсцисс, которая
В соответствует оцененной человеческой дозе, имеет ординату, равную
В искомому добавленному риску рака у человека.
В • Если допущение линейной зависимости недостаточно обосновано и
В имеется достаточно оснований считать ее нелинейной (и тем более
В тогда, когда может быть допущен порог канцерогенного действия),
В US ЕРА отказывается от применения какой бы то ни было нелиней-
В ной математической модели, признавая, что разные модели дают
В слишком отличающиеся оценки риска. В этих случаях экстраполяция
В вообще не производится и человеческий риск не может быть оценен
В как вероятность развития рака или как прогнозируемое добавляемое
В число случаев рака в популяции. Взамен этого используется косвен-
ный критерий величины риска: отношение НЭДю к оцененной че-
* ловеческой дозой — МОЕ (Margin of exposure — приблизительный
перевод: “запас экспозиции”). Этот критерий аналогичен отношению
NOAEL к оцененной человеческой дозе неканцерогенного токсично-
го вещества (см. ниже).
Таким образом, в целом новый методический документ US ЕРА по ряду
позиций сближает подходы к оценке риска канцерогенов и “системных
токсикантов”, однако прежняя методология еще достаточно широко приме-
няется как в самих США, так и в странах, заимствовавших ее.
Сближение подходов US ЕРА к анализу экспериментально устанавлива-
емых зависимостей доза — ответ для канцерогенов и неканцерогенов облег-
чает восприятие методологии оценки риска российскими токсикологами,
которые при установлении ПДК как канцерогенных, так и неканцерогенных
химических веществ исходят из наличия порога дозы, ниже которого дока-
зуемый неблагоприятный эффект отсутствует или по крайней мере не может
быть практически обнаружен.
Однако чисто умозрительная парадигма беспороговости канцерогенного
действия в качестве теоретической основы оценки риска сохраняется боль-
шинством западных экспертов для веществ, канцерогенность которых свя-
зывается с генотоксичностью. На ней и основана предлагаемая экстраполя-
i ция зависимости доза — ответ до нулевой точки, обусловливающая вычис-
ление хоть какого-то конечного риска при сколь угодно малой экспозиции.
Неизбежным следствием при этом оказывается необходимость принять ре-
шение, какая степень риска может быть принята в качестве допустимой —
решение, для принятия которого, по нашему глубокому убеждению, в прин-
ципе не существует научно обоснованных и общественно приемлемых кри-
териев.
Для большинства практически значимых канцерогенных загрязнителей
окружающей среды представляет интерес также оценка риска неканцероген-
ных вредных эффектов. Поэтому для таких веществ, как никель, хром,
мышьяк, кадмий и др., оценка зависимости доза —ответ дается как в
537
i
отношении рака, так и в отношении неонкологических вредных эффектов.
С другой стороны, западные эксперты нередко предсказывают (на основа-
нии экспериментальных данных) канцерогенный риск для населения в
вероятностном выражении и для тех веществ, которые не являются твердо
установленными “человеческими” канцерогенами. Наше отрицательное от-
ношение к распространению этой практики в России вытекает из сказан-
ного выше по поводу идентификации канцерогенов.
15.2.4. Характеристика риска (“risk characterization”)
Характеристика риска — завершающий этап, целью которого является
синтез всех результатов оценки риска и формулировка выводов, передаваемых
лицу или организации, принимающим решения в сфере экологической политики.
На этом этапе оригинальной методологией US ЕРА требуется также
суммировать и охарактеризовать все неопределенности каждого из предыду-
щих этапов оценки риска, сообщив о них лицу, принимающему управлен-
ческие решения, и общественности. Именно обилие таких неопределеннос-
тей и недостаточная обоснованность допущений, принимаемых для их учета,
вызывают наибольшую критику всей системы оценки риска, которой она
подвергается в самих США. Как известно, практически те же неопределен-
ности свойственны и принимаемым в России величинам ПДК. Однако
после обсуждения узким кругом экспертов эти величины устанавливаются
в качестве обязательных нормативов, и информация о неопределенностях
не доводится до сведения пользователей этими нормативами. Очевидно,
необходимо накопить опыт реального использования оценок риска в рос-
сийских условиях, прежде чем установить действительную необходимость,
возможность, объем и порядок предоставления пользователю информации
о неопределенностях таких оценок.
Форма характеристики риска может быть самой различной: от чисто
описательной до полуколичественной и даже количественной (скорее ква-
зиколичественной), но чаще всего используется комбинация этих подходов.
Одним из количественных показателей, используемых для косвенной харак-
теристики неканцерогенного риска, является отношение оцененной суточ-
ной дозы вещества к RfD, называемое коэффициентом опасности (hazard
quotient — HQ). Только HQ >1,0 рассматривается как свидетельство потен-
циального риска для здоровья. Другой мерой потенциальной вредности
экспозиции является запас ее безопасности (МОЕ — margin of exposure),
представляющей собой отношение NOAEL к оцененной в тех же единицах
человеческой дозе. Когда эта величина соизмерима с произведением всех
факторов неопределенности или даже превышает его, необходимость управ-
ления риском представляется неубедительной.
Когда речь идет об оценке риска от загрязнения какого-то одного ком-
понента среды, т.е. в тех случаях, в которых нет необходимости расчета дозы
и уровень экспозиции адекватно оценивается концентрацией, коэффициент
опасности HQ = С : RfC, причем вместо “референтной концентрации” может
быть использована величина ПДК. Этот способ оценки экологической ситуа-
ции с гигиенических позиций давно известен в России. Расчет HQ для
оценки “многосредового” риска допускает сложение доз, полученных из^
разных сред разными путями, и соотнесения такой суммарной дозы с'
переносимой.
При оценке риска, создаваемого несколькими химическими веществами,
обладающими системной токсичностью, если имеются основания допустить
538
аддитивность их действия (в особенности, когда они вызывают один и тот
же эффект, обусловленный сходными механизмами), US ЕРА рекомендует
суммировать величины HQ, соответствующие каждому такому токсиканту
(если нет различий эффекта при разных путях воздействия). Этот способ
оценки опасности комбинированного загрязнения также давно применяется
отечественными гигиенистами (как сумма отношений наблюдаемых кон-
центраций к соответствующим ПДК). Следует иметь в виду, что аддитив-
ность доз является далеко не преобладающим типом комбинированного
действия, в особенности на низких уровнях экспозиции; в частности, для
комбинированной токсичности металлов характерен более или менее выра-
женный антагонизм. Безусловно, могут встретиться и комбинации, обла-
дающие действием выше аддитивного (синергизм, потенцирование). Тем не
менее во всех случаях, когда подобная информация о конкретных токси-
кантах отсутствует, оправдано рассчитывать “коэффициент опасности” как
суммарный.
Однако в любом случае коэффициентом опасности характеризуется не
собственно риск для здоровья как вероятностный параметр в соответствии
с его официальной дефиницией, приведенной в начале этой главы, а лишь
косвенный критерий, который со многими оговорками можно использовать
для ранжирования рисков, но не для их абсолютной оценки. Только зави-
симости доза — ответ, основанные на эпидемиологических данных, позво-
ляют дать такую оценку для веществ, не обладающих канцерогенностью для
человека. В этом случае, на основе единичного риска (оценивающего на
этапе анализа зависимости доза — ответ вероятность развития того или
иного вредного эффекта на единицу экспозиции), перемножаемого на дозу
(найденную на этапе оценки экспозиции), получают величину “индивиду-
ального риска”, т.е. вероятность развития'этого эффекта у жителя рассмат-
риваемой территории, а умножением этой вероятности на численность на-
селения — величин “популяционного риска” в числе ожидаемых случаев
данного нарушения здоровья.
Так, в рассмотренном выше случае кадмиевой нефропатии единичный риск
равен 55,9 % на 1 мг/кг/день, а среднесуточная доза кадмия для населения
города Верхняя Пышма всеми путями экспозиции — 0,353057 мг/кг/день.
Следовательно, индивидуальный риск 55,9 • 0,353057 » 19,74 %. При числен-
ности населения «53 тыс. человек это означает, что сохранение того же
уровня экспозиции на все время его жизни приведет к развитию «10,5 тыс.
случаев нефропатии.
Характеристика риска развития рака состоит либо в том прогнозе веро-
ятного числа дополнительных случаев этого заболевания за весь период
жизни, который получается перемножением дозы на фактор наклона или
путем линейной экстраполяции, либо же через критерий МОЕ (см. выше).
Как уже подчеркивалось, такой количественный прогноз в условиях Рос-
сийской Федерации допустимо давать только для веществ, официально
признанных канцерогенными для человека. Вместе с тем целесообразно
сообщать и о наличии в тех или иных условиях экспозиции к веществам,
канцерогенность которых для человека предполагается (группа В). Допуская
независимость механизмов канцерогенного действия разных веществ и ли-
нейность зависимости доза — ответ, можно суммировать дополнительные
риски развития злокачественных новообразований, создаваемые отдельны-
ми канцерогенами при комбинированной экспозиции.
539
15.2.5. Связь между оценкой риска и управлением им
Характеристика риска служит основой для принятия решений по управле-
нию риском (risk management), т.е. по организационным, политическим, пра-
вовым и иным мерам, направленным на его предупреждение, ликвидацию или
хотя бы снижение. В любой стране это управление зависит не только от
оцененной или предполагаемой величины риска, но и от многих других
факторов, учитываемых при формировании как решения в каждом конкрет-
ном случае, так и в целом позиции государства и общественного менталитета
в сфере вопросов охраны природы и защиты здоровья населения. Эти
факторы относятся к числу социальных, социально-психологических, эко-
номических, политических, технологических и т.д.
Тем не менее сравнительная оценка риска, создаваемого здоровью на-
селения разных территорий либо для разных групп населения (профессио-
нальных, возрастных, половых), либо риска, создаваемого различными ис-
точниками загрязнения окружающей среды и/или разными загрязнителями
ее, либо риска, связанного с загрязнением одним и тем же веществом разных
компонентов окружающей среды и т.п., должна играть важную роль в
ранжировании приоритетов природоохранной политики и требований госу-
дарственного санитарного надзора на различных уровнях (местном, регио-
нальном, федеральном). Совместное Постановление Главного государствен-
ного санитарного врача РФ и Главного государственного инспектора РФ по
охране природы от 10.11.97 г. определяет, что методология оценки риска
должна использоваться при проведении “государственного санитарного над-
зора и государственного экологического надзора, экологической и гигиени-
ческой экспертизы, экологического аудита, экологической и гигиенической
паспортизации, определения зон экологического бедствия и чрезвычайной
экологической ситуации, социально-гигиенического мониторинга в части
оценки воздействия окружающей среды на здоровье населения”. Все эти
виды деятельности либо прямо содержат в себе элементы управления риском
(в особенности упреждающего управления, например, в результате государ-
ственной экспертизы проектов), либо создают важнейшие предпосылки как
для указанного ранжирования приоритетов, так и для финансового и иного
обеспечения мер управления риском (в частности, после придания какой-
либо территории статуса особой зоны).
Экономический анализ управления риском. Существенным подспорьем для
выбора оптимальных “сценариев управления риском” может служить эко-
номический анализ по типу “затраты — эффективность”. Тот сценарий
(иными словами, та система мер управления), для которого прогнозируется
наибольший эффект снижения риска на единицу предстоящих затрат, обыч-
но рекомендуется как предпочтительный. Вместе с тем не меньшее значение
должно придаваться абсолютной величине ожидаемого эффекта.
Следует обратить особое внимание также на объективность и полноту
учета затрат на сопоставляемые сценарии управления. Так, при сравнении
различных подходов к снижению риска от загрязнения окружающей среды
автомобильных выхлопов довольно распространенной ошибкой является
утверждение, что полный переход на неэтилированный бензин не только
наиболее эффективен (что не подлежит сомнению), но и экономически
чрезвычайно выгоден потому, что он якобы не связан вообще с какими-либо
затратами и экономическими потерями. На самом деле проблема значитель-
но сложнее.
С большой осторожностью следует воспринимать широко используемый
на западе экономический анализ по типу “затраты — выгоды”. В этом случае
540
для прогнозирования эффективности различных сценариев управления со-
поставляют затраты на соответствующие мероприятия не просто с эффектом
снижения риска для здоровья населения, а с достигаемым снижением эко-
номических потерь, обусловленных этим риском. Прежде всего следует
подчеркнуть, что такое сопоставление может служить лишь одним из кри-
териев выбора политических и иных решений по управлению риском, но
никак не решающим, поскольку ценность здоровья и человеческой жизни
для общества не эквивалентна экономическим потерям, связанным с болез-
нью и смертью. Кроме того, оценка этих потерь западными экспертами
обычно базируется на двух параметрах, которые не могут быть прямо пере-
несены в расчеты для российских условий. Один из них — “стоимость бо-
лезни”, т.е. усредненная сумма расходов и денежных потерь, связанных с
тем или иным заболеванием. Этот параметр должен быть установлен на
основе конкретных исследований для России в целом, а лучше всего — для
каждого рассматриваемого региона. В условиях экономической нестабиль-
ности дать оценку “стоимости болезни” затруднительно. Другой параметр,
так называемый “готовность платить”, представляет собой сумму, которую
средний представитель населения психологически готов потратить на пред-
упреждение конкретного риска. Эта величина, выясняемая социологически-
ми исследованиями, пока еще не проводившимися в России, безусловно не
может быть перенесена из-за рубежа, где и социально-экономические усло-
вия, и общественный менталитет существенно отличны от российских.
Следует отметить, что в практике US ЕРА имеются случаи привлечения
значительных средств (в частности, затрат так называемого суперфонда на
очистку территорий, загрязненных производственными отходами или в ре-
зультате аварий и т.п. причин) даже тогда, когда оцененному риску для
здоровья подвергается небольшая группа жителей, т.е. при невозможности
“окупить” эти затраты какими-либо финансовыми “выгодами”, как бы они
ни рассчитывались.
Управление риском и гигиеническое нормирование. Важнейшим элементом
оперативного и долгосрочного управления риском в сфере системы государ-
ственного санитарного надзора было и остается научное обоснование, уста-
новление и, главное, контроль за соблюдением нормируемых уровней за-
грязнения окружающей среды (ПДК, ОБУВ). При условии разумной адап-
тации методологии US ЕРА к принципам и практике указанного обос-
нования (в частности, в результате включения в эту методологию принятых
в России критериев безвредности и соответствующего пересмотра американ-
ских рекомендаций в отношении переносимых доз) можно будет предупре-
дить опасность принципиальных противоречий между рекомендациями по
управлению риском, основанными на его оценке по новой для России
методике, с одной стороны, или на необходимости соблюдения действую-
щих нормативов ПДК — с другой.
Еще одна потенциальная возможность таких противоречий связана с
тем, что в отличие от унитарной системы гигиенических стандартов допус-
тимого загрязнения оценка риска в значительной мере определяется пози-
цией производящего ее эксперта, располагаемой им информацией, выбира-
емыми математическими моделями и т.д. Вместе с тем предстоит, как уже
было сказано, решить сложный вопрос о рациональной степени открытой
информации относительно неопределенностей характеристики риска, пере-
даваемой пользователю, от которого органы надзора требуют соблюдать
ПДК как вполне детерминированную величину. Учитывая особое в условиях
России значение системы государственных гигиенических стандартов за-
541
грязнения среды, не имеющей такого развития ни в одной стране мира (за
пределами СНГ), опасно подорвать к ней доверие в результате подобных
коллизий.
Вместе с тем хорошо известной, но все еще не устраненной слабостью
российской системы ПДК является то, что для одного и того же загрязни-
теля в разных компонентах окружающей среды они, как правило, обосно-
вываются независимо, чаще всего разными исследователями, нередко — на
базе не полностью совпадающих критериев безвредности. Определение пе-
реносимой дозы (“референтной дозы”) для системных токсикантов на этапе
оценки зависимости доза — ответ создает возможность расчета соответству-
ющих ей переносимых концентраций в каждом компоненте среды при том
или ином соотношении путей экспозиции. Именно с этих позиций излагает
использование методологии оценки риска один из критериев — документов
Международной программы химической безопасности [28]. Здесь рассмат-
ривается решение этой задачи с учетом не только “сценариев экспозиции”
человека, но и того, насколько надежно и при каких путях эксперименталь-
ной экспозиции определена переносимая доза (ПД), насколько сходны
эффекты, по которым она оценивалась при разных путях экспозиции. При-
ведем два примера такого подхода из числа рассмотренных в этом доку-
менте.
Пример 1. Судя по оцененной экспозиции, 50 % суммарной дозы полу-
чаемы с пищей, 20 % — с водой и 30 % — с воздухом. Имеющиеся данные
адекватны для обоснования как пероральной (ПДор), так и ингалируемой
(ПДИНГ) переносимых доз, которые основаны на сходных эффектах и лежат
в одном порядке величин. За основу расчета может быть принята любая из
них, но, учитывая, что основным путем экспозиции человека является
пероральный, принята ПДор. Таким образом, допустимые дозы, поступаю-
щие с пищей, водой и воздухом, соответственно равны 0,5 ПДор, 0,2 ПДор
и 0,3 ПДор. Эти дозы могут быть пересчитаны в соответствующие ПДК на
базе принятых норм потребления воды, воздуха и пищевых продуктов (с уче-
том состава пищевого рациона).
Пример 2. Судя по сценарию экспозиции, 70 % суммарной дозы полу-
чаемы с воздухом, 20 % — с водой, 10 % — с пищей. Вещество это присут-
ствует также в некоторых потребительских товарах, но количественная оцен-
ка связанной с этим экспозиции невозможна. Данных о концентрации его
в почве нет, но, судя по физико-химическим свойствам вещества, эти
концентрации, вероятно, низки.
Имеющиеся данные адекватны для обоснования как ПДор, так и ПДИНГ,
которые основаны на сходных эффектах и лежат в одном порядке величин.
За основу расчета может быть принята любая из них, но, учитывая, что
основным путем экспозиции человека является ингаляционный, принята
ПДИНГ. Поскольку, однако, на основе экспериментальных данных при этом
устанавливалась переносимая концентрация (RfC в нотации US ЕРА), не-
обходим пересчет ее в мг/кг/сут на основе информации об объеме дыхания,
массы тела и токсико-кинетических параметров, если они доступны. 10 %
ПД резервируются для не поддающегося оценке поступления из потреби-
тельских товаров и почвы. Остальные 90 % распределяются так: 0,63 ПДИНГ —
с воздухом, 0,18 ПДИНГ — с питьевой водой, 0,09 ПДИНГ — с пищей. Эти дозы
могут быть пересчитаны в соответствующие ПДК на базе принятых норм
потребления воды, воздуха и пищевых продуктов (с учетом состава пищевого
рациона).
542
ЛИТЕРАТУРА
1. Авалиани С.Л., Андрианова М.М., Печенникова Е.В. и др. Окружающая среда.
Оценка риска для здоровья (мировой опыт). — М.: Консультационный центр по
оценке риска. — 1996. — 158 с.
2. Кацнельсон Б.А., Привалова Л.И. Оценка риска и гигиеническая регламентация — аль-
тернативы или взаимодополняющие подходы?//Токсикол. вест. — 1996. — № 4. —
С. 5-10.
3. Кацнельсон Б.А., Привалова Л.И., Никонов Б.И. и др. Оценка риска: перспективы
и проблемы ее использования в российских условиях//Вестн. Уральской Гос.
Мед. Академии. — 1998. — Вып. 6. — С. 32—37.
4. Новиков С.М., Авалиани С.Л., Пономарева О.В. и др. — В кн.: Оценка риска для
здоровья. Глоссарий основных терминов. — М.: Консультационный центр по
оценке риска. — 1997. — 146 с.
5. Burger J. The historical basis for ecological risk assessment. — In: Preventive strategies
for living in a chemical world. A symposium in honor of Irving J. Selikoff//Am. NY
Acad. Sci. - 1997. - Vol. 837. - P. 360-371.
6. Burger J. Paradigms for ecological risk assessment. — In: Preventive strategies for living
in a chemical world. A symposium in honor of Irving J. SelikofT//Ann. NY Acad. Sci. —
1997. - Vol. 837. - P. 372-386.
7. Cothern C.R. Principles of risk assessment. — In: Seminar Publication: Risk assessment,
management and communication of drinking water contamination. — Washington:
DC — EPA Office of Water, Office of Research and Development. — 1990. —
P. 29-46.
8. Davies J.C. (ed.). Comparing environmental risks. Tools for setting government priori-
ties. — Washington: DC: Resources for the Future, Center for Risk Management,
1996. - 157 p.
9. Finkel A.M. Disconnect brain and repeat after me: “Risk assessment is too conserva-
tive. — In: Preventive strategies for living in a chemical world. A symposium in honor
of Irving J. Selikoff//Ann. NY Acad. Sci. — 1997. — Vol. 837. — P. 397—417.
10. IPCS (International Programme on Chemical Safety)/Environmental Health Criteria
170. — In: Assessing human health risks of chemicals: derivation of guidance values
for health-based exposure limits". — Geneva: WHO, 1994. — 73 p.
11. IPCS (International Programme on Chemical Safety)/Environmental Health Criteria
165. — In: Inorganic Lead. — Geneva: WHO, 1995. — 300 p.
12. Jarup L., Alfven T., Carlsson D. et al. Cadmium and tubular proteinuria//Epidemio-
logy. - 1998. - Vol. 9, N 4. - Suppl. - P. 112.
13. Krzyzanowski M. Methods for assessing the extent of exposure and effects of air
pollution//Occup. & Environm. Med. — 1997. — Vol. 54. — P. 145—151.
14. Lucier G.W. Risk assessment: good science for good decisions//Environm. Health
Persp. - 1993. - Vol. 101. - P. 366.
15. Masters G.M. Hazardous substances and risk analysis. Chapter 5: Risk assessment//In:
Introduction to Environmental Engineering and Science. — Washington, DC; US
EPA. - 1991. - P. 191-215.
16. Ochs W J. Risk assessment and cost-benefit analysis: in the public interest?//Environm.
Health Persp. - 1993. - Vol. 101. - P. 408-409.
17. Samuels Sh. W. A memoir on risk asessment and environmental policy. — In: Preventive
strategies for living in a chemical world. A symposium in honor of Irving J. Selikoff. —
Ann. NY Acad. Sci. - 1997. - Vol. 837. - P. 418-432.
543
18. US ЕРЛ/Guidelines for carcinogenic risk assessment. — Federal Register. — 1986. —
P. 3392-3409.
19. US ЕРЛ/Guidelines for the health risk assessment of chemical mixtures. — Federal
Register. - 1986. - Vol. 51. - P. 3414-3430.
20. US ЕРЛ/Guidance for superfund. Vol. 1. Human health evaluation manual. — Wash-
ington, DC: EPA Office of Emergency and Remedial Response. —1987.
21. US fPJ/Seminar Publication: Risk assessment, management and communication of
drinking water contamination. — Washington, DC — EPA Office of Water, Office of
Research and Development. — 1990. — 153 p.
22. US EPA/General quantitative risk assessment guidelines for non-cancer health effects.
Second external review draft. — Cincinnati, OH.: EPA Environmental Criteria and
Assessment Office. — 1991.
23. US ETVf/Guidelines for exposure assessment; Notice. — Federal Register. — 1992. —
Vol. 57. - P. 22888-22938.
24. US EA4/Draft report: a cross-specie scaling factor for carcinogen risk assessment based
on equivalence of mg/kg3/4/day; Notice. — Federal Register. — 1992. — Vol. 57. —
P. 24152-24173.
25. US EPA/The use of the benchmark dose approach in health risk assessment. —
Washington, DC: EPA Risk Assessment Forum. — 1995. — 70 p.
26. US fP/l/Proposed guidelines for carcinogenic risk assessment; Notice. — Federal Reg-
ister. - 1996. - Vol. 61. - P. 17960-18011.
27. US ЕРЛ/Proposed guidelines for ecological risk assessment; Notice. — Federal Regis-
ter. - 1996. - Vol. 61. - P. 47552-47631.
28. WHO, UNEP, ILO/Environmental Health Criteria 170. Assessing human health risks
of chemicals: derivation of guidance values for health-based exposure values. — Ge- -
neva: WHO, 1994.
29. Ziegler J. Health risk assessment research: the OTA report//Environm. Health Persp. —
1993. - Vol. 101. - P. 402-406.
30. US EPA/Methods for derivation of inhalation reference concentration and applica-
tion of inhalation dosimetry. — 1994.
Глава 16
ОСНОВЫ ЭКОЛОГИЧЕСКОЙ ТОКСИКОЛОГИИ
| 16.1. Предмет, цель, задачи
Термин “экологическая токсикология”, определяющий самостоятельное
научное направление, введен в 1969 г., когда при Международном научном
комитете по проблемам окружающей среды была организована специальная
комиссия по экологической токсикологии, определившая основные направ-
ления работ по экотоксикологии. В 1978 г. было принято определение
экотоксикологии в качестве “междисциплинарного научного направления, свя-
занного с токсическими эффектами химических веществ на живые организмы,
преимущественно на популяции организмов и биоценозы, входящие в состав
экосистем. Она изучает источники поступления вредных веществ в окружаю-
щую среду, их распространение в этой среде, действие на живые организмы.
Человек, несомненно, является наивысшей ступенью в ряду биологических ми-
шеней”.
Упоминание человека в качестве “биологической мишени” требует ком-
ментариев. Первоначально сфера техногенного загрязнения включала лишь
ограниченные пространства бытовой и производственной деятельности че-
ловека. Вопросы воздействия разнообразных токсичных веществ на человека
или млекопитающих длительное время оставались предметом изучения ряда
научных дисциплин медико-биологического направления: общей и частной
токсикологии, промышленной и коммунальной гигиены, гигиены питания
и др. В рамках этих направлений мы стоим на последовательной антропо-
центрической позиции и ограничиваемся изучением эффектов прямого ток-
сического влияния на человека — токсических проявлений на молекуляр-
ном, клеточно-тканевом и организменном уровнях, а широко используемые
в токсикологических исследованиях лабораторные животные рассматрива-
ются в качестве модельных объектов, с различной мерой адекватности
отражающих воздействие на человека. Направленность токсикологических
исследований на человека оправдана еще и потому, что именно ему в
условиях промышленного производства и в быту в первую очередь прихо-
дится сталкиваться с повышенными уровнями токсичных веществ.
Однако в последнее время становится очевидным, что человек как био-
логический вид и человечество как социальное явление в конечном итоге
страдают не только от непосредственного влияния токсических факторов,
но и от вызываемых ими существенных, иногда необратимых нарушений
состояния отдельных экосистем и биосферы в целом. Эти аспекты, связан-
ные с изменением качества окружающей природной среды как среды оби-
тания человека в результате ее токсического загрязнения, и являются со-
держанием экологической токсикологии.
Таким образом, экологическая токсикология изучает функционирование
и устойчивость биологических систем надорганизменного уровня в условиях
их токсического загрязнения. Последнее обстоятельство представляется нам
принципиальным.
Самостоятельность любого научного направления определяется наличи-
545
18-7127
ем трех непременных его компонент: специфического предмета исследова-
ния, совокупности применяемых методов и методик, а также поставленны-
ми задачами.
Предмет экологической токсикологии — биологические системы надорга-
низменного уровня, подверженные токсическому загрязнению. Естественно,
что теоретической основой экотоксикологии служат фундаментальные за-
кономерности структуры и функционирования природных систем популя-
ционного и биоценотического ранга, активно разрабатываемые современной
теоретической экологией. Важнейшее значение имеет общая концепция
устойчивости и стабильности экологических систем.
Своеобразие применяемых методических подходов и методик определя-
ется сочетанием методологии токсикологической науки и экологии. При
этом физиологические, функциональные, биохимические и другие наруше-
ния, вызванные действием загрязнителя на растительные и животные орга-
низмы, рассматриваются в качестве первичных токсических эффектов, вы-
зывающих нарушение популяционных и биоценотических механизмов.
Отметим, что в настоящее время мы располагаем оперативной инфор-
мацией о содержании токсичных веществ в отдельных компонентах биоты,
а также оценками физических и химических параметров среды. Выявление
значимости этих показателей для состояния изучаемых биологических сис-
тем и прогноза их будущего требует разработки специальных методических
подходов, использующих виварные исследования, эксперименты и наблю-
дения в природных биоценозах, исследование загрязненных территорий,
методы математического моделирования и экстраполяции. Эти и другие
подходы отражают своеобразие методологии экологической токсикологии
самостоятельного научного направления.
Важнейшая цель экотоксикологии, имеющая огромное прикладное зна-
чение, — разработка теоретических основ и основополагающих концепций
взаимодействия природных экосистем и производительной деятельности
человека.
Было бы неправильно ограничивать задачи экологической токсикологии
только изучением потоков техногенных веществ. Сегодня мы располагаем
данными о содержании токсикантов в отдельных компонентах биоты, од-
нако это не отражает еще прямого биологического эффекта. Оценка значи-
мости этих явлений для судьбы популяций и экосистем — важнейшая задача
экологической токсикологии. Научно обоснованное предвидение судьбы
биоценозов, подверженных влиянию токсического загрязнения, позволяет
обоснованно говорить о рациональной эксплуатации природных экосистем,
основываясь на допустимых уровнях воздействия.
Особенностью экологической токсикологии является то, что при изуче-
нии токсических эффектов на популяционном и биоценотическом уровнях
возрастает значение окружающей среды как активного фактора, влияющего
на поведение токсикантов в отдельных компонентах биоты, их фиксацию и
деструкцию в природных системах и как следствие этого определяющего
уровни поступления их в живые организмы. Последнее обстоятельство особо
важно, поскольку условия существования и функционирования природных
популяций и биоценозов могут выступать в качестве модифицирующего
фактора, усиливающего или ослабляющего прямое токсическое влияние.^
Проблема оценки прямого токсического воздействия и эффектов кос-
венных, опосредованных средой обитания — одна из центральных в совре-
менной экотоксикологической науке. Практическая невозможность прове-
дения экотоксикологических экспериментов в природных условиях остро
546
ставит необходимость экстраполяции данных лабораторных и виварных
экспериментов на условия существования природных биосистем. Подобные
подходы широко используются в гигиенической токсикологии и гигиене.
Однако отсутствие оценок вклада в экотоксикологическую реакцию прямого
и косвенного влияния токсических агентов затрудняет такую экстраполя-
цию.
Успешное применение методов экологических аналогов в определенной
степени зависит также от возможности учета прямого и модифицированного
средой эффектов. Отметим, что именно соотношение прямых и опосредо-
ванных эффектов загрязнения природной среды делает экологическое нор-
мирование процедурой, строго приуроченной к конкретным условиям того
района, для которого регламентируется токсическая нагрузка.
Всякое научное направление базируется на основополагающих достиже-
ниях смежных наук. Имеются в виду прежде всего фундаментальные зако-
номерности, установленные в общей экологии и токсикологии. Необходимо
отметить, что отечественные исследования в области экологии, охраны
природы, токсикологии и гигиены еще в 30—40-е годы были не просто на
уровне мировых, но в значительной мере определяли его. Достаточно упо-
мянуть основополагающие работы С.С.Четверикова по генетике популяций,
Г.Ф.Гаузе по экологии популяций, В.Н.Сукачева и его концепцию биогео-
ценоза, а также ведущего российского токсиколога и гигиениста Н.В.Лаза-
рева [9].
Под влиянием токсических факторов в экологических системах проявля-
ются неблагоприятные эффекты на различных уровнях организации: от моле-
кулярно-генетического до биоценотического. Наблюдаются эффекты увеличе-
ния хромосомных нарушений и мутаций, изменение ферментативной ак-
тивности отдельных систем организма, снижение репродуктивных возмож-
ностей и продолжительности жизни организмов, изменение половой и воз-
растной структур популяций, видового состава сообществ, смены домини-
рующих видов, продуктивности биоценозов в целом.
Изучение такого широкого спектра токсических проявлений возможно
лишь при комплексном подходе с участием широкого круга специалистов,
представляющих все направления биологической и медицинской наук. Этим
определяется междисциплинарный статус экологической токсикологии.
Именно поэтому сегодня экологическая токсикология формируется как
синтез двух направлений наук — токсикологии и экологии.
16.2. Надорганизменный характер зависимости
доза — эффект
Экотоксикология относится к классу токсикологических наук, в центре
которых находится изучение механизмов токсического действия и токсических
эффектов химических веществ, жизненно необходимых организмам, но посту-
пающих в избыточном количестве или полностью им чужеродным (ксенобио-
тики).
Однотипность первичных механизмов токсического действия и в ряде
случае близость изучаемых объектов (лабораторные животные и животные
из природных популяций) различных направлений токсикологии и экоток-
сикологии, а также несомненный в прикладном аспекте их нормативный
характер предопределяют и близость методологических подходов.
Казалось бы, проще всего сравнивать наличие токсических эффектов в
группах организмов, подвергшихся токсическому воздействию и интактных.
547
18*
Рис. 16.1. Токсические эффекты биоло-
гических систем молекулярного (А), кле-
точно-тканевого (Б), популяционного (В)
и биоценотического (Г) уровней. Скр],
Скр2> Скрз, Скр4 — соответствующие
пороговые значения уровня токсическо-
го фактора.
Однако широко применяемые в ток-
сикологии сравнения средних реги-
стрируемых показателей (физиологи-
ческих, функциональных, биохими-
ческих и др.) в контрольных и опыт-
ных группах организмов можно счи-
тать лишь предварительной оценкой
токсических проявлений. Необходи-
мо знать, как влияет увеличение
токсической нагрузки на функцио-
нирование и устойчивость природ-
ных популяций и биоценозов. Толь-
ко в этом случае в экологической
токсикологии можно говорить о
безопасных уровнях воздействия.
Связь между величиной токси-
ческой нагрузки и выраженностью
токсического эффекта в количест-
венной токсикологии обычно пред-
ставляется в виде зависимости до-
за — эффект, носящей градирован-
ный или альтернативный характер.
В качестве аргумента в дозовой за-
висимости чаще всего используют
содержание токсичных веществ в
объектах внешней среды или в изу-
чаемых организмах. Токсический
эффект отражает ответ биологической системы соответствующего уровня.
Поясним сказанное примером. Большинство авторов, основываясь на
высоком сродстве свинца, ртути и других тяжелых металлов к SH-группам
белковых молекул, придерживаются мнения о ведущей роли этого механиз-
ма в развитии интоксикации. Блокировка этих групп реализуется широким
спектром физиологических, биохимических и функциональных реакций от-
дельных органов и систем организма. Дозовая зависимость в координатах
“уровень токсического вещества в организме — снижение активности фер-
мента” применительно к конкретной ферментной системе имеет вид, изо-
браженный на рис. 16.1. При некоторой дозе токсиканта CKpi начинается
снижение активности соответствующих ферментных систем вплоть до пол-
ного их подавления. Естественно, что при определенном ингибировании
этих систем (достижение уровня токсического эффекта, соответствующего
Скр2) проявляется поражение отдельных клеточных структур и их функций,
наиболее чувствительных к данному виду интоксикации (см. рис. 16.1, Б).
Б.М.Штабский и соавт. отмечали, что переход количественных изменений
548
к новому качественному состоянию (альтернативный эффект) соответствует
проявлению признаков интоксикации на следующем, более высоком уровне
организации биологических систем [20]. В нашем случае градированная
зависимость на молекулярном уровне при некотором пороговом значении
Скр2 приводит к альтернативному эффекту на уровне ткани и органа. По-
ражение функции органа по мере возрастания токсической нагрузки дости-
гает следующего порогового значения Скрз, при котором возможна гибель
организма. Далее в популяции организмов существует некоторая критичес-
кая численность особей, ниже которой ее существование невозможно (см.
рис. 16.1, В). Есть основания предполагать, что этой критической ситуации
соответствует определенный процент “пораженных” особей. Градированная
зависимость «уровень токсического фактора — число “пораженных” особей»
является базой для перехода к альтернативной оценке судьбы следующего
уровня организации сообщества организмов, биоценоза (см. рис. 16.1).
Несмотря на упрощенный характер обсуждаемого примера, можно гово-
рить об общих принципах проявления токсических эффектов на различных
уровнях биологических систем, определяющих тем самым область интересов
различных направлений токсикологии и экотоксикологии, а также их мето-
дическое единство.
В реальных организмах воздействию подвержены многие системы, об-
ладающие различной толерантностью по отношению к конкретному токси-
ческому фактору. Наличие широкого спектра токсических проявлений не-
избежно расширяет диапазон действующих доз. На каждом последующем
уровне интеграции (организменном, популяционном, биоценотическом)
имеются свои специфические процессы поражения и его компенсации.
Следовательно, популяция или биоценоз как система взаимосвязанных
особей или их группировок уже в силу исходной их разнокачественности
характеризуется разнообразием ответа на любые внешние воздействия. Су-
ществует своеобразный резерв наследственно закрепленной внутривидовой
изменчивости, который проявляется, с одной стороны, в широком наборе
реакций отдельных субпопуляционных группировок на токсическое загряз-
нение среды; с другой — обусловлен наличием специфических популяцион-
ных и биоценотических механизмов компенсации неблагоприятных изме-
нений структуры и функции системы, вызванных токсическим фактором.
В связи с изложенным надорганизменный характер зависимости доза —
эффект должен учитывать следующие обстоятельства:
Количественная оценка дозы предполагает учет меры токсического
воздействия, отражающей не просто средние уровни токсических ве-
ществ в объектах внешней среды или в организмах, а специфику
популяций и биоценозов как гетерогенных объектов, элементы кото-
рых испытывают токсическое воздействие различной интенсивности.
Например, это может быть общее содержание или поток токсикантов,
подразделенный на отдельные компоненты, соответствующие струк-
туре популяции или биоценоза.
Аналогичным образом оценка эффекта должна включать некоторые
интегральные показатели состояния системы, непосредственно кон-
тролирующие стабильность ее структуры и функций. Например, по-
казатели плодовитости, занимаемой площади, выживаемости, обилия,
видового разнообразия и т.д.
При оценке токсического эффекта в биологических системах надор-
ганизменного уровня необходимо исходить из первичных проявлений
549
токсичности на молекулярном, клеточно-тканевом и организменном
уровнях.
Необходимо учитывать большую, чем для других систем, роль факто-
ров внешней среды в реализации токсических эффектов.
Несмотря на то что вводимые в экологической токсикологии показатели
меры токсического воздействия и эффекта во многом аналогичны тем,
которые применяются в гигиене (так называемые эпидемиологические под-
ходы), зависимости, отражающие, например, численность объектов, интен-
сивность процессов деструкции, продуктивность биоценозов и др., приме-
нимы лишь в экологической токсикологии. Следует еще раз подчеркнуть не
столько своеобразие изучаемых ею объектов или систем, сколько непремен-
ный надорганизменный уровень тех показателей, которыми оперирует это
направление токсикологических наук.
16.2.1. Содержание токсичных веществ в компонентах биоты —
важнейший экотоксикологический показатель меры токсической
нагрузки
Многочисленными авторами показано, что повышенное содержание
токсичных веществ во внешней среде, и прежде всего в почвах, неизменно
ведет к повышенным концентрациям этих веществ в растительных и жи-
вотных организмах. Казалось бы, дело обстоит предельно просто: достаточно
знать содержание токсичных веществ в объектах внешней среды, чтобы
прогнозировать их накопление в растительности, по содержанию в расти-
тельности — у животных-фитофагов и т.д,, определяя тем самым токсичес-
кую нагрузку на отдельные компоненты биоты.
Однако в реальных условиях множество трудно учитываемых механизмов
влияют на эти процессы. Все многообразие этих проявлений можно условно
разделить на две группы действующих факторов:
• Пространственную мозаичность и различие уровней загрязненности
территории, определяемых спецификой техногенного воздействия,
локальными почвенно-климатическими и физико-химическими усло-
виями среды.
• Особенности экологии растительных и животных сообществ, вклю-
чающие видовую и сезонную специфику пищевых рационов, разно-
качественность стаций обитания, миграционные потоки и т.д.
Влияние абиотических факторов среды. В качестве примера рассмотрим
влияние кислотности среды на накопление некоторых токсичных веществ
в биоте. Один из приоритетных загрязнителей атмосферного воздуха —
выброс сернистого газа, в результате окисления которого наблюдается сни-
жение pH дождевой воды (так называемые “кислые” дожди). Дренирование
такой дождевой воды через почвенные горизонты приводит к снижению pH
в почвенных водах и водоемах. Таким образом, конечное звено трансфор-
мации выбросов сернистого газа — водные экосистемы, в которых аккуму-
лируются загрязнения значительных территорий и уже в силу этого в наи-
большей степени проявляются токсические последствия. В результате под-
кисления вод в реках и водоемах наблюдаются эффекты, связанные не
только с прямым токсическим действием на гидробионты низких pH, но й
с опосредованным влиянием других факторов.
Из-за того что растворимые формы токсических элементов физиологи-
чески более активны, особое значение приобретают некоторые сопутствую-
550
щие абиотические факторы, включающие процессы осаждения, гидролиза
и комплексообразования, в конечном счете определяющие токсичность эле-
ментов для биоты естественных водоемов. К таким факторам относят:
• адсорбцию токсических элементов на взвешенных частицах или гид-
роксилах железа, марганца и ряда других элементов;
Цр • наличие в водоемах анионов, образующих слаборастворимые неорга-
нические соединения (сульфаты, фосфаты, карбонаты и др.), активно
сорбируемые донными отложениями;
• жесткость, соленость и pH воды водоема.
Проблемы влияния этих показателей на токсичность ряда элементов
широко обсуждаются в литературе. Однако до настоящего времени ученые
не располагают четкой и однозначной картиной этих явлений.
Так, разнообразие реакции биоты на изменение только pH воды можно
иллюстрировать данными некоторых авторов.
Показано, что возрастание pH с 0,6 до 8,0 снижает токсичность свинца
для амфипод. Для радужной форели максимальная токсичность пятиокиси
ванадия наблюдается при pH 7,7. При больших и меньших значениях этого
показателя отмечено снижение токсичности.
На том же объекте изучали влияние токсичности меди при различной
жесткости воды в диапазоне pH от 5,0 до 9,0. Влияние кислотности наиболее
существенно при высокой жесткости и при значениях pH от 6,0 до 7,0. При
меньших и больших значениях токсичность снижалась.
Аналогичным образом общее содержание токсичных веществ в почвах
не всегда адекватно отражает меру токсического воздействия на компоненты
природных популяций и биоценозы. Лишь подвижные формы химических
элементов могут переходить в растительность и далее по трофической це-
почке. По этой причине рекомендуемые в настоящее время ориентировоч-
ные допустимые концентрации некоторых тяжелых металлов и мышьяка
могут отличаться в 3—5 раз в зависимости от типа почв [17].
Отметим, что, кроме чисто химических взаимодействий, в изменении
метаболических свойств и токсичности ряда элементов может участвовать
микробиота почв и водоемов. Так, большое значение имеет комплекс бак-
терий почв и донных отложений, который в анаэробных и аэробных усло-
виях может способствовать изменению химических форм ряда токсических
элементов и изменению связанной с этим их токсичности.
Примером может служить ртуть. Мы имеем в виду интенсивные процес-
сы биологического метилирования, которые, по мнению многих авторов,
протекают наиболее интенсивно в поверхностных слоях донных отложений.
Известно, что интенсивность этих процессов пропорциональна величине pH
водной среды. В этих условиях накопление метил- и диметилртути в при-
донной фауне и планктоне, а вместе с этим и у животных следующих
трофических уровней также зависит от кислотности водоема. Это хорошо
иллюстрируют данные И.К.Степановой и В.Г.Комова [19], установивших
прямую зависимость накопления ртути в мышцах окуня в зависимости от
pH воды озер северо-запада России (рис. 16.2).
Таким образом, в реальных природных экосистемах любые загрязняющие
вещества являются источниками возникновения сложной смеси компонент,
биологическое накопление которых биотой и их токсичность не всегда можно
предвидеть.
Роль пищевых рационов. Отмеченная выше зависимость содержания и
химической формы токсичных веществ от параметров природной среды
551
Рис. 16.2. Зависимость содержания ртути в мышцах окуня от величины pH воды
водоемов [Степанова И.К., Комов В.Т., 1996].
затрудняет прямое определение меры токсического воздействия только по
степени ее загрязнения. Более приемлемой является оценка дозы по уровню
поступления токсичных веществ в компоненты биоты.
Возможны два пути поступления токсичных веществ к живым объектам
наземных биоценозов. Во-первых, это прямое поступление токсикантов
аэральным путем через устьица растений, легкие или органы, их заменяю-
щие у животных. В водных экосистемах — это прямое поступление загряз-
нителей из воды, например, за счет ее фильтрации водными организмами.
Второй путь связан с предварительным накоплением токсикантов в
почве (для растений), растительности (для животных-фитофагов), животных
(для плотоядных). Можно показать, что прямой путь поступления значи-
тельно уступает пищевому поступлению токсических соединений от почвы
к растениям и далее по пищевым цепям. Все это определяет особую роль
состава пищевых рационов в накоплении токсикантов. Следует отметить,
что в природных условиях практически невозможна такая ситуация, при
которой имеет место влияние лишь одного токсического фактора. Чаще
возникает проблема сочетанного действия нескольких токсикантов. Соглас-
но рекомендациям токсикологии, допускается аддитивность действующих
концентраций, а суммарная токсическая нагрузка определяется суммирова-
нием концентраций токсичных веществ в ЖКТ животных, отнесенных к
соответствующим концентрациям у животных с фоновых участков.
Использование содержимого ЖКТ для оценки уровня токсической на-
грузки оправдано еще и потому, что среда обитания характеризуется, как
правило, мозаичностью загрязнения. В этом случае уровень токсикантов в
552
Рис. 16.3. Содержание кадмия в печени (А) и скелете (Б) различных видов мелких
млекопитающих.
1 — лесная мышь; 11 — палевая мышь; III — серые полевки; IV — красная полевка; V — рыжая
полевка; VI — бурозубка.
рационе животных, обладающих широкой кормовой территорией, дает не-
которую интегральную оценку токсической нагрузки на популяцию.
Роль пищевых рационов в оценке токсического воздействия особенно
значима при сравнении животных различного вида, обитающих на одних и
тех же участках. У мелких млекопитающих уровни свинца в скелетах жи-
вотных различного вида отличаются в 4—5 раз. По содержанию кадмия в
печени — соответственно в 50 раз [14] (рис. 16.3). Полевки рода Microtus
(чаще всего серая или пашенная) относятся к типичным зеленоядным зверь-
кам. В условиях аврального воздействия наблюдается интенсивное поверх-
ностное загрязнение растительности, что объясняет более высокие уровни
токсикантов в их организмах по сравнению с типичными зерноядными
видами (лесная и полевая мыши). Отметим, что зерна злаковых оказываются
наименее загрязненными по сравнению с другими частями растений. Лес-
ные полевки (рыжая и красная) обладают смешанным рационом, включа-
ющим веточный корм и частично насекомых. Эти виды имеют промежуточ-
ные уровни металлов. Максимальные уровни рассмотренных металлов от-
мечены у плотоядных зверьков (бурозубки), обитающих на тех же терри-
ториях, но рацион которых включает различные виды насекомых.
Подчеркивая роль экологических факторов в формировании токсичес-
553
кой нагрузки, отметим также четко проявившуюся видоспецифичность по-
ступления токсических элементов в организмах птиц-дуплогнездников. При
совместном обитании в одном биотопе, загрязненном тяжелыми металлами,
содержание последних в рационе мухоловки-пеструшки в 1,4—3,0 раза вы-
ше, чем у большой синицы, а суммарная нагрузка, создаваемая повышен-
ными уровнями свинца, цинка, кадмия и меди в рационах, превышала
таковую на фоновых территориях для всех видов соответственно в 10 и 3,8
раза. Это обстоятельство также обусловлено экологическими особенностями
видов и определяется достаточно тонкими различиями специфики рационов
и мест сбора корма [5]. Если большая синица собирает корм в кроне деревьев
(основная часть рациона состоит из гусениц чешуекрылых), то мухоловка-
пеструшка более универсальна, состав корма ее весьма разнообразен и часто
зависит от характера биотопа. В рацион входят жесткокрылые и двукры-
лые насекомые, среди которых много вторичных консументов.
Можно привести и другие примеры, подчеркивающие роль пищевых
рационов. В этом плане особое значение имеет содержание в рационах
мохообразных растений. Биофагами являются многие виды беспозвоночных
(жуки, бабочки, клопы, клещи и т.д.). Среди позвоночных свыше 7 видов
птиц и более 70 видов млекопитающих. С экотоксикологической точки
зрения такой состав рационов обусловливает повышенное поступление в
организмы большинства тяжелых металлов, поскольку эти растения извест-
ны в качестве активных концентраторов радиоактивных и стабильных эле-
ментов. По сравнению с другими растениями уровни токсических элементов
в бриофитах выше в десятки раз и более. Этим же объясняется повышенное
поступление токсикантов в зимний период, когда эти растения составляют
значительную часть рациона животных (у леммингов, например, до 70—80 %).
Отметим, что сезонность в поступлении токсикантов с пищевыми рациона-
ми может быть обусловлена не только различием их состава, но и сезонной
динамикой содержания токсичных веществ в растительности. Финские эко-
логи показали, например, что независимо от типа леса и особенностей
ландшафта в окрестностях металлургического завода наблюдается изменение
концентрации некоторых элементов в листьях черники в течение вегетаци-
онного сезона. Осенью алюминия и ртути содержится в 2—3 раза больше,
чем весной. Несколько повышена концентрация кадмия. В случае цинка
зависимость обратная [1].
Приведем примеры для водных экосистем. Отмеченные выше биологи-
ческие процессы метилирования ртути приводят к повышенному концент-
рированию этого элемента в придонной фауне и планктоне. Доля этих
компонентов в рационах животных высших трофических уровней опреде-
ляет накопление ими ртути: крупные рыбы (судак, щука — в пресных водо-
емах; акулы, меч-рыба, тунец — в океане) характеризуются максимальными
уровнями ртути, до 90 % которой представлено метилированной формой.
Выраженная способность органической ртути накапливаться в животных
организмах в отличие от неорганической формы обусловлена ее практически
полной абсорбцией в ЖКТ. Это в полной мере относится к млекопитаю-
щим, жизнь которых и питание связаны с водными экосистемами. Было
исследовано содержание ртути во внутренних органах бобров (растительно-
ядные), енотов (всеядные) и выдр (хищники). Содержание ртути в мышцах
животных соответственно возрастало с 32 до 278 и 889 мкг/г по мере
увеличения содержания рыб и водных животных в их рационах [1].
Подобная способность различных видов животных к биологическому
концентрированию ртути в значительной мере определяется долей в их
554
рационах представителей водной фауны, богатой органическими соедине-
ниями. По данным литературы, установлена прямая корреляционная зави-
симость между загрязнением животных ртутью и уровнем этого элемента в
рыбе водоема [1].
Характерно, что видовые различия накапливаемых уровней токсических
элементов, обусловленные спецификой пищевых рационов, тем значитель-
нее, чем выше общее загрязнение природной среды. Так, при изучении
накопления свинца мелкими млекопитающими в придорожных экосистемах
показано, что при низких уровнях загрязнения территории трудно говорить
о наличии существенных видовых различий в содержании свинца в орга-
низмах зверьков. Но эти различия становятся значимыми и увеличиваются
по мере загрязнения среды обитания [2]. К подобным же выводам пришли
и мы при изучении уровней свинца у млекопитающих-фитофагов, обитаю-
щих в условиях различных геохимических провинций.
Отметим, что прямая зависимость “содержание токсикантов в рационах —
уровень накопления их в организмах животных”, рассматриваемая в каче-
стве меры токсического воздействия, не всегда очевидна. Особенность пере-
хода таких химических элементов, как цинк и медь, через стенку ЖКТ
определяется главным образом их биохимической значимостью как микро-
элементов. Хорошо известен ряд ферментных систем, которые функциони-
руют лишь в условиях достаточных количеств этих элементов во внутренних
средах организмов. Естественно поэтому, что статус цинка или меди в
организмах теплокровных эффективно поддерживается системой активного
транспортного переноса через стенку ЖКТ. Регуляторные механизмы под-
держивают состояние гомеостаза этих элементов в условиях их недостаточ-
ности и при избыточном поступлении с рационом. Поэтому, например,
несмотря на повышение содержания цинка в растительности (пяти-, деся-
тикратное), его уровень в организмах мелких млекопитающих, по данным
различных авторов, остается практически неизменным до концентраций
элемента в растительности до 200 мкг/г. По нашим данным, увеличение в
рационах полевок на загрязненных территориях содержания меди в 9 раз
практически не приводит к возрастанию уровня этого элемента в скелете и
печени животных [14].
Если предположить, что содержание химических элементов в яичной
скорлупе птиц отражает их уровень в организмах самок, то и в этом случае
отмечены различия по отношению к различным элементам. По нашим
данным, увеличение содержания свинца в рационе птиц-дуплогнездников в
загрязненной зоне по сравнению с фоновой территорией в 5,6 раза ведет к
увеличению концентрации этого элемента в скорлупе яиц лишь в 1,3 раза.
Аналогично при изменении содержания меди в корме в 6,5 раза ее концент-
рация в скорлупе возрастала лишь в двое [3].
Роль пространственной и эколого-функциональной гетерогенности природ-
ных систем. Важнейший момент, определяющий уровни накопления токсичных
элементов компонентами биоты — пространственная неоднородность терри-
тории. В реальных условиях эколого-климатические факторы проявляют
свою прерывистость во многих пространственно-временных масштабах и
формируют некоторую экологическую мозаику среды обитания природных
популяций, определяя тем самым их структуру. На эту естественную моза-
ичность природной среды накладывается неоднородность полей загрязне-
ния, вызванная неравномерностью воздушных потоков, особенностями ре-
льефа местности и другими географическими параметрами территории.
Таким образом, различия в содержании токсичных веществ в биологических
555
объектах, а значит, и те потоки загрязнителей, которые включаются в общий
круговорот вещества в биоценозах через отдельные пространственные груп-
пировки организмов, являются отражением сочетанного влияния природных
и техногенных факторов.
Сегодня принято считать, что любая популяция организмов представляет
собой совокупность микропопуляций, связанных друг с другом общностью про-
исхождения из единых популяционных стаций резервации. Поэтому интересу-
ющих нас популяционному или биоценотическому уровням биологических
систем должны соответствовать некоторые пространственно-временные
группировки изучаемых организмов. При этом характер пространственной
структуры систем популяционного ранга определяется как наивыгоднейшим
для них использованием ресурса стаций обитания в целом, так и мерой
токсического воздействия на них.
В проблеме токсической деградации территории принципиальным явля-
ется возможность пространственного перемещения биологических объектов.
Имеется в виду возможность поддержания “пораженных” популяций и
биогеоценозов за счет постоянного их пополнения растениями и животными
с более чистых или полностью незагрязненных участков. *
При этом восполнение фитоценозов ограничивается возможностью про-
странственного рассеивания семян или вегетативных побегов. Популяции
животных, как правило, пространственно более мобильны, постоянный
приток особей с чистых территорий может существенно “разбавить” насе-
ление загрязненных участков. Таким образом, мера токсического воздейст-
вия, определяемая по содержанию токсикантов в организмах животных,
может зависеть не только от прямого загрязнения участка, но и от наличия
рядом более чистых стаций обитания, откуда возможен постоянный мигра-
ционный приток животных.
Как отмечали выше, токсическая нагрузка на животных, обладающих
широкой кормовой территорией, так же как их миграционные перемещения,
в определенной мере интегрирует пространственную неоднородность токси-
ческого загрязнения среды. Однако объем и состав рационов характеризуют
не только среду обитания, но отражают энергетические потребности отдель-
ных популяций и субпопуляционных групп организмов. Последнее обстоя-
тельство часто обусловливает различие уровней токсикантов, накапливаемых
отдельными видами и внугрипопуляционными группами.
Многочисленные данные показывают возрастные особенности накопле-
ния токсичных веществ. Так, у мелких млекопитающих максимальные уров-
ни отмечены у перезимовавших, наиболее старых зверьков; меньшие уров-
ни — у половозрелых и неполовозрелых сеголеток.
Отмечают половые различия в накоплении токсичных веществ. Чаще
всего более высокие уровни отмечают у самцов. Это может быть обусловлено
необходимостью иметь более высокий энергетический потенциал в связи с
их ролью в поддержании активной иерархической структуры популяции. Эти
и другие особенности экологии самцов и самок, обитающих в природных
условиях (суточная активность зверьков, размеры индивидуальных участков,
участие в размножении и т.д.), вероятно, могут быть сведены к энергети-
ческим затратам зверьков и как следствие этого к количеству потребляемого
корма и поступающих с ним токсичных веществ.
Отметим еще раз важную закономерность, согласно которой максималь-
ная дифференциация животных (видовая, возрастная, половая) по накопле-
нию ими токсичных веществ проявляется в наибольшей степени по мере
возрастания загрязненности среды обитания.
556
Статистическое распределение концентраций токсикантов в популяционной
выборке. Приводимые выше факты свидетельствуют о том, что уровни ток-
сических элементов, накапливаемые компонентами биоты, зависят не только
от уровня техногенных выбросов (это очевидно! ), но и в значительной мере
контролируются рядом факторов внешней среды, а также важнейшими внут-
рипопуляционными процессами. Токсиканты, загрязняющие природные сис-
темы, включаются в биологический круговорот за счет жизнедеятельности
популяций растений и животных. При этом популяции, будучи системами
взаимосвязанных гетерогенных группировок особей, модифицируют эти по-
токи в соответствии с их эколого-функциональной спецификой, определяя
тем самым разнородность накапливаемых уровней токсикантов и ответные
реакции на воздействие.
Естественно, что мера токсического воздействия, рассматриваемая в
качестве дозы (в токсикологии это body burden), не может быть охаракте-
ризована некоторыми средними значениями содержания токсикантов в
биоте. Такая мера должна отражать, с одной стороны, изменчивость обмен-
ных процессов отдельных организмов, приводящих к вариабельности накап-
ливаемых ими уровней токсикантов в однородных группах, с другой —
учитывать разнокачественность по этому показателю субпопуляционных
групп.
Распределение уровней токсикантов среди организмов в выборке может
быть математически описано одним из законов статистического распреде-
ления. Проведенный нами анализ содержания токсичных веществ в тканях
или цельных организмах, составляющих, казалось бы, однородную выборку
из популяции, показал, что статистическое распределение таких концентра-
ций не симметрично (не может быть описано законом нормального распре-
деления). Наиболее адекватно такой спектр концентраций аппроксимирует-
ся логнормальным законом, при котором доля особей с высоким содержа-
нием токсикантов превышает долю с минимальным.
Такого же мнения придерживаются и другие авторы, изучавшие распре-
деление свинца, ртути, кадмия в волосах и крови жителей Японии, в
организмах жителей Крайнего Севера. В ряде случаев на большом факти-
ческом материале также показана справедливость логнормального распре-
деления токсичных веществ. В этом отношении интересны данные амери-
канских авторов, показавших, что в отличие от токсических загрязнителей
распределение физиологически необходимых микроэлементов (те же медь,
цинк и др.) более близко к нормальному (симметричному), а не логнор-
мальному. Однако в случае, когда эти же элементы поступают в организмы
в количествах, значительно превышающих необходимое, т.е. выступают в
роли токсикантов, закон распределения их концентраций в выборке транс-
формируется в логнормальный (асимметричный) [1].
В экологической токсикологии отмеченный факт асимметрии распреде-
лений концентраций загрязнителей в объектах биоты имеет особое значение.
Дело в том, что далеко не всегда при техногенном загрязнении природных
биоценозов удается отметить существенные изменения средних уровней
токсикантов в отдельных компонентах ценоза. Обычно такие изменения не
выходят за пределы установленной нормы. Нужны значительные воздейст-
вия, чтобы эти уровни достигли допустимых концентраций или превысили
их. В силу же несимметричности распределений концентраций в популяции
даже незначительные изменения средних содержаний приводят к сущест-
венному увеличению встречаемости особей с содержанием токсикантов,
превышающим критическое.
557
Поэтому в качестве меры токсического воздействия в экологической
токсикологии следует рассматривать некоторую интегральную функцию f(x),
описывающую статистическое распределение содержаний токсичных ве-
ществ в организмах, составляющих популяцию или отдельную популяцион-
ную выборку (спектр концентраций). Здесь х — содержание вещества во
внутренних средах (например, концентрации токсикантов в крови, скелете
или в цельном организме). Вводимый показатель является надорганизмен-
ной характеристикой. С одной стороны, он отражает специфику накопления
токсикантов на организменном уровне, ее обусловленность индивидуальной
генетико-функциональной изменчивостью метаболических процессов и
энергетических потребностей организмов, принадлежащих однородным
группировкам. С другой стороны, этот показатель не является простой
суммой уровней загрязненности. Изменяющиеся условия существования
природных популяций, включая токсическое загрязнение среды, прямо от-
ражаются на обилии отдельных эколого-функциональных групп (сезонных,
пространственных, половых, возрастных и т.д.). Это определяет вклад каж-
дой внутрипопуляционной группировки в общее распределение уровней
токсичных веществ в популяциях и позволяет рассматривать такие распре-
деления концентраций в качестве экотоксикологической (надорганизмен-
ной) меры токсического воздействия.
16.2.2. Реакция экологических систем на загрязнение среды
обитания как показатель экотоксикологического эффекта
Концентрация токсикантов в компонентах биоты в силу аналитической •
доступности и возможности простого количественного выражения эффекта
часто рассматривается в качестве экотоксикологического ответа на загряз-
нение природной среды. Однако судьба биологической системы в конечном
счете определяется не тем, каковы уровни ее загрязненности, а тем, на-
сколько выражены отклонения основных популяционных и биоценотичес-
ких характеристик, обусловленных токсической нагрузкой.
16.2.2.1. Экологическая токсикология систем популяционного
уровня
Несмотря на то что до настоящего времени единого понятия “популя-
ция” не существует, мы будем придерживаться того мнения, что в качестве
таковой следует рассматривать устойчивую группу особей, объединенных
территориально, имеющих единый жизненный цикл, а применительно к
организмам с перекрестным оплодотворением — единый генофонд, в какой-
то мере репродуктивно изолированную от других аналогичных группировок
и обладающую способностью к гомеостазу в изменяющихся условиях среды.
В качестве экотоксикологической реакции систем популяционного уровня
рассмотрим эффекты прямого токсического влияния и эффекты, опосредо-
ванные (модифицированные) популяционными механизмами и природной
средой.
Эффекты прямого токсического действия. Очевидно, что признаки пора-
жения, обусловленные накоплением токсикантов в организмах млекопита-
ющих и подробно рассматриваемые в рамках токсикологии, должны иметь
место не только у млекопитающих из природных популяций, но и с опре-
деленной спецификой в других объектах биоты. В наибольшей степени такие
эффекты прямого тонического влияния могут быть выделены на молеку-
558 *
лярном и клеточно-тканевом уровнях функционирования биологических
систем. Это связано с тем, что при наличии мощных эндогенных гомеоста-
тических механизмов суборганизменные показатели в наименьшей степени
подвержены влиянию изменяющихся условий обитания. Важно и то, что в
настоящее время имеются хорошо разработанные количественные методы
диагностики таких отклонений.
Одним из наиболее четких показателей прямого токсического действия
являются биохимические изменения, в наибольшей степени специфичные
к воздействию конкретных токсикантов. Из токсикологии известно, что
поступление в организмы теплокровных животных многих ксенобиотиков
стимулирует генерацию активных форм кислорода. При нарушении или
перегрузке молекулярных механизмов инактивации этих радикалов возмож-
но усиление процессов свободнорадикального окисления и накопление про-
дуктов перекисного окисления липидов. Блокировка этих процессов осу-
ществляется за счет эндогенных антиоксидантов — витаминов А и Е. На-
копление продуктов перекисного окисления липидов теплокровными в
условиях токсического загрязнения среды связано с этим истощением ре-
сурсов эндогенных протекторов. Следствием этого является нарушение
структуры биомембран и ферментных систем метаболизма ксенобиотиков,
т.е. проявление признаков интоксикации. Наиболее четко биохимические
нарушения можно диагностировать у животных, постоянно обитающих в
условиях токсического воздействия.
Показано, например, что в печени птенцов большой синицы в зонах
загрязнения интенсивность перекисного окисления липидов почти в два
раза превышает аналогичные показатели на чистых участках. Аналогичная
картина — у мухоловки-пеструшки [18]. Отмеченные уровни хорошо корре-
лируют с накоплением свинца, цинка, меди в скелете птенцов. Для этих же
видов отмечено достоверное, почти двукратное снижение уровней вита-
минов Е и А в печени птенцов на загрязненных участках. Последние
показатели также коррелируют с содержанием тяжелых металлов в орга-
низмах.
Оценивая подобные эффекты прямого токсического воздействия, необ-
ходимо иметь в виду, что обсуждаемые показатели регистрируются у орга-
низмов, обитающих в природных условиях. Это значит, что отдельные особи
с максимальным проявлением признаков интоксикации, не удовлетворяю-
щие по этой причине жестким требованиям среды обитания, могут элими-
нироваться из популяции. В отличие от лабораторных или виварных экспе-
риментов анализируемые выборки в этом случае отражают результат отбора,
обусловленного как механизмами внутрипопуляционными, так и качеством
среды обитания. В этом отношении цитируемые данные наиболее удачны
для птенцов, поскольку упомянутые факторы отбора в гнездовой период у
птиц выражены в наименьшей степени.
Имеются многочисленные сведения, полученные в том числе и на других
объектах, согласно которым возможна диагностика самых разнообразных
признаков поражения (биохимических, физиологических, функциональных
и др.), вызванных прямым токсическим влиянием. Однако в любом случае
природная среда выступает в качестве своеобразного фильтра, корректиру-
ющего эти показатели. Именно поэтому в отличие от лабораторных экспе-
риментов в природных условиях при равных с лабораторными уровнях
токсической нагрузки, определяемой по содержанию токсичных веществ в
объектах окружающей среды, часто не удается диагностировать у животных
наличие специфических прямых токсических признаков.
559
Приведем еще пример, иллюстрирующий сказанное. Известно, что боль-
шинство загрязнителей природной среды ведет к проявлению у животных
четко выраженных признаков поражения как периферической, так и ЦНС.
Нейротоксические проявления наблюдаются, как правило, при низких уров-
нях воздействия, предшествующих другим клиническим признакам. Прояв-
ляющиеся при этом определенные нейропсихические сдвиги, выраженные
в изменении скорости реакции на внешний раздражитель и поведения
животных, ведут не только к изменению зоосоциального статуса животного,
но и к неадекватной реакции зверьков на опасность. Это показано на
оленьих хомячках, когда животные, отравленные дильдрином, резко снижа-
ли реакцию на появляющуюся тень хищника. Уже поэтому такие животные
должны преимущественно элиминироваться из популяции [4].
Несмотря на очевидную в этих случаях прямую обусловленность токси-
ческих эффектов поступлением загрязнителей в организмы животных, об-
суждаемые показатели нельзя рассматривать в качестве эффектов надорга-
низменного уровня, т.е. строго говоря, эффектов экотоксикологических. Ско-
рее другое. Экотоксикологический ответ системы будет определяться не
столько выраженностью биохимических или иных отклонений, сколько ^вызы-
ваемыми ими изменениями структуры популяции за счет, например, снижения
численности наиболее чувствительных к токсикантам групп организмов.
Роль природной среды в реализации экотоксикологического эффекта.
В обсуждаемой проблеме важно, что природные популяции эволюционно не
готовы к ответу на химическое загрязнение среды. Это значит, что реакция
таких систем на токсическую нагрузку не выходит за рамки их “традицион-
ного”, типичного для систем надорганизменного уровня ответа на изменение
обычных для них природных, климатических и других условий окружающей
среды. Эта неспецифичность экотоксикологического ответа, с одной сторо-
ны, затрудняет его диагностику; с другой — позволяет предвидеть процессы,
защищающие такие системы и компенсирующие неблагоприятные влияния
химического загрязнения. Последнее обстоятельство обусловливает то, что
реакция системы надорганизменного уровня является не столько выраже-
нием прямого токсического влияния, сколько проявлением непрямых, опос-
редованных средой обитания эффектов. В качестве ответа популяции на
токсическую нагрузку можно рассматривать ряд общих популяционных ха-
рактеристик: морфологические показатели (экстерьерные и интерьерные,
органометрические индексы и т.д.), показатели продуктивности и обилия,
половозрастную структуру и пр. При несомненной значимости этих и других
показателей экотоксикологического эффекта определяющим жизнеспособ-
ность популяции являются процессы воспроизводства, позволяющие пос-
ледней поддерживать свою численность в химически загрязненной среде.
Этот важнейший популяционный процесс представляет собой несколько
последовательных стадий и этапов. При анализе состояния популяций мел-
ких млекопитающих в зонах интенсивного загрязнения среды тяжелыми
металлами отмечены: 1) оогенез, в процессе которого в яичниках самок из
первичных ооцитов формируются зрелые яйцеклетки; 2) пренатальный пе-
риод (эмбриогенез); 3) постнатальный период, включающий развитие жи-
вотных от момента рождения до полового созревания и участия в размно-
жении [5]. На каждом из выделенных этапов процесса воспроизводства
рассмотрены последовательные стадии, на которых механизмы элиминации
(атрезия фолликул, до- и постимплантационная гибель, смертность молод-
няка, участие в размножении) исключают из дальнейшего развития часть
репродуктивного материала. Предполагалось, что выраженность этих потерь
560
90
Рис. 16.4. Репродуктивная функция у рыжих полевок в процессе воспроизводства.
1 — однослойные фолликулы; 2 — двухслойные фолликулы; 3 — многослойные фолликулы;
4 — многослойные фолликулы с антрумом; 5 — желтые тела беременности (потенциальная
плодовитость); 6 — живые эмбрионы (фактическая плодовитость); 7 — смертность сеголеток;
8 — доля размножающихся самок; а — фон; б — загрязнение.
на каждой стадии в обычных условиях существования популяции и при
токсическом воздействии будет различной.
Было установлено, что максимальные потери (95 %), одинаковые на
фоновых и загрязненных участках, имеют место в процессе оогенеза. Наи-
более резистентными оказались стадии эмбриогенеза, на которых репродук-
тивные потери не превышали 20 %. Высокими потерями характеризуются и
стадии постнатального развития, достигающие на загрязненных территориях
55 % при 20 % потерях на фоновом участке (рис. 16.4).
Сравнение репродуктивных потерь показывает, что роль токсического
фактора на этапах формирования половых клеток и внутриутробного раз-
вития выражена слабо, свидетельствуя о незначительных проявлениях ток-
сического действия загрязнителей в организмах самок. Наибольшее влияние
отмечено для постнатального периода, включающего развитие особей от
рождения до момента полового созревания и участия в размножении. В этот
период проявление токсичности прямо связано с качеством среды обитания.
Среднее число желтых тел беременности, приходящихся на одну самку,
принято считать в качестве потенциально максимальной плодовитости
зверьков. Фактическую же плодовитость определяют по среднему числу
живых эмбрионов на самку. Соответственно эмбриональные потери можно
оценить как разность (в %) потенциальной и фактической плодовитостей.
Их сопоставление для фоновых и загрязненных участков показало, что
потенциальная плодовитость максимально реализуется у полевок, обитаю-
щих на нарушенных территориях.
Отметим, что подобная компенсация эмбриональных потерь в населении
рыжей полевки на загрязненных участках осуществляется за счет большей
561
доли высоко плодовитых самок. Так, на загрязненных участках самки,
имеющие 6 эмбрионов и более, составляют 76 % от общего числа размно-
жающихся самок, тогда как на фоновых территориях таких зверьков всего
56 %.
Трудно допустить, что подобная реакция может быть вызвана прямым
токсическим действием на самку или развивающиеся эмбрионы. Скорее
речь идет о некоторых популяционных процессах, компенсирующих воз-
можное токсическое поражение особей, населяющих зоны загрязнения. В
связи с этим следует обратить внимание на то, что в нашем случае наряду
с очевидным различием в концентрации токсикантов в объектах внешней
среды (в том числе и в организмах зверьков) имеет место снижение качества
и количества участков, пригодных для обитания животных данного вида.
Показано, что анализируемые участки для рыжих полевок представляют
серию техногенно измененных мест обитания и степень их деградации
закономерно снижается по мере удаления от источника токсических выбро-
сов. Прямым следствием этого является существенное снижение численнос-
ти животных, обитающих на загрязненных территориях. Усредненное по
годам наблюдений относительное обилие рыжей полевки на них изменялось
от 2,2 до 6,2 особей на 100 ловушко-суток на фоне. Это значит, что обычно
действующий в природных популяциях фактор плотности, ограничивающий
на фоновых территориях плодовитость животных, в условиях загрязнения
менее значим. Таким образом, отмеченная нами компенсация эмбриональ-
ных потерь на нарушенных территориях есть результат опосредованного
влияния качества среды обитания, в частности ее экологической емкости.
Отметим, что с момента оплодотворения яйцеклетки и на стадиях эмб-
рионального развития нельзя исключить вклада самцов, также подвержен-
ных токсическому влиянию; репродуктивные показатели самцов на загряз-
ненных территориях также характеризуются более качественными показате-
лями. С.В.Мухачева и Т.Ю.Суркова [16] определили, что индекс семенников
у размножающихся полевок (перезимовавших и прибылых) достоверно
выше и составляет в среднем 18,0 на загрязненных участках против 15,7 на
фоне. Анализ мазковых препаратов содержимого придатков позволяет гово-
рить о нормоспермии у полевок на всех участках. Однако доля патологи-
ческих форм сперматозоидов у самцов загрязненного участка достоверно
ниже и составляет 0,99 % (на фоне до 2,48 %). Достоверно выше и доля
сперматозоидов с оптимальной для оплодотворения величиной у зверьков
на загрязненной территории (90,9 против 33,1 %). Возможно, что приводи-
мые данные также свидетельствуют о наличии в условиях химического
стресса отбора более функционально защищенных животных.
Другим важным фактором компенсации репродуктивных потерь, также
зависящем от плотности населения и от наличия пригодных местообитаний,
является доля самок, вступающих в размножение. В некоторые годы этот
показатель в населении рыжей полевки на загрязненных территориях дости-
гал 100 %, на фоновой — не более 63 %.
Данные о репродуктивных потерях у птиц хорошо дополняют результаты,
полученные на млекопитающих [2, 7]. Гнездовой период у птиц является
методически более доступным, особенно для важного постнатального раз-
вития молодняка. В процессе выкармливания птенцов роль прямого токси-
ческого влияния максимальна. Отметим, что на загрязненных территориях
на выкармливание птенцов влияют два противоположно направленных фак-
тора. С одной стороны, прямое поступление токсикантов с кормом; с дру-
гой — уменьшение чи<|да вылупившихся птенцов в гнезде ведет к увеличе-
562
нию количества корма, приходящегося на каждого, что повышает эффек-
тивность выкармливания.
В качестве репродуктивных показателей у птиц-дуплогнездников на тех
же территориях рассмотрены:
• плодовитость, определяемая средним размером кладки. Наибольшее
снижение плодовитости на загрязненных участках отмечено у мухо-
ловки-пеструшки (с 6,61 на фоне до 4,43 на загрязненных участках).
У большой синицы размер кладки почти не изменялся в градиенте
токсической нагрузки;
• доля брошенных кладок. Речь идет об оставленных самками незавер-
шенными кладках. У мухоловки-пеструшки на загрязненных участках
Е этот показатель достигал 31 % при 3 % на фоновой территории. Воз-
К можно, что в основе этого эффекта лежит нарушение поведения
К размножающихся самок вследствие прямого токсического действия.
Г В то же время нельзя исключить влияния деградации фитоценозов,
v ведущей к демаскировке гнезд. Отмеченный эффект в этом случае
обусловлен средой обитания;
• успешность инкубации, определяемая долей вылупившихся птенцов
от общего количества яиц в кладке. Этот показатель также наиболее
сильно изменяется у мухоловки-пеструшки на загрязненных участках
(почти в 2 раза);
р • успешность выкармливания отражает долю птенцов, доживших до
,.г вылета из гнезда. В градиенте нагрузки этот показатель достоверно
снижается у мухоловки-пеструшки;
$ • масса птенцов перед вылетом из гнезда. Выживаемость молодняка в
о период перехода к самостоятельной жизни определяется мерой раз-
,й вития слетков, их физиологическим и функциональным состоянием
на момент вылета из гнезда. По мере увеличения токсической нагруз-
? ки средняя масса птенцов снижается. Это значит, что птенцы из
гнезда в загрязненной зоне имеют меньше шансов на выживание.
Результаты проведенного анализа этапов гнездового периода птиц пока-
зали, что наибольший вклад в общее поражение репродуктивных процессов
вносят увеличение доли брошенных и снижение объема законченных кла-
док, т.е. те этапы, которые прямо связаны с токсическим влиянием на
родительские пары и состоянием среды обитания. Ожидаемое прямое ток-
сическое влияние на потомство (успешность инкубации, выкармливание
птенцов и их состояние на момент вылета) выражено в меньшей степени.
Доказательством токсической обусловленности отклонений процесса он-
тогенеза является установленная нами корреляционная связь между массой
птенцов перед вылетом из гнезда (их энергоресурсов) с содержанием ток-
сических металлов в скелете. Коэффициент корреляции у большой синицы
достигает 0,82 для цинка, свинца и меди (рис. 16.5).
Реакцию рассмотренных популяций на токсическое загрязнение среды
не удается однозначно дифференцировать на эффекты прямого и опосре-
дованного влияния. Можно говорить лишь об этапах, на которых упомяну-
тые эффекты вероятны в большей или меньшей степени. Так, показано
преимущественное влияние состояния среды на стадиях эмбрионального
развития и постнатального выживания у мелких млекопитающих. У птиц
можно говорить о ведущей роли прямого токсического влияния на этапы
выкармливания птенцов и их выживания с момента вылета из гнезда. Вместе
563
ммяж-s-
эж /.л; i,. ,.
Рис. 16.5. Зависимость мас-
сы тела слетков большой
синицы от содержания
свинца в ее скелете.
с тем могут быть выделены этапы воспроизводства, наиболее резистентные
к влиянию токсикантов (например, стадии оогенеза у млекопитающих).
Судьба популяции. Роль миграционных процессов. Обсуждаемое выше вли-
яние токсических факторов на показатели отдельных этапов процесса вос-
производства однозначно не определяет еще судьбу популяции и ее устой-
чивое существование. Решающее значение имеет способность к поддержа-
нию численности. Наши данные позволяют провести подобные оценки.
Установлено, что среднее количество слетков на гнездо (включая брошен-
ные гнезда) у мухоловки-пеструшки в загрязненных зонах снижается в 3,4
раза, что соответствует лишь 1,5 слетка на каждую родительскую пару. Это
означает, что даже без учета возможной гибели птиц в послегнездовой
период популяция этого вида не способна ежегодно воспроизводить свою
численность на загрязненных территориях. У большой синицы, подвержен-
ной, по нашим данным, меньшей токсической нагрузке, показатель успеш-
ности гнездования снижен на тех же участках почти в два раза. Однако и в
этом случае 5,1 слетка на гнездо, вероятно, не может поддерживать числен-
ность вида на загрязненных участках, поскольку на фоновой территории для
стабильного существования популяции потребно не менее 9 слетков от
каждой размножающейся пары.
В случае мелких млекопитающих устойчивое существование популяции
также определяется тем, в какой мере ей удается компенсировать повышен-
ную элиминацию, обусловленную токсическим воздействием. При этом
определяющим является не средняя величина выводка, а доля родившихся
сеголеток, принимающих участие в размножении на тех же участках. По
нашим данным, каждая самка, дважды в течение сезона участвуя в размно-
жении, потенциально может дать на фоновой территории 2,45 прибылых
самок, из которых в год рождения размножается от 12,5 до 47,6 % особей.
На загрязненных участках на одну размножающуюся самку приходится в
среднем 0,8 прибылых, среди которых половозрелости в год рождения до-
стигают от 33,3 до 90 % особей. В этом случае даже при полном участии
самок в размножении каждая из них будет иметь в среднем в потомстве не
более 0,6 половозрелых самок, т.е. на загрязненных территориях популяция
полевок также не может поддерживать стабильную численность [5].
Таким образом, даже самые оптимистические оценки показывают, что
популяции мелких млекопитающих и птиц вряд ли могут поддерживать
564
стабильную численность в изучаемых нами условиях токсического воздей-
ствия. Между тем многолетние наблюдения свидетельствуют, что даже на
самых загрязненных участках отмечено присутствие и размножение этих
видов. Для перелетного вида мухоловки-пеструшки ежегодное возобновле-
ние населения на загрязненных участках очевидно. В случае частично осед-
лых больших синиц и относительно мало подвижных мелких млекопитаю-
щих следует допустить наличие механизмов поддержания численности. Речь
идет о миграционных перемещениях зверьков.
Многие авторы подчеркивают, что миграция животных выполняет важ-
нейшую функцию в поддержании численности популяций. При этом отме-
чают, что роль и интенсивность миграционных процессов у мелких млеко-
питающих особенно усиливается в пессимальных местообитаниях как есте-
ственного, так и антропогенного происхождения. На основе анализа кривых
вылова рыжих полевок было показано, что в градиенте токсической нагруз-
ки по мере изменения качества среды наблюдается устойчивое изменение
обилия оседлых и мигрирующих зверьков. При этом обилие оседлых особей
закономерно возрастало по мере восстановления качества среды обитания,
достигая максимума в зонах слабой токсической нагрузки и на фоне ее [13,
15]. Наиболее четко по мере увеличения токсической нагрузки возрастала
доля мигрантов в населении мелких млекопитающих.
В условиях сильно деградированных местообитаний вблизи источника
токсической эмиссии создание стабильных поселений оседлых особей за-
труднено, что свидетельствует о крайнем неблагополучии среды обитания
для данного вида и невозможности существования животных в течение
полного жизненного цикла. Население рыжей полевки в этих условиях
представлено главным образом мигрирующими особями из сопредельных
более благоприятных стаций, расположенных на больших расстояниях от
источника загрязнения.
Методами математического моделирования показано, что площадь пря-
мого токсического поражения, на которой резко снижается или полностью
исчезает население мелких млекопитающих, зависит от конкретных условий.
Если интенсивное токсическое загрязнение охватывает наиболее благопри-
ятные стации обитания, а смежные территории слабо обеспечивают воспол-
нение населения животных за счет мигрантов, то общая зона поражения
может существенно превышать территорию интенсивного загрязнения.
Возможен и обратный вариант, когда наличие обильных, не тронутых
токсическим влиянием и пригодных для обитания животных сопредельных
территорий может поддерживать их численность на достаточно высоком
уровне, ограничивая за счет миграционных перемещений зону токсического
поражения [1].
Сказанное можно иллюстрировать, рассматривая две возможные ситуа-
ции. В первой в зону прямого токсического влияния попадает большинство
стаций, благоприятных для укрытия и размножения животных. Во второй —
на той же территории стации преимущественного обитания оказываются вне
зоны интенсивного загрязнения. Можно предположить, что наряду с умень-
шением количества сохранившихся стаций обитания в первом варианте
снижается численность оседлых особей и возрастает доля мигрантов в об-
щем обилии зверьков (рис. 16.6). Согласно нашим данным, в этом случае
можно ожидать большей плодовитости размножающихся самок. Площадь
фактического поражения (см. рис. 16.6) в первом варианте превышает зону
прямого токсического загрязнения. Во втором — она меньше, так как бла-
гоприятные смежные территории за счет мигрирующих особей способны
565
Рис. 16.6. Зоны прямого токсического загрязнения (Зп) и фактического поражения
(Зф — заштриховано) при различном расположении источника выбросов.
I вариант — максимально загрязнены стации преимущественного обитания; II вариант —ста-
ции обитания зверьков сохранены. ч
Зп
II вариант
поддерживать численность населения животных на интенсивно загрязнен-
ных участках.
Таким образом, пространственная гетерогенность природных популяций
позволяет им поддерживать жизнеспособность даже в условиях интенсивного
токсического загрязнения территории. Миграционные перемещения живот-
ных при этом следует рассматривать как проявление обычных неспецифи-
ческих механизмов популяционной адаптации, обусловленных состоянием
среды обитания.
Вариабельность экотоксикологических показателей. Изменчивость морфо-
физиологических параметров организмов, входящих в состав природных
популяций, является важнейшей характеристикой, поскольку определяет
способность последних адаптироваться к условиям внешней среды. При
этом часто отмечают увеличение или снижение вариабельности этих пока-
зателей у животных в неблагоприятных условиях существования (обитание
на границе ареала, химическое загрязнение и др.). В экологической токси-
кологии важным является изменение вариабельности таких популяционных
параметров, как плодовитость, выживаемость молодняка, времени полового
созревания и т.д., связанных с процессами воспроизводства. Именно эти
показатели в большей степени определяют благополучие популяции и ее
способность к адаптации, в том числе к воздействию токсических факторов
среды.
Можно ожидать, что в условиях химического загрязнения естественная
разнокачественность животных из природных популяций реализуется раз-
личиями в их толерантности по отношению к действию токсического фак-
тора. В силу этого реакция популяции будет характеризоваться не только
различием в уровнях основных популяционных показателей, в том числе
репродуктивных, но и их вариабельностью.
Нами показано, что реакция популяции полевок, состоящей из особей
трех функционально-физиологических группировок: перезимовавших зверь-
ков, половозрелых и неполовозрелых сеголеток, на химическое загрязнение
среды определяется неодинаковой чувствительностью к токсическому фак-
тору каждой из выделенных групп [6].
Из общих соображений в градиенте токсической нагрузки (зависимость
566
Рис. 16.7. Зависимость токсического
эффекта (А) и вариабельности этого
показателя (Б) от уровня токсической
нагрузки.
доза — эффект) можно выделить
три диапазона. При низких уров-
нях загрязнения различия в чув-
ствительности этих групп зверь-
ков несущественны и реакция по-
пуляции характеризуется низким
проявлением эффектов токсич-
ности и их вариабельности. Ана-
логично при высоких уровнях на-
грузки, когда сильное поражение
всех групп животных “выравни-
вает” реакцию популяции и сво-
дит к минимуму изменчивость ре-
гистрируемых показателей ток-
сичности.
Наибольший интерес пред-
ставляет некоторый промежуточ-
ный диапазон токсических доз,
при котором разнородность попу-
ляции, выраженная различной
чувствительностью животных, реализуется в максимальной степени. Вариа-
бельность обсуждаемых признаков в этом диапазоне доз возрастает, а затем
снижается. То, в каком интервале доз мы регистрируем проявления токсич-
ности, определяет уровень изменчивости этих показателей. Сказанное ил-
люстрирует рис. 16.7, на котором представлены зависимость доза — эффект
и изменение показателей варьирования признаков токсичности (“эффект”).
В качестве показателя изменчивости признака можно рассматривать
коэффициент варьирования (CV), обладающий той особенностью, что, бу-
дучи безразмерным, позволяет сопоставить изменчивость разнородных при-
знаков и показателей. На рис. 16.8 представлен CV основных показателей
гнездового периода, определяющих репродуктивный успех у птиц-дупло-
гнездников. На фоновых участках приводимая последовательность стадий
характеризуется слабой изменчивостью в процессе воспроизводства с неко-
торым возрастанием значений этих показателей по мере перехода от размера
яиц и их количества в кладке к числу слетков на гнездо. Особо отметим,
что изменение значений CV не может быть обусловлено различием размер-
ности обсуждаемых показателей (объем яиц в 1 мм3, размер кладки в штуках
и т.д.). Нормирование этих показателей и сведение их к единой шкале
размерности не изменило характер описанных закономерностей.
Оценивая влияние токсического стресса на коэффициент вариации об-
суждаемых параметров, отметим, что, как правило, CV возрастает в изуча-
емом градиенте нагрузки. Это возрастание по показателям размера выводка
У мухоловки-пеструшки и большой синицы достигает 3-кратной величины.
Для остальных показателей (размер кладки, количество вылупившихся птен-
цов) у этих видов возрастание вариабельности на загрязненных территориях
меньше, но статистически значимо (см. рис. 16.8).
У млекопитающих на разных стадиях фолликулогенеза под влиянием
Рис. 16.8. Динамика изменчивости показателей процесса воспроизводства у мухо-
ловки-пеструшки в различных зонах токсической нагрузки.
1 — зона максимального загрязнения (импактная зона); 2 — зона частичного загрязнения (бу-
ферная); 3 — фоновая зона; А — объем яиц; Б — размер кладки; В — количество вылупившихся
птенцов; Г — количество слетков на гнездо (исключая брошенные кладки); Д — масса слетков.
токсикантов не отмечено достоверного изменения коэффициентов вариа-
ции. В то же время стадии постнатального развития у животных этого вида
(выживаемость сеголеток, участие в размножении) характеризовались зна-
чимым увеличением изменчивости анализируемых величин.
Следует отметить, что у птиц и млекопитающих на тех стадиях процесса
воспроизводства, вариабельность которых на фоновых территориях мини-
мальна, токсическое воздействие слабо влияет на величину CV. Это касается
стадий эмбриогенеза у рыжих полевок, величины яиц и массы слетков (их
энергообеспеченности) у птиц-дуплогнездников.
Таким образом, реакция репродуктивных процессов в изучаемых попу-
ляциях на загрязнение среды проявляется в изменении варьирования неко-
торых показателей. При этом возрастание или снижение CV определяется
двумя обстоятельствами: с одной стороны, диапазоном действующих токси-
ческих доз (см. рис. 16.7) до или после достижения возможной максималь-
ной изменчивости; с другой — этапом процесса воспроизводства. Имеется
в виду возрастание изменчивости показателей, характеризующих, например,
постнатальный период у млекопитающих, а также снижение этого показа-
теля по сравнению с характеристиками фолликулогенеза. Можно ожидать,
что при переходе от одной стадии к последующей влияние токсического
фактора по вариабельности характерных показателей должно оставаться
постоянным или дажс^ возрастать. Такое увеличение CV связано с тем,
568
казалось бы, очевидным фактом, что на каждой последующей стадии вли-
яние токсиканта накладывается на вариабельность предшествующих и может
усугубляться, вызывая все большую дисперсию изучаемого показателя.
Вместе с тем некоторые стадии (эмбриональное развитие у млекопита-
ющих или состояние птенцов перед вылетом из гнезда) характеризуется
повышенной стабильностью параметров, вариации которых остаются мини-
мальными даже при сильном токсическом воздействии. Можно предполо-
жить, что подобные жесткие требования к стабильности некоторых стадий
обусловлены эндогенной спецификой соответствующих этапов воспроизвод-
ства либо обеспечиваются за счет повышенного отсева особей и/или поло-
вых клеток, не отвечающих требованиям среды. Подобные “узкие” места
цикла воспроизводства можно рассматривать как проявление одного из
механизмов популяционной адаптации, когда за счет повышенной элими-
нации крайних вариант сохраняется часть популяции, способная успешно
завершить процесс воспроизводства.
Такой механизм “очищения” популяции и роль в этом процессе возрас-
тающей под влиянием токсических факторов вариабельности показателей
отдельных стадий воспроизводства можно иллюстрировать данными по раз-
мерным характеристикам яиц у птиц-дуплогнездников [3]. Если распреде-
ление объема яиц на фоновом и частично загрязненном участках у большой
синицы статистически не отличается от нормального распределения (р>0,95)
и характеризуется лишь возрастающей вариабельностью этого показателя,
то в зоне интенсивного загрязнения аналогичное распределение имеет ярко
выраженную левостороннюю асимметрию. Модельные классы распределе-
ния объемов яиц на загрязненной территории лежат в классовом интервале
1600—1700 мм3, тогда как на фоновой зоне этот интервал 1700—1800 мм3
(рис. 16.9). Важным является не просто снижение объема яиц в импактной
зоне, а то, что доля мелких яиц в популяции резко возрастает в градиенте
токсической нагрузки. Этот показатель важен, поскольку качество яиц (за-
пас их энергоресурсов) в значительной мере определяет дальнейшую судьбу
птенца, его возможности роста и развития. Трудности заключаются в выяв-
лении конкретного порога, за которым яйцо можно считать неполноцен-
ным. При изучении влияния размера яиц на рост птенцов у большой синицы
было установлено предельное значение, равное 1000 мм3 (вертикальная
черта, см. рис. 16.9, а), превышение которого должно обеспечивать после-
дующее выживание птенцов. Этот критический параметр основывается на
мнении других авторов, изучавших ооморфологические показатели большой
синицы, обитающей в пессимальных условиях
Если воспользоваться установленным критическим уровнем, то можно
оценить долю неполноценных (мелких, менее 1600 мм3) яиц. Этот показатель
закономерно возрастает у большой синицы в градиенте токсической нагрузки
от 3,0 % на фоне до 35,4 и 48,7 % в зонах частичного и сильного загрязнения
(различия достоверны, р>0,95). Анализ распределения объемов яиц других
видов (мухоловки-пеструшки, московки) показал аналогичные результаты.
Хотя нет прямых данных о связи размеров яиц с выживаемостью эмб-
рионов, статистический анализ можно продолжить, если рассмотреть рас-
пределение массы птенцов перед вылетом из гнезда. Распределение этого
показателя характеризуется у мухоловки-пеструшки на всех участках лево-
сторонней асимметрией. Однако доля птенцов с малой массой тела досто-
верно выше на загрязненных участках (см. рис. 16.9, б). Пониженная масса
тела слетков, свидетельствующая о недостатке энергоресурсов и ослаблении
организмов, может привести к гибели птенцов, порой еще в гнезде. Птенцы,
569
Рис. 16.9. Распределение объема яиц большой синицы (А) и массы слетков мухолов-
ки-пеструшки (Б) в зонах различной токсической нагрузки.
1 — зона максимального загрязнения (импактная зона); 2 — зона частичного загрязнения (бу-
ферная); 3 — фоновая зона.
достигшие возраста слетков, но не сумевшие вылететь из гнезда, у мухолов-
ки-пеструшки отмечены в интервале массы тела в 7,5—12,5 г, а у большой
синицы в интервале 12,0—15,6 г. Следовательно, такие слетки со значением
массы, приходящейся на эти интервалы, принадлежат к “группе риска” с
меньшими шансами на выживание. Доля таких слетков у мухоловки-пе-
струшки составляет в загрязненной зоне 31,3 % при 10,6 % на контрольном
участке, у большой синицы этот показатель соответственно 21,3 и 7,4 % [3].
Таким образом, проведенный анализ вариабельности отдельных этапов
воспроизводства и возможность в ряде случаев определения критических
значений, характеризующих этот процесс, позволяет представить реакцию
570 $
популяции в форме наиболее адекватно отражающей экотоксикологическую
ситуацию в виде доли “пораженных” особей [1].
Оценка экотоксикологического эффекта подоле “пораженных” или “не-
полноценных” особей носит несомненно популяционный, т.е. надорганиз-
менный характер. Пространственная и эколого-функциональная структура
природных популяций в условиях токсического загрязнения среды реализу-
ется различием уровней токсикантов, накапливаемых отдельными субпопу-
ляционными группами организмов. При отличающейся резистентности пос-
ледних к действию токсических факторов следует ожидать у них различной
доли “пораженных” организмов. Это значит, что популяция реагирует на
токсическую нагрузку как гетерогенная система, стабильность которой опре-
деляется тем, сможет ли она в результате адаптивной перестройки своей
пространственной и функциональной структуры преодолеть груз таких “не-
полноценных ” особей, обеспечивая необходимый уровень своей численности.
16.2.2.2. Биоценотический (экосистемный) уровень
экотоксикологического ответа
Под экологическими системами в широком смысле понимают совокуп-
ность совместно обитающих организмов и физических условий их сущест-
вования, взаимодействующих таким образом, что поток вещества и энергии
создает четко определенные биологические структуры. С позиций системной
иерархии экологические системы (часто в русской терминологии — биогео-
ценозы) относятся к биосистемам надорганизменного уровня, т.е. являются
объектами экологической токсикологии.
Проблема оценки состояния таких экосистем опирается на чисто инту-
итивное представление о “хорошей” и “плохой” системе. Оно носит четко
выраженный антропоцентрический характер и предполагает, что “хорошие”
экосистемы даже при значительных внешних воздействиях не имеют видимых
нарушений структуры. В связи с этим приведем определение С.С.Шварца
“хорошего” биогеоценоза, который должен отвечать следующим требованиям.
Продукция (биомасса) на всех основных трофических уровнях должна
быть высокой, превышение фитомассы над зоомассой не должно быть
резко выражено.
Высокой продукции должна соответствовать высокая продуктивность.
Это необходимо для быстрой компенсации возможных потерь биомас-
сы на отдельных трофических уровнях в результате внешнего воздей-
ствия, так как высокая продукция сама по себе не гарантирует доста-
точную компенсаторную активность биологических систем.
Разнородность трофических уровней и структура экосистемы в целом
должны способствовать высокой стабильности биоценоза в широком
диапазоне внешних условий. Динамическое равновесие биогеоценоза
должно обеспечивать состояние гомеостаза его абиотической состав-
ляющей, в том числе и гидрологического режима территории и газо-
вого состава атмосферы.
Скорость биологической самоочистки экосистемы должна быть макси-
мальной за счет большой скорости обмена вещества и энергии (обеспе-
чение биологического круговорота в течение немногих годовых циклов).
Высокая резервная активность (способность к быстрой перестройке
структуры сообществ) должна дополнять высшую степень продуктив-
ности и стабильности экосистемы, что поддерживает биогеоценоз в
оптимальном состоянии при изменении условий среды.
571
Удовлетворение этим требованиям для “хорошего” биоценоза обязатель-
но как для развития в естественной среде, так и в среде, подвергшейся
токсическому загрязнению. При этом возникает соблазн оценить “хоро-
шую” экосистему количественным путем ранжирования доступных для из-
мерения параметров. Главное в этом анализе — выбрать наиболее информа-
тивные признаки, характеризующие состояние основных компонент систе-
мы и подходы, позволяющие интегрировать эти частные информационные
параметры для получения представления о состоянии экологической систе-
мы в целом.
В экологических системах, подверженных токсическому действию, не-
благоприятные последствия могут проявляться на всех уровнях организации
биологических систем от молекулярно-генетического до ценотического. Од-
нако всегда существует ограничение в полном предсказании состояния
системы по показателям иерархически ниже расположенных уровней. Поэ-
тому для получения полного и всестороннего представления о реакции
экосистем на токсическое загрязнение среды следует учитывать показатели
всех структурно-функциональных уровней биогеоценозов. В соответствии с
этим можно выделить следующие две основные группы характеристик эко-
системного уровня. '
• Показатели, отражающие состояние экосистем на ценотическом
уровне: оценка круговорота вещества и энергии; видовое разнообра-
зие экосистем.
• Показатели популяционного уровня.
Говоря о показателях круговорота, фактически мы имеем в виду интег-
ральные характеристики, которые отражают потоки вещества и энергии
между отдельными компонентами экосистемы, а также запас и скорость их
возобновления.
В соответствии с понятием С.С.Шварца “хорошего” биогеоценоза от-
правной точкой для изучения ответа экосистемы на токсическое воздействие
может служить изучение запасов и динамики накопления органического
вещества [4]. В природных фитоценозах для этого можно оценить наземную
и подземную фитомассу, запасы мертвого органического вещества расти-
тельного происхождения, сезонный или годичный прирост древесной рас-
тительности, годичный опад. Кроме того, существуют методы, непосредст-
венно характеризующие продуктивность растительного покрова, скорость
деструкционных процессов и т.д. Собранные воедино эти показатели позво-
ляют сделать вывод о сбалансированности процессов аккумуляции вещества
и энергии с их расходом, оценить, является ли данная система по отноше-
нию к другим “донором” или “акцептором”, т.е. выполняет ли она свои
функции по отношению к природным системам большего масштаба. Это
существенно, поскольку для оценки состояния экосистемы важную роль
играет выбор пространственного масштаба рассматриваемого природного
комплекса. Иными словами, показатели состояния могут быть “плохими”
на локальном уровне, однако пространственные связи могут в определенной
мере компенсировать это отклонение на уровне природных комплексов
более крупного масштаба. Подобное явление мы отмечали выше при обсуж-
дении, например, стабилизирующей роли миграционных перемещений в
популяциях животных.
Другая группа показателей связана с биологическим разнообразием при-
родных экосистем. Согласно закону необходимого разнообразия Эшби, сис-
тема только тогда обладает высокой устойчивостью для блокировки внешних
572 I
100
90 -
80
70
60
50 -
40 -
30 -
20 -
I
1984
1986 1987 1989 1991 1993 1995
Годы
Рис. 16.10. Динамика плотности населения и видового разнообразия почвенного
населения в 3 км от Чернобыльской АЭС [Криволуцкий Д.А., 1996].
1 — численность животных; 2 — количество видов.
и внутренних возмущений, когда она имеет достаточное внутреннее разно-
образие. Поэтому показатели биологического разнообразия можно рассмат-
ривать в качестве оценки состояния экосистемы.
К числу таких показателей биологического разнообразия можно отнести
видовой состав сообществ. Вторжение человека в природные экосистемы, в
том числе их токсическое загрязнение, сопровождается исчезновением не-
которых наименее резистентных видов, а их замена более устойчивыми
видами и формами ведет к смене доминирующих видов и изменению струк-
туры сообществ.
В качестве примера приведем публикацию Д.А.Криволуцкого [11], в
которой проанализирована динамика численности населения и видового
разнообразия почвенной микрофлоры в зоне Чернобыльской АЭС. Данные
из сообщения [11] представляют собой редкий случай восстановления каче-
ства природных биогеоценозов, определяемого по показателям биологичес-
кого разнообразия. Установлено, что общая численность микроартропод
восстановилась через 2—3 года после аварии за счет глубоко живущих
мелких почвенных организмов, их биоразнообразие достигло только 50 %
от контроля в течение 5 лет, а с 1993 г. началось восстановление биоразно-
образия поверхностно обитающих видов. Количество видов во всех гори-
зонтах почвы достигает в настоящее время 75—80 % от контроля (рис. 16.10).
Хорошо известно, что климаксовые сообщества характеризуются наи-
большей сбалансированностью процессов продукции и деструкции органи-
ческого вещества. В связи с этим подчеркнем, что появление новых видов
организмов однозначно свидетельствует о сдвигах в этих процессах. Увели-
чение видового разнообразия в климаксных сообществах и тем более его
573
уменьшение не являются благоприятным для стабильности природных сис-
тем, а означают начало структурной перестройки и потери устойчивости.
Например, ряд авторов отмечают увеличение видового разнообразия мелких
млекопитающих в градиенте токсической нагрузки. Отмечено, что эти по-
казатели прямо отражают деградацию природных систем, смену стаций
обитания и связанное с этим появление новых видов при общем снижении
обилия населения животных.
Проблема видов-индикаторов. Некоторые экотоксикологические показа-
тели, характеризующие состояние природных популяций животных при
токсическом загрязнении среды обитания, рассмотрены выше. В силу тру-
доемкости таких оценок невозможно детально анализировать состояние
популяций даже ограниченного числа видов. Поэтому проблема выбора
минимального числа видов-индикаторов, оценка состояния которых может
в достаточной степени отражать состояние природных экосистем, требует
серьезного обоснования.
По С.С.Шварцу, в структуре природных биогеоценозов могут быть вы-
делены немногочисленные популяции видов-доминантов, определяющих
продуктивность биоценоза и его своеобразие [4]. Остальные популяции
представлены многочисленными видами-сателлитами, обеспечивакЛцими
необходимые условия для протекания биогеохимических циклов, характер-
ных для данного ценоза.
Опыт использования различных групп животных, растений и микроор-
ганизмов в качестве биоиндикаторов состояния экосистем показывает, что
одного универсального индикатора подобрать невозможно. Невозможно по-
добрать и универсальные критерии к отбору видов-индикаторов состояния
экосистем. Эти критерии становятся противоречивыми и не сочетающимися
в одном виде, как только задача характеристики экосистемы начинает уточ-
няться. Тем не менее можно сформулировать некоторые общие требования
к подбору рекомендуемых видов-индикаторов:
• это должны быть массовые виды, хорошо представленные в биоценозе
и смежных территориях, играющие основную роль в создании био-
ценотической среды;
• должны быть известны данные по фоновой динамике численности
вида в условиях, исключающих токсическое воздействие;
• должны быть известны данные об изменчивости основных популяци-
онных параметров вида-индикатора.
В качестве примера приведем дождевых червей — наиболее удобный
вид-индикатор состояния почв. В силу специфики экологии этого вида он
наиболее чувствителен к загрязнению почв тяжелыми металлами и радио-
активными элементами.
Успешно используется и лихеноиндикация, основанная на высокой чув-
ствительности лишайникового покрова к загрязнению атмосферы сернис-
тыми соединениями.
Наиболее рационально использование видов, отражающих состояние
компонентов природных экосистем. Выбор этот должен удовлетворять сле-
дующим требованиям:
среди видов-индикаторов должны быть продуценты, консументы, ре-
дуценты;
среди видов консументов должны быть представители основных тро-
фических звеньев,
Таким образом, выделенные виды-индикаторы должны отражать неспе-
цифические ответы экосистем на разнообразные виды токсического и иного
воздействия. Это позволяет рассматривать их состояние в качестве сочетан-
ного ответа на одновременное действие многих токсических факторов.
В силу неизбежной неполноты имеющейся информации, сложности и не-
линейности характера реакции природных экосистем на токсическое воз-
действие в настоящее время не существует сколько-нибудь надежных мето-
дов диагностики их состояния в условиях загрязнения природной среды.
Отмеченная сложность и неоднозначность диагностики состояния при-
родных экосистем не исключает необходимости введения некоторого еди-
ного подхода, позволяющего классифицировать территорию по степени
экологического неблагополучия. На современном этапе эта задача решается
в рамках Закона РФ “Об охране окружающей природной среды”, согласно
которому вводится следующая градация территории по степени ее наруше-
ния.
Участки территории РФ, где “в результате хозяйственной и иной дея-
тельности происходят устойчивые отрицательные изменения в окружающей
природной среде, угрожающие здоровью населения, состоянию естествен-
ных экологических систем, генетических фондов растений и животных”,
объявляются зонами чрезвычайной экологической ситуации (ст. 58).
Участки территории РФ, где в результате хозяйственной деятельности
“произошли глубокие необратимые изменения окружающей природной
среды, повлекшие за собой существенное ухудшение здоровья населения,
нарушение природного равновесия, разрушение экологических систем, де-
градация флоры и фауны”, являются зонами экологического бедствия (ст. 59).
Несмотря на то что здоровье человека регламентируется системой сани-
тарно-гигиенических нормативов, упоминание в тексте Закона состояния
здоровья населения оправдано, поскольку оно определяется природной сре-
дой.
В 1992 г. в порядке реализации Закона Министерство охраны окружаю-
щей среды и природных ресурсов РФ утвердило “Критерии оценки эколо-
гической обстановки территорий для выявления зон чрезвычайной эколо-
гической ситуации и зон экологического бедствия”, согласно которым пред-
полагается наличие нескольких этапов разрушения природных экосистем.
Зоны экологического риска включают в себя территории с заметным сни-
жением биологической продуктивности и устойчивости экосистем при со-
хранении возможности восстановления их естественного состояния. На та-
ких землях предполагается естественное сокращение хозяйственного их ис-
пользования и планируется их поверхностное улучшение. Доля таких час-
тично нарушенных территорий не должна превышать 5—20 % всей площади.
Отметим, что даже в норме, т.е. в стабильных экосистемах без явного
антропогенного влияния, относительная площадь нарушенных земель может
достигать 5 %. Иногда степень деградации природных экосистем может быть
определена на основании скорости антропогенного преобразования рас-
сматриваемой территории. Экосистемы можно считать стабильными, если
ежегодно преобразуется не более 0,5 % их площади. Зоны экологического
риска характеризуются скоростью преобразования в 1—2 % площади в год.
Зоны экологического кризиса (чрезвычайная экологическая ситуация)
включают территории с сильным снижением биологической продуктивности
и потерей устойчивости, трудно восстанавливаемыми нарушениями экосис-
тем, предполагающими лишь выборочное их хозяйственное использование
и требующими глубокого улучшения их состояния. Такие площади могут
575
достигать 20—50 % от всей площади экологического кризиса, а скорость
антропогенной трансформации — 2—3 % в год.
Зоны экологического бедствия (экологическая катастрофа) включают тер-
ритории с полной потерей продуктивности, практически не восстанавлива-
емыми нарушениями, полностью исключающими эти территории из хозяй-
ственного использования и требующие коренного улучшения (например,
замены почвенного покрова). Доля нарушенных земель в этом случае пре-
вышает 50 % всей площади зоны экологического бедствия. Скорость антро-
погенного преобразования в таких зонах достигает 4 % и более площади в
год.
Отметим, что приводимые оценки экологической нарушенное™ терри-
тории носят условный характер, окончательную оценку степени поражен-
ности могут дать лишь специалисты-эксперты, учитывающие все особен-
ности территории, в качестве которых могут быть рассмотрены отдельные
природные комплексы, водосборные бассейны рек, урочища и лишь в
некоторых случаях административные районы. По некоторым оценкам зоны
экологического бедствия составляют в России от 1 до 16 % всей территории.
Отметим, что вводимое ранжирование территории следует рассматривать
как вынужденный компромисс между современным состоянием Экономики
и объективными требованиями рационального природопользования.
Давая общую оценку состоянию проблем экологической токсикологии
для систем биогеоценотического ранга, отметим их недостаточную совре-
менную разработанность. Это связано с рядом объективных обстоятельств:
высокой сложностью структурно-функциональной и динамической органи-
зации экологических систем. Нелинейность их реакции на токсическое
воздействие не позволяет, как правило, количественно прогнозировать их
реакцию, эффекты поражения. Высокой изменчивостью показателей, харак-
теризующих состояние таких систем, определяемой не только случайным
характером их флюктуаций, но и самой структурой систем. Наличие у
экологических систем “памяти”: поведение системы зависит от ее истории,
так что для прогноза реакции на воздействие недостаточно знать ее состо-
яние в данный момент времени, необходимо учитывать закономерности
эволюционного процесса конкретных экосистем и соответствующих стадий
сукцессии.
Все отмеченное существенно затрудняет и делает невозможной форма-
лизацию реакции систем биоценотического уровня в виде зависимости
доза — эффект. Оценка состояния жизнеспособности, устойчивости и ре-
зервных возможностей экологических систем, подверженных токсическому
воздействию, на современном этапе возможна лишь на основе опыта и
общенаучных, в том числе интуитивных, представлений авторитетных экс-
пертов-экологов.
16.3. Проблема адаптации в экологической
токсикологии
В многочисленных дискуссиях о судьбе природных объектов в условиях
токсического загрязнения часто звучат аргументы, связанные с возможной
адаптацией биологических систем к действию токсического фактора. Дей-
ствительно, в токсикологии явление адаптации — процесса приспособления
животных организмов к неблагоприятному влиянию внешней среды — ши-
роко обсуждается и учитывается при оценке допустимых уровней воздейст-
вия. |
Если рассматривать природную популяцию организмов, то, будучи сис-
темой взаимосвязанных особей уже в силу разнокачественное™ составляю-
- щих ее отдельных пространственных и эколого-функциональных группиро-
вок, ее ответ на любые внешние воздействия будет отражать это разнооб-
разие. Даже в случае морфологически (фенотипически) однородной
• популяционной группы существует скрытый резерв (внутрипопуляционный)
генетической изменчивости, который проявляется при изменении внешней
токсической нагрузки. Этот резерв часто определяют как адаптивный по-
тенциал.
В экологической токсикологии можно говорить о двух уровнях адапта-
ции:
I» • приспособительные реакции в организмах, выраженные в разнооб-
разной коррекции определенных биохимических, физиологических и
* иных процессов, обеспечивающих их нормальное функционирование.
Наличие подобной реакции у животных и растительных объектов
широко подтверждается многочисленными данными токсикологии и
не вызывает сомнения;
• приспособительные реакции надорганизменного характера, типичные
для природных систем, подверженных длительному влиянию небла-
гоприятных факторов. Под термином “адаптация” в этом случае
подразумевается поддержание популяцией некоторого нормального
уровня ее функционирования (за счет толерантности особей, их фер-
тильности, плодовитости и т.д.). В этом случае адаптация популяции
под воздействием токсических факторов выражается в возрастании
изменчивости особей за счет “включения” скрытого резерва генети-
ческой изменчивости, разрушения генных комплексов и других гене-
тических механизмов, ведущих к появлению несбалансированных фе-
нотипов, уклоняющихся от среднего “оптимального” в изменившихся
условиях фенотипа. Все это в предположении, что значения частот и
амплитуд всех этих изменений не выходит за рамки вполне опреде-
ленных границ.
Из широкого спектра возможных явлений надорганизменного ранга мы
остановимся на эффектах, связанных с изменением эколого-генетической
структуры растительных и животных популяций.
Изложенный выше материал подтверждает, что реакция природных по-
пуляций на внешнее токсическое воздействие носит неспецифический ха-
рактер. На влияние как естественных природно-климатических факторов,
так и факторов антропогенного происхождения популяция отвечает “тради-
ционным” комплексом реакций, закрепленных в процессе эволюции.
Одним из важнейших проявлений адаптационных явлений в раститель-
ных ценопопуляциях, например, является направленное изменение их эко-
лого-генетической структуры, позволяющее растительным сообществам вы-
полнять свои биоценотические функции в изменившихся условиях среды.
Такое изменение структуры возникает в результате взаимодействия токси-
ческого фактора и исходного полиморфизма природных популяций.
В качестве примера приведем данные By и соавт. [4], изучавших луговые
сообщества полевицы, расположенные вблизи медеплавильного завода. В
качестве меры устойчивости растений к токсическому фактору был исполь-
зован так называемый “тест корневых систем”. Индекс толерантности рас-
тений определяли как отношение средней длины корней растений, культи-
вируемых в питательных растворах с добавлением определенных количеств
576
577
меди, к тому же показателю у растений, произрастающих в аналогичных
растворах без меди. Авторы изучали растения, отобранные на лугах различ-
ного возраста. Почвы около завода были загрязнены настолько, что молодая
трава, посеянная пятью годами ранее, не покрывала полностью поверхность
земли. В то же время старые луга, возрастом до 70 лет, имели хорошо
развитый покров с большим преобладанием полевицы над другими видами
растений. Установлено, что растения полевицы из незагрязненных мест
полностью не толерантны к меди. Показано, что с течением времени неук-
лонно возрастает доля растений, обладающих повышенным индексом толе-
рантности к меди. Если на загрязненных участках растения с индексом
толерантности большим 25 % полностью отсутствуют, то по мере старения
луга все большая часть растений обладает повышенной устойчивостью, и к
70 годам более половины растений характеризуется индексом толерантнос-
ти, большим 50 %. По мнению авторов, характерный разброс в реакции
такой популяции растений на загрязнение медью является проявлением
наследственной изменчивости исходно разнокачественной популяции этого
вида.
В литературе имеются данные о реакции на загрязнение популяций
животных. Мы имеем в виду, например, работу Хопкинса и Мартина [4],
которые показали, что хищные многоножки, отловленные на местах, харак-
теризующихся повышенными уровнями цинка, кадмия, свинца, меди, по-
казывают большую устойчивость к действию токсических факторов, чем
животные с чистых участков, если тех и других содержать на пищевых
рационах с повышенным количеством перечисленных металлов. Несмотря
на возможность индивидуальной адаптации животных к повышенному по-
ступлению токсикантов, приводимые данные, подобно обсуждаемым ранее
для растительных популяций, скорее всего отражают эффект адаптирован-
ное™ популяционного уровня. В силу исходной разнокачественное™ при-
родных популяций происходит своеобразное “обогащение” популяции то-
лерантными особями. Именно поэтому при экспериментальном содержании
животных на рационах с высокими уровнями токсических элементов эта
группа многоножек характеризовалась повышенной выживаемостью по
сравнению с контролем.
Приведем еще данные Л.С.Некрасовой [2]. Изучалась толерантность по
отношению к хлорофосу личинок комаров. Показано, что выборки этих
личинок из водоемов, расположенных на расстоянии 1 и 15 км от медепла-
вильного комбината, существенно отличаются по чувствительности к яду.
Разнокачественное™ этих популяций проявляется по скорости гибели ли-
чинок, помещенных в раствор хлорофоса. Нам кажется, что установленные
различия в сроках выживания двух групп животных могут свидетельствовать
о наличии некоторых адаптивных механизмов популяционного ранга, обес-
печивающих повышение общей неспецифической устойчивости популяции
к действию токсических факторов разнообразной природы. Поскольку ме-
ханизмы возникновения подобной неспецифической толерантности автором
не выявлены, можно предполагать, что имеет место простой отбор личинок
по интенсивности фильтрации ими воды, приходящейся на единицу массы
животного и определяющей тем самым уровни поступления в организмы
любых ядов. Возможно, что имеют место другие механизмы отбора. Харак-
терно лишь одно — наличие неспецифической толерантности в популяциях,
подверженных токсическому загрязнению.
В плане обсуждаемой проблемы следует остановиться на данных, иногда
встречающихся в при^дных условиях и иллюстрирующих более благопри-
578 •'
ятные показатели состояния организмов, обитающих на загрязненных тер-
риториях, по сравнению с таковыми в фоновой зоне. Так, по данным
Д.Н.Мисюры, у лягушек, обитающих в районе водоемов с промышленными
загрязнителями, отмечены более высокие показатели абсолютной массы
печени, почек, легких и жировых тел во всех возрастных группах [4].
Эти и приводимые ранее примеры (например, повышенная фактическая
плодовитость самок рыжих полевок на загрязненных участках) вряд ли
можно объяснить прямым токсическим влиянием на животных. Вероятнее
всего, мы имеем дело с описанными выше процессами дискриминации, в
результате которых из популяции элиминируются наименее приспособлен-
ные особи. В этом случае показатели относятся к выборкам сохранившихся
в популяции и более благополучных по всем показателям особям.
Приводимые факты, а также отмеченная выше повышенная изменчи-
вость некоторых показателей под влиянием токсического фактора поднима-
ют важный вопрос, является ли это многообразие форм (в цитируемых
случаях, например, спектр индексов толерантности у растений или более
высокие показатели состояния организмов на загрязненных участках) бла-
гом для популяции и выражением подлинной адаптации к токсическому
фактору. Однозначного ответа, видимо, не существует. Можно полагать, что
повышенная изменчивость признаков есть следствие начала потери популя-
цией устойчивости.
Действительно, с одной стороны, если рассматривать токсический фак-
тор в качестве постоянно действующего, то появление в популяции широ-
кого набора форм, в различной мере приспособленных к его влиянию,
видимо, обеспечивает последней большую устойчивость. В случае с полеви-
цей появление со временем на загрязненных участках хорошо развитого
растительного покрова подтверждает этот вывод. С другой стороны, увели-
чение популяционной устойчивости по отношению к токсическому фактору
неизбежно сопровождается потерей иных свойств, обеспечивающих ее при-
способленность в “обычных” природных условиях. Ведь не случайно попу-
ляции на чистых участках имеют в своем составе иные соотношения этих
же форм.
Проблема популяционной адаптации сложнейшая в экологической ток-
сикологии. Ее решение базируется на фундаментальных закономерностях
популяционной генетики.
Сегодня мы располагаем лишь немногочисленными примерами прояв-
ления таких адаптационных явлений популяционного ранга, подробный
анализ которых лишь предстоит.
16.4. Проблемы экологического нормирования
При практическом решении проблем экологической токсикологии часто
приходится исходить из признания невозможности полного предотвращения
загрязнения природной среды даже при условии совершенствования произ-
водства и перехода на так называемые безотходные технологии (принципи-
ально, безотходных технологий не существует). Поступление в природные
биоценозы токсических отходов в определенных пределах в ближайшее
время, по-видимому, неизбежно в силу чрезвычайно больших материальных
затрат, необходимых для полной очистки промышленных выбросов. Поэто-
му проблема научно обоснованного нормирования токсического воздейст-
вия в качестве прикладной задачи экологической токсикологии прямо со-
четается с экономикой.
579
Было бы неправильно считать, что вопрос регламентации антропоген-
ного влияния возник лишь в последние годы. В широком практическом
плане перед человеком всегда стояла проблема: что, где и сколько можно
позволить при взаимодействии с природой. Требовалось подобрать для зем-
леделия соответствующие культуры, соблюдать агротехнику, сроки и нормы
высева, регулировать интенсивность полива, пастбищных нагрузок и т.д.
Добавим к этому богатую практику лесоустроительства и, в частности,
использование расчетных лесосек.
Сегодня нормирование загрязняющих веществ в природных биоценозах бази-
руется на санитарно-гигиенических принципах и нормах, т.е. на приоритет-
ности защиты, прежде всего человека. Из этих принципов исходят токсикологи
и гигиенисты при установлении ПДКразличных веществ в воде, воздухе, почвах
и продуктах питания. Этот принцип ориентации на обеспечение безопасности
человека отражает наше антропоцентрическое мировоззрение и, как правило,
оправдан.
Именно поэтому повсюду в мире, где возникала необходимость регла-
ментации токсичных веществ в окружающей среде, на первый план выхо-
дили гигиенические нормативы. Это было оправдано как первичной лока-
лизацией возможных токсических проявлений, так и упомянутой социаль-
ной значимостью защиты здоровья населения.
Современная система гигиенических нормативов загрязняющих веществ
и их наиболее распространенных сочетаний в основных компонентах окру-
жающей среды (воздух, вода, почвы, продукты питания) ориентирована на
защиту от прямого токсического влияния, прежде всего систем организмен-
ного и суборганизменного уровней, и уже поэтому не может гарантировать
сохранность природной среды. Таким свидетельством недостаточности клас-
сических токсикологических подходов являются все расширяющиеся пло-
щади деградированных токсическим загрязнением наземных и водных эко-
систем, отдельные компоненты которых более чувствительны к токсическим
агентам, чем человек. Поэтому выполнение гигиенических ПДК еще не
гарантирует защиту природных комплексов (например, за счет эффектов
биотрансформации и аккумуляции токсикантов).
Приведем ряд примеров. При длительном воздействии сернистого газа
в концентрациях, не превышающих санитарно-гигиенические нормы для
воздуха, серьезно поражаются хвойные леса. Известно также, что лишайни-
ки гибнут в городской атмосфере, которая по санитарно-гигиеническим
стандартам считается допустимой для человека. В странах Западной Европы
и у нас нередки случаи использования питьевой воды, в которой могут
выжить далеко не все пресноводные организмы. При некоторых загрязне-
ниях почвы нефтью или тяжелыми металлами может сильно пострадать
почвенная мезофауна, в то время как сельскохозяйственная продукция с
этих участков может соответствовать санитарным нормам для продуктов
питания. Подобные примеры можно продолжать, но сегодня ясно, что не
все объекты природных биоценозов можно “нормировать” по регламентам
человека. Здесь требуются другие подходы, учитывающие надорганизменный
характер экологической токсикологии и ее прикладных аспектов.
При обсуждении современного состояния экологического нормирования
нужно говорить о двух подходах к проблеме.
В первом случае предполагается, что в процессе развития производитель-
ных сил общества человек возьмет на себя все регуляторные функции,
касающиеся стабильности всех биогеохимических циклов, как в локальном,
так и в региональном масштабах. Иначе говоря, подобно тому, как контро-
580 Г
лирует и регулирует сегодня человек качество среды своего обитания (про-
мышленную и коммунальную), он сможет организовать и регулировать по
своим потребностям функционирование природных биоценозов. Подход
этот представляется утопическим, отражающим современное технократичес-
кое мышление, открывающее широкие возможности для спекуляции поня-
тием “ноосфера” и упрощающих идеи В.И.Вернадского. Видимость соот-
ветствия этих подходов современным научным взглядам в сочетании с
использованиям для экологического нормирования санитарно-гигиеничес-
ких регламентов создают опасную иллюзию правомерности большинства
технических решений.
Второй подход основан на представлениях о регуляторной функции
биосферы, которая может успешно осуществляться только при сохранении
естественного состояния природных систем различного уровня. Исходным
моментом является здесь концепция о планетарной роли живого вещества,
связанная с именем В.И. Вернадского. Экологическое нормирование при
этом должно исходить из недопустимости нарушения естественного состо-
яния природных экосистем, т.е. неизменности скоростей и объемов биогео-
химических круговоротов в локальном, региональном и глобальном мас-
штабах.
Таким образом, определяющим в стратегии экологического нормирова-
ния должны быть принципы сохранности естественных природных экосис-
тем, а не замена или приспособление их к нуждам человека.
Любые подходы к экологическому нормированию исходят из понятия
допустимой нагрузки, в широком смысле под допустимым антропогенным
воздействием на природную среду следует понимать воздействие, которое
не влияет на качество природной среды или изменяет ее в допустимых
пределах, т.е. не разрушает существующие экосистемы и не вызывает не-
благоприятных последствий у важнейших популяций и, конечно, в первую
очередь у человека.
Проблемы экологического нормирования могут быть сведены к решению
двух кардинальных вопросов: что подлежит нормированию и как реализо-
вать процедуру такой регламентации. В настоящее время однозначных от-
ветов на эти вопросы нет. Д.А.Криволуцкий и соавт. [12], обсуждая вопросы
экологического нормирования при воздействии ионизирующей радиации,
определяет три возможных подхода:
• Требование сохранения устойчивости экосистемы в целом, рассмат-
ривая ее как систему взаимосвязанных подсистем. Если под устойчи-
\ востью понимать способность системы функционировать как целое,
то пределы допустимых воздействий могут оказаться неоправданно
,. широкими. Свойства биоценозов таковы, что при токсических воз-
j действиях, наносящих поражение отдельным звеньям системы, воз-
никает компенсация за счет других элементов, и ценоз продолжает
функционировать. Подобная компенсация наблюдается даже в случае
гибели отдельных видов, роль которых в ценозе берут на себя другие
, звенья. Несмотря на сохранность в этом случае биоценоза как функ-
ционирующей системы, происходящие подобные замены не всегда
можно считать допустимыми, поскольку они могут привести к неже-
лательным изменениям условий существования некоторых видов, ко-
торые, с нашей точки зрения, являются ценными или уникальными.
• Требование сохранности каждой популяции. При этом имеется в виду
. прямое токсическое воздействие на организмы, составляющие попу-
ляции, и их потомство, а также косвенное воздействие, опосредован-
581
ное через систему трофических связей. Например, воздействие на
консументы низших порядков может привести к недостаточности
кормовой базы для консументов более высокого порядка.
• Третий возможный подход к экологическому нормированию исходит
из необходимости учета диапазона естественных колебаний основных
экологических параметров, определяемого по многолетним наблюде-
ниям за функционированием отдельных звеньев или биоценоза в
целом. Граница нормы в этом случае определяется уровнем допусти-
мого риска и может быть задана волевым образом с учетом дисперсии
изменений соответствующих параметров.
Перечисленные подходы фактически постулируют несколько уровней
экологического нормирования, соответствующих надорганизменному харак-
теру экологической токсикологии.
Высший уровень экологической регламентации предполагает ограниче-
ние общей антропогенной нагрузки на элементарную ландшафтно-геогра-
фическую единицу, интегрирующую все разнообразие действующих природ-
ных и антропогенных факторов. Так, при загрязнении природной среды в
качестве такой элементарной единицы целесообразно рассматривать' эле-
ментарный водосборный бассейн 2—3-го порядка. В любом случае подоб-
ный ландшафтно-географический комплекс представляет собой совокуп-
ность отдельных биоценозов, объединенных в единую систему за счет по-
токов абиотических веществ, переноса биомассы, энергии и информации.
В силу природного разнообразия биоценозов и неравномерности нагрузки
отдельные элементы ландшафта не в равной мере подвержены действию
антропогенного пресса. Поэтому стремление в целях экологического нор-
мирования оперировать некоторыми интегральными показателями, характе-
ризующими состояние ландшафтного комплекса в качестве целостной био-
логической системы, трудно реализовать практически. В этих целях необ-
ходимо выделение некоторого числа биоценозов в силу своей метаболи-
ческой активности, в максимальной мере воспринимающих и трансформи-
рующих как потоки эндогенных веществ и энергии, так и экзогенные потоки
антропогенного происхождения.
Предварительная экспертная оценка конкретной ситуации в ландшафт-
но-географическом районе, включающая инвентаризацию источников ток-
сического воздействия и объема токсических выбросов, а также определение
качества отдельных биоценозов с точки зрения их толерантности к конкрет-
ному виду воздействия, позволяет выделить ограниченное их количество, по
отношению к которому необходима регламентация уровня воздействия. На-
пример, при загрязнении атмосферы или водной среды такими критичес-
кими звеньями могут быть экосистемы эстуариев, в максимальной степени
аккумулирующие загрязнители и испытывающие в связи с этим максималь-
ное токсическое влияние. В случае аэрального загрязнения лесных экосис-
тем сернистым газом в качестве критического биоценоза следует рассмат-
ривать хвойные леса, максимально приближенные к источникам выбросов.
Определение допустимых токсических нагрузок на конкретный биоце-
ноз, принятый в качестве критического, прямо связано с возможностью
выделения ограниченного количества интегральных показателей, характери-
зующих с максимальной полнотой перечисленные выше его свойства. При
этом важным и даже решающим условием является аппаратурная и мето-
дическая возможность оперативного контроля этих показателей. Последнее
обстоятельство вынуждает нас к введению следующего уровня регламента-
7
582
ции — нормированию нагрузки на отдельные популяции растений и живот-
ных.
Таким образом, экологическое нормирование на ландшафтно-географичес-
ком уровне может быть реализовано через обоснованный выбор ограниченного
числа биогеоценозов, подлежащих регламентации. В равной мере нормирование
нагрузки на отдельные биоценозы может быть осуществлено через регламента-
цию состояния отдельных популяций или их сообществ, отнесенных нами к
критическим звеньям соответствующих биоценозов.
Ранее мы отмечали, что требует серьезной научной проработки проблема
выбора и обоснования того минимального количества видов-индикаторов,
оценка состояния популяций которых может в достаточной степени отра-
жать состояние соответствующего биоценоза. Подобный подбор популяци-
онных индикаторов неизбежно должен учитывать целевую задачу нормиро-
вания — идет ли речь о сохранности уникальных природных комплексов
(заповедных территорий), отдельных, занесенных в Красную книгу, или
редких видов или же допустима антропогенная трансформация ландшафта
и отдельных биоценозов.
Разработка экологических нормативов возможна лишь на основе коли-
чественной оценки ограниченного числа параметров, характеризующих со-
стояние регламентируемого объекта. Это предполагает необходимость суще-
ственной формализации и упрощения реальных процессов функционирова-
ния природных популяций и их взаимоотношения с окружающими компо-
нентами биоценоза. Выделяемые показатели должны отражать неспецифи-
ческие ответы систем на разнообразные виды токсического воздействия. Это
позволит рассматривать их в качестве показателей сочетанного действия
многих одновременно действующих токсических факторов и оценить их
влияние интегральными показателями.
В заключение отметим, что в силу неизбежной неполноты имеющейся
информации, сложности и нелинейного характера динамики природных
экосистем, с одной стороны, и насущной необходимости скорейшего внед-
рения системы экологического нормирования — с другой, разработка эко-
логических регламентов, приуроченных к конкретной ситуации на совре-
менном этапе, возможна лишь на основе опыта тщательно отобранной
группы экспертов. В связи с этим сошлемся на Итоговый документ Берген-
ской конференции ООН по окружающей среде, в которой отмечается, что
“лучше, если мы окажемся более или менее правы в нужный момент,
нежели абсолютно правы слишком поздно” [10].
Мы сознательно акцентируем внимание на проблемах экологического
нормирования, рассматривая его как некоторый антипод санитарно-гигие-
ническому. Однако практическая реализация этих двух систем нормирова-
ния должна быть построена не только на разграничении их функций (раз-
личие объектов нормирования, надорганизменный и организменный ранг
токсических эффектов и т.д.), но и, что особенно важно с практической
точки зрения, на принципах взаимной увязки экологических и гигиеничес-
ких регламентов.
Следует указать еще одну причину необходимости такой интеграции. Как
только экологическая токсикология сочтет разрабатываемую ею методоло-
гию нормирования достаточной для того, чтобы от дискуссии по тем или
иным нормативам перейти к передаче их государственным органам в каче-
стве стандартов, то наличие, скажем, для одного и того же загрязнителя в
одной и той же точке пространства двух ПДК (одна из которых удовлетво-
ряла бы санитарный надзор, но не удовлетворяла бы природоохранные
583
органы) создает ситуацию, совершенно нелепую с позиций как государст-
венных органов, так и субъектов хозяйственной деятельности. Таким обра-
зом, интеграция здесь совершенно необходима не только с теоретических,
но и сугубо практических позиций. По-видимому, только единая система
экологического и санитарного нормирования в состоянии сегодня обеспе-
чить благополучие человека и природной среды от все возрастающего пресса
промышленности и сельского хозяйства.
В последнее время резко возросло количество публикаций, посвященных
описанию последствий токсического загрязнения конкретных районов или
даже регионов. Расширяется сегодня и круг экспериментальных исследова-
ний. Работы, выполненные в лабораторных или виварных условиях с под-
держанием постоянства основных параметров среды и уровней токсического
воздействия, позволяют получить ценную информацию. Это касается преж-
де всего исследования механизмов токсического действия на природные
биологические объекты и оценок действующих уровней загрязнителей. Кро-
ме того, в научных публикациях активно обсуждаются общие концептуаль-
ные подходы к оценке допустимого токсического воздействия на природную
среду. Вводятся понятия экологического резерва, критического состояния
экосистем, допустимых экологических нагрузок и т.д. При всей значимости
этих работ вводимые понятия часто не имеют количественного выражения
для конкретных ситуаций.
Таким образом, по крайней мере три активно разрабатываемых направ-
ления: 1) полевые исследования конкретных территорий, подверженных
токсическому влиянию; 2) экспериментальное изучение механизмов токсич-
ности; 3) теоретические разработки концепций устойчивости природных
систем сегодня представляют то направление, которое понимается нами в
качестве экологической токсикологии.
Трудности становления экологической токсикологии в качестве самосто-
ятельного направления связаны с отсутствием достаточно строгой теорети-
ческой основы, объединяющей накапливаемый полевой и эксперименталь-
ный материал и объясняющий его. Неоднозначность исходных данных,
получаемых в различных природных условиях и при различных воздействи-
ях, отсутствие объяснимой связи между натурными наблюдениями и экспе-
риментом, оторванность теоретических положений от конкретного их при-
ложения к решению практических задач — все это признаки новизны науч-
ного направления, его первых шагов.
Трудности эти объективны и связаны прежде всего с тем, что биологи-
ческие системы надорганизменного ранга представляют собой сообщества
многих взаимосвязанных и взаимообусловленных компонент, от почвенных
микробных сообществ до популяций крупных животных и высших растений.
Естественно, что описание реакции такой сложной системы на токсическое
воздействие, выраженное в форме аналогов зависимости доза — эффект —
необходимого элемента экологической токсикологии, требует знаний о
функционировании таких систем, причем в достаточно строгом количест-
венном виде.
Сегодня биогеоценология не располагает сколько-нибудь серьезной
обобщающей теорией функционирования природных экосистем, когда пара-
метры среды не выходят за рамки многолетних фоновых значений. Послед-
нее обстоятельство важно. Ведь стоит вопрос, можно ли говорить о теории
и практической реализации основных рекомендаций экологической токси-
кологии, если мы не располагаем достаточными сведениями о функциони-
ровании “в норме” большого количества компонент и биоценоза в целом.
584 |
Современное состояние природной среды часто не оставляет нам воз-
можности на промедление в принятии кардинальных решений по ее сохра-
нению. В этой ситуации мы должны рассчитывать на практический опыт и
методические подходы токсикологии. Сегодня очевидна та исключительная
роль, которую играют методология, общие теоретические подходы и идеи
токсикологии в становлении и формировании экологической тбксикологии.
Следует подчеркнуть их взаимное обогащение. Анализ состояния природных
популяций животных, прежде всего млекопитающих, выполняемых в рамках
экологических исследований, представляет несомненный интерес для гиги-
енистов. Ведь длительное существование природных популяций животных,
обладающих коротким жизненным циклом, в зонах высоких токсических
нагрузок представляет собой экспериментальную модель длительного ток-
сического воздействия на человека. Более того, общая концепция токсико-
логии биологических систем надорганизменного уровня фактически соот-
ветствует эпидемиологическому подходу современной гигиены. В обоих
случаях речь идет о некоторых интегральных оценках, в центре которых
находится судьба не отдельной особи, а благополучие и сохранность в чреде
поколений популяций, сообществ, биогеоценозов и биосферы в целом, а с
ней и человечества.
Таким образом, в современных условиях обеспечение сохранности при-
родных экосистем и благополучия человека возможно лишь на пути полной
взаимной интеграции этих двух направлений токсикологической науки.
ЛИТЕРАТУРА
1. Безель В.С. Популяционная экотоксикология млекопитающих. — М.: Наука,
1987. - 129 с.
2. Безель В. С., Бельский Е.А. Репродуктивные показатели птиц-дуплогнездников в
условиях техногенного загрязнения среды обитания. — В кн.: Докл. РАН. —
1994. - Т. 338, № 4. - С. 555-557.
3. Безель В.С., Бельский Е.А., Мухачева С.В. К проблеме вариабельности показате-
лей воспроизводства в популяциях животных при токсическом загрязнении
среды обитания//Экология. — 1998. — № 3. — С. 217—223.
4. Безель В.С., Большаков В.Н, Воробейчик ЕЛ Популяционная экотоксикология. —
М.: Наука, 1994. — 80 с.
5. Безель В. С., Мухачева С.В. Характер репродуктивных потерь в популяциях рыжих
полевок при токсическом загрязнении среды обитания. — В кн.: Докл. РАН. —
1995. - Т. 345, № 1. - С. 135-136.
6. Безель В.С., Оленев Г.В. Внутрипопуляционная структура грызунов в условиях
техногенного загрязнения среды обитания//Экология. — 1989. — № 3. — С. 40—
45.
7. Бельский Е.А., Безель В.С., Ляхов А. Г. Ранние стадии гнездового периода птиц-
дуплогнездников в условиях техногенного загрязнения среды//Экология. —
1995. — № 2.-С. 146-152.
8. Бельский Е.А., Безель В.С., Поленц Э.А. Ранние стадии гнездового периода птиц-
дуплогнездников в условиях техногенного загрязнения//Экология. — 1995. —
№ 1. - С. 46-52.
9. Кацнельсон Б.А., Безель В.С. Геогигиенические идеи Н.В.Лазарева и современные
проблемы взаимодействия человека и биосферы//Токсикол. вест. — 1995. —
№ 5. — С. 14-17.
сос
10. Коптюг В.А. Конференция ООН по окружающей среде и развитию. — Новоси-
бирск, 1992. — 62 с.
11. Криволуцкий Д.А. Динамика биоразнообразия и экосистем в условиях радиоак-
тивного загрязнения. — В кн.: Докл. РАН. — 1996. — Т. 347, № 4. — С. 567—569.
12. Криволуцкий Д.А., Федоров Е.А., Смирнов Е.Г. и др. Экологическое нормирование
в радиоэкологии. — В кн.: Общие проблемы биогеоценологии. — М.: Наука,
1990.-С. 187-210.
13. Лукьянов О.А., Лукьянова Л.Е. Реакция сообществ и популяций мелких млеко-
питающих на техногенное воздействие//Успехи соврем, биол. — 1998. — Т. 118.—
Вып. 5. - С. 613-622.
14. Мухачева С. В., Безель В.С. Уровни токсических элементов и функциональная
структура популяций мелких млекопитающих в условиях техногенного загряз-
нения//Экология. — 1995. — № 3. — С. 237—240.
15. Мухачева С.В., Лукьянов О.А. Миграционная подвижность населения рыжей
полевки в градиенте техногенных факторов//Экология. — 1997. — № 1. —
С. 34-39.
16. Мухачева С.В., Суркова ТВ. Процессы воспроизводства в популяций рыжей
полевки в условиях техногенного загрязнения. — В кн.: Механизмы поддержа-
ния биологического разнообразия. Материалы конф. — Екатеринбург: УрО
РАН, 1995. - С. 112-113.
17. Ориентировочные допустимые концентрации тяжелых металлов и мышьяка в
почвах//Токсикол. вест. — 1995. — № 2. — С. 38.
18. Степанова З.Л., Лемешева С.А. Влияние техногенного загрязнения на содержа-
ние витаминов А и Е и перекисного окисления липидов в печени мухоловки-
пеструшки//Экология. — 1993. — № 6. — С. Т1—Т).
19. Степанова И.К, Комов В Т. Ртуть в абиотических и биотических компонентах
озер Северо-Запада России//Экология. — 1996. — № 3. — С. 198—203.
20. Штабский Б.М., Каган Ю.С., Кацнельсон Б.А. Определение безвредных уровней
воздействия химических веществ как диагностическая задача гигиены//Гиг. и
сан. - 1983. - № 11. - С. 74-76.
Глава 17
ОБЩИЕ ПРИНЦИПЫ ДИАГНОСТИКИ
И ЛЕЧЕНИЯ ОСТРЫХ ОТРАВЛЕНИЙ
17.1. Распространенность острых отравлений
и их причины
Острые отравления химической этиологии составляют в настоящее время
около 20 % так называемых экологических болезней, связанных с воздейст-
вием вредных факторов окружающей среды —физических (травматические
болезни), биологических (инфекционные болезни), химических (отравле-
ния). Они составляют вторую после сердечно-сосудистых заболеваний при-
чину смертности населения в большинстве развитых стран мира. Широкая
распространенность острых отравлений вызвана производством около 10 млн
применяемых различных химических препаратов ксенобиотиков, которые
используются в промышленности, сельском хозяйстве и быту. В европей-
ских странах по поводу острых отравлений ежегодно госпитализируется
примерно 2—3 человека на 1000 жителей. По данным ВОЗ, в 1990 г. было
зарегистрировано 187 000 смертельных отравлений, причем 17,5 % у детей.
В России в последние годы распространенность острых отравлений, судя по
обращаемости на станции скорой медицинской помощи, составила в сред-
нем 5—7 человек на 1000 жителей, т.е. около 1 млн в год, из них более
55 000 ежегодно погибает. По данным центров лечения острых отравлений,
работавших в крупных городах России с населением свыше миллиона че-
ловек, наиболее частыми видами отравлений являются отравления лекарст-
вами, преимущественно психотропного действия (более 50 % всех госпита-
лизированных больных); алкогольные интоксикации (около 15 %), отравления
наркотиками опиоидного ряда (более 10 %), отравления щелочами, кислотами,
в основном уксусной кислотой (около 10 %), в остальном это отравления
различными инсектицидами (около 5 %), техническими жидкостями, расти-
тельными и животными ядами и др., всего около 120 наименований.
Среди смертельных отравлений на первом месте находятся отравления
алкоголем и его суррогатами (более 60 % всех случаев), которые отмечаются
в основном на догоспитальном этапе, затем отравления лекарствами и
наркотиками (около 15 %), отравления угарным газом (10 %), прижигающи-
ми жидкостями (5 %) и другими токсичными веществами. Средняя леталь-
ность в токсикологических отделениях составляет около 5 %.
Причины острых отравлений делятся на две основные категории: слу-
чайные (около 60 %) и преднамеренные. Среди случайных отравлений ос-
новное место занимают алкогольные интоксикации, наркомания и токси-
комания, самолечение различными лекарствами, ятрогенные лекарственные
и грибные отравления, а так же экстремальные химические воздействия при
авариях на производстве, пожарах, транспортных катастрофах. Основную
массу преднамеренных отравлений составляют суицидальные (90 %), пре-
имущественно с использованием психотропных лекарств и уксусной эссен-
ции, а также криминальные.
587
17.2. Клиническая картина и диагностика
острых отравлений
Развитие острых отравлений проявляется определенной клинической симп-
томатикой, содержание которой зависит от стадии заболевания и избира-
тельной токсичности ядов. В токсикогенной стадии (фазе) отравлений, про-
текающей в присутствии токсической концентрации ядов в крови, в первую
очередь обращают на себя внимание специфические симптомы заболевания,
зависящие от вида и функциональной роли определенных рецепторов ток-
сичности, с которыми взаимодействует токсичное вещество. Например, при
отравлениях ФОС обнаруживается их антихолинэстеразный эффект в виде
мускарино- и никотиноподобной симптоматики, связанной с возбуждением
М- и Н-холинорецепторов (потливость, саливация, бронхоспазм, миоз, ги-
перкинезы хронического и миоклонического типа), курареподобной симп-
томатики (периферические парезы), интоксикационных психозов. Кроме
того, в этой фазе при тяжелых отравлениях обычно развиваются соматоген-
ные синдромы: токсический шок, кома, острая дыхательная недостаточ-
ность, лишенные строгой специфичности. Для соматогенной фазы' насту-
пающей после очищения организма от ядов, характерно появление синдро-
мов, связанных с развившимся токсическим поражением определенных
органов или систем: вторичный иммунодефицит, острая почечная или пе-
ченочная недостаточность, энцефалопатия, пневмония и пр.
Диагностика острых отравлений состоит из трех основных видов диагнос-
тических мероприятий: клиническая, лабораторная и патоморфологическая.
Клиническая диагностика основана на данных анамнеза и изучении
клинической картины заболевания с применением инструментальных мето-
дов обследования больного (электроэнцефало-, электрокардиография, эндо-
скопия и пр.).
При экзогенных отравлениях большое значение имеет выявление симп-
томов, характерных для воздействия на организм определенных токсичных
веществ по принципу их “избирательной токсичности”. Например, при
выраженных нарушениях сознания (оглушение, кома, психомоторное воз-
буждение) скорее всего можно заподозрить острое отравление психотроп-
ными препаратами (алкоголь, наркотики, нейролептики, транквилизаторы
и др.).
Лабораторная токсикологическая диагностика является определяющей для
установления этиологического фактора любого отравления и имеет три основ-
ных направления:
Специфические токсикологические исследования для экстренного об-
наружения токсичных веществ в биологических средах организма
(кровь, моча, ликвор и пр.) в качественном и количественном отно-
шении с помощью различных инструментальных экспресс-методов:
тонкослойная и газожидкостная хроматографии, спектрофотометрия
и пр. Для клинических целей необходимо достаточно быстрое выпол-
нение лабораторного анализа (около 1 ч), для чего требуется первич-
ный клинический диагноз отравления, обусловливающий заказ на
обнаружение определенного вида токсичного вещества (например,
спирт этиловый, фенотиазины, барбитураты и пр.). С клинической
точки зрения большое значение имеет определение зависимости на-
блюдаемых нарушений гомеостаза от уровня концентрации токсичных
веществ в кровг^(“клиническая токсикометрия”), что позволяет пред-
588 4
ставить токсикодинамическую картину отравлений как отражение
сложного взаимодействия ядов с организмом.
Специфические биохимические исследования с целью определения
характерных для данного отравления изменений биохимического со-
става крови. Например, резкое снижение активности холинэстераз
крови бывает только при отравлении ФОС, метгемоглобинемия — при
отравлениях нитритами, карбоксигемоглобинемия — при отравлении
угарным газом и пр.
Неспецифическая биохимическая диагностика имеет вспомогательное
значение для определения степени поражения функции паренхима-
тозных органов — печени и почек (определение в крови креатинина
и его клиренса, мочевины, остаточного азота, электролитов, билиру-
бина, активности внутриклеточных ферментов трансаминаз и пр.).
Прогностические критерии отравлений обычно связаны с данными кли-
нической токсикометрии, по которым выделяются три основных уровня
взаимодействия ядов с организмом: при пороговой концентрации токсич-
ного вещества в крови появляется начальная клиническая симптоматика
заболевания с благоприятным прогнозом, при критической — развивается
неотложное состояние, требующее проведения экстренных лечебных меро-
приятий, от которых во многом зависит исход, при смертельной наблюда-
ется крайнее истощение компенсаторных возможностей организма, опреде-
ляющее обычно неблагоприятный прогноз с учетом различной индивиду-
альной резистентности к яду.
17.3. Лечение острых отравлений
Естественная детоксикация токсичных веществ в организме обеспечива-
ется кооперативной функцией нескольких систем обезвреживания, ксенобио-
тиков, включающих иммунную систему крови (белки и форменные элементы),
детоксикационную систему печени (в основном микросомальную, с участием
ферментов Р-450 и пр.) и систему экскреторных органов (ЖКТ, легкие, почки).
Иммунная система осуществляет детоксикацию крупномолекулярных соеди-
нений типа биополимеров путем специфической их фиксации с участием
иммуноглобулинов по типу реакций антиген — антитело. Кроме того, белки
и форменные элементы крови создают временное депонирование (фикса-
цию) многих токсичных веществ, обладающих способностью связывания с
ними, и тем самым защищают рецепторы токсичности, т.е. избирательные
точки приложения их токсического действия.
Детоксикационная система печени производит биотрансформацию (ме-
таболическое превращение) в основном среднемолекулярных ксенобиотиков
с гидрофобными свойствами путем включения их в окислительные, восста-
новительные, гидролитические и другие реакции, катализируемые соответ-
ствующими форменными системами с последующей конъюгацией, т.е. со-
единением с эндогенными веществами (например, с глюкуроновой и серной
кислотами или химическими группировками — метильными, ацетильными
и др.). В процессе метаболизма и конъюгации обычно достигается увеличе-
ние липофильности и молекулярной массы токсичных веществ, что облег-
чает их выведение из организма почками.
Выделение из организма токсичных веществ и их метаболитов происхо-
дит в основном через почки и ЖКТ. Через почки выделяются главным
образом неионизированные соединения, которые обладают высокой гидро-
589
фильностью и плохо реабсорбируются в почечных канальцах (например,
органические кислоты, ацетаты и пр.). Через ЖКТ с желчью выводятся в
основном высокополярные соединения с большой молекулярной массой, вы-
сокоионизированные основания и различные конъюгаты, которые способны
гидролизоваться под влиянием ферментов и микрофлоры кишечника. Неко-
торые из них могут реабсорбироваться в кровь и вновь поступать в печень для
следующего круга конъюгации и выделения с желчью (так называемая пече-
ночно-кишечная циркуляция, свойственная, например, лепонексу). Вообще
детоксикационная роль ЖКТ при острых отравлениях значительно снижена,
поскольку они имеют преимущественно пероральный характер, поэтому он
больше выполняет роль интоксикационной зоны, откуда идет всасывание и
распределение ядов в организме. Некоторые неионизированные токсичные
вещества выводятся в значительной степени через слюнные, потовые и
молочные железы (например, соединения ртути и других тяжелых металлов).
Летучие липофильные соединения выделяются из организма с выдыхаемым
воздухом через легкие (например, хлорированные углеводороды, алкоголь).
Нормальная функция общей системы естественной детоксикации (“хи-
мического гомеостаза”) осуществляет достаточно надежное очищение' орга-
низма от ксенобиотиков при их концентрации в крови, не превышавшей
определенный для каждого из них пороговый уровень. В противном случае с
нарастанием токсической концентрации происходит накопление молекул ток-
сичных веществ на рецепторах токсичности, т.е. физиологически активных
биохимических структурах с нарушением их функции и развитием клиничес-
кой картины острого отравления. Степень ее выраженности может быть пре-
имущественно связана с накоплением метаболитов более токсичных, чем само
нативное вещество (например, при отравлении ФОИ, амитриптилином), био-
трансформация которого идет по пути летального синтеза (токсификации).
Интенсивность токсического воздействия ядов повышается при имеющих-
ся у больных преморбидных нарушениях со стороны основных систем детокси-
кации (“ситуационная токсичность”), а также у лиц пожилого и старческого
возраста. Токсическое действие ядов развивается тогда при их концентрации
в крови гораздо меньшей, чем пороговая для здорового человека. Во всех
этих случаях возникает экстренная необходимость стимуляции или допол-
нительной поддержки работы общей системы естественной детоксикации
организма для ускоренного его очищения.
С этой целью применяются методы детоксикационной терапии, вклю-
чающие три основные группы лечебных мероприятий: стимуляция естест-
венных процессов детоксикации — А или в тяжелых случаях дополнительное
использование методов искусственной детоксикации (эфферентная тера-
пия) — Б, а также обезвреживание токсичных веществ с помощью специ-
фических фармакологических средств — антидотов (специфическая фарма-
котерапия) — В (табл. 17.1). Кроме того, для коррекции основных патоло-
гических синдромов острых отравлений используется симптоматическая
фармакотерапия — Г.
17.3.1. Стимуляция естественной детоксикации
1. Учитывая преимущественно пероральный характер острых отравлений,
когда в ЖКТ депонируется основное количество токсичного вещества, ос-
новной задачей детоксикационной терапии является его экстренное очищение
590
с целью эвакуации ядов. В этом отношении зондовое промывание желудка —
самый популярный метод детоксикации, однако его эффект ограничивается
относительно небольшим объемом распределения лекарств в полости желудка"
в самые ранние сроки после отравления (1—2 ч). При более позднем начале
лечения, что чаще всего наблюдается в медицинской практике, основная зада-
ча — очищение тонкого кишечника, куда перемещается основное депо токсич-
ных веществ. Традиционное использование различных слабительных средств
(растительных, масляных, солевых) обычно не дает желаемого эффекта в связи
с резким угнетением перистальтики кишечника, свойственного практически
всем веществам психотропного действия. Более действенное средство — фар-
макологическая стимуляция с помощью внутривенного введения прозерина
(1,0 мл 0,05 % раствора), натрия хлорида (100 мл 10 % раствора) или калия
хлорида (20 мл 10 % раствора) в сочетании с гипертоническим раствором
глюкозы (200 мл 20 % раствора) и инсулином (8 ЕД). Однако наиболее
эффективно внутривенное введение серотонина адипината по 10 мг одно-
моментно до 150 мг в сутки. Одновременно рекомендуется пероральное
введение энтеросорбентов (СКТ, СКН, ФАС и др.) по 50 г в водном
растворе.
2. Метод форсированного диуреза применяется при острых отравлениях
водорастворимыми и неионизированными ядами. На первом этапе, учитывая
гиповолемическое состояние больных при выраженной клинике острых
отравлений, проводится инфузионная терапия объемом 1,0—1,5 л в составе
физиологического раствора хлорида натрия, гипертонического раствора
глюкозы, а при наличии кислой среды — 4 % раствор гидрокарбоната на-
трия. На втором этапе внутривенно струйно вводят диуретики', осмотические
(мочевина, маннитол 15—20 % раствор в количестве 1,0—1,5 г/кг) или са-
луретические (лазикс, фуросемид не менее 20 г/кг). На третьем этапе
вводят раствор электролитов (хлорид калия — 13,5 ммоль/л и хлорид на-
трия — 120 ммоль/л) в объеме, соответствующем почасовому диурезу. Вы-
сокий диуретический эффект (500—800 мл/ч) обычно сохраняется в течение
3—4 ч. Сочетанное применение осмотических диуретиков с салуретиками
увеличивает диуретический эффект в 1,5 раза. Выраженное детоксикационное
действие оказывает препарат гемодез, позволяющий одновременно с гемо-
дилюцией обеспечить стимуляцию диуреза. Метод форсированного диуреза
противопоказан при острой сердечно-сосудистой недостаточности и нару-
шениях функции почек (олигурия, азотемия).
3. Фармакологическое регулирование биотрансформации лекарств может
осуществляться в сторону повышения (индукции) активности микросомаль-
ных ферментов печени (зиксоран 800 мг/сут) или ее снижения (циметидин
1 г/сут). Однако лечебное действие этих препаратов наступает на 3—4-е
сутки, когда токсикогенная стадия большинства лекарственных отравле-
ний уже на исходе. Наиболее эффективно применение 0,06 % раствора
натрия гипохлорита внутривенно капельно 400,0 мл в течение 30—45 мин,
что позволяет наряду с индукцией фермента Р-450 осуществлять активное
окисление лекарств непосредственно в крови и тканях, при условии отсутствия
у них возможности образования более токсичных метаболитов (“летальный
синтез”). Для максимального сокращения токсикогенной стадии отравлений
метод химиогемотерапии гипохлоритом натрия обычно сочетают с последу-
ющим проведением методов искусственной детоксикации (гемосорбция, гемо-
диализ).
591
17.3.2. Методы искусственной детоксикации
Общей особенностью всех перечисленных выше детоксикационных ме-
роприятий является их малая эффективность при тяжелых формах отравле-
ний, сопровождающихся выраженными нарушениями общего гомеостаза.
Реальные результаты в таких случаях могут быть достигнуты с помощью
методов искусственной детоксикации организма, ведущее место среди которых
занимает гемосорбция (ГС) — перфузия крови через сорбенты, обладающая
неспецифичностью и высокой сорбционной активностью по отношению к
гидрофобным и связывающимся с белками токсичными веществами, что
сопровождается сокращением периода полупребывания ядов в крови (в
3—10 раз) и быстрым снижением концентраций яда в крови от критических
до пороговых.
С помощью гемодиализа (ГД), проводимого аппаратом “искусственная
почка”, наиболее интенсивному выведению подвергаются гидрофильные
низкомолекулярные яды (барбитураты длительного действия, карбофос, ме-
танол, салицилаты и др.). Для достижения аналогичного детоксикационного
эффекта ГД требуется, однако, значительно больше времени (до 6—12 ч),
чем при ГС (1—2 ч). Это обусловливает сочетанное проведение ГС И ГД и
наиболее часто используется при отравлениях ФОС хлорированными угле-
водородами. Роль ГД и особенно его модификаций (гемофильтрация, гемо-
диафильтрация) также существенно возрастает в случаях, требующих одно-
временной коррекции водно-электролитных нарушений. Не потерял своего
значения и перитонеальный диализ (ПД), одним из основных преимуществ
которого является возможность достаточно интенсивного и длительного (до
суток и более) удаления токсичных веществ, избирательно накапливающих-
ся в жировых депо (например, хлорированные углеводороды) при отравле-
ниях, осложненных нарушением гемодинамики. В целях стимуляции и
коррекции общей системы химического гомеостаза в сочетании с методами
искусственной детоксикации обычно применяются методы физиогемотера-
пии — магнитной и ультрафиолетовой в соответствии с их преимуществен-
ными эффектами по следующему алгоритму, магнитная в самом начале
комплексной детоксикации для коррекции гемореологических и гемодина-
мических нарушений, а УФГТ — на конечном этапе для устранения имму-
нологических расстройств, что позволяет максимально использовать воз-
можности каждого из указанных методов и значительно повысить эффек-
тивность искусственной детоксикации.
В последнее время получены новые данные о механизме лечебного
действия лазерной физиогемотерапии, который сочетает в себе детоксика-
ционные эффекты магнитной и ультрафиолетовой физ ио гемотерапии, на-
правленных на коррекцию реологических и иммунологических свойств
крови. Однако эти эффекты выражены в меньшей степени и поэтому ла-
зерная физиогемотерапия может применяться как метод выбора при острых
отравлениях средней тяжести, протекавших без выраженных нарушений
общего гомеостаза.
Широко используемые аферетические методы детоксикационной тера-
пии (гемаферез, плазмаферез и пр.) значительно уступают по скорости
очищения организма диализно-сорбционным методам и находят примене-
ние в соматогенной стадии острых отравлений для лечения эндотоксикоза.
Обязательным условием эффективности детоксикации является своевремен-
ное проведение посиндромной реаниматологической коррекции нарушений
жизненно важных функций организма (токсического шока, острой дыха-
тельной недостаточности и др.).
17.3.3. Специфическая (антидотная) фармакотерапия
Специфическая фармакотерапия обладает клинической эффективностью
только на ранней токсикогенной стадии острых отравлений, длительность
которой различна и зависит от токсикокинетических особенностей каждого
препарата. Высокая специфичность этого вида фармакотерапии предпола-
гает необходимость достоверной клинико-лабораторной идентификации ле-
карственного препарата, вызвавшего отравление. В противном случае при
обычном введении антидота возможно его токсическое влияние. Эффектив-
ность этой терапии значительно снижена при тяжелых нарушениях крово-
обращения и газообмена, что требует предварительного проведения реани-
мационных мероприятий.
Традиционно все противоядия делятся на 4 основные группы.
Химические (токсикотропные) противоядия, влияющие на физико-хи-
мическое состояние токсичного вещества при контактном действии в
ЖКТ или гуморальной среде организма. К ним относятся указанные
выше энтеросорбенты, а также протамина сульфат, используемый при
передозировке гепарина и др.
Биохимические (токсикокинетические) противоядия, обеспечивавшие
выгодное изменение метаболизма токсичных веществ или исправле-
ния биохимических реакций, в которых они участвует. Например,
применение витамина В$ при отравлении производными изониазида
(фтивазид и пр.), унитиола при отравлении серой ртутной мазью,
глюкозы — при отравлении инсулином и пр.
Фармакологические (симптоматические) противоядия, оказываю-
щие лечебное действие в силу фармакологического антагонизма с
действием токсичных веществ на одни и те же функциональные
системы организма. Это позволяет купировать многие опасные
симптомы отравления, но редко приводит к ликвидации всей кли-
нической картины, так как указанный антагонизм обычно оказыва-
ется неполным. Кроме того, эти антидоты нужно применять в
достаточно больших дозах, создающих лечебную концентрацию,
способную нивелировать действие токсической дозы лекарственных
средств. Наиболее распространенные в клинической практике пре-
параты этой группы — холинолитики (атропин) при отравлении хо-
линомиметиками (пилокарпин), клофелином; налоксон (нарканти) —
при отравлении опиоидными анальгетиками (морфин и др.); его
вводят в дозе 0,4 мг (1,0 мл) внутривенно, при необходимости
введение той же дозы повторяют до восстановления удовлетвори-
тельного дыхания (после устранения явлений механической асфик-
сии); анексат (флумазенил) — при отравлениях бензодиазепинами
устраняет их снотворно-седативное действие, его вводят в начальной
дозе 0,3—0,5 мг внутривенно, при отсутствии эффекта через несколько
минут препарат вводят повторно, внутривенно, капельно до суммар-
ной дозы 2,0 мг.
Антитоксическая иммунотерапия получила наибольшее распростране-
ние для лечения укусов змей и насекомых. Предложена моновалентная
антидигоксиновая сыворотка для лечения отравлений дигоксином,
однако эффективность ее невелика.
593
17.3.4. Симптоматическая фармакотерапия
Симптоматическая фармакотерапия широко используется для лечения
основных патологических синдромов при острых отравлениях, прежде всего
экзотоксического шока и первичного кардиотоксического эффекта.
Экзотоксический шок имеет типичный гиповолемический характер, поэ-
тому для его лечения применяется инфузионная терапия в составе колло-
идных, кристаллоидных и бессолевых растворов (полиглюкин, реополиглю-
кин, гипертонический раствор глюкозы, гидрокарбонат натрия) в объеме
3—5 л в сутки.
При гипокинетическом типе нарушения кровообращения на фоне по-
вышения общего периферического сопротивления вводят глюкокортикоиды
(преднизолон до 1000 мг в сутки), при гипокинетическом типе — допамин
(300—500 мкг/мин) с норадреналином. При наличии острой сердечной не-
достаточности проводится терапия добутрексом по обычной схеме.
При первичном кардиотоксическом эффекте, чаще всего отмечавшемся
при отравлении амитриптилином в виде выраженных нарушений ритма и
проводимости сердца, используется унитиол (5 % — 10,0 мл), а-токоферол
(30 % — 10,0 мг/кг) в сочетании с глюкокортикоидами и добутрексом. '
В соматогенной стадии острых отравлений фармакотерапия также имеет
симптоматический характер и используется при развитии вторичного имму-
нодефицита и инфекционных осложнений (Т-активин, антибиотики и пр.),
а также токсической энцефалопатии (актовегин, пирацетам).
При развитии печеночно-почечной недостаточности проводится про-
граммное лечение эндотоксикоза с применением плазмафереза, гемодиализа
или гемофильтрации, согласно общим принципам лечения этой патологии
независимо от вида отравления.
В заключение следует отметить, что при тяжелых отравлениях фармако-
терапия не имеет решающего значения и применяется в составе комплекс-
ного лечения по следующему алгоритму: очищение ЖКТ и инфузионная
терапия; магнитная или лазерная физиогемотерапия для экстренной кор-
рекции гемореологических и гемодинамических нарушений, затем — методы
искусственной детоксикации (гемосорбция, гемодиализ, кишечный лаваж,
химиогемотерапия) и на конечном этапе — ультрафиолетовая физиогемоте-
рапия для устранения иммунологических расстройств, что позволяет мак-
симально использовать возможности каждого из указанных методов и зна-
чительно повысить общий эффект детоксикации (см. табл. 17.1).
Таблица 17,1, Методы детоксикационной терапии
I. Методы стимуляции естественных процессов очищения организма:
А. Стимуляция выведения.
1. Очищение ЖКТ:
• рвотные средства (апоморфин, ипекакуана),
• промывание желудка (простое, зондовое),
• промывание кишечника (зондовый лаваж 500 мл/кг — 30 л, клизма),
• слабительные средства (солевые, масляные, растительные),
• фармакологическая стимуляция перистальтики кишечника (KOI + питуитрин,
серотонина адипинат).
2. Форсированный диурез:
• водно-электролитная нагрузка (пероральная, парентеральная);
• осмотический диурез (мочевина, маннитол, сорбитол);
• салуретический диурез (лазикс).
3. Лечебная гипервентиляция легких.
594
Продолжение
Б. Стимуляция биотрансформации.
1. Регуляция детоксикационной функции печени:
• ферментативная индукция (зиксорин, фенобарбитал);
• ферментативная ингибиция (левомицетин, циметидин).
2. Лечебная гипер- или гипотермия.
3. Гипербарическая оксигенация.
В. Стимуляция активности иммунной системы крови.
1. Ультрафиолетовая физиогемотерапия.
2. Фармакологическая коррекция (Т-активин, миелопид).
II. Методы искусственной физико-химической детоксикации.
1. Аферетические:
• плазмозамещающие препараты (гемодез),
• гемаферез (замещение крови),
• плазмаферез,
• лимфаферез, перфузия лимфатической системы.
2. Диализные и фильтрационные — гемо- (плазмо-, лимфо-) диализ:
• ультрафильтрация,
• гемофильтрация,
• гемодиафильтрация,
• перитонеальный диализ.
3. Сорбционные:
Экстракорпоральные методы
• гемо- (плазмо-, лимфо-) сорбция,
• биосорбция (аллогенные клетки печени).
Интракорпоральные методы
• энтеросорбция.
4. Физио- и химиогемотерапия:
• ультрафиолетовое облучение крови,
• лазерное облучение крови,
• магнитная обработка крови,
• электрохимическое окисление крови (гипохлорит натрия),
• озоногемотерапия.
Таблица 17.2. Специфическая (антидотная) терапия
Антидоты Токсичные вещества
1. Химические (токсикотропные) противоядия контактного действия Перманганат калия — знтеросорбенты — СКТ, СКН (все, кроме Все, кроме металлов цианидов, железа, лития), карболен, мик- росорб, полифепан и пр. . ,, — аскорбиновая кислота . • , — энтеродез парентерального действия — протамин-сульфат Гепарин комплексоны: — тетацин-кальций Свинец — купренил Медь — дисфераль Железо
595
Продолжение
Антидоты Токсичные вещества
2. Биохимические (токсикокинетические) про- тивоядия — метиленовая синь, амилнитрит — витамин Bg — унитиол, тиосульфат натрия — этиловый спирт — оксимы (диэтиксим) — цитохром С 3. Фармакологические антагонисты — атропин — налоксон (нарканти) — анексат Д.Антитоксическая иммунотерапия — противозмеиная сыворотка — противокаракуртовая сыворотка Цианиды, нитрит натрия Изониазиды (тубазид и др.) Ртуть Метанол, этиленгликоль Фосфорорганические инсектициды Окись углерода Пилокарпин, фосфорорганические инсек- тициды Производные опия Производные бензодиазепина Змеиный яд Яд каракурта
17.4. Основные виды острых отравлений
17.4.1. Лекарственные отравления
1. Антидепрессанты трициклические
Амитриптилин
Симптоматика. В легких случаях отмечаются сухость во рту, нарушения
зрения, психомоторное возбуждение, ослабление перистальтики кишечника,
задержка мочи, мышечные подергивания и гиперкинезы. При тяжелых от-
равлениях (после приема 1000 мг и более) — спутанность сознания вплоть
до глубокой комы, приступы клонико-тонических судорог по типу эпилеп-
тиформных, развиваются расстройства сердечной деятельности (бради- и
тахиаритмии, внутрисердечная блокада, фибрилляция желудочков), острая
сердечно-сосудистая недостаточность (коллапс). Возможно развитие токси-
ческой дистрофии печени, гипергликемии, пареза кишечника.
Неотложная помощь здесь и далее включает: 1. Методы активной деток-
сикации. 2. Антидотное лечение. 3. Симтоматическую терапию.
1. Повторное промывание желудка, энтеросорбция, форсированный ди-
урез. В тяжелых случаях применяют детоксикационную гемосорбцию, пери-
тонеальный диализ, кишечный лаваж. 2. При тахиаритмии вводят в мышцу
физостигмин 0,05 % — 1 мл под кожу или в вену повторно через 1 ч до
урежения пульса (60—70 в 1 мин), лактат натрия 5—10 % по 400 мл, лидо-
каин 100 мг, индерал 0,1 % по 1—5 мл в вену. При брадиаритмии назначают
атропин 0,1 % — 1 мл под кожу или в вену повторно через 1 ч. 3. При
судорогах и возбуждении вводят 5—10 мг диазепама в вену или мышцу. При
нарушении внутрижелудочковой проводимости в мышцу вводят повторно
5 % раствор унитиола 5—10 мл, 125—250 мг гидрокортизона, а-токоферол
2 мл.
2. Барбитураты
Симптоматика. Отравление барбитуратами вызывает наркотическое
опьянение, поверхностно| или глубокое коматозное состояние с падением
596 >
сердечно-сосудистой деятельности и дыхания, гипотермию, в тяжелых слу-
чаях — гипертермию. В глубокой коме дыхание редкое, поверхностное,
пульс слабый, цианоз, зрачки узкие, на свет не реагируют, но в терминаль-
ной стадии могут расширяться; роговичный, сухожильный и глоточные
рефлексы ослабевают или отсутствуют; диурез уменьшен. В случае продол-
жительной комы (свыше 12 ч) возможно развитие бронхопневмонии, кол-
лапса, глубоких пролежней и тромбоэмболических осложнений. В постко-
матозном периоде возникает непостоянная неврологическая симптоматика
(птоз, шаткая походка и пр.), эмоциональная лабильность, депрессия.
Неотложная помощь. 1. При коматозном состоянии — промывание же-
лудка через зонд после предварительной интубации трахеи. Энтеросорбция,
солевое слабительное. Форсированный диурез в сочетании с введением 4 %
бикарбоната натрия в вену. В тяжелых случаях возможно раннее применение
гемодиализа, перитонеального диализа, гемосорбции. 2. В стадии комы —
сердечно-сосудистые средства, санация дыхательных путей, раннее приме-
нение антибиотиков, иммуностимулирующих препаратов, лечение токсичес-
кой коагулопатии.
3. Бензодиазепины
Симптоматика. См. барбитураты.
Неотложная помощь. 1. Форсированный диурез без ощелачивания крови,
перитонеальный диализ, детоксикационная гемосорбция. 2. Анексат 0,3—
0,5 мг в вену повторно до суммарной дозы 2,0 мг. 3. В стадии комы —
сердечно-сосудистые средства, санация дыхательных путей, раннее приме-
нение антибиотиков, иммуностимулирующих препаратов, лечение токсичес-
кой коагулопатии.
4. Фенотиазины
Симптоматика. Резкая слабость, головокружение, сухость во рту, тош-
нота. Возможно появление судорог, потеря сознания. Коматозное состояние
неглубокое, сухожильные рефлексы повышены, зрачки сужены. Учащение
пульса, снижение артериального давления без цианоза. Кожные аллергичес-
кие реакции. При выходе из комы возможны явления паркинсонизма
(экстрапирамидный синдром). При разжевывании драже возникают гипере-
мия и отек слизистой оболочки рта.
Неотложная помощь. 1. Промывание желудка. Энтеросорбция. Форси-
рованный диурез без ощелачивания плазмы. Перитонеальный диализ, гемо-
сорбция. 2. При гипотонии — эфедрин 5 % — 2,0 мл под кожу, витамин В]
6 % — 4 мл в мышцу. При паркинсонизме — депакин, мелипрамин по SO-
75 мг/сут внутрь. Лечение острой сердечно-сосудистой недостаточности.
5. Холинолитические средства
Атропин
Симптоматика. Сухость во рту и глотке, расстройства речи и глотания,
нарушение ближнего видения, диплопия, светобоязнь, сердцебиение, одыш-
ка, головная боль. Кожа красная, сухая, пульс частый, зрачки расширены,
на свет не реагируют. Психическое и двигательное возбуждение, галлюци-
нации, бред, эпилептиформные судороги с последующей потерей сознания,
развитием коматозного состояния, параличом дыхательного центра.
Неотложная помощь. 1. При пероральном отравлении — промывание
желудка через зонд, обильно смазанный вазелиновым маслом. Форсирован-
ный диурез. Энтеросорбция. Гемосорбция. 2. В коматозном состоянии и при
597
возбуждении — эзерин 0,1 % или аминостигмин 0,1 % — 2 мл под кожу или
в вену, аминазин 2,5 % — 2 мл или диазепам 2,5 % по 3—4 мл в вену. При
резкой гипертермии — амидопирин 4 % по 10—20 мл, анальгин 50 % по
1—2 мл или реопирин 5 мл в мышцу, пузыри со льдом на голову и паховые
области, обертывание влажной простыней и обдувание вентилятором.
6. Клофелин
Симптоматика. Головокружение, слабость, оглушение с расстройством
ориентации и памяти. Снижение артериального давления, выраженная бра-
дикардия. Возможно развитие ортостатического коллапса.
Неотложная помощь. 1. Промывание желудка, активированный уголь
внутрь. Форсированный диурез. 2. Для снятия брадикардии — атропин 0,1 %
по 1—2 мл под кожу повторно, алупент — 1 мл под кожу. 3. Назначение
сердечно-сосудистых средств, постельный режим.
7. Отравления наркотическими средствами
Морфин ч
Симптоматика. При приеме внутрь или парентеральном введении ток-
сических доз развивается коматозное состояние, для которого характерно
значительное сужение зрачков с ослаблением реакции на свет, гиперемия
кожи, гипертонус мышц, иногда клонико-тонические судороги. В тяжелых
случаях часто наблюдается нарушение дыхания и развитие асфиксии —
резкий цианоз слизистых, расширение зрачков, сердечно-сосудистая недоста-
точность. При тяжелом отравлении кодеином возможны нарушения дыхания
при сохраненном сознании больного, а также значительное падение АД.
Неотложная помощь. 1. Промывание желудка при внутривенном введе-
нии морфина, энтеросорбция. Форсированный диурез, ощелачивание мочи,
гемосорбция. 2. Введение налоксона по 1—3 мл в вену медленно. 3. Под
кожу и в вену — атропин 0,1 % по 1—2 мл. Согревание тела. Витаминоте-
рапия — В] 5 % 3 мл в вену повторно. Ингаляция кислорода, искусственное
дыхание по показаниям.
17.4.2. Отравления алкоголем и его суррогатами
1. Спирт этиловый
Симптоматика. При приеме внутрь токсических доз после общеизвест-
ных симптомов опьянения быстро развивается кома. Холодная липкая кожа,
гиперемия лица и конъюнктив, снижение температуры тела, рвота, непро-
извольное выделение мочи и кала. Зрачки сужены, а при нарастании рас-
стройств дыхания расширяются. Горизонтальный нистагм. Дыхание замед-
ленное, пульс частый, слабый. Иногда судороги, аспирация рвотными мас-
сами, ларингоспазм. Возможна остановка дыхания, чаще в результате меха-
нической асфиксии с последующим падением сердечно-сосудистой деятель-
ности.
Неотложная помощь. 1. Промывание желудка через зонд. 2. Туалет по-
лости рта, взятие языка на языкодержатель, отсос слизи из полости глотки.
Восстановление нарушенного дыхания: атропин 0,1 % 1 мл, кордиамин 2 мл,
кофеин 2 мл под кожу, лучше внутриязычно или в вену. При отсутствии
глоточных рефлексов — интубация и искусственное аппаратное дыхание.
Глюкоза 40 % 40 мл с инсулином 15 ЕД в вену. Витамины Вл 2 мл и В]
5 мл в мышцу. Ощелачивание — бикарбонат натрия 4 % до 1000 мл в вену
598
капельно. Никотиновая кислота 5 % 1 мл под кожу повторно. Антибиотики.
Лечение токсического шока.
2. Спирт метиловый
Симптоматика. Опьянение выражено слабо, тошнота, рвота, мелькание
“мушек” перед глазами. На 2—3-и сутки появляется неясность видения,
слепота. Боли в ногах, голове, нарастание жажды. Кожа и слизистые сухие,
гиперемированы, с синюшным оттенком, язык обложен серым налетом,
запах алкоголя изо рта. Зрачки расширены, с ослабленной реакцией на свет.
Тахикардия с последующим замедлением и нарушением ритма. Артериаль-
ное давление сначала повышено, затем падает. Сознание спутано, возможно
психомоторное возбуждение, судороги, кома, гипертонус мышц конечнос-
тей, ригидность затылочных мышц, длительный коллапс, паралич дыхания.
Неотложная помощь. 1. Промывание желудка, солевое слабительное,
форсированный диурез с ощелачиванием. Ранний гемодиализ. 2. Этиловый
спирт 30 % 100 мл внутрь, затем каждые 2 ч по 50 мл 4—5 раз. В коматозном
состоянии — этиловый спирт 5 % в вену капельно в расчете 1 мл на 1 кг
массы тела в сутки. 3. Преднизолон — 25—30 мг в вену. Витамины Bi 5 %
5 мл и аскорбиновая кислота 5 % 20 мл в вену. Глюкоза 40 % — 200 мл и
новокаин 2 % 20 мл в вену капельно при появлении слепоты. Лечение
токсического шока. Спазмолитики под кожу повторно.
3. Этиленгликоль
Симптоматика. После приема внутрь вначале наступает состояние лег-
кого алкогольного опьянения при хорошем самочувствии. Спустя 5—8 ч
появляются боли под ложечкой, сильная жажда, головная боль, рвота, боли
в животе. Кожа сухая, гиперемирована. Слизистые с цианотическим оттен-
ком. Психомоторное возбуждение, расширение зрачков, одышка, тахикар-
дия. При тяжелых отравлениях наступает потеря сознания, ригидность за-
тылочных мышц, клонико-тонические судороги. Дыхание глубокое, шумное.
Явления острой сердечной недостаточности, отек легких. На 2—5-е сутки —
анурия вследствие почечной недостаточности.
Неотложная помощь. 1. Промывание желудка через зонд, солевое сла-
бительное. Показан ранний гемодиализ в 1—3-и сутки после отравления.
Форсированный диурез. Лечение острой почечной недостаточности с помо-
щью гемодиализа. 2. Хлористый кальций 10 % или глюконат кальция по
10—20 мл в вену повторно. Этиловый алкоголь 30 % по 10 мл внутрь
повторно или 5 % по 100—200 мл в 1-е сутки в вену. 3. При возбуждении —
сернокислая магнезия 25 % 10 мл в мышцу, спинальная пункция. Двусто-
ронняя паранефральная новокаиновая блокада.
17.4.3. Отравления прижигающими жидкостями
1. Кислоты крепкие
Симптоматика. В начальном периоде поступления крепких кислот
внутрь развиваются явления токсического ожогового шока, на 2—3-и сутки
преобладают признаки токсемии (повышение температуры тела, возбужде-
ние), затем — нефропатии и гепатопатии. Резчайшие боли в полости рта, по
ходу пищевода и желудка. Повторная рвота с примесью крови, пищеводно-
желудочное кровотечение. Значительная саливация, механическая асфиксия
в связи с болезненностью акта откашливания и отеком гортани. При отрав-
599
ленииуксусной эссенцией моча приобретает темно-красный цвет (гемолиз).
К концу первых суток в тяжелых случаях, особенно при отравлении уксус-
ной эссенцией, появляется желтушность кожных покровов как результат
гемолиза, печень увеличена и болезненна. Отмечаются явления реактивного
перитонита, панкреатита. При отравлении уксусной эссенцией наиболее
выражены признаки глобинурийного нефроза (анурия, азотемия). Частое
осложнение — гнойный трахеобронхит и пневмонии. С 3-й недели прояв-
ляются признаки рубцового сужения пищевода или чаще — выходного от-
дела желудка. Постоянно отмечается ожоговая астения с потерей массы тела
и нарушением белкового и водно-электролитного равновесия.
Неотложная помощь. 1. Промывание желудка через зонд, смазанный
растительным маслом, несмотря на наличие в желудочном содержимом
крови. Перед промыванием желудка под кожу морфин 1 % 1 мл и атропин
0,1 % 1 мл. Форсированный диурез. 2. Бикарбонат натрия 4 % до 1500 мл в
вену при появлении темной мочи и развитии метаболического ацидоза.
3. Лечение ожогового шока. Для местного лечения обожженной поверхности
внутрь через каждый 1 ч по 20 мл микстуры следующего состава: эмульсия
подсолнечного масла 10 % — 200 мл; анестезин — 2 мл; левомицетин4— 2 мл.
Сердечно-сосудистые средства (кордиамин 2 мл, кофеин 10 % 2 мл под
кожу). Глюкозо-новокаиновая смесь (глюкоза 5 % 300 мл, глюкоза 40 %
50 мл, новокаин 2 % 30 мл в вену капельно). В случаях значительной
кровопотери повторное переливание крови. Применение массивных доз
антибиотиков. Гормонотерапия: гидрокортизон — 125 мг повторно в мышцу.
Витаминотерапия: В12 — 400 мкг, Bj 5 % 2 мл в Мышцу. Лечение токсичес-
кой нефропатии. Кровоостанавливающие средства. При отеке гортани —
ингаляции аэрозолей: пенициллина 300 тыс. ЕД на новокаине 0,5 % 3 мл с
эфедрином 5 % 1 мл, адреналином 0,1 % 1 мл, гидрокортизоном 125 мг.
В случае безуспешности указанных мероприятий — трахеостомия. Щадящая
диета, при продолжающемся желудочном кровотечении — голод, тромбин,
этамзилат, локальная гипотермия желудка.
2. Щелочи едкие
Симптоматика. При поступлении внутрь — ожоги пищеварительного
тракта, приводящие к развитию болевого шока, повторных массивных пи-
щеводно-желудочных кровотечений, механической асфиксии в результате
ожога и отека гортани, тяжелой ожоговой болезни, реактивного перитонита.
В более поздние сроки (на 3—4-й неделе) развивается сужение пищевода и
антрального отдела желудка. Основные осложнения: массивные кровотече-
ния, аспирационная пневмония.
Неотложная помощь. См. Кислоты крепкие.
17.4.4. Отравления фосфорорганическими инсектицидами
Симптоматика. Отравления развиваются при попадании этих препара-
тов в желудок, через дыхательные пути и кожные покровы. Стадия I —
психомоторное возбуждение, миоз, стеснение в груди, одышка, влажные
хрипы в легких, потливость, повышение артериального давления. В стадии
II преобладают отдельные или генерализованные миофибрилляции, клони-
ко-тонические судороги, хореические гиперкинезы, ригидность грудной
клетки, нарушение дыхания из-за нарастающей бронхореи. Коматозное со-
стояние. В стадии III наблюдается угнетение дыхательного центра до полной
остановки дыхания. Поддержание жизни возможно только путем аппарат-
600
ного дыхания. Далее появляются паралич дыхательных мышц и мышц
конечностей, падение АД, расстройства сердечного ритма (брадикардия,
фибрилляция), нарушения проводимости сердца (увеличение систолическо-
го показателя).
Неотложная помошь. 1. Промывание желудка повторное, энтеросорбция,
гемосорбция, гемодиализ. 2. Стадия I — атропин 0,1 % 3 мл под кожу,
аминазин 2,5 % 2 мл и сернокислая магнезия 25 % 10 мл в мышцу. Атро-
пинизация до сухости во рту в течение суток. В стадии II — атропин по
3 мл в вену в растворе глюкозы, повторно до купирования бронхореи и
сухости слизистых (15—20 мл). При резкой гипертонии и судорогах — маг-
незия сернокислая 25 % 10 мл в мышцу, диазепам 2,5 % 5 мл в вену,
реактиваторы холинэстеразы (дипироксим 15 % 1 мл, диэтиксим 10 % 2 мл)
под кожу повторно. В стадии III — искусственное аппаратное дыхание,
атропин 20— 30 мл в вену, капельно, до купирования бронхореи. Реактива-
торы холинэстеразы. Лечение токсического шока. Гидрокортизон 300 мг в
мышцу. Антибиотики. Ультрафиолетовое облучение крови, повторно до
повышения активности холинэстеразы.
17.4.5. Отравления угарным газом
Симптоматика. Головная боль, стук в висках, головокружение, сухой
кашель, боль в груди, слезотечение, тошнота, рвота. Возможно возбуждение
со зрительными и слуховыми галлюцинациями. Гиперемия кожи. Тахикар-
дия, повышение АД. Далее развиваются адинамия, сонливость, двигатель-
ные параличи, потеря сознания, кома, судороги, нарушение дыхания, нару-
шение мозгового кровообращения, отек мозга. Возможно развитие инфаркта
миокарда, кохнотрофических расстройств.
Неотложная помощь. 1. Гипербарическая оксигенация. 2. Цитохром С в
мышцу. 3. Аскорбиновая кислота 20—30 мл, 500 мл 5 % глюкозы и 50 мл
2 % новокаина в вену. При возбуждении — аминазин 2,5 % 2 мл, димедрол
1 % 1 мл, пипольфен 2,5 % 2 мл, промедол 2 % 1 мл в мышцу. При
нарушении дыхания — эуфиллин 2,4 % 10 мл в вену, искусственное аппа-
ратное дыхание, при судорогах — диазепам 2,5 % 3 мл в вену. Витаминоте-
рапия. При длительной коме — гипотермия головы, гепарин 5—10 тыс. ЕД
в сутки в вену, антибиотики, осмотический диурез без водной нагрузки.
Повторные люмбальные пункции.
ЛИТЕРАТУРА
1. Лопухин Ю.М., Молоденков М.Н. Гемосорбция. — М.: Медицина, 1985. — 288 с.
2. Лужников Е.А. Клиническая токсикология. — М.: Медицина, 1999. — 416 с.
3. Лужников Е.А., Костомарева Л.Г. Острые отравления. — М.: Медицина, 1989. —
432 с.
4. Лужников Е.А., Гольдфарб Ю.С., ОстапенкоЮ.Н Клиническая токсикология на
рубеже XXI в. Анестезиология и реаниматология, 1999. — № 6. — С. 67—70.
5. Seyffart G. Poison index. The treatment of Acute intoxication. Pab. Sci. Pub. — Berlin,
1977.- 671 c.
Предметный указатель
Абстинентный синдром 304, 307, 309, 314, 320,
323
Аденозиндифосфат 92, 107
Азатиопрнн 410
Азота окислы 325
— окись 276
Акриламид 440
Актиномицин D 439
Алкилирующие соединения 236
---алкилирование 236
---биологически активные природные 253
--------- антибиотики 254
---------порфиромнцин 254
---биохимические мишени 239
--- гидролиз ипритов 238
--- действие местное 240
------общерезорбтивное 241
---радиомиметический эффект 241
---механизмы интоксикации 346
--- противоопухолевые препараты 250
---типичные реакции с нуклеофильными ре-
агентами 238
---типы 236
---токсикология 236, 240
Алкилы галоидные 236, 347
--- токсикология 250
Алкилирование 236
Алкоголизм 307
— Потребление алкоголя 411
Алкогольный(ая, ые) бред ревности 312
— галлюциноз 311
— деградация личности 310
— делирий 311, 323
— паранойя 312
— психозы 310, 323
Аллергические реакции 380, 382
---влияние “экологического неблагополу-
чия” 382
---роль клеток Лангерганса 380
Алюминий 397, 411
Амидофос 193
Амины 81, 270
— ароматические 79
Амитриптилин 596
Аммониевые соединения 176
Амфетамины 317
Анаша 315
Анемия(и) апластическая 287
— гемолитическая 140
— гиперхромная 273, 286
— гипопластическая 286
— гипохромная при отравлении ароматически-
ми аминами и нитросоединениями 273
— свинцовая 292
— хронические 273
Анилин 441
Антагонизм действия тяжелых металлов 131
— токсикологический 503
Антидотная фармакотерапия 593
Антидоты 593, 595
Антитоксическая иммунотерапия 593
Антихолинэстеразные вещества 176
---классификация 181
Асбест 397, 409, 410, 413, 423
Атмосферные загрязнения, влияние на генети-
ческие изменения 404
----------иммунологическую резистентность
организма 382
---источники 397
АТФаза 92, 96, 107
Аурамин 411
Афлатоксины 410, 413
Афос 193
Ацетилхолин 177, 179
Ацетон 318
Аэрозоли, особенности хемокинетикн 60
------задержка в организме 66
--------------математическое моделирова-
ние процессов клиренса и задержки 72
--------------реакция альвеолярного фагоци-
тоза 70
--------------самоочищение респираторного
тракта 68
----------отложение частиц при дыхании 61
Барбитураты 316, 596
Бензидин 410, 413, 439
Бензин 318
Бензодиазепины 313, 593, 597
Бензол(ы) 45, 53, 318, 410
— действие на кроветворную ткань 282, 364
— динамика концентрации в выдыхаемом воз-
духе во время экспозиции и после ее пре-
кращения 47
— замещенные 79
— интоксикация 281
— отравления 286, 371
— токсичность 80
Бензольная гемопатия 281
Бериллий 410, 413, 439, 440
Бертолетова соль см. Хлорат калия
Биоактивация токсикантов 77
Биомишени 255
Биосинтез гема 290
Биотрансформация ксенобиотика 34, 76
с участием ДНК 77
фермента 77
Болезнь итаи-итаи 145
Бутоксид 375
Ванилиламиды энантовой кислоты см. Капсаи-
цин
602
Вещества алкилирующие 236, 345
— высокоопасные 440
— малоопасные 441
— наркотические 300
— психоактивные 300, 317
— раздражающего действия 348
— токсичные химические 258, 300, 317, 352
381
------комбинированное действие 497, 512,
516
------механизмы взаимодействия с клеточ-
ными структурами 354
------оценка генетической активности 390
-------------- классы опасности 394
— умеренно опасные 441
— чрезвычайно опасные 439
Винилхлорид 410, 413
Выплавка чугуна и стали 411
Газификация угля 411
Галогензамещенные пропаны 80
— углеводороды 80
Гашиш 315
Гексаметиленамин 289
Гексаметилендиамин 289
Гексахлорциклогексан 289
Гем см. Железопорфирин
Гемоглобин 258
— первичное токсическое угнетение синтеза
289
— структурная формула молекулы 259
Гемоглобинурия 279
Гемодез 591
Гемолиз внутрисосудистый 277
Гемопоэз 281
Гемосорбция 592
Генетическая(ие) токсикология 386
---соматические мутации 386, 407
---“сторожевые” фенотипы 389
---хромосомные аномалии 388
Генные мутации 388
Генотоксичность 385
Гены-супрессоры опухолей 427
Гидроперекись изопропилбензола 277
Гомеостаз 482
— иммунный 352, 407
Денатурированный пигмент 269
“Депрессия кроветворения” 281
ДДТ 423, 441
— иммунотоксичность 369
Диализ перитонеальный 592
Диоксин 13
Дихлортетрафторэтан, хемобиокинетика у
собак 53
Дихлорэтан 371
Дихлофос 367
Диэтилстильбэстрол 410, 423, 439
ДНК 32, 42, 77, 82, 205, 283
Жевательная бетель с табаком 411
Железопорфирин 289
Загрязнение среды обитания 59, 382, 404, 558
Зарин 188, 221
Здоровье репродуктивное 445—449
Иммунная система 363
---иммунитет гуморальный 369, 372
------действие токсикантов 363
-------клеточный 369, 372
---иммуногенез 363
Иммунотокснкология 352
Индивидуальная чувствительность организма к
действию токсического агента 99
Индукторы 37
Инсектициды карбаминовые 228
---острая токсичность при пероральном и
накожном воздействии 228
— фосфорорганические 98, 600
Интерфероны 362
Интоксикация мышьяковистым водородом 279
-------“аноксемическая смерть” 279
Иприты азотистые 238, 246, 249
— аэрозоль 242
— интоксикация, помощь 255
— механизм действия 242
— особенности 243
— симптомы 243
— скрытый период поражения 244
— характеристика рецептур 245
Йодистый метил 252
Кадмиевая остеомаляция 145
Кадмий 108, 114, 116, 128, 134, 145, 158, 397,
410, 553
Кадмиозы 145
Каменноугольные пеки 410
— смолы 410
Канцерогенез многостадийный 420
— Промоция 424
Канцерогены, влияние на процессы репродук-
ции 445—449, 464
----------у женщин 451, 459
--------------мужчин 454, 463
— высокоопасные 440, 464, 495
— классификация 408, 467
---бытовые 411
---доминантные онкогены 426
---лекарственные препараты 410
---природные 410
---производственные 411, 495
---промышленные 410
— критерии вредности 482
— механизм действия 417
- ПДК 443, 493, 496, 498, 525, 538, 542, 580
— умеренно опасные 441, 464, 495
— чрезвычайно опасные 439, 464, 495
Капсаицин 349
Карбаматы, метаболизм, токсичность 227
Карбоксигемоглобин 260
Карбоксигемоглобинемия 260
Карбофос 223
Кинетика самоочищения легких 67
-------клиренс альвеолярный 68
----------математическое моделирование 72
----------пульмональный 69, 75
----------трахеобронхиальный 68
Кинетические закономерности прохождения
ксенобиотиков через организм 59
Кислоты(а) гуминовые 398
— карбаминовые 225
— крепкие 599
— серная 411
— тиобарбитуровая 129
Кластогены 385
Клиренс пульмональный 69
— трахеобронхиальный 68
Клофелин 593, 596, 598
603
I
Кокаин 316
Комплексное действие химических веществ 516
Контрацептивы 410
Кремний кристаллический 410
Ксенобиотики 16, 32, 52, 59
— влияние на биоэнергетические процессы 89,
104
— иммунный гомеостаз 352, 355
— газообразные 43
— генетический мониторинг 385, 404
— кинетические закономерности прохождения
через организм 59
— кумуляция в биологической системе 49, 50,
58, 113
-----------эффекты линейные 56, 58
--------------нелинейные 55, 58
— метаболизм см. Механизмы биотрансформации
---окислительный 34, 76, 97
---энергетический 34, 76, 97
— механизмы биотрансформации 34, 76
---биохимические 39‘
— нарушения энергетического обмена 99
— поступление через желудочно-кишечный
тракт 48
----------- периодическое 49
Лакриматоры 347
Лекарственные средства канцерогенные 410
--- противоопухолевые 249
Лекомании 316
Лиганды 111, 116
Лизоцим 356
Марихуана 315
Масла минеральные неочищенные 410
— сланцевые 410, 413
Мелфалан 410
Метгемоглобин 266, 269
Метгемоглобинемия 266
— бессимптомная 276
— нитратно-нитрнтная 276
Метгемоглобулннообразователи неорганичес-
кой природы 276
------показатели гемотокснческого действия
при хроническом образовании 272
Метилацетат 46
Метил бромистый 252
— йодистый 252
Метилурацил 441
Метод(ы) детоксикационной терапии 594
Милеран 410
Митогены 385
Митомицин С 439
Морфогены 385
Мурамидаза см. Лизоцим
Мутагены 385, 390
— тестирование пищевых продуктов 398
Мутация 422, 428
— пробы на мутагенность 430
Мышьяк 140, 143, 145, 410, 413, 440
Мышьяковистый водород 277, 279
Налоксон 593
Наркомании 301
Наркоманическая интоксикация 301
Натрия гипохлорит 591
— хлорид 591
Нафталины 277, 280
2-Нафтиламин 410, 439
Неотложная помощь при отравлениях алкого-
лем н его суррогатами 598
------------------спиртом метиловым 599
---------------------этиловым 598
------------------ этиленгликолем 599
---------амитриптилином 596
---------атропином 597
---------барбитуратами 596
---------бензодиазепинами 597
---------клофелнном 598
--------морфином 598
---------фенотиазинами 597
---------жидкостями прижигающими 599
---------кислотами крепкими 599
---------фосфорорганическими инсектицида-
ми 600
---------щелочами едкими см. Кислоты креп-
кие
---------угарным газом 601
Нефропатия острая токсическая 161
Никель 128 , 410, 413 , 441
Нитраты 276
Нитриты 276
Нитросоединення 270, 273
Олефнны 236
Оловоорганические соединения 104
Онкогены 425
Опьянение см. Наркоманическая интоксикация
Острая почечная недостаточность 161, 279
— токснческая(ий) нефропатия 161
-----шок 162
Отравление(я) алкоголем 598
-----спиртом метиловым 599
-----этиловым 598
----- этиленгликолем 599
— лекарственные 596
-----амитриптилином 594, 596
-----анальгетиками опиоидными 593
-----атропиноподобными 313
----- барбитуратами 596
-----бензодиазепинами 313, 593
-----дигоксином 593
-----инсулином 593
-----клофелнном 593, 596, 598
-----наркотическими средствами 598
---------морфином 598
-----производными изониазида 593
-----психоактивными веществами 301
-----холиномиметиками 593
— химической этнологии, бензолом 286, 371
-----ванадием 360
----- диагностика 588
-----ДДТ 369
-----диоксином 377
-----дихлорэтаном 371
-----ингаляционными раздражающими
ядами 325
----- лечение 589
-----методы детоксикации 590, 594
-----------искусственной 592
-----фармакотерапия антидотная 591, 593,
595
---------симптоматическая 594
-----оксидом углерода 262, 264
-----опиатами 313
-----пестицидами 361
-----прижигающими жидкостями 599
-----тетрахлорметаном 371
-----тяжелыми металлами 116, 138
604
-----------кадмием 145, 158
-----------марганцем 143
-----------медью 140, 377
-----------мышьяком 140, 143
-----------ртутью 143
-----------свинцом 140, 144, 289, 360, 371
------угарным газом 601
------фосфорорганическими инсектицидами
600
---------соединениями 212, 360, 367, 375
------ хронические 142
------этанолом 372, 377
Очищение тонкого кишечника при отравлении
591
Первая медицинская помощь при интоксика-
ции анкилирующнми соединениями 255
-----------днметилсульфатом 257
-----------ипритами 255
-----------лакриматоров 349
-----------хлорацетофеноном 348
Первитин 315
Пестициды, иммунотокснчность 361
— карбаминовые 227
— критерии тератогенного, эмбрнотокснческо-
го, репродуктивного действия 465
— мутагенная опасность 394
Полициклические ароматические углеводороды
80, 95, 408, 414
Поражение системы кроветворения ксенобио-
тиками 281
------при отравлении остром метгемоглобнн-
образователямн 270—271
-----------свинцом 289
-----------хроническом бензолом 286
Предельно допустимые концентрации избира-
тельно действующих раздражающих веществ
344
Прозерин 591
Производные каннабиса 315
— кислоты гуминовой 398
---карбаминовой 225
------взаимодействие с холинэстеразой 225
------метаболизм 227
------строение 225
------токсичность 227, 228
— эфедрина 315
Производственные процессы канцерогенные
397, 411, 413
------классификация потенциальной опас-
ности их влияния на репродуктивную функ-
цию 464
Пропаны галогензамещенные 80
Протеинурия 279
Противоопухолевые лекарственные средства 249
Противоядия см. Антидоты
Протоонкогены 426
“Психотропные средства" 300
Пульмональный клиренс 69, 74
Радон 410, 411, 414
Репродуктивное(ая) здоровье 445
— система, оогенез 448
--- оплодотворение 448
---пороки развития 449
---сперматогенез 447, 452
--- строение 446
— тератогенность 446
— токсичность 445
— фертильность 446
— фетотоксичность 446
— эмбриотоксичность 446, 449, 451, 452
Ртуть 462
410
Свинец 114, 127, 137, 140, 166, 290, 360, 371,
397, 462, 564
Свинцовая интоксикация 292, 441
Сера 115
Сернистый ангидрид 325
Серотонина адипинат 591
Сероуглерод 106, 462
Сиднокарб см. Амфетамины
Симптом(ы) острого гемолитического состоя-
ния 271
— поражения лакриматорами 348
Синдром(ы) абстинентный 304, 307, 309, 314
— “большие наркоманические” 303, 309
— измененной реактивности организма 302
— Корсакова 310
— нейротоксический 145
— при алкоголизме, лечение 323
Синергизм действия тяжелых металлов 131
Смолы 413
Соединения алкилирующие 236, 345
— аммониевые 176
— антихолинэстеразные 176, 181
— химические 37
---специфичность действия 90
Солнечная радиация 414
Спирты алифатические 38
— нзоприловый 411, 413
— метиловый 46, 599
— этиловый 598
Сульфгемоглобнн 268
Табак 411
Табачный(ые) дым 414
— продукты бездымные 414
Тельца Гейнца 268, 271
- Жолли 270, 271
Тесты краткосрочные на мутагенность 430
ТиоТЭФ 408, 411
Тиофос 221
Токснкогенетика 385
Токсикодинамнка 14, 33
Токсикокинетика см. Хемобиокинетика
Токсикология, биохимические мишени 239
— генетическая 386
— задачи 12
— клиническая 15, 28
— методы 12
— основные понятия 521
------ доза 522
---------переносимая 522
------коэффициент опасности 522
------ ответ 522
------риск, оценка 521
-----------зависимость доза—ответ 522, 529
-----------надорганизменный характер 547
----------- управление 533
--------------экономический анализ 540
----------- характеристика 538
— профилактическая 474
---гигиеническое нормирование 541
---уровни регламентирования токсикантов
488
---экспериментальные модели взаимодейст-
вия химических веществ и организма 477,
489
605
-----экстраполяция данных эксперимента с
животных на человека 487
— судебная 16
— экологическая 545
-----биота 551—557
-----вариабельность экотоксикологических по-
казателей 566
-----влияние абиотических факторов среды 550
-----неблагоприятные эффекты 547
---------роль пищевых рационов 551
-----------природной среды в реализации
экотоксикологических эффектов 560
----- предмет 546
-----проблема видов-индикаторов 574
---------зоны экологического бедствия 576
-------------- риска 575
-----судьба популяции 564
Токсикоманическая(ий) интоксикация 301
— эксцесс 301
-----зависимость психическая 302
-----физическая 302
-----синдром измененной реактивности орга-
низма 302
Токсикомания 301
— классификация 302
-----к антидепрессантам 316
-----амфетаминам 317
----- барбитуратам 316
----- новокаину 316
-----производным каннабиса 315
-----психомиметикам 317
-----средствам антихолинергического дейст-
вия 316
----- эфедрину 315
-----эфирным растворителям 318
— клиническая картина 303
— лечение 319—324
— опиаты 312, 320
— опиоиды 312
— патогенез 305
— “пик" абстиненции 303
— противорецидивная терапия 323
— ремиссия 304
— синдромы 304, 307, 309, 320
— факторы-индукторы 304
— факторы-предикторы 304
— хроническая 314
— частные формы 307
-----алкоголизм 307
--------- дипсомания 309
--------- запои 308
---------алкогольные(ый) галлюцинозы 310
-----------делирий 310
--------- психозы 311
---------энцефалопатии 312
Токсикометрия 13, 343, 479
Толуол 318
Транквилизаторы 316
Трахеобронхиальный клиренс 68
Трихлорэтилен 97, 107
ТХДД 13, 410, 412
ТХМФ-3 193
Тяжелые металлы 114, 138
-----биурет 116
-----взаимосвязь с белками 116, 128
----- механизм действия 131
-----нарушения проницаемости клеточных
мембран 120
— нейротоксичность 143
— отравление, лечение, патогенез 116, 138, 166
— оценка показателей нейтрализации зарядов
и кислотности по Льюису 114
— пути поступления 133
— свойства 114
— токсичность 114
Угарный газ 601
Углерод четыреххлористый 104, 318
Угнетение гемопоэза 281
Унитиол 594
Уравнение Михаэлиса—Ментен 56
Уретан 440
Установление зависимости структура—токсич-
ность с помощью электронных параметров
79
Фагоцитоз 60, 70, 358
Факторы вредные 521
---идентификация 524
— канцерогенные 410—413
---бытовые 411
---по степени доказательности их вреда для
человека 412
— модифицирующие хемобиокинетику 59
— среды абиотические 550
- F1 92
Фенамин см. Амфетамины
Фенацетин 410
Фенилгидразин 277
Фенотиазины 597
Ферригем 269
Феррогем 269
Фитонциды 253
Фозолон 193
Формальдегид 46, 412, 442
Форсированный диурез 591
Фосфорилирование окислительное 95, 99, 106,
108
Фосфорорганические инсектициды 98
---антихолинэстеразная активность 188
------ токсичность 188
---влияние на гладкомышечные органы 222
--------- кровь 223
— соединения 98, 176, 193
---антихолинэстеразная(ые) активность 187,
199
------ свойства 189
--- биологическое окисление 203
---взаимодействие с холинэстеразой 185
--- гидролиз 202
---гидрофобность 207
--- кардиотоксичность 221
---нейротоксическое действие отдаленное
217
---патогенез отравлений 212
---строение 182, 194
---токсичность избирательная 200, 205, 222
---трансферазные реакции 202
---ферментативные превращения 204, 209
Фторотан 44
Фурацилин 440
Хемобиокинетика 14, 33, 42
— аэрозолей 60
— взаимосвязь с токсикодинамикой 33
— дихлортетрафторэтана у собак 53
— системы материнский организм — плод 54
— классификация модифицирующих факторов
59
606
Хемотоксикокинетика, биотрансформация ксе-
нобиотиков 76
Химическая(ий) зависимость см. Наркомании
— канцерогенез см. Канцерогены
----взаимодействие канцерогенных метаболи-
тов с ДНК 420-422
----закономерности 418
----доминантные онкогены 426
----индукция злокачественного роста геноток-
сическими канцерогенами 420
----классы опасности 437
----многостадийный 420
---- мутация 422
----эффект канцерогенный 432
Хлорат калия 277
Хлорацетофенон 348
Хлорбензол 288
Хлорирование воды 398
Хлористый аллил 252
— водород 325
— метил 251, 347
— метилен 251
— Пропил 347
— этил 347
Хлороформ 318, 347
Хлорпикрин 348
Холинолитические средства, атропин 597
Холинэстераза 179, 188
— блокаторы 176
— взаимодействие с ацетилхолином 179
— свойства 179
Хром 397, 410, 413, 439
Хромосомные мутации 388
Цианиды 38, 89, 100
Цикл Кребса 97
Циклофосфамид 411
Чувствительность холинэстеразы к антихолесте-
разным веществам 188
Шок болевой 162
— гипокинетический 594
— экзотоксический 139, 162, 594
Шунт Труэта 162
Щелочи едкие 600
Эзерин 225
Эймса тест 79, 401
Экологическая(ое) катастрофа 576
— нормирование гигиеническое 541, 579
----на ландшафтно-географическом уровне
583
Элиминация ксенобиотика из биологической
системы 57, 61
Эндотоксикоз при печеночно-почечной недо-
статочности, лечение 594
Энтеросорбенты 591
Энцефалопатии острые 312, 314
— токсическая 141
----фармакотерапия 594
Эрионит 408, 410, 413
Эстрадиол 439
Эстрогенотерапия заместительная 410
Эстрогены нестероидные 410
— стероидные 411
Этиленоксид 410, 440
Эфедрин 315
Эфедрон 315
Эфирные растворители 318
Эфиры алкиловые 236
— ариловые 226
— кислоты карбаминовой сложные 176
---- минеральной метиловые 253
----ортофталевой 456
— этиловые 44, 90
Эффект(ы) генетический 386, 396
— канцерогенный 432
— комплексного воздействия ксенобиотика 396
Яд(ы) гонадотропный 446
— классификация 341
— крови
----компенсаторные реакции 282
----нарушения синтеза гема 289
----первичный гемолиз 277
— нервные 212
— раздражающие 326
----анализ параметров токсиметрии 343
----действие на дыхательную систему 326
--------------сурфактант легких 336
----изменение "остроты” обоняния 329
------частоты дыхания 326
---- клеточная реакция 331
---- паранекротические процессы в тканях
легких 335
— тиоловые 111, 116, 131, 133
----гепатотоксичность 165
---- кардиотоксичность 154
---- лечение при отравлениях 166
---- нейротоксичность 143
----нефротоксичность 160
---- хронотропность 113
— хроническая интоксикация 339
— эмбриотропный 446
Руководство
ОБЩАЯ ТОКСИКОЛОГИЯ
Зав. редакцией Т.П. Осокина
Редактор Т.А. Петрова
Художественный редактор С.Л. Андреев
Технический редактор В.И. Табенская
Корректор М.П. Молокова
ЛР № 010215 от 29.04.97. Сдано в набор 19.06.2002.
Подписано к печати 08.08.2002. Формат бумаги
70x100'/16. Бумага офс. № 1. Гарнитура Таймс. Пе-
чать офсетная. Усл.печ.л. 49,40. Усл. кр.-отт. 50,05.
Уч.-изд.л. 49,26. Тираж 3000 экз. Заказ 7127
Ордена Трудового Красного Знамени издательство
“Медицина”. 101990, Москва, Петроверигский
пер., 6/8.
Отпечатано с оригинал-макета в ОАО “Можайский
полиграфический комбинат”. 143200, г. Можайск,
ул. Мира, 93.
isbn а-ввь-очьоч-ь
9 785225 046095
ОБЩАЯ
ТОКСИКОЛОГИЯ
Под редакцией
Б. А.Курляндского, В.А.Филова
Курляндский Борис Аронович
доктор медицински* нау». профессор
директор Российского рвгис’ра потен-
циально опасны» химически» и биоло-
гических вещее*в Минздрава России
Один ил ведущих го»еи«.оперов России
Автор бопер 300 печатных работ, ряда
монографий и справочников Предста-
витель России в международны* Орга-
иизапи0» по химической безопасное-
ты. Председатель правления Россий-
ского токсикологическим о 'Общества
Организатор и руководитель первой в
сис теме государственного сами тарно-
го надзора готси»оло<ичес«ой набора
горим Научно обосновал концепции
Фазовой динамики развития хроничес-
ких интоксикаций и роли в этом про-
цессе гипоталамо-гипофизарной сис-
•
чесмих канцерогенов Впервые е спече •
ствежгой токсикологии обосновал сис-
тему приоритетных показателей для
токсикологической Оценки химически»
веществ Научный руководитель и кон-
сультант 4 докторских и 14 кандидат*
скил диссертации
Филов Владимир Александрович-
доктор биологических наук, профес-
сор академе» РАЕН, заслуженные дея-
тель РФ Руководитель лаборатории
органического синтеза фармакологии
и токсикологии НИИ онколотии им
• трсгва М3 РФ; замести
гель директора по науке "Лиг фирм";
консультант Института коенобиотм»»»
РАЕН 'АСГЛ Исследовательские лабо
ре г ори и'
Один из создателей хемобиокинети*
•и Изучал практические аспекты свези
структуры • сенобиотиков и их токсине-
ского действия, биотраисформяцито
сложны* эфиров в организме Создал
ттиэосомную «онцелцию воздвиг теин
на злокачественный рос’ Организатор
создания и руководитель авторского
цапле»’ива многотомного справочно
эм14иклапвдичесхиго издания 'Вред-
ные химические вещества'. руко-
водств "Основы обше»’ промышленной
Юхсикологии* и "’Фармакокинетика"
автор монографии "Количргтвенная
токсикология", переведенной на не-*
сколько иностранны» языков Автор и
соавтор разработки противоопухоле-
вых гцзелврзтоа сегидрим. диоксадЗ’.
клонизол и многоцелевого препарата
олипифат