Author: Койко Р.
Tags: физиология сравнительная физиология молекулярная биология общая биофизика, общая биохимия и общая физиология медицина иммунология
ISBN: 978-5-7695-4104-9
Year: 2008
Text
УДК 612-083(075.8)
ББК 28.074я73
К55
Рецензенты:
декан медико-профилактического факультета
Московской медицинской академии им. М. С. Сеченова,
д-р мед. наук, профессор Ю. В. Несвижский',
профессор кафедры клинической иммунологии
Московского государственного медико-стоматологического университета,
декан биомедицинского факультета Университета мировой политики и права,
д-р мед. наук С. В. Сучков
Перевод и научное редактирование организованы
филологическим факультетом Санкт-Петербургского государственного университета
Койко Р.
К55 Иммунология : учебное пособие / Р. Койко, Д. Саншайн, Э. Бенджамини; пер. с англ. А. В. Ка-
маева, А. Ю. Кузнецовой под ред. Н. Б. Серебряной. — М. : Издательский центр «Академия», 2008. —
368 с.
ISBN 978-5-7695-4104-9 (рус.)
ISBN 0-471-22689-0 (англ.)
На базе новейших достижений в области биологии и медицины изложены теоретические основы иммунологии.
Рассмотрены важнейшие вопросы развития и функционирования иммунной системы, механизмы врожденного и при-
обретенного иммунитета. Дана характеристика реакций гиперчувствительности. Отдельная глава посвящена иммуноде-
фицитным расстройствам. Рассмотрена проблема трансплантации и выживания трансплантата Приведены сведения об
иммунологии опухолей. Рассказано об иммунизации Приведен словарь терминов, в приложении дан перечень основ-
ных CD-маркеров
Для студентов высших учебных заведений, обучающихся по медицинским, биологическим и ветеринарным специ-
альностям.
УДК 612-083(075.8)
ББК 28.074я73
Оригинал-макет данного издания является собственностью
Издательского центра «Академия», и его воспроизведение любым способом
без согласия правообладателя запрещается
Все права защищены. Авторизованный перевод с английского языка издания,
опубликованного издательством «John Wiley & Sons, Inc.»
© 2003 by John Wiley & Sons, Inc. All Right Reserved
ISBN 978-5-7695-4104-9 (рус.) © Камаев А.В., Кузнецова А. Ю., перевод на русский язык, 2008
ISBN 0-471-22689-0 (англ.) © Издание на русском языке, оформление Издательский центр «Академия», 2008
ОГЛАВЛЕНИЕ
Предисловие.................................11
Об авторах..................................12
Консультанты................................13
Предисловие к пятому изданию................14
Предисловие к четвертому изданию............16
Предисловие к третьему изданию..............17
Предисловие ко второму изданию..............18
Предисловие к первому изданию...............19
• Глава 1. Вступление и обзор...............21
Введение.................................21
Общий обзор..............................22
Врожденный и приобретенный иммунитет....22
Активная, пассивная
и адоптивная иммунизация..............23
Характеристики приобретенного иммунного
ответа................................23
Клетки, участвующие в приобретенном
иммунном ответе.......................24
Клонально-селекционная теория.........24
Гуморальный и клеточный иммунитет.....26
Клеточно-опосредованный иммунитет.....27
Проявление разнообразия
в иммунном ответе.....................28
Успехи иммунологии....................29
Повреждающие эффекты
иммунного ответа......................29
Регуляция иммунного ответа............30
Будущее иммунологии ..................30
• Глава 2. Элементы врожденного
и приобретенного иммунитета.................32
Введение.................................32
Врожденный иммунитет.....................32
Физические и химические барьеры.......32
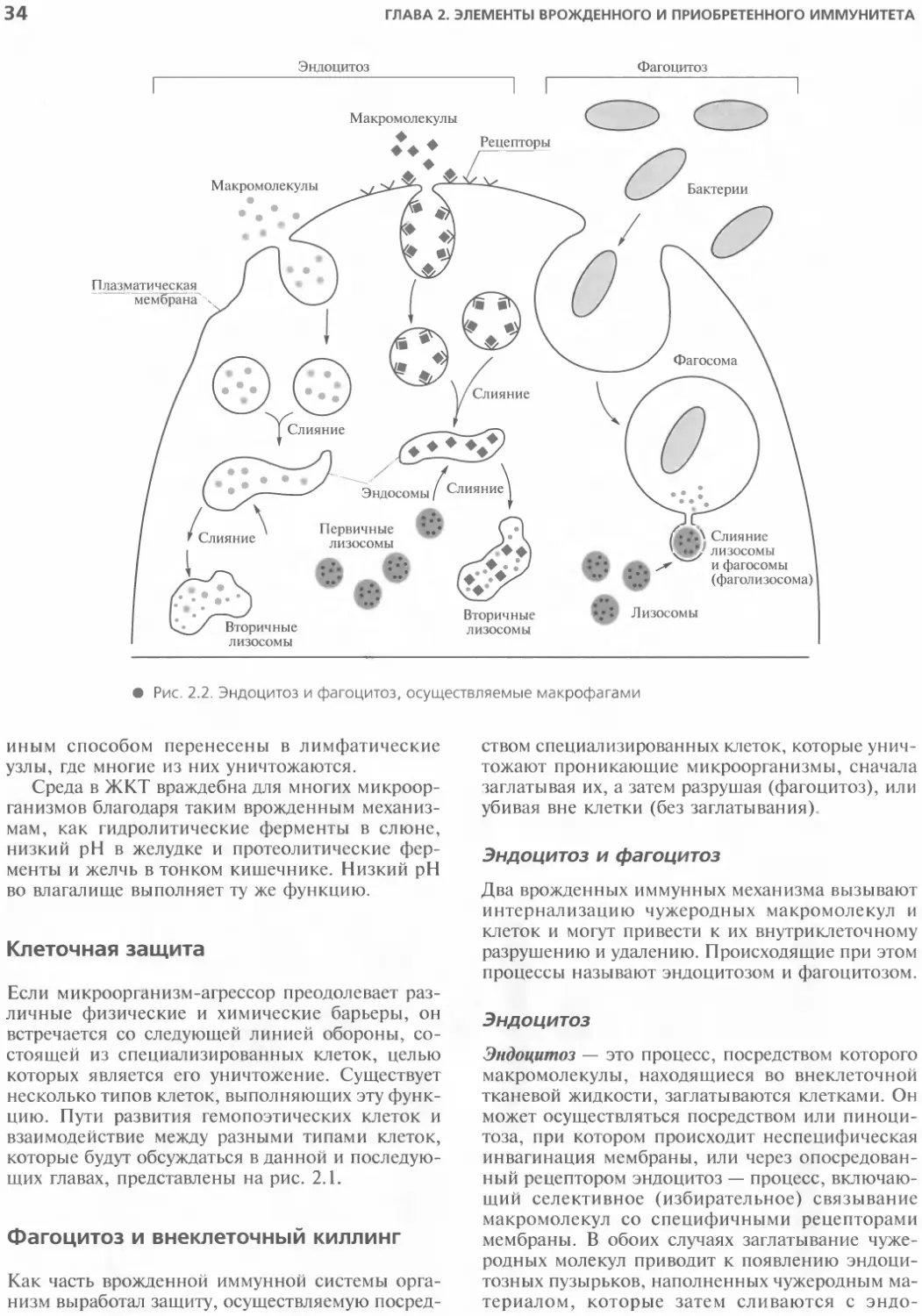
Клеточная защита......................34
Фагоцитоз и внеклеточный киллинг......34
Клетки, участвующие в работе врожденной
иммунной системы......................35
Воспаление............................37
Лихорадка.............................39
Биологически активные вещества........39
Рецепторы, входящие в систему врожденного
иммунитета............................39
Адаптивный (приобретенный) иммунитет.....40
Клетки и органы, вовлеченные
в адаптивный иммунный ответ..............40
Лимфатические органы..................41
Рециркуляция лимфоцитов..................45
Судьба антигена
после пенетрации..........................45
Взаимодействие между врожденным и
приобретенным иммунитетом.................47
• Глава 3. Иммуногены и антигены............49
Введение..................................49
Условия появления иммуногенности..........49
Чужеродность..........................49
Большая молекулярная масса............50
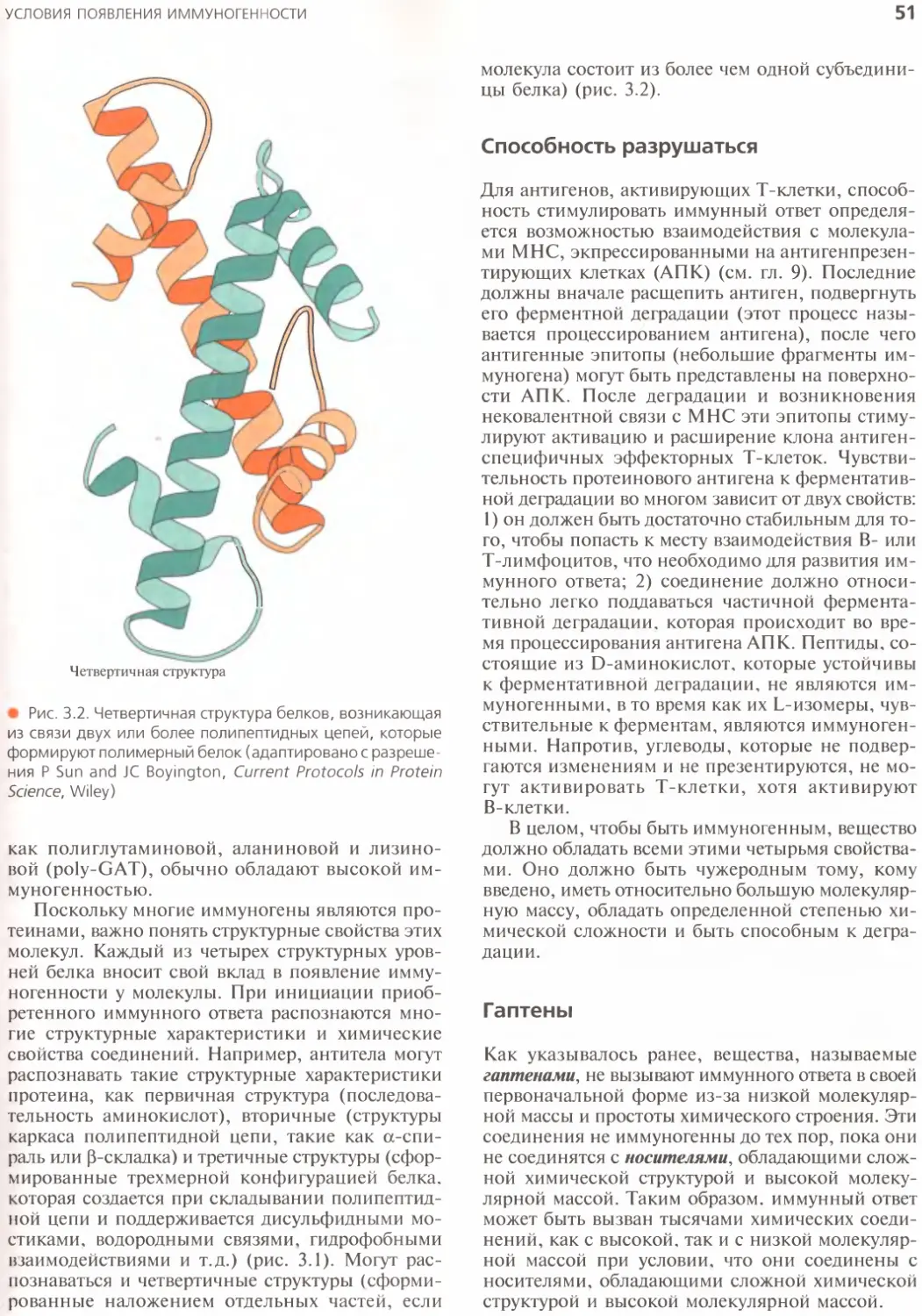
Сложная химическая структура..........50
Способность разрушаться...............51
Гаптены...............................51
Другие условия появления иммуногенности..52
Первичный и вторичный ответы..............52
Антигенность и антигенсвязываюший участок ....53
Эпитопы, распознаваемые В- и Т-клетками...53
Основные классы антигенов.................55
Связывание антигена с антигенспецифичными
антителами или Т-клетками.................55
Перекрестная реактивность.................56
Адъюванты.................................56
• Глава 4. Структура антител и их функции...60
Введение..................................60
Обнаружение антител и определение
их характеристик..........................61
Структура легких и тяжелых цепей..........61
Домены....................................63
Шарнирная область.........................64
Вариабельная область......................64
Варианты иммуноглобулинов.................65
Изотипы...............................65
Аллотипы..............................65
Идиотипы..............................66
Структурные свойства IgG .................67
Биологические свойства IgG................69
Агглютинация и формирование
преципитата...........................69
Прохождение через плаценту и абсорбция
у новорожденных.......................69
Опсонизация...........................70
Антителозависимая клеточно-опосредованная
цитотоксичность.......................70
Активация комплемента.................70
Нейтрализация токсинов................71
Иммобилизация бактерий................71
Нейтрализация вирусов.................71
Структурные свойства IgM..................71
6
ОГЛАВЛЕНИЕ
Биологические свойства IgM...............72
Агглютинация..........................72
Изогемагглютинация....................72
Структурные и биологические свойства IgA.72
Действие IgA при инфекциях слизистых
оболочек..............................74
Бактерицидная активность..............74
Противовирусная активность............74
Структурные и биологические свойства IgD..74
Структурные и биологические свойства IgE.74
Важность IgE при паразитарных инфекциях
и реакциях гиперчувствительности......74
Кинетика образования антител после
иммунизации..............................75
Первичный иммунный ответ..............75
Вторичный иммунный ответ..............75
Суперсемейство иммуноглобулинов..........76
• Глава 5. Взаимодействия антигенов
с антителами. Иммунологические
исследования и экспериментальные системы ....79
Введение.................................79
Взаимодействия антиген — антитело........79
Первичные взаимодействия между антителом
и антигеном .............................81
Константа ассоциации..................81
Аффинность и авидность................81
Вторичные взаимодействия между антителами
и антигенами ............................82
Реакции агглютинации .................82
Реакции преципитации..................84
Иммунологические исследования............86
Иммунологические исследования с прямым
связыванием...........................86
Твердофазные иммунологические
исследования..........................88
Иммунофлуоресценция......................89
Прямая иммунофлуоресценция............89
Непрямая иммунофлуоресценция..........89
Методы сортировки клеток, меченных
флуорохромами............................89
Иммуноабсорбция и иммуноадсорбция........91
Исследования с использованием клеток.....91
Методы для оценки функций лимфоцитов ....91
Исследования пролиферации Т- и В-клеток ....91
Продукция антител В-клетками..........92
Исследования эффекторных Т-клеток
и натуральных киллеров................92
Клеточные культуры ......................92
Первичные культуры клеток и клонируемые
клеточные линии лимфоцитов............92
В-клеточные гибриды и моноклональные
антитела..............................93
Т-клеточные гибридомы ................94
Молекулы и рецепторы, полученные
методами генной инженерии.............95
Экспериментальные модели на животных.....95
Инбредные линии.......................95
Адоптивный перенос и пассивная
иммунизация...........................96
Мыши с тяжелым комбинированным
иммунодефицитом.......................96
Тимэктомированные и бестимусные мыши ...96
Трансгенные мыши и манипуляции с генами...96
Трансгенные мыши.......................96
Мыши с «нокаутными» генами.............97
Анализ экспрессии генов...................97
Микромассивы в исследовании
экспрессии генов.......................97
• Глава 6. Генетическая основа структуры
антител....................................101
Введение.................................101
Краткое описание структуры и экспрессии
неиммуноглобулиновых генов ..............101
Генетические изменения при синтезе
цепей 1g.................................103
Организация и реаранжировка генов
легкой цепи...........................103
Организация и реаранжировка генов
тяжелой цепи .........................105
Регуляция экспресии генов 1g..........106
Переключение класса или изотипа..........106
Обеспечение разнообразия антител.........107
Наличие множества V-генов в зародышевой
линии.................................107
VJ- и VDJ-комбинаторная ассоциация....108
Случайный выбор тяжелых и легких цепей.... 108
Разнообразие межсегментных соединений
и вставки нуклеотидов.................108
Соматический гипермутагенез...........108
Конверсия соматических генов..........108
Редактирование рецепторов.............109
• Глава 7. Биология В-лимфоцита...........112
Введение.................................112
Места ранней дифференцировки В-клеток....112
Онтогенез В-лимфоцитов...................113
Начальные фазы дифференцировки
В-клеток: про- и пре-В-клетки.........113
Незрелые В-клетки.....................114
Зрелые В-клетки.......................115
Анатомическое распределение В-клеток..117
В-1-клетки............................117
Мембранные белки В-клеток................117
Антигенсвязывающие молекулы:
мембранный иммуноглобулиновый
рецептор..............................118
Передача сигналов молекулами,
ассоциированными с мембранным
иммуноглобулиновым рецептором.........118
Молекулы, участвующие
во взаимодействиях Т- и В-клеток......118
• Глава 8. Биология Т-лимфоцитов..........121
Введение.................................121
Природа антигенспецифичного
Т-клеточного рецептора...................121
Молекулы, взаимодействующие
с антигеном...........................121
Корецепторные молекулы................123
Комплекс Т-клеточного рецептора.......123
ОГЛАВЛЕНИЕ
7
Другие важные молекулы, экспрессируемые
на поверхности Т-клетки...............124
Гены, кодирующие
Т-клеточные рецепторы....................126
Разнообразие Т-клеточных рецепторов......127
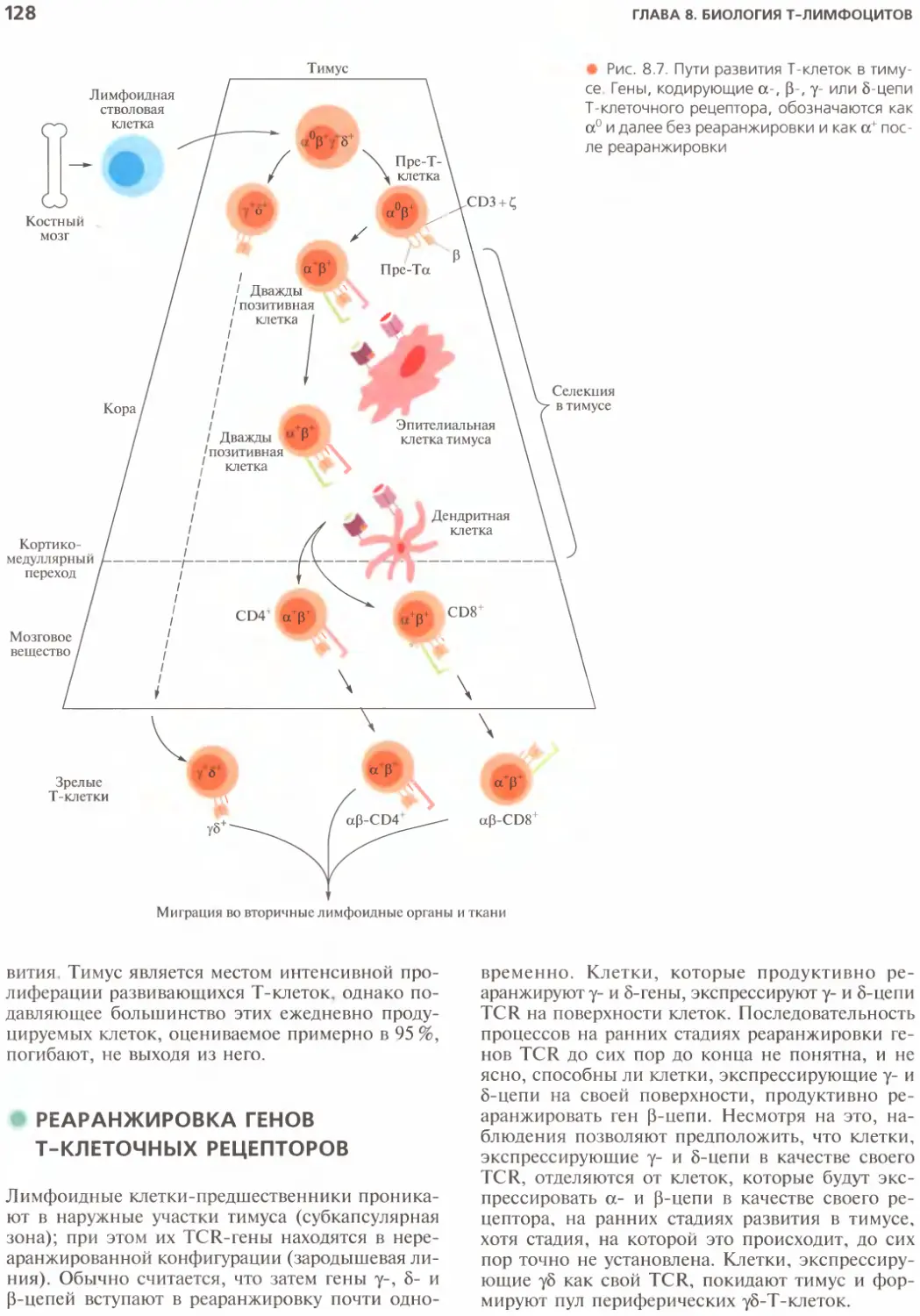
Дифференцировка Т-клеток в тимусе........127
Взаимодействие тимоцитов с тимическими
нелимфоидными клетками...................127
Реаранжировка генов Т-клеточных рецепторов .... 128
Тимическая селекция......................129
Позитивная селекция...................129
Негативная селекция...................129
Роль пептидов в тимической селекции ..130
Характеристики Т-клеток, покидающих
тимус.................................130
• Глава У. Роль главного комплекса
гистосовместимости в формировании
иммунного ответа.........................133
Введение.................................133
Гены МНС и их продукты...................133
Номенклатура..........................133
Варианты экспрессии молекул МНС
в разных клетках......................134
Вариабельность генов и продуктов МНС.....135
Генетический полиморфизм..............135
Кодоминантная экспрессия..............135
Структура молекул МНС....................136
Структура молекул МНС I класса........136
Структура молекул МНС II класса ......138
Функционирование молекул МНС: процессинг
и презентация антигена...................140
Ответы на экзогенные антигены:
образование комплексов
молекула МНС II класса — пептид.......140
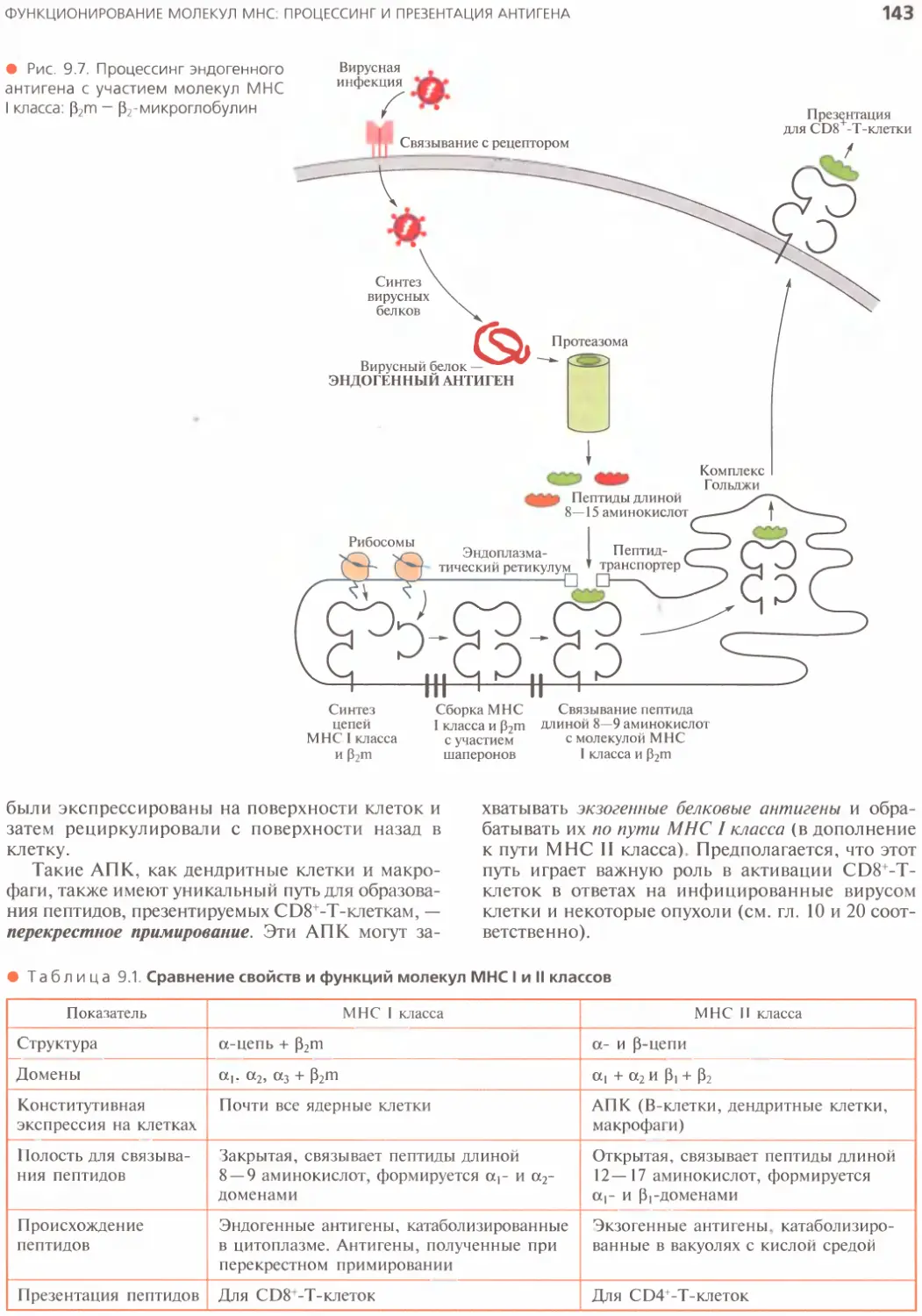
Эндогенные антигены: образование
комплексов молекула
МНС I класса —пептид..................142
Другие пути процессинга и презентации
антигенов.............................142
Какие антигены запускают ответ каких
Т-клеток?.............................144
Связывание молекулами МНС пептидов.
полученных из собственных молекул.....145
Неспособность отвечать на антиген.....145
Различия в молекулах МНС: связь МНС
с устойчивостью или восприимчивостью
к заболеваниям...........................146
Другие гены области МНС..................146
• Глава 10. Активация и функционирование
Т- и В-клеток..............................149
Введение.................................149
Активация СП4+-Т-клеток..................149
Специализированные клетки,
представляющие антиген Т-клеткам......149
Парные взаимодействия на поверхности
АПК и СО4+-Т-клетки...................151
Иммунологический синапс...............152
Межклеточные события при активации
СЭ4+-Т-клетки.........................152
Роли В7 —CD28 и В7 —CD152 в активации
Т-клеток.............................154
Другие пути активации Т-клеток...........155
Суперантигены........................156
Растительные белки и антитела
к поверхностным молекулам Т-клеток...156
Липиды...............................156
Функции Т-клеток ........................156
Субпопуляции СD4+-Т-клеток,
отличающиеся по выделяемым цитокинам ... 157
Т — В-кооперация.....................159
Функции СП8+-Т-клеток....................160
Активация СО84-Т-клеток..............160
Уничтожение СЭ8+-Т-клетками
клеток-мишеней.......................162
Окончание иммунного ответа: индукция
клеток памяти........................163
Функции В-клеток при отсутствии помощи
Т-клеток.................................164
Внутриклеточные механизмы активации
В-клеток.............................164
Модуляция сигнала от BCR.............166
• Глава 11. Цитокины......................170
Введение.................................170
История цитокинов........................171
Общие свойства цитокинов.................171
Общие функциональные свойства........171
Общая системная активность...........172
Общие клеточные источники и каскадность
событий..............................172
Общие рецепторные молекулы...........173
Функциональные группы цитокинов.........174
Цитокины, регулирующие иммунный
ответ................................174
Цитокины, поддерживающие врожденные
иммунные реакции и активирующие
воспалительный ответ.................176
Хемокины — цитокины, активирующие
движение лейкоцитов..................177
Цитокины, стимулирующие гемопоэз.....179
Рецепторы цитокинов......................179
Семейства цитокиновых рецепторов.....179
Общая у-цепь.........................181
Передача сигнала через цитокиновый
рецептор.................................181
Роль цитокинов и цитокиновых рецепторов
при заболеваниях.........................182
Синдром токсического шока............182
Бактериальный септический шок........182
Онкологические заболевания...........182
Аутоиммунные и другие
иммуноопосредованные заболевания ....182
Терапевтическое и диагностическое применение
цитокинов и цитокиновых рецепторов.......183
Ингибиторы цитокинов/Антагонисты.....183
Коррекция клеточных иммунодефицитов .... 184
Лечение иммунодефицитов..............184
Лечение онкологических больных
и пациентов, перенесших трансплантацию... 184
Лечение астмы и аллергических
заболеваний..........................185
8
ОГЛАВЛЕНИЕ
• Глава IX. Толерантность
и аутоиммунитет............................188
Введение................................188
Центральная толерантность...............188
Механизмы обеспечения
аутотолерантности....................189
Анергия, редактирование рецепторов,
делеция и клональное игнорирование...189
Периферическая толерантность............191
Взаимодействие Fas — FasL...............191
Регуляторные/супрессорные Т-клетки......192
Оральная толерантность..................193
Иммунопривилегированные области ........194
Аутоиммунитет и заболевания.............194
Критерии определения аутоиммунного
заболевания..........................195
Причины аутоиммунного заболевания....195
Примеры аутоиммунных заболеваний.....198
Аутоиммунные заболевания, при которых
доминирующую роль в поражении органа
играют антитела......................198
Аутоиммунные заболевания, при которых
Т-клетки играют доминирующую роль
в повреждении органов................202
Аутоиммунные заболевания, возникающие
в связи с дефицитом компонентов
комплемента..........................205
Методы лечения.......................205
• Глава 13. Комплемент....................209
Введение................................209
Пути активации комплемента..............209
Классический путь....................210
Лектиновый путь......................210
Альтернативный путь..................210
Активация СЗ и С5....................212
Терминальный путь....................212
Регуляция активности комплемента........213
Биологические эффекты комплемента.......215
Образование опсонинов................215
Образование анафилатоксинов..........216
Лизис клеток.........................217
Усиление ответа В-лимфоцитов
на антигены..........................217
Контроль за формированием и удалением
иммунных комплексов..................218
Удаление мертвых и погибающих
клеток...............................218
Реакции на вирусы....................218
Недостаточность комплемента.............219
• Глава 14. Реакции гиперчувствительности:
реакции, опосредованные антителами
(I тип).....................................223
Введение.................................223
Определение гиперчувствительности
по Джеллу и Кумбсу......................223
Общие характеристики аллергических
реакций.................................224
Фаза сенсибилизации.....................224
Зависимость продукции антител IgE
от Тн2-клеток........................224
Фаза активации ..........................225
Эффекторная фаза.........................227
Пред существующие медиаторы..........228
Вновь синтезируемые медиаторы........228
Клинические аспекты аллергических
реакций..................................231
Аллергический ринит..................231
Пищевая аллергия ....................231
Атопический дерматит.................231
Астма................................232
Клинические методы выявления
аллергена. Особенности терапии...........232
Выявление аллергена..................232
Особенности терапии..................233
Защитная роль IgE........................235
• Глава 15. Реакции гиперчувствительности:
реакции, опосредованные антителами (II тип),
и реакции, обусловленные иммунными
комплексами (III тип).......................239
Введение...................................239
Цитотоксические реакции:
гиперчувствительность II типа..........239
Реакции, опосредованные комплементом .... 239
Антителозависимая
клеточно-опосредованная цитотоксичность ...239
Опосредованные антителами нарушения
функции клеток........................241
Примеры цитотоксических реакций
гиперчувствительности ....................241
Трансфузионные реакции................241
Реакции, вызванные лекарственными
средствами............................241
Реакции при резус-конфликте ..........241
Аутоиммунные реакции с вовлечением
рецепторов клеточных мембран..........242
Аутоиммунные реакции с вовлечением
детерминант других клеточных мембран..242
Реакции, обусловленные иммунными
комплексами: гиперчувствительность III типа ...242
Системное заболевание, вызванное
иммунными комплексами.................243
Локализованная болезнь иммунных
комплексов............................246
• Глава 10. Реакции гиперчувствительности:
опосредованная Т-клетками
гиперчувствительность замедленного типа
(IV тип)...................................249
Введение...................................249
Общие характеристики и патофизиология
гиперчувствительности замедленного типа....249
Механизмы гиперчувствительности
замедленного типа.......................249
Последствия гиперчувствительности
замедленного типа.......................251
Примеры гиперчувствительности
замедленного типа..........................251
Контактная гиперчувствительность........251
ОГЛАВЛЕНИЕ
9
Гранулематозная гиперчувствительность....253
Реакция гиперчувствительности
туберкулинового типа....................253
Отторжение аллотрансплантата.............254
Другие примеры гиперчувствительности
замедленного типа.......................254
Лечение гиперчувствительности замедленного
типа........................................255
• Глава 1 /. Иммунодефицитные
расстройства и новообразования
лимфоидной системы..........................258
Введение..................................258
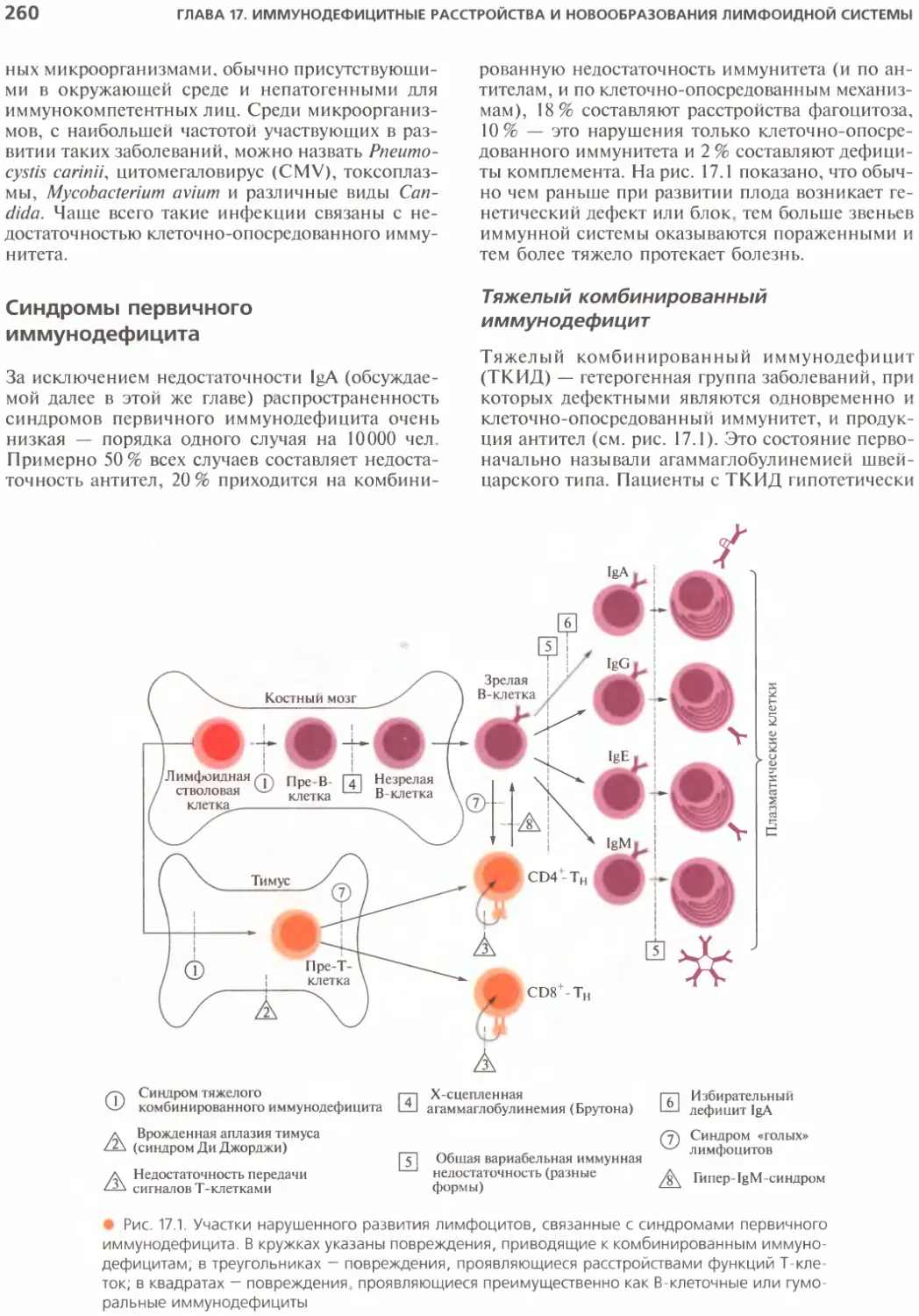
Синдромы иммунного дефицита...............259
Синдромы первичного иммунодефицита....260
Вторичные иммунодефицитные
заболевания...........................272
Синдром приобретенного иммунодефицита.....273
Общая характеристика и эпидемиология..273
Вирус иммунодефицита человека.........273
Клиническое течение...................275
Профилактика, контроль, диагностика
и терапия ВИЧ-инфекции................277
Новообразования лимфоидной системы........279
В-клеточные новообразования...........280
Т-клеточные новообразования...........283
Лимфома Ходжкина (лимфогрануломатоз) ...285
Иммунотерапия.........................285
• Глава 18. Трансплантация.................289
Введение..................................289
Взаимоотношения между донором
и реципиентом.............................289
Иммунные механизмы отторжения
аллотрансплантата.........................291
Реакции на аллоантигены и отторжение
аллотрансплантата.........................291
Сверхострое отторжение................291
Острое отторжение.....................292
Хроническое отторжение................292
Роль молекул МНС в отторжении
аллотрансплантата.........................292
Механизм распознавания аллоантигена
Т-клетками............................292
Роль цитокинов в отторжении
аллотрансплантата.....................294
Лабораторные тесты, используемые
при типировании ткани.....................294
Серологическое определение антигенов
МНС ..................................294
Генотипирование МНС...................294
Реакция смешанной культуры лейкоцитов....295
Продление сроков выживания
аллотрансплантата.........................296
Противовоспалительные лекарственные
средства..............................296
Цитотоксические лекарственные средства ...297
Препараты, препятствующие продукции
сигнальной функции цитокинов..........297
Иммуносупрессивная терапия антителами....298
Новые стратегии подавления иммунитета....298
Трансплантация костного мозга
и гемопоэтических стволовых клеток......298
Реакции «трансплантат против хозяина»...299
Ксеногенная трансплантация..............300
Плод: неотторгаемый аллотрансплантат....300
Пересадка сердца: личное воспоминание...301
• Глава 19. Иммунология опухолей........304
Введение................................304
Опухолевые антигены.....................304
Виды опухолевых антигенов...............305
Продукты генов нормальных клеток.....305
Продукты мутантных клеточных генов...306
Опухолевые антигены, кодируемые
онкогенами...........................307
Иммунологические факторы, влияющие
на частоту возникновения рака........308
Эффекторные механизмы противоопухолевого
иммунитета..............................309
В-клеточные ответы на опухоли........309
Клеточно-опосредованные реакции:
прямое разрушение опухолевых клеток
цитотоксическими Т-лимфоцитами.......309
Цитокины.............................311
Ограничение эффективности иммунного ответа
на опухоли..............................312
Иммунодиагностика.......................313
Выявление миеломных белков,
вырабатываемых опухолями
из плазматических клеток.............313
Определение у-фетопротеина...........313
Раковоэмбриональный антиген..........314
Определение простатоспецифичного
антигена.............................314
Опухолевый антиген 122...............314
Другие маркеры ......................314
Иммунопрофилактика опухолей.............314
Иммунотерапия...........................314
• Глава хи. Сопротивляемость
к инфекционным заболеваниям
и иммунизация..........................319
Введение...............................319
Защита организма
от микробных патогенов.................321
Иммунитет к вирусам.................321
Иммунитет к бактериям...............323
Иммунитет к паразитам...............324
Иммунитет к грибам .................324
Механизмы, с помощью которых патогены
избегают иммунного ответа..............325
Инкапсулированные бактерии..........325
Токсины.............................326
Суперантигены.......................326
Антигенное разнообразие.............326
Внутриклеточное выживание...........327
Подавление иммунной системы.........328
Внеклеточные ферменты...............328
Экспрессия белков, связывающих антитела ...328
Принципы иммунизации ..................328
Цели иммунизации.......................329
10
ОГЛАВЛЕНИЕ
Активная иммунизация....................329
Рекомендуемая иммунизация............329
Вакцинация отдельных групп населения .329
Основные механизмы защиты...............331
Значимость первичного и вторичного
ответов..............................331
Возраст и время иммунизации..........332
Необходимые меры предосторожности.......333
Место введения антигена..............333
Опасности............................334
Новые подходы к созданию вакцин.........335
Вакцины, разработанные с помощью
рекомбинантных ДНК...................335
Конъюгированные полисахариды.........335
Вакцины из синтезированных пептидов...335
Антиидиотипические вакцины...........336
Вакцины на основе вируса-носителя....336
Вакцины на основе бактерии-носителя..336
ДНК-вакцины..........................336
Анатоксины..........................337
Пассивная иммунизация...................337
Пассивная иммунизация посредством переноса
антител через плаценту..................337
Пассивная иммунизация через молозиво.337
Пассивная терапия с помощью антител
и сывороточная терапия..............338
Моноклональные и поликлональные
препараты...........................339
Изготовление иммунного сывороточного
глобулина человека и его свойства...339
Показания к применению
иммуноглобулина.....................340
Предосторожности при иммунотерапии...341
Колониестимулирующие факторы........341
Приложение Некоторые CD-антигены..........344
Словарь терминов..........................347
ПРЕДИСЛОВИЕ
Предлагаемое учебное пособие «Иммуноло-
гия» («Immunology. A Short Course»), предназна-
ченное для студентов медицинских и биологи-
ческих вузов, создано специалистами, которых
объединяет не только направленность научных
исследований, но и огромный педагогический
опыт: многие годы они занимались преподава-
тельской деятельностью на кафедрах микробио-
логии и иммунологии или патологии различных
университетов. А это не менее важно, чем опыт
исследовательской работы. Именно педагогиче-
ский опыт определил важнейшую установку учеб-
ного пособия — приоритет понимания сути яв-
лений и процессов над знанием фактического ма-
териала. Отсюда основная тактика авторов: не
столько углубиться в детали, сколько максималь-
но доступно изложить материал.
Все специалисты, читающие курсы лекций или
пишущие учебники по иммунологии, встречают-
ся с большими трудностями. Практически невоз-
можно излагать материал однонаправлено, линей-
но, потому что многие темы постоянно пересека-
ются. Например, проявления врожденного имму-
нитета нельзя исчерпывающе описать без анали-
за влияния на него факторов адаптивного имму-
нитета, невозможно рассказать об иммунологи-
чески значимых клетках, не упоминая связанные
с ними молекулы, и т.д. Остается путь, избран-
ный авторами учебного пособия: сначала кратко
рассказать обо всем, не вдаваясь в подробности,
и тем самым ввести читателя в круг иммунологи-
ческих идей и понятий, а затем проанализиро-
вать их более детально и полно.
Первые две главы учебного пособия как раз и
являются таким введением. В них даны определе-
ния основных понятий и обозначено фундамен-
тальное разделение иммунитета на врожденный
и приобретенный.
Блок, посвященный фундаментальным основам
иммунитета, образуют гл. 3—13. Сначала рассмат-
риваются антигены, антитела, их взаимодействия,
генетические основы разнообразия распознающих
структур. При описании взаимодействия антиге-
нов и антител читателей знакомят с иммунологи-
ческими методами и базовыми экспериментальны-
ми моделями. Далее перечислены основные типы
лимфоцитов, молекулы главного комплекса гис-
тосовместимости, цитокины, комплемент.
Главы 14 — 20 посвящены преимущественно
прикладным аспектам иммунологии (иммунопа-
тологии, трансплантации, иммуноонкологии, им-
мунизации). Особенностью данного блока явля-
ется то, что в первую очередь рассматриваются
проблемы иммунопатологии. Роли иммунитета в
противоинфекционной защите и проблемам вак-
цинации посвящена последняя глава учебного по-
собия. В этом же блоке отражены проблемы транс-
плантации и иммуноонкологии.
Материал изложен доступным языком и без
чрезмерной детализации. Отражены устоявшиеся
факты и представления, принятые научным со-
обществом. Все главы завершаются резюме, в ко-
торых сконцентрированы наиболее принципиаль-
ные положения. Также в конце глав приведены
тесты и ситуационные задачи.
Надеюсь, что данное учебное пособие поможет
студентам постичь такую сложную дисциплину, как
иммунология. Эта книга, безусловно, будет полез-
на и преподавателям, поскольку многие изложен-
ные вопросы в настоящее время рассматриваются
только в оригинальной специальной литературе.
Зав отделом клеточной иммунологии
Института иммунологии Федерального
медико-биологического агентства России.
д-р мед. наук, профессор А.А.Ярилин
ОБ АВТОРАХ
Ричард Койко (Richard Coico) — профессор,
руководитель кафедры микробиологии и имму-
нологии медицинского факультета Университета
Нью-Йорка (CUNY). Последние 8 лет преподает
курс микробиологии и иммунологии студентам-
медикам, а также аспирантам и слушателям кур-
сов помощников врачей Университета Нью-Йор-
ка. Р.Койко является президентом Ассоциации
кафедр микробиологии и иммунологии медицин-
ских факультетов (AMSMIC) и возглавляет Ко-
митет по обучению AMSM1C. В область его инте-
ресов входят исследования (геномика и протео-
мика), направленные на выявление эпитопов,
экспрессируемых некоторыми человеческими па-
тогенами, неупорядочено связывающимися с раз-
личными аллелями МНС I класса. В лаборатории
Р. Койко применяют методы компьютерной им-
мунологии (биоинформатики) и создают базы дан-
ных для изучения перспективных эпитопов, а так-
же формируют базы знаний для обмена инфор-
мацией.
Джеффри Саншайн (Geoffrey Sunshine) — ве-
дущий исследователь Кембриджского Института
воздействия на здоровье, штат Массачусетс. Об-
ласть его научных интересов включает исследо-
вания биологического воздействия различных ве-
ществ, загрязняющих воздух. Д. Саншайн препо-
дает на кафедре патологии медицинского факуль-
тета Университета Тафта. В течение нескольких
лет он читал курс иммунологии аспирантам-сто-
матологам зубоврачебного факультета Универси-
тета Тафта, а до этого — студентам ветеринарно-
го факультета Университета Тафта. Является чле-
ном Саклеровской школы биомедицинских наук
для аспирантов Университета Тафта. Д. Саншайн
проводит исследования в области презентации
антигена и преподает иммунологию студентам
старших курсов и аспирантам.
Эли Бенджамини (Eli Benjamini) — заслужен-
ный профессор в отставке. Преподавал иммуно-
логию аспирантам и студентам-медикам на кафед-
ре медицинской микробиологии и иммунологии
медицинского факультета Калифорнийского уни-
верситета в Дейвисе. В течение 10 лет являлся
председателем Программы по иммунологии для
выпускников в кампусе Дейвиса, созданию кото-
рой способствовал. В область его интересов вхо-
дят иммунология белковых антигенов, механиз-
мы иммунной регуляции и принципы создания
синтетических вакцин.
КОНСУЛЬТАНТЫ
Артуро Касадевалл (Arturo Casadevall),
д-р медицины
кафедра терапии Медицинского колледжа
Альберта Эйнштейна (Бронкс, Нью-Йорк)
Бетти Даймонд (Betty Daimond),
д-р философии
кафедра микробиологии и иммунологии
Медицинского колледжа Альберта Эйнштейна
(Бронкс, Нью-Йорк)
Сьюзан Р. С. Готтесман (Susan R. S.Gottesman),
д-р медицины, д-р философии
кафедра патологии Университета штата
Нью-Йорк, Бруклинский Центр исследований
в области здравоохранения (Бруклин, Нью-Йорк)
Линда Спате (Linda Spatz),
д-р философии
кафедра микробиологии и иммунологии
медицинского факультета Университета
Нью-Йорка (Нью-Йорк, Нью-Йорк)
ПРЕДИСЛОВИЕ К ПЯТОМУ ИЗДАНИЮ
Пятое издание «Иммунологии» подтверждает
нашу приверженность девизу «Многое в малом»
(Less is тоге), который был нашим основным прин-
ципом при работе над всеми предшествующими
изданиями. В мире науки со времени публика-
ции четвертого издания произошло множество со-
бытий (определение последовательности челове-
ческого генома, возникновение новых научных
областей, таких как геномика, протеомика и био-
информатика), и соблюдать этот принцип стано-
вится все сложнее и сложнее. Помимо новой ин-
формации мы постарались включить в книгу толь-
ко то, что, как мы считаем, необходимо знать изу-
чающему иммунологию.
С момента публикации четвертого издания
наши знания о том, как развивается и функцио-
нирует иммунная система, а также о том, какие
затрагивающие ее физиологические нарушения
могут привести к заболеванию, значительно рас-
ширились. Чтобы заключить результаты новых
исследований в книгу, мы дополнили или пере-
писали каждую главу пятого издания. Всю уста-
ревшую информацию мы исключили. Например,
вопросы толерантности и аутоиммунитета в но-
вом издании объединены и обсуждаются в одной
главе. Мы чрезвычайно признательны докторам
Линде Спате и Бетти Даймонд, которые участво-
вали в написании гл. 12 «Толерантность и ауто-
иммунитет». Мы также хотели бы поблагодарить
докторов Сьюзан Р.С. Готтесман и Артуро Каса-
девалла, которые обновили главы «Иммунодефи-
цитные расстройства и новообразования лимфо-
идной системы» и «Сопротивляемость к инфек-
ционным заболеваниям и иммунизация» соответ-
ственно. Также мы хотели бы поблагодарить док-
тора Джона П.Аткинсона (John Р.Atkinson), ра-
ботающего на медицинском факультете Вашинг-
тонского университета в Сент-Луисе, штат Мис-
сури, за рецензирование полностью переработан-
ной в данном издании главы по комплементу.
Ричард Койко хотел бы выразить признатель-
ность за любовь и постоянную поддержку со сто-
роны его семьи во время написания этой книги:
Лизе за ее вдохновляющее влияние, Джонатану
(подающему надежды писателю) и Дженифер за
их терпение и мягкий юмор. Особую благодар-
ность он выражает коллегам, которые любезно
поделились своим богатым научным опытом и
дали много полезных рекомендаций для пятого
издания: докторам Итану Шеваку (Ethan Shevach)
и Дэвиду Маргулису (David Margulies) (Нацио-
нальный институт здоровья), Ллойду Маеру (Lloyd
Mayer) и Виере Лиме (Viera Lima) (медицинский
факультет Университета Нью-Йорка). Наконец,
Ричард Койко хотел бы выразить благодарность
своим ныне покойным учителям — доктору Ро-
берту А. Гуду (Robert A. Good) — основателю со-
временной иммунологии, который приобщил его
к иммунологическим экспериментам и исследо-
ваниям природы защитных сил организма, а так-
же доктору Дж. Жанетте Торбекк (G. Jeanette Thor-
becke), которая во многом повлияла на его инте-
рес к иммунологии.
Джеффри Саншайн хотел бы поблагодарить
Питера Бродеура (Peter Brodeur) (медицинский
факультет Университета Тафта) за его помощь в
подготовке данного издания. Он также благода-
рен многочисленным друзьям и коллегам, кото-
рые отвечали на возникающие вопросы, касаю-
щиеся тех областей, в которых они специализи-
руются, особенно Марку Эксли (Mark Exley), Поле
Хокман (Paula Hochman) и Антонио да Сильва
(Antonio da Silva). Кроме того, Д. Саншайн хотел
бы поблагодарить свою жену Айлин и детей Кэро-
лайн и Алекса за их постоянную поддержку и
понимание. Он также благодарит Роберта А. Гуда
за роль, которую тот сыграл в его становлении
как ученого, когда Д. Саншайн работал научным
сотрудником в Институте доктора Гуда в Нью-
Йорке.
Авторы благодарят сотрудников компании
«John Wiley and Sons Inc.», которые помогли с
публикацией пятого издания. Особую признатель-
ность авторы выражают секретарям, референтам
и другим сотрудникам издательства, которые по-
могали в подготовке рукописи.
«ИММУНОЛОГИЯ» НА ВЕБ-САЙТЕ
Для студентов и преподавателей, пользующихся
этой книгой при обучении, был создан веб-сайт
(http://www.wiley.com/immuno-shortcourse.com).
На сайте для изучения курса on-line используют
универсальный управляющий инструмент —
WebCT. На сайте размещены:
• оглавление;
• информация об авторах;
• образец главы;
• все рисунки и таблицы, представленные
в четвертом издании;
• страница с пиктограммами с возможностью
загружать клипартовые изображения;
• наглядные и регулярно обновляемые таблицы
CD-антигенов и цитокинов;
• наглядный и регулярно обновляемый словарь
терминов;
• наглядный и регулярно обновляемый раздел
вопросов и ответов;
• ссылки на другие полезные веб-сайты.
Авторы выбрали именно WebCT в качестве
управляющего инструмента, поскольку он, несом-
ненно, является лучшим в системе Интернет-обу-
чения для высшей школы. Веб-сайт и его WebCT-
сопровождение позволяют тем, кто пользуется
пятым изданием «Иммунологии», адаптировать его
для преподавания конкретного курса.
Мы обязуемся регулярно обновлять веб-сайт в
помощь преподавателям и студентам, использую-
щим для самообразования Интернет-обучение.
Первым и главным принципом обновления этого
веб-сайта будет предоставление новейшей инфор-
мации для обучения в области иммунологии в
ясной, сжатой и удобной для студентов форме.
ПРЕДИСЛОВИЕ К ЧЕТВЕРТОМУ ИЗДАНИЮ
Со времени третьего издания были проведены
биомедицинские исследования, результаты кото-
рых позволили понять многие вопросы, касаю-
щиеся иммунной системы. Каждая глава четвер-
того издания переработана, добавлены новые све-
дения и убрана устаревшая информация. Напи-
саны несколько новых глав, в том числе посвя-
щенных цитокинам, резистентности к инфекци-
онным заболеваниям и вакцинации. Кроме того,
в гл. 5 добавлен новый подраздел, посвященный
экспериментальным системам. Это особенно ак-
туально, поскольку в биологии и медицине ис-
пользуют разнообразные экспериментальные ме-
тоды изучения иммунной системы, и важно для
понимания сути иммунологии.
Как и в первых трех изданиях, мы придержи-
ваемся девиза «Многое в малом». Поэтому при
подготовке данного издания нашей целью было
предоставление самого необходимого для введе-
ния в иммунологию материала в сжатой и легко
усваиваемой форме. Дополнительную информа-
цию для студентов и преподавателей этого курса
можно также найти на веб-сайте.
Мы глубоко признательны доктору Сьюзан
Р.С. Готтесман, которая помогла в написании гла-
вы «Иммунодефициты и другие дисфункции им-
мунной системы». Мы также признательны док-
тору Карен Я мага (Karen Yamaga), которая обно-
вила главу, посвященную аутоиммунитету. Мы
благодарим доктора Патрицию Гиклас (Patricia
Giclas), внесшую изменения в главу, посвящен-
ную комплементу, и доктора Артуро Касадевал-
ла, добавившего новую главу, посвященную ре-
зистентности к инфекционным заболеваниям и
вакцинации.
Ричард Койко хотел бы поблагодарить свою
семью за любовь и поддержку. Их стойкость, вера
и бесконечное терпение помогли в работе над
книгой. Особая благодарность выражается тем, кто
благородно поделился своими глубокими научны-
ми знаниями и дал много полезных советов авто-
рам четвертого издания: докторам Итану Шеваку
и Дэвиду Маргулису (Национальный институт
здоровья), Ллойду Маеру (Медицинская школа
горы Синай), Лакшми Тамма (Lakshmi Tamma) и
Линде Спате (медицинский факультет CUNY),
Лорел Экхардт (Laurel Eckhardt) (Колледж Ханте-
ра), Кетлин Барнс (Katheleen Barnes) (Медицин-
ская школа Джона Хопкинса), Солдано Ферроне
(Soldano Ferrone) (Институт памяти Розуэлла Пар-
ка) и Хэрриет Робинсон (Harriet Robinson) (Уни-
верситет Эмори). Наконец, Ричард Койко хотел
бы выразить признательность своим учителям —
докторам Рональду Курлею (Ronald Curley), Сью-
зан Краун (Susan Krown), Роберту А. Гуду и
Дж. Жанетте Торбекк, которые во многом повли-
яли на его приверженность выбранному пути.
Джеффри Саншайн хотел бы поблагодарить
Питера Бродеура (медицинский факультет Уни-
верситета Тафта) и Синди Теодос (Sindy Theodos)
(ветеринарный факультет Университета Тафта) за
их постоянную помощь во время подготовки дан-
ного издания. Они отрецензировали главы как в
третьем, так и в четвертом издании и помогли
сделать материал доступным для неподготовлен-
ного читателя. Он также благодарен своим друзь-
ям и коллегам, которые отвечали на вопросы по
областям, в которых являются специалистами,
особенно Марку Эксли, Сьюзан Каллед (Susan
Kalled) и Поле Хокман. Д. Саншайн хотел бы по-
благодарить свою семью за постоянную поддерж-
ку и понимание.
Авторы благодарят сотрудников компании
«John Wiley and Sons Inc.», которые помогли с
публикацией четвертого издания. Особую призна-
тельность авторы выражают секретарям, референ-
там и другим сотрудникам издательства, которые
помогали в подготовке рукописи.
Наконец, мы хотим отметить большой вклад
доктора Сиднея Лесковитца (Sidney Leskowitz) в
подготовке первых изданий книги. Главы по ги-
перчувствительности посвящаем его памяти.
ПРЕДИСЛОВИЕ К ТРЕТЬЕМУ ИЗДАНИЮ
Со времени второго издания множество иссле-
дований, проводимых учеными по всему миру,
привели к новым открытиям, изменившим наше
понимание многих аспектов деятельности иммун-
ной системы. В связи с этим каждая глава данно-
го издания была либо обновлена, либо перерабо-
тана, включены новые сведения, исключена уста-
ревшая информация.
Как и в первом, и во втором изданиях, мы оста-
лись привержены девизу «Многое в малом». Мы
постарались представить вниманию читателей са-
мый необходимый, по нашему мнению, материал
в сжатой и легко усваиваемой форме. Именно чи-
। атели и будут судить, удалось ли нам это.
Мы глубоко признательны доктору Демосте -
нису Паппагианису (Demosthenes Pappagianis),
который помог в написании главы по иммунно-
профилактике и иммунотерапии, и доктору Ка-
рен Ямага, внесшей вклад в написание главы о
механизмах контроля иммунного ответа и ауто-
иммунитете. Мы хотим поблагодарить многих со-
трудников и студентов, которые помогли в под-
готовке первого и второго изданий, и всех тех,
кто оказывал помощь в подготовке третьего изда-
ния, в частности Роберта Дж. Сцибенски (Robert
J.Scibienski), доктора медицинского факультета
Калифорнийского университета в Дейвисе, и док-
тора Донну М. Ренник (Donna М. Rennick) из Ин-
ститута исследования ДНК, Пало Альто, Кали-
форния. Джеффри Саншайн хотел бы поблаго-
дарить многих своих друзей, которые терпеливо
отвечали на его вопросы во время подготовки
третьего издания, особенно Питера Бродеура,
Марка Эксли и Полу Хокман. Д. Саншайн также
хотел бы поблагодарить свою семью за постоян-
ную помощь: Айлин за ее поддержку и участие в
общем деле, а также Алекса и Кэролайн за их
оптимизм. Свои главы он посвящает отцу Гар-
ри, который не дожил до выхода в свет нового
издания.
ПРЕДИСЛОВИЕ КО ВТОРОМУ ИЗДАНИЮ
Авторам учебников по быстро развивающим-
ся дисциплинам приходится постоянно пересмат-
ривать старый материал и добавлять новый, ко-
торый во время предыдущего издания еще не по-
лучил достаточного подтверждения, а теперь стал
важным фактом. Действительно, быстро развива-
ющаяся область иммунологии требует постоян-
ного пересмотра, что и явилось причиной данно-
го переиздания.
Во втором издании была расширена и обнов-
лена информация о многих концепциях и откры-
тиях. Были добавлены новые сведения и по та-
ким вопросам, как молекулярная биология и гены,
контролирующие синтез антител, а также пере-
ключение изотипа, дифференциация Т-клеток и
Т-рецепторов, процессирование и презентация
антигенов, цитокины и лимфокины, новые тера-
певтические подходы к лечению иммунодефицит-
ных состояний и опухолей и новые аспекты в
профилактике и иммунотерапии инфекционных
заболеваний. Кроме того, мы добавили подраз-
дел, посвященный СПИДу и некоторым методам,
таким как Вестерблот и проточная флуоресцент-
ная цитометрия. Мы также расширили глоссарий
и добавили тесты и несколько подходящих ситуа-
ционных задач.
Хотя мы сократили и убрали несколько под-
разделов, размер книги увеличился за счет рас-
ширения и добавления некоторых тем. Однако мы
заверяем читателей, что как и в первом издании,
мы придерживаемся девиза «Многое в малом» и
пытаемся представить принципы иммунологии в
сжатой и легко усваиваемой форме.
Изменения и дополнения являются постоян-
ной «головной болью» авторов, пишущих о быстро
развивающейся области науки. Студентам в связи
с этим также приходится нелегко. Они должны
быть готовы к осознанию того, что наука не сто-
ит на месте и нужно постоянно стремиться по-
знавать все новое. Пожелаем успеха и нам, и им.
ПРЕДИСЛОВИЕ К ПЕРВОМУ ИЗДАНИЮ
С какой целью была написана эта книга? По-
чему в то время, когда так много прекрасных до-
ступных и отлично иллюстрированных книг, мы
предлагаем вашему вниманию еще одну? Все очень
просто и понятно. За те 40 лет, которые мы пре-
подаем большому числу студентов различных спе-
циальностей, мы убедились, что большинство
учебных изданий не достигают своей цели
Всякий, кто год за годом общается со студен-
ыми, не может не знать о той нагрузке, которая
южится на их плечи. Во время учебы они долж-
ны освоить огромный объем материала по раз-
ным дисциплинам, который постоянно расширя-
йся. Любой студент может подтвердить вам, что
каждый преподаватель рассматривает свой пред-
мет как наиболее нужный, поэтому объем необ-
ходимого материала все растет и растет.
Другое наблюдение стало результатом много-
1сгних опросов студентов: многим из них действи-
тельно не интересна иммунология! В то время как
ня нас, практикующих иммунологов, эта дина-
мично развивающаяся наука чрезвычайно интерес-
на, для студентов иммунология — один из пяти-
шести одновременно изучаемых предметов.
Эта книга задумывалась в соответствии с выс-
казыванием архитектора Миеса ван дер Роэ (Mies
van der Rohe) «Многое в малом». В ней представ-
лены в сжатой форме только самые необходимые
сведения, чтобы каждый студент мог вынести ос-
новные принципы иммунологии и благополучно
изучить курс. Те же, кому нужны более глубокие
знания и кто интересуется этой областью, могут
найти более полные издания.
В книге соблюдены основные правила изло-
жения курса иммунологии. Она разделена на гла-
вы, отвечающие по размеру и содержанию обыч-
ным лекциям.
В начале каждой главы приведено кратное вве-
дение, а в конце резюме и тесты. Тесты составле-
ны таким образом, чтобы студенты смогли оце-
нить, насколько хорошо они изучили материал
Ответы на тесты также направлены на приобре-
тение дополнительных знаний.
Новые термины выделены полужирным кур-
сивом, поэтому их легко отыскать в тексте и за-
помнить.
Мы надеемся, что студенты, взявшие в руки
эту книгу, не падут духом от огромного количе-
ства информации, что часто случается при изуче-
нии иммунологии, а наоборот, у них появится
интерес к предмету и они выберут его для даль-
нейшего изучения.
ОБОЗНАЧЕНИЯ
CD45
Т-клеточный
рецептор
1k
Пептид
МНС
II класса
Т-клеточный
рецептор
Клеточная мембрана
ЦсВ154 Цитокин
Цитокиновый
рецептор
Тирозинкиназа
ZAP 70/Syk
Тирозинкиназа
семейства Src
г Тирозинкиназа
L цитоплазматического
белка
G-белок
Глава
ВСТУПЛЕНИЕ И ОБЗОР
• ВВЕДЕНИЕ
Любой, кому посчастливилось услышать оркестр,
блестяще исполняющий симфонию, сочиненную
одним из великих композиторов, знает, что каж-
1ый из тщательно настроенных музыкальных ин-
струментов вносит свою лепту в общий гармонич-
ный звук, создаваемый музыкантами. Правильно
настроенная иммунная система непрерывно ис-
полняет оркестрованную симфонию для поддер-
жания гомеостаза в целях защиты организма. Од-
нако, как отметил Уильям Шекспир: «мы осла-
бим струны — и сразу дисгармония возникнет»
(«Троил и Крессида»). Так и расстроенная иммун-
ная система может создать диссонанс, проявляю-
щийся аутоиммунитетом, злокачественными опу-
холями или хроническим воспалением. К счастью
ыя большинства из нас, иммунная система нахо-
штся в постоянной готовности к настройке (ре-
|улировке), чтобы обеспечить правильное пове-
(ение ее клеточных компонентов и их симбиоти-
ческое взаимодействие для организации защит-
ных иммунных реакций в целях обеспечения хо-
рошего здоровья.
В своих глубоких исследованиях ученый Л.То-
мас (£. Thomas), рассматривая симбиоз и парази-
там, описал силы, которые превратили бы все
живущее в огромный шар протоплазмы, не будь
механизмов регуляции и распознавания, позво-
ляющих отделять свое от чужого. Эти механиз-
мы возникли на заре эволюции. Многие из них
и шачально были маркерами, позволяющими
клеткам распознавать друг друга, реагировать и
и 1аимодействовать между собой для образования
< имбиотического сообщества. Например, генети-
чески родственные колонии губок, помещенные
рн юм, будут стараться расти навстречу друг дру-
гу и сольются в одну большую колонию. Нерод-
11 венные друг другу колонии будут реагировать
иначе, уничтожая чужие клетки, вступившие
контакт, и создавая полосу отчуждения между ко
лониями.
В мире растений существуют сходные спосо
бы распознавания У самоопыляющихся видо
пыльцевое зерно, попадая на рыльце генетиче
ски родственного цветка, отправляет микроспо
ру вниз по пестику, к завязи, для оплодотворе
ния. Пыльцевое зерно от генетически нерод
ственного растения либо не будет прорастать
либо, уже сформировавшись в пыльцевую тру
бочку, будет разрушено в пестике. В отличие о
этого у перекрестно опыляющихся видов пыль
цевое зерно, отмеченное как собственное, раз
рушается, в то время как чужое вызывает опло
дотворение.
Природа этих примитивных механизмов рас
познавания до конца не расшифрована, но наи
более вероятно, что в них участвуют молекулы н
поверхности клеток, способные специфическ]
связываться и прилипать к другим молекулам н
противостоящих клеточных поверхностях. Это
простой метод молекулярного распознавания с
временем эволюционировал и привел к возник
новению очень сложной иммунной системы, ко
торая сохранила в качестве основного свойств
способность белковой молекулы распознават
структуру определенной формы на другой моле
куле и специфически связываться с ней. Тако
молекулярное распознавание является базовьп
принципом, применяемым для разделения на сво
и чужое при иммунной реакции. Целью этой кни
ги и является описание того, как полностью со
зревшая иммунная система, возникшая на тако
простой основе, использует указанный принци
распознавания все более сложными и изощрен
ными способами.
В становлении иммунологии как науки можн
выделить несколько периодов медленного и ак
22
ГЛАВА 1. ВСТУПЛЕНИЕ И ОБЗОР
тивного развития. Последние обычно начинались
после введения нового метода исследования или
изменения общего подхода к предмету (парадиг-
мы). Вероятно, самым сильным катализатором
прогресса как в этой области, так и во многих
других биомедицинских областях стало появле-
ние методов молекулярной биологии Важно от-
метить, однако, что некоторые технологические
новшества в области молекулярной биологии стали
возможными благодаря предшествующему про-
грессу в иммунологии. Например, важность им-
мунологических методов (см. гл. 5), исполь-
зуемых для очистки белков и идентификации
специфических клонов комплементарных ДНК
(кДНК), не может быть переоценена. Эти до-
стижения в значительной мере предопределили
Дж. Кёлер (G.Kohler) и Ц. Мильштейн (С. Milstein)
(1975) своими замечательными исследованиями,
в которых они разработали метод производства
моноклональных антител. За достижения им при-
судили Нобелевскую премию в области медици-
ны. Это открытие привело к революции в иссле-
довательских разработках практически во всех
областях биомедицинской науки. Некоторые мо-
ноклональные антитела, вырабатываемые против
так называемых опухольспецифичных антигенов,
в настоящее время одобрены Агентством по кон-
тролю над продуктами питания и лекарственны-
ми средствами США для использования у пациен-
тов с определенными видами рака. Технология
моноклональных антител, вероятно, — самый
яркий пример ого, как иммунологическая на-
ука перешла из области медицины в другие сфе-
ры жизни, от сельского хозяйства до пищевой
промышленности.
Учитывая быстрые успехи в иммунологии и
многих других биомедицинских науках и, пожа-
луй, главный из них — определение последова-
тельности человеческого генома, любой современ-
ный учебник по биомедицинским наукам сильно
рискует устареть до того, как его отправят в пе-
чать. Однако мы утешаем себя тем, что новые
определения обычно появляются или развивают-
ся из старых, а не заменяют и не отрицают их
полностью.
В ОБЩИЙ ОБЗОР
Врожденный и приобретенный
иммунитет
Английское слово «иммунитет», которым опре-
деляют все механизмы, используемые организмом
для защиты от чужеродных агентов из окружаю-
щей среды, происходит от латинского термина
«immunis». означающего «освобожденный». Эти
агенты могут представлять собой микроорганиз-
мы или их продукты, пищевые продукты, хими-
ческие вещества, лекарства, пыльцу или чешуйки
и шерсть животных. Иммунитет может быть врож-
денным или приобретенным.
Врожденный иммунитет
Врожденный иммунитет поддерживается всеми
элементами, с которыми рождается человек и ко-
торые всегда присутствуют и по первому требова-
нию доступны для защиты организма от чужерод-
ных агрессоров. Большинство этих элементов де-
тально описаны в гл. 2. В табл. 1.1 суммируются и
сравниваются некоторые свойства врожденной и
адаптивной иммунных систем. Элементами врож-
денной системы являются оболочки тела и его
внутренние компоненты, такие как кожа и сли-
зистые оболочки, кашлевый рефлекс, которые
представляют эффективный барьер для чужерод-
ных агентов. Эффективными химическими барь-
ерами против проникновения многих микроор-
ганизмов являются кислотность (pH) и выделяе-
мые жирные кислоты Другим неклеточным эле-
ментом врожденной иммунной системы является
система комплемента. Как и в предыдущих изда-
ниях этой книги, мы рассмотрели его в отдель-
ной главе (см. гл. 13).
Существуют и другие многочисленные компо-
ненты врожденного иммунитета: лихорадка, ин-
терфероны (см. гл. И), другие вещества, высво-
бождаемые лейкоцитами, и молекулы, распозна-
ющие структуры патогенов, которые могут свя-
зываться с разными микроорганизмами (То11-по-
• Таблица 1.1. Основные свойства врожденной и адаптивной иммунных систем
Свойство Врожденная система Адаптивная система
Характеристики Антигеннеспецифическая Быстрый ответ (минуты) Нет памяти Антигенспецифическая Медленный ответ (дни) Память
Иммунные компоненты Естественные барьеры (например, кожа) Фагоциты Растворимые медиаторы (например, комплемент) Молекулы, распознающие структуры, характерные для патогенов Лимфоциты Антигенраспознающие молекулы (рецепторы В- и Т-клеток) Секретируемые молекулы (например, антитела)
ОБЩИЙ ОБЗОР
23
добные рецепторы или TLR; см. гл. 2), а также
белки сыворотки, например р-лизин, фермент ли-
зоцим, полиамины и кинины. Все перечислен-
ные элементы либо непосредственно действуют
на патогенный объект, либо усиливают реакцию
организма на него. К другим компонентам врож-
денного иммунитета относятся фагоцитирующие
клетки, такие как гранулоциты, макрофаги и мик-
роглиальные клетки центральной нервной систе-
мы (ЦНС), которые участвуют в разрушении и
удалении чужеродного материала, проникающего
сквозь физические и химические барьеры
Приобретенный иммунитет
Приобретенный иммунитет более специализиро-
ван, чем врожденный, и поддерживает защиту,
создаваемую врожденным иммунитетом. С точки
прения эволюции приобретенный иммунитет по-
является относительно поздно и имеется только у
позвоночных.
Хотя индивидуум уже рождается со способно-
стью запускать иммунный ответ на чужеродное
вторжение, приобретается иммунитет только при
контакте с вторгшимся объектом и специфичен
именно к нему; отсюда и его название — приоб-
ретенный иммунитет. Первоначальный контакт
с чужеродным агентом (иммунизация) запускает
цепь событий, которые ведут к активации лимфо-
цитов и других клеток, а также к синтезу белков,
некоторые из которых обладают специфической
реактивностью против чужеродного агента. В этом
процессе индивидуум приобретает иммунитет,
который позволяет противостоять последующей
атаке или защищает при повторной встрече с этим
же агентом.
Открытие приобретенного иммунитета опре-
(елило появление многих концепций современ-
ной медицины. В течение столетий признавалось,
ч го люди, которые не умирали от таких смертель-
но опасных заболеваний, как бубонная чума и
оспа, были в последующем более устойчивы к за-
болеванию, чем люди, которые не встречались с
ними ранее. Окончательное открытие приобре-
I с иного иммунитета приписывают английскому
врачу Э.Дженнеру (Е. Jenner), который в конце
XVIII в. экспериментально вызвал иммунитет к
оспе. Если бы Э.Дженнер проводил свой экспе-
римент сегодня, его медицинская лицензия была
бы аннулирована, а он сам стал бы подсудимым
на сенсационном судебном процессе: он ввел ма-
1снькому мальчику гной из очага поражения у
молочницы, которая болела коровьей оспой —
относительно доброкачественным заболеванием,
родственным оспе. Затем он намеренно заразил
мальчика оспой. Но контакт с возбудителем не
вызвал заболевания! В связи с защитным эффек-
юм введения возбудителя коровьей оспы (vaccinia
01 латинского слова «vacca», означающего «коро-
ва») процесс получения приобретенного иммуни-
icra был назван вакцинацией.
Теорию вакцинации или иммунизации разви-
ли Л. Пастер и П. Эрлих почти 100 лет спустя после
эксперимента Э. Дженнера. К 1900 г. стало ясно,
что иммунитет может быть вызван не только к
микроорганизмам, но и к их продуктам. Сейчас
мы знаем, что он может развиться против бесчи-
сленного количества естественных и синтетиче-
ских веществ, включая металлы, химические ве-
щества с относительно низкой молекулярной мас-
сой, углеводы, белки и нуклеотиды.
Вещество, к которому возникает иммунная
реакция, называется антигеном. Этот термин был
создан для демонстрации способности вещества
генерировать продукцию лн/интел. Конечно, в на-
стоящее время известно, что антигены могут ге-
нерировать реакции, опосредованные и антите-
лами, и Т-клетками.
Активная, пассивная
и адоптивная иммунизация
Приобретенный иммунитет индуцируется пу-
тем иммунизации, которая может достигаться не-
сколькими путями.
• Активная иммунизация — иммунизация инди-
видуума путем введения антигена.
• Пассивная иммунизация — иммунизация по-
средством переноса специфических антител от
иммунизированного к неиммунизированному
индивидууму.
• Адоптивная иммунизация — перенос иммуни-
тета путем переноса иммунных клеток.
Характеристики приобретенного
иммунного ответа
Приобретенный иммунный ответ имеет несколь-
ко общих черт, характеризующих его и отличаю-
щих от других физиологических систем, таких как
циркуляторная, респираторная и репродуктивная.
Это следующие черты:
• специфичность — это способность распознавать
определенные молекулы среди многих других и
реагировать только на них. избегая таким обра-
зом случайного недифференцированного ответа;
• адаптивность — способность реагировать на
ранее не встречавшиеся молекулы, которые в
действительности могли бы и не существовать
на Земле в естественной среде;
• распознавание между «своим» и «чужим» — глав-
ное свойство специфичности иммунного отве-
та; способность узнавать и реагировать на чу-
жеродные («чужие») молекулы и избегать ре-
акции на собственные. Это распознавание и
узнавание антигенов передается специализи-
рованными клетками (лимфоцитами), которые
несут на своей поверхности антигенспецифи-
ческие рецепторы;
24
ГЛАВА 1. ВСТУПЛЕНИЕ И ОБЗОР
• память — способность (как и у нервной систе-
мы) вспоминать предыдущий контакт с чуже-
родной молекулой и реагировать на нее уже
известным образом, однако с большими силой
и скоростью. Для описания иммунологической
памяти используют термин «анамнестический
ответ».
Когда вы дочитаете книгу до конца, вы будете
понимать клеточную и молекулярную основы
иммунного ответа.
Клетки, участвующие в приобретенном
иммунном ответе
В течение многих лет иммунология оставалась
эмпирической наукой, в которой эффекты введе-
ния различных веществ в живые организмы ис-
следовались главным образом с точки зрения по-
лучаемых продуктов. Основной прогресс был до-
стигнут с появлением количественных методов
выявления этих продуктов иммунного ответа
В 1950-х гг. после открытия того, что лимфоциты
являются клетками, играющими основную роль в
иммунном ответе, акценты в иммунологии резко
сместились и в ней выделилась новая область —
клеточная иммунология.
В настоящее время установлено, что существу-
ют три основных типа клеток, вовлеченных в при-
обретенный иммунный ответ, и для индукции
полноценного иммунного ответа необходимо
сложное взаимодействие между ними. Из них
клетки двух типов имеют общую лимфоидную
клетку-предшественник, но в дальнейшем их диф-
ференцировка идет по разным направлениям.
Одна линия клеток созревает в тимусе, и их отно-
сят к Т-клеткам. Другие созревают в костном мозге
и относятся к В-клеткам. Клетки В- и Т-лимфо-
цитарных линий различаются по многим функ-
циональным признакам, но имеют в иммунном
ответе одну важную способность, а именно: обла-
дают специфичностью относительно антигена.
Таким образом, в иммунном ответе основные
функции — распознавание и реагирование — вы-
полняют лимфоциты.
Антигенпрезентирующие клетки (АПК), такие
как макрофаги и дендритные клетки, относятся к
третьему типу клеток, участвующих в приобре-
тенном иммунном ответе. Хотя на этих клетках
нет антигенспецифических рецепторов, как у лим-
фоцитов, они выполняют важную функцию —
процессируют (перерабатывают) и презентируют
антиген специфическим рецепторам (Т-клеточ-
ным рецепторам) на Т-лимфоцитах. Антигенпре-
зентирующие клетки имеют на своей поверхно-
сти два типа специальных молекул, участвующих
в презентации антигена. Эти молекулы, называе-
мые молекулами главного комплекса гистосовмес-
тимости (major histocompatibility complex — МНС)
I и II классов, кодируются набором генов, кото-
рые отвечают также за отторжение или прижив-
ление трансплантированной ткани. Процессиро-
ванный антиген нековалентно связывается с мо-
лекулами МНС I или И класса (или обеими)
Антиген, представляемый на молекулах МНС
I класса, презентируется и участвует в активации
одной из субпопуляций Т-клеток (цитотоксиче-
ских Т-клеток), в то время как антиген, процесси-
руемый и экспрессируемый на АПК в комплексе с
молекулами МНС II класса, приводит к актива-
ции другой субпопуляции (Т-клетки-хелперы). Этот
вопрос более детально обсуждается в гл. 9.
Кроме того, в иммунных ответах участвуют и
клетки других типов, такие как нейтрофилы и
тучные клетки. В действительности, они прини-
мают участие как в реакциях врожденного, так и
приобретенного иммунитета. В основном они во-
влечены в эффекторную фазу реакции. Эти клет-
ки не способны специфически распознавать анти-
ген. Они активируются различными субстанция-
ми, называемыми цитокинами, которые высвобож-
даются другими клетками, в том числе активиро-
ванными антигенспепифическими лимфоцитами.
Клонально-селекционная теория
Поворотным пунктом в иммунологии стало рас-
пространение в 1950-е гг. дарвиновской теории
на клеточную основу специфичности при иммун-
ном ответе. Это была повсеместно принятая в
настоящее время клонально-селекционная теория.
предложенная и развитая Ерне (Jerne) и Берне-
том (Burnet) (оба лауреаты Нобелевской премии),
а также Толмеджем (Talmage). Основные посту-
латы этой теории суммируются далее.
Специфичность иммунного ответа основыва-
ется на способности его компонентов (а именно
антигенспецифичных Т- и В-лимфоцитов) распо-
знавать определенные чужеродные молекулы (ан-
тигены) и реагировать на них, чтобы устранить.
Неотъемлемой частью этой теории является не-
обходимость клональной делеции (выбраковки,
удаления) лимфоцитов, способных быть ауторе-
активными. При отсутствии такого механизма
постоянно возникали бы аутоиммунные реакции.
К счастью, лимфоциты с рецепторами, связыва-
ющимися с собственными антигенами, устраня-
ются на ранних стадиях развития, повышая та-
ким образом толерантность к структурам собствен-
ного организма (рис. 1.1).
Поскольку, как указано ранее, иммунная си-
стема способна распознавать огромное множество
чужеродных антигенов, остается выяснить, как
осуществляется реакция на какой-либо один ан-
тиген. В дополнение к уже доказанному постула-
ту, что аутореактивные клоны лимфоцитов инак-
тивируются, клонально-селекционная теория
предполагает:
• что Т- и В-лимфоциты, отличающиеся огром-
ным разнообразием специфичностей, существу-
ОБЩИЙ ОБЗОР
25
4
3
7
Антиген
Пул неаутореактивных
зрелых лимфоцитов
4
7
3
7
4
3
Стимуляция антигеном
лимфоцитарных клонов
3
7 4
Анти-3 1g
Анти-41g
Анти-7 1g
Антисыворотка к гену
• Рис. 1.1. Теория клональной селекции В-клеток, вырабатывающих антитела
ют еще до того, как произошел какой-либо
контакт с инородным антигеном;
• лимфоциты, участвующие в иммунном ответе,
имеют антигенспецифичные рецепторы на сво-
их поверхностных мембранах. В результате свя-
зывания антигена с лимфоцитом клетка акти-
вируется и высвобождает различные вещества.
В случае В-лимфоцитов рецепторами являют-
ся молекулы (антитела), обладающие той же
специфичностью, что и антитела, которые клет-
ка в дальнейшем будет производить и секрети-
ровать. Т-клетки обладают рецепторами, на-
зываемыми Т-клеточными рецепторами (Т cell
receptors — TCR). В отличие от В-клеток
Т-лимфоциты продуцируют вещества, отлича-
ющиеся от их поверхностных рецепторов и яв-
ляющиеся другими белковыми молекулами,
называемыми цитокинами. Они участвуют в
устранении антигена путем регуляции других
клеток, необходимых для организации эффек-
гивной иммунной реакции;
• каждый лимфоцит несет на своей поверхности
рецепторные молекулы только одной специ-
фичности, как показано на рис. 1.1 для В-кле-
гок, что также справедливо для Т-клеток.
В этих трех постулатах указывается на суше-
спзование широкого спектра возможных разли-
чии по специфичности, формируемых в процессе
размножения и дифференцировки до того, как
происходит какой-либо контакт с чужеродной
субстанцией, на которую должна быть реакция
В ответ на ведение чужеродного антигена из
всех имеющихся разновидностей (специфично-
стей) отбираются те, которые специфичны для
антигена и делают возможным его связывание
(см. рис. 1.1). Схема, показанная на рис. 1.1 для
В-клеток, также подходит для Т-клеток, однако
Т-клетки имеют рецепторы, не являющиеся ан-
тителами, и секретируют молекулы, не являющи-
еся антителами.
Оставшиеся постулаты клонально-селекционной
теории объясняют процесс селекции антигеном
клеток из всего репертуара доступных клеток.
• Иммунокомпетентные лимфоциты соединяют-
ся с чужеродным антигеном или его частью,
называемой эпитопом, посредством своих по-
верхностных рецепторов. В соответствующих
условиях идет стимуляция их пролиферации и
дифференцировки в клоны клеток с соответ-
ствующими идентичными рецепторами к опре-
деленной части антигена, называемой антиген-
ной детерминантой или эпитопом. У В-кле-
точных клонов это приводит к синтезу анти-
тел, имеющих совершенно одинаковую специ-
фичность Комплекс антител, секретируемых
разными клонами, составляет поликлональную
антисыворотку, способную взаимодействовать
с множеством эпитопов, представленных на
26
ГЛАВА 1. ВСТУПЛЕНИЕ И ОБЗОР
антигене. Т-клетки будут таким же образом от-
бираться соответствующими антигенами или их
участками. Каждая селектированная Т-клетка
будет активироваться, чтобы делиться и обра-
зовать клоны той же самой специфичности.
Таким образом, в клональном ответе на анти-
ген количество реагирующих клеток будет ум-
ножено, а образовавшиеся клетки будут вы-
свобождать различные цитокины. Последующий
контакт с тем же антигеном приведет к акти-
вации многих клеток или клонов той же спе-
цифичности. Вместо синтеза и высвобождения
антител, как у В-клеток, Т-клетки синтезиру-
ют и высвобождают цитокины. Эти цитокины,
являющиеся растворимыми медиаторами, осу-
ществляют свое воздействие на другие клетки,
заставляя их расти или активироваться для даль-
нейшего устранения антигена. Распознаваться
могут несколько отделенных друг от друга уча-
стков антигена (эпитопов), соответственно для
создания антител к ним будут стимулировать-
ся несколько различных клонов В-клеток, ко-
торые в свою очередь все вместе будут созда-
вать антигенспецифическую антисыворотку,
объединяющую антитела различной специфич-
ности (см. рис. 1.1). Все клоны Т-клеток, рас-
познающие различные эпитопы на том же ан-
тигене, будут активироваться для выполнения
своей функции.
Последний постулат был добавлен для объяс-
нения способности к распознаванию собственных
антигенов без возникновения реакции.
• Циркулирующие аутоантигены, попадающие в
места развития незрелых лимфоцитов до того,
как начнется определенный этап их созрева-
ния, обеспечивают «выключение» тех клеток,
которые будут специфически распознавать эти
аутоантигены и, таким образом, предотвратят
начало последующего иммунного ответа.
Сформулированная таким образом клонально-
селекционная теория оказала поистине револю-
ционное воздействие на иммунологию и измени-
ла подход к ее изучению.
Гуморальный и клеточный иммунитет
Существуют две ветви приобретенного иммунитета
с разным составом участников и различным пред-
назначением, но имеющие одну общую цель —
устранение антигена Как мы увидим в дальней-
шем, эти две ветви взаимодействуют друг с дру-
гом, чтобы достичь конечной цели — устранения
антигена. Из этих двух направлений приобретен-
ного иммунного ответа одно определяется учас-
тием в основном В-клеток и циркулирующих ан-
тител, в форме так называемого гуморального им-
мунитета (термин «гуморальный» ранее исполь-
зовали для определения жидких сред организма)
Другое направление определяется участием Т-кле-
ток, которые, как мы указывали ранее, не синте-
зируют антител, но синтезируют и высвобождают
различные цитокины, действующие на другие
клетки. В связи с этим данный вид приобретен-
ного иммунного ответа называется клеточным или
клеточно-опосредованным иммунитетом.
Гуморальный иммунитет
Гуморальный иммунитет определяется участием
сывороточных антител, которые являются белка-
ми, секретируемыми В-клеточным звеном иммун-
ной системы (см. гл. 7). Первоначально после свя-
зывания антигенов со специфическими молекула-
ми мембранного иммуноглобулина (1g) (В-кле-
точные рецепторы; В cell receptors — BCR) В-клет-
ки активируются для секреции антител, которые
экспрессируются этими клетками. По имеющим-
ся оценкам, каждая В-клетка экспрессирует при-
мерно 105 BCR совершенно одинаковой специ-
фичности. После связывания антигена В-клетка
получает сигналы на производство секретируемой
формы того иммуноглобулина, который ранее был
представлен в мембранной форме Процесс ини-
циации полномасштабной реакции с участием
антител направлен на удаление антигена из орга-
низма. Антитела представляют собой гетероген-
ную смесь сывороточных глобулинов, которые
обладают способностью самостоятельно связы-
ваться со специфичными антигенами. Все сыво-
роточные глобулины со свойствами антител от-
носят к иммуноглобулинам.
Все молекулы иммуноглобулинов имеют общие
структурные свойства, которые позволяют им:
1) распознавать и специфически связываться с уни-
кальными элементами структуры антигена (т.е. эпи-
топами)} 2) выполнять общую биологическую
функцию после соединения с антигеном. В ос-
новном, каждая молекула иммуноглобулина со-
стоит из двух идентичных легких (L) и двух тяже-
лых (Н) цепей, связанных дисульфидными мос-
тиками. Получающаяся в результате структура
показана на рис. 1.2.
Часть молекулы, которая связывается с анти-
геном, является зоной, состоящей из терминаль-
ных участков аминокислотных последовательно-
стей как на L-, так и на Н-цепях. Таким образом,
каждая молекула иммуноглобулина является сим-
метричной и способна связываться с двумя иден-
L-пепь
_ Антиген^
связывающие
участки
L-цепь
Н-цепь
Н-цепь
• Рис. 1.2. Типичная молекула антитела, состоящая из двух
тяжелых (Н) и двух легких (L) цепей Выделены антиген-
связывающие участки
ОБЩИЙ ОБЗОР
27
точными эпитопами, имеющимися на одной мо-
лекуле антигена или на разных молекулах.
Кроме различий между участками, связываю-
щими антиген, у разных молекул иммуноглобу-
лина имеются и другие различия, наиболее важ-
ные из которых касаются Н-цепей. Существует
пять основных классов Н-цепей (называемых у,
ц, а, г и 8). На основании различий в Н-цепях
молекулы иммуноглобулина были разделены на
пять основных классов: IgG, IgM, IgA, IgE и IgD,
каждый из которых характеризуется уникальны-
ми биологическими свойствами. Например, IgG
является единственным классом иммуноглобули-
нов, пересекающим плацентарный барьер и пе-
редающим материнский иммунитет плоду, в то
время как IgA — основной иммуноглобулин, об-
наруживаемый в таких секретах желез, как слеза
или слюна. Важно отметить, что антитела всех
пяти классов могут обладать совершенно одина-
ковой специфичностью по отношению к антиге-
ну (антигенсвязывающие участки), сохраняя в то
же время различные функциональные (биологи-
ческие эффекторные) свойства.
Связь между антигеном и антителом некова-
лентная, она зависит от множества относительно
слабых сил, таких как водородные связи, ван-дер-
ваальсовы силы и гидрофобные взаимодействия.
Поскольку эти силы слабы, для успешного свя-
зывания антигена с антителом требуется очень
близкий контакт на ограниченном участке, напо-
добие контакта ключа и замка.
Другим важным элементом гуморального имму-
нитета является система комплемента (см. гл. 13).
Реакция между антигеном и антителом активиру-
ет комплемент, который составляют ряд сыворо-
точных ферментов, что приводит или к лизису
мишени, или усиливает фагоцитоз (поглощение
антигена) клетками-фагоцитами. Активация ком-
племента также приводит к привлечению поли-
морфно-ядерных (ПМЯ) клеток, обладающих
высокой способностью к фагоцитозу и являющих-
ся частью врожденной иммунной системы. Эти
события обеспечивают максимально эффективный
ответ гуморальной ветви иммунитета на вторже-
ние чужеродных агентов.
Клеточно-опосредованный иммунитет
Антигенспецифичная ветвь клеточно-опосредо-
ванного иммунитета задействует Т-лимфоциты
(рис. 1.3). В отличие от В-клеток, вырабатываю-
щих растворимые антитела, которые циркулиру-
ют для связывания соответствующих специфич-
ных антигенов, каждая Т-клетка, несущая множе-
ство идентичных антигенных рецепторов, назы-
ваемых TCR (около 105 на клетку), сама направ-
1яется непосредственно к месту, где на АПК экс-
прессируется антиген, и взаимодействует с ней в
б шзком (непосредственно межклеточном) контак-
IC (см. гл. 10).
Иммуноглобулин TCR
м- •
В-лимфоцит Т-лимфоцит
• Рис. 1.3. Рецепторы для антигена, экспрессируемые как
трасмембранные молекулы на В- и Т-лимфоцитах
Существует несколько различающихся по фе-
нотипу субпопуляций Т-клеток, каждая из кото-
рых может обладать одинаковой специфично-
стью по отношению к антигенной детерминанте
(эпитопу), но при этом выполнять различные
функции. В данном случае можно провести ана-
логию с разными классами молекул иммуногло-
булинов, которые обладают одинаковой специ-
фичностью, но различными биологическими
функциями. Имеются две субпопуляции Т-кле-
ток: Т-клетки-хелперы (Тн-клетки), которые экс-
прессируют молекулы CD4, и цитотоксические
Т-клетки (Тс-клетки), которые экспрессируют
молекулы CD8 на своей поверхности.
Разным субпопуляциям Тн-клеток приписыва-
ют различные функции.
• Взаимодействие с В-клетками для увеличения
продукции антител. Такие Т-клетки действуют
путем высвобождения цитокинов, которые
обеспечивают подачу различных активирующих
сигналов В-клеткам. Как указывалось ранее,
цитокины являются растворимыми вещества-
ми или медиаторами, высвобождаемыми клет-
ками; такие медиаторы, высвобождаемые лим-
фоцитами, называются лимфокинами. Группе
цитокинов с низкой молекулярной массой дали
название хемокины. Они, как указывается да-
лее, участвуют в воспалительной реакции. До-
полнительная информация о цитокинах пред-
ставлена в гл. 11.
• Участие в реакциях воспаления. После актива-
ции определенная субпопуляция Т-клеток вы-
свобождает цитокины, индуцируя миграцию и
активацию моноцитов и макрофагов, что при-
водит к возникновению так называемых вос-
палительных реакций гиперчувствительности
замедленного типа (см. гл. 16). Эту субпопуля-
цию Т-клеток, участвующих в реакции гипер-
чувствительности замедленного типа (ГЗТ).
иногда называют Тгзт или просто Тн.
• Цитотоксические эффекты. Т-клетки особой
субпопуляции становятся цитотоксическими
клетками-киллерами, которые при контакте со
своей мишенью способны нанести удар, веду-
щий к гибели клетки-мишени. Эти Т-клетки
28
ГЛАВА 1. ВСТУПЛЕНИЕ И ОБЗОР
называют цитотоксическими Т-клетками (Тс).
В отличие от Тн-клеток они экспрессируют
молекулы CD8 на своих мембранах и поэтому
называются СВ8+-клетками.
• Регуляторные эффекты. Хелперные Т-клетки
могут быть разделены на две различные функ-
циональные подгруппы в соответствии с цито-
кинами, которые они высвобождают. Как вы
узнаете из следующих глав, эти субпопуляции
(Тн1 и Тн2) обладают различными регулятор-
ными свойствами, которые передаются посред-
ством высвобождаемых ими цитокинов (см.
гл. И). Более того, Тн1-клетки могут негатив-
но перекрестно влиять на Тн2-клетки, и на-
оборот. У другой популяции регуляторных или
Т-клеток-супрессоров отмечается коэкспрессия
CD4 и CD25 (CD25 является a-цепью рецеп-
тора интелейкина-2 (см. гл. 11). Регуляторная
активность этих СВ4+/СВ25+-клеток и их роль
в активном подавлении аутоиммунитета обсуж-
дается в гл. 12.
• Эффекты цитокинов. Т-клетки и другие клет-
ки иммунной системы (например, макрофаги)
оказывают различное воздействие на многие
клетки, лимфоидные и нелимфоидные, посред-
ством разных цитокинов, которые они высво-
бождают. Таким образом, прямо или косвенно
Т-клетки связываются и взаимодействуют с
множеством типов клеток.
В результате многолетних иммунологических
исследований было установлено, что клетки, ак-
тивированные антигеном, проявляют целый ряд
эффекторных способностей. Однако только за
последние несколько десятилетий иммунологи
стали осознавать всю сложность событий, кото-
рые происходят при активации клеток антигеном
и при их взаимодействии с другими клетками. Мы
теперь знаем, что простой контакт Т-клеточного
рецептора с антигеном недостаточен для актива-
ции клетки. В действительности для активации
антигенспецифичной Т-клетки должны быть даны
по крайней мере два сигнала. Первый сигнал обес-
печивается связыванием Т-клеточного рецептора
с антигеном, который должен быть соответству-
ющим образом презентирован АПК. Второй сиг-
нал определяется участием костимуляторов, сре-
ди которых имеются определенные цитокины,
такие как IL-1, IL-4, IL-6 (см. гл. 11), и поверх-
ностные молекулы, экспрессированные на АПК,
такие как CD40 и CD86 (см. гл. 10). В последнее
время под термином «костимулятор» стали под-
разумевать и другие стимулы, например продук-
ты жизнедеятельности микроорганизмов (инфек-
ционные, чужеродные) и поврежденная ткань
(«гипотеза опасности» П.Матзингера (Р. Matzin-
ger)), которые будут усиливать первый сигнал, если
он относительно слаб. Как только Т-клетки по-
лучают достаточно четкий сигнал для активации,
происходит ряд событий, и активированная клет-
ка синтезирует и высвобождает цитокины. В свою
очередь эти цитокины контактируют с опре-
деленными рецепторами на различных клетках и
воздействуют на эти клетки.
Хотя обе, гуморальная и клеточная, ветви им-
мунного ответа рассматриваются как самостоя-
тельные и отличные друг от друга компоненты,
важно понимать, что реакция на любой специ-
фический патоген может предусматривать слож-
ное взаимодействие между ними, а также участие
элементов врожденного иммунитета. Все это на-
целено на обеспечение достижения максимально
возможного выживания организма за счет удале-
ния антигена и, как мы увидим далее, защиты
организма от аутоиммунного ответа на собствен-
ные структуры.
Проявление разнообразия
в иммунном ответе
Последние достижения в иммунологических ис-
следованиях обусловлены союзом молекулярной
биологии и иммунологии. Благодаря тому что
клеточная иммунология смогла выявить на кле-
точном уровне суть многочисленных и различных
по спектру реакций, а также природу процессов,
позволяющих достичь уникальной специфично-
сти, появилось множество соображений относи-
тельно реальных генетических механизмов, кото-
рые позволяют всем этим специфичностям стать
частью репертуара у каждого представителя дан-
ного вида.
Вкратце эти соображения таковы.
• По различным подсчетам число специфичных
антигенов, к которым может возникать иммун-
ный ответ, способно достигать 106—107.
• Если каждый специфичный ответ, как анти-
тельный, так и Т-клеточный, определяется од-
ним геном, означает ли это, что каждому ин-
дивидууму потребуется более 107 генов (один
на каждое специфичное антитело)? Каким об-
разом этот массив ДНК передается неповреж-
денным от индивида к индивиду?
На этот вопрос позволили ответить новатор-
ские изыскания, проведенные С.Тонегавой (S.To-
negawa) (лауреат Нобелевской премии) и Ф. Леде-
ром (Ph. Leder), в которых были использованы ме-
тоды молекулярной биологии. Эти исследовате-
ли описали уникальный генетический механизм,
с помощью которого иммунологические рецеп-
торы, экспрессированные на В-клетках и отлича-
ющиеся огромным разнообразием, могут созда-
ваться на базе относительно небольшого количе-
ства ДНК, предназначенного для этой пели.
Природа создала технологию генных рекомби-
наций, при которой белок может кодироваться
молекулой ДНК. составленной из набора реком-
бинируемых (переставляемых) мини-генов, кото-
рые и составляют полный ген. На основе неболь-
шого набора таких мини-генов, способных сво-
ОБЩИЙ ОБЗОР
29
бодно комбинироваться для создания целого гена,
можно получить огромный репертуар специфично-
стей, используя ограниченное число генных фраг-
ментов. (Детально вопрос обсуждается в гл. 6.)
Первоначально этот механизм был призван объ-
яснить существование огромного разнообразия
антител, которые не только секретируются В-клет-
ками, но также фактически составляют антиген-
или эпитопспецифичные рецепторы В-клеток.
Впоследствии было установлено, что подобные ме-
ханизмы отвечают и за разнообразие антигенспе-
цифичных Т-клеточных рецепторов (TCR). Ме-
ханизмы, определяющие возникновение различий
среди В-клеточных рецепторов и антител, описа-
ны в гл. 6. Механизмы, определяющие различия
между Т-клеточными рецепторами, описаны в гл.
8. Достаточно сказать, что существование различ-
ных методов молекулярной биологии, позволяю-
щих не только исследовать гены, но и произволь-
но перемещать их из одной клетки в другую, обес-
печивает быстрый дальнейший прогресс в имму-
нологии.
Успехи иммунологии
Хотя мы до сих пор рассматривали теоретические
аспекты иммунологии, ее практическое примене-
ние имеет первостепенное значение для выжива-
ния человека и должно изучаться в процессе под-
। отовки студентов-медиков.
Иммунология оказалась в центре внимания
человечества после успешного применения вак-
цин против полиомиелита в середине XX в. В бо-
iee позднее время внимание привлекли впечатля-
ющие трансплантации человеческого сердца и дру-
I их крупных органов, таких, например, как печень.
11убличный интерес к иммунологии был подогрет
возможностью применения иммунного ответа для
щагностики и борьбы с раком; а в 1980-х гг. лю-
1ям пришлось ознакомиться с некоторыми аспек-
гами иммунологии в связи с быстрым распро-
странением СПИДа.
Системы врожденного и приобретенного им-
мунитета играют существенную роль в предот-
вращении и излечении от инфекционных заво-
еваний и, несомненно, являются определяющи-
ми для выживания человека. В начале XIX в.
И. И. Мечников впервые высказал предположение,
что клетки-фагоциты составляют первую линию
оСюроны против инфекции и что воспалительная
реакция в действительности помогает защите орга-
ни ша. В самом деле, реакции врожденного им-
мунного ответа несут ответственность за распо-
шавание и быстрое разрушение большинства ин-
фицирующих агентов, с которыми люди встреча-
йся в повседневной жизни. Теперь мы знаем,
чю реакции врожденного иммунного ответа дей-
к 1вуют одновременно с реакциями адаптивного
иммунного ответа, в результате чего вырабатыва-
йся антигенспецифичные эффекторные механиз-
мы, посредством которых происходит разрушение
и выведение инфицирующего патогена. В гл. 20
приведена информация о том, как иммунные си-
стемы реагируют на микроорганизмы и каким
образом методы, разработанные для включения
этих механизмов, могут быть использованы для
иммунопрофилактики Эффективной формой про-
филактики явилась вакцинация против инфекци-
онных болезней. Иммунопрофилактика против
вируса полиомиелита привела к тому, что он пе-
рестал представлять серьезную опасность во мно-
гих частях света, а после вакцинации против оспы
эта широко распространенная ранее болезнь во-
обще исчезла с лица Земли. Последний случай
естественной передачи вируса оспы был офици-
ально зарегистрирован в 1972 г. К сожалению, уг-
роза биологической войны заставляет задуматься
о вероятности возвращения из небытия ряда ин-
фекционных заболеваний, включая оспу. К сча-
стью, имеются возможности проведения широкой
вакцинации людей для устранения или уменьше-
ния опасности применения микробиологических
агентов в качестве оружия.
Последние достижения в иммунологии также
дали надежду на успешную иммунопрофилакти-
ку малярии и некоторых других паразитарных
болезней, поражающих миллионы людей в раз-
ных частях света. С помощью вакцинации домаш-
них животных можно увеличить производство
мяса в развивающихся странах. В то же время вак-
цинация против определенных веществ, участву-
ющих в репродуктивных процессах у млекопита-
ющих, дает возможность осуществлять длитель-
ную контрацепцию как у человека, так и у живу-
щих с ним животных, таких как кошки и собаки.
Повреждающие эффекты
иммунного ответа
Огромное значение иммунного ответа для выжи-
вания человека очевидно. Приобретенный имму-
нитет направлен против инородного агента, его
целью является устранение чужеродной субстан-
ции. В процессе иммунного ответа из-за накоп-
ления компонентов с неспецифическим действи-
ем могут пострадать некоторые ткани организма
Обычно такое повреждение носит временный ха-
рактер. После устранения агрессора ситуация бы-
стро возвращается к норме
Однако бывают случаи, когда выраженный
иммунный ответ, направленный против попавшей
в организм инородной субстанции (такой как ле-
карство, вдыхаемые частицы пыльцы или веще-
ства, попадающие в организм при укусах насеко-
мых), приводит к тяжелым патологическим по-
следствиям или даже смерти. Подобные проявле-
ния называют реакциями гиперчувствительности
или аллергическими реакциями. Понимание ос-
новных механизмов, лежащих в основе этих про-
цессов, имеет фундаментальное значение для их
30
ГЛАВА 1. ВСТУПЛЕНИЕ И ОБЗОР
лечения и контроля над ними и, кроме того, рас-
ширяет наши знания о естественном иммунном
ответе. Данное утверждение справедливо, посколь-
ку в обоих случаях задействованы одинаковые
механизмы, однако в случае гиперчувствительно-
сти эти механизмы направлены не в ту сторону
или выходят из-под контроля.
Реакции гиперчувствительности различают в
соответствии с эффекторами, вовлеченными в них.
Один тип этих реакций характеризуется участием
антител; такая реакция может быть воспроизве-
дена у другого индивидуума с помощью соответ-
ствующего количества и типа антител в сыворот-
ке крови. Данный тип реакций в свою очередь
подразделяется на три класса в зависимости от
специфики определяющих их механизмов, вклю-
чающих или тучные клетки, или комплемент и
нейтрофилы. Подобные реакции характеризуют-
ся быстротой возникновения и развиваются в пе-
риод от нескольких минут до нескольких часов
после контакта с антигеном, поэтому их обычно
относят к реакциям гиперчувствительности немед-
ленного типа (реакции гиперчувствительности
описаны в гл. 14— 16).
Второй большой тип реакций гиперчувстви-
тельности в основном опосредуется Т-клетками с
последующим вовлечением моноцитов и, соответ-
ственно, называется клеточно-опосредованным
иммунитетом. Такие реакции более отсрочены во
времени. Обычно они достигают максимума че-
рез 18 —24 ч и традиционно относятся к реакци-
ям ГЗТ. В отличие от реакций гиперчувствитель-
ности, опосредованных антителом, которые могут
переноситься от чувствительного индивидуума не-
чувствительному с помощью сыворотки, реакции
ГЗТ могут быть переданы только Т-клетками.
Следует еще раз подчеркнуть, что все эти ре-
акции гиперчувствительности дублируют нормаль-
ные реакции, поскольку те же механизмы могут
быть задействованы для защиты организма от чу-
жеродного агента. Только в том случае, если из-
менена точка приложения реакций или отрица-
тельные последствия для организма чересчур вы-
ражены, их называют реакциями гиперчувстви-
тельности.
Регуляция иммунного ответа
Учитывая сложность иммунного ответа и его спо-
собность вызывать повреждения, становится оче-
видным, что он должен осуществляться в услови-
ях четкой регуляции, как и любая другая физио-
логическая система. Механизмы подобного конт-
роля многочисленны и включают ингибирование
по типу обратной связи, в которой участвуют рас-
творимые вещества, а также разные типы меж-
клеточных взаимодействий, которые могут либо
усилить, либо ослабить реакцию. Конечной це-
лью является поддержание гомеостаза таким об-
разом, чтобы реакция, возникающая после вне-
дрения инородного агента, была достаточной для
его устранения, после чего система приходила бы
в равновесие, иными словами — иммунный ответ
прекращался. Однако память о данном агрессоре
сохраняется, что обеспечивает более быстрый и
сильный ответ при повторной встрече с ним.
Нарушения в этих регуляторных механизмах
могут быть вызваны такими условиями, как врож-
денные дефекты, гормональные нарушения или
инфекция; каждое из них может привести к ката-
строфическим последствиям. В качестве примера
уместно привести СПИД, поскольку при нем ин-
фицируются Т-лимфоциты, участвующие в регу-
ляции иммунного ответа. В результате заражения
вирусом иммунодефицита человека (ВИЧ), кото-
рый вызывает СПИД, уменьшается количество и
снижается функциональная активность одной из
субпопуляций Т-клеток, что делает пациента без-
защитным перед инфекциями, вызываемыми
обычно непатогенными микроорганизмами.
Важная форма регуляции касается предотвра-
щения иммунных реакций против собственных
антигенов. По разным причинам подобная регу-
ляция может оказаться нарушенной, что приве-
дет к развитию реакции против собственных струк-
тур. Этот тип иммунного ответа называется ауто-
иммунитетом. Он является причиной таких за-
болеваний, как некоторые формы артрита, тирео-
идита и диабета, очень трудно поддающихся ле-
чению
Будущее иммунологии
Студенту, заглянувшему в будущее иммунологии,
откроется много захватывающих перспектив. Пер-
вую роль будут играть применение методов моле-
кулярной биологии и компьютерные технологии.
Давайте рассмотрим лишь некоторые примеры,
такие как разработка вакцин и регуляция иммун-
ного ответа. Так, в противовес тяжкому эмпири-
ческому подбору аттенуированных вирусов или
бактерий, пригодных для иммунизации, в насто-
ящее время можно использовать данные о пато-
генспецифичной последовательности белка и при-
менять изощренные компьютерные методы для
выявления иммуногенных пептидов, пригодных
для тестирования в качестве вакцин. Помимо этого
ДНК-вакцины, содержащие ДНК-векторы, коди-
рующие иммуногенные белки, могут полностью
изменить протоколы вакцинации в недалеком
будущем. Идентификация различных генов и бел-
ков или их частей (пептидов), кодируемых этими
генами, делает возможным конструировать вак-
цины, направленные к широкому спектру биоло-
гически важных соединений.
Другим перспективным направлением являет-
ся синтез и описание характеристик цитокинов,
контролирующих активацию различных клеток,
связанных с иммунным ответом, а также с други-
ми функциями организма. Методы выделения
ОБЩИЙ ОБЗОР
31
гена, репродукции клонов, цепная полимеразная
реакция и биосинтез также способствовали быст-
рому развитию иммунологии. С помощью техно-
логий применения рекомбинантной ДНК были
синтезированы имеющие большое значение силь-
ные модуляторы, исследуемые в настоящее время
на предмет терапевтической эффективности при
различных заболеваниях, включая многие разно-
видности опухолей. Иногда исследования цито-
кинов проводятся уже не в лабораториях, а на
самих больных, поскольку на основе некоторых
цитокинов созданы лекарственные препараты.
И, наконец, вероятно, одной из наиболее ин-
тересных является технология по генетическому
проектированию разных клеток и даже целых
животных, например мышей, у которых отсутству-
ет один или несколько специфических призна-
ков («нокаут» гена) или присутствует особый при-
знак (перенос гена, трансген). Эти и другие экс-
периментальные системы, основанные на имму-
нитете, будут описаны в гл. 5. Они позволяют им-
мунологам изучать воздействия таких признаков
на иммунную систему и организм в целом, для
loro чтобы можно было понять сложную регуля-
цию, экспрессию и функцию иммунного ответа и
достичь конечной цели — контроля признака во
благо индивидуума. Таким образом, наши увели-
чивающиеся знания о том, как функционирует им-
мунная система, вместе с недавно открытой воз-
можностью изменять ее компоненты и манипу-
шровать ими несут в себе огромные возможное -
। и для будущего человечества.
В следующих главах мы более детально опи-
шем способы функционирования иммунной си-
С1смы, начиная с ее клеточных компонентов. За-
йм рассмотрим вещества, принимающие участие
и реакциях и общую методологию оценки этих
реакций. Дальнейшие главы посвящены форми-
рованию и активации клеточных и молекулярных
компонентов иммунной системы, необходимых
11Я начала реакции. Завершит описание основ-
ной природы иммунитета обсуждение механиз-
мов контроля, регулирующих направление и ин-
тенсивность иммунных реакций В первой полови-
не книги приведена глава о цитокинах и рас-
творимых медиаторах, регулирующих иммунный
ответ и играющих важную роль в гемопоэзе. За
ней следуют главы, касающиеся большого числа
различных болезней с вовлечением иммунологи-
ческих компонентов. Описываемые болезни обу-
словлены как неэффективностью или отсутстви-
ем иммунитета (иммунодефицит) и дискоордини-
рованными (аберрантными) иммунными реакци-
ями (гиперчувствительность), так и реакциями на
собственные антигены (аутоиммунитет) Следую-
щие главы посвящены описанию роли иммунно-
го ответа при трансплантации и противоопухоле-
вым реакциям. В последней главе основное вни-
мание уделяется спектру микроорганизмов, бро-
сающих вызов иммунной системе, и тому, как для
защиты организма от инфекционных заболеваний
запускается чувствительный, хорошо скоордини-
рованный иммунный ответ. Обсуждается и имму-
нопрофилактика с использованием вакцин для
защиты от разнообразных патогенных организмов.
Несомненно, что успешное использование вак-
цин способствовало коренным изменениям в об-
ласти медицины в XX в. В свою очередь, в XXI в.
будут нужны дальнейшие научные исследования
по созданию крайне необходимых вакцин против
уже существующих в природе вирусов, микроор-
ганизмов, появившихся не так давно (наиболее
известен ВИЧ), и против новых, созданных в ка-
честве вероятного биологического оружия, или
еще не идентифицированных.
Изучив данный учебник, можно получить об-
щее, если не сказать — широкое, понимание сущ-
ности иммунного ответа. Для этого мы описали
фундаментальные элементы и основные концеп-
ции иммунологии, объединив в одной книге об-
ширные знания в области предмета. Если чита-
тель заинтересуется более узкими вопросами, чем
те, которые рассмотрены в этом издании, он мо-
жет обратиться к современным книгам, статьям,
обзорам и обучающим сайтам, один из которых
поддерживает данный учебник (см. предисловие).
Глава
ЭЛЕМЕНТЫ ВРОЖДЕННОГО
И ПРИОБРЕТЕННОГО ИММУНИТЕТА
• ВВЕДЕНИЕ
Каждый живой организм противостоит посто-
янным попыткам вторжения из окружающей его
внешней среды Наша иммунная система осна-
щена сетью механизмов для охраны от инфек-
ционных микроорганизмов, которые иначе мог-
ли бы использовать наши тела для своего соб-
ственного выживания. Можно сказать, что им-
мунная система возникла как система надзора,
готовая запускать и поддерживать защитные ре-
акции практически против любого опасного чу-
жеродного элемента, с которым мы можем встре-
титься.
Эти защитные механизмы простираются от
физических барьеров, таких как кожа, до край-
не сложных систем, таких как приобретенный
иммунный ответ. В этой главе описаны меха-
низмы защиты: элементы, составляющие ее,
органы и клетки, участвующие в ней, а также
действия участников в иммунной реакции на
чужеродные субстанции, проникающие в орга-
низм.
У позвоночных иммунитет против микроор-
ганизмов и их продуктов или других чужерод-
ных субстанций, которые могут проникать в орга-
низм, подразделяется на два основных вида:
врожденный, или неспецифический, и приобретен-
ный, или адаптивный.
Эти два вида иммунитета, их происхождение,
компоненты и взаимодействия и обсуждаются в
данной главе.
В данной и последующих главах наглядно
показано, что врожденные иммунные реакции
важны не только потому, что они представля-
ют собой независимую ветвь иммунной систе-
мы, но и потому, что эти реакции кардинально
влияют на характер адаптивных иммунных ре-
акций.
В ВРОЖДЕННЫЙ ИММУНИТЕТ
Врожденный иммунитет существует с рождения и
состоит из многих факторов, которые относитель-
но неспецифичны, т.е. действуют против почти всех
веществ, угрожающих организму. Его принципи-
альная роль — обеспечение ранней неспецифичес-
кой первой линии защиты против патогенов. Боль-
шинство микроорганизмов, с которыми повседнев-
но встречается здоровый индивидуум, выявляются
и уничтожаются в течение минут или часов врож-
денными защитными механизмами.
Врожденный иммунитет связан со многими
индивидуальными свойствами, определенными на
генетическом уровне. Различия во врожденном
иммунитете у разных людей могут, кроме того,
зависеть от возраста, расы, гормонального и ме-
таболического статуса. В данном подразделе опи-
сываются главные клеточные, неклеточные и ре-
цепторные компоненты врожденного иммуните-
та, которые могут служить важной основой для
последующего обсуждения связей между врожден-
ным и адаптивным иммунитетом
Физические и химические барьеры
Большинство организмов и чужеродных субстан-
ций не в состоянии проникнуть через неповреж-
денную кожу, но могут попасть внутрь тела, если
она повреждена. Некоторые организмы могут про-
никать через сальные железы и волосяные фол-
ликулы. Однако низкий pH пота и секрета саль-
ных желез, а также наличие различных жирных
кислот и гидролитических ферментов (например.
лизоцимов), обладающих определенным антимик-
робным действием, уменьшают значимость этого
пути проникновения инфекции. Кроме того, рас-
творимые протеины, такие как интерфероны и
ВРОЖДЕННЫЙ ИММУНИТЕТ
33
определенные компоненты системы комплемен-
та. обнаруживаемые в сыворотке (см. гл. 13), уча-
ствуют в работе неспецифического иммунитета.
Интерфероны — это группа протеинов, выраба-
1ываемых клетками в ответ на вирусную инфек-
цию, которые, по существу, приводят окружаю-
щие клетки в состояние генерализованной про-
1ивовирусной защиты (см. гл. 11). Активация ком-
понентов комплемента в ответ на поступление оп-
ределенных микроорганизмов приводит к конт-
ролируемому энзиматическому каскаду, который
направлен на разрушение мембраны патогенных
м и кроорганизмов.
Во врожденном иммунитете важным механиз-
мом защиты многих участков организма, включая
(ыхательный и желудочно-кишечный (ЖКТ) трак-
ты, является слизистая оболочка, покрывающая
поверхности этих участков. Она является барьером,
улавливающим микроорганизмы, которые затем
выносятся цилиарными эпителиальными клетками
в сторону наружного отверстия. Волосы в носовых
проходах и кашлевый рефлекс также способствуют
предотвращению инфицирования микроорганизма-
ми респираторного тракта. Алкоголь, курение и
наркотики подавляют всю эту защитную систему.
Альвеолярные макрофаги также удаляют мик-
роорганизмы из респираторного тракта. Они, как
видно далее, являются фагоцитирующими клет-
ками, способными захватывать и уничтожать не-
которые микроорганизмы. Другие микроорганиз-
мы, которые проникают сквозь барьер слизистой
оболочки, могут быть захвачены макрофагами или
Потентная
стволовая клетка
Т-зависимые
области лимфа-
тических узлов
и селезенки
В-клеточные
области лимфа-
тических узлов,
селезенки,
пейеровых
бляшек
и миндалин
Макрофаг
Тучная
клетка
Дендритная
клетка
• Рис. 2.1. Путь развития различных типов клеток из потентной стволовой клетки костного мозга
34
ГЛАВА 2. ЭЛЕМЕНТЫ ВРОЖДЕННОГО И ПРИОБРЕТЕННОГО ИММУНИТЕТА
• Рис. 2.2. Эндоцитоз и фагоцитоз, осуществляемые макрофагами
иным способом перенесены в лимфатические
узлы, где многие из них уничтожаются.
Среда в ЖКТ враждебна для многих микроор-
ганизмов благодаря таким врожденным механиз-
мам, как гидролитические ферменты в слюне,
низкий pH в желудке и протеолитические фер-
менты и желчь в тонком кишечнике. Низкий pH
во влагалище выполняет ту же функцию.
Клеточная защита
Если микроорганизм-агрессор преодолевает раз-
личные физические и химические барьеры, он
встречается со следующей линией обороны, со-
стоящей из специализированных клеток, целью
которых является его уничтожение. Существует
несколько типов клеток, выполняющих эту функ-
цию. Пути развития гемопоэтических клеток и
взаимодействие между разными типами клеток,
которые будут обсуждаться в данной и последую-
щих главах, представлены на рис. 2.1.
Фагоцитоз и внеклеточный киллинг
Как часть врожденной иммунной системы орга-
низм выработал защиту, осуществляемую посред-
ством специализированных клеток, которые унич-
тожают проникающие микроорганизмы, сначала
заглатывая их, а затем разрушая (фагоцитоз), или
убивая вне клетки (без заглатывания)
Эндоцитоз и фагоцитоз
Два врожденных иммунных механизма вызывают
интернализацию чужеродных макромолекул и
клеток и могут привести к их внутриклеточному
разрушению и удалению. Происходящие при этом
процессы называют эндоцитозом и фагоцитозом.
Эндоцитоз
Эндоцитоз — это процесс, посредством которого
макромолекулы, находящиеся во внеклеточной
тканевой жидкости, заглатываются клетками. Он
может осуществляться посредством или пиноци-
тоза, при котором происходит неспецифическая
инвагинация мембраны, или через опосредован-
ный рецептором эндоцитоз — процесс, включаю-
щий селективное (избирательное) связывание
макромолекул со специфичными рецепторами
мембраны. В обоих случаях заглатывание чуже-
родных молекул приводит к появлению эндоци-
тозных пузырьков, наполненных чужеродным ма-
териалом, которые затем сливаются с эндо-
ВРОЖДЕННЫЙ ИММУНИТЕТ
35
плазматическими тельцами с кислым содержи-
мым, называемыми эндосомами. В свою очередь
эндосомы сливаются с лизосомами, содержащи-
ми ферменты (т.е. нуклеазы, липазы, протеазы),
чтобы расщепить проглоченные макромолекулы
до небольших продуктов распада, включающих
нуклеотиды, сахара и пептиды (рис. 2.2).
Фагоцитоз
Фагоцитоз — это поглощение отдельными клет-
ками агрессивных чужеродных агентов, таких как
бактерии. Это основной защитный механизм им-
мунной системы. Многие микроорганизмы вы-
свобождают вещества, привлекающие клетки-фа-
гоциты Фагоцитоз может быть усилен рядом фак-
торов, которые делают чужеродный агент более
легкой мишенью. Все эти факторы называют оп-
сонинами (от греческого слова, означающего «го-
товить пишу»); к ним относят антитела и раз-
личные сывороточные компоненты комплемента
(см. гл. 13). После захвата инородная частица за-
ключается в фагоцитарную вакуоль (фагосому).
которая сливается с лизосомой, формируя фаго-
лизосому (см. рис. 2.2). Из лизосом высвобожда-
ются активные ферменты, которые переваривают
частицу.
Фагоциты также могут повреждать внедрив-
шиеся патогены, производя токсические вещества
во время процесса, называемого респираторным
взрывом. Эти токсические метаболиты начинают
вырабатываться во время фагоцитоза патогенов,
таких как бактерии, и катализируются рядом вза-
имосвязанных ферментных процессов. Наиболее
важными из токсических метаболитов являются
окись азота (индуцибельная NO-синтаза), пере-
кись водорода и супероксидный анион (фагоци-
• Рис. 2.3. Полиморфно-ядерный лейкоцит (окруженный
эритроцитами в мазке крови) с трехдольчатым ядром и
цитоплазматическими гранулами (х950) (с любезного
разрешения д-ра AC Enders, School of Medicine, University
of California at Davis)
тарная НАДФН-оксидаза), а также хлорноватис-
тая кислота (миелопероксидаза). Каждый из них
является токсичным для бактерий. Эти микроби-
цидные продукты могут повреждать и клетки орга-
низма. К счастью, ряд защитных энзимов, выра-
батываемых фагоцитами, контролируют действия
этих веществ, так что их микробицидная ак-
тивность в основном ограничена фаголизосомой
(т.е. слившимися фагосомой и лизосомой — см.
рис. 2.2), и таким образом направляют токсиче-
ское действие на захваченные патогены. К этим
защитным ферментам относятся каталаза, кото-
рая расщепляет перекись водорода, и супероксид-
дисмутаза, которая преобразует супероксидный
анион в перекись водорода и кислород. Отсут-
ствие или поломка одного из компонентов рес-
пираторного взрыва в фагоцитарных клетках про-
является в форме иммунодефицита, который пред-
располагает организм к рецидивирующим респи-
раторным инфекциям (см. гл. 17).
Клетки, участвующие в работе
врожденной иммунной системы
Многие типы клеток участвуют в работе механиз-
мов врожденной иммунной системы организма.
Как указывалось ранее, фагоцитоз является ос-
новным защитным механизмом и осуществляется
клетками нескольких типов, включая ПМЯ лей-
коциты, фагоцитирующие моноциты (например,
макрофаги) и фиксированные макрофаги ретику-
лоэндотелиальной системы. При активации все
эти клетки высвобождают растворимые вещества,
называемые цитокинами, которые оказывают раз-
ное действие на различные клегки (см. гл. 11).
Многие из этих и других клеток, участвующих в
работе врожденной иммунной системы, также
вовлечены в основные этапы активизации адап-
тивной иммунной системы, включая презентацию
антигена.
Полиморфно-ядерные лейкоциты
Полиморфно-ядерные лейкоциты представляют
собой популяцию клеток, также относящуюся к
гранулоцитам. В нее входят базофилы, тучные
клетки, эозинофилы и нейтрофилы. Гранулоци-
ты являются короткоживущими фагоцитарными
клетками, содержащими богатые ферментами ли-
зосомы, которые могут способствовать разруше-
нию инфицирующих микроорганизмов (рис. 2.3).
Они могут также вырабатывать пероксидные и
супероксидные радикалы, токсичные для боль-
шинства микроорганизмов. Некоторые лизосо-
мы также содержат бактерицидные протеины,
такие как лактоферрин. Полиморфно-ядерные
лейкоциты играют большую роль в защите от
инфекции. Нарушения их функции сопровож-
даются хроническими или рецидивирующими
инфекциями.
36
ГЛАВА 2. ЭЛЕМЕНТЫ ВРОЖДЕННОГО И ПРИОБРЕТЕННОГО ИММУНИТЕТА
Макрофаги
Макрофаги — это фагоциты, развивающиеся из
моноцитов крови (рис. 2.4). Моноцит сам по себе
является маленькой сферической клеткой с не-
большим числом выпячиваний, широким цито-
плазматическим ободком, небольшим эндоплаз-
матическим ретикулумом и множеством гранул.
После миграции моноцитов из крови в разные
ткани они претерпевают дальнейшую дифферен-
цировку в разные гистологические формы, кото-
рые участвуют в фагоцитозе. Эти клетки вклю-
чают:
• купферовские клетки — крупные клетки с мно-
жеством цитоплазматических выпячиваний,
находятся в печени;
• альвеолярные макрофаги — в легких;
• макрофаги селезенки — в белой пульпе;
• перитонеальные макрофаги — свободно плава-
ют в перитонеальной жидкости;
• микроглиальные клетки — в ЦНС.
Каждая из этих популяций макрофагов входит
в ретикулоэндотелиальную систему (РЭС), кото-
рая распространена по всему организму. Основ-
ная функция РЭС — фагоцитоз микроорганиз-
мов и инородных веществ, находящихся в крови
и разных тканях. Она также участвует в разруше-
нии старых и поврежденных клеток, например
эритроцитов.
Многие из этих клеток, по-разному названные
и расположенные, имеют, однако, общие свой-
ства, такие как способность связывать и захваты-
вать частицы вещества и антигены. В связи с тем
что они располагаются вдоль капилляров, эти клет-
ки чаще всего первыми вступают в контакт с аг-
рессивными патогенами и антигенами, а также,
• Рис. 2.4. Изображение, полученное при сканирующей
электронной микроскопии. Макрофаг со складчатыми
мембранами и поверхностью, покрытой микроворсинка-
ми (х5200) (с любезного разрешения д-ра KL Erikson,
School of Medicine, University of California at Davis; воспро-
изведено с разрешения Lippincott/Harper & Row)
как мы увидим далее, определяют успешное раз-
витие реакций как врожденного, так приобретен-
ного иммунитета.
Клетки-макрофаги имеют две главные функ-
ции. Первая раскрывается их названием («боль-
шой пожиратель»). Она заключается в том, что
макрофаги захватывают материал и с помощью
разрушающих ферментов в своих лизосомальных
гранулах расщепляют его на простые аминокис-
лоты, сахара и другие вещества для дальнейшего
использования или выведения. Таким образом, эти
клетки играют ключевую роль в удалении бакте-
рий и паразитов из организма. Второй функцией
макрофагов, как будет описано в следующих гла-
вах, является захват антигенов, обработка (про-
цессирование) их путем частичной денатурации
или частичного переваривания и презентация на
своих поверхностях специфичным Т-клеткам. Это
означает, что макрофаги выполняют функцию
антигенпрезентирующих клеток (см. гл. 9).
Дендритные клетки являются долгоживущими.
Они находятся в незрелом состоянии в большин-
стве тканей, где распознают и фагоцитируют па-
тогены и другие антигены. Дендритные клетки
присутствуют в коже в виде интердигитальных
клеток тимуса и клеток Лангерганса и развива-
ются из тех же гемопоэтических клеток-предше-
ственников, что и моноциты. Непосредственный
контакт со многими патогенами ведет к созрева-
нию дендритных клеток, что в свою очередь зна-
чительно увеличивает их антигенпрезентирующую
способность. На самом деле, такое созревание
позволяет им активировать наивные антигенспе-
цифичные Т-клетки. Таким образом, они имеют
большое значение как для врожденного иммуни-
тета, так и для инициации адаптивных иммунных
реакций.
По данному краткому описанию можно видеть,
что каждый из этих клеточных компонентов врож-
денной иммунной системы выполняет разные фун-
кции в рамках неспецифической ветви иммунной
системы. Они также играют ключевую роль в аф-
ферентной, или индукционной, ветви приобретен-
ного иммунного ответа (инициируя Т-клеточные
реакции). Наконец, макрофаги участвуют в эффе-
рентной, или эффекторной, ветви приобретенно-
го иммунного ответа на его завершающей стадии в
качестве клеток, которые активируются цитокина-
ми, вырабатываемыми в основном Т-клетками, что
повышает их способность убивать патогены.
Клетки — натуральные киллеры
Измененные свойства мембран аномальных кле-
ток, таких как раковые или пораженные вирусом,
распознаются цитотоксическими клетками или
клетками-киллерами, которые уничтожают клет-
ку-мишень не путем фагоцитоза, а высвобождая
биологически активные молекулы, которые в те-
чение очень короткого промежутка времени ее
убивают. К таким клеткам-киллерам относят ан-
ВРОЖДЕННЫЙ ИММУНИТЕТ
37
тигенспецифичные цитотоксические Т-лимфоци-
ты, являющиеся элементами адаптивной или при-
обретенной иммунной системы (более детально
обсуждается в гл. 10), и натуральные киллеры
(natural killers — NК-клетки), которые являются
элементами врожденной иммунной системы.
Натуральные киллеры, вероятно, играют опре-
деленную роль на ранних стадиях вирусной ин-
фекции или онкогенеза до того, как количество
Т-лимфоцитов, представляющих приобретенный
иммунный ответ, увеличится. Натуральные кил-
леры представляют собой гранулярные лимфоци-
ты, способные лизировать определенные клетки,
зараженные вирусом, и опухолевые клетки без
предварительной стимуляции. В отличие от ци-
тотоксических Т-лимфоцитов, которые распозна-
ют несущие антиген клетки-мишени с помощью
своих TCR, NK-клетки не имеют собственных
антигенспецифичных TCR. Как же в таком слу-
чае они распознают и уничтожают свои мишени?
Натуральные киллеры делают это посредством
механизма, включающего прямой межклеточный
контакт, который позволяет им выяснить, утра-
тила ли потенциальная клетка-мишень собствен-
ный специфичный антиген — белок МНС I клас-
са. Главные комплексы гистосовместимости
I класса экспрессируются практически на всех об-
ладающих ядром клетках. Натуральные киллеры
экспрессируют рецепторы, не родственные TCR,
называемые ингибиторными рецепторами клеток-
киллеров (killer cell inhibitory receptors — KIR),
которые связываются с молекулами МНС I клас-
са. Если KIR связываются, то клетка-мишень за-
щищается от разрушения NK-клетками. На ин-
фицированных вирусом или трансформированных
(опухолевых) клетках уменьшается количество мо-
лекул МНС I класса. Таким образом, когда по-
добные клетки встречаются с NK-клетками, они
не могут эффективно задействовать такие KIR и
становятся чувствительными к цитотоксичности,
опосредованной NK-клетками (рис. 2.5).
Ингибиторный
рецептор
NK-клетки
Мертвая
I клетка
Ишибиторный
рецептор
NK-клетки
Инфицированная вирусом
Лизис
• Рис. 2.5. Лизис и ингибиторные рецепторы NK-клеток
икиллинг
Уничтожение клеток-мишеней достигается пу-
тем высвобождения различных цитотоксических
молекул. Некоторые из этих молекул вызывают
образование пор в мембране клетки-мишени, ве-
дущее к их лизису. Другие молекулы проникают
в клетки-мишени и вызывают апоптоз (програм-
мируемую гибель клетки) клетки-мишени, уси-
ливая фрагментацию ее ядерной ДНК. Активность
NK-клеток значительно усиливается растворимы-
ми медиаторами, такими как IL-2, IL-12 и интер-
феронами. Как указано в гл. 11, IFNa и IFNp яв-
ляются противовирусными протеинами, синтези-
руемыми и высвобождаемыми лейкоцитами, фиб-
робластами и клетками, инфицированными ви-
русами. Интерлейкин-2 и IFNy высвобождаются
активированными Т-лимфоцитами.
NK-T-клетки
Другой популяцией клеток с фенотипическими и
функциональными свойствами, сходными со свой-
ствами NK-клеток, являются NK-Т-клетки тими-
ческого происхождения. Как и другие Т-клетки.
они экспрессируют TCR. хотя с ограниченной
вариабельностью. В отличие от других Т-клеток
эти клетки экспрессируют маркер, называемый
NK1.1, который распознает МНС-ассоциирован-
ный CDl-рецептор, экспрессируемый на антиген-
презентирующих клетках. Т-клетки с маркером
NK-L1 отличаются по своим функциональным
возможностям, поскольку они выполняют функ-
ции и врожденной, и адаптивной иммунных си-
стем. После активации они секретируют несколько
цитокинов, включая IL-4 и IFNy (таким образом
они выполняют иммунорегуляторную функцию)
и убивают клетки-мишени посредством взаимо-
действия рецептора Fas с лигандом Fas.
Воспаление
Важной функцией фагоцитирующих клеток яв-
ляется их участие в воспалении — основном ком-
поненте защитного механизма организма. Далее
описаны важные аспекты воспаления.
Воспаление представляет сложный процесс,
инициируемый повреждением тканей, которое
вызвано эндогенными (такими как некроз тканей
или перелом кости) и экзогенными факторами.
Эти факторы включают различные виды повреж-
дений, такие как механическое (например, порез),
физическое (ожог), химическое (например, кон-
такт с агрессивным веществом) повреждение, био-
логическое воздействие (например, инфицирова-
ние микроорганизмами: см. гл. 20) и иммуноло-
гическое повреждение (например, реакция гипер-
чувствительности: см. гл. 14— 16). Воспалитель-
ная реакция составляет важную часть как врож-
денного, так и приобретенного иммунитета. Она
возникла как защитная реакция против повреж-
дения и инфекции. Хотя в определенных случа-
38
ГЛАВА 2. ЭЛЕМЕНТЫ ВРОЖДЕННОГО И ПРИОБРЕТЕННОГО ИММУНИТЕТА
ях, таких как гиперчувствительность, когда вос-
паление скорее является проблемой, чем ее ре-
шением, воспалительная реакция в основном бы-
вает защитной, т.е. представляет собой один из
ответов на повреждение, и направлена на воз-
вращение поврежденных тканей в нормальное со-
стояние.
Главными признаками воспаления являются
боль, покраснение и повышение температуры.
Каждый из них является результатом специфи-
ческих изменений состояния локальных кровенос-
ных сосудов. Боль вызывается увеличением диа-
метра сосудов, что ведет к усилению кровотока.
таким образом приводя к повышению температу-
ры и появлению красноты в данном месте. По-
следующее уменьшение скорости тока крови и со-
путствующая экспрессия так называемых молекул
адгезии, вызванная цитокинами и кининами на
эндотелиальных клетках, выстилающих кровенос-
ные сосуды, способствует связыванию циркулиру-
ющих лейкоцитов. Эти события облегчают при-
крепление лейкоцитов и проникновение их в тка-
ни, а также привлечение нейтрофилов и моноци-
тов к месту воспаления. Другим важным измене-
нием в местных кровеносных сосудах является
повышение их проницаемости. Оно происходит в
связи с расхождением до этого тесно сомкнутых
эндотелиальных клеток, выстилающих кровенос-
ные сосуды, что ведет к выходу жидкости и про-
теинов из крови и накоплению их в ткани. Все
это приводит к отеку, сопутствующему воспале-
нию, что также значительно усиливает боль.
В течение нескольких минут после поврежде-
ния начинается воспалительный процесс, при
котором происходит активация и повышается кон-
центрация фармакологически активных субстан-
ций, таких как группа протеинов, называемых
белками острой фазы воспаления. Реакции ост-
рой фазы запускают местные и системные реак-
ции. Локализованные воспалительные реакции
частично возникают в результате активации ки-
нинов и коагуляционной системы (свертывание).
Кинины обладают несколькими важными функ-
циями:
• они действуют непосредственно на местную
гладкую мускулатуру и вызывают сокращение
мышц;
• они действуют на аксоны, блокируя нервные
импульсы, что ведет к релаксации дистальных
мышц;
• особенно важно то, что они действуют на клет-
ки сосудистою эндотелия (например, вазоак-
тивный пептид брадикинин), вызывая их сокра-
щение (что ведет к повышению проницаемо-
сти сосудов) и экспрессию молекул адгезии эн-
дотелиальных клеток (endothelial cell adhesion
molecules — ЕСАМ), ведущую к адгезии лей-
коцитов и экстравазациш,
• кинины представляют собой очень сильные
нервные стимуляторы; они являются молеку-
лами, в наибольшей степени отвечающими за
боль (и зуд), связанную с воспалением.
После активации кинины быстро инактивиру-
ются протеазами, вырабатываемыми во время ло-
кализованных реакций.
Коагуляционный каскад состоит из ферментов
плазмы, которые последовательно активируются
вслед за повреждением кровеносных сосудов. Его
роль в воспалительной реакции заключается в
формировании физического барьера (сгусток),
который препятствует поступлению микроорга-
низмов в кровоток.
Системная воспалительная реакция включает
появление лихорадки (рассматривается далее), уве-
личение продукции лейкоцитов, усиленный син-
тез гидрокортизона и адренокортикотропного гор-
мона (АКТГ) и выработку острофазовых белков
(см. гл. 11). Среди острофазовых протеинов важ-
ное место занимает С-реактивный белок. Он
связывается с мембраной определенных микро-
организмов и активирует систему комплемента
(см. гл. 13). Это приводит к лизису микроорга-
низма или усиленному фагоцитозу фагоцитарны-
ми клетками, а также к другим важным биологи-
ческим проявлениям, как мы увидим далее.
Цитокины играют ключевую роль в воспали-
тельной реакции. Интерлейкины-1 и -2 и фактор
некроза опухоли a (tumor necrosis factor — TN Fa)
входят в число наиболее важных цитокинов, вов-
леченных в реакцию (см. гл. И). Эти цитокины,
высвобождаемые активированными макрофагами,
вовлекают в процесс молекулы адгезии на стен-
ках эндотелиальных клеток сосудов, к которым
прикрепляются нейтрофилы, моноциты и лимфо-
циты перед тем, как выйти из сосуда (процесс,
называемый экстравазацией) в поврежденную
ткань. Эти цитокины также вызывают коагуля-
цию и увеличение проницаемости сосудов. Про-
чие цитокины, включая 1L-8 и IFNy, действуют
иначе, в частности повышают хемотаксис лейко-
цитов и усиливают фагоцитоз. Все эги эффекты
приводят к скоплению жидкости (отек) и лейко-
цитов в поврежденных участках. Это в свою оче-
редь усиливает реакцию, поскольку вместе с жид-
костью перемещаются, а также высвобождаются
из скопившихся клеток биологически активные
соединения, привлекая и активируя еще больше
клеток.
Большинство клеток, вовлеченных в воспали-
тельную реакцию, являются клетками-фагоцита-
ми, первоначально представляемыми ПМЯ-лей-
коцигами, которые накапливаются в течение 30 —
60 мин, фагоцитируют внедрившегося возбудите-
ля или повреждают ткань и высвобождают лизо-
сомальные ферменты, пытаясь уничтожить агрес-
сора. Если причина воспалительной реакции со-
храняется и после этого, в течение 4 —6 ч данное
место будет инфильтрировано мононуклеарными
клетками, такими как макрофаги и лимфоциты
Макрофаги дополняют фагоцитарную активность
ВРОЖДЕННЫЙ ИММУНИТЕТ
39
ПМЯ-клеток, таким образом усиливая защиту уча-
стка. Более того, макрофаги участвуют в процес-
сировании и презентации антигенов лимфоцитам,
которые реагируют на чужеродные антигены аг-
рессора, запуская приобретенную иммунную ре-
акцию, специфичную для этих антигенов.
В случае сохранения повреждения или про-
должения инвазии со стороны микроорганизмов
воспалительная реакция будет поддержана и уси-
лена элементами приобретенного иммунитета,
включая антитела и клеточно-опосредованный
иммунитет. Участие антител обеспечивает запуск
каскада комплемента, в котором активируются и
высвобождаются фармакологически активные ве-
щества. К последним относятся вещества, уве-
личивающие проницаемость сосудов и расшире-
ние капилляров, а также хемотаксические веще-
ства, которые притягивают и активируют допол-
нительные ПМЯ-клетки и антигенспецифичные
лимфоциты. Сами по себе лимфоциты способны
уничтожать некоторые чужеродные патогены.
Однако важнее то, что они высвобождают цито-
кины, которые активируют макрофаги и другие
клетки для участия в разрушении и выведении
агрессора.
Многие вещества, активированные во время
воспалительной реакции, участвуют в восстанов-
лении поврежденных тканей. Во время этого
процесса многие клетки, включая лейкоциты,
уничтожаются. Макрофаги, находящиеся в дан-
ном месте, фагоцитируют остатки, и воспале-
ние уменьшается. Ткань может возвращаться в
нормальное состояние или же образуется руб-
цовая ткань.
В некоторых случаях трудно или невозможно
устранить причину воспаления. Поэтому возни-
кает хроническое воспаление, наблюдаемое при
хронических инфекциях (например, туберкулезе),
или постоянная активация иммунной реакции
(например, при ревматоидном артрите и гломе-
рулонефрите). В этих случаях воспалительная ре-
акция продолжается и может быть только времен-
но изменена назначением противовоспалительных
средств, таких как аспирин, ибупрофен и корти-
зон. Эти и другие лекарства действуют на некото-
рые метаболические пути, обеспечивающие про-
дукцию и активацию ряда фармакологических
медиаторов воспаления. Однако они не влияют
на основную причину воспаления, и при их от-
мене симптомы могут появиться вновь.
Лихорадка
Хотя лихорадка является наиболее частым прояв-
лением инфекции и воспаления, информация о
ее значении в протекании инфекции у млекопи-
тающих еще довольно скудна. Лихорадку могут
вызывать многие вещества, вырабатываемые бак-
териями, особенно эндотоксины грамотрицатель-
ных бактерий, но обычно она возникает в резуль-
тате высвобождения эндогенных пирогенов, кото-
рые вырабатываются моноцитами и макрофага-
ми, в частности IL-1 и определенными интерфе-
ронами.
Биологически активные вещества
Многие ткани синтезируют вещества, губитель-
ные для микроорганизмов. Их примерами могут
служить расщепляющие ферменты, токсичные сво-
бодные радикалы, кислоты, ингибиторы роста,
острофазовые протеины и интерфероны. Таким
образом, в зависимости от способности синтези-
ровать эти вещества некоторые ткани могут обла-
дать повышенной резистентностью к инфекции,
вызванной некоторыми микроорганизмами
Рецепторы, входящие в систему
врожденного иммунитета
В отличие от адаптивной иммунной системы, ко-
торая использует антигенспецифичные рецепто-
ры, чтобы позволить эффекторным Т- и В-клет-
кам определить подходящие антигены, врожден-
ная иммунная система не обладает такой специ-
фичностью. Эти рецепторы не распределяются
клонально в отличие от антигенспецифичных ре-
цепторов. Таким образом, данный набор рецеп-
торов будет присутствовать на всех клетках одно-
го клеточного типа. Эта особенность клеточных
рецепторов врожденной иммунной системы ка-
сается и тех рецепторов, которые вовлечены в
фагоцитоз. Например, нейтрофилы экспрессиру-
ют /-Met-Leu-Phe-рецептор, хемотаксический
рецептор, который связывает N-формилирован-
ные петиды, присутствующие на определенных
бактериях, и направляет нейтрофилы к месту ин-
фекции.
На многих типах клеток, принадлежащих врож-
денной иммунной системе, экспрессируются так-
же семейства рецепторов, распознающих структу-
ры патогенных микроорганизмов (pattern recognition
receptors — PRR). Эти рецепторы распознают кон-
сервативные микробные структуры, которые мо-
гут служить отличительными признаками опре-
деленных классов патогенов. Одним из типов PRR
является маннансвязывающий (МС) лектин, по-
зволяющий фагоцитам распознавать экспресси-
руемые микробом полисахариды, которые имеют
структуру, состоящую из остатков этого моноса-
харида с определенным интервалом; такая струк-
тура не обнаруживается на клетках макроорганиз-
ма. Связывание присутствующего на фагоцитах
МС-лектина (рецептора) с этими сахарами ини-
циирует и активирует МС-лектиновый путь ком-
племента. Это приводит к выработке компонен-
тов комплемента, которые покрывают микроор-
ганизм (опсонизация), делая их более чувствитель-
ными к фагоцитозу (см. гл. 13). Следующую группу
40
ГЛАВА 2. ЭЛЕМЕНТЫ ВРОЖДЕННОГО И ПРИОБРЕТЕННОГО ИММУНИТЕТА
фагоцитарных рецепторов представляют рецепто-
ры-мусорщики (scavenger receptors — SR), кото-
рые распознают специфические анионные поли-
меры и ацетилированные липопротеины низкой
плотности, экспрессируемые как определенны-
ми патогенами, так и старыми поврежденными
эритроцитами, что ведет к удалению этих кле-
ток.
Недавно было открыто семейство Toll-подоб-
ныхрецепторов (Toll-like receptor — TLR), игра-
ющих важную роль в распознавании патоген-
специфичных компонентов, присущих микро-
организмам. Toll-генное семейство было открыто
в связи с его участием в формировании дорсаль-
ных и вентральных структур у эмбриона Drosophila
melanogaster. Позднее исследования показали, что
Toll-гены кодируют белки, которые играют реша-
ющую роль во врожденной иммунной реакции мух
на микробную инфекцию. Дальнейшее исследо-
вание подтвердило существование гомологичных
белков у млекопитающих (TLR), которые могут
активировать фагоциты и тканевые дендритные
клетки для борьбы с патогенами. Toll-подобные
рецепторы составляют большое семейство, и каж-
дый распознает специфические микробные ком-
поненты. Активация TLR микробными компонен-
тами ведет не только к активации врожденной
иммунной системы, но и к развитию адаптивного
иммунитета за счет выработки провоспалитель-
ных цитокинов и экспрессии костимулируюших
молекул.
АДАПТИВНЫЙ (ПРИОБРЕТЕННЫЙ)
ИММУНИТЕТ
Если инфицирующий агент не уничтожается по-
средством неспецифических механизмов врожден-
ного иммунитета, включается адаптивный иммун-
ный ответ с выработкой антигенспецифичных лим-
фоцитов (эффекторные клетки) и клеток памя-
ти. которые могут предотвратить повторное ин-
фицирование тем же микроорганизмом. Такие
адаптивные ответы (иногда называемые приобре-
тенными) развиваются долгое время (более 96 ч),
поскольку редкие В- и Т-клетки, специфичные
для вторгшегося микроорганизма, должны прой-
ти через клональную экспансию (размножение
клона) до того, как смогут дифференцироваться в
эффекторные клетки, способствующие устране-
нию инфекции. В отличие от врожденного имму-
нитета, присущего каждому живому организму,
адаптивный иммунитет является более специали-
зированной формой. Он возник на позднем этапе
эволюции и существует только у позвоночных.
Различные элементы, участвующие в работе врож-
денного иммунитета, не отличаются специфич-
ностью к чужеродным агентам, с которыми они
сталкиваются, в то время как приобретенный
иммунитет всегда обладает такой специфичностью.
Как и подразумевает его название, приобретен-
ный иммунитет является следствием встречи с
инородной субстанцией. Первая встреча с опре-
деленной инородной субстанцией, проникшей в
организм, запускает цепь событий, вызывающих
иммунную реакцию, специфическую по отноше-
нию к данной субстанции.
КЛЕТКИ И ОРГАНЫ, ВОВЛЕЧЕННЫЕ
В АДАПТИВНЫЙ ИММУННЫЙ
ОТВЕТ
Приобретенный иммунитет обычно проявляется
только после первой встречи с каким-либо ве-
ществом. Таким образом, он развивается только
после контакта или иммунизации таким веще-
ством. Существуют две основные популяции лим-
фоцитов, являющихся элементами приобретен-
ного иммунитета: В-лимфоциты (названные так,
поскольку они происходят из костного мозга (от
англ, bone marrow) и Т-лимфоциты (поскольку их
дифференцировка происходит в тимусе). Имен-
но В- и Т-лимфоциты определяют ту специфич-
ность, которая присуща реакциям приобретен-
ного иммунитета. В-лимфоциты синтезируют и
выделяют в кровеносное русло антитела, специ-
фичные по отношению к чужеродной субстан-
ции. Этот процесс называется гуморальным им-
мунитетом. Т-лимфоциты, которые обладают
специфичностью по отношению к чужеродной
субстанции, опосредованной их рецепторами
(TCR), не производят антител, но осуществляют
различные эффекторные функции, когда АПК
доставляют антигены во вторичные лимфоидные
органы. Т-лимфоциты также взаимодействуют с
В-клетками, помогая последним вырабатывать
антитела; они активируют макрофаги и играют
главную роль в развитии и регуляции приобре-
тенного иммунитета (см. гл. 10). Приобретенный
иммунитет, опосредованный Т-лимфоцитами,
называется клеточным или клеточно-опосредо-
ванным иммунитетом. Как мы уже знаем, мак-
рофаги являются фагоцитирующими клетками;
они не проявляют специфичности по отноше-
нию к определенной субстанции, но вовлечены
в процессирование и презентацию чужеродных
субстанций Т-лимфоцитам, а также активацию
Т-лимфоцитов (см. гл. 9 и 10).
У представителей млекопитающих циркулиру-
ющие клетки крови имеют общее происхождение
из небольшого кластера клеток, которые переме-
шаются из примитивного желточного мешка в за-
родышевую печень и, наконец, в костный мозг,
где находятся постоянно. Эти клетки являются ге-
мопоэтическими стволовыми клетками, называ-
емыми так потому, что они являются недиффе-
ренцированными клетками, из которых развива-
ются все другие специализированные клетки крови
(см. рис. 2.1).
КЛЕТКИ И ОРГАНЫ, ВОВЛЕЧЕННЫЕ В АДАПТИВНЫЙ ИММУННЫЙ ОТВЕТ
41
Эти недифференцированные стволовые клет-
ки характеризуются способностью пролифериро-
вать на протяжении жизни как самообновляющий-
ся резервуар, пополняющий пул более зрелых
клеток по мере их использования в период нор-
мальной жизнедеятельности. Эти ранние стволо-
вые клетки считаются плюрипотентными, т.е. спо-
собными развиваться в любую более дифферен-
цированную линию клеток под влиянием различ-
ных растворимых факторов, контролирующих как
интенсивность, так и направление созревания.
Выделению и описанию этих самых первых гемо-
поэтических и плюрипотентных стволовых кле-
ток способствовало недавнее обнаружение на их
поверхности молекул, отнесенных к CD34 (но-
менклатура CD обсуждается в гл. 5). Экспрессия
CD34 вполне специфична для ранних клеток-
предшественников (так же как и для эндотели-
альных клеток). Начав дифференцировку в каком-
либо направлении, клетка становится коммити-
рованной к продукции клеток одной линии, т.е.
унипотентной, при этом экспрессия CD34 умень-
шается. Один путь дифференцировки (миелоид-
ная дифференцировка) начинается из стволовых
клеток костного мозга и порождает различные
дифференцированные клетки-предшественники,
а заканчивается эритроцитами, тромбоцитами и
различными гранулосодержащими клетками гра-
нулоцитарно-моноцитарной линии Другой путь
дифференцировки (лимфоидная дифференцировка)
ведет к образованию двух различных типов кле-
ток, называемых Т- и В-лимфоцитами.
Лимфатические органы
Лимфатическими называются органы, в которых
происходят созревание, дифференцировка и про-
лиферация лимфоцитов. Эти органы обычно раз-
деляют на два вида. Первичными (центральными)
лимфоидными органами являются те из них, в ко-
торых Т- и В-лимфоциты созревают в антиген-
распознающие лимфоциты. Как мы увидим из
следующих глав, развивающиеся Т- и В-клетки
приобретают свои антигенспецифичные рецеп-
торы в первичных лимфоидных органах. Зрелые
В- и Т-лимфоциты мигрируют из костного мозга
и тимуса соответственно через кровоток к пери-
ферическим лимфоидным тканям, к которым от-
носят лимфатические узлы, селезенку и лим-
фатические ткани ЖКТ, такие как миндалины.
В таких вторичных (периферических) лимфоидных
органах происходят антигензависимая пролифе-
рация и дифференцировка (рис. 2.6).
Первичные лимфоидные органы
Существует два основных первичных лимфоид-
ных органа, в одном из которых развиваются
Т-клетки, а в другом — В-клетки.
Аденоиды
Миндалины
Правая
подключичная
вена
Лимфатический
узел
Почки
Аппендикс
Лимфатические
сосуды
Сердце
Грудной проток
Селезенка
Костный мозг
Толстый
кишечник
Пейеровы
бляшки
в тонком
кишечнике
Левая
подключичная
вена
Тимус
• Рис. 2.6. Распределение лимфоидных тканей в теле
(воспроизведено с разрешения FS Rosen и RS Geha, Case
Studies in Immunology, Garland Publishing)
Тимус
Клетки-предшественники из костного мозга миг-
рируют в первичный лимфоидный орган — ти-
мус, в котором они дифференцируются в Т-лим-
фоциты Тимус является железой, состоящей из
двух долек и происходящей из энтодермы треть-
его и четвертого глоточных карманов (рис. 2.7).
В период развития плода размер тимуса увеличи-
вается. Рост продолжается до наступления пубер-
татного периода. В дальнейшем тимус постепен-
но атрофируется.
Тимус является лимфоэпителиальным органом
и состоит из эпителиальных клеток, организую-
щих кортикальную (наружную) и медуллярную
(центральную) зоны, инфильтрированные лимфо-
идными клетками (тимоцитами). Кора плотно
заполнена лимфоцитами разных размеров, боль-
шинство из которых являются незрелыми, и рас-
сеянными макрофагами, участвующими в удале-
нии апоптозных тимоцитов. Т-лимфоциты созре-
вают в корковом веществе и мигрируют в мозго-
вое, в котором встречаются с макрофагами и ден-
дритными клетками. Здесь они подвергаются ти-
мической селекции, которая приводит к разви-
тию зрелых функциональных Т-клеток, которые
затем выходят из железы и попадают в перифери-
ческий кровоток, посредством которого транспор-
тируются во вторичные лимфоидные органы. (Раз-
витие Т-клеток детально обсуждается в гл. 8.)
Именно во вторичных лимфоидных органах
Т-клетки контактируют с чужеродными антиге-
нами и реагируют на них.
Созревание Т-лимфоцитов предполагает появ-
ление у данных Т-клеток способности распозна-
вать и реагировать на определенную детерминан-
42
ГЛАВА 2. ЭЛЕМЕНТЫ ВРОЖДЕННОГО И ПРИОБРЕТЕННОГО ИММУНИТЕТА
• Рис. 2.7. Клеточная организация тимуса (воспроизведено с разрешения FS Rosen и RS Geha, Case
Studies in Immunology, Garland Publishing)
ту или эпитоп чужеродного антигена. Подобное
распознавание достигается с помощью специфич-
ного рецептора на Т-клетке (TCR), который при-
обретается в период дифференцировки в тимусе
(см. гл. 8). Созревшие Т-лимфоциты в мозговом
веществе способны реагировать на чужеродные
антигены таким же образом, как они реагировали
бы во вторичных лимфоидных органах. Однако
тимус считается первичным лимфоидным орга-
ном, поскольку является местом, где клетки диф-
ференцируются, чтобы экспрессировать TCR.
Созревание Т-лимфоцитов происходит в основ-
ном в период развития плода и короткое время
после рождения. У мышей удаление тимуса в нео-
натальном периоде приводит к серьезному сни-
жению качества и количества Т-лимфоцитов и
вызывает потенциально смертельный рант-синд-
ром (вейстинг-синдром). Удаление тимуса у взрос-
лой особи обычно не оказывает сильного влия-
ния на количество и качество Т-лимфоцитов, ко-
торые к этому времени уже созрели и заселили
вторичные лимфоидные органы. Однако удаление
этой железы у взрослого может иногда привести
к дефициту Т-клеток в случае неожиданной гибе-
ли Т-клеток, обычно населяющих вторичные лим-
фоидные органы (как это происходит после об-
щего облучения организма). Без тимуса не будет
существовать и механизм для повторного заполне-
ния вторичных органов новыми Т-лимфоцитами
Только 5 — 10 % созревающих лимфоцитов вы-
живают и в последующем покидают тимус; 90 —
95 % всех тимоцитов погибают в тимусе. Понят-
но, что погибают, а потому удаляются те лимфо-
циты, которые приобрели специфичность отно-
сительно собственных структур организма или
не способны создать функциональные рецепто-
ры. У выживших лимфоцитов развивается специ-
фичность к чужеродным антигенам. Все это будет
детально обсуждаться в гл. 9.
Фабрициева сумка и костный мозг
Первичный лимфоидный орган был впервые об-
наружен у птиц. Созревание В-клеток у них про-
исходит в фабрициевой сумке. Этот орган, распо-
ложенный рядом с клоакой, состоит из лимфоид-
ных центров, содержащих эпителиальные клетки
и лимфоциты. В отличие от лимфоцитов в тимусе
эти лимфоциты состоят исключительно из про-
дуцирующих антитела В-клеток (см. гл. 7).
Млекопитающие не имеют фабрициевой сум-
ки. Поэтому чтобы выявить у них эквивалент пер-
вичного лимфоидного органа, в котором В-клет-
ки развиваются и созревают, понадобилось много
времени и сил. В настоящее время ясно, что в
эмбриональный период жизни В-клетки диффе-
ренцируются из гемопоэтических стволовых кле-
ток в печени плода. После рождения и в течение
КЛЕТКИ И ОРГАНЫ, ВОВЛЕЧЕННЫЕ В АДАПТИВНЫЙ ИММУННЫЙ ОТВЕТ
43
жизни индивидуума эта функция переходит к ко-
стному мозгу — структуре, которая считается пер-
вичным лимфоидным органом с функциями, эк-
вивалентными функциям фабрициевой сумки у
птиц. Каждый зрелый В-лимфоцит несет анти-
генспецифичные рецепторы, которые имеют
структуру и специфичность, идентичную антите-
лу, синтезируемому позднее этой В-клеткой Зре-
лые В-клетки переносятся циркулирующей кро-
вью во вторичные лимфоидные органы, где встре-
чаются с чужеродными антигенами и реагируют
на них.
Вторичные лимфоидные органы
Вторичные лимфоидные органы состоят из опре-
деленных структур, в которых зрелые, готовые к
распознаванию антигена (антигенкоммитирован-
ные) лимфоциты стимулируются антигеном, для
того чтобы произошли их дальнейшие деление и
дифференцировка. Основными вторичными лим-
фоидными органами являются селезенка и лим-
фатические узлы. Кроме того, вторичными лим-
фоидными органами считаются миндалины, ап-
пендикс и кластеры лимфоцитов, распределенные
в слизистой оболочке тонкого кишечника (пейе-
ровы бляшки}, а также лимфоидные скопления,
разбросанные повсеместно в слизистой ткани.
Вторичные лимфоидные органы обнаруживаются
в разных участках тела, таких как слизистая обо-
лочка пищеварительного, респираторного и мо-
чеполового трактов, конъюнктива и слюнные же-
лезы, где зрелые лимфоциты взаимодействуют с
антигенами и подвергаются активации. Эти вто-
ричные лимфоидные органы в слизистой оболоч-
ке получили название лимфоидной ткани, ассо-
циированной со слизистыми оболочками (mucosa-
associated lymphoid tissue — MALT). Такие лим-
фоидные ткани, связанные с кишечником, назы-
ваются ассоциированными с кишечником (gut-
associated lymphoid tissue — GALT), а связанные c
бронхиальным деревом — ассоциированными с
бронхами (bronchus-associated lymphoid tissue —
BALT).
Вторичные лимфоидные органы имеют две
основные функции: они крайне эффективны при
улавливании и концентрации чужеродных субстан-
ций и являются основными местами продукции
антител и индукции антигенспецифичных Т-лим-
фоцитов.
Селезенка
Селезенка является крупнейшим вторичным лим-
фоидным органом (рис. 2.8). Она крайне эффек-
тивна в улавливании и концентрации чужерод-
ных субстанций, переносимых кровью. Селезен-
ка является главным органом тела, в котором син-
тезируются антитела и из которого они затем вы-
свобождаются в кровоток Селезенка состоит из
белой пульпы, богатой лимфоидными клетками,
• Рис. 2.8. Селезенка: общий вид и вид в разрезе (вос-
произведено в разрешения FS Rosen и RS Geha, Case Studies
in Immunology, Garland Publishing)
и красной пульпы, которая содержит много сину-
сов, а также большое количество эритроцитов и
макрофагов, некоторое количество лимфоцитов
и несколько других типов клеток.
Вокруг небольших артериол расположены уча-
стки белой пульпы, периферические области ко-
торых богаты Т-клетками; В-клетки находятся в
основном в зародышевых центрах. Примерно 50 %
клеток селезенки составляют В-лимфоциты, 30 —
40 % — Т-лимфоциты. После стимулирования ан-
тигенами зародышевые центры содержат большое
число В-клеток и плазматических клеток. Эти
клетки синтезируют и высвобождают антитела.
Лимфатические узлы
Лимфатические узлы являются небольшими яй-
цевидными структурами (обычно до 1 см в диа-
метре), находящимися в разных регионах по все-
му телу (рис. 2.9). Они располагаются в местах
слияний лимфатических сосудов, которые впада-
ют в грудной проток. В свою очередь грудной
проток переносит лимфу и лимфоциты в полую
вену — сосуд, который несет кровь к правой сто-
роне сердца (рис. 2.10) и из которого она затем
перераспределяется по всему телу.
Лимфатические узлы состоят из мозгового ве-
щества со многими синусами и коры, окруженной
капсулой из соединительной ткани (рис. 2.9, А).
Кортикальный участок содержит первичные лим-
фоидные фолликулы После антигенной стиму-
ляции эти структуры увеличиваются и образуют
44
ГЛАВА 2. ЭЛЕМЕНТЫ ВРОЖДЕННОГО И ПРИОБРЕТЕННОГО ИММУНИТЕТА
Вторичный лимфоидный
фолликул (в основном
В-клетки)
Медуллярный
синус
Трабекула
Зона мантии
П аракортикальный
слой (в основном
Т-клетки)
Антигенпрезенти-
рующие клетки
Мозговое
вещество
Зародышевый
центр
Капсула
Кора
Эфферентный лимфатический
сосуд (стрелка показывает
ток лимфы и лимфоцитов)
Афферентный лимфатический
сосуд (стрелка показывает
ток лимфы и лимфоцитов)
Субкапсулярный
синус —
Первичный
лимфоидный
фолликул
Посткапиллярная венула
(стрелка показывает ток
лимфоцитов)
Б
• Рис. 2.9. (А) Срез лимфатическо-
го узла. Стрелки показывают движе-
ние лимфы и лимфоцитов. (Б) Срез
через лимфатический узел с демон-
страцией капсулы и субкапсулярно-
го синуса, мозгового вещества
(вверху слева) и коры, содержащей
зародышевые центры. Также показан
(вверху справа) фолликул без заро-
дышевого центра (х140) (с любезно-
го разрешения д-ра AC Ender, School
of Medicine, University of California at
Davis)
вторичные лимфоидные фолликулы с зародыше-
выми центрами, содержащими плотные популя-
ции лимфоцитов (в основном В-клеток), подвер-
гающихся митозу. В ответ на антигенную стиму-
ляцию антигенспецифичные В-клетки, пролифе-
рирующие внутри этих зародышевых центров, так-
же вовлекаются в процесс созревания аффинно-
сти, для того чтобы произвести клоны клеток с
рецепторами повышенной аффинности (антите-
ла) для антигенных эпитопов, запустивших пер-
вичную реакцию (см. гл. 7). Оставшиеся антиген-
неспецифичные В-клетки выталкиваются наружу
для формирования области мантии. Глубокая кор-
тикальная зона или паракортикальный регион
содержит Т-клетки и дендритные клетки. Анти-
гены доставляются в эти зоны дендритными клет-
ками, которые презентируют фрагменты антиге-
на Т-клеткам, в результате чего они активируют-
ся. Медуллярная зона лимфатического узла со-
держит плазматические клетки, которые секрети-
руют антитела. Эти клетки перемещаются из коры
в медуллярную область по лимфатическим сосу-
дам.
Лимфатические сосуды высоко эффективны
в улавливании антигена, поступающего через аф-
ферентные лимфатические сосуды. В узле ан-
тиген взаимодействует с макрофагами, Т-клет-
ками и В-клетками. Это взаимодействие вызы-
вает иммунный ответ, проявляющийся выработ-
кой антител и антигенспепифичных Т-клеток.
Лимфа, антитела и клетки покидают лимфати-
ческий узел через эфферентный лимфатический
сосуд, расположенный как раз под медуллярной
областью.
СУДЬБА АНТИГЕНА ПОСЛЕ ПЕНЕТРАЦИИ
45
Рис. 2.10. Циркуляция лим-
фы и судьба антигена после
поступления: 1) через кровоток;
2) кожу; 3) желудочно-кишеч-
ный или респираторный тракт
РЕЦИРКУЛЯЦИЯ ЛИМФОЦИТОВ
Лимфоциты крови поступают в лимфатические
узлы через посткапиллярные венулы, а покидают
их через эфферентные лимфатические сосуды.
которые последовательно сходятся в грудной про-
ток. Этот проток открывается в полую вену — со-
суд, который возвращает кровь сердцу, таким об-
разом обеспечивая постоянную рециркуляцию
лимфоцитов.
Сходным образом функционирует и селезен-
ка. Лимфоциты артериальной крови поступают в
нее через ворота и попадают в трабекулярную ар-
терию, которая в дальнейшем становится узкой и
разветвленной. На самых дальних ветвях трабе-
кулярной артерии находятся капилляры, ведущие
к лимфоидным узелкам. В конце концов, лимфо-
циты возвращаются в венозную циркуляцию че-
рез трабекулярную вену. Как и лимфатические
узлы, селезенка имеет эфферентные лимфатиче-
ские сосуды, откуда лимфа поступает в лимфати-
ческие протоки, по которым клетки продолжают
свою рециркуляцию по организму и возвращают-
ся обратно в афферентные сосуды.
Миграция лимфоцитов между различными
лимфоидными и нелимфоидными тканями и их
хоминг к определенному месту четко регулирует-
ся посредством различных адгезионных молекул
клеточной поверхности (cell-surface adhesion mole-
cules — САМ) и рецепторов к этим молекулам.
Таким образом, за исключением селезенки, где
маленькие артериолы заканчиваются, открывая
доступ лимфоцитам крови к паренхиме, обычно
лимфоциты крови должны проникать (в лимфо-
идную ткань) сквозь сосудистый эндотелий, выс-
тилающий посткапиллярные участки сосудистого
русла, называемые венулами с высоким эндоте-
лием (high endotherial venules — HEV). Этот про-
цесс называется экстравазацией. Рециркулирую-
щие лимфоциты избирательно связываются со спе-
цифическими рецепторами на HEV в лимфоид-
ной ткани или на участках воспаленной ткани и,
похоже, совершенно игнорируют другие участки
сосудистого эндотелия. Более того, оказывается,
что некоторые различные субпопуляции лимфо-
цитов преимущественно связываются с HEV за
счет более высокой специфичности, что избира-
тельно регулирует миграцию лимфоцитов в раз-
личные лимфоидные и нелимфоидные ткани. Ре-
циркулирующие моноциты и гранулоциты также
экспрессируют рецепторы, являющиеся молеку-
лами адгезии, и мигрируют в ткани, используя
такой же механизм.
Благодаря перемещению лимфоцитов между
лимфоидными и нелимфоидными тканями при
контакте антиген и лимфоциты, специфичные к
данному антигену, секвестрируются в лимфоид-
ной ткани, где лимфоциты проходят пролифера-
цию и дифференцировку. Клетки, подвергшиеся
дифференцировке (клетки памяти), покидают
лимфоидный орган и распространяются по телу
для последующей концентрации в месте, где про-
должает сохраняться антиген, и там проявляют
свою защитную функцию.
СУДЬБА АНТИГЕНА
ПОСЛЕ ПЕНЕТРАЦИИ
Ретикулоэндотелиальная система предназначена
для того, чтобы удерживать захватывать и разру-
шать проникшие в организм чужеродные антиге-
46
ГЛАВА 2. ЭЛЕМЕНТЫ ВРОЖДЕННОГО И ПРИОБРЕТЕННОГО ИММУНИТЕТА
ны с помощью системы фагоцитирующих клеток.
Кроме того, постоянное движение лимфоцитов по
организму позволяет депонировать их в стратеги-
ческих участках вдоль лимфатических сосудов.
Система не только задерживает антигены, но и
направляет их в места (вторичные лимфоидные
органы), где на очень маленьком участке антиген,
макрофаги, Т-клетки и В-клетки могут взаимо-
действовать, чтобы запустить иммунный ответ.
На рис. 2.10 показаны пути, по которым анти-
ген проходит через физические барьеры, а также
клеточные и гуморальные компоненты последу-
ющей иммунной реакции. Существуют три глав-
ных пути проникновения антигена в организм.
• Антиген может поступить в организм через кро-
воток. В этом случае он переносится в селе-
зенку, где взаимодействует с АПК, такими как
дендритные клетки и макрофаги. В-клетки так-
же выполняют роль АПК, хотя их основная
задача — это продукция антител в ответ на ан-
тигенную стимуляцию. Антигенпрезентирую-
щие клетки необходимы для активации анти-
генспецифичных Т-клеток. Взаимодействия
между АПК и Т-клетками неизбежно ведет к
активации В- и Т-клеток и, таким образом, к
иммунной реакции. Затем антитела выходят из
селезенки непосредственно в кровоток. Лим-
фоциты также покидают селезенку; они направ-
ляются в эфферентные лимфатические прото-
ки, чтобы возвратиться в кровоток, пройдя че-
рез грудной проток.
• Антиген может задержаться в эпидермисе, дер-
ме или подкожной клетчатке, где вызовет вос-
палительную реакцию. Из этих тканей анти-
ген или в свободном виде, или захваченный
АПК перемещается по афферентным лимфа-
тическим сосудам в регионарные лимфатиче-
ские узлы. В лимфатическом узле антиген, мак-
рофаги, дендритные клетки, Т-клетки и В-клет-
ки взаимодействуют, что вызывает иммунный
ответ. В последующем антигенспецифичные
Т-клетки и антитела, которые были синтези-
рованы в лимфатическом узле, поступают в
кровоток и переносятся в разные ткани. Анти-
генспецифичные Т-клетки, В-клетки и анти-
тела также поступают в кровоток через груд-
ной проток.
• Антиген может также поступать в желудочно-
кишечный или респираторный тракт, где за-
держивается в MALT. Там он будет взаимодей-
ствовать с макрофагами и лимфоцитами. Ан-
титела, синтезируемые в этих органах, депо-
нируются в местных тканях. Кроме того, лим-
фоциты, поступающие в эфферентные лимфа-
тические сосуды, переносятся через грудной
проток в циркуляторное русло и, таким обра-
зом, перераспределяются по различным тканям.
Для индукции адаптивного иммунного ответа
необходимо взаимодействие чужеродного антигена
с лимфоцитами, распознающими этот специфич-
ный антиген. Подсчитано, что у обычных (неим-
мунизированных) животных только один из каж-
дых 103—105 лимфоцитов способен распознавать
типичный антиген. Таким образом, вероятность
того, что антиген встретит подходящие клетки,
очень мала. Проблема осложняется тем, что для
последующего синтеза антитела должны провза-
имодействовать два различных вида лимфоцитов,
а именно Т- и В-клетки, специфичные именно к
этому антигену.
По статистике вероятность взаимодействия
специфичных Т-лимфоцитов с подходящим для
них антигеном, а затем и с В-лимфоцитами, спе-
цифичными к данному антигену, очень мала.
Однако природа выработала простой механизм для
организации контакта этих двух клеток с антиге-
ном: он переносится по дренирующим лимфати-
ческим протокам во вторичные лимфоидные орга-
Врожденный иммунитет
Физические
барьеры
I
Кожа, слизистые
оболочки
Клетки
Химические
Цитокины
Рецепторы, распознающие
структуры патогенных
микроорганизмов, ПМЯ-
клетки, моноциты, макрофаги,
эозинофилы, NK-клетки
Антитела Цитокины
В-клетки Т-клетки
Антигенспецифичные
рецепторы
барьеры
I
pH, липиды,
ферменты и др
Цитокины
Приобретенный
иммунитет
• Рис. 2.11. Взаимодействие между врожден-
ным и приобретенным иммунитетом
ВЗАИМОДЕЙСТВИЕ МЕЖДУ ВРОЖДЕННЫМ И ПРИОБРЕТЕННЫМ ИММУНИТЕТОМ
47
ны. В этих органах антиген представляется на по-
верхности фиксирующих его специализированных
клеток. Поскольку Т- и В-лимфоциты циркули-
руют с относительно высокой скоростью, совер-
шая кругооборот каждые несколько дней, неко-
торые из них, обладающие специфичностью по
отношению к конкретному антигену, имеют воз-
можность пройти мимо него за относительно ко-
роткое время. Когда такие лимфоциты встреча-
ются с антигеном, к которому обладают специ-
фичностью, они активируются, и запускается при-
обретенный иммунный ответ, специфический по
отношению к антигену, его вызвавшему.
а ВЗАИМОДЕЙСТВИЕ МЕЖДУ
ВРОЖДЕННЫМ И ПРИОБРЕТЕННЫМ
ИММУНИТЕТОМ
Приобретенный и врожденный иммунитет как две
ветви иммунной системы обладают способностью
прекрасно взаимодействовать. Система взаимодей-
ствия посредством различных цитокинов и моле-
кул клеточной адгезии позволяет компонентам
врожденной и приобретенной иммунных систем
согласованно функционировать, посылать друг дру-
гу сигналы, активировать друг друга и работать со-
вместно с единой целью — уничтожить и удалить
инфицирующий микроорганизм и его продукты.
Взаимодействие между врожденным и приобретен-
ным иммунитетом показано на рис. 2.11.
РЕЗЮМЕ
1 - Существуют две формы иммунитета: а) врож-
денный, или неспецифический; б) приобретенный,
или адаптивный.
2, Врожденный иммунитет включает многие эле-
менты, такие как различные физические барьеры (на-
пример, кожа), химические барьеры (например, низ-
кий pH в желудке), клеточные компоненты (например,
фагоциты) и рецепторы, распознающие структуры па-
тогенных микроорганизмов (например, TLR).
3. Два основных типа клеток участвуют в осуществ-
лении приобретенного иммунитета и клонально экс-
прессируют антигенспецифичные рецепторы: а) В-лим-
фоциты; б) Т-лимфоциты.
4. Макрофаги составляют существенную часть
РЭС и служат для улавливания, процессирования и
презентации антигена Т-лимфоцитам, таким образом
осуществляя важную функцию в рамках как врожден-
ного, так и приобретенного иммунитета.
5. В- и Т-лимфоциты обладают рецепторами, спе-
цифичными по отношению к конкретным антигенам и,
таким образом, являются компонентами приобретен-
ного иммунитета, отвечающего за антигенную специ-
фичность.
6. В- и Т-лимфоциты развиваются в первичных
лимфоидных органах. В-клетки происходят из лимфо-
идных клеток-предшественников и дифференцируют-
ся в костном мозге. Т-клетки происходят из тех же
лимфоидных клеток-предшественников, что и В-клет-
ки, и дифференцируются в тимусе, чтобы стать функ-
циональными клетками, перед тем как мигрировать в
периферические лимфоидные органы.
7. Зрелые В- и Т-лимфоциты дифференцируются
и пролиферируют в ответ на антигенную стимуляцию.
Эти процессы обычно происходят во вторичных лим-
фоидных органах.
8. В-лимфоциты синтезируют и секретируют анти-
тела. Т-лимфоциты участвуют в клеточно-опосредо-
ванном иммунитете. Они помогают В-клеткам выраба-
тывать антитела, обеспечивая последние растворимы-
ми факторами роста и дифференцировки (цитокина-
ми), необходимыми для активации В-клеток. Они так-
же регулируют и другие процессы в ходе иммунного
ответа, продуцируя цитокины.
9. Лимфоциты постоянно циркулируют между кро-
вью, лимфой, лимфоидными органами и тканями. Ре-
цепторы на них взаимодействуют с молекулами кле-
точной адгезии, расположенными на специализиро-
ванных HEV, способствующих экстравазации в ткани,
где происходит активация иммунных клеток.
ТЕСТЫ
Выберите ОДИН НАИБОЛЕЕ ПРАВИЛЬНЫЙ ответ
на каждый тест.
1, Обычно не относится к костному мозгу (первич-
ному лимфоидному органу) и вторичным лимфоидным
органам:
а) клеточная пролиферация;
б) дифференциация лимфоцитов;
в) клеточное взаимодействие;
г) антигензависимый ответ.
2, К вторичным лимфоидным органам относится:
а) наличие предшественника В- и Т-клеток;
б) циркуляция лимфоцитов;
в) окончательная дифференцировка;
г) клеточная пролиферация.
3- К врожденным иммунным механизмам не отно-
сится:
а) отсутствие специфичности;
б) стимулированная активация;
в) вовлечение клеток многих типов;
г) компонент памяти.
4, Основной функцией лимфоидной системы явля-
ется:
а) врожденный иммунитет;
б) воспаление;
в) фагоцитоз;
г) приобретенный иммунитет.
5- Удаление фабрициевой сумки у цыпленка при-
водит:
а) к заметному уменьшению числа циркулирующих
Т-лимфоцитов;
б) анемии;
в) отсроченному отторжению кожных лоскутов;
г) низкому уровню антител в сыворотке;
д) дефициту врожденного иммунитета
6. Зародышевые центры, находящиеся в корти-
кальной зоне лимфатического узла и периферическом
48
ГЛАВА 2. ЭЛЕМЕНТЫ ВРОЖДЕННОГО И ПРИОБРЕТЕННОГО ИММУНИТЕТА
регионе периартериолярной лимфатической ткани
селезенки:
а) поддерживают развитие незрелых В- и Т-клеток;
б) участвуют в удалении поврежденных эритроци-
тов из кровотока;
в) действуют как основной источник стволовых
клеток и таким образом помогают поддерживать ге-
мопоэз;
г) обеспечивают инфраструктуру, которая после
антигенной стимуляции содержит большие популяции
В-лимфоцитов и плазматических клеток;
д) являются местами для дифференцировки NK-
клеток.
7, Укажите правильную характеристику NK-клеток:
а) пролиферируют в ответ на антиген;
б) уничтожают клетки-мишени путем фагоцитоза и
внутриклеточного переваривания;
в) являются субпопуляцией ПМЯ-клеток;
г) уничтожают клетки-мишени без фагоцитоза;
д) особенно эффективны против определенных
бактерий.
8- Зрелые дендритные клетки способны:
а) активировать первичные антигенспецифичные
Т-клетки;
б) удалять красные кровяные клетки;
в) вырабатывать брадикинин;
г) уничтожать клетки-мишени без фагоцитоза.
ОТВЕТЫ НА ТЕСТЫ
1 — г. Клеточная пролиферация, дифференциров-
ка лимфоцитов и клеточные взаимодействия могут
происходить в костном мозге (или в фабрициевой
сумке). Однако антигензависимые реакции протекают
во вторичных лимфоидных органах, таких как селезен-
ка и лимфатические узлы.
2 — в. Окончательная дифференцировка В-клеток
в плазматические клетки происходит только во вто-
ричных лимфоидных органах, таких как селезенка и
лимфатические узлы. Циркуляция лимфоцитов и кле-
точная пролиферация (но не антигензависимые реак-
ции окончательной дифференцировки) также проис-
ходят в первичных лимфоидных органах, таких как
фибрициевая сумка или ее эквивалент, и тимусе. Кост-
ный мозг является местом, где плюрипотентные ство-
ловые клетки дифференцируются в клетки-предшест-
венники В- и Т-клеток.
3 — г. Врожденный иммунитет не обладает анти-
генной специфичностью, характерной для приобре-
тенного иммунитета. Он активируется такими стиму-
лами, как проникновение чужеродных частиц в орга-
низм. К врожденному иммунитету относятся клетки
многих типов, такие как клетки моноцитарной серии
(макрофаги) и гранулоцитарного ряда (нейтрофилы,
эозинофилы и т.д.).
4 — г. Основная функция лимфоидной системы —
это распознавание чужеродного антигена лимфоцита-
ми, что ведет к возникновению приобретенного им-
мунного ответа. Такие функции, как фагоцитоз и вос-
паление, не требуют обязательного участия лимфоид-
ной системы; они составляют часть врожденного им-
мунитета.
5 — г. Удаление фабрициевой сумки у цыпленка
приводит к значительному снижению уровней антител
в сыворотке, поскольку этот орган работает как первич-
ный лимфоидный орган, в котором созревают В-лим-
фоциты (в последующем синтезирующие и секрети-
рующие антитела). Удаление этого органа не приводит
к значительному уменьшению количества циркулирую-
щих Т-лимфоцитов или анемии, характеризующейся
выраженным уменьшением числа эритроцитов, по-
скольку эритроциты вызревают вне сумки. Удаление
сумки не влияет на отторжение кожных трансплантатов
6 — г. В условиях антигенной стимуляции зароды-
шевые центры содержат большие популяции В-лим-
фоцитов, подвергающиеся митозу, и плазматические
клетки, секретирующие антитела. Наивные (не встре-
чавшиеся с антигеном) лимфоциты развиваются в
первичных лимфоидных органах, а не во вторичных
лимфоидных органах, таких как селезенка и лимфати-
ческие узлы. Зародышевые центры не участвуют в
удалении поврежденных эритроцитов, а также не яв-
ляются источником стволовых клеток; последние на-
ходятся в костном мозге.
7 — г. Натуральные киллеры являются большими
гранулярными лимфоцитами. Их число не увеличива-
ется в ответ на появление антигена. Натуральные кил-
леры уничтожают антигены без фагоцитоза, а их клет-
ками-мишенями являются инфицированные вирусом
или опухолевые клетки. Они не являются особенно
эффективными против бактериальных клеток.
8 — а. После того как незрелые дендритные клет-
ки захватывают патогены (фагоцитоз), они активиру-
ются и созревают, т.е. становятся более эффективны-
ми в презентации антигена и действительно могут ак-
тивировать антигенспецифичные наивные Т-клетки.
Глава
ИММУНОГЕНЫ И АНТИГЕНЫ
9 ВВЕДЕНИЕ
Иммунный ответ возникает в результате воздей-
ствия чужеродного агента. Соединение, которое
вызывает реакцию, относят или к антигенам, или
к иммуногенам. Различие между ними заключает-
ся в их функциях. Антигеном является любой агент,
способный специфически связываться с компо-
нентами иммунного ответа, такими как рецепто-
ры В-клеток (BCR) на В-лимфоцитах, и раство-
римыми антителами. Иммуноген же представля-
ет собой агент, способный вызывать иммунную
реакцию и таким образом являться иммуногенным.
Различать эти два термина необходимо, посколь-
ку имеется много соединений, не способных вы-
зывать иммунную реакцию и в то же время спо-
собных связываться с компонентами иммунной
системы, которые были выработаны специально
против них. Таким образом, все иммуногены яв-
ляются антигенами, но не все антигены являются
иммуногенами. Это различие становится очевид-
ным в случае с соединениями низкой молекуляр-
ной массы, группой веществ, включающей мно-
гие лекарства и антибиотики Сами по себе эти
соединения не способны вызвать иммунный от-
вет, но когда они объединяются с гораздо более
крупными агентами, такими как протеины, фор-
мируется конъюгат, способный вызывать иммун-
ный ответ, направленный против различных час-
тей конъюгата, в том числе и его составляющую с
низкой молекулярной массой. Действующее та-
ким образом низкомолекулярное вещество отно-
сится к гаптенам (от греч. hapto — схватывать), в
го время как соединение с высокой молекуляр-
ной массой, с которым соединяется гаптен, на-
зывается носителем. Таким образом, гаптен яв-
ляется соединением, не способным самостоятель-
но вызывать иммунный ответ, но против которо-
го иммунный ответ может быть получен путем
иммунизации, если гаптен конъюгирован с но-
сителем.
Иммунный ответ был получен против всех из-
вестных семейств биохимических соединений,
таких как углеводы, липиды, протеины и нуклеи-
новые кислоты. Он может быть получен и к ле-
карствам, антибиотикам, пищевым добавкам, кос-
метическим средствам, мелким синтетическим
пептидам, но только в том случае, если они объ-
единены с носителем. В этой главе будут обсуж-
даться основные свойства соединений, которые
делают их антигенами и иммуногенами.
УСЛОВИЯ ПОЯВЛЕНИЯ
ИММУНОГЕННОСТИ
Для того чтобы обладать свойствами иммуноген-
ности, соединение должно иметь следующие ха-
рактеристики: 1) чужеродность; 2) большая моле-
кулярная масса; 3) сложное химическое строение;
4) в большинстве случаев способность к разруше-
нию (деградации) и взаимодействию с МНС орга-
низма-хозяина.
Чужеродность
Обычно у животных не отмечают аутоиммунных
реакций. Так, если кролику, например, вводят
его собственный сывороточный альбумин, он не
вызовет иммунной реакции, поскольку распоз-
нается как собственный. Напротив, если сыво-
роточный альбумин кролика вводят морской
свинке, он будет распознаваться как чужеродный
кроличий сывороточный альбумин и вызывать
иммунный ответ. Чтобы доказать сохранность им-
мунитета у кролика, у которого не наблюдалось
50
ГЛАВА 3. ИММУНОГЕНЫ И АНТИГЕНЫ
иммунной реакции на собственный сывороточ-
ный альбумин, ему можно ввести альбумин мор-
ской свинки. У кролика с сохраненным имму-
нитетом будет наблюдаться иммунная реакция на
сывороточный альбумин морской свинки, по-
скольку эта субстанция будет определяться как
соон
Вторичная
структура
е Рис. 3.1. Уровни организационной структуры протеина
На первичную структуру указывает линейное расположе-
ние аминокислот (для чего используют однобуквенный
код); также отмечается наличие внутри цепи разных ди-
сульфидных мостиков. Вторичная структура возникает при
укладывании полипептидной цепи в а-спирали и р-склад-
ки. Третичная структура, показанная в виде ленточной диа-
граммы, формируется путем складывания участков вто-
ричных структур (адаптировано с разрешения Р Sun,
JC Boyington, Current Protocols in Protein Science, Wiley)
чужеродная. Таким образом, первым требовани-
ем к веществу, рассматриваемому как иммуно-
генное, является чужеродность. Чем более чуже-
родным является вещество, тем более оно имму-
ногенно.
Обычно соединения, синтезируемые в организ-
ме хозяина, не являются для него иммуногенны-
ми. Однако имеются исключения, когда у инди-
видуума отмечается иммунная реакция на свои
собственные ткани. Это состояние называется
аутоиммунитетом (см. гл. 12).
Большая молекулярная масса
Вторым необходимым свойством иммуногена яв-
ляется определенная минимальная молекулярная
масса вещества. Обычно соединения малой мо-
лекулярной массой менее 1 000 Да (например, пе-
нициллин, прогестерон, аспирин) не являются
иммуногенными. Соединения молекулярной мас-
сой между 1000 и 6000 Да (например, инсулин,
адренокортикотропный гормон) могут быть им-
муногенными, а могут и не быть. Соединения
молекулярной массой более 6000 Да (например,
альбумин, столбнячный токсин) обычно явля-
ются иммуногенными. Итак, относительно мел-
кие молекулы соединений обладают низкой им-
муногенностью, в то время как большие — вы-
сокой.
Сложная химическая структура
Третьим свойством, которым должно обладать
соединение, чтобы быть иммуногенным, являет-
ся определенный уровень физико-химической
сложности. Например, простые молекулы, такие
как гомополимеры аминокислот (например, по-
лимер лизина молекулярной массой 30000 Да),
редко являются хорошими иммуногенами. Ана-
логично, гомополимер поли-у-D-глутаминовой
кислоты (материал капсулы бациллы сибирской
язвы) молекулярной массой 50000 Да не явля-
ется иммуногенным. Отсутствие иммуногенно-
сти, несмотря на большую молекулярную массу
этих веществ, обусловлено отсутствием доста-
точной химической сложности. Однако при уве-
личении химической сложности путем присое-
динения к е-аминогруппе полилизина дополни-
тельных частей, таких как динитрофенол, или
других соединений с низкой молекулярной мас-
сой, не являющихся иммуногенными, такая мак-
ромолекула становится иммуногенной. Полу-
чаемый иммунный ответ направлен не только
против спаренных соединений с низкой моле-
кулярной массой, но и против гомополимера с
высокой молекулярной массой. Обычно увеличе-
ние химической сложности соединения сопро-
вождается увеличением его иммуногенности.
Так, сополимеры некоторых аминокислот, таких
УСЛОВИЯ ПОЯВЛЕНИЯ ИММУНОГЕННОСТИ
51
Четвертичная структура
• Рис. 3.2. Четвертичная структура белков, возникающая
из связи двух или более полипептидных цепей, которые
формируют полимерный белок (адаптировано с разреше-
ния Р Sun and JC Boyington, Current Protocols in Protein
Science, Wiley)
как полиглутаминовой, аланиновой и лизино-
вой (poly-GAT), обычно обладают высокой им-
муногенностью.
Поскольку многие иммуногены являются про-
теинами, важно понять структурные свойства этих
молекул. Каждый из четырех структурных уров-
ней белка вносит свой вклад в появление имму-
ногенности у молекулы. При инициации приоб-
ретенного иммунного ответа распознаются мно-
гие структурные характеристики и химические
свойства соединений. Например, антитела могут
распознавать такие структурные характеристики
протеина, как первичная структура (последова-
тельность аминокислот), вторичные (структуры
каркаса полипептидной цепи, такие как ос-спи-
раль или р-складка) и третичные структуры (сфор-
мированные трехмерной конфигурацией белка,
которая создается при складывании полипептид-
ной цепи и поддерживается дисульфидными мо-
стиками, водородными связями, гидрофобными
взаимодействиями и т.д.) (рис. 3.1). Могут рас-
познаваться и четвертичные структуры (сформи-
рованные наложением отдельных частей, если
молекула состоит из более чем одной субъедини-
цы белка) (рис. 3.2).
Способность разрушаться
Для антигенов, активирующих Т-клетки, способ-
ность стимулировать иммунный ответ определя-
ется возможностью взаимодействия с молекула-
ми МНС, экпрессированными на антигенпрезен-
тирующих клетках (АПК) (см. гл. 9). Последние
должны вначале расщепить антиген, подвергнуть
его ферментной деградации (этот процесс назы-
вается процессированием антигена), после чего
антигенные эпитопы (небольшие фрагменты им-
муногена) могут быть представлены на поверхно-
сти АПК. После деградации и возникновения
нековалентной связи с МНС эти эпитопы стиму-
лируют активацию и расширение клона антиген-
специфичных эффекторных Т-клеток. Чувстви-
тельность протеинового антигена к ферментатив-
ной деградации во многом зависит от двух свойств:
1) он должен быть достаточно стабильным для то-
го, чтобы попасть к месту взаимодействия В- или
Т-лимфоцитов, что необходимо для развития им-
мунного ответа; 2) соединение должно относи-
тельно легко поддаваться частичной фермента-
тивной деградации, которая происходит во вре-
мя процессирования антигена АПК. Пептиды, со-
стоящие из D-аминокислот, которые устойчивы
к ферментативной деградации, не являются им-
муногенными, в то время как их L-изомеры, чув-
ствительные к ферментам, являются иммуноген-
ными. Напротив, углеводы, которые не подвер-
гаются изменениям и не презентируются, не мо-
гут активировать Т-клетки, хотя активируют
В-клетки.
В целом, чтобы быть иммуногенным, вещество
должно обладать всеми этими четырьмя свойства-
ми. Оно должно быть чужеродным тому, кому
введено, иметь относительно большую молекуляр-
ную массу, обладать определенной степенью хи-
мической сложности и быть способным к дегра-
дации.
Гаптены
Как указывалось ранее, вещества, называемые
гаптенами, не вызывают иммунного ответа в своей
первоначальной форме из-за низкой молекуляр-
ной массы и простоты химического строения. Эти
соединения не иммуногенны до тех пор, пока они
не соединятся с носителями, обладающими слож-
ной химической структурой и высокой молеку-
лярной массой. Таким образом, иммунный ответ
может быть вызван тысячами химических соеди-
нений, как с высокой, так и с низкой молекуляр-
ной массой при условии, что они соединены с
носителями, обладающими сложной химической
структурой и высокой молекулярной массой.
52
ГЛАВА 3. ИММУНОГЕНЫ И АНТИГЕНЫ
Другие условия появления
иммуногенности
Существует также ряд других факторов, опреде-
ляющих, будет ли вещество иммуногенным. Важ-
ную роль в том, будет ли данное вещество вызы-
вать иммунную реакцию, играет генетическая
организация (генотип) иммунизируемого индиви-
дуума. Генетический контроль иммунной реактив-
ности осуществляется в основном генами, карти-
рованными внутри МНС. Другой решающий фак-
тор, определяющий иммуногенность веществ, —
индивидуальный репертуар В- и Т-клеток. Реак-
ции приобретенного иммунитета запускаются
после связывания антигенных эпитопов с анти-
генспецифичными рецепторами на В- и Т-лим-
фоцитах. Если у индивидуума отсутствует опре-
деленный клон лимфоцитов, состоящий из кле-
ток, несущих идентичный антигенспецифичный
рецептор, необходимый для ответа на данный ан-
тигенный стимул, иммунного ответа на такой
эпитоп не будет. И, наконец, такие важные на
практике факторы, как доза и метод введения ан-
тигена, также играют роль в проявлении веще-
ством иммуногенности.
Недостаточные дозы антигена могут не выз-
вать иммунный ответ в связи с тем, что они будут
не способны в должной мере активировать лим-
фоциты или потому что данная доза делает реа-
гирующие клетки неотвечаюшими. Последнее из
перечисленных явлений вызывает состояние то-
лерантности к данному антигену (будет обсуждать-
ся в гл. 12). Возможность индуцировать иммун-
ный ответ определяется не только необходимо-
стью введения порогового количества антигена,
но и числом вводимых доз. Далее будет показано,
что для получения сильного иммунного ответа не-
обходимо повторно ввести антиген.
Наконец, на результат иммунизации может
повлиять путь введения антигена, поскольку
именно он определяет, какие органы и популя-
ции клеток будут вовлечены в реакцию. Антиге-
ны, вводимые наиболее распространенным спо-
собом — подкожно, обычно вызывают наиболее
сильный иммунный ответ. Это связано с тем, что
их захват, процессирование и представление (пре-
зентация) эффекторным клеткам осуществляют-
ся клетками Лангерганса, находящимися в коже
и являющимися одними из наиболее эффектив-
ных АПК. Реакции на подкожное введение ан-
тигенов проявляются в лимфатических узлах, куда
происходит отток лимфы от места введения. Ан-
тигены, введенные внутривенно, переносятся
вначале в селезенку, где могут индуцировать им-
мунологическую неотвечаемость, или толерант-
ность, или, если они представлены АПК, выз-
вать иммунный ответ. Антигены, поступающие
через рот {гастроинтестинальный путь), вызы-
вают локальный антительный ответ в границах
собственной пластинки кишечника, но часто
приводят к возникновению системной толеран-
тности к антигену (подробно о толерантности см.
в гл. 12). Наконец, введение антигенов через рес-
пираторный тракт {интраназальный путь) неред-
ко вызывает аллергические реакции (см. гл. 14).
Поскольку иммунные реакции зависят от мно-
жества межклеточных взаимодействий, на тип и
выраженность иммунного ответа влияют клетки,
заполняющие орган, в который антиген достав-
ляется первоначально. Обязательные для прояв-
ления иммуногенности условия, перечисленные
ранее, составляют часть тонкого механизма конт-
роля, описанного в следующих главах, который,
с одной стороны, запускает приобретенный им-
мунный ответ, а с другой, защищает индивидуум
от реакции на вещества в тех случаях, когда такие
реакции являются вредными.
ПЕРВИЧНЫЙ И ВТОРИЧНЫЙ
ОТВЕТЫ
Первая встреча индивидуума с иммуногеном рас-
сматривается как первичная иммунизация, кото-
рая вызывает первичный ответ. Как мы увидим в
следующих главах, во время этой первичной им-
мунизации происходит много различных событий:
клетки, процессирующие антиген, запускают про-
лиферацию и дифференцировку антигенспеци-
фичных лимфоцитов. Субпопуляции Т-лимфо-
цитов взаимодействуют с другими субпопуляция-
ми и индуцируют дифференцировку последних в
Т-лимфоциты со специализированной функцией.
Т-лимфоциты взаимодействуют также с В-лим-
фоцитами, побуждая их к синтезу и секреции ан-
тител.
Повторная встреча с тем же иммуногеном при-
водит к развитию вторичного ответа. Этот по-
вторный контакт может произойти после того, как
первичный иммунный ответ затих или полностью
прошел (через недели или даже годы). Вторич-
ный ответ отличается от первичного по многим
показателям. Наиболее заметным и биологиче-
ски обусловленным является гораздо более быст-
рое начало и большая интенсивность реакции
Этот вторичный (и последующие) контакт про-
исходит таким образом, как будто организм «вспо-
минает», что он уже встречался с данным имму-
ногеном. Фактически при вторичных и последу-
ющих ответах вовлекается большее число анти-
генспецифичных лимфоцитов, образовавшихся
в ходе первичного иммунного ответа. Таким об-
разом, увеличивается арсенал реагирующих лим-
фоцитов, что частично обусловливает размах на-
блюдаемой реакции. Вторичный ответ называют
анамнестическим или реакцией памяти, а В- и
Т-лимфоциты, которые участвуют в этом ответе,
называют клетками памяти. Динамика продук-
ции антител после иммунизации детально описа-
на в гл. 4.
ЭПИТОПЫ, РАСПОЗНАВАЕМЫЕ В- И Т-КЛЕТКАМИ 53
• Таблица 3.1. Распознавание антигенов В- и Т-клетками
Характеристика В-клетка Т-клетка
Антигенное взаимодействие В-клеточный рецептор (мембранный иммуноглобулин) связывает антиген Т-клеточный рецептор связывает антиген и МНС
Природа антигенов Белки, полисахариды, липиды Пептиды
Связывание раствори- мых антигенов Да Нет
Распознаваемые эпитопы Доступные, последовательные или прерывистого типа Внутренние линейные пептиды, произво- димые при процессировании антигена (протеолитическая деградация)
• АНТИГЕННОСТЬ
И АНТИГЕНСВЯЗЫВАЮЩИЙ
УЧАСТОК
Иммунный ответ, вызванный антигеном, приво-
дит к появлению антител или лимфоцитов, ко-
торые специфически реагируют с этим антиге-
ном. Антигенсвязывающий участок антитела или
рецептора на лимфоците обладает уникальной
структурой, позволяющей комплементарно соот-
ветствовать некоторым частям структуры специ-
фичного антигена. Часть иммуноглобулина, ко-
торая специфически связывается с антигенной
детерминантой, или эпитопом, концентрирует-
ся в нескольких гипервариабельных участках мо-
лекулы, которая формирует участок, определяю-
щий комплементарность (complementary-
determing region — CDR). Дополнительные струк-
турные характеристики молекулы иммуноглобу-
лина описаны в гл. 4.
В разных исследованиях указано, что размер
эпитопа, который взаимодействует с CDR на дан-
ном антителе, примерно эквивалентен 5 — 7 ами-
нокислотам. Эти размеры были определены жс-
периментальным путем при связывании антител
с полисахаридными и пептидными эпитопами.
Считается, что эти величины примерно соответ-
ствуют размеру комплементарного антительного
связывающего участка, называемого паратопом.
Действительно, эти расчеты были подтверждены
методом рентгенологической кристаллографии.
Малый размер эпитопа (пептида), который свя-
зывается со специфичным Т-клеточным рецепто-
ром (TCR) (пептиды, состоящие из 8 — 12 амино-
кислотных остатков), функционально увеличива-
ется, поскольку вступает в нековалентную связь с
М НС-протеинами АПК. Этот бимолекулярный
комплекс, состоящий из эпитопа и МНС, после
• Рис. 3.3. Пример антигена (миоглобин кашалота), со-
держащего пять линейных В-клеточных эпитопов (крас-
ные), один из которых связан с антигенсвязывающим уча-
стком антитела, специфичного для аминокислотных остат-
ков 56-62
связывания с рецептором Т-клетки формирует
тримолекулярный комплекс (TCR —эпитоп —
МНС).
В ЭПИТОПЫ, РАСПОЗНАВАЕМЫЕ
В- И Т-КЛЕТКАМИ
Существует большое количество данных, указы-
вающих на то, что свойства многих эпитопов, рас-
познаваемых В-клетками, отличаются от свойств
эпитопов, распознаваемых Т-клетками (табл. 3.1).
Как правило, связанные с мембраной антитела,
представленные на В-клетках, распознают и свя-
зывают свободный растворимый антиген. Такие
эпитопы обычно находятся в наружной части мо-
лекулы и доступны для взаимодействия с рецеп-
тором В-клетки. Обычно, В-клеточные эпитопы
составляют концевые части полисахаридных це-
пей и гидрофильные участки белковых молекул.
В качестве примера на рис. 3.3 представлен анти-
ген с пятью линейными В-клеточными эпитопа-
ми, расположенными на внешней поверхности ми-
оглобулина. В-клеточные эпитопы могут также
формироваться в результате конформации моле-
кулы при изгибе ее фрагментов, как показано на
рис. 3.4. Такие эпитопы называются конформаци-
онными {прерывистыми) эпитопами, в которых
аминокислотные остатки, не расположенные по-
54
ГЛАВА 3. ИММУНОГЕНЫ И АНТИГЕНЫ
• Рис. 3.4. Антиген представлен аминокислотными остат-
ками (круги), которые формируют прерывистый эпитоп
«петля» (синяя), образованный с помощью дисульфидно-
го мостика между остатками 64 и 80. Заметьте, что анти-
тело, специфичное к данному эпитопу, связывается с ами-
нокислотами, расположенными непоследовательно
• Рис. 3.5. Структура молекулы МНС I класса (ленточная
диаграмма) с антигенным пептидом (модель, составлен-
ная шариками и палочками)
СВЯЗЫВАНИЕ АНТИГЕНА С АНТИГЕНСПЕЦИФИЧНЫМИ АНТИТЕЛАМИ ИЛИ Т-КЛЕТКАМИ
55
Описание Пример
Один эпитоп Гапте н ы
Много эпитопов
одинаковой
специфичности
Много эпитопов
разной
специфичности
Много
полисахаридов,
гомополимеров
Белки
• Рис. 3.6. Некоторые возможные антигенные структуры,
содержащие единичные и многочисленные эпитопы
следовательно вдоль полипептидной цепи, сво-
дятся вместе в результате конформационных из-
гибов белка, как показано на рис. 3.3.
В отличие от В-клеток Т-клетки не способны
связывать растворенные антигены. Для взаимодей-
ствия эпитопа с рецептором Т-клетки необходи-
мо, чтобы АПК процессировала антиген. При этом
происходит ферментативное разрушение антиге-
на с образованием мелких пептидов, которые за-
тем связываются с МНС. Таким образом, Т-кле-
точные эпитопы могут быть только непрерывными,
или линейными, поскольку состоят из одного сег-
мента полипептидной цепи. На рис. 3.5 показана
структурная организация молекулы МНС I клас-
са, связанной с антигенным пептидом. Обычно
такие, подвергшиеся процессированию, эпитопы
являются внутренними денатурированными линей-
ными гидрофобными участками белков. Полиса-
хариды не имеют таких участков и, как известно,
не связываются с Т-клетками и не активируют их.
Таким образом, полисахариды содержат исключи-
тельно эпитопы, распознаваемые В-клетками, в то
время как в белках находятся эпитопы, распозна-
ваемые как В-, так и Т-клетками (см. табл. 3.1).
Антигенные эпитопы могут иметь характеристи-
ки, представленные на рис. 3.6. Они могут состо-
ять из единичного эпитопа (гаптена) или иметь
разное число идентичных эпитопов на одной моле-
куле (например, полисахариды). Наиболее распро-
страненные антигены (белки) имеют разное число
разнообразных эпитопов на одной молекуле.
♦ ОСНОВНЫЕ КЛАССЫ АНТИГЕНОВ
Антигенами могут быть несколько основных хи-
мических семейств.
• Углеводы (полисахариды). Полисахариды яв-
ляются иммуногенными только тогда, когда
они связаны с белками-носителями. Напри-
мер, полисахариды, которые составляют часть
более сложных молекул (гликопротеины), бу-
дут вызывать иммунную реакцию, часть кото-
рой направлена непосредственно на полиса-
харидную составляющую молекулы. Иммун-
ный ответ, представленный в основном анти-
телами, может индуцироваться против мно-
гих видов полисахаридных молекул, таких как
компоненты микроорганизмов и клеток эука-
риоит. Прекрасным примером антигенности
полисахаридов является иммунный ответ, свя-
занный с группами крови АВО. Полисахари-
ды в данном случае находятся на поверхности
эритроцитов.
• Липиды. Липиды редко являются иммуноген-
ными, но иммунная реакция на них может быть
вызвана, если липиды конъюгированы с бел-
ками-носителям. Таким образом, липиды мо-
гут рассматриваться как гаптены. Также отме-
чены иммунные реакции на гликолипиды и
сфинголипиды.
• Нуклеиновые кислоты. Нуклеиновые кислоты
сами по себе являются слабыми иммуногена-
ми, но становятся иммуногенными при связы-
вании с белками-носителями. Нативная спи-
ральная ДНК обычно не является иммуноген-
ной у животных. Однако во многих случаях от-
мечались иммунные реакции на нуклеиновые
кислоты. Одним из важных примеров в кли-
нической медицине является появление анти-
тел против ДНК у больных системной крас-
ной волчанкой (детально обсуждается в гл. 12).
• Белки. Фактически все белки иммуногенны.
Таким образом, чаще всего иммунный ответ
развивается к белкам. Более того, чем выше
уровень сложности белка, тем сильнее иммун-
ный ответ на этот протеин Размер и сложность
белковых молекул определяют наличие мно-
жества эпитопов.
* СВЯЗЫВАНИЕ АНТИГЕНА
С АНТИГЕНСПЕЦИФИЧНЫМИ
АНТИТЕЛАМИ ИЛИ Т-КЛЕТКАМИ
Связывание антигенов с антителами подробно
обсуждается в гл. 4 и 5. Взаимодействие антигена
с В- и Т-клетками и последующие события рас-
смотрены в гл. 10. На данном этапе важно под-
черкнуть только, что в связывании антигена с
антителом или рецепторами Т-клетки ковалент-
ные связи не участвуют. Нековалентное связыва-
ние может включать электростатические взаимо-
действия, гидрофобные взаимодействия, водород-
ные связи и ван-дер-ваальсовы силы. Поскольку
эти взаимодействующие силы относительно сла-
бы, сцепка между антигеном и его комплемен-
тарным участком на рецепторе антигена должна
происходить на площади, достаточно большой,
чтобы произошло суммирование всех возможных
взаимодействий. Это условие является основой для
исключительной специфичности наблюдаемых
иммунологических взаимодействий.
56
ГЛАВА 3. ИММУНОГЕНЫ И АНТИГЕНЫ
ПЕРЕКРЕСТНАЯ РЕАКТИВНОСТЬ
Поскольку макромолекулярные антигены содер-
жат несколько отстоящих друг от друга эпитопов,
некоторые из этих молекул могут быть изменены
без полного изменения их иммуногенетической и
антигенной структуры. Это имеет важные послед-
ствия при иммунизации против высокопатоген-
ных микроорганизмов или чрезвычайно токсич-
ных соединений. Действительно, проводить им-
мунизацию с помощью патогенного токсина не-
разумно. Однако можно разрушить биологическую
активность такого токсина и целого ряда других
токсинов (например, бактериальных токсинов или
ядов змей), сохранив их иммуногенность. Токсин,
модифицированный до такой степени, что боль-
ше не является токсичным, но все еще сохраняет
некоторые иммунохимические характеристики,
называется анатоксином. Таким образом, мы мо-
жем говорить о том, что анатоксин иммунологи-
чески перекрестно реагирует с токсином. Соот-
ветственно имеется возможность, иммунизируя
индивидуума с помощью анатоксина, вызвать
иммунный ответ к некоторым эпитопам, которые
на анатоксине сохранены в том же виде, как и на
токсине, поскольку не были уничтожены при
модификации. Хотя молекулы токсина и анаток-
сина отличаются по многим физико-химическим
и биологическим характеристикам, они иммуно-
логически перекрестно реактивны. Достаточное
количество сходных эпитопов позволяет вызвать
иммунный ответ на анатоксин и способствовать
эффективной защите от самого токсина. Имму-
нологическую реакцию, в которой иммунные ком-
поненты, будь то клетки или антитела, реагируют
с двумя молекулами, имеющими одинаковые эпи-
топы, но отличающиеся по другим признакам,
называют перекрестной реакцией. Когда два со-
единения обладают перекрестной иммунологиче-
ской реактивностью, они имеют один или не-
сколько общих эпитопов, и в процессе иммунно-
го ответа на одно из соединений будут распозна-
ваться один или более таких же эпитопов на дру-
гом соединении с вовлечением его в реакцию.
Другая форма перекрестной реактивности наблю-
дается в случаях, когда антитела или клетки, спе-
цифичные для одного эпитопа, связываются,
обычно слабее, с другим эпитопом, который не
является совершенно идентичным, но по струк-
туре напоминает первый эпитоп.
Чтобы отметить, что антиген, используемый для
иммунизации, отличен от того, против которого
позднее будут реагировать произведенные иммун-
ные компоненты, используют термины «гомоло-
гичный» и «гетерологичный». Термин «гомологич-
ный» обозначает, что антиген и иммуноген оди-
наковы. Термин «гетерологичный» указывает, что
вещество, использованное для индуцирования
иммунного ответа, отличается от вещества, кото-
рое позднее используется для реакции с продук-
тами индуцированного ответа. В последнем слу-
чае гетерологичный антиген может реагировать,
а может и не реагировать с иммунными компо-
нентами. При появлении реакции можно сделать
заключение, что гетерологичный и гомологичный
антигены проявляют иммунологическую перекрест-
ную реактивность.
Несмотря на то что основным критерием в
иммунологии является специфичность, иммуно-
логическая перекрестная реактивность наблюда-
ется на многих уровнях. Это не означает, что роль
иммунологической специфичности уменьшается,
а скорее указывает на то, что соединения, обла-
дающие перекрестной реактивностью, имеют оди-
наковые антигенные детерминанты. В случаях
наличия перекрестной реактивности антигенные
детерминанты веществ, обладающих перекрестной
реактивностью, могут иметь идентичные химиче-
ские структуры или состоять из одинаковых, но не
идентичных физико-химических структур. В при-
веденном ранее примере токсин и соответствую-
щий ему анатоксин представляют две молекулы:
токсин является первоначальной молекулой, а
анатоксин — модифицированной, которая обла-
дает перекрестной реактивностью по отношению
к первоначальной (нативной) молекуле.
Существуют и другие примеры иммунологи-
ческой перекрестной реактивности, в которых два
вещества, обладающие ею, не родственны друг
другу за исключением того, что обладают одним
или более общими эпитопами, точнее одним или
более участками, имеющими одинаковые трехмер-
ные характеристики. Эти вещества относят к гете-
рофильным антигенам. Например, антигены груп-
пы крови А человека реагируют с антисыворот-
кой, полученной против полисахарида (тип XIV)
капсулы пневмококка. Таким же образом, анти-
гены группы крови В человека реагируют с анти-
телами к определенным штаммам Escherichia
coli. В этих примерах перекрестной реактивности
антигены микроорганизмов относятся к гетеро-
фильным антигенам (относительно антигенов
групп крови).
АДЪЮВАНТЫ
Для усиления иммунного ответа на представлен-
ный антиген часто используются различные до-
бавки и наполнители. Адъювант (от лат. adjuvare —
помогать) является веществом, которое при сме-
шивании с иммуногеном усиливает иммунный
ответ против этого иммуногена. Важно различать
носитель для гаптена и адъювант. Гаптен стано-
вится иммуногенным после ковалентного конъю-
гирования с носителем; он не может быть имму-
ногенным при смешивании с адъювантом. Таким
образом, адъювант усиливает иммунный ответ на
иммуногены, но не придает иммуногенность гап-
тенам.
Адъюванты используются для усиления иммун-
ной реакции на антигены уже более 70 лет. В на-
АДЪЮВАНТЫ
57
стоящее время растет интерес к выявлению но-
вых адъювантов для использования их при вак-
цинации, поскольку многие кандидаты в вакци-
ны не обладают достаточной иммуногенностью.
Это особенно важно для пептидных вакцин. Ме-
ханизм действия адъюванта включает: 1) увеличе-
ние биологического и иммунологического пери-
ода полураспада антигенов вакцины; 2) увеличе-
ние продукции местных воспалительных цитоки-
нов; 3) улучшение доставки, процессирования
антигенов и их представления (презентации) АПК.
особенно дендритными клетками. Эмпирически
было выяснено, что адъюванты, содержащие мик-
робные компоненты (например, экстракты мико-
бактерий), являются лучшими. Патогенные ком-
поненты вынуждают макрофаги и дендритные
клетки экспрессировать костимулирующие моле-
кулы и выделять цитокины. Недавно было пока-
зано, что в такую индукцию, осуществляемую
микробными компонентами, вовлекаются молеку-
лы, распознающие структуры патогенных микро-
организмов (например, TLR 2), экспрессируемые
этими клетками. Таким образом, связывание мик-
робных компонентов с TLR дает клеткам сигнал
экспрессировать костимуляторные молекулы и
секретировать цитокины.
Хотя много различных адъювантов испытаны
в опытах на животных (табл. 3.2) и в эксперимен-
тах на человеке, только один стал использоваться
для обычной вакцинации. В настоящее время
единственными адъювантами, разрешенными к
использованию в патентованных вакцинах для
людей в США, являются гидрат окиси алюминия
и фосфат алюминия.
Как компонент неорганической соли ион алю-
миния связывается с протеинами, вызывая их
преципитацию, что усиливает воспалительную
реакцию, которая неспецифически увеличивает
иммуногенность антигена. После инъекции пре-
ципитированный антиген высвобождается из ме-
ста инъекции медленнее, чем обычный Более
того, если в результате преципитации размер ан-
тигена увеличится, это повысит вероятность того,
что макромолекула будет подвергнута фагоцитозу.
Многие адъюванты используются в экспери-
ментах на животных. Одним из обычно использу-
емых адъювантов является полный адъювант Фрейн-
да (Freund’s complete adjuvant — FCA). состоя-
щий из убитых Mycobacterium tuberculosis или
М. Butyricит, суспензированных в масле. В после-
дующем из них готовится эмульсия с водным рас-
твором антигена. Водно-масляная эмульсия, со-
держащая адъювант и антиген, позволяет антиге-
ну медленно и постепенно высвобождаться, про-
длевая воздействие иммуногена на реципиента.
Другими микроорганизмами, используемыми в
качестве адъювантов, являются бациллы Кальмет-
та-Герена (БЦЖ) (аттенуированные Mycobacte-
rium). Corynebacterium parvum и Bordetella pertusis.
В действительности многие из этих адъювантов
используют способность молекул, экспрессируе-
мых микробами, активировать иммунные клетки.
К таким молекулам относят липополисахариды
(ЛПС), бактериальную ДНК, содержащую неме-
тилированные CpG динуклеотидные повторы, и
бактериальные белки теплового шока. Многие из
этих микробных адъювантов связывают рецепто-
ры, распознающие структуры патогенных микро-
организмов, такие как TLR. Связывание этих
рецепторов, экспрессируемых многими типами
клеток врожденной иммунной системы, способ-
ствует стимуляции адаптивного ответа В- и Т-лим-
фоцитами. Например, дендритные клетки явля-
ются важными АПК, через которые проявляется
• Таблица 3.2. Известные адъюванты и механизм их действия
Адъювант Состав Механизм действия
Гидрат окиси или фосфат алюминия (квасцы) Гель гидрата окиси алюминия Увеличение поглощения антигенов АПК; замедление высвобождения антигена
Алюминий с дипептидом, выделенным из мико- бактерий Гель гидрата окиси алюминия с мурамилдипептидом Увеличение поглощения антигенов АПК; замедление высвобождения антигена; индукция костимуляторных молекул на АПК
Алюминий с Bordetella pertusis Гель гидрата окиси алюминия с убитой Bordetella pertusis Увеличение поглощения антигенов АПК; замедление высвобождения антигена; индукция костимуляторных молекул на АПК
Полный адъювант Фрейнда Водно-масляная эмульсия с убитыми микобактериями Увеличение поглощения антигенов АПК; замедление высвобождения антигена; индукция костимуляторных молекул на АПК
Неполный адъювант Фрейнда Водно-масляная эмульсия Увеличение поглощения антигенов АПК; замедление высвобождения антигена
Иммуностимулирующие комплексы Открытые структуры, напомина- ющие клетку, содержащие холе- стерин и смесь сапонинов Высвобождение антигена в цитозоль; позволяют индуцировать Т-клеточные цитотоксические ответы
58
ГЛАВА 3. ИММУНОГЕНЫ И АНТИГЕНЫ
действие микробных адъювантов. Они отвечают
секрецией цитокинов и экспрессией костимуля-
торных молекул, которые в свою очередь стиму-
лируют активацию и дифференцировку антиген-
специфичных Т-клеток.
РЕЗЮМЕ
1. Иммуногенность — это способность соединения
вызвать иммунный ответ. Условием иммуногенности
являются: а) чужеродность соединения для иммуни-
зируемого индивидуума; б) превышение определен-
ной минимальной молекулярной массы; в) опреде-
ленный уровень химической сложности; г) способ-
ность к деградации или чувствительность к процесси-
рованию антигена, а также представление (презента-
ция) посредством взаимодействия с МНС.
2, Антигенность определяется способностью со-
единения связаться с антителами или клетками им-
мунной системы. Это связывание является высоко-
специфичным; компоненты иммунной системы спо-
собны распознавать различные физико-химические
характеристики соединения. В образование связи
между антигеном и иммунными компонентами вовле-
чены несколько слабых сил, действующих на неболь-
ших расстояниях (ван-дер-ваальсовы силы, электро-
статические взаимодействия, гидрофобные взаимо-
действия и водородные связи), но не задействованы
ковалентные связи.
3. Наименьшая частица антигена, способная свя-
зываться с антителами, называется антигенной детер-
минантой, или эпитопом. Соединения могут иметь
один или более эпитопов, способных реагировать с
иммунными молекулами Иммунный ответ на эти со-
единения подразумевает продукцию антител или об-
разование клеток, специфично направленных против
большинства или всех этих эпитопов.
4, Для иммуноглобулинов, представленных на
мембране В-клетки, или секретируемых антител ха-
рактерно распознавание доступных аминокислотных
последовательностей, которые обычно гидрофобны и
мобильны. Это могут быть как последовательно, так
и непоследовательно расположенные аминокислот-
ные остатки (конформационные детерминанты), ко-
торые сближаются в результате трехмерного склады-
вания белка. Мембранные формы иммуноглобулинов
на В-клетках и антитела способны распознавать по-
лисахариды и липиды.
5. Т-клетки распознают внутреннюю последова-
тельность аминокислот в молекуле белка в комплексе
с молекулами МНС I или II класса. Пептидные фраг-
менты белковых антигенов образуются в результате
процессирования антигена и могут связываться с мо-
лекулами МНС и представляться Т-клеткам.
6- Термин «иммунологическая перекрестная реак-
тивность» означает ситуацию, когда два или более
вещества, которые могут в определенной степени от-
личаться друг от друга, обладают одинаковыми эпито-
пами и способны взаимодействовать с иммунными
компонентами, вырабатываемыми против любого из
них. Так, анатоксин, который является модифициро-
ванной формой токсина, может обладать одним (или
более) общим эпитопом с токсином. Иммунизация
анатоксином ведет к выработке иммунного ответа не
только на анатоксин, но и на нативный токсин.
7. Адъювантами являются вещества, способные
ускорять, продлевать и повышать качество специфич-
ных иммунных ответов. При введении с антигеном
адъюванты способствуют иммунным реакциям, специ-
фичным для данного антигена (но не для самого адъ-
юванта), поскольку усиливают реакцию неспецифи-
чески. Принцип действия адъювантов заключается в
усилении презентации антигена АПК (особенно денд-
ритными клетками), индукции костимулирующих мо-
лекул, а также местного воспалительного цитокиново-
го ответа.
ТЕСТЫ
Выберите ОДИН НАИБОЛЕЕ ПРАВИЛЬНЫЙ ответ
на каждый тест.
1. Большой белок расщеплен ферментами в ла-
боратории для получения смеси пептидов длиной от
4 до 10 аминокислот. После введения пептидной сме-
си экспериментальному животному следует ожидать:
а) что при введении только смеси пептидов будут
вырабатываться специфичные к пептиду антитела;
б) специфичные к пептиду антитела будут выраба-
тываться, только если вместе со смесью пептидов бу-
дет вводиться адъювант;
в) специфичные к пептиду антитела будут выраба-
тываться, только если они вначале будут объединены
с носителем;
г) специфичные к пептиду антитела и Т-клетки бу-
дут формироваться после введения только пептидной
смеси;
д) специфичные к пептиду антитела и Т-клетки бу-
дут образовываться, только если со смесью пептидов
будет вводиться адъювант.
2, Иммунитет против вируса оспы, сформировав-
шийся в результате предшествующей инфекции, выз-
ванной коровьей оспой, обусловлен:
а) антигенной специфичностью;
б) перекрестной реактивностью антигенов;
в) усиленным захватом вирусов макрофагами;
г) врожденным иммунитетом;
д) пассивной защитой.
3. Трансформация токсина в анатоксин:
а) делает токсин более иммуногенным;
б) уменьшает фармакологическую активность ток-
сина;
в) усиливает связывание с антитоксином;
г) индуцирует только природный иммунитет;
д) усиливает фагоцитоз.
4, Гаптены:
а) нуждаются в молекулах-носителях, чтобы стать
иммуногенными;
б) реагируют со специфическими антителами, ког-
да не используются гомологичные носители;
в) взаимодействуют со специфичным антителом,
даже если гаптены моновалентны;
г) не могут стимулировать вторичный антительный
ответ без носителей;
д) все перечисленное
АДЪЮВАНТЫ
59
5, Адъювант является веществом:
а) увеличивающим размер иммуногена;
б) повышающим иммуногенность гаптенов;
в) усложняющим химическую структуру иммуногена;
г) усиливающим иммунный ответ на иммуноген;
д) усиливающим иммунологическую перекрестную
реактивность.
6, Антитела к антигену столбнячного анатоксина
одного типа реагируют с ним, даже если анатоксин
денатурирован с разрывом всех дисульфидных свя-
зей. Антитела другого типа против столбнячного ана-
токсина не могут реагировать с анатоксином после
подобной денатурации. Наиболее логичным объясне-
нием этого будет следующее:
а) первые антитела являются специфичными для
нескольких эпитопов, экспрессируемых анатоксином;
б) первые антитела специфичны для первичной
последовательности аминокислот анатоксина, в то
время как вторые специфичны для конформационных
детерминант;
в) вторые антитела специфичны для дисульфидных
связей;
г) первые антитела имеют более высокую аффин-
ность с анатоксином
ОТВЕТЫ НА ТЕСТЫ
1 — в. Пептиды (длиной 4—10 аминокислот) яв-
ляются молекулами с низкой молекулярной массой.
С учетом небольшого размера они не способны выз-
вать антительный ответ. Пептиды могут стать иммуно-
генными при соединении или связывании с носителем.
2 — 6. Иммунитет против оспы, возникший после
инфицирования вирусом коровьей оспы, является
примером перекрестной реактивности антигенов. Им-
мунизация вирусом коровьей оспы приводит к воз-
никновению иммунного ответа на натуральную оспу,
поскольку эти два вируса обладают несколькими
идентичными или схожими по структуре детерминан-
тами.
3 — б. Трансформация токсина в анатоксин про-
исходит, чтобы уменьшить фармакологическую актив-
ность токсина. После этого можно ввести достаточное
количество анатоксина для индуцирования иммунного
ответа
4 - д. Гаптены обычно являются моновалентными
веществами с низкой молекулярной массой и сами по
себе не могут вызывать иммунные реакции (первич-
ные или вторичные). Но они могут инициировать та-
кие реакции при конъюгировании с носителями, обла-
дающими высокой молекулярной массой. Гаптены
могут реагировать и реагируют с индуцированными
антителами; при этом нет необходимости их конъюга-
ции с носителем.
5 — г. Иммунологический адъювант является ве-
ществом, которое в смеси с иммуногеном усиливает
иммунный ответ на данный иммуноген. Механизм
действия при этом зависит от используемого адъю-
ванта (например, усиление презентации антигена, за-
медление удаления антигена). Адъювант не увеличи-
вает размер антигена и не усложняет его химическую
структуру. Кроме того, адъювант не усиливает иммун-
ную реакцию на гаптен; для индуцирования реакции
против гаптена необходима конъюгация гаптена с им-
муногенным носителем. Адъювант не имеет отноше-
ния к возможной токсичности иммуногена.
6 — 6. Антитела могут распознавать единичные
эпитопы, сформированные первичными, вторичными,
третичными или четвертичными конформационными
структурами. Денатурация белка с разрывом дисуль-
фидных связей обычно разрушает конформационные
детерминанты. Поэтому первые антитела реагируют с
детерминантой, образованной первичной последова-
тельностью аминокислот. Эта детерминанта присут-
ствует как в первоначальном, так и денатурированном
токсине, в то время как следующие антитела распо-
знают конформационную детерминанту, присутствую-
щую только на исходном токсине
Глава
СТРУКТУРА АНТИТЕЛ И ИХ ФУНКЦИИ
ВВЕДЕНИЕ
Одной из основных функций иммунной системы
является продукция растворимых белков, свобод-
но циркулирующих и обладающих особыми свой-
ствами, необходимыми для работы иммунной си-
стемы и защиты от чужеродных субстанций. Эти
растворимые белки — антитела — относятся к
классу белков, называемых глобулинами в связи с
их глобулярной структурой. Первоначально из-за
способности к перемещению при электрофорезе
их назвали у-глобулинами (в отличие от более
быстро перемещающихся альбумина, а-глобули-
нов и р-глобулинов). Теперь они известны под
общим названием иммуноглобулины (1g).
Иммуноглобулины экспрессируются в виде сек-
ретируемых и мембранных форм. Секретируемые
антитела вырабатываются В-клетками на терми-
нальной стадии дифференцировки — плазмати-
ческими клетками, которые служат фабриками по
производству антител и располагаются в основ-
ном в костном мозге. Мембранные антитела при-
сутствуют на поверхности В-клеток, где они слу-
жат антигенспецифичными рецепторами. Мемб-
ранная форма антитела, ассоциированная с гете-
родимером, называемым Iga/Igp, образует В-кле-
точныйрецептор (BCR). Как будет описано в гл. 7,
гетеродимер Iga/Igp проводит внутрь клетки сиг-
налы, связанные с активацией В-лимфоцита.
Структура иммуноглобулинов определяет не-
которые свойства, необходимые для их участия в
иммунном ответе. Двумя наиболее важными из
этих свойств являются специфичность и биоло-
гическая активность. Как будет показано далее,
специфичность обусловлена определенной обла-
стью молекулы антитела, которая содержит ги-
первариабельный участок, или участок, опреде-
ляющий комплементарность (CDR). Этот участок
ограничивает связь антитела только с теми суб-
станциями, которые содержат одну определенную
антигенную структуру. Существование огромно-
го разнообразия потенциальных антигенных де-
терминант, или эпитопов (см. гл. 3), обусловило
эволюцию системы в направлении продукции та-
кого спектра молекул антител, чтобы каждая из
них была способна комбинироваться со строго оп-
ределенной (частной) антигенной структурой. Все
вместе — репертуар антител — характеризуется
большим разнообразием в отношении типов мо-
лекулярных структур, с которыми они способны
реагировать, однако по отдельности эти антитела
проявляют высокий уровень специфичности, по-
скольку одно антитело способно реагировать толь-
ко с одной определенной антигенной структурой.
Хотя количество антител разных специфично-
стей, способных реагировать со многими струк-
турными единицами, очень велико, биологиче-
ские эффекты таких реакций довольно немного-
численны. К ним относятся: нейтрализация ток-
синов, иммобилизация микроорганизмов, нейт-
рализация вирусной активности, агглютинация
(скопление) микроорганизмов или антигенных
частиц (см. гл. 5), связывание растворимого ан-
тигена. ведущее к образованию преципитатов (ко-
торые активно элиминируются фагоцитирующи-
ми клетками; см. гл. 2) и активация сывороточ-
ного комплемента для усиления лизиса микро-
организмов (см. гл. 13) или фагоцитоза и деструк-
ции, осуществляемых либо фагоцитирующими
клетками, либо лимфоцитами-киллерами. Еще
одним важным биологическим свойством анти-
тел является их способность проникать через пла-
центу от матери к плоду. Не все молекулы анти-
тел способны одинаково выполнять все эти био-
логические функции.
Различия в биологических функциях антител
определяются их изотипической структурой (клас-
сом). В то время как одна часть молекулы антите-
СТРУКТУРА ЛЕГКИХ И ТЯЖЕЛЫХ ЦЕПЕЙ
61
ла должна легко подвергаться адаптации, чтобы
обеспечить возможность приспосабливаться к
большому числу эпитопов, другая часть должна
легко адаптироваться для выполнения биологи-
ческих функций, общих для многих антител. Опре-
деление структуры антител, установление взаимо-
связи между их структурой и функцией и выявле-
ние генетической организации молекул иммуно-
глобулинов в значительной степени способство-
вали нашему пониманию эволюционирования
иммунной системы. Весь антительный репертуар
представляет собой сложную, высокоспециализи-
рованную систему, в которой различные структу-
ры (иммуноглобулины) распознают одно и то же —
антиген, но комплекс иммуноглобулина с анти-
геном определяет развитие множества различных
биологических эффектов. В этой главе описыва-
ются структурные и биологические свойства им-
муноглобулинов.
I ОБНАРУЖЕНИЕ АНТИТЕЛ
И ОПРЕДЕЛЕНИЕ
ИХ ХАРАКТЕРИСТИК
Антитела содержатся в сыворотке крови, кото-
рую получают после ее свертывания и удаления
образовавшегося сгустка с находящимися в нем
клетками и факторами свертывания. При электро-
форезе сыворотки (разделении в электрическом
поле) в условиях слабощелочной среды (pH 8,2),
в ней, как правило, можно различить пять ос-
новных компонентов (рис. 4.1). Было показано, что
антитела содержатся в области у-глобулинов, где
располагаются самые медленные с точки зрения
миграции относительно анода элементы. После
выявления этой закономерности провели простое
сравнение элекрофоретических профилей антисы-
воротки, взятой у гипериммунизированного кро-
лика (получившего многоразовую иммунизацию
тест-антигеном) до и после удаления тестируе-
мых антигенспецифичных антител, для чего про-
вели преципитацию с антигеном. Эта процедура
привела к уменьшению размера только фракции
у-глобулинов. Анализ показал, что когда эта фрак-
ция собиралась отдельно, в ней содержались все
определяемые антитела. Позднее было показано,
что активность антител присутствует не только в
у-глобулиновой фракции, но и в области, не-
сколько более близкой к аноду. В результате все
глобулярные белки, обладающие свойствами ан-
тител, были в основном отнесены к иммуногло-
булинам, что подтверждает у-пик (см. рис. 4.1).
Ширина электрофоретических пиков свиде-
тельствует, что они представляют гетерогенную
смесь иммуноглобулиновых молекул с немного
различающимися зарядами. Эта гетерогенность
была одним из первых препятствий на пути опре-
деления структуры антител, поскольку аналити-
ческая химия в качестве первичного материала
(+) Электрофоретическая мобильность (-)
• Рис. 4.1. Электрофоретическая мобильность белков сы-
вороток, полученных от нормального индивидуума (голу-
бая) и больного с lgG-миеломой (красная) (с любезного
разрешения д-ра С Miller, School of Medicine, University of
California at Davis)
требует гомогенных материалов, способных кри-
сталлизоваться. Эта проблема была частично ре-
шена после открытия миеломных белков, которые
являются гомогенными иммуноглобулинами, про-
изводимыми потомством одной плазматической
клетки, подвергшейся опухолевой трансформации
при злокачественном заболевании, называемом
множественной миеломой. Это наглядно демон-
стрирует форма у-глобулинового зубца элекрофо-
реграммы сывороточных белков больного множе-
ственной миеломой (см. рис. 4.1). Когда выясни-
ли, что некоторые миеломные белки связывают
антиген, стало очевидно, что с ними можно обра-
щаться, как с типичными молекулами иммуно-
глобулина.
Другим подспорьем в исследованиях структу-
ры антител стало открытие белков Бенс-Джонса в
моче. Эти гомогенные белки, определяемые в
больших количествах у некоторых больных мно-
жественной миеломой, являются димерами к- или
Х-легких цепей иммуноглобулинов. Они оказались
очень полезными при определении структуры этой
части иммуноглобулиновой молекулы. Сегодня
разработана эффективная методика гибридизации
двух клеток (гибридомная технология), которая
позволяет получать большое количество гомоген-
ных препаратов моноклональных антител прак-
тически любой специфичности (см. гл. 5).
СТРУКТУРА ЛЕГКИХ
И ТЯЖЕЛЫХ ЦЕПЕЙ
Структурные характеристики антител начали ана-
лизировать в 1959 г. после двух открытий, пока-
завших, что эти молекулы могут быть разделены
на части, пригодные для дальнейшего исследова-
ния. В Англии Р.Р. Портер (R.R. Porter) обнару-
жил, что после протеолитического расщепления
62
ГЛАВА 4. СТРУКТУРА АНТИТЕЛ И ИХ ФУНКЦИИ
Н-цепьх
S-S-'
S-S-
Fc-субфрагменты
Fc
□ □
• Рис 4.2. Протеолитическое расщепление иммуногло-
булина с использованием папаина и пепсина
молекулы иммуноглобулина (молекулярная мас-
са 150000 Да) ферментом папаином получаются
три фрагмента примерно одинаковой величины
(рис. 4.2). Два фрагмента сохраняют способность к
специфическому связыванию антигена, хотя в
отличие от интактной молекулы утрачивают спо-
собность к преципитации антигена в растворе. Эти
Связывание
антигена
Связывание
антигена
• Рис. 4.3. Молекула иммуноглобулина с наличием им-
муноглобулиновых петлевых доменов, сформированных
дисульфидными мостиками внутри цепей
два фрагмента назвали Fab-фрагментами (fragment
antigen binding — фрагмент, связывающий анти-
ген), их считают моновалентными (имеющими по
одному связывающему центру) и идентичными
по всем параметрам. Третий фрагмент может быть
выкристаллизован из раствора, что указывает на
его явную гомогенность. Он называется Fc-фраг-
ментом (crystallizable fragment — кристаллизуемый
фрагмент). Он не может связываться с антигеном,
но, как было показано в дальнейшем, отвечает за
биологические функции молекулы антитела пос-
ле того, как антиген связывается с Fab-фрагмен-
том интактной молекулы.
Примерно в то же время в США Д. Г. Эдель-
ман (D. Н. Edelman) обнаружил, что при воздей-
ствии меркаптоэтанола (реактива, разрушающего
S — S-мостики) молекула у-глобулина значитель-
но уменьшается; она разделяется на четыре цепи:
две одинаковые легкие цепи молекулярной массой
около 53000 Да каждая и две другие примерно по
22000 Да каждая. Более крупные молекулы были
названы тяжелыми (heavy — Н) цепями, а более
мелкие — легкими (light — L). На основании этих
результатов была определена структура молекул
иммуноглобулина, как она представлена на рис. 4.2.
В последующем была доказана принципиальная
правильность модели, а Р. Р. Портер и Д. Г. Эдель-
ман поделили Нобелевскую премию за открытие
структуры антител. Таким образом, все молекулы
иммуноглобулина имеют базовую структуру, со-
стоящую из четырех полипептидных цепей — двух
одинаковых тяжелых и двух одинаковых легких,
связанных несколькими дисульфидными мости-
ками. Следует отметить, что папаин расщепляет
иммуноглобулиновую молекулу в N-терминаль-
ном конце шарнирной области до дисульфидного
мостика, в результате чего получаются два моно-
валентных Fab- и Fc-фрагмента. В отличие от
папаина пепсин расщепляет шарнирную область
в С-терминальном конце ниже дисульфидного
мостика, что приводит к получению двухвалент-
ного фрагмента, названного F(ab )2, в котором со-
держатся два Fab-фрагмента, соединенных дисуль-
фидным мостиком, а также несколько Fc-субфраг-
ментов (см. рис. 4.2). Детально базовая структура
молекулы иммуноглобулина, состоящая из двух
гликозилированных тяжелых и двух легких цепей,
представлена на рис. 4.3. Заметьте, что кроме ди-
сульфидных мостиков между цепями, которые
удерживают их вместе, внутри каждой тяжелой и
легкой цепи содержатся дисульфидные мостики,
создающие иммуноглобулиновые (петлевые) до-
мены. которые формируют антипараллельную
р-складку — структуру, характерную для молекул
антител. Далее в этой главе указывается, что дру-
гие молекулы, принадлежащие к так называемо-
му суперсемейству иммуноглобулинов, также об-
ладают этим структурным признаком.
Как в случае с другими белками, иммуногло-
булины одного вида иммуногенны для другого
вида. Использование иммуноглобулинов опреде-
ДОМЕНЫ
63
ленного вида в качестве иммуногенов у другого
вида позволяет вырабатывать различные антисы-
воротки, которые способны распознавать струк-
туру разных цепей иммуноглобулинов. При сов-
местном использовании биохимических и серо-
логических (с использованием сывороточных ан-
тител) методов было показано, что почти у всех
исследованных видов животных имеются два ос-
новных класса легких цепей: к и X. У животных
каждого вида продуцируются легкие цепи обоих
типов, но соотношение к- и Х-цепей различны
для каждого вида (у мыши 95 % к-цепей, у чело-
века 60%). Однако в любой молекуле иммуно-
глобулина обе легкие цепи всегда или к-, или
Х-типа; никогда не бывает по одной цепи каждо-
го типа. Хотя существует всего два типа легких
цепей, было показано, что иммуноглобулины
практически у всех видов состоят из пяти разных
классов (изотипов), различающихся по структуре
тяжелых цепей. Эти тяжелые цепи различаются
по антигенным свойствам (серологически), содер-
жанию углеводородов и размеру. Более важно то,
что они определяют различные биологические
свойства, присущие каждому изотипу. Тяжелые
цепи, чьи константные области являются произ-
водными генов тяжелых цепей иммуноглобули-
нов (детально обсуждается в гл. 6), обозначаются
греческими буквами, как показано в табл. 4.1.
Гены, кодирующие константные области тя-
желых цепей, обозначаются сходным образом (см.
гл. 6). Поэтому гены, кодирующие константные
(С) области, отвечающие за ц, 8, у, а и е тяжелые
цепи, называются Ср, С8, Су, Са, Се соответ-
ственно.
У представителей любого вида есть тяжелые
цепи в пропорциях, характерных для данного вида,
но в любой молекуле антитела обе тяжелые цепи
идентичны (например 2у, 2е). Таким образом,
молекула антитела класса IgG может иметь струк-
туру к2у2 с двумя идентичными легкими к-цепя-
ми и двумя тяжелыми у-цепями. В отличие от
этого антитело класса IgE может иметь структу-
ру к2е2 или Х2е2. В каждом случае именно при-
рода тяжелых цепей придает молекуле ее уни-
кальные биологические свойства, такие как пе-
риод полураспада в кровотоке, способность свя-
зываться с определенными рецепторами и акти-
вировать ферменты (см. гл. 13) в комбинации с
антигенами.
Дальнейшее определение характеристик этих
изотипов с помощью специфических антисыво-
• Таблица 4.1. Распределение иммуноглобулинов
по изотипам в соответствии с наличием тяжелых
цепей
Изотип Тяжелая цепь Изотип Тяжелая цепь
IgM IgD IgG Н 8 Y IgA IgE а Е
роток привело к выявлению ряда подклассов,
имеющих более тонкие отличия. Так, основной
класс IgG человека может быть разделен на под-
классы IgGj, IgG2, IgG3 и IgG4. Иммуноглобу-
лин А также был разделен на два подкласса: IgAj
и lgA2. Подклассы отличаются друг от друга по
числу и организации дисульфидных мостиков
между цепями, а также по изменениям в других
структурных свойствах. Эти изменения в свою
очередь вызывают изменения функциональных
свойств, как описано далее.
• ДОМЕНЫ
На ранних этапах исследования структуры имму-
ноглобулинов стало ясно, что кроме дисульфид-
ных мостиков, которые удерживают вместе лег-
кие и тяжелые цепи, а также две тяжелые цепи,
внутри каждой цепи существуют дисульфидные
мостики, формирующие петли в структуре каж-
дой цепи. Глобулярная структура иммуноглобу-
линов и способность ферментов расщеплять эти
молекулы на крупные составляющие в строго опре-
деленных местах, а не разрушать их до олигопеп-
тидов и аминокислот, указывает на чрезвы-
чайную компактность структуры. Более того, на-
личие дисульфидных мостиков внутри цепи че-
рез регулярные и примерно равные промежутки
по 100—110 аминокислот означает, что каждая
петля в пептидных цепях должна формировать
компактно сложенный глобулярный домен. В дей-
ствительности каждая легкая цепь имеет по два
домена, а тяжелые цепи — по четыре или пять
доменов, разделенных несложно организованны-
ми отрезками (см. рис. 4.3). Наличие таких кон-
фигураций было подтверждено прямыми наблю-
дениями и с помощью генетического анализа
(см. гл. 6).
Молекулы иммуноглобулинов собраны из от-
дельных доменов, каждый из которых располага-
ется вокруг дисульфидного мостика и настолько
гомологичен остальным, что можно предполо-
жить, что они развились из одного общего гена-
предшественника, который дуплицировал себя
несколько раз, а затем изменил свою аминокис-
лотную последовательность, чтобы получившие-
ся разные домены выполняли различные функ-
ции. Каждый домен обозначают буквой, означа-
ющей его принадлежность к легкой или тяжелой
цепи, и числом, указывающим его положение. Как
мы детально рассмотрим далее, первый домен на
легкой и тяжелой цепях всех антител крайне ва-
риабелен по последовательности аминокислот; он
обозначается как VL и VH соответственно (см.
рис. 4.3). Второй и последующие домены на обе-
их тяжелых цепях гораздо более постоянны по
последовательности аминокислот и обозначаются
CL или Сн1, Сн2 и Сн3 (см. рис. 4.3). В дополнение
к дисульфидным мостикам между цепями глобу-
лярные домены связываются друг с другом в гомо-
64
ГЛАВА 4 СТРУКТУРА АНТИТЕЛ И ИХ ФУНКЦИИ
логичные пары в основном за счет гидрофобных
взаимодействий в следующем порядке: VHVL,
CH1CL, СН2СН2, СнЗСнЗ.
ШАРНИРНАЯ ОБЛАСТЬ
У иммуноглобулинов (возможно, за исключением
IgM и IgE) шарнирная область состоит из корот-
кого сегмента аминокислот и обнаруживается
между участками СН1 и Сн2 тяжелых цепей (см.
рис. 4.3). Этот сегмент состоит преимущественно
из остатков цистеина и пролина. Цистеины во-
влечены в формирование дисульфидных мости-
ков между цепями, а пролиновые остатки пре-
дотвращают складывание в глобулярную структу-
ру. Этот участок тяжелой цепи отвечает за важ-
ную структурную характеристику иммуноглобули-
нов. Он обеспечивает подвижность между двумя
Fab - фрагментами Y-образной молекулы антитела.
Это позволяет Fab-фрагментам открываться и зак-
рываться, чтобы обеспечивать связывание с двумя
эпитопами, разделенными фиксированным проме-
жутком, что может наблюдаться на поверхности
бактерии. Кроме того, поскольку этот отрезок ами-
нокислот открыт и доступен, как любой другой
несвернутый пептид, он может быть расщеплен
протеазами для получения Fab- и Fc-фрагментов,
описанных ранее (см. рис. 4.2).
ВАРИАБЕЛЬНАЯ ОБЛАСТЬ
Биологические функции молекулы антитела про-
истекают из свойств константной области, кото-
рая идентична для антител любой специфично-
сти внутри определенного класса. При этом часть
молекулы, которая связывается с эпитопом, со-
ставляет вариабельную область. Основной про-
блемой для иммунологов было определение, ка-
ким образом вариабельная область может обес-
печить такое большое разнообразие индивиду-
альных специфичностей, которое необходимо для
соответствия огромному количеству антигенов.
• Рис. 4.4. Вариабельность аминокислот, составляющих
N-концевые остатки VH, в молекуле иммуноглобулина
Антигенный эпитоп
• Рис. 4.5. Комплементарность между эпитопом и анти-
генсвязывающим центром, состоящим из гипервариа-
бельных участков L- и Н-цепей. Пронумерованные буквы
обозначают CDR тяжелой и легкой цепей, номера в круж-
ках - номера аминокислотных остатков в CDR
Как мы увидим в гл. 6, этот вопрос был в основ-
ном решен.
Когда была определена последовательность
аминокислот у белков с высокой однородностью
(например, миеломные белки и белки Бенс-Джон-
са), обнаружили, что наибольшая вариабельность
последовательностей существует для ПО N-тер-
минальных аминокислот как легкой, так и тяжелой
цепей. Е.А.Кабат (Е.А. Kabat) и Т.Т.Ву (T.T.Wu)
сравнили последовательность аминокислот мно-
гих Vl-h Ун-областей. Они схематически пред-
ставили вариабельность аминокислот в каждой
позиции цепи и показали, что наибольшая сте-
пень вариабельности (определяемая соотношени-
ем числа различных аминокислот в данной пози-
ции к частоте наиболее характерных аминокис-
лот в данной позиции) наблюдается в трех обла-
стях легкой и трех областях тяжелой цепи. Эти
участки называются гипервариабельными. Менее
вариабельные участки, которые находятся между
гипервариабельными участками, называются кар-
касными. Теперь известно, что гипервариабель-
ные участки принимают участие в связывании
антигена и формируют регион, комплементарный
по структуре эпитопу антигена. Исходя из этого,
гипервариабельные участки называются участка-
ми^ определяющими комплементарность легких и
тяжелых цепей: CDR1, CDR2 и CDR3 (рис. 4.4).
Гипервариабельные участки, хотя и разделены
в линейной двухмерной модели пептидных цепей,
в действительности приближены друг к другу в
свернутой форме интактной молекулы антитела.
Вместе они составляют антигенсвязывающий
центр, комплементарный эпитопу (рис. 4.5). Ва-
риабельность этих CDR обеспечивает различия в
конфигурации антигенсвязываюшего центра, ко-
торые необходимы для функционирования анти-
тел различной специфичности. Все известные
силы, вовлеченные во взаимодействие антиген —
антитело, являются слабыми нековалентными вза-
имодействиями (например, ионные, водородные,
ван-дер-ваальсовы силы и гидрофобные взаимо-
ВАРИАНТЫ ИММУНОГЛОБУЛИНОВ
65
действия). Поэтому необходимо, чтобы между ан-
тигеном и антителом был тесный контакт в доста-
точно большой области, чтобы обеспечить общую
связывающую силу, адекватную для устойчивого
взаимодействия. В соединении между эпитопом и
антителом участвуют и тяжелая, и легкая цепи.
Теперь должно быть ясно, что две молекулы
антитела с разной антигенной специфичностью
должны иметь и различную последовательность
аминокислот в своих гипервариабельных участ-
ках, а те, которые обладают одинаковой последо-
вательностью, обычно имеют и одинаковую спе-
цифичность. Однако существует возможность, что
два антитела с разной последовательностью ами-
нокислот обладают специфичностью к одному и
тому же эпитопу. В этом случае аффинность свя-
зывания антител с эпитопом будет, вероятно, раз-
личной, поскольку будут существовать различия
в числе и типах связывающих сил, доступных для
связывания идентичных антигенов с разными свя-
зывающими участками двух антител.
Дополнительный источник вариабельности
может заключаться в размере антигенсвязываю-
щего участка на антителе, который обычно (но не
всегда) имеет форму углубления или щели. В не-
которых случаях, особенно если вовлечены не-
большие гидрофобные гаптены, эпитопы занима-
ют не весь антигенсвязывающий участок. Однако
при этом достигается достаточная аффинность
связывания. Было показано, что антитела, специ-
фичные для таких небольших гаптенов, могут в
действительности реагировать с другими антиге-
нами, не обладающими явным сходством с гапте-
ном (например, динитрофенол и эритроциты ба-
рана). Эти большие отличающиеся антигены свя-
зываются или с большим участком, или же с дру-
гим участком антигенсвязывающего центра на
антителе (рис. 4.6). Таким образом, способность
определенного антигенсвязывающего центра свя-
зываться с двумя (или более) действительно раз-
личными эпитопами называют избыточностью,
Способность одной молекулы антитела перекрест-
но реагировать с неопределенным числом эпито-
пов может уменьшить количество антител, необ-
ходимых для защиты индивида от широкого спек-
тра агрессивных антигенов.
• Рис. 4.6. Варианты того, как антитело (Ац) определен-
ной специфичности может проявлять способность к свя-
зыванию с двумя различными эпитопами (Aq и Аг2)
I ВАРИАНТЫ ИММУНОГЛОБУЛИНОВ
Изотипы
До сих пор описывались черты, общие для всех
иммуноглобулиновых молекул, такие как конст-
рукция из четырех цепей и структурные домены.
В своем противостоянии агрессивным чужерод-
ным субстанциям организм выработал ряд меха-
низмов, каждый из которых основан на каком-то
отдельном свойстве или функции молекулы им-
муноглобулина. Таким образом, когда специфич-
ная молекула антитела соединяется со специфич-
ным антигеном или патогеном, начинают действо-
вать несколько разных эффекторных механизмов.
Эти механизмы опосредованы различными клас-
сами (изотипами) иммуноглобулинов, каждый из
которых может взаимодействовать с одним и тем
же эпитопом, но при этом каждый может запус-
кать отличную от других реакцию. Данные отли-
чия являются результатом структурных вариаций
тяжелых цепей, создавших домены, определяю-
щие разнообразие функций. Структурные изме-
нения обсуждаются в данной главе. Общий обзор
свойств классов иммуноглобулинов представлен
в табл. 4.2 и 4.3 и на рис. 4.7.
Аллотипы
Другой формой вариаций в структуре иммуно-
глобулинов являются аллотипы. Эти вариации ос-
нованы на генетических различиях между инди-
видуумами и зависят от существования аллель-
ных форм (аллотипов) одного и того же белка в
результате присутствия разных форм одного и
того же гена в данном локусе. В результате алло-
типы тяжелой или легкой цепи, составляющие
любой иммуноглобулин, могут присутствовать у
одних представителей вида и отсутствовать у дру-
гих. Подобная ситуация резко отличается от си-
туаций с классами или подклассами иммуногло-
булинов, которые присутствуют у всех предста-
вителей вида.
Аллотипические различия в известных локу-
сах затрагивают только одну или две аминокис-
лоты в константном участке цепи. За редким ис-
ключением наличие аллотипических различий у
двух идентичных молекул иммуноглобулина обыч-
но не влияет на связывание антигена, но служит
важным маркером для анализа наследования по
Менделю.
Некоторые известные аллотипические марке-
ры составляют группы на у-цепи человеческого
IgG (называемую Gm для маркеров IgG), к-цепи
(называемую Кт) и ос-цепи (называемую Ат),
Аллотипические маркеры были обнаружены
у иммуноглобулинов нескольких видов обычно
при использовании антисыворотки, полученной
путем иммунизации представителя данного вида
66
ГЛАВА 4. СТРУКТУРА АНТИТЕЛ И ИХ ФУНКЦИИ
• Таблица 4.2. Наиболее важные свойства изотипов иммуноглобулина
Свойство Изотип
IgG IgA IgM IgD IgE
Молекулярная масса 150000 160000 у мономера 900000 180000 200000
Дополнительные белковые компоненты — J и S J — —
Примерная концентрация в сыворотке, мг/мл 12 1,8 1 0,00-0,04 0,00002
Доля всех 1g, % 80 13 6 0,2 0,002
Месюнахождение Примерно равное вне и внутри сосудов Внутри сосудов и в секрете В основном внутри сосудов На поверх- ности лимфоцита На тучных клет- ках, базофилах, в секрете слизи- стой оболочки носа и слюне
Период полураспада, сут 23 5,5 5,0 2,8 2,0
Прохождение через плаценту + + — — — 1 _
Наличие в секрете — + + — — —
Наличие в молоке + + От нуля до следов — —
Активация комплемента + — + + + — —
Связывание с Fc-рецеп- торами на макрофагах, NK- и ПМЯ-клетках + + — — — —
Относительная агглютини- рующая способность + + + + + + — —
Противовирусная активность + + + + + + + — —
Антибактериальная активность + + + + + (с лизоцимом) + + + (с компле- ментом) — —
Антитоксическая активность + + + — — — + +
Адлер! ическая акшвность — — — — + +
антителами от другого представителя того же вида.
Как и в отношении других аллельных систем, ал-
лотипы наследуются как доминантные менделев-
ские признаки. Гены, кодирующие эти марке-
ры, экспрессируются кодоминантно, и таким
• Таблица 4.3. Важные различия среди
подклассов IgG человека
Характеристика IgGL IgGz IgG, IgG4
Наличие, % общего IgG 70 20 7 3
Период полураспада, сут 23 23 7 23
Связывание комплемента + + + + + -
Прохождение через плаценту + +/- + + + +
Связывание моноцитов + + + + + + + +/-
образом индивидуум может быть гомозиготным
или гетерозиготным относительно данного мар-
кера.
Идиотипы
Как мы убедились, антигенсвязывающий центр
молекулы специфичного антитела состоит из уни-
кальной комбинации аминокислот в вариабель-
ных областях легкой и тяжелой цепей. Поскольку
такая комбинация отсутствует у других молекул
антител, она должна быть иммуногенной и спо-
собной стимулировать иммунологический ответ на
самое себя у животного того же вида. Такой факт
действительно обнаружили Ж.Оудин (J.Oudin) и
Г. Кункель (Н. Kunkel), которые в начале 1960-х гг
показали, что при экспериментальной иммуни-
СТРУКТУРНЫЕ СВОЙСТВА IgG
67
• Рис. 4.7. Разные типы вариаций иммуноглобулинов
зации определенными антителами или миелом-
ным белком можно получать антисыворотку, спе-
цифичную только по отношению к использован-
ному антителу и ни к какому иному иммуногло-
булину данного вида. Такие антисыворотки со-
держат популяции антител, специфичных для не-
скольких эпитопов, называемых идиотопами. ко-
торые присутствуют в вариабельной области (тя-
желой и легкой цепи) антител, использованных
для иммунизации. Совокупность всех идиотопов
на введенной молекуле антитела называется иди-
отипом. В некоторых случаях антиидиотипичес-
кая сыворотка предотвращает связывание анти-
тела с его антигеном. В этом случае считается,
что идиотипическая детерминанта располагается
внутри или рядом с самим антигенсвязывающим
центром. Антиидиотипические сыворотки, кото-
рые не блокируют связывание антител с антиге-
ном, вероятно, направлены против вариабельных
детерминант на каркасном участке, вне антиген-
связывающего центра (рис. 4.8). Основываясь на
теоретических выкладках, можно наглядно пред-
ставить, что антиидиотипическое антитело, свя-
зывающееся с антигенсвязывающим центром,
комплементарным такому центру у идиотипа, на-
поминает эпитоп, который также комплемента-
• Рис. 4.8. Два антиидиотипических антитела к Атг
(А) Антиидиотипическое антитело, направленное против
антигенсвязывающего центра Ат1# предотвращает связы-
вание А^ с антигеном. (Б) Антиидиотипическое антитело
связывается с каркасными участками Ат1# не предотвра-
щая его связывания с антигеном
рен к антигенсвязывающему центру идиотипа.
Таким образом, антиидиотип может представлять
оттиск или внутренний образ условного эпитопа.
Действительно, есть примеры иммунизации экс-
периментальных животных с использованием ан-
тиидиотипических внутренних образов в качестве
иммуногенов. Такие иммуногены приводят к по-
явлению антител, способных реагировать с анти-
геном, несущим эпитоп, к которому направлен
первоначальный идиотип. Появление таких ан-
тител индуцируется без какого-либо контакта
иммунизированного животного с самим первона-
чальным (оригинальным) антигеном.
В некоторых случаях, особенно у инбредных
животных, антиидиотипические антитела реагиру-
ют с несколькими различными антителами, направ-
ленными против одного и того же эпитопа и обла-
дающими сходными идиотипами. Эти идиотипы
называются общими или перекрестно реагирующи-
ми, и обычно данный термин определяет семей-
ство антительных молекул. В отличие от подобной
ситуации сыворотка, которая реагирует только с од-
ной определенной молекулой антитела, определя-
ется как имеющая уникальный идиотип. В гл. 10
показано, что наличие идиотипических детерми-
нант в молекулах иммуноглобулина может играть
роль в контроле и модуляции иммунного ответа,
как описывается в сетевой теории Н. Ерне (N. Jerne),
хотя мнения по этому поводу противоречивы.
На рис. 4.9 представлены различные типы вари-
аций, отмечаемых среди иммуноглобулинов. Отли-
чия между константными областями в результате
вовлечения различных генов константных областей
тяжелых и легких цепей называют изотипами. От-
личия, связанные с различными аллелями одного
гена константной области, называют аллотипами
Наконец, внутри конкретного изотипа (например
IgG) особенности в специфической реаранжиров-
ке VH- и VL-reHOB называют идиотипами.
СТРУКТУРНЫЕ СВОЙСТВА IgG
Иммуноглобулин G наиболее распространен в
крови, лимфе, цереброспинальной и перитонеаль-
ной жидкостях. Молекула IgG состоит из двух
тяжелых у-цепей с молекулярной массой пример-
68
ГЛАВА 4. СТРУКТУРА АНТИТЕЛ И ИХ ФУНКЦИИ
• Рис. 4.9. Структуры основных классов секретируемых антител. Легкие цепи показаны зеленым цветом, а тяжелые —
голубым. Оранжевые кружки показывают участки гликозилирования. Полимерные IgM и IgA содержат полипептид, на-
зываемый J-цепью. Представленная димерная молекула IgA содержит секреторный компонент (показан красным)
но 50000 Да и двух легких цепей (или к, или X)
молекулярной массой примерно 25000 Да каж-
дая, удерживаемых вместе дисульфидными мос-
тиками (см. рис. 4.9). Таким образом, молекула IgG
имеет молекулярную массу примерно 150000 Да
и коэффициент седиментации 7S. При электро-
форезе молекулы IgG располагаются ближе к ано-
ду, чем все другие сывороточные белки, и мигри-
руют в у-область электрофореграммы сывороточ-
ных глобулинов (отсюда и произошло их прежнее
название — у-глобулин или 78-иммуноглобулин)
Класс IgG у человека включает четыре под-
класса’. IgGh IgG2. IgG3u IgG4. названных в соот-
ветствии с частотой их обнаружения в сыворотке
крови (IgG! наиболее распространен). За исклю-
чением вариабельных областей все иммуноглобу-
лины внутри класса обладают примерно 90 % го-
мологией по последовательности аминокислот,
однако между классами имеется только 60 % го-
мология (например, между IgG и IgA). Эта сте-
пень гомологии означает, что антисыворотка к IgG
может быть направлена против детерминанты,
общей и специфичной для всех представителей
данного класса (например, для представителей
класса IgG), в то время как другая созданная ан-
тисыворотка может быть специфична для детер-
БИОЛОГИЧЕСКИЕ СВОЙСТВА IgG
69
минанты, обнаруживаемой только у одного из под-
классов (например, у IgG2). Это отличие впервые
было выявлено по антигенным характеристикам с
использованием антител к различным у-цепям.
Подклассы IgG различаются своими химически-
ми, а также, что более важно, биологическими свой-
ствами, которые будут рассмотрены далее.
• БИОЛОГИЧЕСКИЕ СВОЙСТВА IgG
Присутствующий в сыворотке взрослого челове-
ка IgG составляет в ней примерно 15% общего
белка (остальные белки представлены альбуми-
нами, глобулинами и ферментами). Иммуногло-
булин G примерно одинаково распространен во
внутрисосудистом и внесосудистом пространствах.
За исключением подкласса IgG3, имеющего
короткий функциональный цикл с периодом по-
лураспада 7 сут, период полураспада IgG состав-
ляет примерно 23 сут, что представляет наиболь-
ший срок для иммуноглобулинов всех изотипов.
Такое продолжительное присутствие в сыворотке
делает IgG наиболее пригодным для пассивной
иммунизации путем переноса антител. Интересно,
что как только концентрация IgG в сыворотке
увеличивается (как, например, при множествен-
ной миеломе или после введения очень больших
концентраций IgG), повышается и уровень его
катаболизма, а период полураспада IgG сокраща-
ется до 15 — 20 сут и даже меньше. Недавние ис-
следования дали четкое объяснение длительности
выживания IgG по отношению к другим белкам
сыворотки и уменьшению периода его полурас-
пада при высоких концентрациях. Был обнару-
жен насыщаемый рецептор, который связывается
с Fc-фрагментом IgG и защищает его (так назы-
ваемый FcRp, или рецептор Брамбелла). Данный
рецептор выявляется в клеточных эндосомах и
избирательно возвращает в кровоток IgG из эн-
досом (например, после эндоцитоза иммунного
комплекса антиген —антитело). На рис. 4.10 по-
казано, как этот механизм позволяет очистить
антитело IgG от антигена и собрать антиген для
презентации без разрушения антитела. При вы-
соком уровне содержания IgG FcRp-рецепторы
насыщаются и делают катаболизм избыточного
IgG таким же, как катаболизм альбумина или дру-
гих изотипов 1g.
Агглютинация и формирование
преципитата
Молекулы IgG могут вызывать агглютинацию, или
склеивание антигенных частиц (нерастворимых),
таких как микроорганизмы. Реакция IgG с раство-
римыми мультивалентными антигенами может
привести к появлению преципитатов (см. гл. 5).
Это свойство IgG имеет, несомненно, большое
значение для выживания, поскольку нераствори-
• Рис. 4.10. Рециркуляция IgG при использовании защит-
ного рецептора (FcRp). Циркулирующий мономерный IgG
с антигеном (иммунный комплекс) поступает в антиген-
презентирующую клетку посредством эндоцитоза. Внутри
эндосомы комплекс связывается с FcRp; IgG и антиген раз-
деляются, что позволяет IgG направиться к поверхности
клетки для рециркуляции. Антиген расщепляется в лизо-
соме (процессинг антигена), и фрагменты его протеолиза
в конечном счете экспрессируются на поверхности клетки
в составе молекул МНС II класса
мые комплексы антиген—антитело легко фагоци-
тируются и разрушаются фагоцитирующими клет-
ками. Агрегацию молекул можно вызвать разны-
ми методами. Например, для очистки IgG исполь-
зуется метод спиртовой преципитации, а нагре-
вание при +56 °C в течение 10 мин, используемое
для инактивации комплемента (см. гл. 13), вызы-
вает агрегацию IgG. Агрегированный IgG все еще
сохраняет способность связываться с антигеном.
Многие свойства, приписываемые комплексам
антиген —антитело, проявляет и агрегированный
IgG (без антигена), например прикрепление к
фагоцитирующим клеткам, а также активация
комплемента или других биологически активных
субстанций, способных нанести вред организму.
Такую активацию объясняют соприкосновением
Fc-доменов в процессе агрегации аналогично тому,
как это происходит при формировании иммун-
ного комплекса, индуцированного антигеном.
Поэтому чрезвычайно важно, чтобы в пассивно
переносимом IgG не было агрегированного IgG.
Прохождение через плаценту
и абсорбция у новорожденных
Единственным классом иммуноглобулинов, спо-
собным проходить через плаценту и позволяю-
щим матери передавать иммунитет плоду, явля-
ется изотип IgG (за исключением подкласса IgG2).
Переход через плаценту облегчается экспресси-
70
ГЛАВА 4. СТРУКТУРА АНТИТЕЛ И ИХ ФУНКЦИИ
Fc-рецептор
Фагоцитирующая клетка
Рис. 4.11. Фагоцитоз частицы, покрытой антителами
рованными на плацентарных клетках рецептора-
ми, защищающими IgG (FcRn). Недавно было
показано, что FcRn идентичен рецептору, защи-
щающему IgG (FcRp), обнаруженному в клеточ-
ных эндосомах. Анализ иммуноглобулинов у плода
показал, что на 3 —4-м месяце беременности рез-
ко возрастает концентрация IgG. Этот IgG, не-
сомненно, должен быть материнским, поскольку
в таком возрасте плод еще не способен синтези-
ровать иммуноглобулины. Затем в течение 5-го
месяца беременности плод начинает синтезиро-
вать IgM и следовые количества IgA. Только на-
чиная с 3 —4-го месяца поле рождения, когда уро-
вень полученного от матери IgG падает в резуль-
тате катаболизма (период полураспада IgG 23 сут),
ребенок начинает самостоятельно синтезировать
антитела IgG. Таким образом, защита плода и
новорожденного от инфекции обеспечивается
почти исключительно за счет материнского IgG,
который проходит через плаценту. Было установ-
лено, что прохождение через плаценту опосре-
дуется Fc-фрагментом молекулы IgG; F(ab')2~ и
Fab-фрагменты IgG не проходят через плаценту.
Интересно, что защищающий IgG рецептор
(FcRn), экспрессированный на плацентарных
клетках, короткое время суперэкспрессируется в
тканях кишечника новорожденного. Абсорбция
материнских IgG, содержащихся в молозиве кор-
мящих матерей, достигается связыванием с эти-
ми рецепторами, обильно представленными в тка-
ни кишечника. Рецептор FcRn перестает выяв-
ляться в ткани кишечника к возрасту 2 недели.
Кроме того что прохождение молекул IgG че-
рез плаценту обеспечивает плоду противоинфек-
ционный иммунитет, оно также может обуслов-
ливать развитие гемолитической болезни новорож-
денных (эритробластоз плода) (см. гл. 15). Дан-
ное заболевание вызывается материнскими анти-
телами к эритроцитам плода. Материнские анти-
тела IgG к RJi-антигену, производимые резус-
отрицательной матерью, проходят через плацен-
ту и атакуют эритроциты плода, экспрессирую-
щие Rh-антигены (резус-положительные).
Опсонизация
Иммуноглобулин G является опсонизирующим
антителом (от греч opsoniazo — готовить пищу),
способным за счет этого усиливать фагоцитоз.
Он реагирует с эпитопами (например, экспрес-
сируемыми микроорганизмами) посредством сво-
их Fab-фрагментов, но именно Fc-фрагмент обу-
словливает опсонизационную способность IgG.
Многие фагоцитирующие клетки, такие как мак-
рофаги и ПМЯ фагоциты, экспрессируют мемб-
ранные рецепторы для Fc-фрагмента молекулы
IgG. Эти клетки прикрепляются к покрытой ан-
тителами бактерии посредством Fc-рецепторов.
Эффект сети заключается в закрытии по типу
молнии поверхностной мембраны фагоцитиру-
ющей клетки вокруг микроорганизма по мере
того, как рецепторы для Fc и Fc-фрагменты ан-
тител продолжают соединяться, вызывая окон-
чательное поглощение и разрушение микроор-
ганизма (рис. 4.11).
Антителозависимая
клеточно-опосредованная
цитотоксичность
Молекулы IgG играют важную роль в антите-
лозависимой клеточно-опосредованной цитоток-
сичности (АЗКЦ). При этой форме цитотоксич-
ности Fab-фрагмент связывается с клеткой-ми-
шенью, будь это микроорганизм или опухоле-
вая клетка, а Fc-фрагмент — со специфичными
для него рецепторами, которые обнаруживают-
ся на некоторых больших гранулярных лимфо-
цитах, называемых натуральными киллерами
(см. гл. 2). С помощью этих механизмов моле-
кулы IgG направляют клетки-киллеры на их
мишень, а те уничтожают ее не путем фагоци-
тоза, а с помощью различных высвобождаемых
ими субстанций.
Активация комплемента
В гл. 13 обсуждаются основные свойства систе-
мы комплемента. Если упомянуть об этом вкрат-
це, комплемент представляет собой набор бел-
ков плазмы, способных активироваться, связы-
ваясь с определенными патогенами или антите-
лом (например, патогенспецифичными антите-
лами). Активацию комплемента часто описыва-
ют как серию каскадных ферментативных реак-
ций, приводящих к появлению специфических
СТРУКТУРНЫЕ СВОЙСТВА IgM
71
компонентов комплемента, которые помимо дру-
гих важных иммунологических феноменов вы-
зывают опсонизацию и фагоцитоз вторгшихся
микроорганизмов, а также прямой лизис организ-
ма-агрессора.
Структурные свойства ранних компонентов
комплемента, участвующих в каскаде активации,
в котором задействованы антитела, определяют
классы антител, с которыми будет связываться
комплемент.
Молекула IgG способна активировать систему
комплемента (см. гл. 13). Это приводит к высво-
бождению некоторых важных биологически ак-
тивных молекул и вызывает лизис, если антитело
соединено с антигеном на поверхности клетки.
Некоторые из компонентов комплемента также
являются опсонинами; они связываются с анти-
геном-мишенью и таким образом направляют
фагоциты, несущие рецепторы, специфичные для
этих опсонинов, фокусируя их фагоцитарную ак-
тивность на антигене-мишени. Другие компонен-
ты, получающиеся при активации комплемента,
являются хемотаксическими; в частности, они
привлекают фагоцитарные клетки. В целом, ак-
тивация комплемента IgG обладает огромным био-
логическим воздействием на организм и антиген-
мишень, будь то живая клетка, микроорганизм или
опухолевая клетка.
Нейтрализация токсинов
Молекулы IgG являются антителами, способны-
ми нейтрализовать токсины, такие как столбняч-
ный и ботулинический, и инактивировать яды, на-
пример змеи или скорпиона. В связи со способ-
ностью молекулы IgG нейтрализовать подобные
яды (в основном за счет блокирования их актив-
ных участков) и относительно большим перио-
дом полураспада антитела этого изотипа лучше
подходят для пассивной иммунизации (т.е. пере-
носа антител) против токсинов и ядов.
Иммобилизация бактерий
Молекулы иммуноглобулинов эффективно обездви-
живают различные подвижные бактерии. Взаимо-
действие антител с ресничками и жгутиками, на-
ходящимися на некоторых микроорганизмах, вы-
зывает их слипание, что препятствует движению
и предотвращает распространение и проникнове-
ние микробов в ткани.
Нейтрализация вирусов
Антитела IgG эффективно нейтрализуют вирус.
Одним из механизмов нейтрализации является
прикрепление антител к антигенным детерминан-
там, присутствующим на различных участках ви-
русной оболочки, среди которых имеются участ-
ки, используемые вирусом для прикрепления к
клетке-мишени. Ингибирование места прикреп-
ления вируса эффективно прекращает инфекцию.
Считается, что другие антитела ингибируют пе-
нетрацию вируса или сбрасывание вирусной обо-
лочки, необходимое для высвобождения вирусной
ДНК или РНК, требующейся для развития ин-
фекции.
Разнообразие функций молекулы IgG делает
ее очень важной в иммунном ответе. Ее большая
важность подтверждается теми случаями иммуно-
дефицита, при которых индивидуум не способен
синтезировать молекулы IgG (см. гл. 17). Такие
индивидуумы подвержены инфекциям, способным
привести к токсемии и смерти.
V СТРУКТУРНЫЕ СВОЙСТВА IgM
Как показано далее в этой главе, IgM является
первым иммуноглобулином, продуцируемым после
иммунизации. Его название связано с тем, что впер-
вые он был описан как макроглобулин (М), облада-
ющий большой молекулярной массой (900000 Да).
Он обладает коэффициентом седиментации 19S
и дополнительным Сн-доменом. По сравнению с
молекулой IgG, состоящей из одной четырехце-
почечной структуры, молекула IgM представлена
в виде пентамера, состоящего из пяти таких еди-
ниц, каждая из которых состоит из двух легких и
двух тяжелых цепей, скрепленных вместе допол-
нительными дисульфидными мостиками между их
Fc-фрагментами и полипептидной цепью, назы-
ваемой J-цепью (см. рис. 4.9). Эта цепь, которая
подобно легким и тяжелым цепям синтезируется
в В-клетках или плазматических клетках, облада-
ет молекулярной массой 15000 Да. Подобная пен-
тамерная организация IgM, удерживаемая дисуль-
фидными мостиками, распадается после умерен-
ного воздействия такого редуцирующего агента,
как меркаптоэтанол.
Любопытно, что каждая пентамерная молеку-
ла IgM, как оказалось, пятивалентна (т.е. содер-
жит пять антигенсвязывающих участков), а не де-
сятивалентна, что можно предположить благода-
ря наличию 10 Fab-фрагментов, содержащихся в
пентамере. Это относительное уменьшение валент-
ности, возможно, является результатом конфор-
мационных ограничений, обусловленных полиме-
ризацией. Известно, что пентамерный IgM обла-
дает плоской конфигурацией, в которой каждый
из его Fab-фрагментов не может раскрыться пол-
ностью в момент связывания с антигеном, как это
происходит у IgG, поскольку этому препятствуют
прилегающие Fab-фрагменты. Таким образом, лю-
бой крупный антиген, связанный с одним Fab-
фрагментом, может не допустить связывания с ан-
тигеном участка, находящегося рядом, что пре-
вращает молекулу в пятивалентную (или даже еще
меньшей валентности).
72
ГЛАВА 4. СТРУКТУРА АНТИТЕЛ И ИХ ФУНКЦИИ
• БИОЛОГИЧЕСКИЕ СВОЙСТВА IgM
Иммуноглобулин М, присутствующий в сыворот-
ке взрослого человека, обнаруживается в основ-
ном в сосудистом русле. Период полураспада мо-
лекулы IgM составляет приблизительно 5 сут. В от-
личие от IgG антитела IgM не отличаются мно-
гофункциональностью; они плохо нейтрализуют
токсины и неэффективны при нейтрализации
вирусов. Молекулы IgM также обнаруживаются
на поверхности зрелых В-лимфоцитов вместе с
IgD (см. далее), где они служат антигенспеци-
фичными рецепторами (BCR). После активации
В-клетки, которая следует после связывания BCR
антигеном, может произойти переключение класса
(см. гл. 6) и начнут секретироваться и экспресси-
роваться другие изотипы мембранных иммуногло-
булинов (например, IgG).
Благодаря своей пентамерной форме IgM яв-
ляются антителами, связывающими и активиру-
ющими комплемент. В отличие от иммуноглобу-
линов других классов даже одна молекула IgM,
связавшаяся с антигеном по крайней мере в двух
Fab-фрагментах, может инициировать каскадную
активацию комплемента, что делает этот имму-
ноглобулин наиболее эффективным для запуска
опосредованного комплементом лизиса микро-
организмов и других клеток. Это свойство IgM
при том, что антитела этого класса первыми про-
дуцируются после иммунизации или инфекции,
делает их очень важными для обеспечения пер-
вой линии иммунологической защиты на ранних
этапах бактериальных инфекций.
Антитела IgM не проходят через плаценту.
Однако поскольку они являются единственным
классом иммуноглобулинов, синтезируемым пло-
дом, начиная примерно с 5-го месяца гестации,
повышенные уровни содержания IgM указывают
на врожденную или перинатальную инфекцию.
Антитела IgM синтезируются после иммуниза-
ции или контакта с Т-независимыми антигенами
в значительном количестве и у детей, и у взрослых.
Первичный
иммуногенный
Вторичный
иммуногенный
стимул
стимул
• Рис. 4.12. Кинетика антительного ответа
Иммуноглобулин М — первый изотип, который
синтезируется после иммунизации (рис. 4.12).
Поэтому повышенный уровень IgM обычно указы-
вает или на недавно развившуюся инфекцию, или
на недавний контакт с антигеном
Агглютинация
Молекулы IgM являются эффективными агглю-
тинирующими антителами. Благодаря своей пен-
тамерной форме антитела IgM могут формиро-
вать макромолекулярные мостики между эпито-
пами, настолько отдаленными друг от друга, что
эти эпитопы не могут быть связанными более
мелкими антителами IgG. Более того, благодаря
своей пентамерной форме и множественной ва-
лентности антитела IgM являются особенно под-
ходящими для связывания с антигенами, которые
содержат повторяющиеся структуры одной и той
же антигенной детерминанты, как в случае с по-
лисахаридными антигенами или клеточными ан-
тигенами, которые во множестве экспрессируют-
ся на клеточных поверхностях.
Изогемагглютинация
К антителам IgM относятся изогемагглютинины —
встречающиеся в норме антитела против эритро-
цитарных антигенов групп крови АВО. Считает-
ся, что эти антитела возникают в результате им-
мунизации, осуществляемой бактериями, находя-
щимися в респираторном и желудочно-кишечном
трактах. Эти бактерии несут детерминанты, сход-
ные с олигосахаридами, определяющими группу
крови по системе АВО. Таким образом, без уста-
новленной предварительной иммунизации люди
с группой крови 0 имеют изогемагглютинины к
антигенам А и В; люди с группой крови А имеют
антитела к антигенам В, а люди с антигеном В
имеют антитела к антигену А. Индивидуум с груп-
пой крови АВ не имеет антител ни анти-А, ни
анти-В. К счастью, IgM-изогемагглютинины не
могут проникать через плаценту, и несовмести-
мость по группам крови АВО между матерью и
плодом не представляет угрозы для плода. Одна-
ко трансфузионные реакции, возникающие при
АВО-несовместимости, когда изогемагглютинины
реципиента реагируют с донорскими эритроци-
тами, могут иметь катастрофические последствия.
• СТРУКТУРНЫЕ И БИОЛОГИЧЕСКИЕ
СВОЙСТВА IgA
Основным иммуноглобулином, обнаруживаемом
в выделяемых наружных секретах, таких как слю-
на, слизь, пот, желудочный сок и слезы, является
IgA Более того, он является основным иммуно-
СТРУКТУРНЫЕ И БИОЛОГИЧЕСКИЕ СВОЙСТВА IgA
73
глобулином, находящимся в молозиве кормящих
матерей, и может стать основным средством за-
щиты кишечника в первые несколько недель после
рождения. Молекула IgA состоит из двух легких
или к-, или Х-цепей, а также двух тяжелых «-це-
пей. Причем ос-цепь несколько больше, чем у-цепь.
Молекулярная масса мономерного IgA составля-
ет примерно 165000 Да, а коэффициент седимен-
тации — 7S. При электофорезе сывороточных гло-
булинов IgA смещается в «медленную» р- или
«быструю» у-область. Димерный IgA обладает мо-
лекулярной массой 400000 Да.
В классе IgA содержатся два подкласса: IgAi (93 %)
и IgA2 (7 %). Интересно, что если учитывать про-
дуцируемый IgA на всех слизистых поверхностях
(респираторный, желудочно-кишечный и мочевы-
водящий тракты), то в количественном отноше-
нии он становится основным иммуноглобулином.
У сывороточного IgA период полураспада со-
ставляет 5,5 сут. Находящийся в сыворотке IgA
является преимущественно мономерным (одна че-
тырехцепочечная структура) и, вероятно, высво-
бождается до димеризации, таким образом теряя
способность связываться с секреторным компо-
нентом. Биологическая ценность секреторного IgA
очень высока, но о функции сывороточного IgA
известно мало.
В основном IgA присутствует не в сыворотке, а
в секретах организма, таких как слезы, слюна, пот
и слизь, в которых он выполняет важную биоло-
гическую функцию, являясь, например, частью
MALT, как указано в гл. 2. В секрете слизистых
оболочек IgA существует в виде димера и состоит
из двух четырехцепочечных единиц, соединенных
той же объединяющей (J) цепью, которая при-
сутствует и в молекулах IgM (см. рис. 4.9). Плаз-
матические клетки, секретирующие IgA, синте-
зируют молекулы IgA и J-цепи, формирующие
димеры. Такие плазматические клетки преимуще-
ственно располагаются в соединительной ткани,
называемой lamina propria (собственная пластин-
ка), находящейся непосредственно под базальной
мембраной многих участков эпителия (например,
в околоушных железах, ворсинках кишечника,
слезных железах, лактирующих молочных желе-
зах или под слизистой оболочкой бронхов). Ког-
да эти димерные молекулы высвобождаются из
плазматических клеток, они соединяются с поли-
Ig-рецептором, экспрессируемым на базальной
мембране тесно прилегающих друг к другу эпители-
альных клеток Рецептор транспортирует IgA-ди-
меры через эпителиальные клетки и высвобожда-
ет их во внеклеточные жидкости (например, в про-
свет кишечника или бронха). Высвобождению
способствует ферментативный гидролиз поли-
Ig-рецептора, причем большой фрагмент этого ре-
цептора молекулярной массой 70000 Да (называ-
емый секреторным компонентом) остается свя-
занным с Fc-фрагментом димерной молекулы IgA
(рис. 4.13). Данный секреторный компонент по-
могает защитить димерный IgA от протеолити-
ческого расщепления Следует заметить, что сек-
Эпителиальные клетки
• Рис. 4.13. Транспорт димерного IgA через эпителий. Плазматические клетки в непосредственной близости к эпители-
альным базальным мембранам в кишечнике, легочном эпителии, а также слизистых оболочках слюнных, слезных и лак-
тирующих молочных желез высвобождают димерный IgA. Иммуноглобулин А связывается с поли-1д-рецептором, и этот
комплекс транспортируется в образовавшейся везикуле через клетку. Поли-1д-рецептор отщепляется от комплекса у апи-
кальной поверхности, чтобы высвободить IgA из клетки. Покинув клетку, пентамерный фрагмент поли-lg-рецептора,
называемый секреторным компонентом, остается связанным с димерным IgA и, как полагают, защищает антитело в про-
светах некоторых органов, соединенных с внешней средой
Просвет
компонент
74
ГЛАВА 4. СТРУКТУРА АНТИТЕЛ И ИХ ФУНКЦИИ
реторный компонент также связывается с пента-
мерным IgM и в небольших количествах транс-
портирует его к поверхности слизистых оболочек.
Действие IgA при инфекциях
слизистых оболочек
В связи с тем что секреторный IgA находится в
содержимом таких секретов, как слюна, моча и
желудочный сок, он играет важную роль в каче-
стве первой линии иммунологической защиты
против локальных респираторных и желудочно-
кишечных инфекций. Считается, что его защитный
эффект обусловлен способностью предотвращать
прикрепление вторгающихся микроорганизмов к
эпителиальной поверхности или прохождение
сквозь нее. Например, в случае холеры патоген-
ный микроорганизм прикрепляется к клеткам,
выстилающим ЖКТ, в котором вибрионы выде-
ляют свой экзотоксин, ответственный за все сим-
птомы заболевания, но никогда не проникает
сквозь них. Антитела IgA, которые могут предот-
вратить прикрепление микроорганизма к клеткам,
таким образом обеспечивают защиту от патогена.
Можно сказать, что для защиты от локальных
инфекций гораздо более эффективны такие спо-
собы иммунизации, которые приводят к местной
продукции IgA, чем вызывающие преимуществен-
ное поступление антител в кровь.
Бактерицидная активность
Молекула IgA не содержит рецепторов для комп-
лемента, поэтому он не является комплементак-
тивирующим или комплементсвязывающим им-
муноглобулином. Соответственно, IgA не инду-
цирует комплементзависимый лизис бактерий.
Однако было показано, что IgA обладает бакте-
рицидной активностью против грамотрицатель-
ных микроорганизмов, но только в присутствии
лизоцима, который содержится в тех же секретах,
в которых находится и секреторный IgA.
Противовирусная активность
Секреторные IgA являются эффективными про-
тивовирусными антителами, предотвращающими
проникновение вирусов в клетки. Кроме того, они
также являются и эффективными агглютинирую-
щими антителами.
СТРУКТУРНЫЕ И БИОЛОГИЧЕСКИЕ
СВОЙСТВА IgD
Молекула IgD состоит из двух легких к- или
Х-цепей и двух тяжелых 8-цепей (см. рис. 4.9).
Иммуноглобулин D является мономером молеку-
лярной массой 180000 Да и коэффициентом се-
диментации 7S. При электрофорезе он смещается
в «быструю» у-область сывороточных глобулинов.
Какие-либо аллотипы тяжелых цепей или подклас-
сы молекул IgD не известны.
Иммуноглобулин D присутствует в сыворотке в
незначительных концентрациях, которая при этом
постоянно меняется, вероятно, потому что он не
секретируется плазматическими клетками, а также
потому что по сравнению с другими иммуноглобу-
линами чрезвычайно подвержен протеолитической
деградации. Кроме того, после активации В-клет-
ки транскрипция белка тяжелой 8-цепи быстро по-
давляется; этот феномен позволяет объяснить низ-
кий уровень содержания IgD в сыворотке.
Иммуноглобулин D коэкспрессируется вместе
с IgM на поверхности зрелых В-клеток и подобно
IgM действует как антигенспецифичный BCR. Его
присутствие служит показателем дифференциров-
ки В-клеток в более зрелую форму. Поэтому во
время онтогенеза В-клеток экспрессия IgD идет
вслед за экспрессией IgM (см. гл. 7).
Хотя функция IgD до конца не изучена, экс-
прессия мембранного IgD, похоже, взаимосвяза-
на с удалением В-клеток, способных производить
аутоантитела. Таким образом, в период развития
основная биологическая значимость IgD может
заключаться в «глушении» аутореактивных В-кле-
ток. У зрелых В-клеток IgD является антигенсвя-
зывающим поверхностным иммуноглобулином
вместе с коэкспрессируемым IgM.
СТРУКТУРНЫЕ И БИОЛОГИЧЕСКИЕ
СВОЙСТВА IgE
Молекула IgE состоит из двух легких (к- или Х-) и
двух тяжелых цепей (г). Как и молекула IgM, IgE
имеет дополнительный Сн-домен (см. рис. 4.9).
Иммуноглобулин Е обладает молекулярной мас-
сой примерно 200000 Да и коэффициентом седи-
ментации 8S. При электрофорезе он смещается в
«быструю» у-область сывороточных глобулинов.
До настоящего времени ни о каких аллотипах в
отношении тяжелых цепей, ни о подклассах IgE
не сообщалось.
Важность IgE при паразитарных
инфекциях и реакциях
гиперчувствительности
У IgE, также называемых антителами-реагина-
ми. период полураспада в сыворотке составляет
2 сут. Это самый короткий срок среди иммуно-
глобулинов всех классов. Его концентрация в сы-
воротке является наименьшей среди всех имму-
ноглобулинов. Такой уровень содержания отчас-
ти обусловлен низкой скоростью синтеза и ис-
ключительной способностью Fc-фрагмента IgE,
содержащего дополнительный Сн-домен, связы-
КИНЕТИКА ОБРАЗОВАНИЯ АНТИТЕЛ ПОСЛЕ ИММУНИЗАЦИИ
75
ваться с высокой степенью аффинности с рецеп-
торами (Fee-рецепторами), находящимися на туч-
ных клетках и базофилах. Однажды связавшись с
этими высокоаффинными рецепторами, IgE мо-
жет удерживаться на клетках неделями и месяца-
ми. При повторном появлении антиген взаимо-
действует с Fab-фрагментами IgE, закрепленны-
ми на этих клетках, приводя к перекрестному свя-
зыванию. Клетки при этом активируются и выс-
вобождают содержимое своих гранул: гиста-
мин, гепарин, лейкотриены и другие фармаколо-
гически активные соединения, запускающие ре-
акции гиперчувствительности немедленного типа.
Такие реакции могут быть умеренными, как при
укусе комара, или тяжелыми, как в случае бронхи-
альной астмы; они могут приводить даже к общей
анафилактической реакции, способной вызвать
смерть в течение нескольких минут (см. гл. 14).
Иммуноглобулины Е не являются агглютини-
рующими или активирующими комплемент ан-
тителами, однако играют важную роль в защите
от некоторых паразитов, таких как гельминты
(черви). Защита достигается за счет активации той
же самой острой воспалительной реакции, кото-
рая наблюдается при патологических формах ре-
акции гиперчувствительности немедленного типа.
Повышенные уровни IgE в сыворотке наблюда-
ются при инфекции, вызванной аскаридами. Дей-
ствительно, иммунизация аскаридным антигеном
индуцирует образование IgE.
КИНЕТИКА ОБРАЗОВАНИЯ АНТИТЕЛ
ПОСЛЕ ИММУНИЗАЦИИ
Первичный иммунный ответ
Как указывалось в гл. 3, первый контакт индиви-
дуума с определенным иммуногеном называют
первичной иммунизацией, а определяемый после
этого ответ называют первичным иммунным отве-
том. Как показано на рис. 4.12, первичный гумо-
ральный иммунный ответ может быть разделен
на несколько фаз.
1. Латентная, или скрытая, фаза’, после пер-
воначального контакта с антигеном проходит до-
статочно большой промежуток времени, прежде
чем в сыворотке начинают определяться антите-
ла. Продолжительность этого периода обычно
составляет 1 — 2 недели в зависимости от имму-
низируемого вида, антигена и других факторов
(обсуждаются в следующих главах). Длительность
латентного периода также во многом зависит от
чувствительности метода, используемого для опре-
деления продукта иммунного ответа. Латентный
период (более детально этот вопрос будет об-
суждаться позднее) включает время, необходимое
Т- и В-клеткам для контакта с антигеном, про-
лиферации и дифференцировки. В-клетки также
должны секретировать антитела в количестве, до-
статочном, чтобы их можно было определить в
сыворотке. Чем менее чувствителен метод опре-
деления антитела, тем больше антител потребует-
ся для их выявления и тем длиннее будет опреде-
ляемый латентный период.
2. Экспоненциальная фаза’, во время этой фазы
происходит экспоненциальный рост концентра-
ции антител в сыворотке.
3. Состояние равновесия’, во время этого пери-
ода процесс продукции и разрушения антитела
находится в состоянии равновесия.
4. Фаза снижения’, в конце концов, иммунный
ответ начинает угасать, и концентрация антител
в сыворотке быстро снижается.
При первичном иммунном ответе первым опре-
деляемым классом антител обычно является IgM,
который в некоторых случаях бывает и единствен-
ным классом производимых иммуноглобулинов.
Если затем начинается продукция антител IgG,
их появление обычно сопровождается быстрым
прекращением продукции IgM (см. рис. 4.12).
Вторичный иммунный ответ
Хотя синтез антител после примирования может
полностью прекратиться через несколько недель
(см. рис. 4.12), у иммунизированного индивиду-
ума остается клеточная память об этом контак-
те (т.е. долгоживущие клетки памяти). Наличие
вторичного иммунного ответа (также называемого
анамнестическим) становится очевидным при по-
вторном введении того же самого антигена. После
повторной инъекции длительность латентной
фазы значительно меньше, и время, необходи-
мое для появления антител, может составить
менее половины от срока, необходимого для пер-
вичного ответа. Антитела продуцируются с го-
раздо большей интенсивностью, а в сыворотке
определяются более высокие концентрации ан-
тител. Продукция антител может также продол-
жаться более длительный период, а их устойчи-
вый уровень часто сохраняется в сыворотке ме-
сяцы и даже годы спустя.
При вторичном иммунном ответе отмечаются
выраженные изменения в типе и качестве проду-
цируемых антител. В реакции со стороны изоти-
пов иммуноглобулинов происходит сдвиг, извест-
ный как переключение класса, при котором анти-
тела IgG появляются в больших концентрациях и
дольше сохраняются, чем IgM, содержание кото-
рых может резко снижаться вплоть до полного ис-
чезновения. Это переключение может также при-
водить к появлению IgA и IgE. Кроме того, проис-
ходит созревание аффинности — феномен, при ко-
тором средняя аффинность (константа связывания)
антител с антигеном повышается по мере разви-
тия вторичного ответа Движущей силой этого уве-
личения аффинности может быть процесс селек-
ции, во время которого В-клетки соревнуются со
свободным антителом в захвате антигена, количе-
76
ГЛАВА 4. СТРУКТУРА АНТИТЕЛ И ИХ ФУНКЦИИ
И ммуноглобулин
шшп
ШШ11
Iga/Igp-
гетеродимер
(CD79a/79b)
Рецептор
Т-клетки
р а
(г) <5)
vf h
Поли- Ig-рецептор
VI
CD3 у, 5, £
ШШ
шш
Молекулы МНС
II класс
I класс
р2т
Ешшшшшшш! !
ппппппппппп ППШ
= ШШ1
Н
а
С
р
• Рис. 4.14. Типичные представители суперсемейства иммуноглобулинов. Петлевые иммуноглобулиновые домены (по-
казаны в виде круглых синих петель) являются общим структурным признаком этих молекул Во всех случаях карбокси-
концевая область молекул заякорена на мембране
ство которого уменьшается. Таким образом, обес-
печить процесс дифференцировки В-клеток в плаз-
матические клетки могут только те клоны В-кле-
ток, которые будут связывать антиген поверхност-
ными иммуноглобулиновыми рецепторами с до-
статочно высокой аффинностью. Эти плазматиче-
ские клетки, возникшие из селективно отобранных
В-клеток, синтезируют определяемые антитела,
обладающие высокой аффинностью к антигену.
Способность к вторичному ответу может со-
храняться длительное время (у людей — годы) и
дает явные преимущества с точки зрения отбора
для особей, переживших первый контакт с агрес-
сивным патогеном. Установление такой памяти
при выработке специфического ответа несомнен-
но является целью программ государственного
здравоохранения по иммунизации.
I СУПЕРСЕМЕЙСТВО
ИММУНОГЛОБУЛИНОВ
Общие структурные свойства тяжелых и легких
иммуноглобулиновых цепей, такие как петлевые
домены иммуноглобулина (см. рис. 4.3), обнару-
жены и у значительного числа белков. Большин-
ство этих белков являются гликопротеинами, свя-
занными с мембранами. В связи с такой схоже-
стью структур они были отнесены к представите-
лям суперсемейства иммуноглобулинов. Избыточ-
ность структуры, наблюдаемая у этих белков, ука-
зывает на то, что кодирующие их гены произош-
ли от общего родоначального гена — того, кото-
рый отвечает за получение базовой структуры до-
мена. Дупликация и последующая дивергенция
этого родоначального гена могли бы объяснить
существование большого числа мембранных бел-
ков, обладающих одним или более участками, го-
мологичными петлевому домену иммуноглобули-
на. Генетические и функциональные исследова-
ния белков иммуноглобулинового суперсемейства
показали, что их гены развивались независимо,
поскольку они не имеют общей генетической свя-
зи или общих функций. На рис. 4.14 в качестве
примеров показаны несколько белков — членов
иммуноглобулинового суперсемейства. Прочие
многочисленные примеры обсуждаются в других
главах. Как можно видеть, каждая молекула со-
держит характерную структуру укладки иммуно-
глобулина — петлю, формируемую за счет внут-
рицепочечных дисульфидных мостиков и состоя-
ТЕСТЫ
77
щую примерно из 110 аминокислот. Считается,
что эти домены способствуют взаимодействию
между мембранными белками (например, моле-
кулами CD4 на хелперных Т-клетках и молекула-
ми МНС II класса на АПК).
РЕЗЮМЕ
1. Иммуноглобулины всех классов имеют основ-
ную четырехцепочечную структуру, состоящую из двух
идентичных легких (L) и двух идентичных тяжелых (Н)
цепей. Каждая легкая цепь соединяется с тяжелой
цепью, и две тяжелые цепи соединены между собой
посредством дисульфидных мостиков.
2. В естественном состоянии цепи свернуты в до-
мены, стабилизируемые внутрицепочечным дисуль-
фидным мостиком. Группа других белков (например,
TCR, CD4 и молекулы МНС I и II классов) также со-
держат такие домены, что делает их всех представи-
телями суперсемейства иммуноглобулинов.
3. Иммуноглобулины присутствуют в двух формах:
мембранной (антитела экспрессируются на поверхно-
сти В-клеток) и секреторной (антитела продуцируются
плазматическими клетками). Мембранные антитела
ассоциируются с гетеродимером, называемым Iga/
IgP, для формирования В-клеточного рецептора.
4. N-концевые домены и тяжелой, и легкой цепей
являются вариабельными (V) областями и содержат ги-
первариабельные участки, также называемые участка-
ми, определяющими комплементарность (CDR), кото-
рые составляют антигенсвязывающий центр антитела и
варьируются в соответствии с его специфичностью.
5. Другие домены составляют константные (С) об-
ласти. Эти домены одинаковы внутри каждого класса
молекул иммуноглобулинов.
6. Fc-фрагменты тяжелых цепей отвечают за раз-
личные биологические функции, присущие каждому
классу антител.
7. Изотипы иммуноглобулинов различаются по
константным областям тяжелых цепей. Аллельное
разнообразие иммуноглобулинов в области тяжелой
цепи (состоящие иногда в замене одной или двух
аминокислот) определяют как аллотип, по которому
отличаются отдельные особи внутри вида Идиотипи-
ческие маркеры, наоборот, представлены уникальны-
ми комбинациями аминокислот, которые составляют
антигенсвязывающий центр молекулы антитела; они
уникальны для каждого определенного антитела.
8. Иммуноглобулины G представляют класс анти-
тел, обладающих многочисленными биологическими
функциями, начиная от нейтрализации токсина до ак-
тивации комплемента и опсонизации. Они являются
единственным классом иммуноглобулинов, который
проходит через плаценту и передает материнский
иммунитет плоду. Период полураспада IgG составляет
23 сут и является самым большим среди иммуногло-
булинов всех классов.
9. Иммуноглобулины М экспрессируются на по-
верхности зрелых В-клеток (как мономеры) и секре-
тируются как антитела в пентамерной форме. Из всех
классов иммуноглобулинов они обладают наибольшей
агглютинирующей активностью и способностью к ак-
тивации комплемента.
10. Иммуноглобулины А существуют в мономер-
ной и димерной формах. Димерная форма считается
секреторной, поскольку обнаруживается в секретах
желез. Иммуноглобулины А являются важными проти-
вовирусными иммуноглобулинами.
11. Иммуноглобулины D находятся на поверхности
зрелых В-клеток и экспрессируются совместно с IgM,
обладающими той же антигенной специфичностью.
Функциональные свойства IgD до конца не изучены.
12. Иммуноглобулины Е, называемые также реаги-
новыми антителами, имеют важнейшее значение при
аллергических реакциях. Они играют важную роль в
защите от паразитарных инфекций. Fc-фрагмент IgE
связывается с высокой аффинностью с рецепторами
некоторых клеток, таких как тучные клетки. При кон-
такте с антигеном IgE запускает процесс дегрануля-
ции таких клеток, приводящий к высвобождению фар-
макологически активных субстанций, опосредующих
реакции гиперчувствительности (аллергические).
13. Первичный ответ после первичной иммуниза-
ции состоит в основном в продукции антител IgM Ре-
зультатом вторичного контакта с тем же антигеном
является вторичный ответ или так называемая анам-
нестическая реакция (память). Вторичный ответ раз-
вивается быстрее первичного, при этом происходит
сдвиг от продукции IgM к синтезу IgG и других изоти-
пов. Вторичный ответ по продолжительности значи-
тельно превосходит первичный.
ТЕСТЫ
Выберите ОДИН НАИБОЛЕЕ ПРАВИЛЬНЫЙ ответ
на каждый тест.
1. Функциональные свойства иммуноглобулинов,
такие как связь с Fc-рецептором, определяются:
а) легкими цепями;
б) J-цепью;
в) дисульфидными мостиками;
г) тяжелыми цепями;
д) вариабельными областями.
2. Идиотип молекулы антитела определяется по-
следовательностью аминокислот:
а) константной области легкой цепи;
б) вариабельной области легкой цепи;
в) константной области тяжелой цепи;
г) константных областей тяжелых и легких цепей;
д) вариабельных областей тяжелых и легких цепей.
3. К получению поликлональной кроличьей анти-
сыворотки, специфичной к тяжелым у-, к- и Х-цепям и
Fc-фрагменту иммуноглобулина человека, приведут:
а) белки Бенс-Джонса;
б) совокупность IgG;
в) обработанный пепсином IgG;
г) очищенный Fab-фрагмент;
д) очищенный Р(аЬ')2-фрагмент.
4. Поликлональная антисыворотка, полученная
против пула (совокупности) IgA человека, будет реаги-
ровать:
а) с IgM человека;
б) легкими к-цепями;
в) IgG человека;
78
ГЛАВА 4. СТРУКТУРА АНТИТЕЛ И ИХ ФУНКЦИИ
г) J-цепью;
д) со всем перечисленным.
5. Индивидуум оказался гетерозиготным по алло-
типам 3 и 12 IgGv Различные антитела, которые толь-
ко может продуцировать данный индивидуум, никогда
не будут иметь:
а) двух тяжелых цепей аллотипа 12;
б) двух легких к- или Х-цепей;
в) двух тяжелых цепей аллотипа 3;
г) двух тяжелых цепей: одна — аллотипа 3, другая —
аллотипа 12.
6. Обработанный папаином препарат антител IgG,
специфичных для альбумина куриного яйца (антиген
НЕА):
а) потеряет свою антигенную специфичность;
б) будет преципитировать НЕА;
в) потеряет межцепочечные дисульфидные связи;
г) будет расщеплен на две молекулы Fab и одну
молекулу Fc;
д) ничего из перечисленного не произойдет.
7. У большинства обычных индивидуумов при хро-
нических инфекциях увеличивается содержание им-
муноглобулинов класса:
a) IgA; в) IgG; д) IgD.
б) IgE; г) IgM;
8. Активировать комплемент после связи одной
его молекулы с антигеном может иммуноглобулин:
a) IgA; в) IgG; д) IgD.
б) IgE; г) IgM;
9. Относительный уровень патогенспецифичных
антител IgM может быть важен для диагностики:
а) поскольку IgM легче определяется, чем другие
изотипы;
б) вирусная инфекция часто приводит к резко вы-
раженным изменениям со стороны IgM;
в) антитела IgM гораздо чаще оказывают защитное
действие в отношении реинфекций, чем другие изо-
типы;
г) относительно высокие уровни IgM часто обу-
словлены первым недавним контактом с индуцирую-
щим агентом.
10. Первичный и вторичный ответы со стороны ан-
тител различаются:
а) преимущественно продуцируемым изотипом;
б) числом лимфоцитов, реагирующих на антиген;
в) быстротой появления антител в сыворотке;
г) биологическими функциями, которые демонст-
рируют продуцируемые изотипы иммуноглобулинов;
д) всем перечисленным.
ОТВЕТЫ НА ТЕСТЫ
1 — г. С-концевой участок константной области тя-
желой цепи содержит домен, связанный с биологи-
ческой активностью иммуноглобулинов.
2 — д. Идиотип является антигенной детерминан-
той молекулы иммуноглобулина, включающей участок
связывания антигена, который в свою очередь состо-
ит из вариабельных областей как L-, так и Н-цепей.
3 — б. Только пулированный IgG, содержащий
смесь молекул IgG, каждая из которых экспрессирует
тяжелую у-цепь (следовательно, Fc-фрагмент) и лег-
кие к- либо Х-цепи, будет приводить к выработке ан-
тисыворотки к каждому из этих компонентов иммуно-
глобулина. Никакие другие варианты индукции иммун-
ного ответа не приведут к стимуляции антител ко
всем этим компонентам. Белки Бенс-Джонса являют-
ся димерами легких цепей и обнаруживаются в моче
больных множественной миеломой. Обработка IgG
пепсином приводит к расщеплению Fc-фрагмента.
Очищенные Fab- и Е(аЬ')2-фрагменты не имеют тяже-
лой у-цепи (следовательно, и Fc-фрагмента).
4 — д. Все ответы верны. Антисыворотка к IgA бу-
дет содержать антитела, специфичные к легким к- и
Х-цепям. Эти антитела, конечно, будут реагировать с
IgG и IgM, имеющими такие к- и ^-цепи. Будут иметь-
ся и антитела к J-цепи, если для иммунизации ис-
пользовался димерный IgA.
5 — г. В любом иммуноглобулине, продуцируемом
одной клеткой, две Н-цепи и две L-цепи идентичны
Поэтому любая молекула антитела у этого индивидуу-
ма будет иметь либо Н-цепи аллотипа 3, либо Н-цепи
аллотипа 12, но не их смесь. Также и антитела будут
иметь либо две к-, либо две Х-цепи.
6 — г. Папаин расщепляет молекулы IgG выше
шарнирной области, образуя две молекулы Fab и Fc-
фрагмент. Fab-фрагменты способны связываться с
НЕА, но поскольку они не удерживаются вместе ди-
сульфидными связями, то не смогут преципитировать
антиген. Другой эффект дает обработка IgG пепси-
ном, который расщепляет молекулу ниже шарнирной
области, оставляя целой одну двухвалентную молеку-
лу F(ab')2, способную преципитировать антиген. Фраг-
менты НЕА-специфичных антител после обработки
пепсином будут обладать той же аффинностью к ан-
тигену, что и первоначальные Fab-фрагменты антител,
поскольку CDR молекул будут сохранены.
7 — в. При хронических инфекциях В-клетки мно-
гократно стимулируются к участию в иммунном ответе
из-за присутствия патогена, вызвавшего инфекцию.
Таким образом, в период инфекционного заболевания
у обычных людей уровни IgG в сыворотке будут уве-
личиваться.
8 — г. Только IgM может активировать и фиксиро-
вать комплемент, когда только одна молекула связана
с антигеном. Это обусловлено пентамерной формой
иммуноглобулинов этого класса.
9 — г. Верен только последний ответ. Относитель-
но высокие уровни IgM часто обусловлены первым
недавним контактом с индуцирующим агентом, по-
скольку IgM является первым изотипом, синтезируе-
мым в ответ на иммуноген
Ю-д. Все ответы верны и сами содержат объяс-
нения.
Глава
ВЗАИМОДЕЙСТВИЯ АНТИГЕНОВ
С АНТИТЕЛАМИ. ИММУНОЛОГИЧЕСКИЕ
ИССЛЕДОВАНИЯ И ЭКСПЕРИМЕНТАЛЬНЫЕ
СИСТЕМЫ
ВВЕДЕНИЕ
В предыдущих главах мы по необходимости каса-
лись некоторых методов и аналитических при-
емов, что способствовало лучшему пониманию
некоторых фундаментальных аспектов врожден-
ного и приобретенного иммунитета. В этой гла-
ве мы более детально обсудим лабораторные ме-
тоды исследования и экспериментальные систе-
мы, которые используют в научно-исследователь-
ских и диагностических лабораториях. Некото-
рые из них связаны только с определением ан-
тител (например, серологические методы), в то
время как в других применяют методы молеку-
лярной биологии, генной инженерии, методы
клеточных культур и модели на животных, кото-
рые в значительной мере способствуют понима-
нию физиологии и патофизиологии иммунной
системы. В 2000 г. была открыта последователь-
ность человеческого генома. Благодаря активным
попыткам расшифровки последовательности ге-
номов микроорганизмов появились многообеща-
ющие подходы к изучению иммунной системы —
исследования с использованием биоинформати-
ки и вычислительной биологии (так называемые
эксперименты in silica}. Эти технологии основа-
ны на данных, полученных при изучении гено-
мики и протеиномики, и используют мощные
компьютерные программы и вычислительные
алгоритмы. Для иммунологии они очень много-
обещающи. Это особенно актуально при попыт-
ках идентификации иммуногенных эпитопов,
экспрессируемых возбудителями, которые в даль-
нейшем могут быть использованы для получе-
ния вакцин. Хотя эта тема находится за предела-
ми предмета данной главы, важно помнить, что
будущий прогресс в области иммунологии будет
обеспечен комбинацией исследовательских при-
емов in vitro, in vivo и in silica.
Начнем эту главу с обсуждения физических
механизмов взаимодействия антигена и антитела.
ВЗАИМОДЕЙСТВИЯ
АНТИГЕН - АНТИТЕЛО
Реакция между антигеном и сывороточными ан-
тителами (серология) является основой многих
иммунных исследований. Вследствие строгой спе-
цифичности иммунного ответа для диагностиче-
ских целей, обнаружения и идентификации ан-
тигенов или антител широко используется взаи-
модействие между антигеном и антителом in vitro.
Примером использования серологических мето-
дов для идентификации и классификации анти-
генов является серотипирование микроорганиз-
мов с использованием специфической антисы-
воротки.
Взаимодействие антигена с антителами может
приводить к различным последствиям, включая
преципитацию (если антиген растворимый), агглю-
тинацию (если антиген представляет собой твер-
дую частицу) и активацию комплемента. Все эти
исходы обусловлены взаимодействием между по-
ливалентными антигенами и антителами, которые
имеют по крайней мере два участка для связыва-
ния молекулы антигена. Перечисленные реакции,
развивающиеся при взаимодействии антиген-
антитело, не являются характерными при первич-
ном антительном ответе на соответствующие ан-
тигенные эпитопы, а в большей степени отража-
ют события, развивающиеся при повторном вза-
имодействии поливалентных антигенов с антите-
лами. Такие феномены, как образование преци-
питатов, агглютинация и активация комплимен-
та, развиваются, если антитело с двумя или более
связывающими участками прореагировало с ran-
80
ГЛАВА 5 ВЗАИМОДЕЙСТВИЯ АНТИГЕНОВ С АНТИТЕЛАМИ. ИММУНОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ...
Антиген/гаптен
Антитело/фрагмент
Образуемый комплекс
Взаимодействие
между антителом
и гаптеном
Анти-А
А-анти-А-комплексы
без перекрестного
связывания
Моновалентный
монодетерминантный
антиген (гаптен)
Взаимодействие
между антителом
и поливалентным
антигеном с одной
детерминантой
Анти-А
Перекрестно связанные
А-анти-А-комплексы
Поливалентный
монодетерминантный
антиген
Взаимодействие между
Fab и поливалентным
антигеном с одной
детерминантой
А
Анти-А
Поливалентный
монодетерминантный
антиген
А-анти-А — Fab-комплексы
без перекрестного
связывания
Взаимодействие между
димерами Fab
и поливалентным
антигеном с одной
детерминантой
Анти-А
Перекрестно связанные
А-анти-А-комплексы
Поливалентный моно-
детерминантный антиген
Взаимодействие между
антителами к детер-
минантам А, В и С
и поливалентным
полидетерминантным
антигеном с детерми-
нантами А, В и С
А
С
П ол и валентный
полидетерминантный
антиген
Перекрестно связанные
А-анти-А-, А-анти-В-
и А-анти-С-комплексы
• Рис. 5.1. Взаимодействия между антителами или фрагментами антител и антигенами или
гаптенами
теном (например, антигеном, имеющим одну де-
терминанту, — моновалентным); однако они ини-
циируются при взаимодействии моновалентных
фрагментов антител (например, Fab) с антигеном,
даже если антиген поливалентен. Причины этих
различий показаны на рис. 5.1.
Для преципитации, агглютинации или актива-
ции комплимента требуется, чтобы антитела пе-
рекрестно связывали разные антигенные молеку-
лы, что возможно, только если антиген полива-
лентен, а антитело двухвалентно (либо интактные
антитела, либо Р(аЬ')2-фрагмент, состоящий из
двух антигенсвязываюших участков) (см. рис. 5.1).
Напротив, перекрестное связывание невозмож-
но, если антиген или антитело является монова-
лентным.
ПЕРВИЧНЫЕ ВЗАИМОДЕЙСТВИЯ МЕЖДУ АНТИТЕЛОМ И АНТИГЕНОМ
81
♦ ПЕРВИЧНЫЕ ВЗАИМОДЕЙСТВИЯ
МЕЖДУ АНТИТЕЛОМ И АНТИГЕНОМ
Во взаимодействие между антителом и антиген-
ным эпитопом ковалентные связи не вовлекают-
ся. Следовательно, связующие их силы относи-
тельно слабы. К ним относятся в основном ван-
дер-ваальсовы, электростатические и гидрофоб-
ные силы; для них необходимо очень тесное сбли-
жение между взаимодействующими элементами.
Таким образом, для взаимодействия эпитоп ан-
тигена и антитело должны точно соответствовать,
что часто сравнивают с взаимодействием типа
ключ —замок. Из-за того что во взаимодействие
между антигеном и антителом вовлечены слабые
силы, комплекс антиген — антитело может легко
диссоциировать под влиянием низкого или высо-
кого pH, гиперосмолярности раствора или хао-
тропических ионов (например, цианатов), кото-
рые эффективно разрушают водородные связи мо-
лекул воды.
Константа ассоциации
Взаимодействие между антителом и антигенным
эпитопом удобно рассматривать на примере ре-
акции между антителом и моновалентным гапте-
ном. Поскольку молекула антитела симметрична
и имеет два идентичных антигенсвязывающих Fab-
фрагмента, при связывании одной молекулы ан-
титела с двумя идентичными моновалентными
гаптенами каждый Fab-фрагмент независимо со-
единяется с одной молекулой гаптена. Связь мо-
новалентного антигена (Ag) с каждым сайтом ан-
титела может быть представлена следующим урав-
нением:
кх
Ag + Ab Ab - Ag,
k i
где kx — прямая константа (ассоциации); k\ —
обратная константа (диссоциации); Ab — антитело.
Отношение kx/k_x — это ассоциативная кон-
станта К, мера сродства (аффинности). Она мо-
жет быть рассчитана по отношению концентра-
ции связанных комплексов антиген—антитело к
концентрации несвязанных (свободных) антиге-
нов и антител.
K^kx JAb-Ag]
[Ab][Ag] ’
Константа ассоциации (К) действительно яв-
ляется мерой аффинности (сродства) антитела и
антигенного эпитопа. Когда все антитела, кото-
рые связывают соответствующие гаптены или ан-
тигенные эпитопы, идентичны (как в случае мо-
ноклональных антител), тогда константа К пред-
ставляет собой внутреннюю константу ассоциа-
ции. Однако по причине того, что сывороточные
антитела, даже те, которые взаимодействуют толь-
ко с единственным эпитопом, гетерогенны, сред-
няя константа ассоциации всех антител к эпито-
пам, обозначается как Kq. Взаимодействие между
антителами и каждым эпитопом поливалентного
антигена подчиняется кинетике и силам, сходны-
ми с теми, что участвуют во взаимодействии между
антителами и гаптенами, поскольку каждый эпи-
топ антигена реагирует с соответствующим анти-
телом аналогичным образом, о котором рассказа-
но ранее.
Константа ассоциации может быть определена
с использованием метода равновесного диализа. Для
этого используется диализная камера с двумя от-
секами, разделенными полупроницаемой мемб-
раной, через которую могут свободно проникать
молекулы соответствующего размера. Антитела
помещают с одной стороны полупроницаемой
мембраны, причем они не могут проникать сквозь
нее из-за большого размера. С другой (антиген-
ной) стороны мембраны добавляется известное
число мелких растворимых радиоактивно мечен-
ных гаптенов, олигосахаридов или олигопепти-
дов, предоставляющих эпитопы сложных углево-
дов или белков.
В момент старта гаптен или используемый ан-
тигенный эпитоп (обозначаемый здесь и далее как
лиганд) начинает диффундировать через мембра-
ну: при достижении равновесия концентрация
свободных лигандов будет одинаковой по обе сто-
роны мембраны. Однако общее количество ли-
гандов будет больше с той стороны, на которой
расположены антитела, поскольку некоторые ли-
ганды будут связываться с молекулами антител.
Разница в концентрации лигандов в двух отсеках
диализной камеры отражает концентрацию лиган-
дов, связанных с антителами (т.е. комплексов ан-
тиген-антитело). Чем больше аффинность ан-
тител, тем больше лигандов связывается
Кроме того, в этом исследовании могут быть
использованы разные концентрации лигандов,
поскольку концентрация антител, помещенных в
диализную камеру, может быть предопределена и
остается постоянной. Этот подход используется в
так называемом методе Скэтчарда. Он применя-
ется в ситуации, когда надо определить, являют-
ся ли исследуемые препараты антител гомоген-
ными (например, моноклональные антитела) или
гетерогенными (например, поликлональная анти-
сыворотка), или измерить среднюю константу аф-
финности (Ло).
Аффинность и авидность
Как упоминалось ранее, внутренняя константа ас-
социации, характеризующая связь антитела с ан-
тигенным эпитопом или гаптеном, определяется
как аффинность, сродство. Если антиген состоит
из множества повторяющихся идентичных эпи-
82
ГЛАВА 5. ВЗАИМОДЕЙСТВИЯ АНТИГЕНОВ С АНТИТЕЛАМИ. ИММУНОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ...
топов или поливалентен, взаимодействие между
полной молекулой антигена и антителом зависит
не только от аффинности каждого эпитопа и со-
ответствующего антитела, но и от суммарной аф-
финности всех вовлеченных эпитопов. Например,
аффинность соединения анти-А-антитела с поли-
валентным антигеном А может быть на четыре-
пять порядков выше, чем аффинность связи того
же антитела (т.е. анти-А) с моновалентным анти-
геном А (см. рис. 5.1). Причина в том, что соеди-
нение в пары анти-А-антител с антигеном А уси-
ливается за счет увеличения числа участков анти-
гена А, с которыми могут реагировать анти-А-ан-
титела.
Термин «аффинность» обозначает внутреннюю
ассоциативную константу между антителом и мо-
новалентным лигандом, таким как гаптен, а тер-
мин «авидность» используется для обозначения
общей связующей силы между антителами и по-
ливалентным антигеном. Так, как правило, анти-
тела IgM обладают большей авидностью, чем ан-
титела IgG, хотя соединение каждого Fab-фраг-
мента молекулы IgM с лигандом может иметь та-
кую же аффинность, которой обладает Fab-фраг-
мент молекулы IgG.
• ВТОРИЧНЫЕ ВЗАИМОДЕЙСТВИЯ
МЕЖДУ АНТИТЕЛАМИ
И АНТИГЕНАМИ
Реакции агглютинации
Снова обратимся к рис. 5.1. Взаимодействие ан-
титела с поливалентным антигеном, который яв-
ляется корпускулярным (т.е. представленным не-
растворимыми частицами), приводит к перекрес-
тному связыванию различных частичек антигена
антителами. Это перекрестное связывание в кон-
це концов приводит к группировке или агглюти-
нации частиц антигена антителами.
Титр
Агглютинация антигенов при их перекрестном
связывании антителами зависит от правильного
соотношения между количеством антигена и ан-
тител. Одной из методик, иногда используемой
для измерения уровня сывороточных антител, спе-
цифичных к корпускулярным антигенам, являет-
ся реакция агглютинации. Более чувствительные
количественные исследования (например, имму-
ноферментный метод, обсуждаемый далее) прак-
тически вытеснили эту технологию измерения
уровня антител в сыворотке. Действительно, аг-
глютинационное титрование конкретной сыворот-
ки позволяет только полуколичественно опреде-
лять содержание антител, присутствующих в сы-
воротке; оно не является способом количествен-
ного измерения концентрации антител (масса к
объему) Это исследование проводится путем сме-
шивания двукратных серийных разведений сыво-
ротки с антигеном, концентрация которого фик-
сирована. Высокие разведения сыворотки обыч-
но не вызывают агглютинации антигена, посколь-
ку при таких разведениях содержание антител
недостаточно для развития заметной, визуализи-
руемой агглютинации. Наибольшее разведение
сыворотки, которое дает агглютинацию и после
которого агглютинация не развивается, называ-
ется титром. Часто бывает, что агглютинация не
развивается также и при высоких концентрациях
антител, хотя при большем разведении сыворот-
ки эта реакция происходит Пробирки с высокой
концентрацией сыворотки, в которых не разви-
вается агглютинация, называются прозоной. В этой
прозоне антитела присутствуют в избытке. Аг-
глютинация может не развиваться при высоком
отношении антител к антигену, поскольку каж-
дый эпитоп на частице оказывается связанным с
отдельной молекулой антигена, что предотвращает
перекрестное связывание между разными части-
цами.
Из-за феномена прозоны при определении аг-
глютинирующих антител к конкретному антиге-
ну непременным условием является тестирование
сыворотки в нескольким разведениях. Тестирова-
ние сыворотки только в родном разведении может
привести к необоснованным выводам при отсут-
ствии агглютинации, поскольку оно означает как
прозону, так и отсутствие антител.
Зета-потенциал
Поверхность некоторых корпускулярных антиге-
нов может обладать электрическими зарядами,
как, например, сетка отрицательных зарядов на
поверхности эритроцитов, созданная остатками
сиаловой кислоты. Когда такие заряженные час-
тицы погружаются в физиологический раствор,
между ними возникает электрический потенци-
ал, называемый зета-потенциалом, который пред-
отвращает слишком тесное сближение частиц.
Этот потенциал препятствует агглютинации за-
ряженных частиц антителами, в особенности —
эритроцитов антителами класса IgG. Расстояние
между Fab-фрагментами в молекуле IgG даже при
максимальном удалении слишком мало для эф-
фективного связывания двух эритроцитов и пре-
одоления зета-потенциала. Таким образом, хотя
IgG могут быть направлены против антигенов на
поверхности эритроцита, имеющей отрицатель-
ный заряд, агглютинация не может развиться из-
за отталкивания вследствие зета-потенциала. При
этом некоторые Fab-фрагменты в пентамере IgM
достаточно удалены друг от друга и могут связы-
вать эритроциты, разделенные зета-потенциалом.
Это свойство антител класса IgM, как и пентава-
лентность, является основной причиной их эф-
фективности в качестве антител-агглютининов.
ВТОРИЧНЫЕ ВЗАИМОДЕЙСТВИЯ МЕЖДУ АНТИТЕЛАМИ И АНТИГЕНАМИ
83
о©
о о
Антиген
Антитело (1g)
Отсутствие
агглютинации
• Рис. 5.2. Тест Кумбса (антииммуноглобулиновый)
В течение многих лет предпринимались попыт-
ки улучшить реакцию агглютинации путем сни-
жения разными методами зета-потенциала, но ни
один из них не стал универсальным или доста-
точно эффективным. Однако в 1950-х гг. Р. Кумбс
(R. Coombs) предложил метод, который устранил
эту проблему. Метод, описанный далее, облег-
чает агглютинацию эритроцитов антителами
класса IgG, специфичными к антигенам поверх-
ности эритроцитов. Он также может использо-
ваться при определении неагглютинирующих ан-
тител, которые присутствуют на поверхности
эритроцита.
Тест Кумбса
В тесте Кумбса используются антитела к иммуно-
глобулинам (вот почему он иногда называется
антииммуноглобулиновым тестом). В его основе
лежат два важных факта: 1) иммуноглобулины
одного биологического вида (например, челове-
ческие) являются иммуногенными при их введе-
нии в организм другого биологического вида (на-
пример, кролика) и приводят к продукции анти-
тел против иммуноглобулинов; 2) большинство
антииммуноглобулинов (например, кроличьи ан-
титела к 1g человека) связываются с антигенной
детерминантой на Fc-фрагменте антител, остав-
ляя Fab-фрагменты свободными для реакции с
антигеном. Так, например, если человеческие IgG
связаны с соответствующими им эпитопами на
поверхности эритроцитов, то добавление кроли-
чьих антител к человеческому IgG приведет к их
связыванию с Fc-фрагментами человеческих ан-
тител, уже закрепленных на эритроцитах посред-
ством Fab-фрагментов (рис. 5.2). Эти кроличьи
антитела не только связываются с человеческими
антителами, в свою очередь уже связанными с
эритроцитами, но и формируют перекрестные
связи (мостики) между человеческими антитела-
ми, расположенными на относительно удаленных
друг от друга эритроцитах, преодолевая разделе-
ние, обусловленное зета-потенциалом, что при-
водит к агглютинации. Добавление антииммуно-
глобулинов вызывает агглютинацию, даже если
антитела, направленные против эритроцитов, при-
сутствуют в достаточно больших концентрациях,
чтобы вызвать феномен прозоны.
Существует два варианта реакции Кумбса: пря-
мой и непрямой тесты Кумбса. Эти две версии
несколько отличаются по методике, но обе по-
строены на одном принципе: использовании ге-
терологичных антииммуноглобулинов для обнару-
жения взаимодействия антигена и антитела. В пря-
мом тесте Кумбса антииммуноглобулины добав-
ляются к частицам (например, эритроцитам) для
обнаружения антител, связанных с антигенами на
их поверхности. Например, этот тест использу-
ют, когда у новорожденного подозревают гемо-
литическую болезнь, вызванную материнскими
анти-ИЬ-антителами класса IgG. связанными с
эритроцитами младенца. Для того чтобы доказать
правомочность таких подозрений, в прямом тесте
Кумбса следует получить следующие результаты:
добавление антииммуноглобулинов к суспензии
эритроцитов ребенка путем связывания антиим-
муноглобулинов с материнскими антителами на
поверхности эритроцитов должно вызвать агглю-
тинацию. Непрямой тест Кумбса используют для
обнаружения в сыворотке антител, специфичных
для антигенов на частичках. Добавление к час-
тичкам сывороточных антител, возможно, не при-
ведет к агглютинации из-за наличия зета-потен-
циала. Последующее добавление антииммуногло-
булинов обязательно вызовет агглютинацию. Чаще
всего непрямой тест Кумбса используется для об-
наружения антител класса IgG к резус-фактору в
крови резус-отрицательных женщин (см. гл. 15).
Эта процедура включает, во-первых, реакцию
сыворотки женщины с резус-положительными
эритроцитами, а во-вторых — добавление реаген-
та с антииммуноглобулином (как в прямом тесте
Кумбса). Таким образом, прямой тест Кумбса
выявляет связанные антитела, в то время как не-
прямой тест — сывороточные.
Вначале название «тест Кумбса» использова-
лось для реакции определения человеческих ан-
тител на поверхности эритроцитов. Сегодня этот
термин используется для обозначения любой ре-
акции обнаружения любых иммуноглобулинов,
связанных с антигенами, посредством антиимму-
ноглобулина
84
ГЛАВА 5 ВЗАИМОДЕЙСТВИЯ АНТИГЕНОВ С АНТИТЕЛАМИ. ИММУНОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ...
Пассивная агглютинация
Реакция агглютинации может проводиться с кор-
пускулярными антигенами (например, эритроци-
тами или бактериями) и растворимыми аллерге-
нами в том случае, если растворимый антиген
может быть надежно закреплен на нерастворимой
частице.
Например, растворимый антиген тиреоглобу-
лин можно зафиксировать на частицах латекса,
и тогда добавление антител к тиреоглобулину
приведет к агглютинации частиц латекса, покры-
тых тиреоглобулином. Конечно, добавление ра-
створимого антигена к антителам до их взаимо-
действия с покрытыми тиреоглобулином части-
цами латекса ингибирует агглютинацию, посколь-
ку антитела вначале свяжутся с растворимым
антигеном. Если растворимый антиген присут-
ствует в избытке, антитела вообще не будут спо-
собны связываться с антигеном, связанным с по-
верхностью частиц. Последний пример называ-
ют угнетением агглютинации. Необходимо раз-
личать такое угнетение и случаи, когда антитела
к некоторым вирусам предотвращают агглюти-
нацию эритроцитов самими вирусными частич-
ками. В такой ситуации антитела направлены на
участок или участки оболочки вируса, которые
связываются с соответствующими рецепторами
на красных клетках крови
Если антиген является естественным компо-
нентом частицы, реакцию называют прямой агглю-
тинацией. Если же реакция происходит между
антителами и растворимым антигеном, который
предварительно был закреплен на нерастворимых
частицах, реакцию называют пассивной агглюти-
нацией.
Реакцию агглютинации (прямую или непря-
мую, с применением теста Кумбса или без) ши-
роко используют в клинической практике. В до-
бавление к уже приведенным примерам упомя-
нем типирование эритроцитов в банках крови,
диагностику различных иммуноопосредованных
гемолитических заболеваний (таких как лекар-
ственно-индуцированная аутогемолитическая ане-
мия), тест на обнаружение ревматоидного факто-
ра (человеческий IgM к анти-IgG человека), диа-
гностические тесты при сифилисе и латекс-тест
для обнаружения беременности. Последний на-
правлен на обнаружение хорионического гонадо-
тропина человека в моче беременной женщины.
Реакции преципитации
Реакции в растворах
В отличие от реакций агглютинации, которые
происходят между антителами и корпускулярны-
ми антигенами, реакции преципитации развиваются
при смешивании антител и растворимых антиге-
нов. Как и в случае агглютинации, преципитация
комплексов антиген — антитело развивается бла-
годаря тому, что двухвалентные молекулы анти-
тел способны связываться с поливалентными мо-
лекулами антигенов, образуя решетку.
По достижении определенного размера поли-
молекулярный комплекс антиген — антитело пере-
стает быть растворимым и преципитирует из раст-
вора.
На рис. 5.3 приведены количественные харак-
теристики реакции преципитации. При добавле-
нии раствора с повышающейся концентрацией
антигена в несколько пробирок, содержащих раст-
вор антител постоянной концентрации, количе-
ство преципитата изменяется. Масса преципита-
та в каждой из пробирок может быть измерена
разными методами.
При графическом отображении массы преци-
питата относительно количества добавленного
антигена получим кривую преципитации, подоб-
ную представленной на рис. 5.3.
Значимыми являются три зоны под кривой,
показанные на рис. 5.3: 1) избытка антител; 2) эк-
вивалентности; 3) избытка антигенов. В зоне эк-
вивалентности соотношение антигенов и антител
оптимально для максимальной преципитации;
в зонах избытка антител или антигенов соотно-
шение реагентов не приводит к эффективному пе-
рекрестному связыванию и преципитат не фор-
мируется.
Необходимо подчеркнуть, что зоны на кри-
вой преципитации выделены на основании ко-
личества именно преципитировавших комплек-
сов антиген —антитело. Однако зоны избытка
антигенов или антител могут содержать раство-
римые комплексы антиген —антитело; в частно-
сти в зоне избытка антигенов, когда формирует-
ся небольшое количество преципитата, основная
масса комплексов антиген — антитело присут-
ствует в надосадочной жидкости. Таким образом,
количество образовавшегося преципитата зави-
сит от соотношения между реагирующими анти-
генами и антителами. Правильное соотношение
реагентов приводит к образованию максималь-
• Рис. 5.3. Реакция преципитации
ВТОРИЧНЫЕ ВЗАИМОДЕЙСТВИЯ МЕЖДУ АНТИТЕЛАМИ И АНТИГЕНАМИ
85
Aij Aij
Ат,
А
А12 Аг2
Ат
Ат
Б
Ai2 Ai2
/ Ат2
• Рис. 5.4. (А) Диффузия в геле: антитела и один анти-
ген. (Б) Диффузия в геле: антитела и антигены 1, 2, 3
• Рис. 5.5. Варианты двойной диффузии в геле: идентич-
ность (А), различия (Б) и частичная идентичность (Б) ан-
тигенов
ного количества преципитата; избыток антиге-
нов (или антител) приводит к образованию ра-
створимых комплексов.
Реакции преципитации в гелях
Реакции преципитации между растворимыми ан-
тигенами и антителами могут развиваться не только
в растворах, но и на полутвердых средах, таких
как агаровый гель. Когда растворимые антигены и
антитела размешают в ячейки в геле (рис. 5.4, Л),
реагенты начинают диффундировать в него, при-
чем в непосредственной близости от ячейки кон-
центрация вещества наибольшая, а по мере уда-
ления снижается. На некотором расстоянии от
обеих ячеек реагирующие антигены и антитела
встретятся в концентрациях, оптимальных для
формирования преципитата.
Если в ячейке для антител содержится смесь
антител 1, 2 и 3, специфичных для антигенов 1, 2
и 3 соответственно, причем диффузионная спо-
собность антигенов различна (коэффициент диф-
фузии 1 > 2 > 3), то линии преципитации сфор-
мируются в трех различных положениях. Они
формируются благодаря тому, что антитела анти-1,
анти-2 и анти-3 реагируют соответственно с ан-
тигенами 1, 2 и 3 в трех разных зонах эквивален-
тности (рис. 5.4, Б). Различия в скорости диффу-
зии антигенов и антител связаны с различиями в
концентрации, размере молекул или их форме.
Метод двойной диффузии, разработанный
О. Оухтерлони (О. Ouchterlony) (это имя иногда
используют для описания метода вместо термина
«двойная диффузия»), при котором антитело и ан-
тиген диффундируют навстречу друг другу, весь-
ма полезен при определении антигенных взаимо-
действий между различными веществами. Разли-
чают три варианта реакции при диффузии в гель
(рис. 5.5): идентичность, различие антигенов и
частичная идентичность. В случае, когда антиген-
ные свойства молекул совпадают, реакция фор-
мируется по модели идентичности. Пересечение
линий преципитации друг с другом соответствует
модели, в которой антигены различаются между
собой. Наконец, в случае, когда антигены не пол-
ностью идентичны, т.е. содержат эпитопы, со-
ответствующие и не соответствующие антителам,
в геле формируется линия преципитации, похо-
жая на шпору.
Радиальная иммунодиффузия
Тест радиальной иммунодиффузии является вари-
ацией теста двойной диффузии (рис. 5.6). Ячейки
содержат антиген в разных концентрациях, а ан-
титела однородно распределены по агаровому гелю
Таким образом, линия преципитации выглядит как
кольцо преципитации вокруг ячейки. Расстояние,
на которое сдвигается кольцо преципитации от
центра ячейки, прямо пропорционально концен-
трации антигена в ней. Соотношение между кон-
центрацией антигена в ячейке и диаметром коль-
ца преципитации может быть представлено гра-
фически (см. рис. 5.6). Если ячейки, например F
и G, содержат неизвестное количество какого-либо
антигена, его концентрация может быть опреде-
лена путем сравнения диаметров колец преципи-
тации с диаметром кольца, образуемого ячейкой
с известной концентрацией антигена.
Метод радиальной иммунодиффузии использу-
ют в клинике для определения концентраций бел-
ков сыворотки крови. Для этого антитела к раз-
• Рис. 5.6. Радиальная диффузия. Ячейки А, В, С, D и Е
содержат известные концентрации антигена; F и G — не-
известные концентрации, которые могут быть вычислены
с помощью графика
86
ГЛАВА 5. ВЗАИМОДЕЙСТВИЯ АНТИГЕНОВ С АНТИТЕЛАМИ ИММУНОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ...
ным белкам сыворотки крови вводятся в гель:
концентрация конкретного белка определяется
путем сравнения диаметра образовавшегося кольца
преципитации с диаметром кольца, полученного
при использовании исследуемого белка в извест-
ной концентрации.
Иммуноэлектрофорез
Иммуноэлектрофорез представляет собой разде-
ление смеси белков посредством электрического
поля (электрофорез) с последующим определени-
ем этих белков с помощью антител, диффундиру-
щих в геле Этот метод очень удобно применять
при анализе смеси антигенов с помощью раство-
ра, содержащего антитела к антигенам исследуе-
мой смеси. Например, при клинической характе-
ристике белков сыворотки человека небольшая
капля сыворотки пациента помещается в ячейку
в центре полоски, покрытой агаровым гелемт За-
тем сыворотка подвергается электрофорезу, ко-
торый разделяет разные компоненты в соответ-
ствии с их подвижностью в электрическом поде.
После электрофореза вдоль края полоски выреза-
ют желобок, в который помещают антитела к бей-
кам сыворотки человека. Эти антитела диффун-
дируют в агаре, так же как и разделенные белки
сыворотки крови. При оптимальном соотноше-
нии антигена и антител для каждого антигена и
соответствующих ему антител формируется линия
преципитации. В результате появляется картина,
образец которой представлен на рис. 5.7. При срав-
нении распределения и интенсивности линий,
образуемых сывороткой здорового человека и по-
лученных при исследовании образцов сывороток
больных, можно выявлять отсутствие, избыток или
другой тип изменений одного или нескольких
белков сыворотки крови. Действительно, именно
с помощью метода иммуноэлектрофореза в 1952 г.
был впервые идентифицирован синдром дефицита
антител (агаммаглобулинемия Брутона) (см. гл. 17).
Вестерн блот (иммуноблоттинг)
В методике Вестерн блот (иммуноблоттинг) на
первом этапе антиген (или смесь антигенов) раз-
деляется в геле электрофорезом. Затем разделен-
ный материал переносится (блоттинг) на листы,
способные связывать белок (например, из нитро-
целлюлозы). Далее на лист нитроцеллюлозы на-
носятся антитела, которые связываются со спе-
Альбумин Зрансферин IgM IgA IgG
• Рис. 5.7. Иммуноэлектрофорез белков сыворотки крови
о о
° ° ®
® ® «
о о S
s s 2
О
С С й Выявленные белки ВИЧ:
160 кДа Белки оболочки (env)
120 кДаП
,, _ — — Обратная транскриптаза (+РНКаза)
66 кДа _
Предшественник внутреннего сог-белка
Обратная транскриптаза
55 кДа •* Трансмембранный белок
51 кДа
41 кДа , ' Интеграза
31 кДа щ Главный внутренний сог-белок
24 кДа
17кДа -
Внутренний сог-белок
• Рис. 5.8. Результаты иммуноблотинга сывороток двух
ВИЧ-инфицированных и одного здорового человека
цифичными для них антигенами. Антитела метят,
например, радиоактивными изотопами Если нуж-
но выявить локализацию комплекса антитела с
антигеном, к которому присоединилось первое
антитело, используют меченые антитела к имму-
ноглобулинам. Эта методика, называемая Вестерн
блот, широко используется в исследовательских
и клинических лабораториях для определения и
характеристики антигенов. В частности, иммуно-
блоттинг используется для подтверждения диаг-
ноза ВИЧ-инфекции. Сыворотки пациентов по-
мещаются на лист нитроцеллюлозы, на котором
закреплены антигены ВИЧ. Обнаружение специ-
фичных антител является строгим доказательством
инфицирования вирусом (рис. 5.8).
• ИММУНОЛОГИЧЕСКИЕ
ИССЛЕДОВАНИЯ
Иммунологические исследования
с прямым связыванием
Радиологическое иммунное исследование (radio-
immunoassay — RIA) основано на применении мо-
лекул, имеющих изотопную метку, что позволяет
измерять крайне малые количества антигена, ан-
тител или комплексов антиген — антитело. Кон-
центрация меченых молекул определяется при из-
мерении радиоактивности, что точнее, чем хими-
ИММУНОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ
87
ческий анализ. Этот прием повышает чувствитель-
ность определения на несколько порядков. За раз-
работку этого высокочувствительного аналитиче-
ского метода, который в настоящее время широ-
ко применяется при исследовании гормонов, а так-
же других вешеств, встречающихся в биологиче-
ских жидкостях в очень низких концентрациях,
Р. Ялоу (R.Yalow) получила Нобелевскую премию.
Принцип радиоиммунного исследования по-
казан на рис. 5.9. Известное количество радиоак-
тивно меченного антигена реагирует с ограничен-
ным количеством антител. После этого в раство-
ре образуются антитела, связавшиеся с радиоак-
тивно меченным антигеном, а также находится
немного несвязанного меченого антигена. После
разделения свободных антигенов и антигенов,
связанных с антителами, определяют количество
радиоактивных меток, связавшихся с антителами.
Далее проводят ту же процедуру, в которой неиз-
менное количество меченого антигена смешива-
ется с немеченым (рис. 5.10). Смесь реагирует с
тем же количеством антител, как и ранее, затем
комплексы антиген — антитело отделяются от сво-
бодных антигенов. Немеченый антиген конкури-
рует с меченым за антитела; в результате с анти-
телами связывается меньше меток, чем это было
в отсутствие немеченого антигена. Чем больше
немеченого антигена присутствует в реакционной
смеси, тем меньше отношение связанного с ан-
тителами радиоактивно меченного антигена к сво-
бодному радиоактивно меченному антигену. Это
отношение может быть представлено графически
как функция концентрации немеченого антигена,
использованного для конкуренции за антитела.
Для определения неизвестной концентрации
антигена в растворе образец этого раствора сме-
шивается с заранее определенными количества-
ми меченого антигена и антител. Соотношение
уровней связанной с антителами и свободной ра-
диоактивности сравнивается с уровнем радиоак-
тивности, определяемым в отсутствие немечено-
го антигена (последнее значение принимается
равным 100%).
Важным шагом при проведении RIA, как упо-
миналось ранее, является отделение свободного
антигена от антигена, образовавшего комплекс с
Антиген Антитела Отделение Связанная
(9 единиц) (недостаток) метки, не свя- метка
занной с анти- (6 единиц)
телами, от свя-
занной
Три
единицы
несвя-
занной
метки
• Рис. 5.9. Количество метки, связанной антителами, пос-
ле инкубации с константным количеством антител и мече-
ного антигена
антителом. В зависимости от конкретного антиге-
на это разделение может быть достигнуто разны-
ми методами, основным из которых является ис-
пользование антииммуноглобулинов. Процедура
основана на том, что антиген (меченый или не-
меченый), связанный с антителом, будет преци-
питировать после добавления антител против им-
муноглобулинов, поэтому в надосадочной жидко-
сти останется только несвязанный антиген. Обыч-
но при проведении радиоиммунных исследований
используются кроличьи антитела к изучаемым
антигенам. Эти комплексы кроличьих антител с
антигенами могут преципитировать при добавле-
нии антител козы, направленных против кроли-
чьих иммуноглобулинов.
Поскольку количества антигенов и антител,
необходимые для проведения радиоиммунного
исследования, крайне малы, комплексы антиген-
антитело, реагирующие с антииммуноглобулино-
выми антителами, будут образовывать лишь едва
заметные преципитаты. Обычными методами
сложно, если не невозможно, выделить их коли-
чественно для измерения радиоактивности. Для
преодоления этой проблемы обычно добавляют-
ся иммуноглобулины, неспецифичные к антиге-
ну реакционной смеси; общее количество имму-
ноглобулинов при этом значительно увеличива-
ется до уровня, при котором антитела к иммуно-
глобулинам легко образуют преципитаты без по-
тери количества вещества. Эти преципитаты в
основном состоят из неспецифических иммуно-
глобулинов, с которыми не связан радиоактив-
Меченый антиген
(в той же концентра-
ции, что и на рис. 5 .9)
и немеченый
антиген (9 единиц)
Антитела
(в той же
концентрации,
что и на рис. 5. 9)
Отделение метки,
не связанной
с антителами,
от связанной
Связанная
метка
(3 единицы)
Шесть единиц
несвязанной
метки
(и 6 единиц
несвязанного
немеченого
антигена)
• Рис. 5.10. Радиоиммунное исследование, основанное на конкуренции за анти-
тела между мечеными и немечеными антигенами
88
ГЛАВА 5. ВЗАИМОДЕЙСТВИЯ АНТИГЕНОВ С АНТИТЕЛАМИ. ИММУНОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ...
Антиген
Покрытая антигеном
пластиковая ячейка
Блокирующий
белок
Блокирование незанятых участков
планшета инертным белком
Антитело, меченное
ферментом
• Рис. 5.11. Иммуноферментный анализ с использованием ячеек, покрытых антигеном
ный антиген. Однако в них содержится также край-
не малое количество специфичных антител из
реакционной смеси и каждая связавшаяся с ан-
тителами молекула радиоактивного антигена.
Альтернативный подход к отделению комплек-
сов антиген — антитело от свободного антигена
основан на том, что иммуноглобулины становят-
ся нерастворимыми и осаждаются, если раствор
содержит 33 % насыщенного сульфата аммония.
Поскольку антиген не преципитирует в этих усло-
виях, добавление сульфата аммония приводит к
преципитации комплексов антиген —антитело,
оставляя свободный антиген в растворе. Еще раз
отметим, что количество антител, реагирующее со
специфичным антигеном, очень мало, поэтому не-
обходимо добавлять достаточное количество не-
специфичных антител к реакционной смеси; при
достижении 33 % насыщения сульфатом аммония
из раствора будут осаждены заметные преципи-
таты, что позволит отделить свободный антиген
от связавшегося с антителами.
Твердофазные иммунологические
исследования
Твердофазные иммунологические исследования
являются одними из наиболее широко использу-
емых иммунологических методов. Сейчас они ав-
томатизированы и широко используются в кли-
нической медицине для определения как антиге-
нов, так и антител. Хорошим примером исполь-
зования твердофазного иммунологического ис-
следования является определение антител к ВИЧ
(см. гл. 17).
В твердофазных исследованиях используются
различные виды пластика (например, поливинил
или полистирен), способные сорбировать моно-
молекулярный слой белка на своей поверхности
Хотя адсорбированные молекулы могут терять
некоторые антигенные детерминанты, большин-
ство эпитопов остаются неповрежденными и мо-
гут по-прежнему реагировать с соответствующи-
ми антителами. Наличие антител, связавшихся с
антигеном, сорбированным на пластике, может
быть определено с помощью антииммуноглобу-
линов, меченных либо радиоактивной меткой,
либо ферментом (рис. 5.11). Если в тесте исполь-
зуются антииммуноглобулины, меченные фермен-
том, которые могут быть определены по появле-
нию окрашивания при добавлении субстрата, та-
кой тест называется ферментным иммуносор -
бентным анализом (Enzime-Like ImmunoSorbent
Assay — ELISA).
Важно отметить, что после покрытия планше-
та антигеном поверхность, оставшуюся свободной,
необходимо защитить, чтобы предотвратить аб-
сорбцию на нее других реагентов, особенно мече-
ных. Для этого после добавления антигена поверх-
ность планшета покрывают инертным белком,
таким как желатин, в высокой концентрации.
Иммунные анализы на твердой фазе могут быть
использованы для выявления антител к антиге-
нам, которые покрывают планшет. Поскольку
пластиковые ячейки обычно покрыты сравнитель-
но большим количеством антигена, то, следова-
тельно, чем больше концентрация антител, свя-
завшихся с антигеном, тем большее количество
меченого антииммуноглобулина потребуется для
связывания антител. Таким образом, всегда важ-
но использовать его избыток для обеспечения
достаточного насыщения.
Иммунный анализ на твердой фазе может быть
использован для количественного и качественно-
го определения антигенов. Для этого исследуе-
мую антисыворотку смешивают с разными извест-
ными количествами антигенов, после чего добав-
ляют антисыворотку в ячейки, покрытые антиге-
МЕТОДЫ СОРТИРОВКИ КЛЕТОК, МЕЧЕННЫХ ФЛУОРОХРОМАМИ
89
ном. Такая предварительная процедура приводит
к связыванию антител с растворимым антигеном
и снижает способность свободных антител свя-
зываться с антигеном, покрывающим планшет.
Чем выше концентрация растворимого антигена,
который реагирует с антителами до их добавле-
ния в ячейки, тем меньшее количество антител
свяжется с антигеном на планшете и тем мень-
шее количество меченых антииммуноглобулинов
сможет связаться с этими антителами.
Уменьшение количества связанной метки за-
висит от концентрации антигенов, используемых
для этого уменьшения, что можно отобразить гра-
фически Количество антигена в неизвестном
растворе может быть определено по диаграмме
путем сравнения уменьшения связанной метки,
вызванного неизвестным раствором, с уменьше-
нием, вызванным известной концентрацией чи-
стого антигена.
в ИММУНОФЛУОРЕСЦЕНЦИЯ
Флуоресцентное вещество обладает свойством
испускать свет определенной длины волны при
активации под воздействием света с более корот-
кой длиной волны. Иммунофлуоресценция — это
метод, позволяющий выявить локализацию анти-
генов с использованием меченных флуоресцином
антител. В методе, первоначально описанном
Р. Кумбсом, используют антитела, с которыми
ковалентно связываются флуоресцентные группы,
не вызывающие каких-либо существенных изме-
нений активности антител.
Одно из широко используемых в иммуноло-
гии флуоресцентных веществ — флуоресцинизо-
тиоцианат — под влиянием ультрафиолета флуо-
ресцирует видимым зеленоватым цветом. Он лег-
ко соединяется со свободными аминогруппами.
Другое широко используемое флуоресцентное ве-
щество — фикоэритрин, флуоресцирующий крас-
ным, также легко связывается свободными ами-
ногруппами. Флуоресцентные микроскопы, осна-
щенные источниками ультрафиолетового света,
позволяют визуализировать флуоресцирующие
вещества в микрокопируемых образцах. Флуорес-
центные антитела широко используются для ло-
кализации антигенов в разных тканях и микро-
организмах.
Существуют два важных связанных между со-
бой метода, в которых используют флуоресцент-
ные антитела: прямой и непрямой иммунофлуо-
ресценции.
Прямая иммунофлуоресценция
Прямая иммунофлуоресценция используется для
прямого определения антигена. Для этого иссле-
дуемая ткань (или микроорганизмы) обрабатыва-
ется меченными флуоресцином антигенспецифич-
ными антителами Этот метод широко использу-
ется в клинике для идентификации субпопуля-
ций лимфоцитов и выявления специфических бел-
ковых депозитов в определенных тканях, таких
как почки и кожа, например при системной крас-
ной волчанке (СКВ) (см. гл. 12).
Непрямая иммунофлуоресценция
При непрямой иммунофлуоресценции вначале
мишень реагирует со специфическими антитела-
ми, не имеющими меток. После этой процедуры
проводят обработку антииммуноглобулином, ме-
ченным флуоресцином.
Метод непрямой иммунофлуоресценции ис-
пользуется шире, чем прямой, поскольку один тип
меченных флуоресцином антииммуноглобулино-
вых антител можно использовать для выявления
антител разной специфичности. Более того, по-
скольку антииммуноглобулины содержат антите-
ла ко многим эпитопам специфического иммуно-
глобулина, то применение флуоресцентных им-
муноглобулинов значительно усиливает флуорес-
центный сигнал. Прекрасным примером исполь-
зования метода непрямой иммунофлуоресценции
является скрининг сывороток пациентов для об-
наружения антител к ДНК при СКВ.
* МЕТОДЫ СОРТИРОВКИ КЛЕТОК,
МЕЧЕННЫХ ФЛУОРОХРОМАМИ
Недавно был разработан очень эффективный ме-
тод с применением флуоресцентных антител, спе-
цифичных к антигенам клеточной поверхности.
Это метод сортировки клеток по активированной
флуоресцентной метке (Fluorescence-Activated Cell
Sorter — FACS). Суспензия клеток, меченных спе-
цифическими флуоресцентными антителами, про-
пускается через устройство, формирующее поток
маленьких капелек, каждая из которых содержит
одну клетку. Эти капельки пропускаются между
лазерным лучом ультрафиолетового спектра и де-
тектором, подсчитывающим эмиссию флуоресци-
нов, если в капельке присутствует меченая клет-
ка. Испущенный сигнал передается на электрод,
который заряжает капельки, что приводит к их
отклонению в электромагнитном поле (рис. 5.12).
Таким образом, после прохождения лазерного луча
капельки подсчитываются и могут быть разделе-
ны (например, немеченые от меченых) согласно
тому, испускают ли они световой сигнал. Интен-
сивность флуоресцентного окрашивания, которая
отражает плотность экспрессированных на каж-
дой клетке антигенов, может быть определена с
помощью сложной электроники.
Данные приборы в настоящее время позволя-
ют быстро выявлять профиль пула лимфоцитов
на основании разной экспрессии ими молекул
90
ГЛАВА 5 ВЗАИМОДЕЙСТВИЯ АНТИГЕНОВ С АНТИТЕЛАМИ ИММУНОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ...
• Рис. 5.12. Анализ FACS
клеточной поверхности, относительное количе-
ство молекул клеточной поверхности, экспрес-
сируемых на каждой клетке, а также долю и чис-
ленность каждого типа клеток. Также можно ис-
пользовать этот прибор для разделения (сорти-
ровки) собранных клеток, окрашенных пятью или
более флуоресцинами, что позволяет получить в
высокой степени однородную популяцию клеток
определенного типа. В одном из вариантов этого
метода для разделения клеточных популяций ис-
пользуются флуоресцентные антитела, соединен-
ные с магнитными гранулами. Клетки, связанные
с флуоресцентными антителами, могут быть от-
делены от неокрашенных с помощью магнита. Оба
метода (FACS и метод разделения магнитными
частицами) эффективны при выделении очень
редко встречающихся клеток, таких как стволо-
вые гемопоэтические клетки.
Наиболее распространенный метод фенотипи-
рования и сортировки клеток основан на исполь-
зовании антител, которые реагируют с белками
клеточной поверхности, идентифицируемыми как
антигены кластеров дифференцировки (ciasters of
differentiation — CD). Номенклатура CD была раз-
работана при исследовании моноклональных ан-
тител (они обсуждаются далее) к клеткам, оха-
рактеризованным фенотипически. Было обнару-
жено, что поверхностные маркеры (CD-антиге-
ны) связаны с разными стадиями развития клет-
ки. Более того, эти белки выполняют важные био-
логические функции, необходимые для нормаль-
ного функционирования клетки. Стадии разви-
тия В- и Т-клеток и их функциональные подти-
пы сейчас могут быть фенотипированы на осно-
вании экспрессии ими CD-маркеров. Однако сто-
ит отметить, что поверхностная экспрессия кон-
кретной молекулы не всегда специфична только
для одного типа клеток или даже их семейства.
Тем не менее, экспрессию на поверхности клеток
можно использовать для выделения чистых попу-
ляций или характеристики клеток. На практике
после аббревиатуры CD всегда указывается опре-
деленная арабская цифра, которой обозначается
специфичный белок клеточной поверхности. Но-
мера CD присваиваются Номенклатурным коми-
тетом международного союза иммунологических
наук (Nomenclature Commitee of the International
Union of Immunologic Sciences). Список некото-
рых наиболее важных CD-антигенов, экспресси-
руемых В-клетками, различными субпопуляция-
ми Т-клеток и другими клетками, можно найти в
приложении
ИССЛЕДОВАНИЯ С ИСПОЛЬЗОВАНИЕМ КЛЕТОК
91
♦ ИММУНОАБСОРБЦИЯ
И ИММУНОАДСОРБЦИЯ
Специфическое связывание антигена с антителом
позволяет связать или селективно удалить из жид-
кой смеси антигены тех специфичностей, к кото-
рым направлены антитела. Подобным же обра-
зом, используя специфичный антиген, из смеси
антител можно выделить или селективно удалить
антигенспецифичные антитела.
Есть два основных метода, позволяющих осу-
ществить такое удаление. При использовании пер-
вого метода абсорбция проводится обоими реаген-
тами в растворе (иммуноабсорбция), а при другом
один из реагентов закреплен на нерастворимой
подложке (иммуноадсорбция). Иммуноадсорбпия
имеет преимущества, потому что адсорбированный
материал может быть восстановлен путем тщатель-
ной обработки, которая разрушает комплексы ан-
тиген-антитело. Такой обработкой может быть
снижение pH (добавление гидрохлорида глицина
или уксусной кислоты снижает pH до 2 — 3) или
добавление хаотропных ионов. Это позволяет эф-
фективно очистить антигены или антитела, кото-
рые представляют интерес для исследователя.
• ИССЛЕДОВАНИЯ
С ИСПОЛЬЗОВАНИЕМ КЛЕТОК
В данной главе также описаны иммунологические
исследования, используемые для обнаружения и
изучения клеточных компонентов иммунной си-
стемы. Среди них есть методы, позволяющие оп-
ределять функциональную активность лимфоци-
тов. Методики, измеряющие ответ В-клеток на
антигенную или митогенную стимуляцию, иног-
да используются в клинике для исследования со-
стоятельности гуморального иммунитета. В усло-
виях эксперимента эти исследования помогают
понимать регуляторные и молекулярные механиз-
мы, связанные с активацией В-клеток. Аналогич-
но, методы исследования функциональной актив-
ности Т-клеток используются и в клинике, и в
эксперименте. Они направлены на измерение
пролиферативного и эффекторного ответа и оп-
ределение цитокинового профиля Т-клеток. Ис-
следования Т-лимфоцитов значительно повлия-
ли на понимание функциональной гетерогеннос-
ти Т-клеток, а также на идентификацию многих
цитокинов, производимых клетками, принадле-
жащими к конкретной субпопуляции.
Методы для оценки функций
лимфоцитов
Исследования, применяемые для оценки функ-
ций лимфоцитов, в основном проводятся для того,
чтобы ответить на один из следующих вопросов:
1) нормально ли отвечают Т- или В-клетки на
митогенные стимулы, которые активируют клет-
ки к развитию пролиферативного ответа? 2) вы-
зывает ли митогенная или антигенопосредован-
ная стимуляция продукцию антител (у В-клеток)
или цитокинов (у Т-клеток)? Кроме того, учиты-
вая функциональную неоднородность Т-клеток,
тесты с Т-лимфоцитами могут быть использова-
ны для оценки функциональной интеграции от-
дельных субпопуляций. Это особенно важно при
клиническом обследовании больных с вероятными
иммунодефицитными заболеваниями (см. гл. 17).
В случае определения функциональных характе-
ристик Т-хелперов основным параметром явля-
ется изменение состояния клеток-мишеней, по-
лучающих помощь от Т-лимфоцитов. Например,
при использовании в качестве мишеней В-лим-
фоцитов исследование будет направлено на оценку
способности Т-лимфоцитов усиливать индуциру-
емый синтез антител. В тесте, указанном в этом
примере, будет определяться уровень продукции
антител. Подобно этому при изучении возмож-
ности Т-лимфоцитов поддерживать оптимальную
активацию макрофагов измеряемыми параметра-
ми будут функциональные свойства фагоцитиру-
ющих клеток. Важно отметить, что многие иссле-
дования, используемые для оценки функции кле-
ток Т-хелперов, основаны на измерении специ-
фичных цитокинов, поскольку клетки, которые
получают помощь, могут активироваться и само-
стоятельно производить цитокины.
Исследования пролиферации
Т- и В-клеток
Активация лимфоцитов, стимулированных мито-
генами, запускает биохимические сигнальные кас-
кады, которые приводят к экспрессии генов, син-
тезу белков, пролиферации клеток и дифферен-
цировке. Пролиферативный ответ, вызываемый
действием митогена, поликлонален по своей при-
роде. Есть митогены, избирательно стимулирую-
щие либо В-, либо Т-клеточные популяции. Вот
почему в отличие от иммуногенов, которые акти-
вируют только те лимфоцитарные клоны, кото-
рые несут соответствующие антигенные рецепто-
ры, поликлональные активаторы стимулируют
множество Т- и В-лимфоцитарных клонов неза-
висимо от их антигенной специфичности. Мито-
гены, которые избирательно активируют В-клет-
ки, такие как липополисахаридный (Л ПС) компо-
нент клеточной стенки грамотрипательных бак-
терий, вызывают поликлональную стимуляцию
В-клеток мышей. Интенсивность пролиферации
клеток в ответ на митогенную стимуляцию может
быть измерена при добавлении в культуральную
среду радиоактивно меченных нуклеозидов (на-
пример, тимидина, меченного тритием) и после-
дующего определения количества встроенных
92
ГЛАВА 5 ВЗАИМОДЕЙСТВИЯ АНТИГЕНОВ С АНТИТЕЛАМИ. ИММУНОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ...
молекул в ДНК делящихся клеток, для чего ис-
пользуется жидкостный сцинтилляционный счет-
чик. Подобно этому некоторые белки, связываю-
щие сахара, называемые лектинами, в том числе
конконавалин А (Кон А) и фитогемагглютинин
(ФГА), являются эффективными Т-клеточными
митогенами. Митоген лаконоса (поквид) (МЛ) —
другой пример лектина с выраженными митоген-
ными свойствами. Однако в отличие от Кон А и
ФГА он стимулирует поликлональную активацию
как В-, так и Т-клеток.
Продукция антител В-клетками
Митогенная стимуляция В- и Т-клеток приводит
к пролиферации и дифференцировке множества
клеточных клонов. Поэтому в случае с В-клетка-
ми поликлональные активаторы Л ПС или МЛ
могут быть использованы для изучения способ-
ности популяции В-клеток продуцировать анти-
тела. Для количественного определения уровня
антител чаще всего используется иммунофермент-
ный анализ (ELISA). При другом методическом
подходе {ELISPOT) В-клетки могут быть прости-
мулированы митогенами или специфичными ан-
тигенами. а затем определенное время культиви-
роваться in vitro в камерах непосредственно на
нитроцеллюлозных мембранах. Способность нит-
роцеллюлозы связывать белок облегчает захват
секретируемых антител от каждой отдельной В-клет-
ки. Это приводит к образованию дискретных уча-
стков (фокусов), в которых антитела связались
с нитроцеллюлозой. Для обнаружения этих анти-
тел используют вторичные меченные фермента-
ми антитела, специфичные к связанным с план-
шетом антителам, что позволяет точно вычислить
количество клеток, секретирующих антитела.
Исследования эффекторных Т-клеток
и натуральных киллеров
Как упоминалось ранее, выбор типа эффекторных
клеток, которые будут использоваться в тесте, за-
висит от вопросов, на которые необходимо найти
ответ. Исследования Т-клеток настолько же раз-
нообразны, насколько отличаются функции извест-
ных субпопуляций. Так, были разработаны различ-
ные методы измерения клеточной функции
Т-хелперов, в том числе направленные на изуче-
ние хелперной активности в отношении актива-
ции В-клеток и макрофагов. Существуют также
тесты, измеряющие другие типы хелперной актив-
ности СВ4+-Т-клеток. Кроме того, доступны и не-
сколько видов исследований цитотоксической ак-
тивности СВ8+-Т-клеток. В одном из таких тестов
{цитотоксический тест) измеряется способность
цитотоксических Т-клеток или натуральных кил-
леров (NK-клеток) разрушать радиоактивно мечен-
ные клетки-мишени, экспрессирующие антиген,
к которому чувствительны цититоксические Т-клет-
ки. В сходном исследовании NK-клетки культи-
вируются с радиоактивно меченными клетками-
мишенями, с которыми связались антитела, спе-
цифичные для клеток-мишеней. Обоснованием для
этого подхода послужил тот факт, что NK-клетки
экспрессируют на мембране Ёс-рецептор для свя-
зывания с Fc-фрагментами некоторых изотипов им-
муноглобулинов. Этот метод измеряет важное функ-
циональное свойство NK-клеток, известное как ан-
тителозависимая клеточно-опосредованная цито-
токсичность (АЗКЦ).
КЛЕТОЧНЫЕ КУЛЬТУРЫ
Появление некоторых экспериментальных систем
дало возможность найти ответы на мириады во-
просов, связанных с развитием иммунной си-
стемы, ее функциональными и регуляторными
свойствами, а также патологическими механиз-
мами, связанными с иммунодефицитами и ауто-
иммунными заболеваниями. Большинство этих эк-
спериментальных систем зависят от методики
культивирования клеток, используемой для под-
держания жизнедеятельности клеток in vitro. Бла-
годаря системам культивирования клеток было со-
вершено несколько серьезных научных прорывов,
в том числе и разработка в 1970-х гг. Ц. Милыитей-
ном (С. Milstein) и Г. Кёлером (Н. Kohler) В-кле-
точной гибридомной технологии для получения мо-
ноклональных антител. Определение факторов ро-
ста, необходимых для поддержания лимфоцитов,
сделали возможными клонирование и выращива-
ние функционально компетентных клеток in vitro.
Более того, методики с использованием реком-
бинантной ДНК позволили переносить заданные
гены в клонируемые клеточные линии, таким об-
разом позволяя исследователям отвечать на мно-
гие вопросы, связанные с ними. Методики с ис-
пользованием рекомбинантной ДНК также сде-
лали возможной разработку иммунных молекул и
рецепторов, создаваемых методами генной инже-
нерии, которые могут быть перенесены в клетки
и использованы для выявления биологических по-
следствий экспрессии рецепторов и активации ре-
цепторов (например, при захвате лигандов). Эти
лабораторные техники продолжают использовать-
ся для углубления знаний об иммунной системе
и, в некоторых случаях, для разработки новых био-
логических препаратов и вакцин для клинического
использования.
Первичные культуры клеток
и клонируемые клеточные линии
лимфоцитов
Как и во многих других областях биологической
науки, системы культивирования клеток служат
необходимым исследовательским инструментом
КЛЕТОЧНЫЕ КУЛЬТУРЫ
93
для понимания многих физиологических свойств
клеток, связанных с их созреванием. Способность
культивировать первичные лимфоидные клетки,
состоящие из различных популяций Т- и/или
В-клеток (хотя бы в течение ограниченного пе-
риода времени), позволила иммунологам изучить
биохимические и молекулярные механизмы, кон-
тролирующие многие важные биологические функ-
ции В- и Т-клеток, в том числе генные реаранжи-
ровки. В течение нескольких последних десяти-
летий системы культивирования клеток значитель-
но улучшились, что привело к развитию техноло-
гий клонирования клеток. Для образования кло-
нированной иммортализованной (бессмертной)
клеточной линии необходима трансформация В-
или Т-клеток, происходящих из общей специфи-
ческой родительской клетки, которая достигается
различными методами, в том числе воздействием
на клетки некоторых канцерогенов и вирусов (на-
пример, вирус Эпштейна — Барр для трансформа-
ции В-клеток; вирус Т-клеточного лейкоза чело-
века первого типа для трансформации Т-клеток).
Необходимо отметить, что многие клеточные ли-
нии получены из опухолей, возникших как спон-
танно, так и экспериментально (как результат
назначения канцерогенов или вирусной инфек-
ции). Основное преимущество использования
клонированных клеточных линий состоит в том.
что для исследования доступно огромное число
клеток. Недостатком использования клеток, по-
лученных в результате канцерогенной или вирус-
ной трансформации, является то, что они по оп-
ределению аномальны. Действительно, у многих
трансформированных клеток отмечается аномаль-
ное число хромосом и они часто имеют феноти-
пические и функциональные свойства, не харак-
терные для нормальных клеток.
Существенный прогресс в получении клониро-
ванных лимфоцитов наблюдался в конце 1970-х гг.,
когда выяснилось, что нетрансформированные
клеточные линии и клоны антигенспецифичных
Т-клеток могут расти длительное время в случае,
если в культуру добавлен фактор роста Т-лимфо-
цитов (IL-2), а также присутствует источник ан-
тигена и АПК. У этого подхода было несколько
преимуществ по сравнению с использованием
трансформированных клеток, поскольку клетки
из такой культуры были со всех точек зрения нор-
мальными. Таким образом, стало возможным по-
лучать большие количества нетрансформирован-
ных антигенспецифичных Т-клеток для исследо-
ваний. Действительно, многие из этих клониро-
ванных Т-клеточных линий использовались для
идентификации и биохимической характеристи-
ки цитокинов, что в итоге привело к клонирова-
нию генов, кодирующих эти белки.
Совместное использование систем клонирова-
ния клеток, методов переноса генов и моделей на
животных помогло понять, как развивается ауто-
толерантность лимфоцитов, а также то, как им
удается ускользать от механизмов, индуцирующих
толерантность, и становиться аутореактивными
клетками, иницирующими заболевания. Системы
культивирования клеток открыли для исследова-
телей возможность изучать физиологические и
патофизиологические свойства лимфоцитов. Как
будет обсуждаться далее, системы культивирова-
ния клеток также продуктивно использовались при
разработке многих диагностических и лекарствен-
ных средств, таких как моноклональные антитела
В-клеточные гибриды
и моноклональные антитела
Специфичность иммунного ответа служит осно-
вой серологических реакций, в которых специ-
фичность антител используется для количествен-
ного и качественного определения антигена Од-
нако распознающая способность сывороточных
антител не безгранична, поскольку иммунизация
нативным антигеном (который обычно состоит из
многих эпитопов) приводит к образованию анти-
сыворотки, содержащей смесь антител, обладаю-
щих различной специфичностью и направленных
ко всем эпитопам антигена. Более того, даже ан-
титела к одному эпитопу обычно представлены
смесью иммуноглобулинов с разной степенью
специфичности и поэтому разной аффинностью
к антигенной детерминанте. Иммунизация анти-
геном стимулирует различные популяции анти-
телообразующих В-лимфоцитов. Эти клетки мо-
гут культивироваться недолгое время (порядка
нескольких дней), поэтому практически невоз-
можно вырастить нормальные клетки и получить
клоны, которые производят антитела только од-
ной специфичности. Решающий скачок в техноло-
гии получения антител, обладающих высокой рас-
познающей способностью, произошел в 1970-х гг.
и связан с разработкой метода производства мо-
ноклональных антител. Метод разработали Г. Кё-
лер и Ц. Милыитейн, которые получили за это от-
крытие Нобелевскую премию. Моноклональные
антитела представляют собой гомогенные попу-
ляции молекул антител, полученные от одной ан-
тителопродуцирующей клетки. В таких популя-
циях все антитела идентичны и обладают одина-
ковой специфичностью к данному эпитопу.
В данной методике используются трансформи-
рованные плазматические клетки (иммортализо-
ванные культивируемые линии), которые не про-
дуцируют иммуноглобулины. Эти клетки метода-
ми генной инженерии видоизменяют таким об-
разом, что они не теряют способность произво-
дить фермент — гипоксантингуанинфосфорибо-
зилтрансферазу (ГГФРТ) — и поэтому не могут
выживать в культуре, если этот фермент не будет
добавлен в среду, на которой выращиваются клет-
ки. Модифицированные плазматические клетки
гибридизуют с В-клетками, выделенными у мы-
шей, недавно иммунизированных антигеном (на-
пример, клетками из селезенки) (рис. 5.13). Про-
94
ГЛАВА 5. ВЗАИМОДЕЙСТВИЯ АНТИГЕНОВ С АНТИТЕЛАМИ. ИММУНОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ...
Мышь, иммунизированная
антигеном X
Миеломные клетки мыши
ГГФРТ +, Ig+, в том
числе анти-Х-
клетки из селезенки
Смерть
клеток
ГГФРТ ,1g
Сплавление
Смерть
«Бессмертные» клеток
гибридные клетки,
ГГФРТ+, Ig+,
отобранные на среде,
содержащей
гипоксантин
Скрининг на анти-Х
и клонирование
клеток, производящих
такие антитела
Клон 1
Клон 2
Клон 3
Моноклональные антитела
к антигену X
• Рис. 5.13. Получение моноклональных антител
цедура гибридизации часто выполняется с исполь-
зованием полиэтиленгликоля (ПЭГ). После гиб-
ридизации клетки выращивают в среде, не содер-
жащей ГГФРТ. Поскольку антителопродуцирую-
щие В-клетки синтезируют ГГФРТ, гибридные
клетки (гибридомы), состоящие из иммортали-
зованных плазматических клеток, сплавленных с
В-лимфоцитами, выживают в среде, не обогащен-
ной ГГФРТ. В отличие от гибридных клеток
ГГФРТ-негативные плазматические клетки и
В-лимфоциты, не образовавшие гибридому, гиб-
нут течение нескольких дней. Оставшиеся гибри-
домы, синтезирующие специфичные антитела,
сортируют с помощью тестов на антигенную реак-
тивность (например, ELISA), а затем единичные
клетки клонируют и размножают в клеточной
культуре. Каждый клон синтезирует антитела од-
ной специфичности. Эти высокоспецифичные
моноклональные антитела используют в разных
процедурах, начиная от специфических диагно-
стических тестов и заканчивая иммунотерапией
рака (см. гл. 19). При иммунотерапии различные
препараты или токсины конъюгируют с монокло-
нальными антителами, обеспечивающими достав-
ку этих веществ к клеткам опухоли, к которым
эти антитела специфически направлены.
Т-клеточные гибридомы
Важно отметить, что гибридомная технология при-
меняется не только для производства монокло-
нальных иммуноглобулинов. В конце 1970-х гг.
были разработаны также и методы гибридизации
для Т-клеток, при которых сплавлялись линии
злокачественных Т-клеток и незлокачественных
антигенспепифичных Т-лимфоцитов, популяцию
которых получали при иммунизации антигеном.
Т-клеточные гибридомы оказались очень полез-
ным инструментом при изучении взаимоотноше-
ний Т-клеток одной специфичности с соответству-
ющим им эпитопом.
ЭКСПЕРИМЕНТАЛЬНЫЕ МОДЕЛИ НА ЖИВОТНЫХ
95
Молекулы и рецепторы, полученные
методами генной инженерии
В настоящее время большинство моноклональных
антител получают из мышиных клеток. Эти мо-
лекулы подходят для диагностики и многих дру-
гих целей. Однако их введение в организм чело-
века вызывает осложнения: у больных будут вы-
рабатываться антитела к мышиным иммуногло-
булинам. Пока попытки разработать технологию
получения человеческих моноклональных анти-
тел в целом были малоэффективными.
Моноклональные человеческие антитела полу-
чают методами генной инженерии, используя не-
сколько подходов. В одном из методов использу-
ют технологию рекомбинантной ДНК для произ-
водства химерных антител мышь —человек. Эти
так называемые гуманизированные антитела со-
стоят из константной области иммуноглобулина
человека и вариабельной области иммуноглобу-
лина мыши. Подобный метод используется и для
создания таких гуманизированных антител, в ко-
торых константная область состоит из иммуно-
глобулина человека, а вариабельная область со-
держит гипервариабельную область мыши и кар-
касную (структурную) область человека. При дру-
гом методическом подходе используют полиме-
разную цепную реакцию (ПЦР), с помощью ко-
торой создают генные библиотеки ДНК тяжелых
и легких цепей, полученных из гибридных или
плазматических клеток. Множество тяжелых и
легких цепей рандомно (случайно) соединяют,
после чего получившиеся Fab-клоны скринируют
для определения среди них антител, обладающих
способностью распознавать исследуемый антиген.
В настоящее время с помощью этой технологии
стало можно создавать миллионы клонов разной
специфичности, быстро скринировать их на за-
данную специфичность, затем разрабатывать не-
обходимые Fab-конструкции, не прибегая к им-
мунизации и избегая трудностей, связанных с про-
изводством моноклональных антител, в особен-
ности человеческих.
Генная инженерия иммунных белков не огра-
ничивается только созданием моноклональных
антител Были клонированы многие гены, коди-
рующие мембранные белки, экспрессируемые в
лимфоидных и нелимфоидных клетках; в некото-
рых случаях они встраивались в клетки, обычно
не экспрессирующие такие рецепторы. Экспрес-
сия некоторых костимулирующих молекул об-
легчает межклеточное взаимодействие (напри-
мер, физический контакт между цитотоксической
Т-клеткой и клеткой-мишенью, который закан-
чивается гибелью последней). Экспрессия в ре-
зультате переноса генов таких костимулирующих
молекул (например, В7.1, по-другому называемый
CD80) на опухолевых клетках существенно уве-
личивает способность Т-клеток распознавать и
уничтожать злокачественные клетки Эксперимен-
тальные стратегии получения вакцин (как разно-
видность иммунотерапии) показали, что иммуни-
зация животных с опухолью их собственными
клетками, в которые in vitro введен ген В7.1, мо-
жет усиливать распознавание и уничтожение ро-
дительских опухолевых клеток Т-лимфоцитами.
Следует отметить, что в моделях на животных
подобная стратегия успешно использовалась в
некоторых случаях при внесении в опухолевые
клетки генов цитокинов. Иммунотерапевтические
подходы, используемые при лечении разных за-
болеваний, обсуждаются в гл. 17—19.
• ЭКСПЕРИМЕНТАЛЬНЫЕ МОДЕЛИ
НА ЖИВОТНЫХ
На животных было разработано несколько важ-
ных моделей (in vivo), обладающих эксперимен-
тальной ценностью и клинической пользой и со-
поставимых с системами in vitro, упоминавшими-
ся ранее. В качестве моделей использовали инб-
редные линии мышей с разными генетическими
профилями; некоторые из них были получены
методами генной инженерии. У животных неко-
торых инбредных линий отмечается врожденная
предрасположенность к развитию определенных
заболеваний (например, рак молочных желез, лей-
коз, аутоиммунные заболевания, тяжелый комби-
нированный иммунодефицит). Кроме того, выве-
дены животные с генетическими нарушениями,
способные экспрессировать некоторые клониро-
ванные чужеродные гены (так называемые транс-
генные мыши), или животные, у которых задан-
ные гены не экспрессируются (мыши с «нокаут-
ными» генами). Такие линии используют для изу-
чения последствий экспрессии определенных
трансгенов или последствий отсутствия экспрес-
сии гена у «нокаутных» мышей. Начнем обсужде-
ние с животных инбредных линий.
Инбредные линии
Множество классических экспериментов в обла-
сти иммунологии были проведены с использова-
нием животных инбредных линий, таких как
мыши, крысы и морские свинки. К образованию
инбредной линии обычно приводит селективное
близкородственное скрещивание потомства на
протяжении более чем 20 поколений. Все члены
инбредной линии животных генетически идентич-
ны. Поэтому их называют сингенными, как и иден-
тичных близнецов. Иммунный ответ инбредной
линии можно изучать без учета вариабельности,
связанной с генетическими различиями между
животными. Как будет обсуждаться в гл. 18, транс-
плантация органов между членами инбредной
линии всегда успешна, поскольку их антигены
главного комплекса гистосовместимости (МНС)
96
ГЛАВА 5. ВЗАИМОДЕЙСТВИЯ АНТИГЕНОВ С АНТИТЕЛАМИ. ИММУНОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ...
идентичны. Действительно, знание законов транс-
плантации и того факта, что МНС является ос-
новным генетическим барьером для транспланта-
ции, пришло в результате экспериментов на инб-
редных линиях. Эксперименты с использованием
инбредных линий привели к идентификации ге-
нов МНС I и II классов, основной функцией ко-
торых является доставка пептидных фрагментов
антигена на поверхность клетки, что позволяет
эпитопам быть распознанными антигенспецифич-
ными Т-лимфоцитами. В последующих главах де-
тально освещена важная роль МНС в развитии
нормального иммунного ответа, созревании Т-кле-
ток, чувствительности к заболеваниям и транс-
плантации органов и тканей.
Адоптивный перенос
и пассивная иммунизация
Защита от многих болезней осуществляется кле-
точно-опосредованным иммунитетом, обеспечи-
ваемым антигенспецифичными Т-клетками, в от-
личие от опосредованного антителами (гумораль-
ного) иммунитета. Различие между этими двумя
ветвями иммунной системы хорошо демонстри-
руется адоптивным (заимствованным) переносом
Т-клеток или пассивным введением антивосыво-
ротки или очищенных антител. Адоптивный пе-
ренос Т-клеток обычно проводится в генетиче-
ски идентичных парах донор — реципиент (на-
пример, внутри инбредной линии) и в результате
приводит к формированию долгосрочного адоп-
тивного иммунитета после первого контакта с ан-
тигеном. Напротив, пассивный перенос сыворот-
ки, которая содержит антитела, может быть осу-
ществлен без учета барьеров МНС и остается эф-
фективным лишь в течение того времени, пока
перенесенные антитела сохраняют активность у
реципиента. Вот почему этот тип переноса назы-
вается пассивной иммунизацией.
Мыши с тяжелым комбинированным
иммунодефицитом
Тяжелый комбинированный иммунодефицит (ТКИД)
является расстройством, при котором нарушается
созревание В- и Т-клеток, что приводит к форми-
рованию у индивидуума недостаточности механиз-
мов лимфоцитарной защиты. Причины возникно-
вения ТКИД у людей обсуждаются в гл. 17. В 1980 г.
была выведена инбредная линия мышей, у кото-
рых спонтанно развилась аутосомно-рецессивная
мутация, приволяшая к ТКИД. Вследствие отсут-
ствия функционирующих Т- и В-клеток у ТКИД-
мышей приживлялись клеточные и тканевые транс-
плантаты от мышей других линий или видов. Таким
ТКИД-мышам могут быть введены человеческие
гемопоэтические стволовые клетки для создания
ТКИД-человеческих химер. У таких химерных мы-
шей развиваются зрелые функциональные Т- и
В-клетки, которые являются потомками введенных
человеческих гемопоэтических стволовых клеток-
предшественников. Эта модель на животных стала
ценным исследовательским инструментом, по-
скольку позволяет иммунологам манипулировать
человеческой иммунной системой in vivo и иссле-
довать развитие разных лимфоидных клеток. Бо-
лее того, ТКИД-человеческих мышей можно ис-
пользовать для тестирования создаваемых вакцин,
включая и те из них, которые помогут защитить
людей от ВИЧ-инфекции.
Тимэктомированные
и бестимусные мыши
Значение тимуса в развитии зрелых Т-клеток мож-
но продемонстрировать на мышах, которые в пе-
риод новорожденное™ перенесли тимэктомию,
облучение, а затем пересадку сингенного костно-
го мозга. У таких мышей не развиваются зрелые
Т-лимфоциты. Также у мышей, гомозиготных по
рецессивной мутации пи/пи, не развиваются зре-
лые Т-клетки, потому что мутация приводит к
фенотипу, характеризующемуся отсутствием тиму-
са и волос (отсюда термин «nude» — голые). В обеих
ситуациях развитие Т-клеток может быть восста-
новлено путем пересадки этим мышам эпители-
альной ткани тимуса. Как и модели с ТКИД-мы-
шами, эти животные модели полезны при изуче-
нии развития Т-лимфоцитов. Также они исполь-
зовались для размножения in vivo линий опухоле-
вых клеток и свежих опухолевых эксплантатов от
животных других линий или вида, для чего необ-
ходимо отсутствие Т-клеток. призванных оттор-
гать подобные чужеродные клетки.
• ТРАНСГЕННЫЕ МЫШИ
И МАНИПУЛЯЦИИ С ГЕНАМИ
Трансгенные мыши
Еще одной важной моделью на животных, актив-
но используемой в иммунологических исследова-
ниях, являются трансгенные мыши. Их получают
путем введения клонированного гена (трансгена)
в оплодотворенную мышиную яйцеклетку. Затем
яйцеклетки вводятся псевдобеременной мыши
(рис. 5.14). Уровень успешности этой методики
относительно невысок, трансген экспрессируют
10 — 30% потомства. Поскольку трансген внедря-
ется как в соматические, так и в половые клетки,
он передается потомству как менделевский при-
знак. Конструируя трансген с заданным промо-
тором, можно контролировать экспрессию генов
Например, некоторые промоторы работают толь-
ко в определенных тканях (в частности, инсули-
новый промотор работает только в поджелудоч-
АНАЛИЗ ЭКСПРЕССИИ ГЕНОВ
97
• Рис. 5.14. Общая методика
получения трансгенных мышей
Усилитель
\
Промотор
Завершающая
последова-
тельность
I
Клонированный «трансген»,
вводимый в пронуклеус
Ген
I Имплантирование псевдобеременной
у мыши обработанных яйцеклеток
Скрининг потомства по экспрессии трансгена
Разводят мышей, экспрессирующих трансген,
для получения трансгенной линии
ной железе). Другие промоторы начинают рабо-
тать в ответ на биохимические сигналы, которые
в некоторых случаях могут быть введены в каче-
стве пищевой добавки (например, металлотиони-
новый промотор начинает работать в ответ на
цинк, который можно добавлять в питьевую воду).
Трансгенные мыши использовались для изучения
генов, которые обычно не экспрессируются in vivo
(например, онкогены). Также с помощью транс-
генов изучалось действие отдельных молекул им-
муноглобулинов, Т-клеточных рецепторов, моле-
кул МНС I и II классов и цитокинов. Были выве-
дены трансгенные мыши, у которых весь мыши-
ный иммуноглобулиновый локус был замещен
генами иммуноглобулинов человека. Такая модель
используется для выработки «человеческих» ан-
тител у мышей. Необходимо отметить, что недо-
статком трансгенного метода является то, что
трансген встраивается в геном случайным обра-
зом. Это ограничение вместе с тем фактом, что
экспрессия трансгена в большом количестве в
разных тканях нефизиологична, обязывает иссле-
дователей очень тщательно интерпретировать ре-
зультаты, полученные на трансгенных мышах.
Мыши с «нокаутными» генами
Иногда интересно определить, как удаление про-
дукта конкретного гена повлияет на иммунную
систему. Используя метод генных манипуляций,
можно заместить нормальный ген мутировавшим
или поврежденным, создав мышь с «нокаутным»
(«выбитым») геном. Таким образом, в отличие от
метода, использующегося для создания трансген-
ных мышей, при данном методе «нокаутные»
мыши экспрессируют трансгены, встраиваемые в
собственные специфические гены, с помощью
процесса, названного гомологичной рекомбинацией.
Гипотетически любой ген, для которого существу-
ет мутировавший или поврежденный трансген,
может быть замещен таким путем. Были выведе-
ны «нокаутные» мыши, у которых отсутствует
экспрессия различных важных генов, в том числе
и тех, что кодируют некоторые цитокины и моле-
кулы МНС. «Нокаутные» мыши использовались
для идентификации участков гена, необходимых
для его нормального функционирования. Для это-
го путем трансгенеза обратно в геном внедряли
различные мутантные генные копии, что приво-
дило (или не приводило) к восстановлению функ-
ционирования гена.
* АНАЛИЗ ЭКСПРЕССИИ ГЕНОВ
Микромассивы в исследовании
экспрессии генов
Микромассивы, или генные чипы, являются мощ-
ными инструментами исследования уровня экс-
прессии тысяч генов одновременно. Микромас-
сив состоит из тысяч фрагментов ДНК (у каждо-
98
ГЛАВА 5. ВЗАИМОДЕЙСТВИЯ АНТИГЕНОВ С АНТИТЕЛАМИ. ИММУНОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ...
го из которых уникальная последовательность),
прикрепленных в определенном порядке к стеклу
или другой поверхности. Эти фрагменты ДНК в
форме комплементарной ДНК (кДНК; прибли-
зительно 500 — 5000 пар оснований) или олиго-
нуклеотидов (20 — 80 пар оснований) могут пред-
ставлять гены из всех частей генома. При этом
можно приготовить специализированные микро-
массивы, которые будут использовать только ДНК
исследуемых генов. В исследовании используется
образец общей информационной РНК (и PH К) —
продукт, получаемый в результате транскрипции
всех активных генов.
Для проведения исследования с микромасси-
вом образец общей и PH К от клетки или ткани
обычно тестируется параллельно с контрольным
образцом, необходимым для сравнения экспрес-
сии генов. Например, могут сравниваться разные
типы клеток или тканей, клетки на разных стади-
ях дифференцировки или опухолевые клетки со
своими нормальными аналогами. Образцы, кото-
рые добавляются к микромассиву, обычно не яв-
ляются иРНК; на матрице общей (тотальной)
иРНК проводят обратную транскрипцию, а обра-
зовавшуюся кДНК затем помечают флуоресцент-
ным материалом (флуорохромом). Флуорохромы
разной окраски используют для маркировки кДНК
из различных источников.
На рис. 5.15 показано, как микромассивы ис-
пользуются для сравнения экспрессии генов в
популяции опухолевых лимфоидных клеток и
нормальных лимфоцитов. Красный флуорохром
был использован в качестве метки эксперимен-
тальных кДНК из опухолевых клеток, а зеленый —
для кДНК, приготовленных из контрольных нор-
мальных аналогов. Меченые кДНК наносили на
чип и оставляли для гибридизации пар основа-
ний с соответствующими фрагментами. К микро-
массиву добавляли кДНК как контрольного об-
разца, так и экспериментального, поэтому они
конкурировали за связывание на поверхности
микромассива. Материал, не образовавший гиб-
ридов, смывали, оставляя участки флуоресценции
там, где произошло совпадение. По окончании
гибридизации микромассив сканировали лазером
для обнаружения красных, зеленых или желтых
пятен. Наибольшие уровни каждого типа кДНК
отражал свой цвет: красный — кДНК экспери-
ментальных опухолевых клеток; зеленый — конт-
рольные кДНК; желтый — одинаковые уровни
ДНК обоих образцов. Для интерпретации резуль-
татов флуоресцентный сканер определял точный
уровень флуоресценции каждого пятна на стекле
Полученные данные затем анализировала компь-
ютерная программа, которая сравнивала инфор-
мацию о флуоресценции с генетической базой
данных для определения того, какие гены избы-
точно или недостаточно экспрессируются в тес-
тированных образцах. Характеристика распреде-
ления и количества связывания ДНК с микро-
массивом потенциально может быть полезной в
области иммунологии. В частности, для клини-
ческой диагностики лимфоидных опухолей, раз-
работки препаратов (например, тестирование раз-
ТЕСТЫ
99
рабатываемых иммуносупрессивных препаратов по
их действию на экспрессию цитокиновых генов)
и открытия новых генов.
РЕЗЮМЕ
1. При взаимодействии антитела и антигена кова-
лентные связи не используются; задействованы сла-
бые силы, такие как электростатические, гидрофоб-
ные и ван-дер-ваальсовы. Следовательно, для доста-
точного взаимодействия связывающий участок анти-
тела и антиген должны строго пространственно соот-
ветствовать друг другу, как ключ с замком.
2. Только реакция между поливалентным антиге-
ном и по меньшей мере двухвалентным антителом
может привести к взаимодействию, выраженному пе-
рекрестным связыванием молекул антигена антитела-
ми. Эти реакции невозможны при участии гаптенов
или моновалентных Fab-фрагментов.
3. Взаимодействие между растворимым антите-
лом и нерастворимым корпускулярным антигеном
приводит к агглютинации. Степень агглютинации за-
висит от соотношения взаимодействующих антител и
антигена. При большой концентрации антител агглю-
тинация может не развиться. Это явление называется
прозоной. Под термином «титр» понимают наиболь-
шее разведение сыворотки, при котором еще проис-
ходит агглютинация, после чего при более высоком
разведении она не начинается.
4. Реакция преципитации происходит при смеши-
вании в правильном соотношении растворимого поли-
валентного антигена и (по меньшей мере) двухвалент-
ных антител. Она может протекать в водной среде или
геле.
5. Реакции в геле между растворимыми антигенами
и антителами могут быть использованы для качествен-
ного и количественного анализа антител или антиге-
нов. Примерами таких реакций могут стать диффузия в
геле, радиальная диффузия и иммуноэлектрофорез
6. Радиоиммунное исследование является высоко-
чувствительным тестом для количественного определе-
ния антигенов или антител. В нем используются радио-
активно меченные антигены или антитела, а основой
метода является конкурентное связывание немеченого
и меченого антигенов. Необходимо отделить антиген,
связанный с антителами, от несвязанного меченого ан-
тигена. Обычно разделение достигается использовани-
ем преципитации с антииммуноглобулинами
7. Иммунное исследование на твердой фазе явля-
ется методикой, которая основана на способности
многих белков прикрепляться к пластику с образовани-
ем мономолекулярного слоя. Антиген наносится на
ячейки планшета, добавляются антитела, затем ячейки
отмываются и измеряется наличие и количество свя-
занных антител, для чего используют антииммуногло-
булины с радиоактивной или ферментной меткой.
8. Ферментный иммуносорбентный анализ являет-
ся разновидностью твердофазного иммунного иссле-
дования, в котором ферменты прикреплены к антиим-
муноглобулинам. Количество определяется путем ко-
лориметрической оценки после добавления субстра-
та, который меняет цвет под действием фермента.
9. Иммунофлуоресценция — это метод, при кото-
ром антиген обнаруживают, используя иммуноглобули-
ны, меченные флуоресцином. При прямой иммунофлуо-
ресценции антитела к искомому антигену несут флуо-
ресцентную метку. При непрямой иммунофлуоресцен-
ции антигенспецифичные антитела не маркированы, их
определяют после добавления флуоресцентно мечен-
ных антииммуноглобулинов. Проточные флуоресцент-
ные клеточные сортеры являются приборами, которые
можно использовать для подсчета и сортировки флуо-
ресцентно меченных клеток.
10. В исследованиях, используемых для оценки
функции лимфоцитов, обычно измеряют клеточный
пролиферативный ответ или эффекторные функции.
Например, можно исследовать функциональное со-
стояние В-клеток путем измерения их способности к
пролиферации и продукции антител в ответ на В-кле-
точные митогены, такие как ЛПС или митоген лаконо-
са. Т-клетки обычно исследуют по их способности
усиливать функции других клеток (в случае CD4*-кле-
ток) или по способности уничтожать мишени, имею-
щие специфичные антигены (в случае СЭ8+-клеток).
Кроме того, Т-клетки можно исследовать, измеряя их
способность к пролиферации или продукции некото-
рых цитокинов в ответ на действие Т-клеточных мито-
генов, таких как ФГА и Кон А.
11. Моноклональные антитела являются высоко-
специфичными реагентами, состоящими из гомоген-
ной популяции антител, идентичных по специфично-
сти к определенному эпитопу.
ТЕСТЫ
Выберите ОДИН НАИБОЛЕЕ ПРАВИЛЬНЫЙ ответ
на каждый тест
1. Первичное взаимодействие антигенов с антите-
лами включают все перечисленное, кроме:
а) ковалентных связей;
б) ван-дер-ваальсовых сил;
в) гидрофобных связей;
г) электростатических сил;
д) точного соответствия между эпитопом и антите-
лом.
2. Препарат антител IgG, специфичных к лизоциму
куриного яйца, обработан папаином для образования
Fab-фрагментов. Укажите, какое из следующих поло-
жений, касающихся авидности этих фрагментов, спра-
ведливо:
а) они будут иметь более низкую авидность к ли-
зоциму куриного яйца, чем интактный IgG;
б) они будут иметь более высокую авидность к ли-
зоциму, чем интактный IgG;
в) они будут иметь такую же авидность к лизоци-
му, как интактный IgG;
г) они потеряют авидность для связи с лизоцимом;
д) они будут иметь такую же авидность, но более
низкую аффинность к лизоциму.
3. Исследование методом Вестерн блот образцов
сывороток для определения присутствия антител к
инфекционным агентам, таким как ВИЧ, особенно ши-
роко используется в диагностике:
а) потому что оно более чувствительно, чем ELISA;
б) в нем могут быть обнаружены антитела ко мно-
гим антигенным эпитопам;
100
ГЛАВА 5. ВЗАИМОДЕЙСТВИЯ АНТИГЕНОВ С АНТИТЕЛАМИ. ИММУНОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ...
в) оно обеспечивает количественный результат
анализа образцов;
г) оно позволяет тестировать несколько образцов
одновременно;
д) оно дешевле и отнимает меньше времени, чем
ELISA.
4. Самое главное отличие трансгенных мышей и
мышей с «нокаутными» генами в том:
а) что у трансгенных мышей всегда используются
клонированные гены, полученные от других видов;
б) у трансгенных мышей чужеродные гены встраи-
ваются в заданный локус путем гомологичной реком-
бинации;
в) у трансгенных мышей чужеродный ген, встроен-
ный в их геном, функционирует;
г) у мышей с «нокаутными» генами всегда уникаль-
ный фенотип.
5. У ТКИД-мышей есть генетический дефект, кото-
рый предотвращает развитие функционально зрелых:
а) гемопоэтических клеток;
б) В- и Т-клеток;
в) Т- и NK-клеток;
г) плюрипотентных стволовых клеток;
д) миелоидных клеток.
6. Из приведенных утверждений, касающихся
В-клеточных гибридом, ложным является следующее:
а) они являются иммортализованными клеточными
линиями, которые продуцируют антитела одной спе-
цифичности;
б) они происходят из В-клеток, которые сначала
клонировали, а затем выращивали в краткосрочной
клеточной культуре;
в) они содержат большое ядро, образованное сли-
янием двух ядер;
г) они могут использоваться для производства диа-
гностических или терапевтических моноклональных
антител;
д) они получаются при сплавлении В-клеток с
трансформированными плазматическими клетками,
которые неспособны секретировать иммуноглобулины.
7. Разрабатывается тест ELISA, направленный на
обнаружение сывороточных антител к новому штамму
патогенных бактерий. В начале моноклональные анти-
тела, специфичные к одному из эпитопов этого орга-
низма, были использованы как для придания специ-
фичности (сенсибилизации) ячейкам пластикового
планшета, так и в качестве меченных ферментами ан-
тител при последующем двухслойном иммунофер-
ментном анализе. Однако обнаружить антиген не уда-
лось, несмотря на использование широкого спектра
концентраций антител. Наиболее вероятная причина
проблемы заключается в следующем:
а) антиген, использованный в этом исследовании,
слишком большой;
б) у антител низкая аффинность к антигену;
в) моноклональные антитела, использованные для
сенсибилизации ячеек, блокируют доступ к эпитопу,
поскольку те же антитела, меченные ферментами, не
могут присоединиться к антигену;
г) необходимо использовать вторые антитела, ме-
ченные ферментами, не того изотипа, что использо-
вались для сенсибилизации ячеек;
д) вероятно, использованные моноклональные ан-
титела нестабильны.
ОТВЕТЫ НА ТЕСТЫ
1 — а. Ковалентные связи не используются при
взаимодействии антитела и антигена. Связывающие
силы относительно слабы. Это ван-дер-ваальсовы,
гидрофобные и электростатические силы. Эпитоп и
антитело должны точно соответствовать друг другу.
2 — а. Авидность — это общая энергия связи
между антителом и поливалентным антигеном. По-
скольку Fab-фрагменты моновалентны по сравнению
со специфичной двухвалентной молекулой IgG (благо-
даря присутствию двух Fab-фрагментов), авидность
Fab-фрагмента будет меньше. Вариант «д» неверен,
так как аффинность Fab-фрагментов будет такой же,
как и Fab-фрагментов интактной молекулы IgG
3 — б. Исследование Вестерн блот использует
методику электрофоретического разделения для опре-
деления молекулярной массы данного антигена или
выделения его из смеси антигенов. Поскольку гумо-
ральный ответ на инфекционные агенты приводит к
поликлональному ответу в силу сложности антигенных
детерминант, экспрессируемых этим агентом, Вестерн
блот может подтвердить наличие таких антител, кото-
рые реагируют с электрофоретически разделенными
антигенами известной молекулярной массы.
4 — в. Клонированные чужеродные гены того же
или другого вида внедряют в мышей для получения
трансгенной линии. Внедрение происходит рандомно
и наблюдается как в соматических, так и в половых
клетках. Вариант «г» неверен, поскольку иногда «нокаут-
ные» мыши не имеют уникального фенотипа, связан-
ного с заменой функционального гена на неработаю-
щий, возможно, в связи с активностью компенсатор-
ных механизмов.
5 — б. У ТКИД-мышей есть аутосомно-рецессив-
ная мутация, вызывающая расстройство, при котором
не созревают Т- и В-клетки. Как и у людей с таким
заболеванием, у ТКИД-мышей нарушены лимфоци-
тарные механизмы защиты. Плюрипотентные стволо-
вые клетки, которые присутствуют у ТКИД-мышей,
могут давать начало другим гемопоэтическим линиям,
включая клетки миелоидного ряда и NK-клетки.
6 — 6. Метод, используемый для образования В-кле-
точных гибридом, состоит в сплавлении В-клеток (на-
пример, из селезенки или лимфатических узлов), по-
лученных от иммунизированной мыши, с отобранной
популяцией трансформированных плазматических
клеток, не способных секретировать иммуноглобули-
ны. Перед сплавлением с плазматическими клетками
антигенспецифичные В-клетки не клонируют.
7 — в. При проведении двухслойного ферментного
иммуносорбентного анализа (ELISA) антитела (часто
моноклональные), использованные для покрытия яче-
ек (первые), связываются с эпитопом, к которому они
специфичны. В приведенном примере те же антитела,
специфичные к тому же эпитопу, использованы также
как меченные ферментом обнаруживающие (вторые)
антитела. Первые моноклональные антитела блокиру-
ют доступ к эпитопу тех же самых моноклональных
антител, использованных второй раз, поэтому они не
связываются.
Глава
ГЕНЕТИЧЕСКАЯ ОСНОВА
СТРУКТУРЫ АНТИТЕЛ
ВВЕДЕНИЕ
В предыдущих главах было описано огромное ко-
личество вариантов иммунного ответа; при этом
особое внимание уделялось разнообразию анти-
тел — молекул иммуноглобулинов, которые явля-
ются секретируемыми формами антигенспецифич-
ных рецепторов, обнаруживаемых на отдельных
В-лимфоцитах. Подсчитано, что количество Т- и
В-клеток, обладающих разной антигенной специ-
фичностью, которое может продуцировать отдель-
ный организм, составляет от 1015 до 1018, т.е. каж-
дый индивидуум способен вырабатывать от 1015
до 1018 различных молекул 1g или Т-клеточных ре-
цепторов. Поскольку для геномов (наследуемые
ДНК) многих видов организмов была определена
последовательность генов, число которых соста-
вило всего 30000 — 40000 единиц, возник вопрос:
каким образом столь малое число генов обеспе-
чивает существование такого большого числа раз-
личных молекул антигенных рецепторов?
В работах ряда ученых, выполненных за по-
следние 30 лет, было доказано, что гены 1g и TCR
для достижения уровня разнообразия, необходи-
мого для иммунного ответа, используют уникаль-
ную стратегию генных комбинаций. Первым клю-
чевым открытием стало то, что вариабельные и
константные области молекулы 1g кодируются
разными генами. Оказалось, что многие разные
гены вариабельной (V) области могут присоеди-
няться к одному гену константной (С) области.
Следующее решающее открытие сделал лауреат
Нобелевской премии С.Тонегава (5. Tonegawa). Он
показал, что гены антител способны перемещать-
ся и реаранжировываться (перегруппировывать-
ся) внутри генома дифференцирующейся клетки:
ген V-области может находиться в одном поло-
жении в ДНК на наследуемой хромосоме (состо-
яние зародышевой линии), но затем во время диф-
ференцировки лимфоцита перемещается в дру-
гое место на хромосоме. Этот процесс реаранжи-
ровки во время дифференцировки сводит вместе
набор генов, кодирующих V- и С-области. Набор
реаранжированных генов затем транскрибирует-
ся и транслируется в законченную тяжелую (Н)
или легкую (L) цепь.
Дальнейшие исследования (детально обсужда-
емые в гл. 8) показали, что гены TCR и механиз-
мы, обеспечивающие разнообразие TCR, имеют
много общих черт с генами 1g и механизмами,
отвечающими за разнообразие молекул 1g. В на-
стоящее время стратегии реаранжировки, исполь-
зуемые для выработки антигенспецифичных ре-
цепторов на Т- и В-клетках, считаются уникаль-
ными для организма: не найдено других генов,
проходящих реаранжировку. Далее в этой главе
описано, как организованы гены 1g, как протека-
ет процесс реаранжировки и как с использовани-
ем небольшого числа генов может быть произве-
дено огромное число полипептидных иммуногло-
булинов.
КРАТКОЕ ОПИСАНИЕ
СТРУКТУРЫ И ЭКСПРЕССИИ
НЕИММУНОГЛОБУЛИНОВЫХ ГЕНОВ
Перед обсуждением молекулярной организации
и реаранжировки генов, связанных с синтезом 1g,
рассмотрим организацию и экспрессию неимму-
ноглобулиновых генов. Обратим внимание на ком-
поненты генов, кодирующих обычный белок, эк-
спрессируемый на поверхности клетки, как пока-
зано на рис. 6.1.
• Геном (вся наследуемая ДНК) индивидуума
состоит из линейных последовательностей —
генов — в нитях ДНК различных хромосом.
102
ГЛАВА 6. ГЕНЕТИЧЕСКАЯ ОСНОВА СТРУКТУРЫ АНТИТЕЛ
Интроны
Лидер /
Ъ/ | j [Экзон 1] [Экзон з[ [Экзон з] [Экзюн4] Геномная ДНК
I Транскрипция
Лидер ________ " ________ _________
5 LJ Экзон! Экзон 2 Экзон 3 Экзон 4 [ з' Первичный транскрипт РНК
Сплайсинг
Лидер ''
Экзон 11 Экзон 2[ Экзон з| Экзон 4
Зрелая иРНК
Трансляция в белок
Клеточная
мембрана
'СООН
Цитоплазматический «хвост» - экзон 4
Трансмембранный сегмент (экзон 3)
Домен 2 (экзон 2)
Домен 1 (экзон 1)
NH2
Рис. 6.1. Прототипный ген, кодирующий трансмембранный белок
Ген транскрибируется в РНК, а РНК транс-
лируется в белок.
• Все диплоидные клетки в человеческом орга-
низме содержат одинаковый набор генов. Един-
ственное исключение — лимфоциты, которые,
если говорить вкратце, отличаются от других
клеток и друг от друга по состоянию генов,
кодирующих их антигенспецифичного рецеп-
тора. Клетки в пределах одного организма от-
личаются друг от друга, потому что они транс-
крибируют и транслируют разные гены. Гово-
рят, что эти клетки экспрессируют разные
структуры генов.
• Экспрессия специфических структур генов
определяет функцию клетки. Например, хотя
каждая клетка содержит ген инсулина, экс-
прессируют его только панкреатические р-клет-
ки, что позволяет им производить инсулин
Точно так же все клетки содержат гены 1g, од-
нако только В-лимфоциты (и их дифференци-
рованная форма — плазматические клетки) эк-
спрессируют гены 1g и соответственно синте-
зируют молекулы 1g. Подобно всем другим
клеткам, кроме В-клеток, Т-клетки содержат
гены [g, но не экспрессируют их.
Контроль экспрессии гена осуществляется на
многих уровнях, включая действие транскрип-
ционных факторов (белков, которые иницииру-
ют или модулируют транскрипцию, обычно свя-
зываясь с регуляторными последовательностями
ДНК вблизи 5'-концевого участка генов), а так-
же скорость транскрипции и период полураспа-
да информационной (матричной) РНК. Пони-
мание механизмов, которые регулируют экспрес-
сию гена, в частности то, каким образом гены
«включаются» и «выключаются» в клетках, —
исключительно важно для современных научных
исследований.
• Большинство генов, кодирующих белок, име-
ет характерные структуры — экзоны и интро-
ны. Экзоны представляют собой последователь-
ности пар оснований, которые затем траскри-
бируются в зрелую иРНК. Они отделены друг
от друга интронами — некодирующими участ-
ками пар оснований.
• Когда ген транскрибируется в РНК, весь учас-
ток ДНК (экзоны плюс интроны) транскриби-
руется в первичный траскрипт РНК. Фермен-
ты изменяют этот первичный транскрипт РНК
путем сплайсинга, при котором удаляются не-
кодирующие интроны и соединяются вместе
все кодирующие экзоны. Таким образом, пос-
ле процессирования получается сегмент зре-
лой иРНК, который намного короче, чем пер-
воначальный транскрипт. Эта иРНК трансли-
руется с образованием белка на рибосомах.
Экзон обычно кодирует дискретную область
белка (см. рис. 6.1), такую как внеклеточный
домен, трансмембранный участок, или цито-
плазматический сегмент. Таким образом, бел-
ки составляются путем группирования вместе
многочисленных функциональных участков,
причем каждый участок кодируется отдельным
генным сегментом.
ГЕНЕТИЧЕСКИЕ ИЗМЕНЕНИЯ ПРИ СИНТЕЗЕ ЦЕПЕЙ 1g
103
• Гены, кодирующие белки, экспрессированные
на клеточной поверхности, имеют лидерную
последовательность (L-экзон) на 5'-конце. Она
кодирует последовательность — сигнальный пеп-
тид — состоящую примерно из 10 аминокислот
(в основном гидрофобных) на амино(ЪШ2— )-
концевом отрезке белка. Когда иРНК для бел-
ка, ассоциированного с мембраной, трансли-
руется на рибосомы, этот сигнальный пептид
направляет синтез полипептидной цепи в эн-
доплазматический ретикулум. Образующаяся
полипептидная цепь подается от рибосом
внутрь эндоплазматического ретикулума, где
сигнальный пептид отщепляется. Вновь син-
тезированный белок движется от эндоплаз-
матического ретикулума в комплекс Гольджи,
а затем к клеточной мембране.
На рис. 6.1 изображена поверхностная моле-
кула с аминоконцевым отрезком и двумя внекле-
точными доменами, одной трансмембранной об-
ластью и большой карбокситерминальной об-
ластью внутри клетки.
Структура молекулы мембранного 1g, экспрес-
сированной на поверхности В-клетки, имеет не-
которое сходство со структурой молекулы, пред-
ставленной на рис. 6.1, в частности это касается
внеклеточных N-терминальных доменов и транс-
мембранной области.
Мембранный иммуноглобулин также суще-
ственно отличается от структуры изображенной
молекулы. Во-первых, 1g представляет собой че-
тырехцепочечный гликопротеин. Чтобы получить
полную молекулу 1g, вновь синтезированные от-
дельные Н- и L-цепи должны быть собраны и гли-
колизированы внутри клетки прежде, чем четы-
рехцепочечная молекула достигнет клеточной по-
верхности. Во-вторых, каждая цепь 1g имеет очень
короткий цитоплазматический концевой сегмент
(хвост).
Другие молекулы, участвующие в иммунном
ответе и экспрессирующиеся на клеточной поверх-
ности, имеют различную конфигурацию, напри-
мер С-конец расположен внеклеточно, a N-ko-
нец — внутриклеточно. Еще одни мембранные мо-
лекулы, как, например, CD81, экспрессируемый
на В-клетках, образуют многочисленные петли, про-
ходящие через мембрану (см. гл. 7 и 10). Третьи,
например антиген, ассоциированный с функцией
лейкоцитов (LFA-1, CD58), и регуляторный бе-
лок системы комплемента (ФУД; CD55), полно-
стью внеклеточны, но сцеплены с поверхностью
клетки посредством ковалентной связи с олиго-
сахаридом, который в свою очередь связан с од-
ним из мембранных фосфолипидов — фосфати-
дилинозитолом.
Таким образом, подобные молекулы считаются
мембранными молекулами, сцепленными с гли-
козилфосфатидилинозитолом (ГФИ). (Функции
CD58 и CD55 рассматриваются соответственно в
гл. 10 и 13.)
• ГЕНЕТИЧЕСКИЕ ИЗМЕНЕНИЯ
ПРИ СИНТЕЗЕ ЦЕПЕЙ 1д
Организация и реаранжировка
генов легкой цепи
Как было показано в гл. 4, каждый к- и ^-поли-
пептид L-цепи состоит из двух главных доменов,
вариабельной и константной областей (VL и CL).
При этом VL является аминоконцевой частью лег-
кой цепи, состоящей из примерно 108 аминокис-
лотных остатков. Она кодируется двумя отдель-
ными сегментами гена', вариабельным (V) сегмен-
том, кодирующим 95 аминокислотных остатков,
и небольшим соединительным (J) сегментом, ко-
дирующим приблизительно 13 остатков (96— 108)
на карбокситерминальном конце вариабельной
области. Один V-генный и один J-генный сегмен-
ты собираются вместе в геноме, чтобы образо-
вать генную структуру, которая вместе с геном
С-области кодирует всю L-цепь иммуноглобули-
на. Этот уникальный механизм реаранжировки
генов, называемый У(В^-рекомбинацией (D-сег-
менты рассматриваются далее в подразделе, ка-
сающемся генов Н-цепей), используется только
генами, кодирующими L- и Н-цепи иммуногло-
булина и TCR.
В настоящее время только начинают понимать
сложную, строго регулируемую последователь-
ность молекулярных событий, происходящих при
реаранжировке. Однако известно, что дефект в
этом механизме или регуляции У(ОД-рекомби-
наций может привести к заболеванию (см. гл. 17).
Многие этапы реаранжировки для В- и Т-клеток
оказались одинаковыми. Ферментный комплекс,
называемый V(D)J-peKOM6una3o6, опосредует ре-
аранжировку рецепторных генов в В- и Т-клетках.
Продукты двух генов, RAG-1 и RAG-2 (recombi-
nation-activating genes — гены, активирующие ре-
комбинацию), важны, как свидетельствует их на-
звание, для инициирования рекомбинаций в лим-
фоидных клетках-предшественниках. Белки RAG-1
и RAG-2 необходимы на начальных стадиях вы-
резания ДНК в локусах 1g и TCR: у мышей, не
имеющих одного из этих генов («RAG-нокаутные»
мыши), обычно не развиваются В- и Т-клетки.
Хотя У(ОД-рекомбиназа имеется во всех клетках
и вовлечена в восстановление цепей ДНК, про-
дукты генов RAG-1 и RAG-2 экспрессируются
исключительно в лимфоцитах.
Синтез к-цепи
Сначала рассмотрим синтез легких цепей. На рис.
6.2 представлен ряд генов человека, кодирующих
те из цепей, которые отнесены к к-локусу, распо-
ложенному на хромосоме 2. Генетический анализ
показывает, что существует следующая компонов-
ка (аранжировка) к-генов в зародышевой линии,
т.е. в любой клетке организма: приблизительно
104
ГЛАВА 6. ГЕНЕТИЧЕСКАЯ ОСНОВА СТРУКТУРЫ АНТИТЕЛ
ДНК зародышевой линии
(переаранжированная)
ДНК В-клетки
(реаранжированная)
Первичный
транскрипт РНК
Зрелая иРНК
Полипептид к-цепи
40 разных Ук-генов, каждый из которых может ко-
дировать 95 N-концевых аминокислот вариабель-
ной к-области, расположены линейно, каждый со
своей собственной лидерной (L) последователь-
ностью, и разделяются интронами, как это пока-
зано на рис. 6.2 (для упрощения лидерные после-
довательности на рисунке не показаны). Группа
из пяти 1к-генных сегментов располагается ниже
(т.е. 3'). Каждый Зк-генный сегмент может коди-
ровать оставшиеся 13 аминокислотных остатков
(96—108) вариабельной к-области. Длинный ин-
трон отделяет Ск-генный сегмент (ген, кодирую-
щий один константный участок к-цепи) от JK-reH-
ных сегментов.
Для получения к-цепи недифференцированная
клетка В-лимфоцитарной линии выбирает один
из Ук-генов из своей ДНК и соединяет его (физи-
чески) с одним из Зк-сегментов (на рис. 6.2 V2
реаранжируется к J4). Как происходит этот выбор
V- и J-генов, неизвестно, но, возможно, это слу-
чайный процесс. Объединение предполагает сцеп-
ление последовательностей распознавания, нахо-
дящихся на концах всех генов (как 1g, так и TCR),
которые используют реаранжируемые генные
сегменты при образовании полипептидов. На
рис. 6.3 эта реаранжировка V2 к J4 представлена
более детально. Заметим, что ДНК в этой клетке
все еще содержит переаранжированные генные
сегменты V! и J5. Во время реаранжировки в боль-
шинстве случаев ДНК, расположенная между со-
единяемыми сегментами, собирается в петлю,
вырезается и в конце концов разрушается.
На рис. 6.2 также показано, что после того
как клетка В-клеточной линии реаранжирует
свою ДНК, она создает первичный транскрипт
РНК. Затем происходит сплайсинг этого транс-
крипта с целью удаления всех промежуточных
некодирующих последовательностей, в результате
чего экзоны VK, JK и Ск собираются вместе в зре-
лой иРНК. В шероховатом эндоплазматическом
ретикулуме лидерная последовательность отщеп-
ляется, и иРНК транслируется в к-полипептид-
ную цепь. Эта к-цепь движется в просвет эндо-
плазматического ретикулума, где может объеди-
няться с вновь синтезированной Н-цепью и об-
разовывать молекулу 1g.
Синтез к-цепи
У человека Х-гены расположены на хромосоме 22,
т.е. на хромосоме, далекой от генов к- и Н-не-
пей. Синтез Х-цепей аналогичен в основном син-
тезу к-цепей в том отношении, что он включает
реаранжировку ДНК, которая объединяет Ух-ген
У(Б)3-рекомбиназа
3' ДНК зародышевой линии
3' Реаранжированная ДНК
• Рис. 6.3. Реаранжировка ДНК,
кодирующей легкую к-цепь
ГЕНЕТИЧЕСКИЕ ИЗМЕНЕНИЯ ПРИ СИНТЕЗЕ ЦЕПЕЙ 1g
105
(кодирующий N-концевую область X-вариабель-
ной области) с Jx-сегментом (кодирующим осталь-
ные 13 аминокислот Х-вариабельной области). У лю-
дей Х-локус включает примерно 40 Vx- и четыре
Jx-гена, которые, как известно, являются функ-
циональными. Зх-сегмент также содержит после-
довательности, называемые псевдогенами, — длин-
ные отрезки ДНК с некоторым дефектом, кото-
рый предотвращает их транскрипцию или транс-
ляцию. Организация локуса Х-гена несколько от-
личается от организации локуса к-гена, содержа-
щего только один Ск-ген. В противоположность
ему каждый J^-сегмент ассоциируется со своим
Сх-геном. Таким образом, у человека есть четыре
разных вида Сх-полипептидов.
Организация и реаранжировка
генов тяжелой цепи
Гены Н-цепи находятся на хромосоме, располо-
женной далеко от любой L-цепи (у человека на
хромосоме 14). На рис. 6.4 представлена органи-
зация генов, кодирующих Н-цепь. Можно видеть
сходство и отличия этого локуса от локусов L-цепи.
В противоположность вариабельной области лег-
кой цепи, состоящей из двух генных сегментов,
вариабельная область тяжелой цепи состоит из
трех генных сегментов (Кя, DH и /я). Таким обра-
зом, помимо V- и J-сегментов гены, кодирующие
вариабельный участок Н-цепи, используют также
сегмент разнообразия (diversity), или D-сегмент.
D- и J-сегменты кодируют аминокислотные после-
довательности в третьей гипервариабелъной облас-
ти. или области, определяющей комплементар-
ность (CDR3) тяжелой цепи (см. гл. 4). На рис. 6.4
показано, что локус Н-цепи человека включает
приблизительно 50 Ун-генов, примерно 20 DH-
генных и шесть Зн-генных сегментов.
Второй важной особенностью генов Н-цепи
является наличие в зародышевой линии большо-
го количества генов, кодирующих С-область 1g.
Как описано в гл. 4, С-область определяет класс
и, следовательно, биологическую функцию каж-
дого антитела. С-гены, каждый из которых флан-
кирован с двух сторон интронами, отделяются от
Ун-генов крупным интроном. На рис. 6.4 показан
порядок расположения С-генов у человека. Ближе
всего к генам V-области находятся такие С-гены,
как ц и 8, которые в процессе развития В-клетки
считываются первыми.
При синтезе тяжелой цепи используются те же
механизмы реаранжировки, что и у легких цепей,
а именно: для проведения процесса соединения
разных генных сегментов используется V(D)J-pe-
комбиназа. На ранних стадиях существования оп-
ределенной В-клетки должны происходить две ре-
аранжировки ДНК зародышевой линии. В ходе
первой один D-сегмент устанавливается рядом с
одним J-сегментом. В ходе второй один V-cer-
мент устанавливается рядом с DJ-структурой
(V2D2J5 на рис. 6.4), что создает антигенную спе-
цифичность Н-цепи. Затем реаранжированная
ДНК считывается вместе с ближайшими генами
С-участка: ц и 8. Этот первичный транскрипт
может подвергаться сплайсингу в двух направле-
ниях (альтернативный сплайсинг) и формировать
соответственно или VDJ-p-, или VDJ-8-иРНК
Затем эти две иРНК могут транслироваться в ше-
роховатый эндоплазматический ретикулум и оп-
ределять синтез или ц-, или 8-полипептидов. Та-
ким образом, одна покоящаяся В-клетка может
экспрессировать одновременно как ц-, так и 8-
тяжелые цепи, имеющие идентичную антигенную
специфичность.
Альтернативный сплайсинг первичного транс-
крипта тяжелой цепи также позволяет получать
мембранные и секреторные формы полипептидов
।—VH(n~50)—। ।—Бн(п~20)—। ।—JH(1 6)—। Гены С-области
Ыл vn d2i [pn| щ EK1И И И И E Ы
| Реаранжировка
5' |у2|Рг|j5|Ы И±300Е10НВЕ1
1 Транскрипция
у ДНК зародышевой
линии (неаранжи-
рованная)
, ДНК В-клеток
3 (реаранжированная)
Первичный
транскрипт РНК
• Рис. 6.4. Генетические изме-
нения, приводящие к синтезу
тяжелой цепи у человека
Зрелая иРНК
Полипептид
тяжелой цепи
106
ГЛАВА 6. ГЕНЕТИЧЕСКАЯ ОСНОВА СТРУКТУРЫ АНТИТЕЛ
тяжелой цепи. Два дополнительных экзона (не
представленные на рис. 6.4) находятся на З'-кон-
це каждого Сн-гена, например, один из этих эк-
зонов кодирует трансмембранный и цитоплазма-
тический концевой участок мембранной формы
молекулы, в то время как другой — С-терминаль-
ный конец секреторной формы молекулы. Оба
экзона транскрибируются и входят в состав пер-
вичного транскрипта, но один из них вырезается
из него. Это приводит к образованию ряда иРНК,
которые транслируют или в мембранную, или сек-
реторную форму полипептида тяжелой цепи
Регуляция экспресии генов lg
Теоретически у любой В-клетки есть много генов,
из которых можно выбрать гены для синтеза моле-
кулы 1g: множество V-, D- и J-генов для образова-
ния вариабельных областей и разных генов для лег-
ких к- и Х-цепей. Фактически же каждая В-клетка
использует только один набор VDJ-генов и один тип
легкой цепи. В результате одна В-клетка продуци-
рует Ig только одной антигенной специфичности.
Более того, В-клетка имеет два набора хромо-
сом, по одному от каждого родителя, так что тео-
ретически гены Ig, находящиеся на обеих хромо-
сомах, могли бы синтезировать молекулы Ig. Но
этого не происходит. В отличие от почти всех
других генных продуктов, которые производятся
на основе генов обеих родительских хромосом,
Ig-цепи кодирует только один комплект генов или
с материнской, или с отцовской хромосомы. На-
пример, Н-цепь может кодироваться генами от-
цовской хромосомы, а L-цепь (к- или Х-) — мате-
ринской. Этот феномен использования генов толь-
ко одной родительской хромосомы называется
аллельным исключением.
Все этапы реаранжировки, аллельное исклю-
чение и, следовательно, синтез полной молекулы
Ig жестко контролируются, хотя все контролиру-
ющие механизмы еще не полностью изучены. Если
происходит успешная или продуктивная реаран-
жировка V-, D- и J-генов на одной родительской
хромосоме и образуется полипептид тяжелой цепи,
то на другой родительской хромосоме реаранжи-
ровка тяжелой цепи прекращается под влиянием
некоего супрессивного механизма. Если попытка
реаранжировки V-, D- и J-генов на первой роди-
тельской хромосоме оказывается неудачной (т.е.
не приводит к образованию полипептидной цепи),
то реаранжировка Н-цепи продолжается на вто-
рой родительской хромосоме. Такой же процесс
затем происходит и с L-пепью: сначала с генами
к-цепи, а затем Х-цепи. Продуктивная реаранжи-
ровка, вызванная присоединением V-сегмента к
J-сегменту одного из этих генов, заставляет дру-
гие генные сегменты оставаться в форме зароды-
шевой линии. Так клетка проходит через некото-
рые или все этапы, на которых происходит копи-
рование хромосомного материала до тех пор, пока
успешно не завершится продуктивная реаранжи-
ровка генов для одной Н- или L-цепи. Эти цепи
определяют специфичности антител, представля-
емых данной клеткой.
Можно сделать вывод, что в В-клетке функцио-
нально экспрессируются только одна Н- и одна
L-цепи, несмотря на то что каждая В-клетка со-
держит две хромосомы (от отца и матери), кото-
рые могли бы кодировать тяжелую цепь, и две
хромосомы, которые могли бы кодировать лег-
кую цепь. Этот механизм генного исключения
гарантирует моноспецифичность, т.е. специфич-
ность каждой В-клетки и синтезируемых ею ан-
тител только к одному эпитопу. Таким образом
В-клетка защищается от образования и экспрес-
сии на ее клеточной поверхности молекул Ig с
разной антигенной специфичностью.
• ПЕРЕКЛЮЧЕНИЕ КЛАССА
ИЛИ ИЗОТИПА
Как было описано ранее, одна В-клетка создает
антитела только одной специфичности, которая
определяется природой произошедших VJ- (L-цепь)
и VDJ-реаранжировок (Н-цепь). Эти реаранжиров-
ки происходят в отсутствие антигена на ранних
стадиях В-клеточной дифференцировки. Уже было
описано, как одна и та же В-клетка может синте-
зировать IgM и IgD с одинаковой антигенной спе-
цифичностью. Далее будет продемонстрировано,
как В-лимфоцит может переключаться на созда-
ние антител другого класса, таких как IgG, IgE и
IgA. Это явление носит название переключение клас-
са или изотипа. Переключение класса приводит к
изменению эффекторной функции В-клетки, но
не меняет ее антигенную специфичность.
Переключение класса происходит в стимули-
рованных антигеном зрелых В-клетках, синтези-
рующих IgM и IgD (обсуждается в гл. 7). Этот
процесс связан с дальнейшей реаранжировкой
ДНК, в результате которой VDJ-гены присоеди-
няются к другому гену С-области тяжелой цепи
(рис. 6.5). Помимо антигенного действия пере-
ключение класса зависит от присутствия таких
известных факторов, как цитокины, высвобожда-
емые Т-клетками (см. далее и гл. 10 и 11). В-клет-
ки при отсутствии Т-клеточных цитокинов почти
или вообще не переключают изотипы.
Цитокины, влияющие на переключение клас-
са, вызывают дальнейшую реаранжировку ДНК
В-клеток и переключение на другие классы Ig,
С-генные сегменты которых расположены далее
(например, к IgG4 или IgE). Таким образом, каж-
дая В-клетка, имеющая уникальную специфич-
ность, способна продуцировать антитела всех воз-
можных классов в зависимости от переключений,
возникающих в ДНК, кодирующей ее Н-цепь.
Механизм, посредством которого В-клетки
подвергаются переключению класса, представлен
ОБЕСПЕЧЕНИЕ РАЗНООБРАЗИЯ АНТИТЕЛ
107
------------- Гены С-области---------------►
Переключение класса под влиянием Т-клеток
3' ДНК В-клетки
ДНК В-клетки после
переключения класса
| Транскрипция
ПГП з'
Первичный
транскрипт РНК
Сплайсинг
|V2|P2| J5| У1|
иРНК для тяжелой
У!-цепи
• Рис. 6.5. Механизм переключения класса при синтезе 1g Область переключения, располо-
женная перед константной областью тяжелой цепи, обозначена буквой S
на рис. 6.5. К 5'-концу каждой С-области (Сн-гена)
кроме С§ прилежит один из участков, состоящий
из повторяющихся последовательностей основа-
ний, называемый областью переключения (switch
region — S-область). Эта область переключения
позволяет Сн-генам (за исключением С6) присо-
единяться к VDJ-структуре. На рисунке представ-
лены только Сн-гены уь у3 и а2, но могут ис-
пользоваться и другие. Под влиянием стимули-
рующего воздействия антигенов и Т-клеточных
цитокинов В-клетка с VDJ-структурой, связан-
ной с Сц и С8, реаранжирует далее свою ДНК,
чтобы произошло сцепление VDJ с областью пе-
реключения перед Сн-областью другого гена (на
рис. 6.5 это у]). После образования первичного
РНК-транскрипта с реаранжированной ДНК про-
исходит сплайсинг интронов с появлением иРНК,
кодирующей Н-цепь IgG]. При этом удаляется
РНК, разделяющая С-области. Таким образом,
на данной стадии клетка теряет способность про-
дуцировать антитела того класса, гены С-облас-
ти которых утрачены (в данном примере IgM,
IgD или IgG3).
Переключение класса представляет собой ме-
ханизм, уникальный для Н-цепей 1g в В-клетках.
Он позволяет антителу с определенной антиген-
ной специфичностью ассоциироваться с разны-
ми цепями, имеющими другую константную об-
ласть, и тем самым приобретать другие эффек-
торные функции. Например, VDJ-структура ан-
тител, специфичная в отношении какого-либо
бактериального антигена, может присоединиться
к Су-гену и образовывать молекулу IgG. Эти ан-
титела IgG взаимодействуют с такими клетками
как макрофаги, которые экспрессируют рецепто-
ры для Fcy. Или та же VDJ-структура может при-
соединиться к Се и образовывать молекулу IgE
Антитела IgE взаимодействуют с тучными клет-
ки, экспрессирующими рецепторы для Fce.
Цитокины, присутствующие при активации
В-клеток антигеном, играют ключевую роль в вы-
боре Сн-гена во время переключения изотипа
Например, в присутствии цитокина IFNy В-клет-
ка может реаранжировать VDJ-структуру к СУ2-тя-
желой цепи, и клетка переключается на синтез
IgG2. И наоборот, в присутствии цитокина IL-4
В-клетка может реаранжировать VDJ к СУ4 или
СЕ, и тогда клетка переключается соответствен-
но на синтез IgG4 или IgE. Полагают, что каж-
дый цитокин ослабляет структуру двойной спи-
рали ДНК только в определенных точках вдоль
локуса 1g, позволяя тем самым ферменту, назы-
ваемому переключающей (switch) рекомбиназой.
распознавать ДНК, кодирующую специфические
С-области.
ОБЕСПЕЧЕНИЕ РАЗНООБРАЗИЯ
АНТИТЕЛ
До сих пор описывались уникальные генетиче-
ские механизмы, участвующие в формировании
совокупности чрезвычайно разнообразных анти-
тел, способных противостоять множеству антиге-
нов без того, чтобы задействовать слишком боль-
шой участок ДНК. Однако разнообразие антител
достигается и с помощью других механизмов. Не-
которые из них рассмотрены далее.
Наличие множества V-генов
в зародышевой линии
На основе количества разных генов для V-обла-
сти в зародышевой линии определяется минималь-
ное количество разных антител, которые могут
быть продуцированы.
108
ГЛАВА 6. ГЕНЕТИЧЕСКАЯ ОСНОВА СТРУКТУРЫ АНТИТЕЛ
VJ- и VDJ-комбинаторная ассоциация
Как уже было указано, может произойти ассо-
циация любого V-сегмента с любым J-сегментом
гена, в результате чего образуется вариабельная
область L-цепи. Аналогичным образом при ген-
ной реаранжировке Н-цепи любой V-сегмент гена
может ассоциироваться с любым D- или J-сег-
ментом гена. Все эти отдельные сегменты уча-
ствуют в создании структуры вариабельной об-
ласти. Так как имеются примерно 40 VK- и пять
1к-генов, кодирующих вариабельную область
к-цепи (предполагается случайная ассоциация),
то могут образовываться 40-5, т.е. 200 к-цепей.
При 40 Vx- и четырех J^-генах может появиться
160 Х-цепей. Аналогичным образом при наличии
примерно 50 V-генов, 20 D-генов и шести J-генов,
которые могут кодировать вариабельную область
Н-цепи и также ассоциироваться в любую ком-
бинацию, возникает 50-20-6, т.е. 6000 разных тя-
желых цепей.
Случайный выбор тяжелых
и легких цепей
Помимо разнообразия, достигаемого VJ- и VDJ-
комбинаторными ассоциациями, любая Н-цепь
может ассоциироваться с любой L-цепью. Таким
образом, если любая Н-цепь ассоциируется с лю-
бой к- или Х-цепью, то могут возникать 1,2х
хЮ6 (200 -6000) разных к-содержащих молекул 1g
и 0,96 -106 (160 -6000) Х-содержащих молекул из
всего 165 различных генов (сумма всех Н-, к- и
Х-сегментов)! Из этого видно, как с помощью ог-
раниченного числа генов можно получить огром-
ное количество разных антител.
Разнообразие межсегментных
соединений и вставки нуклеотидов
Точные позиции, в которых происходит слияние
V- и J-сегментов генов (или V-, D-, и J-), не яв-
ляются постоянными, и неточная рекомбинация
ДНК может привести к изменениям состава ами-
нокислот в местах этих соединений. Из-за неточ-
ности при соединении реаранжированной ДНК
происходят делении или изменения в аминокис-
лотных остатках (так называемое разнообразие меж-
сегментных соединений), которые влияют на анти-
генсвязывающий участок, поскольку составляют ту
часть гипервариабельной области, которая опре-
деляет комплементарность к антигену. Кроме того,
небольшое количество нуклеотидов могут встав-
ляться в месте соединения V—D и D—J (вста-
вочное разнообразие). Основной механизм, при-
водящий к вставке нуклеотидов в последователь-
ность ДНК, определяется участием фермента тер-
минальной дезоксинуклеотидилтрансферазы (TdT).
Появляющееся дополнительное разнообразие на-
зывается вариабельностью N-области
Соматический гипермутагенез
Разнообразие антител, продуцируемых популяци-
ей В-клеток, также увеличивают мутации, проис-
ходящие в V-генах тяжелых и/или легких цепей в
период существования В-клетки. Обычно антите-
ла низкой аффинности образуются при первич-
ном ответе на антиген. Секвенирование (опреде-
ление последовательности) ДНК и полипептидов
антител, образующихся при первичном ответе,
показывает, что эти последовательности сопоста-
вимы с последовательностями, которые закоди-
рованы в ДНК зародышевой линии. Однако по
мере «созревания» ответа, особенно после вторич-
ного антигенного стимула, аффинность синтези-
рованных антител в отношении антигена возра-
стает, а аминокислотные последовательности этих
антител отличаются от тех, которые кодированы
в ДНК зародышевой линии.
Эта дивергенция является в основном резуль-
татом точечных мутаций в рекомбинированной
VDJ-структуре V-генов антител, которые приво-
дят к изменению отдельных аминокислот. Это
явление называют соматическим гипермутагене-
зом. поскольку мутации здесь происходят с час-
тотой по крайней мере в 10000 раз большей, чем
обычная частота мутации. Соматический гипер-
мутагенез приводит к повышению аффинности
антител к антигену при вторичном ответе. Как
следствие этой тонкой настройки иммунного от-
вета соматический гипермутагенез увеличивает
разнообразие антител, продуцируемых В-клетка-
ми. Согласно имеющимся данным соматический
гипермутагенез происходит в течение короткого
промежутка времени, а именно периода после
антигенной стимуляции, который протекает в за-
родышевых центрах селезенки и лимфатических
узлов (см. гл. 7).
Конверсия соматических генов
Из исследований, проводимых на мышиных и
человеческих В-клетках, известно, что разнооб-
разие 1g обусловлено VDJ-рекомбинацией и то-
чечными соматическими мутациями. Однако в
последующих исследованиях на других видах
(чаще на птицах и кроликах) было обнаружено,
что у этих животных для получения разной В-
клеточной специфичности задействован механизм,
называемый конверсией соматических генов. Эта
конверсия включает неэквивалентный обмен по-
следовательностями между генами: часть донор-
ского гена или генов «копируется» в акцептор-
ном гене, но изменяется только этот акцептор-
ный ген. Точный механизм, посредством которо-
го это происходит, в настоящее время неизвестен
ОБЕСПЕЧЕНИЕ РАЗНООБРАЗИЯ АНТИТЕЛ
109
Около 20 Функциональные
псевдогенов генные сегменты
У(Б)1-реаранжировка
V D J
ДНК зародышевой
линии
• Рис. 6.6. Конверсия соматических генов
приводит к появлению разнообразия генов
Ig у некоторых видов. На рисунке представ-
лен феномен, наблюдаемый в локусе тяже-
лой цепи иммуноглобулина цыпленка: ко-
роткие последовательности ДНК из одного
или нескольких псевдогенов (на рисунке -
3 и 8) копируются в реаранжированную
В-клеточную VDJ-структуру
В-клеточная ДНК
Конверсия соматических генов
В-клеточная ДНК
На рис. 6.6 представлен локус Н-цепи цыпленка,
включающий один функциональный Ун-ген, ко-
торый реаранжируется во всех В-клетках, и при-
мерно 20 дефектных Ун-генов (псевдогенов), ко-
торые не способны к реаранжировке. На нижней
части рисунка показано, что в данной определен-
ной клетке для придания разнообразия структуре
вариабельного гена в реаранжированный VDJ-ген
включаются две короткие последовательности из
псевдогена 3 и одна — из псевдогена 8. Конвер-
сия соматических генов может также придавать
разнообразие легким цепям
У многих видов, исключая человека и мышь,
получение разнообразия в рамках первичного ре-
пертуара Ig основывается на конверсии сома-
тических генов и соматическом гипермутагенезе,
т.е. оно происходит до антигенной стимуляции.
Например, у цыплят конверсия соматических ге-
нов — основной механизм формирования пер-
вичного репертуара, в то время как у овец для
этого используется соматический гипермутаге-
нез. У других видов животных, например кроли-
ков, крупного рогатого скота и свиней, для дос-
тижения первичного разнообразия Ig использует-
ся очень ограниченное число VDJ-рекомбинаций,
а также конверсия соматических генов и сомати-
ческий гипермутагенез.
Редактирование рецепторов
При некоторых обстоятельствах в клетке В-кле-
точной линии может происходить повторная реа-
ранжировка вариабельных генных сегментов лег-
кой цепи после того, как уже была сформирована
рекомбинированная VJ-структура. Этот процесс
называется редактированием рецепторов (описан
в гл. 7). Механизм редактирования можно понять,
рассмотрев рис. 6.3. Реаранжированная ДНК от-
дельной В-клетки содержит неаранжированные
элементы V] и J5, которые могут использоваться
при повторной реаранжировке Редактирование
рецептора может происходить, когда В-клетка с
рецептором, специфичным в отношении аутоан-
тигена, взаимодействует с ним. Одним из резуль-
татов этого взаимодействия является повторная
реаранжировка V- и J-генов В-клетки, которая мо-
жет приводить к образованию VJ-распознающей
структуры, специфичной скорее для чужеродно-
го, чем для собственного антигена. Следователь-
но, редактирование рецептора может повысить
разнообразие общего ответа на чужеродные анти-
гены.
Все указанные механизмы способствуют фор-
мированию огромной библиотеки или репертуа-
ра В-лимфопитов, содержащего все «специфич-
ности», необходимые для того, чтобы иметь дело
с огромным количеством разнообразных эпито-
пов. Достигаемое разнообразие в специфичности
Ig у индивидуума составляет порядка 1015, при-
чем оно может возрастать за счет соматического
гипермутагенеза.
РЕЗЮМЕ
1. Каждый индивидуум синтезирует огромное ко-
личество различных молекул Ig, каждая из которых
может действовать в качестве рецептора на поверх-
ности В-клетки, специфичной для определенного
эпитопа.
2. Вариабельная область Н-цепи в молекуле Ig ко-
дируется тремя отдельными генами, называемыми
VH-, DH- и Зн-генными сегментами. Отдельный генный
сегмент кодирует константную область тяжелой цепи
Сн- Вариабельная область L-цепи кодируется двумя
генными сегментами VL и JL, отличными от сегментов,
используемых для синтеза тяжелой цепи. В каждой
клетке организма ДНК (зародышевая линия) содержит
множество V-, D- и J-генных сегментов для синтеза
Н- и L-цепей Ig.
3. В ходе дифференцировки В-клетки происходит
реаранжировка ДНК тяжелой цепи, при которой один
\/н-сегмент соединяется с одним DH- и одним JH-cer-
ментом. Объединенная VDJ-структура кодирует всю
вариабельную область тяжелой цепи. Такие реаран-
жировки гена передвигают VDJ-структуру ближе к ге-
нам константной области Н-цепи, т.е. См и Cs.
4. Тот же вид реаранжировок приводит к образо-
ванию генной структуры, кодирующую всю V-область
легкой цепи Ig. Один VL-cerMeHT гена соединяется с од-
110
ГЛАВА 6. ГЕНЕТИЧЕСКАЯ ОСНОВА СТРУКТУРЫ АНТИТЕЛ
ним Зь-сегментом, в результате чего VJ-структура
располагается рядом с геном константной области
легкой цепи. В В-клетке, коммитированной к созда-
нию к-цепи, VKJK-структура перемещается ближе к Ск-
гену, а в В-клетке, коммитированной к образованию
Х-цепи, V^J^-структура располагается ближе к Сх-гену.
5. Первичные транскрипты РНК образуются на ре-
аранжированной ДНК. Из первичного транскрипта
удаляется некодирующая РНК (сплайсинг). В резуль-
тате возникает иРНК для L- и Н-цепей, которая затем
транслируется в L- и Н-цепи IgM и IgD.
6. В В-клетке Н-цепь кодируется собственными
генными сегментами, находящимися на материнской
или отцовской хромосоме. Легкая цепь также кодиру-
ется своими сегментами гена, находящимися на той
или иной хромосоме. Благодаря этому феномену (ал-
лельному исключению) одна В-клетка продуцирует lg
только одной антигенной специфичности.
7. После антигенной стимуляции В-клетка может
далее реаранжировать свою ДНК Н-цепи. VDJ-струк-
тура, которая соединяется с Сц- и С§-генами, может
реаранжироваться для соединения с другим геном
С-области, таким как Су, Са или Се. Этот феномен на-
зывается переключением класса. В результате В-
клетка, синтезирующая IgM и IgD, теперь может син-
тезировать антитела иного изотипа (IgG, IgA или IgE),
но с той же антигенной специфичностью.
8. Разнообразие специфичностей антител достига-
ется:
• множеством наследуемых генов для V-областей
L- и Н-цепей;
• реаранжировкой V-, D- и J-сегментов в разных
комбинациях и случайным набором Н- и L-цепей;
• разнообразием соединений и вставок, формиру-
ющихся при соединении V-, D- и J-генных сегментов;
• соматическим гипермутагенезом, который впер-
вые встречается после антигенной стимуляции и при-
водит к отбору мутаций, придающих антителам более
высокую аффинность к антигену;
• конверсией соматических генов у разных видов,
исключая человека и мышь. Короткие последователь-
ности ДНК из неаранжированных генов копируются в
реаранжированную VDJ-генную структуру.
Эти механизмы позволяют с помощью неболь-
шого числа генов сформировать огромное количе-
ство молекул антител разной антигенной специфич-
ности.
ТЕСТЫ
Выберите ОДИН НАИБОЛЕЕ ПРАВИЛЬНЫЙ ответ
на каждый тест.
1. В В-клетке, продуцирующей 1дС2-антитела к
дифтерийному анатоксину, ДНК для Н-цепи имеет
следующую структуру: 5'-V17 D5J2 СУ2-СУ4-Се-Са2-3'. Для
перехода от эмбриональной ДНК к ДНК этой В-клетки
требуется следующее число отдельных реаранжи-
ровок:
а) 1;
б) 2;
в) 3;
г) 4;
д) ни одной.
2. Если бы было 50 V-, 20 D- и шесть J-сегментов,
способных кодировать тяжелую цепь, и 40 V- и пять
J-генов, способных кодировать легкую цепь, можно
было бы иметь максимальный набор:
а) из 76 + 45 = 121 специфичностей антител;
б) 76-45 = 3420 специфичностей;
в) (40-5) + (50-20-6) = 6200 специфичностей;
г) (40-5)(50-20-6) = 1200000 специфичностей;
д) более 1 200000 специфичностей.
3. Антигенная специфичность определенной
В-клетки:
а) индуцируется взаимодействием с антигеном;
б) определяется только последовательностью лег-
кой цепи;
в) определяется последовательностями вариабель-
ной области Н + L-цепи;
г) изменяется после переключения изотипа;
д) определяется константной областью Н-цепи.
4. Если бы вы могли провести анализ плазмати-
ческой клетки, образующей антитело IgA, на молеку-
лярном уровне, вы бы не обнаружили:
а) последовательности ДНК для V-, D-, J-генов,
транслоцированных рядом с ДНК Са-экзона;
б) иРНК, специфичную или для к-, или для Х-лег-
ких цепей;
в) иРНК, специфичную для J-цепей;
г) иРНК, специфичную для ц-цепей;
д) последовательность ДНК, кодирующую Т-кле-
точный рецептор для антигена
5. Способность одной В-клетки одновременно экс-
прессировать молекулы как IgM, так и IgD на своей
поверхности обусловлена:
а) аллельным исключением;
б) переключением изотипа;
в) одновременным распознаванием двух разных
антигенов;
г) избирательным сплайсингом РНК;
д) использованием генов из обеих родительских
хромосом.
6. Укажите верное утверждение, касающееся орга-
низации lg-генов:
а) V- и J-гены эмбриональной ДНК уже подверг-
лись реаранжировке;
б) гены легкой цепи подвергаются дальнейшей ре-
аранжировке после экспрессии поверхностного IgM;
в) Ун-генные сегменты могут реаранжироваться с
JK- или J^-генными сегментами;
г) VDJ-сегменты, кодирующие lg \/н-области, ассо-
циируются с разными генами константной области тя-
желой цепи;
д) после того как произошло VDJ-соединение, тре-
буется дальнейшая реаранжировка, чтобы поместить
VDJ-структуру рядом с См-геном.
7. Достижению разнообразия В-клеточных рецеп-
торов антигена не способствует:
а) множество V-генов в зародышевой линии;
б) случайный набор легких и тяжелых цепей;
в) неточная рекомбинация V- и J- или V-, D- и J-
сегментов;
г) наследование множества генов С-области;
д) соматическая гипермутация.
ТЕСТЫ
111
8. Укажите неверное утверждение, касающееся
экспрессии lg на В-клетке:
а) легкие цепи IgM и IgD имеют идентичные ами-
нокислотные последовательности;
б) константные области тяжелых цепей IgM и IgD
имеют разные аминокислотные последовательности;
в) IgM и IgD имеют разную антигенную специфич-
ность;
г) если пролиферация и дифференцировка В-клет-
ки в антителосекретирующую плазматическую клетку
запускается антигеном и сигналами, исходящими от
Т-клетки, то эта клетка может потенциально секрети-
ровать антитела IgG, IgE или IgA.
9. В изменении антигенсвязывающего центра В-
клетки после антигенной стимуляции играет роль:
а) множественность J-сегментов;
б) комбинаторное разнообразие;
в) разнообразие зародышевой линии;
г) соматический гипермутагенез;
д) дифференциальный сплайсинг первичных транс-
криптов РНК.
СИТУАЦИОННАЯ ЗАДАЧА
Вы являетесь членом исследовательской группы,
изучающей племя, обнаруженное в отдаленном райо-
не Новой Гвинеи. Вам удалось сделать удивительное
открытие — у представителей этого племени имеются
только два V-гена для легкой цепи и три V-гена для
тяжелой цепи иммуноглобулинов. Тем не менее люди
чувствуют себя здоровыми и могут противостоять
многим патогенам, эндемичным для данного района.
Предположите, чем это можно объяснить.
ОТВЕТЫ НА ТЕСТЫ
1 — в. Необходимы три реаранжировки ДНК. Сна-
чала появляется реаранжировка D5->J2 с последу-
ющей V17-»D5J2. Это запускает синтез молекул IgM и
IgD за счет использования V17D5J2. Третья реаранжи-
ровка — это переключение класса V17D5J2CgC6 в
V17D5J2CY2, что приводит к синтезу молекул lgG2.
2 — д. Если число 1 200000 является произведе-
нием всех возможных комбинаций генов, то вполне
возможно получить еще большее число специфично-
стей антител в результате неточных рекомбинаций
VJ- или VDJ-сегментов, вставки разных нуклеотидов и
соматического гипермутагенеза.
3 — в. Антигенная специфичность определяется
последовательностями и, соответственно, структурой,
образованной комбинацией вариабельных областей
тяжелой и легкой цепей.
4 — г. Как следствие реаранжировки VDJ к Са в
клетке, продуцирующей IgA, произойдет делеция См-ге-
на. В клетке можно будет наблюдать другие последо-
вательности ДНК и виды иРНК.
5 — г. Одновременный синтез IgM и IgD возможен
за счет альтернативного сплайсинга первичного транс-
крипта РНК 5'-VDJ-CM-Cs-3', что приводит к образова-
нию VDJCM- или VDJC5-PHK.
6 — г. Это является основой для переключения
изотипа или класса.
7 — г. Наличие множества генов Сн-области хотя и
является основой функционального разнообразия,
тем не менее не способствует разнообразию антиген-
специфичных рецепторов.
8 — в. Иммуноглобулины М и D, экспрессируемые
на одной В-клетке, используют одни и те же V(D)J-reH-
ные структуры тяжелой и легкой цепей и поэтому
имеют одинаковую антигенную специфичность.
9 — г. Из описанных механизмов достижения раз-
нообразия молекул lg только соматическая гиперму-
тация влияет на антигенсвязывающий центр после
антигенной стимуляции.
ОТВЕТ НА СИТУАЦИОННУЮ ЗАДАЧУ
Несмотря на небольшое количество генов V-обла-
сти, у представителей этого племени сохраняются
другие механизмы генерирования разновидностей ге-
нов их антител. К этим механизмам относятся: нали-
чие нескольких J- и D-сегментов в зародышевой ли-
нии, разнообразие межсегментных участков из-за де-
леции (удаления) или инсерции (вставки) оснований,
случайный набор Н- и L-цепей и соматический гипер-
мутагенез. Таким образом, несмотря на ограниченный
набор V-генов, эти люди обладают достаточным раз-
нообразием специфичностей антител для того, чтобы
выжить.
Глава
БИОЛОГИЯ В-ЛИМФОЦИТА
* ВВЕДЕНИЕ
В гл. 6 мы достаточно подробно обсудили, каким
образом у В-лимфоцитов создается огромное ко-
личество вариантов антигенной специфичности
Именно этой вариабельностью объясняется одна
из основных характеристик адаптивного иммун-
ного ответа, которая рассматривалась в гл. 1 (опи-
сание см. в подразделе «Клонально-селекционная
теория»), — разнообразие, т.е. способность реаги-
ровать на разные антигенные детерминанты —
эпитопы, даже если индивидуум никогда прежде
не встречался с ними.
Среди других важных характеристик адап-
тивного иммунного ответа можно назвать следу-
ющие:
• специфичность — способность различать эпи-
топы;
• память — способность вспоминать предыдущий
контакт с определенным антигеном таким об-
разом, что повторный контакт ведет к разви-
тию более быстрого и эффективного иммун-
ного ответа, чем первичный;
• различение «своего» и «чужого» — способность
реагировать на антигены, которые являются
«чужими» или «не своими», чтобы избежать
реакций на собственные, принадлежащие орга-
низму, антигены.
Эта глава посвящена биологии В-лимфоцитов —
клеток, синтезирующих антитела в ответ на дей-
ствие антигенов.
Рассматриваются основные этапы развития
В-клетки и то, каким образом она приобретает
свои характерные черты, связанные с адаптивным
иммунным ответом: разнообразие, специфичность,
память и способность к распознаванию «своего»
и «чужого».
* МЕСТА РАННЕЙ
ДИФФЕРЕНЦИРОВКИ
В-КЛЕТОК
Пониманию процесса дифференцировки В-клеток
способствовали исследования на животных, в ко-
торых была возможность манипулировать их эмб-
риональным развитием. По этой причине особен-
но хорошо изучена дифференцировка В-клеток у
цыплят и млекопитающих.
Многие этапы процесса дифференцировки
В-клеток являются общими для людей, цыплят и
мышей.
Название «В-лимфоциты» появилось во вре-
мя первых опытов с птицами: было показано, что
для синтеза антитела необходим орган, называе-
мый фабрициевой сумкой (карман из эпителия
клоаки).
Хирургическое удаление фабрициевой сумки
предотвращало синтез антител. Поэтому клетки,
превращающиеся в зрелые антителопродуциру-
ющие клетки, стали называться бурсазависимы-
ми или В-клетками.
В отличие от птиц у млекопитающих такой
фабрициевой сумки нет, а дифференцировка В-
клеток происходит в некоторых определенных
участках.
Предшественники В-клеточной линии об-
наруживаются на ранних стадиях развития пло-
да в ряде мест, в том числе печени. Позднее по
мере развития плода и в течение всей дальней-
шей жизни основным лимфоидным органом, в
котором происходит дифференцировка В-кле-
ток, является костный мозг. В связи с этим ко-
стный мозг рассматривается как первичный лим-
фоидный орган, в котором дифференцируются
В-лимфоциты у человека и других млекопитаю-
щих (см. гл. 2).
ОНТОГЕНЕЗ В-ЛИМФОЦИТОВ
113
• ОНТОГЕНЕЗ В-ЛИМФОЦИТОВ
Начальные фазы дифференцировки
В-клеток: про- и пре-В-клетки
На рис. 7.1 показаны основные стадии процесса
дифференцировки В-клеток. Многие из них опре-
деляются специфическими реаранжировками ге-
нов 1g, что было описано в гл. 6.
В-лимфоциты возникают из гемопоэтических
стволовых клеток. Адгезивные взаимодействия со
стромой костного мозга, нелимфоидными клет-
ками, формирующими каркас, или матрицу, для
костного мозга, а также действие цитокина IL-7
обеспечивают поступление сигналов, способству-
ющих выживанию и усиливающих пролиферацию
клеток В-линии на ранних стадиях. Самой пер-
вой из определяемых клеток В-линии является
так называемая про-В-клетка. у которой сегмент
Он-гена тяжелой цепи реаранжируется к сегмен-
ту JH-rena. На следующей стадии пре-В-клетки
сегменты Ун-гена тяжелой цепи реаранжируют-
ся, чтобы соединиться с реаранжированными
ОнЛн-сегментами, сформировав VDJ-структуру.
После реаранжировки VDJ размещается рядом с См
(см. рис. 6.4), и пре-В-клетка синтезирует ц-пепь.
Реаранжировки гена Ig во время этих ранних
фаз дифференцировки В-клеток происходят в за-
данном порядке, как было описано в гл. 6. Пер-
воначальные реаранжировки D —J в про-В-клет-
ках происходили на обеих хромосомах в локусах
Н-цепи одновременно. Хромосома, на которой
происходит продуктивная DJ-реаранжировка, да-
лее реаранжирует V-генный сегмент к DJ-струк-
туре. Если эти реаранжировки продуктивны, хро-
мосома производит ц-цепь, а на другой хромосо-
ме прекращается реаранжировка в локусе Н-цепи
Если V—DJ-реаранжировка не продуктивна на
первой хромосоме, она тем не менее происходит
на другой хромосоме. Если реаранжировка про-
дуктивна на второй хромосоме, тогда данная хро-
мосома продуцирует p-цепь. Если ни одна из этих
реаранжировок не продуктивна, клетка умирает
посредством апоптоза, также называемого про-
граммируемой смертью клетки.
Основной чертой пре-В-клетки является то, что
она экспрессирует ц-цепь в качестве трансмемб-
ранной молекулы на своей поверхности вместе с
продуктами двух нереаранжируемых генов, назы-
ваемых Х5 и V-npe-B; оба функционируют вместе
как суррогатные легкие цепи. На рис. 7.2, А пока-
зано, что ц-цепь и суррогатные легкие цепи экс-
прессируются на поверхности пре-В-клетки вме-
сте с двумя трансмембранными молекулами: Iga
(CD79a) и /gP (CD79b), которые тесно связаны
друг с другом дисульфидной связью. Комплекс из
ц-цепей и суррогатных легких цепей в соедине-
нии с Iga и Igp называют пре-В-клеточным ре-
цептором (npe-BCR).
Иммуноглобулины аир ассоциируются с мемб-
ранными молекулами [g на всех клетках В-кле-
точной линии: от пре-В-клетки до В-клетки па-
мяти (см. рис. 7.1). Комплекс Iga и Igp, ассоции-
рованный с мембранными молекулами Ig более
зрелых клеток В-лимфоцитарной линии, называ-
ется В-клеточным рецептором (BCR); он пока-
зан на рис. 7.2, Б. Иммуноглобулины а и р не
Стволовая Про-В Пре-В
клетка
Незрелая В Зрелая В В-клетка
памяти
VL
(к или X)
V(D)L-реаранжировка
гена
Dh-Jh Vh-DhJh
Мембранная
экспрессия Ig
ц + Суррогатные IgM
легкие цепи
IgM + IgD Переключение
изотипа на
IgG, IgA
или IgE
Мембранная
экспрессия
отсутствует —
секретируется IgM
или после
переключения
изотипа IgG,
IgA или IgE
• Рис. 7.1. Путь дифференцировки В-лимфоцитов Пунктирными линиями на пре-В-клетке показаны суррогатные легкие цепи
Две сплошные линии, ассоциированные с тяжелой цепью поверхности клетки, представляют сигнальные молекулы Iga и Igp
114
ГЛАВА 7. БИОЛОГИЯ В-ЛИМФОЦИТА
• Рис. 7.2. (А) Пре-В-клеточный рецептор (пре-
BCR). (Б) В-клеточный рецептор (BCR). Тяжелой це-
пью пре-BCR является ц-цепь; тяжелой цепью BCR
может быть ц-, 8-, у-, а- или е-цепь Иммунорецеп-
торная тирозинсодержащая активационная после-
довательность (мотив) (ITAM), описываемая далее
в этой главе, изображена как прямоугольник в по-
липептидах Igoe и IgP
связываются с антигеном. Их функция — переда-
вать сигналы ядру клетки, что ведет к изменению
структуры экспрессируемых генов, в связи с чем
Iga и IgP относят к молекулам, передающим сиг-
нал, ассоциированным с пре-BCR и BCR. Как
показано в гл. 8 и 10, молекулы, передающие сиг-
нал, также ассоциированы с антигенспецифичным
рецептором, экспрессируемым на разных стадиях
развития Т-лимфопита.
На зрелых В-клетках роль Iga и IgP в BCR за-
ключается в передаче сигналов после того, как ан-
тиген свяжется с вариабельным доменом поверх-
ностного 1g (более детально обсуждается в гл. 10).
Однако свидетельства того, что пре-BCR связы-
вается с антигеном, отсутствуют. Данные скорее
указывают на то, что Iga и IgP, ассоциированные
с пре-BCR, сообщают клетке, что она успешно
реаранжировала гены Н-цепи 1g и создала функ-
Связанный с клеткой
аутоантиген Растворимый
Редактирование рецептора =
= реактивация У(ОЦ-рекомбинации
I
В-клетка с рецептором
для неаутологичного антигена
• Рис. 7.3. Взаимодействие незрелой В-клетки с ауто-
антигенами
циональную ц-цепь. В результате этого сигнала
клетка, экспрессирующая пре-BCR, дифференци-
руется дальше: пролиферирует, прекращает син-
тез суррогатных легких цепей, начинает реаран-
жировку гена L-цепи и прекращает дальнейшую
реаранжировку гена Н-цепи.
Реаранжировка легкой цепи в более поздних
фазах развития пре-В-клетки также последователь-
на: гены к-пепи реаранжируются первыми, но если
ни одна из хромосом, кодирующих к-пепи. ус-
пешно не реаранжируется. происходит реаранжи-
ровка Х-гена. (Если не происходит продуктивной
реаранжировки L-цепи, клетка погибает.) Как
указано в гл. 6, биологическим следствием исполь-
зования генов только одной хромосомы для про-
изводства Н- и L-цепи (аллельного исключения)
является то, что отдельная В-клетка экспрессиру-
ет на своей поверхности молекулу 1g, специфич-
ную только к одному определенному антигену.
Незрелые В-клетки
На следующей стадии дифференцировки В-кле-
ток L-цепи составляют пары с ц-цепями, форми-
руя мономерный IgM, который вставляется в мемб-
рану. Клетка, несущая только мономерный IgM в
качестве антигенспецифичного рецептора, отно-
сится к незрелым В-клеткам. Первые эксперимен-
ты показали, что незрелая В-клетка может рас-
познавать и отвечать на чужеродный антиген, но
это взаимодействие приводит скорее к длитель-
ной инактивации, чем к клональной пролифера-
ции и дифференцировке. Более поздние исследо-
вания показали, что незрелая В-клетка может вза-
имодействовать с аутологичными молекулами в
костном мозге, что также может привести к ее
инактивации. Такое взаимодействие аутологичных
молекул и В-клеток играет важную роль в уста-
новлении аутотолерантности у клеток В-линии.
поскольку предотвращает развитие потенциаль-
но аутореактивных клеток.
На рис. 7.3 показаны два варианта развития
аутотолерантности. Если незрелая В-клетка ветре-
ОНТОГЕНЕЗ В-ЛИМФОЦИТОВ
115
чается с собственной молекулой, экспрессируе-
мой на поверхности клеток костного мозга, она
погибает посредством апоптоза (делеция). Напро-
тив, если незрелая В-клетка встречается с моле-
кулой, не находящейся на поверхности клетки
(растворимый антиген) в костном мозге, она инак-
тивируется, но не устраняется, а, как говорится,
становится анергичной (Делеция и анергия опи-
саны в гл. 12.) Инактивацию незрелых В-клеток,
обладающих потенциальной аутореактивностью
при взаимодействии с аутологичными молекула-
ми, называют негативной селекцией. Как указано
в гл. 8, развивающиеся Т-лимфоциты также про-
ходят через негативную селекцию в процессе диф-
ференцировки в тимусе.
На рис. 7.3 также изображен и третий возмож-
ный исход взаимодействия незрелой В-клетки с
аутологичной молекулой, а именно реактивация
клеточной V(D)J-рекомбиназы — феномен, извест-
ный как редактирование рецептора (см. гл. 6).
Вследствие этого гены L-цепи 1g проходят вто-
ричную реаранжировку, используя переаранжи-
рованные V- и J-элементы. Например, в показан-
ной на рис. 6.3 клетке, реаранжируюшей свой
к-локус, Vi и J5 являются переаранжированными
генами, которые могут быть использованы для по-
вторной реаранжировки Редактирование рецеп-
тора может привести к появлению специфично-
сти к «чужому» антигену, и незрелая клетка та-
ким образом «спасется» от инактивации.
Зрелые В-клетки
Следующая фаза в процессе дифференцировки
В-клеток — развитие зрелых IgM4gD- В-клеток.
Считается, что в основном развитие происходит
в костном мозге и, возможно, вторичных лимфо-
идных органах. Сигналы, которые направляют
дифференцировку IgM+-B-KneTOK к IgM+IgD+-CTa-
дии, неизвестны. Иммуноглобулины М и D, экс-
прессируемые на одной В-клетке, обладают оди-
наковой антигенной специфичностью, что явля-
ется результатом альтернативного сплайсинга од-
ного вида РНК, транскрибируемой с VDJ, плюс
ц- и 8-генов (обсуждается в гл. 6). Функция IgD
не вполне ясна. Как указано в гл. 4, В-клетки,
экспрессирующие IgD, не производят антител,
реагирующих с компонентами собственного орга-
низма. Таким образом, экспрессирование IgD
может служить сигналом для «глушения» таких
аутореактивных клонов.
Синтез антител и переключение класса
Взаимодействие антигена со зрелой IgM+IgD+-B-
клеткой обычно приводит к активации в отличие
от описанной ранее инактивации при взаимодей-
ствии антигена с незрелой ^М+-В-клеткой. В ос-
новном они взаимодействуют во вторичных лим-
фоидных органах, лимфатических узлах и селе-
зенке. Большинство антигенов, особенно белки,
называют тимусзависимыми, поскольку для того
чтобы В-клетки синтезировали антитела, необ-
ходимы хелперные Т-клетки (см. гл. 10). Перво-
начальное взаимодействие антигена, хелперных
Т-клеток и зрелых В-лимфоцитов осуществляет-
ся на границе В- и Т-зависимых областей вто-
ричного лимфоидного органа. В-клетки увели-
чиваются (и называются теперь В-клеточными
бластами) и пролиферируют. Некоторые из ак-
тивированных В-клеток могут дифференциро-
ваться далее в специализированную конечную
стадию — плазматические клетки, которые спо-
собны синтезировать и секретировать антитела
(показано справа на рис. 7.1). Антитела, секре-
тируемые отдельной плазматической клеткой,
обладают той же антигенной специфичностью,
что и 1g на поверхности В-клетки, которая изна-
чально была активирована антигеном. Плазма-
тические клетки не экспрессируют мембранные
формы 1g.
Антитела класса IgM синтезируются на ранних
стадиях иммунного ответа. Позднее потомство
IgM+IgD+-B-KJieTOK, которые первоначально реа-
гировали на антиген, может продуцировать анти-
тела разных изотипов. Это переключение класса
(изотипа), механизм которого описан в гл. 6, про-
исходит в результате синтеза цитокинов, выраба-
тываемых хелперными Т-клетками, и контактно-
го взаимодействия В- и Т-клеток (более полно
описано в гл. 10). Соответственно, IgM+IgD+-B-
клетки переключаются на синтез молекул IgA, IgG
или IgE. Какой бы изотип 1g ни продуцировался,
все дочерние клетки обладают одинаковой анти-
генной специфичностью.
Созревание аффинности
и формирование клеток памяти
Еще позднее в процессе иммунного ответа на ти-
мусзависимые антигены некоторые из активиро-
ванных В-клеток формируют во вторичном лим-
фоидном органе специализированный участок —
так называемый зародышевый центр (см. рис. 2.9
и 7.4). На рис. 7.4 показано, что зародышевый
центр преимущественно состоит из активирован-
ных В-клеток, меньшего количества Т-клеток и
небольшого числа специализированных клеток,
называемых фолликулярными дендритными клет-
ками, которые удерживают антиген на своей по-
верхности и презентируют его В-клеткам.
На рис. 7.4 показано также, что зародышевый
центр является местом интенсивной пролифера-
ции В-клеток. Во время этого значительного уве-
личения их первоначальной популяции В-клетки
с мутациями в вариабельной области генов 1g по-
являются с гораздо большей частотой, чем обыч-
но. Этот соматический гипермутагенез (упоми-
нается в гл. 6) приводит к появлению В-клеток.
чьи гены вариабельных областей 1g могут синте-
зировать антитела с более высокой аффинностью
116
ГЛАВА 7. БИОЛОГИЯ В-ЛИМФОЦИТА
Соматический
гипермутагенез
V-генов Ig — селекция
В-клеток с высокой
аффинностью
к антигену
Плазматическая
клетка
В-клетка
памяти
• Рис. 7.4. Развитие В-клеток в зародышевом центре:
соматический гипермутагенез, созревание аффинно-
сти и формирование В-клеток памяти
к активирующему антигену, чем был у первона-
чальной В-клетки, активированной антигеном.
Недавние наблюдения дают основания полагать,
что гипермутагенез возникает в результате дей-
ствия фермента, индуцируемого при активации
В-клеток. В гене V-области Ig фермент превра-
щает цитозин в урацил; попытки исправить это
«неправильное основание» с помощью «механиз-
мов восстановления» в клетке часто приводят к
ошибкам и появлению мутаций.
В-клетки, у которых повышена аффинность
генов V-области, селектируются для создания кло-
на и размножаются в зародышевом центре, в то
время как В-клетки без мутаций в V-областях не
проходят селекцию и погибают. Таким образом,
соматический гипермутагенез приводит к увели-
чению продукции антител, обладающих высокой
аффинностью к определенному антигену, — фе-
номен, известный как созревание аффинности.
В этих клетках также может происходить пере-
ключение изотипа. В-клетки, прошедшие этап се-
лекции в зародышевом центре, покидают лимфо-
идный орган и продуцируют антитела того клас-
са, который необходим.
В-клетки, активированные в зародышевом цент-
ре, в процессе дифференцировки также могут ста-
новиться В-клетками памяти (см. также рис. 7.1),
которые покидают лимфоидный орган и переме-
щаются в ткани. Как именно В-клетки развива-
ются в зародышевом центре, в настоящее время
не ясно, но считается, что плазматические клет-
ки не становятся клетками памяти. В-клетки па-
мяти являются непролиферирующими, обычно
долгоживущими клетками, которые могут быть
активированы в процессе последующего (повтор-
ного) более быстрого ответа на антиген. Эти клет-
ки экспрессируют на своей поверхности изоти-
пы, отличные от IgM и IgD, а именно IgG, IgA и
IgE. В-клетки памяти, похоже, не экспрессируют
на своей поверхности особых молекул, отлича-
ющих их от наивных или активированных зрелых
В-клеток, зато экспрессируют более высокие уров-
ни CD44, чем другие В-клетки; CD44 участвует в
адгезии лимфоцитов к клеткам вне лимфатиче-
ского узла.
Общим результатом описанных этапов диф-
ференцировки является то, что организм созда-
ет постоянно пополняемую библиотеку В-кле-
ток разной специфичности (репертуар), направ-
ленных против огромного множества антигенов.
Таким образом, ответ на действие антигена за-
висит от взаимодействия антигена с существу-
ющим клоном В-клеток, содержащихся в дан-
ной библиотеке. Однако большинство В-клеток
из этого огромного репертуара за время своего
существования никогда не взаимодействуют с
антигеном. Неактивированные зрелые IgM+IgD+-
В-клетки находятся в течение примерно 4 — 5 мес
в селезенке, где хранятся как покоящиеся лим-
фоциты.
МЕМБРАННЫЕ БЕЛКИ В-КЛЕТОК
117
Анатомическое распределение
В-клеток
Как говорилось ранее, дифференцировка В-кле-
ток на ранних этапах происходит в костном моз-
ге. Зрелые В-клетки током крови перемещаются
во вторичные лимфоидные органы, преимуще-
ственно лимфатические узлы, селезенку и пей-
еровы бляшки кишечника. Если В-клетка не вза-
имодействует с антигеном, она или покидает лим-
фоидный орган через лимфатические сосуды и
продолжает циркулировать, или погибает в нем.
Если В-клетка взаимодействует с антигеном и
хелперными Т-клетками, формируется зародыше-
вый центр, как указано ранее. Те В-клетки, кото-
рые превратились в плазматические клетки, сек-
ретирующие IgG, через лимфатическую систему
мигрируют в костный мозг и продолжают синте-
зировать 1g. Плазматические клетки, секретиру-
ющие IgA, находятся в ткани слизистой оболоч-
ки. Миграция наивных В-клеток во вторичные
лимфоидные органы, а В-клеток, активированных
антигеном, и В-клеток памяти в другие ткани
управляется посредством разных типов хоминг-
взаимодействия, описанными в гл. 8 и 9, посвя-
щенных Т-клеткам.
В-1-клетки
Описанные ранее этапы дифференцировки фор-
мируют популяцию В-клеток, доминирующую в
крови, лимфе и вторичных лимфоидных органах.
Эти В-клетки являются В-2-клетками. Вторая
популяция В-клеток, называемая В-1-клетками,
описана у людей, мышей и других животных.
У взрослых особей в селезенке и лимфатических
узлах В-1-клетки представляют минорную (мень-
шую в количественном отношении) популяцию,
но преобладают в перитонеальной и плевральной
полостях. Как в действительности взаимосвязаны
В-1- и В-2-клетки, до конца не выяснено. Похо-
же, В-1-клетки используют ограниченный набор
V-генных сегментов для формирования своего
репертуара. Для большинства, но не всех В-1-кле-
ток характерна поверхностная экспрессия моле-
кул CD5, которые не экспрессируются на В-2-клет-
ках. CD5+-B-1-клетки преобладают при хрониче-
ском лимфоцитарном лейкозе (см. гл. 17).
При попадании в организм разных типов бак-
терий на ранней стадии первичного ответа В-1-
клетки синтезируют преимущественно низкоаф-
финные полиспецифичные (т.е. обладающие ре-
активностью относительно многих разных анти-
генов) антитела IgM. Они осуществляют так на-
зываемый тимуснезависимый ответ на бактери-
альные полисахариды (см. гл. 10), т.е. не нуждают-
ся в Т-хелперах, чтобы синтезировать антитела.
В-1-клетки синтезируют IgM и малые количества
(если вообще синтезируют) 1g других изотипов.
По этим причинам считается, что В-1-клетки важ-
ны в качестве первой линии обороны против мно-
гих патогенов, особенно в иммунной системе слизи-
стых оболочек. Кроме того, полагают, что В-1-клет-
ки отвечают за синтез большинства «естествен-
ных» антител, которыми являются в основном
антитела IgM, обнаруживаемые у индивидуума в
отсутствие примирования антигеном.
* МЕМБРАННЫЕ БЕЛКИ В-КЛЕТОК
Главной особенностью В-клеток является способ-
ность синтезировать антитела после стимуляции
антигеном. Продукция антител В-клетками, как
будет более детально описано в следующих гла-
вах, является многоступенчатым процессом, тре-
бующим тесного взаимодействия В- и Т-клеток.
В следующих подразделах и на рис. 7.5 кратко
Поверхность
В-клетки
IgH + L
(CD79a/CD79b)
В-клеточный рецептор для антигена (BCR)
lg H + L: антигенсвязывающие компоненты
Iga + Ig₽: молекулы, передающие сигнал, которые
ассоциированы с 1g Н-цепью
CD19
CD81
В-клеточныи корецептор
Молекулы, передающие добавочные сигналы,
ассоциированные с BCR
• Рис. 7.5. Важные молекулы, экспрес-
сируемые на поверхностной мембране
зрелой В-клетки
МНС II класса
CD40
В7 (CD80
и CD86)
CD32
Презентация процессированного пептида CD4+-
T-клеткам; связывание с TCR и CD4
Взаимодействие с CD 154 (CD40L) на Т-клетке,
вызвающее переключение класса антител
Костимуляторные молекулы: взаимодействуют
с CD28 и CD 152 (CTLA-4) на Т-клетке
Низкоаффинный Fc-рецептор для IgG (FcyRIIb)
118
ГЛАВА 7. БИОЛОГИЯ В-ЛИМФОЦИТА
описаны некоторые мембранные белки В-клеток,
необходимые для синтеза антител, и другие бел-
ки, обладающие важными функциями.
Антигенсвязывающие молекулы:
мембранный иммуноглобулиновый
рецептор
Наиболее важным свойством В-лимфоцитарной
линии является экспрессия цепей 1g на поверх-
ности клетки. (Заметьте, что при этом ни про-В-
клетка — самая незрелая клетка этой линии, ни
плазматическая клетка — клетка на терминаль-
ной стадии В-клеточной дифференцировки, сек-
ретирующая 1g, — не экспрессируют 1g на своей
поверхности.) Таким образом, поскольку ассоци-
ированный с мембраной 1g связывает антиген, он
может использоваться как для идентификации В-
клеток, так и для их отделения (сепарации) от
других лимфоцитов и одноядерных клеток.
Передача сигналов молекулами,
ассоциированными с мембранным
иммуноглобулиновым рецептором
Функция передающих сигналы молекул, ассоци-
ированных с BCR, более детально описана в гл. 10
в подразделе, посвященном внутриклеточным со-
бытиям, происходящим при активации В-клеток.
Здесь же кратко описаны функции некоторых
отдельно взятых молекул.
Тяжелые и легкие цепи 1g обладают очень ко-
роткими внутриклеточными доменами и непо-
средственно не передают сигнал в В-клеткучпосле
связывания с антигеном. Более вероятно, что ра-
нее описанные молекулы Igoe (CD79a) и Igp
(CD79b), нековалентно ассоциированные с Н- и
L-цепями 1g на мембране В-клеток (см. рис. 7.2),
передают сигнал активации внутрь В-клетки. Од-
ним из самых первых событий, происходящих при
активации В-клетки после связывания антигена с
BCR, является фосфорилирование (добавление
фосфатной группы) к остаткам тирозина в цито-
плазматических участках Igoc/lgp ферментами про-
теинтирозинкиназами. В Iga/IgP тирозиновые
остатки содержатся в аминокислотных последо-
вательностях, относящихся к иммунорецепторной
тирозинсодержащей активационной последователь-
ности (мотиву) (immunoreceptor tyrosine-based
activation motif — ITAM). Аминокислотная пос-
ледовательность рассматривается как мотив, по-
скольку она обнаруживается в ряде других пере-
дающих сигнал молекул на клетках иммунной
системы (например, связанных с Т-клеточными
рецепторами, описываемыми в гл. 8).
Другие молекулы на мембране В-клетки влия-
ют на сигнал, передаваемый через BCR, и таким
образом играют важную роль в его передаче внутрь
В-клетки. Гены CD19. CD81 (известный также как
ТАРА-1) и CD21 ассоциированы в комплекс, на-
зываемый В-клеточным корецептором. Связыва-
ние антигена с корецептором усиливает актива-
ционный сигнал, передаваемый через BCR. По-
этому если антиген связывается к корецептором,
требуется гораздо меньшее количество антигена,
чем при активации В-клетки только через BCR.
Корецептор со сходной функцией ассоциируется
и с Т-клеточным рецептором (описывается в гл. 8).
В В-клеточном корецепторном комплексе CD21
является рецептором для компонента комплемента
C3d, который связывается с микробными патоге-
нами (см. гл. 13). Поэтому считается, что CD21
играет большую роль в усилении В-клеточных
ответов на патогены, которые активируют каскад
комплемента. Также CD21 действует как рецеп-
тор для вируса Эпштейна — Барр, что определяет
возможность инфицирования В-клеток и их про-
лиферацию в ответ на действие вируса. Этот вирус
является возбудителем мононуклеоза и лимфомы
Беркитта в Африке (африканская лимфома).
Некоторые молекулы, экспрессированные на
поверхности В-клеток, оказывают негативное дей-
ствие при активации В-клетки. К ним относится
рецептор CD22. который отрицательно регулиру-
ет корецепторы CD 19, CD81 и CD21, а также
CD32. являющийся низкоаффинным рецептором
к Fc-фрагменту IgG (FcyRII) и экспрессирующий-
ся практически на всех зрелых В-клетках. Рецеп-
тор CD32 связывает IgG, когда его агрегация про-
исходит в отсутствие антигена (см. гл. 4) и когда
IgG находится в комплексе антиген —антитело.
Рецептор CD32 играет важную роль в осуществ-
лении антителами обратной связи — инактива-
ции В-клетки путем подачи ей отрицательного
сигнала.
Молекулы, участвующие
во взаимодействиях Т- и В-клеток
Для активации Т-клеток антиген должны пред-
ставлять антигенпрезентирующие клетки (АПК)
(подробнее см. гл. 8— 10). В-клетки, особенно ак-
тивированные, могут выступать в качестве АПК
для Т-клеток. Они обладают важными чертами,
присущими АПК.
Во-первых, В-клетки экспрессируют на своей по-
верхности белки, являющиеся молекулами главного
комплекса гистосовместимости (МНС) IIкласса
(см. гл. 9). Эти белки играют важнейшую роль в
презентировании антигена большой субпопуляции
Т-клеток, называемых СО4+-Т-клетками. В отли-
чие от образцов экспрессии на многих других клет-
ках экспрессия молекул МНС II класса на В-клет-
ках является конститутивной, т. е. эти молекулы
всегда экспрессируются Экспрессия молекул
МНС II класса на В-клетках может быть в даль-
нейшем увеличена при воздействии определен-
ТЕСТЫ
119
ных цитокинов, таких как IL-4. Молекулы МНС II
класса экспрессируются на всех клетках В-клеточ-
ной линии за исключением про-В-клеток.
Во-вторых, В-клетки экспрессируют высокие
уровни семейства молекул, известных как В7
(CD80/CD86). которые относятся к костимули-
рующим молекулам, поскольку их присутствие, как
и присутствие антигена, необходимо для актива-
ции наивных (непримированных) Т-клеток. По-
коящиеся зрелые В-клетки экспрессируют низ-
кие уровни В7 и являются слабыми АПК, тогда
как активированные В-клетки — очень эффек-
тивными.
В-третьих, В-клетки экспрессируют CD40. ко-
торый взаимодействует с CD 154 (СЭ40-лиганд —
CD40L), экспрессируемым на активированных
Т-клетках. Это взаимодействие активирует В-клет-
ки и играет основную роль в переключении изо-
типа, описанном ранее. Важность взаимодействия
CD40 — CD154 подчеркивается таким состоянием,
как Х-сцепленный гипер-IgM-синдром. У маль-
чиков с мутацией гена CD 154, у которых Т-клет-
ки либо вообще не экспрессируют, либо имеют
нефункциональные гены CD 154, вырабатывают-
ся только антитела IgM, а в их В-клетках не про-
исходит переключения на другие изотипы.
РЕЗЮМЕ
1. У млекопитающих на протяжении всей жизни
ранние стадии дифференцировки В-клеток проходят
в костном мозге Самой первой из идентифицируе-
мых клеток В-линии является про-В-клетка; на этой
стадии происходит первая реаранжировка гена
Н-цепи Ig: Он-генный сегмент реаранжируется к JH-
генному сегменту.
2. Следующая стадия представлена пре-В-клеткой,
у которой \/н-генный сегмент реаранжируется к объ-
единенным DJ-сегментам, формируя VDJ-структуру,
которая приближена Сц-гену. В пре-В-клетке блок ге-
нов VDJCM транскрибируется и транслируется, что ве-
дет к синтезу ц-цепи. Эта цепь экспрессируется на
поверхности пре-В-клетки в ассоциации с суррогат-
ными легкими цепями.
3. На поверхности пре-В-клетки ц-цепь и сурро-
гатные легкие цепи экспрессируются с двумя тесно
связанными трансмембранными молекулами: Iga
(CD79a) и IgP (CD79b). Комплекс из р- и суррогатных
легких цепей в соединении с Iga и lg(3 составляет
пре-В-клеточный рецептор.
4, На следующей стадии дифференцировки начи-
нают реаранжировать гены L-цепи; синтез суррогат-
ных легких цепей прекращается; формируется к- или
Z-цепь, которая ассоциируется с ц-цепью. Это приво-
дит к формированию молекулы IgM, которая экспрес-
сируется на поверхности клетки Такая клетка отно-
сится к незрелым В-клеткам.
5. Если незрелая В-клетка встречается с антиге-
ном, она обычно инактивируется. Взаимодействие не-
зрелых клеток с собственными молекулами организ-
ма, приводящее к инактивации или устранению кле-
ток с потенциальной аутореактивностью, — один из
важнейших путей поддержания состояния аутотоле-
рантности (негативная селекция).
6. На следующей стадии дифференцировки зре-
лые В-клетки экспрессируют IgM и IgD (с одинаковой
антигенной специфичностью) на поверхности клетки.
7. Дальнейшее развитие зрелых В-клеток проис-
ходит преимущественно вне костного мозга и опреде-
ляется контактом с антигеном. Активация В-клеток
ведет к пролиферации и дифференцировке в плазма-
тические клетки, которые синтезируют и секретируют
антитела. Во время первичного ответа после контакта
с антигеном синтезируются преимущественно IgM.
8- В-клетки, взаимодействующие с Т-клетками и
их продуктами — цитокинами, осуществляют пере-
ключение изотипа (класса), т.е. продуцируют антитела
различных изотипов: IgG, IgA, или IgE. Переключение
изотипа включает механизм реаранжировки, харак-
терный только для В-клеток: VDJ-структура тяжелой
цепи, присоединенная к Сц- и С8-генам, реаранжиру-
ется, чтобы присоединить другой ген С-области, та-
кой как CY, Са или Се. В-клетка, которая синтезирова-
ла IgM и IgD, теперь может синтезировать антитела
различных изотипов (IgG, IgA или IgE), но той же ан-
тигенной специфичности.
9- Соматический гипермутагенез генов, кодирую-
щих V-области антител, происходит в зародышевых
центрах вторичных лимфоидных органов. Это ведет к
тому, что селектируются В-клетки с мутациями в об-
ласти иммуноглобулиновых V-генов, кодирующие ан-
титела с более высокой аффинностью к антигену, чем
исходные В-клетки (созревание аффинности). Эти
отобранные В-клетки могут развиваться в В-клетки
памяти или плазматические клетки.
10. У отдельной В-клетки Н-цепь кодируется сег-
ментами гена Н-цепи, находящимися либо на мате-
ринской, либо на отцовской хромосоме; L-цепь также
кодируется сегментами гена L-цепи, находящимися
на одной или другой хромосоме. Этот феномен ис-
пользования генов только на одной хромосоме для
синтеза Н-цепи Ig называют аллельным исключением;
он обеспечивает продукцию отдельной В-клеткой Ig
только одной антигенной специфичности.
11. Экспрессия мембранной формы Ig присуща
только В-клеткам. Молекулы Iga и Igp, а также другие
молекулы, ассоциированные с мембранным иммуно-
глобулиновым рецептором, после связывания антиге-
на с Ig передают сигнал в В-клетку. Та также экспрес-
сирует на своей клеточной поверхности ряд молекул,
играющих решающую роль во взаимодействии с дру-
гими клетками, особенно Т-клетками. Такими молеку-
лами являются и молекулы МНС II класса, В7 и CD40.
ТЕСТЫ
Выберите один НАИБОЛЕЕ ПРАВИЛЬНЫЙ ответ на
каждый тест.
1. Самые ранние стадии дифференцировки В-кле-
ток:
а) наблюдаются в тимусе эмбриона;
б) требуют присутствия антигена;
в) включают реаранжировку сегментов гена к-цепи;
г) включает реаранжировку сегментов гена сурро-
гатной легкой цепи;
120
ГЛАВА 7. БИОЛОГИЯ В-ЛИМФОЦИТА
д) включают реаранжировку сегментов гена тяже-
лой цепи.
2, На поверхности В-лимфоцита экспрессируется:
a) CD40;
б) молекулы МНС II класса;
в) CD32;
г) IgM и IgD;
д) все перечисленное.
3. Из перечисленных утверждений ложным являет-
ся следующее:
а) антитела во время вторичного иммунного ответа
обычно имеют более высокую аффинность к антигену,
чем антитела, образованные во время первичного от-
вета;
б) соматический гипермутагенез генов V-области
может внести свой вклад в изменение аффинности
антител, наблюдаемое во время вторичного ответа;
в) синтез антител при вторичном ответе происхо-
дит преимущественно в крови;
г) переключение изотипа происходит в присут-
ствии антигена;
д) во время первичного ответа вырабатываются
преимущественно антитела IgM.
4, Незрелые В-лимфоциты:
а) имеют реаранжированные сегменты только D- и
J-генов;
б) являются предшественниками как Т-, так и В-лим-
фоцитов;
в) экспрессируют на своей поверхности и IgM, и IgD;
г) находятся на той стадии развития, когда контакт
с антигеном может привести к отсутствию ответа;
д) должны пройти через тимус, чтобы созреть.
5. Антиген, связывающийся с В-клеточным рецеп-
тором:
а) передает сигнал через антигенсвязывающие
цепи;
б) неизменно ведет к активации В-клетки;
в) передает сигнал через молекулы Iga и IgP;
г) приводит к активации макрофагов;
д) ведет к синтезу цитокинов, активирующих Т-клет-
ки
6. На В-клетках памяти не будет обнаруживаться:
a) Iga и lg₽;
б) тяжелые у-цепи;
в) тяжелые е-цепи;
г) суррогатные легкие цепи;
д) легкие к-цепи.
7, Зародышевые центры, находящиеся в лимфати-
ческих узлах и селезенке:
а) поддерживают развитие незрелых В- и Т-кле-
ток;
б) участвуют в удалении поврежденных эритроци-
тов из кровотока;
в) служат основным источником стволовых клеток,
способствуя этим поддержанию гемопоэза;
г) являются местами антигенной стимуляции зре-
лых В-клеток;
д) являются местами дифференцировки Т-клеток.
ОТВЕТЫ НА ТЕСТЫ
1 — д. Самые ранние стадии дифференцировки В-
клеток отмечаются в печени плода и костном мозге
взрослого человека и включают реаранжировку V-, D-
и J-генных сегментов тяжелой цепи.
2 — д. Все указанные молекулы экспрессируются
на поверхности В-клетки.
3 — в. Синтез антител при вторичном ответе про-
исходит преимущественно в лимфатических узлах, а не
в крови.
4 — г. У незрелых В-клеток, экспрессирующих
только IgM, контакт с антигеном ведет скорее к отсут-
ствию ответа, чем к активации.
5 — в. Молекулы Iga и IgP, ассоциированные с по-
верхностной молекулой lg, передают сигнал после
связывания поверхностного lg с антигеном.
6 — г. Суррогатные легкие цепи экспрессируются
только на пре-В-клеточной стадии дифференцировки.
7 — г. Зародышевые центры — это места в лимфа-
тических узлах и селезенке, где активированные антиге-
ном зрелые В-клетки пролиферируют, претерпевают
соматическую гипермутацию и окончательно дифферен-
цируются в плазматические клетки и клетки памяти.
Глава
БИОЛОГИЯ Т-ЛИМФОЦИТОВ
ВВЕДЕНИЕ
В предыдущих главах мы сосредоточили внимание
на характеристиках В-лимфоцитов и их рецепто-
ре к антигену, иммуноглобулину (1g). Молекулы
Ig, секретируемые В-клетками, и антитела игра-
ют основную роль во взаимодействии с антиге-
нами, когда они находятся вне клеток, например
когда встречаются с вирусами в крови или на
поверхности слизистой оболочки. Однако когда
антиген попадает в клетку, антитела обычно не
имеют к нему доступа и поэтому не эффективны
по отношению к антигенам внутри клеток.
Обычно считается, что Т-клетки возникают для
участия в основной фазе ответа на такие патоге-
ны, как вирусы, бактерии и паразиты, которые
проникают внутрь клеток организма. Т-клетки
реагируют в основном на белковые антигены (не-
которые исключения будут описаны в гл. 9 и 10),
поскольку белки являются либо основными ком-
понентами патогенов, либо синтезируются пато-
генами. Т-клетки играют решающую роль в отве-
те почти на все потенциально опасные агенты,
с которыми встречается индивидуум, в фазе внут-
риклеточной инфекции.
Как и В-клетки, Т-клетки экспрессируют ан-
тигенспецифичные рецепторы, которые распре-
деляются по клонам, т.е. каждый клон Т-клеток
экспрессирует Т-клеточные рецепторы (TCR) для
антигена, имеющие уникальную последователь-
ность. Огромный репертуар молекул TCR, состав-
ляющий по оценкам 1015— 1018 возможных струк-
тур, определяется той же стратегией реаранжи-
ровки V(D)J-reHOB, описанной для молекул Ig в
гл. 6. Специфические аспекты, присущие ре-
аранжировке генов TCR, более детально описаны
далее в этой главе. Структуры TCR и В-клеточ-
ного антигенного рецептора Ig, а также органи-
зация генов, кодирующих TCR и Ig, чрезвычай-
но схожи. Это сходство, или гомология, предпо-
лагает, что TCR и Ig (а в действительности и
многие другие молекулы, экспрессируемые на
поверхности клеток) возникли из общего пред-
шествующего гена. Такие гены принадлежат су-
персемейству иммуноглобулиновых генов, а моле-
кулы называются членами суперсемейства имму-
ноглобулинов.
В этой главе описаны характеристики TCR,
проведено их сравнение с характеристиками Ig и
рассказано о других важных молекулах, находя-
щихся на поверхности Т-лимфоцитов. Также опи-
саны основные этапы развития Т-клеток в тиму-
се, органе, в котором развивающиеся Т-клетки
приобретают свои антигенспецифичные рецеп-
торы.
ПРИРОДА
АНТИГЕНСПЕЦИФИЧНОГО
Т-КЛЕТОЧНОГО РЕЦЕПТОРА
Молекулы, взаимодействующие
с антигеном
Каждая Т-клетка экспрессирует на своей поверх-
ности двухцепочечную молекулу TCR, взаимодей-
ствующую с антигеном. На левой стороне рис. 8.1
показаны форма TCR, полипептидные а- и Р-це-
пи, которые экспрессируются на большинстве
зрелых Т-клеток человека и многих других видов.
Эти а- и p-цепи связаны дисульфидными мости-
ками и представляют трансмембранные глико-
протеины с короткими цитоплазматическими уча-
стками. Цепи содержат разное количество угле-
водов, поэтому молекулярная масса а- и Р-цепей
варьирует от 40 до 60 кДа.
122
ГЛАВА 8. БИОЛОГИЯ Т-ЛИМФОЦИТОВ
•— СНО (углевод)
• Рис. 8.1. Преобладающая форма антигенсвязывающих
цепей TCR, а- и p-цепи и связанный с мембраной lg с ука-
занным Fab-фрагментом
На рис. 8.1 сравнивается структура TCR со
структурой мембранного 1g. Каждая цепь TCR
состоит из вариабельной (V) и константной (С)
областей, аналогичных V- и С-областям молекул
lg. Каждая V- и С-область складывается в Ig-no-
добные домены. Более того, как и 1g, V-области
TCR содержат гипервариабельные участки или
участки, определяющие комлементарность (CDR1,
2, 3), которые формируют антигенсвязывающий
центр.
Структуры TCR и 1g обладают, однако, несколь-
кими важными различиями.
• Валентность и конформация. Т-клеточный ре-
цептор является двухцепочечной структурой,
формирующей один антигенсвязывающий
центр. Таким образом, TCR является монова-
лентным и напоминает моновалентный Fab-
фрагмент антитела. Обширные взаимодействия
между доменами каждой цепи TCR придают
его структуре устойчивую конформацию Им-
муноглобулин. напротив, является четырехце-
• Рис. 8.2. Взаимодействие TCR с молекулярным комп-
лексом МНС-пептид
почечной молекулой с шарнирной областью и
двумя антигенсвязывающими центрами. Эти
особенности придают молекуле 1g гибкость, что
позволяет ей бивалентно связываться с анти-
генами разных форм и размеров.
• Распознавание антигена. В гл. 3 и 4 описано,
каким образом 1g связывается с разными типа-
ми антигенов (углеводами, ДНК, липидами и
белками), которые встречаются в жидкостях,
например сыворотке. Мы также указали, что
lg может реагировать на линейные и конфор-
мационные эпитопы в антигене. Таким обра-
зом, для того чтобы вызвать антительный от-
вет, необходимы определенная трехмерная
структура и аминокислотная последователь-
ность антигена.
Поскольку Т-клетки взаимодействуют с бел-
ковыми антигенами, поступающими изнутри клет-
ки, эти клетки используют антигенраспознающую
систему, отличающуюся от той, которую исполь-
зуют В-клетки. Т-клеточный рецептор взаимодей-
ствует с небольшими фрагментами белков (пеп-
тидами), которые экспрессируются на поверхно-
сти клетки организма. Эти пептиды, появляющи-
еся вследствие ферментативного расщепления
белка внутри клетки, ассоциируются с молекула-
ми главного комплекса гистосовместимости
(МНС). Таким образом, как показано на рис. 8.2,
TCR взаимодействует с пептидом, связанным с
молекулой МНС на поверхности клетки. (Роль
молекул МНС в создании эпитопов для Т-кле-
точных ответов кратко отмечалась в гл. 3 и на
рис. 3.4, а более детально будет обсуждаться в гл. 9.)
Соответственно в отличие от разнообразия струк-
тур и форм, распознаваемых молекулами 1g, ан-
тиген, распознаваемый TCR, является комбина-
цией из молекулы МНС и небольшого линейного
пептида.
По результатам кристаллографического иссле-
дования было высказано предположение, что раз-
ные участки TCR вступают в контакт с разными
частями структуры пептид — МНС. Обшей чертой
всех структур пептид — МНС — TCR, которые под-
вергались изучению, являлось то, что CDR3 Vo-
и Vp-цепей TCR взаимодействуют с двумя или тре-
мя аминокислотами в центре пептидной после-
довательности; таким образом, это взаимодей-
ствие, похоже, является решающим в обеспече-
нии специфичности связывания пептида с TCR.
В некоторых кристаллических структурах TCR
CDR1 и CDR2 Va- и Vp-цепей взаимодействует с
МНС-компонентом молекулярного комплекса
МНС —пептид, в то время как в других случаях
все три CDR взаимодействуют с МНС»
• Секреция рецептора. В отличие от lg TCR не
существует в специфической секретируемой
форме и не секретируется при активации Т-
клеток. Как описывается в гл. 10, активация
Т-клеток приводит к секреции цитокинов и/
или киллингу инфицированных клеток орга-
ПРИРОДА АНТИГЕНСПЕЦИФИЧНОГО Т-КЛЕТОЧНОГО РЕЦЕПТОРА
123
низма. Напротив, как сказано в гл. 7, после того
как антиген связывается с мембранным Ig и
активирует В-клетку, В-клетка дифференци-
руется в плазматическую клетку и секретирует
Ig с той же антигенной специфичностью, что
была характерна для В-клетки, которая перво-
начально связала антиген.
• Отсутствие изменений в TCR во время ответа
на антиген. Как указывалось в гл. 6 и 7, в пери-
од ответа на антиген молекулы Ig подвергают-
ся соматическому гипермутагенезу (что связа-
но с созреванием аффинности) и переключе-
нию класса, связывающему один из генных
наборов, кодирующих определенную V-область,
с разными генами С-области. Эти механизмы
являются уникальными для В-клеток: TCR не
изменяются в период ответа на антиген.
Корецепторные молекулы
Т-клеточные рецепторы экспрессируются на по-
верхности Т-клетки в ассоциации с другой транс-
мембранной молекулой, назвываемой корецепто-
ром. На рис. 8.3 показано, что этот корецептор
может быть одной из двух молекул на зрелой Т-
клетке: или CD4. или двухцепочечной CD8 (обе
являются членами суперсемейства Ig). Таким об-
разом, экспрессия корецептора разделяет попу-
ляцию Т-клеток на две подгруппы: CD4+ или CD8+.
(Клетка, экспрессирующая интересующий нас ген,
обозначается как «+», а неэкспрессирующая — как
«-».) Как будет описано далее в этой главе, толь-
ко незрелые Т-клетки, дифференцирующиеся в
тимусе, экспрессируют и CD4, и CD8.
Молекулы CD4 и CD8 выполняют несколько
важных функций.
• Внеклеточные части CD4 и CD8 связываются
с молекулами МНС на поверхности клетки,
представляющей антиген для Т-лимфоцита —
АПК (более полно описаны в гл. 9). Молекула
CD4 избирательно связывается с МНСIIклас-
са. a CD8 — с МНС I класса. На рис. 8.3 по-
казано, что СО4+-Т-клетки взаимодействуют
с клетками организма, экспрессирующими
пептид, ассоциированный с МНС II класса,
а СЭ8+-Т-клетки — с клетками, экспрессиру-
ющими пептид, ассоциированный с МНС I клас-
са. Это формирует основу для рестрикции
(ограничения) Т-клеточного ответа по МНС
(см. в гл. 9).
• Связывание CD4 или CD8 с молекулами МНС,
экспрессируемыми на АПК, способствует уси-
лению связи Т-клеток с АПК. Таким образом,
CD4 и CD8 действуют как молекулы адгезии
при взаимодействии Т-клеток с АПК.
• Молекулы CD4 и CD8 вовлекаются в передачу
сигнала после связывания антигена с TCR. Их
внутриклеточные части специфически связа-
ны с ферментами, известными как белковые
рецептор
• Рис. 8.3. Рецепторы TCR и их взаимодействие с молеку-
лами МНС. (A) CD4 и (Б) CD8. Обозначены все молекулы
тирозинкиназы, которые являются важными
компонентами в процессе ранней активации
Т-клеток. Более детально это обсуждается в
гл. 10.
• Уникальным свойством молекулы CD4 явля-
ется то, что с ней связывается ВИЧ. Это поз-
воляет вирусу инфицировать клетки, экспрес-
сирующие CD4, что в последующем приводит
к развитию СПИДа (см. гл. 17).
Комплекс Т-клеточного рецептора
На рис. 8.4 показано, что антигенраспознающие
а- и p-цепи также экспрессируются на поверхно-
сти Т-клеток в тесной нековалентной ассоциации
с молекулой CD3 и двумя идентичными £- (дзета)-
цепями (CD247; молекулярная масса 16 кДа).
Сочетание а- и P-цепей TCR и CD3 и £ называет-
ся Т-клеточным рецепторным комплексом анало-
гично В-клеточному рецепторному комплексу,
описанному в гл. 7.
Молекула CD3 состоит из трех разных поли-
пептидов у, 8 и 8 (молекулярной массой 25, 20 и
20 кДа соответственно). В настоящее время счи-
тается, что 8 ассоциируется как с у-, так и 8-цепя-
ми в составе комплекса (см. рис. 8.4). Поскольку
CD3 играет роль «спутника» при транспортиров-
ке вновь синтезированной молекулы TCR через
клетку к ее поверхности, она всегда находится в
ассоциации с TCR. Молекула CD3 является ин-
вариантной (т.е. она одинакова на всех Т-клет-
ках) и поскольку экспрессируется исключитель-
но на Т-клетках. может быть использована как
маркер, отличающий Т-клетки от всех остальных.
Молекула CD3 и ^-полипептиды не связыва-
ют антиген. Они являются молекулами, переда-
ющими сигнал, и активируются после того, как
антиген связывается с TCR, подобно молекулам
Iga и Igp, ассоциированным с BCR и описанным
в гл. 7. Каждая цепь комплекса CD3 имеет одну
содержащую тирозин последовательность, назы-
ваемую иммунорецепторной тирозинсодержащей
активационной последовательностью (мотивом)
(ITAM), которая также имеется в Iga и Igp; £-цепь
124
ГЛАВА 8. БИОЛОГИЯ Т-ЛИМФОЦИТОВ
Связывание антигена
• Рис. 8.4. Комплекс TCR. Т-клеточный рецептор и ассо-
циированный комплекс CD3 (у-, 6- и Е-цепи), передающий
сигнал , плюс £. Незакрашенные квадратики — ITAM
Передача
сигнала
£ £
содержит три таких последовательности. Если ан-
тиген связывается с ос- и p-цепями TCR (более
детально это будет рассматриваться в гл. 10),
ITAM, расположенные в структуре CD3 и ^-це-
пей, обеспечивают процессы ранней фазы акти-
вации Т-клеток
Другие важные молекулы,
экспрессируемые на поверхности
Т-клетки
В следующих подразделах и на рис. 8.5 кроме
молекул, ассоциированных с комплексом TCR и
Т-клеточными корецепторами, рассмотрены моле-
кулы, необходимые для функционирования Т-кле-
ток.
Костимулирующие лиганды
В гл. 7 рассказывалось об экспрессии молекул
семейства В7 (из которых больше всего известно
о молекулах В7-1 и В7-2, CD80 и CD86) на В-
клетках и других АПК. Взаимодействие В7 с CD28,
экспрессируемой зрелой Т-клеткой, обеспечива-
ет костимулирующий или второй сигнал для акти-
вации Т-лимфоцита. Костимулирующее взаимо-
действие необходимо в дополнение к взаимодей-
ствию пептид —МНС с TCR для активации наив-
ных Т-клеток (т.е. Т-клеток, которые еше не встре-
чались с антигеном). Активированные Т-клетки
также экспрессируют молекулу, близкородствен-
ную CD28, известную как CD152 (CTLA-4Y кото-
рая взаимодействует с молекулами В7, передавая
отрицательный сигнал активированной Т-клетке.
В гл. 10 взаимодействие молекул В7 с CD28 и
CD152 разобрано более детально.
Молекулы адгезии
Ранее было указано, что CD4 и CD8, экспресси-
рованные на Т-клетке, действуют и как молекулы
адгезии (молекулы, которые усиливают контакт
Т-клеток с АПК), и как молекулы, передающие
сигнал. Почти все зрелые Т-клетки экспрессиру-
ют CD2, который тоже обладает адгезивными
свойствами и способностью передавать сигналы.
У людей CD2 взаимодействуют с CD58 (LFA-3),
экспрессированными на различных клетках.
Молекулы CD2, CD4 и CD8 экспрессируются
почти исключительно на Т-клетках. Другие мо-
лекулы, называемые интегринами — семейство
двухцепочечных молекул, — экспрессируются Т-
клетками и клетками других типов. Интегрины
играют важную роль в адгезии Т-клеток к АПК и
эндотелиальным клеткам кровеносных сосудов.
Опосредованная интегринами адгезия усилива-
ется хемокинами — небольшими цитокинами,
вырабатываемыми во время воспалительных ре-
акций (см. гл. 11). Основной интегрин, экспрес-
сируемый зрелыми Т-клетками, — это LFA-1
(CDllaCD18Y который взаимодействует с некото-
рыми лигандами, включая ICAM-1 (CD54), экспрес-
сируемыми на АПК, таких как макрофаги и ден-
дритные клетки, а также на эндотелиальных клет-
ках. Активированные Т-клетки экспрессируют и
другие интегрины, такие как VLA-4 (CD49dCD29),
которые взаимодействуют с VCAM-1, экспресси-
руемыми на активированных эндотелиальных
клетках. Не ясно, участвуют ли интегрины во внут-
риклеточной передаче сигнала.
Хоминг
Т-клетки также экспрессируют на своей поверх-
ности молекулы, связанные с хомингом — изби-
ПРИРОДА АНТИГЕНСПЕЦИФИЧНОГО Т-КЛЕТОЧНОГО РЕЦЕПТОРА
125
рательным проникновением лимфоцитов разных
типов в различные ткани. Наивные Т-лимфоциты
поступают в периферические лимфатические узлы
и лимфатические скопления в слизистых оболоч-
ках. Хоминг опосредуется связыванием молекул
CD62L (L-селектин или MEL-14), экспрессируе-
мых на поверхности наивных Т-клеток, с гликоп-
ротеиновыми молекулами адресатами, которые
экспрессируются на клетках в определенном уча-
стке сосудистого эндотелия на границе лимфатиче-
ских узлов. Это взаимодействие запускает даль-
нейшие парные взаимодействия, которые приво-
дят к тому, что наивные лимфоциты покидают
кровоток и поступают в лимфатический узел, про-
тискиваясь через тесно прилегающие друг к другу
эндотелиальные клетки. Как будет более деталь-
но описано в гл. 10, активированные антигеном
лимфоциты и Т-клетки памяти выходят из лим-
фатических узлов и поступают в участки кожи и
другие ткани. Этот процесс опосредуется путем
снижения на поверхности клетки экспрессии
CD62L и повышения экспрессии других молекул,
таких как CD44 и интегрин CD49dCD29 (VLA-4),
описанный ранее.
Недавние наблюдения указывают, что наивные
лимфоциты и Т-клетки памяти отличаются по
экспрессии не только молекул хоминга, но и хе-
мокиновых рецепторов. Таким образом, различия
в экспрессии как молекул хоминга, так и хемо-
киновых рецепторов приводят к появлению раз-
личных субпопуляций Т-клеток, избирательно
мигрирующих в разные участки тела.
у§- Т-клетки
Некоторые Т-клетки экспрессируют TCR, отлич-
ный от оср. Этот альтернативный TCR известен
как у8, а клетки, экспрессирующие этот рецеп-
тор, называют у8-Т-лимфоцитами. Вместе с у8-
цепями TCR экспрессируются CD3 и (Заметь-
те, что у8-цепи TCR отличаются от у- и 8-цепей
CD3.) Обычно у у8-клеток отсутствует корецеп-
торная молекула CD4, имеющаяся на Т-клетках,
экспрессирующих ocf}, но некоторые у8-клетки эк-
спрессируют CD8.
У взрослых людей в норме у8-Т-клетки наблю-
даются в значительно меньшем количестве, чем
«р-клетки, но их число возрастает при встрече с
инфекционными агентами. у8-Т-клетки присут-
ствуют у всех млекопитающих в той или иной
степени; в периферической крови жвачных, на-
пример коровы и оленя, могут отмечаться более
высокие уровни циркулирующих у8-Т-клеток, чем
«р-Т-клеток.
Линии ар- и у8-клеток разделяются на ранних
стадиях развития в тимусе, но о фазах у8-Т-кле-
Поверхность
Т-клетки
Т-клеточный рецептор для антигена, а + р
Передающие сигнал молекулы,
ассоциированные с TCR
Корецепторная молекула
CD4 или CD8
CD28
CD152
(CTLA-4)
CD154
(CD40L)
CDlla/CD18
(LFA-1)
CD49d/CD29
(VLA-4)
CD2
CD62L
Лиганды для костимулирующих молекул В7
экспрессируемых на АПК
Взаимодействуют с CD40, экспрессируемыми
на В-лимфоцитах и АПК
Молекулы адгезии
Молекулы хоминга — опосредуют поступление наивных
Т-клеток в лимфатические узлы
• Рис. 8.5. Молекулы, экспрессируемые на по-
верхности Т-клетки
126
ГЛАВА 8. БИОЛОГИЯ Т-ЛИМФОЦИТОВ
точной дифференцировки известно меньше, чем
о развитии «р-Т-лимфоцитов. В процессе разви-
тия индивидуума у8-клетки появляются в тимусе
раньше, чем клетки, несущие оф. Существуют по
крайней мере две субпопуляции у8-клеток, разли-
чающихся по использованию ими различных V7-re-
нов. Субпопуляции у8-клеток мигрируют в раз-
ные области организма, например в кожу или уча-
стки эпителия в легких и кишечнике.
Функции у8-Т-клеток до конца не ясны; обыч-
но они не отвечают на широкий спектр белковых
антигенов. Было обнаружено, что некоторые из
них активируются антигенами микобактерий, а дру-
гие — белками теплового шока (белками, кото-
рые формируются в клетках, подвергающихся воз-
действию высокой температуры или другому стрес-
су). у8-Т-клетки могут продуцировать многие из
цитокинов, синтезируемых оф-Т-клетками в от-
вет на антиген, а также могут иметь другие функ-
ции, присущие оф-Т-клеткам, например цито-
токсичность. Исходя из этой информации, было
предположено, что у8-Т-клетки могут обеспечи-
вать первую линию обороны от агрессивных па-
тогенов.
В отличие от оф-Т-клеток некоторые у8-Т-клет-
ки не реагируют на комплексы, состоящие из пеп-
тида и молекул МНС. Некоторые у8-рецепторы
могут распознавать естественный антиген (такой
как белок вируса), а некоторые взаимодействуют
с другими молекулами поверхности клетки, спо-
собными презентировать антиген, такими как
неполиморфные молекулы МНС I класса и CD1
(описано в гл. 9). Кристаллографические иссле-
дования показали, что основная структура Vg-до-
мена более сходна с V-областью Н-цепи иммуно-
глобулина, чем соответствующие участки оф-TCR.
Это позволяет предположить, что связывание ан-
тигена с уб-TCR может иметь большее сходство со
связыванием антигена с антителом, чем с оф-TCR.
4 ГЕНЫ, КОДИРУЮЩИЕ
Т-КЛЕТОЧНЫЕ РЕЦЕПТОРЫ
Организация генов человека, кодирующих ос-, р-
и 8-цепи Т-клеточного рецептора, показана на
рис. 8.6. (В связи со сложностью организация
у-генов не показана.) Несколько свойств зас-
луживают особого внимания. Во-первых, ос- и у-
цепи конструируются из V- и J-генных сегмен-
тов, подобно L-цепям Ig, в то время как р- и 8-
цепи конструируются из V-, D- и J-генных сег-
ментов подобно Н-цепям Ig. Во-вторых, локусы
Р и у находятся на разных хромосомах, в то вре-
мя как генные сегменты локусов а и 6 располага-
ются на одной. Гены, кодирующие 8-цепь, огра-
ничены с двух сторон (на 5'- и З'-концах) гена-
ми, кодирующими ос-цепь. В-третьих, в зароды-
шевой линии имеется больше Va- и Vp-генов, чем
Vy- и У5-генов (5—10). Заметьте также, что име-
ется два Ср-гена (Ср1 и Ср2), но эти гены и их
продукты практически идентичны и какие-либо
функциональные различия между ними неизве-
стны. Таким образом, их не нужно отождествлять
с изотипами антител, у которых константные
гены Н-цепи Ig и их продукты значительно разли-
чаются.
Отдельные V-области TCR получили номера,
например Va2 и Vp7. Интересно, что использова-
ние определенных V-областей TCR в некоторых
случаях было связано с ответом на специфичные
антигены, в особенности на суперантигены — ряд
антигенов, активирующих все Т-клетки, экспрес-
сирующие определенный Урв качестве компонента
своего TCR (см. гл. 9). Для человека суперантиге-
нами являются некоторые бактериальные токси-
ны. Воздействие этих бактериальных продуктов
на Т-клетки может вызывать множество реакций,
которые часто имеют клинические последствия
(рассматриваются в гл. 11).
В гл. 6 мы также обсуждали аллельное исклю-
чение. описанное для генов Ig, благодаря кото-
рому одна В-клетка производит рецептор только
одной антигенной специфичности. Положение
с TCR-генами некоторым образом сходно с этим;
Р-, у- и 8-гены TCR подчиняются правилу ал-
лельного исключения, а ос-гены — нет. Таким об-
разом, некоторые Т-клетки, которые использу-
ют оф в качестве своих TCR, имеют две разные
ос-цепи, экспрессируемые с одной p-цепью, и,
следовательно, могут обладать двумя различны-
ми антигенными специфичностями. До 30 % оф-
Т-клеток человека и мыши экспрессируют две
ос-цепи, но их функциональная значимость до сих
пор не ясна.
Vp(n~25) Jpl(n = 6) Jp2(n = 6)
-------------1 I------------------1 I-----------
Cp2
|—7 3’ Локус P
Ja(n~50)
Va(~70) + V5(~ 10) I I
I I Dgl Dg2 J51 Jg2 Cg V85 Jal Jan Ca
s' H DB /MZHO~~~0=0 QMZD7 з” л°кУсыаиР
• Рис. 8.6. Организация a-, p- и 5-генов человека, кодирующих Т-клеточный рецептор
ВЗАИМОДЕЙСТВИЕ ТИМОЦИТОВ С ТИМИЧЕСКИМИ НЕЛИМФОИДНЫМИ КЛЕТКАМИ
127
♦ РАЗНООБРАЗИЕ Т-КЛЕТОЧНЫХ
РЕЦЕПТОРОВ
Механизмы возникновения разных Т-клеточных
рецепторов очень схожи с механизмами возник-
новения В-клеточных рецепторов. Основные
принципы реаранжировки генов, описанные в гл. 6
применительно к [g, действуют при синтезе V- и
С-областей каждой цепи Т-клеточного рецептора
(ос, р, у и 8). Для соединения структур VJ или VDJ
используются рекомбиназы и соединительные по-
следовательности, обеспечивающие специфич-
ность вариабильной области определенной поли-
пептидной цепи TCR. В процессе рекомбинации
вВ-иТ -клетках участвуют одни и те же фермен-
ты. Как указано в гл. 6, в активации генов реком-
биназы на ранних стадиях дифференцировки как
В-, так и Т-клеток главную роль играют два гена,
называемые генами активации рекомбинации
(RAG-1 и RAG-2). Таким образом, как и при воз-
никновении различий между Ig, различия TCR
обусловлены: 1) наличием многочисленных V-re-
нов в зародышевой линии; 2) случайной комби-
нацией цепей; 3) вариабильностью соединений и
вставок. Однако существует одно важное отличие
между возникновением различий у TCR и моле-
кул Ig, указанное ранее: в отличие от TCR Ig по-
сле стимуляции антигеном претерпевают сомати-
ческий гипермутагенез.
Репертуар различных TCR считается таким же
или даже большим, чем репертуар молекул Ig (по
оценкам количество возможных различий в спе-
цифичности для оф составляет 1015, а для y8-TCR —
1018). Вариабельность соединений и вставок яв-
ляется важной составляющей в возникновении
различных TCR. Именно благодаря ей образуется
огромное количество различных последователь-
ностей гипервариабельного участка TCR, извест-
ного как CDR3. (В отличие от этого CDR1- и
СВВ2-последовательности TCR не возникают при
реаранжировке, а кодируются V-геном, который
находится в зародышевой линии.) Данные кри-
сталлографии указывают, что CDR3 является уча-
стком связывающего центра «р-TCR, который
контактирует с аминокислотами в центре пептида,
связанного с молекулой МНС (см. рис. 9.3 и 9.4).
Таким образом, большое число различных CDR3-
последовательностей обеспечивает высокую спе-
цифичность связывания TCR с пептидной час-
тью комплекса пептид —МНС.
• ДИФФЕРЕНЦИРОВКА Т-КЛЕТОК
В ТИМУСЕ
Как указывалось в гл. 2, тимус является первич-
ным лимфоидным органом для развития Т-кле-
ток аналогично тому, как костный мозг является
у млекопитающих первичным органом для диф-
ференцировки В-клеток. Это подчеркивает аб-
солютную необходимость тимуса для дифферен-
цировки незрелых клеток-предшественников в
клетки с характеристиками Т-лимфоцитов. Неже-
лательные последствия отсутствия тимуса и, со-
ответственно, отсутствия зрелых Т-клеток могут
наблюдаться у детей, родившихся без тимуса (син-
дром Ди Джорджи, описываемый в гл. 17), и у
мышей с генетически запрограммированным от-
сутствием тимуса (известных как «голые» мыши,
поскольку у них также отсутствует шерсть).
Дифференцировка Т-клеток в тимусе проис-
ходит на протяжении всей жизни индивидуума,
но значительно снижается после пубертатного
периода. Размер самого тимуса у млекопитающих
уменьшается с наступлением полового созрева-
ния (инвалюция тимуса) преимущественно вслед-
ствие синтеза в это время стероидных гормонов.
У некоторых видов, особенно у мышей, популя-
ция зрелых Т-клеток резко истощается, если ти-
мус удалить вскоре после рождения. В действи-
тельности именно это наблюдение позволило вы-
явить определяющую роль тимуса в Т-клеточных
ответах. Удаление тимуса у животных в более позд-
нее время имеет гораздо меньшее влияние на по-
пуляцию зрелых Т-клеток.
Дифференцировка Т-клеток в тимусе является
сложным многоступенчатым процессом. В следу-
ющих подразделах и на рис. 8.7 мы отметим ряд
основных фаз в последовательности дифферен-
цировки
• ВЗАИМОДЕЙСТВИЕ ТИМОЦИТОВ
С ТИМИЧЕСКИМИ
НЕЛИМФОИДНЫМИ КЛЕТКАМИ
На рис. 8.7 показано, что на каждой стадии со-
зревания в тимусе (от клетки-предшественника
до зрелой Т-клетки) развивающиеся Т-лимфоци-
ты {тимоциты) находятся в контакте и взаимо-
действуют с сетью, формируемой нелимфоидны-
ми {стромальными) клетками тимуса. Тимоциты
перемещаются сквозь сеть нелимфоидных клеток
от внешней зоны — коры тимуса — к внутрен-
ней — мозговому веществу тимуса. Наиболее важ-
ными нелимфоидными клетками тимуса являют-
ся: 1) кортикальные эпителиальные клетки', 2) ден-
дритные клетки, располагающиеся преимуще-
ственно на границе коры и мозгового вещества.
Дендритные клетки тимуса происходят из кост-
ного мозга и входят в то же семейство клеток,
которое осуществляет презентацию антигенов Т-
клеткам в других тканях и органах (см. гл. 10).
Далее мы более подробно обсудим, как нелим-
фоидные клетки обеспечивают основные межкле-
точные связи, необходимые для развития созре-
вающих Т-лимфоцитов. Они также вырабатыва-
ют цитокин IL-7, который индуцирует пролифе-
рацию (В-)Т-лимфоцитов на ранних стадиях раз-
128
ГЛАВА 8. БИОЛОГИЯ Т-ЛИМФОЦИТОВ
вития. Тимус является местом интенсивной про-
лиферации развивающихся Т-клеток, однако по-
давляющее большинство этих ежедневно проду-
цируемых клеток, оцениваемое примерно в 95 %,
погибают, не выходя из него.
РЕАРАНЖИРОВКА ГЕНОВ
Т-КЛЕТОЧНЫХ РЕЦЕПТОРОВ
Лимфоидные клетки-предшественники проника-
ют в наружные участки тимуса (субкапсулярная
зона); при этом их TCR-гены находятся в пере-
аранжированной конфигурации (зародышевая ли-
ния). Обычно считается, что затем гены у-, 8- и
P-цепей вступают в реаранжировку почти одно-
временно. Клетки, которые продуктивно ре-
аранжируют у- и 8-гены, экспрессируют у- и 8-цепи
TCR на поверхности клеток. Последовательность
процессов на ранних стадиях реаранжировки ге-
нов TCR до сих пор до конца не понятна, и не
ясно, способны ли клетки, экспрессирующие у- и
8-цепи на своей поверхности, продуктивно ре-
аранжировать ген р-непи. Несмотря на это, на-
блюдения позволяют предположить, что клетки,
экспрессирующие у- и 8-цепи в качестве своего
TCR, отделяются от клеток, которые будут экс-
прессировать ос- и p-цепи в качестве своего ре-
цептора, на ранних стадиях развития в тимусе,
хотя стадия, на которой это происходит, до сих
пор точно не установлена. Клетки, экспрессиру-
ющие у8 как свой TCR, покидают тимус и фор-
мируют пул периферических у8-Т-клеток.
ТИМИЧЕСКАЯ СЕЛЕКЦИЯ
129
Клетки, продуктивно реаранжирующие р-
гены, экспрессируют p-цепь TCR на поверхнос-
ти клетки в ассоциации с инвариантной молеку-
лой, известной как пре-Та Их называют пре-Т-
клетками, а сочетание p-цепи и пре-Тсс (вместе с
CD3 и Q составляют пре-Т-клеточный рецептор
(пре-TCR) аналогично пре-В-клеткам и пре-В-
клеточным рецепторам, описанным в гл. 7.
Клетки, экспрессирующие пре-TCR, диффе-
ренцируются далее. Аналогично фазам дифферен-
цировке пре-В-клеток, описанным в гл. 7, пере-
дача сигнала через пре-TCR прекращает дальней-
шую реаранжировку p-генов TCR. Этим достига-
ется то, что клетки экспрессируют только один
тип p-цепи (аллельное исключение). Кроме того,
клетки пролиферируют, и в этой расширенной
популяции подавляется экспрессия пре-Тос, на-
чинают реаранжироваться ос-гены и допускается
экспрессия CD4- и CDS-генов. Как указано ра-
нее, генные сегменты ос- и 8-локусов TCR распо-
лагаются на одной и той же хромосоме, поэтому
реаранжировка ос-локуса на определенной хромо-
соме приводит к исключению 8-локуса. (Это га-
рантирует то, что p-цепь не становится парной
8-цепи.) Таким образом, следующий важный этап
созревания клетки «р-линии — экспрессия моле-
кул корецепторов CD4 и CD8 на своей поверхно-
сти. Такой аР+-СРЭ+СР4+СР<?+-тимоцит, относя-
щийся к CD4+CD8+, или дважды позитивная клет-
ка. обнаруживается в коре тимуса и формирует
большинство тимоцитов в тимусе молодых мле-
копитающих.
* ТИМИЧЕСКАЯ СЕЛЕКЦИЯ
Позитивная селекция
Дважды позитивный тимоцит проходит через мно-
гоступенчатый процесс тимической селекции (см.
рис. 8.8). (Проходит ли подобный селекционный
процесс перед выходом из тимуса у8-Т-клетка, в на-
стоящее время не ясно.) На первой фазе позитив-
ной селекции TCR дважды позитивного тимоцита
взаимодействуют с молекулами МНС, экспресси-
руемыми на эпителиальных клетках в коре тиму-
са. Это взаимодействие приводит к выживанию
и дифференцировке дважды позитивных клеток;
те же из них, которые не участвуют в этом важ-
ном взаимодействии и поэтому не отбираются, по-
гибают посредством апоптоза. Позитивная селек-
ция также приводит к подавлению экспрессии
генов RAG-1 и RAG-2 и, таким образом, прекра-
щению дальнейшей реаранжировки генов. Сле-
довательно, поскольку, как указано ранее, ос-ген
не подвергается аллельному исключению, пози-
тивная селекция прекращает дальнейшие попыт-
ки реаранжировки ос-цепи.
Другим важным свойством позитивной селек-
ции является то, что развивающаяся «Р-Т-клетка
становится «обученной» в отношении молекул
МНС, экспрессируемых эпителиальными клетка-
ми коры тимуса. Это означает, что всю оставшу-
юся жизнь Т-клетка, даже в виде зрелой клетки,
покинувшей тимус, будет реагировать на антиген
только в том случае, если он связан с молекулами
МНС, с которыми развивающаяся клетка встре-
тилась в тимусе. По этой причине молекулы МНС,
экспрессированные в тимусе индивидуума и «обу-
чившие» его развивающиеся Т-клетки, относят к
ауто-МНС; все другие типы молекул МНС для
данного человека будут являться несобственными.
Этим объясняется возникновение феномена МНС-
рестрикции или, более точно, ауто-МНС-рест-
рикции. которая является основной для Т-клеточ-
ного ответа. Более подробно она описана в гл. 9.
Негативная селекция
Поскольку рекомбинации, затрагивающие возник-
новение TCR, являются более или менее случай-
ными, Т-клетки, экспрессирующие TCR, специ-
фичные относительно чужеродных и собственных
антигенов, могут развиваться в тимусе и прохо-
дить позитивную селекцию. Существует вероят-
ность, что Т-клетки с выраженной реактивностью
к собственным компонентам организма покинут
тимус и будут взаимодействовать с такими анти-
генами в тканях, что может привести к нежела-
тельным аутоиммунным реакциям. Для предот-
вращения этого дважды позитивные клетки под-
вергаются второй фазе отбора — негативной се-
лекции (рис. 8.8).
На рис. 8.8 показана негативная селекция, на-
блюдаемая, когда дважды позитивные клетки вза-
имодействуют с дендритными клетками на гра-
нице кортикального и мозгового слоев. В основ-
ном взаимодействуют молекулы TCR, CD4 и CD8,
экспрессированные на дважды позитивном тимо-
ците, и молекулы МНС, расположенные на денд-
ритной клетке. Поскольку дендритные клетки
обладают пептидами, ассоциированными с моле-
кулами МНС, дважды позитивные клетки, похо-
же, взаимодействуют с МНС и пептидом, экспрес-
сированными на поверхности дендритной клет-
ки. Т-клетки, экспрессирующие TCR, которые
реагируют со слишком высокой аффинностью с
комбинацией пептида и МНС, удаляются посред-
ством апоптоза Подобная негативная селекция
удаляет Т-клетки, экспрессирующие TCR с высо-
кой реактивностью к собственным компонентам.
Дважды позитивные клетки, пережившие не-
гативную селекцию, снижают экспрессию как
CD4, так и CD8 посредством не изученного еще
механизма. Все это приводит к развитию или
CD4+CD8 -, или CD4 СО8+-Т-клеток (монопози-
тивные). Две эти популяции являются конечной
точкой сложного процесса ccp-TCR-клеточной
дифференцировки в тимусе. Они покидают ти-
мус и образуют периферические (т.е. вне тимуса)
линии зрелых CD4+- и СВ8+-Т-клеток.
130
ГЛАВА 8. БИОЛОГИЯ Т-ЛИМФОЦИТОВ
Дважды
позитивная
клетка
Эпителиальная
клетка тимуса
Взаимодействие —
Позитивная селекция
Выживание CD4 CD8 -Т-клеток
с рецепторами, специфичными
по отношению к МНС, + аутоантигенов
• Рис. 8.8. Позитивная и негативная селекция
ap-TCR+CD4+CD8+T-клеток в тимусе
Дважды
позитивная
клетка погибает
и клеток с рецепторами,
специфичными по отношению
к МНС, + чужеродных антигенов
Делеция Т-клеток
с рецепторами,
специфичными
относительно
аутоантигенов
Выживание Т-клеток,
экспрессирующих или CD4-,
или СО8-монопозитивные
клетки с рецепторами, специфичными
по отношению к МНС, + чужеродных антигенов
Роль пептидов в тимической селекции
Остается еще ряд вопросов по механизмам, уча-
ствующим в селекции. Например, каковы роль и
природа пептидов, экспрессируемых нелимфоид-
ными тимическими клетками на разных стадиях
процессов селекции. Данные современных иссле-
дований указывают на то, что пептиды, экспрес-
сируемые кортикальными эпителиальными клет-
ками, играют главную роль на этапе позитивной
селекции. Эти пептиды происходят из аутоанти-
генов, экспрессированных в тимусе или поступив-
ших в него. В настоящее время не ясно, однако,
как эти пептиды, возникающие из аутоантигенов,
отбирают Т-клетки с TCR, специфичными по от-
ношению как к несобственным, так и аутологич-
ным антигенам. Кроме того, не ясно, отличаются
ли пептиды, экспрессированные кортикальными
эпителиальными клетками при позитивной селек-
ции, от тех, которые экспрессируются дендрит-
ными клетками при негативной селекции. Дру-
гим нерешенным вопросом является то, каким
образом взаимодействие TCR. экспрессируемых
на дважды позитивной клетке, с молекулами МНС
и пептидами, представленными на кортикальных
эпителиальных клетках, приводит к выживанию
и дифференцировке дважды позитивных клеток,
в то время как взаимодействие дважды позитив-
ной клетки с дендритной клеткой тимуса инду-
цирует отрицательный сигнал (клеточную смерть)
Эти проблемы продолжают интенсивно изучать.
Характеристики Т-клеток,
покидающих тимус
Дифференцировка в тимусе Т-клеток, экспресси-
рующих оср в качестве своих TCR, приводит к
образованию репертуара периферических CD4+-
и СВ8+-Т-клеток, способных реагировать на огром-
ТЕСТЫ
131
ное количество чужеродных антигенов. Эти клет-
ки имеют две важных характеристики.
• Для них характерна ауто-МНС-рестрикция. Они
взаимодействуют с пептидами, образованны-
ми из несобственных антигенов только тогда,
когда пептиды связаны с тем же набором мо-
лекул МНС, с которым развивающаяся Т-клет-
ка взаимодействовала во время позитивной
селекции в тимусе.
• У них отмечается аутотолерантность. CD4+- и
CD8+-T-клетки не реагируют на собственные
компоненты.
РЕЗЮМЕ
1. У каждого индивидуума есть огромное количе-
ство различных Т-клеток. Каждая Т-клетка обладает
уникальным клонально-детерминированным рецепто-
ром к антигену, так называемым Т-клеточным рецеп-
тором. Процесс реаранжировки и механизм рекомби-
нации, используемые для создания репертуара Т-кле-
ток с разными TCR, аналогичны тем, которые исполь-
зуются у В-клеток для обеспечения разнообразия lg.
2. На большинстве Т-клеток человека и мыши TCR
является двухцепочечной трансмембранной молеку-
лой ар. Он образуется из V- и С-областей аналогично
тому, как это происходит с молекулами lg. Внеклеточ-
ная часть TCR напоминает Fab-фрагмент антитела.
3. ар-Т-клеточный рецептор реагирует с пепти-
дом, связанным с молекулой МНС на поверхности
клетки организма.
4. Корецепторные молекулы ассоциированы с
ap-TCR. На зрелых Т-клетках корецептором является
или CD4, или CD8, что разделяет Т-клетки на две суб-
популяции: ap+-CD4+ или ap+-CD8+. Функциями этих
корецепторных молекул являются: 1) связывание мо-
лекул МНС на АПК; 2) усиление контакта между Т-клет-
кой и АПК; 3) осуществление передачи сигнала после
активации TCR.
5. Антигенсвязывающие ap-цепи TCR экспресси-
руются на поверхности Т-клетки в мультимолекуляр-
ном комплексе (TCR-комплекс) в ассоциации с CD3 и
^-полипептидами, которые действуют как структура,
передающая сигналы после связывания антигена с ар.
6. Т-клетка также экспрессирует молекулы на своей
поверхности с важными костимулирующими адгезив-
ными и/или сигналпередающими свойствами. К таким
молекулам относят CD28 и CD152 (CTLA4), интегрины
CD11aCD18 (LFA-1), CD49dCD29 (VLA-4) и CD2, а также
молекулы, определяющие хоминг в различные ткани.
7. У ограниченной популяции Т-клеток человека и
мышей TCR представлен другими двухцепочечными
структурами — yS. Димеры уб также экспрессируются
на поверхности клетки в ассоциации с CD3 и Боль-
шинство уб+-Т-клеток не экспрессирует CD4, но неко-
торые экспрессируют CD8. Функции yS-T-клеток не
так хорошо изучены, как свойства аР+-Т-клеток.
8. Гены, кодирующие р-, у-, S-цепи TCR, проявляют
аллельное исключение, т.е. для синтеза полипептид-
ной цепи используются гены, расположенные только
на одной хромосоме. При этом a-гены TCR не под-
вергаются аллельному исключению.
9. Первый шаг дифференцировки Т-лимфоцитов,
развивающихся в тимусе, приводит к экспресии TCR
на поверхности клетки. Т-клетки разделяются на ли-
нии, использующие ар- и уб-цепи в качестве своих
рецепторов, на ранней стадии процесса дифференци-
ровки в тимусе.
10. В тимусе ар-ТСП+СО4+СО8+-тимоциты (дважды
позитивные клетки) проходят селекцию, опосредуе-
мую взаимодействиями TCR и молекулами корецепто-
ра на развивающейся Т-клетке с молекулами МНС и
пептидов, экспрессированных нелимфоидными клет-
ками тимуса. Позитивная селекция на кортикальных
эпителиальных клетках «обучает» развивающуюся
Т-клетку: зрелая Т-клетка реагирует на антиген, толь-
ко когда он презентируется клеткой, экспрессирую-
щей такие же молекулы МНС, с какими Т-клетка взаи-
модействовала в период дифференцировки в тимусе
(МНС-рестрикция Т-клеточного ответа). Негативная
селекция на дендритных клетках на границе между
корой и мозговым веществом тимуса удаляет Т-клет-
ки с потенциальной реактивностью к собственным
молекулам, обеспечивая аутотолерантность. Таким
образом, ар-ТСН+-Т-клетки, развивающиеся в тимусе,
подвергались ауто-МНС-рестрикции и обладают ауто-
толерантностью.
11. Прошедшие негативную селекцию ap-TCR+CD4+-
и ар-ТСИ+СО8+-Т-клетки вместе с уб+-Т-клетками поки-
дают тимус. Эти клетки составляют в крови и вторич-
ных лимфоидных органах и тканях репертуар перифе-
рических Т-клеток, которые реагируют на несобствен-
ный (чужеродный) антиген.
ТЕСТЫ
Выберите ОДИН НАИБОЛЕЕ ПРАВИЛЬНЫЙ ответ
на каждый тест.
1. Укажите правильное утверждение, касающееся
развития Т-клетки:
а) Т-клетки-предшественники, которые поступают
в тимус из костного мозга, уже осуществили реаран-
жировку своих генов Т-клеточных рецепторов;
б) взаимодействие с нелимфоидными клетками
тимуса играет основную роль;
в) для созревания в тимусе необходимо присут-
ствие чужеродного антигена;
г) молекулы МНС II класса не вовлечены в процесс
позитивной селекции;
д) зрелые, полностью дифференцированные Т-клет-
ки находятся в коре тимуса.
2. Аутотолерантность в Т-клеточном звене необ-
ходима для предотвращения аутоиммунных реакций
К развитию аутотолерантности у Т-клеток приводит:
а) аллельное исключение;
б) соматическая гипермутация;
в) пролиферация тимоцитов;
г) позитивная селекция;
д) негативная селекция.
3. Укажите правильное утверждение:
а) сигнал в Т-клетку передают ap-цепи TCR;
б) клетка, лишенная СО4-молекул, будет не спо-
собна распознавать антиген;
в) в тимусе не встречаются Т-клетки с полностью
реаранжированными ар-цепями;
132
ГЛАВА 8. БИОЛОГИЯ Т-ЛИМФОЦИТОВ
г) Т-клетки, экспрессирующие уб-рецептор, обна-
руживаются только в тимусе;
д) незрелые СО4^СО8+-Т-клетки составляют боль-
шинство Т-клеток в тимусе.
4. Укажите неправильное утверждение о Т-клет-
ках, использующих ар в качестве своих антигенспеци-
фичных рецепторов:
а) они коэкспрессируют CD3 на клеточной поверх-
ности;
б) могут быть как CD44, так и CD8+;
в) взаимодействуют с пептидами, образовавшими-
ся из чужеродных антигенов;
г) могут проходить дальнейшую реаранжировку
своих генов TCR, чтобы экспрессировать у5 в качестве
своего рецептора;
д) циркулируют в крови и лимфе и мигрируют во
вторичные лимфоидные органы.
5. Молекула CD4 связывается:
а) непосредственно с пептидным антигеном;
б) с молекулами МНС I класса;
в) с молекулами МНС II класса;
г) с CD8 на поверхности Т-клетки;
д) с местом прикрепления пептида у МНС II класса.
6. Укажите неправильное утверждение о TCR- и
lg-генах:
а) у предшественников как В-, так и Т-клеток мно-
гочисленные гены V-, D-, J- и С-областей существуют
в неаранжированном виде;
б) реаранжировка как TCR-, так и lg-генов предпо-
лагает участие ферментов-рекомбиназ, которые свя-
зываются со специфическими участками генома;
в) и Ig, и TCR способны переключать использова-
ние С-области;
г) как Ig, так и TCR используют комбинаторную ас-
социацию V-, D- и J-генов и неточность соединения
для генерации различий.
7. Укажите неправильное утверждение об анти ген-
специфичных рецепторах как В-, так и Т-клеток:
а) они являются клонально-распределенными
трансмембранными молекулами;
б) обладают большими цитоплазматическими до-
менами, взаимодействующими с внутриклеточными
молекулами;
в) состоят из полипептидов с вариабельными и
константными областями;
г) ассоциированы на поверхности клетки с молеку-
лами, передающими сигнал;
д) могут взаимодействовать с пептидами, образо-
вавшимися из чужеродных антигенов.
ОТВЕТЫ НА ТЕСТЫ
1 —6. Взаимодействие тимоцитов с клетками
стромы тимуса (кортикальными эпителиальными клет-
ками и интердигитальными дендритными клетками на
границе между корой и мозговым веществом) являет-
ся главным условием развития Т-клетки.
2 — д. Негативная селекция устраняет развива-
ющиеся Т-клетки с потенциальной реактивностью к
собственным молекулам.
3 — д. Большинство клеток в тимусе составляют
СО4+СО8+-Т-клетки.
4 — г. Гены Т-клеток, использующих аР в качестве
своих рецепторов, не способны к дальнейшей ре-
аранжировке и использованию у5 в качестве своих
рецепторов; сегменты 5-гена TCR распределяются
вместе с а-локусом и удаляются при реаранжировке
а-локуса.
5 — в. Корецептор CD4, экспрессированный на
Т-клетке, связывается с молекулами МНС II класса.
6 — в. Способность изменять константную об-
ласть тяжелой цепи при сохранении той же самой
антигенной специфичности является свойством, при-
сущим только Ig. Другие свойства присущи как TCR
так и Ig.
7 — 6. Как TCR, так и Ig имеют короткие цито-
плазматические хвосты. Передающие сигнал молеку-
лы, ассоциированные с цепями, связывающими ан-
тиген, взаимодействуют с внутриклеточными молеку-
лами.
РОЛЬ ГЛАВНОГО КОМПЛЕКСА
ГИСТОСОВМЕСТИМОСТИ
В ФОРМИРОВАНИИ ИММУННОГО ОТВЕТА
ВВЕДЕНИЕ
В предыдущей главе мы указали на решающую
роль, которую играют молекулы МНС в ответе
Т-клеток на антиген. В частности была упомяну-
та необходимость участия МНС в развитии не-
зрелых Т-клеток и в ответе зрелых Т-лимфоцитов
на антиген. Определяющее влияние молекул МНС
на работу Т-клеток называют МНС-рестрикцией
Т-клеточного ответа В этой главе более полно
описаны структура и функции молекул МНС.
Перед этим мы также обсудим характеристики
генов МНС и их разнообразие.
Термин «главный комплекс гистосовместимости»
появился после первых экспериментов по при-
живаемости или отторжению тканей, т.е. букваль-
но гистосовместимости. Эти опыты проводили,
пересаживая ткани от одного представителя дан-
ного вида к другому (обычно использовали мы-
шей; см. гл. 19). Сначала исследователи устано-
вили, что быстрое отторжение таких трансплан-
татов определяется одним геном, который назва-
ли главным геном гистосовместимости. В дальней-
ших исследованиях было показано, что этот «ген»
на самом деле являлся комплексом — набором
тесно сцепленных между собой генов, наследуе-
мых как единое целое, поэтому его назвали глав-
ным комплексом гистосовместимости. В других ран-
них исследованиях было показано, что Т-клетки
играют важную роль в отторжении транспланта-
та. Совместные результаты исследований по транс-
плантации тканей указали на связь между моле-
кулами, кодируемыми генами МНС, и Т-клеточ-
ным ответом. Поскольку трансплантация не яв-
ляется «естественной» процедурой, то перед ис-
следователями встал вопрос, какова функция МНС
в обычном ответе Т-клеток. Роль молекул МНС в
Т-клеточном ответе организма начала прояснять-
ся в 1970-х гг.
• ГЕНЫ МНС И ИХ ПРОДУКТЫ
Номенклатура
У всех позвоночных есть гены МНС и продукты их
транскрипции, однако наиболее подробные све-
дения исследователи накопили о системах мыши
и человека. На рис. 9.1 показан упрощенный вид
участка хромосомы 6 человека, содержащего гены
МНС, которые называют человеческими лейкоци-
тарными антигенами (human leukocyte antigenes —
HLA). В целом названия МНС других видов похо-
жи; например, BoLA для системы быка или SLA
для системы свиньи. В то же время название МНС
мышей, расположенного на хромосоме 17 (схема-
тически представлен на рис. 9.1, Б), — Н-2, отно-
сится к раннему периоду исследования генов гисто-
совместимости, участвовавших в ответе на транс-
плантацию тканей, как это обсуждалось ранее.
В Т-клеточный ответ вовлечены два больших
набора генов МНС, так называемые МНС 1 и
II классов, а также продукты их экспрессии на
поверхности клеток (молекулы МНС. называемые
иногда также МНС-антигенами, что связано с их
ролью при трансплантации). На рис. 9.1, Л обо-
значены три независимых гена, которые кодиру-
ют молекулы МНС I класса у человека: HLA-A.
HLA-B. HLA-С. На рисунке также показано, что
область МНС II класса представлена тремя набо-
рами генов: HLA-DP. HLA-DQ и HLA-DR. Каж-
дая субобласть МНС II класса содержит гены А
и В, которые кодируют соответственно а- и р-цепи
в составе двухцепочечной молекулы МНС II клас-
са. Так, например, ген HLA-DPA кодирует цепь
DPa молекулы HLA-DP, а ген HLA-DPB кодиру-
ет другую цепь молекулы HLA-DP, DPp. Двухце-
почечные молекулы DQap и DRap также образу-
ются при объединении продуктов генов, распо-
ложенных в субобластях DQ и DR.
134
ГЛАВА 9. РОЛЬ ГЛАВНОГО КОМПЛЕКСА ГИСТОСОВМЕСТИМОСТИ В ФОРМИРОВАНИИ ИММУННОГО ОТВЕТА
II класс
— I класс —►
DP DQ DR
I класс ---II класс---► I класс -►
• Рис. 9.1. Упрощенная схема человеческого (А) и мышиного (Б) МНС, на которой пока-
заны области и гены, кодирующие полиморфные молекулы МНС I и II классов. 02т ~ это
Р2-микроглобулин, который кодируется геном вне области МНС
На рис. 9.1, Б показан МНС мыши Н-2. Пред-
ставлены три независимых гена, кодирующих
молекулы мышиного МНС I класса; эти гены и
соответствующие им молекулы называют К, D
и L, В отличие от трех генных локусов у людей
Н-2 содержит две области генов МНС II класса:
I-A и 1-Е. Они кодируют молекулы I-A-аР и I-E-
соответственно. Гены и их белковые продукты
и у мышей, и у людей высоко гомологичны; это
указывает на то, что гены МНС произошли из
одного гена-родоначальника.
Варианты экспрессии молекул МНС
в разных клетках
Практически каждая ядросодержащая клетка орга-
низма экспрессирует с разной интенсивностью
молекулы МНС ] класса. Молекулы МНС II клас-
са представлены менее широко, чем молекулы
МНС I класса: они экспрессируются коститу-
тивно (т.е. при любых условиях) только на В-лим-
фоцитах, дендритных клетках, эпителиальных
клетках тимуса, а у людей также на макрофагах и
моноцитах. Перечисленные клетки представляют
антиген Т-клеткам (являются антигенпрезенти-
рующими клетками, АПК). На многих других клет-
ках, например фибробластах, эндотелиальных
клетках или макрофагах мышей, экспрессия мо-
лекул МНС II класса может быть индупирована
разными факторами, в частности цитокином ин-
терфероном-у (IFNy), который высвобождается
при ответе на инфекционные агенты.
Экспрессия молекул МНС I класса скоордини-
рована, т.е. все три типа молекул этого класса
появляются на поверхности клетки одновремен-
ВАРИАБЕЛЬНОСТЬ ГЕНОВ И ПРОДУКТОВ МНС
135
но. Так же и молекулы МНС II класса экспресси-
руются координированно, но под другим управ-
лением. Таким образом, молекулы МНС I класса
могут экспрессироваться при полном отсутствии
молекул МНС II класса. Уровень экспрессии мо-
лекул МНС I и II классов на клеточной поверх-
ности может быть в одинаковой степени увели-
чен или снижен разными стимулами: например,
IFNy увеличивает экспрессию молекул МНС как
I, так и II класса.
Таким образом, при отсутствии индуцирующих
факторов большинство клеток экспрессируют
молекулы МНС I класса и не экспрессируют мо-
лекулы МНС II класса. Определенные клетки,
такие как В-лимфоциты, постоянно экспресси-
руют молекулы МНС обоих классов В противо-
положность этому лишь немногие клетки экс-
прессируют молекулы МНС II класса при отсут-
ствии молекул МНС I класса.
• ВАРИАБЕЛЬНОСТЬ ГЕНОВ
И ПРОДУКТОВ МНС
Генетический полиморфизм
Разные организмы в пределах одного вида имеют
незначительно отличающиеся формы каждого гена
МНС I и II классов, называемые аллелями, т.е. в
пределах единственного локуса МНС разные ин-
дивидуумы имеют различные типы исходного гена.
У людей разным аллелям одного гена дают номе-
ра, например HLA-B15 или В27. (У мышей алле-
лям присваивают надстрочные строчные буквы,
например или Kd.) Феномен наличия мно-
жественных устойчивых форм одного гена в по-
пуляции называют генетическим полиморфизмом.
Появление метода полимеразной цепной ре-
акции (ПЦР) показало степень полиморфизма
HLA. У индивидуумов, которые раньше при ис-
пользовании серологических методик (реакция
с антителами, специфичными к определенным
аллелям HLA) признавались идентичными по
определенному HLA-локусу, теперь обнаружи-
лись различия в последовательностях генов
HLA Для лучшего определения вариабель-
ности генов HLA в популяции используется но-
вая номенклатура, более удобная для определе-
ния HLA-аллелей. Например, вместо старого
серологического определения аллеля DR7
применяют новое определение, включающее
локус (например, DRB1; В1 указывается, по-
тому что молекулярное картирование показало
наличие более чем одного гена DRB), за кото-
рым следуют звездочка и две цифры для обо-
значения аллельной группы, обычно такой же,
какая была установлена серологически (напри-
мер, DRB1*O7), а далее две цифры, которые иден-
тифицируют подтип (например, DRBl*0701
или DRBP0704) Эта более широкая и точная
характеристика HLA-аллелей необходима при
подборе доноров и реципиентов при трансплан-
тациях и для выявления лиц, у которых высок
риск развития различных аутоиммунных забо-
леваний (см. гл. 19 и 12).
Генетический полиморфизм определяет разно-
образие молекул МНС в популяции, поэтому ин-
дивиды, имеющие различные гены МНС, экс-
прессируют молекулы МНС с несколько разли-
чающимися последовательностями. Гены МНС яв-
ляются наиболее полиморфной генетической си-
стемой в организме и популяции. Из-за столь
широкого полиморфизма маловероятно, что два
случайных индивидуума будут экспрессировать
идентичные наборы молекул МНС. Как будет рас-
сказано в гл. 19, этот полиморфизм определяет
быстрое отторжение трансплантата между гене-
тически различными индивидуумами.
Кодоминантная экспрессия
Молекулы обоих классов МНС экспрессируются
кодоминантно, т.е. каждая клетка, которая экс-
прессирует молекулы МНС, экспрессирует белки,
транскрибируемые с обеих хромосом: материнской
и отцовской (показано в верхней части рис. 9.2
стрелками от обеих хромосом к клеточной поверх-
ности). Примечательно, что одни и те же продук-
ты генов МНС экспрессируются на каждой клет-
ке отдельного индивидуума, поэтому у одного че-
ловека молекулы МНС 1 класса, экспрессируе-
мые на каждом лимфоците, одинаковы и те же
самые молекулы (антигены) экспрессируются каж-
дой клеткой печени. Это противоречит стратегии
антигенспецифичного разнообразия Т- и В-кле-
точных рецепторов, обсуждавшейся в гл. 6 и 8;
генная реанжировка обеспечивает каждому лим-
фоциту отдельного индивидуума уникальный на-
бор генов, кодирующих антигенспецифичные ре-
цепторы. В результате каждый клон лимфоцитов
экспрессирует свой антигенспецифичный ре-
цептор.
Таким образом, поскольку молекулы МНС экс-
прессируются кодоминантно, каждая клетка у
одного человека экспрессирует до шести разных
молекул HLA I класса: по три, кодируемых гена-
ми HLA I класса от каждой из двух хромосом.
Например, все клетки одного человека могут экс-
прессировать на своей поверхности молекулы
HLA-A2 и А5, HLA-B7 и В13, HLA-C6 и С8. Дру-
гой человек может экспрессировать шесть совер-
шенно других молекул HLA 1 класса. Некоторые
индивидуумы могут экспрессировать меньше ше-
сти разных молекул HLA I класса, поскольку явля-
ются гомозиготами по отдельным аллелям (т.е. обе,
и отцовская, и материнская, хромосомы экспрес-
136
ГЛАВА 9. РОЛЬ ГЛАВНОГО КОМПЛЕКСА ГИСТОСОВМЕСТИМОСТИ В ФОРМИРОВАНИИ ИММУННОГО ОТВЕТА
• Рис. 9.2. Набор генов HLA — гаплотип HLA —
передается как единое целое от родителя ре-
бенку; поскольку гены HLA в популяции раз-
нообразны, гаплотипы HLA детей отличаются
от гаплотипов их родителей
сируют одинаковые аллели). Как мы расскажем в
последующих подразделах, молекулы МНС свя-
зывают пептиды, поэтому индивидуумы,
гетерозиготные по аллелям МНС, связывают бо-
лее разнообразный спектр пептидов, чем те, кто
является гомозиготами. Это может иметь клини-
ческое значение, которое обсуждается далее в этой
главе.
Молекулы HLA DP, DQ и DR также кодоми-
нантно экспрессируются на клетках, которые эк-
спрессируют молекулы HLA II класса. Это при-
водит к экспрессии, по меньшей мере, шести
молекул HLA II класса у индивидуумов, гетеро-
зиготных по всем аллелям этого класса. Часто на
человеческих клетках экспрессируются более ше-
сти различных молекул HLA II класса. Это про-
исходит, потому что в дополнение к молекулам
HLA-DP, DQ и DR а₽ такие генетические про-
дукты из разных генных участков, как DPa и DQP,
могут образовывать пары и экспрессироваться на
клеточной поверхности. Более того, субобласти
HLAII класса DP и DQ имеют более одного гена
А и В, а субобласть DR имеет более одного гена В
(не отображено на рис. 9.1, А). Следовательно,
гены субобласти могут дать начало более чем од-
ному полипептиду ар.
Набор генов МНС I и II классов, расположен-
ных на одной хромосоме индивидуума, называют
гаплотипом. он наследуется потомством как еди-
ное целое (рис. 9.2). Потомки наследуют набор
генов МНС I и II классов и от другого родителя.
Благодаря разнообразию молекул HLA в популя-
ции можно почти всегда гарантировать, что гап-
лотип, привнесенный вторым родителем, будет
отличаться от гаплотипа первого родителя (на ри-
сунке хромосомы обозначены разными цветами).
Таким образом, рис. 9.2 показывает, что гапло-
тип любого потомка будет отличаться от гаплоти-
пов родителей и, как правило, будет отличаться
от гаплотипов других потомков (тождественность
МНС встречается у монозиготных близнецов и
может встречаться в семьях с большим количе-
ством детей). Однако маловероятно, что индиви-
дуумы в пределах одной семьи экспрессируют
идентичные наборы молекул МНС; как уже было
сказано прежде, вероятность обнаружения в об-
щей популяции индивидуумов, схожих по всем
HLA -аллелям, очень мала. В отличие от людей у
других видов возможно проводить селективное
скрещивание с целью создания инбредных линий.
в которых все представители генетически идентич-
ны. Исследования, использующие генетическую
тождественность инбредных линий, в частности
мышей, помогли найти ответы на многие фунда-
ментальные иммунологические вопросы, которые
нельзя было получить в исследованиях на людях.
• СТРУКТУРА МОЛЕКУЛ МНС
Структура молекул МНС I класса
На рис. 9.3, А показана общая схема молекулы
МНС I класса человека или мыши. Каждый ген
СТРУКТУРА МОЛЕКУЛ МНС
137
Т-клеточный
рецептор
Пептид (8—9 амино-
кислотных остатков)
Аллель-
специфичные
карманы
(Х2 (X]
Молекула
МНС I класса
• Рис. 9.3. Разные изображения молекулы МНС I класса. (А) Схема структуры молекулы МНС I класса, связанной с
р2-микроглобулином на поверхности клетки. (Б) Вид сбоку молекулы МНС I класса с р2-микроглобулином. Представлена
полость, связывающая пептид. (Б) Вид сверху на полость, связывающую пептид. (/") Изображение взаимодействия
Т-клеточного рецептора с молекулой МНС I класса и пептидом, закрепленным в полости, связывающей пептид (рисунки
Б и Б из Bjorkman et al., 1987, с разрешения издателя; рисунок Г с изменениями из Rammensee et al., 1993)
МНС I класса кодирует трансмембранный гликоп-
ротеин, молекулярной массой около 43 кДа, ко-
торый обозначается как а или тяжелая цепь. Он
включает три внеклеточных домена: al, ос2 и аЗ.
Каждая молекула МНС I класса экспрессируется
на клеточной поверхности в нековалентной свя-
зи с инвариантным полипептидом, называемым
^2-микроглобулином (р2-*и, молекулярная масса 12
кДа), который кодируется на другой хромосоме.
Он имеет структуру, гомологичную единичному
домену Ig, и в самом деле является представите-
лем этого суперсемейства. Таким образом, на кле-
138
ГЛАВА 9. РОЛЬ ГЛАВНОГО КОМПЛЕКСА ГИСТОСОВМЕСТИМОСТИ В ФОРМИРОВАНИИ ИММУННОГО ОТВЕТА
точной поверхности структура МНС I класса плюс
р2т имеет вид четырехдоменной молекулы, в ко-
торой к мембране примыкают домен а3 молекулы
МНС I класса и р2ш.
Последовательности различных аллельных
форм молекул МНС I класса очень схожи. Разли-
чия аминокислотных последовательностей среди
молекул МНС сосредоточены на ограниченном
участке их внеклеточных доменов cq и а2. Таким
образом, индивидуальная молекула МНС I клас-
са может быть разделена на неполиморфную, или
инвариантную, область (одинаковую для всех ал-
лельных форм ] класса) и полиморфную, или ва-
риабельную, область (уникальную последователь-
ность для данного аллеля). Т-клеточные молеку-
лы CD8 связываются с инвариантными областя-
ми всех молекул МНС I класса (см. рис. 8.3, Б).
Все молекулы МНС I класса, подвергнутые
рентгеновской кристаллографии, имеют одинако-
вую общую структуру, изображенную на рис. 9.3,
Б и В, Наиболее интересной особенностью стро-
ения молекулы является то, что максимально уда-
ленная от мембраны часть молекулы, состоящая
из доменов cq и а2, имеет глубокую бороздку или
полость. Эта полость в молекуле МНС I класса
является местом связывания пептидов. Полость
напоминает корзину с неровным дном (сплетен-
ную из аминокислотных остатков в виде плоской
Р-складчатой структуры), а окружающие стенки
представлены а-спиралями. Полость закрыта с
обоих концов, поэтому в нее вмещается цепочка,
состоящая из восьми или девяти аминокислотных
последовательностей (см. рис. 3.4).
Сравнивая последовательности и структуру
полости у разных молекул МНС I класса, можно
обнаружить, что дно каждой из них различно и
состоит из нескольких карманов, специфичных для
каждого аллеля (рис. 9.3, Г). Форма и заряд этих
карманов на дне полости помогают определить,
какие пептиды связываются с каждой аллельной
формой молекулы МНС. Карманы также помога-
ют закрепить пептиды в таком положении, в ко-
тором они могут распознаваться специфичными
TCR. На рис. 9.3, Г и 8.2 показано взаимодей-
ствие пептида, размещенного в полости, и участ-
ков молекулы МНС I класса с Т-клеточным ре-
цептором. Как уже было описано в гл. 8, центр
связанного пептида — единственная часть белка,
не спрятанная внутри молекулы МНС, — взаи-
модействует с CDR3-TCR аи₽, которые являют-
ся наиболее вариабельными в Т-клеточном рецеп-
торе. Это означает, что для распознавания пепти-
да TCR необходим контакт с небольшим количе-
ством аминокислот центра пептидной цепочки.
Отдельная молекула МНС I класса может свя-
зываться с разными пептидами, но преимуще-
ственно с теми, которые обладают определенны-
ми (специфичными) мотивами (последовательно-
стями). Такими специфичными последовательно-
стями являются инвариантно расположенные 8 —
9 аминокислотных остатков {якорные последо-
вательности), обладающие высоким сродством к
аминокислотным остаткам в пептидсвязывающей
полости данной молекулы МНС. При этом ами-
нокислотные последовательности в позициях, не
являющихся якорными, могут быть представле-
ны любым набором аминокислотных остатков. Так,
например, человеческая молекула I класса HLA-
А2 связывается с пептидами, имеющими во вто-
рой позиции лейцин, а в девятой — валин; в отли-
чие от нее другая молекула HLA-A связывает
только белки, у которых в якорную последова-
тельность входят фенилаланин или тирозин в по-
зиции 5 и лейцин в позиции 8. Другие позиции в
связываемых пептидах могут быть заполнены лю-
быми аминокислотами. Таким образом, каждая
из молекул МНС может связываться с большим
количеством пептидов, обладающих различны-
ми аминокислотными последовательностями. Это
помогает объяснить, почему ответы, опосредо-
ванные Т-клетками, могут развиться, за редким
исключением, по меньшей мере к одному эпито-
пу почти всех белков и почему случаи отсутствия
иммунного ответа на белковый антиген очень ред-
ки.
Структура молекул МНС II класса
Гены аир МНС II класса кодируют цепи массой
около 35000 и 28000 Да соответственно. На рис.
9.4, А показано, что молекулы МНС II класса,
как и I класса, являются трансмембранными гли-
копротеинами с цитоплазматическими «хвоста-
ми» и внеклеточными доменами, похожими на
lg; домены обозначают ан а2, Pi и р2. Молекулы
МНС II класса также являются членами суперсе-
мейства иммуноглобулинов. Как и у молекул МНС
I класса, в состав молекулы МНС II класса вхо-
дят вариабельные, или полиморфные (различные
у разных аллелей), и инвариабельные, или непо-
лиморфные (общие для всех аллелей), области.
Т-клеточная молекула CD4 прикрепляется к не-
изменяемой части всех молекул МНС II класса.
На вершине молекулы МНС II класса также
есть выемка или полость, способная связываться
с пептидами (рис. 9.4, Б и В), которая структур-
но аналогична полости молекулы МНС I класса
Однако в молекуле МНС II класса полость фор-
мируется путем взаимодействия доменов разных
цепочек, а и р. На рис. 9.4, В показано, что дно
полости молекулы МНС II класса состоит из
восьми р-складок, причем домены aj и Pi обра-
зуют по четыре из них каждый; спиральные фраг-
менты доменов ai и Р| формируют каждый по
одной стенке полости. В отличие от полости
молекулы МНС I класса полость молекулы МНС
II класса открыта с обеих сторон, что позволяет
связывать более крупные белковые молекулы.
Таким образом, полость молекулы МНС II клас-
са может связывать пептиды, длина которых ва-
рьирует от 12 до 20 аминокислот в линейной
ФУНКЦИОНИРОВАНИЕ МОЛЕКУЛ МНС: ПРОЦЕССИНГ И ПРЕЗЕНТАЦИЯ АНТИГЕНА
139
цепочке, при этом концы пептида оказываются
за пределами полости. На рис. 9.4, Г показано,
что TCR взаимодействует не только с пептидом,
связанным с молекулой МНС II класса, но и с
фрагментами самой молекулы МНС II класса.
Пептиды, которые связываются с различными
молекулами МНС II класса, также должны обла-
дать определенными мотивами (последователь-
ностями); поскольку длина пептидов в этом слу-
чае более вариабельна, чем у пептидов, которые
могут прикрепляться к молекуле МНС I класса,
мотивы чаше располагаются в центральной об-
ласти пептида, т.е. в том месте, которое соответ-
ствует внутренней поверхности полости молеку-
лы МНС II класса.
Внеклеточное
пространство
Клеточная
мембрана
Полость,
связывающая
пептиды
Участок
связывания
cCD4
р2
Цитоплазматические
«хвосты»
Г
• Рис. 9.4. Разные изображения молекулы МНС II класса (А) Изображение структуры молекулы МНС II класса на поверх-
ности клетки. (Б) Вид сбоку молекулы МНС II класса. Показана полость, связывающая пептиды (из Stern & Wiley,
1994, с изменениями; с разрешения издателя). (Б) Полость, связывающая пептиды, - вид сверху (из Stern et al., 1994, с
изменениями; с разрешения издателя) (С) Взаимодействие Т-клеточного рецептора с молекулой МНС II класса и пепти-
дом, закрепленным в ее полости, связывающей пептиды (из Rammensee et al., 1993)
140
ГЛАВА 9. РОЛЬ ГЛАВНОГО КОМПЛЕКСА ГИСТОСОВМЕСТИМОСТИ В ФОРМИРОВАНИИ ИММУННОГО ОТВЕТА
• ФУНКЦИОНИРОВАНИЕ
МОЛЕКУЛ МНС: ПРОЦЕССИНГ
И ПРЕЗЕНТАЦИЯ АНТИГЕНА
Как уже было упомянуто в предыдущей главе,
возбудители, такие как бактерии и вирусы, могут
проникать в клетки организма и заражать их. При
этом Т-клетки организуют иммунный ответ про-
тив клеток, содержащих проникший микроорга-
низм. Как Т-клеткам удается распознавать инфи-
цированные клетки и вообще присутствие любо-
го чужеродного белка-антигена в клетках организ-
ма-хозяина? Если сказать кратко, в настоящее вре-
мя известно, что белки внутри клетки разделяют-
ся на более мелкие фрагменты — пептиды. Неко-
торые из них ассоциируются с молекулами МНС
I или II класса, а образовавшийся комплекс пере-
мещается на поверхность клетки, где может быть
распознан Т-клеткой с соответствующим рецеп-
тором. В присутствии усиливающих сигналов (они
описаны далее в этой главе и подробно в гл. Ю)
Т-клетка активируется и инициирует иммунный
ответ на распознанный антиген.
Все события, которые сопровождают образо-
вание пептидов из белка внутри клетки, связыва-
ние пептидов с молекулами МНС, представление
комплексов МНС —пептид на поверхности клет-
ки для распознавания Т-клетками, в целом на-
зывают процессингом и презентацией антигена
В этом феномене молекулы МНС играют ключе-
вую роль, и поэтому, как уже было отмечано ра-
нее, говорят о МНС-рестрикции Т-клеточного
ответа. Функции молекул МНС I и II классов в
Т-клеточном ответе, однако, различны. У всех ис-
следованных видов позвоночных функция моле-
кул МНС I класса состоит в презентации пепти-
дов, полученных из белковых антигенов, CD8+-
Т-клеткам. По этой причине принято говорить,
что СВ8+-Т-клетки подвергаются МНС-рестрик-
ции I класса. В отличие от них основная функция
молекул МНС II класса — представление антиге-
нов CD4+-T-клеткам, поэтому они подвергаются
МНС-рестрикции II класса.
Как пептиды, полученные из белковых анти-
генов, связываются с молекулами МНС? Далее
описано, как процессинг двух разных групп бел-
ковых антигенов: экзогенных и эндогенных, при-
водит к связыванию пептидов с молекулами МНС
I или II класса и как образование такого комп-
лекса активирует разные группы Т-клеток.
Ответы на экзогенные антигены:
образование комплексов
молекула МНС II класса — пептид
Как следует из названия, экзогенными являются
антигены, захваченные внутрь клетки обычно пу-
тем эндоцитоза или фагоцитоза (см. рис. 2.2).
Экзогенные антигены являются фрагментами па-
тогенных микроорганизмов (например, бактерий
и вирусов) или чужеродных белков (например,
белка куриного яйца или эритроцитов барана),
которые хотя и не вредят организму-хозяину, ак-
тивируют иммунный ответ. Особенно важны от-
веты на экзогенные антигены, захватываемые
АПК — дендритными клетками, В-лимфоцитами
или макрофагами.
На рис. 9.5 показаны процессинг и презента-
ция типичного экзогенного антигена — белка,
введенного в качестве компонента инактивиро-
ванной или «мертвой» вирусной вакцины. Попадая
внутрь клетки, белок оказывается во внутрикле-
точной вакуоли, которая впоследствии сливается
с существующими эндосомами или лизосомаль-
ными вакуолями. Эндосомы и лизосомы облада-
ют очень кислой средой (pH около 4) и содержат
целый ряд разрушительных ферментов, включая
протеазы и пептидазы. Предполагается, что так-
же протеазы, как катепсины, которые действуют
в кислой среде, вовлечены в избирательное раз-
резание белков в этих вакуолях.
На рис. 9.5 также изображено, что закислен-
ные вакуоли, содержащие фрагменты белков,
встречаются внутри клетки с вакуолями, кото-
рые содержат вновь синтезированные молеку-
лы МНС II класса. Цепи аир молекулы МНС
II класса синтезируются на рибосомах шерохо-
ватого эндоплазматического ретикулума. Внутри
него эти цепи связываются с молекулой CD74 —
инвариантной цепью (П). Одна из областей CD74
взаимодействует с полостью только что синтези-
рованной молекулы МНС II класса, предотвра-
щая связывание с пептидами, которые могут на-
ходиться в эндоплазматическом ретикулуме. (Это
может запустить процессинг эндогенных анти-
генов, описанный в следующем подразделе.)
Молекула CD74 выступает также в роли «шапе-
рона» для вновь синтезированных цепей МНС
II класса: взаимодействие с CD74 позволяет а-
и p-цепям покинуть эндоплазматический ретику-
лум и попасть в комплекс Гольджи, а оттуда вклю-
читься в формирование эндоцитозных вакуолей с
кислой средой. В кислой среде вакуолей CD74
удаляется из молекулярного комплекса. Вначале
CD74 разрушается протеолитическими фермен-
тами, и от него остается только фрагмент CLIP,
связанный с полостью молекулы МНС II класса.
Затем вакуоли, содержащие молекулы МНС II клас-
са, связанные с CLIP, сплавляются с вакуоля-
ми, обладающими кислой средой (эндосомами/
лизосомами), которые содержат пептиды, полу-
ченные в ходе катаболизма экзогенных антиге-
нов. В этих образованиях молекула, которую на-
зывают HLA-DM, облегчает замену пептида в ком-
плексе молекула МНС II класса —CLIP на пеп-
тиды. образовавшиеся из экзогенного антигена.
Так формируется комплекс молекула МНС II клас-
са—пептид, который перемещается к поверхности
клетки, где он может взаимодействовать с CD4+-
ФУНКЦИОНИРОВАНИЕ МОЛЕКУЛ МНС: ПРОЦЕССИНГ И ПРЕЗЕНТАЦИЯ АНТИГЕНА
141
Экзогенный антиген,
например вирусный
белок в вакцине
Презентация CD4 -
Т-клетке
♦ Рис. 9.5. Образование комплексов антигенных пептидов экзогенного происхождения с молекулами МНС II класса: li —
инвариантная цепь; CLIP - фрагмент CD74, который связывается с полостью молекулы МНС II класса
Т-клетками, экспрессирующими рецептор, соот-
ветствующий антигену.
Катаболизм типичного белкового антигена
приводит к образованию нескольких пептидов (на
рис. 9.5 показаны только три). На рис. 9.6 пока-
зано, что связывание молекулы МНС II класса и
пептидов, прошедших процессинг, является се-
лективным'. отдельный пептид связывается с вы-
сокой аффинностью с несколькими, но не со все-
ми молекулами МНС. Эта селективность основа-
на на силе взаимодействия между аминокислота-
ми в составе полости, связывающей белки, в мо-
лекуле МНС и аминокислотами в составе пепти-
дов, появившихся в результате процессинга На
рис. 9.6 пептид 35 — 48 (числа обозначают пози-
ции аминокислот в белковой последовательности)
предпочтительно связывается с HLA-DR4, а пеп-
тид 110 —122 — с HLA-DP2 у человека, организм
которого экспрессирует эти молекулы. Поэтому
мы можем назвать пептиды 35 —48 и 110—122 им-
мунодоминантными Т-клеточными эпитопами об-
суждаемого белка у данного человека, поскольку
они связываются с молекулами МНС, презенти-
руются и активируют СВ4+-Т-клетки.
Пептиды, которые не связываются с молеку-
лами МНС, не активируют Т-клеточный ответ.
На рис. 9.6 пептид 1 — 13 не связывается с моле-
кулами HLA данного организма, поэтому не за-
пускает Т-клеточный ответ. Пептид 1—13, одна-
ко, вполне вероятно, является иммунодоминант-
142
ГЛАВА 9. РОЛЬ ГЛАВНОГО КОМПЛЕКСА ГИСТОСОВМЕСТИМОСТИ В ФОРМИРОВАНИИ ИММУННОГО ОТВЕТА
Процессированные
пептиды
• Рис. 9.6. Избирательное связывание процесси-
рованных пептидов различными аллелями МНС
II класса. Числа соответствуют позициям амино-
кислот в последовательности белкового антигена
Белковый
антиген
ным эпитопом этого белка для организма, экс-
прессирующего другой набор молекул HLA Та-
ким образом, можно почти безошибочно утверж-
дать, что каждый организм может вызвать Т-кле-
точный ответ на этот вирусный белок. Однако
вследствие селективности соединения пептид —
МНС индивидуумы, экспрессирующие разные
аллельные формы молекул МНС, отвечают на
различные части одного и того же белка
Эндогенные антигены:
образование комплексов
молекула МНС I класса — пептид
Эндогенные антигены синтезируются внутри клет-
ки. В основном они извлекаются из патогенов (на-
пример, вирусов, бактерий и паразитов), которые
инфицировали клетку. На рис. 9.7 показаны про-
цессинг и презентация вирусного белка, синтези-
рованного после заражения клетки вирусом. Про-
цессинг эндогенных антигенов происходит ско-
рее в цитоплазме, нежели в вакуолях с кислой
средой, в которых обрабатываются экзогенные
антигены. Главный механизм образования пептид-
ных фрагментов в цитоплазме связан с прохожде-
нием белка через гигантский белковый комплекс —
протеазому. Этот комплекс раскалывает белок на
пептиды длиной около 15 аминокислот. Цитозоль-
ные ферменты (аминопептидазы) удаляют из пепти-
дов еще больше аминокислот. Некоторые пептиды
разрушаются, но некоторые (длиной 8—15 ами-
нокислот) избирательно транспортируются в эн-
доплазматический ретикулум пептидным транс-
портером, продуктом двух генов, ТАР-1 и ТАР-2.
В эндоплазматическом ретикулуме пептиды,
транспортированные из цитозоля, связываются
с вновь синтезированными молекулами МНС
I класса: рис. 9.7 также показывает, что молекулы
МНС I класса и цепи 02-микроглобулина отдель-
но синтезируются в эндоплазматическом ретикулу-
ме и здесь же объединяются. Так же, как и в слу-
чае вновь синтезированных молекул МНС И клас-
са. стабилизировать структуру собранных в эндоп-
лазматическом ретикулуме молекул МНС I клас-
са и цепей 02-микроглобулина и направить комп-
лекс пептид — МНС I класса — 02-микроглобу-
лин сквозь клетку помогают дополнительные бел-
ки. Наиболее изученными дополнительными бел-
ками, уникальными для транспортировки МНС
I класса в эндоплазматический ретикулум, явля-
ются тапазин и шаперон калретикулин.
Молекулы МНС I класса предпочтительно связы-
вают пептиды длиной 8 — 9 аминокислот, т.е. бо-
лее короткие, чем те, что связываются с молеку-
лами МНС II класса, поскольку полость в связу-
ющем участке закрыта с обоих концов. Результа-
ты недавних исследований показали, что обычно
пептиды, достигающие эндоплазматического ре-
тикулума, разрушаются аминопептидазами, кото-
рые отрезают одну аминокислоту за другой до пол-
ного разрушения пептида. «Спасаются» только
пептиды длиной 8 — 9 аминокислот, если связы-
ваются с вновь синтезированной молекулой МНС
I класса. Как и в случае взаимодействия пептид —
МНС п класса, связывание пептидов с молекула-
ми МНС I класса селективно и определяется пос-
ледовательностью и структурой пептида и связу-
ющей полости МНС I класса. Пептид, связываю-
щийся с молекулой МНС I класса в эндоплазма-
тическом ретикулуме, проходит через комплекс
Гольджи к клеточной поверхности, где презенти-
руется СВ84-Т-клеткам, экспрессирующим соот-
ветствующий антигенный рецептор.
Другие пути процессинга
и презентации антигенов
В предыдущих подразделах было описано, как
пептиды из эндогенных и экзогенных антигенов
взаимодействуют с вновь синтезированными мо-
лекулами МНС I и II классов на пути их следо-
вания к клеточной поверхности. Данные также
наводят на мысль, что пептиды могут связывать-
ся с некоторыми молекулами МНС на клеточ-
ной поверхности или с молекулами МНС, не со-
держащими пептиды, или за счет вытеснения
прежде связанных пептидов. Пептиды могут так-
же пересекаться с молекулами МНС, которые уже
ФУНКЦИОНИРОВАНИЕ МОЛЕКУЛ МНС: ПРОЦЕССИНГ И ПРЕЗЕНТАЦИЯ АНТИГЕНА
143
• Рис. 9.7. Процессинг эндогенного
антигена с участием молекул МНС
I класса: р2т — р2-микроглобулин
Синтез
цепей
МНС I класса
и р2т
Сборка МНС Связывание пептида
I класса и р2т Длиной 8—9 аминокислот
с участием с молекулой МНС
шаперонов I класса и р2т
были экспрессированы на поверхности клеток и
затем рециркулировали с поверхности назад в
клетку.
Такие АПК, как дендритные клетки и макро-
фаги, также имеют уникальный путь для образова-
ния пептидов, презентируемых СГ)8+-Т-клеткам, —
перекрестное премирование. Эти АПК могут за-
хватывать экзогенные белковые антигены и обра-
батывать их по пути МНС I класса (в дополнение
к пути МНС II класса). Предполагается, что этот
путь играет важную роль в активации CD8+-T-
клеток в ответах на инфицированные вирусом
клетки и некоторые опухоли (см. гл. 10 и 20 соот-
ветственно).
• Таблица 9.1. Сравнение свойств и функций молекул МНС I и II классов
Показатель МНС I класса МНС II класса
Структура ос-цепь + р2т а- и р-цепи
Домены ocj. ос2, ос3 + р2т Otj + ос2 и Pi + Р2
Конститутивная экспрессия на клетках Почти все ядерные клетки АПК (В-клетки, дендритные клетки, макрофаги)
Полость для связыва- ния пептидов Закрытая, связывает пептиды длиной 8 — 9 аминокислот, формируется аг и а2- доменами Открытая, связывает пептиды длиной 12—17 аминокислот, формируется 0^- и Pj-доменами
Происхождение пептидов Эндогенные антигены, катаболизированные в цитоплазме. Антигены, полученные при перекрестном примировании Экзогенные антигены, катаболизиро- ванные в вакуолях с кислой средой
Презентация пептидов Для CD8 -Т-клеток Для СО4+-Т-клеток
144
ГЛАВА 9. РОЛЬ ГЛАВНОГО КОМПЛЕКСА ГИСТОСОВМЕСТИМОСТИ В ФОРМИРОВАНИИ ИММУННОГО ОТВЕТА
В табл. 9.1 сравниваются свойства молекул МНС
I и И классов и роль этих молекул в обработке
(процессинге) и презентации антигенов.
Какие антигены запускают ответ
каких Т-клеток?
Уже было рассказано, как экзогенные белковые
антигены захватываются АПК, перерабатываются
в органеллах с кислым содержимым, которые пе-
ресекаются с молекулами МНС II класса, пере-
мещающимися своим путем, и активируют CD4+-
Т-клетки. Можно сказать, что почти все без ис-
ключения белки бактерий, вирусов, аллергены
Суперантиген
V-области TCR
ар или уб
Гликолипидный
антиген
Неполяризо-
ванный «хвост»
• Рис. 9.8. Распознавание различных антигенов TCR
(А) Суперантиген связывается с Vp. (Б) Презентация гли-
колипида молекулой CD1
(белки, запускающие аллергический ответ) или
полностью безвредные антигены запускают ответ
СО4+-Т-клеток. Также было рассмотрено, как из
белков, извлеченных из возбудителей, инфици-
ровавших клетки, — бактерий и вирусов, созда-
ются эпитопы (по эндогенному пути или путем
перекрестного примирования), которые презен-
тируются СЭ8+-Т-клеткам. Таким образом, бел-
ки, извлекаемые из этих инфекционных агентов,
активируют CD4+- и СВ8+-Т-клетки.
Заметим, что пути процессинга в большей сте-
пени, чем свойства антигенов, определяют, пред-
ставляется ли белок CD4+- или СО8+-Т-клеткам.
Это положение хорошо иллюстрирует перекрест-
ное примирование (см. ранее), при котором эк-
зогенный антиген перерабатывается по пути МНС
I класса и презентируется СВ8+-Т-клеткам. Ан-
тигены, которые введены в цитоплазму, могут со-
здавать пептиды для представления СЕ)8+-Т-клет-
кам; этот подход может быть полезен для созда-
ния ответов на опухолевые антигены (см. гл. 20).
Суперантигены — это другая категория белко-
вых антигенов. У человека к ним в первую оче-
редь относятся бактериальные токсины, такие как
стафилококковый энтеротоксин. У мыши супер-
антигенами могут быть также продукты некото-
рых вирусов. Суперантигены связываются с мо-
лекулами МНС II класса без предварительного
процессинга, но, как показано на рис. 9.8, Л, бак-
териальные суперантигены связываются с участ-
ком молекулы МНС II класса вне связывающей
пептид полости. На рис. 9.8, А также показано,
что суперантигены связываются с Vp-областью
TCR независимо от экспрессируемой ^-области.
Характерно, что суперантигены связываются с
частью Vp-участка TCR, кодируемого в зароды-
шевой линии, а не с его частью, которая форми-
руется при реаранжировке V-, D- или J-сегмен-
тов p-цепи TCR. Таким образом, поскольку су-
ществует только около 25 эмбриональных генов
Vp (см. гл. 8) и каждый суперантиген связывает от
одной до нескольких эмбриональных последова-
тельностей Vp, то суперантиген может активиро-
вать большое количество Т-клеток организма —
до 10 %, что намного больше, чем обычные анти-
гены. В гл. 10 и И будут более полно рассмотре-
ны клинические последствия активации такого
большого количества Т-клеток.
РАСПОЗНАВАНИЕ ЛИПИДОВ
За последние 10 лет выяснилось, что Т-клетки
могут распознавать липиды и гликолипиды так
же хорошо, как антигены, извлеченные из бел-
ков. Т-клеточный ответ на липидные и глико-
липидные продукты клеточной стенки, извле-
ченные из микобактерий, хорошо известен. На
рис. 9.8, Б показано, что гены и продукты се-
мейства, названного CD1. участвуют в презен-
ФУНКЦИОНИРОВАНИЕ МОЛЕКУЛ МНС: ПРОЦЕССИНГ И ПРЕЗЕНТАЦИЯ АНТИГЕНА
145
тации этих липидов и гликолипидов. Молекулы
CD1 имеют отдаленное родство с семейством
молекул МНС I и II классов, и предполагают,
что они составляют третье семейство антиген-
презентирующих молекул, обеспечивающих
презентацию Т-клеткам липидных и гликоли-
пидных антигенов, извлеченных из микробных
возбудителей.
Молекулы CD1 являются неполиморфными
гликопротеинами клеточной поверхности, не
относящимися к семейству МНС. Они экс-
прессируются в ассоциации с р2-микроглобули-
нами на таких АПК, как дендритные и В-клет-
ки. Соединение липидных антигенов с CD1, как
предполагают, происходит в клеточных вези-
кулах с кислым содержимым, так же как и при
погружении экзогенных пептидов в молекулы
МНС II класса. На рис. 9.8, Б показано, что
структура кристаллизованных молекул CD1
сходна со структурой молекул МНС I класса,
но у CD 1 есть больший связывающий участок
с глубокой полостью. Полость, вероятно, свя-
зывает гидрофобную основу липидного анти-
гена; поляризованный участок липида или гли-
колипида помещается в желобок для связыва-
ния с Т-клеточным рецептором. Было показа-
но, что разные представители семейства CD1
представляют антигены у8+- и оср+-Т-клеткам
и субпопулянии оср+-Т-клеток, называемой
NKl.l-CD4-T-ioieTKn, т.е. клеткам, которые
экспрессируют одновременно поверхностные
молекулы натуральных киллеров и Т-клеток.
Связывание молекулами МНС пептидов,
полученных из собственных молекул
Теперь известно, что феномены процессинга и
презентации антигенов являются компонентами
нормальной физиологической жизнедеятельности
клетки. Другими словами, белки, которые обыч-
но находятся внутри клетки, — собственные бел-
ки — превращаются и метаболизируются тем же
путем, который уже описан в данной главе. На-
пример, рибосомальные или митохондриальные
белки разрушаются внутри клетки и пептиды,
получившиеся из этих молекул, связываются с
молекулами МНС. Действительно, молекулы
МНС, экстрагированные из клеток, почти всегда
содержат пептиды, выделенные из таких собствен-
ных белков.
Однако собственные пептиды, связанные с мо-
лекулами МНС, обычно не активируют Т-клетки;
одна из причин этого состоит в том, что Т-клет-
ки, реактивные к собственным молекулам, уда-
ляются или инактивируются в ходе дифферен-
цировки в тимусе (см. гл. 8). Тем не менее изве-
стно, что зрелые Т-клетки, потенциально спо-
собные реагировать с собственными молекула-
ми, можно обнаружить за пределами тимуса (см.
гл. 11). Почему эти Т-клетки не активируются?
Учитывая, что клетки организма буквально купа-
ются в море собственных белков, которые они
постоянно процессируют и связывают с молеку-
лами МНС, не менее важно узнать, как человеку
удается отвечать на крошечные количества чуже-
родных белков. Это принципиально важные воп-
росы, поскольку Т-клетка должна быть способна
выделить среди множества нормальных клеток
собственного организма, на которые не требуется
вызвать иммунный ответ, клетку, инфицирован-
ную возбудителем, на который необходимо раз-
вить иммунный ответ, чтобы его уничтожить.
Вероятно, ответ на эти вопросы заключается в
том, что для активации иммунного ответа пато-
генные микроорганизмы используют дополнитель-
ные более выраженные эффекты, чем те, что обес-
печивают активацию лимфоцитов только при вза-
имодействии с выделенным пептидом, связанным
с молекулами МНС. Главный эффект, который
вызывают возбудители, заключается в индукции
костимуляторной функции, также называемой
вторыми сигналами, в специализированных клет-
ках, которые представляют антиген Т-клеткам (см.
гл. 10). Костимуляторные сигналы необходимы для
активации наивных Т-клеток (т.е. никогда ранее
не встречавшихся с антигеном). В отличие от па-
тогенов пептиды, полученные из собственных
белков, обычно взаимодействуют с Т-клетками на
клетках нормальной ткани (например, печени или
селезенки), которые не экспрессируют сигналов
с костимуляторной функцией; в этом случае Т-клет-
ки не активируются. Даже если пептиды, полу-
ченные из собственной молекулы, презентируют-
ся АПК в ткани, Т-клетки не активируются. Это
происходит благодаря тому, что АПК в тканях
обычно не экспрессируют костимуляторных сиг-
налов в отсутствие чужеродного антигена или вос-
палительного ответа (см. гл. 10). Эта необходи-
мость в дополнительных сигналах и наличии комп-
лексов МНС —пептид означает, что Т-клетки не
будут отвечать на собственные компоненты, а бу-
дут отвечать на чужеродные потенциально опас-
ные антигены.
Некоторые ученые предполагали, что экспо-
зиция чужеродного антигена может индуцировать
повреждение ткани («гипотеза опасности») и что
сигналы опасности, генерируемые таким образом,
активируют Т-клетки. Эту гипотезу предложили,
чтобы объяснить, почему Т-клетки отвечают на
чужеродные белки и не отвечают на собственные.
Согласно гипотезе собственные белки не образу-
ют сигналов опасности. Для оценки и подтверж-
дения этой гипотезы необходимы дальнейшие
исследования.
Неспособность отвечать на антиген
Как уже описано в предыдущих подразделах, на
клетках любого организма экспрессируется не-
146
ГЛАВА 9. РОЛЬ ГЛАВНОГО КОМПЛЕКСА ГИСТОСОВМЕСТИМОСТИ В ФОРМИРОВАНИИ ИММУННОГО ОТВЕТА
большое число разных молекул (антигенов) МНС
I класса (6) и II класса (обычно от 10 до 20 у
людей; 6 у мышей). Для того чтобы развить Т-кле-
точный ответ, хотя бы один пептид, полученный
в результате процессинга, должен связаться с од-
ной из этих молекул МНС. Пептид, который не
делает этого, не вызывает Т-клеточного ответа.
Поэтому вполне вероятно, что некоторые организ-
мы будут отвечать на небольшой пептид, а другие
особи, отличные по антигенам МНС, не будут.
Подобная ситуация может возникнуть, если не-
скольким людям инъецируют белковую вакцину;
кто-то сформирует на нее ответ, а кто-то — нет.
Если из целого антигена не удается выделить
ни одного пептида, способного связаться с моле-
кулой МНС, то в таком организме Т-клеточный
ответ на этот конкретный антиген не разовьется.
Этот тип нечувствительности к целому антигену
может возникнуть, например, при ответе на син-
тетические полимеры аминокислот, которые со-
держат очень небольшое количество эпитопов.
У патогенных микроорганизмов обычно множе-
ство эпитопов, поэтому неспособность к ответу
на естественные (природные) патогены встреча-
ется крайне редко.
РАЗЛИЧИЯ В МОЛЕКУЛАХ МНС:
СВЯЗЬ МНС С УСТОЙЧИВОСТЬЮ
ИЛИ ВОСПРИИМЧИВОСТЬЮ
К ЗАБОЛЕВАНИЯМ
В этой главе уже был описан выраженный поли-
морфизм генов и молекул МНС. Указывалось, что
такой полиморфизм является серьезным препят-
ствием для приживления ткани, трансплантиро-
ванной от одного организма к другому, посколь-
ку очень маловероятно, что два случайных инди-
видуума будут генетически идентичны (более под-
робно см. гл. 19). Поскольку почти каждый вид
позвоночных вырабатывает подобные различные
наборы генов и молекул МНС, поддержание раз-
нообразия МНС должно иметь какое-то биоло-
гическое преимущество для вида в целом.
Считается, что поддержание разнообразия мо-
лекул МНС является важным механизмом, ко-
торый используют человек и животные, чтобы
защитить себя от массы патогенных организмов.
Чтобы проиллюстрировать это положение, пред-
ставим ситуацию, при которой в популяции су-
ществует только одна молекула МНС, а вновь
возникший возбудитель не продуцирует эпитоп,
способный с ней связаться. В этом крайнем
случае Т-клеточный ответ не будет активиро-
ван, и может исчезнуть целый вид. Таким обра-
зом, поддержание большого числа генов и мо-
лекул МНС в пределах вида значительно сни-
жает риск такого негативного эффекта от одно-
го возбудителя.
Пример того, как разнообразие аллелей МНС
может влиять на прогрессирование заболевания,
был получен при исследовании пациентов, ин-
фицированных ВИЧ-1. У индивидуумов, гетеро-
зиготных (т.е. экспрессирующих разные продук-
ты с отцовской и материнской хромосом) по од-
ному или более локусу HLA I класса, СПИД раз-
вивался позднее, чем у гомозиготных (экспресси-
рующих одинаковые продукты с генов обеих хро-
мосом) индивидуумов. Одним из возможных
объяснений этого является то. что гетерозиготы
по HLA могут презентировать своим Т-клеткам
более широкий спектр пептидов, полученных от
возбудителей, чем гомозиготы, и поэтому у них
более вероятно развитие какого-либо типа защит-
ного ответа
В последние годы стало понятно, что экспрес-
сия определенного аллеля МНС является одним
из важнейших факторов, определяющих воспри-
имчивость или устойчивость к различным инфек-
ционным агентам. У людей экспрессию специ-
фических аллелей HLA связывают с чувствитель-
ностью или устойчивостью к нескольким возбу-
дителям разных инфекционных заболеваний, та-
ким как Т-лимфотропный вирус человека перво-
го типа (HTLV-1), вирус гепатита В, возбудители
лепры, малярии, туберкулеза, а также склонно-
стью к быстрому прогрессированию СПИДа. По-
добные связи восприимчивости и резистентности
с МНС были показаны и для других видов, в ча-
стности болезнь Марека (вирусное заболевание
кур) и вирус бычьего лейкоза у коров. Практи-
чески для всех известных примеров болезней или
состояний, связанных с определенным аллелем
МНС, точные механизмы, связывающие облада-
ние геном с началом или прогрессированием за-
болевания, пока не определены. У пациентов с
определенными аллелями HLA существует боль-
ший риск развития определенных аутоиммунных
или воспалительных болезней. Это более подроб-
но обсуждается в гл. 12.
» ДРУГИЕ ГЕНЫ ОБЛАСТИ МНС
Картирование областей МНС у людей и мышей
показало, что они содержат намного больше ге-
нов (и псевдогенов), чем зоны кодирования по-
лиморфных молекул МНС I и II классов, описан-
ные в этой главе. Область МНС между генами I и
II классов содержит гены МНС III класса, кото-
рые кодируют компоненты сывороточной систе-
мы комплемента С2, С4 и фактор В (описаны в
гл. 13). У людей эта область также содержит и
несколько различных генов: два цитокина (фак-
торы некроза опухоли аир), два белка теплового
шока (hsp 70-1 и 70-2) и 21-гидроксилазу (фер-
мент, участвующий в метаболизме стероидов).
Были идентифицированы дополнительные чело-
веческие (HLA-E, F и G) и мышиные гены МНС
I класса (Qa и TLa), значительно менее полиморф-
ДРУГИЕ ГЕНЫ ОБЛАСТИ МНС
147
ные, чем гены I класса, которые описаны в этой
главе. Функция продуктов большинства этих ге-
нов в настоящее время не очень понятна, но они
могут участвовать в презентации антигенов для
Т-клеток. Предполагается, что экспрессия HLA-
G клетками трофобласта плаценты является од-
ним из механизмов, предотвращающих отторже-
ние плода организмом матери.
Область МНС II класса также содержит не толь-
ко гены, кодирующие молекулы клеточной по-
верхности, которые описаны в этой главе. В част-
ности, это гены HLA-DM и HLA-DO в области
II класса у человека (М и О у мышей). Как было
описано ранее, HLA-DM катализирует замену
пептидов (CLIP, который образуется из инвари-
антной цепи) на пептид из чужеродного белка.
Ген HLA-DO экспрессируется только в В-лим-
фоцитах и эпителиальных клетках тимуса; белок
работает как отрицательный регулятор пептидно-
го обмена, опосредованного HLA-DM. Гены, ко-
торые кодируют молекулы, вовлеченные в путь
презентации антигена с участием МНС I класса, —
белковые транспортные молекулы ТАР-l и ТАР-2
и главные субъединицы протеазомы LMP-2 и
LMP-7, — также находятся в области МНС II клас-
са. Почему все эти гены объединены в комплекс,
который передается по наследству в единстве с
генами, кодирующими основные молекулы меж-
клеточных взаимодействий, в настоящее время
науке неизвестно.
РЕЗЮМЕ
1. Молекулы МНС играют ключевую роль в ответе
Т-клеток на антигены, которые проникают в клетки
организма или живут в них. Эти молекулы связывают
пептиды, полученные из антигенных белков, и презен-
тируют их Т-клеткам с соответствующим рецептором.
Поэтому говорят о МНС-рестрикции Т-клеточного от-
вета.
2. Область МНС кодирует две большие группы
трансмембранных поверхностных клеточных молекул —
I и II классы. Молекулы МНС I класса экспрессируются
на всех ядросодержащих клетках Молекулы МНС
II класса экспрессируются конститутивно только на АПК,
таких как В-клетки или дендритные клетки. Экспрессию
молекул МНС II класса можно индуцировать на клетках
многих типов, особенно в ответ на цитокины, которые
выделяются при ответе на инфекционные агенты.
3. Каждый индивидуум экспрессирует набор раз-
ных молекул МНС I и II классов. Эти различия появля-
ются из-за того, что у конкретных организмов внутри
вида встречаются множество слегка отличающихся
форм (аллелей) генов МНС обоих классов (генетиче-
ский полиморфизм). Благодаря выраженному поли-
морфизму каждый человек обладает почти уникаль-
ным набором наследуемых генов МНС.
4. Внутри одного организма молекулы МНС I и
II классов одинаковы на всех клетках; их экспрессия
на клеточной поверхности кодоминантна (т.е. присут-
ствуют продукты как с материнской, так и с отцовской
хромосомы).
5. На внешней области каждой молекулы МНС I и
II классов находится глубокая бороздка (полость), ко-
торая связывает пептиды, полученные в результате
катаболизма (процессинга) белковых антигенов. Пеп-
тиды с молекулами МНС связываются селективно.
Каждая молекула МНС связывает свой набор пепти-
дов с определенным мотивом.
6. Экзогенные белковые антигены захватываются
внутрь АПК и процессируются до пептидов в вакуолях
с кислой средой, где взаимодействуют с молекулами
МНС II класса. Комплекс пептид — молекула МНС
II класса транспортируется на поверхность клетки, где
взаимодействует с TCR, экспрессируемым СО4+-Т-клет-
кой. Говорят о рестрикции ответа СО4+-Т-клеток мо-
лекулами МНС II класса (собственными молекулами
МНС II класса).
7. Эндогенные белковые антигены, в основном
принадлежащие инфекционным патогенам, проникают
внутрь клетки и процессируются до пептидов в цито-
золе. Пептиды, полученные из этих белков, взаимо-
действуют с молекулами МНС I класса внутри эндо-
плазматического ретикулума. Комплекс пептид —мо-
лекула МНС I класса транспортируется на поверх-
ность клетки, где взаимодействует с TCR, экспресси-
руемым CD8+-T-клеткой. Говорят о рестрикции ответа
СО8+-Т-клеток молекулами МНС I класса (собственны-
ми молекулами МНС I класса).
8. Поскольку белки являются достаточно сложны-
ми структурами, обычно образуется хотя бы один
пептид, способный связаться с молекулой МНС, что
обеспечивает Т-клеточный ответ по меньшей мере на
какую-то часть чужеродного антигена.
9. Молекулы МНС связывают пептиды, получен-
ные из собственных белков, так же как и от чужерод-
ных антигенов, но комплексы молекул МНС с соб-
ственными пептидами в нормальных условиях не ак-
тивируют Т-клеточный ответ. Это связано с тем, что
обычно собственные молекулы не генерируют кости-
муляторные (вторые) сигналы, необходимые для ак-
тивации наивных Т-клеток. Т-клеточный ответ сфоку-
сирован на противодействии чужеродным (несоб-
ственным) молекулам, в частности компонентам мик-
роорганизмов, которые запускают костимуляторные
функции.
10. Восприимчивость или устойчивость к боль-
шинству болезней у людей и других видов связана с
экспрессией определенного аллеля МНС.
ТЕСТЫ
Выберите ОДИН НАИБОЛЕЕ ПРАВИЛЬНЫЙ ответ
на каждый тест.
1. Характеристикой молекул МНС I и II классов не
является следующее:
а) они экспрессируются кодоминантно;
б) экспрессируются конститутивно на всех ядросо-
держащих клетках;
в) являются гликозилированными полипептидами с
доменной структурой;
г) участвуют в презентации фрагментов антигенов
Т-клеткам;
д) экспрессируются на поверхностной мембране
В-клеток.
148
ГЛАВА 9. РОЛЬ ГЛАВНОГО КОМПЛЕКСА ГИСТОСОВМЕСТИМОСТИ В ФОРМИРОВАНИИ ИММУННОГО ОТВЕТА
2. Молекулы МНС I класса важны:
а) для связывания с молекулами CD8 на Т-клетках;
б) презентации экзогенного антигена (например,
бактериального белка) В-клеткам;
в) презентации неизмененных вирусных белков
Т-клеткам;
г) связывания с молекулами CD4 на Т-клетках;
д) связывания с lg на В-клетках.
3. Укажите неправильное утверждение, касающее-
ся молекул МНС II класса:
а) В-клетки могут экспрессировать разные аллель-
ные формы молекул МНС II класса на своей поверх-
ности;
б) молекулы МНС II класса синтезируются в эндо-
плазматическом ретикулуме многих типов клеток;
в) генетически различные индивидуумы экспресси-
руют разные аллели МНС II класса;
г) молекулы МНС II класса связаны с р2-микрогло-
булином на поверхности клетки;
д) пептид, который не связывается с молекулой
МНС II класса, не вызовет СО4+-Т-клеточного ответа
4. Продукты генов ТАР-1 и ТАР-2:
а) связывают с р2-микроглобулином;
б) предотвращают связывание пептидов с молеку-
лами МНС;
в) являются частью протеазомы;
г) транспортируют пептиды в эндоплазматический
ретикулум для связывания с МНС I класса;
д) транспортируют пептиды в эндоплазматический
ретикулум для связывания с МНС II класса
5. Укажите неправильное утверждение о процес-
синге антигена, такого как бактериальный белок, в
клеточной вакуоли с кислой средой:
а) он заканчивается образованием потенциально
иммуногенных пептидов, которые связываются с мо-
лекулами МНС II класса;
б) этим путем процессируются преимущественно
экзогенные антигены;
в) он может привести к активации СО4+-Т-клеток;
г) он может привести к активации СО8+-Т-клеток;
д) пептиды, полученные из бактерий, вытесняют
фрагмент инвариантной цепи из полости для связы-
вания пептидов молекулы МНС II класса.
6. Укажите неправильное утверждение о МНС:
а) он кодирует компоненты комплемента;
б) кодирует обе части молекулы МНС I класса;
в) кодирует обе части молекулы МНС II класса;
г) связан с восприимчивостью и устойчивостью к
различным заболеваниям;
д) полный набор аллелей МНС на хромосоме на-
зывают его гаплотипом.
7. \/(0)и-рекомбинации не требует синтез молекулы:
a) TCRa;
б) TCRp;
в) тяжелой цепи lg;
г) легкой цепи lg;
д) a-цепи МНС II класса
8. Вирус захвачен дендритной клеткой и процес-
сирован по эндогенному пути. Укажите неправильное
утверждение об этом пути:
а) некоторые пептиды, полученные из вирусных
белков, связываются с молекулами МНС I класса;
б) Т-клетки, которые распознают комплекс молеку-
лы МНС и вирусного пептида, процессированного
этим путем, прошли положительный отбор в тимусе;
в) процессинг вирусных белков в пептиды проис-
ходит в протеазоме;
г) прошедшие процессинг пептиды, которые пре-
зентируются Т-клеткам, в длину будут состоять из
12 — 20 аминокислот;
д) конечным результатом этого пути является пре-
зентация СО8+-Т-клетке.
ОТВЕТЫ НА ТЕСТЫ
1—6. Молекулы МНС I класса экспрессируются
почти на всех содержащих ядра клетках, а конститу-
тивная экспрессия молекул МНС II класса ограничива-
ется АПК, таким как В-клетки и дендритные клетки.
Экспрессия МНС II класса может быть индуцирована
цитокинами на клетках других типов, таких как эндо-
телиальные клетки и фибробласты.
2 — а. Взаимодействие CD8, экспрессированного
на Т-клетке, и неизменяемого участка молекулы МНС
I класса, экспрессированной на АПК или клетке-ми-
шени, ограничивает взаимодействие между двумя
клетками и играет определяющую роль в активации
С08+-Т-клеток (см. также гл. 10).
3 — г. С р2-микроглобулином связана молекула
МНС I класса, а не II класса.
4 — г. Продукты генов ТАР-1 и ТАР-2 избирательно
переносят пептиды, образованные в цитоплазме, в
эндоплазматический ретикулум, где они могут свя-
заться с молекулами МНС I класса.
5 — г. СО8+-Т-клетки обычно не активируются про-
дуктами процессинга антигена, происходящего в
органеллах с кислой средой. Такой процессинг экзо-
генного антигена приводит к образованию пептидов,
некоторые из которых могут вытеснять фрагмент ин-
вариантной цепи CLIP из связывающей полости (бо-
роздки) молекулы МНС II класса. Комплексы пептид —
МНС II класс перемещаются на поверхность клетки и
там могут взаимодействовать с CD4+-T-клеткой с со-
ответствующим рецептором.
6 — 6. Ген р2-микроглобулина расположен вне
МНС на другой хромосоме.
7 — д. Цепи lg и TCR образуются рекомбинацией
V(D)J, а цепи МНС синтезируются с индивидуальных
генов в геноме.
8 — г. Пептиды, образованные по эндогенному
пути (включающему деградацию посредством протеа-
зомы в цитоплазме и транспорт в эндоплазматиче-
ский ретикулум), и пептиды, связывающиеся с моле-
кулами МНС I класса, должны быть длиной 8 — 9 ами-
нокислот
Глава
АКТИВАЦИЯ И ФУНКЦИОНИРОВАНИЕ
Т- И В-КЛЕТОК
ВВЕДЕНИЕ
Активация Т- и В-клеток, которые экспрессиру-
ют подходящие рецепторы, завершается пролифе-
рацией — увеличением численности (экспансией)
лимфоцитарного клона — и дальнейшей диффе-
ренцировкой в эффекторные клетки', небольшое
количество размножившихся клеток станет клетка-
ми памяти. Однако эффекторные функции Т- и
В-клеток совершенно различны. Активация и диф-
ференцировка Т-клеток приводят к синтезу и вы-
делению ряда цитокинов, воздействующих на
множество различных типов клеток, или, наобо-
рот, к развитию эффекторных клеток, которые об-
ладают прямым цитотоксическим действием на
клетки хозяина. Напротив, активация и диффе-
ренцировка В-клеток приводят к образованию
антител. В этой главе более детально описано, как
активируются и исполняют свои эффекторные
функции Т- и В-клетки.
АКТИВАЦИЯ CD4+-T-KJ1ETOK
В данном подразделе описано, как СО4+-Т-клет-
ки, которые играют ключевую роль при ответах
почти на все белковые антигены, активируются
экзогенными антигенами. Вначале рассмотрим,
как эти экзогенные антигены захватываются в
организме антигенпрезентирующими клетками
(АПК) и как впоследствии АПК взаимодейству-
ют с CD4+-T-клеткам и.
Специализированные клетки,
представляющие антиген Т-клеткам
Антиген может попасть в организм разными пу-
тями. В этих участках вторжения антигена нахо-
дятся специализированные, или профессиональ-
ные, АПК — особенно в дыхательных путях, ЖКТ
и коже, а также в лимфоидных органах и других
тканях по всему телу. Наиболее важными из них
являются клетки, производные миелоидного рост-
ка костного мозга, — дендритные клетки и мак-
рофаги. Как описано в гл. 9, функциями АПК яв-
ляются захват антигена, его процессинг и презен-
тация Т-клеткам, а также обеспечение костиму-
ляторными сигналами, которые активируют наи-
вные Т-клетки. В настоящей главе более подроб-
но рассмотрена последняя функция.
Дендритные клетки — это гетерогенное семей-
ство клеток, которые можно обнаружить во многих
тканях, включая тимус (как это было описано в
гл. 8). Эти клетки необходимы для инициации от-
вета первичных, или наивных, Т-клеток, т.е. при
первой активации Т-клеток чужеродным антиге-
ном. Для эффективного функционирования ден-
дритных клеток в качестве АПК необходимы мно-
гие свойства: как уже обсуждалось в гл. 9, они
коститутивно экспрессируют высокие уровни
МНС II класса (а также и I класса). Кроме этого
дендритные клетки очень подвижны, быстро пе-
ремещаются из мест, где вошли в контакт с анти-
геном, в лимфатические узлы, в которых смогут
взаимодействовать с Т-клетками. Более того, за-
хват и процессинг дендритными клетками анти-
генов, в частности микробных возбудителей, ин-
дуцируют костимуляторные сигналы, которые не-
обходимы для активации наивных Т-клеток. Да-
лее эти свойства описаны более детально.
На рис. 10.1 показано, что взаимодействие ан-
тигена с дендритной клеткой в ткани определяет
ее созревание, приводящее в конечном счете к
тому, что несущая антиген клетка выходит из тка-
ни в лимфатический узел, дренирующий этот
участок. Антиген, показанный на рисунке, —
грамотрицательная бактерия, захватывается незре-
150
ГЛАВА 10. АКТИВАЦИЯ И ФУНКЦИОНИРОВАНИЕ Т- И В-КЛЕТОК
лой дендритной клеткой в ткани. Бактерия взаи-
модействует с Toll-подобным рецептором (TLR,
см. гл. 2), который экспрессирует дендритная
клетка Семейство TLR является паттернраспо-
знающими молекулами, экспрессирующимися на
клетках врожденной иммунной системы. Они
взаимодействуют с инфекционным микроорга-
низмом или его компонентами: отдельными бак-
териальными продуктами, такими как ДНК, ли-
попротеин и липополисахарид. Некоторые TLR
взаимодействуют с различными бактериальными
компонентами, тогда как другие, как предпола-
гается, — с вирусными продуктами. Клеточная
стенка грамотрицательной бактерии содержит ли-
пополисахарид и взаимодействует с TLR-4, экс-
прессирующимся на дендритной клетке. Это вза-
имодействие, связанное с захватом бактерии в
клетку, активирует феномен, о котором будет
рассказано далее.
Белковые компоненты бактерии процессиру-
ются до пептидов в вакуолях с кислым содержи-
мым по пути МНС II класса, о чем было расска-
зано в гл. 9. На клеточной поверхности появляет-
ся большое количество костимулирующих моле-
кул семейства В7 (CD80/CD86), концентрация
молекул МНС II класса также возрастает. Денд-
ритная клетка тоже синтезирует высокие концен-
трации хемокинов и провоспалительных цитоки-
нов, которые являются растворимыми факторами,
увеличивающими или вызывающими воспалитель-
ный ответ в тканях. К этим цитокинам относят
фактор некроза опухоли (TNF) а и IL-12; об их
функции будет рассказано далее в этой главе и
гл. 12. Таким образом, дендритная клетка, содер-
жащая поцессированные пептиды, покидает ткань,
в которой встретилась с антигеном, и мигрирует
по лимфатическим сосудам в лимфатический узел,
дренирующий эту ткань. (Миграция из ткани ас-
социирована с повышением экспрессии дендрит-
ными клетками хемокинового рецептора CCR7,
см. гл. 12.) В Т-клеточной области лимфатиче-
ского узла уже зрелая дендритная клетка, экс-
прессирующая высокие уровни МНС II класса и
костимулирующих молекул, презентирует пепти-
ды наивной СD4+-Т-клетке, экспрессирующей
Т-клеточный рецептор, специфичный для особой
комбинации МНС и пептида.
Заметим, что при отсутствии сигнала, индуци-
рованного антигеном, незрелые дендритные клет-
ки экспрессируют низкие концентрации кости-
мулирующих молекул. Таким образом, антигены,
не индуцирующие высокие уровни костимулиру-
ющих функций, не активируют наивные Т-клет-
ки. Вот почему, как было рассказано в гл. 9, встре-
ча дендритной клетки с собственными молекула-
ми в нормальной ткани не приводит к активации
этой клетки или Т-клеток — поскольку не инду-
цируется костимулирующая функция. Сходным
образом, как указано в гл. 3, для Т-клеточного и
антительного ответов на многие «безвредные» анти-
Синтез IL-12,
других цитокинов
и хемокинов
Ткань
Toll-подобны и
рецептор
Индукция
МНС II класса
Фагоцитоз и В7
МНС
II класса
В7
• Рис. 10.1. Созревание дендритной клетки после взаимодействия с бактерией в ткани
Незрелая
дендритная клетка
Процессинг
антигена
Миграция нагруженных \
антигеном дендритных
клеток по афферентным
лимфатическим сосудам
в дренирующий
лимфатический узел
Зрелая
дендритная клетка
Презентация
пептида CD4+-
Т-лимфоцитам
Т-клеточная
зона лимфати-
ческого узла
Т-клетка
АКТИВАЦИЯ CD4+-T-KJ1ETOK
151
гены (например, белок куриного яйца, введен-
ный мыши) необходимо присутствие адъюванта
— такого как полный адъювант Фрейнда — кото-
рый включает бактерии или бактериальные ком-
поненты. Бактериальные компоненты адъюванта
используются для активации АПК, в особенно-
сти для экспрессии костимулирующих молекул.
В отсутствие этого добавочного сигнала даже чу-
жеродный антиген может вызвать низкий ответ
или вообще его не вызвать.
Миграция АПК, несущих антиген в дрениру-
ющий узел, сочетается со способностью наивных
Т-клеток рециркулировать по лимфатическим
сосудам в лимфатические узлы (см. гл. 2). Это
увеличивает вероятность того, что единичный
Т-лимфоцит, экспрессирующий подходящий TCR
(по приблизительной оценке это примерно один
из общей популяции, составляющей 105— 106 кле-
ток), взаимодействует с АПК, несущей антиген.
В самом деле, исследования свидетельствуют, что
это взаимодействие происходит в организме в те-
чение нескольких часов после введения антигена.
Хотя ранее в этой главе было подчеркнуто,
что АПК, несущие антиген, и наивные Т-клетки
взаимодействуют в лимфатическом узле, необ-
ходимо отметить, что взаимодействие несущих
антиген АПК и Т-клеток — особенно активиро-
ванных и Т-клеток памяти — может происходить
в любой ткани, зараженной или поврежденной
антигеном. Каскад событий, развивающихся пос-
ле того, как АПК в соединении с пептидом вза-
имодействует с СО4+-Т-клеткой. описывается
далее.
Парные взаимодействия
на поверхности АПК и СО4+-Т-клетки
В этом подразделе, иллюстрацией к которому слу-
жит рис. 10.2, описаны множественные взаимо-
действия между поверхностями АПК и CD4+-T-
клетки
Пептид/МНС и TCR
Взаимодействие комплекса пептид—молекула
МНС II класса, экспрессированного на АПК, и ва-
риабельных областей Va + Vp TCR на Т-клетке
называют первым сигналом Т-клеточной актива-
ции. Это взаимодействие необходимо, но в основ-
ном недостаточно для Т-клеточной активации,
особенно для активации наивных СЭ4+-Т-клеток,
вследствие низкой склонности к взаимодействию
между TCR и комплексом пептид —МНС.
Гпавный комплекс гистосовместимости
II класса и CD4
Взаимодействие неполиморфного участка моле-
кулы МНС II класса (т.е. вне связывающей пеп-
тид полости) с дополнительным рецептором CD4
• Рис. 10.2. Ключевые взаимодействия клеточных поверх-
ностей, ведущие к активации Т-клеток и секреции цито-
кинов Штриховкой указана экспрессия, повышающаяся
при активации
значительно повышает способность Т-клетки от-
вечать на антиген. Показано, что взаимодействие
CD4 - МНС II класса делает клетку в 100 раз
более чувствительной к антигену, чем при его
отсутствии. Рецептор CD4 играет важную роль в
трансдукции Т-клеточного сигнала, о чем будет
рассказано в следующем подразделе. Предпола-
гается, что после того как комплекс пептид — МНС
свяжется с TCR, CD4 приближается к TCR, и ци-
топлазматический хвост CD4, связанный с фер-
ментом, участвует в Т-клеточной активации;
«группирование» CD4 с TCR добавляет этот фер-
мент в комплекс, формирующийся для передачи
сигнала.
Костимулирующие пары: В7 с CD28
или CD152, CD40 с CD154
Ранее в этой главе было описано, как взаимодей-
ствие с чужеродным антигеном индуцирует кос-
тимуляторные молекулы на поверхности АПК.
Костимулятор, или второй сигнал, усиливает и
поддерживает сигналы, образовавшиеся при вза-
152
ГЛАВА 10. АКТИВАЦИЯ И ФУНКЦИОНИРОВАНИЕ Т- И В-КЛЕТОК
имодействии МНС — пептид — TCR (далее будет
рассказано, как это осуществляется). Костимуля-
торы необходимы для активации наивных (непри-
мированных) Т-клеток, но менее важны для ак-
тивации ранее при мированных Т-клеток.
Наиболее изучены костимуляторные взаимо-
действия между семейством молекул, названным
В7, которые экспрессируются на профессиональ-
ных АПК (таких как дендритные клетки, макро-
фаги и активированные В-лимфоциты), и CD28,
конститутивно экспрессируемыми на Т-клетках.
Больше всего известно о молекулах CD80 и CD86
семейства В7 (В7.1 и В7.2 соответственно); обе
связываются с CD28. В настоящее время не ясно,
обладают ли CD80 и CD86 разными функциями.
Они также взаимодействуют с другой молекулой
на Т-клеточной поверхности — CD152 (называе-
мой CTLA-4), которая индуцируется при Т-кле-
точной активации. Молекула CD 152 относится к
тому же семейству молекул, что и CD28, но игра-
ет в активации Т-клеток другую роль (обсуждает-
ся далее). Костимуляторные функции других мо-
лекул семейств В7 и CD28 в настоящее время уточ-
няются.
Взаимодействие комплекса пептид —МНС с
TCR также усиливает экспрессию CD154 (лиганд
CD40 — CD40L) на Т-клетке. Молекула CD 154
взаимодействует с CD40, постоянно экспресси-
руемой АПК, такими как дендритные клетки и
макрофаги, а также В-клетками Взаимодействие
CD40 — CD 154 вызывает повышение экспрессии
В7 на поверхности АПК и таким образом уси-
ливает взаимодействие В7 —CD28 между АПК и
Т-клеткой. Взаимодействие CD 154 на активи-
рованной Т-клетке с CD40, экспрессируемой на
В-клетке, играет ключевую роль во взаимодей-
ствии Т- и В-клеток (описано далее).
Молекулы адгезии: CD54 с CD11a/CD18f
CD58 с CD2
Две пары адгезивных взаимодействий усиливают
и стабилизируют взаимодействие АПК и Т-клет-
ки на несколько часов, которые клеткам необхо-
димо провести в контакте для активации Т-лим-
фоцита. Первое взаимодействие осуществляется
между CD54 (молекула межклеточной адгезии 1;
intercellular adhesion molecule 1 — ICAM-1), экс-
прессируемой на АПК, и интегрином CDlla/CD18
(антиген, связанный с функционированием лейко-
цитов Z; leukocyte function-associated antigen 1 —
LFA-1), экспрессируемым на Т-клетке. Второе
взаимодействие осуществляется между CD58
(LFA-3), экспрессируемыми на АПК, и CD2, экс-
прессируемыми на Т-клетке. Кроме того, пред-
полагается, что эти адгезивные взаимодействия за-
медляют отделение АПК от Т-клеток при первом
взаимодействии; это обеспечивает необходимое
время для сканирования TCR поверхности АПК
в поисках подходящего комплекса МНС п клас-
са — пептид.
Иммунологический синапс
По нынешним представлениям при взаимодей-
ствии АПК и пептида с СО4+-Т-клеткой форми-
руется область межклеточного контакта, назы-
ваемая иммунологическим синапсом. Кроме
комплекса МНС —пептид и TCR, синапс фор-
мируют пары адгезионных молекул, описанные
ранее, и молекулы В7 — CD28 на поверхности
Т-клетки и АПК. (Входит ли взаимодействие
CD40 —CD154 в синапс, еще не решено.) Кроме
того, со стороны Т-клетки синапс формируют
сигнальные молекулы, рекрутируемые изнутри
Т-клетки (описаны далее), и белки цитоскелета.
Похоже, что синапс необходим для поддержа-
ния обмена сигналами между клетками, который
продолжается, пока АПК и Т-клетка не разой-
дутся после контакта длительностью около 8 ч.
Синапс динамично формируется и развивается;
его состав и структура меняются с течением вре-
мени после первого контакта. Например, пар-
ные молекулы адгезии CD54 (ICAM-1) и CD11а/
CD 18 (LFA-1) находятся в различных зонах си-
напса и появляются в разное время от момента
первого контакта между клетками. Кроме того,
другие молекулы включаются или исключаются
из синапса спустя разное время от момента пер-
вого контакта.
Данные нескольких экспериментов свидетель-
ствуют, что после активации Т-клетки реорга-
низуют свою структуру, как внутренний цито-
скелет, так и клеточную мембрану. В мембране
Т-клеток структура липидов негомогенна; они
формируют так называемые микродомены, или
липидные «плоты», обогащенные холестерином
и гликосфинголипидами. При активации Т-кле-
ток эти липидные «плоты», которые до этого
были распределены по мембране, подтягивают-
ся к синапсу и приносят с собой компоненты
межклеточных сигналов (описаны далее). Это
перемещение также выталкивает из зоны кон-
такта молекулы, не вовлеченные во взаимодей-
ствие АПК с Т-клеткой.
Межклеточные события
при активации СО4+-Т-клетки
Множество недавних исследований было посвя-
щено идентификации последовательности акти-
вационных событий внутри СО4+-Т-клетки после
первоначального контакта с АПК, экспресси-
рующей пептид, связанный с молекулой МНС
II класса. Тем не менее все стадии этого сложно-
го и взаимосвязанного процесса полностью не по-
нятны. хотя определенно известно, что актива-
ционный каскад распространяется в определен-
ном порядке от поверхности клетки через цито-
плазму в ядро. Также известно, что некоторые со-
бытия происходят за секунды, другие — через
АКТИВАЦИЯ CD4--Т-КЛЕТОК
153
Активация транскрипционных
факторов, в том числе
NF-кВ, NF-AThAP-1
• Рис. 10.3. Внутриклеточные события при активации Т-лимфоцита. Для простоты показа-
ны только по одной цепи CD3 £ и один фосфорилированный ITAM Оранжевые полукруги
обозначают фосфатные группы, добавленные к активированной молекуле
минуты, а некоторые — спустя часы после нача-
ла взаимодействия. Основные события при акти-
вации Т-клеток описаны в следующих подразде-
лах и на рис. 10.3.
Стартовый сигнал
Связывание комплекса МНС —пептид с внекле-
точными вариабельными областями (Va+ Vp) TCR
приводит к передаче сигнала через плотно свя-
занные молекулы CD3 и £ внутрь Т-клетки. При-
рода передачи через мембрану в настоящее время
еще не известна: возможно, она связана с агрега-
цией нескольких молекул TCR в мембране клет-
ки (подобно первым шагам активации через В-
клеточный рецептор, как будет описано далее) или
с конформационными изменениями трансмемб-
ранной области цепей TCR
Фосфорилирование киназ, сборка
и активация сигнального комплекса
на клеточной мембране
После связывания лиганда с TCR одним из пер-
вых событий, определяемых в Т-клетке через не-
сколько секунд, является активация тирозиновых
киназ — ферментов, которые активируют белки
путем присоединения фосфатных групп к остат-
кам тирозина. Тирозинкиназы связаны с цитоп-
лазматическими участками комплекса TCR и мо-
лекул CD4. (Предполагают, что мембранный бе-
лок CD45 — тирозиновая фосфатаза, активирует
эти киназы, удаляя ингибирующие фосфатные
группы). Тирозинкиназа, связанная с CD3 и £,
называется Fyn, а тирозинкиназа, связанная с
CD4, — Lek, Обе принадлежат к семейству тиро-
зиновых киназ, известных Src (произносится как
154
ГЛАВА 10. АКТИВАЦИЯ И ФУНКЦИОНИРОВАНИЕ Т- И В-КЛЕТОК
«сарк»). Когда Fyn и Lek активированы, они груп-
пируются с областями CD3 и ^-цепями, которые
содержат описанные ранее иммунорецепторные
тирозинсодержащие активационные мотивы (по-
следовательности) (ITAM), и активируют их. Эта
группировка (кластер) также подтягивает CD4,
находящийся в тесной ассоциации с комплексом
TCR, как описано ранее. Фосфорилированные
последовательности ITAM в CD3 и £ служат мес-
том прикрепления еще одной тирозиновой кина-
зы ZAP-70 (она принадлежит ко второму семей-
ству тирозиновых киназ — Syk). Эту стадию счи-
тают ключевой для активации Т-клеток, поскольку
у некоторых пациентов, у которых нет ZAP-70,
Т-клетки не отвечают на антиген Так как CD3 и
£ содержат множество ITAM-последовательностей,
к этому комплексу сигнальных белков присоеди-
няется более одной молекулы ZAP-70.
Тирозинкиназа, связанная с CD4, активирует
ZAP-70, когда она уже присоединена к мульти-
молекулярному комплексу сигнальных белков
Активированная ZAP-70 фосфорилирует множе-
ство белков внутри клетки. Среди наиболее зна-
чимых субстратов активации ZAP-70 можно на-
звать адаптерные молекулы. Эти белки не обла-
дают ферментативной активностью, но содержат
множество участков для связывания с другими
белками. Два типа этих важных адаптерных моле-
кул, фосфорилированных после Т-клеточной акти-
вации, — LAT и SLP-76 — показаны на рис. 10.3.
Фосфорилированные адаптеры привлекаются к
клеточной мембране, увеличивая тем самым ком-
плекс молекул для трансдукции сигнала, форми-
рующийся в иммунологическом синапсе. Таким
образом, на цитоплазматической стороне Т-кле-
точной мембраны собирается и активируется
мультимолекулярный белковый комплекс, состо-
ящий из молекул, последовательно передающих
сигнал.
Активация внутриклеточных
сигнальных механизмов
Активированные адаптерные молекулы, привле-
ченные в иммунологический синапс, связывают
ферменты и другие адаптеры, активирующие не-
которые важные внутриклеточные сигнальные
пути. Адаптерные молекулы связывают фосфоли-
пазу С-у(РЬС-у), которая после фосфорилирова-
ния ZAP-70 катализирует разрушение мембран-
ного фосфолипида фосфотидилинозитола дифос-
фата (Р1Р2). Он разделяется на два компонента:
диацилглиперол (ДАГ), который активирует ас-
социированный с мембраной фермент протеин-
киназу С (РКС). активирующую киназный кас-
кад, который приводит в конечном счете к актива-
ции в цитоплазме фактора транскрипции NF-kB.
и инозитолтрифосфат (1Р3), увеличивающий внут-
риклеточную концентрацию свободного кальция,
который в свою очередь активирует цитоплазма-
тическую молекулу кальциневрина, приводя к
активации фактора транскрипции NF-АТ. Этот
механизм является клинически значимым, по-
скольку иммуносупрессант циклоспорин А, ис-
пользуемый для предотвращения отторжения
трансплантата между генетически различающими-
ся организмами, связывается с кальциневрином
и посредством этого ингибирует следующие эта-
пы Т-клеточной активации (см. гл. 19).
Также активированные адаптерные молеку-
лы связываются и активируют связывающие нук-
леотид гуанозин белки, называемые Ras и Rac.
которые в свою очередь активируют цитоплаз-
матический каскад митогенактивируемых про-
теинкиназ (mitogen-activated proteinkinases —
МАР), ведущий к активации фактора транскрип-
ции АР-1.
Секреция цитокинов и пролиферация
Как показано на рис. 10.3, NF-кВ, NF-АТ, АР-1
и другие активированные факторы транскрипции
поступают в ядро Т-клетки и избирательно свя-
зываются с регуляторными последовательностя-
ми различных генов. В результате гены, кодиру-
ющие цитокин IL-2 и одну цепь рецептора IL-2
(IL2Roc; CD25), транскрибируются и транслиру-
ются (рис. 10.4). IL-2Roc соединяется с другими
цепями рецептора, формируя высокоаффинный
рецептор для IL-2 на активированной Т-клетке
(см. гл. 11). В течение 24 ч клетка увеличивается в
размере (становится Т-клеточным бластом) и
начинает секретировать белок IL-2. Интерлей-
кин-2 является фактором роста Т-клеток и свя-
зывается со своим высокоаффинным рецептором
на этой же самой или другой Т-клетке. Спустя
примерно 48 ч синтезируется ДНК, и приблизи-
тельно еще через 24 ч активированные CD4+-T-
клетки начинают пролиферировать, что ведет к
увеличению их количества в этом конкретном
клоне Т-клеток. Некоторые из этих активирован-
ных клеток развиваются в СО4+-клетки памяти.
Роли B7-CD28 и B7-CD152
в активации Т-клеток
Ранее подчеркивалось значение взаимодействия
членов семейства В7 с CD28 для усиления и под-
держки сигнала от комплекса пептид—МНС и
TCR на наивной СО4+-Т-клетке. Как уже было
отмечено, считается, что при отсутствии кости-
муляторного сигнала В7 —CD28 наивная CD4+-
Т-клетка не производит IL-2 и может оставать-
ся инактивированной (анергичной\ обсуждается в
гл. 12).
Как взаимодействие В7 —CD28 приводит к
«полной» активации Т-клеток, пока не до конца
понятно, но предполагают, что при этом задей-
ствуются несколько различных механизмов. Од-
ним из важных путей является увеличение дли-
тельности жизни некоторых иРНК, в частности
АКТИВАЦИЯ CD4+-T-KJ1ETOK
155
• Рис. 10.4. Секреция IL-2 и его
взаимодействие С высокоаффин- Цепь IL-2Ra (CD25) образует
нмм II -7-ПР1 1рптпппк/1 ппмпппя- высокоаффинный рецептор
иРНК IL-2, в результате активации Т-клетки че-
рез CD28. Это приводит к увеличению синтеза
белка IL-2 в Т-клетках, активированных как пер-
вым, так и вторым сигналом, по сравнению с
клетками, активированными только через TCR.
Результаты исследований также свидетельствуют,
что сигнал от CD28 увеличивает жизнеспособ-
ность Т-клеток путем индукции экспрессии бел-
ка Bcl-х, который угнетает апоптоз. Недавно по-
лученные данные также указывают, что взаимо-
действие В7 —CD28 мобилизует липидные пло-
ты внутри Т-клетки; таким способом CD28 при-
влекает молекулы, такие как тирозиновые кина-
зы, которые участвуют в активации Т-клеток,
находясь внутри них, в месте, где TCR контак-
тирует с АПК. Также было показано, что взаи-
модействие В7 —CD28 активирует киназу, назы-
ваемую фосфатидилинозитол-3-киназа; актива-
ция последующих этапов этого киназного пути,
вероятно, усиливает внутриклеточную передачу
сигнала, проводимого через TCR.
Ранее было указано на возможность контакта
лигандов на поверхности АПК из группы В7
(CD80 и CD86) с поверхностной молекулой
Т-клетки, родственной CD28, CD152 (называе-
мой CTLA-4). В отличие от CD28, которая экс-
прессируется на покоящихся Т-клетках, экспрес-
сия CD 152 индуцируется вследствие активации
Т-клетки.
Взаимодействие В7 с CD 152 передает негатив-
ный сигнал в активированную Т-клетку. Он вы-
ключает продукцию IL-2 и, таким образом, про-
лиферацию Т-клеток, ограничивая длительность
иммунного ответа. Механизм негативного эф-
фекта, связанного с В7 — CD 152, полностью не
ясен; как и при взаимодействии В7 —CD28. ве-
роятно. вовлечены множество биохимических ме-
ханизмов. Последние данные позволяют предпо-
ложить, что CD 152 действует в иммунологиче-
ском синапсе путем замещения ключевых ком-
понентов сигнального комплекса и/или ограни-
чения их функций.
Миграция из лимфатического узла
Спустя несколько дней после первых активаци-
онных этапов, активированные Т-клетки и клет-
ки памяти покидают лимфатический узел и на-
правляются в различные участки организма, в ча-
стности в те, которые подвергались воздействию
или были инфицированы патогенными микроор-
ганизмами. Миграция из лимфатического узла
связана со сменой экспрессии поверхностных кле-
точных молекул, о которой было упомянуто в гл. 8.
В основном на активированных Т-клетках снижа-
ется экспрессия CD64L (L-селектина или MEL-14),
рецептора хоминга наивных Т-клеток, который
позволяет клеткам войти в лимфатический узел.
Активированные Т-клетки увеличивают экспрес-
сию других молекул клеточной поверхности, та-
ких как интегрин CD49dCD29 (VLA-4) и CD44.
Лиганды к этим молекулам экспрессируются за
пределами лимфатического узла в таких тканях,
как кожа, или в очагах воспаления. Результаты
недавно проведенных исследований также указы-
вают, что активированные Т-клетки отличаются
от наивных по экспрессии хемокиновых рецеп-
торов. Таким образом, вследствие этой смены
экспрессии молекул хоминга и хемокиновых ре-
цепторов активированные Т-клетки и клетки па-
мяти выходят из лимфатического узла и направ-
ляются в ткани.
• ДРУГИЕ ПУТИ АКТИВАЦИИ
Т-КЛЕТОК
В предыдущих подразделах преимущественно об-
суждалось, как комплекс пептид — МНС, экспрес-
сируемый на АПК, активирует специфический
клон Т-клеток. Поскольку наивные Т-клетки,
специфичные к какому-либо конкретному пепти-
ду, встречаются редко (примерно одна на 105— 106
Т-клеток), то одним комплексом пептид —МНС
156
ГЛАВА 10. АКТИВАЦИЯ И ФУНКЦИОНИРОВАНИЕ Т- И В-КЛЕТОК
активируется лишь небольшая фракция из всего
Т-клеточного пула. В связи с этим трудно иссле-
довать ответ на антиген таких единичных анти-
генспецифичных Т-клеток, присутствующих в
общей популяции. Для изучения ответа изолиро-
ванных антигенспецифичных Т-клеток, их акти-
вации и функционирования иммунологи разра-
ботали множество методик. Это, например, куль-
тивирование in vitro клонов из отдельной активи-
рованной антигеном Т-клетки и использование
трансгенных мышей, у которых Т-клетки экс-
прессируют только один тип TCR. Эти подходы
обеспечивают получение важной информации
(более полно рассмотрено в гл. 5).
Наивные Т-клетки можно активировать не-
сколькими различными путями, в том числе и
без использования комплексов пептид—МНС.
Применение альтернативных методов активации
позволяет оценивать функции не только неболь-
ших субпопуляций неактивированных антиген-
специфичных Т-клеток, но и функции суще-
ственно более широкой популяции лимфоци-
тов. Некоторые альтернативные пути активации
популяции Т-клеток, не контактировавшей с ан-
тигеном, изложены далее. В основном послед-
ствия активации Т-клеток этими альтернатив-
ными методами, из которых наиболее важными
являются продукция цитокинов и пролифера-
ция клеток, очень похожи на те, которые опи-
саны ранее при активации Т-клеток комплек-
сами пептид—МНС.
Суперантигены
На рис. 9.8 показаны уникальные связывающие
способности суперантигенов. У человека суперан-
тигенами преимущественно являются бактериаль-
ные токсины патогенных микроорганизмов, та-
ких как Staphylococcus aureus. Суперантигены ак-
тивируют СЭ4+-Т-клетки, которые экспрессиру-
ют определенные молекулы Vp в качестве одной
из цепей TCR. Поскольку отдельные области Vp
(например, Vp3 или Vpl I) могут экспрессировать-
ся на 10 % популяции Т-клеток, при контакте су-
перантигена с Т-клетками организма может ак-
тивироваться значительная их часть, причем это
клетки с разной антигенной специфичностью.
Массивное выделение цитокинов вследствие воз-
действия суперантигена может привести к повреж-
дению организма (см. гл. 12).
Растительные белки и антитела
к поверхностным молекулам Т-клеток
Некоторые вещества природного происхождения
обладают способностью активировать многие, если
не все, клоны лимфоцитов. Такие вещества назы-
вают поликлональными активаторами или мито-
генами, потому что они способны индуцировать
митоз в клеточной популяции. Растительные
гликопротеины конканавалин А (Кон А) и фито-
гемагглютинин (ФГА), в частности, являются по-
тенциальными митогенами Т-клеток. Эти моле-
кулы являются лектинами, т.е. связываются с
функциональными углеводными группами бел-
ков. Предполагается, что и Кон А, и ФГА дей-
ствуют через TCR. Поскольку Т-клеточный от-
вет крови здорового человека ограничен четко
определенными рамками, недостаточный ответ
на Кон А и ФГА часто указывает на иммуносуп-
рессию у пациента. Еще один растительный лек-
тин, митоген лаконоса, одновременно активиру-
ет и Т-, и В-клетки.
Некоторые антитела, специфичные к CD3,
обладают способностью активировать Т-клетки.
Поскольку CD3 экспрессируется на всех Т-клет-
ках совместно с Т-клеточным рецептором, такие
анти-СВЗ антитела способны индуцировать про-
лиферацию всех Т-клеток.
Липиды
В гл. 9 описано, как некоторые Т-клетки распоз-
нают антигены липидов и гликолипидов, пред-
ставляемые CD1+ АПК, такими как дендритные
клетки, и отвечают на них. Одной из субпопуля-
ций Т-клеток, активируемых липидами, являют-
ся МК1.1-СО4-Т-клетки — субпопуляция оср+-Т-
клеток, которая одновременно экспрессирует по-
верхностные молекулы натуральных киллеров и
Т-клеток. Эти клетки в ответ на полученный из
инфекционных агентов антиген в больших коли-
чествах синтезируют цитокины, в частности IL-4.
Предполагается также, что эти клетки являются
первой линией защиты от инфекционных микро-
организмов.
• ФУНКЦИИ Т-КЛЕТОК
Одной из ключевых эффекторных функций акти-
вированной СО4+-Т-клетки является синтез ан-
ти ген неспецифичных растворимых факторов —
цитокинов. Выделяемые СО4+-Т-клетками цито-
кины влияют на функции множества типов кле-
ток, в том числе СО8+-Т-клеток, В-клеток, мие-
лоидных клеток (таких как макрофаги и эозино-
филы), а также на дифференцировку костномоз-
говых клеток-предшественников. По этой причине
потеря CD4+-T-kjictok при СПИДе является та-
кой разрушительной. Свойства цитокинов, кото-
рые продуцируют Т-лимфоциты и другие клетки,
природа цитокиновых рецепторов детально об-
суждаются в гл. 11. Многие важные функции Т-
клеток будут обсуждаться в следующих главах, по-
священных клеточно-опосредованному иммуни-
тету и трансплантациям. В следующих подразде-
лах сконцентрируемся на гетерогенности цитоки-
нов, которые образуют СВ4+-Т-клетки, а затем
ФУНКЦИИ Т-КЛЕТОК
157
опишем важные аспекты взаимодействия CD4+-
Т-лимфоцитов и В-клеток и, наконец, обсудим
функции CD8+-T-клеток.
Субпопуляции С04+-Т-клеток,
отличающиеся по выделяемым
цитокинам
Ранее в этой главе было описано, как наивная
СО4+-Т-клетка после стимуляции пептидом, свя-
занным с молекулой МНС, начинает синтезиро-
вать IL-2. Активированная СЭ4+-Т-клетка может
дифференцироваться дальше, чтобы синтезировать
более широкий набор цитокинов. Однако после
антигенной стимуляции не все СО4+-Т-клетки
синтезируют одинаковые цитокины. Исследова-
ния функционирования Т-клеток у мыши и чело-
века показали, что активированные антигеном
СО4+-Т-клетки могут быть разделены по мень-
шей мере на три субпопуляции на основании про-
дукции различных цитокинов: Ти(), ТН1 и Тн2. Как
показано на рис. 10.5, ТН1 и Тн2 образуются в
результате вызываемой антигеном дифференци-
ровки клеток Тн0, которые синтезируют IL-2, IFNy
и IL-4.
ТН1-клетки, которые синтезируют IL-2, IFNy
и TNFp, и Тн2-клетки, синтезирующие IL-4, IL-5,
IL-10 и IL-13, играют разные важные роли в им-
мунном ответе. Поскольку разные цитокины вза-
имодействуют с различными клетками-мишеня-
ми, главным следствием продукции уникальных
наборов цитокинов Тн1- и Тн2-клетками являет-
ся то, что каждая субпопуляция обладает разной
эффекторной функцией. Так, цитокины, синтези-
руемые Тн1-клетками, активируют клетки, во-
влеченные в клеточно-опосредованный иммуни-
тет: СВ8+-Т-клетки, NK-клетки и макрофаги.
Кроме того, цитокины, выделяемые ТН1-клетка-
ми, индуцируют В-клетки к синтезу таких изоти-
пов Ig, как IgG2, которые усиливают фагоцитоз
возбудителей фагоцитирующими клетками (см.
гл. 4 и обсуждение Т—В-взаимодействия далее
в этой главе). Напротив, цитокины, синтезиру-
емые Тн2-клетками, переключают В-клетки на
продукцию антител класса IgE и активацию эози-
нофилов; такая модель характерна для ответа на
аллергены и гельминты. Большинство из этих
функций Т-клеток будет обсуждаться в следую-
щих главах.
Пока результаты попыток охарактеризовать по-
верхностные молекулы, по которым можно было
бы отличать субпопуляции Тн1- и Тн2-клеток, не
дали однозначных результатов, а сами эти иссле-
дования интенсивно продолжаются. Результаты
некоторых недавних исследований показали, что,
возможно, Тн1- и Тн2-клетки экспрессируют раз-
личные молекулы, используемые при межклеточ-
ном взаимодействии в процессе хоминга, в том
числе различные хемокиновые рецепторы; одна-
ко для подтверждения или изменения этих выво-
дов необходимы дальнейшие исследования.
Многие антигены вызывают образование суб-
популяций Тн0, ТН1 и Тн2 СD4+-T-клеток, при-
чем некоторые антигены преимущественно сти-
Дендритная
клетка
• Рис. 10.5. Цитокиновый контроль образования Тн1- и Тн2-субпопуляций CD4+-T-клеток.
Волнистые линии означают угнетение
158
ГЛАВА 10. АКТИВАЦИЯ И ФУНКЦИОНИРОВАНИЕ Т- И В-КЛЕТОК
• Таблица 10.1. Синтез цитокинов субпопуляциями
ТН1 и Тн2 С04+-Т-клеток
Цитокин TH1 TH2
IL-2 + -
IFNy + -
TNFp (лимфотоксин) + -
IL-4 - +
IL-5 - +
IL-6 -(+) + (++)
IL-10 -(+) + (++)
IL-P - (+) + (++)
IL-3 + +
ГМ-КСФ + +
Примечание. Плюсы в скобках показывают, что у лю-
дей IL-6, IL-10 и IL-13 также синтезируются Тн1-клетками,
но в более низких концентрациях, чем Тн2-клетками.
мулируют размножение одной из субпопуляций. В
частности, вирусы и бактерии активируют про-
дукцию ТИ1-клеток, в то время как аллергены и па-
разиты стимулируют преимущественно Тн2-клет-
ки. На рис. 10.5 показано, что основным факто-
ром. определяющим дифференцировку в направ-
лении Тн1- или Тн2-клеток под действием раз-
личных антигенов, является наличие цитокинов
в момент стимуляции Т-клетки.
ТН1-клетки развиваются, если в момент анти-
генной стимуляции присутствует IL-12. Как по-
казано в начале этой главы, IL-12 и другие про-
воспалительные цитокины образуются дендрит-
ными клетками и другими АПК в самом начале
ответа на такие возбудители, как бактерии и ви-
русы. Эти цитокины также синтезируются други-
ми клетками врожденного иммунитета, в том чис-
ле NK-клетками. Напротив, присутствие IL-4 в
начале иммунного ответа приводит к дифферен-
цировке в сторону Тн2-клеток. Источник этого IL-
4 до сих пор не ясен; он может образовываться
или активированными СВ4+-Т-клетками, или туч-
ными клетками. Предполагается, что и другие фак-
торы, такие как концентрация и путь введения
антигена, степень аффинности взаимодействия
между комплексом пептид —МНС и TCR и при-
рода АПК, участвовавшей в ответе, могут влиять
на то, какая субпопуляция СВ4+-Т-клеток разо-
вьется.
На рис. 10.5 также показано, что цитокины,
выделяемые Тн1, могут угнетать функции Тн2, и
наоборот. Например, IFNy, образуемый ТН1-клет-
ками, угнетает размножение Тн2-клеток, a IL-4 и
IL-10, образуемые Тн2-клетками, угнетают раз-
множение ТН1-клеток. В табл. 10.1 представлены
две важные характеристики субпопуляций ТН1 и
Тн2 СD4+-T-клеток. Во-первых, субпопуляции
синтезируют несколько общих цитокинов, в том
числе IL-3 и гранулоцитарно-макрофагальный
колониестимулирующий фактор (ГМ КСФ). Во-
вторых, субпопуляции ТН1 и Тн2 СО4+-Т-клеток
больше различаются у мышей, чем у человека.
Функциональные различия между субпопуля-
циями СЭ4+-Т-клеток у людей могут иметь кли-
ническое значение. В частности, преобладание
ТН1-клеток и цитокинов, выделяемых ими, обна-
руживается при ответе на многие вирусы и бакте-
рии при ГЗТ (см. гл. 16) и заболеваниях, таких
как туберкулоидная форма проказы. Напротив,
присутствие Тн2-клеток и повышенная концент-
рация цитокинов, синтезируемых ими, как было
показано, связаны с аллергическими реакциями
и ответом на паразитарную инвазию (см. гл. 14).
Эти наблюдения свидетельствуют, что регуляция
баланса субпопуляций ТН1 и Тн2 может быть спо-
собом терапии различных заболеваний.
В-клетка захватывает антиген
с помощью антигенспецифичного
рецептора 1g и погружает
внутрь клетки антиген,
связанный с 1g
Антиген процессируется до пептидов
в вакуолях с кислой средой
После процессинга пептиды
связываются с МНС
П класса и перемещаются
на поверхность
В-клетки
• Рис. 10.6 В-клетки захватывают антиген путем взаимодействия с молекулами lg. процессируют его и презентируют
CD4+-T-клеткам антиген, связанный с молекулами МНС II класса
ФУНКЦИИ Т-КЛЕТОК
159
Т — В-кооперация
Почти все белки являются тимусзависимыми ан-
тигенами. Их называют так потому, что для син-
теза антител им необходима «помощь» или коо-
перация СО4+-Т-клеток с В-клетками. По этой
причине группу СП4+-Т-клеток, которые участву-
ют в иммунном ответе, помогая продуцировать
антитела на тимусзависимые антигены, называют
Т-клетками-хелперами (Тн). Т-клетка-хелпер и
В-клетка, которые взаимодействуют в ответе на
конкретный тимусзависимый антиген, должны
быть специфичны к нему. Тн-клетка и В-клетка
обычно отвечают на разные эпитопы антигена,
но для эффективной кооперации Т-хелпера и В-
клетки эти эпитопы должны быть частью одной
белковой последовательности. По этой причине
кооперацию Т- и В-лимфоцитов при ответе на
тимусзависимый антиген также называют связан-
ным распознаванием.
Ключевые стадии Т —В-клеточной кооперации,
приводящие к синтезу антител, представлены на
рис. 10.6 и 10.7. На рис. 10.6 показано, как В-клет-
ка выступает в качестве АПК для СП4+-Т-клетки.
Вначале В-клетка, экспрессирующая иммуногло-
булин, специфичный к конкретному белковому
антигену, захватывает антиген путем связывания
его с Ig на мембране клетки. После этого комп-
лекс антигена с Ig перемещается внутрь клетки и
антиген подвергается процессингу в вакуолях с
кислым содержимым (см. гл. 9). Некоторые пеп-
тиды, образованные при разрушении антигена,
избирательно связываются с молекулами МНС
II класса, также присутствующими в этих вакуолях
с кислым содержимым. Комплексы пептид —МНС
II класса транспортируются к поверхности В-клет-
ки, где взаимодействуют с СЭ4+-Т-клеткой, об-
ладающей подходящим TCR (вверху на рис. 10.7).
В дополнение к комплексу пептид —МНС,
презентируемому В-клеткой для TCR подходящей
Т-клетки, на поверхностях Т- и В-лимфоцитов
взаимодействуют еще несколько пар молекул (см.
рис. 10.7). Эти взаимодействия необходимы для
взаимной активации Т- и В-клеток; в результате
Т-клетка синтезирует цитокины, а В-клетка — ан-
титела. Пары адгезионных молекул CDlla/CD18—
CD54 {LFA-1/ICAM-1) и CD2-CD58. которые
описаны ранее в этой главе на примере взаимо-
действия АПК и Т-клетки, поддерживают кон-
такт между Т- и В-клетками. Костимуляторные
пары В7— CD28 и CD40- CD154 также играют
ключевую роль во взаимодействии В- и Т-лим-
фоцитов.
Презентация В-клеткой комплекса пептид —
МНС II класса для TCR увеличивает экспрессию
CD154 (лиганд CD40 или CD40L) на Т-клетке-
хелпере. Взаимодействие CD40 —CD154 в свою
очередь усиливает экспрессию костимуляторной
молекулы В7 на В-клетке, и В7 взаимодействует с
CD28, экспрессированном на Т-клетке. Как ука-
зано ранее в подразделе, посвященном взаимо-
TCR МНС II класса
С D4*-Т-клетка
Костимуляторные пары
ZZZZX । । ।
CD 154 CD40
(CD40L)
CD28 В7
(CD80, CD86)
Адгезионные пары
В-клетка
CD58 (LFA-3)
CD2
• Рис. 10.7. Ключевые участники Т-В-кооперации Штри-
ховкой обозначены элементы, экспрессия которых усили-
вается при активации. Также показаны цитокины, обра-
зуемые?-клеткой, и их влияние на изотип Ig, секретируе-
мый В-клеткой
действию АПК с СD4+-T-клетками, взаимодей-
ствия CD40 —CD154 и В7 —CD28 стимулируют в
активированной Т-клетке синтез цитокинов, ко-
торые индуцируют пролиферацию. Продукция
цитокинов Т-хелперной клеткой ведет к проли-
ферации как самого Т-хелпера, так и В-клетки и
синтезу Ig, что обеспечивается за счет увеличе-
ния количества цитокиновых рецепторов на ак-
тивированной В-клетке.
Взаимодействие CD40 —CD154 также необхо-
димо для переключения В-клетки на синтез дру-
гих изотипов Ig, отличающихся от IgM. напри-
мер IgG {переключение изотипов). Если такого
160
ГЛАВА 10. АКТИВАЦИЯ И ФУНКЦИОНИРОВАНИЕ Т- И В-КЛЕТОК
взаимодействия не происходит, возможен синтез
только IgM. Эта ситуация описана у людей с не-
функциональным CD 154 при клиническом состо-
янии, названном rnnep-IgM-синдром (см. гл. 17),
и у так называемых «нокаутных» мышей, не име-
ющих гена CD 154. В обеих ситуациях продуциру-
ются только антитела класса IgM, а антитела дру-
гих изотипов отсутствуют.
Для переключения изотипов В-клетками так-
же необходимы цитокины, синтезируемые акти-
вированными Т-клетками. На рис. 10.7 показано,
что изотип антител, которые синтезирует В-клет-
ка, зависит от цитокинов, продуцируемых Т-клет-
кой. Так, если Т-клетка секретирует IL-4, то
В-клетка переключается на продукцию преиму-
щественно IgE и lgG4, а если Т-клетка выделяет
IFNy, то В-клетка переключается на продукцию
таких подтипов IgG, которые активируют комп-
лемент (см. гл. 4 и 13).
В-клетки являются особенно эффективными
АПК для СО4+-Т-клеток при ответах на антиге-
ны, с которыми обе клетки уже встречались ра-
нее. В гл. 7 описано, как это взаимодействие обыч-
но происходит в специализированных участках
лимфатических узлов — фолликулах — с последу-
ющей активацией В-клеток, соматическими му-
тациями и индукцией В-клеток памяти, происхо-
дящей в зародышевом центре лимфатического
узла. Однако, как уже ранее описывалось в дан-
ной главе, наивные СО4+-Т-клетки наиболее эф-
фективно активируются антигенами, которые про-
шли процессинг и презентируются дендритными
клетками. Т-клетки, активированные дендритны-
ми клетками при первичном ответе, затем, веро-
ятно, взаимодействуют и активируют В-клетки,
которые захватывают антиген с использованием
описанных ранее механизмов.
Значение вовлечения Т-клеток в синтез анти-
тел В-клетками может быть адекватно оценено с
учетом данных об антигенах, для ответа на кото-
рые не требуется помощь Т-клеток, — так назы-
ваемых Т-независимых антигенах, которые обсуж-
даются далее в этой главе. Эти антигены не при-
водят к образованию В-клеток памяти, а В-клет-
ки при ответе на них не переключают изотипы
синтезируемых Ig, секретируя только IgM.
ФУНКЦИИ С08+-Т-КЛЕТОК
В предыдущих подразделах описаны функции
одной из наиболее крупных субпопуляций Т-кле-
ток — СО4+-Т-клеток, которые продуцируют мно-
жество цитокинов и таким образом взаимодей-
ствуют с огромным количеством клеток. Теперь
рассмотрим другую важную субпопуляцию Т-кле-
ток — СО8+-Т-клетки. Их основной функцией
является уничтожение (киллинг) клеток, которые
заражены бактериями или вирусами. СО8+-Т-клет-
ки также ответственны за гибель пересаженных
чужеродных клеток при отторжении трансплан-
тата и за уничтожение опухолевых клеток (см. гл. 19
и 20). По этой причине СО8+-Т-клетки часто на-
зывают Т-киллерами или цитотоксическими Т-
лимфоцитами (ЦТЛ). Клетка, уничтожаемая ЦТЛ,
называется мишенью. В этой роли может высту-
пать специализированная АПК, такая как денд-
ритная клетка, или любая другая клетка организ-
ма. В отличие от рецепторов СО4+-Т-клеток TCR
СО8+-Т-клеток распознают комбинацию пепти-
дов, связанных с молекулами МНС I класса на
поверхности клеток. Это взаимодействие в при-
сутствии соответствующих вторых сигналов (об-
суждаются далее) приводит к гибели клетки, пред-
ставившей пептид.
СО8+-Т-клетки также синтезируют цитокины,
в основном те, которые ассоциируются с феноти-
пом ТН1 СО4+-Т-клеток. В частности, это IFNy,
который необходим при некоторых вирусных и
бактериальных инфекциях, а также TNFp, уча-
ствующий в уничтожении клетки-мишени. Одна-
ко некоторые СО8+-Т-клетки синтезируют такие
цитокины, как IL-4, которые ассоциированы с
профилем Тн2 СО4+-Т-клеток.
Активация С08+-Т-клеток
Выходящие из тимуса СО8+-Т-клетки не могут
уничтожать клетки; вначале они должны активи-
роваться, чтобы затем пролиферировать и диф-
ференцироваться. Для активации необходимо при-
сутствие как первого сигнала — взаимодействия
комплекса пептид —МНС с TCR, так и вторых,
или костимуляторных (описаны далее). Развитие
цитолитической функции также требует синтеза
цитокинов, в том числе IL-2, IFNy и IL-12.
На рис. 10.8 показаны два наиболее важных
способа активации ЦТЛ в ответ на вирусную ин-
фекцию. В его верхней части показан первый спо-
соб, в котором принимают участие СЭ4+-Т-клетки,
специфичные к вирусу и продуцирующие IL-2.
При наличии клетки-мишени, инфицированной
вирусом, и IL-2, выделяемого СD4+-T-клеткой,
индуцируются пролиферация и дифференциров-
ка CD8+-T-kjictok. При таком ответе вирусспеци-
фичные СО4+-Т-клетки активируются при пре-
зентации вирусного антигена молекулами МНС
II класса на АПК, такой как дендритная клетка
или макрофаг. При этом пути активации вирус-
ный эпитоп, который активирует CD4+-T-клетку,
вероятнее всего будет отличаться от эпитопа, ак-
тивирующего СО8+-Т-клетку.
В средней части рис. 10.8 показано, как CD8+-
Т-клетки могут активироваться без участия CD44-
Т-клеток. Такой механизм описан при ответе на
некоторые вирусы. В этой ситуации используется
перекрестное примирование. о котором упомина-
лось в гл. 9. При таком пути активации вирусные
антигены переносятся от мертвой или умирающей
инфицированной клетки в профессиональные
АПК, такие как дендритные клетки. Затем денд-
ФУНКЦИИ CD8 -Т-КЛЕТОК
161
АКТИВАЦИЯ CD8+-T-KJIETOK
Путь 1 —
через активацию
CD4+-Т-клеток
АПК
Вирусспецифичная
СБ4+-Т-клетка
МНС II класса CD4
IL-2
Клетка,
инфицированная
вирусом
МНС Вирусный
I класса пептид
Вирус
Пептиды, полученные
из фагоцитированного
вируса
CD8
Вирусспеци-
фичная CD8 -
Т-клетка
Путь 2 — через
перекрестное
примирование
Активация
и дифференцировка
CD8+-Т-клеток
Клетка,
инфицированная
вирусом
МНС I класса
CD8
CD28
Вирусспеци-
фичная CD8-
Т-клетка
R7
Дендритная клетка —
представляет пептиды,
полученные из вируса,
в комплексе с МНС I класса
УНИЧТОЖЕНИЕ КЛЕТКИ-
МИШЕНИ CD8+-
Т-КЛЕТКАМИ Высвобождение Полиперфо-
перфорина риновый
Клетка,
инфицированная
вирусом
Пары адгезионных
молекул
• Рис. 10.8. Активация и уничтожение клеток-мишеней СЭ8+-ЦТЛ
ритные клетки процессируют вирусный антиген,
размещают его в молекулы МНС I класса и пред-
ставляют пептиды вирусспецифичным CD8+-T-
клеткам. Так как дендритные клетки также эксп-
рессируют костимуляторные молекулы, такие как
В7, они могут активировать вирусспепифичные
наивные СЭ8+-Т-клетки. При этом пути актива-
ции СЭ8+-Т-клетка, вероятно, самостоятельно
продуцирует цитокины, необходимые для проли-
ферации и дифференцировки. Предполагают, что
перекрестное примирование может играть важную
роль при активации ответов СВ8+-Т-клеток на
клетки инфицированной ткани, у которых отсут-
ствуют костимуляторные молекулы, а также при
ответах на клетки некоторых опухолей (см. гл. 20).
Какие бы межклеточные взаимодействия ни
участвовали в активации СО8+-Т-клеток, весьма
вероятно, что первые события этой активации
похожи на описанные ранее стадии активации
СВ4+-Т-клеток. Как и CD4, CD8 связан с ти-
розиновой киназой Lek, а также взаимодейству-
ют те же пары костимуляторных и адгезионных
162
ГЛАВА 10. АКТИВАЦИЯ И ФУНКЦИОНИРОВАНИЕ Т- И В-КЛЕТОК
молекул, что и при активации СО4+-Т-клеток:
CD28 - В7, CD 110/CD 18 - CD54 (LFA-1 - ICAM-1)
и CD2-CD58.
Уничтожение С08+-Т-клетками
клеток-мишеней
После активации теперь уже зрелые СО8+-Т-клет-
ки начинают уничтожение клетки-мишени с того,
что прикрепляются к ней. В нижней части рис. 10.8
показано, что пары адгезионных молекул, экс-
прессируемые и на Т-клетке, и на клетке-мише-
ни, помогают поддерживать контакт между клет-
ками в течение нескольких часов. На рисунке так-
же показано, что активированная СЕ)8+-Т-клетка
обладает гранулами^ в которых содержатся ци-
тотоксические белки, и экспрессирует на поверх-
ности клетки молекулу CD 178 (Fas-лиганд). Да-
лее описано, почему эти молекулы являются клю-
чевыми для уничтожения клеток-мишеней.
Предполагают, что СО8+-Т-клетки могут унич-
тожать мишени двумя способами. Первым и, ве-
роятно, преимущественным путем уничтожения
большинства мишеней является выделение ци-
тотоксических веществ, содержащихся в грану-
лах внутри Т-клеток. После прикрепления к клет-
ке-мишени СО8+-Т-клетка перемещает гранулы
к поверхности мембраны, обращенной к мише-
ни, и с помощью процесса, называемого экзоци-
тозом. выделяет их содержимое на поверхность
уничтожаемой клетки. Эти цитотоксические ве-
щества образуют поры в мембране клетки-мише-
ни. Основными компонентами гранул, участву-
ющих в уничтожении клеток-мишеней, являют-
ся перфорин и гранзимы. Перфорин — это моле-
кула, которая полимеризуется с образованием
кольцевидных трансмембранных каналов (или
пор) в мембране клеток-мишеней. Это приводит
к повышению проницаемости клеточной мемб-
раны и, неизбежно, к смерти клетки. Действие
перфорина на мембрану клетки похоже на дей-
ствие мембраноатакующего комплекса компле-
мента, описанное в гл. 13. При уничтожении
клеток этим способом ЦТЛ дополнительно ис-
пользуют гранзимы, набор сериновых протеаз.
Гранзимы попадают в уничтожаемую клетку че-
рез поры, образуемые при полимеризации моле-
кул перфорина, и взаимодействуют с внутрикле-
точными компонентами клетки-мишени, стиму-
лируя апоптоз. Поскольку клеточная смерть пу-
тем апоптоза не приводит к высвобождению кле-
точного содержимого, уничтожение инфициро-
ванной клетки по этому механизму может пре-
дотвращать распространение инфекционного
агента (вируса) в другие клетки.
Вторым способом уничтожения клеток-мише-
ней является взаимодействие CD178 (Fas-лиган-
да) на поверхности Т-клетки с CD95 (Fas) Fas-
рецептором, поверхностной молекулой, экспрес-
сируемой на многих клетках организма. Это вза-
имодействие активирует апоптоз клетки-мишени
путем последовательной активации протеолити-
ческих ферментов каспазы внутри клетки. Это
приводит к тому, что клетка умирает в течение
нескольких часов. После того как СО8+-Т-клетка
запустит один или оба описанных механизма унич-
тожения, она отрывается от клетки-мишени, что-
бы атаковать и уничтожить следующие клетки-
мишени.
Как будет показано в следующих подразделах,
активация СО8+-Т-клеток и уничтожение клет-
ки-мишени являются не связанными событиями.
Это можно продемонстрировать на препарате
СО8+-Т-клеток человека, инфицированного виру-
сом. Эти вирусспецифичные цитотоксические
клетки способны уничтожать клетки, инфициро-
ванные вирусом, и за пределами организма. (Ис-
следование киллинга мишеней СО84-Т-клетками
описано в гл. 5.) При уничтожении инфициро-
ванных клеток-мишеней не нужно добавлять ни-
какие дополнительные факторы.
Еще раз повторим концепцию МНС-рестрик-
ции Т-клеточного ответа, о которой уже упоми-
налось в предыдущих главах. Вирусспецифичный
СО8+-ЦТЛ распознает, а впоследствии уничтожает
клетку-мишень, экспрессирующую специфиче-
скую комбинацию вирусного пептида и опреде-
ленной молекулы МНС I класса. Это означает,
что CD8+-UTJ1, специфичный к вирусу гриппа и
HLA-A2, например, уничтожает только клетки, ко-
торые экспрессируют HLA-A2, нагруженный пеп-
тидом, полученным из вируса гриппа. Этот ЦТЛ
не уничтожит нормальную неинфицированную
клетку организма, экспрессирующую HLA-A2, в
отсутствие пептида гриппа. Кроме того, эта ви-
русспецифичная СО8+-Т-клетка не уничтожит
клетки-мишени, экспрессирующие другие комби-
нации пептидов с молекулами МНС, такие как
пептид из вируса кори с HLA-A2 или даже тот же
пептид вируса гриппа, связанный с HLA-B3. Эти
открытия Р. Цинкернагеля (R.Zinkernagel) и П. До-
герти (Р. Doherty) (оба получили Нобелевскую
премию в 1996 г.) позволили разработать концеп-
цию МНС-рестрикции Т-клеточного ответа, со-
гласно которой Т-клетка распознает комбинацию
антигена с молекулой МНС, а не собственно мо-
лекулу антигена.
Также отметим, что распознавание СО8+-Т-клет-
кой комплекса пептид —МНС I класса происхо-
дит независимо от того, экспрессирует ли клетка-
мишень какие-либо молекулы МНС II класса.
Этот факт имеет серьезные биологические послед-
ствия, поскольку, как уже описано в гл. 9, моле-
кулы МНС I класса экспрессируются почти на
всех клетках организма. Так как инфекционный
возбудитель (такой как вирус, паразит или бакте-
рия) может поражать любую ядерную клетку орга-
низма, из этого возбудителя образуются пептиды,
которые связываются с молекулами МНС I клас-
са и экспрессируются на поверхности любой ядер-
ной клетки организма-хозяина. Экспрессия комп-
ФУНКЦИИ CD8+-T-KJ1ETOK
163
лексов пептидов возбудителя с МНС I класса на
поверхности клетки приводит к распознаванию
инфицированной клетки СО8+-Т-клетками и ее
последующему уничтожению. Таким образом,
уничтожение СО8+-Т-клетками обеспечивает ме-
ханизм элиминации любой клетки организма,
инфицированной патогенным агентом. Очевид-
но, что элиминация патогена приводит к разру-
шению клеток организма-хозяина, но это прием-
лемая цена, которую организм может заплатить
за удаление источника инфекции.
Повторим и углубим концепцию, на которую
ссылались в гл. 9. В основном только патоген-
ные агенты такие как вирусы, паразиты, бакте-
рии, которые инфицируют клетки, образуют пеп-
тиды, связывающиеся с молекулами МНС I клас-
са, и вызывают СЭ8+-Т-клеточный ответ. Эти воз-
будители также активируют патогенспецифичные
СО4+-Т-клетки и индуцируют синтез антител, по-
тому что захватываются АПК, такими как денд-
ритные клетки и макрофаги. Таким образом, все
вместе — и CD4+-, и СЭ8+-Т-клетки (и уо-Т-клет-
ки тоже), и антитела — будут, вероятно, вовлече-
ны в защитный иммунный ответ организма на кон-
кретный возбудитель (см. в гл. 21). Напротив, не-
патогенные или неинфекционные антигены (та-
кие как белок убитого вируса в виде вакцины)
обычно не запускают СО8+-Т-клеточный ответ.
Эти экзогенные антигены захватываются АПК в
вакуоли с кислым содержимым, взаимодействуют
с молекулами МНС II класса и активируют CD4+-
Т-клетки и гуморальный ответ.
СО8+-Т-клетки практически всегда выступают
в качестве цитотоксических клеток как у челове-
ка, так и у мыши. Однако существенная часть
СО4+-Т-клеток у человека и некоторые — у мыши
также обладают цитотоксическими функциями.
Как можно предположить из продолжающегося
обсуждения МНС-рестрикции, эти цитотоксиче-
ские СЭ4+-Т-клетки активируются к уничтоже-
нию при распознавании комплекса пептид — МНС
II класса на АПК или клетке-мишени. Поскольку
активированные СО4+-Т-клетки экспрессируют
CD 178, но не содержат гранул с цитотоксической
активностью, вероятно, они используют взаимо-
действие CD95 —CD178 как основной метод унич-
тожения клеток-мишеней.
Окончание иммунного ответа:
индукция клеток памяти
Антигенная стимуляция увеличивает количество
лимфоцитов, специфичных к стимулирующему
антигену, а также число лимфоцитов и других
эффекторных клеток, которые рекрутируются
цитокинами, синтезированными в ходе ответа.
Однако, когда антиген уже уничтожен, необходи-
мо уменьшить объем этого пула активированных
клеток; в противном случае организм вскоре пе-
реполнится размножающимися клеточными по-
пуляциями. На рис. 10.9 показан основной меха-
низм уничтожения активированных Т-клеток —
клеточная смерть^ вызванная активацией Иссле-
дования показывают, что Т-клетки чувствитель-
ны к апоптозу после того, как они были активи-
рованы, и особенно после повторной стимуляции
антигеном. Апоптоз развивается в результате вза-
имодействия CD95 —CD178, которое описано в
этой главе ранее. Активированные Т-клетки экс-
прессируют одновременно и CD95, и CD 178 (экс-
прессия последнего индуцируется активацией).
После удаления антигена, например после того,
как активированные ПТЛ уничтожили свои инфи-
цированные мишени, эти ЦТЛ взаимодействуют
друг с другом и индуцируют апоптоз. На рис. 10.9
также показано, что активированные клетки вы-
деляют CD 178, и эти секретированные молекулы
также могут взаимодействовать с экспрессируемы-
ми на поверхности клеток CD95 и вызывать апоп-
• Рис. 10.9. Клеточная смерть, вызванная
активацией. После стимуляции антигеном
Т-клетка может уничтожить: 1) саму себя пу-
тем выделения растворимой формы CD178
(FasL), который взаимодействует с CD95
(Fas) на той же клетке; 2) другую Т-клетку
с CD95, который будет взаимодействовать
либо с растворимой, либо мембранной
формой CD178
CD95
Активация
и пролиферация
Наивная
Т-клетка
CD95
CD95
CD 178
Растворимый
CD178
Активированные rnQ<.
Т-клетки CD95
164
ГЛАВА 10. АКТИВАЦИЯ И ФУНКЦИОНИРОВАНИЕ Т- И В-КЛЕТОК
тоз. Предполагают, что взаимодействие CD95 —
CD 178 играет ключевую роль в уничтожении боль-
шинства активированных CD4+- и СВ8+-Т-клеток
по окончании антигенной стимуляции.
Однако не все клетки, активированные анти-
геном, умирают; выживает небольшая популяция
долгоживущих антигенспецифичных клеток. Они
образуют популяцию Т-клеток памяти для
антигена и CD4+- или СО8+-Т-клетки памяти. Вто-
ричные (с участием клеток памяти) Т-клеточные
ответы более эффективны, чем первичные. Одна
из причин этого в том, что стартовый объем кло-
нирования популяции памяти, специфичной для
определенного антигена, больше, чем размер не-
примированной популяции, даже после того, как
посредством клеточной смерти, вызванной акти-
вацией, удалится большинство размножившихся
клеток. Также предполагают, что для индукции
полной активации Т-клетки памяти не нуждают-
ся в костимуляторных взаимодействиях В7 —
CD28.
Никаких поверхностных молекул, уникальных
для Т-клеток памяти, не обнаружено. Скорее,
выявлены небольшие различия в уровне экспрес-
сии тех же молекул (для одних больше, для дру-
гих меньше) между непримированными Т-клет-
ками и клетками памяти. Например, увеличение
экспрессии CD44 и снижение CD64L, описанные
ранее в этой главе. Также описываются измене-
ния изоформ мембранной фосфатазы CD45; пред-
полагается, что при активации CD45 переходит
из формы CD45RA в форму CD45RO, что вызва-
но альтернативным сплайсингом РНК, транскри-
бированной с ее гена. Не ясно, необходимо ли
наличие антигена, хотя бы и в самой незначи-
тельной концентрации, при персистировании кле-
ток памяти; результаты некоторых исследований
показывают, что при отсутствии примирующего
антигена клетки памяти умирают.
I ФУНКЦИИ В-КЛЕТОК
ПРИ ОТСУТСТВИИ помощи
Т-КЛЕТОК
До настоящего момента мы по большей части рас-
сматривали основной набор антигенов — Т-за-
висимые антигены, которым необходимы Т-клет-
ки-хелперы, чтобы В-клетки развили гумораль-
ный ответ. Однако некоторые антигены активи-
руют продукцию антител В-клетками и при от-
сутствии Т-клеток или выделяемых ими цитоки-
нов. Эти Т-независимые антигены (TH) обычно
являются крупными полимерными молекулами с
множественными повторяющимися антигенными
детерминантами. Например, это компоненты стен-
ки бактериальной клетки, такие как липополисаха-
риды или капсульный полисахаридный компонент
Haemophilus influenzae. Механизм, по которому эти
антигены активируют В-клетки. описан далее.
Т-независимые антигены группы ТН-1 в боль-
ших концентрациях являются митогенами, т. е. они
способны одновременно активировать к проли-
ферации и продукции антител множество клонов
В-клеток. Благодаря этому свойству антигенне-
специфической активации такие антигены назы-
вают поликлональными активаторами В-клеток.
У мышей ТН-1-антигенами являются липополи-
сахариды, полученные из множества грамотрица-
тельных бактерий, таких как Е. coli. Однако у
людей эти липополисахариды не активируют про-
лиферацию В-клеток. Во вторую группу Т-неза-
висимых антигенов — ТН-2 — входят бактери-
альные и грибковые полисахариды (например,
пневмококковый полисахарид, декстраны и фи-
колл). Она не является митогенной даже при боль-
ших концентрациях.
У Т-независимых ответов есть два биологиче-
ски значимых свойства. Первое заключается в том,
что в отличие от ответов с участием Т-зависимых
антигенов ответы на Т-независимые антигены
приводят к образованию только первичных IgM
и не вызывают формирования иммунологической
памяти. Другими словами, повторное введение Т-
независимого антигена приведет к образованию
той же концентрации IgM, что и первое, без увели-
чения концентрации, скорости развития или пе-
реключения классов Ig. Этот факт снова подчер-
кивает значение цитокинов, выделяемых Т-клетка-
ми, в развитии клеток памяти и переключении
изотипов у В-клеток. Второе свойство заключает-
ся в том, что иммунный ответ на Т-независимые
антигены возможен, даже если у организма от-
сутствуют Т-клетки. Пациенты с Т-клеточным
иммунодефицитом все же могут вызывать защит-
ный иммунный ответ IgM на внеклеточные бак-
терии, несмотря на то что не развивают заметных
противовирусных ответов, поскольку антигены
вирусов являются Т-зависимыми.
Внутриклеточные механизмы
активации В-клеток
Мультивалентные антигены с повторяющимися
эпитопами, которые составляют большинство Т-не-
зависимых антигенов, напрямую активируют
В-клетки (рис. 10.10). Активация начинается с пе-
рекрестного связывания рецепторов, которое про-
исходит, когда на клеточной мембране собирают-
ся вместе комплексы из более чем одного В-кле-
точного рецептора (BCR). Как и антигенсвязыва-
юшие цепи TCR, Н- и L-цепи Ig обладают очень
короткими внутриклеточными доменами и не иг-
рают непосредственной роли в передаче сигнала
после связывания с антигеном.
На рис. 10.10 показано, что перекрестное свя-
зывание активирует внутри В-клетки механизмы,
очень похожие на каскады, запускаемые во время
активации СВ4+-Т-клетки (описаны ранее). К ним
относятся фосфорилирование киназ, сборка и
ФУНКЦИИ В-КЛЕТОК ПРИ ОТСУТСТВИИ ПОМОЩИ Т-КЛЕТОК
165
Активация факторов
транскрипции, в том числе
NF-кВ, NF-AThAP-1
• Рис. 10.10. Внутриклеточные события при активации В-клетки. Для простоты показана
только одна цепь Iga и IgP, связанная с каждой молекулой Ig. Оранжевые полукруги по-
казывают фосфатные группы, добавленные к активированным молекулам
активация сигнальных комплексов на мембране
клетки, а также активация внутриклеточных сиг-
нальных путей. Однако конечный результат ак-
тивации В-клетки — транскрипция и трансляция
генов IgG и цитокиновых рецепторов в отличие
от транскрипции и трансляции генов цитокинов,
которые являются ключевой особенностью Т-кле-
точной активации. Кратко опишем основные сход-
ства и различия механизмов активации Т- и В-
клеток.
Как и при активации Т-клеток, описанной
ранее, одним из первых событий в активации
В-клетки является активация тирозиновых киназ
семейства Src — Lyn, Blk, Lek и Fyn, связанных с
BCR (см. рис. 10.10). (Также предполагают, что
эти киназы могут активироваться CD45, как опи-
сано при активации Т-клетки.) Активированные
киназы фосфорилируют последовательности
ITAM в молекулах Iga и Igp (CD79a и b), связан-
ных с цепями Ig в мембране. Фосфорилирован-
ные ITAM привлекают к комплексу молекул дру-
гую киназу, Syk, которая тоже фосфорилируется
и активируется. Киназа Syk относится к тому же
семейству, что и ZAP-70, играющая центральную
роль в активации Т-клетки.
Активированная киназа Syk рекрутирует и ак-
тивирует адаптерные молекулы, которые в свою
очередь активируют внутриклеточные сигнальные
механизмы, похожие на те, которые были описа-
ны при активации Т-клеток. Это активация PLC^
ведущая к активации протеинкиназы С; увеличе-
ние концентрации внутриклеточных ионов каль-
ция и последующая активация множества цито-
плазматических ферментов; также активируются
166
ГЛАВА 10. АКТИВАЦИЯ И ФУНКЦИОНИРОВАНИЕ Т- И В-КЛЕТОК
белки Ras и Rac. которые в свою очередь активи-
руют MAP-киназный каскад. В результате этой
последовательной внутриклеточной передачи сиг-
нала в ядро В-клетки входят транскрипционные
факторы (включая NF-АТ, АР-1 и NF-кВ), сти-
мулирующие транскрипцию нескольких генов,
наиболее важными из которых являются гены 1g
и цитокиновых рецепторов. Спустя примерно 12 ч
после антигенной стимуляции В-клетка увеличи-
вается в размерах (становится В-клеточным блас-
том). затем пролиферирует и дифференцируется
в клетку, которая синтезирует и секретирует 1g
(плазматическая клетка). При отсутствии Т-кле-
точных цитокинов В-клетка образует IgM; как
описано в подразделе, посвященном Т — В-коопе-
рации, присутствие цитокинов, вырабатываемых
Т-клетками, приводит к переключению изотипа
на определенные классы 1g и индуцирует повы-
шение (созревание) аффинности и формирование
В-клеток памяти в зародышевом центре лимфа-
тического узла (см. гл. 7).
Модуляция сигнала от BCR
Еще одним общим свойством BCR и TCR является
наличие корецептора. который усиливает сигнал
от антигенсвязывающего рецептора. Для Т-кле-
ток корецепторами являются CD4 или CD8; бла-
годаря этим молекулам АПК или клетка-мишень
более прочно связываются с Т-клеткой; таким
образом снижается количество антигена, необхо-
димое для активации Т-клетки. Молекулы CD19,
CD81 и CD21 (обсуждались в гл. 7), нековалент-
ным образом связанные на мембране В-клетки в
функциональную группу, играют ту же роль ко-
рецептора для BCR (рис. 10.11). Лучше всего роль
корецептора BCR описана при ответе на микроб-
ные антигены; результаты исследований показы-
• Рис. 10.11. Корецептор В-клетки CD19/CD21/CD81 и ком-
понент комплемента C3d усиливают активацию В-клетки
вают, что для стимуляции гуморального ответа
активированной В-клетки комплексом BCR с ко-
рецептором необходимо в 100 или даже 1000 раз
меньше антигена, чем при активации только че-
рез один BCR.
На рис. 10.11 показано, как именно корецептор
снижает пороговый уровень стимуляции В-кле-
точного ответа на микробные возбуцители. Эти
возбудители активируют компоненты комплемен-
та, находящиеся в плазме (см. гл. 13), и покрыва-
ются (т.е. становятся «маркированными») компо-
нентом комплемента C3d. Рецептором для C3d
служит такой компонент корецептора, как моле-
кула CD21, поэтому возбудитель крепится к CD21,
экспрессируемому на В-клетке. Возбудитель так-
же связывается с IgM на той же В-клетке. Это
перекрестное связывание антигена с IgM и C3d
на поверхности В-клетки приводит к одновремен-
ному формированию нескольких активационных
сигналов для В-клетки; CD 19 из корсцепторного
комплекса фосфорилируется и активирует после-
довательности ITAM в Igoc/IgP (CD79a/b). Таким
образом, активация В-клетки через корецептор
одновременно с ее активацией через BCR уси-
ливает индуцированный сигнал по сравнению с
ситуацией, когда антиген взаимодействует только
с BCR.
Однако сигнал, передаваемый через BCR, мож-
но также модулировать отрицательно. Это про-
исходит по механизму отрицательной обратной
связи с антителами, при котором антитела, син-
тезированные в ответ на антиген, могут угнетать
дальнейший ответ В-клетки на этот антиген. Об-
ратную связь с антителами можно выявить в си-
туации, когда в организм сразу после или непос-
редственно в процессе иммунного ответа на ан-
тиген вводят антитела, специфичные этому анти-
гену; введение антител прекращает ответ на этот
антиген. Такое введение антител используют в
клинической практике у новорожденных для пре-
дотвращения продукции антител, которые могут
синтезироваться в ответ на эритроцитарный ан-
тиген Rh (см. гл. 15).
Еще одним важным способом, которым анти-
тела угнетают функцию В-клеток, является взаи-
модействие между сформировавшимся комплек-
сом антиген — антитело и низкоаффинным Fc-pe-
цептором для IgG (FcRyllb, CD32), экспрессиру-
емым на В-клетке. Каким образом это ведет к
отрицательным сигналам для В-клетки, показано
на рис. 10.12. Fc-конец комплекса антиген —ан-
титело связывается с CD32, в то время как анти-
генный коней связывается с 1g на этой же клетке.
Это одновременное связывание с 1g и Fc-рецепто-
ром приводит к отрицательному сигналу для В-клет-
ки. Связывание с внеклеточным участком CD32
привлекает фосфатазу к внутриклеточному фраг-
менту этого белка, который обладает последова-
тельностью аминокислот, содержащей тирозин.
По аналогии с ранее описанными ITAM эта по-
следовательность в CD32 и других молекулах была
ТЕСТЫ
167
• Рис. 10.12. Угнетение активации В-клетки антителами по
механизму обратной связи. Одновременное связывание
компонентов антигена и антитела из комплекса антиген-
антитело с рецепторами на В-клетке (антиген связывается
с Ig а Fc-фрагмент антитела с FcR, CD32) приводит к про-
ведению негативного сигнала в клетку. Прямоугольник в
цитоплазматической части CD32 изображает иммуноре-
цепторный ингибирующий мотив на основе тирозина
(ITIM)
названа иммунорецепторным тирозинсодержащим
ингибирующим мотивом (последовательностью)
(immunoreceptor tyrosine-based inhibitory motif —
ITIM). Фосфатаза, которая связывается с после-
довательностями ITIM в структуре CD32, удаляет
фосфатную группу из тирозиновых остатков в
полипептиде, связанном с BCR и участвующем в
передаче сигналов. В результате прохождение ак-
тивационного сигнала через BCR угнетается.
РЕЗЮМЕ
1. Для активации наивных СЭ4+-Т-клеток необхо-
димы первый сигнал (взаимодействие комплекса пеп-
тид—МНС II класса с TCR), взаимодействия костиму-
ляторных (вторых) сигналов, а также пар адгезионных
молекул на поверхностях АПК и Т-клетки. Дендритные
клетки являются основными АПК для активации отве-
та наивных СЭ4+-Т-клеток.
2. Активация Т-клетки включает каскад событий,
распространяющихся из области контакта АПК и Т-клет-
ки (иммунологического синапса) через цитоплазму к
ядру клетки. Ключевые механизмы этого каскада
включают фосфорилирование киназ, сборку и актива-
цию сигнальных комплексов на клеточной мембране,
а также активацию внутриклеточных сигнальных пу-
тей. Среди наиболее важных генов, которые транс-
крибируются и транслируются при активации, можно
назвать гены, кодирующие цитокины, такие как IL-2, и
цитокиновые рецепторы. В конечном итоге активация
этих генов приводит к пролиферации и дифференци-
ровке Т-клеточного клона.
3- Следствием антигенной активации СЭ4+-Т-клет-
ки является секреция цитокинов, которые влияют на
С08+-Т-лимфоциты, В-лимфоциты и клетки многих
других типов. На основании спектра цитокинов, кото-
рый они выделяют, были выделены субпопуляции
CD4+-T-клеток. Так, ТН1 -клетки выделяют IL-2, IFNy и
TNFp и не выделяют IL-4, IL-5, IL-10 и IL-13. Цитокины,
образуемые ТН1-клетками, активируют другие Т-клетки,
NK-клетки, макрофаги, а также индуцируют В-клетки
к переключению изотипов, продуцируемых Ig, что уве-
личивает фагоцитоз микроорганизмов. Напротив, вто-
рая субпопуляция СЭ4+-Т-клеток, Тн2, секретирует IL-4,
IL-5, IL-10 и IL-13, но не IL-2, IFNy или TNFp. Цитоки-
ны, выделяемые Тн2-клетками, вызывают переключе-
ние В-клеток на синтез IgE и активацию эозинофилов.
4, СО8+-Т-клетки (ЦТЛ) взаимодействуют и уничто-
жают клетки-мишени, инфицированные микроорга-
низмами, такими как бактерии или вирусы. Т-клеточ-
ный рецептор С08+-Т-клеток взаимодействует с пеп-
тидом, полученным из возбудителя и связанным с
молекулой МНС I класса на поверхности клетки-ми-
шени. Для уничтожения клетки-мишени ЦТЛ должны
быть активированы. Существуют два механизма унич-
тожения клеток-мишеней ЦТЛ: 1) секреция перфори-
на и гранзимов; 2) взаимодействие CD95 и CD178
(Fas и Fas-лиганда). Некоторые СЭ4+-Т-клетки также
обладают цитотоксичностью; они распознают комп-
лекс пептид—МНС II класса.
5, Т-клетки способны отвечать и на стимулы, отли-
чающиеся от комплексов пептид—МНС. Суперантиге-
ны активируют все Т-лимфоциты, использующие спе-
цифичную Vp-область для формирования своего TCR.
Лектины, такие как конканавалин А и фитогемагглюти-
нин, активируют пролиферацию множества клонов Т-
клеток путем связывания с гликопротеинами клеточ-
ной поверхности. Т-клетки также распознают липиды
и гликолипиды, представляемые CD1.
6. Для образования антител в ответ на Т-зависи-
мые антигены (абсолютное большинство белковых
антигенов) необходимо наличие антигена, СЭ4+-Т-кле-
ток и В-клеток. Кооперацию Т- и В-лимфоцитов обес-
печивают: 1) взаимодействие между парами молекул
на поверхности CD4+-T- и В-клеток, что приводит к
взаимной активации; 2) секреция цитокинов Т-клет-
ками.
7. Для переключения синтезируемых классов (или
изотипов) антител на IgG, IgA или IgE необходимо
взаимодействие CD40 на В-клетке с его лигандом
CD40L на Т-клетке. Цитокины, образуемые Т-клеткой,
определяют изотип антител, синтезируемых В-клет-
кой после переключения.
8- Некоторые антигены, такие как полисахариды,
молекулы которых имеют множество повторяющихся
идентичных эпитопов, способны активировать В-клет-
ки без существенной помощи Т-клеток. Эти так назы-
ваемые Т-независимые ответы включают в основном
образование IgM и не приводят к формированию им-
мунологической памяти.
ТЕСТЫ
Выберите ОДИН НАИБОЛЕЕ ПРАВИЛЬНЫЙ ответ
на каждый тест.
1. Роль АПК в иммунном ответе не заключается:
а) в ограниченном катаболизме полипептидных ан-
тигенов;
б) создании условий для избирательного связыва-
ния продуктов генов МНС и пептидов;
168
ГЛАВА 10. АКТИВАЦИЯ И ФУНКЦИОНИРОВАНИЕ Т- И В-КЛЕТОК
в) обеспечении вторых сигналов, необходимых для
активации Т-клетки;
г) представлении несобственных пептидов, связан-
ных с молекулами МНС II класса, В-клеткам;
д) представлении комплексов пептид—МНС Т-
клеткам с соответствующими рецепторами.
2, Укажите неверное утверждение об IL-2:
а) изначально синтезируется активированными
макрофагами;
б) синтезируется CD4+-T-клеткам и;
в) может индуцировать пролиферацию CD44-Т-кле-
ток;
г) связывается со специфичным рецептором на
CD44-T-клетках;
д) может активировать СО8+-Т-клетки в присут-
ствии антигена.
3- Для переключения изотипов антител, синтези-
руемых В-клеткой, необходимо взаимодействие на
поверхности В- и Т-клеток пары:
a) LFA-3 (CD58) на В-клетке и CD2 на Т-клетке;
б) ICAM-1 (CD54) на В-клетке и LFA-1 (CD11a/CD18)
на Т-клетке;
в) В7 на В-клетке и CD28 на Т-клетке;
г) CD40 на В-клетке и СЮ40-лиганд (CD154) на Т-
клетке;
д) мембранный Ig на В-клетке и CD4 на Т-клетке.
4, Укажите неверное утверждение об активации
С04+-Т-клеток:
а) активация приводит к быстрому фосфорилиро-
ванию остатков тирозина в белках, связанных с TCR;
б) после активации быстро растет уровень внутри-
клеточного кальция;
в) пептиды, связанные в полости молекулы МНС
I класса, активируют CD4+-T-клетки;
г) взаимодействие В7 и CD28 стабилизирует иРНК
IL-2, поэтому происходит эффективная трансляция IL-2;
д) активированная клетка синтезирует IL-2 и ре-
цептор для IL-2.
5. Укажите неверное утверждение о цитокинах, син-
тезируемых субпопуляциями ТН1 и Тн2 С04+-Т-клеток:
а) цитокины, образуемые ТН1-клетками, включают
IFNy и TNFp;
б) цитокины, образуемые Тн2-клетками, важны для
аллергического ответа;
в) ТН1-клетки секретируют цитокины, которые вы-
зывают активацию макрофагов и NK-клеток;
г) присутствие IL-12 при активации и дифференци-
ровке СЮ4+-Т-клеток предрасполагает к развитию Тн2-
клеток;
д) цитокины, выделяемые Тн2-клетками, могут угне-
тать функцию ТН1-клеток.
6, Укажите неверное утверждение о СО8+-ЦТЛ:
а) уничтожают клетки-мишени путем синтеза пер-
форина и гранзимов;
б) вызывают апоптоз клеток-мишеней;
в) не могут уничтожать СО4+-Т-клетки;
г) взаимодействуют с клеткой-мишенью посред-
ством парных молекул на поверхностях клеток;
д) для выполнения своих цитотоксических функций
эти клетки необходимо активировать.
7, Заражение вирусом коровьей оспы приводит к
активации вирусспецифичных С08+-Т-клеток Если эти
специфичные к вирусу коровьей оспы СО8+-Т-клетки
впоследствии будут выделены из организма, они смо-
гут уничтожить in vitro:
а) клетки, инфицированные вирусом коровьей
оспы и экспрессирующие молекулы МНС II класса от
любого организма;
б) клетки, инфицированные вирусом гриппа, экс-
прессирующие такие же молекулы МНС I класса, как
и исходный организм;
в) неинфицированные клетки, экспрессирующие
такие же молекулы МНС I класса, как и исходный
организм;
г) клетки, инфицированные вирусом коровьей
оспы, экспрессирующие такие же молекулы МНС
I класса, как и исходный организм;
д) клетки, инфицированные вирусом коровьей
оспы, экспрессирующие такие же молекулы МНС
II класса, как и исходный организм.
8- Бактериальный липополисахарид, Т-независи-
мый антиген, стимулирует продукцию антител у мы-
шей. Укажите неверное утверждение:
а) образуемые антитела будут преимущественно IgM;
б) не будет индукции В-клеток памяти;
в) для продукции антител в ходе ответа необходи-
мы IL-4 и IL-5;
г) благодаря полимерной природе антигена будет
установлено перекрестное связывание поверхностных
рецепторов В-клетки;
д) активация В-клетки приведет к фосфорилирова-
нию внутриклеточных молекул.
СИТУАЦИОННАЯ ЗАДАЧА
По-прежнему ведутся интенсивные исследования,
направленные на разработку безопасных и эффектив-
ных вакцин против множества заболеваний. В одном
из исследований пациентам дали белковую вакцину,
разрабатываемую для защиты от бактериальной ин-
фекции. Предполагали, что вакцина должна стимули-
ровать продукцию антител, направленных к одному
специфичному эпитопу белка на поверхностной мемб-
ране возбудителя. Была определена структура этого
эпитопа — пептид длиной 10 аминокислот. Этот пеп-
тид был искусственно синтезирован и использован
для иммунизации людей, входящих в группу риска по
возможности контакта с бактерией. К сожалению, за-
щитного действия не наблюдалось. Предположите,
почему это произошло.
ОТВЕТЫ НА ТЕСТЫ
1 — г. Антигенпрезентирующая клетка не пред-
ставляет пептид и МНС II класса В-клеткам. Все ос-
тальные утверждения описывают свойства АПК
2 — а, Интерлейкин-2 образуют почти исключи-
тельно активированные Т-клетки.
3 — г. Все пары молекул в вариантах а—г важны
при адгезии и/или костимуляции, но только взаимо-
действие между CD40 и СО40-лигандом является
ключевым для переключения изотипов; считают, что Ig
не взаимодействует с CD4,
4 — в. Пептиды, связанные с полостью МНС II клас-
са, или суперантигены, которые связываются с молеку-
ТЕСТЫ
169
лой МНС II класса вне полости, активируют CD4+-T-
клетки.
5 — г. Присутствие IL-4 в момент активации и
дифференцировки С04+-Т-клеток предрасполагает к
развитию Тн2-клеток; IL-12 предрасполагает к разви-
тию ТН1 -клеток.
6 — в. Цитоксический Т-лимфоцит CD8+ может
уничтожить любую клетку, которая экспрессирует мо-
лекулы МНС I класса, связанные с чужеродным пепти-
дом, в том числе, например, СD4+-T-клетку, инфици-
рованную ВИЧ.
7 — г. Принцип МНС-рестрикции указывает, что
TCR СО8+-Т-клетки взаимодействует с клеткой-мише-
нью, которая экспрессирует специфический пептид,
связанный с собственными молекулами МНС I класса.
Таким образом, активированные вирусом коровьей
оспы СО8+-Т-клетки распознают и, следовательно,
уничтожают только клетки-мишени, инфицированные
вирусом коровьей оспы и экспрессирующие соб-
ственные молекулы МНС I класса.
8 — в. Поскольку Т-независимые антигены не сти-
мулируют образование цитокинов Т-клетками, IL-4 или
IL-5 образовываться не будут. Таким образом, при отве-
те на Т-независимые антигены не будет переключения
изотипов или индукции образования клеток памяти
ОТВЕТ НА СИТУАЦИОННУЮ ЗАДАЧУ
Малый размер пептида и, вероятно, недостаточная
сложность — свойства, необходимые для иммуноген-
ности (см. гл. 3), могут стать причиной невозможнос-
ти инициации иммунного ответа. Более того, ответ на
мембранный белок бактерии был почти наверняка ти-
мусзависимым, поэтому пациентов следовало бы им-
мунизировать эпитопом, распознаваемым Т-клетками,
в связке с эпитопом, распознаваемым В-клетками.
Вакцина, содержащая последовательности, распозна-
ваемые как Т-, так и В-клетками, смогла бы вызвать
как хелперный ответ, так и формирование клеток па-
мяти, что обеспечило бы большую вероятность защи-
ты пациента после воздействия возбудителя.
Хотя белковая вакцина, которая была введена па-
циентам, вызывала гуморальный ответ, неизвестно,
был ли этот ответ достаточным для защиты. Напри-
мер, в ответе на некоторые инфекционные агенты, та-
кие как ВИЧ, ответ, развивающийся с участием антител,
не является защитным для организма (см. гл. 17).
В таких случаях, вероятно, важно включить в предпо-
лагаемые вакцины эпитопы, которые распознаются
СО8+-ЦТЛ, а также эпитопы для распознавания Т-хел-
перами и В-клетками.
Глава
ЦИТОКИНЫ
* ВВЕДЕНИЕ
Как обсуждалось в предыдущих главах, иммун-
ная система регулируется растворимыми медиа-
торами, которые называются цитокинами. Эти
белки низкой молекулярной массы продуцируются
фактически всеми клетками врожденной и адап-
тивной иммунной систем и в особенности CD4+-
Т-клетками, которые регулируют многие эффек-
торные механизмы. Важным функциональным
свойством цитокинов является регуляция разви-
тия и поведения клеток-эффекторов иммунной
системы. Некоторые цитокины непосредствен-
но влияют на синтез и работу других цитокинов.
Чтобы проще представить, как работают цито-
кины, сравним их с гормонами — химическими
посредниками эндокринной системы. Цитокины
служат химическими медиаторами в пределах
иммунной системы, хотя также взаимодейству-
ют с определенными клетками других систем,
включая нервную. Таким образом, они участву-
ют в поддержании гомеостаза. При этом они иг-
рают значительную роль в управлении гиперчув-
ствительностью и воспалительным ответом и в
некоторых случаях могут способствовать разви-
тию острого или хронического повреждения тка-
ней и органов.
Как будет обсуждаться далее в этой главе,
клетки, регулируемые определенным цитоки-
ном, должны экспрессировать рецептор к это-
му фактору. Позитивная и/или негативная ре-
гуляция клеточной активности зависит от ко-
личества и типа цитокинов, к которым чувстви-
тельна клетка, а также от повышения или сниже-
ния экспрессии цитокиновых рецепторов. В нор-
ме в регуляции врожденных и приобретенных
иммунных ответов задействован комплекс этих
методов.
• ИСТОРИЯ ЦИТОКИНОВ
Активность цитокинов открыли в конце I960 г.
Первоначально предполагали, что они служат
факторами амплификации, действующими анти-
гензависимо, повышая пролиферативные ответы
Т-клеток. И. Джери (l.Gery) и соавторы впервые
показали, что макрофаги высвобождали митоген-
ный фактор тимоцитов, названный ими лимфо-
цитактивирующим фактором (LAF). Этот взгляд
радикально изменился, когда обнаружили, что на-
досадочная жидкость мононуклеаров перифери-
ческой крови, стимулированных митогеном, вы-
зывает длительную пролиферацию Т-клеток в от-
сутствие антигенов и митогенов. Вскоре после
этого выяснилось, что для изоляции и клональ-
ной экспансии линий функциональных Т-клеток
может использоваться фактор, продуцируемый
самими Т-клетками. Этому фактору, полученно-
му из Т-клеток, разные исследователи давали раз-
ные названия; наиболее известное среди них —
Т-клеточный фактор роста (TCGF). Цитокины,
продуцируемые лимфоцитами, назвали лимфоки-
нами, а продуцируемые моноцитами и макрофа-
гами — монокинами. Результаты исследования
клеточного источника лимфокинов и монокинов,
в конечном счете, выявили, что эти факторы не
были продуктами исключительно лимфоцитов или
моноцитов/макрофагов, что осложнило понима-
ние вопроса. Таким образом, как общее название
этих гликопротеиновых медиаторов был принят
термин «цитокин».
В связи с необходимостью выработки согла-
шения, регулирующего определение факторов,
полученных из макрофагов и Т-клеток, в 1979 г.
была создана международная рабочая группа, ко-
торая занималась разработкой их номенклатуры.
Поскольку цитокины передавали сигнал от лей-
ОБЩИЕ СВОЙСТВА ЦИТОКИНОВ
171
коцита к лейкоциту, был предложен термин «ин-
терлейкин» (IL). Макрофагальному фактору LAF
и Т-клеточному фактору роста дали названия ин-
терлейкин-1 (IL-1) и интерлейкин-2 (IL-2) соот-
ветственно. На сегодняшний день исследовано
29 интерлейкинов, и число их будет, несомнен-
но, возрастать, поскольку продолжаются попыт-
ки идентифицировать новых представителей это-
го семейства цитокинов.
По мере приобретения новых знаний о функ-
циональных свойствах цитокинов в термины, пер-
воначально предназначенные для определения их
функций, стали вкладывать более широкий смысл.
Об этом свидетельствует и то, что терминология,
принятая в 1979 г., устаревает. Хорошо известно,
что многие интерлейкины оказывают важные био-
логические эффекты на клетки, не принадлежа-
щие иммунной системе. Например, IL-2 не толь-
ко активирует Т-клеточную пролиферацию, но и
стимулирует остеобласты — клетки, формирующие
кость. Трансформирующий фактор роста р (TGFP)
также действует на клетки разных типов, в том
числе фибробласты соединительной ткани, Т- и
В-лимфоциты. Таким образом, цитокины в ос-
новном обладают плейотропными свойствами, по-
скольку они могут влиять на активность множе-
ства разных клеточных типов. Кроме того, среди
цитокинов выражена избыточность функций, что
доказывается, например, способностью активи-
ровать рост, выживаемость и дифференцировку
В- и Т -клеток более чем одним цитокином (на-
пример, и IL-2, и IL-4 могут функционировать
как Т-клеточные факторы роста). Как показано
далее в этой главе, этот избыток частично объяс-
няется использованием общих сигнальных субъе-
диниц цитокинового рецептора определенными
группами цитокинов. В конечном счете, цитоки-
ны редко, если вообще когда-нибудь, действуют
в организме в одиночку. Таким образом, клетки-
мишени восприимчивы к окружению, содержа-
щему цитокины, которые часто проявляют адди-
тивные, синергитические или антагонистические
свойства. В случае синергизма совместное дей-
ствие двух цитокинов вызывает более выражен-
ный эффект, чем сумма эффектов отдельных ци-
токинов. И наоборот, когда один цитокин инги-
бирует биологическую активность другого, гово-
рят об их антагонизме.
С 1970 г. знания о цитокинах быстро увеличи-
ваются благодаря их идентификации, определе-
нию функциональных характеристик и молеку-
лярному клонированию. Удобная номенклатура,
разработанная ранее на основании клеточных ис-
точников или функциональной активности опре-
деленных цитокинов, не была широко поддержа-
на. Тем не менее время от времени по мере на-
хождения общих функциональных черт несколь-
ких гликопротеинов вводятся дополнительные
термины, определяющие это семейство цитоки-
нов. В частности, термин «хемокины», принятый
в 1992 г., определяет семейство близкородствен-
ных хемотаксических цитокинов, имеющих кон-
сервативные последовательности и являющихся
мощными аттрактантами для разных популяций
лейкоцитов, таких как лимфоциты, нейтрофилы
и моноциты. Для студентов-иммунологов изуче-
ние быстро расширяющегося списка цитокинов
с разнообразными функциональными характери-
стиками может представлять значительные труд-
ности. Однако достаточно сосредоточиться на от-
дельных заслуживающих особого внимания ци-
токинах, что будет интересной и посильной за-
дачей.
' ОБЩИЕ СВОЙСТВА ЦИТОКИНОВ
Общие функциональные свойства
Цитокины обладают некоторыми общими функ-
циональными чертами. Некоторые, такие как
интерферон-у (IFNy) и IL-2, синтезируются клет-
ками и быстро секретируются. Другие, такие как
фактор некроза опухоли a (TNFoc) и TNFp, могут
секретироваться или экспрессироваться как бел-
ки, связанные с мембранами. У большинства ци-
токинов очень короткий период полураспада', сле-
довательно, синтез цитокинов и их функциони-
рование обычно происходят импульсивно.
Подобно полипептидным гормонам цитокины
обеспечивают взаимосвязь между клетками в очень
низких концентрациях (обычно от 1О"10 до 10 15 М).
Цитокины могут действовать локально и на ту
клетку, которая их секретировала (аутокринно), и
на другие близко расположенные клетки (паракрин-
но); более того, они могут действовать системно,
как гормоны {эндокринно) (рис. 11.1). Так же, как
Эндокринное
• Рис. 11.1. Аутокринные, паракринные и эндокринные
свойства цитокинов. Например, головной мозг отвечает
на воздействие цитокинов как на эндокринное воздей-
ствие
172
ГЛАВА 11. ЦИТОКИНЫ
ТН1-клетки Тн2-клетки
ТН1 Цитокины / ^CD154 . CD4° Внутри- клеточные Макрофаг бактерии Тн2 Цитокины/ ^CD154 *1 вГ) CD40 Бакте- > риаль- * ный токсин Л Антигенспецифичный В-лимфоцит
тн1- цитокины Действие Тн2- цитокины Действие
IFNy Активирует макрофаги; регулирует клетки IL-4 Активирует В-клетки
ГМ-КСФ Активирует макрофаги IL-5 Активирует В-клетки
TNFa Активирует макрофаги IL-10 Ингибирует макрофаги
IL-3 Регулирует гемопоэз IL-3 Регулирует гемопоэз
TNFp Регулирует воспалительный ответ TGFp Ингибирует активацию моноцитов
• Рис. 11.2. Цитокины, продуцируемые Тн1- иТн2-клетками
и другие полипептидные гормоны, цитокины
проявляют свои функции, связываясь со специ-
фичными рецепторами на клетках-мишенях.
При этом клетки, регулируемые определенны-
ми цитокинами, должны экспрессировать рецеп-
тор для данного фактора. Таким образом, ак-
тивность отвечающих клеток может регулиро-
ваться количеством и типом цитокинов, к ко-
торым они чувствительны, или повышением/по-
нижением экспрессии цитокиновых рецепторов,
которые сами могут регулироваться другими ци-
токинами. Хорошим примером последнего по-
ложения служит способность IL-1 повышать экс-
прессию рецепторов для IL-2 на Т-клетках. Как
отмечено ранее, это иллюстрирует одну общую
черту цитокинов, а именно, их способность со-
вместно действовать, создавая эффект синергиз-
ма, что усиливает их воздействие на единичную
клетку.
При этом некоторые цитокины находятся в
антагонистических отношениях с одним или бо-
лее цитокином и таким образом ингибируют дей-
ствие друг друга на данную клетку. Например,
цитокины, секретируемые Т-хелперами (Тн1 ^сек-
ретируют IFNy, который активирует макрофаги,
ингибирует В-клетки и непосредственно токси-
чен для определенных клеток. Тн2-клетки секре-
тируют IL- 4 и IL-5, которые активируют В-клет-
ки и IL-10, который в свою очередь ингибирует
активацию макрофагов (рис. 11.2).
Когда клетки продуцируют цитокины или хе-
мокины в ответ на различные стимулы (т.е. ин-
фекционные агенты), те создают градиент кон-
центрации, который позволяет контролировать
или направлять клеточную миграцию, также на-
зываемую хемотаксисом (рис. 11.3). Как обсуж-
далось в гл. 2 и далее в этой главе, клеточная миг-
рация (т.е. хемотаксис нейтрофилов) необходима
для развития воспалительных реакций, возника-
ющих вследствие локального проникновения мик-
роорганизмов или другой травмы. Хемокины иг-
рают ключевую роль в обеспечении сигналов, ко-
торые повышают экспрессию адгезионных моле-
кул, экспрессируемых на эндотелиальных клет-
ках для обеспечения хемотаксиса нейтрофилов и
трансэндотелиальной миграции.
Общая системная активность
Цитокины могут действовать непосредственно в
месте секреции и отдаленно, вплоть до систем-
ных эффектов. Таким образом, они играют реша-
ющую роль в усилении иммунного ответа, по-
скольку высвобождение цитокинов из всего лишь
нескольких клеток, активированных антигеном,
приводит к активации множества клеток различ-
ных типов, которые необязательно являются ан-
тигенспецифичными или находятся непосред-
ственно в данной области. Особенно ярко это про-
является в реакциях ГЗТ (подробнее см. гл. 16),
при которых активация редких антигенспецифич-
ных Т-клеток сопровождается высвобождением
цитокинов. Как следствие действия цитокинов в
эту зону моноциты привлекаются в большом ко-
личестве, значительно превышающем изначаль-
но активированную Т-клеточную популяцию. Так-
же необходимо отметить, что продукция высоких
концентраций цитокинов под влиянием мощных
стимулов может запускать разрушительные си-
стемные эффекты, такие как синдром токсиче-
ского шока, обсуждаемый далее в этой главе. При-
менение рекомбшнантных цитокинов или антаго-
нистов цитокинов, способных воздействовать на
разные физиологические системы, обеспечивает
возможность терапевтической коррекции иммун-
ной системы, основанной на спектре биологиче-
ской активности, которая связана с данным ци-
токином.
Общие клеточные источники
и каскадность событий
Определенная клетка может продуцировать мно-
жество различных цитокинов. Более того, одна
клетка может быть мишенью для многих цитоки-
нов, каждый из которых связывается со своими
ОБЩИЕ СВОЙСТВА ЦИТОКИНОВ
173
• Рис. 11.3. Стадии хемотаксиса нейтро-
филов (обратимое связывание, последу-
ющая активация, адгезия) и трансэндоте-
лиальная миграция (продвижение между
эндотелиальными клетками, формиру-
ющими стенку кровеносного сосуда, —
экстравазация)
Ток крови-----►
Прокатывание Активация
Адгезия Трансэндотелиальная
специфичными рецепторами на клеточной повер-
хности. Следовательно, один цитокин может вли-
ять на действие другого, что может привести к
аддитивному, синергетическому или антагонис-
тическому действию на клетку-мишень.
Взаимодействия множества цитокинов, выде-
ляемых при типичном иммунном ответе, обыч-
но называют цитокиновым каскадом. В основ-
ном именно этот каскад определяет, будет ли
ответ на антиген преимущественно антитело-
опосредованным (и если так, какие классы анти-
тел будут синтезироваться) или клеточноопосре-
дованным (и если так, то какие клетки будут ак-
тивироваться — обладающие цитотоксическим
действием или участвующие в ГЗТ). Далее в этой
главе рассмотрены механизмы контроля, также
опосредованные цитокинами, которые помога-
ют определить набор цитокинов, выделяющихся
после активации СО4+-Т-клеток. Похоже, что в
инициации цитокинового ответа этих клеток ве-
дущую роль играет стимуляция антигеном. Та-
ким образом, в зависимости от природы анти-
генного сигнала и набора цитокинов, связанных
с активацией Т-клетки, наивная эффекторная
СЭ4+-Т-клетка будет приобретать определенный
цитокиновый профиль, который однозначно
определит тип формируемого иммунного ответа
(опосредованный антителами или клетками).
Цитокиновый каскад, связанный с типами им-
мунного ответа, также определяет, какие еше си-
стемы активируются или угнетаются, а также
выраженность и продолжительность иммунного
ответа.
Общие рецепторные молекулы
Как уже было указано ранее в этой главе, цито-
кины обычно обладают перекрывающимися, из-
быточными функциями: например, и IL-1, и IL-6
вызывают лихорадку и еще несколько общих био-
логических феноменов. Вместе с тем эти цитоки-
ны обладают и уникальными свойствами. Как
будет обсуждаться далее, некоторые цитокины для
распространения своего действия на клетки-ми-
шени используют рецепторы, состоящие из не-
скольких полипептидных цепей, причем некото-
рые из этих рецепторов обладают по меньшей
мере одной общей рецепторной молекулой, ко-
торую называют общей у-цепью (рис. 11.4). Об-
щая у-цепь является внутриклеточной сигналь-
ной молекулой. Эти данные помогают объяснить
наличие перекрывающихся функций у разных ци-
токинов.
• Рис. 11.4. Структурные характе-
ристики членов семейства цитоки-
новых рецепторов I класса. Одина-
ковая у всеху-цепь (зеленая) пере-
дает сигнал внутрь клетки
174
ГЛАВА 11. ЦИТОКИНЫ
• ФУНКЦИОНАЛЬНЫЕ ГРУППЫ
ЦИТОКИНОВ
В этой главе мы не будем пытаться привести весь
список хорошо изученных на сегодняшний день
и молекулярно клонированных цитокинов, Основ-
ные цитокины, играющие роль в иммунном отве-
те, и краткое описание их функций приведены в
табл. I l.l. Для изучения цитокины удобно делить
на функциональные группы, которые мы обсу-
дим далее. Выделение таких групп основано на
общих для некоторых цитокинов свойствах. Важ-
но подчеркнуть, что такое разделение, хотя и яв-
ляется удобным, все же несколько спорно, учи-
тывая плейотропный (множественный) эффект
многих цитокинов.
Цитокины, регулирующие
иммунный ответ
Как обсуждалось в гл. 10, активацию В- и Т-кле-
ток в ответ на антигенную стимуляцию регули-
руют цитокины. В зависимости от вовлеченных
цитокинов регуляция может быть положитель-
ной или отрицательной и влияет на пролифера-
цию, активацию и дифференцировку клеток. Не-
сомненно и то, что цитокины регулируют ин-
тенсивность и продолжительность иммунного
ответа. Основной характеристикой всех адаптив-
ных иммунных ответов является их антигенная
специфичность. Учитывая мощную иммуноре-
гуляторную активность цитокинов, как может
иммунная система получить гарантии, что в ходе
иммунного ответа не будут активированы не-
специфичные для данного антигена В- и Т-клет-
ки? Одним из механизмов обеспечения специ-
фичности иммунного ответа является избира-
тельная экспрессия функциональных цитокино-
вых рецепторов только на лимфоцитах, кото-
рые были простимулированы антигеном. Как
следствие, цитокины стремятся действовать ис-
ключительно на лимфоциты, активированные
антигенами. Второй механизм, предотвращаю-
щий активацию цитокинами антигеннеспеци-
фичных лимфоцитов, основан на потребности
клеток взаимодействовать друг с другом в меж-
клеточных контактах для активации; другое на-
звание такого взаимодействия — когнитивное.
Оно может произойти, например, между CD4+-
Т-клетками АПК (например, дендритными клет-
ками, макрофагами, В-клетками); при этом в
пространстве между взаимодействующими клет-
ками образуются большие концентрации цито-
кинов. Таким образом, только клетка-мишень,
участвующая во взаимодействии, может подвер-
гаться действию выделяемых цитокинов. На-
конец, поскольку период полураспада цитоки-
нов очень короткий, особенно в кровотоке и во
внеклеточных пространствах, время их воздей-
ствия на другие клетки-мишени очень огра-
ничено.
Источники и активность
иммунорегуляторных цитокинов
Основным источником иммунорегуляторных ци-
токинов являются СО4+-Т-клетки. Мы уже об-
суждали некоторые из функциональных свойств
отдельных цитокинов, выделяемых Т-клетками,
в том числе IL-2 и IL-4 (см. гл. 10). Наивные
СО4+-Т-клетки дифференцируются в субпопуля-
ции Тн1- и Тн2-клеток, причем каждая из этих
подгрупп обладает характерными цитокиновыми
профилями (см. рис. 11.2). В момент запуска им-
мунного ответа ключевую роль в определении
направления пути дифференцировки наивных
Тн0-клеток играют антигены. Важно отметить,
что факторы, контролирующие, будут ли CD4-
Т-клетки дифференцироваться в Тн1- или Тн2-
клетки, не до конца изучены. В дополнение к
роли, которую определенные цитокины играют
в направлении последующего адаптивного им-
мунного ответа (см. далее), для обеспечения от-
ветов необходимы также кости муляторы, важна
природа взаимодействия пептид—МНС, так же
как и природа самого антигенного стимула. На-
пример, многие внутриклеточные бактерии (на-
пример, листерия) и вирусы активируют денд-
ритные клетки, макрофаги и натуральные кил-
леры, что приводит к продукции IL-12 и IFNy.
В присутствии этих цитокинов Тн0-клетки на-
чинают превращаться в ТН1-клетки. В противо-
положность этому другие возбудители (например,
черви-паразиты) не вызывают продукцию IL-12,
но вместо этого индуцируют высвобождение IL-4
другими клетками (например, тучными клетка-
ми). Интерлейкин-4 способствует превращению
Тн0-клеток в Тн2-клетки.
Другой путь, который направляет развитие наив-
ных Тн0-клеток в Тн1- или Тн2-клетки, опреде-
ляется самим антигеном и связан с количеством
и природой антигенных пептидов, презентирован-
ных этим клеткам при первой стимуляции. Ма-
лые количества антигенного пептида слабо сти-
мулируют Т-клеточные рецепторы Тн0-клеток.
Вследствие этого наивные Т-клетки преимуще-
ственно дифференцируются в Тн2-клетки, про-
дуцирующие IL-4 и IL-5. В противоположность
этому, когда наивным СО4+-Т-клеткам представ-
лены лиганды с высокой плотностью, крепко свя-
занные с Т-клеточным рецепторами, эти Т-клет-
ки стремятся к дифференцировке в ТН1-клетки,
продуцирующие IL-2, IFNy и TNFp. В конечном
итоге образовавшиеся цитокины определяют, ка-
кой ответ будет доминировать: активация макро-
фагов или продукция антител. Путь ТН1 поддер-
живает клеточно-опосредованный иммунитет
с активацией ответов макрофагов, NK и цитоток-
сических Т-лимфоцитов, тогда как путь Тн2 не-
обходим для гуморального иммунитета.
ФУНКЦИОНАЛЬНЫЕ ГРУППЫ цитокинов
175
• Таблица 11.1. Некоторые цитокины и их функции
Цитокин Продуцирующая клетка Основная функция
Интерлейкины
IL-1 Моноциты, многие другие типы клеток Вызывает лихорадку, стимулирует синтез острофазных белков, способствует пролиферации Тн2-клеток
IL-2 Тн0- и ТН1-клетки Фактор роста Т-клеток
IL-3 1н-клетки, NK-клетки, тучные клетки Фактор роста гемопоэтических клеток
IL-4 Тн2-, СЭ4+-Т-клетки, тучные клетки Фактор роста В-клеток и Тн2-СО4+-Т-клеток, способствует синтезу IgE и IgG, угнетает TH1-CD4+-T-клетки
IL-5 Тн2-клетки, тучные клетки Стимулирует рост и секрецию иммуноглобулинов В-клет- ками, фактор роста и дифференцировки эозинофилов
IL-6 Т-клетки, многие другие типы клеток Индуцирует синтез белков острой фазы, активацию Т-клеток и продукцию IL-2; стимулирует продукцию иммуноглобули- нов В-клетками и рост гемопоэтических клеток-предшест- венников
IL-7 Костный мозг, стромальные клетки тимуса, некоторые Т-клетки Фактор роста предшественников Т- и В-клеток
IL-9 Т-клетки Активация тучных клеток
IL-10 Тн2-клетки, макрофаги Угнетает образование ТН1 -клеток и функцию макрофагов
IL-11 Фибробласты Стимулирует рост мегакариоцитов (предшественников тромбоцитов)
IL-12 В-клетки и макрофаги Активирует NK-клетки и обеспечивает образование Тн 1 -СО4+-Т-клеток
IL-13 Т-клетки Свойства, общие с IL-4 (например, переключает синтез иммуноглобулинов на класс Е), но не влияет на Т-клетки; фактор роста для В-клеток человека
IL-14 Т-клетки Участвует в формировании В-клеток памяти
IL-15 Т-клетки и эпителиальные клетки Фактор роста NK- и Т-клеток; свойства похожи на IL-2
IL-16 Т-клетки, эозинофилы, тучные клетки Хемоаттрактант для Т-клеток, провоспалительный цитокин
IL-17 Т-клетки Индуцирует секрецию провоспалительных цитокинов, обес- печивает дифференцировку гемопоэтических клеток-пред- шественников
IL-18 Макрофаги, моноциты, дендритные клетки, многие другие типы клеток Индуцирует продукцию IFNy; усиливает литическую актив- ность NK-клеток
IFNy ТН1-клетки Активирует NK-клетки и макрофаги; угнетает Тн2-СО4+-Т-клетки; стимулирует экспрессию молекул МНС II класса на клетках многих типов
TGFp Лимфоциты, макрофаги, тромбоциты тучные клетки Увеличивает продукцию IgA; угнетает активацию моноцитов и субпопуляций Т-клеток; активирует рост фибробластов и заживление ран
Факторы некроза опухоли
TNFa Макрофаги, тучные клетки Участвует в воспалительных ответах; активирует эндотели- альные клетки и другие клетки иммунной и неиммунных систем; индуцирует лихорадку и септический шок
TNFp (лимфо- токсин) Т-клетки Участвует в воспалительных ответах; также играет роль при уничтожении клеток-мишеней цитотоксическими СО8+-Т-клетками
Колониестимулирующие факторы
ГМ-КСФ Т-клетки, моноциты Обеспечивает рост гранулоцитов и макрофагов, а также рост дендритных клеток в культуре
М-КСФ Т-клетки, моноциты Способствует росту макрофагов
Г-КСФ Т-клетки, моноциты Способствует росту гранулоцитов
Примечание. Г-КСФ — гранулоцитарный колониестимулирующий фактор; ГМ-КСФ — гранулоцитарно-макрофагаль-
ный колониестимулирующий фактор; IFN — интерферон; 1g — иммуноглобулин; IL — интерлейкин; М-КСФ — макрофагаль-
ный колониестимулирующий фактор; МНС — главный комплекс гистосовместимости; NK — натуральный киллер; TGF —
трансформирующий фактор роста; Тн — Т-клетка-хелпер; TNF — фактор некроза опухоли.
176
ГЛАВА 11. ЦИТОКИНЫ
Как замечено ранее, субпопуляции Тн могут
также регулировать рост и эффекторные функ-
ции друг друга. Этот феномен является результа-
том действия цитокинов, произведенных уже ак-
тивированными субпопуляциями, и очевидная
цель этого — предотвратить смещение ответа в
сторону других субпопуляций. Например, продук-
ция IL-10 и TGFp Тн2-клетками ингибирует ак-
тивацию и рост ТН1-клеток. Сходным образом,
продукция IFNy ТН1-клетками ингибирует про-
лиферацию Тн2-клеток. Эти эффекты позволяют
той или другой субпопуляции преобладать в им-
мунном ответе, подавляя рост другой субпопу-
ляции.
Наконец, цитокины играют важную роль в воз-
вращении клеток, вовлеченных в иммунный от-
вет, в исходное состояние после того, как анти-
генные стимулы (например, инфекционные орга-
низмы) удалены. Таким образом, цитокины обес-
печивают регуляторные сигналы, необходимые для
активации иммунной системы после антигенной
стимуляции, а затем возвращают отвечающие клет-
ки в состояние покоя.
Цитокины, поддерживающие
врожденные иммунные реакции
и активирующие воспалительный ответ
Врожденные иммунные реакции
Некоторые цитокины поддерживают реакции
врожденного иммунитета, стимулированные ви-
русами и микробами. В эту группу включены ци-
токины IL-1, IL-6, TNFa, IFNa и IFNfi. Интер-
лейкин-1 и -6 и TNFa инициируют широкий спектр
биологических действий, помогающих координи-
ровать ответ макроорганизма на инфекцию. Эти
цитокины продуцируются в большом количестве
фагоцитами (например, макрофагами и нейтро-
филами). Они называются эндогенными пирогена-
ми, поскольку вызывают лихорадку. Повышенная
температура тела важна для защиты организма-
хозяина, потому что при ней приобретенные им-
мунные реакции более интенсивны, а большин-
ство микроорганизмов размножаются менее эф-
фективно. Другим важным действием IL-1, IL-6
и TNFa является инициация так называемого ос-
трофазового ответа (связан с продукцией гепато-
цитами острофазовых белков). Как обсуждается
далее, острое воспаление (например, в ответ на
инфекцию) сопровождается системным острофа-
зовым ответом. Обычно изменения концентрации
белков острой фазы в плазме крови наблюдается
в течение 2 сут после инфицирования. Один из
них — С-реактивный белок — связывается с фос-
форилхолином на бактериальной поверхности,
действует как опсонин и активирует комплемент
по классическому пути (см. гл. 13). Другой остро-
фазовый белок, функционирующий как опсонин
и активирующий комплемент, — маппапсвязыва-
ющий лектин (МСЛ) — связывает маннозные ос-
татки, доступные на многих бактериях. По своим
функциональным свойствам они аналогичны ан-
тителам, которые опсонизируют бактерию и ак-
тивируют каскад комплемента. Вместе с другими
представителями семейства острофазных белков
С-реактивный белок и МСЛ обеспечивают удале-
ние (клиренс) бактерий.
Кроме того, эндогенные пирогены (IL-1, IL-6,
TNFa) способствуют увеличению количества цир-
кулирующих нейтрофилов, которые выходят из
костного мозга и кровеносных сосудов, где лей-
коциты свободно прикрепляются к эндотелиаль-
ным клеткам. И, наконец, в ответ на эти цитоки-
ны дендритные клетки мигрируют из перифери-
ческих тканей в лимфатические узлы Поскольку
дендритные клетки обладают выраженной анти-
генпрезентирующей активностью, то в лимфати-
ческом узле они поддерживают адаптивные им-
мунные реакции, необходимые для контроля над
инфекцией.
Цитокины, препятствующие вирусной репли-
кации и таким образом блокирующие распро-
странение вирусов в неинфицированные клетки,
называют интерферонами', IFNa и IFNp синтези-
руются многими типами клеток в ответ на вирус-
ную инфекцию. Они отличаются от другого гли-
копротеина, IFNy, который продуцируется акти-
вированными NK- и эффекторными Т-клетками
и появляется после активации адаптивных иммун-
ных реакций. Дополнительно к антивирусной ак-
тивности IFNa и IFNp увеличивают экспрессию
молекул МНС I класса на большинстве неинфи-
цированных клеток, усиливая их устойчивость к
NK-клетками, но при этом повышают чувстви-
тельность инфицированных клеток к киллингу
СО8+-ЦТЛ. И, наконец, они активируют NK-клет-
ки, которые способствуют раннему ответу орга-
низма-хозяина на вирусную инфекцию.
Воспалительные реакции
Многие цитокины активируют функции воспали-
тельных клеток, поэтому их называют провоспали-
тельными цитокинами. Это, например, IL-1, IL-6
TNFa. В ходе локальных острых воспалительных
реакций все свободные цитокины вызывают по-
вышение сосудистой проницаемости, которая в
конечном итоге ведет к припухлости и покрасне-
нию, ассоциированным с воспалением. Как вос-
палительные медиаторы они действуют вместе с
хемокинами, обеспечивая развитие физиологиче-
ских реакций на разные стимулы, такие как ин-
фекция и повреждение тканей. Острые воспали-
тельные реакции развиваются быстро и длятся
недолго. Кратковременность событий связана,
вероятно, с коротким периодом полураспада во-
влеченных медиаторов воспаления, а также с регу-
ляторным влиянием цитокинов, таких как TGFp,
который ограничивает воспалительный ответ (см.
далее). Обычно эти кратковременные реакции
ФУНКЦИОНАЛЬНЫЕ ГРУППЫ цитокинов
сопровождает системный ответ, характеризую-
щийся быстрым изменением концентрации ост-
рофазных белков (см. далее). Иногда наблюдается
длительная активация иммунитета (например, при
хронической инфекции), что ведет к хроническо-
му воспалению, которое подрывает физиологи-
ческое значение иммунного ответа и вызывает
патологические последствия.
Нейтрофилы играют ключевую роль на ранних
стадиях воспалительных реакций (см. рис. 11.3).
В течение нескольких часов они инфильтрируют
ткань, в которой начинается воспалительный от-
вет. Их миграция из крови в участок ткани конт-
ролируется экспрессией адгезионных молекул на
клетках сосудистого эндотелия, что в свою оче-
редь регулируется медиаторами острого воспале-
ния, такими как IL-1 и TNFoc. Под воздействием
этих цитокинов на эндотелиальных клетках сосу-
дов увеличивается экспрессия адгезионных моле-
кул, например Е- и Р-селектинов, а также и меж-
клеточной адгезионной молекулы 1 (ICAM-1) (см.
гл. 9), которая в свою очередь связывается с ли-
гандами селектинов (например, сиалированной
формой углеводной детерминанты Льюиса), экс-
прессирующимися на поверхности нейтрофилов.
Нейтрофилы прочно прикрепляются к эндотели-
альным клеткам и находятся в состоянии «крае-
вого стояния», прокатываясь по поверхности эндо-
телия. Они также активируются хемокинами, кото-
рые вызывают конформационные изменения в их
мембранных молекулах, интегринах. На рис. 11.5
показаны конформационные изменения в гетеро-
димерной (а- и p-цепи) молекуле интегрина LFA-1.
которые позволяют ей связывать ICAM-1. Эти
изменения увеличивают сродство нейтрофилов и
адгезионных молекул эндотелия. В итоге нейтро-
фил проникает между эндотелиальными клетка-
ми (трансэндотелиальная миграция) и выходит из
сосудистого русла в ткань (экстравазация), где под
непосредственным влиянием хемокинов продол-
жает свой путь к поврежденному или инфициро-
177
ванному участку ткани. Этот процесс называют
хемотаксисом.
Лимфоциты и моноциты также подвергаются
экстравазации. проходя те же основные стадии,
что и нейтрофилы, хотя при этом вовлекаются
другие комбинации адгезионных молекул. В при-
влечении этих клеток важную роль играют другие
цитокины, IFNy и TGF0. Кроме активации мак-
рофагов и увеличения их фагоцитарной активно-
сти IFNy как хемоаттрактант привлекает макро-
фаги в участок ткани, где локализуется антиген
Миграция всех этих типов клеток, включая нейт-
рофилы, лимфоциты, моноциты, макрофаги, эози-
нофилы и базофилы (которые привлекаются к
участку поврежденной ткани при активации ком-
племента), приводит к очищению от антигена и
заживлению ткани. Трансформирующий фактор
роста р обеспечивает завершение воспалительно-
го ответа, активируя накопление и пролиферацию
фибробластов, а также депонирование внеклеточ-
ного белкового матрикса, необходимого для вос-
становления ткани.
Хемокины — цитокины, активирующие
движение лейкоцитов
Хемокинами называют близкородственное семей-
ство хемотаксических цитокинов, обладающих
низкой молекулярной массой, содержащих 70—
80 аминокислотных остатков с консервативными
последовательностями и являющихся мощными
аттрактантами для нейтрофилов, моноцитов и
лимфоцитов. В табл. 11.2 перечислены некоторые
важные хемокины из множества (более 50) уже
идентифицированных. По структурным характе-
ристикам это большое суперсемейство подразде-
ляют на четыре подсемейства. Для каждого из
субсемейств характерно высококонсервативное
расположение в МН2-терминальном конце ами-
нокислотного остатка цистеина (С), например
Мембрана нейтрофила
Мембрана эндотелиальной клетки
IL-8
• Рис. 11.5. Адгезионные молекулы клеточной поверхности и события, происходящие при активации цитокинами нейтро-
фила и последующей его трансэндотелиальной миграции. Слева: слабое связывание селектиновых лигандов на нейтро-
филе с Е-селектином на эндотелиальных клетках. Посередине: усиление под действием интерлейкина-1 (IL-1) и TNFa
экспрессии Е-селектина, что обеспечивает более сильное связывание. Справа: активирующее действие IL-8 на нейтро-
филы вызывает конформационные изменения интегринов (например, лимфоцитактивирующего фактора 1), что обеспе-
чивает их связывание с молекулой межклеточной адгезии 1 (ICAM-1)
178
ГЛАВА 11. ЦИТОКИНЫ
• Таблица 11.2. Некоторые хемокины и их функции
Хемокин П редуцирование Привлекаемая клетка Главная функция
IL-8 Моноциты, макрофаги, фибро- бласты, кератиноциты, эндоте- лиальные клетки Нейтрофилы, наивные Г-клетки Мобилизация и активация нейтро- филов, способствует ангиогенезу
RANTES Т-клетки, эндотелиальные клет- ки, тромбоциты Моноциты, NK-клетки, Т-клетки, базофилы, эозинофилы Вызывают дегрануляцию базофилов, активируют Т-клетки
МСР-1 Моноциты, макрофаги, фибро- бласты, кератиноциты Моноциты, NK-клетки, Т-клетки, базофилы, дендритные клетки Активируют макрофаги, стимулиру- ют высвобождение гистамина из ба- зофилов, активируют Тн2-иммунитет
MIP-la Моноциты, макрофаги, Т-клет- ки, тучные клетки, фибробласты Моноциты, NK-клетки, Т-клетки, базофилы, дендритные клетки Активируют ТН1 -иммунный ответ, конкурируют с ВИЧ-1
М1Р-1р Моноциты, макрофаги, нейтро- филы, эндотелиальные клетки Моноциты, NK-клетки, Т-клетки, дендритные клетки Конкурирует с ВИЧ-1 за связыва- ние с хемокиновым рецептором
Примечание. IL — интерлейкин; МСР — моноцитарный хемотаксический белок; MIP —макрофагальный воспалитель-
ный белок; NK — натуральный киллер; Тн — Т-клетка-хелпер; RANTES — регулятор активации, Т-клеточной экспрессии и
секреции (Human (Regulated upon Activation, Normal T cell Expressed and Secreted)).
CXC, CC или СХЗС, где X — изменяемый ами-
нокислотный остаток. Большинство хемокинов от-
носят к группам СХС и СС. Как обсуждалось ра-
нее, хемокины действуют вместе с воспалитель-
ными медиаторами, регулируя экспрессию и фор-
мы клеточных адгезионных молекул на мембране
лейкоцита. Показано, что некоторые хемокины
вызывают респираторный взрыв, высвобождение
ферментов, мобилизацию внутриклеточного каль-
ция и ангиогенез. Последнее из перечисленных
функциональных свойств некоторых хемокинов —
это биологическая особенность, определяющая
важную ролью этих молекул в заживлении ран и
восстановлении ткани. Продукция хемокинов
может быть или индуцирована, или конститутив-
но обусловлена. Те хемокины, продукция кото-
рых индуцируется или усиливается в перифери-
ческих тканях в результате воспаления, преиму-
щественно участвуют в заживление ран и восста-
новлении ткани. И, напротив, конститутивно про-
дуцируемые хемокины выполняют поддержива-
ющие функции и обеспечивают движение лейко-
цитов в нормальных условиях.
Среди более чем 50 хемокинов, идентифици-
рованных к настоящему времени, наиболее изу-
ченным является IL-8, представитель субсемей-
ства СХС. Он продуцируется различными типа-
ми клеток, в том числе макрофагами, Т-клет-
ками, эндотелиальными клетками, фибробласта-
ми и нейтрофилами, и играет важную роль в вос-
палительных реакциях и заживлении ран глав-
ным образом благодаря своей способности при-
влекать нейтрофилы в участок поврежденной
ткани. Другой важной функцией IL-8 является
его способность активировать нейтрофилы пос-
ле их прикрепления к сосудистому эндотелию
(см. рис. 11.5).
Ценной характеристикой определенных СС-
хемокинов, например RANTES, макрофагального
воспалительного белка la (macrophage inflamma-
tory protein — М1Р-1а) и MIP-ip, является их
способность подавлять инфицирование Т-клеток
М-тропными штаммами ВИЧ in vitro. Эти штам-
мы ВИЧ были изначально названы так вследствие
их способности поражать клетки макрофагаль-
ного ряда в культуре, хотя известно, что в орга-
низме они могут инфицировать дендритные клет-
ки, макрофаги и Т-клетки (см. гл. 17). Сходным
образом лимфотропные штаммы ВИЧ поражают
в культуре только СО4+-Т-клетки. Способность
различных вариантов ВИЧ инфицировать разные
клеточные типы определяется главным образом
наличием хемокиновых рецепторов, которые яв-
ляются корецепторами для ВИЧ. Дендритные
клетки, макрофаги и Т-клетки экспрессируют
CCR5. М-тропные штаммы ВИЧ используют при
первичном инфицировании этот хемокиновый
рецептор, с которым также связываются хемо-
кины RANTES, MIP-la и MIP-ip. Так, добавле-
ние этих хемокинов к лимфоцитам, чувствитель-
ным к ВИЧ-инфекции, блокирует инфициро-
вание вследствие конкуренции между СС-хемо-
кином и вирусом за корецептор CCR5 на клет-
ке-мишени.
Напротив, хемокиновый рецептор, который свя-
зывается с определенными представителями под-
семейства СХС (CXCR4), является корецептором,
ответственным за проникновение лимфотропных
штаммов ВИЧ внутрь клетки-мишени. Образова-
ние гетеротримерного комплекса между белком
вирусной оболочки gpl20, CD4 и одним из этих
цитокиновых рецепторов облегчает вход вируса в
клетку, хотя молекулярные механизмы, связанные
с этим феноменом, только начинают изучать.
РЕЦЕПТОРЫ ЦИТОКИНОВ
179
Цитокины, стимулирующие гемопоэз
Как обсуждалось в гл. 2, миелоидные и лимфоид-
ные клетки происходят из полипотентной ство-
ловой клетки (см. рис. 2.1). Цитокины, способ-
ные индуцировать рост гемопоэтических клеток
in vitro, первоначально изучали в культуре клеток
костного мозга, выращиваемых на мягком агаре,
поэтому их называли колониестимулирующими
факторами (КСФ). Некоторые КСФ, различные
по биохимическим характеристикам, были опре-
делены с помощью особых линий гемопоэтичес-
ких клеток, которые при стимуляции формиро-
вали колонии. К ним относят: макрофагальный
КСФ (М-КСФ), который поддерживает клональ-
ный рост макрофагов; гранулоцитарный КСФ
(Г-КСФ), поддерживающий клональный рост гра-
нулоцитов; гранулоцитарно-макрофагальный
КСФ (ГМ-КСФ), который поддерживает кло-
нальный рост обеих линий. Еще одним цитоки-
ном, стимулирующим клональный рост гемопо-
этических клеток, является IL-3, но в отличие от
КСФ он способен стимулировать пролиферацию
различных клеточных популяций, в том числе
гранулоцитов, макрофагов, мегакариоцитов,
эозинофилов, базофилов и тучных клеток. Более
того, в присутствии эритропоэтина, ростового
фактора почечного происхождения, способного
поддерживать рост и заключительную дифферен-
цировку клеток эритроидного ряда, IL-3 также
способен стимулировать развитие нормобластов
и эритроцитов. Интерлейкин-7, цитокин, про-
дуцируемый в большом количестве клетками
костного мозга и стромальными клетками тиму-
са, вызывает дифференцировку стволовых лим-
фоидных клеток с образованием предшественни-
ков В- и Т-клеток.
Как и в случае других функциональных кате-
горий цитокинов, список факторов, вовлекаемых
в гемопоэз, за последние годы значительно уве-
личился. Возможно, КСФ более чем другие кате-
гории цитокинов востребованы как важные тера-
певтические средства. Например, Г-КСФ исполь-
зуется для лечения больных, страдающих нейтро-
пениями, вызванными высокими дозами химио-
терапевтических препаратов, в перерывах между
курсами А ГМ-КСФ используется для лечения
больных, перенесших пересадку костного мозга,
для стимуляции восстановления популяций гра-
нулоцитов и макрофагов.
’ РЕЦЕПТОРЫ ЦИТОКИНОВ
Семейства цитокиновых рецепторов
Цитокины могут действовать только на клетки-
мишени, которые экспрессируют для них рецеп-
торы. Часто экспрессия цитокиновых рецепторов,
как и сама продукция цитокинов, активно регу-
лируется, поэтому покоящиеся клетки либо не
экспрессируют данный рецептор, либо экспрес-
сируют версию этого рецептора с низкой или ма-
лой аффинностью. Примером последнего положе-
ния может служить рецептор для IL-2, который
может экспрессироваться на мембране клеток либо
в качестве димера, обладающего малой аффинно-
стью (р- и у-цепи), либо в виде тримера с высо-
кой аффинностью, содержащего три субъедини-
цы ос, р и у (см. рис. 11.8). Интерлейкин-2 способен
индуцировать на активированных клетках экспрес-
сию высокоаффинного IL-2-рецептора — свойство,
уникальное для Т-клеток, подвергавшихся анти-
генной стимуляции. Сравнительное значение от-
дельных субъединиц этого рецептора для связыва-
ния с IL-2 и передачи сигнала внутрь клетки-
мишени обсуждается далее в этой главе. Достаточ-
но сказать, что регуляция количества рецепторов,
экспрессированных на мембране клетки-мишени,
и/или формы экспрессируемого рецептора способ-
ствует тому, что только популяция активирован-
ных клеток-мишеней ответит на цитокин(ы) в дан-
ном микроокружении.
Чтобы понять механизмы воздействия цитоки-
нов на клетки-мишени, исследователи проводили
множество опытов. Как сказано далее в этой гла-
ве, информация о характере взаимодействия ци-
токинов с цитокиновыми рецепторами может быть
полезной при разработке стратегий блокирования
активности цитокинов, участвующих в воспали-
тельном ответе, например при ревматоидном арт-
рите, или при нежелательных иммунных ответах,
например при отторжении трансплантата.
Рецепторы к цитокинам можно разделить на
пять семейств в соответствии со свойствами ре-
цепторных белков (рис. 11.6):
• рецепторы суперсемейства иммуноглобулинов;
• семейство цитокиновых рецепторов 1 класса;
• семейство цитокиновых рецепторов II класса;
• суперсемейство рецепторов TNF;
• семейство хемокиновых рецепторов.
Рецепторы суперсемейства иммуноглобулинов
содержат общие структурные компоненты, кото-
рые впервые были описаны именно у них — каж-
дый содержит по меньшей мере один иммуногло-
булиноподобный домен (см. гл. 4). К цитокинам,
рецепторы которых являются членами суперсемей-
ства иммуноглобулинов, относятся М-КСФ и IL-1.
Рецепторы цитокинов I класса (также называют-
ся семейством гемопоэтиновых рецепторов) обыч-
но состоят из двух типов полипептидных цепей:
специфичной к цитокину субъединицы (а-цепь)
и субъединицы, передающей сигнал (0- или у-
цепь). Важное исключение из этого правила (две
структурные субъединицы) в семействе цитоки-
новых рецепторов I класса — высокоаффинные
рецепторы для IL-2 и IL-15, которые являются
тримерами. Большинство цитокинов, идентифи-
цированных к настоящему времени, используют
цитокиновые рецепторы I класса.
180
ГЛАВА 11. ЦИТОКИНЫ
Лиганды IL-1
М-КСФ
IL-2
IL-3
IL-4
IL-5
IL-6
IL-7
IL-9
IL-11 IFNa
IL-12
IL-13
IL-15
ГМ-КСФ
Г-КСФ
Рецепторы
суперсемейства
иммуноглобулинов
IFNp
IFNy
IL-10
Цитокиновые
рецепторы
II класса
TNa
TNFp
CD30L
CD40L
FasL(CD154)
Рецепторы
для TNF
IL-8
RANTES
MIP-1
PF4
MCAF
• Рис. 11.6. Структурные особен-
ности пяти типов цитокиновых
рецепторов. Многие из них со-
держат консервативные остатки
цистеина
Хемокиновые
рецепторы
Цитокиновыерецепторы II класса также назы-
вают семейством интерфероновых рецепторов,
поскольку их лигандами являются интерфероны
(например, IFNa, IFNp и IFNy) или они облада-
ют биологической активностью, которая перекли-
кается с активностью, свойственной некоторым
интерферонам (например, рецептор для IL-10).
Суперсемейство рецепторов TNF (TNFR) делят на
три подгруппы: рецепторы смерти, рецепторы-
ловушки и активирующие рецепторы. Эти группы
различаются по последовательностям (мотивам)
или их отсутствию в цитоплазматических «хвос-
тах» рецепторов. Все представители этих подгрупп
обладают одинаковыми внеклеточными домена-
ми для связывания лигандов. Активированные
TNFR передают сигнал внутри клетки через на-
бор адаптерных белков, называемых факторами,
ассоциированными с рецептором TNF(TRAF). В роли
STAT-димеры перемещаются
в ядро, где они активируют
транскрипцию специфичных
• Рис. 11.7. Модель передачи сиг-
нала от цитокинового рецепто-
ра с использованием киназ, свя-
занных с рецептором, для актива-
ции специфических факторов
транскрипции: STAT - передат-
чик сигнала и активатор транс-
крипции
ПЕРЕДАЧА СИГНАЛА ЧЕРЕЗ ЦИТОКИНОВЫЙ РЕЦЕПТОР
181
лигандов TNFR могут выступать как связанные с
мембраной, так и секретируемые белки. Напри-
мер, большинство эффекторных Т-клеток эксп-
рессируют мембранные формы рецепторов семей-
ства TNFR, в том числе TNFoc и TNFp (также из-
вестный как лимфотоксин-ос), каждый из кото-
рых может высвобождаться как секретируемый
белок. К другим TNFR относятся Fas, который
содержит «домен смерти» в цитоплазматическом
конце, и CD40, вовлеченный в регулирование та-
ких функций В-клеток, как пролиферация, созре-
вание и переключение классов секретирумых 1g.
Таким образом, TNFR и суперсемейство TNF ре-
гулируют жизнь и смерть активированных клеток
иммунной системы. Наконец, хемокиновые ре-
цепторы принадлежат к суперсемейству серпан-
тиновых рецепторов, сцепленных с G-белком, на-
зываемых так из-за уникальной змееподобной
конфигурации внеклеточно-цитоплазматической
структуры, а также из-за их связи с G-бел кам и,
которые передают сигнал внутрь клетки (рис. 11.7).
Пополняется список хемокиновых клонирован-
ных рецепторов СС и СХС, для которых показа-
но, что они могут связывать не только хемокины,
но и множество различных возбудителей, вклю-
чая бактерии (например, Streptococcus pneumonia.
который связывается с рецептором фактора акти-
вации тромбоцитов), паразитов (например. Plasmo-
dium vivax. который связывается с хемокиновым
рецептором, являющимся антигеном группы крови
системы Даффи (Duffy)), и некоторые вирусы (на-
пример, Т-тропные штаммы ВИЧ-1 для проник-
новения в Т-клетки и макрофаги используют хе-
мокиновый рецептор CXCR4, а М-тропные штам-
мы ВИЧ-1 - CCR5).
Общая у-цепь
Важной особенностью цитокиновых рецепторов
I класса является то, что часто субъединицы, пе-
редающие сигнал через мембрану, являются об-
щими и для других членов этого семейства. На-
пример, высокоаффинный рецептор IL-2 (IL-2R)
состоит из специфичной к IL-2 ос-цепи (CD25) и
двух дополнительных цепей (0 и у), ответствен-
ных за передачу сигнала (обсуждается далее). Как
уже упоминалось ранее, общая у-цепь использует-
ся несколькими другими цитокиновыми рецеп-
торами в качестве передающей сигнал субъеди-
ницы. Эта структурная особенность помогает
объяснить перекрестное функционирование и
антагонизм, часто проявляемые отдельными ци-
токинами (см. рис. 11.4). Функциональное значе-
ние общей у-пепи иллюстрируется ролью, кото-
рую она играет в IL-2R. Сам IL-2R может экс-
прессироваться на мембранах клеток в двух фор-
мах: 1) димер с умеренной аффинностью (0- и
у-цепи); 2) высокоаффинный тример, состоящий
из трех субъединиц — а-. 0- и у-цепей (рис. 11.8).
Интерлейкин-2 способен активировать клетки,
IL-2R с умеренной IL-2R с высокой
аффинностью аффинностью
Константа аффинности: ю-9 М
Экспрессия на клетках: NK-клетки,
покоящиеся
Т-клетки
• Рис. 11.8. Сравнение двух форм рецепторов к IL-2, экс-
прессируемых на клетках
экспрессирующие высокоаффинную форму IL-
2R, что характерно для Т-клеток, подвергшихся
антигенной стимуляции. Было показано, что де-
фект общей у-цепи рецептора IL-2 вызывает вы-
раженный иммунодефицит у особей мужского
пола, страдающих тяжелым комбинированным
иммунодефицитным заболеванием, сцепленным
с хромосомой X (см. гл. 17). При этом дефекте фун-
кциональная активность множества цитокинов не
проявляется вследствие того, что рецепторы всех
этих цитокинов используют IL-2Ry-upnb.
« ПЕРЕДАЧА СИГНАЛА
ЧЕРЕЗ ЦИТОКИНОВЫЙ РЕЦЕПТОР
Для того чтобы оказывать биологическое действие
на клетки-мишени, цитокины должны генериро-
вать внутриклеточные сигналы, которые приво-
дят к образованию активных транскрипционных
факторов и обеспечивают последующую экспрес-
сию генов (см. рис. 11.7). Связывание цитокина с
его клеточным рецептором вызывает димериза-
цию или полимеризацию рецепторных полипеп-
тидов на поверхности клетки. Этот механизм при-
меним к большинству, если не ко всем, цитоки-
новым рецепторам семейства I и II классов. Сле-
дует отметить, что неясно, как сохраняется спе-
цифичность сигнала, учитывая, что разные цито-
кины используют одни и те же цитоплазматиче-
ские пути передачи сигналов. В случае с упомяну-
тыми двумя семействами рецепторов цитокинов
димеризация-полимеризация субъединиц рецеп-
торов сближает их цитоплазматические «хвосты»,
таким образом позволяя димерному рецептору
запустить внутрицитоплазматические механизмы
передачи сигнала. Передача начинается с актива-
ции JAK-киназ. семейства цитозольных тирози-
новых киназ, которые взаимодействуют с цито-
плазматическими доменами рецептора. Это при-
182
ГЛАВА 11. ЦИТОКИНЫ
водит к фосфорилированию тирозиновых остат-
ков, присутствующих в цитоплазматическом до-
мене рецептора и молекулах семейства факторов
транскрипции, известных как передатчики сиг-
нала и активаторы транскрипции (signal trans-
ducers and activators of transcription — STAT). После
фосфорилирования эти STAT-факторы транскрип-
ции димеризуются и затем перемещаются из ци-
топлазмы в ядро, где связываются с участками,
ответственными за усиление транскрипции генов,
индуцируемых этим цитокином.
Описанные ранее события, связанные с пере-
дачей сигнала, приводят к осуществлению биоло-
гических свойств, присущих цитокину на клеточ-
ном уровне. Однако эта реализация не прерывает
передачи сигнала, запущенной при связывании
цитокина с цитокиновым рецептором. До послед-
него времени механизмы, отвечающие за инги-
бицию передачи сигналов, индуцированных ци-
токинами, были плохо изучены. В настоящее вре-
мя выявили семейство внутриклеточных белков,
которые играют ключевую роль в супрессии ци-
токинового сигнала. Эти белки, названные су-
прессорами цитокинового сигнала (suppressor of
cytokine signaling — SOCS), регулируют передачу
сигнала путем прямого взаимодействия с цито-
киновыми рецепторами и сигнальными белками,
запуская механизмы, направленные на деграда-
цию белков, с которыми они связаны. Учитывая
ведущую роль цитокинов в различных заболева-
ниях, включая те, которые мы обсудим далее,
дизрегуляция нормальной функции SOCS может
являться причиной развития некоторых из этих
болезней. При этом управление активностью SOCS
может обеспечить высокоэффективный терапев-
тический подход в будущем.
РОЛЬ цитокинов и цитокиновых
РЕЦЕПТОРОВ ПРИ ЗАБОЛЕВАНИЯХ
Учитывая многообразные регуляторные свойства
цитокинов, неудивительно, что избыточная или
недостаточная экспрессия цитокинов или цитоки-
новых рецепторов значима при многих заболева-
ниях. Обсудим несколько примеров заболеваний,
патофизиология которых связана с цитокинами.
Синдром токсического шока
Синдром токсического шока развивается вследствие
выделения суперантигена (энтеротоксина) некото-
рыми микроорганизмами. Например, токсины,
выделенные из Staphylococcus aureus или Streptococcus
pyogenes, вызывают бурное выделение цитокинов
Т-клетками. Токсины вызывают этот эффект пу-
тем активации большого количества СО4+-Т-кле-
ток, которые используют определенные Vp-обла-
сти в структуре своего TCR. Токсин перекрестно
связывается с Vp-областью TCR и молекулой МНС
II класса, экспрессируемой на АПК (см. рис. 9.8).
Было показано, что суперантигены могут активи-
ровать каждую пятую Т-клетку. Активация Т-кле-
ток суперантигенами приводит к избыточной про-
дукции цитокинов, что неизбежно вызывает диз-
регуляцию цитокиновой сети, необычайно высоко
поднимая уровни IL-1 и TNFa. Эти цитокины
вызывают системные реакции, включая лихорад-
ку, тромбообразование, диарею, падение артери-
ального давления и шок. Иногда эти реакции мо-
гут приводить к летальному исходу.
Бактериальный септический шок
Избыточная продукция цитокинов также может
быть связана с инфекциями, вызванными неко-
торыми грамотрицательными бактериями, в том
числе Escherichia coli, Klebsiella pneumonia. Entero-
bacter aerogenes, Pseudomonas aerugenosa и Neisseria
meningitidis. Эндотоксины, выделяемые этими бак-
териями, стимулируют макрофаги к избыточному
выделению IL-l и TNFa, что часто определяет
развитие летальной формы бактериального сеп-
тического шока.
Онкологические заболевания
Показано, что некоторые формы лимфоидных и
миелодных опухолей связаны с аномально высо-
кими концентрациями цитокинов и/или уровня-
ми экспрессии цитокиновых рецепторов Возмож-
но, лучшим примером связи злокачественного за-
болевания с избыточной продукцией одновремен-
но и цитокина, и рецептора к нему, являются па-
циенты с Т-клеточным лейкозом взрослых, кото-
рый строго ассоциирован с вирусом Т-клеточного
лейкоза человека типа I (HTLV-1). Т-клетки, инфи-
цированные HTLV-1, постоянно выделяют 1L-2
и экспрессируют высокоаффинный 1L-2R даже
в отсутствие активации антигеном. Это приводит к
аутокринной стимуляции инфицированных Т-кле-
ток и, следовательно, их неконтролируемому рос-
ту. Другими примерами злокачественных заболе-
ваний, связанных с избыточной продукцией цито-
кинов, являются миеломная болезнь (неопласти-
ческие В-клетки), при которой выделяются боль-
шие количества аутокринного IL-6, и болезнь Ход-
жкина, лимфогрануломатоз, при которой реактив-
ная среда является результатом избыточной про-
дукции цитокинов, в частности IL-5 (см. гл. 17).
Аутоиммунные и другие
иммуноопосредованные заболевания
Существует множество доказательств того, что Т-
клетки контролируют формирование аутоантител
и регуляцию аутоиммунитета (см. гл. 12). Весьма
ТЕРАПЕВТИЧЕСКОЕ И ДИАГНОСТИЧЕСКОЕ ПРИМЕНЕНИЕ ЦИТОКИНОВ И ЦИТОКИНОВЫХ РЕЦЕПТОРОВ
183
вероятно, что некоторые из наблюдаемых фено-
менов являются проявлением действия цитоки-
нов, выделяемых субпопуляциями Т-хелперов,
в том числе IL-10, IFNy и IL-4. Было показано,
что некоторые аномалии цитокинов и цитокино-
вых рецепторов связаны с системными аутоим-
мунными заболеваниями. Некоторые из них раз-
виваются уже в ходе заболевания и, вероятно, не
являются его причиной, в то время как другие
могут нарушать регуляцию иммунного ответа и
способствовать развитию аутореактивности. Было
показано, что такое аутоиммунное заболевание,
как системная красная волчанка (СКВ), связано
с повышенной концентрацией IL-10. Недавние ис-
следования цитокинов, вовлеченных в патогенез
аутоиммунных заболеваний, были посвящены
выяснению того, ответственно ли смещение фе-
нотипа субпопуляций Т-хелперов за инициацию
или прогрессирование заболевания. Хотя боль-
шинство таких работ были проведены с исполь-
зованием моделей аутоиммунных заболеваний на
животных, описывалось значение Тн2-клеток в
обеспечении системного аутоиммунитета. Для
более четкого освещения ролей, которые играют
цитокины, цитокиновые рецепторы и субпопуля-
ции Т-хелперов в развитии аутоиммунных забо-
леваний, необходимы дальнейшие исследования.
Цитокины также играют важную роль в пато-
физиологии других иммуноопосредованных забо-
леваний, таких как аллергия, астма и воспалитель-
ные заболевания (например, ревматоидный арт-
рит). Таким образом, неудивительно, что многие
клинические особенности этих заболеваний яв-
ляются результатом сигналов, передаваемых че-
рез цитокиновые рецепторы, и биологических
эффектов такой передачи (например, клеточная
активация, клеточная смерть). Постепенно мы все
больше узнаем о тех ролях, которые цитокины и
цитокиновые рецепторы играют при различных
заболеваниях. Далее обсуждаются некоторые ре-
зультаты этого знания, определившие разработку
антагонистов цитокинов, используемых для ле-
чения больных с некоторыми воспалительными
заболеваниями.
ТЕРАПЕВТИЧЕСКОЕ
И ДИАГНОСТИЧЕСКОЕ ПРИМЕНЕНИЕ
ЦИТОКИНОВ И ЦИТОКИНОВЫХ
РЕЦЕПТОРОВ
Благодаря тому, что стали известны клеточные и
молекулярные компоненты иммунного ответа на
инфекционные микроорганизмы и. особенно, та
роль, которую играют цитокины в регуляции и
гомеостазе гемопоэтических клеток, появилась
возможность для разработки новых лекарствен-
ных средств. Коммерческий интерес к цитокинам
вызвало то, что в клинической практике стало
можно использовать препараты на основе цито-
кинов, растворимых цитокиновых рецепторов (ан-
тагонистов цитокинов), аналогов цитокинов, ан-
тител к цитокинам или цитокиновым рецепторам.
Эти биологические лекарственные препараты де-
монстрируют многообещающие результаты в не-
скольких направлениях.
Ингибиторы цитокинов/Антагонисты
В кровотоке и других внеклеточных жидкостях
были идентифицированы несколько свободных
цитокиновых рецепторов природного происхож-
дения. В организме они служат ингибиторами ци-
токитов, или антагонистами’, они высвобожда-
ются с поверхности клетки в результате фермен-
тативного расщепления внеклеточного домена
цитокинового рецептора. Циркулирующие раство-
римые цитокиновые рецепторы сохраняют спо-
собность к связыванию с цитокином, к которому
специфичен рецептор, и таким образом нейтра-
лизуют активность этого цитокина. Примерами
таких ингибиторов могут служить рецепторы к
IL-2, IL-4, IL-6, IL-7, IFNy и TNF. Применение
в эксперименте растворимых рецепторов к TNF
привело к разработке нового класса препаратов,
модификаторов биологического ответа, называе-
мых ингибиторами TNF. Была показана возмож-
ность клинического использования ингибиторов
TNF в лечении ревматоидного артрита. У паци-
ентов с этим заболеванием в суставах повышают-
ся концентрации TNF и IL-1. Этот феномен при-
водит к боли, ассоциированной с ревматоидным
артритом, отекам, ограничению подвижности и
другим симптомам. Ингибиторы TNF (раствори-
мые молекулы рецепторов TNF) конкурируют с
рецепторами TNF на клетках за связывание с эн-
догенно образованным TNF (рис. 11.9). У боль-
шинства больных ревматоидным артритом, кото-
рых лечили ингибиторами TNF. выявляли значи-
тельное улучшение состояния, хотя около 30%
оказались резистентными к этой терапии.
Также интенсивно изучают растворимый ре-
цептор к IL-2. Он формируется при протеолити-
ческом отделении фрагмента молекулярной мас-
сой 45 кДа от a-цепи IL-2R (CD25). Хроническая
активация Т-клеток ассоциирована с очень высо-
кими концентрациями растворимого IL-2R в кро-
вотоке. Поэтому его используют в качестве кли-
нического маркера хронической активации Т-кле-
ток у пациентов с некоторыми аутоиммунными
заболеваниями и маркера отторжения трансплан-
тата.
Еще одним хорошо исследованным цитокино-
вым антагонистом природного происхождения
является антагонист рецептора IL-1 (IL-IRa). Этот
белок также участвует в регуляции интенсивно-
сти воспалительного ответа, поскольку связыва-
ется с рецептором к IL-1 на СВ4+-Т-клетках и
предотвращает их активацию. Связывание IL-IRa
с рецептором к IL-1 не приводит к передаче сиг-
184
ГЛАВА 11. ЦИТОКИНЫ
Цитокин
Цитокин (TNF)
связывается
со своим рецептором
на клетке
Сигнал,
запускающий
воспалительный
процесс
Клетка
иммунной
системы
• Рис. 11.9. Растворимые рецеп-
торы TNF могут снижать его вос-
палительную активность
нала внутрь клетки с этого рецептора. Антагонист
IL-1 R был клонирован и сейчас проходит клини-
ческие испытания для определения возможности
его использования в качестве лекарственного сред-
ства для лечения хронических воспалительных
заболеваний.
Коррекция клеточных
и м му нодефи цитов
Цитокины уже используют для лечения таких ос-
трых состояний, как цитопении, развивающиеся
вследствие химиотерапии или радиотерапии; при
этом назначают факторы роста, например Г-КСФ
или ГМ-КСФ. Как обсуждалось ранее в этой гла-
ве, лечение такими гемопоэтическими фактора-
ми роста повышает уровень естественного воспро-
изводства нужной линии гемопоэтических клеток.
Лечение иммунодефицитов
Цитокины также используют для лечения паци-
ентов с иммунодефицитными заболеваниями (об-
суждаются в гл. 17). Например, у пациентов с агам-
маглобулинемией, сцепленной с хромосомой X,
для преодоления нейтропении, связанной с за-
болеванием, успешно применяют Г-КСФ. Паци-
ентов, страдающих формой болезни из группы
тяжелых комбинированных иммунодефицитов
(ТКИД), вызванной дефицитом фермента адено-
зиндезаминазы (АДА) (при этом заболевании ча-
сто обнаруживают выраженный дефицит IL-2),
лечат рекомбинантным человеческим IL-2. На-
конец, несколько заболеваний, обусловленных
отсутствием адгезии лейкоцитов, для которых ха-
рактерны рецидивирующие или прогрессирую-
щие инфекции мягких тканей, периодонтиты,
плохое заживление ран и лейкоцитоз, успешно
лечат рекомбинантным IFNy, в результате чего
снижаются тяжесть и частота инфекций, что,
вероятно, достигается за счет увеличения кисло-
роднезависимой бактерицидности иммунных
клеток.
Лечение онкологических больных
и пациентов, перенесших
трансплантацию
Удается также достичь улучшения состояния он-
кологических больных при назначении цитокинов
в программах пассивной клеточной иммунотера-
пии, в которых используются лимфокинактиви-
рованные клетки-киллеры (ЛАК) (см. гл. 19). При
высоких концентрациях IL-2 культивируемые по-
пуляции NK-клеток или цитотоксических Т-кле-
ток образуют эффекторные клетки с потенциальной
противоопухолевой активностью. Доступность
больших количеств рекомбинантного IL-2 сдела-
ло терапию ЛАК совместно с терапией IL-2 более
доступной; причем у некоторых больных мелано-
мой и раком почек получены объективные резуль-
таты. Вариантом пассивной клеточной иммуно-
терапии является дополнительное использование
IFNy, который увеличивает экспрессию молекул
МНС II класса и опухольассоциированных анти-
генов на опухолевых клетках, что усиливает унич-
тожение этих клеток введенными эффекторными
клетками.
В лечении некоторых форм онкологических
заболеваний также оказались эффективны анти-
тела, специфичные к цитокиновым рецепторам
Относительная доступность лейкозных клеток со
специфичными цитокиновыми рецепторами опре-
делила широкое распространение исследований
нативных или конъюгированных с токсинами ан-
тител. При лечении одного из видов лейкозов, на-
зываемого Т-клеточным лейкозом/лимфомой
взрослых (ТЛЛВ), при котором лейкозные клет-
ки постоянно экспрессируют ос-цепь IL-2R
(CD25), определено, что антитела к CD25 (извест-
ные как анти-Тас-антитела) терапевтически эф-
фективны примерно у трети пациентов.
Лечение антителами к CD25 также применя-
ют как компонент иммуносупрессивной терапии
при лечении пациентов, перенесших органную
трансплантацию. Обоснованием такого лечения
является хроническая активация аллореактив-
ных Т-клеток, вызванная их взаимодействием с
РЕЗЮМЕ
185
аллоантигенами, экспрессируемыми на переса-
женной ткани. Такая активация приводит к экс-
прессии CD25 этими Т-клетками. Терапия анти-
телами к CD25 часто используется в комбина-
ции с другими иммуносупрессивными препа-
ратами для подавления иммунного ответа орга-
низма-хозяина на аллоантигены, таким образом
снижая вероятность отторжения трансплантата.
В гл. 18 приведена дополнительная информация,
касающаяся иммунных препаратов, используемых
для лечения больных после органных трансплан-
таций.
Лечение астмы и аллергических
заболеваний
Современное понимание функциональных свойств
Тн2-клеток и роли, которую играют выделяемые
ими специфические цитокины (например, IL-4 и
IL-13) в продукции IgE, предполагает, что препа-
раты, направленные против этих цитокинов и их
рецепторов, могут оказаться эффективными при
лечении астмы и аллергических заболеваний (см
гл. 14). Учитывая перекрестно-антагонистическое
действие Тн1- и Тн2-клеток, считается возмож-
ным сместить продукцию антител от класса IgE
при ответе на данный аллерген, используя стра-
тегии, позволяющие избирательно подавлять не-
желательную субпопуляцию Тн2-клеток. В насто-
ящее время такой подход является эксперимен-
тальным, и его интенсивно исследуют на живот-
ных. Многообещающие результаты получены в
ходе клинических исследований, в которых ис-
пользовалась похожая стратегия, направленная не-
посредственно против IL-4, основного цитокина,
ответственного за обеспечение переключения изо-
типов синтезируемых антител В-клетками на IgE
(см. гл. 10 и 14). Было показано, что введение
антител, специфичных к IL-4, значительно сни-
жает продукцию этого цитокина у мышей. Дру-
гой схожий подход в лечении астмы и аллерги-
ческих заболеваний заключается в использовании
растворимых рецепторов к IL-4; по нему также
опубликованы многообещающие, но предвари-
тельные результаты. Нельзя недооценивать воз-
можность клинического исспользования резуль-
татов таких исследований, поскольку по всему
миру огромное количество людей страдает раз-
личными аллергическими заболеваниями. В гл. 14
обсуждаются другие режимы терапии на основе
цитокинов, используемые у больных астмой и
аллергическими заболеваниями.
РЕЗЮМЕ
1. Цитокины — это низкомолекулярные антиген-
неспецифичные белки, которые являются посредника-
ми в межклеточных взаимодействиях, включая имму-
нитет, воспаление и гемопоэтическую систему.
2. Цитокины обладают свойствами плейотропно-
сти и избыточности; между различными цитокинами
часто обнаруживается антагонизм или синергизм.
3. Цитокины — короткоживущие молекулы. Они
могут действовать местно на ту же самую клетку, ко-
торая их выделила (аутокринно), или на другие близко
расположенные клетки (паракринно). Также эти моле-
кулы могут оказывать системное действие, как гормо-
ны (эндокринно).
4. У цитокинов широкий спектр функциональной
активности. Это можно проиллюстрировать их спо-
собностями: 1) регулировать специфический иммун-
ный ответ; 2) облегчать ответ в системе врожденного
иммунитета; 3) активировать воспалительный ответ;
4) влиять на подвижность лейкоцитов; 5) стимулиро-
вать гемопоэз.
5- Субпопуляции СО4+-Тн-клеток различаются по
цитокинам, которые они продуцируют. ТН1-клетки сек-
ретируют IL-2 и IFNy (а также некоторые другие цито-
кины), но никогда IL-4 или IL-5. Цитокины, которые
выделяют эти клетки, активируют другие Т-лимфоци-
ты, NK-клетки и макрофаги (клеточно-опосредован-
ный иммунный ответ). Напротив, Тн2-клетки секрети-
руют IL-4 и IL-5 (а также некоторые другие цитокины),
но никогда IL-2 или IFNy. Они преимущественно влия-
ют на синтез антител.
6. Цитокины могут воздействовать только на клет-
ки-мишени, которые экспрессируют к ним рецепторы.
Экспрессия цитокиновых рецепторов интенсивно ре-
гулируется, поэтому покоящиеся клетки или не экс-
прессируют данный рецептор, или экспрессируют
низко- или среднеаффинную версии этого рецептора.
Увеличение уровня экспрессии цитокинового рецеп-
тора или начало экспрессии высокоаффинной формы
данного рецептора предрасполагает клетку-мишень к
ответу на цитокин.
7, Общая у-цепь является субъединицей цитокино-
вого рецептора, используемой для передачи сигнала
внутрь клетки от рецепторов разных цитокинов, в том
числе IL-2, IL-4, IL-7, IL-9 и IL-15. Эта структурная осо-
бенность помогает объяснить наличие перекрестных
функций и антагонизм, которые часто демонстрируют
некоторые цитокины.
8. При связывании цитокиновых рецепторов с ци-
токинами генерируются внутриклеточные сигналы, ко-
торые приводят к продукции активных факторов
транскрипции и, следовательно, экспрессии генов.
Связывание цитокина со своим клеточным рецепто-
ром часто приводит к димеризации или полимериза-
ции рецепторных полипептидов на поверхности клет-
ки и открывает возможность связывания JAK-киназ с
цитоплазматическим доменом рецептора. Эта ассоци-
ация активирует киназы и вызывает фосфорилирова-
ние тирозиновых остатков в молекулах STAT. После
фосфорилирования транскрипционные факторы STAT
образуют димеры, а затем перемещаются из цито-
плазмы в ядро, где связываются с участками усиле-
ния экспрессии генов, индуцируемых этим цитоки-
ном. Супрессия цитокиновых сигнальных белков
уменьшает распространение сигнала и помогает пре-
рывать действие цитокинов.
9. Избыточная или недостаточная экспрессия ци-
токинов или цитокиновых рецепторов является причи-
ной некоторых заболеваний, в том числе бактериаль-
ного токсического шока, бактериального сепсиса, не-
186
ГЛАВА 11. ЦИТОКИНЫ
которых видов лимфоидных и миелоидных лейкозов и
аутоиммунных заболеваний.
10. Лекарственные препараты на основе цитоки-
нов оказались перспективными при некоторых имму-
нодефицитных состояниях, профилактике отторжения
трансплантата и лечении некоторых онкологических
заболеваний. Наиболее удачными примерами исполь-
зования препаратов на основе цитокинов могут слу-
жить: 1) применение гемопоэтических факторов роста
(Г-КСФ, ГМ-КСФ) для борьбы с клеточными цитопе-
ниями, развившимися в результате химио- или луче-
вой терапии; 2) блокирование IL-2R, которое помогает
предотвратить отторжение трансплантата; 3) исполь-
зование IL-2 для образования ЛАК (NK- и цитотокси-
ческих Т-клеток), применяемых для лечения пациен-
тов с некоторыми онкологическими заболеваниями.
ТЕСТЫ
Выберите ОДИН НАИБОЛЕЕ ПРАВИЛЬНЫЙ ответ
на каждый тест.
1. Начавшийся Тн1- или Тн2-ответ поддерживают
цитокины, которые угнетают ответ противоположного
типа. Если активирован гуморальный ответ, его будут
поддерживать:
a) IL-4 и IL-10;
б) IL-4 и IL-5;
в) IL-4 и TNFp;
г) IL-1 и IL-6.
2. У пациента с острым ревматоидным артритом
отмечаются системные проявления: субфебрилитет,
недомогание, утренняя скованность и слабость. Наи-
более вероятно, что за развитие этих симптомов от-
ветственны:
а) ревматоидный фактор;
б) TNF и IL-1;
в) IL-4 и IL-9;
г) компоненты системы комплемента 1—9;
д) поврежденный у-глобулин.
3. После того как активированные презентацией
антигена АПК антигенспецифичные Т-клетки секрети-
руют IL-2, близко расположенные наивные антиген-
неспецифичные Т-клетки:
а) пролиферируют благодаря воздействию IL-2;
б) часто подвергаются апоптозу;
в) начинают экспрессировать IL-2R;
г) начинают секретировать цитокины согласно их
Тн-фенотипу;
д) ничего не происходит.
4. Провоспалительные цитокины IL-1, IL-6, TNFa:
а) вызывают увеличение сосудистой проницаемости;
б) совместно с хемокинами способствуют мигра-
ции воспалительных клеток в очаг инфекции;
в) активируют острофазные реакции;
г) обладают свойствами эндогенных пирогенов;
д) все перечисленное.
5. В завершении воспалительных реакций уча-
ствуют:
a) IL-2;
б) IL-4;
в) TGFp;
г) IFNa;
Е) IL-3.
6. Приняв отсутствие других компенсаторных ме-
ханизмов замены функции IL-8, укажите, какие свой-
ства будут сохранены в качестве функциональной ак-
тивности у линий мышей, «нокаутных» по IL-8:
а) активация нейтрофилов;
б) привлечение нейтрофилов в участок поврежден-
ной ткани;
в) заживление раны;
г) экстравазация нейтрофилов;
д) снижение продукции цитокинов ТН1-клетками.
7. Суперантигены вызывают взрыв продукции ци-
токинов Т-клетками вследствие их способности пере-
крестно связывать:
а) Vp-область Т-клеточного рецептора с молекула-
ми МНС II класса на АПК;
б) \/а-область Т-клеточного рецептора с молекула-
ми МНС II класса на АПК;
в) Т-клеточный рецептор и CD3;
г) многочисленные цитокиновые рецепторы в
большой популяции Т-клеток;
Д) CD3.
СИТУАЦИОННАЯ ЗАДАЧА
В отделение скорой помощи принят мальчик 7 лет
с инфицированной раной на ноге. Со слов матери у
ребенка последние 12 ч высокая температура и диа-
рея В течение последних 2 ч он стал сонливым, не
способен стоять и сильно дезориентирован. Врач об-
наружил, что у мальчика угрожающе низкое кровяное
давление, и предположил, что он находится в состоя-
нии бактериального септического шока, вызванного
раневой инфекцией. Обсудите этиологию бактериаль-
ного шока, а также роль цитокинов в патогенезе этого
заболевания. Какие терапевтические методы могут
применяться с использованием моноклональных ан-
тител или других биологических препаратов для лече-
ния этого заболевания в будущем?
ОТВЕТЫ НА ТЕСТЫ
1 — а. Гуморальные иммунные реакции вызывают
цитокины, продуцируемые Тн2-клетками, которые
среди прочих цитокинов продуцируют IL-4 и IL-10.
Интерлейкин-4 активирует В-клетки совместно с IL-5,
который также продуцируется Тн2-клетками. Интер-
лейкин-10 угнетает ТН1-клетки, таким образом инги-
бируя активацию макрофагов.
2 — б. У пациентов с ревматоидным артритом на-
блюдаются высокие уровни провоспалительных цито-
кинов. Комбинация TNF и IL-1 играет ключевую роль в
развитии боли, отека, неподвижности суставов и дру-
гих симптомов этого заболевания.
3 — д. Цитокины, секретируемые антигенактиви-
рованными Т-клетками, регулируют только активность
других клеток, вовлекаемых в этот иммунный ответ
путем связывания с цитокиновыми рецепторами (на-
пример, высокоаффинный IL-2R), экспрессируемыми
этими клетками. Синтез таких цитокиновых рецеп-
торов начинается только на антигенактивированных
ТЕСТЫ
187
Т-клетках, которые несут соответствующий Т-клеточ-
ный рецептор для этого антигена; они не появляются
на близко расположенных антигеннеспецифичных
Т-клетках. Таким образом, эти клетки не будут активи-
рованы IL-2.
4 - д.
5 — в. Из перечисленных цитокинов в завершении
воспалительных реакций важную роль играет TGFp,
активируя накопление и пролиферацию фибробластов
и депонирование белков внеклеточного матрикса, не-
обходимых для восстановления ткани.
6 — д. Интерлейкин-8 не участвует в регуляции
продукции цитокинов ТН1-клетками — это биологи-
ческое свойство описано для IL-10, продуцируемого
Тн2-клетками. Таким образом, у мышей, «нокаутных»
по гену IL-8, функциональная целостность ТН1 будет
сохранена. Этот цитокин вызывает хемотаксис и акти-
вацию нейтрофилов и их адгезию к эндотелию сосу-
дов, а также их выход из сосудистого русла (экстрава-
зацию). Если ген IL-8 отсутствует, эти функции будут
утеряны. Поскольку эти свойства играют важную роль
в заживлении ран, у таких мышей будет предопреде-
лено нарушение данного феномена.
7 — а. Суперантигены одновременно связываются
с молекулами МНС II класса и Vp-доменом Т-клеточ-
ного рецептора, активируя все Т-клетки, обладающие
этим доменом. Таким образом они активируют боль-
шое количество Т-клеток (5 — 25%) независимо от их
антигенной специфичности, вызывая высвобождение
большого количества цитокинов.
ОТВЕТ НА СИТУАЦИОННУЮ ЗАДАЧУ
Бактериальный септический шок — это состояние,
которое может развиться через несколько часов пос-
ле инфицирования определенными грамотрицатель-
ными бактериями, включая Escherichia coli, Klebsiella
pneumonia, Pseudomonas aerugenosa, Enterobacter
aerogenes и Neisseria meningitidis К характерным
симптомам относят: падение кровяного давления, ли-
хорадку, диарею и диссеминированное тромбообра-
зование в разных органах. Это состояние часто при-
водит к летальному исходу. Шок развивается, когда
эндотоксины бактериальной клеточной стенки стиму-
лируют гиперпродукцию макрофагами IL-1 и TNFa.
Терапевтические подходы, в которых используются
моноклональные антитела, способны нейтрализовы-
вать эффекты IL-1 и TNFa; антагонисты, такие как ан-
тагонист рецептора IL-1 (IL-1 Ra), могут быть перспек-
тивны в лечении бактериального септического шока у
людей.
Глава
ТОЛЕРАНТНОСТЬ И АУТОИММУНИТЕТ
• ВВЕДЕНИЕ
Функцией иммунной системы является защита
организма от проникновения чужеродных орга-
низмов. Однако этот защитный ответ может на-
нести вред организму, если он направлен на соб-
ственные антигены, часто называемые аутоанти-
генами. Поэтому иммунная система выработала
ряд средств проверки и противодействия, кото-
рые помогают ей отличать безопасные сигналы
от угрожающих и реагировать на чужеродные, а не
аутологичные антигены. Для этого как врожден-
ный, так и адаптивный ответы претерпели опреде-
ленную эволюцию. В данной главе основное вни-
мание уделяется адаптивным иммунным ответам,
составляющим основу толерантности к аутоанти-
генам
Один из самых ранних экспериментов, проде-
монстрировавших толерантность, провел Р. Оуене
(/?. Owens) в 1945 г. Он показал, что двуяйцевые
телята-близнецы, имевшие в процессе развития в
матке общую систему кровоснабжения, были во
взрослом возрасте взаимно толерантны к кожным
трансплантатам, взятым друг у друга. Таким об-
разом, к «чужеродным» антигенам, экспрессиру-
емым клетками второго близнеца, обеспечивает-
ся длительная толерантность. Эти наблюдения
создали базу для классических экспериментов,
проведенных П. Медаваром (Р. Medawar) с сотруд-
никами в 1950-х гг. и принесших ему Нобелев-
скую премию. Он был первым, кто показал, что
взрослые мыши линии А отторгают кожные транс-
плантаты, взятые от мышей линии Б, отлича-
ющихся по экспрессии молекул МНС Однако
если мышам линии А в течение 24 ч после рожде-
ния вводились клетки селезенки мышей линии Б,
то после достижения зрелости они не отторгали
кожные трансплантаты, взятые от доноров ли-
нии Б. Этот феномен называется неонатальной
толерантностью. Его основой является то, что
мышь-реципиент становится химерной, имеющей
Т-клетки и АПК, развившиеся из собственных и
донорских клеток селезенки. Зрелые Т-клетки ста-
новятся толерантными к антигенам МНС донор-
ских клеток, поскольку в негативной селекции раз-
вивающихся Т-клеток этих мышей принимают
участие АПК, развившиеся из донорских клеток.
• ЦЕНТРАЛЬНАЯ ТОЛЕРАНТНОСТЬ
Толерантностью называется отсутствие ответа
на антиген. Оно наблюдается, когда взаимодей-
ствие антигена с антигенспецифичными лимфо-
цитами приводит к появлению сигнала, который
либо не активирует, либо инактивирует клетку
Только клетки с антигенспецифичными рецепто-
рами (лимфоциты) могут быть вовлечены в фор-
мирование толерантности. После такого взаимо-
действия, вызывающего толерантность, клетки или
организм, встретившиеся с антигеном, считаются
толерантными. Толерантность, индуцированная на
ранних стадиях развития лимфоцита, называется
центральной толерантностью, а возникшая у зре-
лых лимфоцитов — периферической. Центральная
толерантность развивается в первичных лимфо-
идных органах, а именно, в костном мозге у В-
клеток и в тимусе у Т-клеток.
Процесс возникновения различий среди В-
(BCR) и Т-клеточных рецепторов (TCR) неизбеж-
но приводит к появлению рецепторов, способных
распознавать аутоантигены. В- и Т-клетки с ре-
цепторами к аутоантигенам называются ауторе-
активными. Возникающие аутореактивные В-клет-
ки обычно становятся толерантными в месте сво-
его возникновения — костном мозге, а возника-
ющие аутореактивные Т-клетки превращаются в
толерантные в тимусе в процессе негативной се-
ЦЕНТРАЛЬНАЯ ТОЛЕРАНТНОСТЬ
189
лекции (см. гл. 8). Благодаря негативной селекции
большинство В- и Т-клеток, выходящих на пери-
ферию, реагируют только с чужеродными анти-
генами.
Механизмы обеспечения
аутотолерантности
Иммунная система выработала несколько меха-
низмов обеспечения центральной толерантности
в популяциях В- и Т-клеток. Эти механизмы вклю-
чают анергию, делению и клональное игнориро-
вание. Кроме того, было показано, что у наивных
В-клеток важным механизмом обеспечения толе-
рантности является процесс редактирования ре-
цептора. Далее будет показано, какие механизмы
и при каких условиях используются.
Анергия, редактирование рецепторов,
делеция и клональное игнорирование
Анергией называется функциональная инактива-
ция клеток, приводящая к отсутствию ответа при
контакте с аутоантигеном. Анергичные В-клетки
не могут активироваться к пролиферации и диф-
ференцировке в клетки, секретирующие антите-
ла, после взаимодействия их BCR с антигеном.
Подобно этому связывание TCR энергичных Т-кле-
ток не активирует их для пролиферации и диф-
ференцировки в функциональные Т-клетки, про-
дуцирующие цитокины и рецепторы цитокинов.
Свидетельство наличия анергии у В-клеток впер-
вые получили Дж.Дж. Носсал (G.J.Nossal) и
Б.Л. Пайк (В. L. Pike) в 1980 г. Они продемон-
стрировали, что когда незрелые IgM^B-клетки
встречались с антителами, специфичными для
IgM, которые перекрестно связывали IgM, клет-
ки теряли способность к дифференцировке и сек-
реции антитела. Позднее В-клеточная анергия
была смоделирована с помощью системы транс-
генных мышей, у которых В-клетки, специфич-
ные к аутореактивным В-лимфоцитам, формиро-
вались после введения реаранжированных генов
иммуноглобулина в зародышевую линию мыши.
В конце 1960-х гг. П. А. Бретчер (Р. A. Bretscher)
и М. Кон (M.Cohn) высказали предположение, что
В-клеткам, специфичным к Т-зависимым анти-
генам, нужно для активации два сигнала: первый
обеспечивается антигеном, а второй — Т-клетка-
ми. Исследователи также предположили, что при
отсутствии второго сигнала В-клетки будут при-
водиться в состояние толерантности. Теперь из-
вестно, что этот второй сигнал может быть обес-
печен взаимодействием лиганда CD40 (CD40L) на
поверхности Т-клетки с CD40, экспрессирован-
ным на В-клетке. Опыты с использованием моде-
лей трансгенных мышей подтвердили, что В-клет-
ки при контакте с аутоантигеном в отсутствие
помощи со стороны Т-клетки могут становиться
энергичными (рис. 12.1). Анергичные В-клетки не
могут успешно соперничать с В-клетками, спе-
цифичными к чужеродному антигену, за то, что-
бы попасть в В-клеточные фолликулы селезенки
и лимфатических узлов. Поэтому аутореактивные
В-клетки остаются вне фолликулов и впоследствии
погибают посредством апоптоза.
Т-клеткам также требуется для активации два
сигнала (см. гл. Ю). Первый сигнал обеспечива-
ется комплексом МНС —пептид. Второй сигнал
вызывается взаимодействием между костимулиру-
ющими молекулами, экспрессируемыми специали-
зированными АПК, такими как зрелые дендрит-
ные клетки и В-клетки, с их лигандами на Т-клет-
ках. Основной костимулирующий сигнал обеспе-
чивается взаимодействием В7-1 (CD80) и/или В7-2
(CD86), экспрессированными на АПК, с CD28,
экспрессированным на Т-клетках. Поступление
первого сигнала ведет к индукции ряда транскрип-
ционных факторов, один из которых связывается
с промоторным участком гена IL-2, обеспечивая
его транскрипцию в Т-клетке. В результате взаи-
модействия В7 с CD28 период полураспада иРНК
IL-2 увеличивается и синтезируется белок IL-2.
Если первый сигнал не сопровождается костиму-
лируюшим взаимодействием В7 —CD28, иРНК
IL-2 быстро разрушается и белок IL-2 не обра-
зуется. Таким образом, в отсутствие костимуля-
ции, что происходит, когда клетки, не экспрес-
сирующие костимулирующие молекулы, представ-
ляют антиген, процесс активации прекращается
и Т-клетки становятся энергичными (рис. 12.2).
Редактирование рецептора представляет собой
процесс, при котором реаранжированный вариа-
бельный генный сегмент в области Н- или L-цепи
иммуноглобулина подвергается вторичной ре-
аранжировке: его заменяет расположенная далее
• Рис. 12.1. Отсутствие костимуляции ведет к анергии В-кле-
ток. Для активации В-клеток Т-зависимым антигеном не-
обходимы два сигнала. Первый сигнал обеспечивается при
контакте с антигеном и перекрестном связывании BCR Вто-
рой сигнал обеспечивается взаимодействием CD40L, эксп-
рессированным на Т-клетке, с CD40 на В-клетке. При отсут-
ствии этого второго костимулирующего сигнала В-клетка не
активируется и становится энергичной
190
ГЛАВА 12. ТОЛЕРАНТНОСТЬ И АУТОИММУНИТЕТ
Жизненный цикл--------------►
• Рис. 12.2. Распознавание антигена в отсутствие кости-
муляции ведет к анергии Т-клетки. Необходимы два сиг
нала для активации Т-клетки и секреции ею IL-2. Первый
сигнал обеспечивается распознаванием пептида плюс
МНС. Второй сигнал обеспечивается взаимодействием ко-
стимулирующей молекулы (В7), экспрессированной на по-
верхности АПК (зрелая дендритная клетка), с рецептором
(CD28) на поверхности Т-клетки. Если Т-клетка получает
первый сигнал при отсутствии второго, она становится
энергичной
V-область, что приводит к изменению (редакции)
специфичности рецептора (см. гл. 6 и 7). Этому
предшествует реэкспрессия генов RAG-1 и RAG-2.
Теоретически обосновано, что процесс редакти-
рования рецептора появился в качестве механиз-
ма для предотвращения аутореактивности, по-
скольку в результате получаются BCR или TCR,
обладающие другой специфичностью, часто с от-
сутствием аутореактивности. Впервые редактиро-
вание В-клеточного рецептора подтвердили в на-
блюдениях за костным мозгом у мышей, транс-
Зрелая
дендритная МНС
клетка ц класса
11 KJldVVd
Т-клетка
Секреция IL-2
Клетка МНС
ткани II класса
Т-клетка
Анергия
Т-клетки
• Рис. 12.3. Цикл жизни аутореактивных В-клеток напря-
мую связан с выраженностью перекрестного связывания
рецептора, которое зависит от авидности взаимодействия
между рецептором иммуноглобулина и аутоантигеном
генных в отношении антител к двухцепочечной
ДНК (дцДНК) и по антителам к антигенам МНС
1 класса. Редактирование BCR также отмечалось
в незрелых В-клетках селезенки. Позднее редак-
тирование рецептора наблюдали в Уа-локусе дваж-
ды позитивной Т-клетки, проходящей негативную
селекцию в тимусе.
Делеция представляет собой механизм, с по-
мощью которого аутореактивные В- и Т-клетки
удаляются из репертуара. Основным механизмом
негативной селекции Т- и В-клеток, развива-
ющихся соответственно в тимусе и костном мозге,
является апоптоз (программируемая смерть клеток).
Было показано, что дважды позитивные Т-клет-
ки, которые связываются с высокой аффинностью
с антигенами плюс МНС, быстро удаляются (де-
леция). То же самое происходит и с незрелыми
В-клетками, связывающими с высокой аффинно-
стью аутоантигены в костном мозге.
Клональное игнорирование — это состояние, при
котором аутореактивные лимфоциты не подвер-
гаются анергии, не удаляются и их рецептор не
редактируется. Вместо этого они сосуществуют с
антигеном, оставаясь в неактивном состоянии, что
связано с низкой аффинностью их рецептора к
аутоантигену или низкой концентрацией антиге-
на. В отличие от анергичных клеток клоны кле-
ток, игнорирующих антиген, не обладают врож-
денной ареактивностью к данному антигену. В опре-
деленных условиях они могут быть активирова-
ны, поэтому их присутствие представляет опре-
деленную угрозу для организма. Например, если
В-клетки с низкой аффинностью к аутоантигену
претерпевают соматическую мутацию и приобре-
тают к нему более высокую аффинность, они мо-
гут впоследствии активироваться этим аутоанти-
геном. Кроме того, при клональном игнорирова-
нии Т-клетки, сосуществующие с собственным
пептидом в низкой концентрации, могут быть
активированы, если концентрация этого пептида
увеличится.
Незрелые В- и Т-клетки легче становятся то-
лерантными, чем зрелые лимфоциты. Сила, или
авидность, взаимодействия BCR или TCR с ауто-
антигеном определяет, будет ли аутореактивная
клетка подвергнута анергии или делеции. У В-кле-
ток авидность зависит от аффинности взаимодей-
ствия между иммуноглобулиновым рецептором и
его антигеном, плотности расположения рецеп-
торов на поверхности В-клетки и природы и кон-
центрации аутоантигена. Чем выше аффинность
антитела к своему антигену и чем больше имму-
ноглобулиновых рецепторов экспрессируется на
В-клеточной мембране, тем больше авидность
взаимодействия антиген — антитело. Это напря-
мую коррелирует с выраженностью перекрест-
ного связывания иммуноглобулиновых рецепто-
ров. В-клетки с высокой авидностью к аутоанти-
гену подвергаются делеции, а с умеренной авидно-
стью — анергии (рис. 12.3). В-клетки со слабой
авидностью к аутоантигену вовлекаются в клональ-
ВЗАИМОДЕЙСТВИЕ Fas-FasL
191
ное игнорирование. Природа аутоантигена опре-
деляет его способность индуцировать перекрест-
ное связывание BCR. Например, мультивалент-
ные антигены, прикрепленные к мембране, опо-
средуют более выраженное перекрестное связы-
вание рецептора, чем моновалентные или раство-
римые антигены. В-клетки, встречающиеся с ауто-
антигеном, связанным с мембраной, будут скорее
подвергнуты делеции, а встречающиеся с раство-
римым антигеном — анергии.
На селекцию Т-клеток в тимусе влияет авид-
ность, определяемая аффинностью TCR относи-
тельно комплекса пептид —МНС, уровнем пред-
ставительства TCR на поверхности Т-клетки и мо-
лекул МНС, экспрессированных на поверхности
АПК. Все Т-клетки, распознающие комплекс пеп-
тид—МНС, независимо от своей авидности про-
ходят позитивную селекцию. Т-клетки с высокой
авидностью относительно комплекса пептид —
МНС проходят отрицательную селекцию, в ходе
которой они либо удаляются, либо происходит ре-
дактирование их рецептора.
Наконец, микросреда, в которой аутореактив-
ный лимфоцит встречается с аутоантигеном, ве-
роятно, тоже влияет на судьбу клетки. Недавние
исследования позволили предположить, что дру-
гие клетки, которые вступают в контакт с ауторе-
активными В-клетками, могут давать сигналы,
определяющие, будет ли клетка удалена или под-
вергнется редактированию. После того как уда-
лось выделить популяцию клеток стромы костно-
го мозга Thy lduH, было показано, что эти клетки
защищают незрелые аутореактивные В-клетки от
гибели посредством апоптоза при перекрестном
связывании BCR аутоантигеном. Клетки Thy ldul1
характеризуются экспрессией дополнительного
маркера, который также обнаруживается на NK-
клетках. Эти клетки индуцируют реэкспрессию
генов RAG, позволяя аутореактивным В-клеткам
проходить редактирование рецепторов. Истоще-
ние запасов этих стромальных клеток костного
мозга приводит к тому, что большая часть незре-
лых аутореактивных В-клеток подвергается деле-
ции, а не редактированию рецептора. Исследова-
ния тимуса дали основания предположить, что
кортикальные эпителиальные клетки, презенти-
рующие комплекс пептид — МНС для дважды по-
зитивных тимоцитов, скорее способствуют редак-
тированию рецепторов, чем апоптозу; наоборот,
презентация комплекса пептид —МНС АПК ко-
стномозгового происхождения скорее способствует
апоптозу. Это можно объяснить тем, что корти-
кальные эпителиальные клетки не дают сигналов,
необходимых для апоптоза тимоцитов.
• ПЕРИФЕРИЧЕСКАЯ ТОЛЕРАНТНОСТЬ
Иногда аутореактивные В- и Т-клетки избегают
негативной селекции и поступают на периферию.
Кроме того, В-клетки претерпевают там сомати-
ческие мутации и иногда эти мутации приводят к
приобретению аутореактивной специфичности.
Поэтому периферическая толерантность возник-
ла как страховочная система для обнаружения
аутореактивных В- и Т-клеток, которые укрылись
на периферии или возникли там. Механизмы
периферической толерантности включают не толь-
ко анергию и делецию, но и индуцированную
активацией смерть клетки, а также индукцию ре-
гуляторных Т-клеток. Хотя и было показано, что
редактирование рецепторов происходит и на пе-
риферии, до сих пор не ясно, осуществляется ли
оно для избежания аутореактивности.
Основным механизмом индукции отсутствия
ответа на аутоантиген, который встречается на
периферии, считается анергия Т-клеток. Клетки
из тканей поджелудочной железы, почки, печени
и других органов в норме не экспрессируют ко-
стимулирующие молекулы. Таким образом, анти-
гены, презентируемые этими клетками, скорее
индуцируют анергию, чем приводят к активации.
Точно так же у В-клеток, встречающихся с анти-
генами на периферии, но не имеющих поддерж-
ки Т-клеток, будет индуцироваться переход в со-
стояние анергии. Деления также встречается на
периферии.
* ВЗАИМОДЕЙСТВИЕ Fas-FasL
Считается, что решающую роль в удалении ауто-
реактивных В- и Т-клеток играет Fas-опосредо-
ванный апоптоз. Fas является мономером, экс-
прессируемым активированными лимфоцитами,
и членом семейства рецепторов фактора некроза
опухоли (TNF). Связывание Fas-рецептора Fas-
лигандом (FasL), членом семейства мембранных
белков TNF, дает сигнал к апоптозу клеткам, экс-
прессирующим Fas. Лиганд Fas экспрессируется
клетками нескольких типов, такими как активи-
рованные Т-клетки и некоторые эпителиальные
клетки. Он является тримером, поэтому когда FasL
связывается с Fas, тот становится тримерным. Это
приводит к активации домена смерти у Fas, кото-
рый взаимодействует с доменами смерти ряда
цитозольных адаптерных белков, основной харак-
теристикой которых является наличие Fas-acco-
циированного домена смерти (FADD). Последний,
в свою очередь, включает активацию ряда цисте-
иновых протеаз, называемых каспазами, что ве-
дет к апоптозу клетки (рис. 12.4).
Важность взаимодействий Fas — FasL первона-
чально была показана при исследовании линий
мышей с аутоиммунными расстройствами, при-
водящими к накоплению в селезенке и лимфати-
ческих узлах огромного количества Т-клеток. Было
показано, что дефекты у мышей этих линий, на-
зываемых 1рг (при лимфопролиферации) и gid (при
генерализованных лимфопролиферативных забо-
леваниях), являются следствием мутаций в Fas и
FasL соответственно. Эти мутации предотвраща-
192
ГЛАВА 12. ТОЛЕРАНТНОСТЬ И АУТОИММУНИТЕТ
CD95(Fas)
Домен
смерти
Каспаза 8
Т-клетка
TCR
FADD
Фрагментация
ДНК
Каспаза 3
Апоптоз
Т-клетки
• Рис. 12.4. Апоптоз Т-клеток, опосредованный Fas. Свя-
зывание FasL приводит к тримеризации Fas В результате
активируется домен смерти в Fas, который затем взаимо-
действует с доменом смерти FADD. Это индуцирует акти-
вацию каскада капсаз, что ведет к апоптозу клетки, эксп-
рессирующей Fas
ют у мышей делецию аутореактивных Т-клеток и
отменяют уменьшение их Т-клеточной популяции.
Мутации в гене Fas описаны и у человека. У лиц
с таким дефектом имеется аутоиммунное заболе-
вание — аутоиммунный лимфопролиферативный
синдром (АЛПС), признаки которого сходны с
симптомами у мышей с описанными мутациями.
Было показано, что апоптоз, опосредованный вза-
имодействием Fas —FasL, является механизмом
удаления аутореактивных Т-клеток на периферии,
а недавние исследования указывают на то, что он
также может быть вовлечен в негативную селек-
цию тимоцитов Анергичные Т-клетки также чув-
ствительны к Fas-опосредованному апоптозу.
РЕГУЛЯТОРНЫЕ/СУПРЕССОРНЫЕ
Т-КЛЕТКИ
Эксперименты начала 1970-х гг. показали, что
специализированная популяция Т-клеток подав-
ляет реакции со стороны других лимфоцитов.
Однако невозможность выделения и клонирова-
ния популяции супрессорных Т-клеток вызвала
сомнения в реальности ее существования. Ин-
терес к Т-супрессорным клеткам возродился в
1990-х гг., когда была выявлена популяция CD4+-
Т-клеток, обладающих способностью подавлять
функцию Т-клеток. Было показано, что эти суп-
рессорные, или регуляторные, как их часто назы-
вают, Т-клетки (Treg) экспрессируют CD25, ос-цепь
рецептора IL-2, поэтому обладают фенотипом
CD4*CD25+. Экспрессия CD25 характерна не
только для супрессорных Т-клеток, она также на-
блюдается у эффекторных СЭ4+-Т-клеток. Это
затрудняет выделение чистой субпопуляпии суп-
рессорных Т-клеток для исследования их функ-
ций.
Супрессорные СВ4+СВ25+-Т-клетки составля-
ют примерно 10% периферических СВ4+-клеток.
Когда бестимусным «голым» мышам (пи/пи), у ко-
торых имеется дефицит по всем Т-клеткам (см.
гл. 5), был восполнен недостаток СО4+-Т-клеток,
но без СО4 СГ>25+-Т-супрессорной популяции,
у них развились такие аутоиммунные заболева-
ния, как тиреоидит, гастрит, инсулит и гломеру-
лонефрит. Однако эти заболевания могли быть
предотвращены при введении этим мышам
CD4+CD25+-T-cynpeccopHbix клеток параллельно с
СО4+СО25-Т-клетками. Так была продемонстри-
рована роль СО25+-Т-клеток в обеспечении толе-
рантности. Было показано также, что CD4+CD25+-
Т-супрессорные клетки препятствуют развитию
реакции «Трансплантат против хозяина» (см.
гл. 18), индуцируемой СО4+СО25“-Т-клетками,
а также диабета у мышей, генетически предрас-
положенных к этому заболеванию (нетучные боль-
ные диабетом мыши (NOD)).
Первоначально супрессорные CD4+CD25+-T-
клетки были выявлены у мыши, но позднее их
обнаружили и у человека. Оказалось, что они про-
исходят из отдельной линии СЭ4+-Т-клеток, ото-
бранных в период развития Т-клеток в тимусе.
Они или не продуцируют IL-2, или продуцируют его
в очень небольшом количестве. Некоторые из них
могут продуцировать иммуносупрессивный цито-
кин — трансформирующий фактор роста (TGFP),
но и он не является необходимым для проявле-
ния их супрессорной активности. Такие клетки
экспрессируют хемокиновые рецепторы CCR4 и
CCR8, которые помогают им в миграции в воспа-
ленные органы и лимфатические узлы, куда про-
исходит отток лимфы. Они изначально экспрес-
сируют CTLA-4, хотя значение этого факта еще
не определено.
Для активации СП4'СО25+-Т-супрессорным
клеткам требуется участие специфических TCR,
но пролиферации в ответ на TCR-опосредован-
ную стимуляцию не происходит. После актива-
ции их супрессорная функция является антиген-
неспецифической, для нее необходим контакт с Т-
клетками, отвечающими на антиген (рис. 12.5).
Они ингибируют пролиферацию и активацию и
CD4+-, и СD8+-T-клеток и предотвращают транс-
крипцию IL-2 в реактивных Т-клетках.
Супрессорные СГ)4‘СГ>25+-Т-клстки могут
иметь клиническое значение. Увеличение коли-
чества этих клеток может быть важным для лече-
ния аутоиммунных заболеваний и подавления
реакции отторжения аллотрансплантата. Сниже-
ние численности этих Т-клеток может усилить
иммунный ответ на противоопухолевые вакцины
и вакцины против инфекционных агентов, таких
как ВИЧ.
ОРАЛЬНАЯ ТОЛЕРАНТНОСТЬ
193
• Рис. 12.5. Т-клеточная супрессия. Регуляторная
CD4+CD25+-T-клетка индуцирует супрессию CD8+CD25“-
реактивной Т-клетки при клеточном контакте
IFNy
CD8+
CD25“
АПК
В7 CD28
4b /CD4+
W CD25”
Т-клетка
Регуляторная
Т-клетка
Супрессия
CD8+
CD25“
IFNy
Цитокиновая продукция
и подавление пролиферации
Т-клеток
Внутри СО4+-Т-клеточной субпопуляции были
выделены два других типа клеток, оказывающих
супрессорное действие. Их называют Т-регулятор-
ными клетками первого типа (Tri) и Тн3-клетка-
ми. Эти супрессорные Т-клетки оказались как
CD25 , так и CD251OW и различными по своим ци-
токиновым профилям. Tri-клетки вырабатывают
большое количество IL-10 и TGFp и опосредуют
супрессорное действие с помощью этих цитоки-
нов. Они не вырабатывают или вырабатывают в
очень малом количестве IL-2 и IL-4. У мышей
Тг1, вероятно, вовлечены в защиту кишечника от
воспалительного заболевания, а у крыс предотв-
ращают развитие аутоиммунного диабета. Наблю-
дения указывают на то, что эти Т-клетки могут
возникнуть при активации СЭ4+-Т-клеток в при-
сутствии IL-10. Тн3-клетки были выделены при
изучении оральной толерантности (см. далее). Они
отличаются отТн1- и Тн2-субпопуляций CD4+-T-
клеток. Они в основном продуцируют TGFp и ока-
зывают супрессорное действие посредством сек-
реции этого цитокина. Эти клетки также проду-
цируют различное количество IL-10 и IL-4, ко-
торые отвечают за их дифференцировку. Сходство
и различие между CD4+CD25+-, Tri- и Тн3-ре-
гуляторными/супрессорными Т-клетками и их
возможные взаимосвязи друг с другом в настоя-
щее время интенсивно изучают
♦ ОРАЛЬНАЯ ТОЛЕРАНТНОСТЬ
Оральная толерантность представляет собой от-
сутствие гуморального или клеточного иммунно-
го ответа на антигены, поступающие с пищей. Она
опосредуется Т-клетками. а механизмы ее обес-
печения зависят от дозы поступающего антигена.
Малая доза антигена индуцирует Тн3-супрессор-
ные клетки, в то время как большая индуцирует
Т-клеточную анергию или делецию. Оральная
толерантность первоначально инициируется, когда
поступивший через рот антиген встречается с лим-
фоидной тканью, ассоциированной с кишечни-
ком (GALT), включая эпителиальные клетки вор-
синок, интраэпителиальные лимфоциты, лимфо-
циты lamina propria (собственной пластинки) и
лимфоидные узелки пейеровых бляшек. Дендрит-
ные клетки являются основными АПК в GALT и,
таким образом, процессируют и презентируют
основную часть пищевых антигенов, хотя отме-
чается присутствие и других АПК, таких как мак-
рофаги, В-клетки и эпителиальные клетки При
поступлении больших доз пищевых антигенов не
все из них подвергаются расщеплению ко време-
ни, когда они достигают тонкого кишечника
Поэтому некоторые пищевые антигены всасыва-
ются в изначальном виде, поступая в общую цир-
куляторную систему. Затем антиген процессиру-
ется и презентируется периферическими АПК в
отсутствие костимулирующих взаимодействий, что
приводит к отсутствию ответа у ТН1 -клеток.
Низкодозная толерантность индуцируется ме-
стно в кишечнике. Цитокиновая среда GALT ха-
рактеризуется повышенным уровнем IL-4, IL-10
и TGFp, которые способствуют дифференциров-
ке в Тн2- и Тн3-клетки и подавляют дифферен-
цировку в ТН1-клетки. Тн3-клетки, как уже ука-
зывалось ранее, оказывают супрессорное действие
посредством секреции TGFp. Включение Тн3-кле-
ток является антигенспецифичным, однако его
супрессорное действие не антигенспецифично.
В ряде лабораторных исследований было пока-
зано, что низкие дозы пищевого антигена могут
подавлять развитие смоделированных аутоиммун-
ных заболеваний у животных. Экспериментальный
аутоиммунный энцефаломиелит (ЭАЭ) является
животной моделью рассеянного склероза. У мышей
и крыс, иммунизированных с помошью основ-
ного белка миелина или протеолипидного белка
в полном адъюванте Фрейнда, в миелиновых обо-
лочках ЦНС возникает клеточная инфильтрация,
ведущая к демиелинизации и последующему па-
раличу. Эти симптомы напоминают симптомы у
больных рассеянным склерозом. Мыши, которым
скармливали основной белок миелин в неболь-
ших дозах до того, как ввели его инъекцию, ока-
194
ГЛАВА 12. ТОЛЕРАНТНОСТЬ И АУТОИММУНИТЕТ
зались защищенными от развития ЭАЭ индуци-
рованными регуляторными Тн3-клетками. Таким
же образом прием внутрь коллагена II типа по-
давлял развитие артрита, вызванного коллагеном,
у чувствительных к нему линий грызунов, а при-
ем внутрь тиреоглобулина подавляло развитие
аутоиммунного тиреоидита у мышей.
Клинические исследования, в которых паци-
енты с аутоиммунными заболеваниями принима-
ли внутрь антигены, показали невысокую эффек-
тивность. Присутствие цитокинов и определен-
ных костимулирующих молекул может повлиять
на ответ к принимаемому внутрь антигену. Было
указано, что цитокиновая среда в кишечнике че-
ловека может отличаться от среды у мыши и спо-
собствовать ответу со стороны Тн1, а не Тн2. Эти
различия должны быть определены более тщатель-
но, прежде чем станет возможно использовать
оральную толерантность в качестве эффективно-
го средства лечения аутоиммунных заболеваний.
ИММУНОПРИВИЛЕГИРОВАННЫЕ
ОБЛАСТИ
В организме есть несколько мест, где не развива-
ется иммунный ответ на патогены, клетки опухо-
ли и гистонесовместимые тканевые транспланта-
ты. Этими участками — иммуннопривилегирован-
ными областями — являются глазные яблоки, яич-
ки, головной мозг, яичники и плацента. Наиболее
ярким примером такой области является глазное
яблоко. Например, при пересадке роговицы у че-
ловека не нужно обеспечивать совместимость или
проводить иммуносупрессивную терапию для при-
живления трансплантата. Первоначально счита-
лось, что иммунная защита в привилегированных
областях объясняется отсутствием тока лимфы и
барьером для крови, не позволяющим воспали-
тельным клеткам контактировать с антигенами в
этих местах. Однако теперь известно, что доми-
нирующую роль в обеспечении иммунной при-
вилегии играют другие факторы, такие как имму-
носупрессивные цитокины и экспрессия FasL.
Исследования показали, что FasL экспрессиру-
ется клетками некоторых типов, находящихся в
этих областях, и что взаимодействие этих кле-
ток, экспрессирующих FasL, с инфильтриру-
ющими воспалительными Т-клетками, экспресси-
рующими Fas, ведет к апоптозу последних. Было
установлено, что пигментные эпителиальные
клетки сетчатки человека и эндотелиальные клет-
ки роговицы экспрессируют FasL и индуцируют
апоптоз воспалительных Т-клеток. Успех транс-
плантаций роговицы у мышей, как было показа-
но, обусловлен экспрессией FasL клетками транс-
плантата, которые затем устраняли инфильтри-
рующие Fas+ Т-клетки, предотвращая таким об-
разом воспалительное повреждение трансплан-
тата. При пересадке роговицы от мышей, не име-
ющих функциональных FasL (мыши gid), алло-
генным реципиентам трансплантаты отторгались,
поскольку инфильтрирующие Ра8+-лимфониты не
могли быть устранены путем FasL-опосредован-
ного апоптоза.
АУТОИММУНИТЕТ
И ЗАБОЛЕВАНИЯ
Аутотолерантность является эволюционным фе-
номеном, который должен сохраняться в неизмен-
ном виде для обеспечения нормального роста,
развития и выживания видов. Если что-либо раз-
рушает целостность аутотолерантности (а имеет-
ся множество экзогенных и эндогенных факто-
ров, способных привести к этому), может возник-
нуть аутоиммунный ответ — аутоиммунитет.
Последствия возникновения аутоиммунитета
могут быть как минимальными, так и катастро-
фическими в зависимости от степени нарушения
целостности аутотолерантности. Таким образом,
следует отличать аутоиммунные реакции от ауто-
иммунных заболеваний, при которых распозна-
вание собственного антигена приводит к патоло-
гическим последствиям с возможным вовлечени-
ем антител, комплемента, иммунных комплексов
и клеточно-опосредованного иммунитета.
Далее рассмотрим наиболее распространенные
и изученные аутоиммунные заболевания с учетом
их патофизиологии. До того как мы перейдем к
рассмотрению специфических аутоиммунных за-
болеваний, следует остановиться на нескольких
моментах. Один из них касается определения ауто-
иммунных заболеваний. Все большее число забо-
леваний считаются аутоиммунными по своему
происхождению, но доказательства этому могут
быть не такими уж очевидными. Обсудим крите-
рии, используемые для отнесения заболеваний,
считавшихся идиопатическими (т.е. неизвестной
этиологии), к заболеваниям, имеющим аутоим-
мунное происхождение.
Второй момент касается причины этих заболе-
ваний. Возникновение большинства инфекцион-
ных болезней может быть приписано одному аген-
ту; некоторые генетические заболевания могут
быть обусловлены дефектом одного гена. В про-
тивоположность этому гораздо труднее определить
агент или агенты, ответственные за аутоиммун-
ное заболевание. Наиболее важной характеристи-
кой аутоиммунного заболевания является то, что
его причина многофакторна, т.е. включает как
генетический компонент, так и влияние окружа-
ющей среды.
Третьим моментом является то, что аутоиммун-
ный феномен может быть вторичным по отноше-
нию к заболеванию и определять появление зна-
чительной части патологических нарушений. Тем
не менее заболевание не должно рассматриваться
как первичное аутоиммунное.
АУТОИММУНИТЕТ И ЗАБОЛЕВАНИЯ
195
Критерии определения
аутоиммунного заболевания
Рассмотрим указания, выработанные для опреде-
ления специфических заболеваний как имеющих
аутоиммунное происхождение. При классифика-
ции используются три типа доказательств.
Наиболее четким прямым доказательством
является воспроизведение заболевания при пе-
реносе аутоантител или аутореактивных лимфо-
цитов в организм. По этическим причинам этот
критерий в отношении человека может быть при-
менен только в небольшом числе случаев. Это
может происходить, когда патогенное антитело
переносится трансплацентарно от матери плоду
при таких состояниях, как неонатальная злока-
чественная миастения, болезнь Грейвса и поли-
хондрит (воспаление хрящей). Найти метод опре-
деления патогенетического потенциала популя-
ции Т-клеток можно с помощью мышей с тяже-
лым заболеванием, вызванным комбинирован-
ным иммунодефицитом. Эти мыши с отсутстви-
ем иммунной системы могут быть использованы
в качестве «флакона с тканевой культурой» для
клеток человека. Например, лимфоциты пери-
ферической крови больных системной красной
волчанкой (СКВ), перенесенные в организм этих
лишенных иммунитета мышей, как уже было
показано, индуцируют системные иммунные по-
ражения почек мышей, напоминающие волчаноч-
ный нефрит у людей.
В связи со сложностью получения прямых до-
казательств действия аутоиммунных механизмов
могут быть использованы непрямые доказатель-
ства. Одним из способов является идентифика-
ция антигенов-мишеней у человека, выделение го-
мологичного антигена в модели у животного и вос-
произведение заболевания у экспериментального
животного путем введения причинного антигена.
Примером успеха данного подхода является вос-
произведение аутоиммунного тиреоидита с по-
мощью тиреоглобулина, злокачественной миасте-
нии с помощью ацетилхолинового рецептора,
аутоиммунного увеита с помощью увеального
S-антигена и аутоиммунного орхита с помощью
спермы. Однако в отношении заболеваний чело-
века, для которых еще не существует подходящей
животной модели, проблемами являются много-
факторность событий, которые должны произой-
ти до возникновения заболевания, вовлечение в
процесс нескольких аутоантигенов и отсутствие
данных о патогенетическом антигене.
Другим способом получения непрямого свиде-
тельства является использование генетически де-
терминированных животных моделей. Новозеланд-
ские черные мыши (НЗЧ) страдают спонтанно воз-
никающей гемолитической анемией, в то время как
у новозеландских белых мышей (НЗБ) она отсут-
ствует Гибридные животные (НЗЧхНЗБ)^ про-
дуцируют большое количество антинуклеарных
антител и используются в качестве модели СКВ
человека.
Непрямые доказательства третьего типа осно-
вываются на выделении аутореактивных антител
или Т-клеток из органов-мишеней. Например, ан-
тиэритроцитарные антитела могут быть отделены
от эритроцитов у больных с аутоиммунной гемо-
литической анемией, антитела против ДНК могут
быть выделены у пациентов с СКВ, а цитотокси-
ческие Т-клетки обнаруживаются в щитовидной
железе у больных с болезнью Грейвса. Однако роль
этих антител или Т-клеток в развитии патологии
установить трудно.
Условные доказательства аутоиммунитета, по-
лученные в клинических исследованиях, включа-
ют данные о склонности к заболеванию в семье,
наличие лимфоцитарной инфильтрации и ассо-
циации с МНС и, что наиболее важно, клиниче-
ское улучшение при лечении иммунносупрессив-
ными препаратами. Для большинства заболева-
ний человека последний из критериев наиболее
часто употребляется для отнесения заболевания к
аутоиммунным.
Причины аутоиммунного заболевания
Генетическая предрасположенность
Наиболее частым свидетельством существования
генетической предрасположенности к аутоиммун-
ному заболеванию является более высокая часто-
та заболевания у монозиготных близнецов и бо-
лее низкая, но все еще повышенная частота забо-
левания у дизиготных близнецов и членов семьи
по сравнению с остальной популяцией. Несмот-
ря на существование склонности к заболеванию у
родственников, форма наследования отличается
сложностью, что указывает на полигенетическую
природу заболевания. Это означает, что для воз-
никновения заболевания одного индивидуально-
го гена недостаточно, а необходимо взаимодей-
ствие многих генов.
Многие аутоиммунные заболевания генетиче-
ски гетерогенны, т.е. одинаковое по клинике за-
болевание может быть результатом сочетанного
эффекта различных генов. Дополнительной слож-
ностью в изучении генетической предрасположен-
ности является тот факт, что предрасполагающие
гены достаточно часто встречаются в обычной
популяции.
Семейством широкоизученных генов, ассоци-
ированных с аутоиммунными заболеваниями, яв-
ляется HLA-комплекс, МНС человека. Учитывая
важность молекул HLA в формировании реперту-
ара TCR и их роль в распознавании, осуществля-
емом TCR, эта ассоциация не вызывает удивле-
ния. Специфические аутоиммунные заболевания,
ассоциированные с HLA-аллелями, будут рассмот-
рены далее в этой главе (табл. 12.1). Несмотря на
то что склонность к аутоиммунному заболеванию
196
ГЛАВА 12. ТОЛЕРАНТНОСТЬ И АУТОИММУНИТЕТ
• Таблица 12.1. Аутоиммунные заболевания
Аутоиммунное заболевание Ассоциация с МНС Аллель Проявление ассоциации
Класс I: анкилозирующий спондилит синдром Рейтера острый передний увеит гипертиреоидизм (Грейвса) псориаз В27 В27 В27 В8 Cw6 В*2702, -04, -05 Сильная Сильная Сильная Слабая Умеренная
Класс II: ревматоидный артрит синдром Шегрена системная красная волчанка: у европеоидов японцев целиакия пузырчатка обыкновенная сахарный диабет I типа рассеянный склероз злокачественная миастения синдром Гудпасчера DR4 DR3 DR3 DR2 DR3 DR4, DR6 DR4 DR3 DR2 DR3 DR2 DRB 1*0401, -04, -05 DQAl*0501 DQB1*O3O2 DRB1*15O1 Сильная Умеренная Слабая Умеренная Сильная Сильная Сильная Умеренная Умеренная Слабая Умеренная
может быть связана со специфическими МНС-
аллелями, для возникновения заболевания могут
потребоваться и другие гены или пусковые меха-
низмы, связанные с некоторыми факторами окру-
жающей среды.
Исследования, проведенные на мышах, по-
казали, что нарушения экспрессии различных
не-HLA-генов могут влиять на многие процессы,
связанные с осуществлением клетками своих функ-
ций, и способствовать появлению аутоиммуни-
тета. Было показано, что чрезмерная или недо-
статочная экспрессия генов, причастных к апоп-
тозу или выживанию клеток, цитокинов, ответ-
ственных за проведение сигналов через BCR, ко-
стимулирующие взаимодействия и иммунное уда-
ление апоптозных клеток и иммунных комплек-
сов, — все это определяет аутоиммунный фено-
тип мышей. Дефицит проапоптозных молекул (на-
пример, Fas или FasL) или чрезмерная экспрес-
сия антиапоптозных молекул (например, bcl-2)
ведет к сокращению апоптоза и увеличению чис-
ла аутореактивных В- и Т-клеток, а также увели-
чению продукции антител, особенно антинукле-
арных. Аутореактивность Т-клеток часто являет-
ся следствием чрезмерной экспрессии провоспа-
лительных цитокинов (таких как IL-10) и чрез-
мерной костимуляции, связанной с повышенной
экспрессией костимулируюших молекул (таких как
В7 и CD28) или дефицитом ингибиторов кости-
мулирующих взаимодействий (таких как CTLA-4
и PD-1). Нарушения, касающиеся силы сигнала,
передаваемого В-клеточным рецептором, связан-
ные с недостаточной экспрессией сигнальных мо-
лекул, таких как CD22 или Lyn, или чрезмерной
экспрессией таких молекул, как CD 19 или CD45,
ассоциируются с продукцией аутоантител. Уси-
ленная помощь со стороны Т-клеток, которая
встречается при увеличенной экспрессии CD40
или CD40L, также ведет к выработке аутоанти-
тел. Наконец, к продукции аутоантител ведут не-
достаточная экспрессия белков (таких как сыво-
роточный амилоидный белок (САП)), которые
вовлечены в удаление фрагментов, оставшихся
после апоптоза, или пониженное выведение им-
мунных комплексов, связанное с дефицитом пер-
вых компонентов классического пути активации
комплемента (или Clq, С2, СЗ, или С4). Повреж-
дения органов-мишеней при аутоиммунном за-
болевании могут также быть генетически обуслов-
лены. На моделях аутоиммунного миокардита, по-
лученных на мышах, было показано, что чувстви-
тельность к заболеванию и повреждение сердца
зависели от доступности антигена кардиального
миозина у специфических линий мышей.
Предрасположенность, определяемая
окружающей средой
Кроме генетической предрасположенности суще-
ствует еще ряд факторов окружающей среды, как
инфекционных, так и неинфекционных, кото-
рые могут служить пусковым механизмом ауто-
иммунитета. либо индуцируя высвобождение сек-
вестрированных антигенов или молекулярную ми-
микрию, либо посредством поликлональной акти-
вации.
АУТОИММУНИТЕТ И ЗАБОЛЕВАНИЯ
197
Как указывалось ранее в этой главе, некото-
рые аутоантигены защищены {секвестрированы) от
иммунной системы. Таким образом, даже при
наличии в организме аутореактивных Т- и В-кле-
ток эти клетки не будут активироваться для за-
пуска аутоиммунитета, поскольку они никогда не
будут контактировать с аутоантигеном Предста-
вителями таких секвестрированных антигенов счи-
таются антигены хондроцитов в хряще и некото-
рые антигены нервной ткани и сердца. В тех слу-
чаях, когда они встречаются с иммунной системой
(в результате физического воздействия или инфек-
ции), может возникнуть аутоиммунный ответ. В
некоторых случаях аутоиммунный миокардит на-
блюдался после ишемического сердечного присту-
па. Считается, что аутореактивность в отношении
сердечных антигенов возникает вследствие выхо-
да секвестрированных антигенов после повреж-
дения сердечной ткани.
Аутоиммунитет также может возникнуть, ког-
да антитела или Т-клетки, специфичные по от-
ношению к микробным антигенам, перекрестно
реагируют с аутоантигеном (это связано с тем, что
эпитоп микробного антигена высокогомологичен
эпитопу, присутствующему на аутоантигене). Это
явление называется молекулярной мимикрией.
Обычно Т-зависимый аутоантиген не вызывает
ответа со стороны антител, поскольку отсутству-
ют аутореактивные Т-клетки-хелперы, способные
обеспечить помощь, потому что они были либо
устранены, либо анергизированы. Однако чу-
жеродный антиген, который содержит эпитоп,
сходный с эпитопом на аутоантигене, может вы-
звать ответ со стороны аутоантител, если он со-
держит Т-клеточный эпитоп, отличающийся от
такого эпитопа у аутоантигена (рис. 12.6, А). Это
связано с тем, что чужеродный эпитоп активи-
рует Т-клетки, которые не стали толерантными,
и эти Т-клетки могут оказать помощь аутореак-
тивным В-клеткам. Считается, что молекулярная
мимикрия играет существенную роль в развитии
ревматической лихорадки, которая в некоторых
случаях развивается после стрептококковой ин-
фекции. Полагают, что аутоантитела к кардиаль-
ному миозину возникают в связи с перекрестной
реактивностью со стрептококковым антигеном.
Аутоантиген
Отсутствие помощи
со стороны Т-клеток
из-за анергии или делении
аутореактивных Т-клеток
Микробный антиген
Т-клетка, специфичная
относительно нового
эпитопа
В-клетка, специфичная
относительно аутоантигена
Т-клетка
МНС
Продукция
аутоантител
CD154 CD40
Активация В-клетки
В-клетка
• Рис. 12.6. Вероятные механизмы индукции ауто-
иммунитета. (А) При молекулярной мимикрии
В-клетка, специфичная к аутоантигену, неспособ-
на активироваться при отсутствии помощи со сто-
роны Т-клетки (слева), однако может быть акти-
вирована микробным антигеном, содержащим
перекрестно реагирующий эпитоп, такой же как у
аутоантигена, и отличающийся от него эпитоп
носителя Т-клетка, специфичная относительно та-
кого несобственного носителя, может оказать по-
мощь в активации аутореактивной В-клетки (спра-
ва). (Б) При поликлональной активации В-клеток
все мышиные В-клетки, включая некоторые ауто-
реактивные, могут неспецифически активировать-
ся поликлональным активатором, который связы-
вается с рецептором
/\/\/чШ» Аутоантиген
Микробный антиген
В-клеточный эпитоп (общий для ауто-
и микробного антигена)
Т-клеточный эпитоп микробного антигена
Т-клеточный эпитоп аутоантигена
А
Б
Активация
198
ГЛАВА 12. ТОЛЕРАНТНОСТЬ И АУТОИММУНИТЕТ
В некоторых случаях запускать аутоиммунитет мо-
гут вирусные инфекции, что также обусловлено пе-
рекрестной реактивностью с Т-клетками. Т-клет-
ка, специфичная к вирусному пептиду, может пе-
рекрестно реагировать с пептидом, происходящим
из аутоантигена.
Было доказано, что при аутоиммунном диабе-
те Т-клетка, распознающая пептид из декарбок-
силазы глутаминовой кислоты (антиген р-клеток
островков), перекрестно реагирует с пептидом,
выделяемым из вируса Коксаки. Таким образом,
молекулярная мимикрия может привести к раз-
витию аутоиммунного заболевания после микроб-
ной инфекции.
Микробные агенты также могут индуцировать
аутоиммунитет путем поликлональной активации
Поликлональные активаторы могут неспецифи-
чески запускать многие В- или Т-клеточные кло-
ны (включая аутореактивные). Многие бактери-
альные и вирусные агенты действуют как супер-
антигены, которые способны активировать ряд
различных клонов Т-клеток независимо от их спе-
цифичности, потому что они связываются с до-
менами, которые кодируются Vp-генными сег-
ментами и лежат снаружи от пептидсвязываю-
щей полости (см. рис. 9.8). Было показано, что
консервативные молекулярные структуры на
большой группе микроорганизмов (молекуляр-
ные структуры, ассоциированные с патогенами;
pathogen-associated molecular patterns — РАМР) дей-
ствуют как поликлональные активаторы В-кле-
ток (рис. 12.6, Б). Рецепторы, распознающие эти
РАМР, были обнаружены на всех В-клетках и
других АПК. Липополисахарид является компо-
нентом клеточной стенки грамотрицательных
бактерий, которые способны поликлонально ак-
тивировать В-клетки мышей. Другие обычные
РАМР, такие как микробные липопротеины и ги-
пометилированные ДНК бактерий, могут также
запускать поликлональную активацию человече-
ских В-клеток.
Пусковые механизмы аутоиммунитета
Пусковыми механизмами неинфекционного про-
исхождения могут быть гормоны, лекарственные
средства и утрата супрессорных Т-клеток Влия-
ние гормонов иллюстрируют специфические по
половой принадлежности факторы, способству-
ющие запуску аутоиммунных заболеваний. Напри-
мер, СКВ возникает у женщин в Ю раз чаще, чем
у мужчин, а эстроген может вызывать обострение
заболевания. Некоторые лекарственные средства
могут химически повредить Т-клеточный носи-
тель эпитопа аутоантигена, делая его иммуноген-
ным. Наконец, подавление или утрата супрессор-
ных Т-клеток могут способствовать проявлению
аутоиммунитета Супрессорные Т-клетки обычно
подавляют активацию CD4+- и СВ8+-Т-клеток,
Утрата этих клеток, по-видимому, способствует
усилению клеточно-опосредованной деятельно-
сти, что может привести к аутоиммунитету, опо-
средованному Т-клетками. У больных диабетом
и воспалительными заболеваниями кишечника
количество супрессорных Т-клеток часто пони-
жено.
Примеры аутоиммунных
заболеваний
Традиционно аутоиммунные заболевания класси-
фицировались как заболевания, опосредованные
В- или Т-клетками. В настоящее время известно,
что большинство В-клеточных ответов зависят от
Т-клеток и что В-клетки могут являться важными
АПК для активации Т-клеток. Таким образом,
упомянутая классификация уже устарела. По дру-
гой классификации аутоиммунные заболевания
разделялись на системные и органоспецифиче-
ские. И эта классификация тоже уже не пригод-
на. При некоторых заболеваниях аутоантиген
встречается повсеместно, однако повреждения
ограничиваются одной тканью. Другие аутоиммун-
ные заболевания, ранее считавшиеся связанными
с патогенетическими проявлениями органоспеци-
фических иммунных ответов, теперь признаются
заболеваниями, затрагивающими многие органы.
Поэтому заболевания классифицируют по эффек-
торному механизму, который более всего отвеча-
ет за повреждение органа: антитела, комплемент
или Т-клетки. Такая система тоже несовершенна,
поскольку при многих заболеваниях действуют все
механизмы. В табл. 12.2 перечислены многие ауто-
иммунные заболевания, их аутоантигены-мише-
ни и эффекторные клетки, которые ответственны
*а проявления заболевания
Аутоиммунные заболевания,
при которых доминирующую роль
в поражении органа играют антитела
Аутоиммунная гемолитическая анемия
Гемолитическая анемия является аутоиммунной
в том случае, когда антитела реагируют с собствен-
ными красными кровяными тельцами (эритроци-
тами). При этом заболевании количество цирку-
лирующих эритроцитов снижено, поскольку ан-
титела, направленные на антигены, находящиеся
на поверхности клеток крови, разрушают или ус-
траняют эти клетки. Разрушение эритроцитов
может быть связано с двумя механизмами. В пер-
вом случае происходит активация каскада комп-
лемента с последующим лизисом клеток. Гемо-
глобин, высвобождающийся в результате этого,
может появиться в моче. Такое состояние назы-
вается гемоглобинурией. Во втором случае проис-
ходит опсонизация эритроцитов, которой способ-
ствуют антитела и СЗЬ-компоненты комплемента
АУТОИММУНИТЕТ И ЗАБОЛЕВАНИЯ
199
• Таблица 12.2. Аутоиммунные заболевания, аутоантигены-мишени и эффекторные клетки
Аутоиммунное заболевание Аутоантиген Эффекторные клетки
Болезнь Грейвса Рецептор ТСГ В-кл етки/аутоантитела
Злокачественная миастения Ацетилхолиновый рецептор То же
Пернициозная анемия Париетальные клетки желудка; внутрен- ний фактор »
Васкулит, ассоциированный с антинуклеарными антителами Миелопероксидаза; сериновая протеиназа »
Аутоиммунная гемолитическая анемия Rh-антигены »
Идиопатическая тромбоцито- пеническая пурпура Белок мембраны тромбоцита, инте1рин »
Системная красная волчанка дцДНК; гистоны; малые ядерные рибонуклео- протеины »
Синдром Шегрена Антигены слюнного протока; SS-A-, SS-B-нуклео- протеины »
Склеродермия Центромерные белки фибробластов; нуклеоляр- ные антигены; IgG; Scl-70 Неизвестны
Пузырчатка обыкновенная Десмоглеин 3 В-клетки; аутоантитела
Синдром Гудпасчера Коллаген IV типа базальной мембраны легких и почек То же
Ревматоидный артрит Неизвестный антиген хряща, IgG (ревматоидный фактор) СD4+-T-клетки; ЦТЛ; В-кл етки/аутоантитела
Тиреоидит Хашимото Тиреоидные белки (тирео!лобулин, микросо- мальные антигены, тиреоидная пероксидаза) CD4+-T-клетки
Инсулинзависимый сахарный диабет Антиген р-клеток островков поджелудочной железы CD4+-T-клетки; ЦТЛ; В-клетки/аутоантитела
Рассеянный склероз Основной белок миелина СВ4+-Т-клетки
(см. гл. 13). В последнем случае эритроциты связы-
ваются и захватываются макрофагами, чьи рецеп-
торы к Fc и СЗЬ прикрепляются к антителам, по-
крывающим эритроциты.
Антитела, ответственные за возникновение
аутоиммунной гемолитической анемии, обычно
делят на две группы, основываясь на их физиче-
ских свойствах. Первая группа состоит из тепло-
вых антител, называемых так, поскольку для оп-
тимальной реакции с эритроцитами им необхо-
дима температура 37 °C. Тепловые аутоантитела
принадлежат преимущественно к классу IgG и
некоторые из них реагируют с резус-антигенами
(Rh) на поверхности клеток крови. Поскольку для
активации каскада комплемента нужно плотное
прилегание по крайней мере двух молекул — IgG
и Rh, а Rh-антигены имеют низкую плотность на
поверхности эритроцита, то лизиса, опосредован-
ного комплементом, не происходит. При этом
антитела IgG к этим антигенам эффективно инду-
цируют иммунную адгезию и фагоцитоз. Такие
антитела у больных аутоиммунной гемолитиче-
ской анемией определяют с помощью теста Кумб-
са (см. гл. 5), который создан для выявления IgG,
прикрепленного к поверхности эритроцитов.
Вторым видом антител являются холодовые аг-
глютинины, прикрепляющиеся к эритроцитам,
только когда температура тела ниже 37 °C, и отде-
ляющиеся от клеток, когда температура подни-
мается выше 37 °C. Холодовые агглютинины при-
надлежат преимущественно классу IgM и специ-
фичны относительно I- или i-антигенов, присут-
ствующих на поверхности эритроцитов. Поскольку
холодовые агглютинины относятся к классу IgM,
они чрезвычайно эффективно активируют каскад
комплемента и вызывают лизис эритроцитов, к ко-
торым они прикрепляются. Однако гемолиз, вы-
зываемый холодовыми агглютининами, у паци-
ентов с аутоиммунной гемолитической анемией
выражен нерезко, поскольку температура их тела
поддерживается на уровне 37 °C. Тяжелые при-
ступы гемолиза могут возникать, когда руки, ноги
или кожа охлаждаются и температура циркулиру-
ющей крови падает.
Хотя причина формирования аутоантител ча-
сто неизвестна, информацию для размышления
200
ГЛАВА 12. ТОЛЕРАНТНОСТЬ И АУТОИММУНИТЕТ
Пример антител-антагонистов
(блокирующих), вызывающих болезнь
Пример антител-агонистов
(активирующих), вызывающих болезнь
Болезнь
Злокачественная миастения
Гипофиз
Антитело
к рецептору ТСГ
железы
Болезнь Грейвса
• Рис. 12.7. Антитела, специфичные к рецепторам клеточной поверхности, могут быть как
агонистами, так и антагонистами рецептора. Антитела к ацетилхолиновому (ACh) рецепто-
ру при злокачественной миастении действуют как антагонисты, блокирующие прикрепле-
ние ацетилхолина к рецептору, предотвращая передачу нервного импульса через нервно-
мышечное соединение. Антитела к рецептору ТСГ при болезни Грейвса действуют на рецеп-
тор как агонисты, вызывая хроническую стимуляцию щитовидной железы с высвобождени-
ем ее гормонов
дают случаи анемии, вызванной лекарственными
средствами. Такой препарат, как пенициллин,
действуя как гаптен, может связываться с опре-
деленным белком на поверхности эритроцитов,
и весь этот комплекс затем действует как анти-
ген, привлекающий антитела к поверхности клет-
ки, что ведет к лизису или фагоцитозу. В таких
случаях, однако, заболевание является «самоогра-
ниченным» и проходит после прекращения прие-
ма препарата.
Другим примером анемии, вызванной лекар-
ственными средствами, является анемия, встре-
чающаяся у небольшой части пациентов, прини-
мающих а-метилдопу в качестве гипотензивного
средства. Этот препарат вызывает нарушение,
почти идентичное вызываемому тепловыми ауто-
антителами. Иногда холодовые агглютинины по-
являются после инфекций, вызванных Mycoplasma
pneumonia или вирусами, что подтверждает роль
инфекционного заболевания как пускового меха-
низма у генетически предрасположенных инди-
видуумов.
Злокачественная миастения
Другим аутоиммунным заболеванием, в развитии
которого участвуют антитела к четко установлен-
ному антигену-мишени, является злокачественная
миастения. Аутоантигеном-мишенью при этом
заболевании является ацетилхолиновый рецептор
в нервно-мышечных соединениях Аутоантитело
действует как антагонист, блокирующий соеди-
нение ацетилхолина с рецептором. Это прекра-
щает прохождение нервного импульса через не-
рвно-мышечное соединение, вызывая выражен-
ную мышечную слабость, проявляющуюся затруд-
нениями при жевании, глотании и нарушением
дыхательной функции, приводящим в дальнейшем
к смерти отдыхательной недостаточности (рис. 12.7).
Болезнь поражает людей разного возраста, но наи-
большая ее частота отмечается у женщин около
30 лет и у мужчин примерно 50 — 60 лет. Соотно-
шение между заболевшими женщинами и муж-
чинами составляет примерно 3:2. У некоторых
детей, рожденных матерями, больными миасте-
нией, отмечается транзиторная мышечная сла-
бость, преимущественно связанная с тем, что че-
рез плаценту поступает существенное количество
патогенных IgG.
Это заболевание может быть эксперименталь-
но вызвано у животных путем иммунизации очи-
щенными ацетилхолиновыми рецепторами, взя-
тыми у электрического ската или электрическо-
го угря, которые обладают выраженной перекре-
стной реактивностью с рецепторами млекопита-
ющих. При экспериментальном заболевании
вследствие формирования антител против чуже-
родных рецепторов антитела связываются с ре-
цепторами млекопитающих и почти полностью
воссоздают картину естественного заболевания.
Миастения может пассивно переноситься с по-
мощью антител.
АУТОИММУНИТЕТ И ЗАБОЛЕВАНИЯ
201
Развитие болезни, похоже, связано с тимусом,
поскольку многие пациенты имеют сопутству-
ющую тимому или гипертрофию тимуса, а удале-
ние тимуса иногда ведет к регрессу заболевания.
Молекулы, перекрестно реагирующие с рецепто-
ром ацетилхолина, были обнаружены на различ-
ных клетках тимуса, таких как тимоциты и эпи-
телиальные клетки. Однако являются ли эти мо-
лекулы первичным стимулом для развития забо-
левания, неизвестно. У болезни есть генетический
компонент, поскольку злокачественная миастения
ассоциирована с аллелями HLA-DR3.
Болезнь Грейвса
Одним из основных проявлений болезни Грейвса
является гиперактивность щитовидной железы
{гипертиреоз). Это проявление служит примером
того, как антитела, направленные против рецеп-
тора гормона, могут в большей степени активи-
ровать рецептор, чем мешать его работе. По еще
неизвестным причинам при болезни Грейвса у
пациентов вырабатываются антитела против ти-
реоидных рецепторов для тиреостимулирующего
гормона (ТСГ), расположенных на поверхности
клеток. Взаимодействие этих антител с рецепто-
ром активирует клетку таким же образом, как ее
активирует ТСГ. Таким образом, антитело ведет
себя как агонист (см. рис. 12.7). Длительно про-
должающаяся стимуляция этими антителами ве-
дет к гипертиреозу.
Непрямыми доказательствами того, что болезнь
Грейвса является аутоиммунной, служат семей-
ная предрасположенность, генетическая ассоци-
ация с генами HLA II класса и взаимосвязь титра
антител к рецепторам ТСГ с тяжестью заболева-
ния. Однако наилучшим свидетельством является
перенос антител, стимулирующих щитовидную
железу, от больной тиреотоксикозом матери че-
рез плаценту плоду с появлением у него транзи-
торного неонатального гипертиреоза, сохраня-
ющегося до момента полного распада материн-
ских IgG. Болезнь наиболее часто поражает жен-
щин 30 — 40 лет. В районах, где заболевание не
распространено, соотношение между больными
женщинами и мужчинами составляет примерно
7:1. Генетические факторы играют роль при сцеп-
лении с генами МНС II класса и как семейная
предрасположенность. Недавно Международный
консорциум по изучению генетики аутоиммунных
заболеваний щитовидной железы (International
Consortium for the Genetics of Auttoimmune Thyroid
Disease) определил новый ген предрасположен-
ности к болезни Грейвса на хромосоме 20 (20ql 1.2).
Системная красная волчанка
Системная красная волчанка получила свое на-
звание (красный волк), потому что при этой бо-
лезни на лице и щеках появляется красноватая
сыпь, которая часто является ранним симптомом
• Рис. 12.8. Типичная красноватая сыпь в форме бабочки
на щеках девушки, больной СКВ (с любезного разреше-
ния L. Steinman, Department of Pathology, Stanford University
School of Medicine)
Однако по своей форме высыпания напоминают
скорее крылья бабочки, а не морду волка (рис. 12.8).
Так что название в части, касающейся волка, да-
леко от действительности, но термин «системная»
вполне уместен, поскольку болезнь поражает мно-
гие органы и вызывает лихорадку, боль в суставах
и поражения ЦНС, сердца и почек. Наиболее хо-
рошо изучена патофизиология почечных повреж-
дений, являющихся наиболее частой причиной
смерти от СКВ.
Несмотря на то что причина этого заболева-
ния не установлена, детали иммунологических ме-
ханизмов, ответственных за патологию, частично
изучены. У больных СКВ вырабатываются анти-
тела против некоторых ядерных компонентов
клетки (антинуклеарные антитела — АНА), осо-
бенно против собственной двухцепочечной ДНК
(дцДНК). Иногда антитела вырабатываются про-
тив денатурированной одноцепочечной ДНК и
ядерных гистонов, однако присутствие антител к
дцДНК лучше всего коррелирует с патологичес-
ким вовлечением почек (см. далее). Антитела к
одноцепочечной ДНК вырабатываются и у здо-
ровых людей, но обычно они являются низкоаф-
финными антителами IgM. Однако иногда могут
происходить переключение изотипа и соматиче-
ские мутации, что приводит к продукции антител
IgG, как к одно-, так и двухцепочечным ДНК при
условии, что В-клетки получают соответствующую
помощь от Т-клеток.
Двухцепочечная ДНК может оказаться захва-
ченной гломерулярной базальной мембраной за
счет электростатических взаимодействий с содер-
жимым мембраны, таким как коллаген, фибро-
нектин или ламинин. Связанная двухцепочечная
ДНК может затем захватываться циркулирующи-
ми антителами IgG анти-дцДНК, формируя им-
мунные комплексы. Эти комплексы способны ак-
тивировать каскад комплемента и привлекать гра-
202
ГЛАВА 12. ТОЛЕРАНТНОСТЬ И АУТОИММУНИТЕТ
• Рис. 12.9. Депонирование антител в почке пациента с
СКВ. Меченные флуоресцентным веществом антитела к че-
ловеческим IgG, использованные для иммунного окраши-
вания, указывают на депонирование антител IgG в гломе-
рулах (с любезного разрешения Н. Rennke, Department of
Pathology, Brigham and Women's Hospital, Boston)
нулоциты. В другом случае анти-дцДНК антитела
могут перекрестно реагировать с гломерулярны-
ми антигенами. Депонирование антител IgG в
почке больного волчанкой можно продемонстри-
ровать с помощью иммунного окрашивания сре-
за почечной ткани антителами к человеческим
IgG, меченными флуоресцирующим веществом
(рис. 12.9). Выраженность воспалительной реакции
в почке является основой для классификации ее
патологии. Повреждение почки (гломерулонеф-
рит) в результате приводит к протеинурии и иногда
гематурии, причем симптомы повреждения уве-
личиваются или уменьшаются в зависимости от
повышения или снижения интенсивности фор-
мирования иммунных комплексов. Когда состоя-
ние становится хроническим, воспалительные
CD4+-TH1-клетки поступают в место поражения
и притягивают моноциты, которые затем прини-
мают участие в патологическом поражении.
Хотя антиген, который инициировал выработ-
ку этих антител, неизвестен, предполагают, что
это инфекционный агент. Системная красная вол-
чанка может быть результатом иммунного ответа
на широко распространенные в окружающей среде
организмы только у небольшой части генетиче-
ски предрасположенных индивидуумов. Другими
факторами окружающей среды являются ультра-
фиолетовое излучение, которое обостряет забо-
левание, и действие гормонов. Такие лекарствен-
ные средства, как пеницилламин, могут вызывать
симптомы, сходные с СКВ. Есть свидетельство ге-
нетической предрасположенности: повышенный
риск возникновения СКВ среди членов семьи,
более высокая вероятность появления заболева-
ния у монозиготного близнеца (25 %) по сравне-
нию с дизиготным (менее 3%), связь с HLA-ге-
нами II класса и наличие врожденного дефицита
ранних компонентов комплемента у 6 % больных
СКВ.
Аутоиммунные заболевания,
при которых Т-клетки играют
доминирующую роль
в повреждении органов
Рассеянный склероз
При рассеянном склерозе происходит демиелини-
зация ткани ЦНС. Болезнь характеризуется либо
ремиссиями и обострениями, либо хроническим
прогрессирующим течением. Считается, что она
является аутоиммунной, опосредованной Т-клет-
ками Повреждения напоминают клеточные ин-
фильтраты, ассоциированные с ТН1-клетками,
напоминающие ГЗТ (см. гл. 16).
Не ясно, обусловлен ли аутоиммунный ответ
недостаточностью клональной делении вследствие
нейроантигенной сенсибилизации или молекуляр-
ной мимикрии по отношению к нейроэпитопу, от-
мечаемой после вирусной инфекции. Доказатель-
ство того, что рассеянный склероз является ауто-
иммунным заболеванием, не является прямым.
Оно основывается на моделировании ЭАЭ у гры-
зунов, описанном ранее в этой главе. У животных
с ЭАЭ наблюдаются многие признаки, сходные с
симптомами у больных рассеянным склерозом.
Клоны СО4+-Т-клеток, специфичные к основно-
му белку миелина и многим другим антигенам
ЦНС, способны переносить заболевание ЭАЭ.
Условными свидетельствами аутоиммунной при-
роды рассеянного склероза являются ассоциация
HLA II класса с предрасположенностью к болез-
ни и выявление повышенной реакции Т-клеток
на компоненты миелина в цереброспинальной
жидкости у больных по сравнению с контрольной
группой.
В процессе одного исследования была установ-
лена способность активированных Т-клеток про-
ходить через гематоэнцефалический барьер, ко-
торый обычно препятствует проникновению кле-
ток и макромолекул в ЦНС. У активированных
Т-клеток регуляция интегринов не осуществляет-
ся, что позволяет им прикрепляться к стенкам
сосудов вблизи мозга. Активированные Т-клетки
способны вырабатывать металлопротеиназы, ко-
торые разрушают коллаген базальной мембраны,
позволяя им накапливаться в ЦНС. Попав туда,
Т-клетки должны пройти стимуляцию антигеном
(вероятно, с помощью микроглии, макрофагопо-
бодных АПК, присутствующих в мозге), чтобы
задержаться в мозге. Продуцируются хемокины,
привлекающие дополнительные воспалительные
клетки. Это приводит к накоплению не только
СО4+-Т-клеток, но также макрофагов и микро-
глии; все эти клетки принимают участие в по-
АУТОИММУНИТЕТ И ЗАБОЛЕВАНИЯ
203
• Рис. 12.10. Световая микроскопия островков Лангерганса. (А) Неповрежденная поджелудочная железа мыши. (Б) Под-
желудочная железа мцши NOD с заболеванием, напоминающим инсулинзависимый сахарный диабет. Видна инфильт-
рация лимфоцитами островков Лангерганса (инсулит) (с любезного разрешения М. Atkinson, Department of Pathology,
University of Florida College of Medicine, Gainsville)
вреждении ткани. Воспалительный процесс ин-
дуцирует экспрессию Fas, усиливающуюся на олиго-
дендроцитах, превращая их в мишени для Т-кле-
ток и микроглии, которая экспрессирует FasL; это
приводит к запуску программируемой смерти оли-
годендроцитов.
В семьях больных рассеянным склерозом за-
болевание наблюдается часто, с большей часто-
той возникая у второго (вслед за первым) моно-
зиготного близнеца (25 — 30 %), чем у дизиготно-
го (2 — 5 %) Женщины болеют в 2 раза чаще, чем
мужчины, а пик заболевания приходится на 35 лет.
Недавние исследования указывают на то, что при-
мерно 12 участков генома человека могут иметь
значение с точки зрения предрасположенности к
рассеянному склерозу. Выделение этих генов и
определение, каким образом они связаны с им-
мунной системой, поможет понять первопричи-
ну поражения и иммунопатогенез заболевания.
Инсулинзависимый сахарный диабет
I типа
Инсулинзависимый сахарный диабет представля-
ет собой форму диабета, характеризующуюся хро-
нической воспалительной деструкцией продуциру-
ющих инсулин $-клеток островков поджелудочной
железы. При этом заболевании основную лепту в
разрушение р-клеток вносят цитотоксические
Т-клетки и цитокины, которые индуцируют ауто-
антитела. Среди генетических факторов существу-
ют несколько генов в участках МНС II класса,
ген инсулина на хромосоме 11 и по крайней мере
11 других не связанных с HLA генов предраспо-
ложенности к диабету. Некоторые гаплотипы HLA
II класса предрасполагают к заболеванию, а дру-
гие защищают от него. Например, около 50 %
больных инсулинзависимым сахарным диабетом
являются гетерозиготными по HLA-DR3/DR4,
а в обычной популяции этот гаплотип встречает-
ся в 5 % случаев. Однако индивидуумы с HLA-
DQB1*62 редко болеют этим заболеванием.
Экспериментальная животная модель (мыши
NOD) обладает многими основными чертами забо-
левания, характерными для человека, такими как
разрушение р-клеток островков поджелудочной
железы, лимфоцитарная инфильтрация (рис. 12.10),
ассоциация с генами предрасположенности МНС
и возможность передачи заболевания Т-клетка-
ми. По крайней мере 14 генов влияют на разви-
тие диабета у мышей NOD. Однако между забо-
леванием у человека и моделью заболевания у
мышей есть существенные различия. К ним от-
носятся доминирование Т-клеток у мышей NOD
по сравнению с инсулинзависимым сахарным
диабетом у человека и большая заболеваемость
женских особей у мышей, чем у человека.
Тиреоидит Хашимото
Тиреоидит Хашимото является заболеванием щи-
товидной железы, наиболее часто наблюдаемым у
женщин средних лет. Вначале оно ведет к появ-
лению зоба (рис. 12.11), а затем к атрофии желе-
зы, вызывающей нарушение ее функций и гипо-
тиреоз. В семьях пациентов с болезнью Хашимо-
то гораздо чаще, чем в обычной популяции, от-
мечаются и другие аутоиммунные заболевания.
Заболевание опосредуется Т-клетками, однако в
его развитии могут играть роль и антитела.
В процесс развития заболевания вовлечены
антигены-мишени, такие как тиреоглобулин —
основной гормон, вырабатываемый щитовидной
железой, а также микросомальные антигены ти-
реоидных эпителиальных клеток. У пациентов с
болезнью Хашимото обнаруживаются антитела к
обоим этим антигенам. При гистологических ис-
следованиях отмечается преимущественно ин-
фильтрация мононуклеарными клетками фолли-
кулов щитовидной железы (рис. 12.12). Мононук-
204
ГЛАВА 12. ТОЛЕРАНТНОСТЬ И АУТОИММУНИТЕТ
• Рис. 12.11. Формирование зоба у пациентки с тирео-
идитом Хашимото (из Roitt Im; Brodstoff J, Malem DK (eds)
(1989): Immunology; 2nd ed. New York: Grower Medical)
• Рис. 12.12. Щитовидная железа. (А) Световая микро-
скопия. Нормальная щитовидная железа с фолликуляр-
ными эпителиальными клетками, выстилающими фолли-
кул. (Б) Щитовидная железа пациента с тиреоидитом Ха-
шимото, при котором нормальная структура железы за-
менена интенсивно размножающимися лимфоцитами
(из Goldsby RA, Kindt TJ, Osborne BA (eds) (2000): Kuby
Immunology, 4th ed. New York: Freeman)
леарные инфильтраты содержат большое количе-
ство В-клеток, Т-клеток и макрофагов. Наличие
этих инфильтратов сопровождается постепенной
деструкцией фолликулов и попытками железы
регенерировать, что приводит к ее увеличению.
Когда разрушение фолликулов достигает опреде-
ленного уровня, выработка гормона снижается и
появляются симптомы гипотиреоза: сухость кожи,
отечность лица, ломкость волос и ногтей и посто-
янное ощущение холодности кожных покровов.
Свидетельства важной роли Т-клеточного от-
вета получены при исследованиях эксперимен-
тального аутоиммунного тиреоидита, который
может быть вызван у животных либо путем их
иммунизации тиреоглобулином с полным адъю-
вантом Фрейнда, либо пассивным переносом кло-
нов СD4+-TH1-клеток, специфичных для тирео-
глобулина. В отличие от истинного заболевания,
которое характеризуется хроническим течением с
рецидивами, болезнь, вызванная эксперименталь-
но, протекает остро и не рецидивирует. Таким об-
разом, причиной естественного развития аутоим-
мунного заболевания является скорее длительный
процесс, чем случай единичной иммунизации.
Ревматоидный артрит
Ревматоидный артрит характеризуется хроническим
воспалением синовиальной оболочки с присутстви-
ем в ней большого количества лимфоцитов, что
приводит к разрушению хряща и кости. Воспа-
ленная синовиальная оболочка, обычно состоя-
щая из одного слоя клеток, становится настолько
насыщенной клетками, что начинает напоминать
лимфоидную ткань с формирующимися в ней но-
выми кровеносными сосудами. Синовиальная обо-
лочка плотно набита дендритными клетками, мак-
рофагами, Т-, В-лимфоцитами, NK-клетками и
сгустками плазматических клеток; в некоторых
случаях в ней возникают вторичные фолликулы.
Патология в своей наиболее тяжелой форме яв-
ляется следствием целого ряда иммунопатологи-
ческих механизмов с участием комплексов анти-
ген-антитело, комплемента, ПМЯ-нейтрофилов,
воспалительных CD4+- и цитотоксических CD8+-
Т-клеток, активированных макрофагов и NK-кле-
ток. Вся эта «агрессивная смесь» высвобождает раз-
нообразные цитокины (из которых TNFa и IL-1
появляются одними из первых), расщепляющие
ферменты и медиаторы, разрушающие целост-
ность хряща. Хондроциты, клетки хряща, подвер-
гаются воздействию иммунной системы и поддер-
живают процесс повреждения, в котором являются
не только потенциальными мишенями, но и про-
дуцентами цитокинов и факторов роста. В суста-
вах таких больных часто накапливается синови-
альная жидкость, которая содержит большое ко-
личество ПМЯ-нейтрофилов. После нескольких
приступов воспаления откладывается фибрин.
хрящ заменяется фиброзной тканью и кости су-
става срастаются (анкилоз).
АУТОИММУНИТЕТ И ЗАБОЛЕВАНИЯ
205
Предполагают, что воспалительный процесс
инициируется выработкой аномальных антител
(обычно IgM). называемых ревматоидным фак-
тором. который специфично связывает детерми-
нанты на Fc-фрагменте собственных молекул IgG
больного. Однако существуют сомнения в том, что
ревматоидный фактор является общей причиной
начала заболевания, поскольку у 30% больных
ревматоидным артритом он не определяется со-
временными методами. В группе пациентов, у ко-
торых определяется ревматоидный фактор, бо-
лезнь имеет тенденцию протекать более агрес-
сивно. Ревматоидный фактор является важным
показателем активности заболевания, поскольку
понижение его уровня в сыворотке наблюдается
во время ремиссии. Наличие ревматоидного фак-
тора влияет на течение ревматоидного артрита,
но, по-видимому, не связано с Т-клеточным от-
ветом.
Первоначальный механизм запуска заболева-
ния может быть многофакторным. У большой
части больных ревматоидным артритом повыше-
но количество В-клеток, инфицированных виру-
сом Эпштейна—Барр; уб-Т-клетки этих больных
распознают белки теплового шока; имеется ассо-
циация ревматоидного артрита с бактериями.
Женщины болеют ревматоидным артритом в
3 раза чаше, чем мужчины, а начинается заболе-
вание обычно в возрасте 40 — 50 лет. В семейных
исследованиях, касающихся развития ревматоид-
ного артрита, во многих популяциях проверялась
ассоциация различных генов. Для многих попу-
ляций была подтверждена связь аллелей HLA-DR4
с заболеванием, хотя подтипы и варьировались.
Например, ассоциация HLA-DRB1 для белых
жителей Северной Америки — это *0401 и *0404,
в то время как для израильтян — это *0102 и *0405,
для индейцев Якима — *1402. У прочих ассоциа-
ция с DR4-renaMH отсутствует. Определение по-
следовательности ДНК этих молекул МНС II клас-
са показывает, что все они обладают сегментом
наружного домена [3-цепи HLA-DR, называемым
общим эпитопом. Индивидуумы с двумя различ-
ными HLA-DRB1, обладающие общим эпитопом
[3-цепи, больше всех подвержены риску развития
ревматоидного артрита, и заболевание у них про-
текает в наиболее тяжелой форме. Среди других
генов, прямо ассоциированных с ревматоидным
артритом, можно назвать TNF и белки теплового
шока
Аутоиммунные заболевания,
возникающие в связи с дефицитом
компонентов комплемента
У многих пациентов с дефицитом первых компо-
нентов комплемента возникают аутоиммунные
заболевания, такие как СКВ (см. гл. 17). Кроме
того, специфические аллели некоторых компонен-
тов комплемента предрасполагают к развитию
аутоиммунитета. Как классический, так и альтер-
нативный пути активации комплемента подавля-
ют формирование крупных иммунных комплек-
сов. Компоненты Cl, С4 и С2 классического пути
активации комплемента оказались способными
непосредственно влиять на размер иммунных ком-
плексов, в то время как СЗЬ играет ключевую роль
для обоих путей. Присоединение СЗЬ приводит к
растворению иммунных комплексов. Компонент
СЗЬ уменьшает величину комплекса, возможно,
нарушая способность антител прикрепляться к
антигену. Добавление СЗЬ к комплексу антиген-
антитело способствует его связыванию с СЗЬ-ре-
цептором на клетках многих типов, таких как
фагоцитарные клетки и эритроциты. Комплексы,
связанные с эритроцитами, быстро переносятся в
печень и селезенку, а захваченные фагоцитами
разрушаются.
Отложение иммунных комплексов в неподхо-
дящих местах может происходить при различных
обстоятельствах, приводящих к заболеванию. На-
пример, избыточное формирование иммунных ком-
плексов часто перегружает механизмы их клирен-
са, опосредованного комплементом, как при сы-
вороточной болезни (см. гл. 15). Кроме того, врож-
денный дефицит компонентов классического пути
активации комплемента также может приводить к
отложению (см. гл. 17). Дефект компонентов ком-
племента Cl, С4 или С2 предотвращает актива-
цию классического пути, а дефицит С4Ь и СЗЬ
приводит к невозможности фагоцитоза иммунных
комплексов макрофагами. У более чем 80% лиц с
полным дефицитом Cl, С4 или С2 возникает СКВ
Наконец, неэффективный клиренс иммунных ком-
плексов также вызывают дефекты комплемента или
Fc-клеточных рецепторов на клетках.
Методы лечения
На протяжении многих лет основным методом
лечения большинства аутоиммунных заболеваний
было устранение аутореактивных клеток. Посколь-
ку в обычных условиях невозможно отличать ауто-
реактивную В- или Т-клетку от той, которая за-
щищает от микробной инфекции, использовались
методы удаления значительного числа клеток.
Терапевтическими агентами часто являются ци-
тотоксические лекарственные средства, такие как
циклофосфамид и азатиоприн. которые вмешива-
ются в репликацию ДНК и без разбора уничто-
жают лейкоциты в организме. Кроме того, препа-
раты, подобные циклоспорину А и FK506. блоки-
руют проведение сигнала в клетке и предотвра-
щают ее активацию (см. гл. 18).
Не так давно свою высокую эффективность при
некоторых заболеваниях доказала антицитокино-
вая терапия. Блокада TNFa антителами или рас-
творимыми рецепторами является важным терапев-
тическим методом выбора при лечении ревмато-
206
ГЛАВА 12. ТОЛЕРАНТНОСТЬ И АУТОИММУНИТЕТ
идного артрита или воспалительного заболевания
кишечника. Ингибиция IL-1$ рецепторным ан-
тагонистом также рассматривается в качестве по-
лезной стратегии при лечении ревматоидного ар-
трита. Эти иммуномодулирующие агенты пред-
отвращают воспалительную реакцию. Одновре-
менно с уменьшением выраженности заболевания
они подавляют иммунитет организма, поэтому ос-
новными осложнениями лечения многих ауто-
иммунных заболеваний являются инфекционные
болезни. Некоторые аутоиммунные заболевания
можно лечить, удаляя или вводя цитокины, на-
пример при лечении рассеянного склероза исполь-
зуется интерферон-[3 (IFN[3). Каким образом ци-
токин оказывает терапевтический эффект, не ясно.
Недавно стали изучать более «направленные»
подходы к лечению. Провели тестирование моно-
клональных антител к CD3, не истощающих Т-
клеточную популяцию, при вновь выявленных
случаях развивающегося аутоиммунного диабета.
При ревматоидном артрите и псориазе для пре-
дотвращения взаимодействия молекул В7 с CD28
многообещающей кажется костимуляторная бло-
када. Эти новые подходы к лечению показали свою
эффективность, но, вероятно, наряду с вмешатель-
ством в патогенные иммунные ответы они будут
нарушать и защитные функции, подавляя имму-
нитет. Дополнительная информация о механиз-
мах действия этих и других иммуносупрессивных
препаратов представлена в гл. 18.
Существует несколько антигенспецифических
подходов к лечению, которые могут устранить
аутореактивность, не вызывая общего подавления
иммунитета Измененные пептидные лиганды,
пептиды, которые связываются с пептидсвязыва-
ющим участком МНС, но не способны к актива-
ции данной Т-клетки, использовались для индук-
ции толерантности на животных моделях заболе-
вания (грызуны), но оказались неэффективными
при лечении людей. В опытах с моделями на жи-
вотных для индукции толерантности использовал-
ся пероральный прием антигена внутрь. Однако
клинические исследования, в которых применя-
ли коллаген при ревматоидном артрите и основ-
ной белок миелина при рассеянном склерозе со-
ответственно, не были эффективными. В попыт-
ке получить клонотипспецифические цитолити-
ческие Т-клетки у пациентов в качестве иммуно-
гена использовали Т-клеточные рецепторы. Дан-
ные исследования продолжаются.
Недавнее признание существования многочис-
ленных популяций регуляторных Т-клеток приве-
ло к появлению новой стратегии в лечении. В не-
которых исследованиях указывается на исчезно-
вение или уменьшение количества супрессорных
Т-клеток у пациентов с аутоиммунными расстрой-
ствами. Однако до сих пор клинических исследо-
ваний, посвященных возможности активирования
супрессорных клеток, не проводилось, хотя у
мышей такая стратегия оказалась вполне эффек-
тивной.
РЕЗЮМЕ
1. Толерантность — это состояние отсутствия от-
вета лимфоцита на антиген. Существует несколько
механизмов индукции толерантности В- и Т-клеток к
аутоантигену: анергия (функциональная инактивация
клетки), делеция, редактирование рецептора и су-
прессия Т-клетки.
2. Толерантность может быть индуцирована как на
уровне незрелых, так и зрелых лимфоцитов. Для того
чтобы стать толерантной, клетка должна экспрессиро-
вать антигенспецифичный рецептор (BCR или TCR).
3. Авидность взаимодействия BCR или TCR с ауто-
антигеном и микросреда, в которой аутореактивные
лимфоциты встречаются с аутоантигенами, влияют на
судьбу клетки.
4. Отсутствие костимулирующих взаимодействий
может индуцировать Т- и/или В-клеточную анергию.
5. Супрессия Т-клеток опосредуется регуляторны-
ми СО4+СО25+-Т-клетками.
6. Толерантность, обусловленная низкой дозой
пищевого антигена, индуцирует супрессию Т-клеток, в
то время как толерантность, зависящая от высокой
дозы, индуцирует Т-клеточную анергию или делецию.
7. Экспрессия FasL и продукция иммунносупрес-
сивных цитокинов клетками определенных типов иг-
рает роль в установлении иммунно-привилегирован-
ных областей.
8. Аутоиммунитет является состоянием, при кото-
ром организм запускает иммунный ответ к одному
или более своих составляющих.
9. Определение того, что заболевание является
аутоиммунным, основывается на нескольких типах
доказательств: 1) прямое свидетельство, подтверж-
денное переносом аутоантител или аутореактивных
лимфоцитов с воспроизведением заболевания у дру-
гого здорового индивидуума; 2) непрямое свидетель-
ство, которое требует создания экспериментальной
животной модели, напоминающей заболевание; 3) ус-
ловное свидетельство, основанное на склонности к
заболеванию у родственников, вовлечении иммунных
клеток и антител и клиническом улучшении под дей-
ствием иммуносупрессивных лекарств.
10. Для развития аутоиммунных заболеваний
обычно необходимо сочетание генетических факто-
ров и факторов окружающей среды. Считается, что
многие аутореактивные клоны Т- и В-клеток суще-
ствуют и в норме, но находятся под контролем ме-
ханизмов гомеостаза. Нарушение такого контроля
под действием различных механизмов ведет к акти-
вации аутореактивных клонов и аутоиммунному за-
болеванию
11. При аутоиммунном заболевании в процесс
вовлекаются многие органы и ткани, а эффекторные
механизмы повреждения ткани могут включать анти-
тела, комплемент, Т-клетки и макрофаги.
ТЕСТЫ
Выберите ОДИН НАИБОЛЕЕ ПРАВИЛЬНЫЙ ответ
на каждый тест.
1. В норме иммунный ответ на собственный белок
в организме не развивается в связи с тем:
ТЕСТЫ
207
а) что собственные белки не могут расщепляться
на пептиды;
б) пептиды, полученные из собственных белков, не
могут связываться с молекулами МНС I класса;
в) пептиды, полученные из собственных белков, не
могут связываться с молекулами МНС II класса;
г) лимфоциты, экспрессирующие рецепторы, реа-
гирующие с собственными белками, инактивируются
путем делеции, анергии или редактирования рецеп-
тора;
д) развивающиеся лимфоциты не могут реаранжи-
ровать V-гены, необходимые для продуцирования ре-
цептора к собственным белкам.
2. Дефектом одного гена обусловлено аутоиммун-
ное заболевание:
а) системная красная волчанка;
б) аутоиммунный лимфопролиферативный синдром;
в) рассеянный склероз;
г) ревматоидный арТрит;
д) тиреоидит Хашимото.
3. Ревматоидный фактор, обнаруживаемый в сино-
виальной жидкости у пациентов с ревматоидным арт-
ритом, чаще всего является:
a) IgM, реагирующим с L-цепями IgG;
б) IgM, реагирующим с детерминантами Н-цепи IgG;
в) IgE, реагирующим с бактериальными антигенами;
г) антителом к коллагену;
д) антителом к ДНК.
4. Развитие патологии определяют CD4+-TH1-клет-
ки. цитотоксические СО8+-Т-клетки и аутоантитела
при следующем заболевании:
а) злокачественная миастения;
б) системная красная волчанка;
в) болезнь Грейвса;
г) аутоиммунная гемолитическая анемия;
д) инсулинзависимый сахарный диабет.
5. Системная красная волчанка:
а) обусловлена мутацией в двухцепочечной ДНК;
б) является классическим примером опосредован-
ной Т-клетками аутоиммунной болезни;
в) характеризуется разнообразием симптомов и
повреждением многих органов;
г) является результатом воздействия антител, спе-
цифичных относительно тканей щитовидной железы;
д) повреждает только клетки эпителия кожи.
6. Укажите, блокирование какого из перечислен-
ных процессов не может привести к возникновению
периферической толерантности у зрелых Т-клеток:
а) взаимодействие костимулирующих молекул на
Т-клетках с их лигандами на АПК;
6) внутриклеточные механизмы передачи сигнала;
в) негативная селекция тимоцитов;
г) активация гена IL-2;
д) связывание антигена с молекулами МНС
7. Наименее опасно для развития аутоиммунитета:
а) утрата супрессорных Т-клеток;
б) высвобождение секвестированных аутоантиге-
нов;
в) генетическая предрасположенность;
г) поликлональная активация;
д) увеличенный клиренс иммунных комплексов.
СИТУАЦИОННАЯ ЗАДАЧА
У женщины 31 года после того, как она побывала
на солнце во время семейного пикника, появилась
красная сыпь в области верхней челюсти. Вначале
она подумала, что это сильный солнечный ожог, но
ни у кого из присутствующих на пикнике таких ожо-
гов не было. Женщина отметила, что на протяжении
нескольких последних месяцев чувствовала себя не-
много усталой, а ее волосы стали тонкими. Женщина
обратилась к врачу. Во время опроса выяснилось,
что уже несколько месяцев у нее периодически бо-
лят суставы. Она также отметила, что пальцы на но-
гах и руках краснеют при охлаждении или стрессе
(синдром Рейно). Анализ крови выявил умеренную
анемию. Укажите наиболее вероятный диагноз и тес-
ты, которые следует сделать для его подтверждения.
Почему кожная сыпь проявилась под воздействием
солнечных лучей?
ОТВЕТЫ НА ТЕСТЫ
1 — г. Негативная селекция обычно гарантирует
то, что лимфоциты, экспрессирующие рецептор, ре-
активный к собственному белку, инактивируются пу-
тем делеции или анергии либо редактирования ре-
цептора в случае наличия аутореактивной В-клетки
2 — 6. Было показано, что АЛПС возникает напря-
мую вследствие мутации Fas-гена, что ведет к нару-
шению Fas-опосредованного апоптоза лимфоцитов.
Большинство других аутоиммунных заболеваний (та-
ких как СКВ, рассеянный склероз, ревматоидный арт-
рит и тиреоидит Хашимото) имеют многофакторную
природу; влияние может оказывать также и окружа-
ющая среда.
3 — б. Ревматоидный фактор обычно представляет
собой антитела IgM, реагирующие с детерминантами
на Fc-фрагменте IgG
4 — д. В развитии злокачественной миастении,
болезни Грейвса, СКВ и аутоиммунной гемолитиче-
ской анемии участвуют аутоантитела. Инсулинзависи-
мый диабет I типа опосредуется эффекторными Т-клет-
ками и аутоантителами.
5 — в. Красная волчанка повреждает кожу, почки,
сердце и суставы; ДНК может быть вовлечена в каче-
стве антигена, но это не связано с процессом мутаге-
неза Заболевание инициируется в основном антите-
лами и не считается классическим Т-клеточным забо-
леванием.
6 — в. Вмешательство в негативную селекцию ти-
моцитов оказывает влияние скорее на центральную,
чем на периферическую толерантность Т-клеток.
7 — д. Уменьшение (не увеличение) клиренса им-
мунных комплексов, что наблюдается при определен-
ных дефицитах комплемента, будет предрасполагать
индивидуума к аутоиммунному заболеванию.
ОТВЕТ НА СИТУАЦИОННУЮ ЗАДАЧУ
Наиболее вероятный диагноз — СКВ. Обычными
симптомами при этом аутоиммунном заболевании яв-
ляются: сыпи, болезненность в суставах (артрит), чув-
208
ГЛАВА 12. ТОЛЕРАНТНОСТЬ И АУТОИММУНИТЕТ
ствительность к солнечному свету, усиление выпаде-
ния волос и усталость. Однако СКВ может вызывать
серьезное повреждение почти любого органа, осо-
бенно почек. Какой-либо один тест не может опреде-
лить волчанку, но несколько тестов способны помочь
в диагностике. Для выявления наличия АНА в сыво-
ротке пациента обычно проводят соответствующее
исследование. У большинства больных СКВ тест на
АНА положителен. Существуют также анализы крови,
которые проводят для выявления таких специфичес-
ких аутоантител, как антитела к двухцепочечной ДНК и
рибонуклеарным белкам. Информативным является и
анализ крови, в котором определяется уровень комп-
лемента, поскольку у больных волчанкой его уровень
часто понижен, особенно при обострениях. Кроме
того, можно провести биопсию кожи и почек, если эти
органы повреждены.
Многие больные волчанкой отмечают, что симпто-
мы, особенно кожная сыпь, обостряются после пре-
бывания на солнце. Одна из получивших признание
теорий объясняет это тем, что повреждение, наноси-
мое ультрафиолетовым излучением, связано с усиле-
нием апоптоза. Как было показано, пузырьки жидко-
сти на поверхности апоптозных клеток содержат ауто-
антигены, такие как нуклеосомы, которые могут выз-
вать продукцию аутоантител.
Глава
13
КОМПЛЕМЕНТ
I ВВЕДЕНИЕ
Система комплемента, состоящая примерно из
30 белков, как циркулирующих, так и экспресси-
рованных на мембране, является важной эффек-
торной ветвью как врожденного, так и опосредо-
ванного антителами приобретенного иммунного
ответов. Термин «комлемент» появился в связи с
тем, что этот чувствительный к повышению тем-
пературы материал сыворотки крови был обнару-
жен по свойству «дополнять» способность анти-
тел уничтожать бактерии. Известно, что компле-
мент играет главную роль в защите от многих ин-
фекционных микроорганизмов. Наиболее важны-
ми составляющими его защитной функции явля-
ются: 1) выработка опсонинов — молекул, увеличи-
вающих способность макрофагов и нейтрофилов
к фагоцитозу (см. рис. 2.1); 2) выработка анафи-
латоксинов — пептидов, индуцирующих местные
и системные воспалительные реакции; 3) непос-
редственный киллинг микроорганизмов.
Известны и другие важные функции компле-
мента, такие как усиление антигенспецифических
иммунных ответов и поддержание гомеостаза (ста-
бильности внутри организма) путем удаления
иммунных комплексов и мертвых или умирающих
клеток. Мы знаем также, что нарушение контро-
ля над активацией комплемента может привести
к повреждению клеток и тканей организма.
Компоненты комплемента синтезируются в пече-
ни, а также клетками, участвующими в воспалитель-
ной реакции. Концентрация всех белков компле-
мента в циркулирующей крови составляет пример-
но 3 мг/мл. (Для сравнения: концентрация IgG в
крови составляет примерно 12 мг/мл; см. табл. 4.1.)
Концентрации некоторых компонентов комплемен-
та высоки (например, около 1 мг/мл для СЗ), в то
время как другие компоненты (такие как фактор
D и С2) присутствуют в следовых количествах.
В настоящей главе рассмотрено, как происхо-
дит активация комплемента, как она регулирует-
ся. Также рассказано о наиболее важных функ-
циях комплемента и заболеваниях, вызванных его
недостаточностью или несоответствующей акти-
вацией.
ПУТИ АКТИВАЦИИ КОМПЛЕМЕНТА
Начальные этапы активации комплемента за-
ключаются в последовательной каскадной акти-
вации одного за другим его компонентов. На этой
стадии активация одного компонента индуциру-
ет действие фермента, которое приводит к акти-
вации следующего по очереди компонента. По-
скольку одна активная молекула фермента спо-
собна расщеплять множество молекул субстрата,
этот каскад реакций усиливает относительно сла-
бый начальный сигнал. Эти каскадные свойства
системы комплемента аналогичны наблюдаемым
в других сывороточных каскадах, направленных
на образование сгустка и выработку кининов, сосу-
дистых медиаторов воспаления, описанных в гл. 2.
После активации отдельные компоненты рас-
щепляются на фрагменты, обозначаемые строч-
ными буквами. Меньший из расщепленных фраг-
ментов обычно обозначается буквой «а», боль-
ший — «Ь». Исторически сложилось, однако, что
больший из расщепленных фрагментов С2 обыч-
но относят к С2а, а меньший — к С2Ь. (Однако в
некоторых текстах и статьях фрагменты компо-
нентов комплемента С2 обозначаются обратным
способом.) Дальнейшие фрагменты расщепления
также обозначаются малыми буквами, например
C3d.
Известны три пути активации комплемента:
классический, лектиновый и альтернативный.
Начало каждого из путей активации характеризу-
210
ГЛАВА 13. КОМПЛЕМЕНТ
ется собственными компонентами и процесса-
ми распознавания, однако на более поздних ста-
диях во всех трех случаях используются одни и те
же компоненты. Свойства каждого пути актива-
ции и веществ, их активирующих, обсуждаются
далее.
Классический путь
Классический путь активации так называется по-
тому, что он был определен первым. Белковые
компоненты классического пути обозначаются С1,
С2, ..., С9. (Номера расставлены в том порядке,
в котором компоненты были открыты, а не в том,
в котором они активируются.) Комплексы анти-
ген— антитело являются основными активатора-
ми классического пути. Таким образом, последний
является главным эффекторным путем активации
гуморального адаптивного иммунного ответа. Дру-
гими активаторами являются некоторые вирусы,
погибшие клетки и внутриклеточные мембраны
(например, митохондрий), агрегаты иммуногло-
булинов и [3-амилоид, обнаруживаемый при бо-
лезни Альцгеймера в бляшках. С-реактивный бе-
лок является белком острой фазы — компонен-
том воспалительной реакции; он прикрепляется
к полисахариду фосфорил хол и ну, экспрессирован-
ному на поверхности многих бактерий (например.
Streptococcus pneumoniae), и тоже активирует клас-
сический путь.
Классический путь инициируется, когда С1
прикрепляется к антителу в комплексе антиген —
антитело, например антителу, связанному с ан-
тигеном, экспрессированным на поверхности бак-
терии (рис. 13.1). Компонент С1 представляет
собой комплекс из трех различных белков: Clq
(содержащего шесть одинаковых субкомпонентов),
связанного с двумя молекулами (причем каждой
по две) — С1г и Cis. При активации С1 его гло-
булярные участки — субкомпоненты Clq — свя-
зываются с Clq-специфичным участком на Fc-
фрагментах или одного IgM, или двух близко рас-
положенных молекул IgG, связанных с антигеном
(связывание IgG показано на рис. 13.1). Таким
образом, антитела IgM и IgG являются эффек-
тивными активаторами комплемента. Иммуногло-
булины человека, обладающие способностью свя-
зываться с С1 и активировать его, в порядке умень-
шения этой способности располагаются: IgM >
> IgG3 > IgG 1 » IgG2. Иммуноглобулины IgG4,
IgD, IgA и IgE не взаимодействуют c Clq. не зак-
репляют и не активируют его, т.е. не активируют
комплемент по классическому пути.
После связывания С1 с комплексом антиген —
антитело Cis приобретает ферментативную актив-
ность. Эта активная форма известна как Cls-эс-
тераза. Она расщепляет следующий компонент
классического пути — С4 — на две части: С4а и
С4Ь. Меньшая часть — С4а — остается в раство-
ренном состоянии, а С4Ь ковалентно связывается
с поверхностью бактерии или другой активиру-
ющей субстанцией. Часть С4Ь, прикрепленная к
поверхности клетки, затем связывает С2, который
расщепляется Cis. При расщеплении С2 получа-
ют фрагмент С2Ь, который остается в растворен-
ном состоянии, и С2а В свою очередь С2а при-
крепляется к С4Ь на поверхности клетки с обра-
зованием комплекса С4Ь2а. Этот комплекс назы-
вается СЗ-конвертазой классического пути, по-
скольку, как мы увидим позднее, этот фермент
расщепляет следующий компонент — СЗ.
Пектиновый путь
Лектиновый путь активируется концевыми остат-
ками маннозы в белках и полисахаридах, нахо-
дящихся на поверхности бактерии. Эти остатки
не обнаруживаются на поверхности клеток мле-
копитающих, поэтому лектиновый путь может
рассматриваться в качестве средства распознава-
ния своего и чужого. Поскольку этот путь акти-
вации не требует присутствия антител, он явля-
ется частью системы врожденной иммунной за-
шиты.
На рис. 13.1 показано, как бактериальные ман-
нозные остатки связываются с циркулирующим
комплексом маннозосвязывающего лектина (МСЛ;
по структуре схожий с Clq классического пути)
и двумя ассоциированными протеазами, назы-
ваемыми маннозассоциированными сериновыми
протеазами (МАСП-1 и -2). Это связывание ак-
тивирует МАСП-1 для последующего расщепле-
ния компонентов классического пути комплемен-
та — С4 и С2 с формированием С4Ь2а, СЗ-кон-
вертазы классического пути на поверхности бак-
терий. А МАСП-2 обладает способностью напря-
мую расщеплять СЗ. Таким образом, лектино-
вый путь после фазы активации СЗ аналогичен
классическому.
Альтернативный путь
Альтернативный путь активации комплемента за-
пускается почти любой чужеродной субстанцией
К наиболее изученным веществам относятся ли-
пополисахариды (ЛПС, также известные как эн-
дотоксины клеточной стенки грамотринательных
бактерий), клеточные стенки некоторых дрожжей
и белок, находящийся в яде кобры (фактор яда
кобры). Некоторые агенты, активирующие клас-
сический путь, — вирусы, агрегаты иммуноглобу-
линов и мертвые клетки, запускают также и аль-
тернативный путь. Активация происходит в от-
сутствие специфических антител. Таким образом,
альтернативный путь активации комплемента яв-
ляется эффекторной ветвью системы врожденной
иммунной защиты. Некоторые компоненты аль-
тернативного пути характерны только для него
{сывороточные факторы Ви Dh пропердин, извест-
ПУТИ АКТИВАЦИИ КОМПЛЕМЕНТА
211
С2а
С1
fl С4а С2Ь Формирование
МСЛ + МАСП1
и МАСП2
• Рис. 13.1. Запуск классического, лектинового и альтернативного путей. Демонстрация активации
каждого пути и формирования СЗ-конвертазы
Формирование
СЗ-конвертазы
Связывание
и стабилизация
пропердина
ный также как фактор Р), в то время как другие
(СЗ, СЗЬ, С5, С6, С7, С8 и С9) являются общими
с классическим путем.
Компонент СЗЬ появляется в крови в неболь-
ших количествах после спонтанного расщепления
реактивной тиоловой группы в СЗ. Этот «предсу-
ществуюший» СЗЬ способен связываться с гидро-
ксильными группами белков и углеводов, экс-
прессированных на клеточных поверхностях (см.
рис. 13.1). Накопление СЗЬ на поверхности клет-
ки инициирует альтернативный путь. Оно может
происходить как на чужеродной, так и на соб-
ственной клетке организма; таким образом, с точ-
ки зрения альтернативного пути он всегда запу-
щен. Однако, как указано более детально далее,
собственные клетки организма регулируют тече-
ние реакций альтернативного пути, в то время как
чужеродные не обладают такими регуляторными
способностями и не могут предотвратить разви-
тие последующих событий альтернативного пути.
На следующей стадии альтернативного пути
сывороточный белок, фактор В. соединяется с СЗЬ
на поверхности клетки с формированием комп-
лекса СЗЬВ. Затем фактор D расщепляет фактор В,
212
ГЛАВА 13. КОМПЛЕМЕНТ
который находится на поверхности клетки в комп-
лексе СЗЬВ, в результате чего образуется фраг-
мент Ва, который высвобождается в окружающую
жидкость, и ВЬ, остающийся связанным с СЗЬ.
Этот СЗЬВЬ является СЗ-конвертазой альтерна-
тивного пути, которая расщепляет СЗ на СЗа и
СЗЬ.
Обычно СЗЬВЬ быстро растворяется, но может
стабилизироваться при соединении с пропердином
(см. рис. 13.1). В результате стабилизированный
пропердином СЗЬВЬ способен связываться и рас-
щеплять большое количество СЗ за очень корот-
кое время. Накопление на клеточной поверхно-
сти этих быстро образованных в большом количе-
стве СЗЬ приводит к почти «взрывному» запуску
альтернативного пути. Таким образом, связыва-
ние пропердина с СЗЬВЬ создает петлю усиления
альтернативного пути. Как указано далее, способ-
ность пропердина активировать петлю усиления
контролируется противоположным действием ре-
гуляторных белков. Следовательно, активация
альтернативного пути не происходит постоянно.
Активация СЗ и С5
Расщепление СЗ является основной фазой для всех
трех путей активации. На рис. 13.2 показано, что
СЗ-конвертазы при классическом и альтернатив-
ном путях (С4Ь2а и СЗЬВЬ соответственно) рас-
щепляют СЗ на два фрагмента. Более мелкий СЗа
является растворимым белком анафилатоксином\
он активирует клетки, участвующие в реакции вос-
паления. Больший фрагмент, СЗЬ, продолжает
процесс активации каскада комплемента, связы-
ваясь с клеточными поверхностями вокруг места
активации. Как показано далее, СЗЬ также уча-
ствует в защите организма, воспалении и иммун-
ной регуляции.
Связывание СЗЬ с СЗ-конвертазами как при
классическом, так и альтернативном путях ини-
циирует связывание и расщепление следующего
компонента — С5 (см. рис. 13.2). По этой причи-
не СЗ-конвертазы, связанные с СЗЬ, относятся к
С5-конвертазам (С4Ь2аЗЬ при классическом пути;
СЗЬВЬЗЬ при альтернативном). При расщеплении
С5 образуются два фрагмента. Фрагмент С5а вы-
свобождается в растворимой форме и является ак-
тивным анафилатоксином. Фрагмент С5Ь связы-
вается с клеточной поверхностью и формирует ядро
для связи с терминальными компонентами комп-
лемента, описываемыми в следующем подразделе.
Терминальный путь
Терминальные компоненты каскада комплемен-
та — С5Ь, С6, С7, С8 и С9 — являются общими
для всех путей активации. Они связываются друг
с другом и формируют мембраноатакующий комп-
лекс (МАК), который вызывает лизис клетки
(рис. 13.3).
Первой фазой формирования МАК является
прикрепление С6 к С5Ь на поверхности клетки.
Затем С7 связывается с С5Ь и С6 и проникает в
наружную мембрану клетки. Последующее свя-
зывание С8 с С5Б67 приводит к образованию комп-
лекса, глубже проникающего в мембрану клетки.
КЛАССИЧЕСКИЙ
И ЛЕКТИНОВЫЙ ПУТИ
АЛЬТЕРНАТИВНЫЙ
ПУТЬ
• Рис. 13.2. Расщепление компонента СЗ СЗ-конвертазой и компонента С5 С5-конвертазой при
классическом и лектиновом (наверху) и альтернативном (внизу) путях. Во всех случаях СЗ рас-
щепляется на СЗЬ, который откладывается на клеточной поверхности, и СЗа, высвобождаемый
в жидкую среду. Таким же образом С5 расщепляется на С5Ь, который откладывается на клеточ-
ной поверхности, и С5а, высвобождаемый в жидкую среду
РЕГУЛЯЦИЯ АКТИВНОСТИ КОМПЛЕМЕНТА
213
• Рис. 13.3. Формирование мембраноатакующего комплекса Компоненты комплемента позд-
ней фазы - С5Ь-С9 - последовательно соединяются и формируют на поверхности клетки
комплекс. Многочисленные С9-компоненты прикрепляются к этому комплексу и полимери-
зуются с образованием поли-С9, создавая канал, который пронизывает клеточную мембрану
На мембране клетки C5b —С8 действует как ре-
цептор для С9 — молекулы типа перфорина (см.
гл. 10), который связывается с С8. Дополнитель-
ные молекулы С9 взаимодействуют в комплексе с
молекулой С9, образуя полимеризованные С9
(поли-С9). Эти поли-С9 формируют трансмемб-
ранный канал, нарушающий осмотическое рав-
новесие в клетке: через него проникают ионы и
поступает вода. Клетка набухает, мембрана ста-
новится проницаемой для макромолекул, кото-
рые затем покидают клетку. В результате проис-
ходит лизис клетки.
• РЕГУЛЯЦИЯ АКТИВНОСТИ
КОМПЛЕМЕНТА
Бесконтрольная активация комплемента может
быстро истощить запас его компонентов, и орга-
низм будет неспособен удалить инфицирующие
агенты. Кроме того, как указано ранее в этой гла-
ве, активация комплемента приводит к появле-
нию активных фрагментов (особенно продуктов
расщепления СЗ, С4 и С5), которые вызывают
сильные воспалительные реакции с целью устра-
нения инфицирующих агентов. Однако чрезмер-
ная активность этих реакций может нанести вред
организму. Действительно, считается, что акти-
вация комплемента играет отрицательную роль
при таких заболеваниях, как болезнь Альцгейме-
ра (мы уже указывали на ее связь с активацией
классического пути р-амилоидом), при наличии
аутоантител, а также инфаркте, ишемии и репер-
фузии (см. далее в этой главе).
Обычно неадекватная активация комплемента
не наступает, поскольку на разных стадиях акти-
вации действуют специфические ингибиторы. Зна-
чение этих регуляторов комплемента подчерки-
вается наличием клинических расстройств, воз-
никающих при отсутствии таких регуляторных мо-
лекул, что будет описано в конце этой главы. При
таких расстройствах развивается повышенная чув-
ствительность к инфекционным заболеваниям или
усиливается повреждение тканей при реакциях
воспаления.
Многие молекулы, регулирующие активность
комплемента, экспрессируются на поверхности
клеток млекопитающих, но не на микробных клет-
ках. Соответственно, регуляторы активности ком-
племента ограничивают повреждение, наносимое
организму, направляя активированные компонен-
ты комплемента на устранение микробных пато-
генов. Наиболее важные регуляторы активации
комплемента будут описаны далее.
Первый этап активации классического пути
комплемента подавляется ингибитором С1-эсте-
разы (Clq-инг), который связывается с С1 г и Cis,
отделяя их от Сlq и препятствуя активации ком-
племента. Недавние исследования показали, что
Clq-инг также регулирует альтернативный путь,
подавляя функцию СЗЬВЬ, и лектиновый путь, по-
давляя МАСП-1 и МАСП-2. Как показано далее,
Clq-инг также подавляет функцию ферментов дру-
гих сывороточных каскадов, вовлеченных в гемо-
коагуляцию и выработку кининов — активных ме-
диаторов, действующих на сосуды. На рис. 13.4, А
показано, что некоторые белки регулируют дей-
ствие СЗ-конвертазы классического пути, С4Ь2а,
путем прикрепления к С4Ь и замены С2а — акти-
вированного ферментного компонента — в комп-
лексе. Эти регуляторы являются белками сыво-
ротки крови. К ним относят С4Ь-связывающий
белок (С4Ь-СБ), а также широко распространен-
ные на клеточной поверхности молекулы факто-
ра, ускоряющего диссоциацию (ФУД; CD55), мем-
бранного кофакторного белка (МКБ; CD46) и ком-
понент клеточной поверхности рецептор комплемен-
та 1 (CR1; CD35). На рис. 13.4, А также показан
другой сывороточный протеин — фактор 7, рас-
щепляющий С4Ь на поверхности клетки после вы-
теснения С2а. Белки С4Ь-СБ, МКБ и CR1 отно-
сят к кофакторам расщепления, опосредуемого
фактором I, поскольку для расщепления С4Ь
фактором I необходимо наличие одной или более
этих молекул. (Заметьте, что ФУД приводит к дис-
социации комплекса С4Ь2а, но не действует в ка-
честве кофактора для фактора I.) Фактор I рас-
щепляет С4Ь на два фрагмента: С4с, высвобожда-
емый в растворимой форме, и C4d, который ос-
тается прикрепленным к поверхности клетки.
Фрагменты С4с и C4d не участвуют в каскадной
214
ГЛАВА 13. КОМПЛЕМЕНТ
клетки С4ЬС2а С4Ь
А
АЛЬТЕРНАТИВНЫЙ ПУТЬ
Поверхность CR1 МКБ
клетки
Диссоциация
СЗЬВЬ
Расщепление
СЗЬ
• Рис. 13.4. Находящиеся в растворимой фазе и прикрепленные к поверхности клетки регуляторы СЗ-конвертазы при
классическом (наверху) и альтернативном (внизу) путях. Регуляторы могут вызвать диссоциацию конвертазы, расще-
пить компонент комплемента, остающийся на поверхности клетки, или действовать в качестве кофактора при таком рас-
щеплении. Белок, связывающий С4, является регулятором только классического пути, а фактор Н - альтернативного
Фактор I, ФУД, CR1 и МКБ регулируют оба пути
активации комплемента, и их биологическая роль
неизвестна.
Активация комплемента по альтернативному
пути также регулируется. Сывороточный белко-
вый фактор Я выполняет здесь две важные регу-
ляторные функции. Первая заключается в том, что
он конкурирует с ранее описанным фактором В
за прикрепление к СЗЬ на клеточной поверхнос-
ти (см. рис. 13.1). Фактор В, связываясь с СЗЬ,
продолжает активацию комплемента, однако если
к СЗЬ присоединяется фактор Н, этот процесс
останавливается. Природа поверхности, к кото-
рой прикрепляется СЗЬ, важна для определения
того, какой из факторов связывается с СЗЬ. Сиа-
ловая кислота, покрывающая поверхность клеток
млекопитающих, способствует прикреплению
фактора Н, в то время как поверхности бактери-
альных клеток, на которых сиаловая кислота от-
сутствует, способствуют прикреплению факто-
ра В к СЗЬ. В результате клетки млекопитающих
оказываются защищенными благодаря регулятор-
ной функции фактора Н, в то время как на бакте-
риальных клетках проявляют свое действие акти-
вированные факторы комплемента.
На рис. 13.4, Б показана вторая функция фак-
тора Н: он связывается с СЗЬ в составе СЗ-кон-
вертазы альтернативного пути (СЗЬВЬ) и вытес-
няет ВЬ, предотвращая дальнейшую активацию
комплемента. Как только фактор Н связывается
с СЗЬ, ранее описанный фактор I расщепляет СЗЬ;
таким образом, фактор Н является кофактором
для расщепления как СЗЬ, так и С4Ь, опосредо-
ванного фактором I. Фрагмент СЗЬ последователь-
но расщепляется сначала до iC3b, а затем еще на
два дополнительных фрагмента: СЗс. высвобож-
дающийся в растворимой форме и не выполняю-
щий биологические функции, и C3d, который
остается прикрепленным к поверхности клетки.
Продукты распада iC3b, СЗс и C3d не участвуют в
каскадной активации комплемента, однако, как
видно далее, iC3b и C3d обладают важными био-
логическими функциями. На рис. 13.4, Б также
показано, что конвертаза альтернативного пути
СЗЬВЬ регулируется теми же регуляторными мо-
лекулами на поверхности клетки (ФУД, МКБ и
CR1), которые подавляют функцию и СЗ-кон-
вертазы классического пути С4Ь2а.
Терминальный путь активации комплемента
и формирование МАК также регулируются. По-
скольку связь С5Ь с клеточными мембранами яв-
ляется относительно неспецифической, ассоци-
ация компонентов терминального пути С6 —С9
с С5Ь на поверхности клетки будет формировать
МАК, который способен повредить или лизиро-
вать «невинные посторонние» клетки. Предотв-
ращают такое развитие событий белки, как свя-
занные с мембраной, так и находящиеся в ра-
створимой форме. Широко распространенный
мембранный белок CD59 предотвращает лизис
путем связывания с С5Ь8 на поверхности клетки
и препятствуя полимеризации С9. S-белок (витро-
нектин) и SP-40,40 (кластерин) являются раство-
БИОЛОГИЧЕСКИЕ ЭФФЕКТЫ КОМПЛЕМЕНТА
215
римыми белками, которые прикрепляются к гид-
рофобным участкам С5Ь6, С5Ь67, С5Ь678 и С566789
и предотвращают их взаимодействие с мемб-
ранами.
• БИОЛОГИЧЕСКИЕ ЭФФЕКТЫ
КОМПЛЕМЕНТА
Основные функции системы комплемента пред-
ставлены в общем виде на рис. 13.5 и 13.6.
Образование опсонинов
Наиболее важной защитной реакцией комплемен-
та считается продукция фрагментов, обладающих
активностью опсонинов, которые накапливаются
на поверхности патогенов. Основными опсонина-
ми являются СЗЬ и С4Ь, однако iC3b — фрагмент
СЗЬ, не активирующий комплемент, также обла-
дает такой активностью (см. рис. 13.5). Бактерии,
покрытые опсонинами, быстро захватываются и
уничтожаются фагоцитирующими клетками, та-
кими как макрофаги и нейтрофилы. Эти клетки
экспрессируют рецепторы CR1, CR3 и CR4, ко-
торые обладают широкой специфичностью от-
носительно опсонинов, образовавшихся при ак-
тивации комплемента, и других компонентов
комплемента. Роль CR1 в регуляции активации
комплемента была описана ранее в этой главе.
В табл. 13.1 перечислены названия, функции ре-
цепторов для компонентов комплемента, а так-
же клетки, на которых они экспрессируются. В
таблице представлен широкий спектр клеток, с
которыми взаимодействуют компоненты комп-
лемента.
Лизис клеток
C5b—С9 = мембраноатакующий
комплекс
Бактерия
Смерть клетки
Опсонизация
СЗЬ, iC3b
CR1,CR3
или CR4
Продукция
анафилатоксинов
(Активация Гладкая
комплемента мышца
Сокращение
гладкой мышцы
С5а, СЗа, С4а
Дегрануляция тучной
клетки с высвобождением
вазоактивных субстанций
Активированный
нейтрофил
Активированный
макрофаг
• Рис. 13.5. Основные функции комплемента (1): продукция опсонинов, анафилатоксинов и лизис клеток
216
ГЛАВА 13. КОМПЛЕМЕНТ
Образование анафилатоксинов
Анафилатоксинами называются компоненты ком-
племента СЗа, С4а и С5а. Это небольшие пепти-
ды, которые участвуют в воспалительной реакции,
являющейся частью защитной системы организ-
ма, предназначенной для устранения инфициру-
ющего агента, проникшего в ткани. Наиболее ак-
тивным является компонент С5а, за ним следует
СЗа, а наименее активен С4а. Название «анафи-
латоксин» связано с функцией этих компонентов.
благодаря которой их открыли, — способности
индуцировать симптомы шока при системной
аллергической или анафилактической реакции
(см. гл. 14).
Анафилатоксины взаимодействуют с рецепто-
рами, экспрессированными на клетках различ-
ных типов (см. табл. 13.1). Они активируют клет-
ки сосудистого эндотелия, выстилающие стенки
кровеносных сосудов, повышая их проницаемость
и способствуя локальному накоплению жидко-
сти в тканях (отек) (см. рис. 13.5). Выход в ткань
Усиление В-клеточных ответов
Фолликулярная дендритная
клетка в зародышевом центре
1. Память
2. Активация В-клеток
Удаление иммунных комплексов
аАдА Распад
1Ген^ ► ◄ >
rYYrY
СЗЬ СЗЬ
Yr
СЗЬ
Устранение мертвых клеток
и внутриклеточных мембран
Мертвая
клетка
Митохондрия
Нейтрофил
Избавление
от мертвых
клеток
и мембран
Противовирусный ответ
путь
• Рис. 13.6. Основные функции комплемента (2): усиле-
ние В-клеточных ответов, иммунных комплексов, устра-
нение мертвых клеток и внутриклеточных мембран, а так-
же участие в противовирусном ответе
БИОЛОГИЧЕСКИЕ ЭФФЕКТЫ КОМПЛЕМЕНТА
217
• Таблица 13.1. Рецепторы комплемента
Рецептор комплемента Распределение на клетках Связываемый компонент комплемента Функция рецептора
CR1 (CD35) Эритроциты, моноциты, макрофаги, эозинофилы, нейтрофилы, В-клетки, некоторые Т-клетки, фолликулярные дендритные клетки и тучные клетки СЗЬ. iC3b. СЗс и С4Ь Усиливают фагоци- тоз, регулируют ак- тивацию компле- мента
CR2 (CD21) Поздние предшественники и зрелые В-лимфоциты, некоторые Т-клетки (включая тимоциты) и фолликулярные тендритные клетки СЗЬ, iC3b и C3d Усиливают актива- цию В-клеток бак- териями
CR3 (CDllb/CD18, также извест- ный как Мас-1) Моноциты, макрофаги, натуральные киллеры и гранулоциты iC3b (и многие не относящи- еся к комплементу компонен- ты, включая бактериальные липополисахариды и другие поверхностные молекулы, зимозан и фибриноген) Усиливают фаго- цитоз
CR4 (CD11C/CD18) Миелоидные клетки, дендритные клетки, активированные В-клетки, натуральные киллеры, некоторые цитотоксические лимфоциты и тромбоциты iC3b (и многие лиганды, не относящиеся к компле- менту, сходные с CR3) Усиливают фаго- цитоз
СЗа-рецептор Тромбоциты, тучные клетки, макрофаги, нейтрофилы, базофилы, эозинофилы, моноциты и эндотелиальные клетки СЗа Участвует в анафи- латоксической реакции
С5а-рецептор (CD88) Гранулоциты, тромбоциты, тучные клет- ки. клетки паренхимы печени, гладкие мышцы сосудов легких, эндотелий, астроциты и клетки микроглии мозга С5а Участвует в анафи- латоксической реакции
жидкости, содержащей фагоцитирующие клет-
ки, макрофаги и нейтрофилы, антитела и ком-
поненты комплемента, усиливает реакцию на
патоген.
Анафилатоксины также обладают хемотак-
сическими свойствами в отношении нейтрофи-
лов, т.е. клетки мигрируют из одной области в
другую с учетом возрастания концентрации ана-
филотоксина В результате нейтрофилы, цирку-
лирующие в кровеносном русле, активируются
и выходят в ткани в участке воспаления, где раз-
рушают чужеродное вещество. Анафилатокси-
ны также вызывают сокращение гладкой муску-
латуры.
Взаимодействие анафилатоксинов с базофила-
ми или тучными клетками в тканях приводит к
высвобождению многочисленных медиаторов вос-
паления, включая гистамин. И гистамин, и ана-
филатоксины усиливают проницаемость сосудов
и сокращение гладкой мускулатуры.
Лизис клеток
Последней стадией всех трех путей активации
комплемента является формирование МАК на
поверхности клетки. Он вызывает лизис клеток,
в частности микробных патогенов (см. рис. 13.5).
Усиление ответа В-лимфоцитов
на антигены
Важными эффекторными молекулами при устра-
нении патогенов являются антитела. Компонен-
ты комплемента усиливают реакцию антител раз-
личными путями и таким образом способствуют
устранению микроорганизмов (см. рис. 13.6).
1. Взаимодействие фрагмента комплемента C3d и
CR2 с микробным антигеном усиливает ответ
В-клетки на антиген. Антиген, связанный с IgM
на поверхности В-клетки, способен связываться
с молекулой C3d, образованной в процессе акти-
вации комплемента по любому из путей. Молеку-
ла C3d также может прикрепляться к молекуле
CR2 на поверхности В-клетки (CD21), которая
вместе с CD 19 и CD81 формирует часть корецеп-
торного сигнального комплекса, ассоциированно-
го с В-клеточным антигенным рецептором (об-
суждается в гл. 10). Таким образом, перекрестное
связывание антигена с IgM и CD3d на поверхно-
сти В-клетки обеспечивает одновременную пода-
чу В-клетке двух активирующих сигналов. Резуль-
таты исследований указывают, что при перекрест-
ном связывании C3d снижается порог для акти-
вации В-клетки антигеном, поэтому для инициа-
ции В-клеточного ответа требуется гораздо мень-
218
ГЛАВА 13. КОМПЛЕМЕНТ
ше антигена, чем при отсутствии C3d. 2. Процес-
сирование В-клеткой Т-зависимых антигенов про-
исходит быстрее, когда антиген прикреплен к C3d,
чем при отсутствии такой связи. Возможно, при-
крепление C3d к CR2 на поверхности В-клетки
усиливает захват и процессирование антигена.
Этот механизм может быть одним из способов,
с помощью которого комплемент усиливает В-кле-
точный ответ на Т-зависимые антигены. 3. Комп-
лемент также участвует в индукции иммунологи-
ческой памяти: молекулы C3d, ковалентно свя-
занные с антигеном в иммунных комплексах, за-
хватываются в зародышевых центрах фолликуляр-
ными дендритными клетками, экспрессирующи-
ми CR2 (см. рис. 13.6 и гл. 7). Этим обеспечива-
ется длительное сохранение антигена в лимфоид-
ной ткани.
Контроль за формированием
и удалением иммунных комплексов
После того как антитела связываются с мультива-
лентными антигенами, перекрестное связывание
молекул может приводить к образованию больших
комплексов антиген — антитело, которые увеличи-
ваются в размерах до тех пор, пока не перестают
быть растворимыми. Хотя такая преципитация
комплексов используется при идентификации ан-
тигенов и антител в лабораторных условиях (см
гл. 5), формирование крупных нерастворимых ком-
плексов неблагоприятно для организма. Как ука-
зано в последнем подразделе данной главы, у лю-
дей с дефицитом первых компонентов классиче-
ского пути могут формироваться нерастворимые
иммунные комплексы в таких тканях, как кожа и
почки. Подобные комплексы индуцируют воспа-
ление и повреждение окружающих клеток.
Отложение СЗЬ на крупных комплексах анти-
ген-антитело разрушает связи, удерживающие
комплекс в целости (см. рис. 13.6). В результате
комплекс распадается на более мелкие части, ко-
торые могут удаляться макрофагами. Отложение
СЗЬ на комплексах антиген — антитело также поз-
воляет им закрепиться на эритроцитах, которые
экспрессируют на своей поверхности рецептор
CR1. Эритроциты устраняют комплексы из кро-
вотока, перенося их по сосудистой системе в пе-
чень и селезенку. В этих органах комплексы пе-
ремещаются с эритроцитарных рецепторов CR1
на макрофагальные CR3 и Fc-рецепторы. После
этого макрофаги фагоцитируют комплексы и раз-
рушают их.
Удаление мертвых
и погибающих клеток
Клетки, погибающие путем некроза, могут акти-
вировать комплемент, что приведет к отложению
на их поверхности С4Ь и СЗЬ. Это позволяет уда-
лить клетку при взаимодействии с CR1 или CR3
на фагоцитирующих клетках (см. рис. 13.6). Внут-
риклеточные мембраны органелл, таких как ми-
тохондрии или эндоплазматический ретикулум,
также непосредственно активируют как класси-
ческий, так и альтернативный пути и удаляются
сходным образом. С-реактивный белок, белок
острой фазы воспаления, который упомянут ра-
нее в этой главе, также прикрепляется к повреж-
денным и некротическим клеткам и активирует
классический путь комплемента. Структурой, к
которой прикрепляется С-реактивный белок на
поверхности бактериальной клетки, является по-
лисахарид фосфорилхолин. Он также появляется
на поверхности поврежденных или некротических
клеток. Результаты недавних исследований ука-
зывают на то, что клетки, погибающие путем апоп-
тоза, также могут активировать комплемент. Во
всех этих случаях комплемент удаляет мертвые или
умирающие клетки из тканей и участвует в под-
держании гомеостаза.
При некоторых условиях, однако, активация
комплемента мертвыми или умирающими клет-
ками может иметь неблагоприятные клинические
последствия. Важным примером является случай,
когда комплемент активируется при ишемии и ре-
перфузии. При ишемии в результате прекращения
поступления крови или кислорода участок ткани
погибает (например, сердечная ткань после ин-
фаркта или мозговая ткань после инсульта). Ре-
перфузия же является попыткой восстановить
циркуляцию крови в ткани. Воспалительные ре-
акции и активация комплемента считаются глав-
ными факторами, повреждающими здоровую
гкань в таких случаях. В настоящее время для
уменьшения повреждающего действия воспали-
тельной реакции в этих условиях разрабатывает-
ся метод лечения на основе воздействия на комп-
лемент.
Реакции на вирусы
Комплемент играет существенную роль в защите
от вирусной инфекции (см. рис. 13.6). Фрагмент
С1 может непосредственно связываться с поверх-
ностью некоторых вирусов, таких как ретровиру-
сы типа С, лентивирусы, ВИЧ-1 и HTLV-1, и ак-
тивироваться на них. Кроме того, активация ком-
племента по лектиновому пути происходит при
связывании МСЛ с маннозными остатками на
поверхности ВИЧ-1, ВИЧ-2 и вирусов гриппа.
Антитела против этих вирусов также связываются
с поверхностью вирусной частицы и участвуют в
дальнейшей активации классического пути. По-
вторяющиеся субфрагменты в структуре вирусно-
го капсида или поверхностных мембран также ак-
тивируют альтернативный путь. Связывание бел-
ков комплемента ведет к опсонизации вируса и
лизису вириона. Связывание комплемента также
влияет на способность вируса взаимодействовать
НЕДОСТАТОЧНОСТЬ КОМПЛЕМЕНТА
219
с мембраной клетки-мишени, блокируя проник-
новение вируса в клетку.
Многие вирусы ускользают от действия бел-
ков комплемента. Например, некоторые вирусы
вырабатывают белки, которые напоминают функ-
циональные ингибиторы комплемента: вирус гер-
песа вырабатывает белки, обладающие активно-
стью, сходной с ФУД и/или МКБ, другие же бло-
кируют формирование C5b —С9. Кроме того, ви-
рус коровьей оспы вырабатывает белок, который
прикрепляется к СЗЬ и С4Ь и подавляет актива-
цию комплемента. Он ускоряет расщепление ком-
понентов комплемента и действует как кофактор
для фактора I. Вирус иммунодефицита человека 1,
HTLV-1, вирус иммунодефицита обезьян (SIV) и
цитомегаловирус (CMV) захватывают белки, кон-
тролирующие активность комплемента, — ФУД,
МКБ и CD59, когда вирионы отпочковываются
от мембран клеток организма. В результате этого
вирусы оказываются защищенными от лизиса,
опосредованного комплементом, таким же обра-
зом, как защищены клетки организма.
Некоторые вирусы прикрепляются к рецепто-
рам комплемента и через них получают доступ в
клетки. В этом смысле одним из наиболее изу-
ченных взаимодействий является инфицирование
В-лимсЬоцитов вирусом Эпштейна —Барр: глико-
протеин вирусной мембраны gp350/220 прикреп-
ляется к CR2 (CD21), экспрессированному на по-
верхности В-клетки, что предоставляет вирусу воз-
можность проникнуть в клетку. Некоторые виру-
сы активируют комплемент и используют СЗЬ, на-
капливающийся на них, для того чтобы прикре-
питься к рецептору комплемента на клетке орга-
низма; так, ВИЧ-1 использует CR1, CR2 и CR3
для того, чтобы инфицировать Т-клетки, В-клетки
и моноциты. Другие вирусы связываются с регуля-
торами комплемента, экспрессированными на
мембране: для инфицирования эпителиальных
клеток парамиксовирусы (вирусы кори) использу-
ют МКБ, а вирусы семейства пикорнавирусов —
ФУД.
В НЕДОСТАТОЧНОСТЬ КОМПЛЕМЕНТА
Как указано ранее, система комплемента играет
важную роль в защите организма от микробов. Ее
особое значение заключается в защите от бакте-
рий, называемых пиогенными (продуцирующими
гной), таких как штаммы Neisseria (бактерии, вы-
зывающие менингит и некоторые болезни, переда-
ющиеся половым путем), Streptococcus pneumoniae.
Haemophilus influenzae и Staphylococcus aureus. Ос-
новным способом защиты от этих микроорганиз-
мов является выработка антител IgG, которые свя-
зываются с бактериями, что сопровождается ак-
тивацией комплемента, опсонизацией, фагоцито-
зом и внутриклеточным киллингом. Таким обра-
зом, в ситуациях, когда какая-либо из перечис-
ленных активностей подавлена из-за генетических
нарушений или приобретенных заболеваний, раз-
вивается повышенная чувствительность к этим
микроорганизмам. Кроме того, уже было указа-
но, как важен комплемент для выведения из цир-
куляции иммунных комплексов. В этом подраз-
деле обсуждается, как дефицит определенных ком-
понентов комплемента может привести к депо-
нированию иммунных комплексов в тканях, что
вызывает воспаление и развитие аутоиммунных
заболеваний.
Люди с генетически обусловленным дефици-
том определенных компонентов комплемента
встречаются относительно редко (примерно один
случай на 10000 чел.), кроме того, дефициты не
всегда приводят к заболеваниям. Заболевания,
обусловленные дефицитом компонентов компле-
мента, регуляторных белков комплемента и ре-
цепторов комплемента, указаны в табл. 13.2.
Дефицит любого из компонентов классического
пути — Cl, С4 или С2 — определяет повышен-
ную предрасположенность к аутоиммунным за-
болеваниям, таким как СКВ (см. гл. 12). Эта пред-
расположенность к СКВ является следствием на-
рушения способности к процессированию и уда-
лению иммунных комплексов. Характерно, что
при СКВ в почках вдоль базальной мембраны гло-
мерул накапливаются нерастворимые иммунные
комплексы. У людей с дефицитом одного из этих
компонентов также повышен риск инфекций,
вызываемых пиогенными бактериями, хотя он и
не столь высок, как при дефиците компонентов
поздней фазы или альтернативного пути. Это го-
ворит о том, что при защите от этих бактерий
активация комплемента по классическому пути
может иметь не столь важное значение, как акти-
вация по альтернативному пути.
Дефицит СЗ наблюдается редко, но может быть
тяжелым и даже угрожающим жизни, поскольку
СЗ является центральным компонентом всех пу-
тей активации комплемента. Люди с дефицитом
СЗ подвержены рецидивирующим пиогенным
инфекциям; у них также могут развиваться вос-
палительные расстройства, связанные с циркули-
рующими иммунными комплексами, такие как
мембранозно-пролиферативный гломерулонефрит
(воспаление капиллярных петель в гломерулах
почек, характеризующееся утолщением стенок
капилляров и увеличением количества клеток).
Дефицит компонентов альтернативного пути —
пропердина или факторов В или D — связан с
возникновением пиогенных инфекций, особен-
но вызываемых Neisseria. Дефицит МСЛ может
представлять большую проблему на раннем пе-
риоде жизни, проявляясь тяжелыми рецидиви-
рующими инфекциями. Индивидуумы с дефици-
том компонентов МАК C5b —С9 имеют склон-
ность к рецидивирующим инфекциям, вызывае-
мым Neisseria.
Тяжелые клинические последствия может иметь
дефицит (или дефект) как рецепторов комплемен-
та, так и регуляторных белков. У больных с де-
220
ГЛАВА 13. КОМПЛЕМЕНТ
• Таблица 13.2. Недостаточность комплемента
Дефицит компонента комплемента Влияние на функцию комплемента Клиническое состояние
Cl, С4 или С2 Не активируется классический путь Пиогенные инфекции, аутоиммунные заболевания (СКВ)
СЗ Не вырабатываются СЗЬ и другие опсонины: не активируются терминальные компоненты Пиогенные инфекции и воспалитель- ные заболевания (гломерулонефрит)
М аннансвязывающий лектин Не активируется лектиновый путь Рецидивирующие инфекции
Ингибитор С1 Нерегулируемая активация классического пути Ангионевротический отек
CD59, ФУД Мембраноатакующий комплекс повреждает клетки организма Пароксизмальная ночная гемоглобу- линемия (гемолиз и тромбоз)
Фактор Н фактор I Нерегулируемая активация СЗ Гломерулонефрит, гемолитико-уре- мический синдром
CR3 Нарушается способность к адгезии и миграция лейкоцитов Рецидивирующие бактериальные инфекции
Пропердин, фактор В, фактор D, терминаль- ные компоненты Неспособность вырабатывать МАК Тяжелые пиогенные инфекции
фектом CR3 может развиться иммунодефицит,
обусловленный нарушением адгезии лейкоци-
тов 1 (leukocyte adhesion deficiency — LAD-1, бо-
лее детально описывается в гл. 17), при котором
нарушаются адгезия и миграция лейкоцитов. Та-
кие больные страдают от рецидивирующих непио-
генных бактериальных инфекций. Дефицит фак-
торов Н или I приводит к неконтролируемой ак-
тивации по альтернативному пути и истощению
СЗ. Результатом являются такие же расстройства,
как и у лиц с дефицитом СЗ: повышенная пред-
расположенность к инфекциям, вызванным пио-
генными микроорганизмами, и заболеваниям, свя-
занным с иммунными комплексами. Дефицит
фактора Н также связан с гемолитико-уремиче-
ским синдромом и характеризуется разрушением
эритроцитов, повреждением эндотелиальных кле-
ток и (в тяжелых случаях) почечной недостаточ-
ностью.
Дефицит регуляторного белка Clq-инг, един-
ственного белка, контролирующего компоненты
С1г и Cis классического пути, приводит к некон-
тролируемому расщеплению С2 и С4. Генетиче-
ски обусловленный дефицит Clq-инг приводит к
появлению наследственного ангионевротического
отека (НАО). Это состояние характеризуется ло-
кализованными отеками на коже и слизистых обо-
лочках из-за расширения и повышения проница-
емости капилляров. У больных внезапно развива-
ются отек тканей, например в районе лица или
конечностей, боль в области живота и отек горта-
ни, который может препятствовать дыханию. Счи-
тается, что это заболевание связано с подавлени-
ем активности Clq-инг ферментами сывороточ-
ных каскадов, отличных от каскада комплемента.
Один из этих сывороточных каскадов связан с вы-
работкой кининов, таких как брадикинин, кото-
рый эффективно расширяет сосуды, повышает их
проницаемость, а также вызывает сокращение
гладких мышц. Полагают, что дефицит Clq-инг
ведет к увеличению продукции таких сосудистых
медиаторов.
Пароксизмальная ночная гемоглобинурия (ПНГ)
является редким приобретенным заболеванием,
которое затрагивает регуляторные белки компле-
мента. Оно встречается преимущественно у мо-
лодых людей и характеризуется хроническим раз-
рушением эритроцитов и формированием тром-
бов (агрегатов тромбоцитов и факторов крови,
вызывающих закупорку сосудов), а также гемо-
литической анемией и появлением гемоглобина в
моче, преимущественно в ночное время. Это со-
стояние является следствием соматической мута-
ции генов, контролирующих выработку гликозил-
фосфатидилинозитольного (ГФИ) якоря, который
прикрепляет различные мембранные белки к по-
верхности клетки (см. гл. 6). При ПН Г якорь имеет
дефект и белки не прикрепляются к поверхности
клетки; они секретируются клеткой в жидкую сре-
ду. При этом повреждаются некоторые белки,
включая и регуляторные белки комплемента, такие
как ФУД и CD59. Отсутствие этих молекул дела-
ет мембраны эритроцитов особенно чувствитель-
ными к лизису, опосредованному комплементом.
При других приобретенных заболеваниях ис-
тощение СЗ может достигать такой степени, что
иммунные комплексы не удаляются или развива-
ется повышенная чувствительность к инфекции.
Это наблюдают в тех случаях, когда вырабатыва-
ются аутоантитела, называемые СЗ-нефритиче-
ТЕСТЫ
221
ским фактором', такие антитела стабилизируют
СЗ-конвертазу (СЗЬВЬ) альтернативного пути, что
приводит к появлению высокоэффективного и
долгоживущего растворимого фермента, расщеп-
ляющего СЗ. Этот фактор был описан в некото-
рых случаях СКВ и при редко встречающемся за-
болевании — сегментарной лАодистрофии, при-
водящей к утрате жира в верхней части тела. Эти
заболевания также ассоциированы с гломеруло-
нефритом. Повышенная активность комплемен-
та при развитии сегментарной липодистрофии
определяет утрату жировых клеток, преимуще-
ственно расположенных в верхней части тела Эти
клетки продуцируют фактор D, расщепляющий
СЗЬВЬ, при избыточной активности которого и
развивается опосредованный комплементом ли-
зис жировых клеток.
РЕЗЮМЕ
1. Комплемент состоит из сывороточных и экс-
прессируемых на мембране белков, которые играют
ключевую эффекторную роль в иммунных ответах
(как опосредованных антителами адаптивных, так и
реакциях врожденного иммунитета) на микробные
патогены.
2. Активация комплемента представляет собой
каскад реакций, последовательно производящих био-
логически активные молекулы — ферменты, опсони-
ны и анафилатоксины.
3. Активация комплемента может быть инициирова-
на тремя различными путями: 1) классическим — пре-
имущественно посредством связывания комплексов
антиген— антитело с C1q; 2) лектиновым — за счет
терминальных углеводородных остатков на поверхно-
сти бактерий, взаимодействующих с МСЛ; 3) альтерна-
тивным — различными агентами, такими как клеточные
стенки некоторых бактерий и дрожжей, в присутствии
СЗЬ, сывороточных факторов В, D и пропердина.
4. Финальные стадии всех путей активации комп-
лемента одинаковы — на них формируется МАК,
включающий компоненты от С5Ь до С9.
5. Активность комплемента и его компонентов же-
стко регулируют ряд белков. Некоторые из таких бел-
ков находятся в жидкой форме (факторы Н и I, инги-
битор C1q и С4Ь-связывающий белок), а другие рас-
положены на поверхности многих клеток (ФУД, МКБ
и CR1). Регуляторные белки комплемента не экспрес-
сируются на поверхности микробных клеток.
6. Компоненты комплемента взаимодействуют со
специфическими рецепторами, экспрессируемыми на
клетках многих типов.
7. Основными функциями комплемента являются:
1) продукция опсонинов (особенно СЗЬ и С4Ь); 2) про-
дукция анафилатоксинов (С5а, СЗа и С4а); 3) лизис
клеток (с C5b по С9); 4) усиление ответов В-лимфо-
цитов на антигены (C3d и CR2); 5) контроль над фор-
мированием и удалением иммунных комплексов (СЗЬ,
С4Ь); 6) удаление мертвых и умирающих клеток (СЗЬ,
С4Ь); 7) взаимодействия с вирусами (многие компо-
ненты).
8- Дефицит компонентов комплемента, регулято-
ров комплемента или рецепторов для компонентов
комплемента может привести к повышенной чувстви-
тельности к инфекциям или развитию воспалительных
расстройств.
ТЕСТЫ
Выберите ОДИН НАИБОЛЕЕ ПРАВИЛЬНЫЙ ответ
на каждый тест.
1 - Пациент был госпитализирован с многочислен-
ными бактериальными инфекциями У него обнаружи-
лось полное отсутствие СЗ Укажите функцию опо-
средованную комплементом, которая у этого пациента
сохранилась интактной:
а) лизис бактерий;
б) опсонизация бактерий;
в) выработка анафилатоксинов;
г) выработка хемотаксических факторов нейтро-
филов;
д) все ответы не верны.
2. Комплемент необходим:
а) для лизиса эритроцитов с помощью фермента
лецитиназы;
б) лизиса клеток опухоли, опосредованного NK;
в) фагоцитоза;
г) лизиса бактерий, опосредованного антителами;
д) всего перечисленного.
3. С развитием СКВ связано:
а) дефицит С1, С4 или С2;
б) дефицит С5, С6 или С7;
в) дефицит поздних компонентов комплемента;
г) повышение уровня содержания СЗ в сыворотке
крови;
д) повышение уровней содержания С1, С4 или С2.
4, Активация фрагментов С5 не может привести:
а) к сокращению гладкой мускулатуры;
б) расширению сосудов;
в) привлечению лейкоцитов к месту инфекции;
г) прикреплению лимфоцитов к макрофагам;
д) инициации формирования МАК.
5. Для активации альтернативного пути компле-
мента не характерно:
а) активация компонентов комплементарного кас-
када вслед за СЗ;
б) участие пропердина;
в) выработка анафилатоксинов;
г) активация С4.
6. Фактор, ускоряющий диссоциацию, регулирует
систему комплемента таким образом, что предотвра-
щает лизис клеток, опосредованный комплементом.
При этом происходит:
а) диссоциация комплекса СЗ-конвертазы;
б) блокирование прикрепления СЗ-конвертазы к
поверхности бактериальных клеток;
в) предотвращение прикрепления МАК к бактери-
альным мембранам;
г) действие ФУД как кофактора для расщепления
СЗЬ;
д) инициация диссоциации С5-конвертазы.
7. Альтернативный путь комплемента активируют:
а) липополисахариды;
222
ГЛАВА 13. КОМПЛЕМЕНТ
б) некоторые вирусы и инфицированные вирусами
клетки;
в) стенки клеток грибков и дрожжей;
г) многие штаммы грамположительных бактерий;
д) все перечисленное.
ОТВЕТЫ НА ТЕСТЫ
1 — д. Все эти функции опосредуются компонен-
тами комплемента, появляющимися позднее, чем СЗ,
при каскадной активации комплемента. Таким обра-
зом, при отсутствии СЗ все эти функции нарушаются.
2 — г. Комплемент необходим для лизиса бакте-
рий с помощью IgM или IgG (классический путь).
Комплемент не требуется для лизиса эритроцитов с
помощью лецитиназы или для фагоцитоза. Однако
опсонины, такие как СЗЬ, вырабатываемые при акти-
вации комплемента, могут усиливать фагоцитоз. Хотя
некоторые клетки могут инициировать альтернатив-
ный путь активации комплемента, сам комплемент не
играет никакой роли в лизисе этих клеток, опосредо-
ванном NK.
3 — а. Врожденный дефицит (наследуется по го-
мозиготному типу) одного из первых белков класси-
ческого пути активации комплемента (С1, С4 или С2)
тесно связан с развитием СКВ. Такие дефициты, ве-
роятно, приводят к нарушению выведения (клиренса)
иммунных комплексов в отсутствие функционального
классического пути фиксации комплемента. Уровни
содержания СЗ и С4 в сыворотке крови при СКВ по-
нижаются из-за того, что эти компоненты связывают-
ся с большим количеством иммунных комплексов.
При дефиците поздних компонентов отмечаются ре-
цидивирующие инфекции, вызванные пиогенными
микроорганизмами.
4 — г. Фрагмент С5а является анафилатоксином,
который вызывает дегрануляцию тучных клеток, при-
водя к высвобождению гистамина, вызывающего рас-
ширение сосудов и сокращение гладких мышц. Он
также обладает хемотаксическими свойствами и при-
влекает лейкоциты к месту своего возникновения, где
антиген встречается с антителами и активирует систе-
му комплемента. Это является частью воспалительной
реакции в ответ на инфекцию. Фрагмент С5Ь откла-
дывается на мембранах и инициирует формирование
терминального мембраноатакующего комплекса. Ни
С5а, ни С5Ь не способствуют прикреплению лимфо-
цитов к макрофагам
5 — г. Альтернативный путь активации комплемен-
та совпадает с классическим путем на этапе актива-
ции СЗ. Таким образом, ему не требуется С1, С4 или
С2. Пропердин играет важную роль в активации всех
реакций в каскаде альтернативного пути, поскольку он
стабилизирует комплекс, формируемый СЗЬ и активи-
рованным сывороточным фактором В, СЗЬВЬ, кото-
рый действует как СЗ-конвертаза и активирует СЗ. Во
время активации альтернативного пути вырабатыва-
ются и СЗа, и С5а; оба являются анафилатоксинами и
вызывают дегрануляцию тучных клеток.
6 — а. Фактор, ускоряющий диссоциацию, являет-
ся регулятором активации комплемента, находящимся
на поверхности клетки. Он дестабилизирует СЗ-кон-
вертазы альтернативного и классического путей
(СЗЬВЬ и С4Ь2а соответственно). Как и другие регуля-
торы активации комплемента, такие как CR1, фактор Н
и С4ЬВР, эти белки ускоряют расщепление (диссоциа-
цию) СЗ-конвертазы, освобождая компоненты с фер-
ментативной активностью (ВЬ или С2а) от компонен-
тов, связанных с клеточной мембраной (СЗЬ или С4Ь).
7 — д. Все эти патогены или частицы микробного
происхождения может инициировать альтернативный
путь активации комплемента. Тейхоевая кислота из
стенок клеток грамположительных микроорганизмов
(а также такие паразиты, как трипаносомы) может
активировать комплемент этим способом
Глава
РЕАКЦИИ ГИПЕРЧУВСТВИТЕЛЬНОСТИ: ’
РЕАКЦИИ, ОПОСРЕДОВАННЫЕ I
АНТИТЕЛАМИ (I ТИП) |
ВВЕДЕНИЕ
В некоторых условиях в организме при иммунном
ответе возникают повреждения, которые иногда
даже приводят к смерти. Такие разрушительные
реакции называются гиперчувствительностью.
Следует помнить, что реакции гиперчувствитель-
ности отличаются от защитных иммунных реак-
ций только тем, что они чрезмерно усилены, не-
адекватны и наносят повреждение организму. Од-
нако клеточные и молекулярные механизмы этих
двух типов реакций практически идентичны.
ОПРЕДЕЛЕНИЕ
ГИПЕРЧУВСТВИТЕЛЬНОСТИ
ПО ДЖЕЛЛУ И КУМБСУ
В начале 1960-х гг. Р. Кумбс (R.Coombs) и П.Джелл
(P.Gell) классифицировали реакции гиперчувстви-
тельности, разделив их на четыре типа.
• Тип I. Реакции, опосредованные IgE, стиму-
лируются связыванием IgE (через Fc-фрагмент)
с высокоаффинным IgE-специфичным Fc-pe-
цептором (FceRI), экспрессированным на туч-
ных клетках и базофилах. При перекрестном
связывании антигенами антитела IgE иниции-
руют высвобождение медиаторов воспаления
тучными клетками и базофилами, что ведет к
клиническим проявлениям {аллергическим ре-
акциям), таким как ринит, астма, а в тяжелых
случаях к анафилаксии (от греч. апа — обрат-
ное, противоположное действие, усиление дей-
ствия и phylaxis — защита). Реакции возника-
ют быстро, проявляясь в течение нескольких
минут после контакта, который представляет
собой повторную встречу с антигеном. Поэто-
му аллергические реакции называются также
гиперчувствительностью немедленного типа.
В последние годы синонимом термина «гипер-
чувствительность I типа» стало понятие «ал-
лергия». Здесь и далее будут использоваться оба
термина.
• Тип II. Цитолитические или цитотоксические
реакции возникают, когда антитела IgM или
IgG связываются с антигенами на поверхности
клеток и активируют каскад комплемента, при-
водя к разрушению клеток.
• Тип III. Реакции с участием иммунных комп-
лексов возникают, когда комплексы антигена
с антителами IgM или IgG накапливаются в
сосудистом русле или ткани и активируют кас-
кад комплемента. Гранулоциты притягивают-
ся к месту активации. Вследствие высвобожде-
ния из их гранул литических ферментов и воз-
никает повреждение. Реакции развиваются в
течение нескольких часов после контакта с
антигеном.
• Тип IV. Клеточно-опосредованные реакции
иммунитета, обычно называемые реакциями
гиперчувствительности замедленного типа
(ГЗТ), опосредуются зависимыми от Т-клеток
эффекторными механизмами с вовлечением как
CD4+-TH1-клеток, так и цитотоксических CD8+-
Т-клеток. Антитела не принимают участия в
реакциях гиперчувствительности IV типа. При
активации ТН1-клеток высвобождаются цито-
кины, что приводит к накоплению и актива-
ции макрофагов, в свою очередь вызывающих
местное повреждение. При этом типе реакции
начало отдалено во времени на несколько дней
или недель от контакта с антигеном.
В этой главе рассматривается гиперчувстви-
тельность I типа, также известная как аллергиче-
ская реакция. Гиперчувствительность II и III ти-
224
ГЛАВА 14 РЕАКЦИИ ГИПЕРЧУВСТВИТЕЛЬНОСТИ: РЕАКЦИИ, ОПОСРЕДОВАННЫЕ АНТИТЕЛАМИ (I ТИП)
пов обсуждается в гл. 15, а гиперчувствительность
IV типа — в гл. 16.
ОБЩИЕ ХАРАКТЕРИСТИКИ
АЛЛЕРГИЧЕСКИХ РЕАКЦИЙ
Последовательность событий при аллергических
реакциях может быть разделена на несколько фаз:
1) фаза сенсибилизации, во время которой антите-
ла IgE вырабатываются в ответ на антигенную сти-
муляцию и связываются со специфическими ре-
цепторами на тучных клетках и базофилах; 2) фаза
активации, во время которой повторная встреча
или контакт с антигеном вынуждает тучные клет-
ки и базофилы высвобождать содержимое своих
гранул; 3) эффекторная фаза, во время которой
возникает сложный ответ в результате действия
многих воспалительных медиаторов, высвобожда-
емых тучными клетками и базофилами. Клини-
ческие проявления этих эффекторных механиз-
мов наблюдаются при экземе, астме и рините.
ФАЗА СЕНСИБИЛИЗАЦИИ
Иммуноглобулином, отвечающим за аллергиче-
ские реакции, является IgE. У здоровых лиц анти-
тела IgE, специфичные к различным антигенам,
могут вырабатываться в тех случаях, когда анти-
ген вводится парентерально или несоответствую-
щим способом. Однако некоторые индивидуумы
генетически предрасположены к определенной ал-
лергии (см. далее). Нужно заметить, что аллерги-
ческие реакции могут вызываться не только при
повторном контакте с одним и тем же антигеном,
инициирующим синтез IgE, но также и теми ан-
тигенами, которые имеют общие эпитопы с этим
антигеном. Сенсибилизация к аллергенам может
происходить при различных контактах, включая
контакт с кожей, прием внутрь, инъекцию и вды-
хание. Примерно у 50 % людей ответ со стороны
IgE возникает к антигенам, находящимся в воз-
духе, которые контактируют только со слизисты-
ми поверхностями, такими как эпителий, высти-
лающий слизистую оболочку носа, легких и конъ-
юнктивы. Однако после повторного контакта с
множеством этих «воздушных аллергенов» (пыльца
растений, споры плесени, клещи домашней пыли
и шерсть животных) примерно у 20 % людей в
общей популяции возникают клинические симп-
томы, приводящие к сезонным или постоянным
аллергическим ринитам. Устаревшим, но все еще
часто используемым термином для описания кли-
нических симптомов, вызванных этими аллерге-
нами, является «сенная лихорадка».
Для определения гиперчувствительности, опо-
средованной IgE, часто используется термин «ато-
пия» (от греч. atopos — вне места), а прилагатель-
ное «атопический» используется при описании
заболевания. Дети пациентов с атопией часто стра-
дают от аллергии, что указывает на распростра-
ненную семейную предрасположенность. Наблю-
дения указывают, что продукция IgE генетически
контролируется генами, связанными с МНС, рас-
положенными на хромосоме 6 Недавно были об-
наружены другие гены, регулирующие IgE, к ко-
торым относятся ген высокоаффинного FctRI на
хромосоме 11 и генный кластер Тн2 IL-4 на хромо-
соме 5, содержащий гены IL-3, IL-4, IL-5, IL-9
и IL-13.
Зависимость продукции
антител IgE от Тн2-клеток
Данные нескольких исследований указывают на то,
что реакции со стороны IgE зависят от Тн2-кле-
ток. Механизм, с помощью которого эти клетки
вызывают переключение изотипа В-клеток, до
конца не выяснен, хотя известно, что определен-
ные цитокины, вырабатываемые этими клетками,
особенно IL-4 и IL-13, играют основную роль.
Введение мышам антител, нейтрализующих IL-4,
подавляет продукцию IgE. Кроме того, мыши, у ко-
торых «выбит» ген IL-4, не вырабатывают IgE
после инфекции, вызванной Nippostrongylus brasi-
liensis — нематодой, которая приводит к продук-
ции большого количества IgE у здоровых мышей.
Сравнение уровня IL-4 у людей, страдающих ал-
лергией, и здоровых показывает, что при аллер-
гии уровень содержания IL-4 значительно выше.
С этими данными согласуется и тот факт, что уро-
вень IgE у лиц с аллергией примерно в 10 раз
превышает уровень IgE у здоровых людей. Кон-
центрация IgE в сыворотке у здоровых людей яв-
ляется наименьшей по сравнению с иммуногло-
булинами других классов. Считается, что низкие
уровни антител IgE у людей, не страдающих ал-
лергией, поддерживаются супрессорным действи-
ем интерферона-у (IFNy), который продуцирует-
ся ТН1-клетками и подавляет продукцию IgE. Та-
ким образом, у здоровых людей баланс поддер-
живается цитокинами, производимыми Тн2, ко-
торые усиливают продукцию IgE, и цитокинами,
производимыми Тн1, подавляющим продукцию
IgE. Естественные явления, такие как инфекции,
вызванные некоторыми патогенами, могут нару-
шать этот баланс и стимулировать В-клетки к
продукции IgE. Поэтому аллергическая сенси-
билизация может явиться результатом наруше-
ния контролирующего механизма и привести к
перепроизводству IL-4 Тн2-клетками и, в итоге,
к усиленному производству IgE В-клетками. Пос-
ле того как при повторном контакте аллергена
со слизистой оболочкой при приеме внутрь или
при парентеральном введении достигается опре-
деленный предел и начинают продуцироваться
антитела IgE, человек считается сенсибилизиро-
ванным. Антитела IgE, которые продуцируют и
секретируют В-клетки, простимулированные ан-
ФАЗА АКТИВАЦИИ
225
• Рис. 14.1. Электронная микро-
фотография обычной тучной
клетки: видно большое ядро, как
у моноцита, и электронно-плот-
ные гранулы Справа простиму-
лированная тучная клетка начи-
нает высвобождать содержимое
своих гранул, о чем свидетель-
ствует увеличение их прозрачно-
сти и формирование вакуолей на
поверхности (с любезного разре-
шения Т. Theoharides, Tufts Medi-
cal School)
тигеОм, прикрепляются к тучным клеткам и
базофилам, после чего продолжают циркулиро-
вать вместе с ними.
Тучные клетки, являющиеся основными эф-
фекторными клетками, ответственными за аллер-
гические реакции, представляют собой семейство
повсеместно распространенных клеток, обычно
располагающихся в соединительной ткани вокруг
кровеносных сосудов, в кишечнике и легких. Это
большие одноядерные клетки с выраженной гра-
нуляцией, интенсивно окрашиваемыми основны-
ми красителями (рис. 14.1). Тучные клетки раз-
виваются из клеток-предшественников, которые
мигрируют в ткань, после чего они дифференци-
руются в зрелые тучные клетки. У некоторых ви-
дов, включая человека, циркулирующие в крови
базофилы также принимают участие в аллерги-
ческих реакциях и действуют примерно таким же
образом, как и находящиеся в тканях тучные клет-
ки. В отличие от тучных клеток они созревают в
костном мозге и поступают в сосудистое русло
после окончания дифференцировки. Одной из
наиболее важных характеристик и тучных клеток,
и базофилов является то, что на клеточных мемб-
ранах у них находятся рецепторы (FceRI). Эти
рецепторы связываются с высокой аффинностью
с Fc-фрагментами IgE. После связывания моле-
кулы IgE остаются на поверхности клеток в те-
чение нескольких недель, вследствие чего клетка
остается сенсибилизированной до тех пор, пока
сохраняется достаточное количество прикреплен-
ных антител. Эти антитела могут вызвать актива-
цию клетки, когда она вступает в контакт с анти-
геном.
Сенсибилизация может быть достигнута при
пассивном переносе сыворотки крови, содержа-
щей антитела IgE к специфичному антигену. Ис-
торический интерес представляет проба Прауснит-
ца — Кюстнера. Эта проба применялась для выяв-
ления антител, ответственных за анафилактиче-
ские реакции. При ее проведении сыворотку, взя-
тую у пациента с аллергией, вводили в кожу здо-
рового человека. Через 1—2 сут, во время кото-
рых введенные местно антитела перемешались к
лежащим рядом тучным клеткам и прикреплялись
к ним, в месте инъекции формировалась сенси-
билизация, и при инъекции антигена, к которому
у донора была аллергия, появлялась уртикарная
реакция (крапивница). Такие реакции у пассивно
сенсибилизированных животных называют пассив-
ной кожной анафилаксией.
I ФАЗА АКТИВАЦИИ
При аллергических реакциях фаза активации на-
чинается со стимуляции тучных клеток, высво-
бождающих содержимое своих гранул и воспали-
тельные медиаторы. При этом необходимо, что-
бы по крайней мере два рецептора для Fc-фраг-
мента молекул IgE были связаны мостиком с об-
разованием устойчивой структуры. Самым про-
стым и иммунологически наиболее подходящим
способом является соединение мультивалентным
антигеном, который может связывать различные
молекулы IgE с каждым из нескольких эпитопов
на своей поверхности, перекрестно сшивая их и
эффективно стимулируя реакцию клетки — ее
дегрануляцию (рис. 14.2). Физиологические по-
следствия дегрануляции тучных клеток, опосре-
дованной IgE, зависят от дозы и пути поступле-
ния антигена. Дегрануляция тучных клеток в же-
лудочно-кишечном тракте вызывает увеличение
продукции жидкости и усиление перистальтики,
которая в свою очередь приводит к диарее и рво-
те. В отличие от этого дегрануляция тучных кле-
ток в легких вызывает уменьшение диаметра воз-
духоносных путей и увеличение секреции слизи.
226
ГЛАВА 14. РЕАКЦИИ ГИПЕРЧУВСТВИТЕЛЬНОСТИ: РЕАКЦИИ, ОПОСРЕДОВАННЫЕ АНТИТЕЛАМИ (I ТИП)
• Рис. 14.2. Дегрануляция тучных клеток, опосредованная
перекрестным связыванием антигена IgE, прикрепленно-
го к Fc-рецепторам (FceRI)
Это приводит к застою и блокаде воздухоносных
путей (кашель, стридор, слизь), а также отеку и
секреции слизи в носовых проходах. Наконец,
дегрануляция тучных клеток в кровеносных сосу-
дах вызывает усиление тока крови и увеличение
сосудистой проницаемости, что обусловливает
Перекрестное
связывание лектином
Днты-loF
Перекрестное связывание
антителами к IgE
Химическое
перекрестное связывание
Перекрестное
связывание антителами к FceRI
• Рис. 14.3. Альтернативные пути, с помощью которых
можно вызвать дегрануляцию тучных клеток
накопление жидкости в тканях. Это в свою оче-
редь вызывает усиление тока лимфы из региональ-
ных лимфатических узлов, что ведет к локально-
му увеличению содержания клеток и белка в тка-
ни, способствуя воспалительной реакции.
Перекрестное связывание FceRI-рецепторов
может быть получено и другими эксперименталь-
ными способами. Один из них — добавление ан-
тител, специфичных к IgE (анти-IgE или анти-
идиотипические антитела) или IgE-рецепторным
молекулам на поверхности тучных клеток. Дру-
гой путь перекрестного связывания FceRI — кон-
такт с лектинами, связывающими сахара, и даже
использование химических препаратов (рис. 14.3).
Как и предполагалось, димеры или агрегаты IgE
также перекрестно связывают эти Fc-рецепторы
и активируют дегрануляцию тучных клеток. На-
конец, активация тучных клеток может также быть
достигнута при использовании электрофореза
ионов кальция, что приводит к быстрому попада-
нию ионов кальция в клетку и запускает каскад
сигналов, приводящих к дегрануляции.
Тучные клетки могут также активироваться без
перекрестного связывания IgE с Fc-рецептором.
Анафилатоксины СЗа и С5а, продукты актива-
ции комплемента (см. гл. 13), Ф различные ле-
карственные средства (такие как кодеин, мор-
фин и йодированные радиоконтрастные веще-
ства) способны вызывать анафилактоидные ре-
акции. Активировать тучные клетки могут и фи-
зические факторы, такие как тепло, холод или
давление, что можно наблюдать, например, при
холодовой крапивнице (анафилактическая сыпь,
появляющаяся у некоторых людей при охлажде-
нии участка кожи). Наконец, как указывалось
ранее, определенные лектины (молекулы, связы-
вающиеся с сахарами) также могут перекрестно
связывать Fc-рецепторы для IgE (см. рис. 14.3).
Высокие концентрации лектинов обнаруживают-
ся в определенных продуктах (например, в клуб-
нике). Этим можно объяснить уртикарную сыпь,
возникающую у некоторых людей после употреб-
ления их в пищу.
Стимуляция тучных клеток путем перекрест-
ного связывания их рецепторов инициирует быст-
рую и сложную цепь реакций, приводящих в конце
концов к дегрануляции тучной клетки и высвобож-
дению активных медиаторов воспаления. В связи
с простотой определения реакции тучных клеток
они служат моделью при исследовании клеточ-
ной активации в целом. Среди выявленных быст-
ро происходящих изменений можно назвать аг-
регацию рецепторов и изменение текучести мемб-
ран, являющиеся результатом метилирования
фосфолипидов, которое приводит к временному
увеличению уровня содержания циклического
аденозинмонофосфата (цАМФ). Повышение
уровня цАМФ обеспечивает быстрое поступление
внутрь клетки ионов Са2+. Уровни содержания в
клетке цАМФ и циклического гуанозинмонофос-
фата (цГМФ), как известно, регулируют последу-
ЭФФЕКТОРНАЯ ФАЗА
227
ющие события. Длительное повышение содержа-
ния цАМФ в клетке замедляет или останавливает
процесс дегрануляции. Таким образом, активация
аденилатциклазы, фермента конвертирующего
аденозинтрифосфат (АТФ) в цАМФ, обеспечива-
ет важный механизм контроля анафилактических
реакций.
Как указывалось ранее, аллергические реакции
часто называют гиперчувствительностью немед-
ленного типа. Этот термин является правомерным
с точки зрения исключительно быстрого проявле-
ния последствий перекрестного связывания Fc-pe-
цепторов для IgE, начинающегося с продвижения
гранул тучных клеток к клеточной поверхности
с помощью фибриллярных элементов цито-
плазмы. У поверхности клеточной мембраны гра-
нул сливаются с клеточными мембранами, и со-
держимое высвобождается наружу посредством
экзоцитоза (см. рис. 14.1). В зависимости от ин-
тенсивности перекрестного связывания рецепто-
ров клетка может высвобождать все или некото-
рые из своих гранул. Более того, даже «взрывное»
высвобождение гранул является физиологичным и
не приводит к лизису или смерти клетки. Факти-
чески, дегранулированные клетки регенерируют и,
когда содержимое гранул синтезируется вновь, го-
товы к повторному выполнению свЗоих функций.
* ЭФФЕКТОРНАЯ ФАЗА
Считается, что симптомы аллергических реакций
полностью обусловлены воспалительными меди-
аторами, высвобождаемыми активированными
тучными клетками. Эти медиаторы можно раз-
делить на две основные категории (рис. 14.4).
Одна категория состоит из основных предсущест-
вующих медиаторов. которые удерживаются в гра-
нулах путем электростатического притяжения
к матричному белку и высвобождаются в резуль-
тате поступления ионов, преимущественно Na+.
Среди цитокинов, высвобождаемых из тучных
клеток при дегрануляции, определяются IL-3,
IL-4, IL-5, IL-8, IL-9, TNFa и гранулоцитарно-
макрофагальный колониестимулирующий фактор
(ГМ-КСФ). Все они также участвуют в привле-
чении клеток к месту воспаления и их актива-
ции. Воспалительные клетки совместно с медиа-
торами второй категории, производимыми туч-
ными клетками de novo, ответственны за разви-
тие так называемых реакций поздней фазы. Вновь
синтезируемые медиаторы тучных клеток состо-
ят из веществ, частично синтезированных из мемб-
ранных липидов. Во время дегрануляции высво-
бождаются многие активные субстанции, однако
в этой главе будут рассматриваться только основ-
ные из них.
• Рис. 14.4. Медиаторы, высвобождаемые
при активации тучных клеток
Расщепление арахидоновой
кислоты из мембранных липидов
Высвобождение гранул
с предсушествуюшими медиаторами
(гистамин, гепарин, протеазы,
ХФЭ-А, IL-8 и другие цитокины)
Предсуществующие медиаторы
Арахидоновая кислота
_________к
Циклооксигеназа
I
Простагландины,
тромбоксаны
Липооксигеназа
Лейкотриены
LTB4
LTC4
LTD4
LTE4
гМРС-А
Вновь синтезированные медиаторы
228
ГЛАВА 14 РЕАКЦИИ ГИПЕРЧУВСТВИТЕЛЬНОСТИ: РЕАКЦИИ, ОПОСРЕДОВАННЫЕ АНТИТЕЛАМИ (I ТИП)
Предсуществующие медиаторы
Гистамин
Гистамин формируется в клетках путем декарбо-
ксилирования аминокислоты гистидина и удержи-
вается путем электростатического взаимодействия
с кислым матричным белком гепарином. При
высвобождении гистамин быстро связывается с
двумя основными типами рецепторов (Hj и Н2),
которые представлены на клетках разных типов
и определяют развитие разных эффектов. При свя-
зывании с Hj-рецепторами гладких мышц гиста-
мин вызывает их сокращение; когда гистамин свя-
зывается с Н]-рецепторами эндотелиальных кле-
ток, он приводит к их разъединению в местах кон-
тактов, что увеличивает сосудистую проницае-
мость. Н2-рецепторы вовлечены в стимуляцию
секреции слизи и увеличение сосудистой прони-
цаемости, а также выделение кислоты слизистой
оболочки желудка. Все эти эффекты отвечают за
некоторые основные симптомы системной ана-
филаксии: затруднение дыхания (астма) или ас-
фиксию, вызываемые сокращением гладкой мус-
кулатуры бронхов, и падение кровяного давления,
возникающее из-за выхода жидкости из сосудов
в тканевые пространства, поскольку проницае-
мость кровеносных сосудов увеличивается. Нгре-
цепторы блокируются антигистаминными препа-
ратами, такими как бенадрил, прямо конкуриру-
ющими с гистамином. Когда эти препараты по-
ступают достаточно быстро, они способны про-
тиводействовать эффектам гистамина. Для бло-
кады Н2-рецепторов применяют другие лекар-
ственные средства, например циметидин. Однако
практика использования антигистаминных пре-
паратов показала, что они не предотвращают со-
кращения гладких мышц, которое наступает по-
зднее и является более стойким, чем вызываемое
гистамином. Это наблюдение привело к откры-
тию медленно реагирующих субстанций анафилак-
сии (МРС-А), в настоящее время называемых лей-
котриенами (см. далее).
Серотонин
Серотонин присутствует в тучных клетках только
у определенных животных, таких как грызуны. Его
действие сходно с действием гистамина, т.е. он
вызывает сокращение гладкой мускулатуры и по-
вышает проницаемость сосудов
Цитокины и факторы хемотаксиса
После дегрануляции тучных клеток высвобож-
дается много цитокинов и факторов хемотакси-
са, например такие цитокины, как ГМ-КСФ, IL-5
и TNFa. Высвобождаются также пептиды с низ-
кой молекулярной массой, называемые хемотак-
сическими факторами эозинофилов (ХФЭ). При
этом возникает хемотаксический градиент, спо-
собный привлекать к данному месту эозинофилы.
Кроме того, хемотаксис клеток в зоне воспале-
ния усиливают медиаторы поздней фазы: фак-
тор активации тромбоцитов (ФАТ) и лейкот-
риены (см. далее). Другими важными клетками,
привлекаемыми к месту воспаления, являются
нейтрофилы. Хемотаксис этих ПМЯ-гранулоци-
тов происходит в ответ на высвобождение IL-8
из активированных тучных клеток. Как мы уви-
дим далее, гранулоциты играют важную роль в
поздней фазе гиперчувствительности, опосредо-
ванной [gE. Другими клетками, привлекаемыми
к месту воспаления в ответ на выделение тучны-
ми клетками хемотаксических факторов, явля-
ются базофилы, макрофаги, тромбоциты и лим-
фоциты.
При аллергических реакциях эозинофилы яв-
ляются индикатором IgE-опосредованных реак-
ций, особенно реакций поздней фазы, обсуждае-
мых далее. Они также могут высвобождать арил-
сульфатазу и гистаминазу, которые разрушают
некоторые медиаторы реакции гиперчувствитель-
ности, являясь, таким образом, одним из меха-
низмов ограничения этой реакции. Эозинофилы
выполняют также защитную (|^1кцию при пара-
зитарных инфекциях, что будет обсуждаться да-
лее в этой главе.
Гепарин
Гепарин является кислым протеогликаном, со-
ставляющим матрицу гранул, к которой при-
крепляются основные медиаторы, такие как гис-
тамин и серотонин. Его кислотная природа обу-
словливает метахроматические свойства (интен-
сивное окрашивание) тучной клетки при щелоч-
ном окрашивании, например, толуидиновым си-
ним. Высвобождение гепарина приводит к по-
давлению коагуляции, что может иметь значе-
ние при последующем восстановлении тучной
клетки или для дальнейшего поступления анти-
гена в область реакции; однако гепарин напря-
мую не определяет появление симптомов ана-
филаксии.
Вновь синтезируемые медиаторы
Лейкотриены
При обработке гистамином препарата гладкой
мышцы из рога матки морской свинки отмечает-
ся быстрое сокращение. Как указано ранее, этот
феномен первоначально относили на счет МРС-А.
Теперь известно, что МРС-А состоит из ряда пеп-
тидов, объединенных с метаболитом арахидоно-
вой кислоты и называемых лейкотриенами (LT).
Лейкотриенам дали название LTB4, LTC4, LTD4
и LTE4. В незначительных количествах они вы-
зывают длительное сокращение гладких мышц.
Считается, что у человека лейкотриены опреде-
ЭФФЕКТОРНАЯ ФАЗА
229
ляют основные проявления астмы, резистентной
к антигистаминным препаратам.
Тромбоксаны и простагландины
Лейкотриены составляют лишь малую часть слож-
ной системы веществ, вырабатываемых из арахи-
доновой кислоты с помощью фосфолипаз из ли-
пидов клеточной мембраны при активации туч-
ных клеток. Арахидоновая кислота является по-
линенасыщенным длинноцепочечным углеводом,
который может окисляться двумя разными спо-
собами (см. рис. 14.4): посредством липоксигена-
зы с образованием описанных ранее лейкотрие-
нов и с помощью циклооксигеназы с образовани-
ем простагландинов и тромбоксанов. Многие тром-
боксаны являются вазоактивными веществами,
которые также вызывают сужение бронхов и об-
ладают хемотаксическими свойствами в отноше-
нии многих типов лейкоцитов, таких как нейтро-
филы, эозинофилы, базофилы и моноциты.
Фактор активации тромбоцитов
Фактор активации тромбоцитов вызывает агре-
гацию тромбоцитов и высвобождение содержа-
щихся в них медиаторов, таких как гистамин,
а у некоторых видов и серотонин. Активация
тромбоцитов также может приводить к высво-
бождению метаболитов арахидоновой кислоты,
усиливая таким образом эффект, производимый
тучными клетками. Само по себе действие ФАТ
Дегрануляция с высвобождением гистамина, серотонина,
гепарина, тромбоксанов, простагландинов, лейкотриенов
и цитокинов, действующих на лимфоциты, макрофаги,
эозинофилы и нейтрофилы
Цитокины
(IL-1, IL-4,
IL-6, TNFp)
Макрофаги
Хемотаксис
эозинофилов, активация
и дегрануляция
Инфильтрация T-
В-лимфоцитами
и макрофагами
Лейкотриены,
ФАТ, гистаминаза,
арилсульфатаза,
главный основный
белок, нейротоксин
и гельминтотоксин
Тромбоксаны, цитокины
(IL-3, IL-4, IL-5, IL-13),
хемотаксический фактор
эозинофилов
Хемотаксический
фактор нейтрофилов
(IL-8)
Эозинофилы
и нейтрофилы
входят в тесный
контакт
с антителами,
покрывающими
антиген,
посредством
Fc-рецепторов
на этих клетках
Хемотаксис
нейтрофилов,
активация
фагоцитоза
и дегрануляция
Лизосомальные
ферменты,
лейкотриены ФАТ
в
Продукция Тн2-
цитокинов и антител;
усиление фагоцитоза
макрофагами
Повреждение
ткани
Повреждение
ткани
• Рис. 14.5. Реакция поздней фазы IgE-опосредованной гиперчувствительности I типа и
некоторые участвующие в ней медиаторы
230
ГЛАВА 14. РЕАКЦИИ ГИПЕРЧУВСТВИТЕЛЬНОСТИ: РЕАКЦИИ, ОПОСРЕДОВАННЫЕ АНТИТЕЛАМИ (I ТИП)
считается одной из основных причин сужения
бронхов и расширения сосудов. Он быстро и в
очень малых дозах вызывает симптомы, напоми-
нающие шок.
Реакция поздней фазы
Как указывалось ранее, многие вещества, высво-
бождаемые при активации тучных клеток и их
дегрануляции, ответственны за выраженную вос-
палительную реакцию с инфильтрацией и накоп-
лением эозинофилов, нейтрофилов, базофилов,
лимфоцитов и макрофагов. Преобладают среди
этих клеток эозинофилы и нейтрофилы. Эти наи-
более важные клетки активируются и усиливают
воспаление. Такая реакция часто возникает в те-
чение 48 ч и может продолжаться несколько дней.
Она называется реакцией поздней фазы и показа-
на на рис. 14.5.
Тучная клетка дегранулирует при перекрест-
ном связывании IgE антигеном на ее поверхнос-
ти, высвобождает хемотаксический фактор эози-
нофилов А (ХФЭ-А), который привлекает эози-
нофилы к месту реакции. Их переходу, как и пе-
реходу других лейкоцитов из кровотока в ткани,
способствует повышенная проницаемость сосудов,
вызванная гистамином и другими медиаторами.
Различные цитокины, такие как ГМ-КСФ, IL-3,
IL-4, IL-5 и IL-13, важны как факторы роста и
дифференцировки эозинофилов, а также для ад-
гезии клеток определенных типов. Вместе эти вос-
палительные медиаторы приводят к появлению
длительного сохраняющегося отека и вызывают
вторую волну сокращения гладких мышц, кото-
рая, однако, менее выражена, чем при немедлен-
ной реакции. У лиц, страдающих аллергической
астмой, реакция поздней фазы приводит к разви-
тию одного из кардинальных признаков этого типа
астмы, а именно гиперреактивности бронхов в от-
вет на неспецифические стимулы, такие как гист-
амин и метахолин.
Эозинофилы могут связывать IgE также бла-
годаря экспрессии низкоаффинных Fc-рецепто-
ров для IgE (FceRII или CD23). Они также эксп-
рессируют Fc-рецепторы к Fc-фрагменту IgG. Та-
ким образом, антигены, связанные с IgE и IgG,
будут соединяться с соответствующими Fc-рецеп-
торами на эозинофилах, вызывая активацию этих
клеток. Как и у тучных клеток, у эозинофилов
после активации происходят дегрануляция и выс-
вобождение лейкотриенов, вызывающих сокра-
щение гладких мышц. Эозинофилы также выс-
вобождают ФАТ и главный основный белок (ГОБ).
Этот белок уничтожает различных паразитов (та-
ких как шистосомы), нарушая их ш^особность к
движению и повреждая поверхнос^ Кроме того,
ГО Б оказывает токсическое воздействие на эпи-
телий респираторного тракта млекопитающих.
Наконец, при дегрануляции эозинофилов выс-
вобождается катионный белок эозинофилов — ак-
Антиген проникает
через слизистую
поверхность
Тн2
IgE
IL-4
IL-10
IL-13
В-клетка
FceRI
Тучная
клетка
Предсуще-
ствующие
и вновь
сформи-
рованные
медиаторы
Хемотаксис
воспалительных
клеток и их активация
Фармакологические
эффекты: кровеносные
сосуды, бронхи,
клеточная
инфильтрация
Цитокины, регулирующие
другие клетки и тучные клетки
IL-4, IL-5,1L-6 | |ГМ-КСФ, TNFa, IL-5, ХФЭ
Презентация
антигена
Продукция IgE
Дегрануляция
тучных клеток
и высвобождение
цитокинов
Клинические проявления:
аллергический ринит
астма, экзема, анафилаксия
АПК
• Рис. 14.6. Общее представление об индукционных и эффекторных механизмах при ги-
перчувствительности I типа
КЛИНИЧЕСКИЕ АСПЕКТЫ АЛЛЕРГИЧЕСКИХ РЕАКЦИЙ
231
тивный нейротоксин и гельминтотоксин. Все эти
биологически активные субстанции, эффектив-
ные при борьбе с чужеродными микроорганиз-
мами, могут вызывать и повреждение собствен-
ных тканей.
Нейтрофилы, привлеченные к месту реакции
хемотаксическими факторами, входят в близкий
контакт с антигеном, покрытым антителами, по-
средством Fc-рецепторов для IgG, которые эксп-
рессируются на этих клетках. Соответственно, эти
клетки активируются для фагоцитоза иммунных
комплексов антиген—антитело. При этом из них
высвобождаются активные лизосомальные фер-
менты, которые вызывают повреждение тканей.
Подобно продуктам дегрануляции эозинофилов
продуктами дегрануляции нейтрофилов также
являются лейкотриены и ФАТ. Позднее в зону
реакции проникают лимфоциты (и Т-, и В-), а
также макрофаги, которые осуществляют дальней-
шую защиту организма от чужеродных антигенов
или микроорганизмов.
На рис. 14.6 показан основной механизм раз-
вития аллергических реакций. Такие же события,
вызываемые и опосредуемые IgE, происходят и
при устранении паразитов, что будет описано да-
лее в этой главе. К сожалению, эти же события
происходят у некоторых людей в том случае, ког-
да антигеном является безвредная субстанция,
такая как пыльца, шерсть животных или клещи
домашней пыли, что приводит к повреждению
собственных тканей организма.
< КЛИНИЧЕСКИЕ АСПЕКТЫ
АЛЛЕРГИЧЕСКИХ РЕАКЦИЙ
Клинические последствия аллергических реакций
могут быть как локализованными (аллергический
ринит, астма, атопический дерматит и пищевая
аллергия), так и тяжелыми системными реакция-
ми. угрожающими жизни (анафилаксия). Важно
отметить, однако, что астматическая реакция, даже
отнесенная к локализованным, может быть смер-
тельной. Дегрануляция тучных клеток является
центральным звеном каждой из этих реакций.
Аллергический ринит
Аллергический ринит (часто называемый сенной
лихорадкой) является наиболее распространенным
атопическим расстройством. Он вызывается на-
ходящимися в воздухе аллергенами, которые реа-
гируют с тучными клетками, сенсибилизирован-
ными IgE, в носовых ходах и конъюнктиве. Ме-
диаторы, высвобождаемые тучными клетками,
увеличивают проницаемость капилляров и вызы-
вают местное расширение сосудов, что ведет к
появлению типичных симптомов, таких как чи-
ханье и кашель.
Пищевая аллергия
Пищевая аллергия является еще одним распро-
страненным атопическим расстройством, кото-
рое вызывается определенным продуктом (напри-
мер, арахисом, рисом, яйцами). Если люди, у ко-
торых имеется аллергия, употребляют продукты-
аллергены, происходит перекрестное связывание
аллергенспецифичных IgE, располагающихся на
тучных клетках в верхнем и нижнем отделах ЖКТ.
Дегрануляция тучных клеток и высвобождение
медиаторов ведет к локальному сокращению глад-
ких мышц и расширению сосудов, что часто вы-
зывает рвоту и диарею. В некоторых случаях из-
за увеличения проницаемости слизистых оболо-
чек аллерген всасывается и поступает в крово-
ток Циркулирующий аллерген может вызывать
активацию тучных клеток, находящихся в коже,
что приводит к возникновению кожных реакций
в виде волдырей и участков гиперемии, обычно
называемых крапивницей (атопическая крапивни-
ца, рис. 14.7).
Атопический дерматит
У детей в раннем возрасте наиболее часто на-
блюдается такая форма аллергической реакции,
как аллергический дерматит. Это клиническое
расстройство обусловлено развитием воспали-
тельного повреждения кожи, индуцированного
цитокинами, которые высвобождаются тучными
клетками при дегрануляции. Эти активные вос-
палительные цитокины, высвобождаемые в не-
посредственной близости от места контакта с
аллергеном, стимулируют хемотаксис большого
количества клеток в зоны воспаления, особенно
эозинофилов. Для появляющихся кожных по-
вреждений характерны краснота и гнойнички
(лейкоциты).
• Рис. 14.7. Кожная реакция в виде волдырей и участков
гиперемии (атопическая крапивница)
232
ГЛАВА 14. РЕАКЦИИ ГИПЕРЧУВСТВИТЕЛЬНОСТИ: РЕАКЦИИ, ОПОСРЕДОВАННЫЕ АНТИТЕЛАМИ (I ТИП)
Астма
Астма является еще одной распространенной фор-
мой локализованной анафилаксии. Это хрониче-
ское обструктивное заболевание нижних дыхатель-
ных путей, протекающее с периодическими обо-
стрениями, при которых уменьшается поступле-
ние воздуха и которые являются обратимыми (по
крайней мере, частично). Считается, что клиниче-
ские проявления астмы являются результатом трех
основных патофизиологических изменений брон-
хов: I) обратимого сужения; 2) повышенной чув-
ствительности к различным физическим и хими-
ческим стимулам (гиперреактивность); 3) воспа-
ления. За последние годы заболеваемость астмой
в США и тяжесть течения заболевания чрезвы-
чайно возросли. Наибольшая смертность отмеча-
ется у детей, живущих в крупных городах. Эпиде-
миологические исследования указывают, что основ-
ным аллергеном, вызывающим астму у этих де-
тей, является калике таракана. Аллергическую
астму могут вызывать и многие другие аллерге-
ны, такие как пыльца, пыль, вирусные антигены
и различные химикаты. Помимо этого проявле-
ния астмы могут вызываться физическими нагруз-
ками или низкой температурой независимо от
присутствия аллергена — феномен, известный как
внутренняя астма (в России принят термин ин-
фекционно-воспалительная, прим. ред.).
Как считают, воспаление дыхательных путей
играет основную роль в патогенезе этого расстрой-
ства, а его устранение является основной целью
фармакологического воздействия. Привлечение
цитокинами большого количества клеток, особен-
но эозинофилов, в зоны воспаления приводит к
значительному повреждению тканей. Это повреж-
дение опосредовано большим количеством ток-
сических веществ, высвобождаемых клетками,
среди которых свободные радикалы кислорода,
окись азота и цитокины. Все это приводит к вы-
делению слизи, накоплению белков и жидкости
(отек), а также к повреждению эпителия. Все вме-
сте эти события вызывают сужение просвета брон-
хов. Адгезионные молекулы играют ключевую роль
на ранних этапах воспаления, после того как при-
влечены воспалительные клетки. Различные ци-
токины, высвобождаемые Тн2-клетками и тучны-
ми клетками (например, IL-4, IL-13 и TNFa),
усиливают экспрессию молекул адгезии на лей-
коцитах и эндотелии, включая межклеточную мо-
лекулу адгезии 1 (ICAM-1), селектин Е, адгези-
онную молекулу сосудистой клетки 1 (VCAM-1)
и функционально-связанный антиген лейкоцитов
1 (LFA-1). Адгезия эозинофилов к эндотелию, ин-
дуцированная единичным стимулом, начинает
усиливаться, способствуя миграции эозинофилов
через эндотелий и их длительному нахождению в
тканях легких. В качестве возможного способа ле-
чения астмы исследовали применение антагони-
стов адгезионных молекул (например, монокло-
нальных антител к ICAM-1). Обнадеживающие
результаты использования таких иммунотерапев-
тических препаратов у животных повышают ин-
терес к созданию антагонистов, которые можно
было бы безопасно применять при лечении че-
ловека.
• КЛИНИЧЕСКИЕ МЕТОДЫ
ВЫЯВЛЕНИЯ АЛЛЕРГЕНА.
ОСОБЕННОСТИ ТЕРАПИИ
Выявление аллергена
В клинической практике гиперчувствительность
к определенному аллергену обычно определяется
с учетом анамнеза и выраженности реакций в кож-
ных пробах. Для того чтобы избежать серьезных
последствий внутрикожного введения, пациентам,
которые могут быть чрезвычайно чувствительны
к некоторым аллергенам, сначала проводится уко-
лочная кожная проба с незначительным количе-
ством антигена. Образование на месте пробы вол-
дыря, эритемы (покраснение, обусловленное рас-
ширением кровеносных сосудов) и отека (набу-
хание, вызванное выходом сыворотки крови в
ткань) расценивается как положительный ответ
(см. рис. 14.7). Эта реакция является наиболее
быстрой из всех реакций гиперчувствительности
и достигает своего максимума в течение 10 —
15 мин, после чего угасает без какого-либо оста-
точного повреждения.
Выраженность местной кожной реакции, на-
блюдаемой в уколочных тестах или при внутри-
кожных инъекциях, в которых используется на-
бор предполагаемых аллергенов, примерно опре-
деляют степень чувствительности к определенно-
му веществу. Кроме того, если данные анамнеза
указывают на совпадение времени развития сим-
птомов со временем контакта с антигеном, то кож-
ная анафилактическая реакция может стать сви-
детельством того, что симптомы (например, чи-
ханье и резь в глазах) связаны с определенными
аллергенами, т.е. пыльцой конкретного растения
или шерстью животного, вызвавших кожную ре-
акцию.
В лабораторных условиях для количественно-
го выявления сенсибилизации используют про-
бирочные тесты, однако их результаты не корре-
лируют с клиническими симптомами в 100 % слу-
чаев.
Одно из исследований, радиоаллергосорбент-
ный тест (РАСТ), основан на использовании
ковалентной связи аллергена с нерастворимой
основой, такой как бумажный диск или гранула.
Основа, покрытая антигеном, погружается в об-
разец сыворотки пациента, что позволяет прикре-
питься к ней любым антителам, специфичным к
аллергену. После этого диск промывают и инку-
бируют с раствором антител к IgE, меченных ра-
диоактивным изотопом. Уровень связанной ра-
КЛИНИЧЕСКИЕ МЕТОДЫ ВЫЯВЛЕНИЯ АЛЛЕРГЕНА ОСОБЕННОСТИ ТЕРАПИИ
233
диоактивности определяется количеством специ-
фических антител IgE в пробе сыворотки. Гораз-
до чаще для количественного определения аллер-
генспецифического сывороточного IgE использу-
ют ферментный иммуносорбентный анализ (ELISA),
отличающийся от РАСТ тем, что для выявления
аллергенспецифичного IgE используют не анти-
тела, меченные радиоактивным изотопом, а ан-
титела, связанные с ферментом.
Особенности терапии
Изменение окружающей среды
В некоторых случаях самым простым способом
повлиять на аллергию является устранение кон-
такта с известными аллергенами — совет, кото-
рому редко следуют. В случаях, когда аллергеном
является пыльца, пациент может уехать в районы,
где в сезон активного распространения пыльцы
растениями она отсутствует. Воздушные фильтры
и респираторы также могут играть определенную
роль, но в целом людям, страдающим аллергией,
обычно трудно избежать контакта с аллергеном.
Фармакологические средства
Современная фармакологическая индустрия со-
здает лекарства, более или менее эффективные на
различных стадиях развития аллергических реак-
ций. Многие из них являются бронходилататора-
ми, используемыми для лечения пациентов с об-
структивными заболеваниями легких, такими как
астма. Бронходилататоры являются препаратами,
облегчающими доступ воздуха в легкие. Они по-
зволяют пациентам дышать более свободно и по-
могают преодолеть острый бронхоспазм. Эти пре-
параты также используются как дополнительные
средства для профилактики при симптоматиче-
ском лечении других обструктивных заболеваний
легких, таких как бронхит и эмфизема. В табл. 14.1
представлен список основных фармакологических
препаратов, используемых для лечения аллергии
и обструктивных заболеваний легких.
Иммунологические средства
В течение многих лет клинические иммунологи
использовали одну из форм иммунотерапии, на-
зываемую гипосенсибилизацией, при которой па-
циентам на протяжении продолжительного пе-
риода вводили увеличивающиеся дозы антигена,
к которому он был сенсибилизирован. Угасание
симптомов аллергии, отмечаемое у некоторых па-
циентов, приписывалось нескольким факторам.
Наиболее популярное объяснение основывалось
на том, что некоторые группы исследователей
после инъекций наблюдали увеличение синтеза
антител IgG, специфичных к аллергену. Такие ан-
титела, присутствующие в крови, связывали и уда-
ляли аллергены до того, как они получали воз-
можность встретиться и прореагировать с IgE на
поверхности тучных клеток. Такие IgG стали на-
зывать блокирующими антителами. Отмечается
некоторая корреляция между титрами антител IgG
и клиническим улучшением.
Среди эффектов, наблюдаемых при гипосен-
сибилизации, отмечается первоначальное увели-
чение уровней антител IgE, за которым следует
их длительное снижение при продолжении лече-
ния. Это снижение связано с уменьшением выра-
женности симптомов аллергии и объясняется как
приобретением толерантности, так и переключе-
нием с Тн2- на Тн1-клеточный ответ. После по-
вторных введений субклинических доз антигена
наблюдалось также прогрессивное снижение чув-
ствительности тучных клеток и базофилов к ан-
тигену. Вероятно, выраженный эффект этого вида
иммунотерапии можно объяснить и многими дру-
гими причинами. Какой бы ни была причина, эта
форма терапии обычно дает больший эффект при
прямом поступлении аллергенов в циркуляторное
русло, как, например, при поступлении пчелино-
го яда во время укуса пчелы. Такая терапия не
дает выраженного эффекта в тех случаях, когда
аллергены, например пыльца, проникают в орга-
низм через слизистые оболочки, где IgG, похоже,
неэффективны.
В настоящее время изучаются перспективные
методы иммунотерапии для лечения гиперчувстви-
тельности, опосредуемой IgE. Многообещающим
методом лечения больных астмой и аллергическим
ринитом представляется использование «гумани-
зированных» моноклональных анти-IgE-антител
(см. гл. 5), сконструированных так, что они не
связывают перекрестно IgE, прикрепленные к туч-
ным клеткам и базофилам. Также изучается воз-
можность использования плазмидных ДНК, ко-
дирующих специфический антиген (применяемый
в процессе гипосенсибилизации), цитокинов, та-
ких как IL-12 и IL-10 (используемых для пере-
ключения с Тн2- на Тн1-клеточный ответ), анти-
цитокинов, таких как антител к IL-4 (используе-
мых для подавления продукции IL-4), и антаго-
нистов цитокиновых рецепторов.
Другие иммунологические вмешательства были
опробованы в экспериментах на животных. На-
пример, было показано, что введение химически
измененного аллергена (такого как пыльца амб-
розии, денатурированная мочевиной или соеди-
ненная с полиэтиленгликолем) подавляет первич-
ный или уже имеющийся IgE-ответ. Механизм
действия может включать индукцию супрессор-
ных Т-клеток, обладающих как антигенной, так и
изотипической специфичностью. Модифициро-
ванные аллергены не соединяются с уже суще-
ствующими антителами IgE и, таким образом, не
запускают анафилактических реакций Использо-
вание модифицированных аллергенов считается
перспективным подходом к лечению аллергии.
Другие эксперименты связаны с перенаправлени-
234
ГЛАВА 14 РЕАКЦИИ ГИПЕРЧУВСТВИТЕЛЬНОСТИ: РЕАКЦИИ, ОПОСРЕДОВАННЫЕ АНТИТЕЛАМИ (I ТИП)
• Таблица 14.1. Фармакологические препараты, используемые для лечения аллергии и обструктивных
заболеваний легких
Фармако- логическая категория Препарат Фармакологическое действие Клиническое использование
0-агонисты (бронходи- лататоры) Альбутерол Уменьшает сокращение гладкой мускула- туры бронхиол; увеличивает пространство для прохождения воздуха в легкие; дей- ствует быстро (неотложное лечение) Астма, бронхит и эмфизема; пред- отвращение бронхоспазма, вы- званного физическими упражне- ниями
Сальметерол Сходен с альбутеролом, но не может ис- пользоваться при неотложных состояниях То же
Адреналин Антагонист гистамина; расслабляет глад- кую мускулатуру и уменьшает проница- емость сосудов Острые приступы бронхоспазма при эмфиземе, бронхите или анафилаксии
Метапротеренол Адренергический препарат преимуще- ственно с 02-действием; основное дей- ствие — расширение бронхиол В ряде случаев используется как адреналин; может использоваться для предотвращения бронхоспаз- мов, связанных с хроническими обструктивными заболеваниями легких
Изопротеренол Адренергический препарат с преимуще- ственно 02-действием Астма, бронхит, эмфизема и уме- ренный бронхоспазм
Производ- ные ксан- тина (бронходи- лататоры) Аминофиллин Расслабляет гладкую мускулатуру бронхов и кровеносных сосудов легких Предотвращает тяжелые приступы бронхиальной астмы; используется при лечении апноэ и брадикардии у недоношенных детей
1 еофиллин Расслабляет гладкую мускулатуру бронхов и кровеносных сосудов легких; подавляет де грануляцию тучных клеток То же
Стабилиза- торы мемб- раны туч- ной клетки Кромогликат натрия Уменьшает или предотвращает дегрануля- цию тучных клеток; предотвращает по- ступление Са2+ Используется для лечения и пред- отвращения бронхоспазма при астме, аллергическом рините
Модифика- торы лей- котриенов Зафирл укает Связывается с рецепторами лейкотриенов, предотвращая отек слизистой оболочки носа и бронхов, сокращение гладкой мус- кулатуры и патологические воспалитель- ные процессы При астме
Зилутон Подавляет формирование лейкотриенов, таким образом предотвращая сужение бронхов То же
Антигиста- минные препараты Многочисленны, включая фексо- фенадин (аллег- ра), лоратадин (кларитин), це- тиризин (зиртек) Преимущественно блокируют Н|-рецеп- торы; подавляют сокращение гладких мышц (бронхов и кишечника), мелких кровеносных сосудов и выработку слизи При аллергическом рините, ато- пическом дерматите, крапивнице, некоторых сыпях
Кортико- стероиды Многочисленны, включая гидро- кортизон, метил- преднизолон, преднизолон, преднизон, буде- зонид, флунизо- лид и флутика- зона пропионат Активные противовоспалительные препа- раты с иммунносупрессивным действием при использовании высоких доз; обладают широким диапазоном активности; как иммунномодуляторы действуют, в основ- ном блокируя транскрипцию генов (на- пример, ингибируя синтез циклооксиге- назы 2-го типа) При астме, аллергическом рини- те, крапивнице, экземе
ЗАЩИТНАЯ РОЛЬ IgE
235
— оболочка
Гельминт, покрытый
антителами IgE и IgG,
пассивно связывается
с эозинофилами
Антитела
к антигенам
гельминта
Антиген
гельминта
Гистамин
Дегрануляция /
Слизистая---------——-----------------
оболочка
Хемотаксический -►
фактор А эозинофилов,
хемотаксический фактор
Тучная нейтрофилов (IL-8)
клетка
Повышение
проницаемости
для IgG и лейкоцитов
Капилляр с антителами
и эозинофилами
в просвете
• Рис. 14.8. Повреждение гельминта эозинофилами, мигрировавшими в участок поражения
и активированными после дегрануляции тучных клеток, опосредованной IgE и антигенами
ем Тн2-ответов в сторону Тн1. Этот подход осно-
ван на том факте, что Тн2-клетки играют ключе-
вую роль в аллергических реакциях, определяя
продукцию цитокинов, таких как IL-4. которые
приводят к переключению В-клеток на продук-
цию антител класса IgE.
• ЗАЩИТНАЯ РОЛЬ IgE
Защитные эффекты аллергических реакций мож-
но наблюдать в тех случаях, когда сенсибилизи-
рующий антиген является производным много-
численных червей-паразитов, таких как гельмин-
ты. Иммунный ответ на присутствие гельминтов
способствует стимуляции IgE. В результате пере-
крестного связывания антигенов паразита IgE,
фиксированным на поверхности тучных клеток
(и эозинофилов), высвобождаются гистамин и дру-
гие медиаторы, участвующие в анафилактической
реакции. В результате увеличения проницаемо-
сти, вызванной высвобождением гистамина, к ме-
сту заражения паразитами поступают компонен-
ты сыворотки крови, содержащие в том числе ан-
титела IgG. Эти антитела прикрепляются к по-
верхности гельминта и привлекают эозинофилы,
которые поступают в этот участок в результате хе-
мотаксических эффектов ХФЭ-А. Затем эозино-
филы прикрепляются к гельминтам, покрытым
IgG, посредством своих мембранных рецепторов
к Fc-фрагментам и высвобождают содержимое
своих гранул (рис. 14.8 и 14.9). Как указывалось
ранее, эозинофилы также экспрессируют низко-
аффинные Fc-рецепторы к IgE, которые способ-
ствуют связыванию этих клеток с гельминтами,
покрытыми IgE. Основной составляющей содер-
жимого гранул, высвобождаемых эозинофилами,
является ГОБ, который покрывает поверхность
гельминта и приводит, пока еще неизвестно, ка-
ким образом, к гибели паразита и его последующе-
му выведению из организма. В антипаразитарном
иммунном ответе все компоненты реакции I типа
действуют сообща, обеспечивая защитное дей-
ствие. Положительный эффект анафилактических
реакций у многих животных дает основание по-
лагать, что реакция с вовлечением IgE возникла
у них как раз для борьбы с червями-паразитами.
• Рис. 14.9. Электронная микроскопия (хбООО) эозино-
филов (Е), прикрепившихся к шистозоме (S), покрытой
антителами. Клетки слева еще не начали дегрануляцию,
но рядом с клеткой справа видна выделенная ею элект-
ронно-плотная субстанция (стрелки), которая находится
между клеткой и паразитом (с любезного разрешения
J.Caulfield, Harvard Medical School)
236
ГЛАВА 14. РЕАКЦИИ ГИПЕРЧУВСТВИТЕЛЬНОСТИ: РЕАКЦИИ, ОПОСРЕДОВАННЫЕ АНТИТЕЛАМИ (I ТИП)
РЕЗЮМЕ
1. Аллергические реакции опосредуются антите-
лами IgE, которые связываются с Fc-рецепторами,
специфичными для IgE (FceR), на поверхности туч-
ных клеток и базофилов. Если эти рецепторы пере-
крестно связываются при контакте со специфичны-
ми антигенами, то происходит стимуляция клетки с
высвобождением из ее гранул воспалительных ме-
диаторов, а также синтезом других продуктов из
компонентов мембран.
2. Продукция IgE зависит от Т-лимфоцитов. Ал-
лергены стимулируют индукцию Тн2-клеток, которые
высвобождают цитокины (IL-4, IL-13), определяющие
переключение класса в В-лимфоцитах для производ-
ства IgE.
3. После перекрестного связывания IgE на тучных
клетках возникает воспаление, вызванное высвобож-
даемыми этими клетками воспалительными медиато-
рами. Это воспаление можно условно разделить на
две фазы, последняя из которых длится в течение не-
скольких дней.
4. Симптомы аллергических реакций полностью
определяются воспалительными медиаторами, высво-
бождаемыми активированными тучными клетками
При этом очень быстро появляются симптомы, харак-
терные для реакций и обусловленные увеличением
проницаемости сосудов, сокращением гладких мышц
и притоком эозинофилов.
5. Ранняя стадия аллергических реакций (немед-
ленная фаза) определяется уже существующими или
быстро синтезируемыми короткоживущими медиато-
рами, такими как гистамин и простагландины, которые
вызывают быстрое увеличение проницаемости сосу-
дов и сокращение гладкой мускулатуры.
6. Аллергические реакции поздней фазы связаны
с синтезом и высвобождением активированными
тучными клетками медиаторов, таких как лейкотрие-
ны, цитокины и хемокины. Они привлекают к месту
воспаления другие лейкоциты, включая эозинофилы
и Тн2-клетки. В этом случае отмечается менее выра-
женное сокращение гладкой мускулатуры, чем при
немедленной реакции, стойкий отек и (в случае на-
личия у пациента астмы) гиперреактивность бронхов
при действии неспецифических бронхосуживающих
стимулов, таких как гистамин и метахолин.
7. Клинические проявления аллергии включают
локализованные реакции, такие как аллергический
ринит, атопический дерматит, пищевые аллергии и
обструктивные заболевания легких (например, астма,
бронхит и эмфизема).
8. Системные реакции могут приводить к угрожа-
ющей жизни анафилаксии.
9. Несмотря на опасность системных реакций,
вызванных гиперчувствительностью I типа, опосредо-
ванных IgE, значение этого вида реакций, вероятно,
определяется способностью IgE осуществлять защит-
ные функции при паразитарных инвазиях.
10. Распространенными лекарственными препара-
тами, используемыми для лечения аллергических ре-
акций, являются бронходилататоры (Р-агонисты и про-
изводные ксантина), кортикостероиды, кромогликат
натрия, антигистаминные препараты и модификаторы
лейкотриенов.
ТЕСТЫ
Выберите ОДИН НАИБОЛЕЕ ПРАВИЛЬНЫЙ ответ
на каждый тест.
1. Мужчина 26 лет с выраженной аллергией на ко-
шек посетил дом, где живет много кошек. Два часа
спустя он поступил в центр неотложной помощи с тя-
желым обострением астмы. Его лечили адреналином и
бронходилататорами короткого действия. Вскоре после
начала лечения симптомы исчезли, однако через 8 ч
он был вынужден обратиться в отделение неотложной
помощи с новым обострением. Назовите наиболее ве-
роятную причину появившихся у него симптомов:
а) дополнительное перекрестное связывание IgE
на тучных клетках, приводящее к высвобождению ли-
пидных медиаторов и цитокинов;
б) продукция IFNy CD4+-TH1 -клетками;
в) активация комплемента, приводящая к деграну-
ляции тучных клеток, вызванная С5а и СЗа;
г) инфильтрация эозинофилами и базофилами, ве-
дущая к высвобождению провоспалительных медиато-
ров;
д) привлечение нейтрофилов и высвобождение
компонентов цитоплазматических гранул.
2. Мужчина 24 лет с аллергией на кошек носит за-
щитную маску для уменьшения контакта с аллерге-
ном, когда заходит к другу, у которого есть кошка.
Несколько часов спустя он начинает чихать и кашлять.
Аллергическую реакцию, наблюдаемую у этого мужчи-
ны, объясняет следующее:
а) после перекрестного связывания аллергенспе-
цифичных IgE на поверхности тучных клеток в ЖКТ
происходит их дегрануляция, и воспалительные меди-
аторы перемещаются в легкие;
б) после перекрестного связывания аллергенспе-
цифичных IgE на поверхности тучных клеток происхо-
дит их дегрануляция в сосудах, вызывая системную
воспалительную реакцию;
в) после перекрестного связывания аллергенспе-
цифичных IgE на поверхности тучных клеток происхо-
дит их дегрануляция в легких;
г) после перекрестного связывания аллергенспе-
цифичных IgE на поверхности тучных клеток происхо-
дит их дегрануляция в коже, вызывая системную вос-
палительную реакцию.
3. При аллергических реакциях обычно отмечается
следующая последовательность событий:
а) аллерген связывается с циркулирующими IgE,
а затем комплекс IgE —аллерген прикрепляется к туч-
ным клеткам;
б) аллергены прикрепляются к IgE, фиксированно-
му на тучных клетках;
в) аллерген процессируется АПК, а затем соединя-
ется с гистаминовыми рецепторами;
г) аллерген процессируется АПК и прикрепляется
к тучным клеткам;
д) аллерген соединяется с IgG.
4. Адреналин:
а) вызывает расширение бронхов;
б) эффективен даже после наступления симптомов
анафилаксии;
в) расслабляет гладкую мускулатуру;
ТЕСТЫ
237
г) уменьшает проницаемость сосудов;
д) все перечисленное.
5. Доброволец согласился пройти пассивную сен-
сибилизацию IgE, специфичным к антигену (аллерге-
ну) амброзии. При внутрикожном введении аллергена
у него появилась типичная кожная реакция, связанная
с реакцией немедленной гиперчувствительности. Ука-
жите, какую следовало ожидать реакцию, если бы до
инъекции сенсибилизирующим IgE была проведена
инъекция (в то же место) Fc-фрагментов человеческо-
го IgE:
а) никакой бы реакции не произошло, поскольку
Fc-фрагменты взаимодействовали с аллергеном и
предотвращали их доступ к сенсибилизированным
тучным клеткам;
б) никакой бы реакции не произошло, поскольку
Fc-фрагменты взаимодействовали с IgE-антителами,
делая антигенсвязывающий участок недоступным для
прикрепления антигена;
в) никакой бы реакции не произошло, поскольку
Fc-фрагменты взаимодействовали с FccR-рецептора-
ми тучных клеток;
г) реакция будет усиленной из-за увеличенной мест-
ной концентрации IgE Fc-фрагментов;
д) реакция будет усиленной из-за активации комп-
лемента.
6. Эффективность десенсибилизирующей терапии
у пациентов с аллергией, если известен аллерген, опре-
деляет следующий механизм:
а) усиленная продукция IgG, который связывает
аллерген до того, как происходит его контакт с тучны-
ми клетками;
б) перенаправление Т-клеточных реакций от Тн2
кТн1;
в) уменьшение склонности тучных клеток и базо-
филов к дегрануляции при контакте с аллергеном;
г) уменьшение продукции антител IgE;
д) все перечисленное.
7. Антигистаминные препараты:
а) блокируют Н-|-рецепторы и препятствуют сокра-
щению гладких мышц, расширению мелких кровенос-
ных сосудов и выработке слизи;
б) непосредственно связывают гистамин, блокируя
таким образом его воспалительное действие;
в) воздействуют на активность лейкотриенов;
г) подавляют связывание IgE с тучными клетками;
д) являются адренергическими препаратами, кото-
рые в основном расширяют бронхиолы.
8. В РАСТ с пыльцой амброзии:
а) сыворотка крови пациента первоначально смеши-
вается с анти-IgE, меченным радиоактивным изотопом:
б) выявляются только антитела IgE против амброзии;
в) сыворотка крови пациента конкурентно подавля-
ет связывание анти-IgE;
г) используется моновалентный IgE;
д) используется комплемент.
9. Укажите верное высказывание об анафилакти-
ческих реакциях:
а) развиваются в течение нескольких минут и про-
ходят через 30 мин;
б) спустя несколько часов за ними могут последо-
вать воспалительные явления;
в) являются последствием применения фармако-
логических средств;
г) в них могут участвовать компоненты матрикса
гранул тучных клеток;
д) все перечисленное.
СИТУАЦИОННАЯ ЗАДАЧА
Во время игры в теннис в жаркий день молодой че-
ловек почувствовал, как ему на руку села оса, и смах-
нул ее, но все-таки получил незначительный укус, на
который не обратил внимания. Через 10 мин он ощу-
тил дурноту и зуд в области подмышек и волосистой
части головы. Когда у него появилась крапивница и
стеснение в груди, он обратился в больницу. По доро-
ге в больницу у молодого человека появился озноб и
выступил холодный пот. В такси он потерял сознание.
В отделении неотложной терапии его пульс едва про-
щупывался. Что произошло и почему?
ОТВЕТЫ НА ТЕСТЫ
1 — г. Время развития симптомов, наблюдаемых у
пациента, характерно для аллергических реакций
поздней фазы, при которых происходит инфильтрация
эозинофилами. Выходу эозинофилов, так же как и
других лейкоцитов, из кровотока в ткани способству-
ют повышенная проницаемость сосудов, вызванная
действием провоспалительных цитокинов и гистамина
2 — в. Несмотря на защитные барьеры, такие как
маска для предотвращения вдыхания аллергена, не-
большое количество аллергенов, находящихся в воз-
духе, таких как кошачья шерсть, может все-таки про-
никать с воздухом и вызывать дегрануляцию сенсиби-
лизированных IgE тучных клеток в легких. Все осталь-
ные ответы неправильны.
3 — б. У больных аллергией уже отмечались IgE-
реакции на специфические аллергены. Иммуноглобу-
лин пассивно связывается с клетками, экспрессиру-
ющими высокоаффинные Fc-рецепторы для IgE (на-
пример, тучными клетками), и взаимодействует с ал-
лергеном при его поступлении. Это приводит к пере-
крестному связыванию высокоаффинных FceR и вы-
зывает дегрануляцию тучных клеток. Чтобы связаться
с IgE, аллергену не нужно процессировать АПК.
4 — д. Адреналин вызывает все перечисленные
эффекты и используется для лечения симптомов ост-
рой анафилаксии.
5 — в. Поскольку Fc-фрагменты IgE будут связы-
ваться с высокоаффинными FceR, экспрессируемыми
на поверхности тучных клеток, аллергенспецифичный
IgE не будет иметь доступа к этим рецепторам и, та-
ким образом, не будет связываться с этими клетками.
При введении аллергена внутрикожно, в то время как
он будет связываться на месте с аллергенспецифич-
ными IgE, не будет происходить перекрестного свя-
зывания FceR, прикрепленных к растворимым IgE
Fc-фрагментам. Из этого следует, что не будет и не-
медленной реакции гиперчувствительности.
6 — д. Все перечисленные механизмы в опре-
деленной степени присутствуют при данном виде те-
рапии.
238
ГЛАВА 14. РЕАКЦИИ ГИПЕРЧУВСТВИТЕЛЬНОСТИ: РЕАКЦИИ, ОПОСРЕДОВАННЫЕ АНТИТЕЛАМИ (I ТИП)
7 — а. Антигистаминные препараты действуют пу-
тем блокирования Н^рецепторов гистамина, но не
самого гистамина. Они действуют не путем оказания
влияния на активность лейкотриенов или путем свя-
зывания с IgE на тучных клетках. Они не являются так-
же адренергическими препаратами.
8 — б. В РАСТ определяются антитела IgE, кото-
рым дают возможность связаться с аллергеном, свя-
занным с нерастворимой средой (матриксом). Этот
тест выявляет антитела IgE против амброзии. Во вре-
мя его проведения ни моновалентные IgE, ни компле-
мент не используются.
9 — д. Все утверждения верны. Утверждения «а» и
«в» верны при кожных реакциях с волдырями и гипере-
мией, в то время как в вариантах «б» и «г» описывают-
ся проявления реакции поздней фазы, которая являет-
ся осложнением некоторых анафилактических реакций.
ОТВЕТ НА СИТУАЦИОННУЮ ЗАДАЧУ
Этот случай является классическим проявлением
системной анафилаксии. В отделении неотложной
помощи молодому человеку быстро ввели адрена-
лин, и симптомы, обусловленные повышенной про-
ницаемостью сосудов (крапивница, низкое артери-
альное давление) и сокращением гладкой мускула-
туры, были быстро купированы. Когда он пришел в
себя, молодой человек вспомнил, что в прошлом его
не раз жалили похожие насекомые; последний раз
это случилось 3 мес назад, но тогда каких-либо за-
метных последствий не отмечалось. Эти укусы, оче-
видно, явились сенсибилизирующей иммунизацией,
которая привела к появлению антител IgE в количе-
стве, достаточном для сенсибилизации тучных кле-
ток и базофилов. Таким образом, в последнем слу-
чае, несмотря на небольшое количество введенного
яда, его хватило для возбуждения системной ре-
акции. Тщательный кожный тест с внутрикожным
введением крайне малого количества осиного яда
должен привести к немедленному появлению кож-
ной реакции (волдырь и гиперемия), подтверждаю-
щей такую чувствительность. Молодому человеку
следует порекомендовать: 1) избегать контактов с
осами; 2) носить с собой укладку с адреналином для
инъекций; 3) пройти десенсибилизирующую тера-
пию, направленную на гипосенсибилизацию к анти-
гену осиного яда
Глава
15
РЕАКЦИИ ГИПЕРЧУВСТВИТЕЛЬНОСТИ:
РЕАКЦИИ, ОПОСРЕДОВАННЫЕ АНТИТЕЛАМИ
(II ТИП), И РЕАКЦИИ, ОБУСЛОВЛЕННЫЕ
ИММУННЫМИ КОМПЛЕКСАМИ (III ТИП)
е ВВЕДЕНИЕ
Реакции гиперчувствительности II и III типов
опосредуются антителами, принадлежащими к
IgG, IgM, а в некоторых случаях изотипами IgA
или IgE. В настоящее время известно, что эти
реакции обладают некоторыми общими эффек-
торными механизмами. Различия между двумя
формами гиперчувствительности лежат в типе и
расположении антигена, вовлеченного в реакцию,
и том способе, с помощью которого антиген со-
единяется с антителом. Важно понимать, что во
многих случаях антигены-мишени, вовлеченные
в такие реакции гиперчувствительности, являют-
ся аутоантигенами. Цитотоксические реакции ги-
перчувствительности II типа стимулируются пу-
тем непосредственного прикрепления антитела к
антигену на поверхности клетки. Реакции III типа
стимулируются иммунными комплексами анти-
ген-антитело. Иммунные механизмы, которые
определяют клинические проявления при таких
реакциях гиперчувствительности, рассматриваются
в данной главе.
Цитотоксические реакции:
гиперчувствительность II типа
Как показывают приведенные далее примеры кли-
нически важных реакций гиперчувствительности
II типа, многие из этих цитотоксических реакций
являются выражением аутоиммунитета, опосре-
дованного антителами. Механизмы, связанные с
продукцией аутоантител, были описаны в гл. 12.
Антитела, вовлеченные в такие реакции гипер-
чувствительности, направлены или против обыч-
ных (например, перекрестно-реагирующие анти-
тела, возникшие после инфекции), или против
измененных аутоантигенов (например, аутоанти-
тела, измененные под воздействием лекарствен-
ных средств и возникшие после их связывания с
мембранами некоторых клеток). Клетка-мишень
при этом либо повреждается, либо разрушается
различными механизмами. В таких цитотоксиче-
ских реакциях задействованы три различных ме-
ханизма, опосредованные антителами.
Реакции, опосредованные
комплементом
При реакциях гиперчувствительности, опосредо-
ванных комплементом, антитела реагируют с ком-
понентом мембраны клетки, приводя к фиксации
комплемента. Этим запускается каскад компле-
мента (обсуждалось в гл. 13), что ведет или к ли-
зису клетки, или к опсонизации, опосредованной
рецепторами для Fc или СЗЬ (рис. 15.1, А). Опсо-
низация способствует фагоцитозу и разрушению
клетки макрофагами и нейтрофилами, экспрес-
сирующими поверхностные рецепторы для Fc или
СЗЬ. Наиболее часто этими механизмами повреж-
даются клетки крови. Интересно отметить, что у
мышей, нокаутных по Fc-рецепторам для IgG, не
запускаются реакции гиперчувствительности II ти-
па (и III типа) — эти данные подчеркивают роль
Fc-рецепторов для IgG в инициации каскадов этих
реакций.
Антителозависимая
клеточно-опосредованная
цитотоксичность
При антителозависимой клеточно-опосредован-
ной цитотоксичности (АЗКЦ) используются Fc-
рецепторы, экспрессируемые на клетках многих
240
ГЛАВА 15. РЕАКЦИИ ГИПЕРЧУВСТВИТЕЛЬНОСТИ: РЕАКЦИИ, ОПОСРЕДОВАННЫЕ АНТИТЕЛАМИ...
Мембрано-
атакующий
комплекс
СЗЬ
Осмотический
лизис
Фагоцитоз
макрофагом
АЗКЦ
Антитела против
рецепторов
Апоптоз
Т-клетки
Б
В
• Рис. 15.1. Три разных механизма повреждения, опосредуемого антителом, при гиперчувствительности II типа. (А) Ре-
акции с участием комплемента, ведущие к лизису клеток или делающие эти клетки чувствительными к фагоцитозу
(Б) При АЗКЦ клетку-мишень, покрытую IgG, убивают клетки, несущие Fc-рецепторы для IgG (например, NK-клетки или
макрофаги). (В) Антитела к рецепторам нарушают нормальную функцию рецепторов. В данном случае антитела против
рецептора к ацетилхолину нарушают нервно-мышечную проводимость при злокачественной миастении
типов (например, натуральных киллерах, макро-
фагах, нейтрофилах, эозинофилах), которые обес-
печивают средства привлечения этих клеток и
вступление в контакт с клетками-мишенями, по-
крытыми антителами (рис. 15.1, Б). Лизис этих
клеток-мишеней требует непосредственного кон-
такта, но не связан с фагоцитозом или фиксацией
комплемента. Напротив, лизис клеток-мишеней
при АЗКЦ аналогичен киллингу цитотоксически-
ми Т-клетками и включает высвобождение перфо-
рина и гранзимов из цитоплазматических гранул
(модифицированных лизосом). После высвобож-
дения из литических гранул перфорины проника-
ют в мембрану клетки-мишени и полимеризуются
с образованием пор. При этом гранзимы, к кото-
рым относятся по крайней мере три сериновые про-
теазы, проникают в цитоплазму клетки-мишени и
активируют реакции, ведущие к апоптозу.
В реакциях АЗКЦ участвуют IgG и Fc-рецеп-
торы для IgG (Fcylll, известные также как CD16).
В частности, подклассы IgG — IgGi и IgG3 — спо-
собны вызывать реакции АЗКЦ, поскольку их Fc-
фрагменты способны связываться с CD 16. Однако
в АЗКЦ могут также участвовать антитела класса
IgE. В этом случае низкоаффинные Fc-рецепторы
для IgE (FceRII), экспрессированные на опреде-
ленных клетках, включая эозинофилы, как указы-
валось в предыдущей главе, связываются с Fc-фраг-
ментом антител IgE, прикрепленных к антигенам-
мишеням (например, паразитам, см. рис. 14.7).
ПРИМЕРЫ ЦИТОТОКСИЧЕСКИХ РЕАКЦИЙ ГИПЕРЧУВСТВИТЕЛЬНОСТИ
241
Опосредованные антителами
нарушения функции клеток
Рецепторы клеточной поверхности также могут
служить антигенами-мишенями в реакциях гипер-
чувствительности II типа. Когда аутоантитела при-
крепляются к таким рецепторам, они или наруша-
ют функцию клеток, или вмешиваются в ее регу-
ляцию без повреждения клеток или воспаления.
В следующем подразделе рассмотрены несколь-
ко примеров клинически важных антитело-опо-
средованных цитотоксических реакций гиперчув-
ствительности.
♦ ПРИМЕРЫ ЦИТОТОКСИЧЕСКИХ
РЕАКЦИЙ ГИПЁРЧУВСТВИТЕЛЬНОСТИ
Трансфузионные реакции
Переливание АВО-несовместимой крови приводит
к развитию цитотоксических реакций, опосредо-
ванных комплементом. Например, у людей с груп-
пой крови 0 по еше не достаточно ясным причи-
нам в кровотоке находятся анти-А- и анти-В-ан-
титела класса IgM (изогемагглютинины). которые
реагируют с субстанциями групп крови А и В со-
ответственно. Если такому человеку переливают
эритроциты типа А, мгновенные последствия мо-
гут быть катастрофическими. Поскольку у этих
людей имеется значительное количество анти-
А-антител IgM в кровотоке, на всех перелитых
А-эритроцитах будут закрепляться антитела. В свя-
зи с эффективной активацией комплемента ан-
тителами IgM (одна молекула IgM может активи-
ровать многочисленные молекулы комплемента;
см. гл. 13) и отсутствием механизмов восстанов-
ления мембраны эритроцитов разрушаются ком-
плементом, и клетки подвергаются лизису. При
этом не только не достигается необходимый эф-
фект от переливания, но и реципиент подверга-
ется риску развития почечной недостаточности,
связанной с блокадой почек большим количеством
клеточных мембран эритроцитов, и возможности
токсических эффектов при высвобождении ком-
плекса гема.
Реакции, вызванные
лекарственными средствами
На некоторых людей определенные лекарствен-
ные средства действуют как гаптены. Они соеди-
няются с клетками или другими компонентами
крови и приводят к формированию антител. Ког-
да антитела соединяются с клетками, покрытыми
лекарственным средством, возникает цитотокси-
ческое повреждение. Его тип зависит от типа клет-
ки, соединяющейся с лекарственным средством.
Например, некоторые лекарственные средства
могут соединяться с тромбоцитами, делая их им-
муногенными. Ответы со стороны антител при-
водят к лизису тромбоцитов, вызывая тромбоци-
топению (малое количество тромбоцитов в кро-
ви). Это нарушение в свою очередь приводит к
появлению пурпуры (кровоизлияний в кожу, сли-
зистые оболочки и внутренние органы), что яв-
ляется основной проблемой при тромбоцитопе-
нической пурпуре, вызванной приемом лекар-
ственных средств. Отмена препарата ведет к ис-
чезновению симптомов. Другие лекарственные
средства, такие как хлорамфеникол (антибиотик),
могут связываться с лейкоцитами; феноцитин
(анальгетик) и хлорпромазин (транквилизатор) —
с эритроцитами. Следствием иммунного ответа на
эти лекарственные средства может явиться агра-
нулоцитоз (уменьшение количества гранулоцитов)
в случае, если задействованы лейкоциты, и гемо-
литической анемии в случае, если повреждаются
эритроциты. Повреждение этих клеток-мишеней
в данных случаях может опосредоваться любым
из двух механизмов, описанных ранее: цитоли-
зом посредством активации комплемента или раз-
рушением клеток путем фагоцитоза, опосредован-
ного рецепторами к Fc или СЗЬ.
Реакции при резус-конфликте
В клинической практике резус-конфликт отмеча-
ется при реакциях резус(КЬ)-несовместимости,
встречающихся у детей, рожденных от родителей
с резус-несовместимыми группами крови. Резус-
антигены были названы так, поскольку кроличья
антисыворотка, полученная против эритроцитов
обезьян макак-резус, агглютинировала эритроци-
ты примерно у 85 % обследованных людей. Эри-
троциты таких людей обозначаются как Rh+, в то
время как эритроциты оставшихся 15% населе-
ния — как Rh . Резус-отринательные матери мо-
гут сенсибилизироваться к Rh-антигенам во вре-
мя своей первой беременности ребенком, чьи
эритроциты были резус-положительными. Это
происходит в результате попадания некоторых
эритроцитов ребенка в кровоток матери во время
рождения. Если мать при этом получила доста-
точную иммунизацию, чтобы производить анти-
Rh-антитела изотипа IgG, то следующий плод
будет находиться в группе риска, поскольку ан-
титела IgG способны проходить через плаценту
(см. гл. 4). Таким образом, при второй и последу-
ющих беременностях, когда aHTn-Rh-антитела IgG
проходят через плаценту, они связываются с Rh-
антигеном на эритроцитах плода. Так как плот-
ность расположения Rh-антигена на поверхности
эритроцита мала, эти антитела не способны на-
прямую приводить к лизису или агглютинации
клеток. Однако покрытые антителами клетки ак-
тивно разрушаются посредством опсонического
действия Fc-фрагментов IgG, которые взаимодей-
242
ГЛАВА 15. РЕАКЦИИ ГИПЕРЧУВСТВИТЕЛЬНОСТИ: РЕАКЦИИ, ОПОСРЕДОВАННЫЕ АНТИТЕЛАМИ...
ствуют с Fc-рецепторами на фагоцитирующих
клетках РЭС. Результатом является усиливающе-
еся разрушение эритроцитов плода или новорож-
денного, патологические последствия которого
определяются снижением способности крови пе-
реносить кислород. При этом развивается желту-
ха. обусловленная продуктами разрушения гемо-
глобина, — состояние, называемое гемолитиче-
ской болезнью новорожденных (эритробластозом
плода). Предотвратить такую реакцию Rh-несов-
местимости можно, если ввести матери анти-Rh-
антитела в течение 72 ч в период родов, чтобы
эффективно блокировать фазу сенсибилизации.
Это также приводит к быстрому выведению из
кровотока матери Rh+-KiieTOK. Одним из широко
применяемых препаратов анти-ИЬ-антител являют-
ся антитела (Rhogam) против антигена D, в на-
стоящее время считающегося наиболее сильным
иммуногеном и наиболее важным из всех Rh-ан-
ти генов.
Аутоиммунные реакции с вовлечением
рецепторов клеточных мембран
Примером опосредованной антителами дисфунк-
ции клеток, обусловленной реакцией с клеточ-
ными рецепторами, является аутоиммунное забо-
левание — злокачественная миастения. Антаго-
нистические аутоантитела реагируют с ацетилхо-
линовыми рецепторами концевых пластинок дви-
гательного нерва скелетных мышц, нарушая не-
рвно-мышечную проводимость и вызывая слабость
мышц (рис. 15.1, В). Антитела в некоторых слу-
чаях могут служить и агонистами, вызывая сти-
муляцию клеток-мишеней. Примером последне-
го случая является болезнь Грейвса, при которой
антитела к рецепторам тироидстимулирующего
гормона (ТСГ) на эпителиальных клетках щито-
видной железы стимулируют клетки, приводя к
гипертиреозу. Более детально эти заболевания рас-
смотрены в гл. 12.
Аутоиммунные реакции с вовлечением
детерминант других клеточных мембран
Вследствие некоторых инфекционных заболева-
ний или других пока еще неизвестных причин у
отдельных людей появляются антитела против
собственных клеток крови (аутоиммунная гемо-
литическая анемия) Если клетками-мишенями
являются эритроциты, присоединение антиэрит-
роцитарных антител сокращает их срок жизни
или приводит к их уничтожению посредством
механизмов гемолиза или фагоцитоза с помощью
рецепторов для Fc и СЗЬ. Если продукция новых
эритроцитов не будет компенсировать их убыль,
все это может вызвать прогрессирующую анемию.
Иногда антитела эффективно связываются толь-
ко при низких температурах (холодовые агглюти-
нины); в этих случаях понижение температуры
тела, особенно охлаждение рук и ног, ведет к ак-
тивному прикреплению антител и разрушению
эритроцитов.
Другим примером разрушения клеток аутоан-
тителами является идиопатическая тромбоцито-
пеническая пурпура. При этом заболевании анти-
тела, направленные против тромбоцитов, вызы-
вают их разрушение комплементом или фагоци-
тирующими клетками с рецепторами Fc или СЗЬ
Уменьшение количества тромбоцитов может при-
вести к кровоизлияниям (пурпура). Таким же об-
разом антитела, направленные против гранулоци-
тов, могут привести к агранулоцитозу, что делает
человека восприимчивым к различным инфекци-
ям. Наконец, могут формироваться антитела про-
тив других компонентов ткани, таких как колла-
ген базальной мембраны, вызывая синдром Гуд-
пасчера (см. гл. 12), и против десмосом, приводя
к вульгарной пузырчатке (пемфигусу).
При предыдущем обсуждении внимание ак-
центировалось на реакциях II типа, вызываемых
лекарственными средствами, однако следует учи-
тывать, что гиперчувствительность к ним может
также вызывать реакцию немедленной гиперчув-
ствительности, опосредованную IgE (I типа), ре-
акцию ГЗТ (IV тип; см. гл. 16) и реакции, опо-
средованные иммунными комплексами (III тип),
рассматриваемые далее. Некоторые реакции вы-
зываются лекарственными средствами, действу-
ющими как гаптены, соединяющиеся с некото-
рыми компонентами организма (см. гл. 16). дру-
гие реакции могут индуцироваться лекарствен-
ными средствами, действующими как контакт-
ный аллерген.
• РЕАКЦИИ, ОБУСЛОВЛЕННЫЕ
ИММУННЫМИ КОМПЛЕКСАМИ:
ГИПЕРЧУВСТВИТЕЛЬНОСТЬ III ТИПА
В нормальных условиях циркулирующие иммун-
ные комплексы удаляются фагоцитирующими
клетками, при этом такие комплексы соединяют-
ся с Fc-рецепторами IgG, экспрессированными
на этих клетках. Кроме того, эритроциты, име-
ющие СЗЬ-рецепторы, могут связывать комплек-
сы, соединенные с комплементом, и транспорти-
ровать их в печень, где они удаляются фагоцити-
рующими купферовскими клетками. Если в цир-
кулирующей крови появляется большое количе-
ство иммунных комплексов определенного раз-
мера, они могут откладываться в тканях и спо-
собствовать появлению различных системных пато-
логических изменений, так называемых реакций
гиперчувствительности III типа. Такие реакции
могут быть системными или локализованными.
Они опосредуются отложением иммунных комп-
лексов в тканях, особенно почках, коже, суставах,
сосудистом сплетении и цилиарной артерии глаза.
РЕАКЦИИ, ОБУСЛОВЛЕННЫЕ ИММУННЫМИ КОМПЛЕКСАМИ: ГИПЕРЧУВСТВИТЕЛЬНОСТЬ III ТИПА
243
Формирование иммунных комплексов может ини-
циироваться чужеродными антигенами, такими
как бактерии или вирусы, или, как при реакции
Артюса (описывается далее), при попадании боль-
шого количества чужеродного белкового антиге-
на внутрь кожи или в легкие. В отличие от этого
эндогенные антигены, такие как ДНК, могут быть
мишенью для аутоантител, как при системной
красной волчанке (СКВ). В последнем случае кли-
нический результат наиболее точно определяет
аутоиммунный феномен (см. гл. 12). У больных с
СКВ часто наблюдаются как системное (мульти-
органное), так и локализованное проявления бо-
лезни иммунных комплексов. Локализованное
повреждение ткани возникает в результате фор-
мирования комплексов антиген — антитело во
внесосудистых пространствах (например, в гло-
мерулах почек). Это т^кже происходит при раз-
личных гломерулярных заболеваниях, при которых
иммунные комплексы формируются in situ на ба-
зальной мембране гломерул.
Механизм повреждения, наблюдаемый при за-
болеваниях, опосредованных иммунными комп-
лексами, одинаков независимо от формы отло-
жения иммунного комплекса (т.е. системного или
локального) Центральное место в патогенезе по-
вреждения ткани занимают фиксация комплемен-
та иммунными комплексами, активация каскада
комплемента и высвобождение биологически ак-
тивных фрагментов (например, анафилатоксинов
СЗа и С5а; см. гл. 13). Активация комплемента
приводит к увеличению проницаемости сосудов
и стимуляции привлечения ПМЯ фагоцитов, вы-
свобождающих лизосомальные ферменты (напри-
мер, нейтральные протеазы), которые могут по-
вредить базальную мембрану гломерул.
Изотип имуноглобулинов, вовлеченных в ре-
акции гиперчувствительности III типа, обычно
IgG, но могут вовлекаться и IgM. Как и при ре-
акциях гиперчувствительности II типа, Fc-рецеп-
торы для IgG (CD 16), экспрессируемые на лей-
коцитах, играют решающую роль в инициации
каскадов реакций III типа. Комплексы антиген-
антитело могут фиксировать комплемент и/или
активировать эффекторные клетки (основная
часть представлена нейтрофилами), которые вы-
зывают повреждение ткани. Анафилатоксины СЗа
и С5а, получающиеся при активации комплемен-
та, приводят к высвобождению тучными клетка-
ми и базофилами метаболитов арахидоновой кис-
лоты и хемокинов, которые привлекают допол-
нительные базофилы, эозинофилы, макрофаги и
нейтрофилы в место реакции. Полиморфные
клетки высвобождают свои лизосомальные фер-
менты на поверхности поврежденной ткани.
Происходит стимулирование макрофагов с вы-
свобождением фактора некроза опухоли a (TNFa)
и IL-1, при этом тромбоциты формируют мик-
ротромбы и участвуют в пролиферации клеток
путем высвобождения тромбоцитарного фактора
роста (PDGF).
Системное заболевание, вызванное
иммунными комплексами
Патогенез системного заболевания, вызванного
иммунными комплексами, может быть разделен
на три фазы В течение первой фазы в кровотоке
формируются иммунные комплексы антиген —ан-
титело. Вслед за этим происходит депонирование
иммунных комплексов в разных тканях, которое
приводит к развитию третьей фазы — воспали-
тельным реакциям в них (рис. 15.2). Некоторые
факторы позволяют определить, приведет ли фор-
мирование иммунных комплексов к их депони-
рованию в тканях и заболеванию. В этом смысле
важным является размер комплексов. Очень боль-
шие комплексы, формирующиеся в условиях из-
бытка антител, быстро удаляются из кровотока
фагоцитирующими клетками и таким образом не
представляют опасности. Мелкие и среднего раз-
мера комплексы довольно длительный период
времени циркулируют в кровотоке и прикрепля-
ются с меньшей авидностью к Fc-рецепторам для
IgG, экспрессируемым на фагоцитирующих клет-
ках. Таким образом, мелкие и средние иммунные
комплексы являются более патогенными, чем
большие. Вторым фактором, который может по-
влиять на развитие системного заболевания, вы-
званного иммунными комплексами, является це-
лостность системы мононуклеарных фагоцитов.
Изначальное нарушение функции этой системы
повышает вероятность длительного нахождения
иммунных комплексов в циркуляции. Предпола-
гается, что перегрузка этой фагоцитарной систе-
мы большим количеством иммунных комплексов
также подрывает ее способность удалять их из
кровотока. По еще до конца не выясненным при-
чинам наиболее вероятными местами депониро-
вания иммунных комплексов являются почки,
суставы, кожа, сердце и мелкие сосуды. Локали-
зация отложений в почках может быть частично
объяснена тем, что гломерулы осуществляют функ-
цию фильтрации.
Сывороточная болезнь
Прототипом системного заболевания, вызванно-
го иммунными комплексами, является сывороточ-
ная болезнь. Этот термин возник благодаря на-
блюдениям, сделанным на рубеже XX в. К. П. Пир-
ке (С. Р. Pirquet) и Б. Шиком (В. Schick), в процес-
се лечения некоторых инфекционных заболева-
ний (таких как дифтерия и столбняк) при введе-
нии лошадиной антисыворотки. Было хорошо из-
вестно, что патологические последствия инфек-
ций, вызванных Corynebacterium и Clostridium, обу-
словлены секрецией экзотоксинов, действующих
на клетки организма крайне разрушительно (см.
гл. 20). Сами по себе эти бактерии относительно
неинвазивны и не вызывают тяжелых расстройств.
Поэтому стратегия лечения этих заболеваний за-
244
ГЛАВА 15. РЕАКЦИИ ГИПЕРЧУВСТВИТЕЛЬНОСТИ: РЕАКЦИИ, ОПОСРЕДОВАННЫЕ АНТИТЕЛАМИ...
ферменты нейтрофила
нокомплексной)
ключалась в быстрой нейтрализации токсина до
того, как он появится в тканях в количестве, до-
статочном, чтобы убить организм. Поскольку для
активной иммунизации необходимо несколько
недель, чтобы получить «рабочий» уровень анти-
тел, было необходимо защитить организм путем
пассивной иммунизации — введением большого
количества уже сформировавшихся антител к ток-
сину как можно быстрее после диагностики забо-
левания, чтобы предотвратить вызываемую ими
смерть. Оказалось, что лошади легко иммунизи-
руются и способны вырабатывать большое коли-
чество необходимой антисыворотки, поэтому их
выбрали для получения антитоксина. В настоящее
время известно, что введение большого количе-
ства гетерологичной (полученной от другого
вида) сыворотки вызывает образование антител
к чужеродным иммуноглобулинам у реципиента
А это ведет к формированию комплексов анти-
ген-антитело и появлению симптомов сыворо-
точной болезни. Эта болезнь может возникать у
пациентов в качестве вторичной реакции на вве-
дение небелковых лекарственных средств. Клас-
сическими клиническими проявлениями явля-
ются лихорадка, артралгия, лимфоаденопатия и
кожная сыпь. Кроме того, следует помнить о сы-
РЕАКЦИИ. ОБУСЛОВЛЕННЫЕ ИММУННЫМИ КОМПЛЕКСАМИ: ГИПЕРЧУВСТВИТЕЛЬНОСТЬ III ТИПА
245
вороточной болезни у пациентов, лечившихся от
злокачественных новообразований или аутоим-
мунных расстройств моноклональными антите-
лами, полученными от грызунов, а также при-
нимавших препараты против отторжения транс-
плантата.
Болезнь иммунных комплексов,
связанная с инфекциями
Вероятно, наилучшим примером заболеваний
иммунных комплексов является ревматоидная
лихорадка. У чувствительных людей это заболева-
ние обусловлено инфекциями (например, анги-
нами), вызываемыми стрептококками группы А.
При этом заболевании развивается воспаление и
повреждаются сердце, суставы и почки. Было по-
казано, что в клетках и мембранах стрептококков
находятся различные антигены, обладающие пе-
рекрестной реактивностью с антигенами в мыш-
цах сердца человека, суставах и базальной мемб-
ране гломерул. Полагают, что антитела к стреп-
тококковым антигенам связываются с этими ком-
понентами нормальной ткани и вызывают воспа-
лительные реакции тем же путем, что описан ра-
нее. Существуют наблюдения, что при ревмато-
идном артрите вырабатывается ревматоидный
фактор — аутоантитела IgM, которые связывают-
ся Fc-фрагментами нормальных IgG. Эти иммун-
ные комплексы участвуют в воспалении сустава и
определяют характер повреждения при данном за-
болевании.
При других инфекциях у некоторых людей
вырабатываются антитела, перекрестно реагиру-
ющие с некоторыми составляющими нормальной
гкани. Например, у индивидуумов, предрасполо-
женных к синдрому Гудпасчера (см. гл. 12), это
заболевание иногда развивается после респира-
торных вирусных инфекций У таких пациентов
легочные кровоизлияния и гломерулонефрит воз-
никают из-за того, что антитела прикрепляются
непосредственно к базальной мембране в легких
и почках, активируют комплемент и вызывают
повреждение мембраны в результате накопления
нейтрофилов и высвобождения расщепляющих
ферментов. Иногда синдром Гудпасчера рас-
сматривается как реакция гиперчувствительности
II типа, поскольку при нем также наблюдается
цитотоксическое воздействие на обычные клет-
ки, опосредованное антителами. Различие между
1аким заболеванием, вызванным инфекцией и
опосредованным антителами, и сывороточной бо-
1езнью, связанной с иммунными комплексами,
состоит в том, что при микроскопическом иссле-
ювании определяются отложения, похожие на
1снту, располагающиеся вдоль базальной мемб-
раны (рис. 15.3) и создающие впечатление, что к
поверхностным антигенам прикрепилась гладкая
ковровая дорожка из антител. Напротив, при сы-
вороточной болезни соединение из уже сформи-
ровавшихся иммунных комплексов на базальной
• Рис. 15.3. Отложения антител в виде лент вдоль базаль-
ной мембраны, выявленные с помощью флуоресциру-
ющих антител к иммуноглобулину человека (с любезного
разрешения A.Ucci, Tufts University Medical School)
мембране ведет к образованию комковатых неров-
ных отложений (рис. 15.4).
При некоторых инфекционных заболеваниях
(малярии, проказе, лихорадке Денге) в течении
болезни могут возникать периоды, когда одновре-
менно появляется большое количество и антиге-
нов, и антител, что приводит к формированию
иммунных агрегатов, которые депонируются в
различных местах. Таким образом, при любом из
этих заболеваний комплекс имеющихся симпто-
мов может включать компонент, относящийся к
реакциям гиперчувствительности III типа.
Дефицит комплемента
Как указывалось ранее, большинство иммунных
комплексов не вызывают повреждения, посколь-
ку удаляются из кровотока до того, как отклады-
♦ Рис. 15.4. Прерывисто окрашенная структура флуорес-
цирующих антител, специфичных к иммуноглобулину че-
ловека: депонирование иммунных комплексов в гломеру-
лярной базальной мембране (с любезного разрешения
A. Ucci, Tufts University Medical School)
246
ГЛАВА 15 РЕАКЦИИ ГИПЕРЧУВСТВИТЕЛЬНОСТИ: РЕАКЦИИ, ОПОСРЕДОВАННЫЕ АНТИТЕЛАМИ...
ваются в тканях. Комплексы, содержащие СЗЬ,
прикрепляются к эритроцитам, несущим CR1.
Эритроциты доставляют комплексы к мононук-
леарным фагоцитам в печени и селезенке для уда-
ления путем фагоцитоза. Компоненты классиче-
ского пути комплемента уменьшают число эпи-
топов антигена, к которым могут прикрепиться
антитела, включаясь в структуру комплекса, что
приводит к получению более мелких раствори-
мых комплексов. Именно эти маленькие раство-
римые комплексы наиболее активно соединяют-
ся с эритроцитами. У пациентов с дефицитом
комплемента, затрагивающим Cl, С2 и С4 (см.
гл. 13 и 16), комплексы остаются большими и
плохо связываются с эритроцитами. Эти не свя-
занные с эритроцитами комплексы быстро захва-
тываются печенью, а затем высвобождаются с
последующим отложением в тканях, таких как
кожа, почки и мышцы, где они могут запускать
воспалительные реакции
Локализованная болезнь
иммунных комплексов
В 1903 г. французский ученый М.Артюс иммуни-
зировал кроликов лошадиной сывороткой путем
повторных внутрикожных инъекций. После не-
скольких недель он отметил, что каждая последу-
ющая инъекция вызывает увеличивающуюся по
тяжести реакцию в месте их введения Вначале
наблюдались умеренная эритема (краснота) и отек
(накопление жидкости) в течение 24 ч после инъ-
екции. К следующему дню эти реакции проходи-
ли без последствий, но повторные инъекции вы-
зывали более выраженные отечные реакции, а к
пятой или шестой инъекции поражения станови-
лись геморрагическими, сопровождались некро-
зом и медленно заживали. Этот феномен, назы-
ваемый реакцией {феноменом) Артюса, является
прототипом локализованных реакций иммунных
комплексов. Как и в системных реакциях гипер-
чувствительности, обусловленных иммунными
комплексами, в локализованных реакциях участву-
ет растворимый антиген. Возникающие местные
воспалительные реакции проявляются после вза-
имодействия антигена с уже сформированными
специфичными к данному антигену антителами
IgG. Когда такие предсуществующие антитела
вступают в контакт с антигеном в соответству-
ющих концентрациях (избыток антител) в стенках
сосудов (венулы) или вблизи них, формируются
и накапливаются нерастворимые иммунные ком-
плексы аналогично тому, как это происходит в
диффузионной камере с гелем при иммунодиф-
фузии (см. гл. 5). Последующие патофизиологи-
ческие изменения очень схожи с наблюдаемыми
при системной форме заболевания (см. рис. 15.2).
В результате повреждения сосудистой стенки на-
блюдаются ее разрывы и кровотечения, сопровож-
даемые локальным некрозом ткани (рис. 15.5).
• Рис. 15.5. Реакция гиперчувствительности III типа (фе-
номен Артюса). (А) Увеличенное изображение проявля-
ющейся геморрагии (пурпура). (Б) Гистологические про-
явления реакции Артюса в виде инфильтрата из нейтро-
филов (с любезного разрешения М. Stadecker, Tufts Univer-
sity Medical School)
Клиническим примером реакций гиперчувстви-
тельности по типу Артюса является заболевание,
называемое фермерским легким. Оно является внут-
рилегочной реакцией гиперчувствительности III
типа у больных с экзогенно-аллергическим альвео-
литом. Как свидетельствует название, заболева-
ние иногда возникает у людей, занимающихся
фермерским хозяйством, и поэтому классифици-
руется как профессиональное. У чувствительных
индивидуумов контакт с заплесневевшим сеном
ведет к возникновению тяжелого расстройства
дыхания или пневмониту в течение 6 —8 ч. Было
показано, что у таких больных вырабатывается
большое количество антител IgG, специфичных к
спорам термофильных актиномицетов, растущих на
гниющем сене. Вдыхание бактериальных спор вы-
зывает реакцию в легких, напоминающую реакцию
Артюса в коже, а именно формирование агрегатов
антиген — антитело и последующее воспаление.
Существует много сходных легочных реакций
III типа, названных с учетом профессиональной
принадлежности больных или агента, их вызыва-
ющего, например аллергоз голубеводов, работ-
ников сыродельной промышленности, багассоз
(вызывается вдыханием микроволокон сахарного
ТЕСТЫ
тростника), аллергоз дубильщиков кленовой
коры, болезнь переработчиков паприки и чрез-
вычайно редко — легкое настильщиков соломен-
ных крыш. Загрязненность окружающей среды в
месте работы, определяющая длительный контакт
с большим количеством потенциально антиген-
ного вещества, очевидно, способствует развитию
этой формы профессионального заболевания.
РЕЗЮМЕ
1. Реакции гиперчувствительности II типа приводят
к повреждению клеток-мишеней и опосредуются анти-
телами по трем основным путям. В первом случае ан-
титела (обычно IgM, но также и IgG) активируют каскад
комплемента и вызывают лизис клеток. Во втором слу-
чае антитела (обычно IgG) задействуют рецепторы для
Fc, а СЗЬ — рецепторы для СЗЬ на фагоцитирующих
клетках, вызывая деструкцию мишени, покрытой анти-
телами и/или СЗЬ посредством АЗКЦ. В эти реакции
обычно вовлекаются клетки, находящиеся в кровотоке,
такие как эритроциты, лейкоциты и тромбоциты, а по-
следствия являются такими же, как если бы разрушил-
ся определенный вид клеток. Третий путь ведет к нару-
шению функций клеток с соответствующими послед-
ствиями, которые определяются прикреплением вызы-
вающих заболевание антагонистических или агонисти-
ческих аутоантител к рецепторам поверхности клеток
(например, злокачественную миастению и болезнь
Грейвса соответственно).
2. При реакциях гиперчувствительности III типа,
связанных с иммунными комплексами, происходит
формирование комплексов антиген —антитело, кото-
рые способны активировать каскад комплемента и
индуцировать острые воспалительные реакции. Вы-
свобождение определенных продуктов комплемента
(СЗа и С5а) вызывает местное повышение проницае-
мости сосудов и способствует выходу сыворотки
(отек) и привлечению нейтрофилов с помощью хемо-
таксиса. Нейтрофилы в процессе поглощения иммун-
ных комплексов высвобождают расщепляющие лизо-
сомальные ферменты, которые вызывают поврежде-
ние ткани, характерное для данных реакций.
3. Если местом реакции III типа является стенка
сосуда, то ее результат — кровотечение и некроз;
если место реакции — базальная мембрана гломерул,
то нарушается ее целостность, белок и эритроциты
начинают поступать в мочу. Если местом реакции яв-
ляется мениск сустава, происходит разрушение сино-
виальных оболочек и хряща.
4. Существуют многочисленные формы реакций
гиперчувствительности III типа, от локальных до си-
стемных в зависимости от типа и расположения анти-
гена, а также от того, каким образом он встречается с
антителом. Однако во всех случаях исход будет зави-
сеть от комплемента и гранулоцитов, являющихся ме-
диаторами тканевого повреждения.
ТЕСТЫ
Выберите ОДИН НАИБОЛЕЕ ПРАВИЛЬНЫЙ ответ
на каждый тест.
247
1. У предрасположенных индивидуумов наиболее
часто обусловлено реакцией с гаптенами развитие
следующего заболевания:
а) синдром Гудпасчера после вирусной респира-
торной инфекции;
б) гемолитическая анемия после лечения пеницил-
лином;
в) ревматоидный артрит, развившийся после пара-
зитарной инфекции;
г) фермерское легкое, развившееся после контак-
та с заплесневевшим сеном.
2. Во время эксперимента мышам, используемым
для моделирования аутоиммунной гемолитической
анемии, внутривенно вводили моноклональные мы-
шиные антитела IgA, специфичные к антигенам эри-
троцитов. Однако они не вызывали анемии. Наилуч-
шим объяснением этого является:
а) что IgA будут локализоваться в ЖКТ;
б) Fc-фрагмент антител IgA не прикрепляется к Fc-
рецепторам на фагоцитарных клетках;
в) IgA не способен активировать комплемент после
расщепления С2;
г) используемый IgA обладает низкой аффинно-
стью относительно антигенов эритроцитов;
д) для функционирования используемого IgA необ-
ходим секреторный компонент.
3. Повреждение гломерул при болезни иммунных
комплексов можно продемонстрировать при микро-
скопии с помощью флуоресцирующих антител против:
а) Н-цепей IgG;
б) легких к-цепей;
в) С1;
г) СЗ;
д) всего перечисленного.
4. Иммунные комплексы вовлечены в патогенез
следующего заболевания, связанного с ревматоидной
лихорадкой:
а) гломерулонефрит после стрептококковой ин-
фекции;
б) аллергоз голубеводов;
в) сывороточная болезнь;
г) аутоиммунная гемолитическая анемия
5. Окончательное повреждение сосудов при арт-
рите, опосредованном иммунными комплексами,
обусловлено:
а) цитокинами, вырабатываемыми Т-клетками;
б) гистамином и МРС-А;
в) МАК С5, С6, С7, С8, С9;
г) лизосомальными ферментами ПМЯ-лейкоцитов;
д) цитотоксическими Т-клетками.
6. Сывороточная болезнь характеризуется:
а) отложением иммунных комплексов в стенках
кровеносных сосудов в условиях умеренного избытка
антигенов;
б) фагоцитозом комплексов гранулоцитами;
в) истощением системы комплемента;
г) появлением симптомов до того, как антитела
могут быть обнаружены в кровотоке;
д) всем перечисленным.
7. Гиперчувствительность II типа:
а) не зависит от антител;
б) не зависит от комплемента;
248
ГЛАВА 15 РЕАКЦИИ ГИПЕРЧУВСТВИТЕЛЬНОСТИ: РЕАКЦИИ, ОПОСРЕДОВАННЫЕ АНТИТЕЛАМИ...
в) опосредуется С08+-Т-клетками;
г) требует формирования иммунных комплексов;
д) сопровождается разрушением клеток посред-
ством антител.
8. У пациента подозревают наличие фермерского
легкого. Чтобы спровоцировать проявление заболева-
ния, используют тест с ингаляцией экстракта заплес-
невевшего сена. Острое ухудшение дыхательной функ-
ции отмечается в течение 10 мин. Она возвращается
к норме через 2 ч, но через следующие 2 ч ухудшает-
ся вновь. Наиболее вероятное объяснение состоит в
следующем:
а) у пациента существует гиперчувствительность,
опосредованная Т-клетками;
б) это нормальное явление для фермерского лег-
кого;
в) у пациента развилась вторичная реакция после
ингаляции антигена;
г) симптомы легкого фермера осложнились IgE-
опосредованной реакцией на тот же самый антиген;
д) все перечисленное.
СИТУАЦИОННАЯ ЗАДАЧА
Техник фермы, на которой заготавливают змеиный
яд, однажды по неосторожности был укушен редкой
смертельно опасной египетской коброй. Его срочно
доставили в отделение неотложной помощи. Также
срочно сделали запрос на сыворотку против яда коб-
ры. К счастью, определенное количество сыворотки
нашли, и в течение 5 ч технику внутривенно ввели
15 мл. На следующий день ему ввели еще 10 мл —
последние из полученных. На протяжении нескольких
дней состояние пациента улучшалось, он стал выздо-
равливать и неделю спустя покинул больницу. Через
несколько дней техник вернулся в больницу с жалоба-
ми на боли в суставах, лихорадку и рецидивирующие
зудящие волдыри на теле, руках и ногах. Что по ваше-
му мнению произошло? Обоснуйте свой вывод.
ОТВЕТЫ НА ТЕСТЫ
1—6. Пенициллин может функционировать как
гаптен, прикрепляясь к эритроцитам и вызывая гемо-
литическую анемию. Ответы «а», «в» и «г» являются
примерами реакции иммунных комплексов (III типа), для
которых необходимо присутствие комплемента и нейт-
рофилов, чтобы развились патологические эффекты.
2 — 6. Поскольку фагоцитирующие клетки облада-
ют Fc-рецепторами для IgG, связывание IgA не будет
вызывать захвата и повреждения. Поэтому ответы «а»,
«в» и «д» не верны.
3 — д. Повреждения при болезни иммунных комп-
лексов зависят от присутствия антигена, антител и
комплемента. Все они могут быть выявлены с помо-
щью иммунофлуоресценции в месте повреждения,
поскольку они являются частями IgG (ответы «а» и
«б»), начальными компонентами комплемента, активи-
рованного иммунными агрегатами (ответы «в» и «г»).
4 — а. Ревматическая лихорадка является заболе-
ванием, связанным с инфекциями, вызываемыми
стрептококками группы А. При ней происходит выра-
ботка антистрептококковых антител, перекрестно реа-
гирующих с антигенами, находящимися в сердечной
мышце человека, хряще и базальной мембране гло-
мерул.
5 — г. Ни Т-клетки, ни тучные клетки не отвечают
за окончательное повреждение ткани при болезни
иммунных комплексов. Поэтому варианты «а», «б» и
«д» исключаются. Конечный литический комплекс
комплемента в этом также не участвует, поскольку ак-
тивации комплемента до уровня С5 вполне достаточ-
но для привлечения ПМЯ-лейкоцитов, чьи лизосо-
мальные ферменты вызывают повреждение ткани.
6 — д. Все ответы характеризуют сывороточную
болезнь.
7 — д. Реакции гиперчувствительности II типа воз-
никают после образования антител против антигенов-
мишеней, экспрессируемых на нормальных клетках
или клетках с измененными мембранными детерми-
нантами. Антитела прикрепляются к поверхности этих
клеток и опосредуют повреждение или разрушение с
помощью одного или более механизмов, включая
опосредованные комплементом реакции. Цитотокси-
ческие СО8+-Т-клетки и иммунные комплексы не во-
влечены в эти реакции.
8 — г. Реакции гиперчувствительности III типа при
фермерском легком и сходных профессиональных за-
болеваниях характеризуются развитием симптомов в
течение нескольких часов после контакта с болезне-
творным антигеном. Развитие нарушений дыхания в
течение нескольких минут является указанием на наи-
более вероятное присутствие и анафилактической
реакции I типа. Вероятно, у пациента выработались
антитела как IgE, так и IgG к антигенам актиномице-
тов. Положительная реакция в кожной пробе даст до-
полнительное подтверждение данному выводу
ОТВЕТ НА СИТУАЦИОННУЮ ЗАДАЧУ
Большинство сывороток против ядов экзотических
видов животных, таких как змеи, пауки и скорпионы,
получены от лошадей. Лошадиная антисыворотка ней-
трализует токсин и спасает жизнь пациенту. Однако
будучи чужеродным белком, она вызывает иммунный
ответ, приводя к формированию комплексов анти-
ген-антитело и появлению симптомов гиперчувстви-
тельности III типа, сывороточной болезни. Локализа-
ция этих комплексов в суставах и активация компле-
мента, приводящая к появлению анафилатоксинов,
обусловили наличие у пациента болей в суставах, кра-
пивницы и зуда. Вполне вероятно, что в дальнейшем
у него могут развиться также и симптомы гломеруло-
нефрита. Лечение будет заключаться в назначении
кортикостероидного препарата, обладающего общим
противовоспалительным действием. Для подтвержде-
ния диагноза в список исследований можно включить
определение пониженного уровня содержания СЗ и
С4 в сыворотке в результате активации в тканях, вы-
званной агрегатами антиген —антитело. На стадии вы-
здоровления для окончательного точного подтвержде-
ния диагноза можно также определить антитела к ло-
шадиному иммуноглобулину.
Глава
16
РЕАКЦИИ ГИПЕРЧУВСТВИТЕЛЬНОСТИ:
ОПОСРЕДОВАННАЯ Т-КЛЕТКАМИ
ГИПЕРЧУВСТВИТЕЛЬНОСТЬ
ЗАМЕДЛЕННОГО ТИПА (IV ТИП)
♦ ВВЕДЕНИЕ
В отличие от реакций гиперчувствительности,
опосредованных антителами, которые обсуждают-
ся в двух предыдущих главах, гиперчувствитель-
ность, опосредованная Т-клетками, также назы-
ваемая гиперчувствительностью замедленного
типа (ГЗТ) или IVтипа, определяется иммунны-
ми ответами, инициируемыми в основном анти-
генспецифичными Т-клетками. При этом реак-
ции гиперчувствительности, опосредованные ан-
тителами, можно воспроизвести, если ввести не-
иммунизированному индивидууму сыворотку, взя-
тую у иммунизированного или сенсибилизирован-
ного человека. А реакции гиперчувствительности
IV типа могут быть воспроизведены только с по-
мощью Т-клеток, что показано в экспериментах
на животных.
Так же как и в случае гиперчувствительности,
опосредованной антителами, реакции гиперчув-
ствительности, опосредованные Т-клетками, иног-
да являются патогенными Когда активированные
контактом с антигеном, представляемым атиген-
презентирующими клетками, реактивные Т-клет-
ки высвобождают неоправданно большое коли-
чество цитокинов, некоторые из них привлека-
ют и активируют другие мононуклеарные клет-
ки, которые не являются антигенспецифичными
(моноциты и макрофаги). Это в основном и оп-
ределяет конечный патогенный эффект этих
реакций. Антигены, вызывающие этот тип отве-
та, могут быть чужеродной тканью (как при ре-
акциях на аллотрансплантат), внутриклеточны-
ми паразитами (например, вирусами, микобакте-
риями или грибами), растворимыми белками, а
также одним из многочисленных химических со-
единений, способных проникать через кожу и со-
единяться с белками организма, являющихся для
них носителями.
ОБЩИЕ ХАРАКТЕРИСТИКИ
И ПАТОФИЗИОЛОГИЯ
ГИПЕРЧУВСТВИТЕЛЬНОСТИ
ЗАМЕДЛЕННОГО ТИПА
Клинические проявления реакций гиперчувстви-
тельности IV типа различаются в зависимости от
сенсибилизирующего антигена и способа контак-
та с ним. Вариантами такой реакции могут быть
контактная гиперчувствительность, гиперчувстви-
тельность по туберкулиновому типу и гранулема-
тозная гиперчувствительность (см. следующий
подраздел). В основном, однако, все эти вариан-
ты имеют общие патофизиологические механиз-
мы. Основные события, приводящие к появлению
таких реакций, состоят из трех этапов: 1) актива-
ция антигенспецифичных ТН1 -клеток у ранее сен-
сибилизированного индивидуума; 2) выработка
антигенспецифичными ТН1-клетками провоспа-
лительных цитокинов; 3) привлечение и актива-
ция антигеннеспецифичных воспалительных лей-
коцитов. Эти процессы обычно происходят в те-
чение нескольких дней (24 — 72 ч), вследствие чего
и появился термин «гиперчувствительность замед-
ленного типа». Эта отдаленность по времени яв-
ляется характерным отличием ГЗТ от реакций,
опосредованных антителами, которые проявляют-
ся гораздо быстрее (см. гл. 14 и 15).
Механизмы гиперчувствительности
замедленного типа
Механизмы, вовлеченные в процесс сенсибили-
зации при ГЗТ и индукции реакции после кон-
такта с антигеном, в настоящее время хорошо
изучены. Следует подчеркнуть, что как и при ре-
250
ГЛАВА 16. РЕАКЦИИ ГИПЕРЧУВСТВИТЕЛЬНОСТИ: ОПОСРЕДОВАННАЯ Т-КЛЕТКАМИ ГИПЕРЧУВСТВИТЕЛЬНОСТЬ...
Фаза сенсибилизации Фаза проявления
Инфильтрат из воспа-
лительных клеток
(в основном макро-
фаги) вызывает
накопление плазмы
и повреждение
ткани
Контакт с антигеном
активирует Тн 1 -
клетки; цитокины
активируют
макрофаги и другие
воспалительные
клетки
Т-клетки распознают
пептид/МНС
на АПК и дифферен-
цируются в Тн1-
клетки
Введенный подкожно
антиген процесси-
руется местными
АПК (например,
клетками
Лангерганса в коже)
Кровеносный сосуд
• Рис. 16.1. Реакция ГЗТ. В фазе сенсибилизации антигеном происходит презентация
антигена АПК, приводящая к высвобождению цитокинов и дифференциации Т-кле-
ток в Тн1-клетки. При контакте с антигеном происходит презентация антигена АПК
Тн1-клеткам, ведущая к активации Тн1, высвобождению цитокинов и привлечению и
активации макрофагов: МКБ - мембранный кофакторный белок; TNF - фактор не-
кроза опухоли
IFNy
МКБ-1
TNFa
TNFB
Ак1йви-
рованный
макрофаг
акциях гиперчувствительности, опосредованных
антителами, для появления ГЗТ необходим пред-
шествующий контакт с антигеном. Такой контакт
(фаза сенсибилизации) активирует и увеличивает
количество антигенспецифичных ТН1-клеток па-
мяти, которые при последующем контакте с тем
же антигеном обусловливают ответ с появлением
реакции ГЗТ (фаза проявления). Эти фазы пока-
заны на рис. 16.1. Фаза сенсибилизации обычно
продолжается 1 —2 недели, во время которых дей-
ствуют обычные механизмы активации Т-клеток
(см. гл. 10). В отличие от этого для привлечения
и активации таких клеток после контакта с анти-
геном в фазе проявления необходимы примерно
24 —72 ч — период, который завершается появле-
нием гистологических и клинических признаков
ГЗТ. Клинические проявления ГЗТ способны со-
хранятся несколько недель или в некоторых слу-
чаях наблюдаться постоянно (например, ГЗТ при
некоторых аутоиммунных заболеваниях).
Во время фазы проявления контактировавшие
с антигеном ТН1-клетки секретируют ряд цито-
кинов, особенно хемокины и интерферон-у
(IFNy), которые вызывают хемотаксис и актива-
цию макрофагов (рис. 16.2). Привлечение и ак-
тивация антигеннеспецифичных клеток анти-
генспецифичными ТН1-клетками является при-
мером взаимодействия приобретенного и врож-
денного иммунитета, обсуждаемого в гл. 2. Дру-
гим цитокином, секретируемым этими клетка-
ми, является IL-12. Он подавляет субпопуля-
цию Тн2 и способствует росту субпопуляции
Тн1, таким образом направляя ответ на увеличе-
ние синтеза ТН1-клетками цитокинов, активиру-
ющих макрофаги. Следовательно, IL-12 играет
важную роль в ГЗТ. В табл. 16.1 перечислены
наиболее значимые цитокины, участвующие в
реакциях ГЗТ.
В реакциях ГЗТ также участвуют СО8+-Т-клет-
ки, которые первыми активируются и распрост-
раняются в период сенсибилизационной фазы
реакции. Эти клетки могут повреждать ткани с
помощью механизмов клеточно-опосредованной
цитотоксичности (см. гл. 10). Активация CD8+-
ПРИМЕРЫ ГИПЕРЧУВСТВИТЕЛЬНОСТИ ЗАМЕДЛЕННОГО ТИПА
251
• Рис. 16.2. Действие IFNy на перитонеальные
макрофаги. (А) Нормальные макрофаги в куль-
туре; они еще только начинают прилипать (к стек-
лу или пластику). (Б) Макрофаги после актива-
ции их IFNy распластались на стекле, вытянулись,
образовав многочисленные псевдоподии, и уве-
личились в размерах (с любезного разрешения
М Stadecker, Tufts University Medical School)
Т-клеток происходит в связи с тем, что многие
растворимые в жирах химические вещества спо-
собны индуцировать реакции ГЗТ и проникать
сквозь клеточную мембрану (например, пента-
декакатехол — химическое соединение, которое
приводит к развитию дерматита, вызванного кон-
тактом с ядовитым плющом (сумахом укореня-
ющимся)). Внутри клетки эти химические соеди-
нения реагируют с цитозольными белками с об-
разованием модифицированных пептидов, кото-
рые перемешаются в эндоплазматический рети-
кулум, а затем на поверхность клетки в составе
молекул МНС I класса. Клетки, презентирующие
такие модифицированные собственные белки, за-
тем повреждаются или уничтожаются CD8+-T-
клетками.
• Таблица 16.1. Цитокины, участвующие
в реакциях ГЗТ
Цитокин Функциональный эффект
IFNy Ак1ивируе1 макрофаш для высвобож- дения медиаторов воспаления
Хемокины: Привлекают макрофаги и моноциты к месту инфекции
МКБ-1 —
RANTES —
MIP-la —
MIP-lp —
TNFa Вызывает местное повреждение ткани
TNFp Увеличивает экспрессию молекул адгезии на кровеносных сосудах
Примечание. МКБ — мембранный кофакторный бе-
лок; MIP — воспалительный белок макрофага; TNF — фак-
тор некроза опухоли. Дополнительные функциональные эф-
фекты описаны в гл. 11.
Последствия гиперчувствительности
замедленного типа
Исходя из сказанного, должно быть понятно, что
эффекторные функции при ГЗТ осуществляются
активированными макрофагами. В наиболее бла-
гоприятных условиях ГЗТ приводит к разруше-
нию инфицирующего организма (см. далее), ко-
торый мог вызвать реакцию в месте первого кон-
такта. Считается, что это разрушение происхо-
дит преимущественно в результате фагоцитоза
микроорганизма макрофагами, их активации IFNy
с последующим расщеплением ферментами ли-
зосом и сопутствующими продуктами респира-
торного взрыва, такими как пероксидные и су-
пероксидные радикалы (см. гл. 2). Чужеродная
ткань, опухолевая ткань и растворимые или ко-
ньюгированные антигены уничтожаются таким
же путем.
• ПРИМЕРЫ ГИПЕРЧУВСТВИТЕЛЬНОСТИ
ЗАМЕДЛЕННОГО ТИПА
В основе нескольких известных вариантов клас-
сической ГЗТ лежат одинаковые механизмы. Од-
нако все эти варианты обладают дополнительны-
ми характеристиками, которые описываются в
этом подразделе.
Контактная гиперчувствительность
Контактная гиперчувствительность (иногда на-
зываемая контактным дерматитом) является од-
ной из форм ГЗТ, при которой органом-мише-
нью является кожа, а воспалительная реакция —
это результат контакта с сенсибилизирующими
веществами на поверхности кожи. Таким обра-
252
ГЛАВА 16. РЕАКЦИИ ГИПЕРЧУВСТВИТЕЛЬНОСТИ: ОПОСРЕДОВАННАЯ Т-КЛЕТКАМИ ГИПЕРЧУВСТВИТЕЛЬНОСТЬ...
• Рис. 16.3. (А) Реакция контактной гиперчувствительно-
сти IV типа - выраженное проявление реакции на ядови-
тый плющ. (Б) Реакция контактной гиперчувствительно-
сти IVтипа - гистологическая картина интраэпителиального
пузыря и мононуклеарного инфильтрата в дерме. (В) Кож-
ная реакция, опосредованная базофилами; базофилы и
некоторые мононуклеарные клетки через 24 ч после по-
становки кожного теста (все снимки представлены с лю-
безного разрешения М. Stadecker, Tufts University Medical
School)
зом, это в первую очередь эпидермальная реак-
ция, характеризующаяся экземой в месте контакта
с аллергеном. Обычно пик реакции случается
через 48 — 72 ч со времени контакта. Прототи-
пом этой формы ГЗТ является дерматит после
контакта с ядовитым плющом (сумахом укоре-
няющимся) (рис. 16.3, А). Вещество, вызыва-
ющее реакцию, содержится в масле, выделяемом
листьями ядовитого плюща или другого родствен-
ного растения. Подобные масла содержат кате-
холы (дигидроксифенолы) с длинными углево-
дородными боковыми цепями. Эти особенности
позволяют веществу проникать в кожу за счет
липофильности (которая позволяет ему раство-
ряться в жирах, находящихся в коже), а также за
счет способности ковалентно соединяться (пу-
тем формирования хинонов) со связанными с
клеткой белками (например, молекулами-носи-
телями на поверхности клеток). Другие вещества,
сенсибилизирующие при контакте, обычно так-
же являются растворимыми в жирах гаптенами.
Различные по химической форме, они обладают
общим свойством проникать через кожу и фор-
мировать конъюгаты гаптен — носитель. Хими-
ческие соединения, подобные 2,4-динитрохлор-
бензолу, используются для индукции контактной
сенсибилизации. Поскольку практически у лю-
бого нормального индивидуума можно добиться
появления гиперчувствительности при контакте
с пробной дозой этого соединения, оно часто
используется для оценки склонности пациентов
к развитию Т-клеточных реакций (клеточно-
опосредованный иммунитет). Различные метал-
лы, такие как никель и хром, которые присут-
ствуют в ювелирных украшениях и застежках для
нижнего белья, также способны вызывать реак-
цию со стороны кожи при контакте, вероятно,
путем хелатирования (ионного взаимодействия)
белками кожи.
Считается, что индуцирование контактной
чувствительности происходит путем презентации
причинного аллергена клетками Лангерганса
(АПК в коже). Еще не ясно, прикрепляется ли
сенсибилизирующий агент непосредственно к
компонентам поверхности клетки Лангерганса
или вначале прикрепляется к белкам сыворотки
крови или ткани, а только затем захватывается
этими клетками.
Первоначальный контакт приводит к расши-
рению клонов ТН1-клеток, способных распозна-
вать специфический контактный сенсибилизиру-
ющий антиген. Последующий контакт с сенсиби-
лизирующим антигеном запускает фазу проявле-
ния ГЗТ, как указывалось ранее. Если при этом
варианте ГЗТ провести гистологию, то можно на-
блюдать формирование волдыря в эпителии и моно-
нуклеарных инфильтратов в дерме (рис. 16.3, Б).
При этом происходят отделение эпидермальных
клеток, спонгиоз (воспалительный межклеточный
отек эпидермиса) и формирование пузыря (см.
рис. 16.3, А).
ПРИМЕРЫ ГИПЕРЧУВСТВИТЕЛЬНОСТИ ЗАМЕДЛЕННОГО ТИПА
253
Во многих случаях в месте первичного контак-
та сохраняется достаточное количество сенсиби-
лизирующего антигена. Таким образом, пример-
но в течение I недели, пока наблюдается экспан-
сия Т-клеток, сохранившийся антиген служит
провоцирующим фактором, и реакция в этом ме-
сте будет усиливаться. Поэтому фаза проявления
может возникнуть без нового контакта с сенси-
билизирующим антигеном.
Обычной процедурой для тестирования на на-
личие контактной чувствительности является на-
кожная проба, при которой раствор с вероятным
антигеном наносят на кожу и накрывают плот-
ной повязкой. Появление в течение 3 сут на этом
участке индурации и эритемы указывает на чув-
ствительность к антигену.
Г ранулематозная
гиперчувствительность
В условиях, аналогичных контактному дермати-
ту, когда антиген быстро удаляется, поврежде-
ние проходит медленно с небольшим поврежде-
нием ткани. Иногда, однако, антиген может ока-
заться защищенным и существовать очень долгое
время, как, например, яйца шистосом и инкапсу-
лированные в липидах микобактерии, устойчи-
вые к ферментативному расшеплению. В этих
случаях ответ может затягиваться и становиться
разрушительным для организма. Продолжающе-
еся накопление макрофагов ведет к образованию
кластеров эпителиоидных клеток, которые сли-
ваются с образованием гигантских клеток в гра-
нулемах.
Максимальное время реакции с образовани-
ем гранулемы составляет 21—28 дней. Патоло-
гические изменения возникают из-за неспособ-
ности макрофагов разрушить фагоцитированные
патогены (например, Mycobacterium leprae) или
расщепить большие инертные антигены. Грану-
лемы могут оказать вредоносное воздействие в
связи с тем, что они смещают нормальную ткань
и приводят к казеозному (творожистому) некро-
зу. Подобное явление типично для такого забо-
левания как туберкулез, вызванный М. tuberculosis,
при котором лимфоциты кольцом окружают серд-
цевину и может наблюдаться значительный фиб-
роз.
Патологический процесс при таком заболева-
нии может быть обусловлен не столько воздей-
ствием чужеродного организма, сколько постоян-
ными попытками организма изолировать и удер-
живать паразита с помощью механизмов ГЗТ. При
таких заболеваниях, как оспа, корь, герпес, ха-
рактерные экзантемы (кожная сыпь) частично
связаны с реакциям ГЗТ на вирус, которые ока-
зывают дополнительное деструктивное воздей-
ствие, приписываемое атакам цитотоксических
СО8+-Т-клеток на инфицированные вирусом эпи-
телиальные клетки.
Реакция гиперчувствительности
туберкулинового типа
Реакции туберкулинового типа являются кожны-
ми воспалительными реакциями, характеризующи-
мися появлением плотного красного участка оте-
ка кожи, максимально выраженного спустя 48 —
72 ч после контакта. Название «туберкулиновый
тип» появилось благодаря прототипной реакции
ГЗТ, при которой липопротеиновый антиген,
выделенный из М. tuberculosis и названный тубер-
кулином, использовался в тесте, определяющем
наличие предшествующего контакта организма с
возбудителем туберкулеза. Важно отметить, одна-
ко, что растворимые антигены от других микро-
организмов (таких как М. leprae и Leishmania tropica)
индуцируют такие же реакции ГЗТ туберкулино-
вого типа. В настоящее время тесты на туберку-
лез делают путем внутрикожной инъекции более
очищенного липопротеинового экстракта, выде-
ленного из М tuberculosis и называемого очищен-
ным протеиновым дериватом (purified protein
derivative — PPD). Тест c PPD (также называемый
пробой Манту) часто используют при обследова-
нии населения на туберкулез. Если индивидуум
уже был сенсибилизирован антигенами М. tuber-
culosis в результате инфицирования этим микро-
организмом, то в месте инъекции в течение 48 —
72 ч появится характерное повреждение туберку-
линового типа. Реакция в виде эритемы (покрас-
нение) и индурации (возвышающегося уплотне-
ния), которые появляются после контакта, до-
стигают максимума через 72 ч (рис. 16.4, А). Ин-
дурацию легко отличить от отека (скопления жид-
кости) по отсутствию углубления после надавли-
вания. Эти реакции, даже весьма выраженные,
редко ведут к некротическим повреждениям и
медленно разрешаются. Биопсия, сделанная на
ранней стадии реакции, выявляет преимуществен-
но мононуклеарные моноцитарно-макрофагаль-
ные клетки с небольшим количеством рассеян-
ных лимфоцитов. Характерно, что мононуклеар-
ные инфильтраты появляются в виде периваску-
лярной муфты перед тем, как интенсивно запол-
нить место нахождения антигена (рис. 16.4, Б).
Нейтрофилы не являются характерными участни-
ками ранних стадий реакции. Тяжелые формы
реакции гиперчувствительности туберкулинового
типа могут прогрессировать до гранулематозных
реакций (обсуждались ранее). Биопсия тканей в
таких случаях выявляет более сложную картину,
характеризующуюся появлением В-клеток и фор-
мированием гранулем в случаях хронических по-
вреждений. Уплотнение ткани, или индурация,
объясняется отложением фибрина в месте повреж-
дения.
Хотя тест с PPD обычно очень надежен, в не-
которых случаях встречаются ложноотрицатель-
ные и ложноположительные реакции. У людей с
подавленным иммунитетом (например, у инфи-
254
ГЛАВА 16. РЕАКЦИИ ГИПЕРЧУВСТВИТЕЛЬНОСТИ: ОПОСРЕДОВАННАЯ Т-КЛЕТКАМИ ГИПЕРЧУВСТВИТЕЛЬНОСТЬ...
Б
• Рис. 16.4. (А) Реакция ГЗТ IV типа (туберкулиновая реакция) - общий снимок, демонстрирующий индура-
цию и эритему через 48 ч после туберкулинового теста (с любезного разрешения A. Gottleib, Tulane University
Medical School). (Б) Реакция ГЗТ IV типа - гистологический срез, демонстрирующий инфильтрацию дермы
мононуклеарными клетками и периваскулярные муфты (с любезного разрешения M.Stadecker, Tufts University
Medical School)
цированных ВИЧ или проходящих интенсивную
химиотерапию) иногда отмечают ложноотрица-
тельные реакции с PPD, что обусловлено невоз-
можностью ответа со стороны антигенспецифич-
ных Т-клеток (анергия; см. гл. 12).
В тех ситуациях, когда тест с PPD использует-
ся для определения, имел ли индивидуум ранее
контакт с М. Tuberculosis, у людей, вакцинирован-
ных непатогенными аттенуированными штамма-
ми микроорганизмов, вызывающих туберкулез у
скота (а именно M.bovis — бациллами Кальмет-
та-Герена (БЦЖ)), могут возникать ложнопо-
ложительные реакции. Эффективность вакцины
БЦЖ против легочного туберкулеза у человека
сильно варьирует в различных популяциях. Ос-
новным объяснением этого различия считают вза-
имодействия между вакциной и микобактериями,
характерными для конкретных условий, но точ-
ный механизм этого до сих пор не ясен. Во мно-
гих странах, включая США, не применяют повсе-
местную вакцинацию БЦЖ в связи с ее сомни-
тельной эффективностью и указанным влиянием
на результаты теста, проводимого для определе-
ния, был ли человек инфицирован М. Tuberculosis
ранее.
Отторжение аллотрансплантата
Более детально отторжение аллотрансплантата
рассмотрено в гл. 18. Здесь же укажем, что если
индивидуум получает трансплантат в виде клеток,
тканей или органов от аллогенного донора (гене-
тически отличающийся индивидуум того же вида),
то трансплантат обычно васкуляризируется и пер-
воначально приживается. Однако если генетиче-
ские отличия касаются каких-либо генов гисто-
совместимости, особенно генов МНС, наступает
опосредованный Т-клетками процесс отторжения,
продолжительность и интенсивность которого
зависит от уровня несовместимости донора и ре-
ципиента. Первоначально вслед за васкуляриза-
цией в трансплантат через стенки кровеносных
сосудов проникает смешанная популяция анти-
генспецифичных Т-клеток и антигеннеспецифич-
ных моноцитов. Эта воспалительная реакция вско-
ре приводит к разрушению сосудов, а отсутствие
питательных веществ впоследствии вызывает и от-
торжение пересаженной ткани.
Другие примеры гиперчувствительности
замедленного типа
Необычная форма реакции замедленного типа
наблюдается у человека при повторных внутри-
кожных инъекциях антигена. Начало такой ре-
акции отсрочено во времени (примерно на 24 ч);
обычно оно представляет собой появление эри-
темы без индурации, типичной для реакций ГЗТ.
После того как подобное состояние было изуче-
но в эксперименте, обнаружили, что эритема со-
провождалась появлением небольшого клеточно-
го инфильтрата, но при этом доминирующим ти-
пом клеток были базофилы. Опыты на морских
свинках показали, что реакция была в основном
опосредована Т-клетками и была связана с МНС-
рестрикцией, как и классические реакции, опо-
средованные Т-клетками. При наличии классиче-
ской ГЗТ, однако, инфильтратов из базофилов
ТЕСТЫ
255
не наблюдалось. Таким образом, кожная базо-
фильная гиперчувствительность считается вари-
антом реакций, опосредованных Т-клетками, но
ее точный механизм неизвестен. Общая картина
осложнилась еще больше, когда оказалось, что в
некоторых условиях базофильную реакцию спо-
собен вызывать пассивный перенос сыворотки
крови.
Физиологическое значение кожной базофиль-
ной гиперчувствительности оставалось тайной,
пока не обнаружилось, что у морских свинок,
укушенных определенным видом клещей, разви-
вались тяжелые кожные реакции базофильной
гиперчувствительности в месте прикрепления на-
секомого. Базофильная инфильтрация и, вероят-
но, высвобождение медиаторов воспаления из их
гранул приводили к смерти клеща и его отделе-
нию от животного. Таким образом, кожная базо-
фильная гиперчувствительность может быть важ-
на при определенных формах иммунного ответа
к паразитам. Позднее базофильные инфильтраты
были также обнаружены в случаях контактного
дерматита, вызванного аллергенами, например от
ядовитого плюща, а также в случаях отторжения
почечных трансплантатов и при некоторых фор-
мах конъюнктивитов. Эти наблюдения свидетель-
ствуют о том, что базофилы могут также играть
роль при некоторых типах заболеваний, ассоции-
рованных с ГЗТ.
Другими примерами ГЗТ являются реакции на
аутоантигены при определенных аутоиммунных
заболеваниях (см. гл. 12). Как и при хронических
инфекциях, которые могут вызвать хронические
реакции ГЗТ, эти реакции часто бывают хрони-
ческими и являются результатом продолжающей-
ся активации клонов аутореактивных ТН1-клеток.
В качестве примеров аутоиммунных заболеваний,
в которые вовлечены реакции ГЗТ, можно назвать
ревматоидный артрит, диабет I типа и рассеян-
ный склероз.
• ЛЕЧЕНИЕ ГИПЕРЧУВСТВИТЕЛЬНОСТИ
ЗАМЕДЛЕННОГО ТИПА
Терапия гиперчувствительности, опосредованной
Т-клетками, связана с типом ГЗТ. В большинстве
случаев реакции ГЗТ, такие как контактный дер-
матит и реакции туберкулинового типа, проходят
спустя определенный период, длящийся от не-
скольких дней до нескольких недель от момента
устранения антигена. Исключительно эффектив-
ным для этих форм ГЗТ является местное или
системное применение кортикостероидов При
более тяжелых видах ГЗТ, таких как вызванная
патогеном гранулематозная гиперчувствитель-
ность, отторжение аллотрансплантата и тех, ко-
торые наблюдаются при некоторых аутоиммун-
ных заболеваниях, обычно используется более аг-
рессивная форма иммуносупрессивной терапии,
включающая применение таких лекарственных
средств, как азатиоприн или циклоспорин (см.
гл. 18, подразделы, посвященные иммуносупрес-
сивной терапии)
РЕЗЮМЕ
1. Естественные изменения, связанные с клеточ-
но-опосредованным иммунитетом, являются реша-
ющим способом реагирования для защиты от внутри-
клеточных паразитов, таких как вирусы, многочислен-
ные бактерии и грибы. Однако такие реакции и их
медиаторы также вызывают реакций ГЗТ.
2. Реакции ГЗТ и опосредованные Т-клетками от-
веты классифицируются по Р. Кумбсу и П.Джеллу как
гиперчувствительность IV типа.
3. Основные события, ведущие к таким реакциям,
разделяются на три фазы: 1) активация антигенспеци-
фических воспалительных ТН1-клеток у уже сенсиби-
лизированного индивидуума; 2) выработка провоспа-
лительных цитокинов (особенно IFNy, который активи-
рует макрофаги) антигенспецифичными Т-клетками;
3) привлечение и активация антигеннеспецифичных
воспалительных лейкоцитов.
4. Существует несколько вариантов ГЗТ включая:
1) контактную гиперчувствительность, характеризу-
ющуюся экземой, которая становится наиболее выра-
женной через 48 — 72 ч после контакта с аллергеном;
2) гранулематозную гиперчувствительность, характе-
ризующуюся гранулемой с пиком развития к 21 —
28 сут после контакта с антигеном; 3) гиперчувстви-
тельность по туберкулиновому типу, характеризующу-
юся появлением участка стойкой эритемы (покрасне-
ние) и индурацией (возвышающееся уплотнение) с
максимальной выраженностью через 48 — 72 ч после
контакта. Среди других вариантов выделяют некото-
рые опосредованные Т-клетками аутоиммунные забо-
левания, а также те, которые наблюдаются после ал-
лотрансплантации.
5. Цитотоксические СО8+-Т-клетки также могут уча-
ствовать в повреждении ткани, связанном с реакция-
ми ГЗТ.
6. Фагоцитирующие макрофаги являются основ-
ным гистологическим признаком ГЗТ и отвечают за
защитный эффект, если к этой форме гиперчувстви-
тельности причастен патоген.
7. В тех случаях, когда макрофаги не способны
уничтожить патоген, возникает гранулема (гранулема-
тозная гиперчувствительность). Гранулемы также мо-
гут развиться после фагоцитоза инертных субстанций.
Гистологически гранулемы характеризуются наличием
макрофагов, эпителиоидных клеток, гигантских клеток
и CD4+- и СО8+-лимфоцитов.
ТЕСТЫ
Выберите ОДИН НАИБОЛЕЕ ПРАВИЛЬНЫЙ ответ
на каждый тест
1. Клеточно-опосредованный иммунитет не задей-
ствован в следующей реакции:
а) контактная чувствительность к помаде;
б) отторжение аллотрансплантата;
256
ГЛАВА 16. РЕАКЦИИ ГИПЕРЧУВСТВИТЕЛЬНОСТИ: ОПОСРЕДОВАННАЯ Т-КЛЕТКАМИ ГИПЕРЧУВСТВИТЕЛЬНОСТЬ...
в) сывороточная болезнь;
г) проба Манту;
д) иммунитет к ветряной оспе
2. Положительная кожная реакция ГЗТ включает в
себя взаимодействие:
а) антигена, комплемента и цитокинов;
б) антигена, антигенчувствительных Т-клеток и
макрофагов;
в) комплексов антиген — антитело, комплемента и
нейтрофилов;
г) антител IgE, антигена и тучных клеток;
д) антигена, макрофагов и комплемента.
3. Клеточно-опосредованные иммунные ответы:
а) усиливаются при истощении комплемента;
б) подавляются кортикостероидами;
в) усиливаются при истощении Т-клеток;
г) подавляются антигистаминными препаратами;
д) усиливаются при истощении макрофагов.
4. Кожные реакции замедленного типа на внутри-
кожное введение антигена могут быть значительно
уменьшены посредством:
а) действия высокой дозы рентгеновского излучения;
б) лечения антигистаминными препаратами;
в) лечения с помощью антинейтрофильной сыво-
ротки;
г) удаления селезенки;
д) уменьшения уровня содержания комплемента.
5. Для контактной гиперчувствительности харак-
терно следующее положение:
а) лучшим лекарством является прием внутрь ан-
тигена;
б) накожная проба с аллергеном бесполезна для
постановки диагноза;
в) чувствительность может быть пассивно перене-
сена с помощью сыворотки, взятой у индивидуума,
страдающего аллергией;
г) некоторые химические соединения, действу-
ющие как гаптены, вызывают сенсибилизацию путем
ковалентного соединения с белками организма, дей-
ствующими как носители;
д) препаратами выбора являются антигистаминные
препараты.
6. Положительные кожные тесты на ГЗТ, прово-
димые при введении антигенов внутрикожно, указы-
вают:
а) что наблюдается гуморальный иммунный ответ;
б) наблюдается клеточно-опосредованный иммун-
ный ответ;
в) функционируют системы Т- и В-клеток;
г) у индивидуума ранее наблюдался ответ IgE на
антиген;
д) в месте инъекции сформировались иммунные
комплексы.
7. Иммунные ответы, опосредованные Т-клетками,
могут привести:
а) к формированию гранулем;
б) индурации в месте реакции;
в) отторжению пересаженного сердца;
г) экземе кожи в районе длительного контакта с
прорезиненным нижнем бельем;
д) всему перечисленному.
8. Укажите правильное высказывание, касающееся
кожного теста с PPD:
а) специфичен в отношении Mycobacterium tuber-
culosis;
б) может быть позитивным, если индивидуум до
этого был иммунизирован БЦЖ;
в) не показывает различий между имевшейся или
имеющейся туберкулезной инфекцией;
г) степень выраженности индурации при его про-
ведении может быть различной; таким образом, поло-
жительный результат теста зависит от иммунного ста-
туса тестируемого пациента;
д) варианты «б», «в» и «г» справедливы.
СИТУАЦИОННАЯ ЗАДАЧА
Вы являетесь членом исследовательской группы
антропологов и получили возможность посетить при-
митивное племя в отдаленных районах амазонских
джунглей. Во время визита аборигены проводят обряд
инициации для молодых мужчин. Он состоит, кроме
всего прочего, в том, что их тела покрывают узорами
из лент и кругов красками, выделенными из местных
растений. Спустя 3 недели после возвращения вас по-
просили осмотреть молодого человека, у которого по-
явились мокнущие участки покраснения на коже в виде
резко отграниченных линий, расположенные на спине
и одной из рук. На этих участках молодой человек
ощущает очень сильный зуд. Вспомнив вступительный
курс иммунологии, вы делаете научное заключение о
причине данного явления. Как в таких примитивных
условиях вы можете подтвердить свой диагноз?
ОТВЕТЫ НА ТЕСТЫ
1 — в. Сывороточная болезнь является примером
реакций, опосредованных комплексом антиген — анти-
тело с участием компонентов системы комплемента и
нейтрофилов. Во всех других реакциях в значитель-
ной степени участвует клеточно-опосредованный им-
мунитет.
2 — 6. Клеточно-опосредованные реакции являются
результатом активации Т-клеток антигеном с привлече-
нием макрофагов. Антитела, комплемент и тучные клет-
ки в этом процессе роли не играют, хотя они участвуют
в реакциях немедленной гиперчувствительности.
3 — б. Кортикостероиды обладают общим проти-
вовоспалительным действием, а также вызывают
апоптоз некоторых Т-клеток. Комплемент при этом
роли не играет, а антигистаминные препараты не
дают существенного эффекта. Истощение Т-клеток
или макрофагов будет ослаблять, а не усиливать дан-
ный тип ответа, поскольку он зависит от этих клеток.
4 — а. Высокие дозы рентгеновского излучения
разрушают Т-клетки, которые отвечают за начало ре-
акции. Гистамин, нейтрофилы, селезенка и компле-
мент здесь роли не играют, и любое терапевтическое
вмешательство, направленное на них, не окажет влия-
ния на реакции ГЗТ.
5 — г. Накожная проба заключается в нанесении
действующего аллергена на кожу с последующим на-
ложением окклюзионной повязки Позитивная реак-
ция ГЗТ через 24—48 ч считается признаком чувстви-
ТЕСТЫ
257
тельности, поэтому ответ «б» неверен. Применяемые
в тесте аллергены способны проникать через кожу и
прикрепляться к белкам-носителям организма, так что
ответ «г» правилен. Введение антигена через рот в
определенных экспериментальных условиях иногда
приводит к снижению контактной чувствительности,
но пока еще терапевтическая эффективность при ле-
чении людей не доказана. Поэтому ответ «а» неверен.
Не антигистаминные средства, а кортикостероиды яв-
ляются препаратами выбора для лечения контактной
чувствительности, так что ответ «д» также неверен.
Пассивный перенос клеточно-опосредованных иммун-
ных реакций осуществляется с помощью Т-клеток, а не
сывороткой крови, поэтому ответ «в» неверен.
6 — 6. Реакция ГЗТ, подтвержденная эритемой и
индурацией в течение 24 — 72 ч после введения анти-
гена, указывает на то, что имеет место клеточно-
опосредованная реакция. В таких реакциях не уча-
ствуют антитела, вырабатываемые В-клетками, поэто-
му ответы «а», «в», «г» и «д» неверны.
7 — д. Все эти эффекты являются проявлениями
клеточно-опосредованного иммунитета. В месте реак-
ции обычно развивается индурация. Формирование
гранулем характерно для хронических реакций ГЗТ. От-
торжение пересаженного сердца является примером
реакции на аллотрансплантат. Некоторые из химических
соединений, содержащихся в прорезиненном нижнем
белье, могут вызывать контактную гиперчувствитель-
ность после длительного соприкосновения с ними кожи.
8 — д. За исключением варианта «а» все ответы
верны. Положительный тест с PPD встречается у лиц
с сохраненным иммунитетом, которые были инфици-
рованы М. tuberculosis. Однако положительные реак-
ции на PPD будут также встречаться у лиц, вакцини-
рованных БЦЖ (M.bovis).
ОТВЕТ НА СИТУАЦИОННУЮ ЗАДАЧУ
Появление на коже поражений с четкими очерта-
ниями, а также мокнутьем и зудом предполагает на-
личие контактной чувствительности. Одна из красок,
использованных для окраски тела, скорее всего, яви-
лась сенсибилизатором и, оставаясь на коже длитель-
ное время, спровоцировала опосредованную Т-клет-
ками реакцию после первоначальной экспансии спе-
цифических клонов. При отсутствии сложного лабора-
торного оборудования простой накожный тест с ис-
пользованием образцов различных красок, наклады-
ваемых на здоровые участки кожи, должен вызвать
локализованную контактную реакцию через 24 — 48 ч
в месте, где была помещена вызвавшая реакцию
краска. (В лабораторных условиях можно также про-
вести определение пролиферационной активности
лимфоцитов периферической крови пациента в ответ
на добавление антигена, в данном случае — краски.)
Биопсия участка поражения выявит выраженную ин-
фильтрацию одноядерными клетками.
Глава li
ИММУНОДЕФИЦИТНЫЕ РАССТРОЙСТВА
И НОВООБРАЗОВАНИЯ ЛИМФОИДНОЙ
СИСТЕМЫ
I ВВЕДЕНИЕ
На первый взгляд, связь между иммунодефицит-
ными расстройствами и новообразованиями лим-
фоидной системы неотчетлива, поэтому возни-
кает вопрос о том, целесообразно ли их обсуж-
дать в одной главе. Для иммунодефицитных син-
дромов характерно отсутствие или недостаточ-
ность, в то время как новообразование отражает
избыток или неконтролируемую пролиферацию.
Однако связь между ними является примером
того, насколько тонко настроена и сложна им-
мунная система. Как описывается в настоящей
главе, дефициты, особенно в одном из звеньев
иммунной системы, нарушают способность ос-
тавшихся элементов контролировать собственный
рост. По этой причине иммунодефициты явля-
ются благодатной почвой для развития новооб-
разований. Это не касается дефектов клеток-
предшественников или ранних стволовых клеток,
которые приводят к более выраженным повреж-
дениям функций иммунитета. Аутоиммунные фе-
номены являются более выраженными проявле-
ниями потери иммунной регуляции, которая ча-
сто сопровождает иммунодефициты. Таким об-
разом, три казалось бы несвязанных болезнен-
ных состояния — иммунодефицит, аутоиммун-
ные заболевания и лимфоидные новообразования —
часто сосуществуют в одном организме. Первич-
ные аутоиммунные заболевания уже обсуждались
в гл. 12; аутоиммунные реакции, развивающиеся
вследствие иммунодефицитных состояний или
приводящие к злокачественным лимфоидным но-
вообразованиям, будут рассматриваться в этой
главе.
Как было указано в предыдущих главах, им-
мунный ответ опосредуется Т- и В-лимфоцита-
ми, натуральными киллерами (NK), клетками
миелоидного/моноцитарного ростка и компле-
ментом. Взаимодействия между этими клетка-
ми, выделяемые ими растворимые медиаторы
(антитела и цитокины) и система комплемента
находятся под строгим контролем. Расстройства
развития и дифференцировки этих клеток, син-
теза ими своих продуктов, нарушения взаимо-
действий между ними могут привести к имму-
нодефицитным состояниям, клиническая тя-
жесть которых варьирует от легких до фаталь-
ных.
Однако существенная часть дефицитов не про-
является клинически, поскольку затрагивает те
отделы, где иммунная система проявляет избы-
точность'. так, в участке цитокиновой сети функ-
ции одного компонента могут быть замещены
другим.
Хотя врожденные иммунодефицитные забо-
левания (состояния, с которыми люди рожда-
ются) в основном редки, описания ранних ста-
дий этих «экспериментов природы» пролили свет
на функционирование иммунной системы. Экс-
перименты на животных, в которых имитиру-
ются различные типы иммунодефицитов чело-
века, показали, что клетки специфического им-
мунитета делятся наТ- и В-лимфоциты, т.е. кле-
точно-опосредованный иммунитет против гумо-
рального.
В настоящее время эти редкие синдромы им-
мунодефицита и случаи лимфоидных новообра-
зований анализируются на молекулярном уров-
не. Информация, полученная в ходе исследова-
ний этих заболеваний, применяется для их ле-
чения и разработки иммунологических препа-
ратов для аутоиммунных заболеваний и нелим-
фоидных злокачественных опухолей. Данная гла-
ва начинается с описания врожденных и приоб-
ретенных синдромов иммунного дефицита, а за-
вершается рассказом о новообразованиях иммун-
ной системы.
СИНДРОМЫ ИММУННОГО ДЕФИЦИТА
259
• СИНДРОМЫ ИММУННОГО
ДЕФИЦИТА
Иммунодефицитные состояния разделяются на две
основные группы: первичные, которые могут быть
наследственными или приобретенными, но при-
чиной заболевания является именно иммунный
дефицит; вторичные, при которых иммунный де-
фицит является результатом других болезней или
состояний.
Первичные иммунные дефициты можно клас-
сифицировать, основываясь на клинических про-
явлениях, чго соотносится с поражением опреде-
ленного звена иммунной системы: 1) Т-клеток, или
клеточно-опосредованного иммунитета; 2) В-кле-
ток, или антитело-опосредованного иммунитета;
3) Т- и В-клеточного иммунитета; 4) неспеци-
фического иммунитета, опосредованного фаго-
цитирующими клетками и/или NK-клетками',
5) активацией комплемента. Эта классификация
упорядочивает широкий спектр иммунных рас-
стройств.
Аномалии цитокинов и цитокиновых рецеп-
торов — средств, с помощью которых клетки об-
мениваются информацией и функционируют, не
являются отдельной категорией расстройств, а вхо-
дят в первые четыре группы. Поскольку проявля-
ющийся иммунный ответ часто является резуль-
татом взаимодействия клеток нескольких типов,
недостаточность, например, продукции антител и
функций В-клеток может на самом деле быть обус-
ловлена первичным нарушением Т-клеток или Т-
В-клеточного взаимодействия. Классификация,
основанная на видимом проявлении дефекта и не
нуждающаяся в выявлении его первопричины (ко-
торая может быть неизвестна), является удобным
основанием для диагностики новых случаев забо-
левания. Эта классификация также позволяет вы-
явить корреляцию с экспериментальными моде-
лями на животных, с помошью которых может
быть идентифицирован основополагающий им-
мунный дефект.
Наличие иммунодефицита можно заподозрить
у пациента, страдающего повторными инфекци-
онными заболеваниями. Как показано в табл. 17.1,
тип обнаруживаемой инфекции часто может об-
легчить диагностику причины иммунодефицита.
Например, повторяющиеся бактериальные сред-
ние отиты (инфекции уха) и бактериальные пнев-
монии часто встречаются у лиц с недостаточно-
стью В-клеток и антител. Повышенная воспри-
имчивость к грибковым, протозойным и вирус-
ным инфекциям наблюдается при недостаточно-
сти Т-клеток и клеточно-опосредованного имму-
нитета. Системные инфекции, вызванные бакте-
риями с нормальной или сниженной вирулентно-
стью, поверхностные инфекции кожи или инфи-
цирование пиогенными (образующими гной) мик-
роорганизмами предполагают недостаточность фа-
гоцитирующих клеток; повторные инфекции пио-
генными организмами связаны с дефицитом ком-
племента. Особое значение имеет развитие оппор-
тунистических инфекций, т.е. болезней, вызван-
• Таблица 17 1. Основные клинические проявления иммунных расстройств
Нарушение Ассоциированное заболевание
Недостаточность: В-лимфоцитов — недостаточность иммунитета, опосредованного антителами Т-лимфоцитов — недостаточность клеточно- опосредованного иммунитета Т- и В-лимфоцитов — комбинированная недо- статочность иммунитета, опосредованного и антителами, и клетками фагоцитирующих клеток NK-клеток компонентов комплемента Повторяющиеся бактериальные инфекции, например средние отиты, повторяющиеся пневмонии Повышенная восприимчивость к вирусным, грибковым и протозойным инфекциям Острые и хронические инфекции вирусными, бактериаль- ными, грибковыми и протозойными микроорганизмами Системные инфекции бактериями обычно со сниженной вирулентностью; инфекции пиогенными бактериями; на- рушенное образование гноя и плохое заживление ран Вирусные инфекции, связанные с некоторыми Т-клеточ- ными расстройствами, и сцепленные с хромосомой X лимфопролиферативные синдромы Бактериальные инфекции; аутоиммунные заболевания
Нерегулируемый избыток: В-лимфоцитов Т-лимфоиитов компонентов комплемента Моноклональные гаммапатии, другие злокачественные заболевания из В-клеток Онкологические заболевания из Т-клеток Ангионевротический отек вследствие отсутствия ингиби- тора эстеразы С1
260
ГЛАВА 17. ИММУНОДЕФИЦИТНЫЕ РАССТРОЙСТВА И НОВООБРАЗОВАНИЯ ЛИМФОИДНОЙ СИСТЕМЫ
ных микроорганизмами, обычно присутствующи-
ми в окружающей среде и непатогенными для
иммунокомпетентных лиц. Среди микроорганиз-
мов, с наибольшей частотой участвующих в раз-
витии таких заболеваний, можно назвать Pneumo-
cystis carinih цитомегаловирус (CMV), токсоплаз-
мы, Mycobacterium avium и различные виды Can-
dida. Чаще всего такие инфекции связаны с не-
достаточностью клеточно-опосредованного имму-
нитета.
Синдромы первичного
иммунодефицита
За исключением недостаточности IgA (обсуждае-
мой далее в этой же главе) распространенность
синдромов первичного иммунодефицита очень
низкая — порядка одного случая на 10000 чел
Примерно 50% всех случаев составляет недоста-
точность антител, 20 % приходится на комбини-
рованную недостаточность иммунитета (и по ан-
тителам, и по клеточно-опосредованным механиз-
мам), 18% составляют расстройства фагоцитоза,
10% — это нарушения только клеточно-опосре-
дованного иммунитета и 2 % составляют дефици-
ты комплемента. На рис. 17.1 показано, что обыч-
но чем раньше при развитии плода возникает ге-
нетический дефект или блок, тем больше звеньев
иммунной системы оказываются пораженными и
тем более тяжело протекает болезнь.
Тяжелый комбинированный
иммунодефицит
Тяжелый комбинированный иммунодефицит
(ТКИД) — гетерогенная группа заболеваний, при
которых дефектными являются одновременно и
клеточно-опосредованный иммунитет, и продук-
ция антител (см. рис. 17.1). Это состояние перво-
начально называли агаммаглобулинемией швей-
царского типа. Пациенты с ТКИД гипотетически
ZT4 Синдром тяжелого г—. Х-сцепленная
комбинированного иммунодефицита LU агаммаглобулинемия (Брутона)
л Врожденная аплазия тимуса
(синдром Ди Джорджи)
А Недостаточность передачи
сигналов Т-клетками
Г5] Общая вариабельная иммунная
— недостаточность (разные
формы)
0 Избирательный
дефицит IgA
(ух Синдром «голых»
лимфоцитов
Binep-IgM-синдром
• Рис. 17.1. Участки нарушенного развития лимфоцитов, связанные с синдромами первичного
иммунодефицита. В кружках указаны повреждения, приводящие к комбинированным иммуно-
дефицитам, в треугольниках — повреждения, проявляющиеся расстройствами функций Т-кле-
ток; в квадратах - повреждения, проявляющиеся преимущественно как В-клеточные или гумо-
ральные иммунодефициты
СИНДРОМЫ ИММУННОГО ДЕФИЦИТА
261
• Таблица 17.2. Клинические формы тяжелого комбинированного иммунодефицита
Расстройство Причинно-значимая недостаточность Тип наследования
Подгруппа Т"В+: Х-сцепленный ТКИД аутосомно-рецессивный ТКИД Мутантная у-цепь цитокиновых рецепторов Мутантный ген тирозиновой киназы JAK3 Х-сцепленныи АР* »
Подгруппа ТВ: недостаточ ность аденозиндезам и назы недостаточность фосфорилазы пури- новых нуклеозидов рекомбиназная недостаточность Подгруппа Т+В": синдром Оменна Фермент аденозиндезаминаза Фермент фосфорилаза пуриновых нуклеозидов Фермент RAG-1 или RAG-2 Частичная недостаточность RAG » » » »
Подгруппа Т+В+: синдром голых лимфоцитов недостаточность ZAP-70 Активатор транскрипции МНС II класса (четыре белка) Киназный домен связанной с TCR протеинки- назы ZAP-70 » »
Мультисистемные расстройства: синдром Вискотта —Олдрича атаксия-телеангиэктазия Мутации белка синдрома Вискотта — Олдрича Мутантный белок атаксии-телеангиэктазии, необходимый для восстановления ДНК Х-сцепленный АР
*АР — аутосомно-рецессивный тип наследования.
восприимчивы ко всем типам микробной инфек-
ции (вирусной, бактериальной, грибковой и про-
тозойной), особенно — CMV, Pneumocystis carinii
и Candida. Вакцинация ослабленным живым ви-
русом у таких младенцев может привести к фа-
тальным последствиям.
Заболевание может быть классифицировано по
подгруппам при первичном обследовании в соот-
ветствии с присутствием в крови определенных
субпопуляций лимфоцитов (табл. 17.2). В одной
из подгрупп, обозначаемой Т В+, практически от-
сутствуют Т-клетки, но присутствует нормальное
или повышенное количество нефункциониру-
ющих В-клеток. У больных этой подгруппы мо-
жет не быть и NK-клеток. Во второй подгруппе,
Г В-, отмечается тяжелая лимфопения в связи с
отсутствием как Т, так и В-клеток. Некоторые
больные попадают в подгруппу Т+В+, и лишь еди-
ничные — в подгруппу Т+В . Предпочтительным
методом лечения для всех пациентов с ТКИД яв-
ляется пересадка костного мозга, из которого уда-
рны (деплетированы) Т-клетки, от совместимо-
ю по HLA родственного донора.
Подгруппа Т~В+
Х-сцепленный ТКИД. Пациенты с ТКИД, сцеп-
1енным с хромосомой X, составляют 40 —50 % слу-
чаев ТКИД; в большинстве случаев проявлением
ыболевания служит Т В+-лимфопения Были об-
наружены мутации в гене, расположенном на хро-
мосоме X, который кодирует у-цепь, которая яв-
ляется общей в рецепторах для цитокинов IL-2,
IL-4, IL-7, IL-9 и IL-15 (см. гл. 11). Таким обра-
зом, при этой мутации нарушается ответ на мно-
жество цитокинов (рис. 17.2, А).
При описании заболеваний человека очень
информативным оказалось исследование на экс-
периментальных животных, у которых были смо-
делированы дефекты иммунной системы. У «но-
каутных» мышей (см. гл. 5) отсутствовала у-цепь,
так же как и у пациентов с ТКИД, и обнаружи-
вался дефект развития как Т-, так и В-клеток.
Мыши, у которых отсутствовали IL-7 и IL-7R,
также походили на пациентов с ТКИД, что по-
зволяет предположить, что IL-7 необходим для
развития Т- и NK-клеток и что его функции не
могут быть компенсированы другими цитокинами.
У «нокаутных» мышей, не имеющих гена IL-2,
обнаруживалась только некоторая дисфункция
иммунной системы с нормальным развитием Т-
и В-клеток и отсутствием фенотипа ТКИД.
Аутосомно-рецессивный ТКИД. Небольшая
подгруппа пациентов, для которых характерна
Т В+ -лимфопения, демонстрирует скорее ауто-
сомно-рецессивный, чем сцепленный с хромосо-
мой X тип наследования. Фенотип таких пациен-
тов и больных с Х-сцепленным ТКИД иденти-
чен, и клинически эти подгруппы разделить не-
возможно. Мутации локализуются в гене тирози-
новой киназы JAK3 (рис. 17.2, 5), внутриклеточ-
ной молекулы, ответственной за передачу сигна-
262
ГЛАВА 17. ИММУНОДЕФИЦИТНЫЕ РАССТРОЙСТВА И НОВООБРАЗОВАНИЯ ЛИМФОИДНОЙ СИСТЕМЫ
ТКИД, сцепленный с хромосомой X
IL-2
IL-4
• Рис 17.2. (А) Цитокиновые рецепторы,
обладающие общей у-цепью, при отсут-
ствии этой цепи не могут формировать внут-
риклеточные сигналы после связывания с ли-
гандом (Б) Передача сигнала с цитокиново-
го рецептора, опосредуемая общей у-цепью,
нарушается при отсутствии тирозиновых ки-
наз JAK3. Оба механизма приводят к ТКИД
Отсутствующая JAK3
Аутосомно-рецессивный ТКИД
Ядро ( |
Нарушение активации транскрипции определенных генов
А Б
лов от у-цепи цитокиновых рецепторов (см. гл. 11).
Обычно JAK3 экспрессируется только в гемопоэ-
тических клетках
Подгруппа Т~В~
Дефицит аденозиндезаминазы. Аденозиндезами-
наза (АДА) — фермент цикла утилизации пури-
нов, является повсеместно экспрессируемым фер-
ментом «домашнего хозяйства» (т.е. использует-
ся при постоянном функционировании клетки).
Пациенты, у которых отсутствует этот фермент,
составляют примерно 20 % больных с ТКИД; за-
болевание имеет аутосомно-рецессивный меха-
низм наследования. Недостаточность АДА при-
водит к накоплению токсических отходов мета-
болизма, вызывая с течением времени прогрес-
сию симптомов. Такая картина делает раннюю ди-
агностику и назначение лечения в этой группе
больных жизненно важными.
Дефицит АДА оказывает самое выраженное
влияние на иммунную систему, так как приводит
к недостаточности развития как Т, так и В-лим-
фоцитов. У многих пациентов имеются характер-
ные аномалии скелета. Не совсем понятно, поче-
му у них не развиваются более выраженные муль-
тиорганные проблемы. Исследования такого ред-
кого генетического заболевания показали особен-
ную важность этого «спасательного пути» для раз-
вития и дифференцировки лимфоцитов. Также
они привели к разработке противолейкозных пре-
паратов, предотвращающих рост злокачественных
лимфоцитарных предшественников. Пациенты с
дефицитом АДА, у которых не было подходящего
родственного донора костного мозга, были пер-
вой группой больных, которых лечили с помо-
щью генной терапии, заключавшейся во введе-
нии с помощью вируса функционального гена
АДА. Однако даже после многих лет совершен-
ствования этот экспериментальный подход все еще
сопряжен с трудностями. Альтернативным мето-
дом лечения является дотационная ферментоте-
рапия.
Дефицит фосфорилазы пуриновых нуклеозидов.
Мутация в гене другого фермента пути утилиза-
ции пуринов, фосфорилазы пуриновых нуклео-
зидов (ФПН), сходным образом приводит к из-
бытку токсических продуктов, особенно сильно
повреждающих нервную систему и Т-клетки.
Вследствие этого дефекта во всех лимфоидных
тканях — тимусе, миндалинах, лимфатических
узлах и селезенке, наблюдается выраженный де-
фицит лимфоцитов. Парадоксальным образом,
даже несмотря на заметный иммунодефицит у
детей с этим состоянием, у таких пациентов час-
то встречаются аутоиммунные заболевания.
Недостаточность рекомбиназ. Гены, активиру-
ющие рекомбинации (RAG), 1 и 2 кодируют фер-
менты, участвующие в реаранжировке генов 1g в
пре-В-клетках и генов Т-клеточного рецептора в
пре-Т-клетках (см. гл. 6 и 9). Оба фермента необ-
ходимы для этих реаранжировок, поэтому мута-
ция в любом из них приводит к полному отсут-
ствию Т-клеток, В-клеток и иммуноглобулинов.
Созревание останавливается на стадиях пре-Т- и
пре-В-клеток. Обычно функция NK-клеток не
нарушается.
Подгруппа Т+В~
Синдром Оменна. Синдром Оменна является «те-
кучим» ТКИД со сниженной, но частично сохра-
ненной активностью RAG. Природа этого забо-
левания все еще до конца не изучена. Клиниче-
ские проявления у пациентов больше всего похо-
жи на тяжелые проявления реакций «трансплан-
тат против хозяина» (РТПХ) (они обсуждаются в
гл. 19), чем на симптомы у пациентов с отсут-
ствием активности RAG. Несмотря на тяжелые
проявления иммунодефицита, которые препят-
СИНДРОМЫ ИММУННОГО ДЕФИЦИТА
263
ствуют формированию эффективного иммунного
ответа на любой возбудитель, у таких пациентов
обнаруживается выраженная дизрегуляция иммун-
ной системы. Лимфоциты периферической кро-
ви этих больных имеют фенотип Т+В , а в коже и
ЖКТ отмечается массивная инфильтрация эози-
нофилами и активированными Т-клетками, вы-
деляющими цитокины типа Тн2 (см. гл. 10 и 11).
Это приводит к rnnep-IgE-синдрому и наруше-
нию питания в связи с потерей белка. По сравне-
нию с пациентами с другими типами ТКИД сте-
пень успешности трансплантации костного мозга
у людей с синдромом Оменна невелика. Причи-
ной неудач является отторжение трансплантата.
Таким образом, несмотря на то что пациенты с
синдромом Оменна страдают иммунодефицитом,
они нуждаются в иммуносупрессивной терапии.
Подгруппа Т+В+
Синдром «голых» лимфоцитов. Синдром «голых»
лимфоцитов (СГЛ) развивается в результате на-
рушения экспрессии молекул HLA (человеческо-
го МНС). Его разделяют на три группы в зависи-
мости от того, молекулы HLA какого класса от-
сутствуют: 1,11 или одновременно обоих. Несмотря
на это, признаки постоянного иммунодефицита
возникают только у пациентов, не экспрессиру-
ющих молекулы HLA II класса вне зависимости
от того, экспрессируют они молекулы HLA I клас-
са или нет. Количество циркулирующих Т- и В-
клеток может быть нормальным; однако при от-
сутствии молекул HLA II класса белковые анти-
гены не могут быть презентированы СВ4+-Т-клет-
кам (рис. 17.3). Поэтому не возникает взаимодей-
ствия между АПК (В-клетками, макрофагами/мо-
ноцитами. дендритными клетками) и CD4+-T-
клетками. Вследствие этого не обеспечивается под-
держка функционирования В-клеток или образо-
вания цитотоксических Т-клеток (см. гл. 10). Это
приводит к клиническим проявлениям комбини-
рованного иммунодефицита. Поскольку экспрес-
сия молекул МНС II класса на эпителиальных
клетках тимуса необходима для позитивного от-
бора СВ4+-Т-клеток, то таких клеток в тимусе
образуется мало (см. рис. 17.1, дефект 7). Таким
образом, у большинства пациентов обнаружива-
ется сниженное соотношение CD4+- и CD8+-T-
клеток, что приводит к инверсии нормального
Т-клеточного индекса CD4:CD8. Присутствующие
СВ4+-Т-клетки функционально полноценны, что
подтверждается их способностью отвечать на сти-
муляцию in vitro. Для предотвращения развития
РТПХ этим пациентам необходим донор костно-
го мозга, подходящий по антигенам HLA.
Мутация, ответственная за СГЛ, располагает-
ся не в самих генах HLA II класса, а в одном из
четырех генов, кодирующих регуляторные фак-
торы, необходимые для транскрипции генов HLA
II класса. Можно предположить, что лучшее по-
нимание нарушений транскрипции при СГЛ мо-
жет привести к разработке метода, позволяющего
регулировать экспрессию HLA II класса. Он мо-
жет применяться для предотвращения отторже-
ния трансплантата при пересадке органов (напри-
мер, почек, печени) у иммунокомпетентных па-
циентов.
Было выявлено лишь несколько пациентов с
дефицитом экспрессии молекул HLA I класса;
некоторые из них были обнаружены случайно.
Это, несомненно, связано с тем, что не у всех лиц
с дефицитом экспрессии молекул HLA 1 класса
развивается клинически значимый иммунодефи-
цит. Как и у пациентов с СГЛ с дефектом эксп-
рессии молекул HLA II класса, у лиц с недоста-
точностью молекул HLA I класса мутация гена
молекул HLA I класса отсутствует, но изменен
ген, кодирующий белок-транспортер (ТАР). Как
было рассказано в гл. 9, белок-транспортер перено-
сит пептиды, синтезированные в цитозоле, в эндо-
Отсутствие МНС II класса
Синдром «голых» лимфоцитов
Мутантный лиганд CD40 (CD 154)
• Рис. 17.3. Отсутствие детерминант клеточной
мембраны, необходимых для нормального взаимо-
действия Т-клетки с АПК приводит к нескольким
синдромам первичного иммунодефицита, среди
которых синдром «голых» лимфоцитов. гипер-lgM-
синдром и недостаточность Fas
| Гипер-IgM-синдром [
CD40
Мутантный Fas
Лиганд Fas
Недостаточность Fas I
264
ГЛАВА 17. ИММУНОДЕФИЦИТНЫЕ РАССТРОЙСТВА И НОВООБРАЗОВАНИЯ ЛИМФОИДНОЙ СИСТЕМЫ
плазматический ретикулум, где они взаимодей-
ствуют и стабилизируют структуру молекул МНС
I класса. При отсутствии продукта гена ТАР экс-
прессия молекул МНС I класса на клеточной по-
верхности очень низкая. По непонятным причи-
нам у пациентов с клинически значимым дефек-
том чаще возникают рецидивирующие пневмонии,
нежели ожидаемые вирусные инфекции.
Мутация ZAP-70. Пациенты с мутацией Т-кле-
точной тирозинкиназы ZAP-70, которая перево-
дит сигнал, полученный от Т-клеточного рецеп-
тора, также имеют ТКИД-подобный фенотип. Об
этом будет более подробно рассказано далее.
Другие многосистемные расстройства
В дополнение к комбинированным иммунодефи-
цитным заболеваниям, которые мы только что
обсудили, некоторые полисистемные наследствен-
ные нарушения приводят к ТКИД-подобной кли-
нической картине.
Синдром Вискотта — Олдрича. Синдром Вис-
котта — Олдрича — заболевание, сцепленное с хро-
мосомой X, характеризующееся классической три-
адой симптомов: геморрагический диатез (тенден-
ция к кровоточивости) вследствие тромбоцитопе-
нии (низкого содержания тромбоцитов в крови)
и малого размера тромбоцитов, повторяющиеся
бактериальные инфекции и аллергические реак-
ции (включая экзему, повышенный уровень IgE
и пищевую аллергию). Кроме того, у этих паци-
ентов наблюдается высокий риск развития онко-
патологии, особенно опухолей лимфоидной тка-
ни. Генетической основой этого заболевания яв-
ляется мутация гена хромосомы X, кодирующего
белок синдрома Вискотта —Олдрича (Wiskott-
Aldrich syndrome protein — WASP), который эксп-
рессируется на всех стволовых гемопоэтических
клетках. Современные данные позволяют пред-
положить, что WASP взаимодействует с цитоске-
летом, и в клетках пациентов с этим синдромом
цитоскелет становится не способным видоизме-
няться в ответ на стимуляцию.
Иммунные дефекты вариабельны и затрагива-
ют функции обеих популяций Т- и В-клеток; осо-
бенно снижено количество Т-клеток. Характер-
но, что у этих пациентов не возникает ответ на
полисахаридные антигены. Лечение таких боль-
ных состоит в немедленном назначении антибио-
тиков и противовирусных препаратов при любой
инфекции. После трансплантации костного моз-
га происходит восстановление функции Т- и В-
клеток. Без терапии средняя продолжительность
жизни пациентов составляет около 3 лет. С уве-
личением продолжительности жизни можно ожи-
дать повышения заболеваемости онкологически-
ми заболеваниями.
Атаксия-телеангиэктазия. Другим полисистем-
ным генетическим заболеванием является атак-
сия-телеангиэктазия, при которой неврологиче-
ские симптомы (шатающаяся походка или атак-
сия) и патологическое расширение сосудов (те-
леангиэктазия) сопровождают повышенную чув-
ствительность к инфекциям, лимфопению (низ-
кий уровень лимфоцитов в периферической кро-
ви), гипоплазию тимуса и пониженные уровни
IgA, IgE и иногда IgG. Иммунный дефект охваты-
вает оба звена: клеточный и гуморальный (Т-за-
висимый и Т-независимый) иммунный ответы,
особенно сильно поражая Т-зависимые участки
лимфоидной ткани. В основе генетического дефекта
этого синдрома лежит мутация гена, кодирующе-
го белок (ataxia telangiectasia mutated — ATM), ко-
торый участвует в процессе репарации поврежде-
ний клеточной ДНК после воздействия ионизи-
рующего излучения или оксидативного взрыва
У больных атаксией-телеангиэктазией нарушено
развитие Т- и В-клеток. При нормальном разви-
тии Т- и В-клетки проходят важные фазы интен-
сивной клеточной пролиферации, апоптоза и про-
цессы рекомбинации ДНК, каждая из которых
может быть нарушена под влиянием мутирован-
ного нефункционального белка ATM. Дети с атак-
сией-телеангиэктазией также имеют высокий риск
развития онкологической патологии, особенно
новообразований лимфоидной ткани. Это может
быть связано с дефектом ATM-зависимого вос-
становления ДНК или нарушением клеточного
цикла после хромосомного повреждения. Заболе-
вание ассоциировано с синдромом Блума и ане-
мией Фанкони Оба эти заболевания характеризу-
ются одинотипным вариабельным иммунным де-
фицитом и чувствительностью к повреждению
ДНК.
Таким образом, указанные причины, приводя-
щие к тяжелым дефектам обоих звеньев иммуни-
тета, клеточно-опосредованного и гуморального,
различны Они варьируют от мутаций ферментов,
находящихся во всех клетках, что должно оказы-
вать огромное воздействие на организм в целом,
до мутаций, вовлекающих специфические сигналь-
ные белки, экспрессированные в Т-клетках (му-
тация ZAP-70).
Для понимания природы синдромов, наблю-
даемых у людей, и стадий нормального развития
Т- и В -клеток, много информации можно полу-
чить, изучая модели на животных. Для изучения
этой группы заболеваний первыми моделями были
ТКИД-мутантные породы мышей, имеющие ге-
нетический дефект белка, восстанавливающего
обрывы двухцепочечной ДНК. Впоследствии были
выведены породы «нокаутных» мышей, модели-
рующих большую часть спонтанных генетических
заболеваний человека, что оказало существенную
помощь в исследованиях (см. гл. 5). Кроме того,
ТКИД-мышей и «голых» мышей (обсуждается
далее в этой главе) с ослабленной способностью
к отторжению чужеродных тканей можно исполь-
зовать в качестве «живой тест-пробирки» для изу-
чения роста стволовых гемопоэтических клеток и
опухолей человека.
СИНДРОМЫ ИММУННОГО ДЕФИЦИТА
265
Иммунодефицитные состояния, связанные
с Т-клетками и клеточно-опосредованным
иммунитетом
Как показано в табл. 17.1, пациенты с недоста-
точностью Т-клеточного звена восприимчивы к
вирусной, грибковой и протозойной инфекциям
Более того, поскольку Т-клетки необходимы для
продукции В-клетками антител к Т-зависимым
антигенам (см. гл. 10), у пациентов с дефицитом
Т-клеточного звена также проявляются избира-
тельные дефекты продукции антител. Следователь-
но, пациентов с Т-клеточной недостаточностью
бывает трудно отличить от больных с ТКИД по
клинической картине.
Врожденная аплазия тимуса
(синдром Ди Джорджи)
Синдром Ди Джорджи — это Т-клеточная недо-
статочность, при которой тимус, а также другие
нелимфоидные органы развиваются аномально. Этот
синдром возникает вследствие нарушения мигра-
ции клеток эмбрионального нервного гребешка в
третий и четвертый глоточные карманы. В норме
этот процесс происходит на 12-й неделе гестации.
При синдроме Ди Джорджи развиваются анома-
лии сердца, лицевой области, тимуса и паращи-
товидных желез, что приводит к аплазии тимуса
и гипопаратиреоидизму. Следствием аплазии ти-
муса является отсутствие зрелых Т-клеток и им-
мунодифицит. Моделью синдрома Ди Джорджи
являются «голые» мыши; у этих животных не раз-
виваются тимус и волосяные фолликулы.
Синдром Ди Джорджи не является наследствен-
но обусловленным, но встречается спорадически
как результат делеции хромосомы 22ql 1. У ново-
рожденных отмечают гипокальциемию (низкий
уровень кальция) вследствие отсутствия паращи-
товидных желез и врожденные пороки сердца.
Такие дети страдают от частых или хронических
вирусных, бактериальных, грибковых и протозой-
ных инфекций. У них отсутствуют зрелые Т-клетки
на периферии (в крови, лимфатических узлах или
селезенке) или их очень мало (см. рис. 17.1, де-
фект 2). Хотя В-клетки, плазматические клетки
и уровни 1g в плазме могут быть нормальными,
у многих пациентов не происходит увеличения от-
вета антител после иммунизации Т-зависимыми
антигенами. Недостаток Т-клеток-хелперов, не-
обходимых для переключения на другие изотипы
иммуноглобулинов, приводит к отсутствию IgG
и антител других изотипов после иммунизации
Однако ответ IgM на Т-независимые антигены не
страдает. Поскольку больные с синдромом Ди
Джорджи имеют недостаточность Т-клеточного
звена и не способны генерировать нормальный
антительный ответ, их нельзя прививать живыми
ослабленными вирусными вакцинами!
Изначально детей с синдромом Ди Джорджи
лечили пересадкой эмбрионального тимуса, что
приводило к появлению в организме хозяина Т-кле-
ток в течение недели. Возраст эмбрионального
тимуса, используемого для трансплантации, дол-
жен быть менее 14 недель гистации, что обеспечи-
вает отсутствие РТПХ, которая может встречаться,
если реципиенту с иммунными нарушениями (им-
мунокомпрометированному) были внесены зрелые
донорские клетки тимуса. Донорский эмбриональ-
ный тимус обеспечивает наличие тимических эпи-
телиальных клеток, которые позволяют нормаль-
ным лимфоидным клеткам-предшественникам ре-
ципиента развиться до Т-лимфоцитов. Хотя обра-
зовавшиеся Т-клетки нормальные, клеточно-опосре-
дованный иммунитет и помощь в продукции ан-
тител восстанавливаются неполностью. Т-клетки
реципиента «запоминают» как «свои» молекулы
МНС клеток трансплантированного тимуса и иног-
да плохо взаимодействуют с АПК собственного
организма на периферии (см. гл. 8 и 9). Поскольку
эта лечебная стратегия не была успешной, то в
настоящее время в основном проводят симптома-
тическую терапию. Некоторые пациенты имеют ре-
зидуальную тимическую ткань, которая обеспечи-
вает хотя запоздалое и уменьшенное, но все-таки
развитие Т-клеток. Дополнительной медицинской
проблемой, связанной с этим синдромом, являет-
ся врожденный порок сердца, что ухудшает в об-
щем-то и без того плохой прогноз.
Т-клеточная недостаточность с нормальным
количеством периферических Т-клеток
У определенного числа пациентов были обнару-
жены в большей степени функциональные, не-
жели количественные дефекты Т-клеток. Клини-
чески они могут проявляться оппортунистиче-
скими инфекциями и удивительно высокой часто-
той аутоиммунных заболеваний. Исследование
родословных в таких семьях выявляет аутосомно-
рециссивный тип наследования. Исследования на
молекулярном уровне демонстрируют гетероген-
ность причинно-значимых факторов, в том числе
недостаточную экспрессию тирозинкиназы ZAP-70,
CD3z или CD3y (рис. 17.4).
Как мы уже описали в гл. 10. ZAP-70 требуется
для внутриклеточного преобразования сигнала
после связывания с Т-клеточным рецептором. По
неясным причинам пациенты с дефектом эксп-
рессии ZAP-70 имеют клиническую картину
ТКИД-подобного синдрома (с дефектом клеточ-
но-опосредованного и гуморального иммунитета,
как указывалось ранее в этой главе). Отсутствие
Т-клеточной активности позволяет предположить,
что ZAP-70 играет решающую роль в функцио-
нировании зрелых Т-клеток (рис. 17.1, дефект 3),
однако причины воздействия на функции В-кле-
ток не ясны. Кроме того, хотя количество пери-
ферических клеток крови, лимфатические узлы и
тимус исходно нормальны, у пациентов с дефек-
том экспрессии ZAP-70 отсутствуют СВ8+-Т-клетки.
Этот факт позволяет предположить, что ZAP-70
266
ГЛАВА 17. ИММУНОДЕФИЦИТНЫЕ РАССТРОЙСТВА И НОВООБРАЗОВАНИЯ ЛИМФОИДНОЙ СИСТЕМЫ
также требуется для дифференцировки CD8+-T-
клеток в тимусе. Мутации цепей CD3 достаточно
редки, и описано малое количество пациентов с
таким дефектом. Модели на животных подтверж-
дают, что пептидные цепи CD3 необходимы для
нормальной передачи сигнала через Т-клеточный
рецептор. Однако неясно, точно ли соответству-
ют такие мышиные модели тому дефекту, кото-
рый имеется у описанных ранее пациентов.
Аутоиммунный лимфопролиферативный
синдром
Аутоиммунный лимфопролиферативный синдром
(АЛПС) — наследственное заболевание, характе-
ризующееся массивной пролиферацией лимфоид-
ной ткани с ранним развитием лимфомы. Оно
может считаться аутоиммунным, поскольку такой
генетический дефект приводит к системному ауто-
иммунному феномену и повышенной восприим-
чивости только к хроническим вирусным инфек-
циям. У пациентов повышается количество дваж-
ды негативных (CD4 CD8) Т-клеток и может раз-
виться В-клеточная лимфома. Большинство боль-
ных АЛ ПС имеют мутацию гена, кодирующего
белок Fas (CD95) (см. рис. 17.3). Сигналы, прово-
димые через этот белок, в норме активируют апоп-
тоз, или программируемую гибель клетки (см. гл.
10 и 12). Без активации апоптоза клетки, которые
должны погибнуть, живут, а иммунные реакции,
которые должны «выключиться», продолжаются.
Большинство больных АЛ ПС имеют одну нор-
мальную и одну мутантную молекулу Fas. Это
позволяет предположить, что мутантная молеку-
ла каким-то образом мешает функционированию
нормальной молекулы Fas. Некоторые больные
АЛ ПС имеют дефекты других компонентов запус-
ка апоптоза, таких как Fas-лиганд или каспаза 10.
Две породы мышей — Ips и gid — обладают фе-
нотипом, схожим с фенотипом больных АЛПС; Ips-
мыши имеют мутацию в гене Fas, а g/J-мыши —
в гене Fas-лиганда. В течение многих лет /ps-мыши
изучались как модель аутоиммунного заболевания,
особенно СКВ, пока не был обнаружен дефект в
их Fas-гене.
Хронический кожно-слизистый кандидоз
Хронический кожно-слизистый кандидоз — это
плохо определяемая совокупность синдромов, ха-
рактеризующихся инфицированием кожи и сли-
зистых оболочек грибами рода Candida. Эти гри-
бы обычно присутствуют на поверхности таких
тканей, но не являются патогенным. У пациен-
тов обычно не нарушен клеточно-опосредован-
ный иммунитет к другим микроорганизмам, от-
личным от грибов рода Candida, а также нор-
мальный опосредованный В-клетками иммуни-
тет (продукция антител) в ответ на все микроор-
ганизмы, включая Candida. Таким образом, име-
ется только избирательный дефект функциониро-
вания Т-клеток. Это заболевание поражает и муж-
чин, и женщин, особенно часто проявляется в
детском возрасте, а в некоторых случаях может
быть наследственным.
В-клеточные
или иммуноглобулинассоциированные
иммунодефицитные заболевания
В-клеточные или иммуноглобулинассоциирован-
ные иммунные заболевания варьируют от заболе-
ваний с дефектом развития В-клеток и полным
отсутствием всех классов 1g до заболеваний, свя-
занных с недостаточностью одного класса или
подкласса Ig. Больные страдают от рецидивиру-
ющих или хронических инфекций, которые мо-
гут начаться в детстве (агаммаглобулинемия Бру-
тона) или молодом возрасте. Для диагностики этих
заболеваний необходимо узнать количество В-кле-
ток и исследовать их функцию, провести имму-
ноэлектрофоретическое и количественное опре-
деление классов и подклассов Ig.
СИНДРОМЫ ИММУННОГО ДЕФИЦИТА
267
Х-сцепленная младенческая
агаммаглобулинемия
Х-сцепленную младенческую агаммаглобулине-
мию (ХСА) впервые описал в 1952 г. О. Брутон
(О. Bruton). Это заболевание также называется
агаммаглобулинемией Брутона. Такое расстройство
встречается сравнительно редко (1 случай на
100000 чел.). Впервые оно проявляется в возрасте
5 — 6 мес, когда младенец теряет материнские IgG,
полученные через плаценту. В этом возрасте у мла-
денцев основными проявлениями являются тяже-
лые рецидивирующие бактериальные инфекции
как результат тяжелого угнетения или, возможно,
отсутствия иммуноглобулинов всех классов.
В основе главного дефекта лежит неспособность
предшественников В-клеток, которые представ-
лены в нормальном количестве, превращаться в
зрелые В-клетки. Ген ВТК (Брутоновской тиро-
зинкиназы), который подвергается мутациям при
ХСА, в норме кодирует фермент тирозинкиназу,
расположенную в цитозоле. Он, по-видимому,
является незаменимым участником процесса пре-
образования сигнала, передаваемого от пре-В-кле-
точного рецептора, в развивающихся В-клетках.
Без этого сигнала клеточное развитие не продол-
жается (см. рис. 17.1, дефект 4). Все зрелые В-
клетки улиц, получивших от матерей-носителей му-
тантный ген, образуются только благодаря нали-
чию другой активной (немутантной) хромосомы X.
Таким образом, ХСА является одним из несколь-
ких описанных наследственно обусловленных
иммунодефицитов, за которые ответственна му-
тация цитоплазматической тирозинкиназы. Му-
тации JAK3, вызывающие развитие одной из форм
ТКИД, и ZAP-70, ответственные за форму Т-кле-
точной недостаточности, были описаны ранее.
Исследования крови, костного мозга, селезен-
ки и лимфатических узлов у пациентов с ХСА
выявляют почти полное отсутствие В-клеток и
плазматических клеток, что объясняет низкие
уровни Ig. Характерно, что у детей значительно
недоразвиты миндалины. В-клетки, образующие-
ся в ограниченном количестве, обладают нормаль-
ной способностью к превращению в плазматиче-
ские клетки. Младенцы с ХСА страдают от реци-
дивирующих бактериальных средних отитов, брон-
хитов, септицемии, пневмонии, артритов, менин-
гитов и дерматитов. Наиболее часто обнаружива-
ются микроорганизмы Hemophilus influenzae и
Streptococcus pneumoniae. Часто пациенты также
страдают от мальабсорбции из-за засилия в ЖКТ
Giardia lamblia. При этом такие больные также
чувствительны к вирусной инфекции, которая
проникает через ЖКТ, например эховирусам и
вирусу полиомиелита. Инфекции плохо поддаются
только одним антибиотикам, поэтому лечение
состоит из периодических инъекций внутривен-
ного иммуноглобулина (ВВИТ), содержащего боль-
шое количество IgG (обсуждается в гл. 21). Хотя
эта пассивная иммунизация поддерживает неко-
торых пациентов в течение 20 — 30 лет, прогноз
дается с осторожностью, поскольку из-за частого
рецидивирования инфекций высока вероятность
развития хронических легочных заболеваний.
Транзиторная гипогаммаглобулинемия
У младенцев в возрасте 5 — 6 мес пассивно пере-
несенные материнские IgG исчезают, а продук-
ция иммуноглобулинов в организме начинает воз-
растать. У недоношенных младенцев может быть
транзиторная недостаточность IgG, поскольку они
еще не способны синтезировать иммуноглобули-
ны. Время от времени у младенцев, рожденных в
срок, также может отмечаться снижение уровня
IgG даже при нормальных уровнях IgM и IgA. Это
состояние возникает вследствие снижения коли-
чества Т-хелперов и нарушения их функции. Тран-
зиторная гипогаммаглобулинемия может сохра-
няться от нескольких месяцев до 2 лет. Это забо-
левание не связано с полом и его можно отли-
чить от Х-сцепленного заболевания по наличию
нормального количества В-клеток в кровотоке.
Хотя обычно в лечении нет необходимости, нуж-
но выявлять таких младенцев, поскольку в этот
период не следует проводить иммунизацию.
Общая вариабельная иммунная
недостаточность
У пациентов с общей вариабельной иммунной
недостаточностью (ОВИН) отмечаются значитель-
но сниженные уровни сывороточных IgG и IgA,
при этом уровень IgM нормальный или снижен-
ный, а количество В-клеток в периферической
крови нормальное или сниженное. Причина за-
болевания, которое поражает и мужчин, и жен-
щин, не совсем понятна, а возможно, и не явля-
ется одинаковой во всех случаях. Начало заболе-
вания может отмечаться в любом возрасте, но
выделяют два пика в 1 — 5 и 15 — 20 лет. У забо-
левших отмечают повторные респираторные и ки-
шечные инфекции, вызванные пиогенными бак-
териями, и аутоиммунные заболевания, такие как
гемолитическая анемия, тромбоцитопения и СКВ,
которые ассоциируются с аутоантителами. У мно-
гих также наблюдаются расстройства клеточно-
опосредованного иммунитета. В долгосрочной
перспективе у таких пациентов повышена часто-
та онкологических заболеваний, в частности лим-
фом и рака желудка.
Общая вариабельная иммунная недостаточность
характеризуется нарушением созревания В-клеток
в клетки, секретирующие антитела (см. рис. 17.1,
дефект 5). Этот дефект может быть обусловлен
неспособностью В-клеток пролиферировать в от-
вет на антиген или нормальной пролиферацией
В-клеток без секреции IgM, или секрецией IgM
без переключения изотипа на IgG или IgA (вслед-
ствие внутреннего повреждения В- или Т-клеток),
или нарушением гликозилирования тяжелых це-
268
ГЛАВА 17. ИММУНОДЕФИЦИТНЫЕ РАССТРОЙСТВА И НОВООБРАЗОВАНИЯ ЛИМФОИДНОЙ СИСТЕМЫ
пей IgG. В большинстве случаев расстройство про-
является в результате угнетения синтеза и сек-
реции иммуноглобулинов. Это заболевание явля-
ется семейным или возникает спорадически, при
этом факторы внешней среды, вызывающие за-
болевание, неизвестны.
Лечение зависит от степени тяжести. При тя-
желых формах болезни с множеством повторных
или хронических инфекций назначается лечение
внутривенным иммуноглобулином. У больных,
получающих лечение, как правило, нормальная
продолжительность жизни. У матерей с ОВИН
беременность протекает нормально, но, безуслов-
но, они не передают материнские IgG плоду.
Избирательные дефициты
иммуноглобулинов
Несколько синдромов обусловлены селективны-
ми дефицитами одного класса или подкласса им-
муноглобулинов. Некоторые из них сопровожда-
ются компенсаторным увеличением уровней дру-
гих изотипов антител, как, например, увеличение
концентрации IgM в случаях дефицита IgG или
IgA.
Недостаточность IgA является наиболее рас-
пространенным иммунодефицитным расстрой-
ством на Западе, его частота ориентировочно со-
ставляет один случай на 800 чел. (см. рис. 17.1.
дефект 6). Причина этого расстройства неизвест-
на, но, похоже, связана со снижением высвобож-
дения IgA из В-лимфоцитов. Дефицит IgA также
может возникать и транзиторно, в качестве по-
бочного эффекта действия лекарственных препа-
ратов. Пациенты могут страдать от рецидивиру-
ющих инфекций верхних и нижних дыхательных
путей вирусной или бактериальной этиологии,
целиакии (нарушенной абсорбции в кишечнике)
или не иметь никаких симптомов.
Лечение пациентов, у которых все же отмеча-
ются проявления заболевания, состоит в назначе-
нии антибиотиков широкого спектра действия.
Терапия сывороточным иммуноглобулином не
применяется, поскольку промышленные препа-
раты содержат низкие концентрации IgA и пото-
му что IgA, введенный парентерально, не дости-
гает участков секреторной иммунной системы, где
обычно является защитным иммуноглобулином.
Более того, у пациентов может развиваться гумо-
ральный ответ (обычно IgG или IgE) к IgA из пе-
релитой иммунной сыворотки, что вызывает ре-
акции гиперчувствительности. Тем не менее про-
гноз при селективном дефиците IgA в основном
хороший, и большинство пациентов живут нор-
мально.
Отмечаются селективные дефициты и других
изотипов иммуноглобулинов. Примером являет-
ся недостаточность IgM, редкое расстройство,
при котором пациенты переносят повторные и
тяжелые инфекции, вызванные микроорганизма-
ми, имеющими полисахаридные капсулы, такие
как пневмококки или Haemophilus influenzae. Опи-
саны избирательные дефициты подклассов IgG,
но они чрезвычайно редки.
Расстройства взаимодействия
Т— В-лимфоцитов
Существуют по меньшей мере два заболевания,
при которых линии Т- и В-клеток созревают нор-
мально, но взаимодействия между их представи-
телями нарушены. Хотя причиной обоих этих со-
стояний являются нарушения в Т-клетках, пре-
обладающие клинические проявления связаны с
В-клетками или гуморальным иммунным ответом.
Этими заболеваниями являются rnnep-IgM-син-
дром и Х-сцепленная лимфопролиферативная
болезнь.
Гипер-1дМ-синдром
Х-сцепленный rnnep-lgM-синдром (ХГИМ) про-
является в возрасте 1—2 лет рецидивирующими
респираторными инфекциями и очень низкими
уровнями сывороточных IgG, IgA и IgE в сочета-
нии с нормальным или повышенным уровнем IgM
(см. рис. 17.1, дефект 8). Количество В-клеток у
таких пациентов нормальное, in vitro они полно-
ценно функционируют и способны к переключе-
нию изотипа при соответствующей стимуляции
Т-клетки также присутствуют в обычном количе-
стве, нормально распределены по субпопуляци-
ям и отвечают пролиферацией на митогены. Му-
тация в гене CD40L' расположенном на хромосо-
ме X, приводит к отсутствию лиганда CD40
(CD154) на Тн-клетках (см. рис. 17.3). При этом
CD40L связывается с CD40, экспрессируемым на
В-клетках (см. гл. 10). Это взаимодействие пре-
дотвращает апоптоз В-клеток и представляется
важным, если не необходимым, для переключе-
ния изотипа. При ХГИМ также не происходит
привлечения В-клеток в фолликулы, что приво-
дит к отсутствию сформированных зародышевых
центров. У мальчиков с таким расстройством так-
же наблюдаются небольшие изменения в функ-
циях Т-клеток и частичный блок дифференциров-
ки нейтрофилов и активации макрофагов. Это
может объяснять их подверженность оппортуни-
стическим инфекциям, в частности пневмониям,
вызванным Pneumocystis carinii, и прогноз у них
хуже, чем у пациентов с ХСА.
У второй группы пациентов с такими же кли-
ническими проявлениями, как и при ХГИМ, но с
аутосомно-рецессивным типом наследования, воз-
можно, имеется дефект В-клеток в молекуле CD40
У пациентов третьей группы с дефектом взаимо-
действия CD40 с модулятором транскрипционного
фактора NF-кВ (см. гл. 10) отмечается Х-сцеп-
ленный механизм наследования. Как это часто
бывает при генетических нарушениях, вовлека-
ющих такого типа регуляторные молекулы меж-
клеточных взаимодействий, у заболевших детей
СИНДРОМЫ ИММУННОГО ДЕФИЦИТА
269
• Рис. 17.5. (А) Нарушения адгезии
клеток повреждают способность лейко-
цитов взаимодействовать с эндотелием
сосудов, вызывая поломку в процессе
миграции этих клеток из кровотока к
месту инфекции. (Б) Поломки в меха-
низмах, необходимых для фагоцитоза,
приводят к нарушению внутриклеточ-
ного уничтожения микроорганизмов
Хроническая
гранулематозная болезнь
Синдром
Чедиака—Хигаси
также наблюдаются патологические изменения в
клетках, не принадлежащих иммунной системе.
Например, такие регуляторные молекулы исполь-
зуют множество типов клеток.
Х-сцепленное лимфопролиферативное
заболевание (синдром Дункан)
Впервые Х-сцепленное лимфопролиферативное
(ХСЛ) заболевание было описано у шести род-
ственников по материнской линии мужского пола
в семье Дункан, поэтому такое название стало
нарицательным. Основным компонентом комп-
лексного дефекта, определяющего развитие этого
редкого заболевания, признана неспособность
Т-клеток регулировать рост В-клеток. До контак-
та с вирусом Эпштейна—Барр такие пациенты
клинически здоровы, у них отмечается нормаль-
ное количество Т- и В-клеток. Однако при воз-
действии вируса у них развивается тяжелая фор-
ма инфекционного мононуклеоза, которая может
быть летальной. В том случае, если пациент вы-
живает после перенесенной инфекции, у него ча-
сто развивается злокачественная лимфома или
дизгаммаглобулинемия. Лимфома или дефицит
иммуноглобулинов могут возникнуть у них и без
предварительного контакта с вирусом Эпштейна —
Барр. Среди лимфом преимущественно отмеча-
ются агрессивные В-клеточные лимфомы вне лим-
фатических узлов (экстранодально), в частности
в ЖКТ. Наиболее частым типом является лимфо-
ма Беркитта (описывается далее в этой же главе).
Несмотря на то что тип развивающихся лимфом
такой же, как и у пациентов с другими наруше-
ниями контроля индуцируемой вирусом Эпштей-
на—Барр пролиферации В-клеток, вызванной де-
фектом Т-клеток (например, пациентов со СПИД
или пациентов, получающих иммуносупрессивную
терапию после трансплантации), частота разви-
тия лимфом при ХСЛ значительно выше. Про-
гноз крайне неблагоприятный.
Дисфункции фагоцитирующих клеток
Фагоцитирующие клетки — полиморфноядерные
лейкоциты и макрофаги/моноциты — играют
очень важную роль как во врожденном, так и в
приобретенном иммунитете, действуя против па-
тогенов самостоятельно или вместе с лимфоцита-
ми. Наследственные синдромы недостаточности
фагоцитирующих клеток помогли идентифициро-
вать множество молекул, необходимых на всех
стадиях в действиях фагоцита, необходимых для
уничтожения возбудителя. К этим стадиям и свя-
занным с ними дефицитам относятся: миграция
и адгезия фагоцитирующих клеток (недостаточ-
ность лейкоцитарной адгезии), фагоцитоз и сплав-
ление с лизосомами (синдром Чедиака—Хигаси)
и окислительный взрыв для уничтожения возбу-
дителя (хроническая грануломатозная болезнь)
(рис. 17.5). Фагоцитарная дисфункция может быть
и вторичной, вызванной внешними факторами.
такими как лекарственные препараты и систем-
ные заболевания (например, сахарный диабет),
или дефектами других звеньев иммунной системы.
Недостаточность лейкоцитарной адгезии
Как обсуждалось в гл. 11, чтобы лейкоциты при-
были к месту инфекции в тканях, клеткам преж-
де всего необходимо покинуть кровоток. Этот
процесс состоит из нескольких стадий. На пер-
вой лейкоциты начинают медленно перекатывать-
ся вдоль эндотелия благодаря взаимодействиям
селектинов на эндотелиальных клетках и лиган-
дов селектинов на лейкоцитах (см. рис. 11.2). За-
270
ГЛАВА 17. ИММУНОДЕФИЦИТНЫЕ РАССТРОЙСТВА И НОВООБРАЗОВАНИЯ ЛИМФОИДНОЙ СИСТЕМЫ
тем под действием хемоаттрактантов клетка пре-
кращает перемещение (прокатывание). Такая клет-
ка прикрепляется более плотно, а затем начинает
миграцию через эндотелий. Для осуществления
последней стадии требуется взаимодействие ин-
тегринов на лейкоцитах со своими лигандами на
эндотелиальных клетках.
Недостаточность лейкоцитарной адгезии
(НЛА) — это группа расстройств, при которых
прерывается взаимодействие лейкоцитов с эндо-
телием сосудов (рис. 17.5, А). Выделяют НЛА I —
аутосомно-рецессивное заболевание, ген которо-
го картирован на хромосоме 21. У пациентов вы-
являют дефект в Р-субъединице интегриновых мо-
лекул, который препятствует их экспрессии. При
этом р-субъединица является общей для трех ин-
тегринов, экспрессируемых на гранулоцитах, мо-
ноцитах и лимфоцитах, — LFA-1 (CD1 la/CD18),
Mac-1 (CD1 lb/CD 18) и р 150,95 (CD1 lc/CD18) со-
ответственно. В результате этого нарушается ад-
гезия и миграция всех типов лейкоцитов. Паци-
енты с НЛА I страдают рецидивирующими бакте-
риальными инфекциями мягких тканей, при ко-
торых у них повышается количество лейкоцитов,
но не образуется гной или отсутствует эффектив-
ное заживление ран. Функции лимфоцитов так-
же нарушены из-за отсутствия экспрессии LFA-1.
Отличительной чертой новорожденных с НЛА I
является позднее отпадение остатка пуповины.
У пациентов с НЛА II наблюдается дефект се-
лектиновых лигандов, поэтому их клетки не мо-
гут прокатываться вдоль эндотелиальной поверх-
ности (первый шаг миграции) (см. рис. 17.5, А).
Дефект, определяющий развитие НЛА П, связан
с метаболизмом фукозы, что приводит к отсут-
ствию фукозилированных лигандов, с которыми
могли бы связываться селектины. Симптомы им-
мунодефицита при этом расстройстве менее вы-
ражены. Кроме них дефект метаболизма фукозы
приводит к другим порокам развития. Как и при
НЛА 1, характерно отсутствие или незначитель-
ное образование гноя; у таких детей не выражены
классические клинические признаки воспаления
при тяжелых инфекциях.
Синдром Чедиака — Хигаси
Синдром Чедиака —Хигаси является аутосомно-
рецессивным заболеванием, которое характеризу-
ется аномальными гигантскими гранулами и орга-
неллами в клетках (рис. 17.5, Б). В основном по-
ражаются лизосомы и меланосомы, что приводит
к дефектам пигментации и нарушениям функцио-
нирования нейтрофилов, NK-клеток и тром-
боцитов, а также неврологическим аномалиям.
У нейтрофилов снижена способность к внутри-
клеточному уничтожению организмов, что явля-
ется результатом как дефектной дегрануляции, так
и нарушения сплавления лизосом с фагосомами.
Со временем у пациентов формируются массив-
ные инфильтраты из лимфоцитов и макрофагов в
печени, селезенке и лимфатических узлах Пио-
генные микроорганизмы, такие как стрептокок-
ки и стафилококки, вызывают рецидивирующие,
иногда летальные инфекционные заболевания.
Прогноз неблагоприятный.
Хроническая грануломатозная болезнь
При хронической грануломатозной болезни (ХГБ)
нарушается последняя стадия уничтожения погло-
щенных организмов (см. рис. 17.5, Б). При этом
внутриклеточная персистенция организмов при-
водит к формированию гранулем. У нормальных
индивидуумов активированные нейтрофилы и
мононуклеарные фагоциты уничтожают микроор-
ганизмы посредством окислительного взрыва, при
котором потребляется кислород и выделяются
перекись водорода и свободные супероксидные
радикалы. Мутации в любой из субъединиц фер-
мента, катализирующего этот взрыв, — НАДФ-
оксидазы — могут привести к ХГБ. Наиболее
распространенная форма ХГБ развивается из-за
мутации в одной из субъединиц, связанных с мем-
браной, gp91phox, которая кодируется геном CYBB,
расположенным на хромосоме X. Таким образом,
у большинства пациентов отмечается Х-сцеплен-
ный рецессивный тип наследования. Другие субъ-
единицы НАДФ-оксидазы кодируются аутосом-
ными генами. У пациентов с ХГБ, вызванной му-
тациями в таких аутосомных субъединицах, от-
мечается аутосомно-рецессивный тип наследова-
ния. В основном у них имеются мутации в одной
из двух цитозольных субъединиц фермента, p47phox
или р67р11ОХ.
Симптомы заболевания появляются в первые
2 года жизни. У пациентов наблюдается повышен-
ная восприимчивость к инфицированию микро-
организмами, в обычных условиях обладающих
низкой вирулентностью, таким как Staphylococcus
aureus. Serratia marcescens и Aspergillus. Сопутству-
ющими аномалиями являются лимфаденопатия
(увеличение размеров лимфатических узлов) и
гепатоспленомегалия (увеличение размеров пече-
ни и селезенки), связанные с хроническими и
острыми инфекциями. Лечение состоит в агрес-
сивной иммунизации и терапии антибиотиками
широкого спектра действия, противогрибковыми
препаратами и интерфероном-у.
Кроме ХГБ к снижению способности уничто-
жать внутриклеточные организмы приводят рас-
стройства, при которых наблюдается снижение
или отсутствие активности ферментов, участву-
ющих в процессе фагоцитоза. К ним относятся
глюкоза-6-фосфатдегидрогеназа. миелоперокси-
даза и щелочная фосфатаза.
Недостаточность рецептора интерферона-у
Мутация в гене IFNyRI приводит к неспособно-
сти моноцитов отвечать на IFNy секрецией фак-
тора некроза опухоли a (TNFa). Пациенты с этой
СИНДРОМЫ ИММУННОГО ДЕФИЦИТА
271
мутацией избирательно восприимчивы к слабо
патогенным микобактериям, что подтверждает
значение IFNy в контроле над микобактериаль-
ными инфекциями. Эта избирательность также
свидетельствует, что другие активности IFNy у лиц
с этим расстройством компенсируются. Иммуни-
зация БЦЖ, распространенная в некоторых час-
тях света, может быть опасной для пациентов с
этим дефектом.
Недостаточность NK-клеток
О недостаточности натуральных киллеров у лю-
дей известно очень мало; было описано лишь не-
сколько случаев этого заболевания. Исследования
на животных позволяют предположить, что недо-
статочность NK-клеток нарушает отторжение ал-
лотрансплантатов и связана с повышенной вос-
приимчивостью к вирусным заболеваниям и уве-
личенной частотой метастазирования опухолей.
Дефекты NK-клеток наблюдаются при тяжелых
комбинированных иммунодефицитных расстрой-
ствах, при некоторых расстройствах функций Т-
клеток и фагоцитирующих клеток, а также при
Х-спепленном лимфопролиферативном синдроме.
Заболевания, вызванные нарушением
системы комплемента
Как описано в гл. 13, комплемент необходим для
опсонизации и уничтожения бактерий и повреж-
денных клеток, хемотаксиса и активации В-кле-
ток. Компоненты комплемента также участвуют
в уничтожении комплексов антиген —антитело,
предотвращая депонирование иммунных комплек-
сов и последующие заболевания. Недостаточность
комплемента может наследоваться как аутосом-
ный признак, при этом у гетерозиготных людей
концентрация определенного компонента комп-
лемента будет составлять половину от нормаль-
ной. Для большинства компонентов этого доста-
точно, чтобы предотвратить клинические прояв-
ления заболевания. Период полураспада активи-
рованных компонентов комплемента также обыч-
но строго контролируется ингибиторами, которые
разрушают продукты активации или диссоцииру-
ют комплексы
Недостаточность компонентов комплемента
ранней фазы активации
Компоненты комплемента ранней фазы актива-
ции особенно важны для образования опсонина
СЗЬ (рис. 17.6). У пациентов с дефицитами С1,
4 или 2 по классическому пути активации или соб-
ственно дефицитом СЗ отмечаются более частые
случаи инфицирования инкапсулированными
организмами (Streptococcuspneumoniae. Streptococcus
pyogenes, Haemophilus influenzae) и ревматические
заболевания из-за нарушенного клиренса иммун-
ных комплексов вследствие недостаточного обра-
зования СЗЬ. Наиболее заметным последствием
этого являются частые аутоиммунные заболева-
ния. Действительно, СКВ является одним из наи-
более распространенных проявлений дефицита
некоторых компонентов комплемента. У таких
пациентов СКВ отличается очень ранним нача-
лом заболевания и большей тяжестью по сравне-
нию с СКВ, не связанной с дефицитом компле-
мента. Кроме того, такая СКВ может развиваться
в отсутствие антител, часто обнаруживаемых в
других случаях (см. гл. 12). Недостаточность ман-
нозосвязывающего лектина, который фиксирует-
ся на поверхности микробов без участия антител
и запускает классический путь активации комп-
лемента, также приводит к повышенному риску
бактериальных инфекций и волчанкоподобным
симптомам. Поскольку все пути активации комп-
лемента — классический, лектиновый и альтер-
нативный — требуют активации СЗ, недостаточ-
ность самого СЗ связана с наиболее тяжелыми сим-
птомами, в частности осложненным течением ин-
фекционных заболеваний.
Недостаточность компонентов комплемента
поздней фазы активации
При недостаточности компонентов комплемента
поздней фазы активации (С5 —С9) нарушается
образование мембраноатакующего комплекса
(МАК). Этот комплекс является непосредствен-
ным разрушителем грамотрицательных бактерий,
в частности Neisseria meningitidis, и первой линией
защиты от них (см. рис. 17.6).
Нарушенный контроль за компонентами
комплемента
Наследственный ангионевротический отек. При
наследственном ангионевротическом отеке у па-
циентов отсутствует действующий ингибитор Cl-
эстеразы. Если этот ингибитор отсутствует, дей-
ствие С1 на С4, С2 и калл икре и новую систему не
контролируется, что приводит к образованию
больших количеств вазоактивных пептидов. Эти
пептиды вызывают повышение проницаемости
кровеносных сосудов. У пациентов отмечаются
локализованные отеки, которые могут угрожать
жизни, если развиваются в области гортани, пе-
рекрывая дыхательные пути. Лечение заключает-
ся в устранении провоцирующих факторов, к ко-
торым обычно относятся травмы, и проведении
инфузий ингибитора эстеразы С1.
Недостаточность белков, связанных с гликози-
лированным фосфатидилинозитолом. Семейство
белков, заякоренных ГФИ, экспрессируется на
мембранах эритроцитов, лимфоцитов, гранулоци-
тов, эндотелиальных клеток (клеток, выстилающих
кровеносные сосуды) и эпителиальных клеток. Эти
белки, к которым относятся фактор, ускоряющий
диссоциацию (ФУД, или CD55), и CD59, защища-
ют клетки от спонтанного лизиса комплементом
272
ГЛАВА 17. ИММУНОДЕФИЦИТНЫЕ РАССТРОЙСТВА И НОВООБРАЗОВАНИЯ ЛИМФОИДНОЙ СИСТЕМЫ
Альтернативный путь
активации комплемента
Классический путь
активации комплемента
СЗ
Поверхность
микроба
Полисахариды
Ранняя фаза
Поздняя фаза
Лектиновый
путь активации
комплемента
Иммунные
комплексы
Синдромы
недостаточности
комплемента
Инфекции
инкапсулированными
микроорганизмами
Активированный С1
СЗЬ
СЗЬВЬ=
Маннан-
связывающий
лектин
С4
Фактор D
СЗа
СЗ-конвертаза
альтернативного
пути
СЗ-конвертаза 9
классического -^4t>a2
пути
Ревматоидные
заболевания
(в частности СКВ)
СЗЬВЬЗЬ =
СЗЬ
С5-конвертаза
альтернативного
пути
СЗ-конвертаза
классического =С4Ь2аЗЬ
пути
Инфекции,
вызванные
представителями
рода Neisseria
С5
С5а
С5Ь
С6, С7, С8, С9
С5—9-мембрано-
атакующий
комплекс
• Рис. 17.6. На каскаде активации комплемента видно, что
при недостаточности компонентов комплемента ранней
фазы активации пациенты предрасположены к инфекци-
ям, вызванным инкапсулированными микроорганизмами,
и ревматоидным синдромам. Недостаточность компонен-
тов комплемента поздней фазы активации связана с ин-
фекциями, вызванными Neisseria
(см. рис. 13.4). Если ингибиторы отсутствуют на
поверхности клетки, гранулоциты, тромбоциты
и особенно эритроциты восприимчивы к спон-
танному лизису комплементом. Существует лишь
несколько семей с наследуемыми мутациями
ФУД, CD59 или всех белков ГФИ. У таких паци-
ентов отмечаются симптомы тяжелой анемии,
тромбозы и хронические инфекции.
Приобретенная форма этого заболевания, на-
зываемая пароксизмальной ночной гемоглобинури-
ей (ПНГ), встречается намного чаще. При ПНГ у
пациентов отсутствует фермент, необходимый для
продукции всех белков, заякоренных ГФИ. Это
происходит вследствие приобретенной соматиче-
ской мутации в ранней миелоидной клетке-пред-
шественнике. Поражаются три нелимфоидные
линии: гранулоциты, тромбоциты и эритроциты
У большинства пациентов стволовые клетки с этой
мутацией приобретают и дополнительные мута-
ции, а затем начинают доминировать над нормаль-
ными клетками в костном мозге и прекращают
созревание, что приводит к острому миелоидно-
му лейкозу. При хроническом течении ПНГ раз-
вивается внутрисосудистый гемолиз, особенно за-
метный по ночам в почках, где кислая окружа-
ющая среда запускает активацию комплемента по
альтернативному пути. Это клиническое прояв-
ление и отражается в названии заболевания.
Вторичные иммунодефицитные
заболевания
Вторичные иммунодефицитные заболевания яв-
ляются последствиями других заболеваний. По-
прежнему самой распространенной причиной
иммунодефицитных расстройств по всему миру
является неправильное питание (или его недоста-
точность). В развитых странах более часто встре-
чается ятрогенный иммунодефицит, т.е. вызван-
ный лекарственной терапией, в частности в ре-
зультате использования химиотерапевтических
агентов при лечении онкологических заболева-
ний или контролируемой иммуносупрессией в слу-
чаях пересадки органов или аутоиммунных забо-
леваний. Вторичные иммунодефициты также раз-
виваются при аутоиммунных заболеваниях (не как
следствие лечения) или после выздоровления от
тяжелых бактериальных инфекций. Злокачествен-
ные новообразования иммунной системы также
СИНДРОМ ПРИОБРЕТЕННОГО ИММУНОДЕФИЦИТА
273
часто подавляют нормальные (немалигнизирован-
ные) компоненты, что проявляется у таких паци-
ентов повышенной чувствительностью к инфек-
ционным заболеваниям.
• СИНДРОМ ПРИОБРЕТЕННОГО
ИММУНОДЕФИЦИТА
Общая характеристика
и эпидемиология
В 1981 г. были описаны несколько случаев ати-
пичной пневмонии, вызванной Pneumocystis саппШ
у гомосексуальных мужчин в Калифорнии. Затем
была выделена агрессивная форма саркомы Ка-
поши в аналогичной популяции г. Нью-Йорка.
С момента первого обнаружения случаев СПИДа
до настоящего времени более 20 млн чел. умерли
во всем мире и более 40 млн на сегодняшний день
инфицированы.
Синдром приобретенного иммунодефицита —
инфекция^ вызванная вирусом иммунодефицита
человека (ВИЧ). Это вирус передается через кровь
и другие жидкости организма. Кровь, сперма, ва-
гинальный секрет, грудное молоко и (в меньшей
степени) слюна инфицированного человека со-
держат свободные вирусы или клетки, содержа-
щие вирус. Таким образом, ВИЧ может переда-
ваться при сексуальных контактах, через общие
иглы, переливание крови или ее компонентов, че-
рез плацентарный барьер при прохождении через
родовые пути или при грудном вскармливании.
Хотя эта инфекция впервые была идентифи-
цирована у сексуально активных гомосексуальных
мужчин в крупных городах США, заболевание не
связано с сексуальными предпочтениями. По все-
му миру наиболее распространенный путь пере-
дачи связан с половыми контактами. В США,
несмотря на то что гомосексуальные мужчины и
наркоманы, употребляющие внутривенные пре-
параты, составляют большинство в группе инфи-
цированных, наибольший подъем уровня распро-
страненности СПИДа отмечается среди гетеросек-
суальных женщин и национальных меньшинств,
афроамериканцев и латиноамериканцев. Переда-
ча вируса при трансфузиях крови и ее компонен-
тов в США практически исключена благодаря
скринированию доноров, тестированию собран-
ных образцов крови и тепловой инактивации кон-
центратов факторов свертывания. Однако присут-
ствует опасный «период окна», при котором ин-
фекция в образцах крови не может быть обнару-
жена. Причины этого станут понятны далее. Пере-
дача инфекции от матери к ребенку — путь, с ко-
торым связаны более 80% случаев заболевания
детей — может быть значительно снижена при
противовирусной терапии матери, предотвраще-
нии родов через естественные пути и отмене груд-
ного вскармливания. Однако эти положительные
примеры служат лишь небольшим примечанием
к эпидемии, которая продолжает распространяться
по всему миру без признаков уменьшения, осо-
бенно в Африке и Юго-Восточной Азии.
Вирус иммунодефицита человека
Вирус иммунодефицита человека является упа-
кованным в оболочку ретровирусом человека из
семейства лентивирусов. Описано два штамма ВИЧ
(ВИЧ-1 и ВИЧ-2), причем последний преимуще-
ственно обнаруживается в Западной Африке. Бо-
лее вирулентным штаммом является ВИЧ-L Ви-
русная частичка содержит две идентичные одно-
цепочечные молекулы геномной РНК и три фер-
мента: интегразу, протеазу и обратную транскрип-
тазу (рис. 17.7). Все они упакованы капсидными
белками р24 и р7/9 и окружены матриксным бел-
• Рис. 17.7. Структура ВИЧ-1. Пока-
заны две идентичные цепочки РНК
(вирусный геном) и связанные с
ними ферменты, в том числе обрат-
ная транскриптаза, интеграза и про-
теаза, упакованные в виде конусо-
образного ядра, которое состоит из
капсидного белка р24, окруженно-
го белковым матриксом, составлен-
ным р17. Все это покрыто оболочкой
из фосфолипидной мембраны, полу-
ченной из клетки организма-хозяи-
на. Мембранные белки, кодируе-
мые вирусом (др41 и др120), встро-
ены в оболочку
Липидный бислой
gp41 Вирусные
оболочечные
gp 120 гликопротеины
Обратная транскриптаза
Протеаза
РНК
Интеграза
Матриксный белок pl7
Капсидный белок р24
ГЛАВА 17. ИММУНОДЕФИЦИТНЫЕ РАССТРОЙСТВА И НОВООБРАЗОВАНИЯ ЛИМФОИДНОЙ СИСТЕМЫ
274
ком р17. В составе вирусной оболочки, которая
образуется из мембраны клетки-хозяина, представ-
лены вирусные гликопротеины, в том числе gpl20
и gp41. принципиально важные для инфицирова-
ния. Белок gpl 20 нековалентно связан с gp41, ко-
торый является трансмембранным белком Белок
gpl20 имеет высокую аффинность к CD4. Все клет-
ки, экспрессирующие CD4, являются потенциаль-
ными мишенями вируса; у людей такими клетка-
ми являются макрофаги, моноциты и дендритные
клетки, а также СО4+-Т-клетки.
После связывания с CD4 gpl20 подвергается
конформационным изменениям и затем должен
связаться со второй молекулой, корецептором, на
поверхности клетки-мишени, чтобы ВИЧ мог
попасть внутрь клетки. Было показано, что неко-
торые хемокиновые рецепторы (см. гл. 11) могут
выступать в качестве корецепторов для ВИЧ. Конк-
ретный корецептор, который используется ви-
русом, зависит от варианта молекулы gpl20, экс-
прессируемой на его поверхности. Таким обра-
зом, вариации в gpl20 определяют качество, на-
зываемое тропностью к вирусу, которое диктует,
какая из СП4+-клеток-мишеней будет инфициро-
вана этой вирусной частичкой. Вирус иммуноде-
фицита человека, тропный к макрофагам, исполь-
зует хемокиновый рецептор CCR5 и не нуждает-
ся в высоком уровне экспрессии CD4 на клетке
организма. Этот рецептор присутствует на мак-
рофагах, дендритных клетках (и те, и другие экс-
прессируют небольшие количества CD4) и CD4+-
Т-клетках. Тропный к лимфоцитам ВИЧ исполь-
зует хемокиновый рецептор CXCR4, экспресси-
руемый на Т-клетках; для этого типа вируса не-
обходима высокая плотность CD4 на поверхно-
сти клетки. Сейчас вариант ВИЧ, использующий
рецептор CCR5, называется R5, а тот, который
использует CXCR4, — Х4; варианты, способные
связываться с обоими хемокиновыми корецепто-
рами, обозначаются как R5X4. Оба корецептора
являются G-связанными белками с семью транс-
мембранными доменами. Рецептор CCR5 обыч-
но связывается с хемокином RANTES, моноци-
тарным хемотактическим белком la (М1Р-1а) и
MIP-lp. Рецептор CXCR4 связывает фактор 1,
выделяемый стромальными клетками (SDF-1).
Предполагается, что CCR5 является главным
корецептором для развития первичной инфекции,
поскольку индивидуумы с мутациями в этом ре-
цепторе, похоже, являются частично защищенны-
ми. В случае, когда пациенты первоначально ин-
фицированы при половом контакте вариантом ви-
руса, тропным к макрофагам, инфекция может
развиваться в них и дендритных клетках лимфо-
идной ткани, ассоциированной со слизистыми
оболочками. Эти инфицированные клетки обес-
печивают резервуар для вируса, поскольку не по-
гибают и способны мигрировать по всему орга-
низму. Наличие антигена стимулирует вирусную
репликацию, в частности в макрофагах, а также
переключение вирусов в лимфотропную форму и
дальнейшее быстрое распространение в организ-
ме. Таким образом, тропность вируса, образовав-
шегося в инфицированном организме, меняется
со временем. Эта эволюция связана с мутациями
в гене gpl20, которые приводят к нарушениям
аминокислотных последовательностей.
После связывания gpl20 с CD4 и его корецеп-
тором gp41 проникает через клеточную мембра-
ну, что вызывает сплавление оболочки вируса и
клеточной мембраны, а в дальнейшем и вход ви-
руса в клетку. Внутри хозяйской клетки вирусная
РНК реплицируется в комплементарную ДНК-
копию (кДНК) с помощью вирусного фермента
обратной транскриптазы. Комплементарная ДНК
может оставаться в цитоплазме, а может прони-
кать в ядро, где интегрируется в геном клетки в
качестве провируса с помощью вирусного фер-
мента интегразы. Вирусная репликация продол-
жается на низком уровне иногда в течение не-
скольких лет, поэтому ВИЧ-инфекция остается в
относительно, но не истинно латентной фазе.
В геноме ВИЧ есть на каждом конце область
длинных терминальных повторов (long terminal
repeat — LTR) (рис. 17.8). Она необходима для
вирусной интеграции; кроме того, область LTR
содержит участки для прикрепления регулятор-
ных белков. Когда Т-клетка активируется антиге-
ном. запускается каскад реакций, приводящих к
активации транскрипционного фактора NF-kB.
Этот фактор связывается с участком промотора в
области LTR, активируя транскрипцию провиру-
са клеточной РНК-полимеразой.
В результате транскрипции провируса образу-
ются длинные транскрипты иРНК, которые под-
вергаются альтернативному сплайсингу для син-
теза различных белков. Первыми двумя синтези-
руемыми белками являются Tat и Rev. Белок Tat
входит в ядро, где действует в качестве фактора
транскрипции. Он связывается с областью LTR и
увеличивает частоту вирусной транскрипции. Бе-
лок Rev также действует в ядре, прикрепляясь к
элементу вирусного транскрипта иРНК, отвеча-
ющему на Rev. Связывание с Rev увеличивает
скорость транспортировки РНК в цитоплазму.
Когда иРНК транспортируется в цитоплазму бы-
стрее, сплайсинг в ядре происходит менее интен-
сивно, и из этих заготовок иРНК можно сделать
больше разных белков. В эту вторую волну синте-
за вирусных белков структурные компоненты ви-
русного ядра и оболочки вырабатываются в фор-
ме предшественников. В ходе третьей волны РНК,
не прошедшая сплайсинг, транспортируется пря-
мо в цитоплазму и служит в качестве геномной
РНК для новых вирусных частиц и для трансля-
ции gag и pol. Фрагмент gag кодирует белки р24,
р 17 и р7/р9. Фрагмент pol кодирует вирусную про-
теазу, обратную транскриптазу и интегразу. Про-
теаза расщепляет продукт гена env с образовани-
ем gpl20 и gp41.
Высвобождение вируса из СВ4+-Т-клеток час-
то приводит к лизису клетки. Макрофаги и денд-
СИНДРОМ ПРИОБРЕТЕННОГО ИММУНОДЕФИЦИТА
275
Участок связывания
для транскрипционных
факторов
Усиливает транспорт
РНК в цитоплазму
Усиливает |
отпочкование ।
вирусных частиц I
I
rev
LTR
Способствует
образованию
инфекционного
вируса
Трансактиватор
транскрипции
ВИЧ
I
Сердцевинные
• и матричные
I белки (р24, р17,
I р7/р9)
pol
vpr
I
I
t
Сайты
NF-кВ
Обратная
транскриптаза,
протеаза, интеграза
Слабый
активатор
транскрипции
Оболочечные Способствует
гликопротеины репликации
(gp120, gp41) вируса
• Рис. 17.8. Гены и белки ВИЧ-1. Геном ВИЧ-1, содержащий РНК, обрамлен областями LTR,
необходимыми для вирусной интеграции и регуляции вирусного генома. Некоторые вирус-
ные гены перекрываются, что приводит к разным рамкам считывания и позволяет вирусу ко-
дировать много белков при небольшом геноме Также показаны функции генных продуктов
ритные клетки обычно не уничтожаются ВИЧ,
а служат в качестве резервуара, перенося вирус в
разные части тела (лимфоидную ткань и ЦНС).
и выделяют небольшие количества вирусных час-
тиц без патологических последствий для клетки.
Дендритные клетки переносят вирус в основном
на своей поверхности, в то время как макрофаги
обеспечивают постоянный низкий уровень вирус-
ной репродукции. Стимуляция инфицированных
макрофагов и Т-клеток цитокинами или антиге-
ном приводит к усиленной вирусной репликации
и началу продуктивной фазы.
Клиническое течение
Клиническое течение СПИД можно разделить на
три фазы.
Острая фаза инфекции
В момент инфицирования ВИЧ многие люди не
имеют никаких симптомов инфекции, но у неко-
торых появляются симптомы, подобные гриппу, —
лихорадка, боль в горле и общая слабость, кото-
рые начинаются спустя 2 — 4 недели после инфи-
цирования и продолжаются 1 — 2 недели. В это
время наблюдаются виремия (наличие вируса в
периферической крови) и резкое снижение коли-
чества циркулирующих СВ4+-Т-клеток. Иммун-
ная система отвечает образованием цитотоксиче-
ских Т-лимфоцитов (ЦТЛ) и антител, специфич-
ных к вирусу. Цитотоксические Т-лимфоциты
частично ответственны за уменьшение количества
СБ4+-Т-клеток. так как они уничтожают клетки,
инфицированные вирусом. В этот момент у па-
циентов происходит сероконверсия, т.е. они на-
чинают вырабатывать определяемые количества
антител, специфичных к белкам ВИЧ. Затем ко-
личество СВ4+-Т-клеток в периферической кро-
ви частично восстанавливается. Инфицированные
макрофаги и дендритные клетки распространяют
вирус по лимфоидной ткани на весь организм.
Хроническая латентная фаза
Хотя иммунный ответ выглядит стандартным для
вирусной инфекции, он способствует скорее на-
коплению, а не удалению вируса. Неэффектив-
ность иммунного ответа можно объяснить край-
не высокой скоростью мутации вируса. Устанав-
ливается латентная фаза, которая может продол-
жаться вплоть до 15 лет. В течение этого относи-
тельно бессимптомного периода поддерживается
низкий уровень репликации вируса, что сопро-
вождается постепенным снижением количества
СБ4+-Т-клеток. У ВИЧ, таким образом, никогда
нет настоящей латентной фазы. В отличие от того,
что можно было бы ожидать, количество инфи-
цированных вирусом Т-клеток в периферической
крови крайне низкое. Преимущественной лока-
лизацией инфицированных клеток являются лим-
фатические узлы. Как уже описано ранее, резер-
вуаром инфекции служат макрофаги. Фоллику-
лярные дендритные клетки из зародышевых цен-
тров (см. гл. 7) являются не только резервуаром,
но также представляют захваченный вирус на сво-
ей поверхности. Это приводит к непрекраща-
ющейся презентации вируса Т- и В-клеткам, при-
водящей к интенсивной гиперплазии фолликуляр-
ных зародышевых центров и лимфоаденопатии
(увеличение лимфатических узлов), типичной для
этой фазы.
Т-клетки понемногу подвергаются лизису, ко-
торый в итоге завершается инволюцией лимфа-
тического узла. Эта смерть Т-клеток является, по-
видимому, результатом воздействия комбинации
ряда факторов. Во-первых, лизис вызывает про-
дукция вируса в самих клетках. Во-вторых, ин-
фицированные клетки, вероятно, более подвер-
276
ГЛАВА 17. ИММУНОДЕФИЦИТНЫЕ РАССТРОЙСТВА И НОВООБРАЗОВАНИЯ ЛИМФОИДНОЙ СИСТЕМЫ
• Таблица 17.3. Заболевания, ассоциированные
со СПИДом (по определению CDC)*
Инфекции — часто диссеминированные
Грибковые
Кандидоз
Криптококкоз
Гистоплазмоз
Кокцидиомикоз
Паразитарные
Токсоплазмоз
Пневмоцистная инфекция
Криптоспоридиоз
Изоспориаз
Бактериальные
Микобактериоз, включая инфекции ати-
пичными сальмонеллами
Вирусные
Цитомегаловирус
Вирус простого герпеса
Прогрессирующая мультифокальная лейко-
энцефалопатия
Новообразования
Саркомы
Саркома Капоши
Лимфомы
Лимфома Беркитта
Диффузная крупноклеточная В-лимфома
Эффузионная лимфома
Первичная лимфома ЦНС
Рак
Инвазивный рак шейки матки
Общие состояния
Ассоциированные с ВИЧ энцефалопатия
и деменция
Синдром эндогенной интоксикации
* Некоторые заболевания обсуждаются в тексте.
жены апоптозу. В-третьих, ЦТЛ уничтожают
некоторое количество инфицированных клеток.
И, наконец, неинфицированные СБ4+-Т-клетки
могут быть уничтожены неспецифически, путем,
сходным с антителозависимым клеточно-опосре-
дованным цитолизом, который инициируется при
связывании комплексов, сформированных рас-
творимыми gpl20 и антителами к gpl20, с по-
верхностными молекулами CD4 этих лимфо-
цитов.
В течение этой фазы у пациентов традицион-
но определяют количество СБ4+-Т-клеток перифе-
рической крови и соотношение CD41CD8. У здо-
ровых людей соотношение CD4: CD8 обычно око-
ло 2, но в эту фазу ВИЧ-инфекции оно становит-
ся обратным и количество CDS-клеток превосхо-
дит количество СЭ4-клеток. Обратное соотноше-
ние CD4: CD8 клеток можно наблюдать и при дру-
гих вирусных инфекциях часто из-за увеличения
количества СБ8+-Т-клеток. Однако при ВИЧ,
напротив, снижается количество СО4+-Т-клеток.
По мере того как количество Т-клеток прогрес-
сивно снижается и достигает наиболее низких
значений, у пациента появляются симптомы забо-
левания и развивается финальная фаза СПИДа.
Критическая фаза
Первоначально СПИД был выявлен по клиниче-
ской картине необычных инфекций и злокаче-
ственных новообразований, которые и считаются
отличительными признаками его выраженной кли-
нической картины. Центры профилактики и ле-
чения СПИДа (Centres for Disease Control and
Prevention — CDC) определили заболевания, ко-
торые, как сейчас общепризнанно, ассоциирова-
ны со СПИДом (табл. 17.3). Их разделяют на три
категории: необычные злокачественные новообра-
зования, оппортунистические инфекции и невро-
логические синдромы, отражающие первичное дей-
ствие ВИЧ на иммунную систему и ЦНС.
Предполагается, что для начала этой симпто-
матической или критической фазы необходимо
действие нескольких однонаправленных факторов.
Постепенное снижение количества СО4+-Т-кле-
ток в итоге приводит к иммунодефицитному со-
стоянию, делая человека восприимчивым к оп-
портунистическим инфекциям, так же как у па-
циентов с первичными иммунодефицитами или
получающих иммуносупрессивную терапию после
трансплантации. Антигенная активация Т-кле-
тоК' инфицированных вирусом, приводит к сти-
муляции транскрипции вируса и образованию
его новых поколений. Это вызывает ускорен-
ную смерть Т-клеток и обостряет иммунодефи-
цитное состояние. Быстрая вирусная реплика-
ция также увеличивает скорость мутаций виру-
са, что позволяет возбудителю избегать даже того
иммунного контроля, который еще может со-
храняться.
Типы инфекций и новообразований у челове-
ка в периоде клинической манифестации СПИДа
могут отражать путь передачи ВИЧ этому паци-
енту: половым путем или при внутривенном при-
еме наркотиков. Это предположение можно сде-
лать, исходя из различий между инфекциями и
новообразованиями, которые развиваются у па-
циентов со СПИДом и не наблюдаются у лиц с
иммуносупрессией, вызванной другими причина-
ми, а также исходя из различий между больными
СПИДом, заразившимися разными путями. Осо-
бенно такие различия характерны для злокаче-
ственных новообразований, связанных с вирусны-
ми инфекциями.
Некоторые пациенты, инфицированные ВИЧ,
могут заражаться и другими заболеваниями, пе-
редаваемыми половым путем. Вирус папилломы
человека связан с развитием рака шейки матки у
женщин. Контакт с этим вирусом в сочетании с
иммунодефицитным состоянием пациентки мо-
жет значительно повысить заболеваемость инва-
СИНДРОМ ПРИОБРЕТЕННОГО ИММУНОДЕФИЦИТА
зивным раком шейки матки у ВИЧ-положитель-
ных женщин. Сегодня инвазивный рак шейки
матки включен в список злокачественных ново-
образований, связанных со СПИДом.
Агрессивные формы саркомы Капоши. в прин-
ципе, уникальны для пациентов со СПИДом, осо-
бенно для гомосексуальных мужчин, у которых
она может развиваться на ранних стадиях заболе-
вания. Саркома Капоши — это патологическое
увеличение количества малых кровеносных сосу-
дов, обычно развивающееся как медленно расту-
щая опухоль на коже нижних конечностей у по-
жилых людей. При этой саркоме в опухолях был
обнаружен вирус герпеса человека 8 типа (HHV-8)
у пациентов со СПИДом Является ли это разра-
стание сосудов ответом на вирус или сам вирус
является онкогенным, пока неизвестно. Вирус гер-
песа также связан с необычной формой агрессив-
ной лимфомы, наблюдаемой у пациентов со
СПИДом, — первичной эффузионной лимфомой.
Это злокачественное новообразование более
распространено у гомосексуальных мужчин, стра-
дающих СПИДом; у некоторых одновременно мо-
гут развиваться лимфома и саркома Капоши.
Агрессивные В-клеточные лимфомы, ассоции-
рованные в основном с вирусом Эпштейна—Барр,
наблюдаются с такой же частотой, как у пациен-
тов, получающих иммуносупрессивную терапию
после трансплантации. Обычно развиваются лим-
фома Беркитта или диффузная крупноклеточ-
ная В-лимфома (см. далее), часто располага-
ющаяся вне лимфатических узлов (экстранодаль-
но). У больных СПИДом лимфома часто возни-
кает в цнс.
Инфекционные заболевания, ассоциированные
со СПИДом, характеризуют неспособность замет-
но угнетенного клеточно-опосредованного звена
иммунной системы пациента сдерживать микро-
организмы, которые в обычных условиях не яв-
ляются патогенными (так называемые оппорту-
нистические инфекции). Как и у любого другого
пациента с преимущественно Т-клеточным им-
мунодефицитом, основным инфекционным ослож-
нением является пневмония, вызванная Pneumo-
cystis carinii. Также часто наблюдается кандидоз.
Образование гранулем — функция, зависимая от
Т-клеток — неэффективна у таких пациентов, что
приводит к неконтролируемым микобактериаль-
ным инфекциям. Также угрожающую жизни ин-
фекцию могут вызывать Mycobacterium avium, ко-
торые в норме не являются возбудителями забо-
леваний у человека. Среди наиболее распростра-
ненных организмов, инфицирующих ЖКТ и вы-
зывающих тяжелые диареи, — Mycobacterium
avium. Cryptosporidia и цитомегаловирус. Централь-
ная нервная система воприимчива к инфициро-
ванию криптококками, токсоплазмами и цито-
мегаловирусом.
Множественные инфекции постоянно вызы-
вают некроз (смерть) клеток — основную особен-
ность СПИДа. Возбудители и клеточный детрит
277
поддерживают хроническую антигенную стиму-
ляцию истощенной иммунной системы. В-клетки
имеют признаки ответа на хроническую стимуля-
цию: у пациентов находят поликлональную ги-
пергаммаглобулинемию (повышенные уровни
сывороточных иммуноглобулинов), циркулиру-
ющие иммунные комплексы и заметное увеличе-
ние образования плазматических клеток. Несмотря
на такую активность В-клеток, пациенты не спо-
собны развить достаточный гуморальный иммун-
ный ответ на недавно встреченные антигены, ве-
роятно, вследствие Т-клеточного дефекта; хотя они
также не способны на адекватный Т-независимый
ответ на инкапсулированные микроорганизмы.
Кроме того, В-клетки, инфицированные вирусом
Эпштейна—Барр, который в обычных условиях
уничтожается за счет Т-клеточного ответа, стано-
вятся восприимчивыми к дополнительным транс-
формирующим факторам, вызывающим В-клеточ-
ные злокачественные новообразования, упоминав-
шиеся ранее.
Клетки ЦНС инфицируются ВИЧ, вероятно,
при транспортировке вируса макрофагами. Вирус
инфицирует микроглию (клетки, образующиеся
в костном мозге и принадлежащие той же линии,
что и макрофаги), олигодендроциты и астроци-
ты. В связи с этим может начаться процесс, при-
водящий к СПИД-ассоциированной деменции и
прогрессирующей энцефалопатии, что очень час-
то фиксировалось в медицинских документах.
В целом почти у 50 % пациентов, больных СПИДом,
отмечаются симптомы со стороны ЦНС и более
чем у 70 % обнаруживаются изменения в ЦНС при
вскрытии.
Также больные СПИДом страдают от кахек-
сии. или синдрома эндогенной интоксикации.
Этот синдром протекает значительно тяжелее, чем
при других заболеваниях, связанных с потерей
массы тела и слабостью. Предполагают, что ВИЧ
переключает цитокиновый профиль макрофагов,
повышая продукцию TNF. что приводит к разви-
тию кахексии.
Профилактика, контроль, диагностика
и терапия ВИЧ-инфекции
Наилучших профилактики и контроля ВИЧ-ин-
фекции можно достичь, предотвращая незащи-
щенные контакты с кровью и другими биологи-
ческими жидкостями от инфицированных инди-
видуумов. Знание о заболевании и общая осве-
домленность о том, чего нужно избегать и что без-
опасно (повседневный контакт), необходимы для
контроля над распространением ВИЧ и предотв-
ращения возможной паники.
Начиная с 1985 г., в США все доноры крови
проверяются на наличие антител к ВИЧ. Посколь-
ку развитие антительного ответа после инфици-
рования ВИЧ может занимать 5 недель, при скри-
нинговом методе остается соответствующий вре-
278
ГЛАВА 17. ИММУНОДЕФИЦИТНЫЕ РАССТРОЙСТВА И НОВООБРАЗОВАНИЯ ЛИМФОИДНОЙ СИСТЕМЫ
менной интервал, в течение которого недавно ин-
фицированные люди могут быть не выявлены.
Доноров крови опрашивают, им задают прямые
вопросы в устной и письменной форме о том,
связано ли их поведение с высоким риском ин-
фицирования. Метод определения вирусной РНК,
в котором с помощью полимеразной цепной ре-
акции (ПЦР) проходит ее амплификация, очень
чувствителен. В настоящее время его активно ис-
пользуют. Поскольку иммунному ответу предше-
ствует виремия, развивающаяся сразу после ин-
фицирования, то определение вирусной РНК мо-
жет уменьшить до 2 недель время, когда заболе-
вание не определяется. Однако некоторое «окно»
все еще остается.
Беременным женщинам, положительным по
ВИЧ, назначается противовирусная терапия для
снижения вирусной нагрузки и, таким образом,
уменьшения риска трансплацентарного проник-
новения вируса. Кесарево сечение проводят для
исключения инфицирования при прохождении
через родовой канал. В конечном итоге предот-
вращается инфицирование через грудное моло-
ко. Людям, которые случайно подверглись воз-
действию инфицированными предметами, для
предотвращения развития инфекции назначает-
ся терапия настолько быстро, насколько это воз-
можно.
Диагностика ВИЧ-инфекции, как правило,
осуществляется путем определения антител к ви-
русному белку р24 с помощью иммунофермент-
ного анализа (ELISA) и подтверждается методом
иммуноблоттинга (Вестерн блот). Наблюдение за
больными связано с определением абсолютного
числа СО4+-Т-клеток в периферической крови.
Корреляции показали, что оппортунистические
инфекции в основном не развиваются, если со-
держание CD4+ превышает 500 клеток в 1 мкл.
Полная клиническая картина СПИДа обычно раз-
ворачивается, когда содержание CD4+ падает ниже
200 клеток в 1 мкл.
Терапия проводится азидотимидином (АЗТ),
также называемым зидовудином. Этот нуклеозид-
ный ингибитор обратной транскриптазы стал пер-
вым многообещающим препаратом, использу-
ющимся при ВИЧ-инфекции. Второй класс ис-
пользуемых препаратов — это ингибиторы проте-
аз; ненуклеозидные ингибиторы обратной транс-
криптазы являются третьим классом терапевти-
ческих агентов. Лекарственная устойчивость к еди-
ничным препаратам развивается быстро, посколь-
ку ВИЧ способен к необычно высокой частоте
спонтанных мутаций в течение инфекционного
цикла в одном организме. Это происходит в ре-
зультате недостаточной точности обратной транс-
криптазы и РНК-полимеразы.
Индивидуумы, положительные по ВИЧ, без
клинических симптомов в настоящее время полу-
чают тройную антивирусную терапию — высоко-
активную антиретровирусную терапию (ВААРТ).
Она сочетает три препарата: по меньшей мере,
два из класса ингибиторов, действующих против
обратной транскриптазы ВИЧ, и ингибитор про-
теаз. Хочется верить, что тройная терапия замед-
лит появление мутантных штаммов. Эта терапия
предотвращает инфицирование новых клеток,
однако ранее инфицированные клетки остаются
в организме и постепенно подвергаются лизису.
После начала терапии падение вирусного титра
происходит быстро и существенно (определяет-
ся как вирусная нагрузка с помощью количе-
ственного определения вирусной РНК в ПЦР).
Однако небольшой исходный титр вирусов по-
чти всегда остается. Как и ожидалось, прекра-
щение терапии в течение длительного периода
приводит к восстановлению вирусной нагрузки.
К сожалению, мутации позволяют вирусу усколь-
знуть из-под контроля этих препаратов, поэтому
крайне необходимо создать широкий ассортимент
лекарственных средств для лечения заболевания.
Эта терапия не лишена побочных эффектов, осо-
бенно угнетения гемопоэтических клеток. Необ-
ходимо больше времени, чтобы показать, на-
сколько успешны будут эти терапевтические под-
ходы.
Увеличение продолжительности и качества
жизни были первыми достижениями агрессивно-
го, даже профилактического лечения инфекций,
особенно пневмонии, вызванной Pneumocystis
carnii. Инфекция все еще остается главной непо-
средственной причиной смерти у пациентов со
СПИДом.
Многие инфекционные заболевания контроли-
руются с помощью вакцин — наиболее эффек-
тивного способа предотвращения распространения
инфекции за счет индукции длительно существу-
ющего иммунного ответа, развившегося до воз-
действия инфекционных возбудителей (см. гл. 20).
Однако создание вакцины для ВИЧ представляет
собой серьезную проблему. Во-первых, еще не-
известно, какую ветвь иммунного ответа — с про-
дукцией антител или цитотоксических лимфоци-
тов — необходимо стимулировать для поддержа-
ния реакций по уничтожению вируса. Вирус не-
возможно удалить из организма ранее инфици-
рованных лиц ни с помощью антительного отве-
та, ни с участием цитотоксических Т-клеточных
реакций Во-вторых, серьезными проблемами,
которые необходимо преодолеть, являются спо-
собность вируса «прятаться» в резервуарных клет-
ках и высокая частота мутаций. Кроме того, мо-
дели на животных, которые широко используют-
ся для изучения других инфекционных заболева-
ний, в случае ВИЧ можно применять ограничен-
но. Наилучшей моделью является обезьяна, в орга-
низме которой после инфицирования вирусом
иммунодефицита обезьян (SIV) развивается забо-
левание, похожее на СПИД. Тестирование вак-
цин на людях также связано с этическими про-
блемами. Понимание молекулярной биологии и
структуры всех компонентов ВИЧ является осно-
вой для создания безопасных вакцин.
НОВООБРАЗОВАНИЯ ЛИМФОИДНОЙ СИСТЕМЫ
279
• НОВООБРАЗОВАНИЯ
ЛИМФОИДНОЙ СИСТЕМЫ
Общей темой данной главы является мысль о том,
что нарушение регуляции иммунной системы
может приводить к внезапному появлению ново-
образований, особенно лимфоидных клеток. Это
происходит у пациентов с первичными иммуно-
дефицитными заболеваниями, СПИДом и имму-
носупрессией после трансплантации органов (см.
также гл. 19). При этих состояниях особенно час-
то развиваются агрессивные В-клеточные лимфо-
мы, часто ассоциированные с вирусом Эпштей-
на-Барр. В этом подразделе сначала изложены
общие черты лимфоидных опухолей, а затем рас-
сказано о специфических свойствах их наиболее
важных типов.
Лимфоидный лейкоз и лимфома были изна-
чально отнесены к разным нозологиям на осно-
вании клеточной морфологии и клинических дан-
ных. Определение «лейкоз» подразумевает, что
опухолевые клетки встречаются преимуществен-
но в периферической крови и/или в костном моз-
ге. Лимфома представляет собой твердые массы в
лимфатических узлах, селезенке, тимусе или не-
лимфоидных органах. Иногда одни и те же типы
опухолевых клеток могут встречаться во всех ука-
занных местах {лейкоз/лимфома).
В 1996 г. Всемирная организация здравоохра-
нения (ВОЗ) рекомендовала использовать клас-
сификацию опухолей, основанную на морфоло-
гии исходной клетки: В-клетки в противопостав-
ление T/NK (Т-клетки/натуральные киллеры),
и степени дифференцировки: незрелые (клетки-
предшественники) в противоположность зрелым
(периферическим) (табл. 17.4). Считается, что
опухоли вырастают из трансформированных лим-
фоидных клеток, которые останавливаются в своем
развитии. Они имеют такие же поверхностные
маркеры и многие другие свойства, как и соот-
ветствующие нормальные клетки на этой стадии
развития. Опухолевые клетки, однако, могут не
продолжать созревание и накапливаться в боль-
шом количестве; все они происходят от единого
клона (т.е. они моноклональны). Они также бу-
дут занимать одни и те же участки и мигриро-
вать теми же путям развития, что и их нормаль-
ные двойники, а именно костный мозг для незре-
лых В-клеток, тимус для незрелых Т-лимфоцитов
и т.д.
Анализ ДНК, извлеченной из В- и Т-клеточ-
ных опухолей (Саузерн блот), выявляет одинако-
вый участок связывания и в гене иммуноглобули-
нов, и гене Т-клеточного рецептора соответствен-
но. Такие данные свидетельствуют, что все опу-
холевые клетки имеют одинаковую реаранжиров-
ку этих генов, что и позволяет судить о монокло-
нальности такого лимфоидного роста. Для опре-
деления малой популяции моноклональных кле-
ток перед проведением анализа по методу Сау-
• Таблица 17.4. Классификация лимфоидных
новообразований (ВОЗ)*
В-клеточные новообразования
Лимфобластный лейкоз/лимфома из В-клеток-
предшественников
Зрелые В-клеточные новообразования
Хронический лимфоцитарный лейкоз,
лимфома из малых лимфоцитов, пролимфо-
цитарный лейкоз
Фолликулярная лимфома
Лимфома из клеток мантийной зоны
Лимфома из клеток маргинальной (краевой)
зоны типа MALT
Лимфома из клеток маргинальной зоны
лимфатического узла
Лимфома маргинальной зоны селезенки
Волосато-клеточной лейкоз
Диффузная крупноклеточная лимфома из
В-клеток (включая медиастенальную, пер-
вично эффузионную, внутрисосудистую)
Лимфома Беркитта
Плазмоцитома
Плазмоклеточная миелома
Лимфоплазмоцитарная лимфома
В-клеточная пролиферация с неясной степенью
злокачествен ности
Лимфоматоидный гранулематоз
Посттрансплантационные лимфопролифератив-
ные заболевания
T/NK-клеточные новообразования
Лимфобластный лейкоз/лимфома из клеток-
предшественников Т-лимфоцитов
Зрелые T/NK-клеточные новообразования
(избранные)
Т-клеточный лейкоз из больших гранулярных
клеток
NK-клеточный лейкоз
Периферическая Т-клеточная лимфома
(неспецифическая)
Грибовидный микоз
Синдром Сезари
Первичная кожная анапластическая крупно-
клеточная лимфома
Системная анапластическая крупноклеточная
лимфома
Экстранодальная (внеузловая) NK/T-клеточ-
ная лимфома, назальный тип
Кишечная Т-клеточная лимфома
Гепатолиенальная уо-Т-клеточная лимфома
Т-клеточный лейкоз/лимфома взрослых
Лимфома Ходжкина (лимфогрануломатоз)
Узловая (нодулярная) преимущественно лимфо-
цитарная лимфома Ходжкина
Классическая лимфома Ходжкина
Узловой (нодулярный) склероз
Смешанно-клеточная
Классическая, богатая лимфоцитами
Со сниженным количеством лимфоцитов
* Некоторые заболевания обсуждаются в тексте
280
ГЛАВА 17. ИММУНОДЕФИЦИТНЫЕ РАССТРОЙСТВА И НОВООБРАЗОВАНИЯ ЛИМФОИДНОЙ СИСТЕМЫ
Маркеры CD
Костный мозг
Стволовая Про-В-клетка Пре-В-клетка
клетка
Незрелая
В-клетка
Периферия
Зрелая
В-клетка
Плазматическая
клетка
CD34-----------1
CD 10----------------1
CD 19----------------1-----
CD20
Ферменты TdT----------------1
Экспрессия lg
Цитоплазматические Поверхностный
р-цепи IgM
Поверхностный
lg
Цитоплазмати-
ческий 1g
Злокачественные новообразования В-ОЛЛ В-ОЛЛ
Периферические
В-клеточные
лимфомы
Плазмоклеточная
миелома
• Рис. 17.9. Соотношение стадий развития В-клеток с В-клеточными злокачественными опухолями
зерн блот может быть использована ПЦР. Для не-
которых лимфоидных новообразований были
определены уникальные молекулярные аномалии,
которые могут способствовать трансформации
этих клеток. Эти молекулярные изменения также
внесены в схему классификации. Поскольку клас-
сификация ВОЗ основывается в большей степени
на природе клеток, чем на клинических проявле-
ниях, лейкозы и лимфомы не различают, если они
представлены одинаковыми типами опухолевых
клеток. Классификация ВОЗ имеет большое прак-
тическое значение, поскольку терапия лейкозов
и лимфом часто одна и та же.
В-клеточные новообразования
Лимфобластный лейкоз/лимфома
из В-клеток-предшественников
В-клеточный острый лимфобластный лейкоз/лим-
фома (В-ОЛЛ) затрагивает про- и пре-В-клетки
или все незрелые стадии развития В-клеток, что
демонстрируется экспрессией поверхностных CD-
маркеров и стадией реаранжировки гена 1g в каж-
дом индивидуальном случае лейкоза (рис. 17.9).
Опухолевые клетки могут экспрессировать мар-
керы бластов или маркер стволовых клеток CD34
(особенно про-В-клетки), а также «ранние» мар-
керы В-лимфоцитов: CD 10 и CD 19. Так же как и
нормальные про-В- или пре-пре-В- и пре-В-клет-
ки, соответствующие клетки ОЛЛ экспрессируют
терминальную дезоксинуклеотидилтрансферазу
(TdT) в ядрах. Экспрессия этого фермента, в нор-
ме необходимого для реаранжировки генов 1g,
отражает тот факт, что эти клетки В-ОЛЛ нахо-
дятся в процессе генной реаранжировки. Это зна-
чит, что они еще не экспрессируют полную моле-
кулу 1g на своей поверхности и имеют только
цитоплазматические ц-цепи, что соответствует
стадии пре-В-клеток. При лечении детей с этим
типом лейкоза наиболее эффективна химиотера-
пия.
Существует также вариант агрессивного не-
зрелого В-ОЛЛ, который является лейкозным
двойником лимфомы Беркитта, при котором име-
ются сходные характеристики транслокации ге-
нов (см. далее). Эти клетки похожи на незрелые
В-клетки, только что вышедшие на периферию
из костного мозга. Они экспрессируют CD20, обла-
дают «выключенной» TdT, их ген 1g полностью
реаранжирован, а на клеточной поверхности на-
ходятся IgM.
Лимфома/лейкоз Беркитта
Лимфома Беркитта может проявляться и как лей-
коз, и как лимфома. Она характеризуется транс-
локацией онкогена с-тус в локус гена Н-цепи 1g
или одного из двух генов L-цепей — t(8; 14),
t(8; 22) или t(2; 8) (рис. 17.10). Белок с-длусв нор-
ме вовлекается в активацию генов для клеточной
пролиферации, когда покоящаяся клетка получа-
ет сигнал к делению. Транслокация в гены 1g при-
водит к увеличению экспрессии с-тус и актива-
ции клеточной пролиферации. Возможно, анти-
генная стимуляция В-клеток инициирует повы-
шение экспрессии с-тус под контролем гена 1g.
В экваториальной Африке эта лимфома явля-
ется эндемичной и связана с инфицированием
В-клеток вирусом Эпштейна—Барр. Лимфома
Беркитта — это одна из опухолей, часто развива-
ющихся у пациентов с иммуносупрессией (при
СПИДе и медикаментозной иммуносупрессии).
В клетках лимфомы Беркитта иногда обнаружи-
вается геном вируса Эпштейна — Барр. Другая опу-
холь, диффузная крупноклеточная В-лимфома,
обсуждается далее в этой главе.
НОВООБРАЗОВАНИЯ ЛИМФОИДНОЙ СИСТЕМЫ
281
• Рис. 17.10. Некоторые В-клеточные новообразования,
связанные с транслокацией генов в хромосомный локус,
кодирующий ген Н-цепи Ig на хромосоме 14
Хромосома L8
bcl-2
Фолликулярная лимфома
Хромосома 8
Хромосома 11
с-тус
Хромосома 14
Ьс1-1
IgH
Лимфома Беркитта
Лимфома из клеток мантийной зоны
Фолликулярная лимфома
Фолликулярная лимфома представляет собой
трансформированные В-клетки, в норме обнару-
живаемые в фолликулах лимфатических узлов
(рис. 17.11). Как рассказывалось в гл 7, В-клетки
стимулируются антигеном в фолликуле, образуя
зародышевый центр. Они могут отвечать на эту
стимуляцию пролиферацией, переключением изо-
типов иммуноглобулинов и дифференцировкой в
плазматические клетки (см. гл. 7). Если их анти-
тела плохо соответствуют этому антигену или
имеют к нему низкую аффинность, то клетки под-
вергаются апоптозу, или программируемой кле-
точной гибели. При фолликулярных лимфомах ген
bcl-2, который продуцирует белок, препятству-
ющий апоптозу, транслоцируется в ген Н-цепи Ig
t(14; 18) (см. рис. 17.10). Это приводит к продол-
жительной экспрессии белка bcl-2, предотвраща-
ющего гибель клеток. Фактически, такие В-кле-
точные новообразования имеют только низкий
уровень пролиферации, заболевание отличается
длительным хроническим течением. Их фенотип
(поверхностные CD-маркеры) соответствует фе-
нотипу у нормальных В-клеток фолликулярного
центра: CD19+, CD20+, CD10+ и поверхностные
иммуноглобулины.
Лимфома из клеток мантийной зоны
В норме зародышевый центр окружен венцом ма-
лых покоящихся В-клеток, которые не ответили
на антиген (см. рис. 17.11). Новообразования этих
клеток мантийной зоны обладают таким же В-
клеточным фенотипом, как и их нормальные
двойники, CD19+, CD20+. CD5+, slgM. При мно-
Участки:
Т-клеточных лимфом (ХЛЛ/ЛМЛ)
лимфом из клеток мантийной зоны
фолликулярных лимфом
• Рис. 17.11. Срез нормального лимфатического узла с указанием участков, вовлекае-
мых в Т- и В-клеточные лимфомы; ХЛЛ/ЛМЛ, лимфома из клеток мантийной зоны
и фоликуллярная лимфома происходят из В-клеток
282
ГЛАВА 17. ИММУНОДЕФИЦИТНЫЕ РАССТРОЙСТВА И НОВООБРАЗОВАНИЯ ЛИМФОИДНОЙ СИСТЕМЫ
гих лимфомах из мантийных клеток происходит
транслокация гена bcl-1 в область гена Н-цепи Ig —
t(l 1; 14), приводящая к избыточной экспрессии
белка циклина D1 (см. рис. 17.10). Циклин D1 в
норме отвечает за стимуляцию прогрессии кле-
точного цикла от фазы Gj к фазе S, приводящей к
делению клетки. Эта лимфома обладает более вы-
сокой пролиферативной активностью и более аг-
рессивным течением, чем фолликулярная.
Лимфома из клеток краевой зоны
Лимфомы из клеток краевой зоны наиболее час-
то встречаются в лимфоидной ткани, ассоцииро-
ванной со слизистой оболочкой (MALT), и, что
интересно, могут быть связаны с хронической
антигенной стимуляцией или аутоиммунным за-
болеванием этого органа. Например, хроническая
инфекция Helicobacter pilory желудка может при-
вести к развитию лимфомы желудка, которую,
таким образом, можно предотвратить терапией
антибиотиками. Сходным образом у пациентов с
аутоиммунным тиреоидитом (тиреоидит Хашимо-
то) и аутоиммунным заболеванием слюнных же-
лез (синдром Шегрена) существует высокий риск
развития В-клеточной лимфомы в пораженном
органе.
Взаимосвязь между этими аутоиммунными за-
болеваниями или инфекцией и лимфомой позво-
ляет предложить две интересные и не противоре-
чащие друг другу гипотезы. Во-первых, хрониче-
ская антигенная стимуляция обеспечивает благо-
приятную почву для развития В-клеточной лим-
фомы. В-клетки, в которых гены иммуноглобу-
линов продолжают подвергаться соматическим
мутациям, могут накапливать трансформирующие
мутации при продолжительной стимуляции. Во-
вторых, дефект в регуляции В-лимфоцитов ввиду
то ли внутренних причин, то ли недостаточного
подавления их активности Т-лимфоцитами при-
водит как к аутоиммунному заболеванию, так и,
возможно, к лимфоме.
Как рассказано ранее в этой главе, опухолевые
клетки иммунной системы мигрируют по тем же
путям, что и их нормальные двойники. Лимфома
краевой зоны долгое время остается локализован-
ной, а затем повторяет движение нормальных кле-
ток MALT, перемещаясь в другие участки MALT.
Хронический лимфоцитарный
лейкоз/лимфома из малых лимфоцитов
Считается, что хронический лимфоцитарный лей-
коз (ХЛЛ) / лимфома из малых лимфоцитов (ЛМЛ)
является опухолевым перерождением субпопуля-
ции В-лимфоцитов, известных как В-1-клетки (см.
гл. 7). У некоторых пациентов ее первым клини-
ческим проявлением является лейкоз (с первич-
ным вовлечением крови и костного мозга), тогда
как у других больных сначала вовлекаются лим-
фатические узлы (см. рис. 17.11). Так же как и
нормальные В-1-клетки, клетки ХЛЛ/ЛМЛ экс-
прессируют маркеры зрелых В-клеток CD19 и
CD20, а также CD5 и поверхностный IgM.
Хронический В-клеточный лейкоз — это наи-
более распространенный лейкоз в Северной Аме-
рике и Западной Европе. Особенно часто он
встречается у людей старших возрастных групп.
Такие больные крайне чувствительны к инфек-
ции, что наводит на мысль о том, что их неопу-
холевые клетки функционируют недостаточно хо-
рошо. Характерно наличие аутоантител, особен-
но против эритроцитов, приводящих к развитию
гемолитической анемии. Антитела могут синте-
зироваться опухолевым клоном или, что бывает
чаще, неизмененными В-клетками. Взаимосвязь
этих аутоиммунных состояний с лейкозом/лим-
фомой снова наводит на мысль о том, что лим-
фоидное новообразование возникает на месте на-
рушения иммунной регуляции или по причине
ее возникновения. Заболевание характеризуется
долгим клиническим течением, но возможно и
массивное поражение каждого органа, перифе-
рической крови и костного мозга опухолевыми
клетками.
Диффузная крупноклеточная лимфома
из В-клеток
Диффузная крупноклеточная лимфома из В-кле-
ток — это гетерогенная группа лимфом, которые
могут возникать de novo на единственном участке
и быть формой прогрессии одной из перечислен-
ных медленно растущих лимфом (например, фол-
ликулярной) или следствием плохо контролируе-
мой инфекции вирусом Эпштейна —Барр в орга-
низме больных, получающих иммуносупрессив-
ные препараты (например, у ВИЧ-позитивных
лиц, больных после трансплантации органов или
у пациентов с иммунодефицитом). Во всех случа-
ях клетки экспрессируют В-клеточные маркеры
CD 19 и CD20 и часто — поверхностный Ig. Одна
подгруппа имеет транслокацию bcl-б — протоон-
когена, который в норме действует как супрессор
транскрипции некоторых генов, необходимых для
нормального развития В-лимфоцитов и зароды-
шевых центров.
Поведение возникших de novo диффузных
крупноклеточных В-клеточных лимфом непред-
сказуемо. Благодаря современному микроанали-
зу кДНК для этих разновидностей опухолей (см.
гл. 5) лимфомы разделили на две крупные груп-
пы. Это разделение связано с различиями в об-
разцах генной экспрессии (продукция иРНК),
причем выявлена корреляция между этими мо-
лекулярными образцами и поведением опухоли.
Такая молекулярная характеристика должна при-
вести к лучшему пониманию биологии лимфом
и разработке практических рекомендаций к ле-
чению.
Взаимосвязь инфекции вирусом Эпштейна —
Барр с диффузными крупноклеточными лимфо-
НОВООБРАЗОВАНИЯ ЛИМФОИДНОЙ СИСТЕМЫ
283
мами из В-клеток и лимфомой Беркитта у паци-
ентов с иммуносуппрессией наглядно показыва-
ет, каковы последствия нарушения саморегуля-
ции иммунной системы. Инфекция В-клеток ви-
русом Эпштейна — Барр (через рецептор вируса
CD21) приводит к поликлональной пролиферации
В-лимфоцитов. У здоровых индивидуумов В-клет-
ки, инфицированные вирусом Эпштейна —Барр,
удаляются из организма цитотоксическими Т-лим-
фоцитами (см. гл. 10). Если Т-клеточный конт-
роль оказывается недостаточным, инфицирован-
ные В-лимфоциты продолжают экспансивный
рост, и в некоторых из них могут произойти до-
полнительные мутации, такие как транслокация
гена с-тус, что вызовет злокачественную транс-
формацию клеток и последующий независимый
рост. Например, вирус Эпштейна—Барр можно
использовать для продления жизни В-клеток в
тканевой культуре, в которой В-клетки не явля-
ются объектом, контролируемым Т-лимфоцитами
Это также важно в клинической практике: у па-
циентов, получающих иммуносупрессивную тера-
пию, существует точка, в которой пока еще воз-
можно предотвратить развитие В-клеточной лим-
фомы, прекратив терапию и разрешив иммун-
ной системе организма сдерживать патологиче-
скую В-клеточную пролиферацию. Конечно, это
невозможно у больных СПИД.
Опухоли плазматических клеток
Опухолевый рост плазматических клеток может
происходить на ограниченном участке (изолиро-
ванно), приводя к плазмоцитоме, или на многих,
преимущественно в костях, и тогда он называет-
ся множественной или плазмоклеточной миело-
мой. Как и для нормальных плазматических кле-
ток, фактором роста для миеломных клеток явля-
ется IL-6.
Опухолевые плазматические клетки могут про-
должать синтезировать и секретировать свои про-
дукты — белки, составляющие иммуноглобули-
ны. В большинстве случаев эти секретируемые мо-
ноклональные белки вызывают у пациента боль-
ше проблем, чем сами перерожденные клетки.
Депозиты легких цепей, названные амилоидом,
могут вызывать недостаточность разных органов,
особенно почек. Как было рассказано в гл. 4, вы-
деление из мочи некоторых больных множествен-
ной миеломой свободных легких цепей иммуно-
глобулина — белка Бенс-Джонса — позволяет по-
нять их структуру. Эти белки являются монокло-
нальными; они определяются в сыворотке и иног-
да в моче в виде М-пика в у-области на электро-
фореграмме (см. рис. 4.1). Пик выше погранич-
ной полосы формируется вследствие того, что все
иммуноглобулины идентичны по размеру и заря-
ду и мигрируют в одно и то же место (см. гл. 5).
В большинстве случаев продуцируются монокло-
нальные IgG; IgA являются следующим наиболее
часто обнаруживаемым изотипом иммуноглобу-
лина. Уровни других нормальных 1g у этих паци-
ентов значительно снижаются, что делает их им-
муносупрессивными по продукции антител и, та-
ким образом, восприимчивыми к инфекции. До
появления развернутой клинической картины
миеломы у больных может появляться небольшое
количество моноклональных 1g в течение многих
лет. Многие пациенты остаются на этой стадии,
и заболевание у них не прогрессирует. Малень-
кие М-пики могут быть обнаружены в ассоциа-
ции с другими лимфоидными новообразования-
ми, такими как ХЛЛ, и даже при неопухолевых
состояниях.
Лимфоплазмоцитарная лимфома
(макроглобулинемия Вальденстрема)
Лимфоплазмацитарная лимфома/макроглобулине-
мия Вальденстрема — это новообразование един-
ственного клона В-клеток. При микроскопии оно
выглядит как смесь лимфоцитов, плазматических
клеток и чего-то промежуточного — лимфоплаз-
моцитоидных клеток. Опухолевые клетки нахо-
дятся в лимфатических узлах, костном мозге и
селезенке. Хотя эти лимфомы встречаются нечас-
то, они представляют интерес для иммунологов
вследствие гиперпродукции IgM. Крупный раз-
мер и высокая концентрация IgM в крови может
сочетаться с медленным кровотоком и «засоре-
нием» сосудов их агломератами (синдром повы-
шенной вязкости крови). У некоторых пациентов
IgM имеют патологическую структуру, вследствие
чего при охлаждении они выпадают в осадок (с об-
разованием криоглобулинов) и вызывают рас-
стройства микроциркуляции в конечностях боль-
ных (пальцы рук и ног).
Т-клеточные новообразования
Острый лимфобластный лейкоз/лимфома
из Т-клеток-предшественников
Острый лимфобластный лейкоз из клеток-пред-
шественников Т-лимфоцитов (Т-ОЛЛ) — это но-
вообразование из незрелых Т-клеток с характе-
ристиками незрелых тимоцитов, остановившихся
в своем развитии. Как показано на рис. 17.12,
клетки Т-ОЛЛ экспрессируют все Т-клеточные
маркеры (CD2, CD5 и CD7), которые появляют-
ся на ранних стадиях развития Т-клеток. Некото-
рые Т-ОЛЛ обладают характеристиками незрелых
клеток тимуса и не экспрессируют CD4 или CD8
(т.е. они дважды негативные). Большинство нор-
мальных тимоцитов и клеток Т-ОЛЛ являются
более зрелыми, экспрессируя оба маркера: и CD4,
и CD8 (дважды позитивные)', при этом CD3 на
своей поверхности они экспрессируют в неболь-
шом количестве или совсем не экспрессируют (их
обозначают как общие тимоциты). В этих клетках
еще не завершена реаранжировка генов их Т-кле-
284
ГЛАВА 17. ИММУНОДЕФИЦИТНЫЕ РАССТРОЙСТВА И НОВООБРАЗОВАНИЯ ЛИМФОИДНОЙ СИСТЕМЫ
Стволовая Ранний
клетка тимоцит
Тимоцит
Периферическая
Т-клетка
Маркеры CD
CD34
• Рис. 17.12. Соотношение стадий
развития Т-клеток и злокачествен-
ных новообразований из них
Ферменты
Экспрессия
TCR
Злокачественные
новообразования
CD2
CD7
CD5
CD4
CD8
Дважды
негативная
клетка
Т-ОЛЛ
I
TCR I
I--------------
I
Т-ОЛЛ
I
I
I
I
Периферические
Т-клеточные
лимфомы
точного рецептора (TCR) и все еще экспресси-
руется TdT. Острый лимфобластный лейкоз про-
является в виде лейкоза или тяжелого процесса
в тимусе. Лечение не столь успешно, как при
В-ОЛЛ.
Новообразования из периферических
Т-клеток
Клинические проявления лимфом из перифе-
рических Т-клеток разнообразны. Они обнару-
живаются там, куда обычно мигрируют Т-клетки,
а именно в коже, легких, стенках сосудов, ЖКТ и
лимфатических узлах. Они также сохраняют не-
которые функции нормальных зрелых Т-клеток.
Вследствие этого продукция цитокинов злокаче-
ственными клетками приводит к скоплению вос-
палительных клеток, в том числе эозинофилов,
плазмоцитов и макрофагов. Часто лимфы из пе-
риферических Т-клеток более агрессивны, чем из
В-клеток. Две болезни из этой группы рассмот-
рим подробнее.
Кожная Т-клеточная лимфома
Если опухоль ограничена пределами кожи, Т-кле-
точную кожную лимфому часто называют ее ис-
торически сложившимся названием «грибовидный
микоз», поскольку раньше считалось, что паци-
енты страдают от хронической грибковой инфек-
ции, при которой отмечаются восковое перерож-
дение и истончение кожи в течение многих лет.
Сейчас понятно, что это кожное заболевание обус-
ловлено инфильтрацией эпидермиса злокачествен-
ными СВ4+-Т-клетками. В дальнейшем клетки
могут распространяться в лимфатические узлы и
даже в кровь. Злокачественные Т-клетки, обна-
руживаемые в кровотоке, называются клетками
Сезари; соответственно, у больного развивается
синдром Сезари.
Т-клеточная лимфома/лейкоз взрослых
Т-клеточная лимфома/лейкоз взрослых (ТЛЛВ)
представляет собой агрессивное Т-клеточное но-
вообразование. Его описали в 1970-е гг. в одной
из областей Японии, где оно являлось эндемич-
ным. Также его обнаружили у обитателей Кариб-
ских островов, в некоторых частях центральной
Африки и в небольшой области на юго-востоке
США. Обычно ТЛЛВ является новообразованием
из зрелых СБ4+-Т-клеток. Для таких клеток ауто-
кринным фактором роста является IL-2. При ран-
них попытках терапии показано, что это новооб-
разование временно (несколько месяцев) отвеча-
ет на введение антител (названных как анти-Тас);
как было выявлено позже, они являются специ-
фичными для ос-цепи рецептора к IL-2 (CD25).
Заболевание вызывается человеческим Т-кле-
точным лимфотропным вирусом I типа из семей-
ства ретровирусов (human Т cell lymphotropic vi-
rus 1 — HTLV-1), который был описан и выделен
еще до открытия СПИДа и ВИЧ. Геномная струк-
тура провируса похожа на ВИЧ; она тоже содер-
жит регион LTR и кодирует структурные и регу-
ляторные белки, а также вирусные ферменты (об-
ратную транскриптазу, интегразу и протеазу). Ви-
русный белок Тах, который трансактивирует
транскрипцию HTLV-1 путем связывания с обла-
стью LTR, активирует также и клеточные гены,
в том числе те, которые кодируют IL-2, ос-цепь
IL-2R и гормон, подобный паратиреоидному (в
обычных условиях не экспрессируется Т-клет-
ками). Поэтому активация провирусной транс-
крипции связана с активацией и пролиферацией
Т-клеток. У пациентов с ТЛЛВ часто отмечают
значительно повышенную концентрацию кальция,
что является результатом усиленного синтеза па-
ратиреоидподобного гормона.
Пути передачи HTLV-1 похожи на пути пере-
дачи ВИЧ в том смысле, что он передается через
НОВООБРАЗОВАНИЯ ЛИМФОИДНОЙ СИСТЕМЫ
285
кровь и жидкости тела; наиболее эффективен путь
передачи через грудное молоко. Поэтому многие
пациенты инфицируются HTLV-1 в младенческом
возрасте. Инкубационный период у этого вируса
длительный, обычно 20 — 40 лет. В основном ви-
рус инфицирует СВ4+-Т-клетки, а также поража-
ет нервную систему. У некоторых пациентов за-
болевание имеет клинические черты неврологи-
ческого процесса.
К счастью, только примерно у 1 % инфициро-
ванных пациентов развивается ТЛЛВ. Неясно, что
инициирует развитие заболевания спустя так мно-
го лет. В СЕ)4+-Т-клетках вирус находится в по-
коящемся состоянии. В отличие от ВИЧ после
активации вирус не является цитолитическим для
этих клеток. Напротив, HTLV-1 ведет к транс-
формации Т-клеток. После установления диагно-
за больные ТЛЛВ, как правило, живут не более
6 — 12 мес. Продукты крови в США и Великобри-
тании подвергаются скринингу для исключения
инфекции HTLV-1.
Лимфома Ходжкина
(лимфогрануломатоз)
Лимфома Ходжкина характеризуется наличием
относительно небольшого количества крупных
двуядерных злокачественных клеток, называемых
клетками Рид — Штернберга (описываются далее)
в реактивном окружении, представленном мел-
кими Т-клетами, эозинофилами, плазматически-
ми клетками, макрофагами, и фиброзом. Это ре-
активное микроокружение является результатом
избыточной продукции цитокинов, в частности
IL-5, опухолевыми клетками и/или окружающи-
ми клетками. У больных имеются клинические
признаки избыточной продукции цитокинов, та-
кие как лихорадка, потливость по ночам и умень-
шение массы тела. В классических случаях опре-
деляются также признаки сниженного клеточно-
опосредованного иммунного ответа — отсутству-
ют реакции ГЗТ на наиболее распространенные
тестовые аллергены, повышена восприимчивость
к вирусным и паразитарным инфекциям.
Предметом продолжительной дискуссии явля-
ется происхождение клеток Рид — Штернберга,
поскольку они не экспрессируют маркеров ника-
ких клеточных линий и характеризуются экспрес-
сией только CD 15 и CD30. В последних исследо-
ваниях с использованием молекулярных техноло-
гий была показана возможность реаранжировки
генов Ig, что подтверждает их происхождение из
В-клеточной линии. Открытие гипермутации в
генах иммуноглобулинов свидетельствует, что
клетки Рид — Штернберга образовались из В-кле-
ток, уже прошедших зародышевый центр. Хотя
злокачественные клетки и были идентифициро-
ваны как В-клетки, по течению эти лимфомы от-
личаются от крупноклеточных В-клеточных лим-
фом, что и является причиной того, что их про-
должают классифицировать как самостоятельную
нозологию. Лимфомы, таким образом, подразде-
ляют на лимфомы Ходжкина и неходжкинские.
Иммунотерапия
Увеличившиеся знания по биологии лимфом в
сочетании с техническими возможностями про-
изводства моноклональных антител и белков при-
вели к разработке нового поколения терапевти-
ческих средств. В настоящее время химерные и
гуманизированные антитела, направленные, в ча-
стности, против CD20, широко используются в
лечении В-клеточных лимфом. Если применяют
только одни антитела («холодное» использова-
ние), они могут вызывать уничтожение опухоле-
вых клеток путем их опсонизации при покрытии
антителами, а в случае использования конъюга-
тов этих антител за непосредственное уничтоже-
ние клетки отвечают токсины (см. гл. 20). Кроме
современной химиотерапии дополнительно ис-
пользуют вещества, блокирующие цитокины или
цитокиновые рецепторы, необходимые для про-
лиферации злокачественных клеток. Традицион-
ные средства химиотерапии, которые в основ-
ном являются неспецифическими веществами,
уничтожают все делящиеся клетки. Технологии,
использованные при разработке этих новых спе-
цифичных препаратов, также широко применя-
ются при разработке средств для лечения ауто-
иммунных заболеваний и нелимфоидных онко-
логических заболеваний, таких как рак молоч-
ной железы.
Иммунная система в норме работает как тща-
тельно отрегулированная сеть, отвечающая на па-
тогенные факторы извне, но не причиняющая
никакого вреда самой себе. Причем после того
как угроза миновала, иммунная система возвра-
щается в более спокойное состояние, но уже об-
ладая памятью о произошедших событиях. Исто-
щение, хроническая стимуляция или возможность
неконтролируемого роста одного из компонентов
нарушают работу оставшихся элементов. Таким
образом, поскольку регулирование в сети нару-
шено, развитие каждого из трех главных катего-
рий расстройств: иммунодефицита, аутоиммунно-
го заболевания или лимфоидного новообразова-
ния, делает возможным развитие еще одного или
даже двух типов заболеваний.
РЕЗЮМЕ
1. Иммунодефицитные расстройства называются
первичными, если причиной заболевания является
дефицит, и вторичными, если недостаточность разви-
вается вследствие других заболеваний или в резуль-
тате лечения.
2. Иммунодефицитные заболевания могут разви-
ваться в результате нарушений развития или функцио-
286
ГЛАВА 17. ИММУНОДЕФИЦИТНЫЕ РАССТРОЙСТВА И НОВООБРАЗОВАНИЯ ЛИМФОИДНОЙ СИСТЕМЫ
нирования В-клеток, Т-клеток, фагоцитирующих кле-
ток или компонентов комплемента.
3. Иммунодефицитные расстройства вызывают у
пациентов предрасположенность к рецидивирующим
инфекциям. Тип развивающейся инфекции обычно
зависит от того, какое именно звено иммунной систе-
мы нарушено. Дефекты гуморального звена иммуни-
тета приводят к повышенной восприимчивости к бак-
териальным инфекциям; дефекты в клеточно-опосре-
дованном иммунитете — к вирусным и грибковым ин-
фекциям; дефекты фагоцитирующих клеток — к ин-
фекциям пиогенными микроорганизмами, а дефекты
в системе комплемента — к бактериальным инфекци-
ям и аутоиммунным расстройствам.
4. Иммунодефициты проявляются одним типом
дефектов или расстройств иммунной системы. Други-
ми типами иммунологических расстройств являются
нерегулируемая пролиферация В- или Т-лимфоцитов,
избыточное образование продуктов лимфоцитарных
или фагоцитирующих клеток и нерегулируемая акти-
вация компонентов комплемента. Это может приво-
дить к ассоциациям иммунодефицитов с аутоиммун-
ными заболеваниями или злокачественными новооб-
разованиями.
5. Инфицируя и уничтожая СЭ4+-лимфоциты, ВИЧ
вызывает выраженное иммуносупрессивное заболе-
вание, известное как СПИД.
6. Лимфоидные новоообразования иммунной си-
стемы развиваются в результате неконтролируемой
моноклональной пролиферации, которую можно соот-
нести с развитием нормальных клеток на определен-
ной стадии дифференцировки. При многих злокаче-
ственных лимфоидных новообразованиях обнаружива-
ют специфические хромосомные транслокации, вызы-
вающие нарушения регуляции процессов клеточной
пролиферации или смерть. Некоторые из них связаны
с инфекциями вирусами, такими как вирус Эпштей-
на-Барр и HTLV-1, выступающими или как стимуля-
торы клеточного роста, или как онкогенные вирусы.
ТЕСТЫ
Выберите ОДИН НАИБОЛЕЕ ПРАВИЛЬНЫЙ ответ
на каждый тест.
1. Ребенок в возрасте 8 мес страдает от рециди-
вирующих инфекций, вызванных грамположительны-
ми бактериями. Наиболее возможная причина такого
состояния — это:
а) мать не передала достаточный иммунитет ре-
бенку во время беременности;
б) ребенок страдает от гемолитической болезни
новорожденных;
в) у ребенка дефект альтернативного пути актива-
ции комплемента;
г) у ребенка аллергия к материнскому молоку;
д) все ответы неверны.
2. Рабочий атомной станции в возрасте 50 лет,
у которого предварительно был взят и сохранен в за-
мороженном виде образец костного мозга, внезапно
подвергся воздействию радиации в минимальной ле-
тальной дозе. Впоследствии ему пересадили соб-
ственный костный мозг. У этого пациента можно ожи-
дать:
а) повторные бактериальные инфекции;
б) тяжелые грибковые инфекции вследствие недо-
статочности клеточно-опосредованного иммунитета;
в) развитие антительного ответа только на тимус -
независимые антигены;
г) все перечисленное;
д) все ответы неверны.
3. Исключительно с патологией гуморального им-
мунного ответа связано следующее иммунодефицит-
ное заболевание:
а) Х-сцепленная агаммаглобулинемия (агаммагло-
булинемия Брутона);
б) синдром Ди Джорджи;
в) синдром Вискотта —Олдрича;
г) хронический слизисто-кожный кандидоз;
д) атаксия-телеангиэктазия
4. Резкое увеличение уровня IgG, наблюдаемое в
виде пика в области IgG при электрофорезе сыворо-
точных белков, свидетельствует:
а) о недостаточности IgA или IgM;
б) множественной миеломе;
в) макроглобулинемии;
г) гипогаммаглобулинемии;
д) тяжелых грибковых инфекциях.
5. У пациентов с синдромом Ди Джорджи может
снижаться продукция IgG в ответ на иммунизацию Т-за-
висимыми антигенами:
а) потому что у них снижено количество В-клеток,
продуцирующих IgG;
б) у них наблюдается повышенное число Т-супрес-
соров;
в) у них снижено количество Т-хелперов;
г) у них появляются патологически функциониру-
ющие АПК;
д) они не могут продуцировать IgM в ходе реакций
первичного ответа.
6. У ребенка в возрасте 2 лет было три эпизода
пневмонии и два случая среднего отита. Все эти ин-
фекции были вызваны пневмококком. Наиболее веро-
ятно, что причиной этого было:
а) изолированная транзиторная Т-клеточная недо-
статочность;
б) комбинированная Т- и В-клеточная недостаточ-
ность;
в) В-клеточная недостаточность;
г) транзиторная анемия;
Д) СПИД.
7. Здоровая женщина родила ребенка У новорож-
денного были обнаружены антитела к ВИЧ. Наиболее
вероятно, что это является результатом:
а) переноса вируса через плаценту в организм ре-
бенка;
б) продукции организмом ребенка антител против
ВИЧ;
в) перекрестным реагированием эритроцитарных
антигенов ребенка с вирусом;
г) перекрестным реагированием эритроцитарных
антигенов матери с вирусом;
д) переноса материнских ВИЧ-специфичных IgG
через плаценту в организм ребенка.
8. Иммунодефицитное заболевание может быть
результатом дефекта:
ТЕСТЫ
287
а) развития Т-лимфоцитов;
б) развития стволовых клеток костного мозга;
в) фагоцитарной функции;
г) функционирования системы комплемента;
д) все перечисленное.
9. Ребенок в возрасте 9 мес был вакцинирован
против вируса натуральной оспы ослабленным виру-
сом натуральной оспы. У него развилось прогресси-
рующее некротическое поражение кожи, мышц и под-
кожной клетчатки в месте введения. Поствакциналь-
ные реакции, возможно, были результатом:
а) недостаточности В-лимфоцитов;
б) реакции на адьювант;
в) недостаточности комплемента;
г) Т-клеточной недостаточности;
д) В- и Т-лимфоцитарной недостаточности.
10. Наиболее частые клинические последствия не-
достаточности компонента СЗ — это:
а) увеличение частоты опухолей;
б) увеличение восприимчивости к вирусным ин-
фекциям;
в) увеличение восприимчивости к грибковым ин-
фекциям;
г) увеличение восприимчивости к бактериальным
инфекциям;
д) все перечисленное
СИТУАЦИОННАЯ ЗАДАЧА
Опытный педиатр рассказал историю В 1985 г.
мать, только что переехавшая в город, принесла в
мой офис ребенка 4 лет. Она жаловалась, что ее ре-
бенок престал развиваться, у него отсутствует аппе-
тит, понижается масса тела и его мучает постоянный
кашель. При осмотре ребенок выглядел бледным и
болезненным, у него была небольшая лихорадка, но
других физикальных данных не было В анамнезе
жизни ребенка не было ничего примечательного, кро-
ме перелома ноги в возрасте 1 года, потребовавшего
переливания крови во время хирургического вмеша-
тельства. Но перелом зажил без осложнений. Я вы-
полнил массу исследований. Рентгенологическое ис-
следование показало несколько бактериальных ин-
фильтратов в легких. Количество лейкоцитов было не-
сколько снижено, а количество клеток крови других
типов в норме. При определении сывороточных Ig в
тесте ELISA было выявлено повышение IgG, IgM и IgA.
Кожные тесты с антигенами возбудителей эпидеми-
ческого паротита, ботулизма и антигенами грибов
Candida были отрицательны. Была начата антибакте-
риальная терапия, но во время следующего визита
ребенок выглядел еще более больным; у него увели-
чились лимфатические узлы, селезенка и печень. Ка-
кой диагноз я должен был поставить и как его под-
твердить?
ОТВЕТЫ НА ТЕСТЫ
1 — д. Ничто из перечисленного не может обусло-
вить указанную симптоматику. Возможно, у ребенка
гипогаммаглобулинемия. Это заболевание проявляет-
ся повторными бактериальными инфекциями. Вирус-
ная и грибковая инфекции контролируются клеточно-
опосредованным иммунитетом, который нормально
функционирует у лиц с гипогаммаглобулинемией. Ва-
риант «а» неправильный, поскольку период полурас-
пада материнских IgG, прошедших через плаценту,
составляет 23 дня; таким образом, их не будет в орга-
низме ребенка к 8-му месяцу жизни. В этом возрасте
любые Ig, присутствующие в крови ребенка, синтези-
руются в его организме. Ответ «б» не подходит, по-
скольку гемолитическая болезнь новорожденных вы-
зывается деструкцией ЯИ+-эритроцитов новорожден-
ного антителами к Rh-антигену, синтезированными в
организме Rh-матери. Вариант «в» просто не может
произойти, поскольку будет сохранен классический
путь активации комплемента. Более того, дефект
альтернативного пути не приведет к избирательному
дефекту защиты от грамположительных бактерий.
Ответ «г» неправильный, поскольку даже при нали-
чии аллергии к материнскому молоку ребенок не
должен страдать от часто появлящихся бактериаль-
ных инфекций.
2 — д. Клетки аутологичного костного мозга, со-
держащие стволовые клетки, будут размножаться,
дифференцироваться и заново заселять гемопоэти-
ческую и ретикулоэндотелиальную системы, воспро-
изводя нормальные индивидуальные иммунологиче-
ские параметры. Таким образом, у данного индивиду-
ум не ожидаются бактериальные, вирусные или гриб-
ковые инфекции, так же как и отличный от нормаль-
ного организма ответ на антигены.
3 — а. Только Х-сцепленная агаммаглобулинемия
(агаммаглобулинемия Брутона) является иммуноде-
фицитным заболеванием, связанным с патологией
исключительно гуморального иммунитета. Синдром
Ди Джорджи является результатом тимической апла-
зии, при которой имеет место недостаточность Т-кле-
ток, влияющая на образование IgG, для чего необхо-
димы Т-хелперы. Синдром Вискотта—Олдрича связан
с несколькими аномалиями. Атаксия-телеангиэктазия —
это заболевание с дефектом обоих звеньев (и клеточ-
ного, и гуморального) иммунных ответов с наиболее
тяжелым поражением Т-зависимых зон лимфоидных
тканей. Хронический кожно-слизистый кандидоз —
это плохо определенная группа синдромов, связанных
с избирательным дефектом функционирования Т-кле-
ток.
4 — 6. Этот пример характерен для множествен-
ной миеломы (миелома IgG). Эту болезнь можно рас-
познать по синтезу большого количества однородных
антител любого класса. Хотя пациенты с множествен-
ной миеломой могут страдать от снижения синтеза Ig
других классов, для определения недостаточности IgA
или IgM электрофоретический анализ не нужен.
5 — в. У пациентов с синдромом Ди Джорджи
снижается количество Т-клеток, особенно Т-хелперов,
которые необходимы для развития ответа IgG на Т-за-
висимые антигены. В-клетки этих пациентов нормаль-
но функционируют, они способны отвечать как на
Т-независимые, так и на Т-зависимые антигены, но в
последнем случае развиваются только антитела IgM
(первичный ответ).
6 — в. Наиболее вероятная причина связана с не-
достаточностью В-клеток, которая характеризуется
рецидивирующими бактериальными инфекциями, ве-
дущими к отиту и пневмонии Т-клеточная недостаточ-
288
ГЛАВА 17. ИММУНОДЕФИЦИТНЫЕ РАССТРОЙСТВА И НОВООБРАЗОВАНИЯ ЛИМФОИДНОЙ СИСТЕМЫ
ность обычно приводит к вирусным, грибковым и про-
тозойным инфекциям. То же самое справедливо в от-
ношении сочетания Т- и В-клеточной недостаточно-
сти. Вариант «г» (транзиторная анемия) в данном слу-
чае не подходит; анемия, как правило, не связана с
увеличением частоты инфекций. Маловероятно, что в
случае только пневмококковых инфекций у ребенка
может быть СПИД. Последний синдром чаще ассоци-
ируется с характерными инфекциями, такими как
Pneumocystis carinii, и различными вирусными инфек-
циями.
7 — д. Наиболее вероятное объяснение состоит в
том, что «здоровая» мама была инфицирована ВИЧ-1
и продуцировала антитела класса IgG против ВИЧ,
которые передались плоду и новорожденному через
плаценту. Несмотря на возможность передачи ВИЧ
младенцу через плаценту, это не будет вызывать про-
дукцию антител к вирусу в столь раннем возрасте. Та-
ким образом, ответы «а» и «б» являются неправиль-
ными. Ответы «в» и «г» также неправильные, посколь-
ку эта невероятная ситуация приведет к распознава-
нию вирусных антигенов как «своих» и в организме не
будут продуцироваться аутоантитела.
8 — д. Все ответы верны. Иммунодефицитные
расстройства могут быть результатом нарушения раз-
вития стволовых клеток костного мозга в лимфоциты
и другие клетки, принимающие участие в иммунном
ответе. Они могут также быть результатом дефектов
фагоцитарных функций, которые важны в процессах
фагоцитоза и презентации антигена. К иммунодефи-
цитам также могут приводить дефекты функции комп-
лемента и отсутствие или нарушение функции одного
или более компонентов системы комплемента, акти-
ваторов или регуляторов.
9 — г. Т-клеточная недостаточность будет приво-
дить к отсутствию важнейшей иммунологической за-
щиты против вирусной инфекции — клеточно-опосре-
дованного иммунитета. Он играет важную роль в им-
мунитете против вирусных инфекций, много большую,
чем роль антител или комплемента. Очевидно, что
индивидуумов с поврежденным Т-клеточным иммуни-
тетом нельзя вакцинировать живыми вирусами, кото-
рые, будучи даже ослабленными, могут вызвать серь-
езное заболевание.
10 — г. Недостаточность компонента СЗ связана с
повышенной чувствительностью к бактериальным ин-
фекциям, поскольку он играет важную роль в опсони-
зации и деструкции бактерий; СЗ является компонен-
том всех путей активации комплемента: альтернатив-
ного, классического и маннансвязывающего лектино-
вого Клеточно-опосредованный иммунитет более ва-
жен для развития устойчивости организма-хозяина к
вирусной и грибковой инфекциям. Считается, что для
устойчивости организма-хозяина к опухолям клеточ-
но-опосредованный иммунитет более важен, чем ком-
племент.
ОТВЕТ НА СИТУАЦИОННУЮ ЗАДАЧУ
Наиболее вероятно, что это был случай детского
СПИДа, преимущественно связанный с переливанием
в раннем возрасте крови, полученной из банка крови.
В последующем длительном инкубационном периоде
у ребенка выявились несколько сниженное количе-
ство лейкоцитов, некоторое увеличение уровней Ig и
выраженное нарушение функции Т-клеток. Последнее
было определено по отсутствию кожной реакции на
антигены натуральной оспы, токсины ботулизма и ан-
тигены Candida, каждые из которых запускает Т-кле-
точно-опосредованные реакции ГЗТ у здоровых лиц.
Определение количества циркулирующих CD4+- и
СО8+-клеток выявило, что их отношение составляет
0:4, что вызвано снижением количества СО4^-Т-кле-
ток, которые являются мишенями для ВИЧ. Для даль-
нейшего исследования легочных инфильтратов, не от-
вечавших на антибактериальную терапию, можно вы-
полнить исследование лаважной жидкости, получен-
ной при бронхоскопии. Высока вероятность того, что
микроскопия промывных вод покажет наличие оппорту-
нистического микроорганизма, такого как Pneumocystis
carinii, являющегося наиболее частой причиной смер-
ти пациентов со СПИДом. Окончательное доказатель-
ство ВИЧ-инфекции можно получить при обнаружении
в сыворотке крови ребенка антител к антигенам ВИЧ
На сегодняшний день наличие вирусного генома мож-
но подтвердить при использовании ПЦР, специфич-
ной для ВИЧ.
К счастью, случаи передачи ВИЧ-инфекции при
переливании крови в настоящее время в США встре-
чаются редко благодаря принятым мерам по обследо-
ванию продуктов крови. Это является серьезным пре-
пятствием для распространения СПИДа при трансфу-
зиях крови
Глава
18
ТРАНСПЛАНТАЦИЯ
• ВВЕДЕНИЕ
Иммунная система возникла как способ различе-
ния «своего» и «чужого». Как только чужеродность
установлена, иммунный ответ направляется на
выполнение своей окончательной цели — унич-
тожение чужеродного материала, будь то микро-
организм или его продукт, вещество, находящее-
ся в окружающей среде, или опухолевая клетка.
Запуск иммунной системы в ответ на появление
таких чужеродных субстанций имеет, несомнен-
но, огромное значение для выживания организма.
Эта же способность иммунной системы к раз-
делению «своего» и «чужого» нежелательна при
таких неестественных обстоятельствах, как пере-
садка клеток, тканей или органов от одного ин-
дивидуума к другому в терапевтических целях
Действительно, первоначально результаты транс-
плантаций были катастрофическими и проявля-
лись в итоге феноменом отторжения трансплан-
тата при одном существенном исключении —
переливании крови. Перелитая кровь представ-
ляет собой самый ранний и наиболее успешно
применяемый клеточный «трансплантат», который
по-прежнему больше всего используют. Почему
подобные трансплантации, как правило, успеш-
ны при правильном выполнении? Причина зак-
лючается в простоте подбора эритроцитов донора
для реципиента. В человеческой популяции экс-
прессируется только небольшое число различных
типов основных эритроцитарных антигенов — ан-
тигенов групп крови АВО и Rh (соответственно,
четыре и два). Проведение пробы на совмести-
мость предотвращает быстрое опосредованное
антителами разрушение донорских эритроцитов.
В отличие от данного случая антигены, экспрес-
сируемые органами и тканями, так же как лейко-
цитарные антигены (МНС, см. гл. 9), в челове-
ческой популяции чрезвычайно полиморфны, по-
этому подобрать донора для реципиента очень
сложно.
Современный уровень понимания клеточных
и молекулярных механизмов отторжения транс-
плантата и появление эффективных методов им-
муносупрессивной терапии сделали транспланта-
цию различных клеток, тканей и органов вполне
обычным методом лечения (табл. 18.1). Напри-
мер, ежегодно в мире достаточно успешно пере-
саживают более 10000 почек. Трансплантация серд-
ца, легких, роговицы, печени и костного мозга,
считавшаяся выдающимся достижением и широ-
ко рекламировавшаяся не более чем 25 лет назад,
в настоящее время стала привычной. Несмотря
на то что количество случаев отторжения значи-
тельно уменьшилось в связи с использованием
методов иммуносупрессивной терапии, они не
исчезли окончательно. Таким образом, трансплан-
тационная иммунология продолжает оставаться
важной областью исследования. Далее в этой гла-
ве коротко описан опыт трансплантации сердца,
перенесенной одним из авторов (Э. Б.).
< ВЗАИМООТНОШЕНИЯ МЕЖДУ
ДОНОРОМ И РЕЦИПИЕНТОМ
Перед тем как обсудить иммунологические меха-
низмы, связанные с отторжением трансплантата,
необходимо уяснить ряд градаций в отношениях
между донором и реципиентом при транспланта-
ции. Они представлены на рис. 18.1 и описаны
далее.
• Аутотрансплантат является трансплантатом,
пересаживаемым с одного места на другое у
одного и того же индивидуума, например пе-
ресадка нормальной кожи с одного места на
обожженный участок тела того же человека.
290
ГЛАВА 18. ТРАНСПЛАНТАЦИЯ
• Таблица 18.1. Трансплантация специфических органов и тканей
Орган/ткань Применение в клинике Комментарий
Кожа Ожоги, хронические раны, диа- бетические язвы, венозные язвы Обычно аутотрансплантаты; расширяется использова- ние искусственной кожи из элементов стромы и куль- тивированных клеток аллогенного или ксеногенного происхождения
Почка Конечная стадия почечной недо- статочности В настоящее время в течение года приживаются более 85 % трансплантатов, взятых даже не у родственного донора
Печень Гепатома или билиарная атрезия Выживание в течение года примерно у 2/3 реципиентов
С ердце Сердечная недостаточность Выживание в течение года более 80 % реципиентов
Легкие Далеко зашедшие легочные или легочно-сердечные заболевания Иногда производится вместе с пересадкой сердца
Костный мозг Неизлечимые лейкозы, лимфомы, врожденные иммунодефицитные заболевания Риск развития РТПХ возникает только при пересадке костного мозга, применяется пересадка гемопоэтиче- ских стволовых клеток
Роговица Слепота HLA-типирование преимуществ не дает, поскольку это «привилегированная» область, в которой отсутствует ток лимфы
Поджелудочная железа Сахарный диабе! Иноща одновременно проводится пересадка поджелудоч- ной железы и почки; выживание трансплантата прибли- жается к показателям почечного
Трансплантат распознается как аутохтонный
или аутологичный (собственный), и никакого
иммунного ответа против него не возникает.
Если при трансплантации не возникает техни-
ческих трудностей, то трансплантат, как прави-
ло, выживает, или приживается на новом месте.
• Изотрансплантат, или сингенный трансплан-
тат. является клеточным, тканевым или орган-
ным трансплантатом, пересаживаемым между
сингенными (генетически идентичными) доно-
ром и реципиентом. Примером может служить
трансплантация почки от идентичного (гомо-
зиготного) близнеца другому близнецу. Как и
в случае с аутотрансплантатом, реципиент, ко-
торый генетически идентичен донору по МНС
и другим локусам, распознает донорскую
ткань как «собственную», не развивая против
нее иммунный ответ. Оба индивидуума (т.е. до-
нор и реципиент) называются гистосовмести-
мыми.
• Аллотрансплантат является трансплантатом,
пересаживаемым другому индивидууму того же
вида, отличающемуся по МНС. В связи с тем
что среди представителей данного аутбредного
вида имеется достаточно высокий уровень
МНС-полиморфизма, такая аллогенная транс-
плантация заканчивается отторжением переса-
женной чужеродной ткани. Донор и реципи-
ент в )том случае являются негистосовмести-
мыми или гистонесовместимыми.
Донор
Реципиент
Аутотрансплантат
(приживление)
мнса
Изо- или сингенный
трансплантат
(приживление)
мнса
мнсь
Аллотрансплантат
(отторжение)
МНСХ кролика
Ксенотрансплантат
(отторжение) • Рис. 18.1. Ситуации при трансплан-
тациях органов и тканей
РЕАКЦИИ НА АЛЛОАНТИГЕНЫ И ОТТОРЖЕНИЕ АЛЛОТРАНСПЛАНТАТА
291
• Ксенотрансплантат является трансплантатом,
пересаживаемым от донора одного вида реци-
пиенту другого вида. Трансплантат распозна-
ется как чужеродный, и против него развива-
ется иммунный ответ, который приводит к раз-
рушению или отторжению трансплантата. До-
нор и реципиент также являются гистонесов-
местимыми.
• ИММУННЫЕ МЕХАНИЗМЫ
ОТТОРЖЕНИЯ АЛЛОТРАНСПЛАНТАТА
Прямое свидетельство участия иммунного отве-
та в отторжении трансплантата можно получить
в экспериментах, в которых кожа донора пере-
саживается генетически отличающемуся, но при-
надлежащему к тому же виду реципиенту, а имен-
но в аллогенных парах. Кожа, пересаживаемая
от мыши с черной шерстью на спину мыши с
белой шерстью, отличающейся по МНС, сохра-
няет нормальный вид от I до 2 недель. Однако
примерно через 2 недели кожный аллотрансп-
лантат начинает отторгаться и полностью отде-
ляется в течение нескольких дней. Этот процесс
называется первичным отторжением. Если пос-
ле этого отторжения реципиенту пересаживают
другой участок кожи от того же самого донора,
то трансплантат отторгается в течение 6 — 8 дней.
Это ускоренное отторжение называется вторич-
ным отторжением. При этом кожа, пересажен-
ная от другой мыши, отличающейся по МНС от
первоначального донора, будет отторгаться с та-
кой же скоростью, как и при самой первой транс-
плантации, что определяется как кинетика пер-
вого порядка. Таким образом, вторичное оттор-
жение является проявлением специфической им-
мунологической памяти на антигены, экспрес-
сируемые трансплантатом.
Участие CD44- и СЭ8+-Т-клеток в реакции от-
торжения можно продемонстрировать при пере-
носе этих клеток от индивидуума, сенсибилизи-
рованного к аллотрансплантату, сингенному ре-
ципиенту, не подвергавшемуся ранее сенсибили-
зирующим воздействиям. Если второму реципи-
енту аллотрансплантаиия будет проведена от того
же донора, который был использован при сенси-
билизации донора Т-лимфоцитов, разовьется от-
торжение по вторичному типу. Таким образом,
установлено, что Т-клетки, активированные (при-
мированные) при первичной пересадке, ответ-
ственны за ускоренное отторжение у второго ре-
ципиента. Однако в разрушении пересаженной
ткани при вторичном отторжении могут также
участвовать и антитела.
Помимо этого существуют и другие многочис-
ленные свидетельства иммунологической приро-
ды отторжения трансплантата. Например, гисто-
логическое исследование участка отторжения вы-
являет лимфоцитарную и моноцитарную клеточ-
ную инфильтрацию, напоминающую реакцию
ГЗТ (см. гл. 16); в инфильтрате обнаруживаются и
CD4+-, и СО8+-клетки, и (как видно далее) те и
другие играют решающую роль в отторжении
трансплантата. У животных с недостаточностью
Т-лимфоцитов (как, например, у атимических
или «голых» мышей или у людей с синдромом Ди
Джорджи; см. гл. 17) отторжения аллотрансплан-
татов или ксенотрансплантатов не наступает
Процесс отторжения значительно замедляется
или не возникает у лиц с подавленным иммуни-
тетом. Было также показано, что у здоровых ин-
дивидуумов Т-клетки примируются, а циркули-
рующие в крови антитела индуцируются антиге-
нами, экспрессируемыми алло- или ксено-
трансплантатом.
€ РЕАКЦИИ НА АЛЛОАНТИГЕНЫ
И ОТТОРЖЕНИЕ
АЛЛОТРАНСПЛАНТАТА
По клиническим симптомам отторжение транс-
плантата разделяют на три основные категории:
сверхострое, острое и хроническое. Далее описа-
ны реакции отторжения, какими они могли бы
наблюдаться, например, при пересадке почки Эти
описания соответствуют проявлениям, наблюда-
ющимся при отторжении других тканей.
Сверхострое отторжение
Сверхострое отторжение происходит в промежут-
ке от нескольких минут до нескольких часов пос-
ле трасплантации. Оно начинается в результате
разрушения трансплантата так называемыми
предсуществующими антителами к несовмести-
мым антигенам МНС и в некоторых случаях к
углеводородам, экспрессируемым на пересажен-
ных тканях (например, на эндотелиальных клет-
ках). Эти антитела существуют у реципиента еще
до трансплантации. В некоторых случаях эти
предсуществующие антитела вырабатываются в
результате предшествующих трансплантаций, пе-
реливаний крови или беременностей Такие
цитотоксические антитела активируют систему
комплемента, после чего происходят активация
и депонирование тромбоцитов, вызывающие отек
и интерстициальное кровоизлияние, что приво-
дит к уменьшению кровотока в ткани. В случаях
сверхострого отторжения часто наблюдаются
тромбоз с повреждением эндотелия и фибрино-
идный некроз. У пациента могут отмечаться ли-
хорадка, лейкоцитоз и уменьшение или прекра-
щение отделения мочи. В моче могут содержать-
ся различные клеточные элементы, такие как
эритроциты. В реакциях при сверхостром оттор-
жении совсем не участвует клеточно-опосредо-
ванный иммунитет.
292
ГЛАВА 18. ТРАНСПЛАНТАЦИЯ
Острое отторжение
Острое отторжение наблюдается у реципиента,
который до этого не был сенсибилизирован к
трансплантату. Эта форма отторжения опосреду-
ется Т-клетками и считается результатом непо-
средственного распознавания аллоантигенов, экс-
прессированных донорскими клетками (что бо-
лее детально обсуждается в этой главе далее). Это
обычный тип отторжения, возникающий у инди-
видуумов при ошибке в подборе пересаживаемой
ткани или недостаточности применяемой для
предотвращения отторжения аллотрансплантата
иммуносупрессивной терапии. Например, реак-
ция острого отторжения может начаться через не-
сколько дней после пересадки почки, что через
10— 14 сут приводит к полной утрате почечной
функции Острое отторжение почки сопровожда-
ется быстрым снижением ее функций. Для этого
состояния характерны увеличение и болезненность
пересаженной почки, повышение уровня креати-
нина в сыворотке крови, уменьшение выделения
мочи, снижение почечного кровотока и наличие
клеток крови и белка в моче. При гистологии в
месте отторжения клеточно-опосредованный им-
мунитет проявляется в виде интенсивной лим-
фоцитарной и макрофагальной инфильтрации
Реакция острого отторжения может быть умень-
шена с помощью иммуносупрессивной терапии,
например при использовании кортикостероидов,
циклоспорина и других препаратов, описываемых
далее в этой главе.
Хроническое отторжение
Хроническое отторжение, вызываемое как анти-
телами. так и клеточно-опосредованным имму-
нитетом, развивается спустя месяцы или годы
после того, как ткань аллотрансплантата прижи-
лась и выполняет свою обычную функцию. При
трансплантации почки хроническое отторжение
проявляется как медленное прогрессирующее сни-
жение функции почки. Гистологически картина
хронического отторжения характеризуется клеточ-
но-опосредованными воспалительными повреж-
дениями мелких артерий, утолщением базальной
гломерулярной мембраны и интерстициальным
фиброзом. Поскольку нарушение, вызванное им-
мунным воздействием, уже произошло, то при-
менение иммуносупрессивной терапии на данном
этапе бесполезно и для спасения трансплантата
мало что может быть сделано.
Поскольку предшествующий пример касался
трансплантации почки, важно отметить, что ско-
рость. выраженность и механизмы, лежащие в
основе отторжения, могут различаться в зависи-
мости от пересаженной ткани и места, куда про-
ведена трансплантация. Скорость отторжения
определяют состояние кровоснабжения и оттока
лимфы у реципиента, а также экспрессия антиге-
нов МНС на трансплантате и некоторые другие
факторы. Например, трансплантаты костного моз-
га и кожи более чувствительны к отторжению по
сравнению с трансплантатами сердца, почек и
печени.
• РОЛЬ МОЛЕКУЛ МНС В ОТТОРЖЕНИИ
АЛЛОТРАНСПЛАНТАТА
Антигены, вызывающие иммунный ответ, связан-
ный с отторжением трансплантата, иногда назы-
вают трансплантационными антигенами или ан-
тигенами гистосовместимости. Действительно,
МНС получил свое название в связи с его цент-
ральной ролью в отторжении трансплантата. По-
чему же эти молекулы являются главными анти-
генными мишенями для Т-клеток, полностью от-
вечающих за отторжение трансплантата? Для этого
существуют по крайней мере две причины. Как
указывалось в гл. 9, продуктами генов МНС яв-
ляются поверхностные белки клетки. Все ядросо-
держащие клетки экспрессируют молекулы МНС
I класса, в то время как молекулы II класса в нор-
ме экспрессируются только на субпопуляции ге-
мопоэтических клеток и клетками стромы тиму-
са. У других клеток экспрессию МНС II класса
можно индуцировать при их контакте с провос-
палительным цитокином IFNy. При трансплан-
тации органа, когда донор и реципиент различа-
ются по МНС (аллогенны), иммунный ответ бу-
дет направлен преимущественно против чужерод-
ных антигенов МНС I класса, экспрессирован-
ных на клетках в пересаженной ткани. Более того,
молекулы чужеродного МНС активируют огром-
ное количество клонов Т-клеток реципиента. Счи-
тается, что до 5 % всех клонов Т-клеток в орга-
низме могут быть активированы аллоантигеном —
величина этого ответа гораздо большая, чем при
других антигенных воздействиях. Комплекс, со-
стоящий из чужеродных молекул МНС и за-
крепленных в них пептидов, перекрестно реаги-
рует с рецепторами Т-клеток (TCR), экспресси-
руемых на Т-клетках различных клонов. Другие
механизмы, описываемые далее, также вносят
свою лепту в то, каким образом аллоантигены на
трансплантате презентируются Т-клеткам реци-
пиента.
Механизм распознавания
аллоантигена Т-клетками
Как указывалось в гл. 8 и 9. специфичность Т-кле-
ток в норме ограничена (рестриктирована) соб-
ственными МНС, аллельная специфичность ко-
торых представляется в тимусе при дифференци-
ровке Т-клеток. Таким образом, контакт индиви-
дуума с несобственными молекулами МНС, экс-
прессируемыми на трансплантате, представляет
РОЛЬ МОЛЕКУЛ МНС В ОТТОРЖЕНИИ АЛЛОТРАНСПЛАНТАТА
293
собой искусственно созданную, но клинически
важную ситуацию.
Существуют два механизма распознавания ал-
лоантигенов Т-клетками: прямой и непрямой. Ког-
да Т-клетки вступают в контакт с чужеродными
клетками, экспрессирующими «не свой» МНС
(I или II класса), многие клоны «обманом» вовле-
каются в активацию, поскольку их TCR связы-
ваются с презентируемым комплексом чужерод-
ный МНС —пептид. Этот прямой механизм, ве-
роятно, обусловлен распознаванием чужеродного
МНС и прикрепленных пептидов донорского про-
исхождения, которые создают структуру, облада-
ющую функциональной перекрестной реактивно-
стью с собственной комбинацией МНС —пептид,
на которую эти клоны реагировали бы в норме.
Почему эти донорские клетки, экспрессирующие
МНС, связываются с пептидами донорского про-
исхождения? Вспомним гл. 9 и 10, описывающие
структуры и функции МНС, в которых говори-
лось, что молекулы МНС могут и, действитель-
но, в норме связываются с собственными пепти-
дами. Собственные белки обычно расщепляются
внутри цитозольных органелл, называемых про-
теазомами, а пептиды доставляются в эндоплаз-
матический ретикулум, где могут прикрепляться
к молекулам МНС I класса. Считается, что в та-
ких комплексах МНС — собственный пептид
структуры молекул МНС стабилизируются, и при
их экспрессии на поверхности клеток организма
в норме каких-либо последствий не развивается,
поскольку существует толерантность к аутопеп-
тидам. Однако когда донорские клетки (действу-
ющие как АПК) презентируют такие пептиды
Т-клеткам реципиента, они распознаются как чу-
жеродные. Таким образом, эти Т-клетки реагиру-
ют непосредственно на донорские АПК, экспрес-
сирующие аллогенный МНС в комбинации с пеп-
тидом. Кроме того, эти донорские АПК также
обладают костимулирующим действием, необхо-
димым для индукции второго сигнала, требу-
ющегося для активации Т-клеток. Известно, что
основным источником пептидов донорского про-
исхождения, презентируемых таким образом, яв-
ляются минорные антигены гистосовместимости
(минорные Н-антигены).
Минорные Н-антигены кодируются генами
вне МНС. Отличия по полиморфным минорным
Н-антигенам вызывают менее выраженные иммун-
ные ответы по сравнению с отличиями в МНС.
Минорные Н-антигены являются пептидами до-
норского происхождения, производными от по-
лиморфных клеточных белков, презентируемых
молекулами МНС I класса на трансплантате. От-
веты на минорные Н-антигены обычно опосре-
дуются СО8+-Т-клетками, поскольку эти антиге-
ны презентируются молекулами МНС I класса.
Как указано в этой главе далее, минорные Н-ан-
тигены играют важную роль при трансплантации
костного мозга и участвуют в описываемой далее
реакции «трансплантат против хозяина» (РТПХ)
в тех случаях, когда трансплантации проводятся
с учетом совместимости по антигенам главного
комплекса гистосовместимости HLA.
Второй механизм распознавания аллоантиге-
нов Т-клетками (непрямой) происходит с участи-
ем АПК реципиента. Когда эти АПК встречают
трансплантат, они захватывают аллоантигенные
белки, процессируют эти молекулы, презентируют
получившиеся пептиды на собственных (реципи-
ента) молекулах МНС аллопептидспецифичным
Т-клеткам и активируют их. Таким образом, алло-
активация Т-клеток реципиента может быть пря-
мой — через распознавание чужеродных антиге-
нов МНС, экспрессируемых донорскими клетка-
ми, или непрямой — через распознавание клеточ-
ных пептидов донорского происхождения (минор-
ные Н-антигены), связанных с антигенами МНС,
экспрессируемыми АПК реципиента (рис. 18.2).
Доля участия этих двух механизмов в отторже-
нии трансплантата неясна. Считается, что прямая
аллоактивация важна при остром отторжении
трансплантата, описываемом в этой главе ранее.
Следовательно, разрушение донорских клеток
Прямое распознавание
Непрямое распознавание
Т-клетка организма
Т-клетка организма
распознает комплекс,
состоящий из собственного
МНС и чужеродного
пептида донорского
происхождения
Пептид донорского
происхождения
Аллоантиген
АПК реципиента,
презентирующая
процесс и рованны й
пептид донорского
происхождения
• Рис. 18.2. Прямое и непрямое распознавание аллоантигенов в пересаженных органах
и тканях
294
ГЛАВА 18. ТРАНСПЛАНТАЦИЯ
в этом случае прямо опосредуется Т-клетками. В
отличие от этого непрямая аллоактивация Т-кле-
ток вызывает ответ, также включающий актива-
цию макрофагов, которые вызывают поврежде-
ние ткани и фиброз. Более того, такая активация
ведет к развитию ответов со стороны цитотокси-
ческих аллоантител, которые также могут играть
роль в разрушении трансплантатов.
Роль цитокинов в отторжении
ал л отра нсп л а нтата
Аллоактивация Т-клеток запускает иммунный
ответ, стимулируя и CD4+-, и СО8+-клетки. В ре-
зультате цитокины синтезируются в основном
активированными клонами СО4+-Т-клеток, что
приводит к активации аллореактивных цитоток-
сических Т-клеток. Наиболее важными цитоки-
нами, вырабатываемыми во время этих ответов,
являются: IL-2, IFNa, IFNp, IFNy, а также фак-
тор некроза опухоли a (TNFa) и TNFp. Интер-
лейкин-2 участвует в поддержке пролиферации
Т-клеток, дифференцировке цитотоксических
Т-лимфоцитов (ЦТЛ) и способствует участию Тн1-
клеток в реакциях ГЗТ. связанных с отторжением
аллотрансплантата (см. гл. 16). Интерферон-у ва-
жен для активации макрофагов, мигрирующих к
месту пересадки трансплантата и вызывающих
повреждение ткани. Фактор некроза опухоли р
является цитотоксическим по отношению к транс-
плантату. Более того, IFNa, IFNp и IFNy, так же
как TNFa и TNFp, увеличивают экспрессию мо-
лекул МНС I класса, а IFNy дополнительно уси-
ливает экспрессию молекул МНС II класса на
клетках аллотрансплантата, что увеличивает эф-
фективность распознавания антигена и усилива-
ет отторжение трансплантата.
е ЛАБОРАТОРНЫЕ ТЕСТЫ,
ИСПОЛЬЗУЕМЫЕ
ПРИ ТИПИРОВАНИИ ТКАНИ
Для минимизации риска отторжения трансплан-
тата перед трансплантацией проводят лаборатор-
ные тесты по фенотипированию МНС как доно-
ра, так и реципиента (перекрестная проба). Эти
тесты часто называют тканевым типированием.
Оно заключается в анализе антигенов гистосов-
местимости (у человека — HLA) и позволяет оп-
ределить степень совместимости между двумя
индивидуумами и таким образом предсказать ис-
ход пересадки. С появлением более эффективных
иммуносупрессивных препаратов и методов под-
боры HLA-гистосовместимых донора и реципи-
ента становятся все менее и менее существенны-
ми. Однако во многих случаях (например, пере-
садка костного мозга) анализы HLA являются ре-
шающими для снижения риска отторжения транс-
плантата или, если пересаживается костный мозг,
развития РТПХ (см. далее).
Существует несколько способов определения
степени МНС-совместимости или несовместимо-
сти у донора и реципиента (см. далее). Эти спосо-
бы включают методы серологического и генного
типирования, а также функциональные тесты (ре-
акции смешанной культуры лимфоцитов) для оп-
ределения Т-клеточных пролиферативных реак-
ций реципиента на донорские аллоантигены (или,
в случае пересадки костного мозга, реакции до-
норских Т-клеток на аллоантигены реципиента).
Серологическое определение
антигенов МНС
Для определения фенотипа антигенов МНС, экс-
прессируемых на клетках, часто используются
наборы (панель) антител (HLA-специфические
антисыворотки или моноклональные антитела).
Антисыворотка иногда берется у людей, которым
много раз проводились трансплантации или пе-
реливания, или у женщин, много раз рожавших.
Эти антитела могут быть использованы для фе-
нотипирования в различных тестах, таких как сор-
тировка клеток по флуоресиинактивированной
метке (FACS) (см. гл. 5) или лимфоцитотокси-
ческий тест. В последнем тесте МНС-специфич-
ные антитела в присутствии комплемента исполь-
зуются в качестве цитотоксических антител, фик-
сирующих комплемент, способных повреждать
клетки-мишени, в частности лимфоциты. Лим-
фоциты донора и реципиента в этом тесте реаги-
руют с набором антител, специфичных к широ-
кому ряду аллелей МНС I и II классов (напри-
мер, HLA-A1, HLA-DRB1). Наличие опосредован-
ного комплементом киллинга лимфоцитов (лим-
фоцитотоксичность) указывает на то, что антите-
ла данной специфичности прореагировали с МНС
на поверхности клетки, и следовательно, клетки
являются позитивными по этому аллелю МНС.
Серологическое типирование тканей обеспечи-
вает чрезвычайно надежное определение сходства
(или отличия) между антигенами МНС донора и
реципиента. Однако поскольку количество анти-
сывороток, доступных для проведения таких тес-
тов, ограничено, всегда имеется возможность того,
что даже если тест с набором сывороток показыва-
ет «совместимость», при использовании расширен-
ного набора антисывороток или при проведении
типирования генотипа, основанного на полимераз-
ной цепной реакции (ПЦР), могут быть выявлены
различия. Об этом будет рассказано далее
Генотипирование МНС
Молекулярные методы типирования ткани в на-
стоящее время являются рутинной процедурой для
лабораторий, занимающихся тканевым типирова-
ЛАБОРАТОРНЫЕ ТЕСТЫ, ИСПОЛЬЗУЕМЫЕ ПРИ ТИПИРОВАНИИ ТКАНИ
295
нием Сегменты ДНК аплифицируются с помо-
щью ПЦР для получения количества ДНК, до-
статочного для секвенирования олигонуклеотидов
и сравнительного анализа результатов. Генетиче-
ские варианты ПЦР-амплифицированной ДНК
затем могут идентифицироваться различными
способами, такими как анализ полиморфизма
длин рестрикционных фрагментов (ПДРФ), гете-
родуплексный анализ ПЦР-продукта, анализ по-
следовательностей (секвенирование), аллельспе-
цифическое типирование олигонуклеотидов и
ПЦР с последующей гибридизацией продукта с
сайтспецифическими праймерами. Эти высоко-
чувствительные методы гораздо более точны, чем
серологическое типирование, поскольку могут рас-
познавать отличие на уровне одной аминокисло-
ты. В действительности типирование на геном-
ном уровне указывает на различия в тех случаях,
когда типирование обычными серологическими
средствами указывает на полное совпадение.
Реакция смешанной культуры
лейкоцитов
В реакции смешанной культуры лейкоцитов (СКЛ)
лейкоциты от донора и реципиента в течение не-
скольких дней культивируются вместе. Донорские
Т-клетки реагируют на аллоантигены МНС, экс-
прессируемые на клетках реципиента, стимули-
руются с последующей выработкой цитокинов и
пролиферируют в присутствии данных антигенов
(табл. 18.2). То же самое справедливо и для лей-
коцитов реципиента, которые также будут про-
лиферировать в присутствии аллоантигенов на
донорских клетках. Пролиферация обычно опре-
деляется при введении в культуру меченного ра-
диоактивными атомами нуклеотида ДНК (напри-
мер, меченного тритием тимидина). Чем больше
размах пролиферации, тем больше синтезируется
ДНК пролиферирующими клетками и тем боль-
шая радиоактивность определяется в клеточных
ДНК.
В большинстве случаев важно точно опреде-
лить, будут ли лимфоциты реципиента реагиро-
вать на донорские антигены гистосовместимости
(это гораздо важнее, чем реакция донорских лим-
фоцитов на аллоантигены реципиента). В этих
целях тест СКЛ производится как «односторон-
няя СКЛ», при которой донорские клетки обра-
батываются митомицином С или облучаются для
предотвращения их пролиферации. Таким обра-
зом, единственными клетками, обладающими спо-
собностью к пролиферации, остаются Т-клетки
реципиента. В этих условиях СВ4+-Т-клетки ре-
ципиента будут пролиферировать при их стиму-
ляции чужеродными молекулами МНС II класса.
Этот ответ приведет к продукции цитокинов, ко-
торые способствуют активации аллореактивных
цитотоксических СЭ8+-Т-клеток. Функциональ-
ная активность таких клеток в последующем может
быть определена в клетках при тесте клеточно-
опосредованной цитотоксичности (см. гл. 5 и 10).
Хотя тест СКЛ при определении гистосовме-
стимости является высокочувствительным пока-
зателем уровня совместимости между донором и
реципиентом, он является длительной процеду-
рой и для его проведения необходимо несколь-
ких дней, в то время как серологическое и моле-
кулярное типирование занимает менее 1 сут Та-
ким образом, в то время как трансплантация кле-
ток тканей и органов от живого донора может быть
отложена до получения результатов СКЛ, такого
времени может не хватить, когда органы получе-
• Таблица 18.2. Реакция смешанной культуры лейкоцитов при разных типах трансплантаций
Условие трансплантации Взаимосвязь по HLA Обработка реагирующих лейкоцитов Реакция СКЛ
Ткань от иден- тичного близ- неца Идентичны (сингенная) Отсутствует (-) Реакция отсутствует
Ткань от нерод- ственного донора Различны (аллогенная) Отсутствует (+) Интенсивность реакции зависит от степени различий по HLA между донором и реципиентом
Ткань от нерод- ственного донора Различны (аллогенная) Донорские клетки обработаны инги- битором митоза; таким образом тести- руется реактивность только клеток ре- ципиента (проводится для определе- ния сходства донор — реципиент) (+) Односторонняя СКЛ; интенсив- ность реакции зависит от степени различия по HLA между донором и реципиентом
Трансплантация костного мозга или ткани у реци- пиента с подав- ленным иммуни- тетом Различны (аллогенная) Клетки реципиента обрабатывают ингибитором митоза; таким образом тестируют реактивность только кле- ток донора (проводится для исклю- чения РТПХ) (+) Односторонняя СКЛ; интенсив- ность реакции зависит от степени отличий по HLA между донором и реципиентом
296
ГЛАВА 18. ТРАНСПЛАНТАЦИЯ
ны от недавно умершего человека. Именно поэто-
му создаются так называемые банки органов, бла-
годаря которым как только появляется необходи-
мый орган, он становится доступным для наибо-
лее подходящего реципиента.
Как указывалось ранее, при пересадке тканей
или органов все более полагаются на применение
иммуносупрессивных препаратов для увеличения
срока выживания трансплантата и все менее — на
типирование тканей. Недавно полученные резуль-
таты сравнения сроков выживания транспланта-
тов с использованием иммуносупрессивных пре-
паратов показывают, что в зависимости от пере-
саживаемой ткани различия в выживании транс-
плантата, для которого определена совместимость
или несовместимость между донором и реципи-
ентом, при типировании или перекрестном ти-
пировании, невелики, если применяется эффек-
тивная методика использования иммуносупрес-
соров.
• ПРОДЛЕНИЕ СРОКОВ ВЫЖИВАНИЯ
АЛЛОТРАНСПЛАНТАТА
Основным клиническим вопросом транспланта-
ционной иммунологии является определение того,
каким образом можно управлять компонентами
и регуляторными взаимодействиями, вовлеченны-
ми в отторжение трансплантата, чтобы обеспечить
приживление алло- или ксенотрансплантата. Для
достижения этой цели успешно использовались
неспецифические подходы с применением им-
муносупрессивных препаратов, уменьшающих
общую способность к иммунному ответу у реци-
пиента по отношению ко всем чужеродным анти-
генам. Однако необходимость в постоянном ле-
чении пациентов этими препаратами для под-
держания иммунитета в подавленном состоянии
предрасполагает таких лиц к развитию оппорту-
нистических инфекций и появлению опухолей.
Для уменьшения частоты возникновения инфек-
ции у пациентов с неспецифическим общим по-
давлением иммунитета используют химические
противомикробные препараты. Однако проблему
возникновения рака нельзя решить профилак-
тикой.
Не так давно начали проводить исследования,
направленные на разработку методов предотвра-
щения реакций только на антигены определен-
ного донора. Общей целью такого подхода яв-
ляется достижение длительной толерантности,
обеспечивающей донорспецифическую неотве-
чаемость. Как указывалось в гл. 12, существует
несколько механизмов, с помощью которых до-
стигается толерантность Т- и В-клеток к аутоан-
тигенам. Сюда входят клональная делеция, анер-
гия и супрессия. Хотя проводятся клинические
испытания, в которых методы индуцирования то-
лерантности сочетаются с традиционной имму-
• Таблица 18.3. Иммуносупрессивные препараты,
используемые при трансплантации
Группа Представитель
Ингибиторы экспрессии генов лимфоцитов Корти костериоиды Циклоспарин (неорал) FK-506
Ингибиторы трансдукции сигнала цитокинами Ahth-CD25 Рапамицин Лефлуномид
Ингибиторы синтеза нуклеотидов Азатиоприн (имуран) Меркаптопурин Хлорамбуцил Циклофосфамид
носупрессивной терапией (обсуждается далее), ни
один из этих методов пока не использовался для
замены указанного постоянного курса терапии при
трансплантации в клинике.
В табл. 18.3 приведены несколько стандартных
и экспериментальных иммуносупрессивных пре-
паратов, используемых при трансплантации.
Обычно они используются в различных комбина-
циях друг с другом для предотвращения отторже-
ния трансплантата при пересадках сердца, почек,
легких, печени и других органов и тканей.
Противовоспалительные
лекарственные средства
Сильными противовоспалительными лекарствен-
ными средствами являются кортикостероиды, та-
кие как преднизон, преднизолон и метилпреднизо-
лон. В качестве фармакологических производных
стероидных гормонов семейства глюкокортикои-
дов они оказывают физиологические эффекты
посредством прикрепления к внутриклеточным
стероидным рецепторам, экспрессированным по-
чти в каждой клетке организма. Иммуносупрес-
сивное действие кортикостероидов определяется
рядом эффектов, большинство из которых явля-
ются следствием индуцированной кортикостеро-
идами регуляции транскрипции генов. Кортико-
стероиды снижают экспрессию ряда генов, ко-
дирующих воспалительные цитокины, такие как
IL-1, IL-2, IL-3, IL-4, IL-5, IL-8, TNFa, и грану-
лоцитарно-макрофагального колониестимулиру-
ющего фактора (ГМ-КСФ). Они также подавля-
ют экспрессию молекул адгезии, вызывая подав-
ление миграции лейкоцитов к месту воспаления.
Таким образом, кортикостероиды подавляют ак-
тивность воспалительных клеток. Кроме того, они
способствуют высвобождению клеточных эндо-
нуклеаз, что приводит к индукции апоптоза лим-
фоцитов и эозинофилов. Более того, эти препа-
раты уменьшают способность макрофагов и ней-
трофилов к фагоцитозу и киллингу. а также сни-
жают экспрессию молекул МНС II класса. Таким
ПРОДЛЕНИЕ СРОКОВ ВЫЖИВАНИЯ АЛЛОТРАНСПЛАНТАТА
297
образом, кортикостероиды подавляют активацию
и функцию Т-клеток.
Следует признать, что несмотря на эти полез-
ные противовоспалительные эффекты, кортико-
стероиды также обладают сильным токсическим
действием, которое приводит к задержке жидко-
сти, увеличению массы тела, диабету, истончению
кожи и утрате костной ткани. Поэтому эффек-
тивное использование этих препаратов при конт-
роле заболевания включает разумное применение
и поддержание тщательного баланса между по-
лезным и токсическим воздействиями. Как будет
указано далее, в попытке свести применяемую дозу
и побочные токсические эффекты к минимуму и
с учетом увеличивающегося ассортимента имму-
носупрессивных препаратов кортикостероиды ча-
сто используют в комбинации с другими имму-
носупрессантами общего действия.
Цитотоксические лекарственные
средства
К антиметаболитам, подавляющим иммунный
ответ, относятся антагонисты пурина, такие как
азатиоприн, меркаптопурин и микофенолат мо-
фетил. Эти препараты вмешиваются в синтез РНК
и ДНК, подавляя инозиновую кислоту, предше-
ственника пуриновых адениловой и гуаниловой
кислот. Хлорамбуцил и циклофосфамид алкили-
руют ДНК, а также вмешиваются в ее метабо-
лизм. Эти препараты первоначально разрабаты-
вались для лечения опухолей. Обнаруженная у
них способность оказывать цитотоксическое дей-
ствие на лимфоциты обусловила их применение
в качестве иммунносупрессивных терапевтиче-
ских средств. Однако, как и предполагалось, они
обладают рядом токсических эффектов, посколь-
ку вмешиваются в синтез ДНК во многих тканях
организма. Соответственно, помимо своего им-
муносупрессивного действия эти препараты так-
же могут вызывать анемию, лейкопению, тром-
боцитопению, повреждение кишечника и выпа-
дение волос. Есть также сообщения о смертель-
ных реакциях на эти цитотоксические препара-
ты. Как указывалось ранее, наличие других им-
муносупрессивных лекарственных средств позво-
ляет применять меньшие дозы этих препаратов
при их комбинированном использовании, что
снижает токсичность терапии.
Препараты, препятствующие
продукции сигнальной функции
цитокинов
В число препаратов, вмешивающихся в функцию
цитокинов (продукцию цитокинов и опосредован-
ную цитокинами передачу сигналов), входят цик-
лоспорин FK-506 (такролимус) и рапамицин (си-
ролимус). Они обычно используются в качестве
дополнения к иммуносупрессивным антиметабо-
литам и цитотоксическим препаратам. Свои фар-
макологические эффекты эти лекарственные сред-
ства осуществляют, прикрепляясь к иммунофи-
линам В, семейству внутриклеточных белков,
участвующих в процессе передачи сигналов в
лимфоцитах. После связывания эти препараты на-
рушают процесс передачи сигналов, необходимых
для выработки клонов лимфоцитов.
Циклоспорин А (также называемый просто
циклоспорином) широко используется для по-
давления иммунитета при аллотрансплантации.
В большинстве случаев у лиц, получавших цик-
лоспорин, срок выживания гистонесовместимого
аллотрансплантата был примерно таким же, как
при подборе гистосовместимых донора и реци-
пиента. Циклоспорин является циклическим пеп-
тидом, выделенным из почвенного грибка (Tolypo-
cladium inflatum). Он увеличивает срок выживания
трансплантата, вмешиваясь в транскрипцию ци-
токинового гена в Т-клетках. Комплекс из цикло-
спорина и его цитоплазматического рецептора —
циклофилина — прикрепляется к кальциневрину
и блокирует его фосфатазную активность. Каль-
пиневрин является внутриклеточным сигнальным
белком, необходимым для транскрипционной
активации гена IL-2. Он подавляет продукцию
1L-4 и IFNa, а также синтез рецепторов IL-2
(CD25). Кроме того, известно, что он индуциру-
ет синтез TGFP — цитокина, обладающего им-
муносупрессивным действием. Циклоспорин эф-
фективен при назначении до трансплантации, но
не подходит для подавления уже начавшегося от-
торжения. Существуют свидетельства того, что
он обладает нефротоксическим действием, а так-
же повышает риск рака у пациентов, принима-
ющих его долгое время. Предполагается, что эти
и другие побочные эффекты связаны в основ-
ном со способностью циклоспорина активиро-
вать TGFP
У пациентов после трансплантации также ши-
роко используется препарат FK-506 (такролимус).
Он является макролидным веществом, получае-
мым из филаментозных бактерий Streptomyces
tsukabaenis. Макролиды — это соединения, об-
ладающие многочленным лактоновым кольцом,
к которому присоединены один или более дезок-
сисахаров. Хотя его структура значительно отли-
чается от структуры циклоспорина, их биологи-
ческая и иммуносупрессивная функции схожи.
Как и циклоспорин, FK-506 влияет на активацию
Т-клеток путем блокирования активности каль-
циневрина и связанной с этим продукции цито-
кинов.
Рапамицин (сиролимус) является другим мак-
ролидным соединением и производится из бакте-
рий Streptomyces hygroscopicus. Подобно циклоспо-
рину и FK-506 он подавляет активацию Т-кле-
ток, но действует, используя другой фармаколо-
гический механизм. Рапамицин не блокирует
активность кальциневрина, а подавляет актива-
298
ГЛАВА 18. ТРАНСПЛАНТАЦИЯ
цию Т-клеток, блокируя передачу сигнала, опо-
средованную IL-2 и другими цитокинами, но не
ингибируя продукцию IL-2.
Иммуносупрессивная терапия
антителами
Препараты антилимфоцитарных антител, такие
как лошадиный антилимфоцитарный и кроличий
антитимоцитарный глобулины (АТГ), в течение
многих лет используются в качестве дополнения
к стандартной иммуносупрессивной терапии. Хотя
такой терапевтический подход способен эффек-
тивно избавить от нежелательных лимфоцитов,
лечение людей большим количеством чужеродного
белка может индуцировать сывороточную болезнь,
вызванную формированием иммунных комплек-
сов (см. гл. 15). Несмотря на это, АТГ в насто-
ящее время используется для лечения острого от-
торжения трансплантата. Естественно, что тем, кто
старается создать новую терапевтическую мето-
дику на основе антител для лечения больных после
трансплантации, необходимо создать менее им-
муногенные антитела с одновременным сохране-
нием нужных свойств. С этой целью в настоящее
время используются химерные моноклональные
антитела мышь —человек, созданные с помошью
генной инженерии, и гуманизированные антите-
ла (см. гл. 5). Первыми мышиными моноклональ-
ными антителами, применяемыми в качестве им-
муносупрессивного препарата у человека, были
ОКТЗ, направленные против CD3, экспрессируе-
мых на Т-клетках. Позднее стали использоваться
два других химерных антитела (Daclizamab и Basi-
liximab), специфичные к ос-цепи рецептора IL-2
(CD25). Появление антител, созданных с помо-
щью генной инженерии, может иметь большие
перспективы и снизить ограничения при терапии
аллоантителами за счет минимизации антигенно-
сти этих белков.
Новые стратегии подавления
иммунитета
В настоящее время проводят исследования анти-
тел к некоторым молекулам, имеющим большое
значение для активации Т-клеток и их адгезии
(например, антитела к молекулам межклеточной
адгезии 1 — анти-ICAM-l). Было показано, что
гуманизированные мышиные антитела к CD 154
(также известному как СЭ40-лиганд) блокируют
Т-клеточную активацию и предотвращают оттор-
жение почечного аллотрансплантата у нечелове-
кообразных приматов. Другими антигенами-ми-
шенями являются костимулируюшие молекулы
В7.1 (CD80) и В7.2 (CD86). Как указывалось в
гл. 10, взаимодействие В7.1 или В7.2 с CD28 за-
пускает каскад реакций по активации Т-клеток.
Наоборот, связывание этих кости мул ирующих мо-
лекул с альтернативным лигандом CTLA-4 при-
водит к передаче ингибиторного сигнала к отве-
чающим Т-клеткам Как и предсказывалось, бло-
кирование связывания CD28 препятствует пере-
даче сигналов, необходимых для экспрессии ге-
нов и активации Т-клеток. Таким образом, анти-
тела, которые вмешиваются в активацию Т-кле-
ток, опосредованную костимулирующими моле-
кулами, могут оказаться эффективными у паци-
ентов после трансплантаций. Следует отметить,
что существует экспериментальный подход для
подавления функций этих костимулирующих мо-
лекул, для чего используют ингибиторный лиганд
CTLA-4. Во время опытов на животных было об-
наружено, что инъекция растворимого CTLA-4
позволяла обеспечить длительное выживание оп-
ределенных пересаженных тканей. Полученные
данные позволили предположить, что механизм,
ответственный за положительное воздействие
CTLA-4, включает блокирование костимуляции
Т-клеток, распознающих донорские антигены и
индуцирует таким образом состояние неотвечае-
мости (анергии).
Исходя из сказанного ясно, что в настоящее
время разрабатываются несколько эксперимен-
тальных подходов, направленных на разработку
иммуносупрессивных препаратов, которые обла-
дали бы меньшей токсичностью и не делали бы
реципиента крайне чувствительным к оппортуни-
стическим инфекциям из-за отсутствия полноцен-
ного иммунного ответа. Однако следует отметить,
что несмотря на все упомянутые эксперименталь-
ные подходы, основными препаратами, наиболее
часто используемыми в клинике для подавления
иммунитета, являются кортикостероиды, цикло-
спорин, FK-506 и азатиоприн.
• ТРАНСПЛАНТАЦИЯ КОСТНОГО
МОЗГА И ГЕМОПОЭТИЧЕСКИХ
СТВОЛОВЫХ КЛЕТОК
Попытки использования клеток костного мозга
здоровых индивидуумов для восстановления ут-
раченной функции костного мозга у больных пред-
принимаются по крайней мере уже 60 лет. Пер-
вые попытки трансплантации человеческого кост-
ного мозга были по большей степени безуспеш-
ными, поскольку еще не было научной базы для
ее успешного проведения. Пересадку костного
мозга как форму лечения начали изучать в конце
Второй мировой войны. Она представляет осо-
бую форму трансплантации, поскольку проводится
между донором с сохраненным иммунитетом и
реципиентом с нарушенным иммунитетом. Не-
редко у реципиентов выявляют тяжелый комби-
нированный иммунодефицит (ТКИД), синдром
Вискотта —Олдрича (см. гл. 17) или тяжелый лей-
коз. Они получают костный мозг от идентичных
сиблингов. Трансплантация костного мозга так-
РЕАКЦИИ «ТРАНСПЛАНТАТ ПРОТИВ ХОЗЯИНА»
299
же проводится для лечения заболеваний крови,
таких как талассемия и серповидно-клеточная
анемия, при которых наследуется мутантный ген.
Этот ген проявляет себя только в гемопоэтиче-
ских клетках, формирующих кровь. В этом смыс-
ле трансплантация для этих пациентов является
формой генной терапии: генетически дефектные
стволовые клетки, формирующие кровь, заменя-
ются нормально функционирующими клетками
Конечной целью трансплантации костного
мозга является восстановление или воссоздание
нормального гемопоэза у реципиента путем вве-
дения богатого источника гемопоэтических ство-
ловых клеток — плюрипотентной популяции, от-
вечающей за выработку всех клеток крови (эри-
троцитов, фагоцитов и тромбоцитов), а также им-
мунных клеток (лимфоцитов). Стволовые клетки
также циркулируют в крови в очень небольших
количествах. Существуют различные цитокины
(колиниестимулирующие факторы), которые уве-
личивают их количество как в костном мозге, так
и в крови. В настоящее время для получения до-
статочного количества стволовых клеток для
трансплантации проводят аппаратный гемаферез
(в некоторых случаях после предварительного воз-
действия на доноров соответствующими КСФ),
с помощью которого из больших объемов крови
выделяют популяцию клеток, содержащих ство-
ловые клетки. Поэтому периферическая кровь
становится наиболее частым источником стволо-
вых клеток для трансплантации. Таким образом,
термин «трансплантация костного мозга», кото-
рым сначала называли данную процедуру, в на-
стоящее время часто заменяется термином «транс-
плантация стволовых клеток периферической кро-
ви». хотя по-прежнему часто используется. Наибо-
лее распространенными типами трансплантации
костного мозга считаются аллогенная и аутоло-
гичная трансплантация стволовых клеток. Более
редким видом — трансплантация, выполняемая
между идентичными близнецами (сингенная
трансплантация). Такая трансплантация характе-
ризуется относительно небольшим иммунологи-
ческим риском в связи с генетической идентич-
ностью донора и реципиента.
Трансплантация аутологичных стволовых кле-
ток является важным видом терапии, хотя, строго
говоря, она не является трансплантацией, но тех-
никой получения стволовых клеток из крови или
костного мозга и возвращения их тому же инди-
видууму. В этом случае иммунологических барье-
ров для трансплантации не существует. Эта про-
цедура обычно выполняется для лечения пациен-
тов с онкогематологическими заболеваниями, та-
кими как лейкоз, лимфома или миелома Стволо-
вые клетки, взятые из костного мозга или крови,
хранятся замороженными (криоконсервация), в то
время как пациент получает интенсивную химио-
терапию и/или облучение в целях контроля над
заболеванием и снижения количества злокаче-
ственно трансформированных клеток в крови и
костном мозге. После завершения этой терапии
пациенту вводятся аутологичные стволовые клет-
ки, что приводит к восстановлению продукции
клеток крови.
Трансплантация аллогенных стволовых клеток
предусматривает использование донорских клеток,
получаемых из костного мозга, крови или пупо-
винного канатика, а также плацентарной крови,
в которых концентрация и пролиферативный по-
тенциал стволовых клеток, формирующих кровь,
даже превышают таковые в крови взрослых лю-
дей. В отличие от трансплантации аутологичных
стволовых клеток, при которой на вводимые клет-
ки не развиваются иммунные реакции, при транс-
плантации аллогенных стволовых клеток потен-
циально возможно возникновение иммунного от-
торжения, проявляющегося в двух формах: или
донорские стволовые клетки могут быть отторг-
нуты реципиентом (реакция «хозяин против транс-
плантата»), или же со стороны донорских клеток
может возникнуть иммунная реакция на антиге-
ны МНС реципиента (реакция «трансплантат про-
тив хозяина» — РТПХ; см. далее). При введении
реципиенту с сохраненным иммунитетом аллоген-
ных клеток иммунное отторжение трансплантата
Т-клетками хозяина обычно предотвращается пу-
тем интенсивного применения перед трансплан-
тацией препаратов, подавляющих иммунную систе-
му. Такое же лечение проводится и при некоторых
формах рака для уничтожения быстро размножа-
ющихся клеток опухоли (индукционная терапия).
Пациенты с заболеваниями, сопровождающими-
ся иммунодефицитом (например, ТКИД), не нуж-
даются в такой индукционной терапии, посколь-
ку риска отторжения со стороны организма хозя-
ина не существует. Для уменьшения риска РТПХ
Т-клетки практически полностью устраняются из
популяции донорских клеток. Такое удаление,
которое может быть достигнуто различными ме-
тодами (например, обработкой моноклональны-
ми антителами к Т-клеткам и комплементом),
расширяет возможность выбора донорского кост-
ного мозга.
• РЕАКЦИИ «ТРАНСПЛАНТАТ
ПРОТИВ ХОЗЯИНА»
Как указывалось ранее, трансплантация имму-
нокомпетентных лимфоцитов от донора генети-
чески отличному реципиенту может привести к
возникновению реакции, инициируемой Т-клет-
ками против антигенов МНС (и/или минорных
Н-антигенов) реципиента. Эта реакция «транс-
плантат против хозяина» особенно угрожает ли-
цам с угнетенным иммунитетом, которые не спо-
собны отторгать пересаживаемые клетки. Лучши-
ми примерами подобной ситуации являются слу-
чаи, когда клетки костного мозга пересаживают
лицам с различными иммунодефицитами или в
300
ГЛАВА 18. ТРАНСПЛАНТАЦИЯ
случаях пересадки костного мозга реципиенту с
подавленным иммунитетом. Заслуживает внима-
ния и то, что РТПХ может развиться у реципиен-
тов костного мозга даже в том случае, если донор
и реципиент хорошо совместимы по HLA-анти-
генам. Это, по-видимому, связано с отличиями
по минорным антигенам гистосовместимости ре-
ципиента, которые распознаются Т-клетками до-
нора.
У экспериментальных животных РТПХ может
привести к развитию рант-синдрома; у человека
РТПХ вызывают спленомегалию (увеличение се-
лезенки), гепатомегалию, лимфаденопатию (уве-
личение лимфатических узлов), диарею, анемию,
потерю массы тела и другие нарушения, в осно-
ве которых лежат воспаление и разрушение тка-
ней. Реакция инициируется Т-лимфоцитами до-
нора, которые распознают антигены МНС реци-
пиента (и малые Н-антигены) как чужеродные.
Донорские Т-клетки, таким образом, активиру-
ются, как при реакции на аллотрансплантат. При
РТПХ большинство воспалительных клеток, уча-
ствующих в реакции и в основном отвечающих
за разрушение ткани, являются клетками хозяи-
на, привлеченными к месту реакции цитокина-
ми, высвобождаемыми донорскими лимфоци-
тами.
• КСЕНОГЕННАЯ ТРАНСПЛАНТАЦИЯ
Считается, что более 50000 чел., нуждающихся в
трансплантации органов, умирают каждый год в
ожидании гистосовместимого донора. Для разре-
шения проблемы острой потребности в донорских
органах в настоящее время проводят исследова-
ния по использованию органов животных. По эти-
ческим и практическим соображениям виды жи-
вотных, близкородственных человеку, таких как
шимпанзе, широко не используются. В настоящее
время особое внимание уделяется свиньям, неко-
торые органы которых анатомически схожи с че-
ловеческими. Интересно, что ответ Т-клеток
человека на ксеногенные антигены МНС не так
выражен, как на аллогенные молекулы МНС.
Основной проблемой при использовании ор-
ганов свиньи и животных других видов для пере-
садки человеку является наличие естественных и
предсуществующих антител к углеводородным со-
ставляющим молекул, экспрессируемых на эндо-
телиальных клетках трансплантата. Следствием
этого является очень быстрая активация каскада
комплемента, которая ведет к сверхострому от-
торжению. Наконец, еще одним соображением,
вызывающим споры по вопросу безопасного ис-
пользования ксенотрансплантатов, является воз-
можность того, что органы и ткани животных
могут содержать вирусы, способные инфицировать
человека. Эти опасения подчеркиваются и воз-
можностью того, что пандемия ВИЧ была вызва-
на передачей вируса от обезьяны человеку. В США
в Центрах по контролю заболеваемости и других
учреждениях здравоохранения есть особые инст-
рукции по мониторингу пациентов, получивших
ксенотрансплантаты, в которых предусмотрено
использование чувствительных тестов для опре-
деления возможного присутствия вирусов.
ПЛОД: НЕОТТОРГАЕМЫЙ
АЛЛОТРАНСПЛАНТАТ
Загадочным феноменом, связанным с отторжени-
ем аллотрансплантата, является то, что плод, ко-
торый экспрессирует отцовские антигены гисто-
совместимости, отсутствующие у матери, не от-
торгается материнским организмом как аллотран-
сплантат. Очевидно, что у матери может разви-
ваться антительный ответ на антигены плода, что
проявляется присутствием анти-КИ-антител у
Rh -женщин. Более того, у женщин, перенесших
многочисленные беременности, вырабатываются
антитела к антигенам МНС отца. Однако в боль-
шинстве случаев эти антитела оказываются без-
опасными для плода, поскольку имеет место спо-
собность или, вернее, неспособность материнского
организма вырабатывать цитотоксические Т-клет-
ки против плода. Существуют свидетельства того,
что клетки фетального трофобласта, составля-
ющие наружный слой плаценты, контактирующий
с материнской тканью, не экспрессируют поли-
морфные молекулы МНС I или II классов, а экс-
прессируют только неполиморфные молекулы
МНС 1b класса — HLA-G. Таким образом, фе-
тальный трофобласт не примирует и не вызывает
развития клеточного иммунного ответа, наблю-
даемого при отторжении аллотрансплантата. Было
высказано предположение, что молекулы HLA-G
являются лигандами для ингибиторных рецепто-
ров клеток-киллеров (KIR) на материнских NK-
клетках, которые не позволяют им разрушать клет-
ки плода (см. гл. 2). Антигены HLA-G также экс-
прессируются на эпителии мозгового вещества ти-
муса, где они, по-видимому, обеспечивают толе-
рантность Т-клеток к этой молекуле. И, наконец,
в плаценте не обнаружены клетки, экспрессиру-
ющие большое количество молекул МНС II клас-
са (например, дендритных клеток).
Другими факторами, влияющими на иммун-
ный ответ и. возможно, вовлеченными во взаи-
моотношения мать —плод, могут быть цитокины,
белки, ингибирующие комплемент, и другие из-
вестные и неизвестные факторы. Еще одним фак-
тором, влияющим на выживание плода, является
а-фетопротеин, белок, синтезируемый желточным
мешком и печенью плода. Было показано, что
а-фетопротеин обладает иммуносупрессивными
свойствами. В целом плод, как и некоторые дру-
гие ткани организма, которые не инициируют
иммунный ответ или не повреждаются иммунны-
ми компонентами, относится к иммунологически
ПЕРЕСАДКА СЕРДЦА: ЛИЧНОЕ ВОСПОМИНАНИЕ
301
привилегированным областям. Получается, что за
одну из самых важных иммунологически приви-
легированных областей — плод — отвечают мно-
гие факторы. Увеличивающиеся знания об имму-
нологических механизмах, ответственных за то-
лерантность к плоду, могут дать нам возможность
по-новому взглянуть на то, каким образом можно
индуцировать толерантность к пересаживаемым
клеткам, тканям и органам.
ПЕРЕСАДКА СЕРДЦА:
ЛИЧНОЕ ВОСПОМИНАНИЕ
Один из авторов этой книги (Э. Б.) пережил пе-
ресадку сердца. Это случайное совпадение и не
является каким-либо специальным методическим
приемом. Далее описание идет от лица, пережив-
шего пересадку сердца.
Осознание того, что трансплантация сердца
стала последней возможностью сохранить жизнь,
вызвало у меня шок, несмотря на многолетнюю
кардиомиопатию. Для того чтобы меня включили
в трансплантационную программу медицинского
центра Калифорнийского университета в Сан-
Диего, я прошел около дюжины тестов, некото-
рые из которых были весьма болезненны и не-
приятны. Их проводили для того, чтобы убедить-
ся, что сердце пересаживают не в «больное» тело
или тело, в котором при длительном подавлении
иммунитета могут развиться злокачественные опу-
холи (например, кишечные полипы со временем
могут становиться злокачественными).
После всех необходимых тестов меня включи-
ли в программу, и наступил долгий период ожи-
дания подходящего для пересадки сердца. Я на-
ходился в отделении интенсивной кардиотерапии,
ожидая подходящее по группе крови и Rh-анти-
гену донорское сердце примерно 2 мес. Мое ощу-
щение времени стало размытым, я почти забыл,
почему там находился и чего ожидал. Менее тя-
желые пациенты могут ждать подходящее для пе-
ресадки сердце дома. Ожидание может длиться от
нескольких дней или недель до нескольких меся-
цев. Не все пациенты доживают до этого момента.
Наконец, координатор, отвечающий за транс-
плантацию, принес хорошую новость: есть подхо-
дящее для пересадки сердце. Этот момент был наи-
более эмоционально сложным для меня. Я осо-
знавал, что донор умер не для того, чтобы спасти
меня. Осознание того, что я получаю бесценный
дар — сердце погибшего в автокатастрофе челове-
ка — оказало на меня очень большое воздействие.
Для компетентного хирурга трансплантация
сердца является почти рутинной хирургической
процедурой. Непосредственно перед хирургиче-
ским вмешательством мне дали смесь иммуносу-
прессивных препаратов (циклоспорин, преднизон
и азатиоприн), а также антибиотики, противови-
русные и противогрибковые препараты для пред-
отвращения инфекции, обусловленной неспеци-
фическим подавлением иммунитета. Теперь я, так
же как и реципиенты других аллогенных транс-
плантатов, буду принимать эти препараты всю
оставшуюся жизнь. У таких иммуносупрессивных
препаратов есть множество тяжелых побочных
эффектов: нефротоксичность, диабет и повыше-
ние риска развития онкологических заболеваний.
Поэтому нужно постоянно определять уровень со-
держания циклоспорина в крови; побочные эф-
фекты других препаратов оценивают периодиче-
ски. Однако их эффективность подтверждает тот
факт, что я способен описывать и пересказывать
мою историю 6 лет спустя после трансплантации.
Есть надежда, что в будущем появятся более
подходящие и эффективные иммуносупрессивные
препараты, и аллотрансплантация и даже ксено-
трансплантация станут менее опасными. Мы уве-
рены, что продолжающиеся исследования в этой
области обеспечат еще более высокий уровень
жизни пациентов, переживших трансплантацию.
РЕЗЮМЕ
1, Аллореактивные Т-клетки (клеточно-опосредо-
ванный иммунитет) являются основными клетками,
ответственными за отторжение аллотрансплантата (и
ксенотрансплантата). Антитела, специфичные к алло-
антигенам, отвечают за сверхострое отторжение; они
также могут участвовать в других видах отторжения.
2, Наиболее важными трансплантационными анти-
генами, которые вызывают быстрое отторжение ал-
лотрансплантата, являются продукты МНС донора, ко-
торые у человека называются HLA, а у мыши — Н-2.
Генетические различия между донором и реципиен-
том также могут привести к образованию аллогенных
клеточных пептидов (минорных Н-антигенов), презен-
тируемых молекулами МНС реципиента Т-клеткам
Реакции на эти аллогенные белки могут также приво-
дить к отторжению трансплантата.
3. Существуют два механизма распознавания ал-
лоантигенов Т-клетками организма: 1) прямое рас-
познавание, при котором донорские АПК стимулируют
аллореактивные Т-клетки; 2) непрямое распознава-
ние, при котором АПК реципиента процессируют и
презентируют аллогенные пептиды, происходящие из
донорских тканей или органов.
4, Уровень гистосовместимости между донором и
реципиентом может быть определен серологическим
или, что более распространено, молекулярным типи-
рованием ткани, а также с помощью СКЛ.
5. Выживание аллотрансплантатов продлевается,
если использовать комбинацию иммуносупрессивных
препаратов, таких как противовоспалительные, цито-
токсические препараты и антиметаболиты, а также
вещества, нарушающие продукцию IL-2 и опосредо-
ванную цитокинами передачу сигналов. Новые подхо-
ды включают применение биологических препаратов,
блокирующих костимулирующие молекулы, связанные
с активацией Т-клеток.
6- Плод является естественным аллотранспланта-
том, в отношении которого существует толерантность.
302
ГЛАВА 18. ТРАНСПЛАНТАЦИЯ
Есть множество факторов, обусловливающих эту фор-
му толерантности, включая отсутствие молекул МНС
I и II классов на клетках фетального трофобласта и
«отсутствие» экспрессии МНС II класса на клетках
плаценты.
ТЕСТЫ
Выберите ОДИН НАИБОЛЕЕ ПРАВИЛЬНЫЙ ответ
на каждый тест.
1 - Серологическое типирование ткани перед транс-
плантацией почки показало, что лейкоциты возможно-
го реципиента разрушаются в присутствии компле-
мента следующими анти-Н1_А-антителами: анти-В27,
анти-А1 и анти-АЗ. На основании полученных резуль-
татов можно сделать следующее заключение:
а) возможный реципиент экспрессирует В27, А1 и
АЗ Н1_А-специфичности;
б) возможный реципиент не экспрессирует В27,
А1 и АЗ HLA-специфичности;
в) потенциальный донор и возможный реципиент
не являются сиблингами;
г) возможный донор и возможный реципиент не
являются идентичными близнецами;
д) возможный реципиент не должен получить
трансплантат почки, экспрессирующий эти HLA-спе-
цифичности.
2. При клинической трансплантации предсуще-
ствующие цитотоксические антитела, реактивные в
отношении антигенов МНС, экспрессируемых на пе-
ресаженной ткани, вызывают:
а) хроническое отторжение;
б) сверхострое отторжение;
в) острое отторжение;
г) гиперчувствительность замедленного типа;
д) никаких серьезных осложнений.
3. Главный комплекс чистосовместимости не со-
держит гены:
а) кодирующие трансплантационные антигены;
б) кодирующие иммуноглобулины;
в) регулирующие иммунную реактивность;
г) кодирующие некоторые компоненты компле-
мента;
д) кодирующие антигены I и II классов.
4. Укажите неверное утверждение в отношении
РТПХ:
а) РТПХ может быть результатом различий донора
и реципиента по МНС;
б) для появления РТПХ необходимы иммунокомпе-
тентные донорские клетки;
в) РТПХ может стать результатом введения продук-
тов крови, содержащих живые лимфоциты, реципиен-
ту с нарушенным иммунитетом;
г) для развития РТПХ необходимы натуральные
киллеры;
д) РТПХ может развиться у лиц с подавленным им-
мунитетом.
5. В отторжении трансплантата может участвовать:
а) клеточно-опосредованный иммунитет;
б) гиперчувствительность III типа (иммунных комп-
лексов);
в) комплементзависимая цитотоксичность;
г) высвобождение IFNy аллореактивными ТН1 -клет-
ками;
д) все перечисленное.
6- Укажите правильное утверждение, касающееся
СКЛ:
а) в СКЛ происходит пролиферация клона аллоре-
активных В-клеток;
б) в СКЛ происходит пролиферация клона аллоре-
активных Т-клеток;
в) СКЛ между неродственными индивидуумами,
различающимися по данным серологического HLA-ти-
пирования, обычно является отрицательной;
г) стимуляция пролиферации контролируется пре-
имущественно аллелями HLA-A-области;
д) все перечисленное.
7, Клиническое исследование эффективности гу-
манизированных анти-СО28 моноклональных антител
для продления срока выживания аллотрансплантата
почки показало, что у пациентов, получавших этот
биологический препарат, хроническое отторжение от-
мечается гораздо реже. Возможный механизм, ответ-
ственный за этот эффект, лучше всего объясняется:
а) прикреплением анти-СО28 к В-клеткам, что бло-
кирует их взаимодействие с В7.1 и В7.2, экспресси-
рованными на Т-клетках;
б) формированием циркулирующих иммунных ком-
плексов CD28 —анти-СО28;
в) прикреплением анти-СО28 к Т-клеткам, что на-
рушает передачу сигналов, необходимую для актива-
ции Т-клеток;
г) прикреплением анти-СО28 к супрессорным
Т-клеткам, которые при этом активируются;
д) прикреплением анти-СО28 к В- и Т-клеткам, что
нарушает передачу сигналов и активацию обеих попу-
ляций.
СИТУАЦИОННАЯ ЗАДАЧА
В больницу доставили мальчика 3 лет, страдающе-
го от аплазии костного мозга, возникшей после от-
равления бензолом. Содержание всех элементов кро-
ви находилось на низком уровне, и смерть была неиз-
бежна. Ребенка и его более взрослого сиблинга (бра-
та или сестру) немедленно протипировали. У обоих
выявили эритроцитарные антигены А+, Rh+ и фенотип
HLA-A3,9: В7,8. Костный мозг от сиблинга пересадили
его младшему брату. В течение нескольких дней пока-
затели красной крови улучшились, что указывало на ус-
пешное приживление. Однако 3 недели спустя у ребен-
ка началась диарея и появилась кожная сыпь на ладонях
и подошвах стоп, распространившаяся на туловище
Вслед за этим началась желтуха, увеличились печень и
селезенка. После введения анти-СОЗ моноклональных
антител и циклоспорина состояние несколько улучши-
лось. Что ухудшило состояние и почему?
ОТВЕТЫ НА ТЕСТЫ
1 — а. Эти показатели являются результатом лим-
фотоксического теста. Гибель клеток после их инкуба-
ции вместе с МНС-специфичными антителами и ком-
ТЕСТЫ
303
плементом указывает на то, что они экспрессируют
антигены МНС, для которых эти антитела являются
специфичными — в данном случае к детерминантам
МНС I класса А1, АЗ и В27. Результаты ничего не го-
ворят о взаимоотношениях между донором и реципи-
ентом, поэтому ответы «в» и «г» неверны. Вариант «д»
неверен, поскольку для такого заключения нет инфор-
мации об антигенах МНС реципиента.
2 — 6. Сверхострое отторжение вызывается пред-
существующими цитотоксическими антителами, фик-
сирующими комплемент, которые вызывают актива-
цию и депонирование тромбоцитов, что ведет к отеку
и кровоизлиянию в пересаженную ткань Это быстро
приводит к уменьшению кровотока в ткани и оконча-
тельному отторжению трансплантата. Ответы «а», «в»
и «г» указывают на участие Т-клеток и поэтому невер-
ны. Вариант «д» неверен по очевидным причинам
3 — б. Комплекс МНС содержит все упомянутые
гены, кроме генов, кодирующих иммуноглобулины.
Они находятся на других хромосомах.
4 — г. Реакция «трансплантат против хозяина» вы-
зывается посредством разрушения клеток или тканей
реципиента с угнетенным иммунитетом иммунокомпе-
тентными лимфоидными клетками, перенесенными от
гистонесовместимого донора. Для РТПХ не нужно при-
сутствия NK-клеток.
5 — д. Все ответы верны Важным процессом при
отторжении аллотрансплантата является клеточно-опо-
средованный иммунный ответ. В данном случае Т-клет-
ки, которые распознают аллоантигены, активируются;
они высвобождают цитокины, одним из которых явля-
ется IFNy, привлекающий и активирующий фагоцитар-
ные клетки, которые совместно с цитотоксическими
Т-клетками разрушают трансплантат. Однако в реакции
на аллотрансплантат могут также участвовать антитела
(IgM и IgG), которые способны вызывать повреждение
ткани посредством активации комплемента и привле-
чения полиморфно-ядерных клеток к месту реакции.
Эти клетки могут повреждать трансплантат путем выс-
вобождения своих лизосомальных ферментов.
6 — б. В СКЛ происходит пролиферация аллоре-
активных Т-клеток, которые распознают чужеродные
антигены МНС, экспрессируемые на клетках реципиен-
та, используемых в исследовании. Хотя клоны В-кле-
ток могут также размножаться, основная клеточная
экспансия осуществляется Т-клетками. Реакция СКЛ
между неродственными индивидуумами, которые раз-
личаются по результатам серологического HLA-тести-
рования, чаще положительная, чем отрицательная.
Таким образом, верен только ответ «б».
7 — в. Экспериментальные модели показали что
введение мышам с аллотрансплантатами монокло-
нальных антител анти-СО28 действительно увеличива-
ет время выживания аллотрансплантата. Блокирова-
ние связывания CD28 нарушает передачу сигналов,
необходимую для экспрессии генов (например, синте-
за IL-2) и активации Т-клеток. Лиганды CD28, В7.1
(CD80) и В7.2 (CD86) являются костимулирующими
молекулами, которые экспрессируются на АПК, при-
водя к активации Т-клеток.
ОТВЕТ НА СИТУАЦИОННУЮ ЗАДАЧУ
Симптомы типичны для РТПХ. Срочное обследова-
ние, вероятно, включало только серологическое типи-
рование, а типирование молекул МНС II класса с по-
мощью ПЦР-генотипирования или СКЛ не проводили.
Кроме того, не провели деплетирования зрелых
Т-клеток из костного мозга донора. Вероятно, гисто-
несовместимость между донором и реципиентом выз-
вала атаку донорских Т-клеток на клетки реципиента,
что привело к появлению указанных клинических симп-
томов. Лечение, направленное на уничтожение и по-
давление активированных донорских Т-клеток, не так
эффективно, как их устранение из трансплантата.
Глава
I ИММУНОЛОГИЯ ОПУХОЛЕЙ
ВВЕДЕНИЕ
Иммунные ответы на появляющиеся опухолевые
клетки развиваются по большей части к таким
компонентам, которые экспрессируются на по-
верхности злокачественных клеток, но не на нор-
мальных клетках того же типа и при этом облада-
ют антигенными свойствами. В 1943 г. Гросс
(Gross) сделал наблюдение, что при подкожном
введении опухолевых клеток сингенным (гисто-
совместимым) мышам эти клетки формировали
небольшие узелки, которые в течение нескольких
дней росли, после чего регрессировали. Повтор-
ное введение аналогичных клеток этим мышам
не приводило к образованию узелков или их рос-
ту. Эти наблюдения интерпретировали таким об-
разом, что отторжение опухоли мышами проис-
ходило в связи с появлением иммунного ответа
на опухоль. Впоследствии на многих опухолях как
человека, так и животных были выявлены опу-
хольспецифичные трансплантационные антигены
(ОСТА) или, как их чаще называют, опухолевые
антигены.
В этой главе основное внимание уделено роли
иммунной системы в разрушении клеток опухо-
ли. Считается, что на протяжении жизни у каж-
дого человека возникают опухолевые клетки, ко-
торые затем разрушаются обычными иммунными
эффекторными механизмами незаметно и без по-
следствий. Очевидно, что иммунологические ме-
ханизмы, которые, уничтожая опухолевые клет-
ки, противостоят угрозе развития рака, не всегда
успешно с этим справляются. Однако есть надеж-
да, что рост знаний об эффекторных механизмах
организма, задействованных в иммунологическом
надзоре, позволит по-новому взглянуть на то, как
можно было бы предотвращать образование опухо-
лей и успешнее их лечить. Таким образом, в обла-
сти онкоиммунологии целями являются: 1) выяв-
ление иммунологической взаимосвязи между орга-
низмом и опухолью; 2) использование иммунно-
го ответа на опухоль в целях диагностики, про-
филактики и терапии. В данной главе обсужда-
ются различные подходы к достижению этих це-
лей.
ОПУХОЛЕВЫЕ АНТИГЕНЫ
Достижения в области иммунологии и молекуляр-
ной биологии позволили значительно облегчить
идентификацию опухолевых антигенов, способ-
ных вызывать иммунный ответ Перед тем как
определить их категории, следует уточнить основ-
ные биологические механизмы, такие как мута-
ция, активация генов и амплификация клона, ко-
торые могут приводить к появлению иммуноген-
ных опухолевых антигенов. Как и при обычном
иммунном ответе на чужеродные антигены, им-
муногенный потенциал опухолевых антигенов
проявляется тогда, когда их экспрессия стимули-
рует иммунные эффекторные механизмы. Анти-
генные характеристики, применимые к чужерод-
ным иммуногенам, относятся и к опухолевым ан-
тигенам. Как указывалось в гл. 3, чтобы быть им-
муногенным, вещество должно обладать следу-
ющими свойствами: 1) чужеродность; 2) большая
молекулярная масса; 3) сложность химического
строения; 4) способность к расщеплению вместе
со способностью взаимодействовать с антигена-
ми МНС организма. Иммуногенные опухолевые
антигены соответствуют всем этим критериям и,
таким образом, обладают способностью индуци-
ровать эффекторные реакции.
Некоторые опухолевые антигены могут состо-
ять из структур, уникальных для раковых клеток
и не встречающихся на нормальных клетках та-
кого типа. Другие представляют собой структу-
ВИДЫ ОПУХОЛЕВЫХ АНТИГЕНОВ
305
ры, которые являются общими и для опухоле-
вых, и нормальных клеток, но в нормальных клет-
ках они скрыты, а на злокачественных проявля-
ются. Существуют также антигены, которые пред-
ставляют на опухолевых клетках структуры, каче-
ственно не отличающиеся от структур на нормаль-
ных клетках, но избыточно экспрессированных,
т.е. присутствующих в значительно большем ко-
личестве как продукты клеточных онкогенов. При-
мером является высокий уровень экспрессии ре-
цепторов эпидермального фактора роста челове-
ка (human epidermal growth factor receptor —
HER), обусловленный повышенной экспрессией
онкогена Н ER-2/пей-1 (например, при некоторых
видах рака молочной железы и яичников), а так-
же повышенное содержание продуктов онкогенов
ras на некоторых клетках при раке предстатель-
ной железы у человека. Другие типы антигенов на
злокачественных клетках представляют структуры,
присутствующие на клетках плода или эмбриона,
но отсутствующие в норме на клетках взрослого
человека. Такие антигены относят к онкофеталь-
ным антигенам. Канцерогены могут активировать
и нормальные гены, находившиеся до этого в не-
активном состоянии. Обычно считается, что уни-
кальные опухолевые антигены на опухолях, ин-
дуцированных канцерогенами, являются продук-
тами мутантных генов, обладающих «горячими
точками» для мутаций. Между опухолями, инду-
цированными канцерогенами, перекрестная ре-
активность или отсутствует, или очень невелика.
Отсутствие перекрестной реактивности, вероят-
но, обусловлено беспорядочностью мутаций, ин-
дуцированных химическими или физическими
канцерогенами, приводящих к появлению мно-
жества различных антигенов. Например, если хи-
мический канцероген метилхолантрен наносится
одинаковым образом на кожу двух генетически
идентичных животных или на два разных участка
кожи одного животного, то клетки развивающих-
ся опухолей (сарком) будут обладать антигенами,
уникальными для каждой опухоли и не облада-
ющими иммунологической перекрестной реактив-
ностью между собой. При индукции опухолей
физическими факторами, такими как ультрафио-
летовое или рентгеновское излучение, как и в
случае индукции химическими агентами, перекре-
стная реактивность отсутствует или очень неве-
лика.
Канцерогены могут также вызывать появление
обширного клона из единичной клетки, экспрес-
сирующей частный нормальный антиген, и пре-
образовывать неиммуногенную при других усло-
виях молекулу в иммуногенный антиген. Вызван-
ное канцерогеном трансформационное измене-
ние^), которое приводит к появлению таких об-
ширных клонов, скорее всего, действует на гены,
обладающие склонными к мутациям «горячими
точками», и не затрагивает гены, отвечающие за
другие нормальные белки. Когда эти нормальные
белки являются клонотипическими (т.е. экспрес-
сируемыми только одним клоном клеток), их экс-
прессия резко увеличивается, делая белки мише-
нями для иммунного ответа при условии, что то-
лерантность может быть нарушена. Например,
идиотипы антигенспецифичных рецепторов, эк-
спрессируемых В- или Т-клетками, могут быть
представлены в недостаточном количестве, что-
бы вызвать ответ в нормальном организме, но
могут стать антигенами-мишенями на опухолевых
клетках, имеющих такой же идиотип.
Особенно наглядно опухолевые антигены мо-
гут быть представлены на примере опухолей, выз-
ванных вирусами, которые склонны обладать пе-
рекрестной реактивностью с опухолями, индуци-
рованных теми же вирусами. Некоторые предста-
вители семейства вирусов герпеса и ретровирусы,
которые инфицируют, но не убивают инфициро-
ванные клетки, могут стимулировать контроли-
руемый рост таких инфицированных клеток. Не-
которые примеры подобных онкогенных вирусов
обсуждаются далее в этой главе.
В следующих двух подразделах представлены
обзоры и примеры различных категорий опухо-
левых антигенов и иммунных эффекторных ме-
ханизмов, играющих роль в физиологическом
процессе предотвращения развития опухолевых
клеток. Увеличивающиеся знания в этих областях
опухолевой иммунологии способствуют разработке
клинически эффективных опухольспецифических
методов иммунотерапии.
Я ВИДЫ ОПУХОЛЕВЫХ АНТИГЕНОВ
Существует несколько видов опухолевых антиге-
нов (табл. 19.1). Они различаются как по факто-
рам, вызывающим опухолевую трансформацию,
так и по иммунохимическим свойствам опухоле-
вых антигенов.
Продукты генов нормальных клеток
Некоторые опухолевые антигены являются про-
дуктами нормальных генов, которые в обычных
условиях экспрессируются только во время эмб-
риогенеза, — так называемые онкофетальные ан-
тигены. Примером таких опухолевых антигенов
является семейство белковых антигенов, ассоци-
ированных с меланомой (melanoma-associated
antigen — MAGE), которые не экспрессируются
ни в одной нормальной ткани взрослого человека
за исключением яичек (иммунологически приви-
легированная область). Антигены MAGE рассмат-
риваются как антигены, которые могут использо-
ваться при создании противоопухолевых вакцин,
поскольку их экспрессия выявлена на многих
меланомах. Действительно, как и у многих дру-
гих опухольспецифичных антигенов, у MAGE-1
были обнаружены HLA-рестрикционные элемен-
ты антигенных эпитопов. В настоящее время эта
306
ГЛАВА 19. ИММУНОЛОГИЯ ОПУХОЛЕЙ
• Таблица 19.1. Виды опухолевых антигенов
Вид Тип антигена Название антигена Вид опухолей
Продукты нормальных клеточных генов: эмбриональные дифференнировочные клональная амплифи- кация Онкофетальные антигены Нормальные внутрикле- точные ферменты Онкопротеин Углеводород Идиотип иммуно- глобулина MAGE-1 MAGE-2 Раковоэмбриональный антиген а-Фетопротеин Простатоспецифический антиген Тирозиназа HER-2/neu Антиген Льюиса Специфические антитела клона В-клеток Несколько Несколько Рак легких, поджелудочной железы, молочной железы, ободочной кишки, желудка Рак печени, яичка Рак простаты Меланома Рак молочной железы, яичников Лимфома Лимфома
Продукты мутировавших клеточных генов: точечные мутации Продукт онкогена Продукт гена-супрессора Циклинзависимая киназа Мутантные белки RAS Мутантный р53 Мутантная циклинзави- симая киназа 4 Несколько Несколько Меланома
Продукты вирусного гена: трансформирующий вирусный ген Ядерные белки Белки Е6 и Е7 вируса папилломы человека Рак шейки матки
информация используется в экспериментах, на-
правленных на создание вакцин на основе иммуно-
генных опухолевых пептидов, которые могут пре-
зентироваться антигенами МНС I класса на АПК
для активации цитотоксических (CD8+) Т-клеточ-
ных ответов.
Другими примерами онкофетальных антигенов
являются раковоэмбриональный антиген (РЭА) и
а-фетопротеин (осФП). Первый антиген обнару-
живается преимущественно в сыворотке крови
больных с опухолями ЖКТ, особенно с раком
ободочной кишки. Повышенный уровень РЭА был
также обнаружен в крови больных некоторыми
видами рака легких, поджелудочной железы, мо-
лочной железы и желудка. Однако следует заме-
тить, что повышенные уровни РЭА были выявле-
ны у пациентов с незлокачественными заболева-
ниями, такими как эмфизема, язвенный колит и
панкреатит, а также в сыворотке крови алкоголи-
ков и много курящих людей. В норме аФП при-
сутствует в больших концентрациях в фетальной
и материнской сыворотке, но не встречается в сы-
воротке обычных людей. Этот белок активно сек-
ретируется клетками различных злокачественных
опухолей; он преимущественно обнаруживается у
пациентов с гепатомами и тератокарциномам и
яичек.
Наконец, амплифицированные клоны злока-
чественных В- или Т-клеток, экспрессирующих
антигенспецифичные рецепторы, представляют
еще один пример того, как продукты нормальных
клеточных генов могут характеризоваться как опу-
холевые антигены. Идиотип определенного им-
муноглобулина или Т-клеточный рецептор (TCR),
экспрессируемый трансформированными В- или
Т-клетками, соответственно позволяют эффектив-
но идентифицировать такой клон как особую по-
пуляцию злокачественных клеток.
Продукты мутантных клеточных генов
Определена генная природа некоторых особых
опухолевых антигенов, которые являются продук-
тами мутантных генов. В каждом случае антиген
появлялся в результате соматической мутации, т.е.
в результате генетического изменения, отсутству-
ющего в аутологичной нормальной ДНК. Часто
эти мутации происходят в генах, кодирующих
функционально важные участки экспрессируемого
белка. Существует ряд хорошо описанных при-
меров опухолевых антигенов, являющихся про-
дуктами мутантных клеточных генов. Хрониче-
ский миелолейкоз (ХМЛ) характеризуется наличи-
ВИДЫ ОПУХОЛЕВЫХ АНТИГЕНОВ
307
ем филадельфийской хромосомы — укороченной
хромосомы 22, получившейся в результате взаим-
ной транслокации гена Ьсг на хромосоме 22 и гена
аЫ на хромосоме 9 (t(9; 22)). Молекулярный эк-
вивалент t(9; 22) может быть обнаружен практи-
чески во всех случаях ХМЛ. Он проявляется экс-
прессией слившегося гена bcr/abl. кодирующего
химерные РНК, которые приводят к значитель-
ному увеличению тирозинкиназной активности
гена аЫ. Этот химерный ген, по крайней мере,
частично отвечает за неконтролируемую проли-
ферацию клеток. Недавние клинические испыта-
ния, в которых использовался сильный ингиби-
тор тирозинкиназы, продукта Ьсг/аЬЦ показали
возможность индукции полных гематологических
ремиссий у значительной части больных ХМЛ.
Другим примером является продукт мутантно-
го клеточного гена, встречающийся во многих
случаях семейной меланомы. Это заболевание ас-
социировано с мутацией в гене циклинзависимой
киназы 4 (cycline-dependent kinase — CDK-4), ко-
торая уменьшает ее связывание с ингибитором
(p!6INK-4), являющимся подавляющим опухоль
белком. Еще одним примером опухолевого анти-
гена, возникшего в результате мутации клеточно-
го гена, является мутантный белок р53. Мутация
р53 часто приводит к структурным изменениям
белка р53а, который в норме подавляет клеточ-
ный рост. Мутации р53 являются одними из са-
мых частых при опухолях у человека и экспери-
ментальных животных. Обычно они возникают в
эволюционно консервативных областях гена р53
и приводят к избыточной продукции белка, кото-
рый является антигеном для В- и Т-клеток. Отве-
ты со стороны антител и Т-клеток также наблю-
даются, когда мутации происходят в белках, ко-
дируемых онкогеном ras. Мутантные белки ras.
появляющиеся в результате замены остатка гли-
цина в положении 12, являются также одними из
наиболее распространенных мутаций при опухо-
лях человека.
Возможность применения мутантных белков в
качестве иммунологических мишеней при лече-
нии лучше всего показали эксперименты, в кото-
рых in vivo был индуцирован иммунитет к опухо-
ли путем вакцинации против мутантных пепти-
дов р53, когда их вводили одновременно с IL-12.
Поскольку р53 обычно экспрессируется раковы-
ми клетками, Т-клетки, распознающие нормаль-
ный р53, преимущественно уничтожают опухоле-
вые клетки. Более того, у мышей, «нокаутных»
по гену р53, можно индуцировать продукцию
цитотоксических Т-клеток, специфичных в отно-
шении нормального р53. При адоптивном пере-
носе мышам линий, имеющих ген р53 дикоко типа
(т.е. с сохранным геном р53), они могут разру-
шать опухоли, избыточно экспрессирующие р53.
При этом никаких признаков аутоиммунитета в
организме не развивается.
Опухолевые антигены,
кодируемые онкогенами
Хотя обсуждение всего процесса канцерогенеза не
является целью данной главы, имеет смысл крат-
ко изложить положения теории онкогенов для луч-
шего понимания свойств белков, производных он-
когенов, способных стать опухолевыми антигена-
ми. Известно, что все ретровирусные онкогены в
геномах почти всех нормальных клеток позвоноч-
ных имеют близкородственные гены, называемые
с-олс-генами или протоонкогенами. Было установ-
лено, что генными продуктами протоонкогенов
являются белки, выполняющие в нормальных
клетках известные функции, такие как функции
рецепторов факторов роста и проведение сигна-
лов. Теория онкогенов постулирует, что такие
протоонкогены при мутации или активации дру-
гими аберрантными (измененными, отличными
от нормальных) механизмами либо избыточно
экспрессируются, либо экспрессируют несоответ-
ствующие мутантные формы генных продуктов,
что вызывает неопластическую трансформацию и
развитие рака. Онкогены аберрантно активиру-
ются в соматических клетках при многих формах
опухолей человека, таких как рак, саркома, лей-
коз и лимфома. Основными механизмами акти-
вации являются хромосомная транслокация, то-
чечная мутация и амплификация гена. В табл. 19.2
представлен неполный список протоонкогенов и
связанных с ними опухолей.
Опыты на животных показали, что опухоли,
вызванные вирусами, демонстрируют выраженную
• Таблица 19.2. Активация клеточных протоонкогенов при опухолях человека
Протоонкогены Механизм активации Изменение хромосом Ассоциированный вид опухоли
с-тус Генетическая реаранжировка Транслокация: 8—14, 8 — 2 или 8 — 22 Лимфома Беркитта
с-аЫ Генетическая реаранжировка Транслокация 9 — 22 ХМЛ
c-H-ras Точечная мутация — Рак мочевого пузыря
c-K-ras Точечная мутация — Рак легких или ободочной кишки
N-myc Амплификация гена — Нейробластома
308
ГЛАВА 19. ИММУНОЛОГИЯ ОПУХОЛЕЙ
иммунологическую перекрестную реактивность.
Это обусловлено тем, что определенный онкоген-
ный вирус индуцирует экспрессию одинаковых
антигенов в опухоли независимо от ткани, в ко-
торой она возникает, или от вида животного. На-
пример, у животных ДНК-вирусы, такие как по-
лиомавирусы, вирусы SV40 и папилломы Шоупа,
вызывают опухоли, которые проявляют выражен-
ную перекрестную реактивность в своей группе
вирусов. Многие вирусы, вызывающие лейкоз,
такие как вирус Раушера, вызывают образование
опухолей, проявляющих перекрестную реактив-
ность не только в одной группе вирусов, но так-
же между несколькими группами. По этому во-
просу накоплено достаточно данных, чтобы пред-
положить, что некоторые злокачественные опу-
холи человека вызываются вирусами, такими как
вирус Эпштейна—Барр (лимфома Беркитта и на-
зофарингеальный рак), вирус Т-клеточного лейко-
за человека 1-го типа (Т-клеточный лейкоз взрос-
лых. HTLV-1) и вирус папилломы человека (рак
шейки матки).
Можно предположить, что вирусные белки,
которые в конечном итоге являются уникальны-
ми опухолевыми антигенами, экспрессируются
внутриклеточно преимущественно как нуклео-
протеины. Для того чтобы цитотоксические Т-лим-
фоциты (ЦТЛ) распознали эти антигены, послед-
ние должны процессироваться и презентировать-
ся как пептиды, ассоциированные с МНС. Опы-
ты с использованием ЦТЛ, специфичных к SV40,
подтвердили, что такие клетки могут распозна-
вать процессированные фрагменты белков, кото-
рые первоначально располагались внутриклеточ-
но. Интенсивно исследовали уникальные опухо-
левые антигены клеток, трансформированных
SV40 и некоторыми другими вирусами, такими
как вирус полиомы, аденовирус и вирус папилло-
мы человека, и в некоторых случаях доказали чет-
кую взаимосвязь с трансформированным фено-
типом и возникновением злокачественной транс-
формации. Такие вирусы имеют так называемые
гены ранних участков, обозначаемые Е1А/Е1В и
Е6/Е7, которые транскрибируются как на ранних
стадиях репликации вируса, так и в трансформи-
рованных клетках. Как и прочие категории опу-
холевых антигенов, эти белки являются потенци-
альными мишенями для терапии.
Иммунологические факторы, влияющие
на частоту возникновения рака
В конце 1950-х гг. появилась гипотеза, помога-
ющая объяснить основную причину возникнове-
ния в процессе эволюции позвоночных иммуни-
тета, опосредованного Т-клетками. Было выска-
зано предположение, что основной функцией им-
мунитета, опосредованной Т-клетками, было обес-
печение специфической зашиты от измененных
собственных или неопластических клеток. Для
описания концепции иммунологической зашиты
от развития рака был введен термин «иммуноло-
гический надзор». В настоящее время известно, что
Т-клеточный иммунитет необходим для защиты
от различных инфекций, в первую очередь ви-
русных. В результате опытов на животных, так же
как эпидемиологических и иммунологических
исследований пациентов с различными формами
иммунодефицита (первичного, вторичного или
приобретенного), появились свидетельства, под-
тверждающие данную гипотезу, но только по от-
ношению к новообразованиям, связанным с ви-
русами и в некоторых случаях — с ультрафиоле-
товым облучением. При этом частота наиболее
распространенных форм рака у лиц с недостаточ-
ностью иммунитета не увеличена. Однако паци-
енты, страдающие заболеваниями, сопровожда-
ющимися иммунодефицитом, обычно подверже-
ны вирусным инфекциям и определенным зло-
качественным новообразованиям (табл. 19.3).
Явное отсутствие иммунологического надзора за
спонтанно развивающимися опухолями или опу-
холями, вызванными канцерогенами, не означает
того, что они не являются антигенными. В дей-
ствительности существует достаточно свидетельств
в поддержку вывода, что такие опухолевые клет-
ки, как и трансформированные вирусами, чувстви-
• Таблица 19.3. Злокачественные новообразования, частота которых повышена у людей с иммунодефицитом
Тип иммунодефицита Опухоль Ассоциированный вирус
Первичный (врожденный) Гепатоцеллюлярный рак В-клеточная лимфома Гепатита В Эпштейна — Барр
Вторичный, вызванный лекарствами В-клеточная лимфома Плоскоклеточный рак (кожа) Гепатоцеллюлярный рак Рак шейки матки Эпштейна — Барр Папилломы человека Гепатита В Папилломы человека
СПИД Гепатоцеллюлярный рак Рак прямой кишки или полости рта В-клеточная лимфома Гепатита В Папилломы человека Эпштейна — Барр
ЭФФЕКТОРНЫЕ МЕХАНИЗМЫ ПРОТИВООПУХОЛЕВОГО ИММУНИТЕТА
309
• Таблица 19.4. Эффекторные механизмы противоопухолевого иммунитета
Эффекторный механизм Комментарий
Антитела и В-клетки (лизис, опосредо- ванный комплементом, опсонизация) Роль в противоопухолевом иммунитете недостаточно изучена
Т-клетки (цитолиз, апоптоз) Решающее значение в отторжении опухолей, индуцированных вирусами или химическими веществами
NK-клетки (цитолиз, АЗКЦ, апоптоз) Клетки опухоли, не экспрессирующие ни одной из аллелей МНС I класса, эффективно отторгаются NК-клетками
ЛАК-клетки (цитолиз, апоптоз) Противоопухолевые реакции при некоторых видах рака у человека развиваются вслед за адоптивным переносом ЛАК
Макрофаги и нейтрофилы (цитостаз, цитолиз, фагоцитоз) Могут активироваться бактериальными продуктами и разрушать клетки опухоли или подавлять их рост
Цитокины (апоптоз, привлечение клеток, участвующих в воспалении) Подавления роста можно добиться при адоптивном переносе опухо- левых клеток с определенными цитокинами (например, ГМ-КСФ)
тельны к иммуннологическому разрушению. Од-
нако естественное развитие иммунных ответов
обычно не может предотвратить развитие рака.
Есть надежда, что успешное управление такими
ответами (например, вакцинация опухолевыми ан-
тигенами) позволит в будущем предотвращать или
лечить опухоли.
I ЭФФЕКТОРНЫЕ МЕХАНИЗМЫ
ПРОТИВООПУХОЛЕВОГО
ИММУНИТЕТА
До недавнего времени большую часть информа-
ции, касающейся противоопухолевых иммунных
механизмов и их способности разрушать опухо-
левые клетки, получали в экспериментах с пере-
виваемыми опухолями животных или в экспери-
ментах in vitro. Существует достаточно свиде-
тельств того, чтобы предполагать, что и у челове-
ка важную роль во взаимоотношении между орга-
низмом и опухолью играют адаптивные или врож-
денные иммунные ответы.
Иммунные эффекторные механизмы, потенци-
ально способные разрушать опухоли in vitro, при-
ведены в табл. 19.4. Обычно разрушение опухоле-
вых клеток этими механизмами более эффектив-
но, когда она диспергирована (т.е. опухолевые
клетки-мишени разъединены и находятся в сус-
пензии), а не представляет собой плотное обра-
зование. Это, вероятно, связано с тем, что им-
мунной системе легче справиться с диспергиро-
ванными клетками.
В-клеточные ответы на опухоли
Было показано, что в присутствии комплемента
антитела и IgM, и IgG разрушают опухолевые
клетки in vitro. Некоторые исследования, прове-
денные на мышах, показали, что при лейкозе и
лимфоме противоопухолевые антитела в присут-
ствии комплемента эффективно уничтожают опу-
холевые клетки и в организме, а также уменьша-
ют количество метастазов при некоторых опухо-
лях. Другие исследования in vivo и in vitro, одна-
ко, показали, что те же антитела в присутствии
комплемента неэффективны в уничтожении кле-
ток тех же опухолей, если последние представля-
ют собой плотные образования.
Разрушение опухолевых клеток путем
опсонизации и фагоцитоза
Разрушение опухолевых клеток фагоцитирующи-
ми клетками было показано in vitro, но только в
присутствии противоопухолевой иммунной сыво-
ротки и комплемента. Значение этого открытия
для организма пока неизвестно.
Опосредованная антителами
утрата опухолевыми клетками
адгезионных свойств
Оказалось, что для метастазирования определен-
ных опухолей необходима адгезия клеток опухо-
ли друг к другу и окружающим тканям. Антитела,
направленные против поверхности опухолевых
клеток, могут влиять на адгезионные свойства
опухолевых клеток. Значение этого механизма для
организма также пока неизвестно.
Клеточно-опосредованные реакции:
прямое разрушение опухолевых клеток
цитотоксическими Т-лимфоцитами
Разрушение опухолевых клеток in vitro специфич-
ными иммунными Т-лимфоцитами было проде-
310
ГЛАВА 19. ИММУНОЛОГИЯ ОПУХОЛЕЙ
монстрировано бесчисленное количество раз как
для суспензии клеток, так и для плотных образо-
ваний при различных опухолях. Более того, мно-
гие опыты с экспериментальными животными
(преимущественно мышами) достаточно четко
показали, что ЦТЛ с противоопухолевой специ-
фичностью отвечают за разрушение опухолей,
вызванных вирусами, in vivo. Хотя СВ4+-Т-клет-
ки-хелперы участвуют в индукции и регуляции
функции цитотоксических Т-клеток, разрушение
опухолевых клеток достигается с помощью CD8+-
ЦТЛ, специфичных к поверхностным антигенам
опухолевой клетки.
Антителозависимая клеточно-
опосредованная цитотоксичность
Антителозависимая клеточно-опосредованная ци-
тотоксичность (АЗКЦ) включает: I) прикрепле-
ние опухольспецифичных антител к поверхности
опухолевых клеток; 2) взаимодействие с различ-
ными клетками (такими как гранулоциты и мак-
рофаги), обладающими рецепторами для Fc-фраг-
ментов антител, прикрепленных к опухолевой
клетке; 3) разрушение опухолевых клеток ве-
ществами, высвобождаемыми из тех клеток, ко-
торые несут рецепторы для Fc-фрагмента антите-
ла. Значимость этого механизма для разрушения
опухолевых клеток в организме до сих пор неиз-
вестна
Разрушение опухоли натуральными
киллерами, Т-клетками/натуральными
киллерами и лимфокинактивированными
киллерами
Натуральные киллеры (NK) являются отдельной
субпопуляцией лимфоцитов, которые без предва-
рительной сенсибилизации или МНС-рестрикции
могут убивать определенные опухолевые клетки.
Клетки опухоли, не способные экспрессировать
по крайней мере одну из молекул МНС I класса,
являются мишенями для NK-клеток (см. рис. 2.5).
Эти клетки могут лизировать различные клетки-
мишени, такие как клетки, инфицированные ви-
русом, клетки, покрытые антителами, недиффе-
ренцированные клетки и клетки некоторых опу-
холей. Натуральные киллеры обладают рецепто-
рами для Fc-фрагмента IgG (CD 16) и, как было
показано в гл. 4, могут участвовать в АЗКЦ. Как
и активированные макрофаги, NK-клетки секре-
тируют фактор некроза опухоли a (TNFa), кото-
рый вызывает кровоизлияние и некроз опухоли.
Однако точный механизм, с помощью которого
NK-клетки распознают и убивают клетки опухо-
ли, до сих пор неясен. Недавно были получены
свидетельства, указывающие на то, что NK/T-клет-
ки составляют особую популяцию клеток есте-
ственного иммунитета, важную для элиминации
опухоли из организма (см. гл. 10).
Лимфокинактивированные киллеры (ЛАК) яв-
ляются опухольспецифичными клетками, полу-
ченными от пациента. Клетки культивируют in
vitro в присутствии IL-2, а затем адоптивно пере-
носят обратно в организм больного. Лимфокин-
активированные киллеры представлены гетероген-
ной популяцией лимфоцитов, в которую входят
NK-клетки. Однако их активность не может быть
связана исключительно с NK-клетками, посколь-
ку они способны убивать опухолевые клетки in vitro,
даже если NK-клетки их не убивают. Хотя есте-
ственная биологическая функция ЛАК до сих пор
не очень ясна, в настоящее время они тестируют-
ся на предмет эффективности в процессе имму-
нотерапии людей, больных раком (вопрос обсуж-
дается в этой главе далее). Существуют современ-
ные подходы, касающиеся использования Т-кле-
ток, выделенных из опухоли, выращенных и ак-
тивированных в присутствии IL-2. Было по-
казано, что эти лимфоциты, инфильтрирующие
опухоль, обладают выраженной специфичностью.
Разрушение опухолевых клеток
активированными макрофагами
и нейтрофилами
Макрофаги и нейтрофилы обычно не цитоток-
сичны по отношению к клетокам опухолей in vitro.
Но если они активированы in vitro бактериальны-
ми продуктами, то могут обеспечивать селектив-
ный цитостаз или цитолиз злокачественных кле-
ток. Макрофаги могут также становиться высоко-
цитотоксическими (рис. 19.1 и 19.2), если они ак-
тивированы цитокинами, что наиболее заметно
при использовании IFNy, вырабатываемого по-
пуляцией активированных Т-лимфоцитов, кото-
рые сами по себе не являются цитотоксическими.
Эти СВ4+-Т-клетки являются опухольспецифич-
ными: они секретируют IFNy после активации
опухолевыми антигенами. Другие цитокины, выс-
вобождаемые такими Т-лимфоцитами, активиро-
ванными антигеном, привлекают макрофаги к уча-
стку нахождения антигена. Помимо этого IFNy
также предотвращает миграцию макрофагов от ан-
тигена. Механизм активации макрофагов Т-клет-
ками специфичен по отношению к опухолевому
антигену и приводит к разрушению опухолевых
клеток подобно механизму, действующему при ре-
акциях гиперчувствительности замедленного типа
(ГЗТ) при отторжении аллотрансплантата или
уничтожении микроорганизмов: антигенспеци-
фичные Т-клетки активируются антигеном и выс-
вобождают цитокины, которые привлекают и ак-
тивируют макрофаги. Такие активированные мак-
рофаги цитотоксичны по отношению к микроор-
ганизмам, опухолевым и даже «своим» клеткам,
расположенным вблизи активированных макро-
фагов. Повреждающее и разрушающее действие
активированных макрофагов обусловлено несколь-
кими высвобождаемыми ими продуктами, наибо-
ЭФФЕКТОРНЫЕ МЕХАНИЗМЫ ПРОТИВООПУХОЛЕВОГО ИММУНИТЕТА
311
• Рис. 19.1. На фотографии, сделанной с помощью скани-
рующего электронного микроскопа, виден макрофаг с ни-
тевидными отростками, протянувшимися к поверхности
трех клеток меланомы (х4500) (с любезного разрешения
К. L. Erickson, School of Medicine, University of California, Davis;
воспроизводится с разрешения Lippincott/Harper & Row)
лее активными из которых являются лизосомаль-
ные ферменты и TNFa.
Появляется все больше свидетельств того, что
активированные макрофаги разрушают опухоле-
вые клетки in vitro. Например, резистентность к
опухоли может быть нарушена при специфиче-
ском удалении макрофагов. Кроме того, при уве-
личенном количестве активированных макрофа-
гов отмечается повышенная сопротивляемость к
опухолям. Наконец, активированные макрофаги
часто обнаруживаются в месте регресса опухоли.
Однако взаимоотношения между опухолью и свя-
занными с нею макрофагами достаточно сложны.
С одной стороны, макрофаги способны и действи-
тельно убивают опухолевые клетки. С другой —
макрофаги и опухолевые клетки способны, что
было доказано, продуцировать поддерживающие
друг друга факторы роста, что приводит почти к
симбиотическим взаимоотношениям. Таким об-
разом, изменения хрупкого баланса между мак-
рофагами и опухолевыми клетками может корен-
ным образом повлиять на судьбу опухоли.
Цитокины
Как указывалось ранее, цитокины могут обладать
вспомогательными функциями, которые усилива-
ют иммунные эффекторные механизмы противо-
опухолевого иммунитета. Важно отметить, что в
зависимости от того, какие цитокины продуци-
руются, эффекторные иммунные механизмы либо
стимулируются, либо подавляются. Соответствен-
но, результатом может быть или стимуляция, или
подавление роста предраковых или раковых кле-
ток механизмами приобретенного и/или врожден-
ного иммунитета. Некоторые опухолевые клетки
вырабатывают цитокины, являющиеся их рос-
товыми факторами (аутокринная стимуляция),
й реагируют на них, что обеспечивает эффект уси-
ления роста опухоли. Таким же образом продук-
ция TGFp некоторыми опухолевыми клетками
усиливает рост опухоли, что связано с ангиоген-
ной активностью этого цитокина.
Цитокины, такие как TNF и IFNy, обладают
противоопухолевым действием, поскольку поми-
• Рис. 19.2. «Поцелуй смерти». Электрон-
ная микрофотография, демонстрирующая
место контакта между активированным
макрофагом (слева) и клеткой меланомы
после 18 ч совместного культивирования.
Этот контакт приводит к цитолизу опухо-
левой клетки-мишени Между двумя клет-
ками обнаруживается хлопьевидный мате-
риал; с клеточными мембранами макро-
фагальных выступов связана плотная пла-
стинка; в этих проекциях также видны мик-
ротрубочки (х26000) (с любезного разре-
шения К. L. Erickson, School of Medicine,
University of California, Davis; воспроизво-
дится с разрешения Lippincott/Harper &
Row)
312
ГЛАВА 19. ИММУНОЛОГИЯ ОПУХОЛЕЙ
мо выполнения других функций они способствуют
увеличению количества молекул МНС I и II клас-
сов на некоторых опухолевых клетках. Уменьше-
ние экспрессии МНС-детерминант позволяет опу-
холевым клеткам избегать действия цитотоксиче-
ских Т-лимфоцитов и NK-клеток. Увеличение
числа молекул МНС цитокинами, таким образом,
способствует усилению клеточно-опосредованных
эффекторных механизмов. Эффект длительного
повышения уровня определенных цитокинов изу-
чался путем трансфекции опухолевых клеток ге-
нами цитокинов. Трансфекция генов, кодирующих
цитокины IL-1, IL-7 и IFNy, с последующим адоп-
тивным переносом таких клеток мышам с опухо-
лями оказывала выраженное подавляющее дей-
ствие на рост опухоли.
В ОГРАНИЧЕНИЕ ЭФФЕКТИВНОСТИ
ИММУННОГО ОТВЕТА НА ОПУХОЛИ
Не возникает сомнения, что против опухоли мо-
жет быть вызван иммунный ответ. Почему же тог-
да, несмотря на иммунный ответ, опухоль про-
должает расти? Для этого могут быть задейство-
ваны несколько возможных механизмов, как по
отдельности, так и в сочетании друг с другом. Как
показано в табл. 19.5, факторы, связанные как с
опухолью, так и с организмом, могут влиять на
способность опухолевых клеток избегать разру-
шения иммунной системой. Среди факторов, от-
носящихся к опухоли, есть факторы, связанные
с изменением чувствительности к иммунному воз-
действию, варьирующиеся от отсутствия антиген-
ного эпитопа до устойчивости опухолевых клеток
к туморипидному эффекторному действию. Из-
бежать иммунного разрушения опухоли также
помогает ее низкая иммуногенность. В данном
случае список возможных действующих механиз-
мов опять возглавляет отсутствие антигенного
эпитопа. В неспособность опухолевых клеток вы-
зывать иммунные ответы вносят свой вклад и не-
сколько других механизмов, включая отсутствие
экспрессии костимулирующих молекул на клет-
ках опухоли, а также сбрасывание (шеддинг) опу-
холевых антигенов с последующей индукцией то-
лерантности. Наконец, решающее значение в пре-
дотвращении или разрешении иммунной деструк-
ции опухолевых клеток имеет окружающая стро-
ма. В определенных условиях строма является
местом образования паракринных стимуляторных
петель, которые вызывают быстрый злокачествен-
ный рост и таким образом препятствуют иммун-
ной деструкции.
Связанные с организмом механизмы, помога-
ющие опухоли избежать иммунного разрушения,
также представлены в табл. 19.5. Подавление им-
мунитета, недостаточность презентации опухоле-
вых антигенов АПК и неспособность эффектор-
ных механизмов организма воздействовать на опу-
холь из-за стромального барьера или ее возмож-
ного привилегированного местоположения могут
способствовать тому, что опухоль уклонится от
• Таблица 19.5. Механизмы, с помощью которых опухоль избегает иммунного разрушения
Механизм Условие действия
Связанный с опухолью Неспособность опухоли стать подходящей мишенью • Отсутствие антигенного эпитопа (опухолевого антигена) • Отсутствие молекулы МНС 1 класса • Нарушение процессирования антигена в опухолевых клетках • Антигенная модуляция • Антигенная маскировка опухоли • Устойчивость опухолевых клеток к туморицидному эффекторному воздействию Неспособность опухоли индуцировать эффективный иммунный ответ • Отсутствие антигенного эпитопа • Сниженная экспрессия МНС или опухолевого антигена на клетках опухоли • Отсутствие кости мул ирующе го сигнала • Выработка опухолью ингибиторных субстанций (например, цитокинов) • Сбрасывание (шеддинг) опухолевого антигена и индукция толерантности • Индукция опухолью дефектов проведения сигнала в Т-клетках
Связанный с организ- мом Неспособность организма отвечать на антигенную опухоль • Угнетение иммунитета или иммунодефицит, вызванный апоптозом, дефектом проведения сигнала в Т-клетках в результате действия канцерогена (физического, химического), инфекции или старения • Недостаточность презентации опухолевых антигенов АПК организма • Неспособность эффекторных механизмов организма воздействовать на опухоль (например, из-за стромального барьера) • Обусловленная иммунодоминантными антигенами родительских клеток неспособность орга- низма уничтожать варианты опухолевых клеток
ИММУНОДИАГНОСТИКА
313
иммунного ответа. Наконец, опыты показали, что
экспрессия иммунодоминантного опухолевого ан-
тигена имеет тенденцию предотвращать сенсиби-
лизацию к другим опухолевым антигенам, таким
образом прекращая иммунную атаку на разновид-
ности опухолевых клеток.
Неспецифическое подавление со стороны опу-
холевых клеток также может позволять опухолям
избегать иммунного разрушения. Некоторые виды
опухолей синтезируют различные соединения,
такие как простагландины, которые угнетающе
действуют на многие звенья иммунитета. Однако
роль этого механизма до сих пор неясна.
Наконец, иммунный ответ и его различные
компоненты имеют конечную способность к эф-
фективному разрушению опухоли (и кстати, про-
никших микроорганизмов). Поэтому если имму-
низация может приводить к эффективной защите
против летальной при других условиях дозы опу-
холевых клеток, то этот способ неэффективен,
когда доза опухолевых клеток существенно боль-
ше. Развитие опухоли в организме с сохранным
иммунитетом в условиях наличия иммунного от-
вета может быть связано с быстрым увеличением
опухолевой массы, которое превышает возмож-
ности усиления иммунного ответа до тех пор. пока
не подавляет все виды иммунного ответа.
* ИММУНОДИАГНОСТИКА
Иммунодиагностику опухолей проводят для двух
самостоятельных целей: I) иммунологического
выявления антигенов, специфичных для опухо-
левых клеток; 2) определения иммунного ответа
организма на опухоль. Иммунодиагностика ос-
новывается на иммунологической перекрестной
реактивности. Иммунологические методы мож-
но использовать для определения опухолевых ан-
тигенов и других маркеров в тех случаях, когда у
разных больных с одним и тем же типом опухо-
ли опухолевые антигены имеют существенное
сходство.
Наличие иммунологической перекрестной ре-
активности предполагает, что антитела или лим-
фоциты больных с одним и тем же типом опухо-
ли будут реагировать с опухолевыми антигенами
вне зависимости от индивидуальных особенно-
стей больного, у которого они были получены
Однако несмотря то что мониторирование уров-
ня опухолевого маркера успешно используется у
больных с целью раннего выявления рецидива
опухоли после лечения, пока не найдено каких-
либо онкологических маркеров, обладающих не-
сомненной специфичностью или чувствительно-
стью, что позволило бы использовать их для ран-
ней диагностики онкологических заболеваний
или массового обследования с целью их обнару-
жения.
Как указывалось ранее в этой главе, в цито-
плазме и на поверхности опухолевых клеток мо-
гут присутствовать или секретироваться веще-
ства, которые по своей природе и/или количе-
ству отличаются от веществ, находящихся на нор-
мальных клетках. Поскольку опухолевые марке-
ры обычно обладают слабой антигенностью, то
такие различия, качественные или количествен-
ные, обычно выявляются с помощью ксеноген-
ных антител, получаемых у животных. Примене-
ние мышиных моноклональных антител суще-
ственно увеличило специфичность иммунодиаг-
ностики опухолевых клеток человека и продук-
тов их жизнедеятельности. Моноклональные ан-
титела в настоящее время начинают использо-
ваться не только для выявления антигенов и ве-
ществ, связанных с присутствием опухолевых
клеток; они также оказались эффективны для
получения изображения опухолей и определения
их локализации. Введение опухольспецифичных
антител, меченных радиоактивным веществом
(радиоим му но конъюгаты), онкологическим
больным позволяет с помощью компьютерной
томографии получать изображение опухолей. Этот
метод позволяет выявлять как небольшие мета-
стазы, так и первичные опухоли. Некоторые из
наиболее часто используемых и надежных имму-
нодиагностических методов выявления опухолей
описаны далее.
Выявление миеломных белков,
вырабатываемых опухолями
из плазматических клеток
Опухоли, происходящие из плазматических кле-
ток, выявляются в связи с наличием необычно
высокой концентрации моноклональных иммуно-
глобулинов определенного изотипа в сыворотке
крови или по присутствию легких цепей этих
иммуноглобулинов в моче (белки Бенс-Джонса)
От концентрации миеломных белков в крови или
моче зависит размер опухоли. Соответственно,
эффективность и длительность лечения опухолей
определяют с учетом этих данных.
Определение а-фетопротеина
Альфа-фетопротеин (аФП) является основным
белком, вырабатываемым клетками печени плода
и обнаруживаемым в сыворотке крови плода.
После рождения уровень аФП падает приблизи-
тельно до 20 нг/мл. Он поднимается у больных
раком печени (гепатома), при эмбриональном раке
яичка или яичника, а также при незлокачествен-
ных заболеваниях печени (цирроз или гепатит).
Концентрация аФП в сыворотке на уровне 500 —
1 000 нг/мл обычно указывает на присутствие опу-
холи, вырабатывающей аФП. Поэтому благодаря
мониторингу уровня аФП можно получать дан-
ные о развитии или регрессе опухоли.
314
ГЛАВА 19. ИММУНОЛОГИЯ ОПУХОЛЕЙ
Раковоэмбриональный антиген
Раковоэмбриональным антигеном (РЭА) называ-
ют гликопротеин, обычно вырабатываемый клет-
ками, выстилающими ЖКТ, особенно ободочную
кишку. При озлокачествлении клеток их поляр-
ность может меняться таким образом, что РЭА
высвобождается в кровь, а не в ободочную киш-
ку. Концентрация РЭА в крови, превышающая
2,5 нг/мл, обычно указывает на наличие рака, а мо-
ниторинг уровня РЭА помогает определить нали-
чие роста или регресса опухоли. Однако и в дан-
ном случае повышенные уровни содержания РЭА
в крови могут быть обусловлены не злокачествен-
ными заболеваниями, а например, циррозом пе-
чени и воспалительными заболеваниями ЖКТ и
легких.
Определение простатоспецифичного
антигена
Простатоспецифичный антиген (ПСА) является
гликопротеином, расположенным в эпителиаль-
ных клетках протоков простаты. В низких кон-
центрациях он может обнаруживаться в сыворот-
ке крови здорового мужчины. Его содержание в
крови в концентрации, превышающей 8— Ю нг/мл,
указывает на наличие рака простаты. Для подтвер-
ждения диагноза необходимы дополнительные
тесты, поскольку простатит и доброкачественная
гипертрофия простаты также могут приводить к
высвобождению ПСА, поступающего из эпителия
простаты в кровоток. Этот тест особенно полезен
при мониторинге: значительное увеличение или
уменьшение концентрации ПСА в сыворотке кро-
ви соответствует увеличению или уменьшению
размера опухоли.
Опухолевый антиген 122
Иммунодиагностическое определение содержания
в сыворотке опухолевого антигена 125 (СА-125)
является важным инструментом в диагностике и
мониторинге процесса лечения рака яичника
Уровень СА-125 в крови также повышается при
воспалительных заболеваниях брюшины.
Другие маркеры
Моноклональные антитела В72.3 являются мар-
кером для распознавания всех типов рака у чело-
века (панкарциномный антиген). Этот реагент ис-
пользуется для выявления локализации опухоли,
обнаружения скрытых мест ее расположения. Дру-
гие маркеры, связанные со злокачественными но-
вообразованиями, такие как ферменты и гормо-
ны, также можно обнаружить иммунологическими
методами. Качественные и количественные мето-
ды определения всех опухолевых маркеров имеют
значение при мониторинге размера опухоли и
определении эффекта терапии.
• ИММУНОПРОФИЛАКТИКА
ОПУХОЛЕЙ
Предполагается, что иммунизация против онко-
генных вирусов обеспечит профилактику пораже-
ния вирусами и, соответственно, развития опухо-
ли, вызываемой вирусом. Действительно, этот
подход оказался успешным для защиты цыплят
от болезни Марека и обеспечил достаточный уро-
вень защиты против лейкоза и саркомы кошек,
что было достигнуто путем иммунизации кошек
соответствующими онкогенными вирусами. Как
указано ранее, для иммунизации против самой
опухоли необходимо, чтобы она обладала специ-
фическими опухолевыми антигенами и чтобы эти
антигены обладали перекрестной реактивностью
с любой из приготовленных вакцин. Существуют
тысячи публикаций об эффективной иммуниза-
ции против перевиваемых опухолей у животных;
при этом в качестве иммуногенов использовались:
1) сублетальные дозы живых опухолевых клеток;
2) опухолевые клетки, репликация которых бло-
кирована; 3) опухолевые клетки с химически или
ферментативно модифицированными поверхно-
стными мембранами; 4) экстракты антигенов, взя-
тые с поверхности опухолевых клеток (как ^мо-
дифицированных, так химически модифицирован-
ных). Несмотря на сообщения об успехах в защи-
те экспериментальных животных от перевиваемых
опухолей, эффективность иммунопрофилактики
для защиты человека и животных от спонтанно
возникающих опухолей еще изучена недостаточ-
но хорошо. Отсутствие полноценных исследова-
ний в этой области связано с необходимостью
получения соответствующих иммуногенов и опас-
ностью индукции выработки иммунологических
элементов, способных в действительности усилить
метастазирование и оказаться разрушительными
для организма.
о ИММУНОТЕРАПИЯ
Леонардо да Винчи (1452—1519) писал, что край-
няя неудача — это когда теория опережает опыт
К сожалению, эта фраза исключительно метко
характеризует современное состояние иммуноте-
рапии рака. Предпринимались бесчисленные по-
пытки лечения рака у животных и людей имму-
нологическими методами. Хотя в литературе по-
является все больше сообщений об успешной
иммунотерапии рака у человека, к настоящему
времени она не доказала свою эффективность в
лечении опухолей и при ее применении в каче-
ИММУНОТЕРАПИЯ
315
Опосредованный комплементом
лизис или АЗКЦ
АЗКЦ
Слитый белок
цитокин—Ат
Гуманизированное
МоАт к опухолевым Аг
NK-клетка
Т-клетка
Биспецифическая антительная
конструкция (противоопухолевый
Аг/анти-СОЗ)
Биспецифическая антительная
конструкция (противоопухолевый
CD16)
Лизат опухолевой клетки
кДНК, кодирующие костимулирующие
молекулы (CD80/86) или цитокины
в экспрессирующем векторе
ЦТЛ
• Рис. 19.3. Современные стратегии экспериментальной иммунотерапии: Аг - антиген; МоАт - моноклональное антитело
стве единственного метода лечения, и при соче-
тании ее с другими формами терапии, такими как
химиотерапия, радиотерапия или хирургическое
вмешательство.
В настоящее время применяется широкий
спектр методов экспериментальной иммунотера-
пии опухолей (рис. 19.3). Опухольспецифичные мо-
ноклональные антитела (например, анти-СО20
для лечения определенных лимфом; анти-НЕК2/
neu-1 для лечения некоторых больных раком мо-
лочной железы или яичников) могут опосредо-
вать цитолиз либо путем привлечения Fc-рецеп-
торов NK-клеток (АЗКЦ), либо путем активации
комплемента. В настоящее время проводятся опы-
ты по иммунотерапии опухолей, в которых ток-
сины, например рицин, или радиоактивные изо-
топы, прикрепленные к опухольспецифичным
антителам, доставляются непосредственно к опу-
холевым клеткам для прямого киллинга. Насколь-
ко эти иммунотоксины окажутся эффективными
в лечении опухолей, еще предстоит установить.
Ксеногенные антитела (например, мышиные мо-
ноклональные антитела к опухолевым клеткам
человека) были созданы с помощью молекуляр-
ной инженерии при использовании технологии
рекомбинантных ДНК, что позволяет придать их
константным областям свойства константных об-
ластей иммуноглобулинов человека (см. гл. 5). Их
также исследуют как возможные средства для им-
мунотерапии. В настоящее время исследуют и
биспецифические антитела, сконструированные
для того, чтобы обеспечивать контакт иммунных
эффекторных клеток с клетками опухоли, одно-
временно стимулируя цитотоксическую актив-
ность эффекторных клеток. В качестве примера
можно привести антитела, распознающие уникаль-
ные опухолевые антигены, и Fc-рецепторы к IgG
(CD16) для активации NK-клеток. Таким же об-
разом исследуют конструкции из биспецифиче-
ских антител, содержащие и Fab-фрагменты, спе-
цифичные к опухолевым антигенам, и CD3.
Относительно новым подходом является созда-
ние рекомбинантных белков, состоящих из про-
тивоопухолевых антител и цитокинов (иммуноци-
токины). Такие слитые белки предназначены для
сосредоточения иммунных эффекторных функ-
ций, опосредованных цитокинами, в месте рас-
положения опухоли. Некоторые методы направ-
лены на стимуляцию или поддержание функции
опухольспецифичных ЦТЛ. Специфичные к опу-
холевым антигенам ЦТЛ могут быть созданы, если
придать опухолевым клеткам черты иммунных,
вызвав экспрессию либо костимулирующих мо-
лекул, таких как CD80/CD86, либо цитокинов.
Высокоэффективным методом стимулирования
опухольспецифичных ЦТЛ является презентация
пептидов опухолевых антигенов молекулами МНС
I класса на дендритных клетках. Высокоэффек-
тивные АПК обычно экспрессируют большое ко-
личество костимулирующих молекул на поверх-
ности клетки, увеличивая таким образом способ-
ность презентировать опухолевые антигены эф-
фекторным Т-клеткам (см. гл. 9 и 10). Дендрит-
ные клетки или непосредственно нагружаются
пептидами, или обеспечивается их контакт с ли-
затами опухолевых клеток, белками опухоли, или
проводится трансфекция кДНК, полученной из
опухоли, в векторе, обеспечивающем ее экспрес-
сию. Далее дендритные клетки адоптивно пере-
носятся в организм, пораженный опухолью, где,
как рассчитывают, они активируют цитотоксиче-
ские Т-клетки к разрушению клеток опухоли.
Для активной вакцинации опухолевыми анти-
генами, молекулярные характеристики которых ус-
тановлены, были разработаны рекомбинантные
вакцины, в которых использован вирус вакцины
316
ГЛАВА 19. ИММУНОЛОГИЯ ОПУХОЛЕЙ
оспы, Listeria или вирусоподобные частицы. Так-
же проводились исследования в отношении ак-
тивной иммунизации путем введения генно-ин-
женерной конструкции на основе безоболочечной
плазмидной ДНК (ДНК-вакцины) с целью полу-
чения уникального опухолевого антигена, коди-
руемого и экспрессируемого мышечными клет-
ками. В некоторых исследованиях также исполь-
зуется введение генов, кодирующих цитокины
(например, ГМ-КСФ, IL-2, IL-12), для улучше-
ния презентации опухолевого антигена дендрит-
ными клетками в месте инъекции.
В области иммунотерапии предпринимались
попытки лечения злокачественных опухолей че-
ловека и животных путем усиления специфи-
ческого противоопухолевого иммунитета при
использовании неспецифических активаторов
иммунного ответа. В частности, в ряде случаев
успешно использовалась стимуляция макрофагов
бациллами Кальметта—Герена (БЦЖ) или Corine-
bacterium parvum. Одним из примеров является
применение БЦЖ для лечения больных резиду-
альным поверхностным раком мочевого пузыря;
после хирургического вмешательства терапией
выбора стали повторные инстилляции живых
штаммов Mycobacteria в мочевой пузырь с помо-
щью катетера.
В настоящее время ведутся исследования воз-
действия на регресс опухоли разных цитокинов.
таких как IFNa, IFN0 и IFNy, IL-1, IL-2, IL-4,
IL-5, IL-12, TNF, как по одиночке, так и в соче-
таниях. Пока эти исследования в основном не
привели к каким-либо выводам. Клиническое
использование при лечении рака ЛАК и лимфо-
цитов, инфильтрирующих опухоль (ЛИО), также
дало неоднозначные результаты. Лимфокинакти-
вируемые киллеры продуцируются in vitro при
культивации собственных лимфоцитов перифери-
ческой крови пациента в среде с IL-2. В ряде слу-
чаев сообщалось о кардинальном улучшении после
реинфузии этих клеток пациенту. Имеется под-
твержденное сообщение об успехе применения
ЛИО, адоптивно перенесенных больному мела-
номой. Такие лимфоциты, выделенные из био-
птата опухоли, культивировали in vitro в среде с
IL-2 и вводили обратно больному раком. Они об-
ладали во много раз большей противоопухолевой
активностью, чем ЛАК, поэтому для лечения тре-
бовалось меньшее количество этих клеток.
Увеличивающееся понимание природы рака и
сущности иммунного ответа способствуют разви-
тию новых стратегий в иммунотерапии. В любом
случае для подтверждения потенциальной эффек-
тивности такие стратегии должны проходить до-
клинические испытания на моделях. Однако боль-
шие надежды на то, что иммунная система может
быть использована для профилактики и лечения
рака, следует умерить в связи с тем, что число
подтвержденных случаев эффективного иммунно-
го воздействия невелико. Несмотря на это, в усло-
виях быстрого развития биотехнологии и совер-
шенствования молекулярной идентификации опу-
холевых антигенов человека мы вступаем в новую
эру иммунотерапии рака. В настоящее время мож-
но с уверенностью сказать, что благодаря онко-
иммунологии действительно мы достигли значи-
тельных достижений в диагностике рака и, похо-
же, иммунологические диагностические методы
обеспечат новые подходы к выявлению опухоле-
вых клеток и мониторингу их роста.
РЕЗЮМЕ
1. Онкоиммунология изучает: 1) иммунологиче-
ские аспекты взаимоотношения организма и опухоли;
2) использование иммунного ответа для диагностики,
профилактики и лечения опухолей.
2. Опухолевые антигены, индуцированные канце-
рогенами, не обладают иммунологической перекрест-
ной реактивностью. Однако антигены опухолей, инду-
цированных вирусами, имеют выраженную перекрест-
ную реактивность. Некоторые виды опухолей выраба-
тывают онкофетальные вещества, обычно присутству-
ющие в норме в период эмбрионального развития.
3. Иммунный ответ на опухоли представлен как гу-
моральным, так и клеточным иммунным ответом. Раз-
рушение опухолевых клеток может быть достигнуто:
1) с помощью антител и комплемента; 2) с помощью
фагоцитов; 3) при вызванной антителами утрате опу-
холевыми клетками адгезионных свойств; 4) с помо-
щью цитотоксических Т-лимфоцитов; 5) посредством
АЗКЦ; 6) с помощью активированных макрофагов,
нейтрофилов, NK-клеток, NK/T-клеток и ЛАК.
4. Роль иммунных ответов на опухоли очень важна
во взаимоотношениях организма и опухоли. На это ука-
зывает повышенная частота появления опухолей у лиц с
подавленным иммунитетом, а также присутствие им-
мунных компонентов в местах регресса опухоли. Однако
иммунные ответы на опухоль могут оказаться неэффек-
тивными для ее устранения по различным причинам,
связанным как с опухолью, так и с организмом.
5. Иммунодиагностика может быть направлена на
выявление опухолевых антигенов или определение
иммунного ответа организма на опухоль.
6. Иммунопрофилактика может быть направлена
как против онкогенных вирусов, так и против самой
опухоли
7. При иммунотерапии злокачественных новообра-
зований для усиления опухольспецифических и не-
специфических иммунных ответов применяют различ-
ные препараты. Известны такие терапевтические под-
ходы, как активная иммунизация, пассивная терапия с
помощью антител, местное применение бактериаль-
ных вакцин (БЦЖ), использование цитокинов и адоп-
тивный перенос эффекторных клеток.
ТЕСТЫ
Выберите ОДИН НАИБОЛЕЕ ПРАВИЛЬНЫЙ ответ
на каждый тест.
1. Появление многочисленных первичных лимфоре-
тикулярных опухолей у людей связано с нарушением:
ТЕСТЫ
317
а) гуморального иммунитета;
б) активности NK-клеток;
в) активности NK/T-клеток;
г) функции нейтрофилов;
д) клеточно-опосредованного иммунитета.
2. Иммунологическая перекрестная реактивность
опухолевых антигенов наблюдается при опухолях:
а) вызванных химическими канцерогенами;
б) вызванных РНК-вирусами;
в) любых;
г) вызванных ультрафиолетовым излучением;
д) вызванных одинаковым химическим канцеро-
геном в двух отдаленных местах у одной и той же
особи.
3. Укажите, что не является механизмом, с помо-
щью которого цитокины осуществляют противоопухо-
левое действие:
а) цитокины усиливают экспрессию молекул МНС I
класса;
б) они активируют такие клетки, как ЛАК и ЛИО;
в) они оказывают прямое противоопухолевое дей-
ствие;
г) они вызывают цитолиз, опосредованный комп-
лементом;
д) они усиливают активность цитотоксических Т-кле-
ток, макрофагов и NK-клеток.
4. При отторжении опухоли может наблюдаться:
а) опосредованная Т-клетками цитотоксичность;
б) АЗКЦ;
в) комплементзависимая цитотоксичность;
г) разрушение опухолевых клеток фагоцитарными
клетками;
д) все перечисленное.
5. Лучше всего характеризует иммунотоксины сле-
дующее определение:
а) токсические вещества, высвобождаемые макро-
фагами;
б) цитокины;
в) токсины вместе с соответствующими антитокси-
нами;
г) токсины, соединенные с антигенспецифичными
иммуноглобулинами;
д) токсины, высвобождаемые цитотоксическими
Т-клетками.
6. Было доказано, что В-клеточная лимфома мо-
жет быть устранена с помощью антиидиотипической
сыворотки. Использование такого подхода для лече-
ния опухолей из плазматических клеток не может
быть оправдано:
а) поскольку опухолевые плазматические клетки не
обладают опухольспецифичными антигенами;
б) считается, что опухоли из плазматических кле-
ток нечувствительны к АЗКЦ;
в) опухоли из плазматических клеток могут быть
разрушены in vivo только цитотоксическими В-лимфо-
цитами, несущими такие же антигены МНС I класса;
г) плазматические клетки не имеют поверхностных
иммуноглобулинов;
д) идиотип на поверхности плазматических клеток
отличается от такового на поверхности В-клеток.
СИТУАЦИОННАЯ ЗАДАЧА
Пациента, страдающего редкой формой рака, ле-
чили смесью цитокинов, включающей IL-2 и IL-12 Так
как границы опухоли уменьшились, диагностировали
улучшение, несмотря на побочные эффекты терапии.
У пациента определяли различные параметры, отно-
сящиеся к клеткам периферической крови, до, во
время и после лечения. Данные исследования, на-
правленного на определение фагоцитарной активно-
сти макрофагов, показали значительное усиление фа-
гоцитоза бактерий, опсонизированных антителами,
через сутки после введения смеси цитокинов. Объяс-
ните, за счет чего мог наблюдаться этот эффект. Ка-
ким образом вы можете подтвердить свой вывод?
Расскажите, как эта повышенная фагоцитарная ак-
тивность может обусловить улучшение состояния па-
циента.
ОТВЕТЫ НА ТЕСТЫ
1 — д. У лиц с нарушениями иммунитета, особен-
но клеточно-опосредованного, наблюдается примерно
стократное увеличение частоты образования лимфо-
пролиферативных заболеваний.
2 — 6. Иммунологическая перекрестная реактив-
ность была доказана только для опухолей, индуциро-
ванных вирусами (как РНК-, так ДНК-содержащими).
Опухоли, вызванные химическими или физическими
канцерогенами, не обладают перекрестной реактив-
ностью, даже если они вызваны одним и тем же кан-
церогеном на разных участках тела одного и того же
индивидуума.
3 — г. Интерфероны-а, -р, и -у увеличивают эксп-
рессию молекул МНС I класса на опухолевых клетках,
что делает эти клетки более чувствительными к раз-
рушению ЦТЛ. Интерлейкин-2 активирует такие клет-
ки, как ЛАК и ЛИО. И TNFa, и TNFP обладают прямым
противоопухолевым действием. Интерферон-у повы-
шает активность ЦТЛ, макрофагов и NK-клеток, кото-
рые играют важную роль в разрушении опухолевых
клеток. Цитокины не активируют комплемент; соот-
ветственно, вариант «г» неверен.
4 — д. Разрушение опухолевых клеток может быть
опосредовано цитотоксическими Т-клетками, АЗКЦ,
комплементзависимой цитотоксичностью и фагоци-
тарными клетками, которые привлекаются к опухоли
Т-клеточными лимфокинами и/или компонентами
комплемента и которые активируются цитокинами или
демонстрируют повышенную фагоцитарную актив-
ность вследствие наличия опсонинов на клетках-ми-
шенях.
5 — г. Иммунотоксины состоят из токсических суб-
станций (или радиоактивных атомов), конъюгирован-
ных с молекулами иммуноглобулина, специфичного
для клеток опухоли или других клеток-мишеней.
6 — г. Единственным правильным утверждением
является то, что плазматические клетки не обладают
поверхностными иммуноглобулинами и, таким обра-
зом, не чувствительны к лечению антиидиотипически-
ми антителами. Злокачественные плазматические
клетки обладают опухольспецифичными антигенами и
будут чувствительны к АЗЦТ с антителами к таким ан-
тигенам. Утверждение «в» неверно.
318
ГЛАВА 19. ИММУНОЛОГИЯ ОПУХОЛЕЙ
ОТВЕТ НА СИТУАЦИОННУЮ ЗАДАЧУ
Терапевтическое введение смеси цитокинов мо-
жет вызвать различные иммуномодулирующие эф-
фекты. Известно, что IL-12 индуцирует увеличение
продукции IFNy Т-клетками, которые в свою очередь
повышают активность цитотоксических Т-лимфоци-
тов, макрофагов и NK-клеток. Каждая из этих попу-
ляций клеток играет свою роль в иммунном ответе
на опухоли. Вероятной причиной повышения фаго-
цитарной активности макрофагов больного после
контакта с бактериями, опсонизированными антите-
лами, может быть повышение экспрессии Fc-рецеп-
торов на макрофагах, также вызванное IFNy. Способ-
ность макрофагов прикрепляться к бактериям, по-
крытым антителами, таким образом, значительно по-
высится, а фагоцитоз усилится. Одним из способов
подтверждения этого вывода будет измерение уров-
ня IFNy в периферической крови пациента после
введения смеси цитокинов. В случае, если наличие
данного механизма будет подтверждено, это помо-
жет объяснить улучшение состояния пациента, по-
скольку увеличенная экспрессия Fc-рецепторов
предполагает увеличение активности АЗКЦ, непо-
средственно направленной против опухолевых анти-
генов. Таким образом, если в сыворотке крови паци-
ента находятся антитела, специфичные для опухоле-
вых антигенов, данный противоопухолевый меха-
низм, вероятно, действует на фоне стимулированной
цитокинами туморицидной активности макрофагов и
действия NK-клеток, что приводит к снижению опу-
холевой нагрузки.
Глава
20
СОПРОТИВЛЯЕМОСТЬ
К ИНФЕКЦИОННЫМ ЗАБОЛЕВАНИЯМ
И ИММУНИЗАЦИЯ
ВВЕДЕНИЕ
Основной функцией иммунной системы являет-
ся защита организма от заболеваний, вызываемых
контактом с микроорганизмами. На протяжении
всей истории человечества инфекционные болез-
ни были основной причиной смерти людей, при-
чем наибольшая смертность отмечалась среди де-
тей и новорожденных. История хранит сведения
о многих катастрофических эпидемиях инфекци-
онных заболеваний. Например, бубонная чума,
вызываемая Yersinia pest is, уничтожила четверть
населения Европы в середине XIV в. Таким обра-
зом, инфекционные заболевания оказывали чрез-
вычайно жесткое селективное влияние на эволю-
цию иммунной системы. Защитные силы организ-
ма характеризуются выраженной многоуровнево-
стью и избыточностью. Многоуровневость защи-
ты глубока и определяется и физическими барь-
ерами, такими как кожа и слизистые оболочки,
а также врожденными и адаптивными иммунны-
ми механизмами. Примером избыточности слу-
жит факт присутствия нескольких типов фагоци-
тарных клеток, АПК, клеток, продуцирующих ци-
токины, опсонинов и т.д. Таким образом, для вы-
полнения многих иммунных функций и достиже-
ния требуемой конечной цели существует мно-
жество механизмов. Избыточность иммунной
системы позволяет некоторым организмам выжи-
вать довольно длительное время, несмотря на на-
личие тяжелых иммунных нарушений. Например,
считается, что отдельные индивидуумы с дефи-
цитом некоторых изотипов иммуноглобулинов
(например, дефицит IgA) живут нормальной жиз-
нью, поскольку иммуноглобулины других клас-
сов способны компенсировать эту недостаточность
иммунитета.
Микробы различаются по своей патогенности
и вирулентности. Лишь незначительное меньшин-
ство микроорганизмов на Земле являются пато-
генными для человека. Патогенами называют мик-
роорганизмы, способные вызвать повреждение в
организме. Повреждение может произойти на
клеточном, тканевом или органном уровне. Ког-
да повреждение достигает определенного уровня,
оно может проявиться как болезнь. При выражен-
ном повреждении организм может умереть. По-
вреждение организма может быть вызвано различ-
ными механизмами и опосредовано микробом,
реакциями на него макроорганизма или и тем,
и другим. Примерами механизмов повреждения,
опосредованного микробами, могут служить про-
дукция токсинов, клеточный апоптоз, приводя-
щий к истощению иммунных клеток, и выработ-
ка ферментов, вызывающих некроз ткани. При-
мерами механизмов, опосредованных макроорга-
низмом, могут служить деструктивное воспаление,
фиброз и аутоиммунитет. Осознание того, что по-
вреждение организма является подходящим па-
раметром для определения результата взаимодей-
ствия организм — патоген, явилось основанием
для разработки патогенеза микробного процесса
по схеме «повреждение —ответ». В соответствии
с этой концептуальной схемой термин «патоген-
ность» определяется как способность микроба
вызывать повреждение организма: вирулентность
же определяется относительной способностью
микроба вызывать повреждение организма. Ви-
рулентность и патогенность не являются един-
ственными свойствами микробов, поскольку мо-
гут проявляться только при чувствительности к
ним организмов и отражают сложные взаимодей-
ствия между организмом, микробами и огромным
количеством факторов — социальных, человече-
ских и окружающей среды.
Человеческий организм является прибежищем
для многих видов микроорганизмов. Встреча че-
ловеческого организма с микробом может приве-
320
ГЛАВА 20. СОПРОТИВЛЯЕМОСТЬ К ИНФЕКЦИОННЫМ ЗАБОЛЕВАНИЯМ И ИММУНИЗАЦИЯ
Контакт микроба
с организмом
Персистенция
(хроническая и латентная)
Устранение посредством
лечения или с помощью
иммунитета
Смерть
• Рис. 20.1. Возможный результат взаимодействия организма и микроорганизма. Двуна-
правленные стрелки указывают на ситуации, при которых объем повреждений варьирует в за-
висимости от специфического взаимодействия организма и микроба (взято из Casadevall and
Pirofski, 2000)
сти либо к устранению последнего, либо к ин-
фекции. Устранение происходит в том случае,
когда встреча с микробом не приводит к его при-
нятию организмом. Инфекция же определяется
как принятие микроба организмом. Следует за-
метить, что хотя термин «инфекция» часто исполь-
зуется как синоним термина «заболевание», они
не сходны по значению. Инфекция может приво-
дить к пяти состояниям: элиминации (устранению),
комменсализму, колонизации, персистенции (или
латентному состоянию) и болезни. В последних
четырех случаях взаимодействие между организ-
мом и микробом продолжается, но степень разру-
шения, наносимого организму, разнится (рис. 20.1)
Устранение инфекции может быть результатом
действия механизмов защиты организма или те-
рапевтического вмешательства. Комменсализм или
колонизация редко, если вообще когда-либо, вы-
зывают симптоматическое или клинически выра-
женное повреждение организма, но эти состоя-
ния могут различаться по степени наносимого по-
вреждения и способности развиваться в болезнь
При отсутствии повреждения комменсализм и ко-
лонизация, по существу, являются нераспознава-
емыми состояниями.
Колонизация — термин, который обычно ис-
пользуется для определения состояния, когда мик-
робы, обладающие значительным патогенным
потенциалом, обосновались в организме, не вы-
зывая симптомов. Колонизация может закончить-
ся устранением микробов, персистенцией или
развитием заболевания в зависимости от состоя-
ния защитных сил организма, вирулентности мик-
роба и эффективности иммунного ответа. Мно-
гие случаи колонизации дают эффект иммуниза-
ции и предотвращают в дальнейшем инфекцию
и/или заболевание, вызываемое соответствующим
микроорганизмом. Например, микроорганизм,
обладающий большим патогенным потенциалом,
может обосноваться на слизистой оболочке, на-
нося небольшое повреждение, недостаточное для
появления клинических симптомов, и вызвать
иммунный ответ, устраняющий его. В этом слу-
чае колонизация завершается иммунизацией орга-
низма по отношению к повторному вторжению
данного микроорганизма.
Персистенция (или латентность) является со-
стоянием, при котором микроорганизмы обосно-
вались в организме и не могут быть уничтожены,
несмотря на повреждающую активность по отно-
шению к организму. Например, у многих людей
инфекция, вызванная Mycobacterium tuberculosis.
является бессимптомной, даже когда возбудитель
обосновался в организме и длительное время вы-
ЗАЩИТА ОРГАНИЗМА ОТ МИКРОБНЫХ ПАТОГЕНОВ
321
живает в гранулеме. При этом состоянии местные
повреждения ткани и нарушения вызываются об-
разованием гранулемы, но они недостаточно вы-
ражены, чтобы вызвать клиническое заболевание.
Однако если защитные механизмы организма не
способны уничтожить микобактерии, говорят уже
не о колонизации, а о персистенции инфекции. У
большинства лиц в этом состоянии инфекция
ограничена гранулемой. У некоторых людей это
состояние переходит в туберкулез — заболевание,
вызываемое М. tuberculosis. Исходя из схемы «по-
вреждение — ответ», заболевание возникает тог-
да, когда присутствие возбудителя в организме
вызывает повреждение, достаточное для появле-
ния клинических симптомов.
Микроорганизмы должны обладать достаточ-
ной вирулентностью, чтобы обосноваться и выз-
вать инфекцию в организме человека с сохран-
ными иммунными системами. У пациентов с ос-
лабленной иммунной системой возбудители с низ-
кой вирулентностью могут вызывать тяжелые ин-
фекции. Микроорганизмы, патогенные для лю-
дей с ослабленными иммунными системами, час-
то называют оппортунистическими патогенами.
Поэтому такие свойства микробов, как патоген-
ность и вирулентность, связаны и частично зави-
сят от иммунного статуса организма. В условиях
сохранной функции иммунитета микроорганиз-
мы-комменсалы безвредны и могут играть важ-
ную роль в жизни организма, такую как выработ-
ка витамина К бактериями кишечника. Однако
комменсалы могут стать патогенами в условиях,
когда защитные силы организма ослаблены. На-
пример, Staphylococcus epidermitis и Candida albicans
являются частью нормальной микрофлоры кожи,
но могут вызывать угрожающие жизни инфекции
у пациентов при катетеризации вен, во время ко-
торой нарушается целостность кожи. Некоторые
методы лечения рака приводят к подавлению им-
мунной системы, что увеличивает риск развития
у пациентов тяжелых инфекций, вызванных низ-
ковирулентными микроорганизмами, такими как
комменсалы.
В этой главе обсуждается, каким образом орга-
низмы млекопитающих защищают себя от пато-
генов разных типов и как иммунная система мо-
жет быть примирована посредством активной или
пассивной иммунизации в целях защиты от мик-
роорганизмов. Предполагается, что читатель оз-
накомлен с общими принципами, лежащими в
основе врожденных и адаптивных защитных
свойств организма.
• ЗАЩИТА ОРГАНИЗМА
ОТ МИКРОБНЫХ ПАТОГЕНОВ
Наиболее эффективный иммунный ответ на воз-
действие определенного микроорганизма зависит
от типа патогена и стратегии его патогенеза. Ви-
русы, бактерии, паразиты и грибы используют
характерную для каждого возбудителя стратегию
утверждения в организме, и соответственно, эф-
фективный иммунный ответ для каждого из этих
классов организмов будет различным. Хотя па-
тогены и отличаются друг от друга, при рассмот-
рении иммунных ответов на различные классы
патогенов выделяют определенные характерные
черты
Иммунитет к вирусам
Все вирусы являются облигатными внутриклеточ-
ными патогенами. Многие из них выработали
чрезвычайно сложные механизмы проникновения
в клетку, репликации и уклонения от действия
иммунной системы. Защита организма от вирус-
ных инфекций направлена в первую очередь на
замедление репликации вируса, а затем на устра-
нение инфекции. Ответ на вирусы может быть
сложным, а его результат при взаимодействии
организм — патоген зависит от многих факторов,
таких как путь проникновения, место прикреп-
ления, аспекты патогенеза, выработка интерфе-
рона, антительный ответ и клеточно-опосредо-
ванный иммунитет. Важным начальным механиз-
мом защиты является выработка интерферонов
различных типов, таких как IFNa— лейкоцита-
ми, IFNp — фибробластами и IFNy — Т- и NK-
клетками. Интерфероны являются противовирус-
ными белками или гликопротеинами, вырабаты-
ваемыми многими типами клеток организма мле-
копитающих в ответ на вирусную инфекцию (или
другие индукторы, такие как двухцепочечная
РНК). Интерфероны выступают в качестве ран-
него защитного механизма. Вырабатываемые ин-
фицированными клетками IFNa и IFNp переме-
щаются к соседним клеткам и активируют гены,
которые препятствуют репликации вируса. Эти ин-
терфероны также стимулируют продукцию моле-
кул МНС I класса и протеозомных белков, кото-
рые увеличивают способность инфицированных
вирусами клеток презентировать пептиды виру-
сов Т-клеткам. Более того, IFNa и IFNp активи-
руют NK-клетки, которые распознают и убивают
инфицированные вирусом клетки организма,
уменьшая таким образом продукцию вирусов.
Натуральные киллеры характеризуются спо-
собностью убивать определенные клетки опухо-
лей in vitro без предварительной сенсибилизации
и обеспечивают раннюю защиту клеток от виру-
сов. Позднее в процессе инфекции, когда стано-
вятся доступными антитела к вирусным анти-
генам, NK-клетки могут устранять клетки орга-
низма, инфицированные вирусами, посредством
антителозависимой клеточно-опосредованной ци-
тотоксичности (АЗКЦ). Они также продуциру-
ют IFNy — сильный активатор макрофагов, ко-
торый помогает примировать иммунную систе-
му к выработке адаптивных иммунных ответов.
322
ГЛАВА 20. СОПРОТИВЛЯЕМОСТЬ К ИНФЕКЦИОННЫМ ЗАБОЛЕВАНИЯМ И ИММУНИЗАЦИЯ
Белки системы комплемента повреждают обо-
лочку некоторых вирусов, обеспечивая опреде-
ленную степень защиты при ряде вирусных ин-
фекций.
Хотя действие IFN, NK-клеток и, возможно,
комплемента направлено на замедление и сдер-
живание многих вирусных инфекций, инфекция
может прогрессировать, что сопровождается реп-
ликацией вирусов и повреждениями, которые
могут запустить иммунный ответ. Гуморальный
ответ приводит к выработке антител к вирусным
белкам. Некоторые антитела могут предотвращать
проникновение вирусов в другие клетки. Такие
антитела называют нейтрализующими. Из них наи-
более активным изотипом противовирусных ан-
тител является IgG. Опсонизация представляет
собой конвергенцию гуморального и клеточного
механизмов иммунитета. Соединившись посред-
ством своего Fab-фрагмента с вирусным антиге-
ном на поверхности инфицированной клетки, IgG
соединяется также с Fc-рецепторами клеток не-
которых популяций, таких как NK-клетки, мак-
рофаги и ПМЯ клетки. Эти клетки могут фагоци-
тировать и/или повреждать инфицированную ви-
русом клетку (АЗКЦ).
Антитела к белкам вируса могут предотвращать
инфекцию, вмешиваясь в процесс прикрепления
вируса к клетке организма. Выработка секретор-
ного IgA может защитить организм, предотвра-
щая инфицирование эпителиальных клеток сли-
зистых поверхностей. Антитела также могут вме-
шиваться в развитие вирусной инфекции путем
агглютинации вирусных частиц, а также активи-
руя комплемент на поверхности вирусов и спо-
собствуя фагоцитозу вирусных частиц макрофа-
гами. Ответ со стороны антител призван ограни-
чить распространение вирусов и способствовать
разрушению инфицированных клеток организма
посредством АЗКЦ. Таким образом, эффективный
ответ со стороны антител на вирусы включает
выработку антител, которые:
• нейтрализуют (или препятствуют проявлению)
способность к инфицированию вирусом чув-
ствительных клеток организма;
• фиксируют комплемент и способствуют по-
вреждению комплементом вирионов;
• ингибируют ферменты вируса;
• способствуют опсонизации вирусных частиц;
• способствуют АЗКЦ клеток, инфицированных
вирусами.
Для борьбы с вирусными инфекциями опреде-
ленных типов могут потребоваться различные
типы антител. Рассмотрим такие инфекции, как
грипп и корь. Инфицирование эпителия респи-
раторного тракта вирусом гриппа ведет к его раз-
множению в эпителиальных клетках и распрост-
ранению на прилежащие клетки эпителия. Соот-
ветствующий и достаточный иммунный ответ бу-
дет включать действие антител на поверхности
эпителия Это действие может осуществляться
посредством секреции в данном месте IgA или
экстравазации IgG или IgM. Однако некоторые
вирусные заболевания, такие как корь и полио-
миелит, начинаются с инфицирования эпителия
слизистых оболочек (респираторного или кишеч-
ного тракта соответственно), но основные пато-
генетические эффекты проявляются после гема-
тогенного распространения и достижения других
тканей-мишеней. Антитела, находящееся на по-
верхности эпителия, могут защищать от вируса,
но то же самое могут сделать и антитела, цирку-
лирующие в крови.
Однако как только вирус прикрепляется к клет-
ке, он обычно не может быть вытеснен антите-
лом. Таким образом, эффективный ответ со сто-
роны антител обычно бывает недостаточным для
устранения вирусной инфекции, особенно когда
вирус расположен внутри клеток организма. Для
устранения развившейся вирусной инфекции
обычно требуется эффективный клеточно-опо-
средованный ответ. Адаптивный клеточный ответ
приводит к появлению специфических CD4+- и
СВ8+-Т-клеток, необходимых для устранения ви-
русных инфекций. Считается, что СО4+-Т-клет-
ки вовлечены в организацию эффективных анти-
тельных ответов, способствуя переключению изо-
типа иммуноглобулинов и созреванию аффинно-
сти (см. гл. 7). Также СО4+-Т-клетки вырабаты-
вают важные цитокины, стимулирующие воспа-
лительные реакции в местах вирусной инфекции
и активирующие функцию макрофагов. Цитоток-
сические СО8+-Т-клетки (цитотоксические Т-лим-
фоциты — ЦТЛ) являются основными эффектор-
ными клетками в противовирусных реакциях. Они
продуцируются на ранних этапах вирусной ин-
фекции обычно до появления нейтрализующих
антител. СО8+-Т-клетки могут распознавать ви-
русные антигены в составе молекул МНС I клас-
са и убивать клетки организма, содержащие ви-
русы. Поскольку молекулы МНС I класса эксп-
рессируются большинством типов клеток организ-
ма, С1Э8+-Т-клетки могут распознавать многие
типы инфицированных клеток и, таким образом,
представляют собой исключительно важный ком-
понент адаптивного ответа организма на вирус-
ные инфекции. Однако при некоторых инфекци-
ях, вызванных нецитопатическими вирусами, та-
кими как вирус гепатита В, СО8+-Т-клетки могут
вызывать повреждение ткани. Поэтому хрониче-
ская инфекция, вызванная вирусом гепатита В,
может привести к развитию хронического воспа-
ления и повреждению клеток печени, что вызы-
вает фиброз и прогрессирующую недостаточность
органа.
В целом врожденные иммунные механизмы в
самом начале вирусной инфекции вмешиваются
в ее развитие посредством продукции IFN и кил-
линга инфицированных клеток NK-клетками Эти
ранние защитные механизмы выигрывают время
для развития мощных адаптивных иммунных от-
ЗАЩИТА ОРГАНИЗМА ОТ МИКРОБНЫХ ПАТОГЕНОВ
323
ветов. В ходе адаптивных иммунных ответов появ-
ляются нейтрализующие антитела, приводящие к
уменьшению числа вирусных частиц, и ЦТЛ, ко-
торые убивают инфицированные клетки Присут-
ствие нейтрализующих антител обеспечивает за-
щиту при последующих контактах с тем же виру-
сом.
Иммунитет к бактериям
Защита организма от бактериальных патогенов
достигается посредством различных механизмов,
включающих как гуморальный, так и клеточный
иммунитет. Антибактериальная защита включа-
ет лизис бактерий посредством антител и комп-
лемента, опсонизацию и фагоцитоз с последующим
удалением фагоцитированных бактерий печенью,
селезенкой и другими компонентами ретикуло-
эндотелиальной системы. Бактерии и их продук-
ты интернализуются АПК, такими как макрофа-
ги и дендритные клетки, и процессируются. Пеп-
тиды, получающиеся в результате такого процес-
сирования, презентируются Т-клетками в моле-
кулах МНС II класса (см. гл. 9). Этот процесс
усиливает ответ организма, поскольку Т-клетки
вырабатывают цитокины, активирующие макро-
фаги и привлекающие дополнительные воспали-
тельные клетки. Относительная эффективность
различных иммунных механизмов зависит от типа
бактерий и, особенно, от свойств их клеточной
поверхности. Бактериальные патогены в зависи-
мости от состава их клеточных стенок и мембран
можно условно разделить на четыре класса: грам-
положительные, грамотрицательные, микобакте-
рии и спирохеты. Некоторые грамположительные
и грамотрицательные бактерии создают полиса-
харидные капсулы. Другой важной характеристи-
кой бактериальных патогенов является их при-
надлежность к внутриклеточным или внеклеточ-
ным патогенам. Внутриклеточные бактериальные
патогены остаются в клетках и частично защище-
ны от всего набора средств иммунной защиты
организма, в то время как внеклеточные находят-
ся вне клеток. В целом гуморальный иммунитет
очень важен для защиты от внеклеточных бакте-
рий, тогда как клеточный иммунитет превалиру-
ет в борьбе с внутриклеточными бактериями и их
устранении.
Грамположительные бактерии
Грамположительные бактерии имеют плотную
(при электронной микроскопии) клеточную стен-
ку, состоящую из сложного перекрестно соеди-
ненного пептидогликана, позволяющего бактери-
ям окрашиваться кристаллическим фиолетовым
(отсюда название «грамположительные»). Кроме
толстого слоя пептидогликана клеточная стенка
грамположительных бактерий содержит тейхоивые
кислоты, углеводороды и белки. Тейхоевые кисло-
ты иммуногенны и составляют основные анти-
генные детерминанты грамположительных бакте-
рий. Этот тип клеточной стенки обеспечивает их
толстым защитным слоем, который делает бакте-
рии резистентными к лизису системой компле-
мента. В защите против грамположительных бак-
терий участвуют специфические антитела, ответ-
ственные за обеспечение опсонинами и фагоци-
тирующими клетками, такими как нейтрофилы и
макрофаги. Они захватывают и разрушают бакте-
рии. Опсонизация и фагоцитоз связаны с действием
IgG и IgM, как самостоятельным, так и совмест-
ным с СЗЬ. Альтернативный путь активации ком-
племента может запускаться непосредственно бак-
териальной стенкой грамположительного возбу-
дителя и приводить к депонированию опсонинов
комплемента на поверхности клетки, а также вы-
работке медиаторов воспалительной реакции. Хотя
система комплемента и непосредственно не уча-
ствует в лизисе грамположительных бактерий, она
обеспечивает появление опсонинов и медиаторов
воспаления, которые играют основную роль в за-
щите организма.
Грамотрицательные бактерии
Грамотрицательные бактерии не окрашиваются
кристаллическим фиолетовым. Слоистая структура
их клеточной стенки состоит из наружной и внут-
ренней мембран, разделенных тонким слоем пеп-
тидогликана в периплазматическом пространстве.
Таким образом, грамположительные и грамотри-
цательные бактерии сильно отличаются по струк-
туре клеточной стенки. Наружная мембрана грам-
отрицательной бактерии содержит липополисаха-
рид (ЛПС), известный так же как эндотоксин.
Полисахаридная часть ЛПС обладает антигенны-
ми детерминантами, которые обусловливают ан-
тигенную специфичность. Многие штаммы грам-
отрицательных бактерий содержат варианты с раз-
личными структурами ЛПС, которые серологи-
чески могут быть определены как серотипы. Для
человека ЛПС является сильным токсином и мо-
жет вызвать сердечно-сосудистый коллапс, гипо-
тензию и шок в период инфекции, вызванной
грамотрицательными бактериями. Альтернатив-
ный путь комплемента может быть активирован
непосредственно ЛПС, находящимся на стенке
грамотрицательной бактерии или на ее полиса-
харидной капсуле, действующей на СЗ. Актива-
ция альтернативного пути ведет к выработке хе-
мотаксических молекул СЗа и С5а, а также опсо-
нина СЗЬ, что может привести к бактериолити-
ческому действию со стороны мембраноатаку-
ющего комплекса С5 —С9 (см. гл. 13). Способ-
ность системы комплемента лизировать некото-
рые грамотрицательные бактерии напрямую яв-
ляется важным отличием от грамположительных
бактерий, которые невосприимчивы к опосредо-
ванному комплементом лизису благодаря толсто-
му слою пептидогликана. Защиту от грамотри-
324
ГЛАВА 20. СОПРОТИВЛЯЕМОСТЬ К ИНФЕКЦИОННЫМ ЗАБОЛЕВАНИЯМ И ИММУНИЗАЦИЯ
цательных бактерий обеспечивают система ком-
племента, специфические антитела и фагоцити-
рующие клетки.
Микобактерии
Стенки микобактерий отличаются от стенок грам-
положительных и грамотрицательных бактерий.
Они характеризуются высоким содержанием ли-
пида, который затрудняет окрашивание бактерий.
Другим свойством стенки микобактерии является
кислотоустойчивость, которая позволяет им удер-
живать краситель после обработки кислотой. Ра-
стут микобактерии медленно. Они обладают гид-
рофобными поверхностями, что обусловливает их
скопление в группы. Компоненты микобактери-
альных стенок в период инфекции вызывают силь-
ные иммунные ответы, такие как реакции гипер-
чувствительности замедленного типа (ГЗТ), ко-
торые и дают основание для проведения тубер-
кулинового теста Реакции гиперчувствительно-
сти на белки микобактерий могут быть вовлече-
ны в патогенез микобактериальных инфекций.
Микобактерии вызывают сильный антительный
ответ, хотя роль гуморального иммунитета в за-
щите от микобактерий не определена. Основны-
ми механизмами зашиты от микобактерий явля-
ются макрофаги и клеточно-опосредованный им-
мунитет.
Спирохеты
Спирохеты являются спиралевидными микроор-
ганизмами. К их числу принадлежат возбудители
сифилиса (Treponema pallidum} и болезни Лайма
(Borrelia burgdorferi}. Спирохеты не обладают та-
кими стенками, как грамположительные, грамот-
рицательные бактерии и микобактерии. Вместо
этого у них есть тонкая наружная мембрана, со-
держащая небольшое число белков. Чтобы уви-
деть тонкие и нежные спирохеты, требуется спе-
циальная методика: микроскопия темного поля и
иммунофлуоресцентная микроскопия. В защите
организма от спирохет важную роль играют ком-
племент, специфические антитела и клеточно-
опосредованный иммунитет.
Иммунитет к паразитам
К паразитам относится разнородная группа па-
тогенов, таких как одноклеточные простейшие и
гельминты. Многие паразиты характеризуются
разнообразием тканевых стадий, которые могут
различаться по клеточному расположению и ан-
тигенному составу, создавая, таким образом, серь-
езную проблему для иммунной системы. Разно-
образие паразитов таково, что обобщения отно-
сительно эффективных механизмов защиты от
них организма сделать трудно. Однако ясно, что
врожденные и адаптивные механизмы чрезвычай-
но важны для защиты от паразитарных инфек-
ций. Некоторые паразиты являются простейши-
ми одноклеточными эукариотами, которые мо-
гут существовать как в метаболически активной
форме, называемой трофозоитом, так и в неак-
тивной тканевой форме, известной как циста.
Среди заболеваний, вызванных простейшими,
можно назвать амебиаз, малярию, лейшманиоз,
трипаносомоз и токсоплазмоз. Защита от про-
стейших осуществляется такими механизмами,
как врожденный и адаптивный гуморальный и
клеточный иммунитет, однако их относительная
важность может изменяться в зависимости от
конкретного патогена. Некоторые паразиты из
простейших, например трипаносомы, способны
активировать систему комплемента по альтерна-
тивному пути.
Активация комплемента вместе с фагоцито-
зом, осуществляемым нейтрофилами и макрофа-
гами (компонентами врожденной иммунной си-
стемы), обеспечивает существенную степень за-
щиты от многих паразитарных патогенов. Было
показано, что для многих протозойных инфек-
ций, таких как амебиаз, малярия и трипаносо-
моз, гуморальный иммунитет в форме антител
опосредует защиту от инфекции. Однако для ос-
тальных протозойных инфекций, таких как лейш-
маниоз и токсоплазмоз, более важен клеточный
иммунитет.
Другими паразитами являются многоклеточные
черви, называемые гельминтами. В отличие от дру-
гих патогенных микроорганизмов гельминты яв-
ляются крупными макроскопическими организ-
мами величиной от 1 см до 10 м. Это является
особой проблемой для защитных сил организма.
Для борьбы с гельминтозами необходимо слож-
ное взаимодействие между тканевыми и иммун-
ными реакциями. Гельминты печально известны
своей способностью вызывать хронические инфек-
ции, которые могут приводить к появлению силь-
ных иммунных ответов на антигены червя. Суще-
ствует общее мнение, что такие компоненты врож-
денной иммунной системы, как эозинофилы и
тучные клетки, являются важными эффекторны-
ми клетками для борьбы с гельминтами, но мно-
гие аспекты реакции организма на червей оста-
ются тайной. Считается, что IgE, специфичный к
антигенам гельминта, играет важную роль в за-
щите организма, примируя эозинофилы к АЗКЦ
(см. рис. 14.8). Гельминтозы часто сопровожда-
ются повышенным содержанием эозинофилов в
крови и IgE в сыворотке крови.
Иммунитет к грибам
Грибковые патогены являются эукариотами, ко-
торые могут вызывать тяжелые инфекции в ос-
новном у индивидуумов с нарушениями имму-
нитета. Грибы вызывают повреждение ткани, вы-
рабатывая протеолитические ферменты и ини-
МЕХАНИЗМЫ, С ПОМОЩЬЮ КОТОРЫХ ПАТОГЕНЫ ИЗБЕГАЮТ ИММУННОГО ОТВЕТА
325
циируя воспалительные реакции. Наиболее рас-
пространенным грибковым патогеном является
Candida albicans. Этот организм обычно является
безвредным комменсалом, но может вызывать за-
болевания, когда обычные механизмы защиты на-
рушены, как, например, при нарушении целост-
ности кожных покровов при хирургическом вме-
шательстве или катетеризации. В другую группу
риска по развитию тяжелых заболеваний, вызван-
ных С. albicans, входят лица с транзиторным ис-
тощением нейтрофилов, вызванным проводимой
химиотерапией. Тот факт, что условием для раз-
вития большинства тяжелых кандидозных инфек-
ций является нарушение целостности кожных по-
кровов или истощение нейтрофилов, указывает
на основную роль врожденных механизмов защи-
ты в предотвращении системных заболеваний.
В то же время у больных с далеко зашедшей ВИЧ-
инфекцией наблюдается кандидоз слизистых обо-
лочек, что указывает на важность клеточно-опо-
средованного иммунитета для защиты от этого
возбудителя.
Другие грибы, такие как Histoplasma capsulatum
и Cryptococcus neoformans, в тех местах, где они
обнаруживаются в почве, поступают в организм
при вдыхании. Изучение распространенности бес-
симптомного носительства выявило высокий уро-
вень инфицированное™ при очень низкой забо-
леваемости, что подтверждалось реакциями со
стороны антител и положительными кожными
пробами. Таким образом, похоже, что первона-
чальное проникновение этих микробов в организм
привело к появлению адаптивного иммунного
ответа, защищающего от инфекции. Некоторые
грибы, такие как Н. capsulatum, выживают внутри
макрофагов и являются внутриклеточными пато-
генами. Один из грибковых патогенов С. neoformans
имеет полисахаридную капсулу, ответственную за
вирулентность.
Грибы отличаются от бактерий другим типом
клеточной стенки, которая состоит из перекрест-
но связанных полисахаридов. Клетки гриба обыч-
но не подвержены лизису со стороны системы
комплемента. Реакция организма на грибковые
инфекции включает как гуморальный, так и кле-
точный ответы. Общепризнанно, что основной
формой защиты от патогенных грибов является
клеточно-опосредованный иммунитет. Необходи-
мость в нормальной функции Т-клеток для защи-
ты от грибов особенно наглядно демонстрируется
склонностью больных СПИДом к развитию угро-
жающих жизни инфекций, вызванных такими гри-
бами, как Н. capsulatum и С, neoformans. Истори-
чески сложилось мнение, что иммунитет, опо-
средованный антителами, не имеет существенно-
го значения для борьбы с грибами. Однако за по-
следние годы были сообщения о нескольких за-
щитных моноклональных антителах против С. albi-
cans и С. neoformans. Таким образом, похоже, что
и клеточный, и гуморальный иммунные механиз-
мы участвуют в защите от грибов.
МЕХАНИЗМЫ, С ПОМОЩЬЮ
КОТОРЫХ ПАТОГЕНЫ ИЗБЕГАЮТ
ИММУННОГО ОТВЕТА
Несмотря на трудно преодолимую защиту со сто-
роны иммунной системы, некоторые микроорга-
низмы способны обосновываться в организме и
вызывать угрожающие жизни инфекции. Многие
патогенные микробы обладают специальными
приспособлениями, которые позволяют им избе-
гать действия иммунной системы. Очень важно
изучать механизмы, с помощью которых микроб-
ные патогены избегают иммунного ответа орга-
низма, поскольку благодаря им можно многое
узнать об эффективности и ограниченности ме-
ханизмов защиты организма человека. Более того,
лучшее понимание стратегий, которыми пользу-
ются микроорганизмы в целях выживания после
иммунной атаки, может оказаться полезным для
создания новых методов лечения и вакцин для
борьбы с инфекцией.
Инкапсулированные бактерии
Полисахаридные капсулы являются важными фак-
торами вирулентности для ряда патогенов чело-
века, таких как Streptococcus pneumoniae (пневмо-
кокк), Haemophilus influenzae, Neisseria meningitides
(менингококк) и Crypticoccus neoformans. Эти ан-
тифагоцитарные капсулы защищают патогены от
захвата и киллинга фагоцитарными клетками орга-
низма. Некоторые капсулы также вмешиваются в
действие системы комплемента. Молекулы поли-
сахаридов часто слабо иммуногенны, и инфекция,
вызванная инкапсулированными патогенами, не
обязательно должна приводить к появлению вы-
сокого титра антител при иммунном ответе. Но-
ворожденные и маленькие дети особенно чувстви-
тельны к угрожающим жизни инфекциям, вызы-
ваемым инкапсулированными бактериями, по-
скольку их незрелая иммунная система не выра-
батывает адекватных ответов со стороны антител.
Другими индивидуумами, подверженными боль-
шому риску таких заболеваний, являются лица с
наследственными или приобретенными дефици-
тами, затрагивающими выработку антител, а так-
же те, у кого отсутствует нормальная функция се-
лезенки. Поскольку бактерии устраняются РЭС в
селезенке и печени, эти органы играют решающую
роль в защите от инкапсулированных патогенов.
Индивидуумы с ослабленной функцией РЭС в
результате заболевания (например, серповидно-
клеточная анемия) или хирургического удаления
селезенки особенно подвержены действию инкап-
сулированных бактерий. Механизм действия ан-
тител против инкапсулированных патогенов вклю-
чает фагоцитоз с помощью опсонинов и киллинг,
осуществляемый нейтрофилами и макрофагами.
Антитела к капсулярным полисахаридам действу-
326
ГЛАВА 20. СОПРОТИВЛЯЕМОСТЬ К ИНФЕКЦИОННЫМ ЗАБОЛЕВАНИЯМ И ИММУНИЗАЦИЯ
ют путем стимуляции фагоцитоза непосредственно
через Fc-рецепторы или не напрямую — актива-
цией комплемента.
Токсины
Симптомы заболевания некоторых бактериальных
инфекций вызываются факторами вирулентности,
называемыми токсинами. Бактериальные токси-
ны являются белками. Чтобы проявился физио-
логический эффект, достаточно их наличия в ма-
лых концентрациях. Примерами бактерий, выра-
батывающих токсины, являются Corynebacterium
dipththeriae, Vibrio cholerae и Clostridium tetani, вы-
зывающие дифтерию, холеру и столбняк соответ-
ственно. При дифтерии С. dipththeriae размножа-
ется и производит токсин в носоглотке, что при-
водит к формированию плотной пленки в обла-
сти гортани, способной вызвать у пациента ас-
фиксию. Холера является диарейным заболевани-
ем, вызываемым V.cholerae. При нем возникает
опосредованное токсином нарушение всасывания
воды в клетках слизистой оболочки кишечника.
При столбняке токсин, вырабатываемый С. tetani,
вызывает неконтролируемое возбуждение перифе-
рических мышц, приводящее к судорогам. Связь
функции токсина с бактериальной инвазией и
уклонением бактерии от иммунного ответа измен-
чива и может быть разной для каждого патогена.
Некоторые токсины, такие как столбнячный и
ботулинический, не повреждают иммунную сис-
тему напрямую. Дифтерийный токсин может спо-
собствовать бактериальной инфекции, повреждая
слизистые оболочки. Bacillus anthracis — патоген,
вызывающий сибирскую язву, вырабатывает ток-
сины, приводящие к апоптозу макрофагов. Ос-
новной механизм такого ускользания от иммуно-
логического контроля включает действие так на-
зываемого летального токсина. Этот токсин по-
давляет протеинкиназу макрофага, которая необ-
ходима для транскрипции антиапоптозных генов
вслед за активацией клетки.
Большинство токсинов являются высокоимму-
ногенными и вызывают сильный гуморальный и
клеточный иммунные ответы. Специфические
антитела могут прикрепляться к бактериальным
• Таблица 20.1. Зависимость защитного действия
дифтерийного антитоксина от времени введения
после развития заболевания у людей*
Сутки Число случаев Смертность
1-е 225 9,0
2-е 1445 4,2
3-е 1600 П,1
4-е 1276 17,3
5-е (или позже) 1645 18,7
*С разрешения А. М. Pappenheimer, 1965.
токсинам и нейтрализовать их. Защита от токси-
нов преимущественно связана с IgG, хотя IgA
может также играть важную роль в нейтрализа-
ции определенных экзотоксинов (например, сек-
ретируемых токсинов), таких как холерный энте-
ротоксин. Поскольку экзотоксины плотно связы-
ваются со своими тканями-мишенями, они обыч-
но не могут быть вытеснены при последующем
назначении антитоксина (пассивная иммуниза-
ция с использованием токсинспецифических ан-
тител описывается далее в этой главе). Таким об-
разом, при заболеваниях, опосредованных токси-
нами (например, дифтерия), необходимо быстро
назначить антитоксин, чтобы предотвратить при-
крепление (дополнительного) экзотоксина и по-
вреждение, им вызываемое. Сказанное можно
проиллюстрировать эффективностью антитокси-
на, введенного в различное время для защиты
людей от летальных эффектов дифтерийного ток-
сина (табл. 20.1). По мере прогрессирования ин-
фекции эффективность назначения дифтерийно-
го антитоксина значительно снижается. Некото-
рые бактериальные токсины являются фермента-
ми, такими как лектиназа у бактерии Clostridium
perfringens и яда змеи. Однако антитела, связыва-
ющие токсины, не обязательно подавляют фер-
ментативно активные участки токсинов.
Суперантигены
Взаимодействие определенных токсинов с иммун-
ной системой может иметь серьезные иммуноло-
гические последствия, если токсины способны
связываться с Т-клеточными рецепторами боль-
шого числа Т-клеток. Эти токсины называют су-
перантигенами. Одним из них является стафило-
кокковый токсин синдрома токсического шока (см.
гл. 10). В начале 1980-х гг. многие случаи синдро-
ма токсического шока были вызваны тампонами,
используемыми женщинами при менструациях.
С того времени частота заболевания значительно
снизилась в связи с изменениями в производстве
тампонов. Суперантигены стимулируют большое
количество Т-клеток, которые пролиферируют,
синтезируют цитокины, а затем погибают посред-
ством апоптоза, что приводит к потере важных
иммунных клеток. Проявляется этот феномен ги-
потензией, гиповолемией и органной недостаточ-
ностью, которые могут привести к смерти. Опи-
саны также суперантигены для В-клеток, кото-
рые, связываясь с клетками, нарушают экспрес-
сию определенных семейств генов иммуногло-
булинов.
Антигенное разнообразие
Патогены могут избегать действия иммунной си-
стемы путем создания разновидностей, отлича-
ющихся по антигенному составу. Этот механизм
МЕХАНИЗМЫ, С ПОМОЩЬЮ КОТОРЫХ ПАТОГЕНЫ ИЗБЕГАЮТ ИММУННОГО ОТВЕТА
327
называют антигенным разнообразием. Классиче-
скими примерами патогенов, использующих этот
механизм, являются вирус гриппа, ВИЧ, Strepto-
coccus pneumoniae, трипаносомы и стрептококки
группы А. Каждый из этих патогенов являет со-
бой наглядную иллюстрацию механизма антиген-
ного разнообразия. В случае со стрептококком
группы А М-белок, обусловливающий вирулент-
ность, предотвращает фагоцитоз посредством ме-
ханизма, способствующего отложению фибрино-
гена на поверхности бактерии. М-белки вызыва-
ют образование защитных антител, но отличаются
антигенным разнообразием, и стрептококковая ин-
фекция, вызванная одним штаммом, не приводит
к появлению резистентности к другим штаммам.
Антигенное разнообразие вирусов гриппа обес-
печивается наличием у них сегментированного
РНК -генома. При его переформировании полу-
чаются вирионы, экспрессирующие новые ком-
бинации двух основных поверхностных антиге-
нов: гемагглютинина и белков поверхностной ней-
роаминидазы. Результатом точечных мутаций в
геноме вируса гриппа является антигенный дрейф,
обеспечивающий антигенные изменения у гемаг-
глютинина и нейроаминидазы. Антигенный сдвиг
появляется, когда вирус гриппа экспрессирует
новую аллель гемагглютинина или белка нейро-
аминидазы, что приводит к значительным анти-
генным изменениям и появлению нового штамма
вируса. В результате антигенных дрейфа и сдвига
вирус гриппа быстро изменяется, и одна инфек-
ция гриппа не приводит к появлению резистент-
ности к последующей инфекции. Более того, по-
скольку каждая эпидемия обладает антигенными
отличиями, вакцина против гриппа должна об-
новляться каждый год.
У ВИЧ антигенная изменчивость in vivo про-
является очень быстро, поскольку он обладает
«склонной к ошибкам» обратной транскриптазой,
которая вызывает мутации, приводящие к анти-
генным изменениям у поверхностных белков.
Существование антигенного разнообразия у ВИЧ
явилось основным препятствием на пути созда-
ния эффективной вакцины. У других патогенов,
таких как Streptococcus pneumoniae (пневмококк),
антигенное разнообразие обусловлено наличием
множества серотипов, каждый из которых обла-
дает своим антигенным составом. Существует бо-
лее 80 серотипов пневмококков, и инфицирова-
ние одним серотипом не обеспечивает в дальней-
шем защиты от инфицирования другим сероти-
пом. Таким образом, организм должен бороться с
инфекцией, вызванной каждым серотипом пнев-
мококка, как если бы эта инфекция была вызвана
другим микроорганизмом.
Антигенное разнообразие у патогенов может
быть закодировано в их геномах. Трипаносомы вы-
зывают хронические инфекции через появление во
время инфекции новых антигенных типов, которые
экспрессируют различные варианты поверхност-
ных гликопротеинов (ВПГ). При трипаносомозе
ответ со стороны антител организма осуществля-
ется против ВПГ, экспрессируемых большинством
паразитов, что приводит к устранению их боль-
шей части. Однако при каждой инфекции, вы-
званной трипаносомами, существует небольшое
количество организмов, экспрессирующих другой
ВПГ -антиген, который не распознается антите-
лами. Ответ со стороны антител помогает изба-
виться от основной популяции трипаносом. Ос-
тавшиеся организмы, экспрессирующие другой
ВПГ-антиген, затем пролиферируют, одновремен-
но создавая новую субпопуляцию с новыми анти-
генными вариантами, способную выжить при но-
вом гуморальном иммунном ответе. Затем цикл
повторяется. Поскольку существует много ВПГ-
генов, трипаносомы способны вызывать персе-
стирующие инфекции путем создания «спаса-
ющихся» вариантов, отличающихся по антиген-
ному составу в каждом поколении.
Внутриклеточное выживание
Некоторые микроорганизмы захватываются фа-
гоцитирующими клетками, но способны выживать
во внутриклеточной среде. Такими патогенами
являются бактерии Mycobacterium tuberculosis и
Listeria monocytogenes, грибы Histoplasma capsulatum
и простейшие Toxoplasma gondii. M. tuberculosis вы-
зывает туберкулез, легочную инфекцию. L. mono-
cytogenes является передаваемым с пищей микро-
бом, который вызывает менингит у лиц с подав-
ленным иммунитетом. Н. capsulatum способен вы-
звать угрожающие жизни диссеминированные ин-
фекции. Т.gondii является паразитом, который пе-
редается с необработанной пищей и обычно вы-
зывает бессимптомную инфекцию. Однако у бе-
ременных женщин Т. gondii может инфицировать
плод, вызывая тяжелые врожденные дефекты.
Больные с далеко зашедшей ВИЧ-инфекцией осо-
бенно склонны к заболеванию токсоплазмозом.
Все эти микроорганизмы вызывают разные забо-
левания, но общим для них является способность
выживать внутри клетки организма-хозяина.
Микроорганизмы, расположившиеся внутри
клетки, обладают тем преимуществом, что они на-
ходятся в среде, богатой питательными вещества-
ми, вне досягаемости гуморальных факторов и
нейтрофилов. В целом защита от внутриклеточ-
ных паразитов является прерогативой клеточно-
опосредованного иммунитета, хотя в защите орга-
низма от некоторых патогенов принимает учас-
тие и гуморальный иммунитет. Это положение
иллюстрируется тем фактом, что L. monocytogenes,
Н. capsulatum и Т. gondii вызывают серьезные за-
болевания у лиц с нарушенной функцией Т-кле-
ток, таких как больные СПИДом. Более того, NK-
клетки играют важную роль на ранних стадиях
инфекции, уничтожая инфицированные клетки до
развития специфической резистентности. Грану-
лематозное воспаление является проявлением в
328
ГЛАВА 20. СОПРОТИВЛЯЕМОСТЬ К ИНФЕКЦИОННЫМ ЗАБОЛЕВАНИЯМ И ИММУНИЗАЦИЯ
тканях клеточно-опосредованного иммунитета,
связанного с содержанием в них некоторых внут-
риклеточных патогенов.
Хотя фагоцитарные клетки обычно являются
эффективными антимикробными клетками, суще-
ствуют микроорганизмы, способные выживать
внутри клеток, используя одну из нескольких стра-
тегий для того, чтобы избежать уничтожения после
фагоцитоза. М. tuberculosis блокирует слияние ли-
зосом с фагоцитарной вакуолью, таким образом
препятствуя поступлению антимикробных веществ
к фагосоме (см. гл. 2). Н. capsulatum препятствует
ацидификации (подкислению) фаголизосомальной
вакуоли. Считается, что этот феномен препятству-
ет уничтожению клеток дрожжей внутри макро-
фагов. L. monocytogenes вырабатывает бактериаль-
ные продукты, которые позволяют ей уходить от
фаголизосомальной вакуоли в клеточную цито-
плазму. Считается, что этот механизм обеспечи-
вает ее более благоприятной с точки зрения обес-
печения питательными компонентами нишей и
препятствует действию внутриклеточных антимик-
робных механизмов. Т.gondii вырабатывает свою
собственную вакуоль, в которой она остается за-
щищенной от лизосом организма. Таким образом
она избегает инициации процесса распознавания
инфицированных клеток иммунной системой.
Другие бактерии, такие как Shigella flexneri (микро-
организм, вызывающий диарейное заболевание),
могут обеспечивать свое выживание внутри фаго-
цитарных клеток, инициируя апоптоз и смерть
фагоцитарной клетки.
Подавление иммунной системы
Некоторые патогены обеспечивают свое выжива-
ние в организме млекопитающих активным по-
давлением иммунного ответа. Многие вирусы со-
держат гены, способные влиять на иммунный от-
вет. Например, вирус Эпштейна —Барр, который
инфицирует В-клетки, кодирует ген выработки
белка, гомологичного IL-10, и таким образом сни-
жает иммунный ответ. Другие вирусы, подобно
вирусу простого герпеса, обладают кодируемыми
вирусом Fc-рецептором и рецепторами компле-
мента, которые вмешиваются в функцию антител
и комплемента. Вирус простого герпеса способен
также вмешиваться в распознавание иммунной
системой инфицированных клеток посредством
механизма, подавляющего экспрессию МНС I клас-
са на инфицированных клетках, таким образом
ослабляя их способность презентировать пепти-
ды вирусного происхождения. Аденовирусы ко-
дируют гены, снижающие воспалительную реак-
цию организма. Грибы Cryptococcus neoformans
сбрасывают большое количество капсулярных по-
лисахаридов, которые вмешиваются в процесс
формирования воспалительной реакции в ткани
Вирус иммунодефицита человека инфицирует раз-
личные клетки, такие как СВ4+-Т-клетки, и та-
ким образом способен напрямую влиять на клет-
ки, необходимые для эффективного иммунного
ответа. Вызванное ВИЧ истощение СВ4+-Т-кле-
ток вызывает постепенно ускоряющееся разру-
шение иммунной функции, что приводит к раз-
витию СПИДа и оставляет пациента беззащит-
ным перед многими оппортунистическими инфек-
циями.
Внеклеточные ферменты
Некоторые бактерии вырабатывают ферменты,
расщепляющие иммунные молекулы. Например,
Neisseria meningitides и N. gonorrhhoeae, вызыва-
ющие менингококковый менингит и гонорею со-
ответственно, вырабатывают протеазы IgA, кото-
рые разрушают IgA на поверхности слизистых обо-
лочек. Стрептококки, такие как стрептококки
группы А (которые вызывают острый фарингит),
вырабатывают гемолизины, которые, как считает-
ся, способствуют диссеминации микроорганизма.
Некоторые стрептококки вырабатывают пептида-
зу, расщепляющую белок С5а комплемента.
Экспрессия белков,
связывающих антитела
Некоторые бактерии, такие как Staphylococcus
aureus, экспрессируют белки поверхности клетки,
которые могут связывать иммуноглобулины по-
средством своих Fc-фрагментов. Примерами та-
ких Fc-связывающих белков являются белки AnG.
Способность этих белков связывать молекулы
иммуноглобулина применяется в иммунологиче-
ском исследовании, а именно в аффинной хро-
матографии для очищения IgG (см. гл. 5).
« ПРИНЦИПЫ ИММУНИЗАЦИИ
Защита от инфекционных заболевании с помо-
щью вакцинации является существенным, если
не величайшим достижением биомедицинской
науки. Благодаря вакцинации полностью исчез-
ла оспа, а распространенность других заболева-
ний значительно снизилась, по крайней мере в
тех районах, где вакцины доступны и правильно
используются.
Если может быть иммунизировано достаточно
большое количество людей, достигается популя-
ционный иммунитет, и передача инфекционных
заболеваний между ними прерывается. Хотя сама
по себе намеренная иммунизация может в неко-
торых случаях уменьшить частоту развития забо-
левания до очень низкого уровня, успешное про-
ведение программ иммунизации требует разумного
применения других мер, санитарных и гигиени-
ческих, которые способствуют общему оздоров-
лению населения
АКТИВНАЯ ИММУНИЗАЦИЯ
329
• Таблица 20.2. Примеры активной и пассивной
иммунизации
Тип иммунитета Как достигается
Активный: естественный (не- преднамеренный) искусственный (намеренный) Инфекция Вакцинация
Пассивный: естественный искусственный Передача антител от матери ребенку через плаценту или с молозивом Пассивная терапия с помощью антител (сывороточная терапия, применение человеческого им- муноглобулина)
Иммунизация может быть как активной, так и
пассивной. Активной иммунизацией обычно назы-
вают введение вакцины, которая способна вызывать
иммунный ответ. Пассивная иммунизация — это
введение антител или лимфоцитов, которые обес-
печивают защиту организма реципиента (табл. 20.2).
I ЦЕЛИ ИММУНИЗАЦИИ
Целью активной иммунизации является обеспе-
чение индивидуума длительной иммунологической
защитой от инфекционных агентов. Многие вак-
цины применяются в детстве для защиты от ин-
фекций, которые обычно встречаются в начале
жизни. Целью пассивной иммунизации является
обеспечение временной защиты от определенной
инфекции. Например, человеку, укушенному бе-
шеным животным, можно ввести иммунный гло-
булин против вируса бешенства, чтобы защитить
от инфекции, вызываемой данным вирусом. За-
щита от заболевания может также быть обеспече-
на иммунизацией после контакта. Так, индиви-
дуум после контакта с вирусом бешенства может
быть защищен от этой смертельной инфекции
путем введения как вакцины против бешенства,
так и иммунного глобулина против вируса бешен-
ства. Другими примерами иммунизации после
контакта могут служить применение анатоксина
и антитоксина против дифтерии, вакцинация ана-
токсином столбняка после травмы и введение им-
мунных сывороточных глобулинов против вируса
гепатита А и В после контакта с вирусом. Сейчас
прилагаются большие усилия по разработке тера-
певтических вакцин, которые остановят непрерыв-
ный процесс развития СПИДа у людей, инфици-
рованных ВИЧ.
Возможное использование вакцин для предот-
вращения определенных видов рака у человека об-
суждалось в гл. 19. Развитие некоторых злокаче-
ственных опухолей можно предотвратить с помо-
щью вакцин, предупреждающих инфекции, свя-
занные с последующим развитием рака. Напри-
мер, есть устойчивая связь между развитием пер-
вичного рака печени и инфекцией, вызванной ви-
русом гепатита В. Таким образом, использование
рекомбинантной вакцины против вируса гепати-
та В в группах повышенного риска может защи-
тить как от гепатита, так и последующего воз-
никновения гепатомы.
АКТИВНАЯ ИММУНИЗАЦИЯ
Как указывалось в гл. 1, термины «вакцинация» и
«вакцина» появились после работ Э. Дженнера, ко-
торый более 200 лет назад доказал, что введение
человеку жидкости, взятой из очагов кожных по-
ражений коров, инфицированных коровьей оспой,
защищает людей от высококонтагиозной и смер-
тельной болезни — оспы. Процесс, описанный
Э.Дженером, стал называться «вакцинацией» (от
лат. vacca — корова), а вещество, используемое
для вакцинации, стали называть вакциной. Коро-
вья оспа (вирус вакцинии) вызывает защитный
иммунный ответ относительно вируса оспы, по-
скольку оба эти вируса обладают одинаковыми
антигенными эпитопами, вызывающими защит-
ный иммунный ответ. В табл. 20.3 перечислены
некоторые вакцины разного типа, используемые
в настоящее время. Далее в этой главе рассмотре-
ны новые подходы к созданию вакцин.
Рекомендуемая иммунизация
Рекомендуемая схема активной иммунизации
людей разных возрастов в США представлена в
табл. 20.4. Отметим, что в других странах схема
иммунизации может отличаться. В последние годы
в схему вакцинации детей раннего возраста (пер-
вая доза в возрасте 2 мес) была добавлена вакци-
на из конъюгата анатоксина дифтерийного поли-
сахарида Haemophilus influenzae типа b. Он являет-
ся основной причиной менингита у неиммунизи-
рованных детей. Использование этой вакцины
привело к резкому снижению числа инфекций,
вызванных Н. influenzae типа b у вакцинирован-
ных детей. Недавно было одобрено применение
гептавалентной пневмококковой вакцины для
предотвращения у детей инфекционных заболе-
ваний, таких как средний отит.
Вакцинация отдельных групп
населения
В дополнение к обычной схеме иммунизации,
представленной в табл. 20.4, некоторые индиви-
дуумы проходят дополнительную вакцинацию
(табл. 20.5). Вирус гриппа (инактивированный)
применяют у людей старше 60 лет. детей и взрос-
330
ГЛАВА 20. СОПРОТИВЛЯЕМОСТЬ К ИНФЕКЦИОННЫМ ЗАБОЛЕВАНИЯМ И ИММУНИЗАЦИЯ
• Таблица 20.3. Вакцины, используемые для активной иммунизации
Тип вакцины Состав вакцины Пример
Убитый цель- ный организм Сделана из цельного организма, убитого для достижения безопасности Брюшной тиф
Аттенуирован- ные бактерии Организм культивируется для уменьшения патогенности, но еще сохраняет некото- рые антигены вирулентной формы Бациллы Кальметта —Герена, вакцина против М. tuberculosis, применяемая во многих европей- ских странах, но редко в США
Анатоксины Бактериальные токсины, подвергнутые обработке (например, формальдегидом) для ценатурации белка, с тем чтобы он больше не представлял опасности, но сохранял некоторые эпитопы, приводящие к выра- ботке защитных антител Дифтерия, столбняк
Поверхност- ные молекулы Очищенные поверхностные молекулы, вы- деленные из различных патогенов (напри- мер, гемагглютинины из вируса гриппа) Грипп, поверхностный антиген гепатита В, капсу- лярные полисахариды С. pneumoniae и капсуляр- ные олигосахариды Н influenzae (последнее пред- ставляется в форме конъюгатов белка)
Инактивиро- ванный вирус Цельная частица вируса, обработанная (например, формальдегидом) таким обра- зом, что она становится неспособной ин- фицировать клетки организма, но сохраня- ет некоторые не связанные с этим эпитопы Вакцина Солка против полиомиелита
Аттенуиро- ванный вирус Живые вирусы, ослабленные и непато- генные Вакцина Сейбина против полиомиелита для прие- ма внутрь, вакцины против кори, свинки, краснухи
лых с сердечно-легочными нарушениями Вакци-
на против гепатита В (вирусный белок, произве-
денный с помощью технологии рекомбинантных
ДНК) вводится работникам здравоохранения и
лицам, оказывающим экстренную помощь, кото-
рые контактируют с человеческой кровью. Вирус
гепатита А (инактивированный) был разрешен для
применения у детей и взрослых. Аденовирусные
вакцины используются для предотвращения вспы-
шек респираторных инфекций у новобранцев.
Вакцина против сибирской язвы применяется сре-
ди военного персонала ввиду опасности воздей-
ствия спор Bacillus anthracis при использовании
их в качестве биологического оружия. Вакцина-
ция от оспы уже не рекомендуется для граждан-
ских лиц, но все еще проводится отдельным кон-
тингентам военнослужащих. Однако в настоящее
время идут серьезные дебаты о возможности бо-
• Таблица 20.4. Схема активной иммунизации детей*
Возраст Вакцина
Рождение Против гепатша В, первая доза
1 —4 мес Против гепатита В, вторая доза
2 мес Вакцина против дифтерии, столбнячный анатоксин, бесклеточная вакцина против коклюша (АДС); Н.influenzae типа В (Hib); инактивированная вакцина против полиомиелита (IPV); пневмококко- вая коньюгатная вакцина (PCV), первые дозы
4 мес АДС, Hib, 1PV и PCV, вторые дозы
6 мес АДС, Hib и PCV, третьи дозы
6—18 мес Против гепатита В и 1PV, третьи дозы
12—15 мес Вакцины против кори, свинки, краснухи (MMR), первые дозы; вакцина против ветрянки
15—18 мес АДС, четвертая доза
4—6 лет АДС, пятая доза; IPV, четвертая доза; MMR, вторая доза
11 — 12 лет Бустерная доза столбнячного анатоксина
* Из материалов Центра по контролю заболеваемости (www.cdc.gov/nip).
ОСНОВНЫЕ МЕХАНИЗМЫ ЗАЩИТЫ
331
• Таблица 20.5. Дополнительная вакцинация*
Вакцина Группа населения
Сибирская язва Военнослужащие; лица, работающие с мехом, шерстью, щетиной и костной мукой; исследователи, работающие с B.anthracis} ветеринары из группы риска
Бациллы Кальметта — I ерена Медицинскии персонал, близко контактирующий с туберкулезными больными
Гепатит А Взрослые и дети в районах повышенного риска заболевания
Гепатит В Все дети, работники здравоохранения, подверженные риску заболевания; гомо- сексуалисты, наркоманы, вводящие наркотики внутривенно; лица, контакти- рующие с продуктами крови
Японский энцефалит В Путешественники в районах высокого риска заражения
Грипп Лица старше 65 лет; дети из группы высокого риска
Корь, свинка, грипп, ветря- ная оспа, краснуха Работники здравоохранения, подверженные риску заболевания
Менингококк Военнослужащие; молодежь, проживающая в общежитиях колледжей
Чума Лица, регулярно контактирующие с грызунами; исследователи, работающие с Yersinia pestis
Бешенство Ветеринары, лица, ухаживающие за животными; жертвы укусов животных
Брюшной тиф Путешественники в районах высокого риска заражения
Желтая лихорадка То же
* Из материалов Центра по контролю заболеваемости (www.cdc.gov).
лее широкого применения данной вакцины, учи-
тывая возросшую опасность применения оспы в
качестве биологического оружия.
В отдельных популяциях также используются
некоторые вакцины против бактериальных инфек-
ций. Содержащая несколько антигенных типов
капсулярных полисахаридов поливалентная вак-
цина от Streptococcus pneumoniae вводится людям
с сердечно-легочными нарушениями, с повреж-
денной или хирургически удаленной селезенкой,
а также больным серповидно-клеточной анеми-
ей, почечной недостаточностью, алкогольным
циррозом или сахарным диабетом. Эти люди об-
ладают ограниченной способностью развития ан-
тител ьной/комплементарной/фагоцитарной ак-
тивности, необходимой для борьбы с инкапсули-
рованными бактериями, такими как S. pneumoniae.
К сожалению, эта вакцина не так эффективна у
людей из группы риска заболевания пневмокок-
ковой пневмонией, как у здоровых лиц, посколь-
ку дефекты иммунитета препятствуют выработке
сильного ответа со стороны антител. Вакцина от
Neisseria meningitidis (несколько серологических
групп капсулированных полисахаридов) применя-
ется среди новобранцев и детей в регионах, где
повышен риск заболевания. Эта вакцина также
рекомендуется для использования среди молоде-
жи, проживающей в общежитиях колледжей и
находящейся в группе повышенного риска разви-
тия менингококкового менингита. В настоящее
время для применения в целях защиты от Salmonella
typhi, вызывающей брюшной тиф, доступны как
живая аттенуированная, так и полисахаридная вак-
цины. В связи с ограниченной эффективностью
или потребностью некоторые вакцины рекоменду-
ется использовать только при строго определенных
обстоятельствах. Такие вакцины и соответству-
ющие обстоятельства перечислены в табл. 20.5.
ОСНОВНЫЕ МЕХАНИЗМЫ ЗАЩИТЫ
Значимость первичного
и вторичного ответов
Быстрота реакции памяти при повторной встрече
организма с антигеном обеспечивает защиту на
случай будущих повторных контактов с инфици-
рующим агентом. Эта реакция памяти имеет от-
ношение по крайней мере к двум способам им-
мунопрофилактики. Первый из них может быть
особенно важен в случаях с инфекциями с отно-
сительнодлинным инкубационным периодом (бо-
лее 7 сут), как показано на рис. 20.2. У человека,
инфицированного агентом А, который вызывает
заболевание после инкубационного периода 3 сут,
первичный иммунный ответ возникает некоторое
время (например, 7 — 14 сут) спустя после разви-
тия инфекции. При втором контакте с агентом А
у человека может также развиться заболевание,
поскольку реакция памяти может оказаться недо-
статочно быстрой для подавления этого агента
Человек, инфицированный агентом В, вызыва-
332
ГЛАВА 20. СОПРОТИВЛЯЕМОСТЬ К ИНФЕКЦИОННЫМ ЗАБОЛЕВАНИЯМ И ИММУНИЗАЦИЯ
вызванная контакт
.центом А л
• Рис. 20.2. Взаимосвязь между вторичным и пер-
вичным иммунными ответами и заболеванием,
вызванным агентами А или В. У инфекции, вызван-
ной агентом А, инкубационный период короче
| Время, сут |
Инфекция, Повторный
вызванная контакт
агентом В
ющим заболевание после инкубационного пери-
ода 14 сут, выработает первичный ответ (напри-
мер, 7—14 сут после развития инфекции). При
повторном контакте с агентом В реакция памяти,
развившаяся в течение 7 сут, будет эффективна
для уменьшения тяжести или предотвращения за-
болевания с инкубационным периодом 14 сут.
Вторым важным фактором реакции памяти
является величина, которой достигает иммунный
ответ. В примерах, приведенных ранее, агент А,
который вызывает заболевание через 3 сут, может
не привести к развитию заболевания после по-
вторного контакта, если сохраняется достаточно
высокий уровень антител. Такого уровня можно
достичь намеренно серией иммунизаций (особен-
но при применении неживых антигенов). Таким
образом, обычной практикой стало применение
нескольких инъекций столбнячного анатоксина (в
виде АДС) на протяжении 6 мес при иммуниза-
ции детей. Такие первоначальные инъекции при-
водят к выработке вторичных реакций памяти,
которые существенно повышают концентрацию
антитоксина до защитных уровней, сохраняющих-
ся в сыворотке крови в течение 10—20 лет
Возраст и время иммунизации
На механизмы, участвующие в защите, может
повлиять ряд факторов, таких как характер пита-
ния, наличие заболевания (которое влияет на уро-
вень содержания глобулинов и клеточно-опосре-
дованный иммунитет) и возраст. Время иммуни-
зации у детей в основном определяется тем фак-
том, что эффективность определенных вакцин
зависит от возраста ребенка.
В утробе матери человеческий плод в норме
обычно хорошо защищен от большинства инфек-
ционных агентов, хотя определенные патогены
(например, вирус краснухи Toxoplasma gondii) мо-
гут инфицировать мать и серьезно повредить пло-
ду. Материнский иммунитет защищает плод пу-
тем перехватывания и удаления инфекционных
агентов до того, как они достигают матки; он также
защищает новорожденных посредством транспла-
центарных антител или антител, поступающих из
молочных желез.
У плода и новорожденного плохо развиты лим-
фоидные органы за исключением тимуса, размер
которого ко времени рождения является самым
большим по отношению к размеру тела. Плод
способен синтезировать в основном IgM, кото-
рые появляются после 6 мес беременности. Уро-
вень IgM постепенно увеличивается, составляя
примерно 10% уровня взрослого человека к мо-
менту рождения.
Примерно на 2-м месяце беременности у пло-
да обнаруживают IgG, но этот IgG материнского
происхождения. Его уровень значительно повы-
шается примерно на 4-м месяце беременности и
сильно возрастает в последнем триместре. На
момент рождения концентрация IgG слегка пре-
вышает концентрацию IgG у матери. Таким об-
разом, плод снабжается материнскими IgG, кото-
рые могут обеспечить антитоксическую, проти-
вовирусную и в некоторой степени антибактери-
альную защиту. Уровень этих материнских анти-
тел постепенно понижается, как только ребенок
начинает синтезировать свои собственные анти-
тела. К 2 — 3-му месяцу жизни общий уровень IgG
составляет менее 50 % имевшегося при рождении
Изменения концентрации иммуноглобулинов в сы-
НЕОБХОДИМЫЕ МЕРЫ ПРЕДОСТОРОЖНОСТИ
333
• Рис. 20.3. Концентрация иммуноглобулинов
в сыворотке в период развития человека (с раз-
решения Benich and Johanssen, 1971)
воротке в период развития человека представле-
ны на рис. 20.3.
У новорожденных иммунный ответ, например
против некоторых инфекционных агентов (Toxo-
plasma gondii, Listeria monocytogenes, вирус просто-
го герпеса), недостаточно хорошо проявляется по
ряду характеристик, если решающее значение име-
ет клеточно-опосредованный иммунитет. При
этом новорожденный может вырабатывать анти-
тела к различным антигенам, таким как паренте-
рально вводимый анатоксин, инактивированный
вирус полиомиелита, антигены гепатита В и др.
Однако применение вакцины против коклюша
вскоре после рождения не только не индуцирует
защитный ответ, но и вызывает измененный от-
вет на вакцину, если ее повторно используют в
детстве. Таким образом, за исключением вакци-
ны против гепатита В, которая применяется вскоре
после рождения, в большинстве индустриальных
стран первоначальное применение вакцин откла-
дывается до того времени, пока ребенку не ис-
полнится 2 мес. Однако ВОЗ рекомендует начи-
нать иммунизацию в развивающихся странах не-
сколько раньше (в возрасте 6 недель).
Пока материнские антитела способны обеспе-
чивать новорожденному защиту от различных ин-
фекционных агентов, они также могут уменьшать
ответ на антиген. Например, пока у годовалого
ребенка есть достаточное количество материнских
антител против кори, они могут вмешиваться в
активный ответ со стороны ребенка на вакцину,
поэтому вакцинация обычно откладывается хотя
бы до достижения годовалого возраста.
Дети в возрасте менее 2 лет обычно не способ-
ны вырабатывать достаточно антител в ответ на
введение бактериальных капсулярных полисаха-
ридов, таких как у Haemophilus influenzae типа b,
различных серогрупп Neisseria meningitidis и серо-
типов Streptococcus pneumoniae. Было высказано
предположение, что такая неспособность обуслов-
лена тем, что дети раннего возраста не отвечают
на Т-независимые антигены, несмотря на их спо-
собность (при нахождении в матке) вырабатывать
IgM. Химическая связь полисахарида с Т-зависи-
мыми антигенами (например, анатоксином диф-
терии) или белком наружной мембраны N. menin-
gitidis улучшила иммуногенные свойства таким
образом, что дети моложе 2 лет стали реагировать
на полисахариды. В настоящее время доступна
эффективная конъюгированная вакцина против
Н. influenzae, и вызываемая этим патогеном инфек-
ция практически не возникает у вакцинирован-
ных детей. На сегодняшний день стало обычным
и применение гептовалентной вакцины против
S.pneumoniae, содержащей полисахариды пневмо-
кокков наиболее распространенных при детских
инфекциях серотипов.
В возрастной группе старше 60 лет тоже отме-
чается уменьшение способности к развитию пер-
вичного ответа на некоторые антигены, такие как
у вакцины против вируса гриппа. Однако орга-
низм пожилых людей сохраняет способность ко
вторичному ответу на антигены, с которыми он
до этого встречался. Организм здорового пожи-
лого человека также хорошо реагирует на бакте-
риальные полисахариды, поэтому применение
пневмококковой полисахаридной вакцины обыч-
но может индуцировать выработку антител до
уровня, обеспечивающего защиту от возбудителя.
Другие группы людей, особенно подверженных
развитию пневмококковой пневмонии (см. ранее
в этой главе), также должны быть иммунизирова-
ны. Группы людей с повышенной восприимчи-
востью к инкапсулированному респираторному
патогену — Streptococcus pneumoniae, а также те,
у кого велик риск контакта с возбудителем (на-
пример, работники домов престарелых и медицин-
ский персонал), тоже должны проходить вакци-
нацию против вируса гриппа.
Ф НЕОБХОДИМЫЕ МЕРЫ
ПРЕДОСТОРОЖНОСТИ
Место введения антигена
Обычным местом парентерального (внутрикож-
ного, подкожного или внутримышечного) введения
вакцины у взрослых людей является рука, в част-
334
ГЛАВА 20. СОПРОТИВЛЯЕМОСТЬ К ИНФЕКЦИОННЫМ ЗАБОЛЕВАНИЯМ И ИММУНИЗАЦИЯ
ности дельтовидная мышца. Детям вакцину обыч-
но вводят в бедро. Исследования показали, что
почти оптимальный ответ на введение вакцины
против гепатита В получается при инъекции в яго-
дичную мышцу, а не в руку. Парентеральное вве-
дение инактивированной вакцины против полио-
миелита может вызвать более сильный ответ со
стороны антител в сыворотке крови, чем приме-
нение аттенуированной вакцины через рот; одна-
ко реакция на последнюю, приводящая в том числе
к выработке секреторного IgA, также обеспечива-
ет адекватную защиту. Применение аттенуирован-
ной вакцины против полиомиелита перорально
было приостановлено, поскольку живой вирус
может в исключительно редких случаях вызвать
заболевание.
Некоторые вакцины способны обеспечить бо-
лее высокий гуморальный ответ при введении
через респираторный тракт, чем при применении
в виде инъекции (например, аттенуированная вак-
цина против кори). Однако введение через рес-
пираторный тракт продолжают использовать толь-
ко при исследованиях.
Опасности
Некоторые вакцины таят в себе опасности. Вак-
цины, произведенные из аттенуированных возбу-
дителей (например, кори, свинки, краснухи, по-
лиомиелита (для орального введения) и бацилл
Кальметта— Герена), обладают потенциальной спо-
собностью вызывать прогрессирующее заболевание
у пациентов с нарушенным иммунитетом или боль-
ных, подвергающихся иммуносупрессивной терапии.
В редких случаях вирусы полиомиелита III типа
возвращали себе вирулентные свойства в кишеч-
нике вакцинированного индивидуума, что приво-
дило к развитию паралитического полиомиелита.
Опасения по поводу возможности развития пара-
литического полиомиелита при применении дан-
ной вакцины привели к тому, что для вакцинации
от полиомиелита в США в настоящее время реко-
мендована вакцина из инактивированного вируса.
Этот пример иллюстрирует необходимость неусып-
ного внимания при мониторинге распространен-
ности определенного заболевания в конкретной по-
пуляции и сопоставления риска развития заболе-
вания с риском проведения вакцинации. Хотя вак-
цины обычно обладают очень низкой токсично-
стью, их применяют у большого числа лиц; если
распространенность заболевания снижена, риск
вакцинации может оказаться более велик. Отсюда
возникает парадоксальная ситуация: посредством
эффективной вакцины распространенность забо-
левания уменьшается до такого уровня, что редкие
осложнения, связанные с вакцинацией, встреча-
ются в данной популяции чаще, чем само заболе-
вание. При таком положении опасения населения
относительно вакцинации могут привести к умень-
шению числа ее сторонников.
Нельзя проводить вакцинацию беременным
женщинам живыми аттенуированными микроор-
ганизмами, потому что плоду может быть нанесе-
но повреждение. (При вакцинации от краснухи
вирионы достигали плода, хотя какого-либо по-
вреждающего воздействия не наблюдалось.) Про-
тивопоказано применять живые аттенуированные
вакцины у пациентов с серьезными нарушения-
ми иммунитета. Они могут оказаться не способ-
ными противостоять ослабленным патогенам, на-
ходящимся в вакцине. В связи с устранением воз-
будителя оспы вакцинация против нее не прово-
дится (исключением являются некоторые воин-
ские контингенты). Однако, как уже указывалось,
опасения по поводу возможного применения ви-
руса оспы в качестве биологического оружия при-
вели к дебатам по вопросу о необходимости про-
ведения всеобщей вакцинации. В настоящее вре-
мя планируется вакцинация только тех лиц, ко-
торые потенциально могут подвергнуться биоло-
гической атаке; также обсуждается создание резер-
ва вакцины для профилактического использова-
ния после контакта с возбудителем. Аргументом
против повсеместного использования вакцины яв-
ляется и то, что инокуляция вируса вакцинии
несет в себе серьезный риск не только для лиц с
нарушениями иммунитета, но и для индивиду-
умов с определенными кожными поражениями.
Следует избегать контакта между вакцинирован-
ными и уязвимыми для вируса лицами, пока не
исчезнут повреждения, вызванные вакцинацией.
Обычными (особенно у взрослых женщин), но
преходящими осложнениями после вакцинации
от краснухи являются артрит и артралгия. При-
менение одной из инактивированных вакцин, уби-
той Bordetella pertussis, входящей в вакцину АДС,
было связано с некоторыми серьезными побоч-
ными эффектами, такими как энцефалопатия у
детей. Хотя серьезные побочные эффекты были
относительно редки и преимущества вакцины от
коклюша перевешивали любой предполагаемый
риск иммунизации, убитая бактериальная вакци-
на была заменена бесклеточной, содержащей
инактивированный токсин и один или более ан-
тигенных компонента (например, филаментозный
гемагглютинин и фимбрии). Бесклеточная вакцина
против коклюша, сохраняя эффективность, име-
ет гораздо меньше побочных эффектов, чем пре-
дыдущая.
Столбнячный и дифтерийный анатоксины мо-
гут вызвать местные реакции гиперчувствитель-
ности. Поскольку адекватная первичная серия
иммунизаций, проведенных в детстве, вызывает
иммунитет, сохраняющийся около 10 лет, исполь-
зование бустерных инъекций столбнячного ана-
токсина должно определяться с учетом характера
повреждения и сведений о проводившейся имму-
низации. В связи с повышенной чувствительно-
стью к дифтерийному анатоксину у подростков и
взрослых необходимо использовать меньшие дозы
анатоксина, чем при вакцинации детей. Поскольку
НОВЫЕ ПОДХОДЫ К СОЗДАНИЮ ВАКЦИН
335
вирус гриппа культивируется на куриных эмбрио-
нах, аллергия на куриный белок является проти-
вопоказанием для вакцинации против данного
вируса Цельновирионная вакцина против грип-
па, используемая у взрослых, дает побочные эф-
фекты у детей, поэтому для вакцинации детей
младше 13 лет рекомендуется субъединичная вак-
цина против вируса. Некоторые вакцины содер-
жат консерванты, такие как ртутьсодержащее со-
единение — тимеросал (мертиолат), или антибио-
тики, такие как неомицин или стрептомицин, к ко-
торым у индивидуума может быть аллергия.
НОВЫЕ ПОДХОДЫ
К СОЗДАНИЮ ВАКЦИН
Благодаря достижению в технологиях рекомби-
нантных ДНК, быстрого автоматизированного
синтеза пептидов, а также в других областях био-
инженерии (например, в области моноклональ-
ных антител) появилась возможность совершен-
ствования доступных вакцин и разработки новых
подходов к их созданию.
Вакцины, разработанные с помощью
рекомбинантных ДНК
Технология рекомбинантных ДНК дает возмож-
ность экспрессировать в больших количествах
белковые антигены, которые используют в вак-
цинах. Примером успешного применения техно-
логии рекомбинантных ДНК в производстве вак-
цин является опыт с вакциной против гепатита В.
Это заболевание является основной причиной
инфекции печени и в дальнейшем повышения
риска возникновения гепатоцеллюлярного рака.
В 1970-х гг. путем очищения вирусного антигена
от крови донора — постоянного носителя вируса
была разработана эффективная вакцина против
гепатита В. В конце 1980-х гг. из-за эпидемии ВИЧ
подтвердились данные о передаче патогенов с
кровью и ее продуктами и появились опасения,
что данная вакцина может переносить заболева-
ние. Хотя некоторые исследования и показали
безопасность вакцины, произведенной из плаз-
мы, была создана альтернативная вакцина путем
экспрессирования антигена гепатита В в дрожжах
с использованием технологии рекомбинантных
ДНК. Эта рекомбинантная вакцина упрощает
выработку антигена, устраняя зависимость от
плазмы крови человека, а также любую потенци-
альную опасность, связанную с непреднамерен-
ным загрязнением антигена вакцины патогенами,
находящимися в крови. Технология рекомбинант-
ных ДНК также использовалась для создания пер-
вой эффективной вакцины против болезни Лай-
ма. Другие вакцины, созданные с помощью тех-
нологии рекомбинантных ДНК, проходят различ-
ные фазы клинического тестирования. Некоторые
из этих молекулярных методов могут обеспечить
нас удобными, безопасными и более эффектив-
ными средствами иммунизации, чем в настоящее
время.
Конъюгированные полисахариды
Конъюгатные полисахаридные вакцины произве-
ли революцию в вакцинации против инкапсули-
рованных бактериальных патогенов. Гуморальный
иммунитет играет основную роль в защите от ин-
капсулированных патогенов, но большинство
микробных полисахаридов являются Т-независи-
мыми антигенами, которые обычно слабоимму-
ногенны. Другой проблемой полисахаридных вак-
цин является то, что организм маленьких детей
обычно не дает гуморальный ответ на полисаха-
ридные антигены. В то же время у детей повы-
шен риск инфекций, вызываемых инкапсулиро-
ванными бактериями, такими как Streptococcus
pneumoniae и Haemophilus influenzae. Конъюгация
полисахарида с белком (например, столбнячного
или дифтерийного анатоксина) приводит к созда-
нию молекулы, ведущей себя как Т-зависимый
антиген, и вызывает выраженный ответ со сторо-
ны антител на полисахаридную часть. Вакцины,
эффективные для этой возрастной группы, созда-
ют путем конъюгации таких (бактериальных) по-
лисахаридов или олигосахаридов (например.
Н. influenzae) с белками, например дифтерийным
анатоксином. В настоящее время доступны конъю-
гатные полисахаридные вакцины против Н. in-
fluenzae типа b и определенных серотипов S.pneu-
moniae. Разрабатываются конъюгатные полисаха-
ридные вакцины против других возбудителей, та-
ких как менингококки, стрептококки группы В,
Salmonella typhi и штаммы Shigella. Конъюгатные
полисахаридные вакцины оказывают защитное
действие, вызывая сильный гуморальный ответ на
полисахаридную часть конъюгата.
Вакцины из синтезированных пептидов
Предпосылкой создания вакцин из синтетических
пептидов является идея использования иммуно-
генных пептидов для вызывания иммунного от-
вета. Вакцины из синтетических пептидов созда-
ют на основе информации о последовательности
аминокислот в белковом антигене, вызывающем
защитный иммунный ответ. Теоретически вакци-
ны из синтетических пептидов обладают преиму-
ществом, поскольку пептиды высокой степени
очистки можно производить в больших количе-
ствах. а их более простой антигенный состав обес-
печивает защиту с гораздо меньшими побочными
эффектами. Общий подход заключается в иден-
тификации потенциальных эпитопов в защитном
белковом антигене с использованием различных
336
ГЛАВА 20. СОПРОТИВЛЯЕМОСТЬ К ИНФЕКЦИОННЫМ ЗАБОЛЕВАНИЯМ И ИММУНИЗАЦИЯ
алгоритмов, синтезе ряда пептидов с соответству-
ющей последовательностью аминокислот и про-
верке их на иммунологическую активность. Од-
ной из проблем, связанных с вакцинами из пеп-
тидов, является их слабая иммуногенность ввиду
малой величины, что требует их конъюгации с
белками-носителями. В настоящее время несколь-
ко вакцин из синтетических пептидов проходят
клиническое исследование. Пептидная вакцина
продемонстрировала свою перспективность в от-
ношении вируса-возбудителя пузырчатки полос-
ти рта и конечностей, а также малярии.
Антиидиотипические вакцины
Антитела (идиотипы), индуцированные к специ-
фическому эпитопу антигена, обладают антиген-
связывающим центром (антидетерминантой), со-
ответствующим по структуре эпитопу. Если это
антитело в свою очередь используется в качестве
иммуногена для индуцирования антитела (анти-
идиотип), реагирующего с антигенсвязывающим
центром идиотипа, антиидиотип может по струк-
туре напоминать эпитоп. Эта структурная схожесть
называется внутренним образом. Так как внутрен-
ний образ (антиидиотипическое антитело) напо-
минает антиидиотип и естественный антигенный
эпитоп, его можно использовать в качестве им-
муногена для индуцирования антител против ес-
тественного эпитопа (рис. 20.4). В настоящее вре-
мя несколько антиидиотипических вакцин иссле-
дуются на предмет эффективности при лечении
некоторых видов рака человека.
Одним из примеров является иммуноген, со-
стоящий из полученных у мышей антител, про-
тив моноклональных мышиных антител к поверх-
ностному антигену вируса гепатита В. Иммуни-
зация этими антиидиотипическими антителами,
содержащими внутренний образ эпитопа на по-
верхностном антигене вируса гепатита В, инду-
цирует антитела к этому эпитопу Антиидиоти-
пические антитела можно использовать в тех слу-
чаях, когда токсическое действие определенных
биологических токсинов препятствует их приме-
нению в качестве антигенов.
Вакцины на основе вируса-носителя
С помощью вектора можно ввести в живой ви-
рус (такой как вирус вакцинии, аденовирус или
вирус полиомиелита) ген другого организма, ко-
дирующего нужный антиген. Конструкция с ви-
русом вакцинии размножается в организме, экс-
прессирует чужеродный антиген и таким обра-
зом служит вакциной к данному определенно-
му антигену. Такой подход очень удобен, пото-
му что этот вирус безопасен для организма (на-
пример, у индивидуума с нарушенным иммуни-
тетом). Дополнительным преимуществом подоб-
ных вакцин является то, что они потенциально
способны индуцировать к содержащемуся в них
антигену как клеточно-опосредованный имму-
нитет, так и иммунитет, опосредованный анти-
телами.
Вакцины на основе бактерии-носителя
Аттенуированные бактерии, например штаммы
Salmonella typhi premium. Escherichia coli и бациллы
Кальметта—Герена, могут также служить в каче-
стве переносчиков гена патогена в попытке полу-
чить патогенспецифический ответ. Эти бактерии
изменяют с помощью рекомбинантных техноло-
гий с включением чужеродных генов, которые
могут экспрессировать антигены патогенных мик-
роорганизмов и индуцировать иммунные ответы.
В будущем Salmonella typhi premium может быть
использована как кишечный патоген для имму-
низации слизистых оболочек по отношению к чу-
жеродным антигенам.
ДНК-вакцины
Вакцинация с помощью плазмиды, кодирующей
последовательность ДНК для защитного анти-
гена, связанного с сильным промотером млеко-
питающих, может вызвать иммунный ответ на
белок.
Считается, что ДНК-вакцины позволяют мик-
робному антигену экспрессироваться внутри кле-
ток организма, которые захватывают плазмиду.
Эти вакцины действуют путем производства не-
обходимого антигена внутри клеток. Это являет-
ся преимуществом, поскольку способствует пре-
зентации МНС. Другие преимущества ДНК-вак-
цин выражаются в отсутствии риска инфекции,
большей по сравнению с белковыми вакцинами
стабильности, и возможности доставки антигена
в клетки, которые обычно не инфицируются па-
тогеном, для лучшей модуляции иммунного от-
вета. ДНК-вакцины могут быть полезны для им-
мунизации младенцев, еще имеющих материн-
Эпитоп Идиотип
Антиидиотип
Иммунизация
Иммунизация
(внутренний образ)
Идиотип
Иммунизация
• Рис. 20.4. Антиидиотип (внутренний образ)
иммуногена
ПАССИВНАЯ ИММУНИЗАЦИЯ
337
ские антитела. Возможность иммунизации про-
тив некоторых вирусных, бактериальных и про-
тозойных инфекций с помощью ДНК-вакцин
была продемонстрирована на лабораторных жи-
вотных. В настоящее время некоторые ДНК-вак-
цины проходят тестирование на предмет при-
годности для предотвращения и лечения маля-
рии и инфекций, вызванных вирусом гепатита В
и ВИЧ.
Однако никакие ДНК-вакцины в клинической
практике не применяются. Опасение вызывает
возможная способность ДНК-вакцин становить-
ся мутагенными, интегрируя в ДНК организма.
Однако первые результаты испытаний на челове-
ке указывают на безопасность ДНК-вакцин. На
сегодняшний день ДНК-вакцины продолжают
быть объектом интенсивных экспериментальных
исследований.
Анатоксины
Можно инактивировать токсины и получить не-
патогенные анатоксины, пригодные для вакцина-
ции. Анатоксины представляют собой одни из
первых и наиболее успешно применяемых вак-
цин. Использование анатоксинов, приготовлен-
ных из инактивированных столбнячных, ботули-
нических и дифтерийных токсинов, вызывает от-
вет со стороны антител, предотвращающих раз-
витие болезни.
Анатоксины эффективны несмотря на тот факт,
что естественные инфекции не всегда приводят к
длительному иммунитету, вероятно, потому что
количества вырабатываемого при инфекции ток-
сина может быть недостаточно для получения
сильного иммунного ответа. Таким образом, пе-
реболевший столбняком или дифтерией не обла-
дает иммунитетом к повторному заболеванию, но
вакцинация анатоксином обеспечивает ему пол-
ную защиту.
• ПАССИВНАЯ ИММУНИЗАЦИЯ
Пассивная иммунизация происходит через пере-
нос антител или иммунных клеток одному инди-
видууму от другого, уже непосредственно встре-
чавшегося с антигеном и выработавшего иммун-
ный ответ. Она отличается от активной иммуни-
зации тем, что при ней не полагаются на способ-
ность иммунной системы организма выработать
соответствующий ответ. Таким образом, пассив-
ная иммунизация с помощью антител приводит к
немедленному получению организмом антител для
защиты от патогенов. Она может происходить ес-
тественным образом, как в случае передачи анти-
тел через плаценту или молозиво, так и терапев-
тическим, когда антитела вводят в качестве про-
филактики или лечебного средства от инфекци-
онных заболеваний.
Пассивная иммунизация
посредством переноса
антител через плаценту
Развивающийся плод пассивно иммунизируется
с помощью материнских IgG в результате пере-
носа антител через плаценту. Эти тела есть у него
в момент рождения. Они защищают новорожден-
ного от инфекций, для которых достаточно нали-
чия IgG и к которым у его матери имеется имму-
нитет. Например, передача антител к токсинам
(столбнячному, дифтерийному), вирусам (кори,
полиомиелита, свинки и т.д.), а также некото-
рым бактериям (Haemophilus influenzae или
Streptococcus agalactiae группы В) может обеспе-
чить защиту ребенку в первые месяцы жизни.
Таким образом, адекватная активная иммуниза-
ция матери является простым и эффективным
средством обеспечения пассивной защиты плоду
и новорожденному. (Однако некоторые недоно-
шенные новорожденные могут не получить мате-
ринских антител в той же мере, как младенцы,
рожденные в срок.) Вакцинация анатоксином
может вызвать ответ со стороны IgG, которые
проходят через плаценту и обеспечивают защиту
плоду и новорожденному. Такая защита исклю-
чительно важна в тех районах земного шара, где
загрязненная окружающая среда может привести
к tetanus neonatorum (тетанус у новорожденного,
возникающий обычно вследствие инфицирования
пуповины).
Пассивная иммунизация
через молозиво
Человеческое молоко содержит ряд факторов,
которые могут повлиять на ответ организма кор-
мящегося молоком младенца на возбудителей
инфекций. Некоторые из них являются естествен-
ными селективными факторами и влияют на ки-
шечную микрофлору, а именно способствуют ро-
сту необходимых бактерий и действуют как не-
специфические ингибиторы для некоторых мик-
робов. На микрофлору также может повлиять дей-
ствие лизоцима, лактоферрина, интерферона и
лейкоцитов (макрофагов, Т-клеток, В-клеток и
гранулоцитов). Антитела (IgA) обнаруживаются в
грудном молоке, причем их концентрация выше
в молозиве (первое молоко), появляющемся не-
посредственно после родов (табл. 20.6). Выработ-
ка антител является результатом действия В-кле-
ток, которые стимулируются кишечными антиге-
нами и мигрируют в молочную железу, где выра-
батывают иммуноглобулины (этеромаммарная си-
стема). Таким образом, микроорганизмы, коло-
низирующие или инфицирующие пищеваритель-
ный тракт матери, могут приводить к выработке
антител молозива, которые осуществляют защиту
слизистых оболочек кормящегося материнским
338
ГЛАВА 20. СОПРОТИВЛЯЕМОСТЬ К ИНФЕКЦИОННЫМ ЗАБОЛЕВАНИЯМ И ИММУНИЗАЦИЯ
• Таблица 20.6. Уровни содержания
иммуноглобулина в молозиве, мг/100 мл*
Класс День после родов Примерное содержание у здорового взрослого
1 _ 2 3 4
IgA2* 600 2b0 20U 80 200
IgG3* 80 45 30 16 1000
IgM 125 65 58 30 120
* По данным Michael, Ringenback and Hottenstein, 1971.
2* Примерно 80 % являются секреторными IgA.
3* IgG4 составляет 15% IgG в молозиве и 3,5 % сыворо-
точных IgG.
молоком ребенка от патогенов, поступающих че-
рез кишечный тракт. Было показано наличие ан-
тител к энтеропатогенам Escherichia coli, Salmonella
typhi, штаммам Shegella, вирусам полиомиелита,
Коксаки и эховирусам. Кормление новорожден-
ных с низкой массой тела, не получающих мате-
ринское молоко, смесью IgA (73 %) и IgG (26 %),
взятых из сыворотки крови человека, защищает
их от некротизирующего энтероколита. В моло-
зиве также были обнаружены антитела к непище-
вым патогенам, например антитоксины к столб-
няку и дифтерии, а также антистрептококковому
гемолизину.
Т-лимфопиты, чувствительные к туберкулину,
также передаются новорожденному через моло-
зиво, но роль таких клеток в пассивной передаче
клеточно-опосредованного иммунитета неясна.
Пассивная терапия с помощью антител
и сывороточная терапия
Назначение препаратов специфических антител
было одним из первых методов эффективной ан-
тимикробной терапии. Антитела против опреде-
ленных патогенов вырабатывают у животных, та-
ких как лошади и кролики (гетерологичные ан-
титела), и назначают людям в качестве сыворо-
точной терапии для лечения различных инфек-
ций. Сыворотка людей, излечившихся от инфек-
ций, богата антителами; ее также можно исполь-
зовать для пассивной терапии с помощью анти-
тел (гомологичные антитела). В последние годы
для пассивной терапии инфекционных заболева-
ний с помощью антител использовали некоторые
моноклональные антитела, произведенные в ла-
боратории. В настоящее время исследования в
этой области расширились, и похоже, в недале-
ком будущем возникнут новые методы лечения,
основанные на применении антител.
Активным агентом при сывороточной терапии
является специфическое антитело. До начала эры
антибиотиков (до 1935 г.) сывороточная терапия
часто была единственным доступным методом
лечения инфекций. Ее использовали для лечения
дифтерии, столбняка, пневмококковой пневмо-
нии, менингококкового менингита, скарлатины
и других серьезных инфекций. Например, во вре-
мя Первой мировой войны для лечения раненых
британских солдат применяли противостолбняч-
ный антитоксин, который получали от лошадей.
Результатом стало быстрое снижение частоты слу-
чаев возникновения столбняка. Этот опыт позво-
лил определить минимальную концентрацию ан-
титоксина, необходимую для обеспечения защи-
ты, и показал, что период защиты у человека был
достаточно краток. Это объясняется на рис. 20.5
и 20.6. Гетерологичные лошадиные антитела у
людей разводятся, подвергаются катаболизму,
формируют иммунные комплексы и удаляются.
Наоборот, гомологичные человеческие антитела,
концентрация которых в сыворотке крови дости-
гает максимума примерно 2 сут спустя после под-
кожной инъекции, разводятся, подвергаются
катаболизму и достигают половины максималь-
ной концентрации примерно через 23 сут (пери-
од полураспада человеческих IgGH IgG2 и IgG4
— 23 сут; IgG3 — 7 сут). Таким образом, защит-
ная концентрация человеческих антител в крови
сохраняется значительно дольше лошадиных ан-
тител. Гетерологичные антитела, такие как ло-
шадиные, способны вызывать по крайней мере
два вида реакций гиперчувствительности: I типа
(немедленную, анафилаксия — см. гл. 14) или
III типа (сывороточная болезнь от иммунных комп-
• Рис. 20.5. Концентрация в сыворотке чело-
веческого и лошадиного IgG после введения че-
ловеку
ПАССИВНАЯ ИММУНИЗАЦИЯ
339
• Рис. 20.6. Человеческий и лошадиный IgG пос-
ле введения человеку
лексов — см. гл. 15). Если другое лечение недо-
ступно, у индивидуума с I типом чувствительнос-
ти можно использовать гетерологичную антисы-
воротку, вводя чужеродную сыворотку и посте-
пенно увеличивая ее количество на протяжении
нескольких часов. Некоторые препараты гетеро-
логичных антител (например, лошадиный дифте-
рийный антитоксин и антилимфонитарную сы-
воротку (antilimphocyte serum — ALS)) до сих пор
используют для лечения людей. За последние годы
благодаря достижениям в технологии гибридом и
рекомбинантных ДНК мы получили возможность
синтезировать человеческие иммуноглобулины для
лечения и больше не зависим от животных ис-
точников антител для лечения людей. Человече-
ские антитела обладают значительно более длин-
ным периодом полураспада и пониженной ток-
сичностью.
Моноклональные и поликлональные
препараты
Технология гибридом, позволяющая производить
моноклональные антитела, была открыта в 1975 г.
(см. гл. 5). Поликлональные препараты получа-
ют в результате ответа со стороны антител на им-
мунизацию или выздоровления организма от ин-
фекции. В целом антитела к специфическому
агенту являются только небольшой фракцией всех
антител в поликлональном препарате. Более того,
поликлональные препараты обычно содержат ан-
титела к многочисленным антигенам и включа-
ют антитела различных изотипов. Препараты мо-
ноклональных антител отличаются от препара-
тов поликлональных антител тем, что монокло-
нальные антитела обладают одной специфично-
стью и одним изотипом. В результате активность
препаратов моноклональных антител значитель-
но выше по отношению к общему количеству
белка, присутствующего в поликлональных пре-
паратах. Другим преимуществом моноклональ-
ных препаратов является то, что они неизменны
от партии к партии, что характерно для поли-
клональных препаратов, количественно и каче-
ственно зависящих от иммунного ответа, опре-
деляющего их действенность. Однако поликло-
нальные препараты обладают преимуществом:
в состав таких препаратов входят антитела раз-
личной специфичности и разных изотипов, по-
этому они более разнообразны биологически. За
последние 5 лет для клинического использова-
ния была лицензирована по крайней мере дю-
жина моноклональных антител Большинство из
них были разработаны для лечения рака; однако
в настоящее время лицензируется моноклональ-
ное тело для использования в целях предотвра-
щения инфекций, вызываемых респираторными
синцитиальными вирусами у маленьких детей.
Некоторые препараты моноклональных и поли-
клональных антител в настоящее время приме-
няют для лечения людей.
Изготовление иммунного сывороточного
глобулина человека и его свойства
Иммуноглобулин сыворотки человека стали при-
менять в начале XX в. Тогда сыворотку от паци-
ентов, излечившихся от кори, вводили контакти-
ровавшим с больными детям, симптомы у кото-
рых не успели развиться. Другие попытки при-
менения иммуноглобулина в 1916 г. и позднее
показали, что раннее применение сыворотки, по-
лученной от людей, излечившихся от кори, мо-
жет предотвратить появление клинически выра-
женной болезни. В 1933 г. было также обнаруже-
но, что источником антител против кори может
быть человеческая плацента. Проблемой исполь-
зования сыворотки для пассивной терапии явля-
ется то, что в большом ее объеме содержится от-
носительно небольшое количество антител. В на-
чале 1940-х гг. Р. Кох с сотрудниками открыли
метод выделения фракции гаммаглобулина (у-гло-
булин) из человеческой сыворотки путем преци-
питации с помощью холодного этанола. Этот ме-
тод, названный фракционированием Коха, пред-
ставляет собой легко осуществимый и безопас-
340
ГЛАВА 20. СОПРОТИВЛЯЕМОСТЬ К ИНФЕКЦИОННЫМ ЗАБОЛЕВАНИЯМ И ИММУНИЗАЦИЯ
• Таблица 20.7. Сравнительные характеристики сывороточных иммуноглобулинов
Источник Иммуноглобулин, мг/100 мл
IgG IgA IgM
Цельная сыворотка 1200 180 200
Иммуноглобулины сыворотки 16500 100-500 25-200
Иммуноглобулины для внутривенного введения 3000-5000 Следы Следы
Плацентарные сывороточные иммуноглобулины 16500 200-700 150-400
ный способ получения гомологичных человече-
ских антител для клинического использования.
Плазму собирают от здоровых доноров или
получают из плаценты. Плазму или сыворотку не-
скольких доноров собирают в пул. Полученный
препарат называется иммунным сывороточным
глобулином (immune serum globulin — 1SG) или
нормальным человеческим иммуноглобулином
(human normal immunoglobulin — HNI). Если плаз-
му или сыворотку берут у доноров, предваритель-
но специально отобранных после иммунизации
или введения бустерных доз антигена, а также у
выздоровевших от определенной инфекции, спе-
цифический препарат иммуноглобулина обознача-
ется соответствующим образом: противостолбняч-
ный иммуноглобулин (tetanus immune globulin —
TIG), иммуноглобулин против гепатита В (hepati-
tis В immune globulin — HBIG), иммуноглобулин
против варицеллы-зостер (вируса группы герпе-
са) (varicella-zoster immuneglobulin — VZIG), им-
муноглобулин против бешенства (rabies immune-
globulin — RIG). Большое количество иммуногло-
булина можно получить с помощью плазмафере-
за с последующим возвращением клеток крови
донору. Фракцию, содержащую иммуноглобули-
ны, получают посредством преципитации с по-
мощью холодного этанола. Полученный препа-
рат: 1) теоретически свободен от вирусов, таких
как вирус гепатита и ВИЧ; 2) содержит антитела
IgG, концентрация которых повышена примерно
в 25 раз; 3) сохраняет стабильность в течение не-
скольких лет; 4) может обеспечить пиковые уров-
ни содержания в крови приблизительно через 2 сут
после внутримышечной инъекции. Безопасные
при внутривенном введении препараты (intrave-
nous immunoglobulin — IVIG или intravenous gamma-
globulin — IVGG; в русском переводе — внутри-
венный иммуноглобулин — ВВИГ) готовят при
помощи преципитации холодным этанолом с
последующей обработкой несколькими методами:
фракционированием с помощью полиэтиленгли-
коля или обмена ионами; подкислением до pH
4,0 —4,5; воздействием пепсином или трипсином;
стабилизацией с помощью мальтозы, сахарозы,
глюкозы или глицина. Такая стабилизация умень-
шает агрегацию глобулинов, которая может спро-
воцировать анафилактические реакции (см. далее).
В указанных внутривенных препаратах содержится
IgG от У4 до % от количества, применяемого в
препаратах для внутримышечного введения. В этих
препаратах отмечаются только следы IgA и IgM
(табл. 20.7).
Показания к применению
иммуноглобулина
Антитела к RhD-антигену (Rhogam) вводят ре-
зус-отрицательным матерям в течение 72 ч пос-
ле родов (перинатальный период) для предотв-
ращения их иммунизации фетальными резус-по-
ложительными эритроцитами, которая может по-
влиять на последующие беременности. Как ука-
зывалось в гл. 15, введение Rhogam обеспечива-
ет защиту, содействуя удалению фетальных Rh+-
клеток, с которыми мать контактирует во время
родов, и таким образом устраняет сенсибилиза-
цию резус-отрицательных матерей резус-положи-
тельными антигенами. Антитоксин TIG исполь-
зуется для обеспечения пассивной защиты при
некоторых ранениях или в случаях, когда аде-
кватная активная иммунизация с помощью про-
тивостолбнячного анатоксина не проводилась.
Больным лейкозом, которые особенно чувстви-
тельны к вирусу варицелла-зостер, а также бере-
менным женщинам и новорожденным, контак-
тировавшим с заболевшими или инфицирован-
ными вирусом ветряной оспы, вводится VZIG.
Иммуноглобулин против цитомегаловируса че-
ловека (CMV-ВВИГ) вводится профилактически
реципиентам трансплантатов почек или костно-
го мозга. Индивидуумам, покусанным животны-
ми, у которых есть подозрение на наличие виру-
са бешенства, вводят RIG, одновременно осуще-
ствляя активную иммунизацию человеческой
диплоидной клеточной вакциной против бешен-
ства (человеческий RIG имеется не везде, и в
некоторых районах могут потребоваться лоша-
диные антитела). Препарат HBIG можно вводить
новорожденному, у матери которого имеются
признаки заражения гепатитом В, а также меди-
цинским работникам после случайного укола
иглой для подкожного введения или индивиду-
уму после полового контакта с больным гепати-
том В. (Против гепатита В можно также исполь-
зовать ISG; см. далее.) Иммунный глобулин про-
РЕЗЮМЕ
341
тив вакцинии вводится больным экземой или
людям с подавленным иммунитетом, имеющим
тесный контакт с теми, кто проходил вакцина-
цию от ветряной оспы живой аттенуированной
вакциной. У таких лиц с подавленным иммуни-
тетом аттенуированные вакцины могут вызвать
прогрессирующие деструктивные заболевания.
В некоторых случаях в связи со своими проти-
вомикробными свойствами используется ВВИГ.
Также его успешно применяют против инфекций,
вызванных стрептококками типа В, у недоношен-
ных детей, при хроническом менингоэнцефали-
те, вызванном эховирусами, и болезни Кавасаки
(заболевание неясной этиологии). Внутривенное
введение может снизить инфекционную заболева-
емость у больных раком крови, таких как В-кле-
точный лимфолейкоз и множественная миелома.
Постоянное введение ВВИГ оказалось полезным
у детей с подавленным иммунитетом и недоно-
шенных новорожденных. При гипогаммаглобули-
немии и первичном иммунодефиците необходи-
мо повторно вводить ISG. Терапевтическую цен-
ность при различных аутоиммунных заболевани-
ях представляет и ВВИГ. Например, при иммун-
ной идиопатической тромбоцитопенической пур-
пуре ВВИГ предположительно блокирует Fc-ре-
цепторы на фагоцитарных клетках и препятству-
ет фагоцитозу и разрушению тромбоцитов, по-
крытых аутоантителами. С различной степенью
успеха ВВИГ использовали и при других иммун-
ных цитопениях.
Предосторожности при иммунотерапии
Отличные от ВВИГ препараты нужно вводить
внутримышечно. Внутривенное введение проти-
вопоказано в связи с возможностью анафилакти-
ческой реакции. Это, по-видимому, обусловлено
агрегатами иммуноглобулинов, сформировавших-
ся во время их разделения на фракции во время
преципитации, проводимой с помощью этанола
Эти агрегаты активируют комплемент с получе-
нием анафилатоксинов (IgGl? lgG2, lgG3, IgM —
по классическому пути, a IgG и IgA — по альтер-
нативному пути) или прямо перекрестно связы-
вают Fc-рецепторы, приводя к высвобождению
медиаторов воспаления. Применение безопасно-
го для внутривенного введения ВВИГ получило
широкое распространение особенно в тех случа-
ях, когда необходимы повторные инъекции (агам-
маглобулинемия).
Одним из особых противопоказаний для вве-
дения препаратов иммуноглобулина является на-
личие врожденного дефицита IgA. Поскольку у
таких больных отсутствует IgA, они распознают
его как чужеродный белок и отвечают на него
производством антител, в том числе антител IgE,
что может приводить к последующей анафилак-
тической реакции. Препараты ВВИГ, содержащие
только следы IgA, вызывают меньше проблем.
Колониестимулирующие факторы
Колониестимулирующие факторы (КСФ), как
указывалось в гл. 11, являются цитокинами, сти-
мулирующими развитие и созревание всех лей-
коцитов. Гранулоцитарный (Г-КСФ), гранулоци-
тарно-макрофагальный (ГМ-КСФ) и макрофа-
гальный (М-КСФ) колониестимулирующие фак-
торы были клонированы с помощью технологии
рекомбинантных ДНК и теперь доступны для
клинического применения. Эти КСФ доказали
свою пользу, ускоряя восстановление клеток ко-
стного мозга у пациентов, у которых при лече-
нии рака или пересадке органов подавлялись
миелоидные клетки. У таких пациентов истоще-
ние нейтрофилов (нейтропения) является основ-
ным фактором, предрасполагающим к развитию
тяжелых инфекций. Сокращая период нейтропе-
нии, КСФ уменьшает частоту появления тяже-
лых инфекций у этих пациентов. Такие КСФ
улучшают также функцию лейкоцитов; есть пред-
варительная обнадеживающая информация, что
эти белки могут быть полезны в процессе имму-
нотерапии для усиления защиты организма от
различных патогенов.
Некоторые другие цитокины являются мощ-
ными активаторами иммунной системы; весьма
интересно изучить, как их можно применять в
качестве средства дополнительной терапии при ле-
чении инфекционных болезней. Также мощным
активатором функции макрофагов является IFNy.
Было показано, что он уменьшает частоту разви-
тия тяжелых инфекций у пациентов с врожден-
ным дисфагоцитозом (нарушение переваривания
фагоцитированных бактерий ПМЯ-лейкоцитами).
Интерферон-у дал обнадеживающие результаты в
качестве средства дополнительной терапии при
некоторых инфекциях, таких как инфекция, вы-
званная резистентными к лекарствам штаммами
Mycobacterium tuberculosis, и редкие грибковые
инфекции.
РЕЗЮМЕ
1. Чтобы вызвать заболевание, микроорганизм
должен повредить макроорганизм.
2. Эффективная защита организма от отдельного
патогена зависит от типа этого патогена. Обычно ус-
пешная защита от большинства патогенов зависит от
гуморального и клеточного компонентов врожденной
и адаптивной иммунной систем.
3. Патогены применяют различные стратегии
ускользания от защитных сил организма, например
использование полисахаридных капсул, антигенное
разнообразие, выработку протеолитических фермен-
тов и активное подавление иммунного ответа.
4. Эффективный ответ организма на патоген вклю-
чает компоненты гуморального и клеточного иммуни-
тета. Однако в отношении некоторых патогенов защи-
ту организма может обеспечивать преимущественно
одна из ветвей иммунной системы.
342
ГЛАВА 20. СОПРОТИВЛЯЕМОСТЬ К ИНФЕКЦИОННЫМ ЗАБОЛЕВАНИЯМ И ИММУНИЗАЦИЯ
5. Защиты от инфекционных заболеваний можно
достигнуть посредством как активной, так и пассив-
ной иммунизации.
6. Активная иммунизация может быть следствием
перенесенной инфекции или вакцинации. Пассивная
иммунизация может происходить естественным (та-
ким как перенос антител от матери плоду через пла-
центу или новорожденному — через молозиво) или
искусственным путем (таким как введение иммунных
глобулинов).
7. Активная иммунизация может осуществляться пу-
тем введения одного иммуногена или их комбинации.
8. Инкубационный период заболевания и ско-
рость, с которой количество антител достигает защит-
ных уровней, влияют как на эффективность иммуни-
зации, так и на анамнестический эффект бустерной
инъекции.
9. Место введения вакцины может иметь большое
значение. Многие способы иммунизации приводят к
преимущественному синтезу сывороточных IgM и IgG,
а введение некоторых вакцин через рот — к появле-
нию секреторного IgA в пищеварительном тракте.
10. Благодаря иммунопрофилактике организм лег-
че справляется с последующей инфекцией; иммуно-
терапия характеризуется ограниченной эффективно-
стью при инфекционных заболеваниях.
ТЕСТЫ
Выберите ОДИН НАИБОЛЕЕ ПРАВИЛЬНЫЙ ответ
на каждый тест.
1. При развитии эффективного иммунного ответа
события развиваются в следующем порядке:
а) секреция интерферона, синтез антител, клеточ-
ный иммунный ответ, АЗКЦ NK-клеток;
б) синтез антител, секреция интерферона. АЗКЦ
NK-клеток, клеточный иммунный ответ;
в) АЗКЦ NK-клеток, секреция интерферона, синтез
антител, клеточный иммунный ответ;
г) секреция интерферона, клеточный иммунный
ответ, синтез антител, АЗКЦ NK-клеток;
д) клеточный иммунный ответ, секреция интерфе-
рона, синтез антител, АЗКЦ NK-клеток.
2. Различия между грамположительными и грам-
отрицательными бактериями включают:
а) окрашивание кристаллическим фиолетовым;
б) способность комплемента лизировать клетки;
в) толщину слоя пептидогликана;
г) эндотоксин в стенках клеток грамотрицательных
бактерий;
д) все перечисленное.
3. Антигенное разнообразие является механизмом
ускользания от иммунологического надзора и приво-
дит:
а) к нарушению прикрепления к рецепторам орга-
низма;
б) индукции подавления иммунитета;
в) таким изменениям в важных поверхностных ан-
тигенах, что варианты, ускользнувшие от иммунологи-
ческого надзора, начинают развиваться в результате
иммунной селекции;
г) мутациям в поверхностных антигенах;
д) разрушению антигенов протеолитическими
ферментами
4. Наилучшим способом обеспечения иммунологи-
ческой защиты против столбняка новорожденных яв-
ляется:
а) введение новорожденному человеческого столб-
нячного антитоксина;
б) инъекция новорожденному столбнячного анаток-
сина;
в) введение матери анатоксина не позднее чем за
72 ч до рождения ребенка;
г) иммунизация матери столбнячным анатоксином
до беременности и в раннем ее периоде;
д) введение ребенку антитоксина и анатоксина для
пассивной и активной иммунизации.
5. Активная длительная иммунизация против полио-
миелита может быть достигнута путем орального вве-
дения аттенуированной вакцины (Сейбина) или парен-
теральной инъекции инактивированной вакцины (Сол-
ка). Эти вакцины одинаково эффективны в предотвра-
щении заболевания:
а) поскольку обе индуцируют появление адекватно-
го количества IgA на слизистой оболочке кишечника —
месте проникновения вируса;
б) антитела в сыворотке защищают от виремии,
которая ведет к заболеванию;
в) вирусные антигены прикрепляются к клеткам
переднего рога спинного мозга, препятствуя прикреп-
лению вирулентного вируса;
г) обе вакцины приводят к образованию интерфе-
рона;
д) обе вакцины вызывают умеренную инфекцию,
которая может привести к формированию антител
6. Применение вакцины небезопасно. Укажите, что
с наименьшей вероятностью приведет к неблагопри-
ятным эффектам у индивидуума с нарушенным имму-
нитетом:
а) вакцина против кори;
б) пневмококковая вакцина;
в) бациллы Кальметта —Герена;
г) вакцина против свинки;
д) вакцина против полиомиелита Сейбина.
7. Введение чужеродного (например, лошадиного)
антитоксина для пассивной защиты человека может
привести к сывороточной болезни, которая не харак-
теризуется:
а) выработкой организмом антител на чужеродные
антитела;
б) началом в течение 24—48 ч;
в) использованием гомологичного антитоксина;
г) депонированием комплексов антиген —антитело
в разных местах организма;
д) реакцией, хотя и замедленной во времени, но
не являющейся клеточно-опосредованной замедлен-
ной иммунной реакцией IV типа.
8. Пневмококковую полисахаридную вакцину нельзя
вводить следующей группе людей:
а) лица с хроническими сердечно-легочными забо-
леваниями;
б) люди пожилого возраста (более 60 лет);
в) дети (менее 2 лет);
г) лица с хронической почечной недостаточностью;
д) лица с серповидно-клеточной анемией.
ТЕСТЫ
343
9. Не соответствует действительности следующее
утверждение о человеческом иммунном сывороточ-
ном глобулине:
а) его источником является человеческая плацента;
б) глобулины получаются посредством преципита-
ции с помощью холодного этанола;
в) концентрация IgG в препарате более чем в 10 раз
превышает его концентрацию в плазме;
г) концентрация IgA и IgM в препарате чуть мень-
ших, чем в плазме;
д) преципитация с помощью этанола не избавляет
препарат глобулина от вируса гепатита.
ОТВЕТЫ НА ТЕСТЫ
1 — г. Обычная последовательность событий при
иммунном ответе организма на вирусную инфекцию
следующая: секреция интерферона, клеточный им-
мунный ответ, синтез антител, АЗКЦ NK-клеток. Ин-
терферон вырабатывается на ранней стадии вирусной
инфекции и замедляет инфицирование прилегающих
клеток. Клеточные иммунные ответы в форме цито-
токсических СЭ8+-Т-клеток начинаются на ранних ста-
диях вирусной инфекции и обычно предшествуют по-
явлению сывороточных нейтрализующих антител или
опосредованной NK-клетками АЗКЦ (для которой не-
обходимы специфические антитела).
2 — д. Различия между грамположительными и
грамотрицательными бактериями включают окрашива-
ние кристаллическим фиолетовым. Грамотрицательные
клетки могут лизироваться комплементом, а грамполо-
жительные устойчивы к действию комплемента благо-
даря толстому слою пептидогликана. Грамотрицатель-
ные бактерии обладают эндотоксином, находящимся в
их клеточных стенках. Он способен вызвать гемодина-
мические нарушения и септический шок у пациентов с
грамотрицательным сепсисом. Грамположительные
бактерии не содержат эндотоксина, но в них находятся
тейхоевые кислоты, являющиеся иммуногенными.
3 — в. Антигенное разнообразие является распро-
страненным явлением у многих патогенов и служит
механизмом, с помощью которого они способны ус-
кользать от иммунной системы. Антигенное разнооб-
разие может являться результатом действия различ-
ных механизмов, таких как мутация, изменение эксп-
рессии поверхностного белка и естественного разно-
образия штаммов, которое наблюдается, например,
у пневмококков. Склонность микроорганизмов к анти-
генному разнообразию является основной проблемой
при разработке вакцин.
4 — г. Самым простым и наиболее эффективным
способом защиты новорожденного от «экзотоксиче-
ского» заболевания, такого как столбняк и дифтерия,
является индуцирование выработки антител у матери.
Антитоксические IgG, проходящие через плаценту,
обеспечивают необходимую защиту. Хотя столбнячный
анатоксин может быть использован для обеспечения
кратковременной пассивной защиты, он более дорогой
и требует применения болезненных инъекций, ненуж-
ных при прочих условиях. Введение анатоксина матери
за 72 ч до родов не даст необходимого времени для
индуцирования выработки антител. Хотя антитоксин и
анатоксин могут обеспечить немедленную пассивную,
а в дальнейшем и активную защиту, последняя должна
будет подтверждаться повторными инъекциями ана-
токсина. Введение антитоксина является дорогостоя-
щим мероприятием, а введение антитоксина и анаток-
сина потребует нежелательных инъекций.
5 — 6. Введение и аттенуированной, и инактиви-
рованной вакцин ведет к формированию циркулиру-
ющих в крови антител, которые обеспечивают защиту
путем перехватывания инфицирующего вируса до
того, как он достигает ткани-мишени в ЦНС. В то вре-
мя, как вакцина Сейбина приводит к образованию в
слизистых оболочках кишечника IgA, которые могут
перехватывать вирус в месте проникновения, парен-
терально вводимая вакцина Солка неэффективна в
индуцировании выработки IgA слизистых оболочек.
Вирусный антиген в вакцине может прикрепляться к
клеткам переднего рога нервной системы, но вероят-
но, не обеспечит длительного иммунитета. Индуциро-
вание выработки интерферона потенциально обеспе-
чит только кратковременную защиту. Только аттенуи-
рованная и живая вакцина Сейбина будет вызывать
умеренную инфекцию.
6 — 6. Пневмококковая вакцина состоит из капсу-
лярных полисахаридов Streptococcus pneumoniae и
является неживой вакциной, не способной вызвать
инфекцию. Вакцины против кори, свинки и полиомие-
лита (Сейбина) содержат аттенуированные вирусы,
а бацилла Кальметта —Герена является аттенуирован-
ной бактерией. Эти аттенуированные организмы спо-
собны к пролиферации в организме человека. В нор-
ме организм ограничивает их репликацию, но при не-
достаточности иммунитета может оказаться неспособ-
ным сделать это, и инфекция будет прогрессировать.
7 — 6. Реакции, которыми проявляется сыворо-
точная болезнь, начинаются в течение 6—12 сут
после введения чужеродной субстанции. В этот пе-
риод организм вырабатывает антитела, реагирующие
с чужеродной субстанцией(-ями), которая находится
в организме и ведет к образованию комплексов ан-
тиген-антитело. Эти комплексы могут депониро-
ваться в суставах, лимфатических узлах, коже и дру-
гих местах. Проявления иммунной реакции, хотя и
наступающие позже, все равно классифицируют как
реакции III типа, а не клеточно-опосредованные ре-
акции ГЗТ (IV тип), поскольку в них вовлечены скорее
антитела, чем Т-клетки.
8 — в. У детей младше 2 лет отсутствует адекват-
ная реакция на иммунизацию с помощью вакцины из
чистого бактериального капсулярного полисахарида.
Поэтому их вакцинация может оказаться бесполезной.
Другие лица из перечисленных групп особенно склон-
ны к инфекции, вызываемой Streptococcus pneumo-
niae. Хотя у некоторых из них и не может вырабаты-
ваться оптимальный ответ на вакцину, они все равно
должны быть вакцинированы.
9 — д. Потенциальная опасность вируса гепатита
в человеческой плазме устраняется путем сепарации
преципитированных этанолом глобулинов. Концентра-
ция IgG составляет примерно 16500 мг/100 мл по
сравнению с 1 200 мг/100 мл в плазме. В то время
как концентрация IgG многократно увеличивается в
препарате иммунного сывороточного глобулина, коли-
чество IgA и IgM относительно уменьшено. Их концен-
трация в иммунном сывороточном глобулине, полу-
ченном путем преципитации с помощью этанола, при-
ближается к исходной концентрации в плазме.
ПРИЛОЖЕНИЕ
НЕКОТОРЫЕ CD-АНТИГЕНЫ
CD- антиген Другое название Экспрессирующая клетка Функция/комментарий Лиганд
CD1 — Клетки Лангерганса, денд- ритные клетки, В-клетки, тимоциты Молекула, похожая на МНС I класса, презентирующая липиды и гликолипиды Т-клеткам Липиды, ГЛИКОЛИПИ- ДЫ
CD2 Til, LFA-2 Т-клетки, NK-клетки Г-клеточная молекула адгезии CD58
CD3 ТЗ Т-клетки Передача сигнала от TCR —
CD4 Т4 Тимоциты, значительная часть зрелых Т-клеток (ограниченных по МНС II класса), моноциты, макрофаги Корецептор TCR; передача сиг- нала МН( II класса, ВИЧ-1 и ВИЧ-2, gp!20
CD5 Т1, Тр67 Субпопуляция В-клеток, Т-клетки Экспрессия на В-клетках ассоции- рована с полиреактивной продук- цией IgM —
CD8 Т8 Тимоциты, значительная часть зрелых Т-клеток (ограниченных по МНС 1 класса) — цитотоксиче- ские клетки Корецептор TCR; передача сиг- нала МНС 1 класса
CDlla Цепь LFA-1 Лейкоциты Субъединица адгезионной моле- кулы CDlla/CD18 (LFA-1) 1САМ-1, -2, -3
CD18 — Лейкоциты Интегриновая цепь, которая свя- зывается с CD11а, Ь, с или d —
CD19 — В-клетки Передача сигнала в В-клетке —
CD20 — В-клетки Кальциевый канал в активации В-клетки —
CD21 CR2 В-клетки. фолликулярные дендритные клетки Участвует в активации В-клетки Компонент компле- мента C3d, вирус Эпштейна — Барр
CD25 ТАС Активированные Т-клетки, В-клетки а-Цепь рецептора IL-2 IL-2
CD28 Тр44 Субпопуляции Т-клеток Костимуляторная молекула Т-клеток В7 (CD80 и CD86)
ПРИЛОЖЕНИЕ
345
Продолжение приложения
CD- антиген Другое название Экспрессирующая клетка Функция/комментарий Лиганд
CD32 FcyRII Моноциты, гранулоциты, В-клетки, эозинофилы Низкоаффинный рецептор для IgG Агрегированный Ig и комплексы анти- ген — антитело
CD34 — Эндотелиальные клетки, гемопоэтические клетки- предшественники Маркер ранних стволовых клеток L-селектин (CD62L)
CD40 — В-клетки, макрофаги, дендритные клетки Участвует во взаимодействии Т-клеток с АПК и переключении классов антител; рецептор для ко- стимуляторных молекул CD 154 (CD40L)
CD44 Pgp-1, H-CAM Лейкоциты, эритроциты Лимфоцитарная адгезия на HEV Гиалуроновая кислота
CD50 ICAM-3 Все клетки (не на эндоте- лиальных клетках) Адгезионная молекула LFA-1
CD54 ICAM-1 Все клетки Адгезионная молекула CDlla/CD18, рино- вирус
CD55 ФУД Все клетки Вызывает диссоциацию СЗ-кон- вертаз из каскадов активации комплемента СЗЬ, C4b, CD97
CD58 LFA-3 Лейкоциты, эндотелиаль- ные клетки, эпителиаль- ные клетки, фибробласты Адгезионная молекула CD2
CD62L L-селектин, MEL-14 В-клетки, Т-клетки, моно- циты, NK-клетки Т-клеточная адгезия на HEV CD34
CD74 Инвариантная цепь В-клетки, макрофаги, моноциты, активирован- ные Т-клетки Связывается с МНС II класса в эндоплазматическом ретикулуме —
CD79a, CD79b Iga, lg₽ В-клетки, пре-В-клетки Сигнальные молекулы, компонен- ты В-клеточного рецептора —
CD80 B7.1 В-клетки, макрофаги, дендритные клетки Костимуляторная молекула на АПК CD28. CD152 (CTLA-4)
CD8I Мишень ан- гипролифера- тивных анти- тел (ТАРА-1) Все клетки Связывается с CD 19 и CD21 на поверхности В-клеток для образо- вания В-клеточного корецептора —
CD86 В7.2 Активированные В-клетки. макрофаги, дендритные клетки Костимуляторная молекула на АПК CD28, CD152 (CTLA-4)
CD95 Fas, Аро-1 Активированные Т- и В-клетки, NK-клетки Индуцирует апоптоз после связы- вания с Fas-лигандом (CD 178, CD95L) CD178 (Fas-лиганд. CD95L)
CD97 GR-1 Гранулоциты, макрофаги, активированные Т- и В-клетки Рецептор-счетчик для CD55 CD55
CD 102 ICAM-2 Эндотелиальные клетки, покоящиеся лимфоциты, тромбоциты Адгезионная молекула CDlla(LFA-l)
CD 152 CTLA-4 Активированные Т-клетки Отрицательный регулятор Т-кле- точной активации CD80 (В7 1) и CD86 (В7 2)
346
ПРИЛОЖЕНИЕ
Окончание приложения
CD- антиген Другое название Экспрессирующая клетка Функция/комментарий Лиганд
CD 154 CD40L Активированные Т-клетки Связывание с CD40 на В-клетках приводит к пролиферации В-кле- ток и переключению класса син- тезируемого 1g CD40
CD178 Fas-лиганд, С D95-лиганд Т-клетки и NK-клетки Индуцирует апоптоз у клеток, жспрессируюших CD95; у людей и мышей линии КО при мутации CD 178 отмечается тяжелое ауто- иммунное заболевание CD95 (Fas)
CD210 Рецептор к IL-10 Т- и В-клетки, NK-клетки моноциты, макрофаги .Рецептор IL-10; связывание с IL-10 угнетает продукцию цито- кинов в макрофагах, моноцитах и дендритных клетках IL-10
CD212 P-Цепь рецеп- тора к IL-12 Большинство Т-клеток, NK-клетки, некоторые линии В-клеток Димеризуется и связывается с не- известной цепью с образованием рецептора к IL-12; IL-12 направ- ляет иммунный ответ преимуще- ственно в сторону Тн1-типа реакций IL-12
CD213 Рецептор к IL-13 Широко экспрессируется в кроветворных тканях, нервной системе и других тканях После связывания с IL-13 переда- ет сигнал на угнетение продукции про воспалительных цитокинов моноцитами и макрофагами; у В-клеток IL-13 вызывает проли- ферацию и выработку иммуногло- булинов IL-13
CD217 Рецептор к IL-17 Широко представлен в тка- нях; лимфоциты пуповин- ной крови, лимфоциты периферической крови, тимоциты С низким аффинитетом связыва- ется с IL-17; IL-17 вызывает сек- рецию провоспалительных цито- кинов IL-17
CD220 Рецептор к инсулину Повсеместно, включая эритроциты, печень, мыш- цы, жировую ткань Клеточный рецептор инсулина; мутация в CD220 приводит к ин- сулиннезависимому сахарному диабету Инсулин
CD247 £-Цепь Т-клеточного рецептора, CD3 С Все Т-клетки Компонент комплекса CD3; свя- зывает распознающую антиген часть с передающей на внутрикле- точные пути активации He определен
СЛОВАРЬ ТЕРМИНОВ
Авидность — суммация множества аффинностей
(степеней сродства), например при связывании поли-
валентного антитела с поливалентным антигеном.
Агаммаглобулинемия — см. Х-cue пленная агамма-
глобулинемия.
Агаммаглобулинемия Брутона — см. Х-спепленная
агаммаглобулинемия.
Агглютинация — агрегация частиц антигена антите-
лами.
Адаптерные белки — белки, участвующие в переда-
че сигналов от рецепторов к расположенным ниже уча-
стникам каскадного пути передачи сигнала. Все ис-
пользуют одинаковый 8Н2-домен.
Адаптивный иммунный ответ — см. приобретенный
иммунный ответ.
Адгезионные молекулы — молекулы, обеспечива-
ющие связывание одной клетки с другой или с белка-
ми внеклеточного матрикса, интегринами, селекти-
нами и членами суперсемейства генов иммуноглобу-
линов.
Аденозиндезаминазная недостаточность — форма
тяжелого комбинированного иммунодефицита, при
которой отсутствует фермент аденозиндезаминаза, ка-
тализирующий отделение аминогруппы от аденозина
и дезоксиаденозина с образованием инозина и дезок-
сиинозина соответственно.
Адоптивный перенос — перенос способности к раз-
витию иммунного ответа путем трансплантации им-
мунокомпетентных клеток.
Адъювант — вещество, вводимое вместе с антиге-
ном, которое усиливает ответ на инъецированный ан-
тиген.
Азатиаприн — мощный иммуносупрессивный пре-
парат, который превращается в организме в активную
форму, а затем поражает быстро пролиферирующие
клетки, в том числе лимфоциты, реагирующие на транс-
плантированную ткань.
Активирующий рецептор клеток-киллеров (KAR) —
рецептор, экспрессируемый на натуральных киллер-
ных клетках или цитотоксических клетках. Этот рецеп-
тор активирует уничтожение клетки-мишени.
Акцессорные (вспомогательные) клетки — клетки,
необходимые для инициации иммунного ответа; тер-
мин часто используется для обозначения антигенпре-
зентирующих клеток (см. также антигенпрезентиру-
ющие клетки).
Аллели — две или более альтернативные формы гена,
расположенные в одной и той же позиции (или локу-
се) на определенной хромосоме.
Аллельное исключение — способность гетерозигот-
ных лимфоидных клеток производить только одну ал-
лельную форму антигенспецифичного рецептора (Ig или
Т-клеточного рецептора), в то время как генетический
материал позволяет производить две аллельные фор-
мы. Другие гены антигенспецифичных рецепторов
обычно экспрессируются кодоминантно.
Аллерген — антиген, ответственный за развитие ал-
лергических реакций путем индукции синтеза IgE.
Аллергическая астма — клинический феномен, свя-
занный с констрикцией бронхиального дерева вслед-
ствие аллергической реакции на ингаляционный ан-
тиген.
Аллергическая реакция — ответ на антигены окру-
жающей среды (аллергены), вызванный пред существу-
ющими в организме антителами или активированны-
ми антигеном Т-клетками.
Аллергический ринит — аллергическая реакция в
слизистой оболочке носа, также известная как сенная
лихорадка, которая проявляется насморком, чиханьем
и слезотечением.
Аллергия — термин, объединяющий иммунные ре-
акции на непатогенные антигены, которые приводят к
воспалительным и патологическим изменениям в орга-
низме хозяина.
Аллоантиген — антиген, экспрессируемый на по-
верхности клетки, который стимулирует ответ при
трансплантации генетически отличающемуся предста-
вителю того же биологического вида.
348
СЛОВАРЬ ТЕРМИНОВ
Аллогенный — термин, описывающий генетические
варианты или различия между представителями од-
ного вида; используется при пересадке органов или
тканей между генетически различными индивидуума-
ми и между неродственными представителями одно-
го вида.
Аллотипы — антигенные детерминанты, представ-
ленные в аллельных (альтернативных) формах. В от-
ношении 1g аллотипом называют аллельные варианты
иммуноглобулинов, способные (при иммунизации)
вызвать антительный иммунный ответ у представите-
лей того же вида.
Аллотрансплантация — пересадка (трансплантация)
тканей между генетически различными представите-
лями одного вида.
Альвеолярные макрофаги — клетки, обнаруживае-
мые в альвеолах легких; могут удалять чужеродные ча-
стицы, попавшие в нижние дыхательные пути.
Альтернативный путь активации комплемента — ме-
ханизм активации комплемента, который начинается
с активации СЗ-компонента и связывания фрагмента
СЗЬ с поверхностью клетки.
Анамнестический — термин, описывающий имму-
нологическую память, которая приводит к быстрому
нарастанию иммунного ответа при повторном воздей-
ствии антигена.
Анатоксин — нетоксическое производное токсина,
используемое как иммуноген для индукции синтеза ан-
тител, способных перекрестно реагировать с токсином.
Анафилаксия — немедленная реакция гиперчувстви-
тельности при провокации аллергеном, опосредован-
ная IgE и тучными клетками Эта опасная для жизни
аллергическая реакция вызывается высвобождением
фармакологически активных агентов.
Анафилатоксин — вещество, такое как С5а, СЗа,
способное вызывать освобождение гистамина из туч-
ных клеток и базофилов.
Ангионевротический отек наследственный — рас-
стройство, при котором развиваются рецидивирующие
эпизоды отеков кожи, желудочно-кишечного тракта и
дыхательных путей. Эта патология связана со снижени-
ем концентрации или отсутствием С1-ингибитора (С1-
инг). Наиболее серьезным следствием этого расстрой-
ства является отек гортани, ведущий к асфиксии.
Анергия — состояние отсутствия ответа на специ-
фический антиген, при котором Т- или В-клетки при-
сутствуют, но функционально неактивны.
Анкилозирующий спондилит — хроническое воспа-
лительное заболевание, поражающее позвоночник,
крестцово-подвздошные сочленения и крупные пери-
ферические суставы. К этому заболеванию отмечена
выраженная генетическая предрасположенность, кото-
рая была выявлена в связи с его повышенной частотой
в некоторых семьях. В США около 90 % больных ан-
килозирующим спондилитом имеют HLA-B27, при том
что только 8% пациентов не имеют этой HLA-детер-
минанты.
AHTn-IgG-антитела — антитела, вырабатываемые
против константных доменов 1g; используются для
определения молекул, связанных с антителами, в им-
мунологических и других исследованиях.
Антиген — любой чужеродный материал, который
специфически связывается антителами или лимфоци-
тами; термин широко используется для описания ма-
териалов, которые применяются при иммунизации.
Антигенная детерминанта — один антигенный учас-
ток или эпитоп в составе комплексной антигенной
молекулы или ее части.
Антигенный дрейф — антигенные различия микро-
организмов (например, вирусов, паразитов), возника-
ющие вследствие точечных генных мутаций, приводя-
щих к небольшим различиям по экспрессирующимся
поверхностным антигенам.
Антигенный рецептор — специфический антиген-
связывающий рецептор на Т- или В-лимфоцитах, ко-
торый транскрибируется и транслируется в результате
реаранжировки и транслокации генов V, D и J.
Антигенный сдвиг — обмен участками генома меж-
ду вирусами гриппа, при котором создаются радикаль-
но новые поверхностные антигены.
Антигенпрезентирующая клетка (АПК) — специали-
зированный тип клеток, имеющих на своей поверхно-
сти молекулы МНС II класса, вовлеченные в презен-
тацию антигена Т-клеткам.
Антигенсвязывающий анализ — антиген связывает-
ся со специфическим антителом, и его наличие опре-
деляют с использованием второго антитела, связыва-
ющегося с другим эпитопом.
Антигенсвязывающий участок — участок молекулы
антитела, на котором происходит связывание с анти-
генной детерминантой или эпитопом. Этот участок рас-
полагается в бороздке, образованной N-концевыми ва-
риабельными областями Н- и L-цепей Fab-фрагмента.
Антисыворотка — жидкий компонент крови иммун-
ного организма, полученный после образования сгуст-
ка, в котором содержится набор разнообразных анти-
тел, выработанных против молекул, использованных
для иммунизации. Такие антитела связывают антиген,
использующийся для иммунизации. Каждое антитело
имеет свою собственную структуру, свой эпитоп на
молекуле антигена и свой участок для перекрестного
связывания. Эта гетерогенность обусловливает уникаль-
ность каждой антисыворотки.
Антитело — сывороточный белок, появляющийся
при иммунизации, отличительной чертой которого яв-
ляется способность специфически связываться с им-
мунизирующим антигеном.
Антителозависимая клеточно-опосредованная цито-
токсичность (АЗКЦ) — феномен, при котором клетки-
мишени, покрытые антителами, уничтожаются специ-
ализированными клетками-киллерами (натуральными
киллерами или макрофагами), которые обладают ре-
цепторами к Fc-фрагменту антител, покрывающих
клетку (Fc-рецепторы). Эти рецепторы позволяют клет-
ке-киллеру связываться с клеткой-мишенью, покры-
той антителами.
Антитоксин — специфические антитела к экзоток-
синам. продуцируемым определенными микроорганиз-
мами, такими как возбудители дифтерии и столбняка
Апоптоз — форма программированной гибели кле-
ток вследствие активации эндогенных молекул, кото-
рая приводит к фрагментации ДНК.
СЛОВАРЬ ТЕРМИНОВ
349
Аппендикс — лимфоидная ткань, ассоциированная
кишечником, которая расположена в начале толстой
кишки.
Артюса феномен — реакция гиперчувствительности,
вызванная местным образованием комплексов анти-
ген-антитело, которые активируют систему компле-
мента и вызывают тромбоз, кровоизлияние и острое
воспаление.
Астма — заболевание легких, характеризующееся
обратимой обструкцией дыхательных путей (в большин-
стве случаев), воспалением бронхиального дерева со
значительным участием эозинофилов и гиперреактив-
ностью бронхов в ответ на различные стимулы. В не-
которых случаях астма имеет аллергическую природу
(см. аллергическая астма) и опосредуется, в частности,
антителами IgE, специфичными к средовым аллерге-
нам. В других случаях астма провоцируется неаллерги-
ческими факторами.
Атаксия-телеангиэктазия — мультисистемное рас-
стройство, характеризующееся нарушением мышечной
координации (атаксией), постоянным расширением
кровеносных сосудов (телеангиэктазия) глаз и кожи,
а также различными иммунодефицитными состоя-
ниями, которые затрагивают функции популяций Т- и
В-лимфоцитов.
Атопическая аллергия, или атопия — IgE-опосредо-
ванные аллергические реакции в организме людей,
обычно имеющих генетическую предрасположенность.
Аутоиммунитет — иммунный ответ на собственные
ткани или их компоненты. Такой иммунный ответ
может иметь патологические последствия, приводящие
к аутоиммунным заболеваниям.
Аутологичный — полученный от того же организма,
собственный.
Аутотрансплантация — пересадка ткани из одной
области в другую в пределах одного организма.
Аутохтонный — принадлежащий собственному орга-
низму.
Аффинная хроматография — выделение вещества
на основании его аффинности к другому веществу,
зафиксированному на твердой основе. Например, ан-
тиген может быть выделен с помощью аффинной хро-
матографии на колонке, в которой молекулы анти-
генспецифичных антител ковалентно связаны с гра-
нулами.
Аффинность — величина константы связывания од-
ного антигенсвязывающего участка с одновалентной
антигенной детерминантой.
Базофилы — лейкоциты, содержащие гранулы, ко-
торые окрашиваются основными красителями. Счита-
ется, что они функционально сходны с тучными клет-
ками.
Бактерии инкапсулированные — бактерии с толстой
углеводной оболочкой, которая защищает их от фаго-
цитоза; могут вызывать внеклеточные инфекции. Фа-
гоциты могут эффективно поглощать и уничтожать их,
только если с поверхностью таких бактерий предвари-
тельно связываются антитела и/или компоненты ком-
племента.
Бациллы Кальметта—Герена (БЦЖ) — штаммы
Mycobacterium bovis, которые долгое время использова-
лись в качестве вакцины против туберкулеза, хотя так
и не нашли широкого применения в США.
Белки Бенс-Джонса — димеры L-цепей Ig в моче
больных множественной миеломой.
Белки острой фазы — группа белков, обнаруживае-
мых в крови после начала инфекционного процесса,
участвующих на ранних этапах зашиты организма от
инфекции.
Белок С-реактивный — обнаружен в сыворотке кро-
ви; продуцируется гепатоцитами как часть острофазо-
вого ответа. Воспаление, вызванное бактериальной
инфекцией, некрозом тканей, травмой или злокаче-
ственными опухолями, может вызывать повышение
концентрации С-реактивного белка в сыворотке в те-
чение 48 ч от начала индуцирующего состояния.
Блокирующее антитело — молекула антитела, спо-
собная блокировать взаимодействие антигена с други-
ми антителами или клетками.
Блума Синдром — заболевание, обусловленное му-
тацией фермента ДНК-геликазы, которое характери-
зуется низким содержанием Т-клеток, пониженным
уровнем антител и повышенной чувствительностью к
инфекциям дыхательных путей, онкологическим про-
цессам и радиационному повреждению.
Брадикинин — вазоактивный пептид, который про-
дуцируется при повреждении клеток и действует как
медиатор воспаления.
Вакцинация — любая защитная иммунизация про-
тив возбудителя. Изначально термин относился к им-
мунизации против натуральной оспы с помощью ме-
нее вирулентного вируса коровьей оспы (vaccinia virus)
Вариабельные области (V-области) — области им-
муноглобулина или Т-клеточного рецептора со сторо-
ны N-конца, в которые входит антигенсвязывающий
участок молекулы: V-области образуются в результате
рекомбинации генных сегментов V(D) и J
Венулы с высоким (цилиндрическим) эндотелием
(HEV) — специальные венулы, находящиеся в лимфо-
идных тканях. Лимфоциты мигрируют из кровотока в
лимфоидные ткани в результате закрепления на ци-
линдрических эндотелиальных клетках этих сосудов,
а затем и проникновения через них.
Вестерн блот — методика определения специфиче-
ского белка в смеси. Белки, разделенные электрофо-
резом в геле, осаждаются на нитроцеллюлозную мемб-
рану. Нужный белок выявляется с помощью добавле-
ния радиоактивно меченных антител, специфичных к
этому белку.
Вирион — полностью собранная вирусная частица.
Вирус — организм, состоящий из белковой оболоч-
ки и ДНК- или РНК-генома; для репликации ему не-
обходима клетка-хозяин.
Вирус иммунодефицита человека (ВИЧ) — ретрови-
рус, который инфицирует человеческие СБ4+-Т-клет-
ки и вызывает СПИД.
Возбудитель (патоген) — агент, который вызывает
заболевания.
350
СЛОВАРЬ ТЕРМИНОВ
Волдырь и гиперемия — реакция кожи, сопровож-
даемая зудом, на участке, в который пациенту с ал-
лергией был введен аллерген. Для этой реакции харак-
терны эритема (покраснение вследствие расширения
кровеносных сосудов) и отек (развившийся из-за про-
никновения сыворотки в ткани).
Воспаление — острый или хронический ответ на
повреждение ткани или инфекцию, в ходе которого
накапливаются лейкоциты, белки плазмы и жидкость.
Врожденный иммунитет — антигеннеспецифические
механизмы, участвующие в ранней фазе ответа на воз-
будитель; включает фагоцитирующие клетки, цитоки-
ны и комплемент. Эта реакция не усиливается при
повторной стимуляции возбудителем.
Вспомогательные молекулы — молекулы, не отно-
сящиеся к антигенному рецептору и главному комп-
лексу гистосовместимости. Они участвуют в актива-
ции при распознавании и выполнении эффекторной
функции Т-лимфоцитами в ходе иммунного ответа.
Гаплотип — фиксированный набор генов, представ-
ленных в одном гаплоидном геноме; термин в основ-
ном используется применительно к генам, связанным
с МНС, которые обычно наследуются как один гапло-
тип от каждого из родителей.
Гаптен — соединение обычно небольшой молеку-
лярной массы, которое само по себе не иммуногенно,
но при этом после соединения с белком-носителем или
клеткой становится иммуногенным и индуцирует син-
тез антител, которые могут связываться и с одним гап-
теном в отсутствие носителей.
Гемагглютинин — любое вещество, вызывающее аг-
глютинацию эритроцитов. Гемагглютининами в крови
человека являются антитела, которые распознают ан-
тигены групп крови АВО. Вирус гриппа и некоторые
другие вирусы обладают гемагглютининами, которые
связываются с гликопротеинами на клетках хозяина для
инициации инфекционного процесса.
Гемолитическая болезнь новорожденных (фетальный
эритробластоз) — заболевание, которое вызывается
материнскими антителами класса IgG, синтезируемы-
ми в ответ на отцовские антигены, экспрессируемые
на эритроцитах плода. Обычно мишенью такого им-
мунного ответа служит антиген групп крови Rh. Мате-
ринские антитела IgG против Rh проникают через пла-
центу и атакуют эритроциты плода
Гемопоэз — образование клеточных элементов кро-
ви, таких как эритроциты, лейкоциты и тромбоциты.
Гемопоэтическая стволовая клетка — недифферен-
цированная клетка костного мозга, которая может слу-
жить предшественницей множества клеточных линий
Эти клетки также могут находиться в желточном меш-
ке и позже в печени плода.
Генетическая иммунизация — современный способ
индукции приобретенного иммунного ответа, при ко-
тором вводится (чаше внутримышечно) плазмида ДНК,
кодирующая нужный белок. После этого белок эксп-
рессируется организмом реципиента, а к белку, коди-
руемому введенной ДНК, развивается Т-клеточный
ответ и образуются антитела.
Генная терапия — коррекция генетического дефек-
та путем введения нормального гена в клетки костного
мозга или клетки других типов Также известна как
соматическая генная терапия, поскольку не влияет на
гены половых клеток больного
Генотип — все гены, которыми обладает индивиду-
ум; на практике термин употребляется для обозначе-
ния определенных аллелей, присутствующих в конк-
ретном локусе.
Гены, активирующие рекомбинацию — см RAG-1 и
RAG-2.
Гетеродимер — молекула, состоящая из двух ком-
понентов, которые отличаются друг от друга, но тесно
связаны между собой, как, например, белок, состоя-
щий из двух отдельных цепей. Примерами могут слу-
жить Т-клеточный рецептор, состоящий или из а- и Р-,
или из у- и 8-цепей, и молекулы МНС I и II классов.
Гетерозиготный — характеристика индивидуумов,
у которых имеются два различных аллеля определен-
ного гена.
Гетерофильный антиген — перекрестно реагирующие
антигены, которые появляются у значительно отлича-
ющихся видов, таких как люди и бактерии.
Гибридома — бессмертная гибридная клетка, обра-
зующаяся в результате сплавления in vitro В-клетки.
секретирующей антитела, и миеломной клетки. Такая
клетка секретирует антитела без стимуляции и посто-
янно пролиферирует как in vivo, так и in vitro. Также
может обозначать гибридную Т-клетку, образующуюся
при сплавлении Т-лимфоцита с клеткой тимомы (зло-
качественной Т-клеткой); Т-клеточная гибридома по-
стоянно пролиферирует и секретирует цитокины при
активации антигеном или АПК.
Гийена —Барре синдром — форма идиопатической
полинейропатии, при которой аутоиммуная реакция
на миелин периферических нервов приводит к хрони-
ческой демиелинизации спинного мозга и перифери-
ческих нервов.
Гипервариабельные области — участки L- и Н-це-
пей Ig, которые сильно отличаются по аминокислот-
ной последовательности в каждой молекуле Ig Вместе
они составляют антигенсвязывающий участок молеку-
лы антитела. Фрагменты Т-клеточного рецептора, со-
ставляющие антигенсвязывающий участок (см. учас-
ток, определяющий комплементарность)
Гипергаммаглобулинемия — повышение уровней
сывороточных иммуноглобулинов. Поликлональное
увеличение содержания Ig в сыворотке происходит
при состояниях, связанных с длительной стимуля-
цией иммунной системы, таких как хроническая
инфекция, аутоиммунное заболевание или СКВ
Может быть также связано с увеличением продук-
ции моноклонального Ig, как при множественной
миеломе. Макроглобулинемия Вальденстрема и дру-
гие состояния связаны с формированием монокло-
нальных антител.
Гипериммунный — характеристика животного с вы-
соким уровнем иммунитета, который достигается по-
вторными иммунизациями для получения больших
количеств функционально эффективных антител, в срав-
нении с животными, подвергнутыми вакцинации по
СЛОВАРЬ ТЕРМИНОВ
351
стандартным протоколам, возможно, с меньшим ко-
личеством иммунизирующих процедур.
Гиперчувствительность — состояние большей реак-
тивности на антиген, чем это бывает в норме; приво-
дит скорее к разрушительным, чем защитным послед-
ствиям. Выделяют четыре типа гиперчувствительности
(I-IV).
Гиперчувствительность [ типа — немедленные ре-
акции гиперчувствительности с привлечением ответа
IgE и активацией тучных клеток.
Гиперчувствительность II типа — реакции, вызыва-
ющие разрушение клеток, опосредованное антитела-
ми (преимущественно IgG), связавшимися с антиге-
нами, ассоциированными с клетками-мишенями.
Гиперчувствительность III типа — реакции, при ко-
торых происходит повреждение тканей, обусловленное
депонированием комплексов антиген — антитело, что
приводит к активации комплемента.
Гиперчувствительность IV типа — форма клеточно-
опосредованного иммунитета, выявленная по наличию
антигена в коже. Реакция опосредуется CD4+-TH1-клет-
ками и включает высвобождение цитокинов и привле-
чение моноцитов и макрофагов. Реакция развивается
в течение нескольких часов или дней после введения
антигена.
Гиперчувствительность замедленного типа (ГЗТ) —
см. гиперчувствительность IV типа.
Гиперчувствительность немедленного типа — см.
гиперчувствительность I типа.
Гипоксантинаминоптеринтимидин — смесь, часто
добавляемая при создании селективной клеточной куль-
туры для выращивания гибридом.
Гистамин — вазоактивный амин, хранящийся в гра-
нулах тучных клеток. Он высвобождается при связы-
вании антигена с молекулами IgE на тучных клетках.
Вызывает локальное расширение кровеносных сосу-
дов и спазм гладкой мускулатуры. Высвобождение
гистамина приводит к развитию некоторых симпто-
мов реакций гиперчувствительности немедленного
типа.
Гистосовместимость — способность тканей сосуще-
ствовать вместе (буквально); в иммунологии идентич-
ность по всем трасплантационным антигенам. Такие
антигены в свою очередь обозначают термином «анти-
гены гистосовместимости».
Главный комплекс гистосовместимости (МНС) —
скопление генов, кодирующих полиморфные молеку-
лы поверхности клетки (I и II классов), которые уча-
ствуют во взаимодействиях с Т-клетками. Также игра-
ют важную роль в отторжении трансплантата. В этой
области закодированы и несколько других неполиморф-
ных белков.
Гломерулонефриты — группа заболеваний, характе-
ризующихся повреждением клубочков В большинстве
случаев за развитие первичных и во многих случаях
вторичных гломерулонефритов ответственны иммун-
ные механизмы. У пациентов обычно имеются гломе-
рулярные депозиты иммуноглобулинов, часто с ком-
понентами комплемента.
Гной — смесь клеточного мусора и мертвых нейт-
рофилов, которая присутствует в ранах и абсцессах.
инфицированных внеклеточными инкапсулированны-
ми бактериями.
«Голых» лимфоцитов синдром — иммунодефицит-
ное заболевание, развивающееся при нарушении экс-
прессии молекул МНС I и II классов.
Гомодимер — белок, состоящий из двух идентич-
ных пептидных цепей.
Гранулема — структурное образование из множе-
ства одноядерных клеток в зоне персистирующего вос-
паления. В основном ее клетками являются макрофа-
ги и небольшое количество Т-лимфоцитов на перифе-
рии. Появление гранулемы является типичной реак-
цией ГЗТ, связанной с продолжающимся присутстви-
ем инородного тела или инфекцией.
Гранулоцит — см. полиморфно-ядерный лейкоцит.
Г ранул оцитарно - макрофагальный кол ониестимул и -
рующий фактор (ГМ-КСФ) — цитокин, влияющий
на рост и дифференцировку клеток миелоидной и
моноцитарной линий. Это дендритные клетки, мо-
ноциты, тканевые макрофаги и клетки гранулоци-
тарной линии.
Грейвса болезнь — аутоиммунное заболевание, при
котором антитела к рецептору гормона, стимулиру-
ющего щитовидную железу (тиреотропного гормона),
вызывают гиперпродукцию гормонов щитовидной же-
лезы и, таким образом, гипертиреоз.
Гудпасчера синдром — аутоиммунное заболевание,
при котором продуцируются аутоантитела против ба-
зальной мембраны или коллагена IV типа, вызывающие
тяжелый прогрессирующий васкулит. Быстро приво-
дит к летальному исходу.
Гуманизация — генно-инженерная процедура встра-
ивания мышиных гипервариабельных петель желаемой
специфичности в человеческие антитела. При этом
ДНК, кодирующая гипервариабельные петли мыши-
ных моноклональных антител (V-области), отобранные
в библиотеках фаговых дисплеев, встраиваются в ре-
гионы считывания генов иммуноглобулинов человека.
Это позволяет производить антитела необходимой спе-
цифичности, не вызывающие иммунного ответа у лю-
дей в процессе лечения.
Гуморальный иммунитет — иммунный ответ с учас-
тием антител (в противоположность клеточно-опосре-
дованному иммунитету: Т-клеточные реакции в отсут-
ствие антител). Может быть передан другому лицу сы-
вороткой, содержащей антитела.
Дегрануляция — механизм, посредством которого
цитоплазматические гранулы клеток сливаются с кле-
точной мембраной, чтобы выплеснуть содержимое из
клетки. Классическим примером является дегрануля-
ция тучных клеток или базофилов в реакциях гипер-
чувствительности немедленного типа (I тип).
Дендритные клетки — интердигитальные (отростча-
тые) ретикулярные клетки костномозгового происхож-
дения, которые обнаружены в Т-клеточных зонах лим-
фоидных тканей. Они имеют разветвленную или денд-
ритную морфологию и являются наиболее мощными
стимуляторами Т-клеточных реакций. Эти клетки сти-
мулируют Т-клеточные реакции после активации и миг-
352
СЛОВАРЬ ТЕРМИНОВ
рации в лимфоидные ткани, но не проявляют такой
активности в нелимфоидных тканях.
Десенсибилизация — процедура, в процессе кото-
рой лицам с аллергией вводят нарастающие дозы ал-
лергена с целью подавления аллергических реакций
В случае успеха механизм, вероятно, затрагивает пере-
ключение ответа с CD4+-TH2- на Тн1-клетки, что при-
водит к замене продукции с антител IgE на IgG.
Детерминанта — часть молекулы антигена, которая
связывается с антигенсвязывающим участком антите-
ла или Т-клеточного рецептора; также называется эпи-
топом (см. эпитоп, гаптен).
Ди Джорджи синдром — генетическое рецессивно
наследуемое иммунодефицитное заболевание, при ко-
тором отмечается нарушение развития тимического
эпителия; ему также сопутствует отсутствие паратирео-
идных желез и аномалии крупных сосудов. Предпола-
гается, что развитие этого синдрома связано с дефек-
том развития клеток нервного гребешка.
Диапедез — движение клеток крови, особенно лей-
коцитов, из крови через стенки кровеносных сосудов в
ткани.
Дифтерийный анатоксин — иммунизирующий пре-
парат, полученный в результате инактивации форма-
лином экзотоксинов Corynebacterium diphtheriae. Исполь-
зуется для иммунизации детей против дифтерии; обыч-
но применяется в составе комбинированной вакцины
с бактериями коклюша и столбнячным анатоксином
(АКДС).
Дифференцировочный антиген — антигенная детер-
минанта на клеточной поверхности, которая обнару-
живается только на клетках определенной линии и
определенной стадии развития; используется в каче-
стве иммунологического маркера.
ДНК-вакцинация — процедура вакцинации, при
которой плазмида ДНК используется для инициации
приобретенного иммунного ответа на кодируемый ею
белок.
Домен — компактный участок цепи иммуноглобу-
лина или Т-клеточного рецептора, состоящий из ами-
нокислотных цепей, стянутых S—S-связью
Домен смерти — первоначально определялся в бел-
ках, кодируемых генами, вовлеченными в программи-
руемую гибель клеток, но в настоящее время известно,
что он принимает участие в межбелковых взаимодей-
ствиях
Дренажный лимфатический узел — любой лимфа-
тический узел, располагающийся по ходу оттока лим-
фы от места инфицирования или введения антигена,
в который попадают микробы, антигены и АПК. Час-
то увеличивается в ходе иммунного ответа, поэтому его
можно пальпировать (феномен, ранее называвшийся
«отечные железы»)
Зародышевая линия — относится к генам в поло-
вых клетках в противопоставлении к соматическим
клеткам. В иммунологии обозначает гены в их непе-
рестроенном состоянии в отличие от реаранжирован-
ных генов для продукции молекул иммуноглобули-
нов или Т-клеточных рецепторов.
Зародышевые центры — вторичные лимфоидные
структуры, которые являются зонами интенсивной
пролиферации В-клеток, их селекции, созревания и
смерти в ходе гуморального ответа После миграции
В-клеток эти структуры формируются в лимфоидные
фолликулы вокруг сети фолликулярных дендритных
клеток.
Зрелая В-клетка — В-клетка, имеющая на своей
поверхности и IgM, и IgD.
Идиотип — комплекс антигенных детерминант (идио-
топов), экспрессируемых на вариабельных областях
антител индивидуума, направленных к определенному
антигену.
Изогемагглютинины — естественно образующиеся
антитела, специфичные к антигенам эритроцитов групп
крови системы АВО. Предполагается, что они появля-
ются в результате иммунизации бактериями ЖКТ и
дыхательных путей.
Изотипы — разнообразие антител, связанное со
строением константной области тяжелой цепи (также
классы антител). Существуют IgM, IgG, IgD, IgA и IgE.
Изотип определяет разницу в биологических свойствах
антител. Его можно определить с помощью специфи-
ческих антисывороток, полученных при иммунизации
животных других видов.
Изотрансплантат — ткань, пересаженная от одной
особи другой генетически идентичной (то же, что и син-
генный трансплантат).
Изоэлектрическое фокусирование — методика вы-
деления белков. Белки движутся в электрическом поле
по градиенту pH к зоне такой кислотности, где их чи-
стый заряд становится нулевым (к их изоэлектриче-
ской точке).
Иммунитет — общий термин для обозначения ус-
тойчивости к возбудителям.
Иммунная адгезия — прикрепление корпускулярного
антигена, покрытого СЗЬ, к клеткам, экспрессиру-
ющим рецепторы к СЗЬ; приводит к усилению фаго-
цитоза бактерий макрофагами.
Иммунные комплексы — молекулы, образуемые в
результате взаимодействия растворимого (т.е. некорпус-
кулярного) антигена с молекулами антител. Крупные
иммунные комплексы выводятся быстро, в то время как
более мелкие, образуемые при избытке антигена, могут
депонироваться в тканях, приводя к их повреждению.
Иммуноген — вещество, способное индуцировать
иммунный ответ (а также реагировать с продуктами
иммунного ответа). Сравните с антигеном.
Иммуноглобулин (Ig) — общее обозначение для мо-
лекул антител всех типов: IgM, IgD, IgG, IgA, IgE; каж-
дый иммуноглобулин состоит из двух Н-цепей и двух
L-цепей и имеет два антигенсвязывающих участка.
Иммуноглобулин A (IgA) — класс иммуноглобули-
нов, имеющий Н-цепи а; антитела IgA в основном сек-
ретируются лимфоидными тканями слизистых обо-
лочек.
Иммуноглобулин D (IgD) — класс иммуноглобули-
нов, для которого характерны Н-цепи 8; этот Ig эксп-
рессируется на поверхности наивных В-клеток вместе
СЛОВАРЬ ТЕРМИНОВ
353
с IgM; может выступать в качестве корецептора, кото-
рый связывается с рецепторами для IgD, экспресси-
руемыми на Т-клетках.
Иммуноглобулин Е (IgE) — класс иммуноглобули-
нов, для которого характерны Н-цепи г; этот Ig уча-
ствует в аллергических реакциях.
Иммуноглобулин G (IgG) — класс иммуноглобули-
нов, для которого характерны Н-цепи у; это наиболее
часто встречающийся в плазме класс 1g.
Иммуноглобулин М (IgM) — класс иммуноглобули-
нов, для которого характерны Н-цепи ц; этот Ig пер-
вым появляется на поверхности В-клеток и первым
секретируется после стимуляции В-клеток антигеном.
Иммуноглобулин a (Iga) — см. В-клеточный ре-
цептор.
Иммуноглобулин р (IgP) — см. В-клеточный ре-
цептор.
Иммуноглобулинов суперсемейство — белки, участву-
ющие в клеточном распознавании и взаимодействии,
которые структурно и генетически связаны с иммуно-
глобулинами.
Иммунодефицит — снижение иммунного ответа,
развивающееся в результате отсутствия или дефекта
какого-либо компонента иммунной системы.
Иммунодиффузия — идентификация антигена или
антитела с помощью формирования комплексов анти-
ген-антитело в геле.
Иммуномодуляторы — вещества, контролирующие
выраженность иммунного ответа.
Иммунорецепторный тирозинсодержащий активаци-
онный мотив (ITAM) — последовательность аминокис-
лот в цитоплазматическом конце многих молекул транс-
мембранных рецепторов, в том числе Iga, IgP и CD3-
цепи, которые фосфорилируются и затем связываются
с внутриклеточными молекулами, что является ранним
звеном клеточной активации.
Иммунорецепторный тирозинсодержащий ингибиру-
ющий мотив (ITIM) — последовательность с действи-
ем, противоположным иммунорецепторному тирозин-
содержащему активационному мотиву. Эти последо-
вательности привлекают к рецепторной области фос-
фатазы, которые удаляют фосфатные группы, присое-
диненные тирозиновыми киназами.
Иммунотоксины — антитела, которые химически
связаны с токсическими белками, обычно получаемы-
ми из растений или микроорганизмов. Эти вещества
тестировались в качестве противоопухолевых препара-
тов и как препараты-иммуносупрессоры.
Ингибирующий рецептор клеток-киллеров (KIR) —
рецептор, экспрессируемый на натуральных киллер-
ных клетках, который связывается с молекулами МНС
I класса на клетках-мишенях. Связывание МНС I класса
угнетает передачу сигнала, который в противном слу-
чае приводит к уничтожению клетки-мишени.
Индуцибельная NO-синтаза — вырабатывается мак-
рофагами и многими другими типами клеток. Многие
стимулы запускают активацию NO-синтазы, которая
играет важную роль в устойчивости организма-хозяи-
на к внутриклеточной инфекции.
Интегрины — семейство двухцепочечных адгезион-
ных молекул клеточной поверхности, присутствующих
на лейкоцитах Необходимы для адгезии АПК к лим-
фоцитам, а также для миграции лейкоцитов в ткани
Интердигитальные дендритные клетки — тимусные
клетки, развивающиеся в костном мозге; играют ос-
новную роль в отрицательной селекции развивающих-
ся тимоцитов.
Интерлейкины (IL) — гликопротеины, которые сек-
ретируются различными лейкоцитами; воздействуют на
другие лейкоциты.
Интерфероны (IFN) — группа белков, обладающих
противовирусной активностью и способных усиливать
и модифицировать иммунный ответ.
Интрон — сегмент ДНК, не кодирующий белок;
промежуточная последовательность нуклеотидов меж-
ду кодирующими белок последовательностями, или
экзонами.
Кальнексин — белок эндоплазматического ретику-
лума, который связывает частично собранные белки
иммуноглобулинового суперсемейства и возвращает их в
эндоплазматический ретикулум для завершения сборки.
Кальретикулин — молекулярный шаперон, который
изначально связывается с молекулами МНС I и II клас-
сов и другими белками, содержащими иммуноглобу-
линоподобные домены (например, Т- и В-клеточные
рецепторы).
Кальциневрин — представленная в цитозоле серин-
треониновая фосфатаза, которая играет ключевую роль
в переносе сигнала от Т-клеточного рецептора. Имму-
носупрессивные препараты циклоспорин А и такроли-
мус (FK-506) формируют с клеточными белками (на-
званными иммунофилинами) комплексы, инактивиру-
ющие кальциневрин, подавляя таким образом Т-кле-
точный ответ
Каспазы — семейство близкородственных цистеи-
новых протеаз, важных участников апоптоза, которые
«разрезают» белки в месте, где расположен аминокис-
лотый остаток аспартат.
Классический путь активации комплемента — меха-
низм активации комплемента, инициируемый комп-
лексами антиген — антитело и приводящий к актива-
ции компонентов от С1 до С9.
Кластер дифференцировки (CD) — антигенный кла-
стер, с которыми взаимодействуют антитела, характе-
ризующие молекулы клеточной поверхности
Клеточная смерть, вызванная активацией — смерть
путем апоптоза активированных В- и Т-клеток по окон-
чании иммунного ответа, когда антиген уже удален из
организма.
Клеточно-опосредованная цитотоксичность — разру-
шение (лизис) клеток-мишеней эффекторными лим-
фоцитами.
Клеточно-опосредованный иммунитет — иммунные
реакции, опосредованные Т-клетками (в отличие от
гуморального иммунитета, который опосредуется ан-
тителами). Известен также как гиперчувствительность
замедленного типа.
Клональная анергия — взаимодействие В- или Т-
лимфопита с антигеном, ведущее к функциональной
инактивации лимфоцита. Может развиться, если лим-
354
СЛОВАРЬ ТЕРМИНОВ
фоцит взаимодействует с антигеном в отсутствие вто-
рого сигнала, обычно необходимого для клеточной ак-
тивации.
Клональная деления — потеря лимфоцитов опреде-
ленной специфичности после их контакта с антигеном
Клонально-селекционная теория — преобладающая
концепция, утверждающая, что специфичность и раз-
нообразие иммунного ответа являются результатом
антигенной селекции специфичных реагирующих кло-
нов из большого репертуара предсуществующих лим-
фоцитов, каждый из которых имеет индивидуальную
специфичность.
Кожный лимфоцитарный антиген — молекула кле-
точной поверхности, которая у людей определяет хо-
минг лимфоцитов в кожу.
Колониеобразующая единица (КОЕ) — гемопоэти-
ческая стволовая клетка и поколение клеток, произо-
шедших от нее. Считается, что зрелые клетки крови
развиваются из одной КОЕ.
Колониестимулирующий фактор (КСФ) — глико-
протеины, которые регулируют образование, диффе-
ренцировку и функции гемопоэтических клеток-пред-
шественников. Они вызывают рост, созревание и диф-
ференцировку стволовых клеток с продукцией клеточ-
ных колоний in vitro.
Кольцевая вакцинация — стратегия общественного
здравоохранения по иммунизации определенной груп-
пы людей (обычно в пределах относительно неболь-
шой географической территории), которые уже были
или могут подвергнуться воздействию инфекционных
микроорганизмов, несущих угрозу общественному здо-
ровью, таких как биологическое оружие.
Комбинаторное соединение — присоединение сегмен-
тов ДНК с образованием исходно новой генетической
информации, как это происходит с генами 1g и Т-кле-
точного рецептора в процессе развития В- и Т-клеток.
Это позволяет огромному количеству генных участков
комбинироваться в различных сочетаниях.
Комплемент — совокупность сывороточных и свя-
занных с клеткой белков, вовлеченных в эффекторное
звено иммунного ответа против возбудителей. Комп-
лемент может быть активирован как комплексами ан-
тиген-антитело (классический путь), так и компо-
нентами системы комплемента, связывающимися
непосредственно с чужеродной субстанцией (альтер-
нативный и лектиновый пути активации).
Конверсия соматических генов — нереципрокный
обмен последовательностями между генами: часть до-
норского гена или генов копируется на акцепторный
ген, но изменяется только акцепторный ген. Это меха-
низм образования широкого репертуара 1g у различ-
ных видов.
Конвертаза — фермент, компонент каскада актива-
ции комплемента, который превращает неактивную
форму следующего компонента каскада в активную
форму, расщепляя его на части.
Конгенный (также коизогенный) — описание двух
организмов, отличающихся только генами в опреде-
ленном локусе и идентичным по всем другим локусам.
Конканавалин А (Кон А) — растительный лектин из
растения семейства бобовых (Canavalia ensiformis), кото-
рый индуцирует агглютинацию эритроцитов и стимули-
рует стадию митоза и пролиферацию Т-лимфоцитов.
Константная область (С-область) — невариабельный
терминальный участок молекулы иммуноглобулина или
Т-клеточного рецептора, содержащий карбоксильную
группу, в отличие от вариабельной области, имеющей
аминогруппу на конце цепи.
Контактная гиперчувствительность — форма гиперчув-
ствительности замедленного типа, при которой Т-клет-
ки отвечают на антигены, попавшие в организм при
контакте с кожей. Примером является гиперчувствитель-
ность в ответ на ядовитый плющ, вызванная Т-клеточ-
ным ответом на химический антиген пентадекакатехол,
содержащийся в масле на листьях.
Контактный дерматит — реакция гиперчувстви-
тельности замедленного типа (IV тип), опосредован-
ная Т-лимфоцитами, которая развивается в ответ на
аллерген, помещенный на кожу.
Конформационные эпитопы — прерывистые эпито-
пы белкового антигена, которые формируются из не-
скольких отдельных участков первичных белковых по-
следовательностей, когда они сближаются при сборке
белка. Антитела, связывающие конформационные эпи-
топы, связывают только нативные белки, сохраняющие
конформацию.
Корецептор — белок клеточной поверхности, ко-
торый увеличивает чувствительность рецептора к ан-
тигену путем связывания с сопутствующими лиган-
дами и за счет участия в формировании сигнала акти-
вации.
Кортикостероиды — стероидные гормоны обладают
лимфолитическим действием и вырабатываются в коре
надпочечников. Глюкокортикостероиды (например,
преднизолон и дексаметазон) могут уменьшать размер
и содержание лимфоцитов в лимфатических узлах и
селезенке параллельно с незначительной пролифера-
цией миелоидных или эритроидных стволовых клеток
костного мозга.
Костимуляторные молекулы — связанные с мембра-
ной или секретируемые продукты акцессорных клеток,
которые активируют процессы после трансдукции сиг-
нала дополнительно к процессам, индуцирующимся
при взаимодействии молекул МНС с Т-клеточным ре-
цептором. Они необходимы для полной активации
Т-лимфоцитов.
Костный мозг — орган гемопоэза, в котором из ство-
ловых клеток развиваются клеточные компоненты кро-
ви: эритроциты, моноциты, полиморфноядерные лей-
коциты, тромбоциты и лимфоциты.
Кромогликат натрия — лекарственный препарат,
который блокирует высвобождение фармакологических
медиаторов из тучных клеток и уменьшает симптомы
и реакции гиперчувствительности I типа (т. е. анафилак-
сии). опосредованные иммуноглобулинами класса Е
Ксеногенный — относящийся к чужому виду.
Ксенотрансплантация — пересадка ткани между орга-
низмами, относящимся к двум различным видам.
Кумбса тест — тест, названный по имени исследо-
вателя, впервые его применившего. Используется для
определения антител путем добавления антииммуно-
глобул и новых антител.
СЛОВАРЬ ТЕРМИНОВ
355
Лайма болезнь — хроническая инфекция Borreha
burgdofrii, спирохетой, которая может избегать иммун-
ного ответа.
Лангерганса клетки — клетки из семейства моноци-
тов/дендритных клеток, которые захватывают и обра-
батывают антигены в эпидермальном слое кожи. По
лимфатическим сосудам мигрируют в лимфатические
узлы, дренирующие место воздействия антигена, и диф-
ференцируют в зрелые дендритные клетки
Легкая цепь (L-цепь) — меньшая цепь в молекуле
иммуноглобулина; бывает двух типов: к и X.
Лейкоз — неконтролируемая пролиферация злока-
чественного лимфоцита.
Лейкоциты — белые кровяные клетки; включают
моноциты/макрофаги, лимфоциты и полиморфно-
ядерные клетки.
Лиганд — молекула или часть молекулы, которая
связывается с рецептором.
Лигирование — связывание с рецептором молекулы
(лиганда) или ее части.
Лимфа — внеклеточная жидкость, омывающая тка-
ни. Содержит тканевые продукты, антигены, антитела
и клетки (преимущественно лимфоциты).
Лимфатическая система — структурно организован-
ная система сосудов, по которым перемещается лим-
фа; на пересечениях этих сосудов располагаются лим-
фатические узлы. В основном выполняет три функ-
ции: концентрирует антигены со всех частей тела в
нескольких лимфоидных органах; обеспечивает цир-
куляцию лимфоцитов через лимфоидные органы, что-
бы эти антигены могли взаимодействовать с единич-
ными антигенспецифичными клетками; распространяет
продукты иммунного ответа (антитела и эффекторные
клетки) по циркуляции и в ткани.
Лимфатические узлы — вторичные лимфоидные
органы, в которых зрелые Т- и В-лимфоциты отвеча-
ют на свободные антигены и антигены, представляе-
мые АПК. Эти антигены попадают в лимфатические
узлы по лимфатическим сосудам.
Лимфобласт — лимфоцит, который увеличился в
размере из-за повышенной интенсивности синтеза
РНК и белков.
Лимфоидная ткань, ассоциированная с бронхами
(BALT) — вторичный лимфоидный орган, связанный
с бронхиальным деревом.
Лимфоидная ткань, ассоциированная с кишечником
(GALT) — лимфоидная ткань, расположенная в сли-
зистой оболочке и подслизистом пространстве ЖКТ,
которая составляет иммунную систему пищеваритель-
ного тракта. Представлена пейеровыми бляшками, ап-
пендиксом и миндалинами.
Лимфоидная ткань, ассоциированная со слизистыми
оболочками (MALT) — система, объединяющая лим-
фоидные структуры, встречающиеся в ЖКТ и дыха-
тельных путях, включает миндалины, аппендикс и пей-
еровы бляшки тонкой кишки.
Лимфоидные органы вторичные — органы, в кото-
рых зрелые В- и Т- лимфоциты пролиферируют и диф-
ференцируют после распознавания антигена.
Лимфоидные органы первичные — органы, в кото-
рых происходят ранние стадии дифференцировки Т-
и В-лимфоцитов и впервые экспрессируются антиген-
специфичные рецепторы.
Лимфокин — цитокин, секретируемый лимфоцитами.
Лимфокинактивируемые киллерные клетки (ЛАК) —
гетерогенная популяция лимфоцитов, в которую вхо-
дят натуральные киллерные клетки. Эти клетки полу-
чаются при активации лимфоцитов периферической
крови онкологических больных цитокинами in vitro
Лимфома — лимфоцитарная опухоль, локализован-
ная в лимфоидных или других тканях; обычно лим-
фом ные клетки в циркуляции не встречаются.
Лимфоцит, инфильтрирующий опухоль (ЛИО) —
мононуклеарная клетка, полученная из воспалитель-
ного инфильтрата солидных опухолей.
Лимфоцит — экспрессирует антигенспецифичные
рецепторы. Малые лимфоциты практически не имеют
цитоплазмы; встречаются в крови, тканях и лимфоид-
ных органах, таких как лимфатические узлы, селезен-
ка и пейеровы бляшки. Отвечают за специфичность,
разнообразие, иммунологическую память и разграни-
чение собственных и несобственных клеток.
Линия — группа животных (особенно мыши и кры-
сы), внутри которой все животные являются генети-
чески идентичными.
Липополисахариды (ЛПС) — компоненты клеточ-
ной стенки грамотрицательных бактерий; также изве-
стны как эндотоксины.
Макрофаг — крупная фагоцитирующая клетка, обна-
руживаемая в тканях; происходит из моноцитов крови
Медленно реагирующая субстанция анафилаксии —
группа лейкотриенов, высвобождаемых тучными клет-
ками при анафилактических реакциях Они вызывают
длительный спазм гладкой мускулатуры.
Мембраноатакующий комплекс (МАК) — последние
компоненты каскада комплемента (С7—С9), которые
образуют пору на поверхности клетки-мишени, что
приводит к повреждению клетки или ее смерти.
Миастения злокачественная — аутоиммунное забо-
левание, при котором антитела, специфичные к ре-
цептору ацетилхолина, экспрессируемому в мышцах,
блокируют функции нейромышечного синапса.
Миелома — опухоль из плазматических клеток,
обычно секретирующая один моноклональный имму-
ноглобулин.
Минорные антигены гистосовместимости — антиге-
ны, которые кодируются вне области МНС, но также
стимулируют отторжение трансплантата, хотя и не так
быстро, как молекулы МНС.
Митоген — вещество, которое стимулирует проли-
ферацию множества различных клонов лимфоцитов.
Митоген лаконоса (поквид) — митоген, который
поликлонально активирует Т- и В-лимфоциты.
Мишень — клетка, уничтожаемая одной из кил-
лерных клеток организма, например цитотоксическим
Т-лимфоцитом или натуральным киллером.
Молекулы адгезии клеточной поверхности (САМ) —
см. адгезионные молекулы.
Молекулы адгезии эндотелиальных клеток (ЕСАМ) —
см. адгезионные молекулы.
356
СЛОВАРЬ ТЕРМИНОВ
Молекулы межклеточной адгезии 1, 2, 3 (ICAM) —
адгезионные молекулы на поверхности клеток некото-
рых типов, в том числе антигенпрезентирующих клет-
ках и Т-клетках; взаимодействуют с интегринами; от-
носятся к суперсемейству иммуноглобулинов.
Молекулы DP, DQ и DR — молекулы МНС II класса
человека, которые постоянно экспрессируются В-клет-
ками и антигенпрезентирующими клетками.
Молекулярная мимикрия — идентичность или сход-
ство эпитопов, как экспрессируемых возбудителем, так
и присутствующих на собственных молекулах; благо-
даря ей можно объяснить, как развиваются аутоиммун-
ные реакции.
Моноклональный — образованный одним клоном;
потомством одной клетки. Обычно термин описывает
популяцию Т-клеток, В-клеток или антитела, которые
являются гомогенными и реагируют с одинаковой спе-
цифичностью с каким-нибудь одним эпитопом.
Моноцит — фагоцитирующий лейкоцит, обнаружи-
ваемый в крови; предшественник тканевого макрофага.
Мотив (последовательность) — набор аминокислот
в общей последовательности молекулы, принципиаль-
но важный для связывания лиганда.
Муцины — высокогликозилированные белки кле-
точной поверхности. Молекулы, похожие на муцины,
связываются L-селектином в лимфоидных органах.
Наивные лимфоциты — лимфоциты, которые еще не
встречались со специфичными антигенами и в силу этого
никогда на них не отвечали. В центральных лимфоид-
ных органах обитают только наивные лимфоциты.
Натуральные киллеры (NK-клетки) — крупные гра-
нулярные лимфоцитоподобные клетки. In vitro унич-
тожают различные опухолевые клетки и могут иметь
значение для противоопухолевой устойчивости в орга-
низме; участвуют также в реакциях антителозависи-
мой клеточно-опосредованной цитотоксичности.
Негативная селекция — стадия развития В- и Т-
клеток, на которой функционально инактивируются
клетки, способные реагировать с собственными мо-
лекулами.
Незрелая В-клетка — клетка В-клеточной линии,
обладающая IgM, но не обладающая IgD; легко разви-
вает толерантность при воздействии антигена.
Нейтрализация — способность антител блокировать
или угнетать действие вируса.
Нейтропения — ситуация, при которой снижается
количество нейтрофилов в крови по сравнению с нор-
мой.
«Нокаутные» (выбитые) гены — гены, заблокиро-
ванные в процессе разрушения гомологичной реком-
бинации.
Носитель — крупная иммуногенная молекула или
частица, к которой может присоединяться гаптен или
неиммуногенная молекула, обладающая эпитопом, что
делает их иммуногенными.
Область переключения — участок ДНК тяжелой цепи
иммуноглобулина, на котором происходит рекомби-
нация VDJ-сегмента после стимуляции антигеном;
обеспечивает переключение изотипов (например, с IgM
на IgE).
Обратная транскриптаза — фермент, который транс-
крибирует РНК-геном ретровируса в ДНК. Использу-
ется в молекулярной биологии для превращения РНК
в комплементарную ДНК.
Общая вариабельная иммунная недостаточность
(ОВИН) — неспособность В-клеток созревать до кле-
ток, продуцирующих антитела Для всех пациентов с
этим синдромом характерна гипогам магл обул инемия,
обычно затрагивающая все классы иммуноглобулинов,
но в некоторых случаях в процесс вовлекаются толь-
ко иммуноглобулины класса G. Этот относительно
часто встречающийся врожденный или приобретен-
ный иммунодефицит может иметь как семейную пред-
расположенность, так и быть спорадическим. Среди
семейных форм выделяют различные типы наследо-
вания.
Общие лимфоидные предшественники — стволовые
клетки, которые дают начало всем лимфоцитам.
Общий лейкоцитарный антиген (CD45) — антиген,
экспрессируемый и Т-, и В-лимфоцитами
Онкогены — гены, участвующие в регулировании
клеточного роста. При дефекте в их структуре или эк-
спрессии могут вызывать непрерывный рост клеток с
образованием опухоли.
Опсонизация — покрытие частицы, такой как бак-
терия, антителами и/или компонентом комплемента
(опсонином), что приводит к усилению фагоцитоза этой
частицы фагоцитирующими клетками.
Опухольспецифичный трансплантационный антиген
(ОСТА) — антиген, который экспрессируется только
некоторыми опухолевыми клетками.
Оспа — инфекционное заболевание, вызываемое
вирусом оспы variola.
Оспа коровья — общее название заболевания ко-
ров, вызванного вирусом коровьей оспы, который ус-
пешно использовал Э.Дженнер для вакцинации про-
тив оспы.
Острофазовый ответ — высвобождение белков ос-
трой фазы, например С-реактивного белка, в крово-
ток в течение нескольких часов после воздействия ин-
фекционного агента. Белки острой фазы участвуют в
ранней фазе ответа организма. Острофазовый ответ
может быть ассоциирован с воспалением, поврежде-
нием тканей и в некоторых случаях с новообразова-
ниями.
Отсутствие ответа — неспособность отвечать на
антигенную стимуляцию; может быть специфичной к
определенному антигену (см. толерантность) или об-
щей, неспецифичной, как результат повреждения им-
мунной системы в целом, например после облучения
организма.
Отторжение трансплантата вторичное — ускоренное
отторжение аллотрансплантата у сенсибилизированных
реципиентов.
Отторжение трансплантата сверхострое — быстрая
реакция, вызываемая естественными предсушеству-
ющими антителами, которые направлены к антигенам
ткани аллогенного трансплантата. Антитела связыва-
СЛОВАРЬ ТЕРМИНОВ
357
ются с эндотелием и запускают каскад гемокоагуля-
ции, приводя к тромбозу сосудов и ишемии трансплан-
тата с быстрой потерей органа.
Память — в иммунной системе обозначает, что по-
вторное взаимодействие с антигеном приводит к более
эффективному и быстрому ответу, чем первое (пер-
вичная реакция).
Паракортикальная область — Т-клеточная область
лимфатического узла.
Пассивная гемагглютинация — методика определе-
ния количества антител; покрытые антигенами эри-
троциты агглютинируют при смешивании с антитела-
ми, специфичными для этого антигена.
Пассивная иммунизация — иммунизация организма
путем передачи антител, синтезированных другим орга-
низмом.
Пассивная кожная анафилаксия — пассивная пере-
дача анафилактической чувствительности путем внут-
рикожного введения сыворотки сенситизированного
донора.
Пейеровы бляшки — скопления лимфоцитов, при-
сутствующие в оболочке тонкой кишки.
Пептид инвариантной цепи, связанный с молекула-
ми II класса (CLIP) — пептид переменной длины, от-
щепляемый с помощью протеаз от инвариантной цепи
Остается связанным с молекулами МНС II класса в
нестабильном состоянии до тех пор. пока не удаляется
белком HLA-DM.
Пептидные агонисты — пептидные антигены, кото-
рые активируют специфичные к ним Т-клетки, инду-
цируя их к синтезу цитокинов и пролиферации.
Первичный ответ — иммунный ответ, развивающий-
ся в результате первой встречи с антигеном; обычно
слабый, с длинной фазой индукции или лаг-периодом;
формирует иммунологическую память. При первичном
ответе В-клетки в основном синтезируют IgM.
Первичный фолликул — область вторичного лим-
фоидного органа, содержащая преимущественно не-
стимулированные В-лимфоциты; развивается в заро-
дышевый центр после антигенной стимуляции
Передатчики сигнала и активаторы транскрипции
(STAT) — внутриклеточные белки, фосфорилируемые
Янус-киназами после взаимодействия цитокина с ци-
токиновым рецептором.
Переключение изотипа — переключение, которое
происходит, когда В-клетка перестает выделять анти-
тела одного изотипа или класса и начинает вырабаты-
вать антитела другого изотипа, но с той же антигенной
специфичностью. В ходе этого переключения реаран-
жированный комплексный ген V(D)J соединяется с
другим геном константной области Н-цепи.
Переключение класса — см. переключение изотипа.
Перекрестное реагирование — способность антител,
специфичных к одному антигену, взаимодействовать с
другим антигеном; определяется мерой сродства меж-
ду двумя разными антигенными субстанциями.
Периартериолярное лимфоидное скопление — часть
внутренней области белой пульпы селезенки, в основ-
ном содержащая Т-клетки.
Периферическая толерантность — толерантность,
индуцированная у зрелых лимфоцитов за пределами
тимуса
Периферические лимфоидные органы — лимфоид-
ные органы за исключением тимуса; включают селе-
зенку, лимфатические узлы и лимфоидную ткань, ас-
социированную со слизистыми оболочками.
Перфорин — молекула, синтезируемая цитотокси-
ческими Т-клетками и натуральными киллерами. Эта
молекула полимеризуется на поверхности клетки-ми-
шени и образует пору в мембране, что приводит к смер-
ти клетки-мишени.
Пиноцитоз — втягивание жидкости или очень ма-
лых частичек внутрь клетки путем формирования пу-
зырьков
Пиогенный — обозначает образование гноя в зонах
ответа на крупные инкапсулированные бактерии.
Пироген — вещество, вызывающее лихорадку
Плазма — жидкий компонент несвернувшейся
крови
Плазматическая клетка — конечная, стадия диффе-
ренцировки В-клетки; клетка, продуцирующая анти-
тела.
Позитивная селекция — процесс в первичных лим-
фоидных органах, в результате которого развивающи-
еся В- и Т-клетки получают сигналы, разрешающие
продолжение дифференцировки; при отсутствии таких
сигналов клетки умирают.
Поли-Ig-peuenTop — связывается с IgA на базаль-
ной поверхности эпителиальной клетки, транспорти-
рует его через клетку и высвобождает на апикальной
поверхности в просвет (кишки, бронха или различных
протоков). Секретированный IgA участвует в защите
слизистой оболочки.
Поликлональный активатор — вещество, которое
индуцирует активацию многих различных клонов или
Т-, или В-клеток. См. митоген.
Полимеразная цепная реакция (ПЦР) — образова-
ние больших количеств ДНК на основе последователь-
ности нуклеотидов в течение повторных циклов син-
теза.
Полиморфизм — буквально — имеющий множество
форм. В генетике — существование многих аллелей в
определенном генетическом локусе, что приводит к
наличию вариантов гена и его продукта у разных пред-
ставителей одного вида.
Полиморфно-ядерный лейкоцит (ПМЯ) — лейкоци-
ты, содержащие цитоплазматические гранулы и обла-
дающие характерным ядром из нескольких сегментов;
выделяют три основных типа: нейтрофилы, эозинофи-
лы и базофилы
Полный адъювант Фрейнда (ПАФ) — масло, в ко-
тором содержатся убитые микобактерии Когда вво-
дят эмульсию, содержащую это масло и водный рас-
твор, иммунный ответ на данный иммуноген усили-
вается. Под термином «неполный адъювант Фрейн-
да» понимают ту же эмульсию, но без добавления ми-
кобактерий.
Популяционный иммунитет — неспецифический и
специфический иммунитет, который может играть зна-
чительную роль в устойчивости группы (популяции)
358
СЛОВАРЬ ТЕРМИНОВ
людей или животных к определенной инфекции. Также
термин обозначает, что эпидемия не будет распрост-
раняться, если заразится один из членов популяции,
поскольку он обеспечит остальных иммунитетом к это-
му конкретному инфекционному агенту.
Пре-В-клетка — клетка В-клеточного ряда, у кото-
рой уже реаранжированы гены тяжелых цепей, а лег-
ких еще нет. На своей поверхности экспрессирует сур-
рогатные легкие цепи и тяжелую ц-цепь, соединенную
с молекулами передачи сигнала Iga и Igp; все вместе
эти молекулы составляют пре-В-клеточный рецептор.
Пре-В-клеточный рецептор (npe-BCR) — комплекс
по меньшей мере из пяти белков, которые, экспресси-
руясь на пре-В-клетках, заставляют их входить в кле-
точный цикл и выключать гены RAG. По завершении
этого процесса пре-В-клетки готовы к реаранжировке
своих легких цепей.
Пре-Т-клетка — стадия дифференцировки Т-лим-
фоцита в тимусе, на которой p-гены Т-клеточного ре-
цептора уже реаранжированы и на поверхности эксп-
рессируется полипептид Т-клеточного рецептора вме-
сте с молекулой npe-Ta (gp33). Эти молекулы в комп-
лексе с CD3 и £ образуют пре-Т-клеточный рецептор.
Пре-Т-клеточный рецептор (npe-TCR) — набор мо-
лекул, экспрессируемых на поверхности пре-Т-клет-
ки, состоящий из р-пепи TCR и пре-Та, связанных с
CD3 и
Преднизолон — синтетический стероид с выражен-
ным противовоспалительным и иммуносупрессивным
действием, используемый при лечении острого оттор-
жения трасплантата, аутоиммунных заболеваний и лим-
фоидных опухолей.
Презентирование антигена — представление анти-
гена в виде пептидных фрагментов, связанных с моле-
кулами МНС на поверхности клеток; Т-клетки рас-
познают антиген только в том случае, если он пред-
ставлен таким образом.
Преобразование сигнала — процесс переноса сиг-
нала, полученного на внешней поверхности клетки
(например, при связывании антигена со своим рецеп-
тором), в ее ядро, что приводит к изменению экспрес-
сии генов.
Преципитации реакция — смешивание растворимо-
го антигена и антител в различных пропорциях, кото-
рое может привести к преципитации нерастворимых
комплексов антиген — антитело.
Примирование — активация наивных лимфоцитов
при контакте с антигеном.
Приобретенный иммунный ответ — ответ анти ген-
специфичных лимфоцитов на антигены, включая раз-
витие иммунологической памяти; также известен как
адаптационный иммунный ответ
Провирус — ДНК-форма ретровируса, интегриро-
ванная в клеточную ДНК.
Про-В-клетка — самая ранняя стадия дифферен-
цировки В-клетки, на которой D-сегмент гена тяже-
лой цепи реаранжируется с J-сегментом гена.
Программируемая клеточная смерть — см. апоптоз.
Пропердин (фактор Р) — положительный регулятор
альтернативного пути активации комплемента; стаби-
лизирует СЗЬВЬ
Простагландины — липидные продукты метаболиз-
ма арахидоновой кислоты, которые, как и лейкотрие-
ны, обладают множеством эффектов (например, меди-
аторов воспаления) в разных тканях.
Протеазома — цитоплазматический комплекс из
нескольких белков, который катаболизирует белки до
пептидов.
Протеин А — мембранный белок Staphylococcus aureus,
который связывается с Fc-фрагментом [gG и, как пред-
полагают, защищает бактерию от антител IgG, угнетая
их взаимодействие с комплементом и Fc-рецепторами.
Используется в технологиях очистки IgG.
Протеинкиназа С — фермент, активируемый каль-
цием и диацил глицеролом при активации Т- и В-лим-
фоцитов.
Протоонкогены — клеточные гены, регулирующие
пролиферацию; мутация или нарушение экспрессии
этих генов может привести к злокачественной транс-
формации клетки.
Профилактика — предупреждение заболевания.
Процессинг антигена — разрушение белка до пеп-
тидов, которые могут связываться с молекулами МНС
для презентации Т-клеткам.
Псевдоген — последовательность ДНК, сходная с
геном, но содержащая кодоны, не допускающие обра-
зования РНК-транскрипта полной длины.
Радиоаллергосорбентный тест (РАСТ) — твердофаз-
ное радиоиммуноисследование для обнаружения ан-
тител IgE, специфичных к определенному аллергену
Радиоиммунологическое исследование (RIA) — ме-
тодика измерения количества биологического веще-
ства в образце путем определения связывания анти-
гена с радиоактивно меченными антителами (или на-
оборот)
Раковоэмбриональный антиген (РЭА) — эпитоп мем-
бранного гликопротеина, который в норме представ-
лен на клетках желудочно-кишечного тракта в орга-
низме плода. Уровни РЭА повышены почти у трети
больных колоректальным раком, раком печени, под-
желудочной железы, легких, молочной железы, головы
и шеи, шейки матки, щитовидной железы и предста-
тельной железы.
Рапамицин — иммуносупрессивный агент, исполь-
зуемый для предотвращения отторжения транспланта-
та; блокирует продукцию цитокинов.
Рассеянный склероз — заболевание ЦНС, предпо-
ложительно аутоиммунной природы, при котором вос-
палительный ответ приводит к демиелинизации и по-
тере неврологических функций.
Реакция «трансплантат против хозяина» (РТПХ) —
патологическое следствие ответа, обычно запускаемо-
го иммунокомпетентными донорскими Т-лимфоцита-
ми в организме аллогенного иммунологически неком-
петентного реципиента. Организм реципиента не спо-
собен отторгнуть пересаженные Т-клетки и становиться
мишенью их действия.
Ревматическая лихорадка — вызывается антитела-
ми, образованными в ответ на инфицирование неко-
торыми видами Streptococcus Некоторые из этих анти-
СЛОВАРЬ ТЕРМИНОВ
359
тел перекрестно реагируют с антигенами почек, сус-
тавов и сердца.
Ревматоидный артрит — аутоиммунное воспалитель-
ное заболевание суставов.
Ревматоидный фактор — аутоантитела (обычно IgM),
которые взаимодействуют с IgG собственного организ-
ма; присутствует у пациентов с ревматоидным артритом.
Редактирование рецептора — процесс, при котором
реаранжированные гены в клетке В-клеточной линии
могут подвергаться вторичной реаранжировке, что при-
водит к изменению антигенной специфичности.
Рекомбинация — см. У(О)1-рекомбинация.
Репертуар — полный список антигенных специфич-
ностей, образуемый или В- или Т-лимфоцитами в от-
вет на чужеродный антиген.
Ретикулоэндотелиальная система (РЭС) — общее
название для сети фагоцитирующих клеток
Рецептор — обычно это трансмембранная молеку-
ла, связывающаяся с лигандом на внешней поверхно-
сти клетки, что приводит к биохимическим изменени-
ям внутри клетки.
Рецепторы комплемента (CR) — белки клеточной
поверхности на различных клетках, которые распозна-
ют и связывают белки системы комплемента, связав-
шие патогенные микроорганизмы или другие антиге-
ны. Рецепторы комплемента, расположенные на фаго-
цитах. позволяют им идентифицировать патогенные
микроорганизмы, покрытые белками системы комп-
лемента, что используется для дальнейшего захвата и
деструкции микроорганизмов. Например, CR1 (явля-
ется рецептором для Clq), CR2, CR3 и CR4.
Рид — Штернберга клетки — крупные злокачествен-
ные В-клетки, найденные у пациентов с болезнью Ходж-
кина.
Секреторный компонент — отщепленный компонент
поли-Ig-рецептора, который прикрепляется к димер-
ному IgA и защищает его от протеолитического рас-
щепления в процессе транспортировки через эпители-
альную клетку.
Селезенка — самый крупный из вторичных лимфо-
идных органов; захватывает и концентрирует чужерод-
ные субстанции, принесенные с кровью. Состоит из бе-
лой (богатой лимфатическими клетками) и красной
пульпы (содержащей много эритроцитов и макрофагов).
Селектины — семейство адгезионных молекул кле-
точной поверхности, присутствующих на лейкоцитах
и эндотелиальных клетках; связываются с сахарами в
структуре гликопротеинов.
Сенсибилизация — первичная иммунизация антиге-
ном; обычно возникает при первой встрече с аллергеном.
Сепсис — генерализованная инфекция
Серология — использование антител для определе-
ния антигенов.
Сингенный — буквально — генетически идентич-
ный, например гомозиготные близнецы или мыши
одной линии.
Сингенный трансплантат — см. изотрансплантат.
Система групп крови АВО — основана на антигенах,
экспрессируемых на эритроцитах, которые использу-
ются для типирования человеческой крови при гемо-
трансфузиях.
Системная красная волчанка (СКВ) — аутоиммун-
ное заболевание, которое поражает многие органы тела
и вызывает лихорадку и боль в суставах. У больных
продуцируется большое количество антител к компо-
нентам клеточного ядра, в частности против ДНК, и об-
разуются циркулирующие растворимые комплексы
антиген — антитело. Эти комплексы откладываются в
тканях, например в почках, и активируют каскад ком-
племента, что приводит к повреждению тканей.
Смешанная культура лимфоцитов (СКЛ) — проли-
феративный ответ, который развивается in vitro, когда
смешивают лейкоциты двух индивидуумов. Т-клетки
одного из них (респондера) активируются антигенами
МНС, экспрессируемыми на антигенпрезентирующих
клетках другого (стимулятора).
Созревание аффинности — увеличение аффинности
антител к антигену после иммунизации, отсроченное
по времени. Гены, кодирующие вариабельные области
антител, подвергаются соматическому гипермутагенезу
с последующей селекцией тех В-лимфоцитов, рецепто-
ры которых имеют наибольшую аффинность к антигену
Соматический гипермутагенез — изменение после-
довательности в вариабельном фрагменте иммуногло-
булина, продуцируемого В-клеткой, после антигенной
стимуляции. Приводит к повышению аффинности ан-
тител к антигену.
Сортировка клеток по активированной флуоресцент-
ной метке (FACS) — метод, при котором применяется
прибор с лазером, луч которого по-разному отклоня-
ется поверхностью клеток, связавших и не связавших
антитела, меченные флуорохромом. Таким образом
прибор сортирует популяции клеток как положитель-
ные и отрицательные по флуоресценции.
Суперантиген — молекула, которая активирует все
Т-клетки с особыми Vp-сегментами гена, независимо
от типа экспрессируемого Va.
Супрессия — механизм формирования иммуноло-
гической толерантности, при которой одна клетка или
ее продукты подавляют функцию других.
Суррогатные легкие цепи — переаранжированные
цепи (VX5 и V-npe-B), экспрессируемые совместно с
ц-цепью в пре-В-клетках; образуют часть пре-В-кле-
точного рецептора.
Сцепленное распознавание — необходимое условие,
чтобы Т-хелпер и В-клетка, участвующие в гумораль-
ном ответе на тимусзависимый антиген, взаимодей-
ствовали с разными эпитопами, физически присутству-
ющими на одном антигене.
Сыворотка — жидкая часть крови, отделившаяся
после свертывания; содержит антитела.
Сывороточная болезнь — реакция гиперчувствитель-
ности III типа, развивающаяся в присутствии цирку-
лирующих растворимых комплексов антиген — антите-
ло, приводящих к активации комплемента и нейтро-
филов в тканях, например в почке. Обычно развивает-
ся при терапии большими дозами чужеродных анти-
тел, такими как мышиные моноклональные антитела
(первоначально — при лечении пациентов лошадиной
сывороткой).
360
СЛОВАРЬ ТЕРМИНОВ
Такролимус — иммуносупрессивный пептидный
препарат (также известный как FK-506), который инак-
тивирует Т-клетки путем угнетения передачи сигнала
с Т-клеточного рецептора.
Тапазин — белок, ассоциированный с ТАР. Являет-
ся ключевым веществом для сборки молекул МНС
I класса. Клетки, у которых этого белка не хватает, не
способны экспрессировать молекулы МНС I класса на
своей поверхности.
Терминальная дезоксинуклеотидилтрансфераза
(TdT) — фермент, который вставляет дополнительные
нуклеотиды в места соединений V-, D- и J-генных сег-
ментов в ДНК-локусах иммуноглобулинов и Т-клеточ-
ных рецепторов; эти N-терминальные нуклеотиды уве-
личивают разнообразие антигенспецифичных рецеп-
торов.
Тимоцит — Т-клетка, дифференцирующаяся в ти-
мусе
Тимоцит дважды негативный — незрелая Т-клетка
внутри тимуса, не экспрессирующая ни одним из ко-
рецепторов (CD4 или CD8).
Тимоцит дважды позитивный — промежуточная ста-
дия развития Т-клеток в тимусе, характеризующаяся
тем, что экспрессируются оба корепепторных белка:
и CD4, и CD8.
Тимус — первичный лимфоидный орган для Т-кле-
точной дифференцировки. Состоит из внешней коры
и внутреннего мозгового слоя. Развивающиеся тимо-
циты взаимодействуют в тимусе с эпителиальными
клетками и макрофагами, образованными в костном
мозге, а также с интердигитальными дендритными
клетками.
Тиреоидит Хашимото — аутоиммунное заболевание,
для которого характерна персистенция высоких уров-
ней антител к антигенам, специфичным для щитовид-
ной железы. Эти антитела привлекают в ткань железы
натуральные киллеры, что приводит к ее повреждению
и воспалению.
Тирозиновые киназы — семейство ферментов, кото-
рые фосфорилируют тирозиновые остатки в белках, что
является очень важной стадией лимфоцитарной акти-
вации. Ключевыми тирозинкиназами при активации
Т-клеток являются Lek, Fyn и ZAP-70, а для актива-
ции В-клеток — Blk, Fyn, Lyn и Syk.
Титр — эмпирическая мера авидности антител; об-
ратное значение последнего разведения при титрова-
нии, при котором наблюдался измеряемый эффект —
например, если последнее разведение антител, при
котором наблюдалась заметная агглютинация, было
1:128, титр составит 128.
Токсического шока синдром — системная реакция,
вызываемая токсином, образуемым бактерией Staphylo-
coccus aureus\ токсин выступает в качестве суперанти-
гена, который активирует продукцию цитокинов у зна-
чительной доли СD4+-Т-клеток.
Толерантность — антигенспецифичное отсутствие
ответа В- или Т-клеток.
Трансплантация — пересадка органа (например,
почек или сердца) или клеток (в частности, костного
мозга) от одного организма другому. См. аллотрансп-
лантация, ксенотрансплантация.
Трансплантация костного мозга — метод, использу-
ющийся для лечения как иммунодефицитных состоя-
ний, так и злокачественных процессов, не поддающихся
другим видам терапии. Особенно часто применяется
при апластической анемии, остром лимфобластном
лейкозе и остром нелимфоцитарном лейкозе.
Тромбоциты — клетки, образующиеся в костном
мозге, необходимые для свертывания крови.
Туберкулиновый тест — подкожное введение анти-
генов, полученных из микроорганизма, вызывающего
туберкулез; у лиц, которые контактировали с этим
микроорганизмом, и у тех, кто был вакцинирован ба-
циллой Кальметта — Герена, спустя 24—48 ч в области
инъекции развивается реакция гиперчувствительности
замедленного типа.
Тучная клетка — клетка костномозгового происхож-
дения, содержащая гранулы; обнаруживается в соеди-
нительной ткани. После активации выделяет медиато-
ры, такие как гистамин и цитокины; важный участник
аллергических реакций.
Тяжелая цепь (Н-цепь) — большая из двух типов
цепей, которые образуют обычную молекулу иммуно-
глобулина или антитела.
Тяжелый комбинированный иммунодефицит
(ТКИД) — заболевание, развивающееся в результате
блокирования ранних стадий дифференцировки В- и
Т-лимфоцитов.
Участок, определяющий комплементарность (CDR) —
часть иммуноглобулина и Т-клеточного рецептора,
которая определяет их специфичность и обеспечивает
взаимодействие со специфическими лигандами. В каж-
дом V-домене существуют три таких области (CDR1,
CDR2, CDR3). Они являются наиболее изменчивыми
частями молекул и определяют разнообразие этих мо-
лекул.
Фабрициева сумка — орган у птиц, являющийся про-
изводным клоаки, в котором развиваются В-клетки.
Фагоцитоз — втягивание внутрь частицы или мик-
роорганизма лейкоцитами (макрофагами или нейтро-
филами).
Фактор В — компонент альтернативного пути ак-
тивации комплемента, который связывается с СЗЬ и
расщепляется фактором D с образованием СЗ-конвер-
тазы альтернативного пути комплемента
Фактор Н — регулятор комплемента, присутству-
ющий в кровотоке. Связывается с компонентом СЗЬ и
облегчает диссоциацию СЗ-конвертазы альтернативного
пути комплемента (обозначаемой СЗЬВЬ) на фрагмен-
ты СЗЬ и ВЬ.
Фактор I — регулятор путей активации комплемен-
та. При альтернативном пути он вначале выделяет из
СЗЬ iC3b, а затем уже из него два дополнительных
фрагмента (СЗс и C3d); при классическом пути акти-
вации этот фактор разделяет С4Ь на С4с и C4d.
Фактор Р — см. пропердин.
Фактор, ускоряющий диссоциацию (ФУД, CD55) —
мембранный гликопротеин эритроцитов, лейкоцитов
СЛОВАРЬ ТЕРМИНОВ
361
и тромбоцитов здорового человека, отсутствующий на
эритроцитах пациентов с ночной пароксизмальной ге-
маглобинурией Он облегчает диссоциацию СЗ-конвер-
тазы (С4Ь2а) классического пути комплемента на С4Ь
и С2а. Также вызывает диссоциацию СЗ-конвертазы
альтернативного пути СЗЬВЬ на СЗЬ и ВЬ.
Фенотип — физическая экспрессия генотипа орга-
низма.
Ферментный иммуносорбентный анализ (ELISA) —
методика, при которой к антителам присоединены
ферменты, а для измерения активности фермента ис-
пользуется субстрат. Изменение цвета субстрата позво-
ляет измерить количество связанных антител.
Фермерское легкое — болезнь гиперчувствитель-
ности, вызванная взаимодействием в альвеолярной
стенке легких антител класса IgG с большими коли-
чествами вдыхаемого аллергена. В ходе этого взаимо-
действия там развивается воспаление и нарушается
газообмен.
Фитогемагглютинин (ФГА) — митоген, который
поликлонально активирует Т-клетки.
Флуоресцеинизотиоцианат — флуоресцентный кра-
ситель, который испускает желто-зеленое свечение и
может быть конъюгирован с антителами или другими
белками.
Флуоресцентная микроскопия — метод микроскопии,
в котором для освещения ткани или клетки, окрашен-
ных меченными флуорохромами веществами, исполь-
зуется ультрафиолет; применяется, например, при изу-
чении взаимодействия в ткани антител с нужным ан-
тигеном.
Флуоресцирующие антитела — антитела, меченные
флуоресцентной краской, которые используются для
обнаружения антигенов на клетках, тканях или мик-
роорганизмах.
Фолликул — круглое или овальное скопление лим-
фоцитов в лимфоидной ткани с большим содержа-
нием В-клеток; может встречаться в коре лимфати-
ческих узлов или белой пульпе селезенки. Первич-
ные фолликулы содержат В-лимфоциты малого и
среднего размеров. Антигенная стимуляция вызыва-
ет развитие вторичных фолликулов, содержащих
крупные В-лимфоциты в зародышевых центрах, в ко-
торых можно выявить тканевые макрофаги (фагоци-
тируют ядерные частицы) и фолликулярные дендрит-
ные клетки.
Фолликулярные дендритные клетки — клетки внут-
ри лимфоидных фолликулов, необходимые для селек-
ции антигенсвязывающих В-клеток в ходе гумораль-
ного ответа. Их Fc-рецепторы не перемещаются внутрь
клетки путем рецепторопосредованного эндоцитоза,
поэтому фолликулярные дендритные клетки могут дли-
тельное время удерживать на своей поверхности ком-
плексы антиген — антитело.
Фосфатаза — фермент, который отщепляет фосфат-
ные группы от белков.
Фосфолипаза Су (PLCy) — фермент, участвующий
в активации Т- и В-клеток. Расщепляет фосфатидили-
нозитолбифосфонат на диацилглицерол и инозитол-
трифосфат, что приводит к активации двух основных
механизмов передачи сигнала.
Хемокины — малые цитокины с относительно низ-
кой молекулярной массой, высвобождаемые разными
клетками и вовлекаемые в воспалительные реакции,
а также в процессы миграции и активации преимуще-
ственно фагоцитов и лимфоцитов.
Хемотаксис — миграция клеток по градиенту кон-
центрации аттрактанта.
Химера — мифическое животное, обладающее го-
ловой льва, телом козы и хвостом дракона. Этим тер-
мином описывают организмы, содержащие клеточные
компоненты, полученные от других, генетически от-
личающихся организмов.
Ходжкина болезнь — злокачественное заболевание,
при котором предполагаемым источником трансформиру-
емых клеток служат антигенпрезентирующие клетки, на-
поминающие дендритные. Ходжкинская лимфома отно-
сится к опухолям, в которых преобладают лимфоциты.
Холодовой агглютинин — антитело, которое наибо-
лее активно вызывает агглютинацию определенных
антигенов, таких как бактерии или эритроциты, при
температуре менее 37 °C В клинической практике обыч-
но имеют дело с антителами, вырабатываемыми про-
тив эритроцитарных антигенов, например при синд-
роме холодовой агглютинации.
Хроническая гранулематозная болезнь — заболева-
ние, характеризующееся дефектом фермента НАДФН-
оксидазы, что приводит к снижению потребления кис-
лорода нейтрофилами и моноцитами, уменьшению
утилизации глюкозы с использованием гексозно-мо-
нофосфатного шунта. В 2/3 случаев заболевание насле-
дуется как сцепленное с хромосомой X, а в остальных
носит аутосомно-рецессивный тип наследования.
Хронический лимфоцитарный лейкоз (ХЛЛ) — В-кле-
точный лейкоз, при котором малые долгоживущие лим-
фоциты в течение длительного времени накапливают-
ся в селезенке, лимфатических узлах, костном мозге и
крови. Клетки лейкозного клона при ХЛЛ экспресси-
руют на своей поверхности моноклональные иммуно-
глобулины.
Центральные лимфоидные органы — участки ранне-
го развития лимфоцитов, в которых образуются анти-
генспецифические рецепторы. У людей В-лимфоциты
развиваются в костном мозге, а Т-лимфоциты — в ти-
мусе из клеток-предшественников, образующихся в
костном мозге.
Центробласты — крупные быстро делящиеся клет-
ки, обнаруженные в зародышевых центрах. Эти клет-
ки подвергаются соматическому гипермутагенезу и дают
начало клеткам, секретирующим антитела, и В-клет-
кам памяти.
Циклоспорин А — иммуносупрессивный препарат,
который подавляет передачу сигнала в Т-клетках, пред-
отвращая Т-клеточную активацию и развитие эффек-
торных функций. Он действует, образуя комплекс с
циклофилином, который при связывании инактиви-
рует белок кальциневрин, являющийся серинтреони-
новой фосфатазой.
Циклофосфамид — иммуносупрессивный препарат,
который более токсичен в отношении В-лимфоцитов,
362
СЛОВАРЬ ТЕРМИНОВ
чем Т-лимфоцитов. Следовательно, он является более
эффективным супрессором синтеза гуморальных анти-
тел, чем клеточно-опосредованных реакций.
Цитокин — растворимая субстанция, секретируемая
клетками, которая оказывает разнообразные эффекты
на другие клетки.
Цитокиновые рецепторы — клеточные рецепторы для
цитокинов. Связывание цитокина с рецептором цито-
кина стимулирует передачу сигнала, приводящего к
новым формам активности клеток, таким как проли-
ферация, дифференцировка или гибель.
Цитотоксин — белок, вырабатываемый цитотокси-
ческими Т-клетками, который принимает участие в
разрушении клеток-мишеней. Наиболее изученными
цитотоксинами являются перфорины и гранзимы.
Цитотоксические Т-клетки (лимфоциты) (ЦТЛ) —
Т-клетки, которые могут убивать другие клетки. В ос-
новном цитотоксическими Т-клетками являются CD8+-
Т-клетки, рестриктированные молекулами МНС I клас-
са, но в некоторых случаях клетки-мишени также мо-
гут поражаться СЭ4+-Т-клетками.
Цитофильные антитела — антитела, прикрепля-
ющиеся к клеточной поверхности через Fc-фрагмент,
связываясь с Fc-рецептором. Подобным образом, на-
пример, молекулы IgE связываются с поверхностью
тучных клеток и базофилов.
Чедиака — Хигаси синдром — заболевание, протека-
ющее в детском возрасте, с аутосомно-рецессивным ти-
пом наследования; идентифицируется по наличию в лей-
коцитах крупных лизосомальных гранул, которые очень
стабильны и медленно подвергаются дегрануляции.
Человеческие лейкоцитарные антигены (Н LA) — че-
ло веческий МНС; в него входят гены, кодирующие
полиморфные молекулы МНС I и II классов, а также
множество других важных неполиморфных генов.
Шарнирная область — подвижный открытый сег-
мент молекулы антитела, который обеспечивает кон-
формационные изменения молекулы. Шарнирная об-
ласть расположена между Fab- и Fc-фрагментами; вос-
приимчива ферментативному расщеплению.
Экзон — область ДНК, кодирующая белок или его
сегмент
Экзоцитоз — высвобождение содержимого внутри-
клеточной вакуоли за пределы клетки. Вакуоли про-
двигаются к плазматической мембране, с которой за-
тем сплавляются, что обеспечивает высвобождения
содержимого во внешнюю среду.
Экспериментальный аллергический энцефаломиелит
(ЭАЭ) — экспериментальное воспалительное заболева-
ние ЦНС, вызываемое у грызунов путем иммунизации
нервными антигенами с адъювантом. Это заболевание
является моделью рассеянного склероза у людей.
Эндогенные пирогены — цитокины (например, ин-
терлейкин-1. фактор некроза опухоли а), которые мо-
гут индуцировать подъем температуры тела; экзоген-
ные вещества, такие как эндотоксин из грамотрица-
тельных бактерий, вызывают лихорадку, запуская про-
цессы синтеза эндогенных пирогенов.
Эндотоксины — бактериальные токсины, которые
высвобождаются в случае повреждения или разруше-
ния бактериальных клеток. Самым важным эндоток-
сином является липополисахарид грамотрицательных
бактерий, который запускает синтез цитокинов.
Эндоцитоз — механизм, посредством которого ве-
щества из внеклеточной жидкости перемещаются
внутрь клетки внутри пузырьков, сформированных из
плазматической мембраны. Этот процесс может допол-
няться или пиноцитозом, или рецепторопосредован-
ным эндоцитозом.
Эозинофилы — лейкоциты, играющие важную роль
в аллергических реакциях; считается, что они важны
для защиты от паразитарных инфекций.
Эпитоп — альтернативный термин для обозначения
антигенной детерминанты.
Эритробластоз фетальный (гемолитическая болезнь
новорожденных) — заболевание плода человека, вы-
зываемое антителами IgG, проникающими через пла-
центу от матери к плоду. Эти антитела связываются с
эритроцитами плода, что приводит к разрушению по-
следних.
Эритропоэтин — гликопротеин, вырабатываемый
почками. Его продукция регулируется присутствующи-
ми в почках кислородчувствительными веществами,
такими как гем. Эритропоэтин стимулирует продук-
цию эритроцитов в костном мозге.
Эффекторные клетки — лимфоциты, которые мо-
гут непосредственно принимать участие в удалении воз-
будителей или антигенов из организма без дальней-
шей дифференцировки. Их следует отличать от так
называемых наивных лимфоцитов, которые должны
пройти этап пролиферации и дифференцировки преж-
де, чем смогут выполнять эффекторные функции.
Ядерный фактор активированных Т-клеток — комп-
лекс, состоящий из белка, который удерживается в ци-
тозоле с помощью серинтреонинового фосфорилиро-
вания, и димера Fos — Jun, известного как АР-1. Пере-
мещается из цитозоля в ядро при отщеплении фосфат-
ных остатков кальциневрином.
Янус-киназы (JAK) — тирозиновые киназы, акти-
вируемые цитокинами, связавшимися со своими кле-
точными рецепторами.
В-клетки — предшественники плазматических кле-
ток, продуцентов антител; экспрессируют на своей по-
верхности Ig. Также их называют В-лимфоцитами.
В-клеточный рецептор (BCR) — рецептор для специ-
фического антигена на клеточной поверхности В-кле-
ток, состоящий из трансмембранной молекулы Ig. свя-
занной с инвариантными цепями Iga и Ig[3 в некова-
лентный комплекс.
В7 — кости муляторный гомодимерный белок су-
персемейства Ig; его экспрессия ограничена поверхно-
стью акцессорных клеток (например, В-клеток, мак-
СЛОВАРЬ ТЕРМИНОВ
363
рофагов) Лигандами для В7 являются расположенные
на Т-лимфоцитах CD28 и CD 152.
Cl-ингибитор эстеразы (С1-инг) — белок сыворот-
ки крови, который ингибирует функцию активирован-
ного С1.
С1 -ингибитора (С1-инг) недостаточность — наибо-
лее часто встречающееся расстройство классического
пути активации комплемента; наблюдается у пациен-
тов с наследственным ангионевротическим отеком.
С1-недостаточность — группа заболеваний, которые
могут проявляться как системная красная волчанка,
гломерулонефрит или гнойные инфекции, а также как
заболевания, патогенез которых связан с гиперреак-
тивностью III типа (иммунокомплексный механизм).
Описаны единичные случаи недостаточности Clq, С 1г,
или С1г и Cis.
Clq — полипептидная цепь из 18 аминокислот в
составе компонента С1 первого компонента класси-
ческого пути активации комплемента.
Clq-недостаточность — может быть обнаружена в
сочетании с волчаночноподобными синдромами.
С1г — сериновая эстераза, составляющая первого
компонента классического пути активации комплемен-
та С1.
Cis — сериновая эстераза, составляющая первого
компонента классического пути активации комплемен-
та С1. Связывает две молекулы Cis с осевой молеку-
лой Clq.
С2 — третий компонент классического пути акти-
вации комплемента. Это одноцепочечный полипептид,
который в присутствии ионов магния образует комп-
лекс с молекулами С4Ь на клеточной поверхности.
С2-недостаточность — редкое заболевание. Может
протекать бессимптомно или иметь симптоматику,
сходную с аутоиммунными заболеваниями, такими как
некоторые коллагенозы, системная красная волчанка.
Это заболевание имеет аутосомно-рецессивный тип
наследования.
СЗ — четвертый компонент, задействованный при
активации комплемента по классическому пути. С него
также начинается активация по альтернативному пути;
он имеет внутреннюю тиоэфирную связь, разрыв ко-
торой позволяет молекуле ковалентно связываться с
поверхностью клеток и белков.
СЗа — пептид малой молекулярной массы (9 кДа),
является фрагментом компонента СЗ системы комп-
лемента.
СЗЬ — основной фрагмент, образующийся при рас-
щеплении компонента СЗ системы комплемента кон-
вертазами как классического, так альтернативного
пути — С4Ь2а или СЗЬВЬ соответственно.
СЗ-активация «вхолостую» — феномен, при кото-
ром СЗ-конвертаза альтернативного пути постоянно
образует небольшие количества СЗЬ за счет гидролиза
внутренней тиоэфирной связи СЗ.
СЗ-конвертаза — фермент, который расщепляет
компонент СЗ на СЗЬ и СЗа. СЗ-конвертазой класси-
ческого пути является С4Ь2а, а СЗ-конвертазой аль-
тернативного пути — СЗЬВЬ.
С5-конвертаза — молекулярный комплекс, который
расщепляет С5 на С5а и С5Ь в классическом и альтер-
нативном путях активации комплемента.
С5-недостаточность — очень редкое генетическое
заболевание, имеющее аутосомно-рецессивный тип
наследования. У больных с такой недостаточностью
нарушена способность формировать мембраноатаку-
ющий комплекс, который необходим для эффектив-
ного лизиса вторгшихся микроорганизмов. Они обла-
дают повышенной чувствительностью к развитию дис-
семинированных инфекций, вызываемых микроорга-
низмами рода Neisseria.
С5Ь — основной молекулярный продукт, который
остается после расщепления С5 под действием С5-кон-
вертазы. Имеет участок для связывания Сб-компонен-
та системы комплемента и комплексы, чтобы начать
формировать мембраноатакующий комплекс.
С6 — компонент системы комплемента, принима-
ющий участие в формировании мембраноатакующего
комплекса.
С6-недостаточность — очень редкий генетический
дефект с аутосомно-рецессивным типом наследования.
У людей с данным заболеванием в плазме крови име-
ются только следы компонента С6. У них нарушена
способность формировать мембраноатакуюший комп-
лекс и повышена чувствительность к развитию генера-
лизованных инфекций, вызванных микроорганизмами
рода Neisseria.
С7-недостаточность — очень редкое генетическое
заболевание с аутосомно-рецессивным типом насле-
дования. В сыворотке таких пациентов содержатся толь-
ко следы компонента С7. Это заболевание ассоцииро-
вано с нарушением способности формировать мемб-
раноатакующий комплекс и повышенной частотой раз-
вития диссеминированных инфекций, вызванных мик-
роорганизмами рода Neisseria.
С8-недостаточность — очень редкое генетическое
заболевание с аутосомно-рецессивным типом наследо-
вания. У больных наблюдается недостаточность а- или
0-цепей С8, что приводит к нарушению способности
формировать мембраноатакующий комплекс, а также
к повышенной склонности к диссеминированным ин-
фекциям, вызываемым микроорганизмами рода Neisse-
ria, такими как менингококки.
С9 — компонент системы комплемента; является
одноцепочечным белком, который связывается с ком-
плексом С5Ь678 на клеточной поверхности. Взаимо-
действие 12—15 молекул С9 с одним комплексом С5Ь678
приводит к образованию мембраноатакующего комп-
лекса.
С9-недостаточность — очень редко встречающееся
расстройство с аутосомно-рецессивным типом насле-
дования, при котором в плазме больных присутствуют
только следы (небольшое количество) С9. У них нару-
шена способность формировать мембраноатакуюший
комплекс.
СН50-единица — количество комплемента (разве-
дение сыворотки), которое вызывает лизис 50 % эрит-
роцитов, покрытых специфическими антителами
CTLA-4 (CD 152) — экспрессируется на активиро-
ванных Т-клетках и связывается с костимуляторной
364
СЛОВАРЬ ТЕРМИНОВ
молекулой В7 на антигенпрезентирующих клетках; пе-
редает ингибиторный сигнал.
D-ген — малый сегмент гена Н-цепи иммуноглобу-
лина и Т-клеточного рецептора ДНК, кодирующий
третий гипервариабельный участок большинства рецеп-
торов.
D-генные сегменты — см. D-ген.
ELISPOT — модификация ELISA, при которой на
поверхность с фиксированными антителами или ан-
тигенами наносятся клетки. Антитела или антигены за-
хватывают продукты, которые секретируют клетки. Об-
разовавшиеся комплексы затем можно обнаружить с
помощью антител, меченных ферментами. Эти анти-
тела преобразуют субстрат с формированием локали-
зованных цветных пятен.
Fab — фрагмент антитела, который содержит один
антигенсвязывающий участок; этот фрагмент образует-
ся при разрезании антител ферментом папаином, кото-
рый разрезает антитело в шарнирной области с N-конце-
вой стороны от дисульфидного мостика, связывающего
между собой тяжелые цепи. В результате его действия
из одной молекулы антитела образуется два Fab-фраг-
мента.
F(ab’)2 — фрагмент антитела, в который входят два
антигенсвязывающих участка; образуется при разреза-
нии молекулы антитела ферментом пепсином, кото-
рый разрезает молекулу в шарнирной области с С-кон-
цевой стороны от дисульфидного мостика, связыва-
ющего между собой тяжелые цепи.
Fas (CD95) — представитель семейства рецепторов
фактора некроза опухоли, который экспрессируется на
определенных клетках, делая их восприимчивыми к
уничтожению клетками-эффекторами, экспрессиру-
ющими Fas-лиганд. Связывание Fas с Fas-лигандом за-
пускает апоптоз в клетке, несущей Fas.
Fas-лиганд (FasL, CD 178) — белок поверхности клет-
ки, представитель семейства фактора некроза опухоли.
Связывание Fas-лиганда с Fas запускает апоптоз в клет-
ке, несущей Fas.
Fc — фрагмент антитела без участков связывания
антигенов, образующийся при разрезании молекулы
папаином; состоит из С-концевых доменов тяжелых
цепей иммуноглобулинов.
Fc-рецептор (FcR) — рецептор на поверхности
клетки со специфической связывающей аффинно-
стью к Fc-фрагменту молекулы антитела; обнаружи-
вается на многих типах клеток.
G-белок — белок, который в процессе передачи сиг-
нала внутри клетки связывает ГТФ и превращает его в
ГДФ.
Н-2 — МНС мыши; расположен на хромосоме 17.
Гаплотипы обозначаются строчными буквами в верх-
нем индексе, например, Н-2Ь. Содержит полиморфные
области К, I, D, L и другие неполиморфные гены.
Н-цепь — см. тяжелая цепь.
1а (ассоциированные с 1-областью) — устаревший
термин для обозначения генов и молекул МНС II класса
мыши; состоит из генов I-A и 1-Е.
ISCOM — иммуностимулирующий комплекс, со-
стоящий из антигена, упакованного в липидную обо-
лочку, выступающую в качестве адьюванта и обеспе-
чивающую проникновение антигена в цитоплазму при
сплавлении с цитоплазматической мембраной.
J-ген — участок гена, кодирующий J-сегмент (со-
единительный) иммуноглобулина или Т-рецептора.
J-цепь (соединительная цепь) — полипептид, уча-
ствующий в полимеризации молекул иммуноглобули-
нов классов IgA и IgM.
L-цепь — см. легкая цепь.
МНС I класса — молекула, кодируемая геном МНС,
которая участвует в презентации антигена CD8+(nn-
тотоксическим)-Т-клеткам.
МНС II класса — молекула, кодируемая геном
МНС, которая участвует в презентации антигена CD4+-
Т-клеткам.
МНС III класса — белки, в том числе компоненты
комплемента С2, С4 и фактор В, которые кодируются
в генах области МНС. Молекулы, кодируемые генами
МНС III класса, не участвуют в межклеточных взаи-
модействиях.
МНС-рестрикция — свойство лимфоцитов отвечать
на специфичные антигены, только если они представ-
ляются в ассоциации с собственными молекулами МНС
I или II класса.
NK 1.1-Т-клетки — небольшая субпопуляция Т-кле-
ток. которая жспрессирует маркер NK1.1, молекулу,
обычно обнаруживаемую на натуральных киллерах.
Экспрессируют а/р-Т-клеточные рецепторы ограничен-
ного разнообразия, а также либо корецептор CD4, либо
вообще не экспрессируют корецептора.
RAG-1 и RAG-2 — гены, активирующие рекомби-
нацию; их продукты принципиально важны для V(D)J-
рекомбинации в В- и Т-клетках.
ТН1 — субпопуляция СО4+-Т-клеток, которая син-
тезирует цитокины интерлейкин-2, интерферон-у и
фактор некроза опухоли р; эти цитокины активируют
эффекторные клетки, участвующие в реакциях клеточ-
но-опосредованного иммунитета, такие как натураль-
ные киллеры, макрофаги и СО8+-Т-клетки.
Тн2 — субпопуляция СО4+-Т-клеток, которая син-
тезирует интерлейкины-4, -5, -10 и -13; эти цитокины
СЛОВАРЬ ТЕРМИНОВ
365
преобладают при ответе на аллергены и паразиты (ре-
гулируют в переключении классов иммуноглобулинов
в В-клетках на IgE и активируют эозинофилы).
Т-зависимый антиген — иммуноген, которому для
взаимодействия с В-клетками и индукции синтеза ан-
тител необходимо участие Т-хелперных клеток.
Т-клетки — популяция лимфоцитов, для дифферен-
цировки которых необходим тимус.
Т-клетки-киллеры — Т-клетки, которые уничтожа-
ют клетку-мишень, экспрессирующую чужеродный ан-
тиген, связанный с молекулой МНС, на своей поверхно-
сти. Также называются цитотоксическими Т-клетками.
Т-клетки-хелперы — класс Т-клеток, которые по-
могают запускать продукцию антител к тимусзависи-
мым антигенам В-клетками. Хелперные Т-клетки так-
же помогают в дифференцировке других Т-клеток, та-
ких как цитотоксические Т-клетки.
Т-клеточный рецептор (TCR) — двухцепочечная
структура на Т-клетках, которая связывает антигены. На
основной части Т-клеток рецептор состоит из а/р-це-
пей, на меньшей части Т-клеток — из у/6-цепей. Комп-
лекс TCR состоит из антигенсвязывающих цепей, со-
единенных на поверхности клетки с молекулами, пере-
дающими сигнал: CD3 и
Т-независимый антиген — иммуноген, который за-
пускает синтез антител без участия Т-лимфоцитов или
их продуктов; синтезируемые антитела в основном
имеют изотип IgM. иммунологическая память к ним
не формируется.
ТАР-1 и ТАР-2 — молекулы, которые избирательно
перемещают пептиды из цитоплазмы клеток в эндо-
плазматический ретикулум для связывания с молеку-
лами МНС I класса.
Toll-подобные рецепторы (TLR) — семейство рецеп-
торов, распознающих последовательности, которые
экспрессируются на клетках системы врожденного
иммунитета, таких как макрофаги и дендритные клет-
ки. Эти рецепторы связывают микроорганизмы. Такое
взаимодействие приводит к выделению воспалитель-
ных цитокинов и экспрессии костимуляторных моле-
кул, которые усиливают приобретенный иммунный
ответ.
Toll-сигнальный путь — древний механизм переда-
чи сигнала, который активирует транскрипционный
фактор NF-кВ путем разрушения его ингибитора 1кВ.
TUNEL-тест — (Terminal deoxynucleotidil Transferase
Biotin-dUTP Nick End Labeling) — тест на межнуклео-
сомные разрывы ДНК, используемый для выявления
клеток, находящихся в процессе апоптоза. В этом ис-
следовании метят концевой участок ДНК биотинили-
рованным дезоксиуридинтрифосфатом (дУТФ), встав-
ляемым TdT.
V-области — см. вариабельные области.
¥(В)1-рекомбинация — механизм образования ан-
тигенспецифичных рецепторов Т- и В-клеток; в ходе
этой рекомбинации сегменты V, D и J объединяются
под действием ферментного комплекса V(D)J-peKOM-
биназы и продуктов генов RAG-1 и RAG-2.
Х-сцепленная агаммаглобулинемия (ХСА) — заболе-
вание мальчиков (также известное как агаммаглобули-
немия Брутона); проявляется как отсутствие зрелых В-
клеток; дифференцировка В-клеток не идет дальше
стадии пре-В-клеток вследствие дефекта тирозиновой
киназы Btk.
Х-сцепленный гипер-IgM-синдром — заболевание
мальчиков, проявляющееся в виде неспособности син-
тезировать другие изотипы иммуноглобулинов, кроме
IgM; является результатом дефекта или CD40, или
CD 154.
ZAP-70 — тирозиновая киназа, специфичная для
Т-клеток, которая участвует в активации этих клеток.